산업동향
2014년 FDA 승인으로 본 신약 허가 동향
- 등록일2015-03-16
- 조회수6690
- 분류산업동향 > 제품 > 바이오의약
-
자료발간일
2015-03-02
-
출처
(재)범부처신약개발사업단
- 원문링크
-
키워드
#FDA 승인
출처 : (재)범부처신약개발사업단
정원희. (재)범부처신약개발사업단 전문위원
1. 들어가면서
FDA 최근 발표자료에 따르면 2014년 승인된 신약은 41개로 나타났다. 이는 신약 승인이 다소 저조했던 2013년의 27개보다 14개 (52%) 증가한 수치이며 2000년대 이후 가장 높은 수치이다. 2014년 신약 승인 현황을 세부적으로 살펴보면 과거와 비교하여 단순 수치 증가 뿐 아니라 의미 있는 변화들이 감지되고 있다. 본 기고문에서는 2014년을 포함한 최근 FDA 신약 승인 자료를 고찰하여 신약 허가동향의 트랜드를 분석하고자 한다.
<최근 10년 간 FDA 신약 승인 현황 >
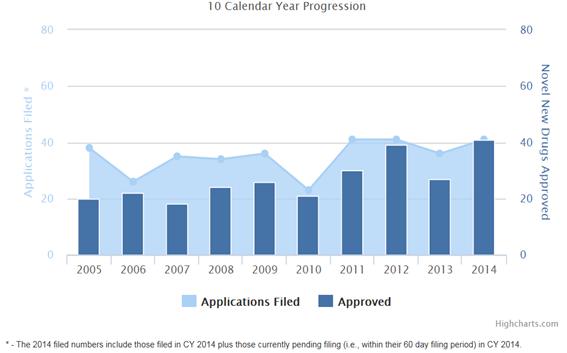
2. 질환 영역별 동향
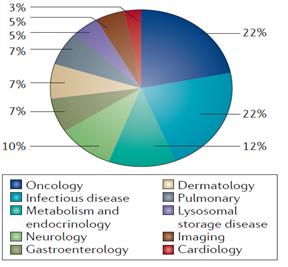
2014년 승인 약물 중 항암제와 항감염제의 비율이 각각 22%로 가장 많은 비중을 차지하고 있는 것으로 나타났으며 대사/내분비 질환 (12%), 신경계 질환 (10%) 등도 다수를 점유하고 있는 것으로 나타났다. 2013년 승인 현황과 비교할 때, 항감염제의 비율이 2배 가량 크게 증가했고 대사/내분비 질환 관련 약물의 비율 또한 소폭 증가했다. 반면, 2012, 2013년 연속 30% 이상의 비율을 점유하던 항암제의 비율은 감소했으며 심혈관계 약물의 비율 또한 4% 감소한 것으로 나타났다. 가장 눈에 띄는 항감염제의 비율 상승은 새로운 HCV 치료 약물의 승인과 더불어 항생제 개발 촉진법 (GAIN: Generating Antibiotic Incentives Now Act)에 근거를 둔 우수 감염증 치료제 (QIDP: Qualified Infectious Disease Product) 제도의 영향에 기인하는 것으로 판단된다. 한편, 획기적치료제 (Breakthrough Therapy)로 지정 받은 약물들의 질환 분류를 살펴보면, 혈액질환 치료제의 비중이 가장 높은 것으로 나타났다.
<2014 질환 분야별 승인현황>
3. BLA (Biologics License Application)
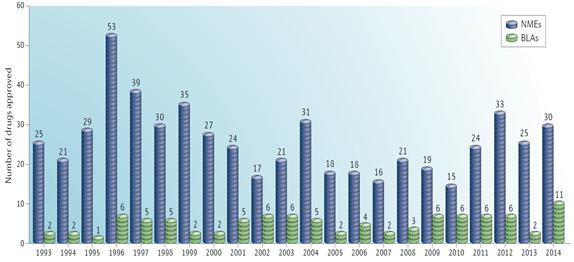
생물학적 제제 품목허가 (BLA, Biologics License Application) 승인 건수는 2014년 11건 (27%)으로 단 2건 승인에 그쳤던 2013년과 매해 6건의 BLA가 승인된 2009년∼2012년과 비교하여 증가한 승인 실적을 나타내었다.
<1993∼2014년 NME 및 BLA 승인 현황>
4. First-in-Class 및 Breakthrough Therapy Designation
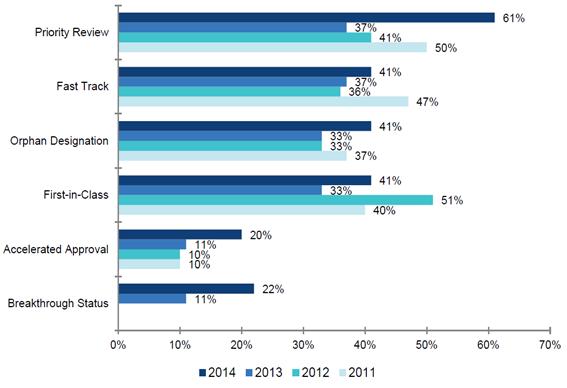
2011∼2013년 Frist-in-Class (계열최초 진입 약물) 약물 비중은 2011년 40% (12개), 2012년 51% (20개), 2013년 33% (9개)로 나타났으며 2014년의 경우에는 41% (17개)로 나타났다. 한편, FDA는 2014년 승인 약물 중 만성 C형 간염치료제인 길리어드 사이언스의 Harvoni (NS5A inhibitor 및 HCV nucleotide-analogue NS5B-polymerase inhibitor), 흑색종 치료제인 머크의 Keytruda (PD1-specific antibody), 머크의 항혈소판제 Zontivity (Protease-activated receptor 1 antagonist)등을 주목해야 할 First-in-Class 신약으로 제시한 바 있다. 또한 FDA는 백혈병 치료제인 암젠의 암젠의 Blincyto (CD19, CD3-bispecific antibody), 흑색종 치료제인 비엠에스의 Opdivo (PD1 inhibitor) 등 9개 품목을 Breakthrough Therapy Designation (획기적 치료제 지정)으로 결정했다. 이는 2013년 (3개 지정)과 비교하여 크게 증가한 수치이다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
지식
동향
- 산업동향 [이슈 브리핑] 엔허투, 모든 HER2 양성 고형암 치료제로 FDA 승인 2024-04-12
- 산업동향 [글로벌 보건산업 동향 Vol.506] 미국 제약사 Abbott, 충전식 뇌심부자극(DBS) 시스템으로 FDA 승인 획득 2024-04-09
- 산업동향 [이슈 브리핑] 중국 베이진, 오랜 지연끝에 테빔브라 FDA 승인 획득 2024-03-27
- 산업동향 2023년 출시가 기대되는 신약 상위 10개와 FDA 승인 현황 2023-06-02
- 산업동향 신약개발 Global Trend 분석 - 2022년 FDA 승인 현황 2023-02-24

