산업동향
미 FDA, 선스크린에 대한 강화된 규제안 발표
- 등록일2019-03-11
- 조회수4959
- 분류산업동향 > 제품 > 바이오의약
-
자료발간일
2019-03-05
-
출처
KOTRA
- 원문링크
-
키워드
#FDA#선스크린
2019-03-05 이성은 미국 달라스무역관
미 FDA, 선스크린에 대한 강화된 규제안 발표
- 안전하고 효과적인 제품을 위해 활성성분, SPF, 라벨링 등 규제 강화 -
- 새로운 제품 개발과 라벨링을 포함한 한국 기업의 적극적인 대응책 필요 -
□ 도입과정 및 배경
ㅇ 현재 시판 중인 선스크린은 2014년 Sunscreen Innovation Act에 따라 FDA에 의해 규제되고 있음.
- 초기 선스크린 제품 출시 이후 햇볕의 영향과 선스크린의 피부 흡수에 대한 연구가 더 많이 됐음.
ㅇ 선스크린의 품질, 안전성 및 효과를 개선하기 위해 2019년 2월 21일 강화된 규정을 제안 및 발표했음.
- 90일간(2019년 5월 28일까지) 공개 검토 및 의견을 수렴할 예정
□ FDA 개정안 주요 내용
ㅇ 활성성분
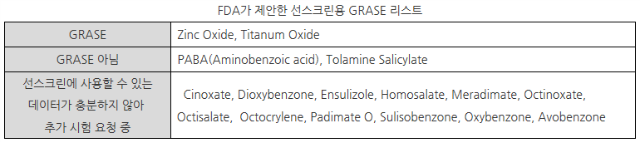
- 현재 시판 중인 선스크린용 활성성분은 16종. 이 중 산화아연(Zinc Oxide), 산화티타늄(Titanum Oxide)은 스프레이, 오일, 로션, 크림, 젤, 버터, 페이스트, 연고, 스틱의 형태로 New Drug Approval 없이 기존대로 시판 가능
- 아미노벤조산(PABA)과 트롤라민 살리신산(Tolamine Salicylate)은 일반적으로 안전하고 효과적인 성분(GRASE, Generally recognized as safe and effective) 리스트에 포함되지 않아 이 두 성분을 포함한 제품의 경우 시판 이전 FDA의 승인을 받아야 함.
- 옥시벤존(Oxybenzone), 아보벤존(Avobenzone)을 포함한 12가지 성분에 대해서는 안전성과 적절한 규제를 결정한 충분한 자료가 없다고 FDA는 발표했으며 화장품 업계에 추가적인 시험을 요청했음.
ㅇ 선스크린 제형
- 오일, 로션, 크림, 젤, 버터, 페이스트, 연고, 스틱, 스프레이 제형으로 시판 가능
- 파우더 제형은 안전성 관련 추가 자료 검토 후 GRASE에 포함 가능. 검토 후 GRASE에 포함이 되더라도 파우더 입자의 크기 제한을 받을 것으로 보임.
- 물티슈(Wipes), 작은 타월(Towelettes), 바디샴푸, 샴푸 등은 선스크린 제형으로 적합하지 않은 것으로 판단
ㅇ 최대 자외선차단지수(SPF) 조정 및 광범위 스펙트럼(Broad Spectrum)
- FDA는 2011년 최대 허용 SPF 라벨을 SPF 50+로 제안했으나 이번 발표에서는 SPF 60+로 상향 조정했음.
- 선스크린 테스트 수행 결과 가장 낮은 수치를 라벨에 기재할 것을 제안. 예를 들어 선스크린 테스트 결과 SPF 15에서 19사이의 값을 얻었다면 라벨에는 SPF 15로 기재해야 함.
- SPF 15 이상인 모든 선스크린은 Broad Spectrum을 차단해야 함.(UVA 및 UVB 차단)
- FDA는 SPF 14 이하의 선스크린이 시장에 존재해야 하는지에 대한 의견을 구하고 있음.
ㅇ 라벨링 변경 제안
- 활성성분은 알파벳 순으로 나열
- SPF 14 이하의 선스크린 제품은 SPF 표기 뒤에 별표를 표기해 소비자들이 피부암·피부 노화 경고(skin Cancer·Skin Aging alert)를 볼 수 있도록 제안
- 라벨의 SPF, Broad Spectrum, 방수(Water Resistance) 표시의 가독성을 높여야 함.
ㅇ FDA 발표 원문 링크(https://www.federalregister.gov/documents/2019/02/26/2019-03019/sunscreen-drug-products-for-over-the-counter-human-use)
□ 현지 반응 및 시사점
ㅇ 현지 반응
- 비영리 보건 및 환경단체인 Environmental Working Group(EWG)은 FDA의 발표에 대해 크게 규제되지 않은 산업을 정리하기 위한 큰 단계라고 밝힘. 특히 EWG는 지난 10년간 옥시벤존이 포함된 선스크린에 대한 우려를 제기했고 FDA가 이를 인지한 것으로 평가
- 과학자인 David Andrews는 미국 내 흑색종(Melanoma) 발생이 계속 증가하는 이유가 선스크린 성분과 제품의 효과에 대한 적절한 연방 안전기준이 없었기 때문이며, FDA가 새로 제안한 변경사항이 채택된다면 미국 소비자들은 안전하고 더 효과적인 제품을 선택할 수 있을 것이라고 밝힘.
ㅇ 화장품 업체 움직임
- 2019년 11월 26일 이전에 제안된 규정에 대한 최종 결정이 내려질 것으로 예상
- 이번 제안이 그대로 통과된다면 FDA는 제조사와 소매업자들에게 일정 기간을 부여해 기존 재고를 판매할 수 있도록 허가
- 현재 미국에서 판매되는 많은 선스크린 제품 중 GRASE로 분류된 Zinc Oxide, Titanum Oxide을 포함하지 않고 있어 기업들은 선스크린에 사용할 수 있는 데이터가 충분하지 않음으로 분류된 12종의 활성성분에 대한 안전성 테스트를 진행할 것으로 예상
ㅇ 우리 기업의 적극적인 대응책 요구
- 기존 성분을 대신해 안전한 활성성분을 이용한 제품 개발이 우선되어야 할 것
- FDA의 새로운 규제안에 맞춘 제품 개발, 라벨링 등 적극적인 대응책 요구
자료원: FDA, Global Trade Atlas, CNN, NBC, EWG, KOTRA 달라스 무역관 자료 종합
< 저작권자 ⓒ KOTRA & KOTRA 해외시장뉴스 >
☞ 자세한 내용은 내용바로가기를 이용하시기 바랍니다.
지식
동향

