BioINwatch
(BioIN + Issue + watch) : 바이오 이슈를 빠르게 포착하여 정보 제공의약품 유형별(합성, 바이오) 개발 특성
- 등록일2018-03-28
- 조회수21526
- 분류레드바이오 > 의약기술, 제품 > 바이오의약
-
발간일
2018-03-27
-
키워드
#신약개발#합성#바이오
- 첨부파일
-
차트+
?
차트+ 도움말
BioINwatch(BioIN+Issue+Watch): 18-23
의약품 유형별(합성, 바이오) 개발 특성
◇ 제약산업은 고령화에 따른 만성질환 증가와 건강에 대한 관심이 고조되고 있어 향후 성장 가능성이 높은 미래 유망산업. 글로벌 신약개발의 트렌드는 합성신약에서 바이오신약으로 이동하고 있으며, 이는 비교적 높은 R&D 생산성과 혁신적 신기술(유전자치료 등) 출현 등에 기인
▸주요 출처 : 한국수출입은행, 세계 의약품 산업 및 국내 산업 경쟁력 현황 : 바이오의약품 중심, 2017.8.; SK 증권, FDA 임상의 단계별 성공 가능성, 2016.7.29
■ 세계 의약품 시장규모는 2016년 1조 1,050억 달러, 이중 바이오의약품 비중은 19.9%에서 2021년 23.4%로 증가할 전망
○ QuintilesIMS 자료에 따르면 세계 의약품 시장은 2016∼2021년까지 연평균 5.9% 성장하여 2021년 1조 4,700억 달러 규모로 성장할 전망
- 바이오의약품 시장규모는 2016년 2,220억 달러(19.9% 비중)에서 연평균 9.4%로 성장하여 2021년 3,440억 달러(23.4% 비중) 전망(출처 : Frost&Sullivan)
< 세계 의약품 시장 현황 및 전망 (단위 : 십억 달러, %) >
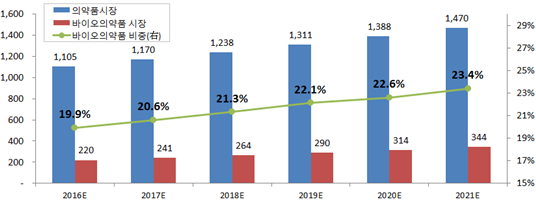
출처 : 의약품 시장규모는 QuintilesIMS, 바이오의약품 시장규모는 Frost&Sullivan, 한국수출입은행 작성
○ 바이오기술의 발전에 따라 (줄기)세포치료제 및 유전자치료제 등 혁신적 바이오의약품 출현 등으로 글로벌 신약개발의 중심은 합성의약품에서 바이오의약품으로 이동
- 최근 10년간(2008∼2017년) 미국 FDA 승인 신약은 총 321건으로 이중 바이오신약은 71건이며, 최근 바이오신약의 승인 비중은 40%에 육박
※ 바이오의약품은 사람이나 다른 생물체에서 유래된 것을 원료 또는 재료로 하여 제조한 의약품으로, 생물학적제제, 유전자재조합의약품, 세포치료제, 유전자치료제, 동등생물의약품(바이오시밀러), 개량생물의약품(바이오베터) 등이 포함
< 최근 10년(2008~2017년)간 미국 FDA 승인 신약(단위 : 개수) >
| 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 합계 |
합성신약 (NDA Approvals) | 21 | 20 | 15 | 24 | 33 | 25 | 30 | 33 | 15 | 34 | 250 |
바이오신약 (BLA Approvals) | 3 | 6 | 6 | 6 | 6 | 2 | 11 | 12 | 7 | 12 | 71 |
합계 (바이오신약 비중(%)) | 24 | 26 | 21 | 30 | 39 | 27 | 41 | 45 | 22 | 46 | 321 |
14.3 | 30.0 | 40.0 | 25.0 | 18.2 | 8.0 | 36.7 | 36.4 | 46.7 | 35.3 | 28.4 |
출처 : FDA, CDER NME Drug & Original BLA Calendar Year Approvals, 2008∼2017
■ 바이오의약품은 일반적으로 합성의약품 대비 약효가 우수하며 부작용이 적어, 전체 과정(임상1상∼신약승인)에서의 성공률이 높음
○ 바이오 및 합성의약품의 전반적인 개발 프로세스*는 동일하나, 발견(Discovery) 단계에서 원료물질의 차이로 최적화 및 생산 과정에 차이
* 신약개발 과정 : 발견(Discovery) ⇒ 개발(Development) ⇒ 상업화(Marketing)
- 합성의약품 개발 과정에서 후보물질의 발굴 및 최적화 과정은 물질 그 자체에 대한 최적화가 주류를 이루고 생산과정은 개발(Development) 과정의 일부
- 바이오의약품 중 단백질의약품의 경우 후보물질의 최적화, 세포주 개발, 생산공정 개발을 포함하는 전체 공정 자체가 의약품의 일부가 됨
< 합성의약품과 바이오의약품 개발 과정 >
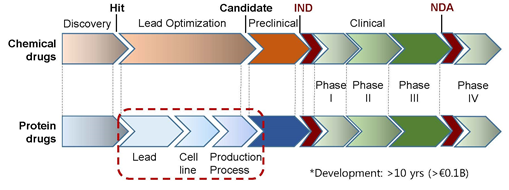
출처 : 범부처신약개발사업단, 단백질 의약품 개발 관점에서의 면역원성, 2015.11.2.
○ 신약개발에 소요되는 기간과 비용에 대한 R&D 생산성 연구에서 공통적으로 최근 들어 신약개발 R&D 생산성은 감소 추세로 조사
- 2010년 Nature Reviews Drug Discovery 발표된 논문에 따르면, 1개의 신약개발에 평균적으로 14년의 기간과 17.8억 달러가 소요되는 것으로 분석
※ 단계별로 보면 발굴 연구에 4.5년, 전임상 시험에 1년, 임상개발에 1상은 1.5년, 2상과 3상은 각각 2.5년, 그리고 승인신청에서부터 시장출시까지 1.5년이 소요
< 신약(NME) 개발에 소요되는 시간 및 비용 >
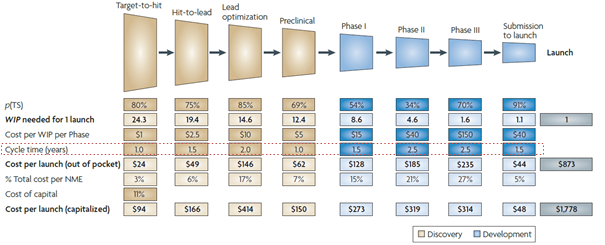
출처 : Nature Reviews Drug Discovery, How to improve R&D productivity: the pharmaceutical industry’s grand challenge, 2010.2.19.
- 제약기업의 R&D 효율성을 분석한 Schuhmacher A.(2016년) 논문에 의하면, 신약 1개당 개발비용은 평균적으로 30억 달러 이상으로 분석
< 다국적 제약기업의 R&D 효율성(2006~2014) >
| 총 R&D 지출 (백만 달러) (2006–2014) | FDA 승인 신약(NMEs) 수 (2006–2014) | R&D 효율성 (백만 달러/NME) (2006–2014) |
Abbott/Abbvie | 31,292 | 1 | 31,292 |
Eli Lilly | 40,232 | 4 | 10,058 |
Roche | 78,340 | 9 | 8,704 |
Sanofi | 42,948 | 6 | 7,158 |
Merck & Co. | 62,745 | 9 | 6,972 |
Pfizer | 72,125 | 11 | 6,557 |
AstraZeneca | 45,081 | 7 | 6,440 |
Novartis | 72,100 | 13 | 5,546 |
Amgen | 30,437 | 6 | 5,073 |
GSK | 47,109 | 12 | 3,926 |
Takeda | 23,361 | 6 | 3,893 |
Bristol-Myers Squibb | 33,006 | 9 | 3,667 |
Boehringer Ingelheim | 22,920 | 7 | 3,274 |
출처 : Journal of Translational Medicine, Changing R&D models in research-based pharmaceutical companies, 2016.4.27.
○ 의약품 유형별 임상시험 단계별 성공률은 임상 1상에서부터 신약 승인까지 합성의약품(6.2%) 보다 바이오의약품(11.5%)이 높음
※ BIO・Biomedtracker・Amplion은 신약개발의 성공률을 측정하기 위해 지난 10년간(2006∼2015년) 미국 FDA에서 임상을 수행했거나 진행 중인 자료를 조사하여 임상단계별 성공률을 분석
- 임상 1상에서부터 FDA 승인을 통과하는 신약승인 성공률은 9.6%
※ 임상 1상 성공 가능성은 63.2%이고, 임상 2상 성공 가능성은 30.7%, 임상 3상은 58.1%, 신약 승인단계인 NDA/BLA는 85.3%로, 임상 2상 단계 성공률이 가장 낮고 NDA/BLA 단계가 가장 높음
- 의약품 유형은 합성의약품(NME), 바이오의약품(Biologic), Non-NME(이미 신약으로 승인된 약물들의 복합체나 개량 신약)으로 분류해 보면, 모든 단계별 임상성공률은 Non-NME > 바이오의약품 > 합성의약품 순으로 분포
※ 일반적으로 바이오의약품(Biologic)은 합성의약품(NME, Chemical drug) 대비 약효가 우수하고 부작용이 적어 임상 성공가능성이 높음. Non-NME는 이미 허가된 신약들의 복합체(Combination) 형태나 개량신약이기 때문에 임상 성공률이 합성의약품 및 바이오의약품 보다 훨씬 높음
- 임상단계별 전환성공률 역시 바이오의약품 및 백신이 합성의약품에 비해 높은 수치를 기록. 임상 2상에서 3상으로 전환되는 확률은 바이오의약품 34.4%이며, 백신은 32.9%, 합성의약품은 26.5%
< 의약품 유형별 임상단계 성공률 >
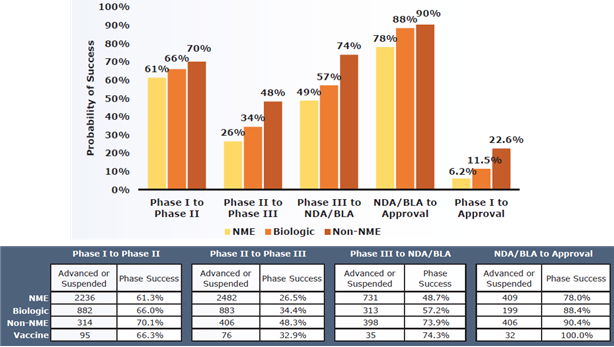
출처 : BIO・Biomedtracker・Amplion, Clinical Development Success Rates 2006-2015, 2016
지식
- BioINpro [국가 바이오 경쟁력] 국가 바이오 경쟁력 평가: 합성생물학(과학기술)과 바이오파운드리(인프라)를 중심으로 2025-04-14
- BioINpro [바이오 융합 소재·제조] 미생물-전극 간 전자 흐름의 재설계: 합성생물학과 바이오인터페이스 기술의 융합 2025-03-31
- BioINwatch 신기술(합성생물학, 유전자편집기술 등) 발전에 따른 유전자변형미생물(GMM)의 합리적 규제 방안 2025-03-27
- BioINwatch AI 신약개발, 무엇이 가능하고 무엇이 한계인가? 2024-12-12
- BioINwatch '중심 원리(Central Dogma)' 패러다임을 확장한 microRNA 2024-11-18
동향


 BioINwatch18-23(3.27)●의약품 유형별(합성 바이오) 개발 특성....
BioINwatch18-23(3.27)●의약품 유형별(합성 바이오) 개발 특성....
 세계 의약품 시장 현황 및 전망 (단위 : 십억 달러, %)
세계 의약품 시장 현황 및 전망 (단위 : 십억 달러, %)
 최근 10년(2008~2017년)간 미국 FDA 승인 신약(단위 : 개수)
최근 10년(2008~2017년)간 미국 FDA 승인 신약(단위 : 개수)