정책동향
2018 바이오의약품표준화분야 WHO 협력센터 연차보고서
- 등록일2019-07-01
- 조회수3857
- 분류정책동향 > 기타 > 기타
-
자료발간일
2019-06-18
-
출처
식품의약품안전처 식품의약품안전평가원
- 원문링크
-
키워드
#바이오의약품#WHO협력#서태평양
- 첨부파일
2018 바이오의약품표준화분야 WHO 협력센터 연차보고서
[목차]
1. 협력센터 소개
2. 2018년 주요성과
2-1. 바이오의약품 관련 WHO 가이드라인 및 권고사항 제. 개정 지원
2-2. 바이오의약품 국제표준품 및 지역표준품 공동연구 참여, 시험법 개발 또는 개선 연구 수행
2-3. WHO 국제교육 등 교육훈련 프로그램을 통해 개발도상국 규제기관 역랑강화 지원
2-4. 서태평양 및 기타 지역에서 WHO 가이드라인 이행 촉진
3. 부록1
3-1. WH 협력센터 개요
3-2. 바이오의약품 표준화 WHO 협력센터 네트워크
4. 부록2
4-1. WHO 가이드라인 개발 참여
4-2. 국제공동연구 참여
4-3. 국제회의 개최
2. 2018년 주요성과
1. 바이오의약품 관련 WHO 가이드라인 및 권고사항 제. 개정 지원
- 평가원은 백신을 포함한 바이오의약품의 품질, 안정성 및 유효성에 관란 WHO 가이드라인 개발에 적극적으로 참여해왔다. 특히, WHO 가이드라인 회의를 개최하거나 전문가를 파견하여 기술 자문을 제공하고 있다.
1.1 바이오의약품 가이드라인 제. 개정을 위한 전문가 자문
평가원은 다음과 같은 WHO 가이드라인 실무자 회의에 참여하였다.
ㄱ) WHO 핵산 백신 평가 규제에 관한 WHO 비공개 전문가 회의 (2018년 2월 231-23일 스위스 제네바 WHO 본부)
ㄴ) 폴리오 백신의 안정성 생산 및 품질관리에 관한 WHO 가이드라인 실무자 회의 (2018년 5월 7-8일, 스위스 제네바 WHO본부)
평가원은 또한 바이오시밀러에 관한 WHO Q&A 문서에 대해 의견을 송부하였다.
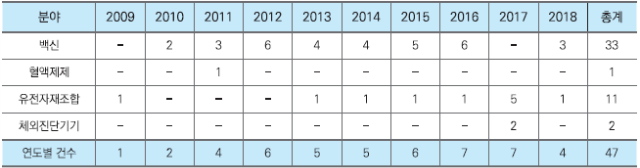
<표1. WHO 가이드라인 기술자문 연도별 건수>
1.2 제 69회 WHO 바이오의약품 표준화 전문가 위원회 (ECBS, WHO Expert Committee of Biological Standardization)
ECBS는 1947년 설림된 이래 혈액제제, 체외진단 기기, 백신 등 바이오의약품의 제조, 허가 관리, 국제표준품 확립에 관한 구체적인 권고사항 및 가이드라인을 제시해왔으며, 매년 10월 스위스 제네바 WHO 본부에 모여 상정된 가이드라인 및 표준품 문서를 검토하고 체택여부를 결정한다. 제 69회 ECBS 회의는 2018년 10월 17-20일 까지 개최되었으며, 식약처는 백신, 혈액제제, 재조합의약품, 세포치료제 및 체외진단기기 등 각 분야별로 전문가를 파견하여 주요 현안 및 회의에 상정된 국제 표준품과
가이드라인에 대해 의견을 반영하였다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
지식
동향


 2018+바이오의약품표준화분야+WHO+협력센터+연차보고서(최종).p...
2018+바이오의약품표준화분야+WHO+협력센터+연차보고서(최종).p...