부처연구성과
재발없이 근원적인 암치료가 가능한 항암제 개발 성큼
- 등록일2013-11-12
- 조회수6167
-
성과명
재발없이 근원적인 암치료가 가능한 항암제 개발 성큼
-
연구자명
배석철
-
연구기관
충북대학교 의과대학 의학과
-
사업명
리더연구자지원사업(창의적연구)
-
지원기관
미래창조과학부와 한국연구재단
-
보도자료발간일
2013-11-12
- 원문링크
-
키워드
#Cancer Cell #암 억제 유전자 #암 줄기세포
- 첨부파일
핵심내용
RUNX3가 암유전자 활성화로 인한 폐암발병을 억제한다는 사실 밝혀
□ 우리나라 연구팀이 참여한 국제 공동연구진이 정상세포가 암줄기세포로 진입하는 길목에서 입구를 차단하는 문지기 역할의 유전자(RUNX3*) 기능을 밝혀냈다. 이미 활성화된 암유전자의 기능을 억제하는 방식과 달리 이에 앞서 일어나는 암줄기세포의 생성과 세포의 방어체계 붕괴과정에 대한 실마리를 제공하여 새로운 개념의 항암제 개발의 단서가 될 것으로 기대된다.
* RUNX3 : 위암억제유전자, 2002년 배석철 교수 연구팀에 의해 밝혀졌다(2002, Cell). 후속연구를 통해 위암 뿐 아니라 폐암, 간암 등 여러 고형암에 대해서도 암억제 유전자로서 기능을 가지는 것이 밝혀졌다.
o 충북대학교 의학과 배석철 교수 연구팀이 주도로 싱가폴대학 이토(Ito) 교수 연구팀과 공동으로 수행한 이번 연구결과는 암연구 분야 학술지 캔서셀(Cancer Cell)지 온라인판 11월 11일자에 게재되었다. 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 리더연구자지원사업(창의적연구) 등의 지원을 받아 수행되었다.
( 논문명 : Runx3 inactivation is a crucial early event in the development of lung adenocarcinoma )
□ 우리 몸은 암유전자가 활성화된 암줄기세포를 선별적으로 사멸시키기 위한 강력한 방어체계인 문지기(gatekeeper) 유전자를 가지고 있어 암줄기세포를 조기에 파괴하는 것으로 알려져 있다.
o 하지만 암줄기세포의 생성과 세포의 방어체계가 무너지는 과정에서나타나는 구체적인 유전자 변형은 알려지지 않았다.
□ 이에 연구팀은 암유전자 활성화 이전에 일어나는 암줄기세포 생성과 방어체계 붕괴를 초래하는 결정적 사건이 RUNX3 불활성화에 의해 일어나는 것을 알아냈다.
o RUNX3가 정상세포의 암 줄기세포로의 전환을 차단하는 문지기 역할을 한다는 것이다.
o 암 발병 초기에 발생하는 분자적 사건을 유전자 수준에서 규명함으로써 치료제 개발을 위한 이론적 근거를 제공할 것으로 기대된다.
□ 실제 폐암세포에서는 RUNX3 유전자의 기능이 저하된 것으로 나타났고, 반대로 이 유전자의 기능을 향상시키면 폐암세포를 선택적으로 사멸시킬 수 있었다.
o 폐암 생쥐모델에서도 RUNX3가 암유전자에 의한 암세포로의 전환을 억제하는 것이 관찰됐다. 연구팀은 RUNX3의 기능을 향상시킴으로써 악성화된 암의 치료가 가능한지 동물모델을 이용한 기초연구를 진행할 예정이다.
□ 특히, 이번 연구성과는 그동안 베일에 가려져 있던 암세포 생성의 초기단계를 밝힘으로써 암줄기세포 제거 가능성도 시사하고 있어 주목받고 있다.
o 배 교수는 “암발병의 초기단계를 차단하는 세포내 방어기전을 규명함으로써 재발없는 항암제 개발전략을 제시한 것”이라고 밝혔다.
상세내용
연 구 결 과 개 요
1. 연구배경
암은 인류의 생명을 가장 심각하게 위협하는 질병으로서 우리나라 사람 4명 중 1명이 암으로 사망한다. 지난 10여 년간 여러 가지 항암 신약이 개발되어 환자 치료에 사용되고 있는데, 대부분 암 유전자의 기능을 억제하면 암이 치료될 것이라는 가설에 근거해 개발된 약물이다. 이런 항암제들은 출시 초기에 큰 기대를 모았지만, 실제 많은 환자들을 대상으로 사용해 본 결과 1~2년 후에 암이 재발하는 빈도가 매우 높아 한계를 드러내고 있다. 이러한 결과로부터 암유전자의 기능을 억제하는 약물은 암을 근원적으로 치료하지 못함을 알게 되었다. 그러므로 암의 완치를 위한 원리의 규명은 생명과학 연구 분야에서 해결해야 할 가장 시급한 과제이다.
암은 어떤 과정을 통하여 발생하는가?
최근 암은 암 줄기세포 생성으로부터 시작되며 이 세포에 암유전자 활성화가 일어나면 암세포로 전환됨이 밝혀졌다. 하지만 암 줄기세포가 만들어져도 모두 암이 발생하는 것은 아니다. 우리 몸에는 암유전자가 활성화된 세포를 선별적으로 사멸시킬 수 있는 강력한 방어체계인 문지기(gatekeeper) 유전자가 있어 암 줄기세포를 조기에 파괴한다는 가설이 통용돼 왔다. 암 줄기세포가 생성되고 이 세포에서 방어체계가 붕괴되는 두 가지 중요한 변화가 일어나야만 암이 발병한다. 아래 그림은 이러한 암 발병의 일반적인 과정을 요약한 것이다.
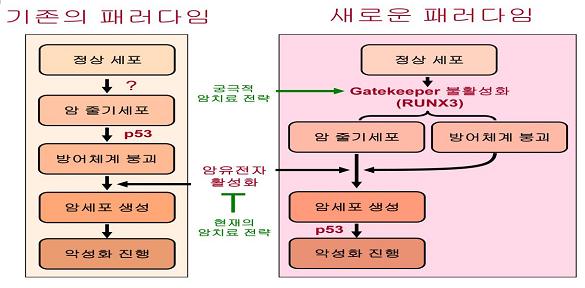
암 발병 과정에 대한 기존의 개념
위의 왼쪽 그림은 암 발병에 관한 기존의 패러다임으로서 첫째 암 줄기세포의 생성과, 둘째 방어체계의 붕괴라는 두 가지 사건이 각각 다른 유전자 변형에 의해 순차적으로 발생하는 별개 사건일 것으로 추정한다. 첫째 사건인 암 줄기세포의 생성을 유도하는 유전자 변형은 아직 분명히 규명되지 않았다. 둘째 사건인 방어체계 붕괴는 문지기 유전자 후보로 지목된 p53의 변형이나 결손이다. 만일 p53이 문지기 유전자라면 p53을 복구해 암을 근원적으로 치료할 수 있을 것이다. 최근 p53이 문지기 유전자라는 것을 증명하기 위한 실험에서 p53이 문지기 유전자가 아니라는 것이 밝혀져, 기존의 암 발병 패러다임은 설 자리를 잃었다.
기존의 암 유전자 활성억제 전략은 왜 암의 완치에 실패하는가?
위 그림으로부터 활성화된 암유전자의 기능 억제가 암 줄기세포에 영향을 미칠 수 없음을 예측할 수 있다. 즉, 항암 치료 후에도 암 줄기세포가 잔존해 있다가 항암제가 작용하지 못하는 다른 암유전자가 활성화되면 암세포가 다시 증식하게 되는 것이 암 재발의 원인으로 알려졌다. 암의 완치를 위해서는 암 발병의 근원이 되는 암 줄기세포를 제거하여야 한다. 하지만 기존의 패러다임으로는 암 줄기세포를 제거하는 전략을 세우지 못한다.
문지기 가설과 노벨상
1997년 Serrano 그룹에 의해 문지기 가설이 제시된 이후로 문지기 유전자를 찾는 수많은 연구가 진행되었다. 이는 하나의 문지기 유전자의 기능 조절을 통하여 다양한 암유전자에 의한 암을 부작용 없이 근원적으로 치료할 수 있을 것이라는 기대 때문이었다. Serrano et al., (1997). Cell, 88, 593-602.
이러한 기적의 유전자를 찾는 수많은 연구 결과는 p53을 가장 유력한 문지기 후보로 제시하였다. 그 결과 p53 유전자 발견자들은 지난 10년간 거의 매년 노벨상 후보에 올랐으나 p53을 이용한 암 치료 효과의 직접적인 동물 실험 결과가 없어서 수상이 유보되었다. 최근 보고된 두 편의 Nature 논문은 이러한 배경 하에 결정적 동물 실험 결과를 얻고자 수행된 것이다. (Junttila et al., (2010). Nature 468, 567-571. , Feldser et al., (2010). Nature 468, 572-575.)
그 결과는 놀랍게도 실패였는데, p53은 악성화한 암세포는 사멸시킬 수 있지만 초기단계의 암세포에는 영향을 미치지 못한다는 결과를 얻게되었다. 기대한 성과를 거두지 못한 연구 결과가 Nature에 두 편이나 함께 실린 것 자체가 암 치료를 위해 p53에 기대가 얼마나 컸는지를 웅변하고 있다. 이는 우리 몸의 세포에 문지기 유전자가 존재하는지 여부가 인류가 궁극적으로 암을 정복할 수 있는지 여부를 결정하는 중요한 개념이기 때문일 것이다.
2. 연구내용
암 발병 과정에 대한 새로운 개념 정립
배석철 교수 연구팀은 본 논문을 통하여 암 발병 과정의 새로운 패러다임을 제시하였다 (위 오른쪽 그림). 이 내용을 요약하면, 폐암 줄기세포의 생성과 폐암 방어체계의 붕괴는 RUNX3의 불활성화 라는 단 하나의 유전자 변형에 기인하며 RUNX3 유전자를 활성화 시키면 암유전자가 활성화된 폐암세포를 사멸시킬 수 있다. 이 연구는 RUNX3가 폐암 발병의 입구를 지키는 문지기 유전자임을 처음으로 밝힌 것이다.
연구팀이 규명한 암 발병원리에 대한 새로운 패러다임은 RUNX3의 활성화가 정상세포에는 무해하며 암세포만을 선별적으로 사멸 시킬 수 있을 뿐 아니라 암 줄기세포까지 제거할 수 있음을 제시하고 있다. 또한 RUNX3는 약물을 통해 활성활 될 수 있는 특징을 가지고 있다. 이러한 원리는 폐암 연구를 통해 얻어진 것이지만 폐암뿐 아니라 다른 다양한 암에도 이러한 원리를 확대 적용할 수 있는 가능성도 함께 제시되었다.
3. 기대효과
우리 몸의 세포에는 암을 일으킬 수 있는 유전자의 수가 대단히 많기 때문에 암의 정복을 위해서는 수많은 종류의 암유전자 억제제가 필요하며 그럼에도 불구하고 재발은 막을 수 없다. 이러한 암의 뒤를 쫒는 전략으로는 암의 정복을 기대하기 어렵다. 이에 반하여 문지기 유전자 복구 전략은 대부분의 암유전자가 필연적으로 지나야하는 길목을 지키는 전략으로서 만약 이러한 원리의 현실 적용이 가능해 진다면 소수의 항암제로 광범위한 암의 근원적 치료에 적용할 수 있는 만큼 암의 완전 정복도 가능해 질 것이다. 본 연구 성과로부터 얻어진 문지기 유전자 복구 전략은 향후 재발 없는 근원적 암 치료제 개발에 크게 기여할 것으로 기대된다. 만약 부작용이 없는 물질로서 문지기 유전자의 기능 촉진이 가능하면 암의 예방에도 기여할 수 있을 것이다.
연 구 결 과 문 답
|
이번 성과 뭐가 다른가 |
|
기존의 암 발병 연구는 주로 암유전자가 어떻게 암을 유도하는지에 대한 연구였다. 이번 성과는 암유전자 활성화가 일어나기 이전의 암세포가 생성되는 초기 단계를 차단하는 문지기 유전자의 실체와 작용기전을 밝힌 것이다. |
|
|
|
|
|
어디에 쓸 수 있나 |
|
기존의 이론에 의한 암유전자 억제 전략으로 개발된 암 치료제는 재발의 문제점을 해결할 수 없었다. 이번 연구의 성과를 통하여 암의 근원세포를 제거할 수 있는 이론이 제시된 만큼 재발 없는 암 치료제 개발에 활용될 수 있다. |
|
|
|
|
|
실용화까지 필요한 시간은 |
|
과거 항암제는 암 유전자 기능 억제제로 개발된 것이다. 이번 규명된 연구 성과를 실용화하기 위해서는 문지기 유전자 기능 활성화제의 개발이 필요하다. 본격적 투자가 이루어진다면 5-10년 내에 실용화가 가능할 것으로 예상된다. |
|
|
|
|
|
실용화를 위한 과제는 |
|
문지기 유전자 활성화를 통한 근원적 항암제 개발 연구가 필요하다. |
|
|
|
|
|
연구를 시작한 계기는 |
|
20년 전 RUNX3 유전자를 발견한 이래 이 유전자의 기능 연구에 매진해왔다. 2002년 RUNX3가 암억제 유전자임을 CELL지에 보고한 바 있다. 인체에는 약 50종의 암억제 유전자가 있는데 이 중에 문지기 유전자가 있을 것으로 예측되어 왔다. 본 연구팀은 후속 연구로서 RUNX3가 암을 억제하는 기전을 연구한 결과 RUNX3가 문지기 유전자임을 밝히게 되었다. |
|
|
|
|
|
선의의 경쟁연구진은 |
|
미국 MIT : Dr. Tylor Jacks
미국 Duke : Dr. Brigid Hogan
스페인 Madrid : Dr. Mariano Barbacid
네덜란드 Amsterdam : Dr. Anton Berns |
|
|
|
|
|
에피소드가 있다면 |
|
본격적인 연구기간 7년, 논문 심사 기간 3년의 긴 시간이 걸렸다. 폐암 발병 기전과 방어기전에 대한 학문적 견해가 달랐던 세계적 대가 Dr. Anton Berns 와 Dr. Brigid Hogan을 미국 학회에서 만나 밤늦게까지 토론 끝에 우리의 새로운 패러다임을 인정받았다. 이때의 토론 결과가 논문의 accept로 이어졌다고 생각된다. |
|
|
|
|
|
꼭 이루고 싶은 목표는 |
|
RUNX3 유전자를 활성화함으로써 실제로 암 환자를 근원적으로 치료할 수 있음을 현실에서 증명하고 싶다. |
용 어 설 명
1. Cancer Cell
○ 암연구 분야 국제학술지(Impact factor 27; 최근 5년 평균)
2. 암 유전자
○ 세포분열 촉진유전자로서 암세포에서 비정상적으로 기능이 향상되어 있는 유전자
3. 암 억제 유전자
○ 암세포 분열 억제 유전자로서 암세포에서 특정 암 억제 유전자의 기능이 결손되어 있다.
4. 문지기 유전자
○ 암억제 유전자의 일종으로서 암 유전자의 비정상적 활성화를 감지하여 이러한 세포를 선별적으로 사멸 시키는 기능을 가질 것으로 예상된 유전자이다. 과거 p53이 문지기 유전자 일 것으로 예상되었으나 최근 p53은 문지기 유전자가 아님이 확인되었다.
5. 암 줄기세포
○ 암세포의 기원이 되는 세포로서 이 세포에 암유전자 활성화가 일어나면 암세포화 된다. 항암 치료 후 암이 빈번히 재발하는 것은 암 줄기세포가 항암제에 내성을 가지기 때문인 것으로 알려져 있다. 암 줄기세포는 암 조직 중에도 극히 소수 존재하기 때문에 그 생성 과정이 거의 밝혀지지 않고 있었다.
그 림 설 명
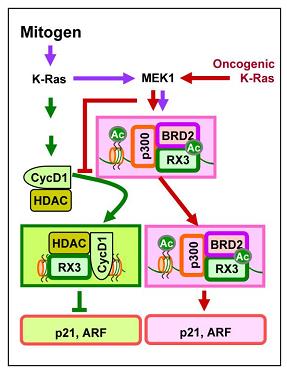
그림 1. RUNX3는 어떻게 암유전자 활성화 암세포를 선별적으로 사멸시키는가?
K-RAS는 정상세포에서 짧은 시간 동안 활성화되어 세포분열 명령을 전달한 다음 곧 바로 불활성화 된다. 그런데 폐선암에서는 K-RAS가 항상 활성화된 상태로 존재하여 지속적으로 세포 분열신호를 생성한다. 이것이 암세포가 무분별하게 분열하게 되는 대표적인 분자적 기전이다.
RUNX3는 K-RAS 활성증감 여부를 모니터링하여 비정상적인 K-RAS 활성이 감지되면 방어체계를 발동시켜 세포를 사멸시킨다. 그러나 RUNX3가 불활성화된 세포에서 K-RASV12D 돌연변이가 생성되면 그 세포는 사멸되지 않고 암세포가 된다. 이 암세포에 다시 RUNX3를 복구시키면 RUNX3에 의한 K-RAS 활성의 증감 모니터링 시스템이 다시 가동하여 세포를 사멸시킨다. RUNX3에 의한 K-RAS 활성의 모니터링 과정의 분자적 기전을 위 그림에 간단히 요약하였다. 정상세포는 보라색과 초록색 경로를 통해 세포가 정상상태임을 확인하고 세포분열 프로그램을 진행한다. 암유전자가 활성화된 경우(oncogenic K-Ras) 세포는 빨간색 경로를 통해 위험한 상태임을 인지하고 스스로 사멸 프로그램을 진행한다.

그림 2. 폐암 세포의 생성 과정
인체 폐암에서 RUNX3 불활성화와 K-Ras 활성화가 빈번히 관찰된다. 위 사진은 선택적 유전자 적중 기술(conditional knock-in/out)을 이용하여 생쥐의 폐세포에 RUNX3 불활성화와 K-Ras 활성화를 유도하고 생성된 악성 암 조직을 SPC(초록색)와 CC10(빨간색) 단백질을 검출하는 항체로 염색한 결과이다.
주황색으로 염색된 세포는 SPC와 CC10을 함께 발현하는 세포로서 암 원인세포 또는 암 줄기세포로 알려져 있다. 주황색 세포가 노랑색을 거쳐 초록색으로 점차적으로 변화하여 아래쪽에 초록색의 큰 암을 형성함을 볼 수 있다 (위 오른쪽 사진, 화살표). 이러한 결과로부터 악성 폐암 발병을 초래하는 결정적 원인이 RUNX3 불활성화와 K-Ras 활성화에 있음을 알 수 있다.
(오른쪽 사진은 왼쪽 사진의 상자로 표시된 부분을 확대한 것임)
관련정보


 재발없이+근원적인+암치료가+가능한+항암제+개발+성큼.hwp
재발없이+근원적인+암치료가+가능한+항암제+개발+성큼.hwp