부처연구성과
사느냐 죽느냐, 활성산소에 대한 세포반응 기전 규명
- 등록일2014-06-09
- 조회수9022
-
성과명
사느냐 죽느냐, 활성산소에 대한 세포반응 기전 규명
-
연구자명
조광현, 권기선
-
연구기관
KAIST 바이오및뇌공학과, 한국생명공학연구원
-
사업명
중견연구자지원사업(도약)과 바이오·의료기술개발사업
-
지원기관
미래창조과학부
-
보도자료발간일
2014-06-09
- 원문링크
-
키워드
#활성산소
- 첨부파일
핵심내용
활성산소에 따른 증식과 사멸이라는 세포의 운명을 가르는 핵심 분자스위치 원리 규명
□ 국내 연구진이 활성산소* 농도에 따라 세포의 운명이 어떻게 달라지는지 그 원리를 규명해냈다. 활성산소는 세포의 성장을 돕는 한편 세포손상을 일으켜 노화 등을 촉진하는 것으로도 알려져 있었다. 이처럼 세포를 죽게도 하고 살리기도 하는 활성산소의 상반된 역할을 설명할 수 있는 실마리를 찾아낸 것이다.
* 활성산소(ROS) : 인체 대사활동에 의해 발생되는 산소 부산물로 세포의 성장과 분화를 돕고 염증을 억제하는 유익한 기능을 하는 한편 세포손상을 유발하여 암, 당뇨 등 여러 질병을 일으키고, 노화를 촉진시키는 것으로 알려져 있다.
o KAIST 바이오및뇌공학과 조광현 석좌교수(교신저자)가 주도하고 이호성 박사과정 연구원(제1저자), 황채영 박사(공동 제1저자), 신성영 박사가 참여하고 한국생명공학연구원 권기선 박사(교신저자)가 공동으로 수행한 이번 연구는 미래창조과학부가 추진하는 중견연구자지원사업(도약)과 바이오·의료기술개발사업의 지원으로 수행되었고 연구결과는 사이언스(Science) 자매지인 사이언스 시그널링(Science Signaling)지 6월 3일자에 게재되었다.
* 논문명 : MLK3 is part of a feedback mechanism that regulates different cellular responses to reactive oxygen species
□ 연구팀은 MLK3*이 매개하는 양성피드백 회로가 활성산소 농도에 대한 ERK**와 JNK*** 경로간 신호흐름 균형을 조절함으로써 세포의 생사를 가르는 분자스위치임을 알아냈다.
* MLK3(Mixed Lineage Kinase 3) : 단백질을 인산화시키는 인산화효소로 세포 사멸에 관여하는 것으로 알려져 있다.
** ERK(Extracellular signal-regulated kinases) : 세포의 생존 및 증식에 관여하는 대표적인 신호전달 분자
*** JNK(c-Jun N-terminal kinases) : 세포의 스트레스 반응 및 사멸에 관여하는 대표적인 신호전달 분자
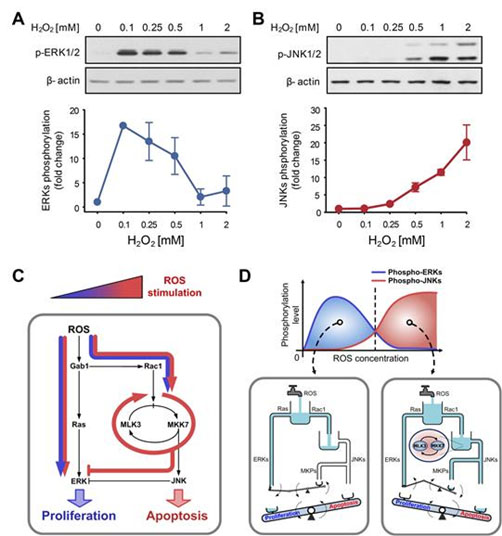
o 활성산소 농도가 낮을 때는 세포증식에 관여하는 ERK 단백질이 활성화되는 반면 활성산소 농도가 높아지면 세포사멸에 관여하는 JNK 단백질이 활성화되었다.
o 이는 적절한 스트레스 환경에서는 ERK 단백질이 활성화되어 세포가 분열하도록 신호를 보내는 반면 과도한 스트레스 상황에서는 JNK 단백질이 활성화 되어 분열을 멈추고 세포가 죽도록 유도하는 것을 말한다.
□ 조 교수는“ IT와 BT의 융합연구인 시스템생물학 연구를 통해 수수께끼로 남아있던 활성산소에 대한 상반된 세포반응의 원리를 규명한 것으로 향후 활성산소로 인한 노화나 암을 극복하기 위한 연구에 활용될 것으로 기대된다”고 밝혔다.
상세내용
연 구 결 과 개 요
1. 연구배경
활성산소는 산소이온과 과산화물을 포함하는 화학적으로 반응성이 높은 분자로 산소 대사 과정에서 발생하는 산소 부산물이다. 활성산소는 세포 증식, 노화, 주기조절 및 사멸 등 다양한 생물학적 과정에서 중요한 기능을 수행한다.
활성산소는 농도에 따라 서로 다른 생물학적 역할을 수행하는 것으로 알려져 있다. 낮은 농도의 활성산소는 세포 내 필수적인 신호전달물질로서 세포신호전달과 항상성 유지에 반드시 필요한 산화환원신호의 매개체가 되지만 과도한 활성산소의 발생은 단백질이나 DNA, 지질 등에 산화적 스트레스를 유발하여 세포 주기 정지 및 세포 사멸 혹은 세포 괴사를 일으킨다.
다양한 생물학적 과정에 관여하는 만큼 활성산소는 암, 당뇨, 심장병 등 각종 질병 및 노화와 같은 많은 생체 현상과 밀접한 관계를 갖고 있다. 이 때문에 그동안 활성산소의 대한 세포 반응의 근본 원리를 밝히고자 하는 많은 시도가 있어왔다. 하지만 활성산소가 서로 다른 기능을 하는 여러 신호전달경로를 조절하기 때문에 그 복잡성으로 인하여 활성산소의 세포 기능 조절 메커니즘은 아직까지 밝혀지지 않았다. 이러한 한계를 극복하고자 조광현 교수 연구팀은 정보기술(IT)과 생명과학(BT)의 융합연구인 시스템생물학(Systems Biology) 연구를 통하여 활성산소로 인해 유발되는 상반된 세포 반응의 복잡한 신호전달 메커니즘을 규명하였다.
2. 연구내용
세포는 활성산소의 농도에 따라 서로 다른 반응을 보인다. 활성산소의 농도가 낮은 경우에는 세포 증식이 활발히 일어나는 반면 활성산소의 농도가 높은 경우에는 오히려 세포 주기의 정지 및 세포 사멸이 유발된다. 그동안 활성산소가 어떻게 세포 반응을 조절하는지 규명하기 위한 많은 시도가 있었으나 그 핵심적인 조절 메커니즘은 지금껏 밝혀지지 않았다.
활성산소에 대한 상반된 세포 반응의 조절메커니즘을 규명하기 위하여 본 연구팀은 세포의 증식, 생존, 분화, 사멸 등의 다양한 세포생리 조절에 중요한 역할을 한다고 알려진 MAPK 단백질들의 활성산소에 대한 활성도를 관찰해보았다. 그 결과, ERK는 낮은 농도의 활성산소에 의해 활성화되는 반면 JNK는 높은 농도의 활성산소에 의해 활성화되는 것을 발견하였다. ERK와 JNK가 각각 세포 증식과 세포 사멸을 매개하는 단백질이라는 점을 고려하여 볼 때, 이러한 실험 결과는 ERK와 JNK가 활성산소의 농도에 따른 상반된 세포 반응을 유발할 수 있음을 시사한다.
그렇다면 ERK와 JNK의 활성도가 어떻게 활성산소의 농도에 따라 상반되게 조절되는 것인가? 이에 대한 기저 메커니즘을 탐구하기 위하여 조광현 교수 연구팀은 광범위한 문헌 조사와 더불어 직접 수행한 실험적 근거들을 바탕으로 ERK와 JNK 신호전달경로를 중심으로 한 활성산소 관련 신호전달 네트워크를 구축하였고 이에 대한 수학모델을 개발하였다.
세포는 피드백 회로를 통해 다양한 기능을 동적으로 조절할 수 있다. 본 연구팀은 활성산소에 대한 ERK와 JNK의 상반된 활성화를 조절하는 신호전달메커니즘을 규명하기 위해서 피드백 회로 분석을 수행하였다. 대규모 시뮬레이션 분석 결과 본 연구팀은 MLK3을 매개하는 양성피드백 회로와 MKPs를 통한 ERK와 JNK간 상호소통(cross-talk)에 관여하는 두 음성피드백 회로가 활성산소에 대한 ERK와 JNK의 상반된 활성화를 일으키는 필수요소임을 밝혀내었고, 이를 분자세포생물학 실험을 통해 검증하였다. 또한 세포 생존도 실험을 통해 그러한 필수 피드백 회로들이 실제 세포의 증식과 사멸에 관여한다는 것을 알아내었다.
활성산소에 대한 상반된 세포 반응에서의 MLK3을 매개하는 양성피드백 회로의 역할을 심층적으로 알아보기 위하여 이 양성피드백 회로의 세기를 변화시켜가면서 ERK와 JNK의 활성도가 어떻게 조절되는지 시뮬레이션 분석을 수행하였다. 균형점(balancing point)은 ERK와 JNK의 활성도가 동등할 때(ERK와 JNK의 활성도가 균형을 이루는 지점)의 활성산소 농도를 의미한다.
이로부터 균형점보다 낮은 농도의 활성산소에 대해서는 ERK의 활성도가 JNK의 활성도보다 우위에 있기 때문에 세포의 증식이 촉진되는 반면 균형점보다 높은 농도의 활성산소에 대해서는 JNK의 활성도가 ERK의 활성도보다 우위에 있기 때문에 세포의 사멸이 유발될 수 있음을 추론하였다. 시뮬레이션 분석을 통하여 조광현 교수 연구팀은 이러한 균형점이 MLK3을 매개하는 양성피드백 회로의 세기에 의존적으로 결정되는 것임을 확인하였다. 이러한 결과는 MLK3을 매개하는 양성피드백 회로가 활성산소에 대한 ERK와 JNK 경로 간 신호흐름 균형을 조절함으로써 세포 반응을 결정하는 핵심 분자 스위치임을 시사한다.
3. 기대효과
이번 연구는 생명현상의 수학 모델링과 방대한 컴퓨터시뮬레이션 분석을 통해 활성산소의 농도에 따른 상반된 세포 반응을 조절하는 장치가 세포내 신호전달 네트워크 속에 내재되어 있음을 규명해냄으로써 정보기술(IT)과 생명과학(BT)이 융합된 시스템생물학 연구를 통해 복잡한 생명현상의 숨겨진 원리를 파악할 수 있음을 보였다. 특히 이번 연구는 활성산소의 동역학적인 세포 반응 조절 메커니즘을 단분자 수준을 초월한 시스템 차원에서 밝힘으로써 활성산소의 생물학적 기능에 대한 이해를 한 단계 높이는 계기가 되었고, 더 나아가 노화의 제어와 암의 치료에 활용될 수 있을 것으로 기대된다.
연 구 결 과 문 답
|
이번 성과 뭐가
다른가 |
|
활성산소와 세포의 증식 또는
사멸과의 관련성에 대한 실험데이터를 모두 집대성하고 이로부터 수학모델을 구축, 대규모 컴퓨터 시뮬레이션 분석을 통해
MLK3를 매개하는 양성피드백 회로가 활성산소의 농도에 따른
상반된 세포반응을 결정하는 핵심 분자 스위치임을 규명한 것이다. |
|
|
|
|
|
어디에 쓸 수
있나 |
|
활성산소의 세포 반응 유발
메커니즘이 시스템 차원에서 새롭게 규명되어 노화의 제어와 암의 치료에 활용될 수 있다. |
|
|
|
|
|
연구를 시작한
계기는 |
|
활성산소가 노화와 암의 발생 등
다양한 생명현상의 원인으로 알려지면서 활성산소의 생체내 기능에 대한 많은 연구가 이뤄졌다. 그러나 활성산소가 여러 신호전달경로를 동시에 조절하는
등 그 복잡성으로 인해 그에 대한 이해는 단편적인 수준에 머물러 있었다. 이러한 한계점을 극복하기 위해 IT와 BT가 융합된
시스템생물학(systems biology) 접근법이 필요할 것이라 생각하여 이번 연구를 시작하게 되었다. |
|
|
|
|
|
꼭 이루고 싶은
목표는 |
|
이번 연구에서는 활성산소 반응에
주로 관여하며 세포의 증식과 사멸을 조절하는 신호전달경로인 MAPK 경로 및 PI3K-Akt 경로에 주로 집중하였다. 향후에는 활성산소에 의한
세포 분화 및 세포 이동에 관여하는 신호전달경로들을 모두 고려하여 보다 포괄적이고 정교한 수학모델을 개발하고 싶다. 더 나아가 활성산소와 밀접한
관련이 있는 노화와 각종 질병을 효과적으로 조절, 제어할 수
있는 새로운 기술 개발을 시도하고자 한다. |
|
|
|
|
|
신진연구자를 위한
한마디 |
|
연구를 진행할 때 대부분의
과학자들은 더 이상 나아갈 수 없는 어려움에 봉착하곤 한다. 역사를 되짚어 보면, 이 때 새로운 돌파구는 종종 전혀 다른 분야와의 융합을 통해
찾아지곤 한다. 특히 이번 연구에서는 생명과학과 전혀 무관한 수학모델링, 컴퓨터시뮬레이션 등이 도입되었는데, 이러한 시스템생물학(systems
biology) 융합연구가 이번 연구에서 기존 연구의 한계를 돌파할 수 있는 새로운 개념과 방법을 제공해주었다. 시스템생물학은 많은 시행착오
끝에 우연한 발견에 도달하는 기존 생명과학의 접근법을 혁신적으로 바꿀 수 있는 미래 생명과학의 새로운 패러다임이다. 세상을 바꿀 수 있는 중요한
연구를 하고 싶다면 자신이 연구하는 분야 이외의 다양한 분야에 대한 폭 넓은 이해와 열린 마음가짐을 가지려는 자세가
필요하다. |
용 어 설 명
1. 사이언스 시그널링(Science Signaling)지
○ 미국과학진흥회(AAAS)에서 발행하는 사이언스(Science)지의 첫 번째 자매지로 세포 신호전달 분야 학술지
2. 시스템생물학(Systems Biology)
○ 복잡한 생명현상이 여러 구성인자들의 상호작용에 의한 것임에 주목하고 수학 모델링과 컴퓨터 시뮬레이션, 분자 세포생물학 실험기법을 융합하여 시스템 차원의 근본적인 생명 메커니즘을 규명하려는 21세기의 새로운 융합연구
3. 신호전달(Signal transduction)
○ 외부 자극 또는 환경 변화를 세포막 수용체 단백질과 리간드(ligand)의 결합을 통해 인식하고 이를 일련의 신호전달 분자 간의 상호작용을 통해 세포 내로 전달함으로써 특정 유전자의 발현을 유도하여 세포반응을 만드는 과정
4. 활성산소(Reactive oxygen species)
○ 산소 대사 과정에서 발생하는 산소이온과 과산화물을 포함하는 산소 부산물
○ 증식, 노화, 주기 및 사멸 등 다양한 세포의 생물학적 과정에 중요한 기능을 수행하며 암, 당뇨 등의 질병 및 노화의 원인이 된다고 알려져 있다.
○ 세포 내의 필수적인 신호전달물질로서 세포신호전달과 항상성에 반드시 필요한 산화환원신호의 매개체가 되지만 과도한 활성산소는 단백질이나 DNA, 지질 등에 산화적 스트레스를 유발하여 세포 주기 정지 및 세포 사멸 혹은 괴사를 일으킨다.
5. MAPK 신호전달 경로 (Mitogen-activated protein kinase pathway)
○ 세포의 증식, 생존, 분화, 사멸 등 세포생리 조절에 관여하는 신호전달 경로로 긴밀하게 상호작용하는 ERK, p38, JNK 단백질계 신호전달 경로 등이 있다.
○ 세포가 활성산소나 UV 등 스트레스에 노출되면 신호전달 경로의 가장 상부에 있는 Raf나 ASK1과 같은 인산화효소가 활성화되어 다음 단계의 인산화효소를 활성화시킨다. 일련의 연속적인 인산화효소 활성화를 통해 활성화된 단백질이 핵 내부로 이동하여 타겟 단백질의 유전자 발현을 증가시키는 방식으로 세포생리를 조절한다.
6. ERK(Extracellular signal-regulated kinases) 단백질
○ 세포의 생존 및 증식에 관여하는 대표적인 신호전달 분자
7. JNK(c-Jun N-terminal kinases) 단백질
○ 세포의 스트레스 반응 및 사멸에 관여하는 대표적인 신호전달 분자
그 림 설 명
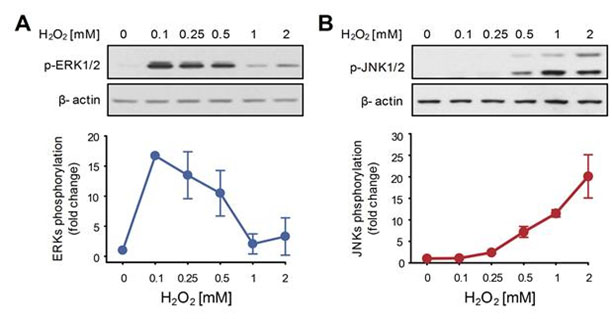
그림 1. 활성산소에 대한 ERK와 JNK의 상반된 활성화
(A, B) 낮은 농도의 활성산소에 대해서는 ERK가 높은 활성도를 보이는 반면, 높은 농도의 활성산소에 대해서는 JNK가 높은 활성도를 보인다는 것을 실험을 통해 확인하였다. ERK와 JNK가 각각 세포 증식, 세포 사멸을 매개하는 단백질이라는 점을 고려하여 볼 때, 이 실험 결과는 ERK와 JNK가 활성산소의 농도에 따른 상반된 세포 반응을 조정할 수 있음을 시사한다.
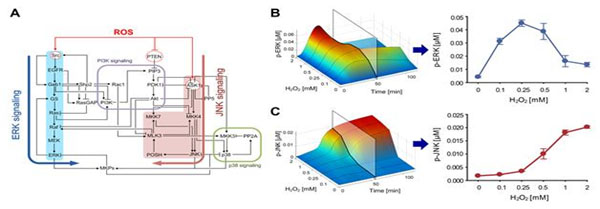
그림 2. 활성산소 관련 신호전달 네트워크 구축과 이에 대한 수학모델 개발
(A) 활성산소의 농도에 따른 상반된 세포 반응에 대한 기저 메커니즘을 탐구하기 위하여 활성산소 관련 신호전달 네트워크를 구축하고 이에 대한 수학모델을 개발하였다. 광범위한 문헌 조사와 더불어 직접 수행한 실험적 근거들을 바탕으로 ERK와 JNK 신호전달경로를 중심으로 한 활성산소 관련 신호전달 네트워크를 구축하였다. 이 신호전달 네트워크는 크게 ERK, JNK, p38, 그리고 PI3K 신호전달 모듈로 구성되어 있다.
(B, C) 구축된 활성산소 관련 신호전달 네트워크에 대한 미분방정식 기반의 수학모델을 개발하였다. ERK와 JNK의 활성도에 대한 수학모델의 시뮬레이션 결과가 실제 실험 데이터의 경향성과 잘 일치하는 것을 알 수 있다.
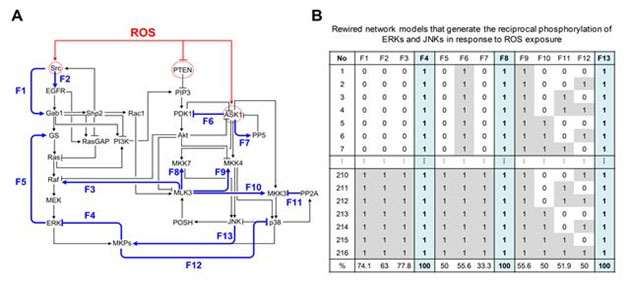
그림 3. 피드백 회로 분석을 통한 활성산소에 대한 ERK와 JNK의 상반된 활성화를 조절하는 핵심회로 동정
(A) 세포는 피드백 회로를 통해 다양한 기능을 동역학적으로 조절할 수 있다. 활성산소에 대한 ERK와 JNK의 상반된 활성화를 조절하는 신호전달메커니즘을 규명하기 위해서 피드백 회로 분석을 수행하였다. 활성산소 관련 신호전달 네트워크에는 모두 13개의 피드백 회로가 존재하는데, 각 피드백 회로를 대표하는 13개의 링크를 선정하였고 이를 피드백 링크로 정의하였다(F1-F13 : 청색 선).
(B) 활성산소에 대한 ERK와 JNK의 상반된 활성화를 만들어내는 핵심 피드백 회로를 찾기 위해 피드백 회로 분석을 수행하였다. 이를 위해, 13 개의 피드백 링크가 각각 연결되어 있거나 혹은 연결이 끊어져 있는 상태로 존재하는 가능한 모든 경우의 조합을 반영한 총 8192(213) 개의 재배열된 네트워크 모델(rewired network model)을 만들고 각 네트워크 모델에서 활성산소에 대한 ERK와 JNK의 상반된 활성화가 관찰되는지 시뮬레이션 분석을 수행하였다(1은 피드백 링크가 연결된 상태임을, 0은 피드백 링크의 연결이 끊어져 있는 상태임을 의미한다). 대규모 시뮬레이션 분석 결과 전체 8,192개 중 216개의 네트워크 모델에서 활성산소에 대한 ERK와 JNK의 상반된 활성화가 관찰되었고, 3개의 피드백 링크(F4, F8, F13)가 이들 216개의 네트워크 모델에서 공통적으로 모두 연결된 상태임을 확인하였다. 이 시뮬레이션 분석 결과는 피드백 링크 F4, F8, 그리고 F13이 포함된 세 개의 피드백 회로, 즉 MLK3을 매개하는 양성피드백 회로(피드백 링크 F8)와 MKPs를 통한 ERK와 JNK간 상호소통(cross-talk)에 관여하는 두 음성 피드백 회로(피드백 링크 F4, F13)가 활성산소에 대한 ERK와 JNK의 상반된 활성화를 조절하는데 필요한 필수 요소임을 시사한다.
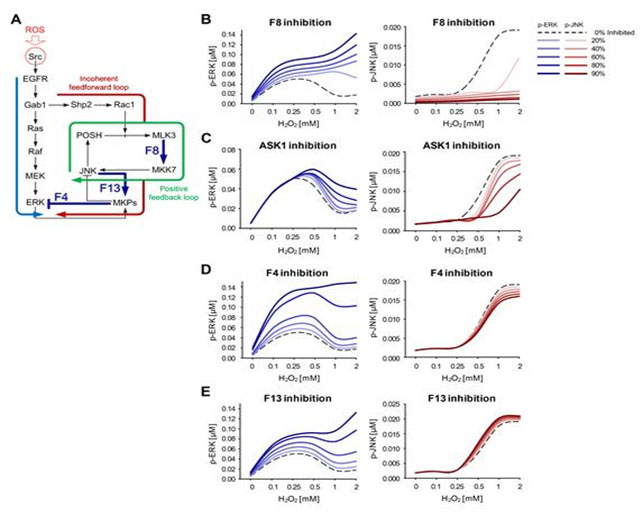
그림 4. 대규모 컴퓨터 시뮬레이션 분석을 통한 각 필수 피드백 회로의 역할 분석
(A) MLK3을 매개하는 양성피드백 회로(피드백 링크 F8)와 MKPs를 통한 ERK와 JNK간 상호소통에 관여하는 두 음성 피드백 회로(피드백 링크 F4, F13)는 활성산소에 대한 ERK와 JNK의 상반된 활성화를 만들어내는데 필수적인 요소이다.
(B) MLK3을 매개하는 양성피드백 회로가 활성산소에 대한 ERK와 JNK의 상반된 활성화에 어떠한 역할을 하는지 알아보기 위하여 피드백 링크 F8의 세기를 점진적으로 감소시키면서 다양한 농도의 활성산소에 대한 ERK와 JNK의 활성도를 시뮬레이션해 보았다. MLK3을 매개하는 양성피드백 회로의 활성도를 억제하는 경우 높은 농도의 활성산소에 대해서 ERK의 활성도는 대조군에 비해 증가하는 반면 JNK의 활성도는 감소하는 것을 시뮬레이션을 통해 확인하였다.
(C) MLK3 외 또 다른 JNK 경로의 MAP3K인 ASK1의 활성도를 억제하였을 경우, 피드백 링크 F8의 세기를 감소시켰을 때와 마찬가지로 높은 농도의 활성산소에 대해서 ERK의 활성도가 대조군에 비해 증가하는 반면 JNK의 활성도는 감소하는 것을 관찰하였다. 이 시뮬레이션 결과는 ASK1이 MLK3을 매개하는 양성피드백 회로의 활성화에 관여할 수도 있다는 점을 시사한다.
(D, E) MKPs를 통한 ERK와 JNK간 상호소통에 관여하는 두 음성 피드백 회로가 활성산소에 대한 ERK와 JNK의 상반된 활성화에 어떠한 역할을 하는지 알아보기 위하여 피드백 링크 F4와 F13의 세기를 각각 점진적으로 감소시키면서 다양한 농도의 활성산소에 대한 ERK와 JNK의 활성도를 시뮬레이션해 보았다. MKPs를 통한 ERK와 JNK간 상호소통이 억제되는 경우 높은 농도의 활성산소에 대해서 ERK의 활성도는 대조군에 비해 증가하는 반면 JNK의 활성도는 유의하게 변화하지 않는 것을 시뮬레이션을 통해 확인하였다.
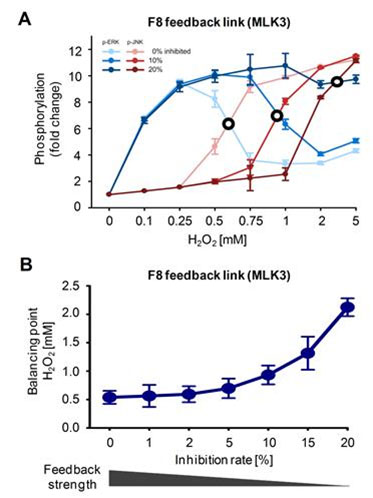
그림 5. MLK3을 매개하는 양성피드백 회로는 활성산소에 대한 ERK와 JNK 경로 간 신호 흐름 균형을 조절하여 세포 반응을 결정하는 핵심 분자 스위치임
(A, B) ERK와 JNK의 활성도가 동등할 때(ERK와 JNK의 활성도가 균형을 이루는 지점)의 활성산소 농도인 균형점(balancing point)은 MLK3을 매개하는 양성피드백 회로의 세기에 의존적으로 결정된다. 이러한 결과는 MLK3을 매개하는 양성피드백 회로가 활성산소에 대한 ERK와 JNK 경로 간 신호흐름 균형을 조절함으로써 세포 반응을 결정하는 핵심 분자 스위치임을 시사한다.
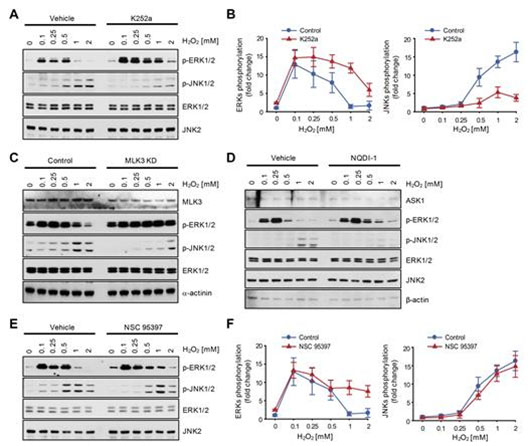
그림 6. MLK3, ASK1 및 MKPs 억제가 활성산소에 대한 ERK와 JNK의 활성도에 미치는 영향
시뮬레이션 분석을 통해 밝혀진 필수 피드백 회로들의 역할에 대한 실험적 검증을 수행하였다.
(A-C) 세포를 MLK3 활성도 억제제(K252a)에 노출시키거나 MLK3 유전자 발현을 억제함으로써(MLK3 knockdown) MLK3을 매개하는 양성피드백 회로의 활성도를 억제하였다. 이 경우, 시뮬레이션 분석으로부터 예측된 바와 같이 높은 농도의 활성산소에 대해서는 ERK의 활성도는 대조군에 비해 증가하는 반면 JNK의 활성도는 감소하는 것을 관찰하였다.
(D) 세포를 ASK1 활성도 억제제(NQDI-1)에 노출시킨 경우, 시뮬레이션 분석과 일관되게 높은 농도의 활성산소에 대해서는 ERK의 활성도는 대조군에 비해 증가하는 반면 JNK의 활성도는 감소하는 것을 확인하였다.
(E, F) 세포를 MKPs 억제제(NSC 95397)에 노출시킴으로써 MKPs를 통한 ERK와 JNK간 상호소통을 억제하였을 때, 높은 농도의 활성산소에 대해서는 ERK의 활성도는 대조군에 비해 증가하는 반면 JNK의 활성도는 유의하게 변화하지 않는 것을 관찰하였고, 이는 시뮬레이션 결과와 일치한다.
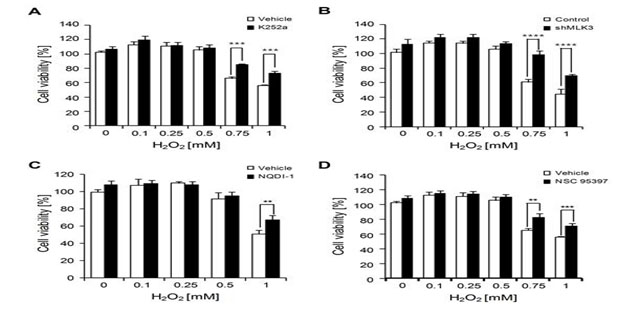
그림 7. MLK3, ASK1 및 MKPs 억제가 활성산소에 노출된 세포의 생존에 미치는 영향
ERK와 JNK의 상반된 활성화를 조절하는 필수 피드백 회로들이 활성산소에 노출된 세포의 증식과 사멸에 어떠한 역할을 하는지 확인하였다. 세포를 (A) MLK3 활성도 억제제(K252a), (C) ASK1 활성도 억제제(NQDI-1), 또는 (D) MKPs 억제제(NSC 95397)에 노출시키거나 혹은 유전자 knockdown을 통해 MLK3 유전자 발현을 억제하였을 때 높은 농도의 활성산소에 대한 세포 생존도가 증가하는 것을 관찰하였다. 이 결과는 본 연구에서 규명한 ERK와 JNK의 활성도를 조절하는 필수 피드백 회로들이 활성산소에 대한 세포 증식과 사멸에 관여함을 시사한다.
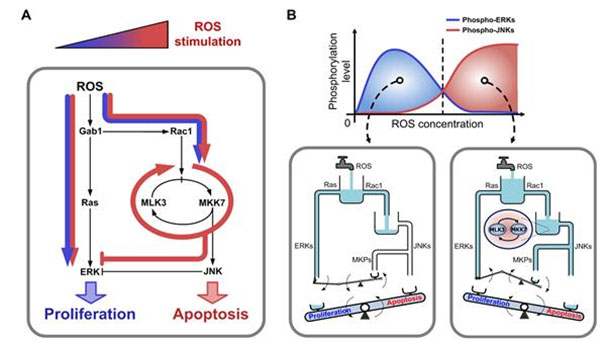
그림 8. 활성산소에 대한 상반된 세포반응을 조절하는 핵심회로
(A) 활성산소(ROS)의 농도에 따른 증식(Proliferation)과 사멸(Apoptosis)이라는 상반된 세포 반응을 조절하는 핵심회로는 MLK3를 매개하는 양성피드백 회로와 MKPs를 통한 ERK와 JNK간 상호소통으로 이루어져 있다. 청색 선은 낮은 농도의 활성산소에서의 핵심 회로내의 신호 흐름을, 적색 선은 높은 농도의 활성산소에서의 핵심회로내의 신호 흐름을 의미한다.
(B 아래 왼쪽) 낮은 농도의 활성산소에 대해서는 ERK의 활성도가 증가되지만, MLK3을 매개하는 양성피드백 회로는 충분히 활성화되지 못하여 JNK 활성도가 낮게 유지되어서 결과적으로 세포의 증식이 촉진된다.
(B 아래 오른쪽) 반면 높은 농도의 활성산소에 대해서는 MLK3을 매개하는 양성피드백 회로가 활성화되고, 이로 인해 JNK의 활성도는 증가되고 ERK 활성도는 억제되어 세포의 사멸이 유발된다.
관련정보


 [보도]+세포의+생사를+가르는+활성산소에+대한+세포반응+기전+규...
[보도]+세포의+생사를+가르는+활성산소에+대한+세포반응+기전+규...