부처연구성과
지능적 DNA 나노머신으로 항암치료 효율 획기적으로 높인다
- 등록일2014-06-30
- 조회수8407
-
성과명
지능적 DNA 나노머신으로 항암치료 효율 획기적으로 높인다
-
연구자명
김원종
-
연구기관
IBS 복잡계 자기조립 연구단
-
사업명
국제과학비즈니스벨트사업
-
지원기관
미래창조과학부와 기초과학연구원
-
보도자료발간일
2014-06-27
- 원문링크
-
키워드
#DNA 나노머신 #항암치료
- 첨부파일
핵심내용
- ACS Nano誌 논문 게재, pH 감응형 DNA 나노머신으로 조건 따라 유전자 전달 -
□ 미래창조과학부(장관 최문기)와 국제과학비즈니스벨트 핵심기관인 기초과학연구원(IBS, 원장 직무대행 신희섭)은 복잡계 자기조립 연구단(단장 김기문)의 김원종 그룹리더(포스텍 교수) 연구팀이 필요한 곳에만 지능적으로 유전자를 전달하고 질병치료 효과 또한 획기적으로 높일 수 있는 원리를 규명하는데 성공했다고 밝혔다.
o 연구진은 세포 내 pH(수소이온 농도지수)를 감응하여 지능적으로 유전자를 전달할 수 있는 DNA 나노머신1) 기반의 나노 구조체를 개발하고, 항암치료에 쓰이는 근적외선2) 광열치료 효과3)를 극대화할 수 있는 원리를 밝혀냈다.
o 이를 활용하면 질병 부위에 특정적으로 유전자를 방출시켜 질병세포 사멸을 유도할 수 있고, 동시에 항암 광열치료 효과도 높일 수 있어 앞으로 의약학, 보건의료, 암치료 등 다양한 분야에 적용될 것으로 기대를 모으고 있다.
□ 연구진은 금 나노입자에 pH 감응형 DNA(이하 i-motif DNA)4),그림1)와 치료 유전자인 간섭 RNA(siRNA, small interfering RNA)5)를 붙여 조건에 따라 거동을 다르게 조절하는 지능적인 DNA 나노머신을 개발하였다.
o 연구진은 i-motif DNA가 낮은 pH 조건에서 모양을 변형하여 서로 모이려는 성질을 가진다는 점에 착안하여 i-motif DNA에 세포사멸을 유도하는 siRNA라는 핵산을 접합시켜 금 나노입자의 표면에 붙였다.
o 이러한 금 나노입자는 세포 밖의 중성 pH에서는 siRNA를 품은 채로 흩어져 있다가, 세포 안으로 들어가면 세포 내의 낮은 pH에 감응하여 서로 결합하면서 siRNA를 전달한다는 사실을 규명하였고, 동시에 금 나노입자가 서로 결합하여 광열효과가 높아져 항암치료 효과 또한 획기적으로 높아짐을 확인했다.
o 빛에 의해 발생하는 고열을 이용한 항암치료(광열치료)는 빛에 감응하는 금 나노입자가 모여 있어야 높은 효과를 기대할 수 있고, 이때 질병세포 사멸을 유도하는 유전자 치료를 병행하면 상승효과를 기대할 수 있다.
□ 이번 연구 성과는 미국화학회가 발간하는 나노분야 세계적인 권위저널인 에이씨에스 나노지(ACS Nano, IF 12.062, JCR 상위 5.33%) 6월 10일자에 온라인 게재됐다.
* (논문제목) DNA-금 나노머신을 이용한 유전자 및 광열치료(i-Motif-Driven Nanomachines in Programmed siRNA Delivery for Gene-Silencing and Photothermal Ablation)
* (제1저자) IBS 복잡계 자기조립 연구단 손세진 연구원
* (교신저자) IBS 복잡계 자기조립 연구단 김원종 그룹리더
□ 김원종 IBS 복잡계 자기조립 연구단 그룹리더는 “주위의 환경에 따라 거동을 달리하는 지능적인 나노머신의 개발로 인해, 유전자로 인한 세포사멸의 유도와 빛에 의한 광열치료의 효과를 획기적으로 높여, 앞으로 원하는 시간, 원하는 부위에 원하는 양의 유전자를 전달할 수 있는 스마트한 유전자 전달 시스템으로의 적용이 가능할 것으로 기대된다.”라고 밝혔다.
상세내용
연 구 결 과 개 요
1. 연구배경
현재까지 DNA는 유전정보의 저장 물질 및 약물로 주목받아왔음. 최근 뛰어난 생체적합성과 물리화학적 성질 (온도 및 pH 와 같은 주변환경 변화에 안정함) 및 단순한 4개의 염기들의 상호작용에 의하여 자기조립체 형성 및 프로그래밍화할 수 있는 능력을 인정받아 뛰어난 생체재료의 하나로 가치가 재조명 되고 있음.
이러한 DNA를 이용하여 개발된 DNA 나노머신은 상보적인 핵산끼리의 서열특이적 상호작용에 의하여 자기조립(self-assembly)된 나노단위의 구조체로써, 주변 환경 (pH, 온도 및 빛)의 변화 및 특이적인 생체물질에 의해 구조변환을 유도하거나 역동적인 움직임을 유발할 수 있음.
외부 자극에 의해 시공간적으로 구조 및 거동이 조절 가능한 지능적인 약물 전달체 개발의 필요성이 대두되고 있으며, 다양한 외부 자극 중 주변 pH의 변화를 이용하는 것은 세포 내부로의 물질 유입 과정중의 다양한 메커니즘을 이용할 수 있어 가장 활발하게 이루어지고 있음.
하지만 현재까지 DNA 나노머신을 지능적 약물전달체로서 의학 분야에 응용한 사례는 거의 없음.
따라서 본 연구에서는 지능적인 DNA 나노머신에 의한 유전자 및 광열치료효과를 상승적으로 높여, 앞으로 의약학, 보건의료, 암치료 등에 다양하게 적용하고자 하였음.
2. 연구내용
i-motif DNA가 낮은 pH에서 모양을 변형하여 서로 회합하는 성질에 착안하여, i-motif DNA에 세포사멸을 유도하는 siRNA라는 핵산을 담지하여 금 나노입자의 표면에 붙였다.
금 나노입자는 세포 밖의 중성 pH에서는 siRNA를 담지한 채로 흩어져 있다가, 세포내로 들어가게 되면 서로 조립하면서 siRNA를 전달하면서도 금 나노입자끼리의 결합을 유도하여 금 나노클러스터를 형성하였다.
금 나노입자가 서로 조립하여 클러스터를 형성하게 되면 빛에 의한 광열효과가 상승함을 밝혔다. 또한 금 나노입자의 조립과 동시에 siRNA 전달로 인한 세포사멸의 유도가 증대되어, 광열효과에 의한 항암효과와 상승적으로 작용함을 밝혔다.
3. 기대효과
본 연구에서는 주위의 환경에 따라서 거동을 달리하는 지능적인 나노머신의 개발로 인해, 유전자로 인한 세포사멸의 유도와 빛에 의한 광열치료의 효과를 획기적으로 높여서 앞으로 원하는 시간, 원하는 부위에, 원하는 양의 유전자를 전달할 수 있는 스마트한 유전자 전달 시스템으로의 적용이 가능할 것으로 기대된다.
본 연구는 약물 전달체로서의 DNA 나노머신의 응용연구를 한 단계 진보시키는 역할을 수행하였으며, 이를 바탕으로 앞으로 다양한 응용연구가 지속적으로 이루어질 것으로 기대된다.
본 연구결과는 지능적인 DNA 나노머신에 의한 유전자 및 광열치료효과를 상승적으로 높여, 앞으로 의약학, 보건의료, 암치료 등에 다양하게 적용될 것으로 기대된다.
용 어 설 명
1. DNA 나노머신(DNA nanomachine)
○ 상보적인 핵산끼리의 서열특이적 상호작용에 의하여 자기조립된 나노단위의 구조체로써, 주변 환경(pH, 온도 및 빛)의 변화 및 특이적인 생체물질에 의해 구조변환을 유도하거나 역동적인 움직임을 유발할 수 있다. DNA 나노머신은 분자단위의 센싱, 지능적인 약물 전달 및 프로그램화된 화학 반응 유도 등과 같은 다양한 응용 가능성을 인정받아 활발히 연구되고 있다.
2. 근적외선
○ 햇빛이나 발열체로부터 방출되는 빛을 스펙트럼으로 분산시켰을 때 적색 스펙트럼의 끝보다 바깥쪽에 있는 것이 적외선이며, 이 가운데 파장이 가장 짧은 것이 근적외선이다. 근적외선은 피부 및 조직 투과력이 우수하기 때문에 의료용으로 많이 이용된다.
3. 광열 효과 (Photothermal effect)
○ 빛을 흡수하여 열의 형태로 에너지를 방출하는 효과를 말한다. 금 나노입자, 탄소 기반 나노입자 등이 뛰어난 광열 효과를 가지고 있는 것으로 알려져 있다.
4. I-motif DNA
○ I-motif DNA는 반복된 시토신(cytosine, C)을 지니는 DNA 서열로써, 낮은 pH 하에서 C-C+ 구조를 형성하면서 (그림1)과 같이 독특한 사면체 입체구조를 형성한다.
5. 간섭 RNA (small interfering RNA, siRNA)
○ siRNA는 특정 단백질의 생산을 억제함으로써 유전자 발현을 방해한다. 21~23개의 뉴클레오티드로 구성된 siRNA는 이중가닥 RNA(double-stranded RNA)로서 특정 전령 RNA(mRNA, messenger RNA)의 상보적인 순서에 맞춰 염기쌍을 형성한다. 그 다음 이러한 siRNA는 세포로부터 전령 RNA를 제거함과 동시에 특수하게 분해시킨다.
6. 엔도솜(Endosome)
○ 물질의 세포 내 유입과정에서 형성되는 주머니 모양의 구조물(소포). 세포 내 유입 초기(수분 이내)의 것을 초기 엔도솜, 후기의 것을 후기 엔도솜이라고 한다.
그 림 설 명
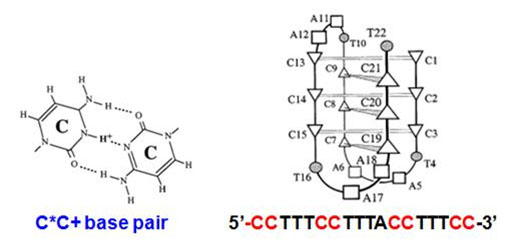
(그림1) 낮은 pH 하에서 생성되는 C-C+ 결합(왼쪽) 및 이에 의해 유도되는 독특한 I-motif DNA 사면체 입체구조(오른쪽).
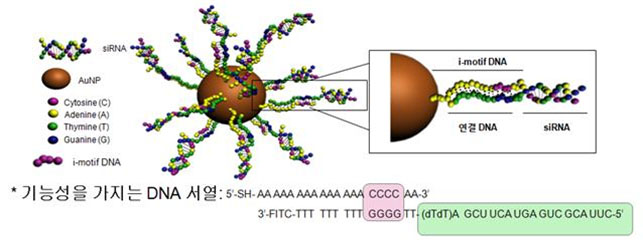
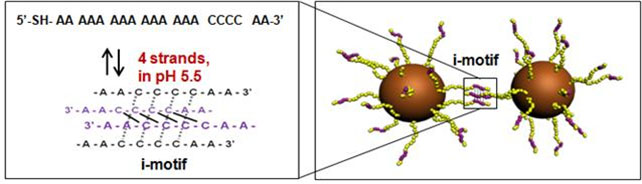
(그림2) pH 에 감응하면서 유전자 치료효과를 지닌 DNA-골드 나노머신의 합리적인 디자인(위쪽). DNA-골드 나노머신은 낮은 pH에 감응하여 입체구조를 형성하는 DNA, 유전자 발현을 억제하는 약물인 siRNA 및 앞의 두 핵산을 연결하는 연결 DNA가 골드나노입자에 연결되어 있다. 이 DNA-골드 나노머신은 낮은 pH하에서 골드 나노입자에 도입된 I-motif DNA 들끼리 서로 상호작용하여 골드집합체를 형성할 수 있다(아래쪽).
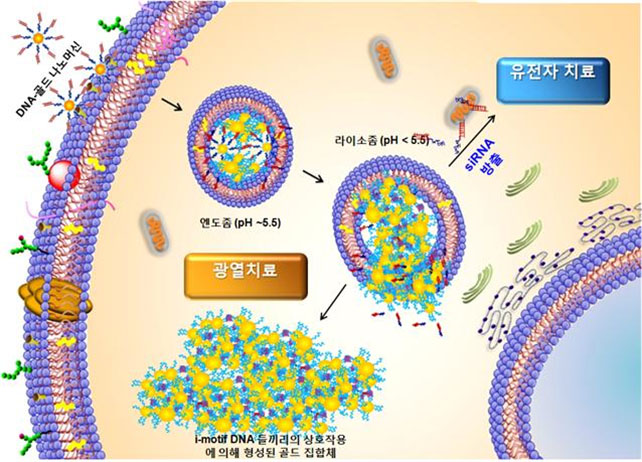
(그림3) i-motif DNA-골드 나노머신의 세포내부로 유입 후 작용 기작.
i-motif DNA는 세포사멸을 유도하는 siRNA를 담지하고 있다가, 낮은 pH에서 금 나노입자의 조립과 동시에 siRNA를 방출하여 유전자에 의한 세포사멸과 금 나노입자의 조립으로 인한 광열치료의 효과를 기대할 수 있다.
i-motif DNA는 세포사멸을 유도하는 siRNA를 담지하고 있다가, 낮은 pH에서 금 나노입자의 조립과 동시에 siRNA를 방출하여 유전자에 의한 세포사멸과 금 나노입자의 조립으로 인한 광열치료의 효과를 기대할 수 있다.
관련정보


 [보도]+지능적+DNA+나노머신으로+항암치료+효율+높여.hwp
[보도]+지능적+DNA+나노머신으로+항암치료+효율+높여.hwp