부처연구성과
암세포에만 결합하는 나노신소재 개발
- 등록일2014-07-10
- 조회수7838
-
성과명
암세포에만 결합하는 나노신소재 개발
-
연구자명
이지원
-
연구기관
고려대학교 화공생명공학과
-
사업명
중견연구자지원사업(도약)과 선도연구센터지원사업
-
지원기관
미래창조과학부
-
보도자료발간일
2014-07-10
- 원문링크
-
키워드
#나노신소재 #나노입자 #암세포
- 첨부파일
핵심내용
- 암세포에 선택적으로 결합할 수 있는 단백질-금 복합 나노입자로 광열치료 효율성 제고 기대 -
□ 단백질로 된 나노입자의 표면 위에 정상세포가 아닌 암세포에만 결합하는 펩타이드*와 금이 결합되어 함께 존재하는 나노신소재가 개발됐다. 암치료 목적으로 이용되는 광열치료**의 효율성과 안전성을 보다 높일 수 있는 실마리가 될 것으로 기대된다.
* 펩타이드 : 아미노산 50개 이하로 구성된 화합물. 아미노산은 단백질의 구성요소이다.
** 광열치료 : 금 나노입자가 근적외선 레이저를 흡수하여 발생하는 열을 이용하여 암 세포를 괴사시키는 암 치료법
o 고려대 이지원 교수와 한국과학기술연구원 김광명 박사가 주도한 이번 연구는 미래창조과학부가 추진하는 중견연구자지원사업(도약)과 선도연구센터지원사업의 지원으로 수행되었고, 첨단재료 분야 국제학술지 어드밴스드 머티리얼스지(Advanced Materials) 7월 8일자에 게재되었다. (논문명 : Proteinticle/Gold Core/Shell Nanoparticles for Targeted Cancer Therapy without Nanotoxicity)
□ 암 부위에 금 나노입자를 전달한 후 레이저를 쬐는 광열치료법의 효과를 높이기 위해 체내 투과율이 높은 근적외선 레이저를 잘 흡수하고 광열효과가 뛰어난 직경 20nm 이상의 금 나노입자를 활용한 연구가 활발하다.
o 하지만 이 정도 크기의 금 나노입자는 체외 배출이 원활하지 않아 잠재적인 위험성이 있다고 보고되고 있으며, 암 부위로의 정확한 전달이 어려워 의료현장에서 적극적으로 활용되지 못하고 있다.
□ 연구팀은 단백질 나노입자 표면에 암세포에 달라붙는 펩타이드와 직경 3nm 이하 초미세 금 나노닷이 동시에 결합되어 존재하는 단백질-금 복합 나노신소재를 개발했다.
o 만들어진 나노신소재는 정상세포가 아닌 암세포에만 결합하고 자발적인 단백질 변성을 통해 해체되어 몸 밖으로 쉽게 배출될 수 있어 보다 효율적이고 안전한 광열치료에 응용될 수 있을 것으로 기대된다.
□ 이 나노신소재를 생쥐의 정맥에 주사한 결과 통상의 금 나노입자에 비해 암 발병부위로의 전달이 훨씬 효과적으로 이뤄졌다.
o 실제 인간 유방암 세포로 종양을 유도한 생쥐에 개발된 나노신소재를 이용, 근적외선 광열치료한 결과 암세포가 괴사되는 것을 확인하였다. 또한 3주간 생쥐의 장기와 조직을 살펴본 결과 금 나노닷이 잔존하지 않음을 확인하였다.
□ 이는 정상세포가 아닌 암세포에만 결합할 수 있도록 인도하는 표적 펩타이드와 체외로 배출되기 쉬운 초미세 금 나노닷을 단백질 나노입자 표면에 동시에 도입한 데 따른 것이다.
o 이 교수는 “개발된 단백질-금 복합 나노신소재로 암 발병 부위로 선택적 전달 효능을 향상시켜 광열치료 효과를 극대화하는 한편 기존 금 나노입자의 체내축적으로 인한 장기/조직 문제를 해결할 수 있는 실마리가 될 것” 이라고 밝혔다.
상세내용
연 구 결 과 개 요
1. 연구배경
암 치료는 외과적 수술에 이은 화학치료요법에 크게 의존하고 있다. 그러나 외과적 수술에 따르는 고통, 화학요법에서 비롯되는 전신성 부작용으로 인해 이들을 대체할 새로운 의학기술의 필요성이 대두되고 있다. 이에 따라 암 발생부위에 선택적으로 금 나노입자를 전달한 후 레이저를 쪼여 발생하는 열로써 암을 치료하는 광열치료법이 새로운 치료기술로 주목받고 있다.
동 연구팀은 기존 연구에서 다양한 기능을 갖는 펩타이드를 단백질 나노입자 표면에 균일하게 고밀도로 표출시킬 수 있는 기술을 발표(2007년 FASEB Journal, 2009년 Nature Nanotechnology, 2013년 ACS Nano)해 왔다.
본 연구에서는 이러한 기술을 이용해 암세포에 선택적 결합을 할 수 있는 펩타이드, 금 이온 환원용 펩타이드를 표출시킨 단백질 나노입자(40nm)를 대장균 세포 내에서 제조한 후, 금 이온 환원과정을 거쳐 직경 3nm 이하의 초미세 금 나노닷을 단백질 나노입자 표면에 형성하였다.
2. 연구내용
대장균 세포 내에서 제조된 단백질 나노입자(40 nm)의 표면에 인간 유방암 세포(MDA MB-468)에서 과량 발현되는 상피성장인자 수용체(Epidermal Growth Factor Receptor, EGFR)에 선택적 결합력을 갖는 펩타이드(EGFR-affibody)와 금 이온 환원용 펩타이드를 표출시켰다.
금 이온 환원용 펩타이드에 금 이온과 환원제(Sodium Borohydride)를 이용하여 체외 배출이 원활한 직경 3 nm 이하의 초미세 금 나노닷 다수가 단백질 나노입자 표면에 형성되면서도, 단백질 나노입자 자체 크기(약 40 nm)에 준하는 금 나노입자와 동일한 광학적 특성을 갖는 단백질-금 복합 나노신소재(Proteinticle/Gold Core/Shell Nano Particle)를 제작하였다.
암세포에 선택적으로 결합할 수 있는 펩타이드(EGFR-affibody)가 존재하는 단백질-금 복합 나노신소재 표면에 형광물질(Cy5.5)을 표지하고 인간 유방암세포(MDA MB-468)와 반응시켰을 때, 암세포가 나타내는 형광을 확인함으로써 펩타이드가 존재할 때 암 세포로의 전달 및 흡수가 촉진됨을 확인하였다.
또한 펩타이드가 존재하는 단백질-금 복합 나노신소재의 촉진된 흡수가 상피성장인자 수용체와의 선택적 결합에 의한 것임을 확인하기 위해서, 암세포 표면을 항-상피성장인자 수용체 항체(Cetuximab)로 포화시켜 선택적 결합을 차단시키고 형광물질이 표지된 단백질-금 복합 나노신소재와 암세포를 반응시켰다. 그 결과, 암세포에서 형광이 나타나지 않음을 통해서 암세포 선택적 펩타이드가 존재하는 단백질-금 복합 나노신소재의 흡수는 수용체와 펩타이드 사이의 선택적 결합에 의한 것임을 확인하였다.
암 세포 선택적 결합 펩타이드가 표출 유무에 따른 두 종류의 단백질-금 복합 나노신소재를 인간 유방암 세포를 발생시킨 실험용 쥐의 정맥에 각각 주입한 후, 시간에 따른 추이를 관찰한 결과 암세포 선택적 결합 펩타이드가 표출된 단백질-금 복합 나노신소재를 주입한 실험용 쥐에서 암 발병 부위로의 선택적 전달이 월등함을 확인할 수 있었다.
암 세포에 근적외선 레이저를 50분간 쬐어준 뒤, 암 세포의 조직 분석과 함께 5일간 암세포 크기의 변화를 관찰하였다. 그 결과 단백질-금 복합 나노신소재를 주입한 쥐는 광열치료로 인한 암세포 괴사가 일어남을 조직 분석을 통해 확인할 수 있었으며, 암 치료 후 5일 뒤 암세포가 사라짐을 확인할 수 있었다.
단백질-금 복합 나노신소재의 장기 및 조직 축적에 의한 나노독성을 확인하기 위하여 기존에 활용되던 금 나노입자와 단백질-금 복합 나노신소재를 각각 실험용 쥐에 주입한 후, 21일 동안 해부학적 방법으로 장기의 변화를 관찰하였다. 또한 암시야 현미경(Dark-Field Microscope)을 통한 금의 산란을 통해 조직 내 축적된 정도를 확인하였다.
그 결과, 금 나노입자를 주입한 실험용 쥐에서는 21일 동안 꾸준히 장기에서 심각한 나노독성을 나타내며 암시야 현미경을 통한 관찰에서 많은 금의 산란이 관찰되었으나, 단백질-금 복합 나노신소재가 주입된 실험용 쥐에서는 장기의 변화가 나타나지 않고, 암시야 현미경을 통한 관찰에서도 금 산란이 거의 일어나지 않음을 알 수 있었다. 금 나노입자의 체외 배출과 관련된 추가적인 보완 실험을 통해서, 이는 단백질-금 복합 나노신소재의 경우, 체내에서 자발적인 단백질 변성과정을 거치면서 개별적인 초미세 금 나노닷으로 해체된 후, 몸 밖으로 쉽게 배출되었기 때문인 것으로 추정된다.
3. 기대효과
기존 암치료 방법이 갖는 수술에 따른 고통, 화학요법에서 비롯된 전신성 부작용을 극복하고, 치료 부위를 암 세포로 한정할 수 있는 개선된 암 치료 기술로서 주목 받아온 광열치료가 실제 암 치료 기술로 적용되기 힘들었던 한계를 극복하기 위한 실마리가 될 것으로 기대된다.
즉 기존 광열치료에 주로 활용되던 일정 크기 이상의 금 나노입자가 체내 주입 이후 체외로의 배출이 원활하지 않아 야기할 수 있는 나노독성과 암 발병 부위로의 낮은 전달 등으로 인해 광열효과가 미흡한 문제점을 극복하기 위해 새로운 광열치료용 신소재로서 단백질-금 복합 나노신소재를 개발함으로써 외과적인 수술을 거치지 않고도 획기적인 효능의 암 치료가 가능할 뿐만 아니라 치료 후 체내 축적에 의한 독성문제가 해결됨으로써 향후 나노독성 부작용 없는 안전한 암 치료가 가능해질 전망이다.
연 구 결 과 문 답
|
이번 성과 뭐가 다른가 |
|
암세포 표적 펩타이드를 포함하는 단백질-금 복합 나노신소재를 활용, 암 부위로의 전달효율을 높여 치료효능을 극대화할 뿐만 아니라 금 나노입자의 체내축적으로 인한 나노독성 문제 해결의 실마리 마련 |
|
|
|
|
|
어디에 쓸 수 있나 |
|
유방암, 피부암 등 근적외선 레이저가 원활이 투과될 수 있는 모든 종류의 암에 활용 가능할 것으로 기대 |
|
|
|
|
|
실용화까지 필요한 시간은 |
|
전임상 및 임상시험에 소요되는 시간 |
|
|
|
|
|
실용화를 위한 과제는 |
|
전임상 및 임상시험 진행 |
|
|
|
|
|
연구를 시작한 계기는 |
|
기존 암 치료기술의 한계 극복 |
|
|
|
|
|
꼭 이루고 싶은 목표는 |
|
단백질-금 복합 나노 신소재를 활용한 암 치료기술의 실용화 |
|
|
|
|
|
신진연구자를 위한 한마디 |
|
포기하지 않는 집요함과 끈기 |
용 어 설 명
1. 어드밴스드 머티리얼스지(Advanced Materials)지
○ 독일 Wiley-VCH 출판사가 매주 발행하는 첨단 재료과학 분야 국제학술지
2. 펩타이드(peptide)
○ 아미노산 간의 펩타이드 결합으로 연결된 고분자 화합물을 단백질로 총칭하는데, 상대적으로 적은 수(일반적으로 50개 이하)의 아미노산을 포함하는 화합물을 구분하여 펩타이드라 부른다.
3. 나노입자(Nanoparticles)
○ 나노크기(100nm 이하)의 입자형태 물질로 금속 나노입자 등을 포함한 무기 나노입자, 고분자 나노입자 등을 포함하는 유기 나노입자, 단백질 나노입자를 포함하는 바이오 나노입자로 분류됨
4. 금 나노닷(Gold Nanodot)
○ 단백질 나노입자 표면에 표출된 직경 3nm 이하의 초미세 금 나노입자
5. 항체(antibody)
○ 바이러스, 세균 등 항원을 비활성화시키고 이들에 대항하여 세포의 외부 자극을 유도하기 위해 만들어지는 물질. 특정 항원에 의해 만들어진 항체는 특정 항원에 대해서만 특이적으로 항원항체반응을 일으킨다.
6. 유방암 세포에 대한 선택적 결합 펩타이드(EGFR-affibody)
○ 인간 유방암 세포는 빠른 분열과 전이를 위해 세포 표면에 정상세포에 비해 월등히 많은 EGFR(상피성장인자 수용체, epidermal growth factor receptor)이 만들어 진다.
○ 이 EGFR에 선택적으로 결합할 수 있는 펩타이드인 affibody에 의해 유방암 세포로의 선택적 전달이 가능해진다. Affibody는 기존 항체보다 작지만 더 강한 항원과의 결합력을 갖는 펩타이드이다.
그 림 설 명
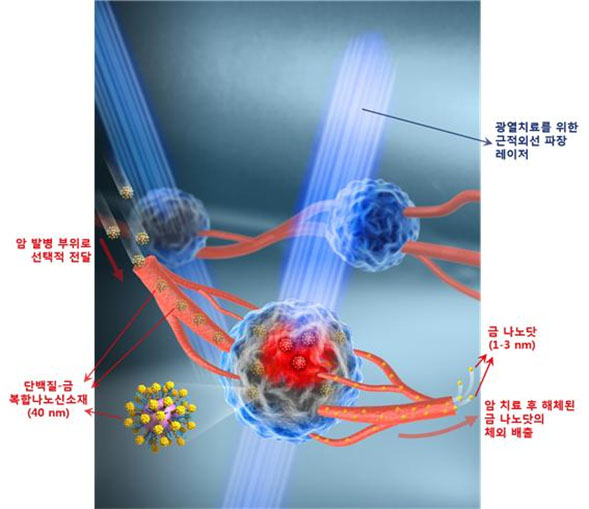
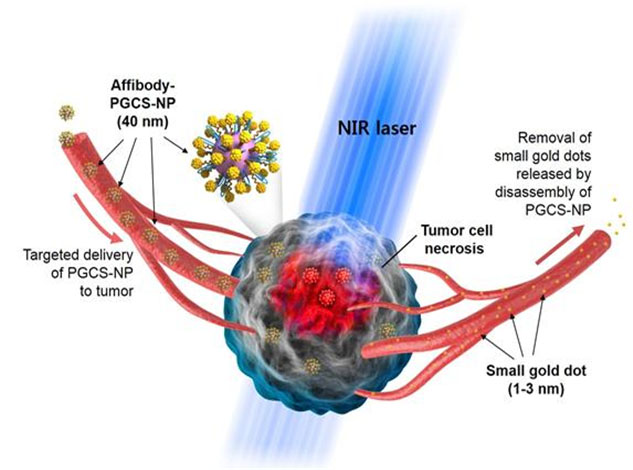
그림 1. 암 발병 부위로의 선택적 전달과 광열치료, 그 이후 금 나노닷의 체외 배출로 이어지는 단백질-금 복합 나노신소재의 작용 모식도

그림 2. 단백질-금 복합 나노신소재의 투과전자현미경 사진 및 모식도
단백질 나노입자 표면에 암세포에 선택적으로 결합할 수 있는 펩타이드(파란색)와 3nm 이하의 초미세 금 나노닷(노란색) 다수가 형성된 단백질-금 복합 나노신소재의 투과전자현미경(TEM) 사진과 모식도
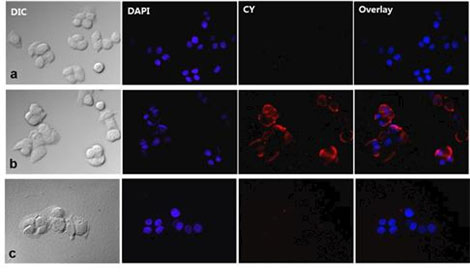
그림 3. 단백질-금 복합 나노신소재의 암세포와의 선택적 결합 및 흡수
암세포 선택적 결합 펩타이드가 없는 단백질-금 복합 나노 신소재(a)와 달리 표면에 펩타이드가 존재하는 단백질-금 복합 나노 신소재(b)만 암세포에 흡수되어 형광(붉은색, CY)이 관찰되었다. 나아가 펩타이드가 있는 단백질-금 복합 나노 신소재를 처리하더라도 항체로 암세포 표면의 결합 수용체를 포화시킨 경우(c)에는 형광이 관찰되지 않는 것을 통해 암세포의 흡수가 펩타이드와 결합 수용체의 선택적 결합에 의한 것임을 확인하였다.

그림 4. 단백질-금 복합 나노 신소재의 암 발병부위로의 전달 효능
암세포 선택적 결합 펩타이드가 없는 단백질-금 복합 나노신소재(위)와 암세포 선택적 결합 펩타이드를 갖는 단백질-금 복합 나노신소재(아래)에 각각 형광물질을 달아 실험용 쥐의 정맥에 주입한 뒤 시간에 따른 암 발병 부위로의 선택적 전달효능을 비교한 결과 펩타이드를 갖는 쥐에서 모든 시간대에 높은 형광(붉은색)이 나타나는 것을 볼 수 있다.

그림 5. 광열치료를 통한 암세포 괴사
생쥐의 암 발병부위에 근적외선 레이저를 50분간 쬐는 광열치료를 수행하고 5일 뒤 암세포의 상태를 확인한 결과 단백질-금 복합 나노 신소재를 주입한 실험용 쥐(C)에서만 암세포 괴사가 일어난 것을 확인할 수 있다.
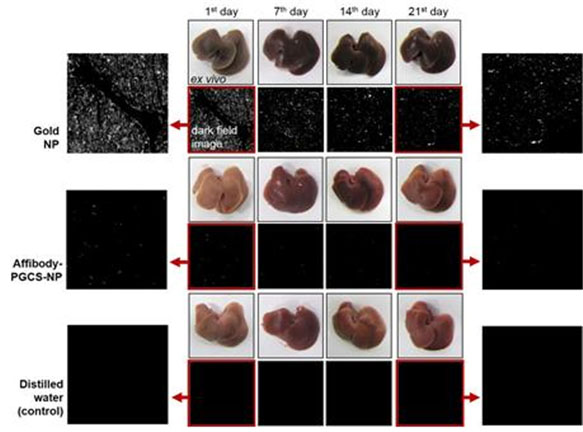
그림 6. 일반 금 나노입자와 단백질-금 복합 나노신소재에 의한 간 손상 및 금 축적 분석 결과
금 나노입자(위), 단백질-금 복합 나노 신소재(가운데) 및 대조군인 정제수(아래)를 각각 실험용 쥐의 정맥에 주사한 후 체내 장기(간)의 변화를 관찰해 보았다. 그 결과 21일 동안 나노독성에 의한 심각한 장기 손상을 보이며 암시야 현미경 상에서 강한 산란을 나타내는 금 나노입자와 달리 단백질-금 복합 나노 신소재의 경우 장기 손상 없이 금 축적에 의한 산란 현상이 1일 이후에는 전혀 확인되지 않았다.
* 왼쪽과 오른쪽 그림은 정맥 주사 후 1일째와 21일째에 암시야 현미경을 통해 장기(간)에 있는 금의 양을 확인한 사진을 확대한 것이다.
지식


 [보도]+암세포에만+결합하는+나노신소재+개발.hwp
[보도]+암세포에만+결합하는+나노신소재+개발.hwp