제도동향
국내 개발 재조합 탄저백신, 임상2상시험 승인
- 등록일2011-08-22
- 조회수9582
- 분류제도동향 > 종합 > 종합
-
자료발간일
2011-08-18
-
출처
보건복지부
- 원문링크
-
키워드
#재조합 탄저백신
- 첨부파일
국내 개발 재조합 탄저백신, 임상2상시험 승인
- 질병관리본부와 (주)녹십자 공동개발, 2013년 개발완료 예정 -
□ 질병관리본부(본부장 전병율)는 자체개발한 재조합 탄저백신의 임상2상 시험 계획을 8월 11일 식품의약품안전청으로부터 승인받았다고 밝혔다.
□ 탄저는 사람 및 가축에게 전염되고 높은 사망률을 나타내는 인수 공통 전염병으로 생물테러나 실제 전투상황에서 생물무기로 탄저균이 악용될 가능성이 높아 이에 대한 국가적 대비가 시급한 상황이다.
□ 질병관리본부 국립보건연구원 감염병센터에서는 1997년 탄저백신에 관한 연구를 시작하여 1998년 백신후보 물질 및 생산균주를 자체개발해 특허를 취득한 바 있으며 2002년부터 (주)녹십자를 통해 학술용역사업으로 생산공정개발 및 비임상시험 등 제품화연구를 수행하였고 2009년 6월 임상1상 시험을 완료한 바 있다.
○ 개발된 탄저백신은 탄저균의 중요한 백신성분인 방어항원(Protective Antigen)을 주성분으로 한 유전자 재조합백신으로 기존 탄저백신의 부작용 등 문제점을 해결한 백신이며, 대량생산 효과가 뛰어난 비병원성균주인 바실러스 브레비스를 발현시스템으로 사용함에 따라 안전성이 확보되고 경제성도 뛰어날 것으로 예상되고 있다.
□ 임상시험 후 제품 승인이 완료되면 유사시를 대비한 탄저백신의 생산 및 비축이 가능할 것으로 기대된다.
<붙임 1> 탄저 및 생물테러 이용사례
□ 탄저
○ 탄저란 탄저균에 의해 사람 및 가축에 발생하는 인수공통질환으로 탄저포자를 흡입하거나(호흡기탄저), 감염된 동물이나 그 동물의 부산물에 피부가 노출되었을 때(피부탄저), 오염된 고기를 먹었을 경우(위장관탄저) 감염되며 감염경로에 따라 치사율에 다소 차이가 있다.
○ 상처난 피부를 통해 감염되는 피부탄저의 경우 항생제 투여로 쉽게 치료가 가능하나 호흡기탄저의 경우는 치사율이 매우 높으며 발병 시 조기에 치료하지 않으면 치명률은 80%에 이른다. 탄저포자에 노출된 사람의 발병억제를 위해 시플로프록사신과 같은 항생제를 60일 이상 장기 투여해야 함에 따라 사전예방이 중요한 질병이다.
□ 생물테러 이용사례
○ 탄저균은 열악한 환경에서 포자를 형성하여 장기간 생존이 가능하고 미사일 등에 탑재해 공기 중 살포가 용이한 특징으로 인해 생물학 무기로 개발되어 테러에 이용될 수 있는 대표적인 생물테러 병원체이다.
○ 특히 탄저균은 2001년 9.11테러 이후 미국 전역에 우편물을 통한 생물테러에 사용되어 22명이 감염되었고 이중 5명이 사망하여 사회적 혼란을 야기한 바 있다.
<붙임 2> 탄저백신 개발현황
□ 질병관리본부 유전자 재조합 탄저백신의 특성
○ 질병관리본부 재조합 탄저백신은 바실러스 브레비스(Bacillus brevis)를 발현시스템으로 사용하여, 탄저균에 감염된 사람이나 동물에서 효과적인 방어효과를 보이는 방어항원을 주성분으로 하여 개발되었다.
○ 국립보건연구원에서는 1997년부터 탄저균 방어항원을 이용한 탄저백신개발 연구를 시작하여 1998년 방어항원 생산균주를 자체 개발하였고 방어항원의 분리·정제법을 확립하고 마우스, 기니픽, 토끼 등의 실험동물에서 면역효능을 확인하였다.
○ 2002년 이후 현재까지 학술용역사업을 통해 (주)녹십자와 공동으로 백신성분의 대량생산공정을 확립하였고, 대동물(토끼, 원숭이)을 이용한 독성·약리시험 등 일련의 개발과정과 2009년 6월 임상1상 시험을 완료하였으며, 이번 임상2상 시험계획 승인에 따라 임상 2상 시험을 진행할 예정이다.
○ 이와 관련된 국내특허 2건을 등록하였으며, 국제특허 1건도 출원중이다.
○ 탄저백신의 장점
- 본 탄저백신은 비병원성균주인 바실러스 브레비스를 사용함에 따라 안전성이 확보되었으며 생산량을 극대화할 수 있는 최적의 발현시스템으로 경제성이 우수할 것으로 기대된다. 특히 미국(BioThrax) 및 영국(AVP)에서 허가된 기존의 사람 탄저백신에 비하여 불필요한 독소성분이 포함되지 않고 방어항원만을 순수 정제하여 이용함으로써 안전성이 향상되었다.
○ 탄저백신 개발 추진현황
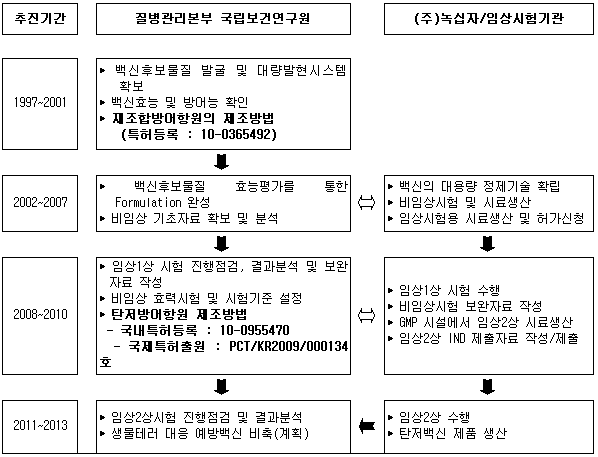
□ 국외 현황
○ 탄저백신은 미국의 경우 1960년 초부터 실험실 종사자 등 고위험군 종사자에 접종되었으며, 1998년 5월 걸프전 발발과 함께 생화학전 가능성이 높아짐에 따라, 전 미군에 대한 BioThrax 탄저백신 접종프로그램이 시작되었다.
○ 현재 미국 및 영국에서 허가된 기존의 사람 탄저백신은 독소는 분비하나 협막은 생성하지 않는 비병원성 탄저균의 배양액을 알럼젤(aluminum hydroxide gel) 등으로 흡착하여 제조하고 있으며, 방어항원을 주성분으로 하나 제조조건에 따라 치사인자, 부종인자 등 기능이 확인되지 않은 성분이 미량 포함되어 통증이나 부작용의 원인이 되는 것으로 알려져 있다.
○ 미국백신의 경우 18개월에 걸쳐 총 5회(0, 4주, 6, 12, 18개월)의 면역을 실시하며 매년 재접종이 필요한 단점이 있다.
○ 미국에서는 2001년 10월 탄저포자의 우편물 테러사건 후에 안전성이 향상된 대민접종용 탄저백신의 필요성이 대두됨에 따라 재조합방어항원을 이용한 사람 면역용 차세대 탄저백신개발 및 비축 프로그램이 진행 중이다.
-
이전글
- 국내 유통 인체조직 92%가 뼈, 피부
-
다음글
- 2011 바이오안전성백서


 국내_개발_재조합탄저백신,_임상2상시험_승인.hwp
국내_개발_재조합탄저백신,_임상2상시험_승인.hwp