Free 라디칼과 산화적 스트레스, 그리고 식품의 항산화 효과에 대한 연구는 많이 진행되어 있으며, 이로써 항산화물질의 이로움이 알려졌다. 하지만, 최근 많은 연구자들은 산화적 스트레스의 기전을 이해하려고 노력하면서도, 항산화물질의 중요성에 의문을 제기하고 있다. 많은 과학자들은 섭취 항산화물질의 양에 관계없이 흡수되는 것은 매우 제한적이며, 어떤 경우에는 prooxidant가 인체 건강에 유익하다고 한다. 항산화물질의 활성을 확인하고, 항산화 효과를 갖는 물질을 찾아내는 시험법이 많지만, 각각 장단점이 있다. 지난 몇 십 년 동안 항산화물질의 생체 내 유익에 대한 논쟁은 커져 왔다. 이 리뷰에서는 항산화물질, prooxi-dants의 잠재적 유익과 인체에 미치는 영향에 대해 다루어 연구의 방향을 제시하고, 항산화물질의 작용 기전과 검출 방법론을 살펴보았다. 또한 항산화물질의 한계와 이 분야의 미래 경향에 대한 전망을 알아본다.
본 자료는 A review on antioxidants prooxidants and related controversy: Natural and synthetic compounds, screening and analysis methodologies and future perspectives. Food Chem Toxicol. 2013; 51(1): 15-25 의 논문을 한글로 번역, 요약한 자료입니다.
목차
1. 배경
1.1 Free 라디칼과 산화적 스트레스
1.1.1 Free 라디칼과 산화적 스트레스의 기전
1.1.2 산화적 스트레스의 영향
1.2 항산화 물질과 prooxidants
1.2.1 천연 항산화 물질
1.2.2 합성 항산화 물질
1.2.3 Prooxidants
2. 항산화 활성 스크리닝 및 항산화 물질 분석 방법
2.1 항산화 활성 스크리닝 기법
2.2 항산화 물질 분석
3. 항산화 물질과 prooxidants의 한계와 논란
3.1 논란
3.2 한계
4. 전망
1. 배경
1.1 Free 라디칼과 산화적 스트레스
우리 몸의 세포와 세포 소기관에서 일어나는 생화학적 반응은 생명을 유지할 수 있는 원동력이다. 낮은 출산률과 증가하는 기대수명으로 인해 가까운 미래에는 세계 인구의 상당수를 노인이 차지하게 될 것이다. 노년기에는 심혈관계 질환, 뇌질환과 면역 질환이 많이 발생하는데, 이는 곧 많은 사회적 비용을 의미한다. 질병으로부터 노인들의 고통을 줄이고 그에 따라 소모될 사회적 비용을 줄이기 위해 위와 같은 만성질환의 증가를 통제하는 것이 중요한데, free 라디칼, 항산화물질, 그리고 보조인자는 노화를 지연시킬 수 있는 주 요인들로, 이들이 인체에서 유발하는 반응에 대한 이해는 위 질병들뿐만 아니라 다른 질병들의 발생을 줄이거나 예방하여 더 나은 질의 삶을 사는데 도움이 될 것이다.
1.1.1 Free 라디칼과 산화적 스트레스의 기전
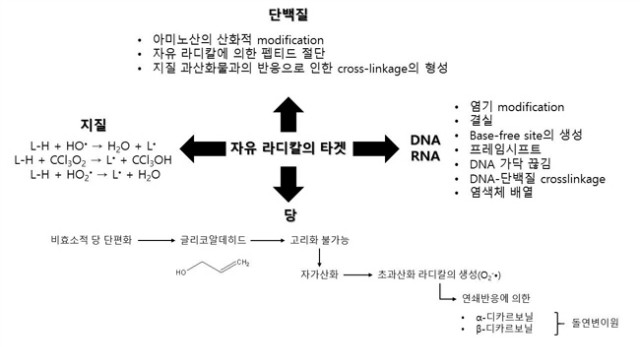
Free 라디칼은 원자, 분자 혹은 이온이 홀전자(unpaired electron)와 함께 있는 것으로, 매우 불안정하고 다른 분자와의 반응성이 크다. Free 라디칼은 산소, 질소, 황에서 얻어지며, 각각 ROS(Reactive Oxygen Species, 활성산소종), RNS(Reactive Nitrogen Species, 활성질소종), RSS(Reactive Sulfur Species)를 생성한다. ROS는 과산화물음이온(superoxide anion, O2-?), hydroperoxy radical(HO2?), 히드록실라디칼(hydroxyl radical, ?OH), 일산화질소(NO), 그리고 과산화수소(H2O2), 일중항 산소(1O2), 차아염소산(HOCl), peroxynitrite(ONOO-)와 같은 종들을 포함한다. RNS는 O2-?가 NO와 반응하여 얻어지며 ONOO-를 형성한다. RSS는 ROS가 티올(thiol)과 반응하여 형성된다. ROS를 생성하는 반응은 그림 1에서 볼 수 있다. HO2?은 pH 7에서 해리되어 O2-?을 형성한다. O2-?은 반응성이 매우 커서 다른 많은 분자들과 반응하여 직접 ROS를 생성하거나, 효소 혹은 금속촉매 반응을 통해 ROS를 생성한다. Superoxide 이온은 SOD(superoxide dismutase)에 의한 dismutation 반응을 통해 과산화수소가 되고, 최종적으로 CAT(catalase)에 의해 물로 바뀌며 무독화 될 수 있다. 만약 과산화수소가 Fe2+ 같은 금속 촉매와 반응하면 fenton reaction이 일어나서, HO?을 형성한다. RNS인 ONOO-는 NO? + O2-? 반응에 의해 형성된다. 마지막으로 RSS는 산화력이 있는 조건에서 thiol이 disulfide로 되고, disulfide가 더 산화되면 중간산물로 disulfide-S-monoxide 혹은 disulfide-S-dioxide이 만들어진다. 마지막으로 환원된 thiol과의 반응은 설펜산(sulfenic acid) 혹은 설핀산(sulfinic acid)을 형성한다.

그림 1. ROS 생성 반응의 개요
1.1.2 산화적 스트레스의 영향
내적으로 free 라디칼은 크산틴 산화효소, 퍼옥시좀, 염증반응, 식세포작용, 아라키돈산 경로, 국소빈혈(ischemia), 운동을 통해 일어나는 미토콘드리아 대사의 정상적인 요소로 생성된다. free 라디칼의 형성을 촉진하는 외적 요인에는 흡연, 환경오염물질, 방사선, 약, 살충제, 공업용 용제, 오존이 있다. ROS의 생성과 항산화 물질에 의한 중화 사이의 균형은 매우 섬세해서 만약 ROS가 과하게 생기는 경향이 있으면 세포는 산화적 스트레스를 받게 된다. 사람의 세포는 매일 HO?과 그 외의 다른 활성 물질에 의해 10만 회 가량 산화 스트레스를 받는 것으로 알려져 있다. ROS, RNS, RSS의 주 타겟은 단백질, DNA, RNA, 당, 지질이다 (그림 2). 단백질은 산화로 변형되는 3가지(특정 아미노산 잔기의 modification, free 라디칼에 의한 펩티드 절단, 지질 과산화물과의 반응으로 인한 단백질의 cross-linkage 형성) 방식이 있다. Free 라디칼에 의한 DNA 손상은 base-free site의 생성, 결실, 모든 염기의 modification, 프레임시프트(frame shift), DNA 가닥 끊김, DNA-단백질 cross-linkage, 염색체 배열과 같이 구조적으로나 화학적으로 특징적인 형태의 변형을 보인다. DNA 손상과 관련된 중요한 반응은 fenton reaction을 통해 HO?이 생성되는 반응이다. HO?는 DNA를 구성하는 퓨린과 피리미딘 염기, phosphate backbone과 반응한다. Peroxyl 라디칼과 OH-라디칼은 DNA 산화에도 관여한다. 당의 산화 스트레스에서는 당화반응(glycation)에서 형성되는 oxygen free radical이 영향을 미친다.
그림 2. Free 라디칼의 타깃
비효소적 글리코실화(glycosylation) 반응 단계에서 단편화된 당은 짧은 사슬을 갖는 글리코알데히드(glycoaldehyde)를 형성하는데, 글리코알데히드의 사슬은 고리화(cyclize)되기에 너무 짧아 자가산화(autooxidation) 되거나 O2-?을 형성하게 된다. 이 라디칼에 의한 연쇄반응은 돌연변이원으로 잘 알려진 α-, β-디카보닐(dicarbonyl)을 형성한다. 지질 과산화는 메틸렌 탄소로부터 수소원자를 끊는 라디칼의 지방산 side chain 공격에 의해 시작된다. 지방산에 이중결합이 많이 존재할수록 수소 원자를 제거하기 쉬워서 라디칼을 쉽게 형성하기 때문에, 다가불포화지방산(polyunsaturated fatty acid, PUFA)보다는 포화지방산(saturated fatty acid, SFA)이나 단불포화지방산(monounsaturated fatty acid, MUFA)이 라디칼에 더 저항성을 보인다. 수소 제거 뒤, carbon centered 지질 라디칼은 분자 재배치가 이루어 질 수 있고, 산소와 반응하여 HO2?를 형성할 수 있다. 이 반응성 높은 물질은 주변 분자로부터 수소 원자를 분리할 수 있고, 지질과산화의 연쇄반응을 유도한다. HO?은 지질과산화의 중요한 라디칼로, fenton reaction의 결과물로 만들어 진다. HO?은 다음처럼 작용한다.
L-H + HO? → H2O + L? (L-H : 지질, L? : 지질 라디칼)
Trichloromethyl 라디칼(CCL3O2?)은 사염화 탄소와 산소가 반응하여 형성되고 다음 방식으로 지질을 공격한다.
L-H + CCl3O2 → L? + CCl3OH
다가불포화지방산은 HO2?에 의해 다음 작용으로 손상을 입는다.
L-H + HO2? → L? + H2O
마지막으로, 지질 과산화물을 만드는 또 다른 방법은 1O2이 다가불포화지방산이나 그 곁사슬을 공격하는 것이다. 이 방식은 1O2이 직접 지방산과 반응을 하는 것으로, HO?에 의한 반응에 비해 덜 중요한 것으로 여겨진다. free 라디칼들이 주변 분자들과 반응하는 기전은 환원성 라디칼과 산화성 라디칼(a), 수소 분리(b), 첨가반응(c), self-annihilation 반응(d), disproportionation(e)과 같이 여러 가지가 있다.
|
(a) HO? + RS- → OH- + RS
(b) CCl3? + RH → CHCl3 + R?
(c) CCl3? + CH2=CH2 → CH2(CCl3)-CH2
(d) CCl3? + CCl3? → C2Cl6
(e) CH3CH2? + CH3CH2? → CH2=CH2 + CH3-CH3 |
이 반응들은 암, 심혈관계 질환, 신경장애, 신장 장애, 간 장애 등을 포함한 많은 심각한 질병과 관련되어 있는 ROS, RNS, RSS의 생성을 유도한다.
1.2. 항산화 물질과 prooxidants
1.2.1 천연 항산화 물질
Halliwell and Gutteridge는 항산화 물질을 ‘산화 가능한 기질 보다 낮은 농도로 존재하며, 기질의 산화를 지연시키거나 억제하는 물질’로 정의 하였다가, 나중에 ‘타겟 분자에 대한 산화적 손상을 억제 또는 예방하거나 지연시키는 물질’로 다시 정의 하였다. 같은 해에 Khlebnikov 등은 ‘ROS를 직접 감소시키거나, 간접적으로 항산화 방어 작용을 up-regulation, 혹은 ROS 생성을 저해하는 물질’이라고 정의하였다. 항산화 물질의 또 다른 특징은 라디칼을 저해 한 뒤, 분자 내 수소 결합이나 산화를 통해 안정된 형태의 라디칼을 형성하는 것이다. 항산화 작용은 자유 지질 라디칼을 저해함으로 free 라디칼의 산화반응을 저해하거나, 자가산화(autooxidation) 연쇄반응의 저해, 1O2 quencher, 다른 항산화 물질과의 공동작용, 히드로과산화물(hydroperoxide)를 안정한 물질로 변환시키는 환원제, 금속 킬레이터, pro-oxidative 효소의 저해제로 작용하는 등 다양한 방식으로 효과를 보인다. 사람의 항산화 체계는 효소적 항산화와 비효소적 항산화로 구성된다(그림 3). 효소적 항산화는 다시 1차, 2차 효소적 방어로 나뉘고, 1차 효소적 방어는 free 라디칼을 예방하거나 중화시키는 글루타티온 과산화효소(glutathione peroxidase), CAT, SOD 효소 3가지로 구성된다. 2차 효소적 방어는 글루타티온 환원효소(glutathione reductase)와 포도당-6-인산탈수효소(glucose-6-phosphate dehydrogenase)를 포함한다. 글루타티온 환원효소는 GSH(글루타티온)를 감소시키고, 포도당-6-인산은 NADPH를 재생하여 환원가능한 환경을 만들어 준다. 이 두 효소는 free 라디칼을 직접 중화시키진 않지만 다른 endogenous한 항산화 물질의 역할을 돕는다. 비효소적 endogenous 항산화 물질에는 비타민A, 효소보조인자 Q10, 질소 화합물 요산, 그리고 펩티드 GSH 등이 있다. 비타민A(레티놀)는 β-카로틴의 분해산물로 간에서 생성되며 피부, 눈, 장기에 좋은 영향을 미치는 것으로 알려져 있다. 비타민A는 지질 과산화가 전파되기 전에 peroxyl 라디칼과 먼저 결합하여 항산화 효과를 나타낸다. 조효소 Q10은 모든 세포에 존재하고, 세포 호흡을 비롯한 세포 내 대사에서 중요한 역할을 하고, 지질 peroxyl 라디칼의 형성을 방지하고 중화하는 역할도 한다. Q10은 또한 비타민 E를 재생시키는 작용을 하는데, 어떤 저자들은 비타민 C를 통해 비타민 E를 재생하는 것 보다 이 과정이 더 잘 일어난다고 주장한다. 요산은 퓨린 염기 대사의 최종산물로 헤모글로빈과 과산화물(peroxide)이 반응하여 형성되는 oxo-hem oxidant의 과생성을 막는 것으로 알려져 있다. 또한 과산화에 의한 적혈구의 융해를 막고, 1O2과 HO?의 좋은 저해제로 알려져 있다. GSH는 수소 원자를 주거나 전자를 주어서 라디칼에 의한 세포의 손상을 막고, 아스코르브산과 같은 다른 항산화물질의 재생에 중요한 역할을 한다. Endogenous 항산화 시스템의 탁월한 효과에도 불구하고 이 것만으로는 충분치 않아서, free 라디칼을 낮은 농도로 만들기 위해 사람들은 음식에 존재하는 다양한 타입의 항산화물질을 이용한다.

그림 3. 천연 항산화 물질의 분류
아스코르브산은 항산화 작용을 보이는 L-아스코르브산과 L-디히드로아스코르브산(dehydro- ascorbic acid)을 포함하고, 위장을 통해 체내로 흡수되거나 생체에서 효소적으로 교환된다. 아스코르브산은 O2-?, H2O2, OH?, 1O2, 반응성 산화질소(nitrogen oxide)를 scavenging하는데 효과적이다.
비타민 E는 4개의 토코페롤류(α, β, γ, δ)와 4개의 토코트리에놀류(α, β, γ, δ), 총 8개의 iso-form으로 구성되며, α-토코페롤은 생물계에 있는 isoform중 가장 많이 존재하고, 가장 강력한 물질이다. 토코페롤의 chroman head group이 항산화 활성을 보이며, phytyl tail은 항산화 효과와는 무관하다. 비타민 E는 자신의 phenolic 수소를 peroxyl 라디칼에 주어서 반응성없고, 연쇄적 산화 반응을 일으킬 수 없는 tocopheroxyl 라디칼을 만들어 지질 과산화를 중단시킨다. 비타민 E는 혈장, 적혈구, 조직에서 발견되는 연쇄적 산화반응을 중지시키는 유일한 지용성 물질로, 지질 막의 손상을 방지한다.
비타민C와 E는 tocopheroxyl 라디칼과 그 중간체 형태를 이용해 비타민 E를 재생하는데 시너지 효과를 보여, 항산화 효과를 회복시키는 역할도 한다.
비타민K는 지용성 물질로 단백질에 붙어있는 글루타메이트를 γ-카르복실글루타메이트로 posttranslational 변환에 필수적이다. 비타민K의 1,4-napthoquinone구조가 항산화 작용에 기여하고, 천연 isoform으로는 K1과 K2이 있다.
플라보노이드(flavonoids)는 플라보놀(flavonols), 플라바놀(flavanols), 안토시아닌(anthocya- ninnns), 이소플라보노이드(isoflavonoids), 플라바논(flavanones), 플라본(flavones)으로 이루어진 항산화 물질들의 그룹으로, 모든 물질들은 diphenyl-propane(C6C3C6) 사슬을 갖는다. 플라바논과 플라본은 보통 같은 열매에서 발견되며, 특정 효소에 의해 관련되어 있다. 반면 플라본은 플라보놀과 공유점이 없으며 함께 발견되는 경우가 거의 없다. 안토시아닌 또한 플라보논이 풍부한 식물에는 존재하지 않는다. 플라보노이드의 항산화 특성은 고리구조에 붙어 있는 phenolic hydroxyl group에 기인하며, 환원제, 수소 기여자, 1O2 quencher, superoxide radical scavenger, 금속 킬레이터로 작용할 수 있다. 또한 항산화 효소를 활성화 시키고, α-토코페롤 라디칼(tocopheroxyls)을 감소시키고, 산화효소를 저해하고, nitrosative 스트레스를 완화하고, 요산의 농도를 증가시킨다. 플라보노이드에서 가장 잘 알려진 물질들은 카테킨(catechin), 카테킨 몰식자산염(catechin-gallate), 퀘르세틴(quercetin), 켐페롤(kaempferol)이다.
종종 식물에서 에스터나 글리코시드 형태로 발견되는 페놀산은 식물 어디에나 존재하며 히드록시신남산(hydroxycinnamic acid)과 히드록시벤조산(hydroxybenzoic acid)으로 구성된다. 페놀산은 킬레이터로도 작용하고, OH?, peroxyl 라디칼, O2-?, ONOO-에 대한 scavanger로도 작용하여 항산화 효과를 보인다. 히드록시벤조산군에서 가장 연구가 많이 되었고 강력한 효과를 보이는 물질은 탄닌의 전구체인 갈산(gallic acid)이다.
카로티노이드는 식물이나 미생물에 의해 합성되는 천연색소로, 두 개 그룹으로 분류 가능하다. 첫 번째 그룹은 리코펜(lycopene)과 β-카로틴(β-carotene)을 포함하는 카로티노이드 탄화수소 그룹이고, 두 번째 그룹은 크산토필(xanthophyl), 루테인(lutein)을 포함하는 산소화된 카로티노이드 (oxygenated carotenoid)그룹이다. 카로티노이드에 의한 항산화 작용은 카로티노이드의 이중결합 때문에 나타나며, 1O2 quenching을 통해 에너지를 얻은 카로티노이드는 용매와의 rotational, vibrational 상호작용을 통해 원래 상태로 돌아오고, 회복된 카로티노이드는 다른 라디칼을 다시 quenching 한다. 카로티노이드 색소를 파괴할 수 있는 유일한 라디칼은 peroxyl 라디칼이다. 카로티노이드는 상대적으로 반응성이 크지 않지만, 라디칼의 반응성을 감소시키고 비라디칼 화합물을 만들어 free 라디칼의 공격 반응을 종결시킨다.
미네랄은 동물에 소량 존재하고, 음식물을 통해 얻는 항산화 물질 중에서 적은 비율을 차지한다. 항산화 작용과 관련하여 가장 중요한 미네랄은 셀레늄과 아연이다. 셀레늄은 체내에 무기물(selenite)과 유기물(selenocysteine, selenomethionine)의 형태 모두로 존재하고, 직접 free 라디칼에 작용하지는 않지만, 많은 항산화 효소(metalloenzymes, glutathione peroxidase, thioredoxin reductase)에 없어서는 안 되는 물질이다.
아연도 셀레늄과 마찬가지로 free 라디칼을 직접 공격하지는 않지만, 라디칼 형성을 방지하는데 중요한 역할을 한다. 아연은 산소로부터 oxygen singlet 라디칼 형성을 촉매하는 NAPDH 산화효소의 저해제이다. 아연은 SOD효소에 존재하고, SOD가 일중항산소를 과산화수소로 전환하는데 도움을 준다. 아연은 OH?의 scavenger인 metallothionein의 생성을 유도하고, 세포벽에 결합하기 위해 구리와 경쟁하여 OH?의 형성을 감소시킨다.
??1.2.2 합성 항산화물질
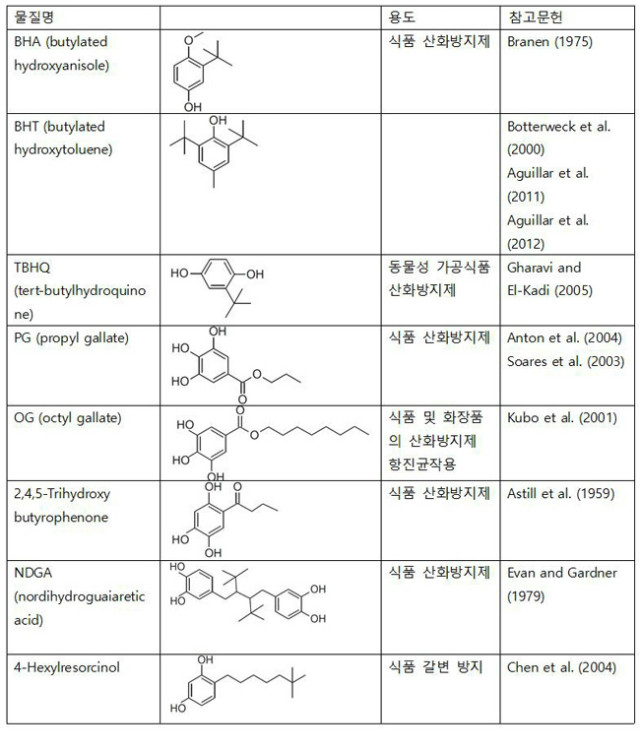
천연 항산화 물질의 항산화 효과를 표준물질과 비교하거나 식품에 첨가하기 위해 합성 항산화물질이 개발되었다. 합성 항산화물질은 식품에 첨가되어 유통기한을 늘려주며 또한 다양한 처리공정에서 보호작용을 한다. 표 1에는 가장 중요하고 널리 사용되는 합성 항산화물질 및 그 쓰임새가 정리되어 있는데, 합성 항산화물질의 주 목적은 식품, 특히 지방산의 산화방지다. 현재 대부분의 가공식품은 안전하다고 알려진 합성 항산화물질을 포함하고 있지만 반대되는 연구결과도 있다.
BHT(butylated hydroxytoluene)과 BHA(butylated hydroxyanisole)은 가장 많이 사용되는 화학적 항산화물질이다. 2011년과 2012년 사이, 유럽식품안전청은 이 두 항산화물질에 대한 모순되는 데이터를 포함, 기존 문헌을 전면 재검토했다. EFSA는 일일 허용섭취량(ADIs)을 재검토하여 BHT는 0.25 mg/kg bw/day로, BHA는 1.0 mg/kg bw/day로 정하고, 성인 및 아동의 노출량은 이 양을 넘지 않을 것이라 발표했다. TBHQ(tert-butyl hydroquinone)은 신선함, 영양가, 맛, 동물성 식품의 색을 유지하게 한다. 2004년에 EFSA는 이 항산화물질이 인체에 미치는 영향에 관한 과학적 의견서를 발행하였는데, 이전의 모순되는 자료에도 불구, 발암성에 대한 과학적 증거가 없다고 서술하였다. EFSA는TBHQ가 개에서 민감성이 가장 높았고 ADI는 0-0.7 mg/kg bw/day로 정했다. Octyl gallate는 식물에서 발견되고, 섭취 후 gallic acid와 octanol로 가수분해되기 때문에 인체에 해롭지 않고 안전한 식품첨가물로 생각된다. NDGA(Nordihydroguaiaretic acid)는 식품 항산화물질이지만 설치류에서 낭성 신장질환을 일으킨다고 알려졌다.
1.2.3 Prooxidants
항산화물질이 대사과정에서 중요한 역할을 하고 세포를 보호한다는 것은 확실하지만, 최근의 모순되는 연구들이 제시되면서 학계에 항산화물질과 prooxidant의 기전에 대한 심도 있는 연구가 필요하게 되었다. prooxidants는 산화적 손상을 유발하는 화학물질을 말하는데, 보통 활성물질을 생성하거나 항산화 시스템을 저해하여 산화적 손상을 유발한다. 놀랍게도 항산화물질도 prooxidants와 같은 영향을 미칠 수 있다.
비타민 C는 강력한 항산화물질로 알려져있고 다양한 생리 작용에 관여하지만 비타민C 또한 prooxidants로 작용할 수 있다. 비타민 C가 철이나 구리와 결합하여 Fe3+를 Fe2+(또는 Cu3+를 Cu2+로)로 환원시키면서 과산화수소를 히드록실라디칼(hydroxyl radical)로 산화시킬 때에는 prooxidants로 작용한다.
α-토코페롤도 유용하고 강력한 항산화물질로 알려져 있지만 높은 농도에서는 항산화 기전에 의해 prooxidants로 작용할 수 있다. α-토코페롤이 free 라디칼과 작용하면 그 자체도 라디칼로 변하는데, 이 때 아스코르브산이 충분치 않으면 α-토코페롤은 반응성이 강한 상태로 존재하여 리놀레산의 자가산화를 촉진하게 된다.
표 1. 주요 합성 항산화물질의 화학 구조 및 용도
증거는 많지 않지만, 카로티노이드 또한 prooxidants로 작용할 수 있다. 특히 산소를 생성하는 히드록실라디칼이 고농도 존재 시 자가산화를 통해 prooxidants 작용을 한다. 플라보노이드도 prooxidants로 작용할 수 있는데, 주변 환경에 따라 다르게 작용한다. 식이성 phenolic 또한 산화환원 금속 존재 시 prooxidants로 작용한다. O2 및 철, 구리와 같은 전이금속은 phenolics의 산화환원 반응을 촉진하여 ROS 생성과 페녹실(phenoxyl) 라디칼을 형성하기도 한다. 이것은 DNA, 지질 및 다른 생체분자물질을 손상시킨다.
Yordi 등은 항산화물질로 여겨지나 특정 조건에서 prooxidants와 유사하게 작용하는 14개의 페놀산을 제시하였다.
2. 항산화 활성 스크리닝 및 항산화물질 분석 방법
2.1 항산화 활성 스크리닝 기법
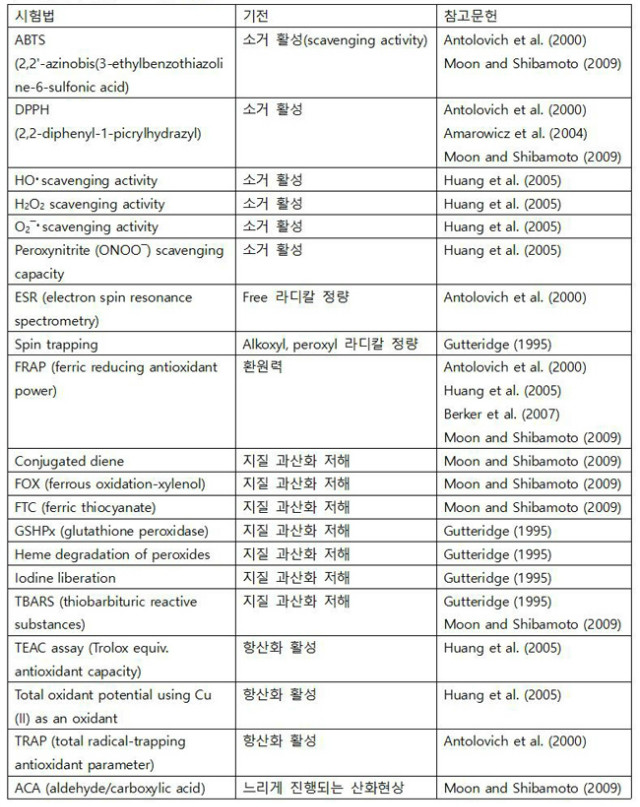
현재까지 기질 내 특정 분자를 측정하는 다양한 항산화 활성 측정 방법이 개발되었고 각 각 장단점이 존재한다. 한 가지 실험법만으로 명백한 결과를 얻을 수는 없기 때문에, 최선의 방법은 다양한 시험법을 사용하는 것이다. 어떤 과정은 합성 항산화물질이나 free 라디칼을 사용하고, 어떤 방법은 지질 과산화에 적용되며 동물이나 식물 세포에서 진행된다. 어떤 것은 더 넓은 범위에 사용되며, 어떤 것은 최소한의 전처리와 지식, 몇 가지의 시약이 필요하며 시간이 얼마 걸리지 않는다. 표 2에는 식품 중 합성 물질이나 천연기질의 항산화 활성을 평가하는 시험법 중 가장 중요하고 널리 쓰이는 방법들이 정리되어 있다.
ABTS(2,2'-azinobis(3-ethylbenzothiazoline-6-sulfonic acid) 시험법은 ABTS 라이칼이 항산화물질(카로티노이드, phenolic 물질 등) 존재 시 발색력을 잃는 원리를 활용한 비색법(colorimetric assay)이다. DPPH(2,2-diphenyl-1-picrylhydrazyl)은 수소 주개(hydrogen donor)가 항산화물질이라는 것을 전제로 한다. 이 방법은 DPPH 라디칼을 사용하는데, 항산화물질 존재 시 자주색에서 노란색으로 변한다. 이것은 예비연구 시 널리 사용되고 있다. HO? 소거활성법에서, 히드록실라디칼(hydroxyl radical)은 p-hydroxy-benzoic acid의 수산화(hydroxylation)에 의하여 간접적으로 확인된다. 플루오레세인(Fluorescein, FL)을 표지자로 사용하여, 항산화물질 존재 및 비 존재 시의 형광감쇠곡선을 측정한다. 곡선하 면적(Area Under Curve, AUC)을 구한 후, 공시료 값을 제거하여 순 AUC를 구한다.
H2O2 소거활성법에서는 horseradish peroxidases가 스코폴레틴(scopoletin)을 산화하여 형광을 띠지 않는 물질로 바꾸며, 항산화물질로 이 반응이 저해되는 것을 측정한다. 이것은 다양한 경로로 저해될 수 있어 결과 해석이 모호하다. O2-? 소거활성법은 효소성 항산화물질에 최적화되어 있으며 사이토크롬 C(표지)와 O2-? 소거제(시료)이 경쟁적으로 O2-?를 환원하는 원리를 사용한다. ONOO? 및 ONOOH는 방향족 화합물, 특히 타이로신의 히드록실화나 니트로화를 일으킨다. 생리학적 조건에서, peroxynitrite는 또한 체액 내의 CO2와 adduct를 형성한다. 이러한 adduct는 단백질 손상을 일으킬 수 있다고 알려져 있다. ONOO?를 측정하기 위한 두 방법으로 타이로신 니트로화의 저해와 dihydrorhodamine 123 산화를 저해하는 것이 있다. ESR(전자스핀공명 분석, Electron Spin Resonance Spectrometry) 방법은 자가산화반응과 연관된 free 라디칼을 특이적으로 측정할 수 있는 유일한 방법이다. Spin trap으로 안정한 나이트록시드(nitroxide)를 형성하는데 이것을 전자스핀공명으로 분석한다. 이 방법은 in vivo에서 활용 가능하다는 장점이 있다. FRAP (ferric reducing antioxidant power) 방법은 원래 혈장 시료에 사용하였으나 현재는 방대한 시료에 일반적으로 사용되고 있다. 환원력을 가지는 물질에 의하여 Fe3+가 Fe2+로 환원되어 노란색에서 파란색으로 바뀌는데, 이것을 분광광도계(spectrophotometer)로 측정하여 분석한다. 지질과산화는 공액 이중결합(conjugated diene)을 측정하여 검출한다. 이 공액 이중결합은 이중결합 2개가 단일 메틸렌기로 분리되어있는 것을 말한다(C=C-C=C). 이것은 주로 다가불포화지방산에서 ROS 및 산소의 영향으로 나타난다. 공액 이중결합은 약 234 nm에서 흡광도를 측정하는데, 일반적인 생체물질이나 천연물질의 흡광도도 같은 범위에서 측정되기 때문에 결과에 영향을 미칠 수 있다는 것이 이 시험법의 주요 문제점이다. FOX(ferrous oxidation-xylenol) 시험법에서는 Fe2+가 산화제(hydroperoxide)에 의하여 산화되어 청자색 물질이 생성되며, 흡광도를 분광광도계로 측정한다. FTC(ferric thiocyanate) 시험법은 FOX 시험법과 매우 유사하며, Fe3+가 thiocyanate 복합체를 형성하여 500 nm에서 분광광도계로 흡광도를 측정한다는 차이만 있다.
표 2. 항산화 활성 스크리닝 기법
GSHPx(glutathione peroxidase) 시험법으로 지질 과산화를 측정하는데 측정 전에 반드시 phospholipase를 이용하여 막으로부터 분리해야 한다. 그 후 GSHPx와 H2O2의 반응으로 GSH(glutahione)을 GSSG(산화된 glutathione)으로 산화시킨다. 마지막으로 glutathione reductase와 NADPH를 첨가하여 GSSG를 GSH로 환원시키는데 이때 NADPH가 소비되고 이를 통하여 과산화물의 양을 측정한다.
과산화물로 인한 heme 분해는 단백질의 heme 부분이 과산화지질을 분해시키는데 이때 활성화된 대사체가 나와 isoluminol과 반응하여 이것이 빛을 발생시킨다. 요오드 또한 과산화지질에 의하여 I?에서 I2로 산화되는데 이것을 thiosulfate로 적정하여 과산화지질을 측정하는 데 사용될 수 있다. 이것은 다른 산화제가 없을 때에는 생체 시료에도 적용할 수 있다. 널리 사용되는 TBARS(thiobarbituric acid reactive substances) 시험법은 간단하고 비특이적이지만 정확한 실험통제가 필요하다. 시료를 thiobarbituric acid(TBA)와 섞으면 분홍빛의 발색체를 형성하는데 이것은 532 nm에서 흡광도로 측정하거나 553 nm에서 형광으로 측정할 수 있다.
Trolox equivalnt antioxidant capacity(TEAC) 시험법은 radical ABTS-?을 사용하는데 이것은 처리 시 흑청색을 띤다. 이것을 에탄올에 희석하여 734 nm에서의 흡광도가 0.7이 되게 한다. 1 mL의 용액을 시료와 섞어서 특정한 간격을 두고 흡광도를 측정한다. 1 mM Trolox와 같은 ABTS-?의 흡광도값의 백분율 변화를 일으키는 항산화제의 농도를 TEAC라고 한다. Cu(Ⅱ) 또한 항산화 효과를 평가할 때 산화제로 쓰일 수 있지만, 많이 쓰이지는 않는다. 이 방법은 Cu(Ⅱ)가 시료 내의 항산화물질에 의하여 Cu(Ⅰ)으로 환원되는 원리를 이용한다. 그 다음 bathocuproine(2,9-dimethyl-4,7-diphenyl- 1,10-phenanthroline)이 Cu(Ⅰ)과 복합체를 형성하여 490 nm에서 최고 흡광도를 나타낸다. Total radical-trapping antioxidant parameter(TRAP) 시험법은 총 항산화능을 측정하기 위하여 사용되는데, AAPH(2,2'-azobis(2-amidinopropane)hydrochloride)의 열분해로 인한 지질 산화 작용에서의 산소 소모량을 통해 총 항산화능을 측정한다. ACA(aldehyde/carboxylic acid) 시험법은 천천히 산화되는 현상에서 (저장 식품) 사용되며 활성 라디칼 존재 시 alkylaldehyde를 alkylcarboxylic acid로 전환한다.
2.2 항산화 물질 분석
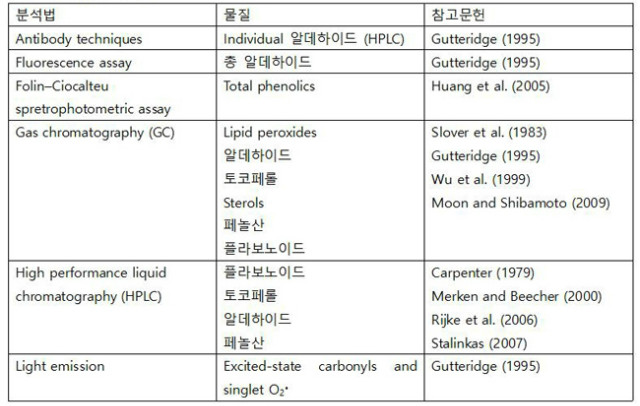
일부 시험법은 복잡한 기질 내 특정 물질의 정확한 양을 측정한다. 이러한 시험법은 HPLC, GC나 Mass Spectrometry (MS) 및 다른 고가의 장비를 사용하여 특정 항산화물질을 검출한다. 이러한 시험법은 다소 긴 시간이 소요되며 깊이 있는 지식이 요구된다. 표 3은 이러한 시험법과 그 시험법으로 검출할 수 있는 물질들을 나타내었다.
항체법(antibody technique)은 지질 과산화 생성물로 인하여 변형된 단백질을 검출하는 데 사용된다: 예를 들어, 불포화 알데하이드와 반응하여 변형된 단백질을 검출할 수 있다. 형광법(Fluorescence assay)은 아미노기가 없을 때 알데하이드가 중합되면 형광물질을 형성하는 원리를 이용한다. Folin-Ciocalteu는 용액 중 모든 환원성 물질과 반응한다. Folin-Ciocalteu 시약은 텅스텐과 몰리브덴(molybdenum)의 혼합물로 황색을 띤다. 염기조건에서 이 시약은 용액 내 모든 항산화물질과 반응하여 청색으로 변하며, 이것을 분광광도계 spectrophotometer를 사용하여 측정한다. Folin-Ciocalteu 시약은 모든 환원성 물질과 반응하기 때문에 민감성이 매우 높지는 않으며 예비연구에 사용된다. GC(가스 크로마토그래피)는 다양한 기질 내 특정 항산화물질의 정확한 양을 측정하고 분리하는 데 사용된다. 이것은 토코페롤부터 페놀산 및 많은 수의 다양한 물질을 측정할 수 있다. HPLC(고성능 액체 크로마토그래피)는 GC처럼 다양한 검출기와 결합되어 특정 항산화 물질을 검출할 수 있는 가장 강력한 기구 중 하나이다. 이것들은 상당한 투자와 지식을 필요로 하지만 또한 가장 정확한 분리 및 정량을 가능하게 한다.
발광(light emission)은 peroxyl 라디칼과 반응하는 들뜬 상태의 carbonyl과 일중항산소(바닥상태로 붕괴 시 빛을 발함)를 이용한 화학발광(chemoluminescence)을 사용하여 ROS를 검출하는 데 사용될 수 있다. 이 방법의 단점은 다른 곳에서 발생한 빛이 영향을 줄 수 있다는 것이다.
표 3. 주요 항산화물질 분석법
3. 항산화물질과 prooxidants의 한계와 논란
3.1 논란
최근 항산화물질과 prooxidants이 광범위하게 연구되고 있는데, 대부분의 식이성 항산화물질은 prooxidant로 작용하는 듯 하며 물질의 농도와 주변 물질의 성질에 따라 달라진다. 식이성 항산화물질을 둘러싼 이러한 논란은 항산화 및 prooxidant 능력이 다양한 요인에 의해 결정되기 때문에 일어난 것이다. 몇 천개의 수많은 연구에서 항산화물질의 유익한 효과를 제시하지만, 또 다른 사람들은 반대 작용을 말한다. Gilgun-Sherki 등은 항산화물질의 신경변성질환에의 영향에 대한 다양하며 상충되는 연구 결과들을 발표하였다. Halliwell은 prooxidant의 영향도 유익할 수 있다고 가정하였는데, 가벼운 정도의 산화적 스트레스는 항산화 방어력과 외인성물질 대사 효소 수준을 증가시켜 결과적으로 세포 보호작용으로 이어질 수 있기 때문이다. Prochazkova 등은 prooxidant가 생존에 반드시 필요한 세포 신호전달 특성을 가지고 있어, prooxidant가 유익할 수도 있다고 가정하였다. 다른 저자들은 플라보노이드의 prooxidant 영향이 특정 종류의 암을 완화할 수 있다는 것을 보여주었다.
앞에서 서술하였듯이, 항산화물질에 관련한 연구는 기하급수적으로 늘어났지만, 이 물질들이 실제 영향을 발휘하기 전에 아직 고려해야 할 제한들이 있다. Heim 등에 따르면 네덜란드에서는 플라보노이드류를 매일 23 mg 정도 섭취한다. 이것은 꽤 많은 양이지만, 혈류에 존재하는 플라보노이드의 양은 그닥 높지 않다. 플라보노이드 대부분은 O-glycosides의 형태로 식품에 존재하며, glycosidic unit 중 포도당(glucose)이 가장 많이 존재하며 그 다음으로는 glucorhamnose와 갈락토오스 순으로 존재한다. 분자크기 때문에 플라보노이드류는 장표피를 통해 흡수되기 전에 더 작고, 낮은 분자량의 물질로 대사되어야 한다. 플라보노이드류는 상피층을 통과하기 위하여 O-메틸화, 히드록실화, 헤테로고리 절단, 탈당질화(deglycolisation) 및 중합(polymeric) 물질의 절단을 거쳐 단량체가 된다. Lotito 및 Frei은 플라보노이드 대사에 관한 연구 검토 후 혈장 내 높은 항산화 활성과 플라보노이드가 풍부한 식품의 섭취를 연결 지으며 플라보노이드가 고도로 대사되기 때문에 그 자체로 이러한 증가를 유도하진 않았을 것이라고 판단했다. 그 대신 간접적인 항산화 활성으로 생각되는 요산 수치를 올렸을 것이라고 주장했다. 안토시아닌 또한 당과 결합하여 흡수가 어렵다. 소화기에서 흡수가 더 잘 되게 하기 위하여, 안토시아닌 아글리콘이나 페놀산으로 가수분해되어야 한다. 이러한 연구에도, McDougall 등은 위장관 유사 조건에서 대부분의 안토시아닌은 소장조건에서 불안정했고, 생물학적 활성은 미확인된 분해 생성물로 인한 것일 것이라고 추측했다.
3.2 한계
항산화물질은 혈액-뇌 장벽 때문에 충분한 신경보호작용을 하는 데 실패한 듯 하다. Halliwell은 항산화물질에 대한 것이 모두 밝혀지기까지 아직 갈 길이 멀다고 말한다. 또한 실험용 쥐는 식이성 항산화물질에 대하여 사람보다 민감하기 때문에, 임상시험이 시작되면 이 점을 분명히 염두에 둬야 한다고 말한다. 항산화물질 연구의 또 다른 한계점은 세포 배양에서 시간이 지남에 따라 변하고 in vitro로 측정되는 항산화물질이 매우 빠르게 배양액과 반응하거나 중화된다는 점이다. 따라서 잘못된 결과가 나올 수 있으나 peer-review 시 보통 간과된다. 식품의 항산화능에서의 또 다른 중요한 한계점은 위에서 언급했듯이 같은 변수를 측정하는 데 다양하고 방대한 시험법이 있다는 것이다. 일부 항산화 시험법은 한계점을 가지고 있고 혼선이 있는데 이 때문에 서로 다른 방법과 연구자들의 결과를 비교하는 데 어려움을 준다. 이 점은 끝없는 다양한 혼합물과 함께 심각한 문제를 야기하여 학계의 연구가 진일보하지 못하게 한다. 따라서 현존하는 항산화 시험법을 더 자세히 살펴 시험법을 개선하고, 몇 가지 통일된 시험법을 의무화하여 기질 간 및 실험 결과 간 비교를 가능하게 해야 한다. Frankel과 Meyer는 항산화능을 평가할 때 간과하지 않고 확실히 답해야 하는 다섯 가지 질문을 제시하였다: (1) 항산화물질의 진정한 보호작용은 무엇인가? 항산화물질은 무엇으로부터 보호하는 것인가? (2) 어떠한 기질이 산화되며 어떠한 결과물이 저해되는 것인가? (3) 이러한 시스템에서 항산화물질 위치는 어디인가? (4) 상호작용하는 다른 물질의 영향은 어떤 것이 있는가? (5) 어떤 조건이 실생활 적용 시와 상응하는가? 이러한 질문에 먼저 답을 해보면 모순된 결과를 점차 좁혀나갈 수 있을 것이다.
4. 전망
지난 세기에 항산화물질과 그의 건강영향에 대한 많은 연구가 진행되지만, 대부분의 기질에 대하여 일관성있고 확실하게 항산화능을 평가하기 위한 표준화된 과정이 부족했다. 이제까지 발표된 결과는 모순된 것이 많으며 서로 비교하기 힘들었다. 또한 항산화물질의 한계와 대사는 이 분야에서 여전히 넘어야 할 산으로 남아있어, 연구자들은 이 문제점들을 반드시 해결해야 한다.
항산화물질을 사용한 새로운 치료 경향 중에는 염증 및 재관류와 관련된 급성 및 만성 통증을 경감하기 위해 SOD 효소 유사작용을 하는 물질도 있다. 또 다른 유망한 연구분야는 유전학으로, 특정 물질을 많은 양을 생산하여 더 큰 항산화 작용이 가능한 유전자 변형 식물을 키우는 것을 목표로 한다. Suntres은 리포솜 항산화제가 미래 항산화물질 연구에 중요한 역할을 할 것이라고 제시하였다. 또한 리포솜 항산화제가 질병 예방 및 치료 효과를 낼 뿐 아니라 특정 지역에 항산화물질을 운반하는 것을 용이하게 할 것이라고 말했다.
Bouayed와 Bohn은 산화작용과 항산화작용의 균형이 건강한 생체시스템(biologic system)을 유지하기 위해 중요하다고 말한다. 낮은 용량의 항산화물질은 생체시스템에 이롭겠지만, 과도한 용량은 균형을 깨뜨릴 수 있다.
결론적으로 항산화물질이 건강에 영향을 주지만, 복용방법(식품 vs 보충제) 및 양은 논란이 될 수 있다. in vitro에서의 강력한 효과를 보인 항산화물질이 in vivo에서 효과가 없을 수도 있다는 사실은 앞으로의 연구를 막는 것이 아니라 자극이 되어야 한다.
항산화물질이 유익하며 인체 항상성 유지에 유용한 역할을 한다는 것은 맞지만, prooxidant도 마찬가지이다; 학계는 암, 신경퇴행성질환, 심혈관계 질환 극복을 위해 항산화물질의 최적 농도와 원하는 기능을 유도하기 위하여 항산화물질의 동역학(kinetics)과 in vivo 기전을 더 심도 있게 연구해야 한다.




 pdf_0002363.pdf
pdf_0002363.pdf