기술동향
동물대체시험법 개발로서의 인공조직 및 인공기관모델
- 등록일2015-08-13
- 조회수14875
- 분류기술동향
-
자료발간일
2015-07-21
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#동물대체시험법#인공조직#인공기관#동물실험#실험동물대체
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
동물대체시험법 개발로서의 인공조직 및 인공기관모델
저자 : 표경호 (서울대학교)
요약문
인간에게 있어 동물은 아낌없이 주는 나무이다. 인생의 반려자로서, 혹은 가축들은 우리에게 식량을 공급하여 주고, 인간의 수명을 증진시키기 위하여 실험동물로서도 희생되고 있다. 가축이 아닌 도구로서의 동물로 인식하고 있는 비윤리적 행동을 경계하는 동물보호단체와 시민들에 의하여 동물보호구호를 외치게 되었으며, 이는 개인이나 단체를 초월하여 국제적으로 움직임이 커지고 있다. 직접적인 예시를 들면, 동물실험을 통해 만들어진 화장품에 대한 불매운동 등이 이에 속한다. 이러한 움직임은 많은 것을 바꾸어 놓았다. 국가차원에서는 동물보호법이 개정 및 시행하고 있고, 동물실험은 윤리적인 틀 안에서 단계적인 심사에 의하여 수행하게 되었다. 이러한 규제와 보호 등에 대한 안전장치가 있다고 하지만, 결국 인간들에게 필요한 신약의 개발을 위해 실험동물의 사용은 점차적으로 증가하고 있으며, 이러한 과정 속에서 실험동물은 목적이나 수단에 더욱 가까운 존재가 되고 있다.
실험동물은 심지어는 유전적인 변이를 통해 새로운 생명체로 창조되기도 한다. 특정 유전자의 삽입 혹은 결실을 유도하기도 하고, 인간에 존재하는 유전자를 발현시키기도 한다. 신약에 대한 타깃 검증 등 다양한 부분에 적용되고 있다. 타깃유전자 발굴에 대한 신약개발과, 다양한 생물학적 제제에 대한 독성 등이 검증되면서 인간의 수명은 증가됨에 반하여, 실험동물로 희생되는 수는 점차 증가하고 있다. 실험동물의 수가 감소되지 않는 가장 결정적인 원인은 바로 동물실험을 대체할 수 있는 방법이 제한적이기 때문이다. 뿐만 아니라, 실험동물을 대체할 수 있는 방법이 존재한다고 하더라도, 마우스 한 마리보다 더 비싼 비용을 지불하고 실험을 할 수 있는 여건이 되지 않으면 이를 이용하기가 힘들며, in vitro 실험의 단점을 보완하기 위한 in vivo 시스템을 완벽하게 모사할 수 없기 때문이라는 시각 또한 큰 원인이다. 만약 실험동물의 생리학적인 현상을 세포나 조직 단위에서 생물학적인 현상을 설명할 수 있다면, 세포와 조직단위 이상의 기관단위를 실험관에서 배양하고 이를 활용할 수 있다면, 동물을 대체할 수 있는 다양한 방법 등이 개발될 것이라 확신한다. 그 결과, 많은 실험동물의 수를 감소시킬 수 있을 것이다. 본 동향에서는 실험동물 대체법으로서의 다양한 조직 및 기관배양 방법과 이를 활용할 수 있는 기술을 소개한다.
목차
아낌없이 주는 ‘동물’
2.2 세포주를 이용한 광독성실험
광독성 실험은 화학물질이 인체에 적용된 이후에 빛에 의하여 유도되었을 때 나타나는 독성 반응을 확인하기 위한 실험으로, 일반적으로 빛에 의하여 나타나는 광반응이 독성을 일으킬 수 있는 형태로 변형되어, 광유전독성, 광알러지, 광발암성 물질로 변형되는 것을 확인하기 위한 실험이다. 기존의 방법은 동물에 이를 처리하고, 화학물질의 흡광계수가 가장 높은 준위에서 빛에 노출을 지속적으로 수행하고 그 결과를 확인하였다면, 대체법의 경우에는 실험용 마우스 (BALB/c)유래 세포주인 NIH3T3 세포를 이용하여 실험을 한다. 이 세포를 96 well plate에 단층배양을 하고, 시험물질을 다양한 농도로 1시간 동안 처리한다. 이후 이 세포들에게 자외선이나 흡광도가 높은 빛에 노출을 한 뒤, neutral red의 흡수 정도를 통해 세포의 생존율을 검사를 한다. 광독성 실험은 OECD의 가이드 라인으로 인증되고 있는 방법으로 3T3 Neutral Red Uptake (3T3-NRU) 방법에 대한 가이드 라인 (OECD test 101)은 다음의 사이트에 자세히 설명되어 있다 (http://ntp.niehs.nih.gov/iccvam/ suppdocs/feddocs/oecd/oecdtg432-508.pdf).
2.3 세포주를 이용한 유전독성실험법
유전독성실험은 현재 in vitro를 이용한 실험과 실험동물을 이용하는 방법 등을 모두 활용하고 있다. 복귀돌연변이시험법은 박테리아를, 체외 염색체이상시험 또는 체외 마우스림포마TK 시험법은 사람 또는 포유동물의 계대배양 세포를 이용하고 있다. 하지만 체내 소핵 실험의 경우에는 현재까지도 동물을 사용하고 있는데, 암컷과 수컷을 각각 사용하여 적혈구의 미성숙 적혈구의 비율을 확인하는데, 확인한다. 최근에는 이를 대체할 수 있는 세포주를 이용한 실험방법이 개발되고 있다.
2.4 그 밖의 대체실험법
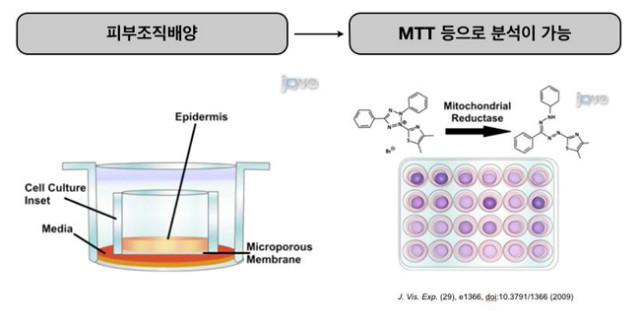
경피흡수성, 투과성 시험방법의 경우에는 피부를 대체할 수 있는 3차원 배양된 피부세포를 이용하는 방법을 적용한다. 대사법의 경우에도 최근 CYP 발현세포를 3차원 배양시스템을 적용하여 활용하고 있다.
위와 같은 실험방법들은 실제로 동물실험을 대체하기 위한 방법으로, 이용되고 있으며, 이 밖에도 다양한 실험방법들이 구상되어 이용되고 있다.
3. In vivo에 가까운 In vitro 실험이 필요하다
동물실험을 하는 궁극적인 목적은, ‘인간의 시스템과 좀 더 가깝다’ 라는 의미가 있다. 심장이 뛰고 있는 동물에서의 검증이 객관적이다라고 하는 생각을 가지고 있기 때문이다. 여기에서 ‘가깝다’라는 의미는 인체유래세포주보다도 이종이지만 한 개체에서의 결과가 좀 더 믿음직스럽다 라는 인식이 저변에 있다. 하지만 조직배양이 가능하다면 조직단위에서 볼 수 있는 생물학적인 현상이 대변해 줄 수 있는 결과들은 좀 더 많은 정보와 의미를 보여줄 수 있다. 예를 들어, 피부조직을 인공적으로 만들어 낼 수 있다면 동물실험을 통해 볼 수 있는 화장품 실험의 다양한 독성연구들을 일부 대변해 줄 수 있다. 혹시 좀더 발전하여 조직에서 ‘기관 (organ)’ 수준이라면 어떠한가? 간과 신장을 인공적으로 만들어 낼 수 있다면 독성연구를 위하여 희생되는 동물의 수가 감소될 수 있다. 동물실험에 있어서 생물학적인 영향을 ‘조직’ 혹은 ‘기관’ 단위에서 볼 수 있다면, 이를 대체할 수 있는 방법은 무궁무진할 것이다.
앞서 설명한 발전된 형태의 배양방법 중 일부는 실제로 실험동물 대체실험방법으로 적용되고 있다. 특히, 피부에 관련된 대체법으로 조직배양 방법과 실험법이 우리나라를 비롯한 선진국에서 적용되고 있다. 그 방법들은 뒤에서 소개하겠지만, 조직 및 기관배양은 기존에 사용되는 평판배양법의 경우와 비교하여 볼 때 차이가 분명히 존재한다. 3차 구조의 미세환경은 세포와 세포간의 의사소통을 수행하고, 분화와 성장을 조절한다. 2차 배양과 3차 배양에 대한 또 다른 차이점은 유전자의 발현 패턴이 다르다는 점이다. SH-SY5Y neuroblastoma 세포의 배양을 2차원과 3차원 배양으로 각기 다르게 배양을 한 뒤 유전자의 발현 패턴을 확인한 결과, 구조단백질인 콜라겐의 발현이 더욱 증가하였을 뿐만 아니라, 구조생리학적인 세포간의 유기성이 더욱 증가하였다는 결과를 확인하였다 (Tissue Eng. 2007 May;13(5):1035-47). 간암세포주인 HepG2 세포 역시 3차 구조로 폴리스티렌 구조체에서 배양을 하였을 때, 정상적인 간세포와 더욱 가까운 형태를 띨 뿐만 아니라, 독성연구에 있어서 동물에서의 독성실험과 유의한 결과가 나왔음을 보여주었다 (J Anat. 2007 Oct;211(4):567-76. Epub 2007 Aug 15). 연골세포배양에 있어서도 3차배양을 하였을 때, 보다 정상적인 연골 조직의 형태로 만들어 졌음을 보고 하였다 (Experimental model for cartilage tissue engineering to regenerate the zonal organization of articular cartilage). 이러한 의미에서 3차 배양은 좀더 in vivo와 비슷한 시스템이며, 이는 in vivo를 대변해 줄 수 있는 기능적인 부분을 찾았을 때, 실험동물 대체법으로서의 가능성을 보여줄 수 있을 것이다.
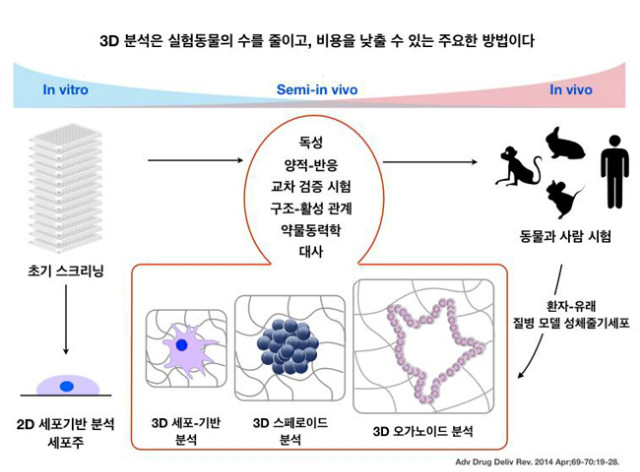
4. 조직배양을 위한 기술은 어디까지 왔나?
3차 조직배양을 통하여 만들어지는 작은 ‘구’체는 스페로이드 (spheroid)라고 불린다. 스페로이드는 일종의 작은 ‘조직’으로서, 외부와 내부가 구분되어 기능이 나뉘기도 하며, 조직의 기능적 단위를 모사하는 형태를 띤다. 스페로이드 배양은 동물이나 인체 조직이 가지고 있는 고유 형태나 성질이 비슷할 뿐만 아니라, 이를 적용하여 연구에 활용할 수 있는 플렛폼으로 개발되고 있다. 암세포를 이용하여 만들어진 스페로이드는 좀더 종양조직과 유사한 형태를 띠어 항암제에 대한 효능이 평면배양 된 암세포에 비해 좀 더 비슷한 결과를 보여준다. 간암세포를 스페로이드로 배양할 경우, 2차 평면에서의 결과보다 더욱 in vivo 데이터와 가까운 간독성 실험결과를 얻을 수 있다고 보고되었다[1]. 기존의 간독성 실험은 주로 HepG2 세포에 신약을 처리하여 나타나는 독성인자를 확인하는 것이 일반적이었으나, 최근에는 3D 형태의 HepG2 3D spheroid를 이용하여 결과를 확인하고 있다. 3D spheroid는 CYP3A4와 같은 P-450 계열의 대사산물이 독성이 높을 경우 많이 발현되는데, 이는 2D에서 배양된 형태보다 더욱 증가된 경향을 확인하였다[1]. 뿐만 아니라 aflatoxin B를 통해 확인된 독성의 결과가 in vivo 실험과 유사하게 나타났다[2]. 최근 스페로이드를 생산할 수 있는 상업용 플렛폼들이 개발됨에 따라서, 대량 약물모니터링 등이 가능하게 되었다. 이러한 3차 조직배양을 수행할 수 있는 물질이나 방법들을 아래 간단하게 소개하겠다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 pdf_0002360.pdf
pdf_0002360.pdf