기술동향
암 나노기술: 현대 암 생물학 시대에서 수동, 능동적 약물 표적화의 영향
- 등록일2015-08-19
- 조회수11745
- 분류기술동향 > 플랫폼바이오 > 바이오융합기술
-
자료발간일
2015-08-18
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#암 나노기술#암 생물학#암 #나노기술#약물 표적화
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
암 나노기술: 현대 암 생물학 시대에서 수동, 능동적 약물 표적화의 영향
[요약문]
암 나노치료학은 2000년대 초반부터 기하급수적으로 발전하고 있다. 종양치료제의 상업화는 멀고 험하지만, 나노입자 기술이 항암제 개발의 성공에 기여할 수 있다. 이에 따라 제약회사들도 나노입자 기술을 갖고 있는 기업, 사람들과의 동업을 빠르게 진행하고 있다. 나노기술은 새로운 항암제 후보들의 효과와 내약성을 증진시켜줌으로써 임상적으로 좋은 결과를 얻게 하고 제품을 차별화한다. 이번 리뷰는 1세대 나노치료제인 DOXIL®과 Abrax-ane®의 상업화를 통해 배운 교훈들을 담고 있다. 다양한 개발단계에 있는 특이적, 비특이적 나노입자의 이해를 위해 이야기를 할 것이다. 또한, 개인 특화 치료가 주류가 되고있는 지금 시대에 기회와 도전들에 대해 이야기할 것이다. 최종적으로 이 리뷰의 목적은 암을 치료하기 위한 나노입자의 디자인과 개발에 대한 이해를 증진시키는 것이다.
키워드: Nanoparticle, Drug delivery, Active targeting, Personalized medicine
분야: Cancer Biology/Oncology,Nanobio, Pharmacology
본 자료는 Cancer nanotechnology: The impact of passive and active targeting in the era of modern cancer biology. Adv Drug Deliv Rev 2014; 66: 2?25 의 논문을 한글로 번역, 요약한 자료입니다.
[목차]
1. 서론
2. 수동적 약물 표적화: 30년간의 EPR 효과
2.1 EPR의 기본 원칙들
2.2 EPR 효과에 영향을 미치는 요인들
2.2.1 혈관외유출
2.2.2 간극에서의 확산과 대류
2.3 종양 생물학
2.3.1 종양 맥관구조
2.3.2 종양 혈관 밖의 환경
2.3.3 종양 생명활동 변화에 의한 EPR 향상
2.4 물리화학적 파라미터들
2.4.1 크기
2.4.2 전하
2.4.3 모양
2.5 사람에서의 EPR 효과
2.6 수동적 약물 표적화에서의 미래 전망
3. 능동적 약물 표적화: 마법의 탄환에 가까워지는가?
3.1 능동적 약물 표적화의 기본 원칙들
3.2 리간드 활용/부착 전략들
3.2.1 전-도입 vs. 후-제형 전략들
3.2.2 도입을 위한 합성 전략들
3.2.3 비공유 결합 접근법들
3.3 능동표적 나노입자의 구조의 영향
3.3.1 리간드 밀도
3.3.2 나노입자의 크기와 모양
3.3.3 표면과 리간드의 전하
3.3.4 표면 소수성
3.4 약물표적화 리간드
3.4.1 항체와 조각들
3.4.2 다른 단백질
3.4.3 펩타이드
3.4.4 핵산기반 리간드
3.4.5 저분자 물질
3.5 인간에서의 능동적 약물 표적화
3.5.1 목표 설정
3.5.2 능동적 약물표적화의 영향 평가
4. 암 나노의약품의 가까운 미래
1. 서론
개발 중인 나노입자 기술이 굉장히 많고, 대부분은 아직 임상 전의 개념증명(Proof of Concept) 단계도 없다. 하지만, 이 연구 분야의 성장과 잠재력은 주목할만하다: 2013년 11월에 Pubmed에서 “nanoparticle”라는 단어로 검색된 81,000개의 논문에서 절반 이상이 2010년 이후에 발표되었다.
나노입자는 약물을 용해시켜주고, 분자를 보호해주고, 그들의 혈류순환과 조직분포에 영향을 준다. 이러한 성질들은 다양한 물리화학적 성질을 갖고 있고, 넓은 범위에서 독성을 일으키는 세포독성물질을 다루는 종양학에서 매력적이다.
나노기술은 또한 암치료에서 흔히 쓰이는 병용투여요법을 용이하게 하는 측면에서 매력이 있다. 하나의 나노입자 안에 여러 개의 활성원료를 봉입함으로써 약제 내성의 위험을 줄이고 치료에 시너지효과를 일으킬 수 있기 때문이다. 그럼에도 불구하고, 나노입자를 이용한 최적 치료 조합의 선택은 어려운 작업이다. 하나의 약물을 사용하여 환자 개개인에 맞게 용량이 조절되는 기존의 항암치료에 비하여, 다른 항암 활성원료가 특정 비율로 봉입되어있는 나노입자는 개발과정 중에 이미 최적화가 되어야 한다. 항암요법의 큰 다양성이 최적의 조합을 선택하기 어렵게 한다. 또한, 병용투여는 어떤 한 약물이 다른 약물의 효과에 영향을 주지 않아야 한다. 암 주변에 산소 공급을 끊는 신생혈관생성 억제제가 다른 화학요법제가 암세포에 접근하는 것을 줄이기도 한다. 나노입자로부터 활성 원료의 방출을 독립적으로 조절하는 것이 가능하다고 해도, 치료 효과의 극대화를 위해 약물 방출의 순서가 고려되어야 한다. 탄탄한 화학, 제조, 관리 체계가 복합항암제의 성공적인 개발과 상업화를 위해 고안되어야 한다.
최근 나노의약품에 대한 높은 관심에도 불구하고, 나노입자의 개발과 임상적 진행은 여전히 실험실에서만 이뤄지고 있다. 임상적으로 검증된 나노의약품 중에서, 오로지 nab-PTX만이 암의 1차 치료법의 부분으로서 공식적으로 사용 되고 있다. 매우 최근에는 gemcitabine과 nab-PTX의 병용요법이 gemcitabine 단일요법에 비해 췌장암환자의 생존기간을 6.7개월에서 8.5개월로 25%를 증가시켰다. 이러한 발견은 gemcitabine과 nab-PTX의 병용요법을 1차 치료법으로 이끌었다. 나노의약품이 임상적 결과를 증진시키는 실질적 시작은 나노입자를 이용한 항암치료로부터 환자가 받는 이익을 이해하기 시작할 때 일어날 것이다. 유전학, 종양생물학, 나노 기술에 대해 더 잘 이해하는 개인화 약물 시대에는 환자 개인에 맞게 다양하고 복잡한 전략으로 치료할 것이고, 결국 이는 치료효과를 증진시키고 암 생존율을 높일 것이다.
분자단위의 표적 치료법들은 환자들의 종양의 유전적 특성을 기반으로 한 개인 맞춤 치료방법으로 쓰인다. 수동적 약물 표적화의 경우는 예측보다 더 복잡한 경우가 많은데, 이는 종양 내, 종양 간 다양성이 혈관과 종양의 구조에 영향을 끼치기 때문이다. 능동적 표적화 나노입자는 비교적 최근에 사람을 대상으로 한 임상시험에 사용되었다. 이 전략은 입자의 표면 리간드(ligand)와 암세포의 표면 사이 친화도를 이용하여 나노입자를 전달하는 것이다. 능동 타깃팅 전략으로부터 효과를 얻기 위해서는 목표로 하는 세포에 나노입자가 접근 가능한 특이 항원이 있어야 한다. 또한 치료하는 동안 항원이 적절한 자리에 충분하게 발현되어 있어야 한다. 이러한 맥락에서, 특정한 경향이 있는 환자에 대한 식별과 자료수집은 단순한 유전적 조사 그 이상인 것이다. 종양 안에서 나노물질의 분배, 잔류 등의 생물학적 과정을 이해하는 것은 개인화된 나노의약품 개발에 있어서 필수적이다.
이번 리뷰에서, 우리는 종양과 암세포에 대한 나노의약품의 표적화의 기초에 대해 다룰 것이다. 암 주변 맥관구조의 형태와 세포주변의 구성물들 혹은 암세포주변 환경에서 면역세포의 존재유무가 나노입자의 분배에 어떻게 영향을 주는지를 살펴볼 것이다. 또한, 새로운 치료 나노입자의 관점으로 나노소재의 물리화학적 파라미터들이 어떻게 나노입자의 국소적 잔류, 세포 결합, 효과, 독성 등에 어떤 영향을 끼치는지 알아볼 것이다.
2. 수동적 약물 표적화: 30년간의 EPR 효과
나노입자는 종양의 간극에 들어가 장기적인 기간 동안 머물러 있는 경우가 있다. 이렇게 암에 우선적으로 분배되는 것은 불완전한 종양 주변 혈관에 구멍들이 존재하고, 조직으로의 림프액 전달이 줄었기 때문이다. 이러한 두 가지 현상의 조합으로 생기는 것이 바로 투과와 체류증진(EPR: Enhanced Permeation and Retention) 효과 이다. 과학자들이 폴리머, 리포좀, 나노입자 등 무엇을 연구하든 EPR 효과는 자주 반복되어 나타나는 요소이다. 그럼에도 불구하고, EPR 효과는 처음에 규정된 것보다 훨씬 더 복잡하다. 환자와 그들의 종양에 따라 분배와 축적이 다르듯이, 나노입자의 암세포에서의 분배와 축적은 각 재료의 생물학적, 물리화학적 성질 등 많은 요소에 의해 영향을 받는다. 이러한 이유로 어떠한 현상을 단순하게 EPR이라고 정의하는 것은 개인화 의약품이 출현한 새로운 시대에 뒤쳐진 것이라 할 수 있다.
2.1 EPR의 기본 원칙들
고형 암이 일정 크기가 되면 종양의 성장을 위한 산소 공급을 제공하기에 일반적인 주변 혈관 구조로는 충분하지 않다. 세포들이 죽기 시작하면서 주변 모세혈관에 새로운 혈관을 만들기 위한 성장인자들(growth factors)을 분비한다. 신생혈관생성(angiogenesis)라고 불리는 이 과정은 새로운 혈관을 아주 빠르게 만들어 내기에 중간중간 비정상적인 구조가 만들어지고 기저막이 부족한 부분도 있다. 모세혈관에 이러한 구멍이 생겨서 종양의 종류에 따라 200-2000 nm의 크기를 갖는 입자들이 도달하여 머물 수 있는 환경이 생긴다. 이에 입자의 투과증진 효과가 나타나는 것이다. 일반 조직에서 세포외액은 일정속도로 지속적으로 림프관으로 흘러간다. 이러한 과정 때문에 세포액과 구성물들이 순환하고 새로 대체된다. 하지만, 종양에서는 림프절의 기능이 부족하여 새로운 액이 채워지지 못하고 순환도 덜 일어난다. 이러한 현상에 의해 체류 증진 효과가 나타나는 것이다.
1980년대 Matsumura와 Maeda의 연구 이후에 EPR 효과에 대해서는 다양한 종양 종류와 동물 모델에서 많은 연구가 발표되었다. 거대분자와 나노입자의 분배에 영향을 주는 파라미터들이 더 이해가 되었고, EPR 효과에서 애매했던 부분들이 점점 밝혀지고 있다.
2.2 EPR 효과에 영향을 미치는 요인들
고형 암에서 종양으로의 분자의 분배는 3가지의 독특하면서 서로 연관되어 있는 현상에 의해 조절된다: (1) 혈관으로부터 콜로이드의 혈관외유출, (2) 혈관 밖 조직으로의 확산, (3) 종양의 세포 외 혹은 세포 내 표적과의 상호작용이다. 이러한 것들은 모두 종양 내 입자의 축적 평형상태에 영향을 끼친다. 이것들은 재료의 성질, 조직의 구성성분과의 친화도, 암의 구성요소들 등에 영향을 받는다.
2.2.1 혈관 외 유출
혈류순환으로부터 콜로이드의 혈관 외 유출은 혈액 내에서 이것들의 농도, 거대분자와 나노입자의 상대적 투과능력, 혈관 외 환경 등에 의해 영향을 받는다. 혈액으로부터 콜로이드가 빠져 나오는 것에 대한 각 요인들을 반영하기 위해, 현상이 매우 간단한 수학적 관계로 표현될 수 있다. 수학적으로 재료가 종양으로 수송되는 전체 비율은 확산력, 대류의 힘 그리고 잘 모르는 부분이 더해진다.
암생물학과 나노기술에서 최근의 진전에도 불구하고 여전히 암의 미세환경과 콜로이드가 혈관에서 유출되어 암세포로 어떻게 가는지에 대해 아직 모르는 부분이 많고 더 연구되어야 할 부분이 많다.
2.2.2 간극에서의 확산과 대류
콜로이드가 혈관에서 유출되어 종양으로 가면 이 주변의 환경은 세포간질액(interstitial fluid), 암, 스트로마 세포(stromal cell), 그리고 세포 외 기질(ECM: extracellular matrix)로 구성된다. 간극에서 구성성분들의 움직임은 대류의 힘, 확산력 그리고 다른 현상 등에 의해 조절된다.
2.3 종양 생물학
종양환경은 너무 복잡하여 일반적인 해부학, 생리학적 원칙으로 설명하기 힘들다. 암세포의 무차별적 성장과 혈관생성을 위한 인자들의 분비는 마구잡이식의 혈관구조와 복잡한 혈관 밖 환경을 만든다. 역설적으로, 이러한 구조적 불완전성은 EPR 효과에 대한 원인이고, 일정하지 않은 종양 내에서의 나노입자의 체류에 대한 중요한 원인이다.
2.3.1 종양 맥관구조
암세포로부터 신생혈관생성인자의 방출은 혈관구조와 혈관벽 형태에 영향을 준다. 뒤얽히고 체계적이지 않은 모세혈관은 구멍이 많다. 구멍이 난 정도와 거대분자의 혈관 투과성은 암의 종류, 암의 진행 단계 등 많은 요인에 의해 영향을 받는다. 혈관에 있는 미세 구멍들이 콜로이드가 빠져 나오기 위한 길이 되는 한편, 비연속적이고 비 조직적인 혈관의 구조가 혈류와 체액의 압력 등에 영향을 미치기도 한다.
2.3.2 종양 혈관 밖의 환경
종양 혈관 밖 환경은 콜라겐 섬유들과 글리코사미노글리칸(GAG: Glycosaminoglycan)들이 다른 단백질, 세포들의 잔해 등과 함께 복잡하게 엉켜있는 환경이다. 세포간질액이 세포들에 효율적으로 배분되는 건강한 조직과는 다르게 암의 체계적이지 않은 구조는 체액의 확산과 대류를 방해한다.
나노입자들이 혈관 밖으로 유출되면 ECM이 종양에서 나노입자의 확산과 대류를 조절한다. 종양의 세포간극에서의 효과적인 확산은 단순한 용액에 있는 콜로이드일 때 나타난다는 것을 in vivo와 ex vivo 조건에서 시행한 많은 연구들이 밝혔다.
2.3.3 종양 생명활동 변화에 의한 EPR 향상
EPR 효과에 대한 우리의 지식이 발전하면서 거대분자와 나노입자의 분배를 증진 시키기 위해 종양 미세환경을 최적화하는 약물학적 방법들이 제안되었다. 종양 내에서 콜로이드의 이동을 원활하게 해주기 위해 ECM에 효소를 주입해주는 방법, 저분자 약물이나 광면역학 요법을 사용하여 혈관주위의 환경을 리모델링 하는 방법 등이 발표되었다. 이러한 접근들은 전임상 모델에서 나노입자의 암 분포와 종양세포를 파괴하는 종양바이러스의 치료효과를 증진시켰다. 또 다른 방법으로는 혈관벽간의 대류를 증진시키기 위해 뿌리는 압력을 증가시키는 것이다. 이를 위해 angiotensin II와 같은 고혈압을 일으키는 분자들의 투여에 대한 연구들이 진행되었다.
초기 종양의 구조에 의해 혈관의 형태를 변화에 굉장히 영향을 받는다. 혈관내피증식인자(VEGF: vascular endothelial growth factor)의 활성에 영향을 주는 다양한 저분자 타이로신 카이네이즈(tyrosine kinase) 저해제는 대장과 췌장암의 다른 쥐 모델에서 다른 영향을 나타낸다.
임상모델에서의 이런 결과들은 종양생물학을 조절함으로써 EPR 효과를 조절할 수 있다는 것을 뜻한다. 앞으로 임상상황에서 어떻게 효율적인 다른 전략들로 다가갈지에 대한 더 많은 노력이 필요하다.
2.4 물리화학적 파라미터들
콜로이드들의 물리화학적 파라미터들은 콜로이드의 확산성, 혈관벽 투과성, 액체에서의 저항, 종양 내에서 세포와 ECM과의 상호작용 등에 영향을 주면서 혈관 밖으로 빠져 나오는 것에 영향을 끼친다. 게다가, 치료나 진단에 쓰이는 외인성 물질의 물리화학적 성질들은 숙주의 방어 메커니즘이 혈류순환으로부터 물질들을 어떻게 대할지에 대해 영향을 준다. 각각의 물리화학적 파라미터들은 전체적 혈류순환운동 동역학(kinetic), 입자가 혈류로 빠져 나오는 과정, 종양 내에서 확산되는 것까지 영향을 주기 때문에 특정 특성에 의한 EPR로의 영향을 측정하는 것은 어렵다.
그럼에도 불구하고, 나노입자가 혈액에 노출된 양과 시간은 EPR 효과에 의한 종양으로의 입자의 분배에 영향을 미치는 중요한 요인이다. 확산과 대류의 힘은 모두 혈류에서의 콜로이드의 농도에 영향을 받는다. 나노입자가 혈액에서 순환한 시간이 길수록 더 많은 입자가 혈류로부터 종양으로 빠져나간다. 혈액 순환 동력학과 종양 내 입자축적 사이의 상관관계는 폴리머, 리포좀, 나노입자 등에 의해 일반화 되었다.
2.4.1 크기
나노물질의 크기는 종양 내 축적의 정도와 동역학(kinetics)에 영향을 미친다. 재료는 혈관 사이 틈보다 작은 크기일 필요가 있다. 크기는 혈류로부터 종양으로 빠져나가는 것과 종양 내에서 확산에 영향을 미치는 요인 중에 하나이기도 하다. 대게 50 nm 미만의 작은 입자들이 종양 내에 축적이 잘된다는 연구들이 있다. 하지만, 나노입자에 따라 혈액순환의 특징이 다르기 때문에 다른 다양한 파라미터들도 충분히 고려되어야 한다.
2.4.2 전하
다른 물리화학적 파라미터와 같이 거대분자와 나노물질의 전하는 인체 전체의 혈류와 종양 내에서 일어나는 일들에 영향을 준다. 표면전하의 존재는 물질의 옵소닌 작용과 MPS의 기관에서 세포의 인식, 그리고 혈류순환 모두에 영향을 준다. 표면에 음전하를 띄면 나노입자의 혈액 내 소실을 증가, 감소 혹은 효과가 없기도 하지만, 양전하는 나노입자의 혈액 노출에 부정적인 효과로 인식되어 왔다. 양전하는 나노입자와 종양혈관과의 상호작용을 촉진시키고 종양 내로 깊게 확산되는 성향을 없앤다. 이러한 현상은 매우 최근에 전입상 모델에서 신생혈관억제 약을 종양 혈관 내피에 타깃으로 할 때 고려된다. 종양 내피와의 상호작용 때문에 나노입자가 혈관 밖으로 빠져나가는 것이 제한되는 것 이외에도, 전하는 ECM에 붙어 간극 사이로 확산하는 것도 제한한다.
2.4.3 모양
나노입자의 모양은 MPS와의 상호작용을 조절함으로써 나노입자의 혈액 내 노출에 영향을 준다. 최근 44 nm의 막대기모양의 나노입자(nanorod)는 35 nm의 구형태의 나노입자와 같은 유체역학적 반경을 보여줬다. 유사한 혈액순환 특성에도 불구하고, 막대기 모양 나노입자는 구형태 나노입자보다 4배 빠르게 혈관을 나오고 종양 내부 깊숙이 확산됐다. 이러한 결과를 바탕으로 긴 형태를 가진 입자가 EPR 효과에 더 유리하다고 할 수 있다.
2.5 사람에서의 EPR 효과
피하와 해부, 유전적 변형을 통해 만든 암모델 설치류에서 많은 EPR 효과가 연구되어왔지만 일반 암과 전이암을 가진 사람들 사이에서 많은 연구가 이뤄져야 한다. 사람에서 EPR 효과의 데이터가 부족한 것에는 많은 이유가 있고, 여전히 사람 신체 내에서 분배가 어떻게 되는지에 대한 의미 있는 데이터를 얻는 것은 매우 어렵다.
전임상 모델은 일차 암에만 신경 쓰는 반면, 전신 화학요법이 보통 전이암이 있는 환자에게 사용되는 것도 중요하다. 일차 암과 전이암 병변이 다른 양상을 보이기 때문에 일차 암에서 나노입자의 활동양상이 전이암에서의 활동과 연관성이 있다고 확신하기 어렵다. 또한, 조기임상에 참여한 환자들은 항암제에 노출되었을 확률이 매우 높고, 이미 다양한 약물을 사용하여 종양의 환경이 복잡하다.
사람에서의 EPR 효과를 평가하기 어려운 또 다른 이유는 동물모델실험에서 최대 분배와 머무름을 가져오는 파라미터들이 사람에서의 최적의 파라미터와 다르기 때문이다. 쥐에서 나노입자의 다른 물리화학적 특성들을 선별해내는 것은 상대적으로 쉽지만, 복잡한 요소가 많은 사람에게서는 거의 불가능하다.
2.6 수동적 약물 표적화에서의 미래 전망
지난 30년간 EPR은 거대분자와 나노물질의 종양으로의 전달에 중요한 역할을 했다. 그럼에도 불구하고, 여전히 EPR 효과에서 환자간의 질병의 상이함에 대한 이해와 암의 이질성(heterogeneity)에 대한 이해가 필요하다. 나노물질의 물리화학적 성질과 종양생물학은 매우 중요하다. 환자 개개인의 종양 미세환경을 평가하고 EPR 효과에 대한 민감성을 평가하는 것이 결국 치료방법을 결정하는 중요한 절차가 될 것이다. 또한, 나노입자의 효과를 최적화하기 위하여 약물의 확산과 방출제어, 약과 폴리머의 접합 등이 고려되어야 한다. 수동적 표적화 나노입자를 디자인할 때 암 환경에 대한 약의 친화도와 작용을 고려해야 하고, 방출 또한 개개인에 따라 최적화 되어야 한다.
3. 능동적 약물 표적화: 마법의 탄환에 가까워지는가?
리간드(ligand) 표적화, 능동적 표적화는 특정 질환 세포에 약물을 많이 투과시키고 머무르게 하기 위해 나노입자의 표면에 질환세포와 친화력이 있는 리간드를 붙이는 것이다. 리간드는 질병이 있는 기관, 조직, 세포, 세포 이하의 영역에 많이 발현되어있는 분자나 수용체에 잘 달라붙는 것이 선택 되어야 한다.
나노입자의 구조, 리간드를 붙이기 위한 화학, 리간드의 종류 등 능동 표적화 나노입자 시스템의 효과에 영향을 미치는 것이 많아 이 시스템을 설계하는 것은 복잡하다. 표적화 리간드가 달린 나노입자 전략, 이점, 단점 등에 대해 알아보도록 하겠다.
3.1 능동적 약물 표적화의 기본 원칙들
능동적 표적화의 주요 메커니즘은 목표로 하는 물질에 대한 리간드의 인식이다. 리간드에는 대표적으로 항체, 단백질, 펩타이드, 핵산, 설탕, 저분자 물질 등이 있다. 목표로 하는 물질은 질환 기관이나 세포 표면에 있는 단백질, 당, 지질이다. 능동 표적화에서 시스템의 효과를 평가하기에 가장 중요한 두 가지 요소는 질환세포에 대한 특이성과 전달 능력 이다. 특이성은 목표로 하는 물질이 없는 세포에 비해 목표 물질이 있는 세포에 얼마나 선택적으로 전달하는지의 여부를 본다. 능동 표적화 나노입자는 표적들이 부근에 있어야 하고 이를 인식하고 상호작용 해야 한다. 이때에도 나노입자가 혈류에서 순환하는 시간이 중요하다.
최근에는 하나의 나노입자에 여러 가지 표면 리간드를 붙이는 in vitro 연구도 수행 중이다. 그러나 이런 연구들이 실제 임상에서 효능을 검증하기 까지는 아직 여러 면에서 연구가 되어야 한다.
3.2 리간드 활용/부착 전략들
나노입자의 결합능은 리간드의 밀도와 연관되어 있기 때문에 나노입자에 리간드를 붙이는 접근법들은 능동표적화 시스템에서 중요한 요소이다. 대부분의 경우에서, 리간드의 공유결합은 선호되는 전략이다. 또한, 친화력을 이용한 물리적인 결합도 효과적으로 사용된다. 유기와 비유기 물질이 다른 물리화학적 성질을 띠기 때문에 나노입자의 재료에 따라 리간드를 접합하는 방법이 많이 달라진다. 모든 경우에서, 리간드와 나노입자의 결합의 안정성이 입자 표면의 표적 리간드 유지에 있어서 중요하다.
3.2.1 전-접합 vs. 후-도입 전략들
나노입자가 만들어지기 전에 나노입자 재료와 리간드를 접합하는 것은 상대적으로 쉽다. 전-접합은 저분자, 펩타이드, 앱타머(aptamer)들에 의해 이루어진다. 전-접합은 한 단계이기 때문에 다른 부가 반응들이 일어난 위험성이 적고, 나노입자의 성질을 조정하기 쉽다. 전-접합의 대안이 되는 것이 후-도입 전략인데, 이는 다 만들어진 나노입자에 리간드를 반응시키는 것이다. 이 전략에는 항체, 단백질, 펩타이드, 압타머, 저분자 등이 사용되고, 이 전략은 유기용매에서 리간드의 안정성에 문제가 있을 때, 리간드가 너무 클 때, 리간드가 나노입자 물질의 성질을 바꿀 때 사용된다.
3.2.2 도입을 위한 합성 전략들
두 가지 기능을 하는 연결기(linker)가 리간드를 나노입자에 접합시키는데 사용된다. 카르복시기 그룹을 활성화 시키거나 리간드에 친핵성이 있는 그룹과 반응시킴으로써 리간드와 나노입자간의 결합이 형성된다. 또한 나노입자 표면에 maleimide 그룹을 이용하여 접합하기도하고 리간드의 thiol 그룹을 사용하여 강한 thioether 결합을 만들어 접합하기도 한다. 최근에는, “click chemistry”라고 불리는 바이오 접합 과정이 개발되었는데, 이는 촉매제를 사용하거나 사용하지 않으면서 이종원자를 포함하는 단일단계 반응이다. 알킨 그룹과 azide 그룹을 이용한 결합. 구리촉매를 이용한 방법 등이 있다.
3.2.3 비공유 결합 접근법들
Streptavidin-biotin 산호작용은 합성 바이오 접합의 한계를 극복하는데 좋을 수 있다. Biotin은 아주 작기 때문에 리간드 자체의 기능을 바꾸지 않아 많이 사용된다. Avidin-biotin 전략 외에 Vancomycin/D-Ala-D-Ala 같은 높은 친화력을 같는 복합체와 adamantine-사이클로덱스트린 결합이 있다.
3.3 능동표적 나노입자의 구조의 영향
나노입자의 표면에 리간드를 접합하는 것은 표적화 분자와 나노 재료의 성질을 바꾼다. 리간드가 나노입자에 붙으면서 움직이는 자유도를 잃으면서 표적물질과 더 잘 결합한다. 유사하게, 크기와 표면 성질(전하나 소수성), 나노입자의 구성요소들이 바뀔 수 있다. 능동 표적화 나노입자의 성질을 이해하기 위해서 나노입자의 물리화학적 성질들이 목표로 하는 물질과의 상호작용에 어떻게 영향을 미치는지 아는 것이 중요하다.
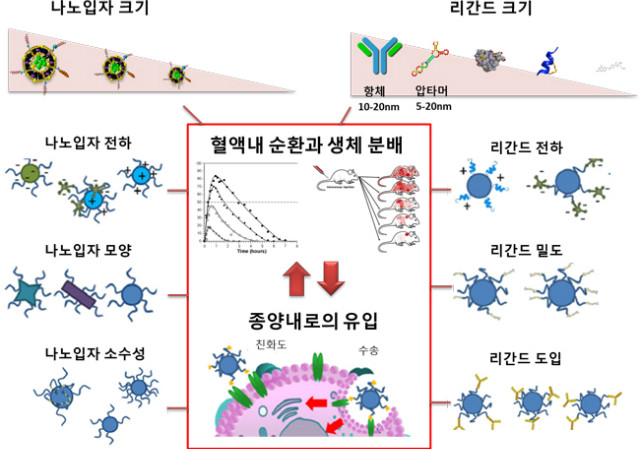
그림 1. 리간드와 나노입자의 물리화학적 성질이 혈류 내에서 이들의 양상과 생체분배, 암으로의 투과 등에 영향을 미친다.
3.3.1 리간드 밀도
나노입자의 표면에 표적화 분자의 밀도는 목표로 하는 기질과의 친화도에 영향을 준다. 열역학적으로 목표물질에 리간드가 결합하면 주변에서도 연속적인 결합이 일어나기 쉽다. 생물학적으로 나노입자와 세포막의 다양한 상호작용은 수용체의 국소적인 농도를 증가시켜 세포막의 internalization을 유도한다. 낮은 친화도를 갖는 리간드를 많이 사용하는 것도 효과적일 수 있다. 하지만 리간드 개수에 따라 친화도가 비례적으로 올라가는 것은 아니다. 때때로 리간드의 너무 높은 밀도는 공간적으로 장해(steric hindrance)를 일으켜 세포부착에 더 안 좋은 효과를 초래하기도 한다. 종양에 선택적으로 높은 친화력을 갖는 리간드는 세포에 빠르게 부착하여 종양에서 깊게 확산되는 과정을 막기도 한다. 그러므로, 나노입자 표면에 리간드의 밀도를 적절히 설정하는 것이 입자가 충분히 머물 시간을 주고 세포 내에 최대로 흡수되게 한다.
3.3.2 나노입자의 크기와 모양
나노재료의 크기와 모양은 표적화 나노입자의 기본에 굉장히 중요한 요소이다. 작은 크기의 구 형태 입자에서는 곡률 때문에 리간드를 후-도입 방법으로 달기 어려울 수 있다.
게다가 나노입자의 표면에 높은 분자량을 갖는 리간드를 수식하는 것은 필요 없는 부분으로 인해 크기가 너무 커진다. 사이즈는 세포 내 흡수와 혈액 내 순환에 큰 영향을 끼치기에 매우 중요하다. 모양 또한 나노입자와 세포표면 사이의 작용을 조절하여 세포 흡수에 영향을 미친다.
3.3.3 표면과 리간드의 전하
리간드가 붙지 않은 나노입자의 전하와 리간드의 전하는 결합 수율과 표면의 리간드 배치에 영향을 준다. 나노입자의 표면과 리간드 사이에 밀고 당기는 힘은 결합을 방해하거나 리간드의 구조에 영향을 줄 수 있다. 최종으로 리간드가 붙은 나노입자의 전하는 능동나노입자의 효능에 영향을 미친다. 양전하를 띄는 나노입자와 음전하를 띄는 세포막 사이의 상호작용 때문에 양전하의 나노입자는 세포결합과 흡수가 증가된다. 대부분의 리간드가 전하를 띄는 분자이기 때문에 나노입자의 전하는 리간드의 재료, 밀도, 조성 전략에 의해 결정된다.
3.3.4 표면 소수성
전하 이외에도 표면 소수성은 리간드의 배치에 영향을 준다. 최종적으로 만들어진 나노입자의 소수성 또한 세포와의 상호작용에 영향을 준다. 한편, PEG를 붙이면 혈중 단백질과 옵소닌의 흡착을 지연시킬 수 있다. 길고 밀도가 있는 PEG 사슬의 사용은 외부 공격으로부터 리간드를 보호할 수 있다.
3.4 약물표적화 리간드
적절한 리간드를 찾는 것은 능동 표적화 나노입자에 있어서 매우 중요하다. 초기 표적화 나노입자는 높은 특이성을 가지고 넓은 유용성을 가진 항체들이 많이 사용되었다. 그 이후로 단백질, 펩타이드, 핵산, 저분자 기반의 다양한 리간드들이 사용되어 왔다.
3.4.1 항체와 조각들
항체는 ‘Y’ 모양의 큰 당단백질이고, 이는 외부 물질(항원)의 특정 부분을 인식한다. Fab라고 불리는 항체의 끝부분은 조금씩 다른 구조를 아주 다양하게 갖고 있고, 각각이 다양한 항원을 인식한다. 이러한 항체를 나노입자에 결합시키는 것은 그들의 특이성과 친화성에 대한 성질을 나노입자에 부여하는 것이다. 능동수송에 있어 항체가 각광받고 주목 받는 물질이었지만 몇 가지 단점이 있다. 첫째로, 항체는 150kDa의 큰 단백질이다. 둘째로, 항체는 생리학적으로 활성이 있다. 세 번째로, 항체는 온도나 염농도 등의 환경에 민감하다. 이러한 단점에도 불구하고 MCC-465와 SGT-53같은 것들은 임상 단계에 있으며, Basel병원을 중심으로 한 과학자 그룹이 PEG가 달린 doxorubicin 리포좀인 DOXIL®을 개발하였다.
3.4.2 다른 단백질들
단백질의 삼차원적 모양은 특정 기질에 친화력을 주기 때문에 항체가 아닌 단백질도 표적화 물질로 사용될 수 있다. Transferrin같이 자연적으로 만들어지는 단백질도 다양한 치료 표적화 물질로 적용된다. 또한 affibodies, ankyrin 반복 단백질, 펩타이드 압타머, 단백질 scaffold같은 합성 단백질도 표적화 물질로 사용되곤 한다.
3.4.3 펩타이드
펩타이드는 아미노산서열로 이루어져 있다. 단백질과는 다르게 50개 미만의 잔기로 이루어져있다. 크기가 작고 3차구조도 더 단순하다기 때문에 안정성이 좋아 쉽게 합성하고 결합할 수 있다. 작은 크기는 전-도입 부착도 용이하게 해준다. 가장 흔하게 쓰이는 펩타이드 리간드는 RGD 펩타이드 그룹이다. 또한, 맥관구조를 표적으로 하는 것은 EPR 효과에 있어 매우 흥미로운 것이다. 내피세포투과 펩타이드는 나노입자를 세포막을 투과하여 특정세포 기관으로 도달하게 해주기도 한다. 이러한 펩다이드로는 LyP-1, iRGD, CREKA, NGR, LABL이 있다.
3.4.4 핵산기반 리간드
핵산기반 압타머는 펩타이드 기반 압터머와는 완전히 다른 구조를 가지고 있다. 핵산 압타머는 DNA, RNA와 같은 단일가닥 올리고뉴클레오타이드이다. 이들의 독특한 구조는 높은 친화력과 특이성을 준다. 전임상에서의 이러한 장점에도 불구하고 임상에서는 몇 가지 한계점 때문에 개발이 지연되었다. 먼저, 생물학적 환경에서 핵산은 뉴클레아제에 의해 분해되기 때문에 안정성이 떨어진다. 다른 한계점은 나노입자에 리간드로서 붙였을 때 혈액 내 순환 동력학이 바뀐다는 것이다. 개발비용 또한 무시할 수 없는 부분이다.
3.4.5 저분자 물질
저분자량 물질은 전-도입 결합 전략으로 간단하게 나노입자와 합성할 수 있다는 장점이 있다. 하지만, 기질에 대해 새로운 친화력을 갖는 리간드를 동정하기 힘들다는 단점이 있다. 자연과 합성 저분자 리간드 중에 가장 유명한 것은 바로 엽산이다. 엽산은 강한 친화력 때문에 아주 널리 이용된다. 그리고 엽산 수용체는 인간의 다양한 종양의 표면에 많이 발현되어 있기 때문에 표적으로 삼기 좋은 수용체이다. 하지만, 실험을 할 때 세포 표면에 노출되어 있는 엽산만을 살펴본다는 한계점이 있다. 50-70%의 엽산은 막 안쪽에 존재해 있어 이를 살펴보기 힘들다. 또 다른 문제점은 엽산이 종양뿐만 아니라 다른 기관의 세포에도 많이 발현되어 있다는 점이다.
3.5 인간에서의 능동적 약물 표적화
시중에 능동 표적화 나노입자로서 판매되는 의약품이 없음에도 불구하고 5개의 능동 표적화 리포좀과 2개의 표적화 폴리머 나노입자 치료제가 임상시험에 진행 중이다. 몇 년 후 환자에서의 나노입자에 대한 평가가 진행되면 능동표적화에 대한 연구가 많이 향상될 것이다.
3.5.1 목표 설정
임상적 활용을 위한 능동 표적화 나노입자의 설계는 과학적인 부분뿐만 아니라 경제적인 부분도 고려 해야 한다. 능동 표적화 약물전달시스템은 종종 수동 표적 나노입자의 개발에 비해 비싼 것으로 인식이 되지만, 충분한 효과를 보여준다면 더 연구 개발될 것이다. 물론 임상3상에서 시판까지 더 보여줘야 할 것이 많지만, 능동 표적화 리간드가 임상에서 좋은 결과를 얻는다면 위험과 비용은 복잡한 화학, 제조, 조절 과정에서만 발생할 것이다.
능동 표적화 약물전달 시스템 확립은 다양한 암을 한번에 표적화 할 수 있는 플랫폼이라는 측면에서 투자자와 임상의사들에게 매우 매력적으로 들린다. 하지만, 복용량 제한 부작용과 낮은 내약성이 치료 약물로 만드는데 제한이 있고, 큰 스케일로 제조하고 상업화 하는데 어려움이 있다. 이러한 어려움에도 불구하고 PSMA같은 목표를 이용한 좋은 연구가 진행 되고 있다. PSMA는 모든 종류의 고형암의 맥관구조에서 발견된다. 이런 연구들의 좋은 결과를 바탕으로 환자들의 여러 종류의 암을 치료할 기회가 제공 될 수 있다.
3.5.2 능동 약물표적화의 영향 평가
사람에서 능동 약물 표적화의 영향을 평가하는 것은 그리 간단하지 않다. 전임상 모델에서 각 개개의 연구는 각각 다른 나노입자로 반복되는 방법으로 평가되었다. 사람에서 치료의 효과를 평가하는 것은 시간과 자원이 많이 필요하다. 그렇기 때문에 능동 표적과 비표적 나노입자를 같은 조건으로 연구하는 것은 실행되지 않고 있다. 나노의약품에 대한 우리의 이해가 향상된다면 환자들에게 최대의 이익을 제공할 수 있을 것이다.
4. 암 나노의약품의 가까운 미래
30년전 EPR 효과가 처음 발견된 후, 치료 나노입자에 대한 전망은 밝았다. 나노입자에 대한 임상연구가 여러 개 진행되고, 제약회사와 나노기술 회사의 파트너십도 활발했고 나노재료와 생체시스템 사이에 대한 우리의 이해도 기하급수적으로 증가했다. 많은 과학적 증거들이 치료 나노입자가 암을 포함한 많은 인간 질병의 패러다임을 바꿀 것을 뒷받침하고 있다. 과거 대부분의 노력이 이미 개발된 활성성분의 다른 캐리어의 개발에 머물렀지만, 나노입자의 진정한 잠재력은 부형제들에 대한 개발이다. 특히 암이라는 질병은 복잡하기 때문에 숙달된 팀의 협동이 필수적이다. 재료 과학자들은 나노입자의 설계, 합성, 성질을 위한 탄탄한 연구들을 진행하고 있다. 많은 부분에 있어서 비표적, 표적 치료 나노입자의 미래가 밝다. 몇 십년 후에 좀 더 안전하고 효과적인 치료 방법으로써 주류가 될 것이다. 아무리 의약품 개발의 과정이 길다 할지라도 나노기술은 전자전기와 같은 과학분야에서 많은 업적을 이뤘듯이 결국 긍정적인 영향을 끼칠 것이다. 이러한 기술이 암과 같은 많은 질병들의 패러다임을 바꿀 것이다.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 pdf_0002371.pdf
pdf_0002371.pdf