기술동향
생촉매의 업그레이딩을 위한 고정화 연구 동향
- 등록일2015-09-08
- 조회수7974
- 분류기술동향
-
자료발간일
2015-08-21
-
출처
지능형 바이오시스템 설계및합성 연구단
- 원문링크
-
키워드
#생촉매#업그레이딩#고정화#효소#효소활성
- 첨부파일
출처 : 지능형 바이오시스템 설계및합성 연구단
생촉매의 업그레이딩을 위한 고정화 연구 동향

건국대학교 화학공학과 이정걸 교수
1. 개요
효소는 고온에서 민감하고
불안정하며, 안정적 효소 활성을 위해서는 수용성 매질을 필요로 하는 것으로 알려져 있다. 이러한 특성은 촉매로서는 적합하지 않으며 합성
반응에서도 바람직하지 않다. 대부분의 경우, 이러한 단점들을 극복할 수 있는 간단한 방법은 효소를 고정화시키는 것이다. 즉, 생촉매의 연속
공정에서 장기간 재사용이 가능하고 반응 후 생화학적 특성이 손실되지 않도록 하기 위해서 수용성 효소를 비수용성 고체 지지체에 고정시킨다. 적절한
지지체에 연결고리를 통해 생촉매를 다점 및 다소단위체 공유결합을 시키면 고정화된 효소 구조에 강성을 부여하고, 온도 변화나 유기 용매에 대해
안정성을 제공한다. 이와같이 효소의 고정화는 매우 유용한 것으로 입증되어 왔으며, 지난 40년 동안 산업 공정에서 활성도, 안정성, 기질
특이성과 같은 효소의 특성을 향상시키기 위한 방법으로 성공적으로 사용되어 왔다 (그림 1). 효소 고정화의 오랜 역사와 명백한 이점에도
불구하고, 생체 촉매 과정에서 고정화 효소 중 약 20%만 반응하는 것으로 추정된다. 따라서 선결 주요 과제는 고정화 시 효소 활성을 잃지
않으면서 동일한 반응에 효소가 반복적으로 사용될 수 있는 적절한 고정화 방법을 개발하는 것이다. 고정화 기술의 발전으로 인하여, 관심의 초점이
특정 용도에 적합한 특성을 가진 변형된 효소 모듈의 개발로 바뀌었다. 고정화의 장점은 다중, 반복, 또는 연속 사용이 가능하며 반응시간의
최소화, 높은 효소 안정성, 향상된 공정제어, 다중 효소 시스템, 제품분리의 용이성이다. 또한 노동 집약도가 비교적 낮고, 비용효과가 크며,
사용이 안전하며 친환경 적이다. 단점은 낮은 효소 활성도, 효소의 구조 변화, 효소 변성, 특성의 변화, 기질 및 생산물의 물질 전달 제한,
비수용성 매질에서의 활성 감소 등이다. 본 보고에서는 산업 공정에 적합한 효소의 특성을 제공하기 위한 다양한 고정화 전략 방안 및 최신
연구동향을 제시하고자 한다.
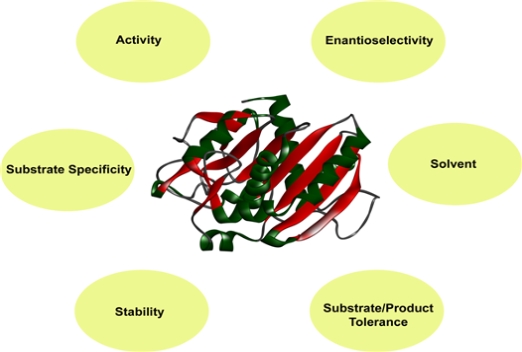
그림 1. 산업적 공정에서 효소의 성공적 사용을 위한 효소 개량 요인
2. 고정화를 통한 생촉매의 특성 향상
고정화된 아미노아실라제가 1967년에
아미노산 분해를 위한 산업 공정에 최초로 사용된 이후, 효소 고정화 기술은 점점 더 많은 관심을 받게 되었으며, 최근 수십 년 동안 비약적인
발전을 이루었다. 효소는 다양한 산업용, 생체의학용, 분석용 프로세스에서 촉매로 사용되고 있다. 효소 고정화 기법 개발이 많은 관심을 끄는
이유는 고정화 된 효소가 수용성 효소와 비교해 안정성이 높으며 반응과정에서 쉽게 분리할 수 있기 때문이다. 효소 고정화에는 다양한 방법이
사용되며, 가장 흔히 사용되는 세가지 방법들은 흡착, 포착, 및 교차결합 (지지체에 공유 결합)이다 (그림 2). 최근 효소고정화의 주요
관심사는 유기 용매에서 고활성을 유지하고 안정적으로 선택적인 반응이 가능한 효소를 개발하는 것이다. 특정 효소의 이상적인 고정화 방법은 시간이
지남에 따라 높은 촉매 활성을 유지하면서 효소의 높은 전환율을 가능하도록 하는 것이다. 단백질은 다양한 입자의 표면에 물리적으로 흡착시키거나
활성화 된 나노 입자에 공유 결합함으로써 고정화된다.
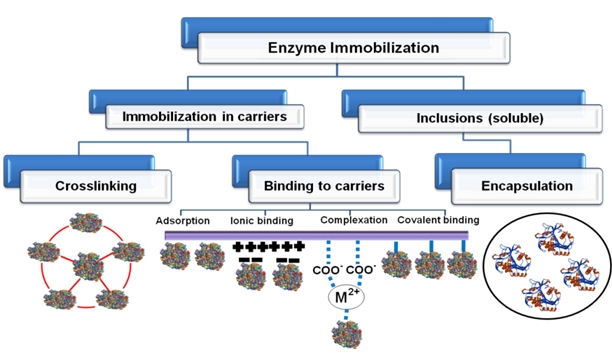
그림 2. 다양한 방법을 통한
효소 고정화
2.1. 활성도
1960년대 초 골드스타인의 연구에서 미세환경 효과로 인해
고정화 된 효소의 활성이 향상됨을 확인하였다. 일반적으로, 고정화에 따른 효소 활성의 향상은 미세 환경, 분할 효과, 확산 효과, 구조 변화,
분자 배향, 구조의 유연성, 유도 및 접합 방식에 따라 달라진다. 많은 고정화된 효소들이 천연 상태의 효소들과 비교해 높은 활성을 나타내는
것으로 관찰되었다 (Hirsh et al. 2010). 고정화된 효소가 기질에 의해 저해되는 것을 억제할 때, 천연 효소보다 더 활성이 높아질
수 있다. 예를 들어, 다공성 셀룰로오스 입자에 칸디다 유틸러스에서 얻은 자당효소를 고정화시킴으로써 기질 저해가 감소되고 효소의 활성도가
증가하였다. 최근 고정화기술, 특히 배향성 고정화기술의 발전으로 인해 유리한 기질의 접근성 증대와 활성부위 변성을 줄여줌으로 인해 무작위로
고정화된 효소와 비교하여 고활성이 확보되고 있다. 일반적인 고정화 기술들의 경우 활성도 유지율이 제한적이고, 효소 부하량, pH, 운반체, 화학
결합 작용과 같은 고정화 조건들을 지속적으로 관찰해야 한다. 공유 결합에 의한 배향성 효소고정화는 효소의 기능성은 보존하면서도 균질층을 형성하게
된다. 최근에 시토크롬 C 환원효소를 분석한 결과 배향성 고정화 효소 샘플은 유리한 접근성때문에 무작위로 고정화된 효소와 비교해서 활성도가 3배
높았다 (Marcuello et al. 2012). 질서정연하게 배향성 고정화 된 효소 분자들은 대체로 무작위로 고정화 된 효소분자와 비교해
활성도나 안정성이 높다.
2.2. 열안정성
효소의 안정성을 위한 고정화 방법으로 교차결합, 다지점
접합, 공유 및 비공유 고정화 등 많은 유용한 전략들이 개발되었다. 고정화된 효소의 안정성은 지지체와의 상호 작용, 접착 위치, 접합의 수,
구조의 자유도, 미세 환경, 지지체의 구조, 스페이서의 특성 (전하를 띤 또는 중립, 친수성 또는 소수성, 크기), 고정화 조건과 같은 다양한
요인에 의해 결정된다. 고정화된 효소의 안정성은 종종 개별 안정화 인자 또는 개별 인자의 누적 효과에 의해 결정된다. 동일한 고정화 방법을
사용하더라도 선택한 지지체와 고정화 조건에 따라 안정성이 달라진다. 고정화 공정에 대한 이해가 늘어나면서, 고정화를 이용한 효소의 안정성도
고려해야만 한다. 호열성 및 과호열성 효소는 고정화를 이용해 안정성을 더 향상 시킬 수 있는데, 이는 고정화가 효소의 안정성을 향상시키는 속성을
가지고 있음을 의미한다.
물리적 흡착과 공유 결합 모두가 효소 침출을 감소시키거나 방지하고, 평면에 접합할 경우 안정성이 감소하거나 단백질
변성을 초래할 수 있다. 효소의 교차 결합은 일반적으로 활성을 낮추나, 안정성을 증가시킨다. 마이셀 또는 마이셀 폴리머로 마이크로캡슐을
형성시키면, 물질의 전도 문제가 발생할 수는 있지만 효소 수명연장과 효소 침출 방지에 있어서 큰 잠재력을 가지고 있다. 외부 유기 또는 무기
지지체에 효소를 결합하면 추가적인 공유 또는 비공유 상호 작용을 유도할 수 있다. 이러한 추가적 상호작용은 효소의 구조적 유연성을 감소시키고
고정화된 효소에 강성을 부여함으로써, 결과적으로 효소의 변성을 감소시키게 된다. 그림 3은 안정성을 향상시키기 위해 지지체에 효소를 고정화
시키는데 사용되는 다양한 전략을 보여준다. 운반체에 효소를 고정화시켜 안정성을 향상시키는 다지점접착 (또는 교차결합)은 안정된 운반체에 고정된
효소를 설계하기 위해서 연구되었다. 다지점접합을 사용해서 효소를 고정화 시킬 경우 안정성 향상 정도는 효소와 지지체 사이에 형성된 결합의 수에
의해 결정된다. 최대수의 효소군이 고정화될 수 있도록 지지체, 반응군, 고정화 조건의 속성을 신중하게 선택해야
한다.
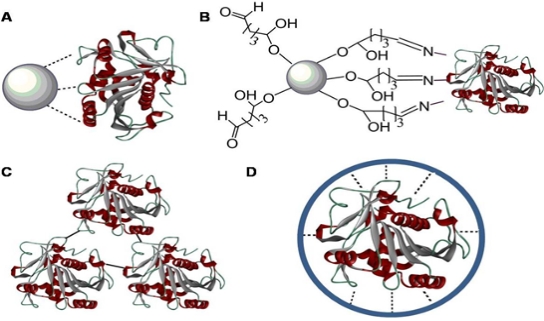
그림 3. 고정화 즉, 외부 매트릭스에 추가적인 공유 및 비공유 접합력 부여를 통한 효소의 안정성 향상 방법. (가) 효소를 나노입자에 비공유 물리적 흡착 (나) 효소를 나노입자에 공유 결합 (다지점 접착), (다) 효소를 공유 교차결합, (라) 효소를 micelle을 이용해 미세갭슐에 고정
운반체에 효소를 공유 결합시키면 효소가 단단히 고정된다는 이점이 있는데, 이는 효소와 운반체 간의 다중의 공유 결합이 형성되면 구조적 유연성과 열진동이 감소하고 결과적으로 단백질 풀림이나 변성을 방지할 수 있기 때문이다 (Hanefeld, Gardossi and Magner 2009; Wong, Khan and Micklefield 2009). 대부분의 경우 안정화율은 1000~10,000배, 활성 복원률도 약 60%이다. 주의할 점은 안정된 효소를 얻기 위해 다른 기법을 사용하고자 할 경우, 다지점 공유 접합에 의한 효소 안정성 향상기법과 호환이 가능한 지를 확인해야 한다. 이는 고정화기법이 산업용 생체촉매를 준비하는데 반드시 필요한 단계이기 때문이다.
2.3. 용매 안정성
효소는 유기 용매에서 응집체를 형성하는 경향이 있으며,
따라서 기질에 접근하는 것이 어렵다. 효소에 대한 유기 용매의 효과는 일반적으로 부정적이지만, 이러한 부정적인 영향력은 고정화 된 효소를 사용할
경우 완화될 수 있다. 효소를 고정화하면 유기 용매 내에서 효소의 활성도를 100배 수준까지 증가시킬 수 있다. 다공성(mesoporous)
물질은 외부 계면과 상호작용하지 않고도 효소 분자를 완전히 분산시킬 수 있는 공극 구조를 갖고 있기 때문에 많은 관심을 끌었다. 또한 고정화된
효소의 분자는 외부의 소수성 계면과 접촉하지 않게 되고, 고체의 공극안에 고정된 효소를 비활성화시킬 수 없게 한다. 유기 용매에서는 고정화된
효소가 수용상에서 용해되는 분자들과 접촉할 가능성도 있지만 유기상의 분자와는 접촉하지 않는다. 따라서, 다공성 고체 안에 효소를 고정화하는 모든
기법은 효소의 천연상태의 구조에 영향을 주지 않고 효소에 기능 안정성을 제공한다. 고정화된 효소의 활성은 호수성(aquaphilicity)과
같은 지지체의 속성에 영향을 받는다. 예를 들어, 실리카겔에 라카제(laccase)를 고정시키면 활성이 에틸 아세테이트와 메틸렌 클로라이드와
비교 시 다이에테르에서 활성도가 각각 20배와 72배 더 높다. 나아가, 나일론 66 멤브레인 지지체는 위의 세가지 용매에서 가장 높은 라카제
활성을 보여준다. 이는 지지체 매트릭스의 효소활성에 대한 영향이 용매에 따른 효소 활성의 차이보다 더욱 두드러지게 높게 나타난다는 것을
의미한다.
2.4. 선택성
광학적으로 고순도 중간체에 대한 제약산업의 수요가 증가하고
있기 때문에 효소의 선택성은 근래 들어 효소매개 비대칭 합성에서 가장 중요한 자산이다. 효소는 천연 기질에 대해 높은 기질 특이성을 보이며 천연
기질이 아닌 다른 합물에 대해 사용할 때, 그 활성이 크게 감소한다. 효소의 선택성은 기질 선택성, 입체 선택성과 위치 선택성으로 구성되며,
이는 특정 고정화 기법을 선택하여 조절이 가능하다 (Yilmaz et al. 2011). 효소 선택성을 조절하기 위해서 유전 공학기법이 널리
사용되어 왔으나, 공유접합법, 포괄법, 흡착법과 같은 다양한 고정화기법을 사용해서 보다 간편하게 효소 선택성을 조절한 다수의 흥미로운 사례가
있다. 클로로퍼옥시다제와 같은 비선택적 효소가 고정화 이후에 입체선택적 효소로 변환되고 S-선택적 효소가 공유 고정화 후, R-선택적 효소로
변환된 사례를 보여주는 많은 연구들이 있다.
고정화 기술에 의해 영향을 받을 수 있는 선택성은 지지체 제어 방식 (기공
크기 제어 및 확산 제어)과 구조 제어 방식 (미세 제어 및 활성 부위 제어) 두 개의 주요 그룹으로 세분화 할 수 있다. 효소 선택성 향상과
관련해 위와 같이 반응 선택성, 기질 선택성, 입체 선택성, 또는 화학 선택성과 같은 선택성이 반응 매개 공학과 함께 고정화 절차에 의해 영향을
받을 수 있음을 보여주는 고정화 효소 사례가 많이 있다. 그러나, 고정화를 통해 효소 선택성을 개선하는 것은 근본적으로는 새로운 시도라서,
실험에 지침이 될 수 있는 가이드라인이 부족하다. 그럼에도 불구하고, 효소 선택성과 유전자 공학 또는 다른 화학적 변형에 따른 구조적 변화
사이의 상관관계에 대한 이해가 증가하면, 가까운 미래에 고정화를 통한 효소 선택성 개선의 성공 사례가 급증할 것으로
예상된다.
2.5. 기질 내성
반응 중
기질, 반응 생성물, 대용량 반응 용액의 구성물질에 의한 효소의 억제는 산업 공정에서 생체촉매의 응용에 있어서 중요한 이슈이다. 억제의 유형에
따라, 특정 억제제는 특정 위치에 있는 효소 구조와 상호작용을 함으로써 억제를 야기하는 경향이 있다. 이때 고정화는 서로 다른 상황에서 억제제의
종류에 따라 억제를 감소시킬 수도 있다. 첫째, 억제제가 입체적으로 다른 부위 (allosteric site)에 작용할 경우, 활성 중심부위와
다른 위치에 있는 단백질과 반응 시, 효소의 입체적 allosteric site는 고정화 절차 과정에서 차단되고, 이로 인해 효소 활성의 억제는
감소된다. 둘째, 억제제가 단백질의 활성부위와 상호 작용할 시, 고정화하는 효소의 활성부위를 막거나, 일부의 경우 기질의 결합부위보다 억제제
결합부위에서 더 많이 막아 기질이 결합하지 못하게 할 수도 있다. 만약 기질이 억제제보다 더 크고 더 많은 수의 효소의 단위체와 상호작용하게
되면 그 발생 가능성이 더욱 높다.
2.6. 다단계 반응
공동
고정화 다중 효소 시스템은 경제적 및 환경적 제약으로 인해 더욱 더 각광 받고 있는데, 이는 각각의 촉매를 구획화하여 인공적 효소 연쇄 과정을
통해 다중 효소 반응을 유도하는 것이다. 결합된 효소 시스템의 공동 고정화는 활성도와 안정성을 향상시킬 수 있다 (Cho et al.
2012). 나이트로벤젠, 나이트로리덕타아제 및 글루코스-6-인산 탈수소효소를 실리카 입자 안에 공동 캘슐화하였을 때 글루코스-6-인산
탈수소효소가 NADPH의 재생을 가능하게 해준다. 이와 같이 공동 고정화는 분자 바이오센싱에서 보조인자의 재생과 다중 생체촉매의 조합에
이르기까지 다양한 생체기술 응용 분야에 걸쳐 혜택을 제공한다 (Betancor et al. 2006). 고정화 동안 효소를 선택적으로 구획화하는
것은 이점을 제공할 수 있다 (van Dongen et al. 2009). 즉, 이소시아노펩티드와 스티렌의 공동합체를 사용하여 고추냉이
과산화물과 CAL?B 및 글루코스 옥시다제를 각각 멤브레인 표면 위, 이중층 멤브레인 안과 폴리머좀 내강 안에 고정시킨 다공성 폴리머좀을
형성하였을 때, 이 세 효소는 세 가지의 순차적 단계의 반응을 효율적으로 수행할 수 있었다. Spherezymes를 이용해서 이와 유사한 구획화
및 다중 효소 (라카아제와 리파아제)를 제조하였다 (Brady et al. 2008). 또한 상업용 α-아밀라아제, 셀룰라아제, 프로테아제 및
리파제를 플라스틱 비커의 내부와 플라스틱 브러시의 솔에 공유 공동 고정화한 후 천의 얼룩 제거에 사용에 대해 보고한 바 있다 (Pundir
and Chauhan 2012). 공동 고정화한 효소는 보다 경제적이고 환경 친화적인 공정을 개발하기 위해 최근에 고가의 상업용 및 생물학적
접근법에서 광범위하게 사용되고 있다.
3. 효소고정화의 발전 및
신기술
나노와 하이브리드 기술분야의 최근 발전은 다양한 재료를 이용해 효소 고정화에 더 저렴한 소재를 사용할 수 있도록 해
주었다. 그 결과, 유기와 무기물을 혼합한 다양한 나노구조의 재료들이 고유의 넓은 표면적과 기공 크기, 친수성/소수성 밸런스, 친수성 및 표면
화학과 같은 물리 화학적 특성때문에 효소고정화 지지체로서 많은 관심을 받아 왔다. 넓은 표면적과 제어된 기공 크기는 종종 효소 로딩량을
향상시키는데, 이는 재래식 재료와 비교해 단위 부피당 효소 활성을 증가시킨다. 크기 및 형태를 조절할 수 있는 능력을 가진 나노 구조 물질은
효소와의 상호작용을 향상시키고, 고정화 효율을 증가시키며, 효소의 장기 보존 및 재활용 안정성을 향상시킨다 (Kim, Grate and Wang
2008). 또한, 이러한 유기, 무기 또는 하이브리드 재료는 적절한 미세 환경에서 강도, 탄성, 소성, 및 화학적 결합과 향상시키는 특정
기능을 제공할 수 있다. 이러한 다중벽탄소 나노튜브, 자성 나노입자, 실리카 나노입자 및 quantum dot과 같은 다양한 유기 또는 무기
나노물질은 추가적인 물리적 특성 및 기계적 안정성을 가진 하이브리드 복합 나노섬유를 생성하는데도 이용되고 있다 (Hwang et al.
2011).
지난 10년 동안 고정화 효소의 안정성을 확보하고 새로운 지지체를 개발하기 위해 지지체 표면 위 효소를 위한 미세 환경 조절을
위한 많은 연구가 수행되어 왔다. 그러나 체외 환경에서 효소의 특성을 향상시키기 위해 세포의 환경을 모방하는데 중점을 둔 연구는 거의 없었다.
더욱이, 많은 시도들은 고정화된 효소의 열 안정성을 향상시킨다고 보고된 방법으로 지지체 위에 단백질을 다중 공유결합을 통해 부착하는 방법에
집중되어 왔다. 그러나 안정화 효과는 특정 임계점에 도달하기 전까지는 효소와 지지체 사이에 공동 결합의 수에 비례해서 증가한다. 지지체 표면
위에 존재하는 잉여 활성화 단위체는 효소비활성화 가능성을 증가시킨다.
3.1. 초단파 복사
최근
초단파 복사는 화학 반응을 급격히 가속화시키고 고정화에 드는 반응시간을 단축시킨다는 것이 증명되었다 (Dallinger and Kappe
2007). 초단파 복사는 질량 이동에 추가적인 원동력을 제공하고 질량 이동을 가속화 한다. 그로인해 많은 고전적인 유기 반응을 향상시키고 반응
조건을 간소화시키는데 초단파 복사가 사용되어 왔다. 초단파 복사 하에서 수행된 반응은 기존 조건에서 수행된 반응과 비교해 더 빠르게 진행되고,
더 깨끗하며, 산출량은 더 많으며, 재생률은 더 높다. 최근에는 초극파를 이용한 불균질 산화와 환원 반응이 많은 관심을 받고 있다.
3.2. 광고정화
기술
단백질 분자는 광반응성 중합체와 함께 365 nm의 자외선에 노출 시, 약 10 ~ 20 분 후, 중합체의 반응성이
높은 니트렌에 의한 공유 결합을 통해 고정화된다. 광반응성 중합체가 자외선에 노출될 시 C-H 결합 사이에 끼어드는 특성을 가지고 있으며
생체분자와 결합할 수 있는 능력을 가진 고반응성의 니트렌을 생성하는데, 이는 기능성 단위체와 상관없이 생체분자를 고정화하는데 중요한 역할을
한다. 최적의 고정화를 위해 필요한 햇빛의 강도가 21,625 룩스 내외로 간주되며, 따라서 광고정화를 위한 365nm 자외선과 비교해 햇빛이
좋은 대안이 될 수 있다. 그러므로 광고정화는 친환경 기법이며 대규모 및 소규모 고정화에 모두 적합하다.
3.3. 효소에 의한
효소고정화
효소 단백질의 부분적 변성을 피하기 위해서는 유독한 화학 물질을 사용하지 않고 친환경 성분을 사용하는 것이 효소
산업에 있어서 주요 목표이다. 효소를 이용한 효소고정화는 고체 단백질 형성물을 제작하는 유망 기술이다. 향상된 녹색 형광 단백질 (EGFP)과
글루타티온 S-전달효소 (GST)를 모델 단백질로서 카제인 코팅된 폴리스티렌 표면에 고정화한 연구에 따르면 EGFP와 GST는 각각의 C-말단에
MTG (Leu-Leu-Gln-Gly, LLQG-tag)를 위해 중립적인 Gln 공여기질 펩타이드를 태그하였다. 이 전략은 루시페라제
(Luc)와 GST ybbR-융합 단백질, 티오레독신 융합 단백질 등 다양한 단백질을 고정화하는데 적용되었다.
3.4. 다공성 물질 위에 효소
제어고정화
단백질 지지체 결합의 화학적 성질에 초점을 맞추어 낮은 단백질 로딩 조건 하에서 고정화 속도를 변경하여 형광
단백질의 분포를 제어하는 다양한 방법이 제시되었다 (Bolivar et al. 2011). 가시적인 고정화 속도 제어에 의한 단백질 고정화
제어는 두 가지의 형광 단백질을 동일한 운반체에 고정화하며, 그로 인해 네 가지의 다른 분포 패턴을 형성한다. 두 가지 단백질이 하나의 다극성
운반체 내부에 맞춤식으로 분포시키는 것은 고정화 기술을 선도하고 있다. 두 단백질군 중의 하나는 알칼리 조건 하에서 반응성이 높기 때문에 강한
공유 단백질-지지체 결합을 촉진시킬 수 있는 반면, 다른 군은 비교적 중성 PH 6-8 하에서 단백질을 가역적으로 고정화한다. 단백질 분포를
제어하는 또 다른 흥미로운 접근 방법은 다른 반응 단위체에 의해 활성화된 동일한 고체 지지체에 다중 효소계를 고정화하는 것이다. 근래에 활성화된
아가로스-타입 지지체 위에 재생용 탈수소효소를 포함한 세가지 생체-산화환원 연쇄반응을 위한 공동 고정화에 대한 연구 결과를 발표된 바 있다
(Rocha-Martin et al. 2012).
4. 결론
이상과 같이
안정성, 선택성, 기질 또는 효소의 용제 내성 등의 문제를 해결하기 위한 방법과 고정화된 효소의 생화학적 및 물리적 특성을 조절한 사례를 살펴
보았다. 단백질 공학이나 고정화 중 한 가지 방법만을 사용해서는 산업 공정을 위한 이상적인 효소 촉매반응을 만들 수 없다. 현재까지는 효소의
특성을 산업 현장에서 요구되는 수준으로 조절할 수 있는 보편 절대적인 방법은 개발되지 않고 있다. 따라서 효소고정화 단독 또는 단백질 공학과
효소고정화의 조합은 많은 산업 공정을 개선할 수 있는 강력한 도구이며, 앞으로도 이와 관련해 더 많은 노력이 있을 것으로 예상된다. 적합한
산업화 공정 설계를 구축할 경우, 고정화 단독 또는 단백질 공학과 효소고정화의 복합 사용은 산업적으로 중요성이 큰 효소 공정의 산업화를 위한
성공적 전략이 될 것이다.
5. 인용문헌
1.
Betancor, L., C. Berne, H. R. Luckarift & J. C. Spain (2006)
Coimmobilization of a redox enzyme and a cofactor regeneration system. Chemical
Communications, 3640-3642.
2. Bolivar, J. M., A. Hidalgo, L. Sanchez-Ruiloba,
J. Berenguer, J. M. Guisan & F. Lopez-Gallego (2011) Modulation of the
distribution of small proteins within porous matrixes by smart-control of the
immobilization rate. J. Biotechnol, 155, 412-420.
3. Brady, D., J. Jordaan,
C. Simpson, A. Chetty, C. Arumugam & F. S. Moolman (2008) Spherezymes: A
novel structured self-immobilisation enzyme technology. BMC Biotechnology,
8.
4. Cho, E. J., S. Jung, H. J. Kim, Y. G. Lee, K. C. Nam, H. J. Lee &
H. J. Bae (2012) Co-immobilization of three cellulases on Au-doped magnetic
silica nanoparticles for the degradation of cellulose. Chem Commun, 48,
886-8.
5. Dallinger, D. & C. O. Kappe (2007) Microwave-assisted synthesis
in water as solvent. Chemical Reviews, 107, 2563-2591.
6. Hanefeld, U., L.
Gardossi & E. Magner (2009) Understanding enzyme immobilisation. Chem Soc
Rev, 38, 453-68.
7. Hirsh, S. L., M. M. M. Bilek, N. J. Nosworthy, A.
Kondyurin, C. G. dos Remedios & D. R. McKenzie (2010) A comparison of
covalent immobilization and physical adsorption of a cellulase enzyme mixture.
Langmuir, 26, 14380-14388.
8. Hwang, E. T., R. Tatavarty, H. Lee, J. Kim
& M. B. Gu (2011) Shape reformable polymeric nanofibers entrapped with QDs
as a scaffold for enzyme stabilization. J Materials Chem, 21, 5215-5218.
9.
Kim, J., J. W. Grate & P. Wang (2008) Nanobiocatalysis and its potential
applications. Trends Biotechnol, 26, 639-46.
10. Marcuello, C., R. de Miguel,
C. Gomez-Moreno, M. Martinez-Julvez & A. Lostao (2012) An efficient method
for enzyme immobilization evidenced by atomic force micros. Protein Eng Des
Sel, 25, 715-23.
11. Pundir, C. S. & N. Chauhan (2012) Coimmobilization
of detergent enzymes onto a plastic bucket and brush for their application in
cloth washing. Ind Engineer Chem Res, 51, 3556-3563.
12. Rocha-Martin, J., B.
de las Rivas, R. Munoz, J. M. Guisan & F. Lopez-Gallego (2012) Rational
co-immobilization of bi-enzyme cascades on porous supports and their
applications in bio-redox reactions with in situ recycling of soluble cofactors.
Chemcatchem, 4, 1279-1288.
13. van Dongen, S. F. M., M. Nallani, J. L. L. M.
Cornelissen, R. J. M. Nolte & J. C. M. van Hest (2009) A three-enzyme
cascade reaction through positional assembly of enzymes in a polymersome
nanoreactor. Chemistry-a European Journal, 15, 1107-1114.
14. Wong, L. S., F.
Khan & J. Micklefield (2009) Selective covalent protein immobilization:
strategies and applications. Chem Rev, 109, 4025-53.
15. Yilmaz, E., K. Can,
M. Sezgin & M. Yilmaz (2011) Immobilization of Candida rugosa lipase on
glass beads for enantioive hydrolysis of racemic naproxen methyl ester.
Bioresour Technol, 102, 499-506.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 생촉매의 업그레이딩을 위한 고정화 연구 동향_이정걸 교수.pdf
생촉매의 업그레이딩을 위한 고정화 연구 동향_이정걸 교수.pdf