기술동향
효소를 이용한 천연물 유도체의 글리코실화
- 등록일2016-01-20
- 조회수7166
- 분류기술동향
-
자료발간일
2016-01-07
-
출처
지능형 바이오시스템 설계 및 합성 연구단
- 원문링크
-
키워드
#효소#글리코실화#천연물 유도체#천연물#생리활성
- 첨부파일
출처 : 지능형 바이오시스템 설계 및 합성 연구단
효소를 이용한 천연물 유도체의 글리코실화
서강대학교 화학과 이현수 교수
1. 서론
탄수화물(carbohydrates)은 많은 생체 내의 분자들에서 발견되고, 다양한 생명 현상에서 중요한 역할을 한다. 천연물 또는 천연물 유도체로부터 개발된 생리활성을 가진 분자들은 탄수화물을 포함하고 있는 경우가 많다. 이러한 생리활성 분자들에서 발견되는 탄수화물은 그 약물의 효능 및 약물동역학 (pharmacokinetics) 등에 결정적인 역할을 한다. 예를 들어, 잘 알려진 항생제 중의 하나인 vancomycin에 존재하는 이당체 (disaccharide)는 이 약물의 효능에 매우 중요해서, 이 이당체를 제외한 vancomycin은 거의 약효를 나타내지 않고, 또 이러한 탄수화물의 변형은 전혀 다른 형태의 약효를 보이기도 한다. 또 다른 천연물인 digitoxin은 삼당체를 포함하고 있고, 이 삼당체를 다양한 단당체로 치환하면, 보다 향상된 항암효과와 독성의 감소를 나타내었다.(그림 1) 이러한 중요성 때문에 천연물에 존재하는 탄수화물을 변형하여 신약을 개발하려는 시도가 꾸준히 진행되고 있다. 그러나, 천연물의 탄수화물을 변형할 수 있는 화학적 방법의 부재로 인해서 괄목할 만한 진전이 없는 상태이다. 본 총설에서는 효소, 특히 글리코실트랜스퍼라제 (glycosyltransferases, GTs)를 이용한 약물 또는 저분자 화합물의 글리코실화, 특히 다양한 구조의 당을 도입하는 glycorandomization에 대한 내용을 소개하고자 한다.
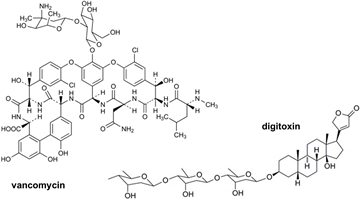
그림1 . Vancomycin과 digitoxin의 구조.
2. 글리코실화에 중요한 효소들
생물체 내에 존재하는 탄수화물을 포함한 분자들은 대부분 효소에 의한 글리코실화에 의해서 합성된다. 여기서는 glycorandomization에 이용될 수 있는 효소들에 대해서 살펴보고자 한다 (그림 2). 자연에서 글리코실화를 위해 사용되는 많은 효소들이 있지만, glycorandomization에 이용될 수 있는 적절한 효소를 선택하는데 있어서는 다양한 기질에 작용할 수 있는 넓은 기질 선택성 (broad substrate specificity)과 다양한 기질에 대한 효소의 효율성, 그리고 효소와 기질의 합성의 편의성 (availability)이 고려되어야 한다.
2-1. 글리코시데이즈 (glycosidases)와 트랜스그리코실화 (transglycosylation)
글리코시데이즈는 적절한 leaving group을 가지는 이당, 삼당, 올리고당 또는 글리코사이드 (glycosides)로부터 당을 받아들이는 분자 (sugar-acceptors)에 당을 전달하는 반응에 작용하는 효소이다. 이러한 글리코실화는 높은 위치/입체 선택성을 가지지만, 열역학적 변수와 가수분해 반응과의 경쟁 등에 의해서 효율이 떨어지는 한계를 가진다. 그리고 원형 (wild type) 글리코시데이즈는 약물 유사체나 천연물을 기질로 받아들이지 않기 때문에 변형된 글리코시데이즈가 글리코실화에 이용되어 왔다. 이러한 변형 글리코시데이즈에는 글리코신테이즈 (glycosynthases), 티오글리코라이게이즈 (thioglycoligases), 티오글리코신테이즈(thioglycosynthases), O-글리코라이게이즈(O-glycoligases) 등이 있다. 이 변형된 효소들에서 나타나는 공통점은 원형 효소 활성부위에 존재하는 친핵체 (대체로 아스파틱 산이나 글루타민 산)가 다른 비활성 아미노산으로 변형되었고, 글리코실화 효율의 향상을 위해서 다양한 활성화된 글리코실 전달체 (glycosyl halides나 aromatic glycosides)를 사용했다는 점이다.
2-2. 글리칸포스포릴레이즈 (glycan phosphorylases)
글리칸포스포릴레이즈는 당의 phosphorylysis를 통해서 sugar-1-phosphates의 형성을 촉매한다. 글리코시데이즈에 의한 글리코실화와 비교해서 글리칸포스포릴레이즈의 장점은 가수분해와 같은 경쟁하는 부반응이 거의 없다는 것이다. 최근에 이 효소를 이용하여 다양한 글리코실 수용체 (acceptor)에 글리코실화를 성공한 예가 몇 가지 발표되었다. 앞으로 이 효소의 변형을 통해서 이 효소를 이용하여 글리코실화를 시킬 수 있는 기질이 다양화될 것으로 기대가 된다. 그러나 glycorandomization으로의 응용성의 확대를 위해서는 다양한 sugar-1- phosphate를 쉽게 얻을 수 있는 방법의 개발이 수반되어야 한다.
2-3. 글리코실트랜스퍼레이즈 (Glycosyltransferases, GTs)
위에서 언급한 효소와 비교할 때, GTs는 다양한 기질에 대해서 글리코실화를 진행시키는 것으로 알려져 있고, 65,000개 (대부분이 Leloir-type GTs, 즉 글리코실 전달체로 sugar nucleotides를 사용하는 GTs이다)가 넘는 GTs가 알려져 있기 때문에 GTs는 glycorandomization을 위해서 보다 효과적인 효소라고 볼 수 있다. 게다가 GT 변형체 라이브러리를 HTS (high-throughput screening) 할 수 있는 방법들이 개발되어서 좀 더 개량된 GTs를 얻을 수 있는 가능성이 높다. 한가지 단점은 GTs의 글리코실 전달체로 사용되는 sugar nucleotides들이 시중에서 구입할 수 있는 것이 많지 않다는 점이다. 그러나 최근 이러한 한계를 극복할 수 있는 방법들이 개발되고 있기 때문에, GTs를 이용한 좀 더 확장된 glycorandomization 관련 연구들이 계속 진행될 것으로 기대된다.
3. 효소를 이용한 sugar nucleotides 합성
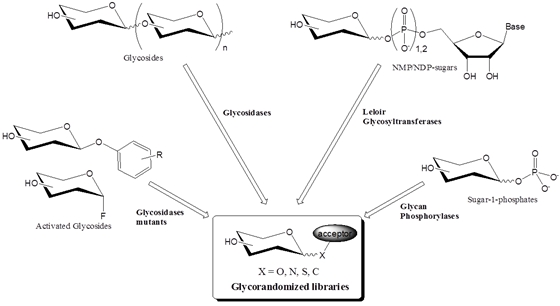
그림2 . 효소를 이용하여 Glycorandomized library를 구축하는데 사용되는 일반적인 방법들.
효소를 이용한 glycorandomization이 효율 및 위치/입체 선택성 면에서 장점이 있지만, 가장 큰 걸림돌로 작용하는 것이 sugar donors를 얻기가 힘들다는 점이다. 특히 GT를 이용한 glycorandomization에서는 sugar nucleotide가 donor로 사용되고, 앞에서도 언급했듯이, 다양한 sugar nucleotide를 얻는 것이 매우 어렵다. 가장 직접적인 방법은 이러한 donor를 화학적으로 합성하는 것이지만, 다양한 구조의 당에 대해서 sugar nucleotide library를 만드는 데는 탄수화물의 화학적 특성을 고려할 때, 근본적인 한계가 있다. 따라서 여기서는 최근에 연구된 효소를 이용한 sugar nucleotide의 합성에 관하여 살펴보고자 한다. (그림 3)
3-1. NDP-sugar 생합성 과정을 개량한 다중 효소에 의한 합성
이 방법은 in vivo와 in vitro에서 진행되는 과정으로 나눌 수 있다. in vivo에서 사용하는 방법은 자연에 존재하는 NDP-sugar의 생합성 과정에 관여하는 효소들을 2차 대사물을 생산하는 미생물에서 발현시켜서 다양하게 글리코실화된 2차 대사물을 얻을 수 있다. in vitro에서 사용하는 방법은 우선 NDP-sugar의 생합성 과정에 관여하는 효소들을 발현하고, 정제하여 NDP-sugar를 합성하는 방법이다. 이 방법들을 이용하여 NDP-sugar를 합성하는 것은 가능하지만, 원형 효소의 활성에 의존하기 때문에 다양한 NDP-sugar를 얻는 데는 한계가 있다.
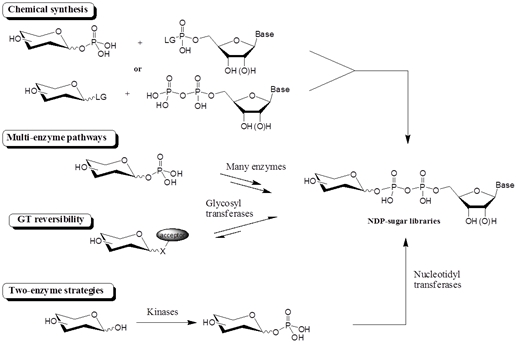
그림3 . Glycorandomization을 위해 사용되는 NDP-sugar library의 합성을 위한 일반적인 방법.
3-2. 이중 효소에 의한 합성
자연에서 찾을 수 있는 가장 짧은 NDP-sugar 합성 루트는 카이나제(kinase)가 아노머 인산화 (anomeric phosphorylation)에 의해 sugar-1-phosphate를 합성하고, 그 다음 뉴클레오디딜트렌스페라제 (nucleotidyltransferases, NTs)가 이미 합성된 sugar-1-phosphate에 뉴클레오티드를 더하는 과정이다 (그림 3). 이 합성 루트를 이용하면 비교적 쉽게 다양한 NDP-sugar를 합성할 수 있다.
다양한 sugar-1-phosphate의 합성에는 주로 아노머 카이나제 (anomeric kinase)가 사용된다. 아노머 카이나제는 NTP의 γ-phosphate가 sugar의 아노머 위치로 도입되는 반응을 촉매하여 sugar-1-phosphate를 합성한다. 현재까지 아주 다양한 아노머 카이나제가 sugar-1- phosphate를 합성하는데 사용되었다. 공간의 부족으로 여기서는 자세히 언급할 수 없지만 각 카이나제가 어떤 sugar를 기질로 사용할 수 있는지는 참고문헌에 잘 정리되어 있다.
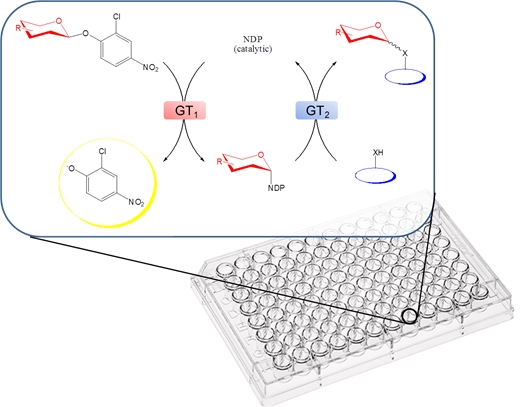
그림4 . 2-chloro-4-nitrophenyl glycoside를 이용한 NDP-sugar library 합성을 응용하여 글리코실화를 가능하게 하는 GT를 찾기 위한 high- throughput, colorimetric screening 방법.
NTs는 sugar-1-phosphate와 NTPs로부터 NDP-sugar를 합성하는 반응을 가역적으로 촉매한다. 아노머 카이나제와 함께 NTs도 다양한 종류의 효소가 연구되어 비교적 광범위한 sugar-1-phosphate에 작용하여 NDP-sugar를 합성하는 NTs가 보고되었다. 자세한 NTs의 종류와 각 NT에 기질로 사용되는 sugar-1-phosphates는 역시 참고문헌에 잘 정리되어 있다. 현재까지 아노머 카이나제와 NTs를 이용한 이중 효소 방법에 의해 180여개의 NDP-sugars가 합성되었고, 이 중에는 다음 과정에서 labeling 등에 이용될 수 있는 흥미로운 작용기 (예를 들어 azide 같은 작용기)를 가지고 있는 것들도 포함되어 있다.
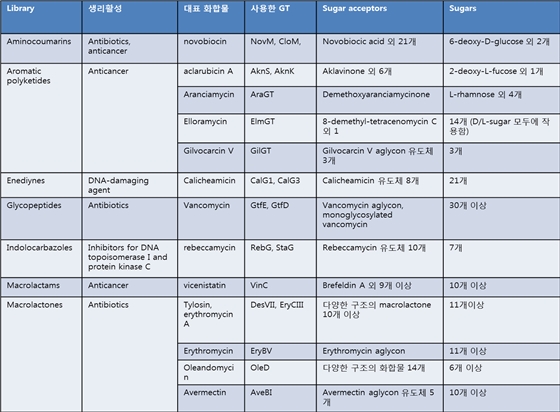
표 1. 대표적인 glycorandomized libraries.
3-3. GT의 가역성을 이용한 방법
GT에 의한 글리코실화 반응은 가역적이기 때문에 이 반응의 평형을 역반응 쪽으로 치우치게 하면 NDP로부터 NDP-sugar를 간단하게 합성할 수 있다. 이 방법의 또 다른 문제점은 일반적으로 GT 반응의 결과로 생성된 glycosides는 복잡한 구조를 가지고, 또 다양한 구조의 sugar에 작용하는 GT를 찾기가 어렵다는 것이다. 그러나 최근에 2-chloro-4-nitrophenol glycosides와 oleandomycin D GT 변형체를 이용하여 다양한 구조의 UDP-/dTDP sugar를 합성한 연구가 보고되었다 (그림 4). 이 방법을 좀 더 확장하여 다른 NDP-sugar도 합성이 가능하게 되면 glycorandomization에 큰 성장이 있을 것으로 기대된다.
4. 대표적인 glycorandomized libraries
지금까지 GT에 의한 glycorandomization 방법을 이용하여 다양한 glycorandomized libraries가 합성되었다. 여기서는 생리활성이 있는 2차 대사물이나 약물 유도체를 중심으로 이러한 libraries를 요약하여 소개하고자 한다.
4-1. 원형 glycosyltransferases에 의해 합성된 libraries
표 1에서는 자연에 존재하는 GT를 그대로 이용하여 glycorandomized library를 만든 예들을 요약하였다. 이 표는 참고문헌에 서술된 내용 중, 중요한 내용만을 요약하여 정리한 것으로, 각각의 예에 대한 자세한 내용은 참고문헌를 참조하기 바란다.
4-2. 변형된 GT에 의해 합성된 libraries
표 1에서 요약된 자연에 존재하는 GT를 이용하여 합성된 glycorandomized library는 아주 많은 화합물들을 포함하고 있다. 하지만, 그 화합물들은 원형 GT에 존재하는 한정된 기질 선택성에 의존하기 때문에 화합물의 구조적 다양성에 있어서 한계가 있다. 그래서 원형 GT를 변형하여 보다 다양한 구조의 glycorandomized library를 구축하려는 노력이 진행되어 왔다. 질량분석법20이나 pH에 따라 색이 변하는 지시약을 이용하여 변형 GT library로부터 원하는 기질에 작용하는 GT를 얻어낸 예들이 있다. 하지만 이 방법들은 제한된 시스템에 대해서는 응용될 수 있지만, 비용적인 문제나 신호의 민감도 등의 문제로 다양한 구조의 library를 만드는 데는 한계가 있다.
최근에 형광에 기초한 GT assay 방법이 개발되었고, 이를 이용하여 비교적 다양한 구조의 천연물 유도체와 sugar-donor로부터 glycorandomized library를 구축한 예들이 보고되었다. 이 예들에서는 Oleandomycin D (OleD) 변형 library를 만들고, 이들 중 다양한 기질들에 작용할 수 있는 변형 OleD를 screening을 통해서 찾아냄으로써, novobiocin 유도체 등 매우 다양한 종류의 글리코실화된 화합물들을 얻을 수 있었다. 특히 3-3에서 언급한 2-chloro-4-nitrophenol glycosides와 Ole D 변형체로부터 만들어진 다양한 sugar-donor를 이용하여 GT library를 screening하면 기존에 있던 sugar-donor의 합성과 assay에 있어서의 한계를 모두 극복할 수 있음이 보고되었다 (그림 4). 실제로 이 시스템을 이용하여 vancomycin 유도체 등 11개의 글리코실화된 화합물을 합성하였다.
5. 결론
신약 개발에 있어서 당을 포함한 화합물들의 유용성을 생각할 때, 위에서 살펴본 glycorandomized library의 구축은 신약 개발에 큰 기여를 할 것으로 기대된다. 이러한 library 구축을 위한 방법으로써, 효소를 이용한 접근법은 아주 효과적인 방법이고, 앞으로도 많은 연구를 통한 큰 발전이 있을 것으로 기대된다.
6. 참고문헌
1. Ge, M., Chen, Z., Onishi, H. R., Kohler, J., Silver, L. L., Kerns, R., Fukuzawa, S.,Thompson, C., and Kahne, D. Science 1999, 284, 507?511.
2. Solenberg, P. J., Matsushima, P., Stack, D. R.,Wilkie, S. C., Thompson, R. C., and Baltz, R. H. Chem. Biol. 1997, 4, 195?202.
3. Langenhan, J. M., Peters, N. R., Guzei, I. A., Hoffmann, F. M., and Thorson, J. S. Proc. Natl. Acad. Sci. USA 2005, 102, 12305?12310.
4. L. X. Wang and W. Huang, Curr. Opin. Chem. Biol., 2009, 13, 592?600.
5. L. F. Mackenzie, Q. Wang, R. A. Warren and S. G. Withers, J. Am. Chem. Soc., 1998, 120, 5583?5584.
6. S. M. Wilkinson, C. W. Liew, J. P. Mackay, H. M. Salleh, S. G. Withers and M. D. McLeod, Org. Lett., 2008, 10, 1585?1588.
7. S. M. Hancock, J. R. Rich, M. E. Caines, N. C. Strynadka and S. G. Withers, Nat. Chem. Biol., 2009, 5, 508?514.
8. Z. Armstrong, S. Reitinger, T. Kantner and S. G. Withers, ChemBioChem, 2010, 11, 533?538.
9. Y. W. Kim, R. Zhang, H. Chen and S. G. Withers, Chem. Commun., 2010, 46, 8725?8727.
10. (a) H. Nakai, B. O. Petersen, Y. Westphal, A. Dilokpimol, M. Abou Hachem, J. O. Duus, H. A. Schols and B. Svensson, Protein Eng., Des. Sel., 2010, 23, 781?787. (b) S. Kawazoe, H. Izawa, M. Nawaji, Y. Kaneko and J. Kadokawa, Carbohydr. Res., 2010, 345, 631?636.
11. (a) G. J. Williams, C. Zhang and J. S. Thorson, Nat. Chem. Biol., 2007, 3, 657?662. (b) R. W. Gantt, R. D. Goff, G. J. Williams and J. S. Thorson, Angew. Chem., Int. Ed., 2008, 47, 8889?8892.
12. H. S. Lee and J. S. Thorson, Anal. Biochem., 2011, 418, 85-88.
13. A. Aharoni, K. Thieme, C. P. Chiu, S. Buchini, L. L. Lairson, H. Chen, N. C. Strynadka, W. W. Wakarchuk and S. G. Withers, Nat. Methods, 2006, 3, 609?614.
14. R. W. Gantt, P. Peltier and J. S. Thorson, Nat. Chem. Biol., 2011, 7, 685-691.
15. J. A. Salas and C. Mendez, Curr. Opin. Chem. Biol., 2009, 13, 152?160.
16. L. Tang and R. McDaniel, Chem. Biol., 2001, 8, 547?555.
17. H. Chen, M. G. Thomas, B. K. Hubbard, H. C. Losey, C. T. Walsh and M. D. Burkart, Proc. Natl. Acad. Sci. USA., 2000, 97, 11942?11947.
18. H. Takahashi, Y. N. Liu and H. W. Liu, J. Am. Chem. Soc., 2006, 128, 1432?1433.
19. R. W. Gantt, P. Peltier and J. S. Thorson, Nat. Prod. Rep., 2011, 28, 1811-1853.
20. M. Yang, M. Brazier, R. Edwards and B. G. Davis, ChemBioChem, 2005, 6, 346?357.
21. CM. Persson and M. M. Palcic, Anal. Biochem., 2008, 378, 1?7.
22. G. J. Williams and J. S. Thorson, Nat. Protoc., 2008, 3, 357?362.
23. C. Albermann, A. Soriano, J. Jiang, H. Vollmer, J. B. Biggins, W. A. Barton, J. Lesniak, D. B. Nikolov and J. S. Thorson, Org. Lett., 2003, 5, 933?936.
24. G. J. Williams, R. D. Goff, C. Zhang and J. S. Thorson, Chem. Biol., 2008, 15, 393?401.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
지식


 효소를 이용한 천연물 유도체의 글리코실화_이현수 교수.pdf
효소를 이용한 천연물 유도체의 글리코실화_이현수 교수.pdf