기술동향
대안적 텔로미어 유지기작의 분자적 활성 기전
- 등록일2016-02-15
- 조회수9058
- 분류기술동향
-
자료발간일
2016-02-11
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#텔로미어 유지기작#텔로미어#결합 단백질#단백질 구조#유지기작
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
대안적 텔로미어 유지기작의 분자적 활성 기전
본 자료는 Molecular mechanisms of activity and derepression of alternative lengthening of telomeres. Nature structural & molecular biology, 2015; 22(11): 875?880 의 논문을 한글로 번역, 요약한 자료입니다.
목차
1. 진핵생물 역사 속의 텔로미어 유지 기작
2. 대안적 텔로미어 유지 기작의 작동기전
3. 대안적 텔로미어 유지 기작의 활성을 위한 주형
4. 텔로미어 염색질의 대안적 텔로미어 유지 기작 억제 기능
5. 암세포에서 ALT의 억제가 풀리는 방식
5.1 유전적 변화
5.2 텔로미어 결합 단백질의 변화
6. 텔로미어 DNA 복제과정에서 발생하는 스트레스가 ALT에 미치는 영향
7. 결론과 전망
모든 염색체 양쪽 끝 부분에 존재하는 DNA인 텔로미어(telomere)는 G 염기가 큰 비중을 차지하는 반복서열로 이루어져 있다. 예를 들어, 척추동물의 텔로미어는 TTAGGC의 반복서열로 이루어져 있다. 일반적인 체세포의 경우 세포분열을 거듭함에 따라 텔로미어가 점진적으로 짧아진다. 텔로미어의 길이가 특정한 한계 이하로 줄어들면 세포가 더 이상 분열할 수 없게 된다. 이러한 방식으로 텔로미어는 세포가 복제할 수 있는 최대 한계치를 설정한다. 암의 중요한 특징 중 하나는 그 자신이 가진 무제한적인 분열 능력인데, 이 능력을 획득하기 위해서는 세포가 분열하는 동안 짧아지는 텔로미어의 길이를 유지해야만 한다. 공격적이고, 현재 치료하기 어려운 암세포 가운데 상당수는 상동 재조합을 통한 DNA 복제방식으로 텔로미어 길이를 유지하는데, 이러한 유지 기작을 대안적 텔로미어 유지 기작(alternative lengthening of telomeres, 약어로 ALT)라고 부른다 (그림 1). 이 리뷰에서는 대안적 텔로미어 유지기작의 본질과 정상 세포에서 억제되고 있는 방식에 대한 최근의 연구성과들에 초점을 맞추었다.
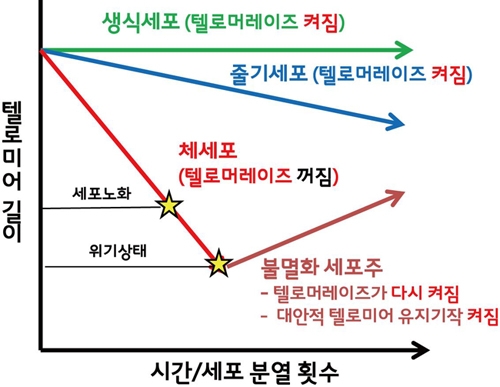
그림 1. 암세포에서 텔로미어 유지기작의 활성화
1. 진핵생물 역사 속의 텔로미어 유지기작
ALT 작동과정의 주요 요소인 상동 재조합과 DNA 합성은 궁극적으로 진핵생물 훨씬 이전에 존재했던 DNA 의존적인 생명체(선형 염색체를 가지고 있으므로 텔로미어 유지 기작이 필요)가 형성되고, 존재하는 데 중요한 역할을 수행했다. 텔로머레이즈(telomerase, 자체 RNA 주형을 가지고 있는 역전사효소)가 처음 나타난 시기는 불분명하지만, 텔로머레이즈가 다양한 종에 널리 퍼져있는 것으로 미루어 볼 때, 진핵생물 역사의 초기에 나타났을 것으로 예상된다. 최초의 진핵생물이 나타나기 전에 텔로머레이즈가 이미 진핵생물의 조상에 존재했을 것이라고 주장하는 연구자들이 있는 반면, 최초의 진핵생물은 텔로미어 유지를 위해 긴 말단 반복서열이 없는 레트로 트렌스포존(retrotransposon)이나 t 고리(loop)에 의해 시작된 상동 재조합을 사용하다가 이 기작이 쉽게 조절 가능한 텔로머레이즈가 나타난 이후 사라졌을 것이라고 주장하는 연구자들도 있다.
우리는 상동 재조합 의존적인 텔로미어 복제가 다양한 진핵생물에서 텔로머레이즈와 지속적으로 공존했을 것이라고 전망한다. 상동 재조합에 의한 텔로미어 길이 유지 기작은 모기와 같은 몇몇 진핵생물에서 주된 텔로미어 유지 기작으로 사용되고, 다른 진핵생물에서는 텔로머레이즈 활성이 망가졌을 때를 대비한 백업(backup) 기작으로 사용될 수 있다. 상동재조합이 백업 기작으로 사용되는 사례는 효모 사카로마이세스 세레비지애(Saccharomyces cerevisiae)와 클루이베로마이세스 락티스(Kluyveromyces lactis), 예쁜꼬마선충(Caenorhabditis elegans), 애기장대(Arabidopsis thaliana), 쥐, 인간 등에서 다양하게 존재한다. 그러므로 다양한 인간 암세포에서 보이는 ALT 활성은 정상적인 텔로미어 유지 기작의 조절이 망가진 버전으로 볼 수 있다. 만약 이러한 설명이 옳다면 ALT는 텔로머레이즈와 유사하게 텔로미어가 짧아지는 정상 세포에서는 부분적으로 혹은 완전히 억제되어 있다가, 특정 종류의 암세포에서 억제가 풀려 텔로미어가 짧아지는 것을 막아 암세포가 지속적으로 분열할 수 있도록 만든다고 볼 수 있다.
2. 대안적 텔로미어 유지 기작의 작동기전
오랫동안 텔로미어 길이는 텔로머레이즈에 의해서만 늘어난다고 알려져 왔다. 이러한 상황에서 간헐적으로 보고되기 시작했던 대안적 텔로미어 유지 기작은 텔로머레이즈가 아닌 방식으로 텔로미어 길이를 늘이는 모든 기작을 지칭하는 데 사용되었다. 고등동물에서 대안적 텔로미어 유지 기작에 대한 연구는 주로 텔로머레이즈 활성이 없는 암세포나 불멸화 세포주(immortalized cell lines)에서 수행되었다. 대안적 텔로미어 유지 기작의 작동기전일 것이라고 처음 제안된 모델은 DNA 주형을 이용한 텔로미어 복제이다. 이 모델은 인간의 ALT 암세포와 정상 생쥐의 세포 등에서 염색체의 텔로미어 서열에 삽입한 꼬리표(tag)가 다른 염색체의 텔로미어나 자신의 원래 위치에서 복제되는 현상에 기반을 두고 있다. 이 현상에 대한 가장 단순한 해석은 텔로미어가 자기 자신 혹은 자신의 상동염색체나 자매 염색분체에 있는 텔로미어를 주형으로 이용하여 복제할 수 있다는 것이다.
이후 염색체 말단에 발생한 파손을 수리하기 위해 사용된다고 제안된 파손-유도 복제(break-induced replication - 부러진 DNA의 한쪽 끝이 주형으로 침입하여 복제하는 기전)는 위의 해석과 본질적으로 같은 방식으로 작동한다. 효모 클루이베로마이세스 락티스는 염색체 바깥에 존재하는 원형 DNA를 주형으로 이용하여 텔로미어 길이를 늘인다. 인간의 ALT 세포에는 염색체 바깥에 존재하는 많은 양의 선형, 원형 혹은 복잡한 형태의 텔로미어 DNA가 존재한다. 그러므로 대안적 텔로미어 유지 기작은 아마 다양한 형태 혹은 위치의 텔로미어 DNA를 주형으로 이용하여 텔로미어 길이를 늘일 수 있는 능력을 갖추고 있을 것으로 예상된다. 그러나 인간의 경우 아직까지 염색체의 텔로미어 내부에 있는 DNA를 주형으로 사용할 수 있다는 증거 이외에 다른 염기서열을 주형으로 사용할 수 있다는 증거는 없다.
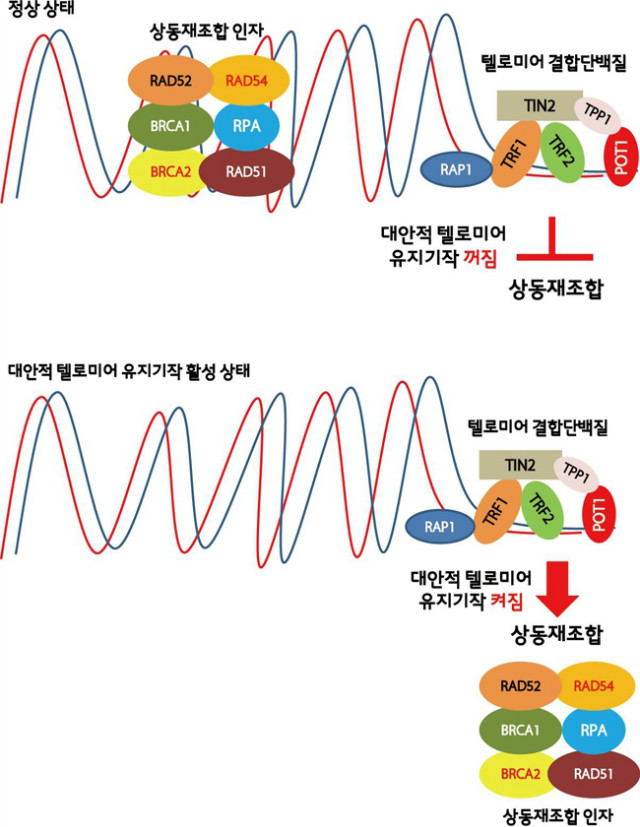
그림 2. 상동재조합과 대안적 텔로미어 유지기작
대안적 텔로미어 유지 기작이 상동 재조합과 관련되어 있을 것이라는 가설은 효모에서 수행된 유전학 실험을 바탕으로 제기되었다. 텔로머레이즈 활성 없이도 생존할 수 있는 효모의 경우 상동재조합과 관련된 유전자인 Rad50, Rad51, Rad52, Sgs1이 자신의 생존에 필수적이다. 이를 바탕으로 인간의 ALT 세포에서 진행된 연구에 따르면 MRN 복합체를 형성하는 상동재조합 단백질인 MRE11, Rad50, NBS1을 비롯하여 SMC5, SMC6, MMS21, FEN1, MUS81, FANCA, FANCD2 등이 ALT 세포의 텔로미어 유지에 필요하다는 사실이 밝혀졌다 (그림 2). 또 다른 정황적 증거로 많은 인간의 ALT 세포에서 피엠엘 체(PML bodies)에 다양한 상동 재조합 관련 단백질과 텔로미어 DNA와 텔로미어 결합 단백질들이 모여 ALT 특이적인 세포체를 형성하는 패턴을 보인다. 이러한 증거들을 바탕으로 미루어볼 때 대안적 텔로미어 유지 기작은 텔로미어가 다른 DNA 가닥으로 침입하여 상동 재조합 중간 구조(intermediate)를 형성하여 텔로미어 길이를 늘이게 될 것이라고 예상할 수 있다.
텔로미어의 가장 끝 부분은 G 염기가 풍부한 단일 가닥이 돌출된 형태다. 이렇게 돌출된 부분은 구조적으로 상동 재조합 과정에서 다른 염색체 서열로 침입하기 쉬울 것으로 예상된다. 그러므로 정상 세포에서 텔로미어의 돌출 부분은 텔로미어 결합 단백질, 특히 POT1에 의해 코팅되어 상동 재조합 단백질이 작동하는 것을 막고 있다. 따라서 대안적 텔로미어 유지 기작이 작동하기 위해서는 텔로미어 돌출부를 코팅하고 있는 POT1이 상동 재조합 단백질인 RAD51로 교체되어야 한다. 이러한 교체를 촉발하는 스위치에 대해서는 현재 밝혀진 바가 없다. 그런데 촉발 이후 중간 과정에서 POT1이 DNA 복제에 관여하는 단백질인 RPA로 교체되는 일이 발생한다. 텔로미어 서열로 구성된 RNA인 TERRA와 RNA 단백질인 hnRNPA1가 POT1이 RPA로 교체되는 중간과정에 관여한다. RPA는 DNA 복제과정 중 단일 가닥 DNA에 결합하여, DNA가 다시 이중나선으로 돌아가는 것을 막는다. 단일 가닥 DNA에서 RPA 코팅을 제거하기 위해서는 RAD51과 중재자(mediator)단백질이 함께 작용해야 한다.
상동 재조합 단백질에 의해 텔로미어가 주형 DNA를 찾아낸 이후에는 중합효소가 작동하여 새로운 텔로미어를 합성하는 과정이 필요하다. 아직 이 과정에 특이적으로 작동하는 DNA 중합효소는 밝혀지지 않았지만, DNA 중합효소 델타(delta) 혹은 제타(zeta)가 이러한 역할을 할 것이라고 예상된다. 실제로 ALT 세포에서 DNA 중합효소 델타의 부속 단백질인 PCNA는 ALT 특이적인 세포체에 위치한다. 또한, DNA 중합효소 델타의 소단위(subunit)인 Pol31과 Pol32 단백질이 효모 사카로마이세스 세레비지애의 파손-유도 복제 기전에 필요하다.
이렇게 상동 재조합을 이용한 복제를 진행한 이후에는 결합된 중간구조를 풀어주는 과정이 필요하다. 이 과정은 교차 과정에서 나타나는 홀리데이 연접(Holliday junction)을 풀어주는 과정과 유사하며, 이 과정은 염색체 분리 전에 이루어야 한다. 이러한 교차구조를 풀기 위해 사용되는 복합체에는 GEN1, SLX4-SLX1, MUS81-EME1과 포함된다. 또한, 교차구조를 분리하기 위해 사용되는 복합체에는 BLM-TOP3A-RMI1-RMI2 복합체가 포함된다. 이러한 두 종류의 복합체 사이에 일어나는 경쟁은 ALT 세포의 텔로미어에서 나타나는 상동 재조합 중간구조를 처리하는 과정에서 비슷한 형태로 나타날 수 있다. SLX4와 BLM 단백질 모두 텔로미어 결합 단백질인 TRF2와 직접 결합할 수 있다. 따라서 이 두 가지 단백질이 텔로미어에 결합하기 위해 경쟁하게 되리라 예측할 수 있다. SLX4는 다양한 종류의 엔도뉴클라아제(endonuclease)를 텔로미어로 모아, 상동 재조합 중간구조의 가공을 조절한다. 최근 보고에 따르면 BLM 단백질이 없으면 딸 염색분체 간의 텔로미어 교환이 증가하고, 그와 반대로 SLX4 단백질이 없으면 이러한 교환이 감소한다. 즉, SLX4는 ALT 세포에서 텔로미어를 감소시키는 방향으로 작동한다. 그러므로 BLM과 SLX4는 텔로미어 상동 재조합 중간구조의 가공을 위해 경쟁한다. BLM 단백질은 텔로미어 합성을 촉진하여 대안적 텔로미어 유지 기작을 활성화하는 방식으로 작동하고, SLX4는 텔로미어 합성이 일어나지 않은 상태로 상동 재조합 중간구조를 분해하여 대안적 텔로미어 유지 기작을 억제하는 방향으로 작동한다.
상동 재조합 중간구조가 분리된 이후 남아있게 될 텔로미어의 돌출 부분에 DNA 중합효소가 작동하는지 여부는 아직 전혀 밝혀지지 않았다. 만약 이러한 합성 과정이 진행된다면, 또 다른 DNA 중합효소가 이 과정에 작동할 가능성이 있다.
3. 대안적 텔로미어 유지 기작의 활성을 위한 주형
딸 염색분체 혹은 같은 염색체의 텔로미어 서열이 상동 재조합에 의한 텔로미어 복제를 위한 주형으로 사용될 가능성이 크다. 같은 염색체의 텔로미어 서열을 복제하기 위해 다양한 방식의 고리 구조를 형성할 것이라는 모델이 오랫동안 제기되었다. G 염기가 풍부한 서열에서 고리 구조를 형성하는 것은 G-4(quadruplex)의 형성을 촉진할 수 있을 것이다.
텔로미어 결합 단백질 중의 하나인 TRF2를 암호화하고 있는 유전자를 제거하면, 텔로미어에서 DNA 손상 신호가 발생하고, 세포핵 내부에서 텔로미어의 이동능력이 향상된다. 이 결과와 유사하게 ALT 세포의 텔로미어에도 DNA 손상 신호가 나타나고, 이 신호가 TRF2 유전자의 손상 없이도 발생한다. 또한 ALT, 텔로미어 중 일부는 방향성을 가진 움직임이 증가하는 패턴을 보인다. 이러한 움직임으로 인해 각 텔로미어 간의 결합이나 ALT 특이적인 세포체와의 결합이 증가한다. ALT 특이적인 세포체는 ALT 세포에서 텔로미어 간의 재조합이 일어나는 공간으로 추정된다. 흥미롭게도 세포에 DNA 손상을 일으키는 물질을 처리하면 ALT 특이적인 세포체가 유도된다.
최근 연구에서 ALT 세포가 복제를 위한 상동 서열을 찾기 위한 특별한 움직임을 보인다는 사실이 밝혀졌다. ALT 세포의 텔로미어는 상동 서열을 찾기 위해 먼 거리를 빠르게 직선적으로 이동하여 텔로미어들의 무리를 형성한다. 텔로미어 결합 단백질인 TRF1에 뉴클레아제(nuclease) 활성을 가진 FokI 단백질을 결합하여 발현시키면 텔로미어 특이적인 이중 가닥 절단을 유도할 수 있다. 이렇게 텔로미어 특이적인 이중 가닥 절단을 유도한 상황에서 텔로미어가 이동하는 궤적을 살펴보면, 일부의 텔로미어들이 마이크로미터 수준의 먼 거리를 이동하여 텔로미어와 APB에 상대적으로 안정적인 방식으로 결합하게 되는 것을 확인할 수 있다. 이러한 텔로미어의 이동에는 Hop2와 Mnd1 단백질의 복합체가 관여한다. 이 복합체는 RAD51 단백질과 단일 가닥 DNA가 형성한 필라멘트를 안정화하고, 상동 재조합 결합 과정을 촉진한다. 얼마나 많은 ALT 세포에서 가까운 곳에 있는 텔로미어 서열이 아니라 먼 거리를 이동하여 텔로미어를 복제하는 방식을 사용하는지는 아직 밝혀지지 않았다.
4. 텔로미어 염색질의 대안적 텔로미어 유지기작 억제 기능
텔로미어 DNA는 뉴클레오솜(nucleosome)과 연결(linker)-DNA로 단단히 포장되어 있다. 텔로미어를 감싸고 있는 연결-DNA의 길이는 다른 DNA를 감싸고 있는 염색질에 비해 40bp가량 짧다. DNA 중합 효소가 진행되기 위해 뉴클레오솜은 역동적으로 붙고, 떨어질 수 있는 구조로 되어있다. 특히 텔로미어 DNA를 감싸고 있는 뉴클레오솜은 이동하기 쉬운 형태로 되어 있으며, 텔로미어 결합 단백질 TRF1은 뉴클레오솜이나 뉴클레오솜 결합 부위에 있는 연결-DNA에 결합하여 뉴클레오솜의 결합 패턴을 바꿔 텔로미어의 이동성을 증대시킬 수 있다. 같은 유전체를 가진 텔로머레이즈 활성 세포와 ALT 세포를 직접 비교해보면 뉴클레오솜 밀도와 ALT 활성간에 상관관계가 있음을 알 수 있다. 따라서 ALT 세포에서 텔로미어 뉴클레오솜의 구성이 바뀌어 있을 것으로 예상된다.
ATP 의존적인 염색질 개조 복합체 단백질과 히스톤 샤페론(histone chaperone) 단백질은 뉴클레오솜 이동을 증가시킬 수 있다. 히스톤 샤페론 가운데 히스톤 조절자 A (HIRA) 단백질과 염색질 결합인자1 복합체(CAF1 complex)와 결합하는 ASF 단백질의 두 파라로그 (paralog)인 ASF1a와 ASF1b 유전자를 텔로머레이즈 활성이 있는 세포와 일반세포에서 동시에 제거하면, ALT 세포 특이적으로 나타나는 표지가 유도된다. 흥미롭게도 이러한 현상은 긴 텔로미어를 가진 세포에서만 나타난다. 또한 ASF 단백질의 억제는 텔로머레이즈의 전사체의 양을 감소시켜 텔로머레이즈 활성을 낮추는 역할을 한다. ASF 단백질 억제 때문에 DNA 복제 분기점(replication fork)에서 일어나는 히스톤 순환이 막히거나 RPA 단백질이 단일가닥 DNA에 결합하여 ATR 키나아제(kinase) 신호전달을 활성화하는 방식으로 ALT 활성을 유도할 것으로 예상된다. 비록 다양한 ALT 세포 주에서 ASF1 유전자의 돌연변이가 발견되지는 않았지만, 이러한 실험 결과는 정상적인 염색질 구조가 정상 세포에서 ALT를 억제하는 데 중요한 역할을 하고 있을 가능성을 제기한다.
텔로미어 염색체에는 일반적으로 히스톤 억제 수정표지(repressive histone modification)가 많이 축적되어 있다. 이러한 억제 표지에는 세 번 메틸화가 일어난 이질염색질(heterochromatin) 히스톤 H3K9, 세 번 메틸화가 일어난 히스톤 H4K20, HP1 단백질의 결합, 히스톤의 아세틸화 저해 등이 해당된다. 쥐에서 히스톤 메틸화에 관여하는 유전자에 결손을 유도하면 텔로미어의 이질염색질 양이 감소하며, 텔로미어 재조합을 통한 텔로미어 길이 증가 현상이 나타난다. 이러한 현상이 텔로머레이즈 활성 증가로 나타났을 가능성을 완전히 배제할 수는 없지만, 이 현상은 텔로미어 이질염색질이 정상적인 텔로미어 이질염색질 형성이 ALT와 깊은 관련이 있는 텔로미어 재조합을 억제하고 있을 가능성을 제기한다. 즉, 텔로미어 이질염색질에 변화를 유도하면 재조합이 일어나기 좋은 환경으로 바뀌어 ALT를 유도하게 될 가능성이 있다. 그러나 아직 텔로머레이즈 활성 세포와 ALT 세포 간의 어떤 히스톤 수정표지의 차이도 밝혀진 바가 없다.
5. 암세포에서 ALT의 억제가 풀리는 방식
5.1 유전적 변화
다양한 인간의 암에서 ALT 활성과 ATP 의존적인 헬리카제(helicase)인 ATRX 단백질 혹은 ATRX 와 결합하는 단백질인 H3.3 히스톤 특이적인 샤페론 DAXX 의 돌연변이 간의 강한 상관관계가 있다. 또한, ATRX와 DAXX는 ALT 특이적인 PML 체의 구성요소이기도 하다. 췌장 신경내분비성(pancreatic neuroendocrine) 종양 41종의 61%인 25종이 ALT 활성을 보였는데, ALT 활성을 보인 종양 모두 ATRX나 DAXX 유전자에 돌연변이를 가지거나, 이 단백질들의 비정상적인 발현 양상이 관찰되었다. 지방육종(liposarcoma)과 중추신경계에 발생한 암세포에서도 역시 ATRX 돌연변이와 ALT 활성 간의 상관관계가 확인되었다. 또한, 다양한 ALT 세포주를 조사해본 결과 86%의 세포주에서 ATRX의 비정상적인 발현패턴이 나타났다. 정상적인 ATRX와 DAXX 유전자를 가진 세포주에서 추가적인 연구가 필요하지만, ATRX와 DAXX에 발생한 기능상 문제와 ALT 활성 간에 강한 상관관계가 있음은 명백하다.
세포 불멸화 연구에 따르면 ATRX 손실은 ALT 활성 과정 초기에 나타나며, ATRX가 다시 발현되면 ALT 활성이 억제된다. 그러므로 ATRX는 ALT를 억제하는 역할을 한다. 그러나 ATRX 유전자의 제거 혹은 발현 감소만으로는 텔로머레이즈 활성 세포를 ALT 활성 세포로 바꾸거나, 정상 세포에서 ALT 활성을 유도할 수 없다. 비록 쥐의 배아 줄기세포에서 ATRX-DAXX가 텔로미어에 히스톤 H3.3의 축적하는 역할을 수행하고, ATRX과 텔로미어 반복서열과 G-4 구조에 결합하며, ATRX가 특이한 DNA 이차구조를 이용하여 DNA 복제를 촉진하고, 텔로미어 결합에 관계한다는 다양한 증거가 있긴 하지만, 이러한 기능이 직접 정상 세포에서 ALT를 억제하는 데 관여하는지는 아직 불명확하다. ATRX-DAXX와 같은 ALT 억제인자의 발견은 ALT가 진핵세포에서 오랫동안 유지된 고대 텔로미어 유지 기작일 가능성을 제기한다.
5.2 텔로미어 결합 단백질의 변화
ALT 텔로미어에는 텔로미어 특이적인 DNA 손상 반응이 나타난다. 이러한 반응은 텔로미어 길이에 비-의존적인 방식으로 나타나며, TRF2를 과발현 시키는 방식으로 이 반응을 억제할 수 있다. 이렇게 증가한 DNA 손상 반응은 ALT 세포에서 특이적으로 나타나는 텔로미어 서열의 변화와 결합 단백질의 변화와 관련이 있다. 인간의 ALT 세포 텔로미어에는 변이가 발생한 텔로미어 서열이 많이 존재한다. 인간 텔로미어의 가장 끝 부분은 주로 TTAGGG 염기서열의 반복으로 이루어져 있지만, 텔로미어에서 염색체 내부와 가까운 지역에는 다양한 변이 텔로미어 서열이 존재한다. ALT 세포의 상동 재조합 의존적인 방식의 복제기작은 텔로미어의 다양한 지역에서 일어날 수 있으므로 확률적으로 일반적인 텔로미어 서열과 변이 텔로미어 서열이 섞인 형태의 복제가 일어난다. 이러한 방식의 복제로 인해 ALT 텔로미어에는 변이 텔로미어가 전체 텔로미어로 퍼지게 된다.
ALT 텔로미어에 발생한 서열변화는 텔로미어 결합 단백질의 변화를 초래하고, 이는 부분적으로 본래 결합하고 있던 텔로미어 단백질의 제거를 초래한다. 텔로미어 결합 단백질은 텔로미어에 DNA 손상 반응이 유도하는 염색체 간 결합과 상동 재조합을 억제하는 역할을 한다. ALT 텔로미어에서 본래 결합하고 있던 텔로미어 결합 단백질이 떨어져 나가면 그 결과로 DNA 손상 반응이 유도된다. 변이 텔로미어에는 새로운 종류의 단백질이 결합하게 된다. 예를 들어, ALT 세포에서 TCAGGG 변이 서열에는 핵 호르몬(nuclear hormone) 수용체 단백질인 TR2, TR4, COUP-TF1, COUP-TF2, EAR2이 결합한다. TR4와 COUP-TF2는 아연 집게(zinc-finger) 단백질인 ZNF827을 데려오게 되고, ZNF827은 자신의 N-말단에 존재하는 RRK 모티프(motif)를 이용하여 뉴클레오솜 개조 및 히스톤 아세틸화 제거 활성을 가진 NuRD 복합체 단백질에 결합하여, ALT 활성을 촉진한다. NuRD-ZNF827 복합체는 텔로미어 히스톤의 아세틸화를 줄이게 되는데, 이러한 변화는 ALT 텔로미어에 발생하는 히스톤 풀림 현상에 부분적으로 대응하는 현상일 것이라고 예상된다. 또한, NuRD-ZNF827 복합체는 텔로미어 간의 결합을 촉진하고, DNA 손상 반응에 관여하는 BRIT1과 상동 재조합-치료 단백질인 BRCA1과 같은 상동 재조합 단백질을 끌어오는 역할을 한다.
ALT 세포에서는 텔로미어 지역뿐만 아니라 변이 텔로미어 서열인 TCAGGC가 있는 게놈의 다양한 지역에서 핵 호르몬 수용체 단백질이 결합하는 패턴이 나타난다. 이러한 결합은 텔로미어와 다른 게놈 지역에 있는 변이서열 간의 연결을 초래한다. 게놈 내부에 끼어들어 간 텔로미어 서열은 전반적인 게놈의 안정성을 해칠 수 있다는 보고가 있다. 따라서 ALT 세포에서 발견되는 게놈 내부의 텔로미어 서열은 부분적으로 ALT 세포에서 나타나는 핵형 재조합과 소형 염색체(micronuclei) 형성과 같은 유전체의 불안정성과 관련이 있을 것이다.
6. 텔로미어 DNA 복제과정에서 발생하는 스트레스가 ALT에 미치는 영향
텔로미어는 자신이 가진 본질적 특징 때문에 DNA 복제 과정에서 어려움을 겪는다. 따라서 에피디콜린(apidicolin)으로 DNA 복제 스트레스를 유도하면 텔로미어 부분은 쉽게 부러진다. G 염기가 풍부한 DNA는 G-4, DNA-RNA 혼성체, D 고리, t 고리, 홀리데이 연접과 같은 이차구조를 형성하게 되는데, 이런 구조는 모두 DNA 복제의 진행을 가로막는다. DNA 복제가 정지된 곳은 유전적 안정성을 유지하기 위해 반드시 수리되어야 한다. 따라서 다양한 종류의 단백질이 텔로미어에 발생하는 DNA 중간 구조물을 처리하는데 동원된다. 여기에는 BLM, WRN, RecQL4, RTEL1과 같은 헬리카제 엑소뉴클라아제(exonuclease)인 Apollo, 다양한 종류의 특정 구조에 작용하는 엔도뉴클라아제가 결합하는 플랫폼 역할을 하는 SLX4 같은 단백질들이 포함된다. 이들은 비정상적인 DNA 구조를 분해하여 DNA 복제가 막힘없이 진행될 수 있도록 돕는다.
텔로미어에 결합하는 단백질은 텔로미어 복제를 돕는 기능도 수행한다. TRF1은 텔로미어가 부러지는 것과 텔로미어 DNA 복제가 멈추는 것을 막는 역할을 한다. DNA 복제 문제가 계속 나타나면 다양한 세포 내 체계가 협동하여 DNA 손상을 치료하고, 세포 주기를 재개시키고, 세포 사멸 신호가 활성화되는 것을 막는다. ATM과 ATR 신호전달은 텔로미어 DNA 손상 반응에서 핵심적인 역할을 수행한다. 이들은 평소에 텔로미어 결합 단백질에 의해 부분적으로 억제된다. 특히, 텔로미어 결합 단백질 TRF2는 이중 가닥 손상에 ATM 신호전달이 작동하는 것을 막고, 텔로미어 결합 단백질 POT1은 이중 가닥 손상이나 DNA 복제가 멈췄을 때 생길 수 있는 DNA 단일 가닥에서 ATR 신호전달이 작동하는 것을 막는다.
ALT 텔로미어에서는 본래 결합하고 있던 텔로미어 단백질과 변이 텔로미어 서열에 결합하는 단백질 간의 경쟁이 발생하기 때문에 아마도 훨씬 더 큰 DNA 복제 스트레스를 유발될 것으로 예상된다. 앞에서 언급한 것처럼, ALT 세포에는 정상 텔로미어에 비해 높은 수준의 DNA 손상 반응이 나타난다. 흥미롭게도, 최근 연구에 따르면 ALT 활성이 있는 암세포는 ATR 억제제에 과반응하여, 염색체가 산산이 부서지고, 세포사멸이 일어나게 된다고 한다. 이는 ALT 세포에서 이미 높은 ATR 신호전달 반응이 일어나고 있었기 때문이라고 해석할 수 있다. 따라서 DNA 복제 스트레스는 역설적으로 상동 재조합을 촉진해 ALT 활성을 증가시키게 된다.
7. 결론과 전망
지난 몇 년 동안 암세포에서 억제된 ALT의 활성이 풀리는 분자적 기전에 대한 연구에서 많은 진전이 있었다. 대표적으로, ATRX-DAXX 복합체의 기능 저해, 변이 텔로미어 서열의 증가 및 변이 텔로미어 서열에 특이적으로 결합하는 단백질, 텔로미어 염색질의 변화 등이 ALT 세포에서 특이적으로 관찰된다는 사실이 밝혀졌다. 또한, ALT 세포와 ATR 신호전달 간의 관계와 손상이 발생한 텔로미어에서 나타나는 장거리 이동과 같은 현상 또한 새롭게 규명되었다.
그러나 아직 ALT 기작에는 아래와 같은 수많은 질문이 남아있다. 왜 특정 암세포에서 ALT 활성이 주로 나타나는가? ATRX-DAXX가 ALT를 억제하고 있는 분자적 기작은 무엇인가? ATRX-DAXX 유전자의 돌연변이가 나타나지 않았을 때, 어떠한 유전적 변화가 ALT 활성을 유도하는가? 이러한 질문을 바탕으로 ALT 기작을 좀 더 구체적으로 이해하고, 어떻게 ALT를 조절할 수 있을지 알게 된다면 좀 더 효과적인 항암 치료제를 개발할 수 있을 것이다.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 pdf_0002468.pdf
pdf_0002468.pdf