기술동향
High content screening (HCS) 플랫폼을 활용한 신약개발 연구 및 기술 동향
- 등록일2017-06-22
- 조회수9169
- 분류기술동향
-
자료발간일
2017-06-22
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#High content screening#신약개발#Phenotypic drug discovery#Target based drug discovery
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
High content screening (HCS) 플랫폼을 활용한 신약개발 연구 및 기술 동향
김성영 / 대웅제약
[요약문]
High-content screening (HCS)는 20여 년 전에 나온 이후로 신약개발에 있어 매우 유망한 분석 방법으로 이용되고 있다. 제약회사뿐 아니라 대학 및 연구소에서도 광범위하게 이용되고 있으며, 신약개발뿐 아니라 다른 생물학적, 의학분야에도 적용되고 있다. 평가 하드웨어 및 소프트웨어의 발달, 생물학적인 평가 toolbox (3D culture, induced pluripotent stem cells, genome editing technology)의 진보는 전통적인 세포독성평가에서 벗어나 약물의 다양한 생물학적 특성 규명을 빠른 시간에 가능하게 만들어줬다.
[목 차]
1. 서론
2. 본론
2.1 Biological models HCS assay readouts
2.2 HCS applications in different phases of drug discovery
3. 결론
4. 참고문헌
1. 서론
High content analysis (HCA)는 medium-high throughput을 이용하여 하나의 세포에서 다양한 정보를 확보하는 시험법을 의미한다[1]. HCA assay는 biological sample (individual cells in culture, tissue samples, organoids 혹은 whole organisms)에서 staining (fluorescent dyes, molecular probes, antibodies, fluorescent proteins 혹은 reporter genes)을 하고 readout을 통하여 데이터를 추출하는 과정으로 이루어진다. HCA를 적용하여 chemical library 혹은 천연물 library를 screening하는 것을 High Contents Screening (HCS)이라고 한다. HCS의 기본적인 개념은 간단하지만, 이를 응용하는 것은 간단한 작업이 아니다. HCS 분석의 key component는 models, readouts, instrumentation/data acquisition technologies 3가지이다. HCS의 획기적인 발전을 가져온 것은 다음과 같다. 첫째, computer의 발전이다. 고성능 컴퓨터의 개발로 인하여 현미경의 autog, image acquisition, real time analysis of cellular samples in multiwell microtiter plates가 가능해졌다. 둘째, antibody dye, chemical prober와 같은 분자생물학 실험에 이용되는 toolbox의 발전이다.
High content screening이라는 단어는 Giuliano, Taylor와 그의 co-workers에 의해 1997년에 처음으로 사용되었다[2]. 초기 HCS 논문에서는 스크리닝의 capability를 주로 실험하였고, 이후에는 reference cellular assay를 통해 HCS의 신뢰성을 검증하는 내용이 보고되었다[3-5].
신약개발에서 HCS의 중요성은 다음에서 알 수 있다. 1999-2008년 사이에 FDA에 승인된 first-in-class 약물 중 대부분은 phenotypic screening을 통해 발견되었다[6]. Phenotyping screening은 phenotypic drug discovery (PDD)라고도 불리며, small molecule 혹은 천연물을 세포에 처리 후 현미경을 통하여 세포의 phenotype을 관찰하는 방법이다. PDD는 cell proliferation이나 metabolic response를 확인할 수 있지만 약물이 작용하는 타겟이 무엇인지는 알 수 없다. 그래서 PDD는 ‘target agnostic(타겟에 상관없음)’이라고 불린다. Primary screening을 통하여 원하는 phenotype이 확인된 약물은 proteomics/genomics 기법을 이용하여 타겟을 확인할 수 있다. 이것을 ‘target deconvolution’이라고 한다. 신약개발을 함에 있어 후보물질이 되기 전에 약물에 대한 타겟 확인이 꼭 필요한 것은 아니다. PDD는 drug repositioning 전략에 유용하며, 타겟을 모르는 natural product library 스크리닝에 적합한 방법이라고 할 수 있다[7-8]. PDD와 반대되는 개념으로는 target-based drug discovery (TDD)가 있다. 이것은 타겟을 설정한 후 이 타겟에 대한 저해제가 원하는 phenotype이 나오는지 확인하는 방법이다. 이 방법은 reverse pharmacology라고도 하며 최근 genome sequencing 기술이 발달하면서 타겟 확보가 용이해졌다. 대표적인 예가 암과 관련된 유전자가 확인되면서 이 유전자를 표적으로 하는 항암제이다.
2. 본론
2.1 Biological models and HCS assay readouts
Robust, disease-relevant biological models과 적합한 readouts이 성공적인 HCS를 위한 핵심 요소이다[9]. 일반적으로 HCS에는 immortalized cell line이 많이 쓰인다. 하지만 cell line들은 인공적인 가공기술이 들어갔기 때문에 생리학적인 환경을 반영하기에는 정확도가 떨어진다. 이에 대한 대안으로 primary cell culture, genome editing을 이용한 cell line, induced pluripotent stem cells (iPSC), 3D cell culture, tissue, organoids, whole organism이 사용되고 있다. Biological models과 함께 분자생물학 toolbox (antibodies, fluorescent dyes, probes, fluorescence proteins)의 발전, instrumentation, 이미지 분석 software의 개발이 HCS의 발달을 가져왔다[10-11]. HCS를 어떻게 design하냐에 따라서 세포의 전체적인 변화(morphology, motility, cell adhesion, cell-cycle phase, cell death, differentiation등)를 정량적인 관찰이 가능하고, 또한 subcellular mechanisms (protein-protein interaction, protein localization, post-translational modifications, gene expression, membrane trafficking) 확인도 가능하다.
문헌에 따르면 HCS에 가장 많이 쓰인 cell line은 cancer cell line이었다[12]. 그 중에서 가장 많이 쓰인 것은 Hela, U-2 OS 세포주이다. 초창기 HCS 셋업 단계뿐 아니라 현재까지도 이 cell line이 standard방법으로 많이 쓰이고 있다. 왜냐하면 키우기 쉽고, genetically homogenous population이기 때문이다. 하지만 대부분 cancer cell lines들은 DNA repair pathway에 결함이 있기 때문에, passage가 오래되면 mutation이 쌓여서 homogenous하지 않게 된다. 그렇기 때문에 passage가 오래된 세포는 original 세포와 비교했을 때, phenotype이 다르거나, external stimuli에 대한 반응이 다를 수 있다[13]. Cell line의 long term culture는 빠르게 자라는 세포의 확장을 가져올 수 있고, 세포마다 단백질의 발현이 다를 수 있기 때문에 실험의 편차가 커질 수 있다. 그렇기 때문에 특히 HCS에서 authenticated, well characterized, cell lines, homogenous cell culture가 가장 중요하다. Cell culture의 homogeneity를 증가시킬 수 있는 가능한 전략은 division-arrested cells의 사용이다[14]. 또한 origin tumor와 cancer cell line의 genotype이 다를 수 있기 때문에, primary tumor cell을 이용하는 것이 좋다. Primary cells은 in vivo의 생리학적 환경을 대변하는 좋은 시스템이다. 하지만 세포준비 과정이 복잡하며, 계대배양을 많이 할 수 없다는 단점이 있다. 또한 많은 세포를 얻기 힘들다.
Embryonic/fetal stem cells, adult pluripotent stem cells, cancer stem cells, iPSC 는 HCS에 성공적으로 이용되고 있다. 일반적으로 stem cells는 self-renewal, differentiation 조절 평가에 이용된다[15-19].
Engineered cells는 유전적으로 결함이 있는 질환에 이용하기 좋은 모델이다. 이 모델에는 genome editing 기술을 적용한 primary cell이나 cancer cell line이 있다. 예를 들면, mutation된 drive oncogene 삽입 혹은 tumor suppressor gene이 knockdown된 cancer cell line이다. Genome editing 기술에는 homologous recombination, zinc-finger nucleases, tranion activator-like effector nucleases (TALEN), CRISPR-Cas9 등이 있다. 항암제 내성에 관련된 유전자 point mutation을 도입한 세포를 이용하여 스크리닝 시 항암제 내성을 극복할 수 있는 약물을 개발할 수 있다. 대표적인 oncogenic kinase target으로 Alk, Bcr-Abl, BRAF, c-kit, EGFR, ERBB2, PDGFRA, RET가 있다[20-23].
각각의 세포의 phenotypic alteration(protein expression, post-translational modification, intracellular re-localization or morphological changes)은 readout을 통해 구분할 수 있다. High content fluorescent readouts는 biosensors, reporter gene과 같은 fluorescent protein (e.g. GFP), immunofluorescence, DNA나 organelle dyes같은 fluorescent probes에 기반한다. HCS에 많이 쓰이는 molecular tools와 readouts을 table 1에 나타내었다[24-27].
표 1. Common fluorescent readouts in high-content screening
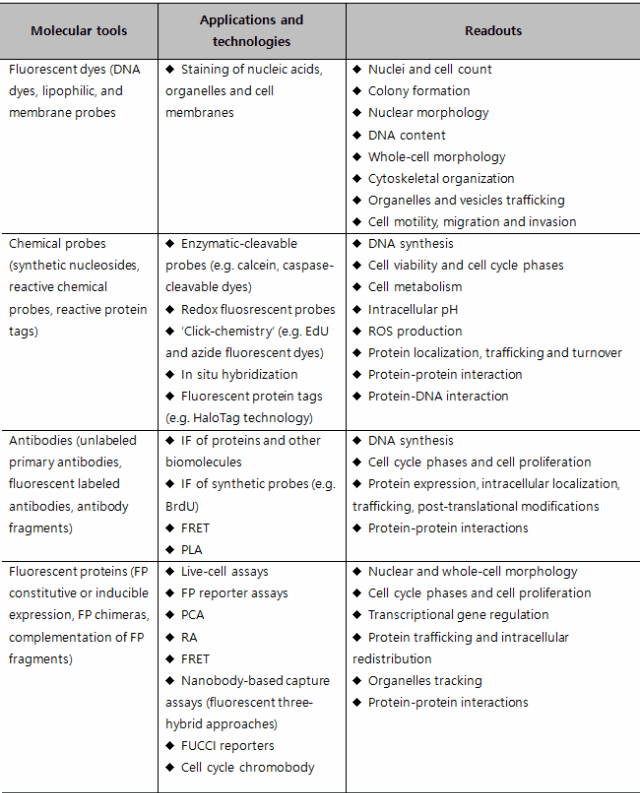
HCS가 다른 cell-based approaches와 구별되는 점은 multiplexing capability이다. HCS는 하나의 fluorescent staining에서 10개 parameter 이미지 분석을 통하여 데이터를 추출하는 것이 가능하다. Nuclear 또는 whole-cell morphology 분석이 예이다. DNA dyes나 nuclear fluorescent protein (e.g. histone H2B-GFP)으로 염색한 세포 형광 이미지는 nuclear fluorescence intensity (proportional to DNA content), nuclear texture, area, shape in interphase and in mitosis, presence of polynuclei, micronuclei 등 다양하게 이미지를 분석할 수 있다. Supervised machine learning methods는 수백 개의 정량적인 nuclear features에 기초하여 cell phenotypic recognition과 clustering에 적용된다. 이런 상대적으로 저렴하고 강력한 접근방법은 small interfering RNA (siRNA) libraries의 phenotypic screening에 사용되어 왔다[28].
하지만 비록 HCS의 강점이 multiplexing 능력이지만 실제 문헌상에서 3가지 이상의 marker를 분석하는 경우는 거의 없다[29]. 그래서 HCS가 정말로 ‘high content’인지 의문이 있다. 이런 현상은 후속 문헌조사에 의해 증명되었다. 이 문헌에서는 HCS assay의 대부분(60~80%)이 하나 혹은 두 개의 세포 특성만 이용하는 것으로 보고되었다. 왜 이런 걸까? 가장 큰 이유는 fluorescent cross-talking 때문에 multiple molecular marker를 detection하기 힘들기 때문이다. 이러한 한계를 극복하기 위한 sequential antibody staining과 de-staining 등 다양한 protocol들이 제안되고 있다[30].
2.2 HCS applications in different phases of drug discovery
신약개발 과정은 많은 시간과 돈이 들어가는 과정이다. HCS 기술이 drug discovery에서 광범위하게 이용됨에 따라 시간과 돈을 절약할 수 있게 되었다. 전임상 과정에서 HCS적용을 그림 1에 나타내었다.
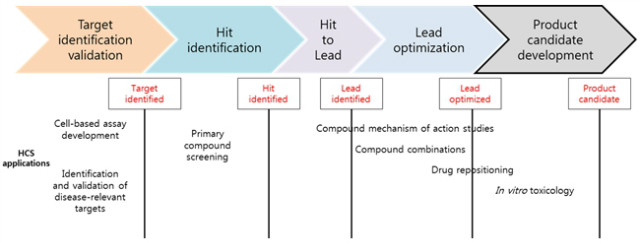
그림 1. 신약개발 전임상 과정에서의 HCS의 적용
TDD의 핵심은 신약 target의 발견과 validation이다. Poor target validation이 drug discovery 실패에 큰 원인인 점을 생각할 때, target validation 과정에서 적합한 tool과 실험방법은 매우 중요하다고 할 수 있다. 과거에는 타겟 발굴을 breakthrough 논문에서 주로 하였지만, 실제 신약개발 과정에서 재현이 안되는 결과를 많이 가져왔다. 그래서 요즘은 제약회사에서는 target validation을 in house data로 먼저 검증을 하고 있다[31-32].
Target validation의 가장 흔한 전략은 loss of function 접근 방법이다. Large scale의 siRNA-induced genetic knockdown하여 HCS technology를 활용한 phenotypic screening이 대표적이다. siRNA 전략은 타겟 발굴에 적합한 전략으로 보이지만 몇 가지 한계가 있다. 첫째, siRNA off-target 효과, 둘째, knockdown efficiency, 셋째, siRNA oligonucleotides의 낮은 안정성, 넷째, 적합하지 않거나 최적화되지 않은 transfection 조건(세포독성이 생길 가능성)이다. 최근에는 CRISPR-Cas9이라는 혁신적인 gene-ablation technology가 나와서 target identification과 validation에 활용되고 있다. 세포에 siRNA oligonucleotide library를 처리하는 작업은 많은 연구 영역에 적용되었다. 이 중에서 genome wide RNAi screening의 세 가지 예는 다음과 같다.
1) 세포주기에 영향을 미치는 유전자 profiling
2) 콜레스테롤 축적에 영향을 미치는 유전자 검색
3) Apoptosis의 새로운 조절 유전자 검색
Target에 상관없는 phenotypic drug discovery (PDD)는 새로운 물질을 찾는 검증된 방법이다. HCS는 각각의 조건에서 compound library를 phenotypic screening하는데 많이 쓰였다. 예를 들어 암세포에서 직접적 혹은 간접적으로 signal transduction pathway를 저해하는 화합물 탐색, nuclear hormone receptor translocation 저해제 탐색이 있다. Primary HCS를 수행할 때, fluorescent protein-based assay는 immunofluorescence assay보다 광범위하게 많이 쓰인다. 그 이유는 비용이 저렴하고 시험 과정이 간단하기 때문이다.
신약개발 과정에서 hit identification은 유효물질을 찾는 과정이다. Primary HCS에서는 일반적으로 수천 개~수만 개 화합물을 스크리닝 한다. 이것은 수백만 개를 스크리닝 하는 biochemical 혹은 cell proliferation assay보다는 적은 수치이다. Compound library 숫자가 제한되는 이유는 첫째, reagent (antibody, chemical probe, engineered cells)의 비용 문제, 둘째, 샘플 준비과정 (cell fixation, staining, washing)의 시간 소모, 셋째, 많은 HCS data set (raw images, multiparametric single-cell measurements)의 보관, 관리, 분석의 어려움 때문이다.
Drug repositioning은 허가된 약물의 새로운 적응증을 찾는 전략으로, 허가된 약물은 전임상과 임상에서 안전성이 보장되었기 때문에, 새로운 적응증에서의 약효만 확보된다면 빠르게 약물개발이 가능하다. HCS는 이 같은 drug repositioning에서 효과적인 스크리닝 방법이다. 예를 들어, 2,426개의 발매된 약물 collection을 HCS를 통하여 5개의 phenotypic assay (glucagon-like peptide 1 (GLP-1) secretion, insulin secretion, wnt pathway potentiation, oncogenic KRAS synthetic lethality, anti-angiogenesis를 진행하였다. 몇몇 약물들이 기대하지 않게 하나 혹은 그 이상에서 activity를 나타내었다. 예를 들어 insecticide rotenone과 antifolate drugs (pyrimethamine, metoprine, nolatrexed)는 wnt pathway를 activation시켰고, cholesterol antagonist/inhibitor인 cetaben은 anti-angiogenic factor로써 확인되었다[33].
Natural product library는 아직 특성이 명확히 밝혀지지 않은 bacteria, fungi, plants, marine organisms의 extracts, 혹은 fermentation products의 mixture로 구성된다. 이러한 천연물들의 biological activities를 규명하는데도 HCS가 유용하다[34].
TDD나 PDD 전략에서 도출된 Hit는 secondary assay를 통하여 검증하게 된다. 이 후 과정은 ‘hit to lead’, ‘Lead optimization’, ‘Product candidate development’로 구분한다. Hit to lead 단계에서는 primary 스크리닝을 통하여 발굴한 hit의 potency와 selectivity를 강화시키며, chemical-physical properties(예를 들어 solubility, cell membrane permeability)를 향상시키는 단계이다. 이 단계에서는 SAR (structure-activity relationship)을 분석하기 위하여 구조가 다양한 화합물들을 평가하게 되며, 화합물의 rationale을 확보하기 위하여 structural chemistry approaches를 사용하기도 한다(예를 들어 타겟과 결합한 화합물의 co-crystalization). 또한 확보한 hits는 mode of action이 target validation data와 일치하는지 세포에서 확인하는 실험을 진행하게 된다. Mode of action 연구 또한 HCS를 통하여 평가할 수 있다. ‘Hit identified’에서 ‘hit to lead’ stage로 넘어가기 위해서는 약물이 세포에서 작용하며, on-target activity를 통하여 phenotype이 나온다는 과학적인 증거가 필요하다. Lead 물질이 확보되면, 다음 단계로 pharmacological profile을 향상시키는 lead optimization 연구를 수행한다. In vivo animal model에서 약효 평가와 pharmacokinetics (PK), absorption, distribution, metabolization, excretion (ADME), toxicology 연구가 수행된다. HCS를 이용하면 세분화된 다양한 생물학적 특성을 분석할 수 있다. 이 단계에서 HCS의 주된 장점은 화합물의 potency뿐 아니라 off-target effect도 평가할 수 있다는 점이다. 전임상 연구의 마지막 단계에서는 good laboratory practice (GLP)에서 safety를 평가하며, 안전성이 확보되면 임상시험을 위한 후보물질이 된다[35].
전임상 단계에서 cell based assay의 주된 목적은 efficacy, toxicity평가를 통해 in vivo 평가에 적합한 화합물을 선택하는 것이다. 아직 세포를 이용한 in vitro 평가 시스템이 in vivo 시스템을 대체할 수는 없다. 하지만 high content toxicity-predictive assay를 통해 nephrotoxicity, cadiotoxicity, hepatotoxicity를 평가할 수 있고 이것은 in vivo 결과를 예측하는 data로 활용된다. 좀 더 시스템이 in vivo에 가까운 tissue, organ에서의 HCS는 in vivo 결과 예측 가능성이 더 크며, 앞으로 in vivo 실험을 대체할 것으로 예측된다. 실제로 화장품 개발에 있어서는 동물모델 평가가 금지되었다.
3. 결론
HCS 기술이 신약개발을 비롯한 여러 분야에 쓰이기 시작한지 20여년이 지났다. 현재 TDD, PDD 약물개발에 광범위하게 이용되고 있다. TDD에서는 target identification, validation에 도움을 주며, PDD에서는 primary screening으로 이용된다. 전임상 후기 단계에서는 mode of action 연구와 독성을 평가하는데 이용된다.
몇십 년 전에는 cell baed assay는 많은 약물을 스크리닝할 때 단순한 cytotoxicity assay용으로만 사용하였지만 중요한 성공을 거두었고, 이러한 방법으로 만들어진 약물(antibiotics, anti-inflammatory, cytotoxic drugs 등)은 아직까지 쓰이고 있다. 한 가지 예는 paclitaxel이다. 1962년에 발견되었고, 후에 anticancer cytotoxic agent로 사용되고 있다. 메인 타겟인 tubulin은 1979년이 되어서야 밝혀졌다[36].
타겟과 mode of action이 명확하지 않지만 허가된 약물은 꽤 된다. Cyclosporine A는 1970년대에 fungal extract에서 발견되었고 후에 immunosuppressant agent로 사용되고 있다. 1970년 후반에 임상시험이 시작되었고, 1983년에 FDA 허가를 받았다. 메인 타겟인 cycolphilin은 3년 후에 발견되었고, mode of action 연구는 현재까지도 진행 중이다[37]. 또 다른 예는 thalidomide이다. 이것은 50년대에 발견되었고, sedative hypnotic agent이며 상업 이름은 Contergan이다. 이 약물은 신생아의 발달과정에 결함을 초래하여 1961년에 마켓에서 퇴출되었다. 하지만 관련 연구는 계속 되었는데 90년대에 이 약물 및 derivative가 anticancer agent로 효과가 좋다는 것이 밝혀졌다. Thalidomide는 2006년에 multiple myeloma 환자에 dexamethasone과 병용투여와 FDA 허가를 받았다. 이 약물의 MOA는 10년 후에 밝혀졌다. 이러한 예들은 약물개발에 있어 명확한 MOA 규명이 꼭 필요조건이 아니라는 것을 말해준다[38].
90년대 이후부터 유전체학이 비약적으로 발전하며, genetic 정보가 축적됨에 따라 표적치료제의 혁신적인 발달을 가져왔다. 대표적인 예로 Abl kinase inhibitor인 imatinib이 있다. 이렇듯 TDD의 중요성이 커졌지만, PDD 또한 여전히 약물개발의 전략으로 중요하며, PDD에 대한 HCS의 중요성도 계속 증가하고 있다.
요즘 많은 학교 연구소에서는 compound와 siRNA libraries를 스크리닝할 수 있는 시설을 구축하고 있다. 그뿐만 아니라 contract research organizations에서도 HCS service를 제공하고 있으며, 제약회사에서도 open innovation을 활용하여 약물을 스크리닝하고 있다. 타겟과 상관없는 PDD의 예를 보자. 화합물 JTP-70902는 2007년에 cell-based screening을 통하여 p15 mRNA expression을 증가시키는 기능을 하는 것으로 발견되었다. 후에 타겟 발굴 실험을 통하여 MEK1/2가 주요 타겟임을 밝혔다. 이 화합물의 analog인 JTP-74057 (trametinib, GSK1120212)은 2013년에 BRAF V600 mutation을 가지는 흑색종 환자에게 BRAF inhibitor인 dabrafenib과 병용투여로 FDA 허가를 받았다[39].
초기 HCS platform은 autofocus와 automatic plate scanning을 위한 linear motor로 구성된 형광 현미경과 software로 구성되었다. 하드웨어는 점점 발전하여 optics, detectors, confocal modules, live-cell analysis modules 등 복잡한 구성을 이루어서 사용을 위해서는 숙련된 과학자가 필요했다. 최근에는 트렌드가 다시 comfact하고 가격이 비싸지 않은 기기로 돌아가고 있는 것으로 보인다. 2014년에 Thermo Fischer Scientific은 새로운 HCS reader인 CellInsigntTM CX5를 론칭했는데, 이것은 전 ArrayScanTM HCS platform과 비교했을 때, compact해지고 가격이 내려갔다. 다른 예로서, EnSightTM multimode plate reader (Perkin-Elmer), SparkTM reader (Tecan), CytationTM multimode reader (BioTek)이 있다. 이러한 트렌드의 원인으로는 전체 시장 마켓을 키우려는 점이 점으로 추측된다. 또한 실제 이용자들은 1~2개의 assay만 이용한다는 점도 고려됐을 것이다.
HCS는 급속히 커지는 분야이다. In vivo 시스템과 비교했을 때, 다양한 생물학적 특성 분석 및 시간절약 등 장점이 확실하기 때문에 앞으로 약물개발 및 다른 다양한 분야에서 그 중요성이 더욱 커질 것으로 전망된다.
4. 참고문헌
==> PDF 참조
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
지식
동향


 플랫폼을 활용한 신약개발 연구 및 기술 동향.pdf
플랫폼을 활용한 신약개발 연구 및 기술 동향.pdf