기술동향
DNA 이중사슬 손상에 대한 복구 경로의 선택 및 결과
- 등록일2017-08-03
- 조회수7452
- 분류기술동향
-
자료발간일
2017-07-26
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#DNA이중사슬#손상 복구#HR
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
DNA 이중사슬 손상에 대한 복구 경로의 선택 및 결과
이백승 / 블루버드바이오
[목 차]
1. DNA DSB의 복구 기작
2. DSB 복구 선택에서 말단 절제(resection)의 역할
3. 상동 재조합 조절: 상동성 기반 복구 경로 선택에서 RAD51 허브
3.1 HR의 양성 조절자
3.2 HR의 음성 조절자
4. Annealing 의존성 DSB 복구
4.1 HR과 alt-EJ 사이의 연계
4.2 HR과 SSA의 상관관계: RAD52는 유일한 조절인자인가?
5. Annealing 의존성 DSB 복구 결과 및 돌연변이성 특징
6. 결론
[요약문]
DNA 이중사슬 손상(Double-Strand Break, DSB)은 세포독성 손상을 일으켜 게놈의 온전성을 위협한다. 그러므로 DSB의 복구 실패는 게놈 불안정 및 세포사멸과 같은 치명적인 결과를 초래한다. 실제로, DSB의 복구오류는 부적절한 말단 결합을 초래하며, 이는 염색체 전위(translocation)에 따른 발암성 형질전환의 흔한 기저요인이다. 전형적으로, 세포는 상동성 재조합(Homologous Recombination, HR)과 고전적 비상동성 말단 접합(Classical Nonhomologous End Joining, C-NHEJ)의 두 가지 주요 DSB 복구 기작을 이용한다. 추가로, 대체 오류성 DSB 복구 경로로, 대체 말단 접합(alternative End Joining, alt-EJ) 및 단일사슬 결합(Single-Strand Annealing, SSA)이 최근에 여러 다른 조건에서 작용하고 게놈 재배열 및 발암성 형질전환에 관여함이 밝혀지고 있다. 본 리뷰에서는, DSB 복구 경로 선택을 조절하는 기작 그리고 상동성 재조합 경로와 annealing-의존 오류성 DSB 복구 경로 사이의 잠재적 상호작용을 함께 논한다.
1. DNA DSB의 복구 기작
손상 DNA의 감지와 정확한 복구는 게놈의 온전성에 필수적이다. 많은 유형의 DNA 손상은 복제 포크(replication fork) 진행을 방해하여 복제 포크의 붕괴와 게놈의 물리적 연속성의 상실에 따른 DSB 형성을 초래한다. DSB의 복구에 관여가 가능한 네 가지 기작이 있다(그림 1). 첫 번째 기작은 C-NHEJ로, 이 기작에서 DSB는 염기서열 상동성과 관계없이 평활 말단 결합으로 복구되며, Ku70/80, DNA-PKcs, 및 DNA ligase IV가 요구된다(그림 1A). C-NHEJ는 모든 세포 주기에서 일어날 수 있다. C-NHEJ의 돌연변이 유발성에도 불구하고, 이 경로의 빠른 동역학은 게놈의 온전성을 보호하는 역할을 하며, 최소한 대부분의 복구에서 염색체 전위(translocation)를 현저히 억제한다. 다른 경로에서는 DSB 말단이 절제(resection)되어, 3′ 단일사슬 DNA (ssDNA) 돌출이 생성된다. 절제(resection)된 DSB는 3 가지의 가능한 기작으로 복구될 수 있다. 여기에는 HR, SSA, 및 alt-EJ 등이 있고, HR은 DNA 복제 활동이 최고이고 자매 염색체 주형의 이용 가능한, 중기-S 및 중기-G2 세포 주기에서 주로 일어난다.
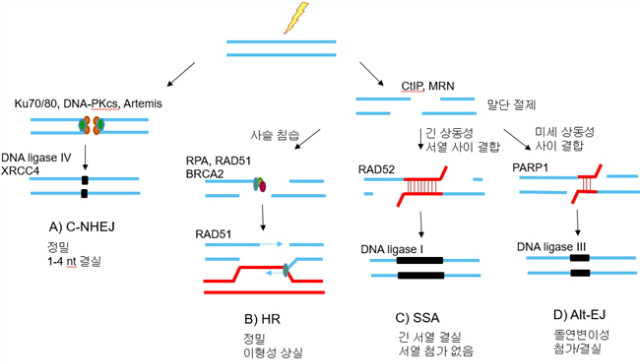
그림 1. DNA 이중 사슬 손실(DSB) 복구의 네 가지 경로
HR은 복구를 위해 자매 염색분체 또는 동족 염색분체를 요구하기 때문에 이 경로는 재조합효소 RAD51로 매개되는 사슬 침습(strand invastion)이 요구되며, HR의 완료는 종종 오류성 중합효소가 요구되나 전형적으로 무오류 과정이다(그림 1B). 절제(resection)된 DSB는 SSA 또는 alt-EJ와 같은 돌연변이 유발성 복구 경로에 의해서도 복구될 수 있다. SSA는 산재성 뉴클레오티드 반복 사이의 말단 접합을 매개하며, RAD52 단백질에 의한 복제단백질(Replication Protein A, RPA)로 감싸진 ssDNA의 재결합을 수반한다. 이 경로는 상동성 지시 복구임에도, 반복 서열의 한 복제 서열 및 반복 서열들 사이의 간섭 서열이 복구 산물에서 결실되기 때문에 유전 정보의 손실이 초래된다(그림 1C). 최근 몇 년간 C-NHEJ에 추가하여 alt-EJ 경로에 대한 개념이 더욱 확실해지고 있다. DNA DSB에 대한 alt-EJ의 사용은 여러 세포 조건들에서 기술되어 왔지만, 이 경로의 상세 기작은 명확하지 않았다. DSB 복구를 위한 alt-EJ의 사용은 상이 염색체 상의 DSB의 접합을 위한 명백한 편애성 때문에 게놈 온전성에 유해한 결과를 가지며, 따라서 염색체 전위 및 돌연변이 유발성 재배열이 초래된다(그림 1D). Alt-EJ에 대한 초기 증거는 C-NHEJ가 결핍된 효모 및 포유동물 세포가 여전히 말단 접합을 통하여 DSB를 복구할 수 있음을 보여주는 연구에서 나왔다. 나아가 C-NHEJ가 결핍된 마우스가 여전히 염색체 전위 및 V(D)J 재조합을 보이는 관찰에서 alt-EJ에 대한 증거가 나타났다. C-NHEJ가 결핍된 세포에서 이 alt-EJ 활성에 대한 분자적 특성은 XRCC1/DNA ligase III 복합체 및 PARP1 리보실중합 효소가 관여함을 나타냈다. 초기의 alt-EJ는 이 경로의 오류성 성질 및 C-NHEJ의 부재 때에만 관찰되는 최초 증거로 인해, V(D)J 재조합에서 염색체 DSB의 말단을 접합하는 단순 백업 복구 경로로 간주되었다. 하지만 후속 연구에서 alt-EJ가 생물학적 조건에 따라 내생의(endogenous) 염색체 DSB의 복구에 더욱 주도적인 역할이 있을 수도 있음이 밝혀졌다.
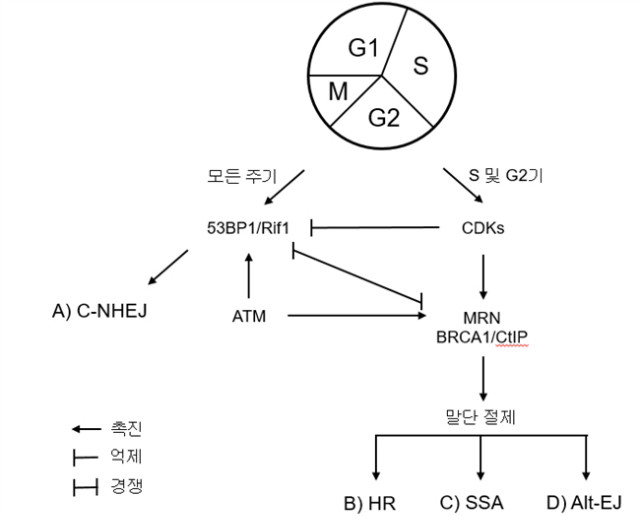
그림 2. 포유동물 세포에서 DNA 말단 절제(resection)를 조절하는 기작 및 이 기작들이 DNA 복구 경로 선택에 미치는 영향
2. DSB 복구 선택에서 말단 절제(resection)의 역할
말단 절제(resection)의 초기 단계에 세 가지의 경로가 분화하며(그림 1), 말단 절제(resection)가 경로 선택 및 복구 결과를 결정하는 것으로 여겨진다. '말단 깍아내기'로 불리는 말단 절제(resection)의 초기 단계는 구조 특정 핵산분해효소 MRE11 및 CtIP에 의해 수행된다. 단, 이 단계에서 비교적 작은 숫자의 염기쌍(예, 포유동물 세포에서 20 bp 또는 효모에서 100-300 bp)이 처리되어 DNA 말단을 alt-EJ에 이용 가능하게 만든다. ‘연장성 절제(resection)’로 불리는 말단 절제(resection)의 2 단계에서는 풀기효소(helicase)와 핵산말단분해효소(예, DNA2, BLM, WRN, CtIP, 및 EXO1)가 긴 ssDNA 가닥을 생성하여 세포가 HR 또는 SSA를 수행하게 한다. 세포 주기는 경로 선택 결정에서 중요한 역할을 하며, 말단 절제(resection)는 사이클린 의존성 인산화효소(Cyclin-Dependent Kinases, CDK)에 의해 촉진된다(그림 2). 출아효모의 Dna2와 Sae2 (CtIP 동족체)라는 두 핵산분해효소의 S-CDK 매개 인산화는 효과적인 말단 절제(resection)를 촉진한다. 포유동물 세포의 유사 과정에서는 CDK 의존성 CtIP 인산화가 관여하여 S/G2기에서 CtIP?BRCA1 상호작용을 촉진하나, 말단 절제(resection)를 위한 이 상호작용은 논란의 여지가 있다(그림 2). 또한, EXO1의 CDK 의존성 인산화는 말단 절제(resection)를 촉진하고, EXO1 인산화의 장애는 절제(resection), 세포 생존 및 HR을 감소시키고 DNA 손상에 대한 NHEJ 활성을 증가시킨다. 이들 결과와 부합하게, DSB 말단의 절제(resection)는 비순환성 세포에서 급격히 감소하며, 절제(resection) 의존 복구 경로(HR, alt-EJ, 및 SSA)에 비해 C-NHEJ이 선호된다.
기타 번역후 변형(Post-Translational Modifications, PTM)도 말단 절제(resection)의 조절에 관여한다. 예로, 아세틸화는 출아효모에서 말단 절제(resection)를 저해하는 한편, 수모화(sumoylation) 는 이를 촉진한다. 몇몇 관련 기질 또한 식별되었다. 효모에서 Sae2, Mre11, Sgs1, 및 Exo1 그리고 인간 세포에서 BLM 및 CtIP 등이 있다. 최근 연구에서 RNF111/UBE2M-매개 네딜화(neddylation)가 BRCA1 및 CtIP-매개 DNA 말단 절제(resection)의 저해제로 작용함이 밝혀졌다. 또한 CtIP 및 MRN 복합체(MRE11, RAD50, 및 NBS1)와 복합체를 형성하고 DSB 말단 절제(resection)의 촉진에 중요한 역할을 하는 BRCA1이 PARP1에 의해서 중합라이보실화(polyribosylation)됨이 밝혀졌고, 이는 HR 수위를 조절하는데 중요 역할을 하는 것으로 추정된다. 말단 절제(resection)의 조절을 통하여 보조 인자들도 복구 경로에 기여한다. 예로, BRCA1과 53BP1 사이의 균형은 말단 절제(resection)의 촉진 또는 방해를 통하여 경로 선택을 조절한다. 53BP1은 CtIP의 DNA 말단 접근을 방해하여 DNA 절제(resection)를 차단한다. 따라서, 53BP1은 C-NHEJ를 통한 복구를 지시하며, C-NHEJ는 BRCA1 무표지(null) 세포에서 상승 조절된다(그림 2). 이 53BP1의 말단 보호 기능은 확장성 운동실조 돌연변이(Ataxia Telangiectasia Mutated, ATM) 단백질에 의한 인산화에 의존하고, 상호작용 인자 Rif1 및 PTIP의 모집 및 아르테미스(Artemis) 같은 하위 핵산분해효소의 후속 모집을 촉진한다. 53BP1의 절제(resection) 저해 기능은 생리적 C-NHEJ에서 돌연변이 유발성 C-NHEJ를 제한하며, 적절한 면역글로불린 클래스 스위치 재조합(immunoglobulin class switch recombination, CSR)을 위해 필요하다. 하지만, Rif1나 53BP1이 결여되었을 때, DSB가 광범위하게 절제(resection)되며 C-NHEJ에 의해 복구되지 않고, 지속성 염색체 손상 및 게놈 불안정을 초래한다. 아주 최근에 REV7도 Rif1의 하위에서 DNA 말단 절제(resection)를 억제하여 C-NHEJ를 촉진하는 것으로 나타났다. 말단 절제(resection)를 조절하는 인자(53BP1, REV7 등)의 기능상실돌연변이는 C-NHEJ의 감소를 초래하고, DNA 말단 절제(resection)를 회복하며, 이는 HR 활성이 선호되며 BRCA1 결핍 세포의 PARP 억제제(PARPi) 저항성을 야기한다. C-NHEJ와 HR 모두에서 작용하는 MRN 복합체, BRCA1 및 ATM 등의 인자들이 MRN 복합체, ATM 및 말단 절제(resection) 사이의 연계는 절제(resection) 의존 복구 경로에 대한 잠재적 조절 기작을 제공한다(그림 2). ATM은 MRN 복합체의 모든 구성인자를 모집하고 인산화시키며, 이는 후속적으로 BRCA1, CtIP, EXO1, BLM 등 다른 HR 인자의 인산화를 초래하여 효과적인 DSB 절제(resection)를 촉진한다. HR 조절에 직접적으로 관여하는 ATM이 말단 절제(resection) 의존 오류성 DSB 복구 경로에도 중요한 조절인자일 수 있음을 쉽게 짐작할 수 있다(그림 2). DSB 복구에서 말단 절제(resection)는 효모에서 광범위하게 설명된 반면, 복구 경로 및 결과에서의 명확한 중요성에도 불구하고 기타 진핵세포에서는 이 절제(resection) 과정에 대하여 별로 알려진 것이 없다. 인간 세포에서 말단 절제(resection)를 연구하기 위한 새로운 접근법과 기술의 발달로 더욱 복잡한 조절 기작이 밝혀질 수 있을 것이다.
3. 상동 재조합 조절: 상동성 기반 복구 경로 선택에서 RAD51 허브
일단 말단 절제(resection)가 일어나면, C-NHEJ 경로는 차단되고 SSA, alt-EJ 및 HR 등 세 상동성 기반 경로가 적용된다. 이들 경로의 이용은 RAD51 시냅스 전후 단계의 조절 및 완료에 의해 영향을 받는다. RAD51 기능의 양성 및 음성 조절자에 대해 집중적으로 설명해 보겠다. 효모와 포유류에서 DNA 손상이 시작되면 RPA 복합체는 초기에 RAD51와 ssDNA에 결합하기 위한 경쟁을 한다. 하지만 RAD51이 일단 ssDNA로 적재되면, 이차 구성 형성을 제거하고 DNA 말단을 분해로부터 보호하여 시냅스전 뉴클레오필라멘트 형성을 선호하기에 RPA는 친재조합유전성 (pro-recombinogenic) 역할도 가지고 있다. 나아가 절제(resection)된 DNA에 RPA의 결합은 미세상동성 사이의 자발적 결합을 방지하며, 이는 미세상동성이 매개된 복구에 대한 조절의 한 단계로 생각된다. 효모와 인간에서 SSA는 ssDNA에 RPA 결합이 요구되고 RAD51에 독립적이므로 RPA는 SSA도 조절한다.
3.1 HR의 양성 조절자
몇몇 보조 단백질 조절인자는 RPA 치환, RPA 뉴클레오필라멘트 형성 및 사슬 교환 활성을 양성적으로 조절하며, RAD51 패럴로그, BRCA2, 및 RAD52가 가장 중요하다. 포유동물 세포에서 BRCA2는 BRC 반복으로 불리는 진화적으로 보존된 8 개의 부위를 통하여 RAD51 뉴클레오필라멘트 형성 및 사슬 교환에 관여하는 주 조절인자이다. BRCA2 BRC 도메인은 자가 결집된 RAD51 저중합체를 파괴하고 대신 RAD51 단량체의 일대일 결합을 촉진하여 ssDNA로의 RAD51 적재를 촉진한다. BRCA2 결합은 RAD51의 ATP아제 활성을 안정화시켜 RAD51의 ssDNA 결합 활성을 촉진한다. 2 단계에서 BRCA2 C-말단 도메인은 RAD51?ssDNA 나선체의 형태로 RAD51 저중합체에 결합하고, 따라서 뉴클레오필라멘트 성장을 촉진하고 사슬 침습(strand invasion)에 참여한다. BRCA2가 없는 효모에서는 유사한 재조합유전성 기능이 Rad52에 의해서 수행되는 것으로 생각된다.
3.2 HR의 음성 조절자
역으로, 사슬 교환 조절을 위하여 많은 인자가 RAD51 뉴클레오필라멘트 형성을 음성적으로 조절하며, 이로써 과잉 재조합 및 교차(Crossover)로 견인된 재조합을 방지한다. 효모 Srs2는 Rad51 기능에 대해 밝혀진 첫 음성 조절인자이다. Srs2 DNA 풀기효소(helicase)는 DNA 풀기에 연계된 ATP 가수분해 활성을 통하여 전시냅스 필라멘트에서 Rad51을 제거한다. 포유동물 세포에서 PCNA (Proliferating Cell Nuclear Antigen)-상호작용 인자, PARI는 ATP 가수분해가 요구되는 과정에서 RAD51 뉴클레오필라멘트를 해체하는 것으로 알려져 있다. 최근에, 중합효소 Polυ가 항재조합효소로 전시냅스 단계에서 작용하는 것으로 알려져 있다. Polυ는 ssDNA에 이미 결합된 RAD51을 치환시킬 수는 없으나, RAD51과 ATP 가수분해가 요구되는 기작에서 Polυ는 여전히 RAD51 뉴클레오필라멘트의 형성을 제한할 수 있다. Srs2, PARI, 및 Polυ는 alt-EJ, TLS (translesion synthesis), 또는 SSA 등의 오류성 복구 기작도 촉진할 수 있다.
유사한 항재조합 유전성(antirecombingenic) 활성은 RecQ 풀기효소를 포함한 몇몇 포유동물 세포 풀기효소에 의해 나타난다. RECQL5는 ATP 의존 방식과 BRC 유사 도메인을 통하여 RAD51 필라메트를 파괴한다. HR을 제한하는 한편, RECQL5는 RAD52에 대한 RAD51의 억제 효과에 길항작용을 하고, 합성 의존 사슬 결합(Synthesis-Dependent Strand Annealing, SDSA)을 촉진하여 교차를 제한한다. 판코니 빈혈(Fanconi Anemia, FA) 세포에서 RECQL5의 결손은 게놈 불안정성을 증가시키며, HR 결핍 조건에서 RECQL5가 생존에 필수적인 보정적 복구 기작을 야기할 수 있는 것으로 추측된다. 또 다른 RecQ 풀기효소인, BLM은 유사한 ATP 의존 방식으로 ssDNA에서 RAD51를 치환(displacing)하는 초기 재조합 유전성(recombigenic) 단계를 저해한다. 최근의 두 연구는 DSB 복구에서 BLM의 이중 기능을 밝혔다. BLM은 53BP1 및 Rif1과 상위적(epistatic)으로 alt-EJ를 억제할 수 있다. 53BP1 또는 Rif1의 부재 하에 BLM에 의해 alt-EJ가 선호될 수 있다. 이들 두 RecQ 풀기효소 이외에, ANCJ와 FBH1 풀기효소도 RAD51 뉴클레오필라멘트의 분해를 촉진한다. DT40 세포에서 FBH1의 결손이 자매 염색분체 교환(SCE)율의 상승 원인이 되나, FBH1이 오류성 DSB 복구를 촉진할 수 있는지는 확실하지 않다.
RAD51 뉴클레오필라멘트 형성 후에도 사슬 교환 단계에서 HR이 조절될 수 있다. DNA 복구 동안 특정 DNA 풀기효소에 의한 D 루프 치환은 교차를 억제한다. 이는 부정확한 염색분체 교환이 전위를 초래할 수 있는 유사분열 동안 선호된다. 풀기효소 RTEL1은 ATP 가수분해 의존성 기작을 통하여 D 루프 분해를 효과적으로 견인한다. FANCM은 유사하게 RAD51로 둘러싸인 D 루프를 파괴할 수 있다. RTEL1 및 Mph1(효모 FANCM 동족체)은 HR을 억제하는 한편, SDSA 매개 비교차 산물의 형성도 촉진한다. 이들 인자의 결핍은 RAD51 촛점(foci)의 축적과 높은 자매 염색분체 교환(SCE)율을 초래한다.
사슬 교환 후 RAD51은 dsDNA에서 제거되며, 이는 사슬 연장, 접합부 해결 및 염색분체 재결합에 중요하다. 전시냅스 HR의 중요 조절자인 ATM은 RAD54의 활성화를 통해서 HR의 마지막 단계도 조절하는 것으로 추정된다. HELQ 풀기효소는 dsDNA에서 RAD51을 제거하고 ATP 비의존 방식으로 사슬 연장을 촉진한다. 종합적으로 이들 결과는 비HR 경로 및 HR 복구 단계의 철저한 조절 둘 다에서, DSB 복구의 경로 선택에 RAD51이 중심에 있음을 확실히 보여준다.
4. Annealing 의존성 DSB 복구
4.1 HR과 alt-EJ 사이의 연계
S기에서 alt-EJ의 기능은 C-NHEJ 인자들에 독립적이며, 최근까지 염색체 DSB(특히 V(D)J 재조합)을 위한 C-NHEJ의 백업 복구 경로로 간주되었다. 하지만 최근의 진전된 연구에서는 alt-EJ와 HR 경로가 DSB 복구에 경쟁적임이 밝혀졌다. Alt-EJ와 HR 모두 공통의 초기 절제(resection) 기작을 공유하며, HR에서 절제(resection) 말단의 처리는 진핵생물의 RecA 동족체인 RAD51에 의해서 처리되는 반면, PARP1이 alt-EJ 의 미세상동에서의 결합을 매개하는 것으로 생각된다. HR에서 RAD51은 ssDNA 상에 필라멘트를 형성하여 상동 주형과의 사슬 교환을 견인한다. PARP1은 TLS 중합효소같은 alt-EJ 복구 인자들을 손상 주변의 미세상동성 서열로 모집하는 플랫폼의 역할을 하는 것으로 추정되었다. 유전적 또는 화학적 수단을 통한 RAD51이나 PARP1의 조절은 각각 HR과 alt-EJ에 영향을 미친다. 예로 출아효모 Srs2 풀기효소는 Rad51?ssDNA 전시냅스 시험관내 실험에서 뉴클레오필라멘트를 파괴하며, 원하지 않는 HR의 방지 및 효과적 alt-EJ의 촉진에 관여한다. Srs2의 결손은 SSA 빈도도 감소시키며 이는 Srs2가 HR과 annealing 의존성 DSB 복구의 교차점에 위치함을 암시한다. 세포에서 PARP 억제제(PARPi)를 통한 PARP 기능의 화학적 억제는 HR 복구를 감소시켜 합성적 치사를 야기하며, 이는 이들 세포에서 PARP1 매개 alt-EJ가 HR 결손을 보완함을 암시한다. 하지만, PARPi는 기타 PARP 계열 단백질을 억제할 가능성이 있고 이런 상승적 관계가 alt-EJ에 대한 화합물의 효과일 수 있다. 다른 PARP 계열 단백질인 PARP3은 DSB에 대한 세포 반응의 중요한 인자이며, PARP3의 발현억제(silencing)가 말단 절제(resection) 및 돌연변이 유발성 alt-EJ를 증가시키는 반면 HR은 감소시킴이 밝혀졌다. 또한 최근의 연구에서 PARP1과 PARP2 사이의 합성적 치사 상호작용이 있음을 밝혔다. 실제로parp1?/? parp2?/? 생쥐는 배아단계 치사를 보이며 이는 이들 단백질들이 게놈 안정성의 유지에 중복(overlapping) 및 비다중성(nonredundant) 기능을 가지고 있음을 보여준다.
인간 세포에서 alt-EJ와 HR 사이에 상경적 관계가 있음이 최근 입증되었다. Polυ (POLQ에 의해 부호화)라는 TLS 중합효소는 alt-EJ에서 기능을 하며, ATP 가수분해 및 RAD51 결합이 요구되는 기작에서 RAD51에 결합하여 RAD51 뉴클레오필라멘트 형성을 억제하여 HR을 억제한다. 이는 spn-A(인간 RAD51의 동족체)의 돌연변이가 전리 방사선(Ionizing Radiation, IR)에 민감하고 mus308 (인간 Polυ의 동족체)의 유실이 방사선에 대한 spn-A 돌연변이 민감성을 증가시킴을 보여준 초파리의 연구와 일치한다. ssDNA상에 RAD51의 집합을 방지하여 Polυ이 RAD51 독성(RAD51의 과발현에 의한 잠재적 결과)을 제한한다고 생각할 수도 있다. 동시에 Polυ는 진화적으로 보존된 루프 도메인에 의존하는 과정을 거쳐 절제(resection)된 DSB에 직접 결합하여 alt-EJ를 수행할 수 있다. 이 과정에서 미세상동성의 쌍짓기가 이루어진다. 그 이후에, Polυ는 반대 돌출부위를 주형으로 사용하여 염기 쌍짓기된(base-paired) 부위에서 각 사슬을 연장시킬 수 있다. 흥미롭게도 Polυ는 HR 결핍 자궁암 및 유방암에서 상승조절되며, 이는 HR에 결핍이 있을 때 alt-EJ가 DSB 복구에 백업 경로 역할을 할 수 있음을 의미한다.
Polυ가 결핍되면, HR 결핍 세포는 세포 독성 제제에 과민 반응하게 되고 HR 결핍과 Polυ 결핍 생쥐 사이에 교배된 배아는 생존할 수 없다. 이는 HR과 Polυ 매개 alt-EJ사이의 합성적 치사 관계를 나타낸다. 따라서 Polυ 활성에 대한 소분자 억제제의 생산은 비활성 HR을 동반한 암에 대한 새로운 잠재적 치료법을 제공할 수도 있다. Polυ는 상동 재조합(HR)과 대체 말단 접합(alt-EJ) 사이의 균형을 조절한다.
Alt-EJ 인자 Polυ는 HR을 억제하는 반면, FA 단백질들을 포함한 여러 HR 인자들이 alt-EJ를 촉진함이 최근 연구 결과에서 암시되었다. 하지만 alt-EJ에서 이들 단백질들의 기능은 완전히 알려지지 않았다. FA 사슬간 교차 결합(Interstrand Crosslink, ICL) 복구 경로의 주요 조절인자인 FANCD2의 발현은 Polυ와 상관관계를 가지며, 이는 공통 조절 기작을 암시한다. 나아가, 최근에 FANCD2가 직접적으로 CtIP와 상호작용을 하고 사슬간 교차 결합 복구 동안 효과적 말단 절제(resection)을 위해 필수적임이 밝혀졌다. CtIP는 말단 절제(resection)에 대한 조절의 중요 교점으로 결과적으로 HR, alt-EJ, 및 SSA 사이의 균형을 조절하기에, CtIP와 상호작용하는 인자들은 맥락 의존적 방식으로 복구 경로에 직접적으로 영향을 미칠 수 있을 것으로 짐작된다. 종합적으로 이들 발견은 HR과 alt-EJ 사이의 다단계 연계가 있다는 개념을 확인하고 몇몇 인자는 여러 복구 경로에서 기능할 수 있음을 입증하며, 이는 조절에 대한 다중 경로를 암시한다.
4.2 HR과 SSA의 상관관계: RAD52는 유일한 조절인자인가?
HR과 반대로, SSA 경로는 독특하게 공여 DNA 배열이 필요하지 않고, SSA는 사슬 침습(strand invasion)을 동반하지 않고 RAD51에 독립적이다. 대신 SSA는 노출된 상보적 배열에 결합하기 위하여 절제(resection) 말단을 사용하여 복구를 완료한다 SSA의 단계는 출아효모에서 밝혀져 왔다. 동족체 Rad59 단백질과 결합하여 Rad52은 DSB 측면에 노출된 반복 배열에 결합한다. 이 결합(annealed) 복합체는 Msh2?Msh3 부정합(mismatch) 복구 단백질에 의해서 안정화되는 것으로 생각되고 비상동성 조각부위는 Saw1과 Slx4 단백질 의존성 기작에서 Rad1?Rad10 핵속핵산분해효소(endonuclease)에 의해 절단된다. 포유동물 세포 연구에서 Rad52 (RAD52)와 Rad1?Rad10 (ERCC4?ERCC10)의 포유동물 동족체들이 SSA에 관여함이 밝혀졌다. 그러나, 고등 진핵생물계에서 이 경로에 대한 추가 구성요소는 여전히 밝혀지지 않았다. 예로 최근 연구에서 ICL 복구 감지자인 UHRF1이 기능적 동족체로 제안되기는 하였지만, 명확한 포유동물 Saw1 동족체는 존재하지 않는다. UHRF1과 SLX4이 포유동물 SSA에 필수적인지의 실험은 흥미로울 것이다. 추가로 효모 Rad52는 Rad51 의존성/비의존성의 모든 HR 하부경로에 관여하기에 이의 부재는 아주 심한 결함 및 방사선 민감도를 보인다. 반면에 BRCA2 동족체를 소유한 생물체(깜부기, 닭, 인간 및 생쥐)에서는 RAD52 비활성화는 미미한 DNA 복구 결핍을 보인다. 이들 관찰은 BRCA2가 있는 생물체에서는 RAD52가 제한적인 HR 기능을 지니는지에 대한 의문을 제기한다.
이러한 차이점에도 불구하고 하등 및 고등 진핵생물 세포 모두에서 DSB에 대한 HR과 SSA 사이의 경쟁관계가 나타난다. 예로 효모에서 Rad51은 상보적 ssDNA에 대한 Rad52 매개 결합(annealing)을 방지하며 포유동물 세포에서 RAD51 억제는 RAD52 매개 SSA 활성을 상승조절한다. HR 보유 포유동물 세포에서 RAD52 결핍은 세포 성장과 생존에 영향이 없지만, HR 인자(BRCA1, PALB2, 및 BRCA2)가 결핍된 세포에서 RAD52 기능의 결핍은 합성적 치사를 보인다.
HR 결핍 세포에서 RAD52의 결핍이 게놈 불안정성을 증가시키는 기작은 불명확하나, BRCA1/2 결핍 세포에서 RAD52가 RAD51 의존 상동성 지시 유전자 전환(gene conversion)을 유지하는 것으로 생각된다. BRCA 결핍 종양이 SSA에 의존적인지, SSA 활성이 HR의 결핍에 의해 증가되는지는 논란의 여지가 있으며, HR 결핍 종양에서 SSA의 이용에 대한 이해는 항암 치료의 새로운 표적을 밝힐 수 있을 것이다. 이들 발견은 척추동물에서 RAD52 그리고 이 단백질의 HR과의 관계에 대한 새로운 연구의 필요성을 제시한다. 실제로, ATM 결핍 생쥐에서 단일 RAD52 유전자 제거에 의한 T 세포 림프종의 발달 감소는 생쥐 RAD52의 중대한 생체 내 기능을 보여준다. 놀랍게도, ATM 결핍 생쥐를 POLQ 결핍 생쥐에 교배할 때에도 비슷한 결과가 얻어졌다. 이중 돌연변이 생쥐는 지체된 T 림프종의 발생과 유의한 생쥐 생존률의 증가를 보였다. 이들 관찰은 POLQ 또는 RAD52가 HR 결핍의 인간 및 생쥐에서 DNA 복구에 지배적으로 이용되는지에 대한 의구심을 제기한다.
5. Annealing 의존성 DSB 복구 결과 및 돌연변이성 특징
Annealing 의존성 경로를 이용한 DSB의 복구는 삽입 및/또는 결실을 초래하기에, 게놈의 온전성을 보존하는 HR 매개 복구와 다르게 이 DNA 복구 기작은 특정 게놈상의 표식 즉 ‘게놈상의 상처(genomic scar)’를 남기는 것으로 생각된다. 최신 차세대 염기서열분석법으로 여러 암 위험성 대립유전자를 빠르게 식별할 수 있음에 따라, 전체 게놈 염기서열분석 및 이형접합성의 결핍 프로필로 HR 결핍을 나타내는 특정 돌연변이 프로필을 발견하였다. 높은 비율의 유방암 및 자궁암이 BRCA1/2, FA 유전자, 또는 DNA 부정합 복구 유전자와 같은 DNA 복구 유전자의 돌연변이에 의한 유전적 위험에서 기인한다. 몇몇 HR 결핍 종양은 PARP 억제제(PARPi)같은 약물에 증가된 민감도를 보인다. 최근에 유방암의 아집단(즉, 기저양 유방암[basal-like breast cancer])에서 복제 개수( number) 이상이 많이 나타남이 밝혀졌다. 이 집단은 백금 기반 화학요법에 양호한 반응을 보이고 복제 개수 이상은 이 질병에 대한 후보 예측 생체지표를 제공한다. 암 세포의 유전적 및 분자적 특징에 대한 더 많은 이해에도 불구하고, 종양의 유전적 특징(HR 결핍)과 임상적으로 적절한 평가변수(질환 반응 및 환자 반응 성과) 사이의 관계는 잘 알려지지 않았다. 이는 부분적으로는 현재의 'HR 결핍 유전적 표식'이 포괄적이지 않기 때문이다. 예로, HR 매개 복구에 결핍이 있는 거의 20%의 중증 자궁암 및 기저양 유방암은 BRCA1/2 유전자에 돌연변이가 없으며, 그러므로 모든 치명적 HR 돌연변이가 식별된 것은 아닌 것으로 추정된다. HR 결핍을 더욱 포괄적으로 정의하기 위해서는, 알려진 HR 생체지표(예로 BRCA)의 결핍하에서 다른 유전적 표식을 식별하는 것이 중요할 것이다. 이런 연구 방향에서 BRCA1/2 돌연변이 종양은 명확한 돌연변이 스펙트럼을 가지고 있음이 관찰된다.
현재의 HR 결핍의 유전적 특징은 손상부위 접합부에 중복 미세상동성을 동반한 3bp보다 긴 삽입 및 결실과 강한 연관 관계를 보인다. 돌연변이성 alt-EJ와 SSA 경로가 HR에 대한 백업 역할을 하고 HR 결핍 기저양 유방암에서 복제 개수 이상이 이들 오류성 경로들의 사용을 촉진하는 것으로 보아, alt-EJ 또는 SSA를 통한 복구는 모든 HR 결핍 종양에서 관찰되는 특징적 돌연변이 스펙트럼을 설명할 수 있다. Alt-EJ에서 메꿔넣기 합성(fill-in synthesis)은 Polυ 중합효소에 의해 매개되는 것 같으며, 이 과정은 오류성으로 점돌연변이(point mutation) 및 무작위 삽입/결실(indel)을 일으키기 쉽다. 출아효모 Polυ의 상승조절은 20-200 bp의 무작위 결실이나 삽입을 일으키는 것으로 나타난다. 그러므로 HR 결핍의 지표일 수 있는 alt-EJ의 사용은 미세상동성 매개 복구 자리에 삽입 및 결실(indel)로 이루어진 돌연변이성 표식을 남길 가능성이 있다(10 bp). 또한 HR 결핍은 SSA 활성도 증가시킴으로, SSA 돌연변이성 표식의 결정은 HR 결핍 종양의 식별에 도움이 될 수도 있다. 효모에서의 문헌과 연구에 기반하면, 상승조절된 SSA에서 유래된 예상 돌연변이성 표식은 긴 상동성 반복 서열(30 bp)을 보이는 자리에서의 긴 결실이다. Alt-EJ 및 SSA의 사용과 관련된 돌연변이 표식을 밝혀 HR 결핍 유전적 표식의 현재 목록을 확장할 수 있을 것이며, 궁극적으로 특정 유전적 기능과 해당 임상 평가변수 사이에 더욱 정확하고 포괄적인 관계의 확립이라는 목표에 도달할 수 있을 것이다. 이는 잠재적으로 더욱 직접적이고 확실한 항암 치료 선택 및/또는 환자의 결과를 예측할 수 있는 새로운 임상 생체지표를 식별할 수 있게 할 것이다.
6. 결론
본 리뷰에서는 임상 적용의 관점에서 DSB의 복구에 사용되는 경로에 관해 현재 우리가 아는 바를 검토하였다. 네 가지의 알려진 DSB 복구 경로의 조절과 오류성 DNA 복구 경로가 어떻게 HR 결핍을 보정할 수 있는지에 대해서 논의되었다. DNA 복구 기작의 기본적인 조절에 대한 이해는 합성적 치사 기반의 약물 개발에 진전을 가져왔다. 수십 년 동안 설계자(designer) 치료 제제의 표적으로 이용될 수 있는 특정 발암 단백질 또는 경로의 식별에 많은 노력이 이루어져 왔다. 이 접근법을 이용한 몇몇 괄목할만한 성공에도 불구하고, 비특이적으로 DNA를 손상시키는 시스플라틴(Cisplatin) 같은 1세대 약물이 아직 대부분의 항암 치료법의 근간을 이루고 있다. 각 개인의 종양에 존재하는 DNA 복구 경로의 돌연변이 상태를 확인하는 대규모의 유전체학 연구가 진행됨에 따라, 종양 복구 경로 돌연변이에 기반한 DNA 손상 제제를 이론적 근거에 따라 선택하는 것이 가능해 질 수도 있을 것이며, 사용가능한 DNA 손상 제제를 설계자 방식으로 사용할 수 있을 것이다. 발암 억제에서 DNA 복구 경로의 핵심 역할에 부합하게, 이의 비활성은 여러 암의 소인이 될 수 있다(예로, 유방/자궁, 전립선 및 췌장 암 등의 초기 발병에서 BRCA1/2 돌연변이). 실제로 암 세포는 종종 최소 하나의 DNA 복구 경로에 결핍이 있으며, 높은 비율의 암(특히 유방 및 자궁 암)에서 HR 경로를 포함한 DNA 복구 유전자의 결핍이 입증되었다. 종양 세포가 특정 DNA 복구 경로에 결핍이 있을 경우, 이 결핍이 이차 경로의 활성화에 의해서 보정된다는 원리에 기반한 표적 요법을 이용할 수 있는 시기가 다가오고 있다. 그러므로 종양은 생존을 위해 이 대체 경로에 의존하고, 이를 억제하면 정상 세포에는 거의 영향이 없이 악성 종양 세포를 죽일 수 있다(합성적 치사, synthetic lethal). 합성적 치사의 유전학적 개념은 암에 대한 새로운 치료 접근법의 설계에 대한 근간을 제공한다. 생식세포계열 BRCA1 또는 BRCA2 유전자 돌연변이를 동반한 환자에게 PARPi를 투여하면 효과가 있을 것으로 예상되는 이 접근법을 이용한 임상 시험에서 유망한 적응증이 나타났다. 억제되었을 때 HR 결핍과 합성적 치사를 보이는 PARP1은 alt-EJ를 통한 여러 DSB 복구 등 다양한 세포 내 과정에 관여하는 것으로 알려졌다. 그러므로 오류성 DSB 복구 경로는 HR 결핍 세포의 성장과 생존에 중요한 하나의 과정일 수 있다. 이는 DSB 복구 경로에 대한 연구 그리고 이 경로의 구성 요소, 기작 및 조절의 결정이 중요함을 보여준다. 이들 연구에서 약물 개발 및 새로운 합성적 치사에 대한 표적이 발견될 수 있을 것이며 이는 임상적으로 평가될 수 있을 것이다.
미해결된 의문사항
말단 절제(resection)가 어떻게 DNA DSB에 대한 복구 경로 선택을 조절하는가?
인간 세포에서 말단 절제(resection)를 조절하는 핵심 인자는 무엇인가?
이들 핵심 인자는 어떻게 조절되는가?
HR 결핍 시에 이들 인자들인 다르게 조절되는가?
Annealing 의존성 DSB(SSA 및 alt-EJ)가 어떻게 HR 결핍을 보정하는가?
어떤 대체 경로가 주로 이용되는가?
HR 결핍 세포의 생존에 SSA 또는 alt-EJ의 어떤 기능이 중요한가?
HR 결핍 시에 alt-EJ와 대비해서 어떻게 SSA의 이용이 시작되는가?
SSA 및/또는 alt-EJ의 이용에서 유래되는 게놈상의 표식은 어떤 연관성을 내포하는가?
현재의 HR 결핍 게놈상의 표식과 병합한 이들 표식의 평가로 HR 결핍에 대한 개선된 측정 및 암 환자 치료 성과가 가능한가?
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 pdf_0002785.pdf
pdf_0002785.pdf