기술동향
조직-특이적 종양 형성: 상황적 문제(Context matters)
- 등록일2017-09-06
- 조회수7482
- 분류기술동향
-
자료발간일
2017-08-22
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#조직-특이적#종양 형성
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
조직-특이적 종양 형성: 상황적 문제(Context matters)
최지혜 / 아주대학교 의생명과학과
[목 차]
1. 서론
2. 조직-특이적 종양 형성
2.1 기원 세포, 세포의 적응성(plasticity) 및 전이 분화(transdifferentiation)
2.2 종양 억제 인자 장벽(barrier)
2.3 염색질 구성, 복제 타이밍 및 조절(regulatory) 요소
2.4 암을 위한 유전적 경로
2.5 DNA 손상 및 복구, 발암성 스트레스의 내성
3. 상황에 따른 발암성 신호 전달
3.1 발암성 경로의 context-specific 조직(organization)
3.2 암 유전자의 첨가물(additivity), epistasis historical contingency
4. 환경적 요인들
4.1 종양의 미세 환경(microenvironment)
4.2 종양의 거시 환경(macroenvironment) 및 대사
4.3 감염, 염증, 미생물 및 기타 환경적 요인들
5. 전망
[요약문]
어떻게 하면 암을 더 효과적으로 치료할 수 있을까? 전통적으로, 같은 해부학적 위치의 종양들은 하나의 종양 개체로 간주되어 왔다. 최근 암 유전체 및 번역(translational) 연구의 발전으로 분자 유전체 프로파일링이 가능해짐에 따라, 이러한 개념에 대한 문제가 제의되고 있다. 다양한 종양 타입들 간에 공유되는 암 조절 인자(driver)의 규명 및 검증을 통해, off-label 약물 사용 또는 basket이나 umbrella로 불리는 시험(trial)들이 해부학적 위치의 조절 인자를 표적하는 새로운 패러다임으로 고무되고 있다. 이러한 시험들은 하나의 종양 개체에서의 분자적 변이(alteration)를 다른 종양 개체의 변이로 추론(extrapolation)이 가능한지의 여부를 테스트하도록 설계되었다. 그러나 최근 임상 및 전임상 연구들은 종양 형성(tumorigenesis)과 발암성 신호 전달 경로 구성에 있어서 조직- 및 세포- 특이적인 차이가 있음을 제시하였다. 본 오피니언 글에서 우리는 장기-특이적(organ-specific)인 종양 형성의 분자적(molecular), 세포적(cellular), 시스템적(systemic) 및 환경적인(environmental) 결정 요인과 상황 특이적인(context-specific) 발암성 신호 전달 메카니즘에 초점을 맞추었다. 이러한 차이에 대한 조사, 인식 및 심층적인 생물학적 이해는 미래의 차세대 임상시험의 설계 및 암 치료법의 구현에 필수적이다.
1. 서론
지난 30년간 분자적 종양 프로파일링과 기능 연구는 특정 종양 타입에서 조절 장애 또는 돌연변이가 되는 결정적 유전자 및 경로의 규명 및 검증을 이끌어 왔다. 동시에 암 조절 인자(cancer driver)들 중 일부를 효과적으로 차단하기 위한 표적 치료제들이 지속적으로 개발되어 오고 있다. 전 임상 시험에서 몇몇 표적 약물은 비교할 수 없는 활동을 보였으며, 분자 종양 프로파일이 일치하는 환자의 치료의 금본위체(gold standard)가 되었다. 성공적인 표적 암 조절 인자의 예로, 유방암에서 ERBB2과 발현(overexpression), 흑색종(melanoma)에서 BRAF 돌연변이, 만성 골수성 백혈병(chronic myeloid leukaemia, CML)에서 ABL1 재배열(rearrangement), 위장 간질 종양 (gastrointestinal stroma tumour, GIST)에서 KIT 돌연변이 및 비소 세포 폐암(non-small cell lung cancer, NSCLC)에서 ALK 재배열 또는 EGFR 돌연변이 등이 있다. 이러한 예들은 바이오마커(biomarker)를 조절하는 정밀 의학(precision medicine)의 실현 가능성과 힘을 명확히 보여준다.
전통적으로 암 치료 방법의 결정은 의학 종양학(medical oncology), 방사선 종양학(radiation oncology), 병리학(pathology)과 같은 다양한 분야의 전문가들이 각 암 개체의 전문가와 함께 환자의 건강 상태 및 치료 옵션들을 검토하고 의논하는 과정을 통해 이루어진다. 적합하게 강화된 3 상(phase III) 무작위 통제 시험(randomized controlled trial, RCT)은 치료 효능 및 안정성에 관한 확실한 데이터를 제공한다. 지난 10년 동안, 대규모 유전체 프로파일링을 위한 기술이 빠르게 발전하여, 다양한 종양 개체에 걸친 암 유전체의 포괄적인 분석이 가능해졌다. 이를 통해 단일 종양 개체에서 발견된 암 조절 돌연변이들(driver mutations)이 다른 해부학적 부위의 종양에도 존재한다는 것을 밝혀졌다. 예를 들어, 발암성(oncogenic) BRAF 돌연변이는 모발 세포 백혈병(hairy cell leukaemia)의 100%, melanoma의 약 50%, 유두 갑상선(papillary thyroid cancer)의 약 50%, 뇌종양(brain tumour)의 약 10%, 대장암(colorectal cancer, CRC)의 약 10%에서 발생하며 이 밖의 다른 암 종에서는 더 낮은 빈도로 발생하고 있다.
암 조절 인자들은 다른 종양 타입들 사이에서 공유되기 때문에, 암의 기원(origin) 조직이나 장기에 기반한 전통적인 암 분류법은, 분자적 변이(molecular alteration) 기반의 분자적 표현형(molecular phenotype)에 따른 새로운 분류법으로 교체되어야 한다고 제안되고 있다. 이러한 변이들은 암의 기원 세포나 조직과 관계없이 공통 표적이 가능한 취약성(vulnerability)을 보일 수 있다. 이는 하나의 종양 타입에서 치료 효과의 증명 후에, 해부학 적으로 다른 암 종에 걸친 표적 약물 사용의 외삽 및 일반화 하는 발상을 이끌어 냈다. 그 결과, 암 연구자들은 점점 오프 라벨(off-label) 분자적 표적화된 약물(molecular targeted drug) 사용을 늘리고 있으며, 환자들은 basket 또는 umbrella 시험(trial)에 포함되고 있다. 이 시험은 특정 약물에 반응하는 분자적 변이를 공유하는 다른 암 유형의 환자들을 함께 등록한다. Umbrella 시험의 예로, 최근 시작된 National Cancer Institute Molecular Analysis for Therapy Choice (NCI-MATCH) 연구가 있다. NCI-MATCH는 약 5,000명의 환자의 종양 생검(biopsy) 표본을 조사하여 잠재적인 약물 치료가 가능한 표적(druggable target) 발굴을 목적으로 하고 있다. 이 시험은 새로운 임상 시험 계획의 실현 가능성과 효과에 관한 중요한 통찰을 제공할 것이다. 또한, 분자적 표적 치료에 반응하는 환자의 아형(subgroup)을 규명하고, 약물 반응과 관련된 바이오마커의 발견뿐만 아니라 초기 치료 저항성(resistance)의 메커니즘을 밝히기 위한 중요한 단계이다. 나아가 데이터 기반 인간 암 모델을 생성하고 동시 발생(co-occurring) 및 상호 배타적인(mutually exclusive) 유전자 변형의 생물학적 영향을 기계론적으로(mechanistically) 조사하기 위한 미래의 기초 및 번역의(translational) 암 연구를 향하기 위한 풍부한 자원을 창출할 것이다.
그러나, 최근의 basket 시험은 분자적 변이 특이적 항암제 반응성이 종종 해부학적 암종에 의존적이라는 결과를 보이며, 다른 종양 개체 간의 off-label 표적 약물의 사용이 표준 치료보다 우수하지 않을 수 있다는 증거들이 제시되고 있다. 예를 들어, 동일한 발암성 BRAFV600E 돌연변이를 표적 하는 약물은 melanoma, NSCLC 및 hairy cell leukaemia에서 전례 없는 효과를 보였지만, CRC에서는 실패하였다. 그러므로 조절 돌연변이가 다른 종양 개체들 간에 유사하게 행동한다는 가정은 일반적으로 유효하지 않을 수 있다. 같은 맥락으로, 발암성 조절 인자 및 신호 전달 경로 구성이 조직 특이적(tissue-specific)이며 치료의 반응성(response) 및 저항성(resistance)의 중요한 결정 인자라는 실험적 증거가 영향력을 보이고 있다.
본 오피니언 글에서, 우리는 조직 특이적 종양 발달의 분자적, 세포적 및 시스템적인 결정 요인들을 요약하였다. 우리는 발암성 조절 인자의 신호 전달 출력이 조직 유형들 간에 크게 다를 수 있으며, 환경적 요인들이 암 유전자들의 조직 특이적 신호 전달을 형성하는 전형적인 방법의 예를 제시하였다. 우리는 분자적 표적 치료법의 설계를 위한 조직 상황(tissue context)에서의 영향들을 논의하고, 다차원적 암의 생물학 및 표적 연구 방법의 중요성을 주장하였다. 치료는 장기의 유형, 환경적 상황 및 공동으로 발생하는 돌연변이들과 같은 유전적 교란 요인들(confounders)을 포함하여, 다양한 측면들을 고려해야 한다고 생각된다. 조직 특이적 발암성 신호 전달에 대한 우리의 이해가 아직 초기 단계이기 때문에, 우리는 조직 상황에서 각 잠재적 암 조절 인자의 생물학적 특성의 조사에 대한 필요성을 강조하였다. 이는 임상시험 계획을 가이드 할 수 있는 잠재력을 가지며, 상황에 맞는 환자가 알맞은 basket에 등록되도록 할 수 있다. 분자 종양 프로파일과 조직 유형의 결합은 치료 효과를 증가시키고 분자적 정밀 치료를 촉진시킬 것이다.
2. 조직-특이적 종양 형성
발암성 조절 돌연변이에 대한 반응은 세포 및 조직 유형들 간에 큰 차이를 보인다. 이러한 차이는 선종성 결장 폴립증(adenomatous polyposis coli, APC) 생식 계열 돌연변이(germline mutation)에 의한 가족성 대장 폴립증(familial adenomatous polyposis, FAP)과 같은 유전성 암 소인 증후군(hereditary cancer predisposition syndromes)에서 뚜렷하다. APC 돌연변이에 의한 CRC 발병 위험은 거의 100 %에 달하지만 다른 종양 타입은 발병이 드물다. 다른 예로, 유전성 유방암과 난소암 증후군을 일으키는 BRCA1과 BRCA2, 유전성 diffuse 위암 증후군을 유발하는 cadherin 1 (CDH1; E-cadherin), 망막아종(retinoblastoma)을 유발하는 RB1, von Hippel-Lindau 증후군 및 clear cell renal cell cancer (ccRCC) 소인을 유발하는 von Hippel-Lindau (VHL) 종양 억제 인자(tumor suppressor) 및 GIST 소인을 일으키는 KIT과 같은 생식 계열 돌연변이들이 있다(그림 1). 이는 조직들이 특정 발암성 사건에 대한 감수성(susceptibility)이 상당히 다르며, 종양 형성 장벽(barrier)이 매우 조직 특이적임을 설명하고 있다. 그러나 Li-Fraumeni 증후군을 일으키는 TP53 생식 계열 돌연변이와 같은 유전자 변이는 훨씬 광범위한 암종과 관련되어 있으며, 이러한 유전자들은 일반적인 암 유전자(cancer genes)로 간주된다. 이와 같은 맥락으로, 다양한 산발성(sporadic) 종양이 그들의 기원 위치에 따라 특유의 암 유전자의 우세를 보인 반면, TP53 돌연변이는 다양한 암종에 존재한다(그림 2). 예를 들어, VHL은 산발성 ccRCC에서 비활성화(inactivation)되지만, 다른 종양에서는 변이가 드물게 일어난다. 또한, CML의 BCR-ABL1 전좌(translocations), CRC의 APC 돌연변이 및 소세포 폐암(small cell lung cancer, SCLC)의 종양 억제 유전자 RB1의 돌연변이가 있다.
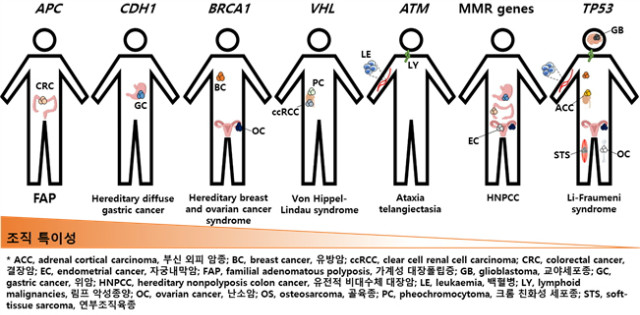
그림 1. 유전성 암 소인 증후군 및 조직 특이적 종양 형성
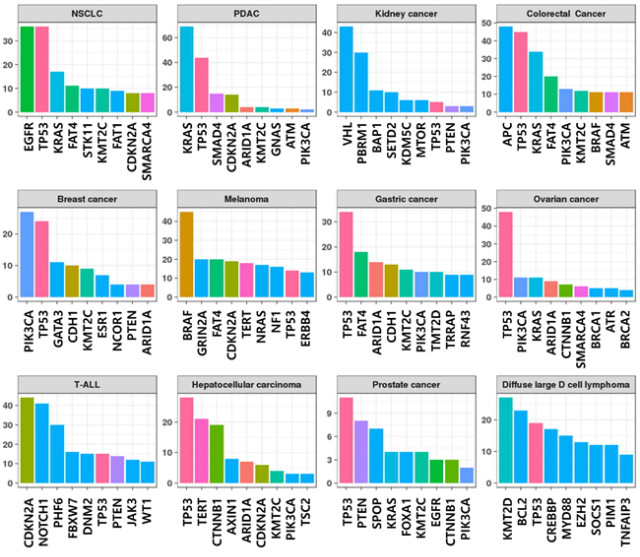
그림 2. Catalogue of Somatic Mutations in Cancer (COSMIC)의 주요 암종에서의 체세포 돌연변이 빈도수
조직 특이적 암 발달의 가장 명백한 이유는, 아마 암 조절 인자의 발현이 종양이 발달하는 조직에 국한되기 때문일 것이다. 그러나 대부분의 암 유전자는 다양한 조직에서 발현되며 암이 유래한 조직에만 국한되지 않는다. 이것은 암 조절 인자의 조직 특이적 발암성 기능(oncogenic function)과 기원 세포의 특성들(예를 들어 스트레스 반응, 신호 전달 경로의 연결성, 신호 출력 및 보상 메커니즘)과 같은 다른 요인들과 함께 유전적 및 후성적 변화가 존재하며, 그들과 조합 작용이 있음을 시사한다. 또한, 각각의 암 조절 요인들의 조직 특이성은 세포-세포 신호 전달(cell-cell sig-nalling), 모자이크 현상(mosaicism) 및 각각의 종양 미세 환경(microenvironment) 및 거시 환경 (macroenvironments)에 의해 영향 받을 수 있으며, 이외의 환경적 요인들의 상황에서 각각의 세포 유형 사이의 협력(cooperation)과 경쟁(competition)같은 세포-외부(cell-extrinsic) 인자들에 의해 영향을 받을 수 있다.
2.1 기원 세포, 세포의 적응성(plasticity) 및 전이 분화(transdifferentiation)
기원 세포와 그 분화 상태는 암 유전자에 의한 발암성 형질전환의 민감성(susceptibility)을 결정하는 주요한 인자이다(그림 3). 몇몇 암 조절 인자들은 줄기(stem)와 전구(progenitor) 세포의 자가 재생(self-renewal), 유지 및 계통 관련(lineage commitment)에 상황 특이적 영향을 갖는다(그림 3a). 예를 들어 APC는 WNT 신호 전달 경로(장의 줄기세포 항상성에 필수적임)의 중요한 조절 인자이다. 쥐에서 WNT 신호 전달을 제거하면 장상피세포가 완전히 손실되고, Apc 결실(deletion)에 의한 장내 줄기세포에서의 WNT의 활성화는 장내 종양 형성을 야기한다. 반면에, 분화된 장상피세포에서 Apc 비활성화는 이러한 영향을 주지 못한다.
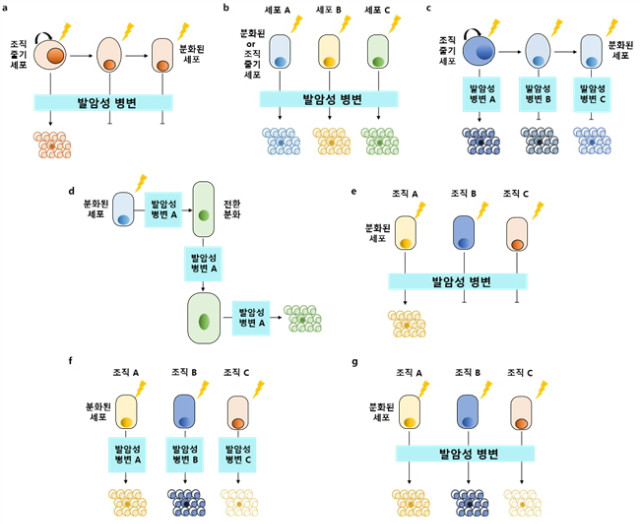
그림 3. 기원 세포 및 분화 상태에 따른 상황 특이적 종양 형성 및 종양 간 이질성 모델
다른 암 조절 인자들은 하나의 조직 내의 서로 다른 세포 유형에서 발산하는 표현형(divergent phenotypes)을 생성한다(그림 3b). 예를 들어, PIK3CA 유전자(PI3K catalytic subunit-α를 코딩 함)는 유방암에서 가장 빈번하게 변이되는 유전자 중 하나이며, 특정 분자적 유방암 아형과 관련되어있다. 기원 세포에 따라, 종양 유전자(oncogene)는 마우스의 유선(gland) 내에서 초기에 발현되고, 그 Pik3ca 돌연변이들은 다른 형태(morphology), 성장 패턴, 침습성 및 공격성을 가진 근본적으로 다른 종양 유형들을 유발시킨다. 다중 분화 세포 타입은 또한 KrasG12D가 유도된 NSCLC를 유발하고, 기원 세포에 따라 NSCLC의 스펙트럼 및 그 조직 병리학적 표현형이 영향 받는다.
암 조절 인자가 다른 세포 유형 또는 다른 분화 단계에서 별개의 기능을 가질 수 있다는 개념은 림프의 계통 분화(differentiation lineage)에서 입증되어 왔다(그림 3c). 예를 들어, 모든 경우에서 트랜스포존 동원(transposon mobilization)은 T 세포 급성 림프 구성 백혈병(T cell acute lymphoblastic leukaemia T-ALL)을 유발하지만, 서로 다른 세포 유형에서 활성화 또는 비활성화된 유전자들은 상당히 달랐다. 이러한 데이터들은 특정 기원 세포가 종양 아형의 기원 세포로써 역할을 위해, 특정 돌연변이군을 필요로 함을 시사한다.
세포의 적응성(cellular plasticity)은 췌장과 피부와 같은 뚜렷한 해부학적 부위에서 조직 특이적 종양 발달에 결정적으로 관여한다(그림 3d). 예를 들어, 발암성 KRAS에 의해 췌장의 선포 세포(pancreatic acinar cells)는 관 모양의 표현형(duct-like phenotype)으로 재프로그램(reprogramm) 되어 전환분화(transdifferentiation)하며, 췌장 관세포암(pancreatic ductal adenocarcinoma, PDAC) 발달의 첫 번째 단계인 ADM (Acinar-to-ductal metaplasia)을 특징짓는다.
암 조절 인자가 계통 분화에서 상황 특이적인 효과를 가지는 것처럼, 그들은 서로 다른 조직에서 다양한 효과를 나타낼 수 있다(그림 3e, g). 기저세포(basal-cell) 암에서, 성체 마우스 표피(epidermis)에서 SMO (constitutively active smoothened) 돌연변이 단백질 발현의 유발은 분화된 표피 세포를 배아의 모발 전구체 유사 세포(embryonic hair follicle progenitor-like cells)로 재프로그램하고 암 형성을 유발한다. 그에 반해서, 동일한 SMO 돌연변이는 췌장에서 ADM 또는 종양 발생을 유도할 수 없었다(그림 3e). 또한, 동일한 조절 인자는 다른 조직에서 별개의 표현형을 가지는 종양들을 유도할 수 있다(그림 3g). 이러한 예들은 두 가지의 중요한 결론을 뒷받침한다. 첫째, 특정 해부학적 부위에서 세포의 재프로그램(cellular reprogramming) 및 종양 발생을 유도하기 위해서는 뚜렷한 발암성 조절 인자가 필요하다. 둘째, 재프로그램은 특정 종양 유전자 및 종양 억제 인자의 조직 친화도(tissue tropism)를 설명하는, 특정 세포의 상황에서만 발생한다.
2.2 종양 억제 인자 장벽(barrier)
종양 억제 인자 장벽은 조직 및 상황 특이적이며 여러 가지 상호작용을 하는 신호 전달 분자(signaling molecule)들에 의존적이다. 이러한 신호 전달 네트워크는 발암성 스트레스에 반응하여 종양 억제 장벽을 유발하기 때문에, 종양 형성 과정 동안 중요한 역할을 하는 것으로 입증됐다. 예를 들어, PTEN은 PI3K 경로의 음성(negative) 조절 인자로 전립선 암과 같은 여러 가지 암 유형에서 결실되는 종양 억제 인자이다. 반면에, 마우스에서 Pten의 제거는 AKT 및 종양 억제 인자 p53의 활성화로 프리 B 세포 급성 림프 구성 백혈병(pre-B cell acute lymphoblastic leukaemia, pre-B-ALL) 발달을 억제한다.
조직 특이적 영향들은 돌연변이된 RAS family 구성원과 같은 고전적 종양 유전자에 서도 기술되어 왔다. 발암성 KRAS가 유발된 암 발달은 폐 및 췌장과 같은 특정 마우스 조직에서만 발생하고, 대부분의 다른 조직 타입은 발암성 변형에 저항한다. 이러한 발견들은 인간 암종에도 반영된다(그림 2). 메카니즘적으로, KRAS는 상황 특이적인 종양 발생에 기여하는 종양 억제 경로를 유도한다. 예를 들어, 쥐의 근육과 같은 중간엽(mesenchymal) 조직에서, 발암성 KRAS는 종양 억제성 p19ARF 경로를 광범위하게 유발시키며, p19ARF의 발현은 근유래 육종(muscle-derived sarcomas)의 형성을 막는다. 또한, p19ARF와 p16INK4A의 상황 특이적 발현은 조직 특이적 세포 반응을 결정하는 중요한 인자이다. Polycomb 그룹 단백질들은 폐에서 p19ARF 발현을 억제하는 반면, SWI/SNF 염색체-재구성 복합체(chromatin-remodelling complex) 구성원인 SNF5 (SMARCB1으로도 알려짐)는 중간엽 조직에서 KRAS가 유도된 p19ARF 발현이 가능한 환경을 만든다. 이는 같은 초기 종양 형성 병인(lesion)이 있는 경우에도, 뚜렷한 종양 억제 인자 장벽이나 신호 전달 임계값(signaling thresholds)들이 서로 다른 조직 유형에서 작동함을 시사한다.
2.3 염색질 구성, 복제 타이밍 및 조절(regulatory) 요소
차세대 암 게놈 유전체 및 기능 분석은, 염색질 구성, DNA 접근성, 복제 타이밍 및 전사 개시(tranion initiation)와 같은 상황 특이적 차이들로 인해, 체세포 돌연변이의 비율이 서로 다른 세포 유형의 유전체에 상당히 다양하게 존재하고 있음을 밝혔다. 예를 들어, 활성화된 전사 인자 결합 부위(tranion factor-binding site, TFBS)에서 뉴클레오타이드 제거 회복(nucleotide excision repair, NER)의 활동은 손상된다. 이는 흑색종 또는 폐암과 같은 NER 의존적인 특정 종양에서, 활성화된 유전자 프로모터 영역에서 상황 특이적으로 DNA 돌연변이 비율을 증가시키지만, CRC와 같이 NER에 크게 의존하지 않는 암에서는 그렇지 않다. CRC의 기원 세포인 결장의 성체줄기세포에서 나타나는 상황 특이적 돌연변이 시그니처(mutation signature)는 CpG 영역에서의 메틸화된 시토신(cytosine) 잔기가 티민(thymine)으로 자발적인 탈아민화(spontaneous demethylation)를 나타내며, 이는 복제 타이밍 및 결장 줄기세포의 높은 분화율과 상당히 연관된다. APC, CTNNB1, TP53 및 SMAD4와 같은 CRC 조절 유전자들의 많은 점 돌연변이(point mutation)가 CpG 디뉴클레오티드(dinucleotide)에서 비슷하게 C/G에서 T/A로의 전이(transition)되기 때문에, deamination이 유발된 C-to-T 돌연변이생성(mutagenesis)은 조직 특이적 암 조절 인자이며, 이 종양 개체에서 점 돌연변이 하중(point mutation load)의 결정 인자일 수 있다. 결과적으로, 기원 세포의 염색질 및 후성 유전체의 특징은 암세포에서 국소(local) 체세포 돌연변이 밀도(density)의 가장 좋은 예측 인자이며, 암의 기원 세포는 유전체 상의 돌연변이의 분포에 따라 밝혀낼 수 있다.
슈퍼 인핸서(super-enhancer)는 조직 특이적 종양 형성의 또 하나의 결정 인자이다. 슈퍼 인핸서는 유전자들의 전사를 조절하는 조절 요소들(regulatory elements)의 집단(cluster)이다. 슈퍼 인핸서는 WNT의 전사 작동체(tranional effectors), TGFβ (transforming growth factor-β) 및 LIF (leukaemia inhibitory factor) 신호 전달 경로와 같은, 세포 유형 특이적인 마스터 전사 인자에 의해 결합 및 조절된다. 암세포는 인핸서의 활동을 조절하는 발암성 전사 인자나 후성 인자의 돌연변이, 국소 증폭(focal amplification), 염색체 전위(translocation) 또는 과발현을 통해 슈퍼 인핸서를 얻을 수 있다. 이러한 과정은 상당히 종양- 및 상황- 특이적인 슈퍼 인핸서를 발생시켜 암의 발달과 진행을 조절한다. 예를 들어, T-ALL에서, 작은 단일 대립형 삽입(monoallelic insertion)은 조혈 모세포 전사 인자 MYB에 대한 결합 부위를 생성한다. 이는 종양 유전자 TAL1 (T cell acute lymphocytic leukaemia 1)의 상위(upstream)에 발암성 슈퍼 인핸서를 응집시켜 비정상적인 발현이 일어나게 한다. 이러한 예들은 슈퍼 인핸서의 세포 유형 특이성이 암 내에서 보존되고 있으며 상황 특이적 종양 형성에 상당히 기여함을 시사한다.
2.4 암을 위한 유전적 경로
유전체 시퀀싱 연구는 chromothripsis, chromoanasynthesis 및 chromoplexy와 같은 다양한 종류의 복잡한 유전적 재배열들이 있음을 확인했으며, 이들은 단일의 대변동적 사건(catastrophic event)으로부터 얻어진 것으로 보인다. 이와 같이 유전체는 하나의 단일 사건에 의해 여러 복잡한 변이들을 획득할 수 있다. Catastrophic event의 빈도는 서로 다른 종양 개체 간에 상당히 다양하게 나타난다. TP53 돌연변이가 있는 SHH- (sonic hedgehog)가 유도된 수모세포종(medulloblastoma) 같은 몇몇 암종의 아형은 항상 chromothripsis를 보인다. Chromothripsis는 다양한 메커니즘에 의해 작동되는데, 예를 들면 고에너지 이온화 방사선, 외인성 인자(exogenous agent), 독소 및 복제 스트레스(replicative stress)에 의해 생성된 이중 가닥 절단(double-strand breaks, DSB), 중단된 세포 사멸 또는 소핵 내에서 갇힌 염색체와 같은 메커니즘 등이 있으며, 이들 모두 결함이 있는 DNA 복제를 야기한다. 염색체의 재배열은 유전자 융합(gene fusion), 종양 억제 인자의 분열 및 발암성 유전자의 증폭(amplification) 등을 일으킨다. Chromothripsis는 흑색종, 신경아 세포종 및 여러 골수종(myeloma)에서 불량한 예후와 관련되어 왔다. 그러나 chromothripsis가 실제로 종양 형성을 유도하는지, 암 형성의 다단계 과정과는 다른 단일 사건인지의 여부는 실험적으로 입증되어야 한다.
2.5 DNA 손상 및 복구, 발암성 스트레스의 내성
DNA 손상 경로는 특정 암종들과 상당히 연관되어 있다. 예를 들어, CRC는 가장 많은 수의 DNA MMR 유전자 결함을 가진다. 장의 줄기세포에서 MMR은 DNA 복제 동안 돌연변이의 축적을 막기 위한 주요 메커니즘이다. 대조적으로, 유방암과 폐암은 DSBR (DSBR repair) 유전자 변이의 비율이 가장 높다. 에스트로겐 및 담배 연기와 같은 특정 상황에서 DNA DSB가 유도되어 DSBR 유전자 결함을 축적시킬 수 있다.
에스트로젠과 같은 호르몬은 세포의 동일성(cellular identity)을 유지하는데 필수적인 역할을 하며, 또한 인지체 수용체(cognate receptor)를 발현하는 조직의 증식을 유도할 수 있다. 에스트로겐 노출은 유방암 발병의 중요한 위험 요소이다. 에스트로겐 수용체(ER)는 유방암의 약 70%에서 과발현되어 있으며, ERα 활성화의 차단은 유방암 위험을 크게 감소시킨다. 따라서 에스트로겐은 ERα가 발현하는 유방암의 발달을 조절하는 주요 인자이다. 최근 연구에 따르면 에스트로젠은 BRCA1과 같은 암 유전자에서 치명적인 돌연변이의 내성에 근본적인 역할을 한다. 유방암 및 유방 상피 세포에서, 에스트로겐이 유도된 경로는 활성 산소 종(reactive oxygen species, ROS)에 의한 세포 사멸을 막기 때문에, BRCA1 결손(loss)이 살아남는다. 그러나, 에스트로겐에 반응하지 않는 다른 조직 유형들에서는 그렇지 않다. BRCA1 돌연변이가 유방 및 난소와 같은 호르몬 반응 조직에서 거의 독점적으로 종양 형성을 촉진한다는 것을 고려하면, 에스트로겐과 BRCA1이 결핍된 세포의 생존 간의 연관성은 BRCA1 결핍 암의 조직 친화도(tissue tropsm)에 대한 중요한 통찰력을 제공한다.
3. 상황에 따른 발암성 신호 전달
앞서 기술된 암 유전자의 조직 특이적인 발암성 기능에 이어, 발암성 신호 전달 경로의 상황 특이적 구조는 또 다른 복잡성을 더한다. 이에 대한 이해는 아직까지 부족한 상황이지만, 중요한 치료적 영향력을 가지고 있다. 조직 상황에서 발암성 신호 전달 경로를 형성하는 분자 및 세포의 메커니즘의 일부 선정된 예를 논의하고자 한다.
3.1 발암성 경로의 상황 특이적 구조
세포 반응 및 세포 운명 결정은 제한된 수의 신호 전달 경로에 의해 조절된다. 이러한 경로는 외부 및 내부 신호의 전송뿐만이 아닌 인코딩(encode), 처리 및 통합 한다. 따라서 신호 전파 수준과 출력 강도를 미세 조정하여 외부 자극에 대한 분명하고 적절한 반응을 제공한다. 최근 세포 내의 명확한 신호 임계 값은 다양한 때로는 반대의 세포 반응을 일으킨다는 것이 분명해져 왔다. 암 조절 인자 경로를 표적으로 하는 약물의 효과는 암의 종류에 따라 크게 다르다. 유전적으로 조작 된 마우스 모델(genetically engineered mouse model, GEMM) 실험에서는 이것이 조직 특이적 신호 전달 출력으로 인한 것임을 제시하였다. 예를 들어, PDAC 및 NSCLC 마우스 모델에서는 발암성 KRAS에 의해 서로 다른 하위(downstream) 경로가 관여한다. PDK1 (3-phosphoinositide-dependent protein kinase 1)을 경유하는 신호 전달은 PDAC 발달에 필수적이다. 반면에 NSCLC 형성에는 CRAF가 결정적인 역할을 한다.
암을 유발하기 위해서는 신호를 특정 수준(즉, 신호 임계 값)으로 증폭하는 것이 필요한 것으로 보인다. 이 임계값은 조직 유형, 세포 분화 단계 및 종양 발생 단계에 따라 다르며, 종종 단백질 키나아제(kinase)와 하위 반응기 경로(downstream effector pathway)의 상황 특이적인 결합에 의해 조절된다.
NSCLC와 같은 암종에서, 증가된 신호 출력은 주요 종양 유전자의 증폭에 의해 이루어지며, 또한 자가분비 피드-포워드 루프(autocrine feed-forward loop) 또는 수용체 티로신 키나아제(receptor tyrosine kinase)로부터의 상위 시그널의 결합에 의해서도 이루어질 수 있다. 상황 특이적 자가 분비 및 파라크린(paracrine) 신호 전달 루프는 유방암, 난소암, NSCLC, PDAC 및 CRC와 같은 몇 가지 종양 타입에서 종양 유도 경로의 주요 증폭 인자이다. 췌장에서 발암성 KRAS는 자가분비 피드-포워드 루프를 유도하여 EGFR을 활성화한다. 이는 PDAC의 발달에 필요한 임계값 도달을 위한 KRAS 신호 전달 출력을 증폭시키는데 필요하다. KRAS가 유발된 NSCLC나 CRC의 마우스 모델에서는 Egfr의 결손은 통해 종양 형성을 막지 못한다. 이는, KRAS 돌연변이가 NSCLC 및 CRC 환자의 EGFR 억제에 대한 초기 저항성(resistance)의 예측 인자이지만, PDAC 환자에서는 그렇지 않음을 시사한다.
이러한 결과들은 KRAS 신호 전달의 세포적 출력(cellular output)이 매우 조직 특이적임을 뒷받침한다. 치료의 반응성(therapeutic response)을 고려할 때, 이러한 결과들은 KRAS가 유발된 종양 개체에서의 치료 효과를 다른 종양 개체까지 기대할 수 없음을 나타낸다. 예를 들어 MEK 억제제인 trametinib을 사용한 몇몇 KRAS 돌연변이가 있는 폐 및 췌장 종양 모델의 치료를 통해, 세포 자발적인 FGFR1 (fibroblast growth factor receptor 1) 의존적인 생존 경로가 있음이 밝혀졌다. 그러나 이러한 경로는 KRAS가 변이된 CRC 세포에는 존재하지 않는다. 나아가 세포 상황에 따라, FGF 신호 전달은 폐암의 경우 자가분비 피드-포워드 루프를 통하여 활성화하고, 전립선 암의 경우 종양의 미세 환경으로부터 리간드(ligand) 분비를 통한 간질-상피(stroma-epithelium) 상호 작용의 파라크린 매개체로써 활동할 수 있다.
이러한 모든 연구 결과는 수용체가 세포 유형 특이적으로 매개체 및 신호 전달 경로의 증폭기 역할을 함을 시사한다. 따라서 서로 다른 암종들 사이에 서로 다른 단계의 신호 경로 조절 장애(dysregulation) 및 출력이 존재하며, 이는 하위 신호 전달, 신호 전달 크로스토크(crosstalk) 및 신호 전달 루프와 같은 종양 세포 내 신호 구조에 영향을 미친다.
다른 경로들 간의 억제적 크로스토크(Inhibitory crosstalk)뿐만 아니라 동일한 경로에 영향을 미치는 음성 피드백 루프(negative feedback loop)는 건강과 질병에서 중심적인 역할을 한다. 이러한 억제 신호 전달 회로는 생리적 조건 하에 신호 출력을 미세 조정하여, 성장 인자와 같은 외부 자극에 대한 적절한 반응을 제공한다. 흥미롭게도, 피드백 억제의 지속성은 많은 암에서 보존되며 종양의 기원 세포에 특이적이다. 그러나 이러한 음성 피드백 프로그램 조절자(modulator)의 하향 조절(downregulation), 또는 포스파타제(phosphatase)(예: PTEN)의 비활성화와 같이 음성 피드백을 우회하는 추가적인 돌연변이가 종양 형성 동안에 발생할 수도 있다.
상황에 따른 음성 피드백 보존의 개념을 통해, 종양 유전자 중독(oncogene addiction)이 특정 단계의 신호 출력을 유지하는 방법에 대한 설명이 가능하다. 종양 단백질(oncoprotein)이나 그 하위 반응기 경로를 차단하는 것은 음성 피드백 루프에 영향을 미치기 때문에, 분자적으로 표적화된 치료법의 설계에 중요한 영향을 미친다. 예를 들어, CRC에서 약학적(pharmacological) 발암성 BRAF 유전자의 차단은 EGFR 신호 전달을 막는 음성 피드백 루프를 감소시켜, EGFR 신호가 활성화되어 EGFR이 유발된 PI3K-AKT 경로를 통해 CRC 세포가 증식할 수 있게 한다. 이에 반해서, BRAF가 유발된 흑색종에서의 BRAF 차단은 EGFR 신호 전달에 영향을 미치지 않고 MAPK 활성화를 억제한다. 따라서 조직 특이적인 EGFR과 PI3K의 신호 전달은 BRAF가 유도된 CRC에서 BRAF 억제를 우회하여 초기 치료의 저항성을 중재하는 것으로 보인다. 결과적으로, BRAF 억제와 함께 EGFR 또는 PI3K-AKT 신호 전달을 막는 것이 CRC의 전임상 모델에서 하나의 효과적인 치료 전략이다. 종합적으로, 이러한 결과들은 음성 피드백이 암에서 주요 조직 특이적인 기전이라는 것을 나타낸다. 대부분의 암종 및 종양 유전자에 대해, 암 유발 경로의 상황 특이적 신호 전달 루프, 피드백 메커니즘 및 신호 크로스토크는 대체로 알려지지 않았다. 이러한 메커니즘을 이해하는 것은 향후 보다 효과적인 치료법 개발에 필수적이다.
3.2 암 유전자의 첨가물(additive), epistasis historical contingency
돌연변이의 공동 발생(co-occurrence)나 상호 배타성(mutual exclusivity)과 같은 분자적 변이들 간의 조직 상황 특이적 관계는 많은 암 유형에서 관찰되었다. 그러나 현재 대부분의 경우 근본적인 생물학적 원리와 치료적인 결과는 명확하지 않다. 앞서 기술된 바와 같이, KRAS 돌연변이는 CRC, PDAC, 및 NSCLC와 같은 종양 유형들 간에 서로 다른 영향을 미친다. 이러한 KRAS가 유발된 종양의 표현형은 다른 암 유전자의 돌연변이의 동시 발생에 의해 추가로 변형된다. 예를 들어, NSCLC에서 KRAS와 STK11 돌연변이의 동시 발생은 경로 활성화 및 면역 원성 (immunogenicity)의 차이, 치료적 취약성과 같은 생물학적 특징들을 결정한다.
동시 발생 돌연변이는 암 발달 과정 동안에 추가적으로 또는 우세적으로(epistatically) 행동할 수 있다. 그들은 유전자가 상호 작용하지 않을 때 첨가물(additive)로 간주되며, 그들의 생물학적 결과는 단일 영향들의 합이다. 그러나 암에서 이러한 부가적인 영향은 상대적으로 드물다. 대부분의 유전자들은 최소한 일정 수준의 정상적인 상호 작용을 나타내며, 각각의 효과에서 예상되는 것보다 더 크거나 약한 결과를 가진다. 따라서 우성적인(epistatic) 상호작용은 일부를 허용하고 다른 것들을 차단함으로써 암의 신호 전달 경로를 형성한다. 역동적으로 변화하는 환경 조건에 의해 특징지어지는 암과 같은 복잡한 상황에서, 생체 내 우성적인 상호 작용의 정량화는 중요한 과제로 남아 있으며, 그러한 효과를 정확하게 측정하기 위한 새로운 접근법이 시급히 필요하다.
3,000개 이상의 암에서 얻은 데이터를 사용하여, 암 조절 인자의 상호 배타성과 동시 발생은 빈번하고 조직 특이성이 있는 것으로 나타났다. 암 조절 인자 상호 작용의 90% 이상이 단일 종양 유형에서만 발견되었으며, 적어도 절반은 종양 유형들 사이에 서로 다른 상호 작용 강도를 나타낸다. 예를 들어, 상황 특이적 동시 발생 돌연변이는 CRC에서의 KRAS와 PIK3CA, NSCLC에서의 EGFR 증폭과 MGMT (O6-methylguanine-DNA methyltransferase) 메틸화가 있으며, 상호 배타적인 변이로는 glioblastoma에서 EGFR 증폭과 IDH1 (cytosolic isocitrate dehydrogenase 1) 또는 TP53 돌연변이가 있다. 중요한 것은, 정해진 분자적 경로에 영향을 미치는 유전자 변이(alteration)는 상호 배타적인 경향이 있으며, 이는 기존의 정립된 개념에 부분적으로 도전한다. Epistasis는 종양 형성 과정에서 정해진 경로에서 시너지 작용을 하는 조직 특이적인 여러 유전 변이의 축적을 설명 한다. 예를 들어, KRAS가 유도된 PDAC에서의 MAPK3(또는, ERK1으로도 알려진)의 증폭은 MAPK 경로에 시너지 영향을 준다. 또한, 자궁체 자궁내막암(uterine corpus endometrial carcinoma)에서 KRAS, PIK3CA 및 PTEN의 동시 발생 유전적 변이는 PI3K 신호 전달 경로에 시너지 영향을 주며, 교아세포종(glioblastoma)에서의 EGFR 돌연변이와 PTEN 결손(deletion)은 PI3K 경로에 시너지 영향을 준다(cBioPortal for Cancer Genomics 참조). 때문에, 이러한 시너지를 일으키는 epistatic 상호 작용이 경로 중심의 다중 표적 접근법(pathway-focused multiple-targeting approach)에 의해 치료적으로 이용될 수 있는지를 테스트하는 것이 중요하다.
최근의 연구 또한, 피드백 루프(feedback loop) 또는 시그널링 크로스 토크(signaling crosstalk) 뿐만 아닌 세포 환경의 차이와 같은, 발암적 신호 전달 네트워크에서의 조직 특이적인 차이들이 정상적인 상호 작용에 영향을 미친다는 것에 대한 증거들을 제시하고 있다. 이러한 발견과 마찬가지로, epistatic 상호 작용은 종양의 기원 세포와 관련될 뿐만 아니라, epistatically 연관된 유전자들의 상황 특이적인 생물학적 기능과 암 환자의 생존에도 영향을 미친다. Epistatic 상호 작용의 세포 유형 특이성은 개인화된(personalized) 치료에 중요한 영향을 미치며, 또한 합성 치사 (synthetic-lethal, 두 유전자의 변이들의 조합은 세포 사멸을 일으키지만, 어느 한 유전자의 돌연변이는 효과가 없음) 작용에 영향을 미친다. 합성 치사(synthetic lethality)는 표적 취약성 (targeted vulnerability)을 가지고 있는 종양의 아형에 효율적일 것으로 예측되기 때문에, 암 치료법 개발을 위한 합성 치사(synthetic lethality)의 이용은 세포 및 조직 특이적인 epistatic 상호 작용을 고려해야 한다. 이는 특정 세포 또는 종양 유형에서 효과가 있는 합성 치사 전략이 다른 유형에서는 실패함을 보인 대규모 스크린 및 실험 데이터와 일치한다.
BRAFV600E가 유도된 톱니 형상의 장암(serrated intestinal cancer) 마우스 모델에서 보여진 바와 같이, 암 유전자의 변이가 일어나는 순서 또한 신호 전달 조직(organization)과 출력(output)의 중요한 결정 인자가 될 수 있다. 이 특이적인 CRC 아형은 톱니 형상의 조직 병리학적 형태의 특징을 가지며, hyperplasia-serrated, adenoma-serrated carcinoma의 순서로 진행되어, MSI로 정착성 암을 일으킨다. Vogelstein et al.에 의해 기술된 전형적인 CRC 진행 모델(APC 돌연변이와 연이은 WNT 경로 활성화에 의해 시작되고, RAS 경로 및 MAPK 경로 활성화와 같은 추가적인 유전적 변이가 뒤따름)과는 반대로, BRAF가 유도된 serrated CRC는 MAPK 신호 전달의 증폭에 의해 시작되며, 이후 종양 발달 동안 WNT 경로가 활성화된다. 이러한 MAPK-WNT 경로 활성화의 'inverted' 순서는 발암성 신호 전달 출력에 중요한 영향을 줄 뿐만 아니라, 병리학적(톱니 형 조직학), 유전적(MSI 및 DNA과 메틸화된 CpG 섬) 및 임상적(나쁜 예후) 특성에도 영향을 미칠 수 있다. 역사적 우연성(historical contingency)으로 알려진, 다른 변이들이 먼저 발생했을 때만 특정 유전적 변이가 이롭(beneficial)거나 생존하는 현상은 서로 다른 암종들 간에 상당히 상이하다. 예를 들어, 골수 형성 이상 증후군(myelodysplastic syndromes, MDS)에서는, RNA splicing machinery와 관련된 유전자와 같은 조기 암 조절 인자의 활성화가 이후의 유전적 이벤트와 종양의 진화 경로를 구별하는 유전적 'predestination'이 존재한다. MYC와 BCL2의 유전적 변이들 간의 조직 특이적 상호 작용의 예가 있다. 다양한 B 세포 림프종에서, 항 세포사멸적인(anti-apoptotic) 종양 형성 유전자(proto-oncogene) BCL-2는 전좌(translocation)에 의해 활성화된다. MYC의 과활성(hyperactivation)은 B 혈통 세포(B lineage cell)의 세포 사멸을 유도한다. 그러나, BCL-2과 발현(overexpression)은 이러한 효과를 차단하고 발암성 MYC가 종양을 유도하도록 한다. 다른 조직 유형에서는, MYC 활성화가 keratinocytes에 의해 용인된다. 이러한 세포에서 MYC는 증식, hyperplasia 및 종양 형성뿐만 아닌 매우 낮은 정도의 세포 사멸을 유발시킨다. 피부에서 파라크린 (paracrine) 생존 신호의 존재는 조직 특이적 세포 사멸 임계치(threshold)의 결정 인자일 수 있다.
CRC과 PDAC에서, TP53은 높은 등급(high-grade)의 상피 내 neoplasia에서 carcinoma로의 전이 상황에서 공통적으로 비활성화된다. TP53의 돌연변이가 일찍 발생하는 CRC와 PDAC에서는 종양 세포의 침습성(invasiveness)을 제어하는 p53의 분명한 기능을 나타내며, 유방암에서는 잠재적으로 세포 주기 정지(cell cycle arrest)를 조절하는 기능을 나타낸다. 피드백, 신호 전달 크로스토크(signaling crosstalk), 환경 요인 및 복잡한 비선형(nonlinear) 신호 전달 역학(dynamics)은 이러한 순차적 프로세스의 조직 특이성 및 타이밍을 결정할 수 있다. 이러한 예들은 암 조절 인자를 이용한 치료법 개선을 위해서는 종양 발생 중에 활동하는 세포 유형 특이적인 신호 전달 네트워크의 진화(evolution)를 고려해야함을 보여준다.
4. 환경적 요인들
조직 특이적 종양 형성 및 상황 특이적 발암성 신호 전달 경로는 종양의 미시- 및 거시- 환경, 대사, 미생물, 급성 및 만성 염증 과정, 감염 및 면역과 같은 비세포 자율 요인들 (non-cell-autonomous factors)에 의해서도 영향을 받는다. 뿐만 아니라 환경적인 화학 물질과 독소들에 의해서도 영향을 받는다.
4.1 종양의 미세 환경(microenvironment)
종양의 미세 환경(tumour microenvironment, TME)은 발암성 신호 전달 경로의 주요한 중개자 및 조절자이며, 상피 세포의 미세 환경에는 분명한 조직 특이적 차이가 있다. TIME 이질성의 가장 좋은 예 중 하나는 간과 췌장에서 근섬유 아세포와 유사한 성상 세포(myofibroblast-like stellate cell)의 특이적인 존재이다. 이러한 세포들은 두 장기에서 조직 섬유화의 주요한 병인적 조절 인자이다. 조직 손상이나 특정 발암성 공격에 의한 활성화 후, 성상 세포(stellate cell)는 세포외 기질 (extracellular matrix, ECM) 성분, 프로테아제(protease), 사이토카인(cytokine) 및 성장 인자(growth factor)를 분비하여 함께 조직 복구를 유도하지만, 종양 및 섬유조직형성(desmoplasia)을 촉진할 수도 있다. 따라서, 주요한 섬유조직형성의(desmoplastic) 기질 반응(stroma reaction)은 같은 암 유전자 유전자에 의해 유발되더라도 일부 종양 개체(예를 들어, PDAC)를 육종(sarcoma)과 같은 다른 종양 유형과 구별할 수 있다. 조직 특이적인 차이들이 섬유아세포(fibroblast)와 근섬유아세포 (myofibroblast)의 아형 및 계통의 구성에 존재하는지 여부는 여전히 결정되어야 한다. 이러한 변이들은 종양의 발달을 촉진하거나 억제할 수 있으며 TME 이질성에 영향을 줄 수 있다. 다른 유형들의 섬유아세포(fibroblast)가 피부에서 확인되고, SHH나 TGFβ와 같은 파라크린(paracrine) 신호에 차별적인 반응을 보임으로써 이러한 차이들이 존재할 수 있다.
간질 섬유아세포(stromal fibroblast)에서의 TGFβ 신호 전달의 상황 특이적인 역할은 종양이 시작되는 동안에 보여져 왔다. 마우스의 모든 섬유아세포(fibroblast)에서 TGFβ 수용체 2(Tgfbr2)의 전역적(global) 비활성화는 전립선과 전장(forestomach)에서만 종양 형성을 유도했다. 이 경우, 전립선과 전장에서 Tgfbr2-knockout fibroblast에 의한 HGF (hepatocyte growth factor) 분비의 증가가 상피 세포에서 HGF 수용체(MET)를 활성화시켜 종양 형성을 일으키는 것이 근본적인 메커니즘인 것으로 보인다. 그러므로, fibroblast는 특정 조직 유형에서 인접한 상피 세포의 종양 발생 가능성을 증가시킬 수 있다. 암과 관련된 fibroblast는 종양에서 많은 양의 HGF를 분비시킬 수 있다는 발견은, 형질전환된 세포(transformed cell)의 성공적인 성장이 분자적인 변이(alteration)뿐 아니라 주어진 미세 환경에 의존적이라는 관점을 뒷받침 한다.
대부분의 성체 조직(adult tissue)은 지속적으로 줄기세포로부터 재생된다. 조직 유형에 따라, 상주하는 줄기세포는 그들 지역의 미세 환경에서 특정 세포로부터 자체 재생(self-renewal) 인자들을 받거나 그들의 신호 자체를 스스로 생성할 수 있다. 이는 조직 특이적 종양 형성에 중요한 영향을 미칠 수 있다. 장에서 간엽세포(mesenchymal cell)는 장내 줄기세포를 유지하기 위해 WNT 단백질을 공급하며, 이는 줄기세포와 틈새 세포(niche cell)가 기능적으로 결합되어 있음을 나타낸다. 이에 반해서, 피부의 표피 간 융체의 줄기세포(epidermal interfollicular stem cell)는 self-renewal에 필요한 자체의 WNT 리간드(ligand)를 생성한다. 이와 일치하여, CRC의 stemness는 활성화된 근섬유아세포에서 분비되는 인자에 의존하며, WNT 경로를 과활성화시켜 종양 진행을 유도한다. 이는, TME를 표적하는 것은 CRC에 대한 조직 특이적인 치료적 조건이 될 수 있음을 제시한다. 이러한 치료 전략은 암세포화되는 self-renewing 인자들의 공급을 차단할 것이다. 종합적으로, 이러한 정보들은 TME 이질성이 조직 특이적 종양 형성을 조절하며, 특정 종양 타입에서 치료를 위한 표적이 되는 중요한 기능적 결정 인자라는 아이디어를 뒷받침한다.
그러나 종양과 미세 및 거대 환경 사이의 복합적인 상호 작용에 대한 메커니즘과, 어떻게 이러한 상호 작용이 치료 반응성과 저항성에 영향을 미치는지에 대해서는 아직까지 이해가 부족합니다. 이것은 생체 내에서 특정 세포 유형을 표적화하고 분석하는 적절한 방법이 없기 때문이다. 이 분야에서 최근 이중 재조합 효소 기반 시스템(dual-recombinase-based system) 개발은 전체 동물에서 특정 세포 유형의 고도 제어와 독립적인 유전적 조작을 가능하게 하였다. 이러한 접근법은 서로 다른 세포 집단 또는 하위 집단 간의 협력과 경쟁 및 암에서의 모자이크 현상(mosaicism)의 역할을 조사하는 수단을 제공한다. 이러한 모델 및 다른 시스템의 사용과 함께, 조직 및 세포 유형별 세포-세포 통신(cell-cell communication) 및 유전자 양(dose)과 신호 전달 반응 사이의 상황 의존적(context-dependent) 관계를 조사하는 것이 가능할 것이다.
4.2 종양의 거시 환경(macroenvironment) 및 대사
과체중 비만, 제1형 및 제2형 당뇨병은 암 위험을 증가시키고 결장암과 췌장암과 같은 특정 암으로 인한 사망 가능성을 높이며, 이는 장기 특이적인 메커니즘이 작동하고 있음을 시사한다. 비만은 정상 췌장에서 지방증(steatosis), 염증 및 섬유증(fibrosis)을 촉진한다. PDAC 마우스 모델에서, 비만은 IL-1β (interleukin-1 β)와 같은 많은 양의 사이토카인을 분비하는 비대화 지방 세포(hypertrophic adipocyte)의 축적을 특징으로 하는 특정 미세 환경을 형성한다. 이는 종양 형성 및 성장을 가속화시키고 별 모양의 세포(stellate cell) 활성화, 증가된 표피 형성(desmoplasia), 호중구 침윤(neutrophil infiltration) 및 염증으로 인한 치료 저항성을 향상시키며, 이러한 영향들은 IL-1β 억제를 통해 막을 수 있다. 이는 정상적인 장 및 장의 종양 발생과는 대조적으로, 비만 관련된 염증이 아닌 줄기세포 기능에 별개의 영향을 미친다. 이 조직에서 비만은 장의 줄기세포의 수를 증가시키고 - peroxisome proliferator-activated receptor-δ (PPARδ) 매개된 WNT 활성화를 통해 - 장의 줄기세포의 틈새 의존성(niche dependency)을 감소시키며, Apc 손실 후 쥐에서 비줄기세포가 종양을 형성하도록 유도한다. 조직 특이적 거대 환경적 암 조절 인자의 다른 예는 유방 및 전립선과 같은 생식 조직의 암에 관련된 성 호르몬(sex hormone)이다. 안드로겐 수용체(androgen receptor)의 조건적 과발현은 마우스 전립선의 발암적 형질전환(transformation)을 유도한다. 더욱이, 인간 전립선 암 특이적으로, 안드로겐 자극은 발암성 ETS 융합 유전자의 생성 및 과발현을 유도하며, 이는 PI3K 경로 활성화와 협력하여 암 진행을 촉진시킨다.
최근 암세포의 조직 및 상황에 따른 대사의 필요 조건들이 밝혀져 왔다. 흥미롭게도 종양의 대사는 유전적 병인과 기원 조직 모두에 의존적이다. 세포 유형 특이적 대사의 변이(alteration)는 종양 세포가 특정 영양분과 대사 경로에 선택적으로 의존하게 할 수 있으며, 기원 조직에 특이적인 치료적 취약성(vulnerability)을 이끌 수 있다. KRAS가 유발된 NSCLC는 그들의 대사적 필요 사항을 충족시키기 위해 순환하는 분지 아미노산(branched-chain amino acid, BCAA)을 포함하고 있다. 이는 BCAA 흡수가 감소되는 KRAS가 유도된 PDAC과는 대조적이다. 결과적으로, 이 특정 대사 경로를 방해를 통해 NSCLC에 치료적 기회를 제공할 수 있다. 그러나 PDAC에서는 그렇지 않다. 또한, 암의 대사 변화는 발암 신호 전달 조직(organization)과 출력에 영향을 줄 가능성이 있다. 따라서 암 치료를 위한 대사 경로의 타겟팅은 다양한 종양 유형의 상황에 따른 대사 변화를 확인해야 한다.
4.3 감염, 염증, 미생물 및 기타 환경적 요인들
Helicobacter pylori, B형 간염 및 C형 바이러스, Epstein-Barr 바이러스 또는 HPV (human papillomavirus)에 의한 만성 감염뿐만 아니라 간염, 췌장염 및 대장염과 같은 만성 염증성 질환은, 감염이나 염증을 일으킨 각 장기에서 암의 위험이 더 높다(예를 들어, 구강 인두(oropharynx), 위장, 결장, 항문(anus), 자궁 경부(cervix), 췌장 또는 간). 지속적인 감염과 염증은 상피 세포 증식을 유발시킨다. 또한, 활성화된 면역 세포는 산소와 질소를 포함하는 반응성이 강한 분자를 만들어 DNA에 손상을 줄 수 있다. 최근의 연구 결과에 따르면 염증 과정에서 DNA 손상과 세포 분열이 동시에 발생하면, 세포 분열이 DNA 손상으로 인한 돌연변이에 더 취약하기 때문에 암을 유발시킨다는 사실이 입증되었다.
자외선이나 독소(예: 담배 연기)의 노출과 같은 다른 환경적 요인들은 매우 높은 돌연변이 율을 유도하여 다양한 암 발병을 유발할 수 있다. 종양의 발달은 이후에 유전적으로 매우 이질성을 띄지만, 그들은 암 병인학과 관련된 돌연변이 시그니쳐(signature)을 가지고 있다. CTLA4 (cytotoxic T lymphocyte-associated antigen 4)-, PD1 (programmed cell death protein 1)-, 또는 PDL1 (PD1 ligand 1)- 특이적 항체와 같은 면역 체크포인트(immune checkpoint) 억제제를 사용한 치료에 대한 반응은 돌연변이하중(mutational load)과 강하게 연관되어 있으며, 자외선으로 인한 흑색종과 흡연으로 인한 NSCLC에서 가장 높은 연관성을 보인다. 또한, MSI를 나타내는 MMR이 결여된 CRCs는 과 돌연변이(hypermutation) 시그니처를 가지고 있으며 면역 체크포인트 억제제에 민감한 경향을 보인다. 그러나 돌연변이 비율이 낮고 면역 치료에 잘 반응하는 종양의 예도 있다. 조직 특이적인 네오항원(neoantigen)의 경우, 높은 PDL1 발현 수준 또는 종양 기질(stroma)의 상황 특이적 면역 생물학(immunobiology)이 치료 효과에 영향을 줄 수 있다. 최근의 한 연구는 종양의 미세 환경에서 국소 면역 세포가 침윤하는 세포 용해(cytolytic) 활동이 18개의 종양 유형에 따라 상당히 다름을 밝혔다. 이는 WNT 또는 PI3K와 같은 특정 종양 신호 경로, 네오항원 부하(neoantigen load) 및 외인성(exogenous) 또는 내인성(endogenous) 바이러스의 존재뿐만 아니라 면역치료법 및 전반적인 생존에 대한 민감성과 관련이 있다. 종합적으로, 이러한 예들은 조직 특이적인 종양 발생의 근본적인 병원성 기전(pathogenic mechanism)이 종종 중요한 치료적 연관성을 갖는다는 것을 보여준다.
종양의 개시 및 유지에 있어 미생물의 역할과 항 종양 면역 감시(antitumour immunosurveillance)에 미치는 영향은 활발한 연구 영역이다. 장내 미생물군집(microbiome)의 뚜렷한 패턴은 치료 반응성과 저항성뿐만 아니라 장암의 형성을 촉진하거나 억제할 수 있다는 것이 밝혀져 왔다. 또한 'estrobolome(에스트로겐을 대사 할 수 있는 장내 박테리아 단백질의 집합체)'의 차이가 ER 양성 유방암의 발병에 실질적으로 영향을 줄 수 있다는 증거가 늘어나고 있다. 그러므로, 조직 특이적 암 형성과 발암성 신호 전달 생성에 있어 미생물의 역할은 실험적으로 다루어져야 한다.
5. 전망(perspectives)
본 오피니언 글에서 요약된 바와 같이, 여러 요소와 그들의 상호 작용에 의해 종양의 조절 인자 선택과 발암성 신호 전달 구조를 매우 조직- 및 상황- 특이적인 방식으로 결정된다. 이는 개인화된(personalized) 암 치료의 성공이 동일한 분자 변이를 지닌 다른 종양 유형의 효과로부터 항상 외삽될 수 없다는 것을 나타낸다. 오히려, 약물 개발, 환자 계층화 및 치료 결정을 가이드 하기 위해서는, 잠재적인 암 조절 인자의 생물학적 특성들이 조직의 상황에서 조사되어야 한다는 증거가 축적되고 있다.
어떻게 이러한 문제를 해결할 수 있을까? 우리는 임상 시험에서 각 암 조절 인자의 조직 및 상황 특이적인 취약성을 조사할 수 없음이 분명하다. 첫째, 종종 소수의 환자만이 각각의 조절 인자 병변을 가진다. 특히 드물게 발생하는 질병의 경우, 적절한 임상 시험 수행이 불가능하다. 두 번째로, 지금까지 환자에게서 확인된 다양한 암 조절 인자를 모두 표적하기 위한 임상적으로 승인된 적절한 약물이 없다. 셋째, 우리는 암 환자에서 조직 특이적 상황에서 분자적 변이의 생물학적 현상을 메카니즘적으로 조사하고 이해할 수 없다.
대신 인간 암의 특정 분자적 아형의 생물학적 특성을 밀접하게 반영하는 전임상 모델 시스템이 필요하다. 여기에는 사람, 돼지, 쥐의 종양 및 특정 암 조절 인자에 의해 변형된 정상 조직으로부터 유래한 세포 기반 체외 모델(cell-based in vitro model)이 포함된다(인간 종양의 미세 환경을 모방 한 in vitro 3D 암 모델, PDX (patient-derived xonograft) 및 동종동형, 동종이형 모델, 유전자 변형 및 발암 유발 물질이 유발된 오토크론톤(autochrhonous) 소형 및 대형 동물 모델)(그림 4a). 각 모델에는 해결해야 할 과학적 의문에 따른 장단점이 있다. 돼지 모델링은 현재 급속도로 발전하고 있는 새로운 분야로, 유전적으로 정의된 인간 규모의 전임상 암 모델에 대한 충족되지 않은 요구를 해결한다.
인간의 암에서 많은 유전적 변이 및 그들의 빈번한 동시 발생 상황에 관련하여, 특정 조직 유형에서의 암 조절 인자 및 그들의 상위 상호 작용의 규명 및 검증은 분명이 큰 도전 과제이다. 종간의 비교 분석 및 전산적 접근법은 사용하여 동시 발생 유전자 변이 및 시너지적인 우세적 상호 작용뿐만 아닌 상호 배타성을 정의할 수 있으며, 이러한 연구 결과는 조직 상황에서 특정 분자적 암 아형을 모델링하는데 도움이 될 것이다. 한가지 전략은 특정 종양 아형에 고유한 특징들을 재생산하기 위해, in vitro 또는 in vivo에서 적절한 표적 세포에 다수의 돌연변이를 도입하는 것이다 (그림 4a). 이는 각각의 돌연변이가 종양의 표현형에 어떻게 기여하는지, 그리고 그것이 어떻게 중재 전략에 영향을 미치는지에 대한 질문에 대한 답을 얻을 수 있게 해줄 것이다. CRISPR-Cas9-mediated 유전자 편집의 출현으로 높은 효능으로 결합적 유전자 변이의 도입을 처음으로 할 수 있게 되었다. 다중화된 체세포 CRISPR-Cas9 기반의 유전체 편집은 관련된 인간 암 아형을 면밀히 모델링 할 수 있는 강력한 도구인 것으로 나타났다. 이 접근법을 통해 우리는 in vitro 및 in vivo에서 암 조절 인자의 상황 특이적인 생물학적 근거를 더 잘 이해할 수 있는 잠재력을 가지게 되었다. 또한 특정 조직의 상황에서 적절한 치료적 표적으로의 암 유전자를 유전적으로 검증하고, 1차 및 2차 치료 저항성을 평가하는 새로운 방법이 최근 개발되었다(그림 4b). 여기에는, 자생의 종양에서 암 유전자의 불활성화를 유도하는 짧은 헤어핀 RNA (short hairpin RNA, shRNA) 또는 이중 재조합효소(dual-recombinase) 전략이 포함된다. 또한, 이중 재조합효소에 기초한 순차적인 유전자 조작은 종양 형성의 타이밍 및 단계를 모델링 할 수 있게 한다. 암 아형 특이적인 shRNA, CRISPR-Cas9 및 약학적 스크리닝은 상황 특이적인 치료의 취약성을 확인하기 위한 다른 매력적인 옵션들이다.
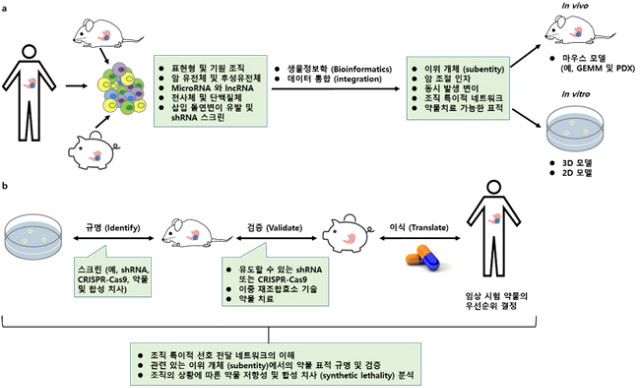
그림 4. 상황에 따른 암 조절 인자의 규명, 분석 및 검증을 위한 접근법
지난 수십 년 동안 전임상 암 모델에서 확립된 치료법의 효과는 종종 임상적으로 옮겨지지 않았다. 이는 기존의 모델이 임상 효능의 불량한 예측 인자임을 나타낸다. 이것은 아마도 인간의 암세포 주를 사용하는 이종 이식(xenotransplantation) 모델과, 종양의 모델이 인간 종양 아형과 적절히 일치하지 않는 한계 때문일 것이다. 그러나 지난 20년 동안 인간의 암을 충실히 재현하고, 다른 모델보다 더 정확하게 치료 반응을 예측할 수 있는 몇 가지 차세대 모델이 개발되었다. 따라서 우리는 전임상적으로 우선 순위가 결정된 임상 시험을 수행하기 위해, 암 아형에 대해 잘 특성화된 모델 시스템의 파이프 라인을 구축해야함을 제안한다. 이를 통해 성공률을 높이고 비용과 자원을 절약할 수 있다.
종합적인 분자적 종양 프로파일링은 임상적 결정을 크게 돕고 암 치료를 향상시킬 것이다. 증가하는 표적 약물과 함께, 이러한 정보는 올바른 환자를 올바른 약물과 맞출 수 있는 도구를 제공할 것이다. 이러한 목표를 달성하기 위해, 환자의 분자적 종양 프로필과 반응성 데이터의 효과적인 공유와 보급이 필수적이다. 그러나 치료 반응성과 저항성의 중요한 결정 인자로써, 조직의 상황이 고려되어야 하고 실험적으로 검증되어야 한다.
우리는 환자의 약물 반응을 예측하기 위해, 분자적 종양 프로파일과 해부학적 위치 모두를 고려하는 것이 이들 중 어느 하나를 단독으로 고려하는 것보다 더 나은 접근 방법이라고 생각한다. 따라서 조직 특이적 종양 생물학 및 약물 반응과 관련된 분자 메커니즘에 대한 철저한 이해가 새로운 차세대 표적 치료 요법의 계획에 필요하다.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 조직-특이적 종양 형성 상황적 문제(Context matters).pdf
조직-특이적 종양 형성 상황적 문제(Context matters).pdf