기술동향
박테리오파지의 인체여행
- 등록일2018-02-08
- 조회수11207
- 분류기술동향
-
자료발간일
2018-01-25
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#박테리오파지
- 첨부파일
출처 : 생물학연구정보센터(BRIC)
박테리오파지의 인체여행
경희대학교 / 김민수
[요약문]
우리 몸에는 박테리아(bacteria), 진균(fungi), 원생동물(protozoa), 바이러스(virus)와 같은 다양한 미생물이 살고 있다. 이 중 박테리오파지(bacteriophage)는 박테리아를 감염하는 바이러스로, 피부, 구강, 호흡기, 소화기, 비뇨기 등에 존재한다. 즉, 우리는 박테리오파지에 항상 노출되어 있고, 그들과 상호작용하고 있을 것으로 예측하지만, 그들이 우리의 세포(cell), 기관(organ), 면역시스템(immune system)에 어떤 영향을 미치는지 알지 못한다. 본 리뷰는 박테리오파지 입장에서 인간의 미생물체(microbiome), 신체(human body), 면역시스템을 바라보고, 박테리오파지와 포유동물 사이에서 발생하는 다양한 상호작용에 관해 논하려 한다.'
[목 차]
1. 서론
2. 우리 몸 속의 박테리오파지 군집
3. 박테리오파지와 점막장벽(mucosal barrier)
4. 장내 파지 - 장 표피세포로 아래로의 이동
5. 체내 파지(intra-body phages)의 기능과 면역조절
6. 체내 파지(intra-body phages)의 세대전달 및 신경조절
7. 전망
1. 서론
바이러스(virus)는 지구상에서 가장 많은 수로 존재하는 생물학적 집단(biological entity)으로, 그 다양성(diversity) 역시 가장 크다. 바이러스는 대부분의 생명체를 감염하기에, 생명체가 살고 있는 모든 환경에 존재한다. 박테리오파지(bacteriophage) 또는 파지(phage)는 박테리아(bacteria)를 감염하는 바이러스로, 바이러스의 대부분을 차지하고 있고, 자연계에서 가장 큰 다양성을 가진 집단이다. 한편으로, 박테리오파지는 소화기, 피부, 호흡기, 비뇨기 등에 살고 있는 인체 미생물체(human microbiome)의 주요 구성원이기도 하다. 우리 몸에는 30조에 가까운 미생물이 살고 있으며, 그 중 대부분은 대장(large intestine)에 집중되어 있다. 분변 1g에 1013-1014 미생물이 존재하는 장내 미생물체(gut microbiome)는 우리의 건강에 직접적인 영향을 미친다. 장내 미생물체는 오랜 시간 동안 우리와 함께 진화(co-evolution)한 공생체(symbiont)로, 식이 대사, 장 점막장벽(mucosal barrier) 유지, 면역 반응 조절, 병원균의 정착 및 증식 저해 등 다양한 역할을 하는 것으로 보고되고 있다. 장내 미생물체가 불균형(dysbiosis)하면 우리의 장은 염증 반응을 동반한 면역반응을 보이게 된다. 이 때문에, 염증성 장질환(inflammatory bowel disease, IBD)의 증상을 식이 및 미생물 조절을 통해 개선하려는 시도도 있다. 박테리오파지 역시 장내 미생물체의 주요 구성원으로서, 소화기관에 존재한다. 박테리오파지는 단일 박테리아뿐만 아니라 장내 미생물 전체에 영향을 주고, 이는 다시 인체 건강에 영향을 미치게 된다. 우리 몸은 지속적으로 다양한 박테리오파지에 노출되어 왔지만, 박테리오파지가 어떤 영향을 미치는지에 대해서는 거의 연구되지 않았다. 본 리뷰에서는 우리 몸에 존재하는 박테리오파지에 대해 소개하고, 인체 미생물체, 인간 세포(cell), 기관(organ) 및 면역 시스템 등에 박테리오파지가 미치는 영향을 살펴보려고 한다.
2. 우리 몸 속의 박테리오파지 군집
우리 몸은 태어나면서부터 다양한 박테리오파지에 노출되며, 노출된 박테리오파지는 우리 몸에 정착한다. 파지를 포함한 박테리아와 진균은 모체의 질(vagina) 미생물체, 체액(body fluid), 주변환경(environment)으로부터 유래하는 것으로 알려져 있다. 파지는 피부, 구강, 호흡기, 소화기, 비뇨기 등에 정착하게 된다. 그 중, 장내 미생물체는 가장 복잡하고 많은 수의 미생물로 이뤄진 집단으로, 장내 박테리아는 10조 정도, 장내 박테리오파지는 20조 정도 존재하는 것으로 추산한다. 파지는 일반적으로 박테리아를 활용하여 증식한다. 파지는 박테리아에 붙어 자신의 유전체를 박테리아 안으로 주입하여 자손을 만들고, 박테리아를 파괴한 뒤, 주변환경으로 다시 나오는 용균성 생활사(lytic lifecycle)를 가진다. 반면, 파지가 자손 생성을 잠시 미루고, 박테리아 유전체 내로 들어가 프로파지(prophage) 형태로 존재하기도 하는데, 이를 용원성 생활사(lysogenic lifecycle)라고 부른다. 프로파지는 박테리아와 함께 증식하게 되고, 박테리아의 딸세포(daughter cell)로도 전달된다. 이 때문에, 프로파지는 숙주 박테리아가 잘 생존할 수 있도록 돕는 역할을 한다. 예를 들어, 다른 파지의 감염으로부터 숙주를 보호하고(superinfection immunity), 새로운 유전자를 숙주에게 전달해 주며(lysogenic conversion, transduction), 자가 유도(self-induction)를 통해 주변의 경쟁적 박테리아를 제거하기도 한다. 따라서, 특정 군집 내 용원성 파지(lysogenic phage)와 용균성 파지(lytic phage)가 얼마나 존재하는지를 통해 박테리오파지의 생태학적, 생화학적, 병리학적 영향을 파악할 수 있다.
지금까지의 연구를 종합하면, 소화기관에서는 용원성 파지가 다수 존재하는 것으로 나타난다. 이는 용균성 파지가 Kill-the-winner dynamics를 통해 활발히 활동하는 해수 환경과는 사뭇 다른 모습이다. 일반적으로 숙주 밀집도(host density)가 높은 환경에서는 용균성 생활사가 활발하고, 숙주 밀집도가 낮은 환경에서는 용원성 생활사가 활발하다고 알려진 것에 비춰보면, 소화기관의 바이러스는 특이한 생활사를 보인다. 최근에 발표된 Knowles et al. 연구를 보면, 파지가 숙주 밀집도가 아주 높은 환경에서는 오히려 용원성 생활사를 보인다고 주장한다. 실제로, 장내 파지의 유전체에는 박테리아에게 도움이 될 만한 다양한 기능성 유전자가 탐지되는데, 이는 후생동물(metazoan) 체내에서 숙주 박테리아가 원활히 정착·생존할 수 있도록 돕는 장치일 것으로 예측한다. 박테리오파지가 장내 미생물체 군집(community) 구조와 기능에 어떤 영향을 미치는지에 관한 연구는 꽤 이뤄졌다. Reyes et al.은 바이러스 메타유전체(바이롬, virome) 분석을 통해, 한 개인의 장내 바이러스는 다른 사람과 큰 차이를 보이며, 1년이라는 기간 동안 95% 이상 유전적 안전성을 보인다고 하였다. 하지만 장내 바이롬의 80% 이상이 공공 데이터베이스에 존재하는 유전정보로는 해석되지 않기 때문에, 장내 바이러스의 유전정보를 이해하거나 사람의 장내 바이러스 군집 변화를 관찰하는 것은 여전히 제한적이다. Dutilh et al.은 거대한 바이롬으로부터 97kbp 크기를 갖는 단일, 신규 바이러스 유전체를 발굴하였고, 이를 “crAssphage”라 명명하였다. 해당 파지는 현재까지 보고된 대부분의 인체 바이롬에서 탐지되었으며, 그 양 역시 많았다. 이는, 사람 간 장내 바이러스 군집의 차이가 생각보다 크지 않을 수 있다는 것을 의미한다. Minot et al.은 메타유전체 분석을 통해 사람의 장내 바이러스가 2년 반 동안 80% 이상 보존되어 있다고 보고하였다. 정리하면, 사람의 장내 바이러스 군집은 용원성 파지로 구성되어 있으며, 개인에 따라 차이를 보인다는 것이다.
장내 미생물체 연구를 통해 “건강한 장내 미생물체(healthy gut microbiome)”라는 개념이 발생하였다. 즉, 개개인의 소화기관에 정착한, 서로 동일하지는 않지만 유사한 미생물 조합이 동일한 기능으로 우리의 건강에 영향을 미친다는 것이다. 이는 장내 바이러스에도 적용될 수 있다. Manrique et al.은 “건강한 장내 페이좀(healthy gut phageome)”을 연구하였다. 건강한 사람들에서 공통적으로 나타나는 핵심(core) 파지를 찾고, 그 분포를 연구한 것이다. 특이하게도, 핵심 파지는 염증성 장질환을 가진 환자에게서 적게 발견되었다. 이러한 현상은 빈영양(malnutrition), 비만(obesity), 식이변화(diet) 모델에서도 관찰되었다. 즉, 장내 바이러스의 변화가 사람의 건강에 관여할 수 있다는 것을 말한다. 이러한 현상은 기지균외무균마우스(gnotobiotic mouse)를 활용한 연구를 통해서도 그 가능성을 엿볼 수 있다. Weiss et al.은 비병원성 Escherichia coli만 정착한 무균마우스에 T4와 T7 파지를 주입하여, T7 파지가 소화기관에서 활발히 증식할 수 있음을 보여주었다. Duerkop et al.은 Enterobacoccus faecalis 프로파지가 무균마우스와 항생제 처리 마우스에서 증식함을 보여주었다. Reyes et al.은 15종류의 박테리아만이 정착한 무균마우스에 장내 바이러스를 주입하여, 박테리오파지가 박테리아를 감염·증식할 수 있으며, 반대로 박테리아는 박테리오파지에 대한 저항성을 획득할 수 있다는 것을 보고하였다. 무균마우스를 이용한 연구를 통해, 생체 내에서 파지와 박테리아 간 긴밀히 상호작용이 일어나고 있다는 것을 알 수 있다.
3. 박테리오파지와 점막 장벽(mucosal barrier)
소화기관의 표피세포(gut epithelial cells)는 점막장벽(mucosal barrier)으로 덮여있다. 점막 표면은 박테리오파지를 포함한 다양한 미생물이 집중적으로 살고 있는 지역이다. Barr et al.은 점막층(mucus layer)에는 주변 환경보다 휠씬 많은 박테리오파지가 존재한다는 사실을 밝혔다. 평균 4.4배 많은 파지가 존재하고, 해당 현상을 통해 BAM(bacteriophage adherence to mucus) 모델을 제시하였다. BAM 모델은 점막에 집중되어 있는 파지가 병원성 미생물을 포함한 외부 미생물의 정착과 생존을 차단할 수 있다는 이론이다. BAM 모델은 파지 capsid가 뮤신(mucin)에 결합한다는 특징을 바탕으로 이뤄진다(그림 1). Minot et al.은 사람 장내 파지는 immunoglobulin(Ig) superfamily protein 유전자를 가지고 있고, 해당 유전자에서 hypervariable loci가 존재한다는 것을 밝혔다. Ig-like protein은 결합 작용으로 널리 알려진 단백질로, 박테리아는 이를 cell-to-cell adhesion에 활용하고, 척추동물의 면역반응에도 필수적으로 작용하며, 25% 이상의 Caudovirales 파지의 구조 단백질에도 존재하는 것으로 알려져 있다. 일반적으로 파지의 tail fibers에서도 Ig-like domains이 존재하는데, 이는 박테리아 표면에 원활히 붙기 위한 용도이다. 하지만, 왜 capsid에 존재하는지는 밝혀지지 않았다. 또한, T4 파지의 outer capsid 에 존재하는 4가지 Ig-like domains을 “Hoc”이라고 부르는데, 그 기능에 대해서도 딱히 알려진 것이 없었다. Barr et al.의 연구에서 보여준 “파지가 점막에 집중적으로 존재한다.”는 사실을 통해, capsid의 Ig-like domains이 뮤신과 결합하기 위해 발달한 것으로 이해할 수 있다. 실험적으로, wild-type T4 파지와 hoc protein이 결실된 T4?hoc 파지를 비교해 보면, wild-type T4 파지가 뮤신에 대한 결합 능력이 휠씬 뛰어난 것을 알 수 있다. 또한, wild-type T4 파지와 T4?hoc 파지를 610 종류의 포유류 glycan에 노출시키면, wile-type T4 파지가 200개 이상의 glycan에 결합하는 것으로 나타났다. 파지의 뮤신 결합력은 human parainfluenza virus와 장내 공생 박테리아인 Bifidobacterium longum subsp. infantis에 비해서 약하지만, 파지 capsid에 존재하는 155 Hoc 구조단백질과 그 속에 있는 620 Ig-like fold copies가 약한 결합력을 보완하는 구조를 갖는다. crAssphage 역시 뮤신에 결합하는 유전자가 존재하며, Bacteroidetes-associated carbohydrate-binding (BACON) 역시 같은 기능으로 생각된다. Vibriophage VP2나 Enterobacteria phage RB69 역시 Ig-like domains를 가지고 있다. 따라서, BAM 모델은 multimeric capsid proteins을 통해 작동되고, 파지가 포유류의 뮤신층에 붙기 위해 진화적으로 발달한 것으로 이해할 수 있다.
점막은 98%의 물과 뮤신의 glycoprotein으로 구성되어 있다. 뮤신은 아미노산 골격에 당이 붙은 구조로, 수백 개의 glycan이 수많은 가지를 치고 있어, 솔(bottle brush)과 같은 형태를 갖는다. 이 때문에 많은 물을 함유할 수 있게 되고, 젤(gel) 형태를 갖게 된다. 뮤신은 다양한 미생물을 움켜잡을 수 있는 그물 구조이면서, 동시에 미생물 생장에 필요한 glycan을 함유하고 있는 미생물 서식지이다. 즉, 뮤신 분비 정도에 따라 파지를 포함한 미생물의 밀집도가 결정되는 것이다. 파지는 확산으로 이동되는 비활성 물질이다. 젤과 같은 뮤신층에서는 파지나 박테리아 같은 물질의 이동이 기본적으로 느려진다. 특히, 파지의 glycan 결합력은 확산을 더 느리게 하여, 뮤신 가지(branch) 주위에 머무르게 한다. 결국, 뮤신층에 살고 있는 박테리아는 같은 뮤신층에 머무르며, 뮤신 가지 주위에 응집된 파지를 만나게 될 가능성이 높아지는 구조인 것이다. 그에 따라, 파지의 급격한 증식이 뮤신층 곳곳에서 발생하고, 뮤신층 전체적으로 파지에 의한 항균기능을 하는 면역층이 생기게 된다.
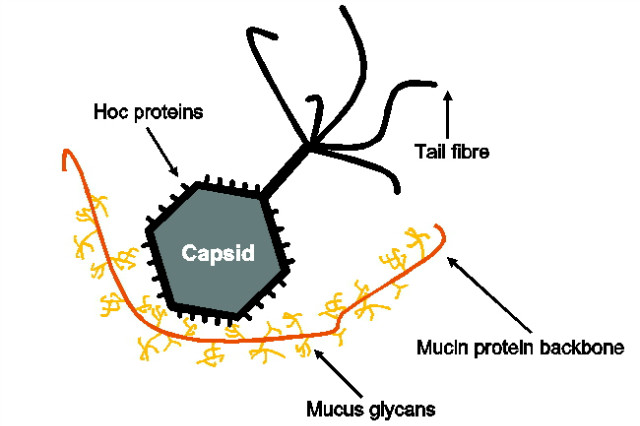
그림 1. 뮤신에 달라붙는 박테리오파지.
하지만 BAM 모델을 연구하는데 어려움이 많다. 무엇보다, 사람으로부터 직접 시료를 얻기 힘들기 때문이다. 널리 사용되고 있는 분변 시료의 경우, 뮤신층에 존재하는 박테리아와 파지를 잘 대변하지 못한다. 앞으로 우리는 어떻게 뮤신층에 존재하는 파지를 활용할 수 있을까? 첫째, 파지 및 박테리아의 생리활성 및 서식지 분포에 대한 이해가 선행되어야 한다. 대부분의 장내 미생물은 빈영양 상태로 증식이 활발하지 않기 때문에 파지의 주요 감염 대상으로 적합하지 않다. 반면, 생리활성과 대사활성이 활발한 keystone 박테리아를 활용하면 보다 적합할 것이다. 둘째, 박테리아를 strain에 따라 구분하여 이해할 필요가 있다. 치료용 파지는 숙주에 대해 일반적으로 좁은 감염 범위를 가지고 있고, 기하급수적 증식하기 위해서는 최소 103 cfu/mL 정도의 숙주가 존재해야 한다. 이러한 조건은 박테리아 strain 다양성이 증가할수록 갖춰지기 어려운 조건이다. 방글라데시의 급성 세균성 설사 환자에게 파지테라피(phage therapy)를 실시한 연구를 보면 해당 조건이 소화기관에서 갖춰지기 힘들다는 것을 알 수 있다. 숙주로 작용하는 병원성 E. coli 가 적게 존재하고, 숙주 박테리아가 strain 단위에서는 파지의 감염 범위를 벗어나는 것이 많기 때문에 효과적인 증식이 어렵다.
정리하면, BAM 모델은 뮤신층에서 파지의 감염 및 증식이 활발히 일어나는 상황에 적합하다. 뮤신층의 파지가 박테리아를 만날 가능성은 숙주 박테리아 농도가 상대적으로 낮고, 뮤신층이 두꺼워질 때인데, 이러한 조건은 장 속에서 흔하다. 이론적으로, 뮤신층에 붙은 파지가 숙주 박테리아(~103 cfu/mL)를 만날 가능성은 뮤신층에 붙지 않은 파지에 비해 19배나 높다. 따라서 뮤신층에 결합하는 파지의 성질을 활용하여, 박테리아를 제어하는 것은 가능할 수 있다. 그리고 이러한 현상은 Ig-like domains에 의한 glycan 결합력과 뮤신층에 존재하는 다양한 glycan에 의해 일어난다. 이를 통해, 파지와 진핵생물의 뮤신층 간 진화적 관계를 통해 우리 몸이 어떻게 미생물을 제어하는지를 이해하는데 큰 도움이 될 것이다.
4. 장내 파지 - 장 표피세포로 아래로의 이동
점액 형태의 뮤신층 아래에는, transmembrane 뮤신이 장 표피세포를 덮고 있다. Transmembrane 뮤신은 장 표피세포의 바깥으로 노출된, glycosylated extracellular region과 단일 형태의 hy-drophobic transmembrane domain, 장 표피세포의 cellular cytoplasm으로 들어가는 cytoplasmic tail로 구성되어 있다. 따라서 구조적으로 physiological barrier와 cellular receptor로서의 기능을 다 가지게 된다. Transmembrane 뮤신은 signal transduction, ion channel regulation, inflammation에 관여한다. 한 예로, MUC1 transmembrane 뮤신은 tyrosine physphorylation site를 가진 long cytoplasmic tail 형태로, signal transduction, cell proliferation, differentiation, apoptosis, cellular secretion에 관여하는 것으로 보고되었다. Pseudomonas aeruginosa flagellin은 external MUC1 glycocalyx region에 결합하여, cytoplasmic tail의 phosphorylation을 유도하고, extracellular signal-regulated kinase (ERK) signaling pathway로 이어져, 염증반응을 일으킨다. 이러한 현상이 mucus-adherent 파지에 의해서도 일어날까? Bloch 연구팀에 의하면, 파지가 다양한 동물 유래 malignant tumour cells의 증식을 억제한다고 보고하였다. Dabrowska et al.은 T4 파지가 cancer cells에 붙어 tumour growth와 metastasis를 억제한다고 보고하였다. 최근에는 Talago 연구팀이 T4 파지가 A549 lung cells의 MUC1 transmembrane 뮤신에 결합한다고 하였다. 또한, 파지에 노출된 cells과 그렇지 않은 cells간 단백질 함량이 다르다고 연구되었으며, 파지 자극에 의한 MUC1 cytoplasmic tail이 apoptosis와 tranion factor의 nucleus translocation을 유도하는 것으로 보고되었다. 즉, 파지와 transmembrane mucin domains간 상호작용이 일어날 수 있다는 것을 말한다(그림 2).
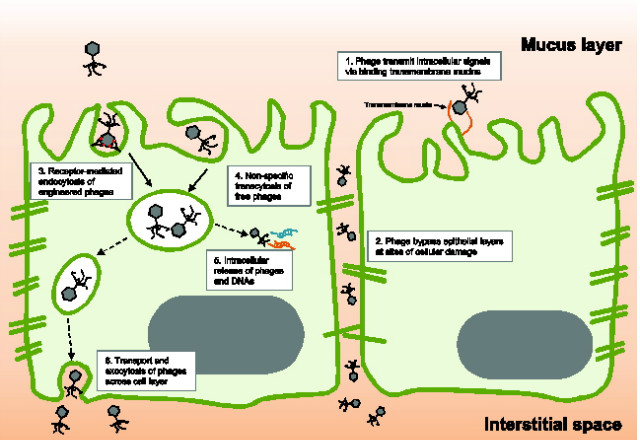
그림 2. 박테리오파지와 장 표피세포 간 상호작용.
하지만, 파지가 근본적으로 원핵세포를 감염하듯 진핵세포를 감염하지는 않을 것이다. 오래 전부터 파지가 인간을 포함한 척추동물의 몸 속으로 침투한다는 것은 알려져 있었다. Salmonella typhimurium을 감염시키는 파지가 감염동물의 혈액에서 검출된다거나, 파지의 복강주입은 콩팥, 간, 뇌, 비장에서 발견된다거나, 구강 주입된 파지가 혈액에서 관찰된다는 연구가 보고되었다. 종합하면, 장으로 흡수되거나 특정한 부위에서 합성된 파지가 동물모델의 혈액에서 발견된다는 것이다. 결국, 무균으로 여기던 체내에서 파지가 관찰되는 것을 통해, 파지가 어떻게 체내로 들어가는지가 밝혀져야 한다. 가장 많이 언급되는 경로는 “leaky gut”이다. 장 표피에서 cellular damage나 염증반응으로 인해 생긴 punctured vasculature를 통해 체내로 유입된다는 것이다. 다음은, 진핵세포의 직접적인 흡수로 인한 것이다. Trojan Horse mechanism처럼, 파지에 감염된 박테리아를 진핵세포가 잠식하여 자연스럽게 파지가 유입된다는 것이다. 또 다른 방법은, 진핵세포가 파지 그 자체를 endocytosis한다는 것이다. 이는 아직까지 밝혀지지 않았지만, 실제로 T2 파지가 phagocytic cells 안에 존재하는 장면이 관찰되기도 하였고, 파지 transcytosis에 관해 논의되기도 하였다.
세포 안으로 파지의 이동은 eukaryotic organelles, cellular machinery, cellular immunity와의 상호작용으로 이어질 수 있다. 아직까지 intracellular pattern recognition receptors가 파지 capsids나 유전물질을 병원성으로 인식하는지는 확실치 않다. 하지만, mitochondrial tranion과 replication apparatus의 주요 구성원이 T-odd 파지로부터 유래했을 가능성이 보고되었다. 파지 유래 유전자가 proto-mitochondrion으로 대체되었다는 이론이며, 이러한 종류의 mitochondria 유전자가 cyanophages 유전체에서 발견된 것으로 보아, 실제로 파지와 proto-mitochondrion 간 수평적 유전자 전달(horizontal gene transfer)이 발생했을 가능성이 있다. 즉, 파지 흡수 현상이 미토콘드리아에서 발견된 파지 유사 유전자의 존재를 이해할 수 있는 실마리로 작용할 수 있다. 세포 내 파지 현상을 통해 진핵세포가 파지 유전물질을 직접적으로 사용할 가능성도 생각할 수 있다. Merril et al.은 lambda 파지가 mammalian tissue culture cells로 유입되어, tranion과 translation이 진행될 수 있다고 보고하였다. α-D-galactose-1-phosphate uridyl (GPU) transferase activity가 결여된 fibroblast cells에 GPU-containing lambda 파지를 감염시켜, 41일 동안 GPU 효소 활성을 유도한 연구도 있다. 즉, 아직 밝혀지지 않는 경로를 통해 파지 유래 유전물질이 tranion과 translation된다는 것을 말한다. Geier와 Merril은 human cells이 파지가 가진 유전물질을 발현할 수 있다는 것을 보여주기도 하였다. 또한, 재조합 파지를 활용하여, 원하는 물질 또는 유전자를 진핵세포 내로 전달, 발현시키는 연구도 다수 보고되었다. 장내 파지는 숙주에 유용한 기능성 악세서리 유전자(accessory genes)를 가지고 있다. 만약 이러한 유전물질이 진핵세포에서 직접적으로 발현된다면? 물론, 파지의 숙주인 원핵생물과 진핵생물인 포유류의 tranional sites, phosphorylation, restriction endonucleases, codon usage, tRNA distribution 등의 차이로 인해 tranion과 translation은 제한적일 것이지만, 그 가능성이 어느 정도이고, 그 영향이 얼마나 클 지 연구되어야 한다.
5. 체내 파지(intra-body phages)의 기능과 면역조절
앞서서 장 점막 및 표피층을 통과하여 무균으로 인식하고 있는 체내 다양한 기관으로 파지가 접근하여 기능을 할 수 있다는 것을 살펴보았고, 앞으로는 체내로 유입된 파지를 “체내 페이좀(intra-body phageome)”으로 명명하고 이에 관해 논의한다. Breitbart와 Rowher는 염기서열 분석법을 통해 처음으로 사람 혈청에 박테리오파지가 있을 수 있음을 보고하였고, Fancello et al.은 심막액에 존재하는 DNA 바이러스 군집 조사를 통해 Staphylococcus, Enterobacteria, Streptococcus, Burkholderia, Pseudomonas 관련 파지 염기서열이 존재함을 확인하였다. Dinakaran et al.은 건강한 사람과 심혈관 질환자의 혈액으로부터 바이러스를 탐지하였고, 심혈관 질환자에서 더 많은 바이러스 염기서열이 탐지됨을 보고하였다. Thannesberger et al.은 mammalian cell culture와 사람의 임상시료에 존재하는 바이러스를 조사하여, 기존에 보고되지 않은 바이러스가 탐지된다고 하였다. 흥미로운 것은, 이 중 90% 이상이 파지로 나타났고, 이들은 동물 혈청으로부터 유래한 것으로 추측한다. Kowarsky et al.은 광범위한 염기서열 분석법을 통해 188명의 1,351 혈액 시료를 분석하였는데, 다양한 미생물과 바이러스가 탐지되었음을 보고하였다. 체내 페이좀은 소화기관으로부터 유래한 것으로 예측한다. 분변시료 g 당 5.09×109 파지가 존재하고, 성인의 장 속에는 2.09×1012 파지가 존재할 것으로 예측하기 때문이다. 장내 파지는 다양성이 매우 높고, 오랜 시간 동안 장내 미생물과 함께 진화해왔다. 따라서 우리는 장내 파지가 장 표피층을 통과하여 체내로 유입될 가능성을 생각해 볼 수 있다. 그러면, 체내 파지는 림프계로 이동하고, lymph nodes, circulation system을 통해 다양한 기관(organs)으로 유입될 것이다. 체내 파지의 반감기는 하루보다 짧은 것으로 보고되었기 때문에, 소화기관으로부터 꾸준히 유입된 체내 페이좀이 혈액, 림프를 통해 몸 전체로 확산될 것으로 본다.
가장 쉽게 떠올릴 수 있는 체내 페이좀의 기능은 non-host-derived 항균제이다. 외부로부터 유입된 기회감염균을 제어하는 역할이다. 장내 미생물 역시 점막세포를 통과하면 언제든지 기회감염균으로 변화할 수 있기 때문에, 체내로 유입된 공생 미생물을 포식자-피식자 관계을 통해 제어할 것으로 추측한다. 체내 페이좀은 면역시스템에 작용하여 면역조절을 할 수도 있다. 파지는 외부로부터 유래한 면역형성물질로 작용하여, 체액면역(humoral immunity)를 통해 anti-phage antibodies 생성을 유도할 수 있다. 하지만, 체내 페이좀에 지속적으로 노출됨에도 특별한 염증반응이 나타나지 않는다는 것은 파지에 대한 자극이 아주 약하게 발생하는 것으로 본다. 진화적으로 파지 유래 면역반응이 후생동물에 오래 전부터 노출되어서 면역억제가 생긴 것일 수도 있다. Majewska et al.은 4×109 phage/mL T4 파지를 구강(oral injection)으로 100일간, 피하주사(subcutaneous injection)로 48일간 마우스에 주입함으로써, 체액면역반응과 anti-phage antibodies가 생성되는 것을 관찰하였다. 하지만, 이는 미약하였으며, 반응을 유지하기 위해 고농도의 파지를 지속적으로 주입해야 했다. Gorski et al.은 파지에 의해 T cell proliferation, antibody down-regulation이 나타남을 보여주었다. 또한, 체내 페이좀이 regulatory T (Treg) cells을 통해 면역억제효과를 나타낼 수도 있다. Treg cells은 regional lymph nodes와 감염부위로 이동하여 증식하게 되는데, 여기서 tissue-specific self-antigens 또는 microbial antigens에 의해 활성화된다. 활성화된 Treg cells 중 일부는 clonally expansion하고 면역억제기능을 지속하는데 활용되게 되는데, regional lymph nodes로 확산된 체내 파지가 Treg cells의 면역억제에 관여할 수 있다는 것이다. 이는 Treg과 effector cell 간의 균형 관계를 통해 유추할 수 있을 것이다. 즉, 충분한 Treg cell은 체내 파지의 존재가 문제가 없다는 것을 말할 것이고, 반대로 Treg cell의 감소는 체내 파지를 문제로 인식하고 있다는 것을 말할 것이다.
비정상적인 파지 흡수와 장내 미생물체의 변화로 인한 체내 페이좀의 변화가 인체 면역시스템에 영향을 줄 수도 있다. 장 표피층을 완전히 통과하지 못한 파지는 진핵세포에 남아 오토파지(autophagy)를 통해 제거되는데, 과도한 파지 흡수는 ER stress와 unfolded protein re-sponse로 이어져 염증반응을 일으킬 수 있다. 반대로, 장 표피층으로 파지 유입이 저해되어 파지 유래 면역억제가 원활하게 작동하지 않을 수 있으며, 그 자체로 염증반응을 유발할 수도 있다. 또한, 장내 미생물체의 변화로 인해 체내 파지가 변화하면, 새로운 파지로 인해 보다 강한 면역반응이 유발될 수도 있다. Norman et al.은 염증성 장질환 대상자에서 장내 파지의 종 다양성(species richness)이 증가한 것을 제시하였는데, 이를 다시 한번 생각해 볼 필요가 있다. 이를 체내 페이좀과 연결하면, 급격히 변화된 장내 바이롬이 활성화된 Tregs의 면역억제기능을 저해하고, 염증반응을 유발했을 수 있기 때문이다. 따라서, 체내 파지의 발생, 유지, 후천성 면역시스템으로의 영향에 대한 연구가 필요하며, 이를 통해 염증성 장질환과 같은 자가면역질환을 해결할 수 있는 실마리를 얻을 수 있다.
6. 체내 파지의 세대 전달 및 신경조절
체내 파지는 수직전달(vertical transmission)에 의해 다음 세대로 전달될 수 있을 것이다. 모계를 통한 미생물 전달은 많이 알려져 있으며, 다양한 미생물이 germ cells, embryos, offspring에 쉽게 접근할 수 있다는 것은 모계를 통한 미생물 전달이 진화적으로 형성된 이점이라는 것을 말한다. 그럼 체내 파지가 유아로 전달될까? “sterile womb paradigm”에 의하면 태반장벽에 의해 태아는 미생물 노출로부터 보호되고 있다. 하지만 최근 연구에서는 태아가 미생물과 출생 전부터 교감을 한다는 가능성을 제기한다. Jimenez et al.은 모유로부터 분리한 Enterococcus faecium에 유전적 표지(labeling)를 한 뒤, 임신한 마우스에 급여하였는데, 표지된 미생물이 마우스 태변에서 검출된 것이다. 즉, 자궁 내에서 모계 미생물이 태아로 전달될 수 있다는 것을 말한다. 이에 비춰보면, 체내 파지도 다음 세대에 전달될 수 있다는 것이다. 일반적으로 출산과정에서, 그리고 모유를 통해 유아는 모계의 미생물을 전달받는다. 모유는 성장에 필요한 영양분과 면역물질을 전달해 주고, 병원성 미생물의 정착을 저해함으로써, 공생미생물의 정착 및 형성을 돕는 역할을 한다. 모유에는 Proteobacteria와 Firmictues에 속하는 다양한 미생물이 존재하며, 유아의 장에 정착하여 유아의 면역시스템 발달을 돕는다. Urbaniak et al.는 모유는 무균상태가 아니며, 다양한 미생물이 존재하는 공간이라고 말한다. 하지만, 어떻게 인체 미생물이 유선(mammary gland)으로 이동하는지는 밝혀지지 않았다. 그럼 체내 파지도 모유를 통해 유아의 장으로 전달될까? Breitbart et al.는 생후 1주일 된 유아의 장내 바이러스를 조사하였고, 모유나 유아식이에 존재하는 바이러스와는 거리가 먼 바이러스가 존재한다고 말하였다. Lim et al.의 연구를 보면, 출생 초기에는 eukaryotic 바이러스의 종 다양성이 극히 낮은 것을 볼 수 있다. 즉, eukaryotic 바이러스는 외부 환경으로부터 온 것이다. 파지의 종 다양성은 초기에 아주 높았으며, 시간이 지날수록 감소하게 된다. 반면, 장내 박테리아는 종 다양성이 증가한다. 물론 해당 연구를 통해 우리는 파지 유래를 정확히 밝힐 수는 없지만, 초기 환경이 중요하다는 것을 알 수 있다. 정리하면, 체내 파지가 유선으로 이동하여, 모유를 통해 다음 세대로 전달될 가능성이 높다. 따라서 성장과정을 통해 발달한 장내 핵심파지가 모계 전달을 통해 유아의 장 속으로 정착하는 과정에 대한 연구가 필요할 것이다.
인체 미생물체는 우리의 행동 및 신경전달, 뇌 발달에도 영향을 미치는 것으로 보고되고 있다. 그럼, 체내 파지가 행동과 신경전달에도 영향을 미칠 수 있을까? 파지는 blood-brain barrier (BBB)를 통과할 수 있으며, 뇌에 축적되어 항균기능을 보일 수 있을 것이다. BBB는 tight junction proteins으로 구성된 물리적인 장벽으로, central nervous system (CNS)와 연결되어 있다. BBB는 paracellular transport를 막고, 작은, 소수성의 500 Da 이하의 물질만 passive transcytosis한다. 이는, 대부분의 저분자 약물과 고분자 신경치료제를 제한한다는 것이다. 1943년 Dubos et al.는 혈관으로 anti-Shiga 파지를 주입하여 파지가 마우스의 뇌에서 축적, 증식할 수 있음을 보여주었으며, 1958년 Keller와 Engley는 복강 주입된 anti-Bacillus 파지가 마우스의 뇌에서 최대 6시간 동안 존속할 수 있음을 보여주었다. 가장 최근에는, Ksendozovsky et al.이 convection enhanced delivery를 통해 뇌간으로 전달된 M13 파지가 뇌의 곳곳으로 퍼져, 별다른 독성 없이 영장류의 신경활성을 증가시켰다고 하였다. Carrera et al.은 코카인 결합 단백질이 발현된 filamentous fd 파지를 마우스의 뇌 속으로 주입하여, 코카인에 대한 신경반응을 차단하기도 하였다. 일련의 연구를 통해 파지가 CNS와 BBB를 통과하여 뇌로 충분히 이동할 수 있다는 것을 알 수 있다. 관련 연구로는 파지를 통해 뇌수막염을 억제할 수 있다는 보고가 있었으며, 파지가 amyloid-beta plaques, cancers, tumour cells에 결합할 수 있다는 것도 보고되었다. Frenkel et al.은 비강을 통해 anti-beta amyloid antibodies를 발현하는 filamentous M13 파지를 주입하고, 마우스의 뇌에서 amyloid-beta 와 결합하는 것을 확인하였다. 이를 발전시키면, 알츠하이머와 파킨슨 병의 원인인 misfolded proteins을 효과적으로 제거할 수 있을 것이다. Dabrowska et al.는 cancer and tumour에 결합하는 T4 파지가 tumour의 전이와 침투를 낮춰주는 것을 보여주었다. 즉, 파지가 뇌나 다른 기관의 plaques, cancer, tumour cells을 제거하기 위한 도구로도 활용될 수 있을 것이다. 정리하면, 아직까지 보고된 바는 없지만, “microbial mind control”과 같이 “bacteriophage mind control”에 대해 연구해 볼 필요가 있으며, 세균이나 진균과 같이 박테리오파지가 물질 그 자체로도 CNS를 통해 행동과 신경활동에 영향을 미칠 수 있을 것이다.
7. 전망
박테리오파지가 미생물체, 세포, 기관, 면역시스템, 신체와 상호작용할 수 있다. 파지는 성장과정을 통해 우리 몸 곳곳에 정착하며, 우리의 건강에 영향을 미치고 있다. 뮤신층에 존재하는 파지는 non-host-derived 면역물질로 작용할 수 있으며, 장내 미생물의 조절도 할 것이다. 장내 파지가 장 점막 및 표피층를 통과하여 lymphatic system과 circulatory system으로 들어가면, 체내 페이좀으로 작용할 것이다. 아직까지는 체내 파지에 대한 연구는 없지만, 면역조절, 염증반응, 세대전달, 신경기능과 같은 역할을 할 수 있을 것으로 기대한다. 또한, 파지의 활용을 통해 우리 몸의 기능을 조절할 수 있을 것이며, bacteriophage biology, microbiology, immunology, cell biology, nutrition, bioinformatics 간 융합연구를 통해 그 가능성을 확인할 수 있을 것이다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
-
이전글
- 대식세포 활성기전 및 역할에 대한 최근 연구동향
-
다음글
- 대식세포를 분류하는 새로운 개념 (대식세포의 발생적 기원과 조직미세환경 그리고 이를 구분 지을 수 있는 새로운 기술들)


 pdf_0002895.pdf
pdf_0002895.pdf