Global Oncology Trend : R&D Pipeline
IQVIA 가 Global Oncology Trend 2018 보고서를 2018년 5월에 발간하였다. (첨부한 보고서 참고) 현재 개발되고 있는 R&D Pipeline이 잘 정리되어 있어서 이를 요약해 보았다. 또한, 보고서에는 2017년 항암제 허가 현황이 포함되어 있는데, 그림으로 잘 정리되어 있으니 살펴보면 좋을 듯 하다. 이 내용은 이미 사업단 홈페이지에 게재한 바가 있어 별로도 정리하지 않았다.
Pipeline of therapeutics innovation prospects
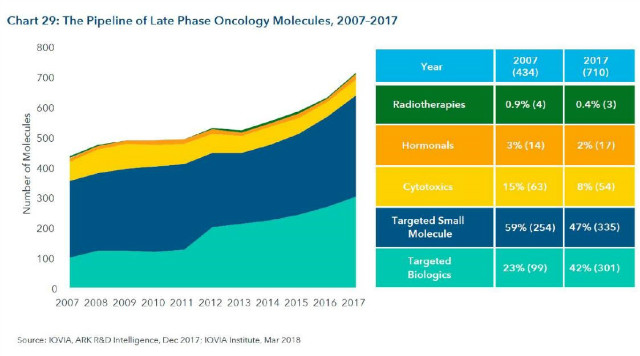
1. Late stage 개발단계에 있는 항암제 신약 개수는 700개 이상으로 2007년과 비교시 60%이상 증가
- 700개 중에 90% 이상이 targeted theraphy
- Targeted biologics 99건에서 301건으로 23%에서 42%로 증가 (면역치료제 증가로 인함)
- Breakthrough theraphy가 많아져서 임상1/2상 이후에 허가 받는 경우가 많아짐
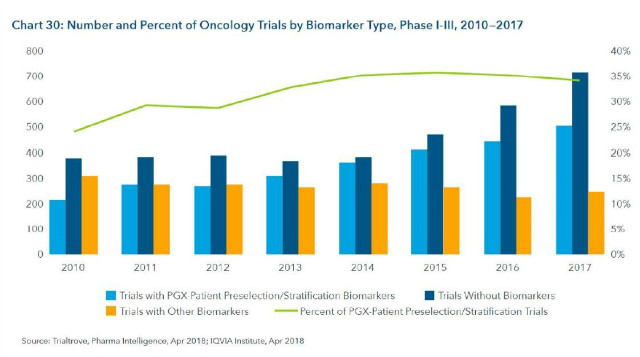
2. 2017년에 바이오마커를 이용한 환자를 선별하여 진행하는 임상이 전체의 35%를 차지
- 2017년 바이오마커 임상시험은 총 754개로 계속 증가(전체의 45%), 그러나 비율로 보면 2016년의 47%대비 줄어듬 (바이오마커와 관련 없는 checkpoint 저해제 임상 증가로 인함)
- 약물유전체(pharmacogenomics)환자선별 임상은 2010년 이후로 계속 증가세 (2010년 24% → 2017년 34%)
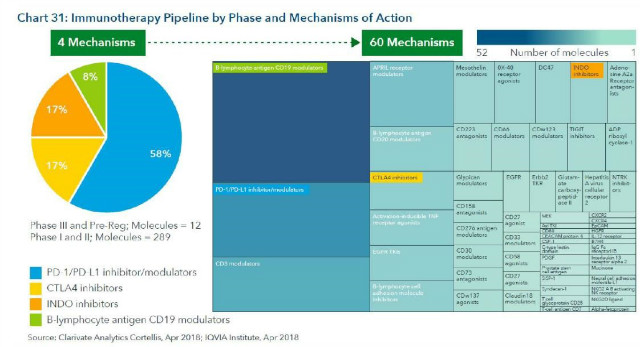
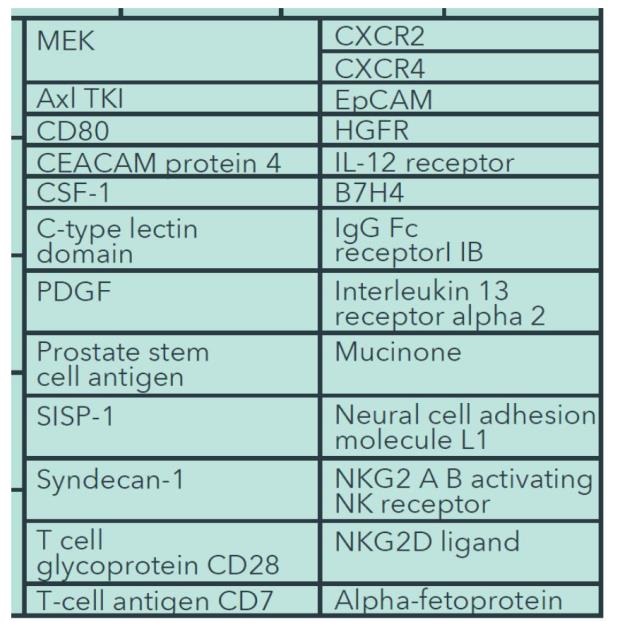
3. 차세대 면역치료제는 60개의 작용기전에 대해 개발 중
- 면역치료제는 300개 이상이 임상이상 단계에 있음.
- late stage는 MOA(작용기전)이 4개, early stage는 60개 MOA로 개발 중
- PD-1, PD-L1, CD-19, CTLA-4가 주요 MOA (이들과 병용도 많음)
- 오른쪽 아래 부분을 확대하면 아래와 같음
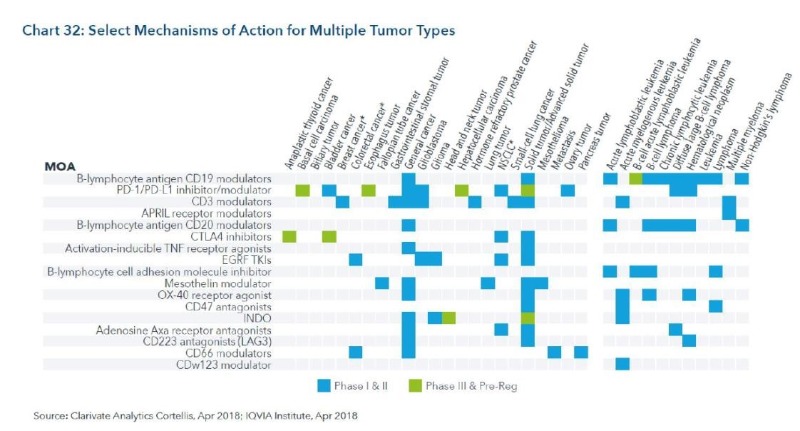
4. 면역항암제는 새로운 기전과 넓은 범위와 적응증으로 확대 중
– 면역항암제는 다양한 MOA뿐 아니라 적응증도 다양해 지고 있음
– CD-19, PD-1, PD-L1 이 18개 적응증을 Cover 함
– 2013년 부터 2017년 동안 breakthrough theraphy 는 15건, fast track은 18건을 기록
– MOA 축과 적응증 축을 확대하면 아래와 같음
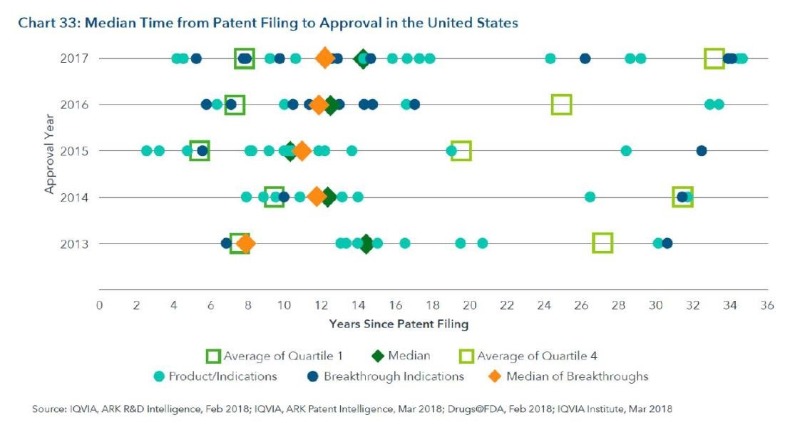
5. 신약개발 기간을 단축하려는 시도들이 어느 정도 성공을 거두고 있음
– 2017년 평균 개발기간 (특허 출원 ~ 허가)는 14.25년으로 2013년에 14.38년에 비해 약간 줄어듬. (Breakthrough theraphy가 2013년부터 지정 시작 → 추후 개발기간 단축될 가능성 높음)
– 14,15,16년에 비해서는 김 (breakthrough theraphy 지정시 late stage 있는 물질들은 개발기간 단축 효과 없음
– Breakthrough 지정 이후 허가까지는 기간은 평균 11~18개월 소요
– Breakthrough 의 경우는 일반보다 1.86년 빨리 허가 받음
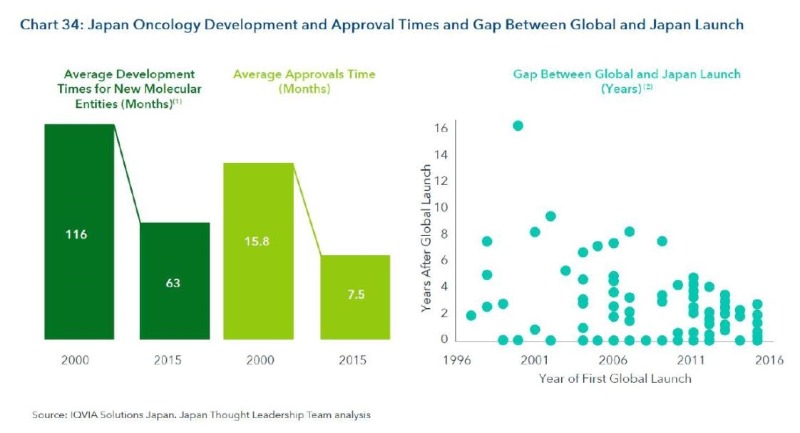
6. 일본 정부가 신약허가 기간 단축에 많은 기여
– 지난 10년간 일보니정부의 노력으로 개발기간 및 허가기간을 1/2로 단축시킴
– 글로벌 허가 이후 일본에서는 평균 4년 이내에 허가 받음. (그 Gap은 1997-2006 동안 49개월에서 2007-2016년 동안 26개월로 획기적으로 단축됨)
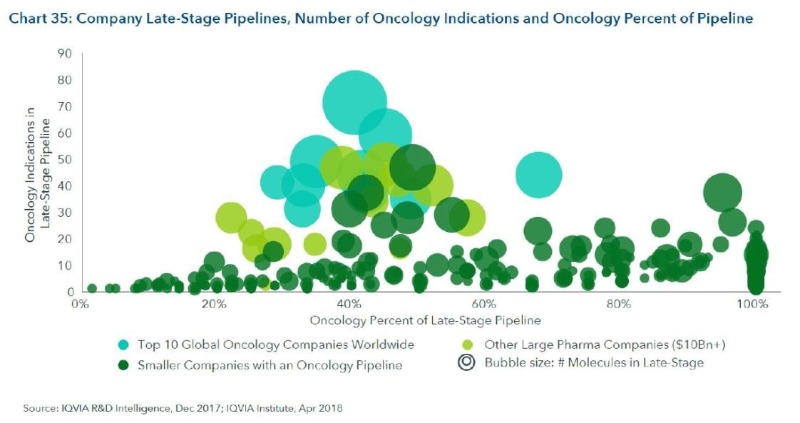
7. 700개 이상의 회사가 Late stage 항암제를 개발 중(14개 대형기업이 1/3 이상을 항암제 개발에 투자)
– 710개 물질에 대해 700개 기관이 관여하고 있음(공동개발, 라이센싱 등의 이유)
– 100억불 이상 매출액을 가지고 있는 대형사의 경우, 40% 정도가 항암제 개발에 투자
– 항암제에 집중하고 있는 회사들은 late stage에 평균 18개 물질, 2개 이상의 적응증에 대해 임상 진행 중
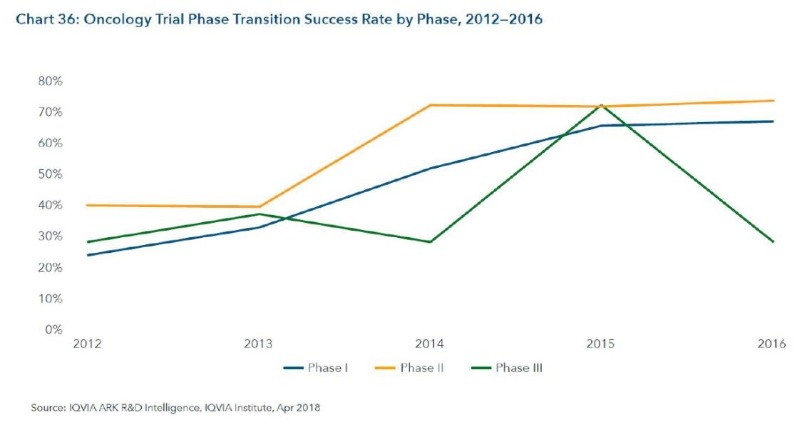
8. 2016년 임상 1상 성공율이 66%, 임상3상 성공율이 73% 로 향상
– 2012년과 2016년을 비교하면, 임상 1상 성공률은 23%에서 66%로, 임상 3상은 40%에서 73%로 향상됨(임상 2상은 변동이 크지 않음)
– 임상 1상에서 Efficacy를 확인할 수 있고, 용량을 결정하는 단계이므로 임상 1상이 중요해 지고 있음
– 임상 2상의 성공률은 해마다 변화가 심함. Breakthrough theraphy 들이 허가 받으면서 변수가 많아진 것이 원인
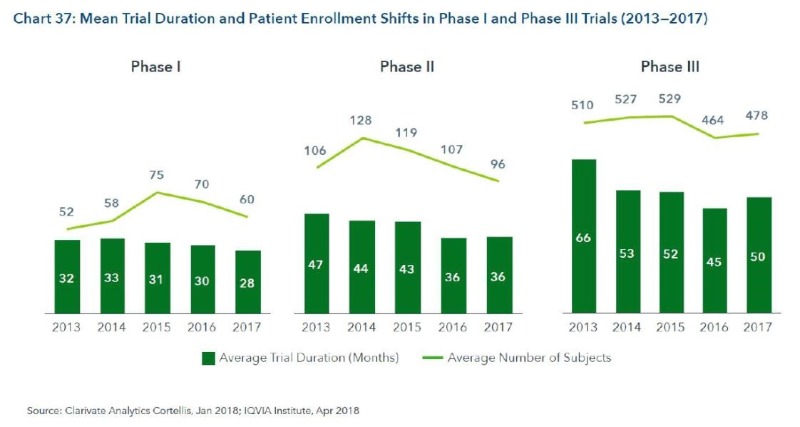
9. Late Stage 임상시험 기간이 단축되고 임상 참여 환자수가 줄고 있음.
– 지난 5년간 임상 2상과 3상의 참여 환자수가 줄고 있음 (이유는 바이오마커 선별 임상이 많아지면서 총 환자수가 적어지고 있고, 희귀 적응증의 환자수가 적고, 신속 허가 등이 많아진 것이 그 이유임)
– 반면 임상 1상은 대상 환자수가 많아지고 있음(efficacy 확인과 바이오마커 연구 등으로 인함)
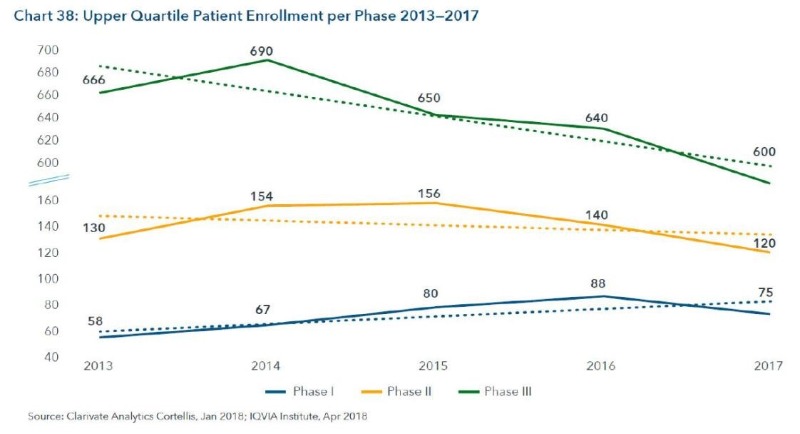
10. 대형 임상시험에서 참여 환자수가 감소 중
– 상위 75% 이상 규모의 임상시험의 경우, 임상 3상의 환자수가 줄어들고 있고, 임상 1상은 증가하고 있음(임상 1상과 2상의 중요성이 더 커지고 있기때문)
– FDA 에서도 임상 2상에서 환자수를 늘여서 진행한 경우, 조기 허가를 내어 주는 경우가 종종 있음
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.