기술동향
Oncolytic virus 기반 항암제 개발관련 리뷰
- 등록일2018-11-08
- 조회수8589
- 분류기술동향 > 레드바이오 > 의약기술
Oncolytic virus 기반 항암제 개발관련 리뷰
(연세대 의대 의생명과학부 교수, 송재진)
Science 잡지가 Cancer Immunotherapy를 2013년 breakthrough of the Year로 선정한 경우에서 보듯이 많은 암종에서 여러 방식의 immune checkpoint inhibition과 세포 기반 면역치료가 수행되어 효과가 입증되었다. 그럼에도 불구하고 일부 환자들만 치료효과가 있다는 점에서 새로운 immune-oncology 분야의 필요성이 대두되었으며 그 중의 하나인 oncolytic virus (OV) 분야는 바이러스의 항암 잠재성에 대한 이해를 바탕으로 악성종양에 대한 검증된 치료법으로 인정받기에 이르렀다. 그 전환점은 2015년 herpes simplex virus 1 기반 T-Vec (ImlygicTM)이 전이성 흑색종에 대한 치료제로 FDA 승인을 받은 이후이다. OV의 특징은 종양에 투여된 바이러스가 감염 및 복제되어 종양을 직접적으로 용해시키고 이후 유도되는 항종양 면역반응이 전신으로 퍼져 나가면서 OV가 국소적으로 도입되어도 그 효과가 전신적으로 파급된다는 것이다.
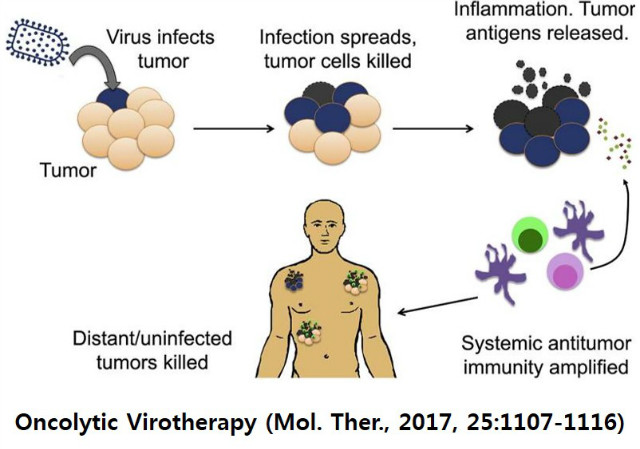
종양내 T-VEC을 투여받은 흑색종 환자의 경우 투여 된 병소 부위에서는 46.1%, 투여부위가 아닌 병소 부위는 30.1%, 투여부위가 아닌 장병소 부위는 9.4% 만이 완전반응을 보였는데 이는 OV가 종양에서 항 종양 면역반응이 더 좋았음을 의미하며 종양이 퍼져 있는 체내 곳곳으로 항 종양면역 반응이 유도되는 전신적 전달 방식이 이루어졌다는 것을 의미한다. 따라서 전신적 전달이 충분히 이뤄지면 치료 반응률이 최대화될 것으로 기대할 수 있다.
T-VEC은 단독투여로도 전이성 암환자의 17%에서 완전 반응한 결과가 보고되는 등 OV가 독성에서도 호의적인 profile을 가지고 있고 in vitro와 in vivo에서도 인상적으로 활성을 보이고 있으나 대부분의 OV가 단일인자로 임상효능을 보이는 경우는 아직까지는 제한적이다. 무엇보다 놀라운 것은 immune checkpoint 저해제들과의 복합투여에 대한 승인을 둘러싼 임상적 이슈가 엄청나다는 것이다. 2018년 현재 전세계적으로 OV가 임상시험에 사용되고 있는 건수는 철회 건수 포함하여 모두 79 case가 보고되었다. 이중 상당수가 immune checkpoint 저해제나 화학요법과 복합치료로 진행중인 것으로 나타났다. OV가 immune checkpoint 저해에 의한 면역치료에 적당한 이유는 OV가 immune checkpoint 저해제에 잘 반응하지 않는 차가운 종양(cold cancer)을 잘 반응하는 뜨거운 종양(hot cancer)으로 변화시켜 주는 장점이 있기 때문이다.
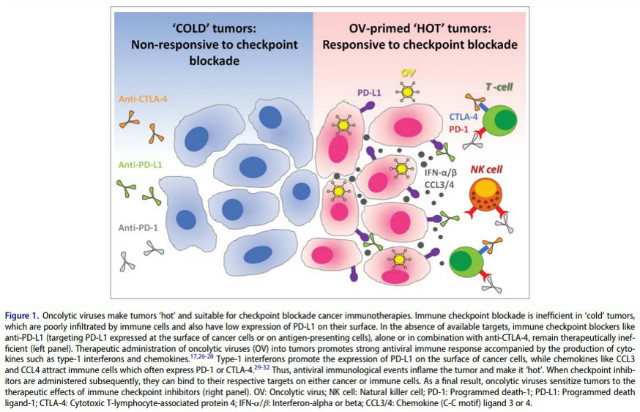
Virotherapy에 의해 유도되는 항종양 면역반응을 신장시키는 (boosting) 방법 중 현재까지 가장 많이 이용하고 있는 전략은 GM-CSF같은 cytokine 또는 chemokine을 바이러스에 탑재하여 발현시키는 것이다. 현재 승인 받았거나 임상시험중인 대부분의 바이러스 기반 항암제들이 바이러스벡터에 GM-CSF를 탑재하고 있다. GM-CSF는 항원제시세포의 모집, 성숙, 활성을 돕는다.
환자의 주된 사망 원인인 전이암과 재발암에는 국소적인 치료가 한계가 있기 때문에 정맥주사를 통한 전신치료가 요구된다. 그러나 현실적으로 OV의 정맥주사를 통한 전신전달에 대한 장벽이 잘 알려져 있는데, 1) 혈액내에서 바이러스가 대량으로 희석되고 2) 혈액내 항바이러스 항체나 보체단백질에 의해 중화작용이 일어나고 3) 간의 Kuppfer cell 이나 spleen의 macrophage 등에 의한 포획으로 인한 감소 4) 종양 신혈관에서 종양으로의 투과 제한 및 5) 종양으로 침윤하는 leukocytes나 macrophages 등 의 항바이러스 활성에 의한 감소 등이 잘 알려져 있다1, 4, 5, 6. 뿐만 아니라 혈액 내 중화항체 등 장애물을 뚫고 종양부위로까지 도달하더라도 종양미세환경은 결코 바이러스의 전파에 녹록한 환경이 아니다. 종양미세환경은 앞서 언급한 종양침윤 면역세포 이외에도 바이러스가 종양부위에서 주변으로 전파되는 것을 효과적으로 막는 두꺼운 세포 외 기질로 이루어져 있다.
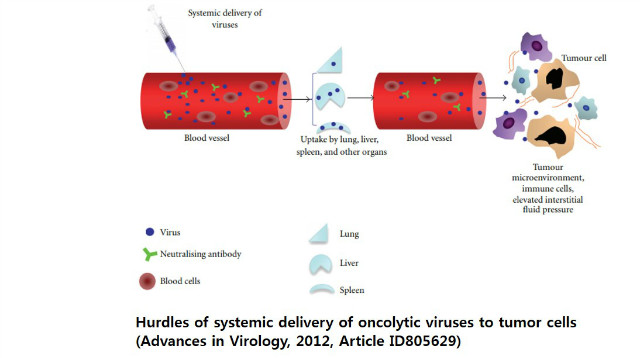
만약 OV가 전신투여 방식으로 사용되면 위와 같은 항바이러스성 면역반응에 의해 바이러스 자체가 종양부위로 도달되는 것을 저해하여 치료효과를 반감시킬 수 있다. 그러나 종양내 주사투여 방식은 종양조직으로 직접 도달되며 부작용도 감소되는 장점은 있으나 대상 암종이 제한될 수 밖에 없다. 종양에 바이러스가 감염되면 종양에 침윤한 면역세포가 이를 인지하고 바이러스에 대하여 면역반응을 일으키게 된다. 바이러스에 노출되면 이들 세포들은 강력한 항바이러스성 cytokine, interferon 또는 다른 effector molecules를 분비하여 바이러스 복제를 저해하고 제거하여 종양용해와 면역치료효과를 반감시킨다. 그러나 한편으로는 종양으로 침윤된 면역세포들로부터 분비된 항바이러스성 cytokine이나 interferon 등에 의해 자신들의 항종양효과 신장시키는 기능을 발휘하는 이중적 측면이 있다. 즉, 비록 바이러스 감염에 의해 유도된 항종양 면역물질들이 바이러스 복제를 정지시키는데 작용하지만 감염된 바이러스가 종양세포를 직접 죽이거나 종양주변으로 더 많은 항종양 면역 작용물질들을 모집함으로써 유도된 면역반응에 의해 종양세포가 bystander killing 될 수 있다는 부분은 항종양 효과에 긍정적인 측면이다. 따라서 바이러스 감염 시 필연적인 항바이러스 면역반응에 의해 바이러스의 clearance가 일어나는 것은 불가피하나 바이러스 감염 초기단계에는 면역억제에 의해 바이러스 복제를 극대화하고 후기에는 항바이러스 면역반응을 포함한 항종양 면역체계의 활성화가 극대화되게 유도하는 전략이 바람직하다.
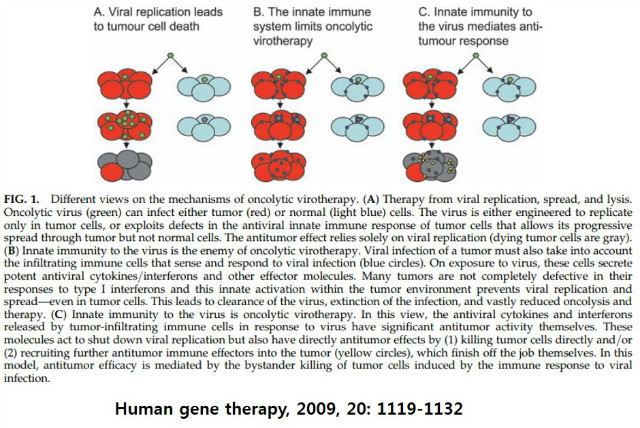
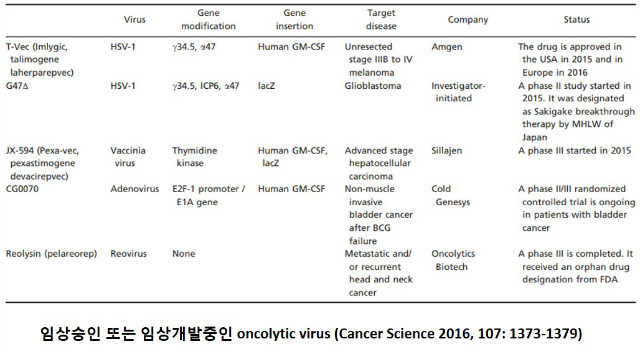
실제 임상에서 무엇보다 중요한 점은 바이러스의 항면역 효과를 최대로 끌어 올리는 것이다. 같은 종양조직 내에서조차 유전적 배경이 다른 이질성(intratumor heterogeneity)이 재발이나 전이의 주된 요인으로 작용하는 것으로 알려져 있고 현재까지 알려진 OV의 종양선택성 부여 방식을 놓고 보면 특정 종양에만 작용하도록 종양특이성을 엄격하게 부여하는 것은 오히려 좋지 않을 수도 있다. 현재까지 개발되거나 개발중인 대표적인 바이러스기반 항암제들의 종양선택성을 들여다 보면 다음과 같다.
T-vec의 경우 HSV-1의 ICP34.5 유전자와 icp47 유전자 부위를 결여시켰다. ICP34.5의 원래 역할은 HSV-1이 뉴런 신경세포나 다른 건강한 세포에 감염된 후 eIF-2을 탈 인산화하여 PKR(Protein Kinase R)에 의해 유도되는 단백질 합성중단을 저해하여 바이러스 복제가 지속되도록 하는데 있다. 따라서 ICP34.5유전자 결여는 정상세포에서는 바이러스 복제가 저해된다. 그러나 흑색종 세포 중 대략 70%가 BRAF 또는 NRAS driver mutations을 보이고 특히 PKR의 활성을 억제하는 MAP kinase 경로가 항상 활성화된 상태이기 때문에 ICP34.5가 결손되어도 흑색종세포에서는 바이러스 복제가 지속 가능하다. ICP47은 MHC class I에 항원 loading을 방해하는 역할을 하는데, ICP47이 결여되면 세포표면에 MHC class I 발현과 감염된 암세포의 종양항원제시가 향상되어 항종양면역반응을 유도하며 정상숙주세포에서 HSV-1 면역회피능을 손상시켜 safety를 증가시킨다. 또한 ICP47 결손 시 US11 유전자 발현이 바이러스 복제사이클 초기로 전환 유도되어 PKR에 결합하여 불활성화시켜 부분적으로 바이러스의 감퇴를 되돌려 암세포에서 lytic 활성을 향상시키는데 기여하는 역할을 수행한다8. JX-594 (Pexa-vec, pexastimogene devacirepvec)는 처음 진행단계의 hepatocellular carcinoma (HCC)를 타겟으로 개발되었으며, 여기에 부여한 종양선택성은 바이러스유래 thymidine kinase (TK) 유전자를 불활성화시킴으로써 높은 수준의 세포내 TK 유전자가 발현되는 증식하고 있는 암세포에서만 복제가 원활하게 일어나는데 반하여 정상세포에서는 복제가 효율적으로 일어날 수 없도록 고안되었다. 즉, TK gene 발현의 차이로 정상세포와 종양세포에서의 바이러스 복제 선택성을 부여하였다. 그리고 CG0070은 E2F1 promoter를 이용하여 retinoblastoma 종양억제 단백질 (Rb)이 결여된 종양세포에서만 E1A 의 발현이 유도되도록 종양선택성을 부여한 아데노바이러스이다. 정상적인 Rb는 E2F1 전사인자와 결합한 상태로 이로 인해 DNA합성이 유도되지 않지만 방광암에서 많이 나타나는 돌연변이 형태인 Rb는 E2F1 promoter에 결합하는 부위가 결여되어 있어 E2F1 전사인자가 Rb로부터 유리된다. 유리된 E2F1 전사인자가 CG0070의 E2F1 promoter에 결합하게 되면서 CG0070의 복제가 일어나게 되고 이로 인해 발현된 E1A 단백질에 의해 DNA 합성 및 세포 분화가 유도된다. 반면에 Reolysin은 현재 임상개발중인 유일한 야생형 reovirus로 두가닥의 RNA genome을 가지며 이론적으로는 Ras 신호가 활성화된 세포에서 oncolysis 특성을 보인다.
이렇게 선택성을 부여하는 방식에서 보듯이 OV에 의한 항종양 면역반응이 동반되는 상황에서는 종양의 이질성이 존재함에도 종양 선택성에 대한 dtringency는 아주 높지 않아도 safety에는 큰 문제는 없는 것으로 보인다.
이상 살펴본 바에 의하면 OV가 전신투여에 의한 효과적인 항암치료법의 하나로 자리잡기 위해서는 앞서 언급한 여러 장벽들을 최소의 손실로 통과하고 종양조직의 광범위한 지역에서 임계수준의 이상의 감염과 복제가 일어나는 조건을 확립하게 되는 경우 OV를 이용한 항종양 면역치료에 큰 진전을 이룰 수 있을 것으로 보인다.
References
1.Russell, S. J. and Peng, K. W. (2017) Oncolytic virotherapy: A contest between apples and oranges. Molecular Therapy 25: 1107-1116.
2.Gujar, S., Pol, J. G. and Kroemer, G. (2018) Heating it up: Oncolytic viruses make tumors ‘hot’ and suitable for checkpoint blockade immunotherapies. Oncoimmunology 7: e1442169.
3.Fukuhara, H., Ino, Y. and Todo, T. (2016) Oncolytic virus therapy: A new era of cancer treatment at dawn. Cancer Science 107: 1373-1379.
4.Ferguson, M. S., Lemoine, N. R. and Wang, Y. (2012) Systemic delivery of oncolytic viruses: Hopes and hurdles. Advances in Virology Article ID805629.
5.Alemany, R. (2014) Oncolytic adenoviruses in cancer treatment. (2014) Biomediciens 2: 36-49.
6.Parato, K., Senger, D., Forsyth, P. A. J. and Bell, J. C. (2005) Recent progress in the battle between oncolytic viruses and tumors. Nature Reviews 5: 965-976.
7.Prestwich, R. J., Errington, F., Diaz, R. M., Pandha, H. S., Harrington, K. J., Melcher, A. A. and Vile, R. G. (2009) The case of oncolytic viruses versus the immune system: Waiting on the judgment of Solomon. Human gene therapy 20: 1119-1132.
8.Conry, R. M., Westbrook, B., McKee, S. and Norwood, G. (2018) Talimogene laherparepvec: First in class oncolytic virotherapy. Human vaccines & immunotherapeutics 14: 839-846.
9.Gong, J., Sachdev, E., Mita, A. C. and Mita, M. M. (2016) Clinical development of reovirus for cancer therapy: an oncolytic virus with immune-mediated antitumor activity. World Journal of Methodology 6: 25-42.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
-
이전글
- 감정 기억의 저장과 회상을 관장하는 편도체(Amygdala)의 신경회로에서 시냅스 가소성(Synaptic Plasticity), 기억 심상(Engram)과 신경망 진동(Network oscillation)의 중요성
-
다음글
- 빅데이터를 활용한 스마트농업
지식
동향

