2005 생명공학백서

- 발행일 2005-12-31
- 출처 백서2005(총서 제58권)
- 담당자 김영철 ( 042-879-8379 / yckkr@kribb.re.kr )
- 조회수 10599
-
키워드
#생명공학백서
-
첨부파일
-
 2005생명공학백서.pdf
(다운로드 1713회)
바로보기
2005생명공학백서.pdf
(다운로드 1713회)
바로보기
-
개요
개요
■『생명공학백서』 발간을 통하여 우리나라 BT 정책 추진현황 및 R&D 활동현황, 국내외 BT 동향과 전망 등 정보를 체계적으로 종합하고 일반에 제공함
- 생명공학분야 국내외 동향, 성과 등에 대한 종합적 안내서 기능
- 차세대 성장동력으로서 중요성을 더해가고 있는 BT 육성 정책에 대한 국민적 이해를 촉진하고 호응을 유도
- 국가 생명공학의 발전과정에 관한 사적 자료로서도 공여
첨부파일 다운로드가 안되시는 이용자께서는 아래 링크를 클릭하세요~!


■ 제 1장 생명공학의 비전 제 1절 생명공학과 우리의 미래 |
![]() 개요
개요
생명공학은 생명체가 지닌 복잡하고 정교한 생명현상을 해명하고 이해하는 과학이며 동시에 연구 결과로 얻어진 성과를 이용하여 현대 산업의 각 분야에 응용하는 것을 목표로 한다. 특히 생명공학은 다른 분야와는 달리 고부가가치, 지식집약형 기술로써 인류가 직면한 식량, 에너지, 질병의 해결에 크게 기여할 것으로 기대된다. 이러한 생명공학의 발달에 따른 우리의 환경변화는 예전에 미처 상상하지 못했던 일들을 가능하게 하며, 늘 꿈꿔오던 이상적인 미래를 우리에게 보여주고 있다.
이처럼 생명공학은 21세기 경제성장을 주도할 핵심 산업으로 부각되고 있으며, 우리가 당면하고 있는 각종 문제들을 해결할 대체산업으로써의 역할이 기대되어지고 있다. 이에 서구 선진국들은 지난 수십년 간 생명공학 연구에 대한 투자를 점차적으로 늘려왔으며 기술개발을 위한 각국의 경쟁이 매우 치열하게 진행되어 지고 있다.
그동안 정보과학과 생명공학이 40년 이상 동안 독자적으로 발전해 왔으나, 이제는 서서히 기술적 경계를 허물고 하나로 융합되어 발전하고 있다. 새로운 생명공학기술의 기초 자원인 방대한 유전자 정보를 해독, 관리, 조직하는데 컴퓨터의 이용이 증대되어 생물정보학(Bioinformatics)이라는 새로운 학문 분야가 생겨났고 유전자 은행이 생겨나 생물 데이터 은행에 있는 풍부한 유전자 정보를 이용하여 연구할 수 있는 시대에 도래했다. 2002년 인간게놈지도의 완성이 발표된 이후 전 세계적으로 생명공학은 새로운 전기를 맞고 있다 해도 과언이 아니다. 32억개의 염기의 배열 순서를 분석해 낸 유전체 연구의 성과를 바탕으로 이제 생명공학은 후기 게놈시대의 새로운 기술 혁신기를 맞이하게 되었다. 바이오산업이 21세기 새로운 경제엔진으로써 미래 국가 경쟁력을 좌우할 가장 중요한 전략산업으로 급부상하고 있는 것이다.
이와 같은 현상은 생명현상에 대한 인류의 관심을 확대시켰고 정보기술(IT) 시대 이후 생명공학(BT) 시대의 도래를 이끄는 견인차 역할을 하게 되었으며, 생명공학기술의 발전과 성과를 앞당기는 데에 정보과학기술이 사용됨으로써 멀게만 보였던 바이오시대가 예상치보다 더 급속도로 진행되고 있다. 또한 각 분야별 기술들이 융합되어 상호 보완해 가며 발전하는 양상으로 변모되어 가고 있는 실정이다.
최근에는 전 세계의 관심이 줄기세포 연구에 의해 다시 한번 생명공학에 집중되었다. 수많은 난치병·불치병 환자에게 희망과 기적을 안겨줄 배아줄기세포 치료 연구에 대한 가부가 미국 대선에서도 쟁점이 될 정도로 부각되었고, UN차원에서 복제연구를 금지할 것인지에 대한 회원국들간의 논쟁이 벌어졌으나 결국 선언적 효력밖에 없는 「복제금지선언문」을 채택하는데에 그쳤다.
복제에 대한 논쟁이 끊임없는 미국에서조차 캘리포니아 주(州)정부에서는 2004년 11월 줄기세포 연구지원을 위해 “주민발안 71(Proposition 71)”이라는 법안을 통과시켜 향후 10년간 한화 3조 원이라는 막대한 규모의 금액을 지원키로 결정하여 서부개척시대의 Gold-Rush 이후에 다시 한번 新 골드러시를 방불케 하듯 유명 연구기관, 바이오기업들이 몰려들어 엄청난 경제적 파급효과를 만들고 있으며, 이에 자극받은 다른 주(州)들도 줄기세포연구 금지쪽에서 허용 및 지원쪽으로 급선회하여 주(州) 차원의 허용 법안 제정을 활발히 진행하고 있다. 줄기세포 분야 선두를 차지하기 위한 전 세계적인 치열한 경쟁속에서 결국 2005년 5월 미국 하원은 「줄기세포증진법안」을 압도적인 표차이로 통과시켰다.
2005년에 한국은 냉동 잔여배아를 이용한 줄기세포 획득기술의 미국 특허 획득, 세계최초 개복제 성공 등 줄기세포 재생의학분야에 많은 발전을 이루었다. 하지만 재생의학의 산업화를 위해서는 임상적용에 앞서 영장류를 이용한 기술개발과 전임상 연구가 절대적으로 필요하다. 영장류의 배아줄기세포 및 질환모델의 개발·활용연구가 충분히 이루어져야만 재생의학의 실현을 앞당길 수 있을 것이다. 정부에서도 이러한 부분에 대한 인식을 같이 하여 신약개발 및 재생의학의 산업화를 위해 전임상, 임상 부분의 인프라를 구축하기 위한 노력을 지속적으로 추진하고 있다.
이러한 연구개발의 급진전 속에서 우리는 숨겨진 유전자 기능을 완전히 분석해 냄으로써, 암·고혈압·당뇨병 등 난치성 질병들의 원인을 규명하고, 신약개발, 맞춤의약, 치료 유전자의 확보 및 노화현상의 의문까지 해결함으로써 전 인류의 숙원인 무병장수, 불치병으로부터의 해방을 실현할 수 있는 날도 멀지 않았다.
![]() 생명공학의 발전 추이
생명공학의 발전 추이
총체적 생명현상 연구(-Omics)가 전개되면서 국경을 넘어선 협력·제휴가 확대되고 있다. 인간을 비롯 총 243개 생물종의 유전자 지도가 작성 완료(2005년 1월) 되면서 Post-Genome 시대 진입으로 유전자기능규명, 산업적 활용에 보다 중점을 두게 되었으며 연구영역의 확대 및 대규모 사업으로 전개되게 되었다.
Biochip, Nanobiotech, 생물정보학 등 새로운 융합기술 및 Tool Box 연구영역이 확대되고, 신약개발의 기술혁신이 가속화되었으며, SNP(단일염기변이), Pharma-co--ge-nomics(약물유전체학), 배아줄기세포배양 등에 의한 예방의학, 맞춤의약, 재생의학 등 새로운 의약학적 발전추세가 태동되고 있다.
또한 기초연구와 응용/산업연구 간의 구분이 모호해지고, 실험실 연구 성과가 바로 산업화 및 임상의료 현장과 연계(Bench to Bedside)되어 지식 생산자와 기술 이용자간의 네트워크가 중요한 요소로 등장하게 되었고, BT와 IT 등을 융합하여 생체 컨텐츠를 개발·서비스하기 위한 생체핵심 및 첨단 응용기술에 대한 관심이 고조되는 등 생명공학과 IT, NT 등 첨단기술간 융합화에 따라 신기술 영역이 급속히 확대되고 있다. 즉, “유전자에서 생명체 자체에 이르는 생명현상 전체 범위(Gene to Life)”를 첨단 IT, NT기술을 활용하면서 총체적으로 연구하고, 신약개발 등 산업적으로 응용하는 연구가 확산되고 있는 것이다.
IT, NT 등 첨단 기술과 BT기술의 융합은 생명공학기술 혁신을 더욱 가속화시키고 있으며, Systems biology와 같은 in silico(컴퓨터내) 연구개발 추세를 확대시키고 있다. 또한 이러한 융합기술의 중요성은 신약 후보물질 발굴 및 신약개발 비용절감에 있어 상대적으로 고효율을 가져다주는 것으로 평가되고 있다.
Post-Genome 시대 유전자 혁명에서 우위를 선점하기 위한 국가간 경쟁중에서 생명공학분야의 특허 증가, 특히 포스트게놈 기술분야의 특허경쟁이 가속화되고 있는 추세이다. 이러한 Post-Genome 관련 신기술의 파급 승수효과는 Genome 기술의 약 3배로 보고되고 있다.
이와 더불어 생명윤리에 대한 사회적 관심의 고조와 연구개발 및 산업화에 대한 사회·윤리·법적 논의가 OECD를 통해 국제적으로 진행되고 있으며, 광범위한 연구자, 연구기관이 유기적으로 결합된 대규모 국제협력 프로그램(HGP, HUPO)의 등장으로 연구개발이 대형화되고 국경을 초월한 전략적 제휴·협력이 확대되고 있다.
생명공학은 이미 보건의료분야 및 농·식품분야를 중심으로 산업화가 진전되어 왔다. 이러한 추세는 앞으로도 당분간 지속될 것으로 보이지만, 생명공학은 최종제품의 생산을 위한 고효율, 환경친화적 공정혁신에도 기여가 확대되고 있으며, 최근에는 생명공학 연구개발을 위한 주요한 장비(Tool)의 개발, 서비스 및 바이오칩 등 융합기술영역에서도 대규모 새로운 시장이 형성되고 있다.
<표 1-1-2-1> 세계 생명공학 산업가치(1999-2003)
년도 | 산업가치(billion $) | 성장률(%) |
1999 | 54.3 | |
2000 | 65.4 | 20.60% |
2001 | 77.4 | 18.30% |
2002 | 89.4 | 15.50% |
2003 | 101.7 | 13.70% |
연평균(99-03년) | 17.00% | |
출처: DATAMONITOR, 2005.6 | ||
생명공학 산업은 향후 5년 이내, 그리고 처음 산업이 시작된 이후 25년의 역사가 흐른 시점에서 드디어 수익 창출이 가능해 질 것으로 예측되고 있다. 2003년 세계 생명공학 산업은 총 1,020억$(전년대비 13.7%) 규모이며 ’99~’03년까지 연평균 17%의 놀라운 성장률을 보여왔다.
<표 1-1-2-2> 세계 생명공학 산업 현황(2004)
구분 | 세계 | 미국 | 유럽 | 캐나다 | 아시아/태평양 |
상장기업 | |||||
총수익(백만$) | 54,613 | 42,740 | 7,729 | 2,091 | 2,052 |
R&D비용(백만$) | 20,888 | 15,701 | 4,151 | 782 | 253 |
순손실(백만$) | 5,304 | 4,317 | 484 | 408 | 94 |
고용인력(명) | 183,820 | 137,400 | 25,640 | 7,370 | 13,410 |
기업수(개) | 4,416 | 1,444 | 1,815 | 472 | 685 |
- 상 장 | 641 | 330 | 98 | 82 | 131 |
- 비상장 | 3,775 | 1,114 | 1,717 | 390 | 554 |
출처: Ernst & Young’s Global Biotechnology Report, 2005
미국이 세계 생명공학 산업을 주도하고 있다. 세계 생명공학 기업(상장+비상장)의 33%가 미국에 존재하며, 상장기업 기준 수익의 78%, 고용 인력의 75%를 점유하고 있다. 미국 다음으로는 유럽이 세계 생명공학 산업의 약 25%를 차지하고 있으며, 전세계 상장기업의 17%를 점유하고 있다.
응용분야에 있어서는 보건의료분야가 생명공학 총 시장의 60%(440억 불)를 점유하고 있는 최대 응용분야이다. 2003년 말 기준 미 FDA 승인 후 시판 중인 바이오 의약·백신은 총 155개에 달하고 있고, 이 중 70%가 지난 6년 동안에 승인된 것임을 볼 때 관련분야에서의 기술혁신이 급속히 전진되고 있는 것으로 보인다. 현재 개발 중인 바이오신약 후보물질은 380개를 상회하며 이 중 항암제가 절반 이상을 차지하고 있다. 국내 기업은 특허가 만료된 바이오신약을 모방 생산하는데 주력하고 있으며, 최근 들어 혁신 신약에 대한 연구개발을 강화하고 있다. 향후 HGP의 성과에 힘입어 전체유전자의 동정 및 기능 규명을 통해 신약을 개발하기 위한 연구가 더욱 가속화될 전망이다.
농업분야에서의 산업적 응용이 가속화되고 있다. 유전자변형작물(GMO작물)의 바이오안전성 규제에 의하여 유럽을 비롯한 일부 국가에서는 산업적 재배가 지체되고 있지만, 미국을 비롯하여 GMO작물의 상업적 재배는 크게 확대되었다. 우리나라는 「바이오안정성의정서」를 국제협약으로 채택(’00.1)하였으며 이에 따라 「유전자변형생물체의 국가간 이동 등에 관한 법률」(’01.3) 및 동법 시행령을 제정(’05.9)하여 국내법적 근거를 마련하였으며 현재 시행규칙 및 부처별 관련 고시가 제정중이어서 안전한 유전자변형작물 및 생물체의 수입과 수출을 위한 만반의 준비를 하고 있다. 미국이 전 세계 GMO작물의 생산을 주도하고 있으며 2004년 세계 GMO작물의 시장규모는 약 45억 달러에 달하며, 국내에서는 농촌진흥청에서 45종의 GMO식물을 개발하고 있다.
<그림 1-1-2-1> 세계 유전자변형 작물 재배 현황

![]()
출처: ISAAA. Global Status of Commercialized Biotech/GM Crops, 2004
생명공학 산업은 제품의 개발이나 생산 과정에서 막대한 고용창출력을 갖고 있으며, 기술특성상 의약, 농업, 에너지, 환경 및 자원 등 광범위한 분야에 걸쳐 파급효과가 크기 때문에 21세기에 정보통신 및 항공우주 분야와 더불어 경제성장을 주도하는 핵심 산업으로 부각될 것이다. 생명현상의 근본적인 이해를 위한 기초 연구를 비롯해서 환경보전과 안정성 연구, 보건의료의 향상은 물론 식량자원의 확보와 식생활 안정화, 그리고 생물 및 그 기능의 공업적 이용 등 인간 생활과 밀접한 관계에 있는 여러 산업 분야에 응용할 수 있는 응용기능성 산업이다. 또한 두뇌기술집약형, 탈공해형, 자원 및 에너지절약형 기술로 그 적용 범위와 발전 가능성이 무궁무진하다.
이러한 생명공학 분야는 장기투자를 요하나 무형가치가 투입되어 고부가가치를 창출하는 성장성이 높은 새로운 첨단지식기반산업이다. 특히 우리에게 잘 알려진 항암제 인터페론은 1g당 5천 달러이고 부가가치 비중이 60%인데 반해, 256 KD램 반도체의 경우에는 1g당 360달러이고 부가가치 비중도 30%에 불과하며 항암보조제인 G-CSF는 1g당 54만 달러, 빈혈치료제인 EPO는 1g당 67만 달러를 호가할 정도로 고부가가치 산업으로써의 특성을 가지고 있다. 또한 기존산업, 정보기술·나노기술·환경기술(IT·NT·ET) 등의 신기술과 결합하여 다양한 산업적 응용과 신산업 창출이 가능한 기술 중심 미래 유망산업으로 기대되고 있다.
이러한 기술은 우리의 생명, 생존과 밀접한 건강, 식량, 환경, 에너지 등 21세기 인류의 난제를 해결할 인간과 환경에 적합한 차세대 핵심사업으로 원료의 재생가능성, 제조과정의 온화성, 인체와 환경에 대한 제품의 적합성, 폐기물처리의 우수성 등의 특성을 갖고 있다.
21세기에는 생명공학 기술을 선도할 수 있는 나라가 곧 선진국이 될 수밖에 없는 불가피한 실정이다. 따라서 현재의 과학기술을 선도하고 있는 선진 각국은 획기적인 정부의 개입에 의한 전략적 육성과 정책적인 투자계획을 수립하여 지원하고 있는 실정이다. 21세기 생명공학분야에 있어서 세계적 경쟁력 확보와 기술개발의 선도적 역할을 위해서는 우리의 관련 연구개발 환경 및 능력을 획기적으로 개선시키는 것이 무엇보다도 시급하다.
우리 정부는 지난 80년부터 생명공학의 육성을 위해 지원을 해왔으며 최근에는 국가 중장기 생명공학 육성 비전과 중점영역의 설정을 위한 정비작업을 추진하고 있다. 특히, 국가과학 기술지도(NTRM)에서 “건강한 생명사회구현”을 위한 비전과 기술지도를 설정하였으며, 차세대 성장동력기술로 “바이오신약·장기” 분야를 선정하여 선택과 집중에 의한 연구개발의 효율성을 높이기 위해 박차를 가하고 있다. 또한 기술경쟁이 향후 국력의 향방을 가름하는 지표임을 인식하여 정부의 혁신정책의 일환으로 과학기술부가 부총리 체제로 승격되었고, 범부처적인 종합·조정을 위해 과학기술혁신본부가 출범한지도 1년째에 접어들면서 그동안 부처별로 진행되고 이미 추진되었던 생명공학 분야에서의 각종 연구개발에 대한 종합·조정을 통해 효율성을 높이고 내실있는 연구개발을 위한 필요·충분조건을 갖추기 위해 시스템 구축이 추진 중에 있다.
그동안의 한국의 생명공학 연구 성과를 보면 세계 3대 저널인 셀, 사이언스, 네이처에 게재된 한국인 저자 논문의 수는 1992년 전무하던 것이 2004년에는 16건으로 게재되어 한국의 생명공학 분야가 빠른 시간에 세계적인 성과를 내었음을 짐작할 수 있으며 이는 정부의 지속적이고 체계적인 지원에 힘입은 바 크다고 볼 수 있다.
미국특허를 기준으로 보았을 때 한국의 생명공학 특허경쟁력은 15위 수준에 달한다. 2000년~2003년 중 총 204건으로 2000년 이후 85% 성장률을 기록한 반면에 미국의 경우 같은 기간에 미국 생명공학 특허는 10% 성장률로 그쳐 한국 생명공학 특허의 급성장이 이루어지고 있음을 알 수 있다.
범정부적 육성전략 아래 세계적 수준의 연구결과가 도출되고 있고 정부의 투자도 확대되는 추세에 있으나, 발전기반 및 기술 경쟁력이 선진국에 비해 아직 취약한 것(미국 생명공학 예산 대비 우리나라 예산은 2.5% 수준)으로 분석되고 있다. 한정된 자원으로 최대한의 성과를 내는 것이 우리가 처한 현실이고 이러한 이유로 정부는 정책 추진실태를 종합 점검, 세계적으로 경쟁력 있는 핵심 분야를 위주로 선택과 집중을 통한 투자, 우수벤처 선별 지원 확대, 선진국과의 기술협력 가속화, 선진 바이오클러스터와의 연계 등의 보완책 마련을 위해 바이오산업육성을 위한 전략을 마련하고 전문연구분야에 대한 집중을 통한 예산의 효율적인 집행과 대형 연구성과 창출을 위한 기반을 구축 중에 있다.
이러한 정부의 노력속에서 국내 생명공학 분야에서도 세계적 연구 성과가 도출되는 등 기술경쟁력 제고가 이루어지고 있는 추세이다. LG생명공학의 “팩티브”가 FDA에 신약 승인을 획득함으로써 우리나라는 세계 10번째 FDA 신약 승인 국가가 되었다.
![]() 생명공학의 미래와 전망
생명공학의 미래와 전망
19세기 말 파스퇴르의 미생물 발효 현상, 멘델의 유전법칙, 미셔의 핵산발견 등 생물학의 3대 발견 이후 현재까지 생명공학은 눈부신 성장과 발전을 거듭해 왔다. 지금 우리는 생명공학 기술이 21세기 인류의 미래를 이끌어 나갈 중요한 분야라는 것을 아무도 의심하지 않는다. 산업혁명과 정보통신 혁명을 잇는 새로운 혁명의 시대가 도래하고 있는 중요한 시대에 우리는 살고 있는 것이다.
세계 각국은 생명공학 산업을 IT 이후 세계 경제의 핵심 산업으로 선정, R&D 투자 확대·인프라 확충·전문인력 양성 등 역량 강화에 주력하고 있으며, 21세기는 생명공학의 시대로서 인류가 당면하고 있는 보건·식량·환경·에너지의 4대 난제를 해결해 줄 수 있을 것이라 예상되고 있다.
중국 진시황제가 그토록 찾으려했던 불로장생초의 일화에서 엿볼 수 있듯이 무병장수, 식량난과 질병으로부터의 해방은 인류가 지구상에 존재한 이래 오늘날까지 지속되어 왔다. 이제 생명을 연장시키기 위한 인류의 바램은 생명공학 기술의 발달로 인해 각종 질병을 정복하고 생명을 비약적으로 연장할 수 있는 단계에 이르렀다.
생명공학은 보건ㆍ의료, 환경, 농수축산, 에너지 등 산업적 응용 범위가 넓고 소량 다품종의 고부가가치 제품창출이 가능해 시장잠재력이 매우 크다.
보건ㆍ의료 측면에서는 각종 난치성질병의 예방 및 조기진단, 치료가 쉽게 이루어지게 됨에 따라 인간수명의 연장과 고령화 사회가 이루어질 것으로 전망된다.
농업 측면에서는 다수확 질병저항성 농작물의 개발과 보급 등으로 전 세계적 난제인 식량난 해결에 크게 기여할 것으로 기대받고 있으며, 생명공학 기술을 활용한 환경친화적 오염방지기술은 지구적 환경오염문제를 해결할 수 있을 전망이다.
청정연료인 수소에너지 같은 바이오에너지가 새롭게 개발되면 기존 화석에너지를 대체함으로써 환경뿐만 아니라 산업경제에 매우 긍정적인 영향을 미칠 것으로도 기대되고 있다.
향후 미래의 생명공학 산업은 어느 분야보다도 의과학 분야가 가장 주목받는 핵심 분야가 될 것이다. 인간 유전체 프로젝트가 완료되면서 뒤이어 수많은 유전자 기능(gene function)연구가 활성화되고 있다. 따라서 앞으로 유전자 기능 연구에 많은 관심을 가져야 할 것이며 이와 관련하여 유전자 치료제(gene therapy) 연구도 활발히 진행될 것이다.
G-Economy(gene-economy)라고 불리우는 유전자 경제의 시대가 도래한 것이다. 유전자의 원인 규명을 통해 각국의 특허 획득을 통한 기술경쟁도 치열해질 전망이며 이를 대비한 생명공학 특허전략, R&D와 특허를 연계한 특허 시스템의 구축이 절실한 때이다.
많은 우려와 논란 속에서도 인간복제 관련 연구와 재생의학 분야는 21세기 중요한 연구개발 대상 분야가 될 수밖에 없을 것으로 보이며 이러한 기술들은 질병치료나 장기이식 등에 이용하는 방향으로 진행될 것이다. 한국 재생의학 분야에서 세계적인 경쟁력을 갖추고 있는 만큼, 자칫 과학적 이해의 부족과 윤리적인 기준에 의한 철학적, 종교적 판단 및 지나친 규제로 인해 미래의 고부가가치 첨단 산업의 발전에 지장이 초래되어서는 안될 것이며, 이러한 사회적 갈등의 요소와 의혹을 해결하기 위해서는 무엇보다도 과학기술 분야에 대한 이해와 각계 각층의 의견대립을 최소화하고 상호 이해와 화해 속에서 연구가 진행되어야 하며 윤리문제에 대한 가이드라인을 정비하여 연구자가 안전하고 명확하게 연구에만 집중할 수 있는 연구환경 조성을 위해서도 노력을 해야 한다. 잠시 방심하는 사이 치열한 기술경쟁력의 사회에서 곧 도태되거나 기술의 우위를 선점하지 못하는 불행한 결과를 낳을 수 있다는 사실을 직시하여 건강한 생명사회를 구현하기 위한 범국가적 노력이 절실히 필요한 때이다.
■ 제 1장 생명공학의 비전 제 2절 생명공학 산업의 장기 전망 |
![]() 생명공학 산업의 현재
생명공학 산업의 현재
가. 정의 및 범위
OECD는 생명공학 기술(biotechnology, BT)을 지식 재화 및 서비스의 생산을 위한 생물 또는 무생물을 변형시키는 과정에서 생물체 혹은 생물체의 일부, 제품, 제품관련 모델에 과학적인 논리와 기술을 적용하는 활동이라 정의한다(OECD 자료, 2004년). 또한 생명공학 산업(bioindustry or biotechnology industry)의 범위는 OECD 기준에 따르면 의약, 농축수산, 환경, 에너지 시장 등으로 구분한다. 특히, 의약 시장의 경우 생명공학 기술 및 의약화학 기술을 동시에 이용한 제품이 의약 시장의 90% 규모를 차지함에 따라 생명공학 산업의 의약 시장은 저분자 합성 의약을 포함하여 해석하고 있다.
나. 생명공학 산업군 및 세계 시장 규모
생명공학 산업은 의약산업을 포함, 농·축·수산 분야에서의 식량문제 해결, 환경복원, 폐기물처리 기술개발을 포함한 환경문제 해결, 고갈되어 가고 있는 석유에너지 자원을 대체할 바이오에너지 개발, 바이오전자산업 등, 모든 산업군에 적용될 것으로 예측하고 있다. 본 보고서는 이 중 부가가치가 가장 크고, 생명공학 산업의 꽃인 의약산업 위주로 시장동향, 신기술의 발전 및 미래전망 순으로 기술하고자 한다.
전 세계 생명공학 산업의 규모는 2004년 5천4백억 달러에서 2005년 6천억 달러, 2010년에는 1조억 달러에 육박할 것으로 예상되며, 의약 시장이 전체 시장의 90%를 차지하고 있다<표 1-2-1-1>.
생명공학 산업의 90% 이상을 차지하는 의약 시장에 있어서 작년 한 해 판매되었던 주요 대형 의약품은 <표 1-2-1-2>와 같다.
<표 1-2-1-1> 생명공학 산업 및 예상 시장 규모
산업 부문 | 주요제품 | 현재 단계 | 2010년 시장 규모 (억 달러) | 주요 참여 기업 |
의약 | 콜레스테롤저해제 적혈구 성장 촉진제 | 상용화 | 9,700 | Pfizer, GSK, Amgen, Genetech |
생명공학 치료 | 세포치료, 유전자 치료제, 수혈제품 | 기초 원리 발견, 응용 연구중 | 562 | Aastrom, ONYX, Vical |
U-Health | 바이오칩, 운용체계 | 응용기술 축적 | 300 | Affimetrics, Medtronics |
유전자변형 생물체 | 작물, 동물, 어류 | 상용화 | 150 | Monsanto, Syngenta |
생명공학 기기 | 영상진단기, 분석기기 | 상용화 | 850 | HP, GE, Agilent |
생명공학 환경·에너지 | 미생물 분해, 생명공학 연료 | 상용화 초기 | 160 | Shell, BP |
생명공학 공정 | 기존 공정의 대체 | 상용화 초기 | 250 | Cargill-Dow, BASF, Dupont |
출처: 삼성경제연구소 보고서, IMS health, Jain PharmaBiotech Report 2005 등 | ||||
<표 1-2-1-2> 세계의 주요 대형 의약품(2004년) | ||||
제품명 | 판매회사 | 매출액(억불) | 적응증 | 출시 연도 |
Lipitor | Pfizer | 108.6 | 콜레스테롤 저하제 | 1996 |
Zorcor | Merck | 52.0 | 콜레스테롤 저하제 | 1991 |
Seretide | GlaxoSmithKline | 45.0 | 천식 치료제 | 1998 |
Norvasc | Pfizer | 44.6 | 고혈압 치료제 | 1992 |
Zyprexa | Eli Lilly | 44.2 | 정신분열증 | 1996 |
Nexium | AstraZeneca | 38.8 | 위궤양 치료제 | 2000 |
Procrit/Eprex | Johnson & Johnson | 36.0 | 빈혈 치료제 | 1990 |
Zoloft | Pfizer | 33.6 | 우울증 치료제 | 1991 |
Effexor | Wyeth | 33.5 | 우울증 치료제 | 1993 |
Plavix | Bristol Myers Squibb | 33.3 | 혈전 용해제 | 1997 |
Celebrex | Pfizer | 33.0 | 관절염 치료제 | 1998 |
Fosamax | Merck | 31.6 | 골다공증치료제 | 1995 |
Epogen | Amgen | 26.0 | 빈혈치료제 | 1989 |
Aranesp | Amgen | 24.7 | 빈혈치료제 | 2001 |
Enbrel | Amgen | 19.0 | 관절염 치료제 | 1998 |
Neulasta | Amgen | 17.4 | 항암보조 치료제 | 2002 |
Rituxan | Genetech | 17.1 | 항암제 | 1997 |
Viagra | Pfizer | 16.8 | 발기부전 치료제 | 1998 |
Actos | Takeda | 16.9 | 당뇨병 치료제 | 1999 |
Gleevec/Glivec | Novartis | 16.3 | 항암제 | 2001 |
출처: Top 400 prescription drugs(Med Ad News, 2005) | ||||
다. 생명공학 연구 개발 기술 동향
생명공학 산업은 미국, 영국, 일본, 독일 등 일부 국가가 주도하는 가운데 기업간 경쟁이 매우 치열하다. 미국을 포함하는 상위 6개국이 전 세계 연구 개발비 투자액의 88%를 차지하고 있으며, 미국 중심의 상위 20개 기업이 전체 시장의 60%를 점유하고 있다.
미국 중심의 다국적 제약회사들은 연구 개발에 대한 투자를 점차 강화하여, 2004년 미국 정부의 국립보건원 연구 개발비 약 280억 달러보다 많은 380억 달러에 이르는 엄청난 규모의 금액을 투자하고 있다. 그러나 점차 증가되어온 연구 개발에 대한 투자에 비해, 실제로 신약 개발 과정을 거쳐, 제품화 되어 출시되는 제품의 수는 감소하고 있으며, 효율적인 기업 운영을 위해 생명공학 벤처와의 제휴를 통한 파이프라인 확보에 점점 투자를 늘리고 있는 경향이다. 아래는 2004년 기준으로 매출액 대비 연구 개발 투자액 상위 10개 국내외 제약사들이다<표 1-2-1-3>..
<표 1-2-1-3> 국내·외 10대 제약기업 비교 | ||||||
순위 | 국내 | 해외 | ||||
업체명 | 투자 금액 (백만 원) | 비율 (%) | 업체명 | 투자 금액 (백만 달러) | 비율 (%) | |
1 | LG 생명공학 | 52,103 | 24.90 | Eli Lilly | 2,350.2 | 18.7 |
2 | 한미약품 | 26,405 | 8.33 | AstrZeneca | 3,451.0 | 18.3 |
3 | 유유 | 3,737 | 6.52 | Aventis | 3,311.2 | 16.4 |
4 | 보령제약 | 4,217 | 6.46 | Sanofi-synthelabo | 1,490.3 | 16.4 |
5 | 대웅제약 | 19,870 | 6.46 | Pfizer | 7,131.0 | 15.8 |
6 | 근화제약 | 3,135 | 5.66 | Novartis | 3,756.0 | 15.1 |
7 | 유한양행 | 19,246 | 5.65 | F Hoffman-Ra | 3,478.0 | 15.0 |
8 | 부광약품 | 5,798 | 5.12 | Merck | 3,178.1 | 14.1 |
9 | 일동제약 | 9,822 | 4.98 | Wyeth | 2,093.5 | 13.2 |
10 | 대원제약 | 1,913 | 4.77 | GlaxoSmithKline | 4,531.6 | 13.0 |
평균 | 7.2% | 15.6% | ||||
출처: 보건산업진흥원 국감자료, 2005 | ||||||
생명공학 산업의 발전과 가장 밀접하게 관계된 사회적 이슈는 인간 유전체프로젝트(Human Genome Project)의 완성이며, 이에 따른 혜택을 가장 빨리, 가장 직접적으로 받는 분야는 바로 의약산업이다. 현재 2005년의 의약 시장은 연간 5천억 달러 이상이며, 이것이 앞으로 전개될 포스트 유전체 시대(유전자 서열이 밝혀진 이후의 시대)에는 얼마나 증가할지 예측하기도 어려운 상황이다. 따라서, 병을 치료하거나 삶의 질을 향상시킬 수 있는 신약의 연구가 21세기에 인간 유전체 프로젝트의 결과를 이용하여 가장 큰 경제가치를 창출할 수 있는 분야라고 얘기할 수 있다.
인간 유전체 프로젝트가 완성되고 생물정보학, 유전체학, 단백질체학, 화학유전체학 등의 혁신적인 신기술들의 발전과 함께 신약 연구는 그 체계와 방법론에 있어서 혁명적인 혁신을 추구하고 있다. 우선, 새로운 신약 발굴 연구의 대부분은 표적단백질의 발굴에서 시작된다. 현재 500여 개에 불과한 신약 발굴 질환표적은 향후 3,000~4,000개로 급속히 증가할 것으로 예측되고 있다. 그러나, 이 단백질에 대한 정보는 직접적으로 이 단백질의 기능을 조절하는 물질에 대한 정보로 연결될 수는 없다. 즉, 이러한 연구의 추세로 인하여, 신약 발굴에 사용될 질환 표적 단백질은 많이 발굴되고 있으나, 이러한 표적 단백질에 작용하는 신약의 수는 신약 표적의 수를 따라가지 못하는 상황이 되었다. 세계 의약업계가 직면하고 있는 이런 상황을 “Targets rich but leads poor environment”(Science, 2003)라고 한다. 한마디로 표적은 충분히 있으나 의약을 연구하기 위한 고유 선도물질의 발굴은 상대적으로 크게 미흡하다는 것을 의미한다. 생명공학시대에 화학의 영역인 선도물질의 발굴이 강조되고 있는 것이 의아하기도 하지만, 유전자 정보만을 가지고는 충분한 수익을 올릴 수 없고 오직 의약의 발굴을 통해서만 그 부가가치를 보상받을 수 있기 때문이다. 2002년 미국 나스닥에서 생물 정보학 및 유전체학 회사들의 주가가 폭락한 것은 이와 같은 상황을 반영한다고 볼 수 있다. 또한, 이는 생명공학의 궁극적 목표는 난치병 등을 치료할 신약 개발에 있으며, 따라서 생명공학 기술이 발전할수록 입으로 먹을 수 있는 인간 편의성을 갖춘 합성 의약의 역할이 더욱더 중요해질 것이라는 것을 의미한다고 볼 수 있다.
인간 유전체의 서열이 밝혀졌으나, 이제 어떠한 연구가 필요할 것인가? 미국과 일본 정부는 다음 목표로써 중요 단백질들의 구조를 밝히는 구조 유전체학(Structural Genomics)에 막대한 자금을 투자하고 있다. 미국에서는 2000년부터 연방정부(NIGMS)가 대학중심의 9개 연구 센터에 1억 5천만 달러를 투자하고 있으며, 일본은 2001년 6개 센터에 미국보다 훨씬 더 큰 규모로 정부와 민간의 콘소시움을 구성하여, 막 단백질을 포함한 인간 및 마우스 단백질의 구조연구에 집중 투자하는 등, 이 분야의 신기술 확립과 함께, 구조유전체학 분야에서의 정보 선점을 추구하고 있다. 단백질 구조정보는 지적 재산권의 확보도 가능하기 때문에, 이 분야에서 경쟁력을 지닌 기술의 확립은 매우 중요하다. 다국적 제약사의 경우, 일반적으로 신약 개발을 위해 평균 12년간 8억 파운드(1조 5,000억 원)를 투자한다. 후보 물질이 신약으로 개발될 확률은 10% 미만이다. 그러나 유전자 정보 및 질환 단백질의 구조를 이용하면 현재 평균 5년 정도인 신약 후보 발굴 연구가 1~3년 정도로, 무려 2~4년이나 줄일 수가 있게 되며, 이 기술을 활용하게 되면 약이 작용할 표적 단백질의 구조를 원자 수준에서 눈으로 보고, 정보 기술(IT)을 활용하여 신약을 디자인 할 수 있어, 실패 비용 및 부작용도 크게 줄어들 것으로 전망하고 있다. 이러한 배경에서, 구조 유전체학을 활용한 신약 발굴은 21세기 의약 산업의 속도 및 경쟁력에 크게 영향을 미칠 기술이며, 그 경제적 가치는 수천억 달러에 달할 것이다.
라. 생명공학 산업의 시장 변화
이러한 생명공학 산업의 변화는 2005년 Ernst & Young 보고서(미국)에 따르면 다음과 같은 특징을 가지고 있다. 첫째, 지역의 경계가 없이 전 세계 국가들의 강점을 활용한 생명공학 산업의 성장이다. 중국과 인도가 다국적 제약사들의 임상 시험 무대로 적극 활용되기 시작하는 것이 그 예이다. 또한 국가간 전략적 제휴 및 인수 합병의 경우, 2003년 대비 14% 증가한 480건에 이르고 있다. 둘째, 혁신적인 생명공학의 기술 개발 및 적용을 통한 산업의 변화이다. 구조 기반 신약 발굴 기술(Structure-Based Drug Discovery)과 고속 약물 탐색 기술(High Throughput Screening)은 개발 기간의 단축 및 부작용이 적고, 약효가 뛰어난 신약 발굴의 효율성을 크게 증가시켰으며, 결국 의약품 시장 전체에 혁신을 일으키고 있다. 또한, 생명공학의 혁신적인 신기술들은 유전적으로 변형된 효소개발을 활용한 기존의 기반 산업인 전통적인 화학공업의 제조 공정상의 혁신을 불러일으키고 있듯이, 타 여러 기존산업들의 발전에도 영향을 미치고 있다. 셋째, 신기술을 적용한 제품의 출시로 제품의 한계를 극복하는 경우이다. 맞춤형 의약품의 개발은 의료 산업에 매우 큰 영향을 미치고 있다. 그 예로 특정한 표적 단백질을 목표로 한 백혈병 치료제 글리벡의 경우, 맞춤형 치료제의 대표적인 약물로 현재 백혈병 치료제 시장(2004년 16억불 매출)에서 확고한 위치를 확보하고 있다. 이와 더불어 인간화 항체기술을 활용한 표적치료제 개발로 부작용이 적은 새로운 항암치료제들의 맞춤의약개발이 활발하게 전개되고 있다.
![]() 생명공학 산업의 미래 전망
생명공학 산업의 미래 전망
가. 선진국은 성장기, 한국은 도약기 단계
2005년 올해 지난 5년간 판매된 신약들 중에 5억 불 이상의 매출을 올릴 것으로 예상되는 제품은 20개가 넘을 것으로 예상된다. 특히 작년 매출이 100억 불 이상인 화이자의 콜레스테롤 강하제 ‘리피토’의 예에서 알 수 있듯이 신약 하나의 경제적 가치는 상상하기 힘들 정도의 큰 규모이다. 이와 더불어, 10억 불 이상 매출 신약 한 제품으로부터의 수익은 소나타 자동차 300만 대의 수출로 번 수익을 능가하고 있다. 2004년 기준으로 전임상 이상의 단계에 위치한 신약은 5565개이며, 이 중 임상 3상 중인 상위 15대 약효군은 769개로 나타났다. 이 중 일부 약물들의 경우, 매출액이 10억 달러를 넘어설 것으로 예상되는데, 이는 신약 개발 성공률이 낮아지는 상황에서도 그 시장 규모는 계속적인 성장세를 유지할 것임을 의미한다.
생명공학 시장 중에서 90% 이상을 차지하는 의약 시장에서는 항암제, 항생제 등 기존의 치료약 시장도 중요하지만, 노화, 스트레스, 비만, 기억력 증진, 알츠하이머 등 삶의 질 향상을 위한 신약 시장도 의약 비즈니스 측면에서 매우 중요한 위치를 점유할 것으로 예측하고 있다. 출시를 앞둔 신약 중 비만 치료제인 사노피-아벤티스사의 ‘아콤폴리아’, 화이자와 뉴로크린 바이오사이언스의 수면제 ‘인디플린’ 등이 예로써, 매출이 최고조에 이르렀을 때 연간 60억 달러 이상을 기록할 것으로 예상하고 있다. 이것은 유전체연구, 단백질 구조 및 기능 연구 등 첨단 생명공학 기술의 발전에 의한 것이며, 이러한 첨단 생명공학 기술의 필요성과 인간욕구의 다양성 및 노령화 사회를 고려하면, 삶의 질 개선제 발굴은 인간의 궁극적인 목표인 건강하고 행복한 삶을 추구하려고 하는 꿈의 실현이기도 하다. 이러한 의약품을 삶의 질(QOL, quality of life) 개선제 또는 해피드럭(happy drug)이라고 부른다. 이들 해피드럭은 전 세계적으로 엄청난 잠재 시장을 가지고 있어, 향후 제약 기업의 투자 욕구를 충족시키기에 충분하다. 전 세계 삶의 질 개선제 시장은 지난해 항우울제 126억 달러 등 약 500억 달러로 추정되며 전체 의약품 시장의 약 10%를 차지하는 것으로 추산하고 있다. 또한, 시장 성장률도 전체 의약품 시장 성장률 7%보다 높은 연 평균 12% 이상 성장해 2005년 627억 달러, 2010년 985억 달러로 확대될 것으로 전망하고 있다. 국내에서도 2001년 2월 시판된 비만치료제 ‘제니칼’은 시판 100일 만에 100억 원 가량이 판매되었고, 99년 10월 판매되기 시작한 비아그라는 연간 180억 원, 또 대머리치료제 ‘프로페시아’도 연간 70억 원 규모의 판매를 형성할 정도로 짧은 시간에 큰 시장을 형성하고 있다. 과거에는 치료가 불가능하다고 생각되었고, 생명에 지장이 없으므로 치료제를 찾을 생각조차 안했던 것이 사실이지만, 이제 시대가 바뀌고 있는 것이다. 첨단 디지털 생명공학 시대인 21세기의 생활 패턴은 과거 식량 및 생존의 문제 보다는 자신의 삶의 구현을, 단순한 장수보다는 젊음을 유지한 건강한 삶을 추구하고 있다. 또한 비만, 스트레스 등은 알츠하이머, 당뇨병이나 암 등 각종 질병과 깊은 관련이 있어, 이러한 증상을 치료하지 않으면 심각한 생명의 위협이 생기게 될 가능성이 높아지고 있다. 결국 21세기에는 이러한 증상도 심각한 질환의 한 종류로 취급하여 이를 의식한 선진 제약사들도 개인의 삶의 질을 높여주고 생활을 풍요롭게 하는 신약 발굴에 적극 나서고 있다.
국내 기업들은 생명공학 산업, 특히 신약 개발 성공 체험이 미약하고, 확신이 없어 투자에 소극적이지만, 정부의 강한 육성 의지 및 성장동력산업으로의 선정 및 우수한 생명공학자들의 급증하고 있는 우수 논문 발표로 생명공학에 대한 기대가 고조되고 있으나, 아직 산업은 도약기 단계이다. 그 이유는 인간의 삶과 직결된 제품들이므로 연구를 통한 개발후보 발굴에 수년간이, 이어서 동물을 이용한 전임상 및 인간을 이용한 임상 1, 2, 3상 연구라는 안정성 및 유효성 평가과정이 평균 10여 년이 소요되므로, 다른 산업과 기간으로 직접 비교하는 것은 무의미하고, 우수한 인력에 우수한 기초 및 응용 기술을 갖추고 장기적인 투자 여부에 운명이 달려 있는 산업이기 때문이다. 그러나, 2003년 LG 생명공학의 신약 팩티브(Factive)가 국내 최초로 미국 FDA 허가를 받음으로써, 한국이 신약 개발 능력이 있음을 전 세계에 과시하였다.
국가의 성장동력 산업으로써 생명공학 산업은 세계적인 신약 발굴을 통한 선진국 시장 진출이 최선의 전략이다. 부가가치가 가장 높은 산업인 신약 산업은 현재 기존 제약사 및 대기업들보다는 생명공학 벤처사들이 과감하게 도전하고 있다. 곧, 한국의 생명공학 산업 발전은 생명공학 벤처의 육성을 통한 세계적 신약 발굴이며, 이에 부응하여 정부에서도 기술력을 갖춘 생명공학 벤처들이 현재 수익성이 적자이더라도 미국 나스닥 시장과 같이, 코스닥 문호를 개방함으로써, 제한된 정부의 연구 예산의 투자에서, 거대한 민간 자금의 수혈을 통한 세계적인 생명공학 벤처사의 성장이 가능하도록 문호를 개방하고 있다. 따라서, 지금부터 10여 년 후에는 생명공학 산업이 한국의 미래 성장 동력으로써 경쟁력 있는 산업으로 가시화될 것이다.
나. 경쟁력 재고를 위한 기업간(바이오텍-제약 또는 바이오텍-바이오텍) 제휴 및 인수 합병 강화
거대 제약사들의 신약 개발 생산성 저하 및 생명공학 벤처사들의 효율성 향상으로 바이오텍-제약기업 또는 바이오텍-바이오텍사와의 인수 합병(M&A) 및 전략적 제휴 체결은 시간이 갈수록 더욱 증가되고 있다.
<표 1-2-2-1>은 연도별 제약 및 바이오텍 기업간의 전략적 제휴 체결 현황을 나타내며 <표 1-2-2-2>는 최근 체결된 주요한 기업간 전략전 제휴를 나타낸다.
<표 1-2-2-1> 연도별 제약 및 바이오텍 기업간의 전략적 제휴 체결 현황
연도 | 체결 건수 |
1995-1996 | 577 |
1997-1998 | 645 |
1999-2000 | 631 |
2001-2002 | 641 |
2003-2004 | 813 |
출처: Recombinant Capital (2003~2004 경우 9개월간의 자료임) | |
<표 1-2-2-2> 최근 체결된 주요한 기업간 전략전 제휴 (단위: 백만 불)
기술이전자 | 기술도입자 | 이전기술 | 개발단계 | 기술이전료 | Upfront (지분투자) |
Tularik | Amgen | 항암제 | 발굴단계 | 75 | |
Array | AstraZeneca | 항암제 | 전임상 | 95 | 10 |
(주)태평양 | Schwarz | 진통제 | 전임상 | 107.5* | 3.25* |
Antisoma | Roche | 항암제 | 임상 | 500 | 6.56 |
Medivir | GlaxoSmithKline | 감염증 | 임상 1상 | 99.5 | 6.9 |
Zealand Pharma | Aventis | 당뇨병 치료제 | 임상 1상 | 110 | 10 |
Biovitrum | Amgen | 비만 | 임상 2상 | 521 | 86.5 |
Medivir | Boehringer Ingelheim | 후천성 면역결핍증치료제 | 임상 2상 | n/a | 122* |
Bristol Myers Squibb | Merck | 고지혈증 치료제 | 임상 2상 | 375 | 100** |
ImClone | Bristol Myers Squibb | 항암제 | 임상 3상 | 2,000 | 1,000 |
Eyetech | Pfizer | 안과질환 | 임상 3상 | 1,340 | 75 |
Neurocrine | Pfizer | 불면증 치료제 | 임상 3상 | 400 | 100 |
*유로(euro)화, **2년간 연구지원금 14백만 불 포함.
출처: 각 사들의 보도자료
다. 아시아 기업들의 대두
전 세계 생명공학 산업은 미국이 주도하고 있으며, 아시아에서는 한국을 비롯해 인도와 중국, 일본, 싱가포르 등이 생명공학 산업 발전에 국가적 역량을 모으고 있다. Ernst & Young 2005년 보고서는 한국, 싱가포르, 스웨덴 등이 국가 전략 산업으로 선정하여 장기적인 안목에서 집중투자하고 있는 연구 환경이 조성된 국가들이 미국을 앞서나갈 것이라고 예상했다.
또한, 신약의 경우 한국(2003년)과 중국(2004년)이 신약 개발 국가 대열에 합류 하였다. 한국의 경우, 상대적으로 비용이 적게 들고 지적 재산권을 확보할 수 있는 신약 후보 발굴 단계에 있어서는 다국적 제약사와 경쟁할 수 있는 우수한 연구인력과 기술을 확보하고 있다. 그 바탕은 우수한 생명공학 인력, 특히 의약화학 및 구조생물학 분야의 우수한 인력과 과학기술부가 G7 등 막대한 투자로 방사광 가속기, 고자장 핵자기 공명기기, 슈퍼컴퓨터 등의 첨단 인프라 시설, 그리고 FDA 승인을 받은 10번째 신약개발 국가란 저력들이 있기 때문이다. 이러한 강점을 충분히 살려 신약 연구개발에 집중 투자를 할 경우, 21세기 한국은 반도체 및 정보기술(IT) 산업에서 뿐만 아니라 생명공학 산업을 통한 국부창출과 더불어 선진국으로서 당당히 G7 국가대열에 진입할 수 있게 될 것이다.
■ 제 1장 생명공학의 비전 제 3절 생명공학 미래전망과 우리의 대응 |
![]() 미래사회 전망
미래사회 전망
미래사회에서 ‘생명공학’과 관련하여 예측되는 대표적인 주제어로는 ‘지속가능한 발전’, ‘인구성장과 자원’, ‘새로운 질병’ 등을 들 수 있다.
가. 지속가능한 발전
미래사회에는 첫번째로, 물 순환구조의 변화로 인해 동・식물종과 식생환경의 변화로 인한 산림황폐, 그리고 말라리아, 황열병 등으로 인한 기존 전염병 재창궐과 SARS, 조류 인플루엔자 등의 신종 전염병의 등장이 예상되며, 이것은 자연생태계에 큰 영향을 미칠 것으로 보인다.
두 번째로 곡물수확모형에 따르면 일부 온난한 지역에서 온도가 약간 상승했을 때 잠재적 생산량이 증가하나, 온도가 많이 증가하면 수확량이 감소하고, 대부분의 열대 및 아열대 지역에서 생산량은 온도증가에 대해 감소하는 것으로 나타난다. 따라서 미래에 기온이 점차 오르는 온난화는 전 지구적으로 식량의 가격을 올리고, 취약인구에 대한 기아의 위험을 증가시킬 것으로 예상된다.
세 번째로, 생태계의 생산성과 생물의 다양성은 기후변화와 해수면 상승에 의해 변화를 겪을 것으로 보이는데 일부 취약한 생물종의 멸종위험이 증가하여 2050년에 이르러서는 백만 가지 이상의 종이 멸종의 위협을 받을 것으로 예측된다.
나. 인구성장과 자원
만약 현재의 인구추세가 계속된다면, 2050년에는 연령평균이 현재의 26세에서 37세로 높아질 것으로 예측된다.
또한 미래에는 수명연장 기간이 현재의 65세에서 75세로 높아지고, 60세 이상의 고령인구가 20억 명 이상이 되어 15세 이하의 인구보다 많아질 것이다. 이로 인해 은퇴 및 의료보험 체계, 문화의 변화가 일어날 것으로 보인다. 이 시기에는 어떠한 산업국가라 할지라도 여성 1인당 2.1명 이상의 자녀를 출산하지 않을 것으로 전망된다.
비록 현재의 인구성장률이 완만해지고 있고 식량 효율성이 증가할 것으로 보이지만 순수 인구증가율을 고려하면 향후 50년 이내로 식량 수급에 있어 큰 어려움에 직면할 것으로 전망된다. 전 세계의 작물수확량은 4년 연속 수급치를 밑돌고 있다. 현재의 젊은 세대 혹은 다음 세대의 경제적 부담을 경감시키고 삶의 질을 향상시키기 위해서는 사람들로 하여금 더 오래 일하며, 인터넷 기반의 산업, 파트타임 직업에 대한 이해 및 참여와 직업순환을 장려해야 할 것이다. 또한, 유형자원의 비용 감소와 자동화의 진전은 투입을 반감시키고 산출을 증대시킬 수 있다. 전 세계적으로 동물성 단백질에 대한 수요는 중산층의 증가에 따라 증가할 것이며 이는 유전자 조작 식품과 양식, 육류생산을 위한 대규모 투자를 촉진할 것으로 예측된다.
다. 새로운 질병
코펜하겐 합의회의(The Copenhagen Consensus)는 2004년 HIV/AIDS와의 전쟁을 세계가 직면한 가장 중요한 이슈로 선정한 바 있다. AIDS가 사하라 이남 아프리카 지역의 가장 주된 사망원인인 것은 사실이지만, 현재는 동유럽과 중부 및 남아시아에서도 급격히 확산되고 있는 것이다.
한편 생화학 테러리즘이 핵전쟁의 위협에 이어 새롭게 등장했으며, 이는 유전학적 백신과 격리시스템 개발을 위한 연구개발을 촉발시켰다. SARS와 현재에도 진행 중인 조류 인플루엔자의 억제를 위해 이루어진 신속하고 유래 없는 국제협력은 이러한 위협에 대응하기 위한 전 지구적 시스템에 있어 핵심요소이다.
전 세계적으로 감염성 질병으로 인해 사망하는 사람은 전체 사망원인의 30%에 이른다. 지난 20년 동안 조류 인플루엔자나 Ebola, AIDS, SARS, 아프리카에서 발견된 종간 전염되는 바이러스 등과 같이 30개 이상의 질병들이 새롭게 정의된 바 있다.
![]() 미래변화 모습
미래변화 모습
가. 생명공학 분야
먼저, 기존 생명공학 기술의 확대와 세련화, 이로 인한 각종 의약품 개발을 들 수 있다. 둘째, 인간 게놈 프로젝트의 후속연구로 인해 신규 유전자의 기능이 밝혀지고 유전자간의 네트워킹이 어떻게 형성되는가를 이해하게 됨에 따라 의학과 제약업의 발달이다. 셋째, 개인의 유전체 정보를 빠르고 저렴하게 해독할 수 있는 시스템이 발달됨에 따라 관련기술과 연합되어 소위 ‘맞춤의학’의 시대가 열릴 것이다. 넷째, 그동안 미지의 세계로 간주되어 왔던 정신과 행동의 기본원리가 생물학적, 생화학적으로 밝혀짐에 따라 관련 질환은 물론 종교와 윤리 부문에 큰 영향을 미치고 기존 질서와 신사고간의 갈등이 불가피할 것이다. 다섯째, 생명공학과 정보통신 기술의 접목으로 인해 기존 의학과 제약업, 의료서비스 분야에서 혁명적 변화가 일어나거나 최소한 이에 대한 기반이 조성되어 사회, 문화, 보건복지 체계에 큰 변혁이 있을 것으로 예상된다.
하지만 이러한 생명공학 분야 기술의 발전은 다음과 같은 이슈를 야기할 것으로 보인다. 먼저 지금과 같은 기술발전 속도를 유지한다면 향후 개인 유전정보를 모두 파악하는 것은 시간과 경비 문제일 따름이다. 개인에 대한 유전정보는 물론 각종 병력, 건강관련 정보가 카드나 칩에 집적될 것이다. 여러 병원에서 독자적으로 가지고 있던 의료정보를 통합하여 운영하는 시스템이 개발되거나 이를 상품화하는 회사가 설립될 수 있다. 개인 유전정보의 결정과 이의 활용은 한 인간의 건강을 체계적으로 관리하고 질병에 대처하는 데 지극히 유용하게 사용되겠지만 반면 많은 개인 유전정보의 공유와 활용에 관해 사회적 논란과 갈등도 유발할 것이다.
지금까지는 사회적으로 획득하거나 교육되어 진다고 생각했던 행동들에 대하여 유전자의 역할과 비중이 밝혀짐에 따라 기존의 사회 질서와 윤리 개념이 흔들리며 특정집단간, 세대간 갈등이 심화될 가능성도 존재한다.
나. 노인인구 증가
우리나라는 그동안 경제성장과 의료기술의 발달로 인구의 평균 수명이 꾸준히 증가하여 2002년도에 77.0세(남자 73.4세, 여자 80.4세)에서, 2010년 79.1세, 2030년에 81.9세, 2050년에는 평균수명이 83.3세로 증가할 전망이다(통계청, 2005).
특히, 65세 이상 노인인구는 2000년에 7.2%로 고령화시대에 진입한 이후 2018년에 14.3%가 되어 고령사회, 그리고 2026년에는 20.8%로 초고령사회가 될 전망이다. 2030년에는 65세 이상 노인인구수가 전체인구의 24.1%를 차지할 것으로 예상된다.
근래 들어 경제사회 수준 향상과 의학의 발전에 따라 노인의 만성질환 발병률이 점차 감소하는 추세가 두드러지고 있다. 앞으로 2030년 의학기술의 발달로 상당수의 만성질환에 대한 혁신적인 치료법이 개발되어 노령층의 만성질환 유병률이 감소할 것으로 예상된다. 이와 함께 건강증진과 예방사업의 활성화, 경제수준 향상 등으로 노인의 건강수준 뿐 아니라 독립적인 생활을 영위할 수 있는 기능상태도 크게 향상될 것으로 예상된다.
특히, 보건의료와 요양서비스에 대한 필요도가 급증하는 80세 이상 후기노인(old-old)의 비율이 65~79세의 전기노인(young-old)보다 빠른 속도로 증가하고 있는 양상을 보이고 있다(2030년 80세 이상 인구수 2,711천명, 전체인구의 5.5%로 추정되고 있다).

<그림 1-3-2-1> 노령층 인구 및 생산가능 인구 비중
이러한 고령화시대의 보건의료 분야 변화의 주요 특징은 건강노인부터 질병 및 장애노인에 이르기까지 건강특성과 다양한 필요에 부합하는 의료가 행해져 맞춤의료(personalized healthcare)가 도래한다는 점이다. 이와 함께 환자 개인이 원할 때 언제, 어디서나 자신의 건강상태를 확인(ubiquitous care)하고 진료에 임하는 형태로 의료행위가 변할 것이다. 의료의 주체가 의사로부터 개인(노인)으로 바뀌며 노인 스스로 자기 건강을 책임지고 적극적으로 대처하는 ‘자기 돌봄식’ 의료가 전개될 것으로 전망된다.
![]() 미래 국가유망기술
미래 국가유망기술
과학기술혁신본부는 지난 8월 이러한 미래변화에 적극적으로 대응하고자 미래사회를 선도할 국가 유망기술을 21개 선정하여 발표한 바 있다. 여기서 미래 국가유망기술이란, 현재 산업화・실용화되지는 않았으나 향후 산업과 국민의 삶에 획기적 변화를 가져올 수 있는 신생(emerging) 기술 중 국가차원의 전략적 접근이 필요한 기술 분야를 말한다. 그러므로 현재시점의 시장성보다 향후 발전 가능성에 초점을 맞춘 기술이다. 특성은 <그림 1-3-3-1>과 같다.
이러한 미래 국가유망기술은 전문가들로 구성된 위원회에서 <그림 1-3-3-2>의 3대 기준 축(삶의 질, 시장성(경제성), 공공성)에 의거하여 최종 선정되었다.

<그림 1-3-3-2> 미래국가유망기술 선정을 위한 3대 기준 축
![]() 미래를 위한 우리의 대응
미래를 위한 우리의 대응
생명공학 분야가 우리나라에서 주요 이슈로 논의되기 시작한 지 20년, 본격적인 정부 지원이 이루어진 지는 10여 년의 역사를 가진다. 그동안 생명공학 분야는 급격한 패러다임의 변화로 말미암아 수많은 변화를 거듭하여 왔는데, 최근에는 연구결과의 실용화, 산업화 등과 관련된 많은 성과가 축적되면서 이제는 ‘생명공학 산업화’라는 주제가 낯설지 않는 상황에 이르고 있다.
정부는 이러한 인식을 토대로 미래사회 변화에 효과적으로 대응하기 위해서 단·중·장기적으로 다양한 관점에서 대응방안을 마련하고 있다. 단기적 관점에서는 지난 8월 도출한 미래 국가유망기술을 ‘차세대성장동력’으로 육성·발전시키기 위해 내년 8월까지 「미래 국가유망기술개발 종합계획」을 수립할 계획이다.
중장기적인 측면에서는 생명공학육성법에 의거한 「생명공학육성기본계획(1994~2006)」이 내년에 최종 종료함에 따라 새로운 틀 내에서 2차 계획을 수립할 예정이다. 이 계획의 주요 내용은 과학기술경쟁력, 산업화, 고용 확대 등 다양한 성과목표의 설정과 이에 따른 중점 추진전략 및 과제 제시 등이다.

■ 제 2장 세계 주요국의 생명공학 동향 제 1절 미국 |
2003년에 발간된 「2003 생명공학 백서」에서는 미국의 생명공학 동향을 미국 생명공학 혁신체제의 특성에 초점을 맞추어 포괄적으로 살펴보았다. 그 결과 2003년 백서에는 미국 정부의 생명공학 예산, 과학지식 기반, 자본시장, 규제 제도, 사회적 수용, 노동시장의 유연성, 활발한 산학 연계, 지적재산권 제도 등 미국 생명공학 혁신체제의 특성을 나타내는 주요 요소들이 서술되어 있다. 이번 백서에서는 그 사이 변화된 연방정부의 예산 현황을 최근 자료화하고, 최근 국내외에서 주요 이슈로 부상하고 있는 줄기세포 연구에 대한 미국의 정책 동향을 간략하게 정리하기로 한다.
![]() 미국 연방정부의 생명공학 연구개발 예산
미국 연방정부의 생명공학 연구개발 예산
미국 국립과학재단(National Science Foundation, NSF)이 매년 발표하는 연방정부의 연구개발 예산 자료에서 생명공학 분야의 예산 규모를 알아보는 방법은 두 가지가 있다. 하나는 전체 연구개발 예산의 기능별 분포에서 ‘보건’과 ‘농업’ 분야를 보는 것이고, 다른 하나는 ‘연구’ 예산의 학문 분야별 분포에서 ‘생명공학’ 분야를 보는 것이다. NSF는 연구개발 예산을 ‘연구(research)’, ‘개발(development)’, ‘연구개발 설비(R&D plant)’의 3가지 범주로 구분하여 예산액을 추계하고 있는데, 기능별 분포를 집계할 때는 이 3가지 범주가 모두 포함된 전체 연구개발 예산을 대상으로 하는 반면, 학문 분야별 분포를 집계할 때는 3가지 범주 중 오직 ‘연구’ 부문에 대해서만 집계를 하고 있다.
우선 기능별 분포를 살펴보자. NSF의 최신 자료에 따르면 미국 연방정부는 2005년의 전체 연구개발 예산으로 1,319억 달러를 책정하였다. 이것의 기능별 분포를 보면 보건 분야에 293억 달러(전체의 22.2%), 농업 분야에 18억 달러가 책정되어 있다<표 2-1-1-1>. 농업 분야의 예산은 규모도 작고 매년 조금씩 줄고 있는 반면 보건 분야는 매년 증가하고 있다. 미국 연방정부의 생명공학 연구 지원은 주로 국립보건원(National Institutes of Health)을 통해 이루어지기 때문에 여기에 나타난 보건 분야와 농업 분야 예산액이 미국 연방정부의 생명공학 예산을 대표한다고 보아도 무리가 없을 것이다.
‘연구’ 예산의 학문 분야별 분포에서 생명공학 분야가 차지하는 금액도 이와 비슷한 것을 확인할 수 있다. <표 2-1-1-2>를 보면 2004년도 미국 연방정부의 ‘연구’ 예산은 540억 달러로, 이는 같은 해 전체 연구개발 예산 1,265억 달러의 42.7%에 해당한다. 이 중 생명공학 분야는 293억 달러로, 이는 2004년도 전체
<표 2-1-1-1> 미국 연방정부의 기능별 연구개발 예산(2003-2005) (단위: 백만 달러) | |||
2005년 순위/기능 | 2003 actual | 2004 preliminary | 2005 proposed |
총액 | 118,065 | 126,452 | 131,906 |
1 National defence | 63,708 | 70,501 | 74,668 |
2 Health | 27,677 | 28,428 | 29,266 |
3 Space research and technology | 9,677 | 9,875 | 10,415 |
4 General Science and basic research | 6,999 | 7,263 | 7,398 |
5 Natural resources and environment | 2,198 | 2,248 | 2,170 |
6 Transportation | 1,888 | 1,925 | 1,903 |
7 Agriculture | 2,042 | 1,924 | 1,847 |
8 Energy | 1,412 | 1,457 | 1,457 |
9 Veterans benefits and services | 817 | 820 | 770 |
10 Administration of justice | 316 | 664 | 669 |
11 Education, training, employment and social services | 444 | 478 | 551 |
12 Commerce and housing credit | 534 | 513 | 463 |
13 International affairs | 269 | 269 | 255 |
14 Community and regional development | 48 | 48 | 48 |
15 Income security | 38 | 38 | 27 |
주: 연구(research)와 개발(development)과 연구개발 설비(R&D plant) 예산까지 모두 포함한 전체 연구개발 예산이며, 법에 의해 정부의 지출의무(obligation)를 부담할 수 있도록 승인된 수권예산(budget authority) 기준임. 출처: NSF (2004.12), p.8(Table 1). | |||
<표 2-1-1-2> 미국 연방정부의 분야별 Research 예산(2002-2004) (단위: 백만 달러) | |||
분 야 | 2002 | 2003 (preliminary) | 2004 (preliminary) |
계 | 48,007 | 52,569 | 54,072 |
Life sciences | 25,477 | 28,442 | 29,340 |
Biological (excluding environmental) | 14,499 | NA | NA |
Environmental biology | 779 | NA | NA |
Agricultural | 1,048 | NA | NA |
Medical | 6,427 | NA | NA |
그 외 생명공학 | 2,724 | NA | NA |
Psychology | 906 | 1,009 | 1,050 |
Physical sciences | 4,983 | 5,105 | 5,417 |
Environmental sciences | 3,418 | 3,690 | 3,762 |
Mathematics & computer sciences | 2,631 | 2,738 | 2,829 |
Engineering | 8,275 | 9,074 | 9,127 |
Social sciences | 1,039 | 1,176 | 1,203 |
그 외 과학 | 1,278 | 1,334 | 1,344 |
주: 연방정부의 지출의무액(obligations) 기준임. 2002년은 확정액, 2003년과 2004년은 잠정액. NA=Not Available., 출처: NSF (2005.2), p.69(Table C-19). | |||
연구개발 예산 중 보건과 농업 분야를 합한 예산액 304억 달러와 비슷한 수치이다. 그런데 2004년도의 생명공학 예산 293억 달러는 ‘연구’ 부문에만 투입된 금액이므로, ‘개발’이나 ‘연구개발 설비’ 부문을 합하면 이 보다 더 많은 금액이 생명공학의 연구개발에 투입된 것으로 예상할 수 있다. 그러나 3가지 범주에 대한 각 부처별 예산 현황을 조사한 다른 표를 보면 ‘개발’ 부문은 대부분 국방부를 통해 지원되고, 국립보건원(NIH)이 소속된 보건복지부나 농림부에서는 ‘개발’ 부문에 대한 지원이 미미한 것을 확인할 수 있다(NSF, 2005.2: p.28의 Table C-5 참조). 따라서 미국 연방정부의 생명공학 연구개발 예산은 대부분 ‘연구’ 부문에 국한되어 있고, 주로 보건 분야에 집중되어 있다고 결론 내릴 수 있다.
생명공학 연구 예산의 부처별 분포를 보면 국립보건원(NIH)에 예산이 집중되어 있음을 볼 수 있어서 미국의 생명공학 연구가 보건 분야 중심으로 진행되는 것을 다시 확인할 수 있다. <표 2-1-1-3>을 보면 2002년도 생명공학 연구 예산 255억 달러 중 77%인 197억 달러가 국립보건원(NIH)의 예산이다. 이는 같은 해 전체 연구 예산 480억 달러의 41%에 해당하는 액수이다. <표 2-1-1-3>을 보면 국립보건원(NIH)의 연구비 중 128억 달러가 ‘생물학(biology)’ 분야에 지원된 것으로 나오는데, 여기서 ‘생물학’으로 분류된 분야는 보건의료와 관련된 기초 생명공학 분야로 파악된다.
<표 2-1-1-3> 미국 연방정부의 부처별 생명공학 Research 예산(2002) (단위: 백만 달러) | ||||||
부처/기관 | 계 | 생물학 | 환경생물학 | 농업 | 의료 | 기타 |
계 | 25,477 | 14,499 | 779 | 1,048 | 6,427 | 2,724 |
농림부 | 1,496 | 200 | 308 | 959 | 29 | 0 |
상무부 | 206 | 36 | 149 | 13 | 5 | 2 |
국방부 | 1,126 | 350 | 21 | 2 | 656 | 97 |
교육부 | 17 | 0 | 0 | 0 | 0 | 17 |
에너지부 | 373 | 249 | 7 | 0 | 115 | 2 |
보건복지부 | 20,658 | 12,979 | 0 | 0 | 5,222 | 2,457 |
NIH | 19,725 | 12,833 | 0 | 0 | 4,554 | 2,338 |
FDA | 136 | 136 | 0 | 0 | 0 | 0 |
질병예방센터 | 521 | 0 | 0 | 0 | 521 | 0 |
그외 | 276 | 10 | 0 | 0 | 147 | 119 |
내무부 | 169 | 90 | 79 | 0 | 0 | 0 |
법무부 | 0 | 0 | 0 | 0 | 0 | 0 |
노동부 | 0 | 0 | 0 | 0 | 0 | 0 |
교통부 | 12 | 0 | 0 | 0 | 6 | 5 |
재무부 | 0 | 0 | 0 | 0 | 0 | 0 |
보훈부 | 248 | 0 | 0 | 0 | 248 | 0 |
국제개발협력처 | 165 | 0 | 0 | 71 | 0 | 94 |
환경보호처 | 132 | 48 | 60 | 0 | 0 | 23 |
항공우주국 | 322 | 135 | 12 | 2 | 146 | 27 |
과학재단 | 513 | 391 | 122 | 0 | 0 | 0 |
스미스소니안(연) | 41 | 20 | 21 | 0 | 0 | 0 |
주: 백만단위에서 반올림해서 합계가 다를 수 있고, 소액이 0으로 표시된 경우도 있음. 출처: NSF (2005.2), p.79-80(Table C-23). | ||||||
이상의 내용을 지난 2003년 백서의 내용과 비교하면 미국 연방정부의 생명공학 예산이 매년 크게 증가하고 있음을 확인할 수 있다. 2000년 180억 달러와 2001년 211억 달러이던 것이(이상 2003년 백서 자료), 2002년 255억 달러, 2003년 284억 달러, 2004년 293억 달러로 증가하였다. 5년 만에 63%나 증가한 것이다. 이러한 증가세는 대략 두 가지 이유로 해석할 수 있다. 첫째는 생명공학이 국민의 보건과 직결되는 분야이기 때문에 국가가 주도적으로 투자해야 하는 당위성이 있고, 둘째는 정보기술(IT), 자동차, 기계와 같은 성숙 분야와 달리 생명공학기술(BT)이나 나노기술(NT)과 같은 신생(emerging) 분야는 민간 부문이 성숙할 때까지 정부가 지원해야 하기 때문이다. 이 두 가지 이유는 우리나라에도 동일하게 적용되며, 특히 생명공학과 관련된 민간부문(예: 제약회사)이 미국에 비해 현저하게 미발달한 우리나라는 당분간 국가 주도의 연구개발을 더 강화해야만 하는 입장이다.
![]() 줄기세포 연구에 대한 미국의 정책 동향
줄기세포 연구에 대한 미국의 정책 동향
미국 남부의 기독교 근본주의를 정치적 배경으로 하는 부시의 공화당 정권이 재선을 통해 5년째 집권하면서, 미국 연방정부는 배아줄기세포 연구에 대해 매우 소극적인 태도를 계속 유지하고 있다. 이는 배아줄기세포를 획득하는 과정에서 필연적으로 발생하는 배아 파괴가 윤리적으로 심각한 문제가 있다고 보기 때문이다. 이에 비해 성인의 몸에서 추출하는 성체줄기세포 연구에 대해서는 적극적으로 지원하고 있다.
배아복제 및 배아줄기세포 연구에 대한 미국 연방정부의 현재까지의 입장은 배아복제와 배아줄기세포 연구 자체를 법적으로 금지하지는 않지만, 연방정부의 연구비는 매우 제한적으로만 지원한다는 입장이다. 미국의 생명공학 연구에서 연방정부의 지원이 차지하는 비중이 매우 크기 때문에 이러한 정부의 입장은 배아줄기세포 연구에 큰 타격이 될 수 있다. 법적으로는 부시가 처음 집권한 2001년 8월에 배아복제를 금지하는 법안이 하원을 통과하였으나 상원에서 부결되어 현재까지도 배아복제 자체에 대한 연방정부 차원의 법적 제약은 없는 상태이다. 즉, 미국에서도 체세포 핵이식 방식에 의한 배아복제는 현재도 가능하다. 그러나 부시는 2001년 8월 9일의 담화문을 통해 당시 시점까지 이미 확립되어 있던 78개의 배아줄기세포주에 대한 연구 외에는 연방정부의 연구비 지원을 하지 않겠다는 방침을 발표하였다. 이 78개의 세포주들은 1998년에 위스콘신 대학의 James A. Thomson이 폐기될 냉동 수정란으로부터 최초로 배아줄기세포를 얻어낸 것을 시작으로 그동안 미국 및 해외에서 확립되어 국립보건원(NIH)에 등록된 배아줄기세포주들인데, 이들은 모두 복제배아가 아닌 냉동 수정란에서 얻어진 세포주들이다. 부시 행정부의 입장은 배아줄기세포가 인류의 질병 치료에 획기적인 기여를 한다는 것이 분명해질 때까지는 윤리적인 난점을 안고 있는 배아줄기세포 연구를 세금으로 지원할 수는 없다는 것이고, 배아줄기세포의 의학적 가능성을 분명하게 밝히는 데는 당시까지 이미 확립된 78개의 세포주만으로도 연구가 가능하므로, 연방정부는 그 78개의 세포주에 대해서만 연구비를 지원하겠다는 입장이었다(Bush, 2001. 8. 9).
그러나 시간이 지나면서 78개의 세포주들 중 상당수가 연구에 적합하지 않은 상태로 변질되었고(줄기세포는 공기 중에 오래 방치되면 산소에 의해 유전자 변이가 일어난다), 현재는 22~23개의 세포주들 만이 연구에 사용될 수 있는 온전한 상태라는 것이 국립보건원(NIH)의 보고이다. 여기에 더하여 환자 단체들은 2001년 이후 매년 1억 달러 규모의 연방정부 연구비가 배아줄기세포 연구를 위해 책정되었지만 실제로는 2천만 달러 내외의 지원만 이루어지고 있다고 불만을 토로하고 있다(JDRF, 2005). 이렇게 연방정부가 소극적 태도로 일관하는 동안 미국의 배아줄기세포 연구는 주로 주정부나 민간의 주도에 의해 이루어져 왔다.
최근 들어 이러한 연방정부의 기조에 저항하는 움직임이 의회를 통해 일어나고 있다. Castle과 DeGette 등 민주당 의원들은 2005년 2월 15일 「공중보건법(Public Health Service Act)」에 대한 개정안을 하원에 제출하였는데, 「2005년 줄기세포 연구 증진 법안(Stem Cell Research Enhancement Act of 2005)」이라고 이름 붙여진 이 개정안은 몇 가지 조건을 만족시키는 배아줄기세포주에 대해서는 그 세포주의 확립일자에 관계없이(“regardless of the date on which the stem cells were derived from a human embryo”) 연방정부가 연구를 추진하고 지원하는 것을 골자로 하고 있다. 그 몇 가지 조건이란, ① 배아줄기세포가 불임치료를 위해 생성되었다가 남은 잔여 배아로부터 얻어진 것이어야 하고, ② 배아 공여자에게 잔여 배아가 자궁에 착상되지 않을 것이고 폐기될 것이 분명하다는 확답을 얻어야 하며, ③ 배아 공여자는 고지된 동의서(informed consent)를 서면으로 작성해야 하고 재정적 대가 등 공여를 유도할 수 있는 어떤 것도 제공받아서는 안 된다는 조건이다(US Congress, 2005). 즉, 이 법안에서도 복제배아로부터 얻어진 줄기세포 연구는 지원 대상에서 제외되어 있고, 오직 냉동 수정란에서 얻어진 줄기세포만을 지원 대상으로 국한하고 있다.
2005년 2월에 제출되어 하원에 계류 중이던 이 법안은 2005년 5월 24일에 하원을 통과하였으며(찬성 238, 반대 194), 언론은 이 법안이 시행될 경우 연방정부의 연구비 지원을 받을 수 있는 배아줄기세포주가 78개에서 8,000여 개로 늘어날 것으로 추정하고 있다(한겨레신문 인터넷판 2005. 5. 25). 즉, 연방정부가 연구비를 지원하지 않는 동안에도 미국에서 배아줄기세포주는 계속 생성되고, 연구되고 있었던 것이다. 한편, 부시 대통령은 이 법안이 하원을 통과한 직후, 동 법안이 상원을 통과하더라도 거부권을 행사하겠다는 입장을 분명히 하였다. 대통령의 거부권 행사를 막으려면 상원 표결에서 재적 의원 2/3의 동의를 얻어야 할 뿐 아니라 논의의 한 발단이 되었던 황우석 교수의 성과에 대하여 진실성 파기가 일어남으로써, 현재 상원에 계류 중인 이 법안이 발효될 수 있을지는 매우 미지수이다.
미국 연방정부가 배아복제와 배아줄기세포연구에 대해 소극적인 입장을 유지하는 동안 각 주 정부들은 나름대로의 프로그램을 가지고 줄기세포 연구를 지원하고 있는데, 각 주의 집권당의 정치적 성향에 따라 상이한 접근들을 보이고 있다. 우선, North Dakota 등 5개 주는 연구 목적의 배아복제를 법으로 금지하고 있다. 이와 반대로 California와 New Jersey의 2개 주는 배아복제를 허용할 뿐 아니라 배아줄기세포를 포함한 치료 목적의 줄기세포 연구를 적극 지원하고 있다. 기타 44개 주들은 아직까지 연구 목적의 배아복제에 대한 규제가 불분명하거나 없는 상태이다<표2-1-2-1>.
<표 2-1-2-1> 배아복제 연구에 대한 미국의 주별 입법 현황(2005. 4. 현재) | |
구 분 | 주 |
연구 목적의 배아복제를 금지하는 주 | North Dakota, South Dakota, Iowa, Arkansas, Michigan(5개 주) |
배아복제를 포함한 치료 목적의 줄기세포 연구를 지원하는 주 | California, New Jersey(2개 주) |
연구용 배아복제에 대한 규제가 불분명하거나 없는 주 | 기타 44개 주 |
출처: Aldhous (2005), p. 695. | |
<표 2-1-2-2>에는 미국의 주요 주들의 줄기세포 관련 정책 동향이 정리되어 있다. 표에서 보듯이 각 주마다 주지사의 소속 정당과 주의회의 다수 정당이 어디냐에 따라 각기 상이한 정책적 움직임들이 나타나고 있다. 배아줄기세포 연구에 대해 가장 적극적인 곳은 New Jersey와 California 주이다. New Jersey 주는 주정부 단위로는 최초로 줄기세포 관련 연구기관인 Stem Cell Institute of New Jersey을 설립하였고, 여기에 7년간 3억8천만 달러를 투입하는 정책을 추진하고 있다. California 주는 ‘주민발안 71 (Proposition 71)’에 따라 향후 10년간 30억 달러를 줄기세포 연구에 지원할 것이 결정된 상태이다. ‘주민발안 71’은 주민발의 형식으로 제안되어 2004년 11월 2일 대통령 선거일에 대통령 투표용지에 함께 오른 법안으로, 주정부가 30억 달러의 채권을 발행해서 배아줄기세포 연구를 지원하도록 하는 것을 골자로 하고 있으며, 당시 투표에서 통과됨에 따라 현재 새로이 설립된 California Institute for Regenerative Medicine을 통해 후속 조치가 진행되고 있다. Illinois 주에서도 10억 달러 규모의 Illinois Regenerative Medicine Institute의 설립을 추진하고 있다. 이 밖에 Washington 주와 Massachusetts 주에서 배아복제를 허용하고 줄기세포 연구를 명시적으로 지원하기 위한 입법화 노력이 이루어지고 있고, 다른 여러 주에서는 줄기세포 관련 연구비나 연구기금을 조성하기 위한 다각도의 노력들이 이루어지고 있다. 이와 반대로 New York 주와 Florida 주는 주의회나 주지사의 반대에 부딪혀 줄기세포 연구에 대한 지원이 잘 이루어지지 못하고 있다.
<표 2-1-2-2> 미국 주요 주의 줄기세포 관련 정책 동향(2005. 4. 현재)
주 | 주요 동향 |
California | ‘법안 71’에 따라 향후 10년간 30억 달러를 줄기세포 연구에 지원할 계획이며, California Institute for Regenerative Medicine을 설립하여 이 연구비를 집행하도록 함. |
Washington | 출산 목적의 복제는 금지하지만 연구 목적의 배아복제는 지원하는 법안이 주하원을 통과하여 상원에 계류 중. 민주당 소속의 주지사 Christine Gregoire는 선거 운동 동안 배아줄기세포 연구를 지지한 바 있음. |
Wisconsin | 1998년에 Wisconsin 대학의 James Thomson이 최초로 냉동배아로부터 배아줄기세포를 추출한 곳. 2004년 11월, 주지사 Jim Doyle은 줄기세포 연구를 포함하는 전체 생명공학 연구에 7억 5천만 달러의 예산 지원을 제안함. 여기에는 Thomson이 소속된 Wisconsin 대학의 Wisconsin Institute for Discovery에 3억 7,500만 달러를 지원하는 것이 포함됨. |
Illinois | 주정부는 연내에 10억 달러 규모의 Illinois Regenerative Medicine Institute를 설립하는 사업을 추진 중. 이 연구소는 선택적(보험 비대상) 미용성형 수술에서 얻어진 세금으로 운영되며 줄기세포 연구를 담당할 것임. 관련 법안이 3월 17일에 주하원을 통과했음. |
New York | 지난 몇 년간 배아줄기세포 연구에 우호적인 법안들이 공화당 주도의 상원에서 부결됨. 올해에도 2006년에 1천억 달러를 배아줄기세포 연구에 지원하자는 법안이 주하원에 제안되어 심의를 기다리고 있음. |
Massachusetts | 세계 최고의 줄기세포 연구자들과 수백만 달러 규모의 민간 줄기세포 연구재단을 보유한 주로서, 명시적으로 줄기세포 연구를 지지하는 법률을 제정하기 위해 노력 중. 현재 의학 연구 목적의 ‘치료 복제’를 허용하는 법안이 상원에서 2/3의 동의를 얻어 통과된 상태이며, 이는 공화당 소속 주지사의 거부권 행사를 막을 수 있는 표결 결과임. |
Connecticut | 주지사가 줄기세포 연구에 2년간 2천만 달러를 지원하는 것을 제안. Yale 대학과 Connecticut 대학의 과학자들은 이것을 ‘10년간 1억 달러’로 늘이기 위해 로비 중. |
New Jersey | 지난해에 California주보다 한 발 앞서서 최초의 주정부 차원의 줄기세포 연구기관인 Stem Cell Institute of New Jersey 설립을 추진하여 올해 8월에 건축이 시작될 예정. 주정부는 이미 1,150만 달러를 이 연구소에 투입했으며 주지사는 향후 7년간 3억 8천만 달러를 투자하기 위해 로비 중임. |
Maryland | 주의회에서 배아줄기세포 연구에 2,300만 달러를 지원하는 법안이 하원을 통과하여 상원에 계류 중. |
Virginia | 주의회는 배우이자 줄기세포 연구 지지자인 Christopher Reeve 이름으로 연구 기금을 조성함. 그러나 이 기금은 배아줄기세포 연구에 지원하지 않음. |
Florida | 환자단체들이 줄기세포 연구를 촉진하기 위해 노력하고 있고, 주정부도 생명공학산업의 육성에 적극적이지만 주지사인 Jeb Bush가 George W. Bush 대통령의 동생이어서 이들의 의도가 실현되기는 쉽지 않을 것임. |
출처: Aldhous (2005), p.695.
■ 제 2장 세계 주요국의 생명공학 동향 제 2절 일본 |
![]() 개요
개요
일본 과학기술정책의 골간은 1995년 제정된 과학기술기본법이며, 정책을 추진하는 최고 의사결정기구는 2001년 발족한 종합과학기술회의이다. 이 회의의 위원장은 총리이며 각 장관들과 일부 전문가가 위원으로 되어 있다. 일본 정부는 지난 10년간 5년 단위로 두 차례에 걸쳐 과학기술기본계획을 추진해왔다.
유전체해석기술의 개발에서 미국에 크게 뒤져 있었지만 포스트유전체 연구에서는 그 전철을 밟지 않겠다는 반성에서 종합과학기술회의는 2001년 9월 생명공학분야의 추진전략을 책정하여 독창적이고 새로운 기초연구 및 분야간 융합영역에 대한 연구개발을 적극적으로 추진하기로 하였다. 또한 연구성과를 신속히 산업으로 연결시키기 위하여 2002년 4월에는 ‘생명공학 전략대강’을 채택하였으며, 뒤이어 경제산업성은 2004년 5월 건강복지기기·서비스의 강화를 통한 건강한 장수사회의 구축에 중점을 둔 ‘신산업창조전략’을 책정하기도 하였다.
2005년은 제2기 과학기술기본계획의 마지막 해이면서 제3기를 준비하는 해이기도 하다. 지금까지의 정책이 예산 확충과 중점 배분, 기초연구 진흥에 힘을 실었다면 앞으로는 인재 양성과 산학 연계, 성과 평가에 주안점을 둘 것으로 보인다. 특히 향후 5년의 화두는 ‘이공계 인재 양성’으로 대학의 개혁에 한층 속도가 붙을 것 같다.
이하에서는 생명공학 관련 정부의 육성 정책과 과학기술시스템의 변화 동향을 중점적으로 다루고자 한다. 정부의 육성 정책에서는 중점 연구개발 분야와 2005년 정부의 예산을 주요 성(省)별로 살펴본다. 과학기술시스템의 변화 동향에서는 경쟁적 자금제도의 확대, 연구개발 관리의 강화, 지적재산전략, 지역 혁신 강화 등의 핵심사항을 생명공학과 관련하여 살펴본다.
![]() 정부의 육성 정책
정부의 육성 정책
가. 생명공학의 중점 연구개발 분야
생명공학은 정보 통신, 환경, 나노기술 재료 등과 같이 국가적, 사회적 과제에 대응한 정부의 4대 중점 연구개발 분야 중 하나로써, 다른 분야에 우선하여 연구개발 자원이 배분되고 있다. 생명공학분야에서 중점적으로 추진되고 있는 영역과 사항은 다음과 같다.
(1) 인간유전체를 비롯해 다양한 생물의 유전체서열 해독을 통한 유전자 기능 연구와 생체분자간 상호 작용 연구의 활성화에 힘입어 유전체 정보에 근거한 기초적 연구를 충실히 함과 동시에, 특히 유전체네트워크, 단백질체 등의 포스트 유전체 연구를 추진한다. 이러한 성과를 개인 맞춤형 의료 등의 실현, 종합 생물학의 확립 등에 적용하는 연구를 강화한다.
(2) 세계에서의 주도권 확보를 위해, 일본이 우위에 있는 분야인 cDNA, 단백질, 단일염기변이(SNP), 당쇄 등을 종합적으로 활용하는 연구를 중시한다.
(3) IT/NT 융합 분야 연구 개발, 특히 생물정보와 세포 시뮬레이션 기술 등의 개발, 첨단 계측 및 분석 기술, 기기의 연구 개발을 추진한다.
(4) 개인보건 분야에서는 고령화 사회에 있어서의 건강 증진을 목표로 하여, 암이나 생활 습관에 기인한 질병의 예방, 진단, 치료를 위한 연구를 추진한다.
(5) 개인 식생활 분야에서는, 이삭 유전체 연구 등의 성과를 안정적인 식량 공급, 고기능 식품 개발 등에 이용할 수 있는 연구와 음식의 안전 확보를 위한 연구를 추진한다.
(6) 개인 생활환경 분야에서는, 생물의 유용한 기능의 해명을 추진하고, 그 기능을 응용한 생명공학과 유용 생물 생산 등에 관한 연구를 추진한다.
나. 정부의 생명공학 예산
일본 정부의 2005년 생명공학 관련 주요 5개 부처의 예산은 총 2,560억 엔으로 2004년에 비해 1% 증가에 머물렀다. 후생노동성이 약 1,290억 엔으로 가장 많은 예산을 사용하고 있고 문부과학성이 약 829억 엔으로 그 뒤를 따르고 있다. 농림수산성은 약 148억 엔으로 2004년에 비해 7.4% 증가한 반면 환경성은 약 27억 엔으로 2004년에 비해
<표 2-2-2-1> 일본 정부의 생명공학 예산 (단위: 백만 엔) | ||
2004년 예산 | 2005년 예산 | |
경제산업성 | 25,594 | 26,528 |
농림수산성 | 13,761 | 14,779 |
후생노동성 | 129,020 | 129,076 |
환경성 | 3,559 | 2,713 |
문부과학성 | 81,416 | 82,912 |
계 | 253,350 | 256,008 |
출처: JBA 2005 연감, 바이오인더스트리협회, 2005년 7월. | ||
오히려 23.8% 감소하였다. 경제산업성은 2005년 약 265억 엔의 예산을 사용하고 있다. 각 성(省)별 2004년과 2005년의 생명공학 관련 예산은 위 <표 2-2-2-1>과 같다. 이러한 정부의 예산에는 정부 산하 독립행정법인의 운영비 교부금과 출자 및 융자를 위한 예산은 포함되어 있지 않다.
(1) 경제산업성
경제산업성의 예산에서는 건강안심프로그램에 138억 엔, 생물기능 활용형 순환산업 시스템 창조 프로그램에 50억 엔, 창업·사업전개지원 및 안전관리에 10억 엔, 기반연구의 추진 및 생명공학 관련시책에 79억 엔을 할당하였다. 건강안심프로그램에서는 2005년 기능성 RNA, 모델세포를 이용한 유전자기능 등의 해석, 유전체정보통합, 차세대 DDS형 악성종양시스템, 분자 이미징 기기, 재생의료 평가, 의료기기개발 가이드라인작성 등을 신규 사업으로 추진한다. 한편, 그린바이오프로그램과 연구개발성과의 조기 사업화를 촉진시키기 위한 창업·사업전개와 관련된 지원시책을 계속 추진한다.
(2) 농림수산성
농림수산성은 생명공학 일등첨단산업기술 관련 예산을 중심으로 지역의 식료산업 활성화, 음식에 대한 안전·안심의 확보, 금후 식량공급기반의 강화, 경쟁적 연구자금의 충실 등의 주요한 사업을 전개하고 있다. 특히, 첨단 기술을 활용한 농림수산연구고도화사업에서는 현장에 밀착된 시험연구를 한층 강화함으로써 식품의 안전·안심에 관한 위험관리 등을 강화하는 연구(위험관리형 연구), 타성청의 기초·기반연구에서 비롯된 기술들을 농림수산분야에 적극적으로 응용하는 연구(타성청 연휴(連携)형 연구), 연도 도중에 발생된 긴급과제에 대응한 단기간 조사연구(긴급과제 즉흥형 조사연구)를 실시하고 있다.
(3) 후생노동성
후생노동성의 과학기술관련 시책에서는 제3차 암 대응 종합전략과 신규·재발성 감염증연구를 지속적으로 추진하는 한편, 건강 프론티어전략을 실시하고 기반적 기술과 최첨단기술의 연구개발과 의료현장을 지원하는 기술의 개발보급 등을 추진함으로써 건강수명을 늘리는 생명공학 기술의 발전을 목표로 하고 있다. 또한 의약품·의료기기산업의 국제경쟁력의 확보를 위해서 인간유전체·재생의료 등에 관한 연구, 나노약품 관련 연구, 혁신적 의료기기의 개발 등을 추진한다. 이를 위해 의약품·의료기기 분야에 있어 핵심적인 연구시설을 갖춘 독립행정법인 의약기반연구소를 설립할 예정이다.
(4) 환경성
환경성의 생명공학 관련 예산에는 관계 부성(府省)의 국립시험연구기관 등에 있어서의 환경연구예산(지구환경보전 등 시험연구비), 생명공학의 환경이용에 관계된 조사 경비 등이 포함되어 있다. 약 77억 엔 규모의 경쟁적 연구자금도 생명공학 관련 연구를 위해 사용될 수 있으나, 환경성의 생명공학 관련 예산에는 포함되지 않았다.
(5) 문부과학성
문부과학성은 2002년 12월 생명공학 전략대강의 수립을 주도하였다. 2005년에는 세계적으로 선구적인 연구분야를 중점적으로 추진하여 사회의 수요를 해결하는 생명공학 분야의 연구개발을 중점적으로 추진할 예정이다. 2005년도 중점 추진 분야는 감염증 대책과 신약 및 진단절차 개발 등 사회 수요를 해결하는 생명공학 분야의 연구개발(경쟁적 자금을 활용하는 방식으로 새롭게 추진), 획기적인 의약·의료 등을 실현하기 위한 유전체 연구의 추진, 제3차 암 대응 10개년 종합전략에 기초한 암연구의 추진, 발생·재생연구의 추진, 뇌과학연구의 추진, 세포·생체기능 시뮬레이션과 광기술을 융합하는 생체기능계측기술 등 전략적 중요연구의 추진, 국가 생물자원의 활용 등 생명공학 분야에 있어 연구개발기반정비의 추진 등이다. 그리고 경쟁적 자금의 활용을 통해 기초연구 및 인재양성 등을 추진하고 있다.
![]() 과학기술시스템의 변화 동향
과학기술시스템의 변화 동향
가. 경쟁적 자금제도의 확대 및 연구개발 관리의 강화
생명공학에서도 엄정한 평가를 통한 연구자금의 효율적 배분과 함께 연구개발의 경쟁을 통한 효율성 증대를 목적으로 한 경쟁력 연구자금의 꾸준한 확대가 지속되고 있다. 2005년까지의 과학기술기본계획에서는 2000년도 약 3,000억 엔이었던 경쟁적 연구자금에 대해서 5년간 2배 증가를 목표로 하였는데, 2004년에 약 3,600억 엔에 그쳤으며 2005년에는 약 1.5배인 4,500억 엔을 목표로 하였다.
제3기 과학기술기본계획에는 경쟁적 자금의 목표 대비 차액을 조속히 보충함과 동시에 연구의 실효성을 확보하기 위한 관리체제의 확립, 공정하고 투명한 평가방법, 연구목적과 성과를 일반 국민이 이해할 수 있게 하고 사회에 환원시킬 수 있는 구조를 형성한다는 생각을 포함시킬 계획이다. 관리 강화책으로는 실시과제의 선정과 평가를 맡은 프로그램임원(PO), 제도운용관리를 담당할 프로그램관리자(PD)의 확보가 급선무로 이들 직무를 연구자의 경력으로 정당하게 평가하도록 학계에 요구하며 세계연구동향에 대한 조사·분석능력 강화를 위해 연구자가 사용한 조사활동 비용을 경쟁적 자금에서 끌어낼 수 있도록 하는 등의 제도개혁을 시도할 예정이다.
나. 지적재산전략
생명공학분야는 타 분야와 달리 연구개발에서 제품화까지 많은 시간이 요구되며, 기초연구와 응용연구 및 제품개발의 차이가 적으며, 유전자 연구 등 연구의 상류에 위치하는 것이 많으며, 한 건의 특허가 상품에 주는 영향이 크다는 등의 특징을 갖는다. 따라서 생명공학은 대학연구에 대한 의존성이 높고 지적재산의 활용 전략도 타 분야와 크게 다르다. 일본 정부는 중점기술 분야로서 생명공학 분야의 연구개발의 국제경쟁력을 산업의 국제경쟁력으로 전환하기 위한 효과적 지적재산 전략의 수립을 중장기적 과제로 제시하고 있다.
일본에서 지적재산의 전략은 대학의 기반 정비와 지역에서의 활용을 강조하고 있다. 대학과 관련해서는 대학의 지적재산 창조 기반의 정비, 대학의 속성이 배려된 지적재산관리 활용체제의 정비, 지적재산의 보호 강화 등을 강조하고 있으며, 지역지적재산의 효과적 활용을 위해서는 대학, 지역기업, 지방자치단체의 공설시험기관과의 제휴강화를 도모하는 한편 이들 간의 원활한 제휴를 위한 지적재산에 대한 조언자 및 조정관 같은 전문가 육성을 적극적으로 추진하고 있다.
다. 지역 혁신 강화
일본은 생명공학의 연구시설과 관련 사업을 한데 묶은 ‘바이오클러스트’를 여러 곳에 설치해 지역산업을 진흥시키고 이를 통해 일본을 최강의 생명공학 선진국으로 끌어올리려는 야심찬 계획을 추진하고 있다. 적어도 20곳 이상의 지역에서 생명공학을 견인차 삼아 지역경제와 산업에 활기를 불어 넣기 위해 대학, 연구소와 기업의 두뇌, 자금을 결합시킨 생명공학단지에 심혈을 기울이고 있다.
피부, 혈관 등의 재생의료 분야에서 높은 명성을 얻고 있는 ‘고베의료산업도시’는 영국 에딘버러대학, 호주 모나슈대학과 손잡고 세포이식수술에 도전하는 호주와 일본의 벤처기업이 공동으로 세운 합작회사를 유치하였다. 또한 고베의료산업도시에는 이미 50여개에 달하는 기업들이 사무소나 연구소를 이곳에 거점으로 설치해 놓고 있다. 야마가타현 쓰루오카시에 2001년 문을 연 게이오대학의 첨단생명공학연구소는 컴퓨터를 이용한 세포연구에서 유명한 곳이면서도 자동차로 30분 이내의 거리에 스키장과 온천장, 해수욕장이 즐비한 곳이다. 이 연구소의 도미타 마사루 소장은 “독창적 연구 분야에 파고 들려면 굳이 대도시에 거점을 둘 필요가 없어 벽지와도 같은 쓰루오카를 찾아 왔다”고 말했다.
소도시들이 적극적으로 생명공학을 통한 산업 진흥의 꿈을 키우고 있지만, 도쿄, 요코하마, 쓰쿠바 일대를 한데 묶은 도쿄만 유전체 베이(Bay)에도 7개의 생명공학단지가 포진하고 있다. 이화학연구소의 요코하마연구소와 요코하마시가 참가한 게이힌 임해재생특구와 치바현 신산업 창출특구, 사이타마 바이오프로젝트, 첨단건강산업집적특구 등이 주축을 이루며 거대한 클러스터를 형성하여, 오사카 일대의 간사이 생명공학 산업 클러스터와 함께 일본의 생명공학 강국 도약에 앞장서고 있다.
![]() 결론
결론
일본에서 생명공학 산업은 장래의 산업구조의 변혁을 가져올 21세기의 유망 신산업으로 간주되고 있다. 2004년 일본의 생명공학 관련 시장은 2003년에 비해 5.2% 성장하여 1조 7,500억 엔이었다. 이러한 시장확대는 유전자조작작물의 수입 증가와 생명공학 의약품 판매의 신장에서 비롯된 것이다. 유전자조작작물의 수입은 전년 대비 10% 증가하여 3,300억 엔으로 확대되었고, 생명공학 의약품에서 항체의약의 시장은 80% 증가하여 440억 엔에 이르렀다. 또한 생명공학 벤처도 착실히 성장을 지속하고 있다. JBA(일본생물산업협회)의 조사에 따르면 2004년 생명공학 벤처의 수는 2003년 대비 77개사가 증가하여 464개사로 증가하였으며, 전국 각지의 생명공학 클러스터와 연계시키면 2010년경에는 1,000개사로 증가할 것이라고 전망되고 있다.
이와 같이 일본에서 생명공학 산업은 21세기의 일본 경제를 견인하여 고용 창출과 건강 환경사회를 동시에 실현할 수 있을 것으로 크게 주목받고 있다. 이러한 인식하에 일본은 ‘보다 잘사는 삶’, ‘보다 잘 먹는 식(食)’, ‘보다 잘사는 생활’이라는 3대 미래 사회상의 실현을 향하여 생명공학 연구개발 노력을 한층 강화하고 있다.
■ 제 2장 세계 주요국의 생명공학 동향 제 3절 유럽연합(EU) |
![]() 서론
서론
2000년 LISBON 정상회의 이후로 유럽연합의 전략적 연구영역(European Research Area, ERA)2)의 기반 확립이 프레임워크 프로그램(FP: Framework Program)을 통하여 본격화되기 시작하였다. 동시에, 통일된 유럽연합차원의 전략 및 정책방향을 정립하여 지역별·국가별 한계를 극복하고 동시에 개별 경쟁을 강화시켜 생명공학과 생명공학 산업의 국제경쟁력을 향상시키고자 유럽연합이사회(European Commission)가 4대 전략을 제시하는 ‘생명공학에 대한 유럽의 전략(Life Science & Biotechnology - A Strategy For Europe, 2001)’ 계획을 발표하였고 이후 국제 경쟁력 측면에서 많은 변화가 있어왔다.
그러나, 이러한 유럽연합차원의 연구 인력간의 협력 또는 경쟁을 통한 혁신은 유럽전체의 생명공학 연구 환경을 부분적으로만 변화시켜 왔으며 실질적으로 유럽국가에서 생명공학 분야 연구개발에 대한 지원은 개별 국가위주로 이루어지고 있다. 따라서 유럽연합 내의 국가간 연구개발 투자규모는 상당한 편차를 보여주고 있으며 영국, 독일, 프랑스는 타 국가에 비하여 상대적으로 월등한 위치를 차지하고 있다.
향후 생명공학에 대한 유럽의 전략은 2007년 봄 유럽연합이사회에서 수정보완될 예정이며 이에 대한 사전적인 작업으로 지금까지의 유럽연합이 추진해온 프레임워크 프로그램 및 유럽의 경쟁력에 대한 사전적인 평가보고서가 작성되고 있는 것으로 조사되었다. 이제까지의 추진현황을 분석하여 보고한 자료에는 아직도 유럽연합의 경쟁력은 더욱 향상되어야 한다고 기록하고 있고 유전자변형생물체(GMO), 생명윤리문제 등 규제와 관련된 특정이슈에 대해서 더욱 국가간의 상호작용을 통해 해결해 나갈 것을 제안하고 있다.
![]() 연구개발 지원현황
연구개발 지원현황
생명공학 기술은 4차 FP에서부터 강조되기 시작하여 5차 FP에서는 중점투자분야로 채택되고 6차 FP에서부터는 유럽차원의 연구개발전략인 유럽연구영역(ERA)을 실현하고 유럽연구연합의 개발자원을 집약하는 형태로 변화하기 시작하였다. 따라서 유럽연구의 집중통합, 유럽연구공간의 구조화, 유럽연구공간의 기반 강화 등의 대주제로 통합되었으며 자원 집약을 위하여 프로젝트가 대형화되기 시작하였다. 생명공학 분야는 이러한 프레임워크 계획의 최우선 중점 분야이며 나노기술과 함께 유럽연합의 핵심적인 투자분야 중의 하나로 자리 잡게 되었다. 5차 계획에서 ‘생활의 질’ 등 건강·의료분야에 22억 5,500백만 유로를 지원하였고 특이한 점은 6차 계획에서 ‘식품의 질과 안전’ 분야가 개별 프로그램화되면서 6억 8,500백만 유로, ‘생활의 질’에 24억 1,300만 유로가 투자되어 5차 계획 대비 5억 유로 이상 연구비가 증가되었다. 이들 프로그램은 유전자의 기초적 연구와 신약개발, 새로운 진단법, 예방법에 대한 투자를 증가시켜왔고 5차 FP의 세포공장과 6차 FP의 선진적 지노믹스 및 그 건강에 대한 응용에서 대부분 연구되고 있다. 특히, 6차 계획에서는 바이오소재, 생명공학기술을 응용한 폐기물 관리, 식품생산 및 안정성 등이 새롭게 강조되고 있다.
그러나 서두에서 언급한 바와 같이 유럽연합차원의 프로그램보다는 개별 국가의 정책적 지원에 대한 투자가 상대적으로 큰 것으로 조사되었으며 프레임워크 프로그램을 통해 통합적인 모습을 나타내고 있는 것으로 사료되나
<표 2-3-2-1> 유럽의 연구개발 투자현황
구분 | 공기업 | 산업전체 |
수익(U$백만) | 7,533 | 13,733 |
연구개발 지출(U$백만) | 4,244 | 7,485 |
수익 대비 연구개발지출 | 56.3% | 54.5% |
출처: Ernst & Young, 보건산업진흥원
전체적인 유럽의 연구개발 투자는 영국, 독일, 프랑스 3개국에 집중되어 있는 것으로 분석된다.
EU의 생명공학 산업에 대한 연구개발 지출은 2001년 기준, 75억 불로 조사되었고 이는 수익 대비 54.5%를 지출한 것에 해당되며 공기업의 연구개발 지출은 42억 불로 산업전체의 56.7%에 해당한다. 또한 공기업의 연구개발 투자규모가 민간부문보다 크게 나타나고 있다고 보고된다.
공공부문의 연구개발 자금 지원에서 생명공학이 차지하는 비율은 단연 미국이 61%로 1위를 차지하고 있으며 영국(34%), 일본(27%), 프랑스(22%), 독일(21%), 핀란드(19%) 순으로 나타났다. GDP 대비 정부 연구개발 투자에서 생명공학이 차지하는 비율은 미국(0.26%), 핀란드(0.19%), 일본(0.18%), 프랑스(0.17%), 영국(0.16%), 독일(0.16%) 순으로 나타났고 점차 기초과학이 기술혁신에 기여하는 비중이 증가하고 있다고 보고되고 있다.5) 산업화를 고려하지 않던 순수연구기관의 지적재산권 취득이 증가하는 현상을 통해 생명공학 분야에서의 기초과학의 중요성이 제시되고 있다. 따라서 지속적 투자가 관건이며 정부가 이러한 의지를 가지고 계속적으로 지원하고 있는 미국, 일본, 유럽연합의 주요국들은 미래의 기술 선점을 위한 치열한 경쟁을 벌이고 있다고 사료된다.
![]() 유럽연합의 생명공학 산업현황
유럽연합의 생명공학 산업현황
가. 유럽연합 생명공학 산업의 위상
유럽연합 생명공학 정책의 제일 목표는 생명공학 클러스터 육성이며 옥스퍼드, 케임브리지, 스톡홀름과 독일의 바이오-리전(Bio-Region) 등이 대표적인 생명공학 클러스터의 사례에 해당한다. 또한, 미국에 뒤떨어졌던 기술 및 산업경쟁력을 제고하기 위해 정부, 기업 등 산·학·연의 적극적인 협력 아래 유럽연합의 생명공학 인프라는 최적의 상태로 운영되고 있다. 이제 그 노력에 힘입어 미국에 크게 뒤떨어지는 것으로 평가되었던 유럽연합의 생명공학 산업 경쟁력이 언급한 바와 같이 효과적인 정부정책 및 산업육성전략으로 크게 향상된 것으로 재평가되고 있다.
<표 2-3-3-1> 유럽의 생명공학 산업현황
구분 | 유럽7개국 | 영국 | 독일 | 프랑스 | 미국 | |
기업수 | ’03 | 1,484 | 455 | 525 | 225 | 1,830 |
’02 | 1,511 | 494 | 527 | 222 | 1,891 | |
’01 | 1,434 | 456 | 513 | 215 | - | |
고용인력 | ’03 | 73,600 | 22,400 | 17,300 | 8,900 | 172,400 |
’02 | 76,800 | 24,400 | 18,600 | 8,500 | 168,000 | |
’01 | 75,000 | 25,100 | 16,200 | 8,300 | - | |
임상실험단계 신약개발 | ’03 | 420 | 224 | 79 | 69 | 1,110 |
’02 | 387 | 226 | 68 | 45 | 1,164 | |
’01 | - | - | - | - | - | |
매출액 (10억 유로) | ’03 | 16.3 | 5.0 | 3.1 | 1.9 | 41.7 |
’02 | 16.8 | 5.2 | 3.3 | 1.9 | 39.7 | |
’01 | 16.4 | 4.9 | 2.9 | 1.6 | - | |
총주가 (10억 유로) | ’03 | 1.3 | 0.555 | 0.222 | 0.167 | 7.3 |
’02 | 1.9 | 0.675 | 0.644 | 0.352 | 6.8 | |
’01 | - | - | - | - | - | |
창업회사 | ’03 | 100 | 36 | 31 | 11 | 83 |
’02 | 115 | 50 | 29 | 13 | - | |
’01 | 209 | - | ||||
연구개발 투자 (10억 유로) | ’03 | 5.22 | 1.76 | 1.28 | 0.61 | 16.39 |
’02 | 6.05 | 2.16 | 1.58 | 0.55 | 18.31 | |
’01 | 5.54 | 1.99 | 1.28 | 0.53 | - | |
출처: 보건산업진흥원
이와 같이 유럽연합이라는 그룹으로서의 위상은 기술적, 상업적으로 미국에 견주어 도전할 수 있는 잠재력을 지니고 있는 것으로 재평가되고 있지만, 상당수의 개별국가들은 아직도 기술수준 및 산업경쟁력 측면에서 미국, 일본에 비해 훨씬 못 미치고 있는 상황이다.
전체적으로 미국 및 유럽연합간의 생명공학 분야 기술수준은 예전에 비해 서로간의 격차를 좁히고 있는 것으로 조사되었으나 아직도 연구인력, 연구개발 투자지출, 재무건전성 등 상당부분이 미국에 비해 뒤떨어져 있는 것으로 분석되었다.
나. 유럽 생명공학 기업의 재정 건전도
아직도 생명공학은 여전히 지속적 투자에 대한 관심의 대상이며 최근 가장 많은 투자가 이루어지고 있는 연구영역 중의 하나이다. 생명공학 기업의 재정적 지원에 관한 가장 큰 장벽은 신생 기업의 존폐여부가 3~5년 이내에 결정된다는 사실에 기인한다. 그 이유는 그 기간 내에 시장에 진출하지 못할 경우 투자된 자금은 거의 바닥이 나서 더 이상 버티지 못하고 합병 내지는 막을 내리는 경우가 대부분이기 때문이다. 그러나 다행히도 각국 정부의 계속적인 지원 때문에 실제적인 기업의 존폐여부가 시장에서 결정되고 이는 개별기업의 신속한 사업화 전략을 요구하며 긍정적인 방향으로 유럽연합의 생명공학 산업을 이끌고 있다.
2003년 전 세계 생명공학 기업의 자금공모 금액은 15.7억 유로이고 2004년에는 대략 17억 유로에 이르는 것으로 분석되고 있다. 이 중 미국 내 기업공개(IPO) 건수는 64건인데 비해 유럽의 경우 15개 기업이 공개적으로 상장되고 있으며 액수로는 4.1억 유로에 이른다. 또한 2004년 유럽 내 벤처 자금은 9.1억 유로이며 미국의 경우 29억 유로로써 아직도 미국 내 벤처자금에 비해 상당한 편차를 보이고 있다. 건강관련 분야인 치료나 진단에 총 연구개발비의 90% 이상이 투자되고 있으며 환경이나 서비스 분야에는 대략 8% 수준의 소규모 투자가 이루어지고 있다. 2002년 이후 유럽 내 자금사정은 좋아지고 있으나 아일랜드, 스위스의 일부 기업이 기여한 금액이 대부분이며 재정 건전화를 위한 파트너링 노력은 부진한 상태이다.
다. 유럽의 개별 국가간 위상 및 유망기업(Elite European Companies)
유럽의 생명공학 기업 1,976개사를 나라별로 살펴보면 독일 525개, 영국 455개, 프랑스 225개, 네덜란드 119개, 스웨덴 108개, 스위스 97개 등의 순이다. 연구개발, 재정적 능력 등을 고려하여 유럽의 유망기업을 선별하여 분석한 결과 영국, 독일, 프랑스 등 주요 3~5개국에 집중 분포되어 있는 것으로 드러나고 있다<그림 2-3-3-1>. 따라서 이들 국가는 향후 유럽 생명공학 산업 선도국가로서의 역할에 막대한 영향을 미칠 것으로 사료된다.
언급한 바와 같이 EU는 유럽연합 차원의 공동협력 프로그램을 수행하는 한편 국가별 생명공학 산업 경쟁도 병행하고 있다. 2002년, 임상시험단계에 있는 의약품의 수가 456개에 이르고 있는데 국가별로 살펴보면 영국 194개, 스위스 79개, 스웨덴 32개, 덴마크 28개, 독일 15개 등의 순으로 집계되고 있다. 국제특허에서 유럽연합이 차지하는 비중은 생명공학 기술특허 부문에서 19%, 약품특허 부문에서 33%, 인간 DNA 배열 특허 부문에서 24%이며, 미국에 비해 큰 열세를 보이고 있었으나 최근 들어 많은 변화를 나타내었다. 최근 특허분석결과를 살펴보면<표 2-3-3-2> 미국, 일본에 이어 유럽의 주요국들이 경쟁을 벌이고 있는 것으로 분석되었고 유럽연합차원에서는 일본을 앞지르며 미국을 추격하고 있는 것으로 분석된다. 독일, 프랑스 등은 광범위한 연구개발 내용으로 인하여 양적 측면에 비해 질적 수준이 낮게 평가되고 있음을 알 수 있고 영국은 양적, 질적 측면에서 모두 상위권에 위치하고 있어 유럽의 생명공학 기술을 선도해 나가고 있는 것으로 분석된다.
한편, 유럽연합위원회(EC)는 지난 2003년 생명공학 연구 및 산업에 영향을 미치는 11가지 지표를 설정하여 측정하고 이들과의 상호연관관계를 분석함으로써 기술혁신을 달성한 국가들을 제시하고 있다<표 2-3-3-3>. 물론 이러한 지표값이 절대적인 성공의 수치를 나타내는 것은 아니지만 중요한 몇 가지 시사점을 제시하고 있다. 실제 투자국가와 기업이 다른 곳에 존재할 수 있음을 즉, 생명공학산업의 국제성을 인식하게 해주고 있다. 또한 연구비 투자와 지식창출의 양은 비례관계를 나타내고 있으나 그 외에도 북유럽의 혁신사례에서 보는 바와 같이 또 다른 성공적 요소가 존재함을 알 수 있다. 백신(Vaccine) 또는 단일클론항체(Monoclonal antibodies)와 같은 틈새시장에서의 소규모 혁신활동에 대한 집중 전략에서 경쟁력을 선도하는 경우로써 이는 광범위한 활동을 하여 전체적인 우위를 점하고 있는 영국, 독일, 프랑스와는 다른 각도에서의 혁신활동의 예라 할 수 있다.

<그림 2-3-3-1> 유럽 내 유망기업의 분포도
출처: Biotechnology in Europe : 2005 Comparative study
<표 2-3-3-2> 세계 특허분석 결과
순위 | 특허등록건수 | 인용도지수(CPP) | 기술력지수(CII) | |||||||||
1996-1999 | 2000-2003 | 1996-1999 | 2000-2003 | 1996-1999 | 2000-2003 | |||||||
1 | 미국’ | 17,854 | 미국 | 19,760 | 스웨덴 | 1.33 | 미국 | 1.20 | 미국 | 1.16 | 미국 | 1.12 |
2 | 일본 | 1,917 | 일본 | 1,868 | 미국 | 1.19 | 캐나다 | 1.13 | 스웨덴 | 1.05 | 스웨덴 | 1.11 |
3 | 독일 | 1,096 | 독일 | 1,479 | 캐나다 | 0.98 | 오스트리아 | 1.12 | 캐나다 | 0.98 | 캐나다 | 1.04 |
4 | 영국 | 831 | 영국 | 929 | 영국 | 0.97 | 영국 | 1.05 | 덴마크 | 0.86 | 덴마크 | 0.98 |
5 | 프랑스 | 714 | 캐나다 | 923 | 스위스 | 0.95 | 덴마크 | 1.02 | 영국 | 0.86 | 영국 | 0.97 |
6 | 캐나다 | 707 | 네덜란드 | 863 | 덴마크 | 0.90 | 핀란드 | 0.98 | 핀란드 | 0.80 | 스위스 | 0.90 |
7 | 네덜란드 | 581 | 프랑스 | 832 | 이스라엘 | 0.86 | 스웨덴 | 0.93 | 네덜란드 | 0.73 | 이스라엘 | 0.88 |
8 | 덴마크 | 334 | 덴마크 | 506 | 벨기에 | 0.82 | 이스라엘 | 0.76 | 벨기에 | 0.72 | 인도 | 0.87 |
9 | 호주 | 265 | 스위스 | 417 | 네덜란드 | 0.81 | 스위스 | 0.72 | 호주 | 0.71 | 핀란드 | 0.81 |
10 | 스위스 | 261 | 호주 | 371 | 인도 | 0.80 | 프랑스 | 0.71 | 인도 | 0.71 | 오스트리아 | 0.80 |
11 | 스웨덴 | 193 | 이스라엘 | 262 | 핀란드 | 0.78 | 인도 | 0.65 | 스위스 | 0.70 | 벨기에 | 0.70 |
12 | 이스라엘 | 189 | 스웨덴 | 248 | 독일 | 0.66 | 독일 | 0.63 | 이스라엘 | 0.68 | 독일 | 0.67 |
13 | 이탈리아 | 188 | 벨기에 | 245 | 프랑스 | 0.61 | 벨기에 | 0.62 | 독일 | 0.62 | 뉴질랜드 | 0.64 |
14 | 벨기에 | 136 | 한국 | 204 | 대만 | 0.61 | 한국 | 0.52 | 프랑스 | 0.61 | 네덜란드 | 0.63 |
15 | 한국 | 111 | 인도 | 151 | 오스트리아 | 0.59 | 네덜란드 | 0.51 | 오스트리아 | 0.59 | 프랑스 | 0.60 |
16 | 핀란드 | 91 | 이탈리아 | 148 | 이탈리아 | 0.54 | 이탈리아 | 0.51 | 대만 | 0.54 | 호주 | 0.59 |
17 | 오스트리아 | 81 | 대만 | 102 | 호주 | 0.54 | 뉴질랜드 | 0.51 | 이탈리아 | 0.52 | 한국 | 0.55 |
18 | 대만 | 49 | 뉴질랜드 | 74 | 뉴질랜드 | 0.54 | 일본 | 0.49 | 일본 | 0.49 | 이탈리아 | 0.53 |
19 | 인도 | 38 | 핀란드 | 73 | 일본 | 0.50 | 호주 | 0.48 | 한국 | 0.40 | 대만 | 0.50 |
20 | 뉴질랜드 | 32 | 오스트리아 | 68 | 한국 | 0.39 | 대반 | 0.32 | 뉴질랜드 | 일본 | 0.46 | |
출처: 특허청, 한국특허정보원 2004, 생명공학 특허동향, 생명공학 심층평가용 특허분석결과
<표 2-3-3-3> 생명공학 혁신지표와 주요국가들
지표 | 유럽연합 내 선두국가 |
1인당 생명공학 분야 박사학위 소지자 국내총생산 대비 정부의 생명공학 연구개발 지출비 1인당 생명공학 간행물 수 간행물당 인용빈도 1인당 특허신청 1인당 특허획득 1인당 생명공학 기업 수 국내 총생산 대비 벤쳐 캐피탈 비율 1인당 인가된 약품 수 농산물 국내 총생산 (단위 10억) 당 유전자조작 작물 일반인의 생명공학에 대한 이해도 | 프랑스, 아일랜드 벨기에, 영국 스웨덴, 덴마크 영국, 독일 네델란드, 덴마크 덴마크, 핀란드 스웨덴, 아일랜드 벨기에, 독일 덴마크, 아일랜드 벨기에, 스웨덴 스웨덴, 네델란드 |
출처: 보건산업진흥원, 유럽보건의료산업동향(2003, 6월호),
![]() 주요국가의 현황
주요국가의 현황
가. 영국
2003년 통계에 따르면 유럽연합은 400여 개의 생명공학 산업 관련 기업(400 기업, 25,000 고용인, 30억 매출)을 보유하고 있으며 생명공학 산업에 종사하는 조직을 유형별로 살펴보면 기업보다는 공공연구기관의 비중이 매우 높은 것으로 나타나고 있다. 무역산업부(Department of Trade and Industry)를 중심으로 생명공학에 대한 정책적 지원을 아끼지 않고 있으며 기업의 창업 및 성장을 지원하고 있다. 이와 같은 강력한 정부지원과 함께 세계수준의 과학기반, 강력하고 경험 있는 벤처투자 산업의 배경 등을 바탕으로 유럽의 생명공학을 리드하고 세계적 선도자의 위치에 서고 있다. 현재 영국의 임상수준(3상)은 유럽 내 임상건수의 40% 이상을 점유하고 있는 것으로 조사되었다.
정부차원의 산업 응용 촉진(Biotechnology Means Business), 정부와 기업의 공동출자 연구조합(Club), 정부지원 연구결과 상업화 목적(LINK), 지역별 클러스터 등을 통해 생명공학 산업을 집중 육성 중이며 정부의 최우선 투자방향으로 설정하고 있다.
영국의 생명공학 발전계획(Bioscience 2015)은 2015년까지 미국에 이어 2위권의 세계적 리더로서의 자리를 굳히는 것을 장기 비전으로 채택하고 있다. 그러나 현안과제로써 ① 환자의 이익을 위해 NHS와 산업의 상호 호혜적 협력관계 구축, ② 기술혁신을 지원하는 공공 및 규제 환경 조성, ③ 의약개발에 필요한 장기간에 걸친 충분하고 적절한 자금 지원, ④ 생명공학 혁신을 촉진할 강력한 생물공정분야 육성, ⑤ 고급 과학기술 및 경영 인력 개발, 유인 및 유지, ⑥ 생명공학분야 대화를 위한 생명공학 지도자 위원회 설치 등을 추진할 계획이다.
영국 내에서 스코틀랜드의 경제는 다소 독립적이며 이에 따라 산업정책 또한 독자적인 전략을 수립하고 있다. 따라서 생명공학 부문의 육성에 관해서는 서로 의견이 일치하지만 그 진행과정에는 다소 차이가 있음을 시사하고 있고 별도의 생명공학 장기발전계획을 수립하고 있는 것으로 조사되었다. 스코틀랜드에는 영국전체 생명공학 기업의 21%가 위치하고 있으며 최근 신규업체의 성장세가 두드러지고 있는 지역으로 조사되었다.6)
나. 독일
유럽의 기간산업 중심지로 알려졌던 독일은 자금난 등 내부적 문제와 기업간 합병 등 외부적 문제로 압박을 받으면서도 유럽의 생명공학 메카 중의 하나로 자리매김을 해가고 있다. 기초과학분야에 우수한 역량을 지니고 있으면서도 이러한 지식기반 요소를 활용하여 산업화에 이르는 데는 미국 등 타 선진국에 못 미치고 있어 왔다고 평가되고 있으나 2001년 이후로 ‘지식으로 시장창출’ 등 행동 프로그램을 통해 산업화에 대한 전략을 본격적으로 추진하고 있다. 대학을 비롯한 많은 연구기관들을 통해 지식과 산업의 연계에 대한 정책을 강력히 추진하고 있으나 아직은 수익이 창출되지 못하고 있지만 자금난에도 불구하고 지속적인 투자를 이어나가고 있다. 특히 치료제 약물 등 제약 산업에 유전공학이 많이 응용되고 있다. 최근 들어(2003) 메디젠(Medigene)이 개발한 항암제가 임상단계를 거쳐 약품허가를 받으면서 첫 상용화 시도가 성공적이었다고 알려져 있으며 현재 다수의 약품이 임상허가를 얻기 위한 개발 단계에 있는 것으로 알려져 있다.
정부는 BioRegio, BioFuture, BioChance 및 BioProfile 등 생명공학 활성화 프로그램을 통해 생명공학 클러스터, 지역혁신, 산업화를 위한 산·학·연 공동연구개발, 유망기업의 창업 등 정책목표를 달성해가고 있으며 ‘BioFuture’ 상을 통해 해외로 유출되었던 우수 인력의 국내유입을 시도하였다. 또한 벤처기업의 활성화를 위해 앞으로 수년 동안 생명공학 벤처에 1억 유로 투자계획을 가지고 있다. 독일의 연간 매출규모는 10억 유로이며 연구개발비는 13억 유로에 이른다. 연방정부의 생명공학 산업에 대한 연구개발비는 대략 2.5억 유로에 이르는 것으로 조사되었다. 생물정보, 단백질체학, 조직공학, 나노바이오공학 등에 상당한 비중으로 투자가 이어지고 있는 것으로 나타났다.
다. 프랑스
프랑스는 1980년 이후 생명공학 분야에 지속적인 투자를 해오고 있으며 특히 약물생산 부문에서는 세계 3위를 기록하며 어려운 경제 환경 속에서도 주도적인 위치를 차지하고자 노력하고 있다. 1999년 이후로 ‘혁신과 연구에 대한 법’을 제정하여 학계 및 연구계 인력들의 창업보육에 관한 씨드(seed)를 마련하고 이를 통해 공공연구기관과 민간기업의 협력을 유도하였다. 스톡옵션 및 세제혜택 등을 통해 연구원들의 민간 활동을 활성화함으로써 생명공학 산업의 진흥을 도모하였다. 특히 정부는 인큐베이팅 단계의 기업들에 대한 세제혜택과 국영연구소 시설지원, 추가 펀딩 등을 지원함으로써 생명공학 산업의 활성화를 유도하였다.
생명공학 산업을 집중육성하기 위한 ‘Plan Biotech’이라는 프로그램을 통해 2006년까지 유럽 최고의 생명공학 산업국가로 이끌기 위한 시도를 하고 있으며 연간 1억 500만 유로가 투입된다. 미국, 영국, 독일 등에 비하여 뒤늦게 위기의식을 느낀 프랑스 정부는 이제 생명공학 산업에 대한 각별한 의지를 보이면서 유럽투자은행에 생명공학 산업육성 등에 관한 추가 투자자금을 요청하고 있는 상황이다. 또한, 정보통신 분야와 같은 전철을 밟지 않겠다는 강력한 의지를 표명하고 영국과 미국 등에 대한 추격전을 준비하고 있는 것으로 전해진다.
■ 제 2장 세계 주요국의 생명공학 동향 제 4절 중국 |
![]() 중국 생명공학의 특징
중국 생명공학의 특징
14억의 인구대국 중국은 남한의 약 100배 크기의 광대한 국토면적과 풍부한 생물자원을 보유하고 있으며, 32개의 성(省)과 자치구들이 각각 독특한 자연환경, 문화, 산업을 지니고 지방자치 및 자급경제를 추구하는 한족(漢族)과 55개 소수민족으로 구성된 다민족 국가이다. 중국은 세계 최대의 인구보유국인 만큼 건강, 농업분야가 국가적으로 매우 중요하며, 특히 인간 질병의 예방 및 치료수준의 향상이 시급하다. 또한 계획출산 정책이 국가차원에서 시행되어 왔고, 최근에는 생활건강, 피임, 노령화 등이 심각한 문제로 부각되고 있다. 중국의 농업은 최근 많이 발전하였으나 전반적인 효율성과 질적인 측면에서는 아직 만족할 만한 수준에 도달하지 못한 상태이다. 또한 생물자원과 환경보호에도 많은 어려움이 있다. 이와 같은 이유로 중국이 지속적으로 발전하기 위해서는 생명공학의 발전이 매우 필수적이다. 특히 세계적으로 가장 많은 생물자원(동물, 식물, 미생물 및 인간유전자원 포함)을 지니고 있는 나라 가운데 하나일 만큼의 자원대국이므로, 생물다양성 보호와 이용이라는 중대목표를 수행하면서 생명공학 발전을 위한 풍부한 재료를 쉽게 제공할 수 있는 강점을 지니고 있다. 역사적으로 중국은 의학, 농학 분야에 매우 우수한 과학기술을 보유하고 있으며, 20세기 후반 특히 개혁 개방이후 생명공학의 이론 및 기술체계가 빠르게 발전하고 있는 추세이다.
최근 중국은 세계무역기구(WTO) 가입을 계기로 세계경제의 흐름에 적극적으로 참여하고 있으며, 고부가가치의 첨단기술개발을 국가전략으로 내세우고 세계 최대의 생명공학 산업시장으로 매우 빠른 속도로 성장하고 있다. 세계 각국이 생명공학(BT)의 연구개발 및 산업발전에 국가전략차원의 지원을 경쟁적으로 수행하고 있는 것과 같이, 중국도 863계획 및 105계획을 통해 생명공학을 첨단기술의 핵심과제로 선정하는 등 생명공학 분야 연구 및 육성에 박차를 가하고 있다. 중국은 개발도상국가로서 기초연구에 사용하는 예산의 제한이 있어 당면한 사회문제 해결에 과학기술 투자의 중점을 두고 있다. 생물산업의 발전도 생명공학의 창조적 연구와 분리하여 생각할 수 없으므로 국가목표와 최첨단 과학기술연구의 유기적인 결합을 강조하고 있다.
전통적으로 중국의 생명공학 연구는 의학, 농학 및 생물자원이용에 중점을 두었다. 중국정부는 오랜 기간에 걸쳐 생명공학 중점학과에 국가중점실험실과 국가공정센터를 설립하였다. 중국과학원 산하에 생명공학관련 연구소는 20여 개이며, 현재 북경, 상해, 서남, 무한 등 4개 지역으로 나누어 운영되고 있는데, 북경기지는 농업 및 환경 관련연구, 상해기지는 인구와 건강연구, 서남기지는 생물다양성, 무한기지는 수생생물 및 바이러스학을 중심으로 관련연구를 수행하고 있다. 국가급 연구소 83개, 국가중점연구실 24개, 국가급 자연보호구 152개가 있다.
![]() 중국의 생명공학 육성정책
중국의 생명공학 육성정책
대표적인 첨단 과학기술 육성정책으로 1986년 3월 덩샤오핑(鄧小平)에 의해 수립된 863계획과 횃불계획이 있으며, 그 중 생명공학 분야는 첨단 기술 핵심과제 중 하나이다. 1997년 3월부터 실시된 973계획은 중국의 미래 산업 발전에 필요한 최첨단 기술 기초연구와 응용기초연구를 실행하는 국가 중점 연구개발 프로젝트로서 광학 전기기능 결정체, 질병 유전자학, 나노과학기술, 대뇌과학, 고대생물학, 화학 등에 중점을 두고 있다. 2000년 10월 장쩌민(江澤民) 국가주석이 중국 공산당 제15기 중앙위원회 제5차 전체회의에서 생명공학 산업을 집중 육성하겠다고 발표하고, 중국과학기술부는 105계획(10차 5개년 계획, 2001년~2005년) 기간동안 21세기 첨단과학기술 중 생명공학, 정보통신, 신소재 분야를 집중 육성할 것이라고 하였다.
2001년부터 2005년(105기간)동안 중국 정부는 생명공학 연구개발에 총 120억 위엔을 투자하였는데, 이는 1996년부터 2000년까지 같은 기간동안 중국 정부가 생명공학 분야에 투자한 총 연구비의(15억 위엔) 8배 이상 증가한 것이다. 그러나 중국의 생명공학 연구개발은 세계 선진기술 수준과 비교해 볼 때 여전히 상당한 격차가 존재하고 있다. 주요 원인은 핵심기술과 우수 인재의 부족 때문이며, 따라서 인재를 배양하는 것이 중국 생명공학을 발전시키는 매우 중요한 요인이다.
최근 중국 국무원은 ‘국가 생명공학 연구개발과 산업화 촉진 지도자 그룹’을 만들었고, 동시에 ‘중국 생명공학 및 산업화 발전 계획’, ‘생물안전법’을 제정하였다. 또한 중국생물산업체협회를 설립하였으며 생명공학 연구개발 예산에 대한 대대적인 지원을 강화하고 있다. 중국 국가과학기술부는 2005년 9월, 중국정부 9개부서와 유엔식량농업기구(FAO) 등 5개 국제기구가 공동으로 참여한 ‘제1회 국제생물산업 고위급 포럼’에서 ‘중국의 생명공학 기술 및 생물산업 마스터플랜’을 공식 발표하고, 농업, 의약, 공업, 환경, 에너지, 해양, 중의약 등 발전분야를 확정하고 기술 축적을 위해 모든 노력을 다하겠다고 발표하였다. 이번 마스터플랜에서는 ‘향후 2020년도 중국의 생명공학 및 산업화 발전 전략목표는 중국을 생명공학 기술 강국과 생물산업 대국으로 건설하는 것이며, 15년간의 노력을 통해 중국의 생명공학 기술과 산업화 수준을 세계 선진국에 도달시키는 것이 기본 목표이다’라고 정리하고 있다. 중국 국가과학기술부 산하 ‘중국 국가 생명공학 발전센터’에서 작성한 이번 마스터플랜에서는 중국이 3단계를 거쳐 2020년 생명공학 기술 강국, 생물산업 대국으로 부상하는 전략 목표를 실현할 것이라고 설명하고 있다.
이번 마스터플랜에서는 향후 20년간 중국 생물산업 발전의 9개 중점분야를 다음과 같이 제시하였다. 첫째, 농업생명공학 기술로 제2차 녹색혁명을 추진한다. 둘째, 의약생명공학 기술로 제4차 의학혁명을 추진하고 중국 민족의 평균수명을 연장한다. 셋째, 공업생명공학 기술로 ‘녹색제조업’ 발전을 추진하고 녹색 GDP를 대폭 증대시킨다. 넷째, 에너지생명공학 기술을 발전시켜 중국의 에너지 부족현상을 해소한다. 다섯째, 환경생명공학 기술로 환경친화적 산업발전을 추진한다. 여섯째, 생물자원의 심층개발을 통해 새로운 생물산업을 육성한다. 일곱째, 해양생명공학기술로 해양생물산업을 발전시킨다. 여덟째, 생물안전과 생물테러 방지기술 연구개발을 추진하여 생물안전보장 시스템을 구축한다. 아홉째, 중의(中醫)와 서의(西醫)를 효과적으로 결합시킨 새로운 의료보건체계를 구축하고 중의약(中醫藥)산업 발전을 추진한다.
![]() 중국의 생명공학 기술 및 산업화
중국의 생명공학 기술 및 산업화
중국의 논벼 교잡종과 형질전환 옥수수, 목화, 유채 등의 연구와 응용기술은 세계 수준이며, 그 중 논벼 잡교기술은 이미 세계 30여 개국에서 널리 사용하는 기술로써 이에 의한 세계 벼 증산량은 3.5여 억 톤 이상이다. 또한 세계 최초로 논벼, 집누에, 흡혈충의 모든 유전자지도를 완성하였고, 체세포 복제소, 복제물고기도 중국과학자에 의해 완성된 주요 성과이다. 의약생명공학 기술은 중국생명공학 연구의 중점분야로 2004년 상반기까지 임상연구 단계에 진입한 생물의약은 약 150여 종에 달하며, 그 중 1/5이 중국 1류 신약으로 비준되었고 인터페론 등 21종의 생명공학 의약품을 생산하고 있다. 또한 유전자 치료, 접종백신, 발효공정 분야에서 괄목할 만한 성과를 얻었는데, 그 가운데서도 에이즈 치료 백신, B형 간염과 형질전환 식물 등 정부차원의 적극적인 투자가 있었던 연구프로젝트는 모두 큰 성과를 얻었다.
중국은 풍부한 생물자원을 보유하고 있다는 장점을 바탕으로 생물산업 발전 속도를 촉진하고 있다. 관련 통계에 따르면 중국에는 동식물, 미생물이 26만 종이 있으며 세계에서 천연자원과 생물다양성이 가장 풍부한 국가 중의 하나이다. 이미 3,000여 종의 질병 근원 미생물 수집에 성공하였고, 농작물 재배에 유용한 천연 생물자원도 32만 종이나 확보하여 그 수치는 단연 세계 제1위를 차지한다. 그밖에 형질전환기술, 단백질공학, 복제기술 등을 포함한 첨단 생명공학 기술은 개발도상국가 중 우위를 차지하고 있으며 일부는 세계 수준으로 평가받고 있다.
특히 2004년에 중국은 생명공학 분야에서 다양한 성과를 이루었다. 2004년 1월 특허를 가진 ‘인간 재조합 p53 선(腺) 바이러스 주사액’이 국가식품감독관리국의 심사비준을 거쳐 공식생산을 허가 받음으로써 중국은 세계 최초의 유전자 치료 약물을 출시한 국가가 되었다. 물론 세계 최초라는 점에선 여러 논란이 있지만 중국은 국가발전개혁위원회의 지원 아래 유전자 치료 약물의 산업화 시범공정을 적극적으로 추진하였다. 현재 광동성 심천시에 유전자 치료 약물을 전문적으로 생산하는 산업화 거점을 구축하고 있어 동 거점이 구축되면 연간 생산액이 30억 위엔에 이를 것으로 전망된다. 그리고 세계에서 제일 먼저 임상연구를 시작한 SARS 백신과 치료형 B형간염 백신 등을 연구 제조하였다. ‘생명의 기원’ 연구분야에서 2004년 6월 중국과학원과 중국공학원 원사대회에서 중국은 현재 수행하고 있는 대륙 시추탐사과학 연구 공정으로 지하2,000m 깊이의 극한 환경 속에서 대량의 미생물들이 생존하고 있으며, 이런 미생물들은 철, 에틸렌 등의 성분으로 생존하고 있다는 사실을 공식적으로 발표하였다. 이번 연구 성과는 중국이 최근 몇 년 동안 진행해 온 원시생명연구 중 가장 중대한 발견으로서 지하 생물권(圈) 및 생명기원 연구 분야의 중대한 성과이다. 그 밖에 ‘고대생물연구’, ‘광합성작용에서 주요단백질 3차원 구조 측정’, ‘세계 최초로 인간의 중대질병에 대항할 수 있는 새로운 면역세포 아군(亞群)’, ‘세계 최초의 식물염색체 불규칙 변이 대규모 발견’, ‘복제양 양양(陽陽) 가족의 4대 세대 육종 성공’, ‘세포 박동폭의 새로운 기작 연구’ 등 다양한 연구 성과를 달성하여 세계적으로 중국의 생명공학 연구수준을 제고시키는데 커다란 역할을 하였다. 중국 전체에는 중앙정부, 유관정부부처 및 지방정부가 지원하는 생명공학 중점연구실이 약 200개 정도 있고, 기술 및 제품 연구 인력은 약 2만여 명으로 추정되며, 많은 대학이 생명공학 분야의 전공을 개설하고 있다.
중국의 생명공학 응용연구 및 산업화는 농업생명공학 기술(형질전환 농작물, 첨단육종과 슈퍼잡교 논벼, 식물조직배양, 생물농약, 사료생물기술, 가축용 백신)과 의약생명공학 기술(생명공학 약물, 백신, 혈액제품, 생화학품, 진단시약, 조직장기공학)이 중심이며, 중약(천연물)은 중국 정부가 중화민족의 자부심을 가지고 추진하는 생명공학 산업분야이다. 이 밖에 105(10차 5개년 계획) 기간에 ‘기능성 게놈과 바이오칩(Biochip)’이라는 주요 과학기술 전문프로젝트의 시행을 통해 바이오칩이 초보적인 산업규모를 갖추도록 하였고, 인간의 주요 생명기능 및 간암, 위암, 폐암, 식도암, 백혈병, 고혈압 등 질병과 관련된 신규 유전자 1,500개를 성공적으로 연구하였다. 그 중에는 향후 개발 전망이 있는 기능성 유전자 160개, 신제품으로 개발되어 사용되는 유전자 24개, 지적재산권을 보유하고 기업이나 약물연구기관과 공동으로 약물표적이나 생명공학 의약품 전 단계 개발을 진행하고 있는 유전자 8개가 포함되어 있다.
최근 중국발전개혁위원회는 115(11차 5개년 계획, 2006~2010)기간에 진행할 발전계획을 편성하고 관련 생물산업정책을 준비 중이며, 40억 위엔의 국가자금을 조성하고 약 400억 위엔을 사회투자로 조달받아 400여 건의 생명공학 기술 산업화 프로젝트를 실시하고 바이오칩, 줄기세포, 조직공학 등 20여 개 국가공정연구센터 건설사업과 농작물 유전자원 중대과학공정 등을 추진하고 있는 것으로 알려지고 있다.
이러한 기술성과가 지속적으로 산업화됨에 따라 2000년 이후 첨단 생명공학 산업은 연간 3배로 성장하고 있으며, 2004년 중국 전체 생물산업은 총생산량 4,200억 위엔을 달성하였다. 그러나 연구개발 기술에 비하여 생명공학 기술의 산업화는 상당히 미흡한 실정이다. 중국 14억의 인구가 식량을 섭취하고 5억 정도가 보건식품을 소비하고, 1.4억의 인구가 환자이며 새로운 품종의 농작물을 재배할 농경지가 20억 무(1畝=66평)나 되는 등 중국은 세계에서 가장 큰 생물제품 소비시장을 보유하고 있어 향후 발전 가능성이 매우 크다. 중국 생물산업에 관한 예측연구에 의하면 생물의약, 형질전환제품, 기능성 식품, 바이오센서 등 10대 세부 생물산업에서 150개 항목을 연구 개발하였고, 연간 총생산액이 15,000억 위엔으로 추정되며, GDP의 15%를 차지한다고 한다.
중국 내 첨단 생명공학 관련기업은 약 500여 개이고 종사인력은 약 5만여 명으로 집계되며, 북경과 상해, 심천 등에 이미 20여 개의 생명공학 육성지구가 설립되어 있다. 중국 과학기술부 쉬관화(徐冠華)장관은 이러한 중국의 생명공학이 향후 15년 동안 더욱 커다란 발전 잠재력을 보유하고 있고, 중국의 생명공학 연구개발은 식량안보, 인구건강, 환경증진, 에너지 안보에 주력하고 경제사회 개발의 병목현상을 해결할 수 있으며, 생물비료 개발, 감염질환 진단기술 개발, 대기오염 개선 등을 추진할 것이라고 발표했다. 또한 최근 중국 정부가 공식발표한 생물산업정책에 의하면, 중국 정부는 북경 천진일대와 장강 삼각주지구, 주강 삼각주지구 등 3군데에 종합적인 생물산업기지 발전을 점차적으로 추진할 것이며, 동북지구, 중서부지구내 전문성을 보유한 생물산업기지의 발전도 동시에 추진할 계획이라고 한다.
![]() 중국의 생명공학 투자현황
중국의 생명공학 투자현황
현재 중국에서 진행 중인 국가과기공관계획, 863계획, 973계획, 자연과학기금, 횃불계획 등 여러 과학기술 및 산업발전계획은 모두 첨단 과학기술 가운데 생명공학을 우선적 발전분야로 하고 있다. 하지만 중국정부가 지원하는 연구개발 투자예산은 아직까지 상당히 미흡한 실정으로 GDP의 0.5~1.0% 수준에 불과하다. 이는 개발도상국인 인도보다도 낮은 수치로 해외 선진국의 생명공학 기업 1개 업체의 연구개발비에도 미치지 못한다고 한다. 2003년 기준 중국의 GDP는 13,000억 달러이고 그중 단지 5%인 650억 달러가 의료 및 건강사업에 투입되고 있다. 중국의 GDP가 증가함에 따라 의료위생과 건강사업에 투자되는 비율도 점차 증가하고 있으며, 2010년까지 관련연구기관의 예산은 연간 위생과 건강사업 총 투자액의 1%이며 약 50~60여 개 연구소 및 연구센터로 확대될 전망이다. 연구기관의 외부과제 연구개발비는 연구원 총 예산의 2/3 수준이 되도록하고 약 4,000여 과제를 지원할 계획이다. 이는 중국 생물의학 연구발전에 상당한 원동력이 될 것이다. 하지만 선진국이나 상위 개발도상국에 비해 규모가 작은 정부지원금은 결국 중국의 생명공학 발전을 저해하는 주요 요인으로 작용하기 때문에 중국 정부와 각 성(省) 정부는 화교자본을 포함한 해외투자자본 유치를 위해 관련 법률을 제정하는 등 정책적으로 적극 장려하여 자금부족의 취약점을 보완하고 있다.
또한 중국은 현대과학 연구시스템을 갖추기 위하여 국가연구기관을 개혁함으로써 새로운 형태의 생명공학 연구기관을 설립하고 있다. 예를 들면 중국 과학기술부와 국가발전개혁위원회가 공동 설립한 북경생명과학연구소는 세계 수준의 중국 생명공학 기초분야를 연구 중이며, 2003년 7월에 개원한 중국과학원 광주생물의학건강연구원은 중국과학원과 광동성 정부, 광주시 정부가 공동으로 설립하여 생물의학연구 및 산업화를 촉진하고 있다. 최근에는 상해시 정부도 유사한 연구기관을 설립할 계획이며 이러한 연구기관은 지역의 우수 조건과 발전 추세에 부합하고 현대과학 연구모델 구축을 위한 새로운 시도로 인식되고 있다.
중국은 32개의 성(省)과 자치구로 구성된 지방자치 중심국가로서 각 지역별로 대규모 생명공학 투자사업을 진행하고 있다. 대표적인 사례로 북경의 중관촌 생명과학단지 조성사업과 해남성 해구(海口) 제약밸리 건설사업 등이 있고, 총 5,000여만 위엔을 투자한 광주(廣州)시 생물 첨단기술 산업화 시범기지가 2006년에 완공될 계획이다. 또한 심천시, 석자강시, 장춘시 등 중국 최대규모의 3대 생물산업기지와 난링시 영장류 실험동물기지 등 크고 작은 시설투자도 활발히 진행되고 있다.
최근 세계의 유수 다국적기업들은 중국을 ‘글로벌 공장’에서 ‘글로벌 연구중심’으로 인식을 전환하면서 신약 연구개발 관련 공동 연구과제를 추진하고 있다. 이는 중국의 의약시장이 연간 15% 이상 발전하고 있고 의약시장 매출액이 2005년 140억 달러, 2010년 240억 달러에 달할 것으로 예상하고 있기 때문이다. 대표적인 사례로 중국과학원 상해약물연구소와 Norvatis는 2001년에 1차, 2004년에 2차 신약개발 연구협정을 체결했고, Immusol은 2005년 8월 북경대학과 치료에 효과가 있는 화합물에 대해 성분결정, 특성분석에 관한 연구를 공동으로 진행하는 협정을 맺었다. 중국에는 이미 Roche, GSK 등 세계 20대 다국적 제약업체들이 중국 현지에 연구개발센터를 설치하였으며 최근 ABB도 중국 내 생명공학 분야에 진출할 것이라고 발표하였다.
중국의 권위 있는 전문가는, 중국은 향후 10년 내에 농업 및 의약생명공학 기술과 관련 산업분야에서 세계 최고의 생명공학 기술 강국이 될 수 있고, 이 과정에서 약 1,000억 위엔의 투자가 필요할 것이라고 전망하였다. 세계 생명공학의 강국으로 성장하고자 하는 중국의 원대한 목표는 앞으로 생명공학 분야에 대한 중국 정부의 관심과 투자가 증폭될 것을 명확히 보여주고 있다.
<표 2-4-4-1> 중국의 생명공학 분야 분류 | ||
분류 | 세부 연구분야 | 산업화 분야 |
기초생명공학 | 유전체학(genomics, 지노믹스) | 유전자 표적기술 등 (gene targeting) |
기능유전체학(functional genomics) | ||
단백질체학(proteomics, 프로테오믹스) | ||
구조유전체학(structural genomics) | ||
생물정보학(bioinformatics) | ||
의약생명공학기술 | 생명공학의약품 및 백신 | 생명공학의약품, 백신 혈액제품, 생물화학약품 진단시약, 조직/기관공학 등 |
생물치료 | ||
농업생명공학기술 | 유전자변이식물 | 유전자변이농작물 현대육종과 슈퍼 교잡벼 식물조직배양 생물농약 생명공학기술 사료제품 동물(獸)용 백신 등 |
슈퍼 교잡벼 | ||
분자표지(mark) 보조육종기술 | ||
동물생물반응기(bioreactor) | ||
동물배아이식/체세포복제기술 | ||
동물분자육종기술 | ||
동물생명공학제품/사료생물첨가제 | ||
미생물비료 | ||
공업생명공학기술 | 중요공업 생명공학제품 | 아미노산 발효유기산 촉매제 등 |
생물재료 | ||
생물에너지 | ||
생물자원과 생물안전 | 환경생명공학기술 | 관련 기술의 응용 |
해양생명공학기술 | ||
생물안전(biosafety) | ||
생태안전 | ||
식품안전 | ||
<표 2-4-4-2> 중국의 생명공학 및 생물산업 포럼(2005.9)에 제시된 전략목표 | ||
단계 | 기간(년) | 세부목표 |
1단계 (기술축적단계) | 2005~2010 | ◦생명공학 연구개발 전체 수준을 개발도상국 중 제일 높은 수준으로 도달시킴 ◦논문, 특허 수 세계 6위 달성 ◦생물산업 총 생산액 8,000억 위엔 달성 |
2단계 (산업발전단계) | 2010~2015 | ◦생명공학 연구개발 전체 수준을 세계 선진수준으로 도달시킴 ◦논문, 특허 수 세계 3~4위 달성 ◦생물산업 총 생산액 15,000억 위엔 달성 |
3단계 (지속발전단계) | 2015~2020 | ◦생명공학 연구개발과 산업화 전체 수준을 세계 선진 국가 수준에 도달시킴 ◦세계 생명공학 및 기술분야 최우수 인재를 유치하며, 세계 생명공학 연구 혁신의 중심지로 성장 ◦생물산업 총생산액 25,000~30,000억 위엔 달성 및 GDP에서 차지하는 비율 7~8%으로 향상 ◦생명공학 산업을 중국의 기간산업으로 육성 |

■ 제 3장 국가 생명공학 육성 현황 제 1절 국가 생명공학 육성 정책 |
![]() 생명공학 종합조정과 발전방향(과학기술혁신본부)
생명공학 종합조정과 발전방향(과학기술혁신본부)
가. 새로운 과학기술행정체계의 도입
우리나라는 지난 40여 년간 세계에 유례 없는 고도성장으로 2003년 현재 세계 11위의 경제대국으로 발돋움하였다. 이러한 고속성장은 정부의 주도적인 경제발전 계획과 양질의 풍부한 노동력, 저리의 외자도입과 외국기술의 모방ㆍ개량에 힘입은 것으로, 추격형 발전전략의 대표적인 성공사례로 언급되고 있다.
그러나, 아직까지는 전반적으로 원천기술 개발역량이 미흡한 상황이며, 지속적인 정부 연구개발 투자규모의 확대에도 불구하고 절대규모로는 미국의 1/18, 일본의 1/8에 불과하다(2005년). 또한, 과학기술인력 양성의 면에 있어서도 양적인 성장을 이루었으나 질적인 수요는 충족시키지 못하고 있으며, 이공계 기피현상이 사회 이슈가 되고 있다.
이러한 상황을 극복하고 1인당 국민소득 2만 불 이상의 선진국가로 성장하기 위하여 우리의 위상을 정확히 파악하여 최적의 성장전략을 도출하고자 기술혁신을 국가전체차원에서 달성하는 국가혁신체계(National Innovation System) 구축을 추진하고 있다. 이는 첨단기술과 지식을 바탕으로 질적인 성장을 추구하는 「혁신주도형 경제」로의 전환을 목표로 하는 것으로 새로운 성장동력 산업을 발굴하고 기존 산업을 고도화하고자 하는 것이다.
작년에 새롭게 개편된 과학기술행정체제는 이를 위한 노력의 일환으로 국민소득 2만 불 시대를 열기 위하여 과학기술을 중심에 놓고 과학기술과 관련된 산업·인력 등 미시경제의 질적 향상을 통해 거시경제의 기초를 튼튼하게 발전시키려는 것이다. 이러한 개편으로, 과학기술부가 부총리 부서로서 과학기술정책을 국가목표에 따라 일관성 있고 효율적으로 추진할 수 있는 기반이 마련되었으며, 과학기술혁신본부가 출범되어
|
<그림 3-1-1-1> 新과학기술행정체계 출범에 따른 생명분야 부처간 역할 |
국가과학기술위원회가 실질적인 조정능력을 발휘할 수 있게 되었다. 또한, 과학기술혁신본부가 과학기술혁신정책과 관련된 산업·인력·지역 혁신정책을 종합·조정하며, 국가 연구개발 예산을 중장기적인 국가 발전 목표에 맞게 조정·배분하는 역할을 수행하게 되었다. 지난 40여 년간 유지되어온 과학기술행정체계를 혁신적으로 바꾼 것으로 우리나라 경제발전전략의 근본적 변화를 의미하는 것이다. 과학기술혁신본부는 국가 전체 연구개발 투자의 효율성 제고라는 목표를 위해 정책 조정기능, 조사·분석·평가 기능 및 연구개발 예산조정·배분 기능을 중점적으로 수행해 나가고 있다. 생명공학 분야도 새로운 과학기술행정체계에 따라 부처간의 역할 분담이 이루어지고 과학기술혁신본부가 종합 조정기능을 수행하도록 역할이 부여되었다<그림 3-1-1-1>.
나. 생명공학분야의 예산조정·배분 절차의 변화
이러한 新과학기술행정체계의 출범에 따라 생명공학을 포함한 분야의 예산 조정·배분 과정도 연구개발 예산을 보다 효율적으로 활용될 수 있도록 변화되었다.
매년 1월 말까지 각 부처로부터 생명공학 분야 사업의 중기사업계획서를 제출받아 생명공학 분야의 전문가들로 구성된 「생명분야 전문위원회」의 검토의견과 국가 전략목표 등을 고려하여 사업별 지출한도를 설정하게 된다. 그 후 다른 기술분야의 지출한도와 종합하여 전체 연구개발 예산 지출한도를 설정하여 기획예산처와 협의하여 부처별 지출한도를 설정하게 된다. 이를 토대로 각 부처는 사업별 예산요구서를 작성하여 5월 말까지 제출하면 6월에 전문위원회의 기술적인 검토와 7월 중순까지의 「연구개발예산심의회」를 거쳐 대략적인 사업 예산을 정한 후, 「국가과학기술위원회」 산하 기획·예산조정전문위원회 및 운영위원회에서 검토하게 되며 최종적으로는 「국가과학기술위원회」에서 예산조정·배분(안)을 확정하여 기획예산처로 통보하게 된다. 기획예산처는 그 결과를 반영하여 차년도 국가 예산(안)을 편성하게 되는 것이다<표 3-1-1-1>.
<표 3-1-1-1> 변경된 연구개발 예산 조정·배분 절차 | |
절 차 | 일 정 |
중기사업계획서 접수 | 1월말 |
연구개발 예산 지출한도 설정을 위한 전문위원회 개최 | 2월말~3월초 |
부처별 지출한도 결정 후 각 부처와 예산처에 통보 | 3월말 |
부처별 사업요구서 접수 | 5월말 |
사업설명회 및 전문위원회 검토 | 6월초~6월말 |
전문위원회 심의 의견서 작성 | 6월말 |
연구개발예산심의회 심의 | 7월초~7월 중순 |
국과위 기획·예산조정전문위원회 | 7월말 |
국과위 운영위원회 | 7월말 |
국과위 연구개발 예산 조정·배분(안) 확정 | 8월말 |
이러한 예산조정·배분 절차의 변화는 조사·분석·평가 기능의 강화와 동시에 진행되었다. 사업(Program) 차원의 평가는 1999년 2월부터 국가과학기술위원회에서 매년 실시해 왔으나 제한된 시간과 인력의 제약으로 심층평가에 애로가 있었다. 올해 새로운 新과학기술행정체계 상에서는 이러한 애로사항을 해결하기 위하여 기존의 조사·분석·평가 결과가 연구개발 예산 조정·배분에 반영될 수 있도록 사업목적별 평가소위원회와 예산 조정·배분을 위한 전문위원회 위원을 일정 부분 공유토록 하였다. 또한, 기술분야별 전문위원회의 기술검토 의견을 사업목적별 평가소위원회에서 검토토록 하여 좀 더 심도있는 평가가 가능하도록 하였다<그림 3-1-1-2>.
|
<그림 3-1-1-2> 국가 연구개발 예산조정·배분 체계 |
또한, 과학기술혁신본부를 중심으로 생명공학 분야 연구개발 사업들을 핵심기술 분야별로 분류하고 상시적으로 분석·검토하는 체제가 운영되고 있으며, 향후 조정·배분된 예산의 투입 성과에 대한 기술적인 검토가 이루어 질 예정이다.
변화된 생명분야 연구개발 예산의 조정·배분 절차를 통해 미래 국가경쟁력 확보를 위한 국가 발전전략과 연구개발 예산 간의 연계가 강화되었다.
다. 생명공학 분야의 중요한 조정 사례
新과학기술행정체계의 출범으로 생명공학 분야의 새로운 변화는 국가 발전전략에 맞춘 연구개발 예산의 조정·배분과 정책 조정기능의 강화를 들 수 있다. 많은 부처들이 의욕적으로 다양한 생명공학 관련 연구개발사업을 추진해 온 결과로 현재까지 생명공학 분야가 괄목할 만큼 성장해 온 것은 누구도 부정할 수 없는 사실이나, 일부 특정 분야에서 서로간의 업무 협조가 원활하지 못한 경우가 발생한 예들이 있는 것도 엄연한 현실이다. 생명공학 분야가 매우 다양하고 연구개발사업이 빠른 속도로 확대되고 있는 만큼 조정의 필요성도 증가되어 왔다. 생명공학 분야에서 범부처간 조정이 필요한 문제가 발생하는 경우, 혁신본부를 중심으로 관계부처, 민간 전문가 등의 의견을 수렴하여 해결방안을 수립하고 이를 과학기술관계장관회의 또는 국가과학기술위원회 등의 심의기구를 통하여 확정하여 오고 있다. 또한, 예산의 조정이 필요한 사항인 경우에는 연구개발 예산 조정·배분 절차에 적극적으로 반영함으로써 정책 목표를 구체적으로 실현할 수 있도록 조치하고 있다.
혁신본부는 2005년 5월 개최된 제7회 과학기술관계장관회의에서 바이오관련 8개 부처와 공동으로 “바이오 연구개발의 효율적 추진방향”을 제시한 바 있고, 이어 11월의 제12회 과학기술관계장관회의에서는 바이오 연구개발에 대한 범부처적 종합조정‧기획‧평가의 추진과 관련 부처간 차별적 협조‧연계시스템의 효율화를 위하여 “바이오 연구개발의 효율적 추진전략”을 상정‧확정한 바 있다. 상기 안건에서는 바이오 ‘연구개발’과 ‘산업화 촉진’ 및 ‘국민적 인지’ 등 3대 중점분야의 설정과, 1) 바이오 연구개발에 대한 정책 조정체계의 강화, 2) 세계적 선도‧유망분야에 대한 집중 투자, 3) 바이오 예산운용 방안의 제시와 성과평가체계의 도입, 4) 바이오 산업화 촉진을 위한 전략 수립, 5) 부처간 연계강화를 통한 전주기 인프라의 확충, 6) 신산업 창출을 위한 정책영향 분석 및 환류체계 정비, 7) 바이오에 대한 국민적 인지 확대 등 7대 추진전략이 구체적으로 제시되었다.
이러한 조정의 구체적인 사례로는 「생물·유전자원 국가관리방안」 마련, 식품 의약품 안전성 확보를 위한 식품의약품안전청 예산 확대, 국가적인 현안사항인 소나무재선충 방제기술 개발 관련 예산 확대 등을 들 수 있으며, 현재는 범부처 신약개발 연구개발 총괄조정전략 등을 수립하고자 노력하고 있다.
생물·유전자원 국가관리방안은 국가간 생물자원 확보 경쟁 심화 등 국내외 환경변화에 적극적으로 대응하여 생물자원의 국가자산으로서의 가치를 증대시키기 위하여 현재 각 부처에서 분산 관리하고 있는 생물자원의 효율적 보존·활용 및 정보관리 체제를 구축하고자 마련되었다. 개별 실물 부문, 개별정보 부문 관리는 각 부처가 현 체제로 유지하고, 종합관리는 각 부처 관계자로 「국가생물유전자원종합관리위원회」를 구성하여 과학기술혁신본부에서 담당하도록 조정하였으며<그림 3-1-1-3>, 「국가생물자원정보관리센터」 구축, 「생명공학육성법」 개정, 부처별 생물자원 해외유출 방지 법규 보완 등을 추진하고 있다.

<그림 3-1-1-3> 국가생물유전자원 종합관리 방안 모식도
또 다른 조정 사례로는, 식품 의약품 안전성 확보를 위한 식품의약품안전청의 연구개발 예산 확충을 들 수 있다. 2005년도 식품의약품안전청의 연구개발 예산은 444억 원이었으나 2006년 정부예산안은 546억 원으로 조정되어 예산 요구가 이루어졌다. 이는 전년대비 약 23% 증가로서 2006년 전체 국가 연구개발 예산 평균증가율인 15%를 훨씬 상회하는 수준이다. 이러한 획기적인 예산의 증가는 삶의 질 향상에 대한 국민의 높은 요구수준을 적극적으로 반영하기 위한 안전성평가 기술개발을 지원하기 위한 것으로 전체 생명공학 관련 연구개발사업들에 대한 기술적인 검토를 바탕으로 조정한 것이기에 가능한 것으로 평가되고 있다.
국가적인 현안과제로 떠오르고 있는 소나무재선충 문제의 해결을 위한 연구개발예산의 대규모 확대도 정책적 목표 달성을 위한 좋은 사례가 될 수 있다. 소나무의 AIDS라고 불리기도 하는 소나무 재선충에 의한 피해는 매우 심각하여, 1988년 우리나라에 처음 유입되어 부산 금정산에서 피해가 발생한 이래, 피해면적이 매년 증가 중이며, 2005년 8월 현재 경북 안동까지 북상, 총 22,525 ha의 산림이 피해를 입었다. 일본의 경우, 1905년 최초 발생, 1977년 특별법을 제정하여 대처하였으나, 현재 소나무 전멸 위기를 맞고 있는 상황이다. 피해의 확산 속도와 규모를 고려할 때, 국가적인 차원의 대처가 필요하여 2006년 연구개발 예산 부처 요구액 9.5억 원(산림청 6.5억 원과 농림부 농림기술개발사업 내 3억 원)을 총 54억 원으로 대폭 증액하도록 조정하였고 국립산림과학원 주관으로 산·학·연·관이 모두 참여하는 사업단을 구성하도록 권고하였다. 현재 농림부와 산림청, 국립산림과학원이 사업단의 구성 및 추진방향에 대하여 논의하고 있는 상황이다.
2005년 2월부터 현재까지 진행되고 있는 범부처 신약개발 연구개발 총괄조정전략 수립은 10~15년의 장기간의 투자와 산·학·연·관 등 다방면에 걸쳐 진행되는 신약개발 특성을 고려하여, 신약개발 전주기에 대한 범부처 추진전략을 수립함으로써 신약 관련 연구개발의 효율성을 제고하고자 하는 목적으로 추진되고 있다. 우리나라 제약 시장규모는 약 10조 원(2003년)으로 세계 10위의 규모이나, 시장규모에 비해 국내 기업수가 과다(약 200개 이상)하며, 연구개발 투자비용이 매출액의 3~5% (선진제약사의 경우 10~20%)로서 대부분의 제약사가 신약개발을 위한 임계규모에 미달하는 것으로 파악되고 있다. 우리나라 신약개발 연구에는 과학기술부 선도기술개발사업부터 연구비 지원이 시작되었다고 볼 수 있다. 그 결과로, 2005년까지 국산신약이 11건(동아제약 스티렌 캅셀 등)개발되었으며, 2004년 팩티브 개발로 세계 11번째 신약개발국이 되었으나, 신약개발이 활성화되지 못하고 있는 상황이다. 이를 해결하기 위하여 2005년 2월 범부처 합의를 통한 효율성 제고방안 협의를 시작으로 신약개발 연구현황 파악, 관련 부처 역할 및 연계방안 논의를 진행 중이다. 생명공학 연구개발의 실용화의 상당한 부분이 신약개발로 귀결된다는 점을 비추어 볼 때, 과학기술부, 산업자원부, 보건복지부 등 주요한 부처들이 국가 전체의 전략을 기초로 효율성을 극대화하는 것이 한정된 연구개발 예산 범위 내에서 신약개발 성공을 가능하게 할 수 있다는 목표 하에 추진되고 있다.
라. 앞으로의 생명공학 분야 종합조정 방향
2005년도가 新과학기술행정체계의 출범 및 정착의 단계라고 한다면 다가오는 2006년도는 성숙의 단계라고 할 수 있다. 많은 기대와 걱정 속에서 탄생한 新과학기술행정체계가 뿌리를 내리고 국민소득 2만 불 달성의 견인차가 되기 위해서는 올해에 갖추어진 제도들이 얼마나 정교하게 자리잡고 효과적으로 작동하는가가 관건인 것이다. 그러한 성숙의 단계에서 가장 필요한 것들 중 하나가 여러 기술분야에서 연구개발 사업들이 좋은 성과를 낼 수 있도록 어떻게 종합조정할 것인가이다. 하루하루가 다르다고 할 수 있는 생명공학의 발전은 우리나라에게는 매우 좋은 기회임과 동시에 위기임을 인식하고 국민 삶의 질 향상과 국민경제 발전을 위해 실질적인 성장동력이 될 수 있도록 매진해야만 할 것이다.
이러한 시대적인 요청에 부응하기 위하여 혁신본부를 중심으로 올해에 이어 범부처 생명공학 정책 종합조정, 생명분야 연구개발예산의 효율적인 조정·배분 등을 강력히 추진해 나갈 것이며, 특히 유전체, 단백질체, 뇌연구, 기초의과학, 질환관련 연구 등의 분야에 대하여 종합적이며 심층적인 분석을 진행할 예정이다.
기초생명과학과 보건의료 분야와 함께 생명공학 분야의 한 축을 이루고 있는 농림분야의 연구개발사업에 대해서도 체계적인 검토와 부처간 협의를 통하여 농림분야의 급격한 외부환경변화에 연구개발이 가장 효과적이면서도 적극적인 대응책이 될 수 있도록 실질적인 발전전략을 수립할 예정이다. 또한, 관련부처와 협의하여 선택과 집중의 원칙하에, 여러 가지 농림분야 중 연구개발의 필요성이 높은 분야들을 파악하여 우선순위를 설정하고 중점투자방향을 도출하여 연구개발예산을 차등적으로 지원하고자 한다.
또한, 빠르게 태동하고 있는 새로운 융합기술 분야에 대하여 세계적인 연구 및 정책 동향을 파악하고 각 부처에서 추진하고 있는 융합기술 분야에 대한 연구개발사업을 분석하여 정책적으로 융합기술 분야에 대한 지원방안을 수립할 예정이다.
마지막으로, 생명공학 분야에서 산업화가 지연되고 있는 원인에 대한 고찰을 통해 연구개발에서 시작하여 산업화 및 재투자로 이어지는 선순환구조를 도출하기 위한 전략을 수립하고자 한다.
![]() 생명공학 연구개발 지원정책(과학기술부)
생명공학 연구개발 지원정책(과학기술부)
가. 개요
우리나라에서 정부 차원의 생명공학 육성은 1982년 과학기술부에서 생명공학을 핵심전략기술로 선정하여 특정연구개발사업으로 지원을 시작하면서부터이다. 이후 1983년 「유전공학육성법」(現 「생명공학육성법」)을 제정하여 정부의 생명공학 육성·지원을 위한 법적 기반을 마련하였고, 1985년 동법을 기반으로 한국과학기술연구원(KIST) 부설로 “유전공학센터”(現 “한국생명공학연구원”)를 설립하여 생명공학의 본격적 육성·지원을 시작하였다.
특정연구개발사업은 선도기술개발사업(G7), 중점연구개발사업, 국책연구개발사업, 국가지정연구실사업(NRL), 21세기프론티어 연구개발사업, 나노-바이오기반기술개발사업 등의 연구지원프로그램으로 지원을 확대하고, 1989년부터 기초분야 육성을 위해 우수연구센타(SRC, ERC), 국가핵심연구센타(NCRC), 기초의과학연구센타(MRC) 등의 연구협력센터를 대학 내에 설치하여 연구를 지원하고 있다.
그리고 1993년 12월 8개 부처가 참여한 생명공학 육성기본계획(Biotech 2000, 1994~2007)을 수립하였고 현재 제3단계(2002~2007) 계획을 수립·운영하고 있으며 매년 시행계획을 수립하고 있다. 이와 별도로 뇌연구촉진을 위해 1998년 「뇌연구촉진법」을 제정하고, 5개 부처를 포함한 뇌연구촉진기본계획(Braintech 21, 1998~2007)을 수립하였으며 매년 시행계획을 수립하고 있다.
나. 연구개발 지원 체제
(1) 법적, 제도적 기반
(가) 생명공학 육성법
과학기술부는 유전공학의 연구기반을 조성하여 유전공학을 보다 효율적으로 육성하고 산업화를 촉진하여 국민경제의 건전한 발전에 기여하기 위하여 1983년 「유전공학육성법」을 제정하였다. 그리고 1995년 생명공학 기술의 발전에 따라 법의 적용범위를 유전공학에서 생명공학으로 확대하는 내용의 제3차 개정을 하고 법률명을 「생명공학육성법」으로 개명하였다.
1997년 첨단 생명공학의 기초인 유전체에 대한 관심과 중요성이 증대됨에 따라 생명공학의 영역에 유전체학을 포함하고, 생명공학 분야의 확대로 관련부처에 해양수산부 및 정통부를 추가하는 등 현재까지 제8차 개정을 하여 추진중이다. 생명공학육성법은 생명공학 연구의 기반을 조성하여 생명공학을 보다 효율적으로 육성·발전시키고 그 개발기술의 산업화를 촉진하여 국민경제의 건전한 발전에 기여하게 함을 목적으로 하며, 주요내용은 생명공학 육성기본계획 및 연차별 시행계획의 수립, 생명공학종합정책심의회 설치·운영, 8개 부처(교육인적자원부, 과학기술부, 농림부, 산업자원부, 정보통신부, 보건복지부, 환경부, 해양수산부)의 생명공학 육성시책의 강구 등이다.
(나) 뇌연구촉진법
뇌연구촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성·발전시키고 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 기여하기 위하여 ’98년 6월『뇌연구촉진법』을 제정·운영하고 있다.
뇌연구촉진법은 뇌연구 촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성·발전시키고 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 기여함을 목적으로 하며, 주요 내용은 뇌연구촉진기본계획 및 연차별 시행계획의 수립, 뇌연구촉진심의회의 구성·운영, 뇌연구 투자의 확대, 5개 부처의(교육인적자원부, 과학기술부, 산업자원부, 정보통신부, 보건복지부) 뇌연구촉진시책 강구 등이다.
(다) 생명공학종합정책심의회, 뇌연구촉진심의회
생명공학육성기본계획을 수립하고, 그 집행 및 조정에 관한 업무를 담당하기 위하여 과학기술부장관 소속하에 8개 부처 차관 및 민간전문위원으로 구성된 “생명공학종합정책심의회”(위원장: 과학기술부장관)를 두어 생명공학에 대한 전반적 계획수립 및 조정을 하고 있다.
또한 뇌연구촉진기본계획수립, 예산확대방안, 뇌연구인력개발 및 교류 등을 심의하기 위하여 과학기술부 소속하에 과학기술부 차관이 위원장이며 4개 부처 국장 및 민간위원으로 구성된 뇌연구촉진심의회를 두어 뇌연구촉진법에서 위임된 사항과 그 시행에 관하여 필요한 사항을 규정함을 목적으로 뇌연구에 관한 중요사항을 심의·조정하고 있다.
(2) 한국생명공학연구원
과학기술부는 「유전공학육성법」에 근거하여 1985년 2월 30명의 연구원으로 KIST 부설로 유전공학센터를 설립하여 유전공학연구를 본격적으로 지원 육성하기 시작하였다. 이후 1990년 12월 KIST 부설 유전공학연구소로 명칭을 변경하였고, 유전공학육성법이 생명공학육성법으로 개정되어 1995년 3월 KIST 부설 생명공학연구소로 명칭을 변경하고, 1999년 5월 기초기술연구회 산하 생명공학연구소로 독립하였다. 2001년 1월 기초기술연구회 산하 생명공학전문연구원으로 승격하였고 현재는 정부출연연구소로 과학기술부에 소속되어 있다. 주요 연구분야는 유전체, 단백체, 세포체, 바이오의약, 바이오소재, 융합생명연구등의 생명공학 첨단연구 및 핵심원천기술의 개발, 보급이며 이외에도 공공지원 등에 950여명(정규직원 300여명, 박사 190여명)의 연구원 및 직원이 종사하며 총예산은 약 980억원이다. 현재 지방 분원 및 오창 제2캠퍼스 건립이 추진되어 명실상부한 국내 최고의 생명공학 전문연구기관으로 위상을 제고키 위해 노력 중이다.
(3) 생명공학육성기본계획 및 시행계획 수립
(가) 생명공학육성기본계획
과학기술부는 「생명공학육성법」 제4조에 근거하여 생명공학 분야의 효율적인 연구개발 촉진을 위하여 ’94년부터 범국가적인 “생명공학육성기본계획(Biotech 2000, 1994~2007)”을 수립하여 시행하고 있다.
<그림 3-1-2-1> 생명공학 육성 추진체계
생명공학전문기관 조정협의회 | ○주관 : 과 기 부 ○협조 : 교육부, 농림부 산자부, 정통부 복지부, 환경부 해양부 | -생명공학종합 정책심의회 | 생명공학육성 기본계획 | ||||||||||||||||||||||||||||
생명공학육성 연도별 시행계획 | |||||||||||||||||||||||||||||||
산 업 계 | 연 구 계 | 학 계 | |||||||||||||||||||||||||||||
○생명공학연구조합 ○바이오산업협회 ○바이오벤처협회 ○기타 관련회사 | ○한국생명공학연구원 ○기타 국·공립 연구기관 | ○대학연구소 ○우수연구센터 (SRC, MRC, NCRC, ERC) | |||||||||||||||||||||||||||||
기본계획의 전체목표는 총16조 924억 원(정부 6조 4,134억원, 민간 9조 6,790억 원)을 투자하여 2000년대 초까지 우리기술을 선진국 수준으로 높이고, 세계 생명공학시장에 우리기술로 도전하여 5% 이상 점유하는 것이다. 현재는 제3단계(2002~2007) 기본계획을 수립하여 추진중이며(1단계: 1994~1997, 2단계: 1998~2001) 총 12조 9,075억 원(정부 5조 1,620억 원, 민간 7조 7,455억원)을 투자할 예정이다. 동계획은 과학기술부 주관으로 교육인적자원부·농림부·산업자원부·정보통신부·보건복지부·환경부·해양수산부 등 8개 부처가 공동 추진하고 있으며 추진체계<그림 3-1-2-1>과 전략은 <그림 3-1-2-2>와 같다.
(나) 생명공학육성 연도별 시행계획수립
과학기술부는 『생명공학육성법』 제5조에 근거하여 관계부처와 합동으로 생명공학육성기본계획에 따른 연도별 “생명공학육성 연도별 시행계획”을 매년 수립하여 시행하고 있다.
2005년도 시행계획의 주요내용은 과기부 등 8개 부처에서 총 7,086억원을 투입하여 기초·융합·보건의료·농축산·식품·환경·해양 생명공학분야, 제조·생물공정분야, 생물정보분야 등의 연구개발과, 국가유전체정보센터 등의 공공 R&D 인프라 구축사업을 지원하며 부처별 연구개발 투자실적 및 계획은 <표 3-1-2-1>과 같다.
다. 주요 연구개발 프로그램
(1) 기초과학연구사업
<표 3-1-2-1> 부처별 연구개발 투자실적 및 계획 | ||||||||||
부처 연도 | 구분 | 과기부 | 교육부 | 농림부 | 산자부 | 복지부 | 정통부 | 환경부 | 해양부 | 총계 |
2004년도 실 적 | R&D | 1,893 | 233 | 589 | 632 | 576 | 88 | 189 | 46 | 4,246 |
인프라 | 154 | 0 | 159 | 652 | 743 | 27 | 17 | 18 | 1,770 | |
계 | 2,047 | 233 | 748 | 1,284 | 1,319 | 115 | 206 | 64 | 6,016 | |
2005년도 계 획 | R&D | 2,158 | 264 | 609 | 801 | 686 | 102 | 195 | 62 | 4,877 |
인프라 | 167 | - | 183 | 1,088 | 692 | 40 | 18 | 21 | 2,209 | |
계 | 2,325 | 264 | 792 | 1,889 | 1,378 | 142 | 213 | 83 | 7,086 | |
증가율(%) | - | 13.6 | 13.3 | 5.9 | 47.1 | 4.5 | 23.5 | 3.3 | 29.7 | 17.8 |
대학 등의 기초분야 연구에 대한 지원사업으로 특정기초연구지원, 창의적연구진흥사업, 기초의과학연구센터(MRC), 국가핵심연구센터(NCRC), 과학연구센터(SRC), 공학연구센터(ERC) 등이 있으며, 2005년 생명공학분야에 약 639억 원을 지원하고 있다.
(가) 특정기초연구지원사업
창의성 높은 이공계 분야의 기초연구 및 인접 인문사회과학분야와의 학제간 연구를 3인 내외의 연구원이 공동 수행하고, 우수연구인력 양성기반을 조성하기 위하여 과제당 연간최대 1.2억 원의 연구비를 최장 5년간 지원하는 사업이다. 2005년도 생명공학 분야에 약 247억 원을 지원하고 있다.
(나) 창의적연구진흥사업
창의적연구진흥사업은 차세대연구자를 발굴하여 세계적인 과학자로 집중 육성함으로써 기초연구 역량을 강화하고, 나아가 핵심·원천기술 및 미래 신산업 창출의 토대를 마련하기 위하여 매년 5~8억 원씩 9년간 지원하는 사업이다. 2005년도 생명과학 분야에는 102억 원을 지원하고 있다.
(다)기초의과학연구센터(MRC: Medical science and engineering Research Center)
생명공학과 임상의학에 공동으로 활용 가능한 기초의과학 분야 중 대규모로 장기간 연구개발이 필요한 분야에 대한 연구개발 및 기초의과학 전공인력양성을 위한 거점을 설립·운영하기 위하여 2002년부터 시작하여 최장 9년간 지원하는 사업이다. 2005년 현재 18개 센터에 64.5억 원을 지원하고 있다.
(라) 국가핵심연구센터(NCRC)사업
미래지향적 융합과학기술분야에서 지식과 경쟁력을 창출할 수 있도록 학제적 융합연구를 유도하고 전문인력 양성을 위해 2003년부터 연구센터를 설립·운영하고 있다. 2005년도 생명공학분야에는 60억 원을 지원하고 있다.
(마) 우수연구센터(SRC: Science Research Center, ERC: Engineering Research Center)
우리나라의 기초연구 발전과 대학 연구 활성화를 위하여 선도적인 역할을 담당할 국제수준의 우수연구센터 육성을 목표로 연구기반 및 잠재력이 우수한 대학을 거점으로 목표 중심의 연구과제 및 연구집단을 구성하여 세계적인 선도과학자군으로 육성하고 있다. 2005년도 생명공학 분야에는 165억 원을 지원하고 있다.
(2) 특정연구개발사업
21세기 신산업을 선도할 미래 원천·핵심기반기술 및 공공복지 기술 등의 전략적 개발을 통하여 국가 경쟁력 강화와 국민 삶의 질 향상에 기여하기 위한 연구개발 프로그램으로 1982년 처음 지원을 시작하였다. 현재 생명공학분야의 지원 프로그램으로는 나노·바이오기술개발사업, 차세대바이오신약·장기사업, 21세기 프론티어연구개발사업, 국가지정연구실사업(NRL) 등이 있으며 2005년 현재 약 1,398억 원을 생명공학 분야에 지원하고 있다.
(가) 나노·바이오기술개발사업
나노·바이오연구개발사업은 21세기 신산업·신기술 혁명을 주도할 나노 및 바이오 분야의 핵심원천기반기술을 개발하고 관련 인프라를 확충하기 위한 중장기 연구개발사업으로 대형연구개발사업의 인큐베이터 역할을 수행한다. 현재 생명공학 분야는 바이오디스커버리사업(분자 및 세포기능, 대사체 분석 및 기능연구 등), 바이오퓨전사업(시스템생물학, 생물정보학, 바이오전자 등), 바이오인프라구축사업(국가유전체정보센터, 유전자원지원·활용, 안전성평가기술개발 등), 바이오코웍사업(유용식물소재추출물연구) 등이 있으며, 2005년도에는 약 492억 원을 지원하였다.
(나) 차세대바이오신약·장기사업
소득 2만 불의 선진경제로 도약하기 위해서 우리에게 강점이 있고 부가가치가 큰 바이오신약·장기 분야에 핵심제품을 개발하는 사업으로 5년내 핵심기술의 특허출원 및 제품화가 가능한 분야 위주로 최종목표와 사업범위를 구체화하여 추진하며, 장기복제이식기술개발, 단백질칩기술개발, 지능형약물전달시스템개발, 면역기능제어기술개발 등 4개 분야의 핵심제품을 개발하며 2005년도에는 100억 원을 지원하였다.
(다) 21세기 프론티어연구개발사업
선진국과 경쟁시 비교우위가 있다고 판단되는 기술분야에 선택·집중 투자하여 세계 초일류 기술로 발전시키기 위한 장기 대형 연구개발사업으로 10년간 매년 100억 내외를 지원한다. 현재 생명공학 분야 사업은 인간유전체기능연구, 자생식물이용기술, 작물유전체기능연구, 생체기능조절물질개발, 미생물유전체활용기술, 세포응용연구, 단백질체학이용, 뇌기능활용 및 뇌질환치료기술개발 등 8개 사업이 있으며 2005년도에는 약 646억 원을 지원하였다.
(라) 국가지정연구실사업(NRL)
NRL은 기술의 기반성·공공성을 유지하고 있는 소규모 연구실을 집중 지원하여 탁월한 연구실로 성장시킴으로써 산업경쟁력 향상에 기여하기 위한 중기사업으로 매년 연구실당 2~3억 원을 5년간 지원하며, 현재 생명공학 분야에는 2001~2003년 선정 40개 연구실, 2004년 선정 14개 연구실, 2005년 선정 19개 연구실 등 73개 연구실을 지원하고 있으며, 2005년도에는 약 160억 원을 지원하였다.
라. 추진방향 및 발전과제
(1) 생명공학 기술개발사업간 연계성 강화
생명공학 분야 나노-바이오기술개발사업, 21세기 프론티어연구개발사업, 차세대성장동력사업간의 연계성을 강화하여 생명공학 분야의 연구활성화를 도모하고, 효율적인 연구개발을 추진해 나갈 계획이다.
(2) 대국민 홍보 강화
생명공학은 생명체를 다루는 학문이기에 국민에게 생명공학을 알리고 국민의 의견을 수렴하는 절차가 필요하다. 과학기술부는 생명공학의 미래 비전을 제시하여 국민의 인지를 확보하고, 한편으로 복지부, 산자부 등 관계부처와 협력하여 배아줄기세포연구, 유전자변형생물(LMO) 등과 관련한 법적, 제도적 기반을 국제적 수준으로 제고하기 위한 노력을 중점 추진해 나갈 계획이다.
(3) 해외협력강화
국내 생명공학 분야의 기술수준을 빠르게 제고하고 세계적 수준의 생명공학산업 육성을 위해서는 해외 우수연구소를 적극 유치하여 선진국의 우수한 연구기법을 습득하고, 생물다양성이 풍부한 해외 지역에 생물자원공동연구센터를 설치하여 현지의 생물자원을 체계적으로 수집함으로써 다양한 생물소재를 확보하고, 해외의 우수 연구자와 공동연구로 기술을 이전받을 수 있는 해외협력을 강화해 나갈 예정이다.
![]() 생명공학 산업 육성정책(산업자원부)
생명공학 산업 육성정책(산업자원부)
산업자원부는 우리나라 생명공학 산업의 경쟁력 강화를 위해 2005년 7월 「BIO 산업발전을 위한 3·12 프로젝트」를 수립하여 추진하고 있다. 우선, “초일류 기업의 발굴, 전통 바이오의 세계상품화로 2010년 수출 100억 불 달성”이라는 정책비전을 제시하고, 이를 달성하기 위해 첨단 생명공학의 상품화를 촉진하는 산업화 기술개발, 지역혁신과 세계시장 진출을 견인하는 인프라 구축, 생명공학산업 기업경영의 체감여건 개선의 3대 정책목표를 설정하고 이를 달성하기 위한 실천과제로써 12대 정책과제를 설정하여 추진하고 있다.
가. 산업화기술개발 드라이브
(1) 생명공학 산업화 기술발전 로드맵 작성
생명공학 산업 세부영역별 국내외 시장규모 및 발전가능성 조사, 제품 세부개발단계별 개발기술의 특성 및 국내외 개발동향 등을 파악하여 생명공학 산업발전을 견인하는 요소기술(Tool)과 핵심기반(Platform)기술의 현황 및 발전방향을 제시하고, 정부가 우선적으로 개발할 과제를 발굴하여 지원할 계획이다.
(2) 산업화 중심의 바이오연구개발 집중 투자
’05년 중장기 및 단기 기술개발과제 118개 사업에 총 695억 원을 지원하고 있으며, 연구개발중 중장기과제는 의약품, 바이오칩, 정보기술 및 생명공학기술 융합기술개발 중심이며, 단기과제는 의약품, 소재, 식품, 진단기기, 의료장비 등 다양한 분야를 포함한다.

<그림 3-1-3-1> 생명공학 산업발전전략 정책 로드맵
(3) 바이오스타 창출을 위한 연구개발 프로젝트 추진
전 세계 챔피언급의 스타 제품 개발을 통해 선도 기업의 세계시장 성공사례를 제시하기 위해 생명공학산업의 특성을 반영한 “Bio-Star 프로젝트”를 ’05년 신규사업으로 추진하였다. 특히 바이오스타 사업은 전임상 및 임상초기 비용 등 세계시장 진출이 가능한 범위의 자금을 지원(과제당 연간 10~15억 원)하여 블록버스터급 신약이 창출될 수 있도록 할 계획이며, 금년에는 5개 기업이 선정되어 연구개발을 지원받고 있다.
<표 3-1-3-1> 4개 항목 13개 기술분야(중장기 기술개발) | |
구 분 | 기술분야 |
바이오물질 (4개 분야) | ① 단백질제품(의약용/산업용), ② 소분자 의약품 ③ 산업용효소(아미노산/탄수화물 등), ④ 바이오소재 |
응용기반기술 (2개 분야) | ⑤ 약물전달체계(지속성주사제/경구제제 등) ⑥ 실용화기반기술(QC/QA/Scale-up/HTS/안전성평가 등) |
바이오융합기술 (4개 분야) | ⑦ 바이오칩(DNA 칩/단백질 칩/Lab-on-a-chip 등) ⑧ 생물정보학기술(생물정보학/HW/SW/활성분석 등) ⑨ 단백질체학관련기술(단백질 구조/기능 관계분석 등) ⑩ 초고감도 High Contents Screening System 기술개발 |
생체치료기술 (3개 분야) | ⑪ 유전자치료기술 개발(특이질환 유전자전달체 개발 등) ⑫ 세포치료기술 개발(항암치료용 세포치료제 개발 등) ⑬ 면역조절치료제 기술개발 |
<표 3-1-3-2> 24개 바이오센터 구축현황
지역 | 성격 | 품목 | 지원 종료 | 지역 | 성격 | 품목 | 지원 종료 | ||
대전 | 1 | BVC* | 의약 | ’03년 | 경남 진주 | 1 | BVC* | 화학소재 | ’03년 |
2 | 지역센터 | 바이오 | ’07년 | 2 | 지역센터 | 화학소재 | ’08년 | ||
충남 논산 | 지역센터 | 동물자원 | ’07년 | 대구 | 1 | 지역센터 | 식품 | ’08년 | |
충북 | 오창 | 지역센터 | 보건의료 | ’07년 | 2 | 지역센터 | 한방 | ’08년 | |
영동 | BVC* | 식품 | ’05년 | 경북 | 울진 | 지역센터 | 해양, 환경 | ’07년 | |
제천 | 지역센터 | 전통의약 | ’07년 | 경북 | 안동 | 지역센터 | 건강산업 | ’07년 | |
전북 전주 | BVC* | 식품 | ’03년 | 강원 춘천 | 1 | BVC* | 바이오 | ’03년 | |
전남나주 | 1 | BVC* | 생물 | ’03년 | 2 | 지역센터* | 바이오 | ’07년 | |
2 | 지역센터 | 식품 | ’07년 | 경북 | 상주 | BVC* | 식품 | ’05년 | |
전남 | 화순 | 지역센터 | 농업, 백신 | ’07년 | 강원 | 강릉 | 지역센터 | 해양 | ’07년 |
부산 | 1 | BVC* | 해양 | ’03년 | 제주 | 1 | BVC* | 식품 | ’05년 |
2 | 지역센터 | 해양 | ’08년 | 2 | 지역센터* | 향장 | ’05년 | ||
*표시 11개 센터는 ’05년 6월말 기준 생산활동 진행 중 | |||||||||
나. 산업 인프라의 확충 및 질적 고도화
(1) 지역특화자원과 연계한 바이오클러스터의 육성
산업정책 차원에서 9개 바이오벤처기업지원센터(BVC)와 지역균형발전 차원에서 15개 바이오지역특화센터의 설립이 경쟁적으로 진행되고 있으며 이를 연계키 위한 Korea Bio-Hub센터 구축을 통해 전국 24개 바이오센터를 네트워킹하고 고부가가치 창출형 혁신클러스터로 육성할 계획이다.
(2) 산·학·연 공동 활용을 위한 생산, 평가 및 시험기반의 확충
현재 국내에는 선진시장에 진출이 가능한 의약품 생산시설인 cGMP (current Good Manufacturing Practice) 공장이 전무한 상태로 바이오기업의 선진시장 진출과 국산의약품의 세계 상품화를 촉진하기 위하여 미국 FDA 기준에 적합한 바이오의약품 위탁생산시설(CMO) 구축을 추진하고 있다. 1998년부터 인천 송도에 건설하고 있는 생명공학 산업기술실용화센터는 의약품공장(cGMP동, 동물세포배양라인, 미생물발효라인, 완제라인)과 부속시설(non-GMP동, QC-Lab 등)로 구성되며, 2005년 완공, 2006년 Validation(검증) 완료, 2007년부터 상업생산을 개시할 예정이다.
또한 국제수준의 전임상시설인 GLP (Good Laboratory Practice) 운영체제를 갖추기 위하여 한국화학연구원의 안전성평가센터(1997~2002년, 400억 원)와 한국화학시험연구원의 유해성시험평가지원센터(2000~2005년, 57억 원)를 구축하였고, 현재는 전북대학교에 기능성식품임상지원센터(2004~2008년, 50억 원)를 구축하여 기능성식품의 임상시험을 지원하고, 대구한의대의 한방소재임상지원센터(2004~2005년, 35억 원)를 구축하여 한방의약품 및 한방제품에 대한 임상시험을 지원하는 등 생명공학 산업의 생산, 평가 및 시험기반을 선진국수준으로 향상시켜 나갈 계획이다.
(3) 바이오 전문인력의 양성
바이오는 지식기반산업으로 우수 인력의 확보는 산업경쟁력의 관건이나, 첨단기술 인력이나 기술발달에 따른 전문인력은 현재 부족한 상황이므로 전문인력 양성교육 확대와 수급시스템 개선사업을 지속적으로 추진하고 있다.
바이오전문인력 양성 3대 사업의 질적 고도화
◈ 바이오기술의 개발을 선도하는 하이테크 연구개발 전문인력 양성 *생명공학산업기술인력 단기양성 프로그램 : ’01~’05년, 사업비 80억 원 *cGMP(우수의약품생산시설) 전문인력 해외 양성프로그램 개설 계획 ◈ 급변하는 생명공학산업에 민첩하게 대응하는 현장맞춤형 인력 공급 *생명공학전문생산 기능인력 양성 : ’02~’05, 사업비 80억 원 *24개 지역센터·지자체·지역 기업을 연계하는 ‘지역별 재교육 네트워크’ 구축 ◈ 바이오관련 고등교육의 산업지향 프로그램 운영 *생명공학교육혁신을 위한 산·학 협동과정 : ’03~’07, 사업비 93억 원 *BIT, BNT 등 기술융합화에 대응한 학제간 교육프로그램 개설 |
다. 바이오기업경영의 체감여건 개선
(1) 바이오생산·유통·무역 관련 제도의 재정비
바이오제품의 국내유통 및 국제무역과 관련된 법령·제도를 적기에 정비하여 기업의 원활한 생산 및 수출활동을 지원하고자, 생산·유통 관련 과도한 규제의 완화 및 개선, 생물무기금지협약의 국내이행법 마련, 유전자변형생물체(LMO)관련 국내법 정비(시행령 및 시행규칙 제정) 및 위해성 평가기반 구축 등의 사업을 추진하고 있다.
(2) 가치사슬(Value Chain) 참여자간 전략적 파트너쉽 형성
생명공학 산업의 발전을 위해서 가치사슬(Value Chain)의 상류에서 하류까지 전반에 걸친 참여자들의 혁신역량을 극대화하기 위해, 기술·경영·정책관련 전문가 등이 참석하는 정책포럼 운영, 바이오 기술이전 기반구축사업(’05~’09년간 35억 원) 등을 지원하고 있다.
(3) 전략적 해외진출 및 협력사업 추진
미·유럽 기업의 아시아 시장 진출 추세를 국내 투자의 전기로 활용하고자 선진기업의 연구개발 및 제조 기지를 한국에 적극 유치할 계획이며, 산업바이오 육성을 위한 동아시아 공동체 경제네트워크 등을 활용하여 국내 바이오기업들의 해외시장 진출을 적극 지원할 계획이다.
세계 바이오사업은 1990년대 이후 연 11% 이상 급성장세를 유지하고 있으며, 인구의 고령화, 생명공학기술의 혁신적 발전 등으로 거대시장의 도래가 가시화되고, 선진각국의 경쟁이 격화되고 있다. 이러한 상황에서 이제 태동기를 벗어나 도약기로 전환하고 있는 국내 생명공학산업의 역량을 점검하고, 생명공학산업의 비전과 발전전략을 제시하고자, 2005년 “바이오산업발전을 위한 3·12 프로젝트” 및 ‘2015 바이오산업 미래비전 및 발전전략’을 발표하였다.
동 전략에서 우리나라의 강점분야를 중심으로 선택과 집중을 통해 조기산업화가 가능한 유망분야에 대한 집중 투자를 통하여 미래시장을 선점한다는 전략을 수립하고, 2015년 “바이오강국 G7진입, 생산 60조 원, 수출 250억 불 달성”이라는 비전을 제시하였다.
이를 위해 산자부는 향후 10년간 2조 원의 예산을 생명공학 산업 연구개발 지원과 인프라 구축에 투자하여 목표한 비전이 달성될 수 있도록 적극 지원할 계획이다.
![]() 생명공학 기초과학 진흥 및 인력양성 정책(교육인적자원부)
생명공학 기초과학 진흥 및 인력양성 정책(교육인적자원부)
가. 생명공학 분야 기초과학진흥
(1) 필요성
최근 체세포 복제 및 인간배아 복제실험 성공, 유전자 연구 및 신경망계 연구 등에서 급속한 진전을 보이고 있는 생명공학은 우리 미래생활에 큰 변화를 예고하고 있다. 기초과학을 응용한 신약개발 및 새로운 세포 및 유전자 치료와 장기 이식의학 기술개발로 많은 질병이 퇴치되고 있으며 수명도 연장되고 있다. 이러한 생명공학의 성과는 관련분야의 기초과학 발전이 있었기에 가능한 것이었다. 즉 생물학, 생화학, 생리학, 생물물리학 등 관련 기초과학의 다양한 실험결과의 성과에 기인한 것이었다. 아울러 고령화 사회의 진전에 따라 실버산업 활성화 등 생명공학에 대한 사회적 수요가 급증하고 있으며, IT·NT·ET 등과의 상호 융합 발전 추세에 따라 21세기 첨단 산업사회 발전을 주도할 분야 중 하나로 집중 조명을 받고 있다.
이미 미국은 국립보건원(NIH)을 중심으로 인간게놈프로젝트(Human Genome Project) 결과를 활용한 신약 개발 등 상업화에 주력(’05년도 예산: 286억 달러)하고 있으며, 일본 역시 포스트 유전체 연구에서 우위를 선점하기 위하여 생명공학 분야에 집중 투자(’04년도 예산: 2,527억 엔)를 하고 있다.
(2) 기초과학진흥 추진현황
교육인적자원부에서는 기초학문(인문사회분야, 기초과학분야)의 균형육성을 통한 대학교수의 기초연구역량 강화와 대학원생의 연구능력 함양을 제고하고, 기초연구 인프라를 구축하고자 1963년부터 학술연구조성사업을 추진해 오고 있다. 이러한 학술연구조성사업의 지원사업 중 과학기술분야와 관련된 것으로는 순수기초연구그룹에 대한 지원과 창의적 과학기술지식 생산을 촉진하고자 지원하는 기초과학연구지원사업 등이 있다.
(가) 순수기초연구그룹지원
과학기술부에서는 탁월·수월성 위주의 「목적기초사업」을 추진하고 있는 반면 교육인적자원부에서는 한국학술진흥재단을 통하여 보편성·일반성 위주의「순수기초연구」를 중점 지원하고 있다. 이에 따라 교육인적자원부에서는 순수기초연구에 대한 지원을 통하여 새로운 지식과 원리를 탐구하는 연구풍토를 조성함으로써 기초과학분야의 연구기반을 구축하고 국가과학기술발전의 잠재력을 확대하고자 대학, 연구소 등에 산재되어 있는 동일분야 연구자들을 그룹화하여 연구를 할 수 있도록 지원하고 있다.
<표 3-1-4-1> 순수기초연구그룹지원 현황
구 분 | 내 용 | 비 고 |
지원대상 | 동일전공자간에 구성된 순수기초연구그룹 | |
지원분야 | 수학, 물리학, 화학, 생물학, 지구과학, 통계학, 천문학, 지질학, 대기과학, 해양학분야 등의 순수기초연구분야 | |
지원규모 | ‘05년 191억 원(66과제) |
(나) 기초과학연구지원
기초과학분야 지원을 통해 지식기반사회에서 가장 중요한 창의적 과학기술지식 생산을 촉진하고자 기초과학분야에 대한 지속적인 지원을 해 오고 있다.
<표 3-1-4-2> 기초과학연구지원 현황
구 분 | 내 용 | 비 고 |
지원대상 | 기초과학분야를 연구하는 과제 | |
지원분야 | 수학, 물리학, 화학, 생물학, 지구과학, 통계학, 천문학, 지질학, 대기과학, 해양학, 기초의약학 분야 | |
지원규모 | ‘05년 150억 원(308과제) |
(3) 과학기술부 이관사업 추진현황
과학기술부에서 이관된 사업(’04년도 10월)들 중 순수기초과학분야의 연구지원을 통하여 기초과학분야의 질적 수준을 높이고 연구자들의 연구 분위기 진작 및 인력양성을 위하여 지원하고 있는 사업으로는 「선도과학자육성지원」과 「선도기초과학연구실지원」이 있다.
(가) 선도과학자육성 지원
국내 기초과학자들에게 보다 높은 수준의 연구를 유도하여 질적 수준을 향상시키고 연구자들의 연구 분위기 진작 및 과학기술 경쟁력 강화를 위하여 순수기초과학분야의 연구자들을 선별지원하는 방식으로 이루어지고 있다.
<표 3-1-4-3> 선도과학자육성 지원 현황
구분 | 내용 | 비고 |
지원대상 | 기초과학분야를 연구하는 과제 | |
지원분야 | 수학, 물리학, 화학, 생명과학, 지구과학 | |
지원규모 | ’05년 40.5억 원(44과제) |
(나) 선도기초과학연구실 지원
21세기 과학기술 경쟁력 강화를 위해 국가 차원에서 육성이 필요한 순수기초과학분야를 지원하는 것으로, 해당분야를 연구하는 창의성이 높은 소규모 연구 주체를 전략적으로 지원하는 방식으로 이루어지고 있다.
<표 3-1-4-4> 선도기초과학연구실 지원 현황
구분 | 내용 | 비고 |
지원대상 | 순수기초과학분야를 연구하는 연구실 | |
지원분야 | 수학, 물리, 화학, 지구과학, 생물학 | |
지원규모 | ’05년 50억 원(25개 연구소) |
나. 생명공학 분야 인력양성
(1) 추진현황
21세기 신 성장산업으로 부상하고 있는 생명공학 산업의 국가경쟁력을 확보하기 위해서는 우수한 생명공학 기술인력을 확충하여 원활히 공급해 주는 것이 핵심과제라 할 수 있다.
(가) 국가전략분야 인력양성 추진
BK21사업의 경우 2003~2004년간 생명공학 분야에 268억 원을 지원하였으며, 2005년에는 134억원을 지원하는 등 1999~2005년(7년간)까지 총 856억 원을 지원하였다. 현재 기획단계에 있는 제2단계 BK21사업(2006~2012)에서도 생명공학분야의 지원은 계속될 예정이다.
<표 3-1-4-5> BK21과학기술분야 중 생명공학분야에 대한 연차별 지원현황 (단위: 천 원) | ||||||||
대학수 | 생명공학 사업단수 | 1차 (‘99년) | 2차 (‘00년) | 3차 (‘01년) | 4차 (‘02년) | 5차 (‘03년) | 6차 (‘04년) | 7차 (2005년) |
10개 | 11개 | 7,549,000 | 13,043,000 | 12,698,000 | 12,130,000 | 13,408,000 | 13,408,000 | 13,408,000 |
(나) 의치의학 전문대학원제 도입 등 생명공학 기술인력양성 기반 구축
교육인적자원부에서는 생명공학 기술분야 인력양성 기반을 공고히 하기 위하여 ’02년과 ’03년에 각각 71명, 30명씩 총 101명의 국립대 기초과학분야 교수를 증원하였으며, ’05년과 ’06년에도 추가로 총 70명의 교수를 증원할 계획이다. 아울러, 2005년부터 의/치의학 전문대학원제를 도입함으로써 현행 학부수준의 의학교육(2년 예과+4년 본과)과 병합하여 전문대학원 수준에서 의학교육(4+4제)을 실시할 수 있게 되었다.
이에 따라 향후 보다 수준 높은 교육이 이루어질 것으로 예상되며, 다양한 학문적 배경을 가진 양질의 임상의사를 양성할 수 있을 뿐 아니라 M.D. 및 Ph.D. 과정도입이 가능해짐으로써 의학분야의 기초과학 발전을 견인할 의과학자의 양성도 기대할 수 있게 되었다.
2005년도에 의/치의학 전문대학원으로 전환한 대학은 의대 4개교, 치대 5개교 등 총 9개교로, 2009년까지 의대 20개교, 치대 7개교 등 27개교(52%)가 전환할 예정으로 있다.
(2) 문제점 및 개선방안
그동안 정부의 생명공학 기술 투자는 지속적으로 증가하여 왔으나 2005년도 예산지원은 7,046억 원(전년대비 17.6% 증가)으로 정부 전체 연구개발 예산대비 9.0% 수준(일본정부의 13% 수준)으로 선진국과 비교하여 볼 때 아직까지는 절대적 투자규모에 있어 미흡하다고 볼 수 있다.
연구인력의 공급에 있어 유전체학, 단백질체학, 생물정보학 등 생명공학 기술관련 첨단기술분야 연구인력은 2010년에 3천여 명이 필요할 것으로 예상되나, 이에 대한 공급은 1천여 명 수준으로 예상되어 공급부족 현상이 심화될 것으로 예측되고 있다. 현재 국내 생명공학 분야 인력은 12,000명 수준으로 국내에서 배출되는 생명공학분야 전문인력 규모를 정량적으로 비교해 보면 미국의 1/3수준에 불과한 실정이다.
<표 3-1-4-6> 미국과 한국의 생명공학분야 졸업자 현황 (단위: 명) | |||||||||
미 국 | 한 국 | ||||||||
학사 | 석사 | 박사 | 소계 | 학사 | 석사 | 박사 | 소계 | ||
1998 | 85,079 | 10,230 | 6,549 | 96,858 | 22,689 | 4,999 | 1,661 | 29,349 | |
2000 | 83,148 | 10,183 | 6,791 | 100,122 | 23,128 | 6,115 | 2,141 | 31,384 | |
2003 | - | - | 6,526(‘01) | - | 24,330 | 7,129 | 2,575 | 34,034 | |
(출처: S&E Indicators, Appendix Table 2, NSF, 2004)
또한, 생산기술 전문인력의 경우에도 최근 생명공학 벤처의 폭발적 증가에 따라 이에 대한 인력이 크게 부족할 전망이다.
따라서, 정부에서는 향후 예산 편성 시 중점 신규투자분야, 차세대성장동력사업 등의 생명공학 분야에 대한 투자규모 확대를 위하여 적극적인 예산반영과 인력부족에 대비하기 위한 시장수요와 대학교육간의 연계를 확보·강화하여야 할 것이다. 아울러, 생명공학 산업 발전을 선도할 수 있는 핵심기술분야 고급인력양성에 주력하는 등 인력양성사업에 대한 사회적 인식제고 및 정부의 지속적인 지원강화가 필요하다고 하겠다.
![]() 농림분야 생명공학 육성정책(농림부)
농림분야 생명공학 육성정책(농림부)
가. 농림분야 생명공학 기술 육성정책 개요
수입개방으로 열악해지는 농업환경과 전통농업이 가진 성장의 한계를 극복하고 농업을 국가 부 창출의 주력산업으로 개편하여 노동집약적인 1차산업에서 친환경·고부가가치 지식기반형 산업으로 전환하기 위한 정책의 일환으로 농업생명공학이 주목받고 있다.
농업생명공학 기술을 이용하여 우리고유의 원천기술과 응용기술을 개발함으로써 다양한 신기능성 품종 개발로 농업의 국제경쟁력을 확보하고 첨단 생명공학 산업화 소재개발로 농업을 고부가 지식기반형 산업으로 전환하여 농촌의 삶의 질을 향상시키기 위하여 농업생명공학을 육성하고 있다.
(1) 농업생명공학 육성정책의 기본전략
(가) 관련제도 정비를 통한 우수 연구인력을 확보하며 작목별 연구기관의 생명공학연구기능을 강화하여 농업분야 생명공학 연구의 중심축이 되는 국가연구시스템을 구축한다.
(나) 농업생명공학 연구 관련 대학, 출연연구소, 민간연구소 등과의 연합 시스템을 구축하고 생명공학 연구개발 관련부처간 역할분담 및 협조체계를 구축하는 국가차원의 총괄적 기획, 조정 및 상호 연계시스템을 구축한다.
(다) 농촌진흥청, 대학, 출연연구소 및 민간연구소의 전문 연구인력이 총괄 참여하는 산·학·연 공동연구사업을 위한 대규모 국책연구사업을 추진한다.
우리나라의 농업생명공학 기술은 미국 등 선진국과 비교할 때 기술경쟁력에서 취약하여 결과위주의 연구로 원천기술개발이 미흡하지만, 기본적으로 연구 인프라가 구축되어 있는 우리나라의 농업생명공학 분야는 초기투자를 적극적으로 할 경우 충분한 국제경쟁력을 확보할 수 있을 것이다.
현재 우리나라의 농업기술수준은 벼의 단위 면적당 생산량과 품종육종기술은 세계 최고이며 작물, 가축, 미생물 등 모든 생물체의 종합적인 연구로 생물정보를 풍부하게 보유하는 등의 기반을 확보하고 있으므로 원천소재 확보 후 실용화 기술을 접목할 경우 폭발적인 상승효과를 유발할 수 있을 것이다.
<표 3-1-5-1> 세계 유전자변형생물체(GMO) 개발 현황 (’05. 01. OECD) | ||||||||
구 분 | 옥수수 | 유채 | 콩 | 면화 | 감자 | 토마토 | 기타(11품목) | 계 |
품목수 | 21 | 17 | 5 | 9 | 7 | 6 | 22 | 17작물 87품목 |
<표 3-1-5-2> 국가별 유전자변형생물체(GMO) 재배 현황 (’05. 01. ISAAA, 백만 ㏊) | ||||||
구 분 | 1996 | 2000 | 2001 | 2002 | 2003 | 2004 |
미 국 | 1.5 | 30.3(69%) | 35.7(68%) | 39.0(66%) | 42.8(63%) | 47.6(59%) |
아르헨티나 | 0.1 | 10.0(22) | 11.8(22) | 13.5(23) | 13.9(21%) | 16.2(20%) |
캐 나 다 | 0.1 | 3( 7) | 3.2( 6) | 3.5( 6) | 4.4(6%) | 5.4(6%) |
중 국 | - | 0.5( 1) | 1.5( 3) | 2.1( 4) | 2.8(4%) | 3.7(5%) |
기타(12개국) | - | 0.3( 1) | 0.4( 1) | 0.6( 1) | 3.8(6%) | 8.1(10%) |
합 계 | 1.7 | 44.2(100) | 52.6(100) | 58.7(100) | 67.7(100%) | 81.0(100%) |
전년대비 증가율 | - | 11% | 19% | 12% | 15% | 20% |
나. 해외동향
(1) 생명공학 작물 세계 현황
1990년대 중반부터 유전자변형작물(LMO)의 재배가 시작된 이래로 그 규모가 해마다 급진적인 증가 추세를 보이고 있으며, 2004년 유전자변형작물(LMO) 작물의 총 재배면적은 8,100만 ha로(James, 2004), 이는 2003년도의 6,770만 ha에 비하여 20%가 증가한 것이다.
2004년도에는 모두 17개국, 825만 명의 농부에 의하여 유전자변형작물(LMO)이 재배되었으며 특히, 미국은 4,760만 ha에서 유전자변형작물(LMO)을 재배하였는데, 이는 세계 전체의 59%에 해당되며, 아르헨티나가 1,620만 ha(20%), 캐나다가 540만 ha(6%), 브라질이 500만 ha(6%), 그리고 중국이 370만 ha(5%)에 해당한다.
작물별로 보면, 대두가 세계적으로 4,800만 ha에서 재배되어 총 유전자변형작물(LMO) 재배면적의 60%를 차지하고 있는데, 이는 2003년의 4,140만 ha에서 다소 증가한 수준이며 유전자변형 옥수수는 1,930만 ha(23%)에서 재배되어 2003년도의 1,550만 ha를 크게 상회하였다. 또한 목화가 900만 ha(11%)로 2003년도의 720 ha에 비하여 증가하였으며, 유채가 430만 ha(6%)에서 각각 재배되었다.
<표 3-1-5-3> 작물별 유전자변형생물체(GMO)재배 추이 (’05. 01. ISAAA, 백만 ㏊) | ||||||
구 분 | 1996 | 2000 | 2001 | 2002 | 2003 | 2004 |
콩 | 0.5 | 25.8 | 33.3 | 36.5(62%) | 41.3(61.3%) | 48.4(60%) |
옥 수 수 | 0.3 | 10.3 | 9.8 | 12.4(21) | 15.5(23%) | 19.3(23%) |
면 화 | 0.8 | 5.3 | 6.8 | 6.8(12) | 7.2(11%) | 9(11%) |
유 채 | 0.1 | 2.8 | 2.7 | 3.0( 5) | 3.6(5.3%) | 4.3(6%) |
기 타 | 0.1미만 | 0.1미만 | 0.1미만 | 0.1미만 | 0.1미만 | 0.1미만 |
계 | 1.7 | 44.2 | 52.6 | 58.7 | 67.7 | 81.0 |
재배면적별로는 대두가 전 세계 8,600만 ha에서 재배되며, 이 중 60%에 해당하는 면적을 유전자변형 대두가 차지하며, 옥수수는 총 1억 4,300만 ha 중 14%, 목화는 총 3,200만 ha 중 21%, 그리고 유채는 총 면적 2,300만 ha의 19%인 2,300만 ha에서 유전자변형작물(LMO)로 각각 재배되고 있다. 이들 4작물을 모두 합치면 총 2억 8,400만 ha 중 29%에서 유전자변형작물(LMO)이 재배되어, 2003년도의 25%에서 증가한 것으로 집계된다.
시장규모를 살펴보면, 2004년 유전자변형작물(LMO)의 세계 시장 규모는 47억 달러로 2003년 전체 작물시장 규모인 325억 달러 대비 15% 정도를 차지하며, 이는 세계 종자시장 규모인 300억 달러의 16%를 점유하는 것이다.
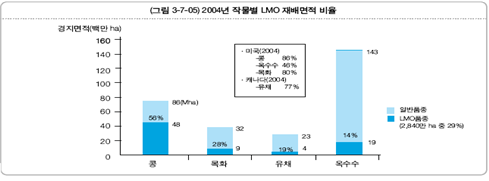
<그림 3-1-5-3> 2004년 작물별 LMO 재배면적 비율
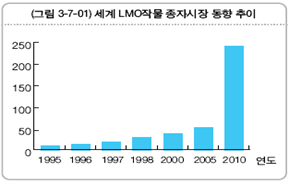
<그림 3-1-5-4> 세계 LMO작물 종자시장 동향 추이
시장규모를 살펴보면, 2004년 유전자변형작물(LMO)의 세계 시장 규모는 47억 달러로 2003년 전체 작물시장 규모인 325억 달러 대비 15% 정도를 차지하며, 이는 세계 종자시장 규모인 300억 달러의 16%를 점유하는 것이다.
유전자변형작물(LMO)의 세계 시장 규모는 2005년에는 60억 달러 이상 성장할 것으로 전망하고 있다. 특히, 향후에 주목받고 있는 ‘제3세대’ 유전자변형 농산물(LMO)인 기능성 건강식품은 현재 650억 달러(비 LMO) 규모의 시장에서 2027년에 15조 달러(연 22.5% 증가)의 시장으로 확대될 것으로 예상하고 있다.
다. 국내현황
(1) 농업생명공학 목표와 추진전략
취약한 농업생명공학기술을 선진국 수준으로 향상시키고 농업의 새로운 소득원 발굴을 위하여 정부의 보다 많은 역할이 중요시되고 있으며 이에 따라 정부의 역할 효율성을 제고하기 위한 연도별 중점추진방향을 설정하여 집중적으로 투자하고 있다.
(가) 농정의 목적에 따른 장기적인 계획에 의하여 농업생명공학의 분야별 기술지도(Road-map)를 작성하여 이를 바탕으로 수요자의 요구를 반영하는 전주기적인 연구체계를 구축하며 산업화를 전제한 기술개발로 투자효율성을 제고시킨다.
(나) 고유의 원천기반기술이 없이는 지속적 성장과 국부의 유출이 심화되므로 이에 대비한 미래대비형 원천기반기술의 확립과 개발된 기술의 산업화를 적극 유도하며 중복투자를 방지하기 위한 관련기술의 공개와 기술이전 체계를 구축한다.
(다) 농업생명산업에 대한 국민들의 정확한 이해가 없이는 지속적인 성장을 추구할 수 없으므로 이에 대한 다양한 대국민 홍보 프로그램과 바이오안전성의정서의 발효에 대비한 제도적·기술적인 안전관리 체계를 구축한다.
(2) 2005년 농림부 세부추진 사업
(가) 투자실적 및 계획
(’03년)581억 원 → (’04)748억 원 → (‘05)762억 원(5.9%증가)
<표 3-1-5-4> 투자실적 및 계획 (단위: 억 원) | ||||
사 업 명 | 사업기간 | ‘04실적 | ‘05계획 | 주관기관 |
○ 농림기술개발사업 | ’94~계속 | 51.6 | 56.6 | 농 림 부 |
○ 바이오장기생산연구사업 | ’04~’13 | 20 | 45 | 농 림 부 |
○ 바이오신약생산연구사업 | ’05~’13 | - | 13 | 농촌진흥청 |
○ 농업생물기술개발사업 | ’94~계속 | 240 | 233 | 농촌진흥청 |
○ 농업생명공학기술개발사업 | ’01~’10 | 246 | 308 | 농촌진흥청 |
○ 산림자원 고부가가치 생산 및 이용 기술개발 | ’04~’13 | 8.1 | 9.1 | 산 림 청 |
○ 수의과학기술개발사업 | ’98~계속 | 160 | 98 | 수 과 원 |
○ 인프라 구축 사업 | 계 속 | (159) | (183) | 농촌진흥청 |
총 계 | 748.2 | 762.7 | ||
※농업생물기술개발사업(인프라구축사업 예산 포함 : ’04년 159억, ’05년 183억) | ||||
(나) 중점추진방향
① 농업생명공학 분야 중 비교우위 분야를 선택하여 집중 투자함으로써 단기간 내에 고부가·고기능성 신품종 개발 등 생명공학기술의 산업화를 위한 기반기술개발에 주력하고, 연구성과의 활용 및 산업화를 유도한다.
② 형질전환 가축을 이용하여 가축의 젖과 오줌 등에서 고부가가치 바이오신약 생산 및 산업화 기술을 개발한다.
③ 농업생명공학 안전성 확보 기술개발 및 생명공학 산업 활성화를 위한 인프라 구축에 집중 투자하고, 생명공학 기술의 육종소재인 농업유전자원의 종합관리대책을 수립한다.
(3) 유전자변형생물체(GMO) 연구개발 현황
(가) 농촌진흥청 연구개발 현황
농촌진흥청은 ’91년부터 농업생명공학 연구를 착수하여 20품목 50종에 대한 형질전환 작물 및 가축을 개발 중이며 아직까지 실용화된 작물은 없으나, 현재 선발과정이나 안전성평가 단계에 있다.
<표 3-1-5-5> 유전자변형작물 개발 현황: 18작물 45종 | |
구 분 | 개발 특성 |
유전자도입 검정단계 | 카테킨 생산 상추 등 22종 |
기능 검정단계 | 비타민 E 강화 들깨, 철분강화 감자 등 19종 |
안전성 평가단계 | 제초제저항성 벼, 고추, 들깨, 바이러스저항성 감자 등 4종 |
* 4작물은 현재 격리포장에서 농업적특성, 환경영향 등에 대한
평가시험을 수행 중에 있으며 3~4년 내에 실용화가 가능
<표 3-1-5-6> 유전자변형가축 개발 현황: 2축종 5종 | |
구 분 | 개발 특성 |
유전자도입 검정단계 | 조혈촉진, 섬유소 분해 돼지 등 2종 |
기능 검정단계 | 혈전증치료, Albumin 생산 및 비만조절 닭 등 3종 |
(나) 대학 및 민간 부문의 연구개발 현황
국내 대학, 연구소 및 종묘회사 등에서도 연구개발이 이루어지고 있으나 보급 및 판매를 위해 승인된 유전자변형작물은 국내에 아직까지 없으며, 그간 학회 등에서 보고된 자료는 아래 표와 같으나 사실 확인이 어려운 경우가 많다.
<표 3-1-5-7> 대학 및 민간부문에서 보고된 유전자변형생물체(GMO) 개발 현황 | |
작물명 | 개발 특성 |
벼 | 제초제저항성, 한발저항성 등 11종 |
감자 | 내병성, 살충성 등 6종 |
고추 | 전신획득 저항성, 개화 조절 등 5종 |
당근 | 가축 세균병 방제 백신 등 2종 |
사과 | 개화조절, 착색증진 등 4종 |
상추 | 염분, 건조저항성 등 2종 |
수박 | 내병성, 내재해성 등 2종 |
토마토 | 생산효율 향상, 살충성 등 2종 |
갓 | 크롬저항성 등 1종 |
카네이션 | 바이러스저항성, 화색변경 등 2종 |
포플러 | 중금속저항성 등 2종 |
현사시나무 | 중금속저항성, 가뭄저항성 등 2종 |
<표 3-1-5-8> 바이오신약 생산기술 비교 | ||
구 분 | 미국 등 선진국 | 한 국 |
빈혈치료제 (EPO) | 세포배양법에 의한 EPO 생산으로 연간 68억 불 매출 *세포배양법: 동물세포를 배양 증식하여 의료물질 생산 | 형질전환법에 의한 EPO 생산 돼지 세계 최초 개발('98) *형질전환법: 유전자가 후대에 전이되면서 의료물질 생산 |
혈전증치료제 (tPA) | 산양의 젖에서 혈전증치료제 생산 추출 | 돼지의 젖과 오줌에서 혈전증치료제 생산 추출 |
혈우병치료제 (vWF) | 사람의 혈액에서 혈우병치료제 분리(세계시장 규모 26억 불) | 형질전환 돼지에서 혈우병 치료제 분리(세계 최초 개발, 2004) |
(다) 바이오신약 생산기술 개발 현황
생명공학 기술 분야의 시장규모는 지속적으로 증가하고 있으며, 주로 미국, 유럽 등이 주도하였으나 최근 우리나라도 빈혈·혈전증·혈우병 치료제의 획기적인 바이오신약 생산기술을 개발하였다.
① 빈혈치료제의 세계시장 규모는 68억 불로 추정하고 있으며, 우리나라는 1998년에 사람의 빈혈치료제 생산에 필요한 유전자(EPO)를 보유한 형질전환 돼지 개발에 성공하였으며, 이것은 미국의 세포배양법에 의한 빈혈치료제 생산 기술보다 훨씬 앞선 기술이다.
② 혈전증치료제의 가격은 1 g당 54백만 원 정도로 부가가치가 매우 높고 세계시장 규모는 6억 불 수준으로 추정되며, 우리나라는 2003년에 사람의 혈전증치료제를 생산할 수 있는 유전자(tPA)를 보유한 형질전환 돼지를 개발하였다.
③ 혈우병치료제의 세계 시장 규모는 26억 불로 추정되며, 우리나라는 2004년 세계 최초로 사람의 혈우병치료제(vWF)를 생산하는 형질전환 돼지 개발에 성공하고 돼지 젖 속에 있는 혈우병치료제의 분리·정제를 실시하였으며, 앞으로 산업화를 위한 전임상시험 등을 추진할 예정이다.
(라) 바이오장기생산 연구개발 현황
①차세대서장동력사업 종합실천계획 수립(’04.4)에 따라 바이오장기복제 이식 기술개발을 과기부(원천기술), 농림부(바이오장기생산), 복지부(임상기술)와 역할을 분담하여 추진하고 있다.
② 농림부는 바이오장기 생산용 형질전환 무균복제 돼지를 개발하기 위하여 향후 10년간 585억 원의 예산을 투입할 계획이다.
- 투자계획 : (’04) 20억 원 → (’05) 45억 원 → (’06) 65억 원
라. 발전전망
(1) 농민들도 경제성, 노동 절감 등을 이유로 유전자변형작물 선호
현재 17개 국가에서 825만 농민들이 수확량 증가, 노동력 감소 및 환경오염 방지 등에서 효과가 인정되어 유전자변형작물 재배를 선호하고 있으며 특히, 유전자변형 대두는 전 세계 대두 재배면적의 60% 이상에서 재배가 이루어지고 있다.
<표 3-1-5-9> 유전자변형 작물의 예 (NCFAP, '01) | |||
구 분 | 경제적 이익 (수확량 증가, 생산비 절감) | 환경오염방지 (농약사용 감소) | 노동력 경감 (살포횟수 감수) |
해충저항성 유전자전환 옥수수 | 150$/ha | 6% | 14% |
해충저항성 유전자전환 면화 | 514$/ha | 14% | 22% |
제초제 저항성 유전자전환 콩 | 160$/ha | 28% | 30% |
(2) 신기능성 유전자변형작물의 시장규모가 급속하게 성장
생명공학의 중심축이 점차적으로 생명공학의약 분야에서 농업, 환경 및 에너지 분야로 이동할 것으로 전망되고 있으며, 신기능성 유전자변형작물의 시장규모가 급속하게 성장될 전망되고 있다. 1996년에 1.7백만 ha의 농경지에서 유전자변형작물의 재배가 시작된 이후 재배면적은 2004년도에 81백만 ha 재배함으로써 48배로 증가하는 등 급속히 확대되고 있다.
(3) 유전자변형농산물에 대한 소비자의 불신 해소가 관건
농업생명공학은 성공 가능성이 낮고 투자자금 회수기간이 길어 민간기업의 적극적인 투자를 유치하기가 어려우며 유전자변형농산물에 대한 소비자들의 불신은 상품화의 장애요인으로 작용하여 농업생명공학의 지속적인 발전을 저해하는 요인으로 작용하고 있음에 따라 유전자변형농산물이 안전하다는 대국민 홍보를 함께 지속해야 할 것이다.
![]() 보건분야 생명공학 육성정책(보건복지부)
보건분야 생명공학 육성정책(보건복지부)
가. 보건분야 생명공학 육성정책 개요
보건의료분야는 생명공학기술(BT), 정보기술(IT) 및 나노기술(NT) 등의 융합으로 개념 자체가 바뀔 뿐 아니라, 그와 관련된 사회 구조 및 생활상도 크게 변화할 것으로 예상된다. 이에 보건복지부는 “첨단 바이오보건산업 육성을 통한 건강부국 건설”의 비전을 가지고 연구개발 투자, 인프라 구축, 산업화 지원 등의 전략을 수립하여 시행하고 있다.
연구개발 투자 | 인프라 구축 | 산업화 지원 | ||
▫신약개발사업 ▫바이오장기기술개발사업 ▫의료기기기술개발사업 ▫의료정보기술개발사업 ▫건강기능제품개발사업 ▫보건의료생명공학기술개발사업 ▫보건의료기술인프라개발사업 | ▫오송생명과학단지 조성 ▫유전체실용화사업 | ▫보건의료기술이전 사업 ▫기업지원 펀드 조성·운영 ▫수출진흥사업 |
나. 연구개발투자현황 및 계획
보건복지부는 보건의료기술진흥법(1995.12)을 제정하여 지난 1995년부터 신약, 의료기기, 의과학 등 “보건의료기술연구개발사업”을 추진해오고 있으며, 2008년까지 총 1조 3000억 원을 투자할 계획이다.
(1) 그간의 연구성과
1995년 보건의료기술진흥사업을 시작하여 2005년 현재까지 신약 7건, 의료기기 116건, 생명공학제품 48건, 해외기술수출 11건 등의 우수한 연구성과를 냈으며, 특히 국산신약 1호인 SK제약의 선플라(주)를 비롯하여 지금까지 11개(정부지원 7개)의 신약이 개발됨으로써 우리나라는 세계 11번째 신약 개발국으로 도약하고 있다. 이 외에도 세계 최초로 비브리오균의 유전체 염기서열을 완전 해독하여 미국 국립생물정보센터(NCBI)에 등록(’02. 12. 전남대 장관계유전체연구센터)하는 등 유전체 연구 분야에서도 성과가 나오고 있다.
(2) 연구개발 투자현황
국내 제약산업의 독자적인 신약개발체계 구축을 통한 신약개발 선진국 진입을 위해 신약개발사업을 추진하고 있다. 특히, 천연물신약개발촉진법(2000.1)의 제정으로 천연물신약 개발을 지원하고 있으며, 2004년부터 차세대 성장동력 분야인 바이오신약 개발을 위해 세포치료제, 치료용백신, 항체치료제 등 6대 분야를 대상으로 전임상·임상시험을 지원하고 있다. 또한, 전문연구센터 육성을 위해 “기능성세포치료제개발센터”와 “항체치료제기술개발센터”를 선정하였고, 내수중심의 국내 신약 개발 국제화를 위해 해외 선진국과의 “국제협력연구”를 연간 10억원, 9년 이내에서 지원하고 있다.
난치성 질환을 치료하고 장기이식 수급 불균형을 해소하기 위해 바이오장기기술개발사업을 추진하고 있으며, 줄기세포연구와 근골격계 등의 생체조직장기 등을 지원하고 있으며, 차세대 성장동력 분야인 바이오이종장기의 원천기술 선점과 대량생산 및 임상적용을 위해 “바이오이종장기연구개발사업단”을 선정하여 2004년부터 연간 40억 원, 9년 이내에서 집중 지원하고 있다.
차세대 신기술(생명공학기술, 정보기술, 나노기술)을 적용하여 지능형 의지·보조기, 장애인 감각기능회복장치 등 인간 중심의 보건의료환경 조성을 위해 의료기기기술개발사업이 2002년부터 지원되고 있다. 또한, 의료정보 표준화, 전자건강기록(EHR) 등 연구 지원을 위한 의료정보기술개발사업, 고부가가치 기능성 식품 및 화장품 개발을 위한 건강기능제품개발사업을 추진하고 있다.
또한 유전체 연구를 통한 난치성 질환 치료기술, 고부가가치 바이오물질 개발 등 미래 핵심기술 개발을 위해 보건의료생명공학기술개발사업을 추진하고 있다. 보건의료유전체·단백질체연구, 생명·노화연구, 나노보건기술개발 등을 위해 질환군별유전체연구센터(12개), 병원성미생물유전체연구센터(3개), 약물유전체연구사업단(1개),질병유전단백질체종합지원센터(1개), 생명노화연구센터(2개), 나노인공시각개발센터(1개), 의료용나노치료소재개발센터(1개) 등을 지정하여 집중 지원함으로써 개개인의 유전체형에 근거한 예측·맞춤의학의 기반을 마련할 수 있을 것으로 기대된다. 또한, 차세대 성장동력 분야로 진단용DNA칩개발센터(2개)를 2004년부터 신규로 선정하여 지원하고 있다.
<표 3-1-6-1> 연구개발 투자 현황 (단위: 억 원) | ||
사 업 명 | ~2004 | 2005 |
•신약개발사업 •바이오장기기술개발사업 •의료기기기술개발사업 •의료정보기술개발사업 •건강기능제품개발사업 •보건의료생명공학기술개발사업 •보건의료기술인프라개발사업 | 1,282 143 1,109 142 289 609 2,005 | 281 77 109 38 55 237 237 |
계 | 5,578 | 1,033 |
그리고, 생명공학기술에 기반하여 의과학 등 연구개발, 연구인프라 구축 등을 지원하는 보건의료기술 인프라 개발사업을 추진하고 있다. 특히, 신약 개발 활성화와 선진국 수준의 임상시험 인프라 구축을 위해 지역임상시험센터(6개)를 신규로 선정하였고, 국내 의료수준 향상을 도모하기 위해 성인고형암치료, 허혈성심질환 등 임상연구센터(6개)를 선정하여 집중 지원하고 있다. 또한, 2005년부터 기초연구 성과를 보건의료 분야에 적극적으로 응용하고, 창의연구를 활성화하기 위해 질병중심 중개연구(translational research)를 특화하여 지원 중에 있다.
(3) 향후 계획
’03. 8. 22 우리 경제를 향후 5~10년간 이끌어 나갈 차세대 성장동력산업으로 생명공학 신약·장기·칩이 선정된 바 있으며, 보건의료의 주무부처로서 보건복지부는 이들 분야의 기술개발, 제품화 그리고 그에 따르는 생명윤리를 비롯한 여러 이슈들에 대하여 주도적인 역할을 할 것이다.
보건의료분야 생명공학 육성정책에 있어서 중요한 것은 국민건강증진에 우선적으로 필요한 연구분야를 파악하여 한정된 자원을 효율적으로 배분하고, 우수한 인력을 활용하여 연구개발과 제품화가 신속하게 이루어지도록 하며, 개발된 치료기술·신약·의료용구 등이 의료현장에서 실질적으로 사용될 수 있도록 정책적인 뒷받침을 하는 것이다. 보건복지부는 병원·의료인력 등 자원의 합리적 배분과 의료보험제도 운영 등의 책임이 있으므로 이를 적극적으로 활용하여 보건의료분야 생명공학 육성정책을 전개해 나가고자 한다.
2004년 1월, 생명공학 신약·장기·칩 분야의 집중 육성을 위해 기획위원회를 구성·운영하여, 보건의료 차세대성장동력 육성계획을 마련하였으며, 동 계획에 따라 부처별 역할분담 등을 고려하여 사업을 지원중에 있다. 이와 더불어 「생명윤리및안전에관한법률」을 제정하여 배아연구·유전자연구에 따르는 생명윤리와 안전에 관한 문제를 해결하고, 생명공학이 국민건강에 건전하게 기여할 수 있도록 할 것이다.
또한 보건복지부는 2003. 7. 22 미국의 보건부와 MOU를 체결하여 양국간 인력교류와 공동연구에 합의하였으며, 향후 지속적인 교류를 통하여 미 FDA 승인절차 간소화 등의 협의가 이루어진다면 우리의 바이오보건산업이 세계시장에서 경쟁력을 확보하는 발판을 마련할 수 있을 것이다.
다. 인프라 구축현황 및 계획
(1) 오송생명과학단지 조성
지난 1994년 보건의료기술혁신방안의 일환으로 시작된 「오송생명과학단지」는 2002년 이후 본격적으로 사업이 추진되고 있으며, 용지보상이 마무리 단계에 들어섬에 따라 2003년 10월 27일 단지조성공사 기공식을 개최하였다.
「오송생명과학단지」는 보건산업 관련 산·학·연·관이 동일 단지에 모여 상호 기술지원 및 업무교류가 이루어지는 우리나라 최초의 「바이오 보건산업 특화단지」이다. 단지조성을 통해 연구개발 및 산업화 활동을 집적시키고 이를 연계할 인적·물적 인프라를 구축하여 바이오보건산업 육성과 관련된 일련의 활동들이 단지 내에서 활발히 이루어지고, 더 나아가 생명공학산업분야 동북아 허브로 기능할 수 있는 기반을 마련하고자 한다.
이를 위하여 식품의약품안전청, 국립보건원, 국립독성연구원, 한국보건산업진흥원 등 주요 국책기관을 2006년까지 이전함은 물론, 단지 내 고급 기술인력 양성을 위한 「보건과학기술원」, 업체의 연구개발 및 제품화를 지원하기 위한 「생명의과학연구소」, 「바이오보건산업정보센터」 및 「창업보육센터」 등의 지원시설을 2007년까지 설치할 계획이다.
현재 「오송생명과학단지」는 의약품, 의료기기, 식품, 화장품 등 160여 개 업체가 입주를 희망하고 있으며, 이와 더불어 우수 외국인 투자기업을 유치하기 위해 “외국인기업전용단지”도 조성할 계획이다.
(2) 유전체실용화사업
국립보건원 유전체연구소는 한국인 및 병원성 미생물의 유전자원을 수집·관리하여 질병과 관련된 국내 유전체연구 인프라를 구축하고 예방중심의 국가질병관리체계 구축에 필요한 과학적 근거를 제공하고자 유전체실용화사업을 수행하고 있으며, 이를 위해 2010년까지 1,103억 원을 투입할 예정이다.
국립보건원은 지역사회 인구집단을 대상으로 임상정보 및 역학정보(식생활, 영양조사, 가족력, 생활습관 등)에 관한 대규모 역학조사사업을 수행하고, 연구개발사업으로 실시중인 보건의료유전체 연구와 연계하여 국내 유전체연구 네트워크를 구성하고 있다. 사업을 통해 수집된 정보를 바탕으로 임상-역학-유전체-단백질체의 연계분석을 실시하기 위한 통합정보데이터베이스를 개발하고, 확보된 총 49,066건의 유전체 시료(불멸화세포, 유전체, 혈청, 요, 유전자 및 BAC clone 등)를 수집·관리·분양하여 국내 보건의료 유전체연구를 활성화하고자 한다. 이 외에도 생물정보학 인력을 양성하고, 유전체연구 공통기반기술을 개발하여 국내 연구진에게 지원하고 있다. 또한 일본 게이오대학 의과학센터(2003년 9월)와 협약을 체결하는 등 국내·외 공동연구를 위한 기반을 마련하고 있으며, 매년 국제 심포지움 및 국내 유전체연구발표회 개최를 통하여 유전체관련 정보교류와 협력의 장을 제공하고 있다.
라. 산업화지원정책
연구개발이 제품화·산업화로 연결되지 않으면 국가경쟁력을 가질 수 없다. 산업화를 지원하기 위하여 개발된 기술의 신속한 제품화를 위한 기술이전사업, 영세한 보건산업체의 자금난을 해소하기 위한 기업지원 펀드조성, 그리고 보건산업의 수출진흥을 위한 전략들을 마련하고 있다.
(1) 보건산업기술이전사업
기술이전은 연구개발 투자 산물인 기술을 널리 확산시킴으로써 투자의 효율성을 제고할 수 있는 분야로서, 2001년 9월부터 한국보건산업진흥원 내에 보건산업기술이전센터 설치를 통해 기술이전사업을 실시해 오고 있다. 2003년 현재 16건의 기술거래가 성사되었고 55건이 진행 중에 있으며, 그 외에도 우수기술설명회, 보건산업기술대전, 특허경비 지원을 비롯한 다양한 사업을 통해 보건의료기술의 산업화를 지원하고 있다.
첫째, 보건산업기술이전센터를 중심으로 온라인 기술평가 및 이전시스템을 운영하여 보건산업분야 기술이전 및 사업화지원센터 기반을 확충하고 있으며,
둘째, 보건산업기술이전센터 사업영역 확대를 위하여 해외기술마케팅사업을 본격 추진하고 있으며, 해외 파트너를 물색하여 국내 보건산업체의 기술이전 및 사업동반자로서 기회를 제공(미국, 유럽, 아시아 등)하고 있다. 또한 우수 보건산업기술의 산업재산권화를 위하여 특허경비지원사업을 실시하고 있고,
셋째, 관련기관(한국기술거래소, 발명진흥회, 대학기술이전센터, 수도권공공기술이전컨소시엄)과 네트워크 구축 및 협력사업의 확대로 이전사업의 효율화를 꾀함과 동시에 보건산업기술의 주요 수요처인 미국·유럽 등에 소재하고 있는 기술이전 및 사업화지원 기관과의 네트워크 확보 및 협력사업을 추진하고 있다.
(2) 기업지원 펀드 조성·운영
바이오보건산업분야 벤처기업의 수는 2000년 이전에 비해 많이 증가했으나, 초기 투자비용이 크고 투자회수기간이 길어 민간부문의 투자를 기대하기 어려운 상황이다.
이에 보건복지부는 2001년 7월 연기금의 주식 및 벤처투자를 허용하는 ‘국민연금법시행령’ 개정에 따라 바이오투자조합을 결성하여 운영하고 있다. 바이오투자조합은 국민연금 25억 원, 우리기술투자 25억 원 등 50억 원 규모로 조성하여 2003년 11월 현재 6개 업체에 44억 원을 투자하고 있으며, 향후 유망 바이오보건벤처기업을 대상으로 투자규모를 확대해 나갈 계획이다.
(3) 보건산업 수출지원
WTO DDA1) 협상에 따른 보건산업의 개방이 불가피함에 따라 보건산업의 전략적 우위를 선점하기 위한 선진국의 기술개발 노력과 기술보호주의가 강화되고 있다. 세계경쟁이 심화되는 상황하에서 국내 보건산업이 처한 여러 가지 구조적인 문제들(예를 들어, 규모의 영세성, 해외시장 정보부족, 국제품질인증기구(ICH, PIC, CE 등)2)의 미가입, 해외마케팅 능력의 한계 등)을 극복하고 보건산업의 수출경쟁력을 강화하기 위하여 한국보건산업진흥원에 수출전담 조직을 신설하고 보건산업제품의 수출확대, 국산화 및 수입대체, 보건산업체의 해외진출 등 수출진흥을 위한 전략적인 준비를 진행하고 있다.
![]() 정보통신분야 생명공학 육성정책
정보통신분야 생명공학 육성정책
가. 추진배경
정보-생명공학(IT-BT) 융합기술은 고령화 사회의 건강문제, 환경·안전문제 등 미래 사회 문제를 해결할 핵심 기술이 될 것으로 기대된다. 미래학자인 앨빈 토플러는 한국은 정보기술과 생명공학기술의 융합을 바탕으로 신산업/시장을 창출해야 하며, 한국의 미래는 융합기술에 달려있다고 말한 바 있다. 유럽연합(EU) 등 선진각국은 융합기술의 성장가능성과 파급효과를 인식하고 융합기술 발전 전략을 수립하여 융합기술 혁명에 대비하고 있다. 특히, 유럽연합(EU)는 2004년도에 지식사회 건설을 위한 융합기술전략을 수립한 바 있다. 이에 따라 정보기술 및 인프라에 강한 우리나라는 정보기술(IT)기반으로 미래 유망기술인 융합기술을 선점하여 새로운 시장을 창출하고 건강하고 안전한 삶을 구현할 필요가 있다.
나. 시장전망
융합기술이란 이종기술간 융합을 통하여 신제품/서비스를 창출하거나 기존 제품의 성능을 향상시키는 기술로서, IT-BT, IT-NT 융합기술이 활발하게 전개되고 있으며, 앞으로도 이종기술간 융합을 주도할 것으로 예측된다.
전 세계 IT-BT 융합기술 시장규모는 ’05년 222억 달러 수준에서 10년 720억 달러 규모로 성장할 전망이다. 이중 바이오 전자(510억 달러), 생물정보(100억 달러), 생체정보인터페이스(70억 달러) 등의 시장규모가 클 것으로 예상된다.

<그림 3-1-7-1> 주요 IT-BT 융합기술 품시장 규모 전망
다. 국내 IT-BT융합 기술수준
국내 IT-BT 융합기술은 전반적으로 발전 초기단계로 선진국의 최고 기술수준 대비 70~80% 수준인 것으로 파악되고 있다. 특히, 기초·원천기술분야인 바이오 컴퓨터 등의 분야는 기술수준이 선진국에 비해 많이 떨어지고 있는 실정이다.
<표 3-1-7-1> 국내 IT-BT 융합기술 수준 | ||||
기술명 | 단계 | 국내현황 | 해외현황 | 기술수준 |
바이오전자 | 도입기 | 프론티어사업단, ETRI* | 美: 정부(NIH), 기업(Agilent) | 70% |
바이오인포메틱스 | 도입기 | KRIBB†, ETRI | 美: 정부(NIH), 기업:연구개발 | 80% |
바이오컴퓨터 | 발아기 | 산자부, 차세대 신기술사업 | 美: DNA바이오 컴퓨터칩 기반기술 개발 | 65% |
생체 정보보호 | 도입기 | 한국전자통신연구원(ETRI) | 美·유럽 공공부문 필드시험 | 80% |
생체정보 인터페이스 | 도입기 | 한국전자통신연구원(ETRI) | 유럽: 정부주도 연구개발 | 75% |
발전단계: 발아기, 도입기, 성장기, 성숙기]
*ETRI: 한국전자통신연구원, †KRIBB: 한국생명공학연구원
라. 융합기술 산업 및 벤처기업
해외 글로벌 IT기업은 헬스케어, 바이오칩, 생물정보 등 융합기술분야에 적극적인 투자를 하고 있다. 대표적인 글로벌 IT 기업의 IT-BT 융합기술 분야 진출 현황은 아래와 같다.
<글로벌 IT 기업의 융합기술분야 진출 현황>
☞ 헬스케어 : Intel, CISCO, HP, GE, Hitachi, Motorola, Philips, Qualcomm 등
☞ 바이오칩 : Intel, Agilent, Infineon technology 등
☞ 생물정보 : Sun Microsystems, Compaq, IBM, Hitachi, Fujitsu 등
국내 융합기술 산업은 현재 태동단계로 일부 대기업과 벤처기업에서 융합기술을 이용한 제품 개발 및 상용화를 추진하고 있다. 하지만, 융합기술 관련 벤처기업은 융합기술 관련 정보데이터베이스 미비 등으로 연구개발 및 상용화 관련 정보를 주로 해외데이터베이스에 의존하고 있는 실정이다.
<국내 대기업 및 벤처기업의 IT-BT 융합기술 진출 현황>
☞ 대 기 업 : LG전자-휴대폰과 혈당측정기 결합제품 출시(’04년)
☞ 벤처기업 : 마크로젠-유전병 진단용 DNA Chip 개발(’03년 매출 110억 원)
랩프런티어-단백질 칩 개발(’04년 매출 107억 원)
마. 융합기술 전문인력 현황
국내 융합기술 전문인력 양성을 위해 2002년을 전후하여 일부 대학에서 융합기술 관련학과 또는 협동과정을 개설하는 등 융합기술 인력 양성에 대해 관심을 갖기 시작하고 있다. 현재 10개 대학(학과 개설 3개, 협동과정 7개)에 452명이 관련과정에 재학하고 있다. 산업계를 대상으로 한 설문조사에서 전체 조사대상 기업의 약 80%가 융합기술 인력이 부족하다고 응답하였다(KIET, 2004). 융합기술의 발전을 위해서는 장기적 인력수급 분석 등을 통해 학제적 지식과 기술을 갖춘 융합기술 전문인력 양성 전략의 수립이 필요하다. 즉, IT기술인력에 대한 BT, NT 등 타분야 전문기술 및 지식 교육과 함께 산·학·연간 다양한 전공자들의 융합기술 분야 공동연구 등이 필요하다. 또한, 글로벌 경쟁력을 갖춘 우수인력 확보 및 양성을 위한 국제 협력 체계 구축이 요구된다. 이를 위해 국제 공동연구, 인력교류 등 활성화가 필요한 시점이다.
바. 국내 융합기술산업 SWOT 분석 및 시사점
국내 융합기술산업은 적극적인 정부지원의지가 강하고, 세계적 IT 기술 및 인프라 기반이 갖추어져 있으며, 국민들의 새로운 서비스에 대한 높은 수용성 등의 강점을 가지고 있다. 반면, 기술경쟁력 및 원천기술 축적이 미흡하고 관련 전문인력이 부족하며, 산·학·연간 협력기반이 미약하다는 약점도 가지고 있다.
앞서 살펴본 바와 같이 IT-BT 융합기술 세계시장은 대폭 성장할 전망이며, 아직까지 세계적으로도 발전 초기단계로써 향후 다양한 산업에 큰 파급효과를 미칠 것으로 예상되는 등 긍정적 요소가 많이 있다. 한편, 원천기술을 확보한 선진국의 지식재산권을 통한 공세가 예상되며, 중국 등 신흥국가의 도전에 따른 위협요인이 상존하고 있다. 또한, 기술의 특성상 장기간의 연구개발비 투입이 요구되며 실패위험도 안고 있다.
이에 따라 원천기술의 확보와 경쟁력 제고가 무엇보다 필요하다. 원천기술을 통한 지식재산권 전략을 마련하고 표준화를 선점함으로써 기술적 경쟁우위를 확보하는 것이 무엇보다 필요하다. 또한, 융합기술산업을 활성화하기 위해서는 관련 기술분야간 협력체계 구축이 필요하고 초기시장 창출을 위한 노력과 함께 관련 기업에 대한 체계적인 지원방안이 마련되어야 한다. 아울러, 다양한 분야를 겸비한 전문인력의 양성도 병행되어야 할 것이다.
사. IT-BT 융합기술 전략분야
정부는 미래사회의 변화와 서비스 수요를 전망하고 시장 규모, 상용화 시기, 기술 확보 가능성 등을 고려하여 핵심기술을 도출하고 이를 통해 핵심기술을 적용하여 미래 서비스 수요를 충족할 수 있는 융합기술 전략분야를 도출하였다.
미래사회는 건강한 삶, 쾌적하고 안전한 환경 등에 대한 사회적 필요와 이를 충족하기 위한 U-Health 서비스 등 신기술서비스 수요가 확대될 것으로 전망된다.
이런 미래사회의 요구를 반영할 수 있는 IT-BT 전략기술은 시장규모(30%), 상용화시기(30%), 기술확보 가능성(40%)을 고려하여 생명공학 정보분석 S/W, 바이오 센서, 생체 이미징, 바이오칩, 유해유기물센서, 생체신호인터페이스, 바이오 데이타보호, 생체정보보호 8개로 선정하였다.
<표 3-1-7-2> 미래사회의 수요 및 서비스 수요 전망 | |||
미래사회 수요 | 서비스 수요 | ||
건강하고 쾌적한 삶 | 건강한 삶 | ⊳노인대상 건강 모니터링 및 원격진료 ⊳성인병, 만성질환 등 환자 상태 상시 점검 ⊳맞춤식 건강관리 프로그램 ⊳위해물질 인체노출 감시 및 경보 | U-Health 서비스 |
쾌적하고 안전한 환경 | ⊳주거 환경 감시 및 환경오염 예방 ⊳환경오염 모니터링/오염원의 이동경로 추적 ⊳효과적인 재난/재해 예방체계 구축 | 안전/환경 감시서비스 | |
※출처: 과학기술예측을 위한 미래 사회의 이슈 및 수요 도출(STEPI, 2003) 재정리 | |||
도출된 핵심 융합기술을 활용하여 미래사회의 서비스 수요를 최대한 충족할 수 있도록 융합기술 전략 서비스분야로 건강환경 도우미(Pervasive Lifecare Com-panion)를 선정하였다. 건강환경 도우미 서비스는 개인의 건강상태를 실시간으로 감지하여 상시 건강관리와 응급상태 예방을 지원하는 U-Health 서비스와 함께 실시간으로 사물·환경정보를 감지하여 환경오염 및 유해식품 감지, 재난재해 경보 등의 환경관련 서비스를 제공하게 된다.

<그림 3-1-7-2> IT기반 융합기술 정책 추진체계
아. 융합기술 발전비전 및 추진전략
정부는 IT융합기술 연구개발을 강화하고 산업화 촉진, 초기시장 창출 등을 통해 우리나라를 2015년까지 세계 3위권의 IT융합기술 강국으로 발전시키고, 전세계 융합기술 시장 중 우리나라가 5% 이상의 시장점유율을 확보할 계획이다. 이를 통해 건강하고 안전한 미래사회를 구현할 수 있는 기반을 조성할 계획이다.
IT-BT 융합기술 발전을 위해 (i) 전략분야 기술 선점 → 초기시장 창출 → 산업화 촉진을 유기적으로 연계하여 융합기술의 순환적 발전을 도모하고, (ii) 기존의 NT/BT분야 기술개발과 차별화된 서비스 지향의 기술개발 전략을 추진 (원천기술/부품·소재/시스템 연계)하며, (iii) 다양한 기술분야의 전문가들이 자유롭게 연구하고 토의할 수 있는 ‘학제간 연구의 장’을 확대하고, (iv) 융합기술 발전 전략, 연구개발, 인력, 산업육성 등을 유기적으로 종합·조정하고 발전시키기 위한 전담조직을 설치·운영할 계획이며, (v) 학제간 공동연구 등 산·학·연 역할분담 및 관계부처/기관간 협력체계를 구축·운영할 방침이다.
자. IT-BT 융합기술 연구개발 및 산업화 추진계획
비만, 스트레스 등 건강상태 측정, 암/만성질환 검사, 유해생활환경 감시 등 건강하고 안전한 생활환경을 구현하기 위해 다양한 맞춤형 P-라이프케어 서비스를 구현하기 위한 밑바탕을 2015년까지 단계적으로 개발한다.
우리나라가 융합기술의 연구개발 허브 기능을 수행할 수 있도록 ‘디지털 컨버전스 센터’ 설치를 추진할 계획이다. 이 센터는 융합기술 관련 국내외 기술/시장/정책 동향을 파악/제공하며, 학제간 연구, 국제 공동연구 등 융합기술개발 전략 및 산업화 전략 수립을 지원하며, 융합기술 신제품, 서비스 시험·인증 시설 공동 활용 등의 서비스를 제공한다. 또한, 대학 기초연구 역량 강화 및 해외 연구개발센터 유치 등을 통한 선진국과 전략적 연구협력체제를 구축하고, 핵심·원천 기술개발을 통한 국제특허 확대를 통해 미래시장 선점 및 글로벌 경쟁력을 확보할 계획이다.
IT-BT 융합기술 인력양성을 위해 먼저 중장기 융합기술 인력수급계획을 수립하고, 대학 등을 통한 다분야의 기술·지식을 겸비한 중장기 핵심인력 양성 및 해외 우수인력 유치를 추진한다. 특히, 융합기술 특성에 맞는 맞춤형 현장기술 재교육시스템을 구축할 예정이다.
IT-BT 융합기술 초기시장 창출을 위해 관련시범사업을 발굴하여 U-City 또는 기업도시 등에서 시범 적용할 계획이다. 보건복지부, 서울시 등 관계기관과 협의하여 2007~2010년까지 매년 1개 시범사업을 발굴할 예정이다. 또한, 융합기술 관련 제품/서비스를 제공하는 기업의 창업 및 시장 관련 진입규제 완화 방안을 강구하게 된다.
아울러, IT 기업의 융합기술분야 투자 확대 유도 및 융합기술관련 규제 완화를 위해 융합기술 기업도시 구축 방안을 검토하고, 국책연구소의 기술이전, 공동 연구개발 프로젝트 확대 등을 통해 융합기술 벤처기업의 기술개발 및 사업화를 지원할 계획이다.
![]() 환경분야 생명공학 기술 육성정책(환경부)
환경분야 생명공학 기술 육성정책(환경부)
가. 기술개발 필요성
(1) 환경생명공학기술
일반적으로 “환경기술(Environmental Technology, ET)”이란 ‘환경오염을 저감·예방·복원하는 기술’을 말한다. “환경기술 개발 및 지원에 관한 법률”에서는 환경기술을 ‘환경의 자정능력을 향상시키고 사람과 자연에 대한 환경피해유발요인을 억제·제거하는 기술로써 환경오염을 사전에 예방·저감하고 오염 및 훼손된 환경을 복원하는 등 환경의 보전 및 관리에 필요한 기술’이라고 정의하고 있다.
이러한 환경기술 중에서도 환경생명공학기술(EnviroBio Technology, EBT)은 환경오염을 저감·예방·복원시키기 위하여 생물과 생물학적 처리공정을 이용하는 생명공학기술(Biotechnology, BT)을 환경기술에 접목시킨 기술로서 환경과학, 생태학, 분자생물학간의 유기적인 협조가 필요한 기술이다.
환경생명공학기술은 생명공학의 기본적인 핵심기술1) 중에서도 생물공정기술(발효공정제어, 분리정제, 배양기 설계·제작)과 미생물이용기술(미생물분리·배양, 항암물질 탐색기술)을 주로 활용하고 있다. 이러한 환경생명공학기술은 아직까지는 환경기술로서의 그 역할이나 중요성이 크게 부각되지 않았으나, 근래 각 분야에서의 첨단기술이 적극 개발됨에 따라 오염환경 정화(remediation)에서 오염예방(prevention) 및 생물학적 방법에 의한 오염검출(detection)분야로 그 영역이 점차 확대될 것으로 전망되고 있다.
(2) 환경기술개발정책 패러다임의 변화
21세기 들어 생명공학, 신물질개발, 정보기술의 발전 등 과학기술의 급속한 발전에 따라 새로이 등장한 환경문제에 대응하는 방향으로 환경기술개발이 적극 추진되고 있다. 환경문제에 대한 인식이 메조(meso)수준의 단위시스템 관점에서 매크로(macro) 수준인 네트워크 개념의 사회통합적 관점으로 접근함에 따라 과학기술적 연구와 사회과학적 연구의 통합적 접근전략이 강화되고 있다. 또한 분자생물학, 나노과학기술, 전자현미경 등의 발전과 맞물려 나노(nano)수준에서 환경문제에 대한 설명이 가능해짐에 따라 나노수준의 과학적 규명에 바탕을 둔 생명공학 환경정책의 추진이 가능해지고 있다.
<표 3-1-8-1> 환경기술개발 영역의 변화 | |||
구분 | 제 1 세대 환경기술 연구개발 | 제 2 세대 환경기술 연구개발 | 제 3 세대 환경기술 연구개발 |
환경인식 | ·경제발전을 위해서 오염물질배출 불가피 | ·원천적 환경오염물질 배출 최소화 | ·사회경제통합적 관점에서 지속가능한 환경 유지 |
기술개발 주요특징 | ·오염물질 사후처리 기술(waste treatment) | ·사전오염예방 ·환경친화제품 | ·환경복원·보전 및 재생 ·장기환경변화예측 대응 |
학문영역 | ·환경/화학공학, 기계전자 | ·환경/화공, 기계전자, 신소재, 생명공학 | ·생명공학, 신소재, 나노테크, 정보통신 등 |

<그림 3-1-8-1> 환경기술개발 정책 패러다임의 변화
현대사회의 복잡성 증가에 따라 발생하고 있는 다양한 환경문제에 대응하기 위해서는 새로운 과학기술 지식을 바탕으로 한 환경정책 추진이 불가피해지고 있으며, 생명공학 등 신기술과의 접목을 통한 환경기술 개발 수요도 점차 증가하고 있다.
나. 국내·외 환경생명공학기술 개발 현황
전 세계적으로 오존층 파괴물질, 온실가스, 생물다양성 등 국제규모의 환경문제가 대두되고 환경과 연계된 국제규제가 증가함에 따라 미, 일 등 선진국들은 자국산업의 경쟁력 확보차원에서 국제규모의 환경문제 대응기술 개발을 적극적으로 추진하고 있다.
또한 선진 주요국들은 생명공학의 발전에 따른 유전자변형생물체(GMOs, LMOs)의 환경(인체, 생태계) 위해성 평가를 적극적으로 추진하고 있다. 또한 내분비계 장애물질 문제의 대두로 기존 화학물질 및 의약산업·화학산업의 발전에 따른 새로운 화학물질에 대한 위해성 평가 연구도 중요하게 부각되고 있다. 이와 더불어 토양·지하수 오염은 장기간에 걸쳐 이루어져서 오염복원을 위한 비용도 장기적으로 크게 발생하는 환경문제로써 1990년대 이후 중요하게 부각되면서 선진 각국들은 이에 대응하기 위한 생태계 보전 및 복원 기술개발을 집중적으로 추진하고 있다.
(1) 미국
수질오염방지기술 분야에서는 생명공학 기술을 이용하여 하수처리장의 부영양화 방지를 위한 질소·인 제거 등의 고도처리기술 및 폐·하수처리기술, 폐수를 배출하지 않는 폐쇄계 등의 개발에 대한 실용화 단계의 연구가 진행 중이다.
사전오염예방기술 분야에서는 화학물질 자체를 무공해 또는 저공해화 하여 환경오염을 근원적으로 제거하기 위한 플라스틱, 계면활성제 등의 청정물질 개발 및 태양광에 의해 분해되는 광분해성 고분자, 미생물에 의해 분해되는 생분해성 고분자, 두 가지 성질을 겸비한 자연분해성 고분자의 개발이 부분적으로 실용화 단계에 있다.
환경복원기술 분야 중 생물학적환경정화 (bioremediation) 관련기술을 해양에 유출된 기름, 유류 저장탱크의 누출에 의한 토양오염, 오염된 지하수, 침전물(sedi-ment), 지표수 처리 등에 이용하고 있다.
(2) 일본
미생물 이용기술을 유기물과 질소나 인의 제거에 널리 활용하고 있으나, 난분해성 물질의 분해 및 처리에 있어서는 큰 진전이 없는 상태이다. 한편, 천연 또는 미생물 유래의 생분해도가 높은 계면활성제가 연구 중이며, 지구환경보전기술 분야에서는 미세조류를 이용한 이산화탄소 고정기술을 집중적으로 연구하고 있다. 오염현장에 대한 생물학적환경정화 기술은 아직 실용화되지 못하고 있으나, 생물학적환경정화 지침 작성예산을 높이는 등 관련기업의 활동이 점차 활발해지고 있다.
(3) 한국
미생물 제제(폐수처리용)를 이용한 기술개발이 활발하며, 주종은 유기물 분해균이고 일부는 난분해성 물질 분해균, 팽화제거균 등 특수제제이다. 또한 폐수처리시스템에서 미생물 담체(활성화탄소와 같은 미생물 부착재료) 이용 및 접촉재(플라스틱류의 유동상과 섬모상 생물막 등의 고정상) 개발을 연구하고 있다. 그러나, 아직 연구규모와 범위가 넓지 않아 전반적인 기술수준이 선진국에 비해 미흡한 실정이다.
다. 차세대 핵심환경기술개발사업 관련 환경생명공학기술 분야
21세기 유망기술인 환경기술을 집중 개발하여 환경오염문제를 적극 해결함으로써 국민의 삶의 질을 향상시키고 환경과 경제가 상생하는 환경복지국가를 구현하기 위하여 환경부는 2001년부터 차세대 핵심환경기술개발사업(Eco-Techno-pia 21, ET21사업)을 추진하고 있다.
ET21사업은 G-7 환경공학사업(’92~’01)을 통해 축적된 환경부문 연구역량을 활용하여 미래 환경수요에 대비한 원천기술과 차세대기술을 중점 개발하되, 환경현안해결기술과 수출유망산업기술을 병행 개발한다는 전략을 가지고 총 10년(2001~2010)간 1조 원(매년 1,000억 원 수준 투자) 투자를 목표로 추진되고 있다. 현재까지의 투자성과를 보면 2001년도에 500억 원, 2002년도에는 700억 원, 2003년도에는 750억 원, 2004년도에는 884억 원(기술료 재투자 34억 원 포함), 2005년도에는 882억 원이 투자되었다.
그 동안의 사업성과(2005년 6월 현재)로는 산업재산권 출원·등록 835건, 학술지 게재·학술회의 발표 4,174건, 기술실시계약 170개 과제(계약금 133억 원) 등의 성과가 나타나고 있다. 산업경쟁력 측면에서는 수출 76억 원, 공사실적 1,602억원, 국내 제품판매실적 256억 원을 올리는 등 사업이 진행됨에 따라 괄목할 만한 성과를 달성하고 있다.
<표 3-1-8-2> ET21사업 투자계획 | |||||
구 분 | 1단계 (2001~2003) | 2단계<예상> (2004~2007) | 3단계<예상> (2008~2010) | ||
기본 목표 | ∙환경기술(ET) 수준 세계 5위권 달성 | ∙현안 환경오염 처리기술 확보 | ∙중기 전략적 환경기술 확보 | ∙미래 원천 환경기술 확보 | |
투자 (억원) | 계 | 14,500 | 2,950 | 6,600 | 4,950 |
정부 | 10,000 | 1,950 | 4,600 | 3,450 | |
민간 | 4,500 | 1,000 | 2,000 | 1,500 | |
<표 3-1-8-3> ET21사업 추진 기술개발 과제 중 생명공학 접목 관련 과제 현황 | |||||
사업년도 | ET 21 | ET21과제 중 생명공학 관련 과제 | |||
협약과제수 | 국고지원금 | 협약과제수 | 국고지원금 | % | |
계 | 1,537 | 3,716 | 384 | 763 | 20 |
2001 | 219 | 500 | 43 | 99 | 20 |
2002 | 317 | 700 | 68 | 126 | 18 |
2003 | 340 | 750 | 90 | 171 | 23 |
2004 | 365 | 884 | 103 | 189 | 22 |
2005 | 296 | 882 | 80 | 178 | 20 |
한편 ET21사업에서 생명공학을 접목한 환경생명공학기술분야는 크게 4가지 분야로 나누어 볼 수 있다. 미생물 균주의 개발 및 개량 분야에서는 미생물분리·배양, 배양기 설계·제작(bioreactor개발), 단백질분리정제, 악취/VOC 제거용 바이오 필터 개발, 발효소멸 시스템, 난분해성 유기물(유류)을 분해하는 복합미생물 제제 개발 등이 있다. 생물분석기술 개발 분야에서는 실내 대기질 측정용 멀티센서 제조기술 및 제어시스템, DNA Microarray 기술, 효소센서, lab-on-a-chip기술, DNA 진단 기법 등이 있다. 처리공정의 개선 분야에서는 고농도 폐수처리 신공정개발 및 통합 제어시스템 개발, 미생물의 정보처리기능해명과 환경 monitoring system개발 등이 있다. 고유생물자원 이용으로는 부식, 식균성 동물(곤충)의 증식이 있다.
ET21사업에 추진 중인 기술개발 과제 중 생명공학을 접목한 관련 과제는 아래와 같이 전체의 1/5 정도를 차지하고 있다.
라. 향후 추진방향
ET21사업에서는 국내·외의 환경기술 수요조사 등을 토대로 중장기 환경기술개발 목표 및 계량화된 단계별·분야별 사업목표를 설정함으로써 중점기술개발 목표, 기술개발지도(Technology Road Map), 재원조달방안 등을 도출하기 위하여 차세대 핵심환경기술개발사업 10개년 마스터플랜을 마련(2002.7)하였다. 이에 따라 기술지도(TRM)에 맞추어 활용도, 환경개선기여도가 높은 우수한 EBT를 선택하여 중장기적으로 집중 지원해 나가고 있다.
1단계 사업('01~'03)이 마무리됨에 따라 1단계 연구성과 및 미비점을 분석한 결과, 1단계 사업은 기술지도(TRM)에 의거하며 체계적인 기술개발을 추진한 점은 돋보였으나, 실용화·상용화 위주(80%)의 개별과제 지원이라는 일원적 사업구조를 유지함으로써 10개년 마스터플랜에서 도출된 다원적 추진전략의 실질적 반영이 미흡한 것으로 나타났다.
이에 따라 2단계 사업부터는 10개년 마스터플랜의 추진전략을 구체적으로 반영하여 사업단, 실증지원기술개발사업, 미래원천기술개발사업 등 사업추진형태에 따라 지원규모, 지원기간 및 과제관리 등의 지원조건을 다각화하였다. 특히 미래원천기술개발사업은 생명공학 등 신기술과의 접목을 통해 ET의 경쟁력을 더욱 강화함으로써 대기·수질·폐기물·생태계 및 토양·위해성 관리 등의 분야에서 환경문제를 해결하여 국민의 삶의 질을 높이고, 수출형 미래 환경신기술제품 개발을 선도하며, 과학적 규명연구를 토대로 환경표준기술확보 등 과학기술기반의 선진국 수준 환경관리 능력을 확보하기 위한 전략적 단위사업이다.
신기술은 본격적인 실용화의 전 단계 기술로, 전통산업의 고부가가치화 또는 대체를 통해 장래 유망산업을 창출할 수 있는 기반기술이다. 환경기술 분야는 IT에 이어 신산업을 형성하면서 급성장하고 있으나, 국내 IT 분야 기술수준이 선진국의 60~70% 수준으로 크게 발달되어 있는 반면, 환경기술 분야는 아직 선진국 수준에는 비해 미흡한 형편이다. 일본 경제의 장기침체 원인이 “신기술 중심으로의 산업재편 부진”에 기인함을 감안할 때, 국내의 경우 세계적인 정보화 조류에 맞추어 성장한 IT를 제외하고는 환경기술, BT 등 후속 신기술에 대한 투자부족으로 향후 성장장애 요소로 작용할 것으로 전망2)되고 있다.
중국 등 후발개도국의 급속한 성장과 신기술을 주도로 한 미국 등 선진국의 재도약 사이에서 신기술 투자를 통한 미래 신산업시장의 선점은 지속성장을 위한 우리의 불가피한 생존전략이다. 우리 경제가 활력을 유지하면서 성장을 지속하기 위하여 환경기술 분야의 후속신기술 연구개발투자를 확대해 나갈 것이다. 환경기술개발 전반적으로는 IT·BT 등의 신기술과 접목한 사전오염예방기술 분야 및 환경복원, 지구환경보전 등 공공 성격의 첨단 환경기술개발에 대한 투자를 지속적으로 확대해 나갈 계획이다.
![]() 해양수산분야 생명공학 육성 정책(해양수산부)
해양수산분야 생명공학 육성 정책(해양수산부)
가. 개요
생명공학기술은 정보기술, 나노기술, 우주항공기술, 환경기술, 문화기술과 함께 21세기 국가발전을 선도할 첨단기술 분야로 인구폭증, 자원고갈, 환경오염 등 인류가 당면한 문제들을 해결할 수 있으며 인류 삶에 혁명적 역할을 가져 올 핵심 분야로 전 세계적으로 관심이 집중되고 있다. 이러한 생명공학관련 연구개발, 기술 및 산업에서 최근 중요하게 인식되고 있는 분야가 바로 해양생물을 이용한 해양생명공학기술이다. 해양은 지구표면의 약 71%를 차지하고, 지구상 동식물의 80%가 서식하고 있으며, 다양한 해양환경에 적응해 있는 해양생물의 특이한 생체구조와 생명기능은 생명공학의 주요한 소재이다. 특히 무인 잠수정과 같은 첨단장비들의 개발로 과거 우리가 접근할 수 없는 극지와 심해의 새로운 해양자원이 계속해서 보고되고 있어 연구범위가 점차 확대되고 있으며, 유용 신물질의 탐색대상도 육상생물에서 해양생물로 이동하는 추세이다. 해양생명공학기술은 해양생물 유전자원의 확보, 해양생물로부터 분리한 해양천연물을 이용한 의약품과 신물질 등의 생산, 유용 해양생물의 분자육종 및 형질전환 등을 통한 수산식량자원의 생산, 유전자변형 수산물의 관리 등 환경, 산업신소재, 식량자원, 건강·보건, 에너지 등 그 적용 범위가 매우 다양하다.1) 해양수산부에서는 이러한 해양생명공학기술의 중요성을 인식하고 해양생명공학산업을 미래 첨단 국가기간 사업으로 육성하기 위한 정책을 추진하고 있다.
나. 현황
(1) 해양생명공학육성 정책
해양수산부에서는 이미 해양개발기본계획(1996)과 21세기 해양시대의 일류국가로 지향하기 위한 ‘해양한국 21’(2000)을 통하여 첨단해양과학기술로 해양생명공학분야를 육성한다는 계획을 포함하여 발표한바 있다. 그리고 2000년에는 해양생명공학산업의 발전을 위한 기획연구 보고서를 작성하여 동 분야의 종합적이고 체계적인 계획수립과 실행을 위한 기초를 마련하였으며 2004년에 마린바이오21사업 추진계획을 수립, 동년 10월부터 사업을 수행하고 있다. 특히, 2004년에는 해양산업의 경쟁력 확보 및 해양국토의 관리강화를 위해 자체적으로 해양과학기술(Marine Technology, MT) 개발 계획을 수립하여 소규모로 산발적으로 수행되고 있던 기존의 사업을 체계적으로 관리하고 생명공학기술을 어업자원 복원·첨단양식 분야와 해양생물·유전자 자원개발 및 이용에 접목하여 미래 주요산업으로 육성하기 위해 향후 10년간 3,000억 원 이상의 연구개발비를 투자할 계획으로 있다.2)
<표 3-1-9-1> 정부 및 해양수산부의 생명공학관련 연구개발투자 실적3) (단위: 억 원, %) | ||||||
구 분 | 정 부 | 해양수산부 | ||||
연구개발 | 인프라 | 계 | 연구개발 | 인프라 | 계 | |
2004 | 4,246 | 1,770 | 6,016 | 46 | 18 | 64 |
2005 | 4,877 | 2,209 | 7,086 | 62 | 21 | 83 |
증가율 | 17.8 | 29.7 | ||||
해양생명공학관련 연구개발예산은 2001년도 34억 원 수준에 불과했으나 2004년도에는 64억, 그리고 2005년도에는 83억으로 꾸준히 확대되고 있다<표 3-1-9-1>. 아직까지 타 부처에 비하면 연구개발에 대한 투자가 미미한 실정이고 2005년도 정부 생명공학분야 연구개발예산 중 차지하는 비중이 1.2% 정도에 그치고 있지만 해양수산부 자체 투자액은 전년대비 29.7%로 증가하여 2005년도 정부부분 생명공학분야 투자계획이 전년도 대비 17.8% 증가한 것에 비교한다면 해양생명공학분야에 대한 상당한 예산 확대가 이루어지고 있음을 알 수 있다. 해양수산부에서는 앞으로도 매년 연구비의 꾸준한 증가를 통해 2006년 이후에는 연간 100억 원 이상의 예산을 확보하여 해양생명공학기술 발전에 기여할 예정이다.
그리고 지난 3월에는 ‘해양수산 R&D사업 관리체계 구축 및 활성화 방안’을 수립하여 여러 부서에서 산재하여 관리하고 있던 연구개발사업을 해양정책국으로 관리 부서를 일원화하였다. 또 2006년부터 해양수산연구관리 전문기관을 설립이며, 현재 국립수산과학원, 한국해양연구원, 해양수산개발원 등으로 분산 위탁 관리되고 있는 연구개발 사업을 통합 관리하는 방안을 추진하고 있다. 전문기관이 운영될 경우 전문가들에 의한 관련 분야의 연구동향이나 기술 예측, 기술 수요조사 등이 원활히 수행되고 또한 산업화를 위한 체계적인 관리가 가능하여 연구개발의 효율성을 높일 것을 기대하고 있다.
(2) 주요 연구개발사업
(가) 마린바이오21사업
마린바이오21사업은 2004년부터 2013년까지 10년 동안 총 2,500억 원의 연구비를 투자하여 첨단해양생명공학기술의 중점개발로 해양생명공학산업을 21세기 미래 주도형 고부가가치 성장동력산업으로 육성을 목표로 하고 있다. 해양·극한생물 분자유전체연구, 해양바이오프로세스연구 그리고 해양천연물신약연구의 3대 중요중점과제를 각각 해양연구원, 부경대학교, 서울대학교에 연구단을 두고 연구를 수행 중에 있다. 본 사업은 해양생물 유용유전자의 대량 발굴 및 활용기술개발, 해양산업용 신소재 및 해양기능성 식품·환경성 소재 개발, 신약 후보물질 및 질병 치료제 개발 등을 통해 해양바이오기술을 활용한 해양생물자원의 고부가가치 산업화를 실현해나갈 계획이다.4) 그리고 1999년부터 수행해오고 있던 ‘해양생물을 이용한 유용신물질 개발사업을 2005년부터 본 사업에 통합하여 추진함으로써 관련 연구들간의 유기적인 체계를 강화하였으며, 극지 유용생물자원연구와 남서태평양 해양생물자원개발 사업을 본 사업과 연계함으로써 극한 환경의 생물자원과 해외기지를 활용한 해양생명공학연구개발 범위를 확대하는 계기를 마련하였다.
<표 3-1-9-2> 주요 해양생명공학 연구사업 (단위: 억 원) | ||||
사업명 | 주요내용 | 2004 | 2005 | 구분 |
마린바이오21사업 | 해양생명공학기술을 활용한 해양생물자원의 고부가가치 산업화 | 30 | 62 | 연구개발 |
해양생물을 이용한 유용신물질개발5) | - | 16 | - | 연구개발 |
유전자변형 수산물의 안전성평가 연구 | 유전자변형수산물의 안전관리체계 구축 및 LMO's 바이오안전성 정보센터 운영 | 0.42 | 0.3 | 연구개발 |
해양생명공학기술 개발 | 해양생물 유전자원 확보와 종 보존 및 생명공학을 이용한 양식 신품종 개발 | 17.38 | 20.5 | 인프라 |
계 | 63.8 | 82.8 | ||

<그림 3-1-9-1> 마린바이오21사업의 주요 연구내용
(나) 유전자변형수산물 안전성평가 연구
유전자변형수산물 안전성평가 연구는 수산·해양 유전자변형생물체(Living Modi-fied Organisms, LMO)의 안전관리체계를 구축하고 수산·해양 LMO 바이오안전성 정보센터 운영을 위해 2003년부터 국립수산과학원에서 수행하고 있다. 본 연구는 유전자변형생물체 수산물의 위해성 평가기술을 확립하고 유전자변형수산물의 수출입에 따른 국제적인 규제에 대비하는 것은 물론 해양수산 유전자변형생물체(LMO)에 대한 위해성 심사대행 기관 지정 운영 및 표시제도 관리업무를 수행하고 있다.
(다) 해양생명공학기술 개발
해양생물 유전자원을 확보하고 생물자원 은행 구축을 위해 국립수산과학원에서는 유전체 연구와 분자육종 연구를 통해 우량품종을 개발하기 위한 해양생물의 유전체 연구 및 활용기술 개발, 수·해양 생물자원으로부터 기능성 천연물질을 추출하여 고부가가치의 수산 식·의약산업의 창출을 위한 수산물의 산업과학화 연구, 우리나라의 토속종, 양식대상종, 양식가능종 및 외국이식종에 대한 유전학적 분석을 실시하고 유전자원은행 운영을 위한 생물자원유전자정보은행 운영, 그리고 육종 프로그램 연구에 의한 주요 양식대상 품종의 우량화를 위한 양식생물 품종개량 등의 연구를 수행하고 있다.
(3) 향후 추진방향
해양생명공학산업은 아직 시장형성단계이나 성장잠재력이 높아 국가적 차원의 집중 투자가 필요하다. 특히, 우리나라의 생명공학 기초기술의 경우 선진국과의 격차가 적으므로 기존의 생명공학 기술을 해양생물에 적용했을 때 상승효과를 나타낼 수 있을 것이다. 그리고 우리나라는 전통적으로 수산식품을 애용하고 세계적으로도 인정받는 양식기술을 보유하고 있으며 고성장 형질전환 어류 개발 기술은 이미 선진국 수준에 이르고 있다. 따라서 집중투자를 통해 단기간에 세계적 수준에 도달할 가능성이 매우 크며 세계 5위권의 해양생명공학 기술 강국 진입과 세계 해양생명공학 산업시장의 5%를 점유할 수 있을 것으로 기대된다. 해양수산부에서는 산업화가 가능한 과제의 지속적인 발굴과 조기산업화를 유도하여 해양생명공학산업의 육성은 물론 유전육종 기술을 적용한 새로운 품종개발 및 고급어종 생산으로 안정적인 식량공급을 도모하고 수산물의 질병관리 및 유전자조작 해양생물에 대한 안전성 기술 개발을 통해 수산식품과 해양환경에 대한 국민의 신뢰성 증대를 위한 지속적인 연구를 추진하고자 한다.
국제적으로 해양생명공학분야의 발전은 매우 빨리 진행되고 있다. 우리나라에서는 다른 생명공학 연구 분야보다 연구개발이 늦었고 아직까지 예산 투자가 미흡한 편이지만 미래 해양생명공학기술 강국 진입을 위해 정부에서는 체계적인 계획 수립과 인프라 구축 및 기술 개발을 적극 지원하고, 연구 집단에서는 기초기술 및 실용화기술을 개발하며 산업체에서는 산업화를 위한 기술 개발을 주도하는 등 해양생명공학기술 발전을 위한 각 분야의 유기적인 노력이 요구된다.
■ 제 3장 국가 생명공학 육성 현황 제 2절 생명공학 경쟁력 지표 현황 |
![]() 투자현황
투자현황
가. 정부의 연구개발 투자현황
(1) 연구개발예산 규모 추이
과학기술이 국정운영의 중심이 되는 「과학기술 중심사회」 구현과 「제2의 과학기술입국」 실현을 위해 새롭게 수립된 참여정부의 과학기술기본계획(2003~2007년)에 근거하여 우리나라 과학기술정책은 2002년에 범부처적으로 작성한 국가기술지도(NTRM)의 내용을 주요 국가전략기술개발 계획에 반영토록 하고, 「지식·정보·지능화 사회」, 「건강한 생명사회」, 「지속가능 발전사회」 등 5대 비전별로 중점추진과제와 기술개발 방향을 제시하였다. 2004년부터는 「선택」과 「집중」의 원칙에 따라 5대 부문별로 핵심·전략기술을 개발하고 차세대 성장동력 사업을 본격 추진하기 위해 정부는 매년 총 예산 증가율 이상으로 정부의 연구개발 투자를 증대할 계획이다.
정부의 2004년도 총 연구개발예산은 일반회계와 특별회계를 포함해서 6조 273억 원으로 2003년도의 5조 5,768억 원에서 4,505억 원(8.1%) 증가하였다. 정부 총 연구개발 예산규모(일반회계+특별회계)의 비중은 2004년 4.8%로 2003년 4.5%에 비해 0.3%가 증가하였다. 2004년도 정부의 연구개발예산 편성의 주요특징은 크게 차세대 성장동력산업 지원, 기초 연구투자의 지속적 확대 추진, 청년실업 및 이공계 기피경향 해결을 위한 예산 배정, 지방화전략에 따른 예산의 차등 지원 등이다. 최근 3년간 정부의 연구개발예산 규모 추이는 <표 3-2-1-1>에 나타나 있다.
<표 3-2-1-1> 정부연구개발예산 규모 추이(2002-2004년) (단위: 억 원) | |||||
구분 | 2002년 예산 | 2003년 예산(A) | 2004년 예산(B) | 증감 | |
(B-A) | % | ||||
연구개발 예산규모(일반회계, A) | 48,501 | 52,678 | 56,751 | 4,073 | 7.7 |
(A/B, %) | (4.4) | (4.5) | (4.8) | ||
일반회계+특별회계 | 51,583 | 55,768 | 60,273 | 4,505 | 8.1 |
정부예산규모(일반회계, B) | 1,096,298 | 1,181,323 | 1,183,560 | 2,237 | 0.2 |
출처: 2004년도 정부연구개발예산 현황(KISTEP)
(2) 6T 분야별 연구개발 예산 분포 현황
정부는 미래의 성장동력을 창출해 줄 미래 유망 신기술로 BT(생명공학)를 위시하여 NT(나노), IT(정보통신), ET(환경), ST(우주), CT(문화) 등 6개 분야를 선정하여 집중적으로 투자를 확대하고 있다. 2004년도 전체 연구개발예산 중 6T 분야 투자비중은 29.9%(1조 8,022억원)으로 전년대비 7.4% (1,240억원) 증가하였으며, 미래 유망 신기술에 대해 투자를 확대한다는 정부방침에 따라 꾸준히 증가하는 추세에 있다. 최근 3년간 미래 유망 신기술에 대한 예산 현황은 <표 3-2- 1-2>에 나타나 있다.
<표 3-2-1-2> 미래 유망 신기술 예산 현황(2002-2004년) (단위: 억 원, %) | ||||||||
구분 | 2002년 | 2003년 | 2004년 | 증감 | ||||
예산 | 비중 | 예산(A) | 비중 | 예산(B) | 비중 | (B-A) | % | |
BT | 4,329 | 8.4 | 4,964 | 8.9 | 5,504 | 9.1 | 540 | 10.9 |
IT | 4,513 | 8.7 | 5,015 | 9.0 | 4,726 | 7.8 | -289 | △5.8 |
NT | 1,740 | 3.4 | 1,992 | 3.6 | 2,158 | 3.6 | 166 | 8.4 |
ET | 2,311 | 4.5 | 2,718 | 4.9 | 3,184 | 5.3 | 466 | 17.1 |
ST | 1,799 | 3.5 | 1,844 | 3.3 | 2,207 | 3.7 | 363 | 19.7 |
CT | 134 | 0.3 | 249 | 0.4 | 243 | 0.4 | -6 | △2.7 |
합계 | 14,826 | 28.7 | 16,782 | 30.1 | 18,022 | 29.9 | 1,240 | 7.4 |
연구개발 예산 | 51,583 | 55,768 | 60,273 | 4,505 | 8.1 | |||
출처: 2004년도 정부연구개발예산 현황(KISTEP). 추정에 의해 산정된 값으로 각 분야별 육성계획의 수치와는 차이가 있으므로 기술분야간 예산분포를 살펴보는 참고용 자료임. | ||||||||
정부 연구개발 예산의 6T 분야별 분포를 살펴보면, 2003년까지는 IT 분야가 가장 많았으나 2004년부터 생명공학분야가 9.1%(5,504억 원)로 가장 많은 비중을 차지했다. IT 분야의 예산감소는 연구개발사업의 기준 재조정에 따라 산업자원부의 전자상거래기술개발, 산업부분 B2B네트워크구축 등의 사업이 제외되었기 때문이다. 생명공학 분야의 예산증가는 과학기술부 21세기 프론티어연구개발사업 중 인간유전체기능연구와 미생물유전체활용기술 분야의 예산증가, 산업자원부의 생명공학 산업기술실용화센터 예산 증가, 보건복지부의 바이오보건기술연구개발 분야 예산증가 등에 기인한 것이다.
나. 주요부처의 생명공학분야 연구개발 투자현황
(1) 생명공학분야 정부 투자현황
정부의 생명공학분야 투자는 「생명공학육성법」에 의해 1994년 수립된 「생명공학육성기본계획(Biotech 2000)」에 의해 추진되고 있다. 생명공학육성기본계획이 수립된 1994년 이후 정부예산은 연평균 28% 비율로 꾸준히 증가하고 있다.
(2) 2005년도 투자계획
「2005년도 생명공학육성시행계획」에 따른 정부 투자는 총 7,086억 원이며 연구개발부문은 4,877억 원으로 전년대비 14.9% 증가했고, 인프라부문은 2,209억 원으로 전년대비 24.4% 증가했다<표 3-2-1-3>. 이러한 증가의 주요 요인은 산업자원부 인프라지원사업에 1,068억 원, 해양수산부 마린바이오21사업에 62억 원, 정보통신부 BIT융합원천기술개발사업에 102억 원, 과학기술부 나노바이오사업에 419억 원, 교육인적자원부 BK21사업에 224억 원, 보건복지부 신약개발사업에 290억 원, 농림부 바이오그린21사업에 308억 원, 그리고 환경부 차세대핵심환경기술개발사업에 195억원 투자하는데 기인한 것이다.
<표 3-2-1-3> 부처별 연구개발 투자계획 (단위: 억 원, %) | ||||||||||
부처 년도 | 구분 | 과기부 | 교육부 | 농림부 | 산자부 | 복지부 | 정통부 | 환경부 | 해양부 | 총계 |
2005년도 투자계획 | 연구 개발 | 2,158 | 264 | 609 | 801 | 686 | 102 | 195 | 62 | 4,877 |
인프라 | 167 | - | 183 | 1,088 | 692 | 40 | 18 | 21 | 2,209 | |
계 | 2,325 | 264 | 792 | 1,889 | 1,378 | 142 | 213 | 83 | 7,086 | |
2005년도 정부투자는 실적치가 아닌 생명공학육성시행계획상의 계획치임.
부처별로는 과학기술부, 산업자원부, 보건복지부, 농림부 등 4개 부처에서 생명공학분야 투자가 활발하며, 과학기술부가 32.8%를 점유하고 이어서 산업자원부가 26.7%, 보건복지부가 19.4%, 농림부가 11.2%를 점유하고 있다
<표 3-2-1-4> 과학기술부의 주요사업 투자현황 (단위: 억 원) | ||
사업명 | 세부사업명 | 2005년 예산 |
21세기 프론티어 연구개발사업 | 인간유전체기능연구, 자생식물이용기술, 작물유전체기능연구, 생체기능조절물질개발, 미생물유전체활용기술, 세포응용연구, 단백질체학이용, 뇌기능 활용 및 뇌질환 | 646 |
생명공학연구 개발사업 | 바이오디스커버리, 바이오퓨전, 바이오인프라, 바이오코웍 | 422 |
바이오 신약·장기사업 | 장기이식용 형질전환돼지 생산 원천기술개발, 단백질칩 기술개발, 지능형 약물전달시스템기술개발, 면역기능제어기술개발 | 100 |
합 계 | 1,168 | |
(3) 4개 주요부처별 투자현황
(가) 과학기술부
범부처사업인 21세기 프론티어연구개발사업 중 인간유전체의 기능분석을 통해 위암/간암 진단·예방·치료기술 개발, 자생식물 보존·활용 및 천연 신기능성 식품의약 개발, 작물유전체 구조·기능 연구 및 품종육성 실용화기술 개발, 성인형 질환치료제용 합성신약 후보물질 및 신기술 개발, 미생물유전체 정보활용 고기능 세포 재설계 및 응용기술 개발, 줄기세포 분화조절기술 개발 및 임상치료기술 개발, 첨단 단백질체학 연구를 통한 호발성질환 치료제 개발, 뇌유전체 기능연구 및 뇌기능 항진과 뇌질환 핵심기전 연구 등에 총 646억 원을 투자하였다. 또한 생명공학연구개발사업(바이오디스커버리, 바이오퓨전, 바이오인프라, 바이오코웍)에 총 422억 원을 투자하고, 바이오신약·장기사업(차세대 성장동력 사업)에 총 100억 원을 투자하였다<표 3-2-1-4>.
(나) 산업자원부
중장기 및 단기 기술개발과제에 695억원, 인프라 부문은 1,053억원을 지원하여 생명공학분야(바이오에너지 개발은 제외)에 총 1,748억원을 투자했다. 연구개발 중 중장기과제는 의약품, 바이오칩, IT 및 NT 융합 기술개발 중심이며, 단기과제는 의약품, 소재, 식품, 진단기기, 의료장비 등 다양한 분야를 포함한다<표 3-2-1-5>.
<표 3-2-1-5> 산업자원부의 주요 기술개발사업 투자현황 (단위: 억원) | ||
구 분 | 사업명 | 2005년 예산 |
중장기 | 중기거점기술개발, 차세대신기술개발, 성장동력기술개발, 바이오스타프로젝트, 바이오융합사업, 바이오챌린저, 국제협력기술개발, 핵심기반기술개발 | 475 |
단 기 | 부품소재기술개발, 공통핵심기술개발, 신기술실용화기술개발, 지역중점기술개발, 청정생산기술보급사업 | 220 |
합 계 | 695 | |
<표 3-2-1-6> 산업자원부의 주요 인프라구축사업 투자현황 (단위: 억원) | ||
구 분 | 사업명 | 2005년 예산 |
기반구축 | 생명공학산업기술실용화센터,바이오안전성정보센터, LMO 위해성평가센터, Korea Bio-Hub 구축, 산·학·연 공동연구 기반구축, 단백질체학 생물정보인프라, 생물의약품 생산시설 표준화기반구축, 산업기술인력양상사업, 생명공학산업 기술이전 기반구축 | 340 |
지역산업 | 지역기술혁신센터(TIC), 9개 시·도 지역특화센터, 4개 시·도 2단계 지역특화센터, 지역혁신특성화(RIS) 시범사업, 4개 지역 기술지원 사업, 4개 지역 인력양성사업 | 713 |
합 계 | 1,053 | |
인프라는 cGMP, 안전성평가, 전임상시설, 표준화 등을 위한 산업기반 구축이 핵심이며, 지역균형발전을 위해 각 시도에 지역특성에 맞는 바이오센터를 구축한다<표 3-2-1-6>.
(다) 보건복지부
바이오신약, 바이오장기, 바이오칩 등 보건의료 차세대 성장동력 사업 분야의 연구개발에 중점 투자하고, 국내 신약 개발의 선진화 및 국제화를 위한 신약개발 선진국과의 협력연구를 지원하며 최근 급속한 고령화 현상에 대비하여 건강한 삶을 유지하게 하고 노인성 퇴행성질환을 예방할 수 있는 생명·노화연구에 투자했다. 또한 보건의료기술개발 촉진을 위한 인프라를 구축하여 기술평가, 기술중개, 사업화지원 등 보건산업기술 사업화지원사업을 활성화하는데 투자했다<표 3-2-1-7>.
<표 3-2-1-7> 보건복지부의 주요사업 투자현황 (단위 : 억 원) | |
사업명 | 2005년 예산 |
신약개발사업 | 290 |
바이오장기기술개발사업 | 80 |
의료기기기술개발사업 | 113 |
의료정보기술개발사업 | 39 |
건강기능제품개발사업 | 57 |
보건의료바이오기술개발사업 | 245 |
보건의료기술인프라개발사업 | 210 |
한방치료기술개발사업 | 65 |
오송생명과학단지조성사업 | 279 |
합 계 | 1,378 |
<표 3-2-1-8> 농림부의 주요사업 투자현황(산하기관 포함) (단위: 억 원) | ||
주관 기관 | 사 업 명 | 2005 계획 |
농림부 | 농림기술개발사업 | 56 |
바이오장기생산연구사업 | 45 | |
농촌진흥청 | 바이오신약생산연구사업 | 13 |
농업생물기술개발사업 | 233 | |
농업생명공학기술개발사업 | 308 | |
인프라구축사업(농업생명공학정보센터 구축 및 운영) | (183) | |
산림청 | 산림자원 고부가가치 생산 및 이용 기술개발 | 9 |
국립수의과학검역원 | 수의과학기술개발사업 | 98 |
총 계 | 762 | |
(라) 농림부
농업 생명공학연구개발 성과의 실용화 및 산업화 정책 추진(고품질 기능성 제품 등 고부가가치 지식기반형 생명공학기술 개발, 기술이전과 거래시장 활성화로 연구성과의 활용 및 산업화 유도), 형질전환 가축이용 바이오 신약·장기생산기술 개발(형질전환 가축을 이용, 고부가가치 바이오신약 생산 및 산업화 기술개발, 인간에게 이식 가능한 형질전환 무균 복제돼지 개발 및 산업화 추진), 농림 생명공학산업 활성화를 위한 인프라 구축 및 환경조성(유전자변형생물체(GMO) 안전성 평가 및 정성·정량 분석기술 개발, 생명공학기술과 농업유전자원의 정보관리 및 지원대책 강화) 등에 총 762억 원을 투자했다<표 3-2-1-8>.
![]() 인력현황
인력현황
가. 생명공학인력의 현황
(1) 생명공학산업의 인력 현황
2004년에 한국생명공학 산업협회에서 조사 발표한 2003년도 국내 생명공학산업의 인력 활용실태에 의하면 산업계 학사 이상 취업자는 총 7,051명으로 파악되었다. 생명공학산업은 첨단과학기술을 바탕으로 하는 지식집약산업이기 때문에 대부분의 기업이 연구개발에 많은 투자를 하고 있고 인력 또한 대부분이 연구부문에 종사하는 것으로 조사되었다. 즉, <표 3-2-2-1>에 따르면 총 7,051명 가운데 74.4%인 5,248명이 연구인력으로 구성되어 있다.
이들 인력의 학력별 구성을 보면, 박사급은 14.7%이고, 석사와 학사급 인력이 각각 40%를 조금 상회하는 비중을 차지하고 있다. 즉, 석사급 이상이 전체 취업인력의 57.5%를 차지하여 고학력 위주의 인력구성임을 알 수 있다. 또한 고급인력일수록 연구에 종사하는 것으로 나타났는데, 박사인력의 약 97%, 석사급의 88%가 연구에 종사하고 있다. 학사급은 연구인력과 생산인력이 5:5의 비율로 나타났다. 이처럼 생명공학 산업이 고급인력이자 연구인력 중심의 구성을 보이지만 이들 석·박사인력의 비중은 매년 조금씩 줄어들고 있다.
<표 3-2-2-1> 생명공학 산업부문 인력(2003년) (단위: 명, %)
구 분 | 박 사 | 석 사 | 학 사 | 합 계 |
연구인력 | 1,001 (19.1) | 2,654 (50.6) | 1,593 (30.4) | 5,248 (100) |
생산인력 | 35 ( 1.9) | 363 (20.1) | 1,405 (77.9) | 1,803 (100) |
총 계 | 1,036 (14.7) | 3,017 (42.8) | 2,998 (42.5) | 7,051 (100) |
주 1. 연구인력은(생명공학부문 연구개발 인력)+(연구관리직(생명공학 전공자)) 해당
2. 생산인력은 연구소 이외의 생명공학 산업관련부문 생산직 해당
출처: 한국생명공학 산업협회, 2004
<표 3-2-2-2> 생명공학산업의 학력별 고용 증가율(1997-2003) (단위: %/년) | ||||
구 분 | 박 사 | 석 사 | 학 사 | 합 계 |
연구인력 | 21.9 | 19.0 | 23.9 | 20.9 |
생산인력 | 27.9 | 21.8 | 32.6 | 29.7 |
합 계 | 22.1 | 19.3 | 27.5 | 22.8 |
출처: 한국생명공학 산업협회(각년도) | ||||
(2) 생명공학산업의 고용 추이
한국생명공학 산업협회가 조사한 1997~2003년 생명공학산업의 인력 고용실태를 분석하면 이 기간 동안 인력규모는 연평균 22.8% 증가한 것으로 나타났다. 이는 매 4년마다 인력규모가 (5/4)씩 늘어나는 것으로 그동안 생명공학산업이 급격히 성장했음을 보여준다. 같은 기간에 연구개발비는 1,263억 원에서 3,419억 원으로, 시설투자비는 600억 원에서 1,330억 원으로 급증한 것 또한 이를 반영한다.
인력증가의 내용에 있어서는 연구인력보다 생산인력의 증가가 컸다. 또한 이 기간 동안 학사가 27.5%의 증가율로 석·박사에 비해 높았다. 이것은 박사급 인력의 증가율이 가장 높았던 2003년 백서3) 자료와 비교해 차이를 보이는 것이며 2000년 이후의 생산인력 증가 추세와 병행되어 진행되고 있다. 동시에 <표 3-2-2-2>를 통해 첨단고급기술 인력에 대한 강력한 수요 역시 병존하고 있음을 확인할 수 있다.
나. 생명공학인력의 수요 및 공급전망
(1) 생명공학산업인력의 수요전망
수요전망에 있어서는 생명공학산업의 학력별·직무별 고용증가율을 근거로 생명공학산업의 전체 종사자를 추정하고 2015년까지의 신규수요를 전망하였다. 특히, 수요전망의 경우 기존 산업분류에 따라 생명공학산업을 정의할 경우 생명공학 전문기업 및 전문인력에 대한 수요를 과대평가할 가능성이 큼에 따라 본 수요전망은 생명공학 전문기업에 대한 한국생명공학 산업협회의 실태조사를 바탕으로 하였다.
이러한 추세를 기반으로 하여 향후 생명공학인력 수요를 추정하면, 2003년에는 10,000여 명 수준이었던 생명공학인력의 규모는 2010년에는 약 31,000명으로 늘어나고, 2015년에는 약 92,000명을 상회할 것으로 전망된다<표 3-2-2-3>. 이처럼 생명공학산업의 고용규모가 매 5년마다 세 배씩 늘어날 것으로 예상되는 가운데, 새로운 인력수요는 박사급에서는 현재(2005년) 약 300명에서 2010년 757명과 2015년 2,053명으로, 석사급에서는 697명에서 1,687명(’10)과 4,084명(’15)으로, 학사급은 1,050명에서 3,532명(’10)과 11,883명(’15)으로 증가할 것으로 추정되었다.
<표 3-2-2-3> 기술수준별 생명공학인력 수요전망 (단위: 명) | |||||
연 도 | 총종사자수 | 신규수요 | |||
소계 | 박사 | 석사 | 학사 | ||
2005 | 10,712 | 2,025 | 279 | 697 | 1,050 |
’06~’08 | 49,760 | 9,490 | 1,265 | 3,008 | 5,217 |
’09~’11 | 94,408 | 18,219 | 2,301 | 5,113 | 10,804 |
’12~’15 | 272,307 | 53,274 | 6,240 | 12,777 | 34,258 |
합 계 | 427,188 | 83,008 | 10,085 | 21,595 | 51,328 |
(2) 생명공학인력의 공급 추이 및 전망
생명공학 분야의 전문지식을 습득하기 위해서는 해당 기술과 관련된 학문분야를 전공하거나, 관련분야에서 필요한 훈련과정을 거쳐야 한다. 특히 생명공학처럼 첨단 기술을 생산과정과 연구개발활동에 적용하기 위해서는 대부분 학사, 석사 및 박사 등 고등교육과정 이수를 필요로 한다.
본 절에서는 ‘향후 필요한 수요를 충당하기 위해 인력공급이 충분한가’라는 질문에 답하기 위해 생명공학 분야 과학기술인력의 공급 구조를 분석하도록 한다. 우선 생명공학인력의 연평균 공급 증가율은 <표 3-2-2-4>와 같다. 즉, 1999년에서 2004년 사이 생명공학 관련 졸업생수는 매년 비슷한 수준이었다. 그러나 학력별로 보면 박사는 연평균 7.9% 증가했으나 석사는 2.4% 늘어났고, 학사는 0.7% 감소했다.
이러한 추세 및 학령인구 전망 등을 고려하여 2005년에서 2015년까지 생명공학인력의 학위별 공급을 전망하면 <표 3-2-2-5>와 같다. 즉, 대학에서 배출되는 학사 이상 인력은 2005년 9,353명에서 ’06~’08년에는 연평균 9,290명, ’09~’11년과 ’12~’15년에는 8,672명과 7,062명으로 계속 감소한다. 학력별로 보면 박사는 2005년 461명에서 503명(’12~’15, 평균)으로, 석사는 1,857명(’05)에서 1,981명(’12~’15 평균) 늘어난다. 하지만 학사는 2005년 7천명 수준에서 학령인구 감소의 영향으로 감소하는 것으로 전망된다.
<표 3-2-2-4> 학위별 생명공학인력 공급 증가율(1999-2004) (단위: %/년) | |||
합 계 | 박 사 | 석 사 | 학 사 |
0.1 | 7.9 | 2.4 | -0.7 |
자료: 교육인적자원부·한국교육개발원(각년호) | |||
<표 3-2-2-5> 학위별 생명공학인력 공급전망 (단위: 명) | ||||
연 도 | 신규공급 | |||
소계 | 박사 | 석사 | 학사 | |
2005 | 9,353 | 461 | 1,760 | 7,133 |
’06~’08 | 27,869 | 1,412 | 5,438 | 21,019 |
’09~’11 | 26,016 | 1,457 | 5,673 | 18,886 |
’12~’15 | 28,248 | 2,014 | 7,924 | 18,311 |
합 계 | 91,486 | 5,343 | 20,794 | 65,349 |
전망치는 「교육통계DB」와 한국직업능력개발원의 졸업생 실태조사를 바탕으로 하였다. | ||||
(3) 수급차 분석
앞서 제시한 수요전망과 공급전망을 바탕으로 수급차를 분석하면 <표 3-2- 2-6>과 같다. 먼저 2006년부터 2015년까지 10년간의 총 수요와 총 공급을 비교해 보면 박사와 석사는 공급부족이, 학사에서는 초과공급이 예상된다. 즉, 박사는 수요가 공급을 상회하는 것으로, 석사는 수요와 공급이 비슷한 수준인 것으로, 그리고 학사는 수요가 전체 공급의 80% 수준이 될 것으로 전망되었다. 그러나, 전망기간 중 모든 학력군에서 수요가 공급에 비해 보다 빠르게 성장함으로써 생명공학인력은 공급과잉에서 공급부족으로 전환되고, 전망의 최종년도인 2015년에 이르면 전반적으로 수요에 비해 공급이 부족하게 될 것으로 나타났다.
<표 3-2-2-6> 기술수준별 생명공학인력 수요-공급 비중 (단위: %)
연 도 | 소계 | 박사 | 석사 | 학사 |
2005 | 21.7 | 60.6 | 39.6 | 14.7 |
’06~’08 | 34.1 | 89.6 | 55.3 | 24.8 |
’09~’11 | 70.0 | 157.9 | 90.1 | 57.2 |
’12~’15 | 188.6 | 309.9 | 161.3 | 187.1 |
합 계 | 90.7 | 188.7 | 103.9 | 78.5 |
![]() 특허현황
특허현황
가. 특허개요
생명공학분야에 있어서 특허는 매우 중요한 의미를 갖는다. 막대한 연구개발비가 투입되고 장기간의 연구개발기간이 소요되며, 일부 분야는 시장진입을 위한 법적 승인을 위해 장시간이 소요되는 특성을 지니고 있어 생명공학분야에서 투자회수를 위한 법적장치인 특허의 획득은 매우 중요하다고 할 수 있다.
특히, 생명공학분야의 연구개발정책 수립을 위해서는 특허정보에 대한 분석이 반드시 필요하다. 특허정보는 연구개발과의 밀접한 연관성, 풍부하고 객관적인 정보의 제공, 데이터의 접근 용이성 등의 특징을 갖고 있어 연구개발성과 측정 및 국가의 과학기술정책을 수립하는 기초자료로 활용이 가능하기 때문이다.
나. 분석기준
생명공학분야의 기술분류는 OECD에서 특허분류를 대상으로 정의한 생명공학범주를 참고하여 특허청의 전문가집단에서 세분화한 6개 산업 13개 기술분류를 기준4)으로 사용하였다.

<그림 3-2-3-1> 생명공학의 기술분류
분석대상국가로는 한국과 세계적 동향을 파악하기 위해 특허를 가장 강하게 보호하고 시장규모도 큰 미국 특허를 대상으로 하였으며, 1995~2004년까지의 출원/등록된 특허를 조사하였다.
다. 한국에 출원된 생명공학 특허건수 동향
한국에 출원된 생명공학분야 특허분석 결과, 생명공학분야 특허는 1999년 이후 급격한 증가세를 보이고 있는 것으로 나타났다.
<표 3-2-3-1> 한국에 출원한 생명공학분야의 연도별 특허출원건수
1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 계 | |
내국인 | 546 | 618 | 670 | 785 | 856 | 1,311 | 1,577 | 1,689 | 1,798 | 1,756 | 11,606 |
외국인 | 633 | 719 | 918 | 761 | 799 | 1,025 | 1,102 | 956 | 1,001 | 1,172 | 9,086 |
한국에 특허출원하는 외국인의 경우, 미국이 3,543건으로 가장 많으며, 그 다음으로 일본이 1,857건, 독일이 928건 순으로 나타났다.
<표 3-2-3-2> 한국에 출원한 생명공학분야의 국가별-연도별 특허출원건수
1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 계 | |
미국 | 245 | 326 | 380 | 282 | 337 | 402 | 423 | 362 | 328 | 458 | 3,543 |
일본 | 127 | 129 | 156 | 159 | 154 | 171 | 247 | 245 | 231 | 238 | 1,857 |
독일 | 58 | 74 | 87 | 91 | 73 | 125 | 114 | 92 | 115 | 99 | 928 |
영국 | 22 | 29 | 50 | 31 | 34 | 50 | 51 | 37 | 43 | 47 | 394 |
스위스 | 24 | 29 | 33 | 44 | 28 | 41 | 25 | 24 | 45 | 52 | 345 |
프랑스 | 22 | 29 | 43 | 34 | 29 | 38 | 33 | 32 | 31 | 36 | 327 |
라. 미국에 등록된 생명공학 특허건수 동향
미국에 등록된 생명공학분야의 특허조사결과, 한국은 지난 10년 동안 378건의 특허가 등록되어 특허건수 순위로는 15위를 차지하고 있으며 아시아권에서는 일본에 이어 2위를 차지하고 있는 것으로 나타났다.
<표 3-2-3-3> 미국에 등록된 생명공학분야의 국가별-연도별 특허건수
1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 합계 | 순위 | |
미국 | 1,958 | 2,744 | 4,008 | 5,623 | 5,479 | 4,831 | 5,356 | 5,148 | 4,425 | 4,199 | 43,771 | 1 |
일본 | 342 | 398 | 396 | 606 | 517 | 468 | 525 | 439 | 436 | 415 | 4,542 | 2 |
독일 | 145 | 195 | 253 | 311 | 337 | 287 | 347 | 377 | 468 | 372 | 3,092 | 3 |
영국 | 82 | 125 | 169 | 249 | 288 | 240 | 254 | 227 | 208 | 176 | 2,018 | 4 |
네덜란드 | 78 | 88 | 122 | 182 | 189 | 188 | 144 | 299 | 232 | 279 | 1,801 | 5 |
프랑스 | 71 | 117 | 158 | 220 | 219 | 194 | 226 | 203 | 209 | 152 | 1,769 | 6 |
캐나다 | 72 | 104 | 140 | 205 | 258 | 233 | 233 | 249 | 208 | 181 | 1,883 | 7 |
덴마크 | 23 | 50 | 64 | 116 | 104 | 113 | 132 | 144 | 117 | 131 | 994 | 8 |
스위스 | 46 | 52 | 52 | 78 | 79 | 76 | 110 | 141 | 90 | 79 | 803 | 9 |
호주 | 31 | 40 | 49 | 82 | 94 | 59 | 123 | 109 | 80 | 75 | 742 | 10 |
이스라엘 | 34 | 37 | 21 | 64 | 67 | 47 | 67 | 71 | 77 | 52 | 537 | 11 |
스웨덴 | 27 | 31 | 33 | 70 | 59 | 56 | 61 | 63 | 68 | 55 | 523 | 12 |
벨기에 | 14 | 15 | 20 | 49 | 52 | 57 | 47 | 55 | 86 | 78 | 473 | 13 |
대한민국 | 11 | 18 | 11 | 29 | 53 | 33 | 63 | 56 | 52 | 52 | 378 | 15 |
인도 | 2 | 4 | 9 | 12 | 13 | 12 | 28 | 56 | 55 | 47 | 238 | 17 |
대만 | 6 | 5 | 13 | 13 | 18 | 14 | 35 | 31 | 22 | 25 | 182 | 19 |
중국 | 3 | 2 | 4 | 7 | 4 | 7 | 9 | 15 | 10 | 18 | 79 | 25 |
전체건수 | 3,019 | 4,154 | 5,658 | 8,125 | 8,041 | 7,086 | 7,945 | 7,883 | 7,030 | 6,575 | 65,516 | - |
마. 미국특허로 본 생명공학분야의 국가별 기술수준
생명공학분야의 국가별 기술수준을 분석하기 위해 양적지표인 특허건수와 질적지표인 PII (Patent Impact Index)를 사용하여 각 국가별 기술력을 분석하였다.
그 결과, 한국은 1995~1999년 20위에서 2000~2004년에는 14위로 기술력 순위가 높아지고 있는 것으로 나타났다. 그러나, 기술력 상위에 있는 국가들에 비해서는 여전히 부족한 것으로 나타나, 양적인 성장과 함께 질적인 성장도 동시에 필요한 것으로 조사되었다.
<표 3-2-3-4> 미국특허로 살펴본 국가별 기술수준
국가 | 특허건수 | 특허영향지수(PII) | 기술력(TS) | |||||
95-99 | 00-04 | 95-99 | 00-04 | 95-99 | 순위 | 00-04 | 순위 | |
미국 | 19,812 | 23,959 | 1.14 | 1.18 | 22,586 | 1 | 28,272 | 1 |
일본 | 2,259 | 2,283 | 0.52 | 0.53 | 1,175 | 2 | 1,210 | 2 |
독일 | 1,241 | 1,851 | 0.60 | 0.61 | 745 | 4 | 1129 | 3 |
영국 | 913 | 1,105 | 0.86 | 0.95 | 785 | 3 | 1050 | 5 |
네덜란드 | 659 | 1,142 | 0.70 | 0.43 | 461 | 6 | 491 | 7 |
프랑스 | 785 | 984 | 0.55 | 0.62 | 432 | 7 | 610 | 6 |
캐나다 | 779 | 1,104 | 0.91 | 0.97 | 709 | 5 | 1071 | 4 |
대한민국 | 122 | 256 | 0.36 | 0.43 | 44 | 20 | 110 | 14 |
대만 | 40 | 198 | 0.69 | 0.22 | 27 | 21 | 44 | 21 |
인도 | 55 | 127 | 0.41 | 0.66 | 23 | 22 | 84 | 18 |
중국 | 20 | 59 | 0.81 | 0.89 | 16 | 25 | 53 | 20 |
전체 | 28997 | 36519 | 1 | 1 | 28997 | 36519 | ||
기술분야별로 연도별 특허출원추이를 살펴보면, 생물의약, 유전체, 측정진단, 형질전환동식물개발기술 등의 특허활동이 활발하게 이루어지고 있음을 보여주고 있다.
기술분야별로 국가별 특허전략을 상대적 집중도 지수인 AI(Activity Index)를 통해 살펴보았다. 네덜란드를 제외한 주요 국가들은 기초, 의약, 공정분야의 AI가 높게 나타났다. 한국은 생물자원탐색, 생물농약, 환경생명공학분야의 AI가 2 이상으로 평균(=1)의 2배 이상의 높은 특허집중도를 보였다.
<표 3-2-3-5> 각 국가별-기술별 상대적 특허집중도
응용 산업 | 세부 기술 | 미국 | 일본 | 독일 | 영국 | 네덜란드 | 프랑스 | 캐나다 | 한국 |
기초 | 생물자원탐색 | ∇ | ◎ | ◎ | ◎ | ∇ | ◎ | ◎ | ◉ |
동식물세포배양 | ◎ | ∇ | ∇ | ∇ | ∇ | ◎ | ◎ | ◎ | |
효소공학 | ◎ | ◎ | ◎ | ∇ | ∇ | ∇ | ∇ | ∇ | |
유전체 | ◎ | ∇ | ∇ | ◎ | ∇ | ◎ | ◎ | ◎ | |
단백질체 | ◎ | ◎ | ∇ | ∇ | ∇ | ∇ | ◎ | ∇ | |
항체이용 | ◎ | ◎ | ∇ | ◎ | ∇ | ∇ | ◎ | ∇ | |
공정 | 생물공정 | ∇ | ◎ | ◎ | ◎ | ∇ | ◎ | ∇ | ◎ |
측정진단 | ◎ | ∇ | ◎ | ◎ | ∇ | ∇ | ◎ | ∇ | |
의약 | 생물의약개발 | ◎ | ∇ | ∇ | ∇ | ∇ | ◎ | ◎ | ◎ |
농업 | 생물농약 | ◎ | ◎ | ∇ | ∇ | ∇ | ◎ | ◎ | ◉ |
형질전환동식물 | ∇ | ∇ | ◎ | ◎ | ◉ | ∇ | ∇ | ∇ | |
식품 | 발효식품 | ∇ | ◎ | ◎ | ∇ | ◎ | ∇ | ◎ | ◎ |
환경 | 환경생명공학 | ∇ | ◎ | ∇ | ∇ | ∇ | ◎ | ◎ | ◉ |
다음의 기준으로 나타난 표임. ∇(0
주요 국가들의 생명공학분야의 기술개발 주기(Technology Cycle Time : TCT)와 기초과학과의 연계성(Non Patent Reference : NPR)을 살펴본 결과, 최근에 오면서 주요 선진국들은 기초과학분야에 대한 연구개발을 가속화시키고 있는 것으로 나타났다. 또한 기술개발주기도 일본을 제외하고는 조금씩 짧아지고 있는 것으로 조사되었다.
![]()

<그림 3-2-3-3> 국가별 생명공학분야의 연구개발방향(NPR)과 기술혁신주기(TCT) 동향
사. 미국특허로 본 생명공학분야의 기술분야별 선두주자
각국의 연구개발방향이 기초분야로 치우치고 있음에 따라 최근 5년(2000~2004)동안의 기술분야별로 기초분야의 선두주자를 살펴보았다. 최근 이슈화되고 있는 줄기세포 관련 기술인 동식물세포배양의 주요 선두주자는 University of California(38건)으로 조사되었고, 5년 동안 가장 많은 특허를 등록한 기업은 유전체기술분야의 Isis Pharmaceuticals로 256건의 특허를 보유하고 있는 것으로 조사되었다.
<표 3-2-3-6> 미국특허에서 생명공학분야 기초 산업의 연구개발 선두주자
세부기술 | 2000~2004(최근 5년) | ||
출원인 | 국적 | 건수 | |
생물자원 탐색 | US Dept of Agriculture | 미국 | 14 |
Lexicon Genetics | 미국 | 14 | |
E I DuPont de Nemours & Co | 미국 | 13 | |
동식물 세포배양 | University of California | 미국 | 38 |
Pioneer Hi-Bred Int'l | 미국 | 37 | |
University of Michigan | 미국 | 15 | |
효소공학 | Smithkline Beecham | 미국 | 78 |
Applera | 미국 | 78 | |
Novozymes A/S | 덴마크 | 70 | |
유전체 | Isis Pharmaceuticals | 미국 | 256 |
Smithkline Beecham | 미국 | 118 | |
University of California | 미국 | 115 | |
단백질체 | Smithkline Beecham | 미국 | 61 |
Genentech | 미국 | 60 | |
Human Genome Sciences | 미국 | 52 | |
항체이용 | Genentech | 미국 | 26 |
Human Genome Sciences | 미국 | 24 | |
Johns Hopkins University | 미국 | 18 | |
아. 미국연방정부 지원 특허현황
다음은 미국연방정부에서 지원한 연구개발사업을 통해 발생된 특허현황(Go-ver-nment Interest: GI5))을 조사하였다.
부처별로 연구개발 산출특허의 비율을 살펴보면, 2000~2004년 사이에는 미 보건부(HHS)가 전체 특허 중 약 50%의 점유율을 차지하고 있는 것으로 나타났다. 연구주체별로 살펴보면 전체적으로 대학의 비중이 약 65%를 차지하고 있는 것으로 나타나, 미국의 경우 연방정부의 생명공학분야의 지원은 대학을 중심으로 이루어지고 있는 것으로 조사되었다.
<표 3-2-3-7> 부처별-연구개발주체별 특허건수 및 점유율
Department | 연구주체 | 1995~1999 | 2000~2004 | ||
특허수 | 점유율 | 특허수 | 점유율 | ||
보건부 | 개인 | 72 | 2.8% | 85 | 2.7% |
기업 | 934 | 36.3% | 941 | 30.2% | |
공공기관 | 11 | 0.4% | 33 | 1.1% | |
대학 | 1,558 | 60.5% | 2,061 | 66.1% | |
소 계 | 2,575 | 100% | 3,120 | 100% | |
에너지부 | 개인 | 12 | 6.1% | 5 | 2.3% |
기업 | 72 | 36.7% | 74 | 33.5% | |
공공기관 | 4 | 2.0% | 2 | 0.9% | |
대학 | 108 | 55.1% | 140 | 63.3% | |
소계 | 196 | 100% | 221 | 100% | |
국립과학 재단 | 개인 | 8 | 5.6% | 6 | 3.0% |
기업 | 24 | 16.9% | 17 | 8.6% | |
공공기관 | 0 | 0.0% | 2 | 1.0% | |
대학 | 110 | 77.5% | 173 | 87.4% | |
소계 | 142 | 100% | 198 | 100% | |
농림부 | 개인 | 0 | 0.0% | 6 | 3.8% |
기업 | 18 | 17.0% | 20 | 12.7% | |
공공기관 | 2 | 1.9% | 5 | 3.2% | |
대학 | 86 | 81.1% | 126 | 80.3% | |
소계 | 106 | 100% | 157 | 100% | |
기타부처 | 개인 | 19 | 4.2% | 22 | 4.5% |
기업 | 206 | 45.2% | 218 | 44.8% | |
공공기관 | 40 | 8.8% | 38 | 7.8% | |
대학 | 191 | 41.9% | 209 | 42.9% | |
소계 | 456 | 100% | 487 | 100% | |
합 계 | 3,475 | - | 4,183 | - | |
세부기술별로 살펴보면, 기초, 공정, 의약산업분야에 대한 투자가 활발히 진행되고 있는 것으로 조사되었으며, 특히 측정진단, 생물의약, 유전체 등의 기술분야에서 특허가 가장 많이 생산되고 있는 것으로 조사되었다.
<표 3-2-3-8> 미국 정부의 기술분야별 특허건수 및 점유율
세부기술 | 1995~1999 | 2000~2004 | 합 계 |
측정진단 | 922(26.5%) | 1,161(27.8%) | 2,083(27.2%) |
생물의약개발 | 671(19.3%) | 905(21.6%) | 1,576(20.6%) |
유전체 | 659(19.0%) | 734(17.5%) | 1,393(18.2%) |
단백질체 | 313(9.0%) | 300(7.2%) | 613(8.0%) |
생물공정 | 258(7.4%) | 296(7.1%) | 554(7.2%) |
동식물세포배양 | 203(5.8%) | 202(4.8%) | 405(5.3%) |
효소공학 | 125(3.6%) | 203(4.9%) | 328(4.3%) |
생물자원탐색 | 135(3.9%) | 95(2.3%) | 230(3.0%) |
항체이용 | 82(2.4%) | 85(2.0%) | 167(2.2%) |
형질전환동식물개발 | 57(1.6%) | 110(2.6%) | 167(2.2%) |
생물농약개발 | 34(1.0%) | 74(1.8%) | 108(1.4%) |
환경생명공학 | 14(0.4%) | 13(0.3%) | 27(0.4%) |
발효식품개발 | 2(0.1%) | 5(0.1%) | 7(0.1%) |
합 계 | 3,475 | 4,183 | 7,658 |
![]() 논문현황
논문현황
가. 논문 개요
연구 개발의 목적에는 자연현상에 관한 인과관계나 법칙의 탐구라는 면과 그 현상(법칙성)을 인간사회에 이용하는 기술의 확립이란 두 가지의 면이 있다.
전자의 결과는 논문화 되는 것이 많으며, 후자의 과정에서 생성된 경험이나 지식이 논문화 되기도 한다. 논문으로 발표되는 연구개발 성과는 인류의 지적 공유재산이 된다. 따라서 논문에 관한 지표는 연구개발성과의 수준과 인류의 과학기술 지식에의 공헌을 나타내는 것으로 생각된다.
과학기술의 논문에 관한 지표 작성을 위해 직접 방대한 수의 논문지로부터 산출하는 것이 어렵기 때문에 문헌 데이터베이스를 사용한다. 국제적으로 SCI 데이터베이스(Science Citation Index Database, 이하 SCI라 표시함)를 많이 활용하는데 이는 과학기술 전반을 대상으로 하고, 논문의 인용정보를 얻을 수 있으며, 수록대상 저널의 선정기준을 엄격하게 하고 있는 점이 타 데이터베이스에 비해 우수하다고 할 수 있다. 논문현황자료는 SCI에 근거한 Thomson Scientific ISI (In-sti--tute for Scientific Information)의 NSI (National Science Indicators, 1981-2004)를 기반으로 지표를 산출했다.
나. 논문수
2004년 전 세계 SCI 논문수는 78만 7,677편이며 우리나라 논문수는 세계 논문수의 2.45%인 19,279편으로 14위를 차지했다.
<표 3-2-4-1> 최근 5년간 우리 나라 논문 발표수 추이
연 도 | 2000년 | 2001년 | 2002년 | 2003년 | 2004년 |
논문발표수(편) | 12,471 | 14,889 | 15,862 | 18,787 | 19,279 |
세계 총 논문수(편) | 738,617 | 756,322 | 752,287 | 813,832 | 787,677 |
세계 점유율(%) | 1.69 | 1.97 | 2.11 | 2.31 | 2.45 |
세계 순위 | 16 | 15 | 14 | 14 | 14 |
다. 논문의 피인용도
최근 5년간 우리나라가 발표한 논문 81,288편 중 1회 이상 인용된 논문은 44,008편으로 논문의 피인용 비율은 54.14%이고, 5년간 논문의 총 피인용 횟수는 227,397회로 논문 1편당 평균 피인용 횟수는 논문수 5,000편 이상 국가 중 29위 수준인 2.80회로 세계평균(4.33회)의 64.67%, 피인용도 상위 10개국 평균(5.84회)의 47.95%에 불과한 수준이나 연도별 피인용 횟수를 보면 연도가 누적됨에 따라 피인용도가 높아지는 성향을 보이고 있다.
우리나라 논문의 5년 주기별 1편당 평균 피인용 횟수는 낮은 수준이나 세계전체 평균보다 빠른 속도로 증가하고 있어 논문의 질적인 측면도 향상되고 있음을 보여주고 있다.
<표 3-2-4-2> 최근 5년간(2000-2004) 논문 평균 피인용횟수 상위 국가
순위 | 국 가 | 평균 피인용횟수 | 피인용횟수 | 논문수 |
1 | 스위스 | 6.89 | 488,805 | 70,911 |
2 | 미국 | 6.17 | 8,050,224 | 1,304,533 |
3 | 덴마크 | 6.06 | 239,991 | 39,631 |
4 | 네덜란드 | 5.90 | 580,493 | 98,347 |
5 | 스웨덴 | 5.61 | 427,060 | 76,151 |
6 | 영국 | 5.51 | 1,935,883 | 351,230 |
7 | 핀란드 | 5.40 | 202,753 | 37,548 |
8 | 독일 | 5.22 | 1,726,207 | 330,496 |
9 | 캐나다 | 5.10 | 889,626 | 174,357 |
10 | 벨기에 | 5.08 | 269,684 | 53,101 |
10개국 평균 | 5.84 | 14,810,726 | 2,536,305 | |
세계 전체 | 4.33 | 16,673,672 | 3,848,735 | |
한 국 | 2.80 | 227,397 | 81,288 | |
* 발표 논문수 5,000편 이상 국가를 대상으로 한 것임.
<표 3-2-4-3> 5년 주기별 평균 피인용횟수 현황 (단위: 회)
국가명 | ’96-’00 | ’97-’01 | ’98-’02 | ’99-’03 | ’00-’04 |
한 국 | 2.00 | 2.18 | 2.39 | 2.63 | 2.80 |
세계전체 평균 | 3.90 | 4.03 | 4.12 | 4.27 | 4.33 |
라. 생명공학분야 논문수
SCI 과학기술 중분류 18개 분야 중 최근 5년간(2000~2004) 우리나라가 발표한 생명공학 6개 분야의 논문현황은 다음과 같다.
<표 3-2-4-4> 최근 5년간 생명공학분야 논문수 점유율 (단위: 편, %)
분야명 | 분야 논문수 | 국내 점유율 | 우리나라 총 논문수 | 세계 점유율 | 세계분야 총 논문수 |
생물학&생화학 | 5,241 | 6.45% | 81,288 | 1.85% | 282,906 |
면역학 | 746 | 0.92% | 81,288 | 1.19% | 62,518 |
미생물학 | 1,838 | 2.26% | 81,288 | 2.19% | 83,892 |
분자생물학&유전학 | 1,177 | 1.45% | 81,288 | 1.07% | 110,104 |
신경과학&행동과학 | 1,795 | 2.21% | 81,288 | 1.23% | 146,496 |
약리학 | 2,579 | 3.17% | 81,288 | 3.16% | 81,615 |
최근 5년간 국가별 생명공학분야 논문수를 보면 미국이 6개 분야 모두 월등히 앞서며 일본, 영국, 독일, 프랑스 순으로 뒤를 이었고, 중국은 우리나라와 비슷한 수치를 보였다(생물학 & 생화학: 6,514편, 면역학: 660편, 미생물학: 1,777편, 분자생물학 & 유전학: 2,027편, 신경과학 & 행동과학: 1,974편, 약리학: 3,031편).
<표 3-2-4-5> 최근 5년간 우리나라 연도별 생명공학분야 논문현황
분야명 | 구분 | 2000 | 2001 | 2002 | 2003 | 2004 | 00-04 |
생물학 & 생화학 | 논문수 | 878 | 914 | 1,052 | 1,177 | 1,220 | 5,241 |
피인용수 | 8,195 | 6,526 | 5,416 | 2,588 | 400 | 23,125 | |
편당평균 | (9.33) | (7.14) | (5.15) | (2.2) | (0.33) | (4.41) | |
면역학 | 논문수 | 126 | 152 | 123 | 150 | 195 | 746 |
피인용수 | 1,229 | 1,106 | 561 | 376 | 79 | 3,351 | |
편당평균 | (9.75) | (7.28) | (4.56) | (2.51) | (0.41) | (4.49) | |
미생물학 | 논문수 | 306 | 311 | 370 | 458 | 393 | 1,838 |
피인용수 | 2,173 | 1,620 | 1,520 | 709 | 97 | 6,119 | |
편당평균 | (7.1) | (5.21) | (4.11) | (1.55) | (0.25) | (3.33) | |
분자생물학& 유전학 | 논문수 | 121 | 113 | 111 | 149 | 152 | 646 |
피인용수 | 1,615 | 1,271 | 753 | 460 | 79 | 4,178 | |
편당평균 | (13.35) | (11.25) | (6.78) | (3.09) | (0.52) | (6.47) | |
신경과학 & 행동과학 | 논문수 | 280 | 305 | 335 | 434 | 441 | 1,795 |
피인용수 | 2,889 | 2,351 | 1,587 | 948 | 117 | 7,892 | |
편당평균 | (10.32) | (7.71) | (4.74) | (2.18) | (0.27) | (4.4) | |
약리학 | 논문수 | 387 | 386 | 492 | 636 | 678 | 2,579 |
피인용수 | 2,594 | 2,019 | 1,600 | 775 | 106 | 7,094 | |
편당평균 | (6.7) | (5.23) | (3.25) | (1.22) | (0.16) | (2.75) |
우리나라 생명공학분야 SCI 발표논문수는 1984년에는 6개 분야 합이 62편에 불과하였으나, 1994년에는 생물학 & 생화학(238편)이 9.9배, 면역학(21편)이 21배, 미생물학(108편)이 7.7배, 분자생물학 & 유전학(26편)이 13배, 신경과학 & 행동과학(52편)이 26배, 약리학(117편)이 5.6배 늘었다. 그 후 생명공학분야는 급격한 성장세를 보이며 2004년에는 10년 전과 비교하여 생물학 & 생화학(1,220편)이 5.1배, 면역학(195편)이 9.3배, 미생물학(393편)이 3.6배, 분자생물학 & 유전학(152편)이 5.8배, 신경과학 & 행동과학(441편)이 8.5배, 약리학(678편)이 5.8배 늘었다.
마. 생명공학분야 피인용도
최근 5년간 생물학 & 생화학분야 발표논문 5,241편 중 1회 이상 인용된 논문은 3,462편으로 논문의 피인용률은 66.06%로, 국내평균 피인용률(54.14%)의 1.22배이며, 면역학은 61.39%로 1.13배, 분자생물학 & 유전학은 68.14%로 1.26배, 신경과학 & 행동과학은 59.16%로 국내평균의 1.09배이며, 면역학·미생물학·신경과학 & 행동과학·약리학은 동분야 세계대비 비율보다 높게 나타났다.
<표 3-2-4-6> 최근 5년간 생명공학분야 논문 피인용률
분야명 | 피인용률 | 피인용된 논문수 | 분야 논문수 | 세계대비 비율 | 세계분야 평균피인용률 |
생물학 & 생화학 | 66.06 | 3,462 | 5,241 | 0.93 | 71.25 |
면역학 | 61.39 | 458 | 746 | 1.04 | 59.14 |
미생물학 | 46.79 | 860 | 1,838 | 1.04 | 45.12 |
분자생물학 & 유전학 | 68.14 | 802 | 1,177 | 0.96 | 71.24 |
신경과학 & 행동과학 | 59.16 | 1,062 | 1,795 | 1.05 | 56.17 |
약리학 | 54.05 | 1,394 | 2,579 | 1.00 | 54.02 |
최근 5년간 생명공학분야 발표논문에 대한 피인용현황을 보면 평균피인용지수(IF: Impact Factor)가 <표 3-2-4-7>에 제시된 것과 같이 국내평균지수(2.80)에 비해 분자생물학 & 유전학이 2.5배 등 약리학을 제외한 5개 분야 모두 높게 나타났다. 그러나 동분야 세계대비 비율은 매우 저조하다.
<표 3-2-4-7> 최근 5년간 생명공학분야 논문 피인용 현황
분야명 | 평균(I.F) | 피인용 횟수 | 분야 논문수 | 세계대비 비율 | 세계분야 평균(IF) |
생물학 & 생화학 | 4.41 | 23,125 | 5,241 | 0.60 | 7.39 |
면역학 | 4.49 | 3,351 | 746 | 0.43 | 10.34 |
미생물학 | 3.33 | 6,119 | 1,838 | 0.50 | 6.60 |
분자생물학 & 유전학 | 7.13 | 8,394 | 1,177 | 0.56 | 12.64 |
신경과학 & 행동과학 | 4.40 | 7,892 | 1,795 | 0.57 | 7.75 |
약리학 | 2.75 | 7,094 | 2,579 | 0.58 | 4.76 |

<그림 3-2-4-3> 최근 5년간(2000-2004) 생명공학분야 한국, 세계의 논문 1편당 피인용수.
|* ( )안의 피인용수는 세계 분야 평균(IF)을 의미함.
생명공학분야의 5년 주기별 평균 피인용횟수를 보면 생물학 & 생화학, 분자생물학 & 유전학, 신경과학 & 행동과학, 약리학은 빠른 속도로 증가하고 있음을 볼 수 있다.
<표 3-2-4-8> 5년 주기별 생명공학분야 평균 피인용횟수 현황 (단위: 회)
국가명 | ’96~’00 | ’97~’01 | ’98~’02 | ’99~’03 | ’00~’04 |
생물학&생화학 | 3.03 | 3.41 | 3.85 | 4.16 | 4.41 |
면역학 | 3.44 | 4.07 | 4.67 | 5.27 | 4.49 |
미생물학 | 3.78 | 3.84 | 2.97 | 3.17 | 3.33 |
분자생물학&유전학 | 4.12 | 5.25 | 5.92 | 6.53 | 7.13 |
신경과학&행동과학 | 3.80 | 4.17 | 4.26 | 4.37 | 4.40 |
약리학 | 1.79 | 2.08 | 2.35 | 2.52 | 2.75 |

■ 제 4장 분야별 연구개발 및 관련산업 현황 제 1절 기초생명공학 |
![]() 유전체학
유전체학
가. 유전체연구의 개요
우리 인류는 원인도 모른 채 암을 포함한 많은 종류의 난치성 질병에 시달려 오고 있다. 질병은 때로 예고 없이 건강한 우리에게 찾아오기 때문에 누구나 막연한 질병에 대해 공포감을 느끼고 있다. 질병은 인간유전체에서 유전정보의 부분적 잘못에 기인함은 이미 잘 알려져 왔다. 그렇다면 만일 인간유전체의 정보를 완전히 해독하고 이를 이용하여 모든 질병의 원인을 모두 파악하게 된다면, 질병 예방 및 진단, 치료신약 그리고 치료기술의 개발에 대한 획기적인 전기가 마련될 수 있을 것이라는 기대감을 가질 수 있다. 위와 같은 기대감을 가지고 1990년, 인간유전체연구(Human Genome Project)가 공식 출범하였다. 미국 국립보건원의 주도 아래 10여 년간 전 세계 수십 개 연구기관이 공동으로 참여하면서 30억 달러라는 과학사상 최대 규모의 연구비가 투자되었으며, 2003년 봄 인간유전체 완전해독에 대한 대장정의 결과를 발표하였다.
왜 이토록 전 세계가 인간유전체연구의 결과에 흥분하는 것일까? 그 이유는 머지않은 미래에 보건의료기술의 획기적인 발전에 따른 우리 인류 모두에게 주어질 수 있는 불로장생 등에 대한 커다란 기대감 때문일 것이며, 한편으로는 고부가가치의 경제적 부를 창출할 수 있는 생명공학 산업에 대한 강한 기대감으로 이어 질 수 있기 때문일 것이다. 즉 인간유전체프로젝트가 21세기 바이오혁명을 주도할 수 있다는 것이다.
나. 2005년 기준 인간유전체연구의 성과
실제로 2003년 인간유전체의 완전해독을 발표할 당시에는 완전해독이 완성되지 않은 상태였으며 현재도 최종 완성을 위한 막바지 연구에 박차를 가하고 있는 상황이다. 그러나 지금까지 축적된 정보를 기반으로 새로운 응용기술이 봇물처럼 개발됨으로써 기능유전체연구(Functional Genomics)의 시대를 활짝 열어 놓았으며 암을 포함한 많은 난치성 질병유전자의 동정에 활발하게 활용되고 있다.
(1) 인간유전체 염기서열의 완성도
|
<그림 4-1-1-1> 인간의 염색체별 염기서열 완성도. 노란 색으로 표기된 염색체들이 2005년 12월 현재 완전해독된 염색체임. |
2003년 4월 15일 인간유전체의 전체 32억 쌍에 해당되는 염기서열의 완성을 발표 한 바 있다. 그러나 당시 실제로 염기서열의 완전해독이 완료된 염색체들은 7번, 14번, 19번, 20번, 21번, 22번, Y 등의 7종의 염색체들이었다. 그 이후 2003년 말에 6번 염색체가 추가되었으며, 2004년에 5번, 9번, 10번, 13번, 16번 염색체의 염기서열이 완성되었으며, 2005년에는 2번, 4번, X 염색체 등이 추가적으로 완성되었다. 따라서 총 24종의 염색체 중에서 현재 16종의 염색체에 대해 염기서열 해독이 완료된 상태이며, 나머지 1번, 3번, 8번, 11번, 12번, 15번, 17번, 18번 등의 8종의 염색체들도 95% 이상의 완성도를 보이고 있어 1~2년 내에 인간유전체 전체의 염기서열이 완성될 전망이다<그림 4-1-1-1>.
(2) 인간유전자 동정 및 유전자 지도 작성
<표 4-1-1-1> 인간유전체연구의 결과로써 동정된 유전자와 이들 유전자를 발굴하기 위해 사용된 각종 표지자 및 염기변이의 수 | |||||||||
Chromosome | CpG | Genes | ESTs | UniGenes | SAGE tag | STS | Variation | ||
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 X Y MT | 28,639 23,825 17,638 15,687 16,885 17,336 20,118 14,360 15,504 15,947 15,416 16,617 9,058 10,452 10,691 16,073 19,015 7,467 20,518 9,375 4,999 9,224 14,111 2,429 8 | 2,580 1,742 1,378 1,017 1,188 1,385 1,367 927 1,069 983 1,692 1,261 491 1,173 884 1,031 1,354 400 1,584 710 337 693 1,125 255 37 | 409,340 287,602 232,593 152,819 194,257 249,554 207,109 147,415 164,144 151,013 277,480 292,573 69,586 145,088 141,348 166,759 274,476 58,023 267,924 116,915 42,462 113,860 131,765 8,310 3,696 | 20,601 17,981 14,650 11,043 12,403 12,543 12,741 9,887 9,671 10,581 11,083 11,596 5,713 7,494 7,985 7,775 10,475 4,654 8,032 5,441 3,117 4,707 6,222 620 109 | 55,494 37,588 32,401 20,461 26,203 28,947 25,402 20,192 19,609 21,541 34,132 34,681 9,289 18,137 19,780 22,456 36,019 7,890 32,257 16,332 5,096 15,227 18,284 884 - | 11,612 8,496 7,615 8,218 6,698 7,156 7,382 5,279 4,434 5,187 6,897 6,303 3,463 4,865 3,700 3,740 4,508 2,565 3,030 3,155 1,980 2,256 6,134 1,355 21 | 725,753 707,154 584,898 565,396 525,376 599,717 491,132 436,555 420,410 470,531 461,883 434,081 339,684 259,894 241,989 274,502 237,802 240,470 186,233 274,351 129,801 156,871 312,600 28,105 - | ||
Total | 351,392 | 26,663 | 4,306,111 | 227,124 | 558,262 | 126,049 | 9,105,188 | ||
인간유전체의 염기서열로부터 유전자 예측 프로그램 및 지금까지 발굴된 EST(Expressed Sequence Tag) 및 UniGene들이 이용되어 1번 염색체로부터 2,580개, 2번 염색체로부터 1,742개 등 전체 24종의 염색체로부터 총 26,663개의 유전자가 동정되었으며, 이들의 염색체상에서의 위치가 결정되어 각종 질병과의 연관 유전자 발굴에 활용할 수 있게 되었다<표 4-1-1-1>. 동시에 휴먼게놈 염기서열 정보 및 각종 EST의 염기서열 정보, 그리고 독립적인 SNP(단일개체염기변이) 분석에 의해 910여만 건의 염기서열 변이에 대한 정보가 생산되어 질병과의 연관 분석에 활용할 수 있게 되었다.
(3) 완전장 유전자의 발굴
인간유전자의 기능연구를 위해 필수적인 완전한 유전자 구조를 보유한 완전장 유전자(full-length cDNA)의 확보를 위한 노력의 결과, 미국 NIH의 Mammalian Gene Collection 프로그램으로부터 11,124개, 일본의 NEDO Human cDNA Se-quen--cing Project 및 Kazusa cDNA Project 등으로부터 21,243개, 독일의 German cDNA consortium으로부터 5,322개 등이 각각 확보됨으로써 대략 25,000개의 완전장 유전자가 확보된 셈이며 국제교류를 통해 상호 교환함으로써 항체생산 및 유전자 기능연구에 활용하고 있다.
(4) 개체간 염기변이 SNP의 발굴 및 HapMap 연구
인간유전체연구를 통해 인간유전체 32억 쌍의 염기서열을 완성하는 과정에서 염기결실 및 삽입, 그리고 개체간 염기변이 등 약 천만 건의 각종 염기서열 변이를 발견한 바 있으며 이 중에서 개체 사이의 뚜렷한 단일염기서열 차이인 SNP 약 170만 종(>5% polymorphism, 다형성)을 선별하였으며, 이들 SNP의 Haplotype (일배체형) 지도를 작성하기 위한 국제공동연구인 “국제 HapMap 연구”가 출범한 바 있다. 이 연구의 목적은 1) 인간유전체에 존재하는 재조합지도를 작성하고, 2) 이에 존재하는 SNP 유전자형을 규명하는 한편, 3) 각각의 유전자형을 표지할 수 있는 최소한의 SNP(Tag-SNPs)를 동정함으로서 질병유전자 발굴이나 약물반응 유전자 발굴에 사용되어야 할 SNP 표지자의 수를 대폭 줄여 질병의 유전적 연구의 효율화를 도모하겠다는 것이며, 향후 약물유전체학 또는 맞춤의학 연구에 필요한 핵심적인 기반정보를 제공할 것으로 기대하고 있다.
이를 위하여 2002년 10월, “국제 HapMap 콘소시엄”에 미국을 주축으로 영국, 캐나다, 일본, 중국 등이 참여하고 2년간(2002년 10월~2004년 12월) 총 예산 1300억 원(US$108 million)을 투자하여 흑인, 백인, 황인종으로 이루어진 270명의 시료를 분석하여 Haplotype 지도를 구축하기로 하였다. 2005년 10월, 국제 HapMap 콘소시엄에서는 당초 목표대로 SNP을 이용한 전체 게놈에서의 LD block을 완성하고 향후 질병-연관분석에 유용하게 사용될 평균 5kb 간격을 갖는 최소한의 Tag-SNP을 공개하였다. 즉 나이지리아 흑인으로부터 474,409개, 유럽계 백인으로부터 293,835개, 그리고 중국의 한족 또는 일본인으로부터 259,779개의 Tag-SNP을 선별하였다(Nature 437: 1299-1320, 2005).
(5) 인간유전체연구의 2005년 성과 정리
이상과 같이 인간유전체의 염기서열의 해독결과를 바탕으로 막대한 인간유전체의 유전자 정보 및 유전자자원을 확보하게 되었으며 이와 같은 성과는 <그림 4-1-1-2>와 같이 정리할 수 있다.
|
<그림 4-1-1-2> 인간유전체프로젝트의 경과 및 성과(2005년 현재) |
(6) 인간유전체연구 성과를 기반으로 하는 미래기술의 전망
(가) 난치성 질환 유전자의 초고속 탐색
인간유전체연구의 성과물로써 얻게 된 무형의 인간유전체정보 및 유형의 유전자자원은 인류의 난치병을 포함한 각종 질병의 원인유전자의 동정에 새로운 시각을 갖게 하였으며, 과거 하나의 질병 원인유전자를 동정하는데 소요되던 수십년의 시간을 단 며칠 또는 몇 달로 앞당길 수 있게 되었다. 특히 난치병 가운데에서도 해마다 환자 수가 급증하며 세계적으로 가장 많은 사망자를 발생시키는 암을 정복하고자 인간유전체정보 및 유전자자원을 활용하여 초고속으로 원인유전자를 동정하는 새로운 기술 및 조기진단과 예후를 판정하기 위한 새로운 기술의 개발에 대단위의 연구투자가 집중되고 있다<그림 4-1-1-3>. 따라서 이러한 노력들로 인하여 난치성 질환의 조기진단을 통해 암 발생을 낮추거나 일단 발생된 암의 효과적인 치료제 및 재발을 막음으로써 생존율을 높이기 위한 새로운 패러다임을 기대할 수 있게 되었다.
|
<그림 4-1-1-3> 인간유전체연구 성과를 바탕으로 개발된 난치성 질환 유전자의 초고속 탐색 방법들 |
(나) 미래 맞춤의학 기술 개발
인간게놈연구 및 국제 HapMap 연구 성과의 하나로써 발굴된 평균 5 kb 간격을 갖는 최소한의 Tag-SNP은 향후 질병-연관분석에 커다란 장점을 가지고 유용하게 사용될 전망이다. 현재 선별된 Tag-SNP을 기반으로 잠재적인 기능성에 따라 그 중요성을 결정하는 작업이 진행 중이다. 예를 들어 단백질의 아미노산 서열을 변화시키거나, 또는 다른 종과 비교하여 높게 염기서열이 보존되어 기능적으로 중요할 것으로 판단되는 염색체 영역 등으로부터의 SNP을 생물정보학을 이용하여 선별 중이다.
과연 이렇게 발굴된 SNP은 인간의 질병 또는 약물에 대한 다양한 개체간 반응성 연구에 어떻게 활용될 것인가? 만일 HapMap 연구가 수행되지 않은 상태에서 환자의 약물 반응성에 영향을 주는 분자표적에서의 유전적 변이를 찾고자 할 경우, 충분한 변이 수를 동정하기 위해서는 연구 집단에서 연구대상인 개체들로부터 특정 유전자에 대한 염기서열을 수행해야만 한다. 그러나 이러한 작업은 이제 HapMap 데이터를 활용하면 수분 안에 해결될 수 있게 된 것이다.
예를 들어 첫 번째 단계로써 연구대상의 유전자 관련한 SNP 데이터는 HapMap 웹사이트에서 자유로이 볼 수 있다<그림 4-1-1-4>. 두 번째 단계는 획득한 SNP 사이에서 밀접하게 연관된 다시 말해서 같은 빈도를 보이는 SNP은 동일한 색깔로 나타나게 되며 이때 동일한 색깔의 SNP 중에서 하나를 선택해 Tag-SNP을 구성하게 된다<그림 4-1-1-4>. 이러한 절차에 따라 전체 SNP 중에서 수를 대폭 줄여 Tag-SNP을 구성할 수 있게 된다. 이러한 방법으로 전체 게놈으로부터 필수적인 Tag-SNP set를 선별할 수 있다. 세 번째 단계는 분석하고자 하는 연구 집단에서 특정 약물에 대한 반응성 유무와 같은 형질에 대해 Tag-SNP set를 이용하여 유전자형이 분석될 수 있다.
|
<그림 4-1-1-4> SNP를 이용하여 개인별 맞춤치료 실현을 위한 개념도(왼쪽). 오른쪽 그림은 약물반응성과 관련한 SNP을 발굴한 SNP칩 분석결과 (출처: Nature 437:1241-1242, 2005). |
이때 특정 생리학적 반응과 관련성이 있는 것으로 밝혀진 Tag-SNP은 그 SNP의 하나가 그 반응에 영향을 주고 있음을 뜻한다. <그림 4-1-1-4>에서 녹색으로 표시된 SNP 중의 하나는 개체 사이에 약물에 대한 반응성과 밀접하게 연관성을 보이고 있음을 뜻한다. 이러한 방법으로 질병과 연관된 Tag-SNP을 동정할 수 있는 것이다.
다. 유전체관련 산업과 전망
1999년부터 염기서열분석자동화 기기의 개발과 이로부터 나오는 엄청난 DNA 서열 정보를 모으고 분석할 수 있는 고도의 성능을 가진 컴퓨터 기술의 개발이 활발하던 시기였다. 염기서열 자동화 분석기기를 만든 퍼킨엘머 회사는 인간유전체프로젝트의 빠른 진행에 큰 기여를 했다고 볼 수 있으며, 한편 고성능 컴퓨터기기나 분석프로그램의 개발 등은 유전체 연구에 필수적인 장비와 프로그램으로써 이 분야 산업화에 큰 몫을 했다.
이와 같은 유전체 연구는 생물학분야 뿐만 아니라 기기 개발, 산업(기계공학분야, IT 분야)을 활성화되게 하였고 DNA 염기서열에 필요로 하는 화학물질 등의 시약들의 개발은 화학분야의 산업 등 타 분야 산업을 활성화하였다. 또한 유전자들의 서열이 알려짐에 따라 이들을 목표유전자로 하여 질병과 관련성 여부들을 조사하고 이를 조절하기 위해 새로운 약물의 개발 과정이 단축될 수 있어 의약산업이 활성화되고 있다.
현재 기능이 알려지거나 질병과의 연관성이 있는 유전자가 약 1,000개 미만이며 현재 이들을 타겟으로 개발하고 있는 신·의약 등으로 의약업계의 경제적 가치가 $3,000억인데 비해 미래에는 인간유전자들의 기능이 가속적으로 밝혀져 의약품 개발의 대상 유전자들이 가속적으로 늘어나면 이로부터 개발되는 의약품들은 2015년경에는 $10,000억 가치를 창출할 것으로 전망하고 있다. 따라서 향후 알려진 DNA 서열에 담겨있는 유전자들이 기능을 밝히기 위한 생명공학분야의 기술과 주변의 기술들이 활발하게 개발될 것이다. 특히 생물체의 기능을 세포수준이 아닌 더 작은 나노수준에서 검증할 수 있어야 하므로 나노측정기술 산업은 물론이고 고성능의 IT 분야의 기술, 정보처리 보급 기술 등의 산업화가 가속될 것이다. 신약 개발의 단계도 과거 15년 이상 걸리던 것이 10년 이내로 단축될 것이므로 이를 위한 새로운 고속대량스크리닝(HTS) 개념의 산업 등이 필수적으로 수반될 것이다.
또한 많은 난치성 질환의 원인 유전자들이 대거 밝혀질 것이므로 새로운 개념의 질병의 진단, 치료기술이 보급되어 이와 관련된 새로운 보건의료 산업이 요구될 것이며 이를 충족하기 위한 새로운 형태의 의료기기산업들이 추진될 것이다.
새로운 기기산업, 정보산업, 화학의약산업, 보건의료산업 등 생물분야와 융합되는 분야에서의 새로운 산업들의 출범이 가시화 될 것이다. 또한 지금까지 인간유전체연구를 통해 개발된 기술들을 식물, 미생물, 동물 등에 적용하여 의료, 보건 산업뿐만 아니라 농업, 산업적으로 가치가 있는 식물, 작물, 동물들을 대상으로 한 유전체연구가 가속화되고 이로부터 얻어지는 소재, 정보 등은 농업분야에서 고수확량 농작물, 가축개발 개량, 다양한 생물의 유전적 특성, 기능을 가진 농작물 개발 등으로 연결되어 소득의 증대와 활성화 식품의 안전성, 품질향상 등 소득의 증대와 활성화, 식품의 안전성, 품질향상 등 식품산업화와 수준향상, 토양 수질오염, 정화, 재생 가능한 자원 활용 등 환경 분야 산업화에도 큰 영향을 줄 것이다.
![]() 단백질체학
단백질체학
가. 단백질체학 개요
(1)단백질체학(Proteomics)란?
단백질체학은 세포내의 단백질 기능 및 변화에 관한 연구로써1) 생체의 활동, 질병, 약품에 대한 반응에 따른 단백질 발현 정량화와 동정뿐 아니라 단백질의 위치와 변화, 단백질의 상호작용과 기능 분석까지를 포함하는 유전체에서 발현된 모든 단백질들에 대한 연구이며, 새로운 치료제 및 진단 시약개발에 가장 강력한 분석 기술로 인식되고 있는2) 기술이다.
(2)단백질체학의 핵심기술
|
<그림 4-1-2-1> 단백질체학 핵심기술 |
단백질체학의 기술 영역은 크게 프로테옴 분석기술과 프로테옴 기능 규명기술, 단백질체 정보기술로 나뉠 수 있으며 각 영역별 핵심기술은 <그림 4-1-2-1>과 같다.
나. 해외 동향
(1) 주요국 연구개발 투자 동향
국가 | 구 분 | 연구개발 투자내용 |
미국 | NCI (National Cancer Institute) | •임상프로테오믹스선도기술개발사업:104M (5년간) •암 바이오마커 발굴: $13.4M(2년간) •조기진단네트워크: $9.8M(첫해, 총 5년) |
NIH (National Institutes of Health) | •단백질 네트워크 연구: $7M(추가투자) •PSI 2단계사업의 단백질 구조결정: $300M | |
NHLRI (National Heart, Lung and Blood Institute) | •단백질체학 이용한 혈소판기능 연구: $2.2M (2년간) | |
일본 | RIKEN 요코하마연구소 (세계최대(40개) NMR보유기관) | •Protein3000(단백질 구조와 기능해석 프로젝트): 5000억 원(5년간), 2007년부터 7,000억 원 규모로 조정 확정 |
EU | 제6차 Framework 자급지원계획 | •유전자 발현과 프로테오믹스 등 생명공학 분야 연구사업 : C=382.6M |
MolPAGE (당뇨, 혈관질환관련 바이오마커 발굴) 컨소시엄 | •학계, 바이오텍 회사, 제약회사 참여 : C=1.2M | |
국제 컨소 시엄 | HUPO (Human Proteome Organization) | •HPPP: 1단계사업 완료, 2단계 추진 중 •Antibody Initiative: 정상궤도에 들어섬 •질환별 Initiative 구성 중 |
ICBC (International Cancer Biomarker Consortium) | •미국, 한국, 중국, 대만, 싱가포르, 홍콩 참여 •05년 10월 시애틀에서 1차 Meeting개최 |
<표 4-1-2-1> 주요국 연구개발 투자동향
(2) 최근 기술개발동향
(가) 분리분석기술
단백질체 분석기술은 2D-PAGE, capillary-LC(Liquid Chromatography), CE (Capillary Electrophoresis)와 이를 질량분석기로 확인할 수 있는 복합기술이다. 최근, Scripps의 Yates그룹에서는 MudPIT(Multi dimensional Protein Identification)을 이용한 tandem LC 방법을 개발하여 대량 단백질 확인에 사용하고 있으며, PNNL에서는 1m 이상의 고정밀도 LC컬럼을 개발하였다. 또한 LC기술 뿐 아니라 Monolithic 컬럼과 같이 재질 향상과 초고압 펌프를 이용한 분리방법을 통하여 분리 성능을 개선하는 움직임도 활발히 전개되고 있다.
(나) 질량분석기술
MS기기는 ABI, Micro MS, Finnigan, Bruker 등 기기회사에서 주로 개발되고 있으며, 2002년에 MALDI-TOF/TOF MS가 시판됨에 따라 throughput이 크게 증가하고, 50 fmol까지 분석이 가능하게 되었다.
최근에는 초 고정도·고감도 MS인 RPLC/nanoESI/FT-ICR(4-16T)이 개발되어, 감도 100 amol-150 zmol까지 측정이 가능하게 되었고 mass 정밀도를 0.1 ppm까지 낮춤에 따라 단백질 혼합물의 확인 및 펩타이드 시퀀싱(peptide sequencing)이 가능하게 되었다. 또한, ion trap-FTICR보다 분해능은 떨어지나 가격과 속도면에서 월등한 ion trap-Orbitrap이 개발되어 상용화되었다. 이러한 질량분석기들은 미량 단백질 변형 분석에는 많은 어려움이 있어, 이를 해결하기 위한 연구가 진행되고 있다.
(다) Informatics기술
질량분석에서 얻어진 결과를 정확히 분석하고, 생산된 프로테오믹스 결과에서 생물학적 의미를 추출하기 위한 informatics 기술은 Scripps, ISB, PNNL 등에서 분석의 자동화와 생산된 결과의 분석을 위한 소프트웨어 환경을 구축하여 사용하고 있으며, 보완·개선을 위한 지속적인 연구가 수행되고 있다. 한편, 최근 생물학적으로 매우 중요한 단백질 변형분석을 위한 알고리즘의 개발도 진행되고 있다.
(라) 단백질체 정량기술
ISB의 Aebersold group은 동위원소를 이용한 ICAT(isotope coded affi-nity tags)방법을 이용한 high throughput 정량법을 개발하였으며, Mann group에서는 ICAT방법을 보완하여 SILAC(stable isotope labeling with amino acids in cell culture) 방법을 개발, 단백질의 발현정도를 상대비교 하는데 사용하고 있다. 또한, 최근 각 단백질의 절대량 측정을 위해 동위원소로 치환된 tryptic peptide를 시료에 첨가하여 분석하는 SISCAPA(Stable Isotope Standards with Capture Anti-Peptide Antibody), QCAT proteotypic pep-tide기술 등이 개발되었으며, 2D PAGE 방법의 단점을 보완한 DIGE (double labeled fluorescence detection)방법도 상용화되었다.
그러나 단백질의 변형 정량이 아직 불가능하여 단백질 변형을 정량할 수 있는 방법의 개발이 필요하다.
(마) PTM (Post Translational Modification) 분석기술
단백질체 중에서 특정한 PTM을 갖는 subgroup만을 그 PTM의 화학적 성질을 이용하여 선택적으로 분리하는 다양한 기술(phospho-capture, glyco-cap-ture, cysteine-capture)이 개발되고 있다.
(3) 단백질체학의 시장 규모
세계 프로테오믹스 시장은 예측기관마다 큰 차이를 보이고 있으나, 2003년 15억 불에서 연평균 약 15.2%씩 급속히 성장하여 2008년 약 26억 불에 이를 것으로 전망된다.
다. 국내동향
(1) 연구개발 투자 현황
프로테오믹스 관련 정부 지원 연구개발은 과학기술부 및 산업자원부, 보건복지부를 중심으로 연구개발 투자를 확대하고 있다<표 4-1-2-2>.4)
(2) 관련산업현황
민간 부문의 연구개발 투자는 벤처기업을 중심으로 소규모 프로테오믹스 연구가 수행 중이나, 투자 규모가 선진국에 비하여 크게 못 미치고 있다.5)
<표 4-1-2-2> 정부 지원 프로테오믹스 연구 현황 | ||||
부 처 명 | 사 업 명 | 수행 기간 | 2005년 연구비 | 비 고 (주관 기관 등) |
과학기술부 | 프로테오믹스이용기술개발사업 (21세기프론티어사업) | 2002~ 2011 | 60억 | 한국과학기술 연구원 |
보건복지부 | 질병유전단백체종합연구지원센타 (바이오보건기술개발사업) | 2003~ 2010 | 20억 | 연세대학교 |
과학기술부 | 고분해능 질량분석기(FT-ICR MS) 구축사업(기초과학연구사업) | 2003~ 2006 | 16억 | 한국표준연구원 |
과학기술부 | HTS용 단백질 침 및 차세대바오칩 기술개발(차세대성장동력사업) | 2004~ 2011 | 25억 | 한국생명공학연구원 |
산업자원부 | Protein/DNA Chip System개발 (차세대신기술개발사업) | 2000~ 2008 | 24억 | 삼성종합기술원 |
<표 4-1-2-3> 국내 대표적 프로테오믹스 벤처기업 현황
기업명 | 주요 업종 | 설립 | 비고 |
(주)프로테오젠 | 단백질칩, 단백질 기능분석 장치개발 및 판매 | 2000. 2 | |
(주)랩프런티어 | 단백질칩 개발연구, 항체 생산 | 2000. 9 | |
(주)펩트론 | 단백질 정제용 레진, 단백질 서방성 제제 생산 및 판매 | 1997.11 | |
(주)프로테옴텍 | 시료 준비, 젤 이미지 분석, 질량분석 서비스 제공 | 2000. 3 | |
(주)크리스탈지노믹스 | 질환 단백질의 3차 구조관련 신약 발굴 | 2000. 7 | |
(주)프로메디텍 | 단백질 구조 기반 신약 개발 | 2000.12 | |
(주)씨그몰 | 생산단백질의 활용성 제고, 신기능 단백질기술개발 | 2000. 6 |
라. 발전과제
단백질체학 관련 미국과 우리나라의 특허 출원 및 등록 건수를 비교한 결과 미국은 최근 질량분석(Mass Analysis)기술과 어레이/칩(Array/Chip) 기술에 관련된 특허 등록 건수가 크게 증가<그림 4-1-2-4>한 반면, 우리나라는 어레이/칩 분야와 바이오마커/단백질 분야에서 특허 출원이 상대적으로 크게 증가<그림 4-1-2-3>한 것으로 나타나 있다.
|
|
<그림 4-1-2-3> 프로테오믹스 관련 연도별, 기술별 출원추이(국내) | <그림 4-1-2-4> 프로테오믹스 관련 연도별, 기술별 등록추이(미국) |
제약 산업 등 생명공학 산업의 국제 경쟁력을 확보하기 위하여 기능 유전체 연구의 초기 단계인 현 단계에서 우리나라는 IT와 BT 분야의 강국답게 바이오마커/단백질 발굴과 바이오인포메틱스 분야, 어레이/칩 분야 등에 주력할 필요가 있다.
![]() 세포체학
세포체학
가. 세포체학 연구의 개요
질병의 원인은 외부 병원체와 생체 내부의 요인으로 대별된다. 박테리아, 바이러스 및 진균 등 외부병원체에 의한 감염성 질환이 전자의 대표적 예이며, 백신을 사용하여 예방하거나 약물치료 및 수술 등의 치료법이 이용되고 있다. 생체의 내적요인에 의한 질병도 약물치료 및 수술요법이 이용되나 선천적 또는 후천적 요인에 의한 질병의 경우 기존치료법으로는 완치되기 어렵다. 특히, 노화 및 식생활 패턴의 변화에 의하여 발생되는 뇌, 심장질환 및 당뇨병 등의 퇴행성/대사성 질환 그리고 화상과 교통사고 등에 의한 신체장애 등에 대하여 과학자들은 새로운 치료법 개발에 많은 노력을 기울이고 있다. 최근에 개발된 줄기세포 배양기술을 이용하여 우리 몸의 손상 받은 조직이나 세포를 정상세포로 대체하는 “세포치료기술” 개발이 집중적으로 시도되고 있다. 또한, 줄기세포를 이용하여 유전자 혼재동물을 생산한 후 이로부터 고가의 치료약물을 생산하는 시도도 동물세포를 이용하여 빠르게 진행되고 있다.
생체에 존재하는 세포를 이용하여 치료기술 및 신약을 개발하는 연구 분야를 세포체학 연구로 정의하였을 때, 본 장에서는 세포체 연구의 주된 연구대상인 인간줄기세포와 동물줄기세포의 최근연구동향에 대하여 기술하고자 한다.
나. 연구의 동향
줄기세포는 발달단계의 배아로부터 확보하는 배아줄기세포와 우리 몸의 각 조직에서 발견되는 성체줄기세포로 대별된다. 세포특성으로 볼 때 배아줄기세포는 대량 확보가 비교적 용이하고 생체를 구성하는 모든 세포로 분화할 수 있는 능력(전능성; pluripotency)을 가진 반면, 성체줄기세포는 분리가 어렵고 배아줄기세포보다 상대적으로 분화능력이 떨어져 특정계 또는 기관을 구성하는 세포로만 분화가 가능하다. 그러나 성체줄기세포는 분화능이 떨어지는 반면 이식 시 종양생성능(tumorigenicity)과 면역거부반응 유도가 적어 임상적 안전성이 배아줄기세포보다 상대적으로 우월하다고 인식되고 있다. 배아 및 성체줄기세포 모두 분화능력을 가지고 있는 동시에 줄기세포의 특성을 지속적으로 보유할 수 있는 자가생성능력(self-renewal)을 가지고 있고, 타 세포와 구별하기 위하여 형태적 특성 및 세포막이나 세포질에 존재하는 줄기세포 특이물질을 검색하거나 전능성과 다능성을 체내/외에서 검증한다.
(1) 배아줄기세포 (embryonic stem cells)
약 20년 전 생쥐로부터 배아줄기세포가 처음 분리되었으며, 1998년 11월 미국 Wisconsin-Madison 대학의 톰슨박사 연구팀이 인간배아줄기세포 확보에 최초로 성공하였다. 일반적으로 최초 분화가 일어난 배반포(blastocyst)기 배아에서 유래한 줄기세포를 배아줄기세포라고 정의하나 태아의 성선(gonad) 조직에서 유래한 배아생식선세포(embryonic germ cell)와 종양조직에서 유래한 배아암세포(embryonic carcinoma cell)도 줄기세포의 특성인 전능성과 자가생성능을 가지고 있으므로 배아줄기세포로 간주한다. 배아줄기세포는 지금까지 200여 종의 기능성 체세포로 분화할 수 있다는 것이 알려져 임상적 주목을 받고 있으며, 현재 원하는 세포를 대량 생산할 수 있는 분화기술 개발에 모든 노력이 집중되고 있다. 인간배아줄기세포를 확보하기 위하여 일반적으로 임상치료 후 남은 잉여배아를 이용하고 있다.
인간 배아줄기세포 연구는 실험동물에서 이루어진 연구결과를 토대로 활발히 진행되고 있다. 따라서 실험동물 연구는 치료기술 개발을 위한 기초 및 전임상 연구에 활발히 이용되고 있다. 현재 다양한 질환모델 계통이 확립된 마우스가 주로 이용되어지나 임상적 활용도가 높은 영장류 및 비교유전학적 측면에서 조류(닭) 줄기세포 연구도 중요성이 점차 더해가고 있다. 배아줄기세포 연구는 2000년대 초반에는 적극적 임상가능성 검토에서 출발하였으나, 안정성 확보 및 효율적인 분화기술 개발을 위하여 기초연구가 최근 활발하게 진행되고 있다. 이와 별도로 배아줄기세포의 효율적 확보를 위한 다양한 기술도 축적되고 있다. 또한, 배아줄기세포의 임상 안전성 확보를 위하여 인간유래의 배양액 첨가물질이나 줄기세포 지지세포를 이용하는 연구도 활발히 진행되고 있다.
다양한 조직세포로 배아줄기세포를 분화시키는 연구가 현재 이루어지고 있으나, 주된 연구대상은 심혈관계, 신경계 및 조혈계통 세포로의 분화시도가 이루어지고 있다. 우선 배아줄기세포를 심근세포로 분화시키는 방법과 조건은 실험동물연구를 통하여 개발되었다. 심근에서 특이적으로 발현되는 유전자를 배아줄기세포에 삽입하였을 경우 효율적으로 심근세포로 분화시킬 수 있으며 분화된 세포를 심혈관계 질환 치료에 이용하려는 노력이 진행되고 있다. 1996년에 Klug 등은 배아줄기세포 유래의 심근세포를 심장병 모델 마우스에 이식하는데 성공하였으며, 심근경색 모델동물의 심장에 배아줄기세포 유래 심근세포를 이식하여 32주 동안 생착시켰다(Min 등, 2002; 2003). 이후, VEGF와 같은 성장촉진인자를 유전자 적중기술에 의하여 발현시킨 후 심혈관 재생 및 증상완화에 성공하였다. 인간의 경우, 배아줄기세포로부터 심근세포로 분화시키는데 성공했으나 아직 정확한 조건 및 방법을 확립하지는 못하였다. 최근, Kehat 등은 인간 배아줄기세포 유래 심근세포를 방실결절이 제거된 돼지에 이식하여 심장박동이 재생되었음을 관찰하였다.
한편 신경계 세포로의 분화연구의 경우 배아줄기세포를 외배엽성 세포로 분화시켰으며, 중추신경계 세포로의 발생에 성공하였다. 인간 배아줄기세포에서 유래한 뇌 세포를 갓 태어난 생쥐에 이식한 결과 생쥐의 뇌에서 뉴론과 뇌아교세포가 재생되는 것이 관찰되었다. 2004년 Ben-Hur 등은 인간 배아줄기세포를 도파민 생성 뉴런(dopaminergic neuron)으로 분화시키는데 성공하였으며, 이식 후 증상의 호전을 보고하였다. 한편, 이식 후 종양발생이 문제점으로 지적되어 이를 방지하기 위한 많은 시도가 이루어져 왔는데, 2005-년 Hukuda 등은 SOX-1 유전자를 이용하여 신경전구세포만을 분리·이식하여 종양발생을 억제하였다고 보고하였다.
배아줄기세포를 조혈모세포로 분화시키는 연구도 지속적으로 진행되고 있다. 특히, 조혈모세포의 경우 이식한 후에도 정확한 작용부위로 이동·생착하여 본래의 기능을 발휘하므로 임상활용도가 매우 뛰어나다. 그럼에도 불구하고 아직까지 배아줄기세포로부터 조혈모세포를 분화시키는 데에는 성공하지 못하였는데, 이는 혈구세포가 가진 분화 복잡성과 면역능 획득에 기인하는 것으로 추측되고 있다. 최근, Kyba 등(2002)은 배아줄기세포 유래 조혈세포에 HoxB4 유전자를 항진 발현시켜, 이식 후 체내에서 혈구세포로 분화유도를 하였다. Burt 등(2004)은 배아줄기세포를 1차 분화시켜 이식한 결과, 일정비율로 골수세포 및 림프구가 분화되는 것을 관찰하였다. 특히 이 연구에서는 기존방법처럼 배아줄기세포 유래의 조혈모세포 혹은 조혈세포를 정맥 주사를 통하지 않고 직접 대퇴골에 이식하였다. 이러한 결과는 배아줄기세포 유래의 조혈모세포가 아직 완전하게 성숙하지 않았음을 의미한다. 그럼에도 불구하고 2005년 Zhang 등은 영장류에서 지지세포 비사용(feeder cell- free) 조혈모세포 분화유도시스템을 개발하는데 성공하였다.
(2) 성체줄기세포 (adult stem cell)
성체줄기세포는 배아줄기세포가 가지고 있는 기술적 어려움을 상당부분 극복 할 수 있는 장점을 가지고 있다. 현재 골수에 존재하는 조혈줄기세포와 간엽줄기세포, 탯줄에서 유래된 제대혈 줄기세포, 그리고 신경줄기세포 등이 활발히 연구되고 있다. 특히 기존의 성체줄기세포가 가진 분화능을 개선하기 위하여 다른 계통의 태아조직이나 다른 기관의 세포로 분화시키는 교차분화(trans-differentiation) 연구가 활발히 이루어지고 있다. 조혈줄기세포의 경우 백혈구 생성기능을 이용하여 혈액종양의 치료에 이용되고 있을 뿐 아니라, 간엽 줄기세포 및 탯줄혈액 줄기세포와 같이 지방, 연골, 뼈, 근육, 피부, 신경 등 다양한 종류의 세포로 분화를 시도하고 있다. 그럼에도 불구하고 성체줄기세포를 본격적으로 임상에 이용하기 위해서는 분화능력의 한계와 분리·유지의 어려움을 극복해야만 한다.
최근 10여 년간 성체줄기세포의 임상적용가능성이 입증되고 있다. 일부 성체줄기세포는 현재 상용화되어 실제적으로 임상에 이용되고 있다. 2002년 세포이식 건수는 전 세계에서 대략 50,000회 이상 이루어지고 있으며, 이식되는 세포의 공급원으로는 골수가 70%, 말초혈액 25%, 그리고 제대혈이 약 5% 분포를 이루고 있다. 가장 많이 활용되는 골수의 경우 이로부터 채취한 조혈줄기세포가 백혈병 치료에 활발히 이용되고 있다. 조혈줄기세포로부터 뼈를 생성하거나, 다른 배엽 유래의 세포로 분화(교차분화)시켜 치료에 이용하는 가능성도 검토되고 있다. 특히 심혈관 질환 치료에 교차분화능을 가진 줄기세포 활용이 시도되고 있다.
제대혈 부분에서도 빠른 발전이 이루어지고 전 세계적으로 40개 이상의 제대혈은행이 수립되어(2003년 기준), 150,000개 이상의 제대혈세포 확보 및 3,000건 이상의 이식이 수행되고 있다. 제대혈 은행의 시장규모는 2007년 약 6억 불에 도달할 것으로 예상된다. 제대혈에서도 전능성 또는 교차분화능을 가진 줄기세포를 회수하려는 노력이 지속되고 있으나, 아직 이를 위한 효과 기술 확립은 이루어지고 있지 않다.
<표 4-1-3-1> 줄기세포를 이용하여 세포치료 가능성이 제시되고 있는 질병 | |
이용세포 | 치료대상 지환 |
신경세포 | 파킨슨병, 헌팅턴병, 근위축성 축색경화증(루게릭병), 뇌졸증 |
척수신경세포 | 척수손상, 마비 |
간세포 | B형 간염, 마비 |
피부세포 | 화상, 궤양, 만성피부손상 |
심근세포 | 심장마비, 퇴행성 심장질환 |
췌장세포 | 당뇨병 |
혈관내벽세포 | 동맥경화 |
연골세포 | 퇴행성 관절염 |
골세포 | 골다공증 |
조혈세포 | 빈혈, 면역결핍 |
근육세포 | 근육성 영양실조 |
호흡상피세포 | 낭포성 섬유증, 폐암, 폐기종 |
부신피질세포 | 부신부전증 |
망막색소상피세포 | 노인성 황반, 모반퇴화증 |
출처: 줄기세포 최근 기술이슈 및 시장동향(보건산업 진흥원, 2005) | |
신경줄기세포의 경우 성체줄기세포 연구의 효시가 되었으며, 지금까지 수많은 연구가 이루어졌다. 유산태아의 뇌 조직을 파킨슨병 환자의 뇌에 이식하여 증상이 호전되었다는 보고 이후로 신경을 대상으로 하는 연구 보고가 이루어지고 있다. 또한 신경줄기세포 및 이로부터 분화한 신경세포의 기능적·유전적 특성을 밝힌 수많은 보고가 있다. 주로 신경줄기세포 연구는 파킨슨병, 루게릭병 및 헌팅턴병 등의 퇴행성 질환, 그리고 교통사고 등에 의한 척수손상 회복 치료 등이 목적이 되고 있으며, 이미 확립된 모델동물시스템을 활용하여 효율적으로 이루어지고 있다.
이외에도 다양한 종류의 조직에서 유래하는 줄기세포를 임상치료에 이용하려는 시도가 지속되고 있으면 이를 <표 4-1-3-1>에 정리하였다.
(3) 동물 줄기세포의 연구현황
인간과 달리 동물의 배아줄기세포는 주로 형질전환동물 생산을 통한 난치병치료약물 대량생산에 활용되고 있는데, 포유동물보다는 조류에서 빠르게 진행되고 있다. 조류의 경우 원시생식선 세포가 포유동물과 달리 혈관을 통하여 생식선으로 이동하기 때문에 형질전환 된 줄기세포 이식을 통하여 유전자혼재동물(chimeric animal)을 생산한 후 계대교배에 의하여 원하는 형질전환동물을 만들 수 있다. 특히, 치료물질 생산을 위하여 알을 이용하는데 구성단백질이 단순하기 때문에 추출정제 및 이에 따른 생산성 향상에 큰 장점을 가지고 있다. 2003년 Han 등은 최초로 원시생식선세포의 이식을 통한 카이메라 닭 생산에 성공하였으며 2005년에는 닭의 배아생식선세포 특성분석에 성공하였다. 한편, 돼지의 경우 이종장기 이식기술 개발을 위하여 배아줄기세포를 확보하는 노력이 계속되고 있으며, 이러한 세포를 대상으로 형질전환기술에 의하여 면역관련 유전자 기능을 조절하려는 시도가 이루어지고 있다.
(4) 생명윤리를 고려한 줄기세포 확보기술 개발
인간의 배아줄기세포는 필연적으로 배아를 이용하여 확립하므로 인간배아를 실험목적에 이용하게 된다. 또한 확보된 배아줄기세포는 복제배아 생산에도 이용될 수 있기 때문에 생명윤리에 대한 우려를 야기하게 되었다. 이러한 점을 해결하기 위한 기술들이 2000년대 초부터 개발되고 있다. 2003년 Lim 등은 인간의 제대혈세포를 소의 무핵난자에 이식한 후 이종 간 복제배아를 배반포까지 발생시키는 데 성공하였다. 그러나 배반포에서 유전적 비정상성이 다수 관찰되었기 때문에 배아줄기세포 확립은 더 이상 진행되지 않았다. 2005년 8세포기의 마우스 배아에서 한 개의 할구(blastomere) 만을 확보한 후 이로부터 배아줄기세포를 확립하는데 성공하여, 배아를 파괴하지 않고 줄기세포를 확보할 수 있는 방법이 제시되었다. Jamieson 등(2005)은 백혈병에서 자기재생능력이 있는 종양줄기세포(cancer stem cell)가 체세포로부터 유래한다는 가능성을 제시하여 줄기세포 확보의 새로운 방안을 제시하였다. 한편 유전자 적중기술을 이용하여 착상에 필요한 유전자를 제거한 체세포복제 배아를 생성하여 이로부터 줄기세포를 확립하는데 성공하였으며(Meissner와 Jaenisch, 2005), 체세포와 배아줄기세포를 융합하여 새로운 줄기세포를 확보하는 방법(Cowan 등, 2005)이 개발되기도 하였다. 이러한 노력은 각국에서 제정되고 있는 생명윤리법규 준수 및 줄기세포연구의 사회적 공감대 확산에도 크게 기여할 것이다.
다. 발전과제
현재 줄기세포연구는 꾸준한 발전에도 불구하고 아직까지 해결되어야 할 많은 과제가 남아있다. 무엇보다 필요한 세포를 자유자재로 분화시키는 분화유도기술이 가장 시급히 개발되어야한다. 이 기술이 개발될 경우 줄기세포 활용의 효율성 증대는 물론 이식 후의 안전성에도 괄목할 만할 발전이 이루어질 수 있다. 또한, 줄기세포의 면역유도 조절도 성공적인 세포치료 기술 확립에 필수적이며 이에 관한 면역학적 연구도 시급히 이루어져야 한다. 윤리논쟁을 피하기 위하여 배아를 이용하지 않고 줄기세포를 확립하는 방법도 개발되어야 하며, 보다 안정적인 줄기세포 은행시스템의 확보도 빠른 시일 내에 이루어져야 한다. 연구의 효율적 추진을 위하여, 연구진에 대한 교육 및 안정적 인적/물적 자원관리, 그리고 연구의 투명한 관리체계도 동시에 발전되어야 할 것이다. 동물의 경우 줄기세포를 이용하여 난치병 치료약물을 생산하는 형질전환 생체반응기(transgenic bioreactor) 생산을 위하여 보다 효율적이고 안전한 유전자적중기술 및 다양한 줄기세포 확보기술이 개발되어야 한다. 결론적으로 줄기세포를 통한 세포치료기술 개발은 효율성과 안전성, 그리고 윤리성을 동시에 확보되는 방향으로 기초 및 임상연구가 진행되고 있다.
![]() 대사체학
대사체학
가. 대사체학 연구의 개요
(1) 정의
대사체학 연구는 다양한 유전적, 생리적 또는 환경적 조건 하에서 변화되어 나타나는 대사체군의 구성과 농도를 분석하고 해석함으로써 생명현상의 변화 원인을 규명해 나가는 연구 분야이다. 대사체군(metabolome)이란 세포, 조직 또는 생체 내에 존재하는 저분자량의 대사체 집단을 이른다. 메타볼로믹스는 최근의 연구 추세인 “-omics”의 한 분야이며, 유전자나 단백질의 기능을 밝혀낼 수 있는 중요한 연구 분야로 인식되고 있다. 대사체(meta-bolite)는 실제로 생명체의 표현형(phenotype)을 가장 잘 나타내는 소분자이다. 완전한 대사체 프로파일은, 그 자체로서 또는 유전인자의 발현(gene expre-ssion)과 연관된 지식의 데이터와 조합하여, 생체에서 일어나는 여러 생리학적, 병리학적 발현에 관한 상당한 정보를 제공한다.
|
<그림 4-1-4-1> 대사체학 개요 |
대사체학은 이러한 중요성으로 인하여 2005년 5월에 발간된 Techn-ology Review지에 올해의 10대 과학기술(10 Emerging Technology) 중의 하나로 소개되었다. 본 연구에서는 생체 내 대사체군 분석을 통하여 질환 관련 표지 대사체를 발굴함으로써 진단법을 개발하고 그 기능을 규명하여 병인을 밝혀나갈
<표 4-1-4-1> 유전체학, 단백질체학과 대사체학간의 비교 | |||
연구분야 | 유전체학 | 단백질체학 | 대사체학 |
연구대상 | 유전자 | 단백질 | 대사산물 |
분석대상 분자량 | >100,000 | 5,000 - 200,000 | 100 - 1,000 |
분석기술 | Systemic DNA sequencing | 2D-gel peptide mass fingerprinting | Hyphenated techniques NMR, Mass |
연구내용 | 염기서열 분석 유전자지도 작성 | 단백질 분리 및 기능분석 | 대사체 분리, 정량 및 기능조절 |
연구결과 | 진단표식인자 | 진단표식인자 작용점 발굴 | 진단표지대사체 작용점 발굴 대사조절물질 개발 |
수 있다. 또한 새로운 대사체 관련기술 및 신약개발을 위한 신규 작용점을 도출하여 21세기 국내 생명공학 관련 연구개발 체계의 완성을 가능하게 할 수 있다. 본 연구는 미지의 유전자들의 기능을 밝혀내고자 하는 기능 유전체학(functional genomics) 또는 체내의 단백질이 얼마의 양으로 어떤 환경에서 발현되는가를 연구하는 단백질체학(proteomics)의 연구방향과는 구별되어지는 분야이다<표 4-1-4-1>.
(2) 연구개발의 필요성
(가) 기술적 필요성
대사체 연구는 현대 생명공학의 추구 방향인 “Systems biology”와 “포스트 게놈시대”의 핵심 분야이다. 따라서 유전체 연구, 단백질체 연구, 대사체학 연구, 생체기능조절물질 연구(신약개발)로 이어지는 국내 생명공학 관련 연구개발사업의 체계적 연계 및 시너지 효과를 창출할 수 있게 된다. 실제로 대사체학(metabolomics) 연구는 선진국에서도 도입단계에 있는 최첨단 연구 분야로서 이를 중점적으로 연구하는 대사물질(metabolite) 관련 국제학회가 시작된 것이 불과 3년밖에 되지 않았다. 또한 “Metabolomics”라는 국제학회가 2005년 6월에 일본에서 처음 개최되었으며, 동일한 이름의 국제 저널도 2005년 1월부터 발간되기 시작하였다. 이와 같이 국내의 대사체학 연구는 선진국과의 기술격차가 거의 없으므로, 국가차원에서의 중점적인 지원이 이루어진다면, 본 분야의 연구기반 구축 및 활용에 집중하여 국제 경쟁력 상위권 확보가 가능한 연구 분야이다.

<그림 4-1-4-2> 국내 생명공학 관련 연구개발사업의 체계적 연계 및 시너지 효과
(나) 사회, 경제적 필요성
본 기술은 새로운 질병 치료제 및 진단 표지의 개발에 중요한 역할을 할 것이다. 따라서 연구결과는 질환진단 표지대사체로 활용될 수 있으며, 검증을 거쳐 질환 작용점이 도출될 경우 막대한 라이센싱아웃/기술료 수입 효과 등 경제적 이익의 창출이 예상된다. 또한 진단법 개발은 질병의 조기진단 및 예방을 가능하게 함으로써 질병에 의해 초래되는 막대한 경제적 손실을 방지하고, 삶의 질을 향상시킴으로써 사회적 기회비용을 절감할 수 있다.
(다) 활용분야
① 진단분야
질병상태에서 변화되는 주요 대사체군 및 대사체를 검출하고 규명하여 정상상태의 대사체 프로파일과 비교함으로써 질병을 진단할 수 있다. 특히 극소량의 대사체 변화를 신뢰성 있고 감도가 우수한 방법으로 검출함으로써 증상이 발현되기 전인 질병의 초기상태에서의 조기진단도 가능하다. 이러한 대사체들의 global profiling의 분류에 의해 질병진단 표지물질(marker)의 도출이 용이하며 나아가 군집패턴(clustering pattern) 분석을 이용한 바이오마커 도출도 가능하게 된다. 대사체 fingerprinting 또는 대사체 phenotyping은 질병의 진단 및 예방에 마치 DNA 감식법(profiling)이나 DNA 지문감정법(finger-printing)과 같이 유용하게 사용될 수 있다.
② 신약개발 및 신규작용점 도출분야
질병의 직접적 원인이 되는 새로운 작용점이 확인됨으로써 기존 의약의 약효 및 부작용의 문제점을 극복할 수 있고, 난치성 질환과 같이 치료약이 없던 질환들에 대하여도 신약 개발이 가능할 것이다. 대사체군은 질병의 최종표현형을 직접적으로 나타내므로, 병인에 대한 정확한 정보로부터 유망한 신약개발 작용점 발굴에 매우 유리한 연구수단으로 사용될 수 있다.
③ 약물의 효능과 독성의 평가(Drug efficacy and toxicity evaluation)
약물의 개발 단계 또는 임상실험단계인 Phase I 과 Phase II 연구에서 세포실험, 동물실험 그리고 인체실험에서의 대사체군 프로파일링(profiling)을 통하여 약물의 예측가능한 부작용과 독성을 스크리닝하며, 더불어 약제 효능을 예측하여 신약후보물질의 표적화(targeting)에 이바지 할 수 있다.
④ 생명공학적 기술(biotechnology)의 총체적 네트워크 구성
대사체 라이브러리(library) 확보 및 생합성 네트워크 구축으로 대사공학을 통한 신 생물자원 창출을 가능하게 하며, 대사체 정보로부터 분석기법 및 생명공학산업의 응용기술 개발에 기여할 수 있다.
나. 해외동향
미국, 유럽 등의 연구진들이 2000년대 초부터 식물 및 미생물모델을 활용한 대사체학 기반연구를 시작하여 왔으나, 최근에 들어서 동물모델 및 인체질환모델을 중심으로 한 대사체학 연구가 핵심을 이루고 있다. <표 4-1-4-2>에 해외동향을 예시하였다.
<표 4-1-4-2> 대사체학 연구의 해외동향
관련기관(국가) | 내 용 |
Metabolon 사 (미국) | 생화학적 변화에 대한 spectrum과 metabolic pathway의 변화를 mapping함으로써 새로운 약물의 도출과 동시에 약물의 유효성 및 부작용 평가를 연구함. |
Tokyo 대학 (Dr. Taguchi; 일본) | Lipidomics는 phospholipids에 대한 이론적인 mass ion intensities를 기초로 Lipid Search engine을 구축하고, LC-MS/MS 분석을 자동적으로 profiling 하고, 동시에 mass ion의 증가 또는 감소관계를 측정함으로써 신진대사경로에 대한 정량적 측정을 가능하게 함. |
ESA 사 (미국) | 정상인과 퇴행성뇌질환인과의 개체간 생화학적 분류 측정에 근거하여 치료 선택의 개선과 질병 예측 또는 인지 marker의 도출을 연구함. |
SIDMAP 사 (미국) | GC/MS를 이용하여 in vivo나 in vitro 상에서 double-labeled 13C-glucose를 주입하고, 13C-carbonyl 갯수와 위치를 결정함으로써 정상군과 질병 상태, 후보약물의 도출을 연구함. |
Pfizer 사 (미국) | 질병의 잠복기를 지닌 동물모델에 high-throughput screening을 이용함으로써 새로운 후보 약물 도출을 연구함. |
UC Davis (Dr. Viant; 미국) | NMR spectros를 이용하여 traumatic brain injury (TBI)모델에서 뇌내의 대사 프로파일링 연구를 수행함. |
맨체스터 대학 (Dr. Kell; 영국) | Metabolic fingerprinting을 이용하여 silent mutation의 phenotype 분석을 수행함. |
Human Metabolome 사 (일본) | CE/MS분석을 기반으로 한 high-throughput metabolome 분석 기술을 개발하여 분자량 m/z 70에서 1000 사이의 cellular metabolite를 동시에 많은 양을 정량할 수 있게 함. |
Imperial 대학 (Dr. Nicholson; 영국) | Global metabolic profiling 연구를 통해 약물의 유효성과 독성 평가를 위한 시스템을 구축함. |
Chiba 대학 (Dr. Saito; 일본) | 애기장대(Arabidipsis thaliana) 식물 모델에서 metabolome과 trans-criptome분석을 통하여 새로운 유전자 기능을 확인함. |
Oxford 대학 (Dr. Ratcliffe; 영국) | System-wide metabolic 분석은 대사체의 구성에 따라서 phenotype을 정의하는 것에 중점을 두고 fingerprinting 과 profiling 기법을 통해 식물 대사 네트워크의 구조 및 기능을 연구함. |
Max Plant Institute (독일) | 콩, 감자 등의 식물을 이용하여 동시다발적이며 빠르게 대사산물을 분석 하는 방법으로 방향족 아미노산 생합성 경로의 대사흐름을 연구함. |
다. 국내 현황
국내의 연구현황을 <표 4-1-4-3>에 예시하였다.
<표 4-1-4-3> 대사체학 연구의 국내동향
관련기관(국가) | 내용 |
KIST | 고성능 질량분석법을 활용하여, 다양한 생체시료 matrix (요, 혈장, 세포, 모발, 등)로부터 최적의 대사체분석법을 개발, 호르몬 의존성 질환(유방암 등) 및 신경내분비계질환(탈모증 등)환자들에 대한 targeted/ global profiling을 통한 질환고유의 진단표지대사체 도출을 시도하고 있음. 또한 통계분석을 통한 clustering기술과 metabolic pattern 분석을 통해, 약물의 유효성/독성평가를 위한 총체적인 대사 network 확립 및 drug target발굴을 위한 high throughput screening 기법개발연구를 수행 중. |
한국생명공학 연구원 | 식물 대사 및 미생물 이차대사연구의 일환으로 lipid계열의 대사체 profiling 및 DB 구축연구를 진행. 또한 질환모델의 대사체-단백체 상호작용에 대한 기초연구도 일부 수행중. |
KAIST | 미생물 genome project를 통해 균주 내부의 대사회로인 인실리코(in silico) 모델을 구축하고 모델링 검증작업, 시뮬레이션, 그리고 그 시뮬레이션 결과와 실제 실험과의 검증작업을 거침으로써, 균주의 전체대사회로를 작동원리와 그의 산업적 이용 방안 제시. |
경희대 식물대사연구센터 | 식물대사 중 에너지의 생산과 소비, 저장에 이르는 전 과정인 식물의 source대사 및 sink대사, source기관 및 sink기관의 발달대사, source-sink 대사로서의 이차대사, 그리고 이들 대사를 연구할 수단으로 기능성유전체학(functional genomics) 관련 연구를 수행 중. |
라. 발전과제
대사체학의 발전과제로 아래와 같은 연구개발이 이루어져야 할 것이다.
첫째, 대사체학 관련 핵심 신기술 개발을 위한 기반구축과정으로 질량분석 과 핵자기공명분석 등에 의한 대사체 분리 및 확인 기법 연구, 대사체군의 생체 시스템 기초한 모니터링 및 profiling기법 개발 및 통계분석을 이용한 대사체군 clustering 및 판별 pattern기법 연구가 구축되어야 할 것이다.
둘째, 대상 인체질환모델, 동물모델, 식물/미생물모델별 대사체 pro-fi-ling 구축과정으로 생체시료별 대사체군 profiling 확보, 기초 대사체군 및 대사경로 데이터베이스 구축 및 대사체 네트워크, 대사체/단백질, 대사체/유전체 상호작용 기초연구가 이루어져야 할 것이다.
셋째, 인체질환모델, 동물모델, 식물/미생물모델별 표지 대사체군의 도출로서 변형된 대사프로필로부터 후보 표지대사체 도출 및 후보 표지대사체들의 조합방식에 의한 최적 표지대사체 발굴이 이루어져야 할 것이다.
넷째, 대사체 라이브러리 확보 및 검증과정으로 대사체 표준물질 합성에 의한 라이브러리 확보 및 효소대사반응 및 효소 억제제에 의한 대사경로 mapping이 필요할 것이다.
다섯째, 총체적 대사체군 pool 완성 및 대사체군 네트워크 구축과정으로 질환모델별, 식물/미생물 모델 등에 대한 대사체 및 대사경로의 데이터베이스화 및 대사체 네트워크 모델시스템 확보가 필요할 것이다.
여섯째, 대사체군 pool 및 대사체 네트워크의 활용 및 상용화로서 질환 조기진단용 대사체칩의 개발 및 실용화, 도출된 대사경로 및 대사체 데이터베이스에 의한 신규 작용점 도출 및 유용 대사산물의 고효율 생산기술 개발이 필요할 것이다.
![]() 시스템생물학
시스템생물학
가. 시스템생물학의 개요
시스템생물학(systems biology)이란 생물학적 체제들을 전체적으로, 그리고 상호 유기적으로 이해하는 것을 목적으로 하고 있는 생물학의 한 분야이다. 뉴클레오티드와 유전자(gene)를 글자와 단어로 비유한다면, 시스템생물학은 단어들로 이루어진 문장들의 구문론(syntax)을 연구하는 학문이라 할 수 있다. 시스템생물학을 통합생물학(integrative biology) 또는 디지털생물학(digital biology)으로 부르기도 하지만 시스템생물학이라는 이름이 현재 점차 보편화되고 있다. 시스템생물학의 개념은 W. B. Cannon이 1933년 발간한 “The wisdom of the body”란 책 속에 소개한 “항상성(homeostasis)”에서 그 근원을 찾을 수 있다. 그 후 N. Wiener는 동물체를 기계와 비교함으로써 동물체의 기능을 기계적, 시스템적으로 접근하는 길을 열었다. L. von Bertalanify는 시스템의 일반적 법칙을 유도하고자 노력하였으며, 현재에 통용되는 시스템생물학의 정의는 H. Kitano의 “Perspectives on systems biology (2000)”에서 그 유래를 찾을 수 있겠다.
최근에 볼 수 있는 시스템생물학의 붐은 분자생물학의 발전과 밀접한 관계가 있다. DNA 이중나선의 발견 이후 급속히 발달한 분자생물학적 지식을 기반으로 현재 “-omics”로 표현되는(예: genomics, transcriptomics, proteomics, metabolomics and physiomics) 여러 연구 분야에서 많은 양의 독립적 데이터들이 대량-발굴(high-throughput, HT)되고 있으며, 그 축적된 데이터가 생물학의 시스템적인 접근을 가능케 한 것이다. 그러나 시스템생물학 연구를 위해서는 생물학적 시스템들을 전체적인 관점에서 이해하기 위한 방법론과 기술의 개발이 필요하며, 다양한 과학 및 기술의 집합(예: 분자생물학, 정밀계측, 컴퓨터과학, 제어이론)을 바탕으로 하고 있다.
시스템생물학적 연구를 위해서는 각 시스템들의 구성인자 및 그들간의 상호작용의 규명이 중요하다. 나아가 시간의 변화와 외/내부 조건에 따른 시스템의 행동(시스템 동역학)을 분석하여야 한다. 시스템생물학의 연구를 위해서는 현재 사용가능한 정보(생물정보학)뿐 아니라 유전체학(genomics), 단백질체학(proteomics) 등의 방법을 통한 다량의 새로운 실험데이터가 또한 요구된다. 시스템모델 정립을 위한 전산학적 연구, 시스템분석, 제어 및 회로 설계를 위한 분석 방법의 개발도 필요하고, 때에 따라서는 단일분자활성측정기술 등 나노기술 개발 등이 병행되어야 한다.
나. 해외 동향
<표 4-1-5-1>에서는 해외의 대표적인 시스템생물학 프로그램들을 소개하고 있다. 기타 프로젝트로는 미연방 에너지부가 주관하는 “Microbial Cell Pro-ject”가 있으며 일본에서는 게이오대학에서 “E-Cell Project”를 추진하고 있는데 E. coli 세포내에서 일어나는 모든 생명현상을 전산모델화 시키는 작업을 추진하고 있다. 유럽의 경우 “European Systems biology Consortium” (ESBIGH)을 구성하여 특화된 소규모 과제들을 중심으로 연구가 진행 중인데 독일에서는 간세포 모델시스템 연구가 진행되어 왔고, 영국의 맨체스터대에서는 신호전달기작 등을 대상으로 수학적 모델을 개발하고 있으며, 캠브리지대에서는 세균주화성(bacterial chemotaxis)의 생화학 회로의 시뮬레이션을 해오고 있다. 프랑스에서는 “In silico Cell Simulation Intiative(SiliCell)”을 중심으로 신호전달 모델을 개발하고 있다.
시스템생물학 국제 심포지엄(International Conference on Systemsbiology, ICSB)이 일본 동경에서 2000년에 시작되어 미국 파사데나(2001), 스웨덴 스톡홀롬(2002), 미국 세인트루이스(2003), 독일 하이델베르그(2004) 그리고 올해는 미국 보스턴에서 개최되었다. ICSB는 시스템생물학분야의 유일한 범세계적 모임으로 그 모임에서 발표되는 논문의 수와 연구내용이 시스템생물학의 풍향
<표 4-1-5-1> 시스템생물학 연구의 해외 동향 예 | |
관련기관(국가 또는 URL) | 내 용 |
Institute for Systems Biology (미국 http://www.systemsbiology.org) | 다수의 생물학자, 공학자, 전산학자, 물리학자 들이 유전체학, 단백질체학을 바탕으로 시스템생물학의 선도적인 연구를 수행하고 있음. 최근 cir---cadian clock, 성게의 발생에 대한 유전자 네트워크를 규명한 대표적 연구소. |
Systems Biology Institute (일본 http://www.sbi.jp) | ERATO-SORST Kitano Symbiotic System 프로젝트로 SBML과 호환되는 Pathway 시각화 표준을 제시하고 EGFR 및 Toll-like 수용체 신호전달계의 지도 작성. |
Computational and Systems Biology Initiative at MIT (미국 http://csbi.mit.edu) | NIH-Center of Excellence program으로 생물학, 공학, 전산학을 연결시켜 복잡한 생명현상을 시스템적으로 분석하고 있고, 현재 줄기 세포 및 암 연구에 중점을 두고 있음. |
Department of Systems Biology at Harvard Medical School (미국 http://sysbio.med.harvard.edu) | 세계 최초의 본격적인 시스템생물학과를 표방하고 있으며 M. Kirschner를 중심으로 12명의 fa-cu-l-ty를 보유하고 있음. |
Receptor Tyrosine Kinase Consortium (일본 http://receptorkinase.gsc.riken.jp) | RIKEN Genomics Sciences Center를 중심으로 인간 및 생쥐의 유전체 정보와 기타 포유동물의 Re-cep--tor Tyrosine Kinase 신호 전달 경로의 시스템 생물학 연구에 집중. |
Yeast Systems Biology Network (http://www.ysbn.org) | Yeast 신호전달시스템 연구를 위해 생물학자, 수학자, 전산학자들이 모여 모델 시스템과 실험 기법을 공유하고 정량적인 데이터를 얻어 수학적 모델을 만들기 위한 협력체. |
Alliance for Cellular Signaling (http://www.signaling-gateway.org) | A. Gilman의 주도로 대학과 기업들이 참여하는 세포 내 신호전달에 대한 선도사업으로 다양한 실험기법의 개발과 각 단백질에 대한 정보를 종합한 연구 자원 DB를 운영. |
SBML (http://www.sbml.org) | 생화학적 반응 네트워크 모델들을 서술하는 커뮤니티 표준 마크업 언어를 개발하고 있으며 일본JST와 영국 BBSRC에 의해 지원됨. 현재 SBML2가 나와 있으며 90개 이상의 모델링 프로그램에서 지원됨. |
을 가늠할 수 있다. 2005년 10월에 개최된 보스턴 모임에는 세계 30개국에서 552명이 참가하였으며, 미국 397명, 독일 28명, 영국 26명, 일본 23명 순이며 한국은 5명으로 아홉 번째이다. 논문 발표 수<표 4-1-5-2>로는 미국이 단연 선두를 차지하고(60.9%) 그 뒤를 일본(8.5%), 독일(7.7%), 영국(5.5%), 네덜란드(3%), 한국(1.8%)이 뒤따르고 있다. 미국 내에서는 명문대학인 MIT, 하버드, 칼텍, 프린스턴, 캘리포니아대가 미국 전체 논문의 40%를 차지했다.
<표 4-1-5-3>은 시스템생물학 분야별 논문발표 수를 나타내고 있는데 기초생물학분야(Systems biology of basic biological systems)에서 전체 논문의 58%를 점유하였으며, 의학 분야(Medical systems biology)는 10%로 아직 시작단계에 있으며, 방법론개척 분야(Expanding fronts in systems biology)에서 27%를 점유하고 있다. 특히 신호전달(Signal transduction)과 방법 개발(Novel expe-rimental and computational technologies)에 많은 논문이 집중되어 있다.
순위 | 국가 | 논문발표건수 | 비율 (%) |
1 | United States | 165 | 60.9 |
2 | Japan | 23 | 8.5 |
3 | Germany | 21 | 7.7 |
4 | United Kingdom | 15 | 5.5 |
5 | Netherlands | 8 | 3.0 |
6 | South Korea | 5 | 1.8 |
| Israel | 5 | 1.8 |
8 | Italy | 4 | 1.5 |
9 | Czech Republic | 3 | 1.1 |
| Singapore | 3 | 1.1 |
11 | Canada | 2 | 0.7 |
| Denmark | 2 | 0.7 |
| Sweden | 2 | 0.7 |
14 | Belgium | 1 | 0.4 |
| Finland | 1 | 0.4 |
| India | 1 | 0.4 |
| Ireland | 1 | 0.4 |
| Mexico | 1 | 0.4 |
| New Zealand | 1 | 0.4 |
| Portugal | 1 | 0.4 |
| South Africa | 1 | 0.4 |
| Spain | 1 | 0.4 |
| Switzerland | 1 | 0.4 |
| Taiwan | 1 | 0.4 |
| Uruguay | 1 | 0.4 |
| Puerto Rico | 1 | 0.4 |
합계 | 26개 국가 | 271 | 100.0 |
분야 | 논문발표건수 | 비율 (%) | |
1. Systems Biology of Basic Biological Systems | |||
1-a | Evolutionary and Developmental Systems Biology | 16 | 5.9 |
1-b | Metabolomics and Systems Biology | 26 | 9.6 |
1-c | Cyclic and Dynamic Behavior | 29 | 10.7 |
1-d | Systems Neurobiology | 6 | 2.2 |
1-e | Signal Transduction | 52 | 19.2 |
1-f | Gene Expression | 29 | 10.7 |
|
|
|
|
2. Medical Systems Biology | |||
2-a | Systems Biology of Cancer | 6 | 2.2 |
2-b | Systems Immunology | 5 | 1.8 |
2-c | Cardiovascular Systems Biology | 7 | 2.6 |
2-d | Bioprocess Development and Synthetic Biology | 10 | 3.7 |
|
|
|
|
3. Expanding Fronts in Systems Biology | |||
3-a | Chemical Genomics and Drug Discovery | 4 | 1.5 |
3-b | Complex Systems | 15 | 5.5 |
3-c | Physical Principal of Cellular Systems | 8 | 3.0 |
3-d | Novel Experimental and Computational Technologies | 47 | 17.3 |
4. Etc | 11 | 4.1 | |
합계 | 271 | 100.0 | |
다. 국내 현황
2003년 4월에 서울대 문화관에서 국내에서는 처음으로 시스템생물학 국제학술대회(Seoul Symposium on Systems Biology 2003)를 개최하여 국내 시스템생물학의 토대가 마련되기 시작하였다. 과학기술부는 시스템생물학을 국책연구사업과제로 설정하였으며 2003년 6월부터는 “시스템생물학사업단”이 출범하여 11개의 융합과제들이 결합된 세부과제를 중심으로 시스템생물학연구가 시작되었다. 2005년 5월부터 2단계사업이 시작되었는데, 진핵성세포시스템 분야의 “칼슘대사시스템생물학연구”와 원핵성세포시스템 분야의 “대사회로분석 및 가상세포시스템연구”가 선정되어 현재 연구가 진행 중이다.
라. 시스템생물학의 전망
시스템생물학과 관련된 국제 SCI 논문발표 수를 관찰하면, 지난 1년간 발표된 논문 수(314편)가 과거 5년간에 발표된 논문 수(558편)의 56%를 차지한다. 이 사실은 시스템생물학이 현재 세계적으로 붐을 맞고 있고, 또한 포스트게놈(Post-genome) 시대의 새로운 대안으로 자리 잡고 있는 것을 암시한다. 미래에 있어서 개연성 있는 시스템생물학의 중요한 적용 분야는 작용기작에 기반을 둔 약물 개발이다. H. Kitano는 최근의 리뷰(Nature Reviews on Sys-tems Biology, May 2005)에서 암세포의 시스템생물학 연구를 통한 암 치료제 개발의 가능성을 암시하였다.
![]() 구조생물학
구조생물학
가. 구조생물학 개요
유전체는 생명체의 생명현상에 대한 정보를 담고 있는 생체분자로 건축에 비교하면 건축물의 설계도에 해당하는 것이다. 이 유전체가 만들어 내는 각각의 단백질은 생명체내에서 화학반응을 일으키고, 세포와 세포사이의 신호를 전달하기도 하고, 감염균들과 싸운다. 또 세포를 성장시키거나 분열시키고, 유전체의 활동을 조절하고, 구조적이고 기계적인 지지, 근육의 수축이나 세포의 이동 및 신경신호를 발생시키고 전달을 하는 등 모든 생명체에서 생명을 유지하는 실질적인 대행자이다. 그러므로 단백질이 수행하는 기능과 작용하는 방법을 시간과 공간적으로 알게 되면 생명현상의 이해와 조절도 가능할 것이다.
대부분의 인간질병 암, 에이즈, 헌팅턴, 파킨슨병 및 호흡기 질환 등의 불치, 난치의 질병들은 단백질의 기능 이상기능으로 일어나게 되는데 이런 단백질의 기능을 이해하는 가장 중요한 방법 중의 하나가 3차원 구조를 알아내는 것이다. 왜냐하면 보통 물체의 3차원 구조는 그 기능과 바로 연관되어 있기 때문이다.
단백질의 3차원 구조로부터 기능의 정보를 얻으려고 하는 학문적 영역이 바로 구조생물학이라고 정의할 수 있다. 특히 1980년대 말에 시작한 인간게놈 프로젝트가 21세기 시작과 더불어 완성된 이후에 발견된 각종 질병과 관련된 유전자 및 단백질 등은 신약개발 표적이 되는 것으로 새롭게 알려지는 단백질의 종류가 급격하게 증가하고 있다. 인간의 몸에는 약 10만 개 정도의 단백질이 활동하고 있는 것으로 추정되고 있지만 밝혀진 단백질의 종류는 약 2만 종 정도이며 이 중에서 5% 미만의 단백질만이 구조가 밝혀진 상태이다(www.llnl.gov/str/Balhorn.html). 불치, 난치의 질병을 예방, 치유하고, 치매와 노화원인을 규명하여 생명을 건강하게 연장시키기 위한 연구와 이런 질병을 치유할 수 있는 신약을 개발하기 위한 표적단백질의 3차원 구조연구에 세계 각국에서는 많은 투자를 하고 있다. 그러므로 단백질 구조를 연구하는 방법 중에서 주가 되는 방사광을 이용한 X-선 회절결정학 방법을 중심으로 소개하고자 한다.
나. 해외동향
(1) 연구활동
전 세계과학자들은 인간게놈지도를 작성하면 질병의 근원을 이해할 수 있다고 인식하지만 실제로는 게놈기능을 10% 밖에 이해할 수 없고 나머지 90%는 모르는 상태다. 이를 이해하려면 단백질 수준으로부터 연구해야만 인류의 생리와 병리구조를 이해할 수 있게 된다. 이미 발견한 500종의 단백질의 기능에 근거하여 인류는 지금까지 전체 2,000여 종의 약물을 개발하였다. 단백질연구 계획사업의 추진에 따라 세계 각국에서는 국가적인 차원에서 이 분야에 여러 대형 프로젝트를 만들어 장기적이고 집중적인 투자를 진행하고 있다. 미국은 국립보건원(NIH)을 중심으로 9개의 지역기반 프로젝트를 진행하고 있으며 이에 뒤질세라 일본과 유럽 및 기타 지역에서도 여러 대형프로젝트를 진행시키고 있다<표 4-1-6-1>.
(2) 연구시설
이런 대형프로젝트에는 반드시 단백질의 구조를 연구하기 위한 기반 시설로 방사광 가속기의 단백질 회절결정학 빔라인이 필수적인 관계로 세계 17개국 이상에서 이런 방사광 가속기와 빔라인을 앞다투어 건설하고 있다<표4-1-6-2>. 또한 세계의 주요 방사광 가속기에서의 단백질결정 구조연구 빔라인은 전체 빔라인 수에 대하여 9~28% 정도 차지하고 있다<그림 4-1-6-1>.
<표 4-1-6-1> 국가별 유전체학 프로젝트(www.rcsb.org/pdb/strucgen.html) | |
국가 | 유전체학 센터 |
USA France Japan Israel Korea Canada UK EU Germany | The Berkeley Structure Genomics(BSGC) Center for Eukaryotic Structural Genomics(CESG) The Joint Center for Structural Genomics(JCSG) The Midwest Center for Structural Genomics(MCSG) The New York Structural Genomics Research Consortium(NYSGRC) The Northeast Structural Genomics Consortium(NEGS) The Southeast Collaboratory for Structural Genomics(SECSG) Structural Genomics of Pathognic Protozoa Consortium(SGPP) The TB Structural Genomics Consortium(TB) Structural Genomics(SGX) Structure 2 Function Project(S2F) Syrrx deCode Genetics Bacterial Targets at IGS-CNRS(BIGS) Marseilles Structural Genomics Program(MSGP) Paris-Sud Yeast Structural Genomics(YSG) Biological Information Research Center(JBIRC) Protein Structural Factory(PSF) RIKEN Structural Genomics Initiative(RIKEN) Structural Geonomics Consortium for Research on Gene Expression System (SGCGES) Israel Structure Proteomics Center(ISPC) Korean Structural Proteomics Research Organization(KSPRO) Montreal-Kingtom Bacterial Structural Genomics Initiative Ontario Center for Structural Proteomics Structural Genomics Consortium(SGC) North West Structural Genomics Center(NWSGC) Oxford Protein Production Facility(OPPE) Structural Proteomics in Europe(SPINE) Mycobacterium Tuberculosis Structural Proteomics Project(XMTB) |
국가 | 도시 | 장치이름 | 에너지(GeV) | 상태 |
Armenia | Yerevan | Candle | 3.2 | design/dedicated |
Australia | Melbourne | Australian Synchrotron | 3 | dedicated* |
Canada | Saskatoon | CLS | 2.9 | dedicated |
China | Shanghai | SSRF | 3.5 | dedicated |
Beijing | BLS | 2.2-2.5 | design/dedicated | |
France | Gernoble | ESRF | 6 | dedicated |
Orsay | SOLEIL (LURE) | 2.5-2.75 | dedicated* | |
Germany | Karlsruhe | ANKA | 2.5 | dedicated |
Berlin | BESSY | 1.7-1.9 | dedicated | |
Hamburg | DORIS III | 4.5 | dedicated | |
India | Indore | INDUS-II | 2 | dedicated* |
Italy | Trieste | ELETTRA | 2-2.4 | dedicated |
Japan | Rokakasho | MOSLA | 2 | design/dedicated |
Ichihara | NANO-HANA | 1.5-2 | design/dedicated | |
Tsukuba | PF | 2.5 | dedicated | |
Nishi Harima | SP-8 | 8 | dedicated | |
Jordan | Allaan | SESAME | 2.5 | dedicated* |
Korea | Pohang | PLS | 2.5 | dedicated |
Russia | Moscow | Siberia II | 2.5 | dedicated |
Spain | Barcelona | AURORA | 2.5 | dedicated* |
Sweden | Lund | MAX-IV | 3 | design/dedicated |
Switzerland | Villigen | SLS | 2.4 | dedicated |
UK | Daresbury | SRS | 2 | dedicated |
Oxfordshire | DIAMOND | 3 | dedicated* | |
USA | Argone, IL | APS | 7 | dedicated |
Berkeley, CA | ALS | 1.9 | dedicated | |
Stanford, CA | SSRL | 3 | dedicated | |
Upton, NY | NSLS II | 2.5-2.8 | dedicated |
<표 4-1-6-2> 국가별 방사광전용 가속기 분포
(* : 건설 중, designed/dedicated : 계획 중, dedicated: 방사광전용)
<표 4-1-6-3> X-선을 이용한 단백질의 구조를 연구하는 기관별 그룹수의 분포 (방사광이용자 통계 이용) | ||
학계 | 연구소 | 산업체 |
21 | 6 | 3 |

<그림 4-1-6-1> 단백질 구조연구 빔라인이 건설되어 있는 세계의 대표적인 방사광가속기에서
총 빔라인수와 단백질 구조연구 빔라인 수의 비교
다. 국내현황
(1) 전문가 수
산·학·연에 X-선을 이용한 단백질 구조를 연구하는 주 연구자(그룹리더)의 분포는 대학이 주를 이루고 있으며 그 다음으로는 연구소과 산업체를 들 수 있다<표 4-1-6-3>.
국내에서는 크리스탈지노믹스와 LG 생명공학연구원 두 회사만이 전문 연구 그룹을 가지고 구조를 기반으로 한 신약개발에 참여하고 있는데 비하여 대부분의 해외 유수 제약회사들이 적어도 하나 이상의 구조생물학 연구팀을 보유하고 있다. 그렇지만 국내의 대학이나 연구소에서 구조생물학을 연구하는 그룹은 꾸준히 증가하고 있는 상황으로 미래에는 국내의 유수 제약회사에서도 구조생물학 연구팀을 보유할 것으로 예상된다.
(2) 연구활동
지금까지 치매관련 단백질, 저산소증관련 단백질, 파킨스씨병의 진행에 관련된 단백질, 암 옥은 암에 관련 단백질, 비만관련 단백질 및 발기부전 치료제 관련 단백질의 구조 등 많은 질병 관련 단백질과 DNA의 구조 및 수리관련 단백질의 구조가 국내의 연구진에 의해 풀렸으며 최근의 대표적인 것은 DNA의 오른쪽 나선의 핵산(B형 핵산)과 왼쪽 나선의 핵산(Z형 핵산)이 이웃하는 접합부위(BZ junction)의 삼차원 입체구조를 세계 최초로 규명함으로써, 핵산의 나선 방향이 오른쪽에서 왼쪽으로 전환하는 방법을 원자수준에서 설명하는 기초과학 분야의 기념비적 연구 성과를 이루기도 했다(Nature 표지발표). 앞으로도 더 좋은 결과를 발표할 것으로 기대하고 있으며 대표적인 논문은 다음과 같다.
1. Byung Il Lee, Kyoung Hoon Kim, Soo Jeong Park, Soo Hyun Eom, Hyun Kyu Song and Se Won Suh, “Ring-shaped architecture of RecR: implications for its role in homologous recombinational DNA repair” EMBO Journal 23, 2029–2038 (2004)
2. Yong-Seok Heo, Su-Kyoung Kim, Chang Il Seo, Young Kwan Kim, Byung-Je Sung, Hye Shin Lee, Jae Il Lee, Sam-Yong Park, Jin Hwan Kim, Kwang Yeon Hwang, Young-Lan Hyun, Young Ho Jeon, Seonggu Ro, Joong Myung Cho, Tae Gyu Lee, and Chul-Hak Yang, “Structural basis for the selective inhibition of JNK1 by the scaffolding protein JIP1 and SP600125” EMBO Journal 23, 2185-2195 (2004)
3. Sung Chul Ha, Ky Lowenhaupt, Alexander Rich, Yang-Gyun Kim & Kyeong Kyu Kim, “Crystal structure of a junction between B-DNA and Z-DNA reveals two extruded bases” Nature 437, 1183-1186 (2005)
(3) 국내 연구시설
단백질 결정학 분야에서의 중요한 주요 연구 기자재는 X-선 발생장치, 자기공명장치 및 전자현미경 등이다. 각 장치의 특성은 상호 보완적이지만 국내에서 대부분은 X-선을 이용한 단백질 구조 연구가 주를 이루고 있다.
X-선 장치로는 크게 보통 실험실에서 사용하는 X-선 발생장치와 방사광 가속기단백질 회절결정학 빔라인이 있다. 방사광 빔라인의 경우 2001년 3월부터 사용하기 시작한 휨자석을 광원으로 하는 실험 장치와 2005년 1월부터 사용하기 시작한 Wiggler를 광원으로 하는 실험장치 2개가 운영 중에 있다. 휨자석 광원의 휘도는 보통 실험실에 비하여 수십 배 밝기 때문에 보통 실험실에서 얻을 수 없는 고해상도의 결정회절 자료를 얻을 수 있다. 그러나 Wigger 광원은 휨자석 광원보다 30배 정도 휘도가 더 밝은 것으로 결정의 자료 수집 시간을 획기적으로 줄여주고, 휨자석 광원에서 보다 훨씬 높은 해상도의 결정회절 자료를 제공해 주고 있다.
이 외에도 1기의 휨자석을 광원으로 하는 빔라인이 2005년 완공을 목표로 건설이 진행되고 있다. 이렇게 되면 빔타임이 모자라거나 휘도가 약해서 외국을 나가는 경우는 당분간 없어질 것이다. 또한 차세대 자기공명장치로 800~900MHz 자기장을 발생시켜 원자수준에서 단백질 등 생체 고분자의 입체구조를 분석하는 장치가 현재 조립 중에 있어 앞으로 제약업체, 대학, 연구기관 등 신약 물질 분석 개발 등을 하는 기관에서 활용할 수 있게 될 것이다.
라. 발전전망
한국은 이 분야에서 이미 우수한 연구 결과를 다수 발표하는 등 상당한 경쟁력을 갖춘 우수한 인력을 확보하고 있다. 그리고 이미 2005년 초부터 Wiggler 빔라인이 가동되어 기반 시설로서의 경쟁력도 갖추기 시작했다. 2005년 말 완성 예정인 또 다른 단백질결정학 빔라인이 완성될 경우 이용자들이 단백질 구조실험을 하기 위하여 외국으로 갈 필요가 없을 것이다. 아울러 Wiggler 빔라인의 자동화 설비가 2006년 완성 목표로 진행되고 있는데 이것이 완성되면 빔라인의 효율은 더욱 증대될 것이고 실험도 훨씬 용이해질 것이다.
이런 결정회절 자료수집의 자동화와 더불어 단백질 결정화를 자동화하는 기술도 개발되어 단백질 결정화 검색에 필요한 단백질의 양을 획기적으로 줄일 수 있게 되었다. 기존에는 주로 한 조건당 1~2μl의 단백질을 이용하여 50~100가지의 결정화 조건을 검색하는 것이 보통이었지만 최근에는 5~20 nl의 단백질로 4,000~9,000 가지의 조건을 검색할 수 있는 로봇 기술이 개발되어 앞으로 질병관련 중요 단백질의 결정화 성공률을 획기적으로 높일 것으로 예측되고 있다.
이러한 기술발전에 힘입어 초기에는 특수한 목적으로만 활용되던 방사광가속기가 최근에는 신약후보물질과 표적 단백질의 복합체 구조규명을 통한 신약설계 및 최적화를 위하여 다량의 후보물질 복합체 결정구조를 단시간에 고해상도로 규명하는데에 활용되고 있다. 단백질 회절결정학의 활용은 신약개발의 효율성 증대에 있어서 더욱더 중요한 위치를 차지할 것으로 보인다. 국내에서도 두 곳의 기업체에서 이미 이와 같은 3차원 구조를 바탕으로 한 새로운 신약 후보군의 발굴에 방사광을 많이 활용하고 있으며 점점 더 활용의 빈도를 높여가고 있는 상황이다.
신약의 부가가치는 이미 잘 알려진 바와 같이 차세대의 부의 원천으로 여겨 선진국에서도 이 분야에 투자를 집중하고 있는 것이 세계적인 추세다. 국내에서도 흩어져 있는 인프라를 잘 활용하고 통합적으로 연구할 수 있는 국가적인 규모의 연구프로젝트를 추진하는 것이 바람직할 것이다.
![]() 뇌과학
뇌과학
가. 개요
뇌과학은 생명공학(BT)의 한 분야로서 나노공학(NT) 및 정보기술(IT)과 함께 21세기를 이끌 핵심기반 분야이며 미래지향적인 성장 동력 기술이다. 뇌과학은 뇌의 신경생물학적 구조와 기능의 분자세포생물학적 이해를 바탕으로 인지, 사고, 언어 및 행동 등의 고등신경 정신활동에 대한 포괄적인 이해를 통해 궁극적으로 인간의 정체성과 본질을 밝혀내고자 하는 연구 분야이다.
뇌과학은 수학·물리학·화학·생물학 등 기초과학 분야는 물론, 의학·공학·인지과학 등을 복합적으로 적용해 뇌의 신비를 밝히고, 이를 통해 인간이 갖는 물리적·정신적 기능성의 전반을 심층적으로 탐구하는 한편, 넓게는 뇌 정보처리 메커니즘의 이해를 바탕으로 모방과 응용을 통해 인간의 두뇌와 유사한 지능형 기계를 개발하는 것까지도 포함하고 있다.
최근 뇌연구 핵심분야는 크게 뇌기능과 뇌발달에 관한 분자세포수준의 기초연구와 이를 바탕으로 알츠하이머병, 파킨슨병, 헌팅턴병, 간질 등 뇌질환의 병인규명으로 나눌 수 있다. 또한 최근 급격히 발달한 생물정보학, 유전체학, 단백질체학 등을 뇌연구에 접목하여 신경유전체학, 신경단백질체학 등이 발전하고 있으며 새로운 뇌질환모델개발, siRNA기법, 마이크로어레이(microarray) 기법, 뇌영상이미지기법 등 다양한 뇌연구 기술을 개발하는 것이다.
나. 해외 동향
미국은 1990년 ‘Decade of the Brain’ 법안이 의회를 통과한 이래 전 세계적으로 뇌연구의 주도권을 쥐고 있으며 국립보건원(NIH)과 국립과학재단(NSF)을 중심으로 국가주도의 연구개발 투자를 하고 있다. 새로운 뇌연구 기법 개발, 대형 콘소시움을 통하여 기능적 신경연접과 시냅스의 변화 등의 DB구축 등 대형사업을 추진하고 있는 것이 특징이다. 또한 단일 신경세포에서 개체에 이르는 시스템연구, 분자이미징기술, 뇌-기계접속기술(Brain--Machine Interface, BMI)을 개발하여 인공와우, 인공망막, 심부뇌자극기술 등을 산업화 하고 있다.
일본은 21세기를 ‘뇌의 세기’라고 명명하고 이화학연구소(RIKEN)에 설립된 뇌연구종합연구소(BSI)를 중심으로 국가주도의 뇌과학 연구개발사업을 추진해오고 있다. 유럽연합(EU)도 국가단위를 초월하여 범 유럽연구개발사업을 활발히 추진하고 있으며, 영국은 MRC와 Welcome Trust를 중심으로, 프랑스는 국립과학연구소(CNRS)와 국립생명공학연구소(INSERM)를 중심으로, 독일은 막스프랑크연구협회(MPI)를 중심으로 뇌연구를 수행하고 있다.
뇌질환 치료제 시장은 전 세계적으로 40조 원에 이르며 신약개발 시장 중 가장 빠른 성장률을 보이고 있다<그림 4-1-7-1>. 이는 현대 의학의 발달로 인한 고령화 인구의 증가, 복지 수준에 대한 관심, 심각한 질환으로 인식되지 않았던 질병에 대한 관심이 높아지고 있으며 이에 따른 질병 메커니즘에 대한 연구와 이해의 증가 등과 연관이 있다.
|
<그림 4-1-7-2> 2003년 임상 통계(Neurologic disorder) |
<표 4-1-7-1> 2002년 및 2003년 신약 승인 된 뇌질환 치료제 | |||
제품명 | 승인연도 | 개발사 | 적응증 |
Namemda | 2003년 | Mertz, Forest Laboratories | 중증 알츠하이머 |
Abilify | 2002년 | Bristol-Myers Squibb | 정신분열증 |
Relpax | 2002년 | Pfizer | 편두통 |
Strattera | 2002년 | Eli Lilly | ADHD |
Xyrem | 2002년 | Orphan Medical | Cataplexy associate with narcolepsy |
Rebif | 2002년 | Serono | Multiple sclerosis |
2003년 현재 임상 진행 중인 뇌질환 관련 신약은(정신질환 분야 제외) 모두 172종으로 44종의 통증치료제, 28종의 뇌종양 치료제, 26종의 알츠하이머 치료제, 18종의 파킨슨병 치료제, 15종의 Stroke 치료제, 14종의 편두통 치료제, 12종의 다발성 경화증 치료제, 9종의 간질치료제, 7종의 수면장애 치료제가 포함되어 있다<그림 4-1-7-2>(Pharma Report, 2003).
2003년 미식품의약국(FDA)에 의해 승인된 신규 의약품의 수는 모두 86종으로 이 중 21종은 합성신약이며 14종은 바이오 신약으로 집계되었다. 2003년 한 해 뇌질환 치료제 분야에서 승인된 신약은 알츠하이머 치료제인 Memem-tine HCI(상품명 Namenda) 1종이 유일하게 포함되어 있다<표 4-1-7-1>(Phrma Report, 2004).
다. 국내 동향
뇌과학 연구의 중요성을 인식하고 국가주도의 연구개발을 지원하고 있는 선진국 추세에 발맞추어 우리나라에서도 1998년 뇌연구 활성화를 위한 ‘뇌연
구촉진법’을 제정하였고, 1999년 범부처 차원의 ‘뇌연구촉진기본계획(Brain-tech 21)’을 수립 시행하였다. 이에 따라 국내에서는 ‘뇌신경생물학사업단’, ‘뇌의약학사업단’, ‘뇌신경정보학사업단’ 3개 사업단을 주축으로 국내 뇌연구의 활성화를 모색하게 되었다. 2003년 10월 과학기술부는 국가 대형장기프로젝트인 21세기 프론티어연구개발사업의 하나로써 ‘뇌기능 활용 및 뇌질환 치료기술 개발 연구사업단’을 출범시킴으로써 국내 뇌과학 연구의 획기적 개선을 도모하게 되었다.
현재 국내 뇌관련 연구 인력(석사급 연구원 이상)은 약 1800여 명이며, 남여의 비율은 8:2로 나타나고 있다. 또한, 국내 뇌연구 투자예산은 일본의 1/10, 미국의 1/200 수준으로 2004년에는 총 391억 원, 2005년에는 총 417억 원으로 계획되어 있다. 이러한 국내 연구투자예산은 민간부문의 투자를 포함한다면 보다 크게 증가될 것이다<표 4-1-7-2, 4-1-7-3>(뇌연구촉진시행계획, 2005).
국내 뇌질환 관련 기업으로는 미국 존슨앤존슨사로부터 천만불 이상 규모의 기술료를 징수한바 있는 국내 선두그룹 (주)SK를 비롯하여 동아제약 등이 있으며, 이외 두각을 나타내는 뇌질환 관련 벤처기업으로는 (주)뉴로테크, (주)크리스탈지노믹스, (주)디지탈 바이오텍 등이 있다. 다만 벤처기업의 경우 상대적으로 뛰어난 기술력에도 불구하고 신약 개발에 대한 지속적 투자에 어려움을 겪을 것으로 예상된다. 몇몇 벤처기업에서는 새로운 EEG 측정기술, 지능검사 등 뇌신경생리학적 연구와 뇌영상기법을 응용하여 뇌-기계접속기술도 활발히 연구개발하고 있으나 전반적인 수준은 다소 미진하다고 사료된다.
<표 4-1-7-2> 뇌연구 투자예산 비교 | |||
구 분 | 한국 | 일본 | 미국 |
예산규모(2003년) | 349억 원 | 350억 엔* | 59억 불* |
비 율 | 1 | 10 | 203 |
* 일본과 미국의 수치는 2002년 자료 | |||
<표 4-1-7-3> 뇌연구 투자예산 (총괄표)(단위 : 백만 원) | ||||
관계부처 | 사 업 명 | 사업기간 | 2004실적 | 2005계획 |
과학기술부 | ○뇌 프론티어연구사업 | ’03~2012 | 9,033 | 9,033 |
○뇌신경생물학연구사업 | ’98~2007 | 2,000 | 2,000 | |
○뇌혈관한의학기반연구 | ’05~2014 | - | 1,500 | |
○뇌영상용 초고자장MRI연구 | ’05~2011 | - | 1,000 | |
○뇌질환연구센터(SRC) | ’98~계속 | 873 | 800 | |
○Brain Research 24개 사업(특정기초) | ’78~계속 | 2,005 | 2,102 | |
○치매정복연구단 등 8개 사업(창의연구) | ’97~계속 | 5,097 | 5,065 | |
○신경신호조절연구실 등 4개 연구실(국가지정연구실) | ’99~계속 | 908 | 873 | |
보건복지부 | ○뇌의약학연구사업 | ’98~2007 | 4,011 | 3,015 |
교육인적 자원부 | ○기초과학연구지원사업 및 선도연구자지원사업 등 일부 | ’98~계속 | 2,500 | 2,500 |
산업자원부 | ○슈퍼지능칩 및 응용기술 개발 | ’00~2010 | 3,052 | 3,386 |
○뇌신경정보학연구사업 | ’98~2008 | 2,400 | 3,000 | |
출연기관 고유사업 | ○뇌질환 표적단백질 발굴 및 조절물질연구(KIST) | ’02~2012 | 4,881 | 5,000 |
○뇌자도 기술 개발(표준연) | ’01~2006 | 300 | 300 | |
○의료기반 VR Therapy기술 개발(전자통신) | ’00~2006 | 1,052 | 1,069 | |
○생체화학분자개발사업(화학연) | ’03~2005 | 1,035 | 1,050 | |
계 | 40,116 | 42,648 | ||
라. 발전과제 및 전망
국내의 뇌과학 수준은 짧은 기간과 적은 수의 핵심 인력에도 불구하고, 투자 대비 뛰어난 연구성과를 보여주었으며, 치료제 개발을 중심으로 한 관련 산업계의 잠재역량도 뛰어난 편이라고 할 수 있다.
뇌연구 투자 대비 연구성과 조사결과에 의하면 국내 뇌연구 투자가 비교적 효율적으로 이루어지고 있는 것으로 나타나고 있다. 정부투자 1억 원당 국내 뇌연구 논문의 수는 1.4편인 반면, 일본은 0.7편, 미국은 0.25편으로 집계되고 있다. 이 수치는 민간부문 지원을 감안할 때 미국 또는 일본에 비하여 2배 가량의 논문이 배출되고 있다는 것을 의미한다. 다만 논문인용지수(IF) 등을 감안할 때 미국의 경우 질적 수준이 높은 논문이 소량 배출되고, 국내의 경우 질적 수준이 높지 않은 논문이 다수 배출되고 있다는 점이 지적되고 있다. 이러한 측면으로 볼 때 연구의 수준을 높이기 위해서는 선진국형 연구체제로의 개편을 시행하는 것이 여전히 시급한 과제로써, 국내 연구비 심사 및 평가 시스템에 연구논문의 질적 심화도, 실질적 공동연구 진행도 등을 평가하는 것도 한 가지 개선책이 될 것으로 보인다.
국내 뇌질환 치료제 전문 개발 기업은 아직 미미한 실정이며, 투자 재원 확보에 있어서도 선진국의 경우처럼 Alzhimer foundation, ALS foundation, Strok foundation 등 민간 연구재단을 통한 투자 재원 확보 방안이 없어 전 임상, 임상단계의 연구에 많은 어려움이 있다. 다행스러운 것은 최근 정부차원의 대형실용화 연구사업을 통해 신약 후보물질 발굴이 실용화로 이어질 수 있는 발판이 생긴 것은 매우 바람직하다고 하겠다.
최근 뇌과학 연구개발이 세계적 규모의 공동연구를 통해 수행되는 경우가 증대되고 있고 2004년에는 선진국 국제협력프로그램인 HFSP(Human Fron-tier Science Program)에 우리나라가 정식 가입하게 되었다. 뇌기능연구프론티어사업단의 경우 2005년 2월 영국의 시냅스가소성 MRC(브리스톨대학) 등 협력연구기관과 뇌질환 신약 개발을 위한 국제공동연구사업을 추진하고 있다.
2006년 2단계 연구사업에 진입하는 뇌기능연구프론티어사업단이 ‘뇌신경생물학사업단’, ‘뇌의약학사업단’, ‘뇌신경정보학사업단’ 3개 국책사업단과의 협력기반 위에서 국내 뇌연구 인프라 및 뇌과학의 수준 제고에 중심역할을 수행할 것을 기대한다.
■ 제 4장 분야별 연구개발 및 관련산업 현황 제 2절 보건의료 |
![]() 합성신약
합성신약
가. 신약 연구개발 개요
제약산업은 연구개발이 필수적인 대표적인 지식기반 산업으로 지난 50년간 혁신적인 기술개발이 가장 많이 이루어진 분야 중의 하나이다. 특히 90년대부터 전통적 신약 관련 과학기술과 장비개발, 분석기술개발, 컴퓨터 및 정보산업 등이 동시에 발전하면서 고속검색, 조합화학, 구조기반 약물설계 등의 새로운 기술들이 연구에 활용되었다<그림 4-2-1-1>. 1990년대 신약 하나의 품목당 연구개발비는 8억 달러에 이르러 1970년대 대비 6배 이상 증가하였다. 연구개발비의 증가와는 달리 1990년대 후반기부터 신규 신약 허가품목수가 감소하는 연구개발의 생산성 저하가 나타나고 있다. 그럼에도 ‘IMS health report’에 의하면 2004년도 전 세계 의약품 매출액은 약 5,500억 달러로 사상 처음 5,000억 달러의 분기점을 돌파하였고 2003년 대비 7% 성장으로 다른 산업에 비하여 여전히 고도성장을 하였으며 2004년에 총 31개의 신규합성신약(NCE)이 도출되었다.
|
<그림 4-2-1-1> 신약개발 패러다임의 변화 |
나. 신약개발의 해외 동향
(1) 연구개발 투자 현황 미국 제약협회(PhRMA) 회원의 2004년 총 연구비 투자액은 388억 달러로 2003년 대비 12.6% 증가하였다. PhRMA의 2004년 보고에 의하면 미국 제약회사는 평균적으로 매출액의 15.6%를 연구개발비에 투자하고 있으며 이는 전 세계 연구개발비의 50%를 훨씬 넘는 규모이다<표 4-2-1-1>.
(2) 신약 개발 파이프라인 현황
의약품 정보분석기관인 Datamonitor가 2004년 1월 전 세계 제약회사 데이터베이스를 분석한 결과, 약 200개 회사에서 1,377개의 개발후보물질들이 전 임상 이상의 개발단계에 있는 것으로 파악되었다.
순위 | 회사 | 국가 | 2004년 매출액 ($m) | 2003년 대비 성장률 (%) | 연구비 $m (매출액대비 %) |
1 | Phizer | 미국 | 46,133 | 16% | 7,520 (16.3) |
2 | GlaxoSmithkline | 영국 | 31,377 | 5% | 5,195 (16.6) |
3 | Sanofi-Aventis | 프랑스 | 30,919 | 12% | 9,310 (29.4) |
4 | Johnson & Johnson | 미국 | 22,128 | 13% | 5,203 (23.5) |
5 | Merck | 미국 | 21,493 | - 4% | 4,010 (18.7) |
6 | AstraZeneca | 영국 | 21,426 | 13.5% | 3,803 (17.7) |
7 | Novartis | 스위스 | 18,497 | 2.5% | 3,480 (18.9) |
8 | Brisol-Myers Squibb | 미국 | 15,482 | 4% | 2,500 (16.1) |
9 | Wyeth | 미국 | 13,964 | 10.5% | 2,460 (17.6) |
10 | Abbott | 미국 | 13,756 | 11.6% | 1,690 (12.3) |
11 | Eli Lilly | 미국 | 13,059 | 4% | 2,690 (20.6) |
12 | Roche | 스위스 | 17,322 | 41.5% | 5,400 (31.2) |
13 | Amgen | 미국 | 10,600 | 35% | 1,996 (18.8) |
14 | Boehringer-Ingelheim | 독일 | 8,698 | 8% | 1,527 (17.6) |
15 | Takeda | 일본 | 8,274 | 12% | 1,223 (14.8) |
16 | Schering Plough | 미국 | 6,417 | 4% | 1,607 (25.0) |
17 | Schering AG | 독일 | 6,085 | 11% | 745 (12.2) |
18 | Bayer | 독일 | 5,440 | 1% | 1,527 (28.1) |
19 | Eisai | 일본 | 5,006 | 32% | 724 (14.6) |
20 | Teva | 이스라엘 | 4,276 | 30.5% | 338 (7.9) |
<표 4-2-1-1> 상위 20개 회사의 2004년 매출액 및 연구개발 투자비
출처: Pharmaceutical Executive, May 2005, 주; 매출액은 인체 처방약만임. 진단, 의료장비, 동물용 의약품은 제외되었음.
(가) 개발단계별 파이프라인
1,377개 개발후보물질 중 전임상 단계인 것이 190개(13.8%), 임상 I상인 것이 666개(48.4%), 임상 II상인 것이 319개(27.5%), 허가단계인 것이 6개(0.4%) 였다.
(나) 치료군별 파이프라인
현재 개발 중에 있는 1,377개 신약 후보 중 항암제 관련 신약 후보물질이 전체의 29.3%로 가장 많았으며, 그 다음이 중추신경계(16%), 관절염/염증/면역 관련 질환(10.7%), 감염증(10.6%), 심장순환계(10.2%) 순이었다.
|
<그림 4-2-1-3> 치료군 별 파이프라인 품목 수(출처: Datamonitor com-pany reported data; IDdb 13 January 2004, Thompson Scientific; Biospace). |
(다) 작용점별 신약개발 현황
초기 약효검색시스템인 고속대량스크리닝(High-throughput screening, HTS)의 2004년도 작용점별로 수행된 건수는 Kinase, Ion channel과 GPCR(G-pro-tein coupled receptors) 세 개의 작용점 그룹이 전체 약효검색의 2/3를 차지한다. 이러한 추세는 2005년도에도 계속될 것으로 예상된다.
|
<그림 4-2-1-4> 작용점별 연간 수행된 HTS 건수 |
(라) 신약 연구개발 실패 원인
1991년에 40%에 해당되었던 약동력학적 원인에 의한 실패율은 약동력학 연구기술의 향상 및 초기단계부터의 적극적인 약동력학연구에 의해 2000년 10% 이하로 줄어들었다. 반면 2000년 가장 높은 실패 원인은 유효성의 확인에 의한 것인데, 복잡한 신호전달체계가 관여하는 질환 및 작용점의 경우 동물실험 단계에서 유효성이 입증되었더라고 하여도 인체 신호전달체계의 복잡성으로 인하여 그 효능이 사람에게 직접 적용되지 않는 경우가 많기 때문일 것으로 판단된다.
|
<그림 4-2-1-5> 신약개발 단계에서의 주요 실패 원인 (1991년-2000년) |
(3) 신약 개발 신기술 동향
(가) 조합화학: 합성 및 정제 기술을 반응매개체에 따라 고체 狀 합성법 (solid-phase synthesis)과 용액 狀 합성법(solution-phase synthesis)으로 분류할 수 있다.
|
<그림 4-2-1-6> 고체 狀 합성법의 대표적인 예 |
|
<그림 4-2-1-7> 용액 狀 합성법의 대표적 예 |
(나) Fragment-based 디자인: HTS에서 얻어진 유효물질(Hit)을 최적화하는 과정에서 분자량이 커지고 소수성이 증가함으로써 약물로 적절하지 못한 선도물질이 도출되는 사례가 많이 발생함에 따라 도입된 선도물질 도출 방법이다.
<그림 4-2-1-8> 유효물질의 최적화 및 Fragment-based library design
(출처 DDT 2005, p987)
(다) 약동력학 및 독성의 고속 검색: 분석기술의 발달로 고속으로 흡수/분포/대사/배설 및 독성을 검색하는 것이 가능해졌다.

<그림 4-2-1-9> 약동력학/독성의 고효율 검색
(출처: Curr. Opin. Chem. Biol. 2004, 339)
(4) 세계 의약품시장 현황
(가) 치료군별 시장현황
치료군 | 2004 매출($b) | 시장 점유율(%) | 전년 대비 성장률(%) |
콜레스테롤 저해제 | 30.2 | 5.8 | 11.7 |
항궤양제 | 25.5 | 4.9 | 1.4 |
세포증식 억제제 | 23.8 | 4.6 | 16.9 |
항우울제 | 20.3 | 3.9 | 1.3 |
정신병치료제 | 14.1 | 2.7 | 12.1 |
비스테로이드성 진통제 | 13.0 | 2.5 | 3.3 |
안지오텐신II 저해제 | 12.0 | 2.3 | 22.1 |
칼슘길하제 | 11.6 | 2.2 | 1.6 |
혈구, 호르몬생성 촉진제품 | 11.4 | 2.2 | 8.9 |
항경련제 | 11.3 | 2.2 | 17.7 |
<표 4-2-1-2> 2004년 상위 10대 치료군별 세계의약품 시장
출처: IMS health, IMS MIDAS, Dec 2004
심장순환기계 약물시장이 여전히 1위를 차지하였으며, 그 중 콜레스테롤 및 중성지방 저하제가 302억 달러(시장점유율 5.8%)로 매출순위 1위였고 안지오텐신 II 저해제(120억 달러), 칼슘 길항제(116억)의 순이었다. 2004년 세포증식억제제(항암제) 시장은 2003년 대비 16.9% 성장하여 성장률이 가장 높았다.
(나) 지역별 시장현황
2004년 미국(캐나다 포함) 의약품시장은 2,480억 달러로 전체시장의 47.8%를 점유하였고, EU가 1440억 달러로 27.8%의 시장 점유율을 나타내었다. 일본은 580억 달러, 11.1%의 시장점유율로 단일국가로는 미국 다음으로 2위였으며 일본을 제외한 아시아지역의 시장이 400억 달러(7.7%), 중남미 시장이 190억 달러(3.8%), EU를 제외한 유럽국가가 90억 달러(1.8%)의 시장을 형성하였다.
다. 신약 개발 국내 동향
(1) 국내 신약 허가 현황
1999년 대한민국 1호신약인 선플라의 발매 이래 2003년 말까지 모두 11개의 국내신약이 개발되었으며 이 중 LG 생명과학의 팩티브는 국내에서는 처음으로 2003년 미국 FDA의 승인을 받았다. 국내개발 신약들은 조인스정과 스티렌캅셀만이 2003년 각각 80억 원 및 62.5억 원의 매출을 올렸을 뿐 국내 제약시장에서의 판매액은 미미한 상태이다. 물론 시장자체의 규모가 작거나 효과가 다국적 기업의 경쟁품에 비해 많이 떨어지는 것도 원인이 되지만, 일본 제약회사의 성장의 배경에는 일본 자국신약에 대한 처방을 보조하는 정책적 배려가 있었다는 것을 참고하여야 할 것이다.
제품명 | 회사명 | 적응증 | 허가일자 | 유형 | 단계 |
선플라주 | (주)SK케미칼 | 위암 | 1999.07.14 | 백금착제 | 시판 |
콘드론 | (주)셀론텍 | 무릎연골세포재생 | 2001.01.30 | 생명공학 신약 | 시판 |
EGF외용액 | (주)대웅제약 | 당뇨성 족부궤양 | 2001.05.30 | 생명공학 신약 | 시판 (3상) |
조인스정 | (주)SK케미칼 | 관절염 | 2001.07.05 | 천연물 신약 | 시판 |
밀리칸주 | (주)동화약품 | 간암 | 2001.07.06 | 방사선 약품 | 시판 (3상) |
큐록신정 | (주)중외제약 | 요로감염증 | 2001.12.17 | 항균제 | 시판 |
스티렌캅셀 | (주)동아제약 | 위염 | 2002.06.12. | 천연물 신약 | 시판 |
팩티브정 | (주)LG생명과학 | 호흡기감염증 | 2002.12.27 | 항균제 | 시판 |
아피톡신주 | (주)구주제약 | 관절염 | 2003.05.03 | 천연물 신약 | 시판 |
슈도박신주 | (주)CJ | 녹농균 예방 | 2003.05.28 | 백신 | 시판 (3상) |
캄토벨주 | (주)종근당 | 난소암, 세포폐암 | 2003.10.06 | 캠포테신계 | 시판 (3상) |
<표 4-2-1-3> 국내 신약 허가 현황 (2003년 말 현재)
출처: 식품의약품안전청; 과학기술정책연구원 정책연구집 2004-12, p149
(2) 국내 신약 개발 현황
현재 전임상을 포함, 임상이 진행 중인 국산 신약은 모두 93개로 집계되었다. 한국신약개발연구조합이 2005년 1월을 기준으로 집계한 바에 따르면 임상 1상~3상 중인 신약은 20개 업체의 33개 품목이었다.
<표 4-2-1-4> 국내 주요 신약개발 현황(3상)
업체명 | 제품명 | 성분명/코드명 | 약효명 또는 용도 |
녹십자 | r-Factor VIII | Factor 8결핍 혈우병치료 | |
동아제약 | DA-8159 | 발기부전치료제(3상종료) | |
부광약품 | 레보비르 | Clevudine | 만성B형간염치료제 |
SK케미칼 | SK3530 | 발기부전치료제 | |
유유 | YY-280 | 허혈성뇌졸증예방 및 치료 | |
유한양행 | 레바넥스 | Revaprazan | 소화성궤양 치료제 |
일양약품 | IY-81149 | 항궤양제 |
출처: 한국 신약 개발 연구조합
<표 4-2-1-5> 국내 주요 신약개발 현황(2상)
업체명 | 제품명 | 성분명/코드명 | 약효명 또는 용도 |
녹십자 | 골다공증치료제 | 골밀도 형성촉진 | |
동아제약 | DA-6034 | 염증성 장질환 치료제 | |
동화약품 | DW167HC | 피부암치료제 | |
바이넥스 | DC-Vac/EP-L inj. | 폐암 세포치료제 | |
바이넥스 | DC-Vac/IR inj. | 대장암 세포치료제 | |
삼천당 | 천연물복합신약 | 간질환 예방 및 치료 | |
안국약품 | AG1321001 | 기침 및 천식치료제 | |
에스비씨 | 에스비주사 | 폐암/대장암 치료제 | |
SK | YKP509 | 간질 치료제 | |
SK | YKP10A | 우울증 치료제 | |
LG | LP80380 | B형 간염 치료제 | |
일양약품 | 이뮤난 | 면역항암제 베타 | 항암보조요법제,면역조절제 |
출처: 한국신약개발연구조합
라. 신약 개발 국내 전망
1980년대 후반 물질특허가 도입되면서부터 완제 의약품의 제조·판매가 중심이던 국내 제약업계의 신약 연구가 시작되었지만 작용점 측면에서 뿐 아니라 화학구조 측면에서도 특허를 회피하기 위한 모방연구가 주를 이루었다. 1990년대 후반부터 2000년대 들어오면서 국내 대형제약회사 및 정부출연연구소를 중심으로 첨단의 신기술 및 국제적 규격에 맞는 연구 시스템을 도입하여 신약 연구개발에 대한 노력은 하고 있으나, 시장규모가 10조 원 정도로 전 세계 의약품 시장의 1.5% 내외이며 Pfizer한 회사의 연구개발투자비(8조원) 정도인 제약산업의 규모와 더욱이 국내 제약회사의 평균 연구개발비 투자가 5% 미만인 현실을 고려할 때 세계적 신약의 개발이 어려운 것이 현실이다. 그러나 열악한 환경에서도 해외 기술 라인센싱 사례들이 도출되고 있으며 미국 FDA의 승인을 획득한 신약이 개발되는 등 연구결과들은 우수하다고 볼 수 있다. 제약산업을 21세기의 주요 산업으로 정착시키고 대한민국의 성장동력으로 발전시키기 위해서는 성공확률은 낮지만 고급인적자원이 풍부한 우리의 잠재력을 고려할 때 연구/개발 중심의 산업이며 고부가가치산업인 신약개발에 지속적인 투자가 필요하다.
한편 한정된 국내 연구재원의 효율적 활용을 위하여 산·학·연에 분포되어있는 연구진의 적절한 역할분담이 요구되며 이들의 협동을 통한 연구효율성의 극대화가 필요하다. 또한 국가는 제한된 연구역량과 연구투자에도 불구하고 최고의 연구생산성을 이룰 수 있도록 합리적인 연구개발 정책을 실시하여야 할 것이다.
![]() 바이오신약
바이오신약
가. 바이오신약 개요
생명공학산업의 유래는 1980년대 초반으로 거슬러 올라간다. 당뇨병치료에 유용하게 사용되는 인슐린은 소 또는 돼지의 췌장에서, 성장호르몬은 인간의 뇌하수체에서, 혈우병에 사용되는 혈액제제는 인간의 혈장에서 각각 추출하여 사용하였다. 이렇게 추출 정제된 단백질들은 양적 제한 뿐만 아니라, 질적으로도 많은 문제를 갖고 있었다. 실제로 인간의 뇌하수체에서 추출 사용된 인간성장호르몬은 1985년에 시장에서 철수되었으며, 혈액제제를 투여 받은 대다수의 사람들은 HIV나 HCV (Hepatitis C virus)와 같은 치명적인 바이러스에 감염된 사태가 일어났으며 또한 아직 발견되지 않은 바이러스들에 대한 감염가능성을 배제할 수 없는 게 현실이었다.
1980년대 초 유전자 조작기술과 같은 분자생물학 및 유전자 공학 기술들의 도입으로 유용한 인간의 생리활성 단백질들이 대장균, 효모 및 동물 세포주 등에서 대량으로 생산이 가능하게 되었으며, 또한 치료용 단백질들의 기존 문제점들을 해결할 수 있게 되었으며, 이들 기술들을 이용한 생명공학 기업들이 미국을 중심으로 형성되면서 생명공학산업이 시작되었다.
인슐린, 인간성장호르몬, EPO, 인터페론 등의 유용한 인간 단백질들을 대장균, 효모 및 동물 세포 등에서 대량 생산하는 것이 가능하면서, 재조합 치료용 단백질들은 과거 20년 이상 생명공학사업의 근간이 되어 왔다. 그 결과 2004년도에 약 260억 불의 거대한 시장을 형성하고 있으며, 2010년도에 530억불로 꾸준하게 성장할 것으로 예측된다.
바이오의약은 유전자 재조합에 의해 제조된 인체의 유용한 생리활성 재조합 단백질 이외에도, 1997년부터 본격적으로 신약의 대열에 들어선 치료용 항체들 또한 거대한 시장을 형성하고 있다. 단백질 의약품 시장에서의 새로운 돌파구로서 항체시대를 열었음을 의미한다.
항체 시장은 2004년도에 100억 불의 전 세계적 판매를 기록하였고, 2010년에는 현재 시장 크기의 3배인 300억 불로 성장할 것으로 예측된다. 최근의 첨단 항체 기술들의 개발은 성숙기에 들어선 재조합 단백질 시장을 다시 재도약 시킬 것으로 판단된다. 재조합 단백질과 치료용 항체 두 시장의 합이 2010년도에 약 830억 불의 거대한 시장으로 성장될 것으로 예상된다.
재조합 단백질과 치료용 항체 이외에도 치료용 백신 및 유전자 치료제들은 새로운 개념의 바이오의약으로서 활발히 연구되고 있다. 이들은 비록 아직 세계적인 신약 허가를 받지는 못했지만 향후 커다란 잠재력을 갖고 있는 분야로 예의 주시해야 할 분야이다.
유전자치료는 지난 1990년 미국에서 처음 시작한 이래 전 세계에서 3,500여 건, 일본에서 10여 건이 실시되었으며, 유전자 지도가 완성되고 각종 유전자의 기능이 밝혀지면서 유전자치료 산업은 더욱 활성화될 것이며 미래 의학의 핵심요소로 예상하고 있으나 여러 가지 기술적인 난관이 해결되어야 할 것이다.
생명공학산업을 미래의 전략산업으로 육성하기 위한 국가간의 경쟁은 매우 치열하다. 특히 선진 국가들은 포스트 게놈연구를 통한 바이오 신약개발에 주력을 하고 있다. 이미 완성된 인간게놈프로젝트의 혜택을 가장 많이 받을 분야가 바로 의약산업으로 향후 지식경제사회 및 고령화 사회에서 가장 큰 경제적 가치를 창출할 수 있는 분야이다.
바이오신약 개발 역사를 지난 1980년대 초반부터 기술 발전 추세를 태동기, 확장기 및 혁신기로 구분하여 정리하면 <표 4-2-2-1>과 같다.
단계별 | 기간 | 주요 제품 및 특징 |
태동기 | 1982~ 1991 | 5개의 초대형급 재조합 단백질들이 FDA허가를 받았다. 두개의 인슐린 (Lilly’s Humulin과 Novo’s Novolin), Intron-A (Schering- Plough’s 인터페론 알파), Epogen (Amgen’s erythropoietin) 및 Neupogen (Amgen’s colony-stimulating factor) |
확장기 | 1992~ 2001 | 다양한 적응증에 다양한 계열의 단백질 의약품이 선보인 시기. 희귀 유전병 치료를 위한 효소 단백질 의약 (Cerezyme, Replagal, Fabrazyme, Aldurazyme), Fc fusion protein inhibitor (FPI) (Enbrel, Kineret, Natrecor, Xigris, Amevive) 및 항체의약(Retuxan, Herceptin, Remicade 등) 등이 있다. |
혁신기 | 2002년 부터 | - 재조합 단백질분야는 성숙기에 진입. 주요 대형 제품의 특허가 만료 - 이들 특허 만료제품의 슈퍼바이오제네릭 등장하여 시장 재편 및 적응증확대로 시장 창출(예, 인터페론 알파: C형 간염, 인터페론 베타: 다발성경화증) - 혁신적인 인간화 및 인간항체제조기술의 보편화로 항체 개발 프로그램의 폭발적인 증가 - Remicade 및 Retuxan 등의 예상외의 성공으로, 초대형 품목으로의 성장하며, 항체의 위상 정립. 바이오회사이외에도 대형 제약사도 항체분야에 진입. - 인간지놈프로젝트의 완성, 유전체 및 프로테옴분야의 혁신적인 기술 개발 - 유전자 치료제 및 세포 치료제의 실용화를 위한 기술 개발 등 |
<표 4-2-2-1> 바이오신약의 단계별 주요 제품 및 특징
나. 해외동향
(1) 재조합 단백질 개발 동향
전체 재조합 단백질(항체 제외)들을 계열별로 분류하면 다음과 같이 11개로 나눌 수 있으며 이들 재조합 단백질은 2004년 현재 11개 계열로 구분되며, 현재 판매되고 있는 제품 및 판매액은 <표 4-2-2-2>와 같다. 총 81개 제품에 약 360억 불의 시장을 갖고 있으며, 현재 전임상이후의 개발과제 수는 107개에 이른다.
<표 4-2-2-2> 재조합 단백질 제품 및 개발 중인 파이프라인 수
계열 이름 | 계열 이름 (약자) | 2004년 제품수 | 개발 중인 파이프라인 수 |
Erythropoietins | EPO | 6 | 4 |
Interferons | IFN | 11 | 15 |
Insulins | INS | 10 | 9 |
Colony Stimulating Factors | CSF | 8 | 1 |
Fusion Protien Inhibitors | FPI | 4 | 7 |
Blood Factors | BF | 6 | 5 |
Hormonal Therapy | HT | 13 | 14 |
Enzymes | ENZ | 7 | 8 |
Interleukins | IL | 6 | 15 |
Growth Factors | GF | 6 | 22 |
Plasminogen Activators | PA | 4 | 7 |
합계 | 81 | 107 |
재조합 단백질 치료제 전체 시장은 2001년 217억 불에서 2002년 263억 불, 2003년 264억 불, 그리고 2004년 316억 불로 연성장률은 각각 21.4%, 20%, 증가하였고, 2004년 13.1%의 증가율을 나타내었다. 전체 치료용 재조합 단백질 11개 계열을 이들 계열별 시장현황 및 계열 내 품목의 점유율은 <표 4-2-2-3>과 같다.
가장 연구 개발이 활발한 분야는 GF(growth factor)로 총 22개의 프로그램을 차지하고 있으며, 그 다음은 IL(인터루킨)과 IFN(인터페론)이 각각 15개, HT가 14개로 나타났다.
거대한 시장을 갖고 있는 EPO계열과 IFN계열은 긴 단백질 반감기를 갖는 제품개발 경쟁이 계속될 것이다. 이러한 제품개발의 주역은 단백질 안정화 기술로, 단백질의 당화 및 PEG 부착 기술, HSA(Human serum albumin), Fc 등을 이용한 단백질 퓨전 기술 등이 있다.
스타 바이오텍(Emerging Biotech) 회사들은 주로 틈새시장을 공략하며, 주 공략 대상은 생명을 위협하는 질환으로 주로 GF들을 개발하고 있다. 이러한 GF의 예는 FGF(Fibroblast grwoth factor), GGF2(Glial growth factor), NRG2 (Neu-re-gulin)를 들 수 있다.
<표 4-2-2-3> 재조합 단백질 치료제 계열별 시장 및 점유율
계열 | 2001년 | 2002년 | 2003년 | 2004년 | ||||
판매량 | 점유율 | 판매량 | 점유율 | 판매량 | 점유율 | 판매량 | 점유율 | |
EPO | 6,211 | 28.6 | 7,868 | 29.8 | 9,465 | 29.9 | 10,339 | 28.9 |
BF | 1,916 | 8.8 | 2,376 | 9.0 | 2,692 | 8.5 | 3,076 | 8.6 |
PA | 217 | 1.0 | 202 | 0.8 | 202 | 0.6 | 207 | 0.6 |
GF | 111 | 0.5 | 144 | 0.5 | 161 | 0.5 | 174 | 0.5 |
INS | 3,868 | 17.8 | 4,315 | 16.4 | 4,895 | 15.5 | 5,453 | 15.2 |
HT | 2,047 | 9.4 | 2,185 | 8.3 | 2,435 | 7.7 | 2,562 | 7.2 |
CSF | 1,659 | 7.6 | 2,137 | 8.1 | 3,033 | 9.6 | 3,565 | 10.0 |
IFN | 3,773 | 17.4 | 5,279 | 20.0 | 5,327 | 16.8 | 5,909 | 16.5 |
FPI | 927 | 4.3 | 701 | 2.7 | 1,890 | 6.0 | 2,686 | 7.5 |
IL | 236 | 1.1 | 294 | 1.1 | 398 | 1.3 | 472 | 1.3 |
ENZ | 767 | 3.5 | 880 | 3.3 | 1,131 | 3.6 | 1,341 | 3.7 |
합 | 21,732 | 100.0 | 26,381 | 100.0 | 31,629 | 100.0 | 35,784 | 100.0 |
성장률 (%) | 21.4 | 19.9 | 13.1 | |||||
한편 IFN계열은 주 질환 타깃을 간염(알파 인터페론) 및 다발성경화증 (베타 인터페론)으로 약물 전달 방법 및 약효 지속성 제품이 활발히 연구될 것이다.
항암 치료제를 위한 신규 IL계열의 개발은 IL-12, IL-7 및 IL-21 등이 될 것이다.
반면 수용성 단백질 리셉터(soluble protein receptor)에 대한 관심이 지속적으로 증대될 것이다. 또한 가장 성공적인 단백질의약품 중 하나인 Enbrel(관절염 치료제)에 고무되어 FPI계열(항체 FC fusion)도 지속적으로 개발될 것으로 기대되며 주 타깃은 면역질환이 될 것이다.
2004년 현재 단백질 치료제 질환별 파이프라인은 항암 분야와 인슐린을 대표하는 당뇨분야가 가장 활발한 개발 프로그램을 갖고 있다. 2004년부터 2008년까지 5년간 승인이 될 것으로 예상되는 단백질 치료제 제품은 약 28개 품목으로 이중 암질환과 당뇨 및 내분비 분야가 주요 질환분야가 될 것이다.
2004년부터 2008년까지 5년간 개발 파이프라인에 있는 프로그램 중 승인이 될 것으로 예상되는 단백질 치료제 제품은 약 28개 품목으로 이중 판매액 기준으로의 기여도는 INS, GF, ENZ, EPO, HT, IL, FPI순이다.
(2) 치료용 항체 개발 동향
항체시장은 전체 제약 산업에서 가장 빠르게 성장하며 가장 매력적인 시장 중에 하나이다. 1997년부터 본격적으로 승인을 받기 시작한 치료용 항체 시장은 2004년 현재 19개의 제품이 출시되었으며, 향후 성장 잠재력은 무한한 시장이다. 2003년과 2004년 사이에 약 50% 정도의 성장률을 보여주고 있으며, 2004년 치료용 항체의 판매액은 104억 불에 도달하였다. 시장은 향후 6년간 빠른 성장률을 보여주며 이 기간 동안 평균 성장률은 약 20%를 보여주어, 2010년에 현 시장의 3배인 300억 불 이상으로 커질 것으로 예측된다.
항체의 주요 시장은 6개의 질환 분야로 볼 수 있으나, 2004년 기준으로 종양계와 면역계 시장이 각각 47.1%, 36.9%의 점유율을 갖고 있으며, 이 두 분야가 84%의 점유율을 갖고 있다. 이는 주로 항체가 암 및 면역질환과 같은 난치성질환에 집중적으로 개발되고 있음을 의미한다. 향후에는 여러 분야로 적응증을 확대될 수 있는 잠재력이 있다.
2005년 4월까지 상품화된 항체 및 주요 기업의 선별된 연구개발 단계별 항체 프로그램수는 총 327개이며, 가장 많은 분야는 암으로 186건이 보고되었고, 면역질환분야는 77개, 감염질환으로 31개, 면역의 일종인 천식을 포함한 호흡기 질환이 16개를 차지하고 있다. 암과 면역질환이 대부분을 포함하고 있다.
<그림 4-2-2-1> 질환별 개발 프로그램 수(총 327개)
(3) 유전자 치료제 개발 동향
유전자 치료제는 암, 심혈관 질환, 선천성 유전병 등 대부분의 난치성 질환의 근본적인 치료법으로 주목을 받고 있다. 일반적으로 유전자 치료제는 환자의 조직 안으로 직접 유전자를 운반하는 것이 어렵기 때문에 유전자 전달체라는 것이 사용되며, 안전하고 효과적인 유전자 전달체를 개발하는 것이 유전자 치료제 개발의 핵심이다.
1990년 최초의 유전자 치료제 임상시험이 시작된 이래 현재까지 1,020건 이상의 임상시험이 승인을 받아 진행되고 있다. 그 중 66% 이상이 항암 치료제로 개발되고 있으며, 다음으로 유전질환, 혈관질환, 감염성질환에 대한 치료제가 개발되고 있다. 현재 세계적으로 200여 개 이상의 회사에서 개발하고 있는 유전자 치료제 중 임상시험의 마지막 단계에 진입한 건이 약 30건으로 조만간 물밀듯이 출시될 것으로 보인다.
유전자 치료제 시장은 아직 형성되었다고 할 수 없으나, 향후 2~3년 내 약 10~50억 불 규모로 형성될 것으로 전망되며 2008년까지 167억 불, 2013년에는 416억 불의 시장을 형성할 것으로 예상된다. 2010년 이후에는 유전자치료법이 21세기 의약품 시장을 주도할 것으로 예상되고 있으며, 가장 효과적인 유전자 치료제 개발이 예상되는 암 및 심혈관 관련 유전자치료제 시장은 연평균 약 20% 이상의 고성장이 예상된다.
다. 국내동향
국내에서 생명공학산업의 시작은 1980년대 초반에 시작되었으며, 이 시기는 세계적으로도 생명공학산업의 시작이기도 하다. 위에서 언급했듯이 초기 10년간은 바이오의약이 소수이며, 이들 또한 원천 특허에 의해서 글로벌 시장으로의 진출은 매우 제한되어 있었다.
따라서 국내 제약사들은 그 돌파구를 국내시장을 목표로 바이오제품을 개발하기 시작하였으며, 단백질의약품 생산을 위한 발효, 정제, 단백질 분석 기술들을 축적하였다.
본격적인 단백질 치료제, 특히 최근에 세계적으로 많은 투자가 이루어지고 있는 단일클론항체 치료제 분야의 연구개발은 아직까지 미국이나 유럽 등의 선진국에 비해 많이 뒤떨어져 있는 실정이다. 이러한 기술적인 열세는 제약산업의 영세화 및 초기 단백질의약품 시장의 원천특허 부재에 의한 세계적 상품 개발 한계에서 온 연구개발의 소극성 등에 기인한다고 볼 수 있다.
전 세계적으로 단백질의약품 시장의 최근 경향은 소수의 품목에서 다양한 형태의 다수 품목으로의 확대되는 경향이 있으며, FPI나 항체는 실제로 다양한 질환을 타깃으로 개발될 수 있으며, 혁신적인 아이디어에 의하여 바이오신약의 개발 기회가 그만큼 많아졌음을 의미한다. 이러한 추세에 맞추어 국내에서도 생명공학산업의 중요성이 부각되면서 민간기업 뿐 아니라 정부의 연구개발비도 높은 증가폭을 보이고 있다.
2006년까지 6개의 바이오제네릭을 글로벌 상품으로의 개발을 목표로 하는 LG 생명과학은 자체적 R&D 능력과 생산 설비를 갖춘 세계적 주요 바이오제네릭 회사 대열에 합류하였다. 효모에서 생산되는 인간성장호르몬의 국내 출시와 동물성장호르몬의 경우 생산과정에서 고품질과 높은 경쟁력을 확보하였다. 지난 2001년에 Sr-hGH의 임상 1상 결과를 토대로 스위스 바이오파트너와 공동개발 계약을 체결하였고 현재 미FDA 허가를 위한 임상 2상 시험이 진행 중에 있으며 곧 신약 허가를 신청하여 2005년 하반기부터 전 세계 시장에 판매할 예정이다. 최근에 Sr-hGH에 관한 조성물 및 제형기술에 대해 영국과 독일을 포함한 유럽 22개국으로부터 특허를 등록받았다. 히알우론산을 이용한 Sr-hGH의 제형기술은 인체 내에서 일정 기간 약효를 지속시킬 수 있기 때문에 매일 1회 투여해야 하는 기존 제제와는 달리 1주일에 1회 투여가 가능하다. 최근에 바이오의약품의 시장판도에 제형의 구성을 변화시켜 투약의 편리성이나 효율성을 증가시키는 제품을 개발하는 기술적 변화가 시도되고 있는데 이러한 기술적 동향에 발맞추어 hGH의 차세대 제형기술을 개발하여 특허를 취득한 것은 국내 바이오의약품 생산기술의 한 단계 발전된 모습을 보여주는 실례이다. 특히 이러한 제형기술은 알파인터페론과 같은 대형 바이오의약품에 활용될 수도 있기 때문에 특허기간이 만료된 이후 예상되는 바이오 제네릭 간 시장점유 경쟁에서 강력한 경쟁력을 확보한 셈이 된다.
녹십자는 그동안 재조합 효모 및 대장균의 고농도 배양 기술, 그리고 단백질 정제에 관한 풍부한 기반기술을 바탕으로 재조합 간염백신, 인터페론-알파 및 G-CSF, 인간성장호르몬을 성공적으로 산업화하였고, 이들 의약용 단백질의 전임상/임상을 위한 생산공정확립, 제제화 등에 참여했다. 유전자 재조합 Factor VIII이 혈우병 치료제로 전임상시험을 완료했다. 또한 녹십자는 B형 간염 치료용 인간화 항체를 개발하여 현재 전임상실험을 수행중이며 혈우병 치료제로 개발되고 있는 재조합 Factor VIII의 경우 현재 임상 3상이 진행 중에 있다.
대웅제약의 경우 당뇨병성 족부 궤양 치료제로 이지에프를 개발하여 현재 판매하고 있다. 지난 1991년에 연구에 착수하여 10년간 80억 원 이상의 연구개발비를 투입해 2001년에 의약품화에 성공하였다. 이지에프는 당뇨성 족부 궤양 이외에도 화상, 욕창, 성형 수술 등 다양한 용도로도 사용이 기대되고 있는데 2004년 12월에는 요르단으로부터 품목허가를 취득하여 이라크, 시리아, 수단, 알제리 등 대부분의 중동 국가에서 허가 취득이 가능해졌으며 2006년까지 중동 전 지역에서 허가 취득이 완료될 것으로 기대되고 있다. 대웅제약은 이번 중동 수출 외에도 중국 및 동남아시아 수출을 적극적으로 추진 중에 있어 본격적인 아시아 시장진출이 기대되고 있다.
매년 10% 수준의 성장을 지속하여 2005년에는 시장규모가 300억 원을 훨씬 상회할 것으로 예상되고 있는 빈혈치료제 시장은 CJ의 에포카인과 중외제약의 리코몬(로슈 제품)이 치열한 경쟁을 벌이고 있다. 1998년에 발매되어 현재 국내 시장의 절반 정도를 점유하고 있는 CJ의 에포카인은 가격 경쟁력과 국내 기술로 제조한 제품이란 점을 이용해 에포카인보다 4년 먼저인 1994년 발매된 중외제약의 리코몬보다 비교 우위를 누리고 있다. 하지만 현재 중외제약 제품과 특허 분쟁이 진행 중이고 최근에 Amgen사의 2세대 EPO 인 아라네스프가 제일기린을 통해 시장 경쟁에 참여하고 있어 지속적인 시장우위를 앞으로도 낙관할 수만은 없는 실정이다.
이 밖에도 이수화학을 비롯해 녹십자, 생명공학 연구원 창업 벤처인 에이프로젠 등에서 치료용 항체의 연구개발이 활발하게 시작되고 있다. 이수화학의 경우 산하 생명공학 사업본부에서 2000년도부터 항체 중심 신약 개발 사업을 진행해 왔는데, 2001년 이수그룹과 연세의료원의 제휴로 설립된 페타젠으로 이관하였고, 최근에는 이수 앱시스(ISU ABXIS)로 명칭을 바꾸어 항체의약 및 진단 사업을 강화하고 있다.
벤처기업 중에는 생명공학 연구원 창업 벤처인 에이프로젠에서 치료용 항체를 개발하고 있다. 에이프로젠은 B형 간염 치료용 인간화 항체와 대장암 치료용 항체를 개발했으며, 현재 이를 대량 생산하기 위한 세포주를 개발 중이다. 이와 같이 일부 대기업과 벤처기업에서 본격적으로 단백질 치료제 특히 단클론 항체치료제 분야의 연구를 시작하였지만 아직까지는 선진국에 비교하면 극히 초기 단계이고 무엇보다도 가장 중요한 플랫폼 테크놀로지를 갖춘 회사가 없다는 점이 큰 약점으로 지적되고 있다. 또한 국내에는 cGMP 기준을 충족시킬 단백질 생산공장이 전무한 실정이다. 하지만 최근에 미국 Genentech 사의 자회사인 Vaxgen 사가 한국의 넥솔 아이오텍 및 담배인삼공사와 합작으로 셀트리온사를 설립하여 인천 송도에 cGMP 기준에 적합한 단백질 생산공장을 설립하고 있어 추이가 기대되고 있다.
현재 우리나라의 유전자치료제 개발 수준은, 유전자치료제 기반기술인 벡터개발의 경우 선진국과 차이가 없으나, 유전자치료제의 대량생산·안전성 검사·임상시험 및 관리 등은 선진국 대비 약 3~4년 정도의 격차를 가지는 것으로 평가된다.
국내에서의 유전자 전달체 관련 기술이 세계적인 수준에 이르렀으며, 이를 바탕으로 임상 단계에 진입한 기업이 존재한다. 최근 치료 유전자 발굴 성과도 잇따르고 있어, 명실상부하게 세계적인 경쟁력을 확보한 유전자 치료제가 개발될 가능성이 차츰 확대되고 있다.
2001년 (주)바이로메드가 개발한 허혈성 족부궤양 유전자 치료제가 국내 최초로 임상시험 승인을 받았으며, 동아제약 주관으로 삼성서울병원에서 진행된 동 임상시험은 현재 1상을 마치고 연세대 세브란스 병원까지 포함하여 2상 임상에 진입하였다.
세계적으로 아직은 상용화 초기 단계이기 때문에 우리도 충분한 국제 경쟁력을 가질 수 있으며, 특히 우리나라는 산업자원부 등에서 유전자 치료제의 기반기술 및 응용기술에 대한 연구개발 투자를 수년 전부터 진행해오고 있어 국제 경쟁력 확보에 커다란 도움이 되고 있다.
라. 발전 전망
(1) 재조합 단백질 발전 전망
재조합 단백질 시장은 2004년 358억 불에서 2010년 530억 불로 성장할 것으로 예측된다. 반면 성장률은 2004년 13%에서 2010년 5.3%로 점차 포화된다. 이러한 성장률은 현재의 기술을 반영한 것으로 향후 신기술개발 및 신규 질환 타깃이 개발될 경우 시장성장률은 변화될 수 있다.
<표 4-2-2-4> 계열별 중분류별 2004~2010년까지의 재조합 단백질(항체 제외) 성장 예측
*2015년의 예측시장은 각 대분류별 산출하였으며, 대분류별 총 시장에 평균 성장률을 적용하였다.
대분류 | 중분류 | 계열 | 2,004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 평균 성장률 |
순환기계 | 혈액인자 | EPO | 10,339 | 11,037 | 11,359 | 11,661 | 11,530 | 11,355 | 11,380 | |
BF | 3,076 | 3,401 | 3,667 | 3,906 | 4,090 | 4,270 | 4,453 | |||
PA | 207 | 205 | 222 | 232 | 261 | 297 | 353 | |||
GF | 174 | 273 | 349 | 534 | 677 | 809 | 934 | |||
합 | 13,796 | 14,916 | 15,597 | 16,333 | 16,558 | 16,731 | 17,120 | |||
성장률 | 8.1 | 4.6 | 4.7 | 1.4 | 1.0 | 2.3 | 3.7 | |||
내분비계 | 당뇨 | INS | 5,453 | 5,670 | 5,725 | 5,833 | 6,041 | 6,500 | 7,152 | |
호르몬류 | HT | 2,562 | 2,772 | 2,967 | 3,189 | 3,437 | 3,623 | 3,906 | ||
합 | 8,015 | 8,442 | 8,692 | 9,022 | 9,478 | 10,123 | 11,058 | |||
성장률 | 5.3 | 3.0 | 3.8 | 5.1 | 6.8 | 9.2 | 5.5 | |||
종양계 | 암/면역조절 | CSF | 3,565 | 4,143 | 4,281 | 4,443 | 4,555 | 4,678 | 4,778 | |
IFN | 5,909 | 6,862 | 7,777 | 8,510 | 9,102 | 9,579 | 10,022 | |||
합 | 9,474 | 11,005 | 12,058 | 12,953 | 13,657 | 14,257 | 14,800 | |||
성장률 | 16.2 | 9.6 | 7.4 | 5.4 | 4.4 | 3.8 | 7.8 | |||
면역계 | 자가면역 | FPI | 2,686 | 3,474 | 4,116 | 4,621 | 5,087 | 5,588 | 6,139 | |
면역조절 | IL | 472 | 566 | 654 | 824 | 929 | 1,063 | 1,164 | ||
합 | 3,158 | 4,040 | 4,770 | 5,445 | 6,016 | 6,651 | 7,303 | |||
성장률 | 27.9 | 18.1 | 14.2 | 10.5 | 10.6 | 9.8 | 15.2 | |||
유전질환계 | 효소 | ENZ | 1,341 | 1,639 | 1,911 | 2,245 | 2,401 | 2,563 | 2,707 | |
성장률 | 22.2 | 16.6 | 17.5 | 6.9 | 6.7 | 5.6 | 12.6 | |||
총합 | 35,784 | 40,042 | 43,028 | 45,998 | 48,110 | 50,325 | 52,988 | |||
성장률 | 11.9 | 7.5 | 6.9 | 4.6 | 4.6 | 5.3 | 6.8 |
대분류별 재조합 단백질 시장현황 분석: 종양계, 면역계, 유전질환 분야에서 각각 7.8%, 15.2%, 12.6%로 괄목할 성장세를 보이며, 반면 순환기계(혈액인자) 및 내분비계(당뇨 및 호르몬류)는 포화상태를 나타낸다. 면역계에서의 연 15.2%의 성장은 주로 FPI계열에서 자가면역질환에서의 성장률에 기인된다.
계열별 2010년 성장률을 비교하면, EPO, BF, INS, HT 및 CSF계열은 성장크기가 2004년 대비 1.5배 이하로 시장이 포화상태를 이루는 반면, ENZ, IL, FPI, GF 및 PA는 1.7배 이상의 성장을 할 것으로 예상된다. 이 중 시장의 크기와 성장률을 동시에 생각할 경우 ENZ, IFN 및 FPI계열의 성장이 괄목된다.
(2) 치료용 항체 발전 전망
치료용 항체 시장은 2003년 70억 불에서 2004년 104억 불로 약 50%의 경이적인 성장률을 보여주고 있으며, 2010년 300억 불로 성장할 것으로 예측된다. 2015년까지 연평균 성장률을 적용할 경우 약 740억 불로 성장할 것으로 예측된다. 이중 항암 및 면역질환에서는 연 평균 20%의 성장률을 지속적으로 보여주고 있다. 이러한 경향은 현재의 질환 중에서 난치병과 같은 수요가 채워지지 않은 분야에서 항체가 각광을 받고 있음을 보여준다. 2004년 전 세계적으로 매출을 보여주는 제품이 25개에서 2010년에는 약 65개로 다양한 제품이 허가를 받을 것으로 예측된다.
질환별 향후성장률을 보면, 종양계와 면역계에서 가파른 성장과 함께 이 두 시장의 합이 항체 전체시장 약 300억 불의 90%에 해당하는 약 270억 불에 달할 것으로 예상된다.
전 세계적으로 치료용 항체 시장은 당분간 지속적인 가파른 성장을 계속
할 것으로 기대되며, 향후에 가장 각광을 받게 될 기술은 완전인간항제 제조기술이다.
세계 100대 회사들에서 선별된 291개의 항체 개발 프로그램을 기술별(Mu-rine, Chimeric, Humanized, Fully human, Fragment, Payload 등)로 분석하면 미래의 기술 추세는 완전인간항체 기술임을 알 수 있다. 완전인간항체의 개발 프로그램은 전임상, 임상 1 및 2상이 주축을 이루고 있다. 또한 항체 절현 및 항체 페이로드기술도 초기 개발단계에 진입되어 있다.
(3) 유전자 치료제 발전 전망
Frost & Sullivan에 의하면 2004년 최초로 시판될 유전자 치료제 시장은 2008년경 미국에서만 5조 원 이상이 될 것으로 예상되며, 세계 시장을 미국 시장의 약 2배라고 보았을 때 세계 시장은 약 10조 원이 될 것으로 예측된다. 최초의 항암 치료제가 시판되는 이후에는 심혈관질환 치료제와 유전질환 치료제가 개발 완료될 것으로 보이며, 향후 감염성 질환과 자가면역질환에까지 그 대상 질환을 확장시켜 나갈 것으로 예상된다.
![]() 바이오장기
바이오장기
가. 바이오장기의 개요
(1) 바이오장기의 정의
바이오장기 이식은 동물의 세포, 조직 및 장기를 사람에게 이식하여 체내에 안착시킴으로써, 환자의 기능부전 장기의 기능을 대체하고자하는 치료법이다.
(2) 바이오장기 이식의 필요성
평균 수명의 연장으로 말기 장기부전 환자들이 급증하고 있으며, 장기 이식 수술은 이들 환자들에게 유일한 치료법이지만, 타인으로부터 공급되는 장기의 절대수가 부족한 상황이다.
(가) 장기 수요·공급 현황
국내외적으로 장기이식 수요는 급증하는데 비해 공급은 제한되어 이식대기자 수가 지속적으로 증가되고 있으며<그림 4-2-3-1>, 2003년 뇌사자 이식이 활성화 되어 있는 미국의 경우에도 장기 제공률의 증가가 1.3%에 불과하다. 국내 장기 이식률은 신장 및 심장이 대기자의 약 20%, 간이 약 40%에 불과하여 많은 환자들이 이식 대기 중에 사망하는 실정이다<그림 4-2-3-2>. 특히 국내에서는 성인병의 증가, 사회의 고령화, 유교 문화, 핵가족의 영향으로 국외보다 이식장기 수요 공급의 불균형 현상이 심각하다. 이러한 결과로 불법 장기 매매가 성행하고 있으며, 최근에는 국내보다 낮은 의료기술 수준의 외국에서 장기이식을 받는 사례가 증가되어 외교적, 법률적 문제로 비화되고 있다.
|
<그림 4-2-3-1> 미국내 장기 이식 수요 공급 현황 (UNOS 2002) |
|
<그림 4-2-3-2> 국내 장기 이식 수요 공급 현황 (KONOS 2003) |
(나) 형질전환 동물을 이용한 장기복제 기술의 필요성
장기 부전 환자를 위한 대체 장기 확보방법으로 줄기세포 응용, 생체조직 공학 응용, 이종 복제 장기 등이 있다. 줄기세포를 이용하는 방법은 세포 치료에 도움이 될 것으로 기대되나, 아직 장기별 분화에 대한 이론적 토대가 마련이 되어 있지 않아 상용화까지는 많은 시간을 기다려야 하는 상황이다. 자가 혹은 타인의 세포가 조직공학적 방법으로 연골, 뼈, 피부 제작에 응용되고 있으나, 이런 방법만으로는 여러 종류의 세포가 구조를 형성하여 기능을 하는 장기를 제작하는데는 많은 어려움이 있다. 이종장기 복제 방법은 생명에 직접 관여되는 대체 가능한 장기를 제공할 수 있으며, 충분한 수의 분화된 면역관용 세포를 공급할 수 있어 줄기세포 및 조직공학 발전에 상승효과를 기대할 수 있다<그림 4-2-3-3>.
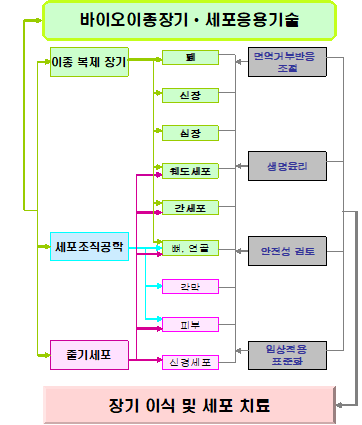
<그림 4-2-3-3> 세포 및 장기 대체 기술 사이의 상호 관계
(3) 이종장기 공급원
영장류는 번식이 잘 안되고, O형 혈액형이 거의 없으며, 사람에게 치명적인 바이러스를 보유할 위험이 있고, 희귀동물이어서 이종장기 제공 대상에서 제외되었다. 영장류 이외에 토끼, 양 등의 장기를 이용하려는 시도가 있었으나, 아래의 장점 때문에 복제된 돼지의 장기가 가장 활발히 이용되고 있다. 우선 돼지는 인간과 비슷한 크기의 장기를 지니고 있으며 생리적 특성에서도 유사점이 많다. 또한 돼지는 다산성으로 연간 어미 1두가 20마리 이상의 새끼돼지를 생산할 수 있어 이식용 장기의 대량공급이 가능하다. 유전공학 기법으로 형질이 전환된 복제 돼지의 대량 생산이 가능하여 장기 공급 물량에 제한을 받지 않는다. 따라서 재이식은 물론 고령층 등 순위도에서 밀려있던 환자층에도 공급의 제한이 없어질 것으로 예상된다. 이식대기 시간 없이 즉시 수술이 가능하며, 뇌사자 이식과는 달리 미리 준비, 계획된 이식 수술을 받을 수 있다. 또한 환자에 이식 적합한 장기를 미리 준비할 수 있다. 간염이나 AIDS 바이러스와 같은 인체에 치명적인 감염원 회피가 가능할 것으로 예상되어 인간에게 유해한 특정병원균이 제거된 무균돼지의 사육기술이 확립되어 장기이식 시 발생할 수 있는 병원균의 전이를 극복할 수도 있을 것으로 예상된다. 그러나 복제된 돼지의 장기를 이용한 이식의 문제점으로 지적되는 초급성, 급성, 세포매개성 거부반응의 극복이 필요하다.
나. 바이오장기의 해외 동향
(1) 바이오장기 산업 출현 및 발전
30년 전부터 이루어진 연구 활동에 이어 국외에서는 10년 전부터 바이오 이종장기 생산 전문 기업들이 활성화되었다. Imutran사는 1992년 세계 최초의 hDAF 형질전환 돼지인 ‘Astrid’ 생산에 성공하였다. NexTran사는 형질전환 돼지 심장을 생산하였고, 1995년 형질전환 돼지 간 이식 임상시험이 FDA의 허가를 받았다. Alexion사는 척수 손상 환자에게 돼지 신경세포를 이식하였다. PPL-Therapeutics사는 1997년 복제양 ‘Dolly’를 만든 Roslin 연구소의 복제 기술을 상업화하여 2000년에 세계 최초로 형질전환 돼지의 복제에 성공하였다. Biotransplant사는 2000년 돼지의 레트로 바이러스인 PERV를 전파시키지 않는 형질전환 돼지 생산에 성공하였다. 영국은 1997년부터 1999년까지 184마리 이상의 형질전환 돼지를 수출하였다. 이후 OECD에서 이식용 돼지의 수출입 관련 안건 논의를 시작하게 되었다.
NexTran : www.nex-tran.com
Alexion : www.alexionpharmaceuticals.com/index.cfm
PPL-Therapeutics : www.ppl-therapeutics.com
Roslin : www.roslin.ac.uk/about/
(2) 바이오장기 산업의 도약(바이오장기 기업의 합병 및 집중화)
2000년 장기이식 분야 거대 제약회사인 Novartis는 10억 달러를 투자한 바이오 이종장기 기업인 Imutran 및 BioTransplant사와 클로닝 기술을 보유한 Infigen사를 통합하여 Immerge BioTherapeutics를 출범시켜 집중화를 통한 전문성과 생산성 극대화를 도모하게 되었다. 이후 이 회사는 돼지 바이러스를 전염시키지 않는 형질전환 돼지 개발에 성공하였고, 바이오장기 거부반응에 대한 면역 조절 기술 발전을 위해 노력하고 있다.
Novartis : www.novartis.com
Infigen : www.infigen.com
Immerge BioTherapeutics : www.immergebt.com
다. 바이오장기의 국내 현황
국내의 경우 보건복지부, 과학기술부, 농림부가 주축이 되어 바이오이종장기개발 사업단, 장기복제이식기술 개발 사업단, 무균돼지 생산 사업단을 형성하였으며, 현재 활발히 바이오장기의 기반 기술연구, 임상연구, 산업화 연구를 시행하고 있다. 장기복제이식기술 개발 사업단은 이식용 형질전환 복제 무균 미니돼지의 안정적인 생산을 위한 원천 기술을 확립하고, 이종이식 거부반응 분석과 조절을 위한 분자생물학적, 면역학적 인프라 구축으로 이종이식 현실화 기반 확보를 그 최종 목표로 지향하고 있다. 바이오 이종장기개발 사업 사업단은 면역거부반응을 최소화할 수 있는 이식용 이종장기의 생산과 면역 거부반응의 극복을 위한 효과적 방법의 모색 및 이를 바탕으로 이종이식 기술을 개발, 적용하여 만성 장기부전 환자의 구제 및 이 기술을 산업화하는 것을 최종 목표로 하고 있다. 무균돼지 생산 사업단은 인간에게 이식 가능한 형질전환 무균 복제 돼지의 생산체계를 구축하고, 바이오장기 생산동물의 관리기술 개발 및 형질전환복제동물의 생산효율 증진에 필요한 기술을 확립하여 면역적으로 인간에게 거부반응이 없는 돼지를 생산하는데 필요한 기반을 체계적으로 구축함으로써 바이오장기 생산 무균돼지의 산업화를 최종목표로 하고 있다.
보건복지부 : www.mohw.go.kr
과학기술부 : www.most.go.kr
농림부 : www.maf.go.kr
라. 바이오장기의 발전과제와 전망
(1) 바이오장기 산업의 발전 전망
(가) 바이오장기 산업 수요 및 파급 효과
이식 장기 수요의 폭발적인 증가로 수급 불균형이 심화될 것으로 예상되고 있다. 아울러 장기 이식은 21세기 고부가가치 신산업인 생명공학산업의 제분야가 결집되는 ‘생명공학산업의 총체이자 꽃’으로 관련 생명공학산업의 동반 발전 및 응용 기회를 제공할 것으로 예상되고 있다.
(나) 시장 규모
현재 장기 이식에 따른 면역억제제의 시장 규모만 해도 2001년 기준으로 3조 4200억 원 규모에 달하고 매년 6%씩 증가되어 2010년경에는 5조 5050억 원에 이를 것으로 예상하고 있다. 또한 형질전환 장기 시장규모가 2010년경에는 600억 달러에 이를 것으로 추산되고 있다.
(2) 바이오장기 산업 발전을 위한 이종이식 거부반응극복의 필요
이식한 돼지 복제 장기는 인체에서 초급성, 급성혈관성, 세포매개성 및 만성 거부반응을 유도한다. 이를 극복하는 것이 이종장기 이식의 최우선 과제이다<그림 4-2-3-4>.
(가) 초급성 거부반응의 극복
돼지의 알파-갈(α-Gal)에 대한 자연항체에 의해서 혈청보체계와 혈액응고계의 활성화가 유발되어 이식 수분 이내에 장기 기능이 정지된다. 이는 알파-갈 형질전환 돼지 제작 및 혈청 여과 기술로 극복 가능하다.
(나) 급성혈관성 거부반응의 극복(형질전환 돼지 생산 및 면역학적 조절)
자연항체, 자연살해(nature killer) 세포와 단핵구에 의한 혈관내피세포 활성화에 기인하며 활성화의 주요 원인인 알파-갈에 대한 유전자적중 기술, 혈청보체 조절인자 형질전환 돼지 제작 기술 및 혈관내피세포 안정화, 내피세포 유래 면역 매개물질 조절, 혈소판 기능조절로 극복 가능할 것으로 예상된다.
|
<그림 4-2-3-4> 이종이식 거부반응의 3단계 |
(다) 세포매개성 거부반응(면역학적 조절 및 면역관용 유도)
다양한 이종항원이 직ㆍ간접 항원 전달 방법에 의해 면역세포 활성화에 기인하며 동종이식에서 사용되었던 면역억제 방법의 응용이나 면역관용 유도로 극복하려는 노력이 활발히 시도되고 있다.
(2) 형질전환 복제 돼지의 생산
장기이식 관련 유전자를 검색, vector 제작, 체세포 유전자 적중 기술 등을 통하여 이종 장기 이식에 최적인 형질 전환 복제 돼지의 생산은 그 기반기술이 확립된 상태이며 산업화가 활발히 진행되고 있다<그림 4-2-3-5>.
|
<그림 4-2-3-5> 체세포 핵이식 기술을 이용한 장기이식용 형질전환 돼지의 생산 |
■ 제 4장 분야별 연구개발 및 관련산업 현황 제 3절 바이오 융합 분야 |
![]() BT+IT
BT+IT
가. 개요
생물정보학(Bioinformatics)은 생물학 실험자료를 이용하여, 생명현상을 정보처리학적인 현상으로 보고, 전산, 수학, 통계, 화학, 물리학 분야의 방법론과 도구를 사용하여 생명현상을 모사하여, 생명현상의 궁극적 이해와 활용을 추구하는 과학학문이다.
주로 하는 일은 생물학적 데이터들의 패턴이나 연관관계를 규명하는 것이며, 생물학적 정보의 수집, 처리, 저장, 배포, 분석, 해석, 가시화 등의 모든 분야를 포함하는 종합 혹은 융합학문이다. 생물정보학은 생물학과 정보학의 융합으로 IT 기술을 사람의 모든 유전자를 통칭하는 인간유전체학이나 단백질체학, 상호작용체학과 같은 작업처리량이 많은 대량발굴(high-throughput) 생물학 연구에 대한 실제적 이용에 초점이 맞추어져 있다. 점차, 자료유도 생물학이 원리유도 생물학으로 바뀌어 감에 따라 생물정보학은 수학, 물리, 화학, 통계학 등을 포함하는 기반 학문으로 발전할 것이고, 생물학에서의 뇌기능 역할을 수행하게 될 것이다. 생물정보학은 한국에서는 특이하게도, BIT 산업이라고도 많이 불리며, 아래의 그림에 그 융합의 대략적 분야들이 있다.
나. 생물정보학 역사/배경
1850년대의 다윈의 진화론과 멘델의 유전법칙의 이론적 기반에서 시작된 연구이며, 생물정보학의 실질적 시작점으로 볼 수 있다. 1950년대의 DNA 구조 모델링을 통해, 이중나선구조가 제안되었고, 1960년대의 단백질 구조해석을 위한 많은 수동/자동 전산처리작업과 알고리즘 개발이 실질적인 토대를 나았다. 1970년대 이르러서 생거의 단백질과 DNA 서열해석 기술을 이용하여, 본격적으로 생물서열, 분자구조, 그들 사이의 상동성 검색기술들이 개발되었으며, 1980년대에는 단백질 구조 접힘 문제에 많은 생물정보학자들이 기여를 했으며 현재 사용되고 있는 많은 통계학적, 수학적 알고리즘들을 개발하였다. 1970년에 니들만 원취(Needleman and Wunsch)의 다이내믹프로그래밍을 이용한 전산 서열 정열 알고리즘은 전산적 생물정보학의 중요한 계기가 되었다. 그 뒤, 1990년 초의 팀 버너즈리라는 유럽의 CERN 연구소에서 개발된 HTTPD라는 컴퓨터프로그램과 HTML이라는 양식이 보편화 되면서, 많은 생물정보학자들이 인터넷을 통해 정보를 유통하고 그에 필요한 기반 기술을 만들어 내면서 생물정보학은 인터넷을 타고 전 세계로 번진다. 생물정보학자들이 학문계에 있어서는 인터넷의 발전에 가장 많은 기여를 했고, 지금도 인터넷의 중요한 문제들이 생물정보분야에서 도출된 것이 많다. 영국 케임브리지의 생거의 바이러스와 미토콘드리아 게놈프로젝트가 90년대의 인간 게놈 프로젝트로 결실을 맺고, 그동안 축적된 많은 생물정보학적 기술들이 2000년대에 와서 폭발적인 성장을 하게 된다. 생물정보학은 대량의 실험 데이터를 DB화하고 이를 이용한 개개의 유전자나 단백질의 기능과 용도 분석 등에 주력하였다. 염기서열결정(sequencing) 등에서 생산되는 유전자 서열정보 등 방대한 양의 새로운 생물학 데이터들을 저장하고 관리하기 위한 생거센터의 ACEDB와 같은 유전체 데이터베이스의 개발이 최초로 이루어졌다. 서열간의 유사성을 분석하기 위한 FASTA와 BLAST 등의 프로그램이 미국의 니들만 분취의 기술에 더하여 개발되었고, 현재에는 Hidden Markov Model(HMM) 및 SVM과 같은 고급 통계학적 알고리즘도 사용한다.

<그림 4-3-1-1> 생물정보학의 융합 분야
분자생물학에서 발생하는 자료는 핵심 구성물인 유전자와 단백질에 대한 구조, 발현, 변이, 기능과 상호 작용에 대한 것이다. 생물정보학은 이런 자료에 대하여 데이터베이스를 구축하고 이를 알고리즘에 적용하여 해석하기 위한 도구를 포함한다.
<표 4-3-1-1> 생물학 분야에서의 연구 대상, 실험 기법 및 해석 방법
Biology Genes Proteins | Tools & Assays | Interpretation |
Genetic sequences Protein structure | DNA sequences Protein sequences Mass Spectrometry X-ray crystallography NMR | Sequence assembly Hidden Markov model Sequence Homology Protein modeling Structure homology Structure predictions |
Genetic variation Protein variation | Genotyping Mutation detection Alternative splicing Post translational modification Phase display | SNP association studies Protein comparisons |
Gene expression Protein expression | Microarrays 2-D gels Protein chips Mass Spec Chromatography | Gene clustering Image comparisons Mass Spec-Protein ID |
Gene function Protein function | Gene knock-ins, knock-outs, knock-downs Monoclonal antibodies Protein-protein interactions | Comparative genomics Functional annotation Functional prediction Functional annotation Functional prediction |
Genetic networks Systems biology | Computational integration | Pathway reconstruction Pathway modeling Biological models Simulations |
출처: Cambridge Healthtech Institute 2002
염기서열 결정(Sequencing), 유전자 발현 개요 작성과 유전형에 대한 연구가 최근의 기술 발달에 힘입어 급속히 발달하였다. 포스트유전체학은 유전자에 대하여 어떤 단백질이 발현되는지와 세포와 조직에서의 전체적 역할을 연구하여, 유전체(genome)상의 모든 유전자의 역할을 이해하는 것을 목표로 하며, 단백질체학, SNP(단일염기변이), 마이크로어레이 등의 기법을 포함한다. 포스트 게노믹스의 최종 목표는 복잡한 생물계에 대한 통일된 관점을 보이는 것으로 그 시작은 유전자 발현과 기능 데이터로부터 유전자 네트워크를 만드는 것이다.
분자생물학의 연구의 초점이 유전체학(genomics)에서 기능 유전체학(func-tio-nal geno-mics)으로 바뀜에 따라 생물정보학의 연구방향도 이에 맞추어 확대되고 있다. 포스트게노믹스 분야에서 필요한 여러 분야에 대한 연구가 활발히 진행되고 있다. 포스트게노믹스 분야는 광범위한 분야의 데이터를 통합, 해석하는 것이 필요하며, 이를 위한 데이터를 모으고 종합하기 위한 고도화된 체계를 만드는 것이 특정한 분야에서의 새로운 분석 도구를 만드는 것보다 더 중요해졌다.
다. 국외 동향
(1) 주요 연구기관
매우 많은 연구 기관이 존재하며 다음은 그 중 가장 대표적인 기관들이다.
■ NCBI(www.ncbi.nih.gov): 미국 NIH의 생물정보학 부서로 컴퓨터를 활용하여 생물학 및 의학 분야의 방대한 데이터를 분석하기 위한 DB를 구축하고 분석도구를 개발하는 것이 주요 임무이다. 가장 널리 쓰이는 분석 도구인 BLAST 서열 검색용 프로그램 등을 개발하였다. 이는 미국에서 생물정보학의 중앙통합의 중추이며, 세계에서 가장 강력한 생명정보기관이다. 생물학적으로 중요한 분자의 구조와 기능을 분석하기 위한 컴퓨터 정보 처리 기술 연구, 수학적, 전산학적 방법을 사용한 생물학 및 의학적 문제의 분자 수준에서의 연구, 분자생물학, 생화학, 유전학에 대한 지식을 저장, 분석하기 위한 자동화 시스템 개발, DB와 S/W 개발, 생명공학 기술 정보 수집, 연구소, 학회, 산업체, 정부 기관 등과의 협력, 과학적 정보교환 강화, 전산생물학의 기초 및 응용 연구 훈련 지원, 다양한 DB와 S/W의 사용 지원, 데이터 축적 및 교환, 생물학적 명명법의 표준 개발 등의 활동을 하고 있다. NCBI에서 개발되는 모든 데이터와 알고리즘은 무료로 소스코드와 함께 배포된다. NCBI는 연구소와 같이 협력하는 기업을 통해서 효율적으로 프로그램개발을 진행하는 방식을 취하고 있다.
■ EBI(www.ebi.ac.uk): 유럽의 대표적인 생명정보 연구기관으로 생물정보학 분야 순수 및 응용연구, 생물학 DB 구축, 관리, 제공, 데이터의 저장 및 개발 지원, 생명공학, 화학, 제약 기업 등의 산업체 지원 등의 활동을 하고 있다. 동시분석 등의 도구를 제공하고 있다. 미국의 NCBI에 대항하기 위해서 정치적으로 EU에서 설립한 기관이며, EMBL의 한 부서로 되어 있다. 케임브리지에 있으며, 세계에서 가장 강력한 생명정보연구기관 중의 하나이고, 미국의 NCBI와 계속해서 경쟁할 기관이다.
■ DDBJ(www.ddbj.nig.ac.jp): 미국의 NCBI와 유럽의 EBI에 상응하는 일본의 생물정보학 전문 기관이다. 많은 양의 생명정보 미러를 하고 있으며, 자체적인 DB구축과 함께 연구도 매우 활발하다.
■ TIGR(www.tigr.org): 크레이그 벤터가 주도한 유전체 서열해석 기관이다. 다양한 생물의 유전체 구조와 기능 분석 및 비교유전체학을 연구하고 있다. 많은 종류의 미생물과 진핵 생물에 대한 유전체 DB를 제공하고 있다.
■ SIB(Swiss institute of bioinformatics): EBI 이전부터 존재한 유럽의 중요한 생물정보 연구 서비스 기관이다. 대표적인 종합적인 단백질 분석 서버인 ExPASy(expert protein analysis system)을 운영하고 있으며, Swiss- prot, TrEMBL, Swiss-2D Page 등의 DB를 제공한다.
|
<그림 4-3-1-2> EBI 전경. 영국 케임브리지 소재 |
<표 4-3-1-2> 공공 생물정보 데이터베이스들: http://biodb.net/
분야 | DB 이름 | URL |
Biomedical Literature | PubMed | http://www.nlm.nih.gov/ |
Nucleotide | Genbank | http://www.ncbi.nih.gov/ |
DDBJ | http://www.ddbj.nig.ac.jp http://www.ddbj.nig.ac.jp | |
EMBL | http://www.ebi.ac.uk/ | |
MGDB | ||
GSX | ||
NDB | ||
Protein sequence | Swiss-prot | http://www.expasy.ch/sprot/sprot-top.html |
TrEMBL | http://www.expasy.ch/srs7 | |
PIR | http://www-nbrf.georgetown.edu | |
3D structure | PDB | http://www.rcsb.org |
MMDB | ||
Enzyme and compounds | Ligand | http://www.expasy.ch/sprot/enzyme.html |
Protein functional sites | PROSITE | http://www.expasy.ch/prosite |
BLOCKS | http://www.blocks.fhcrc.org | |
PRINTS | http://www.bioinf.man.ac.uk/dbbrowser/PRINTS/ | |
ProDom | http://prodes.toulouse.inra.fr/prodom/doc/prodom.html | |
Pfam | http://pfam.wustl.edu | |
SMART | http://smart.embl-heidelberg.de | |
TIGRFAMs | http://www.tigr.org/TIGRFAMs | |
Protein 3D folds | SCOP | http://scop.mrc-lmb.cam.ac.uk/scop |
CATH | http://www.biochem.ucl.ac.uk/bsm/cath_new | |
Transcription factor | TRANSFAC | http://transfac.gbf.de/TRANSFAC |
Protein interactions | PSIMAP | http://psimap.org/ |
BIND | http://www.bind.ca | |
DIP | http://dip.doe-mbi.ucla.edu | |
Protein pathways | KEGG | http://www.genome.ad.jp/kegg |
EcoCyc | http://www.ecocyc.org | |
WIT | http://wit.mcs.anl.gov/WIT2 | |
Metabolic pathway DB | PathDB | |
Ortholog groups | COG | http://www.ncbi.nlm.nih.gov/COG |
Microarray | SWISS-2DPAGE | http://www.expasy.ch/ch2d/ch2d-top.html |
Gene expression | ||
Controlled vocabulary | GO | http://www.geneontology.org |
(2) 연구 분야별 대표적인 웹 사이트
현재 약 1,000여 가지의 큰 생물학 분야의 DB가 존재하며 대부분 웹을 이용하여 사용할 수 있도록 되어 있다. 각 웹 사이트는 DB를 제공하거나 DB를 검색, 분석할 수 있는 프로그램을 사용할 수 있는 웹 인터페이스를 제공한다. 또 널리 사용되고 있는 공개 DB나 해석용 프로그램을 구할 수 있다. 제공되는 정보의 활용도를 높이기 위하여 웹 인터페이스 뿐 아니라 프로그램적으로 접근할 수 있는 방법, XML형식 등으로 정보를 제공하는 곳이 증가하고 있다. 여러 분야에 걸쳐 포괄적이고 종합적인 정보를 제공하거나, 특정한 분야에 특화되어 있는 사이트도 많다. 특히 유전체학(Genomics)분야에 대한 많은 DB와 해석용 프로그램이 존재하며 이는 웹을 이용하여 쉽게 구할 수 있다. <표 4-3-1-2>는 각 분야에 대하여 포괄적인 정보를 얻을 수 있는 대표적인 웹 사이트이다.
(3) 업계동향
대표적인 업체로는 Accelrys Inc, Structural Bioinformatics Inc, Compugen, App-lied Biosystems, Incyte Genomics, Lion Bioscience, Gene Logic, IBM Life Sciences, Informax, CuraGen, Affymetrix, Amersham Biosciences, TimeLogic, Sun Microsystems, Silicon Genetics, 3rd Millennium 등을 들 수 있다. 한국에서는 ISTECH(www.istech21.com), OITEK(www. oitek.com)과 Smallsoft(www. small-soft. co.kr) 등의 회사가 있다.
생물정보학은 2000년대 초기의 지나친 기대감에서 비롯된 과잉투자 및 전문가에게 제대로 투자되지 못하는 등의 문제로 인해 2004~5년대에 연구비나 그 성과에서 매우 저조하였으나, 2006년 이후 실수요와 실제적으로 활동하는 전문가의 수가 늘어남에 따라 점차 시장이 새로 형성될 것이며, 2007년 이후부터는 상업화에 완전히 진입할 만한 요소들이 나올 것으로 전망된다.
생물정보학 업체가 제공하는 서비스로는 다음과 같은 분야가 있다.
■생물정보 S/W: 생물정보데이타의 시각화와 번역, 분석에 관한 S/W 패키지 제작 및 판매
■생물정보 서비스: 생물정보 데이터베이스를 구축, 관리하면서 전 세계의 관련 기업이나 연구자들에게 연구개발 관련 정보 제공
■생물정보 인프라 제공: 초고속의 데이터 처리와 데이터베이스 운영에 필요한 IT 시스템을 구축, 서버, 스토리지 등 생물정보 인프라 제공
■생물정보 교육: 국가유전체정보센터와 같은 전문 생물정보학 연구기관이 지속적으로 교육을 진행해오고 있고, 개인수준과 학교에서의 교육이 지속적으로 늘어나고 있다.

<그림 4-3-1-3> Data의 통합과 mining(Front Line)
기존에는 각 업체들이 대부분 한 분야에 특화되어 있었다. 현재는 유전체학 이외에 마이크로어레이, 단백질체학이나 상호작용체학 등 다른 분야에 대한 도구나 솔루션 개발 등을 확대하고 있다. Merck & Co-Rosetta Inphar-ma-tics, Lion Bioscience-Trega Biosciences MedImmune-Aviron, Lion Bio-Scinece-Paradigm Genetics, Merck-Celera Genomics 간의 전략적 제휴나 M&A를 통한 연구 개발과정에의 직접 참여가 증가하고 있다. 또, 거대 IT 업체인 IBM, Sun Microsystems, HP, Oracle, Hitachi 등의 업체가 생명과학분야에 진출하여 IT 인프라 이외에도 tool, solution의 개발 등에 많은 투자를 하고 있다.
계속 진행되고 있는 염기서열분석, 생성되는 데이터의 증가, 마이크로어레이 분석, 단백질체학, 약물유전체학(pharmacogenomics) 연구 등은 생물정보학의 활용을 필요로 하며 이는 생물정보학 시장에 새로운 기회를 제공한다. 보다 광범위한 자체 제품과 역량을 지닌 회사가 생존할 것이며 차후 급격한 성장을 하게 될 것이다.
(4) 최근의 연구 방향
(가) 연구 분야의 변경
많은 대학, 연구소, 회사들은 유전체학의 다음 단계인 비교 유전체학, 기능 유전체학, 단백질체학, 시스템생물학, 전체기관 모델링 등으로 빠르게 연구개발의 초점을 바꾸고 있으며 이 분야에 대한 생물정보학 연구가 진행되고 있다.
(나) Data의 통합의 필요성
유전체학에서는 주로 염기서열 자료(sequencing data)에 대하여 이를 데이터베이스화하고 정리, 분석하기 위한 정보학으로, 다루는 데이터가 비교적 간단하였다. 포스트 게노믹스에서는 <그림 4-3-1-3>과 같이 매우 다양한 데이터를 다루어야 하며 이를 통합 운영하고, 여기에서 유용한 지식을 추출하는 것이 중요하다. 이를 위한 지식 관리와 통합 기술에 대한 관심이 증대되고 있다. 이러한 통합은 다음을 포함하며, 과학적 연구에 집중할 수 있도록 하여 연구의 최적화를 이룰 수 있게 해 준다.
■광범위한 sources로부터의 데이터 접근
■데이터와 여러 종류의 응용 프로그램과 도구의 기능을 통합사용
■데이터를 안전하게 저장하고 이를 쉽게 관리
■지식 창출을 위한 협력
■새로운 응용분야의 통합
통합의 방법으로 여러 DB에 걸친 질의, hyperlink의 이용, 관절 통합, 자료 저장소 등의 방법이 사용되고 있으며 현재는 XML을 기반으로 하는 웹 서비스가 큰 관심을 받고 있다.
(다) 생물정보학의 분야들

<그림 4-3-1-4> 각종 체학들의 집합으로서의 생명정보 매트릭스
생물정보학의 분야는 생물학의 모든 분야와 다른 학문 분야들에 걸친다고 생각할 수 있는데, 다음과 같은 매트릭스를 사용하면 한눈에 볼 수 있다. 아래그림에서 알 수 있듯이, 생물정보학은 각종 ‘Omics’(체학)으로 세분화 확장화 하고 있다(www.omics.org). 아래의 영역들에서 작용체, 기능체 및 문헌체는 생명현상의 규명과 활용에 가장 중점적인 체학들이다.
(라) 본체학(Ontology)과 표준화
정보를 효과적으로 공유하기 위해서는 사용하는 용어의 통일이 필요하다. 각 지식분야의 주된 개념을 담기 위한 고도로 선택된 용어의 집합을 본체학(Ontology)이라 하는데, 유전자 본체학 컨소시엄의 주도하에 유전체학 분야의 본체학이 만들어졌으며, 다른 분야에 대한 ontology도 개발 중에 있다. Onto-logy의 공유를 통하여 생물학적 객체를 묘사할 수 있으나, 각각의 객체에 대한 이름을 줄 수는 없다. 따라서 LSID(Life Science Identifier) 등 각 객체에 대해 유일한 이름을 줄 방법이 연구되고 있다.
새로운 적용분야를 개발하고 배포하는 것은 다른 프로그램과의 연동이나 장시간에 걸친 이용을 위하여 분야별 특성을 반영한 표준에 따라야 한다. 이에 의하여 빠르고 안전하게 자료를 교환할 수 있게 되어, 같은 투자에 대하여 더 많을 일을 더 효과적으로 하게 되어, 결론적으로 더 좋은 결과를 얻을 수 있다. 현재 I3C, GO, MGED, PSI와 같은 Informatics 컨소시엄에서 표준화를 위한 노력을 기울이고 있다. 많은 변수가 존재하는 마이크로어레이 실험 데이터의 표준화가 이루어져 마이크로어레이 실험 관련 논문 발표 시 MIAME 표준에 따르는 실험 데이터를 등록하도록 되었다.
분산 시스템인 서열 분야의 주석을 공유하기 위한 DAS(distributed Anno-tation System)가 사용되고 있으며, 이를 다른 분야에 확대 적용하기 위한 BioMOBY나 MyGrid 등의 프로젝트가 수행되고 있다.
<표 4-3-1-4> 주요 표준화 기구
이름 | 분야 | URL |
Gene Ontology 컨소시엄 | gene annotation | www.geneontology.org |
Microarray Gene Expression Data society | 마이크로어레이 | www.mged.org |
Proteomics Standards Initiative | 단백질체학 | www.psidev.sourceforge.net |
I3C | www.i3c.org |
라. 국내 동향
한국에서의 BIT관련 관심은 높으나, 실질적인 결과가 적다. 현재 숭실대를 비롯한 일부 학교에 생물정보학과가 생겼고, 생물정보학 관련하여 2개의 학회가 있다(유전체학회와 생물정보학회).
정통부의 IMT2000기금을 바탕으로 2001년 대규모의 연구과제가 시작되었다. 그러나 2005년 말 현재 연구투자에 비해 생산성이 미약하고, 생물학자들에게 실질적인 도움이 되는 서비스가 많지 않다. 국가유전체정보센터가 유일하게 국가적으로 생명정보 전체 분야를 관장하는 국가기관으로 지정되어 있고, 현재 54명의 인원이 그 센터에 있다. 그 외에, KISTI의 CCBB에 약 10명정도와 ETRI에 10명 정도의 전문 생물정보 개발자들이 있고, 국립보건원의 중앙유전체연구소에도 약 5명 정도의 인원이 있다.
<표 4-3-1-5> 국내 주요 생물정보학 연구 기관 | |
기관/조직명 | 목표/주요 과제 |
한국생명공학연구원 국가유전체정보센터 | 공통활용 인프라 구축 및 국내 발생 연구결과 연계, 통합, 교육 국제적 생명정보기관과 협력관계 형성 |
농업생명공학연구원 | 생물자원 정보 종합 DB화 및 활용시스템 구축 |
한국전자통신연구원 바이오정보팀 | 고성능 바이오 정보처리 기술개발 및 서비스 |
국립보건원 중앙유전체연구소 | 역학 DB 구축, 생정보학 인력양성, 유전자 분석 알고리즘 개발 |
KISTI CCBB | 컴퓨터를 활용한 생물학적 데이터 수집, 관리, 저장, 평가, 분석 |
국내 생물정보학은 인프라 구축이나 관련 기업들의 역량 등 여러 면에서 선진기업 및 국가에 크게 뒤져 있으며 분석 기술, 투자 규모, 전문 인력 등의 면에서도 선진 기업에 비하여 매우 취약한 수준이다. 또한 연구결과의 통합 및 관리가 제대로 이루어지지 않아 선진 기업 및 국가에 비해 각종 게놈 및 유전자 데이터베이스 구축에 있어 매우 뒤진 상황이라고 할 수 있다. 핵심역량 확보 노력과 함께 정부차원에서도 인프라 구축 및 관련 인력 양성 등의 지원에 적극 참여하여 정부기관이 주축이 되어 흩어져 있는 연구결과를 통합할 수 있는 생명정보 데이터베이스를 개발하고, 유전체학 관련 연구기관들간의 협력과 유기적인 네트워크를 구축하며, 인력 부족이 심각한 생물정보학 관련 인력을 양성하는 등의 역할을 하여야 할 것이다. 또, 능동적이고, 성과 위주의 호전적 경영을 위하여 미국과 유럽처럼 독립된 생명정보 전문기관의 창설이 필요하다.
마. 전망
생물정보학이 미래의 생물학에 핵심 역할을 할 것이라는 것은 명백하다. 현재 중요 단백질에 대하여 이름, 연관된 유전자의 이름, 반응 속도 등의 물리적 상수와 알려진 물리적, 유전적 상호 작용을 컴퓨터의 도움 없이 추적하는 것은 불가능하다. 이런 면에서 컴퓨터는 보조 두뇌의 역할을 하여 수천 개의 복잡한 분자와 그들의 상호 작용을 다룰 수 있도록 해 준다. 유전자 발현 배열 기술의 경우 컴퓨터의 도움 없이는 많은 실험이 불가능하다. 묘사적인 생물학으로부터 정량적이며 예상 가능한 생물학으로의 변천은 새롭고 막대한 양의 데이터를 발생, 저장, 공유 및 이용을 필요로 한다. 여러 가지 포스트 게노믹스(post-genomics) 연구과정의 실험 데이터를 정리 해석하고 실험적으로 검증할 수 있는 가설을 세우는 것에도 더욱 중요한 역할을 할 것이다. 포스트 게노믹스 분야로의 연구 분야 확대, 데이터의 통합의 필요성에 의한 통합 방법이나 표준화 연구, 증가하는 전산 자원요구를 충족하기 위한 분산 com-puting이나 격자(grid) computing 등에 대한 연구가 활발히 진행되고 있다.
생물정보학과 전산생물학(computational biology)의 중요성은 매우 극적으로 증대하여, 모든 생물학자는 상당한 수준의 생물정보학에 대한 교육이 필요로 하게 되고 생물학 분야에서의 필수 기반 요소 분야가 될 것이다.
산업적으로 2005년에는 실수요의 많은 생물학적 요청이 생겨나기 시작했고, 2006년부터는 기업들의 활동도 향상되며, 2007년 이후는 국제적 경쟁체제가 필요하다. Bioprospecting과 같은 역할을 담당할 전문기관이 2006년에는 생길 가능성이 크다.
![]() BT+NT
BT+NT
가. 바이오나노기술의 개요
바이오나노기술은 바이오시스템 및 이들이 무기물 나노구조와 결합된 융합시스템을 나노크기의 수준에서 조작 및 분석하고 이를 제어하는 기술이다. 1 나노미터의 길이는 대략 작은 분자 1개의 크기에 해당되며, 이러한 작은 크기의 물체를 인간이 원하는 방향으로 만들고, 움직이려는 시도가 바로 나노기술 또는 나노엔지니어링이며 대상물질이 바이오시스템일 경우 바이오나노기술로 정의될 수 있다. 생명공학의 기본은 DNA와 단백질에 대한 연구라고 할 수 있으며, 실제로 DNA의 크기는 약 100 나노미터이며 단백질의 크기는 1-10 나노미터에 해당되어 생체분자 자체적으로 완벽한 나노시스템을 구현하고 있다. 이와 같이 생명체를 이루는 분자 개체를 분자수준에서 관찰함은 물론 인위적으로 조작하여 응용할 수 있는 바이오나노기술은 미래 생명공학의 혁명을 가져올 것으로 기대되고 있다.
바이오나노기술의 핵심분야로는 나노생체분석, 나노바이오칩/센서, 나노생체소재 등이 있다. 나노생체분석은 단일세포 및 단분자 분석이 가능한 기술을 의미한다. 단일 세포 각각의 기능 분화 및 세포 내에서의 생물분자의 변화의 측정을 통한 생화학적인 메커니즘 규명과 이를 이용한 센서 개발 및 질병 발생 규명 등의 진단 시스템에 응용할 수 있다. 단분자 나노 생체분석 기술은 특별한 증폭 과정 없이 극소량의 표적 생물분자를 정확히 검출해 낼 수 있는 기술이다. 나노바이오칩/센서란 나노기술을 접목하여 기존 바이오칩/센서를 소형화, 고감도화 할 수 있으며, 기존 기술로 불가능하였던 스마트 기능을 수행할 수 있는 시스템이라 할 수 있다. 나노생체소재는 각종 분자모터, 단백질, 나노캡슐, 나노와이어, polymeric structure로의 응용기술이나 나노크기의 생물학적 응용이 가능한 소재로 정의할 수 있다.
나. 해외 동향
(1) 나노생체분석
(가) SPM 기술을 이용한 나노생체분석
최근 10년간 나노테크놀로지 장을 연 원자힘 현미경이 강력한 생체분석의 도구로 사용되고 있다. 원자힘 현미경은 생리학적 조건에 가까운 환경에서 실시간으로 살아있는 세포 생물학 연구를 가능하게 해 주었다. 또한 원자힘 현미경은 해상도의 제한으로 광학 현미경으로는 불가능했던 살아있는 세포의 나노미터 수준의 세부구조, 세포내구조물, 생체 분자 등을 관찰 또는 변형 가능하게 해준다. 1980년대 초에 나온 스캐닝 터널링 현미경(Scanning Tun-ne-ling Micros; STM)의 터널링 전류를 대신하여 탐침과 표면 샘플의 반데르발스(van der Waals) 힘을 이용하여 만들어진 원자현미경은 그 뒤에 많은 다른 종류의 원자현미경(MFM, LFM, FMM, EFM, SCM, EC-SPM, NSOM, SThM 등) 개발의 계기가 되었다.
최근에는 AFM을 활용하여 표면 높낮이를 측정하는 수준을 넘어 힘-거리간 곡선(force-distance curve)를 측정하는 force spectros 기술이 개발되고 있다. <그림 4-3-2-1>에 RNA와 DNA 단분자의 force spectros 기술의 최근 방법을 정리하였다(Williams & Rouzina, Curr. Opi. Struct. Biol. 2002, 12, 330-336).



<그림 4-3-2-1> Single-molecule force spectros. (a) optical tweezers instru--ment,
(b) magnetic tweezers instrument, (c) AFM ex-pe-riment.
광학현미경은 시료의 본래 상태로 볼 수 있어 살아있는 세포를 직접 관찰할 수 있으나, 분해능은 가시광 영역에서 200 nm 정도로 분자수준의 관찰은 불가능하였다. 지난 20년간 분해능 향상을 위한 많은 노력들이 있어 왔다. Interference 및 structured light 방법을 사용하여 100 nm까지 분해능이 향상되었으며, 비선형 방법을 사용하여 30 nm까지 내려왔다(Garini 등, Curr. Opi. Biotechnol. 2005, 16, 3-12). NSOM(near-field scanning optical micros)은 지름 20~200 nm 조리개(aperture)를 통하여 빛을 비추면서 표면에서 10~50 nm 거리에서 스캔하기 때문에 렌즈를 사용한 경우의 분해능 한계를 극복할 수 있다. 최근에 1초당 100개의 이미지를 얻을 수 있는 초고속 스캔 기술(Hum-phris 등, Appl. Phys. Lett. 2003, 83, 6-8), 수지상세포(dendritic cell) 표면 단분자를 수용액상에서의 측정(Koopman 등, FEBS Lett. 2004, 573, 6-10), 무공(aper-tureless) 근접장 기술을 이용하여 분해능을 10 nm 이하로 향상시키는 기술 등이 개발되고 있다.
단분자 분석(single molecule detection, SMD)과 단일세포 분석(single cell assay, SCA)으로 대변될 수 있는 나노생체분석의 연구는 매우 다양하기 때문에 본 고에서 상세하게 서술하기 어려우며, 다음에 서술될 나노바이오칩/센서 및 나노생체소재 연구와 밀접한 관련성을 가진다.
(2) 나노바이오칩/센서 분야
(가) 바이오칩, 바이오센서
바이오칩과 바이오센서는 기술의 역사적 배경이 다르긴 하나 바이오리셉터와 신호변환 기술의 결합이라는 개념적인 면에서 유사성을 가진다. <그림 4-3-2-2>에 바이오칩과 바이오센서의 기술분류를 요약한 도표를 도시하였다(참조: 바이오칩, 바이오센서 및 바이오MEMS 기술분류, 생명공학정책연구센터 발간 자료, 2005). 그림에서 알 수 있는 바와 같이 다양한 개념 및 형태의 바이오칩/센서가 개발되고 있으며, 향후 나노기술의 접목은 필수적인 것으로 인식되고 있다.
(나) 나노바이오칩

<그림 4-3-2-2> 바이오칩, 바이오센서 및 바이오MEMS 기술분류
나노입자를 바이오칩에 활용하는 기술은 최근 가장 활발하게 연구되는 분야 중의 하나로서, 크게 바이오칩 표면과 표지물질로 활용하는 것으로 나눌 수 있다. 바이오칩 표면으로 활용하는 것은 국소표면 플라즈몬(localized surface plasmon) 현상을 이용하는 것이 대표적이다. Nath & Chilkoti는 금 나노입자 표면에 strep-tavidin 단백질을 정량할 수 있음을 보고하였다(Nath & Chilkoti, Anal. Chem. 2002, 74, 504-509). 나노입자를 표지물질로 활용할 경우 흡광, 형광, 라만 등 다양한 측정방식을 활용할 수 있다. 금 나노입자를 라벨링 기술로 이용하는 것은 전통적으로, 진단용 킷에 많이 활용되고 있다. 금, 은 나노입자를 SPR, SERS(surface-enhanced Raman scattering) 증폭용 표지물질로 사용한 예가 최근 발표된 바 있다(He 등, J. Am. Chem. Soc. 2000, 122, 9071-9077; Cao 등, Science, 2002, 297, 1536-1540). 향후 금속 나노입자 및 퀀텀 닷 나노입자를 바이오칩에 활용하는 것에 대한 연구가 더욱 폭넓게 진행될 것으로 예상된다.
바이오칩 측정 방식은 일반적으로 형광, 발색, 동위원소와 같이 특정한 방식의 표지(labeling)가 이루어져야 가능하다. 표지방식은 감도를 높이는 데 있어서 필수적인 기술이기는 하나, 표지에 의해 생체분자가 변형되거나 저분자 물질은 표지가 불가능할 수 있는 문제점이 있다. 비표지 방식의 바이오칩 측정기술로 SPR(surface plasmom resonance), Mass, QCM(quarts crystal micro-balance), 임피던스, 캔틸레버, SPM(scanning probe micros) 등과 같은 측정방법이 있으며, 현재 SPR이 가장 많이 이용되고 있다. SPR 바이오칩은 50 nm 정도의 금 박막 표면을 이용한 것으로 Biacore사에서 제품화 하였으며, 현재는 마이크로어레이 형태의 생체분자 결합을 어떻게 측정할 것인가 하는 것에 많은 관심을 쏟고 있다. 특히 SPR 이미징(imaging) 기술은 일찍이 Max- Plank 연구소의 Knoll 연구팀에 의해 발표된 후, Corn 박사 연구팀 및 한국생명공학연구원(KRIBB) 바이오나노연구센터 정봉현 박사 연구팀 등에 의해 단백질 결합 분석을 위해 연구가 계속되고 있다(Ro 등, Appl. Environ. Microbiol. 2005, 71, 1089- 1092).
(다) 나노바이오센서
현재 바이오센서 기술에서 요구하는 생체분자 결합의 민감도 향상, 생체적합성, 비특이 결합의 최소화, 극소 크기 등을 만족하기 위하여 나노바이오센서의 개발이 필요하다. 나노바이오센서란 나노기술이 도입된 바이오센서로서 기존 바이오센서의 한계를 극복하여 단일세포 및 단분자 분석, 현장진단, 재택진단, 실시간 진단이 가능하게 하는 기술이다. <표 4-3-2-1>에 최근 나노바이오센서의 연구동향을 간략하게 정리하였다.
<표 4-3-2-1> 나노바이오센서 연구 동향 | ||||
나노기술 | 측정방식 | 장점 | 단점 | Ref. |
금속 나노패턴 | LSPR | - SPR에 비해 소형화 유리 - 비표지 측정 - 다성분 측정이 용이 | - 센싱 거리가 짧음 | Nath & Chilkoti, 2002 Yonzon 등, 2004 |
나노- 광섬유 | 형광 | - 소형화 용이 - Single cell 분석 | - 표지 | Cullum & Vo-Dinh, 2000 Song 등, 2004 |
나노입자 | 형광, SPR, QCM, 전기화학, Raman 등 | - Single cell 분석 - 다양한 측정 방식에 접목하여 signal enhancement | - 표지 | Clark 등, 1999 Liu 등, 2004 |
Nanowire, nanotube | FET, conductance | - 소형화 용이 - 비표지 측정 | - 측정 물질의 특성에 영향을 받음 - 센싱 거리가 짧음 | Cui 등, 2001 Chen 등, 2003 |
Cantilever | 광학(PSD), piezoresistive, resonant frequency | - 소형화 용이 - 비표지 측정 | - 3차원 구조체 제작에 따른 재현성 | Fritz 등, 2000 |
LSPR: localized surface plasmon resonance, PSD: position-sensitive detector QCM: quartz crystal microbalance, FET : Field-effect transistor | ||||
(3) 나노생체소재 분야
(가) 생체유래 나노소재
생명체는 세포내외로의 물질 이동을 위하여 다양한 종류의 분자모터들을 가지고 있다. 세균 감염 바이러스인 박테리오파지(bateriophage)가 자신의 염색체를 세균으로 주입하기 위하여 가지고 있는 phage portal motor, 세균의 운동을 위한 bacterial flagella motor, 에너지생산을 위한 F0F1APTase, 세포내 단백질 및 DNA 이동을 위한 myosin/dynein/kinesin, 핵산 합성을 위한 RNA/ DNA polymerase 등 다양한 생체유래 분자 모터가 보고되고 있으며 이러한 분자모터를 나노생체소재화 하려는 다양한 시도가 이루어지고 있다. 예를 들면 RNA 합성효소인 RNA polymerase를 glass 표면에 고정하고 DNA를 기질로 하여 RNA 합성을 DNA에 결합된 magnetic bead의 회전량으로 검출하는 기술이 보고된 바 있다. 이러한 기술은 장차 DNA 선상에서 RNA poly-me-rase를 이용하여 나노스케일의 물질이동에 유용하게 사용될 것이다<그림 4-3-2-3>(Pomerantz 등. Nano Lett. 2005, 5, 1698-1703).
마이크로 레벨의 미세주형은 광식각을 이용한 반도체, 랩온어칩, MEMS 등의 연구에 주로 이용되어 왔으나 미생물 세포외막(S-layer) 등에서 관찰되는 크리스탈 형성 생체분자의 자기 조립성(auto assembly)을 활용할 경우 나노 수준의 보다 정밀한 주형도 제조가능하다(Hu et al. Langmuir. 2005, 21, 9103-9109). 이러한 분자주형(molecular template)은 나노바이오센서와 같은 나노기구의 개발에 이용할 수 있는 가능성이 있으며, 항체, DNA, Quantum dot를 비롯한 각종 바이오 기능성물질의 패턴화(patterning)에도 이용될 수 있다.

<그림 4-3-2-3> RNA polymerase의 분자모터 특성
DNA는 2 nm의 직경에 3.4 nm의 나선형의 피치(helical pitch)를 가진 이중나선(double helix)으로서, 끝부분의 상보적 부착단(cohesive end)을 통하여 무한정의 DNA 2차구조들을 자가조립(self-assemble)할 수 있는 특징을 가진 무한한 가능성을 가진 나노소재이다. 생체 내에서 발견되는 대부분의 DNA는 1차원적 구조를 가지고 있지만 염색체의 교차(cross-over)시에 나타나는 holiday junction과 같이 2차원적 구조도 발견된다. 이러한 2차원적인 DNA구조는 인공적으로 상보적인 DNA사슬을 만들고 이들을 교배(hybridization) 시킴으로써 생체 밖에서 만드는 것이 가능하다. 이러한 DNA의 2차원 구조는 그끝부분에 DNA block간의 상호작용을 통하여 연결될 수 있게 상보적 부착단을 만들어 주면 3차원의 DNA 골격(scaffold)도 만들 수 있다<그림 4-3- 2-4>(He 등, Angew. Chem. Int. Ed. 2005, 44, 6694-6696).

<그림 4-3-2-4> DNA 2D array의 AFM image
(2) 나노소재의 활용
CdSe core에 ZnS shell을 입힌 Quantum dot은 직경이 수 나노미터에서 수십 나노미터에 이르는 구형의 물질로서 입자의 크기에 따라서 다른 파장의 형광을 발산하는 특징을 가지고 있어서 살아있는 세포의 이미지 관찰과 같은 기초 생명과학뿐 아니라 각종 단백질칩 및 바이오센서 분야 같은 응용 생명과학에도 다양하게 사용되고 있다.
나노과학에 바탕을 둔 약물전달법은 연구결과의 단기적 시장성면에서 상당한 가치가 있는 분야이다. 특히 유전자 치료(gene therapy) 분야에서는 기존의 바이러스 중심의 방법을 극복하기 위하여 다양한 시도가 나노파티클(nano-particle)을 통하여 이루어지고 있다. Hood 등의 Science 논문에서는 DNA의 골격(backbone)이 phosphate group의 존재로 인하여 음전하로 하전되는 점을 이용하여 표면이 양전하로 하전된 나노입자를 제작하고 여기에 특정 단백질을 발현하는 plasmid DNA를 부착시켜 암세포 성장의 억제를 시도하였다.
다. 국내 현황
(1) 분야별 연구개발 현황
(가) 나노생체분석
생체분석은 생물학의 일부분으로 오래전부터 존재해왔지만 나노생체분석은 최근에 개발된 나노테크놀로지를 기초로 초보적인 단계에 있다. 현재까지는 다분자 검출기술에 대한 연구가 중심적으로 연구되고 있으며, 단일분자검출 분야에서는 기초 연구만이 이루어지고 있다. 단일분자를 검출하기 위한 나노바이오 물질의 거동 분석과 형광 물질에 의한 전기 화학적인 기본 메커니즘에 대한 기초 연구가 진행 중에 있고, 실질적인 적용에 대한 연구로 SPM을 이용한 분석 및 나노 전선 등을 이용한 연구는 시작 단계에 있다.
(나) 나노바이오칩/센서
단백질칩 진단시스템 개발에 관심이 매우 높아 많은 연구기관에서 연구개발을 진행하고 있다. 그러나 현재 진행되고 있는 연구는 대부분 형광물질을 이용하는 DNA칩 시스템을 응용해 면역칩(immunochip)을 제작하는 단계에 있으며, 단백질어레이(protein array) 보다는 단백질 상호작용 분석에 집중되어 있다.
최근 SPR에 대한 관심이 높아져 활발한 연구가 진행되고 있다. SPR 기술을 이용한 단백질칩 개발은 한국생명공학연구원, 한국전자통신연구원, 강원대 등에서 연구개발을 진행하고 있으며 단백질 상호작용을 분석하고 있다. 한국생명공학연구원에서는 생체분자 결합의 마이크로어레이 분석이 가능한 SPR 이미지 시스템을 개발하여 벤처기업인 케이맥(주)에 기술이전 하여 현재 시제품 생산 중에 있다.
(다) 나노생체소재
생체유래 나노소재의 개발능력 면에서 우리나라는 이미 상당한 수준에 도달한 상태이나, 생체소재들을 실제로 나노소재로 개발하고자하는 시도는 거의 전무한 실정이다. 국내 나노기술 전문가는 나노구조체 합성, 벌크 나노소재, 나노소재분야에서는 정보통신 분야의 발전과 산업화에 의해서 한국이 선진국에 상당히 접근된 수준을 나타내고 있으나, 바이오나노 및 표면 나노 소재분야는 선진국에 비해서 상당히 낙후되어 있다. 국내에서 생체재료를 이용한 나노소재, 소자 산업은 대부분 바이오센서 산업에 국한되어 있다. 현재 바이오센서 시장에서는 장비에서부터 소프트웨어, 시약에 이르기까지 200여개의 업체들이 참여하고 있다.
(2) 바이오나노 분야 정부지원 현황
2002~2004년도 바이오나노 기술 분야 투자 현황을 <그림 4-3-2-5>에 정리하였다. 2002~2004년 기간 동안 바이오나노기술 분야 연구지원은 나노기술전체 지원액의
|
<그림 4-3-2-5> 2002~2004년도 바이오나노 기술 분야 투자 현황 |
5% 정도로 매우 미미한 상태이다. 또한 나노 팹 등 기반구축사업에 있어서도 바이오나노기술을 위한 시설들은 거의 고려되지 않고 있다. 바이오나노분야내의 기술 중에서는 진단, 치료, 극한제어 기술에 대한 투자가 두드러졌는데, 이는 이 기술들이 의료 및 연구용 측정기술 개발과 직접 관련되어 있기 때문으로 판단된다. 반면, 정보, 에너지, 영향평가 및 표준화 등 원천성과 공공성이 강한 분야에의 지원이 매우 적거나 전무한 상태이다. 나노생필품 기술은 정부투자가 미미한 반면, 최근 각광받는 은나노기술 관련 산업으로 오히려 민간분야에의 연구가 활발히 진행되는 것으로 드러났다. 바이오나노 농림수산 기술은 선진국에서도 최근에야 연구가 시작되는 분야이고, 국내에 연구자가 매우 드문 상태이기에 그동안 정부 투자가 없었던 것으로 판단된다.
라. 발전 방향
AFM과 같은 기존 나노툴과 새롭게 개발되고 있는 NSOM, NSOM-Raman, 광자력 현미경 등을 활용한 살아있는 세포의 표면 및 내부 관찰과, 생체 단분자의 거동, 기능, 구조 관찰은 과학적 측면에서 매우 중요한 분야이다. 초고속, 초고분해능 바이오-나노 탐침 측정 기술로 SPM을 이용한 단일 바이오 분자의 검출 및 조작 기술의 개발, 단일 세포의 선택적 고정화 기술 개발, Lab-on-a-chip 기술과 나노 탐침 기술의 결합에 의한 단일 세포의 나노측정용 칩 기술 등 아직 개발해야 할 연구 분야가 많은 것으로 사료된다.
바이오칩 기술은 바이오칩 제작에서 분석기술로 연구 중심축이 전환되는 시점이며, 향후 활용기술의 개발에 의해 시장이 넓혀지게 될 것이다. 바이오칩/센서 활용기술에 있어서 가장 중요한 점은 질병 마커와 같은 바이오컨텐츠의 개발일 것이다. 바이오센서의 경우 전체 시장 80%를 점유하고 있는 혈당센서는 향후 지속적으로 성장할 것이나, 바이오센서 시장의 더 큰 성장을 위해서 바이오리셉터와 신호변환기의 적절한 조합에 의한 성능 향상과 응용 확대가 중요한 관건이라 할 수 있다. 특히 혈당센서 외 바이오센서의 상업적 성공을 거두기 위해서 효소반응이 아닌 선택적 생화학적 결합 반응을 측정하는 바이오센서 개발이 필요하다. 생체분자 결합 분석의 경우 형광표지의 검출한계(limit of detection, LOD)는 단백질 10 pg/mL, 비표지 방법인 SPR의 검출한계는 단백질 1 ng/mL 정도이다. 혈액 내 극미량의 단백질을 측정하는 것이 향후 바이오센서 시장 확대의 중요한 관건이 될 수 있으므로 민감도 향상이 필요하다.
바이오나노기술은 진단칩, 신약후보 물질의 초고속 발굴, 생물분석기기 등 비교적 단기간에 제품화가 가능한 기술일 뿐만 아니라, 전반적인 생명공학연구의 원천기술로 활용될 수 있다. 바이오나노기술은 많은 생명공학 연구를 효율적으로 수행할 수 있는 나노생체분석, 나노바이오칩/센서의 개발 및 활용, 그리고 새로운 생체유래 나노소재 발굴 등과 같이 보다 시스템화 된 바이오나노 연구가 필요한 시점이라 여겨진다. 이를 위하여 학제간, 그리고 산·학·연간 기술교류 노력을 통한 바이오나노기술 개발이 절실히 요구된다.
■ 제 4장 분야별 연구개발 및 관련산업 현황 제 4절 농림생명공학 |
![]() 우리나라 농업생명공학 연구의 시작과 주요 연구개발 분야
우리나라 농업생명공학 연구의 시작과 주요 연구개발 분야
정부는 1980년대 초에 생명공학 연구개발을 위한 정책적 및 재정적 지원을 시작하였다. 1983년에는 생명공학육성법 제정에 의한 법률적 지원근거를 마련하였고 2000년에는 생명공학 연구개발을 위한 Biotech2000 계획을 수립하여 생명공학분야 연구개발을 적극적으로 지원 육성하고 있다. 연구개발 주체는 농림부, 과학기술부, 농촌진흥청, 대학 및 일부 산업체 등이 중심이 되어 수행하고 있으며, 유전체 연구 등 기반기초 연구 분야에서부터 유전자변형 작물의 개발 및 실용화를 위하여 산·학·연 공동협력연구에 의한 생명공학기술의 농업적 이용연구를 수행하고 있다.
생명공학기술을 농업연구에 적용하기 위한 최초의 전문연구실은 1983년에 농촌진흥청 농업기술연구소(현 농업과학기술원)가 설치한 유전공학연구실이었으며, 1986년에는 농업기술연구소 생물부에 유전공학과로 확대설치하였다. 현재에는 농업생명과학대학 또는 관련대학에서도 생명공학 관련학과 또는 전공을 설치하여 인력양성과 연구를 수행하고 있다.
국내에서 농업분야 적용 목적으로 수행 중인 주요 생명공학 연구개발 분야는 동·식물 및 농용미생물의 유전체정보 해독과 기능해석 연구, 신규 유전자 개발과 형질전환에 의한 유전자변형 생물체 개발, 그리고 생명공학기술 산물의 식품 소재화 및 안전성 확보 연구 등으로 구분할 수 있다.
가. 농생물 유전체 연구
농촌진흥청 연구팀이 벼 유전체 해독을 위한 국제공동연구프로그램의 벼 염색체의 염기서열 완전 해독작업에 참여하는 것을 시작으로 배추 등 작물과 돼지, 벼흰잎마름병원균 등 동식물 및 미생물 유전체 해독연구를 수행하였거나 수행 중에 있다. 유전체 염기서열 해독 기술은 급속히 발전하였으며 게놈 내의 유전자 기능해석을 위한 기반연구가 활발히 수행되고 있다.
나. 유전자변형 생물체 개발 연구
유용유전자의 개발과 유전자변형 작물의 주요 개발목표는 생산성 향상, 노동력 절감에 의한 생력1) 농업, 친환경 농업 실현, 농산물 성분개선 및 품질 향상 등이며, 근래에는 식물 및 동물 등 농생물을 이용한 의료용 단백질 등과 바이오에너지 생산 소재를 개발하기 위한 연구도 추진하고 있다.
다. 생명공학 기술 이용 식품 이용 연구
우리나라에서 개발하여 상품화한 생명공학기술 적용 식품 또는 식품소재가 상업화된 경우는 아직 없는 실정이며 정부 부처별로 연구개발 정책을 수립하여 정책적 재정적 지원을 하고 있다. 식품의약품안전청은 몬산토 및 아벤티스 등 다국적 기업들이 개발하여 상업화한 제품의 국내시장 판매를 위한 식품안전성 심사를 실시하여 승인하고 있고, 농촌진흥청은 생명력을 가진 유전자변형 작물(LMO)의 환경방출에 대비하여 개발자가 제시한 환경위해성 평가 자료를 심사하여 승인함으로써 유전자변형 식물의 우리나라 생태계에 미칠 수도 있는 부정적 영향을 사전에 평가한다.
![]() 농생물 유전체 해독 연구
농생물 유전체 해독 연구
가. 벼 유전체 해독 연구
일본 벼 게놈연구사업단(RGP) 및 미국의 주도로 1998년에 벼 염색체 염기서열 완전해독 국제공동연구단(IRGSP)이 우리나라를 비롯한 11개 국가와 국제컨소시엄이 구성되었고, 10개국 14개 연구팀이 참가하여 2004년 12월까지 6년간 총사업비 약 2000억 원의 연구를 수행하였다. 우리나라에서는 농촌진흥청 농업생명공학연구원 연구팀(책임자 한장호)이 참가하여 유전체 해독의 기반을 확보하였다.
해독대상 벼 품종은 일본형인 니폰바레(Oryza sativa L. ssp. japonica cv. Ni-ppon-bare)를 이용하였고, 전체 12개 염색체의 389Mb 염기쌍 중에서 현재 기술로 해독 가능한 약 95%인 370Mb 염기서열을 높은 정밀도(99.99%)로 해독하여 유전자 지도와 함께 정보 공개하였다(Nature v436: 793-800, 2005년 8월). 해독 결과 37,544개의 유전자를 확인하였으며 그 중 2,859개 유전자는 벼 고유의 유전자인 것으로 밝혀졌으며, 일본형 벼와 인도형 벼 간의 차별적인 유전체변이 80,127개 유전자의 변이정보를 발굴하였고 단일염기변이(SNP) 빈도는 0.53~0.78%로서 애기장대(Arabidopsis thaliana)의 20배에 달하였다.
유전체 해독 연구결과를 이용하여 금후에는 벼 유전자 기능 연구를 통한 유용 유전자 발굴 강화하여 고품질, 환경 내성, 병 해충저항성, 기능성 유전자 개발연구를 수행할 수 있게 되었고, 벼, 밀, 보리 등 화본과 작물간의 유전자 변이 및 진화 연구를 위하여 유전체 진화, 종 분화 및 적응 등을 연구할 수 있고 종내 유전자 변이는 분자 마커로 개발하여 육종기술로 활용할 수 있다.
나. 배추 유전체 해독 연구
농촌진흥청 농업생명공학연구원(책임자 박범석)은 배추(Brassica campestris rapa. pekinensis cv. Chiifu)의 유전체 완전해독을 위한 1단계 사업(2004-2008)을 확정하고 한국, 영국 등 10여개 국가들과 협의체를 구성하였다. 배추의 전체 게놈 크기는 약 550Mb로 추정되며 한국은 크기가 약 77Mb로 추정되는 1번 염색체외에도 2번 염색체의 유전체 해독을 수행하고 있다. 배추 유전체 해독에 의하여 생육 및 분화발달에 관여하는 유전자들과 무사마귀병 및 무름병 등 병 관련 유전자를 분리하여 생산성 향상과 내병성 육종 등에 활용할 수 있다.
다. 돼지 유전체 해독 연구
이종장기 생산 등 인체적용 범위가 넓은 돼지의 유전체 해독을 위하여 2004년부터 2006년까지 3년 기간의 국제컨소시엄이 한국, 미국, 영국, 프랑스, 캐나다, 중국, 독일, 덴마크, 일본 등 9개국으로 구성되었다. 우리나라에서는 농촌진흥청 축산연구소 연구팀(책임자 오성종)이 주축이 되어 경상대, 건국대, 한국생명공학연구원 등이 참여하고 있다. 돼지의 전체 게놈사이즈 약 3,000 Mb(3Gb) 중 우리나라 연구팀은 전체의 2%(60Mb)를 연차별로 1년차 20%, 2년차 60%, 그리고 3년차 20% 예정으로 해독을 담당하고 있다.
돼지의 유전체 해독 연구를 통하여 유전체 정보의 선점으로 원천기술 확보 및 산업적 활용기술 개발 가능하고 한국 재래돼지의 유전체 정보와 비교분석을 통해 창의적이고 독점적인 기술 개발 기초자료 확보가 가능하다.
라. 벼흰잎마름병원균 유전체 해독 연구
농촌진흥청 농업생명공학연구원(책임자 이병무)은 벼흰잎마름병원균인 Xan--tho-monas oryzae pv. oryzae의 유전체 완전해독 연구를 2001년부터 2004년까지 3년간 수행하여 유전체 완전해독 정보를 국제유전자은행(NCBI)에 등록(등록번호 AE013598, 2004)하였다. 벼흰잎마름병원균의 게놈크기는 4.94Mb로서 유전자수는 4,637개인 것으로 확인되었으며, 유전체 해독정보를 이용한 유전자 기능분석 연구를 수행하여 관련 정보에 대한 지적재산권을 조기 확보하기 위하여 미국, 프랑스 등과 국제공동연구를 추진 중에 있다.
마. 벼세균성알마름병원균 유전체 해독 연구
과학기술부 21C프론티어사업 작물기능유전체연구사업단과 서울대학교 농업생명과학대학(책임자 황인규)은 벼세균성알마름병원균인 Burkholderia glumae의 유전체 완전해독 연구를 2001년부터 2004년까지 수행하여 유전체 완전해독 정보를 공개하였다. Burkholderia glumae는 chromosome 2개, plasmid 4개로 구성되어 있으며 게놈 크기는 7.2 Mb이며 확인한 유전자 수는 6000여개로 추정되었다. 유전체 정보를 확보함으로써 병원성에 가장 중요한 요인을 밝히고 관련 유전자 기능 연구를 통하여 병원성 지배요인 조절물질 개발을 통한 저항성 벼를 육성할 수 있고, 생물무기에도 이용될 수 있는 인체병원균인 Burkholderia pseudomallei, B. mallei의 중요 유전자 기능연구에 모델 균으로 사용하여 인체 및 식물 병원균의 반응 연구를 위한 Burkholderia universal DNA칩 개발도 가능할 수 있다.
바. 벼도열병원균 유전체 해독 연구
서울대학교 농업생명과학대학(책임자 이용환)에서는 한국, 미국, 영국, 프랑스 등과 함께 벼도열병원균 국제컨소시엄에 1999년부터 2004년까지 주도적으로 참여하여 전체 게놈크기가 38Mb에 달하는 벼도열병원(Magnaporthe grisea)의 7개 염색체의 유전체 정보를 해독 완료하였다. 유전체 해독 결과 11,109개의 유전자를 확인하였으며 우리나라 연구팀은 신호전달체계 및 전사인자에 관한 분석을 주도적으로 담당하였다. 이 연구결과는 금년에 공개된 벼 유전체 염기서열 정보를 활용하여 기주와 병원균간의 식물병 발생 및 방어 메커니즘을 밝히는데 모델이 될 것이며 병저항성 품종을 육성하고 환경친화적 병 방제기술개발 기반이 될 것이다.
![]() 생명공학기술을 이용한 유전자변형 농생물체 개발 연구
생명공학기술을 이용한 유전자변형 농생물체 개발 연구
가. 유전자변형 작물 연구개발 현황
현대 분자생물학 기술을 적용한 작물의 유전적 특성개량을 위한 생명공학연구는 유용 신규 유전자 개발과정과 이들 유전자를 작물에 형질전환하여 유전자변형 작물을 개발하는 연구와 주요 형질을 효과적으로 선발할 수 있는 분자마커 개발 등으로 구분할 수 있다. 농업생명공학 연구는 주로 농진청 등 국가연구기관과 대학, 그리고 정부부처가 지원하는 연구개발과제 및 특성화연구사업단 등에서 이루어지고 있으며 연구개발 과정이나 성과 등을 효율적으로 관리하고 있다.
(1) 농촌진흥청의 연구개발 현황
농촌진흥청은 생명공학기술을 이용한 우량작물을 개발하기 위하여 농업생명공학연구원을 중심으로 소속기관별로 기반기술 및 실용화를 위한 연구개발을 수행하고 있으며, 동시에 산·학·연 협동연구개발을 지원하기 위하여 바이오그린21 출연금사업을 수행하고 있다. 농촌진흥청 소속연구기관에서 연구개발 중인 형질전환 식물체는 18작물 45종(2005년 10월 현재)이며 이들 작물 중 형질전환 도입유전자의 기능발현이 확인된 유전자변형 작물은 약 9작물 23종류인 것으로 집계되고 있으며 이중 안전성평가 연구 중인 작물은 4작물 4건이다<표 4-4-3-1>.
<표 4-4-3-1> 농촌진흥청이 개발 중인 주요 유전자변형작물 현황 | |||
작 물 | 기 능 | 형질전환 식물체 실험단계 | |
도입유전자 기능 확인 | 안전성 평가 단계 | ||
벼 | 광합성능력 향상 | ○ | |
라이신함량 증진 | ○ | ||
제초제(근사미) 저항성 | ○ | ||
해충(혹명나방) 저항성 | ○ | ||
벼멸구 저항성 | ○ | ||
흰잎마름병 저항성 | ○ | ||
제초제(바스타) 저항성 | ○ | ||
고추 | 제초제(바스타) 저항성 | ○ | |
상추 | 전분 조절 | ○ | |
감자 | 재해 저항성 | ○ | |
철분 강화 | ○ | ||
제초제(바스타) 저항성 | ○ | ||
내병성 | ○ | ||
바이러스 저항성 | ○ | ||
세균병 저항성 | ○ | ||
배추 | 좀나방 저항성 | ○ | |
웅성불임성 | ○ | ||
양배추 | 웅성불임성 | ○ | |
토마토 | 바이러스 저항성 | ○ | |
들깨 | 제초제(바스타) 저항성 | ○ | |
비타민 E 강화 | ○ | ||
박 | 제초제(바스타) 저항성 | ○ | |
칼슘이온 흡수 촉진 | ○ | ||
출처: 농촌진흥청 2005 국정감사 자료 발췌 | |||
<표 4-4-3-2> 바이오그린21사업 제1단계 주요 결과 요약 | ||
구 분 | 2003 | 2004 |
유전자변형 작물 | 왜성유전자(AP1, AG) 형질전환 사과 | 플라보노이드 생산 벼 |
EREBP C-3와 bZIP TF 유전자 형질전환 고추 | 내건성 형질전환 토마토 (ABF3) | |
돼지 설사병균 Rotavirus 항원유전자 VP-6 형질전환감자 | QTLs 분자마커 우량계통 선발 (벼멸구저항성, 도열병저항성, 벼흰잎마름병저항성, 일장반응, 웅성불임성) | |
유전자, 프로모터 및 마커 | 분화 및 발달 조절 옥신결합 단백질 유전자(ABP57) | 점박이응애의 페리스로이드 저항성 유전자 |
광생리 조절기능이 개선된 파이토크롬 변이유전자 | 저온저항성유전자 (AtCTF1) | |
돼지 설사병균 (Rotavirus)의 항원유전자 3종 | 배추 유관속 특이 프로모터 | |
도열병에 의해 매우 초기에 유도 발현되는 것으로 알려진 OsERG1 | 참깨 유래 종자특이 발현유전자(SeFAD2) 프로모터 | |
DNA binding protein EREBP C-3와 bZIP TF 유전자 | 배추 화분특이 프로모터 | |
살충제저항성 AChE 유전자 | 들깨 유래 종자특이 발현유전자 (PfFAD3) 프로모터 | |
출처: 농촌진흥청 바이오그린21사업단 제공
바이오그린21사업은 2001년부터 2004년까지 4년간 제1단계사업을 수행하였고 2003년도 125과제(191억원)를 수행하였고 2004년도에는 151과제(256억원)를 수행하였다. 사업 수행 결과 2003년도 81건의 특허 출원(등록2건 포함), 2004년도 130건의 특허 출원(등록22건 포함) 성과를 거두었으며 주요 결과를 요약하면 <표 4-4-3-2>와 같다.
(2) 국립산림과학원 연구개발 현황
산림청 국립산림과학원은 수목류를 이용한 중금속류 오염토양 환경정화와 환경재해저항성 수목 개발을 위한 생명공학연구를 수행하고 있다. 2003년도 9과제, 2004년도 11과제의 관련 시험연구사업을 수행하여 18건의 특허를 출원하여 그 중 7건의 등록을 마쳤다<표 4-4-3-3>.
(3) 농림기술관리센터 연구개발 현황
농림부 농림기술관리센터가 농특세원을 활용하여 수행하는 특정연구개발사업은 2003년도에 약 54억 원의 연구비 지원에 의하여 생명공학관련 71과제를 수행하였고, 2004년도에는 약 52억 원의 연구비로 67과제를 수행하였는데 2년 동안 13건의 특허와 형질전환 작물 및 제품 및 제법을 개발하였다. 주요 연구개발 결과를 요약하면 <표 4-4-3-4>와 같다.
<표 4-4-3-3> 국립산림과학원 주요 결과 요약
구 분 | 2003년도 | 2004년도 |
형질전환 식물체 | 구리대사 조절 유전자 (copper chaperon poCCH) 도입 포플러 | Osmotin 유전자 도입 포플러 |
Trehalose 합성 유전자(ots A) 포플러 | Cu/Zn SOD 유전자 도입 포플러 | |
Trehalose합성 유전자(otsB) 포플러 | Glutation S-transferase 포플러 | |
- | Protein kinase 유전자 포플러 | |
- | Steroid membrane 합성 유전자 도입 포플러 | |
제품 | 양고추냉이 정유를 이용한 저장물해충 방제제 | - |
출처: 국립산림과학원 제공
<표 4-4-3-4> 농림기술관리센터 수행 주요 연구결과 요약
구분 | 2003년도 | 2004년도 |
형질전환 생물체 | (SOD유전자 전환 가뭄 저항성 토마토 | 환경스트레스내성 벼 |
Ferritin 유전자전환 고농도 철단백 벼 | 안토시아닌 생합성조절유전자전환 벼 | |
Virus 유전자 형질전환을 이용한 CGMMV 저항성 수박 | 콩에서 분리한 스트레스 저항성 유전자 | |
제품 및 제법 | 폐효모를 이용하여 제조한 식물 면역활성제 | 느타리버섯 바이러스병 진단시약 |
초기 탄저감염 검정 바이오마커 | 바이러스 무병주 느타리버섯 | |
Rhizobacteria의 유도 저항성에 의한 식물병 방제 | 감자 더뎅이병을 억제하는 신규 바실러스 균주 | |
탄저균 치사독소에 대한 대식세포 반응유전자 분석방법 | 감자더뎅이병 억제 신규 바실러스균 생산 항생물질 및 이를 함유하는 미생물제제 |
출처: 농촌경제연구원 부설 농림기술관리센터 제공
(4) 작물유전체기능연구사업단 연구개발 현황
과학기술부 21C 작물유전체기능연구사업단은 2001년부터 2004년까지 제1단계 사업을 수행하였는데 신규 유용유전자, 형질전환 식물체 및 형질전환기술 등에 관한 특허 총 123건을 출원 및 등록하였고 이들 중 국내 특허는 94건, 국제특허는 29건이며 학술지 게재한 217편의 논문 중 SCI등재 저널에 게재된 논문은 144편이었다.
<표 4-4-3-5> 작물유전체기능연구사업단 제1단계 연구개발 성과요약
유용 유전자 | 활용 단계 | |
유전자기능 확인 | 형질전환 적용 단계 | |
뿌리 발달 촉진 Expansin 1 | ○ | |
작물 성장속도 촉진 histone deacethylase 유전자 | ○ | |
SGR 유전자 (stay green) | ○ | |
거대배아 쌀 선발용 마커 | ○ | |
형질전환 기술 | 실용화 적용 여부 | |
실용화 가능성 검증단계 | 실용화 단계 | |
고효율 고추형질전환 체계 | ○ | |
배추, 수박 등 채소 작물의 대규모 형질전환 체계 | ○ | |
RecA 유전자 이용 고효율 엽록체 형질전환 기술 | ○ | |
형질전환 작물 | 형질전환 식물체 실험 단계 | |
도입유전자 기능 확인 | 안전성 평가 단계 | |
가뭄, 냉해 등 환경 스트레스 저항성 벼 | ○ | |
역병저항성 고추 | ○ | |
출처: 작물유전체기능연구사업단 제공
나. 유전자변형 동물 개발 연구 현황
(1) 대학 및 기업의 연구동향
국내 대학 및 기업의 동물복제 및 형질전환 동물 개발 연구는 세계적으로 선진 수준에 이르러 있으며 이종장기 생산 및 의료용 물질 생산을 목적으로 활발한 연구를 진행하고 있다. 2003년부터 2005년까지 3년간 보고된 복제동물 및 형질전환 동물 생산 연구결과를 요약하면 <표 4-4-3-6, 4-4-3-7>과 같다.
<표 4-4-3-6> 국내 대학 및 기업의 복제 동물 생산(2003-2005)
복제 동물 | 형질전환 특성 | 개발 연도 | 연구기관 |
복제 돼지 | 조혈모생성촉진(EPO) 유전자 생산 체세포 복제방식. 성장과정 중 털과 피부색 변함 | 2003 | 경상대 |
복제 고양이 | 수컷 체세포 핵을 난자에 이식 | 2004 | 순천대 |
개 | 수컷 체세포 핵을 난자에 이식(스너피) | 2005 | 서울대 |
생쥐 | 정자 없이 난자로만 수정(아빠 없는 생쥐) | 2004 | 마크로젠 |
출처 : 생명공학정책연구센터 기술동향 2005-4
<표 4-4-3-7> 국내 대학 및 기업의 형질전환 동물 생산(2003-2005)
형질전환 동물 | 형질전환 특성 | 개발연도 | 연구기관 |
형광 닭 | 녹색형광 유전자 유정란에 주입 (바이러스 벡터) | 2004 | 가톨릭의대, 건국대, 건국대, 축산연구소 |
무균 미니돼지 | 인간의 면역유전자(hDAF)가 조절된 형질전환 | 2004 | 서울대 |
돼지 | 면역 거부 유전자 “GGAT1”을 체세포 배양단계에서 제거, 초급성 면역거부 반응을 없앰 | 2002 | 엠젠바이오 |
돼지 | 녹색형광 유전자 형질전환 돼지 “형광이” | 2003 | 엠젠바이오 |
생쥐 | 당뇨병 모델 생쥐 | 2004 | 마크로젠 |
출처: 생명공학정책연구센터 기술동향 2005-4
(2) 농촌진흥청 축산연구소 연구개발 현황
농촌진흥청 축산기술연구소에서는 한우, 돼지 및 닭 등 가축의 복제 및 형질전환 연구를 1998년부터 수행하고 있으며 2003년도 2과제 11세부과제, 2004년도 2과제 10세부과제, 그리고 2005년도 2과제 12세부과제의 생명공학관련 연구를 수행하고 있으며 그 결과를 요약하면 <표 4-4-3-8>과 같다.
<표 4-4-3-8> 농촌진흥청 축산연구소 복제동물 및 형질전환 동물 생산 연구 결과 요약
구분 | 2003 | 2004 | 2005 |
복제 동물 | 우량형질 한우 복제 | 태아섬유아세포 복제 | - |
태아섬유아세포 복제 | - | - | |
계 1종 5건 | 계 1종 1건 | - | |
형질전환 동물 | 혈전증치료제(mUPII-tPA, b-beta-casein-tPA)생산 돼지 4두 생산 | 혈우병치료제(b-alfa-s1-vWF) 생산 돼지 | 빈혈치료제(EPO) 생산 돼지 |
- | 혈우병치료제생산돼지 | 혈우병치료제생산돼지 | |
- | 형광 닭 | 혈전증치료제생산돼지 | |
- | - | 형광 닭 증식 | |
계 1종 4두 | 계 3종 25두 | 계 4종 63두 | |
지적재산권 (출원/등록) | 국내특허 등록 1건 | 영국 특허등록 1건 | 국내특허출원 1건 |
출처: 농촌진흥청 축산연구소 제공
![]() 생명공학기술 이용 식품개발 현황
생명공학기술 이용 식품개발 현황
가. 우리나라의 연구개발 현황
생명공학기술을 이용하여 국내에서 개발하여 상품화한 식품 또는 식품소재는 없는 실정이며 농림부, 과학기술부, 보건복지부, 그리고 농업진흥청 등에서 연구개발 사업을 수행 및 지원하고 있다. 농림부에서는 농림기술관리센터를 통하여 기능성식품 및 소재개발 연구과제를 기획 및 지원하고 있고, 과학기술부는 한국과학기술정책연구원을 통하여 기능성 식품소재, 바이오디스커버리, 바이오챌린저 사업 등 연구개발과제를 지원하고 있다(현재는 한국과학재단이 수행). 보건복지부는 보건의료기술연구개발사업, 미래보건산업기술예측사업을 통하여 연구개발을 지원하고 있으며, 식품의약품안전청 연구개발사업에서는 유전자재조합 식품의 평가기술의 개발 및 안전관리에 관한 사항을 확립하기 위한 사업을 추진하고 있다. 농촌진흥청은 농업진흥청 시험연구사업, 바이오그린21사업을 통하여 산·학·연공동연구에 의한 연구개발을 지원하고 있다.
나. 생명공학 기술 이용 식품의 심사 승인 현황
유전자재조합식품의 국내생산 및 판매를 위해서는 식품의약품안전청이 시행중인 유전자재조합식품 식품첨가물 안전성평가 자료심사지침에 의한 안전성 심사를 받아야한다. 2005년 10월 현재 식품의약품안전청의 안전성 심사승인 현황을 보면 11종의 유전자재조합 식품첨가물에 대한 심사가 완료된 상태이며<표 4-4-4-1>, 42종의 유전자재조합 원료농산물에 대한 유전자재조합 원료농산물의 식품안전성심사 신청이 접수되어 2005년 10월 현재 35종에 대한 식품안전성 심사가 완료되었다<표 4-4-4-2>.
<표 4-4-4-1> 유전자재조합식품첨가물의 식품안전성 심사완료 현황
번호 | 제 품 | 신청자 | 특 성 |
1 | Maltogenic amylase | Novo Nordisk | Amylase |
2 | Termamyl | Novo Nordisk | Amylase |
3 | PromozymeD | Novo Nordisk | pullulanase |
4 | Lipozyme RM IM | Novo Nordisk | lipase |
5 | Novoshape | Novo Nordisk | pectinesterase |
6 | Riboflavin | Roche | Vitamin |
7 | Maturex L | Novozymes Korea | α-acetolactate decarboxylase |
8 | lecitinase ultra/lipopan H BG | Novozymes Korea | lipase |
9 | lecitinase Novo/lipopan F BG | Novozymes Korea | lipase |
10 | Optimax L-1000 | (주)옥전바이오텍 | pullulanase |
11 | Lipopan 50BG/lipozyme TL IM | (주)노보자임스 코리아 | lipase |
출처: 식품의약청. 2005년 10월 현재
<표 4-4-4-2> 유전자재조합농작물의 식품안전성 심사완료 현황
번호 | 분류 | 제 품 | 신청자 | 특 성 |
1 | 콩 | RRS | (주)몬산토코리아 | 제초제내성 |
2 | 옥수수 | MON810 | (주)몬산토코리아 | 병충해저항성 |
3 | 옥수수 | 1507 | (주)유한회사 듀퐁 | 병충해저항성 |
4 | 옥수수 | GA21 | (주)몬산토코리아 | 제초제내성 |
5 | 옥수수 | NK603 | (주)몬산토코리아 | 제초제내성 |
6 | 옥수수 | Bt11 | (주)신젠타 종묘 | 병충해저항성 |
7 | 면화 | 531 | (주)몬산토코리아 | 병충해저항성 |
8 | 면화 | 757 | (주)몬산토코리아 | 병충해저항성 |
9 | 면화 | 1445 | (주)몬산토코리아 | 제초제내성 |
10 | 캐놀라 | GT73 | (주)몬산토코리아 | 제초제내성 |
11 | 옥수수 | T25 | 아벤티스 | 제초제내성 |
12 | 면화 | 15985 | (주)몬산토코리아 | 병충해저항성 |
13 | 옥수수 | MON863 | (주)몬산토코리아 | 병충해저항성 |
14 | 옥수수 | Bt176 | 신젠타 종묘 | 병충해저항성 |
15 | 감자 | SPBT02-05 | (주)몬산토코리아 | 콜로라도 감자벌레 저항성 |
16 | 감자 | RBBT06 | (주)몬산토코리아 | 콜로라도감자벌레 저항성 |
17 | 감자 | Newleaf Y(RBMT15-101, SEMT15-02, SEMT15-15) | (주)몬산토코리아 | 콜로라도감자별레 및 감자바이러스 Y저항성 |
18 | 감자 | Newleaf PLUS(RBMT21-129, RBMT21-350, RBMT22-82) | (주)몬산토코리아 | 콜로라도감자벌레 및 leafroll 바이러스저항성 |
19 | 옥수수 | DLL25 | (주)몬산토코리아 | 제초제내성 |
20 | 옥수수 | DBT418 | (주)몬산토코리아 | 해충저항성 |
21 | 면화 | 281/3006 | (주)다우아그로사이언스 | 제초제내성 및 해충저항성 |
22 | 옥수수 | MON863×NK603 | (주)몬산토코리아 | 제초제내성 및 해충저항성 |
23 | 옥수수 | MON863×MON810 | (주)몬산토코리아 | 해충저항성 |
24 | 옥수수 | MON810×GA21 | (주)몬산토코리아 | 제초제내성 및 해충저항성 |
25 | 옥수수 | MON810×NK603 | (주)몬산토코리아 | 제초제내성 및 해충저항성 |
26 | 옥수수 | 1507×NK603 | (주)유한회사 듀폰 | 해충저항성 및 제초제내성 |
27 | 옥수수 | MON810×Mon863 ×NK603 | (주)몬산토코리아 | 제초제내성 및 해충저항성 |
28 | 캐놀라 | Ms8/Rf3 | (주)바이엘크롭사이언스 | 제초제내성 |
29 | 캐놀라 | T45 | (주)바이엘크롭사이언스 | 제초제내성 |
30 | 옥수수 | DAS-59122-7 | (주)유한회사 듀폰 | 제초제내성 및 해충저항성 |
31 | 면화 | 15985×1445 | (주)몬산토코리아 | 해충저항성 및 제초제내성 |
32 | 면화 | 531×1445 | (주)몬산토코리아 | 해충저항성 및 제초제내성 |
35 | 캐놀라 | MS1/RF1 | (주)바이엘크롭사이언스 | 제초제내성 |
36 | 캐놀라 | MS1/RF2 | (주)바이엘크롭사이언스 | 제초제내성 |
37 | 캐놀라 | Topas 19/2 | (주)바이엘크롭사이언스 | 제초제내성 |
출처: 식품의약청. 2005년 10월 현재
■ 제 4장 분야별 연구개발 및 관련산업 현황 제 5절 환경생명공학 |
![]() 서론
서론
가. 환경생명공학의 정의
환경생명공학(Environmental Biotechnology)이란 환경공학(Environmental Techn-ology, ET)과 생명공학(Biotechnology, BT)이 융합된 합성어로써 오염원으로부터 환경을 보전하고 환경을 효율적으로 관리하기 위해 생명공학기술을 이용하는 학문을 말한다. 생명공학기술은 21세기의 새로운 혁신기술로 각광을 받고 있으며 환경공학, 의학, 농학, 식품영양학 등 기존의 여러 학문들과 융합되어 빠르게 발전되고 있다. 특히 환경생명공학은 자연친화적으로 오염물질을 정화할 수 있는 기술뿐만 아니라 경제적으로도 비교적 저렴하게 오염원을 탐지·측정하는 기술, 환경을 원래 상태에 가깝게 복원시키는 기술 및 환경에 대한 오염원의 영향을 평가하는 기술을 모두 포함한다.
나. 환경생명공학 기술개발의 필요성
환경오염 관리를 위해 지금까지 이용되어 오던 오염관리기술들은 산업발달 및 소비증가로 인한 오염물질의 기하급수적인 증가를 효과적으로 제어하는 데에는 한계가 있음이 드러나고 있다. 따라서 점증하는 오염원에 대한 환경친화적이고도 경제적인 관리는 물론 배기가스의 총량을 국제적으로 관리하기 위한 쿄토의정서와 같은 전 지구적 규모의 환경협약 등에 능동적으로 대처하기 위해서는 기존 오염관리기술의 한계를 극복할 수 있는 환경생명공학기술의 개발을 통한 국가적 차원의 새로운 오염대처 방안의 수립이 절실히 요구되고 있다.
![]() 연구개발현황
연구개발현황
가. 국제 동향
환경생명공학은 생명공학기술을 이용하는 대표적인 학문인 ‘단백질체학 (Pro-teomics: 기능성단백질의 합성에 대하여 연구하는 학문)’와 더불어 산업적으로 활발히 이용되고 있어 ‘백색생명공학(white biotechnology)’이라 불리고 있으며 지속가능한 개발과 보다 건강한 자연환경을 만들기 위한 응용과학으로 발전하고 있는 분야이다.
생명공학과 관련된 산업을 통칭하여 ‘생물산업(Bioindustry)’이라 하는데, Mc-kin-sey & Company사의 2001년 보고서에 의하면 전 세계 화학제품 시장의 약 5%를 생물산업에서 생산된 제품들이 차지하고 있으며 2010년까지 이 비율은 20%까지 증가될 것으로 전망하였다. 이것은 금액으로 약 2천8백억 달러에 이르는 것이다. 한편 2002년 Leslie Burk가 조사한 보고서에는 2001년도 환경생명공학산업의 시장규모를 약 250억 달러에 이르는 것으로 보고하고 있으며 이중 복합미생물제품이 차지하는 시장 규모가 46%로 가장 큰 것으로 나타났다.
국제적으로 활발히 연구가 진행되고 있는 환경생명공학분야 중에 대표적인 분야로는 i) 석유화학성분이 첨가되지 않고 쉽게 자연분해가 가능한 바이오플라스틱, 바이오연료, 인공섬유의 제조분야와 ii) 식물 및 미생물을 이용한 폐기물 및 오염물질의 저감·제어 분야인 ‘생물학적정화(Bioremediation)’ 분야를 들 수 있다.
이중에서도 특히 생물학적 정화분야는 백색생명공학에서도 핵심적인 연구 분야로서 지속가능한 발전을 위해서 절실히 요구되는 기술분야이다. 생물학적 정화는 i) 독성물질을 미생물과 식물 등을 이용하여 제거하는 분야와 ii) 이러한 생물들이 가진 기능성 유전자를 유전자변형기술을 이용하여 다른 생물에 도입하는 분야로 다시 나눌 수 있다.
독성물질들 중에 자연친화적 관리연구의 대상이 되는 오염물질들은 방출되면 생태계에 축적성이 매우 높은 수은, 납, 아연, 니켈, 비소 등의 중금속들이다(UNU-IAS, 2005). 박테리아들 중에는 metallothionein과 같은 metal-binding protein을 함유하고 있어 중금속에 오염된 환경에서도 잘 생존할 수 있고 중금속을 생체 내에 흡수할 수 있는 박테리아들이 있으나 자연 상태에서 쉽게 배양할 수 있는 종들은 매우 드물다. 미국 코넬대학의 연구팀은 metallothionein의 유전자를 잘 알려진 대장균인 Escherichia coli에 도입하는데 성공하였다. 이러한 연구를 통하여 대량으로 배양된 metallothionein의 유전자를 가진 Esche-richia coli들은 생물학적 정화시설에서 수은에 오염된 수질을 수은이 거의 포함되지 않는 물로 정화할 수 있다. 생물학적 정화중에서 식물을 이용하는 방법을 ‘식물정화(Phytoremediation)’라고 한다. 미세조류(micro-algae)나 대형조류(macro-algae)를 이용하여 하천 및 폐광지역의 중금속 및 오염물질을 흡수하고, 나중에 이들을 건조, 소각하여 남겨진 중금속을 재이용 하는 방법들이 미국, 캐나다, 프랑스, 호주, 남아프리카공화국 등 여러 나라에서 시도되고 있다(UNU-IAS, 2005). 미국에서는 이미 위와 같은 방법이 여러 회사들에 의해 2002년부터 상업화되고 있으며 그 잠재시장규모는 2004년 현재 미화 약 100만 달러에 이를 것으로 전망된다.
환경생명공학에 대한 전문적인 학회들도 1990년대 초부터 만들어지기 시작하였으며 대표적인 학회로는 ‘국제환경생명공학회(International Society for Envi-ronmental Biotechnology)’를 들 수 있다. 이 학회에서는 지속가능한 발전을 위한 환경생명공학기술에 대한 정보를 공유하기 위해 1992년부터 2년마다 국제학술 심포지엄을 개최하고 있으며 2004년 미국 시카고에서 제7차 국제환경생명공학심포지움이 개최된 바 있다.
나. 국내 현황
우리나라의 생명공학기술 분류체계에서 환경생명공학기술은 유전공학기술 및 단백질공학기술과 함께 13개의 대분류 항목 중의 하나로 분류 되고 있으며 청정기술을 포함한 4개의 중분류 기술이 여기에 포함된다<표 4-5-2-1>.
그러나 기술이 발달함에 따라 여러 기술들이 서로 융합되어 발전하고 있어 기술 간의 구분이 점차 미약해져가고 있는 것이 현실이다. 일례로 대분류에 속하는 생물전자공학기술(Bioeletronics)의 하나인 바이오센서 제작기술(Bio-sensor Fabrication) 역시 환경생명공학기술의 환경오염제어 및 관리기술의 오염원의 감지 및 측정에 이용될 수 있다. 우리나라의 생명공학 관련연구 분야들 중에서 환경생명공학에 대한 연구는 상대적으로 그리 활발하게 진행되지 못한 것이 사실이다. 하지만 유전자변형생물체의 환경위해성 관리에 대한 필요성이 강력히 제기됨에 따라 2002년 환경부는 국립환경과학원 내에 유전자변형생물체 환경위해성 심사단을 조직하였고 지금까지 환경위해성 관리에 대한 정책연구와 환경생명공학을 이용한 환경정화용 유전자변형생물체에 대한 연구를 실시해 오고 있다. 한국생명공학연구원 내의 환경생명공학연구실에서도 5년째 식물을 이용한 환경정화 연구를 계속해오고 있으며 고구마에서 황산화 효소의 유전자를 만드는 물질을 분리해 내는 성과를 내기도 하였다. 또한 최근 포항공대 생명과학과 이영숙 교수팀은 중금속을 흡수하는 유전자를 효모로부터 추출하는데 성공하였다.
<표 4-5-2-1> 환경생명공학 기술 분류표 (기술표준원, 2004) | ||
국문명 | 영문명 | |
대분류 | 환경생명공학기술 | Environmental Biotechnology |
중분류 | 청정기술 공정관련 청정기술 생물농약개발기술 생분해성 소재 생산기술 청정 유기용매 개발기술 | Clean Technology Process-related clean technology Biological agrochemicals development Biodegradable material production Bio-based solvent technology |
환경오염제어 및 관리기술 대기오염제어 및 처리기술 수질오염제어 및 처리기술 토양오염제어 및 복원기술 폐기물 처리기술 환경오염측정 분석기술 환경계측 및 제어기술 생태계복원기술 | Environmental pollution control and management technology Air pollution control and processing Water pollution control and processing Soil pollution control and remediation Waste processing Environmental measurement and analysis Environmental assessment and control Ecosystem restoration | |
바이오에너지기술 바이오에탄올 생산기술 I (전분질계 생체) 바이오에탄올 생산기술 II (섬유소계 생체) 바이오디젤생산기술 바이오가스생산기술 바이오가스이용기술 바이오수소생산기술 | Bioenergy Technology Bioethanol production I (Starch biomass) Bioethanol production II (Lignocellulosic biomass) Biodiesel production Biogas production Biogas utilization Biohydrogen production | |
달리 분류되지 않는 환경생명공학 기술 | Environmental Biotechnology, n.e.s. | |
생명공학기술을 이용하는 생물산업의 국내 총생산액은 2003년 약 2조7백9십억 원이며 이중 환경생명공학기술을 주로 이용하는 생물환경산업이 차지하는 비율은 약 4.43%인 921억 원으로 조사되었다. 생물환경산업제품의 수입액도 생물산업제품 전체 수입액의 0.04%인 2억1천만 원에 지나지 않았다. 이에 비해 생물환경산업을 주력 업종으로 하는 산업체의 수는 2003년 현재 약 74곳으로 전체 생물산업체 605곳의 12.2%로 나타나 산업체당 생산액이 전체 생물산업체의 평균에 못 미치는 것으로 나타났다.
<표 4-5-2-2> 중분류 환경생명공학기술별 생산된 상품의 수(기술표준원, 2004) | |||||||||
상품 중분류기술 | 청정 기술 | 공정관련 청정기술 | 생물농약개발기술 | 생분해성 소재생산기술 | 대기오염 제어 및 처리기술 | 수질오염 제어 및 처리기술 | 폐기물 처리기술 | 환경계측 및 제어기술 | 생태계 복원기술 |
바이오화장품 및 생활화학제품 | 1 | ||||||||
생물농약 및 비료 | 2 | ||||||||
기타 생물 화학 제품 | 1 | ||||||||
환경 처리용 미생물 | 1 | 2 | 9 | 3 | 2 | ||||
미생물 고정화 소재 및 설비 | 1 | 6 | 1 | ||||||
생물환경제제 및 시스템 | 1 | 1 | 1 | 1 | 1 | 2 | |||
환경오염 측정시스템 | 1 | 1 | 2 | ||||||
환경건설시설 및 복원 사업 | 5 | 3 | 2 | ||||||
기타 생물환경제품 및 서비스 | 1 | ||||||||
기타 생물공정 및 기기 | 1 | ||||||||
총계 | 1 | 1 | 4 | 2 | 5 | 23 | 4 | 10 | 2 |
환경생명공학기술을 이용하여 생산되는 상품은 2003년 현재 총 9개 중분류 기술분야에서 51개 상품으로 나타났다<표 4-5-2-2>(기술표준원, 2004). 이중에서 환경처리용 미생물 상품이 17개로 가장 많았으며, 그 다음이 환경시설건설 및 복원사업 건수가 10개로 2번째로 많았다. 기술별로는 수질오염 제어 및 처리기술이 23건으로 산업적으로 가장 많이 이용되는 기술로 나타났다<표 4-5-2-2>.
<표 4-5-2-3> 생물환경산업 기업체 크기별 투자규모(기술표준원, 2004) 단위: 백만원 | |||||||
기업체수 | 기업연구개발총액 | 생물(환경)산업 연구개발비 | 생물(환경)산업 시설투자비 | ||||
총액 | 기업당 평균 | 총액 | 기업당 평균 | 총액 | 기업당 평균 | ||
생물산업 전체 기업체 | 605 | 1,269,102 | 2,098 | 341,854 | 565 | 133,005 | 220 |
생물환경산업체 | 74 | 74,121 | 1,002 | 13,280 | 179 | 1,987 | 27 |
1-10인 기업 11-50인 기업 51-500인 기업 501인이상 기업 | 30 34 7 3 | 5,090 13,645 12,046 43,340 | 170 401 1,721 14,447 | 2,709 7,538 1,787 1,246 | 903 222 255 415 | 219 1,153 600 5 | 7 34 86 1.7 |
투자면에서도 생물환경산업부분은 전체 생물산업의 기업별 평균투자액보다 크게 낮은 것으로 나타났다. 생물환경산업체의 관련 부분 연구개발비는 생물 산업체 전체평균의 약 31%였으며 관련부분 시설투자비는 이보다도 더 적은 생물산업체 전체평균의 약 12%에 그쳤다<표 4-5-2-3>.
![]() 발전방향
발전방향
미국, 캐나다, 호주 등 선진국을 중심으로 경제적이고 자연친화적으로 오염원을 정화할 수 있는 환경생명공학기술들이 활발히 개발되고 있으며 부가가치가 높은 상품으로 만들어지고 있다.
이에 비해 우리나라의 환경생명공학은 아직까지 초기단계에 머물러 있는 것이 사실이다. 이것은 생명공학기술을 이용하는 생물산업 부문에서 환경생명공학을 이용하는 생물환경산업의 기술 및 시설 투자규모가 매우 낮게 나타나는 것을 보면 쉽게 알 수 있다. 깨끗한 환경에서 생활하고자 하는 삶의 질 향상에 대한 욕구가 그 어느 때 보다 커지고 있으며 생명공학기술이 하루가 다르게 발전하고 있는 것을 고려할 때 환경생명공학기술은 그 어느 기술보다도 산업화 할 필요성이 높고 부가가치도 또한 매우 큰 기술이다.
특히 바이오센서 등을 이용하여 환경오염 정도를 측정하는 기술과 유전자변형식물 등을 이용한 중금속 등 축적성이 높은 오염원을 제거하는 기술 등이 각광받을 것으로 전망된다. 이러한 기술들은 유전자변형기술 등, 크고 작은 여러 가지 기술들이 함께 요구되는 분야로 산·학 공동연구나 산·학·연 공동연구를 통하여 기술개발 분야를 분담하는 것이 필요하다. 또한 산업화 이전에 자연생태환경에 미칠 수 있는 잠재적 위해성 등에 대하여 정확히 평가하는 과정도 필수적으로 요구된다.
■ 제 4장 분야별 연구개발 및 관련산업 현황 제 6절 해양생명공학 |
![]() 개요
개요
해양생명공학이란 해양생물이나 그들의 구성성분, 시스템(system), 프로세스(process), 기능 등을 연구하여 궁극적으로 인간복지를 위한 상품과 서비스를 제공하는 학문 혹은 산업을 말한다. 해양생물공학의 발전을 통해 우리는 해양생물자원생산의 증대를 통한 식량문제 해결, 질병치료 방법의 모색, 에너지 문제의 해결, 지구환경의 문제점 해결 등을 통한 삶의 질을 높일 수 있다.
![]() 해외 동향
해외 동향
최근 연구가 활발히 진행되고 있는 유전체연구 동향을 살펴봄으로써 해양생명공학 연구 동향을 살펴볼 수 있을 것이다. 2005년 11월 7일 현재 1,693개의 게놈 프로젝트가 진행되고 있고, 그 중 317개가 발표 완료되었고, 804건이 원핵생물, 549건이 진핵생물에 대해 유전체연구가 진행 중이다. 발표 완료된 연구 중 연구대상으로 세균이 226건으로 가장 높고, 고세균 및 바이러스는 각각 21건, 3건을 차지하며 나머지는 진핵생물이다. 이 중 해양생물은 52종이 완료되어 전체 완료된 생물종의 16% 정도를 차지하고 있다. 해양생물 52종 중에는 고세균 19종, 세균 21종, 바이러스 1종, 진핵생물 11종이고 자세한 내역은 다음 인터넷 주소에서 확인할 수 있다(www.tigr.org, www.sanger. ac.uk, www. genomesonline.org).
본 분석을 통해 유전체연구가 진행된 고세균 중 해양종이 유독 많은 부분(90%)을 차지하고 있는 점으로부터, 해양특이환경의 극한미생물이 새로운 유전자원으로서 매우 중요함을 알 수 있다. 또한 2003년도 10월 조사치에 비해 특히 해양 진핵생물에 대한 유전체연구가 많이 진행되어 이에 대한 관심이 높아지고 있음을 알 수 있다(과학기술부, 2003).
다음은 각 국별로 해양생명공학분야의 예산규모와 연구동향을 살펴보기로 한다.
가. 미국
해양생명공학에 대한 연구를 주도하고 있는 국가로서, 연방정부 차원에서 생명공학육성책인 「21세기를 위한 생명공학(Biotechnology for the 21st Century)」을 수립하였고, 해양생명공학을 4대 생명공학과제(해양생명공학, 농업, 환경, 생산공정) 중 하나로 선정하여 집중 지원하고 있다. 해양생명공학분야 개발 분야의 정부 투자예산 현황은 <표 4-6-2-1>과 같이 1999년도 현재 총액 규모 약 1.3억불에 이른다.
미국 해양생명공학 대표 연구기관 중 하나인 메릴랜드대학 해양생명공학센터(COMB: Center of Marine Biotechnology)는 미국 동부 볼티모어 내항에 위치한 1.6억 불짜리 최신 건물인 Columbus Center에 자리잡고 있으며 연구 분야는 아래와 같이 대별된다.
□ 양식 및 어류생명공학
·청게(Blue crab) 연구
<표 4-6-2-1> 기관별 미국 해양생명공학 분야 예산규모 단위: 백만 불(1999년도) | ||
기관 | 예산 | 비고 |
ONR | 5.6 | |
DOI | 2 | 2000년도 |
NIH | 100 | 기반구축 및 연구투자 |
NSF | 12 | |
NOAA | 10 | 연방정부: 2/3, 주정부: 1/3 |
출처: 2002, 생물산업, 15(2):16-18. | ||
·청게(Blue crab) 최신연구 콘소시움(BCARC)
□ 해양기능유전체학
□ 해양환경생명공학
□ 해양천연물
□ 해양미생물 및 극한미생물의 생명현상
2002년도 총 연구비 투자규모는 480만 불이고, 총 예산은 860만 불 규모이다. 연방정부 및 주정부 지원이 각각 45, 44%를 차지하고 있어 대부분을 차지하며, 나머지는 비영리기관 혹은 산업체에서 지원되는 예산이다. COMB에는 18명의 교수, 43명의 연구지원 인력, 32명의 학생 및 연수생, 31명의 객원과학자, 자원봉사자 등이고, 운영관리 인력 6명, 행정인력 10명으로 총 140명과 COMB에 속하지 않는 과학자 30명 등으로 모두 170명이 근무하고 있다. COMB의 특수 최신시설로는 DNA 합성, 염기해독, 정량분석장비, 극한미생물 배양장치, 생물안전등급 3의 실험실, 형질전환연구에 필요한 핵심시설 등이고, 해양과학과 생물공학의 혼합된 연구를 할 수 있는 능력이 있다는 특징이 있다. 또한 COMB이 자랑하는 해양수산동물을 키울 수 있는 완전 무방류 시스템인 최신 시설이 연구소 안에 500여 평 규모로 구비되어 있어 어패류생산 및 부화에 관한 기술개발을 용이하게 한다.
나. 일본
일본은 해양생명공학연구소(MBI: Marine Biotechnology Institute)와 해양연구개발기구(JAMSTEC: Japan Agency for Marine-Earth Science and Technology)가 21세기 국가 전략산업으로 해양생명공학 연구를 수행하는데 주도적인 역할을 하고 있다. 정부와 민간 기업이 출자하여 설립한 MBI에서는 최근 해양미생물연구에 새로운 전기를 마련하였다. 일명 “Green Biotechnology Program”이라 하여 일본 경제통상 산업부(METI)가 지원하는 “유전체정보 활용을 위한 미지 해양미생물의 유전자원 라이브러리 구축”이라는 사업이다. 본 사업은 2002년 8월부터 2009년 3월까지 약 7년간 추진계획을 갖고 NEDO(New Energy Deve-loment Organization)가 직접 관리한다. 주관 연구기관은 NITE(National Institute of Technology and Evaluation), MBI(Marine Biotechnology Institute), JBA(Japan Bio-tech-nology Association)와 Xanagen Co.이고 기타 관련회사, 대학 및 연구기관이 세부연구에 참여하고 있다. 본 사업의 최종 목적은 미배양 미생물의 탐색, 산업적 유용유전자 확보를 위한 메타게놈 라이브러리 구축, 지원기술 개발이다. 특히 본 사업을 통해 10,000종의 신규미생물 분리라는 야심찬 계획을 갖고 있고, 2004년도 IJSEM(International Journal of Systematic and Evolutionary Micro-biology)에 약 300종의 신규 종을 이미 보고하기도 하였다.
사업의 과제구성은 아래와 같다.
□ 신규미생물의 탐색방법 개발 및 라이브러리 구축
○ 신규미생물 수집, 배양, 보존 방법 개발
ㆍ해양환경으로부터 미생물 농후배양 및 탐색
ㆍ물리학적/화학적 스트레스를 이용한 미생물의 효율적 분리
ㆍ환경시료 수집 및 다양성 분석: 2003년도 종료
ㆍ폴리머 막을 이용한 세균분리시스템 개발
○ 미생물 분류, 동정방법 개발
ㆍ다중유전형질에 기초한 해양미생물의 분자동정
ㆍ미생물의 간단한 구별방법: 2003년도 종료
ㆍ생물자원 라이브러리의 신규미생물 분류 및 동정
○ 신규미생물의 유용기능 특성 분석
ㆍ신규 이차대사산물의 효율적 분석방법 개발(metabolomics-I)
ㆍ신규 생촉매의 효율적 탐색방법 개발 및 분리미생물의 기능 분석
□ 환경DNA로부터 기능유전자 직접클로닝 방법 개발 및 유전자 특성 분석
○ 기능유전자 직접클로닝 방법 개발
ㆍ난배양성 미생물로부터 유전자 회수방법 개발: 2003년도 종료
ㆍ메타게놈 라이브러리 구축방법 개발
ㆍ환경시료 수집 및 다양성 분석: 2004년도 수행보류
ㆍ단세포로부터 전체 유전체 증폭방법 개발
ㆍ공생관계 유전자 in-vitro 탐색기술 개발
○ 환경유전체 유전자 특성 분석
ㆍ신규 대사유전자의 기능 규명(metabolomics-II)
ㆍ이화작용효소 유전자의 기능 규명
ㆍ대용량 유전자 탐색시스템 개발
ㆍ메타게놈라이브러리로부터 유용기능 탐색
ㆍ자동 탐색시스템 개발
연구현황은 7개 지역으로부터, 즉 국내에서는 혹가이도의 Muroran에서 subarctic algae 확보를 비롯하여, Iwate, Shizuoka, Awaji, Okinawa로부터 시료를 채취하였고, 국외는 Palau, Fiji로부터 총 500개의 열대 무척추동물시료를 확보하였다. 본 사업에서는 해양세균, 균류 및 미세조류를 대상으로 확보하며, 해양환경 유전체가 주 대상이다. 본 사업 시작 전 2001. 8. 10 기준, 영국에는 미배양 해양세균의 16S rDNA gene 1,645종, 배양 해양세균의 16S rDNA gene 1,653종, 합계 3,298종 확보하였으나, MBI에는 배양 해양세균의 16S rDNA gene이 확보되지 않았었다. 그러나 프로젝트 시작 후 2004. 11. 9 현재 영국은 전자 7,442종, 후자 3,410종을 확보하였고, MBI는 배양 해양세균의 16S rDNA gene 9,391 종 확보에 이르게 되었다. 2001년도 당시 MBI는 해양세균 700종, 미세조류 300종을 보유하였으나 현재 해양세균 2,613종, 미세조류 628종을 각각 MBI의 ICB(Identification and Classification of Bacteria)와 MBIC(Marine Biotech-nology Insti-tute Culture Collection)에 보존하고 있다. 한편 확보된 자원을 활용하여 다양한 탐색이 진행 중이며, 주관기관이 배양액 5 ml을 동결건조하여 각 기관에 분배하면 참여기관인 RIKEN, MBI 외 3개 대학 및 1개 회사가 참여하여 세포저해, 항암, 항균, 항HIV, 항알러지, 항분열 활성 등에 관한 탐색을 진행한다.
이와 유사한 사업으로는 미국 Diversa사 등의 biodiversity discovery program을 들 수 있고, 해양생물을 중점적으로 연구한다는 면에서 시사하는 면이 크며, 우리도 이와 관련된 연구가 본격적으로 시작될 수 있게 노력하여야 할 것이다.
한편 일본의 해양생명공학관련기관 중 대표적인 기관인 JAMSTEC은 2004년도에 많은 변화가 있었다. 이름도 독립행정법인 해양연구개발기구(JAMSTEC: Japan Agency for Marine-Earth Science and Technology)로 바꾸고, 2004년 7월 1일 조직개편을 단행하였다. 그 중 주로 해양생명공학분야를 담당하고 있는 부서는 극한환경생물권 연구센터(XBR: ExtremoBiosphere Research Center)로 개편되었다.
극한환경생물권 연구센터는 특수 고유한 기능을 갖는 생물을 해양 중ㆍ심층, 심해저, 해저 지각 내 등과 같은 다양한 환경으로부터 탐사하고, 그 생태 및 기능 등에 관한 연구를 추진한다. 이로부터 얻어지는 성과를 기초로 사회와 경제의 발전에 이바지하며 생물의 기능·응용에 대해서 연구개발을 추진하는 것을 목표로 하고 있다(www.jamstec.go.jp). 극한 환경생물권 연구 센터에서는 아래와 같은 사업을 수행하여 해양의 다양한 생물과 생태계가 갖고 있는 특수하고 고유한 기능을 파악하기 위해 심해시추 연구선 지구호와 중층, 심층탐사 연구선 등을 이용하여 해저의 열수구, 냉수대, 심해저, 해저 지각 내 등을 대상으로 생물탐색 및 특징적인 생태계 조사를 실시한다. 이것들의 결과 및 실험, 시뮬레이션을 통하여 생물의 기능, 환경과 생물의 상호관계, 생물의 다양성과 진화에 대해서 연구를 실시하며, 생물기능을 이용한 유용물질 생산 등의 산업응용을 추진하고 있다(JAMSTEC 2004).
- 지각 내 미생물연구 프로그램(Deep Subsurface Extremophiles Research Pro-gram)
- 해양생태ㆍ환경연구 프로그램(Marine Biology and Ecology Research Program)
- 극한환경생물 전개연구 프로그램(Extremophiles Research Program)
- 심해바이오사업화 추진계획(Cooperative Research Project for Extremophiles)
다. 중국
중국의 해양생명공학기술개발 프로그램은 국가재원으로 추진하고 있는 것이 특징이다. 두 개의 주요 해양과학기술 발전 프로그램은 973과 863 프로그램이다. 이 사업들은 전략적으로 중국 과학기술부에 의해 투자, 관리되고 있다. 해양생명공학 연구재원의 70% 정도가 국가전략연구프로그램에서 지원되며, 나머지 부분은 중국 과학아카데미(CAS: Chinese Academy of Sciences), 국가 자연과학재단(NSFC: National Natural Science Foundation of China), 지방정부 및 기관을 통해 지원되고 있다.
863 프로그램은 5개년 계획(1996-2000)으로 진행되었고, 해양생명공학분야가 최초로 주요 분야로 선정되어 중국정부가 9,750만 RMB(인민폐)를 투자하였다. 2001년 4월 중국 대의원회에서는 863 프로그램을 5년간 계속 지원하기로 결정하고, 2001~2005년 동안 20,000 RMB 이상을 투자하기로 계획하였다.
1996년 해양생명공학분야가 863 프로그램에서 시작한 이래 육종공학(Bree-ding engineering), 질병제어(Control of the disease), 생산시스템 및 배양시설 개발(Production system and culture facilities), 해양의약품 및 생물제품(Marine drug and bioproducts), 기능유전자 및 유전체학(Functional genes and genomics), 내염성 식물육종(Breeding of the salt-resistant plants)에 집중적인 연구를 수행한 결과, 특히 해양생물 프로세스 및 공정과 미세조류 생산물의 대량생산 분야에서 괄목할 만한 성과를 얻었다.
주요 기반연구 국가 프로그램인 973 프로그램은 1997년 주정부 과학, 교육 운영그룹에 의해 구성되었다. 이 프로그램은 국가 전략목표 선상에서 기초연구의 강화를 주 목표로 하고 있다. 이 전략들은 국가의 사회, 경제적 성과발전을 목적으로 하고 있으며, 국가전략과 마찬가지로 973 프로그램은 농업, 에너지, 정보, 자원 및 환경, 인구 및 건강, 물질 등의 분야에서 주요 기초연구를 지속적으로 강화하고 있다. 이것은 생명과학, 나노기술, 정보기술, 지구과학과 같은 전략적으로 중요한 프론티어 분야에서 돌파구를 찾기 위하여 연구와 혁신을 증진시키고자 하는 목표를 갖고 있다. 973 프로그램에서는 5년 동안 2,000~3,000만 RMB까지 각 기초연구과제를 지원하고 있다. 첫 단계 1997~2002 사이 5년 동안은 133 과제에 전부 25억 RMB가 지원되었다.
라. 유럽국가
유럽국가의 해양생명공학분야 전략은 산업, 기술, 의약분야 발전의 기초로서 특히 연구개발에 국가적으로나 국제적으로 매우 중요한 분야로 인식하고 있으나, 유럽 해양생명공학분야 종합프로그램은 아직 구성이 되고 있지 않다. 그러나 EU의 제4차 프로그램(1994~1998)에서는 Marine Science and Techno-logy (MAST III)프로그램 하에 9개 과제를 지원하였고, 제5차 프로그램(1998~2002)에서는 “Sustainable Marine Ecosystems”이라는 제목 하에서 해양생명공학분야 4개 과제를 지원하였다<표 4-6-2-2>.
유럽연합(EU)은 단일 국가가 직접적으로 해양생명공학 전체분야에 초점을 맞추는 전략보다는 각국의 과학집단의 관심에 따라 단일 주제에 집중적인 연구를 수행한다. 예를 들어 독일은 50% 정도를 제약 및 화학 산업체로부터 지원을 받아 해양천연물분야에 집중하며, 프랑스는 심해열수미생물과 미세조류로부터 고부가가치 분자물질연구를 위한 특별프로그램이 있다. 한편 영국은 생물공학적 탐사를 위해 해양미생물 다양성연구 및 생물보존에 대한 연구에, 노르웨이는 국가 해양생명공학 프로그램에서 양식산업의 질병제어에 집중적인 관심을 갖고 있다. 이와 같은 연구결과로 현재 다양한 제품이 상용화되었다<표 4- 6-2-3>.
<표 4-6-2-2> 유럽의 해양생명공학분야 연구지원 과제
과제명 | 주관기관/국가 |
Collaborative marine biotechnology projects supported under MAST-III Programme(1994-1998) | |
Bioactive marine natural products in the field of antitumoral, antiviral and immunomodulant activity | Nantes 대학/France |
Microorganisms in deep sea vents and marine hot springs as sources of potentially valuable chemicals(MICROPHI) | Centre National de la Recherche Scientifique/France |
Application of marine biotechnology for the development of antifouling coatings | X-GNAT Laboratories Ltd./UK |
Biomarkers in marine sponges: molecular approaches to assess pollution risks and ecosystem health in the ocean in order to support management for its sustainable use(BIOMARK) | Johannes Gutenberg 대학/Germany |
Marine bacterial genes and isolates as sources for novel biotechnological products(MARGENES) | 생물공학연구협회 (유한회사)/Germany |
Methods to improve the supply of marine organisms for pharmaceutical-related natural products chemistry (FAIRE) | Institute Biomar S.A./Spain |
Electroacoustic prototype for controlling the behaviour of marine mammals | S. Vito Pesca Arl./Italy |
Biology of sponge natural products(SYMBIOSPONGE) | Universiteit van Amsterdam/Netherlands |
Marine cyanobacteria as a source for bioactive(apoptosis modifying) compounds with potential as cell biology reagents and drugs | University of Bergen/Norway |
Collaborative marine biotechnology projects supported under Key Action 3 “Sustainable Marine Ecosystems”(1998-2002) | |
Lead potential of marine microorganisms from coastal, shelf and deep sea sediments, a comparative assessment for optimized search strategies(MICROMAR) | Technical University Berlin/Germany |
Development of non-degrading, Novel Marine TECnologies (NOMATEC) for the sustainable exploitation and protection of Mediterranean marine resources | University Gesamthochschule Essen/Germany |
BIODEEP - Biotechnologies from the deep | British Museum-Natural History Museum/UK |
Deep Bacteria Under Ground(deepBUG) | The University of Bristol/UK |
출처: European Science Foundation Marine Board (2001)
<표 4-6-2-3> 해양생명공학 제품의 예 | ||||
제품 | 제품성분 | 원천생물 | 사용범위 | 회사/상표명 |
Algal polysaccharides | Carrageenans, Agars, Alginates | Red algae | Cosmetics, thickener, pharmacy, Mucoprotector Anti-coagulant, antiviral | Marine colloids USA Danisco Denmark SOBALG France |
Glycosamino- glycans | Chondroitin sulfate | Fish | Cosmetics, Tissue replacement, Anticoagulant | CTTP(France) |
Collagen | - | - | Cosmetics, Artificial tissue | - |
Chitosan B | (1-4)N-acetyl glucosamine | Crustacean shells, Fungi | Cosmetics, colloids Pharmacy, microencapsulation | - |
Lipids | Long chain PUFA (AA, EPA, DHA) | Microalgae, Seaweed, Fish | Prevention of heart disease, mental development in premature children Antitumoural Lipid metabolism | BIONAGROL 3000 AGE OMEGA 3 (Arkopharma), MAXEPA (Pierre Fabre Medicament) |
Peptides | Hormones, cyclic peptides | Fish hydrolysates | Antioxidant, Immunostimulants, Nutraceutical products | Promarine |
출처: European Science Foundation Marine Board(2001) | ||||
![]() 국내 현황
국내 현황
2005년도 생명공학육성시행계획에 의하면 정부부문 생명공학분야 R&D 및 인프라 투자액은 2004년도 5,989억 원이며, 2005년도 계획은 1,057억 원 증가한 7,046억 원이다. 이는 전년 대비 17.6% 증가한 것이다. 이 중 해양생명공학분야 주무부처인 해양수산부 투자액은 64억 원에서 83억 원으로 29.7% 대폭 증가하였으나, 정부의 생명공학 분야 총 투자액의 1.2% 수준에 불과한 형편이다.
해양수산부의 2005년도 R&D 투자액이 대폭 증가한 원인은 국내의 유일한 해양생명공학분야 국가대형 연구사업으로서 마린바이오21사업에 62억 원 규모를 투자하였기 때문이다. 본 연구 사업은 한국해양연구원, 부경대, 서울대가 각각 해양극한생물분자유전체연구단, 해양바이오프로세스연구단, 해양천연물신약연구단을 주관하며 <표 4-6-3-1>과 같은 주요 연구내용을 수행하고 있다.
<표 4-6-3-1> 마린바이오21사업 연구단 및 주요 연구내용
연구단명 | 주요연구내용 |
해양ㆍ극한생물 분자유전체연구단 | ○ 해양유용・극한생물 자원뱅크 및 유전자원정보 시스템 구축 ○ 해양·극한생물 유용 유전자 및 단백질 자원의 대량 발굴 및 활용기술 개발 ○ 생물유전자원 및 정보자원을 활용한 산업화 핵심기술 개발 및 상용화(생촉매, 의약품 등) |
해양바이오 프로세스연구단 | ○ 해양 산업용 신소재, 해양기능성 식품 및 해양 향장 신소재 등 개발(예: 효소, 색소, 펩타이드, 고분자 다당체, 바이오 폴리머, 지질 등) ○ 바이오 리엑터 개발 및 활용기술 개발 ○ 환경 기능성 소재 개발 등(예: 방오제 등) |
해양천연물 신약연구단 | ○ 대사성질환 치료제 개발(당뇨, 비만, 동맥경화, 고지혈증, 고혈압 치료제 등) ○ 면역억제제/질환치료제 개발(장기이식용 면역억제제, 면역증진제, 항암용 면역제 등) ○ 감염성질환 치료제(비브리오 폐혈증, 무좀균치료제, 내성균용 항생제 등) ○ 뇌질환 치료제(치매, 파킨슨씨병 치료제 등) ○ 항종양제 개발 등 |
<표 4-6-3-2> 산자부 BT분야 인프라구축 바이오집적지 조성사업 중 해양생물자원분야 사업 단위: 억원 | |||||
지역 | 전문화 분야/사업명 | 주관기관/ 위치 | 사업기간 | 총사업비(국비) | 사업명 |
제주 | 해양,바이오첨가제 | 제주대 | ’01~’05 | 70 (47) | 바이오벤처지원센터 조성사업 |
부산 | 해양생물자원 | 신라대 | ’02~’06 | 153 (45) | 〃 |
강원 | 해양수산자원산업지원센터 | 강릉 | ’02~’07 | 387 (283) | 지역진흥사업 |
경북 | 해양생명환경산업지원센터 | 울진 | ’04~’07 | 133 (83) | 〃 |
부산 | 해양생물산업육성센터 | 부산 | ’04~’08 | 245 (117) | 〃 |
출처: 생명공학육성시행계획 (2004, 2005) | |||||
한편 산업자원부에서는 생명공학분야 인프라구축으로 바이오집적지 조성사업을 중점적으로 지원하고 있다. 그 중 해양생물분야 지역진흥사업으로 강릉, 울진, 부산 지역을 지원하고, 바이오벤처지원센터 조성사업으로는 제주대, 신라대를 지원하고 있다<표 4-6-3-2>. 또한 지역 바이오산업 육성을 위한 지역 바이오클러스터와의 연계 및 지원을 위하여 2004년도부터 KOREA 바이오허브 구축을 시작하였고, 본 사업은 2004년부터 2008년까지 990억원(국비 520억원, 민자 470억원)의 투자를 계획하고 있다. 또한 2005년도 지역협력연구센터(RRC) 육성사업 60억 원 예산 중 대구가톨릭대학교 해양바이오산업연구센터 RRC에 일부 지원되고 있으며, 제주하이테크 산업진흥원은 지역진흥사업의 일환으로 제주 해양생물다양성 활용에 대한 산업체 지원을 일부 수행하고 있다.
![]() 발전전망
발전전망
1997년 미국 메릴랜드대학의 로버트 코스탄자는 전 지구 생물권에 대한 생태계 역할의 경제적 가치를 연간 16~54조 달러, 연평균 33조 달러로 평가하였다. 해양에는 전 지구 생물 종의 약 80%가 서식하고 있으므로 해양생물 다양성의 경제적 가치는 연평균 약 26조 달러에 이른다고 평가할 수 있다. 이 수치는 연간 전지구상 국가들의 총 생산액인 18조 달러에 비해서도 매우 높은 어마어마한 가치라고 할 수 있다. 이와 같이 생물다양성은 경제적으로 중요한 기여를 하고 있으며 지속 가능한 경제개발과 환경보존에 지대한 영향을 미친다. 또한 생물산업 분야에서 유전자원을 이용한 상품의 연간 세계시장 규모는 5천억 불~8천억 불로 평가되고 있다. 전 세계의 석유화학 제품 연평균 판매량 5천억 불, 1997년 컴퓨터 시장의 소프트웨어, 하드웨어 및 정보기술서비스 분야를 합한 8천억 불 규모인 다른 산업 분야와 비교해도 생물산업 시장규모가 결코 작지 않음을 알 수 있다.
해양생명공학 시장규모를 비교하기 위해 Ernst & Young LLP에서 예측한 자료와 OECD 자료(1997)를 살펴보았다<표 4-6-4-1>. 먼저 전자의 자료는 1997년 해양생명공학산업 시장규모는 전체 생물산업 시장규모의 약 3%에서 2010년에는 8%로 점차 비중이 높아짐을 예상하였고, 성장률은 약 21% 정도로 추정하였다. OECD 자료(Biotechnology & Trade, 1997)에 의하면 생물농업ㆍ해양분야의 경우 1997년 16억불, 2000년 27억불, 2003년 37억불, 2008년 75억불, 2013년 126억불로 성장하여 연평균 28.2% 성장률을 예상하고 있다. 물론 이 자료에는 생물농업 분야가 포함되어 있어 과대계상된 것으로 추정되나, 또한 의약, 화학, 환경, 식품, 에너지자원 시장 중 해양생명공학분야가 누락된 것을 감안한다면 과소평가되었을 가능성도 있다. 이는 Ernst & Young LLP에서 예측한 성장률과 유사한 것으로 미루어 알 수 있다.
<표 4-6-4-1> 세계 전체 및 해양 생물산업시장 규모 예측치 단위: 억 불 | |||
전체 생물산업 | 해양생물 산업 | ||
Ernst & Young LLP | OECD1) | ||
1997 | 313 | 10 | 16 |
2000 | 540 | 30 | 27 |
2003 | 740 | - | 37 |
2005 | 910 | 60 | 75 |
2008 | 1,250 | - | - |
2010 | 1,540 | 120 | - |
2013 | - | - | 126 |
성장률 | 21% | 28.2% | |
출처: Ernst & Young LLP(1998), OECD(1997) 1) 생물농업분야 포함 | |||
결론적으로 현재 해양생물공학산업 시장규모는 전체 생명공학 시장에 비해 상대적으로 작으나 향후 발전 잠재력이 매우 높음을 알 수 있고, 이를 선점하기 위한 국가간 경쟁은 더욱 치열해질 것으로 예상된다.
□ 참고문헌
1. 과학기술부, 교육인적자원부, 농림부, 산업자원부, 보건복지부, 환경부, 해양수산부. 2004년도 생명공학육성시행계획. p. 287. 2004.
2. 과학기술부, 교육인적자원부, 농림부, 산업자원부, 보건복지부, 환경부, 해양수산부. 2005년도 생명공학육성시행계획. p. 54. 2005.
3. 과학기술부. 2003 생명공학백서. p. 390. 2003.
4. 김상진. 해양바이오산업 발전에 대한 소고. 생물산업 15(2):16-18, 2002
5.Biotechnology Research Subcommittee, National Science and Technology Council (NSTC). Biotechnology for the 21st Century: New Horizon. p. 138. 1995.
6.Department of Trade and Industry, UK. Marine biotechnology: looking beneath the surface-a mission to China. Global Watch Mission Report. p. 76. 2005.
7.European Science Foundation Marine Board Marine Biotechnology: A Euro-pean Strategy for Marine Biotechnology. ESF Marine Board Position Paper 4, Feasibility Study Group Report. p. 27. 2001.
8. OECD, Biotechnology & Trade, 1997.
■ 제 4장 분야별 연구개발 및 관련산업 현황 제 7절 제조 및 생물공정 |
![]() 개요
개요
생물공정기술은 생명공학기술의 한 분야로서 “생명공학의 연구발견을 실제제품 및 공정 또는 사회적 수요에 부합하는 시스템으로 변환시키는 기술”을 총칭하는 것으로 정의된다. 생물공정기술의 세부기술로는 배양공정기술, 생물전환공정기술, 생물분리정제 공정기술로 대표되는 전통적인 공정기술과 생물전자/정보, 생물엔지니어링기술 및 생물기기 제조기술이 있고, 빠른 속도로 발전되고 있는 관련기술들의 융합을 바탕으로 한 나노생명공학기술(nano-bio-technology)이 새로운 혁신적인 생물공정기술로 떠오르고 있다<표 4-7-1-1>.
수년전까지만 해도 생물공정기술의 주요 영역은 발효탱크, 날개바퀴(im-peller), 콤프레서(compressor), 펌프, 컬럼, 파이프 및 밸브와 같은 발효생물제품생산에 요구되는 설비들을 설계하고, 이를 이용한 미생물 발효제품 생산공정 개발과 효소전환기술개발 및 대량분리정제기술개발 분야였다.
생물공정기술의 영역은 1980년대를 전후로 미생물외에 식물 및 동물세포 배양공정까지 확대되었으며, 2000년대에 이르러서는 산업적으로 유용한 미생물들의 유전자 서열이 속속 밝혀지고, 생물정보학의 발달과 DNA칩의 출현으로 유전자의 발현양상을 대량으로 신속 정확히 분석할 수 있게 되면서 거시적(macroscopic) 배양조건에서 일어나는 현상들을 미시적인(submicroscopic) 관점에서 관찰할 수 있게 되었다. 이는 시스템생물학(systems biology)과 대사공학기술(metabolic engineering)의 발달을 가능하게 하였고, 궁극적으로 이러한 일련의 기술들을 미생물 발효제품 및 재조합 단백질 생산공정에 활용하는 분자생물공정기술(molecular bioprocess engineering)의 발달로 이어지고 있다.
<표 4-7-1-1> 생물공정기술의 분류 | |
세부기술 | 핵심기술 |
배양공정기술 | 세포배양기술, 대사공학기술, 마이크로어레이(microarray) 분석기술, 공정설계기술 |
생물전환 공정기술 | 초고속 효소 탐색기술, 초고속 효소 개량기술, 생체촉매 고정화기술, 생물반응기 설계기술 |
생물분리정제 공정기술 | 고순도분리정제기술, 극미량고속분석기술, SMB(Simulated Moving Bed) 분리공정기술, 초임계 분리정제기술 |
나노 생물공정기술 | 극미세 분리정제기술, 생체모방기술, 바이오 MEMS 기술, 미세유체역학기술 |
기타 생물공정기술 | 생물전자/정보기술, 생물엔지니어링기술, 생물기기 제조기술 |
현재 미생물을 이용한 생물공정기술을 활용하여 생산되고 있는 제품들의 원료물질은 생물촉매를 이용한 생물전환공정에서 중간원료물질들의 생산에 사용되는 화학원료들을 제외하고는 대부분 생물자원, 특히 식물자원을 기반으로 하고 있다. 발효공정기술로 생산되고 있는 대표적인 산업제품들로는 알코올, 젖산, 비타민, 아미노산, 알칼로이드, 스테로이드(alcohol, lactic acid, citric acid, vitamins, amino acids, alkaloids, steroids), 항생제, 바이오폴리머, 생물농약, 효소, 색소, 유화제, 유기용매 등이 있으며 <표 4-7-1-2>에서 보는 바와 같이 저가 대량생산 제품에서부터 고가의 정밀화학제품까지 제품군이 다양하다.
최근에는 화석에너지 가격의 가파른 상승으로 인하여 석유화학 제품들을 생물자원(바이오매스)을 기반으로 한 생물제품으로 대체하고자 하는 등의 지속가능 산업으로 white biotechnology 연구가 새로운 테마를 형성하고 있다. McKinsey & Company는 2010년까지 시판되고 있는 화학물질의 10~20% 정도가 생명공학제품으로 대체될 것으로 예측하고 있다.
![]() 해외 동향
해외 동향
최근 세계적으로 앞서가고 있는 기업들은 인간(People), 지구(Planet), 이익(Profit), 즉, 3P로 상징되는 사회, 환경, 기업이익을 동시에 만족할 수 있는 지속가능한 기술개발을 미션으로 하고 있는 추세이다. 이는 기존의 화학공정기술로는 한계가 있으며 생물공정기술이 유력한 대안이 될 수 있다. 즉, 특정 물질의 생산에 효과적인 생물공정기술이 개발에 성공하면 에너지 효율의 증가와 이산화탄소 발생의 감소 및 원료물질의 절약이 가능할 것이다. 이러한 목표아래 많은 선도기업들은 <표 4-7-2-2>에서와 같이 미생물 또는 효소를 이용하여 화학공정을 대체할 수 있는 다양한 생물공정기술을 개발하여 상용화에 성공하고 있다7).
<표 4-7-2-1> 주요 생물공정제품 시장규모
Bio-based Product | World Production (ton/year) | World market price (€/kg) |
Bio-ethanol L-Glutamic acid (MSG) Citric acid L-Lysine Lactic acid Vitamin C Gluconic acid Antibiotics (bulk products) Antibiotics (specialties) Xanthan L-Hydroxyphenylalanine Dextran Vitamin B12 | 26,000,000 1,000,000 1,000,000 350,000 250,000 80,000 50,000 30,000 5,000 20,000 10,000 200 10 | 0.40 1.50 0.80 2 2 8 1.50 150 1,500 8 10 80 25,000 |
<표 4-7-2-3>미국의 바이오매스 활용 화석원료 대체계획 | ||||
바이오매스 대체 산업분야 | 2001 | 2010 | 2020 | 2030 |
전력생산 | 2% | 3% | 4% | 5% |
수송연료 | 0.5% | 4% | 10% | 20% |
생물제품 | 5% | 12% | 18% | 25% |
<표 4-7-2-2> 화학공정 대체 지속가능 생물공정기술에 의한 제품생산 예시
제품/기업 | 기존공정 | 생물공정 | 효과 | |
환경개선 | 생산원가 | |||
Vitamin B2/BASF | 화학합성(8단계) | 1단계 발효 | ‒40% | ‒40% |
Cephalexin/DSM | (생)화학합성(10단계) | 발효 및 효소반응(2단계) | 원료비 ‒65%, 에너지 ‒65% | ‒50% |
섬유가공/Novozyme | 고온 알칼리 처리 | 효소처리 | 에너지 ‒25% 용수 ‒60% | ‒20% |
고분자/Cargill Dow, Du Pont | 화석원료, 화학반응 | 옥수수, 발효 | 원유‒17~‒55% | 경쟁적 |
에탄올 | 화석원료, 화학반응 | 식물원료, 발효 | CO2발생‒108% | 개발중 |
에틸렌 | CO2발생‒106% | |||
위와 같이 기존의 화학공업의 추세가 화석원료 대신에 재생 가능한 생물자원을 사용하는 생물공정을 기반으로 한 지속가능한 산업으로 재편을 추진하는 것은 고갈되어가고 있는 석유 의존도를 낮추기 위한 것이 가장 큰 이유이다. 미국의 경우에는 이미 2000년도에 주요 산업분야에서 화석원료를 바이오매스로 대체하기 위한 계획을 수립하였다 <표 4-7-2-3>.
이러한 사업을 추진하기 위해서는 생물공정기술을 포함한 다양한 분야의 협동연구가 필수적이며 이를 추진하기 위해서 2003년에 미국 에너지국(DOE)과 농업국(USDA)에서 각각 1억 2,500만 불과 2억 5,900만 불을 투자하였다. 이와는 별도로 미국 애너지국은 바이오매스를 발효가 가능한 당(sugar)으로 전환하고 이를 발효기질로 사용하여 고부가 가치소재를 생산하는 생물정제(bio-refinery)기술개발에 1억 불을 투자하였다. 미국 정부차원에서도 Cargill, Dow, Du-pong과 같은 농업 및 화학 관련 기업들과 Genencor, Novozyme, Diversa와 같은 생물촉매 관련 바이오회사들과 밀접한 관계를 맺고 바이오매스를 이용한 생물공정기술개발사업을 추진하고 있다9).
일본은 한국과 마찬가지로 오래전부터 미생물을 이용하여 전통발효식품을 생산해온 경험을 바탕으로 아미노산 발효공정기술에 있어서 세계적인 기술을 보유하고 있다. 특히, 바이오매스 자원이 부족한 대신 효소공정기술에 강점을 가지고 있는데 Mitsubishi Rayon사는 화학합성공정의 20% 밖에 에너지가 들지 않는 효소공정을 이용한 아크릴아마이드 생산기술을 세계 최초로 산업화 시켜 세계시장을 석권하고 있으며, Kaneka Fuji사는 생물공정에 의한 의약품 중간원료물질 생산기술에 전념하고 있다.
![]() 국내 현황
국내 현황
국내의 생물공정기술은 주로 미생물 발효공정기술에 치중되어 있었다. 특히 CJ와 BASF의 라이신을 중심으로 한 아미노산 발효제품 생산기술과 CJ와 대상의 MSG 생산기술, 셀바이오텍과 한국야쿠르트의 유산균 발효기술, 동양제과의 자이리톨(xylitol) 생산기술, 유한화학과 종근당을 중심으로 한 항생제 생산공정기술 및 녹십자를 중심으로 한 백신 생산기술, LG화학과 태평양에서 개발한 히알루론산(hyaluronic acid) 생산공정기술은 세계적인 수준에 올라 있다. 최근에는 대상에서 클로렐라의 발효생산공정을 개발하였고, 기타 바이오 폴리머, 코앤자임 큐 10(Coenzyme Q10), 균사체 배양액 생산공정기술도 개발 또는 산업화되었다. 재조합 단백질 생산공정으로는 LG 생명과학에서 개발한 성장호르몬(human growth factor) 생산기술이 대표적인 예다. 미생물 발효 외에 동물세포 배양공정기술로 CJ에서는 EPO(erythropoietin) 생산기술을 개발하였고, 기타 다양한 항체생산공정기술이 산업화되어 있다. 이외에 가장 괄목할 만한 산업화 실적으로는 셀트리온의 동물세포배양공정에 의한 단백질 의약품 생산을 위한 FDA 기준에 준한 50,000리터 규모의 cGMP 시설과 이를 이용한 계약생산 체계를 구축한 것이다. 식물세포 배양공정기술로는 삼양제넥스에서 탁솔(taxol) 생산공정기술을 확립한 것이 대표적인 성과이고, 몇몇 벤처기업들에 의해서 산삼 배양근 생산공정기술이 세계 최초로 산업화되었다.
효소를 이용한 생물전환공정기술에 의해서는 7-아미노세팔로스포린(Amino-cephalosporanic acid, 7-ACA), 프라바스타틴(Pravastatin)과 같은 의약품 원료물질과 포도당, 과당, 아스파탐(aspartam), 프락토올리고당(fructooli-gosaccha-ride), 키토올리고당(chitooligo-saccharide), 폴리덱스트로스(polydextrose)와 같은 식품원료들이 생산되고 있다.
반면에 생물공정기술의 한 축인 생물분리정제공정기술은 국내에서 새롭게 개발된 보고 예는 드물다. 이는 분리정제 기술은 특성상 목표물질에 따라 기업체에서 수시로 개발된 노하우 위주의 기술이기 때문일 것으로 추정되며, 이는 대부분 분리정제기기 및 장비 개발업체에서 개발된 방법을 기본으로 하여 경우에 따라 운전조건을 변경하여 최적화하는 것이기 때문이다.
생물공정 기기분야 특히 발효조의 경우에는 국내시장이 침체되어 있다. 대표적인 발효조 제작회사인 코바이오텍의 2004년도 매출액 47억 원 중에서 수출이 27억 원, 내수가 20억 원으로 수출비중이 더 높았으며, 신생기업인 바이오트론도 수출을 목표로 디지털 기술이 도입된 개량된 발효기 개발에 많은 투자를 하고 있다. 특히 코바이오텍에서는 2005년도부터 발효기 제조 외에 직접 발효설비를 갖추고 프라바스타틴, 타이코플라닌(teicoplanin)과 같은 원료 의약품 생산분야로 사업영역을 확장하였다. 반면 원심분리기, 농축기, 진공건조기, 냉동건조기(freeze dryer), 분무건조기(spray dryer)와 같은 다운스트림(down-stream) 공정에 필요한 기기들은 국산화율이 높아졌고, 벤처 및 중소기업에 의한 수요도 증가하고 있는 추세이다. 또 다른 중요한 축인 생물공정관련 바이오센서 개발 및 생산은 아직도 전무한 상태인 가운데 한국생명공학연구원에서 바이오 나노기술을 이용한 초고속 단백질칩 분석시스템을 개발하여 산업화에 성공한 것이 관심을 끌만한 성과이다.
위 예에서 알 수 있듯이 전통적인 생물공정기술인 발효배양공정 기술개발분야, 특히 장치분야는 성숙단계로 더 이상의 신공정기술 개발 자체가 답보상태에 있는 반면 미생물 발효 또는 생체촉매를 이용한 새로운 원료물질 생산기술은 꾸준히 개발되고 있는 추세이다. 특히 최근에는 세계적인 추세에 맞춰 국내에서도 생물공정기술의 범위가 그동안의 공학적 공정개념을 넘어 생산공정에 적합한 균주개발 분야까지 확대되고 있다. 즉, 유전체학과 시스템 생명공학, 대사공학, 바이오 나노기술 및 인실리코(in silico) 기술을 종합적으로 생물공정기술개발에 접목한 분자생물공정기술로 전환되고 있는 추세이다. 일례로 한국과학기술원에서 개발한 대사경로분석 및 예측 프로그램 개발과 이를 활용한 숙신산(succinic acid) 생산 최적화 기술개발이 좋은 예이다.
![]() 전망
전망
세포배양 및 분리정제로 이어지는 down stream 공정에 중점을 두었던 생물공정기술은 유전체학(genomics), 단백질체학(proteomics), 대사체학(metabolomics)로 대표되는 포스트게놈(post-genome) 시대의 도래와 함께 앞으로는 시스템 생명공학과 나노생명공학과 같은 엔지니어링을 기반으로 한 새로운 분야와 융합하여 새로운 영역으로 확대되어 나갈 것이다. 즉, 기존의 upstream/downstream 기술경계가 희미해지면서 세포의 대사흐름과 목적 산물의 생산을 동시에 고려하는 한 단계 더 진화된 고효율 생물공정기술로 발전되어 가고 있다.
그동안 미생물 및 동물세포 배양공정에 치중되어 있던 공정기술은 앞으로 식물 또는 동물 자체를 생체반응기로 사용하는 기술개발이 확대될 것이며 이들 생체로부터 목적산물을 대량으로 분리정제하기 위한 공정기술개발이 뒤따를 것이다. 또한 줄기세포를 이용한 치료기술이 발전함에 따라 산업적으로 줄기세포를 배양하기 위한 생물배양기 및 배양공정기술 개발이 각광을 받을 것으로 예상되고, 이와 관련된 새로운 분리정제기술도 개발되어야 할 것이다.
특히 최근의 유가상승은 생물전환공정기술을 활용한 대체에너지 및 석유화학 대체 원료 생산기술개발을 촉진할 것이다. DNA 셔플링(shuffling)과 같은 방향성 진화(directed evolution) 기술을 통한 초고속 단백질 개량 기술은 기존의 화학공정을 효소공정으로 대체할 수 있도록 효소의 물리화학적 안정성 문제와 활성도 문제를 해결할 수 있는 길을 열어 놓았으며, 이로 인하여 생물자원을 원료로 사용한 석유화학공업 대체 생물공정기술개발이 활성화 될 것이다. 이와 같은 관점에서 바이오매스의 주성분인 섬유소, 전분, 헤미셀룰로오스 등을 육탄당(glucose) 또는 오탄당(xylose)으로 전환하기 위한 생물전환공정기술과 이들 발효성 당을 탄소원으로 사용하여 화학공업에 기반이 되는 platform 물질들, 예를 들어 젖산(lactic acid), 숙신산, 3-hydroxypropionic acid, 1,3- propanediol 등의 생물학적 생산을 위한 생물공정기술개발의 중요성이 증대되고 있다. 즉, 바이오매스로부터 이들 핵심물질들을 생산하여 화학공업에서 중요한 위치를 차지하고 있는 중간원료물질들을 생산하기 위해서다<표 4-7-4-1>. 이는 앞으로 전개될 새로운 생물화학공업의 주도권을 누가 쥘 것인가를 좌우할 수 있는 중요한 분야가 될 것이다.
<표 4-7-4-1> 생물공정으로 생산가능 한 기반화학물질 및 유도체
기반화학물질 | 생산가능 주요 유도체 |
Succinic acid | 1,4-Butanediol, g-Butyrolactone, Tetrahydrofuran, 2-Pyrrolidone, Methyl-N-2-Pyrrolidone (NMP) |
2,5-Furan dicarboxylic acid | 2,5-Bis (aminomethyl)-tetrahydrofuran (THF), 2,5-Dihydroxymethyltetrahydrofuran, 2,5-Dihydroxymethylfuran |
3-Hydroxy propionic acid | 1,3-Propanediol, Acrylic acid, Methyl acrylate, Acrylamide |
Aspartic acid | 3-Aminotetrahydrofuran, Amino-γ-butyrolactone, Aspartic anhydride, 2-Amino-1,4-butanediol (BDO) |
Glucaric acid | Glucaro-γ-lactone, Glucaro-δ-lactone, Glucarodilactone, Polyhydroxypolyamides |
Glutamic acid | Glutaminol, Glutaric acid, 1,5-Pentandiol, 5-Amino-1-butanol, Norvoline |
Itaconic acid | 3- & 4-Methyl γ-Butyrolactone(GBL), 3-Methyl-THF, 2-Methyl-1,4-BDO, 3- & 4-Methyl NMP, 3-Methylpyrrolidine |
Levulinic acid | g-Valerolactone, 2-Methyl THF, Diphenolic acid, b-Acetylacrylic acid, 1,4-Pentanediol, Angelilactones |
3-Hydroxybutyrolactone | 3-Hydroxytetrahydrofuran, Acrylate-lactone, 2-Amino- 3-Hydroxytetrahydrofuran, 3-Aminotetrahydrofuran |
Glycerol | Glyceric acid and other oxidation product, 1,3-Propanediol, Propylene glycol, Branched polyesters and nylons, |
Sorbitol | Propylene glycol, Ethylene glycol, Glycerol, 2,5-Anhydrosugars, Isosorbide |
Xylitol/Arabinitol | Xylaric acid, Propylene glycol, Ethylene glycol, Glycerol |
■ 제 4장 분야별 연구개발 및 관련산업 현황 제 8절 생물자원 |
![]() 생물자원의 개요
생물자원의 개요
21세기 핵심 산업으로 주목받고 있는 생명공학은 생물이 갖는 신비한 생명현상을 규명하고 다양한 생물자원의 유용한 기능 및 특성을 발견하여 인류에 유익하도록 생물자원(biological resources)을 이용하는 것이라고 정의할 수 있다. 그 속에는 유전자공학기술을 활용하여 인위적으로 변화시키거나 만들어낸 새로운 생물자원을 이용하는 기술도 포함된다. 이와 같이 생명공학연구의 재료이자 기반이 되는 생물자원은 지구를 구성하는 토양, 해양 및 수상 생태계에 존재하는 살아있는 동물, 식물, 곤충, 어류, 미생물 등을 모두 포함한다. 생물자원이 인류에게 주는 혜택은 식량, 가축생산, 해충의 생물학적 방제, 식물수분, 약물, 기타 자연 산물과 더불어 휴식처 제공, 지구온난화의 주범인 이산화탄소의 감소와 유기폐기물 처리에 의한 환경정화, 생물학적 질소고정 등이 있다. 또한 생물자원은 생물의약, 생물화학, 기능성식품, 생물농업, 생물환경 등 다양한 생물산업군에서 활용되고 있다.
현재 지구상에 존재하는 생물종의 개수는 3백만 정도인데 그 중 175만 개 종류만이 이름을 가지고 있다1). 그러나 각종 개발 및 환경오염 등으로 인한 자연서식지 파괴에 따라 매년 25,000~50,000종의 생물이 멸종되어가고 있다2). OECD는 이와 같이 중요한 가치를 지니는 생물자원의 적절한 관리와 국가간 교환이 향후 생명공학 발전과 지속적인 개발을 위한 역량 축적에 필수적이라고 인식하고, 세계 각국의 주요 균주은행을 중심으로 생물자원센터의 설립을 권고하여 생물자원의 현지외 보존을 담당하게 하였다. 이에 따라 생물자원센터는 배양유기체(미생물, 식물, 동물, 인간세포)와 유기체의 복제가능 부분(게놈, 플라스미드, 바이러스, DNA) 및 배양 가능하지만 아직 배양되지 않은 유기체, 세포, 조직은 물론 이와 관련된 분자, 생리, 구조적 정보 소장하며, 현지외 보존이 불가능한 생물자원의 경우 생물다양성협약을 통한 생물자원의 현지내 보존, 현황파악 및 DB구축을 통한 관리를 추진하고 있다.
![]() 해외연구동향
해외연구동향
가. 미생물분야
생물자원 확보 및 관리와 관련한 국제기구로는 OECD 산하 생명공학작업반이 활동 중에 있으며 2004년 12월에 열린 제17차 생명공학작업반 회의에서는, 향후 추진할 과제로 생물자원센터의 확대를 포함하여 4개의 분야가 집중 토론되었다. 생물자원센터의 확대는 글로벌 생물자원센터 네트워크 구축 (GBRCN) 및 운영기준마련에 중점을 두고 추진되고 있으며, 1999년부터 생명공학작업반 산하에 생물자원센터 태스크포스를 구성해 생물자원 접근과 활용을 통해 과학과 경제 발전을 달성하기 위한 국제협력을 추진하며 향후 미생물, 인간, 식물, 동물 외에 유전체(genomics) 분야를 포함하기로 논의하였다.
세계균주보존연맹(World Federation for Culture Collection, WFCC)은 균주은행 설립을 촉진하며, 균주은행과 사용자간의 정보네트워크를 구축하는 한편 워크샾, 컨퍼런스, 출판 및 뉴스레터를 발행하고, 중요한 균주은행의 지속적인 운영을 지원하는 역할을 담당하고 있으며, 2005년 10월 말 현재 66개국의 502개의 균주은행들이 회원으로 활동하고 있다.
생물자원을 탐색, 보존 및 보급하는 분야에서 주도적 역할을 담당하고 있는 생물자원은행 중 미국의 ATCC (American Type Culture Collection)는 The Global Bioresource Center를 표방하며 전 세계에서 가장 방대한 생물자원을 보유하고 있다. 독일의 DSMZ (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH)는 특허자원을 포함하여 22,000여 균주를 보존하고 있으며 특히 고세균 등 특수 환경 자원의 연구 및 확보와 세균의 분자계통분류학적 기술 분야에서 세계 최고 수준을 자랑하고 있다. 네덜란드의 CBS(Centraalbureau voor Schimmel-cultures)는 곰팡이와 효모자원 확보 분야에서 주목을 받고 있으며, 특히 곰팡이 분류 분야에서 다양한 서적 및 출판물들을 발간하고, 워크샾 등을 실시하여 연구자들을 지원하고 있다. 아시아의 경우 자원강국인 일본은 문부과학성을 중심으로 2002년부터 국가생물자원 프로젝트를 시작하여 생명공학산업에 활용되는 생물자원의 체계적 수집, 보존 및 보급을 목표로 동물, 식물, 미생물 및 Cell/ DNA 분야로 나누어 총 24개의 Central Resource Center와 1개의 Information Center를 운영 중에 있다. 중국의 경우 국가과학기술부가 ‘중국의 생물기술 및 생물 경제 남피서(蘫皮書)’를 공식 발표하고 2020년까지 중국을 생물기술 강국, 생물산업 대국으로 부상시키고자 하는 전략적 목표를 설정하고 향후 20년간 중국 생물산업 발전의 9개 중점 분야를 선정하였는데, 그중에 생물자원의 심층개발을 통해 새로운 생물산업 육성을 추진한다는 내용을 담고 있다. 2003년 조사에 따르면 중국에서는 20개 이상의 다양한 균주은행들이 운영 중에 있으며 이들이 보유하고 있는 균주는 총 10만여 주에 이른다.
또한 인간 유전체연구를 시작으로 중요성이 대두된 유전체 연구는 다른 생물자원 연구에도 영향을 미치게 되었는데 현재까지 유전체 정보가 발표된 생물체는 총 200여 개이다(www.genomesonline.org). 생물군으로 보면 고세균(Arch-aea)이 19개, 세균(Bacteria)이 153개로 세균이 172개나 된다. 나머지 진핵생물(Eukarya)의 28개도 균류 6, 원생생물 9, 식물 3, 동물 10개로, 유전체 분석이 상대적으로 수월한 미생물이 187개로 90% 이상을 차지하고 있다3).
나. 식물분야
<표 4-8-2-1> 주요국의 식물 유전자원 보존현황 | ||||||
국가 | 대한민국 | 미국 | 중국 | 러시아 | 일본 | 인도 |
보유수(점) | 151,082 | 465,000 | 380,000 | 349,000 | 278,000 | 256,000 |
1999년 현재 국제기관에 보고된 식물 유전자원 현황에 따르면 전 세계적으로 1,320개 유전자원 보존은행에 약 650만 점의 식물자원이 보존되고 있으며4), 우리나라에서 보유하고 있는 유전자원은 1,777종 151,082점으로 양적으로는 세계 6위 수준이다. 그러나 대부분의 자원이 식량작물로 구성되어 있고, 유전적 다양성의 척도가 되는 종수(미국 11,350천 종, 러시아 2,529천 종)는 빈약한 편이다<표 4-8-2-1>.
<표 4-8-2-2> 식물 유전자원 관리에 관한 국제기구와 활동 | |
국제기구명 | 활동 내용 |
세계무역기구 (WTO) | 식물의 기본 재료와 품종에 관련된 지적재산권 교역협의 |
식량농업기구 (FAO) | 식물유전자원의 범위설정, 국가간 접근, 보존 및 교환협의 |
국제농업연구자문그룹(CGIAR) | 16개 전문 작목 연구기관 중심으로 작목별 식물 유전자원 탐색, 보존, 평가, 이용 및 관련 훈련을 지원 |
국제식물유전자원연구소(IPGRI) | 식물 유전자원의 국가간 공동이용 협력사업 추진, 세계 각국의 식물 유전자원 국가 시스템과 정보화 강화 및 식물 유전자원 보존전략 및 기술개발 |
식물 유전자원 관리에 관여하고 있는 대표적인 국제기구로는 세계무역기구(WTO), 식량농업기구(FAO), 국제농업연구자문그룹(CGIAR), 국제식물유전자원연구소(IPGRI) 등이 있으며 각 기구의 활동내용은 <표 4-8-2-2>에 나타내었다.
세계 주요국가의 식물 연구동향을 살펴보면, 우선 미국은 식물유전자원 국가관리 조직체계(NPGS)를 구성·운영하여 유전자원의 탐색, 보존, 평가, 이용 등 전반에 대한 조정 기능을 수행하고 있다. 실행 부서로는 국립식물자원연구소 (GRL), 국립유전자원보존센터(NCGRP), 국립식물자원검역소, 열대농업연구소(Pu-erto Rico), Active Collection 영양체 자원 저장소(8개소), 주요작물 저장소(대두 등 7개소), Genetic Stocks Center (4개소) 등이 있다. 국립유전자원보존센터에서는 자원의 장기보존, 종자활력 및 저장에 관한 연구, 초저온 저장방법 등을 개발하고 있으며, 국립유전자원연구소는 도입 및 분양자원의 검역, 자원의 보존, 세계 수집종 밀, 보리, 귀리, 호밀 등을 보존하고 있다. 일본은 국립농업생물자원연구소에서 식물, 미생물, 동물, 수목, 수산생물 및 DNA를 보존, 관리하고 있다. 식물은 농업생물자원연구소, 임목육종센터가 센터뱅크로, 농업연구센터 등 9기관, 임목은 산림종합연구소가 서브뱅크로 지정되어 있다. 연구 활동 및 연계망은 중앙단위은행에 수집, 종자보존, 조직, 세포 보존, 포장보존, DNA 보존, 자료관리 및 관련 연구를 하고 있으며 이는 대학, 민간기구, 국립연구기관, 공공기관과 연계되어 있다. 중국은 중국농업과학원 작물유전자원연구소를 중심으로 관리, 운영되고 있으며 국립종자은행은 장기 및 단기보존을 실시하고 국립유전자원포장보존센터(National Field Gene Bank)를 전국 25개 지역에서 운영하여 영양체자원을 보존하는 한편, 전국 11개 지역농업과학원에서 12개소의 종자보존소를 운영하고 있다5). 러시아는 바빌로프식물산업연구소(VIR)를 중심으로 식물자원을 보존관리하고 있는데 식물도입분류과에서 탐색, 수집, 교환, 검역, 현지보존법 등을 관할하고, 국제협력과는 외국과의 협력과제를 수행한다. 식물자원연구부는 9개 전문 작목별로 단기저장, 평가, 이용, 증식방법, 증식, 전산화, 정리 자원의 종자은행 입고 등을 관리한다. 기초 연구 부서에서는 기내 보존기술 개발, 대량 증식연구, 단백질 핵산 연구, 우량 자원연구, 활성물질 연구, 생리적 유전적 기초연구를 하고 있다. 지역시험장은 12개 기관이 있으며 자원의 수집, 평가, 단기 보존 및 육종을 담당한다5). 영국의 경우 영국식물유전자원그룹(UKPGRG)에서 총괄연구 및 관리를 담당하고 작목별 17개 연구기관에서 품종육성과 연계하여 수집보존소를 운영하여 작목별 큐레이터(Curator)를 지정운영하고 있다. 보존량은 12만 점이며 World Collection에 한하여 장기저장하고 있다. 특수자원은 직접 보존하나, 특성평가는 국가연구기관 및 대학이 공동으로 실시하고 있다5).
다. 동물분야
일본의 농림수산성은 2002년에 시작한 ‘곤충산업창출 프로젝트’를 확충하여 2003년부터 게놈창약, 유용물질생산, 신소재개발의 3개 주제연구를 진행 중이다. 일본은 세계 제일의 누에정보 보유국으로 약 650계통을 보유하고 있다. ICLARM (International Center for Living Aquatic Resources Management)에서는 어류관련 연구기관들이 특정지역 정보를 제공받아 세계 어류에 관한 정보를 DB화하여 지원하고 있다. 전 세계적으로 해양생물과 관련된 균주은행은 20여 개에 이르며, 해양세균을 서비스하는 기관은 미국 메릴랜드대학, 곰팡이는 영국의 PPCC (Ports-mouth Polytechnic Culture Collection), 조류는 CCAP (Culture Collection of Algae and Protozoa) 그리고 해양미생물은 NCIMB (National Collection of Indu-strial and Marine Bacteria)에서 취급하고 있다. 또한 아프리카를 중심으로 멸종야생동물보호, 자연 공원 지정, 재래 가축 보호, 축산 농가 단위의 전통가축 보호가 추진되고 있으며, 실험동물은 세계적으로 1993년 국제기구에서 실험동물 국제지표에 의해 마우스 3,290계통, 랫드 750계통, 토끼 70계통, 개 15계통, 영장류 36계통 등 22종류의 실험동물 계통이 확립되어 있다. 실험동물 취급기관으로 현재 전 세계에 1,050기관이 등록되어 있으며, 미국, 이탈리아, 프랑스, 독일은 마우스에 대한 실험동물 및 정보를 제공하고 있으며, 랫드와 영장류의 경우 미국, 일본 중심으로 실험동물을 세계 각국에 제공하고 있다9).
라. 생물다양성분야
2005년 캐나다에서 열린 생물다양성에 관한 국제적인 프로젝트 발표회에서 “Ecosystems and Human Well-being: the Biodiversity Synthesis Report”라는 제목으로 5년 동안 95개국 1,360명의 전문가들이 참여하여 지구상의 생물다양성 및 종들의 변화 추세를 관찰한 결과를 보고하였는데, 이 보고에 따르면 조류 12%, 포유류 23%, 구과를 맺는 식물 25%, 양서류 32%가 멸종의 위기에 처해 있음을 지적하였다. 다양한 인간 활동에 기인한 자연생태계의 파괴는 이를 근간으로 살아가는 생물종의 파괴를 불러와 생물다양성의 감소를 유발하며, 인류가 활용할 수 있는 다양한 생물자원의 소실로 이어질 수 있으므로, 국제기구를 중심으로 지구의 생물다양성을 보전하기 위한 노력이 경주되고 있다. 현재 생물다양성을 보전에 참여하는 범세계적인 기구는 100여 개가 있지만 그 중에서 대표적인 기구로는 GBIF (Global Biodiversity Information Facility)와 Species 2000 및 CHM (Clearing- house Mechanism for CBD) 등이 있다.
일본은 자국의 생태계를 위협하는 외래의 동식물 대책을 강구하기 위하여 2005년 ‘외래종피해방지법’ 시행을 위해 전문가협의회를 구성하여 포유류와 조류, 파충류와 양서류, 어류, 곤충류, 척추동물, 식물 등 6개 그룹으로 나누어 제일 먼저 규제해야 할 특정 외래생물 리스트를 발표했다. 중국의 환경보호총국은 2005년 5월 6가지 조치로 생물종의 안전 감독 관리를 추진하고자 선언하고 생태환경의 퇴화 및 외래침입 생물종의 위해를 막고 중국 내 생물유전자원의 유실을 막고 생물다양성 보호를 적극적으로 추진하는 정책을 수행 중에 있다. 프랑스는 생물다양성에 관한 국제학회의 동식물보존 분과위원회 발표에서 전 세계적으로 생물의 멸종이 가속화되는 현상을 경고하고 생물다양성의 변화를 관찰할 국제연합기구 창설을 제의했다. 또한 프랑스는 생물다양성연구소를 중심으로 약 140만종에 대한 생물종 목록 작성을 완료하였으며 생물다양성을 지키기 위하여 Reunion과 Guyane 제도에 새로운 해양국립공원을 창설하고 뉴칼레도니아 제도에 산호초 보호 방조제를 건설하여 유네스코에 자연 유산으로 등록할 예정이다. 미국의 경우 텍사스대학을 주축으로 지구상의 생물종 모두를 등재하는 작업을 25년 내에 완성하기 위해 전체생물종사업(All Species Foundation)이라 명명된 프로젝트를 수행 중에 있다.
![]() 국내 연구 현황
국내 연구 현황
<표 4-8-3-1> 정부 부처별 주요업무 | |
부처명 | 주요업무 |
과학기술부 | 미생물, 동・식물 세포주, 유전체 및 관련정보 |
농림부 | 쌀, 보리, 콩 등 5대 주곡 자원 및 농업유전자원의 보존관리 |
문화관광부 | 천연기념물 관리 |
보건복지부 | 인간유전체, 질병바이러스 및 식품관련 생물자원의 보존관리 |
해양수산부 | 수산, 해양환경보전, 해양자원 개발, 해양과학기술연구·개발 |
환경부 | 동식물 성체 생물자원, 생물표본의 보존관리 및 생태계 보존 |
국내 생물자원의 관리체계는 종합적으로 국무조정실에서 생물자원연구에 관한 이해가 상충되거나 조정이 필요한 내용에 관하여 담당하고, 국제적 이슈에 대한 대응은 외교통상부에서 국제기구의 동향에 대응하며, 이를 환경부 및 관련 부처에 사안별로 공동 협조 대응하는 것으로 되어 있다. 환경부 국립환경과학원에서는 자연환경보전법 등 생물다양성에 관한 국가 정책을 입안하는 기관으로 생물다양성 국가 전략 등 정책과 연구를 하고 있으며, 과학기술부는 한국생명공학연구원에서 생명공학연구 및 유전자원의 이용과 보전에 관한 연구를 전담하고 있는데 생명공학육성법에 의하여 과학기술부 장관이 생명공학육성 기본계획을 수립 집행하도록 되어 있으며 생명공학종합정책심의회에서 조정하도록 되어 있다12,13). 생물자원의 현지내 보존과 현지외 보존을 담당하는 정부 부처로는 과학기술부, 농림부, 환경부, 보건복지부, 해양수산부, 문화관광부 등 6개 부처가 있으며 이중 현지내 보존은 환경부, 해양수산부, 문화관광부가 주가 되고 있으며 현지외 보존은 주로 과학기술부, 농림부, 보건복지부 등이 전담하고 있으며 그 주요내용은 <표 4-8-3-1>과 같다.
국내에는 생명공학산업의 기초가 되는 생물자원의 탐색, 확보, 관리, 보급 및 정보화와 관련하여 각 대학의 관련학과, 정부출연연구소, 민간 연구자, 기업 등 다양한 연구그룹에서 그 중요성을 인식하여 참여하고 있는데 주요 부처별 연구현황을 <표 4-8-3-2>에 정리하였다. 우리나라는 지구상 생물자원(1,000만~3,000만 건)의 0.3~1%에 불과한 약 10만 건의 생물자원을 확보하고 있으며 생물자원 DB 구축현황은 <표 4-8-3-3>과 같다.
생물다양성사업은 1992년 나이지리아에서 열린 유엔환경개발회의(UNCED)에서 생물다양성협약(CBD)이 채택된 이후 생물다양성의 중요성을 인식하고 1994년 생물다양성 협약에 공식 가입하고 국제동향을 조사하고 대응하기 위해 부처별로 업무를 분장하여 운영 중이다. 과학기술부는 한국생명공학연구원을 중심으로 생물자원인프라 구축, 실험 동・식물 및 곤충계통보전, 산업용 생물자원조사 및 현지외 보존, 생물다양성 DB 구축 등의 사업을 실시하고 있으며14), 농림부는 농촌진흥청의 농업생명공학연구원, 농업과학기술원, 축산연구소, 작물과학원에서 자생식물자원의 재배기술개발/보급, 주요 농작물의 유전공학적 육종, 종자은행, 재래종 보전관리를 담당하고 있으며, 임업연구원과 산림청에서 주요산림자원의 보전/관리를 맡고, 수산진흥원이 연안생물, 수산자원 개발/보전을 담당하고 있다. 보건복지부는 국립보건원에서 생물안전성 지침작성/관리를 담당하고, 생약자원개발 및 관리는 국립안전연구원에서 담당하고 있다. 환경부는 국립환경과학원을 중심으로 생물표본의 보존·관리기법에 관한 연구, 생태유전적 특성을 고려한 멸종위기 야생식물의 보전 전략 연구, 외래식물의 생태적 위해성 평가 연구, 철새이동경로 및 도래서식 조사, 야생동물 실태조사를 수행하고 있다15). 해양수산부는 한국해양연구원에서 해양생물의 연구를 수행하고 있다. 그 외 문화관광부에서는 자연사박물관 건립과 생태관광 및 레저산업 육성에 힘을 써 국민들에게 생물다양성의 중요성을 홍보하고 누릴 수 있도록 조치하고 있다. 또한 현재 착공을 기다리는 제주생물종다양성연구소는 제주지역의 육・해상 생물종자원에 대한 연구를 담당할 예정이며 2007년까지 250억 원을 투자해 제주의 육상 및 해상의
<표 4-8-3-3> 국내생물자원 확보 및 DB구축 현황 | |||
부처 | 기관 (홈페이지) | 주요내용 | 자원 보유현황 |
과학 기술부 | 생명(연) 생물자원센터 http://www.brc.re.kr | 미생물, 유전체소재 수정란,동·식물세포주 | 11,600여 주 |
인간유전체기능사업단 http://21cgenome.kribb.re.kr | cDNA clone Human cDNA library Genomic DNA | 447,000여 clone | |
자생식물이용기술사업단 http://www.pdrc.re.kr | 야생식물종자 식물추출물 식물유전자DB | 종자 370여 점 식물추출물 4,300 여 건 | |
미생물유전체활용사업단 http://www.microbe.re.kr | 미생물, 메타볼룸, 프로테움, 메타게놈 | 22,280여 건 | |
한국과학기술정보연구원 http://www.ccbb.re.kr | 동물, 곤충, 식물, 어류, 균류 등 | 43,433여 건 | |
국립중앙과학관 http://www.science.go.kr | 조류, 포유류, 화석 곤충, 패류, 거미 등 | 50,000여 건 | |
국가지정연구소재은행사업 http://www.ccarm.or.kr 외 외 23개 대학소재 | 야생버섯균주, 항생제내성균주, 식물바이러스 등 | 340,250여 건 | |
농림부 | 농업생명공학연구원 http://www.niab.go.kr/ | 식물 및 미생물자원 | 종자 1,777종 151,082점 영양체 996종 22,625점 미생물 621종 15,244균주 |
농업과학기술원 http://www.niast.go.kr | 곤충 및 누에유전자원 | 곤충 100천 점, 누에 321종 963점 | |
축산연구소 http://agis.nlri.go.kr/korea/ | 가축유전자원 | 가축:7축종, 19품종, 10,333마리 가축DNA:7축종, 37품종, 14,115점 | |
국립산림과학원 http://www.kfri.go.kr | 산림자원 | 소나무 등 1,150종 | |
국립수목원 http://www.koreaplants.go.kr | 산림자원 | 전문전시원 3,344종, 유용식물자원 보존원 1,825종, 종자은행 2,217종 | |
보건 복지부 | 국립보건연구원 유전체 연구부 http://www.ngri.go.kr | 인간유전체 및 바이오자원 | 인간 DNA, 인간세포주, 혈청, 혈장, 병원미생물 등 90,711여 건 |
환경부 | 국립생물자원관 http://www.nbrc.go.kr | 야생동·식물 | 동물, 식물, 무척추 동물 등 86만종 |
해양 수산부 | 국립수산과학원 http://www.nfrda.re.kr | 어류, 패류, 갑각류 담수어류 | 어류 36종, 패류 19종, 갑각류 7종, 담수어류 20여종 등 총 500여 점 |
동・식물 등 생물종 자원에 대한 추출물은행, 종자은행, 유전자은행 등을 구축하고 생물자원의 안정성, 유효성 평가 등 산업화 연구를 종합적으로 수행한다.
한국생명공학연구원은 2005년 9월 남미 코스타리카 생물다양성연구소와 한・코스타리카 생물자원센터(KCBRC) 설립을 위한 양해각서를 체결하고 세계 6%에 해당하는 풍부한 생물다양성 자원을 보유한 코스타리카와 천연신약, 식품의약 소재를 개발하기로 하였다. 대학에서 운영하고 있는 생물다양성 관련 기관으로는 강원대학교 생물다양성연구소가 있으며 곤충자원, 식물자원, 미생물자원연구실 운영하며 강원도를 중심으로 한반도의 생물다양성을 연구하고 보존하고자 활동하고 있다. 강원대학교 생물다양성연구소 곤충자원연구실에는 현재 100만 점 이상의 곤충표본을 보유하고 있다.
<표 4-8-3-2> 주요 부처별 주요 연구현황 | ||
부처 | 주관기관 | 사업명 |
과학기술부 | 한국생명공학 연구원 | - 바이오인프라구축 및 지원 사업 - 식물추출물은행구축 - 메타게놈/프로테옴/메타볼롬뱅크 - 특수환경 미생물 다양성 확보 및 탐색 - 기능성 미생물 자원은행 구축 - 미생물소재은행 - 야생화 및 멸종위기 식물종자은행사업 - 국가유전체 정보센터 운영체제 구축 - 생물소재 성과관리를 위한 기반 기술 개발 |
한국과학기술 정보연구원 | - 생물유전자원정보네트워크 구축 및 관련기술연구 | |
한국식품연구원 | - 식품미생물 유전자은행 사업 | |
한국해양연구원 | - 극지유용생물의 기능성소재 개발사업 - 해양특수환경 미생물다양성 및 메타게놈자원 확보 및 탐색 - 해양미생물다양성 확보 및 유전자원 이용기술 | |
강원대학교 | - 베트남 지역의 생물다양성(곤충)탐색 및 유용생물자원개발 | |
건국대학교 | - 전기화학활성을 가진 난배양성 미생물의 메타게놈탐색 | |
서울대학교 | - 국내 혐기성 원핵미생물자원 확보, 분류, 보존기술개발 - 뇌질환자 샘플의 DB 및 은행 구축 - 인간전분화능 줄기세포 확립 및 세포주은행 운영 | |
아주대학교 | - 수생식물자원정보은행 구축 | |
대학 | - 특수소재은행사업 | |
농림부 | 농촌진흥청 | - 농용미생물자원 다양성 확보 및 활용시스템 구축 - 두류유전자원의 다양성 확보, 계통분류 및 유용성평가 - 벼유전자원의 다양성 확보 및 활용 연구 - Genetic stocks 및 돌연변이 유전자원의 국가관리체계 구축 - 메타게놈 뱅크 구축 및 작물병 억제관련 신규유전자선발 - 국내유전자원탐색 및 수집 연구 - 환경미생물자원의 분류동정 및 보존연구 - 십자화과 유전자원의 수집 및 다양성 연구 - 자생약용식물자원의 분포 및 보존 |
목원대학교 | - 저영양배양 및 식물생장촉진미생물 탐색과 분류 | |
국립산림과학원 | - 산림유전자원의 탐색 및 보존기술 | |
원예연구소 | - 무사마귀병 저항성 계통 육성, 마커 개발 및 병균 분리, 동정 | |
보건복지부 | 국립보건연구원 | - 유전체실용화사업 - 국내분리전염병 병원체 자원화 사업 |
국립암센터 | - 종양은행의 운영 | |
해양수산부 | 국립수산과학원 | - 수산생물의 유전자은행 운영 및 정보관리 - 내수면 생물자원 보존연구 - 해양생물자원 보존 연구 |
한국해양연구원 | - 해양극한생물유전체연구 - 남서태평양 해양생물자원 개발 | |
환경부 | 자연보전국 자연자원과 | - 한국고유종의 데이터베이스 구축 |
교육인적 자원부 | 제주대학교 | - 제주산해조류 추출물은행 구축 |
연세대학교 | - 미토콘드리아 핵산염기서열을 이용한 과실파리아과의 계통분류학적 연구 | |
서울대학교 | - 미역에서 서식하는 하르팍티쿠스류(갑각강, 요각아강)의 계통분류 및 분자마커에 관한 연구 | |
![]() 생물자원의 발전과제
생물자원의 발전과제
차세대 원동력으로 주목받고 있는 생명공학은 기반이 되는 생물자원의 확보와 보존, 관리(정보화) 및 보급이 산업화의 핵심이라 할 수 있다. 따라서 선진각국은 생물자원의 다양성 확보, 안전 보존, 이용 그리고 정보화에 국가 역량을 집중,하고, 있다7,16,17). 생물자원확보는 차세대 국부창출을 위한 중요한 전략사업이지만 우리나라는 생물산업의 근간이 되는 생물자원의 수가 적은 자원빈국에 속한다. 따라서 자원 부국과 긴밀한 협력을 통한 지속적인 생물자원 확보 노력이 요구된다. 세계에서 가장 높은 생물다양성을 보유하고 있는 대표적인 나라는 남미의 브라질, 아르헨티나, 칠레 등을 들 수 있으며 브라질의 경우 55,000여 종의 식물종이 보고되어 있는데 이는 전 세계 식물의 1/4에 해당할 만큼 엄청난 양이다. 생물자원의 확보와 더불어 주요하게 추진해야 될 부분은 생물다양성(Biodiversity) 보존사업이다. UN 환경 프로그램의 새 천년 생태 평가서(Millennium Ecosystem Assessment, MEA)에 따르면 2050년까지 남아있는 생물자원의 10~20%가 농업으로 인한 땅의 이용으로 파괴될 것으로 예측된다. 따라서 생태계 및 생물 다양성의 보전과 인간의 경제 활동을 모두 만족시키면서 지속 가능한 활용을 이루기 위한 효과적인 방법 모색이 필요하다고 할 수 있다. <표 4-8-4-1>는 향후 산업적으로 활용 가능한 생물자원의 예를 나타내고 있다.
지구 생물 총량의 60%를 차지하는 미생물은 여타 생물자원과 비교해 생명현상이 단순하여 학문적 접근이 용이하며, 다양한 서식지에 적응하는 탁월한 생존능력을 가지고 있다는 점에서 산업화에 유리하다고 할 수 있다. 그러나 인류가 현재의 기술로 배양할 수 있는 미생물은 1% 정도에 불과하다고 알려져 있으며 99%의 미생물이 발견 혹은 배양되지 못한 채 남아있다. 이들은 특유의 생명현상과 기능을 가지고 있으리라 예상되며 집중적인 연구가 필요하다. 미발견 미생물들을 발굴하여 생명공학산업에 활용하기 위해서는 새로운 배양기법 개발(난배양성 미생물 분리 및 배양기술 등), 새로운 생태환경 탐색(해양, 우주 및 극한환경서식지; 극지, 화산, 온천, 사막 등), 미생물유전체 연구, 메타게놈 라이브라리(metagenome library) 구축, 첨단 스크리닝 기술, 미생물 군집 분포 모니터링 등의 다양한 기술개발을 포함하여 토착미생물과 산업미생물을 중심으로 연구대상 전환이 필요한 시점이다. 식물의 경우 인류가 사용하고 있는 약품 중 70%는 식물에서 유래할 만큼 인류 복지에 주요한 생물자원이라 할 수 있으며, 최근 삶에 대한 웰빙 열풍과 함께 인공화합물에서 나타나는 부작용을 걱정하지 않아도 되는 식물 유래의 천연물질에 대한 인식이 그 어느 때보다 증대되어 있는 실정이다. 선진 각국은 의약 및 다양한 산업에 활용할 식물 유래의 신물질을 발견하기 위하여 남미와 아프리카 등 생물다양성이 보존된 산림 및 정글을 탐색하고 있다. 우리나라는 전통적으로 내려오는 민간요법 및 전통 의학 지식을 활용하고 한국고유 식물자원을 이용하여 고부가가치 신물질 탐색에 집중할 필요가 있다. 동물자원의 경우 최근 전 세계적으로 지대한 관심을 모으고 있으며 상대적으로 경쟁력을 갖춘 줄기세포 자원 분야에서 유망한 신규 생물자원을 확보할 수 있으리라 예상된다.
<표 4-8-4-1> 개발 가능한 생물자원 | ||
생물자원 | 분류군 | 활용 범위 |
난배양성 미생물 | 미생물 | 계면활성제, 항생물질, 효소, 생리활성 물질 등 |
공생미생물 | 미생물 | 산업용 효소, 에너지생산, 식물생장촉진, 항생물질, 생리활성 물질 등 |
특수환경미생물 | 미생물 | 항생물질, 효소, 생리활성 물질, 생물정화, 환경복구, 산업폐기물 처리, 바이오에너지 생산 등 |
유전체 | 미생물, 식물, 동물 | 인간의 유전적 연구모델, 농업이나 생태에 활용, 미생물의 산업적, 의학 등 |
해양생물자원 | 미생물, 동물, 식물 | 항균제, 항산화제, 항암, 항혈액응고제, 항 고혈압, 항동맥경화, 바이오색소, 수술용 접착제, 효소류, 건강음료 등 |
메타게놈 | 미생물, 식물, 동물 | 산업용 유용효소, 신규생리활성 물질 등 |
곤충자원 | 곤충 | 혈액응고 방지 물질, 기능성 식품 등 |
줄기세포 (Stem cell) | 동물 | 난치병 치료(척수마비, 파킨슨씨병, 녹내장, 당뇨병 등) |
영장류 자원 | 동물 | 에이즈 및 감염증 해석, 유전자치료와 게놈기능해석, 노화, 포스트게놈 프로젝트(post-genome project) 등 |
한국고유 식물 | 식물 | 의약품, 기능성 식품, 원예산업 등 |
또한 지난 반세기 동안 컴퓨터 기술과 유전자 관련 기술의 융합으로 바이오인포매틱스(Bioinformatics)와 같은 새로운 학문분야가 탄생했으며 BT와 IT의 융합은 인간유전체 정보해석, 생물정보시스템연구, 바이오컴퓨터, 바이오 전자소자 지능시스템 등 다양한 신산업분야를 개척하고 있다. 생물자원의 활용에서도 타 분야 기술의 접목 및 융합을 통해 새로운 활용가치를 제시하는 발상의 전환이 필요한 시점이다. 상기에서 언급한 생물자원을 인류에 유익한 자원으로 활용하기 위해서는 생물자원센터 보급, 생물다양성보전 및 생물자원정보 생산 및 확보라는 세 분야의 네트워킹을 통한 시너지 효과 창출이 핵심요소라고 할 수 있다. 그러므로 현재 수행중인 생물자원 연구와 관련된 사업들에 대한 범부처적이고 총체적인 국가 ‘종합관리체제’ 확보가 시급하다고 사료된다.
■ 제 4장 분야별 연구개발 및 관련산업 현황 제 9절 생명공학 인프라 |
![]() 개요
개요
Pilot Plant는 실험실에서 연구개발한 결과를 토대로 제조과정을 개발하거나, 테스트용으로 이용되는 소량의 신제품을 제조하기 위한 시험생산규모(pilot scale)의 시설 및 설비를 의미하며, 규모는 통상 실험실규모(lab scale)의 10~20배, 본 생산을 위한 공장규모(plant scale)의 1/10 정도이다. 기존에 생산 공정이 이미 알려진 카피()제품의 경우에는 처음부터 공장규모로 생산이 가능하나, 신 공정 개발이 필요한 모든 제품의 경우는 정확한 공정프로세스가 설정되지 않아 실험실규모의 데이터를 가지고 반드시 시험생산규모를 거친 후 공장규모로 생산하여야 한다. 이는 실험실규모에서 개발된 신제품 제조공정을 공장규모의 대규모 시설·장비 투입 이전에 시험생산규모를 도입·운전하여 운전규모 확대시 발생 가능한 제반 문제점을 해결하고, 생산제품의 품질 및 시장반응 등을 종합적으로 검증함으로써 초기에 자본투입으로 인한 기업체의 위험부담을 최소화하고자 하는 것이다. 특히 자본력이 부족한 중소 바이오벤처기업의 경우에는 시험생산규모의 검증이 매우 중요하다.
Pilot Plant가 판매용이 아닌 시제품 시험생산을 위한 생산규모 개념인 반면, GMP시설은 실제적으로 제품을 생산하기 위한 제조기준에 적합한 시설을 의미한다. 다시 말해, GMP(Good Manufacturing Practice)는 품질이 보증된 우수제품을 생산하는데 필요한 제반시설(H/W) 및 운영기준(S/W) 등에 필요한 규정을 지칭하며, 원료물질의 제조 및 구입에서부터 완제품의 제조 및 출하에 이르기까지의 제조공정 전반에 걸쳐 지켜야할 최소한의 요건을 규정한 것이다.
일반 소비자는 제품의 불량 여부를 사전에 가릴 수가 없으므로 제조업자가 품질을 확보하도록 하여, 불량제품으로 인한 소비자의 피해를 최대한 방지할 필요가 있다. 이를 위해서는 먼저 합리적이고 과학적인 구조설계와 우수한 제조설비·시설의 확보가 필요하며, 이를 기반으로 한 과학적인 근거와 타당성에 기초한 제조관리 방법의 확립과 최적의 운영체계를 갖추고 있어야 한다. 바로 이러한 면에서 GMP가 필요한 것이다.
오늘날에는 국제교류의 필요에 따라 미국 FDA의 current GMP(cGMP; 우수의약품제조 및 품질관리기준), 유럽시장 진출을 위하여 획득해야하는 유럽연합(EU)의 EU GMP 및 생산제품 별로 GMP 제도의 도입을 유도하였으며, <표 4-9-1-1>과 같이 우수의약품, 원료의약품, 화장품, 의료용구, 생물제제, 건강기능식품 등의 제조를 위한 각종 GMP를 적용 또는 제정하여 실시하고 있다.
<표 4-9-1-1> 생산제품의 성격에 따른 GMP 분류
GMP의 명칭 | 제정근거 | 제정연도 | 규제대상 | 약칭 |
우수의약품제조 및 품질관리기준(cGMP) | 미국연방규정(21 CFR Parts 210.211) | 1963 | 우수의약품 | cGMP |
우수의약품제조 및 품질관리기준(EU GMP) | 유럽연합규정(EMEA) | 1989 | 우수의약품 | EU GMP |
의약품제조 및 품질관리기준 | 약사법 시행규칙 제40조[별표.4] | 1977. 3. | 의약품제조업 | KGMP |
우수의약품(인삼류)제조관리기준 | 보건복지부 예규 제513호 | 1986.12. | 홍삼제품제조업 | 폐지(1998) |
우수화장품제조 및 품질관리기준 | 식품의약품안전청 고시 제2000-59호 | 2090. 4. | 화장품제조업 | cosmeticGMP |
우수원료의약품제조 및 품질관리 | 약사법 시행규칙 제40조[별표 4] | 1990. 4. | 원료의약품제조업 | BGMP |
우수위생용품제조 및 품질관리기준 | 보건복지부 예규 제576호 | 1990. 4. | 위생용품제조업 | 폐지(2000) |
한약(생약)제제의 KGMP실시지침 | 약정 제31260-9165호 | 1991. 7. | 한약제제제조업 | - |
의료용구제조 및 품질관리기준 | 약사법 시행규칙 제40조[별표 4의 2] | 1997. 6. | 의료용구제조업 | - |
수입의료용구제조 및 품질관리기준 | 약사법 시행규칙 제40조[별표 4의 3] | 2000. 3. | 수입의료용구업 | - |
생물학적제제등제조 및 품질관리기준 | 약사법 시행규칙 제40조[별표4의 4] | 2000. 6. | 생물학제제 등 제조업 | BioGMP |
수입혈장관리기준 | 약사법 시행규칙 제40조[별표4의 5] | 2002. 1. | 혈장수입업 | - |
우수건강기능식품제조기준 | 식품의약품 안전정 고시 제2004-7호 | 2004. 1. | 건강기능식품 | GMP |
<표 4-9-1-2> Pilot Plant와 GMP의 비교 | ||
구분 | Pilot Plant | GMP |
정의 | ・시험생산공장 | ・우수제품을 제조하기 위한 기준 |
목적 | ・시제품 생산 ・Scale-up상의 문제점 해결 ・대규모 자본투입 전 의사결정 자료 제공 | ・판매용 제품 생산 ・불량제품으로 인한 소비자 보호 |
인허가 및 승인 | ・없음 | ・있음 |
생산품목 | ・다양한 품목 가능 | ・특정 범주의 품목 |
범위 | ・H/W(시설) | ・H/W(시설) + S/W(기준서 및 규정) |
참고 용어 | ・Lab-scale production (실험실 규모 생산) ・Production-scale process (실제 생산규모 공정) | ・GLP (Good Laboratory Practice, 전임상) ・GCP (Good Clinical Practice, 임상) ・GTP (Good Tissue Practice, 조직공학) ・CMO (Contract Manufacturing Organization, 위탁생산) |
Pilot Plant와 GMP는 <표 4-9-1-2>와 같이 서로 상이한 부분이 있으나, 서로 대립적인 개념이 아니며, Pilot Plant를 GMP기준에 맞게 구축·운영할 수도 있다.
![]() 해외 동향
해외 동향
선진국에서는 cGMP시설을 보유한 우수의약품 제조업체가 2001년 말 현재 미국 800개, 일본 49개, 이탈리아 30개, 영국 26개, 프랑스 18개, 독일 16개 등이 있으며, 생물의약품 생산을 위한 cGMP시설에 대한 전 세계적인 수요는 계속적으로 증가하여 2008년에는 2003년 기준으로 2배 수준의 생산시설이 요구될 것으로 예상된다(Hightech Business Decision사, 2003년). 또한 외국은 정부지원 하에 설립된 cGMP시설 사례로 영국의 Celltech(1980년 설립, 1987년 민영화, 1996년 Lonza사에 일부 매각), 싱가폴의 Bioprocessing Technology Center(1990년 설립), 대만의 Biomedical Engineering Center(1999년 설립) 등이 있다(한국생산기술연구원 자료). 특히 Lonza사는 스위스 등 총 8개 나라에 18개 공장을 두고 있으며 2003년 매출 2조 원 중 우수의약품 매출이 2,700억 원에 이르는 전문 CMO회사로 4,800억 원을 추가설비에 투자하는 기업이다.
![]() 국내 현황
국내 현황
국내에서는 GMP기준 등의 시설에서 생산되는 바이오식품(45%) 및 생물의약품(41%)은 생물산업 전체 생산규모(2003년 2조 791억 원)의 86%를 차지하고 있으며, 특히 생물의약 분야는 특허가 만료되어 모방생산이 가능한 제너릭의약품 및 원료의약품에 대한 경쟁력이 확보되기 시작함에 따라 시장점유율이 증가되고 있다. 또한 이와 관련된 제조업체는 2003년 현재 경기(31%), 서울(23%), 대전(10%) 등 약 64%가 수도권과 대전에 집중되어 있는 실정이다(“2003년 국내바이오산업실태조사”, 기술표준원, 2004년 12월). 최근 국내 기업의 생명공학 의약품 등의 제조와 관련해서 생물학적 약물제제(75개 품목), 생명공학 및 원료의약품(95개 품목), 진단용의약품(10개 품목), 기타 기능성소재·제품(10개 품목) 등 43개 업체에서 190개 품목이 출시되었다(한국신약개발연구조합, 2005년 1월).
그러나, 국내 생물의약 분야의 성장에도 불구하고 현재까지 성장기로의 도약에 걸림돌이 되는 인프라 여건이 취약하다. 즉, 국내에는 미국 FDA의 인증을 받은 우수의약품제조 및 품질관리기준인 cGMP기준의 생산공장이 전무한 실정이다. 이에 산업자원부에서는 취약한 인프라 여건을 감안하여 국내 생물산업계의 수요를 반영하고 생물의약품 개발 및 수출을 촉진하기 위하여 수도권(인천)에 생물산업기술실용화센터건립사업(1998년~2005년, 총사업비 918억원)을 추진하고 있다.
또한, 수도권 이외의 지역은 중소 바이오벤처기업들을 위한 산업화 인프라 지원을 위해 산업정책 차원에서의 바이오벤처기업지원센터(BVC, 1998년~2006년, 총사업비 1,200억 원) 및 지역균형발전 차원에서의 바이오 지역특화센터(2002년 ~2008년, 총사업비 4,106억원)의 설립을 통해 기술 개발 및 시제품생산에 필요한 고가의 시설·장비를 집적하여 지역별로 특화된 분야의 지역 거점별 창업 및 성장단계별 집적화, 공동연구, 공동장비활용, 정보제공, 교육훈련 등을 지원하고 있다. 현재 전국의 각 센터는 초기에 연구개발 장비 및 시제품생산용 Pilot Plant 장비를 구축하였으나, 바이오벤처기업의 성장, 유치 등에 따라 line-up된 Pilot Plant 장비가 요구되었고, 일부 지역특화센터에서는 지역 내 기업들이 기술개발을 완료한 후 GMP시설에서 신제품을 소량생산하여 시장진입 가능성을 판단하고자 하는 경우가 많아지면서 실제 제품을 생산할 수 있는 규모 수준의 시설·장비가 구축되고 있다. 그러나 아직은 바이오 집적지로 발전하기에는 한계가 있는 것이 현실이다.
2005년 6월 말 기준으로 전국의 바이오벤처기업지원센터 및 바이오 지역특화센터의 11개가 가동 중이며(13개는 건립 중), 센터당 평균 입주기업 14개, 고용인력 60명, 매출액 126억 원, 수출액 1백만 불 등의 성과를 도출하였으며, 향후 지역경제에 센터 당 고용 273명, 소득 300억 원 등을 창출할 전망이다(“BIO 산업발전을 위한 3·12프로젝트”, 산업자원부, 2005년 7월).
<표 4-9-3-1> 바이오벤처기업지원센터 및 바이오 지역특화센터 현황-2005년 11월 현재 | |||||
지역 | 과제명 | 주관기관 | 사업기간 (총사업비) | 특화분야 | 추진현황(Pilot Plant시설 등) -인력, 입주기업, 장비구축- |
경기·인천 | ㅇ생물산업기술실용화센터 | 한국생산기술연구원 | ’98-’05(918억 원) | 생물의약 | cGMP시설, 2005년 10월 준공 |
대전 | (TIC) 생물의약TIC | 한국생명공학연구원 | ’99-’03(174억 원) | 생물의약 | 전임상 제품지원, PP(52대) |
(지역특화) 바이오 벤처타운조성 | (재)대전첨단산업 진흥재단 | ’02-’07(억 원) | 생물의약 | 인력(5), 입주(15), GMP수준(30대) | |
충북 영동 | (TIC) 생물의약 및 식품TIC | 영동대학교 | ’01-’06(107억 원) | 생물의약·식품 | 인력(20), 입주(7), PP(119대) |
오창 | (지역특화) 보건의료산업종합 지원센터건립 | (재)충북바이오산업 진흥재단 | ’04-’07(249억 원) | 보건의료 | 인력(5), 입주예정(3) |
제천 | (지역특화) 전통의약품개발 지원센터건립 | (재)충북바이오산업 진흥재단 | ’03-’07(238억 원) | 전통의약 | 인력(6), PP(103대) |
충남 논산 | (지역특화) 동물자원사업화 지원센터건립 | (재)충남동물자원센터 | ’03-’06(81억 원) | 동물자원 | 인력(8), 입주예정(6) |
전북 전주 | (산기반) 생물벤처기업지원 센터설립 | (재)전북생물산업 진흥원 | ’00-’04(126억 원) | 생물식품 | 인력(21), 입주(26), PP(585대) |
전남 나주 | (산기반) 생물산업산·학·연 협동연구 및 실용화기반구축 | 동신대학교 | ’00-’04(84억 원) | 생물식품 | 인력(11), 입주(24), PP(359대) |
나주 | (지역특화) 생물식품사업화 지원센터건립운영 | (재)전남생물산업 진흥재단 | ’02-’07(428억 원) | 생물식품 | 인력(12), 입주(6), GMP수준(9대) |
화순 | (지역특화) 생물농업산학공동 연구센터건립운영 | (재)전남생물산업 진흥재단 | ’02-’07(252억 원) | 생물농업·의약 | 인력(10), GMP수준(13대) |
국내 바이오벤처기업지원센터 및 바이오 지역특화센터 등 생명공학분야 인프라 현황은 <표 4-9-3-1>에 예시한 바와 같다.
<표 4-9-3-1> Continued
지역 | 과제명 | 주관기관 | 사업기간 (총사업비) | 특화분야 | 추진현황(Pilot Plant시설 등) -인력, 입주기업, 장비구축- |
제주 | (TIC) 기능성바이오 첨가제 및 생물자원 TIC | 제주대학교 | ’01-’06(76억원) | 생물 식품 | 인력(15), 입주(5), PP(152대) |
(지역특화) 바이오 사이언스파크 | (재)제주하이테크 산업진흥원 | ’02-’07(289억원) | 생물 화장품 | 인력(7), 입주(15), GMP수준(695대) | |
경북 상주 | (TIC) 생물농업 및 식품용생물소재TIC | 상주대학교 | ’01-’06(114억원) | 생물 소재 | 인력(10),입주(5), PP(92대) |
안동 | (지역특화) 생물건강 산업사업화 지원센터건립 | (재)경북바이오 산업연구원 | ’02-’07(229억원) | 생물 식품 | 인력(13), 입주(13), PP(143대) |
울진 | (지역특화) 해양생명 환경산업지원센터 건립 | (재)경북테크노파크 | ’04-’07(233억원) | 해양 환경 | 인력(6) |
강원 춘천 | (산기반) 생물산업 벤처기업지원기반조성 | (재)춘천바이오 산업진흥원 | ’98-’01(204억원) | 생물 의약 | 인력(15), 입주(33), PP운영중, GMP수준(118대) |
춘천 | (지역특화) 춘천 바이오타운조성 | (재)춘천바이오 산업진흥원 | ’02-’07(505억원) | 생물 의약 | |
강릉 | (지역특화) 강릉해양 생물산업지원센터 | (재)강릉해양생물 산업진흥원 | ’02-’07(394억원) | 해양 생물 | 인력(9), 입주(10), PP(178대) |
부산 | (산기반) MarineBio 산업지원센터구축 | 신라대학교 | ’02-’07(158억원) | 해양 생물 | 인력(7), 입주(19), PP(101대) |
(지역특화) 해양생물 산업육성센터 | (재)부산테크노파크 | ’04-’08(245억원) | 해양 생물 | 인력(4), 입주(6) | |
대구 | (지역특화) 전통생물 소재산업화센터 | (재)대구테크노파크 | ’04-’08(200억원) | 생물 식품 | 인력(11), PP(39대) |
(지역특화) 한방산업 지원센터 | (재)대구테크노파크 | ’04-’08(80억원) | 한방 바이오 | 인력(4) | |
경남 진주 | (산기반) 생물화학소 재산업지원센터설립 | (재)바이오21센터 | ’00-’04(206억원) | 생물 소재 | 인력(17), 입주(19), PP(111대) 입주시설, CRO기관 유치 중 |
진주 | (지역특화) 바이오 벤처프라자건립 | (재)바이오21센터 | ’04-’08(243억원) | 생물 소재 |
![]() 발전 과제
발전 과제
일반 제약회사 등에서도 시제품을 생산하기 위한 Pilot Plant구축에 있어서 경제적인 부담과 실패 위험성 때문에 우수한 후보제품을 개발하고도 더 이상 투자를 하지 못하는 경우가 많이 있다. 그리고 통상적으로 전임상시험 단계에 진입하는 의약품 후보물질이 실제 제품으로 성공하는 경우는 1/250에 불과하고 국내에는 이런 시제품 제조가 가능한 GMP수준의 Pilot Plant도 거의 없으며, 전체 공장 가동률도 60%정도 밖에 되지 않는다. 따라서 현재 국가에서 추진하고 있는 생물산업기술실용화센터(cGMP시설) 및 바이오 지역특화센터(Pilot Plant 또는 GMP수준)가 공공차원에서 이런 역할을 담당한다면, 일반 제약업체를 포함한 지역 내 중소 바이오벤처기업들의 투자 위험성을 국가가 일부분 부담함으로써 신제품 개발에 동기부여가 가능하고, 나아가 국가경쟁력 확보에 도움을 줄 수 있을 것으로 보인다.
그러나 바이오 지역특화센터가 GMP수준의 인프라를 구축하였다 하더라도 현행 약사법 등에서 규정하고 있는 제품보유 기준에 따라 중소벤처기업의 기술개발제품을 생산·지원해주는 것에는 현실적으로 어려움이 있다. 이에 보건복지부를 통하여 제조허가와 품목허가의 분리에 대한 의견이 포함된 약사법 개정안이 제시되었다. 만약 향후 약사법 개정에 의해 제조허가와 품목허가가 분리된다면 지역특화센터에서 품목 확보 없이도 제조허가를 획득하여 공공성격의 생산지원을 통한 핵심지원 인프라의 구축, 고수익으로 인한 자립화 기여, 기술집약형 중소 벤처기업 육성의 핵심적 역할을 담당할 수 있을 것이고 해당기업 및 연구자에 대한 지원효과가 매우 클 것이다. 또한, 유사업종의 기업집적화를 통해 지역특화 소재에 대한 공동 브랜드화에도 크게 이바지할 수 있을 것이다. 다만, 공공차원의 서비스 제공을 위해서는 지역 내 바이오벤처기업의 생산품 및 임상시험제품의 생산에 한정하여 일반 민간기업에서 구축·운영하는 공장과 차별되어야 함이 전제되어야 한다.
궁극적으로 막대한 국가자금이 투여되는 만큼, 바이오 지역특화센터 건립은 영세한 지역 내 중소 바이오벤처기업을 스타기업으로 육성하기 위한 미래지향적이고 생산적인 관점에서 실질적인 시설·장비구축이 이루어져야 할 것이다. 또한 거점기관 간 시행착오를 최소화하기 위한 정보교류와 상호협력관계 구축방안 등도 매우 중요하다.
[참고자료]

출처: BT분야 인프라 현황도 -Pilot Plant 및 GMP- (2005년 11월 현재)

■ 제 5장 생명공학 관련 법제도 현황 제 1절 바이오 안전성 동향 |
![]() 서론
서론
현대 생명공학기술의 산물인 유전자변형생물체(Living Modified Organisms: LMOs, 이하 ‘LMOs’)는 경제적, 기술적, 과학적 측면에서 우리에게 많은 혜택을 가져다주고 있다. 하지만, 다른 한편으로는 이들 유전자변형생물체(LMOs)에 의한 인류와 생태계에 미칠 수 있는 위험성에 대한 논쟁도 끊이지 않고 있는 상황이다. 특히, 유전자변형생물체가 국제적 산업에 응용되면서 국가간 이동이 시작되자 이로 인해 발생할 수 있는 잠재적 영향을 사전에 예방하고 안전성을 확보하고자 국제적 차원에서의 규범 체계 필요성이 대두되었다. 이에 1995년 생물다양성협약(CBD: Convention on Biological Di-ver---sity) 당사국들은 이러한 국제적 요구에 부응하여, LMOs의 잠재적 위험을 다루게 될 바이오안전성의정서(이하, ‘의정서’)의 작성을 촉진하기에 이르렀으며, 지난 2003년 9월 11일부로 LMOs의 국가간 이동에 중점을 둔 동 의정서가 국제적으로 발효되어 2005년 현재 126개국이 가입하고 있다.
의정서 가입 현황에서 눈여겨 볼만한 점은 유전자변형작물을 재배하고 있는 것으로 파악된 17개 국가 중 11개국(중국, 스페인, 독일, 루마니아, 멕시코, 온두라스, 콜롬비아, 파라과이, 브라질, 인도, 남아공)이 가입하고 있으며, 대다수의 재배면적을 점유하고 있는 나머지 6개국(미국, 캐나다, 아르헨티나, 호주, 우루과이, 필리핀)은 가입하지 않고 있다<표 5-1-1-1>. 이들 국가가 가입하지 않고 있는 것은 의정서 이행에 따른 유전자변형작물의 개발 및 수출에 타격을 받을 것을 고려한 조치로 보이고 있다. 그러나 최근 유전자변형작물 재배규모가 세계 4위에 해당하는 중국이 2005년 6월 제2차 당사국회의를 앞둔 시점에서 의정서에 가입했고, 이로써 개발도상국이 주였던 당사국 대열에 중국이 합류함으로써 의정서 이행에 더욱 탄력을 받을 것으로 예상된다.
<표 5-1-1-1> 바이오안전성의정서 가입 현황 2005년 10월 말 기준 126개국 | |||
지역구분 | 의정서 발효 기준 50개국 (2000년 10월 5일∼ 2003년 6월 13일) | 발효 기준일 이후 가입국 (∼2005년 10월) | 계 |
아프리카 | 보츠와나, 카메룬, 지부티, 가나, 케냐, 레소토, 라이베리아, 말리, 모리셔스, 모잠비크, 탄자니아, 튀니지, 우간다(13) | 나이지리아, 부르키나파소, 남아공, 세네갈, 에티오피아, 마다가스카르, 이집트, 잠비아, 세이셸, 감비아, 토고, 르완다, 알제리, 니제르, 나미비아, 짐바브웨, 베냉, 에리트리아, 콩고, 수단, 리비아, 모리타니 | 35 |
아시아· 태평양 | 부탄, 피지, 인도, 몰디브, 마샬군도, 나우루, 니우에, 오만, 팔라우, 사모아(10) | 몽고, 북한, 말레이시아, 캄보디아, 통가, 요르단, 이란, 일본, 키프로스, 베트남, 방글라데시, 타지키스탄, 시리아, 키리바시, 스리랑카, 솔로몬, 라오스, 인도네시아, 중국, 키르기스스탄, 파푸아뉴기니 | 31 |
중앙· 동부 유럽 | 벨로루시, 불가리아, 크로아티아, 체코, 몰도바, 슬로베니아, 우크라이나(7) | 루마니아, 리투아니아, 슬로바키아, 폴란드, 헝가리, 라트비아, 에스토니아, 아르메니아, 알바니아, 아제르바이잔, 유고 | 18 |
중남미· 카리브해 | 바베이도스, 볼리비아, 콜롬비아, 쿠바, 에콰도르, 멕시코, 니카라과, 파나마, 세인트키트네비스, 트리니다드토바고, 베네수엘라(11) | 세인트빈센트, 앤티가바부다, 엘살바도르, 브라질, 바하마, 그레나다, 벨리즈, 파라과이, 페루, 도미니카, 과테말라, 세인트루시아 | 23 |
서유럽 및 기타 | 오스트리아, 덴마크, 프랑스, 룩셈부르크, 노르웨이, 스페인, 스웨덴, 스위스, 네덜란드(9) | 터키, 아일랜드, 영국, 독일, 이탈리아, 벨기에, 그리스, 핀란드, 포르투갈, 뉴질랜드 | 19 |
자료: 바이오안전성의정서 홈페이지(www.biodiv.org/biosafety/) 내용 재구성. | |||
의정서의 국제적 흐름 속에서 우리나라는 2000년 9월 동 의정서에 서명하였으며, 시민단체 등 바이오안전성 확보 요구와 더불어 의정서 국내이행체제 구축에 대한 초석을 마련하고자 2001년 3월 산업자원부가 주관이 되어 ‘유전자변형생물체의 국가간 이동 등에 관한 법률’을 제정·공포하였다. 이후 각 부처별로 동법 시행에 필요한 하위 법령 제정을 위해 노력해 왔고, 최근 이러한 노력의 결과로써 동법 시행령이 확정(2005년 9월 20일)되기에 이르렀다.
이에, 본 절에서는 의정서 발효(2003년 9월 11일) 이후 개최된 두 차례의 당사국회의를 통해 의정서를 중심으로 한 국제적 논의동향을 살펴보고, 아울러 우리나라는 동 의정서 이행 및 바이오안전성 확보를 위해 어떠한 노력이 이루어지고 있는지를 기술해 보고자 한다.
![]() 의정서 논의 동향
의정서 논의 동향
가. 제1차 당사국회의 논의 동향
제1차 당사국회의(COP MOP-1)는 의정서가 발효된 약 5개월 후인 2004년 2월 23일부터 27일까지 말레이시아 콸라룸푸르에서 개최되었다. CBD(생물다양성협약) 사무국이 주최한 제1차 당사국회의는 의정서당사국, 비당사국, UN기구, 정부간기구, 비정부간(NGO) 기구 등 2,000여 명의 대표가 참석하였으며, △수입당사국의 수입의사 결정 촉진을 위한 절차 및 메커니즘 △정보공유 및 BCH(바이오안전성 정보센터) △능력형성 △LMOs의 취급, 운송, 포장 및 식별 △의무준수 절차 및 메커니즘 △배상책임 및 피해배상 △모니터링 및 보고 △재정체계 등이 주요 핵심 의제로 다루어졌다.
제1차 당사국회의에서는 의정서 채택 초기부터 쟁점이 되었던 LMOs 농산물 등 식용·사료용·가공용 유전자변형생물체(LMOs-FFP)의 국가간 이동에 필요한 서류요건이 가장 핵심적인 이슈로 논의되었으며, 이를 둘러싸고 호주, 뉴질랜드, 캐나다, 미국, 브라질 등 농산물 수출국들과 EU 및 주로 개도국들인 농산물 수입국들간의 첨예한 대립양상을 보였다.
회의 결과 당사국들은 LMOs 국가간 이동시 취급·운송·포장·명기 등의 상세사항에 대해 어느 정도 합의를 이뤄내 향후 전문가회의를 통해 이를 구체화하기로 결정하였다. 이에 의정서의 의무준수위원회를 구성하고, 책임 및 복구에 관한 전문가그룹 설치를 합의해 위임권한을 확정하는 등 LMOs의 국가간 이동에 관한 국제규범으로써 의정서의 실질적 이행에 필요한 기초를 마련하는 장을 열었다는 평가를 받고 있다. 또한, LMOs의 취급·운송·포장·명기사항, 의무준수, 책임 및 복구, 능력형성, 정보공유 및 바이오안전성정보센터(BCH), 수입국의 결정절차, 의정서의 중기작업계획 등 총 11개의 결정문을 채택하였다.
앞서 언급했듯이 제1차 당사국회의에서는 향후 전문가 그룹회의를 통해 구체화하기로 한 결정에 따라 제2차 당사국회의를 앞두고 아래와 같은 전문가 그룹회의를 개최함에 따라 제2차 당사국회의 결정문초안 등을 작성하기도 하였다<표 5-1-2-1>.
<표 5-1-2-1> 전문가 그룹회의 논의 현황 | |||
회의일시 | 회의명 | 회의내용 | |
1 | 2005년 1월 26일~27일 (캐나다 몬트리올) | 바이오안전성 능력형성 활동의 시행 및 기금 조성을 위한 정부·국제기구 조정 제1차 회의 | 조정회의 운영 절차 및 가이드라인과바이오안전성능력형성 네트워크 운영세칙을 채택함. |
2 | 2005년 1월 27일~28일 (캐나다 몬트리올) | 바이오안전성 능력형성 연락 그룹 회의 | 의정서의 효율적인 이행을 위한 능력형성 실천계획의 시행과 조정 촉진을 위한 조치 등을 논의하고 연락그룹의 위임사항과 운영세칙을 심의 후 채택함. |
3 | 2005년 3월 14일~16일 (캐나다 몬트리올) | 바이오안전성 의정서 의무준수위원회 제1차 회의 | 의무준수위원회규정(안)을 채택하고, 2005년 5월말 개최될 제2차 당사국총회에서 승인받기로 결정함. |
4 | 2005년 3월 16일~18일 (캐나다 몬트리올) | LMOs-FFP의 식별요건에 대 한 개방형 기술전문가 그룹 제1차 회의 | 의정서 제18조 2(a)항에 따라 LMOs-FFP의 식별요건에 대한 결정문초안을 작성하기로 하였으나 합의에 이르지 못하였음. |
출처: 바이오안전성동향(2005년 1분기, www.biosafety.or.kr) 내용 재구성. | |||
나. 제2차 당사국회의 논의 동향
2005년 5월 30일부터 6월 3일까지는 의정서가 채택된 캐나다 몬트리올에서 의정서 제2차 당사국회의가 개최되었다. 제2차 당사국회의는 2004년 2월 개최된 제1차 당사국회의 논의 당시 향후 5년간 매년 당사국회의를 개최하기로 한 결정에 따른 것이다. 제2차 당사국회의는 총 119개국에 달하는 의정서 당사국 중 100개 당사국 대표 및 미국 등 11개 옵서버 국가대표, FAO (국제연합식량농업기구) 등 UN전문기구, 미국곡물협회, 그린피스 등 89개 비정부기구 대표 등을 포함해 약 750명 이상이 참가하는 성황을 이루었다.
제2차 당사국회의 역시 제1차 당사국회의와 마찬가지로 식용·사료용·가공용 유전자변형생물체(LMOs-FFP)의 취급·포장·운송 등 국가간 이동에 필요한 서류요건에 대한 결정문 채택 문제가 가장 주요한 이슈로 떠올랐다. 그 밖에도 △의무준수위원회 의사규칙안 채택 △BCH 운영 및 작업계획 채택 △개도국 능력형성 지원 △수출국 통보 △위해성 평가 및 관리 지침 및 체제 마련 △책임 및 복구체제 △LMOs의 사회·경제적 영향에 대한 연구 및 정보교환 협력 △대중인식 제고 및 참여 등에 관한 세부사항들에 대한 의제가 논의되었으며, 이는 향후 의정서의 효과적인 이행을 위한 기반구축에 크게 기여할 것으로 보인다.
우리나라는 제1차 당사국회의에 이어 의정서를 비준하지 않아 옵서버로 참여하였으나, 지난 제1차 당사국회의 이후 의정서 이행을 위한 준비를 착실히 진행해 오고 있으며, 한국바이오안전성정보센터(KBCH)가 실시한 아시아지역 대상 능력형성 활동 워크숍 개최 및 UNEP-GEF 국가바이오안전성 체제구축 프로젝트 완료 등 의정서 이행을 위한 우리나라의 활동 내용을 소개하는 성과를 올렸다. 또한 국내 관련법령이 완비되는대로 의정서를 비준할 계획임을 설명하였고, 이번 회의가 모든 이해관계자들의 이해를 균형 있게 반영하는 현실적인 접근이 필요하다는 점 등을 강조하기도 하였다.
특히 우리나라는 BCH 등 주요 이슈에 우리 입장을 개진하여 BCH 사업들이 보다 활발하게 수행되기 위해서는 사무국이 마련한 BCH 다년운영계획안의 Time- frame 단축이 필요하다는 점을 제기하여 결의문에 반영되는 성과를 거두었다.
이번 당사국 회의에서도 가장 핵심적으로 논의가 되었던 LMOs-FFP 동반서류 세부명기사항의 결정문 채택은 실패로 돌아갔다. 이는 LMOs-FFP를 둘러싼 호주, 뉴질랜드, 캐나다, 미국, 브라질 등 농산물 수출국들과 유럽연합(EU) 및 주로 개도국들인 농산물 수입국들 간의 이해 조정이 쉽지 않음을 다시 한 번 확인시켜 주었다. 따라서 이 문제는 내년 3월 브라질에서 개최 예정인 제3차 당사국회의에서 재차 논의하기로 하였다. 하지만, 제3차 당사국회의까지는 1년도 채 남지 않았기 때문에 LMOs-FFP 세부명기사항을 둘러싼 수출국과 수입국가들간의 첨예한 이해가 해소될 수 있을지는 주목해봐야 할 것이다.
한편, 비록 LMOs-FFP 세부명기사항 결정문 채택에는 실패했지만, 당사국들의 의정서 이행을 지원하기 위한 여러 조치 및 의정서의 성공적인 이행에 중요한 위해성 평가 및 관리, BCH 운영 및 활동, 능력형성, 대중인식 및 참여 제고 등 여러 이슈에 있어 건설적인 논의가 이루어져 총 14개의 결정문이 채택되었다.
![]() 국내 동향
국내 동향
가. 국내이행법 동향
우리나라는 2000년 9월 의정서에 서명하였으며, 2001년 3월 의정서 국내이행 및 바이오안전성 확보 차원에서 산업자원부 주관으로 ‘유전자변형생물체의 국가간 이동 등에 관한 법률’을 제정·공포하였다. 동 법 제정 이후 2002년 6월 동법 시행령(안)이 입법예고 되었지만, 바이오안전성 확보에 필요한 국가 능력형성 및 기반구축마련을 위해 오랫동안 시행령(안) 확정 및 의정서 국내 비준절차가 미루어져 왔다.
그러나 그동안 관계 부처간 협의를 거쳐 동법 시행령 및 시행규칙, 관련 지침·고시 등이 상당 부분 정비되었고, 이에 따라 지난 2005년 9월 20일에는 동법 시행령이 국무회의를 통과함으로써 확정되기에 이르렀다. 국내 이행법은 의정서의 국내 이행을 위하여 유전자변형생물체(LMOs)의 수입 및 생산승인제도, 유전자변형생물체의 개발·이용에 관한 연구시설의 설치와 바이오안전성위원회를 설치하도록 규정하고 있으며, 이에 유전자변형생물체의 수입 및 생산승인방법 및 절차에 관한 사항 등 법에서 위임된 사항과 그 시행에 있어 필요한 사항을 금번 확정된 시행령에서 정하였다.
시행령의 주요 내용을 살펴보면, LMO의 용도에 따라 관계 중앙행정기관의 업무를 구분하였으며(시행령 제2조), LMO 수입 및 생산 승인(5조~15조), 위해성 심사(16조~17조), 연구시설 허가(23조), 바이오안전성위원회(28조~29조) 등을 규정하여 LMO의 안전성 확보 조치를 위한 근거를 마련하였다.
나. 바이오안전성 관계부처별 동향
최근 시행령 확정에 이르기까지의 관계부처의 준비상황을 살펴보면, 우선 바이오안전성의정서의 국가책임기관인 산업자원부에서는 국내이행법 시행령 및 시행규칙 확정을 위해 노력하였다. 이를 위해 시행령(안)에 존재하는 일부 불명확한 부분과 재량권 남용의 여지가 있는 조항을 관계부처간의 협의를 거쳐 수정하였다. 이 밖에도 관계중앙행정기관의 역할로써 산업용 유전자변형생물체의 환경위해성 평가자료의 심사에 대한 고시(안), 위해성 평가기준 및 항목에 대한 고시(안), 산업용 유전자변형생물체의 표시·취급관리·보고 및 검사 절차에 대한 고시(안), 바이오안전성위원회 구성 및 운영에 대한 계획(안)을 마련 중에 있다.
농림부는 국내이행법 및 농산물품질관리법에 의거하여 농업·임업·산림용 유전자변형생물체의 연구개발, 생산, 유통 등 단계별로 산하기관간 업무분담을 통해 LMOs의 효율적인 안전관리 체계를 구축해 왔다. 구체적으로는 농업연구 관련 유전자변형생물체의 실험실 안전관리, 유전자변형농산물의 환경위해성 평가심사, 유전자변형농산물의 수출입 및 생산 승인, 유전자변형 농산물의 취급관리, 유전자변형농산물의 국경감시, LMOs의 표시제 등을 준비 중에 있다. 또한, 농림부는 수입농산물의 수급 상황을 고려하여 우리나라에서 유통되고 있거나, 유통될 가능성이 있는 대부분의 유전자변형농산물의 환경위해성 심사를 마친 상태이거나 일부 진행 중에 있다.
보건복지부는 보건의료용 유전자변형생물체의 인체위해성 평가심사, 시험·연구용 유전자변형생물체에 대한 수입·개발·실험의 사전 승인과 유전자변형생물체를 개발하거나 사용하는 연구시설의 설치·운영에 대한 허가 등이 수행해야할 업무이다. 이에 ‘시험연구용 등 유전자변형생물체의 수입 및 개발·실험에 대한 국가승인 심사지침 고시(안)’을 마련한 상태이다. 또한, 과학기술부와 공동으로 ‘유전자변형생물체 연구시설의 설치기준 및 안전관리규정(안)’을 마련하였다.
해양수산부는 해양 및 수산용 유전자변형생물체의 평가심사와 유통을 담당하고 있다. 해양 및 수산용 유전자변형생물체는 아직까지는 개발 및 상업화가 두드러지지는 않지만, 최근 유전자변형 농산물 못지않게 유전자변형 수산물의 환경 및 인체에 대한 위해성 논란이 국제적으로 이슈화 되고 있는 실정이라 해양수산 분야에서 보다 철저한 안전관리 확보대책이 필요하다고 보고 있다. 이에 의정서 국내 발효에 대비한 사전준비 체제 구축과 환경위해성 심사제도 시범운영, 표시제와 취급지침 마련·시행, 환경위해성 평가제도와 정보보호 등을 마련해 일부 수행하고 있다.
환경부는 환경정화용 유전자변형생물체의 개발·생산·수출입·판매·운반·보관 등에 대한 안전관리를 담당하고 있으며, 다른 부처 소관 유전자변형생물체가 자연생태 환경에 미치는 영향에 관해 협의하는 책임이 있다. 이에 따라 ‘환경정화용 유전자변형생물체의 환경위해성 안전관리를 위한 고시(안)’ 등을 마련하는 등 유전자변형생물체의 환경위해성 평가연구에 최선을 다하고 있다.
과학기술부는 시험·연구용 유전자면형생물체의 안전성 확보를 관장하여, 그에 따른 지침 마련, 국내 시험·연구용 유전자변형생물체의 개발 및 이용실태 정보 구축 등을 추진하고 있으며, 아울러 유전자변형생물체의 위해성 평가 기초기술 개발 및 평가기반 구축에도 최선을 다하고 있다.
다. 향후 전망
의정서는 채택 초기부터 식용·사료용·가공용 유전자변형생물체(LMOs- FFP)의 세부명기사항과 관련하여 수출국과 수입국간 첨예한 대립 양상을 보였고, 이 문제는 의정서 발효 후 2년 내에 구체적인 사항을 결정하기로 합의한 바 있다. 하지만, 의정서 발효 후 2년을 앞둔 지난 제2차 당사국회의에서조차 합의를 이끌어내지 못했기 때문에 앞으로 있을 차기회의 결과가 주목될 것으로 예상된다. 특히 선진국들은 이미 LMOs와 관련한 국내법령을 완비하여 LMOs로부터 보호를 받고 있지만, 개도국들의 경우에는 국내 체제구축 등의 미비로 무방비상태라는 점이 국제적으로 우려를 낳고 있다. 하지만, 최근 중국 등이 의정서를 가입함으로써 미국 등 대다수 수출국들이 의정서 비당사국이라 할지라도 향후 의정서에 의한 LMOs의 국가간 이동 체제를 간과할 수는 없을 것으로 보인다. 또한, LMOs-FFP 세부명기사항과 관련해서도 의무준수 및 책임복구 체제의 수립과 연계되어 있는 만큼 향후 몇 년간 이러한 의정서 이행체제 마련 여부에 있어 매우 중요한 시기가 될 것이라고 점쳐지고 있다.
이에 우리나라도 내년 초에 있을 제3차 당사국회의에서의 당사국 지위 확보를 목표로 국내비준 준비를 위한 막바지 단계에 있다. 이에 지난 9월 30일에는 ‘유전자변형생물체의 국가간 이동 등에 관한 법률 시행령’이 확정되었고, 이에 따라 바이오안전성의정서의 비준, 시행규칙 제정, 관계 중앙행정기관의 관련 고시 제정 등이 현재 이루어지고 있어 늦어도 2006년 상반기 중에는 의정서 및 국내이행법이 발효될 것으로 전망되고 있다.
또한, 관계 중앙행정기관은 앞으로 있을 국내이행법 시행에 따른 현안 문제 등을 논의 중에 있으며, 시행규칙, 고시 등의 하위규정이 정비됨과 동시에 LMO의 수입, 생산, 유통, 취급관리, 연구개발과 관련한 이해당사자들을 대상으로 한 설명과 이해 제고를 위한 절차도 진행할 예정이다.
■ 제 5장 생명공학 관련 법제도 현황 제 2절 생명윤리관련 입법 동향 |
![]() 개요
개요
생명공학기술은 궁극적으로 인간의 질병에 대한 예방‧진단‧치료를 목적으로 하는 학문 분야이기 때문에 인간과 깊은 관련성을 가지면서 발전하고 있다. 따라서 생명공학기술에 대한 연구는 초기 단계부터 인간과 관련된 여러 가치들과 위험 및 이익 등을 고려하여야 하며 여러 윤리적, 법적, 사회적 문제를 검토하면서 진행되어야 한다. 우리나라에서도 복제양 돌리의 탄생을 계기로 생명공학기술에 대한 윤리적, 법적, 사회적 논의가 본격화되었으며, 활발한 논쟁의 결과로 <생명윤리및안전에관한법률>이 제정되어 시행되고 있다. 2003년 12월 국회를 통과한 <생명윤리및안전에관한법률>은 2004년 1월 29일 법률 제7150호로 공포되어 2005년 1월 1일부터 전면적으로 시행되었다. <생명윤리및안전에관한법률>은 생명공학기술의 거의 모든 분야를 망라하여 규율하는 법률로서 생명공학기술에 대한 기본법적 성격을 가지고 있다.
생명공학기술에 대한 법적 규율은 아직 전세계적으로 통일되어 있는 것으로 보이지는 않는다. 이러한 현상은 개별적인 연구를 바라보는 시각이 다양할 뿐만 아니라 생명공학기술이 계속 새로운 분야로 그 영역을 확장시키고 있는 데에 기인하는 것으로 보인다. 특히 체세포핵이식술을 이용한 줄기세포연구나 유전자검사 등의 영역에서는 연구의 허용 여부부터 허용 범위 등을 둘러싸고 격렬한 논쟁이 벌어지고 있다. 우리나라의 경우에는 다른 국가들과 비교할 때 매우 일찍이 생명공학기술을 규율하는 법률인 <생명윤리및안전에관한법률>을 제정하여 시행하고 있음에도 불구하고 그와 같은 논쟁은 여전하다. 이와 같은 현상은 다음과 같은 점들에서 기인하는 것으로 보인다. 첫째, 생명공학기술 분야는 정지하여 있는 분야가 아니라 나날이 발전하고 새로운 영역을 스스로 개척하여 나가는 분야이다. 생명공학기술에 대한 연구가 궁극적으로는 인간에 대한 이해를 넓히고 인간의 질병을 치료하여 삶의 질을 향상시키려는 것이라면, 인간이라는 종이 존재하고 있는 한 생명공학기술은 끊임없이 자신의 영역을 넓혀 나갈 것이다. 따라서 새로운 영역의 생명공학기술이 출현할 때 마다 혹은 그것이 예견될 때 마다 새로운 차원의 논의가 등장할 것이다. 둘째, <생명윤리및안전에관한법률>은 일종의 타협의 산물이라는 점에서 그 한계가 노출되어 있다. 생명공학연구자들은 자신들의 연구의 자유가 침해당하지 않기를 바라고 있으며, 생명공학기술이 국가의 경쟁력 고양에 기여하고 경제적 이익을 가져다 줄 수 있을 것이라는 점을 강조하고 있다. 이에 반하여 윤리학계, 종교계, 시민단체 등은 생명공학기술이 야기할 수 있는 윤리적 문제점들을 부각시키면서 가능한 연구의 범위를 축소하고자 하고 있다. 셋째, <생명윤리및안전에관한법률>은 생명공학기술 전반에 대한 규율을 목표로 하고 있기 때문에 개별적인 생명공학기술에 대한 충분한 규정들을 가지고 있지 아니하다. 먼저 개별적인 생명공학의 문제들을 규율함에 있어서 세부적인 내용을 하위법령들에 위임할 수밖에 없으며 이로 인하여 법적 안전성이나 예측성을 저해하는 상황이 발생하기도 한다.
<생명윤리및안전에관한법률>은 9장 55조와 부칙으로 구성되어 있다. 제1장 총칙에는 법률의 목적, 법률에서 사용되는 용어에 대한 정의, 법률의 적용 범위, 국가나 지방자치단체, 생명공학연구자의 책무, 자기결정권에 대한 규정을 두고 있다. 제2장은 대통령 소속의 국가생명윤리심의위원회와 각 연구기관에 설치하도록 되어 있는 기관생명윤리심의위원회(IRB: Institutional Review Board)에 대하여 규정하고 있다. 제3장은 배아 등의 생성·연구에 대하여 규정을 하고 있는데, 제1절에서는 인간복제 등의 금지에 대하여, 제2장에서는 배아의 생성 등 인공수정배아에 대한 규정을, 제3절에서는 체세포복제배아와 관련한 규정을 하고 있다. <생명윤리및안전에관한법률>제4장은 유전자검사에 대하여 규정하고 있는데, 세부적으로는 유전자검사기관에 대한 규정, 유전자검사의 허용범위, 검사대상물의 제공 및 폐기, 기록의 관리 및 열람에 대한 규정을 하고 있다. 제5장은 유전정보 등의 보호 및 이용에 대하여 규정하고 있는데, 유전자정보에 의한 차별금지, 유전자은행의 운영에 대한 규정을 하고 있다. 제6장은 유전자치료에 대한 규정을 하고 있는데, 유전자치료의 범위를 열거적으로 규정하고 있으며, 유전자치료기관에 대하여 규정을 하고 있다. 제7장은 <생명윤리및안전에관한법률>에 의하여 규율되는 사항에 대한 감독에 대하여 규정하고 있는데 감독의 주체는 보건복지부장관으로 하고 있다. 제8장은 보칙 규정으로서 성체줄기세포연구에 대한 국가 또는 지방자치단체의 재정지원에 대하여 규정하고 있으며, 국고보조에 대한 사항, 보건복지부장관의 권한의 일부 위임과 위탁 등에 대한 사항, 비밀누설금지 등에 대한 사항을 규정하고 있다. 제8장은 <생명윤리및안전에관한법률>에 의하여 규율되는 사항을 위반한 행위에 대한 벌칙을 규정하고 있다. 부칙은 <생명윤리및안전에관한법률>의 시행일 및 잔여배아의 연구에 대한 경과조치에 대하여 규정하고 있다.
생명공학기술을 둘러싼 윤리적, 법적, 사회적 논쟁은 생명공학기술 전반에 걸쳐서 발생할 수 있다. 우리나라에서의 논쟁도 생명공학기술 전반에 걸쳐서 발생하고 있지만 주로 활발한 논쟁이 벌어지는 주제는 체세포핵이식술에 의한 줄기세포연구와 유전자검사와 관련된 윤리적, 법적, 사회적 합의에 대한 것이다. 특히 최근의 체세포핵이식술을 이용한 환자 특이적 줄기세포 생성의 가능성이 논의되고 관련 연구자의 논문 조작 사실들이 문제가 되었고 최근에 체세포핵이식술에 의한 줄기세포연구에 대한 윤리적, 법적, 사회적 논의가 매우 격렬하게 전개되고 있다. 이하에서는 체세포핵이식술에 의한 줄기세포연구에 대한 <생명윤리및안전에관한법률>의 규정들을 살펴보고 외국에서의 논의현황을 간략하게 검토하고자 한다.
![]() 체세포복제행위에 대한 규율
체세포복제행위에 대한 규율
가. <생명윤리및안전에관한법률>
<생명윤리및안전에관한법률>에 의하면 체세포핵이식술에 의한 줄기세포연구는 제한적으로 허용된다. <생명윤리및안전에관한법률>에 대한 본격적인 논의는 체세포핵이식술에 의한 생명복제를 둘러싼 사회적 논의로부터 본격적으로 촉발되었다. 따라서 본 법률에는 체세포핵이식술에 의한 생명복제와 관련된 여러 규정들이 있다.
체세포핵이식술에 대한 <생명윤리및안전에관한법률>의 기본적인 태도는 인간의 개체복제와 이종간 융합행위를 금지하고 체세포핵이식술에 의한 줄기세포연구는 제한적으로 허용하는 것이라고 할 수 있을 것이다. 동법 제11조 제1항은 “누구든지 체세포복제배아를 자궁에 착상시켜서는 아니되며, 착상된 상태를 유지하거나 출산하여서는 아니된다.”라고 규정하여 인간개체를 생산할 목적의 체세포핵이식행위를 전면적으로 금지하고 있다. 나아가 동법 제11조 제2항은 제1항의 행위를 유인하거나 알선하는 행위도 금지하고 있다. 동법 제11조 제1항을 위반한 경우에는 10년 이상의 징역에 처해지며(동법 제49조 제1항), 미수범도 처벌한다(동법 제49조 제2항). 또한 유인이나 알선행위의 경우에도 3년 이하의 징역에 처하도록 하고 있다(동법 제51조 제1항 제1호).
또한 <생명윤리및안전에관한법률> 제12조는 이종간의 착상 등의 행위를 금지하고 있다. 동조 제1항은 “누구든지 인간의 배아를 동물의 자궁에 착상시키거나 동물의 배아를 인간의 자궁에 착상시키는 행위를 하여서는 아니된다.”라고 규정하여 인간배아를 자궁에 착상하여 연구에 이용하거나 개체를 생성하려는 행위, 혹은 동물배아를 인간의 자궁에 착상하여 연구에 이용하거나 개체를 형성하려는 행위를 모두 금지하고 있다. 이는 인간종과 타 동물종간의 혼합을 막으려는 규정이라고 생각된다. 배아 자체가 특정 종에 의해서만 형성된 것이라고 하더라도 자궁에 착상되는 경우 임신을 유지하는 개체와 배아간의 혈액 및 영양분의 교류 등을 통하여 종간 융합이 발생할 가능성을 배제할 수 없으며, 인간의 존엄성을 침해할 가능성이 있다는 전제에서 이와 같은 규정을 마련한 것으로 생각된다. 본 규정을 위반하여 인간의 배아를 동물의 자궁에 착상시키거나 동물의 배아를 인간의 자궁에 착상시킨 자는 5년 이하의 징역에 처한다(동법 제50조). 동조 제2항은 각호에서 금지되는 행위들을 열거하고 있으며, 각 호에서 금지하는 행위를 행한 자는 3년 이하의 징역에 처하도록 하고 있다(동법 제51조 제1항 제2호). 동조 제2항 제1호는 “인간의 난자를 동물의 정자로 수정시키거나 동물의 난자를 인간의 정자로 수정시키는 행위”를 금지하고 있는데, “다만, 의학적으로 인간 정자의 활동성 시험을 위한 경우”는 허용하고 있다. 인간과 동물의 생식자를 융합하는 행위는 전형적인 이종간 이식행위이므로 이는 금지된다고 할 것이다. 동조 제2항 제2호는 “핵이 제거된 인간의 난자에 동물의 체세포 핵을 이식하는 행위”를 금지하고 있다. 본 규정은 체세포핵이식술에 의한 이종간 이식행위를 금지하는 규정이다. 이종간 이식이 생식자간의 직접 이식방법뿐만 아니라 체세포핵이식술에 의하여서도 이루어질 수 있음을 염두에 둔 규정이다. 그러나 본 규정은 핵이 제거된 인간의 난자에 동물의 체세포 핵을 이식하는 행위만을 금지하고 있을 뿐, 핵이 제거된 동물의 난자에 인간의 체세포 핵을 이식하는 행위는 금지하고 있지 아니하다. 인간의 난자에 체세포의 핵을 이식하여 연구를 수행하거나 질병의 치료를 위한 줄기세포의 추출을 시도할 경우 인간의 난자를 획득하기에 어려움이 있으며, 난자를 제공하는 여성의 신체에 대한 위험이 발생할 수 있다는 점에서 상대적으로 획득이 용이하고 인간에 대한 위험성이 적은 동물의 난자를 이용한 연구를 허용하여야 한다는 주장도 있으나, 동물의 난자에 인간의 체세포의 핵을 이식하는 행위도 이종간 이식의 일종이므로 이에 대한 적절한 법적 규율방안이 마련되어야 할 것이다. 동조 제2항 제3호는 “인간의 배아와 동물의 배아를 융합하는 행위”를 금지하고 있다. 생명공학기술의 발달로 인하여 생식자단계에서의 이종융합뿐만 아니라 배아단계에서의 이종융합이 가능할 수 있다는 점을 염두에 둔 규정이라고 생각된다. 동조 제2항 제4호는 “다른 유전자를 가진 인간의 배아를 융합하는 행위”를 금지하고 있는데, 이와 같은 규정은 이종간의 융합뿐만 아니라 인간 사이의 유전자융합이 인위적으로 이루어지는 것을 방지하고자 하는 목적으로 생각된다. 자연적으로 일어나는 생식의 경우에도 정자를 제공하는 측의 유전자와 난자를 제공하는 측의 유전자가 융합하여 하나의 수정란을 형성한다. 따라서 서로 다른 유전정보를 가진 인간 유전자의 융합은 생식의 일부분이다. 본 규정은 이와 같은 유전자의 융합이 배아단계에서 인위적으로 이루어짐으로써 유전자 조작 등 여러 부작용이 발생하는 것을 막고자 하는 규정으로 생각된다.
체세포핵이식술에 의한 줄기세포연구에 대해서는 찬, 반 양론이 팽팽하게 대립하여 왔고, 최근에는 관련 연구자의 논문조작 사실이 알려지면서 새로운 국면을 맞고 있다. 체세포핵이식술에 의한 줄기세포연구는 인간의 질병을 치료하고 불임 등에 대한 지식 획득 및 치료술을 개발하기 위한 목적을 가진다. 하지만 체세포핵이식과정에서 생성되는 핵치환 구조물(nuclear transfer construct)에게 어떤 윤리적, 법적 지위를 부여할 것인지가3) 본 연구와 관련된 찬, 반 논란의 핵심이다. 인간배아는 결국 인간으로 발전할 수 있는 잠재성을 가진 존재이고,4) 체세포핵이식에 의한 줄기세포연구에서 얻을 수 있는 과학적·의학적 효용성을 잔여배아의 연구나 성체줄기세포연구에 의하여 획득할 수 있다는 주장도 있기 때문에4) 체세포핵이식술에 의한 줄기세포연구를 반대하는 주장도 거세다. 이러한 주장은 체세포핵이식술에 의한 생성된 구성물이 인간배아와 동일한 존재이며, 인간배아도 완전한 인간으로서 존중되어야 한다는 점을 전제로 하고 있다. 또한 잔여배아의 경우와는 달리 체세포핵이식술에 의하여 생성된 구성물은 생성 목적 자체가 연구나 타인의 질병치료이기 때문에 잔여배아의 연구 목적 이용을 허용한다고 할지라도 체세포핵이식술에 의한 줄기세포연구는 허용할 수 없다고 주장한다. 한편 체세포핵이식술에 의한 줄기세포연구가 인간의 존엄성에 위배되지 아니한다는 주장은 먼저 인간생명의 시작은 수정된 때가 아니라 원시선이 발생하는 수정 후 14일부터라는 데서 출발한다. 인간의 징표는 개체의 동일성인데 개체의 동일성은 원시선이 발생한 후부터 시작된다는 것을 근거로 들고 있다. 두 번째 근거는 체세포핵이식술은 탈핵된 난자와 체세포핵을 이용하기 때문에 전통적인 의미에서의 수정이라는 과정을 거치지 않는다는 것이다. 따라서 체세포핵이식술에 의한 생성물을 인간배아라고 지칭하여서는 안 되며 이를 체세포핵이식술에 의하여 생성된 구성물이라고 지칭하여야 한다고 주장한다.
<생명윤리및안전에관한법률>은 이와 같은 찬, 반론의 대립을 절충하는 형태로 법적 규율방안을 마련하였다. 본 법률에 의하면 ① 근이영양증, ② 기타 대통령령이 정하는 희귀·난치병의 연구를 목적으로 하는 경우에만 체세포핵이식술에 의한 줄기세포연구가 허용된다. 또한 체세포핵이식행위를 할 수 있는 연구의 종류·대상 및 범위는 국가생명윤리심의위원회의 심의를 거쳐 대통령이 결정하도록 하고 있다(<생명윤리및안전에관한법률> 제22조). 본 규정을 위반한 행위를 한 자에 대해서는 3년 이하의 징역에 처하도록 하고 있다(<생명윤리및안전에관한법률> 제51조 제1항 제6호). 또한 미수범도 처벌한다(동법 제51조 제13항).
나. 외국의 현황
체세포핵이식술을 이용한 줄기세포연구에 대한 세계 여러 국가의 입장은 통일되어 있지는 않다. 최근에는 유엔에서 모든 유형의 인간복제를 금지하자는 정치적 선언이 나오기도 하였다. 체세포핵이식을 통한 줄기세포연구를 법률 혹은 정부정책으로 금하고 있는 국가는 프랑스, 독일, 스페인, 덴마크, 핀랜드, 오스트리아, 일본 등이며, 금지하는 방향으로 입법을 추진 중에 있는 국가는 미국, 호주 등이다. 반면 체세포핵이식술을 이용한 줄기세포연구를 허용하고 있는 국가는 영국이며, 엄격한 조건하에서 허용할 것을 검토 중에 있는 국가는 스웨덴, 이스라엘, 중국, 싱가포르 등이다.
체세포핵이식술을 이용한 줄기세포연구에 대하여 미국은 연방정부의 지원을 금지하는 입장을 취하고 있다. 1996년 이후 Dicky Amendment는 Depart- ment of Health and Human Services (DHHS)가 인간배아의 생성을 지원하는 것을 금지하고 있다. 하지만 Dicky Amendment는 다른 자금을 이용하여 배아줄기세포를 연구하는 것을 금지하고 있지는 않다. 2001년 9월 부시대통령은 2001년 9월 이후 인간배아를 파괴하여 인간배아줄기세포주를 형성하는 연구에 연방자금이 지원되는 것을 금지하도록 하였다. 한편 2004년 11월 캘리포니아주에서는 “캘리포니아재생의학연구소(California Institute for Regenerative Medicine)”를 만들어서 줄기세포연구를 지원하도록 하는 법안에 대한 주민투표가 실시되었다.
영국의 인간수정 및 발생에 관한 법률은 원시선이 나타기 전까지는 즉 14일 이전까지는 불임, 선천성지병, 유전인자 및 염색체 비정상, 유산, 피임 등의 목적의 경우, 배아생산 및 배아연구를 허용하고 있다. 영국은 2001년 1월 에 인간수정 및 발생에 관한 법률에 따른 <인간수정및발생(연구목적)에관한규정(The Human Fertilisation and Embryology (Research Purposes) Regulations 2001)>을 제정하여 체세포핵이식술에 의한 줄기세포연구의 허용 범위를 확대하였다. 영국은 개체복제를 목적으로 체세포핵이식술을 이용하는 것은 금지하고 있지만 줄기세포연구의 목적으로 체세포핵이식술을 이용하는 것은 개별적인 사안마다 행정당국의 허가를 얻어 시행할 수 있도록 하고 있다. 또한 최근에는 줄기세포은행을 설립하여 운영하기도 하고 있다. 영국에서는 최근 허용되는 생명공학기술의 연구범위가 점차 확대되어 가는 양상을 보이고 있다.
독일은 제2차 세계대전 이후 인간존엄성에 대한 존중을 매우 중시하는 경향이 있어왔다. 1990년에 제정된 <배아보호법(Gesetz zum Schutz von Em- bryonen)>은 제6조 제1항에서 “사람의 배아나 다른 배아, 태아 사람 또는 사망한 자와 같은 유전인자를 같도록 인위적으로 조작한 자는 5년 이하의 자유형 또는 벌금형에 처한다.”고 규정하고 있다. 동조 제2항에서는 제1항에 규정된 배아를 부녀에게 이식한 자도 동일하게 처벌하며, 제3항에서 미수범도 처벌하고 있다. 또한 제2조에서 임신이외의 목적으로 사람의 배아를 체외에서 배양시키는 행위를 금지하고 있다. 독일의 이와 같은 법규정들은 배아를 인간존재로 보고 이를 파괴하는 행위를 엄격하게 규율하고자 하기 위한 취지이다. 하지만 생명공학기술의 발전이 세계적인 추세이기 때문에 줄기세포에 대한 독일의 규율도 변화를 보이게 되었다. 2002년에 제정된 <배아줄기세포법(Gesetz zur Sicherstellung des Embryonenschutzes im Zusammen-hang mit Einfuhr und Verwendung menschlicher embryonaler Stammzellen, StZG)>은 외국으로부터 수입된 줄기세포를 이용한 연구를 허용하도록 규정함으로써 제한적이나마 배아줄기세포의 연구가 허용되게 되었다.
일본은 2000년 제정된 <인간에관한복제기술등의규제에관한법률(ヒトに關すゐクロン技術等’の規制に關する法律)>에 의하여 체세포핵이식술을 이용한 개체복제는 물론 줄기세포연구도 금지되어 있는 상황이다. 하지만 최근 일본 문부성은 체세포핵이식술에 의한 줄기세포연구를 금지하고 있는 <특정배아취급에대한지침>을 개정하여 체세포핵이식술에 의한 줄기세포연구를 허용하고자 하는 움직임을 보이고 있다.
스위스는 2004년 11월 국민투표에 회부된 관련 법안을 통과시킴으로써 2005년 3월부터 유럽의 다른 국가들과 동등한 수준의 줄기세포연구를 할 수 있도록 하였다. 현재 제네바대학 등에서 줄기세포연구가 진행되고 있다.
![]() 전망 및 과제
전망 및 과제
<생명윤리및안전에관한법률>의 제정은 그동안 많은 논란 속에 진행되어오던 생명공학기술에 대한 연구 및 임상적 적용을 법적 테두리 내로 끌어들였다는 데에서 커다란 의의가 있다고 할 것이다. <생명윤리및안전에관한법률>의 제정으로 인하여 연구자들은 법적 보호 속에서 안정적으로 연구를 할 수 있게 되었다. 또한 생명공학기술에 대한 연구와 임상적 적용으로 인하여 발생할 수 있다고 예상되는 많은 위험들을 사전에 예방할 수 있는 장치도 어느 정도 마련되었다고 할 수 있다. 최근 많은 논란을 불러일으키고 있는 체세포핵이식술을 이용한 줄기세포연구의 경우 그 허용범위가 국가생명윤리심의위원회의 심의에 의한 대통령의 결정에 맡겨져 있다는 점에서 예측 가능성이 떨어지고 개별적 연구를 진행함에 있어서 신속한 진행에 어려움이 있을 것으로 예상된다. 생명공학기술 분야의 진행이 세계 각국의 경쟁적 연구 속에서 이루어진다는 점을 고려할 때 보다 효율적이고 예측 가능한 시스템의 도입이 필요하다고 생각된다. 현재의 법률규정에 의하면 결국 전문소위원회의 운영이 얼마나 진지하고 효율적으로 이루어지는가에 따라 생명공학연구의 방향이 정해질 것이다.
줄기세포연구를 포함한 몇몇 생명공학기술의 경우에는 상대적으로 우리나라가 국제적 경쟁력을 가지고 있는 것으로 평가를 받고 있다. 또한 생명공학기술이 의료행위와 직접적 관련성을 가진다는 특성 때문에 국제적으로 공동연구가 필요한 분야이다. 따라서 국제적 연구의 경우 어떠한 기준에 의하여 연구가 이루어져야 할 것인지에 대한 규정이 필요하다. 국제적 연구에서 주도적 역할을 하기 위해서는 기술이 앞서야 할뿐만 아니라 그 기술을 운용할 수 있는 법적, 제도적 장치가 국제적으로 인정받고 우리가 만든 기준이 표준적 기준이 될 수 있어야 한다.
<생명윤리및안전에관한법률>은 생명과학기술 전반을 규율함을 목적으로 하고 있지만 생명공학기술의 중요분야임에도 불구하고 이에 대한 규정이 미흡한 부분이 있다. 가장 큰 문제는 현재의 <생명윤리및안전에관한법률>이 체세포핵이식술에 의한 줄기세포연구를 중점적으로 고려하고 있음에도 불구하고 정작 줄기세포연구에 대한 규정은 거의 없다고 하는 점이다. <생명윤리및안전에관한법률>이 규정하고 있는 줄기세포연구에 대한 규정은 “국가 또는 지방자치단체는 성체줄기세포의 연구를 육성하기 위하여 재정지원을 할 수 있다.”라는 제46조의 규정 정도이다. 잔여배아를 이용한 연구나 체세포핵이식술이나 모두 그 목적은 줄기세포의 획득 및 임상적 적용에 있다는 점을 고려할 때 줄기세포연구 및 임상적 적용에 대하여 충분히 규정하는 것이 타당할 것으로 생각한다. 또한 바이오장기 혹은 이종장기연구 및 임상적 적용에 대한 부분은 규정이 전무한데, 바이오장기연구 및 임상적 적용이 생명공학기술의 중요한 분야임을 고려할 때 이에 대한 법적 규율장치도 마련하여야 할 것이다.
이제 생명공학기술을 둘러싼 윤리적, 법적, 사회적 논의는 금지냐 허용이냐의 논의로부터 보다 구체적이고 세부적인 논의로 넘어가야 할 시기이다. 즉 어떠한 기준을 가지고 어떠한 절차에 의하여 규율할 것인가가 논의의 핵심이라고 할 것이다. 이를 결정함에 있어서는 특정 집단이나 특정 개인의 신념이나 믿음이 아닌 당사자들 모두 참여하는 합리적인 논의가 필수적이다. 또한 최근 황우석 교수 사태에서도 볼 수 있듯이 이 논의 과정에서 연구자들은 생명공학이 가져올 혜택에 대한 지나친 기대를 조장하는 방식으로 국민적 지원을 얻으려는 시도는 장기적인 생명공학 발전을 위해 바람직하지 않음을 주지해야 할 것이다. 다른 연구에 비해 위험성과 불확실성이 큰 반면 성공할 경우 이득도 큰 생명공학 분야의 특수성을 고려할 때, 국내 과학계가 경쟁력을 갖추고 있는 분야에 대한 냉정한 판단에 입각하여 제반 윤리·사회적 논쟁을 염두에 둔 연구가 이루어져야 할 것이다. 그리고 생명공학기술의 대상 혹은 수혜자가 될 일반국민들의 의사도 매우 중요하다고 할 것이다. 보다 구체적이고 세부적인 사항에 대한 합리적인 의식조사와 논의를 통하여 해결책을 마련하는 것이 앞으로의 과제인 것이다.
■ 제 5장 생명공학 관련 법제도 현황 제 3절 생명공학 지적재산권 제도동향 |
![]() 개요
개요
생명공학 분야는 살아있는 생물체를 발명의 대상으로 하고 있다는 특성 때문에 다른 기술 분야와는 별도의 독특한 지식재산권 제도를 운영하고 있다. 최근 생명공학 분야의 연구 방법이 지속적으로 개발되어 새로운 유형의 발명이 증대되고 이에 따라 특허 출원의 내용과 수준도 날로 복잡·다양해지고 있는 추세이며, 특히, 인간 유전체 연구(Human Genome Project)의 완성 이후 국가간에 유전자 혁명을 선점하기 위한 경쟁이 치열하게 전개되는 양상을 보이고 있다.
그동안 미생물에 특허를 허용할 수 있는가 하는 문제에서부터 출발해 최근 생물체 자체나 그로부터 분리된 물질에까지 특허 대상을 허용할 것인지에 이르기 까지 특허 대상을 놓고 각 국가별로 상당한 논란이 계속되어 왔다. 생명공학의 급속한 발전이 가져온 배아복제나 배아줄기세포 관련 발명 등은 인류의 의료기술에 획기적인 기여를 할 것으로 예상되는 반면 일각에서는 지적하는 바와 같이 인간 복제의 가능성 등에 따른 윤리적인 문제도 수반되고 있다.
현재까지도 이 분야는 특허성 판단을 위한 심사 실무나 청구범위의 해석, 침해 여부의 판단에 이르기까지 모든 단계에서 다른 기술과 차별화된 특수성을 보이고 있으며 이에 부합할 심사의 질 제고와 꾸준한 제도변화가 요구되고 있다.
생명공학은 기술의 특성상 장기간의 연구 개발비를 통해 특허가 산출되나, 도용은 상대적으로 쉬운 분야이므로 지식재산권을 통한 보호의 강도를 높여 주어야 하는 분야라는 점에서는 국제적인 공감대가 형성되어 있으며 결국 원천기술에 대한 확보와 이를 위한 장기적 투자가 경쟁력의 핵심으로 자리 잡을 전망이다. 우리나라는 아직 많은 분야에서 기초 기술 단계로 정부의 장기적 로드맵에 따른 집중적인 연구개발 투자가 필요하며 개발된 연구 성과에 대해서는 강력한 특허 보호정책을 통하여 국내 산업 발전을 유도할 필요성이 대두되고 있다.
![]() 생명공학관련 특허출원 현황
생명공학관련 특허출원 현황
가. 생명공학 분야 특허출원 및 등록 현황
생명공학분야 특허출원은 2004년도에 2,909건으로, 출원이 본격적으로 증가된 1998년 이래 연평균 10.1%의 증가 추세를 보이고 있으며, 국내 생명공학 산업이 꾸준히 발전하고 있음에 따라 내국인의 출원은 62.5%에 이르고 있다. 다만, 최근 들어서는 특허출원 건수 자체의 증가세는 둔화되고 있으나 이는 지식재산권에 대한 인식이 성숙됨에 따라 특허출원 전략이 단순한 양적인 증가보다 질적인 증가를 추구하는 쪽으로 수정된 것에 따른 결과로 판단된다<표 5-3-2-1>.
<표 5-3-2-1> 연도별 생명공학분야 특허출원 현황 (단위: 건) | ||||||||
구 분 | ‘98년 | ‘99년 | '00년 | '01년 | ‘02년 | ‘03년 | ‘04년 | ‘05년 8월 |
내국인 | 857 | 998 | 1,550 | 1,896 | 1,983 | 1,938 | 1,817 | 1,063 |
외국인 | 773 | 826 | 1,042 | 1,110 | 963 | 998 | 1,092 | 527 |
계 | 955 | 1,097 | 2,592 | 3,006 | 2,946 | 2,936 | 2,909 | 1,590 |
* ‘05년은 8월말까지 확정분류된 출원건수 기준 | ||||||||
출원량의 증가와 지속적인 심사관 증원으로 인한 심사량의 증가로 2000~2001년도에 잠시 감소 추세를 보이기도 하였던 생명공학분야에서 등록특허 건수는 2004년에는 1700여 건에 이르는 등 최근 들어 급속한 증가세를 나타내고 있다<표 5-3-2-2>. 기술 분류별로는 국제특허분류기호(IPC) C12N에 해당하는 미생물, 효소, 유전공학에 대한 발명이 가장 많은 비중을 차지하고 있음을 알 수 있고, 그 뒤로 생물의약이나 미생물을 이용한 수처리, 단백질 관련 발명이 뒤를 잇고 있다. 특히 외국인의 출원에 의한 등록 건수는 별다른 증가가 이루어지지 않은데 반해, 국내 출원인에 의한 등록 건수가 비약적으로 증가하고 있는 점은 주목할 만한 점이다. 다만, 국내 출원은 대부분 원천기술이라기보다는 개량·응용기술에 주력하고 있는 경우가 많으므로 앞으로 핵심 원천 기술의 특허화가 이루어질 수 있도록 생명공학 산업 전체의 기술개발 투자가 확대되어야 할 것이다.
<표 5-3-2-2> 연도별 생명공학분야 특허등록 현황 (단위: 건수) | |||||||||
연도 분류 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005.8 | |
AO1H (식물 신품종) | 내 | 6 | 8 | 10 | 18 | 36 | 17 | 28 | 43 |
외 | 1 | 1 | 3 | 1 | 3 | 1 | 7 | 2 | |
계 | 7 | 9 | 13 | 19 | 39 | 18 | 35 | 45 | |
A01K 67/00~67/04 (신규 동물) | 내 | 5 | 5 | 14 | 15 | 9 | 8 | 16 | 8 |
외 | 1 | 1 | 1 | 2 | 2 | - | - | - | |
계 | 6 | 6 | 15 | 17 | 11 | 8 | 16 | 8 | |
A01N 63/00~65/00 (생물 농약) | 내 | 8 | 6 | 6 | 13 | 9 | 14 | 19 | 29 |
외 | 7 | 5 | 3 | 7 | 5 | 2 | 3 | 5 | |
계 | 15 | 11 | 9 | 20 | 14 | 16 | 22 | 34 | |
A61K 7/26, 7/28, 35/12~35/84, 38/00~39/44, 48/00, 51/00~51/10(생물 의약) | 내 | 98 | 88 | 41 | 80 | 104 | 139 | 111 | 127 |
외 | 90 | 97 | 80 | 85 | 70 | 78 | 67 | 46 | |
계 | 188 | 185 | 121 | 165 | 174 | 217 | 178 | 173 | |
C02F 3/00~3/34, 11/02~11/04 (미생물 이용 폐수처리) | 내 | 108 | 160 | 157 | 206 | 219 | 121 | 348 | 141 |
외 | 15 | 13 | 6 | 8 | 9 | 7 | 12 | 7 | |
계 | 123 | 173 | 163 | 214 | 228 | 128 | 360 | 148 | |
C07H 19/00~21/04 (당류) | 내 | 5 | 3 | 1 | 3 | 13 | 5 | 5 | 7 |
외 | 30 | 13 | 13 | 8 | 23 | 16 | 15 | 15 | |
계 | 35 | 16 | 14 | 11 | 36 | 21 | 20 | 22 | |
C07K (단백질) | 내 | 52 | 73 | 37 | 27 | 45 | 38 | 78 | 86 |
외 | 108 | 122 | 56 | 47 | 73 | 71 | 76 | 60 | |
계 | 160 | 195 | 93 | 74 | 118 | 109 | 154 | 146 | |
C12C~M (발효 및 그 장치) | 내 | 37 | 42 | 38 | 42 | 70 | 50 | 105 | 62 |
외 | 9 | 10 | 2 | 4 | 7 | 6 | 6 | 3 | |
계 | 46 | 52 | 40 | 46 | 77 | 56 | 111 | 65 | |
C12N (미생물, 효소, 유전공학) | 내 | 275 | 199 | 175 | 155 | 242 | 235 | 401 | 255 |
외 | 133 | 203 | 99 | 54 | 107 | 94 | 104 | 102 | |
계 | 408 | 402 | 274 | 209 | 349 | 329 | 505 | 357 | |
C12P (발효 생성물) | 내 | 62 | 42 | 34 | 33 | 36 | 40 | 71 | 39 |
외 | 43 | 55 | 34 | 17 | 22 | 22 | 34 | 22 | |
계 | 105 | 97 | 68 | 50 | 58 | 62 | 105 | 61 | |
C12Q, S (시험, 측정, 분리정제) | 내 | 22 | 26 | 19 | 31 | 28 | 33 | 138 | 74 |
외 | 28 | 35 | 14 | 22 | 16 | 15 | 38 | 31 | |
계 | 50 | 61 | 33 | 53 | 44 | 48 | 176 | 105 | |
G01N 33/50~33/98 (진단 시약) | 내 | 12 | 15 | 7 | 18 | 8 | 16 | 31 | 15 |
외 | 27 | 29 | 20 | 15 | 12 | 12 | 11 | 8 | |
계 | 39 | 44 | 27 | 33 | 20 | 28 | 42 | 23 | |
계 | 내 | 690 | 667 | 539 | 641 | 819 | 716 | 1,351 | 886 |
외 | 492 | 584 | 331 | 270 | 349 | 324 | 373 | 369 | |
계 | 1,182 | 1,251 | 870 | 911 | 1,168 | 1,040 | 1,724 | 1,255 | |
주) 1. 국제특허분류(IPC 7판 기준)에 의함 2. 내: 내국인 출원, 외 : 외국인 출원 | |||||||||
나. 국가연구개발사업에 의한 생명공학 특허분석
2004년까지 공개되어 내용 분석이 가능한 1998~2002년 사이에 출원된 국가연구개발사업에 의해 산출된 국내 특허에 대한 분석에 따르면, 생명공학 분야에서 국가연구개발에 의해 산출되어 출원된 국내 특허는 1,462건으로 이중 과학기술부가 65.9%(963건)를 점유하고 있으며, 그 외 보건복지부가 13.3%(195건), 산업자원부가 12.0%(175건)순으로 나타났으며 이들 세 부처가 총 출원건수 중 91.2%를 점유하는 것으로 분석되었다.
국가연구개발사업에 의한 생명공학 분야 국내 특허를 연구개발 주체별로 분석해 보면, 산업체가 전체 38.5%를 차지하여 가장 높은 비율을 보이고 있고, 개인(30.3%)과 국공립연구소(18.6%), 학계(12.5%)순으로 나타나고 있다.
세부 기술별로 분석을 해본 결과 OECD의 생명공학 분야 국제특허분류를 토대로 마련된 생명공학분야 기술 분류에는 포함되지 않는 “기타기술”이 전체 1,282건의 42.8%를 차지하고 있었고, 그 외에는 유전체 기술, 생물의약 개발기술, 단백질 기술, 생물자원 탐색기술 등의 기술 분야에 특허가 집중되어 있음을 알 수 있다. 이중 기타 기술로 분류된 출원을 분석해보면, 일반 의약이 29.9%, 유기화학물질이 24.5%, 의료기기 또는 의료용품이 11.2%로 나타나 아직 우리나라의 국가 연구개발에 의한 생명공학분야 특허 기술은 첨단생명공학 기술이라기보다는 개량 의약(generic drug)에 가까운 분야에 대한 출원 건수가 많은 것으로 나타났다.
<표 5-3-2-3> 국가연구개발에 의한 국내 특허출원의 기술 분야 별 분포 | |||
건수 | 비율(%) | 비율(%,기타제외) | |
생물자원탐색기술 | 75 | 5.9 | 10.2 |
동식물세포배양기술 | 17 | 1.3 | 2.3 |
효소공학기술 | 30 | 2.3 | 4.1 |
유전체기술 | 208 | 16.2 | 28.4 |
단백질기술 | 87 | 6.8 | 11.9 |
항체이용기술 | 14 | 1.1 | 1.9 |
생물공정기술 | 45 | 3.5 | 6.1 |
측정진단기술 | 71 | 5.5 | 9.7 |
생물의약개발기술 | 139 | 10.8 | 19.0 |
생물농약개발기술 | 6 | 0.5 | 0.8 |
형질전환동식물개발기술 | 25 | 2.0 | 3.4 |
발효식품개발기술 | 5 | 0.4 | 0.7 |
환경생물공학기술 | 11 | 0.9 | 1.5 |
기타 | 549 | 42.8 | - |
합계 | 1282 | 100.0 | 100.0 |
자료출처: BT 분야 국가연구개발 심층분석 및 평가에 관한 연구(2004.9) | |||
![]() 생명공학 분야 심사 인프라 확충
생명공학 분야 심사 인프라 확충
특허청에서는 급속히 발전하고 있는 생명공학분야의 새로운 기술을 보호하는 한편 국제화 추세에 발맞추어 생명윤리 문제의 판단기준을 제시하고자 심사기준을 개정하고 있으며, 기술개발 추이에 발맞추어 우수특허의 권리를 효율적으로 보호할 수 있도록 지식재산권 제도와 인프라를 확충하고 심사의 전문화를 꾀하고 있다.
가. 생명공학 특허 심사 기준의 제정 및 개정
(1) 생명공학 특허심사 기준의 제정 (1998. 3월)
생명공학 분야 특허란 직접 또는 간접적으로 자기복제를 할 수 있는 생물학적인 물질(biological material) 즉, 자기 복제력을 「생물」, 「유전정보」 및 그 「복제」에 관련된 발명을 포함하는 특허를 의미한다. 이러한 생명공학분야 출원기술의 심사에 대한 표준운영절차를 확립하고자 1998년 산재된 관련 심사기준을 통합하여 생명공학 분야 산업부문별 심사기준을 제정하였다. 「유전공학 관련발명」, 「미생물관련 발명」, 「식물관련 발명」, 「동물관련 발명」으로 크게 네 개의 분야로 나눠서 심사기준을 신설하고 윤리성 기준과 불특허 요건을 명시하였다.
(2) 생명공학 특허심사 기준 1차 개정 (2000. 12월)
인간 유전체 연구(HGP)의 1차 결과가 발표됨에 따라 그의 산물인 DNA 단편, SNP(개체간 단일염기변이) 등 새로운 형태의 발명이 출현하고 있어 이를 보호할 기준 마련을 위해 개정하였다. 주요 내용으로는 HGP의 산물인 EST (expressed sequence tags) 등 DNA 단편, SNP 등에 대한 심사기준을 마련하였고, 유전자, 단백질, 모노클로날 항체 등에 대한 포괄적인 청구범위 기재를 인정하고, 안티센스에 대한 기재요건을 추가하는 등 기존의 심사 실무를 반영하였으며 대용량 유전정보 출원에 대비한 단일성 판단기준에 대해서 정비하였다.
(3) 생명공학 특허심사 기준 2차 개정 (2003. 12월)
생명공학 분야의 새로운 기술을 보호하는 한편, 생명윤리문제의 판단기준을 제시하고 유전공학관련 발명의 실절적인 보호에 중점을 두었다. 이에 따라 유전자 및 단백질 변이체에 대한 청구범위 기재요건을 강화하고 서열로 특정할 수 없는 경우의 단백질의 특정 요건을 구체화하였으며, 모노클로날(monoclonal) 항체의 실시가능성요건 및 청구범위 기재요건을 보호하는 등의 보완이 이루어졌다.
(4) 생명공학 특허심사 기준 3차 개정 (2005. 5월)
당초 2차 개정안에서는 생명공학기술의 생명윤리 및 안전을 확보하기 위해 제정될 예정이었던 「생명윤리및안전에관한법률」에 근거하여 생명공학 분야 발명의 생명윤리 문제를 판단하는 내용이 포함되어 있었으나, 법률의 제정 및 시행이 늦어짐에 따라 이 내용이 삭제된 채로 개정되었었다. 3차 개정에서는 「생명윤리및 안전에관한법률」의 시행에 연계하여 정부의 공식 승인을 받은 연구 성과물에 대한 발명은 특허등록 대상으로 하는 한편, 동법에서 금지하는 행위 또는 연구 성과물에 대한 발명은 특허법 제32조의 규정에 의거 특허를 받을 수 없는 발명으로 하여 생명공학분야 발명의 생명윤리 및 안전에 대한 판단 기준을 보완하였다. 개정된 생명공학 분야 특허심사기준은 특허청 홈페이지(www.kipo.go.kr)의 화학생명공학심사본부 메뉴 내에 심사자료실에서 다운받을 수 있다.
나. 심사 전문인력 확보 및 역량 강화
특허청은 생명공학분야의 특허출원 증가에 효율적으로 대처하고 심사 전문성을 제고하기 위하여 해당분야 전문 심사인력을 지속적으로 채용하고 있으며, 2005년 11월 말 현재 생명공학기술 전문 심사인력은 해당분야 박사학위소지자 31명을 포함하여 전공 심사관 37명을 확보하고 있다.
기술간의 융합화 현상이 진전되고 있는 생명공학분야 심사를 위해서는 다양한 분야의 최신 기술의 습득이 필수적이다. 이를 위해 한국생명공학연구원에서 매년 200개 이상의 소주제로 개최되는 세미나인 「KRIBB Conference」를 심사관이 신기술 습득의 기회로 활용할 수 있도록 추진하였으며, 2004. 8월부터 참가하기 시작하여 연인원 190명이 참가하여 최신 생명공학 기술동향에 대한 정보를 수집하였다.
그리고, 국내외적으로 관심이 집중되고 있는 생명공학 분야의 최근 논의를 점검하고, 기술 및 특허 동향을 분석하기 위하여 관련분야의 특허청내·외 인사들로 구성된 바이오특허 연구회를 운영하고 있다. 바이오특허 연구회에서는 특허청내 회원은 물론, 외부의 연구 또는 지재권분야 전문가를 초청하여 세미나 및 토론회를 개최함으로써 최신 기술과 정보를 습득·교류하는 기회를 마련하고 있고, 연간 활동 보고서를 발간하여 배포하는 등 심사의 질 향상과 생명공학 기술의 전파에도 적극 노력하고 있다. 최근 국제적으로 신지식재산권의 일환으로 이슈가 되고 있는 유전자원 및 전통지식의 보호 문제와 관련해서는 유전자원·전통지식연구회를 결성·운영하여 특허청내·외 담당자 및 전문가로 구성된 실무 작업반을 중심으로 국내외 관련 현안을 연구·검토하고 세계지식재산권기구(WIPO)에서 개최되는 정부간위원회에 대표단을 파견하는 등 대외 활동을 강화하고 있다.
다. 유전자 서열목록 심사를 위한 제도
핵산 또는 아미노산 관련 발명의 신속 정확한 검색 및 서열 DB구축을 위하여 1999년 이후에 특허출원된 발명에 대해서는 핵산염기 및 아미노산 서열 데이터의 전자파일 제출을 의무화한 이래 유전자서열 검색시스템의 효율 향상을 위해 2004. 7. 8. 한국생명공학연구원과 업무협정을 체결하고, 특허출원된 유전자 서열 데이터를 한국생명공학연구원내 국가유전체정보센터에 제공을 하고 유전자서열 검색 시스템을 제공받음으로써 검색기능과 속도가 비약적으로 향상된 검색 시스템을 확보하였다.
<표 5-3-3-1> 서열목록을 포함한 특허출원 건수 (단위: 건) | ||||||||
구 분 | 1998년 | 1999년 | 2000년 | 2001년 | 2002년 | 2003년 | 2004년 | 2005년 8월 |
내국인 | 857 | 998 | 1,550 | 1,896 | 1,983 | 1,938 | 1,817 | 1,063 |
외국인 | 773 | 826 | 1,042 | 1,110 | 963 | 998 | 1,092 | 527 |
계 | 2,855 | 2,997 | 2,592 | 3,006 | 2,946 | 2,936 | 2,909 | 1,590 |
* ’05년은 8월 말까지 확정 분류된 출원건수 기준 | ||||||||
국가유전체정보센터에서는 매월 공개분에 대한 특허서열을 특허청에서 제공받아 국내외 연구자들이 자유롭게 특허서열을 검색하고 이용할 수 있도록 웹기반의 검색 서비스(www.patome.net)를 제공하고 있다.
|
<그림 5-3-3-1> 국내 특허서열 검색시스템 PATOME 화면 |
![]() 미생물 기탁제도 운영
미생물 기탁제도 운영
가. 미생물 기탁제도의 취지
미생물에 대한 발명은 살아있는 생명체를 대상으로 하는 것이어서 아무리 상세하게 해당 미생물의 균학적 특질이나 성질이 기재되어 있다고 하여도 제3자가 그 미생물을 입수하는 것을 실질적으로 불가능하다. 이처럼 특허명세서에 타인이 반복 재현할 수 있도록 기재하는 것이 곤란하기 때문에 출원된 미생물을 공인기탁기관에 기탁하고, 특허 공개 후에는 제3자가 분양받을 수 있도록 함으로써 명세서 기재 사항을 보완하기 위한 것이다. 여기서 미생물이란 사전적 정의에 따르면 크기가 작기 때문에 인간의 육안으로는 식별이 곤란한 생물을 말하나, 우리나라 특허법상으로는 유전자, 벡터, 형질전환체, 모노클로날항체, 바이러스, 세균, 효모, 곰팡이, 버섯, 단세포조류, 원생동물, 동식물의 세포 등을 모두 포함하는 특허절차상 기탁 가능한 생물학적 물질(biological material)을 의미한다고 할 수 있다. 미생물에 관계되는 발명을 특허출원하기 위해서는 특허법 시행령 제2조에 따라 그 미생물을 특허청장이 정하는 기탁기관 또는 특허절차상 미생물 기탁의 국제적인 승인에 관한 부다페스트 조약에 따른 국제기탁기관에 기탁하고 그 수탁증을 출원서에 첨부하여야 한다.
|
<그림 5-3-4-1> 미생물 기탁 및 출원 절차 개요 |
나. 미생물 기탁기관 및 관리 현황
국내에 기탁기관은 아래와 같이 4개 기관을 운영하고 있으며, 이들 기관은 발명자가 미생물을 기탁하면 고유번호를 부여하고 기탁증을 발급해 주고 있다. 제3자가 특허관련 미생물의 분양신청을 할 경우 특허청은 미생물 분양자격증명서를 발급하여 기탁미생물의 분양을 허락할 수 있으며 기탁된 미생물의 관리실태를 분기별로 점검하고 있다.
<표 5-3-4-1> 국내 미생물 기탁기관 현황 | ||||
구 분 | 한국생명공학연구원 유전자은행 (KCTC) | 한국미생물 보존센터 (KCCM) | 한국세포주 연구재단 (KCLRF) | 농업생명공학연구원한국농용미생물 보존센터 (KACC) |
국제기탁기관 (지정일) | 자격있음 (‘90. 6. 30) | 자격있음 (‘90. 6. 30) | 자격있음 (‘93. 8. 31) | 자격없음 |
국내기탁기관 (지정일) | 자격있음 (‘81. 8. 25) | 자격있음 (‘81. 8. 25) | 자격없음 | 자격있음 (‘02. 1. 1) |
최근에는 미생물 기탁업무에 대한 개선 대책을 추진하여 부다페스트조약 및 규칙에 어긋나던 일부 미생물 기탁기관의 내부 규정을 개정하고, 기탁기관별로 상이하던 서식을 통일화하는 작업을 수행하였다. 또한, 신청자 편의 위주로 미생물 분양 절차를 간소화하고 온라인 신청체계를 마련하여 특허청 홈페이지에서 온라인상으로 신청이 가능하도록 조치를 완료하였다.
특허 생물자원은 특허를 받을 정도로 산업적으로 중요한 자원이나, 특허기간 만료 후 폐기될 예정이므로 소중한 국가자원이 소실될 우려가 있고, 일본, 미국 등 주요 선진국에서는 이런 중요성을 인식하여 특허미생물을 중요한 국가 생물자원으로 별도의 장소에 백업 보존하고 있다. 현재는 특허출원시 확보된 생물자원에 대한 백업 시스템이 없고 단일시설에서 보존할 경우 유사시 언제든지 사멸 가능하고 이 경우 특허발명의 실시가 불가능할 수도 있기 때문에 2006년에 특허 미생물 보존 및 관리 사업을 실시하여 기존 기탁 미생물 보관 장소와는 별도의 장소에 자동 액체질소 동결 보관용기를 설치하고 특허 미생물에 대한 백업 관리를 실시하도록 할 예정이다.
■ 제 5장 생명공학 관련 법제도 현황 제 4절 생명공학제품 인·허가 현황과 과제 |
![]() 서론
서론
생명공학산업은 생명공학기술(Biotechnology Engineering)을 바탕으로 생물체가 가지고 있는 기능과 정보를 활용하여 인류가 필요로 하는 유용물질을 생산하는 산업으로 여기서 생산되는 모든 제품을 생명공학제품이라 칭하고 있다. 다만 생명공학기술을 이용하여 개발되는 제품들 중 대부분은 의약품과 의료기기 또는 식품이 주를 이루고 있으며, 이 중 인류의 건강증진, 질병의 예방, 진단 및 치료에 사용되는 의약품 영역이 60% 이상을 차지하고 있어 의약품을 중심으로 인허가 현황과 과제를 설명하고자 한다.
현재 정부에서는 생명공학산업을 차세대 성장동력 산업으로 육성 지원하기 위하여 생명공학제품 연구·개발에 연간 수천억의 예산을 투자하고 있고 앞으로도 투자규모를 점차 확대해 나갈 계획이며, 이러한 투자로 세포치료제, 유전자치료제, DNA칩, 단백질치료제 등의 영역에서 상당한 성과가 가시화되고 있으며 다양한 생명공학 제품이 빠른 시일 내에 임상에 진입하는 등 학문적·기술적 영역에서 산업영역으로 급속히 이행될 것으로 전망하고 있어 우리나라 차세대 성장동력으로서의 무한한 잠재력과 가능성을 보이고 있다.
많은 발표를 통해 알려졌지만, 생명공학 제품 중 국내에서 허가를 받은 제품으로 자기유래연골세포치료제와 자기유래피부세포치료제가 있으며, 지난 5월에는 최초로 동종유래피부세포치료제가 허가된 바 있으며, 현재 약 30여 종의 생명공학제품이 식약청과 임상 또는 허가를 위해 상담을 진행하고 있다.
그러나 정부와 민간에서의 생명공학제품 연구·개발에 막대한 투자와 노력에도 불구하고 제품의 양산체계 정착을 위해서는 인허가 부분에서 상당부분 해결해야 할 과제가 있는 것도 사실이다.
생명공학분야에 있어서 우리나라의 경우 기초기술이나 실용화기술은 선진국의 80~90% 수준으로 파악되고 있으며 상대적으로 다른 산업에 비해 높은 국가 경쟁력을 확보하였다고 볼 수 있다. 문제는 인·허가시 생명공학제품의 안전성과 유효성을 평가할 수 있는 기술적 수준이 선진국에 미치지 못하고 있다는 것이다. 결국 생명공학 분야의 투자가 성과로 이어져 제품화 단계에서 반드시 거쳐야 할 안전성·유효성 평가는 의약품으로 개발된 생명공학제품에 생명력을 불어 넣는 최종단계가 될 것이다.
특히, 생명공학제품은 지금까지의 의약품 개념과는 달리 새로운 물질이거나 새로운 기술이 접목된 제품일 가능성이 크므로 안전성과 유효성을 담보하지 못한 상태에서의 시장진입은 불가능할 것이며, 국제 시장에서의 신뢰도 확보에 어려움을 겪을 것이다. 이와 관련하여 생명공학제품의 특징 및 인허가 과정, 국내외 생명공학의약품 개발동향, 생명공학의 제약산업에 대한 영향, 식약청의 생명공학제품 안전관리 방향, 생명공학제품 산업화의 당면과제, 향후 발전방향과 이에 대한 식약청의 준비상황을 살펴보기로 한다.
![]() 생명공학 의약품의 특징 및 인허가 과정
생명공학 의약품의 특징 및 인허가 과정
생명공학산업은 타 산업에 비해 엄청난 고부가가치와 성장 잠재율을 가지고 있어 부존자원이 없는 우리나라의 경우 인적자원만의 활용으로도 세계시장에서의 경쟁력을 갖춘 산업이라 할 수 있다. 생명공학 의약품 중 빈혈치료제로 사용되는 치료용 단백질 제제인 EPO(erythropoietin)의 경우 1 g이 67만 달러에 해당할 정도로 생명공학제품의 대표적 고부가가치 상품으로 알려져 있으며 현재 연평균 20% 이상의 고 성장률을 통해 생명공학산업 성과의 60% 이상을 차지하고 있는 것은 생명공학 산업의 고부가가치와 성장 잠재율을 간접적으로 증명하는 것이라 할 수 있다.
이러한 생명공학 산업의 특성에도 불구하고 생명공학 의약품은 타 의약품과 마찬가지로 인체의 질병을 치료, 처치, 경감, 진단을 목적으로 개발하는 것으로 시장진입을 위해서는 반드시 안전성과 유효성의 평가를 거쳐야 하며, 동 과정이 산업화 여부의 직접적인 판단기준이 된다고 할 수 있다. 아래 그림과 같이 의약품이 개발되는 과정은 약 10년 이상의 연구·개발 기간이 소요되며 실질적인 투자비용의 대부분이 동물을 대상으로 하는 비임상시험 연구와 인체를 대상으로 하는 임상시험 과정에 투입되고 이중 임상시험에 투자비용의 대부분을 투입하게 된다. 즉, 생명공학 의약품의 안전성·유효성 평가를 위한 비임상 및 임상시험 자료의 수집과정과 이를 평가하는 과정의 수준이 경쟁력 있는 생명공학산업의 주춧돌이 된다고 해도 과언이 아니다.
바꾸어 말해 생명공학 의약품의 안전성과 유효성 평가를 얼마나 과학적이고 합리적으로 수행되는지가 생명공학 의약품의 산업화를 앞당길 수 있는 길이라는 것이다. 일례로 합리적 평가기준에 따라 준비된 안전성·유효성 평가자료 작성을 위해 소요되는 기간과 비용은 평가기준이 제대로 갖춰지지 않는 경우 작성해야 될 불필요한 안전성·유효성 평가자료 작성에 소요되는 기간과 비용 비교 시 상대적 투자자금의 회수와 시장선점의 기대효과가 크다고 할 수 있다.
신약개발의 선진국으로 자타가 인정하고 많은 전문 인력을 확보하고 있는 미국의 경우에서조차 미국 식품의약국(FDA)에 제출된 자료의 70%가 제품의 직접적 안전성·유효성 입증과는 관련이 없는 자료였음이 밝혀지고 있는 점을 고려할 때 생명공학 의약품 개발자가 예측할 수 있는 안전성·유효성 평가기준의 마련과 이를 통한 과학적, 합리적 평가는 실로 중요하다 할 것이다.
이는 외국의 평가기준이 실시간으로 파악되는 현 상황을 고려할 때 우리나라도 이러한 사례로부터 자유롭지 못할 것이며, 상대적으로 과학적·합리적 평가에 필요한 전문 인력을 충분히 확보하고 있지 못한 현재의 국내 상황을 고려할 경우 그만큼 안전성·유효성 평가부분에서의 국가 경쟁력 확보가 생명공학 산업 육성차원에서도 빠른 시일 내에 정비되어야 할 것이다. 즉, 현재의 정부가 기치를 내세우고 있는 차세대 성장동력으로서의 생명공학 산업의 입지 확보를 위해 종래의 의약품의 경우와 같이 선진국의 규정들을 신속하게 벤치마킹하여 경쟁력을 확보해 나가던 수준으로는 향후 생명공학 의약품의 산업화와 국제경쟁력 확보는 곤란하며, 독자적이고 과학적, 합리적인 안전성·유효성 평가체계 구축 없이는 그간 투자해온 생명공학 분야의 경쟁력을 상실할 수도 있다는 것이다.
|
<그림 5-4-2-1> 신약개발에서 허가과정까지의 개요 |
![]() 국내외 생명공학의약품 개발동향
국내외 생명공학의약품 개발동향
최근까지 개발되어온 생명공학의약품은 주로 유전자재조합 기술을 활용한 백신과 EPO로 대변되는 치료용 단백질을 들 수 있다. 이에 반해 지금 중점적으로 투자되고 있는 분야는 크게 유전자치료제(Gene Therapy Products), 안티센스(Antisense), 세포치료제(Cell Therapy Products), 단일클론항체(Monoclonal Antibody), 유전자재조합의약품(DNA Recombinant Pharmaceutical Products)으로 분류할 수 있다.
유전자치료제는 질병치료 등을 목적으로 유전물질 또는 유전물질을 이입한 세포를 인체에 투여하는 의약품을 말하며, 현재 국내에서는 동아제약의 VMDA-3601 주사액(혈관생성유전자 치료제)이 제2상 임상시험 진행 중에 있으며, 중국의 경우 세계에서 최초로 유전자치료제를 시판허가한 상태다.
안티센스는 생명공학기술 가운데에서도 상당히 주목받고 있는 분야의 의약품으로 mRNA가 병의 기인이 되는 단백질을 생성하는 것을 억제하는 작용을 활용하여 암과 바이러스 감염증, 자기면역 질병 등의 난치병 치료에 이용하거나 대량의 유전자합성 기술을 활용한 유전자기능분석에 활용할 수 있을 것으로 기대되며 현재 다양한 질환의 동물실험이 진행 중에 있다.
세포치료제는 세포와 조직의 기능을 복원시키기 위하여 자가(autologus), 동종(allogenic) 또는 이종(xenogenic)세포를 증식·선별하거나 여타한 방법으로 세포의 생물학적 특성을 변화시키는 등의 일련의 행위를 통한 치료, 진단 및 예방의 목적으로 사용하는 의약품으로 줄기세포를 이용한 제품을 포괄하는 의약품이다. 국내에서는 2001년 세계에서 두 번째로 (주)셀론텍에서 자기유래 연골세포치료제인 “콘드론”을 시판허가 받았으며, 2002년 12월에는 세계 두 번째로 (주)테고사이언스에서 자기유래피부세포치료제인 “홀로덤”을 허가받았으며 금년도에는 세계에서 처음으로 동종유래피료세포치료제인 “칼로덤”을 허가받아 시판 중에 있으며, 배아줄기세포, 제대혈을 이용한 성체줄기세포의 연구와 세포은행 설립으로 난치성, 유전성 질환 치료에 대한 연구가 활발히 진행되고 있다.
단일클론항체는 질병과 연관된 특정 항원만 인식하여 작용하는 항체를 생산하는 혈장세포를 분화시켜 체외에서 다량의 항체를 생산하여 인체에 적용하는 의약품으로 정부차원의 많은 연구·개발비가 투자되고 있는 상태이나 국내·외에서 의약품으로 허가된 제품은 없다.
유전자재조합의약품은 인체에서 생리활성을 나타내는 다양한 효소나 호르몬의 정보를 담고 있는 유전자를 대장균이나 효모와 같은 미생물 등에 이입하여 목적하는 단백질을 합성하여 대량생산으로 제조한 의약품을 말한다. 이와 같은 유전자재조합 기술을 이용한 단백질의약품은 인슐린, 성장호르몬, 각종 면역조절 사이토카인들을 비롯하여 백신에 이르기까지 광범위하며, 현재 단백질칩으로 개발하여 진단용의약품으로 활용하고자 하는 연구로도 영역이 많이 확대되었다.
DNA칩은 분자 생물학적 지식과 기계 전자 기술이 접목돼 적게는 수백 개 많게는 수십만 개의 DNA를 반도체와 같이 작은 공간에 집어넣어 특히 개인간, 인종간, 개체간, 또는 건강인과 환자 간의 유전자 구조의 차이를 밝힘으로 암이나 유전병을 진단하거나 장기이식 전 조직 적합성 검사, 약제내성연구, 결핵이나 인유두종 바이러스 등의 병원성 미생물 바이러스의 동정 등에 활용이 가능한 의약품으로 신약개발과 궁극적으로는 유전자 치료 영역에서 획기적인 발전에 기여하리라 예측된다.
참고로 2001년부터 생명공학제품에 대한 상업화를 촉진하기 위하여 식약청에서는 제품 개발단계에서부터 상업화 단계에 이르기까지 행정적, 기술적 지원을 위해 민원후견인 제도를 도입하여 지원하고 있다. 그동안 세포치료제 19건, 유전자치료제 13건, DNA칩 2건, 기타 유전자재조합의약품 등 2건 등 총 29개 업소에서 37개 품목에 대하여 사전상담이 진행 중이거나 이루어졌으며, 이 중 세포치료제 3개 제품 및 DNA칩 2개 제품이 시판허가 되었다.
<표 5-4-3-1> 2005년 현재 국내 바이오의약품 상담진행 현황 | ||
상담품목 | 시판품목 | 종류 |
세포치료제 (19개품목) | 피부세포치료제 연골세포치료제 (3품목) | 심근세포, 자기유래 지방세포, 자기유래 뼈세포, 자기유래 구강점막세포, 자가유래 수지상세포, 피부각질세포, 췌도이식 동종유래 세포, 간엽줄기세포, 자기유래 NK세포, 자기유래 근육세포, 활성화림프구 세포, 섬유아세포치료, 자기유래연골세포, 배아줄기세포 |
유전자치료제 (13개품목) | - | 연골치료, 에이즈백신, 간암 및 파킨슨 치료제 |
DNA칩 | 2품목 | 자궁경부암 진단 |
기타(2개품목) | 인공혈액제제 | |
![]() 생명공학의 제약산업에 대한 영향
생명공학의 제약산업에 대한 영향
생명공학기술의 발전은 비단 생명공학 의약품으로서의 제품화 영역뿐만 아니라 신약개발의 효율적 수단으로 작용하고 있다. 인체의 게놈정보가 알려지면서 종래 신약개발후보물질로써 연간 500개 정도의 후보물질이 검색되었던 것과는 달리 현재는 전 세계적으로 5,000~10,000개의 후보물질이 검색되고 있으며 유전자 기능 분석을 위해 안티센스를 활용할 경우 수 년 내에 분석이 될 수 있을 정도로 그 속도가 향상되었다. 또한 안티센스나 유전자 활성측정시험으로 짧은 시간에 후보물질 검색이 가능해지고 있다. 또한 독성유전체학, 약리유전체학의 발전에 의한 전임상 분야의 효율성이 제고되고 있으며, 임상단계에서도 장기별 세포배양에 의한 안전성·유효성 평가의 가능성이 검토되고 있어 많은 전문가들은 향후 생명공학기술에 의한 신약개발 기간은 3분의 1로 줄어들면서도 신약개발비용은 1/20로 절감될 것으로 전망하고 있다.
아울러 약과 개인별 유전형을 맞추는 약물유전체학의 실용화에 따라 현재와 같이 집단적 개발약물 시대에는 부작용 발생이 개인의 체질 특수성에 기인한 것으로 판단되던 사례들도 미래에는 회사책임으로 전환되거나 부작용 발생이 최소화 될 개연성을 가지고 있으며, 이와 같은 게놈분석을 통한 신약개발경쟁 가속화와 책임영역 확대는 제약회사의 통·폐합을 통한 대형화를 유도할 것으로 보인다.
![]() 식약청의 생명공학제품 안전관리 추진방향
식약청의 생명공학제품 안전관리 추진방향
식약청은 생명공학 의약품에 대한 과학적인 안전성·유효성평가를 통해 소비자의 안전을 최우선으로 하면서 안전성 평가 수준 향상으로 생명공학의약품의 대외 경쟁력을 확보하는 것을 기본 목표로 하고 있다. 이를 위하여 첫째, 2002년부터 운영해오던 민원후견인 제도를 보완하여 2005년 3월부터 생명공학분야 연구자 또는 연구기관이 그 연구결과를 의약품, 의약외품, 의료기기 또는 화장품으로 제품화·산업화하기 위하여 행정적·기술적 지원을 요청하는 경우 이를 지원하기 위한 생명공학의약품 등 후견인제도의 운영에 관한 규정을 마련하여 제품의 개발단계에서부터 신속한 행정적·기술적 지원으로 산업화를 유도하고 있다.
아울러, 과학의 발전에 따라 2종이상의 복합적 기능(예: DNA칩, 인공피부 등)을 가진 제품이 개발되거나 개발 중에 있어, 처리절차를 표준화하여 담당부서가 2개소 이상 다원화에 따른 업무혼선 등 그 처리가 지연될 가능성을 최소화하는 등 효율적 처리를 위하여 “다기능의약품등 신속처리규정”을 제정하여 생명공학제품의 효율적 허가관리가 가능하도록 하였다.
또한 첨단 생명공학제품의 산업화를 준비 중인 업계의 사전예측력을 제고하여 불필요한 투자 및 중복투자를 방지함은 물론 제제별 고유의 특성이 강하여 일반화학물질 의약품과 같은 정형화된 안전성·유효성관련 공통기준 설정·적용이 어려워 오히려 안전평가의 합리성을 약화시킬 개연성이 높은 생명공학 제품(세포치료제, 유전자치료제, DNA칩 등)의 특성을 고려하여 30종 이상의 가이드라인을 제정하였으며 2005년부터 2009년까지 매년 15개씩 연구용역사업을 실시하여 제품별 안전성·유효성 평가 가이드라인을 제정하고자 매년 연구용역사업을 추진 중에 있다.
그 외에 생명공학산업 지원을 위하여 제도개선이나 정보제공, 그리고 연구자와의 동반자라는 의식으로 지원체계를 점차적으로 구축해 나가고 있으며, 일례로 식약청 홈페이지에 백신·BT방을 개설하고 생명공학의약품 등 관련 소식지 제작·배포 등을 통해 정보제공 서비스를 강화하였고, 산·학·연의 유기적 협조체계 구축을 위해 관련단체와 정책간담회 및 설명회 등을 지속적으로 개최하는 한편 각 분야의 산·학 전문가로 구성된 연구회 등을 구성하여 향후 산업화로 이행될 분야에 대한 사전 안전성·유효성 평가체계에 만전을 기하고 있다. 더불어 생명공학제품의 특성을 고려한 “생물학적제제 등 허가 및 심사에 관한규정”을 2003년에 제정한 바 있다.
특히, 생명공학제품의 산업화지원을 위해 의약품제조업소와 연구·개발벤처의 핵심역량을 최대화하기 위하여 의약품제조업허가와 제조품목허가 분리를 위한 약사법 개정을 추진하고자 보건복지부와 협의과정 중에 있으며 년내에 마무리 지을 계획을 가지고 있어 벤처기업의 핵심역량인 연구·개발 분야에 투자를 집중할 수 있도록 하여 생명공학제품의 산업화를 앞당기고자 노력하고 있다.
![]() 생명공학제품 산업화의 당면과제
생명공학제품 산업화의 당면과제
생명공학분야 연구성과의 산업화 성공여부는 기초과학분야, 기술 실용화 분야, 안전성평가 분야 전반에 걸친 종합적 경쟁력이 국가 경쟁력을 좌우하게 될 것이지만 현재 국내 생명공학 신물질의 제품화에 필수적인 안전성 평가 기술은 선진국의 수준에 미치지 못하여 궁극적으로 산업화 단계에서 병목현상으로 작용할 가능성이 농후하다고 볼 수 있다.
또한 현재 국내 범정부적 생명공학 투자는 생명공학 기술을 이용한 신물질의 탐색 및 개발과 제품화 단계에서 결정적이고 장기간 소요되는 안전성·유효성 평가분야에 대한 투자가 균형있게 이루어지고 있으나, 실제 제품화 단계의 생명공학제품의 성공가능성을 점치기는 어려우나 투자나 연구 역량을 제품화 단계에 투자해야 할 필요성이 있으며, 이를 위해 비임상 또는 임상단계에서 시행착오 방지 및 시간적·재정적 손실을 최대한 줄일 수 있는 인적·물적 인프라를 구축 필요하며 자본 조성여건이 열악한 국내 중소·벤처기업의 기초연구를 상품화할 수 있도록 국제수준의 품질 및 바이오안전성 평가기술 개발, 시험방법 개발, 선진국의 의약품안전관리 제도 연구 및 지침작성을 위한 정부차원의 지속적인 지원이 절대적으로 필요하다고 할 수 있다.
![]() 향후 발전방향
향후 발전방향
식약청에서는 과학적 안전성·유효성평가 토대위에 생명공학제품의 신속한 산업화를 도모하기 위하여 민간연구기관의 후보물질 제품화를 신속하게 허가 할 수 있는 안전성·유효성 평가체계 확립 및 행정적, 기술적 지원체제 마련과 정보제공 기능을 위하여 식약청 산하 국립독성연구원내에 생명공학지원팀을 설립하여 식약청과 연구자 또는 벤처기업간의 코디네이터 역할을 수행하도록 하였다. 또한 차세대 성장동력으로서의 생명공학산업이 기반을 조성할 수 있도록 현재 정부에서 투자하고 있는 제품화 단계의 투자부분에 대하여 적절한 연구방향 제시와 자료준비에 도움을 주고자 “바이오신약·장기 지원팀”을 구성하여 운영할 계획으로 있다. 아울러 산업화 진입이 임박한 민간 또는 정부지원 품목과 연계한 사전 연구 사업을 실시하여 안전성·유효성 평가 가이드라인을 품목진입 이전에 설정하고 기술 평가부서와의 유기적인 협조체계를 구축하여 안전성·유효성 평가기간을 효율적으로 단축해 나갈 계획이다.
■ 제 5장 생명공학 관련 법제도 현황 제 5절 생명공학 기업 현황과 지원제도 |
![]() 세계적인 동향
세계적인 동향
가. 생명공학산업 시장규모 확대
<표 5-5-1-1> 2004년도 상장 기업(Public Company) 중심의 세계 생명공학산업 현황 (단위: 백만 달러, 명, 개, %) | ||||
구분 | 주요 내용 | 2004년 | 2003년 | 증감률 |
상장 기업 (Public Company Data) | 수입(Revenues) | 54,613 | 46,553 | 17 |
연구개발비(R&D expense) | 20,888 | 18,636 | 12 | |
순 손실(Net Loss) | 5,304 | 4,548 | 17 | |
종업원 수(No. of Employees) | 183,820 | 174,520 | 5 | |
기업수 (No. of Companies) | 상장 기업(Public Companies) | 641 | 611 | 5 |
비상장 기업(Private Companies) | 3,775 | 3,860 | –2 | |
상장·비상장 기업 (Public & Private Companies) | 4,416 | 4,471 | –1 | |
자료: Ernst & Young, Beyond Borders Global Biotechnology Report 2005, 2005년 6월 | ||||
2004년도 생명공학산업분야의 세계 시장규모는 820억 달러 규모로 추정되고 있는 가운데, Ernst & Young사에 의하면 2004년도 생명공학산업분야 상장 기업(Public Company)의 수입규모(Revenues)는 546억 달러 규모이며, 4,400여개 이상의 기업이 활동하고 있다<표 5-5-1-1>.
나. 국가전략산업 육성차원의 지원제도 운영
미국을 비롯한 일본이나 유럽의 선진국뿐만 아니라 개발도상국 또는 저개발국도 생명공학산업을 국가전략산업으로 선정하여 집중적으로 육성하고 있으며, 연구개발비 지원 및 인프라 구축 등 국가적인 차원에서 각종 지원제도를 마련하여 시행하고 있다.
![]() 해외 현황
해외 현황
가. 미국 현황
(1) 기업 및 제품판매 동향
<표 5-5-2-1> 미국의 2004년도 생명공학산업 현황 (단위: 억 달러, 개사, 명, %) | ||||||
구 분 | 상장 기업 (Public Company) | 산업체 합계 (Industry Tortal) | ||||
2004년 | 2003년 | 증감률 | 2004년 | 2003년 | 증감률 | |
제품 매출액(Product Sales) 수입(Revenues) 기술개발비(R&D expense) 기업수(No. of Companies) 종업원수(Employees) | 310 427 157 330 137,000 | 259 359 136 314 124,800 | 19.4 19.2 15.7 5.1 10.1 | 333 460 198 1,444 187,500 | 284 392 179 1,473 177,000 | 17.4 17.2 11.0 -2.0 6.0 |
자료: Ernst & Young, Beyond Borders Global Biotechnology Report 2005, 2005년 6월 | ||||||
2004년 미국의 생명공학산업 매출규모(Sales)는 333억 달러, 수입규모(Re-venues)는 460억 달러로 성장하였다<표 5-5-2-1>. Eli Lilly·Johnson & Johnson사 등 대형기업 및 전문기업 중에 특히, Amgen사는 빈혈치료제 Erythro-poietin 등 5개 생물의약품을 중심으로 105억 5,000만 달러의 총수입 및 23억 6,300만 달러의 순이익을 기록하여 미국의 대표적인 성공사례로 활용되고 있으며, Genentech사 등이 순이익을 내는 전문기업으로 부상하였다<표 5-5-2-2>.
<표 5-5-2-2> 주요 생명공학산업 전문기업의 2004년도 경영현황 (단위: 백만 달러, 명) | |||||
회사명 | 수입 (Revenues) | 기술개발비 (R&D Expense) | 순이익 (Net Income) | 종업원 (Employees) | 시장가치 (Market Cap.) |
Amgen Genentech Biogen IDEC Genzyme Chiron Gilead Sciences Biovail | 10,550 4,621 2,212 2,201 1,723 1,325 887 | 2,028 948 688 392 431 224 70 | 2,363 785 25 87 79 449 161 | 14,400 7,646 4,266 7,100 5,400 1,654 2,291 | 81,500 57,100 22,200 14,400 6,200 15,100 2,600 |
자료: Ernst & Young, Beyond Borders Global Biotechnology Report 2005, 2005년 6월 | |||||
<표 5-5-2-3> 2003년도 Blockbuster 생물의약품 (단위: 백만 달러) | |||||||
No. | 상품명 | 판매회사 | 판매액 | No. | 상품명 | 판매회사 | 판매액 |
1 | Procrit | J & J | 3,984 | 8 | Rituxan | Biogen IDEC | 1,489 |
2 | Epogen | Amgen | 2,400 | 9 | Neulasta | Amgen | 1,300 |
3 | Intron-A | Schering- Plough | 1,851 | 10 | Neupogen | Amgen | 1,300 |
4 | Remicade | J & J | 1,729 | 11 | Avonex | Biogen IDEC | 1,168 |
5 | Enbrel | Amgen | 1,600 | 12 | Humulin | Eli Lilly | 1,060 |
6 | Epogin/Neo Recormon | Roche/Chugai | 1,560 | 13 | Humalog | Eli Lilly | 1,021 |
7 | Aranesp | Amgen | 1,500 | 계 | 21,962 | ||
자료: Ernst & Young, Resurgence : Global Biotechnology Report 2004, 2004년 6월 | |||||||
미국 식품의약국(FDA)에서 승인을 획득하여 판매 중인 생물의약품은 2004년도 기준 340개 제품이며, Ernst & Young사 보고서에 의하면 2003년도 매출액 10억 달러 이상의 Blockbuster 생물의약품은 13개이다<표 5-5-2-3>. 생물의약품의 경우 동물세포이용 및 치료용 항체(Therapeutic Antibody) 산업화 열기가 확산되고 있으며, 생명공학을 이용한 저분자 의약품의 승인사례도 나타나고 있다.
(2) 지원제도 운영현황
미국은 지속적인 선두유지 목표를 달성하기 위해 지적재산권 취득 및 시장선점의 국가경쟁력 강화전략을 강력하게 추진하고 있는데, 연방정부는 2004년도 생명과학 연구개발에 272억 달러를 투자하였으며, 개발된 기술을 민간자본으로 상업화를 촉진하는 SBIR(Small Business Innovation Research)제도, 생물테러 대응 Project Bioshield(생물방어 프로젝트) 등을 지원하고 있다.
주정부는 조세지원제도 시행은 물론 기술이전 및 투자유치를 지원하고 있으며, 다수의 계약연구기관(CRO: Contract Research Organization)들이 활동하고 있다.
나. 일본 및 유럽 현황
2004년도 일본 생명공학산업분야 총 시장규모는 1조 7,469억 엔이며 <표 5-5-2-4>, 경제산업성 등 6개 부처에서 생명공학산업관련 예산 2,656억 엔을 투자하였고, 2005년도에는 정부 예산 2,679억 엔을 투자하여 연구개발 등 지원정책을 펴고 있다.
그리고 유럽 생명공학산업의 수입규모(Revenues)는 113억 유로 규모이며 <표 5-5-2-5>, EU간 공동협력과 함께 국별 경쟁 지원정책을 시행하고 있다.
<표 5-5-2-4> 일본의 2004년도 생명공학산업 총 시장규모 (단위: 억 엔) | |||
구 분 | 내 용 | 총 시장규모 | |
2004년 | 2003년 | ||
생명공학 상 품 | ∙ 유전자조작제품 ∙ 세포융합제품 ∙ 세포배양제품 | 11,138 992 392 | 10,155 992 443 |
생명공학 관련상품 | ∙ 의약·정밀화학제품 ∙ 식품 ∙ 기기·시약 ∙ 생물정보·서비스·센서·환경·기타 | 1,187 1,247 1,298 1,215 | 1,166 1,252 1,246 1,180 |
합 계 | 17,469 | 16,434 | |
자료: 일경BP사, 일경바이오연감 2005, 2004년 12월 | |||
<표 5-5-2-5> 유럽의 2004년도 생명공학산업 현황 (단위: 백만 유로, 개사, 명, %) | ||||||
구 분 | 상장 기업 (Public Company) | 산업체 합계 (Industry Tortal) | ||||
2004년 | 2003년 | 증감률 | 2004년 | 2003년 | 증감률 | |
수입(Revenues) 기술개발비(R&D expense) 기업수(No. of Companies) 종업원수(Employees) | 6,261 3,363 98 25,640 | 6,606 3,746 96 32,470 | -5 -10 2 -21 | 11,337 6,189 1,815 72,420 | 11,277 6,354 1,861 77,910 | 1 -3 -2 -7 |
자료: Ernst & Young, Beyond Borders Global Biotechnology Report 2005, 2005년 6월 | ||||||
![]() 국내 현황
국내 현황
가. 산업체 현황
산업자원부 기술표준원/산업연구원/한국바이오산업협회가 2004년 실시한 2003년도 국내 생물산업 실태조사에 응답한 605개사의 참여유형은 연구개발 및 제품판매 432개사, 연구개발단계 173개사 정도이다. 생명공학산업제품 판매기업의 형태는 국산제품 387개사, 수입제품 45개사, 국산 및 수입제품 동시판매 41개사 정도로 파악되고 있다.
산업체의 전문인력 11,013명 중 연구인력 5,808명(53%), 생산인력 5,205명(47%)인데, 연구인력은 석사급이 46%, 생산인력은 기술직이 65%를 차지하고 있다.
나. 산업 규모
2003년도 국내 생명공학산업 실태조사에 의하면 생명공학산업의 총 수급규모는 2조 5,923억 원 규모인데<표 5-5-3-1>, 이 중에서 수요부문은 내수가 1조 5,985억 원이고 수출은 9,938억 원이며, 공급부문은 생산이 2조 791억 원이고 수입이 5,132억 원 규모이다. 2004년도 총 수급규모는 3조 원 규모로 추정하고 있다.
<표 5-5-3-1> 2003년도 국내 생명공학산업 총 수급규모 (단위: 백만원, %) | |||
공 급 | 생 산 | 금 액 | 2,079,070 |
비 중 | 80.2 | ||
수 입 | 금 액 | 513,226 | |
비 중 | 19.8 | ||
계 | 2,592,296 | ||
수 요 | 내 수 | 금 액 | 1,598,448 |
비 중 | 61.7 | ||
수 출 | 금 액 | 993,848 | |
비 중 | 38.3 | ||
자료: 산업자원부 기술표준원/산업연구원/한국바이오산업협회, 2003년도 국내 생물산업 실태조사, 2004년 | |||
<표 5-5-3-2> 2003년도 국내 생명공학산업 시장규모 (단위: 백만 원) | ||||
구 분 | 주 요 제 품 | 국산 | 수입 | 계 |
생물의약 | 혈액제제, 백신류, 진단키트 외 | 653,635 | 320,244 | 973,879 |
생물화학 | 효소/시약류, 생물농약/비료 외 | 78,652 | 41,512 | 120,164 |
바이오식품 | 건강기능식품, 식품첨가물 외 | 177,036 | 1,468 | 178,504 |
생물환경 | 환경복원, 환경 미생물제제 외 | 91,057 | 210 | 91,267 |
바이오에너지 및 자원 | 유전자변형 동식물, 실험동물 외 | 12,959 | 2,137 | 15,096 |
생물전자 | DNA칩, 바이오센서 외 | 5,712 | 414 | 6,126 |
생물공정 및 기기 | 생물공정 및 분석기기 외 | 31,759 | 146,785 | 178,544 |
생물검정 및 서비스 | 생물안전성평가, 유전자분석 외 | 34,412 | 456 | 34,868 |
합 계 | 1,085,222 | 513,226 | 1,598,448 | |
자료: 산업자원부 기술표준원/산업연구원/한국바이오산업협회, 2003년도 국내 생물산업 실태조사, 2004년 | ||||
2003년도 국내 시장규모는 1조 5,985억 원인데<표 5-5-3-2>, 국산제품 1조 853억 원(68%), 수입제품 5,132억 원(32%)이다. 이 중 생물의약품 9,739억 원(61%), 생물공정 기기/바이오식품 3,570억 원(22%), 기타 2,676억 원(17%)으로 구성되어 있다. 2004년도 시장규모는 1조 9,180억 원 규모로 추정하고 있다.
다. 지원제도 현황
정부는 과학기술부, 산업자원부, 보건복지부 등 8개 관련부처에서 2004년도에는 6,016억 원을 투자하였고, 2005년도에 7,086억 원을 투자할 계획이다<표 5-5-3-3>.
그리고 차세대 성장동력산업으로 선정된 바이오신약/장기사업은 범정부 공동추진체계로 2005년도에는 바이오장기, 바이오칩, 바이오신약분야에 정부지원금 356억 원을 지원할 계획이다.
우리나라의 생명공학산업관련 지원제도는 크게 기술개발과 인프라구축 지원으로 대별되고 있는데, 과학기술부는 바이오디스커버리사업 등 5개 국책연구개발사업과 핵심유망기술 및 차세대 원천기반기술을 중점 지원하며, 정부 생명공학분야 연구개발 예산의 33%를 담당하고 있다.
<표 5-5-3-3> 정부의 생명공학분야 예산 (단위: 억 원) | ||||||||||
연도 | 구분 | 과기부 | 교육부 | 농림부 | 산자부 | 복지부 | 정통부 | 환경부 | 해양부 | 총계 |
2004 년도 실적 | R&D | 1,893 | 233 | 589 | 632 | 576 | 88 | 189 | 46 | 4,246 |
인프라 | 154 | - | 159 | 652 | 743 | 27 | 17 | 18 | 1,770 | |
계 | 2,047 | 233 | 748 | 1,284 | 1,319 | 115 | 206 | 64 | 6,016 | |
2005 년도 계획 | R&D | 2,158 | 264 | 609 | 801 | 686 | 102 | 195 | 62 | 4,877 |
인프라 | 167 | - | 183 | 1,088 | 692 | 40 | 18 | 21 | 2,209 | |
계 | 2,325 | 264 | 792 | 1,889 | 1,378 | 142 | 213 | 83 | 7,086 | |
자료: 과학기술부, 2005년도 생명공학육성시행계획, 2005년 4월 | ||||||||||
산업자원부는 산업기술개발사업 및 바이오스타프로젝트 등 산업화기술 개발과 위탁생산시설(CMO) 확보 등 인프라 조성을 지원하고 있으며, 정부 연구개발 예산의 27%를 담당하고 있다.
보건복지부는 보건의료바이오기술개발사업 등의 연구개발사업 및 보건의료기술 인프라개발사업 등의 인프라구축사업을 지원하고 있으며, 정부 연구개발 예산의 19%를 담당하고 있다.
기타 농림부·교육부·정통부·환경부·해양부 등 5개 부처는 영역별 연구개발 사업을 지원하고 있으며, 정부 연구개발 예산의 21%를 담당하고 있다.
상기의 전반적인 지원 이외에도 정부 관련부처 및 관련기관은 생명공학산업의 발전을 촉진할 수 있는 생명공학산업관련 시설자금 융자·창업 및 보육 지원·지역 클러스터 및 국제협력 지원 등을 통해 기업체의 활성도 제고를 추진하고 있다.
![]() 발전과제
발전과제
가. 선진국의 추진전략 사례연구 및 모니터링
생명공학산업분야의 기술 및 산업화 추세는 매우 빠르게 전개되고 있고, 선진국은 새로운 산업으로서의 성장 가능성을 점차 입증해가고 있으므로 우리나라는 지속적으로 선진국의 추진전략을 모니터링하고 분석하여 활용하여야 한다. 이는 미국의 신속한 특허심사와 시장선점의 경쟁력 강화방안, 일본의 관주도 생명공학 전략, 유럽의 EU차원 협력 및 경쟁전략뿐만 아니라 경쟁국인 캐나다, 호주 등과 저개발국에 대한 진출 노력이 요구되고 있는 시점이기 때문이다.
나. 대표적인 성공사례 창출 및 활용
생명공학산업의 최강국인 미국은 Amgen사 성공사례 등을 창출하여 미국 생명공학산업 전체의 발전 및 성장을 리드하고 있는 상황 등을 고려하여 우리나라도 생명공학산업 발전 촉진을 위한 획기적인 성공사례 창출을 통해 산업전체 성장 또는 지역산업 발전을 견인할 수 있는 성공모델 정립이 필요한 상황에서 특히, 산업체의 결실노력에 따른 생명공학산업분야에 지속적으로 투자가 이루어질 수 있도록 집중이 필요하다.
다. 생명공학산업제품 개발방향
생물의약품의 경우 주요 제품이 2006년 이후 특허가 만료되므로 후발 제네릭 생물의약품 개발 및 산업화를 중점적으로 추진해야 하며, 생물의약품 이외의 생명공학산업제품은 생물공정 등 산업 생명공학(Industrial Biotechno-logy)에 의한 제품 생산성 및 질 향상을 통한 제품 개량도 본격적으로 추진해야 할 것으로 분석되고 있다.
이와 병행하여 면역치료제·약물전달체 등 바이오신약, 세포치료·유전자치료 등 바이오치료, 바이오칩·운영체계 등 U-헬스, 작물·동물·어류 등 유전자변형생물체(GMO), 영상진단기·분석기기 등 바이오기기, 미생물분해·바이오연료 등 바이오환경·에너지, 기존 공정의 대체 생물공정 등의 바이오신사업 기회 분석을 통하여 사업화를 추진하고 산업화 추세에 대응하여야 한다. 아울러 BIT(바이오인포메틱스) 등 융합부문에 대한 기술축적 및 산업화 대응도 중요하다 하겠다.
합성 플라스틱·합성 세제·화학 농약 등과 같이 상용화되고 있는 기존 제품에 대해 취해질 규제조치를 대비하여 대체 또는 신규 생명공학산업제품 개발을 지속적으로 추진해야 할 것이다.
□ 참고문헌
1. 산업자원부, 바이오산업 발전을 위한 3·12 프로젝트, 2005년 7월
2. 산업자원부 기술표준원/산업연구원/한국바이오산업협회, 2003년도 국내 생물산업 실태조사, 2004년
3. 과학기술부, 2005년도 생명공학육성시행계획, 2005년 4월
4. 한국바이오산업협회, 바이오인더스트리 제39호~42호, 2004년~2005년
5. 김문기, 바이오의약품의 해외진출 방향, 제1차 바이오의약품 해외진출 포럼, 2005년
6. Ernst & Young, Resurgence : Global Biotechnology Report 2004, June 2004
7. Ernst & Young, Beyond Borders Global Biotechnology Report 2005, June 2005
8. Biotechnology Industry Organization, BIO 2005-2006 Guide to Biotechnology, June 2005
9. Cheng KC, Biotechnology and Bio-industry Development, The 8th World Chinese En-tre-preneurs Convention, October 2005
10. 日經BP社, Nikkei Biotechnology, No. 536/2004年 2月, No. 562/2005年 2月
11. 日經BP社, 日經バイオ年鑑 2005, 2004年 12月

■ 생명공학 백서 부록 생명공학 연표 |
■ 기원전 8000년
○ 인간이 농작물과 가축을 경작하고 사육하기 시작
○ 최초로 감자를 식용으로 경작
■ 기원전 4000~2000년
○ 이집트에서 효모를 사용해 빵과 맥주의 발효 시작
○ 수메리아, 중국, 이집트에서 치즈를 생산하고 포도주를 발효시킴
○ 바빌로니아인들은 몇 그루 수술 나무의 꽃가루를 가지고 선별적으로 암술 나무에 수정하여 대추야자를 생산
■ 기원전 500년
○ 중국에서 항생물질을 내재한 곰팡이가 핀 두부로 종기를 치료
■ 서기 100년
○ 중국에서 최초 살충제를 국화에 살포함
■ 1322년
○ 아랍에서 우성 말을 생산하기 위해 최초로 인공수정을 사용
■ 1590년
○ Janssen, 현미경 발명
■ 1663년
○ Hooke, 세포의 존재 발견
■ 1675년
○ Leeuwenhoek, 박테리아를 발견
■ 1761년
○ Koelreuter, 다른 종의 농작물의 성공적인 이종교배를 보고
■ 1797년
○ Jenner, 아이들에게 천연두를 막기 위한 바이러스성 백신을 접종
■ 1830~1833년
○ 1830년 단백질 발견
○ 1833년 최초로 효소가 발견되고 분리됨
■ 1835~1855년
○ Schleiden와 Schwann, 모든 유기체는 세포들로 구성되어 있다고 제안
○ Virchow, “모든 세포는 세포에서 생겼다”고 선언
■ 1857년
○ Pasteur, 미생물들이 발효를 유발한다고 제안
■ 1859년
○ 찰스 Darwin, 자연 도태의 진화론을 발표(1800년대 후반 유전학의 무지에도 불구하고 선택된 부모와 도태된 다양한 자손에 대한 개념은 동식물 사육사들에게 매우 큰 영향을 줌)
■ 1865년
○ 유전학 연구 시작
○ Gregor Mendel, 오스트리아인 수도사인 그는 완두를 연구하여 유전법칙에 의해 유전적 특징이 부모로부터 자손에게 물려진다는 점을 발견함
■ 1870~1890년
○ Darwin의 이론을 이용하여 면화를 이종교배하고 수백가지의 우성 품종을 개발
○ 최초로 농부들이 수확량을 늘리기 위해 농지에 질소고정 박테리아 미생물을 섞음
○ William James Beal, 최초로 실험실에서 실험용 옥수수 잡종 생산
■ 1877년
○ Koch, 박테리아를 염색하고 동정을 위한 기술 개발
■ 1878년
○ Laval, 최초로 원심분리기 개발
■ 1879년
○ Fleming, 후에 염색체라 불려지는 세포핵 안쪽의 봉모양의 염색질을 발견
■ 1900년
○ 초파리가 유전연구에 사용
■ 1902년
○ 면역학이라는 용어가 처음으로 나타남
■ 1906년
○ 유전학이라는 용어가 소개됨
■ 1911년
○ Rous, 최초로 암을 유발하는 바이러스 발견
■ 1914년
○ 최초로 박테리아를 영국 멘체스터의 하수처리에 사용
■ 1915년
○ Phage(박테리아성 바이러스)발견
■ 1919년
○ 최초로 생명공학(Biotechnology)이라는 단어가 출판물에 사용
■ 1920년
○ Evans와 Long, 인간성장 호르몬 발견
■ 1928년
○ Alexander Fleming, 항생물질인 페니실린 발견
○ 유럽에서 조명충 나방제어를 위한 소규모의 Bacillus thuringiensis(Bt) 테스트 시작
○ 1938년 프랑스에서 미생물 살충제의 상업적 생산 시작
○ Karpechenko, 무와 양배추를 교배하여 서로 다른 속(屬)의 식물사이에서 번식력이 강한 자손을 만듬
○ Laibach, 최초로 오늘날 이종교배라 알려진 광범위한 교배로부터 잡종을 얻기 위해 배구제(embryo rescue)를 사용
■ 1930년
○ 美 의회가 식물육종생산의 특허를 가능하게 하는 식물특허법(Plant Patent Act) 통과
■ 1933년
○ 1920년대 Henry Wallace에 의해 개발된 잡종옥수수가 상업화됨(1945년에는 엄청난 매출액은 증가된 연 종자구입비를 능가했고 잡종 옥수수는 미국 전체 옥수수 생산량의 78%를 차지)
■ 1938년
○ 분자 생물학이란 용어가 생김.
■ 1941년
○ 유전공학이란 용어가 폴란드 Lwow의 기술연구소에서 효모복제에 관한 강의를 맡고 있는 덴마크의 미생물학자 A. Jost에 의해 최초로 사용
■ 1942년
○ 박테리아를 감염시키는 박테리오파지를 규명하고 확인하기 위해 전자 현미경을사용
○ 페니실린을 미생물에서 생산함
■ 1944년
○ Avery와 그 외 다른 사람들에 의해 DNA가 유전정보를 운반한다는 점이 입증됨.
○ Waksman, 결핵에 효과적인 항생제인 streptomycin을 분리(추출)
■ 1946년
○ 새로운 타입의 바이러스를 형성하기 위해 서로 다른 바이러스로부터의 유전물질이 결합할 수 있다는 일종의 유전자 재조합이 발견
○ 유전적 다양성의 상실로 인한 위협을 인식한 미의회는 식물수집과 보존 그리고 이러한 인식의 홍보에 막대한 자금을 제공함
■ 1947년
○ McClintock, 옥수수에서 소위 움직이는 유전자(jumping genes)라 불리는 전이요소를 발견
■ 1949년
○ Pauling, 겸상(鎌狀) 적혈구 빈혈증(흑인의 유전병)이 헤모글로빈 내 단백질 분자의 돌연변이로 야기된 “분자병”임을 밝혀냄
■ 1951년
○ 냉동정액을 사용한 가축의 인공수정이 성공적으로 수행
■ 1953년
○ 과학저널 Nature는 현대 유전학의 출발을 상징하는 DNA의 이중나선구조를 묘사한 James Watson과 Francis Crick의 원고를 출판
■ 1955년
○ 핵산 합성에 관한 효소가 처음으로 추출됨
■ 1956년
○ Kornberg, DNA 복제에 필요한 효소 DNA 중합효소Ⅰ(DNA polymeraseⅠ) 발견
■ 1958년
○ 겸상 적혈구 빈혈증이 단일 아미노산의 변화 때문에 발생한다고 밝혀짐
○ DNA가 처음으로 시험관에서 만들어짐
■ 1959년
○ 조직 살균제가 개발됨
○ 단백질 생합성의 첫 단계가 그려짐
■ 1950년대
○ 바이러스 증식억제 물질(interferon) 발견
○ 최초 합성 항생 물질 개발
■ 1960년
○ 시냅시스(세포의 감수분열 초기에 있는 상동염색체의 병렬접착)를 이용해 DNA- RNA 잡종 분자가 만들어짐
○ 메신저 리보 핵산(Messenger RNA) 발견
■ 1961년
○ 美 농림부가 최초 미생물 살충제인 Bacillus thuringiensis를 등록함
■ 1963년
○ Norman Borlaug에 의해 신품종 밀이 개발됨으로 인해 생산량이 70% 상승함
■ 1964년
○ 필리핀의 국제 벼 연구소(The International Rice Research Institute)는 새로운 품종을 개발하여 충분한 비료를 주면 이전의 생산량보다 2배 많은 수확량을 얻을 수 있는 녹색 혁명을 일으킴
■ 1965년
○ Harris와 Watkins는 성공적으로 생쥐와 사람 세포를 융합시킴
■ 1966년
○ 유전암호가 해독되고 일련의 3개의 뉴클리오티드가 하나의 아미노산을 결정한다는 사실이 밝혀짐
■ 1967년
○ 최초로 자동 단백질 서열 분석기 완성
■ 1969년
○ 처음으로 효소가 생체외에서 합성됨
■ 1970년
○ 노르만인 Borlaug, 노벨 평화상 수상(1963년 참조)
○ 유전물질을 자르는 제한 효소(두 줄 사슬 DNA를 특정 부위에서 절단하는 효소)의 발견으로 유전자 복제의 장이 열림
■ 1971년
○ 처음으로 유전자가 완벽하게 합성됨
■ 1972년
○ 인간의 DNA 구성이 침팬지와 고릴라의 DNA와 99% 유사함이 발견됨
○ 최초로 배이식(胚移植)이 시도됨
■ 1973년
○ Stanley Cohen와 Herbert Boyer, 제한효소와 리가제(ligases)를 사용해서 DNA를 자르고 붙이는 기술과 박테리아에서 새로운 DNA를 복제하는 기술을 완성함
■ 1974년
○ 美國 NIH는 유전자 재조합 연구를 총괄하기 위해 재조합 DNA 자문위원회(Recombinant DNA Advisory Committee) 구성
■ 1975년
○ 최초로 미국 정부가 캘리포니아 Asilomar 회의에서 유전자재조합 실험을 규제하기 위한 가이드라인 개발을 주장함
○ 단일클론항체가 생산됨
■ 1976년
○ 유전자 재조합 기술이 유전 장애인에 최초로 적용
○ 분자교배가 태아의 alpha thalassemia 진단에 사용됨
○ 효모의 유전자가 대장균(E.coli)에서 발현됨
○ 최초로 특정유전자의 염기쌍 순서가 결정됨(A, C, T, G)
○ 美國 재조합 DNA 자문위원회(NIH Recombinant DNA Advisory Committee)에 의해유전자 재조합 실험에 대한 가이드라인이 처음으로 발표
■ 1977년
○ 인간유전자를 박테리아에서 처음으로 발현시킴
○ 전기영동을 이용해 DNA의 긴 마디를 빠르게 나열하기 위한 연구수행
■ 1978년
○ 바이러스의 고방사선 구조가 최초로 확인됨
○ 재조합 인간 인슐린이 최초로 생산됨
○ 미국 노스캐롤라이나 과학자들이 DNA 분자상의 특정 위치에 특정 돌연변이를 일으키는 것이 가능하다는 것을 보여줌
■ 1979년
○ 최초로 인간성장 호르몬이 합성됨
■ 1970년대
○ 유전공학 제품을 개발하기 위해 최초의 상업적 회사가 설립
○ 중합효소(polymerases)의 발견
○ 뉴클리오티드(nucleotides)의 빠른 나열기술 완성
○ 유전자 표적화
○ RNA splicing
■ 1980년
○ Diamond v. Chakrabarty 재판에서 미 연방법원은 유전자재조합 생물형태에 대한 특허를 인정했으며, Exxon 석유회사가 기름 먹는 미생물에 대한 특허 취득
○ 美國 정부 유전자복제에 대한 권한을 Cohen과 Boyer에게 부여
○ 최초의 유전자합성 기계 개발
○ 인간인터페론유전자를 박테리아로 형질전환(Transformation) 시킴
○ 노벨 화학상이 유전자 재조합분자를 개발한 Berg, Gilbert, Sanger에게 수여됨
■ 1981년
○ 오하이오 대학의 과학자들이 다른 동물의 유전자를 쥐에 이식함으로서 최초로 유전자 이식동물을 생산함
○ 중국의 과학자가 최초로 복제 물고기 금잉어를 만듦
■ 1982년
○ 미국의 Applied Biosystems社는 단백질 서열분석에 필요한 샘플의 양을 획기적으로 줄일 수 있는 상업적 가스 상 단백질 서열분석기를 발표
○ 가축을 위한 최초의 유전자 재조합 DNA 백신 개발
○ 유전적 변이를 거친 박테리아에서 생산된 인간인슐린이 미국 FDA로부터 최초의 생명공학 기술에 의한 의약품으로 승인 받음
○ 최초의 유전자 변형식물인 피튜니아 생산
■ 1983년
○ 중합효소연쇄반응(PCR) 기술이 소개(유전자와 유전자 조각의 복제를 위해 열과 효소를 사용하는 PCR 기술은 이후 유전공학에서의 연구와 개발에 광범위하게 쓰이는 중요한 도구가 됨)
○ TI 플라스미드(plasmid: 염색체와는 따로 증식할 수 있는 유전인자)에 의한 식물 세포들의 유전학적인 변형이 수행됨
○ 최초로 인공염색체 합성
○ 특정유전병 유발인자 발견
○ 생명공학기술을 이용해 피튜니아를 완전 성장시킴
○ 피튜니아 식물을 통해 유전자변형식물의 새로운 특징이 자손에게 전달됨을 확인함
■ 1984년
○ DNA 지문검색 기술이 개발
○ HIV 바이러스의 전체 게놈이 복제되고 서열 결정됨
■ 1985년
○ 신장병과 낭포성 섬유증을 유발하는 유전인자 발견
○ 법적 증거로서 유전자 지문법이 도입
○ 최초로 곤충과 박테리아, 바이러스에 저항력이 있는 유전자 변형 식물이 시험됨.
○ 미국 NIH는 인간을 대상으로 하는 유전자 치료법 실험수행에 대한 가이드라인을 정함
■ 1986년
○ 유전자 재조합 B형 간염 백신 최초 개발
○ 최초의 유전공학 항암치료제 인터페론 생산
○ 미국 정부는 유전자 재조합 유기체에 대해 전통적인 유전자재조합 기술로 만들어진 제품에 적용된 규정보다 더 엄격한 “the Coordinated Framework for Regulation of Biotechnology” 규정 확립
○ California Berkeley 대학의 화학자가 신약을 개발하기 위해 항체와 효소를 결합하는 방법(abzymes) 제시
○ 유전자 변형식물(담배)의 실제 실험이 수행됨
○ 최초로 환경 보호국이 유전자변형 담배의 판매를 승인
■ 1987년
○ 바이러스에 내성이 있는 토마토의 field test를 최초로 승인함
○ 캘리포니아에서 농작물의 서리 형성을 억제하는 유전자 변형 박테리아인 Frostban을 딸기와 감자를 통해 시험하였는데 이것이 처음으로 공식 승인한 유전자 재조합 박테리아 외부실험임
■ 1988년
○ 미국 정부는 하바드 대학 분자유전학자에게 유전자 변형동물 즉 유전자변형 쥐에 대한 특허권을 부여함
○ 세제에 사용할 수 있는 표백제 내성을 지닌 단백질 분해효소를 만드는 공정에 대한특허권이 부여됨
○ 미국 의회가 다른 종의 게놈뿐만 아니라 인간유전자 암호를 해독하고 지도를 만드는 인간 게놈프로젝트 연구비를 승인함
■ 1989년
○ 최초로 유전자변형 해충방지 면화의 field test 승인
○ 식물 게놈 프로젝트 시작
■ 1980년대
○ 진화의 역사를 밝히기 위한 DNA 연구 시작
○ 유럽에서 유전자 재조합 동물백신의 사용 승인
○ 기름 청소에 미생물을 이용한 생물학적 정화기술 사용
■ 1990년
○ 미국 최초로 유전자재조합 기술을 이용하여 치즈제조에 쓰이는 인공적으로 제조된 chymosin 효소인 Chy-MaxTM이 소개됨
○ 인체의 모든 유전자 지도를 제작하려는 국제적인 노력인 인간 게놈 프로젝트가 시작됨
○ 면역장애를 앓고 있는 4살 여자 어린이를 대상으로 실시한 유전자 치료가 성공적으로 수행됨
○ 유아 조유용 우유 단백질을 만드는 유전자 변형 젖소 탄생
○ 해충에 강한 옥수수인 Bt 옥수수 생산
○ 영국 최초로 유전자변형 효모식품이 승인됨
○ 유전자 변형 척추동물 송어의 실지실험이 수행됨
■ 1992년
○ 미국과 영국의 과학자들이 시험관 내에서 배아에 낭포성 섬유증과 혈우병과 같은 유전적 기형을 테스트하는 기법을 밝힘
○ 미국 FDA는 유전자 이식 음식이 유전적으로 위험하지도 않고 특별한 규정도 필요 없다고 선언함
■ 1993년
○ 미국 FDA, 낙농가의 우유생산 촉진을 위해 BST(Borine Somatotropin)를 승인
■ 1994년
○ 미국 FDA, 생명공학으로 만들어진 FLAVRSAVRTM tomato 승인
○ 최초로 유방암 유전자 발견
○ CF 환자의 폐에 단백질이 쌓이지 않게 하는 재조합 인간 DNase 승인
○ 소 성장호르몬(POSILAC)이 상용화됨
■ 1995년
○ 에이즈 환자에게 최초로 비비의 골수가 이식됨
○ 최초로 바이러스 이외의 살아있는 유기체(Hemophilus Influenzae)의 완벽한 유전자 배열이 완성됨
○ 암정복을 위해 면역시스템 모듈, 유전자 재조합 항체형성과 같은 유전자 치료가 도입됨
■ 1996년
○ 파킨스병과 관련된 유전자의 발견으로 퇴행성 신경질환의 잠재가능한 치료와 그 원인 연구의 중요한 이정표를 제시함
■ 1997년
○ 스코틀랜드에서 어른세포로 복제된 최초의 복제양 Dolly 탄생
○ 해충방지 농작물인 Roundup ReadyTM 콩과 BollgardTM 해충방지 면화와 같은 작물이 상업화됨
○ 아르헨티나, 호주, 캐나다, 중국, 멕시코와 미국 등 전세계적으로 500만 에이커 면적에서 유전자조작 작물이 재배됨
○ Oregon주 연구자들은 두 마리의 붉은털 원숭이를 복제했다고 주장함
○ 유전병 연구의 새로운 기술을 창조하기 위해 PCR, DNA 칩과 컴퓨터를 결합한 새로운 DNA기술 탄생
■ 1998년
○ 하와이대학 연구진이 어른의 난소 적(cumulus)세포 핵으로부터 쥐를 복제함
○ 인간 배아줄기세포주가 확립됨
○ 일본 Kinki 대학 연구진은 한 마리 어른암소로부터 얻은 세포를 이용 8마리의 동일 송아지 복제함
○ 최초로 C. elegans 벌레에 대한 동물 게놈 염기서열 해독 완료
○ 30,000개의 이상의 유전자 위치를 보여주는 인간 게놈지도의 초안 완성
○ 동남아시아 다섯 나라가 병에 강한 파파야 나무를 개발하기 위해 컨소시엄을 구성
■ 1990년대
○ 최초로 영국에서 유전자 지문법을 이용해 유죄를 판결함
○ 규정질량의 일반적 융기에 착상된 유전자 분리성공
○ 유전성 대장암이 DNA 치료 유전자의 결핍으로 야기된다는 사실 발견
○ 유전자 재조합 광견병 백신을 너구리에 실험
○ 미국에서 농약을 기본으로 한 생명공학 제품판매 승인
○ 특수이식 유전자를 가진 쥐에 관한 특허 허용
○ 최초로 유럽에서 발암물질에 민감한 유전자변형 쥐에 관한 특허 제기
○ 유방암 유전자 복제
■ 2000년
○ 최초로 애기장대(학명 Arabidopsis thaliana)의 게놈지도 개발
○ 13개 나라에서 총 1억 89만 에이커 면적에서 생물공학 농작물이 재배됨
○ 최초로 바이러스에 강한 고구마가 케냐에서 실질 시험됨
○ 인간게놈 배열의 초안 발표
■ 2001년
○ 최초로 벼 게놈지도 완성
○ 오스트리아 연구진들은 Barley Yellow Dwarf Virus와 같은 바이러스 예방백신에 사용되는 hairpin RNA를 이용한 기술개발을 보고함
○ Chinese National Hybrid 연구진들은 일반 쌀 생산량보다 두 배 많은 super rice 종 개발을 보고함
○ 유럽위원회(The European Commission)가 모든 유전자 변형 식품에 라벨을 붙일 것을 제기함
○ 농업적으로 중요한 시노라이조비움 멜리로티(Sinorhizobium meliloti) 박테리아의 DNA배열 완성
○ 염분이 있는 물과 땅에서 성장 가능한 최초의 농작물을 만들기 위해 애기장대로부터 추출된 유전자가 토마토에 이식됨
○ 농업에 중요한 식물병원균 Agrobacterium tumefaciens의 게놈서열이 공표됨
○ 스트레스에 더 강한 농작물 개발의 실마리로서, 손상을 입거나 스트레스를 받았을 때 빛을 발하는 세일 크레스(thale cress)라 불리는 실험용 식물 재배
○ 최초로 땅콩의 종합적 분자지도가 완성됨
■ 2002년
○ 완성된 인간 게놈 배열을 과학전문지에 게재함
○ 효모의 프로테옴(Proteome: 단백질간 상호작용과 네트워크의 총합)의 기능지도(functional map)의 초안 완성, 효모의 게놈지도는 1996년에 발표되었음
○ 줄기세포의 분화에 관여하는 조절인자 연구에 큰 발전이 있었으며, 이에 관여하는 200여개의 유전자가 밝혀짐
○ 생명공학 농작물이 16개국, 1억 4천 5백만 에이커에서 재배되고 있으며 이는 2001년보다 12% 증가한 것임
○ 자궁경구암에 대한 백신 개발에 성공하였으며 이는 특정 암에 대한 예방백신이 가능함을 처음으로 보여준 성과임
■ 2003년
○ 인간게놈 완전 해독(4월)
○ 정신분열증과 우울증 등 정신병의 발병 위험을 증가시키는 특정유전자 변형을 확인한 연구결과 발표
○ 美 최초의 GM 애완동물로 광고된 붉은 빛 형광물고기 GloFish 상업화
○ 세계적으로 생명공학작물 이용의 활성화 증대
○ 영국은 최초로 상업적인 생명공학작물인 제초제 저항옥수수를 인정
○ 미국 환경 보호국은 최초로 형질전환 해충저항성 옥수수를 승인함
○ 2003년 banteng 들소가 최초로 복제되었으며, 노새, 말, 사슴도 복제되었음
○ 1997년 포유동물의 최초 복제양 돌리는 폐병연구 후에 안락사 됨
○ 일본 연구팀은 자연적으로 카페인을 제거하는 생명공학 커피를 개발함
○ RNA 형태는 유전자 형식을 지시, 변형시키며 줄기세포와 배(胚)의 성장에 영향을 미침을 밝힘
○ 쥐의 배 세포줄기가 정자나 난자 세포로 성장할 수 있음을 확인
○ 남성을 결정짓는 Y 염색체가 동일한 유전자를 함유하고 있음을 발견
○ 종양으로 하여금 암의 전이에 필요한 혈관을 생성하지 못하도록 하는 약물의 개발
■ 2004년
○ 미국 식품의약국(FDA)은 아바스틴이라는 최초의 신세대 항암제를 승인함.
○ FDA는 다양한 종류의 약물치료와 질병을 위해 첫 DNA칩 및 유전자칩 개발
○ RNA 방해 제품으로, 임상 시험에 들어가는 첫 번째 RNAi 제품 생산
○ 국제연합 식량농업기구(FAO)의 생명공학 작물 승인
○ 국립과학연구원 산하 의학연구소에서는 ‘생명공학작물이 건강에 해를 끼치지 않는다’라고 밝힘.
○ FDA는 식품안전성 검토 후 생명공학 밀의 안전성 밝힘.
○ 몬산토사는 지방산을 감소 삭제한 low-linolenic 콩을 소개함
○ 닭 게놈 DNA 완전 해독
○ 최초로 애완 새끼고양이 복제
○ ‘쓸모없는 DNA (junk DNA)’ 규명
○ 인간의 유전자 DNA 중 단백질을 합성하는 DNA는 전체 게놈의 10%에 불과하며 아무런 기능이 없는 DNA에 대한 규명 이루어짐
○ 지난 3월 영국의 과학자들, 지난 20년간 나비 58종의 개체 수가 71% 줄었으며, 조류는 54% 감소했다고 보고
○ 新의약품 개발 활발
○ 유엔(UN), 대학, 민간자선단체, 제약업체 등 공공단체와 민간기업이 손을 잡고 미개발국의 환자를 위해 의약품을 개발하는 새로운 움직임이 일어남.
○ 미생물게놈 추출성공
인간게놈프로젝트 주역인 미국 크레이크 벤터 박사는 3월 사이언스에 바닷물에서 미생물 게놈을 추출해 10억 5000만 염기쌍을 한꺼번에 분석하는 데 성공했다고 밝힘
■ 2005년
○ 게놈지도와 야외 관찰로 진화가 일어나는 복잡한 과정을 밝힘
○ 유럽 호이겐스 탐사선이 토성의 달 타이탄에 착륙하고, NASA의 Deep Impact가 혜성에 충돌한 실험 등
○ 분자 생물학자들이 봄에 꽃이 다양한 색깔을 내게 하는 원리라고 발견
○ 위성과 지상망원경이 도시 크기의 죽은 별들인 중성자별 관찰
○ 정신분열증, 난독증, 안면경련증과 같은 뇌 신경질환 연구
○ 외계에서 온 암석과 지구의 암석을 비교 분석한 결과 지구 생성에 대해 새로운 이론 설립
○ volage-gated potassium channel의 분자 구조 밝힘
○ 인간 활동에 의한 지구 온난화의 증거 추가 발견
○ 분자 생물학자들이 복잡한 시스템의 행태를 이해하기 위해 엔지니어 기술 이용
○ 120억 달러 규모의 국제 핵융합 실험로(International Thermonuclear Ex- perimental Reactor) 위치가 18개월의 논란 끝에 프랑스 Cadarache로 결정
○ Z 나선형 DNA와 B 나선형 DNA의 결합구조 규명, 네이처지 게재
※ 출처: 미국 생물산업협회, 사이언스, 네이처
■ 생명공학 백서 부록 생명공학 주요 통계 |
I. 생명공학 투자 현황
생명공학육성기본계획 부처별 투자계획(1994~2007) (단위: 억 원)
구 분 | 제1단계 (’94~’97) | 제2단계 (’98~’01) | 제3단계(2002~2007) | 계 | ||||||
’02 | ’03 | ’04 | ’05 | ’06 | ’07 | 소계 | ||||
과 학 기술부 | 2,150 | 4,418 | 2,059 | 2,482 | 3,232 | 4,076 | 4,892 | 5,957 | 22,698 | 29,266 |
교육인적 자원부 | 197 | 823 | 414 | 521 | 679 | 856 | 1,027 | 1,251 | 4,748 | 5,768 |
농림부 | 723 | 887 | 576 | 725 | 945 | 1,192 | 1,430 | 1,741 | 6,609 | 8,219 |
산 업 자원부 | 167 | 1,299 | 635 | 856 | 1,114 | 1,405 | 1,686 | 2,053 | 7,749 | 9,215 |
보 건 복지부 | 448 | 886 | 609 | 822 | 1,070 | 1,349 | 1,620 | 1,972 | 7,442 | 8,776 |
환경부 | 93 | 196 | 117 | 146 | 192 | 242 | 290 | 354 | 1,341 | 1,630 |
해 양 수산부 | 78 | 149 | 90 | 113 | 148 | 186 | 224 | 272 | 1,033 | 1,260 |
총 계 | 3,856 | 8,658 | 4,500 | 5,665 | 7,380 | 9,306 | 11,169 | 13,600 | 51,620 | 64,134 |
출처 : ’03년 생명공학육성연차별시행계획, 과학기술부
국내 BT 연구개발 투자 실적(1994~2005) (단위: 억 원)
구분 | 1단계(’94~’97) | 2단계(’98~’2001) | 3단계 | |||||||||||
’94 | ’95 | ’96 | ’97 | 소계 | ’98 | ’99 | ’00 | ’01 | 소계 | ’02 | ’03 | ’04 | ’05 | |
정부 | 536 | 868 | 1,234 | 1.218 | 3,856 | 1,115 | 1,608 | 2,462 | 3,791 | 8,976 | 4,503 | 5,302 | 5989 | 7,046* |
민간** | 801 | 1,062 | 1,252 | 1,263 | 4,378 | 1,319 | 1,616 | 1,779 | 2,461 | 7,175 | - | - | - | - |
출처: 연도별 생명공학육성 시행계획
*: ’05년도 정부투자는 실적치가 아닌 ’05년도 생명공학육성시행계획사의 계획치
**: 민간투자는 한국바이오협회의 조사결과 인용
부처별 생명공학 연구개발 투자실적(’04년) 및 계획(’05년) (단위: 억 원, %)
부처 년도 | 구분 | 과기부 | 교육부 | 농림부 | 산자부 | 복지부 | 정통부 | 환경부 | 해양부 | 총계 |
2004년도 실 적 | R&D | 1,893 | 233 | 589 | 632 | 576 | 88 | 189 | 46 | 4,246 |
인프라 | 154 | - | 159 | 652 | 743 | - | 17 | 18 | 1,743 | |
계 | 2,047 | 233 | 748 | 1,284 | 1,319 | 88 | 206 | 64 | 5,989 | |
2005년도 계 획 | R&D | 2,158 | 264 | 609 | 801 | 686 | 102 | 195 | 62 | 4,877 |
인프라 | 167 | - | 183 | 1,088 | 692 | - | 18 | 21 | 2,169 | |
계 | 2,325 | 264 | 792 | 1,889 | 1,378 | 102 | 213 | 83 | 7,046 | |
증가율(%) | - | 13.6 | 13.3 | 5.9 | 47.1 | 4.5 | 15.9 | 3.3 | 29.7 | 17.6 |
출처: 2005년도 생명공학육성시행계획, 과학기술부
2005년 생명공학 부처간 연구개발비 점유현황

출처: 2005년도 생명공학육성시행계획, 과학기술부
미래유망 신기술(6T분야) 투자현황(2001~2004) (단위: 억 원, (%))
6T | 2001년 | 2002년 | 2003년 | 2004년 | CAGR* | ||||
금액 | 비율(%) | 금액 | 비율(%) | 금액 | 비율(%) | 금액 | 비율(%) | ||
IT(정보기술) | 12,417 | 58.9 | 10,582 | 50.5 | 10,141 | 45.8 | 13,673 | 41.5 | 2 |
BT(생명공학기술) | 3,742 | 17.8 | 4,213 | 20.1 | 4,917 | 22.2 | 7,717 | 23.4 | 20 |
NT(나노기술) | 819 | 3.9 | 1,531 | 7.3 | 1,840 | 8.3 | 3,041 | 9.2 | 39 |
ET(환경기술) | 2,193 | 10.4 | 2,585 | 12.3 | 3,000 | 13.6 | 5,468 | 16.6 | 26 |
ST(우주항공기술) | 1,572 | 7.5 | 1,771 | 8.5 | 1,810 | 8.2 | 2,550 | 7.7 | 13 |
CT(문화기술) | 323 | 1.5 | 267 | 1.3 | 423 | 1.9 | 531 | 1.6 | 13 |
합계 | 21,065 | 100 | 20,949 | 100 | 22,131 | 100 | 32,980 | 100 | |
출처: 2005 주요 과학기술통계, 2005년도 국가연구개발사업 조사·분석 결과(안),
과학기술부. 2004년도 국가연구개발사업 조사분석평가 및 사전조정 결과, 국가과학기술위원회
* CAGR(Compound Annual Growth rate, 누적 복합 연평균 성장률)
- 첫 회부터 매년 일정한 성장률을 지속한다고 환산할 때의 성장률을 의미함
- CAGR = {[(최종수치/최초수치)^(1/년도 수)]-1} *100
미래 유망 신기술 투자실적 및 분포(2004)

출처: 2005년도 국가연구개발사업 조사·분석 결과(안), 과학기술부
<6T분야별 주요국 투자현황 분포(2003)> (단위: 억 원, (%))
국명 기술 | 한국(’03) | 미국(’03) | 일본(’03) | 독일(’02) | 영국(’01) |
정보기술(IT) | 5,053(9.2) | 24,553(1.8) | 27,710(7.7) | 10,959(9.3) | 2,056(1.6) |
생명공학기술(BT) | 4,962(9.0) | 358,332(25.8) | 43,160(12.0) | 16,373(13.8) | 15,278(12.3) |
나노기술(NT) | 1,965(3.6) | 9,172(0.6) | 14,910(4.2) | 1,418(1.2) | 4,032(3.2) |
환경‧에너지기술(ET) | 2,505(4.5) | 42,838(3.1) | 81,160(22.6) | 9,295(7.9) | 6,819(5.5) |
우주항공기술(ST) | 1,840(3.3) | 117,587(8.4) | 3,569(1.0) | 11,349(9.6) | 2,474(2.0) |
합계(B) (B/A) | 16,325(29.6) | 552,482(39.7) | 170,509(47.5) | 49,394(41.8) | 30,659(24.6) |
총 R&D 예산(A) | 55,241 | 1,389,969 | 359,160 | 118,300 | 124,545 |
R&D 예산규모 비교(한국 1) | 1 | 25.2 | 6.5 | 2.1 | 2.3 |
출처: 2005년 주요 과학기술통계, 과학기술부
(주)1. 문화기술(CT) 분야는 IT분야에 포함.
2. 국제비교를 위해 한국 자료도 2003년 정부연구개발예산(일반+특별회계)만을 기준으로 산출함.
3. 미국의 미래 유망기술분야는 비국방부문(nondefense) 분야만을 대상으로 한 것이며, 비율은 전체(국방 및 비국방부문) 대비 비율임. 미국경우 국방부문에서 정보기술의 비중이 높은 것으로 추정되나 정확한 추계가 이루어지지 않으므로 동 통계에서는 비국방 부문의 통계만을 활용함
4. 독일의 경우 2002년 정부 총 연구개발예산(연방+지방정부) 중 연방정부 예산만을 대상으로 함.
5. 일본의 우주항공기술(ST) 규모는 운영비용(operating cost)을 제외한 순수연구비만을 산정함.
6. 적용환율: 1$=1,185원, 100¥=1,000원, 1€=1,300원, 1£=1,900원
<자료원> 1. 미국: 과학진흥협회(AAAS), R&D FY 2004, 2003.
2. 일본: 일본국립과학재단, 메모렌덤 2004
문부과학성, 2002년도 과학기술관계경비 자료, 2002.2
3. 독일: 연방교육연구부(BMBF), Bundesdeutsche Forschung 2002, 2002
4. 영국: 무역산업부(DTI), The Forward Look 2001, 2002
II. 생명공학 인력현황
![]() 인력현황
인력현황
국내 바이오분야 종사 전문인력 현황(1997~2003) (단위: 명)
연도 | 기업 | 정부(연) | 대학 | 합계 | 박사 | 석사 | 학사 |
1997 | 2,153 | 1,827 | 4,504 | 8,485 | 3,928 | 3,176 | 1,381 |
1998 | 1,894 | 1,485 | 4,205 | 7,584 | 3,737 | 2,731 | 1,116 |
1999 | 2,083 | 1,516 | 4,643 | 8,242 | 4,121 | 2,948 | 1,172 |
2000 | 2,701 | 1,467 | 5,224 | 9,392 | 4,427 | 3,431 | 1,534 |
2002 | 3,543 | 1,315 | 5,338 | 10,195 | - | - | - |
2003 | 3,535 | 1,324 | 5,476 | 10,335 | 4,684 | 4,018 | 1,633* |
출처: 2003년도 생명공학백서, 2004년 과학기술활동조사보고서에 근거한 가중치 적용
* 학사인력에 기타인력(65명)을 포함한 수치임
전공에 따른 학위별 남녀구분 현황(2003) (단위: 명)
구분 | 박사 | 석사 | 학사 | 기타 | 총계 | ||||
남자 | 여자 | 남자 | 여자 | 남자 | 여자 | 남자 | 여자 | ||
이학 (화학,생물학) | 1,187 | 290 | 1,045 | 491 | 334 | 198 | 5 | 3 | 3,553 |
공학 (식품,유전공학) | 791 | 250 | 840 | 399 | 581 | 192 | 23 | 26 | 3,102 |
의약학보건 (의학,약학) | 1,109 | 280 | 539 | 214 | 60 | 49 | 2 | 1 | 2,254 |
농림축산학 (농림학,축산학) | 723 | 55 | 405 | 85 | 130 | 22 | 6 | 1 | 1,427 |
총계 | 3,810 | 875 | 2,829 | 1,189 | 1,105 | 461 | 36 | 31 | 10,336 |
출처: 2004년 과학기술활동조사보고서에 근거한 가중치 적용
바이오산업 인력 변화 추세(1998~2003)

출처: 2003년도 국내생물산업통계(2004), 산업연구원
생명과학분야 졸업자 현황(1998~2003)

출처: S&E Indicators, Appendix table 2(2004), NSF
바이오분야 국가연구개발사업 부처별 참여인력 현황(2004)

출처: BT분야 국가연구개발 동향분석 사업(2005), KISTEP
![]() 인력 수급 현황
인력 수급 현황
바이오분야 전문인력 수급전망(2005, 2010) (단위: 명)
구분 | 2005 | 2010년 | |||
수요 | 공급 | 수요 | 공급 | ||
유전체학 | 박사 | 350 | 240 | 450 | 310 |
석사 | 600 | 280 | 700 | 350 | |
단백질체학 | 박사 | 400 | 50 | 500 | 70 |
석사 | 600 | 100 | 700 | 200 | |
생물정보학 | 박사 | 70 | 20 | 100 | 40 |
석사 | 250 | 50 | 400 | 150 | |
소계 | 박사 | 820 | 310 | 1,050 | 420 |
석사 | 1,450 | 430 | 2,100 | 700 | |
총계 | 석·박사 | 2,270 | 740 | 3,150 | 1,120 |
부족율(%) | 박사 | –62.2 | –60.0 | ||
석사 | –70.4 | 67.7 | |||
출처: 생물산업 발전기반 조성을 위한 5개년 계획 수립연구(2000.8), STEPI
6T 분야 인력 수급전망(2005년까지) (단위: 명)
분야 | 신규수요 | 양성인력 | 과부족(%) | 대상 분야 |
IT | 270,525 | 138,851 | △131,674(48.7) | 소프트웨어, 통신서비스, 정보통신기기 등 |
BT | 9,470 | 3,080 | △6,390(67.5) | 유전체학, 단백질체학, 생물정보학 등 |
NT | 4,200 | 2,415 | △1,785(42.5) | 나노전자공학, 환경·에너지, 나노소자, 의료·바이오, 나노측정 등 |
ST | 1,100 | 730 | △370(33.6) | 발사체, 위성체, 항공전기·전자, 항공재료 등 |
ET | 7,084 | 6,417 | △667(9.4) | 통합환경관리, 생태계보전, 사전오염예방, 지구환경·기후변화 등 |
CT | 116,100 | 70,500 | △45,600(39.3) | 게임, 에니메이션, 방송, 영화, 음반 등 |
계 | 408,479 | 221,993 | △186,486(45.6) |
출처: 2004 주요 과학기술통계, 과학기술부
각 부처 전문인력 양성 계획(2001~2007) (단위: 억 원)
번호 | 추진사업 | 주관부처 | 지원계획 (2001~2007) | 비고 |
1 | BT 산업기술인력 단기양성 프로그램 운영 | 산자부 | 38.0 | 민자27.0 |
2 | 생물정보학 단기 인력양성 | 복지부 | 5.3 | - |
3 | 바이오 안전성 전문 인력양성 | 농림부 등 | 52.2 | - |
4 | BT 전문생산 기능 인력 양성 | 산자부 | 30.0 | 민자75.0 |
5 | 산·학 협동과정 지원(BT 교육혁신지원) | 산자부 | 56.0 | 민자37.6 |
6 | 바이오 시스템 학과 운영 | 과기부 | 142.5 | 민자257.4 |
7 | BT21사업 | 교육부 | 1310.9 | - |
8 | 연합대학원 대학설립 통한 BT융합발전 추진 | 과기부 | - | - |
9 | BT 전문인력 통합 D/B 구축 | 산자부 | 6 | 민자2 |
10 | 기초 의과학 연구센터 운영 | 과기부 | 1250 | - |
합계 | 2890.9 | 민자399 | ||
출처: 2003년도 생명공학 백서
바이오인력 인큐베이터 프로그램 인력양성 계획(2003~2020) (단위: 명)
연도 양성프로그램 | 도입기 (2004~2005) | 성장기 (2006~2010) | 성숙기 (2011~2020) | 총기간 (2003~2020) |
1. 전문 기술인력 2. 산업 기술인려 3. 전문가 재교육 4. 벤처창업 아카데미 5. 청소년 Knowledge Camp | 100 250 50 50 (200) | 750 1000 500 375 (1,000) | 1,750 2,100 2,100 1,400 (3,000) | 2,600 3,350 2,650 1,825 (4,740) |
총계 | 500 (700) | 2,500 (3,500) | 7,000 (10,000) | 10000 (14,200) |
출처: 2003년도 생명공학 백서
III. 생명공학 기술현황
![]() 논문현황
논문현황
IF 구간별 논문 게재 순위의 국가별 비교

(구간1: 1≤IF≤2, 구간2: 2≤IF≤3, 구간3: 3≤IF≤5, 구간4: IF≥5)
출처: BT분야 국가연구개발 심층분석 및 평가에 관한연구(2004), 국가과학기술위원회
SCI논문 IF 15이상 저널 한국논문 발표현황(1992~2005)

출처: 1. Thomson ISI Web of Science의 database 분석
2. 분석기간: 1992~2005.6.10
3. IF(Impact factor)는 2003년 기준
최근 5년간 한국의 연도별 생명공학분야 논문현황(2000~2004)
분야명 | 구분 | 2000 | 2001 | 2002 | 2003 | 2004 | 00-04 |
생물학 & 생화학 | 논문수(a) | 878 | 914 | 1,052 | 1,177 | 1,220 | 5,241 |
피인용수(b) | 8,195 | 6,526 | 5,416 | 2,588 | 400 | 23,125 | |
*편당평균 | (9.33) | (7.14) | (5.15) | (2.2) | (0.33) | (4.41) | |
면역학 | 논문수 | 126 | 152 | 123 | 150 | 195 | 746 |
피인용수 | 1,229 | 1,106 | 561 | 376 | 79 | 3,351 | |
편당평균 | (9.75) | (7.28) | (4.56) | (2.51) | (0.41) | (4.49) | |
미생물학 | 논문수 | 306 | 311 | 370 | 458 | 393 | 1,838 |
피인용수 | 2,173 | 1,620 | 1,520 | 709 | 97 | 6,119 | |
편당평균 | (7.1) | (5.21) | (4.11) | (1.55) | (0.25) | (3.33) | |
분자생물학& 유전학 | 논문수 | 121 | 113 | 111 | 149 | 152 | 646 |
피인용수 | 1,615 | 1,271 | 753 | 460 | 79 | 4,178 | |
편당평균 | (13.35) | (11.25) | (6.78) | (3.09) | (0.52) | (6.47) | |
신경과학 & 행동과학 | 논문수 | 280 | 305 | 335 | 434 | 441 | 1,795 |
피인용수 | 2,889 | 2,351 | 1,587 | 948 | 117 | 7,892 | |
편당평균 | (10.32) | (7.71) | (4.74) | (2.18) | (0.27) | (4.4) | |
약리학 | 논문수 | 387 | 386 | 492 | 636 | 678 | 2,579 |
피인용수 | 2,594 | 2,019 | 1,600 | 775 | 106 | 7,094 | |
편당평균 | (6.7) | (5.23) | (3.25) | (1.22) | (0.16) | (2.75) |
출처: SCI database에 근거한 Thomson Scientific ISI(Institute for Scientific Information)의
NSI(National Science Indicators, 1981-2004)를 기반으로 지표를 산출했음. KAIST 학술정보처
주)* 편당평균: 논문 1편당 피인용수(b/a)
최근 5년간 국가별 생명공학분야 논문수 현황(2000~2004)

출처: SCI database에 근거한 Thomson Scientific ISI(Institute for Scientific Information)의
NSI(National Science Indicators, 1981-2004)를 기반으로 지표를 산출했음. KAIST 학술정보처
![]() 특허현황
특허현황
한국에 출원된 생명공학분야 특허의 국가별연도별 현황(1995-2004) (단위: 특허건수)
연도 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 계 |
미국 | 245 | 326 | 380 | 282 | 337 | 402 | 423 | 362 | 328 | 458 | 3,543 |
일본 | 127 | 129 | 156 | 159 | 154 | 171 | 247 | 245 | 231 | 238 | 1,857 |
독일 | 58 | 74 | 87 | 91 | 73 | 125 | 114 | 92 | 115 | 99 | 928 |
영국 | 22 | 29 | 50 | 31 | 34 | 50 | 51 | 37 | 43 | 47 | 394 |
스위스 | 24 | 29 | 33 | 44 | 28 | 41 | 25 | 24 | 45 | 52 | 345 |
프랑스 | 22 | 29 | 43 | 34 | 29 | 38 | 33 | 32 | 31 | 36 | 327 |
계 | 498 | 616 | 749 | 641 | 655 | 827 | 893 | 792 | 793 | 930 | 7,394 |
분석기준: 1. 한국 출원특허, 2. 1995~2004년
출처: 한국특허정보원
미국특허의 국가별연도별 현황(1995~2004) (단위: 특허건수)
구분 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 합계 | 순위 |
미국 | 1,958 | 2,744 | 4,008 | 5,623 | 5,479 | 4,831 | 5,356 | 5,148 | 4,425 | 4,199 | 43,771 | 1 |
일본 | 342 | 398 | 396 | 606 | 517 | 468 | 525 | 439 | 436 | 415 | 4,542 | 2 |
독일 | 145 | 195 | 253 | 311 | 337 | 287 | 347 | 377 | 468 | 372 | 3,092 | 3 |
영국 | 82 | 125 | 169 | 249 | 288 | 240 | 254 | 227 | 208 | 176 | 2,018 | 4 |
네덜란드 | 78 | 88 | 122 | 182 | 189 | 188 | 144 | 299 | 232 | 279 | 1,801 | 5 |
프랑스 | 71 | 117 | 158 | 220 | 219 | 194 | 226 | 203 | 209 | 152 | 1,769 | 6 |
캐나다 | 72 | 104 | 140 | 205 | 258 | 233 | 233 | 249 | 208 | 181 | 1,883 | 7 |
덴마크 | 23 | 50 | 64 | 116 | 104 | 113 | 132 | 144 | 117 | 131 | 994 | 8 |
스위스 | 46 | 52 | 52 | 78 | 79 | 76 | 110 | 141 | 90 | 79 | 803 | 9 |
호주 | 31 | 40 | 49 | 82 | 94 | 59 | 123 | 109 | 80 | 75 | 742 | 10 |
이스라엘 | 34 | 37 | 21 | 64 | 67 | 47 | 67 | 71 | 77 | 52 | 537 | 11 |
스웨덴 | 27 | 31 | 33 | 70 | 59 | 56 | 61 | 63 | 68 | 55 | 523 | 12 |
벨기에 | 14 | 15 | 20 | 49 | 52 | 57 | 47 | 55 | 86 | 78 | 473 | 13 |
대한민국 | 11 | 18 | 11 | 29 | 53 | 33 | 63 | 56 | 52 | 52 | 378 | 15 |
인도 | 2 | 4 | 9 | 12 | 13 | 12 | 28 | 56 | 55 | 47 | 238 | 17 |
대만 | 6 | 5 | 13 | 13 | 18 | 14 | 35 | 31 | 22 | 25 | 182 | 19 |
중국 | 3 | 2 | 4 | 7 | 4 | 7 | 9 | 15 | 10 | 18 | 79 | 25 |
전체건수 | 3,019 | 4,154 | 5,658 | 8,125 | 8,041 | 7,086 | 7,945 | 7,883 | 7,030 | 6,575 | 65,516 | - |
분석기준: 1. 미국 등록특허, 2. 1995~2004년
출처: 한국특허정보원
미국특허의 생명공학분야 각국의 특허 건수 및 점유율(1998~2001)

미국특허의 생명공학분야 각국의 연구주체별 등록건수 및 점유율(1985~2003)

미국 특허내에서 주요국의 생명공학 기술별 점유율(1985~2003)

출처: 한국특허정보원
![]() 국가간 기술수준 비교
국가간 기술수준 비교
25개 핵심기술의 국가간 기술수준 비교(2003)
핵 심 기 술 | 한국 | 주요국의 기술수준(%) | ||||
기술 수준(%) | 기술 격차(년) | 미국 | 일본 | 유럽 | 중국 | |
1. 생체 진단 기술 | 67.1 | 4.6 | 100.0 | 85.0 | 76.3 | 50.7 |
2. 초고속 분석시스템 기술 | 60.0 | 5.0 | 100.0 | 84.3 | 83.3 | 48.6 |
3. Target 인식 및 타당성 검증 기술 | 59.2 | 5.0 | 100.0 | 81.2 | 83.8 | 56.9 |
4. 선도물질 도출 기술 | 49.5 | 6.5 | 100.0 | 76.8 | 84.1 | 44.4 |
5. 선도물질 최적화 기술 | 56.8 | 4.3 | 100.0 | 80.0 | 85.9 | 43.3 |
6. 후보물질 도출 기술 | 53.6 | 5.3 | 100.0 | 85.6 | 82.8 | 42.2 |
7. 대량생산공정 기술 | 60.0 | 4.5 | 100.0 | 84.0 | 84.5 | 53.5 |
8. 제제화 기술 | 71.3 | 4.0 | 100.0 | 86.9 | 90.6 | 56.3 |
9. 약물전달시스템 기술 | 65.1 | 5.0 | 100.0 | 81.1 | 84.2 | 48.6 |
10. 안전성 및 약효 분석·평가 기술 | 61.9 | 6.2 | 100.0 | 84.0 | 92.9 | 37.3 |
11. 임상시험 기술 | 49.4 | 5.5 | 100.0 | 75.0 | 90.0 | 33.3 |
12. 생체신호 처리 기술 | 67.7 | 5.1 | 100.0 | 87.5 | 85.0 | 50.6 |
13. 생체영상 처리 기술 | 66.9 | 4.8 | 100.0 | 81.9 | 86.0 | 48.1 |
14. 바이오 칩/센서 기술 | 65.0 | 4.1 | 100.0 | 83.3 | 86.1 | 57.8 |
15. 생체재료 기술 | 61.4 | 5.3 | 100.0 | 78.5 | 82.5 | 51.1 |
16. 줄기세포 응용 기술 | 71.3 | 3.1 | 100.0 | 74.3 | 83.9 | 47.1 |
17. 유전자 조작 및 전달 기술 | 55.0 | 3.8 | 100.0 | 80.8 | 86.7 | 36.4 |
18. 생체기능 모니터링 기술 | 58.1 | 6.3 | 100.0 | 80.0 | 85.6 | 45.0 |
19. 생체정보 생성·저장 분석 활용기술 | 55.0 | 5.7 | 100.0 | 82.7 | 89.5 | 56.4 |
20. 바이오에너지 기술 | 54.5 | 6.4 | 100.0 | 81.3 | 79.9 | 50.3 |
21. 고품질 다수확 작물 생산 기술 | 65.2 | 6.4 | 100.0 | 86.7 | 91.3 | 46.5 |
22. BT활용 고부가 농·수·축산물 개발 기술 | 57.5 | 5.8 | 100.0 | 84.7 | 90.0 | 52.5 |
23. 고기능성 식품의 생산·가공·보존 기술 | 65.3 | 6.1 | 100.0 | 89.1 | 86.2 | 48.9 |
24. 친환경 수산 증양식 개발·응용 기술 | 69.7 | 6.2 | 91.6 | 100.0 | 95.2 | 52.6 |
25. 유용 동식물 자원의 보전 및 이용 기술 | 51.9 | 7.7 | 100.0 | 81.3 | 87.4 | 49.7 |
평 균 | 60.74 | 5.31 | 99.66 | 83.04 | 86.15 | 48.32 |
출처: 2003년도 기술수준평가
IV. 생명공학 산업분야
![]() 국내 산업규모 및 현황
국내 산업규모 및 현황
국내 생명공학산업 시장규모(1992-2003) (단위: 억 원, %)
구 분 | 공 급 | 계 | 수 요 | ||||||
생 산 | 수 입 | 내 수 | 수 출 | ||||||
금 액 | 비 중 | 금 액 | 비 중 | 금 액 | 비 중 | 금 액 | 비 중 | ||
1992 | 827 | 63.8 | 384 | 31.7 | 1,211 | 965 | 79.7 | 246 | 20.3 |
1993 | 1,521 | 67.5 | 731 | 32.5 | 2,252 | 1,683 | 74.7 | 569 | 25.3 |
1994 | 1,735 | 69.7 | 753 | 30.3 | 2,488 | 1,919 | 77.1 | 569 | 22.9 |
1995 | 2,387 | 73.4 | 864 | 26.6 | 3,251 | 2,516 | 77.4 | 735 | 22.6 |
1996 | 4,681 | 81.7 | 1,052 | 18.3 | 5,733 | 3,285 | 57.3 | 2,448 | 42.7 |
1997 | 5,879 | 80.9 | 1,385 | 19.1 | 7,264 | 4,246 | 58.5 | 3,018 | 41.5 |
1998 | 8,198 | 82.8 | 1,702 | 17.2 | 9,900 | 5,085 | 51.4 | 4,815 | 48.6 |
1999 | 9,130 | 81.2 | 2,114 | 18.8 | 11,244 | 6,701 | 59.6 | 4,543 | 40.4 |
2000 | 11,795 | 78.1 | 3,306 | 21.9 | 15,101 | 9,000 | 59.6 | 6,101 | 40.4 |
2001 | 13,950 | 76.9 | 4,196 | 23.1 | 18,146 | 11,783 | 64.9 | 6,363 | 35.1 |
2002 | 18,934 | 80.8 | 4,493 | 19.2 | 23,427 | 14,232 | 60.8 | 9,195 | 39.2 |
2003 | 20,791 | 80.2 | 5,132 | 19.8 | 25,923 | 15,985 | 61.7 | 9,938 | 38.3 |
출처: 1999~2001년도, 2003년도 국내 생물산업 실태조사. 산업자원부,
한국바이오산업협회
국내 바이오산업 연도별 현황(2002~2005) (단위: 억 원, %)
연도 | 공 급 | 계 | 수 요 | ||||||
생산 | 수입 | 내수 | 수출 | ||||||
금액 | 비중 | 금액 | 비중 | 금액 | 비중 | 금액 | 비중 | ||
2002실적 | 18,934 | 80.8 | 4,493 | 19.2 | 23,427 | 14,232 | 60.8 | 9,195 | 39.2 |
2003실적 | 20,791 (9.8%) | 80.2 | 5,132 (14.2%) | 19.8 | 25,923 (10.7%) | 15,985 (12.3%) | 61.7 | 9,938 (8.1%) | 38.3 |
2004추정 | 24,000 (15.4%) | 80.0 | 6,000 | 20.0 | 30,000 (15.7%) | 19,500 (22.0%) | 65.0 | 10,500 | 35.0 |
2005전망 | 26,880 (12.0%) | 80.0 | 6,720 | 20.0 | 33,600 (12.0%) | 21,840 (12.0%) | 65.0 | 11,760 | 35.0 |
* 자료: 산업자원부 기술표준원/산업연구원/한국바이오산업협회,
2002년도 및 2003년도 국내 생물산업 실태조사, 2004년도 수급규모는 한국바이오산업협회 추정자료
주: ( )의 %는 2004년도 및 2005년도의 전년대비 증가율
바이오산업 투자비 추이(1997~2004)

출처: 국내바이오산업의 현주소(2005), 산업연구원
국내와 미국 바이오산업체의 투자규모 비교(2002)

국내 바이오산업의 세계 경쟁력 현황

출처: 바이오산업-정부의 투자확대로 성장모멘컴 확보(2005). 하나증권
국내 바이오기업의 공동연구개발 대상 기관

출처: 생물산업기초분석(2002), 산업연구원
세계 일류 제품 중 국내 바이오산업 제품 현황
생산업체 | 생산품목 | 주요 경쟁국 및 기업 | 선정 년도 | 구분 |
마리아바이오텍 AG코리아 | 세포대체요법용 치료세포 | 미국, 영국 | 2001 | 차세대 세계 일류 상품 |
유진사이언스 | 콜제로(기능성식품) | 미국Johnson & Jonhson | 2002 | 차세대 세계 일류 상품 |
코바이오텍 | 발효기 | 미국 NBS, 독일 Barun | 2002 | 차세대 세계 일류 상품 |
CJ | 쓰레오닌(아미노산) | 독일 Degussa, 일본 Ajinomoto | 2003 | 차세대 세계 일류 상품 |
셀바이오텍 | 유산균분말 | 덴마크 크리스찬한센 | 2003 | 차세대 세계 일류 상품 |
셀론텍 | 자기유래 뼈세포 치료제 |
| 2003 | 차세대 세계 일류 상품 |
바이오니아, 제노텍, 코스모진텍, | 대용량 합성유전자 | 미국 Sigma-Genosys, 독일 MWG | 2004 | 차세대 세계 일류 상품 |
바이오니아 | 칼륨 클라블라네이트 | 영국 GSK, 오스트리아 Sandoz | 2004 | 차세대 세계 일류 상품 |
LG생명과학 | 동물성장촉진제 | 미국 Monsanto | 2001 | 현재 세계 일류 상품 |
CJ, 한국바스프 | 라이신(아미노산) | 일본 Ajinomoto | 2001 | 현재 세계 일류 상품 |
CJ, 대상 | 핵산(식품첨가물) | 일본 Ajinomoto | 2002 | 현재 세계 일류 상품 |
녹십자백신 LG생명과학 | B형 간염 예방백신 | 벨기에 GSK, 미국 Merck | 2002 | 현재 세계 일류 상품 |
한스바이오메드 | 의료용 시술재료 | 미국 Life Cell | 2002 | 현재 세계 일류 상품 |
에스디 | 에이즈진단키트 | 미국 Abbott | 2003 | 현재 세계 일류 상품 |
CJ | 클로렐라 | 일본 클로렐라협회, 대만 클로렐라 | 2004 | 현재 세계 일류 상품 |
출처: 바이오산업-정부의BT투자확대로성장모멘컴확보(2005), 하나증권.
미국과 한국의 바이오벤처 투자실적비교(1999~2003)(단위: 억 원)
구분 | ’99년 | ’00년 | ’01년 | ’02년 | ’03년 | |
전체 투자실적 | 미국 | 624 | 1,295 | 416 | 254 | 218 |
한국 | 9.7 | 16 | 9.5 | 5.7 | 6.1 | |
바이오부문 투자실적 | 미국 | - | 119 (9.2%) | 64.2 (16.0%) | 55.9 (21.8%) | 58.8 (26.9%) |
한국 | - | 1.1 (6.9%) | 0.8 (8.4%) | 0.42 (7.4%) | 0.23 (3.8%) | |
출처: 보건산업벤처투자조합 제안서(2004), 보건산업진흥원
국내 바이오벤처기업센터 현황 (단위: 억 원)
지역 | 전문화 분야 | 주관기관 | 사업 기간 | 총사업비 (국비) | ‘03년 지원 | 비고 |
강원 | 생물환경-공정 | 춘천시 | ‘98-‘02 | 159(58) | - | 산기반 |
대전 | 생물의약 | 생명공학 연구원 | ‘99-’03 | 160(50) | 10 | TIC |
전북 | 천연물 소재 | 전북생물센터 | ‘00-’04 | 141(50) | 11 | 산기반 |
경남 | 생물화학소재 | 바이오21센터 | 〃 | 207(50) | 16 | 산기반 |
전남 | 생물농업-식품 | 동신대 | 〃 | 84(50) | 16 | 산기반 |
충북 | 생물의약, 기능성식품 | 영동대 | ‘01-’06 | 67(48) | 9 | TIC |
경북 | 기능성 생물소재 | 상주대 | 〃 | 91(46) | 8 | TIC |
제주 | 해양,바이오첨가제 | 제주대 | 〃 | 70(47) | 9 | TIC |
부산 | 마린바이오 산업화 | 신라대 | ‘02-’07 | 148(50) | 8.5 | 산기반 |
합계 | 1,127(449) | 87.5 | ||||
출처: 생물(BT)산업(2004), 산업자원부
코스닥 상장 바이오벤처기업 현황(2005.10)
NO | 업체 명 | 대표자 | 분야 | 주력 제품 | 종업원 (명) | 설립 일자 | 등록 일자 |
1 | 농우바이오 | 조대현,고희선 | 생물농업 | 야채 종자(개량형) | 249 | ’90.06. | ’02.04. |
2 | 대성미생물연구소 | 조항원 | 생물의약 | 동물용 백신 | 129 | ’66.02. | ’00.04. |
3 | 대한뉴팜 | 박명래 | 생물농업 | 동물용 항생제 | 135 | ’84.10. | ’02.02. |
4 | 대한바이오 | 고영근,이시현 | 생물농업 | 실험동물(마우스, 랫드) | 58 | ’93.04. | ’01.01. |
5 | 도들샘 | 노태욱,노원석 | 음식료제조 | 김치, 밤, 딸기, 꽃게 | 353 | ’78.06. | ’04.01. |
6 | 라이브코드 | 홍상혁 | 음식료제조 | 기능성식품, 화장품 | 70 | ’97.08. | ’99.12. |
7 | 라이프코드 | 최수환 | 생물의약 | 제대혈은행, 산업용기계 | 57 | ’85.10. | ’96.07. |
8 | 렉스진 바이오텍 | 권석형 | 바이오식품 | 건강기능성 식품 | 46 | ’95.02. | ’02.11. |
9 | 리젠 | 배은희 | 생물의약 | 조직재생 및 항암 단백질 등 | 112 | ’79.09. | ’97.01. |
10 | 마크로젠 | 서정선 | 생물검정 | DNA chip, 유전자분석서비스 | 70 | ’95.06. | ’00.02. |
11 | 메디포스트 | 양윤선 | 제조,제약 | 재대혈 은행 | ’00.06. | ‘05.07. | |
12 | 바이넥스 | 이백천 | 생물의약 | 정장제, 소화제,임신진단시약 | 130 | ’85.06. | ’01.08. |
13 | 바이오랜드 | 정찬복 | 생물화학 | 화장품 소재, 미생물 배양제품 | 45 | ’95.09. | ’01.05. |
14 | 바이오메디아 | 조신형 | 생물환경 | 수도용 및 원예용 상토 | 65 | ’98.08. | ’01.10. |
15 | 바이오스페이스 | 차기철 | 생물기기 | 정밀체성분 분석기 | 59 | ’95.05. | ’00.12. |
16 | 솔고바이오 | 김서곤 | 생물기기 | 가정용 온열치료기,의료기구 | 211 | ’95.07. | ’00.08. |
17 | 쎌바이오텍 | 정명준 | 바이오식품 | 유산균 원말 및 완제품 | 32 | ’95.02. | ’02.12. |
18 | 씨티씨 바이오 | 김성린,조호연 | 생물농업 | 동물항병원성제품,생균효소 | 35 | ’95.12. | ’02.02. |
19 | 에스디 | 조영식 | 생물화학 | 진단시약 | 32 | ’99.02. | ’03.01. |
20 | 에스텍파마 | 김재철 | 생물의약 | 원료의약품 | 49 | ’99.01 | ’04.02. |
21 | 에코솔루션 | 황종식 | 생물환경 | 토양오염 진단, 복원 | 49 | ’98.03. | ’01.12. |
22 | 이-글벳 | 강승조 | 생물농업 | 사료첨가제(항생,영양) | 60 | ’83.12. | ’00.11. |
23 | 이노셀 | 정현진 | 생물의약 | 제대혈은행, 간암치료제 | 40 | ’92.09. | ’98.09. |
24 | 이지바이오시스템 | 지원철,최상열 | 바이오식품 | 발효식품,동물사료, 기능성소재 | 82 | ’88.03. | ’99.11. |
25 | 인바이오넷 | 구본탁 | 생물농업 | 미생물배양체 | 41 | ’96.05. | ’01.06. |
26 | 제일바이오 | 심광경 | 생물농업 | 사료첨가제, | 90 | ’89.02. | ’02.01. |
27 | 조아제약 | 조성환 | 제조,제약 | 의약품,의약부외품,보건보조식품 | 193 | ’96.03. | ’99.08. |
28 | 중앙바이오텍 | 김무진 | 생물농업 | 사료첨가제(항생, 영양) | 119 | ’80.12. | ’00.08. |
29 | 중앙백신 | 윤인중 | 생물의약 | 동물용 백신 전문 제조업체 | 95 | ’94.07 | ’03.10. |
30 | 진양제약 | 최윤환 | 제조,제약 | 의약품, 소부날, 옥티란 | 174 | ’78.06 | ’00.07 |
31 | 코미팜 | 양용진 | 생물의약 | 동물용백신/한국미생물연구소 | 94 | ’72.09. | ’01.10. |
32 | 코바이오텍 | 유대환 | 생물기기 | 생물 반응기(발효기) | 45 | ’87.04. | ’01.10. |
33 | 한서제약 | 권 철 | 제조,제약 | 고덱스 등 의약품 | 137 | ’84.12. | ’04.11. |
34 | 화일약품 | 이정규 | 생물의약 | 의약품원료, 암치료제 | 54 | ’80.11. | ’02.04. |
35 | EBT네트웍스 | 문원국 | 바이오식품 | 사료첨가제, 기능성소재 | 34 | ’92.12. | ’01.06. |
상장* | 알앤엘바이오 | 라정찬 | 생물의약 | 줄기세포치료제, 항균제 등 | 64 | ’61.07. | ’76.06. |
상장 | 오리엔트바이오 | 장재진 | 생물의약 | 백신, 생물, 진단, 신약 개발 등 | 141 | ’59.04. | ’76.12. |
상장 | 한국콜마 | 윤동한 | 생물의약 | 화장품, 연고제류 및 의약품 | 340 | ’90.05. | ’02.04. |
상장 | LG생명공학 | 양흥준 | 생물의약 | 전문의약품, 동물의약품, | 1,112 | ’02.08. | ’02.08. |
등록 예상 | 서린바이오사이언스 | 황을문 | |||||
바이오니아 | 박한오 | ||||||
바이로메드 | 강대연 | ||||||
크리스탈지노믹스 | 조중명 | ||||||
랩프론티어 | 박종세 |
출처: 한국바이오벤처협회(2005년 10월 현재) * 증권거래소 등록업체
![]() 세계 산업 규모 및 현황
세계 산업 규모 및 현황
세계 바이오산업 시장규모 발전 추이(1992~2010) (단위: 억 달러, %)
연도 | ’92 | ’95 | ’96 | ’97 | ’98 | ’99 | ’00 | ’05 | ’10 | ’15 | 연평균 증가율 | ||
’00~ ’05 | ’05~ ’10 | ’11~ ’15 | |||||||||||
시장 규모 | 100 | 238 | 266 | 313 | 390 | 465 | 540 | 910 | 1,540 | 3,090 | 11 | 11.1 | 15.0 |
출처: 생물산업의 발전 전략(1999) 산업연구원, Biotechnology and Trade(1997) OECD,
Ernst & Young(1998) 등을 참조하여 산업연구원 추정
세계 바이오산업 시장규모(2000~2013) (단위: 억 달러, %)
분야별 | 2000 | 2003 | 2008 | 2013 | 연평균증가율 (’00~’13년) |
생물의약 | 324 | 444 | 688 | 1,155 | 19.7 |
생물화학 | 38 | 52 | 100 | 168 | 26.3 |
생물환경 | 32 | 44 | 87 | 147 | 27.6 |
바이오식품 | 27 | 37 | 75 | 126 | 28.2 |
바이오에너지ㆍ자원 | 11 | 15 | 37 | 63 | 36.4 |
생물농업ㆍ해양 | 27 | 37 | 75 | 126 | 28.2 |
생물공정ㆍ측정시스템 | 81 | 111 | 188 | 315 | 22.2 |
계 | 540 | 740 | 1,250 | 2,100 | 26.9 |
출처: Biotechnology & Trade(1997), OECD
바이오산업 분야별 2010년도 세계 시장 규모

출처: 바이오산업-정부의 BT투자확대로 성장모멘텀 확보(2005), 삼성경제연구소
세계 바이오산업 현황(2004)
세계 | 미국 | 유럽 | 캐나다 | 아시아/태평양 | |
상장기업 | |||||
총수익(백만 $) | 54,613 | 42,740 | 7,729 | 2,091 | 2,052 |
R&D비용(백만 $) | 20,888 | 15,701 | 4,151 | 782 | 253 |
순손실(백만 $) | 5,304 | 4,317 | 484 | 408 | 94 |
고용인력(명) | 183,820 | 137,400 | 25,640 | 7,370 | 13,410 |
기업수(개) | 4,416 | 1,444 | 1,815 | 472 | 685 |
- 상 장 | 641 | 330 | 98 | 82 | 131 |
- 비상장 | 3,775 | 1,114 | 1,717 | 390 | 554 |
출처: Ernst & Young’s Global Biotechnology Report 2005
![]() 각국 산업 규모 및 현황
각국 산업 규모 및 현황
미국 바이오산업 현황(2003~2004) (단위: 억 불, 개사, 명)
분 류 | 상장기업 | 산업전체 | ||||
연 도 | ’03 | ’04 | 증감(%) | ’03 | ’04 | 증감(%) |
매출 | 259 | 310 | 19.4 | 284 | 333 | 17.4 |
수입 | 359 | 427 | 19.2 | 392 | 460 | 17.2 |
R&D 지출 | 136 | 157 | 15.7 | 179 | 198 | 11.0 |
전업기업 수 | 314 | 330 | 5.1 | 1,473 | 1,444 | -2.0 |
고용인력 | 124,800 | 137,400 | 10.1 | 177,000 | 187,500 | 6.0 |
출처: Ernst & Young’s Global Biotechnology Report 2005
미국, 유럽, 캐나다의 벤처기금 결성 변화추이(2003~2004)
구분 | 2004 | 2003 | 변화율(%) | ||||||
미국 | 유럽 | 캐나다 | 미국 | 유럽 | 캐나다 | 미국 | 유럽 | 캐나다 | |
벤처기금 (백만달러) | 3,551 | 1,447 | 271 | 2,826 | 1,040 | 206 | 26 | 43 | 32 |
미국대비 비중(%) | - | 40.7 | 7.6 | - | 36.8 | 7.3 | |||
출처: Ernst & Young(2005)
미국 생명공학 대기업, 제약기업 현황(2004)
수익($M) | 종업원당 수익($000) | R&D 지출 ($M) | 종업원당 R&D 비용($000) | 순수익 (손실)($M) | 종업원수 (명) | |
Biotech | ||||||
Amgen | $10,550 | $733 | $2,028 | $141 | $2,363 | 14,400 |
Genentech | $4,621 | $604 | $948 | $124 | $785 | 7,646 |
Biogen IDEC | $2,212 | $518 | $688 | $161 | $25 | 4,266 |
Genzyme | $2,201 | $310 | $392 | $55 | $87 | 7,100 |
Chiron | $1,723 | $319 | $431 | $80 | $79 | 5,400 |
Gilead Sciences | $1,325 | $801 | $224 | $135 | $449 | 1,654 |
Medimmune | $1,141 | $577 | $327 | $166 | ($4) | 1,976 |
Biovail | $887 | $387 | $70 | $31 | $161 | 2,291 |
Weighted average | $551 | $114 | ||||
Pharma | ||||||
Pfizer | $52,516 | $457 | $7,684 | $67 | $11,361 | 115,000 |
Johnson & Johnson | $47,348 | $431 | $5,203 | $47 | $8,509 | 109,900 |
Merck & Co. | $22,939 | $364 | $4,010 | $64 | $5,813 | 63,000 |
Bistol Myers Squibb | $19,380 | $451 | $2,500 | $58 | $2,388 | 43,000 |
Eli Lilly Co. | $13,858 | $311 | $2,691 | $60 | $1,810 | 44,500 |
Weighted average | $416 | $59 | ||||
출처: Ernst & Young’s Global Biotechnology Report 2005
유럽의 생명공학산업 현황(2003~2004) (단위: 백만 유로, 개사, 명)
분 류 | 상장기업 | 산업전체 | ||||
연 도 | ’03 | ’04 | 증감(%) | ’03 | ’04 | 증감(%) |
수입 | 6,606 | 6,261 | -5 | 11,277 | 11,337 | 1 |
R&D 지출 | 3,746 | 3,363 | -10 | 6,354 | 6,189 | -3 |
전업기업 수 | 96 | 98 | 2 | 1,861 | 2,054 | -2 |
고용인력 | 32,470 | 25,640 | -21 | 77,910 | 72,420 | -7 |
출처: Ernst & Young’s Global Biotechnology Report 2005
유럽 각국의 생명공학 기업수(2003)

출처: Biotechnology in Europe: 2005 Comparative study(2005), EUROPABIO
일본의 바이오산업 현황(1998~2004) (단위: 억 엔)
구 분 | 세부범위 | 연도별 총 시장규모 | ||||||
’98 | ’99 | ’00 | ’01 | ’02 | ’03 | ’04 | ||
바 이 오 상 품 | 유전자조작, 세포융합, 세포배양 제품 | 9,184 | 9,767 | 9,119 | 9,707 | 11,088 | 11,590 | 12,522 |
바 이 오 관련상품 | 의약·정밀제품, 식품·센서, 기기시약·생물정보 등 | 2,378 | 2,642 | 3,268 | 3,624 | 4,096 | 4,844 | 4,947 |
합 계 | 11,562 | 12,409 | 12,387 | 13,331 | 15,184 | 16,434 | 17,469 | |
출처: 일본BP사(NB Publications, Inc.), 일경바이오연감 2005 등
![]() 산업군에 대한 세계 규모 및 현황
산업군에 대한 세계 규모 및 현황
가. 바이오의약
국내 신약개발 현황(2005.6)
구분 | 제품명 | 회사명 | 적응증 | 허가년도 |
합성 신약 | 선플라 | (주)SK 케미칼 | 위암치료제 | 1999 |
밀리칸 | (주)동화약품공업 | 간암치료제 | 2001 | |
큐록신 | (주)중외제약 | 퀴놀론계 항생제 | 2001 | |
팩티브 | (주)LG 생명과학 | 퀴놀론계 항생제 | 2002(한국) 2003(미국) | |
캄토벨 | (주)종근당 | 난소암, 소세포폐암 | 2003 | |
메스마빌 | (주)유유 | 골다공증(복합체) | 2004 | |
레바넥스 | (주)유한양행 | 십이지장퀘양 | 2005 | |
Bio신약 | 콘드론 | (주)셀론텍 | 연골결손치료제 | 2001 |
EGF | (주)대웅제약 | 당뇨성 족부궤양 | 2001 | |
천연물신약 | 조인스 | (주)SK 케미칼 | 관절염치료제 | 2001 |
스니텐 | (주)동아제약 | 급성/만성위염 | 2002 |
출처: 한국신약개발연구조합(2005년)
국내 신약 연구개발 총괄(2005.6)
개발단계 | 품목수 | 계 | |
제품출시 | 11 | 36개 기업 115개 품목 | |
임상 | 3상 | 7 | |
2상 | 12 | ||
1상 | 12 | ||
소계 | 31 | ||
전임상 | 50 | ||
Discovery | 23 | ||
출처: 한국신약개발연구조합(2005년)
국내기업의 FDA 신청현황(2005)
제품명 | 약효명/용도 | 기업명 | 개발단계 |
팩티브 | 퀴놀론계 항생제 | (주)LG 생명과학 | 제품출시 |
서방출형 인간성장호르몬 | 저신장증 | (주)LG 생명과학 | 임상3상 |
B형 간염치료제 | B형 간염 | (주)LG 생명과학 | 임상2상 |
DA-8159 (자이데나) | 발기부전 | (주)동아제약 | 임상2상 |
YKP 509 | 간질 | (주)SK | 임상2상 |
YKP 10A | 우울증 | (주)SK | 임상2상 |
골다공증 치료제 | 골생성 촉진 | (주)녹십자 | 임상1상 |
출처: 한국신약개발연구조합(2005년)
유망 바이오 신사업 기회 7선(2010)
산업부문 | 주요 제품 | 발전 단계 | 2010년 시장규모 (억 달러) | 주요 참여기업 |
바이오신약 | 면역치료제, 약물전달체 | 상용화초기 | 1,300 | Amgen, Genentech, Biogen, LG생명과학 |
바이오치료 | 세포치료, 유전자치료 | 기초원리, 기술발견 | 400 | Aastrom, ONYX, Vical, 크레아젠, 바이로메드 |
U-헬스 | 바이오칩, 운영체계 | 응용기술 축적 | 300 | Affymetrics, Medtronics, 삼성전자, KT |
GMO | 작물, 동물, 어류 | 상용화 | 150 | Monsanto, Syngenta |
바이오기기 | 영상진단기, 분석기기 | 상용화 | 850 | HP, GE, Agilent, 메디슨 |
바이오환경 에너지 | 미생물분해, 바이오연료 | 상용화초기 | 160 | Shell, BP |
바이오공정 | 기존 공정의 대체 | 상용화초기 | 250 | CarGill-Dow, BASF, DuPont |
출처: 바이오 신사업기회와 대응전력(2004년), 삼성경제연구소
세계 5대 제약사와 국내 5대 제약사의 R & D 규모(2004)
구 분 | ’04년 평균매출액 | 순이익/매출액 | 평균 R&D 비용 | R&D/매출액 |
세계5대 제약사 (Pfizer, GSK, Novartis, Merck, AstraZeneca) | 329억 달러 | 19.2% | 50억 달러 | 16% |
국내5대 제약사 (동아, 유한, 중외, 한미, 대웅) | 4억 달러 | 8.6% | 2,000만 달러 | 5.7% |
출처: 2015년 바이오산업 비전과 발전전략, 제3차 BioExecutive forum(2005), 전국경제인연합회
개발성공 개량신약의 개발기간 및 연구비 현황
제품명 | 개발회사 | 개발기간(년) | 연구개발비(억 원) | 계(억 원) | |
정부출연금 | 민간부담금 | ||||
사이톱신주 | (주)CJ | 3 | 0.35 | 4.65 | 5 |
커노펜겔 | (주)일동제약 | 4 | 1.1 | 3.9 | 5 |
임프란타/ 네오프란타 | (주)한미약품 | 2 | 1.2 | 15 | 16.2 |
뉴팩탄 | (주)유한양행 | 4 | 1.25 | 10 | 11.25 |
본키주 | (주)유유 | 2 | 0.8 | 3 | 3.8 |
트리스트패취 | (주)SK케미칼 | 7 | 0.93 | 39 | 39.93 |
니코스탑 | (주)삼양사 | 2 | 1.36 | 7 | 8.36 |
타나민주 | (주)유유 | 2 | 1.5 | 5.5 | 7 |
일비스정 | (주)대웅제약 | 8 | 2.4 | 14 | 16.4 |
베아겔액 | (주)대웅제약 | 8 | 3.9 | 20 | 23.9 |
뉴디짐 | (주)대웅제약 | 1 | 0.8 | 1 | 1.8 |
디디셀캅셀 | (주)대웅제약 | 1.5 | 0.4 | 1 | 1.4 |
13개제품 | 8개기업 | 10 | 15.99 | 124.05 | 140.04 |
출처: 복합제 연구개발동향(2004), 한국보건산업진흥원
국내 및 해외제약사의 시장점유율(2004)

출처: 제약업종-제약산업지표의 견조한 성장 지속으로 금년 2분기부터 수익성개선(2005), 하나증권
세계 의약품 시장 현황 및 전망(2003~2010) (단위: 10억 달러, %)
구분\연도 | 2003 | 2004 | 2005 | 2007 | 2010 | CAGR |
Ethical | 437.6 | 477.6 | 521.3 | 620.9 | 807.4 | 9.1 |
Generics | 37.0 | 41.9 | 47.4 | 60.6 | 81.9 | 11.6 |
OTC | 82.0 | 85.5 | 89.2 | 97.0 | 109.9 | 4.3 |
Biopharama -ceuticals | 36.5 | 40.6 | 45.1 | 55.8 | 72.5 | 9.9 |
Total | 593.1 | 645.8 | 703.1 | 833.6 | 1,068.6 | 8.7 |
출처: World Pharmaceutical Market(2004), BBC, Inc.
세계 바이오제네릭 시장 현황 및 전망(2004~2008)

출처: The Market for Generic Biologics(2004), Kolorama Information
세계 제약시장의 부문별 성장 전망(2000~2008) (단위: 10억 달러)
구분 | 2000 | 2001 | 2002 | 2003 | 2008(E) | 2003~2008 연평균증가율 |
전문의약품 | 317.1 | 363.0 | 401.0 | 437.6 | 677.8 | 9.1% |
일반의약품 | 70.5 | 73.8 | 78.5 | 82.0 | 101.0 | 4.3% |
제네릭 | 24.0 | 27.0 | 30.5 | 37.0 | 64.0 | 11.6% |
바이오제약 | 22.1 | 26.3 | 31.0 | 36.5 | 58.6 | 9.9% |
총계 | 733.7 | 490.5 | 541.0 | 593.1 | 901.4 | 8.7% |
출처: [산업이슈분석] 의약품 도매업(2004), 하나경제연구소
신약개발 단계에 따른 소요비용 및 기간

출처: The Price of Innovations; New Estimates of Drug Development Costs(2003),
Jounal of Health Economics
미국 임상시험시장 현황 및 전망(2001~2007)

출처: 아시아 임상실험 시장동향(2004), 한국보건산업진흥원. BCC Inc.
세계 제약 및 바이오산업 기업순위(2004)
순위 | 종합제약기업 | 바이오산업 기업 | ||
기업명 | 매출액(억 달러) | 기업명 | 매출액(억 달러) | |
1 | Pfizer(美) | 525 | Amgen(美) | 106 |
2 | Johnson & Johnson(美) | 473 | Genentech(美) | 46 |
3 | Merck & Co(美) | 229 | Biogen Idec(美) | 22 |
4 | Bristol-Myers Squibb(美) | 194 | Genzyme(美) | 22 |
5 | Eli Lilly & Co.(美) | 139 | Chiron(美) | 17 |
출처: Ernst & Young(2005)
주요 바이오의약품의 특허만료 동향
No. | 상품명 | 일반명 | 개발기업 | 만료 |
1 | Humulin | Human insulin | Eil Lilly | 2001년 |
2 | Cerezyme / Ceredase | Alglucerase | Genzyme | 2001년 |
3 | Intron A | Interferon alpha-2b | Schering-Plough | 2002년 |
4 | Avonex | Interferon beta-1a | Biogen | 2003년 |
5 | Humatrope | Somatotropin | Eli Lilly | 2003년 |
6 | Nutropin | Somatotropin | Genentech | 2003년 |
7 | Epogen or Procrit | Epoetin alfa | Amgen, J & J, Sankyo | 2004년 |
8 | Novolin | Human insulin | Novo Nordisk | 2005년 |
9 | Activase | Alteplase | Genentech, BI, Mitsubishi, Kyowa Hakko, | 2005년 |
10 | Protropin | Somatrem | Genentech | 2005년 |
11 | Neupogen | Filgrastim | Amgen, Roche | 2006년 |
출처: Chemical & Engineering News(2002년 9월 23일)
아시아지역 의약품시장 국가별 점유율(2003)

출처: IMS Health-MIDAS(2003.9), MAT
아시아 주요국 의약품시장 성장 전망(2003~2007)

출처: IMS Market Prognosis Global, CMR International Audited Data
나. 바이오전자 및 화학
바이오칩 세계 지역별 시장 현황 및 전망(2002~2007)

출처: Biochips(2004), Global Industry Analysisi Inc.
바이오칩 분류별 시장 현황 및 전망(2002~2007)

출처: Biochips(2004), Global Industry Analysisi Inc.
바이오센서 세계 시장규모(2001~2011)

출처: World Biosensors Market(2005), Frost and Sullivan
* CAGR: Compound Annual Growth Rate, 누적 연평균 성장률
다. 바이오농업
세계의 유전자 변형작물 시장규모 예측(1995~2010) (단위: 억 달러)
년도 | 1995 | 1997 | 1999 | 2002 | 2005 | 2010 |
시장규모 | 0.75 | 6.7 | 23 | 38 | 50 | 200 |
출처: 유전자변형식품(2004), 한국기술은행
세계 유전자변형작물 재배현황(1995~2003) (단위: 100만 ha)
구 분 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 |
면 적 | 0.0 | 1.7 | 11.0 | 27.8 (153%) | 39.9 (43.5%) | 44.2 (10.8%) | 52.6 (19%) | 58.7 (11.6%) | 67.7 (15%) |
경작국가수 | - | 6개국 | 6개국 | 9개국 | 12개국 | 13개국 | 13개국 | 16개국 | 18개국 |
출처: Global Status of Commercialized Transgenic Crops(2002, 2003) ISAAA.,
The International Service for the Acquisition of Agri-biotech Applications, Ithaca, NY(1997, 1998, 1999, 2000, 2001, 2002a, 2002b)
주: ( )안의 숫자는 전년도 대비 증가율임.
국가별 유전자변형 작물의 재배 면적과 주요 작물현황(2003)
국가명 | 재배면적 (Million hectare) | 재배이율(%) | 주 재배 작물 (재배면적별 작물순위) |
USA | 42.8 | 68% | 콩, 옥수수, 면화, 유체 |
Argentina | 13.9 | 21% | 콩, 옥수수, 면화 |
Canada | 4.4 | 6% | 유채, 옥수수, 콩 |
Brazil | 3 | 4% | 콩 |
China | 2.8 | 4% | 면화 |
South Africa | 0.4 | 1% | 옥수수, 콩, 면화 |
Australia | 0.1 | 면화 | |
India | 0.1 | 면화 | |
Romania | 〉0.05 | 콩 | |
Uruguay | 〉0.05 | 콩, 옥수수 | |
Spain | 〈 0.05 | 면화, 콩 | |
Mexico | 〈 0.05 | 옥수수 | |
Philippines | 〈 0.05 | 옥수수 | |
Colombia | 〈 0.05 | 옥수수 | |
Bulgaria | 〈 0.05 | 옥수수 | |
Honduras | 〈 0.05 | 옥수수 | |
Germany | 〈 0.05 | 옥수수 | |
Indonesia | 〈 0.05 | 면화 |
출처: Global Status of Commercialized Transgenic Crops(2003) ISAAA
세계 유전자변형작물의 연도별 경작면적 추이(1996~2003)

라. 바이오공정
미국의 효소시장을 기준으로 추정한 세계 효소시장 예측(1999~2009) (단위: 억 달러)
효소시장 | 1999년 | 2004년 | 2009년 |
특수 효소시장 | 44.2 | 65.0 | 95.2 |
산업용 효소시장 | 16.2 | 21.8 | 28.8 |
전체 효소시장 | 60.4 | 86.8 | 124.1 |
출처: 의료용 효소(2003), 한국기술거래소
미국의 효소시장 변화예측(1999~2009)
효소분류 | 효소종류 | 효소시장(억달러, 5년간 증가율 %) | ||
1999 | 2004 | 2009 | ||
특수효소 | Specialty medical Polymerases & related Nuclease & related Other specialty enzymes | 8.70 2.00 1.20 1.50 | 12.75(46.6) 2.85(42.5) 1.60(33.3) 2.50(66.7) | 18.55(45.4) 3.70(29.8) 2.10(31.3) 4.50(80.0) |
소계 | 13.40 | 19.70(47.0) | 28.85(46.5) | |
산업용 효소 | 식품 & 음료 농업 세제 화장품 섬유 기타 | 1.68 1.30 1.09 0.31 0.25 0.27 | 2.30(36.9) 1.70(30.8) 1.48(35.8) 0.50(61.3) 0.37(48.0) 0.25(--) | 3.20(39.1) 2.23(31.2) 2.00(35.1) 0.75(50.0) 0.55(48.7) 0.02(--) |
소계 | 4.90 | 26.30(43.7) | 37.60(43.0) | |
합 계 | 18.30 | 26.30(437) | 37.60(43.0_ | |
출처: 의료용 효소(2003), 한국기술거래소
생물반응기 세계시장 규모(2000)
구분 | 시장규모(2000년, 억 달러) |
Chemicals | 135 |
Pharmaceuticals | 120 |
Energy | 180 |
Food | 180 |
Agriculture environments materials | 225 |
출처: 생물반응기(2003), 한국기술은행
마. 바이오환경 및 에너지
국내외 환경산업 성장 전망(2002~2006) (단위: 억 달러)
구분 | 2002 | 2003 | 2004 | 2005 | 2006 | 연평균성장률 (%) |
세계환경시장 | 5,594 | 6,270 | 6,602 | 6,952 | 7,320 | 5.3 |
대체에너지 | 1,355 | 1,491 | 1,640 | 1,803 | 1,984 | 10.0 |
국내환경시장 | 104 | 119 | 136 | 155 | 177 | 14.2 |
출처: 환경산업발전전략(2001), 환경부. 과학기술기본계획(2001), 과기부
대표적인 환경복원에 대한 세계규모(2001)
Market(2001) | Current estimated market value ($ millions) |
Global remediation services and products (excluding bioremediation and U.S) | 14,350 |
US remediation services and products (excluding bioremediation) | 9,450 |
Global bioremediation services and products (Excluding US) | 650 |
US bioremediation services and products | 550 |
Total global market remediation services and products | 25,000 |
출처: Post-genome 시대의 환경생명공학기술, New & Information for chemicalengineers(2003). 434p.
세계 바이오에너지 시장규모(1997~2013)

출처: http://cc.kangwon.ac.kr/~wonhur/LecFermTech/BioVenture.htm
주요 국가별 바이오에너지 보급 현황(2002)
국가 | 바이오에너지(106 toe/년) | 총 에너지중 비율(%) |
USA Canada Sweden Finland Ireland Norway Austria UK Switzerland Denmark New Zealand Belgium Korea | 64.0 6.4 6.3 4.7 1.1 1.1 1.0 0.6 0.3 0.2 0.1 0.1 0.084 | 4.0 3.0 13.0 14.0 13.0 4.0 4.0 0.3 1.6 1.0 0.4 0.2 0.04 |
출처: 바이오에너지의 보급 현황과 기술개발 전망(2003), 한국에너지기술연구원
■ 생명공학 백서 부록 생명공학 관계법령 |
[일부개정 2004.12.31 법률 7284호]
제1조 (목적)
이 법은 생명공학연구의 기반을 조성하여 생명공학을 보다 효율적으로 육성·발전시키고 그 개발기술의 산업화를 촉진하여 국민경제의 건전한 발전에 기여하게 함을 목적으로 한다. <개정 1995.1.5>
제2조 (정의)
이 법에서 “생명공학”이라 함은 다음 각호의 학문과 기술을 말한다.
1.산업적으로 유용한 생산물을 만들거나 생산 공정을 개선할 목적으로 생물학적 시스템, 생체, 유전체 또는 그들로부터 유래되는 물질을 연구·활용하는 학문과 기술
2.생명현상의 기전(기전), 질병의 원인 또는 발병과정에 대한 연구를 통하여 생명공학의 원천지식을 제공하는 생리학·병리학·약리학 등의 학문[이하 “기초의과학(기초의과학)”이라 한다]
[전문개정 2003.12.30]
제3조 (적용범위)
생명공학에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 의한다. <개정 1995.1.5>
제4조 (생명공학육성기본계획의 수립<개정 1995.1.5>)
① 제13조의 규정에 의한 관계부처의 장은 소관별로 생명공학육성에 관한 계획을 과학기술부장관에게 제출하여야 한다.
<개정 1995.1.5, 2003.12.30>
② 과학기술부장관은 제1항의 규정에 의하여 관계부처의 장이 제출한 소관사항에 관한 생명공학육성계획을 종합·조정하여 생명공학육성기본계획(이하 “기본계획”이라 한다)을 수립한다.
<개정 1995.1.5, 2003.12.30>
③ 제2항의 규정에 의한 기본계획에는 다음의 사항이 포함되어야 한다.
<개정 1995.1.5, 1997.8.28>
1.생명공학의 기초연구 및 산업적 응용연구의 육성에 관한 종합계획과 지침
2.생명공학의 연구에 필요한 인력자원의 개발종합계획과 인력자원의 효율적인 활용에 관한 지침
3.생명공학의 연구 및 이와 관련된 산업기술인력의 국제교류와 해외과학기술자의 활용에 관한 계획과 그 지침
④ 과학기술부장관은 기본계획을 수립하고자 할 때에는 제6조의 생명공학종합정책심의회의 심의를 거쳐야 한다. <개정 1995.1.5, 2003.12.30>
제5조 (생명공학육성 연차별 시행계획의 수립 등<개정 1995.1.5>)
① 관계부처의 장은 기본계획에 따라 생명공학육성 연차별 시행계획(이하 “시행계획”이라 한다)을 수립하고 이를 시행하여야 한다. <개정 1995. 1.5>
② 관계부처의 장은 시행계획을 수립하고자 할 때에는 미리 과학기술부장관과 협의하여야 한다. <개정 2003.12.30>
③ 과학기술부장관은 시행계획의 수립을 위하여 필요한 때에는 그 계획의 수립에 필요한 기본지침을 작성하여 관계부처의 장에게 통보할 수 있다. <개정 2003.12.30>
④ 시행계획의 수립 및 그 시행에 관하여 필요한 사항은 대통령령으로 정한다.
제6조 (생명공학종합정책심의회<개정 1995.1.5>)
① 기본계획의 수립과 그 집행 및 조정에 관한 업무를 관장하기 위하여 과학기술부장관소속하에 생명공학종합정책심의회(이하 “심의회”라 한다)를 둔다. <개정 1995.1.5, 2003.12.30>
② 심의회는 다음 사항을 심의 결정한다.
<개정 1995.1.5, 1997.8.28, 2003.12.30>
1. 생명공학의 기초연구 및 산업적 응용연구의 육성에 관한 계획의 수립 및 그 집행의 조정
2. 생명공학의 연구 및 기술개발에 관한 기본계획의 수립과 이에 따른 중요정책의 수립 및 그 집행의 조정
3. 생명공학분야 인력개발에 관한 종합계획과 이에 따른 중요정책, 인력활용지침의 수립 및 그 집행의 조정
4. 생명공학의 연구 및 이와 관련된 산업기술인력의 개발교류와 해외과학기술자의 활용에 관한 계획의 수립 및 그 집행의 조정
5. 유전자원의 이용과 보전을 위한 연구개발계획의 수립 및 그 집행의 조정
6. 기타 생명공학육성에 관하여 과학기술부장관이 필요하다고 인정하는 사항
③ 심의회는 위원장 1인을 포함한 17인 이내의 위원으로 구성한다. <신설 2003.12.30>
④ 위원장은 과학기술부장관이 되고 위원은 다음 각호의 자가 된다. <신설 2003.12.30>
1. 대통령령이 정하는 관계 중앙행정기관의 차관급 공무원
2. 학계·연구기관 또는 산업계에 종사하는 생명공학 관계자 및 생명윤리 전문가
⑤ 이 법에서 규정한 사항 외에 심의회의 조직 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다. <신설 2003.12.30>
제7조 삭제 <2003.12.30>
제8조 삭제 <2003.12.30>
제9조 (연구 및 기술협력)
과학기술부장관은 생명공학의 연구 및 기술에 관한 국제협력의 증진에 노력하고 선진기술의 도입을 위한 효율적인 방안을 강구한다.
<개정 1995.1.5, 2003.12.30>
제10조 (공동연구의 촉진)
정부는 생명공학연구 및 기술개발의 효율적 육성을 위하여 학계·연구기관 및 산업계간의 공동연구를 촉진하여야 한다. <개정 1995.1.5>
제11조 (생명공학의 산업적 응용촉진에 대한 지원)
정부는 생명공학 연구개발을 활성화하고 그 결과의 산업적 응용을 촉진하기 위하여 다음 각호의 사항에 대한 지원시책을 강구하여야 한다.
1. 생명공학관련 신기술제품의 생산지원에 관한 사항
2. 생명공학 연구결과의 산업적 응용을 촉진하기 위한 연구개발 및 지역거점 구축에 관한 사항
3. 생명공학관련 중소·벤처기업의 창업지원에 관한 사항
[전문개정 2003.12.30]
제12조 (기술정보의 수집과 보급)
정부는 생명공학연구에 관한 정보를 수집, 관계기관에 보급함으로써 연구개발 촉진에 노력하여야 한다. <개정 1995.1.5>
제13조 (생명공학육성시책강구 등)
① 정부는 생명공학의 효율적인 육성을 위하여 생명공학의 기초연구 및 산업적 응용연구에 관하여 다음 각호의 시책을 강구한다. 다만, 기초의과학(기초의과학)분야의 연구개발 촉진 및 육성업무는 과학기술부장관 및 보건복지부장관의 소관으로 한다. <개정 1997.8.28, 2001.1.29, 2003. 12.30, 2004.12.31>
1. 교육인적자원부장관은 생명공학분야의 연구를 촉진시키기 위한 전문인력의 양성과 생명과학기초분야의 연구지원
2. 과학기술부장관은 제4조제2항의 규정에 의한 기본계획의 수립과 부처별 정책수립의 지원 및 종합조정, 생명공학관련 기초기술 및 첨단기술의 개발지원, 과학기술 분야의 유용한 유전자의 확보·분석·이용·보전을 위한 연구의 지원, 생명공학 지원기관의 육성·발전
3. 농림부장관은 동·식물 및 미생물의 육종·품종개량 및 식품소재의 개발 등 응용연구의 지원 및 농림분야의 유용한 유전자의 확보·분석·이용·보존 등 기초연구의 지원 및 연구기관의 육성·발전
4. 산업자원부장관은 생명공학관련 산업공정의 개발과 개선, 신·재생에너지개발, 에너지 및 광물자원의 효율적 활용, 생명공학관련 생산기술개발 등의 지원과 그 개발기술의 산업화 촉진
4의2. 정보통신부장관은 생명공학의 육성·발전을 위한 정보통신기술의 개발 지원
5. 보건복지부장관은 보건·의료·식품위생 등 생명공학과 관련되는 기술에 대한 연구개발의 촉진과 관련전문인력 양성, 임상시험 관련사업 육성 및 연구의 지원
6. 환경부장관은 생물다양성의 보전, 그 구성요소의 지속가능한 이용 및 생명공학기술을 이용한 폐수·폐기물의 처리 및 환경오염의 방지 등을 위한 기술개발과 기초연구 및 응용연구의 지원
7. 해양수산부장관은 해양수산생물을 이용한 유용물질의 생산과 해양수산생물의 육종·개량 및 식품소재의 개발 등 응용연구의 지원, 해양수산분야의 유용한 유전자의 확보·분석·이용·보존 등 기초연구의 지원, 해양오염방지 등을 위한 기술개발 및 연구기관의 육성·발전
② 과학기술부장관과 보건복지부장관은 기초의과학(기초의과학)을 육성하기 위한 시책을 수립하고자 하는 때에는 협의하여야 한다. <신설 2003. 12.30>
[전문개정 1995.1.5]
제14조 (검정 및 임상)
① 정부는 생명공학 관련제품에 대한 임상 및 검정체제를 확립한다.
<개정 1995.1.5>
② 제1항의 임상 및 검정체제확립에 관하여 필요한 사항은 대통령령으로 정한다.
제15조 (실험지침의 작성·시행 등)
① 정부는 생명공학연구 및 산업화의 촉진을 위한 실험지침을 작성·시행하여야 한다. <개정 1995.1.5>
② 제1항의 실험지침에서는 생명공학의 연구와 이의 산업화 과정에서 예견될 수 있는 생물학적 위험성, 환경에 미치는 악영향 및 윤리적 문제발생의 사전방지에 필요한 조치가 강구되어야 하며, 유전적으로 변형된 생물체의 이전·취급·사용에 대한 안전기준이 마련되어야 한다. <개정 1995.1.5>
제16조 (한국생명공학연구원<개정 1995.1.5, 2003.12.30>)
① 생명공학연구[다만, 기초의과학(기초의과학)연구를 제외한다. 이하 이 조에서 같다] 및 유전자원의 이용과 보전에 관한 연구의 중추적 기능을 담당하고 생명공학분야에서의 학계·연구기관 및 산업계간의 상호유기적 협조체제를 유지·발전시키며, 이들을 지원하기 위하여 재단법인인 한국생명공학연구원(이하 “연구원”이라 한다)을 설립할 수 있다. <개정 1995.1.5, 2003.12.30>
② 제1항의 규정에 의한 연구원은 특정연구기관육성법의 적용을 받는 특정연구기관으로 한다. <개정 2003.12.30>
③ 삭제 <1995.12.6>
제17조 (기초의과학육성지원기구)
① 정부는 기초의과학(기초의과학)을 육성하기 위하여 기초의과학육성지원기구(이하 “육성지원기구”라 한다)를 지정하여 운영할 수 있다.
② 정부는 예산의 범위안에서 육성지원기구의 운영에 필요한 경비를 지원할 수 있다.
③ 육성지원기구의 지정 및 운영에 관하여 필요한 사항은 대통령령으로 정한다.
[본조신설 2003.12.30]
제18조 삭제 <1995.12.6>
제19조 (사후승인 통관절차<개정 2003.12.30>)
① 삭제 <2003.12.30>
② 생명공학연구활동에 필요한 관련 자재·기기 또는 시약 중 국내에서 생산되지 아니하는 품목 중 변질 기타로 인하여 시기적으로 그 안정성의 확보가 어려운 시약 등에 대해서는 관세법의 절차에 불구하고 대통령령이 정하는 바에 의하여 사후 승인의 통관절차로 대신할 수 있다. <개정 2003.12.30>
제20조 삭제 <2003.12.30>
부칙 <제3718호,1983.12.31>
이 법은 공포한 후 2월이 경과한 날로부터 시행한다.
부칙(정부조직법) <제4268호,1990.12.27>
제1조 (시행일) 이 법은 공포한 날부터 시행한다. <단서 생략>
제2조 및 제3조 생략
제4조 (문교부의 명칭변경에 따른 다른 법률의 개정) ① 내지 <42>생략
<43>유전공학육성법 중 다음과 같이 개정한다.
제13조제1호 중 “문교부장관”을 “교육부장관”으로 한다.
<44>내지 <50>생략
제5조 내지 제10조 생략
부칙(정부조직법) <제4541호,1993.3.6>
제1조 (시행일) 이 법은 공포한 날부터 시행한다.
제2조 및 제3조 생략
제4조 (상공자원부 신설에 따른 다른 법률의 개정) ① 유전공학육성법 중 다음과 같이 개정한다.
제13조제3호를 다음과 같이 하고, 동조 제4호를 삭제한다.
3. 상공자원부장관은 유전공학연구를 통한 산업공정의 개발과 개선, 대체에너지 개발, 에너지절약 및 광물자원의 효율적 이용
② 내지 <100>생략
제5조 생략
부칙 <제4938호,1995.1.5>
이 법은 공포 후 6월이 경과한 날부터 시행한다.
부칙(기금관리기본법) <제4980호,1995.12.6>
제1조 (시행일) 이 법은 1996년 1월 1일부터 시행한다. <단서 생략>
제2조 (다른 법률의 개정) ① 생략
② 생명공학육성법 중 다음과 같이 개정한다.
제16조제3항·제17조 및 제18조를 각각 삭제한다.
③ 내지 <24>생략
부칙 <제5400호,1997.8.28>
이 법은 공포 후 3월이 경과한 날부터 시행한다.
부칙(정부조직법) <제6400호,2001.1.29>
제1조 (시행일) 이 법은 공포한 날부터 시행한다. <단서 생략>
제2조 생략
제3조 (다른 법률의 개정) ①내지 <60>생략
<61>생명공학육성법 중 다음과 같이 개정한다.
제13조제1호 중 “교육부장관”을 “교육인적자원부장관”으로 한다.
<62>내지 <79>생략
제4조 생략
부칙 <제7014호,2003.12.30>
이 법은 공포 후 6월이 경과한 날부터 시행한다.
부칙(신에너지및재생에너지개발·이용·보급촉진)
<제7284호,2004.12.31>
제1조 (시행일) 이 법은 공포 후 6월이 경과한 날부터 시행한다.
제2조 및 제3조 생략
제4조 (다른 법률의 개정) ① 내지 ③ 생략
④ 생명공학육성법 중 다음과 같이 개정한다.
제13조제1항제4호 중 “대체에너지개발”을 “신·재생에너지개발”로 한다.
⑤ 내지 ⑧ 생략
제5조 생략

[일부개정 2004.6.29 대통령령 18452호]
제1조 (목적)
이 영은 생명공학육성법(이하 “법”이라 한다)에서 위임된 사항과 그 시행에 관하여 필요한 사항을 규정함을 목적으로 한다. <개정 1995.7.13>
제2조 (생명공학육성기본계획)
과학기술부장관은 법 제4조제2항의 규정에 의한 생명공학육성기본계획을 5년마다 수립하여 이를 법 제13조제1항제1호·제3호 내지 제7호의 관계부처의 장에게 통보하여야 한다. <개정 1995.7.13, 2004.6.29>
제3조 (생명공학육성연차별시행계획의 수립 및 변경통보)
법 제13조제1항제1호·제3호 내지 제7호의 관계부처의 장은 법 제5조제1항의 규정에 의하여 생명공학육성연차별시행계획(이하 “시행계획”이라 한다)을 수립하거나 변경한 때에는 이를 과학기술부장관에게 통보하여야 한다. <개정 1995.7.13, 2004.6.29>
제4조 (시행계획기본지침의 작성)
과학기술부장관은 법 제5조제3항의 규정에 의하여 시행계획수립에 필요한 기본지침을 작성할 때에는 법 제6조제1항의 규정에 의한 생명공학종합정책심의회(이하 “심의회”라 한다)의 심의를 거쳐야 한다. <개정 1995.7. 13, 2004.6.29>
제5조 (심의회의 구성<개정 2004.6.29>)
① 삭제 <2004.6.29>
② 법 제6조제4항제1호에서 “대통령령이 정하는 관계중앙행정기관”이라함은 다음 각호의 기관을 말한다. <개정 2004.6.29>
1. 재정경제부
2. 교육인적자원부
3. 과학기술부
4. 농림부
5. 산업자원부
6. 정보통신부
7. 보건복지부
8. 환경부
9. 해양수산부
10. 기획예산처
③ 법 제6조제4항제2호의 규정에 의한 위원은 과학기술부장관이 위촉하되, 위촉위원의 임기는 2년으로 한다. <개정 2004.6.29>
제6조 (위원장의 직무)
① 위원장은 심의회를 통할하며, 심의회의 회의를 소집하고 그 의장이 된다.
② 위원장이 사고가 있는 때에는 위원장이 지명한 위원이 그 직무를 대행한다.
제7조 (회의)
① 심의회의 회의는 정기회와 임시회로 구분한다.
② 정기회는 매년 1회 심의회에서 정한 날에 소집하고, 임시회는 필요에 따라 위원장이 수시로 소집한다.
③ 회의는 재적위원 과반수의 출석으로 개의하고, 출석위원 과반수의 찬성으로 의결한다.
제8조 (간사)
① 심의회의 서무를 처리하기 위하여 심의회에 간사 1인을 둔다.
② 간사는 과학기술부장관이 소속직원 중에서 임명하는 자가 된다. <개정 2004.6.29>
제9조 삭제 <2004.6.29>
제10조 (의견청취)
심의회는 필요하다고 인정할 때에는 생명공학에 관한 전문적인 지식과 경험이 있는 관계공무원 또는 관계전문가를 심의회에 출석하게 하여 그 의견을 들을 수 있다. <개정 1995.7.13, 2004.6.29>
제11조 (수당)
심의회에 출석한 위원과 관계공무원 또는 관계전문가에 대하여는 예산의 범위 안에서 수당 또는 실비를 지급할 수 있다. 다만, 공무원인 위원 또는 관계공무원이 소관업무와 직접 관련되어 출석한 경우에는 그러하지 아니하다. <개정 2004.6.29>
제12조 (공동연구의 지원)
과학기술부장관은 학계·연구기관 및 산업계간의 생명공학연구 및 기술개발을 위한 공동연구를 촉진하기 위하여 공동연구에 필요한 연구기자재·시약의 공동구입 및 연구시설의 공동활용 등을 권고하고, 이에 필요한 지원을 할 수 있다. <개정 1995.7.13, 2004.6.29>
제13조 (신기술제품의 생산지원)
① 과학기술부장관은 생명공학연구결과의 산업화를 촉진하기 위한 신기술제품의 생산을 지원하기 위하여 심의회의 심의를 거쳐 관계부처의 장에게 자금의 지원과 제품의 우선구매 등 필요한 조치를 요청할 수 있다. <개정 1995.7.13, 2004.6.29>
② 제1항의 규정에 의한 요청을 받은 관계부처의장은 특별한 사유가 없는 한 자금의 지원 등 필요한 조치를 하여야 한다.
제14조 (임상시험 및 검정지침의 작성)
①농림부장관·산업자원부장관·정보통신부장관·보건복지부장관·환경부장관 및 해양수산부장관은 법 제14조의 규정에 의한 소관생명공학관련제품에 대한 임상 및 검정체제의 확립을 위하여 그 임상시험 및 검정에 관한 지침을 심의회의 심의를 거쳐 작성·시행하여야 한다. 다만, 다른 법령에 특별한 규정이 있는 경우에는 그러하지 아니하다. <개정 1993.3.6, 1994.12.23, 1995.7.13, 2004.6.29>
② 제1항의 임상시험 및 검정에 관한 지침에는 다음 각호의 사항이 포함되어야 한다. 다만, 생명공학관련제품의 성질이 특수하여 정할 수 없는 사항이 있는 경우에는 이를 정하지 아니할 수 있다. <개정 1995.7.13>
1. 생명공학적 변이생물체에 의하여 생산·제조되는 제품의 동물시험
2.생명공학적 변이생물체에 의하여 생산·제조되는 의약제품의 임상시험
3.생명공학적 변이생물체에 의하여 생산·제조되는 제품의 성분·순도 및 활성도 등의 분석에 관한 사항
4.기타 생명공학관련제품에 대한 임상시험 및 검정에 관하여 필요한 사항
제15조 (실험지침의 작성)
① 보건복지부장관은 법 제15조의 규정에 의한 생명공학연구 및 산업화의 촉진을 위한 실험지침을 심의회의 심의를 거쳐 작성·시행하여야 한다. <개정 1994.12.23, 1995.7.13>
②제1항의 실험지침에는 다음 각호의 사항이 포함되어야 한다.
<개정 1995.7.13>
1. 생명공학적 변이생물체의 전파·확산을 방지하기 위한 봉쇄방법 등 생물학적위험발생의 사전방지에 필요한 사항
2. 사람을 대상으로 하는 유전자재조합 등 인간의 존엄성을 해치는 결과를 가져올 수 있는 실험의 금지 등 윤리적 문제발생의 사전방지에 필요한 사항
제16조 (기초의과학육성지원기구의 지정·운영)
① 법 제17조제1항의 규정에 의한 기초의과학육성지원기구는 과학기술부장관과 보건복지부장관이 협의하여 지정한다.
② 기초의과학육성지원기구는 다음 각호의 업무를 수행한다.
1. 기초의과학의 육성을 위한 사업의 집행 및 관리
2. 기초의과학분야의 학술 및 연구활동의 지원
[전문개정 2004.6.29]
제17조 삭제 <2004.6.29>
제18조 삭제 <2004.6.29>
제19조 삭제 <2004.6.29>
제20조 삭제 <2004.6.29>
제21조 삭제 <2004.6.29>
제22조 삭제 <2004.6.29>
제23조 (사후승인통관절차 등)
① 법 제19조제2항의 규정에 의하여 사후승인의 통관절차로 대신할 수 있는 시약 등은 다음 각호의 1에 해당하는 품목의 시약 등으로서 과학기술부장관이 인정하는 것으로 한다. <개정 1995.7.13, 2004.6.29>
1. 생화학시약
2. 방사성물질시약
3. 미생물균주 및 동식물세포주
4. 유전자물질
5. 효소제품
6. 제1호 내지 제5호에 준하는 생명공학관련품목
② 사후승인통관절차에 의하여 제1항 각호에 규정된 대상품목을 수입하고자 하는 당해 품목의 품명 및 수량과 사후승인통관이 필요한 사유 등을 기재한 서류를 과학기술부장관에게 제출하여야 한다. <개정 2004.6. 29>
③ 과학기술부장관은 제2항의 규정에 의한 서류를 제출받은 때에는 그 내용을 심사하고, 사후승인통관의 필요성이 있다고 인정할 때에는 관할세관장에게 당해 품목에 대하여 관세법 제252조의 규정에 의한 수입신고수리전 반출절차에 의하여 사후승인통관을 하여 줄 것을 요청할 수 있다. 이 경우 관할세관장은 특별한 사유가 있는 경우를 제외하고는 이에 응하여야 한다. <개정 2000.12.29, 2004.6.29>
부칙 <제11512호,1984.9.22>
이 영은 공포한 날로부터 시행한다.
부칙(교육부와그소속기관직제) <제13282호,1991.2.1>
제1조 (시행일) 이 영은 공포한 날부터 시행한다.
제2조 내지 제4조 생략
제5조 (다른 법령의 개정) ① 내지 <83>생략
<84>유전공학육성법시행령 중 다음과 같이 개정한다.
제5조제2항 중 “문교부차관”을 “교육부차관”으로 하고, 제9조제2항 중 “문교부”를 “교육부”로 한다.
<85>내지 <148>생략
부칙(상공자원부와그소속기관직제) <제13870호,1993.3.6>
제1조 (시행일) 이 영은 공포한 날부터 시행한다.
제2조 및 제3조 생략
제4조 (다른 법령의 개정) ① 내지 ⑮ 생략
<16>유전공학육성법시행령 중 다음과 같이 개정한다.
제5조제2항제4호 중 “상공부차관”을 “상공자원부차관”으로 하고, 동항제5호를 삭제하며, 제9조제2항 중 “상공부·동력자원부”를 “상공자원부”로 하고, 제14조제1항 중 “동력자원부장관”을 “상공자원부장관”으로 한다.
<17>내지 <188>생략
부칙(재정경제원과그소속기관직제) <제14438호,1994.12.23>
제1조 (시행일) 이 영은 공포한 날부터 시행한다.
제2조 내지 제4조 생략
제5조 (다른 법령의 개정) ①내지 <91>생략
<92>유전공학육성법시행령 중 다음과 같이 개정한다.
제5조제2항제1호 ‘제기획원차관’을 ‘재정경제원차관’으로, 제9조제2항 중 ‘경제기획원’을 ‘재정경제원’으로, 제16조제4항, 제19조제3항, 제20조제2항 중 ‘재무부장관’을 ‘재정경제원장관’으로 한다.
<93>내지 <327>생략
부칙(보건복지부와 그 소속기관직제) <제14446호,1994.12.23>
제1조 (시행일) 이 영은 공포한 날부터 시행한다. <단서 생략>
제2조 생략
제3조 (다른 법령의 개정) ① 내지 ⑭ 생략
⑮ 유전공학육성법시행령중 다음과 같이 개정한다.
제5조제2항제6호 중 “보건사회부차관”을 “보건복지부차관”으로 하고, 제9조제2항 중 “보건사회부”를 “보건복지부”로 하며, 제14조제1항 및 제15조제1항 중 “보건사회부장관”을 각각 “보건복지부장관”으로 한다.
<16>내지 <140>생략
부칙 <제14731호,1995.7.13>
이 영은 공포한 날부터 시행한다.
부칙(기획예산처직제) <제16326호,1999.5.24>
제1조 (시행일) 이 영은 공포한 날부터 시행한다.
제2조 및 제3조 생략
제4조 (다른 법령의 개정) ① 내지 <61>생략
<62>생명공학육성법시행령 중 다음과 같이 개정한다.
제5조제2항에 제7호의2를 다음과 같이 신설한다.
7의2. 기획예산처차관
제9조제2항 중 “보건복지부 및 과학기술부”를 “보건복지부·과학기술부 및 기획예산처”로 한다.
<63>내지 <109>생략
부칙(관세법시행령) <제17048호,2000.12.29>
제1조 (시행일) 이 영은 2001년 1월 1일부터 시행한다.
제2조 내지 제8조 생략
부칙(교육인적자원부와그소속기관직제) <제17115호,2001.1.29>
제1조 (시행일) 이 영은 공포한 날부터 시행한다.
제2조 내지 제4조 생략
제5조 (다른 법령의 개정) ①내지 <114>생략
<115>생명공학육성법시행령 중 다음과 같이 개정한다.
제5조제2항제2호 중 “교육부차관”을 “교육인적자원부차관”으로 한다.
제9조제2항 중 “교육부”를 “교육인적자원부”로 한다.
<116>내지 <152>생략
부칙 <제18452호,2004.6.29>
이 영은 2004년 7월 1일부터 시행한다.

[일부개정 2005.3.24 법률 7413호]
제1장 총칙
제1조 (목적)
이 법은 생명과학기술에 있어서의 생명윤리 및 안전을 확보하여 인간의 존엄과 가치를 침해하거나 인체에 위해를 주는 것을 방지하고, 생명과학기술이 인간의 질병 예방 및 치료 등을 위하여 개발·이용될 수 있는 여건을 조성함으로써 국민의 건강과 삶의 질 향상에 이바지함을 목적으로 한다.
제2조 (정의)
이 법에서 사용하는 용어의 정의는 다음과 같다.
1. “생명과학기술”이라 함은 인간의 배아(배아)·세포·유전자 등을 대상으로 생명현상을 규명·활용하는 과학과 기술을 말한다.
2. “배아”라 함은 수정란 및 수정된 때부터 발생학적으로 모든 기관이 형성되는 시기까지의 분열된 세포군을 말한다.
3. “잔여배아”라 함은 인공수정으로 생성된 배아 중 임신의 목적으로 이용하고 남은 배아를 말한다.
4. “체세포핵이식행위”라 함은 핵이 제거된 인간 또는 동물의 난자에 인간의 체세포 핵을 이식하는 것을 말한다.
5. “체세포복제배아(체세포복제배아)”라 함은 체세포핵이식행위에 의하여 생성된 배아를 말한다.
6. “유전자검사”라 함은 개인의 식별, 특정한 질병 또는 소인(소인)의 검사 등의 목적으로 혈액·모발·타액(타액) 등의 검사대상물로부터 염색체·유전자 등을 분석하는 행위를 말한다.
7. “유전정보”라 함은 유전자검사의 결과로 얻어진 정보를 말한다.
8. “유전자은행”이라 함은 유전정보의 획득을 목적으로 검사대상물·유전자 또는 개인정보가 포함된 유전정보(이하 “유전정보 등”이라 한다)를 수집·보존하여 이를 직접 이용하거나 타인에게 제공하는 기관을 말한다.
9. “유전자치료”라 함은 질병의 예방 또는 치료를 목적으로 유전적 변이를 일으키는 일련의 행위를 말한다.
제3조 (적용범위)
생명과학기술에 있어서의 생명윤리 및 안전에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 의한다.
제4조 (책무)
① 국가 또는 지방자치단체는 생명과학기술의 개발·이용과정에서 일어날 수 있는 생명윤리 및 안전에 관한 문제에 효율적으로 대처할 수 있도록 필요한 시책을 마련하여야 한다.
② 생명과학기술을 연구·개발 및 이용하고자 하는 자는 생명과학기술이 인간의 존엄과 가치를 침해하지 아니하고 생명윤리 및 안전에 적합하도록 노력하여야 한다.
제5조 (자기결정권)
누구든지 자신이 생명과학기술의 적용대상이 되는 경우 생명윤리 및 안전에 관하여 충분한 설명을 들은 후 이에 관한 동의여부를 결정할 권리를 가진다.
제2장 국가생명윤리심의위원회 및 기관생명윤리심의위원회
제6조 (국가생명윤리심의위원회의 설치 및 기능)
① 생명과학기술에 있어서의 생명윤리 및 안전에 관한 다음 각호의 사항을 심의하기 위하여 대통령소속하에 국가생명윤리심의위원회(이하 “심의위원회”라 한다)를 둔다.
1.국가의 생명윤리 및 안전에 관한 정책의 수립에 관한 사항
2.제17조제3호의 규정에 따라 잔여배아를 이용할 수 있는 연구의 종류·대상 및 범위에 관한 사항
3.제22조제2항의 규정에 따라 체세포핵이식행위를 할 수 있는 연구의 종류·대상 및 범위에 관한 사항
4.제25조제1항의 규정에 따라 금지되는 유전자검사의 종류에 관한 사항
5.제36조제1항제3호의 규정에 따라 유전자치료를 할 수 있는 질병의 종류
6.그 밖에 윤리적·사회적으로 심각한 영향을 미칠 수 있는 생명과학기술의 연구·개발 또는 이용에 관하여 심의위원회의 위원장이 부의하는 사항
② 심의위원회의 위원장은 제1항제1호 내지 제5호의 규정에 해당하는 사항으로서 재적위원 3분의 1 이상이 발의한 사항에 관하여는 심의위원회에 이를 부의하여야 한다.
제7조 (심의위원회의 구성)
① 심의위원회는 위원장 1인, 부위원장 1인을 포함한 16인 이상 21인 이하의 위원으로 구성한다.
② 위원장은 위원 중에서 대통령이 임명 또는 위촉하고, 부위원장은 위원 중에서 호선한다.
③ 위원은 다음 각호의 자가 된다. <개정 2005.3.24>
1.교육인적자원부장관·법무부장관·과학기술부장관·산업자원부장관·보건복지부장관·여성가족부장관·법제처장
2.생명과학 또는 의과학(의과학)분야에 전문지식과 연구경험이 풍부한 학계·연구계 또는 산업계를 대표하는 자중에서 대통령이 위촉하는 7인 이내의 자
3.종교계·철학계·윤리학계·사회과학계·법조계·시민단체(비영리민간단체지원법 제2조의 규정에 의한 비영리민간단체를 말한다) 또는 여성계를 대표하는 자중에서 대통령이 위촉하는 7인 이내의 자
④ 제3항제2호 및 제3호의 위원의 임기는 3년으로 하되, 연임할 수 있다.
⑤ 심의위원회에 간사위원 2인을 두되, 간사위원은 과학기술부장관과 보건복지부장관으로 하며, 수석간사위원은 보건복지부장관으로 한다.
제8조 (심의위원회의 운영)
① 심의위원회의 효율적인 운영을 위하여 심의위원회에 분야별 전문위원회를 둘 수 있다.
② 심의위원회의 사무는 수석간사위원이 처리한다.
③ 심의위원회의 회의 등 활동은 공개함을 원칙으로 한다.
④ 이 법에서 규정한 것 외에 심의위원회 및 전문위원회의 구성·운영 그 밖에 필요한 사항은 대통령령으로 정한다.
제9조 (기관생명윤리심의위원회의 설치 및 기능)
① 다음 각호의 기관은 생명과학기술에 있어서의 생명윤리 및 안전을 확보하기 위하여 당해 기관에 기관생명윤리심의위원회(이하 “기관위원회”라 한다)를 두어야 한다.
1.제18조의 규정에 따라 보건복지부장관에게 등록한 배아연구기관
2.제32조제1항 본문의 규정에 따라 보건복지부장관의 허가를 받은 유전자은행
3.제37조제2항의 규정에 의한 유전자치료기관
4.그 밖에 윤리적·사회적으로 심각한 영향을 미칠 수 있는 생명과학기술을 연구·개발 또는 이용하는 기관으로서 보건복지부령이 정하는 기관
② 기관위원회는 제1항 각호의 기관에서 행하여지는 생명과학기술의 연구·개발 또는 이용에 관하여 다음 각호의 사항을 심의한다.
1.생명과학기술 연구계획서의 윤리적·과학적 타당성
2.환자 또는 정자·난자·검사대상물의 제공자로부터 적법한 절차에 따라 동의를 받았는지의 여부
3.환자, 정자·난자·검사대상물의 제공자 또는 유전정보의 주체에 대한 안전대책 및 정자·난자·검사대상물을 타인에게 제공하는 경우에 성명·주민등록번호 등 개인을 식별할 수 있는 정보(이하 “개인정보”라 한다)에 대한 보호대책
4.그 밖에 제1항 각호의 기관에서 행하여지는 생명과학기술의 연구·개발 또는 이용에 관한 사항
③ 제1항 각호의 기관의 장은 당해 기관에서 행하여지는 생명과학기술의 연구·개발 또는 이용으로 인하여 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있는 경우에는 지체없이 기관위원회를 소집하여 이를 심의하도록 하고, 그 결과를 보건복지부장관에게 보고하여야 한다.
④ 제1항 각호의 기관 중 기관의 규모 또는 연구자 수 등이 보건복지부령이 정하는 기준 이하인 기관이 기관위원회를 설치한 동종의 기관과 제2항 각호 및 제3항의 규정에 의한 사항의 심의에 관한 협약을 체결한 경우에는 제1항의 규정에 불구하고 기관위원회를 설치한 것으로 본다.
제10조 (기관위원회의 구성 및 운영)
① 기관위원회는 위원장 1인을 포함하여 5인 이상 9인 이하의 위원으로 구성하되, 생명과학 또는 의과학분야 외의 종사자 1인과 해당 기관에 종사하지 아니하는 자 1인이 포함되어야 한다.
② 위원은 제9조제1항 각호의 기관의 장이 위촉하며, 위원장은 위원 중에서 호선한다.
③ 기관위원회의 심의대상인 연구·개발 또는 이용에 관여하는 위원은 해당 연구·개발 또는 이용과 관련된 심의에 참여하여서는 아니된다.
④ 그 밖에 기관위원회의 구성 및 운영에 관하여 필요한 사항은 대통령령으로 정한다.
제3장 배아 등의 생성·연구
제1절 인간복제 등의 금지
제11조 (인간복제의 금지)
① 누구든지 체세포복제배아를 자궁에 착상시켜서는 아니되며, 착상된 상태를 유지하거나 출산하여서는 아니된다.
② 누구든지 제1항의 규정에 의한 행위를 유인 또는 알선하여서는 아니된다.
제12조 (이종간의 착상 등 금지)
① 누구든지 인간의 배아를 동물의 자궁에 착상시키거나 동물의 배아를 인간의 자궁에 착상시키는 행위를 하여서는 아니된다.
② 누구든지 다음 각호의 1에 해당하는 행위를 하여서는 아니된다.
1.인간의 난자를 동물의 정자로 수정시키거나 동물의 난자를 인간의 정자로 수정시키는 행위. 다만, 의학적으로 인간의 정자의 활동성 시험을 위한 경우를 제외한다.
2.핵이 제거된 인간의 난자에 동물의 체세포 핵을 이식하는 행위
3.인간의 배아와 동물의 배아를 융합하는 행위
4.다른 유전정보를 가진 인간의 배아를 융합하는 행위
③ 누구든지 제2항 각호의 1에 해당하는 행위로부터 생성된 것을 인간 또는 동물의 자궁에 착상시키는 행위를 하여서는 아니된다.
제2절 인공수정배아
제13조 (배아의 생성 등)
① 누구든지 임신외의 목적으로 배아를 생성하여서는 아니된다.
② 누구든지 임신을 목적으로 배아를 생성함에 있어서 다음 각호의 1에 해당하는 행위를 하여서는 아니된다.
1.특정의 성을 선택할 목적으로 정자와 난자를 선별하여 수정시키는 행위
2.사망한 자의 정자 또는 난자로 수정시키는 행위
3.미성년자의 정자 또는 난자로 수정시키는 행위. 다만, 혼인한 미성년자가 그 자녀를 얻기 위한 경우를 제외한다.
③ 누구든지 금전 또는 재산상의 이익 그 밖에 반대급부를 조건으로 정자 또는 난자를 제공 또는 이용하거나 이를 유인 또는 알선하여서는 아니된다.
제14조 (배아생성의료기관)
① 인공수태시술을 위하여 정자 또는 난자를 채취·보관하거나 이를 수정시켜 배아를 생성하고자 하는 의료기관은 보건복지부장관으로부터 배아생성의료기관으로 지정받아야 한다.
② 배아생성의료기관으로 지정받고자 하는 의료기관은 보건복지부령이 정하는 시설 및 인력 등을 갖추어야 한다.
③ 배아생성의료기관의 지정기준 및 절차, 제출서류 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제15조 (배아의 생성 등에 관한 동의)
① 제14조의 규정에 따라 배아생성의료기관으로 지정받은 의료기관(이하 “배아생성의료기관”이라 한다)은 배아를 생성하기 위하여 정자 또는 난자를 채취하는 때에는 정자제공자·난자제공자·인공수태시술대상자 및 그 배우자(이하 “동의권자”라 한다)의 서면동의를 얻어야 한다.
② 제1항의 규정에 의한 서면동의에는 다음 각호의 사항이 포함되어야 한다.
1. 배아생성의 목적에 관한 사항
2. 배아의 보존기간 그 밖에 배아의 보관에 관한 사항
3. 배아의 폐기에 관한 사항
4. 임신외의 목적으로 잔여배아를 이용하는 것에 대한 동의여부
5.동의의 철회, 동의권자의 권리 및 정보보호 그 밖에 보건복지부령이 정하는 사항
③ 배아생성의료기관은 제1항의 규정에 의한 서면동의를 받기 전에 동의권자에게 제2항 각호의 사항에 대하여 충분히 설명하여야 한다.
④ 제1항의 규정에 의한 서면동의를 위한 동의서의 서식 및 보존 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제16조 (배아의 보존기간 및 폐기)
① 배아의 보존기간은 5년으로 한다. 다만, 동의권자가 보존기간을 5년 미만으로 정한 경우에는 이를 보존기간으로 한다.
② 배아생성의료기관은 제1항의 규정에 의한 보존기간이 도래한 배아 중 제17조의 규정에 의한 연구의 목적으로 이용하지 아니하고자 하는 배아를 폐기하여야 한다.
③ 배아생성의료기관은 배아의 폐기에 관한 사항을 기록·보관하여야 한다.
④ 배아의 폐기 절차 및 방법, 배아의 폐기에 관한 사항의 기록·보관에 관하여 필요한 사항은 보건복지부령으로 정한다.
제17조 (잔여배아의 연구)
제16조의 규정에 의한 배아의 보존기간이 경과된 잔여배아는 발생학적으로 원시선이 나타나기 전까지에 한하여 체외에서 다음 각호의 1의 목적으로 이용할 수 있다. 다만, 보존기간을 5년 미만으로 정한 잔여배아를 이용하고자 하는 경우에는 동의권자로부터 해당 목적으로의 이용에 대하여 새로이 동의를 받아야 한다.
1. 불임치료법 및 피임기술의 개발을 위한 연구
2. 근이영양증 그 밖에 대통령령이 정하는 희귀·난치병의 치료를 위한 연구
3. 그 밖에 심의위원회의 심의를 거쳐 대통령령이 정하는 연구
제18조 (배아연구기관)
제17조의 규정에 따라 잔여배아를 연구하고자 하는 자는 보건복지부령이 정하는 시설·인력 등을 갖추고 보건복지부장관에게 배아연구기관으로 등록하여야 한다.
제19조 (배아연구계획서의 승인)
① 제18조의 규정에 따라 보건복지부장관에게 등록한 배아연구기관(이하 “배아연구기관”이라 한다)이 제17조의 규정에 의한 배아연구를 하고자 하는 때에는 보건복지부령이 정하는 바에 따라 미리 보건복지부장관에게 배아연구계획서를 제출하여 승인을 얻어야 한다. 대통령령이 정하는 중요한 사항을 변경하는 경우에도 또한 같다.
② 제1항의 규정에 의한 배아연구계획서에는 배아연구기관 안에 설치된 기관위원회의 심의결과에 관한 서류가 첨부되어야 한다.
③ 보건복지부장관은 다른 중앙행정기관의 장이 연구비를 지원하는 배아연구기관으로부터 연구계획서를 제출받은 때에는 승인여부를 결정하기 전에 그 중앙행정기관의 장과 협의하여야 한다.
④ 배아연구계획서의 승인기준 및 절차, 제출서류 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제20조 (잔여배아의 제공 및 관리)
① 배아생성의료기관이 제19조제1항의 규정에 따라 배아연구계획서의 승인을 얻은 배아연구기관에게 연구에 필요한 잔여배아를 제공하는 경우에는 무상으로 하여야 한다. 다만, 배아생성의료기관은 잔여배아의 보관 및 제공에 필요한 경비를 보건복지부령이 정하는 바에 따라 배아연구기관에 요구할 수 있다.
② 제1항의 규정에 의한 잔여배아의 제공절차, 경비의 산출 그 밖에 필요한 사항은 보건복지부령으로 정한다.
③ 배아생성의료기관과 배아연구기관은 잔여배아의 보관 및 제공 등에 관한 사항을 보건복지부령이 정하는 바에 따라 보건복지부장관에게 보고하여야 한다.
④ 제16조제2항 내지 제4항의 규정은 배아연구기관이 제1항의 규정에 따라 잔여배아를 제공받은 후 연구의 목적으로 이용하지 아니하고자 하는 잔여배아의 폐기에 관하여 이를 준용한다. 이 경우 “배아생성의료기관”은 “배아연구기관”으로 본다.
제21조 (배아생성의료기관 및 배아연구기관의 준수사항)
배아생성의료기관 및 배아연구기관은 다음 각호의 사항을 준수하여야 한다.
1. 제15조의 규정에 의한 동의서에 기재된 목적으로 배아를 취급할 것
2. 잔여배아의 보관·취급·폐기 등의 관리를 철저히 할 것
3. 배아연구기관은 당해 기관에서 행하여지는 연구로 인하여 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있는 경우에는 연구의 중단 등 적절한 조치를 취할 것
4. 그 밖에 제1호 내지 제3호에 준하는 사항으로서 생명윤리 및 안전의 확보를 위하여 필요하다고 인정하여 보건복지부령이 정하는 사항
제3절 체세포복제배아
제22조 (체세포핵이식행위)
① 누구든지 제17조제2호의 규정에 의한 희귀·난치병의 치료를 위한 연구목적 외에는 체세포핵이식행위를 하여서는 아니된다.
② 제1항의 규정에 의한 연구목적에 따라 체세포핵이식행위를 할 수 있는 연구의 종류·대상 및 범위는 심의위원회의 심의를 거쳐 대통령령으로 정한다.
제23조 (체세포복제배아의 생성 및 연구)
① 체세포복제배아를 생성하거나 연구하고자하는 자는 보건복지부령이 정하는 시설 및 인력 등을 갖추고 보건복지부장관에게 등록하여야 한다.
② 제19조 내지 제21조의 규정은 체세포복제배아의 연구에 관하여 이를 준용한다. 이 경우 “잔여배아”는 “체세포복제배아”로 본다.
제4장 유전자검사
제24조 (유전자검사기관 등)
① 유전자검사를 하고자 하는 자 또는 직접 검사대상물을 채취하여 유전자에 관한 연구를 하고자 하는 자는 유전자검사시설 또는 연구시설의 소재지, 기관장, 유전자검사 또는 연구항목 등의 사항에 대하여 보건복지부령이 정하는 바에 따라 보건복지부장관에게 신고하여야 한다. 다만, 국가기관이 유전자검사 또는 유전자에 관한 연구를 하는 경우에는 그러하지 아니하다.
② 제1항의 규정에 따라 신고한 사항 중 대통령령이 정하는 중요한 사항을 변경하는 경우에도 제1항과 같다.
③ 보건복지부장관은 제1항의 규정에 따라 신고한 유전자검사를 하고자 하는 자(이하 “유전자검사기관”이라 한다)로 하여금 보건복지부령이 정하는 바에 따라 유전자검사의 정확도 평가를 받게 할 수 있고, 그 결과를 공개할 수 있다.
④ 유전자검사기관은 유전자검사의 업무를 폐업하거나 휴업하고자 하는 경우에는 보건복지부령이 정하는 바에 따라 보건복지부장관에게 신고하여야 한다.
제25조 (유전자검사의 제한)
① 유전자검사기관은 과학적 입증이 불확실하여 검사대상자를 오도(오도)할 우려가 있는 신체외관이나 성격에 관한 유전자검사 그 밖에 심의위원회의 심의를 거쳐 대통령령이 정하는 유전자검사를 하여서는 아니된다.
② 유전자검사기관은 근이영양증 그 밖에 대통령령이 정하는 유전질환을 진단하기 위한 목적 외에는 배아 또는 태아를 대상으로 유전자검사를 하여서는 아니된다.
③ 의료기관이 아닌 유전자검사기관에서는 질병의 진단과 관련한 유전자검사를 할 수 없다. 다만, 의료기관의 의뢰를 받아 유전자검사를 하는 경우에는 그러하지 아니하다.
제26조 (유전자검사의 동의)
① 유전자검사기관 또는 유전자에 관한 연구를 하는 자가 유전자검사 또는 유전자연구에 쓰일 검사대상물을 직접 채취하거나 채취를 의뢰하는 때에는 검사대상물을 채취하기 전에 검사대상자로부터 다음 각호의 사항이 포함된 서면동의를 얻어야 한다.
1. 유전자검사 또는 유전자연구의 목적
2.제1호의 규정에 의한 목적 외로 검사대상물을 이용하거나 타인에게 제공하는 것에 대한 동의여부 및 그 범위에 관한 사항
3.제2호의 규정에 따라 검사대상물을 타인에게 제공하는 경우에 개인정보를 포함 시킬 것인지 여부
4. 검사대상물의 보존기간 및 관리에 관한 사항
5. 동의의 철회, 검사대상자의 권리 및 정보보호 그 밖에 보건복지부령이 정하는 사항
② 유전자검사기관외의 자가 검사대상물을 채취하여 유전자검사기관에 유전자검사를 의뢰하는 경우에는 검사대상자로부터 제1항의 규정에 의한 서면동의를 얻어 이를 첨부하여야 한다. 이 경우 보건복지부령이 정하는 바에 따라 개인정보를 보호하기 위한 조치를 취하여야 한다.
③ 검사대상자가 미성년자·심신박약자 또는 심신상실자인 경우에는 제1항의 규정에 의한 본인의 동의 외에 법정대리인의 동의를 얻어야 한다. 다만, 질병의 진단 또는 치료를 목적으로 유전자검사를 하는 경우에 있어서 심신박약 또는 심신상실 등의 사유로 본인의 동의를 얻을 수 없는 때에는 이를 생략할 수 있다.
④ 제1항 내지 제3항의 규정에 불구하고 다음 각호의 1에 해당하는 경우에는 서면동의 없이 유전자검사를 할 수 있다.
1.시체 또는 의식불명의 자에 대하여 개인식별을 하여야 할 긴급한 필요가 있거나 특별한 사유가 있는 경우
2.다른 법률에 특별한 규정이 있는 경우
⑤ 제1항 내지 제3항의 규정에 따라 서면동의를 얻고자 하는 자는 미리 검사대상자 또는 법정대리인에게 유전자검사의 목적과 방법, 예측되는 유전자검사의 결과와 의미 등에 대하여 충분히 설명하여야 한다.
⑥ 제1항 내지 제3항의 규정에 의한 동의의 절차 및 동의서의 서식 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제27조 (검사대상물의 제공)
① 유전자검사기관은 제26조의 규정에 따라 검사대상자로부터 연구목적으로 검사대상물을 이용하는 것에 대하여 서면동의를 얻은 경우에는 유전자에 관한 연구를 하는 자 또는 제32조의 규정에 따라 유전자은행의 개설허가를 받은 자에게 검사대상물을 제공할 수 있다.
② 유전자검사기관은 제1항의 규정에 따라 제공하는 검사대상물에 개인정보를 포함시켜서는 아니된다. 다만, 개인정보를 포함시키는 것에 대하여 검사대상자 또는 법정대리인이 서면으로 동의하는 경우에는 그러하지 아니하며, 이 경우 동의서의 사본을 첨부하여야 한다.
③ 유전자검사기관, 유전자에 관한 연구를 하는 자 또는 제32조의 규정에 따라 유전자은행의 개설허가를 받은 자(이하 “유전자검사기관 등”이라 한다)는 제1항의 규정에 따라 검사대상물을 제공하거나 이를 제공받은 때에는 보건복지부령이 정하는 바에 따라 검사대상물의 제공에 관한 기록을 작성하여야 한다.
④ 제1항 내지 제3항의 규정은 검사대상물을 제공받은 자가 다른 연구자 또는 유전자은행에 검사대상물을 제공하는 경우에 이를 준용한다.
제28조 (검사대상물의 폐기)
① 검사대상물의 보존기간은 5년으로 한다. 다만, 검사대상자 또는 법정대리인이 제26조제1항의 규정에 의한 동의서에 보존기간을 별도로 정한 경우에는 이를 보존기간으로 한다.
② 유전자검사기관등은 보존기간 경과 후 지체없이 검사대상물을 폐기하여야 한다. 다만, 검사대상자 또는 법정대리인이 검사대상물을 폐기하지 아니할 것을 서면으로 요청한 경우에는 그러하지 아니하다.
③ 유전자검사기관등은 검사대상물의 보관 중에 검사대상자 또는 법정대리인이 검사대상물의 폐기를 요청하는 경우에는 이에 응하여야 한다.
④ 유전자검사기관등은 검사대상물의 폐기에 관한 사항을 기록·보관하여야 한다.
⑤ 유전자검사기관등은 휴업·폐업 그 밖에 부득이한 사정으로 인하여 검사대상물을 보존할 수 없는 경우에는 보건복지부령이 정하는 바에 따라 검사대상물을 처리 또는 이관하여야 한다.
⑥ 검사대상물의 폐기 절차 및 방법, 검사대상물의 폐기에 관한 사항의 기록·보관 및 제5항의 규정에 의한 검사대상물의 처리 또는 이관에 관하여 필요한 사항은 보건복지부령으로 정한다.
제29조 (기록의 관리 및 열람)
① 유전자검사기관 등은 다음 각호의 서류를 보건복지부령이 정하는 바에 따라 보존하여야 한다.
1. 제26조의 규정에 의한 동의서
2. 유전자검사 결과
3. 제27조제3항의 규정에 의한 검사대상물의 제공에 관한 기록
② 유전자검사기관 등은 검사대상자 또는 법정대리인이 제1항 각호의 규정에 의한 기록의 열람 또는 사본의 교부를 요청하는 경우에는 이에 응하여야 한다.
③ 제2항의 규정에 의한 기록의 열람 또는 사본의 교부에 관한 신청절차 및 서식 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제30조 (유전자검사기관 등의 준수사항)
① 유전자검사기관 등은 다음 각호의 사항을 준수하여야 한다.
1. 제26조의 규정에 의한 서면동의 내용
2. 유전정보의 보호
3. 그 밖에 제1호 및 제2호에 준하는 사항으로서 생명윤리 및 안전의 확보를 위하여 보건복지부령이 정하는 사항
② 유전자검사기관 등은 유전자검사에 관하여 허위표시 또는 과대광고를 하여서는 아니된다.
③ 제2항의 규정에 의한 허위표시 또는 과대광고의 범위 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제5장 유전정보 등의 보호 및 이용
제31조 (유전정보에 의한 차별금지)
① 누구든지 유전정보를 이유로 하여 교육·고용·승진·보험 등 사회활동에 있어서 다른 사람을 차별하여서는 아니된다.
② 다른 법률에 특별한 규정이 있는 경우를 제외하고는 누구든지 타인에게 유전자검사를 받도록 강요하거나 유전자검사의 결과를 제출하도록 강요하여서는 아니된다.
제32조 (유전자은행의 허가 및 신고)
① 유전자은행을 개설하고자 하는 자는 대통령령이 정하는 바에 따라 보건복지부장관의 허가를 받아야 한다. 다만, 국가기관이 직접 유전자은행을 개설하고자 하는 경우를 제외한다.
② 제1항의 규정에 불구하고 다른 법령에 따라 중앙행정기관의 장으로부터 연구비지원의 승인을 얻어 유전자은행을 개설하고자 하는 경우에는 당해 중앙행정기관의 장으로부터 연구비지원의 승인을 얻은 때에 보건복지부장관의 허가를 받은 것으로 본다. 이 경우 해당 중앙행정기관의 장은 미리 보건복지부장관과 협의하여야 한다.
③ 제1항의 규정에 따라 개설된 유전자은행이 개설장소를 이전하거나 그 개설에 관한 허가사항 중 대통령령이 정하는 중요한 사항을 변경하고자 하는 경우에는 보건복지부령이 정하는 바에 따라 보건복지부장관에게 신고하여야 한다.
④ 유전자은행의 장은 유전자은행의 업무를 폐업하거나 휴업하고자 하는 경우에는 보건복지부령이 정하는 바에 따라 보건복지부장관에게 신고하여야 한다.
⑤ 제1항의 규정에 의한 유전자은행의 시설·장비 기준 및 허가절차 그 밖에 필요한 사항은 대통령령으로 정한다.
제33조 (유전정보 등의 제공)
① 유전자은행으로부터 유전정보 등을 이용하고자 하는 자는 유전정보 등의 이용계획서를 유전자은행의 장에게 제출하여야 한다.
② 유전자은행의 장은 제1항의 규정에 따라 제출된 이용계획서에 대하여 제9조의 규정에 의한 기관위원회의 심의를 거쳐 유전정보 등의 제공 여부를 결정하고, 그 결과를 보건복지부장관에게 보고하여야 한다.
③ 유전정보 등의 이용계획서 기재내용, 제출절차 그 밖에 유전정보 등의 제공·관리에 관하여 필요한 사항은 보건복지부령으로 정한다.
제34조 (유전자은행의 장의 준수사항)
① 유전자은행의 장은 제33조의 규정에 따라 유전정보 등을 타인에게 제공함에 있어 개인정보를 포함시켜서는 아니된다.
② 유전자은행의 장은 유전정보 등을 타인에게 제공하는 경우에는 무상으로 하여야 한다. 다만, 유전자은행의 장은 유전정보 등의 보관 및 제공에 필요한 경비를 보건복지부령이 정하는 바에 따라 요구할 수 있다.
제35조 (유전정보등의 보호)
① 유전자은행의 장 또는 그 종사자는 직무상 얻거나 알게 된 유전정보 등을 정당한 사유 없이 타인에게 제공하거나 부당한 목적으로 사용하여서는 아니된다.
② 의료기관은 의료법 제20조제1항 단서의 규정에 따라 환자외의 자에게 제공하는 의무기록 및 진료기록 등에 유전정보를 포함시켜서는 아니된다. 다만, 해당 환자와 동일한 질병의 진단 및 치료를 목적으로 다른 의료기관의 요청이 있고 개인정보의 보호에 관한 조치를 한 경우에는 그러하지 아니하다.
제6장 유전자치료
제36조 (유전자치료)
① 누구든지 유전자치료는 다음 각호의 1에 해당되는 경우 외에는 하여서는 안된다.
1. 유전질환·암·후천성면역결핍증 그 밖에 생명을 위협하거나 심각한 장애를 초래하는 질병의 치료
2. 현재 이용 가능한 치료법이 없거나 유전자치료의 효과가 이용 가능한 다른 치료법과 비교하여 현저히 우수할 것으로 예측되는 치료
3. 그 밖에 심의위원회의 심의를 거쳐 보건복지부장관이 정하는 질병의 예방이나 치료를 위하여 필요하다고 인정하는 경우
② 제1항의 규정에 불구하고 정자·난자·배아 또는 태아에 대하여 유전자치료를 하여서는 안된다.
제37조 (유전자치료기관)
① 유전자치료를 하고자 하는 의료기관은 보건복지부장관에게 신고하여야 한다. 대통령령이 정하는 중요한 사항을 변경하는 경우에도 또한 같다.
② 제1항의 규정에 따라 보건복지부장관에게 신고한 의료기관(이하 “유전자치료기관”이라 한다)은 유전자치료를 하고자 하는 환자에 대하여 다음 각호의 사항에 관하여 미리 설명한 후 서면동의를 얻어야 한다.
1. 치료의 목적
2. 예측되는 치료결과 및 그 부작용
3. 그 밖에 보건복지부령이 정하는 사항
③ 유전자치료기관의 신고요건 및 절차, 동의서의 서식 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제7장 감독
제38조 (보고와 조사 등)
① 보건복지부장관은 생명윤리 및 안전의 확보와 관련하여 필요하다고 인정할 때에는 배아생성의료기관·배아연구기관·유전자검사기관 등·유전자치료기관(이하 “피감독기관”이라 한다) 또는 그 종사자에 대하여 보건복지부령이 정하는 바에 따라 이 법의 시행에 관하여 필요한 보고 또는 자료의 제출을 명할 수 있고, 생명과학기술의 연구·개발·이용으로 인하여 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있는 때에는 그 연구·개발·이용의 중단을 명하거나 그 밖에 필요한 조치를 할 수 있다.
② 보건복지부장관은 이 법이 정하고 있는 사항의 이행 또는 위반 여부의 확인을 위하여 필요하다고 인정할 때에는 관계공무원으로 하여금 피감독기관 또는 그 사무소 등에 출입하여 그 시설 또는 장비, 관계장부나 서류 그 밖의 물건을 검사하게 하거나 관계인에 대한 질문을 하게 할 수 있으며, 시험에 필요한 시료를 최소분량에 한하여 수거하게 할 수 있다. 이 경우 관계공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 내보여야 한다.
③ 피감독기관 또는 그 종사자는 제1항 및 제2항의 규정에 의한 명령·검사·질문 등에 대하여 정당한 사유가 없는 한 이에 응하여야 한다.
제39조 (폐기명령)
보건복지부장관은 피감독기관 또는 그 종사자에 대하여 제13조, 제14조, 제15조제1항, 제16조제2항, 제17조 내지 제19조, 제20조제1항·제4항, 제22조제1항 또는 제23조의 규정을 위반하여 생성·보관 또는 제공된 배아 또는 체세포복제배아 및 제24조제1항, 제25조, 제26조제1항 내지 제3항, 제27조제1항·제2항·제4항, 제28조제2항·제3항 또는 제32조제1항·제2항의 규정을 위반하여 채취·보관 또는 제공된 검사대상물을 폐기할 것을 명할 수 있다. 이 경우 폐기의 절차 및 방법에 관하여는 제16조제4항 또는 제28조제6항의 규정을 준용한다.
제40조 (개선명령)
보건복지부장관은 피감독기관에 대하여 그 시설·인력 등이 제14조제2항·제18조·제23조 또는 제32조제5항의 규정에서 정하는 시설기준 등에 적합하지 아니하여 연구·채취·보관 또는 배아의 생성 등을 하는 경우에 생명윤리나 안전에 중대한 위해가 발생하거나 발생할 우려가 있다고 인정하는 때에는 그 시설의 개선을 명하거나 당해 시설의 전부 또는 일부의 사용을 금지할 것을 명할 수 있다.
제41조 (허가 등의 취소와 업무의 정지)
① 보건복지부장관은 배아생성의료기관·배아연구기관·유전자검사기관·유전자은행·유전자치료기관이 다음 각호의 1에 해당하는 때에는 그 지정·등록 또는 허가를 취소하거나 1년 이내의 기간을 정하여 그 업무의 전부 또는 일부의 정지를 명할 수 있다.
1. 제9조제1항·제3항, 제10조제1항·제3항, 제11조 내지 제14조, 제15조제1항·제3항, 제16조제2항·제3항, 제17조, 제19조제1항, 제20조, 제22조, 제24조제2항·제4항, 제25조, 제26조제1항 내지 제3항·제5항, 제27조, 제28조제2항 내지 제5항, 제29조제1항·제2항, 제32조제3항·제4항, 제33조제2항, 제35조, 제36조 또는 제37조제1항 후단·제2항의 규정을 위반한 때
2. 제21조·제30조 또는 제34조의 규정에 의한 준수사항을 이행하지 아니한 때
3.제38조제1항·제39조 또는 제40조의 규정에 의한 명령을 이행하지 아니한 때
4. 제38조제2항의 규정에 의한 검사·질문·수거에 불응한 때
② 제1항의 규정에 의한 행정처분의 세부기준은 그 위반행위의 유형과 위반의 정도 등을 고려하여 보건복지부령으로 정한다.
제42조 (청문)
보건복지부장관은 제41조제1항의 규정에 따라 지정·등록 또는 허가를 취소하고자 하는 경우에는 청문을 실시하여야 한다.
제43조 (과징금)
① 보건복지부장관은 배아생성의료기관 또는 유전자치료기관이 다음 각호의 1에 해당하여 업무정지처분을 하여야 할 경우로서 그 업무정지가 당해 사업의 이용자에게 심한 불편을 주거나 그 밖에 공익을 해할 우려가 있는 때에는 대통령령이 정하는 바에 따라 그 업무정지처분에 갈음하여 2억원 이하의 과징금을 부과할 수 있다.
1. 제14조, 제15조제1항·제3항, 제16조제2항·제3항 또는 제36조의 규정을 위반한 때
2. 제21조의 규정에 의한 준수사항을 위반한 때
3.제38조제1항·제39조 또는 제40조의 규정에 의한 명령을 이행하지 아니한 때
4. 제38조제2항의 규정에 의한 검사·질문·수거에 불응한 때
② 제1항의 규정에 따라 과징금을 부과하는 위반행위의 종별과 정도 등에 따른 과징금의 금액 그 밖에 필요한 사항은 보건복지부령으로 정한다.
③ 보건복지부장관은 제1항의 규정에 의한 과징금을 납부하여야 할 자가 납부기한까지 이를 납부하지 아니하는 때에는 국세체납처분의 예에 따라 이를 징수한다.
제44조 (수수료)
보건복지부장관은 이 법의 규정에 따라 지정·등록·허가·승인을 받고자 하거나 신고를 하는 자 또는 그 내용을 변경하고자 하는 자로 하여금 보건복지부령이 정하는 바에 따라 수수료를 납부하게 할 수 있다.
제8장 보칙
제45조 (성체줄기세포연구의 지원)
국가 또는 지방자치단체는 성체줄기세포의 연구를 육성하기 위하여 필요한 재정지원을 할 수 있다.
제46조 (국고보조)
보건복지부장관은 생명과학기술에서의 생명윤리 및 안전의 확보에 이바지할 수 있는 연구사업 및 교육의 육성·지원을 위하여 대통령령이 정하는 바에 따라 해당 단체·연구기관·생명과학관련종사자 등에게 필요한 연구비의 전부 또는 일부를 보조할 수 있다.
제47조 (위임 및 위탁 등)
① 보건복지부장관은 이 법에 의한 권한의 일부를 대통령령이 정하는 바에 따라 소속기관의 장에게 위임할 수 있다.
② 보건복지부장관은 대통령령이 정하는 바에 따라 다음 각호의 1에 해당하는 업무의 일부를 관계 전문기관 또는 단체에게 위탁할 수 있다.
1. 제14조의 규정에 의한 배아생성의료기관의 관리에 관한 업무
2. 제18조의 규정에 의한 배아연구기관의 관리에 관한 업무
3. 제24조의 규정에 의한 유전자검사기관의 관리에 관한 업무
4. 제32조의 규정에 의한 유전자은행의 관리에 관한 업무
5. 제37조의 규정에 의한 유전자치료기관의 관리에 관한 업무
③ 보건복지부장관은 제2항의 규정에 따라 관계 전문기관 또는 단체에게 관리업무를 하게 한 때에는 그 관리에 필요한 예산을 보조할 수 있다.
제48조 (비밀누설 등의 금지)
피감독기관 또는 그 종사자나 업무에 종사하였던 자는 그 직무상 알게 된 비밀을 누설하거나 도용(도용)하여서는 아니된다.
제9장 벌칙
제49조 (벌칙)
① 제11조제1항의 규정을 위반하여 체세포복제배아를 자궁에 착상시키거나 착상된 상태를 유지 또는 출산한 자는 10년 이하의 징역에 처한다.
② 제1항의 미수범은 처벌한다.
제50조 (벌칙)
제12조제1항의 규정을 위반하여 인간의 배아를 동물의 자궁에 착상시키거나 동물의 배아를 인간의 자궁에 착상시킨 자 또는 동조제3항의 규정을 위반하여 동조제2항 각호의 1에 해당하는 행위로부터 생성된 배아를 인간 또는 동물의 자궁에 착상시킨 자는 5년 이하의 징역에 처한다.
제51조 (벌칙)
① 다음 각호의 1에 해당하는 자는 3년 이하의 징역에 처한다.
1.제11조제2항의 규정을 위반하여 체세포복제배아를 자궁에 착상시키거나 착상된 상태를 유지 또는 출산하는 행위를 유인 또는 알선한 자
2. 제12조제2항 각호의 1에 해당하는 행위를 한 자
3. 제13조제1항의 규정을 위반하여 임신 외의 목적으로 배아를 생성한 자
4. 제13조제2항 각호의 1에 해당하는 행위를 한 자
5. 제13조제3항의 규정을 위반하여 금전 또는 재산상 이익 그 밖에 반대급부를 조건으로 정자 또는 난자를 제공하거나 이를 이용한 자
6. 제22조제1항의 규정을 위반하여 희귀·난치병의 치료를 위한 연구목적 외에 체세포핵이식행위를 한 자
7. 제48조의 규정을 위반하여 비밀을 누설하거나 도용한 자
②제17조의 규정을 위반하여 잔여배아를 이용한 자는 3년 이하의 징역 또는 5천만 원 이하의 벌금형에 처한다.
③ 제1항제1호의 미수범은 처벌한다.
제52조 (벌칙)
다음 각호의 1에 해당하는 자는 2년 이하의 징역 또는 3천만 원 이하의 벌금에 처한다.
1. 제13조제3항의 규정을 위반하여 금전 또는 재산상 이익 그 밖에 반대급부를 조건으로 정자 또는 난자를 제공하도록 유인하거나 알선한 자
2. 제15조제1항의 규정을 위반하여 배아생성에 관한 서면동의를 얻지 아니하고 정자 또는 난자를 채취한 자
3. 제25조의 규정을 위반하여 유전자검사를 한 자
4. 제26조제1항 내지 제3항의 규정을 위반하여 유전자검사에 관한 서면동의를 얻지 아니하고 검사대상물을 채취하거나 동의서를 첨부하지 아니하고 유전자검사를 의뢰한 자
5. 제31조제1항 또는 제2항의 규정을 위반하여 유전정보를 이용하여 다른 사람을 차별한 자 또는 다른 사람에게 유전자검사를 받기를 강요하거나 유전자검사의 결과를 제출하도록 강요한 자
6. 제34조의 규정을 위반하여 유전정보 등을 타인에게 제공함에 있어 개인정보를 포함시킨 자
7. 제35조제1항의 규정을 위반하여 유전정보 등을 정당한 사유 없이 타인에게 제공하거나 부당한 목적으로 사용한 자
8. 제36조제1항 또는 제2항의 규정을 위반하여 유전자치료를 한 자
9. 제39조의 규정에 의한 폐기명령을 위반한 자
제53조 (벌칙)
다음 각호의 1에 해당하는 자는 1년 이하의 징역 또는 2천만 원 이하의 벌금에 처한다.
1. 제14조의 규정을 위반하여 배아생성의료기관으로 지정받지 아니하고 인간의 정자 또는 난자를 채취·보관하거나 배아를 생성한 자
2. 제16조제2항 또는 제3항의 규정을 위반하여(제20조제4항에서 준용하는 경우를 포함한다) 배아를 보건복지부령이 정하는 바에 따라 폐기하지 아니하거나 배아의 폐기에 관한 사항을 기록·보관하지 아니한 자
3. 제18조의 규정을 위반하여 배아연구기관으로 등록하지 아니하고 잔여배아를 연구한 자
4. 제19조제1항의 규정을 위반하여(제23조제2항에서 준용하는 경우를 포함한다) 보건복지부장관의 승인을 얻지 아니하고 배아연구를 한 자
5. 제20조제1항 또는 제3항의 규정을 위반하여 유상으로 잔여배아를 제공하거나 잔여배아의 보관 및 제공 등에 관한 사항을 보건복지부령이 정하는 바에 따라 보건복지부장관에게 보고하지 아니한 자
6. 제23조제1항의 규정을 위반하여 등록하지 아니하고 체세포복제배아를 생성하거나 연구한 자
7. 제30조제1항의 유전자검사기관등의 준수사항을 위반하거나 동조제2항의 규정을 위반하여 유전자검사에 대하여 허위표시 또는 과대광고를 한 자
8. 제32조제1항의 규정을 위반하여 허가를 받지 아니하고 유전자은행을 개설한 자
9. 제40조의 규정에 의한 개선명령 등을 위반한 자
제54조 (양벌규정)
법인의 대표자나 법인 또는 개인의 대리인·사용인, 그 밖의 종업원이 그 법인 또는 개인의 업무에 관하여 제49조 내지 제53조의 규정에 해당하는 위반행위를 한 때에는 그 행위자를 벌하는 외에 그 법인 또는 개인에 대하여도 해당 조의 벌금형을 과한다.
제55조 (과태료)
① 다음 각호의 1에 해당하는 자는 500만 원 이하의 과태료에 처한다.
1. 제24조제1항·제2항 또는 제4항의 규정에 의한 신고를 하지 아니한 자
2. 제28조제2항 내지 제5항의 규정을 위반한 자
3. 제29조제1항 각호의 서류를 보존하지 아니하거나 동조제2항의 규정에 의한 기록의 열람 또는 사본의 교부를 거부한 자
4. 제32조제3항 또는 제4항의 규정에 의한 신고를 하지 아니한 자
5. 제35조제2항의 규정을 위반하여 환자의 유전정보를 포함한 기록을 환자 외의 자에게 제공한 자
6. 제37조제1항의 규정을 위반하여 신고하지 아니하고 유전자치료를 한 자
② 제1항의 규정에 의한 과태료는 대통령령이 정하는 바에 따라 보건복지부장관이 부과·징수한다.
③ 제2항의 규정에 의한 과태료처분에 불복이 있는 자는 그 처분의 고지를 받은 날부터 30일 이내에 보건복지부장관에게 이의를 제기할 수 있다.
④ 제2항의 규정에 의한 과태료처분을 받은 자가 제3항의 규정에 따라 이의를 제기한 때에는 보건복지부장관은 지체 없이 관할법원에 그 사실을 통보하여야 하며, 그 통보를 받은 관할법원은 비송사건절차법에 의한 과태료의 재판을 한다.
⑤ 제3항의 규정에 의한 기간 이내에 이의를 제기하지 아니하고 과태료를 납부하지 아니한 때에는 국세체납처분의 예에 따라 이를 징수한다.
부칙 <제7150호,2004.1.29>
① (시행일) 이 법은 2005년 1월 1일부터 시행한다. 다만 제11조, 제12조, 제49조, 제50조 및 제51조제1항제1호·제2호의 규정은 공포한 날부터 시행한다.
② (잔여배아의 연구에 관한 경과조치) 다음 각호의 요건에 해당하는 잔여배아는 발생학적으로 원시선이 나타나기 전까지에 한하여 제17조 각호의 1의 목적으로 이용할 수 있다.
1. 이 법 시행 전에 생성되었을 것
2. 생성 후 5년이 지났을 것
3. 동의권자의 동의를 얻을 것. 다만, 소재불명 등으로 동의권자의 동의를 얻을 수 없는 경우를 제외한다.
③ (체세포복제배아의 연구에 관한 경과조치) 이 법 시행 당시 제17조제2호의 규정에 의한 연구목적으로 체세포복제배아의 연구를 하고 있는 자는 다음 각호의 요건에 해당하는 경우에는 보건복지부장관의 승인을 얻어 당해 연구를 계속할 수 있다.
1. 3년 이상 체세포복제배아에 관한 연구를 계속하였을 것
2. 관련 학술지에 1회 이상 체세포복제배아에 관한 연구논문을 게재한 실적이 있을 것
④ (다른 법률의 개정) 장기 등 이식에 관한 법률 중 다음과 같이 개정한다.
제2장의 제목 중 “생명윤리위원회”를 “장기 등 이식윤리위원회”로 한다.
제7조의 제목 “(생명윤리위원회)”를 “(장기 등 이식윤리위원회)”로 하고, 동조제1항 중 “생명윤리위원회”를 “장기 등 이식윤리위원회”로 한다.
부칙(정부조직법) <제7413호,2005.3.24>
제1조 (시행일) 이 법은 공포한 날부터 시행한다. 다만, 다음 각호의 사항은 각호의 구분에 의한 날부터 시행한다.
1. 제26조…부칙 제2조 내지 제4조의 규정은 이 법 공포 후 3월 이내에 제42조의 개정규정에 의한 여성가족부의 조직에 관한 대통령령이 시행되는 날
2. 생략
제2조 생략
제3조 (다른 법률의 개정) ①내지 ⑤생략
⑥ 생명윤리 및 안전에 관한 법률 일부를 다음과 같이 개정한다.
제7조제3항제1호 중 “여성부장관”을 “여성가족부장관”으로 한다.
⑦ 내지 ⑭ 생략
제4조 생략

[일부개정 2002.12.26 법률 제06811호]
제1조 (목적)
이 법은 뇌연구 촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성·발전시키고 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 기여함을 목적으로 한다.
제2조 (정의)
이 법에서 사용하는 용어의 정의는 다음과 같다.<개정 2001.1.29>
1. “뇌연구”라 함은 뇌과학, 뇌의약학, 뇌공학 및 이와 관련된 모든 분야에 대한 연구를 말한다.
2. “뇌과학”이라 함은 뇌의 신경생물학적 구조 및 인지, 사고, 언어심리 및 행동 등의 고등신경 정신활동에 대한 포괄적인 이해를 위한 기초 학문을 말한다.
3. “뇌의약학”이라 함은 뇌의 구조 및 기능상의 결함과 뇌의 노화 등에 기인한 신체적·정신적 질환 및 장애에 대한 원인 규명과 이의 치료, 예방 등에 관한 학문을 말한다.
4. “뇌공학”이라 함은 뇌의 고도의 지적 정보처리 구조와 기능을 이해하고 이의 공학적 응용을 위한 이론 및 기술에 관한 학문을 말한다.
5. “관계중앙행정기관”이라 함은 교육인적자원부, 과학기술부, 산업자원부, 정보통신부, 보건복지부를 말한다.
제3조 (적용범위)
뇌연구에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 의한다.
제4조 (정부 등의 책무)
① 정부는 뇌연구 촉진을 지원하기 위한 시책을 강구하고, 이를 적극적으로 추진하여야 한다.
② 대학·연구기관·기업 및 개인 등 뇌연구를 수행하는 자는 제1항의 규정에 의한 시책에 적극 협력하여야 한다.
제5조 (뇌연구촉진기본계획의 수립)
① 관계중앙행정기관의 장은 소관별로 뇌연구 촉진을 위한 계획과 전년도 추진실적을 과학기술부장관에게 제출하여야 한다.
② 과학기술부장관은 제1항의 규정에 의하여 관계중앙행정기관의 장이 제출한 소관사항에 관한 뇌연구 촉진을 위한 계획을 종합·조정한 후 제7조의 규정에 의한 뇌연구촉진심의회의 심의를 거쳐 뇌연구촉진기본계획(이하 “기본계획”이라 한다)을 수립하고, 이를 관계중앙행정기관의 장에게 통보하여야 한다. 기본계획을 변경하는 경우에도 또한 같다.
③ 제2항의 규정에 의한 기본계획에는 다음의 사항이 포함되어야 한다.
1. 뇌연구의 중장기적 목표 및 내용
2. 뇌연구에 필요한 투자재원의 확대방안 및 추진계획
3. 교육·산업·보건복지·정보통신·과학기술 등 각 분야의 뇌연구에 관한 계획
4. 뇌연구에 필요한 인력자원의 개발 및 효율적인 활용에 관한 종합계획
5. 뇌연구 결과의 이용과 보전에 관한 계획
6. 기타 뇌연구 촉진을 위하여 필요한 중요사항
제6조 (뇌연구촉진시행계획의 수립)
① 관계중앙행정기관의 장은 기본계획에 따라 매년 뇌연구촉진시행계획(이하 “시행계획”이라 한다)을 수립하고 이를 시행하여야 한다.
② 관계중앙행정기관의 장은 시행계획을 수립하고자 할 때에는 미리 과학기술부장관과 협의하여야 한다.
③ 과학기술부장관은 필요한 때에는 시행계획의 수립에 필요한 기본지침을 작성하여 관계중앙행정기관의 장에게 통보할 수 있다.
④ 시행계획의 수립 및 그 시행에 관하여 필요한 사항은 대통령령으로 정한다.
제7조 (뇌연구촉진심의회)
① 뇌연구에 관한 중요사항을 심의하기 위하여 과학기술부장관소속하에 뇌연구촉진심의회(이하 “심의회”라 한다)를 둔다.
② 심의회는 다음 각호의 사항을 심의한다.
1. 기본계획의 수립·변경과 이에 따른 중요정책의 수립 및 그 집행의 조정
2. 뇌연구관련 예산의 확대방안에 관한 사항
3. 뇌연구 분야 인력개발 및 교류에 관한 종합계획과 이에 따른 중요정책, 인력활용지침의 수립 및 집행의 조정
4. 뇌연구 결과의 이용과 보전을 위한 계획의 수립 및 그 집행의 조정
5. 기타 뇌연구에 관하여 위원장이 필요하다고 인정하는 사항
③ 심의회는 위원장 1인을 포함한 20인 이내의 위원으로 구성한다.
④ 위원장은 과학기술부차관이 되고 위원은 위원장이 임명하는 관계중앙행정기관의 공무원과 학계, 연구기관, 산업계에 종사하는 뇌연구 전문가로서 위원장이 위촉하는 자(이하 “위촉위원”이라 한다)가 된다.
<개정 2002.12.26>
⑤ 삭제 <2002.12.26>
⑥ 심의회의 구성 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
제8조 (뇌연구실무추진위원회)
① 심의회에 상정할 안건의 작성 및 심의회에서 위임한 업무를 처리하게 하기 위하여 과학기술부장관소속하에 뇌연구실무추진위원회(이하 “추진위원회”라 한다)를 둔다.
② 추진위원회는 관계중앙행정기관의 공무원 및 학계, 연구기관, 산업계에 종사하는 뇌연구 전문가로 구성한다.
③ 추진위원회의 구성 및 운영에 관하여 필요한 사항은 대통령령으로 정한다.
제9조 (뇌연구 투자의 확대)
① 정부는 제5조제3항제2호의 투자재원의 확대방안 및 추진계획에 따라 예산의 범위 안에서 뇌연구투자의 확대를 위하여 최대한 노력하여야 한다.
② 과학기술부장관은 매년 뇌연구투자확대계획을 작성하여 심의회의 심의를 거친 후, 이를 국가과학기술자문회의법에 의한 국가과학기술자문회의에 보고하여야 한다.
제10조 (연구 및 기술협력)
정부는 뇌연구 및 그 기술개발에 관한 국제협력의 증진에 노력하고 선진기술의 도입을 위한 전문인력 파견, 해외 전문인력 유치 등의 방안을 강구하여야 한다.
제11조 (공동연구 및 학술활동 촉진)
정부는 뇌연구 및 기술개발의 효율적 육성을 위하여 학계, 연구기관 및 산업계간의 공동연구를 촉진하고 관련 학회 및 학술활동을 적극 지원하여야 한다.
제12조 (관계산업체에 대한 지원)
정부는 뇌연구 결과의 산업화를 촉진하기 위하여 신기술제품의 생산을 지원할 수 있다.
제13조 (기술정보의 수집과 보급)
정부는 뇌연구에 관한 정보를 수집하여 이를 관계기관에 보급하도록 노력하여야 한다.
제14조 (뇌연구추진시책강구)
관계중앙행정기관의 장은 뇌연구를 효율적으로 촉진하기 위하여 다음과 같은 시책을 강구한다. <개정 2001.1.29>
1. 교육인적자원부장관: 뇌분야의 연구를 촉진시키기 위한 전문 인력의 양성과 뇌과학 기초분야의 연구지원
2. 과학기술부장관: 기본계획의 수립과 시행계획 수립의 지원 및 조정, 뇌 관련 기초기술 및 첨단기술의 개발, 유용한 연구결과의 이용 및 보전을 위한 연구의 지원, 공공적 성격의 뇌연구 지원체제의 육성
3. 산업자원부장관: 뇌연구 결과를 생산 및 산업공정에 효율적으로 응용하기 위한 응용기술의 개발과 개발기술의 산업화 촉진
4. 정보통신부장관: 뇌연구 결과의 정보·통신 등 분야에의 응용기술의 개발 및 개발기술의 산업화 촉진
5. 보건복지부장관: 보건·의료 등에 관련되는 뇌의약연구와 그 결과의 응용기술 개발 및 개발기술의 산업화 촉진
제15조 (임상 및 검정)
① 정부는 뇌연구 관련 제품에 대한 임상 및 검정체제를 확립한다.
② 제1항의 임상 및 검정체제 확립에 관하여 필요한 사항은 대통령령으로 정한다.
제16조 (실험지침의 작성·시행 등)
① 정부는 뇌연구 및 그 산업화의 촉진을 위한 실험지침을 작성·시행하여야 한다.
② 제1항의 실험지침에서는 뇌연구와 그 산업화 과정에서 예견될 수 있는 생물학적 위험성, 인간에 미치는 악영향 및 윤리적 문제 발생의 사전방지에 필요한 조치 및 안전기준이 마련되어야 한다.
제17조 (연구소의 설립)
① 뇌분야에 관한 연구 및 그 이용과 지원에 관한 기능을 수행하고 뇌분야에서의 학계, 연구기관 및 산업계간의 상호유기적 협조체제를 유지·발전시키기 위하여 정부가 출연하는 연구소를 설립할 수 있다.
② 제1항의 규정에 의한 연구소는 특정연구기관육성법의 적용을 받는 특정연구기관으로 한다.
부칙 <제5547호,1998.6.3>
이 법은 공포한 날부터 시행한다.
부칙(정부조직법) <제6400호,2001.1.29>
제1조 (시행일) 이 법은 공포한 날부터 시행한다. <단서 생략>
제2조 생략
제3조 (다른 법률의 개정) ①내지 <59>생략
<60>뇌연구촉진법 중 다음과 같이 개정한다.
제2조 제5호 중 “교육부”를 “교육인적자원부”로 한다.
제14조제1호중 “교육부장관”을 “교육인적자원부장관”으로 한다.
<61>내지 <79>생략
제4조 생략
부칙 <제6811호,2002.12.26>
이 법은 공포한 날부터 시행한다.

[제정 2001.3.28 법률 6448호]
제1장 총칙
제1조 (목적)
이 법은 바이오 안전성에 관한 카르타헤나 의정서(이하 “의정서”라 한다)의 시행과 유전자변형생물체의 개발·생산·수입·수출·유통 등에 관한 안전성의 확보를 위하여 필요한 사항을 정함으로써 유전자변형생물체로 인한 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 미치는 위해를 사전에 방지하고 국민생활의 향상 및 국제협력을 증진함을 목적으로 한다.
제2조 (정의)
이 법에서 사용하는 용어의 정의는 다음과 같다.
1. “유전자변형생물체”라 함은 다음 각목의 현대생명공학기술을 이용하여 얻어진 새롭게 조합된 유전물질을 포함하고 있는 생물체를 말한다.
가. 인위적으로 유전자를 재조합하거나 유전자를 구성하는 핵산을 세포 또는 세포내 소기관으로 직접 주입하는 기술
나. 분류학에 의한 과의 범위를 넘는 세포융합으로서 자연 상태의 생리적 증식이나 재조합이 아니고 전통적인 교배나 선발에서 사용되지 아니하는 기술
2. “환경 방출”이라 함은 유전자변형생물체를 시설·장치 그 밖의 구조물을 이용하여 밀폐하지 아니하고 의도적으로 자연환경에 노출되게 하는 것을 말한다.
3. “관계중앙행정기관”이라 함은 유전자변형생물체의 개발·생산·수입·수출·판매·운반·보관 등(이하 “수출입 등”이라 한다)의 업무에 따라 대통령령이 정하는 기준에 의하여 해당되는 중앙행정기관을 말한다.
제3조 (적용제외)
이 법은 인체용 의약품으로 사용되는 유전자변형생물체에 대하여는 이를 적용하지 아니한다.
제4조 (다른 법률과의 관계)
유전자변형생물체를 수출입 등을 함에 있어서 그 취급 및 안전관리에 관하여 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법이 정하는 바에 의한다.
제5조 (국가 등의 책무)
국가와 지방자치단체는 유전자변형생물체로 인한 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 대한 위해를 방지하기 위하여 필요한 시책을 강구하여야 한다.
제6조 (국가책임기관 등)
① 의정서 제19조의 규정에 의한 국가연락기관은 외교통상부로, 국가책임기관은 산업자원부로 한다.
② 국가책임기관의 장은 대통령령이 정하는 바에 따라 국가책임기관으로서 의정서의 이행에 관하여 필요한 업무를 수행한다.
제7조 (유전자변형생물체 안전관리계획의 수립)
① 관계중앙행정기관의 장은 소관별로 유전자변형생물체안전관리계획(이하 “안전관리계획”이라 한다)을 수립·시행하여야 한다.
② 안전관리계획에는 다음 각호의 사항이 포함되어야 한다.
1. 유전자변형생물체의 수출입 등에 따른 안전관리의 기본방침에 관한 사항
2. 유전자변형생물체를 취급하는 시설 및 작업종사자의 안전에 관한 사항
3. 유전자변형생물체에 관한 기술개발 및 지원에 관한 사항
4. 그 밖에 유전자변형생물체의 안전관리와 관련한 중요사항
③ 관계중앙행정기관의 장이 안전관리계획을 수립·시행하고자 하는 경우에는 미리 제31조의 규정에 의한 바이오안전성위원회의 심의를 거쳐야 한다.
④ 관계중앙행정기관의 장은 안전관리계획의 시행을 위한 세부시행계획을 수립·시행하여야 하며, 이를 위하여 필요한 경우에는 안전관리지침을 정하여 고시할 수 있다.
제2장 유전자변형생물체의 수출입 등 및 안전관리
제8조 (수입승인 등)
① 유전자변형생물체를 수입(휴대하여 수입하는 경우를 포함한다. 이하 같다)하고자 하는 자는 대통령령이 정하는 바에 따라 관계중앙행정기관의 장의 승인을 얻어야 한다. 승인을 얻은 사항을 변경하고자 하는 경우에도 또한 같다. 다만, 대통령령이 정하는 경미한 사항을 변경하고자 하는 때에는 이를 신고하여야 한다.
② 환경 방출로 사용되는 유전자변형생물체를 수입하고자 하는 자는 제1항의 규정에 불구하고 국가책임기관의 장을 거쳐 관계중앙행정기관의 장에게 수입승인을 신청하여야 한다. 이 경우 국가책임기관의 장 및 관계중앙행정기관의 장은 대통령령이 정하는 바에 따라 의정서 제8조 내지 제10조의 규정에 의한 당해 유전자변형생물체의 국가간 이동에 필요한 절차를 따라야 한다.
③ 제1항 및 제2항의 규정에 의한 승인을 신청하는 자는 당해 유전자변형생물체를 생산 또는 수출하는 자가 작성한 위해성 평가서와 유전자변형생물체를 수출하고자 하는 자의 정부기관이 발행하는 위해성심사서를 제출하여야 한다.
④ 제3항의 규정에 불구하고 유전자변형생물체에 대한 위해성심사서를 발행할 수 있는 정부기관이 없거나 그 밖에 대통령령이 정하는 사유가 있는 경우에는 관계중앙행정기관의 장이 대통령령이 정하는 바에 따라 지정하는 위해성 평가기관(이하 “위해성 평가기관”이라 한다)이 작성한 위해성 평가서를 제출하여야 한다.
⑤ 관계중앙행정기관의 장은 제1항 및 제2항의 규정에 의한 승인신청을 받은 경우에는 당해 유전자변형생물체의 위해성을 심사하고 당해 유전자변형생물체가 국내 생물다양성의 가치에 미칠 사회·경제적 영향을 고려하여 그 승인여부를 결정하여야 한다.
⑥ 관계중앙행정기관의 장은 제5항의 규정에 의한 승인여부를 국가책임기관의 장에게 통보하여야 한다.
⑦ 제3항의 규정에 의한 위해성 평가서의 평가항목·기준 등에 관하여 필요한 사항은 관계중앙행정기관의 장이 정하여 고시한다.
제9조 (시험·연구용 등의 유전자변형생물체의 수입)
① 제8조의 규정에 불구하고 시험·연구용으로 사용하거나 박람회 또는 전시회에 출품하기 위하여 유전자변형생물체를 수입하고자 하는 자는 대통령령이 정하는 바에 따라 관계중앙행정기관의 장의 승인을 얻거나 관계중앙행정기관의 장에게 신고하여야한다.
② 관계중앙행정기관의 장은 제1항의 규정에 의한 승인여부 및 신고내용을 국가책임기관의 장에게 통보하여야 한다.
제10조 (우편물로 수입되는 유전자변형생물체의 수입검사)
① 세관장은 국제우편물에 제8조 또는 제9조의 규정에 의한 승인을 얻지 아니하거나 신고를 하지 아니한 유전자변형생물체가 담기어 있거나 담기어져 있다고 의심이 되는 경우에는 지체 없이 그 사실을 관계중앙행정기관의 장에게 통보하여야 한다.
② 제1항의 규정에 의한 세관장의 통지가 있는 때에는 관계중앙행정기관의 장은 당해 국제우편물을 검사한 후 폐기, 반송 등 적절한 조치를 하여야 한다.
③ 유전자변형생물체가 담겨져 있는 국제우편물을 받은 자는 당해 유전자변형생물체가 제8조 또는 제9조의 규정에 의한 승인을 얻지 아니하거나 신고를 하지 아니한 것임을 안 때에는 지체 없이 관계중앙행정기관의 장에게 이를 신고하고, 관계중앙행정기관의 장이 명하는 바에 따라 이를 처리하여야 한다.
제11조 (수입항구 등의 지정)
① 국가책임기관의 장은 유전자변형생물체의 안전관리를 위하여 필요하다고 인정하는 경우에는 관계중앙행정기관의 장과 협의하여 유전자변형생물체를 수입하는 항구·공항 등을 지정할 수 있다.
② 국가책임기관의 장은 제1항의 규정에 의하여 항구·공항 등을 지정하는 경우에는 지체없이 이를 공고하여야 한다.
제12조 (생산승인 등)
① 유전자변형생물체를 생산하고자 하는 자는 대통령령이 정하는 바에 따라 관계중앙행정기관의 장의 승인을 얻어야 한다. 승인을 얻은 사항을 변경하고자 하는 경우에도 또한 같다. 다만, 대통령령이 정하는 경미한 사항을 변경하고자 하는 때에는 이를 신고하여야 한다.
② 제1항의 규정에 의한 승인을 신청하는 자는 제8조제3항의 규정에 의한 위해성평가서를 제출하여야 한다.
③ 제8조제5항 내지 제7항의 규정은 유전자변형생물체를 생산하고자 하는 경우에 이를 준용한다.
제13조 (위해성 심사절차 및 대행 등)
① 관계중앙행정기관의 장은 제8조제5항 또는 제12조제3항의 규정에 의하여 유전자변형생물체의 위해성 심사를 하는 경우에는 당해 유전자변형생물체가 인체에 미치는 영향에 대하여는 보건복지부장관과, 환경 방출되거나 환경 방출될 우려가 있는 유전자변형생물체의 경우에는 다음 각호에 정하는 기관의 장과 미리 협의하여야 한다.
1. 당해 유전자변형생물체가 자연생태계에 미치는 영향에 대하여는 환경부장관
2. 작물재배환경에 미치는 영향에 대하여는 농림부장관
3. 해양생태계에 미치는 영향에 대하여는 해양수산부장관
② 제8조제5항 또는 제12조제3항의 규정에 의한 위해성 심사의 기준·방법 그 밖에 필요한 사항은 관계중앙행정기관의 장이 이를 정하여 고시한다.
③ 관계중앙행정기관의 장은 제8조제5항 또는 제12조제3항의 규정에 의한 유전자변형생물체의 위해성 심사업무를 대통령령이 정하는 바에 따라 지정하는 자(이하 “위해성심사대행기관”이라 한다)로 하여금 대행하게 할 수 있다.
④ 관계중앙행정기관의 장은 제8조 또는 제12조의 규정에 의하여 유전자변형생물체의 수입 또는 생산승인을 함에 있어서는 미리 당해 유전자변형생물체에 관한 정보를 국민에게 알리고 의견을 수렴하여야 한다.
제14조 (수입 또는 생산의 금지 등)
① 관계중앙행정기관의 장은 다음 각호의 1에 해당하는 유전자변형생물체(제2호의 생물체를 포함한다)의 수입 또는 생산을 금지하거나 제한할 수 있다.
1. 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다고 인정되는 유전자변형생물체
2. 제1호에 해당하는 유전자변형생물체와 교배하여 생산된 생물체
3. 국내 생물다양성의 가치와 관련하여 사회·경제적으로 부정적인 영향을 미치거나 미칠 우려가 있다고 인정되는 유전자변형생물체
② 관계중앙행정기관의 장은 제1항의 규정에 의하여 유전자변형생물체의 수입 또는 생산을 금지하거나 제한하는 경우에는 국가책임기관의 장에게 이를 통보하여야 한다.
③ 국가책임기관의 장은 제1항 각호의 규정에 의하여 수입 또는 생산을 금지하거나 제한하는 생물체의 품목 등에 관하여 필요한 사항을 공고하여야 한다.
제15조 (위해성이 없는 유전자변형생물체)
① 국가책임기관의 장은 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해가 발생할 우려가 없는 유전자변형생물체에 대하여 그 품목 등을 고시하여야 한다.
② 국가책임기관의 장은 제1항의 규정에 의한 유전자변형생물체의 품목 등을 고시함에 있어서는 미리 제31조의 규정에 의한 바이오안전성위원회의 심의를 거쳐야 한다.
③ 제1항의 규정에 의하여 고시된 품목의 유전자변형생물체를 수입 또는 생산하고자 하는 자는 제8조 또는 제12조의 규정에 불구하고 국가책임기관의 장에게 이를 신고하여야 한다.
제16조 (대외무역법에 의한 수입승인 의제 등)
① 제8조 및 제9조의 규정에 의하여 관계중앙행정기관의 장이 수입승인을 하거나 신고를 수리한 유전자변형생물체에 대하여는 대외무역법 제14조제2항의 규정에 의하여 산업자원부장관이 수입승인을 한 것으로 본다.
② 제15조제3항 및 제20조의 규정에 의한 유전자변형생물체를 수입 또는 수출하고자 하는 자가 국가책임기관의 장에게 그 내용을 신고 또는 통보한 유전자변형생물체에 대하여는 대외무역법 제14조제2항의 규정에 의하여 산업자원부장관이 수입 또는 수출에 대한 승인을 한 것으로 본다.
제17조 (승인의 취소)
① 관계중앙행정기관의 장은 다음 각호의 1에 해당하는 경우에는 제8조·제9조 또는 제12조의 규정에 의한 유전자변형생물체의 수입승인 또는 생산승인을 취소할 수 있다. 다만, 제1호 또는 제2호에 해당하는 경우에는 승인을 취소하여야 한다.
1. 수입승인 또는 생산승인을 얻은 유전자변형생물체가 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다는 사실이 밝혀진 경우
2. 속임수 그 밖에 부정한 방법으로 승인을 얻은 경우
3. 수입승인 또는 생산승인을 얻은 유전자변형생물체를 승인을 얻은 용도와 다르게 사용하는 경우
4. 이 법 또는 이 법에 의한 명령이나 처분을 위반하는 경우
5. 그 밖에 대통령령이 정하는 사유에 해당하는 경우
② 관계중앙행정기관의 장은 제1항의 규정에 의하여 승인을 취소한 경우에는 지체 없이 국가책임기관의 장에게 이를 통보하여야 한다.
제18조 (재심사)
① 제8조·제12조 및 제17조제1항제1호의 규정에 의한 처분에 불복이 있는 자는 대통령령이 정하는 바에 따라 관계중앙행정기관의 장에게 재심사를 요청할 수 있다.
② 관계중앙행정기관의 장은 제1항의 규정에 의한 재심사를 요청받은 경우에는 국가책임기관의 장과의 협의 및 제31조의 규정에 의한 바이오안전성위원회의 심의를 거쳐 재심사에 대한 결정을 하여야 한다.
제19조 (폐기처분 등)
① 관계중앙행정기관의 장은 다음 각호의 1에 해당하는 유전자변형생물체의 소유자에 대하여 대통령령이 정하는 바에 따라 일정한 기간을 정하여 당해 유전자변형생물체의 폐기·반송 등을 명할 수 있다.
1. 제8조·제9조 또는 제12조의 규정에 의한 관계중앙행정기관의 장의 승인 또는 변경승인을 얻지 아니하거나 관계중앙행정기관의 장에게 신고를 하지 아니한 유전자변형생물체
2. 제14조의 규정에 의하여 수입 또는 생산이 금지되거나 제한된 유전자변형생물체
3. 제17조의 규정에 의하여 수입승인 또는 생산승인이 취소된 유전자변형생물체
② 관계중앙행정기관의 장은 유전자변형생물체의 소유자가 제1항의 규정에 의한 폐기·반송 등의 명령에 따르지 아니한 경우에는 대통령령이 정하는 바에 따라 당해 유전자변형생물체의 소유자의 부담으로 소속 공무원으로 하여금 이를 직접 폐기·반송 등을 하게 할 수 있다.
③ 관계중앙행정기관의 장은 수입된 유전자변형생물체에 대하여 제1항의 규정에 의한 유전자변형생물체의 폐기·반송 등을 명한 때에는 관세청장에게 그 내용을 통보하여야 한다.
제20조 (수출통보)
유전자변형생물체를 수출하고자 하는 자는 산업자원부장관에게 품목, 수량, 수출국가 등 대통령령이 정하는 사항을 미리 통보하여야 한다.
제21조 (경유신고)
유전자변형생물체를 국내를 경유하여 다른 국가로 수출하고자 하는 자는 국가책임기관의 장에게 품목, 수량, 수출국가, 수입국가 등 대통령령이 정하는 바에 따라 신고하여야 한다.
제22조 (연구시설의 설치·운영허가 등)
① 유전자변형생물체를 개발하거나 이를 이용하는 실험을 실시하는 시설(이하 “연구시설”이라 한다)을 설치·운영하고자 하는 자는 대통령령이 정하는 바에 따라 연구시설의 안전관리 등급별로 관계중앙행정기관의 장의 허가를 받거나 관계중앙행정기관의 장에게 신고를 하여야 한다. 허가받은 사항을 변경하고자 하는 경우에도 허가를 받아야 한다. 다만, 허가받은 사항 중 대통령령이 정하는 경미한 사항을 변경하고자 하는 때에는 대통령령이 정하는 바에 따라 이를 신고하여야 한다.
② 관계중앙행정기관의 장은 제1항의 규정에 의한 연구시설의 설치·운영의 허가여부 및 신고내용을 국가책임기관의 장에게 통지하여야 한다.
③ 제1항의 규정에 의하여 연구시설의 설치·운영에 대한 허가를 받거나 신고를 한 자는 연구시설의 안전관리 등급별로 대통령령이 정하는 바에 따라 유전자변형생물체를 개발하거나 실험을 실시할 수 있다. 다만, 위해가능성이 큰 유전자변형생물체를 개발하거나 실험하는 경우로서 대통령령이 정하는 경우에는 관계중앙행정기관의 장의 승인을 얻어야 한다.
④ 연구시설의 안전관리의 등급 및 설치·운영에 대한 허가기준 등에 관하여 필요한 사항은 대통령령으로 정한다.
제23조 (허가의 취소 등)
① 관계중앙행정기관의 장은 연구시설의 설치·운영의 허가를 받거나 신고를 한 자가 다음 각호의 1에 해당하는 경우에는 그 허가를 취소하거나 1년 이내의 기간을 정하여 그 시설의 운영을 정지하도록 명할 수 있다. 다만, 제1호에 해당하는 경우에는 허가를 취소하여야 한다.
1. 속임수 그 밖에 부정한 방법으로 허가를 받은 경우
2. 제22조제1항 후단의 규정에 의한 변경허가를 받지 아니하고 그 허가내용을 변경한 경우
3. 제22조제3항 단서의 규정에 의한 승인을 얻지 아니하고 개발 또는 실험을 실시한 경우
4. 제22조제4항의 규정에 의한 허가기준에 미달한 경우
② 관계중앙행정기관의 장은 제22조제3항 단서의 규정에 의하여 승인을 얻은 유전자변형생물체의 개발 또는 실험이 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다는 사실이 밝혀진 경우에는 승인을 취소할 수 있다.
제24조 (표시)
① 유전자변형생물체를 개발·생산 또는 수입하는 자는 당해 유전자변형생물체 또는 그 유전자변형생물체의 용기나 포장에 유전자변형생물체의 종류 등 대통령령이 정하는 사항을 표시하여야 한다.
② 누구든지 제1항의 규정에 의한 표시를 허위로 하거나 또는 이를 임의로 변경하거나 삭제하여서는 아니된다.
③ 제1항의 규정에 의한 표시의 방법 그 밖에 필요한 사항은 관계중앙행정기관의 장이 이를 정하여 고시한다.
제25조 (취급관리)
① 유전자변형생물체의 수출입 등을 하는 자는 유전자변형생물체를 취급 또는 관리함에 있어서 밀폐운송 등 대통령령이 정하는 취급관리기준을 준수하여야 한다.
② 제1항의 규정에 의한 취급관리의 방법 그 밖에 필요한 사항은 관계중앙행정기관의 장이 이를 정하여 고시한다.
제26조 (관리·운영기록의 보존)
유전자변형생물체의 수출입 등을 하는 자 및 연구시설을 설치·운영하는 자는 산업자원부령이 정하는 바에 따라 유전자변형생물체의 수출입 등 및 연구시설의 관리·운영에 관한 기록을 작성하여 보관하여야 한다.
제27조 (위해방지를 위한 비상조치)
① 국가책임기관의 장은 유전자변형생물체로 인한 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 중대한 부정적인 영향이 발생하거나 발생할 우려가 있다고 인정되는 때에는 대통령령이 정하는 바에 따라 지체 없이 필요한 조치를 하여야 한다.
② 유전자변형생물체의 수출입 등을 하는 자가 유전자변형생물체의 부정적인 영향을 알게 된 때에는 관계중앙행정기관의 장 또는 국가책임기관의 장에게 지체 없이 그 내용을 통보하여야 한다.
제3장 유전자변형생물체의 정보보호
제28조 (정보보호)
유전자변형생물체에 대한 정보를 취급하는 관계중앙행정기관, 국가책임기관, 위해성 평가기관, 위해성 심사대행기관 및 제32조의 규정에 의한 바이오안전성정보센터(이하 “정보취급기관”이라 한다)의 장은 유전자변형생물체의 정보가 도난·누출 또는 훼손되지 아니하도록 정보보호에 필요한 조치를 강구하여야 한다.
제29조 (정보이용 및 제공의 제한)
① 정보취급기관의 장은 대통령령이 정하는 경우를 제외하고는 유전자변형생물체의 정보를 상업적으로 이용하거나 다른 자에게 제공하여서는 아니된다.
② 정보취급기관의 장은 유전자변형생물체의 정보를 다른 자에게 제공하는 때에는 사용목적·사용방법 등에 관하여 필요한 사항에 대하여 제한을 하거나 정보보호를 위하여 필요한 조치를 강구하도록 요청할 수 있다.
제30조 (정보취급기관의 임원·직원의 의무)
정보취급기관의 임원·직원이나 임원·직원이었던 자는 직무상 알게 된 정보를 누설하거나 타인의 이용에 제공하는 등 부당한 목적을 위하여 사용하여서는 아니된다.
제4장 바이오안전성위원회 등
제31조 (바이오안전성위원회)
① 유전자변형생물체의 수출입 등에 관한 다음 각호의 사항을 심의하기 위하여 국무총리 소속하에 바이오안전성위원회(이하 “위원회”라 한다)를 둔다.
1. 의정서의 이행에 관한 사항
2. 안전관리계획의 수립·시행
3. 제15조의 규정에 의한 위해성이 없는 유전자변형생물체의 품목 등의 고시
4. 제18조의 규정에 의한 재심사
5. 유전자변형생물체의 수출입등과 안전관리에 관련된 법령·고시 등에 관한 사항
6. 유전자변형생물체로 인한 피해예방 및 대책에 관한 사항
7. 그 밖에 위원장 또는 국가책임기관의 장이 심의를 요청하는 사항
② 위원회는 위원장 1인을 포함한 15인 이상 20인 이하의 위원으로 구성한다.
③ 위원회의 위원장은 국무총리가 되고, 위원은 다음 각호의 자로 한다.
1.재정경제부장관·교육인적자원부장관·외교통상부장관·과학기술부장관·농림부장관·산업자원부장관·보건복지부장관·환경부장관 및 해양수산부장관
2.대통령령이 정하는 자 중에서 국가책임기관의 장의 제청으로 위원장이 위촉하는 자
④ 국가책임기관의 장은 제3항제2호의 규정에 의한 위원을 제청하고자 하는 때에는 미리 관계중앙행정기관의 장과 협의하여야 한다.
⑤ 위원회의 효율적인 운영을 위하여 위원회 밑에 분과위원회 및 실무위원회를 둘 수 있다.
⑥ 위원회에 간사 1인을 두되, 간사는 산업자원부소속 공무원 중에서 위원장이 지명하는 자가 된다.
⑦ 위원회·분과위원회 및 실무위원회의 구성·기능·운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
제32조 (바이오안전성정보센터)
① 국가책임기관의 장은 유전자변형생물체의 정보관리 및 정보교환에 관한 사항 등을 전문적으로 수행하는 바이오안전성정보센터(이하 “바이오안전성정보센터”라 한다)를 지정할 수 있다.
② 바이오안전성정보센터는 유전자변형생물체의 안전성에 관한 정보를 국민에게 공개하여야 한다.
제5장 보칙
제33조 (자금 등의 지원)
① 정부는 유전자변형생물체의 안전성에 대한 국민의 이해를 증진하고 소비자의 인식을 제고하기 위하여 관련 기관 및 단체가 실시하는 홍보 및 교육사업 등에 필요한 자금 등을 지원할 수 있다.
② 정부는 연구시설의 안전성을 확보하기 위하여 필요한 시설의 설치·운영 등에 필요한 자금 등을 지원할 수 있다.
제34조 (재원의 확보)
국가책임기관의 장은 유전자변형생물체의 수출입 등과 관련하여 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 피해가 발생하는 경우에 대비한 안전성 확보를 위한 재원확보 방안을 강구하여야 한다.
제35조 (수수료)
① 다음 각호의 1에 해당하는 자는 수수료를 납부하여야 한다.
1. 제8조제1항·제2항의 규정에 의하여 수입승인을 얻고자 하는 자
2. 제9조제1항의 규정에 의하여 수입승인을 얻고자 하는 자
3. 제12조제1항의 규정에 의하여 생산승인을 얻고자 하는 자
4. 제22조제1항의 규정에 의하여 연구시설 설치·운영의 허가를 받고자 하는 자
② 제1항의 규정에 의한 수수료의 금액·납부방법 및 납부기간 등에 관하여 필요한 사항은 대통령령으로 정한다.
제36조 (보고 및 검사)
① 관계중앙행정기관의 장 또는 국가책임기관의 장은 유전자변형생물체의 안전관리를 위하여 다음 각호의 1에 해당하는 자로 하여금 보고를 하게 하거나 자료 또는 시료의 제출을 요구할 수 있으며, 소속 공무원으로 하여금 당해 사무소·연구시설·사업장·보관 장소 등에 출입하여 관계 서류나 시설·장비 및 보관상태 등을 검사하게 할 수 있다.
1.제8조제1항·제2항, 제9조제1항 또는 제12조제1항의 규정에 의하여 수입 또는 생산승인을 얻거나 수입신고를 한 자
2. 제15조제3항의 규정에 의하여 신고를 한 자
3. 위해성평가기관
4. 위해성심사대행기관
5. 제22조의 규정에 의하여 연구시설의 설치·운영허가를 받거나 신고를 한 자
6. 제25조의 규정에 의하여 취급 또는 관리를 하는 자
② 관계중앙행정기관의 장 또는 국가책임기관의 장은 승인을 얻지 아니하거나 신고를 하지 아니한 유전자변형생물체로 판단되는 물품의 수출입 등을 하거나, 허가를 받지 아니하거나 신고를 하지 아니하고 연구시설을 운영하고 있다고 의심되는 자에 대하여는 소속 공무원으로 하여금 당해 사무소·연구시설·사업장·보관 장소 등에 출입하여 관계 서류나 시설·장비 및 보관상태 등을 검사하게 할 수 있다.
③ 제1항 또는 제2항의 규정에 의하여 출입·검사를 하는 공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 내보여야 한다.
제37조 (청문)
관계중앙행정기관의 장은 다음 각호의 1에 해당하는 처분을 하고자 하는 경우에는 청문을 실시하여야 한다.
1. 제17조의 규정에 의하여 수입승인 또는 생산승인을 취소하는 경우
2. 제23조의 규정에 의하여 연구시설 설치·운영의 허가를 취소하는 경우
제38조 (벌칙적용에 있어서의 공무원 의제)
위해성평가기관, 위해성심사대행기관 및 바이오안전성정보센터의 임원 및 직원은 형법 제129조 내지 제132조의 적용에 있어서는 이를 각각 공무원으로 본다.
제6장 벌칙
제39조 (벌칙)
다음 각호의 1에 해당하는 자는 5년 이하의 징역 또는 7천만 원 이하의 벌금에 처한다.
1. 제14조의 규정에 위반하여 수입 또는 생산이 금지되거나 제한된 유전자변형생물체(제2호의 생물체를 포함한다)를 수입 또는 생산한 자
2. 제17조제1항제1호의 규정에 의하여 승인이 취소된 유전자변형생물체를 수입 또는 생산한 자
3. 제19조제1항의 규정에 의한 폐기·반송 등의 명령에 위반하여 유전자변형생물체를 국내에 유통하게 한 자
제40조 (벌칙)
다음 각호의 1에 해당하는 자는 3년 이하의 징역 또는 5천만 원 이하의 벌금에 처한다.
1. 제8조제1항·제2항, 제9조제1항 또는 제12조제1항의 규정에 의한 승인 또는 변경승인을 얻지 아니하고 유전자변형생물체를 수입 또는 생산한 자
2. 제17조제1항제2호 내지 제5호의 규정에 의하여 승인이 취소된 유전자변형생물체를 수입 또는 생산한 자
3. 제22조제1항 전단의 규정에 의한 허가를 받지 아니하거나 동항 후단 본문의 규정에 의한 변경허가를 받지 아니하고 연구시설을 설치·운영한 자
4. 제22조제3항 단서의 규정에 의한 승인을 얻지 아니하고 개발 또는 실험을 실시한 자
제41조 (벌칙)
다음 각호의 1에 해당하는 자는 2년 이하의 징역 또는 3천만 원 이하의 벌금에 처한다.
1. 제9조제1항의 규정에 의한 신고를 하지 아니하고 유전자변형생물체를 수입한 자
2. 제19조제1항의 규정에 의한 폐기·반송 등의 명령을 이행하지 아니한 자
3. 제20조의 규정에 의한 통보를 하지 아니하고 유전자변형생물체를 수출한 자
4. 제21조의 규정에 의한 신고를 하지 아니하고 유전자변형생물체를 국내 경유한 자
5. 제22조제1항 전단의 규정에 의한 신고를 하지 아니하고 연구시설을 설치·운영한 자
6. 제23조의 규정에 의한 연구시설의 운영정지명령을 위반한 자
7. 제30조의 규정에 위반하여 직무상 알게 된 정보를 누설하거나 타인의 이용에 제공한 자
제42조 (벌칙)
다음 각호의 1에 해당하는 자는 1년 이하의 징역 또는 2천만 원 이하의 벌금에 처한다.
1. 제24조제1항 또는 제2항의 규정에 위반하여 유전자변형생물체의 종류 등의 표시를 하지 아니하거나 이를 허위로 표시한 자 또는 표시를 임의로 변경하거나 삭제한 자
2. 제25조의 규정에 의한 취급관리기준을 준수하지 아니한 자
제43조 (양벌규정)
법인의 대표자나 법인 또는 개인의 대리인·사용인 그 밖의 종업원이 그 법인 또는 개인의 업무에 관하여 제39조 내지 제42조의 규정에 의한 위반행위를 한 때에는 행위자를 벌하는 외에 그 법인 또는 개인에 대하여도 각 해당 조의 벌금형을 과한다.
제44조 (과태료)
① 다음 각호의 1에 해당하는 자는 1천만 원 이하의 과태료에 처한다.
1. 제8조제1항 후단 단서의 규정에 의한 변경신고를 하지 아니한 자
2. 제10조제3항의 규정에 의한 신고를 하지 아니하거나 관계중앙행정기관의 장의 명령을 이행하지 아니한 자
3. 제11조제1항의 규정에 의하여 지정되지 아니한 수입항구·공항 등의 장소로 유전자변형생물체를 수입한 자
4. 제12조제1항 후단 단서의 규정에 의한 변경신고를 하지 아니한 자
5. 제15조제3항의 규정에 의한 신고를 하지 아니한 자
6. 제22조제1항 후단 단서의 규정에 의한 변경신고를 하지 아니한 자
7. 제26조의 규정에 의한 관리·운영기록을 작성·보관하지 아니한 자
8. 제36조제1항 또는 제2항의 규정에 의한 출입·보고·검사·자료 또는 시료제출을 거부·방해 또는 기피한 자
② 제1항의 규정에 의한 과태료는 대통령령이 정하는 바에 의하여 관계중앙행정기관 또는 국가책임기관의 장이 부과·징수한다.
③ 제1항의 규정에 의한 과태료처분에 불복이 있는 자는 그 처분의 고지를 받은 날부터 30일 이내에 관계중앙행정기관 또는 국가책임기관의 장에게 이의를 제기할 수 있다.
④ 제1항의 규정에 의한 과태료처분을 받은 자가 제3항의 규정에 의하여 이의를 제기한 때에는 관계중앙행정기관 또는 국가책임기관의 장은 지체없이 관할법원에 그 사실을 통보하여야 하며, 그 통보를 받은 관할 법원은 비송사건절차법에 의한 과태료의 재판을 한다.
⑤ 제3항의 규정에 의한 기간이내에 이의를 제기하지 아니하고 과태료를 납부하지 아니한 때에는 국세체납처분의 예에 의하여 이를 징수한다.
부칙 <제6448호,2001.3.28>
이 법은 의정서가 우리나라에 대하여 효력을 발생하는 날부터 시행한다.

[제정 2005.3.31 법률 7425호]
제1장 총칙
제1조 (목적)
이 법은 대학이나 연구기관 등에 설치된 과학기술분야 연구실의 안전을 확보함과 동시에 연구실 사고로 인한 피해를 적절하게 보상받을 수 있도록 함으로써 연구자원을 효율적으로 관리하고 나아가 과학기술 연구·개발활동 활성화에 기여함을 목적으로 한다.
제2조 (정의)
이 법에서 사용하는 용어의 정의는 다음과 같다.
1. “대학·연구기관 등”이라 함은 다음 각목의 기관을 말한다.
가. 「고등교육법」 제2조의 규정에 따른 대학·산업대학·전문대학 및 기술대학, 같은 법 제29조의 규정에 따른 대학원, 같은 법 제30조의 규정에 따른 대학원대학, 「과학기술분야 정부출연연구기관 등의 설립·운영 및 육성에 관한 법률」 제33조의 규정에 따른 대학원대학, 「한국과학기술원법」에 따른 한국과학기술원 및 「광주과학기술원법」에 따른 광주과학기술원
나. 국·공립연구기관
다. 「과학기술분야 정부출연연구기관 등의 설립·운영 및 육성에 관한 법률」의 적용을 받는 연구기관
라. 「특정연구기관 육성법」의 적용을 받는 특정연구기관
마. 「기술개발촉진법」 제7조제1항제2호의 규정에 따른 기업부설연구소
바. 「민법」 또는 다른 법률에 따라 설립된 과학기술분야의 법인인 연구기관
2. “연구실”이라 함은 대학·연구기관 등이 과학기술분야 연구개발 활동을 위하여 설치한 시설·장비·연구실험실·연구재료 등 연구시설을 말한다.
3. “연구주체의 장”이라 함은 대학·연구기관 등의 대표자 또는 해당연구실의 소유자를 말한다.
4. “연구 활동 종사자”라 함은 대학·연구기관 등에서 과학기술분야 연구개발 활동에 종사하는 연구원·대학생·대학원생 및 연구보조원 등을 말한다.
5. “안전점검”이라 함은 경험과 기술을 갖춘 자가 육안 또는 점검기구 등에 의하여 검사를 실시함으로써 연구실에 내재되어 있는 위험요인을 조사하는 행위를 말한다.
6. “정밀안전진단”이라 함은 연구실에서 발생할 수 있는 재해를 예방하기 위하여 잠재적 위험성의 발견과 그 개선대책의 수립을 목적으로 대통령령이 정하는 기준 또는 자격을 갖춘 자가 실시하는 조사·평가를 말한다.
제3조 (적용범위 등)
① 이 법은 대학·연구기관 등이 연구개발활동을 수행하기 위하여 설치한 연구실에 관하여 적용한다. 다만, 연구실의 유형 및 규모 등을 고려하여 대통령령이 정하는 연구실에 관하여는 이 법의 전부 또는 일부를 적용하지 아니할 수 있다.
② 「산업안전보건법」의 적용대상 근로자에 대해서는 「산업안전보건법」이 정하는 바에 따른다.
③ 「고등교육법」 제2조의 규정에 따른 대학·산업대학·전문대학 및 기술대학, 같은 법 제29조의 규정에 따른 대학원 및 같은 법 제30조의 규정에 따른 대학원대학이 연구개발활동을 수행하기 위하여 설치한 연구실의 안전환경에 관하여는 과학기술부장관이 교육인적자원부장관과 협의하여야 한다.
제4조 (정부의 책무)
① 정부는 연구실의 안전한 환경을 확보하기 위한 연구활동을 지원하는 등 필요한 시책을 수립·시행하여야 한다.
② 정부는 연구실의 안전환경을 조성하기 위한 연구개발활동 및 연구실에 관한 유형별 안전관리 표준화 모델과 안전교육 교재의 개발·보급 등 안전환경 조성에 필요한 지원시책을 적극적으로 강구하여야 한다.
제5조 (연구주체의 장의 책임)
연구주체의 장은 연구실의 안전유지 및 관리를 철저히 함으로써 연구실의 안전환경을 확보할 책임을 진다.
제2장 연구실의 안전조치
제6조 (안전관리규정의 작성 및 준수 등)
① 연구주체의 장은 연구실의 안전을 유지관리하기 위하여 다음 각호의 사항을 포함한 안전관리규정을 작성하여 각 연구실에 게시 또는 비치하고, 이를 연구활동종사자에게 알려야 한다.
1. 안전관리조직체계 및 그 직무에 관한 사항
2. 연구실별 안전관리담당자의 지정 및 그 책임과 권한의 부여
3. 주기적 안전교육의 실시에 관한 사항
4. 연구실 안전표식의 설치 또는 부착
5. 사고발생시 긴급대처방안과 행동요령에 관한 사항
6. 사고조사 및 후속대책수립에 관한 사항
7. 그 밖의 안전관리에 관한 사항
② 연구주체의 장 및 연구활동종사자는 제1항의 규정에 따른 안전관리규정을 성실히 준수하여야 한다.
③ 연구주체의 장은 연구실 안전환경과 관련된 주요사항을 협의하기 위하여 연구실안전관리위원회를 구성·운영할 수 있다.
④ 연구실안전관리위원회에서 협의하여야 할 사항은 다음 각호와 같다.
1. 제1항의 규정에 따른 안전관리규정의 작성 또는 변경
2. 제8조의 규정에 따른 안전점검계획의 수립
3. 제9조의 규정에 따른 정밀안전진단 계획의 수립
4. 그 밖의 연구실 안전환경 증진에 관한 주요사항
⑤ 연구실안전관리위원회에는 당해 대학·연구기관 등의 연구활동종사자가 2분의 1 이상 포함되어야 한다.
⑥ 연구주체의 장은 연구실안전관리위원으로서 정당한 활동을 수행한 것을 이유로 당해 위원에 대하여 불이익한 처우를 하여서는 아니된다.
⑦ 제1항의 규정에 따른 안전관리규정을 작성하여야 할 연구실의 종류·규모와 제3항 및 제4항의 규정에 따른 연구실안전관리위원회의 구성·운영에 관한 세부기준 등은 과학기술부령으로 정한다.
제7조 (안전점검 및 정밀안전진단 지침)
① 과학기술부장관은 대통령령이 정하는 바에 따라 연구실의 안전점검 및 정밀안전진단의 실시내용·방법·절차 등에 관한 안전점검지침 및 정밀안전진단지침을 작성하여 이를 관보에 고시하여야 한다.
② 과학기술부장관은 제1항의 규정에 따른 지침을 작성하는 경우에는 미리 관계중앙행정기관의 장과 협의하여야 한다.
제8조 (안전점검의 실시)
① 연구주체의 장은 연구실의 기능 및 안전을 유지관리하기 위하여 제7조의 규정에 따른 안전점검지침에 따라 소관 연구실에 관한 안전점검을 실시하여야 한다.
② 제1항의 규정에 따른 안전점검의 실시 시기, 안전점검을 실시할 수 있는 자의 자격 등에 관하여 필요한 사항은 대통령령으로 정한다.
③ 연구주체의 장은 안전점검을 직접 실시하거나 대통령령이 정하는 일정 요건을 갖춘 전문기관으로 하여금 대행하게 할 수 있다.
제9조 (정밀안전진단의 실시)
① 연구주체의 장은 제8조의 규정에 따른 안전점검을 실시한 결과 연구실의 재해예방과 안전성 확보 등을 위하여 필요하다고 인정하는 경우에는 제7조의 규정에 따른 정밀안전진단지침에 따라 정밀안전진단을 실시하여야 한다. 다만, 대통령령이 정하는 연구실로서 유해·위험물질 및 시설·장비를 취급하는 등 유해 또는 위험한 작업을 필요로 하는 연구실은 정기적으로 정밀안전진단을 실시하여야 한다.
② 제1항의 규정에 따른 정밀안전진단의 실시시기, 정밀안전진단을 실시할 수 있는 자의 자격 등에 관하여 필요한 사항은 대통령령으로 정한다.
③ 연구주체의 장은 정밀안전진단을 직접 실시하거나 대통령령에서 정하는 일정 요건을 갖춘 전문기관으로 하여금 대행하게 할 수 있다.
제10조 (안전점검 및 정밀안전진단 실시 결과의 보고 및 공표)
① 제8조 및 제9조의 규정에 따라 안전점검 또는 정밀안전진단을 실시한 연구주체의 장은 지체 없이 그 결과를 과학기술부장관에게 보고하고, 이를 공표하여야 한다. 다만, 과학기술부장관이 경미한 사항이라고 인정하는 경우에는 공표하지 아니할 수 있다.
② 제1항의 규정에 따라 보고받은 과학기술부장관은 연구실에 대통령령이 정하는 중대한 결함이 있다고 인정하는 경우 이를 즉시 관계 중앙행정기관의 장 및 지방자치단체의 장에게 통보하여야 하고, 필요하다고 인정하는 경우에는 연구주체의 장에게 제17조의 규정에 따른 조치를 요구할 수 있다.
③ 과학기술부장관은 제1항의 규정에 따라 제출받은 안전점검 및 정밀안전진단 실시 결과에 관한 기록을 유지·관리하여야 한다.
제11조 (검사)
과학기술부장관은 연구주체의 장의 안전점검 및 정밀안전진단의 실시현황 등 그 업무에 관한 사항을 파악하기 위하여 필요하다고 인정하는 경우에는 대학·연구기관 등에 대하여 소속 공무원으로 하여금 관련 서류 등을 검사하게 할 수 있다.
제12조 (증표 제시)
① 제11조의 규정에 따라 소속 공무원이 관련 서류를 심사하거나 제16조의 규정에 따라 관련 전문가가 사고조사 등을 행하는 경우에 소속 공무원 또는 관련 전문가는 그 권한을 표시하는 증표를 지니고 이를 관계인에게 내보여야 한다.
② 제1항의 규정에 의한 증표의 서식에 관하여 필요한 사항은 과학기술부령으로 정한다.
제13조 (비용의 부담 등)
① 제8조 및 제9조의 규정에 따른 안전점검 및 정밀안전진단에 소요되는 비용은 해당 대학·연구기관 등이 부담한다.
② 대학·연구기관 등은 대통령령이 정하는 바에 따라 매년 소관 연구실의 안전 및 유지관리에 필요한 비용을 확보하여야 한다.
③ 연구주체의 장은 연구과제 수행을 위한 연구비를 책정할 때 안전관련 예산을 반영하여야 한다.
④ 제3항의 안전관련 예산에 관한 세부적인 사항은 과학기술부령으로 정한다.
제14조 (보험가입)
① 연구주체의 장은 대통령령이 정하는 기준에 따라 연구활동종사자의 상해·사망에 대비하여 연구활동종사자를 피보험자 및 수익자로 하는 보험에 가입하여야 한다.
② 연구주체의 장은 제1항의 규정에 따른 연구활동종사자에 대하여 보험에 가입하는 경우 대통령령이 정하는 기준에 따라 보험가입에 필요한 비용을 매년 예산에 계상하여야 한다.
제15조 (안전점검 및 정밀안전진단 실시자의 의무 등)
① 제8조 및 제9조의 규정에 따라 안전점검 또는 정밀안전진단을 실시하는 자는 제7조의 규정에 따른 안전점검지침 및 정밀안전진단지침에 따라 성실하게 그 업무를 수행하여야 한다.
② 과학기술부장관은 제1항의 규정을 위반하여 안전점검 또는 정밀안전진단업무를 성실하게 수행하지 아니함으로써 연구활동종사자나 공중의 위험을 발생시킬 우려가 있는 경우에는 연구주체의 장에게 기간을 정하여 그 시정을 명할 수 있다.
제16조 (사고조사의 실시)
① 과학기술부장관은 연구실에 안전사고가 발생한 경우 그 재발을 방지하기 위하여 연구주체의 장에게 안전사고 관련 자료의 제출을 요청할 수 있고, 필요하다고 인정되는 경우에는 안전사고가 발생한 연구실에 대하여 대통령령이 정하는 바에 따라 관련 전문가로 하여금 사고경위 및 사고원인 등을 조사하게 할 수 있다.
② 과학기술부장관은 제1항의 규정에 따라 제출된 자료와 조사 결과에 관한 기록을 유지·관리하여야 한다.
제17조 (연구실 사용제한 등)
① 연구주체의 장은 제8조 및 제9조의 규정에 따른 안전점검 및 정밀안전진단의 실시 결과 또는 제16조의 규정에 따른 사고조사의 결과에 따라 연구활동종사자 또는 공중의 안전한 이용을 위하여 긴급한 조치가 필요하다고 판단되는 경우에는 연구실의 사용제한·금지 또는 철거 등 안전상의 조치를 취하여야 한다.
② 연구활동종사자는 연구개발활동을 수행함에 있어 연구실의 안전한 이용에 중대한 문제가 발생하거나 발생할 가능성이 있어 연구실에서 긴급한 조치가 필요하다고 판단되는 경우에는 직접 연구실의 사용제한 등의 필요한 조치를 취할 수 있다. 이 경우 연구주체의 장에게 그 사실을 지체 없이 보고하여야 한다.
③ 제1항 및 제2항의 규정에 따른 조치가 있는 경우에는 연구주체의 장은 그 사실을 과학기술부장관에게 즉시 보고한다. 이 경우 과학기술부장관은 이를 공고하여야 한다.
제18조 (교육·훈련 등)
① 연구주체의 장은 연구실의 안전관리에 관한 정보를 연구활동종사자에게 제공하여야 한다.
② 연구주체의 장은 연구활동종사자에 대하여 대통령령이 정하는 바에 따라 연구실 사용에 따르는 안전성 확보 및 사고예방에 필요한 교육·훈련을 실시하여야 한다.
③ 연구주체의 장은 인체에 치명적인 위험물질 및 바이러스 등에 노출될 위험성이 있는 연구활동종사자에 대하여 정기적인 건강검진을 실시하여야 한다.
④ 제3항의 건강검진에 관한 구체적인 사항은 과학기술부령으로 정한다.
⑤ 연구활동종사자는 이 법에서 정하는 연구실 안전관리 및 재해예방을 위한 각종 기준과 규범 등을 준수하고 연구실 안전환경 증진활동에 적극 참여하여야 한다.
제3장 보칙
제19조 (신고)
① 연구실에서 이 법 또는 이 법에 따른 명령을 위반한 사실이 있을 때에는 연구활동종사자는 그 사실을 과학기술부장관에게 신고할 수 있다.
② 연구주체의 장은 제1항의 신고를 이유로 당해 연구활동종사자에 대하여 불리한 처우를 하여서는 아니된다.
제20조 (비밀 유지)
제8조 및 제9조의 규정에 따른 안전점검 또는 정밀안전진단을 실시하는 자는 업무상 알게 된 비밀을 제3자에게 제공 또는 도용하거나 목적 외의 용도로 사용하여서는 아니된다. 다만, 연구실의 안전 및 유지관리를 위하여 과학기술부장관이 필요하다고 인정할 때에는 그러하지 아니하다.
제21조 (권한의 위임·위탁)
과학기술부장관은 이 법에 의한 권한의 일부를 대통령령이 정하는 바에 따라 관계중앙행정기관의 장에게 위임하거나, 연구실 안전과 관련된 업무를 대통령령이 정하는 바에 따라 필요한 인력과 장비를 갖춘 기관에 위탁할 수 있다.
제4장 벌칙
제22조 (벌칙)
① 다음 각호의 어느 하나에 해당하는 자는 5년 이하의 징역 또는 5천만 원 이하의 벌금에 처한다.
1. 제8조 및 제9조의 규정에 따른 안전점검 또는 정밀안전진단을 실시하지 아니하거나 성실하게 실시하지 아니함으로써 연구실에 중대한 손괴를 야기하여 공중의 위험을 발생하게 한 자
2. 제17조제1항의 규정에 따른 조치를 이행하지 않아 공중의 위험을 발생하게 한 자
② 제1항 각호의 죄를 범하여 사람을 사상에 이르게 한 자는 3년 이상 10년 이하의 징역에 처한다.
제23조 (벌칙)
제20조의 규정을 위반하여 직무상 알게 된 비밀을 제3자에게 제공 또는 도용하거나 목적 외의 용도로 사용한 자는 1년 이하의 징역이나 1천만 원 이하의 벌금에 처한다.
제24조 (양벌규정)
① 법인의 대표자나 법인 또는 개인의 대리인·사용인 그 밖의 종업원이 그 법인 또는 개인의 업무에 관하여 제22조의 위반행위를 한 경우는 행위자를 벌하는 외에 당해 법인 또는 개인에 대하여도 동조의 벌금형을 과하고, 벌금형이 규정되어 있지 않은 경우에는 1억 원 이하의 벌금에 처한다.
② 법인의 대표자나 법인 또는 개인의 대리인·사용인 그 밖의 종업원이 그 법인 또는 개인의 업무에 관하여 제23조의 위반행위를 한 경우에는 행위자를 벌하는 외에 당해 법인 또는 개인에 대하여도 동조의 벌금형을 과한다.
제25조 (과태료)
① 다음 각호의 어느 하나에 해당하는 자는 2천만 원 이하의 과태료를 과한다.
1. 제9조제1항의 규정에 따른 정밀안전진단을 실시하지 아니하거나 성실하게 수행하지 아니한 자
2. 제14조제1항의 규정에 따른 보험에 가입하지 아니한 자
② 다음 각호의 어느 하나에 해당하는 자는 1천만 원 이하의 과태료를 과한다.
1. 제8조제1항의 규정에 따른 안전점검을 실시하지 아니하거나 성실하게 수행하지 아니한 자
2. 제15조제2항의 규정에 따른 명령을 위반한 자
③ 다음 각호의 어느 하나에 해당하는 자는 500만 원 이하의 과태료를 과한다.
1. 제6조제1항의 규정에 따른 안전관리규정을 게시 또는 비치하지 아니하거나 제6조제2항의 규정에 따라 이를 성실하게 준수하지 아니한 자
2. 제10조제1항의 규정에 따라 보고를 하지 아니하거나 거짓으로 보고한 자
3. 제16조제1항의 규정에 따라 자료제출이나 사고경위 및 사고원인의 조사를 거부·방해 또는 기피한 자
④ 제1항 내지 제3항의 규정에 따른 과태료는 대통령령이 정하는 바에 따라 과학기술부장관이 부과·징수한다.
⑤ 제4항의 규정에 따른 과태료 처분에 불복이 있는 자는 그 처분의 고지를 받은 날부터 30일 이내에 과학기술부장관에게 이의를 제기할 수 있다.
⑥ 제4항의 규정에 따라 과태료 처분을 받은 자가 제5항의 규정에 따라 이의를 제기한 경우에는 과학기술부장관은 지체없이 관할법원에 그 사실을 통보하여야 하며, 그 통보를 받은 관할법원은 「비송사건절차법」에 따른 과태료의 재판을 한다.
⑦ 제5항의 규정에 따른 기간 이내에 이의를 제기하지 아니하고 과태료를 납부하지 아니한 경우에는 국세체납처분의 예에 따라 이를 징수한다.
부칙 <제7425호,2005.3.31>
이 법은 공포 후 1년이 경과한 날부터 시행한다.

[일부개정 2005.1.27 법률 7375호]
제1장 총칙
제1조 (목적)
이 법은 사람의 신체적 완전성을 기하고 생리적 기능회복을 위하여 인체조직의 기증·관리 및 이식 등에 필요한 사항을 정함으로써 인체조직의 적정한 수급과 안전성을 도모하고 국민보건향상에 이바지함을 목적으로 한다.
제2조 (기본이념)
① 인체조직의 기증·관리 및 이식은 인도적 정신에 따라 행하여져야 한다.
② 자신의 인체조직 기증에 관하여 표시한 의사는 존중되어야 한다. 이 경우 그 의사는 자발적이어야 한다.
③ 인체조직의 이식을 필요로 하는 사람은 사회적·경제적 조건 등에 관계없이 공평하게 이식을 받을 수 있는 기회를 가져야 한다.
④ 인체조직의 기증·관리 및 이식은 윤리적으로 타당하고 의학적으로 인정된 방법에 의하여 행하여져야 한다.
제3조 (정의)
이 법에서 사용하는 용어의 정의는 다음과 같다. <개정 2005.1.27>
1. “인체조직”이라 함은 장기 등 이식에 관한 법률 제3조제1호의 규정에 의한 장기 등에 속하지 아니하는 다음 각목의 1에 해당하는 것(이하 “조직”이라 한다)을 말한다.
가. 뼈·연골·근막·피부·양막·인대 및 건
나. 심장판막·혈관
다. 신체의 일부로서 사람의 건강, 신체회복 및 장애예방을 위하여 채취하여 이식될 수 있는 것으로 대통령령이 정하는 것
2. “조직기증자”라 함은 보건복지부령이 정하는 바에 따라 대가없이 특정한 조직을 제공하는 자를 말한다.
3. “조직이식”이라 함은 조직기증자로부터 기증된 안전성이 확보된 조직을 환자의 질환치료 등을 목적으로 이식하는 행위를 말한다.
4. “조직은행”이라 함은 이식을 목적으로 조직의 관리를 위하여 제13조제1항의 규정에 따라 허가받는 기관을 말한다.
5. “조직관리”라 함은 조직을 채취·저장·처리·보관 및 분배하는 행위를 말한다.
6. “살아있는 자”·“뇌사자”·“가족” 또는 “유족”의 정의는 장기 등 이식에 관한 법률 제3조를 준용한다.
제4조 (적용범위)
이 법은 사람의 신체의 완전성을 기하고 생리적 기능의 회복을 위하여 이식의 목적으로 살아있는 자·뇌사자·사망한 자로부터 기증·관리 및 이식 등과 관련하여 국내에서 생산 혹은 외국으로부터 수입된 조직에 적용한다. 다만, 다음 각호의 1은 제외한다.
1. 자가이식용 조직
2. 약사법·의료기기법 그 밖의 다른 법령의 적용을 받는 품목
제5조 (조직의 매매행위 등의 금지)
① 누구든지 금전 또는 재산상의 이익 그 밖의 반대급부를 주고받거나 주고받을 것을 약속하고 다음 각호의 1에 해당하는 행위를 하여서는 아니된다.
1. 뇌사자 또는 사망한 자의 조직을 제3자에게 주거나 제3자에게 주기 위하여 받는 행위 또는 이를 각각 약속하는 행위
2. 자신의 조직을 타인에게 주거나 타인의 조직을 자신에게 이식하기 위하여 받는 행위 또는 이를 각각 약속하는 행위
3. 제1호 또는 제2호의 행위를 알선하는 행위
② 누구든지 제1항의 규정을 위반한 행위가 있음을 인지한 때에는 그 행위와 관련되는 조직을 관리하거나 이식하여서는 아니된다.
제6조 (인체조직안전관리자문위원회)
① 조직의 기증·관리 및 이식 등에 관하여 보건복지부장관의 자문에 응하여 다음 각호의 사항을 심의하기 위하여 보건복지부에 인체조직안전관리자문위원회(이하 “위원회”라 한다)를 둔다.
1. 조직은행의 허가기준 및 운영에 관한 사항
2. 수입 조직의 관리방안에 관한 사항
3. 조직품질·조직검사 또는 조직관리의 정확도 평가(이하 “정도관리”라 한다)에 관한 사항
4. 그 밖에 조직의 기증·관리 및 이식에 관한 조사·연구 등에 관하여 보건복지부장관이 부의하는 사항
② 위원회의 구성 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
제2장 조직의 관리
제7조 (조직의 기증에 관한 동의)
① 조직 기증에 관한 동의는 장기 등 이식에 관한 법률 제11조의 규정을 준용한다.
② 제1항의 규정에 의한 동의에는 다음 각호의 사항이 포함되어야 한다.
1. 조직의 보존기간 그 밖의 보관에 관한 사항
2. 동의의 철회 등 동의자의 권리 및 정보보호에 관한 사항
3. 그 밖에 보건복지부령이 정하는 사항
③ 조직을 채취하고자 하는 자는 제1항의 규정에 의한 동의를 얻는 때에는 미리 제2항 각호의 사항에 대하여 충분히 설명하여야 한다.
④ 동의서의 서식 및 보존 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제8조 (조직의 채취요건)
① 뇌사자와 사망한 자의 조직은 다음 각호의 1에 해당하는 경우에 한하여 이를 채취할 수 있다. 다만, 정신질환자 및 정신지체인의 조직의 경우에는 제1호의 경우에 한하여 이를 채취할 수 있다.
1. 본인이 뇌사 또는 사망 전에 조직의 채취에 동의한 경우. 다만, 그 가족 또는 유족이 조직 등의 채취를 명시적으로 거부하는 경우를 제외한다.
2. 본인이 뇌사 또는 사망 전에 조직의 채취에 동의 또는 반대하였다는 사실이 확인되지 아니한 경우로서 그 가족 또는 유족이 조직의 채취에 동의한 경우. 다만, 본인이 16세 미만의 미성년자인 경우에는 그 부모가 조직의 채취에 동의한 경우에 한한다.
② 살아 있는 자로부터 조직을 채취할 경우에는 본인의 동의가 있는 경우에 한한다. 다만, 미성년자의 조직을 채취하고자 하는 경우에는 본인의 동의 외에 부모의 동의를 얻어야 한다.
③ 제1항 및 제2항의 규정에 의하여 동의한 자는 조직의 채취를 위한 수술이 시작되기 전까지 언제든지 조직채취에 관한 동의의 의사표시를 철회할 수 있다.
제9조 (조직의 분배·이식의 금지 등)
다음 각호의 1에 해당하는 조직은 이를 분배하거나 이식하여서는 아니된다. <개정 2005.1.27>
1. 이식에 적합하지 아니한 B형 또는 C형 간염·매독·후천성면역결핍증후군 등 전염성질환에 감염되거나 감염이 의심되는 조직
2. 치매 등 퇴행성 신경질환을 가진 기증자의 조직
3. 사망원인이 분명하지 아니한 기증자의 조직
4. 유해성물질에 노출된 기증자의 조직
5. 암세포의 전이 우려가 있는 조직
6. 그 밖에 제1호 내지 제5호에 준하는 조직으로 이식대상자의 생명·신체에 위해를 가할 우려가 있어 이식에 적합하지 아니하다고 보건복지부령이 정하는 조직
제10조 (조직의 안전성확보)
① 보건복지부장관은 국내 조직은행에서 처리된 조직과 외국에서 수입되는 조직에 대하여 보건복지부령이 정하는 바에 의하여 이식의 적합성여부를 검사하고 안전성이 확보되지 아니한 조직은 폐기를 명하여야 한다.
② 제1항의 규정에 의한 조직이식의 적합성여부에 관한 판정기준은 보건복지부령으로 정한다.
제11조 (조직은행의 정도관리)
① 보건복지부장관은 조직은행으로 하여금 정도관리를 받게 할 수 있고, 정도관리 결과를 공개할 수 있다.
② 제1항의 규정에 의한 정도관리의 절차, 정도관리 결과의 공개 그 밖에 정도관리에 필요한 사항은 보건복지부령으로 정한다.
제12조 (조직이식의 우선순위)
조직은행은 조직이식을 행하는 의료기관(이하 “조직이식의료기관”이라 한다)에 조직을 배분하는 경우에 의료적 측면에서 조직이식의 시급성 및 기대효과의 경중을 감안하여 분배우선순위를 적용하여 제공하여야 한다.
제13조 (조직은행의 허가 등)
① 조직은행을 설립하고자 하는 자는 대통령령이 정하는 시설·장비·인력·품질관리체계 등을 갖추고 보건복지부장관의 허가를 받아야 한다.
② 조직은행으로 허가를 받을 수 있는 자는 다음 각호와 같다. 다만, 제3호 및 제4호에 해당하는 자는 조직의 기증 또는 채취 업무를 할 수 없다.
1. 의료법 제3조의 규정에 의한 의료기관
2. 조직에 관련된 사업을 주된 목적으로 하여 설립된 비영리법인
3. 조직가공처리업자
4. 조직수입업자
③ 조직은행의 업무는 다음 각호와 같다.
1. 조직의 채취·저장·처리·보관 및 분배에 관한 업무
2. 조직기증자의 관리 및 조직기증을 위한 홍보·상담에 관한 업무
3. 조직기증자의 선별 및 조직의 품질보증에 관한 업무
4. 그 밖에 조직이식의 안전성확보를 위하여 필요한 사항으로서 대통령령이 정하는 업무
제14조 (조직은행의 허가갱신)
① 보건복지부장관은 허가받은 조직은행에 대하여 3년마다 그 허가의 갱신을 받도록 할 수 있다.
② 제1항의 규정에 의한 허가갱신의 기준·절차 등에 관하여 필요한 사항은 대통령령으로 정한다.
제15조 (조직은행의 준수사항)
① 조직은행은 조직의 안전을 보증하기 위하여 보건복지부장관이 정한 세부운영지침을 준수하여야 한다.
② 조직은행이 다른 조직은행과의 협력을 통하여 각각의 업무를 수행하는 경우 협력관계 및 계약관계를 명확히 하여야 한다.
③ 조직은행이 조직이식의료기관에게 시술에 필요한 조직을 제공하는 경우에는 비영리원칙을 준수하여야 한다. 다만, 조직은행은 기증·관리 및 이식 등에 소요된 경비를 보건복지부령이 정하는 바에 의하여 조직이식의료기관에 요구할 수 있다.
④ 조직은행에 종사하는 조직 취급관련 의료인 그 밖의 종사자로서 보건복지부령이 정하는 자는 보건복지부령이 정하는 소정의 교육을 받아야 한다.
⑤ 조직의 제공절차, 조직의 보관규모, 관리책임자 및 관리현황의 보고 그 밖의 필요한 사항은 보건복지부령으로 정한다.
제16조 (조직의 채취시 준수사항)
① 조직을 채취하고자 하는 조직은행은 다음 각호의 사항을 준수하여야 한다.
1. 제7조 또는 제8조제1항·제2항의 규정에 의한 동의의 사실을 확인할 것
2. 본인 또는 동의권자에게 다음 각목의 사항을 충분히 설명할 것
가. 조직기증자의 병력·혈청검사 등의 문답지 작성에 관한 사항
나. 조직의 채취수술의 내용
다. 조직기증후의 장례절차에 대한 사전 설명
라. 그 밖에 조직의 기증과 관련하여 사전에 알아두어야 할 사항
② 제1항의 규정에 의한 본인 또는 동의권자에 대한 설명 시 준수하여야 할 세부절차·내용 그 밖의 필요한 사항은 보건복지부장관이 정한다.
제17조 (조직의 수입)
① 조직은행외의 자는 조직을 수입하여서는 아니된다.
② 조직의 수입에 관한 세부적인 사항은 대통령령으로 정한다.
제18조 (해부 또는 검시의 우선)
형사소송법 또는 검역법에 의하여 해부 또는 검시를 하여야 하는 경우에는 그 해부 또는 검시 전에 조직의 이식을 위한 조직의 채취를 할 수 없다. 다만, 진료를 담당한 의료인이 채취할 조직과 사망의 원인 간에 상관관계가 없고 해부 또는 검시를 기다려서는 채취할 시기를 상실할 우려가 있다고 판단하는 경우에는 관할 지방검찰청 또는 지방검찰지청의 검사, 관할 검역소장의 승인과 유족의 동의를 얻어 조직을 채취할 수 있다.
제19조 (기록의 작성 및 보고 등)
① 조직은행은 연 1회 보건복지부령이 정하는 바에 의하여 조직의 기증·관리 및 이식에 관한 사항을 작성하고 보건복지부장관에게 보고하여야 한다.
② 조직이식의료기관은 이식결과를 보건복지부령이 정하는 바에 의하여 조직은행에 통보하여야 한다. 이를 통보받은 조직은행은 제1항의 규정에 의한 보고 시 이를 포함하여 보고하여야 한다.
③ 조직은행 및 조직이식의료기관은 조직이식과 관련된 감염 등 보건복지부령이 정하는 중대한 부작용이 발생한 경우 이를 즉시 보건복지부장관에게 보고하여야 한다.
제20조 (기록의 보존)
조직은행 및 조직이식의료기관의 장은 조직의 기증·관리 및 이식 등에 관한 기록을 보건복지부장관이 정하는 바에 따라 10년간 보존하여야 한다.
제21조 (기록의 열람 등)
조직은행의 장은 조직을 기증한 자나 그 유족이 당해 조직의 채취 또는 이식에 관한 기록의 열람 또는 사본의 교부를 요구하는 경우에 조직기증 제반에 관한 기록 또는 이식에 관한 기록을 열람시키거나 사본을 교부하여야 한다. 다만, 진료를 담당한 의료인이 그 기록의 내용을 조직을 기증하거나 이식받은 자가 알게 되는 경우 그의 치료 또는 회복에 현저한 지장을 초래할 우려가 있다고 판단하는 때에는 이를 거부할 수 있다.
제22조 (비밀의 유지)
① 조직은행·조직이식의료기관 또는 조직의 기증·관리 및 이식 관련 업무에 종사하는 자로서 대통령령이 정하는 자는 이 법에 특별히 규정한 경우를 제외하고는 당해 조직기증자 등의 조직 채취·이식과 관련된 업무를 담당하는 자 외의 자에게 다음 각호의 1에 해당하는 사항을 알려주어서는 아니된다.
1. 조직기증자와 채취한 조직에 관한 사항
2. 이식대상자와 이식한 조직에 관한 사항
3. 조직 기증희망자에 관한 사항
② 다음 각호의 1에 해당하는 경우에는 제1항의 규정을 적용하지 아니한다.
1. 범죄수사를 위한 수사기관이 조직 등의 채취 또는 이식과 관련된 자료를 요청한 경우
2. 재판과 관련되어 법관이 조직 등의 채취 또는 이식과 관련된 자료를 요청한 경우
제3장 감독
제23조 (보고·조사 등)
① 보건복지부장관은 조직의 기증·관리 및 이식 등과 관련하여 필요하다고 인정하는 경우에는 조직은행·조직이식의료기관의 장 및 그 종사자에 대하여 그 업무에 관하여 필요한 명령을 하거나 보고 또는 관계서류의 제출을 명할 수 있다.
② 지부령이 정하는 바에 따라 관계공무원으로 하여금 조사하게 할 수 있다. 이 경우 조사를 담당하는 관계공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 내보여야 한다.
③ 조직은행 또는 조직이식의료기관의 장 및 그 종사자는 정당한 사유가 없는 한 제1항 및 제2항의 규정에 의한 명령 또는 조사에 응하여야 한다.
제24조 (시정명령)
보건복지부장관은 조직은행 또는 조직이식의료기관의 장 및 그 종사자가 다음 각호의 1에 해당하는 경우에는 해당기관의 장에게 일정한 기간을 정하여 위반사항의 시정을 명할 수 있다.
1. 제19조의 규정에 의한 보고를 하지 아니한 경우
2. 제20조의 규정에 의한 기록을 보존하지 아니한 경우
제25조 (허가취소 등)
① 보건복지부장관은 조직은행이 다음 각호의 1에 해당하는 경우에는 그 허가를 취소하거나 보건복지부령이 정하는 바에 따라 1년 이내의 기간을 정하여 그 업무의 전부 또는 일부의 정지를 명할 수 있다.
1. 제13조제1항의 규정에 의한 시설·장비·인력·품질관리체계 등을 갖추지 아니한 경우
2. 제23조제1항의 규정에 의한 명령을 이행하지 아니하거나 동조제2항의 규정에 의한 조사에 불응한 경우
3. 제24조의 규정에 의한 시정명령을 이행하지 아니한 경우
② 보건복지부장관은 조직은행이 제1항의 규정에 의한 업무의 정지명령을 위반하여 업무를 한 때에는 그 허가를 취소할 수 있다.
③ 제1항 및 제2항의 규정에 의하여 허가가 취소된 조직은행은 그 허가가 취소된 날부터 1년 이내에 조직은행으로 허가를 받을 수 없다.
④ 제1항의 규정에 의한 행정처분의 세부기준은 그 위반행위의 유형과 위반의 정도 등을 고려하여 보건복지부령으로 정한다.
제26조 (폐업 등의 신고 및 자료이관)
① 조직은행이 폐업하고자 할 경우 조직기증자 및 처리·보관 조직 등에 관한 사항을 보건복지부장관에게 신고하여야 한다.
② 제1항의 규정에 의하여 폐업하거나 제25조의 규정에 의하여 허가가 취소된 조직은행의 장은 대통령령이 정하는 바에 따라 관련 자료를 보건복지부장관에게 이관하여야 한다.
제4장 보칙
제27조 (조직은행 등에 대한 지원)
국가 또는 지방자치단체는 조직은행 및 조직기증자에 대하여 예산의 범위 안에서 필요한 지원을 할 수 있다.
제28조 (권한의 위임)
보건복지부장관은 이 법에 의한 권한의 일부를 대통령령이 정하는 바에 의하여 소속기관의 장, 식품의약품안전청장, 특별시장·광역시장·도지사 또는 시장·군수·구청장(자치구의 구청장을 말한다. 이하 같다)에게 위임할 수 있다.
제29조 (협조의무)
보건복지부장관 또는 조직은행의 장은 조직을 안전하고 신속하게 채취·운반하거나 이식하기 위하여 필요한 조치를 관계기관의 장에게 요청할 수 있다. 이 경우 관계기관의 장은 정당한 사유가 없는 한 이에 응하여야 한다.
제30조 (청문)
보건복지부장관은 제25조 규정에 의한 취소처분을 하고자 하는 때에는 청문을 실시하여야 한다.
제31조 (비용의 부담 등)
① 조직의 채취 및 이식에 소요되는 비용은 해당 조직을 이식받은 자가 부담한다. 다만, 이식받은 자가 부담하는 비용에 대하여 다른 법령이 따로 정하는 경우에는 당해 법령이 정하는 바에 의한다.
② 제1항의 규정에 의한 비용의 산출은 국민건강보험법이 정하는 바에 의한다. 다만, 국민건강보험법이 규정하지 아니한 비용의 산출은 보건복지부령이 정하는 바에 의한다.
제5장 벌칙
제32조 (벌칙)
제9조의 규정을 위반하여 동조 각호에 해당하는 조직을 다른 사람에게 이식할 목적으로 분배 또는 이식한 자는 무기징역 또는 2년 이상의 유기징역에 처한다.
제33조 (벌칙)
① 금전 등을 주고받거나 주고받을 것을 약속하고 제5조제1항제1호 또는 제3호의 규정을 위반한 자는 7년 이하의 징역에 처한다.
② 금전 등을 주고받거나 주고받을 것을 약속하고 제5조제1항제2호의 규정을 위반한 자는 5년 이하의 징역 또는 3천만 원 이하의 벌금에 처하거나 이를 병과할 수 있다.
③ 제1항 또는 제2항의 규정을 위반하여 주고받은 금전 또는 재산상의 이익 그 밖의 반대급부는 이를 몰수한다. 다만, 이에 대한 몰수가 불가능할 때에는 그 가액을 추징한다.
제34조 (벌칙)
다음 각호의 어느 하나에 해당하는 자는 2년 이하의 징역 또는 1천만 원 이하의 벌금에 처한다.
1. 제5조제2항의 규정을 위반하여 조직을 관리하거나 이식한 자
2. 제13조의 규정을 위반하여 허가받지 아니하고 조직은행을 설립한 자
3. 제22조의 규정을 위반하여 조직기증자와 채취한 조직에 관한 사항 등을 알려준 자
제35조 (자격정지의 병과)
이 법에 위반한 자를 유기징역에 처할 경우에는 10년 이하의 자격정지를 병과할 수 있다.
제36조 (양벌규정)
법인의 대표자나 법인 또는 개인의 대리인·사용인 그 밖의 종업원이 제33조제2항 및 제34조의 규정을 위반한 때에는 행위자를 벌하는 외에 그 법인 또는 개인에 대하여도 각 해당 조의 벌금형을 과한다.
제37조 (과태료)
① 다음 각호의 1에 해당하는 자는 500만 원 이하의 과태료에 처한다.
1. 제16조제1항의 규정을 위반하여 동의사실을 확인하지 아니하거나 충분한 설명을 하지 아니한 자
2. 제18조 본문의 규정을 위반하여 조직을 채취한 자
② 다음 각호의 1에 해당하는 자는 300만 원 이하의 과태료에 처한다.
1. 제19조의 규정을 위반하여 작성 또는 보고하지 아니한 자
2. 제20조의 규정을 위반하여 기록을 보존하지 아니한 자
3. 제21조 본문의 규정을 위반하여 기록의 열람 또는 사본의 교부요구에 응하지 아니한 자
4. 제23조제1항의 규정에 의한 명령을 이행하지 아니한 자
5. 제24조의 규정에 의한 명령을 이행하지 아니한 자
6. 제26조의 규정을 위반하여 신고 또는 자료이관을 하지 아니한 자
제38조 (과태료의 부과·징수절차)
① 제37조의 규정에 의한 과태료는 대통령령이 정하는 바에 의하여 보건복지부장관, 그 소속기관의 장, 특별시장·광역시장·도지사 또는 시장·군수·구청장(이하 “부과권자”라 한다)이 부과·징수한다.
② 제1항의 규정에 의한 과태료처분에 불복이 있는 자는 그 처분의 고지를 받은 날부터 30일 이내에 부과권자에게 이의를 제기할 수 있다.
③ 제1항의 규정에 의한 과태료처분을 받은 자가 제2항의 규정에 의하여 이의를 제기한 때에는 부과권자는 지체없이 관할법원에 그 사실을 통보하여야 하며, 통보를 받은 관할법원은 비송사건절차법에 의한 과태료의 재판을 한다.
④ 제2항의 규정에 의한 기간 이내에 이의를 제기하지 아니하고 과태료를 납부하지 아니한 때에는 국세 또는 지방세체납처분의 예에 의하여 이를 징수한다.
부칙 <제7097호,2004.1.20>
① (시행일) 이 법은 2005년 1월 1일부터 시행한다.
② (인체조직안전관리자문위원회의 구성준비) 보건복지부장관은 이 법 시행 전에 제6조의 규정에 의한 인체조직안전관리자문위원회의 구성을 위하여 필요한 사무를 처리할 수 있다.
③ (조직은행의 설립·허가 준비) 보건복지부장관 및 조직은행의 장은 이 법 시행 전에 제13조의 규정에 의한 조직은행의 설립 및 허가에 필요한 사무처리를 할 수 있다.
부칙 <제7375호,2005.1.27>
이 법은 공포한 날부터 시행한다.

[일부개정 2004.1.29 법률 7150호]
제1장 총칙
제1조 (목적)
이 법은 장기 등의 기증에 관한 사항과 사람의 장기 등을 다른 사람의 장기 등의 기능회복을 위하여 적출 및 이식하는데 필요한 사항을 규정함으로써 장기 등의 적출 및 이식의 적정을 도모하고, 국민보건의 향상에 이바지함을 목적으로 한다.
제2조 (기본이념)
① 장기 등의 적출 및 이식은 인도적 정신에 따라 행하여져야 한다.
② 장기 등을 기증하고자 하는 자가 자신의 장기 등의 기증에 관하여 표시한 의사는 존중되어야 한다. 이 경우 장기 등을 기증하고자 하는 자의 의사는 자발적인 것이어야 한다.
③ 장기 등을 이식받을 기회는 장기 등의 이식을 필요로 하는 모든 사람에게 공평하게 주어져야 한다.
④ 장기 등의 적출 및 이식은 윤리적으로 타당하고 의학적으로 인정된 방법에 의하여 행하여져야 한다.
제2조의2 (장기 등 기증자의 존중) 장기 등 기증자의 이웃에 대한 사랑과 희생정신은 항구적으로 존중되어야 한다.
[본조신설 2002.8.26]
제3조 (정의)
이 법에서 사용하는 용어의 정의는 다음과 같다.
1. “장기 등”이라 함은 사람 내장의 여러 기관 등으로서 다음 각목의 1에 해당하는 것을 말한다.
가. 신장·간장·췌장·심장·폐
나. 골수·각막
다. 사람의 기관 또는 조직 중 다른 사람의 장기 등의 기능회복을 위하여 적출하여 이식될 수 있는 것으로서 대통령령이 정하는 것
2. “장기 등 기증자”라 함은 다른 사람의 장기 등의 기능회복을 위하여 대가없이 자신의 특정한 장기 등을 제공하는 자를 말한다.
3. “장기 등 이식대기자”라 함은 자신의 장기 등의 기능회복을 목적으로 다른 사람의 장기 등을 이식받기 위하여 제12조제1항의 규정에 의한 장기이식등록기관에 등록한 자를 말한다.
4. “살아있는 자”라 함은 사람 중에서 뇌사자를 제외한 자를 말하며, “뇌사자”라 함은 이 법에 의한 뇌사판정기준 및 뇌사판정절차에 따라 뇌 전체의 기능이 되살아 날 수 없는 상태로 정지되었다고 판정된 자를 말한다.
5. “가족” 또는 “유족”이라 함은 살아있는 자, 뇌사자 또는 사망한 자의 다음 각목의 1에 해당하는 자를 말한다. 다만, 14세 미만인 자를 제외한다.
가. 배우자
나. 직계비속
다. 직계존속
라. 형제자매
마. 가목 내지 라목의 가족 또는 유족이 없는 경우에는 4촌 이내의 친족
제4조 (적용범위)
이 법은 다른 사람의 장기 등의 기능회복을 위한 이식의 목적으로 살아있는 자 등으로부터 적출 및 이식되는 장기 등에 적용한다.
제5조 (국가 및 지방자치단체의 의무)
국가 및 지방자치단체는 장기 등의 이식을 필요로 하는 모든 사람이 장기 등을 공평하게 이식받을 수 있는 기회가 보장되도록 하여야 하며, 장기 등의 적출 및 이식이 적정하게 이루어지도록 하여야 한다.
제6조 (장기 등의 매매행위 등의 금지)
① 누구든지 금전 또는 재산상의 이익 기타 반대급부를 주고받거나 주고받을 것을 약속하고 다음 각호의 1에 해당하는 행위를 하여서는 아니된다. <개정 1999.9.7>
1. 타인의 장기 등을 제3자에게 주거나 제3자에게 주기 위하여 받는 행위 또는 이를 약속하는 행위
2. 자신의 장기 등을 타인에게 주거나 타인의 장기 등을 자신에게 이식하기 위하여 받는 행위 또는 이를 약속하는 행위
3. 제1호 및 제2호의 행위를 교사·알선·방조하는 행위
② 누구든지 제1항제1호 및 제2호에 위반되는 행위를 교사·알선·방조하여서는 아니된다.
③ 누구든지 제1항 또는 제2항의 규정에 위반되는 행위가 있음을 안 때에는 그 행위와 관련되는 장기 등을 적출하거나 이식하여서는 아니된다.
제2장 장기 등 이식윤리위원회 및 장기이식관리기관
<개정 2004.1.29>
제7조 (장기 등 이식윤리위원회<개정 2004.1.29>)
① 장기 등의 적출 및 이식과 뇌사판정 등에 관한 보건복지부장관의 자문에 응하기 위하여 보건복지부에 장기 등 이식윤리위원회(이하 “위원회”라 한다)를 둔다. <개정 2004.1.29>
② 위원회는 다음 각호의 사항을 심의한다.
1. 뇌사판정기준에 관한 사항
2. 장기 등을 이식받을 자(이하 “이식대상자”라 한다)의 선정기준에 관한 사항
3. 제12조제1항의 규정에 의한 장기이식등록기관 및 제21조의 규정에 의한 장기이식의료기관의 지정기준에 관한 사항
4. 기타 장기 등의 적출 및 이식 등에 관하여 보건복지부장관이 회의에 부치는 사항
제8조 (위원회의 구성과 운영)
① 위원회는 위원장을 포함한 15인 이상 20인 이하의 위원으로 구성하되, 위원은 의사 또는 변호사의 자격을 가진 자, 판사, 검사, 공무원과 학식과 사회적 덕망이 풍부한 자 중에서 보건복지부장관이 임명 또는 위촉한다.
② 위원장은 위원 중에서 호선한다.
③ 위원회는 위원회의 효율적 운영을 위하여 분야별로 전문위원회를 둘 수 있다.
④ 위원회 및 전문위원회의 구성 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
제9조 (국립장기이식관리기관)
① 장기 등의 이식에 관한 사항을 적정하게 관리하기 위하여 장기이식관리기관을 두되, 장기이식관리기관은 국·공립의료기관 또는 보건복지부 소속기관 중에서 보건복지부령이 정하는 기관(이하 “국립장기이식관리기관”이라 한다)으로 한다.
② 국립장기이식관리기관의 업무는 다음 각호와 같다. <개정 2002.8.26>
1. 이식대상자의 선정
2. 장기 등 기증자 및 장기 등 이식대기자의 인적사항과 신체검사의 결과에 관한 자료의 관리
3. 제12조제1항의 규정에 의한 장기이식등록기관, 제15조제1항의 규정에 의한 뇌사판정기관, 제16조의2의 규정에 의한 뇌사판정대상자관리전문기관 및 제21조의 규정에 의한 장기이식의료기관에 대한 지도·감독
4. 장기 등의 적출 및 이식에 관한 조사·연구, 정보·통계의 관리 및 홍보
5. 기타 장기 등의 적출 및 이식에 관하여 대통령령이 정하는 업무
③ 국립장기이식관리기관의 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
제3장 장기 등의 적출 및 이식 등
제1절 통칙
제10조 (장기 등의 적출·이식의 금지 등)
① 다음 각호의 1에 해당하는 장기 등은 이를 적출하거나 이식하여서는 아니된다. <개정 1999.9.7>
1. 장기 등의 이식에 부적합한 전염성 병원에 감염된 장기 등
2. 암세포에 침범된 장기 등
3. 기타 이식대상자의 생명·신체에 위해를 가할 우려가 있는 것으로서 대통령령이 정하는 장기 등
② 이식대상자가 정하여지지 아니한 경우에는 장기 등을 적출하여서는 아니된다. 다만, 각막 등 상당한 기간이 지난 후에도 이식이 가능한 장기 등으로서 대통령령이 정하는 장기 등의 경우에는 그러하지 아니하다.
③ 살아있는 자로서 다음 각호의 1에 해당하는 자의 장기 등은 이를 적출하여서는 아니된다. 다만, 제1호에 규정된 자의 경우에는 골수에 한하여 이를 적출할 수 있다.
1. 16세 미만인 자
2. 임부, 해산한 날부터 3월이 경과하지 아니한 자
3. 정신질환자·정신지체인
4. 마약·대마 또는 향정신성의약품에 중독된 자
④ 살아있는 자로서 16세 이상인 미성년자의 장기 등(골수를 제외한다)은 배우자·직계존비속·형제자매 또는 4촌 이내의 친족에게 이식하는 경우를 제외하고는 이를 적출할 수 없다.
⑤ 살아있는 자로부터 적출할 수 있는 장기 등은 다음 각호의 것에 한한다.
1. 신장은 정상적인 것 2개 중 1개
2. 간장·골수 및 대통령령이 정하는 장기 등은 의학적으로 인정되는 범위 안에서 그 일부
제11조 (장기 등의 기증에 관한 동의)
① 장기 등의 기증에 관한 이 법에 의한 장기 등 기증자 본인 및 가족·유족의 동의는 다음 각호에 의한 것이어야 한다. <개정 1999.9.7, 2002.8.26>
1. 본인의 동의
본인이 서명한 문서에 의한 동의 또는 민법의 유언에 관한 규정에 의한 유언의 방식에 의한 동의
2. 가족 또는 유족의 동의
제3조제5호 각목의 규정에 의한 가족 또는 유족의 순위에 의한 선순위자 2인(가족 또는 유족이 1인인 경우에는 1인)의 서면에 의한 동의. 다만, 선순위자 2인이 모두 미성년자인 경우에는 그 미성년자의 동의외에 미성년자가 아닌 차순위의 가족 또는 유족 1인이 함께 동의한 것이어야 하며, 선순위자가 행방불명 그 밖에 대통령령이 정하는 부득이한 사유로 동의를 할 수 없는 경우에는 그의 차순위자가 동의할 수 있다.
② 제18조제2항제1호의 규정에 의한 뇌사자 또는 사망한 자의 장기 등의 적출에 관한 그 가족 또는 유족의 거부의 의사표시는 제3조제5호 각목의 규정에 의한 가족 또는 유족의 순위에 의한 선순위자 2인 중 1인이 이를 하여야 한다.
③ 제1항제2호 및 제2항의 규정에 의한 선순위자 2인을 확정함에 있어서 선순위자에 포함되는 자가 3인 이상인 경우에는 다음 각호의 방법에 의하여 이를 확정한다. <개정 1999.9.7>
1. 최선순위자가 3인 이상인 경우: 최선순위자 중 촌수·연장자순(촌수가 우선한다)에 따른 2인
2. 최선순위자가 1인이고 그 다음 순위자가 2인 이상인 경우: 최선순위자 1인과 그 다음 순위자 중 촌수·연장자순(촌수가 우선한다)에 따른 1인
제2절 장기 등 기증자 및 장기 등 이식대기자의 등록
제12조 (장기이식등록기관)
① 장기 등 기증자, 장기 등 기증희망자 및 장기 등 이식대기자의 등록에 관한 업무를 수행하고자 하는 자는 대통령령이 정하는 시설·인력 등을 갖추고 보건복지부장관으로부터 장기이식등록기관(이하 “등록기관”이라 한다)으로 지정을 받아야 한다. 이 경우 보건복지부장관은 대통령령이 정하는 바에 의하여 당해 등록기관이 등록을 받을 수 있는 장기 등의 종류를 정하여 지정할 수 있다.
② 등록기관으로 지정받을 수 있는 자는 다음 각호와 같다.
1. 국가 또는 지방자치단체
2. 대한적십자사조직법에 의하여 설립된 대한적십자사
3. 의료법 제3조의 규정에 의한 의료기관(이하 “의료기관”이라 한다)
4. 장기 등의 기증 및 이식에 관련된 사업을 주된 목적으로 하여 설립된 비영리법인
③ 등록기관의 업무는 다음 각호와 같다.
1. 장기 등 기증자 또는 장기 등 이식대기자 등의 등록에 관한 업무
2. 장기 등 기증자 또는 장기 등 이식대기자로 등록하고자 하는 자의 신체검사에 관한 사항
3. 장기 등 기증자 또는 장기 등 이식대기자 등의 등록결과에 대한 국립장기이식관리기관에의 통보
4. 기타 제1항의 규정에 의한 등록에 관하여 대통령령이 정하는 업무
제13조 (장기 등 기증자 등의 등록)
① 장기 등 기증자 또는 장기 등 이식대기자로 등록하고자 하는 자는 보건복지부령이 정하는 바에 의하여 등록기관에 등록신청을 하여야 한다. 다만, 장기 등 기증자가 뇌사자 또는 사망한 자인 경우에는 그 가족 또는 유족 중 1인이 등록신청을 할 수 있다.
② 등록기관의 장은 제1항의 규정에 의한 신청을 받은 때에는 다음 각호의 기준에 의하여 등록 여부를 결정하여야 한다.
1. 장기 등 기증자의 경우
제11조 및 제18조의 규정에 의한 본인이나 가족 또는 유족의 동의 여부와 등록기관의 장이 실시하는 신체검사(등록기관이 의료기관이 아닌 경우에는 등록기관의 장이 지정하는 의료기관이 실시하는 신체검사를 말한다. 이하 같다) 결과 장기 등 기증자로 적합한지의 여부. 다만, 장기 등 기증자로 적합한지의 여부를 확인할 수 있는 신체검사 결과가 있는 경우에는 신체검사를 생략할 수 있다.
2. 장기 등 이식대기자의 경우
등록기관의 장이 실시하는 신체검사 결과 장기 등 이식대기자로 적합한지의 여부
③ 등록기관의 장은 장래에 장기 등을 기증할 의사표시만을 하는 자에 대하여는 제11조의 규정에 의한 본인의 동의 여부만을 확인한 후 장기 등 기증희망자로 등록할 수 있다.
④ 등록기관의 장은 제2항 및 제3항의 규정에 의하여 등록을 결정한 경우에는 그 등록을 하고, 지체없이 그 결과를 신청인 및 국립장기이식관리기관의 장에게 통보하여야 한다.
⑤ 제2항의 규정에 의한 신체검사의 항목 및 방법 기타 신체검사의 실시에 관하여 필요한 사항은 국립장기이식관리기관의 장이 보건복지부장관의 승인을 얻어 이를 정한다.
⑥ 등록기관의 장은 등록을 한 자가 장기 등의 기증 등에 관한 의사표시를 철회한 때에는 즉시 그 등록을 말소하여야 한다.
제3절 뇌사의 판정
제14조 (뇌사판정의료기관 및 뇌사판정위원회)
① 장기 등의 적출 및 이식을 위한 뇌사판정업무를 하고자 하는 의료기관은 보건복지부령이 정하는 바에 의하여 국립장기이식관리기관의 장에게 통보하여야 한다.
② 뇌사판정업무를 하고자 하는 의료기관은 제1항의 규정에 의한 통보 전까지 보건복지부령이 정하는 시설·장비·인력 등을 갖추고, 당해 의료기관에 뇌사판정위원회를 설치하여야 한다.
③ 제2항의 규정에 의한 뇌사판정위원회는 대통령령이 정하는 바에 따라 전문의사 3인 이상을 포함한 6인 이상 10인 이하의 위원으로 구성한다. <개정 2002.8.26>
④ 뇌사판정위원회의 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
⑤ 제1항의 규정에 의하여 통보한 의료기관이 아니면 장기 등의 적출 및 이식을 위한 뇌사판정업무를 할 수 없다.
제15조 (뇌사의 판정신청)
① 뇌사로 추정되는 자(이하 “뇌사판정대상자”라 한다)의 장기 등의 기증을 위한 뇌사판정을 받고자 하는 자는 보건복지부령이 정하는 바에 의하여 뇌사판정대상자에 대한 검사기록 및 진료를 담당한 의사의 소견서를 첨부하여 제14조의 규정에 의하여 국립장기이식관리기관의 장에게 통보한 의료기관(이하 “뇌사판정기관”이라 한다)의 장에게 뇌사판정의 신청을 하여야 한다.
② 제1항의 규정에 의하여 뇌사판정의 신청을 할 수 있는 자는 다음 각호의 1에 해당하는 자로 한다.
1. 뇌사판정대상자의 가족
2. 뇌사판정대상자의 가족이 없는 경우에는 진료를 담당한 의사(뇌사판정대상자가 제13조제3항의 규정에 의하여 장기 등의 기증에 동의한 경우에 한한다)
제16조 (뇌사의 판정등)
① 뇌사판정기관의 장은 제15조제1항의 규정에 의한 뇌사판정의 신청을 받은 경우에는 보건복지부령이 정하는 바에 의하여 전문의사 2인 이상과 진료를 담당한 의사가 함께 작성한 뇌사조사서를 첨부하여 뇌사판정위원회에 뇌사판정을 요청하여야 한다.
② 제1항의 규정에 의하여 뇌사판정의 요청을 받은 뇌사판정위원회는 전문의사인 위원 2인 이상을 포함한 재적위원 3분의 2 이상의 출석과 출석위원 전원의 찬성으로 뇌사판정을 한다. 이 경우 뇌사판정의 기준은 별표와<%생략:별표0%> 같다.
③ 뇌사판정위원회는 뇌사판정을 위하여 필요하다고 인정하는 경우에는 뇌사조사서를 작성한 전문의사와 진료를 담당한 의사로 하여금 뇌사판정위원회에 출석하여 의견을 진술하게 할 수 있다.
④ 뇌사판정위원회는 제2항의 규정에 의하여 뇌사판정을 한 경우에는 대통령령이 정하는 바에 의하여 출석위원 전원이 서명 또는 기명날인한 뇌사판정서 및 회의록을 작성하고 이를 뇌사판정기관의 장에게 제출하여야 한다.
⑤ 뇌사판정기관의 장은 제4항의 규정에 의하여 뇌사판정서 및 회의록을 제출받은 때에는 그 사본과 보건복지부령이 정하는 자료를 국립장기이식관리기관의 장에게 송부하여야 하며, 뇌사판정 신청자에 대하여는 뇌사판정서의 사본을 송부하여야 한다.
제16조의2 (뇌사판정대상자관리전문기관)
① 국립장기이식관리기관의 장은 제15조제1항의 규정에 의하여 뇌사판정의 신청이 된 뇌사판정대상자에 대하여 장기 등 기증, 뇌사판정, 장기적출·이식 등에 관한 일련의 업무를 통합하여 수행할 수 있는 뇌사판정대상자관리전문기관을 지정할 수 있다.
② 제1항의 규정에 의하여 뇌사판정대상자관리전문기관으로 지정될 수 있는 기관은 다음 각호의 요건을 모두 갖추어야 한다.
1. 제12조제1항의 규정에 의하여 지정된 등록기관일 것
2. 제14조의 규정에 의하여 통보된 뇌사판정기관일 것
3. 제21조의 규정에 의하여 지정된 장기이식의료기관일 것
③ 뇌사판정대상자관리전문기관의 지정기준·업무 그 밖의 필요한 사항은 보건복지부령으로 정한다.
[본조신설 2002.8.26]
제17조 (뇌사자의 사망원인)
뇌사자가 이 법에 의한 장기 등의 적출로 사망한 때에는 뇌사의 원인이 된 질병 또는 행위로 인하여 사망한 것으로 본다.
제4절 장기 등의 적출 및 이식
제18조 (장기 등의 적출요건)
① 살아있는 자의 장기 등은 본인이 동의한 경우에 한하여 이를 적출할 수 있다. 다만, 16세 이상인 미성년자의 장기 등과 16세 미만인 미성년자의 골수를 적출하고자 하는 경우에는 본인의 동의 외에 그 부모(부모가 없고 형제자매에게 골수를 이식하기 위하여 적출하고자 하는 경우에는 법정대리인)의 동의를 얻어야 한다.
② 뇌사자와 사망한 자의 장기 등은 다음 각호의 1에 해당하는 경우에 한하여 이를 적출할 수 있다. 다만, 정신질환자 및 정신지체인의 장기 등의 경우에는 제1호의 경우에 한하여 이를 적출할 수 있다.
1. 본인이 뇌사 또는 사망 전에 장기 등의 적출에 동의한 경우. 다만, 그 가족 또는 유족이 장기 등의 적출을 명시적으로 거부하는 경우를 제외한다.
2. 본인이 뇌사 또는 사망 전에 장기 등의 적출에 동의 또는 반대하였다는 사실이 확인되지 아니한 경우로서 그 가족 또는 유족이 장기 등의 적출에 동의한 경우. 다만, 본인이 16세 미만의 미성년자인 경우에는 그 부모가 장기 등의 적출에 동의한 경우에 한한다.
③ 제1항 또는 제2항의 규정에 의한 동의를 한 자는 장기 등의 적출을 위한 수술이 시작되기 전까지는 언제든지 장기 등의 적출에 관한 동의의 의사표시를 철회할 수 있다.
제19조 (장기 등의 적출 시 준수사항)
장기 등을 적출하고자 하는 의사는 다음 각호의 사항을 준수하여야 한다. <개정 2002.8.26>
1. 제18조의 규정에 의한 동의 사실을 확인할 것
2. 장기 등 기증자가 살아있는 자인 경우에는 본인 여부를 확인하고 본인과 그 가족에게 다음 각목의 사항을 충분히 설명할 것
가. 장기 등 기증자의 건강상태
나. 장기 등의 적출수술의 내용과 건강에 미치는 영향
다. 장기 등의 적출 후 치료계획
라. 기타 장기 등 기증자가 장기 등의 적출과 관련하여 사전에 알아야 할 사항
제20조 (해부 또는 검시의 우선)
형사소송법 또는 검역법에 의하여 해부 또는 검시를 하여야 하는 경우에는 그 해부 또는 검시 전에 장기 등의 이식을 위한 장기 등의 적출을 할 수 없다. 다만, 진료를 담당한 의사가 적출할 장기 등과 사망의 원인 간에 상관관계가 없고 해부 또는 검시를 기다려서는 적출할 시기를 상실할 우려가 있다고 판단하는 경우에는 관할지방검찰청 또는 지방검찰청지청의 검사, 관할검역소장의 승인과 유족의 동의를 받아 장기 등을 적출할 수 있다.
제21조 (장기이식의료기관)
① 장기 등의 이식을 위하여 장기 등을 적출하거나 이를 이식하고자 하는 의료기관은 보건복지부장관으로부터 장기이식의료기관(이하 “이식의료기관”이라 한다)으로 지정을 받아야 한다.
② 이식의료기관으로 지정을 받고자 하는 의료기관은 대통령령이 정하는 시설·장비·인력 등을 갖추어야 한다.
③ 이식의료기관이 아니면 장기 등의 이식을 위하여 장기 등을 적출하거나 이를 이식할 수 없다.
제22조 (이식대상자의 선정 등)
① 국립장기이식관리기관의 장은 제13조제4항의 규정에 의하여 장기 등 기증자의 등록결과를 통보받은 때에는 대통령령이 정하는 장기 등 이식대상자의 선정기준에 의하여 장기 등 이식대기자중에서 이식대상자를 선정하여야 한다. 이 경우 국립장기이식관리기관의 장은 이를 장기 등 기증자 또는 이식대상자가 등록된 등록기관의 장에게 통보하여야 하며 등록기관의 장은 선정사실을 등록된 장기 등 기증자 또는 이식대상자와 그 가족·유족에게 즉시 통보하여야 한다.
② 제1항의 규정에 불구하고 각막의 경우와 이식대상자의 선정을 기다려서는 이식의 시기를 상실할 현저한 우려가 있는 경우 등 대통령령이 정하는 부득이한 사유가 있는 경우에는 이식의료기관의 장이 이식대상자를 선정할 수 있다. 이 경우 이식의료기관의 장은 그 사유 및 선정결과를 국립장기이식관리기관의 장에게 통보하고, 등록기관의 장, 장기 등 기증자 및 이식대상자와 그 가족·유족에 대하여 선정결과를 통보하여야 한다. <개정 2002.8.26>
③ 살아있는 자로서 20세 이상인 장기 등 기증자와 20세 미만인 자 중 골수를 기증하고자 하는 자는 제1항의 규정에 불구하고 자신의 장기 등의 이식대상자를 선정할 수 있다. 이 경우 보건복지부령이 정하는 바에 의하여 미리 국립장기이식관리기관의 장의 승인을 얻어야 한다.
④ 이식대상자의 선정은 제2항 및 제3항과 제10조제4항의 규정에 해당되는 경우를 제외하고는 제1항의 규정에 의하여 국립장기이식관리기관의 이식대상자 선정절차를 거쳐야 한다.
제23조 (뇌사판정 의사의 장기 등의 적출 등 금지)
다음 각호의 1에 해당하는 자는 당해 뇌사자의 장기 등을 적출하거나 이식하는 수술에 참여하여서는 아니된다.
1. 당해 뇌사자에 대한 뇌사조사서를 작성한 전문의사와 진료를 담당한 의사
2. 당해 뇌사자에 대하여 뇌사판정을 한 뇌사판정위원회에 출석한 위원인 의사
제5절 기록의 작성 및 열람등
제24조 (기록의 작성 및 장기 등의 적출사실 통보 등)
① 장기 등을 적출하거나 이식한 의사는 보건복지부령이 정하는 바에 의하여 그 기록을 작성하여 당해 장기 등을 적출하거나 이식한 이식의료기관의 장에게 제출하여야 한다.
② 제1항의 규정에 의하여 기록을 제출받은 이식의료기관의 장은 보건복지부령이 정하는 바에 의하여 그 내용을 국립장기이식관리기관의 장에게 통보하여야 한다.
③ 뇌사자의 장기 등을 적출한 이식의료기관의 장은 지체 없이 그 사실을 관할 지방검찰청 또는 지방검찰청지청의 장에게 서면으로 통보하여야 한다.
제25조 (기록의 보존)
① 뇌사판정기관의 장은 제16조제4항의 규정에 의한 뇌사판정서 및 회의록 기타 보건복지부령이 정하는 뇌사판정에 관련된 자료를 15년간 보존하여야 한다.
② 이식의료기관의 장은 제24조제1항의 규정에 의한 장기 등의 적출 또는 이식에 관한 기록을 보건복지부령이 정하는 바에 의하여 보존하여야 한다.
제26조 (기록의 열람등)
이식의료기관의 장은 다음 각호의 1에 해당하는 경우에는 장기 등의 적출 또는 이식에 관한 기록을 열람시키거나 사본을 교부하여야 한다. 다만, 진료를 담당한 의사가 그 기록의 내용을 장기 등을 기증하거나 이식받은 자 본인이 알게 되는 경우 그의 치료 또는 회복에 현저한 지장을 초래할 우려가 있다고 판단하는 때에는 이를 거부할 수 있다.
1. 장기 등을 기증한 자 또는 그 가족·유족이 당해 장기 등의 적출에 관한 기록의 열람 또는 사본의 교부를 요구하는 경우
2. 장기 등을 이식받은 자 또는 그 가족·유족이 당해 장기 등의 이식에 관한 기록의 열람 또는 사본의 교부를 요구하는 경우
제27조 (비밀의 유지)
① 국립장기이식관리기관·등록기관·뇌사판정기관 또는 이식의료기관에 종사하는 자로서 대통령령이 정하는 자는 이 법에 특별히 규정한 경우를 제외하고는 당해 장기 등 기증자 등의 등록 또는 장기 등의 적출 또는 이식과 관련된 업무를 담당하는 자 외의 자에게 다음 각호의 1에 해당하는 행위를 하여서는 아니된다.
1. 장기 등 기증자와 적출한 장기 등에 관한 사항을 알려주는 행위
2. 이식대상자와 이식한 장기 등에 관한 사항을 알려주는 행위
3. 장기 등 기증희망자 및 장기 등 이식대기자에 관한 사항을 알려주는 행위
② 다음 각호의 1에 해당하는 경우에는 제1항의 규정을 적용하지 아니한다.
1. 범죄수사를 위한 수사기관이 장기 등의 적출 또는 이식과 관련된 자료를 요청한 경우
2. 재판과 관련되어 법관이 장기 등의 적출 또는 이식과 관련된 자료의 제출명령을 한 경우
제4장 감독
제28조 (보고·조사 등)
① 보건복지부장관 또는 국립장기이식관리기관의 장은 장기 등의 기증·적출 또는 이식등과 관련하여 필요하다고 인정하는 경우에는 등록기관·뇌사판정기관 또는 이식의료기관의 장 및 그 종사자에 대하여 그 업무에 관하여 필요한 명령을 하거나, 보고 또는 관계서류의 제출을 명할 수 있다.
② 보건복지부장관 또는 국립장기이식관리기관의 장은 제1항의 규정에 의한 등록기관등의 관계서류 등을 관계공무원으로 하여금 조사하게 할 수 있다. 이 경우 조사를 담당하는 관계공무원은 그 권한을 증명하는 증표를 내보여야 한다.
③ 제1항 및 제2항의 경우에 등록기관·뇌사판정기관 또는 이식의료기관의 장 및 그 종사자는 정당한 사유가 없는 한 이에 응하여야 한다.
제29조 (시정명령)
보건복지부장관은 등록기관·뇌사판정기관 또는 이식의료기관의 장 및 그 종사자가 다음 각호의 1에 해당하는 경우에는 해당기관의 장에게 일정한 기간을 정하여 위반된 사항의 시정을 명할 수 있다.
1. 제13조제4항의 규정에 의하여 장기 등 기증자 등의 등록결과를 통보하지 아니한 경우
2. 제16조제5항의 규정에 의하여 뇌사판정서 및 회의록의 사본 등을 국립장기이식관리기관의 장에게 송부하지 아니한 경우
3. 제24조제1항의 규정에 의하여 장기 등의 적출 또는 이식에 관한 기록을 작성하지 아니한 경우
4. 제24조제2항 또는 제3항의 규정에 의한 통보를 하지 아니한 경우
제30조 (지정취소 등)
① 보건복지부장관은 등록기관 또는 이식의료기관이 다음 각호의 1에 해당하는 경우에는 그 지정을 취소하거나 1년 이내의 기간을 정하여 장기 등 기증자 등의 등록, 장기 등의 적출 또는 이식에 관한 업무의 정지를 명할 수 있다.
1. 제12조제1항 전단 또는 제21조제2항의 규정에 의한 시설·장비·인력 등을 갖추지 아니한 때
2. 제12조제1항 후단의 규정에 의하여 등록받을 수 있는 장기 등이 아닌 장기 등에 대한 등록업무를 한 때
3. 제28조제1항의 규정에 의한 명령을 이행하지 아니하거나 동조제2항의 규정에 의한 조사에 불응한 때
4. 제29조의 규정에 의한 시정명령을 이행하지 아니한 때
5. 기타 대통령령이 정하는 사유에 해당하는 때
② 보건복지부장관은 뇌사판정기관이 다음 각호의 1에 해당하는 경우에는 3년 이내의 기간을 정하여 뇌사판정업무의 정지를 명할 수 있다.
1. 제14조제2항의 규정에 의한 시설·장비·인력 등을 갖추지 아니한 때
2. 제14조제2항 내지 제4항의 규정에 의한 뇌사판정위원회를 설치하지 아니한 때
3. 제16조의 규정을 위반하여 뇌사판정업무를 한 때
4. 제28조제1항의 규정에 의한 명령을 이행하지 아니하거나 동조제2항의 규정에 의한 조사에 불응한 때
5. 제29조의 규정에 의한 시정명령을 이행하지 아니한 때
6. 기타 이 법 또는 이 법에 의한 명령에 위반한 때
③ 보건복지부장관은 등록기관 또는 이식의료기관이 제1항의 규정에 의한 업무의 정지명령을 위반하여 업무를 한 때에는 그 지정을 취소할 수 있다.
④ 제1항 및 제3항의 규정에 의하여 지정이 취소된 등록기관 및 이식의료기관은 그 지정이 취소된 날부터 1년 이내에 등록기관 또는 이식의료기관으로 지정받을 수 없다.
제31조 (폐업 등의 신고·통보 및 자료이관)
① 등록기관 또는 이식의료기관이 폐업하고자 하거나 장기 등 기증자 및 장기 등 이식대기자등의 등록이나 장기 등의 적출 또는 이식업무를 종료하고자 하는 때에는 보건복지부령이 정하는 바에 의하여 국립장기이식관리기관의 장에게 신고하여야 한다.
② 뇌사판정기관이 뇌사판정업무를 종료하고자 하는 때에는 그 사실을 국립장기이식관리기관의 장에게 통보하여야 한다.
③ 제1항 및 제2항의 규정에 의하여 폐업하거나 업무를 종료하고자 하는 등록기관·이식의료기관 또는 뇌사판정기관의 장, 제30조의 규정에 의하여 업무의 정지명령을 받거나 지정이 취소된 등록기관·이식의료기관 또는 뇌사판정기관의 장은 대통령령이 정하는 바에 의하여 관련 자료를 국립장기이식관리기관의 장에게 이관하여야 한다.
제5장 보칙
제32조 (국립장기이식관리기관 등에 대한 지원)
국가 또는 지방자치단체는 국립장기이식관리기관·등록기관·뇌사판정기관·뇌사판정대상자관리전문기관 및 이식의료기관에 대하여 필요한 지원을 할 수 있다. <개정 2002.8.26>
제33조 (협조의무)
보건복지부장관 또는 국립장기이식관리기관의 장은 장기 등을 안전하고 신속하게 적출·운반하거나 이식하기 위하여 필요한 조치를 관계기관의 장에게 요청할 수 있다. 이 경우 관계기관의 장은 정당한 사유가 없는 한 이에 응하여야 한다.
제34조 (국립장기이식관리기관 등의 명칭 사용금지)
이 법에 의한 국립장기이식관리기관·등록기관·뇌사판정기관·뇌사판정대상자관리전문기관 또는 이식의료기관이 아니면 각각 당해 명칭을 사용하지 못한다. <개정 2002.8.26>
제35조 (권한의 위임)
이 법에 의한 보건복지부장관의 권한은 그 일부를 대통령령이 정하는 바에 의하여 소속기관의 장이나 특별시장·광역시장·도지사 또는 시장·군수·구청장(자치구의 구청장을 말한다. 이하 같다)에게 위임할 수 있다.
제36조 (청문)
보건복지부장관은 제30조제1항 및 제3항의 규정에 의한 취소처분을 하고자 하는 때에는 청문을 실시하여야 한다.
제37조 (장기 등의 적출·이식 비용의 부담 등)
① 장기 등의 적출 및 이식에 소요되는 비용은 해당 장기 등을 이식받은 자가 부담한다. 다만, 이식받은 자가 부담하는 비용에 대하여 다른 법령이 따로 정하는 경우에는 당해 법령이 정하는 바에 의한다.
② 제1항의 규정에 의한 비용의 산출은 국민건강보험법이 정하는 바에 의한다. 다만, 국민건강보험법이 규정하지 아니한 비용의 산출은 보건복지부령이 정하는 바에 의한다. <개정 2002.8.26>
제38조 (수수료)
① 장기 등 이식대기자로 등록하고자 하는 자는 등록기관의 장에게 수수료를 납부하여야 한다.
② 제1항의 규정에 의한 수수료의 금액 등에 관하여는 보건복지부령으로 정한다.
제6장 벌칙
제39조 (벌칙)
① 다음 각호의 1에 해당하는 자는 무기징역 또는 2년 이상의 유기징역에 처한다. <개정 1999.9.7>
1. 제10조제1항의 규정에 위반하여 전염성 병원에 감염된 장기 등, 암세포에 침범된 장기 등 또는 이식대상자의 생명·신체에 위해를 가할 우려가 있는 장기 등을 적출하거나 이식한 자
2. 제10조제2항의 규정에 위반하여 이식대상자가 정하여지지 아니한 장기 등을 적출한 자
3. 제10조제3항의 규정에 위반하여 동항 각호의 1에 해당하는 자로부터 장기 등을 적출한 자
4. 제10조제4항의 규정에 위반하여 16세 이상인 미성년자의 장기 등을 적출한 자
5. 제10조제5항의 규정에 위반하여 살아있는 자로부터 적출할 수 없는 장기 등을 적출한 자
6. 제16조의 규정에 의한 뇌사판정을 받지 아니한 뇌사판정대상자의 장기 등을 적출한 자
7. 제16조제2항의 규정에 위반하여 뇌사판정을 한 자
8. 제18조제1항의 규정에 위반하여 본인 등의 동의를 받지 아니하고 장기 등을 적출한 자
9. 제18조제2항의 규정에 위반하여 뇌사자로부터 장기 등을 적출한 자
② 제1항의 각호의 1의 규정에 위반하여 사람을 사망에 이르게 한 자는 사형·무기징역 또는 5년 이상의 유기징역에 처한다.
제40조 (벌칙)
① 제6조제1항제1호 또는 제3호의 규정에 위반하여 장기 등을 주고받거나 주고받을 것을 약속하거나, 이를 교사·알선·방조하는 자 또는 동조제3항의 규정에 위반하여 장기 등을 적출하거나 이식한 자는 2년 이상의 유기징역에 처한다.
② 제6조제1항제2호의 규정에 위반하여 장기 등을 주고받거나 주고받을 것을 약속하거나, 동조제2항의 규정에 위반하여 동조제1항제1호 및 제2호의 행위를 교사·알선·방조하는 자는 10년 이하의 징역 또는 5천만 원 이하의 벌금에 처하거나 이를 병과할 수 있다.
③ 제22조제1항 내지 제3항의 규정에 의한 이식대상자의 선정 또는 선정 승인과 관련하여 금전, 재산상의 이익 기타 대가적 급부를 받은 자는 7년 이하의 징역 또는 3천만 원 이하의 벌금에 처하거나 이를 병과할 수 있다.
④ 제1항 내지 제3항의 죄를 범하여 얻은 금전이나 재산상의 이익은 이를 몰수한다. 다만, 이를 몰수할 수 없을 때에는 그 가액을 추징한다.
제41조 (벌칙)
① 제16조제1항의 규정에 의한 전문의사 또는 진료를 담당한 의사가 뇌사조사서를 허위로 작성하여 뇌사자가 아닌 자에 대하여 뇌사판정을 하게 한 때에는 1년 이상의 유기징역에 처한다.
② 제1항의 죄를 범하여 사람을 상해에 이르게 한 때에는 2년 이상의 유기징역에 처한다.
③ 제1항의 죄를 범하여 사람을 사망에 이르게 한 때에는 사형·무기징역 또는 5년 이상의 유기징역에 처한다.
제42조 (벌칙)
① 제16조제1항의 규정에 의한 전문의사 또는 진료를 담당한 의사가 업무상 과실로 인하여 뇌사조사서를 사실과 다르게 작성하여 뇌사자가 아닌 자에 대하여 뇌사판정을 하게 한 때에는 5년 이하의 금고 또는 2천만 원 이하의 벌금에 처한다.
② 제1항의 죄를 범하여 사람을 상해에 이르게 한 때에는 7년 이하의 금고 또는 3천만 원 이하의 벌금에 처한다.
③ 제1항의 죄를 범하여 사람을 사망에 이르게 한 때에는 10년 이하의 금고 또는 5천만 원 이하의 벌금에 처한다.
제43조 (벌칙)
다음 각호의 1에 해당하는 자는 5년 이하의 징역 또는 3천만 원 이하의 벌금에 처한다.
1. 제14조제1항의 규정에 위반하여 국립장기이식관리기관의 장에게 통보하지 아니하고 뇌사판정업무를 하거나 제30조제2항의 규정에 의한 뇌사판정업무의 정지기간 중에 뇌사판정업무를 한 의료기관의 장
2. 제14조제2항 내지 제3항의 규정에 의한 시설·장비·인력 등을 갖추지 아니하거나 뇌사판정위원회를 설치하지 아니하고 뇌사판정업무를 한 의료기관의 장
3. 제18조제2항의 규정에 위반하여 사망한 자로부터 장기 등을 적출한 자
4. 제21조제3항의 규정에 위반하여 장기 등을 적출하거나 이식한 자
5. 제22조제1항 전단의 규정에 위반하여 이식대상자의 선정기준에 따르지 아니하고 이식대상자를 선정한 자
6. 제22조제4항의 규정에 위반하여 이식대상자를 선정하거나 그 장기 등을 이식한 자
7. 제23조의 규정에 위반하여 뇌사자의 장기 등의 적출 또는 이식수술에 참여한 자
제44조 (벌칙)
다음 각호의 1에 해당하는 자는 3년 이하의 징역 또는 2천만 원 이하의 벌금에 처한다.
1. 제22조제2항 후단의 규정에 위반하여 이식대상자를 선정한 사유 및 선정결과를 국립장기이식관리기관의 장에게 통보하지 아니한 자
2. 제24조제3항의 규정에 위반하여 뇌사자의 장기 등의 적출사실을 관할 지방검찰청 또는 지방검찰청지청의 장에게 서면으로 통보하지 아니한 자
3. 제27조의 규정에 위반하여 동조제1항 각호의 1에 해당하는 행위를 한 자
제45조 (벌칙)
다음 각호의 1에 해당하는 자는 2년 이하의 징역 또는 1천만 원 이하의 벌금에 처한다.
1. 업무상 과실로 인하여 제10조제1항의 규정에 위반하여 전염성 병원에 감염된 장기 등, 암세포에 침범된 장기 등 또는 이식에 부적합한 장기 등을 적출하거나 이식한 자
2. 제12조제1항의 규정에 위반하여 등록기관으로 지정받지 아니하고 장기 등 기증자 등의 등록업무를 수행한 자
3. 제16조제5항의 규정에 위반하여 뇌사판정서 및 회의록의 사본과 해당 자료를 국립장기이식관리기관의 장에게 송부하지 아니한 자
4. 제20조의 규정에 위반하여 장기 등을 적출한 자
5. 제22조제3항의 규정에 위반하여 국립장기이식관리기관의 장의 승인을 받지 아니하고 이식대상자를 선정하여 장기 등을 기증한 자
6. 제24조제1항의 규정에 위반하여 장기 등의 적출 또는 이식에 관한 기록을 작성하지 아니하거나 허위로 작성한 자
7. 제25조제1항의 규정에 위반하여 뇌사판정서등 뇌사판정에 관련된 자료를 15년간 보존하지 아니한 자
8. 제25조제2항의 규정에 위반하여 장기 등의 적출 또는 이식에 관한 기록을 보존하지 아니한 자
제46조 (자격정지의 병과)
이 법에 위반한 자를 유기징역에 처할 경우에는 10년 이하의 자격정지를 병과할 수 있다.
제47조 (양벌규정)
법인의 대표자나 법인 또는 개인의 대리인·사용인 기타 종업원이 제40조제2항 및 제3항, 제42조 내지 제45조의 위반행위를 한 때에는 행위자를 벌하는 외에 그 법인 또는 개인에 대하여도 각 해당 조의 벌금형을 과한다.
제48조 (과태료)
① 다음 각호의 1에 해당하는 자는 300만 원 이하의 과태료에 처한다. <개정 2002.8.26>
1. 제13조제4항의 규정에 위반하여 등록결과를 국립장기이식관리기관의 장에게 통보하지 아니한 자
2. 제19조의 규정에 위반하여 동의 사실 또는 본인 여부를 확인하지 아니하거나 필요한 설명을 하지 아니한 자
3. 제22조제1항 후단 또는 제2항 후단의 규정에 위반하여 이식대상자의 선정사실을 장기 등 기증자, 이식대상자와 그 가족·유족에게 통보하지 아니한 자
4. 제31조제3항의 규정에 위반하여 국립장기이식관리기관의 장에게 관련 자료를 이관하지 아니한 자
② 다음 각호의 1에 해당하는 자는 200만 원 이하의 과태료에 처한다. <개정 2002.8.26>
1. 제28조제1항의 규정에 의한 명령을 이행하지 아니하거나 동조 제2항의 규정에 의한 조사를 거부·방해 또는 기피한 자
2. 제34조의 규정에 위반하여 국립장기이식관리기관·등록기관·뇌사판정기관·뇌사판정대상자관리전문기관 또는 이식의료기관이라는 명칭을 사용한 자
③ 다음 각호의 1에 해당하는 자는 100만 원 이하의 과태료에 처한다.
1. 제26조의 규정에 위반하여 기록의 열람 또는 사본의 교부 요구에 응하지 아니한 자
2. 제31조제1항 및 제2항의 규정에 의한 신고 또는 통보를 하지 아니한 자
제49조 (과태료의 부과·징수절차)
① 제48조의 규정에 의한 과태료는 대통령령이 정하는 바에 의하여 보건복지부장관 또는 그 소속기관의 장, 특별시장·광역시장·도지사 또는 시장·군수·구청장 (이하 “부과권자”라 한다)이 부과·징수한다.
② 제1항의 규정에 의한 과태료처분에 불복이 있는 자는 그 처분의 고지를 받은 날부터 30일 이내에 부과권자에게 이의를 제기할 수 있다.
③ 제1항의 규정에 의한 과태료처분을 받은 자가 제2항의 규정에 의하여 이의를 제기한 때에는 부과권자는 지체 없이 관할법원에 그 사실을 통보하여야 하며, 통보를 받은 관할법원은 비송사건절차법에 의한 과태료의 재판을 한다.
④ 제2항의 규정에 의한 기간 내에 이의를 제기하지 아니하고 과태료를 납부하지 아니한 때에는 국세체납처분 또는 지방세체납처분의 예에 의하여 이를 징수한다.
부칙 <제5858호,1999.2.8>
① (시행일) 이 법은 공포 후 1년이 경과한 날부터 시행한다.
② (등록기관등에 대한 경과조치) 이 법 시행당시 장기 등 기증자 등의 등록, 장기 등의 이식을 위한 장기 등의 적출 또는 이식업무를 행하고 있는 자로서 이 법 시행일부터 14일 이내에 보건복지부장관에게 다음 각호의 사항을 신고한 자는 이 법 시행일부터 6월까지는 각각 제12조제1항 및 제21조제1항의 규정에 불구하고 이 법에 의한 등록기관·이식의료기관의 업무를 행할 수 있다.
1. 당해 기관의 명칭·소재지 및 대표자의 인적 사항
2. 당해 기관의 설립근거 및 법인인 경우 그 정관
3. 당해 기관의 장기 등 기증자 등의 등록, 장기 등의 적출 또는 이식 업무의 실적, 그 시설·장비·인력
③ (다른 법률의 개정) 시체해부 및 보존에 관한 법률 중 다음과 같이 개정한다.
제1조중 “해부·보존 및 부분분리”를 “해부 및 보존”으로 한다.
제5조를 삭제한다.
제11조제2항 전단 중 “구청장”을 “구청장(자치구의 구청장을 말한다. 이하 같다)”으로 한다.
제19조제3호·제4호 및 제21조제1항제1호를 각각 삭제한다.
부칙 <제6023호,1999.9.7>
이 법은 2000년 2월 9일부터 시행한다.
부칙 <제6725호,2002.8.26>
이 법은 공포후 6월이 경과한 날부터 시행한다.
부칙(생명윤리및안전에관한법률) <제7150호,2004.1.29>
① (시행일) 이 법은 2005년 1월 1일부터 시행한다. <단서 생략>
② 및 ③ 생략
④ (다른 법률의 개정) 장기 등 이식에 관한 법률 중 다음과 같이 개정한다.
제2장의 제목 중 “생명윤리위원회”를 “장기 등 이식윤리위원회”로 한다.
제7조의 제목 “(생명윤리위원회)”를 “(장기 등 이식윤리위원회)”로 하고, 동조 제1항 중 “생명윤리위원회”를 “장기 등 이식윤리위원회”로 한다.

[일부개정 2001.1.29 법률 6400호]
제1장 총칙
제1조 (목적)
이 법은 천연물과학의 육성 등 천연물신약연구개발의 기반을 조성하고 천연물을 이용한 신약연구개발과 그 개발기술의 산업화를 촉진하여 국민건강의 증진과 국가경제의 발전에 기여함을 목적으로 한다.
제2조 (정의)
이 법에서 사용하는 용어의 정의는 다음과 같다.
1. “천연물”이라 함은 육상 및 해양에 생존하는 동·식물 등의 생물과 생물의 세포 또는 조직배양산물 등 생물을 기원으로 하는 산물을 말한다.
2. “천연물 성분”이라 함은 천연물에 함유되어 있는 물질로서 생체에 직·간접적으로 영향을 미치는 등 생물활성을 가지는 물질을 말한다.
3. “천연물신약”이라 함은 천연물 성분을 이용하여 연구·개발한 의약품으로서 조성성분·효능 등이 새로운 의약품을 말한다.
4. “천연물과학”이라 함은 천연물로부터 천연물 성분의 분리, 화학구조의 구명, 생물활성의 탐색, 효과적인 생산 및 제조방법의 탐구 등 천연물과 그 성분을 연구·활용하는 학문과 기술을 말한다.
제3조 (연구개발계획의 수립)
① 보건복지부장관은 제4조의 규정에 의한 천연물신약연구개발정책심의회의 심의를 거쳐 천연물신약연구개발을 촉진하기 위한 계획을 수립·시행한다.
② 제1항의 규정에 의한 계획(이하 “연구개발촉진계획”이라 한다)에는 다음 각호의 사항이 포함되어야 한다.
1. 천연물신약연구개발의 중장기적 목표 및 내용
2. 천연물신약연구개발에 필요한 투자재원의 확보방안
3. 천연물신약연구개발에 필요한 인력자원의 개발 및 효율적인 활용에 관한 사항
4. 천연물신약연구개발 결과의 이용과 보전에 관한 사항
5. 천연물과학의 연구 및 발전에 관한 사항
6. 기타 천연물신약연구개발 촉진을 위하여 필요한 중요사항
③ 보건복지부장관은 제1항의 연구개발촉진계획의 수립·시행을 위하여 필요한 경우에는 관계 기관·단체 등에 대하여 그 계획의 수립·시행에 필요한 협조를 요청할 수 있다. 이 경우 협조요청을 받은 관계 기관·단체 등은 특별한 사유가 없는 한 이에 응하여야 한다.
④ 연구개발촉진계획의 수립 및 그 시행에 관하여 필요한 사항은 대통령령으로 정한다.
제4조 (심의회의 설치)
연구개발촉진계획의 수립 등 천연물신약연구개발에 관한 정책을 심의하기 위하여 보건복지부장관 소속하에 천연물신약연구개발정책심의회(이하 “심의회”라 한다)를 둔다.
제5조 (심의회의 구성)
① 심의회는 관계부처의 공무원 및 산업계·학계·연구기관에 종사하는 천연물신약연구개발 관계자로 구성한다.
② 심의회의 구성 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
제6조 (연구개발 투자의 확대)
보건복지부장관은 천연물신약연구개발에 대한 투자를 확대하기 위하여 적극 노력하여야 한다.
제7조 (국제협력)
보건복지부장관은 천연물신약연구개발에 관한 국제협력의 증진에 노력하고 선진기술의 도입을 위한 효율적인 방안을 강구하여야 한다.
제8조 (공동·협동연구개발의 촉진)
보건복지부장관은 천연물신약연구개발을 효율적으로 추진하기 위하여 산업계·학계 및 연구기관간의 공동·협동연구개발을 촉진하여야 한다.
제9조 (관련 산업체에 대한 지원)
보건복지부장관은 천연물신약연구개발 결과의 산업화를 촉진하기 위하여 필요한 지원시책을 강구하여야 한다.
제10조 (연구개발정보의 수집과 보급)
보건복지부장관은 천연물신약연구개발을 효율적으로 촉진하기 위하여 연구개발 동향, 시장동향 등 국내외 천연물신약연구개발에 관한 정보를 수집·분석하여 이를 체계적이고 종합적으로 관리·보급하여야 한다.
제11조 (천연물과학 등의 육성)
① 정부는 천연물과학 등을 육성·발전시키기 위하여 다음 각호의 시책을 강구하여야 한다.<개정 2001.1.29>
1. 교육인적자원부장관은 천연물과학의 연구를 촉진시키기 위한 전문인력의 양성과 천연물과학 기초연구의 육성 및 지원
2. 과학기술부장관은 천연물과학 관련 기초기술 및 첨단기술의 개발·육성 및 지원
3. 농림부장관은 육상천연물자원의 개발·보존·생산·이용 등에 관한 기초연구의 육성 및 지원
4. 보건복지부장관은 보건·의료·식품위생 등의 분야에 응용할 수 있는 천연물과학에 대한 연구개발의 지원과 임상시험 관련 사업의 육성 및 지원
5. 해양수산부장관은 해양천연물자원의 개발·보존·생산·이용 등에 관한 기초연구의 육성 및 지원
② 보건복지부장관은 천연물과학 및 천연물자원의 이용과 보전에 관한 연구를 지원하고, 천연물과학 분야에서의 산업계·학계 및 연구기관간의 상호유기적 협조체제를 유지·발전시키기 위하여 이들을 지원하는 공공적 성격의 지원체제를 구축하여야 한다.
제12조 (관련 전문기관·단체의 지정·활용)
보건복지부장관은 제8조의 규정에 의한 공동·협동연구개발, 제10조의 규정에 의한 정보의 관리·보급 및 제11조제2항의 규정에 의한 천연물과학 및 천연물자원연구의 발전과 산업계·학계 및 연구기관간의 협조증진을 위한 지원체제 구축을 위하여 관련 전문기관·단체를 지정하거나 활용할 수 있다.
제13조 (조세의 감면)
정부는 천연물과학 또는 천연물신약연구개발활동에 필요한 관련자재·기기·시약 중 국내생산이 불가능하여 수입하여야 하는 품목의 수입에 대하여는 관세법 및 부가가치세법이 정하는 바에 의하여 관세 및 부가가치세를 감면할 수 있다.
제14조 (다른 법률의 적용)
이 법에 규정한 것 외에 천연물신약연구개발에 관한 사항에 관하여는 보건의료기술진흥법에 의한다.
부칙 <제6165호,2000.1.12>
이 법은 공포 후 6월이 경과한 날부터 시행한다.
부칙(정부조직법) <제6400호,2001.1.29>
제1조 (시행일) 이 법은 공포한 날부터 시행한다. <단서 생략>
제2조 생략
제3조 (다른 법률의 개정) ①내지 <68>생략
<69>천연물신약연구개발촉진법 중 다음과 같이 개정한다.
제11조제1항제1호 중 “교육부장관”을 “교육인적자원부장관”으로 한다.
<70>내지 <79>생략
제4조 생략
![]()


채택 1964. 6. 제18차 총회 (핀란드 헬싱키)
개정 1975. 10. 제29차 총회 (일본 동경)
개정 1983. 10. 제35차 총회 (이태리 베니스)
개정 1989. 9. 제41차 총회 (홍콩)
개정 1996. 10. 제48차 총회 (남아프리카공화국 서머셋 웨스트)
개정 2000. 10. 제52차 총회 (스코트랜드 에딘버러)
서 문
1. 세계의사회는 사람을 대상으로 하는 의학연구에서 의사 및 기타 관계자에게 지침을 제공하기 위해 이에 대한 윤리원칙으로 헬싱키 선언을 개발시켜 왔다. 사람을 대상으로 하는 의학연구에는 신원이 식별이 가능한 사람의 자료 또는 증명할 수 있는 자료에 대한 연구를 포함시킨다.
2. 인류의 건강을 증진, 보호하는 것은 의사의 의무이다. 의사는 자신의 지식과 양심을 바쳐 이러한 의무를 수행해야 한다.
3. 세계의사회 제네바선언에서는 “나의 환자의 건강이 나의 제일의 관심사이다”라고 선언함으로써 의사에게 의무를 부여하고 있으며, 의료윤리에 대한 국제강령에서는 “환자의 신체 및 정신상태를 약화시킬 수 있는 치료에 있어서, 의사는 오직 환자의 이익만을 위해서 행동해야 한다”라고 선언하고 있다.
4. 의학발달은 궁극적으로는 사람을 대상으로 한 실험에 근거한 연구를 기본으로 하여 이루어진다.
5. 사람을 대상으로 하는 의학연구에 있어서 그로 인한 과학적, 사회적 이익보다는 대상이 되는 사람의 안녕이 우선적으로 고려되어야 한다.
6. 사람을 대상으로 하는 의학연구의 제일의 목적은 질병의 예방, 진단, 치료절차를 개선시키고 질병의 발병 원인 및 병리에 대한 이해의 향상에 있다. 예방, 진단, 치료방법이 이미 증명된 최선의 방법이라 하더라도, 그 유효성, 효율성, 접근성 그리고 질에 관한 연구를 통해서 끊임없이 발전시켜야 한다.
7. 현재의 의료 및 의학연구에 있어서는 대부분의 예방, 진단, 치료절차에는 위험부담이 수반된다.
8. 의학연구는 인간을 존중하며 이들의 건강과 권리를 보호하고자 하는 윤리적 기준에 합당하여야 한다. 약자의 입장에 있는 연구대상집단에는 특별한 보호가 요구된다. 경제적, 의학적으로 불리한 입장에 있는 사람들의 특별한 요구를 인식할 필요가 있다. 또한, 스스로 동의할 수 있거나 거부할 수 없는 자, 강제에 의해 동의할 우려가 있는 자, 연구로부터 개인적으로 이익을 얻을 수 없는 자, 그리고 그 연구가 자신의 치료와 관계있는 자에 대해서도 특별한 주의가 요구된다.
9. 연구자는 사람을 대상으로 하는 연구 시 적용되는 국제적 요건뿐만 아니라 자국의 윤리적, 법적, 규제상의 조건들도 숙지하고 있어야 한다. 어떠한 자국의 윤리적, 법적, 규제상의 요건에서도 이 선언에서 명시하고 있는 연구대상자에 대한 보호를 약화시키는 행위가 허용되어서는 안된다.
모든 의학연구에 해당되는 기본원칙
10. 의학연구에 있어서 연구대상자의 생명, 건강, 사생활, 존엄성을 보호해 주는 것은 의사의 의무이다.
11. 사람을 대상으로 하는 의학연구는 일반적으로 인정되는 과학적 원칙에 따라야 하며, 과학적 문헌의 충분한 지식이나 기타 관계 정보원, 적절한 실험실, 그리고 필요하다면 동물실험 등에 근거하지 않으면 안된다.
12. 환경에 영향을 미칠 수 있는 연구를 할 경우 적절한 주의가 요구되며, 연구에 이용되는 동물의 생활환경도 배려되어야 한다.
13. 사람을 대상으로 하는 각 실험절차의 설계 및 실행은 실험 계획서 내에 명시되어 있어야 한다. 이 계획서는 고찰, 논평, 조언 및 적절한 경우에는 승인을 얻기 위해 특별히 지명된 윤리심사위원회에 제출되어야 하며, 이 위원회는 연구자나 후원자 등 부적절한 영향을 미칠 수 있는 어떠한 종류의 외부 영향으로부터도 독립성을 유지해야 한다. 이 독립된 위원회는 연구가 수행되는 국가의 법 및 규제를 준수해야 하며, 또한 진행 중에 있는 실험의 감독 권한을 가진다. 연구자는 위원회에 감독에 필요한 정보, 특히 중대한 부작용에 관한 정보를 제공할 의무가 있다. 또한 연구자는 연구자금, 후원자, 연구기관간 제휴관계, 기타 발생할 수 있는 이해의 충돌, 그리고 연구대상자에 대한 보장 등에 대해서도 위원회가 검토하도록 자료를 제출해야 한다.
14. 연구 계획서에는 항상 윤리적 문제에 관한 성명을 포함시켜야 하며, 선언에 명시된 원칙에 따를 것을 지시해야 한다.
15. 사람을 대상으로 하는 의학연구는 과학적 자격을 갖춘 사람에 의해 행해져야 하며 의학적으로 실험을 하기에 충분한 자격을 갖춘 사람의 관리 감독 하에서 행해져야 한다. 연구대상자에 대한 책임은 항상 의학적 자격을 갖춘 사람이 져야 하며, 연구대상자가 책임질 것에 동의하였다 하더라도 이들에게 책임을 지워서는 안된다.
16. 사람을 대상으로 하는 모든 의학연구사업은 연구대상자 또는 제3자에 대하여 예상할 수 있는 위험 및 부담을 예측 가능한 이익과 비교하는 주의 깊은 평가 작업이 선행되어야 한다. 이것은 의학연구에 건강한 자원봉사자의 참여를 배제하자는 것이 아니며, 모든 연구계획은 공개가 가능해야 한다.
17. 의사는 관련 위험에 대한 적절한 평가 및 충분한 관리가 이루어져왔다고 확신할 수 없을 경우에는 사람을 대상으로 하는 연구사업에 관여하는 것을 삼가야 한다. 의사는 실험을 통해 얻어지는 잠재적 이익보다 위험성이 더 높다고 판단될 경우, 또는 긍정적이고 유익한 결과가 확정적일 경우에는 어떠한 종류의 연구도 중단해야 한다.
18. 사람을 대상으로 하는 의학연구는 그 목적이 연구대상자의 위험과 부담보다 더 중요할 경우에만 행해져야 한다. 이것은 연구대상자가 건강한 자원봉사자일 경우 특히 중요하다.
19. 의학연구는 연구대상집단이 연구결과를 통해 이익을 얻을만한 합당한 가능성을 지니고 있을 때만이 정당화되어진다.
20. 연구대상자는 자원봉사자이어야 하며 충분한 설명을 들은 다음 연구사업에 참여토록 해야 한다.
21. 연구대상자는 본인의 존엄성이 존중되어질 권리가 있다. 연구대상자의 사생활, 환자 개인정보의 비밀 유지, 그리고 연구가 연구대상자의 육체적, 정신적 존엄성 및 그들의 인격에 미치는 영향을 최소화하기 위한 모든 예방조치를 강구해야 한다.
22. 사람을 대상으로 하는 모든 연구에서 연구대상예정자에게 연구의 목적, 방법, 연구자금의 재원, 가능한 이해관계의 충돌, 연구자 관련기관과의 관계, 연구에서 예상 가능한 이익 및 잠재적 위험, 필연적으로 수반되는 불쾌한 상황 등에 대하여 충분히 알려줘야 한다. 연구대상자에게 연구에 참여하지 않을 수 있는 권리 또는 언제라도 아무런 보복 없이 연구 참여를 취소할 권리가 있음을 알려줘야 한다. 연구대상자가 이러한 사항에 대하여 이해했다는 것을 확인한 후, 의사는 연구대상자의 자유 의지에 의한 고지동의(告知同意)를 가급적이면 문서로 받아야 한다. 문서에 의한 동의를 얻지 못했을 경우에는 동의 내용을 공식적으로 문서화하고 증인에 의해 증명해 놓아야 한다.
23. 연구사업과 관련하여 고지동의를 얻는 경우, 의사는 연구대상자가 의사와 종속관계에 있거나 어떠한 협박에 의해 동의했을 가능성이 있는 경우에 특히 주의하여야 한다. 그러한 경우, 고지동의는 내용을 잘 알고 있으면서 연구와 관련이 없고 연구와 완전히 독립적인 관계에 있는 의사를 통해 얻어야 한다.
24. 법적 무능력자, 육체적 또는 정신적으로 동의할 수 없는 자, 또는 법적으로 자격이 없는 미성년자를 연구대상자로 할 경우, 연구자는 적용되는 법에 의거 법적 자격이 있는 자로부터 고지동의를 얻어야만 한다. 이러한 집단은 연구가 집단 전체의 건강을 증진시키는데 필요하거나, 연구대상자를 법적 능력이 있는 자로 대체하는 것이 불가능한 경우에 한해서 연구대상자에 포함될 수 있다.
25. 미성년자와 같이 법적 무능력자로 간주되는 연구대상자가 연구 참여에 찬성할 경우, 연구자는 이들 연구대상자의 동의 이외에도 법적으로 자격이 있는 대리인으로부터의 동의에 더하여 미성년자의 찬성을 얻어야 한다.
26. 대리인의 동의 또는 사전 동의를 포함하여, 동의를 얻을 수 없는 사람을 대상으로 하는 연구는 고지동의를 얻을 수 없도록 하는 육체적, 정신적 상태가 그 대상 집단에 필요한 특성일 경우에만 행해져야 한다. 연구대상자가 고지동의를 할 수 없는 특별한 이유는 심사위원회의 검토, 승인을 위해 실험계획서에 명시되어야 한다. 계획서에는 연구대상자 본인 또는 법적으로 자격이 있는 대리인으로부터 계속 연구에 참가한다는 동의를 가능한 빨리 얻어내야 한다는 것이 명시되어야 한다.
27. 저자와 발행자에게는 윤리적인 의무가 있다. 연구결과를 간행함에 있어서, 연구자는 그 결과의 정확성을 유지할 의무가 있다. 긍정적 결과뿐만 아니라 부정적 결과도 함께 발표되거나 다른 방법으로라도 발표되어 이용될 수 있어야 한다. 연구자금의 재원, 관련기관과의 관계, 가능성이 있는 어떠한 이해관계의 충돌이라도 간행 시 명시되어야 한다. 이 선언에 정한 원칙에 맞지 않는 실험보고서는 간행될 수 없다.
의학적 치료를 겸한 의학연구를 위한 추가 원칙
28. 의사는 연구의 잠재적 예방, 진단, 치료의 가치에 의해 연구가 정당화되는 범위에 한하여 의학연구와 의학적 치료를 겸할 수 있다. 의학연구가 의학적 치료와 겸하여 행해질 때, 연구대상 환자를 보호하기 위한 추가 기준이 적용되어야 한다.
29. 새로운 방법의 이익, 위험, 부담, 효과가 현재 최선으로 되어 있는 예방, 진단, 치료법과 비교하여 검증되어야 한다. 이것은 검증되지 않은 예방, 진단, 치료법을 수행하는 연구에서 위약(僞藥)의 사용을 배제하거나 치료제를 사용하지 않는 것을 뜻하는 것이 아니다.
30. 연구 종료 후, 연구에 참여한 모든 환자는 연구에 의해 증명된 최선의 예방, 진단, 치료법의 이용을 보장받아야 한다.
31. 의사는 치료의 어느 부분이 연구에 관련되어 있는 가를 환자에게 충분히 설명해야 한다. 환자의 연구 참여 거부가 환자와 의사와의 관계를 결코 방해해서는 안된다.
32. 환자를 치료함에 있어 검증된 예방, 진단, 치료법이 존재하지 않거나 효과가 없다고 여겨질 때, 환자로부터 고지 동의를 얻은 의사가 아직은 검증되지 않은 새로운 예방, 진단, 치료법이 생명을 구하거나, 건강을 회복하며, 고통을 완화시키는 데 희망이 있다고 판단할 경우, 그러한 방법을 자유로이 사용할 수 있다. 가능하다면, 이러한 방법은 그 안전성과 유효성을 평가하기 위해 계획된 연구의 대상이 되어야 한다. 모든 경우에서, 새로운 정보는 기록으로 남겨야 하며, 적절한 경우에는 간행되어야 한다. 이 선언에 대한 관련 지침은 따로 정한다.
* 각주 :
세계의사회 헬싱키 선언 제29조에 대한 해설
세계의사회는 속임약 대조군을 적용하는 임상시험을 할 때는 최대의 주의를 기울여야 하며 이 방법은 일반적으로 현재까지 증명된 치료법이 없을 경우에 한해서만 사용해야한다는 입장을 재확인한다. 그러나 다음의 경우에는 비록 증명된 치료법이 있다 하더라도 속임약 대조군을 적용하는 임상시험이 윤리적으로 받아들여질 수 있다:
- 절대적이며 과학적으로 건전한 방법론적 이유로 인해 그 사용이 예방적, 진단적 또는 치료적 방법의 효능이나 안전성을 결정하는데 필요할 경우, 또는
- 예방적, 진단적 또는 치료적 방법이 2번째 방법으로 고려되고 있고, 속임약을 투여 받는 환자에게 심각하거나 돌이킬 수 없는 추가적 위험이 없을 경우.
헬싱키 선언의 다른 모든 조항도, 특히 적절한 윤리적, 과학적 검토는 반드시 지켜져야 한다.
■ 생명공학 백서 부록 생명공학 개요, 용어 정리 |
■ 생명공학과 관련한 총제적(-omics) 학문 ■
○ 유전체학(Genomics)
게놈(genome)은 유전자(gene)와 염색체(chromosome)의 합성어로, 염색체에 담긴 유전자를 총칭하는 말이며, Genomics는 유전정보 전체(유전체)를 연구하는 학문분야를 말함
○ 기능유전체학(Functional genomics)
유전자와 유전자 산물의 기능, 유전자 산물 간의 상호작용을 밝히는 학문 분야. 이러한 연구를 통해 인간 유전자를 기능상으로 분류할 수 있으며, 이를 통해 질병 진단과 예후 예측, 치료제 개발에 유익한 정보를 제공할 수 있다.
○ 대사체학(Metabolomics)
세포 내에 존재하는 대사물의 총체인 대사체를 연구하는 학문.
○ 독성유전체학(Toxicogenomics)
독성물질에 의해 발현양성이 변하는 유전자를 유전체학(genomics) 기법을 동원하여 대량으로 동정한 후 이 결과를 활용하여 개체의 독성물질 피폭 여부 등을 조사하는 학문 또는 기술, 이 기술을 이용하면 동물 또는 기타 시험관 내 방법에 비해 신속, 정확하게 독성물질을 스크리닝할 수 있으며 한 번의 실험으로 다수 유전자의 변화를 분석할 수 있다.
○ 약리유전체학(Pharmacogenomics)
개체 간에 나타나는 약물 효과, 독성 등의 차이를 개체의 유전적 요인과 관련지어 연구하는 학문 분야로서 목표는 개개인의 유전적인 요인을 파악해 약에 대한 반응성을 예측할 수 있도록 하는 것이다.
○ 단백질체학(Proteomics)
단백질의 3차원 구조분석, 기능확인, 다른 생체물질과의 상호작용 등에 대한 연구를 통해 질병의 작용기구를 파악하고, 신약개발에 활용하는 분야
○ 글라이코믹스(Glycomics)
당쇄를 인위적으로 목적한 기능을 갖게 변화시킴으로써 의약품 개발에 응용하려는 연구 분야
※ 당쇄? 단당류가 연쇄상으로 다수 결합된 분자로 일반적으로 생체의 세포 표면에 존재하는 당쇄를 지칭. 이러한 당은 당화(Glycosylation)되는 과정에서 단백질의 기능을 결정하거나 안정화시키는 데 중요한 역할을 함
○ 화학유전체학(Chemical Genomics)
Genomics와 조합화학이 결합된 분야로 유전자 분석을 통하여 특정 질환에 관련된 단백질 등 생체내 타깃을 찾고 이와 반응할 수 있는 구조의 화합물들을 대량으로 합성하여 Lead (신약 후보의 구조적 출발물질)를 찾아내는 분야
■ 생명공학과 관련한 기타 학문 ■
○ 면역유전학(Immunogenetics)
개체간의 면역학적 차이를 연구하는 유전학 분야. 혈액형, 조직적합성, 면역 응답 등에 관련된 정보를 이용한다.
○ 당쇄공학(Glyco engineering)
천연에 존재하는 당쇄 구조 화합물의 기능·활성 규명, 구조 수식, 유도체 합성 등에 관련된 기술 분야. 당쇄 구조 화합물은 세포간 인식, 정보 전달에 중요한 역할을 하는 것으로 알려져 있다.
○ 조직공학(Tissue engineering)
생명과학, 의학, 공학의 기본 개념과 기술을 바탕으로 하여 인공생체조직 또는 기관을 만들어 이용함으로써 생체 기능의 유지, 향상, 복원을 목표로 하는 학문 분야
○ 세포공학(Cell engineering)
염색체나 유전자의 인위적인 조작 또는 이전 기술을 통해 유용한 유전자 형질을 발현할 수 있는 새로운 세포를 만들어 내는 기술. 세포융합에 의한 잡종 세포 형성을 이용하는 연구나 하이브리도마세포 제작을 비롯해 돌연변이주의 분리법이나 조직배양, 세포배양 기술 등이 포함된다.
○ 시스템생물학(Systems biology)
생물 시스템을 구성하는 각각 요소의 행동을 해석할 뿐만 아니라, 전 구성 요소의 동적인 상호 관계를 시스템 전체 수준으로 분석해 고차적인 특성을 총체적으로 연구하는 학문.
○ 단백질공학(Protein engineering)
기존 단백질 구조와 기능 간의 관계를 규명하고 새로운 단백질을 설계, 창출하는 기술. 아미노산 서열 결정, 유전자조작, 단백질 입체 구조 규명, 단백질의 분리와 정제, 컴퓨터 그래픽스 등의 기술이 요구된다. 신기능 효소, 고활성 효소, 의약용 단백질 개발에 이용된다.
■ 생명공학 용어 ■
○ 게놈(Genome)
게놈은 유전자(gene)와 염색체(chromosome)의 합성어로서 한 생물체가 지닌 모든 유전정보(DNA)의 집합체를 뜻함
○ 나노바이오테크놀로지(Nanobiotechnology)
나노기술과 생명공학기술이 접합된 형태의 기술 분야. DNA칩, 단백질칩, 초소형 바이오센서, 고속대량스크리닝(HTS) 시스템의 개발과 적용에 핵심적인 분야이다.
○ 단백질(Protein)
아미노산을 단량체로 하는 고분자 유기화합물의 총칭. 세포의 주요 구성 성분이다. 생명현상에 관여하는 효소, 항체, 호르몬 등이 포함된다.
○ 단일클론항체(Monoclonal antibody)
단 하나의 항원성결정기에만 작용하는 항체. 하이브리도마 또는 재조합 미생물 배양을 통해 생산된다. 미량 물질의 분리, 감염증이나 암 진단과 치료 등과 같은 의료 분야에 있어서 중요한 역할을 한다.
○ 단세포단백질(Single-cell protein(SCP))
세균, 효모, 사상균, 방선균, 곰팡이, 조류 등의 미생물을 대량 배양하여 균체로부터 추출한 단백질, 사료첨가물이나 식품첨가물, 증량제로 사용된다.
○ 단백질칩(Protein chip)
실리콘, 유리 등의 표면에 여러 종류의 단백질을 고밀도로 고정화시킨 바이오칩의 일종. 단백질-단백질(항원-항체), 단백질-리간드, 단백질-DNA, 효소-기질 등 단백질이 관여하는 모든 상호작용의 분석에 이용된다. 이를 통해 생명 현상의 이해, 질병의 진단과 원인 규명, 신호 전달 체계의 이해가 가능하며, 궁극적으로 질병의 예방 및 치료법을 개발할 수 있다.
○ 단백질삼차구조(Tertiary structure of protein)
단백질 사슬 내에서 비교적 멀리 떨어진 기능기 간의 수소 결합, 이황화결합, 소수성 상호작용(hydrophobic interaction)등에 의하여 형성되는 입체 구조. 효소의 활성, 특이성 등 단백질의 기능과 밀접한 관계가 있다.
○ 돌연변이(Mutation)
한 개체의 유전체를 구성하는 염색체나 DNA의 일부에 생긴 영구적인 변화, 염기서열 상의 염기 1개가 다른 염기로 치환된 경우를 점 돌연변이라고 한다. 여러 개의 염기를 포함하는 DNA 영역에 걸쳐 변화가 일어나는 경우도 있다. 생식세포에 생긴 돌연변이는 후대에 전달된다. 체세포돌연변이는 후대에 전달되지 않는다.
○ 미생물(Microorganism)
육안으로는 관찰이 불가능한 미세한 생물체. 일반적으로 크기 0.1 mm 이하인 생물체를 의미한다. 주로 단일 세포 또는 균사체로 존재하며, 최소 생활 단위를 유지한다. 세균류, 사상균류, 효모류, 조류, 원생동물류, 바이러스 등이 이에 속한다.
○ 면역치료제(Immunotherapeutic)
체내의 면역반응에 관여하는 세포. 단백질로서 치료제로 사용되는 물질. 인터페론, 인터루킨 등이 대표적인 예이다.
○ 면역억제제(Immunosuppressive agents/immunosuppressants)
생체의 면역 반응을 억제하는 활성을 지닌 물질. 대표적으로 사이클로스포린 A(cyclosporin A) 등이 있으며 장기 이식 시 거부반응을 억제하기 위해 사용된다.
○ 마이크로어레이(Microarray)
기판 위에 DNA나 단백질과 같은 포획 탐침(capture probe)이 미세한 점으로 고정화된 어레이 장치. 특정 DNA나 단백질의 분석을 통해 유전질환의 진단, 유전자 발현 모니터링 등에 사용된다.
○ 복제 DNA(Clined DNA)
공여체로부터 분리, 동정된 후 벡터에 삽입된 DNA
○ 복제장기(Cloned organ)
인간 또는 동물의 장기의 일부분 또는 세포를 이용하여 장기로서의 기능이 가능하도록 배양된 생물학적 인공장기. 복제동물의 사육을 통하여 얻을 수도 있다.
○ 복제동물(Cloned animal)
무성적으로 복제되어 유전적으로 모체와 동일한 동물 개체. 난세포에서 핵을 제거하고 모체 체세포의 핵을 이식하는 과정을 거쳐서 복제된다.
○ 배아줄기세포(Embryonic stem cell(ESC))
발생 초기의 배반포에서 얻어지는 미분화 상태의 세포. 자가 재생산 능력이 뛰어나 대부분의 조직 및 세포로 분화할 수 있다.
○ 발현벡터(Expression vector)
목적 유전자의 효율적인 발현을 위해 제작된 벡터. 전사가 효율적으로 이루어지도록 강력한 프로모터와 적절한 조절 유전자를 갖는다.
○ 바이오필터(Biofilter)
담체에 고정화된 미생물을 이용해 여러 가지 독성 물질이나 악취 물질을 제거하는 환경 처리 장치
○ 바이오칩(Biochip)
1) 유리, 실리콘 등의 재질로 된 작은 고체 기판위에 DNA, 단백질 등의 생체 물질을 고밀도로 고정화시킨 마이크로어레이칩, 유전자 발현 양상, 유전자 결함, 단백질 분포, 반응 양상 등을 분석하는데 이용된다.
2) 단백질이나 지질, 신경세포 등의 생체 물질로 구성되며, 기본적인 연산이나 정보 처리 기능을 갖는 소자, 현재는 싸이토크롬이나 박테리오로돕신 등이 갖는 전자/광 스위치 특성을 이용한 소자들이 개발되고 있다.
○ 바이오연료(Biofuel)
생물체(바이오매스 자원)에서 만들어지는 연료. 액체 연료로는 에탄올, 메탄올, 바이오디젤, 피셔-트롭쉬(Fischer-Tropsch) 디젤이 있고 기체 연료로는 수소와 메탄이 있다.
○ 바이오에너지(Bioenergy)
바이오매스(biomass) 및 이를 원료로 하여 생물학적 또는 열화학적으로 생산되는 연료로부터 바이오매스(biomass) 및 이를 원료로 하여 생물학적 또는 열화학적으로 생산되는 연로로부터 얻어지는 에너지. 경우에 따라서는 바이오매스로부터 생산되는 연료를 지칭하기도 한다.
○ 바이오센서(Biosensor)
생체 물질이 갖는 반응 특성과 그 반응에 의해 발생되는 전기 화학적 또는 광학적 신호 등을 이용해 특정 물질을 검출하거나 정량 분석하는 장치.
○ 바이오리파이너리(Biorefinery)
석유 대신 바이오매스로부터 연료 및 화학 원료를 제조하는데 필요한 기술의 집합.
○ 배아
난자와 정자의 수정이 이루어진 후 8주까지(인간의 경우)를 말하며 후에 태아가 된다.
○ 세포융합(Cell fusion)
두 개의 서로 다른 세포의 원형질체(protoplast)를 융합하는 것. 동시다발적 유전 형질 변환이 가능하다. 식물세포에서는 육종 기술로서 동물세포에서는 단일클론항체 생산을 위한 하이브리도마 세포주를 만드는데 사용된다. 미생물 분야에 있어서는 곰팡이와 방선균 등의 균주 개발에 이용된다.
○ 생체모방기술(Biomimetics)
생체의 기능을 다른 재료로 대체하거나 생체 기능을 모방, 이용하는 기술, 생체모방화학, 바이오일렉트로닉스, 바이오미캐닉스 등이 포함된다.
○ 생체고분자(Biomolecule)
생체내에서 합성되는 거대분자의 총칭. 단백질, 핵산, 지질, 다당류가 있다.
○ 생물학적지표(Biological indicator)
생리활성 물질의 효능. 환경오염 또는 독성의 정도를 특정 생물을 대상으로 하여 수량적으로 표시하는 지표
○ 생물의약(Biopharmaceutical)
생물체 또는 이로부터 유래된 물질을 이용해 생산되는 의약품의 총칭. 단백질 치료제, 백신, 항생제, 세포 치료제, 유전자치료제 등이 포함된다.
○ 생물융합기술(Biohybrid technology)
생명공학, 마이크로시스템, 센서시스템 등 여러 가지 분야의 기술이 융합된 것. 생명공학 연구에 필요한 여러 가지 방법을 자동화, 병렬화, 동기화하기 위해서 개발된 기술이다.
○ 생물안전성(Biosafety)
생명공학 기술과 그 생산물로부터 유래하는 잠재적 위해성을 감소시키기 위한 노력을 지칭하는 용어
○ 생물산업(Bioindustry)
생명공학 기술을 이용하거나 이에 관련된 산업의 총칭
○ 생물다양성보존(Biodiversity conservation)
생태계에 있어서 종 구성의 다양성과 다양한 종들 사이의 상호작용. 그 기능과의 상관관계를 활용해 자연 환경을 안정하게 유지하는 것
○ 성체줄기세포(Adult stem cell)
조혈기관 상피조직 등의 세포재생계에서 세포생산의 기초가 되는 세포. 줄기세포를 추출하여 치료목적의 조직 세포로의 분화를 연구
○ 세포치료기술
손상된 조직 또는 기관 부위를 치료할 목적으로 체외에서 세포를 배양하여 체내에 투여하는 치료법이다.
○ 인터페론(Interferon(IFN))
인체세포 내에서 바이러스 RNA와 단백질의 생성을 억제하는 항바이러스 단백질의 발현을 유도하는 기능을 갖는 당단백질의 총칭, 생성장소와 기능이 각기 다른 3가지가 있는데 IFNα는 주로 백혈구, IFNβ는 섬유모세포 그리고 IFNy는 주로 림프구에서 생성된다. 항바이러스 작용 외에 면역조절작용도 갖는다. IFNα와 IFNβ는 주로 항바이러스활성을 나타내는 반면 IFNy는 주로 면역조절작용을 한다. IFNα는 자연살해세포의 활성을 증강시키는 작용도 지니고 있다. 산업적으로는 유전공학적인 방법으로 생산이 가능해졌으며, 바이러스 간염의 치료에 사용되며 IFNα는 모발상세포 백혈병의 치료에도 유효하게 사용된다.
○ 인공장기(Artificial organ)
장기의 인공적인 대체물, 심장, 신장, 간장 등의 대체 장기 외에도, 인공혈관, 인공혈관 밸브 등도 포함된다. 인공 재료와 배양 세포를 결합시킨 혼성(hybrid)형도 있다.
○ 인간화항체(Humanized antibody)
항원을 다른 동물에 주입했을 때 생성되는 항체 구조 중 항원이 결합하는 부위인 상보성결정부위(CDR)에 해당되는 유전자 배열만을 인간 항체 유전자에 대체하는 과정을 통하여, 인간 항체와 특징이 유사하도록 제조된 재조합 항체. 동물로부터 유래된 부분이 적기 때문에 체내 투여용 항체치료제로 사용되기에 적합하다.
○ 약물전달시스템(Drug delivery system(DDS))
약물 방출 속도를 조절하거나 약물을 목표 부위에 효율적으로 전달시키는 방법 등을 통해 의약품의 부작용을 최소화하고 효능 및 효과를 극대화시키는 기술 및 시스템
○ 알츠하이머병(Alzheimer's disease)
퇴행성 뇌질환의 하나. 치매의 원인 중 가장 흔한 형태이다. 병리 조직학적으로는 뇌의 전반적인 위축, 뇌실의 확장, 신경 섬유의 다발성 병변(neurofibrillary tangle)과 초로성 반점(neuriticplaque) 등이 특징이다.
○ 유전공학(Genetic Engineering)
생물체에 주어진 유전형질을 인위적으로 변형·개조시켜 새로운 형질을 가진 생물체를 만들어내는 기술(세포융합핵치환 단백질공학 유전자 재조합)
○ 줄기세포(Stem Cell)
조직분화 과정에서 볼 수 있는 미분화된 세포. 줄기세포는 신체 내 모든 조직으로 분화될 수 있는 가능성을 가지고 있음
○ 진핵생물(Eukaryote)
핵막으로 둘러싸인 핵과 다양한 세포 소기관을 가지는 세포로 구성되어 있는 생물. 원생생물, 조류, 사상곰팡이, 효모, 식물, 동물이 포함된다. 원핵생물과 대응된다.
○ 재조합 DNA 기술(Recombinant DNA technology)
목적 유전자를 제한효소를 이용해 잘라내고 이를 벡터에 삽입해 재조합 DNA를 제작한 후, 숙주에 도입해 발현시키는 과정에 관련되는 기술의 총칭
○ 자가면역질환(Autoimmune disease)
자가면역에 의해 생체 방어 기능을 담당하는 면역계가 자기 세포를 공격해 발생하는 질병, 만성 류마티스성 질환이 대표적인 예이다.
○ 체세포융합(Somatic cell hybridization)
유전자가 다른 체세포를 접합하여 새로운 유전자형의 세포를 만드는 기술
○ 체세포변이(Somaclonal variation)
한 개체에서 단일세포를 떼어내어 재배양했을 때 얻어진 새로운 개체가 원래의 개체와 유전적으로 동일하지 않은 현상.
○ 체세포돌연변이(Somatic mutation)
발생이 진행 중인 개체 또는 완전한 개체 내에서 방사선이나 다른 원인들에 의해 일부의 체세포에 변화가 일어나 새로운 형질이 만들어지는 현상
○ 항상성효소(Constitutive enzyme)
세포의 생존, 성장과 함께 항상 발현되는 효소, 일상적인 배양조건하에서 세포의 일상적인 기능을 수행하기 위한 효소들이 이에 해당된다. 이들의 유전자는 특정 대사물질에 의해 조절되는 작동 유전자(operator)를 가지고 있지 않다.
○ 표지유전자(Marker gene)
특정 형질에 대한 유전적 해석의 척도로 이용되는 유전자, 유전 질환, 약제내성(항생물질 내성 등), 염도 감수성, 영양 요구성 등을 유전적으로 판단하는데 이용된다.
○ 표지단백질(Marker protein)
특정 질병 진단의 척도로 사용되는 단백질, 특정 질병 상태에서 발현된다. 일례로 간암의 경우 혈액 내의 알파태아단백(AFP: α-fetoprotein)을 표지단백질로 사용한다.
○ 폴리펩타이드(Polypeptide)
대략 10개 이상의 아미노산잔기로 이루어진 펩타이드. 단백질과 같은 뜻으로 쓰기도 하나 보통 분자량이 작은 단백질을 가리킬 때 쓰인다.
○ 펙틴(Pectin)
식물의 세포벽이나 세포벽 사이에 존재하는 다당류의 하나. 주성분은 D-갈락투론산이 α-1,4 결합한 고분자이다. 팽윤성이 뛰어난 수용성 식이섬유로서 섭취 시 포만감을 주나 칼로리는 매우 낮다. 배변활동을 원활하게 하고, 지방흡수 저하, 지방합성 저해, 체지방 분해 등의 작용을 하므로 다이어트 식품의 원료로 사용된다.
○ 페니실린(Penicillin)
푸른곰팡이(penicillium)가 생산하는 β-락탐계의 4원자 고리화합물의 항생 물질. 세균의 세포벽 구성 성분인 펩티도글리칸의 합성을 저해하는 대표적인 세균 감염증 치료제이다. 모핵은 6-아미노페니실란산(6-amino peni-cillanic acid, 6-APA)으로, 치환기를 화학적으로 수식한 많은 종류의 유도체(반합성 페니실린)가 개발되었다. Flemming (1928)에 의해서 최초로 발견된 후, 생물공학기술에 의해 대량 생산이 가능하게 된 대표적인 생물산업 제품이다.
○ 키토산(Chitosan)
키틴을 탈아세틸화한 물질. 의약 분야에서는 인공 피부, 약물전달시스템 등에 응용되며 환경 분야에서는 응집제로도 사용된다. 세포를 활성화해 노화를 억제하고 면역력을 강화해주며 질병을 예방해 주는 것으로 알려져 있어 건강 기능 식품의 소재로 사용된다.
○ 클로렐라(Chlorella)
클로렐라과의 비운동성 담수 조류. 건강 보조 식품, 유제품의 원료로 주로 사용된다.
○ 캡사이신(Capsaicin)
고추의 매운맛을 내는 성분으로 무색의 휘발성 알칼로이드 화합물. 약용과 향료로 이용된다. 진통작용과 체지방 감소 효과가 있는 것으로 알려져 있다.
○ 치료용효소(Therapeutic enzyme)
치료제로 이용되는 효소 또는 그 제제. 혈전용해제로 사용되는 조직플라스미노젠활성인자(tPA:tissue plasminogen activator), 스트렙토카이네이즈(strep-tokinase), 유로카이네이즈(urokinase)와 항혈액응고제인 안티트롬빈 III (antithrombin III) 등이 대표적인 예이다.