2007 생명공학백서

- 발행일 2007-12-28
- 출처 백서2007(총서 제66권)
- 담당자 김영철 ( 042-879-8379 / yckkr@kribb.re.kr )
- 조회수 14709
-
키워드
#생명공학백서
-
첨부파일
-
 2007생명공학백서.pdf
(다운로드 766회)
바로보기
2007생명공학백서.pdf
(다운로드 766회)
바로보기
-
개요
● 추진목적
차세대 성장동력으로 주목받고 있는 생명공학 분야의 주요 정책 및 R&D 현황, 국내외 동향과 전망 등 우리나라 생명공학 전반의 정보를 체계적으로 종합하여 국민들에게 제공
● 개요
’05년도 생명공학백서 발간(두번째) 이후 ’07년 상반기까지 진행된 국가 생명공학의 주요 성과 및 발자취를 종합적으로 정리·수록
특히 ‘Bio-Vision 2016’의 의의 및 주요 내용을 특집으로 소개하여, 2016년까지의 생명공학 비전과 목표 제시
● 세부내용
- 국가 중장기 생명공학 정책방안에 따른 중점분야를 중심으로 관련 시책의 추진실적, 현황 및 전망 등을 체계적으로 정리
- 국내·외 최신 동향정보를 소개하고, 향후 비전을 조망
- 관련 법령, 기초통계 및 관련 정보를 수록
- 제1차 생명공학육성기본계획(’94∼’06)의 추진 성과 및 의미를 분석하여 함께 소개
과학기술부에서는 '2007 생명공학백서'를 발간하였습니다.
본 백서의 주요 내용은 Bioin 홈페이지 외 과학기술부 홈페이지(www.most.go.kr)에서도 e-book으로 홍보되고 있으며, 특히 정부간행물판매센터를 통하여 판매도 병행하고 있으니 여러분들의 많은 관심 부탁드립니다.
첨부파일 다운로드가 안되시는 이용자께서는 아래 링크를 클릭하세요~!




21세기는 과학기술이 중심이 되는 지식기반사회이다. 한편 인류는 화석연료의 고갈로 인한 에너지 문제, 에이즈 및 사스(SARS)와 같은 새로운 질병의 창궐, 대기오염 등 환경파괴로 인한 지구 온난화 현상 등 새로운 도전에 직면해 있는 양상이다.
이러한 시기에 생명공학은 인류가 당면하고 있는 많은 고민을 해결할 수 있는 과학기술 분야이자 정보통신 이후 세계경제를 주도할 핵심 성장동력으로 인식되고 있다. 전문가들은 세계경제가 농업경제, 산업경제, 공업경제, 정보/디지털경제를 거쳐 2020년경에는 바이오 경제에 진입할 것으로 전망하고 있다.1) 또한 고령화 시대에 맞춤의약·바이오장기 등을 통한 국민의 복지 향상, 생태계복원기술 개발 등 환경·에너지 문제에 대한 대처, 고품질 식품 공급 등을 통한 식량 안보에 대한 대비, 바이오테러 대응 등 생명공학은 다양한 분야의 인류 난제를 극복하는 데 기여할 수 있는 핵심기술로 주목받고 있다.
최근에는 post-genome 시대에 따른 신기술이 등장하고 있다. 특히, ‘Gene to Life’와 같이 생명현상에 대한 총체적 연구가 이루어지고 있으며 IT, NT 등 첨단기술과 융합하여 신기술이 창출되는 융합화와 기술혁신이 가속화되고 있다. 세계 생명공학 관련 시장도 연평균 12.3%로 급성장하면서 시장이 확대되고 있다.
미국, EU, 일본 등 주요 선진국은 생명공학의 육성과 산업화를 위해 정부 차원에서도 적극적인 지원을 하고 있고, 중국은 2005년에 ‘2020년 생명공학기술 강국과 바이오산업대국 건설’을 목표로 하는 마스터플랜을 발표하기도 하였다.
우리 정부도 생명공학을 국가 차원에서 육성하고자 1983년 생명공학육성법(‘유전공학육성법’에서 명칭 변경)을 제정하였고, 이로부터 10년 뒤인 1994년에는 「제1차 생명공학육성기본계획(Biotech 2000)2)」을 수립하여 본격적인 생명공학 지원에 나서게 되었다. 2006년 11월에 수립된 제2차 생명공학육성기본계획(Bio-Vision 2016)3)은 제1차 생명공학육성기본계획(Biotech 2000)에 이어 향후 10년의 생명공학 육성 비전과 정책방향을 제시한 정부 차원의 중장기 계획으로,4) 8개 부처의 21개 관련 계획을 포괄하는 생명공학 분야의 상위 계획이다.
특히 제1차 생명공학육성기본계획(Biotech 2000) 동안 확보된 연구기반을 바탕으로 ‘세계적인 원천기술을 확보’하고 ‘산업화를 위한 핵심 인프라 강화’에 역점을 두어 세계 생명공학을 ‘선도(leading)’해 나가기 위한 새로운 전략이 필요한 시점에서, 제2차 생명공학육성기본계획(Bio-Vision 2016)은 그간의 성과평가와 국내·외 환경 분석 등을 통해 「건강한 생명중심 사회와 풍요로운 바이오 경제 구현」을 비전으로, 세계 7위의 논문 및 특허기술 수준 제고, 60조원 규모의 시장 창출 등을 목표로 제시하고 있다.
또한 이러한 비전과 목표를 구현하기 위하여 ① 국가 생명공학 육성체계 혁신, ② 연구개발 선진화 기반 확충, ③ 바이오산업의 발전 가속화 및 글로벌화, ④ 법/제도 정비 및 국민 수용성 제고 등 4대 전략과 14대 실천과제를 수립하고 생명과학, 보건의료, 농축산․식품, 산업공정/환경·해양, 바이오융합 등 5개 분야별 세부계획을 마련하였다. 앞으로 정부는 매년 시행계획을 수립하여 구체적인 사업을 추진하게 된다.
제2차 생명공학육성기본계획(Bio-Vision 2016)은 그동안 조성된 연구기반을 바탕으로 원천기술을 확보하고, 산업인프라를 구축하여 바이오 경제 시대를 준비하는 중장기 계획이라는 점에서 의의가 있다. 무엇보다 향후 10년의 생명공학 비전을 제시하고 생명공학 분야 산업체 및 관련 종사자, 연구소, 관련 대학 및 학생, 그리고 일반국민의 생명공학에 대한 신뢰와 믿음을 제고하는 데 기여할 수 있기를 기대한다.
|
◉ 제2차 생명공학육성기본계획(Bio-Vision 2016)의 미래상(예시) 【생명과학 분야】 노벨상을 수상하는 생명과학자 탄생 기대
【보건의료 분야】 치료중심에서 예방중심으로 변화하여 조기진단을 통한 개인 맞춤형 치료 시대 개막 - 자궁경부암 예방백신 ‘가다실’과 같이 다양한 암 조기진단 및 예방기술이 개발되어 국민들이 암의 공포로부터 벗어나게 될 것으로 기대됨
【농축산·식품 분야】 조류독감, 광우병 걱정 없는 안전한 먹을거리가 국민들에게 제공되는 사회 기대 - 형질전환 동·식물개발로 우수품종이 개량되고, 세계적으로 경쟁력을 갖는 농축산물을 생산·수출하게 될 것으로 기대됨
【산업공정/환경·해양수산 분야】 바이오매스에서 바이오에너지를 생산하고, 환경오염을 사전에 방지하여 생태계환경이 깨끗하게 보전되는 쾌적한 환경을 갖게 될 것으로 기대
【바이오융합】 암세포만을 공격하는 나노미사일, 그리고 혈관 속을 돌아다니며 질병을 치료하고 수술하는 나노기계의 등장 - 원격의료시스템으로 환자의 건강정보가 병원으로 전달되고 병원에서는 진찰정보를 환자에게 무선으로 송신하는 “유비쿼터스 헬스케어”가 실현될 것으로 기대.
|



* 2010년 이후는 기술융합 가속화 등으로 합성신약이 바이오의 범주에 포함되어 시장규모는 급성장할 것으로 예상(12.5조원은 합성신약을 포함한 2005년 시장규모임)
출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006(생명공학정책연구센터 재가공)

2006년으로 제1차 생명공학육성기본계획(Biotech 2000, 1994~2006)이 종료됨에 따라 생명공학육성법 제4조에 근거, 과학기술부 주관으로 총 8개 부처가 참여하여 제2차 생명공학육성기본계획(Bio-Vision 2016, 2007~2016)을 수립하게 되었다.

※ 관계부처 : 교육인적자원부, 과학기술부, 농림부, 산업자원부, 정보통신부, 보건복지부, 환경부, 해양수산부(생명공학육성법 제13조)
제2차 생명공학육성기본계획(Bio-Vision 2016)은 관계 부처의 생명공학관련 계획을 종합, 체계화한 상위계획으로서 장기적 비전과 전략에 따라 생명공학 육성을 위한 기본 정책지침으로서의 역할을 수행하게 된다.
생명공학육성기본계획의 주요 추진경과는 아래와 같다.
▪2006년 3월 : 생명공학육성기본계획 수립을 위한 기획연구 착수
▪2006년 4월 25일 : 정책수요 반영을 위한 토론회 개최
※ 토론회를 녹화하여 웹사이트(www.sntnet.or.kr)에 게재, 의견수렴 병행
▪2006년 4~8월 : 초안 작성
※ 총괄추진위원회 2회, 5개 분과별 위원회 각 4회 등 개최
※ 생명공학육성기본계획에 대한 성별영향평가 추진(2006년 7월~2006년 11월)
▪2006년 9월 : 기본계획(안)에 대한 사이버 공청회(9월 5일~30일), 권역별 공청회
※ 9월 11일(영남권), 9월 12일(호남권), 9월 15일(중부권), 9월 25일(서울)
▪2006년 9~10월 : 관계부처 협의
▪2006년 10월 : 기본계획 별칭 공모
▪2006년 11월 15일 : 생명공학종합정책심의회 심의 및 확정

국내 생명공학 분야는 지난 10여 년간 제1차 생명공학육성기본계획(Biotech 2000, 1994~2006)의 적극적인 추진에 힘입어 비교적 짧은 기간과 선진국 대비 부족한 연구 환경에도 불구하고 가시적인 성과를 창출하면서 괄목할만한 성장을 하였다.
정부의 연구개발투자는 1994년 536억원에서 2006년 8,021억원으로 연평균 23% 증가율을 보이며 투자계획 대비 93%의 실적을 보였다. 생명공학 우수인력 배출도 크게 증가하여 1999년 6,700명에서 2006년에는 9,700명으로 1.5배 증가하였다.
인적․물적 투자 증대를 바탕으로 과학기술경쟁력 또한 제고되었다. SCIE5) 기준 국제 논문 순위는 1994년 세계 29위에서 2005년 13위로 크게 증가하였고 기술의 질적 측면을 고려한 특허기술력 지수에서도 21위(1994~1997)에서 14위(2002~2005)로 상승되었다.
이런 기초과학 역량을 바탕으로 최근에는 산업적 성과도 태동되고 있다. 1999년을 시작으로 총 12개의 신약개발 및 1개의 글로벌 신약 개발에 성공하였고, 국내 제약시장 규모는 1994년 1,700억원에서 2005년 2.7(12.5조원)6)조원으로 10배 이상 성장하였다. 시장성장과 함께 관련 제약회사 300개, 바이오 벤처 600여 개, 기능성 식품업체 250개가 활발히 활동하고 있다.

출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006(생명공학정책연구센터 재가공)

Post-genome시대의 신개념 과학·기술 출현 및 첨단 IT, NT(BIT, BNT, BINT) 등의 과학․기술 융합화를 통한 기술혁신 가속화를 통하여 예방의학, 맞춤의약, 재생의학 등 다양한 의․약학적 분야가 출현하였다. 또한 생명공학을 차세대 성장동력으로 육성하기 위한 차세대 성장동력사업 등 범부처 공동연구 사업이 확대되고 있으며, 부처별로 다양한 육성정책을 추진하고 있다.

출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006(생명공학정책연구센터 재가공)
주요 선진국 또한 생명공학을 차세대 국가성장산업으로 인식하고 육성을 위한 다양한 추진 전략을 수립하고 있다.
미국의 경우 세계 1위의 기술우위를 바탕으로 연방정부 중심의 육성 정책을 강화하고 2006년 보건 분야 R&D예산으로 296억 달러를 배정하기도 하였다. EU는 EU 차원의 종합발전전략을 수립하여 국가간 협력과 경쟁 체제를 병행하는 방식으로 생명공학 육성정책을 추진하고 있으며, 제7차 Framework(2007~2013) 계획 수립을 통해 95.2억 유로를 생명공학 육성에 투자할 계획이다. 일본은 바이오산업화 전략을 추진하여 산업화 연계를 가속화하고 제3차 과학기술기본계획에서 생명공학 분야를 종합육성 분야로 선정하여 전략적으로 육성하고 있다.

제2차 생명공학육성기본계획(Bio-Vision 2016)은 제1차 생명공학육성기본계획(Biotech 2000)으로 확보된 “연구기반”을 바탕으로 “세계적 원천기술 확보”, “산업화를 위한 핵심 인프라 강화”를 목표로 하고 있다.

출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006(생명공학정책연구센터 재가공)
이를 위해 우선 원천기술 확보 등 국가의 전략적 목적을 분명히 하고 이에 따라 범부처적 종합조정 및 예산 배분 시스템을 효율화하고자 한다. 무엇보다 제1차 생명공학육성기본계획(Biotech 2000) 기간 중 선진기술 도입(Catch up)에 의한 연구기반 조성에 이어 세계적 주도(Leading)를 위한 창조・원천기술 확보 전략을 더욱 강화해 나갈 계획이다.
또한 기초연구성과의 산업적 활용을 전략적으로 지원하며, 특히 기업 등 민간 수요가 높은 핵심 인프라를 확충하고자 한다. 아울러 바이오안전성 및 생명윤리, 연구진실성 등에서 선진국 수준의 제도적 기반을 정비하여 국민의 신뢰를 기반으로 한 발전을 추진할 것이다.

제2차 생명공학육성기본계획(Bio-Vision 2016)은 국가 생명공학 육성체계 혁신, 연구개발 선진화 기반 확충, 바이오산업의 발전가속화 및 글로벌화, 법․제도 국민수용성 제고의 4대 추진전략과 추진전략에 따른 14개 실천과제로 구성되어 있다.
|
전 략 |
실천과제 |
|
국가 생명공학육성 추진체계 혁신 |
① 생명공학 분야 전략적 투자 강화 및 효율화 ※ 국가기획과 연계된 예산운용 및 목적 지향적 관리체계로 전환 ② 범부처 종합 조정 기능 강화 ※ 주요 사안별 역할분담, 의제별 갈등관리카드 운영 등 ③ 생명공학 정책 분석평가 체계 확충 ※ 생명공학 표준분류체계 정비, 연구기획․평가체제 강화 |
|
연구개발 선진화 기반 확충 |
① 국가생명공학 기초연구 역량의 선진화 ※ 핵심원천기술, 융합기술 등 지원 강화 ② 환경변화에 대응한 생명공학 인력 양성 강화 ※ 기초의약학 및 융합・신생기술 인력 양성 강화 ③ 국제공동연구 및 국제 협력 활동의 내실화 ※ 생명공학관련 국제적 규범 제정 논의에 적극 참여 등 ④ 생명공학 연구개발 인프라의 확충 ※ 생명자원 종합관리대책 추진 등 |
|
바이오산업의 발전 가속화 및 글로벌화 |
① 생명공학 실용화/산업화 연구개발 지원 가속 ※ 임상단계의 정부지원 강화 ② 바이오기업 경쟁력 제고 및 글로벌화 ※ 선진기업 유치 및 해외시장 진출 지원 등 ③ 바이오산업 인프라 확충 ※ 산업계 및 지역 수요가 높은 주요 인프라 확충 ④ 기술이전 활성화 및 바이오산업 지원제도 정비 ※ 바이오제품 생산․유통․무역 관련 제도의 재정비 등 |
|
법/제도 정비 및 국민 수용성 제고 |
① 생명공학 연구윤리 및 진실성 문화 정착 ※ 연구윤리․진실성 검증시스템 정착 ② 생명윤리 및 바이오안전성 법‧제도 정비 ※ 기술영향평가 활성화 등 ③ 국민 홍보․인지도․문화 저변 확대 ※ 정보포탈 구축 및 대국민 정보제공 서비스 강화 등 |
출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006(생명공학정책연구센터 재가공)

계획기간(2007년~2016년) 중 기존 사업의 확대와 연구개발, 공공 인프라 확충, 바이오 신산업 창출을 위한 신규 사업에 총 14조 2,881억원(국고)이 소요될 것으로 추정되고 있다. 단, 연차별 투자소요는 예산편성 및 국가재정운용계획 수립 과정에서 변경될 수 있으며 정부는 매년 시행계획 수립을 통하여 부처별 투자실적을 평가할 예정이다
[투자계획]
(단위 : 억원)
|
구 분 |
계 (2007~2016) |
2007년 |
2011년 |
2016년 |
|
생명공학 분야 투자 |
142,881 |
8,713 |
12,764 |
21,843 |
|
- 연구개발 - 인프라 |
104,661 38,220 |
6,578 2,135 |
9,382 3,382 |
15,509 6,334 |
출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006(생명공학정책연구센터 재가공)
또한 2007년~2016년까지 10년간 총 13만 7,900명(연평균 5.4% 증가)의 생명공학 분야 석․박사 인력 배출을 목표로 하고 있으며, 생명공학 25.1%, 보건의료 29.7%, 농축산·식품 19.6%, 산업공정/환경·해양수산 9.0%, 융합 16.6%의 분야별 인력을 배출할 예정이다.
[고급인력(석·박사) 배출 예측]
(단위 : 명)
|
영 역 |
계 (2007~2016) |
2007년 |
2011년 |
2016년 |
연평균 증가율 |
|
졸업자 배출 |
137,900 (101,300) |
10,800 (7,900) |
13,200 (9,700) |
17,300 (12,700) |
5.4 |
주) 괄호안의 수치는 석사인력을 나타냄
※ 추정 근거(통계 출처 : 국가교육통계정보센터)
(저출산으로 인해 생산인구는 2016년, 총인구는 2020년을 기점으로 감소할 것으로 예측)
출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006(생명공학정책연구센터 재가공)

가. 생명공학 투자
정부의 적극적인 육성정책에 따라 생명공학 분야에 대한 투자는 지속적으로 증가하는 추세로, 제1차 생명공학육성기본계획(Biotech 2000)이 수립된 1994년 이후 2006년까지 정부 투자는 총 4조 3천억원으로 연평균 23%의 증가율을 보이고 있다. 동 기간 과학기술 분야 예산 증가율은 11%로 생명공학 분야 투자는 상대적으로 높은 증가추세를 유지하고 있다.
[연도별 투자 실적]

출처 : 연도별 생명공학육성시행계획, 과학기술부, 2007(생명공학정책연구센터 재가공)
제1차 생명공학육성기본계획(Biotech 2000)상의 투자계획 대비 실적은 93%로 무난한 실적을 보이고 있으며, 관련 부처도 확대되어 현재 과학기술부, 산업자원부, 보건복지부, 농림부 등 8개 부처가 참여하고 있다.
(단위 : 억원)
|
1단계 (1994~1997) |
2단계 (1998~2001) |
3단계 (2002~2006) |
||||||
|
계획 |
실적 |
비율 |
계획 |
실적 |
비율 |
계획 |
실적 |
비율 |
|
5,000 |
3,856 |
77% |
6,149 |
8,976 |
146% |
38,020 |
30,578 |
80.4% |
출처 : 연도별 생명공학육성시행계획, 과학기술부, 2007(생명공학정책연구센터 재가공)
부처별 투자는 주관부처인 과학기술부가 41.2%(17,873억원)로 가장 많은 투자를 하고 있으며, 산업자원부 18%(7,800억원), 보건복지부 16.5%(7,184억원), 농림부12.8%(5,556억원) 순으로 투자하고 있다.
분야별로는 생명공학과 보건의료 분야의 비중이 전체의 63.7%로 높은 점유율을 나타낸다. 보건의료 33.8%(1조 4,658억원), 생명공학 29.9%(1조 2,990억원), 농림수산 29.8%(1조 2,893억원), 바이오융합 6.5%(2,841억원) 순으로 투자되고 있으며, 성격별로 분류할 경우 기초연구 43%, 응용연구 32%, 개발연구 25%로 상대적으로 기초연구 지원 비중이 높다.
나. 생명공학 인력
생명공학 분야 인력은 2005년 기준 30,652명으로 양적인 측면에서 부족하지 않다고 평가되고 있다. 전문대학 이상 생명공학 관련 졸업자는 1999년 28,052명에서 2002년 29,590명으로, 2005년에는 30,652명으로 증가하고 있다. 신규 배출 인력 중 우수인력인 석․박사 비중은 20% 정도의 일정 수준을 유지하고 있으며, 이중 여성의 비중은 1999년 29%에서 2005년 38%로 크게 증가하였다. 그러나 우수인력 중 여성 비율은 선진국과 비교했을 때 아직 미흡한 실정이다.
생명공학 인력 배출은 충분하나 신생․융합기술 등 첨단 인력과 산업현장 수요 전문 인력은 미흡한 실정이다. 바이오신약․장기 발전을 견인할 핵심인력은 2010년 7천명 이상 부족할 것으로 전망되고 있으며 cGMP 공정, 위해성평가, 품질관리 등 생산전문 인력이 부족한 것으로 분석되고 있다.
생명공학 분야 산업 발전에 따라 산업인력(연구직, 생산직 포함)은 지속적인 증가 추세에 있다. 2004년 기준 총 인력은 12,138명으로 연평균 17.7%(1997~2004)의 높은 증가율을 나타낸다. 또한 생명공학 인력구조는 고학력 위주의 구조적인 특성을 보유하고 있다. 주력 기간산업의 경우 석․박사 인력의 비중은 14.7%인 것에 반해 바이오산업은 57.7%를 나타낸다.

가. 공공인프라 구축
제1차 생명공학육성기본계획(Biotech 2000) 기간 동안 정부는 민간에서 자체적으로 추진하기 어려운 대형 공공인프라 구축을 단계별로 확대하여 왔다. 인프라 부분 투자는 1998년 121억원에서 2006년 1,600억원으로 13배 증가하였으며, 최근 다양한 기술과 산업화에 부응한 부처별 인프라 투자가 활성화되는 추세이다.
[생명공학관련 부처별 주요사업 현황]

출처 : 연도별 생명공학육성시행계획, 과학기술부, 2007(생명공학정책연구센터 재가공)
나. 국가 생명공학 클러스터 확충
지역 바이오산업 활성화를 위해 지역별 특성에 적합한 바이오산업 클러스터 구축도 적극 추진되고 있다. 산업정책 차원에서 9개 바이오벤처기업지원센터, 지역균형 발전차원에서 15개 바이오지역특화센터를 설립하였고 대전․충청권, 강원․경상권, 전라․제주권의 지역별 클러스터를 구축하여 특화된 연구개발을 추진하고 있다.
최근 중앙정부 및 지자체 공동의 대규모 특화 클러스터가 속속 구성되고 있다. 국책기관과 산학연 협력을 통한 선진 바이오 혁신클러스터 육성을 목표로 하는 ‘오송 생명공학단지’와 바이오메디컬 산업의 기술혁신 및 경쟁력 확보를 위한 ‘인천 바이오메디컬 허브’가 대표적이다.
다. 주요 제도 개선실적
제1차 생명공학육성기본계획(Biotech 2000)의 단계별로 보면, 1단계(1994~1997)는 생명공학육성법 개정(1995)을 통한 기반조성 및 제도적 절차가 마련된 ‘생명공학 육성을 위한 제도 정비의 시기’이다. 2단계(1998~2001)는 유전자 변형 농산물 개발 및 유통 등 국제적 이슈가 활발했던 시기로 ‘생명공학 안전성․생명윤리 논란의 확산기’라고 볼 수 있다. 마지막으로 3단계(2002~2006)는 생명윤리 및 연구진실성 등의 이슈가 부각되는 등 급변하는 생명공학 분야의 이슈 및 국제 규범에 대응하기 위한 ‘국제 규범 수준의 제도 정비 노력기’이다.
[제1차 생명공학육성기본계획(Biotech 2000) 단계별 규범 이슈]
|
구분 |
1단계(1994~1997) |
2단계(1998~2001) |
3단계(2002~2006) |
|
규범 이슈 |
․생물다양성협약 체결 ․신(新) 국제무역질서에의 대응 ․“생물자원전쟁”의 가능성에 대비 ․복제양 돌리 탄생으로 윤리 문제 태동 |
․생명공학 안전성 관련조치 ․유전자 특허에 대한 논란 ․생명공학 안전성 관련 국내 법령 및 제도의 정비
|
․생명윤리법 제정을 둘러싼 사회적 갈등 ․ELSI 프로그램 추진 ․연구윤리․진실성 문제 대두
|
|
제도 개선 실적 |
․생물다양성협약 가입 (1994) ․생명공학육성법 개정 (1995) ․유전자재조합실험지침 제정 (1997)
|
․“유전자재조합식품․식품첨가물 안전성평가자료 심사지침”시행(1999) ․유전자재조합식품 등의 표시 기준 고시(2000) ․유전자 변형 생물체의 국가간 이동 등에 관한 법률 제정(2001) ․유전자 변형 농산물 표시 요령 고시(2000) ․유전자 변형 농산물 표시제 시행(2001) |
․생명윤리 및 안전에 관한 법률 제정(2004) 및 시행(2005) ․유전자 변형 생물체의 이동 등에 관한 법률 시행령 및 시행규칙 제정(2006) ․연구윤리․진실성 확보를 위한 가이드라인 제정 추진(2006) |
출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006(생명공학정책연구센터 재가공)

선진국과의 협력 및 정보교류의 확대를 위한 침팬지 유전체(HCCGP), 벼 유전체 해독(IRGSP), 휴먼 프론티어(HFSP), 인간프로테옴(HUPO) 등 국제협력 사업에의 참여가 증가하고 있다. 또한 미국 등 선진국에 바이오벤처기업 해외 진출거점을 마련하여 공동연구․기술교류 및 마케팅을 지원하기 위해 노력하고 있으며, 해외 현지 공동연구센터 설립을 통한 기술교류 및 연구자원 확보에 힘쓰고 있다.
해외 우수 연구기관의 국내 유치 및 투자 유치를 위한 다양한 지원정책에 힘입어 파스퇴르연구소(2004), 이화학연구소 협동연구센터(2005) 등의 세계적인 바이오 연구기관이 국내에 설립된 바 있다. 또한 셀트리온(벡스젠 30백만 달러 투자 유치), 녹십자 백신(베르나 바이오텍, 10백만 달러 투자 유치) 등 다국적 바이오기업의 투자유치가 이루어진 바 있다.
글로벌 연구개발 네트워크 구축을 위한 외국정부와의 정부 간 바이오산업협력협정(MOU) 체결 및 국가 간 협력센터 구축에 있어, 한․중협력연구센터(1998, 한국생명공학연구원)가 설치되는 등 7개국의 협력센터․창구가 구축되는 등 성과가 창출되었다.

가. 논문 성과 측면
생명공학 분야 SCIE 논문 수는 1994년 420건으로 29위에 머물렀으나, 2005년 한해 총 4,089건의 논문이 발표되어 13위로 크게 상승하는 등 양적인 성장을 이뤘다. 또한 세계 유명저널인 NSC(Nature, Science, Cell) 게재 논문 수도 최근 크게 증가하고 있어, 우리나라 생명공학 분야 논문이 양적․질적으로 향상되고 있음을 알 수 있다.
세계 상위 30개 국가 간 상대비교에서 우리나라의 생명공학 분야 총 논문 산출량 수준은 지속적으로 제고되고 있으나, 논문 피인용 지수로 본 질적 수준에서는 경쟁국과의 격차가 존재하여 질적 도약이 필요하다.
[논문 성과 현황(NSC 및 SCIE 논문 중심)]

출처 : 한국생명공학연구원, 2006(생명공학정책연구센터 재가공)
나. 특허 성과 측면
제1차 생명공학육성기본계획(Biotech 2000)이 착수된 이후 생명공학 분야 특허는 1단계 기간 미미한 실적이 보이다가 2단계에 들어 본격적으로 증가하기 시작하였다. 미국 등록특허 기준 한국 생명공학 분야 특허건수는 1단계(1994~1997) 47건, 2단계(1998~2001) 178건, 3단계(2002~2005) 207건으로 특허 창출 역량이 크게 증가하였다. 또한 기술력지수에 의한 한국의 기술수준은 1단계(1994~1997) 21위, 2단계(1998~2001) 17위, 3단계(2002~2005) 14위로 상승하는 등 한국의 생명공학 특허는 양적․질적 성장 추세에 있다.
3단계 기간 동안 응용 분야별 특허기술력은 농업 분야가 51.9로 가장 높으며, 그 뒤로 의약 분야 36.0, 공정 분야 31.7, 기초 분야 14.7순으로 분포되어 있다. 농업(2단계 13위 → 3단계 7위) 및 환경 분야(1단계 22위 → 2단계 9위 → 3단계 4위)의 기술경쟁력 제고가 두드러진다.
한편, 국내 특허청에 출원된 생명공학 분야 특허는 제1차 생명공학육성기본계획(Biotech 2000)의 시작 연도인 1994년 이후 외국인에 의한 특허출원이 우세하다가 1998년을 기점으로 내국인의 국내특허 출원이 외국인을 능가하기 시작하였다.
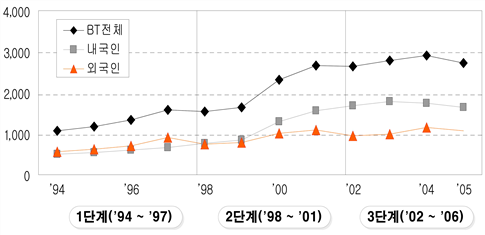
출처 : 한국특허정보원, 2006(생명공학정책연구센터 재가공)

가. 시장규모

* 1) 05년 2.7조원은 의약품시장 중 바이오신약 분야만 포함한 것이고, 12.5조원은 합성의약 시장규모를 합한 것임
출처 : 연차별 국내 생물산업통계, 산업자원부. 바이오산업, 산업․전망세미나
자료(2005), 한국바이오산업협회. 미래 Trend와 제약산업(2005), LG경제연구원
국내 바이오시장(생산) 규모는 2005년 기준 2.7조원으로 1994년 1,700억원에서 연평균 28.3%의 높은 성장률을 보이며 성장하였다. 2005년 바이오시장규모는 의약품 시장 중 바이오신약 분야만 포함한 액수로, 합성의약까지 포함한 바이오시장규모는 12.5조원이다.
국내 생산규모는 생물의약과 바이오식품이 84%의 점유율을 보이며 집중된 양상을 보인다. 상대적으로 적은 규모이나 생물전자 분야의 규모가 최근 크게 확장되고 있다(2002년 대비 2004년 증가율 : 생물전자 293%, 생물의약 52%, 생물화학 45%).
나. 산업구조
국내 바이오산업 업종별 기업 분포는 생물의약, 바이오식품, 생물화학 순으로 분포되어 있으며, 최근 생물전자 등 신 기술 분야의 기업 수가 뚜렷한 증가 추세에 있다. 2004년 기준 생물의약 기업은 234개, 식품 183개, 화학 145개, 환경 102개, 기타 127개로 생물의약 관련 업체가 가장 많이 존재하며, 생물전자 분야 기업 수는 2003년 7개에서 2004년 33개로 약 5배 증가하였으며, 바이오에너지․자원 분야 기업 수는 2003년 16개에서 2004년 52개로 증가하는 등 생물전자 등 신기술 분야의 증가 추세가 두드러진다.
2006년 기준으로 600여 개의 벤처기업이 활동하고 있으며, 이중 42개 기업이 코스닥에 등록되었다. 바이오벤처는 2000년 전후 붐을 형성하면서 빠르게 증가하였으나 최근 둔화 추세이다. 1999년 71개 기업, 2000년 233개 기업이 창업하다가 2002년에는 20개 정도가 창업한 실정이다. 코스닥 등록 벤처기업 수는 2000년 이전 6개 기업에서 2000년 이후 36개 기업이 등록되었다.
다. 주요 제품개발 성과
제1차 생명공학육성기본계획(Biotech 2000)의 추진으로 축적된 기초과학 역량을 기반으로 세계 시장에서 인정받는 일류 상품은 1단계 0개에서 2단계 2개, 3단계 14개로 크게 증가하고 있으며, 기능성 식품군에서 의료용 진단 및 치료제품으로 변화․다양화되고 있다.
1999년 SK제약의 선플라주를 시작으로 2005년 기준 총 12건의 국산 신약이 개발되었다. 그러나 아직까지 화합물 신약의 비중이 전체의 58%로 높고 대부분이 20억원 이하의 저조한 매출 실적을 보이는 한계가 있다.
2003년 팩티브의 국내 최초 미국 FDA 승인 이후 국내 기업에서 연구개발한 여러 신약후보물질들의 FDA 허가 신청이 증가하고 있어 2005년 기준 미 FDA 임상을 신청한 신약은 총 6개이다.
또한 국내에서 다국적 제약사에 의한 다 국가 임상시험이 증가하는 등 글로벌 임상 역량이 강화되는 추세이다. 임상시험 승인건수는 2000년 총 33건에서 2005년 146건으로 4.4배 증가하였다. 이중 다국가 임상시험 비중은 2000년 6%(5건)에서 2005년 51%(75건)로 크게 증가하여 글로벌 임상 역량이 점차 강화되고 있다고 평가할 수 있다.



OECD에서는 생명공학 기술을 ‘지식, 재화 및 서비스의 생산을 목적으로 생물 또는 무생물을 변형시키는 과정에서 생물체, 생체유래 물질 및 생물학적 모델에 과학과 기술을 적용하는 활동’으로 정의하였으며, 미국 바이오산업협회인 BIO(Biotechnology Industry Organization)에서는 ‘문제해결 혹은 유용제품 생산을 위한 세포 및 생물 분자적 과정의 이용’이라 정의하고 있는 가운데 생명공학 기술의 범위가 확대되고 있는 추세이다.

최근 정보통신기술, 나노기술 등과의 기술융합화가 가속화되면서 생명공학기술의 범위도 점차 확대되고 있는 추세이다.
바이오산업은 이러한 생명공학 기술을 바탕으로 생물체의 기능과 정보를 활용하여 인류의 건강증진, 질병예방․진단․치료에 필요한 유용물질과 서비스 등 다양한 부가가치를 생산하는 산업을 총칭하며, 정보통신, 나노 등 여타 신기술과의 융합을 통해 생성되는 새로운 개념의 산업들을 포함한다.
이처럼 최근 생명공학 기술혁신이 급속히 진행되면서 바이오산업의 경계도 허물어지고 있다. OECD에서는 2030년 경에 이르면 생명공학기술과 이를 활용한 제품들이 일상생활과 산업 전반에 깊숙이 자리하여, IT혁명을 넘어서는 “바이오 경제” 시대가 도래할 것으로 예견하였으며 주요국들 또한 이에 적극적으로 대비하고 있다.


생명공학 기술의 역사는 효모를 이용한 발효기술로 빵과 술을 만들어 먹던 기원전 4000∼2000년 사이 고대 이집트로 거슬러 올라간다. 그러나 근대적인 개념의 생명공학 기술이 발전하게 된 것은 17세기 이후이다. 1663년 Hooke가 세포(cell)를 발견하였고, 1859년 Charles Darwin은 자연선택에 의한 진화설을 발표하였으며, 1928년 Alexander Fleming은 최초의 항생물질 페니실린을 발견하여 많은 사람의 목숨을 구했다. 1953년 James Watson과 Francis Crick에 의해 DNA 이중나선 구조가 밝혀지고 1973년 Stanley Cohen과 Herbert Boyer가 개발한 유전자재조합 기술은 현대 생명공학의 기틀이 되었다.
이로부터 10년이 지난 1983년, PCR(Polymerase Chain Reaction)이라는 DNA 증폭기술이 개발되어 오늘날 생명공학 연구개발에 없어서는 안 될 필수적인 기기로 자리 잡았으나, 1997년 체세포 복제를 통해 최초의 복제양 돌리가 탄생하므로써 전 세계적으로 생명공학 기술의 윤리적 논쟁이 뜨겁게 진행되었다.
2002년 인간 유전체지도의 초안이 발표되면서 생명공학 기술 발전의 한 획을 그었으며, 2006년 Monsanto와 Cargill의 연합벤처인 Renessen LLC에서 생명공학 기술로 품질이 향상된 작물인 MaveraTM를 시판하기까지 생명공학 기술은 우리의 삶에 알게 모르게 영향을 미치며 발전해왔다[그림 1-1-2-1].

출처 : 미국바이오산업협회 자료(www.bio.org) 내용 재가공
|
그림 1-1-2-1 |
생명공학기술 발전사
OECD 추정에 의하면 2006년 전 세계 IT 산업 성장률이 6%인데 반하여 바이오산업은 2000년 이후 2010년까지 연평균 11%의 높은 성장률로 체적을 키워 나가고 있다. 생명공학 기술의 융합화 및 산업화의 진전에 의한 응용범위 확대로 2011년부터 2015년까지는 연평균 15%로 그 성장추세가 더욱 빨라질 것으로 전망하고 있다[표 1-1-2-1]. OECD에서 주요 13개국을 대상으로 조사한 결과에 따르면 바이오산업 중 보건의료(Health, Red 바이오) 분야가 80%, 농축산․식품(Agro-food, Green 바이오) 분야가 6%, 산업공정․환경(Industry-environmental, White 바이오) 분야가 5%, 기타(주로 서비스)가 9%를 차지하여[그림 1-1-2-2] 바이오산업 내에서 보건의료 분야로의 생명공학기술 활용이 가장 중요한 위치를 차지하고 있다고 할 수 있다. 또한 앞으로도 생명공학기술은 보건의료 분야에서의 활약이 기대되는 가운데 건강하고 쾌적한 환경을 위해서 농축산․식품 및 산업공정․환경 분야에서 바이오산업이 크게 성장할 것으로 전망된다.
|
표 1-1-2-1 |
세계 바이오산업 시장현황 및 전망, 2000∼2015년
|
세계시장규모(억 달러) |
연평균 성장률(%) |
|||||
|
2000년 |
2005년 |
2010년 |
2015년 |
2000∼2005 |
2005∼2015 |
2000∼2015 |
|
540 |
910 |
1,540 |
3,090 |
11.00 |
13.0 |
12.3 |
출처 : 산업자원부, “바이오산업 미래비전과 발전전략

출처 : OECD,
그림 1-1-2-2 세계 바이오산업 응용 분야별 분포현황

미국 MIT에서 2001년부터 매년 초에 발표하는 ‘10대 유망기술’은 10년 이내에 사회나 비즈니스에 영향을 줄 것으로 예상되는 기술들이다. 2002년을 제외하고 2007년까지 선정된 60개 기술 중 넓은 범위의 생명공학 기술은, 2001년 2개에서 2006년 4개로 해가 갈수록 그 수가 증가하고 있어, 미래 유망기술에서 생명공학 기술이 차지하고 있는 바는 크다고 할 수 있다[표 1-1-3-1].
또한 미국 연구개발 연구소인 RAND에서 2006년 발표한 보고서에서도 2020년까지 사회․경제적으로 영향을 크게 미칠 16개의 주요 기술 중 넓은 범위의 생명공학기술은 8개[유전자 개량 작물(Genetically Modified Crops), 급성 생물조사법(Rapid Bioassays), 정수용 필터와 촉매(Filters and Catalysts for Water Puri- fication and Decontamination), 특정부위 약물전달법(Targeted Drug Delivery), 친환경 제조법(Green Manufacturing), 침투형 센서(Pervasive Sensors), 조직공학(Tissue Engineering), 개량된 진단법 및 수술법(Improved Diagnostics and Surgical Methods)] 등으로 생명공학 기술은 미래 우리의 삶에 큰 영향을 미칠 것으로 예측된다.
|
표 1-1-3-1 |
MIT 선정 유망 10대 기술
|
2001년 |
2003년 |
2005년 |
2007년 |
|
Flexible transistor |
Quantum Cryptography |
Airborne Network |
P2P Peer Video |
|
Microphotonics |
Wireless Sensor Network |
Silicon Photonics |
Mobile Augmented Reality |
|
Data Mining |
Grid Computing |
Universal Memory |
Compressive Sensing |
|
Natural Langage Processing |
Software Assurance |
Environmatics |
Neuron Control |
|
Untangling Code |
Injectable Tissue Engineering |
Cell Phone Viruses |
Single-Cell Analysis |
|
Biometrics |
Glycomics |
Bacterial Factories |
Personalized Medical Monitor |
|
Microfluidics |
Nano Solar Cells |
Metabolomics |
Nano Healing |
|
Brain-Machine Interface |
Nano Imprint Lithography |
Quantum Wires |
Meta Materials |
|
Robot Design |
Molecular Imaging |
Magnetic Resonance Force Microscopy |
Optical Antennas |
|
Digital Rights Management |
Mechatronics |
Biomechatronics |
Quantumdot Solar Power |
출처 : MIT,“10 Emerging Technologies가. Red 바이오
위에서 살펴본 바와 같이 미래 유망 분야로 손꼽히는 생명공학 기술은 질병진단, 예방 및 치료 분야 등 Red 바이오산업에 커다란 기여를 해왔다. 미국 FDA에서 바이오신약 혹은 새로운 적응증으로 승인 받는 약물의 수가 1995년 이후 태동기를 거치면서 빠르게 증가하고 있다[그림 1-1-3-1]. 또 데이터모니터에서 발표한 자료에 따르면 전 세계 의약품 시장에서 화학합성에 의한 저분자의약품의 비중은 2006년 83.3%에서 2012년까지 저분자의약품의 연평균 성장률은 0.6%로 2011년 이후 시장은 오히려 감소하는 추세를 보일 듯하다. 그러나 치료용 단백질, 단일 클론 항체 등 바이오의약품은 보다 높게 성장하며, 그 중에서도 백신은 연평균 19.1%로 성장하여 미래 시장요구가 더욱 높을 것으로 전망하고 있다([표 1-1-3-2]와 [그림 1-1-3-2]).

출처 : 미국바이오산업협회(BIO),“Guide to Biotechnology
|
그림 1-1-3-1 |
바이오신약과 새로운 적응증에 대한 FDA 승인 현황
|
표 1-1-3-2 |
의약품 종류별 판매액 전망(백만 달러), 2006∼2012년
|
|
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
2011년 |
2012년 |
CAGR (%) |
|
Small molecule (저분자의약품) |
354,073 |
368,514 |
379,049 |
391,113 |
403,735 |
408,978 |
367,135 |
0.6 |
|
Therapeutic protein (치료용 단백질) |
47,781 |
51,679 |
54,793 |
58,065 |
60,374 |
62,548 |
64,495 |
5.1 |
|
Monoclonal antibody (단일클론 항체) |
19,573 |
24,767 |
29,185 |
33,531 |
37,496 |
40,820 |
43,381 |
14.2 |
|
Vaccine(백신) |
3,398 |
4,849 |
6,416 |
7,906 |
9,239 |
10,313 |
9,711 |
19.1 |
|
합 계 |
424,824 |
449,809 |
469,444 |
490,615 |
510,845 |
522,659 |
484,721 |
2.2 |

출처 : Datamonitor, “Monoclonal Antibodies Report Part I”, 2007
*CAGR : Compound Average Growth Rate, 연평균 성장률
|
그림 1-1-3-2 |
의약품 종류별 판매액 전망(백만 달러), 2006∼2012년
또한 최근 글로벌제약사는 바이오의약품을 비롯한 신약개발 파이프라인 다양성 확보를 위해 신약 자체개발에서 라이선스-인(Licensing-in) 전략으로 바꾸는 추세이다. 이에 따라 글로벌 제약사의 바이오 제약기업에 대한 M&A 추이가 증가하고 있으며, Red 바이오에서의 생명공학기술은 개인 맞춤형 의약, 재생의약, 백신 등의 개발로 부작용이 적으며 안전한 질병 치료용 의약품, 보다 빠르고 정확한 질병진단 및 예방 분야로 활발하게 산업화가 진행될 것으로 보인다.
나. Green 바이오
1990년 초반 16억 명이던 세계 인구는 현재 60억 명을 넘었으며 2030년에는 100억 명에 다다를 전망이다. 국제연합식량농업기구(The United Nations Food and Agriculture Organization)에서는 이 같은 인구증가에 대비하기 위해서는 현재의 경작 넓이에서 2배의 식량을 생산해야 할 것으로 추정하고 있다.
이러한 미래 환경에서 생명공학 기술을 이용한 환경 친화적 해충관리 및 물과 비료의 최소사용 등으로 농업 생산성을 높이는 것이 1960년대 녹색혁명 이후 늘어가기만 하는 식량 수요에 대한 새로운 대처방법으로 중요시되고 있다. 최근 집계된 생명공학 기술을 이용한 유전자변형 작물의 재배면적은 전 세계적으로 2005년 21개국 8,800만 헥타르(ha)에서 2006년 22개국 1억 헥타르(ha)로 13% 증가하였으며, 세계적으로 5만 헥타르(ha)의 유전자변형 작물 재배면적을 소유한 메가 국가는 14개 국가로 점차 재배 면적과 해당 국가가 증가하고 있는 추세이다[그림 1-1-3-3]. 앞으로 Green 바이오에서 생명공학 기술은 작물생명공학, 산림생명공학, 농림생명공학, 수경재배, 식품생명공학 등으로 나누어 형질전환 동식물을 이용한 질병 및 환경 스트레스 내성 농작물, 의약품 생산용 농작물 등 안전하면서도 생산성이 향상된 농축산․식품 생산을 위한 기술개발이 이루어질 것으로 예측된다.

출처 : ISAAA,“Global Status of Commercialized Biotech/LM Crops: 2006”, 2007
|
그림 1-1-3-3 |
세계 각국의 유전자변형작물 재배현황 및 면적
다. White 바이오
보건의료나 농축산․식품만큼 주목 받지 못하였으나 생명공학 기술의 ‘제3의 물결’로 산업 및 환경 분야(White 바이오) 응용에 커다란 관심이 모아지고 있으며 실제로 생명공학기술을 이용한 지속가능한 개발로 전통적 제조공정이 성공적으로 경쟁하고 있다.
산업적 지속가능성은 끊임없는 혁신, 향상 및 청정기술의 사용으로 오염과 자원소비를 감소시키는 것을 말하며, 현대 생명공학이 이를 달성할 수 있을 것으로 기대하고 있으며 White 바이오에서 생명공학기술은 독성을 지닌 부산물, CO2 등의 온실가스, 제조비용 감소 및 에너지 절감을 위한 새로운 생물활성을 보이는 효소, 바이오에너지, 친환경 플라스틱 및 환경 모니터링 기술 개발이 주요하게 이루어질 것으로 예상된다.
특히 2006년과 2007년은 바이오에너지산업 대폭풍의 시기로, 바이오에너지 시장의 유망한 미래에 대해서 사회․정치․경제․ 환경적 측면에서 관심이 고조되고 있다. 미국의 부시 대통령이 2007년 연두 연설에서 ‘2017년까지 재생 가능한 대체 에너지의 사용량을 5배로 늘리겠다’고 언급한 것에서 알 수 있듯이, 세계 최대 에너지 소비국인 미국을 비롯하여 세계 각국에서 바이오에너지 관련 육성정책 등을 펴고 있다[그림 1-1-3-4].

출처 : Ernst & Young, “Beyond Borders; Global Biotechnology Report 2007”, 2007
|
그림 1-1-3-4 |
각국의 바이오에너지 육성 현황

2006년 RAND 보고서에 의하면 2020년까지 16개 기술응용 분야에서 국가별 과학기술 역량을 평가한 결과, 14개 이상 분야에서 기술을 확보할 것으로 전망한 과학 선진국(미국, 캐나다, 독일, 일본, 호주, 이스라엘)에 우리나라를 포함시켰다.
과학기술 경쟁력 확보에 있어서 우리나라는 비용과 자본, 연구개발 투자, 인프라, 자원사용, 교육, 인구 규모와 구조 등의 측면에서 장점을 가지고 있으나 법규, 정책, 사회가치, 여론 및 정치, 국정관리, 안정성 등 단점으로 지적된 부분에서는 우리에게 시사하는 바가 크다. 생명공학 기술 및 바이오산업은 기초생명공학의 기틀 없이 이루어질 수 없는 것으로 기초생명공학 연구개발을 더욱 탄탄하게 다져야 할 것이다. 또한 생명공학은 다양한 학문 및 기술과 접목되어 현재 존재하지 않던 새로운 과학적․기술적 패러다임을 생성할 수 있으며, 이로 인한 신(新)시장 개척으로 가치사슬 변화 등 산업구조에도 커다란 파급효과를 가져올 것으로 예상된다.
1973년 Herbert Boyer와 Stanley Cohen에 의해서 개발된 유전자재조합 기술은 서로 다른 생명체 유래의 유전자를 조합하는 기술로써 현대 생명공학에 없어서는 안 될 중요한 기술인 동시에 현대 생명공학에 대한 윤리 및 안전성 논쟁을 촉발한 기술이기도 하다. 생명공학은 생명을 대상으로 연구하며 또한 그것에 기술을 직접 적용한다는 측면에서 생명윤리와의 원활한 대화와 균형 잡힌 조화를 이루어야 한다. 하지만 기술발전이 가속화되고 있는 상황에서 이에 관한 사회윤리를 합리적으로 도출해낸다는 것은 기술 발전과 사회 윤리간의 괴리와 어려움을 수반한다.
그렇다고 생명공학의 성과에 밀려 생명윤리가 뒷전에 묻혀서는 안 된다. 앞으로 생명공학 연구개발과 함께 윤리적, 법적, 사회적 영향(ELSI)에 대한 합리적 연구와 논의를 활성화하고 제도적 장치를 마련하는 길이 건강하고 풍요로운 바이오산업 국가로의 길과 연결될 수 있으리라 생각한다.


가. 정의 및 범위
바이오산업은 DNA․단백질․세포 등 생명공학관련기술을 직접 활용하여 제품(바이오의약품․바이오디젤 등) 및 서비스를 생산하는 산업이다.
또한 바이오산업(bioindustry or biotechnology industry)의 범위는 OECD 기준에 따르면 의약, 농축수산, 환경, 에너지 시장 등으로 구분한다[표 1-2-1-1]. 특히, 의약품 시장의 경우 생명공학 기술 및 의약화학 기술을 동시에 이용한 제품이 의약품 시장의 90% 규모를 차지함에 따라 바이오산업에서 의약품 시장은 저분자 합성의약을 포함하여 해석하고 있다.
|
표 1-2-1-1 |
바이오산업 분야
|
분 야 |
범 위 |
|
생물의약 |
호르몬제, 항암제, 항생제, 면역제 등 치료제, 백신, 진단시약, 유전자요법 등 |
|
생물화학 |
생분해성 고분자, 아미노산, 유기산, 기능성 다당류, 향료, 색소 등 |
|
생물환경 |
환경정화용 미생물제 및 공정, 대기탈황, 탈취제, 응집제 |
|
바이오식품 |
저칼로리형 대체감미료, 기능성 지질, 식품첨가물, 발효식품 등 |
|
바이오에너지, 자원 |
연료용 에탄올, 메탄발효, 이산화탄소 고정화, 광합성, 바이오가스 등 |
|
생물농업, 해양 |
인공종자, 동물백신 및 진단제, 미생물농약, 해양생물자원, 사료제 등 |
|
생물공정, 엔지니어링 |
발효공정, 동식물 세포 배양, 생물반응기, 생물 전환기술 |
|
생물학적 측정 시스템 |
안전성과 효능 평가기술, 바이오센서, 바이오칩, 진단기술 등 |
출처 : 삼성경제연구소 보고서, 2005
나. 바이오산업군 및 세계 시장 규모
바이오산업은 의약산업을 포함하여 농축수산 분야에서 식량문제 해결, 환경복원, 폐기물처리 기술개발을 포함한 환경문제 해결, 고갈되어 가고 있는 석유에너지 자원을 대체할 바이오에너지 개발, 바이오전자산업 등 모든 산업군에 적용될 것으로 예측되고 있다.
전 세계 바이오산업의 규모(바이오산업 중 가장 규모가 크고 부가가치가 높은 의약품 산업 중심 통계임)는 2004년 5,400억 달러에서 2006년 6,000억 달러, 2020년에는 1.3조 달러(PricewaterhouseCooper, 2007)에 육박할 것으로 예상되며, 이 중 의약품 시장이 전체 시장의 90%를 차지하고 있다[표 1-2-1-2].
|
표 1-2-1-2 |
바이오산업 및 예상 시장 규모
|
산업 부문 |
주요 제품 |
현재 단계 |
2010년 시장 예상 시장 규모 (억 달러) |
주요 참여 기업 |
|
의약 |
콜레스테롤 저해제, 적혈구 성장 촉진제, 성장호르몬 |
상용화 |
9,700 |
Amgen, Genentech, Pfizer, GSK |
|
생명공학 치료 |
세포치료제, 유전자 치료제, 수혈제품 |
응용 연구 중 |
562 |
Aastrom, ONYX, Vical |
|
U-Health |
바이오칩, 운용체계 |
응용 기술 축적 |
300 |
Affymetrics, Medtronics |
|
유전자변형 생물체 |
작물, 동물, 어류 |
상용화 |
150 |
Monsanto, Syngenta |
|
생명공학 기기 |
영상진단기, 분석기기 |
상용화 |
850 |
HP, GE, Agilent |
|
생명공학 환경, 에너지 |
미생물 분해, 생명공학 연료 |
상용화 초기 |
160 |
Shell, BP |
|
생명공학 공정 |
기존 공정의 대체 |
상용화 초기 |
250 |
Cargill-Dow, BASF, Dupont |
출처 : 삼성경제연구소 보고서, IMS Health, Jain PhrmaBiotech Report, 2005 등
다. 생명공학 연구개발 기술동향과 기술발전의 전개 방향
인간 유전체 프로젝트(Human Genome Project) 이후 동물, 식물, 미생물 등 많은 생물종에 대한 유전체 지도가 완성됨에 따라 생명 현상에 대한 총체적인 접근(시스템 생물학이라고 일컬음)을 통해 바이오 제품들이 개발되기 시작했다. 이러한 post-genome 시대에서 첨단 생명공학 기술의 활용 범위는 기초 연구개발 단계에서 산업화 단계로 발전하고 있다.
생명공학 기술은 IT, NT 등 첨단 기술 간의 융합을 통해 새로운 제품 개발에 기여하여 바이오칩, 바이오센서, 나노 바이오기술, 생물 정보학 등 새로운 융합기술 제품들이 상업화되고 있다. 또한 SNP(Single Nucleotide Polymorphism, 단일염기변이), 약물 유전체학(Pharmacogenomics), 줄기세포 연구 등의 첨단 연구결과들 역시 예방의학, 맞춤의약, 재생의약의 관점에서 시장에서 활용되기 시작하여 난치병 및 유전병 치료에서 새로운 돌파구가 시도되고 있으며 점차 예방의학에 더 집중하여 삶의 질을 개선하는 방향으로 진행되고 있다.
바이오산업, 특히 의약품 산업은 첨단 기반 기술과 함께 산업화를 위한 장기간 막대한 투자가 필요하다는 점에서 미국, 영국, 독일, 일본 등 일부 국가에서 산업 발전을 주도하고 있으며, 선도 기업 간의 경쟁이 매우 치열하다. 미국을 포함한 상위 6개국이 전 세계 연구 개발비 투자액의 88%를 차지하고 있으며, 미국 중심의 상위 20개 기업이 전체 시장의 60%를 점유하고 있다.
미국 및 영국 중심의 대형 다국적 제약 및 바이오기업들은 연구 개발에 대한 투자를 점차 강화하여, 2005년 미국 정부의 국립보건원은 연구 개발에 투자한 약 290억 달러보다 많은 약 400억 달러에 이르는 엄청난 규모의 금액을 투자하고 있다. 그러나 연구개발에 대한 지속적인 투자증가에도 불구하고 임상 개발되어 식약청의 허가를 받아 출시되는 제품의 수는 증가하고 있지 않다. 이에 따라 기업운영의 생산성을 제고하기 위해 다국적 제약 및 생명공학 기업들은 신기술 확보와 파이프라인 강화를 위해 소규모 벤처와의 제휴에 투자를 확대하고 있다.
바이오산업의 발전과 가장 밀접하게 관계된 사회적 이슈는 인간 유전체 프로젝트의 완성이며, 이에 따른 혜택을 가장 빨리, 가장 직접적으로 받는 분야는 바로 의약품산업이다. 현재 2006년의 의약품산업시장은 연간 6천억 달러 이상이며, 이것이 앞으로 전개될 post-genome 시대(유전자 서열이 밝혀진 이후의 시대)에는 얼마나 증가할지 예측하기도 어려운 상황이다. 곧 병을 치료하는 기존의 개념에서 삶의 질을 향상시킬 수 있는 예방의학 및 신약 연구가 21세기에 인간 유전체 프로젝트의 결과를 이용하여 가장 큰 경제 가치를 창출할 수 있는 분야라고 예견하고 있다.
인간 유전체의 서열은 밝혀졌으나, 이제 어떠한 연구가 필요한 것인가? 미국과 일본 정부는 다음 목표로써 중요 단백질들의 구조 및 기능에 주목하여 관련 분야(구조유전체학(Structural genomics), 단백질체학(Proteomics), 시스템 생물학(Systems biology) 및 화학 유전체학(Chemical genomics)등)에 막대한 투자를 하고 있다.
그 예로 미국에서는 2000년부터 연방정부연구소(NIGMS)에서 대학 중심의 9개 연구센터에 1억 5천만 달러를 투자하고 있으며, 일본은 2001년 6개 센터에 미국보다 훨씬 더 큰 규모로 정부와 민간의 컨소시엄을 구성하여, 막단백질을 포함한 인간 및 마우스 단백질의 구조연구에 집중 투자하는 등 이 분야의 신기술 확립과 함께, 구조유전체학 분야에서의 정보 선점을 추구하고 있다. 단백질 구조정보는 지적 재산권의 확보뿐만 아니라 신약발굴에도 매우 중요한 기반 기술이기 때문에 이 분야에서 경쟁력을 지닌 기술의 확립은 매우 중요하다.
라. 바이오산업의 시장 예측
생명공학 시장은 2006년 약 6,000억 달러에서 2020년 약 1조 3천억 달러로 성장할 것으로 예상된다. PricewaterhouseCoopers7)에 따르면 2020년에 이르면 의약품시장에서 의사보다는 행정부와 수요자들에 의한 가격 결정권한이 강화되고, E7 국가들(브라질, 중국, 인도, 인도네시아, 멕시코, 러시아, 터키)의 경제가 크게 성장하여 이들 국가들이 전 세계 바이오산업시장의 약 20%를 차지할 것으로 예상된다.
또한 보건의료에 대한 치료정책보다는 금연캠페인 등을 통한 예방정책이 강화되고, 현재까지는 주로 서방 선진국들에서 수행되어 온 기초과학 및 생명공학에 대한 연구가 고비용 등으로 아시아 국가들로의 이동하는 현상이 발생하게 될 것이다.
바이오 벤처들의 신속한 의사결정 및 연구개발 속도가 다국적 제약 기업들의 복잡하고 느린 의사결정 시스템과 연구개발 문화에 대한 변화를 일으키고 있으며, 유전체 연구를 통한 바이오마커들의 발견으로 보다 안전하고 효과적인 신약을 더 빠르고 저렴하게 개발할 수 있게 될 것이다. 또한 2020년 경이 되면 전 세계가 하나의 임상 개발 규정(One global regulatory system)으로 통일되어 막대한 비용과 개발 기간을 대폭 감소시킬 것으로 예상되고 있다.
제약사 등의 공급사슬이 자동차 부문과 같은 제조 및 배송 시스템으로 혁신이 이루어지고, 공급측면의 블록버스터 판매 모델이 사라지고 수요측면에서 소비자 중심의 혁신이 이루어 질 것으로 예상된다. 한편, 의약도매상이 사라지고 직접 제조업체에서 소비자에게 배달되는 배송 시스템의 혁신이 이루어 질 것이며, 혁신적인 신약이나 백신 등 삶의 질을 높이고 예방할 수 있는 신약들에 대해서는 특허기간을 현재보다 더 길게 하여 제조회사들을 보호하고, 모방의약(me-too medicine)이나 개량 신약들에 대해서는 특허기간을 축소하여 생명공학 및 제약사들의 혁신 신약 연구개발을 촉진하는 방향으로 전개될 것으로 예상된다.

가. 바이오산업의 미래
2005년 Ernst & Young 보고서에 따르면 바이오산업 시장의 미래 전망은 다음과 같다.
첫째, 지역의 경계가 없이 전 세계 국가들을 상대로 각국의 강점을 활용한 바이오산업의 성장이다. 중국과 인도가 다국적 제약사들의 임상 시험 무대로 적극 활용되기 시작하는 것이 그 예이다. 또한 국가간 전략적 제휴 및 인수 합병의 경우, 2003년 대비 2005년에는 14% 증가한 480건에 이르고 있다.
둘째, 혁신적인 생명공학의 기술 개발 및 응용을 통한 산업의 변화이다. 구조 기반 신약 발굴 기술(Structure-Based Drug Discovery)과 고속 약물 탐색 기술(High Throughput Screening)은 개발 기간의 단축 및 부작용이 적고, 약효가 뛰어난 신약 발굴의 효율성을 크게 증가시켰으며, 기능 유전체학 및 화학 유전체학 기술들은 신약 연구 개발에 혁신을 일으키고 있다. 또한, 생명공학의 혁신적인 신기술들은 유전적으로 변형된 효소 개발을 활용한 기존의 전통적인 화학공업의 제조 공정상의 혁신을 불러일으키고 있듯이 타 여러 기존산업들의 발전에도 큰 영향을 미치고 있다.
셋째, 신기술을 적용한 제품의 출시로 제품의 한계를 극복하는 경우이다. 맞춤형 의약품의 개발은 의료 산업에 매우 큰 영향을 미치고 있다. 그 예로 특정한 표적 단백질을 목표로 한 백혈병 치료제 글리벡의 경우, 맞춤형 치료제의 대표적인 약물로 현재 백혈병 치료제 시장(2006년 약 20억 달러 매출)에서 확고한 위치를 확보하고 있다. 이와 더불어 인간화 항체기술을 활용한 표적 치료제 개발로 부작용이 적은 새로운 항암치료제들의 맞춤의약 개발이 활발하게 전개되고 있다.
전 세계적으로 보았을 때 바이오신약, 바이오장기, 바이오칩을 포함하는 세계 바이오산업은 연평균 10%대의 성장률을 보이면서 빠르게 성장하고 있다. 공개시장에 상장된 기업을 기준으로 했을 때 미국은 2005년 전 세계 총 수입의 77%, 고용 인력의 75%를 차지하고 있다. 2006년에 발표된 Ernst & Young 보고서에 의하면, 2005년 상장기업 기준 세계 바이오산업 규모를 6,000억 달러라고 했을 때 76%를 미국이 차지하고 있으며, 유럽이 16%, 캐나다가 4%, 아시아/태평양 국가가 5%를 차지하고 있다.

출처:Ernst & Young社, Global Biotechnology Reports 2006
|
그림 1-2-2-1 |
생명공학 분야 상장기업 기준 주요국 매출 비중
바이오신약 분야의 주요 제품은 분자 수준의 질병 예방, 진단, 치료, 기능 향상에 활용되는 저분자 의약품, 단백질, 유전자 및 세포 치료제 등이다. 바이오신약이 활용되는 세계 보건의료 서비스 시장은 연평균 8% 수준에서 지속적으로 성장하는 추세이며 2010년에는 9,000억 달러 이상 규모까지 성장할 것으로 추산하고 있다.
전 세계 의약품 시장은 연평균 13% 이상의 고성장 추세를 보이고 있으며 Amgen, Genentech, Gilead, Biogen-IDEC 등 바이오 전문 기업 및 다국적 제약기업들이 시장을 선도하고 있다.
바이오산업이 성장함에 따라 그 기술적 경제적 기여도는 보건의료 분야에서 가장 뚜렷하게 나타나고 있다. 생명공학 기술의 발전은 보건의료 환경을 총체적으로 혁신시키고 있으며 제약 및 의료기기 산업 등 의료산업 내부의 공급 산업과 의료산업 내 수요산업인 의료 서비스 산업간 연계성이 크게 강화되고 있다.
현재 우리나라 바이오산업의 기술 경쟁력은 선진국 대비 70% 수준이지만 2020년 경에는 현재 가장 앞선 미국과 유사한 수준에 이를 것으로 예상되고 있다. 세부 분야별로는 바이오신약 분야 68%, 바이오장기 75%, 바이오칩 79% 정도로 평가되었다.
국내 바이오신약, 바이오장기, 바이오칩 산업은 향후 2020년까지 생산 기준 연평균 성장률 19%로 성장할 것으로 전망되어 세계시장 성장률 13%를 크게 상회할 것으로 예상되고 있다. 향후 유망 바이오산업이 본격적으로 산업화되는 시기는 선진국의 경우 2015년 직전인 데 반해 우리나라는 2015년 이후로 전망되고 있다.
나. 바이오산업의 발전 방향
전 세계적인 경향으로 보았을 때 바이오산업은 역량을 갖춘 다양한 혁신 주체간 네트워킹이 경쟁력의 관건인 반면 우리나라는 개별 혁신 주체의 역량뿐 아니라 네트워킹이 상대적으로 매우 취약하다. 특히 R&D 결과를 산업화로 연계하는 전임상 및 임상 단계에서 임상시험 후반기를 담당할 기업의 역량이 전무한 편이다. 따라서 바이오산업을 성공적으로 발전시키기 위해서는 글로벌 네트워킹을 통하여 혁신체계의 취약성을 극복할 필요가 있고, 바이오산업의 첨단기술 및 연구개발 성과들을 성공적으로 상업화하기 위해서는 전임상 및 임상단계의 국제 규격에 따른 안정성 및 신뢰성 확보가 무엇보다 중요하며, 이를 위한 전략적 연계‧협력‧제휴도 필요하다. 그리고 세계 수준의 원천‧핵심‧선도형 기술을 개발하여 고부가가치 지적 재산권을 확보하고 가치사슬 단계별 기술이전 등을 활성화하여 고부가가치를 창출해야 한다.
국가 연구개발 사업에서 실질적인 국제 공동연구가 활성화 되어야 하며 혁신적인 성과 확산을 위해 연구개발 과제 초기 단계부터의 기업 참여 방안 등이 마련되어야 한다. 우리나라는 현재 대규모의 국가 연구개발 사업단 중심으로 R&D를 추진하고 있는데, 이와 함께 글로벌 R&D 네트워킹을 통한 세계적인 경쟁력 제고가 필요하다.
2000년대 들어서면서 완료된 여러 생물종에 대한 유전체 프로젝트의 성과로 인해 인간 유전체 정보에 기반을 둔 새로운 패러다임의 신약‧장기‧칩 개발 연구가 활성화 되면서 벤처기업과 제약회사, 병원간의 R&D 연계‧협력이 글로벌 수준에서 추진되고 있다. 이는 세계적인 현상인데, 대형 제약사들의 신약 개발 생산성 저하 및 바이오벤처사들의 효율성 향상으로 점차 바이오텍-제약기업 또는 바이오텍-바이오텍 기업 간의 인수합병(M&A) 및 전략적 제휴가 증가되고 있다.
|
표 1-2-2-1 |
바이오산업체(제약, 바이오텍) 내 전략적 제휴 체결 현황
|
연 도 |
체결 건수 |
|
1995 ∼ 1996 |
577 |
|
1997 ∼ 1998 |
645 |
|
1999 ∼ 2000 |
631 |
|
2001 ∼ 2002 |
641 |
|
2003 ∼ 2004 |
813 |
출처 : Recombinent Capital
|
표 1-2-2-2 |
생명공학 기업간 주요 기술 이전/전략적 제휴
(단위 : 백만 달러)
|
기술이전자 |
기술도입자 |
이전기술 |
개발단계 |
기술이전료 |
Upfront (지분투자) |
|
Tularik |
Amgen |
항암제 |
발굴단계 |
|
75 |
|
Array |
AstraZeneca |
항암제 |
전임상 |
95 |
10 |
|
(주) 태평양 |
Schwarz |
진통제 |
전임상 |
107.5* |
3.25* |
|
Antisoma |
Roche |
항암제 |
임상1상 |
500 |
6.56 |
|
Medivir |
GSK |
감염증 |
임상1상 |
99.5 |
6.9 |
|
Zealand Pharma |
Aventis |
당뇨병치료제 |
임상1상 |
110 |
10 |
|
Biovitrum |
Amgen |
비만 |
임상2상 |
521 |
86.5 |
|
Medivir |
Boehringer Ingelheim |
AIDS 치료제 |
임상2상 |
n/a |
122* |
|
BMS |
Merck |
고지혈증 치료제 |
임상2상 |
375 |
100** |
|
ImClone |
BMS |
항암제 |
임상3상 |
2,000 |
1,000 |
|
Eyetech |
Pfizer |
안과질환 치료제 |
임상3상 |
1,340 |
75 |
|
Neurocrine |
Pfizer |
불면증 치료제 |
임상3상 |
400 |
100 |
* 유로(euro) 화
** 2년간 연구지원금 14백만 달러 포함
출처 : Pharma Licensing Data, 2006(크리스탈지노믹스(주) 재작성)
다. 우리나라 바이오산업의 발전 가능성
전 세계 바이오산업은 미국이 주도하고 있으며, 아시아에서는 한국을 비롯해 인도와 중국, 일본, 싱가포르 등이 바이오산업 발전에 국가적 역량을 모으고 있다. Ernst & Young 2005년 보고서는 한국, 싱가포르, 스웨덴 등 국가 전략 산업으로 선정하여 장기적인 안목에서 집중투자하고 있고, 우수한 연구 인력과 저렴한 연구개발 비용으로 서방 선진국들을 앞서나갈 것이라고 예상했다.
의약품산업의 경우, 한국은 미국 FDA 승인을 받은 10번째 국가라는 저력이 있으며, 지적 재산권에서는 세계 4대 특허국가로 인정받고 있다. 특히 과학기술 분야 중 생명공학 분야에서 세계 최고의 학술지에 가장 많은 연구 성과를 게재하고 있으며, 우수한 연구 인력의 증가와 함께 첨단 기술들을 확보하고 있는 중이다. 그 바탕은 우수한 생명공학 인력, 특히 분자생물학, 구조생물학, 독성학, 약학, 의약화학 및 의학 등의 여러 분야에서의 우수한 선진국 경험 인력과 국가 주도의 적극적이고 전략적인 집중투자의 성과라고 할 수 있다.
이러한 훌륭한 기초과학의 성과를 잘 활용하여 어느 산업보다도 부가가치가 가장 높은 신약 분야에 장기 집중투자를 할 경우, 21세기 한국 바이오산업은 반도체 및 정보기술(IT) 산업을 잇는 새로운 성장 동력으로 도약할 수 있을 것이다.


생명공학은 21세기 생명 중심 사회를 견인하는 핵심기술로서 급속한 고령화에 따른 질병 발생의 예방 및 관리를 통한 국민의 건강 및 복지향상, 환경과 에너지 문제 등의 해결을 통한 지속가능한 경제 성장 유도, 고품질 및 안전한 식품 공급을 통한 식량문제의 해결, 바이오테러 대응을 통한 국민의 안전 확보 등 직접적인 경제적 효과의 창출은 물론 사회‧문화 전반에 대한 비경제적 효과도 크게 창출될 것으로 전망된다.
생명공학 기술을 바탕으로 세계경제는 2020년을 전후하여 바이오 경제로 진입할 것으로 전망되고 있다8). 바이오 경제란 “생명공학 발전으로 신제품의 보급이나 서비스의 향상을 통하여 인류에 편익을 가져다주는 다양한 경제활동을 포괄하는 개념”(OECD, 2006)을 의미한다.

출처 : Davis et al., Harvard Univ.
|
그림 1-3-1-1 |
바이오 경제로의 변화
이처럼 바이오 경제를 향한 생명공학 분야의 과학‧기술 발전 추세는 아래와 같은 몇 가지 경향을 보이고 있다.
첫째, 기능유전체학(Functional Genomics), 단백질체학(Proteomics) 등 Post-genome 신기술이 국가 생명공학 경쟁력의 관건으로 등장하는 등 신개념의 과학‧기술이 출현하고 있으며 새로운 응용 분야로의 확대‧발전이 진전되고 있다.
둘째, IT, NT 등의 첨단기술과 융합하여 신기술을 창출하고 있는데 이러한 융합화는 신기술 창출만이 아니라 기술혁신의 가속화도 함께 유도하며, 그와 관련된 사회 구조 및 생활상의 변화도 예상되고 있다. 구체적으로 생물정보학, 유전자분석 S/W‧기기 등은 BT+IT(BIT)의 예가 되며, 바이오칩(DNA칩, 단백질칩), 나노바이오텍 등은 BT+NT(BNT)의 좋은 예이다.
셋째, SNP, Pharmacogenomics, 세포치료 기술 등의 발전으로 예방의학‧맞춤의약‧재생의학 등 다양한 새로운 의약학적 분야가 출현하고 있으며, 구조생물학‧화학유전체학을 활용한 의약품 개발연구가 확대되는 등 생명현상에 대한 총체적 연구(Gene to Life)와 맞춤형 의약개발이 활성화되고 있다.
넷째, 인간 유전체 프로젝트(HGP), 인간프로테옴연구(HUPO), 침팬지유전체국제컨소시엄(HCCGP), 벼유전체해독국제공동연구(IRGSP), 휴먼프론티어사이언스프로그램(HFSP) 등 광범위한 연구자와 연구기관이 유기적으로 결합된 대규모 국제협력 프로그램이 등장하면서 국경을 초월한 전략적 협력이 강화되고 있다.
다섯째, 생명공학 기술의 산업화 진전에 따라 유용 유전자 정보 선점이 응용 연구개발과 산업화의 주도권 확보에 중요하다는 인식이 확산되면서 세계 각국은 생물다양성협약(CBD), 생물다양성정보기구(GBIF), OECD 생물자원센터 네트워크 등 국제협약을 통해 생물자원의 전략화가 강조되는 등 바이오산업 성장 동력의 필수소재로써 국가간 생물자원 활용 및 확보 방안이 강화되고 있다.
생명공학기술에 기초하는 바이오산업은 고부가가치를 창출할 수 있는 대표적인 지식기반산업으로 IT의 뒤를 잇는 차세대 성장 동력 산업의 하나로 주목받고 있다.
이는 생명공학기술이 정보통신기술(IT)이나 나노기술(NT) 등 첨단신기술과 더불어 미래 생활에 폭넓고 다양하게 기여할 것으로 예상되기 때문이다. 즉, 맞춤의학 등의 발전으로 질병의 예방, 조기진단 및 치료 등이 가능해 질 수 있음은 물론, 식량‧환경‧에너지 등 인류가 직면하고 있는 각종 문제점도 해결할 수 있는 21세기형 산업이라고 할 수 있다.

출처 : 미래전략산업 육성을 위한 차세대 기술혁신 방식 분석 및 제언, STEPI, 2005
|
그림 1-3-1-2 |
생명공학 분야 기술 수명 주기
이러한 바이오산업의 5대 특성에 대해 산업자원부는「2015년 바이오산업 미래비전과 발전전략」에서 ‘장기간의 초기 R&D 투자가 필요(Long-Term Investment)’, ‘개발과정에 엄격한 규제가 적용(Strict Regulation)’, ‘투자의 성공확률은 낮으나 성공시 고수익률(High-risk, High-return)’, ‘산업적 도약을 위해 원천기술 기반이 필요(Dependent on Basic Technology)’, ‘세계시장에서 규모의 경제발생(Scale Economy in a Global Way)’을 제시하였다.
세계 바이오산업은 ‘학문적(생명공학)‧기술적(생명공학)’ 성과의 축적으로 ‘산업적’ 응용이 확대되면서 IT 혁명 이후 세계 경제를 선도할 핵심전략산업으로 급부상되고 있다.
실제 경제지표를 보더라도 1990년대 이후 연 11% 이상 급성장세를 유지하고 있으며, 인구의 고령화, 생명공학 기술의 혁신적 발전 등으로 거대시장의 도래가 가시화(2015년 세계 바이오시장 규모는 3,090억 달러)9)되어 바이오산업의 패권 장악을 위한 선진 각국의 경쟁이 격화되고 있다.
또한, 바이오산업의 세부 분야별 발전 전망은 생명공학 제1의 물결인 의약 분야에서 제2‧3의 물결인 농업, 환경, 전자, 에너지, 해양 등 전 분야에 확산될 것으로 예측되고 있다.

경제학자 지식단체(Economist Intelligence Unit)의 협력으로 발간한 델로이트 백서(Deloitte White Paper, 2006. 11)에서는 바이오산업(Life Science Industry)의 미래에 대해 언급하고 있다.
세계 생명공학계의 중진 지도자들을 대상으로 온라인 설문조사, 원탁토론, 심층면접 등을 통해 작성된 보고서에는 연구개발의 필요성, 생명공학 산업의 경제적 제휴와 동맹, 적재적소에의 적임자 배치 등이 중요하다고 제시되고 있다
이러한 흐름은 우리나라의 정책추진방향에 있어서도 유사하게 나타나고 있다. 즉, 연구개발 분야와 관련해서는 주요 국가계획에서 생명공학을 국가 전략적 집중 분야로 지정하여 국가 발전전략의 핵심기술로써 생명공학 육성 강화를 전면에 부각시키고 있다.
또한 산업화와 관련해서는 2000년을 전후하여 벤처가 바이오산업 구조의 한축을 형성하면서 사회 전체적으로 생명공학에 대한 관심이 확대되었고 개별 부처차원의 응용영역별 육성계획 수립이 활성화되었는데, 2004년 과학기술혁신본부 출범 이후에는 범부처 차원의 종합조정 노력이 더욱 가속화되어 효율성이 제고되고 있는 상황이다.
실제로 2007년 2월에 발표된 국가 R&D 사업 Total Roadmap에서는 우리나라의 과학기술에 대하여, 적극적인 투자와 혁신으로 과학기술 경쟁력이 지속적으로 상승하고 있으나, 원천기술 부족 등 과학기술 혁신역량은 여전히 선진국에 비해 취약하다고 지적하였다.
이를 해결하기 위한 방안으로 대내외 여건과 현 단계의 역량을 분석‧점검하여 국가 과학기술 혁신역량 제고를 위한 국가 R&D 사업의 특성화‧효율화 방향을 제시하였는데, 생명공학은 분야별 투자전략 및 국가 중점 육성기술에 정보‧전자와 더불어 가장 핵심적인 분야로서 포함되었다.
|
표 1-3-2-1 |
생명 분야 특성화기술
|
기술명 |
기술적 실현시기(년) |
사회적 적용시기(년) |
정부‧민간 역할분담(민간의견) |
||
|
민간 연구주도 |
정부역할 조정 |
정부주도 선행연구 |
|||
|
줄기세포 응용기술 |
2017 |
2024 |
25% |
0% |
75% |
|
신약개발 전임상/임상기술 |
2011 |
2016 |
0% |
25% |
75% |
|
신약타겟 및 후보물질도출 기술 |
2011 |
2016 |
0% |
25% |
75% |
|
약물전달기술 |
2012 |
2015 |
0% |
25% |
75% |
|
암 조기진단 기술 |
2015 |
2021 |
0% |
0% |
100% |
|
인체 안전성‧위해성 평가기술 |
2011 |
2013 |
0% |
0% |
100% |
|
농수축산물 고부가가치화 가공 및 생산기술 |
2012 |
2015 |
25% |
25% |
50% |
출처 : 국가 R&D 사업 Total Roadmap, 과학기술부 / 과학기술혁신본부 / KISTEP, 2007.02

출처 : 국가 R&D 사업 Total Roadmap, 과학기술부 / 과학기술혁신본부 / KISTEP, 2007.02
|
그림 1-3-2-1 |
생명 분야 국가중점육성기술
이러한 장기적인 국가차원의 노력은 2016년까지 세계 7위의 생명공학 강국 진입을 목표로 생명공학의 새로운 비전과 대응전략을 제시한 제2차 생명공학육성기본계획(Bio-Vision 2016)에도 잘 나타나고 있다.
제2차 생명공학육성기본계획(Bio-Vision 2016)의 중점추진방향은 제1차 생명공학육성기본계획(Biotech 2000)으로 확보된 “연구기반”을 바탕으로 “세계적 원천기술을 확보”하고 “산업화를 위한 핵심인프라를 강화”한다는 것이다

출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006(생명공학정책연구센터 재가공)
|
그림 1-3-2-2 |
생명공학 정책변화와 과학기술혁신본부의 역할
그렇다면, 상기와 같은 기본계획과 중점추진방향을 기초로 우리가 추진하여야 할 구체적인 대응전략에는 어떠한 것들이 제시될 수 있는가?10)
첫째, 글로벌 연계‧협력‧제휴의 활성화 전략이 필요하다. 유망 바이오산업의 세부 분야들은 R&D성과를 상업화하고 시장에 진출하기까지 다양한 혁신 주체들의 역량과 막대한 자금의 장기적인 투자를 필요로 하므로 글로벌 차원의 연계‧협력‧제휴를 통해 임계 규모이상의 투자와 시장을 확보해야만 한다. 이를 위해서는 유망 바이오산업 세부 분야별로 우리나라의 경쟁력 확충에 필요한 주요 제휴대상 업체를 중심으로 협력을 추진해야 하며 기업의 수요 및 제품특성에 따라 다각적으로 접근할 필요가 강조된다.
둘째, 원천기술 및 핵심기술 확보를 위한 R&D 추진이 요구된다. 세계수준의 원천‧핵심‧선도형 기술을 개발하여 지식재산권을 확보하고 가치사슬 단계별 기술이전 등을 활성화함으로써 고부가가치를 창출하기 위해서는 국가 연구개발 사업에서 실질적인 국제공동연구가 활성화될 수 있도록 정책이 지원되어야 한다. 또한 혁신적인 성과의 확산을 위해서는 연구개발 과제 초기 단계부터의 기업 참여 방안이 마련됨과 동시에 연구개발 성과의 지식재산권 관리 방안이 관련 규제 및 규정 개선 등을 통해 마련되어야 한다.
셋째, 세계시장에서의 선도적 위치 선점을 위한 산업화가 촉진되어야 한다. 세계적 수준의 전임상‧임상‧생산시설 등 실용화 인프라 확보 및 안정적 산업발전 구조를 구축함으로써 글로벌 경쟁‧협력 환경을 조성해야 한다. 이를 위해서는 유망 바이오산업관련 전임상 및 임상단계 인프라 경쟁력을 우선적으로 강화하고 전임상 및 임상초기단계의 연구개발에 대한 소프트웨어적 지원도 확대해야 한다. 또한 세계시장 대상의 제품 출시 및 글로벌 마케팅 지원 시스템을 구축하고 기업간 인수‧합병을 통해 규모의 경제를 구현함으로써 글로벌 시장 진출을 위한 총체적 경쟁력 확보 및 시장실패 위험 부담을 최소화해야 한다.
결론적으로 바이오산업은 21세기 이후 기술적, 산업적 파급효과를 가장 크게 나타낼 것으로 주목받고 있는 고부가가치 산업으로써, 경제적 효과와 함께 사회‧문화에 대한 비경제적 효과 역시 매우 클 것으로 전망되고 있다. 때문에 국가정책적인 관점에서 보면, 건강과 삶의 질, 식량, 환경, 에너지 등 가장 중요한 당면과제들을 해결해야 하고 경제적․비경제적 효과를 긍정적인 방향으로 극대화할 수 있도록 첨단 바이오산업 발전의 촉진 필요성을 매우 강조하여야 한다.



2007년도 미국 연방정부의 생명과학 R&D 예산은 약 307억 달러이다. 미국 과학재단(NSF)의 자료에 따르면 2007년도 R&D 예산으로 보건 분야는 290억 달러, 농업 분야는 17억 달러가 책정되었다[표 2-1-1-1]. 보건 분야는 전체 R&D의 21.2%로 비국방 R&D의 절반을 차지하고 있으며, 농업 분야의 투자는 상대적으로 미미하다. 지난 1990년대 후반부터 2000년대 초반까지 미국의 보건 R&D는 국립보건원(NIH) 예산의 증액을 통해 가파르게 성장했으나 최근에는 정체되어 있다.11)
과학 및 공학 분야별 예산을 집계한 NSF의 다른 자료에 의하면 2006년도 생명과학 분야 연구(research) 예산은 282억 달러이고[표 2-1-1-2], 같은 해 NIH의 예산은 278억 달러이다.12) 2004년도 생명과학 분야 연구 예산의 부처별 분포를 보면 NIH가 대부분을 차지하고 있음을 알 수 있다[표 2-1-1-3]. 이러한 수치들은 미국 연방정부의 생명과학 R&D가 대부분 NIH를 통해 보건 분야 연구에 투자되고 있음을 의미한다.
|
표 2-1-1-1 |
미국 연방정부의 기능별 연구개발 예산(2005~2007)
(단위 : 백만 달러)
|
2007년 순위/기능 |
2005년 actual |
2006년 preliminary |
2007년 proposed |
2007년 비중(%) |
|
총액 |
131,259 |
135,205 |
136,850 |
100.0 |
|
1 National defence |
74,641 |
77,630 |
78,388 |
57.3 |
|
2 Health |
29,129 |
29,088 |
29,025 |
21.2 |
|
3 Space research and technology |
9,656 |
10,411 |
11,478 |
8.4 |
|
4 General Science and basic research |
7,477 |
7,495 |
8,321 |
6.1 |
|
5 Natural resources and environment |
2,245 |
2,202 |
2,043 |
1.5 |
|
6 Agriculture |
2,094 |
2,128 |
1,711 |
1.3 |
|
7 Transportation |
1,866 |
1,741 |
1,507 |
1.1 |
|
8 Energy |
1,324 |
1,419 |
1,363 |
1.0 |
|
9 Administration of justice |
779 |
1,011 |
895 |
0.7 |
|
10 Veterans benefits and services |
742 |
765 |
765 |
0.6 |
|
11 Education, training, employment and social services |
495 |
522 |
519 |
0.4 |
|
12 Commerce and housing credit |
475 |
457 |
486 |
0.4 |
|
13 International affairs |
255 |
255 |
255 |
0.2 |
|
14 Community and regional development |
45 |
55 |
68 |
|
|
15 Income security |
35 |
27 |
27 |
|
주 : 연구(research), 개발(development), 연구개발 설비(R&D plant) 예산까지 모두 포함한 전체 연구개발 예산이며, 법에 의해 정부의 지출의무(obligation)를 부담할 수 있도록 승인된 수권예산(budget authority) 기준임
출처 : Federal Research and Development Funding by Budget Function: Fiscal Years 2005~07, p.68 (Table 1, 3), NSF(2006.12)
|
표 2-1-1-2 |
미국 연방정부의 분야별 Research 예산(2004~2006)
(단위: 백만 달러)
|
분 야 |
2004 |
2005 |
2006 |
|
계 |
53,358 |
55,546 |
54,979 |
|
Life sciences |
27,728 |
28,543 |
28,207 |
|
Biological (excluding environmental) |
13,092 |
NA |
NA |
|
Environmental biology |
670 |
NA |
NA |
|
Agricultural |
1,087 |
NA |
NA |
|
Medical |
10,899 |
NA |
NA |
|
그 외 생명과학 |
1,981 |
NA |
NA |
|
Psychology |
1,855 |
1,916 |
1,934 |
|
Physical sciences |
5,211 |
5,473 |
5,394 |
|
Environmental sciences |
3,742 |
3,876 |
3,754 |
|
Mathematics & computer sciences |
2,949 |
3,115 |
3,081 |
|
Engineering |
8,866 |
9,481 |
9,397 |
|
Social sciences |
1,090 |
1,131 |
1,178 |
|
그 외 과학 |
1,916 |
2,010 |
2,034 |
주 : 1. 연방정부의 지출 의무액(obligations) 기준이며, 2004년은 확정액, 2005~2006년은 잠정액.
NA=Not Available.
2. NSF의 통계는 전체 연구개발 예산을 research, development, R&D plant로 구분한다. 분야별 분포는 이 중 research 예산에 대해서만 집계되는데, 생명과학 분야는 development와 R&D plant 부문의 예산이 미미하기 때문에 research 투자액이 전체 투자액과 비슷하다.
출처 : Federal Funds for Research and Development: Fiscal Years 2004~2006, p.59 (Table 19), NSF(2007.6)
|
표 2-1-1-3 |
미국 연방정부의 부처별 생명과학 Research 예산(2004)
(단위: 백만 달러)
|
부처/기관 |
계 |
농업 |
생물학 |
환경생물학 |
의료 |
기타 |
|
계 |
27,728 |
1,087 |
13,091 |
670 |
10,899 |
1,981 |
|
농림부 |
1,577 |
987 |
227 |
332 |
32 |
0 |
|
상무부 |
90 |
17 |
34 |
26 |
4 |
9 |
|
국방부 |
766 |
2 |
277 |
26 |
349 |
112 |
|
교육부 |
19 |
0 |
0 |
0 |
0 |
19 |
|
에너지부 |
417 |
0 |
238 |
0 |
173 |
6 |
|
보건복지부 |
22,919 |
0 |
11,340 |
4 |
9,871 |
1,704 |
|
NIH |
21,997 |
0 |
11,208 |
0 |
9,168 |
1,621 |
|
국토안보부 |
160 |
7 |
147 |
2 |
3 |
1 |
|
내무부 |
175 |
0 |
90 |
85 |
0 |
0 |
|
법무부 |
0 |
0 |
0 |
0 |
0 |
0 |
|
교통부 |
7 |
0 |
0 |
0 |
6 |
1 |
|
보훈부 |
342 |
0 |
0 |
0 |
342 |
0 |
|
국제개발협력처 |
173 |
72 |
0 |
0 |
0 |
101 |
|
환경보호처 |
212 |
0 |
147 |
59 |
0 |
5 |
|
항공우주국 |
273 |
1 |
119 |
10 |
118 |
24 |
|
과학재단 |
556 |
0 |
452 |
104 |
0 |
0 |
|
스미소니언(연) |
43 |
0 |
21 |
22 |
0 |
0 |
주 : NIH의 2004년 예산은 26,890백만 달러이며, 그 중 이 표에서 제시된 21,997백만 달러 이외의 금액은 생명과학 이외의 분야에 투자된 것임
출처 : Federal Funds for Research and Development: Fiscal Years 2004~2006, p.74~75(Table 24), NSF (2007.6)
미국에서는 연방정부 외에 민간부문에서도 생명과학에 많은 투자를 하고 있는데, 민간부문의 대표적인 R&D 투자 주체는 제약회사와 바이오텍 벤처들이다. 미국의 거대 제약회사들의 협회인 PhRMA 자료에 따르면 미국 제약회사들은 2006년에 총 429억 달러를 R&D에 투자하였다[표 2-1-1-4]. 또한 Ernst & Young의 집계에 따르면 미국의 바이오텍 벤처들은 2005년에 198억 달러를 R&D에 투자하였다[표 2-1-1-5]. 이상 미국 연방정부, 제약회사, 바이오텍 벤처들의 2006년도 R&D 투자를 모두 합하면 940억 달러에 육박한다. 여기에 각 주정부의 R&D 예산과 LMO 관련 농산물 기업들의 R&D를 포함하면 미국 전체의 생명과학 R&D는 1천억 달러를 크게 상회할 것으로 추정된다.
|
표 2-1-1-4 |
미국 제약회사들의 R&D 투자(2001~2006)
(단위: 백만 달러)
|
연도 |
국내 R&D |
해외 R&D |
총 R&D |
증가율(%) |
|
2006 |
33,967 |
9,005 |
42,973 |
7.8 |
|
2005 |
30,969 |
8,888 |
39,857 |
7.7 |
|
2004 |
29,555 |
7,462 |
37,018 |
7.4 |
|
2003 |
27.064 |
7,388 |
34,453 |
11.1 |
|
2002 |
25,655 |
5,357 |
31,012 |
4.2 |
|
2001 |
23,502 |
6,220 |
29,772 |
14.4 |
출처 : Pharmaceutical Research and Manufacturers of America(PhRMA), 2007, Pharmaceutical Industry Profile 2007, p.42.(www.phrma.org)
|
표 2-1-1-5 |
미국 바이오텍 벤처기업의 재무 지표(2001~2005)
(단위 : 억 달러)
|
연도 |
매출 |
수익 |
R&D 지출 |
순손실 |
공개기업 수 |
기업 수 |
|
2005 |
321 |
507 |
198 |
41 |
329 |
1,415 |
|
2004 |
281 |
438 |
196 |
68 |
331 |
1,346 |
|
2003 |
284 |
392 |
179 |
54 |
314 |
1,473 |
|
2002 |
243 |
296 |
205 |
94 |
318 |
1,466 |
|
2001 |
214 |
296 |
157 |
46 |
342 |
1,457 |
출처 : Ernst & Young, Annual Biotechnology Industry Reports 2002~2006. Biotechnology Industry Organization, 2007, Guide to Biotechnology 2007, p.3에서 재인용

미국 연방정부의 생명과학 투자는 대부분 NIH를 통해 집행되므로, NIH의 투자 방향과 정책적 지향점이 곧 미국 연방정부의 생명과학 투자 방향을 결정한다고 볼 수 있다. NIH는 예산의 15% 정도만 내부에서 사용하고(내부연구, 운영, 연구관리 등) 나머지는 대학 등 외부 기관에 연구비로 지원함으로써 사실상 미국 전역의 생명과학 연구를 주도하고 있다. 따라서 NIH의 투자 동향을 통해 미국 생명과학 연구의 방향을 가늠해볼 수 있다.
가. NIH의 질환별/주제별 투자 포트폴리오
NIH는 독립적인 27개의 질환별 센터 및 연구소를 통해 내부연구와 외부연구 지원 기능을 수행하는 다원적 조직 구조를 가지고 있기 때문에 NIH의 전체적인 투자 방향을 간단한 분석으로 요약하기는 어렵다. 대신 NIH 전체의 질환별, 주제별 투자 포트폴리오를 통해 NIH의 중점적인 투자 방향을 살펴볼 수 있다.
NIH 연구비의 질환별 상대적 분포를 보면 감염 질환이 10.5%로 가장 높고, 신경 9.7%, 암 6.3%, 순환기 4.6%, 태아/소아 3.4%, 산부인과 3.4%, 외상/중독 3.0%, 정신 2.4%, 내분비/대사 2.3%, 소화기 2.1% 순으로 나타났다[표 2-1-1-6]. 질환별 포트폴리오에서 발견되는 특징은 감염 질환이 가장 큰 비중을 차지하고, 암보다도 신경계 연구가 많다는 것이다.13)
감염 질환 연구 중에서는 AIDS와 신종 감염 질환에 대한 연구가 높은 비중을 차지하고 있어서 미국적 상황을 반영한다고 볼 수 있다. 신경계 연구는 신경과학과 뇌연구가 대부분을 차지하고 있다. 암 연구에서는 유방암, 전립선암, 직장암, 폐암에 대한 연구가 높게 나타나서 간암과 위암 중심의 우리나라와 확연한 차이를 보인다.
|
표 2-1-1-6 |
미국 NIH의 질환별 연구비 현황
(단위: 백만 달러)
|
코드 |
질환 |
FY 2004 Actual |
FY 2005 Actual |
FY 2006 Actual |
FY 2007 Estimate |
FY 2008 Estimate |
합계 |
평균 비중 |
|
1 |
감염 |
13,863 |
13,836 |
13,792 |
13,716 |
13,702 |
68,909 |
10.8% |
|
2 |
암 |
7,914 |
8,036 |
7,927 |
7,905 |
7,877 |
39,659 |
6.2% |
|
3 |
혈액/면역 |
1,268 |
1,255 |
1,247 |
1,242 |
1,242 |
6,254 |
1.0% |
|
4 |
내분비/대사 |
2,815 |
2,951 |
2,942 |
2,936 |
2,922 |
14,566 |
2.3% |
|
5 |
정신 |
3,057 |
3,131 |
3,122 |
3,112 |
3,106 |
15,528 |
2.4% |
|
6 |
신경 |
12,347 |
12,424 |
12,290 |
12,243 |
12,214 |
61,519 |
9.6% |
|
7 |
눈 |
752 |
773 |
765 |
762 |
762 |
3,814 |
0.6% |
|
8 |
귀 |
16 |
15 |
17 |
16 |
16 |
80 |
0.0% |
|
9 |
심혈관 |
5,903 |
5,852 |
5,908 |
5,906 |
5,899 |
29,468 |
4.6% |
|
10 |
호흡기 |
1,992 |
2,108 |
2,126 |
2,156 |
2,175 |
10,557 |
1.6% |
|
11 |
소화기 |
2,571 |
2,690 |
2,700 |
2,692 |
2,683 |
13,336 |
2.1% |
|
12 |
피부 |
6 |
6 |
8 |
7 |
7 |
34 |
0.0% |
|
13 |
근골격 |
1,310 |
1,306 |
1,289 |
1,285 |
1,278 |
6,468 |
1.0% |
|
14 |
비뇨기 |
1,056 |
1,083 |
1,051 |
1,042 |
1,040 |
5,272 |
0.8% |
|
15 |
산부인과 |
4,269 |
4,326 |
4,243 |
4,230 |
4,229 |
21,297 |
3.3% |
|
16 |
태아/소아 |
4,368 |
4,430 |
4,321 |
4,309 |
4,285 |
21,713 |
3.4% |
|
17 |
선천기형 |
142 |
135 |
136 |
134 |
132 |
679 |
0.1% |
|
18 |
기타증상 |
2,657 |
2,736 |
2,748 |
2,736 |
2,724 |
13,601 |
2.1% |
|
19 |
외상/중독 |
3,851 |
3,931 |
3,868 |
3,851 |
3,842 |
19,343 |
3.0% |
|
20 |
사망외인 |
48 |
46 |
43 |
43 |
42 |
222 |
0.0% |
|
21 |
건강검진 등 |
401 |
422 |
417 |
417 |
417 |
2,074 |
0.3% |
|
N/A |
56,306 |
58,093 |
57,306 |
57,154 |
57,003 |
285,862 |
44.6% |
|
|
총합계 |
126,912 |
129,585 |
128,266 |
127,894 |
127,597 |
640,255 |
100.0% |
|
주 : 이 표는 NIH가 215개의 세부 질환 및 연구 분야별로 연구비를 집계한 자료를 토대로, 각 세부 질환들을 WHO 질환군에 따라 재분류하여 합계를 산출한 것임. NIH의 원 자료가 세부 질환 및 연구 분야별로 중복 집계되었기 때문에 이 표에서는 질환군 사이 뿐 아니라 한 질환군 내에서도 중복 집계가 있으며 그 때문에 총합계가 NIH 전체 예산을 크게 넘어섬. N/A는 특정 질환으로 분류하기 어려운 연구 영역들을 의미함
출처 : “Estimates of Funding for Various Diseases, Conditions, Research Areas”, NIH 홈페이지(www.nih.gov/ news/fundingresearchareas.htm)
특정 질환으로 분류되지 않는 주제별 연구가 전체 연구비의 44.5%를 차지하는 것으로 나타났다. 여기에 포함되는 분야들로는 생명과학(9,974), 임상연구(8,785), 예방(6,815), 유전학(4,878), 행동과학/사회과학(3,001), 임상시험(2,767), 보건 불평등(2,766), 소수자 보건(2,423), 생물방어(1,766), 생물공정(1,546), 줄기세포 연구(1,325), 희귀질환 의약품(1,255), 인간유전체(1,065), 기초 행동과학/사회과학(1,062), 보건 서비스(929), 진단 방사선(712), 재생의학(614), 이식(551), 흡연과 건강(517), 담배(515), 질병부담(508), 네트워크정보기술(423), 유전자치료제(388), 장기 이식(363), 재활의학(324), 식품 안전성(316), 보완대체의학(301), 농촌 보건(202), 나노기술(192), 보조공학(182), 비용 효과성 연구(143) 등이 있다(괄호 안의 숫자는 2006년 연구비, 단위 백만 달러). 이들 주제들을 보면 일반적인 생명과학이나 임상연구 외에도 생물방어, 줄기세포, 희귀질환 의약품, 재생의학, 유전자치료제, 보완대체의학 등 최근의 주요 이슈들이 고르게 분포되어 있음을 확인할 수 있다.
나. NIH Roadmap for Medical Research
NIH 예산은 연방정부의 보건 연구 강화 방침에 따라 1999년부터 2003년까지 5년 동안 두 배로 증액되었다. 연구비 규모가 크게 확대됨에 따라 NIH는 변화된 지식 기반과 연구 환경, 이해관계자들(국민, 정부, 과학자 등)의 요구를 반영하기 위해 연구 포트폴리오를 재점검할 필요에 직면하였다. 특히 인간유전체 연구를 비롯한 그동안의 많은 과학적 진보를 의학적 성과로 연결시키는 데 장애가 되는 과학적 문제들을 해결하기 위한 새로운 연구가 필요했다.
이러한 배경 속에서 2002년 5월, 15대 원장으로 임명된 Zerhouni 박사는 취임 직후 Roadmap 작업에 착수하였다. Roadmap의 목표는 NIH의 27개 센터 및 연구소들이 지닌 원래의 연구 방향과 사업들을 재조정하는 것은 아니었고, 개별 연구소 차원에서는 다루기 어렵지만 의학 연구의 결정적인 진보를 위해 전체 NIH 차원에서 협력하여 진행할 필요가 있는 연구 사업들을 도출하는 것이었다. 즉, Roadmap은 NIH의 센터 및 연구소들이 공동으로 참여하는 범NIH 차원의 신규 연구 사업이라고 할 수 있다. 미국을 대표하는 300여 명의 전문가들이 참여하여 1년 넘게 작업한 끝에 NIH는 2003년 중반에 3개 주제(theme), 9개 실행 그룹(implementation group), 28개 연구 사업(initiative)을 발표하였다[표 2-1-1-7]. Roadmap 연구 사업들은 2004 회계연도부터 지원되기 시작하였고 매년 수요조사를 통해 새로운 사업들이 추가되고 있다. 2008년도 예산 요구안에서 Roadmap 예산은 4억 8,600만 달러로 전체 NIH 예산의 1.7% 정도이며, 이 예산으로 200여 개의 연구과제가 지원되고 있다.
[표 2-1-1-7]에 있는 NIH Roadmap의 주요 내용을 보면 혁신적 신약 개발에 필요한 기초연구와 기초연구 결과를 임상에 적용하기 위한 임상연구를 강화하는 것에 주된 초점이 맞추어져 있음을 알 수 있다. 현재 미국을 비롯한 세계 제약 산업은 기하급수적으로 증가하는 연구개발 투자에도 불구하고 혁신적인 신약 개발 건수가 줄어드는 연구개발 생산성 저하의 문제를 심각하게 겪고 있다. 이러한 상황에서 NIH는 혁신적 신약 발굴을 지원하기 위해 새로운 약물표적(drug target)이나 선도물질(lead compound)의 발굴에 필요한 연구들을 Roadmap 내에 포함시켜서 추진하고 있다.
첫 번째 주제인 “New Pathways to Discovery”에 속한 연구 사업들이 모두 여기에 해당한다. 또한 임상연구 네트워크를 강화하고 임상연구 인력을 양성함으로써 기초연구 성과가 임상으로 연계되는 것을 지원하고 있다. 특히 중개연구(translational research) 지원 사업을 통해서는 민간 기업의 관심을 받지 못한 대학의 신약 후보물질들에 대해 전임상 테스트를 지원함으로써 임상 시험에 진입할 수 있도록 지원하는 RAID(Rapid Access to Interventional Development) 프로그램을 시행하고 있다.
|
표 2-1-1-7 |
NIH Roadmap의 주요 내용(2007년 기준)
|
Theme 1 : New Pathways to Discovery |
|
IG1 : Building Blocks, Biological Pathways, and Networks ○ National Technology Centers for Networks and Pathways ○ Metabolomics Technology Development ○ Standards for Proteomics and Metabolomics/ Assessment of Critical Reagents for Proteomics |
|
IG2 : Molecular Libraries and Imaging ○ Molecular Libraries Screening Center Network (MLSCN) ○ Cheminformatics ○ Technology Development ○ Development of High Specificity/High Sensitivity Probes to Improve Detection ○ Comprehensive Trans-NIH Imaging Probe Database ○ Core Synthesis Facility to Produce Imaging Probes |
|
IG3 : Structural Biology ○ Protein Production Facilities |
|
IG4 : Bioinformatics and Computational Biology ○ National Centers for Biomedical Computing |
|
IG5 : Nanomedicine ○ Planning for Nanomedicine Centers |
|
IG6 : Human Microbiome Project (2007년 신규) |
|
Theme 2 : Research Teams of the Future |
|
IG7 : High-Risk Research ○ NIH Director’s Pioneer Award ○ NIH Director’s New Innovator Award (2007년 신규) |
|
IG8 : Interdisciplinary Research ○ Interdisciplinary Research Centers ○ Interdisciplinary Research Training Initiative ○ Interdisciplinary Research in The Behavioral and Social Sciences ○ Removing Structural Barriers to Interdisciplinary Research ○ NIH Intramural Program as a Model for Interdisciplinary Research ○ Interagency Conference on the Interface of Life Sciences and Physical Sciences |
|
IG9 : Public-Private Partnerships ○ Designation of a Public-Private Sector Liaison ○ High-level Science-driven Partnership Meetings |
|
Theme 3 : Re-engineering the Clinical Research Enterprise |
|
IG10 : Clinical Research ○ Clinical Research Networks/NECTAR ○ Clinical Research Policy Analysis and Coordination ○ Clinical Research Workforce Training ○ Dynamic Assessment of Patient-Reported Chronic Disease Outcomes ○ Translational Research |
주 : IG=implementation group, ○=initiative
출처 : http://nihroadmap.nih.gov


1970년대 이후 분자생물학 등 생명공학기술의 근간을 이루는 기초연구가 빠르게 발전함에 따라, 이를 상업화로 연결시키려는 연구개발도 급증하기 시작했다. 일본의 경우, 미국이나 유럽에 비해 생명공학기술의 역사가 짧고, 특히 기초기술 분야에서는 크게 뒤쳐진 상태였지만, 최근 들어 생명공학기술에 대한 관심이 증폭되면서 국가 중점 산업 분야로의 성장을 도모하고 있다.
일본의 바이오산업 육성은 이 분야에 종사하는 기업의 수와 종업원을 늘리고, 기업의 규모를 확장시키는 전략으로부터 출발하고 있다. 그 일환으로 정부 차원의 연구비를 대폭 증액하는 한편, 연구소 신설 등 다양한 지원 대책을 마련하고 있다. 하지만 이런 국가적 투자가 가시적 성과로 나타나기까지는 많은 시간이 필요하므로 기술융합 등을 통해 단기적 효과를 유도하는 시책도 병용하고 있다.

생명공학 기술이 본격적으로 도입되던 1980년 일본 생명공학 관련시장의 규모는 약 2,000억엔 수준에 불과했다. 그러나 생명공학기술을 활용한 의약품 시장이 빠르게 성장하고, 연구관련 서비스를 수행하는 CRO(Contract Research Organization)의 시장이 꾸준히 확대되면서 2006년엔 시장규모가 거의 10배 가깝게 성장했다. 2006년도 일본 생명공학 관련시장을 분석해 보면, 의약품을 비롯한 생명공학제품의 시장이 1조 2,899억엔으로 약 70%의 비중을 차지하고 있고, 나머지가 바이오 관련제품 및 서비스 시장으로 5,566억엔이며, 전체 시장규모는 2005년도 시장 대비 약 3.4%가 증가한 약 1조 8,465억엔을 형성하고 있다. 특히 생명공학제품 중 유전자재조합 기술을 활용한 제품의 매출이 1조 1,538억엔으로 약 90%를 차지했다는 것은 이미 대부분의 전통적 생명공학기술이 현대 생명공학기술로 전환되었음을 의미하는 것이다[표 2-2-2-1].
|
표 2-2-2-1 |
2006년도 일본 바이오산업 총 시장규모
(단위 : 억엔)
|
구 분 |
내 용 |
시장규모 |
||
|
2005년 |
2006년 |
|||
|
바이오제품 |
유전자재조합제품 |
11,040 |
11,538 |
(+4.5%) |
|
세포융합제품 |
1,012 |
1,002 |
(-1.0%) |
|
|
세포배양제품 |
368 |
359 |
(-2.4%) |
|
|
소 계 |
12,420 |
12,899 |
(+3.9%) |
|
|
바이오 관련 제품 및 서비스 |
의약‧정밀화학제품 |
1,528 |
1,601 |
(+4.7%) |
|
식품 |
1,368 |
1,324 |
(-3.3%) |
|
|
기기‧시약 |
1,273 |
1,288 |
(+1.1%) |
|
|
생물정보‧서비스‧센서‧ 환경‧기타 |
1,274 |
1,354 |
(+6.2%) |
|
|
소 계 |
5,443 |
5,566 |
(+2.3%) |
|
|
|
합 계 |
17,863 |
18,465 |
(+3.3%) |
출처 : Nikkei Biotechnology & Business사, 일경바이오연감, 2007
가. 단백질의약품 시장의 확대
생명공학의 성장에 크게 기여한 분야는 지난 10여 년 동안 급성장한 단백질의약품이다. 신성빈혈 치료제인 에리트로포이에틴(Erythropoietin, EPO), 인슐린 제제, 성장호르몬, 인터페론 알파, 항암치료 보조제인 과립구 콜로니 자극인자(Granulocyte- Colony Stimulating Factor, G-CSF) 등 5대 단백질 의약품 시장은 이미 성숙기에 접어들었다.
최근엔 약가인하정책으로 인해 단백질의약품의 시장이 정체를 보이고 있지만, 이를 대신해 항체의약품 시장이 빠르게 성장하면서 새로운 성장 동력으로 부상하고 있다[표 2-2-2-2].
|
표 2-2-2-2 |
일본의 주요 단백질의약품 시장
(단위: 억엔)
|
제품군 |
2005년 매출액 |
2006년 매출액 |
|
EPO |
1,388 |
1,326 |
|
인슐린 |
688 |
740 |
|
성장호르몬 |
574 |
558 |
|
인터페론 알파 |
380 |
390 |
|
G-CSF |
400 |
387 |
|
항체의약품 |
396 |
454 |
출처 : Nikkei Biotechnology & Business사, 일경바이오연감, 2007
현재 일본에서 시판 중인 항체의약품은 8종에 불과하지만, 미국과 유럽처럼 R&D 파이프라인에 다수의 제품이 올라있고, 개발주체들이 다케다, 아스텔라스, 에자이 등 대형 제약기업이므로 향후 의약품 시장을 주도할 기술 분야로 될 것이다. 또한 다른 단백질의약품과는 달리 항체의약품은 이제 성장기에 들어선 까닭에 당분간 두 자리 성장률이 꾸준히 유지될 전망이므로 생명공학 의약품시장은 계속 확장될 것으로 기대되고 있다.
나. 의약품 심사제도의 개혁
일본은 미국과 유럽에 비해 생명공학 의약품을 개발하는 데 소요되는 기간이 비교적 오래 걸리는 편이다. 이는 약사법 등 관련제도의 개선이 생명공학기술의 발전을 뒤따라가지 못하는 데서 오는 것으로, 이에 따라 최근에는 규제를 완화시키려는 움직임이 활발하며, 2006년에는 임상시험이나 임상연구에 관련된 문제가 주요 사안으로 논의된 바 있다.
일본의 임상시험 환경을 살펴보면, 1998년에 의약품의 임상시험 실시기준에 관한 규정인 신(新) GCP(Good Clinical Practice)가 1998년에 실시된 이후 임상시험 건수가 급감했고, 이로 인해 임상시험의 공동화가 문제로 지적되었다. 이에 후생노동성은 2005년에 전국 임상시험(治驗) 활성화 3개년 계획을 마련하여 임상시험의 네트워크화 추진 및 의약기관의 임상시험 실시 시스템화를 추진해 이를 개선하고 있다. 또한 CRO와 SMO(Site Management Organization : 治験実施施設管理機関) 등 임상시험 서비스 기관의 증가도 일본의 임상시험 환경개선에 큰 기여를 하고 있다.
그러나 유럽에서 승인된 의약품이 일본에는 직접 도입되지 않아 환자들이 세계표준 의료혜택을 즉각 받을 수 없다는 Drug lag의 문제가 부상하고 있는데, 그 원인은 의약품 심사를 맡고 있는 전문 인력이 부족하기 때문이다. 이런 이유에서 임상시험뿐만 아니라 의약품 승인 심사기구의 체제도 함께 정비될 필요가 있으며, 정부에서도 이를 반영해 2006년 10월부터 의약품 허가를 신속하게 심사할 수 있도록 제도를 개선 중에 있다.

2007년도 일본 정부의 바이오산업 예산 총액은 2006년과 거의 비슷한 수준인 2,645억엔이다. 각 부처별 예산을 통해 중점 육성하는 분야를 살펴보면, 암 치료 관련 분야 및 임상시험 개혁 분야(후생노동성)와 기초연구성과를 임상에 응용하는 목적으로 수행하는 연구(경제산업성, 문부과학성) 등에 예산이 증액되었고, 최근 세계적으로 큰 관심이 증폭되고 있는 바이오연료(농림수산성, 환경성) 분야도 예산이 증가되었다[표 2-2-3-1].
|
표 2-2-3-1 |
2007년 일본 정부의 바이오산업관련 예산
(단위 : 억엔)
|
정부기관 명 |
2006년도 |
2007년도 |
|
경제산업성 |
256 |
220 |
|
농림수산성 |
282 |
264 |
|
후생노동성 |
1,308 |
1,315 |
|
문부과학성 |
684 |
688 |
|
환 경 성 |
109 |
145 |
|
경 찰 청 |
9 |
13 |
|
합 계 |
2,648 |
2,645 |
출처 : Nikkei Biotechnology & Business사, 일경바이오연감, 2007
가. 산학연구의 확대
일본의 생명공학 분야가 미국과 유럽에 비해 뒤쳐진 이유 중 하나는 산학(産學) 연계가 활성화되어 있지 않다는 것으로 분석되고 있다. 일본에도 의대․약대는 물론 농대․이공대에 걸쳐 생명공학 관련학과가 많이 존재하지만 산업계와의 실질적 연결은 부족했다는 지적이 있다. 하지만 최근에는 국가가 지원한 연구비라도 대학을 통해 개발되면 그 기술의 소유를 대학이 갖게끔 해, 기술개발을 통해 대학이 수익을 올릴 수 있는 법적 제도를 마련하고 있는 미국처럼, 일본에서도 대학의 기술이 산업화로 직접 연결될 수 있도록 대학의 독립법인화 등을 시행해 동기를 부여하고 있다.
나. 바이오벤처의 육성
일본에서는 최근 5~6년 사이에 많은 바이오벤처가 생겼다. 2006년 6월, 일본의 바이오벤처 수는 531개에 이르고, 2010년에는 1,000개를 넘어설 것으로 예상하고 있다. 이는 약 20년 전 미국의 상황과 비슷한 것으로, 이처럼 일본의 바이오벤처의 활성화가 늦어진 것은 법 제도와 전문 인력 등 벤처기업을 활성화할 수 있는 사회 환경이 그동안 성숙되지 않았기 때문이다.
또한, 신약연구를 목표로 창업한 바이오벤처의 경우, 미국 벤처기업보다는 연구개발비 규모가 현저히 작아 R&D 경쟁력이 뒤쳐질 수밖에 없었다. 이를 극복하기 위한 방안으로 일본은 미국 등 글로벌 시장으로의 사업영역을 확대하는 전략을 수립하고 있으며, 구체적으로는 바이오벤처의 미국 특허 획득을 확대하도록 유인하는 한편, 미국시장에 밝은 인재 육성과 CRO 등 신약연구 서비스산업의 활성화를 통해 바이오벤처를 정부 차원에서 직․간접적으로 지원하고 있다.
다. 관련 산업과의 접목
바이오산업은 부가가치가 높지만 투자회수까지 걸리는 기간이 비교적 길기 때문에 일본은 자신들의 중점 산업 분야와 생명공학을 접목시켜 단기적 효과를 유인하는 전략도 적극 활용하고 있다. 특히 일본의 주력 산업 분야인 전자산업, 정밀기기 산업 분야와 바이오산업의 기술융합을 통해 신규 바이오산업의 창출을 유도하고 있으며, 정보기술(Information Technology), 나노기술(Nano Technology)도 생명공학기술과의 융합을 통해 신개념의 차세대 제품 탄생을 도모하고 있다. 예를 들면, 차세대 혈당 센서는 직접 채혈하는 대신에 적외선 등의 소형레이저로 혈류 중의 포도당을 직접 측정할 수 있으며, 체내에 심은 캡슐로부터 지속적으로 약물이 방출되도록 하는 약물 전달기술은 실용화가 빠르게 이루어질 것으로 기대하고 있다. 또한 세포나 단백질 연구에 필요한 실험과정에는 숙련된 인재가 많이 필요해 고비용이 요구되는 분야이므로 이 과정에 자동화된 기계장치나 로봇을 활용하는 융합기술도 매력적인 프로젝트가 되고 있다.


유럽의 생명공학 동향과 관련된 주요정책 및 과제는 “연구와 기술개발을 위한 프레임워크 프로그램(Framework Programme for Research and Technological Development)”에 나타나 있다. 제7차 프레임워크 프로그램(FP7)이 2007년부터 시작되어 2013년까지 7년간 진행되며, 전체 예산은 505억유로이다. FP7은 다음과 같이 크게 4개의 특정 프로그램들과 1개의 핵연구프로그램으로 구성되어 있다.

이중에서 생명공학과 관련이 있는 프로그램은 1. 협력(Cooperation) 프로그램으로써, 여기에는 건강(Health)과 식품․농업․바이오테크놀로지(Food․Agriculture․Biotechnology) 등을 포함하는 총 10개의 세부 프로그램이 있다. 첫 번째로 건강(Health) 세부 프로그램은 협력프로그램의 주요 주제이며, 7년의 FP7 기간 동안 60억유로의 예산이 배정되었고 이는 전체 협력 프로그램 예산(324억유로)의 18.5%에 해당한다.
FP7에서의 건강연구의 목적은 유럽시민의 건강을 증진시키고, 건강과 관련된 산업과 사업의 경쟁력을 높이는 것이다. 이와 관련된 대표적 연구는 미생물 저항, HIV/AIDS, 말라리아, 결핵, 유행병 등이다. 주요 지원 분야는 다음과 같다. 기초적 발견들의 임상적용, 새로운 치료법의 개발과 확인, 연구결과의 커뮤니케이션, 건강증진과 질병예방 방법, 진단기법과 기술, 지속가능하고 효율적인 헬스케어 시스템의 개발 등이다. 주요 연구 사업은 크게 인류 건강을 위한 생명공학, 유전공학기술, 인류 건강을 위한 전이연구(Translating research) 및 유럽시민들에 대한 헬스케어의 파급 최적화 등으로 구분될 수 있다.

출처 : P7-factsheets www.cordis.europa.eu/fp7
|
그림 2-3-1-1 |
FP7 협력 프로그램의 중점추진 분야별 예산(단위:백만유로)
재정 계획면에서 볼 때, 큰 규모의 통합 과제는 EU의 기여가 최소 6백만유로에서 최대 12백만유로 정도이다. 중소규모의 특정 연구과제는 그 규모가 최대 3백만유로이다. 중소기업과 국제협력을 목표로 한 과제는 최대 3백만유로, 협력은 최소 3개 이상의 법인체가 있어야 하며, 그 중 한 법인체가 지원을 해야 한다.
다음으로, 식품․농업․바이오테크놀로지(Food․Agriculture․Biotechnology) 세부 프로그램이다. 목적은 유럽 지식기반 바이오 경제(European Knowledge Based Bio-Economy, KBBE)를 구축하는 것이다. 유럽연합 국가들은 FP7 기간(2007~2013) 동안 19억유로(전체협력과제 대비 5.9%) 이상을 배정하기로 결정하였다. 식품․농업․바이오테크놀로지(Food․Agriculture․Biotechnology) 세부 프로그램은 다시 세 개의 주요 활동들로 나뉘는데, 첫 번째 활동은 토양, 숲, 해양환경으로부터 나오는 생물자원의 지속적 생산과 관리이며, 두 번째 활동은 해산물을 포함한 음식, 건강, 복지 등이고, 세 번째 활동은 지속가능한 생명공학, 바이오테크놀로지 및 생화학 활동이다.

가. 영국
영국 내에서 생명공학 산업은 세계적으로 성공한 산업의 일례로 일컬어지고 있으며, 54년 전의 DNA 이중 나선 구조의 발견에서 시작하여 영국이 생명공학 분야에서 선봉의 위치에 있다고 자부하고 있다. 현재 영국의 생명공학 산업 수준은 유럽에서 선두에 있으며 미국에 이어 세계 두 번째 위치를 차지하고 있다. “Improving National Health, Increasing National Wealth”라는 표어를 내세우며 2003년 11월에 발표한 장기발전 계획 ‘BIOSCIENCE 2015’에 따르면, 영국 정부는 생명공학 분야에서 글로벌 리더(global leader)로서 현재의 위치를 확고히 다지고자 하고 있으며, 이를 위해 정부차원에서 적극적으로 나서고 있다.
영국 정부는 기존의 Department of Trade and Industry(DTI)에서 올해 6월 28일 새로운 Department for Innovation, Universities and Skills(DIUS)를 분리하여 조직했다. 새로 생긴 DIUS의 장관으로 임명된 Rt Hon John Denham은 연구, 과학, 혁신 그리고 기술(research, science, innovation and skills) 분야에 효과적으로 투자를 증진시켜, 영국을 과학과 연구 그리고 혁신(science, research and innovation) 분야의 세계 최고로 만들어 영국 정부의 장기발전 계획에 이바지 하겠다고 밝혔다. 2006~2007 회계연도의 연구개발 동향을 살펴보면, 여러 전문 분야의 협력으로 이루어지는 다학제간(multidisciplinary) 프로젝트에 대한 지원이 2천만 달러 이상(9.6M pounds 이상)을 차지하고 있다. 예를 들면, 이들 프로젝트에는 ‘대사체학에서의 로봇기술 개발’(robotic technology in metabolonics), ‘의과학 분야에서 생체 내를 보기 위한 비디오 원자현미경과 전자스핀공명 이미징 프로젝트’(video atomic force microscopy for imaging in vivo, and electron spin resonance imaging in biomedical science) 등이 포함되어 있다.
지난해의 성공적인 사례로 2007~2008 회계연도에도 ‘고효율 면역 측정법을 위한 새로운 광바이오센서 설계’(the design of a novel photonic biosensor for high-throughput immunoassays) 등과 같은 다학제간(multidisciplinary) 프로젝트들에 680만 달러 이상(3.4M pounds, 1파운드 = 2 달러)이 지원될 예정이다.
이밖에 주요 동향을 살펴보면, 기초적인 줄기세포 연구를 실제치료에 적용시키는 것을 실현시키고자 2006년 7월에 발족된 영국 줄기세포 네트워크(UK National Stem Cells Network)에 3년 동안 매년 30만 달러(150K pounds)가 지원되고 있고, 조류 독감 연구에(Combating Avian Influenza initiative) 920만 달러(4.6M pounds)가 지원되었으며, 작물연구에도(Innovation in Crop Science initiative) 2천 660만 달러(13.3M pounds)가 지원되었다. 그리고 올해 3월, 상무부(Department of Trade and Industry) 장관은 실제 이용될 수 있는 바이오에너지(bioenergy) 분야의 주도권을 잡기 위해서 바이오에너지 프로그램에(Bioenergy Programme) 4천만 달러(20M pounds)를 지원하겠다고 발표한 바 있다.
영국은 국내의 독자적 연구 외에도 기존의 유럽연합, 미국, 중국, 일본, 인도 그리고 올해 3월 새롭게 맺은 브라질과의 연구협력(Brazil-UK Partnership in Science)을 계기로 과학기술의 발전을 꾀하려 적극적으로 노력하고 있다.
나. 독일
독일은 유럽국가들 중에서 가장 많은 생명공학관련 기업이 있다. 약 500여 개의 기업들이 있으며, 20개 이상의 기업이 주식 시장에 상장되어 있고, 59개의 기업이 혁신적인 기업으로 분류되어 있다. 또한 독일은 관련 특허와 벤처 자본에 있어서도 유럽에서 선두를 달리고 있으며, 매출의 거의 50%를 연구개발에 재투자하는 등 연구 집중도가 높고 이 금액이 2005년도에 1억유로를 넘어섰다. 독일 생명공학 기업에 대한 민간과 정부의 지원은 풍부하며 증가추세에 있다고 할 수 있다. 40%의 기업이 안정적인 벤처 자본 조달을 하고 있고, 나머지 60%는 공공지원금과 보조금 수혜를 받고 있다. 또한 독일은 해외 생명공학 기업들에게 협력을 위한 문호를 개방하고 있다. 진단에서 제약, 녹색 생명공학에서 나노 생명공학까지 외국기업들은 수월하게 파트너십 기회를 찾을 수 있으며 특히 건강/의약 분야 생명공학기업들의 80%가 외국 기업과 협력하고 있다. 그 다음으로 협력이 많은 분야는 생명공학의 산업응용과 생물공정 분야이고, 독일 생명공학기업의 25%가 이 분야에 해당한다.
생명공학특허에 있어서 독일은 다른 유럽국가들보다 월등히 많은 특허를 보유하고 있다. 2000년부터 2004년 사이에 유럽특허사무소에 등록된 전 세계 생명특허의 30%가 독일에서 나왔다. 과학적 발견을 상업화하는 기술이전 분야에서도 유연한데, 기업은 효율적인 기술이전을 수용하기 위하여 대학 및 연구기관들과 협력적인 파트너십을 개발하고 있다.
예를 들어 막스플랑크연구소(MPS)는 “Max Planck Innovation”이라는 기술이전전담기구를 만들어서 특허를 관리하고 다양한 기술을 상업화하고 있다. 한편 신규기업 창업자에 대한 교육도 하고 있다. 그리하여 28개의 벤처기업 분사를 유도하였으며, 450여 개의 협약체결을 도왔고, 1억유로 이상의 기술이전 매출을 기록하였다. 프라운호퍼연구소에서는 “Fraunhofer Venture Group”이 기술이전을 담당하고 있고, 헬름홀츠와 라이프니츠의 연구소들은 “Ascenion”이라는 기술이전 전문기업과 파트너십을 통해 기술이전을 활성화하고 있다.
|
표 2-3-2-1 |
독일 생명공학 기업의 주요 연구 분야(2007)

출처 : 다. 프랑스
프랑스에서의 생명공학은 건강과 관련된 산업뿐만 아니라 환경, 농업, 식품, 혁신적 산업 공정 분야에서도 갈수록 중요한 역할을 하고 있다. 건강 분야에 있어서, 질병의 원인 연구, 새로운 치료법의 개발, 신약 개발 등을 위한 생명공학에 의존하고 있다. 생명공학 연구는 처음에 제약회사에서 시작되었으나 갈수록 생명공학관련 기업으로 확대되고 있다. 15%의 신약이 제약회사가 아닌 생명공학 회사에서 개발되고 있으며, 2010년도에는 40%에 육박할 것으로 예상된다. 제약 분야를 넘어서, 생명공학은 생명산업·환경 및 농업 분야에서 갈수록 중요한 역할을 하고 있다.
프랑스의 생명공학 분야는 첨단을 달리며 급격히 성장하고 있다. 생명공학관련 회사는 대부분 최근에 만들어진 중소기업이며, 연구개발 과제에 중요하게 참여를 하고 있다. 2005년 현재 300여 개의 기업에서 10,000명의 직원이 일하고 있는 것으로 추정된다. 기업의 생명공학 관련 분야는 크게 10개로 나뉘며, 진단과 분석서비스(21%), 치료법(17%), 법률연구와 생산(10%), 유전체학과 단백질체학(9%), 환경·농업생명·식품(7%), 생물정보학·생물전자공학(7%)순이다.
프랑스 정부는 생명공학 분야 수준이 세계적 수준보다 뒤쳐진 것으로 판단하고 전략적으로 관련 기업들을 지원·발전시키려고 하고 있다. 이를 위해 관련 법규 개정과 분위기를 조성하고 연구개발 과제들을 지원하고 있다. 2004년 6월에 만들어진 건강환경국가계획(PNSE, Plan National Santé Environment)은 2004년부터 2008년까지 환경 악화에 기인한 건강의 피해를 줄이기 위하여 만들어졌다. 이와 관련하여 2007년 7월에 발간된 중간평가보고서에 의하면, PNSE를 통해서 주변 유럽 국가들에 비해서 뒤쳐져 있는 부분들을 따라잡고 있는 것으로 나타났으며, 범부처간의 상호 협력이 적극적으로 이루어짐은 물론 지방도 활성화되고 있다.

출처 : www.france-biotech.org, 2005
|
그림 2-3-2-1 |
프랑스 생명공학기업의 10개 주요 분야
참 고 자 료
1. FP7-factsheets www.cordis.europa.eu/fp7
2. Annual Review 2006/07 by Research Council UK (RCUK)
3. Annual Report & Accounts 2006-2007 by BBSRC (Biotechnology and Biological Sciences Research Council)
4. RCUK Annual Delivery Plan Report 2006-07 by RCUK
5. Bioscience 2015 (report on 2003) by the Bioscience Innovation and Growth Team
6. International 2007 (report) by BBSRC
7. Annual Report and Accounts 2006-2007 by EPSRC (Engineering and Physical Sciences Research Council)
8. Homepage of “Department for Innovation, Universities and Skills (DIUS)”
http://www.dius.gov.uk/pressreleases/press-release-20070720.htm
9. Biotech “Made in Germany”, Invest in Germany 社
10. www.biotechnologie.de
11. “Evaluation à mi-parcours du Plan national santé environnement” [Rapport de Comité d'évaluation (2007.7, agence française de sécurité sanitaire de l'environnmenent et du travail)
12. Venture Valuation (www.frenchbiotech.com)
13. www.france-biotech.org


1981년에 등소평은 “농업문제의 돌파구는 최종적으로 생명공학이 해결할 수 있으니, 관련 첨단기술에 의지해야 한다”고 언급한 적이 있다. 이에 1986년 중국 정부는 ‘863계획’을 발표하고 생명공학을 우선 분야로 하여 지원을 아끼지 않았으며, 생명공학기술과 관련하여 ‘863계획’은 3가지 주제14), 6가지 핵심과제15)를 중심으로 13가지 세부 프로젝트16)를 국가 전략으로 선택하여 관련 기술을 개발하고자 하는 것이다.
또한 1988년 8월 중국 국무원의 비준을 받아 중국 과학기술부에 의해 실시되고 있는 ‘횃불계획(첨단기술산업잘전계획)’은 첨단기술성과 상품화, 첨단기술상품 산업화, 첨단기술 산업 국제화를 목표로 7대 활동17)을 통해 중국 첨단기술 산업화의 중추적 역할을 수행하고 있다.
아울러 1997년 3월부터 확정 실시된 중국 국가 중점 연구개발 프로젝트인 ‘973계획’은 미래 기술을 중점 연구하는 정부의 선행 연구 프로젝트로써 중국의 미래 산업 발전에 필요한 최첨단 기술 기초연구와 응용 기초연구를 실행하는 국가 중점 연구개발 프로젝트에 속하며 광학 전기 기능 결정체, 질병 유전자학, 나노 과학기술, 대뇌 과학, 고대 생물학, 화학 등 분야의 국제학술 및 과학연구 분야에서 중요한 영향력을 발휘하고 있다.
2001년부터 2005년까지(“105”기간, 10차 5개년 계획) 중국 정부는 생명공학 연구개발에 총 120억위엔을 투자하였는데 이는 1996년부터 2000년까지 같은 기간 동안 중국 정부가 생명공학 분야에 투자한 총 연구비(15억위엔)의 8배 이상 증가하였다. 그러나 중국의 생명공학 연구개발은 세계 선진기술 수준과 비교해 볼 때 여전히 상당한 격차가 존재하고 있다. 주요 원인은 핵심 기술과 우수 인재의 부족으로 이 때문에 인재를 배양하는 것이 중국 바이오산업을 발전시키는 중요한 과제이다. 따라서 중국은 인재의 육성, 활용, 유치 등 3가지 측면으로 우수 인재팀을 구축하여 첨단기술 인재규모 분야에서 선진국과의 차이를 축소하려 노력하고 있다.
최근 중국 국무원은 “국가생명공학연구개발과 산업화 촉진 지도자 그룹”을 조직하였고 동시에 “중국생명공학기술 및 산업화 발전 계획” 및 “생물안전법”을 제정하였다. 또한 중국 생명공학산업체협회를 조직하였으며 생명공학 연구개발비에 대한 대대적인 지원을 강화하고 있다. 중국 국가 과학기술부는 2005년 9월 14일에 ‘중국의 생명공학 및 생물산업 전략계획’(마스터플랜)을 공식 발표하고 농업, 의약, 공업, 환경, 에너지, 해양, 중의약 등 중점 발전 분야를 확정함으로써, 기술 축적을 위해 전력을 다하겠다고 발표하였다.
이 ‘전략계획’에서는 “향후 2020년도 중국의 생명공학 및 산업화 발전 전략 목표는 중국을 생명공학기술 강국과 바이오산업 대국으로 건설하는 것이며, 15년간의 노력을 통해 중국의 생명공학과 산업화 수준을 세계 선진국 수준에 도달시키는 것이 기본 목표이다”라고 정리하고 있다. 중국 국가 과학기술부 산하 ‘중국 국가생명공학발전센터’에서 작성한 이 계획에서는 중국이 3단계를 거쳐 2020년 생명공학기술 강국 및 바이오산업 대국으로 부상하는 전략 목표를 실현할 것이라고 설명하고 있다. 또한 2007년 6월 17일 중국생물산업대회의 ‘생물산업정책 및 생물산업기지발전포럼’에서도 국가발전개혁위원회에서 제정한 ‘생물산업발전 11.5 계획’을 더욱 강조하였다.
이 ‘전략계획’에서는 향후 20년 간의 중국 바이오산업 발전의 9개 중점 분야를 다음과 같이 제시하였다. 첫째, 농업 생명공학으로 제2차 녹색혁명을 추진한다. 둘째, 의약 생명공학으로 제4차 의학혁명을 추진하고 중화 민족의 평균 수명을 연장한다. 셋째, 공업 생명공학으로 ‘녹색 제조업’ 발전을 추진하고 녹색 GDP를 대폭 증가시킨다. 넷째, 에너지 생명공학을 발전시켜 중국의 에너지 부족 상황을 개선시킨다. 다섯째, 환경 생명공학으로 순환(循環) 경제 발전을 추진시킨다. 여섯째, 생물자원의 심층 개발을 통해 새로운 바이오산업을 육성한다. 일곱째, 해양 바이오산업을 발전시켜 해양경제를 발전시킨다. 여덟째, 생물안전과 생물테러 방지기술 연구개발을 추진하여 생물안전관리시스템을 구축한다. 아홉째, 중의(中醫)와 서의(西醫)를 효과적으로 결합시킨 새로운 의료 보건 체계를 구축하고 중의약(中醫藥) 산업 발전을 추진한다.
|
표 2-4-1-1 |
‘중국의 생명공학 및 생물산업 전략계획(마스터플랜)’에 제시된 전략목표
|
단 계 |
기간(년) |
세 부 목 표 |
|
1단계 (기술축적단계) |
2005 ∼ 2010 |
◦ 생명공학 연구개발 전체 수준을 개발도상국 중 제일 높은 수준으로 도달시킴 ◦ 논문, 특허 수량 세계 6위 달성 ◦ 바이오산업 총 생산액 8,000억위엔 달성 |
|
2단계 (산업발전단계) |
2010 ∼ 2015 |
◦ 생명공학 연구개발 전체 수준을 세계 선진수준으로 도달시킴 ◦ 논문, 특허 수량 세계 3~4위 달성 ◦ 바이오산업 총 생산액 15,000억위엔 달성 |
|
3단계 (지속발전단계) |
2015 ∼ 2030 |
◦ 생명공학 연구개발과 산업화 전체 수준을 세계 선진 국가 수준에 도달시킴 ◦ 세계 생명공학과 기술 분야 최우수 인재를 유치하며, 세계 생명공학 연구 혁신의 중심지로 성장 ◦ 바이오산업 총 생산액 25,000~30,000억위엔 달성 및 GDP에서 차지하는 비율 7~8%로 향상 ◦ 바이오산업을 중국의 기간산업으로 육성 |
출처 : 투자금은 아직까지 상당히 미흡한 실정으로 GDP의 0.5%~1.0% 수준에 불과하다. 이는 개발도상국인 인도보다도 낮은 수치로 해외 선진 생명공학기업 1개 업체의 연구개발비에도 미치지 못한다고 한다. 2003년 기준 중국의 GDP는 13,000억 달러이고 그 중 단지 5%인 650억 달러가 의료 및 건강사업에 투자되고 있다. 그러나 중국의 GDP가 증가함에 따라 의료위생과 건강사업에 투자되는 비율도 점차 증가하고 있으며 2010년까지 관련 연구기관의 예산은 연간 위생과 건강사업 총 투자액의 1%, 연구기관은 약 50~60여 개 연구소 및 연구센터로 확대할 전망이다. 또한 연구기관의 외부과제 연구개발비는 연구원 총예산의 2/3 수준이 되도록 하고 약 4,000여 과제를 지원할 계획이다. 이는 중국 생물의학연구 발전에 상당한 원동력이 될 것이다. 하지만 선진국이나 상위권 개발도상국에 비해 규모가 작은 정부 지원금은 결국 중국의 생명공학 발전을 저해하는 주요 요인으로 작용하기 때문에 중국 정부와 각 성(省) 정부는 화교 자본을 포함한 해외 투자금 유치를 위해 관련 법률을 제정하는 등 정책적으로 적극 장려하여 자금부족의 취약점을 보완하고 있다.
또한 중국은 현대과학연구시스템을 갖추기 위하여 국가 연구기관을 개혁함으로써 새로운 형태의 생명공학연구기관을 설립하고 있다. 예를 들어 중국 과학기술부와 국가발전개혁위원회가 공동 설립한 북경생명공학연구소는 세계 수준의 중국 생명공학 기초 분야를 연구 중이며, 2003년 7월에 개원한 중국과학원 광주생물의학건강연구원은 중국과학원과 산동성 정부, 광주시 정부가 공동으로 설립하여 생물의학연구 및 산업화를 촉진하고 있다. 최근에는 상해시도 비슷한 연구기관을 설립할 계획이며, 이러한 연구기관은 지역의 우수 조건과 발전 추세에 부합하고 현대과학연구 모델 구축을 위한 새로운 시도로 인식되고 있다.
중국은 지역별로 대규모 생명공학 투자 사업을 진행하고 있다. 대표적인 사례로 북경의 중관촌 생명공학단지 조성사업과 해남성 해구(海口)제약밸리 건설사업 등이 있고, 광주(廣州)시 생물첨단기술산업화시범기지는 2006년에 완공되었다. 그리고 심천시, 석가장시, 장춘시의 중국 최대 규모의 3대 바이오산업기지와 난링시 영장류실험동물기지 등 크고 작은 시설 투자도 진행되고 있다. 중국 최대의 국가과학기술단지로 건설 중인 빈해과학단지에서도 바이오산업을 중점 육성시키려는 계획을 실현시키고자 노력하고 있다. 또한 2006년 북경에서 기공식을 한 생명공학학술센터는 500여 연구팀과 100여 개 생물기업을 동시에 수용할 수 있는 아시아 최대 규모의 바이오산업 인큐베이터로 건설되고 있다. 현재 국가 발전개혁위원회는 석가장, 장춘, 심천, 북경, 상해, 광주, 장사, 중경, 성도, 곤명, 무한, 청도 등 12개 국가바이오산업기지를 지정하였다.
최근 세계 유수의 다국적 기업들은 중국을 ‘글로벌 공장’에서 ‘글로벌 연구중심’으로 인식을 전환하면서 신약 연구개발 관련 공동 연구 사업을 추진하고 있다. 이는 중국의 의약시장이 연간 15% 이상 발전하고 있고 의약시장 매출액이 2005년 140억 달러, 2010년 240억 달러에 달할 것으로 전망되며 향후 미국, 일본, 독일, 프랑스에 이은 세계 5대 시장으로 발전할 것이 예상되고 있기 때문이다. 2005년 11월 상해에 설립한 Pfizer 중국 R&D센터를 비롯하여, 이미 설립된 Novo Nordisk, AstraZeneca, Eli Lily, Roche, GSK 및 최근 설립계획을 밝힌 Aventis, Novartis, Wyeth 등 다국적 제약기업들의 R&D 설립 붐으로 중국은 세계 신약개발 전진기지로의 변모를 기대하고 있다.
중국의 권위 있는 관계자에 따르면, 중국은 향후 10년 안에 농업 및 의약 생명공학 기술과 관련 산업 분야에 있어 세계 최고의 생명공학기술 강국이 될 수 있고, 이 과정에서 약 1,000억위엔의 투자가 필요할 것이라고 전망하였다. 세계 생명공학 강국으로 성장하고자 하는 중국의 원대한 목표는 앞으로 생명공학 분야에 대한 중국 정부의 관심과 투자가 획기적으로 증대될 것을 단적으로 보여준다.



가. 과학기술행정체계의 정착
과학과 기술이 국가경쟁력의 핵심이 되고 있는 21세기 지식기반 시대에 있어서는 과학기술 혁신역량을 배양하여 지속적인 경제성장과 발전을 도모해 나가는 것이 무엇보다 필요하다.
정부는 이러한 인식에서 2004년 과학기술행정체계를 대폭 정비하여 세계적으로 유례가 없는 독특한 과학기술혁신본부를 출범시켰으며, 현재 다음과 같은 기능과 업무를 수행하고 있다[그림 3-1-1-1].

출처 : 과학기술부 홈페이지, 2007
|
그림 3-1-1-1 |
과학기술혁신본부 조직도
첫째, 과학기술정책과 관련 산업·인력·지역혁신 등 미시경제정책을 관계부처 간에 조율해 나감으로써 경제 활력의 회복과 중장기적인 성장 동력 창출에 기여해 나가고 있다.
둘째, R&D 예산을 조정·배분하고 국가 연구개발 사업에 대해서는 정례적으로 그 성과를 평가하여 보다 효율적인 R&D투자 전략을 마련하고 있다.
셋째, 세계시장을 선점할 수 있고 경제적 파급효과가 큰 기술 분야에 대한 연구개발과 실용화를 촉진해 나가면서 이를 뒷받침할 핵심 과학기술인력을 체계적으로 양성하는 데 적극 노력하고 있다.
이러한 개편으로, 과학기술부가 부총리 부서로서 과학기술정책을 국가목표에 따라 일관성 있고 효율적으로 추진할 수 있는 기반이 마련되었으며, 과학기술혁신본부를 통해 국가과학기술위원회가 실질적인 조정능력을 발휘할 수 있게 되었다. 지난 40여 년간 유지되어온 과학기술행정체계를 혁신적으로 바꾼 것으로 우리나라 경제발전전략의 근본적 변화를 의미하는 것이다.
주요 정책의 완성도를 제고하여 미래 성장 동력의 확보, 경제 활성화와 양극화 해소에 기여한다는 목표 하에 2006년 2월 출범한 제2기 과학기술부총리 체제에서는 특히 과학기술혁신체제의 확고한 정착 방안 마련을 최우선 과제로 과학기술관련 미시경제정책의 기획․조정․평가 체제를 고도화하기 위해 노력하고 있다.
구체적인 방안으로 1) 부처별 과학기술관련 중장기계획들이 서로 중복․상충되지 않고 국가 정책목표를 지향하도록 조정하며 이를 위해 현재 17개 부․청의 80여 개 중장기 계획을 과학기술기본계획에 부합하도록 조정, 2) 국가과학기술위원회 및 과학기술관계장관회의 등에서 확정된 과학기술정책 우선순위에 따라 연구개발 예산을 편성하여 정책과 예산 간에 유기적인 연계 방안 마련, 3) 국가 연구개발 조정시스템과 인적자원개발 조정시스템의 긴밀한 연계 방안 모색, 4) 생명공학 기술(BT)․나노 기술(NT) 등 부처간 업무영역이 중첩되는 분야의 관련 산업정책 효율성 제고 방안 마련, 5) 지식재산권 관련업무의 종합적․체계적 조율방안 마련을 위한 범정부 차원의 대책 마련, 6) 지역혁신체계(RIS) 사업의 예산편성과 성과평가가 국가기술혁신체계(NIS) 사업과 연계되도록 국가과학기술위원회 및 국가균형발전위원회간 긴밀한 협조 방안 마련을 제시하고 있다.
새로운 과학기술행정체계의 출범 및 제2기 과학기술부총리 체제 출범에 따라 생명공학 분야에서도 부처 간의 역할 분담 및 과학기술혁신본부의 종합 조정기능이 강화되고 있다[그림 3-1-1-2].

출처 : 과학기술혁신본부 내부자료
|
그림 3-1-1-2 |
신(新)과학기술행정체계 출범에 따른 생명 분야 부처간 역할
나. 생명공학 분야의 예산조정․배분 절차의 변화
이러한 신(新)과학기술행정체계의 출범에 따라 생명공학을 포함한 분야의 예산 조정․배분 과정도 연구개발 예산을 보다 효율적으로 활용될 수 있도록 변화되었다.
매년 1월말까지 각 부처로부터 생명공학 분야 사업의 중기사업계획서를 제출받아 생명공학 분야의 전문가들로 구성된 「생명분야 전문위원회」의 검토의견과 국가 전략목표 등을 고려하여 사업별 지출한도를 설정하게 된다. 그 후 다른 기술 분야의 지출한도와 종합하여 전체 연구개발 예산 지출한도를 설정하여 기획예산처와 협의하여 부처별 지출한도를 설정하게 된다. 이를 토대로 각 부처는 사업별 예산요구서를 작성하여 6월말까지 제출하면 7월에 전문위원회의 기술적인 검토와 8월 중순까지의 「연구개발예산심의회」를 거쳐 대략적인 사업 예산을 정한 후, 「국가과학기술위원회」 산하 기획․예산조정전문위원회 및 운영위원회에서 검토하게 되며 최종적으로는 「국가과학기술위원회」에서 예산조정․배분(안)을 확정하여 기획예산처로 통보하게 된다. 기획예산처는 그 결과를 반영하여 차년도 국가 예산(안)을 편성하게 되는 것이다[표 3-1-1-1].
|
표 3-1-1-1 |
변경된 연구개발 예산 조정․배분 절차
|
절 차 |
일 정 |
|
중기사업계획서 접수 |
1월말 |
|
연구개발 예산 지출한도 설정을 위한 전문위원회 개최 |
1월말~2월초 |
|
부처별 지출한도 결정 후 각 부처와 예산처에 통보 |
2월말 |
|
부처별 사업요구서 접수 |
6월말 |
|
사업설명회 및 전문위원회 검토 |
7월초~7월 중순 |
|
전문위원회 심의 의견서 작성 |
7월 중순~7월말 |
|
연구개발예산심의회 심의 |
7월말~8월초 |
|
국과위 기획․예산조정전문위원회 |
8월초 |
|
국과위 운영위원회 |
8월 중순 |
|
국과위 연구개발 예산 조정․배분(안) 확정 |
8월말 |
출처 : 과학기술혁신본부 내부자료
이러한 예산조정․배분 절차의 변화는 조사․분석․평가 기능의 강화와 동시에 진행되었다. 사업(Program) 차원의 평가는 1999년 2월부터 국가과학기술위원회에서 매년 실시해 왔으나 제한된 시간과 인력의 제약으로 심층평가에 애로가 있었다. 올해 새로운 신(新)과학기술행정체계 상에서는 이러한 애로사항을 해결하기 위하여 기존의 조사․분석․평가 결과가 연구개발 예산 조정․배분에 반영될 수 있도록 사업목적별 평가소위원회와 예산 조정․배분을 위한 전문위원회 위원을 일정 부분 공유토록 하였다.
또한 과학기술혁신본부를 중심으로 생명공학 분야 연구개발 사업들을 핵심기술 분야별로 분류하고 상시적으로 분석․검토하는 체제가 운영되고 있으며, 향후 조정․배분된 예산의 투입 성과에 대한 기술적인 검토가 이루어지고 있다.
생명 분야 연구개발 예산의 조정․배분 절차의 변화와 함께 지난 2006년 12월 확정된 국가 R&D Total Roadmap에 따라 생명 분야에 대한 투자를 꾸준히 확대토록 중장기 국가 R&D 포트폴리오가 변경됨으로써 미래 국가경쟁력 확보를 위한 국가 발전전략과 연구개발 예산 간의 연계 강화와 동시에 향후 생명 분야에 대한 국가적인 지원 강화의 발판을 마련하였다. 실제로 2008년 예산 조정 배분 과정에서 생명 분야에 대한 정부 R&D 예산 지원 증가율은 전년 대비 0.5% 이상 늘어남으로써 여러 분야 중에서 가장 확대 폭이 큰 분야 중 하나였다.

출처 : 국가 R&D사업 Total Roadmap, 과학기술부 / 과학기술혁신본부 / KISTEP, 2007. 02
|
그림 3-1-1-3 |
중장기 분야별 정부 R&D투자 비중 변화추이 예측
다. 생명공학 분야의 중요한 조정 사례
신(新)과학기술행정체계의 정착으로 생명공학 분야의 새로운 변화는 국가 발전전략에 맞춘 연구개발 예산의 조정․배분과 정책 조정기능의 강화를 들 수 있다. 많은 부처들이 의욕적으로 다양한 생명공학 관련 연구개발 사업을 추진해 온 결과로 현재까지 생명공학 분야가 괄목할 만큼 성장해 온 것은 누구도 부정할 수 없는 사실이나, 일부 특정 분야에서 서로 간의 업무 협조가 원활하지 못한 경우가 발생한 예들이 있는 것도 엄연한 현실이다. 생명공학 분야가 매우 다양하고 연구개발 사업이 빠른 속도로 확대되고 있는 만큼 조정의 필요성도 증가되어 왔다. 생명공학 분야에서 범부처간 조정이 필요한 문제가 발생하는 경우, 혁신본부를 중심으로 관계부처, 민간 전문가 등의 의견을 수렴하여 해결방안을 마련하고 이를 과학기술관계장관회의 또는 국가과학기술위원회 등의 심의기구를 통하여 확정하고 있다. 또한 예산의 조정이 필요한 사항인 경우에는 연구개발 예산 조정․배분 절차에 적극적으로 반영함으로써 정책 목표를 구체적으로 실현할 수 있도록 조치하고 있다.
과학기술혁신본부는 생명공학 관련 11개 부・처・청간 정책현안 협의를 위한 「바이오 실무협의회」를 구성・운영하고 있으며, 생명해양심의관을 위원장으로 11개 부처・청 과장급으로 구성되어 2006년에 총 4회, 2007년 현재까지 총 3회의 회의를 개최하였다. 본 협의회를 통하여 「바이오 연구개발의 효율적 추진전략」의 공동 추진과 모니터링, 「바이오 연구개발의 실용화 촉진전략」의 공동 제안, 제2차 생명공학육성기본계획(Bio-Vision 2016) 추진현황 점검 및 관련 정책이슈 논의 등이 활발하게 논의되고 있다.
본 협의회의 논의를 거쳐 과학기술관계장관회의에 소관 분야 상정・확정된 안건으로는 범부처 신약개발 R&D 추진전략(2006. 2), 국가 생명자원 확보・관리체제 구축방안(2006. 9), 바이오 연구개발의 실용화 촉진전략(2006. 10), 인수공통전염병 범부처 R&D 추진전략(2007. 3), 유전체연구 종합 추진전략(2007. 6) 등이 있다.
이러한 조정의 구체적인 사례로는 「유전체연구 종합 추진전략」 마련, 「범부처 신약개발 사업 조정」 등을 들 수 있으며, 현재는 국가 생명자원 확보·관리체제 구축방안(2006. 9)을 토대로 국가 생명자원 확보·관리 및 활용 마스터플랜을 관련 부처와 합동으로 수립하고자 노력하고 있다.
「유전체연구 종합 추진전략」은 인간 유전체 프로젝트 완료 등에 따라 유전체 연구는 생명공학 기술․산업시대의 패러다임을 변화시킨 방법론으로써 농수산, 보건의료 등 광범위한 분야에서 활용되는 등 모든 생명공학 분야의 산업화를 위한 필수적인 방법론으로 대두되었다. 그리하여 “유전체 연구개발을 통한 지속가능한 바이오 경제 기반확보 및 삶의 질 향상”이란 비전 아래 “향후 2016년까지 유전체 연구 분야의 국가경쟁력 선진 7위권 진입”을 목표로 관련부처와 공동으로 정부 정책의 일관성 및 효율성을 제고하기 위한 추진방안을 마련하였다. 한정된 R&D 예산의 효율성을 제고하기 위하여 유전체 연구에 있어서 부처간 역할분담을 실시하고, 유전체 사업 간의 연계를 강화하기 위하여 부처 간의 협력을 유도하여 가시적 성과 도출을 위한 연구역량을 강화하고자 하였다[그림 3-1-1-4].
유전체 연구 조율을 위하여 기존의 바이오실무협의회 내에 「(가칭)유전체 연구 분과」를 설치를 제안하였고, 관련 인프라의 공동 활용, 전문 인력 양성 및 국제협력 강화를 위한 「(가칭)국가 유전체 연구소」 설립 추진을 검토 중이다.
신약개발 관련 범부처 사업조정은 제13회 과학기술관계장관회의에서 확정된 범부처 신약개발 R&D 추진전략(2006. 2)에 따라 과학기술부, 보건복지부, 산업자원부 등 관련부처의 2007년 및 2008년도 R&D예산 조정을 통하여 추진되었다. 과학기술부는 후보물질의 도출에 집중하고, 보건복지부 및 산업자원부 등은 전임상, 임상 R&D 및 산업화 쪽에 집중하는 형태로 조정되었다. 신약개발 사업에 대한 이러한 사업조정은 내년에도 지속적으로 추진될 예정이며, 한미 FTA를 맞아 위기감이 고조되고 있는 제약 산업에 활력을 줄 수 있을 것으로 전망된다.

출처 : 유전체연구 종합 추진전략(제25회 과학기술관계장관회의), 과학기술혁신본부, 2007. 6
|
그림 3-1-1-4 |
국가 차원의 유전체연구 연구체계 및 부처별 역할 분담
라. 앞으로의 생명공학 분야 종합조정 방향
2007년도까지를 신(新)과학기술행정체계의 정착 및 성숙 단계라고 한다면 다가오는 2008년도 이후는 고도화의 단계라고 할 수 있다. 많은 기대와 걱정 속에서 탄생한 신(新)과학기술행정체계가 어느 정도 뿌리를 내렸다고 내외부에서 평가를 하고 있지만, 국민소득 2만 달러 달성의 견인차가 되기 위해서는 과학기술혁신본부 주도의 조정 방안 및 제도들이 얼마나 명확하게 자리잡고 보다 정교하게 작동하는가가 관건이라고 할 수 있다. 이러한 고도화 단계의 진입시점에서 가장 필요한 것들 중 하나가 생명공학관련 연구개발 사업들이 좋은 성과를 낼 수 있도록 어떻게 종합, 조정할 것인가와 국민의 삶의 질 향상에 실질적인 기여를 할 수 있도록 할 것인가에 관한 부처별 투자 비중이 2006년을 기준으로 과학기술부(32%), 산업자원부(22%), 보건복지부(17%), 농림부(15%) 순이며, 범부처 대형 사업으로, 차세대 성장동력사업, 21세기 프론티어 연구개발사업, 대형국가연구개발 실용화사업 등이 추진되고 있다. 부처별 연구개발의 활성화 및 연구 분야의 세분화에 따라 이러한 사업들이 우수한 성과를 창출하고 이들 간의 연계를 통한 상승효과를 얻기 위한 종합, 조정의 필요성도 더욱 증대되고 있는 실정이다.
지난 2006년 ‘바이오 혁신전략 보고회’에서 제시되었듯이 다가오는 바이오 경제 시대를 맞이하여 바이오 연구개발을 더욱 고도화해 나가면서, 그러한 결과가 국민 삶의 질 향상과 국가 경쟁력 제고에 기여할 수 있도록 연구개발, 산업, 인프라 및 제도 등 다양한 측면에서 범부처적 노력이 더욱 요구되고 있다. 이를 효율적으로 대응하기 위한 혁신정책 방향으로 지난 2004년 7월 수립된 국가기술혁신체계(NIS)를 기본 틀로 하여 바이오 혁신체계(BIS)를 구축하는 노력이 절실하다. 즉 범부처․기관의 협력체제 강화를 통한 ‘시스템 혁신’, 연구개발의 효율 극대화, 산업혁신 가속화 및 글로벌화를 통한 ‘지식․기술혁신’, 생명윤리와 문화 인프라 확충을 통한 ‘제도․문화혁신’ 등 선순환적 혁신체계를 구축하는 것이다.
출처 : 미래 바이오 혁신전략 보고회, 과학기술부, 2006. 6
|
그림 3-1-1-5 |
바이오 혁신체계 구축 선순환 구조
이러한 시대적인 요청에 부응하기 위하여 과학기술혁신본부를 중심으로 올해에 이어 범부처 생명공학 정책 종합조정, 생명 분야 연구개발예산의 효율적인 조정․배분 등을 강력히 추진해 나갈 것이며, 생명자원(생물자원, 생물다양성, 생명정보를 총칭), 고령화 사회 대응 연구, 질환관련 연구 등의 분야에 대하여 지금까지 분석된 결과를 바탕으로 보다 심층적인 대응 전략을 마련할 예정이다. 특히 생명공학 분야에서 산업화가 지연되고 있는 원인에 대한 고찰을 통해 연구개발에서 시작하여 산업화 및 재투자로 이어지는 선순환 구조를 도출하기 위한 전략을 수립함으로써 바이오 경제시대 진입에 따른 대응전략을 도출하고자 한다.

가. 개요
정부 차원의 생명공학 육성은 1982년 과학기술부에서 생명공학을 핵심전략기술로 선정하여 특정연구개발사업으로 지원을 시작하면서부터다. 이후 1983년 「유전공학육성법」(현(現) 「생명공학육성법」)을 제정하여 정부의 생명공학 육성․지원을 위한 법적 기반을 마련하였고, 1985년 동법을 기반으로 한국과학기술연구원(KIST) 부설로 “유전공학센터”(현(現) “한국생명공학연구원”)를 설립하여 생명공학의 본격적 육성․지원을 시작하였다.
연구지원 프로그램으로 특정연구개발사업인 바이오기술개발사업, 21세기 프론티어연구개발사업, 차세대 바이오신약장기사업을 추진하고 있다. 1989년부터 기초 분야 육성을 위해 국가지정연구실사업(NRL), 우수연구센터(SRC, ERC), 국가핵심연구센터(NCRC), 기초의과학연구센터(MRC) 등의 연구협력센터를 대학 내에 설치하여 연구를 지원하고 있다.
또한 1993년 12월 8개 부처가 참여한 ‘제1차 생명공학육성기본계획(Biotech 2000, 1994~2007)’을 수립하였고, 2005년 시행계획 수립과정에서 국내외적으로 급변하는 정책 환경을 반영하여 당초 3단계(2002~2007) 기본계획을 1년 앞당겨 2006년에 종료하였다. 급변하는 생명공학기술의 발전과 정책 환경변화에 부응하는 국가 생명공학육성의 새로운 전략을 모색하기 위해 ‘제2차 생명공학육성기본계획(Bio-Vision 2016, 2007~2016)’을 수립․운영하고 있으며 매년 시행계획을 수립하고 있다.
이와 별도로 뇌연구촉진을 위해 1998년 「뇌연구촉진법」을 제정하고, 5개 부처를 포함한 ‘제1차 뇌연구촉진 기본계획(Braintech 21, 1998~2007)’을 수립하였으며 매년 시행계획을 마련하고 있다. 또한 세계적으로 이슈화가 된 줄기세포연구의 촉진을 위해 줄기세포연구종합추진계획(2006. 5)을 수립하여 2007년 시행계획을 수립․운영하고 있다.
나. 연구개발 지원 체제
(1) 법적, 제도적 기반
(가) 생명공학육성법
과학기술부는 유전공학의 연구기반을 조성하여 유전공학을 보다 효율적으로 육성하고 산업화를 촉진하여 국민경제의 건전한 발전에 기여하기 위하여 1983년 「유전공학육성법」을 제정하였다. 그리고 1995년 생명공학 기술의 발전에 따라 법의 적용범위를 유전공학에서 생명공학으로 확대하는 내용의 제3차 개정을 하고 법률명을 「생명공학육성법」으로 개명하였다.
1997년 첨단 생명공학의 기초인 유전체에 대한 관심과 중요성이 증대됨에 따라 생명공학의 영역에 유전체학을 포함하고, 생명공학 분야의 확대로 관련부처에 해양수산부 및 정보통신부를 추가하는 등 현재까지 제8차 개정을 하여 추진 중이다. 생명공학육성법은 생명공학 연구의 기반을 조성하여 생명공학을 보다 효율적으로 육성․발전시키고, 그 개발기술의 산업화를 촉진하여 국민경제의 건전한 발전에 기여하게 함을 목적으로 하며, 주요내용은 생명공학 육성기본계획 및 연차별 시행계획의 수립, 생명공학종합정책심의회 설치․운영, 8개 부처(교육인적자원부, 과학기술부, 농림부, 산업자원부, 정보통신부, 보건복지부, 환경부, 해양수산부)의 생명공학 육성시책의 강구 등이다.
(나) 뇌연구촉진법
뇌연구촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성․발전시키고, 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 기여하기 위하여 1998년 6월「뇌연구촉진법」을 제정․운영하고 있다.
뇌연구촉진법은 뇌연구 촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성․발전시키고 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 기여함을 목적으로 하며, 주요 내용은 뇌연구촉진기본계획 및 연차별 시행계획의 수립, 뇌연구촉진심의회의 구성․운영, 뇌연구 투자의 확대, 5개 부처(교육인적자원부, 과학기술부, 산업자원부, 정보통신부, 보건복지부)의 뇌연구 촉진 시책 강구 등이다.
(다) 생명공학종합정책심의회, 뇌연구촉진심의회
생명공학육성기본계획을 수립하고, 그 집행 및 조정에 관한 업무를 담당하기 위하여 과학기술부장관 소속 하에 8개 부처 차관 및 민간전문위원으로 구성된 “생명공학종합정책심의회”(위원장 : 과학기술부장관)를 두어 생명공학에 대한 전반적 계획수립 및 조정을 하고 있다. 또한 뇌연구촉진 기본계획 수립, 예산확대방안, 뇌연구 인력개발 및 교류 등을 심의하기 위하여 과학기술부 소속 하에 과학기술부 차관이 위원장이며 4개 부처 국장 및 민간위원으로 구성된 뇌연구촉진심의회를 두어 뇌연구촉진법에서 위임된 사항과 그 시행에 관하여 필요한 사항을 규정함을 목적으로 뇌연구에 관한 중요사항을 심의․조정하고 있다.
(2) 한국생명공학연구원
과학기술부는 「유전공학육성법」에 근거하여 1985년 2월, 30명의 연구원으로 KIST 부설의 유전공학센터를 설립하여 유전공학연구를 본격적으로 지원 육성하기 시작하였으며, 1990년 12월에는 ‘KIST 부설 유전공학연구소’로 명칭을 변경하였다. 이후 「유전공학육성법」이 「생명공학육성법」으로 개정됨에 따라, 1995년 3월 ‘KIST 부설 생명공학연구소’로 명칭을 변경한 뒤, 1999년 5월에는 기초기술연구회 산하 ‘생명공학연구소’로 독립하였다. 그리고 2001년 1월 기초기술연구회 산하 ‘생명공학전문연구원’으로 승격하였고 현재는 정부출연연구소로 과학기술부에 소속되어 있다.
주요기능으로는 바이오신약, 바이오소재, 미래융합기술, 바이오정보 분야의 생명공학 첨단연구 및 기반기술개발보급 그리고 공공인프라 및 산․학․연 협력거점, 국가정책의 Think-tank로 산․학․연 및 정부에 대한 공공인프라지원서비스, 마지막으로 주요 연구 성과 기술이전, 첨단 바이오산업 전문 인력 양성 및 지원의 바이오산업화 지원이다. 2006년말 932명(정규직원 294명, 박사 188명)의 연구원 및 직원이 종사하며 총 예산은 약 875억원이다. 전북분원(2007년) 및 오창캠퍼스 내 바이오평가센터(2006년) 건립이 완료되어 생명공학 전문연구기관으로 위상을 제고하기 위해 노력 중이다.
(3) 생명공학육성기본계획 및 시행계획 수립
(가) 생명공학육성기본계획
과학기술부는 「생명공학육성법」 제4조에 근거하여 생명공학 분야의 효율적인 연구개발 촉진을 위하여 1994년부터 범부처적인 “제1차 생명공학육성기본계획(Biotech 2000, 1994~2006)”을 수립하여 시행하였고, 이어서 제2차 생명공학육성기본계획(Bio-Vision 2016, 2007~2016)을 수립하여 시행하고 있다.
동 기본계획(1994~2006)간의 추진 성과로 세계적 수준의 창조적 기초과학 성과가 창출되어 경쟁력이 제고 되었으며 이를 기반으로 산업․경제적 성과가 나타나는 시기로 진입하고 있다.
또한 동 기본계획 기간 동안 정부의 적극적인 육성정책에 따라 계획대비 93%의 정부 투자 실적으로 총 4조 3천억원(연 증가율 23%)을 투자하였으며, 생명공학 우수인력(석․박사) 배출은 1999년 6,700명에서 2006년 9,700명으로 증가하였다. 인적․물적 투자증대로 과학기술경쟁력 제고 및 산업성과 태동으로 SCIE논문 건수가 1994년(420건) 대비 2005년 4,089건으로 9.7배 증가하였으며, 미국에 등록된 특허건수도 1995년 11건 대비 2005년 52건으로 4.7배 증가하였다.
제2차 생명공학육성기본계획(Bio-Vision 2016, 2007~2016)은 기존사업의 확대 및 신규 사업 투자에 총 14조 2,881억원(국고)이 소요될 것으로 추정하였고, 생명공학 분야 세계 7위 기술 강국으로 진입을 목표로 하고 있다. 그리고 국내 산업화 시장(생산) 창출은 2016년에 60조원으로 급성장할 것으로 예상하고 있다.
위 계획은 과학기술부 주관으로 교육인적자원부․농림부․산업자원부․정보통신부․보건복지부․환경부․해양수산부 등 8개 부처가 공동 추진하고 있으며 추진체계[그림 3-1-2-1], 추진전략 및 실천과제는 [그림 3-1-2-2]와 같다.

출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006(생명공학정책연구센터 재가공)
|
그림 3-1-2-1 |
생명공학 육성 추진체계

출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006(생명공학정책연구센터 재가공)
|
그림 3-1-2-2 |
제2차 생명공학육성기본계획(Bio-Vision 2016) 추진전략과 실천과제
(나) 생명공학육성 시행계획 수립
과학기술부는「생명공학육성법」제5조에 근거하여 관계부처와 합동으로 생명공학육성기본계획에 따른 연도별 “생명공학육성 연도별 시행계획”을 매년 수립하여 시행하고 있다. 2007년도 시행계획은 과학기술부 등 8개 부처에서 총 8,515억원을 투입하여 생명공학, 보건의료, 농․축산식품, 산업공정/환경․해양, 바이오융합의 연구개발과 공공 R&D 인프라 구축을 위한 시설기반구축, 인력양성, 지원을 내용으로 하며 부처별 연구개발 투자실적 및 계획은 [표 3-1-2-1]과 같다.
|
표 3-1-2-1 |
부처별 연구개발 투자실적 및 계획
|
구 분 |
2007년 투자계획(백만원) |
2006년 실적 |
증감율 (%) |
|||
|
연구개발 |
시설 및 기반구축 |
인력양성 |
계 |
|||
|
교육인적자원부 |
27,900 |
|
34,500 |
62,400 |
60,900 |
3 |
|
과 학 기 술 부 |
235,328 |
11,922 |
|
247,250 |
232,463 |
6 |
|
농 림 부 |
84,072 |
600 |
500 |
85,172 |
88,679 |
△4 |
|
산 업 자 원 부 |
73,333 |
97,085 |
970 |
171,388 |
151,906 |
13 |
|
정 보 통 신 부 |
22,199 |
4,500 |
|
26,699 |
26,329 |
1 |
|
보 건 복 지 부 |
149,978 |
|
|
149,978 |
162,541 |
△8 |
|
환 경 부 |
22,179 |
|
|
22,179 |
22,478 |
△1 |
|
해 양 수 산 부 |
11,700 |
|
|
11,700 |
10,700 |
9 |
|
출 연 기 관 |
63,629 |
11,114 |
|
74,743 |
70,988 |
5 |
|
총 계 |
690,318 |
125,221 |
35,970 |
851,509 |
826,984 |
3 |
출처 : 2007 생명공학육성시행계획, 과학기술부, 2007
(다) 줄기세포연구 종합추진계획
정부는 줄기세포연구의 중요성을 인식하고 2002년 과학기술부 프론티어 사업으로 세포응용연구사업단을 출범하여 본격적인 연구를 지원하였다. 세계 각국은 범국가적 차원에서 줄기세포 분야를 집중지원하고 이를 기반으로 국가간 기술경쟁력을 확보하기 위한 노력을 경주하고 있으며, 이에 대한 대응으로 한국주도형 기술개발로 원천기술 선점을 통한 영역 확대와 경쟁력 제고 및 강력한 국가기반 확보를 위해 국가차원의 종합적인 추진계획을 수립하였다. 줄기세포종합추진계획은 “2015년 줄기세포 분야 글로벌 Top 3진입”이라는 비전 아래 줄기세포 분야에 대한 국가적 기술주도권 확보를 목표로 하여 원천기술 확보, 체계적 임상연구의 추진, 국가차원의 인프라 구축, 생명윤리 정착의 추진 전략 하에 4개 부처(교육인적자원부, 과학기술부, 산업자원부, 보건복지부)가 참여하는 계획이다.
다. 주요 연구개발 프로그램
(1) 특정연구개발사업
21세기 신(新)산업을 선도할 미래 원천․핵심기반기술 및 공공복지 기술 등의 전략적 개발을 통하여 국가 경쟁력 강화와 국민 삶의 질 향상에 기여하기 위한 연구개발 프로그램으로 1982년 처음 지원을 시작하였다. 현재 생명공학 분야의 지원 프로그램으로는 바이오기술개발사업, 21세기 프론티어 연구개발사업, 차세대 바이오신약․장기사업이 있으며 2007년에 약 1,440억원을 생명공학 분야에 지원하고 있다.
(가) 바이오기술개발사업
바이오 경제시대를 주도할 생명공학 분야의 원천기술 확보 및 바이오관련 연구 인프라 구축을 통해 과학기술경쟁력을 확충하기 위한 중장기 연구개발 사업으로 9개 분야 40여개 사업을 지원하고 있다. 바이오원천기술개발을 위해 신약타겟디스커버리, 바이오소재연구, 뇌연구, 노화제어연구, 오믹스연구, 바이오재생연구, 바이오인포메틱스, 바이오인터페이스 사업을 추진하고 2007년에 약 516억원을 지원하고 있으며, 바이오관련 연구 인프라의 체계적 구축으로 원천기술 확보 가속화 마련을 위해 생명자원등록활용사업, 생명공학종합정보 및 정책지원사업, 바이오안전성(LMO)평가사업 등에 2007년 87억원을 지원하고 있다.
(나) 21세기 프론티어연구개발사업
미래원천기술, 공공원천기술 중 강점 분야를 전략적으로 선택하여 세계 초일류기술을 확보하고 고부가가치 신산업 창출 기반 마련을 위한 장기 대형 연구개발 사업으로 10년간 매년 사업단별로 약 80~100억을 지원하고 있다. 현재 생명공학 분야 사업은 인간유전체기능연구, 자생식물이용기술개발, 작물유전체기능연구, 생체기능조절물질개발, 미생물유전체활용기술, 세포응용연구, 프로테오믹스이용기술개발, 뇌기능활용 및 뇌질환치료기술개발 등 8개 사업이 있으며 2007년에 677억원을 지원하고 있다.
(다) 차세대성장동력사업(바이오신약․장기사업)
소득 2만 달러의 선진경제로 도약하기 위해서 우리에게 강점이 있고 부가가치가 큰 바이오신약․장기 분야에 핵심제품을 개발하는 사업으로 핵심기술의 특허출원 및 제품화가 가능한 분야 위주로 최종목표와 사업범위를 구체화하여 추진하며, 장기복제이식기술개발, 단백질칩기술개발, 지능형약물전달시스템개발, 면역기능제어기술개발 등 4개 분야의 핵심제품을 개발하며 2007년에 160억원을 지원하고 있다.
(2) 기초생명공학육성사업
대학 등의 기초 분야 연구에 대한 지원 사업으로 특정기초연구지원, 창의적연구진흥사업, 기초의과학연구센터(MRC), 국가핵심연구센터(NCRC), 과학연구센터(SRC), 우수연구센터, 국가과학자지원사업, 국가지정연구실사업 등이 있으며, 2006년 생명공학 분야에 약 920억원을 지원하고 있다.
(가) 특정기초연구지원사업
생명공학 분야를 포함한 과학기술 전 분야(인접 인문사회과학 분야 포함)의 기초연구 및 학제 간 소규모 공동연구를 지원하여 탁월성 있는 역량강화를 위해 3인 내외의 연구원이 공동 수행하고, 우수연구인력 양성기반을 조성하기 위하여 1986년부터 시행하여 과제당 연간최대 1.5억원의 연구비를 최장 5년간 지원하는 사업이다. 2006년도 생명공학 분야에 약 340억원을 지원하였다.
(나) 창의적연구진흥사업
창조적인 원천기술개발과 우수연구 양성 및 출연기관 우수 연구 인력의 창의적 연구 활동의 안정적 지원으로 미래 신(新)산업 창출이 가능한 독자적 핵심원천 기술을 확보하고 창의적 연구문화 창출 및 세계적인 연구리더 육성 토대를 마련하기 위하여 1995년부터 시행하여 매년 5~8억원씩 9년간 지원하는 사업이다. 2006년도 생명공학 분야에는 약 102억원을 지원하였다.
(다)기초의과학연구센터
생명공학과 임상의학에 공동으로 활용 가능한 기초의과학 분야 중 대규모로 장기간 연구개발이 필요한 분야에 대한 연구개발 및 기초의과학 전공인력양성을 위한 거점을 설립․운영하기 위하여 2002년부터 시작하여 최장 9년간 3단계(2+3+4년)로 중간평가를 통해 지원하는 사업이다. 2006년도에는 생명공학 분야 17개 센터에 70.5억원을 지원하였다.
(라) 국가핵심연구센터사업
미래지향적 학제․융합 분야의 전문연구인력 양성과 연구개발, 교육 및 훈련의 실질적이고 적극적인 연계프로그램 개발․운영을 통해 국가차원의 전략적이고 필요한 미래지향적 과학기술 분야에서 세계수준의 지식 및 경쟁력을 창출할 수 있는 연구센터를 2003년부터 육성하고 있는 사업이다. 2006년 생명공학 분야에는 4개 센터에 약 47억원을 지원하였다.
(마) 우수연구센터
주요과학기술 분야에 있어 연구능력이 축적된 대학을 거점으로 산재한 우수 연구 인력을 특정 분야별로 조직화하여 선도적인 역할을 담당할 국제수준의 우수연구센터 육성을 목표로 세계적인 선도과학자 군으로 육성하기 위해 1990년부터 시행하고 있다. 2006년 생명공학 분야에는 37개 센터에 약 208억원을 지원하였다
(바) 국가과학자지원사업
세계 최고 수준의 연구를 지향하는 우수한 과학 기술인을 선정하여 자신의 연구를 심화 발전시켜 세계적인 연구업적을 올리고 국가경제와 과학기술발전에 크게 기여하기 위해 2006년부터 시행하고 있다. 2006년 생명공학 분야에는 2명의 국가과학자를 선정하고 30억원을 지원하였다.
(사) 국가지정연구실사업
국가지정연구실사업은 기술의 기반성․공공성을 유지하고 있는 소규모 연구실을 집중 지원하여 탁월한 연구실로 성장시킴으로써 산업경쟁력 향상에 기여하기 위한 중기사업으로 매년 연구실 당 2억원 내외를 5년간 지원하며, 2006년 생명공학 분야에는 142개 과제를 선정하여 121억원을 지원하였다.
라. 추진방향 및 발전과제
생명공학은 IT 혁명 이후, 세계 경제를 선도할 핵심 전략기술 분야이자 그동안의 인류 난제를 해결할 수 있는 분야로 더욱 주목받고 있다.
과학기술부는 우리나라 생명공학 육성의 주무부처로써 생명공학이 미래 국가경제성장의 원동력이 되고 인류가 건강하고 쾌적한 삶을 누릴 수 있게 하는 데 기여할 수 있도록 필요한 지원을 강화해 나갈 계획이다.
특히 고령화, 삶의 질 향상에 따라 의료수요 및 건강에 대한 관심 증대, 연구성과의 상업화 요구, 한․미 FTA 체결 등 생명공학 분야의 환경 변화에 대응하여 신약개발 등의 의약․의료 분야에 대한 투자를 확대해 나갈 계획이다. 이를 위해 현재 질환별 글로벌 신약후보물질 도출 사업을 준비하고 있다.
또한 현재의 약물요법 및 수술요법 등으로는 치료가 불가능한 난치병의 근원적인 해결 가능성을 제시하고 있는 줄기세포 분야의 지속적 육성을 통해 원천기술을 확보해 나갈 계획이며, 줄기세포은행 등 연구기반 구축을 위한 인프라 확충에도 힘써 나갈 예정이다.
아울러 뇌졸중, 파킨슨병 등 퇴행성 뇌질환의 증대, 뇌 중심의 융합기술 위주로 연구 패러다임 변화 전망 등에 따라「제2차 뇌연구촉진기본계획」에 기반하여 태동기 연구 분야인 뇌연구를 지속 지원해 나갈 계획이다. 특히 향후 국가 뇌연구를 종합적으로 이끌고 뇌융합기술개발을 선도해 나갈 국가 뇌연구기관의 설립을 준비하고 있다.
한편, 과학기술부는 바이오 경제의 씨앗이자 막대한 시장창출 잠재력을 보유한 잠재적 고부가가치 자원으로 각광받고 있는 생명연구자원의 효율적 확보․관리 및 활용을 촉진하기 위하여「생명연구자원의 확보․관리 및 활용에 관한 법률」제정을 추진하고 있다. 산발적으로 관리되어 온 생명연구자원 분야의 법․제도적 기반 확충을 통해 생명공학 연구의 중요한 소재인 생명연구자원이 효율적으로 활용되고 국가적 자산으로 관리될 수 있을 것으로 기대된다.

가. 바이오산업의 정의와 분류
(1) 정의
바이오산업(Biotechnology Industry)은 DNA․단백질․세포 등 생명체 관련 기술(Biotechnology)을 직접 활용하여 제품(바이오의약품․바이오디젤 등) 및 서비스를 생산하는 산업이다.
현대 생명공학기술을 이용하여 기존 의료․농림수산․식품 등의 산업군에서 화학․에너지․전자․서비스 등 다양한 산업군과의 접목을 통한 새로운 개념의 제품이 창출되는 성장 단계의 산업군이라 할 수 있다.
(2) 바이오산업의 분류
응용되는 생명공학기술에 따라 크게 의약(Healthcare) 바이오(Red Bio18)), 농업(Agriculture) 바이오(Green Bio19)) 및 산업(Industry) 바이오(White Bio20))로 구분이 가능하며, 전통적인 의약산업에서 농업을 거쳐 산업바이 분야로 나아가는 추세이다.
우리나라는 통계 등의 목적을 위해 산업자원부가 바이오산업의 범위를 생물의약, 생물화학, 바이오식품, 생물환경, 바이오에너지 및 자원, 생물전자, 생물공정 및 기기, 생물검정․정보개발서비스 및 연구개발 등 8개 부문으로 분류하고 있다.
나. 바이오산업 육성을 위한 산업자원부의 주요 시책
산업자원부는 국내 바이오산업의 경쟁력 제고를 위해 바이오산업을 Post-IT 시대의 국민경제 성장엔진으로 육성하고 2015년 생산 60조원, 수출 250억 달러를 달성하여 바이오 7대 강국으로 성장한다는 비전을 책정하였다.
또한 이를 달성하기 위해 산업화가 가능한 핵심기술을 선점하고, 선진국 수준의 인프라를 구축하며, 글로벌 네트워크를 강화하고, 바이오 지원 제도를 정비하는 등의 4대 발전전략을 추진할 예정이다.
(1) 산업화 가능 핵심기술 선점
최근 산업자원부는 “바이오 전략기술개발” 체제로 바이오산업 R&D 구조를 개편, 정부 주도로 바이오산업의 선진화 체제 구축을 위해 중점 지원이 요구되는 생명공학 분야 기술군(의약․산업바이오 등)을 선정하여 Top-down 방식으로 전략적인 개발을 추진할 계획이다.
기존 기술개발 과제를 점검․평가하여 통폐합 등 구조조정을 추진하며, 기반 조성․인력양성․특허․표준 등 기술특성에 맞는 패키지형 지원이 이루어질 예정이다.
|
표 3-1-3-1 |
바이오 전략기술개발사업 중점 추진 분야
|
중점 추진 분야 |
세 부 추 진 계 획 |
|
의약 바이오 (Red BT) 개발기술 |
□ 재조합 생물의약품 (단백질, 항체, 백신, 유전자) □ 재생의학제품 (세포/조직치료제, 인공장기) □ 고효율 의약품 (약물전달시스템, 개량신약) □ 의약 바이오제품 산업화 개발기술 |
|
산업 바이오 (White BT) 개발기술 |
□ 환경친화형 바이오폴리머 개발기술 □ 석유대체 바이오리파이너리(Biorefinery) 개발기술 □ 기능성 바이오소재 (식품, 화장품, 생물자원 등) |
|
융합 바이오 (Fusion BT) |
□ 생체신호 진단기기 개발 (칩, 바이오정보 등) □ 바이오장비 제작 (시료제조, 분리장비, 세포공학) |
|
생산기반기술 |
□ 바이오제품 생산기반 (인력, 시료제조기반 등) |
출처 : 산업자원부 자체자료, 2007
(가) 바이오스타 창출을 위한 연구개발 프로젝트 추진
특기할만한 R&D 사업은 “Bio-Star 프로젝트”로, 전 세계 챔피언급의 글로벌 스타 제품 개발을 통한 선도 기업의 세계시장 성공사례를 제시하기 위해 2005년 신규 사업으로 추진하였다.
동 사업은 의약품 개발의 산업화 단계인 전임상 및 임상초기에 대한 비용을 지원(과제당 연간 10~15억원)하여 국내 신약 창출의 가능성을 제고하며, 2005년 5개 과제, 금년 4개 과제를 선정하여 총 9개 과제를 지원하고 있다.
(나) 친환경 화석연료 대체기술인 산업 바이오 발전 시책 추진
최근 화학 산업 주원료인 석유자원 고갈․유가 급등․환경규제의 심화 등으로 화석연료 대체기술인 산업 바이오 분야가 주목받고 있으며, 바이오 화학제품 생산기술 및 핵심역량 제고를 위해 바이오매스로부터 바이오에너지 및 화학제품을 제조하는 과정인 바이오 리파이너리 파일롯플랜트(Biorefinery Pilot-Plant)를 구축하여 시범 운영할 예정이다.
(2) 선진국 수준의 인프라 구축
태동기 단계인 국내 바이오산업의 도약을 위해 선진국 수준에 부합한 산업화 기반 구축, 바이오 클러스터 조성 및 전문 인력 양성 등을 중점 지원할 예정이다.
(가) 산업화 기반을 위한 인프라 구축
① 생물산업기술실용화센터 건립 및 운영
현재 국내에는 선진시장 진출을 위한 바이오의약품 생산시설이 전무한 실정으로, 바이오기업의 시설 공동 활용 및 수출산업화 촉진을 위해 미국 FDA의 cGMP (current Good Manufacturing Practice) 기준에 적합한 바이오의약품 위탁생산시설(CMO, Contract Manufacturing Organization)을 건립하였다.
동물세포배양라인과 미생물발효라인이 위치한 cGMP동과 QC/QA 등을 진행하는 non-GMP 동으로 이루어진 생물산업기술실용화센터는 1998년 인천 송도에 건립을 시작하였으며, 2005년 건물 완공, 2007년 Validation(유효성 검증)을 완료하여 2008년부터 상업 생산을 개시할 예정이다.
② 선진국 모델 기반 구축을 위한 표준화 추진
2002년부터 생명공학기술 및 제품이 표준화 사업을 추진하여 바이오산업 표준산업 분류, 용어 표준화, 바이오산업 표준화 기술지도(Roadmap) 및 지침 등을 마련하였다. 또한 중소기업 등이 선진국 수준의 CMO를 원활하게 이용하고 향후 국내 기준의 업그레이드를 위하여 cGMP 용어 표준화, 품질관리시스템 운영절차 표준문서 발간 등 cGMP 표준화 기반 마련을 추진 중에 있다.
(나) 지역 특성화 사업과 연계된 바이오클러스터 중점 육성
산업정책 차원에서 9개 바이오벤처기업지원센터(BVC)와 지역균형발전 차원에서 19개 바이오지역특화센터의 설립이 경쟁적으로 진행되고 있으며, 이의 구심점 역할을 위한 코리아 바이오허브(Korea Bio-Hub) 구축을 통해 전국 28개 바이오센터를 네트워킹하고 산업화 지원에 적극적으로 노력할 전망이다.
|
표 3-1-3-2 |
28개 지역 바이오센터 구축 현황
|
지역 |
성격 |
품목 |
종료 |
지역 |
성격 |
품목 |
종료 |
||
|
강원 |
춘천 |
BVC |
의약 |
2002 |
전남 |
화순 |
지역센터 |
백신 |
2008 |
|
지역센터 |
바이오 |
2007 |
장성/곡성 |
지역센터 |
생물 |
2008 |
|||
|
강릉 |
지역센터 |
해양 |
2007 |
경북 |
상주 |
BVC |
식품 |
2005 |
|
|
충북 |
영동 |
BVC |
식품 |
2005 |
울진 |
지역센터 |
해양 |
2007 |
|
|
오창 |
지역센터 |
보건의료 |
2007 |
안동 |
지역센터 |
건강산업 |
2007 |
||
|
제천 |
지역센터 |
전통의약 |
2007 |
대구 |
1 |
지역센터 |
식품 |
2008 |
|
|
충남 |
논산 |
지역센터 |
동물자원 |
2007 |
2 |
지역센터 |
한방 |
2008 |
|
|
대전 |
1 |
BVC |
의약 |
2003 |
경남 |
진주 |
BVC |
화학소재 |
2003 |
|
2 |
지역센터 |
바이오 |
2007 |
진주 |
지역센터 |
화학소재 |
2008 |
||
|
전북 |
전주 |
BVC |
식품 |
2003 |
부산 |
1 |
BVC |
해양 |
2003 |
|
전주 |
지역센터 |
식품 |
2007 |
2 |
지역센터 |
해양 |
2008 |
||
|
전남 |
나주 |
BVC |
생물 |
2003 |
제주 |
1 |
BVC |
식품 |
2005 |
|
나주 |
지역센터 |
식품 |
2007 |
2 |
지역센터 |
향장 |
2007 |
||
|
화순 |
지역센터 |
농업 |
2007 |
경기 |
판교 |
BVC |
의약 |
2010 |
|
출처 : 산업자원부 자체자료, 2007
(다) 생명공학 분야 전문 인력 양성
① “현장 맞춤형”인력 양성 프로그램 지원
바이오산업 연구개발 인력은 그 수가 꾸준히 증가하고 있으나 생산시설, 특히 선진국 기준의 시설 경험자가 절대적으로 부족한 상황이므로 기업 및 지역 특성에 적합한 수요 지향적 전문 인력 양성을 위한 “현장 맞춤형” 인력 양성 프로그램을 지원 중이다.
바이오전공 미취업자를 위한 현장 전문 연수교육 및 특성화 지역 기업에 적합한 현장실습 중심 인력 양성 프로그램을 추진하고 있으며, 내년부터 국내 유일의 cGMP 시설인 생물산업기술실용화센터를 이용한 cGMP 현장교육을 실시할 계획이다.
② 해외 기술 습득 및 교류 촉진을 위한 인적 네트워크 구축
해외 한인 생명공학 과학자 네트워크(KASBP21))를 활용하여 매년 기술협력 컨퍼런스 등을 개최하고 있으며, 선진 생명공학 전문기관․교육시설 등과의 인력교류 협력 프로그램 등을 추진하고 있다.
(3) 글로벌 네트워크 강화
(가) 적극적 해외마케팅 전략 수립 및 투자 유치 활성화 방안 마련
“의료산업 해외마케팅 센터”를 이용하여 해외 각국별 의약품 현지 인증체계 및 수출절차 등을 조사, DB를 구축하는 한편, 수출 희망 기업에 정보를 제공하고 현지 컨설팅 비용을 일부 지원하여 수출 네트워크 활성화를 추진할 예정이다.
또한 개발기술의 산업화 및 기술이전 등을 촉진하기 위한 수요자와 공급자간 중개의 장(의약품 거래장터)을 마련하고, 해외 바이오 클러스터와의 교류 및 협력 사업을 수행할 계획이며, 유수의 다국적 제약회사와 국내 기업간 네트워크 구축으로 상호 licensing-in/out 활성화를 촉진할 계획이다.
아울러 국내 바이오산업 저변 확충을 위해 적극적인 외국인 투자 유치를 모색 중인 바 KOTRA22), 지자체, 유관기관 등이 참여하는 T/F를 구성하였다. 그리고 Bio Korea 및 국제박람회 등을 기회로 국내 인센티브제도 소개 등의 적극적인 투자 유치 활동을 전개하였다.
(나) 국제협약의 효과적 이행 체계 구축
생물작용제의 제조․보유, 수출입 등을 규율하는 「생물무기금지협약」 및 유전자변형생물체의 국가간 이동 등을 규율하는 「바이오안전성의정서」의 효과적인 국내 이행, 이를 위해 관련 국내 법․제도를 마련하고 홍보를 강화하는 한편, 국제 동향 파악 및 상호 간에 정보 교류를 위한 당사국 총회 참석 등 해외 활동도 본격화할 전망이다.
(4) 바이오 지원 제도 정비
바이오산업은 부처별 역할 분담을 통한 전주기적 지원체제를 구축하고 있으나 장기간(약 15년) 집중 투자가 필요한 바이오산업 특성을 감안할 때 산업화 단계의 제도적 뒷받침이 필요하다고 판단된다. 특히 바이오산업의 분류 체계가 통일되어 있지 않아 자원의 효율적인 투자 및 체계적인 성과 관리가 미흡한 형편이다.
산업화 단계 지원을 위하여 성공시 원리금 및 특별 부담금을 부담하나, 실패할 경우 원리금을 대폭 감면․면제하는 “성공불융자 제도”의 도입을 검토하고 있으며, 단일화된 국내 통계 자료 작성 등을 준비 중이다.
다. 생명공학육성과 산업자원부
그동안 국내 바이오산업은 연 28% 정도의 고속성장을 해왔으나, 선진국에 비해 핵심원천기술의 미확보와 기업의 영세성, 선도기업의 부재, 기술개발 성과물의 산업화 미흡 등 가시적 성과가 적어 미래 성장가능성에 비해 아직 산업으로서의 위상이 취약한 상황이다.
다만 인구의 고령화, 생명공학기술의 혁신적 발전 등으로 거대 시장이 도래할 전망이며, 우수한 인력 등을 보유한 국내 현실을 감안할 경우 선진국간 격화된 경쟁에서도 생존할 수 있는 여건이 조성되어 있다고 하겠다.
앞서 언급한 2015년 생산 60조원, 수출 250억 달러를 달성하여 바이오 7대 강국으로 성장하기 위하여 산업자원부는 바이오산업 연구개발 및 인프라 구축에 적극적인 지원을 할 방침이다.

가. 생명공학 분야 기초과학진흥
(1) 필요성
최근 유전체학/단백질체학 및 세포체학/대사체학 연구 등에서 급속한 진전을 보이고 있는 생명공학은 우리의 미래 생활에 큰 변화를 예고하고 있다. 기초과학을 응용한 개인별 유전적 특성을 고려한 의약품 개발 및 진단․세포/유전자 치료법 개발 기술, 유전체 대량 분석과 정보를 활용한 난치병 예방, 진단 및 치료법 개발 기술, 세포 치료제 개발 기술로 인해 많은 질병이 퇴치되고 수명이 연장되고 있다. 이러한 생명공학의 성과는 생물학, 생화학, 생리학, 생물물리학 등 관련 기초과학의 다양한 실험 기술의 성과에서 기인한 것으로 관련 분야의 기초과학 발전이 있었기에 가능한 것이었다. 아울러 뇌기능 조절 메커니즘 규명, 뇌기능 향진 기술 개발, 뇌질환 관련 치료제 및 치료기술 개발의 발전에 힘입어 고령화 사회에 따른 실버산업 활성화 등 기술적, 사회적, 경제적 파급효과가 클 것으로 기대되며, 융합과학의 발전 추세에 따라 21세기 바이오 경제를 주도하여 미래의 국가 경제를 선도할 분야 중 하나이다.
이에 따라 제2차 생명공학육성기본계획(Bio-Vision 2016)에서는 건강한 “생명 중심 사회”와 “풍요로운 바이오 경제” 구현을 비전으로 과학기술 논문 창출과 특허 기술 경쟁력을 2005년 각각 13위와 14위에서 2016년에는 세계 7위라는 목표를 세웠으며, 이를 위해 1) 국가 생명공학 육성 추진계획 혁신, 2) 연구개발 선진화 기반 확충, 3) 바이오산업의 발전 가속화 및 글로벌화, 4) 법/제도 정비 및 국민 수용성 제고 등의 4대 전략을 수립하였다.
(2) 기초과학 진흥 추진 현황
2002년 OECD Frascati Manual에 기초연구의 개념이 기술된 바 기초연구란 관찰 가능한 현상과 사실들의 기저에 놓여 있는 근본 원리에 대한 새로운 지식 획득을 목적으로 수행되는 실험적 혹은 이론적 작업이라 정의하였다. 순수 기초연구는 자연현상의 원리 규명을 통해 새로운 창조적 지식을 획득하는 연구이며, 목적 지향적 기초연구는 미래의 광범위한 응용을 위하여 원천지식의 토대를 산출하는 연구라고 정의하였다.
이에 비해 응용연구는 이미 알려진 지식을 심화․발전시켜 특정 문제를 해결하거나 특정 상황에 적용하여 활용하는 연구로 연구가 성공적으로 이루어져 기대하는 결과(물)를 얻을 경우, 그 결과(물)가 적용될 수 있는 분야가 확실한 연구라 하였으며, 개발연구란 실용적이고 유통 가능한 (시)제품, 물질, 장치 또는 제품의 공정 과정을 개발하기 위한 연구라 정의하였다.
2004년 과학기술부에 “과학기술혁신본부” 설치 및 부총리급 격상에 따라, 정부간 합의를 거쳐 기존 과학기술부에서 추진하던 기초연구 사업을 3개 유형으로 나누어 순수 기초연구와 기초과학기반구축사업은 교육인적자원부에서 주관하고 목적 기초연구는 과학기술부에서, 응용 연구 부분에 대하여는 산업자원부와 정보통신부에서 주관하도록 조정하였다. 이와 더불어 교육인적자원부는 대학연구의 제도 및 기반을 구축하고 대학의 우수 연구 인력양성 지원 사업을 하도록 학술진흥 및 학자금대출 신용보증 등에 관한 법률 시행령 제5조에 명시하였다.
이에 따라 교육인적자원부는 기초연구에 대한 정책 변경 및 예산편성 기준을 존중하여 정책결정 및 예산편성을 하고 있다. 그러나 최근 교육인적자원부와 과학기술부간 일부 사업 중복에 대한 논란이 발생하고 있는 바, 학술연구와 기초연구의 차이에 대한 인식 변화가 필요하다. 학술 진흥 및 학자금대출 신용보증 등에 관한 법률에 의거, “학술”이라 함은 모든 학문 분야 기초과학과 응용과학을 말하며(제2조 1항), 교육인적자원부장관은 학술 진흥을 위한 정부의 종합계획과 그 기본시책을 수립하고, 이에 수반되는 업무를 종합적으로 조정․관리하도록 규정되어 있다.
정부는 기초과학연구의 진흥을 위한 여건 조성을 위하여 기초과학연구에 관해 1) 대학교수, 박사 후 연구원 등 관계 전문가의 연수 및 연구비 지원, 2) 석사 및 박사과정 학생의 연구 장학금 지원, 3) 연구교수(연구조교포함)제도, 교수의 연구휴가제도, 객원교수제도 및 객원연구원제도의 활용, 4) 대학의 연구시설 및 기자재 지원, 5) 대학부설연구소 및 우수 연구 집단 형성 지원, 6) 대학, 국공립연구소, 정부출연연구소 및 기업부설연구소와의 공동연구 추진 등 산업계, 학계 및 연구소간 교류 촉진, 7) 기업의 대학 기초과학 연구 활동 지원 추진 8) 기타 연구 환경 조성 및 연구기반 구축에 필요한 사항 등을 강구하도록 기초과학연구진흥법 제9조에 규정하고 있다.
이에 따라 교육인적자원부에서는 기초학문(인문사회 분야, 기초과학 분야)의 균형적인 육성을 통한 대학교수의 기초 연구 역량 강화와 대학원생 연구 능력 함양을 제고하고, 기초연구 인프라를 구축하고자 1963년부터 학술연구 조성사업을 추진해 오고 있다. 이러한 학술연구조성사업의 지원 사업 중 과학기술 분야와 관련된 기초과학 학술연구조성사업은 1) 우수기초연구지원사업, 2) 학술기반구축사업, 3) 특정목적사업, 4) 국제교류사업 등 크게 4개군으로 나뉘어 추진하고 있다.
(가) 우수기초연구지원사업
교육인적자원부에서는 한국학술진흥재단을 통하여 우리나라 연구력의 근본이라 할 수 있는 기초연구를 중점 지원하고 있다. 이에 따라 개인 또는 소규모 공동연구 중심의 기초연구를 지원하여 국가 연구 역량 토대를 구축하고 국제적 수준의 연구 결과를 도출하여 국가 사회 발전과 학문의 발전을 도모할 수 있도록 지원하고 있다. 이 사업은 박사 후 국내외 연수부터 신진교수, 중진교수 및 연구업적이 탁월한 우수학자까지 생애주기(life cycle)에 따라 연구자를 지원하는 학술진흥연구 사업이다. 한국학술진흥재단은 자연과학단, 공학단, 생명공학단 및 일부 복합학단에서 생명공학 분야 연구 과제를 지원하고 있다. 특히 생명공학단에서는 의학, 치의학, 수의학, 한의학, 약학, 보건학, 간호학 분야, 농수해양 분야, 생물학 전반 및 화학 분야의 생화학 분야를 지원하고 있다.
|
표 3-1-4-1 |
2007년도 우수기초연구지원사업
|
사업구분 |
지원대상 |
지원 분야 |
지원규모(억원) |
|
학문후속세대양성지원 |
박사후 연수 5년 이내 |
이공계 전 분야 |
164 |
|
신진교수연구지원 |
교수임용 후 5년 이내 |
이공계 전 분야 |
205.25 |
|
기초연구과제지원 |
우수연구자(개인 및 공동) |
이공계 전 분야 |
612 |
|
우수학자지원 |
우수업적 연구자 |
수학, 물리, 지구과학, 화학, 생물 |
72 |
출처 : 2007년도 학술연구조성사업 기본계획, 교육인적자원부
(나) 학술기반구축사업
대학연구소 전문화 및 특성화를 위해 대학부설연구소를 지원하는 중점연구소지원사업과 국제적 수준의 권위 있는 학술회의 개최나 학술지 발행비 지원을 하는 학술단체지원사업이 있다. 중점연구소지원사업은 과학재단의 우수연구센터(SRC / ERC)와 달리 기존에 존재하던 각 대학의 연구소가 세계적 수준으로 발돋음 할 수 있도록 기반 구축을 도와주기 위한 인력양성사업이다. 즉 연구 사업을 위해 연구단을 구성하는 우수연구센터(SRC / ERC)와 달리 이미 대학에 존재하던 연구소를 대상으로 하며, 사업이 종료한 후에도 해체되지 않고 자립할 수 있는 여건을 만들어주기 위한 사업이다. 2007년 현재 생명공학단 소관 중점연구소는 39개 중점연구소로 보건의료 분야 17개, 농수해양 분야 10개, 생명공학 분야(생물) 12개이며, 2007년도 학술단체 지원액은 인문․사회 분야를 포함하여 80.82억원이다.
(다) 특정 목적사업
기업 또는 연구소의 자체 기술력으로 해결하기 곤란하거나 아웃소싱 하고자 하는 문제를 대학의 이공계 분야 석․박사 과정생이 지도교수와 함께 해결하도록 하고, 이 과정을 통해서 문제 해결형 인력 양성을 목적으로 하는 문제해결형인력양성지원사업(79억원), 지역대학의 우수한 연구자의 창의적이고 다양한 연구 활동을 지원하여 지역의 과학기술 역량제고 및 지역 경제 발전에 이바지하도록 하는 지역대학우수과학자지원사업(104억원), 여성과학자들의 연구지원을 통해 여성연구자들의 연구력 강화를 도모하는 여성과학자지원사업(70억원), 우수여성과학기술자와 초중고, 대학의 여학생간 연계체제를 통하여 우수여성과학기술자의 전문지식, 가치관 등을 여학생들에게 전수하고 과학기술 분야로 진출을 유도하는 학술성과확산지원사업(20억원), 남북학술자간 공동연구 및 학술대회 활성화를 위한 남북학술교류지원사업(2억원)이 있다.
(라) 국제교류사업
국내 이공계열 신진교수, 대학(원)생, 연구원들이 해외 우수대학 및 연구기관에서 해외연수 및 연구에 참여할 수 있도록 지원하여 과학기술의 국제화를 선도하는 국제공동연구지원사업(38억원)과 해외 고급과학기술인력 유치 활용을 지원하여 국내 취약 연구 기술 인력의 보강 및 해외 원천 핵심기술 획득을 목적으로 하는 국제연구인력교류사업(92억원)이 있다.
나. 생명공학 분야 인력 양성
(1) 추진현황
21세기 신(新)성장산업으로 부상하고 있는 바이오 경제의 국가경쟁력을 확보하기 위해서는 우수한 생명공학 기술 인력을 확충하여 원활히 공급해 주는 것이 핵심과제라 할 수 있다.
|
표 3-1-4-2 |
국내 생명공학 분야 졸업자 현황
(단위 : 명)
|
구 분 |
학 사 |
석 사 |
박 사 |
|
2001 |
29,759 |
5,539 |
2,011 |
|
2002 |
29,590 |
5,943 |
2,023 |
|
2003 |
30,471 |
6,262 |
2,345 |
|
2004 |
28.988 |
6,702 |
2,525 |
|
2005 |
30,652 |
7,028 |
2,654 |
출처 : 교육통계서비스시스템, 국가교육통계정보센터(http://std.kedi.re.kr)
(가) 국가전략 분야 인력양성추진
시대적 요청에 따라 2001년 국가전략 분야로 선정하여 범부처 공동으로 인력양성사업을 수립․시행해 오고 있다. 교육인적자원부의 제2단계 BK21사업과 지방대학 혁신역량강화사업이 대표적인 인력양성사업이다. 제2단계 BK21(2006∼2012년)사업의 경우 생명공학 관련으로 21개 전문서비스(의치의학) 사업단, 과학기술(기초) 분야 14개 사업단과 31개 사업팀, 과학기술(응용) 분야 48개 사업단과 81개 사업팀을 지원하고 있으며, 교수 3,188명, 석사 5,222명, 박사 2,805명 및 전문 서비스과정 대학원생 9,530명이 참여하고 있다.
|
표 3-1-4-3 |
2006년 생명공학 분야 BK21 지원 현황
|
대분류 |
소분류 |
사업단 (팀) |
참여인력(사업선정 시 현황, 명) |
국고지원금 (억원) |
|||
|
교수 |
석사 |
박사 |
대학원생 |
||||
|
전문서비스 (의치의학) |
사업단 |
21 |
1,501 |
- |
- |
9,530 |
170.51 |
|
과학기술 (기초) |
사업단 |
14 |
309 |
986 |
694 |
1,680 |
157.48 |
|
사업팀 |
31 |
141 |
327 |
109 |
436 |
58.70 |
|
|
과학기술 (응용) |
사업단 |
48 |
865 |
3,084 |
1,718 |
4,082 |
415.60 |
|
사업팀 |
81 |
372 |
825 |
284 |
1,109 |
148.54 |
|
출처 : 1차년도 BK21사업 연차보고서, 2007. 3
국제 서비스 시장 개방 등에 대비하여 Global standard에 맞는 의학, 치의학 분야 고급 전문 인력 양성을 목적으로 한 의치학전문대학원 BK21사업 참여 대학은 의학 계열 17개 사업단과 치의학 계열 4개 사업단이 선정되어 의생명공학 분야에 기여를 할 수 있게 되었으며 향후 MD/DDS-Ph.D 프로그램을 운영하여 보다 전문적인 의과학자 양성을 하게 될 것이다.
또한 수도권 집중을 완화하고 국가균형발전 추진을 위해서 지방대학 육성이 필수이며, 지방대학 중심의 세계적인 지역 혁신 전략에 의해 2004년에 시작된, 지방대학 혁신역량강화사업인 누리사업 중 생명공학 분야는 강원지역 5개 사업단, 부산/경남지역 2개 사업단, 대전/충청지역 3개 사업단, 대구/경북지역 3개 사업단, 광주/호남지역 4개 사업단에 316.39억원을 지원하였다.
|
표 3-1-4-4 |
2006년도 생명공학 분야 누리사업 지원현황
|
권역 |
사업단 수 |
지원액 (억원) |
참여교수 (명) |
학사과정 (명) |
석사과정 (명) |
박사과정 (명) |
|
강원 |
5 |
103.32 |
190 |
4,507 |
280 |
105 |
|
부산/경남 |
2 |
71.62 |
212 |
4,592 |
193 |
76 |
|
광주/호남 |
4 |
54.43 |
257 |
4,997 |
225 |
128 |
|
대전/충청 |
3 |
76.50 |
287 |
5,923 |
257 |
160 |
|
대구/경북 |
3 |
10.52 |
287 |
5,232 |
49 |
9 |
|
합 계 |
17 |
316.39 |
1,233 |
25,251 |
1,004 |
478 |
출처 : 누리사업 성과자료집, 2006, 12
(2) 문제점 및 개선방안
그동안 정부의 생명공학 기술투자는 지속적으로 증가되었으며 2006년도 예산지원은 8,021억원으로 전년 대비 19.1% 증가하였으며, 분야별로는 생명공학 분야 2,253억원(29.9%), 보건의료 분야 2,662억원(33.8%), 농축산․식품 분야 1,757억원(20.7%), 산업공정/환경․해양수산 분야 474억원(9.1%) 및 바이오융합 분야 875억원(6.5%)이었다. 이러한 수준은 아직까지는 선진국과 비교하여 볼 때 절대적으로 투자규모가 미흡하다고 할 수 있다.
연구 인력의 공급에 있어 유전체학, 단백질체학, 생물정보학, 구조생물학 등 생명공학기술 관련 첨단기술 분야 연구 인력은 2010년 3천여 명이 필요할 것으로 예상되나, 이에 대한 공급은 1/3 수준으로 추측되어 공급 부족 현상이 심화될 것으로 예측되고 있다. 2004년도 바이오산업 분야 종사자 인력은 연구인력 6,608명, 생산인력 5,530명, 총 12,138명으로 생명공학 분야 전문 인력 규모를 정량적으로 비교할 경우 미국의 1/3 수준에 불과하다. 또한 바이오 벤처산업의 급속한 증가에 비해 생산기술 전문 인력은 크게 부족할 전망이다. 따라서 정부는 향후 예산 편성시 중점 신규투자 분야, 차세대성장동력사업 등의 생명공학 분야에 대한 투자 규모 확대를 위하여 적극적인 예산반영과 인력 양성을 위해 시장 수요와 산업 발전을 선도할 수 있는 핵심기술 분야 고급인력 양성에 주력하는 등 인력 양성사업에 대한 사회적 인식 제고와 정부의 지속적인 지원 강화가 필요하다 하겠다. 이런 관점에서 교육인적자원부에서 인적자원정책본부를 설치하여 국가인적자원에 대한 종합적인 정책을 수립하는 것은 뜻있는 일이라 하겠다.

가. 농림생명공학 추진배경
농림업의 국제경쟁력이 토지, 노동, 자본과 같은 전통적인 투입요소의 효율적 활용에 의해 결정되었던 것과 달리, 근래에는 기술, 지식, 정보와 같은 새로운 투입요소가 경쟁력을 좌우하고 있다. 최근 생명공학기술의 발달과 더불어 “이제 농림 분야에서도 신(新)성장동력 창출의 핵심수단은 농림생명공학”이라는 인식이 확산되고 있다.
농림생명공학기술은 농생물자원을 이용한 고품질․안전농축산물 생산, 유전자변형 작물 개발 및 안전성 연구, 가축 형질전환 및 복제, 농생물유전체 연구, 친환경 농자재 및 기능성 식품 생산, 동물 질병 예방․진단․위생 관련 기술 등, 그 적용범위가 매우 다양하다.
농림생명공학기술은 연구개발 및 산업화 과정을 거쳐 농림바이오 상품으로 개발되어 농림업의 생산성 향상은 물론 잠재실업률이 높은 농림업인의 소득 향상에도 기여하게 된다.
이러한 농림생명산업 분야에 대한 수요는 최근 급격한 증가 추세에 있으며, 정부에서도 이에 대한 중요성을 인식하고 농림바이오산업을 국가의 기간산업으로 육성하기 위한 다양한 정책을 추진하고 있다.
나. 생산규모
2005년도 기준, 농림생명공학 관련 산업의 생산규모는 국내 생명공학 관련 산업 생산규모(2.7조원)의 48%인 1.3조원 수준이다. 주요 상품으로는 바이오식품이 86%를 차지하여 주종을 이루고 있으며, 기타 동물약품, 생물농약 및 비료, 유전자변형 동식물, 실험동물 등이 제품화되어 생산되고 있다. 생산품 중 약 65%(8.7천억원)는 수출되고 있으며, 주요 수출품 역시 현재까지는 바이오식품 분야가 주종을 이루고 있다.
|
표 3-1-5-1 |
농림바이오산업 생산규모(2005)
(단위 : 억원)
|
구 분 |
제 품 |
생산규모 |
|||
|
국 내 |
수 출 |
계 |
비중(%) |
||
|
생물의약 |
동물약품 |
684 |
104 |
788 |
5.9 |
|
생물화학 |
생물농약 및 비료 |
353 |
3 |
356 |
2.7 |
|
바이오 식품 |
건강기능식품 |
794 |
50 |
844 |
6.3 |
|
발효식품 |
120 |
21 |
141 |
1.0 |
|
|
아미노산 |
383 |
5,750 |
6,133 |
45.9 |
|
|
식품첨가물 |
536 |
2,642 |
3,178 |
23.8 |
|
|
사료첨가제 |
1,090 |
19 |
1,109 |
8.3 |
|
|
기타 바이오식품 |
48 |
- |
48 |
0.3 |
|
|
바이오에너지 및 자원 |
인공종자 및 묘목 |
6 |
- |
6 |
0.1 |
|
실험동물 |
82 |
8 |
90 |
0.7 |
|
|
유전자변형동식물 |
5 |
- |
5 |
0.1 |
|
|
생물공정 및 기기 |
생물반응기 |
37 |
22 |
59 |
0.4 |
|
생물공정 및 분석기기 |
341 |
75 |
416 |
3.1 |
|
|
생물정보 개발서비스 |
생물정보서비스 |
13 |
1 |
14 |
0.1 |
|
바이오안전성 및 생리활성 평가서비스 |
166 |
13 |
179 |
1.3 |
|
|
계 |
|
4,658 |
8,708 |
13,366 |
100 |
출처 : 2006 한국바이오산업협회 발간자료 재작성
다. 육성현황
농림 분야 생명공학 육성은 주로 기술개발 및 인프라 구축을 통해 이루어진다. 이를 위해 제1차 생명공학육성기본계획(Biotech 2000)이 추진된 1994∼2006년까지 지난 13년간 농림부에서는 총 5,556억원(국가생명공학 투자액의 12.8%)을 투자했다. 지속적인 투자결과 기초/원천 단계의 우수 기술이 꾸준히 개발되어 국내외에서 특허출원 되거나 주요 저널을 통해 논문으로 발표되었으며, 이렇게 축적된 농림생명공학은 기초과학 역량을 바탕으로 최근에는 산업적 성과도 일부 태동하고 있다. 현재 농림부에서 추진하고 있는 주요 농림생명공학 육성 사업은 다음과 같다.
(1) 농림기술개발사업
농림기술개발사업은 농림생명산업 육성을 위해 산․학․연 협동 연구개발을 통한 농림기술의 실용화 촉진을 목표로 추진되고 있다. 실용화 연구가 진행되고 있는 주요 농림생명공학 분야로써는 바이오 신소재, 분자마커, DNA Kit, 고부가가치 동식물 신(新)품종개발 분야 등이 있다.
본 사업은 현장접목이 가능한 농림기술개발을 위해 1994년부터 추진되어 오고 있으나 2006년부터는 생명공학 분야 중 고기능성 농식품, 생물자원 분야에 대한 투자를 강화하는 한편, 산업체의 연구과제 참여를 의무화 하는 등 농림생명공학의 실용화 성과 실현에 많은 역점을 두고 사업을 추진해 나가고 있다.

출처 : 농림기술관리센터 내부자료
|
그림 3-1-5-1 |
농림기술개발사업 연구 성과 주요 활용방안
|
표 3-1-5-2 |
농림생명공학 연구개발 사업
(단위:억원)
|
사 업 명 |
사업기간 |
2006 |
2007 |
주 관 기 관 |
|
농림기술개발 |
1994~계속 |
69.35 |
67.32 |
농 림 부 |
|
수의과학기술개발 |
1998~계속 |
137.00 |
155.00 |
농 림 부 (수의과학검역원) |
|
바이오그린21 |
2001~2010 |
348.00 |
423.00 |
농촌진흥청 |
|
바이오장기생산연구 |
2004~2013 |
650.00 |
40.00 |
농촌진흥청 |
|
바이오신약생산연구 |
2005~2013 |
32.00 |
32.00 |
농촌진흥청 |
|
농업생명공학정보 전산화 및 국가활용체계 구축 |
2003~계속 |
12.00 |
10.00 |
농촌진흥청 |
|
유용유전자 대량발굴 및 형질전환작물 개발 |
1994~계속 |
66.60 |
67.10 |
농촌진흥청 |
|
농업유전자원의 국가관리체계 확립 및 활용 |
1994~계속 |
14.00 |
15.50 |
농촌진흥청 |
|
임업시험연구 |
2004~2013 |
12.00 |
16.00 |
산 림 청 |
|
LMO 국가관리 및 안전성평가 |
2004~계속 |
14.50 |
14.80 |
농촌진흥청 |
|
합 계 |
|
770.45 |
840.72 |
|
출처 : 2007년도 생명공학육성시행계획 재작성
(2) 수의과학기술개발사업
수의과학기술개발사업은 선진화된 수의과학기술 개발을 목표로 1998년부터 추진되고 있는 사업으로 동물 질병, 검역, 동물의약품 개발 등을 위한 연구가 진행되고 있다. 본 사업을 통해 유전자칩․단백질칩 등 첨단기술을 이용한 동물 질병 진단․예방 등 가축질병 방역기술 개발, 해외악성전염병(구제역 등), 특수전염병(광우병 등) 및 신종유해화학물질 등에 대한 국제적 수준의 검역․방역․검사기술 개발, 동․축산물의 독성평가, 축산가공식품의 성분규격화 및 미생물 오염방제기술, 동물용 의약품의 품질관리 및 표준화 기술개발 연구 등이 수행 중에 있다.
(3) 바이오그린21사업
바이오그린21사업은 2001년도부터 2010년까지 10년간 약 3,300억원의 연구비를 투자하여 농업생명공학 분야의 고부가가치 원천기술 개발을 목표로 추진되고 있는 농림생명공학 분야의 대규모 사업이다.
본 사업은 자원다양성, 유전체분석, 안전성 등의 5개 연구 분야에 대하여 농업생물자원다양성연구단, 동물유전체개발연구단, 분자육종연구단, 기능성소재연구단, LMO안전성연구단 등 8개 연구단 형태로 운영되고 있다. 바이오그린21사업을 통해 기술 종속형 모방 중심의 연구에서 탈피하여 독창적인 원천기술을 확보하고 분자육종 기술을 활용하여 주요 작목별 신(新)품종 개발 및 고부가 신소재를 개발해 나갈 계획이다.
(4) 바이오장기생산사업
바이오장기생산사업은 장기 부족에 따른 사회문제 해결을 통한 의료복지 실현에 기여함을 목표로 추진되고 있다. 본 사업은 바이오장기 제공용 무균돼지를 효율적으로 산업화시키는 데 초점을 맞추고 3개의 중점 분야(무균돼지 생산시스템 구축에 관한 연구, 바이오장기 생산 무균돼지의 관리기술 개발 연구, 형질전환 복제돼지의 생산효율 증진에 관한 연구)로 특화하여 연구를 진행하고 있다.
(5) 농업유전자원의 국가 관리체계 확립 및 활용사업
농림업이 내외연적으로 확대되면서 지속가능한 농림업 실현을 위한 농업유전자원의 다양성 확보, 장기 안전보존 및 종합전산화를 통한 국가 관리체계 구축 등 국가의 자원주권 확보에 대한 중요성이 증대되고 있다.
이러한 측면에서 본 사업은 국내외 농업 유전자원의 수집․보존, 유전자원 증식 및 특성평가, 통합정보시스템 구축을 목표로 추진되고 있다. 2006년 11월에는 ‘국립농업유전자원센터’가 준공되어 농업유전자원을 보다 효율적으로 관리할 수 있는 기틀도 마련되었다.
(6) 임업시험연구사업
임업시험연구사업은 생명공학기술을 적용한 고부가가치 산림자원의 효율적 이용기술 개발을 목표로 추진되고 있다. 2004년도부터 2013년까지 10년간 약 170억원의 연구비를 투자하여 ‘산림자원 유래 신기능성 물질 개발’, ‘세포공학 이용 대량 균질한 산림자원 생산’, ‘임목의 고유유전자 특성 구명 및 신(新)기능 품종 육성’을 실현해 나갈 계획이다.
라. 향후 추진방향
농림업이 직면하고 있는 대내외적인 위기를 극복하고 고부가가치산업으로 한층 도약하기 위해서는 기술경쟁력 기반의 신(新)성장 동력원 창출이 중요하다. 농림 분야도 이제는 생명공학 기반의 신(新)성장 동력 창출을 통해 기술․지식 집약적 농림업으로 전환될 필요가 있다.
우리나라 농림생명공학이 아직은 산업화 태동기이나 성장잠재력이 높아 향후 국가 기간산업으로의 규모 확대가 기대되는 상황이다. 특히 이를 위해 농림생명공학은 전략적이고 체계적으로 육성되어야 한다. 장기간의 기술 개발 소요시간, 복잡한 산업화 과정과 대규모 자본투입을 요하는 점 등을 고려할 때 농림생명공학은 국가 차원의 집중 투자가 요청된다.
농림생명공학 투자는 산업화 실현을 전제로 이루어져야 한다. 독자적인 원천기술을 지속적으로 개발해 나가는 한편, 개발기술의 산업화 촉진을 위한 투자가 뒤따라야 한다. 2008년부터는 ‘농림바이오기술 산업화 지원 사업’을 신규 추진함으로써 개발기술의 산업화연구 및 고부가가치 농산품 생산을 촉진할 것이며, 아울러 산업인프라 확충 및 기술금융제도 개선을 통해 산업화를 뒷받침 할 계획이다.
세계적으로 농림생명공학 분야의 발전은 매우 빠르게 진행되고 있다. 우리나라도 일부 기술은 세계적 수준에 올라 있어 투자 확대에 따라 발전 가능성이 점쳐지고 있는 현실이다.
정부의 지속적인 기술기반 및 인프라 투자 지원, 연구기관의 차별화된 기술 개발, 산업체의 고부가가치 상품 생산을 선순환 체계 구축을 통해 농림생명공학은 국가의 기간산업으로 거듭날 것이다.

가. 개요
보건의료 분야는 국민의 건강 및 생명유지․증진에 필요한 의약품, 의료기기, 식품, 화장품, 의료서비스 등 상품, 서비스를 포함하며 최근 경제발전과 소득증대로 그 관심이 증대되고 있다.
|
사회․경제적 수요측면 |
|
․ 빈곤에서의 해방과 경제적 소득증대로 건강한 삶에 대한 관심 증대 ․ 고령화 사회의 진입으로 노인성 치매, 파킨슨병 등 뇌질환 치료제 및 새로운 의료기기 개발 등 실버기술 개발 필요 ․ 사회 환경 및 식생활의 변화로 생활습관성․신종감염 질환의 발생과 확산 가능성이 점차 증가 |
|
|
|
|
|
기술․산업적 공급측면 |
|
․ 신(新)기술 출현, 기술범위 확대, 첨단기술 분야간 융합화로 고부가가치 창출 가능한 기술의 지속적 개발 필요 ․ 국내 보건의료 분야 우수한 연구인력 보유 |
이에 보건복지부는 보건의료기술을 활용한 건강사회구축을 위해 “건강수명의 연장, 삶의 질 향상, 보건의료 산업 경쟁력 강화”의 비전을 가지고 연구개발 투자, 인프라 구축 등을 지원하고 있다.
보건복지부는 보건의료기술연구개발사업을 비롯하여 한방치료기술개발, 질병관리본부, 국립암연구소운영사업 등으로 매년 약 2,000억원 가량을 지원하고 있다.
|
표 3-1-6-1 |
보건복지부 R&D 예산 현황(2006~2007)
|
|
|
(단위 : 억원) |
|
사 업 명 |
2006년 |
2007년 |
|
보건의료기술연구개발 |
1,232 |
1,018 |
|
한방치료기술연구개발 |
70 |
70 |
|
질병관리본부(기본사업비 등) - 질병관리연구, 유전체실용화 포함 |
193 |
220 |
|
국립암연구소 운영 |
313 |
348 |
|
한국보건산업진흥원 운영 |
87 |
95 |
|
국립병원임상연구사업 등 |
49 |
57 |
|
합 계 |
1,944 |
1,808 |
출처 : 보건복지부 내부자료
나. 주요 연구개발 사업
(1) 보건의료기술연구개발
(가) 개요
보건복지부는 21세기 지식기반경제의 핵심 산업으로 등장하고 있는 보건의료산업을 국민건강 증진과 국가경제 발전에 이바지하는 고부가가치 국가 전략산업으로 육성․발전시키기 위하여 보건의료기술진흥법(1995. 12)을 제정하여「보건의료기술연구개발사업」을 추진해 오고 있으며, 지난 1995년부터 2006년까지 12년간 총 7,851억원의 정부 연구개발 자금을 지원하였다. 아직은 선진국에 비해 보건의료 R&D투자 비율이 미흡하지만 고령화 사회로 접어들면서 투자가 점진적으로 확대되고 있다. 이 사업의 목적은 국민건강문제 해결 및 새로운 의료기술의 개발로 국민건강 증진, 수명 연장 등 국민의 삶의 질을 향상시키고, 2010년까지 선진국 수준의 보건의료기술 경쟁력을 확보하고 보건의료기술의 기반 강화 및 실용화 촉진을 통해 보건산업을 21세기 국가 핵심전략산업으로 발전․육성하는 것이다.
(나) 지원내용
보건의료기술연구개발사업은 사업의 효율적 추진을 위해 사업목적이 유사한 사업을 통합, 기존의 7개 사업을 3개 사업으로 재편하여 지원하였다.
|
표 3-1-6-2 |
보건의료기술연구개발사업 사업구조
|
<2005년> |
|
<2006~2007년> |
|
|
신약개발사업 |
|
차세대 성장 동력 사업 |
차세대 성장 동력 산업인 바이오신약, 바이오이종장기, 바이오칩 분야 집중 육성 |
|
바이오장기기술개발사업 |
|||
|
의료기기기술개발사업 |
|||
|
⇨ |
|||
|
바이오산업화 기술개발사업 |
보건산업기술을 집중 개발하여 국민의 삶의 질을 향상시키고, 핵심전략산업으로 집중 육성 |
||
|
의료정보기술개발사업 |
|||
|
사업추진의 효율성 제고 |
|||
|
건강기능제품개발사업 |
|||
|
미래보건 기술개발사업 |
BT, NT 등을 활용한 미래 보건의료 핵심기술 개발로 질병극복 및 보건산업의 활성화에 기여 |
||
|
보건의료바이오기술개발사업 |
|||
|
보건의료기술인프라개발사업 |
|||
|
7개 단위사업 |
|
3개 단위사업 |
|
출처 : 2006 보건의료기술진흥사업 시행계획
2006년도에는 정부지원 연구개발비 총 1,232억원을 투입하였으며, 2007년도에는 보건복지부 R&D사업비를 지원하고 있는 건강증진기금 부족으로 인하여 전체 연구비가 삭감되어 1,018억원이 지원되었다. 분야별 세부 지원현황은 다음과 같다.
|
표 3-1-6-3 |
보건의료기술연구개발사업 지원 현황
(단위 : 억원)
|
사 업 |
세부사업 |
2006년 |
2007년 |
|
보건의료기술연구개발 |
차세대 성장 동력 사업 |
193 |
194 |
|
바이오산업화기술개발사업 |
486 |
406 |
|
|
미래보건기술개발사업 |
406 |
328 |
|
|
10대질병정복메디클러스터구축 |
80 |
90 |
|
|
대형국가실용화 |
67 |
- |
|
|
합 계 |
1,232 |
1,018 |
|
출처 : 보건복지부 내부자료
그리고 보건복지부는 우리나라가 독자적인 신약개발 체계를 구축하여 신약개발 선진국으로 진입할 수 있도록 다양한 의약품 R&D사업을 지원하고 있다. 특히 2000년 1월에 제정된 천연물신약개발촉진법에 따라 천연물신약개발을 지원하고 있으며, 2004년부터는 차세대 성장 동력 분야인 바이오신약개발을 위해 세포치료제, 치료용 백신, 항체치료제 등 6대 분야를 대상으로 전임상․임상시험을 지원하고 있다. 또한 전문연구센터 육성을 위해 “기능성세포치료제개발센터”와 “항체치료제기술개발센터”를 선정하였고, 내수중심의 국내 신약개발 국제화를 위해 해외 선진국과의 “국제협력연구”(연간 10억원, 9년 이내)를 지원하고 있다.
난치질환을 치료하고 장기이식 수급 불균형을 해소하기 위한 바이오장기 분야에서는 지난 2004년부터 줄기세포 응용연구와 근골격계, 심혈관 및 신경계 등의 생체조직 장기 개발을 위해 전문연구센터 2개를 선정하여 연간 10억원, 6년 이내에서 지원하고 있으며, 차세대 성장 동력 분야인 바이오이종장기의 원천기술 선점과 대량생산 및 임상적용을 위해 바이오이종장기사업단을 선정하여 2004년부터 연간 40억원, 9년 이내에서 지원하고 있다.
한편 보건복지부는 차세대 신기술(BT, IT, NT)을 적용하여 지능형 의지․보조기, 장애인 감각기능회복장치 등 인간 중심의 보건의료 환경을 조성하기 위해 2002년부터 의료기기개발을 지원하고 있다. 특히 2005년부터 Digital Radiography용 X선 검출기 등 의료기기개발에 필수적이고 업체간 공동 활용이 가능한 핵심공통부품개발을 지원해오고 있으며 지난해부터 의료기기 분야의 다각적인 임상시험 수요를 충족시킬 수 있도록 임상평가시험, 식품의약품안전청(KFDA) 품목허가 임상시험, 연구임상을 지원하고 있다. 의료정보 표준화, 전자건강기록(EHR23)) 등 연구 지원을 위한 의료정보 분야와 고부가가치 기능성 식품 및 화장품 개발도 지원하고 있다. 이를 위해 2005년 기능성식품신소재개발센터, 기능성화장품신소재개발센터를 선정하여 연간 5억원 이내에서 지원하고 있다.
또한 개개인의 유전체형에 근거한 예측․맞춤의학의 기반을 마련하기 위해 보건의료유전체, 생명․노화, 나노보건기술개발 연구 사업을 통해 질환군별유전체연구센터(12개), 병원성미생물유전체연구센터(3개), 약물유전체연구사업단(1개), 질병유전단백체종합지원센터(1개), 생명노화연구센터(2개), 나노인공시각개발센터(1개), 의료용나노치료소재개발센터(1개) 등을 지정하여 집중 지원하고 있고 차세대 성장 동력 분야로 진단용 DNA칩개발센터(3개)를 2004년부터 선정하여 지원하고 있다.
생명공학기술에 기반한 의과학 연구, 중개연구 및 임상연구, 연구인프라 구축 등 보건의료기술인프라 분야를 지원하고 있다. 특히 신약개발 활성화와 선진국 수준의 임상시험인프라 구축을 위해 2004년부터 현재까지 지역임상시험센터(9개)를 신규로 선정하였고, 국내 의료수준 향상을 도모하기 위해 성인고형암치료, 허혈성심질환 등 임상연구센터(7개)를 선정하여 연간 7억원 이내에서 집중 지원하고 있다. 또한 2005년부터 기초연구 성과를 보건의료 분야에 적극적으로 응용하고, 창의연구를 활성화하기 위해 질병중심 중개연구(translational research)를 특화하여 지원 중에 있다. 그리고 산․학․연이 연계된 메디클러스터를 조성하기 위해 병원 내 연구 환경 조성을 위한한 제도를 개선하고 연구역량이 강화된 혁신형 연구중심 병원을 육성하고 있으며 2006년 하반기부터 10대 질병정복 메디클러스터 구축 사업을 신규 사업으로 추진하여 2개의 사업단에 연간 40억원씩 집중 지원하고 있다.
(2) 한방치료기술연구개발
(가) 개요
최근 의료기술의 급속한 발전에도 불구하고 인구의 고령화 등으로 인하여 만성․난치성질환이 증가하고 있다. 한편 세계적으로 웰빙에 대한 관심과 친환경주의에 대한 선호도가 높아지면서 전통의학과 보완대체의학에 대한 수요가 급증하고 있다. WHO에 따르면 세계 전통의학 시장이 2000년 600억 달러에서 2008년까지 2,000억 달러 규모로 성장하고 이용자 또한 급격히 증가하여 세계인구의 60%를 상회할 것으로 추정된다. 이렇게 전통의학 및 보완대체의학에 대한 관심이 증대되고 세계 전통의학 시장이 급성장하면서 각국은 이 분야에 대한 투자를 강화하고 있다.
우리 정부도 오랜 전통을 가진 우리의 고유 전통의학인 한의학적 접근방법을 통해 치료기술을 개발할 경우 세계적인 경쟁력을 가질 수 있을 것으로 인식하고 1998년부터「한방치료기술연구개발사업(2020 프로젝트)」를 추진하고 있다.
한방치료기술연구개발사업은 한의약의 과학화․표준화․세계화의 비전과 한의약의 경험과 지식정보를 이용하여 핵심원천기술 및 응용기술을 개발하고, 한의약의 안전성․유효성을 입증하여 국민보건향상과 한방산업에 기여한다는 사업목표를 달성하기 위하여 기초연구단계(1998~2002년), 연구심화단계(2003~2007년), 실용화단계(2008~2012년) 등 3단계 목표를 수립하여 추진하고 있으며, 1998년부터 2006년까지 당초 투자계획의 38% 정도인 393.4억원의 정부예산이 지원되었다.
(나) 지원내용
단계별 목표에 따라 2006년도에는 한방의 경험과 지식에 대한 선행연구 성과를 바탕으로 핵심원천기술을 개발하고 한의학 산업의 경쟁력을 향상시키기 위해 산․학․연, 다학제 협력연구를 지원하고 있으며, 이를 위해 2004년부터 지원해 오고 있는 한방바이오퓨전연구사업을 통해 연간 3~5억원으로 3년간 지원하는 다년도 연구 14개 연구과제(58억원)와 1.5억원의 단년도(16개월) 2개 과제(3억원)를 지원하였다.
또한 집중적인 연구지원이 필요한 한방연구 분야를 선정하여 연구수준을 선진화하고 선도적 전문 연구기관으로 육성하기 위하여 2003년부터 골관절 및 뇌질환 분야의 2개 특정질환센터를 선정하여 지원(각 5억원, 연구기간 6년)하고 있다.
(3) 질병관리연구
(가) 개요
질병관리연구는 국내 질병관리의 실무를 담당하고 있는 질병관리본부 국립보건연구원에서 수행중인 연구로서 1999년부터 본격적으로 시작되었다. 질병관리연구는 국내 발생 질병에 대한 현안 대응의 측면에서 효율성을 인정받고 있으며 주요 연구 분야는 국내 발생 전염병 및 만성질환에 대한 예방, 진단 및 치료 기술 개발연구와 질환관련 유전체의 분석을 통해 질병을 예측하기 위한 유전체 사업이다.
(나) 지원내용
질병관리연구는 주로 질병관리본부 국립보건연구원의 자체 수행 과제로 이루어져 있다. 그러나 유전체 분석과제 등과 같이 기기구입 및 관련 전문가 확보 등 부가적 비용이 필요한 경우에는 용역과제의 형태로 외부 연구기관에 위탁하여 수행하고 있다. 연구사업의 주요 내용은 ▸감염병에 대한 진단 및 예방치료 연구, ▸병원감염 원인균 탐색 및 해결방법 탐구 연구, ▸생물테러 등에 이용되어 국민 안전을 위협할 수 있는 고위험병원체에 대응하기 위한 기술개발연구, ▸비만․당뇨 등 생활습관의 변화로 인하여 급증하고 있는 만성질환 예방연구, ▸한국인의 유전 형질에 따른 질병발생 추이 확인 및 질병예측 프로그램 개발을 위한 유전체연구사업 등이다. 질병관리본부는 이들 연구사업의 수행을 바탕으로 국민 건강 증진에 기여하는 일선 기관으로서의 역할을 다하고자 노력하고 있다.
(4) 국립암연구소 지원
(가) 개요
보건복지부는 국민보건의 향상에 이바지하기 위해서 전문적인 암 연구와 암환자의 진료 등을 위해 2000년에 국립암센터법을 제정하여 국립암센터를 설립․운영하고 있으며, 기관고유연구사업을 통해 암의 발생․예방․진단․치료 및 관리 등에 관한 연구를 수행하고 있다.
아울러 1996년도에 수립된 제1차 암정복 10개년 계획(1996~2006)에 따라 발족한 암정복추진단을 통해 수행되어 오던 암정복추진연구개발사업을 2000년에 이관 받아 추진하고 있다.
지난 7년간 국립암센터 기관고유연구사업 및 암정복추진연구개발사업에 총 814억원의 정부연구개발자금이 지원되었다. 향후 암에 관한 연구 및 투자는 국민의 보건향상에 중요한 만큼 선진국에 버금가는 투자를 할 수 있도록 확대되어야 할 것이다.
(나) 지원내용
국립암센터는 암 발생률 및 사망률 감소, 치료율 제고와 직결되는 4대 연구 분야를 선택하여 집중 수행하고 있으며, 특히 기초연구와 임상연구를 상호 유기적으로 연계하는 이행성 연구에 중점을 두고 있다. 또한 우리나라 생명공학 분야의 국가 경쟁력 향상에 기여하기 위해 암 관련 기술 개발성과를 실용화하기 위한 과제를 수행하고 지원하고 있다.
특히 기관고유연구사업을 통하여 암연구기반구축 및 국가암관리 사업 기획․평가를 지원하고 있으며, 암정복추진연구개발사업을 통하여 국내 암연구 수준 향상 및 저변 확대를 위한 암 연구를 지원하고 있다.
다. 향후 발전방향
최근 고령화 사회로 접어들면서 만성질환, 난치질환 등이 증가추세에 있으며, 세계적으로도 경제 수준이 높아짐에 따라 맞춤형 고급의료에 대한 관심증대로 그 중요성이 부각되고 있다.
국내외적으로 국가연구개발 사업은 미래 경쟁력 확보를 위한 전략적 중점 분야에 대한 연구개발 투자 확대 및 투자의 효율성을 강조하고 있는 추세이다. 그러나 우리나라의 경우, 이 분야에 대한 미래 성장가능성이나 중요성에 비해 R&D투자 비율은 아직까지 주요 선진국 수준에 비해 미흡하여 지원 규모의 지속적 확대와 더불어 신기술 발전추세 및 미래 환경변화 등을 반영한 전략 분야의 선택과 집중, 현장 수요의 반영, 사업간 유기적 연계 등을 통해 투자 효율성을 제고할 필요가 있다.
보건복지부는 지난 1995년부터 보건의료기술진흥사업을 추진하여 지원 분야 및 내용 또한 다양화되어 왔으며, 보건산업 진흥과 보건의료기술 발전을 위한 견인차 역할을 담당해 왔다. 그러나 보건의료기술진흥사업을 비롯한 전반적인 연구 사업에 대해 국가차원에서 타 부처 사업과의 차별성과 부처간 역할분담 문제, 그리고 연구개발사업간 전략적 연계성 등에 대한 문제들은 향후 극복해 나가야 할 과제로 남아 있다.
따라서 보건복지부는 앞으로 질병문제 해결을 목표로 연구개발투자 포트폴리오를 작성함으로써 타 부처 R&D사업과 차별화하고 보건의료 분야의 특성을 살린 사업을 추진해 나갈 계획이다.
이를 위해 기존 제품․기술개발 중심에서 건강, 질환 중심의 임무지향형 R&D로 전환하고, 보건의료 기술전략로드맵(HT Roadmap)을 작성하고 이에 따른 중장기 발전계획을 수립하여 “선택과 집중”의 전략성을 강화하고자 한다.
앞으로 보건복지부는 의료인력, 임상데이터 및 병원의 우수한 연구자원 활용, 관련 제도와 기술개발과의 상호 연계․발전을 도모하는 등 보건의료 분야의 특성을 살린 R&D사업을 주도적으로 추진해 나갈 계획이다.

가. 추진배경
개인 컴퓨터의 보급과 인터넷의 발달을 거쳐 와이브로(WiBro, wireless broadband internet)에 이르기까지 고도화된 정보통신기술(IT)이 생명공학기술(BT)과의 접목을 통하여 인간의 삶의 질 향상이나 인간의 능력의 극대화에 크게 기여할 것으로 전망된다.
사회적으로 대두되고 있는 세계적인 고령화문제, 환경․안전문제 등을 해결할 수 있는 핵심기술로서 IT와 BT의 융합기술의 필요성이 강조되고 있다. 미국이나 유럽연합(EU) 등 선진국에서는 이러한 필요성과 나아가서는 차세대 산업으로서 융합기술의 성장가능성을 인식하여 융합기술 발전 전략을 수립하여 다양한 정책을 시행 중에 있다. IT에 강한 우리나라는 IT 기반으로 융합기술(IT 융합기술)을 선점하여 블루오션 창출과 더불어 초고령화로 치닫는 국내의 사회문제 해결에 앞장 설 필요가 있다.
나. IT융합기술 서비스 현황 및 전망
IT융합기술을 활용하여 가장 두드러지게 활성화될 수 있는 서비스 분야는 건강․의료 서비스 분야가 된다. IT의 발전은 의료서비스에도 많은 변화를 불러왔다. 의사가 환자를 대면하여 진료하는 기존의 방식에서 인터넷의 발달로 원격의료, 재택의료 방법이 도입이 되었고 유비쿼터스 시대에 따라 언제 어디서나 건강관리가 가능한 u-헬스 시대가 열리고 있다. 특히 당뇨병이나 심장질환 등 만성질환의 경우 혈당폰 등이 세계 최초로 국내에서 개발되어 IT강국의 위상을 높이고 있지만 국내에서는 아직 법제도가 따르지 않아 사업화는 여전히 문제로 남아있는 실정이다.
고령화 사회에서 IT를 활용하면 노인들의 질병관리나 노령 장애를 극복하기 위한 일상생활 관리나 노인들의 고립감 해소 서비스가 가능하며, 이는 향후 매우 확대될 것으로 예상되는 실버시장에서 더욱 활용될 것으로 예상된다.
또한 인터넷을 통한 진료예약 뿐 아니라 RFID24)(무선인식) 등의 IT가 도입되면서 병원의 의료서비스가 개선되고 있고, 전자의무기록이 활성화되면 환자의 기록이 언제나 필요시에 연동되어 맞춤형 진료가 가능하게 될 것이다.

출처 : 한국전자통신연구원(ETRI) 내부자료
|
그림 3-1-7-1 |
IT도입에 따른 의료경향의 변화
농업, 축산, 수산 같은 기존 산업에 IT가 도입되어 미래에는 산업 환경이나 생태가 실시간 모니터링 되고 조류독감이나 전염병 감지 서비스 및 식품의 이력관리 등 거의 모든 바이오산업 분야의 획기적인 서비스가 가능해질 것이다. 이외에도 건축이나 의류 등 전통산업에 홈헬스나 바이오셔츠와 같은 신제품이 개발되어 산업의 첨단화를 꾀할 수 있을 것이다.
이와 같이 IT융합기술을 활용하여 파생될 수 있는 새로운 서비스는 매우 다양하여 전 산업의 파급효과가 막대할 것으로 예상된다.

출처 : 한국전자통신연구원(ETRI) 내부자료
|
그림 3-1-7-2 |
IT융합기술 서비스 개념도
다. IT융합기술 국내외 시장 현황 및 전망
IT융합기술시장의 가장 큰 분야인 u-헬스케어 시장규모는 고령화와 만성질환자 증가에 따라 크게 확대될 것으로 전망되며, 2010년 경에는 u-헬스케어 국내 시장규모가 서비스와 장비를 포함하여 약 1조 5천억원이 될 것으로 추정된다. 이는 연평균 성장률 124%로써 전체의료비의 3.7%에 해당된다.
최근 조사에 따르면 20~60대 인구기준으로 전체 u-헬스케어 서비스 이용 성향은 인구수로 환산하면 약 1,350만 명 정도로써 u-헬스케어 서비스의 수용 성향이 높다고 할 수 있다. u-헬스케어 시장에서는 30∼40대가 차지하는 비율이 전체 20~60대의 절반 이상을 차지하고 있는데 이는 IT활용에 적극적인 동시에 건강에 관심을 갖는 주 연령인 것으로 분석되고 있다(이상 출처 : u-헬스 수요전망과 수용영향요인 보고서, ETRI, 2007; 신규 u-헬스 비즈니스 모델개발을 위한 시장수요 분석 보고서, ETRI, 2005).
IT융합기술의 해외시장은 미국이 가장 큰 시장을 차지하고 있는데, 미국에서는 만성질환자를 주된 대상으로 하는 홈&모바일 헬스케어 시장이 급성장할 전망으로 2006년 9.7억 달러에서 2010년 57억 달러, 2015년 336억 달러로 성장할 전망이다(출처 : Who Pays for Healthcare Unbound?, Forrester Research, 2004). 미국은 의료비 절감이라는 당면문제를 해결하기 위하여 법/제도의 완화 정책을 강력하게 추진 중이므로 관련 시장은 더욱 활성 될 것으로 예측된다.

출처 : 신규 u-헬스 비즈니스 모델개발을 위한 시장수요 분석 보고서, 한국전자통신연구원(ETRI), 2005
|
그림 3-1-7-3 |
국내 u-헬스 시장 전망
IT융합기술 시장은 기술별로 2010년에 바이오전자(510억 달러), 생물정보(100억 달러), 생체정보인터페이스(70억 달러) 등의 시장규모가 전망된다(출처 : IT기반 융합 부품․소재 육성계획, 정보통신부, 2006).
라. IT융합기술 산업 현황
국내 업계는 신(新)산업으로써의 가능성과 중요성을 인식하고 있지만 기술의 난이성과 시장개척의 위험성으로 적극적인 투자는 이루어지지 않고 있다. IT융합기술 분야 중 가장 사업화된 u-헬스케어 분야에 가장 발 빠르게 움직이는 곳은 IT업계로, 국내에서는 삼성 SDS, LG CNS, SK C&C, 코오롱정보통신, 현대정보기술 등이 있다. 홈네트워크 사업을 하는 전자업계에서도 u-헬스케어 시장은 놓칠 수 없는 분야이기에 LG전자, 삼성전자 등이 추진 중에 있다. KTF와 SK를 중심으로 한 휴대폰업계도 u-헬스케어서비스로 고객잡기 경쟁을 전개하고 있는데, 그 예로 개인별 금연관리서비스인 ‘금연 길라잡이’를 휴대폰으로 이용할 수 있다.
전반적으로 우리나라는 원격 및 재택 진료에 필수적인 인터넷 또는 무선 통신 인프라는 잘 갖춰져 있지만 바이오센서나 휴대용의료기기 기반기술, 의료정보 분석 및 보안 기술은 상대적으로 낙후되어 있고 현재 상용화 중인 대부분의 휴대용 생체신호계측기기를 수입에 의존하고 있어 이에 대한 기술개발이 시급한 실정이다.
해외에서는 IT기업의 진출이 두드러지고 있으며 주요 진출 분야는 수퍼컴, 서버, 소프트웨어 등 연구 인프라, 데이터베이스네트워크 등을 총괄하는 정보인프라 분야, 바이오칩 및 관련 장비 분야, 헬스케어 서비스 분야로서 매우 다양한 분야에 진출하고 있다.
정보인프라 분야에서는 메이저 컴퓨터 제조업체인 HP, IBM, NEC, 히다치 등이 참여하고 바이오칩 및 관련 장비 분야에는 Motorola, HP Agilent, 히다치 등의 IT기업이 참여하고 있다.
글로벌 IT기업의 IT융합기술 분야 진출이 활발하게 이루어지고 있는데 Intel, CISCO, HP, GE, 히다치, Motorola, Philips, Qualcomm 등이 헬스케어에 진출하고 있고 Intel, Agilent, Infinion, Affymetrix 등이 바이오칩에 사업을 추진 중이며 Sun Microsystems, Compaq, IBM, 히다치, 후지쓰 등이 생물정보 분야에 진출하고 있다.
마. IT융합기술 전략 분야
미래사회는 건강한 삶, 쾌적하고 안전한 환경 등에 대한 사회적 필요와 이를 충족시키기 위하여 앞서 언급된 서비스 수요가 확대될 것으로 전망되어 정부는 IT융합기술 8개(생물정보분석SW, 바이오센서, 생체이미징, 바이오칩, 유해유기물센서, 생체신호인터페이스, 바이오데이터보호, 생체정보보호) 전략 분야를 선정하였다.
도출된 핵심기술을 활용하여 미래사회의 서비스 수요를 최대한 충족할 수 있도록 전략서비스 분야로 건강환경도우미(Pervasive Lifecare Company)를 선정하였다. 건강환경도우미서비스는 개인의 건강상태를 실시간으로 감지하여 상시 건강관리와 응급상태 예방을 지원하는 u-헬스 서비스와 함께 실시간으로 사물 환경정보를 감지하여 환경오염 및 유해식품감지, 재난재해경보 등의 환경관련 서비스를 제공하게 된다.

출처 : IT 기반 융합 부품 소재 육성계획, 정보통신부, 2006
|
그림 3-1-7-4 |
IT융합기술 전략서비스 분야
바. IT융합기술 연구개발 및 산업화 추진계획
비만, 스트레스 등 건강상태 모니터링, 만성질환 등 질병 스크리닝, 유해환경 감시 등 건강하고 안전한 생활환경 구현을 위해 다양한 맞춤형 라이프케어 서비스를 구현하기 위한 밑바탕을 2015년까지 단계적으로 개발하고 있다.
단계적으로 개발된 국책연구 결과물을 조기 산업화하기 위하여 사업화기반을 구축할 계획이다. IT융합기술 사업화 검증을 위한 표준 정형화된 테스트베드 플랫폼을 구현하여 연구개발결과물의 사업화 기간과 비용을 단축하고, 또한 테스트베드를 활용하여 시범단지에서 서비스함으로써 사업화 가능성을 체계적으로 확인할 수 있는 기반을 조성하고자 한다.

출처 : 차세대 IT기반 사업화기반조성사업계획서, 정보통신부, 2007
|
그림 3-1-7-5 |
테스트베드구축을 통한 사업화 지원
인력양성을 위하여 IT융합기술 특성에 맞는 맞춤형 현장기술 재교육시스템을 구축할 예정이다. 아울러 IT기업의 IT융합기술 분야 투자확대 유도 및 관련 규제 완화를 위해 국책연구소의 기술이전, 공동연구개발 프로젝트 확대 등을 통해 사업화를 지원할 계획이다.

가. 기술개발 필요성
(1) 환경생명공학기술
환경기술 개발 및 지원에 관한 법률에서, “환경기술(Environmental Technology, ET)”을 ‘환경의 자정능력을 향상시키고 사람과 자연에 대한 환경피해 유발요인을 억제․제거하는 기술로써 환경오염을 사전에 예방․저감하고 오염 및 훼손된 환경을 복원하는 등 환경의 보전 및 관리에 필요한 기술’이라고 정의하고 있다.
환경기술 중에서도 환경생명공학기술(Enviro Biotechnology, EBT)은 환경오염을 저감․예방․복원시키기 위하여 생물과 생물학적 처리공정을 이용하는 생명공학기술(Biotechnology, BT)을 ET에 접목 또는 융합하는 기술로써 환경과학, 생태학, 분자생물학 간의 유기적인 협조가 필요한 기술 분야로 정의될 수 있다.
EBT는 BT의 기본적인 핵심기술25) 중에서도 생물공정기술(발효공정제어, 분리정제, 배양기 설계․제작)과 미생물이용기술(미생물분리․배양, 항암물질 탐색기술)을 주로 활용하고 있다. 이러한 EBT는 아직까지는 환경기술로서의 역할이나 중요성이 크게 부각되지 않았으나, 근래 각 분야에서의 첨단기술이 적극 개발됨에 따라 오염 환경 정화(remediation)에서 오염 예방(prevention) 및 생물학적 방법에 의한 오염 검출(detection) 분야로 그 영역이 점차 확대될 것으로 전망되고 있다.
(2) 환경기술개발정책 패러다임의 변화
21세기 들어 생명공학, 신(新)물질 개발, 정보기술의 발전 등 과학기술의 급속한 발전에 따라 새로이 등장한 환경문제에 대응하는 방향으로 환경기술개발이 적극 추진되고 있다.
환경문제에 대한 인식이 메조수준의 단위시스템 관점에서 매크로(macro)수준인 네트워크 개념의 사회 통합적 관점으로 접근함에 따라 과학기술적 연구와 사회과학적 연구의 통합적 접근전략이 강화되고 있다. 또한 분자생물학, 나노과학기술, 전자현미경 등의 발전과 맞물려 나노(nano)수준에서 환경문제에 대한 설명이 가능해짐에 따라 나노수준의 과학적 규명에 바탕을 둔 환경정책의 추진이 가능해 지고 있다.
현대사회의 복잡성 증가에 따라 발생하고 있는 다양한 환경문제에 대응하기 위해서는 새로운 과학기술 지식을 바탕으로 한 환경정책 추진이 불가피해지고 있으며, 이에 따라 환경기술(ET)와 생명기술(BT)의 접목 또는 융합을 통한 신기술 개발 수요도 점차 증가하고 있다.

출처 : 차세대 핵심환경기술개발사업 10개년(2001~2010) 종합계획, 환경부, 2002
|
그림 3-1-8-1 |
환경기술개발 정책 패러다임의 변화
나. 선진국의 ET/BT 융합기술 연구방향
미, 일 등 주요 선진국들은 자국 산업의 경쟁력 확보차원에서 국제규모의 환경문제 대응기술 개발을 적극적으로 추진하고 있다. 특히 생명공학의 발전에 따른 유전자변형동식물(LMO)의 환경(인체, 생태계) 위해성 평가 분야를 적극적으로 지원하고 있으며, 내분비계 장애물질 문제의 대두로 기존 화학물질 및 의약산업․화학 산업의 발전에 따른 새로운 화학물질에 대한 위해성 평가 연구도 중요하게 부각되고 있다. 이와 더불어 생태계 훼손, 토양․지하수 오염은 장기간에 걸쳐 이루어져서 오염 복원을 위한 비용도 장기적으로 크게 발생하는 환경문제로 1990년대 이후 중요하게 부각되면서 선진 각국들은 이에 대응하기 위한 생태계 및 토양․지하수 보전 및 복원 기술개발을 집중적으로 추진하고 있다.
다. 차세대 환경기술개발사업 등 관련 EBT 분야
환경부에서는 환경오염문제 해결을 통해 국민의 삶의 질을 향상시키기 위하여 2001년부터 2010년까지 총 1조원을 투자하는 “차세대 핵심환경기술개발 사업(Eco- Technopia 21, ET21 사업)”을 추진하고 있다.
|
표 3-1-8-1 |
ET21사업 투자계획
|
구 분 |
1단계 (2001∼2003) |
2단계 (2004∼2007) |
3단계 (2008∼2010) |
||
|
투 자
(억원) |
계 |
14,500 |
2,950 |
6,600 |
4,950 |
|
정부 |
10,000 |
1,950 |
4,600 |
3,450 |
|
|
민간 |
4,500 |
1,000 |
2,000 |
1,500 |
|
출처 : 차세대 핵심환경기술개발사업 2단계(2004~2007) 연구기획, 환경부, 2003
현재까지 환경부에서는 ET21사업에 총 7,787억원(정부 출연금 5,727억원, 민간부담금 2,060억원)을 투자하여 총 1,040개 과제를 수행하고 있으며 상용화가 완료된 325개 과제에 대하여 기술료 149.7억원의 기술료를 징수하였다.
이러한 기술개발 투자 성과로는 지식재산권 출원․등록 1,722건, 학술지 게재․학술회의 발표 8,210건 등의 과학기술적 성과를 이루었으며, 또한 국내외 제품 판매실적 329건에 1,357억원 공사실적 480건 5,413억원 성과도 이루었다(2006년 12월 기준).
한편 ET21사업에서 추진 중인 생명공학 관련 사업은 주요 동식물의 DNA 바코드화 및 DNA 바코드를 이용한 생태계 관리기술 등의 생태계 복원․관리 분야, 지표생물을 이용한 생태독성 모니터링 기술 등의 위해성 평가․관리 분야 및 친환경 소재․제품 분야와 ET/BT 융합 측정분석 장치 분야 등으로 대별할 수 있다.
또한 ET21 사업 이외 생명공학 분야로는 유전자변형생물체(LMO)의 환경방출에 따른 잠재적 위해성을 사전에 예방하여 안전성을 확보함으로써 국내 자연생태계를 보전하고자 하는 “유전자변형 생물체의 자연생태계 영향평가 및 안전관리 사업(2007년, 378백만원)”과 전국 야생 동식물 서식지 및 생물다양성 현황을 파악하고자 하는 “제3차 전국 자연 환경조사 사업(2007년 2,801백만원)”이 있다.
ET21사업에 추진 중인 생명공학 관련 사업과제 및 예산을 살펴보면 총 예산의 약 20%를 투자하고 있다.
|
표 3-1-8-2 |
ET21 사업 중 생명공학 관련 사업 과제 수 및 예산 현황(2001~2007)
|
사업 년도 |
ET21 |
ET21과제 중 생명공학 관련 과제 |
|||
|
협약과제 수 |
국고지원금 |
협약과제 수 |
국고지원금 |
% |
|
|
계 |
2,181 |
5,727 |
578 |
1,207 |
21 |
|
2001 |
219 |
500 |
43 |
99 |
20 |
|
2002 |
317 |
700 |
68 |
126 |
18 |
|
2003 |
340 |
750 |
90 |
171 |
23 |
|
2004 |
365 |
884 |
103 |
189 |
22 |
|
2005 |
315 |
907 |
84 |
188 |
21 |
|
2006 |
311 |
965 |
96 |
217 |
22 |
|
2007 |
314 |
1,021 |
94 |
217 |
21 |
출처 : 차세대 핵심환경기술개발사업비 자료 재작성, 환경부
라. 향후 추진방향
국내 ET 분야 기술수준은 선진국의 60~70% 수준으로 아직 미흡한 실정이다. 일본 경제의 장기침체 원인이 “신기술 중심으로의 산업재편 부진”에 기인함을 감안할 때, 국내의 경우 세계적인 정보화 조류에 맞추어 성장한 IT를 제외하고는 ET, BT 등 후속 신기술에 대한 투자부족으로 향후 성장장애 요소로 작용할 것으로 전망26)되고 있다.
2006년 12월 과학기술혁신본부에서 발표한 “국가 R&D 사업 Total RoadMap” 투자 배분 방향에 따르면 “생명․에너지․자원․환경 및 기초과학” 분야를 성장 잠재력 확보와 국민의 삶의 질 향상 측면에서 투자확대 분야로 선정하여 2020년까지 점진적으로 투자를 늘려야 하는 분야로 분류한 바 있다. 이것은 환경기술(ET)의 중요성이 점차 증대되고 있으며 또한 생명 분야 기술과의 접목이나 융합의 필요성이 절실함을 시사하고 있는 대목이다.
21세기에 접어들면서 환경기술 개발은 현안 환경오염문제 해결뿐만 아니라 점차 증대하는 국제 무역환경규제에 효과적으로 대응하기 위해서도 그 중요성이 더욱 증대되고 있는 실정이다. 환경기술 개발이 국가 경쟁력 제고에 필수요소가 되고 있는 것이다. 특히 다변화되고 복잡한 환경시장에서의 경쟁력을 확보하기 위하여 기존 ET21사업을 성공적으로 마무리하여 국내 ET기술 수준을 선진국 대비 80%까지 제고하는 한편 환경기술에 BT/IT 등이 융합된 사전오염예방기술 분야 및 환경복원, 지구환경보전 등 공공 성격의 첨단 환경기술개발 등을 통하여 지속가능하고 신(新)가치를 창출할 수 있는 기술개발에 적극 투자할 계획이다.

가. 개요
해양에는 지구 생물종의 80%에 달하는 1,000만 종 이상의 생물이 서식하는 것으로 알려져 있으며, 매년 지구상에서 생산되는 2,000억 톤의 광합성양 중 90%가 해양에서 이루어지고 있다.
갯벌 및 연안에서부터 심해, 열대에서부터 한대에 이르기까지 다양한 해양환경에 광범위하게 분포하는 해양생물들의 가치는 기후조절, 오염물질 자정 능력만 계산하여도 육상의 2배인 연간 26조 달러에 이르는 경제적 가치를 지니는 것으로 추정된다.
|
|
|
|
|
별불가사리 출처 :이화여대 자연사박물관 |
부채뿔산호 출처 : 이화여대 자연사박물관 |
군소 출처 : 해양극한생물분자유전체연구단 |
|
|
|
|
|
미역쇠 출처 : 해양극한생물분자유전체연구단 |
가시복 출처 : 해양극한생물분자유전체연구단 |
예쁜이해면 출처 : 해양극한생물분자유전체연구단 |
|
그림 3-1-9-1 |
해양생물의 다양성
해양생물은 육지와 다른 해양의 높은 수압과 염도, 저온에 적응하며 진화하여 왔기 때문에 육상생물에서는 발견할 수 없는 특이한 대사물질 및 생리활성물질 등을 생산한다. 이러한 해양생물의 유용물질들에 대한 식품, 의약 및 화학 등의 분야에서의 관심이 집중되면서 해양생물은 생명공학의 주요 자원으로 급부상하고 있다. 또한 WTO/DDA 및 FTA 협정으로 인하여 양식어업의 경쟁력 강화가 불가피하게 되었으며, 중국으로부터 수입되는 저가의 수산물과의 경쟁에서 살아남기 위해서는 가격경쟁에서 벗어난 새로운 품종 및 브랜드 개발이 요구되고 있다. 더불어 수산양식생물의 대량 폐사 및 유전적 열성화로 인한 생산성 약화, 그리고 양식원가 절감의 한계 등을 극복하기 위해서도 생명공학기술을 전통 수산양식산업에 적용할 필요가 있다.
해양생명공학 분야는 특징적으로 해양천연물 또는 해양생물에서 기원한 의약재 혹은 고분자물질, 화학소재 등을 생산하며, 원천기술 확보가 용이하여 독점적 물질특허권 확보가 가능하다는 점, 신물질 발견율, 제품화 비율이 높으며 신제품 개발기간 단축이 가능하고, 극한 환경 미생물의 생체기능을 이용하기 위한 특수기술이 필요하다는 점, 그리고 생물오손, 수산양식 등의 고유한 영역을 지닌다는 특징이 있다. 이와 같이 해양생명공학기술은 해양생물의 유전자원 확보, 해양생물 유래의 유용물질 및 신물질 생산, 유용 해양수산생물의 분자육종 등을 통한 안정적 식량자원 창출 등 그 적용 범위가 매우 다양하다.
출처 : 해양수산부 내부자료
|
그림 3-1-9-2 |
해양생명공학의 중요성
나. 현황
(1) 국외현황
국제적으로 생명공학은 IT혁명 이후 세계경제를 선도할 대표적인 핵심전략기술로 급속히 부상하고 있으며 급속한 기술발전과 IT, NT, ET 등과의 기술융합을 통한 영역의 확대로 이어지고 있다.
최근의 국제적인 생명산업 시장은 의약산업(red bioindustry), 농림생명산업(green bioindustry), 환경생명산업(white bioindustry), 해양생명산업(blue bioindustry)으로 크게 대별될 수 있다.
Red Biotechnology로 대별되는 신약개발과 관련하여 2006년에는 31개의 신약과 12개의 Biologics(Biogeneric) 제품이 미국 FDA의 판매 허가를 받았으며 이는, 2001년부터 2004년까지 집중된 미국의 집중 투자에 힘입은 것이다. 그러나 최근 신약개발연구비 등은 축소되고 있는 경향이 있으며 대형 제약회사들조차 상대적인 투자비용이 적은 Biologics의 제너릭버전(Biosimilar)에 치중하려는 경향이 강해지고 있다.
이는 막대한 신약개발비용과 이미 고갈된 육상의 소재 등으로 인한 것이다. 실제로 대형제약회사의 신약 개발에는 평균 14년의 연구개발 기간과 1조원의 연구개발비가 소요되어 왔다. 해양생물은 국제적인 새로운 신약을 개발할 수 있는 좋은 소재로써 우리나라에서도 이를 최대한 활용하여 세계적 신(新)의약품 개발을 위한 노력이 필요한 시점이다.
2006년부터 활발히 논의된 White Biotechnology는 교토의정서에서 요구하고 있는 이산화탄소 배출량 감소의 중요 수단으로써 인식되는 바이오연료를 의미한다. 이러한 바이오연료의 도입은 2030년까지 배출될 것으로 예상되는 전 세계 이산화탄소 16.8기가(giga) 톤 중에서 1.4기가(giga) 톤(8.3%)을 감소시킬 수 있는 수단으로 인식되고 있다. 현재 우리나라는 2004년 기준으로 4억 6210만 톤을 배출하고 있어서 세계 10위를 차지하므로 그 대책 마련이 시급한 상황이다. 현재 각 국가별로 자국 보유자원을 활용하는 것을 연구 중에 있으며 바이오연료관련 기술개발 및 생산시설 투자는 지속적으로 확대될 것으로 전망되며, 보다 경제적이고 저렴한 원료를 확보하려 하고 있어서 앞으로는 해조류 등 해양생물에 대한 활용도가 보다 높아질 것으로 예상된다.
이미 선진국에서는 생명산업의 대상이 육상생물로부터 해양생물로 이동하였으며, 해양생물자원을 개발하여, 고갈에 직면한 에너지, 식량, 기능성물질을 얻고자 하는 해양생명산업의 육성에 막대한 자금을 투여하고 있다. 예를 들어 이 분야의 투자가 가장 앞선 미국의 경우 7년간(1995~2002) 8,600만 달러를 이미 투자하였으며, 중점 투자 분야로 수산과 양식(3,000만 달러), 천연물질 개발(2,600만 달러), 수질오염 방지대책(1,150만 달러) 등을 선정하여 연구개발을 지원하고 있다.
국외에서는 해양생물을 이용한 기능성 고분자물질, 수술용 접착제, 바이오색소, 오존 방지제, 심층수, 건강음료(아르긴산, 후코이단) 등이 이미 상품화되어 있고, 신(新)기능성 미생물과 효소에 대한 탐색도 활발히 추진되고 있다.
전 세계적으로 해양생명 산업 중 가장 규모가 큰 분야는 조류(algae)를 이용한 산업이다. 조류는 단백질 자원일 뿐 아니라 다양한 무기물, 비타민, 식이섬유, 클로로필, 생리활성물질 등이 풍부하여 그 상업적 가치가 탁월하다. 특히 클로렐라와 같은 미세조류는 건강식품의 소재로 큰 각광을 받고 있다.
대형 조류의 경우 세계적인 산업규모는 연간 10조 달러에 이른다. 동아시아에서는 전통적으로 대형 조류를 양식하여 다시마, 김, 미역, 톳 등을 식용으로 이용해 왔으며, 최근 다시마는 아르긴산 원료로, 홍조류는 카라기난 원료로 추출하는 주요 원료가 되어왔다.
일본에서는 녹조류를 이용하여 이산화탄소를 에너지로 이용하는 방안과 갈조류인 마크로시스티스가 생산하는 메탄가스를 에너지화 하는 연구 등이 진행되고 있다. 또 미세조류를 이용한 산업용 폐수나 축산 폐수의 정화 실험도 이루어지고 있으며, 갈조류에서 추출한 아르긴산 및 유황함유 푸코이단 음료는 이미 상용화되어 있다. 중국에서는 다시마 양식이 매우 활발하다.
유럽에서는 조류를 식용(43%), 공업용(42.8%), 의약용(7.7%) 및 사료용(6.5%)으로 이용한다. 북유럽에서는 해조류를 오래전부터 가축용 분말사료로, 미세조류 분말은 새우를 포함한 수산물의 양식, 석회성 조류와 남조류는 비료원료로 사용해 왔다. 세계 생명산업시장은 2007년 현재 전체 산업매출이 73조원이며, 연구개발에 투자되는 비용도 27조원에 달한다. 해양 생명산업은 국제적으로 연간 3조원정도 수준이지만, 매년 수배씩 증대되어 오고 있다. 세계 생명산업시장의 규모는 큰 폭으로 증대되어 2013년도에 200조원 정도까지 이를 것으로 추정되며 그중 해양 생명산업 시장이 차지하는 비중은 10% 정도가 되어 약 20조원 정도가 될 것으로 추정된다. 그러나 아직까지는 전체 해양생물의 5% 정도만 활용되고 있어서 우리나라의 시장진입 가능성은 아주 크다고 할 수 있다.
(2) 국내현황
해양수산부에서는 1996년도에 해양개발기본계획을 발표한 이래 2000년도에 21세기 해양시대의 일류국가로 지향하기 위한 ‘해양한국(Ocean Korea)21’ 계획을 수립하였으며, 2004년도에는 ‘해양과학기술(Marine Technology, MT) 개발 계획’을 발표하여 첨단해양과학기술로 해양생명공학 분야를 육성하고 있다. 특히 ‘해양과학기술 개발계획’을 통해서는 소규모로, 산발적으로 수행하고 있던 기존의 사업을 체계적으로 관리하고, 생명공학기술을 어업자원복원․첨단양식 분야와 해양생물․유전자원 개발 및 이용에 접목하여 미래 주요 산업으로 육성하기 위해 10년간 3,000억원 이상의 연구개발비를 투자하기로 하였다.
해양수산부의 주요 해양생명공학 연구 사업으로는 2004년부터 2013년까지 10년 동안 총 2,500억원의 연구비를 투자하는 연구개발사업인 ‘마린바이오21사업’과 국립수산과학원의 기반연구사업인 ‘수산생명공학기술개발’과 ‘유전자변형 수산물의 안전성평가 연구’가 있으며, 이를 통하여 첨단해양생명공학기술의 중점개발로 해양바이오산업을 21세기 미래 주도형 고부가가치 성장 동력 산업으로 육성하는 것을 목표로 하고 있다.
(3) 해양생명공학사업
마린바이오21사업은 해양수산부의 대표적인 생명 분야 R&D사업으로써 ‘건강한 생명사회 지향(신의약․신물질 개발), 안정적 식량자원 및 수산자원확보 등을 위한 해양수산 생물자원의 선행적 확보와, 해양생물자원을 효율적으로 이용하기 위한 핵심기술 개발’을 목표로 2004년부터 10년간 추진해오고 있는 사업이다.
|
표 3-1-9-1 |
마린바이오21사업의 단계별 목표
|
구 분 |
목 표 |
내 용 |
|
1단계 (2004~2006) |
원천기술 개발 |
■ 해양생물의 기능․구조분석기술 개발 - 해양생물자원 확보, 분리 및 보존기술 개발 - 해양생물 유전체 기능분석 기반 기술 - 유용물질 탐색기술 개발 |
|
2단계 (2007~2009) |
응용기술 개발 |
■ 해양생물자원의 활용기술 개발 - 유전체기능/프로테움 기술을 이용한 진단․치료제 개발 - 형질전환 해양생물 개발 - 해양천연물신약 선도물질 개발 |
|
3단계 (2010~2013) |
산업화기술 개발 |
■ 해양 유래 소재, 물질 상품화 기술개발 - 해양 생체기능 이용 및 공정기술 개발 - 기능성 해양생물자원 창출 - 세계적 해양천연물신약 후보물질/신기술 개발 |
출처 : 해양수산부 내부자료
마린바이오21사업은 세계 해양생명 산업시장의 5%(연1조원, 2013년 기준) 점유를 목표로 2004년부터 핵심기술 확보 및 특화기술의 산업화연구를 수행 중에 있다(1단계:2004~2006, 2단계:2007~2009, 3단계:2010~2013).
마린바이오21사업은 해양․극한생물 분자유전체연구, 해양바이오프로세스연구 및 해양천연물 신약연구의 3대 주요 중점과제를 각각 해양연구원, 부경대학교, 서울대학교에 연구단을 두고 연구를 수행 중에 있다.
2005년부터 마린바이오21사업은 1998년부터 단편적으로 수행되어 오던 ‘극지유용생물자원연구’, ‘남서태평양 해양생물자원개발사업’, ‘해양생물이용 유용신물질개발사업’ 등을 편입시켰고, 2006년부터는, 2002년부터 국립수산과학원의 생명공학연구단의 세부과제로 단편적으로 추진되어 오던 수산생명공학기술개발사업까지 마린바이오21사업 내로 편입하여 해양생명관련 사업들을 통합 추진하게 되었다.

출처 : 해양수산부 내부자료
|
그림 3-1-9-3 |
마린바이오21사업 추진체계
이를 통해 마린바이오21사업은 해양특이생물 및 극한생물의 분자유전체 연구를 통한 해양생물자원의 새로운 이용기술개발 및 제품화, 해양산업용 신소재 및 해양기능성 식품․환경성 소재 개발, 신약 후보물질 및 질병 치료제 개발 등을 통해 해양바이오기술을 활용한 해양생물자원의 고부가가치 산업화를 실현해 가고 있다. 또한 수산생명공학기술개발을 통해 수산양식생물 유전체의 유전자 발현 및 기능연구, 유전자 표지를 이용한 우량형질 탐색 및 개발, 수산양식생물 유전자은행 구축 및 정보관리 등이 기반 연구로 수행하고 있으며, 수산양식생물의 산업과학화를 위하여 수산물 유래의 활성소재 개발 연구가 수행되고 있다. 이러한 수산생명공학연구를 통하여 전통수산양식산업을 고부가가치의 첨단산업으로써 견인할 것으로 기대된다.
이러한 마린바이오21사업의 성과를 타 부처의 바이오사업과 단적으로 비교하기는 곤란하나 수치만을 놓고 볼 때, 마린바이오21사업의 투자 금액 대비 성과가 2배 정도에 이른다. 또한 계획 대비 사업목표 달성도(학술적․기술적 연구실적, 상용화․실용화 실적, 연구 인프라 실적, 연구 성과 확산 실적 등)에 있어서도 평균 200%가 넘는 높은 성과를 내고 있다.
※ SCI급 논문(185편), 국내특허출원(134건), 국내특허등록(29건), 국외특허출원(47건), 시제품(13건), 기술이전(5건)
※ 시제품 13건 : 중금속 세정 기능성화장품(해조류), 비누, 수용성 칼슘흡수촉진(어뼈)제, 기능성간장(생선껍질), 비만예방 기능성 어류(참치), 고지혈증 예방식품(매생이), 천연 게향료(5종) 개발 등

출처 : 국립수산과학원
그림 3-1-9-4
해조류를 이용한 기능성 화장품 개발

출처 : 포항공대 차형준
그림 3-1-9-5
홍합을 이용한 고효율 접착제 개발
다. 향후 추진방향
우리나라는 2004년 ‘해양과학기술(MT) 개발계획’ 수립 이후 표면적으로는 선진국에서 추진되고 있는 해양생명공학 연구의 대부분을 수행하는 것으로 나타나 있지만, 실제로는 선진국 기술 수준의 57.5% 정도로 약 5년 정도의 기술격차가 있는 것으로 평가되고 있다. 사실상 우리나라는 해양수산부뿐만 아니라, 전 부처의 해양관련 예산을 모두 합하여 비교한다 하여도 미국, 일본은 물론 중국의 1/3수준의 투자수준이기 때문에 좀더 과감한 정부의 투자 증액이 필요한 실정이다. 예를 들어 2005년과 2006년 2개년 동안 해양수산부의 해양생명공학사업 예산을 타 부처의 생명관련 사업 예산과 비교해 보면, 정부 8개 생명관련 부처 전체 예산 14,757억원의 1.3%인 190억원에 그치고 있어서, 해양생명공학의 무한한 가치에 비하여 투자가 매우 열악한 실정이라는 것을 알 수 있다.
우리나라는 육지 면적의 4.5배에 달하는 44만 3천 평방 km의 관할해역을 보유한 천혜의 해양국가로서, 생명공학(BT), 정보통신(IT) 기술 및 전통적인 수산 강국이며, 해양소재에서 제품화 성공률은 1/6,000, 육상생물소재의 1/3,000보다 두 배나 높고, 그 효율성 또한 높아서 해양생명산업의 발전 가능성과 가치는 어느 나라보다도 높다고 하겠다.
해양수산부에서는 국제적 해양생물자원의 상업화에 대처하고 해양생물에 대한 국가주권을 확보하여 해양생명산업을 21C 국가전략 산업 분야로 집중 육성하기 위하여 ① ‘국가생명자원 확보․관리 및 활용 마스터플랜’ 수립을 위한 ‘해양생명자원관리방안’ 도출 ② ‘제2차 국가생명공학육성기본계획(Bio-Vision 2016) 및 시행계획’ 수립에 대한 ‘해양생명공학육성 및 산업화 중장기계획(가칭 Blue-Bio Plan)’ 수립 ③ 구게식물신품종보호동맹(UPOV)27)에 대비한 ‘해조류 품종 개발 및 관리를 위한 방안’ 수립 ④ ‘해양생명 분야 사업’의 경제성 분석 및 추진 지원을 위한 법제화(초안)를 위해 2007년 7월부터 기획연구를 추진 중에 있으며 올해 안에는 기본안을 마련할 예정이다.
이를 기반으로 정부는 해양생명산업이 활성화될 수 있도록 지원․육성하고 수산식품기업을 고부가가치 해양바이오산업체로 전환하며, 산․학․연의 연구를 강화하는 등 민간이 할 수 없는 다양한 공공 분야의 투자와 인프라 구축을 위해 적극적으로 주도해 나갈 것이다.
|
핵심역할 |
|
추진체계 |
|
비고 |
||||||||||
|
|
|
|
|
|
|
|||||||||
|
의견조정, 종합, 정책제안 |
|
총괄조정위원회 (해양수산부) |
|
기본계획 확정 |
||||||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
총괄지원본부 (한국해양수산 기술진흥원) |
|
총괄 조정 지원, 토론회 및 공청회 |
|||||||
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
세부과제 기획 수행 |
|
제1세부 |
제2세부 |
제3세부 |
제4세부 |
|
세부과제 보고서 (조정가능) |
|||||||
|
|
해양생명자원 |
해양생명공학 |
UPOV |
법제화 |
|
|||||||||
출처 : 해양수산부 내부자료
|
그림 3-1-9-6 |
기획연구사업 추진체계

가. 추진배경
생명자원28)은 바이오 경제를 지탱하는 무궁한 가치의 미래자원으로써 농․축산업, 발효산업뿐만 아니라 최근에는 생명공학 관련 기술의 발달에 따라 첨단 신약, 신(新)종자 등 고부가가치 제품 개발을 위한 생명공학의 필수 소재로 재인식되고 있다.

출처 : 국가 생명자원 확보․관리 및 활용 마스터플랜(안), 과학기술혁신본부, 2007
|
그림 3-1-10-1 |
생명자원의 범주
이러한 인식하에 전 세계적으로 생명자원 확보 경쟁이 치열해지고 있으며, 우리로서도 자원선점이 미래 ‘바이오 한국’ 실현의 핵심 과제로 대두되고 있다. 또한 생명자원(생물자원, 생물다양성, 생명정보)의 유기적 연계를 통한 시너지효과 창출 및 국가 생명자원의 효율적 활용을 위한 범부처적 종합관리가 필요하며, 이에 대한 다양한 대책 마련이 시급한 상황이다.
이에 과학기술혁신본부에서는 “향후 10년 이내 생명자원 분야 국가경쟁력 선진 7위권 진입”을 목표로 효율적인 범부처 차원의 생명자원 종합관리 방안으로 ‘국가 생명자원 확보․관리 및 활용 미스터플랜’을 수립하여 (1) 생명자원 발굴을 위한 기반기술 확보를 통해 국내의 미래 고부가가치 생명자원의 확보, (2) 생명정보의 확보‧관리 효율화를 위한 생명자원의 종합 및 연계 시스템 강화, (3) 산업적 가치창출을 위한 생명자원의 산업화 활용체계 강화, (4) 생명자원 육성 및 종합관리를 위한 정책 및 법‧제도 정비를 실현하고자 한다.

출처 : 국가 생명자원 확보․관리 및 활용 마스터플랜(안), 과학기술혁신본부, 2007
|
그림 3-1-10-2 |
생명자원의 연계 및 종합화
나. 추진경과
그동안 생명자원의 종합관리를 위해 과학기술혁신본부는 2006년 9월에 개최된 제18회 과학기술관계장관회의에서 농림부, 보건복지부 등 관련 5개 부처와 공동으로 「국가 생명자원 확보․관리체제 구축방안」을 마련하였으며, 2007년 1월에는 이를 바탕으로 정보과학기술보좌관실에 「미래 생명자원 부국화 전략」으로 보고하여 생명자원의 중요성을 부각시키고자 노력하였다. 이의 후속조치로써 2007년 3월에 「국가 생명자원 확보‧관리 및 활용 마스터플랜」을 관련 5개 부처(과학기술부, 농림부, 보건복지부, 환경부, 해양수산부)와 공동으로 착수하였다.

출처 : 국가 생명자원 확보․관리 및 활용 마스터플랜(안), 과학기술혁신본부, 2007
|
그림 3-1-10-3 |
국가 생명자원 확보‧관리 및 활용 마스터플랜 추진 현황
다. 생명자원의 중요성
바이오산업의 소재인 생명자원은 막대한 시장 창출의 잠재력을 보유한 차세대 성장 동력으로써 생물자원의 세계시장 규모는 2003년 8천억 달러에서 2010년까지 2조 5천억 달러로 급성장할 것으로 전망되고 있다(cf. 석유화학제품 5천억 달러).

출처 : Ten Kate & Laird, The Commercial use of biodiversity-access to genetic resources and benefit sharing, 2003(국가 생명자원 확보․관리 및 활용 마스터플랜(안) 재가공, 과학기술혁신본부, 2007)
|
그림 3-1-10-4 |
생명자원 세계시장규모 현황 및 예측
또한 바이오 R&D의 필수 소재로써 그 중요성이 나날이 커지고 있다. 생명자원은 관련 기술의 발전에 따라 바이오산업 경쟁력의 원천이 되고 있으며 유용 생명자원 선점을 위한 국제적 경쟁이 치열해지고 있다.
특히 생명자원을 활용한 Taxol(연간 12억 달러), 은행잎 제제(연간 20억 달러) 등 천연물을 활용한 대형신약들이 개발되어 고부가가치를 창출하고 있으며 국내에서도 2002년 개발되어 2006년에만 395억원의 매출을 기록한 스티렌 등의 천연물 신약이 개발되고 있다. 또한 최근 IT기반기술이 접목되면서 생명자원 관련 정보 콘텐츠의 중요성이 확대되고 있다. 특히 생물정보학은 바이오신약뿐만 아니라 저분자 신약 개발의 거의 모든 과정에 활용되는 기반기술로 자리 잡고 있다. 실제로 Novartis사의 경우 3차원 결정구조에 기반을 둔 분자설계 기술을 활용하여 Gleevec을 개발한 바 있다.
라. 생명자원의 해외현황
선진 각국은 생명자원의 효율적 활용을 위한 국가 관리 육성 체제를 강화하고 있는데, 생명자원 최대보유국인 미국은 자국 및 아시아․태평양 권역의 생명자원을 지속적․전략적으로 확보하고 있으며, 일본은 생명자원 종합 관리를 위한 국가차원의 통합거점센터 운영, 유럽연합은 생명자원의 주도권 확보를 위해 개별국가차원을 초월한 연합국간 자원 정보 통합 시스템 구축 및 표준화를 추진하고 있다. 이에 비하여 자원부국인 코스타리카의 경우는 생물다양성법을 개정하였으며, 필리핀, 인도네시아, 브라질 등은 독립적인 특별법을 제정하는 등 자국의 자원을 보호하기 위하여 노력 중이다.
출처 : 국가 생명자원 확보․관리 및 활용 마스터플랜(안), 과학기술혁신본부, 2007
|
그림 3-1-10-5 |
생명자원 관련 국제기구의 동향 흐름도
자원선점에 있어 선진국과 개도국간 첨예한 대립 양상을 보이고 있으며, 선진국은 생물자원(동식물, 미생물 등)은 소유권의 대상이 아니라고 주장하며, 세계 곳곳에서 자원을 채취하고 특허를 통해 독점권 행사하고 있으며, 개도국은 자국의 생물자원을 선진국들이 유출하여 이윤을 챙기는 「유전자 해적행위」를 비난하며 자국의 생물자원 보호 및 강화를 추진하고 있다. 생물다양성협약, OECD 생물자원센터 네트워크, 세계생물다양성정보기구, 세계지식재산권기구(WIPO), 세계무역기구(WTO), 국제식물신품종보호협약(UPOV)등 다양한 국제기구를 통하여 생명자원의 공동 활용 방안을 모색하는 한편 자원제공 국가의 권리에 대한 국제적 기준 마련을 위한 논의를 활발히 진행하고 있다. 특히 세계지식재산권기구 등은 주로 개도국의 입장에서 생물자원의 보존과 개발 논의를 진행하고 있고 이에 반하여 세계무역기구, 국제식물신품종보호협약 등은 주로 선진국 입장에서 지식재산권 보호입장을 견지하고 있다. 이에 따라 무역관련 지식재산권에 관한 협정(TRIPs, Agreement on Trade-Related Aspects of Intellectual Property Rights)에서 생물자원의 이용에 대하여 심도 있는 논의가 진행되고 있으며 특히 TRIPs 협정 중 특허보호대상에 대한 제27조 조항 및 특허출원 요건에 대한 제29조 조항에 대하여 개도국과 선진국 간에 첨예한 대립을 보이고 있다.
마. 우리의 현황과 문제점
1904년부터 자생수목 260여 종이 미국 등으로 반출되었다가 최근에는 조경수로 고가에 역수입되는 현실이며, 외국기업(Syngenta, Semminis)이 국내 1~3위 종묘회사인 서울, 흥농, 중앙을 인수하는 등 종자산업 등과 관련된 산업의 해외잠식이 본격화되고 있다.
생명자원에 대한 정부예산은 꾸준히 증가되고 있으나, 절대적 예산규모와 공공기관 등에 확보된 생명자원 규모는 선진국과 대비했을 때 크게 미흡한 상황으로, 2006년 기준 생명공학 분야의 전체 투자 예산 7,560억원 중 생명자원 관련 사업에는 7개 부처에서 총 1,144억원(16.1%)을 투자하고 있다(2007년 생명공학육성시행계획).

출처 : 국가 생명자원 확보․관리 및 활용 마스터플랜(안), 과학기술혁신본부, 2007
|
그림 3-1-10-6 |
생명자원 관련 정부예산 추이
이는 미국의 대표적인 생명자원 기관 중 하나인 NCBI29)(3,150억원, 2006년 기준)에 비하여 한국 생명자원 총 예산은 약 1/3수준에 불과한 실정이며, 우리나라가 확보하고 있는 식물자원(종자)은 약 15만점으로 미국(47만점)의 1/3, 중국(38만점)의 1/2.5, 일본(28만점)의 1/1.8수준이다.

출처 : 국가 생명자원 확보․관리 및 활용 마스터플랜(안), 과학기술혁신본부, 2007
|
그림 3-1-10-7 |
주요 국가별 식물자원(종자) 보유 현황
또한 미생물, 작물, 인간유전체 등의 프론티어사업단을 중심으로 대량의 생명자원 확보를 추진 중이며, 생명자원의 산업화를 추진하기 위한 전략수립의 필요성을 인식하여 국가차원의 계획을 수립하는 단계이나 아직까지 가시적인 성과는 미흡하다. 게다가 확보된 자원의 활용성 제고를 위한 정보표준화 등에 대한 논의는 극히 미흡한 실정이다. 2004년 과학기술혁신본부 출범 이후 부처별/사업별 중복을 방지하고 연구개발 예산의 효율화를 위한 조정을 추진 중이나, 아직까지 생명자원에 대한 전략적이고 종합적인 관리가 미흡한 상황이다.

출처 : 국가 생명자원 확보․관리 및 활용 마스터플랜(안), 과학기술혁신본부, 2007
|
그림 3-1-10-8 |
생명자원 관련 국내 정책변화
바. 시사점
국가 미래발전전략의 핵심요소로써 생명자원 확보 및 활용 강화를 위해 미래 생명자원 발굴을 위한 대형사업화 확산 및 기술선도를 위한 관련 학문, 산・학・연 협력 환경의 활성화가 필요하며, 이에 따라 생명자원의 주도권 확보, 산업화 촉진을 위한 국가적 운영방안 수립 및 범부처적 생명자원 종합운영을 위한 법・제도 정비 등 국가차원의 종합관리 및 조정 시스템 강화가 시급하다 할 수 있다.
또한 산업화를 위한 생명자원의 활용시스템 구축, 산업계 수요 및 특성을 반영한 생명자원발굴(bioprospecting) 전략을 구축하는 등 유용 생명자원 활용을 통한 산업적 가치의 제고가 필요하다. 세계경쟁구도 변화에 유연한 대응을 위해 생명자원 확보․관리 및 활용이 미래 바이오 경제 시대의 패권을 결정짓는 중요한 요소라는 인식의 확대 및 생명자원 관련 국제법 및 기구에서 지식재산권을 포함한 지식기반의 국가경쟁력 강화가 절실히 필요한 시점이다.

출처 : 국가 생명자원 확보․관리 및 활용 마스터플랜(안), 과학기술혁신본부, 2007
|
그림 3-1-10-9 |
국가생명자원 확보·관리 및 활용을 위한 중점추진사항
마. 미래 자원으로서의 파급효과
「국가 생명자원 확보・관리 및 활용 마스터플랜」 수립이 완료되고 관련 기본법이 제정되면 국가 차원의 체계적인 자원관리를 통한 효율성 증대를 통해 부처별 관련 자원, 인력 등에 대한 정확한 실태파악을 통하여 관리체계가 개선될 수 있을 것으로 예상된다. 분야별 책임기관협의회를 중심으로 자원관리 및 정보공유를 통하여 국가차원의 유기적 관리체계 확립으로 국내 생명자원 관련 정보통합검색 및 산업적 활용성이 극대화될 것으로 예상되며 이를 바탕으로 한 생명자원의 국가적 종합관리 및 전략화를 실현할 수 있을 것이다.
또한 각종 국제협약, 국제기구 등에 대한 국가 차원의 전략적 대응을 통해 토종 유용자원 관리체계 마련 및 지식재산권의 국가 대응체계가 강화될 것으로 전망되며, 이를 통한 미래 생명자원의 확보 및 융합 신기술 개발로 고부가가치 산업 발전 도모, 미래 신(新)성장 동력 확보 및 향후 도래할 바이오 경제시대의 신(新)산업의 창출이 기대된다.
이러한 산업적 측면 외에도 안전한 먹거리, 양질의 의료서비스, 쾌적한 환경 등 국민의 건강증진 및 삶의 질 향상 도모와 생태관광 또는 녹색관광을 통한 쾌적한 자연환경 및 건강치료법 제공(예, 그린제품, 치료 숲) 등을 통하여 생명자원을 활용한 새로운 가치를 창출할 수 있을 것으로 전망된다.
생명자원은 후손에게 물려주어야 할 소중한 공공의 자산으로 우리가 가진 토종 생명자원을 보호하고 나아가 더 많은 생명자원을 발굴‧확보하는 것은 후손들의 풍요로운 삶에 대한 현 세대의 사명이라고 할 수 있다.


가. 정부의 연구개발 투자 현황
(1) 국가연구개발사업 투자 규모 추이
21세기 지식기반경제가 심화되면서 세계 각국은 과학 기술력을 중심으로 국가경쟁력 향상에 노력하고 있다.
우리나라도 국가연구개발사업 예산규모가 1990년 이후부터 점차 확대되고 있으며, 참여정부는 과학기술부총리 체제 출범과 과학기술혁신본부 신설 등 과학기술혁신체제를 구축하여 연구개발 효율성을 높이고 연구개발성과를 미래 성장 동력으로 연계시키고자 하고 있다.
2006년도에는 국가연구개발사업 효율화 및 특성화를 위한 중장기 투자전략인 「국가 R&D사업 Total Roadmap」을 수립하여 기술 분야별로 정부 R&D투자 포트폴리오를 제시하였는데, 생명 분야는 향후 15년 동안 투자를 강화하는 투자비중 증가형 그룹에 포함되어 있다. 생명 분야에 대한 투자비중의 증가는 2020년을 전후하여 가시화될 것으로 여겨지는 바이오 경제(bioeconomy) 시대에 대한 적절한 대비가 될 것이다.
2006년도 정부 연구개발 총 투자는 일반회계, 특별회계 및 기금을 포함해서 8조 9,096억원으로 2005년의 7조 7,996억원에서 1조 1,100억원(14.2%) 증가하였으며, 2000년부터 2006년까지 연평균 증가율은 13.4%로 나타났다. 일반회계를 기준으로 정부 연구개발예산의 비중은 2006년 4.2%로 2005년과 동일한 수준이었다. 2006년도 국가연구개발사업에는 총 8조 7,639억원이 집행되었는데, 이는 2006년도 정부 연구개발예산에서 1,456억원이 미집행 되었음을 의미한다. 최근 7년간 국가연구개발사업 규모 변화 추이는 [표 3-2-1-1]에 나타나 있다.
|
표 3-2-1-1 |
국가연구개발사업 규모 변화 추이(2000∼2006년)
(단위 : 억원)
|
구 분 |
2000년 |
2001년 |
2002년 |
2003년 |
2004년 |
2005년 |
2006년 |
연평균 증가율 |
|
|
일반회계 예산(A) |
887,363 |
991,801 |
1,096,298 |
1,181,323 |
1,201,394 |
1,352,156 |
1,469,625 |
8.8 |
|
|
R&D
예산 |
일반(B) |
35,313 |
41,635 |
48,501 |
52,678 |
57,418 |
56,612 |
61,094 |
9.6 |
|
(B/A, %) |
(4.0) |
(4.2) |
(4.4) |
(4.5) |
(4.8) |
(4.2) |
(4.2) |
|
|
|
일반+특별 |
37,495 |
44,853 |
51,583 |
55,768 |
60,995 |
67,368 |
72,283 |
11.6 |
|
|
기금 |
4,479 |
12,487 |
9,833 |
9,386 |
9,832 |
10,628 |
16,813 |
24.7 |
|
|
총 투자 |
41,974 |
57,340 |
61,416 |
65,154 |
70,827 |
77,996 |
89,096 |
13.4 |
|
|
조사 ․ 분석 대상 |
투자액 |
30,746 |
45,283 |
46,984 |
49,036 |
59,847 |
77,904 |
87,639 |
19.1 |
|
사업수 |
204 |
217 |
211 |
266 |
314 |
390 |
357 |
9.8 |
|
|
과제수 |
16,812 |
21,237 |
22,921 |
25,794 |
26,514 |
30,425 |
31,967 |
|
|
출처 : 2007년도 국가연구개발사업 조사‧분석 보고서, 국가과학기술위원회, 2007
(2) 미래유망신기술(6T) 분야별 투자 규모 추이
우리나라는 선진국에 비해 10여 년 뒤쳐진 1980년대에 생명공학기술 연구기반 구축에 착수하였으나30), 2000년대에 들어서 IT(정보통신기술), NT(나노기술), ET(에너지‧환경기술), ST(우주기술), CT(문화기술)과 함께 BT(생명공학)를 미래 성장 동력을 창출해 낼 미래유망신기술로 선정하여 집중적으로 투자를 확대하고 있다. 2006년도 6T 분야 투자액은 전년 대비 8,820억원 증가하여 총 4조 9,380억원으로 정부연구개발 투자 중 61.4%를 차지하였다. 최근 3년간 미래유망신기술에 대한 투자 현황은 [표 3-2-1-2]에 나타나 있다31).
|
표 3-2-1-2 |
6T별 투자 추이(2004∼2006년)
(단위 : 억원)
|
6T |
2004년 |
2005년 |
2006년 |
증 감 |
||||
|
금액 |
비중(%) |
금액(A) |
비중(%) |
금액(B) |
비중(%) |
B-A |
% |
|
|
IT |
13,673 |
22.8 |
14,748 |
20.4 |
16,260 |
20.2 |
1,512 |
9.3 |
|
BT |
7,717 |
12.9 |
10,967 |
15.2 |
13,019 |
16.2 |
2,052 |
15.8 |
|
NT |
3,041 |
5.1 |
3,191 |
4.4 |
3,432 |
4.3 |
241 |
7.0 |
|
ET |
5,468 |
9.1 |
6,842 |
9.5 |
9,440 |
11.7 |
2,599 |
27.5 |
|
ST |
2,550 |
4.3 |
4,270 |
5.9 |
6,745 |
8.4 |
2,475 |
36.7 |
|
CT |
531 |
0.9 |
541 |
0.7 |
483 |
0.6 |
△58 |
△12.1 |
|
소계 |
32,981 |
55.1 |
40,560 |
56.2 |
49,380 |
61.4 |
8,820 |
17.9 |
|
기타 |
26,866 |
44.9 |
31,658 |
43.8 |
31,013 |
38.6 |
△645 |
△2.1 |
|
합계 |
59,847 |
100.0 |
72,218 |
100.0 |
80,393 |
100.0 |
8,175 |
10.2 |
출처 : 2007년도 국가연구개발사업 조사‧분석 보고서, 국가과학기술위원회, 2007
생명공학 분야에 대한 투자를 살펴보면, 2006년도에 1조 3,019억원으로 정부 연구개발 투자에서 차지하는 비중은 16.2%로 나타났는데, 이는 전년도 대비 15.8% 증가한 액수이다. 최근 3년 간의 추이를 살펴보면, 생명공학(BT) 분야에 대한 투자액은 IT 분야보다 뒤지고 있으나, IT 분야 투자비중은 22.8%(2004년도)에서 20.2% (2006년도)로 낮아진 반면에 생명공학 분야는 12.9%에서 16.2%로 투자비중이 계속 증가하고 있는 것으로 나타났다.
나. 부처의 생명공학 분야 연구개발 투자 현황
(1) 연구개발단계별 투자 현황
2006년도 생명공학 분야에 대한 부처별 투자현황을 살펴보면, 과학기술부가 4,213억으로 전체 생명공학 분야의 32.4%를 투자하였고 농촌진흥청 2,119억원(16.3%), 산업자원부 1,858억원(14.3%), 보건복지부 1,755억원(13.5%) 순으로 투자가 이루어졌다. 연구개발단계별로 살펴보면 기초연구, 응용연구, 개발연구에 각각 34.9%, 30.0%, 31.5%가 투자된 것으로 나타났다.
기초 및 응용연구는 과학기술부가 각각 2,464억원, 1,174억원을 투자하였고, 개발연구는 산업자원부가 1,354억원으로 가장 많은 투자를 한 것으로 나타났다[표 3-2-1-3].
|
표 3-2-1-3 |
생명공학 분야 부처별 연구개발단계별 투자 현황(2006년)
(단위 : 백만원)
|
연구개발단계 |
과학 기술부 |
교육 인적 자원부 |
농림부 |
산업 자원부 |
보건 복지부 |
환경부 |
해양 수산부 |
방위 사업청 |
농촌 진흥청 |
산림청 |
중소 기업청 |
식품 의약품 안전청 |
총합계 |
|
기초 연구 |
246,413 |
65,744 |
8,409 |
14,799 |
37,422 |
4,872 |
7,855 |
- |
44,963 |
2,426 |
4,077 |
17,503 |
454,483 |
|
응용 연구 |
117,413 |
21,523 |
20,375 |
28,687 |
69,842 |
915 |
8,122 |
- |
98,158 |
10,504 |
187 |
15,147 |
390,873 |
|
개발 연구 |
53,821 |
2,620 |
40,626 |
135,389 |
51,272 |
- |
24,048 |
1,391 |
59,600 |
14,439 |
22,649 |
4,442 |
410,297 |
|
기타 |
3,649 |
9,140 |
- |
6,913 |
16,969 |
- |
- |
- |
9,180 |
- |
- |
405 |
46,256 |
|
총합계 |
421,296 |
99,027 |
69,410 |
185,788 |
175,505 |
5,787 |
40,025 |
1,391 |
211,901 |
27,369 |
26,913 |
37,497 |
1,301,909 |
출처 : 2007년도 국가연구개발사업 조사‧분석 보고서, 국가과학기술위원회 관련 자료에서 산출, 2007
(2) 국가과학기술표준분류별 투자 현황
2006년도 생명공학 분야에 대한 투자를 국가과학기술표준분류 19개 대분류 기준으로 살펴보면, 보건‧의료 분야에 4,348억원(33.4%), 생명공학 분야에 3,871억원(29.7%), 농림‧수산 분야에 3,633억원(27.9%) 순으로 투자가 이루어진 것으로 나타났다. 생명공학 분야는 과학기술부가 2,344억원, 보건‧의료 분야는 보건복지부가 1,635억원, 농림‧수산 분야는 농촌진흥청이 1,827억원으로 분야별로 가장 많은 투자를 한 것으로 나타났다[표 3-2-1-4].
|
표 3-2-1-4 |
생명공학 분야 부처별 국가과학기술표준분류별 투자현황(2006년)
(단위 : 백만원)
|
표준 분류 |
과학 기술부 |
교육 인적 자원부 |
농림부 |
산업 자원부 |
보건 복지부 |
환경부 |
해양 수산부 |
방위 사업청 |
농촌 진흥청 |
산림청 |
중소 기업청 |
식품의약품 안전청 |
총합계 |
|
수 학 |
799 |
474 |
|
|
|
|
|
|
|
|
|
|
1,273 |
|
물리학 |
3,590 |
700 |
|
189 |
|
|
|
|
|
|
144 |
130 |
4,753 |
|
화 학 |
15,123 |
3,713 |
|
8,864 |
375 |
|
120 |
300 |
|
|
1,151 |
190 |
29,836 |
|
생명공학 |
234,440 |
34,539 |
2,380 |
54,657 |
11,450 |
5,156 |
1,489 |
1,091 |
27,576 |
2,826 |
5,252 |
6,285 |
387,141 |
|
지구과학 |
2,139 |
|
|
|
|
|
|
|
|
|
|
|
2,139 |
|
기 계 |
5,419 |
477 |
968 |
5,225 |
|
|
|
|
|
|
1,111 |
|
13,200 |
|
재 료 |
2,459 |
633 |
|
4,875 |
45 |
|
|
|
|
|
981 |
|
8,993 |
|
화학공정 |
1,541 |
467 |
|
1,874 |
|
|
500 |
|
|
|
2,725 |
100 |
7,207 |
|
전기‧전자 |
2,514 |
304 |
|
570 |
|
|
|
|
|
|
897 |
|
4,285 |
|
정 보 |
200 |
291 |
|
296 |
|
|
|
|
|
|
41 |
|
828 |
|
통 신 |
|
|
|
|
|
|
|
|
|
|
16 |
|
16 |
|
농림‧수산 |
16,660 |
19,111 |
65,762 |
22,151 |
|
|
26,227 |
|
182,666 |
24,543 |
5,837 |
345 |
363,302 |
|
보건‧의료 |
108,549 |
35,930 |
230 |
82,897 |
163,512 |
|
3,794 |
|
1,534 |
|
7,911 |
30,447 |
434,804 |
|
환경 |
600 |
1,989 |
70 |
442 |
|
631 |
620 |
|
90 |
|
739 |
|
5,181 |
|
에너지‧자원 |
|
14 |
|
|
|
|
|
|
20 |
|
|
|
34 |
|
원자력 |
22,702 |
54 |
|
|
123 |
|
|
|
|
|
|
|
22,879 |
|
건설‧교통 |
125 |
|
|
|
|
|
|
|
|
|
84 |
|
209 |
|
우주‧항공‧ 천문‧해양 |
4,436 |
323 |
|
78 |
|
|
7,275 |
|
|
|
24 |
|
12,136 |
|
기술혁신‧과학기술 정책 |
|
8 |
|
3,670 |
|
|
|
|
15 |
|
|
|
3,693 |
|
총합계 |
421,296 |
99,027 |
69,410 |
185,788 |
175,505 |
5,787 |
40,025 |
1,391 |
211,901 |
27,369 |
26,913 |
37,497 |
1,301,909 |
출처 : 2007년도 국가연구개발사업 조사‧분석 보고서, 국가과학기술위원회 관련 자료에서 산출, 2007
(3) 주요 부처별 투자현황
2006년도 생명공학 분야 투자액을 기준으로, 4개 주요 부처(청 포함)의 생명공학 분야 주요 연구개발 사업내용을 살펴보면 다음과 같다[표 3-2-1-5].
|
표 3-2-1-5 |
4개 부처 주요사업별 투자현황(2006년)
(단위 : 백만원)
|
부 처 |
주요 연구사업명 |
2006년 투자액 |
|
과학기술부 |
21세기프론티어연구개발사업 |
66,626 |
|
기반기술개발(나노‧바이오), 특정기초연구지원 |
83,445 |
|
|
우수연구센터육성, 창의적 연구진흥사업, 국가지정연구실사업 |
55,275 |
|
|
동북아R&D허브기반조성 |
20,387 |
|
|
차세대성장동력사업(바이오신약‧장기) |
15,500 |
|
|
농림부 |
농림기술개발 |
44,204 |
|
수의과학검역원, 바이오장기생산연구 |
25,206 |
|
|
농촌진흥청 |
원예연구, 작물연구 |
59,902 |
|
바이오그린21, 농업생명공학연구 |
41,560 |
|
|
축산연구 |
27,511 |
|
|
농업기초연구 |
20,616 |
|
|
고령지농업연구, 난지농업연구 |
17,527 |
|
|
산림청 |
국립산림과학원, 산림과학기술개발 |
27,369 |
|
보건복지부 |
보건의료기술연구개발(기금) |
123,197 |
|
국립암센터연구소지원 |
27,282 |
|
|
질병관리연구 |
16,780 |
|
|
식품의약품 안전청 |
독성연구개발, 독성연구소 |
22,900 |
|
의약품안전연구개발, 식품안전연구개발, 의료기기안전연구개발 |
13,708 |
|
|
산업자원부 |
차세대신기술 |
28,429 |
|
산업혁신기술개발-중기거점기술, 성장동력기술개발 |
22,775 |
|
|
생물산업기술실용화센터 건립 |
16,500 |
|
|
중소기업청 |
중소기업기술혁신개발 |
19,068 |
출처 : 2007년도 국가연구개발사업 조사‧분석 보고서, 국가과학기술위원회 관련 자료에서 산출, 2007
(가) 과학기술부
21C프론티어연구개발사업 사업단에 666억원, 차세대성장동력사업(바이오신약․장기)에 155억원을 비롯하여 기초‧원천기술개발을 위한 나노바이오기술개발사업에 484억원, 특정기초연구개발사업 지원에 350억원, 우수연구자 육성을 위한 우수연구센터육성사업에 330억원, 창의적 연구진흥사업에 116억원, 국가지정연구실사업에 107억원 등을 투자한 것으로 나타났다.
(나) 농림부 ‧ 농촌진흥청 ‧ 산림청
농림부는 농림기술개발사업에 442억원, 수의과학검역원에 190억원, 바이오장기생산연구사업에 62억원을 투자한 것으로 나타났다. 농촌진흥청은 원예연구에 353억원, 바이오그린21사업에 308억원, 축산연구에 275억원, 작물연구에 246억원, 농업생명공학연구에 108억원 등을 투자한 것으로 나타났다. 산림청은 국립산림과학원에 265억원 그리고 산림과학기술개발사업에 8.7억원을 투자한 것으로 나타났다.
(다) 보건복지부 ‧ 식품의약품안전청
보건복지부는 보건의료기술연구개발사업에 1,232억원을 투자하였고, 한의학 R&D (한방치료기술연구개발), 질병관리연구(급만성 질환연구, 항생제 내성연구 등), 코호트연구 중심의 유전체실용화사업, 국립암센터의 암정복추진연구개발사업 등 질환중심의 연구개발에 투자하였다. 식품의약품안전청은 독성연구개발사업에 가장 많은 금액인 132억원을 투자하였고, 독성연구소에 97억원, 의약품안전연구개발에 67억원 등을 투자하였다.
(라) 산업자원부 ․ 중소기업청
산업자원부는 차세대신기술사업에 284억원, 산업혁신기술개발사업(중기거점기술, 성장동력기술개발)에 228억원 등 생명공학 분야 관련 연구를 지원하였는데, 신약개발 전임상/임상 지원을 위한 Bio-Star를 위한 Total Solution 지원 사업, 차세대신기술/중기거점사업 등 바이오 연구개발의 제품화 관련 사업 및 바이오제품의 생산을 위한 생물산업기술실용화센터건립사업 등을 통해 주로 제품화 연구개발에 투자하였다. 중소기업청은 중소기업기술혁신개발사업을 통해 생명공학 분야에 191억원을 투자하였다.

가. 바이오산업의 인력현황
한국바이오산업협회가 조사 발표한「2005년도 국내 바이오산업의 인력 활용실태(2006. 11)」에 의하면 산업계 취업자는 총 13,867명이다. 2005년도 바이오산업의 연구개발비는 4,746억원으로 지식집약산업이며, 인력 또한 연구부문에 종사하는 비중이 높다. 즉, 전체 인력의 53.6%인 7,430명이 연구 인력이며, 나머지 6,437명이 생산인력으로 구성되어 있다[표 3-2-2-1].
|
표 3-2-2-1 |
바이오산업부문 인력(2005년)
(단위:명, %)
|
구 분 |
박 사 |
석 사 |
학 사 |
기 타 |
합 계 |
|
연구인력 |
1,181 (15.9) |
3,576 (48.1) |
1,925 (25.9) |
748 (10.1) |
7,430 (100) |
|
생산인력 |
97 ( 1.5) |
762 (11.8) |
2,249 (34.9) |
3,329 (51.7) |
6,437 (100) |
|
총 계 |
1,278 ( 9.2) |
4,338 (31.3) |
4,174 (30.1) |
4,077 (29.4) |
13,867 (100) |
주 1. 연구 인력은 생명공학부문 연구개발 인력 + 연구 관리직(생명공학 전공자) 해당
2. 생산인력은 연구소 이외의 바이오산업 관련부문 생산직 해당
3. 기타는 테크니션 및 연구보조원 해당
출처 : 한국바이오산업협회, 2006
이들 인력의 학력별 구성을 보면 박사는 10.2%, 석사와 학사인력이 각각 34.5%와 33.2%를 차지하고 있다. 즉, 석사 이상이 전체 취업인력의 40.5%를 차지하여 고학력 인력의 비중이 대단히 높다. 또한 고학력 인력일수록 연구에 종사하는 것으로 나타났는데, 박사인력의 92.4%, 석사인력의 82.4%가 연구부문에 종사하고 있다. 학사인력은 연구부문과 생산부문에 46:54의 비율로 종사하고 있다. 이처럼 바이오산업이 연구인력 중심의 구성을 보이지만 이들 석․박사인력의 비중은 매년 조금씩 줄어들고 있다.
[표 3-2-2-2]는 산업별로 바이오산업의 인력구성을 살펴본 것이다. 종사자 규모를 볼 때 생물의약산업이 5,262명(37.9%)으로 가장 크고, 다음으로 바이오식품산업 3,550명(25.6%), 생물화학산업 1,826명(13.2) 순으로 이들 세 산업이 전체의 76.7%를 차지한다. 이들 주요 산업에서 연구 인력과 생산인력이 차지하는 비중은 각각 54:46, 43:57, 60:40으로 생물화학산업이 상대적으로 연구인력 집약적인 것으로 나타났다. 나머지 산업들의 경우 연구부문 종사자가 절반 이상을 차지하고 있어 전술한 바와 같이 바이오산업이 지식집약화된 산업임을 알 수 있게 한다. 특히 생물전자산업과 생물검정 및 기타산업32)의 연구인력 비중은 각각 63.9%와 82.7%로서 바이오산업들 중 가장 높은 편이다.
|
표 3-2-2-2 |
바이오산업의 산업별 인력 구성
(단위: 명, %)
|
생물의약 |
생물화학 |
바이오식품 |
생물환경 |
|
5,262 (37.9) |
1,826 (13.2) |
3,550 (25.6) |
1,189 ( 8.6) |
|
생물전자 |
생물공정 및 기기 |
바이오에너지 및 자원 |
생물검정 및 기타 |
|
180 ( 1.3) |
692 ( 5.0) |
457 ( 3.3) |
711 ( 5.1) |
출처 : 한국바이오산업협회(각 년도)
나. 바이오산업의 고용 추이
한국바이오산업협회가 조사한 1997~2005년 바이오산업의 인력 고용실태를 분석하면 이 기간 동안 인력규모는 연평균 19.7% 증가한 것으로 나타났다. 이는 매 4년마다 인력규모가 약 2배씩 늘어난 것으로 그동안 바이오산업이 급격히 성장했음을 보여준다. 같은 기간에 연구개발비는 1,263억원에서 4,746억원으로, 시설투자비는 600억원에서 2,620억원으로 각각 연평균 18.0%와 20.2% 증가한 것 또한 이를 반영한다. 이 기간 동안 인력증가의 내용에 있어서는 연구 인력보다 생산인력의 증가가 다소 컸다. 즉, 연구 인력은 연평균 18.7%, 생산인력은 20.9% 늘어났다. 또한 이 기간 동안 학사가 27.5%의 증가율로 석사의 19.5%나 박사의 19.2%에 비해 높았다.33) 이것은 2000년 초반 이후의 생산인력 증가 추세와 병행되어 진행되고 있다. 동시에 [표 3-2-2-3]을 통해 고급인력에 대한 수요 역시 병존하고 있음을 확인할 수 있다.
|
표 3-2-2-3 |
바이오산업의 학력별 고용 증가율(1997∼2005)
(단위: %, 년)
|
구 분 |
박 사 |
석 사 |
학 사 |
기 타 |
합 계 |
|
연구인력 |
18.4% |
18.3% |
20.3% |
17.1% |
18.7% |
|
생산인력 |
36.6% |
27.2% |
31.0% |
15.8% |
20.9% |
|
합 계 |
19.2% |
19.5% |
25.0% |
16.0% |
19.7% |
출처 : 한국바이오산업협회(각 년도)
다. 생명공학인력의 수요전망
수요전망에 있어서는 바이오산업의 학력별․직무별 고용증가율을 근거로 바이오산업의 전체 종사자를 추정하고 2015년까지의 신규수요를 전망하였다. 특히 수요전망의 경우 생명공학인력 수요에 대한 과대평가를 방지하기 위해 생명공학 전문기업에 대한 한국바이오산업협회의 실태조사를 바탕으로 하였다.
전술한 고용추세를 반영하여 향후 생명공학인력 수요를 추정하면, 2005년에 14,000여 명 수준이었던 생명공학인력의 규모는 2010년에는 36,000여 명으로 늘어나고, 2015년에는 약 10,000명에 이를 것으로 전망된다[표 3-2-2-4]. 직무별로 보면 2005년 7,430명이던 연구 인력의 규모는 2010년에 17,526명 그리고 2015년에는 2005년보다 5.6배 정도 늘어난 41,411명에 이를 것으로 보인다. 학력별로는 향후 10년 동안 박사인력이 6.7배, 석사 6.4배, 학사 10.9배 그리고 기타인력이 4.4배 등으로 늘어난 것으로 보아 생산 활동의 확대와 더불어 학사인력의 수요가 가장 큰 폭으로 늘어날 것임을 보여준다.
|
표 3-2-2-4 |
기술수준별 생명공학인력 수요전망
(단위: 명)
|
연 도 |
총종사자수 |
직 무 별 |
학 력 별 |
||||
|
연구직 |
생산직 |
박사 |
석사 |
학사 |
기타 |
||
|
2005 |
13,867 |
7,430 |
6,437 |
1,278 |
4,338 |
4,174 |
4,077 |
|
2010 |
36,128 |
17,526 |
18,602 |
3,214 |
10,821 |
13,525 |
8,567 |
|
2015 |
99,971 |
41,411 |
58,560 |
8,610 |
27,645 |
45,704 |
18,013 |
출처 : 2005년 조사 결과(박재민)와 2006년 조사 결과(박재민)에 대해 최근 연도의 추세를 감안하여 수정
이처럼 바이오산업의 고용규모가 매 5년마다 2.7배 내외씩 늘어날 것으로 예상되는 가운데, 새로운 인력수요는 현재(2005년) 총 1,700명 수준에서 2008년에는 약 4,300명, 2010년 6,400명 그리고 2015년에는 19,000명 수준으로 점증할 것으로 추정되었다.
참 고 문 헌
박재민, “생명공학(BT) 전문인력의 현황과 전망”,「2003 생명공학 백서」, 과학기술부, 2003
박재민, “BT인력의 중장기 수급 현황 및 전망”,「인적자원의 중장기 수급전망」, 교육인적자원부․한국직업능력개발원, 2005
박재민, “생명공학 경쟁력 지표 현황: 인력현황”,「2005 생명공학 백서」, 과학기술부, 2005
박재민, “생명공학(BT) 전문인력의 현황과 추이 분석”, 연구자료, 2007
한국바이오산업협회,「국내 생물산업 현황」, 각 연도

가. 생명공학 특허 개요
생명공학 분야에 있어서 특허는 매우 중요한 의미를 갖는다. 막대한 연구개발비가 투입되고 장기간의 연구개발기간이 소요되며, 일부 분야는 시장진입을 위한 법적 승인을 위해 장시간이 소요되는 특성을 지니고 있어 생명공학 분야에서 투자회수를 위한 법적 장치인 특허의 획득은 매우 중요하다고 할 수 있다.
특히 생명공학 분야의 연구개발 정책 수립을 위해서는 특허정보에 대한 분석이 반드시 필요하다. 특허정보는 연구개발과의 밀접한 연관성, 풍부하고 객관적인 정보의 제공, 데이터의 접근 용이성 등의 특징을 갖고 있어 연구개발성과 측정 및 국가의 과학기술정책을 수립하는 기초자료로 활용이 가능하기 때문이다.
나. 분석기준
생명공학 분야의 기술 분류는 주로 OECD에서 분류한 기준을 토대로 한국특허청의 전문가 집단에서 6개 산업, 13개 기술 분류, 27개의 세 분류로 구분하였다.
분석대상 국가로는 특허를 가장 강하게 보호하고 시장규모도 큰 미국 특허를 대상으로 하였으며, 한국은 출원시점을 1996~2005년까지로, 미국 특허는 등록기준을 1996~2006년까지로 동향을 파악하였다.
|
표 3-2-3-1 |
생명공학의 기술 분류
|
산 업 |
기술 분류 |
세 분 류 |
|
공 정 |
생물공정 |
동식물 세포배양장치, 분리정제, 생물학적합성, 효소 미생물관련 장치 |
|
측정진단 |
조사․분석, 측정․시험 |
|
|
기 초 |
생물자원탐색 |
미생물, 바이러스 |
|
동식물세포배양 |
동식물세포 |
|
|
효소공학 |
효소 |
|
|
유전체 |
당유기함유핵산, 유전공학 |
|
|
단백질체 |
고정화펩타이드, 펩타이드, 하이브리드펩타이드 |
|
|
항체이용 |
면역글로블린 |
|
|
농 업 |
생물농약 |
생물농약 |
|
형질전환동식물 |
신규한동물, 신규한 식물 |
|
|
식 품 |
발효식품 |
알콜발효 및 장치 |
|
의 약 |
생물의약 |
단백질치료제, 방사선의약, 신약후보물질, 유전자치료, 치료용 항체 |
|
환 경 |
환경생물공학 |
생물학적 수처리, 슬러지처리 |
출처 : 생명공학특허동향, 특허청/한국특허정보원, 2003
다. 한국에 출원된 생명공학특허건수 동향
한국에 출원한 생명공학 분야의 특허출원건수를 살펴보면, 1999년 이후 급격한 증가세를 보이고 있는 것으로 나타났다. 세부기술별로 살펴보면, 연평균 200여 건 이상 출원되고 있는 분야는 측정진단의 측정․시험 분야, 단백질체의 펩타이드 분야, 생물자원탐색의 미생물 분야, 유전체의 유전공학 분야, 생물의약의 신약후보물질 분야, 환경생물공학의 생물학적 수처리 분야가 있다. 특이한 점은 가장 많은 특허출원을 보이던 신약후보물질 분야가 2004년에 485건을 출원하였으나, 2005년에는 57건으로 급격한 출원감소세를 보이고 있다는 것이다.
|
표 3-2-3-2 |
한국에 출원한 생명공학 분야의 기술 분류별 / 연도별 특허출원건수
|
기 술 분 류 |
1996 |
1997 |
1998 |
1999 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
||
|
공정 |
생물공정 |
동식물세포배양장치 |
|
2 |
2 |
6 |
5 |
6 |
10 |
8 |
16 |
16 |
|
분리정제 |
2 |
1 |
3 |
|
1 |
|
|
2 |
|
1 |
||
|
생물학적합성 |
68 |
83 |
105 |
96 |
135 |
127 |
133 |
150 |
102 |
101 |
||
|
효소, 미생물 관련장치 |
6 |
11 |
17 |
12 |
38 |
34 |
37 |
23 |
38 |
45 |
||
|
측정진단 |
조사분석 |
64 |
76 |
36 |
55 |
67 |
93 |
117 |
155 |
152 |
150 |
|
|
측정, 시험 |
69 |
71 |
90 |
82 |
137 |
222 |
236 |
277 |
285 |
396 |
||
|
기초 |
단백질체 |
고정화펩타이드 |
1 |
|
|
2 |
3 |
1 |
|
|
|
3 |
|
펩타이드 |
178 |
196 |
158 |
132 |
235 |
247 |
220 |
209 |
265 |
250 |
||
|
하이브리드펩타이드 |
|
4 |
|
3 |
10 |
18 |
23 |
35 |
18 |
24 |
||
|
동식물 세포배양 |
동식물세포 |
21 |
32 |
27 |
44 |
40 |
47 |
59 |
67 |
125 |
128 |
|
|
생물자원 탐색 |
미생물 |
90 |
117 |
126 |
87 |
197 |
189 |
218 |
208 |
191 |
209 |
|
|
바이러스 |
6 |
5 |
14 |
8 |
24 |
23 |
22 |
12 |
15 |
21 |
||
|
유전체 |
당류기함유핵산 |
39 |
36 |
36 |
44 |
45 |
39 |
50 |
37 |
27 |
46 |
|
|
유전공학 |
264 |
294 |
331 |
322 |
397 |
378 |
313 |
324 |
388 |
424 |
||
|
항 체 |
면역글로블린 |
9 |
47 |
15 |
21 |
43 |
47 |
52 |
68 |
83 |
85 |
|
|
효소공학기술 |
효소 |
51 |
46 |
38 |
53 |
70 |
82 |
90 |
76 |
74 |
73 |
|
|
농업 |
생물농약개발 |
생물농약 |
15 |
29 |
24 |
33 |
29 |
47 |
40 |
38 |
52 |
78 |
|
형질전환 동식물 |
신규한동물 |
6 |
7 |
11 |
17 |
20 |
14 |
25 |
28 |
29 |
36 |
|
|
신규한식물 |
12 |
36 |
24 |
47 |
34 |
46 |
58 |
68 |
35 |
48 |
||
|
식품 |
발효식품 |
알콜발효 및 장치 |
40 |
37 |
48 |
62 |
82 |
118 |
108 |
87 |
83 |
100 |
|
의약 |
생물의약 |
단백질치료제 |
92 |
111 |
96 |
90 |
110 |
140 |
104 |
125 |
156 |
175 |
|
방사선의약 |
8 |
4 |
3 |
8 |
4 |
13 |
6 |
11 |
7 |
13 |
||
|
신약후보물질 |
101 |
122 |
118 |
167 |
314 |
365 |
391 |
458 |
485 |
57 |
||
|
유전자치료 |
3 |
18 |
5 |
16 |
22 |
22 |
17 |
15 |
24 |
26 |
||
|
치료용항체 |
51 |
60 |
44 |
66 |
72 |
104 |
86 |
90 |
86 |
114 |
||
|
환경 |
환경생물 공학 |
생물학적수처리 |
130 |
130 |
173 |
169 |
193 |
251 |
222 |
210 |
187 |
217 |
|
슬러지처리 |
10 |
11 |
2 |
13 |
9 |
11 |
9 |
18 |
5 |
10 |
||
|
계 |
1,336 |
1,586 |
1,546 |
1,655 |
2,336 |
2,684 |
2,646 |
2,799 |
2,928 |
2,846 |
||
기준 : 제1IPC, 특허공개공보기준(선 등록의 경우 소급적용)
출처 : Patmetrics DB34), 한국특허정보원, 2007
라. 한국특허로 본 생명공학 분야 중 기초산업의 선두주자
최근 5년(2001~2005년) 동안 생명공학 분야 중 기초산업의 기술 분류별 Top 3를 조사한 결과 생명공학연구원이 기초산업 전 분야에서 다출원 상위 3개사에 포함되어 있는 것으로 나타났다. 생물자원탐색에서는 CJ가 70건의 특허를 출원하였고, 동식물세포배양에서는 서울대학교가 14건으로 가장 많은 특허를 출원하고 있는 것으로 나타났다. 효소공학, 단백질체, 항체이용 분야는 외국기업인 노보자임스(23건), 메르크파텐트(36건), 제넨테크(30건)가 각각 다출원 1위 기업으로 조사되었다.
|
표 3-2-3-3 |
한국특허의 생명공학 분야 기초 산업의 연구개발 리더
|
세부기술 |
2001∼2005(최근5년) |
||
|
출원인 |
국적 |
건수 |
|
|
생물자원 탐색 |
CJ |
KR |
70 |
|
한국생명공학연구원 |
KR |
48 |
|
|
(주)프로바이오닉 |
KR |
28 |
|
|
동식물 세포배양 |
서울대학교 |
KR |
14 |
|
제론(코) |
US |
9 |
|
|
한국생명공학연구원 |
KR |
8 |
|
|
효소공학 |
노보자임스(AS) |
DK |
23 |
|
한국생명공학연구원 |
KR |
13 |
|
|
서울대학교 |
KR |
11 |
|
|
유전체 |
한국생명공학연구원 |
KR |
70 |
|
고려대학교 |
KR |
48 |
|
|
제넨테크 |
US |
38 |
|
|
단백질체 |
메르크파텐트(GMBH) |
DE |
36 |
|
서울대학교 |
KR |
26 |
|
|
한국생명공학연구원 |
KR |
21 |
|
|
항체이용 |
제넨테크 |
US |
30 |
|
한국생명공학연구원 |
KR |
18 |
|
|
이뮤노메딕스(코) |
US |
9 |
|
출처 : Patmetrics DB, 한국특허정보원, 2007
마. 미국에 등록된 생명공학 특허건수 동향
미국의 생명공학 특허건수는 1990년대 중반이후 급성장하였으나, 2000년 이후 점차 그 건수가 줄어들고 있다. 이는 1990년부터 15년간 계획으로 실시된 인간유전체프로젝트의 영향과 미국경제의 호황 및 미국 정부의 R&D투자에 대한 성과가 나타나면서 생명과학 분야가 급성장35)하였다. 그러나 1998년 이후 인간 유전체 프로젝트의 종료와 시장의 긴축으로 투자자 및 생명공학 분야 업체들이 수익성을 중시하는 경향이 나타나고 일종의 기술거품이 빠지면서 조정기를 거치는 가운데 특허건수가 줄어드는 것으로 나타났다.36) 그런데 이러한 조정기는 2005년을 기점으로 특허건수가 다시 증가세를 보여 예단하기는 이르지만 향후 생명공학 분야의 특허가 다시금 증가세로 전환할 수 있는 계기가 될 수 있을 것으로 판단된다.
세부기술별로 살펴보면, 연평균 300여 건 이상 등록되고 있는 분야로는 생물공정의 생물학적합성 분야, 측정진단의 조사․분석 및 측정․시험 분야, 단백질체의 펩타이드 분야, 유전체의 당류기함유핵산 및 유전공학 분야, 효소기술공학 분야, 형질전환동식물의 신규한 식물 분야, 생물의약의 단백질치료제 및 치료용 항체 분야가 있다.
|
표 3-2-3-4 |
미국에 등록된 생명공학 분야의 기술 분류별 / 연도별 특허출원건수
|
기술분류 |
1996 |
1997 |
1998 |
1999 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
||
|
공정 |
생물공정 |
동식물세포배양장치 |
19 |
45 |
70 |
51 |
37 |
16 |
18 |
17 |
5 |
11 |
18 |
|
분리정제 |
16 |
4 |
13 |
18 |
17 |
20 |
10 |
14 |
8 |
4 |
7 |
||
|
생물학적합성 |
346 |
457 |
669 |
615 |
524 |
612 |
546 |
464 |
403 |
374 |
512 |
||
|
효소, 미생물 관련장치 |
62 |
54 |
61 |
50 |
59 |
116 |
134 |
130 |
107 |
85 |
81 |
||
|
측정진단 |
조사분석 |
372 |
458 |
668 |
572 |
465 |
543 |
510 |
489 |
455 |
370 |
539 |
|
|
측정, 시험 |
559 |
753 |
1,111 |
1,121 |
1,087 |
1,329 |
1,122 |
976 |
875 |
730 |
869 |
||
|
기초 |
단백질체 |
고정화펩타이드 |
7 |
15 |
11 |
10 |
9 |
14 |
19 |
15 |
23 |
14 |
18 |
|
펩타이드 |
249 |
399 |
528 |
491 |
403 |
425 |
420 |
372 |
312 |
306 |
442 |
||
|
하이브리드펩타이드 |
5 |
10 |
10 |
16 |
10 |
6 |
5 |
4 |
2 |
3 |
3 |
||
|
동식물세포배양 |
동식물세포 |
168 |
257 |
338 |
306 |
276 |
282 |
257 |
238 |
199 |
180 |
216 |
|
|
생물자원탐색 |
미생물 |
162 |
170 |
211 |
213 |
140 |
156 |
122 |
134 |
103 |
107 |
135 |
|
|
바이러스 |
23 |
37 |
46 |
42 |
41 |
35 |
53 |
30 |
31 |
23 |
35 |
||
|
유전체 |
당류기함유핵산 |
188 |
303 |
375 |
417 |
427 |
433 |
486 |
399 |
345 |
316 |
426 |
|
|
유전공학 |
318 |
523 |
688 |
738 |
613 |
644 |
495 |
475 |
456 |
361 |
579 |
||
|
항체 |
면역글로블린 |
40 |
100 |
151 |
126 |
94 |
112 |
104 |
110 |
106 |
100 |
183 |
|
|
효소공학기술 |
효소 |
175 |
164 |
398 |
431 |
373 |
415 |
427 |
366 |
310 |
282 |
374 |
|
|
농업 |
생물농약개발 |
생물농약 |
39 |
64 |
114 |
122 |
131 |
159 |
153 |
132 |
114 |
79 |
104 |
|
형질전환동식물 |
신규한동물 |
5 |
4 |
7 |
5 |
21 |
56 |
51 |
51 |
35 |
26 |
58 |
|
|
신규한식물 |
159 |
156 |
328 |
413 |
360 |
328 |
278 |
234 |
318 |
305 |
397 |
||
|
식품 |
발효식품 |
알콜발효 및 장치 |
14 |
18 |
20 |
29 |
17 |
16 |
10 |
19 |
21 |
15 |
26 |
|
의약 |
생물의약 |
단백질치료제 |
442 |
614 |
868 |
778 |
671 |
643 |
546 |
535 |
527 |
522 |
701 |
|
방사선의약 |
24 |
75 |
104 |
91 |
82 |
79 |
52 |
65 |
48 |
36 |
43 |
||
|
신약후보물질 |
119 |
139 |
148 |
184 |
146 |
202 |
256 |
244 |
196 |
199 |
176 |
||
|
유전자치료 |
7 |
52 |
65 |
93 |
114 |
96 |
86 |
73 |
70 |
56 |
69 |
||
|
치료용항체 |
150 |
289 |
453 |
500 |
482 |
502 |
480 |
468 |
396 |
323 |
509 |
||
|
환경 |
환경생물공학 |
생물학적수처리 |
114 |
86 |
109 |
96 |
111 |
109 |
97 |
96 |
121 |
115 |
116 |
|
슬러지처리 |
1 |
2 |
2 |
5 |
1 |
1 |
|
2 |
1 |
2 |
|
||
|
계 |
3,783 |
5,248 |
7,566 |
7,533 |
6,711 |
7,349 |
6,737 |
6,152 |
5,587 |
4,944 |
6,636 |
||
출처 : Patmetrics DB, 한국특허정보원, 2007
바. 미국 특허로 본 생명공학 분야의 기술 분야별 선두주자
최근 5년(2002~2006년) 동안 생명공학 분야 중 기초산업의 기술 분류별 Top 3를 조사한 결과, 효소공학에서는 Applera Corporation이 114건, 유전체에서는 Isis Pharmaceuticals Inc.가 168건, University of California가 112건의 특허를 보유하고 있는 것으로 나타났다.
|
표 3-2-3-5 |
미국특허의 생명공학 분야 기초 산업의 연구개발 리더
|
세부기술 |
2002∼2006(최근5년) |
||
|
출원인 |
국적 |
건수 |
|
|
생물자원 탐색 |
Lexicon Genetics Incorporated |
US |
22 |
|
Council of Scientific and Indust |
IN |
19 |
|
|
E I DuPont de Nemours & Co |
US |
16 |
|
|
동식물 세포배양 |
University of California |
US |
25 |
|
Council of Scientific and Indust |
IN |
17 |
|
|
Pioneer Hi-Bred Int'l, Inc. |
US |
17 |
|
|
효소공학 |
Applera Corporation |
US |
114 |
|
Novozymes A/S |
DK |
79 |
|
|
Millennium Pharmaceuticals, Inc. |
US |
60 |
|
|
유전체 |
Isis Pharmaceuticals Inc |
US |
168 |
|
University of California |
US |
112 |
|
|
Pioneer Hi-Bred Int'l, Inc. |
US |
85 |
|
|
단백질체 |
Genentech Inc |
US |
80 |
|
Human Genome Sciences, Inc. |
US |
53 |
|
|
ZymoGenetics, Inc. |
US |
42 |
|
|
항체이용 |
Human Genome Sciences, Inc. |
US |
54 |
|
Genentech Inc |
US |
51 |
|
|
Schering Corporation |
US |
15 |
|
출처 : Patmetrics DB, 한국특허정보원, 2007
사. 고(高)인용(Highly Cited Patent) 특허로 본 우수특허 발굴
2006년에 등록된 특허에 인용되어진 고(高)인용(Highly Cited Patent)된 상위 1%의 특허를 연도별로 살펴보면 아래와 같다. 특허의 특성상 등록기간이 오래된 특허일수록 많이 인용되는데, 1996년에서 1998년 사이에 등록된 특허가 2006년에 많이 인용되어지는 것을 보면 알 수 있다.
|
표 3-2-3-6 |
2006년도에 인용된 특허의 연도별 건수
|
년도 |
∼1995 |
1996 |
1997 |
1998 |
1999 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
|
건수 |
198 |
51 |
48 |
52 |
33 |
29 |
9 |
4 |
1 |
2 |
1 |
출처 : Patmetrics DB, 한국특허정보원, 2007
2006년도에 가장 많이 인용되어진 고(高)인용특허 Top 5를 살펴보면 모두 형질전환동식물 중 신규 식물 분야의 특허들로 조사되었다. Goldsmith Seeds사의 특허가 156회로 가장 많이 인용되었고, Pioneer Hi-Bred International사의 특허 3건이 2~4위의 다인용특허로 나타났다.
|
표 3-2-3-7 |
2006년도에 인용된 고(高)인용특허 Top 5
|
등록 번호 |
등록 년도 |
발명의 명칭 |
청구항수 |
국가 |
등록권자 대표명 |
인용 회수 |
|
05523520 |
1996 |
Mutant dwarfism gene of petunia |
20 |
US |
Goldsmith Seeds, Inc. |
156 |
|
05304719 |
1994 |
Inbred corn line PHT47 |
8 |
US |
Pioneer Hi-Bred Int’l, Inc. |
133 |
|
05367109 |
1994 |
Inbred corn line PHHB9 |
11 |
US |
Pioneer Hi-Bred Int’l, Inc. |
133 |
|
05850009 |
1998 |
Inbred maize line PH0HC |
13 |
US |
Pioneer Hi-Bred Int'l, Inc. |
132 |
|
05968830 |
1999 |
Soybean transformation and regeneration methods |
11 |
US |
Mississippi State University |
83 |
출처 : Patmetrics DB, 한국특허정보원, 2007

가. 논문 개요
연구 개발의 목적에는 자연현상에 관한 인과관계나 법칙의 탐구라는 면과 그 현상(법칙성)을 인간사회에 이용하는 기술의 확립이란 두 가지의 면이 있다.
전자의 성과는 논문으로 나타나는 것이 많은데 후자의 활동 중에 생성되어진 경험이나 지식이 논문의 형태로 나타나는 경우도 있다. 논문으로 발표되는 연구개발 성과는 인류의 지적 공유재산이 된다. 따라서 논문에 관한 지표는 연구개발성과의 수준과 그 인류의 과학기술 지식에의 공헌을 나타내는 것으로 생각된다.
과학기술의 논문에 관한 지표 작성에 있어서는 직접 방대한 수의 논문지로부터 산출하는 것이 어렵기 때문에 문헌 데이터베이스를 사용하기로 한다. 국제적으로 SCI 데이터베이스(Science Citation Index Database, 이하 SCI라 표시함)를 많이 활용하는데 이는 과학기술 전반을 대상으로 하고, 논문의 인용정보를 얻을 수 있으며, 수록대상 저널의 선정기준을 엄격하게 하고 있다는 점에서 타 데이터베이스에 비해 우수하다고 할 수 있다. 논문현황자료는 SCI에 근거한 Thomson Scientific ISI(Institute for Scientific Information)의 NSI(National Science Indicators, 1981 ~2006)를 기반으로 지표를 산출했다.
나. 분석기준
SCI 과학기술 18개 분야 중 생명공학 분야인 6개 분야를 대상으로 한 후, 한국과 세계 평균을 10년간(1997~2006) 비교하였다. 국가간 비교에는 세계 논문 수 상위 10개국과 BRICS국가(브라질, 러시아, 인도, 중국)를 대상으로 조사하였다.
다. 논문현황
2006년 SCI 세계 논문 수는 89만 9,074편이며 우리나라 논문 수는 세계 논문 수의 2.59%인 23,286편으로 세계 순위는 13위를 차지했다.
|
표 3-2-4-1 |
최근 10년간 우리나라 논문 발표 수 추이
|
연 도 |
1997년 |
1998년 |
1999년 |
2000년 |
2001년 |
|
논문발표수(편) |
7,866 |
9,843 |
11,326 |
12,475 |
14,893 |
|
세계 총 논문수(편) |
701,106 |
727,104 |
740,828 |
739,220 |
757,025 |
|
세계 점유율(%) |
1.12 |
1.35 |
1.53 |
1.69 |
1.97 |
|
세계 순위 |
18 |
16 |
16 |
16 |
15 |
|
연 도 |
2002년 |
2003년 |
2004년 |
2005년 |
2006년 |
|
논문발표수(편) |
15,902 |
18,830 |
19,328 |
23,089 |
23,286 |
|
세계 총 논문수(편) |
753,384 |
815,001 |
788,978 |
907,551 |
899,074 |
|
세계 점유율(%) |
2.11 |
2.31 |
2.45 |
2.54 |
2.59 |
|
세계 순위 |
14 |
14 |
14 |
14 |
13 |
출처 : KAIST 학술정보처, 2007
최근 5년간 우리나라가 발표한 논문 100,435편 중 1회 이상 인용된 논문은 57,653편으로 논문의 피인용 비율은 57.40%이고, 5년간 논문의 총 피인용 횟수는 323,101회로 논문 1편당 평균 피인용 횟수는 3.22회이다. 이는 세계평균(4.57회)의 70.46% 수준이나 연도별 피인용 횟수를 보면 연도가 누적됨에 따라 피인용도가 높아지는 성향을 보이고 있다.
우리나라 논문의 5년 주기별 1편당 평균 피인용 횟수는 낮은 수준이나 세계전체 평균보다 빠른 속도로 증가하고 있어 논문의 질적인 측면도 향상되고 있음을 보여주고 있다.
|
표 3-2-4-2 |
5년 주기별 논문 1편당 평균 피인용 횟수 현황
(단위 : 회)
|
국 가 명 |
1997~2001 |
1998~2002 |
1999~2003 |
2000~2004 |
2001~2005 |
2002~2006 |
|
한 국 |
2.18 |
2.39 |
2.36 |
2.8 |
3.04 |
3.22 |
|
세계 전체 평균 |
4.04 |
4.12 |
4.27 |
4.33 |
4.51 |
4.57 |
출처 : KAIST 학술정보처, 2007

출처 : KAIST 학술정보처, 2007
|
그림 3-2-4-1 |
한국과 세계의 논문 1편당 평균 피인용 횟수 현황
다. 생명공학 분야 논문 수
SCI 과학기술 분야 18개 분야 중 최근 5년간(2002~2006) 우리나라가 발표한 생명공학 6개 분야의 논문현황은 다음과 같다.
|
표 3-2-4-3 |
최근 5년간 생명공학 분야 논문 수 점유율
(단위: 편, %)
|
분 야 명 |
분야 논문 수 |
국내 점유율 |
우리나라 총 논문 수 |
세계 점유율 (논문 순위) |
세계 분야 총 논문 수 |
|
면역학 |
876 |
0.87% |
100,435 |
1.40% (18위) |
62,710 |
|
미생물학 |
2,331 |
2.32% |
100,435 |
2.61% (12위) |
89,274 |
|
분자생물학 & 유전학 |
1,544 |
1.54% |
100,435 |
1.35% (18위) |
114,125 |
|
생물학 & 생화학 |
6,396 |
6.37% |
100,435 |
2.17% (14위) |
295,277 |
|
신경과학 & 행동과학 |
2,260 |
2.25% |
100,435 |
1.46% (16위) |
154,719 |
|
약리학 |
3,428 |
3.41% |
100,435 |
3.94% (9위) |
86,904 |
출처 : KAIST 학술정보처, 2007
최근 5년간 발표된 국가별 생명공학 분야 논문 수를 보면 미국이 6개 분야에서 모두 월등히 앞서고 있으며 영국, 일본, 독일, 프랑스 순으로 뒤를 이었고, BRICs국가(브라질, 러시아, 인도, 중국)는 우리나라와 비슷한 수치를 보였다.

출처 : KAIST 학술정보처, 2007
|
그림 3-2-4-2 |
최근 5년간 국가별 생명공학 분야 논문 수 현황
우리나라 생명공학 분야 SCI 발표 논문 수는 1987년에는 6개 분야의 총합이 99편에 불과하였으나, 1997년에는 생물학 & 생화학(530편)이 12.3배, 면역학(49편)이 12.3배, 미생물학(186편)이 9.3배, 분자생물학 & 유전학(85편)이 10.6배, 신경과학 & 행동과학(105편)이 4.2배, 약리학(253편)이 13.3배 늘었다. 그 후 생명공학 분야는 급격한 성장세를 보이며 2006년에는 10년 전과 비교하여 생물학 & 생화학(1,463편)이 2.8배, 면역학(230편)이 4.7배, 미생물학(524편)이 2.8배, 분자생물학 & 유전학(383편)이 4.5배, 신경과학 & 행동과학(528편)이 5.0배, 약리학(741편)이 2.9배 늘었다.
|
표 3-2-4-4 |
최근 10년간 우리나라 연도별 생명공학 분야 논문현황
|
분야명 |
구분 |
1997 |
1998 |
1999 |
2000 |
2001 |
|
면역학 |
논문수 |
49 |
72 |
125 |
125 |
146 |
|
피인용수 |
954 |
1,086 |
2,517 |
1,788 |
1,682 |
|
|
편당평균 |
(19.47) |
(15.08) |
(20.14) |
(14.30) |
(11.52) |
|
|
미생물학 |
논문수 |
186 |
204 |
238 |
306 |
312 |
|
피인용수 |
4,336 |
2,601 |
3,237 |
3,335 |
2,869 |
|
|
편당평균 |
(23.31) |
(12.75) |
(13.60) |
(10.90) |
(9.20) |
|
|
분자생물학 & 유전학 |
논문수 |
85 |
103 |
144 |
209 |
190 |
|
피인용수 |
1,944 |
2,247 |
2,980 |
4,318 |
3,688 |
|
|
편당평균 |
(22.87) |
(21.82) |
(20.69) |
(20.66) |
(19.41) |
|
|
생물학 & 생화학 |
논문수 |
530 |
651 |
744 |
879 |
914 |
|
피인용수 |
6,909 |
9,428 |
10,583 |
12,084 |
11,010 |
|
|
편당평균 |
(13.04) |
(14.48) |
(14.22) |
(13.75) |
(12.05) |
|
|
신경과학 & 행동과학 |
논문수 |
105 |
158 |
216 |
280 |
305 |
|
피인용수 |
2,713 |
3,344 |
4,000 |
4,213 |
3,974 |
|
|
편당평균 |
(25.84) |
(21.16) |
(18.52) |
(15.05) |
(13.03) |
|
|
약리학 |
논문수 |
253 |
326 |
324 |
387 |
386 |
|
피인용수 |
2,339 |
3,246 |
3,162 |
4,014 |
3,670 |
|
|
편당평균 |
(9.25) |
(9.96) |
(9.76) |
(10.37) |
(9.51) |
|
분야명 |
구분 |
2002 |
2003 |
2004 |
2005 |
2006 |
|
면역학 |
논문수 |
120 |
146 |
188 |
192 |
230 |
|
피인용수 |
1,157 |
1,356 |
1,270 |
563 |
105 |
|
|
편당평균 |
(9.64) |
(9.29) |
(6.76) |
(2.93) |
(0.46) |
|
|
미생물학 |
논문수 |
370 |
459 |
394 |
584 |
524 |
|
피인용수 |
3,240 |
2,955 |
1,797 |
1,294 |
159 |
|
|
편당평균 |
(8.76) |
(6.44) |
(4.56) |
(2.22) |
(0.30) |
|
|
분자생물학 & 유전학 |
논문수 |
212 |
273 |
289 |
387 |
383 |
|
피인용수 |
3,806 |
3,174 |
2,436 |
1,452 |
235 |
|
|
편당평균 |
(17.95) |
(11.63) |
(8.43) |
(3.75) |
(0.61) |
|
|
생물학 & 생화학 |
논문수 |
1,050 |
1,181 |
1,226 |
1,476 |
1,463 |
|
피인용수 |
11,159 |
9,840 |
6,715 |
3,818 |
530 |
|
|
편당평균 |
(10.63) |
(8.33) |
(5.48) |
(2.59) |
(0.36) |
|
|
신경과학 & 행동과학 |
논문수 |
336 |
434 |
441 |
521 |
528 |
|
피인용수 |
3,501 |
3,350 |
2,307 |
1,371 |
173 |
|
|
편당평균 |
(10.42) |
(7.72) |
(5.23) |
(2.63) |
(0.33) |
|
|
약리학 |
논문수 |
492 |
636 |
678 |
881 |
741 |
|
피인용수 |
3,609 |
3,191 |
2,359 |
1,243 |
131 |
|
|
편당평균 |
(7.34) |
(5.02) |
(3.48) |
(1.41) |
(0.18) |
출처 : KAIST 학술정보처, 2007

출처 : KAIST 학술정보처, 2007
|
그림 3-2-4-3 |
우리나라 연도별 생명공학 분야 발표논문 수 추이
라. 생명공학 분야 피인용도
최근 5년간 분자생물학 & 유전학 분야 발표 논문 1,544편 중 1회 이상 인용된 논문은 1,133편이며, 논문의 피인용율은 73.38%로, 국내평균 피인용율(57.40%)의 1.28배이며, 면역학은 70.55%로 1.23배, 생물학 & 생화학은 70.65%로 1.23배, 신경과학 & 행동과학은 69.34%로 국내 평균의 1.21배이고, 생물학 & 생화학․분자생물학 & 유전학 등은 동 분야 세계 대비 비율 수치에 근접하게 나타났다.
|
표 3-2-4-5 |
최근 5년간 생명공학 분야 논문 피인용률
|
분 야 명 |
피인용률 |
피인용된 논문 수 |
분야 논문 수 |
세계대비 비율 |
세계 분야 평균 피인용률 |
|
면역학 |
70.55% |
618 |
876 |
0.89 |
79.46% |
|
미생물학 |
69.15% |
1,612 |
2,331 |
0.92 |
75.33% |
|
분자생물학 & 유전학 |
73.38% |
1,133 |
1,544 |
0.93 |
79.01% |
|
생물학 & 생화학 |
70.65% |
4,519 |
6,396 |
0.94 |
74.84% |
|
신경과학 & 행동과학 |
69.34% |
1,567 |
2,260 |
0.90 |
76.63% |
|
약리학 |
63.39% |
2,173 |
3,428 |
0.90 |
70.16% |
출처 : KAIST 학술정보처, 2007
최근 5년간 생명공학 분야 발표 논문에 대한 피인용 현황을 보면 평균 피인용지수(IF : Impact Factor)는 국내평균지수(3.22)에 비해 분자생물학 & 유전학이 2.2배 등 약리학을 제외한 5개 분야 모두 높게 나타났다. 또한 동 분야 세계 대비 비율은 매우 저조하지만, 지식구조에 있어서 1997~2001년의 세계 평균 대비 국내 피인용수에 비해 2002~2006년에서 우리나라 지식구조가 세계와 유사한 경향으로 개선되고 있음을 보여 주고 있다.

출처 : KAIST 학술정보처, 2007
|
그림 3-2-4-4 |
생명공학 분야의 한국과 세계의 논문 1편당 피인용수 비교
|
표 3-2-4-6 |
생명공학 분야 한국 및 세계의 논문 피인용 추세 상대 비교
|
분 야 명 |
1994~1997 |
1998~2001 |
2002~2006 |
|||
|
국내평균 (IF) |
세계평균 (IF) |
국내평균 (IF) |
세계평균 (IF) |
국내평균 (IF) |
세계평균 (IF) |
|
|
면 역 학 |
20.72(2) |
42.66(2) |
15.11(3) |
32.94(2) |
5.08(2) |
11.81(2) |
|
미생물학 |
19.40(3) |
27.59(5) |
11.36(5) |
22.65(5) |
4.05(5) |
7.73(5) |
|
분자생물학 & 유전학 |
17.73(4) |
50.28(1) |
20.48(1) |
40.22(1) |
7.19(1) |
13.46(1) |
|
생물학 & 생화학 |
13.77(5) |
31.66(4) |
13.52(4) |
24.58(4) |
5.01(3) |
8.28(4) |
|
신경과학 & 행동과학 |
25.03(1) |
35.68(3) |
16.19(2) |
27.18(3) |
4.74(4) |
8.53(3) |
|
약 리 학 |
8.28(6) |
18.62(6) |
9.90(6) |
15.70(6) |
3.07(6) |
5.70(6) |
※ 세계평균 : SCIE 상위 10개국과 BRICs(브라질, 러시아, 인도, 중국) 전체 평균
출처 : KAIST 학술정보처, 2007
생명공학 분야의 5년 주기별 평균 피인용 횟수를 보면 생물학 & 생화학, 분자생물학 & 유전학, 신경과학 & 행동과학, 약리학은 빠른 속도로 증가하고 있음을 볼 수 있다.
|
표 3-2-4-7 |
5년 주기별 생명공학 분야 평균 피인용횟수 현황
(단위: 회)
|
국 가 명 |
1997~2001 |
1998~2002 |
1999~2003 |
2000~2004 |
2001~2005 |
2002~2006 |
|
면 역 학 |
4.13 |
4.74 |
5.32 |
4.54 |
4.81 |
5.08 |
|
미생물학 |
3.82 |
2.94 |
3.15 |
3.34 |
3.58 |
4.05 |
|
분자생물학 & 유전학 |
5.25 |
5.92 |
6.50 |
7.03 |
7.17 |
7.19 |
|
생물학 & 생화학 |
3.42 |
3.86 |
4.18 |
4.46 |
4.76 |
5.01 |
|
신경과학 & 행동과학 |
4.17 |
4.26 |
4.39 |
4.42 |
4.58 |
4.74 |
|
약 리 학 |
2.08 |
2.35 |
2.52 |
2.75 |
2.83 |
3.07 |
출처 : KAIST 학술정보처, 2007

출처 : KAIST 학술정보처, 2007
|
그림 3-2-4-5 |
5년 주기별 생명공학 분야 평균 피인용 횟수 추이



가. 유전체 연구의 개요
유전체(genome)는 유전자(gene)와 염색체(chromosome)의 합성어로 각각의 생물체가 고유하게 갖고 있는 모든 유전정보를 표현하는 것이다. 유전체 연구는 생물체의 유전체 염기서열정보를 바탕으로 유전자 기능을 총체적으로 조사하여 생명현상을 규명하는 것이다.
지구의 모든 생물종은 유전체 연구의 대상이 된다. 특히 인류의 보건의료향상 등과 같은 우리들의 삶과 보다 직접적으로 연관된 유전체 연구 분야는 중요하다. 인간유전체를 완전히 해독하고 이를 이용하여 모든 질병의 원인을 모두 파악하게 된다면 질병의 예방, 진단 및 새로운 치료기술의 개발에 대한 획기적인 전기가 마련될 수 있을 것이다. 이러한 기대감은 인간유전체 연구를 진행하게 된 계기가 되었다.
1990년 인간 유전체 프로젝트(Human Genome Project)가 시작되었다. 미국 국립보건원의 주도 아래 10여 년간 전 세계 수십 개 연구기관이 공동으로 참여하면서 30억 달러라는 과학사상 최대 규모의 연구비를 투자하여, 2003년에는 인간유전체 염기서열을 거의 완벽하게 해독하였다.
인간 유전체 프로젝트에서 비롯된 결과에 의해 인간의 불로장생에 대한 가능성이 생겼고, 고부가가치를 창출할 수 있는 소재와 수단이 개발되었다. 이 장에서는 인간 유전체 프로젝트를 중심으로 최근 2년간의 유전체기술개발동향을 살펴보도록 하겠다.
나. 2007년 기준 인간 유전체 프로젝트의 성과
(1) 인간 유전체 염기서열 및 유전자 지도 완성
2006년도에 24종의 인간염색체가 완전 해독되었고 “유전자 지도(Gene Map)”가 완성되어 염색체상에서 각 인간유전자에 대한 위치를 알 수 있게 되었다. 또한 각 유전자의 구조적 특성이 상세하게 밝혀졌다[그림 4-1-1-1].

* 21번 염색체의 q22.11∼q22.12 영역의 약 2,000,000 염기쌍 내의 유전자의 위치가 나열된 유전자지도 (gene map) 및 유전자 조절부위에서의 CpG island, SNP의 위치가 표기된 SNP map
출처 : UCSC Genome Bioinformatics, http://genome.ucsc.edu/
|
그림 4-1-1-1 |
인간 유전체의 유전자 지도 작성의 예
(2) 개체간 단일염기변이(SNP) 발굴 및 일배체형지도(HapMap) 완성
인간 유전체의 염기서열을 해독하는 과정에서 다양한 형태의 염기서열 변이가 발견되었다. 이 중에서 개개인 사이에 뚜렷한 차이를 보이는 단일염기서열 변이를 “SNP”라 한다. SNP는 인간유전체의 염기서열에서 대략 300염기마다 하나 꼴로 관찰되는데, 이들 위치에 따라 유전자의 산물에 영향을 끼침으로써 개인간 표현형 차이를 유발할 것으로 보고 있다. SNP의 Haplotype(일배체형) 지도를 작성하기 위해서 2002년도에 “국제 HapMap 연구”가 시작되었다. 이 연구의 목적은 각각의 유전자형을 표지할 수 있는 최소한의 SNP를 동정함으로써 질병유전자 혹은 약물반응 유전자 발굴에 필수적인 SNP를 알아내어 약물 유전체학 또는 맞춤의학 연구에 필요한 핵심적인 기반정보를 획득하는 것이었다. 2005년 10월 이 사업을 통하여 질병-연관분석에 유용하게 사용될 평균 5kb 간격을 갖는 최소한의 Tag-SNP가 공개되었다(Nature 437, 1299-1320, 2005).
(3) 고밀도 SNP 칩을 이용한 질병관련 유전자 찾기
인간 유전체에서 발견된 SNP 중에서 인종간 또는 집단 내에서 약 5% 이상의 다형성을 나타내는 약 170만 종의 SNP가 선별되고 이를 근거로 한 고밀도 SNP 칩이 개발되었다[그림 4-1-1-2].
|
|
|
|
* 환자군과 정상군의 유전체를 SNP 칩으로 분석하여 특정 SNP가 정상군 대비 환자군에서 빈번하게 관찰될 때, 이 SNP는 특정질환과 연관된 것으로 판단함 출처 : Nature 447, 645~646, 2007 |
* 지금까지 단백질 정보를 갖고 있는 유전자(초록색 원들로 표시)에 관심이 집중되었기 때문에, 인간유전체 염기의 98%를 차지하는 non-gene DNA의 의미를 알지 못하였음. Non-gene DNA(붉은색)가 중요한 유전체 조절기능을 갖고 있음을 밝히고 있음 출처 : Nature 447, 782~783, 2007 |
|
그림 4-1-1-2 50만개의 SNP가 탑재된 고밀도 칩 모형도 및 이를 이용한 질병관련 유전자 찾기 |
그림 4-1-1-3 Non-gene DNA의 기능 찾기 |
3일 정도의 짧은 시간에 한 개인의 유전체에서 50만종 이상의 SNP에 대한 정보를 얻을 수 있는 SNP 칩을 이용하여 유전체 수준에서 질병관련 유전자를 찾기 위한 연구(genome-wide association study)가 대규모로 수행되고 있다. 영국의 웰컴 트러스트 연구팀은 조울증(bipolar disease), 관상동맥질환, 크론씨 질환(chronic inflammatory bowel disease), 류마치스성 관절염, 제1형 및 제2형 당뇨병 환자 각각 2,000명씩 전체 14,000명을 대상으로 하고 대조군 3,000명을 대상으로 연구한 결과 질병과 연관성이 있는 대립형질유전자들이 위치한 SNP를 찾아내었다(Nature 447, 661-678, 2007).
그러나 이 연관성연구는 질병과 연관된 SNP를 갖고 있는 사람의 경우, 질병을 갖는 확률이 그렇지 않은 경우보다 높다는 것을 의미하는 것이므로 이러한 발견이 임상적으로 적용되기 위해서는 더 많은 연구가 필요하다. 또한 상기한 질병들은 여러 개의 유전자가 관여하며, 각 개인의 생활 습관 등 환경 요인에 의해 크게 영향을 받기 때문에 더욱 그러하다.
(4) Non-gene DNA의 존재 이유 밝히기
통상적으로 단백질 정보를 갖고 있는 DNA를 유전자로 정의하고 있다. 인간 유전체를 해독한 결과 유전자는 약 2만~2만 5천개에 불과하였고, 이는 인간 유전체의 2%에 해당한다. 그러면 나머지 98%의 non-gene DNA는 왜 인간 유전체에 존재하는 것일까? 기능이 있다면 이들이 하는 일은 무엇일까?
이에 대한 답을 찾기 위해서 2003년 인간유전체의 1%에 해당하는 3천만 개의 염기쌍에 존재하는 모든 “기능적 요소(functional elements)”들을 찾는 연구를 시작하였고(ENCyclopaedia Of DNA Elements: ENCODE 연구사업), 2007년 그 결과를 공개하였다(Nature 447, 799-816, 2007).
그 결과 첫째, 3천만 개의 염기쌍의 80%가 발현되어, non-gene DNA의 전사체를 확인할 수 있었다. 둘째, 유전자의 발현을 조절하는 중요한 기능적 염기서열들은 생쥐, 원숭이, 인간에게 진화적으로 잘 보존되었을 것으로 기대하였지만, 실재적으로는 그렇지 않았다. 셋째, 3천만 개의 염기쌍에는 532개의 promoter(유전자 발현조절 부위)만이 알려졌으나, 732개의 프로모터가 있었고, 놀랍게도 이 프로모터의 약 25%는 유전자의 앞쪽(5'-region of gene)에 존재하지 않고 유전자의 뒤쪽(3'-region of gene)에 존재하였다.
이 결과들은 유전자 발현이 다차원의 총체적 연결체계(network)를 통하여 조절된다는 것을 의미한다. microRNA의 발견과 더불어 non-gene DNA의 역할은 유전체 연구에서 중요한 의미를 갖게 될 것으로 보인다.
다. 해외 동향
|
표 4-1-1-1 |
유전체 연구 해외 동향
|
유전체 기능 분석기술 |
연구 목적 및 내용 |
기술주도국, 기관, 연구사업명 |
|
고밀도 SNP 칩 개발 |
질병관련 마커 발굴 및 표현형관련 CNV(copy number variation) 연구 |
미국 Affymetrix사(Genome-Wide Human SNP Array 5.0) 및 Illumina사 (HumanHap 550 Genotyping Beadchip)가 주도 |
|
유전체 수준 질병관련 유전자 발굴 및 검증 |
노인성 시력상실(Science, 2005 & 2006), 조울증, 관상동맥질환, 류마치스성 관절염, 크론씨 질환 (Science, 2006; Nat Genet, 2007), 천식, 정신분열증, 암, 당뇨병(Nat Genet, 2007; Nature, 2007), 알쯔하이머 질병(Nat Genet, 2007), 비만, 뇌경색, 기억관련 유전자 발굴을 통한 질병예방, 진단, 치료기술개발 |
- 미국 NHGRI GAIN사업(Genetic Association Information Network): 2006년 산-연 연구 사업으로 출범. 미국 NIH, Abbott, Pfizer, Affymetrix, Perlogen, Broad Institute가 참여 - 일본(Nat Genet, 2007), 프랑스(Nat Genet, 2007), 스위스(Science, 2006), 영국 Well- come Trust 콘소시엄(Nature, 2007)
|
|
질병발생과 환경인자 상관성 조사 |
미국 NHGRI, GEI (Genes, Environment, and Health Initiative) 연구사업, 2006년 출범 |
|
|
Non-gene DNA 기능규명 |
초파리와 꼬마 선충을 이용한 non-gene DNA의 기능 조사(Nature, 2007) |
미국 NHGRI, modENCODE 연구사업: 5,700억원의 연구비로 2006년부터 4년간 수행
|
|
암 유전체 기능분석 |
뇌암, 난소암, 폐암 대상 암 발생원인 규명, 약물반응 예측, 암 치료 기술 적용 방법, 암 예방 수단 등을 개발(Nature 447, 2007) |
미국 NHGRI 및 NCI가 TCGA(The Cancer Genome Atlas)연구사업 공동 추진: 5,000억원의 연구비로 2006년부터 3년간 수행
|
|
초고속 저비용 DNA염기서열 분석 |
$1,000 인간유전체 염기서열 분석을 통한 맞춤의료기술 개발
|
미국 Solexa/ABI tech 및 454 Life Science사가 기술개발 주도 (Nature 448, 2007: Science 315, 2007). 미국 NHGRI는 100명의 인간유전체 염기서열 분석을 계획 중 |
출처 : 미국국립인간유전체연구소(http://www.genome.gov)
라. 국내 동향
|
표 4-1-1-2 |
유전체 연구 국내동향
|
유전체 기능 분석기술 |
연구 목적 및 내용 |
지원 부처, 기관, 연구사업명 |
|
인간유전체 활용 질병관련 유전자 발굴 및 검증 |
인간유전자원 확보 및 위암, 간암 유전체연구 |
과학기술부, 21세기 프론티어 인간유전체기능연구사업단 (한국생명공학연구원) |
|
사람의 질병과 관련된 유전적 소인규명, 인체시료 채취, 보관 |
보건복지부, 국립보건원, 질병관리본부, 자체사업 |
|
|
당뇨, 심혈관, 뇌신경계질환 등 각종 질환 유전체연구 |
보건복지부, 의과대학 및 병원 중심 유전체 연구 사업 |
|
|
인간 유전체 소재 발굴 |
한국인 고유 유전체 분석 |
과학기술부․국내 벤처기업 및 각 대학이 참여, 동북아 민족 기능성 유전체분석, 한국인Haplotype 작성 사업 |
|
생물정보 활용기술 |
유전체 정보 수집, 분석 및 지원 |
과학기술부, 국가유전체정보센터구축사업 |
출처 : 과학기술부, 보건복지부
마. 발전 과제
미국 국립보건원 산하 국립인간유전체연구소(NHGRI; National Human Genome Research Institute)가 2003년 완료된 인간 유전체 해독사업을 주도하였고, post- genome 연구도 영국의 Sanger연구소와 함께 세계적으로 주도하고 있다. 미국이 인간 유전체 프로젝트에 투자하는 연구비 규모를 고려할 때 미국 국립인간유전체연구소가 전 세계 인간 유전체 프로젝트의 흐름을 주도하고 있으며 선도적인 역할을 하고 있다. 유전체 수준에서 많은 질병관련 유전자(2005년 현재 약 1,850개)가 밝혀지고 있다(http://genome.gov/10000007). 이러한 유전자들이 질병과 기능적으로 관련되는지를 실험적으로 또 환경적으로 검증하는 연구, 인간유전체의 98%를 차지하고 있는 non-gene DNA 역할 규명, 암 유전체의 변이의 총체적 규명 등의 도전적이고 창의적인 연구 사업이 진행되고 있다[그림 4-1-1-4].
현재까지의 인간 유전체 연구결과를 바탕으로 다음과 같은 연구가 활성화될 것으로 보인다. 첫째, 유전체 수준에서 파악된 질병관련 유전자 또는 유전자군에 대한 기능연구가 수행되어 발병기 전에 대한 분자생물학적인 이해가 촉진될 것이다. 둘째, 인간 유전체 기능연구를 통한 질병발생의 원인조사는 그 경로를 차단 또는 보상할 수 있는 치료적인 방법론의 개발로 발전될 것이다. 셋째, 특정 질병과 연관된 바이오마커들은 질병의 발생을 예측하거나 조기에 진단하는 기술개발로 발전될 것이다. 넷째, 개인간 유전자형의 차이 및 환경인자 규명은 개인별 맞춤치료법 개발로 발전할 것이다.

출처 : 미국국립인간유전체연구소(http://www.genome.gov)
|
그림 4-1-1-4 |
인간 유전체 연구 흐름도

가. 단백질체학(Proteomics;프로테오믹스) 개요
(1)단백질체학(Proteomics)의 핵심기술
단백질체학은 세포 내의 단백질 발현 및 기능에 관한 연구로써, 생명 활동, 질병, 노화 등에 따른 단백질 발현의 정량화 뿐 아니라 단백질의 위치와 변화, 단백질 상호작용과 기능 분석까지를 포함하는 단백질에 대한 모든 연구이며, 새로운 치료제 및 진단시약 개발에 강력한 분석기술로 인식되고 있다. 단백질체학 기술은 크게 프로테옴 분석기술, 단백질기능 규명기술, 단백질체 정보기술로 구분되며, 핵심기술인 프로테옴 분석기술은 2차원 전기영동과 액상크로마토그라피와 같은 프로테옴 분리기술, 질량분석을 이용한 단백질 동정기술이 주를 이룬다. 단백질기능 분석은 단백질 상호작용 및 경로 분석, 단백질구조 규명 및 디자인, 세포 및 개체 내 단백질 기능 검증기술 등으로 구분되며, 단백질체 정보기술은 단백질체학 모든 과정에서 자료 분석 및 결과 해석에 기반이 되는 기술이다.
나. 해외 동향
(1) 최근 기술개발 동향
(가) 분리분석기술
2D-PAGE, capillary Reverse-Phase Liquid Chromatography(RPLC), CE (Capillary Electrophoresis) 등의 분리분석기술은 프로테옴 분석에 반드시 필요한 기술이다. 긴 분리칼럼과 초고압 펌프를 이용하여 펩타이드 분리분해능과 감도를 극대화하고, 두 개 이상의 분리기술을 결합한 다차원 분리기술의 개발이 추세이다. 최근 LC 기술에서 주목할 만한 것은 고정상 충진물의 소형화 추세로서, 직경 2μ 이하의 고정상 충진물을 이용할 경우에 폭넓은 flow rate에 대해 분리분해능이 크게 영향을 받지 않아서 고속으로 분리가 가능하다. 이때, 기존의 LC 시스템보다 더 높은 압력에서 안정적으로 gradient composition과 flow speed를 줄 수 있는 고압 HPLC 시스템이 필요하다. 2μ 이하의 소형 고정상 충진물 칼럼과 고압 HPLC 시스템의 결합이 앞으로 바이오시료의 분리에 주요한 기술로 대두될 것이다.
(나) 질량분석기술
최근 질량분석기술의 새로운 동향 중의 하나는 다양한 질량분석기술의 혼성화(hybridization)이다. 최근에 출시된 이온트랩-후리에 변환(Fourier transform:FT) 질량분석계의 결합, 이온트랩-오비트랩 질량분석계의 결합, 그리고 ion mobility 기기와 후리에 변환 질량분석계 혹은 Q-TOF과의 결합 등 다양한 혼성 질량분석계가 제품화되고 있다. FT-ICR은 높은 감도(100 amole - 150 zmole 까지 측정 가능), 높은 질량분해능, 1 ppm 이하의 높은 질량측정정확도 등으로 단백질 혼합물의 확인 및 peptide sequencing 정보의 향상을 가능하게 한다. 또한 ECD, ETD 등 다양한 펩타이드/단백질 분해 기술의 개발로 프로테옴 시료에 대한 좀 더 정확한 화학적 정보를 얻을 수 있게 된다. 아직 미량 단백질의 동정과 미량 단백질 변형 분석에는 많은 어려움을 가지고 있다.
(다) Informatics기술
질량분석에서 얻어진 방대한 데이터를 정확히 분석하고, 생산된 단백질체학 결과에서 생물학적 의미를 추출하기 위한 informatics 기술은 Scripps(DTAselect), ISB(TPP), PNNL(PRISM), FHCRC(CPAS) 등에서 분석의 자동화와 생산된 결과의 분석을 위한 소프트웨어 환경을 구축하여 사용하고 있으며, 보완․개선을 위한 지속적인 연구가 수행되고 있다. 또한 생물학적으로 매우 중요한 단백질 변형분석을 위한 알고리즘의 개발도 활발히 진행되고 있다. 최근에는 global proteomics를 통해 얻어진 방대한 데이터를 Gene Ontology 분석, enriched functional-related gene group의 clusterization, pathway map 작성, network 분석 등을 통해 시스템스바이올로지 접근의 informatics기술의 필요성이 대두되고 있다.
(라) 단백질체 정량기술
단백질체 정량기술은 대체로 ICAT(isotope coded affinity tags), ITRAQTM (Applied Biosystems, Inc.), SILAC(stable isotope labeling with amino acids in cell culture), IDBESTTM(Target Discovery, Inc.) 등의 비교정량기술과 SISCAPA(Stable Isotope Standards with Capture Anti-Peptide Antibody), QCAT proteotypic peptide 기술 등의 절대정량기술로 분류된다. 2D PAGE의 단점을 보완한 DIGE(double labeled fluorescence detection)방법도 비교정량기술로 상용화되었다. 최근에는 다차원 LC/MS/MS 실험을 통한 label-free quantitation 방법이 바이오마커 발굴에 활발히 적용되고 있다.
(마) PTM(Post Translational Modification) 분석 기술
PTM이 가지고 있는 특이적인 물리, 화학적 성질을 이용 특정 PTM단백질체들만 enrich하는 기술들(phospho-capture, glyco-capture, cysteine-capture)이 활발하게 개발되고 있다. 또한 top-down proteomics를 이용하여, 단백질 하나에 나타나는 복잡한 PTM의 조합을 알아내는 분석기술이 최근 소개되기도 하였다.
(바) 바이오마커 연구
바이오마커는 질병의 조기진단, 예후, 약물치료에 대한 반응 추적, 신약 후보 물질에 대한 평가 인자 등으로 단백질체학 분석기술의 발달로 단백질 바이오마커 후보가 다량으로 나오고 있지만, 그들의 실제 유용성을 평가하는 부분은 시간이 걸리는 단계이다. 2006년 미국 식품의약청(FDA)에서 발표한 ‘Critical Path Opportunities Report’에 따르면, 신약개발이 좀 더 효율적으로 진행되기 위해서는 각 단계(특히 임상 2․3상)를 평가할 수 있는 새로운 바이오마커의 개발이 무엇보다 중요하다고 역설하였다. 최근 미국 NCI, FDA, AACR(미국암학회) 등을 중심으로 바이오마커 개발 및 적용에 대한 가이드라인의 제정을 추진하고 있다.
단백질체학을 이용한 바이오마커 개발은 SELDI-TOF 질량분석방법을 이용하여 난소암을 진단할 수 있는 방법이 개발되었고(OvaCheckTM), 삼성종기원에서는 ‘Lab-on-a-Disc’로 불리는 Compact disk형 혈액 검사기기를 개발하여 단백질 바이오마커 검출을 한 장의 CD에서 구현하고자 한다. 최근 IT회사들이 진단 관련 사업으로 확장하는 추세이다(구글의 23andMe 지분 인수, 마이크로소프트의 AzyxxiTM 인수).
(2) 주요국 연구개발 투자 동향
|
표 4-1-2-1 |
주요국 연구개발 투자동향
|
국가 |
구 분 |
연구개발 투자내용 |
|
미국 |
NCI (National Cancer Institute) |
임상프로테오믹스선도기술개발사업: $104M (2006~2011) 조기진단네트워크: $9.8M (2006 예산), 총 5년 |
|
NIH (National Institutes of Health) |
단백질 네트워크 연구: $7M (추가 선정 예정) 개정 로드맵 ‘-omics’ 평가를 위한 $30M 예산 포함 |
|
|
NIGMS (National Institute of General Medical Science) |
PSI 2단계사업의 단백질 구조결정: $300M (2006~2011) National Center for Systems Biology (NCSB) 총 7개 지원 (센타 평균 $15M 5년간 지원) |
|
|
일본 |
RIKEN 요코하마연구소 |
Protein3000(단백질 구조와 기능해석 프로젝트): 5000억원(5년간), 2007년부터 7,000억원 규모로 조정 확정 |
|
호주 |
교육과학훈련부 |
Biotech Initiative로 단백질체학 분야에 $40M 지원 |
|
EU |
EU 6th Framework 프로그램 |
유전자 발현과 단백질체학 등 생명공학 분야 연구사업 : €382.6M |
|
스웨덴 |
Uppsala 대학에 퇴행성뇌질환 바이오마커 센타 건립 $23M |
|
|
영국 에너지 및 물리과학 연구위원회 |
단일세포 단백질체학 기법을 위한 기반 연구 : $9.8M |
|
|
덴마크 Novo Nordisk 재단 |
질환 단백질 연구를 위한 센터 코펜하겐대학에 건립 : $109M |
|
|
노르웨이 |
기능유전체 연구 2단계 $70M 지원 (2007~2011) |
|
|
독일 헬름홀츠재단 |
난치성질환 시스템스바이올로지 $32M 지원 (2007~2011) |
|
|
국제 컨소 시엄 |
HUPO (Human Proteome Organization) |
Antibody Initiative : 정상궤도에 들어섬 질환별 Initiative 추진 배아 및 성체 줄기세포 단백질체학 Initiative 결성 |
|
ICBC (International Cancer Biomarker Consortium) |
미국, 한국, 중국, 대만, 싱가포르, 홍콩, 프랑스 등 참여 바이오마커 발굴 기술적 평가 전문가 운영위원회의 |
출처 : 프로테오믹스이용기술개발사업단 자체분석자료
(3) 단백질체학의 시장 규모
세계 단백질체학 시장은 2005년 19억 달러에서 연평균 약 13.6%씩 성장하여 2010년 약 37억 달러로 예측된다. 기술 분야별로 보면 80% 이상이 Expression Proteomics 분야이며, 시장의 지역별 분포는 다음과 같다.

출처 : Proteomics - Global Strategic Business Report, Global Industry Analysts, Inc., 2006
|
그림 4-1-2-1 |
주요 국가별 단백질체학 시장 전망
다. 국내 동향
(1) 연구개발 투자 현황
|
표 4-1-2-2 |
정부 지원 단백질체학 연구 현황
|
부 처 명 |
사 업 명 |
수행 기간 |
2006년 연구비 |
비고 (주관 기관 등) |
|
과학기술부 |
프로테오믹스이용기술개발사업 (21세기프론티어사업) |
2002~ 2011 |
80억 |
한국과학기술 연구원 |
|
보건복지부 |
질병유전단백체종합연구지원센타 (바이오보건기술개발사업) |
2003~ 2010 |
27억 |
연세대학교 |
|
과학기술부 |
단백질 칩 기술개발사업 (차세대성장동력사업) |
2004~ 2011 |
34억 |
한국생명공학연구원 |
|
산업자원부 |
산업용 초소형 Protein/DNA Chip System 대량생산 기술 (차세대신기술개발사업) |
2000~ 2008 |
20억 |
삼성종합기술원 |
출처 : 2007년도 생명공학육성시행계획 정리(2007. 3)
(2) 관련 산업 현황
민간 부문의 투자 규모는 선진국에 비하여 크게 못 미치고 있다.
|
표 4-1-2-3 |
국내 대표적 단백질체학 벤처기업 현황
|
기업명 |
주요 업종 |
설 립 |
비고 |
|
프로테오젠 |
단백질 칩, 단백질 기능분석 장치개발 및 판매 |
2000. 2 |
|
|
에이비프런티어 |
항체 생산, HUPO Antibody Initiative에 참여 |
2007. 2 |
|
|
(주)펩트론 |
단백질 정제용 레진, 단백질 서방성 제제 생산 및 판매 |
1997.11 |
|
|
(주)프로테옴텍 |
시료 준비, 젤 이미지 분석, 질량분석 서비스 제공 |
2000. 3 |
|
|
크리스탈지노믹스(주) |
질환 단백질의 3차 구조관련 신약 발굴 |
2000. 7 |
|
|
(주)씨그몰 |
생산단백질의 활용성 제고, 신기능 단백질기술개발 |
2000. 6 |
|
출처 : 프로테오믹스이용기술개발사업단 자체 조사
라. 발전과제
단백질체학 관련 한국의 국제적 연구 활동은 괄목할 만 하나, 제약산업 등 바이오산업의 국제 경쟁력 확보를 위해서는 단백질체학 기술에 대한 전문가 양성 및 인프라 구축에 대한 지속적 지원이 필요하며, 바이오마커/질환표적 단백질 발굴과 Array/Chip 분야 등에 주력할 필요가 있다.

가. 세포체학 연구의 개요
병원체 또는 기능이상에 의하여 발생하는 수많은 질병을 치료하기 위하여 외과적 수술법 또는 약물투여방법이 이용되고 있으며, 백신 등을 활용한 질병예방 기술들도 빠르게 개발되고 있다. 생명공학 시대로 일컬어지는 21세기에는 생명공학과 의료기술이 접목되어 지금과는 비교할 수 없을 정도로 질병의 근본적인 치료 및 예방이 가능해질 것이다.
유전자 수준에서 질병을 예방하는 유전자치료술(gene therapy), 환자 개개인의 신체적 특성을 고려하여 약물의 종류 및 투여량이 결정되는 맞춤형 약물투여기술, 그리고 손상된 조직이나 장기를 대체하는 세포치료-장기이식기술 등이 빠르게 발전될 것이다.
이러한 첨단 의료기술을 개발하기 위하여 관련지식과 연구 분야가 통합된 융합학문 분야가 빠르게 발전하고 있으며 전임상(preclinical)과 임상 연구가 결합된 중개연구(translational research) 분야가 발굴되고 있다. ‘세포체학’은 세포 및 세포가 구성하는 조직을 연구대상으로 하는 융합학문으로 손상된 세포나 조직을 대체하는 ‘세포/조직 치료기술(cell and tissue therapy)’ 개발과 난치병치료에 필수적인 생리활성물질/신약 대량생산을 목적으로 하는 ‘생체반응기(bioreactor)생산’을 추구한다.
본 장에서는 현재 세포체학 연구 분야에서 가장 주목을 받고 있는 사람과 동물의 줄기세포를 대상으로 하는 최근 연구 동향을 정리하고자 한다.
나. 연구 동향
자가생성능력(self-renewal)과 전능성(pluripotency)을 가지고 있는 줄기세포는 발달단계의 배아에서 유래하는 배아줄기세포와 우리 몸의 각 조직에서 추출한 성체줄기세포로 대별되고 있다.
배아줄기세포는 대량 확보가 비교적 용이하고 생체를 구성하는 모든 세포로 분화할 수 있는 전능성이 뛰어나 분화조절만 가능하다면 임상응용성이 매우 높은 세포이다. 반면 성체줄기세포는 극소수 존재하기 때문에 생체조직에서 분리가 어렵고 상대적으로 분화능력이 배아줄기세포보다 떨어지는 단점이 있다. 그러나 성체줄기세포는 이식 후 종양생성능(tumorigenicity)과 면역거부반응 유도가 적어 임상적 안전성이 배아줄기세포보다 상대적으로 우월하며, 배아줄기세포 확립에 따르는 세포치료술의 윤리적 문제점을 해결할 수 있는 대안을 제시할 수 있다.
줄기세포를 다른 세포와 구별하기 위하여 1) 세포미세구조를 포함한 줄기세포의 형태적 특징을 확인하는 방법, 2) 줄기세포의 세포막이나 세포질에 존재하는 특정물질, 또는 특이적인 유전자/유전자발현을 검색하는 방법, 3) 줄기세포의 분화능을 체외와 이식을 통하여 체내에서 검증하는 방법, 그리고 4) 카이메라(chimera) 생산 및 생식선 전이(germline transmission)를 통하여 줄기세포의 전능성을 확인하는 방법 등이 일반적으로 사용된다. 단 이러한 검증에는 세포집단(colony)을 형성하여 안정화된 줄기세포만을 이용하고 있다.
지금까지 줄기세포 연구는 배아와 성체줄기세포가 상호보완하며 발전을 거듭하여 왔다. 1990년대 후반부터 2000년도 초반까지는 배아줄기세포의 전능성과 성체줄기세포의 임상적 우수성을 적극 활용하여 직접적인 임상적용이 시도되었다. 그렇지만, 배아줄기세포의 전능성을 제어할 수 있는 효과적인 방법이 단시간 내에 개발될 수 없을 뿐 아니라, 성체줄기세포가 가진 전능성의 한계 때문에 2000년대 중반부터는 줄기세포를 활용한 적극적 임상시도보다는 기초연구 및 전임상 중심의 연구가 강조되고 있다. 한편 성체 및 배아줄기세포의 장점을 살리고 단점을 제거하며, 환자 맞춤형치료를 보다 가능하게 하기 위하여 성체조직으로부터 면역특이적인 전능성 줄기세포를 확보하는 이른바 ‘대체줄기세포 확보(alternative stem cell establishment)’ 기술이 2000년대 초반부터 개발되기 시작되었다.
지금까지 종양조직(Lotem 등, 2006 외 1편), 생식조직(Guan 등, 2006 외 1편), 골수 및 뼈 조직(Kucia 등, 2006 외 2편), 피부 및 모근(Crigler 등, 2007 외 2편) 그리고 혈액 및 제대혈(Habich 등, 2006 외 2편) 등에서 전능성 세포의 분리가 성공되었다. 최근, 세포의 유전자 발현과 기능을 조절하여 분화된 세포를 역분화시켜 전능성 줄기세포를 확보하는 기술이 미국과 일본 연구진에 의하여 개발되었으며(Wernig 등, 2007 외 1편), 체세포와 줄기세포의 융합(Ambrosi 등, 2007 외 3편) 및 배아의 할구로부터 줄기세포를 분리하는 기술(Chung 등, 2006 외 2편) 등도 제안되었다. 국내의 경우 정부 및 자치단체의 연구비를 지원받는 중/대형의 줄기세포 연구 사업단이 설립되어 배아 및 성체줄기세포, 그리고 제대혈세포에 관련한 연구 활동을 활발하게 진행하고 있다. 국내의 줄기세포연구는 2005~2006년도에 발생하였던 줄기세포 연구스캔들과 생명윤리법 시행에 따르는 각종 규제 등으로 인하여 배아줄기세포 연구가 주춤하였으나 세계적 추세에 따라 배아줄기세포 관련 연구 활동이 다시 활발해져 가고 있다. ‘생명윤리법’ 등 줄기세포 연구지원 및 연구관리 시스템도 갖추어져 향후 보다 내실 있는 연구 성과가 기대되고 있다. 배아줄기세포 분야의 경우 microRNA 등의 기초연구와 세포배양기술 개발이 두드러지고 있으며(Kang 등, 2007 외 12편) 대체줄기세포 확보 분야의 경우 자연 퇴화되는 미성숙난포와 단성생식을 활용하는 맞춤형 배아줄기세포 확보기술이 보고되었다(Lee 등, 2007). 또한 체세포역분화를 통한 전능성 줄기세포 확보기술 등 다양한 기술들에 대한 지적 우선권이 순수 국내 연구진에 의하여 확보되고 있다(Lim 등, 2006). 성체줄기세포 연구 성과도 지속적으로 축적되고 있으며(Yang 등, 2006 외 9편), 임상적용을 위한 다양한 시도가 줄기세포 연구 사업단별로 이루어지고 있다.
동물줄기세포 연구의 경우 전 세계적으로 포유동물에서 형질전환 기술을 이용한 생체반응기 생산연구가 지속적으로 이루어지고 있으나(Weise 등, 2007 외 4편) 목적물질의 분리/정제의 어려움과 효율성 저하로 인하여 연구 진행이 정체되어 있는 실정이다. 이러한 단점을 보완하기 위하여 조류를 이용한 생체반응기 생산이 대안으로 제시되고 있으며, 유전자 혼재 카이메라 생산과 형질전환 조류개발이 계속 성공되고 있다(Yamamoto 등, 2007 외 6편). 국내 연구진에 의해서도 형질전환 조류생산이 성공하였으며, 이와 관련된 유전체학 및 생물정보학이 급속하게 발전하고 있다(Jung 등, 2007 외 6편). 한편 직접적인 치료기술 적용을 위하여 이종간 이식을 통한 이종세포/조직 이식기술 개발가능성이 탐색되고 있으며, 주로 돼지를 실험 대상으로 하여, 이와 관련된 연구가 지속적으로 진행되고 있다(Lee 등, 2006 외 6편).
다음 각 절에서는 배아, 성체 및 동물줄기세포 연구 분야, 그리고 줄기세포 확립을 위한 대체기술 개발에 관련한 최근의 업적을 보다 구체적으로 소개하고 최종적으로 세포체학의 미래전망에 대하여 기술하였다.
(1) 배아줄기세포 (embryonic stem cell)
최근 배아줄기세포 연구의 특징은 확립된 연구인프라를 활용하여 줄기세포의 자가생성과 분화능에 대한 기초연구가 활발히 이루어지고 있다는 점이다. 자가생성능 관련연구의 경우, 줄기세포의 유지에 필요한 다양한 유전자 및 유전체 기능연구가 생물정보학, 시스템생물학(systems biology) 및 분자생물학 분야에서 중점적으로 수행되고 있으며(Watanabe 등, 2007 외 7편), 관련 연구결과를 토대로 줄기세포 기능에 관련된 단백질체학 등의 연구도 발전되고 있다(Baharvand 등, 2006 외 5편). 이를 토대로 배아줄기세포의 안정적 유지에 필요한 다양한 응용 및 실용화 연구가 진행되고 있으며, 줄기세포의 안정적 유지를 위한 SOP(standard operation protocol) 및 줄기세포 은행을 통한 공급시스템이 구축되어가고 있다. 앞으로도 배아줄기세포 배양관련 연구(Watanabe 등, 2007 외 1편)가 지속적으로 이루어질 것이며, 맞춤형 배아줄기세포 배양(Lee 등, 2007 외 2편), 인간지지세포이용 배양(Inzumza 등, 2005 외 3편) 및 줄기세포단독배양법(Kimanskaya 등, 2005 외 3편) 그리고 배아줄기세포의 유전학적/세포학적 안전성 확보(Mantel 등, 2007 외 2편) 관련 첨단기술들이 지속적으로 개발될 것이다. 최근에는 줄기세포 연구가 배아줄기세포와 기초연구로 무게중심이 옮겨가고 있으므로 이러한 연구결과들은 배아줄기세포의 전능성 유지에 관련한 첨단연구 발전을 효과적으로 지원할 수 있을 것이다.
국내의 경우 2005년 현재 약 30여 종의 배아줄기세포가 확립되어 다양한 연구에 활용되고 있었다. 2005년 후반부터 대대적인 줄기세포 정비가 진행되어 확립된 배아줄기세포를 대상으로 전반적인 세포 품질관리(quality control) 작업 및 줄기세포 은행 재배치 작업이 수행되었다. 또한 국내 연구기관에 줄기세포 치료기술 연구를 위한 GMP급 설비도 계속 증가하였다. 체세포 핵이식이 가진 윤리적 문제를 보완하기 위한 실험실 및 연구관리 시스템도 계속 정비되고 있으므로 앞으로 국내 배아줄기세포 연구지원을 위한 인프라 구축은 빠른 시일 내에 이루어질 수 있을 것으로 기대하고 있다.
배아줄기세포 분화연구의 경우, 지금까지 많은 시도가 이루어져 왔으나 주된 연구대상은 몇 가지 질환 및 장기에 집중되고 있다. 또한 조직공학의 첨단지식과 줄기세포 연구기술이 융합하여 인공조직 개발연구가 진행되고 있다.
현재 심혈관계(Kattman 등, 2006 외 3편), 신경계(Enzmarn 등, 2006 외 3편) 및 조혈계통(Vodyanik 등, 2005 외 2편) 세포로의 분화시도가 이루어지고 있다. 췌장의 경우 당뇨병 치료에 대한 임상적 중요성에 따라 연구진행이 이루어지고 있으나 임상까지는 많은 노력이 필요하다.
인간의 경우, 2000년대 초반에 배아줄기세포의 심근세포 분화(Kehat 등, 2001 외 1편) 및 중간엽/골수줄기세포의 심근세포 분화유도(Toma 등, 2002 외 1편)가 성공하였으나 아직 정확한 조건 및 방법을 확립하지는 못하였다(Laflamme 등, 2005 외 1편). 한편 배아줄기세포를 외배엽성 세포로 분화시켰으며(Reubinoff 등, 2001 외 1편), 중추신경계 세포로 발생에 성공하였다(Perrier 등, 2004 외 2편). 이식 후 종양발생이 문제점으로 지적되어 이를 방지하기 위한 방법들이 연구되어왔다(Roy 등, 2006 외 1편). 배아줄기세포를 조혈모세포로 분화시키는 연구도 지속적으로 진행되고 있다(Lu 등, 2007 외 2편).
2005년 Zhang 등은 영장류에서 지지세포(feeder cell)를 사용하지 않고 조혈모세포 분화유도시스템을 개발하는 데 성공하였다. 최근 배아줄기세포를 이용하여 생식세포로 분화시키는 연구가 개시되었다(Rye 등, 2006 외 8편).
(2) 성체줄기세포 (adult stem cell)
골수에 존재하는 조혈줄기세포와 중간엽줄기세포, 탯줄에서 유래된 제대혈 줄기세포, 그리고 신경줄기세포 등의 연구가 활발히 진행되고 있다. 특히 기존의 성체줄기세포가 가진 분화능을 개선하기 위하여 다른 계통의 태아조직이나 다른 기관의 세포로 분화시키는 교차분화(trans-differentiation) 연구가 활발히 이루어지고 있다. 조혈줄기세포의 경우 백혈구 생성기능을 이용하여 혈액종양의 치료에 이용되고 있을 뿐 아니라(Kim 등, 2006), 중간엽 줄기세포 및 탯줄혈액 줄기세포와 같이 지방, 연골, 뼈, 근육, 피부, 신경 등 다양한 종류의 세포로 분화를 시도하고 있다(Le 등, 2006 외 2편). 그럼에도 불구하고 성체줄기세포를 본격적으로 임상에 이용하기 위해서는 분화능력의 한계와 분리․유지의 어려움을 극복해야만 한다.
우선 성체줄기세포 분리 분야에서 배아줄기세포와 비슷한 속성을 가진 정자생성 줄기세포를 마우스에서 추출하는 데 성공하였다(Guan 등, 2006 외 4편). 남자 정소에서 채취한 미성숙 생식세포를 줄기세포로 전환, 신경, 심장 및 골세포로 배양하는 데에도 성공했다(Primegen, 2006). 모낭 돌출부(bulge)에 있는 세포 중 일부는 배아줄기세포와 성체줄기세포의 장점을 고루 갖춘 가소성(plasticity)이 매우 높은 줄기세포라는 것이 입증되었다(Hu 등, 2006 외 1편). 모낭줄기세포는 환자 자신의 모낭에서 채취해 쓸 수 있기 때문에 이식했을 때 조직 불일치 가능성이 없으며 또 배아줄기세포와 관련된 윤리문제도 피할 수 있다.
최근 10여 년간 성체줄기세포의 임상적용이 지속적으로 시도되고 있으며, 제대혈세포를 포함한 일부 성체줄기세포의 경우 현재 상용화되어 임상적용이 적극 검토되고 있다. 가장 많이 활용되는 골수의 경우 이로부터 채취한 조혈줄기세포가 백혈병 치료에 활발히 이용되고 있다(Fukushima 등, 2005 외 1편). 조혈줄기세포로부터 뼈를 생성하거나(Zhu 등, 2007 외 2편), 교차분화시켜(Ishikawa 등, 2006 외 1편) 치료에 이용하는 방법도 검토되고 있다. 특히 심혈관질환 치료에 교차분화능을 가진 줄기세포 활용이 시도되고 있다(Elsenberg 등, 2006 외 2편). 제대혈 부분에서도 빠른 발전이 이루어져 2003년에 이미 전 세계적으로 40개 이상 설립된 제대혈은행이 중심이 되어 지난 3년간에도 지속적으로 성장하고 있으며 시장규모는 2007년에는 약 6억 달러에 도달할 것으로 예상된다. 제대혈에서도 전능성 또는 교차분화능을 가진 줄기세포를 회수하려는 노력이 지속되고 있으나, 아직 이를 위한 효과적 기술 확립은 이루어지고 있지 않다. 국내연구진에 의한 성과도 빠르게 축적되어 제대혈 세포의 분화 및 임상적용 가능성이 지속적으로 보고되고 있다(Jang 등, 2007 외 4편). 성체줄기세포 임상적용의 효시인, 유산태아의 뇌 조직을 파킨슨병 환자의 뇌에 이식하여 증상이 호전되었다는 보고(Michehjda 등, 1987) 이후 신경줄기세포 및 이로부터 분화한 신경세포의 기능적․유전적 특성을 밝힌 수많은 보고가 이루어졌다. 신경줄기세포 연구는 주로 파킨슨병, 루게릭병, 헌팅턴병 등의 퇴행성 질환 그리고 교통사고 등에 의한 척수손상 회복 치료 등이 목적이 되고 있으며(Marutle 등, 2007 외 5편), 기 확립된 모델동물시스템을 활용하여 전 임상연구도 진행되고 있다(Parr 등, 2007 외 3편). 단 병인의 복합성과 조직재생범위를 고려하였을 때 파킨슨병에 대한 세포치료기술이 가장 빠르게 개발될 것으로 판단된다.
이 외에도 다양한 종류의 조직에서 유래하는 줄기세포를 임상치료에 이용하려는 시도가 지속되고 있으며(Choi 등, 2006 외 4편) 영국 런던의 헤어필드병원 연구팀은 세계 최초로 줄기세포에서 심장의 일부를 만들어 내는 데 성공했다(신문기사).
|
표 4-1-3-1 |
줄기세포를 이용하여 세포치료 가능성이 제시되고 있는 질병
|
이용세포 |
치료대상 질환 |
|
신경세포 |
파킨슨병, 헌팅턴병, 근위축성 축색경화증(루게릭병), 뇌졸중 |
|
척수신경세포 |
척수손상, 마비 |
|
간세포 |
B형 간염, 마비 |
|
피부세포 |
화상, 궤양, 만성피부손상 |
|
심근세포 |
심장마비, 퇴행성 심장질환 |
|
췌장세포 |
당뇨병 |
|
혈관내벽세포 |
동맥경화 |
|
연골세포 |
퇴행성 관절염 |
|
골세포 |
골다공증 |
|
조혈세포 |
빈혈, 면역결핍 |
|
근육세포 |
근육성 영양실조 |
|
호흡상피세포 |
낭포성 섬유증, 폐암, 폐기종 |
|
부신피질세포 |
부신부전증 |
|
망막색소상피세포 |
노인성 황반, 모반퇴화증 |
출처 : 줄기세포 최근 기술이슈 및 시장동향, 보건산업진흥원, 2005
(3) 동물 줄기세포의 연구현황
우선, 형질전환-생체반응기 생산을 위하여 포유동물의 대안으로 조류를 대상으로 하는 연구가 빠르게 진행되고 있다. 조류의 경우 원시생식선 세포가 혈관을 통하여 생식선으로 이동하기 때문에 형질전환된 줄기세포 이식을 통하여 유전자혼재동물(chimeric animal)을 생산한 후, 후대교배에 의하여 원하는 형질전환동물을 만들 수 있다. 특히 치료물질 생산을 위하여 알을 이용하는데 구성단백질이 단순하기 때문에 추출정제 및 이에 따른 생산성 향상에 큰 장점을 가지고 있다.
2005년 국내연구진에 의하여 닭의 배아생식선세포 특성분석에 성공한 이후(Jung 등, 2005), 정소세포 이식을 통한 카이메라 닭 생산에도 성공하였다(Lee 등, 2006). 닭 배아에서 원시생식세포를 분리, 배양, 유전적으로 변형시키는 데 성공하였으며(Heoi 등, 2006), stage X 단계의 area pellucidae에서 분리한 배아줄기세포를 장기 배양하여 체세포유전자혼재동물을 생산하였다(van de Lavoir 등, 2006).
한편 이종장기 이식기술 개발을 위하여 돼지 전능성 줄기세포 연구를 확보하려는 노력이 계속되고 있으며, 전능성 세포의 면역유전자 기능조절 연구도 활성화 되어있다(Kim 등, 2007 외 3편). 손상된 피부를 대신해 줄 수 있는 대체적인 방법으로 미니어처 돼지의 상피 줄기세포 확립에도 성공하였으며(Motlik 등, 2007), 돼지 골수에 있는 중간엽줄기세포를 분리, 특성을 검증하고 체외에서 심근세포까지 분화시키는 데에도 성공하였다(Moscoso 등, 2005). 또한 돼지의 태아에서 상피 줄기세포를 분리하여 난자와 유사한 세포로 분화시킨 후 이를 배아줄기세포까지 발달시키는 데 성공하였다(Dvce 등, 2006). 형광단백질을 발현시킨 배아생식세포주를 돼지에서 확립하는 데 성공하였으며(Rong 등, 2006), 어린 돼지의 gonocyte에 특별하게 붙는 lectin을 이용하여 PGC를 분리한 후 수컷의 생식세포주를 확립하는 데에도 성공하였다(Goel 등, 2007).
줄기세포 첨단기술 개발모델로서 주로 활용되는 마우스 연구의 경우, 성체 정소로부터 spermatogonial stem cell을 분리하여 전능성을 확인하였다(Guan 등, 2006). 또한 마우스의 웅성 생식선 줄기세포(male germline stem cell)를 혈청이나 지지세포가 없는 상태에서 장기배양 할 수 있는 시스템을 확립하였으며 확립한 세포주의 단일세포에서 유래한 자손발생에도 성공하였다(Kanatsu-Shinohara 등, 2005).
(4) 생명윤리를 고려한 줄기세포 확보기술 개발
인간의 배아줄기세포 확보를 위해서는 반드시 배아를 희생시켜야 하며, 확보된 배아줄기세포는 복제배아 생산에도 이용될 수 있기 때문에 생명윤리에 대한 우려를 야기하게 되었다. 이러한 문제점을 해결하기 위하여 연구목적의 배아사용을 최소화하거나, 배아 이외의 세포에서 전능성세포를 개발하는 연구들이 2000년대 초부터 진행되고 있다.
2005년 8세포기의 마우스 배아에서 한 개의 할구(blastomere)만을 확보한 후 이로부터 배아줄기세포를 확립하는 데 성공하여, 배아를 파괴하지 않고 줄기세포를 확보할 수 있는 방법이 제시되었다. Jamieson 등(2004)은 백혈병에서 자기재생능력이 있는 종양줄기세포(cancer stem cell)가 체세포로부터 유래한다는 가능성을 제시하여 줄기세포 확보의 새로운 방안을 제시하였다.
한편 유전자 적중기술을 이용하여 착상에 필요한 유전자를 제거한 체세포복제 배아를 생성하여 이로부터 줄기세포를 확립하는 데 성공하였으며(Meissner와 Jaenisch, 2005), 체세포와 배아줄기세포를 융합하여 새로운 줄기세포를 확보하는 방법(Cowan 등, 2005)이 개발되기도 하였다. 이러한 노력은 각국에서 제정되고 있는 생명윤리법규 준수 및 줄기세포연구의 사회적 공감대 확산에도 크게 기여할 것이다.
2005~2007년도의 업적을 간추리면, 기존의 배아의 희생을 최소화 하기 위하여 배아 전체가 아닌 할구세포를 이용한 배아줄기세포주 확립기술이 개발되었다. 또한 극체를 이용하여 전능성을 가진 배아줄기세포주를 확립하기도 하였다(Wakayama 등, 2007).
성체 마우스로부터 유전자(Stra8) 선별을 통해 SSC를 분리하여, 배양 후 전능성을 확인하는 데에도 성공하였다(Guan 등, 2006). 마우스 배아 및 성체 섬유아세포에 특정 유전자 Oct3/4, Sox2, c-Myc, Klf4를 도입함으로써, 체세포를 전능성 줄기세포로 유도하였다(Takahashi 등, 2006). 이를 기초로, Oct3/4, Sox2, c-Myc, Klf4 네 개의 유전자를 섬유아세포에 도입하고, 새로운 유전자 선별 방법을 통해 보다 배아줄기세포에 근접한 전능성 줄기세포 확립에 성공하였다(Wernig 등, 2007 외 2편).
한편 미성숙 난포의 체외배양기술을 통해 성숙난자를 생산하고, 이들 성숙난자의 단성생식을 통해 형성된 배반포를 이용하여 자가 유래 배아줄기세포를 확립하였다(Lee 등, 2007). 최근에는 영장류에서 단성생식을 이용한 자가 면역 줄기세포주 개발에 성공하였다(Vrana 등, 2003).
다. 발전 과제
줄기세포연구는 꾸준한 발전에도 불구하고 아직까지도 해결해야 할 많은 과제가 남아있다. 무엇보다 필요한 세포를 자유자재로 분화시키는 분화유도기술이 가장 시급히 개발되어야 한다. 이 기술이 개발될 경우 줄기세포 활용의 효율성 증대는 물론 이식 후의 안전성에도 괄목할 만할 발전이 이루어질 수 있다. 또한 줄기세포의 면역유도 조절도 성공적인 세포치료 기술 확립에 필수적이며 이에 관한 면역학적 연구도 시급히 이루어져야 한다.
체외에서 배양된 줄기세포의 유전적 안전성 및 안정성에 관한 문제도 시급히 해결해야 하며 윤리논쟁을 피하기 위하여 배아를 이용하지 않고 줄기세포를 확립하는 방법도 개발되어야 하고, 보다 안정적인 줄기세포 은행시스템의 확보도 빠른 시일 내에 이루어져야 한다.
연구의 효율적 추진을 위하여, 연구진에 대한 교육 및 안정적 인적/물적 자원관리, 그리고 연구의 투명한 관리체계도 동시에 발전되어야 할 것이다. 동물의 경우 줄기세포를 이용한 난치병 치료약물 생산과 이종장기 이식기술 개발을 위하여 보다 효율적이고 안전한 유전자적중기술 및 목적에 적합한 줄기세포 확보기술이 개발되어야 한다.
결론적으로 줄기세포를 통한 세포치료기술 개발은 효율성과 안전성 그리고 윤리성도 동시에 확보하는 방향으로 연구가 진행되어야 하며 임상적용에 앞선 기초 및 전임상 연구에 연구역량을 집중하여 세포체학 분야의 인적/물적 인프라 확보에 최선을 다하여야 한다.
우리나라의 경우 줄기세포 연구 분야의 우수한 연구 성과를 축적하는 것만큼 성과에 대한 국제적 신뢰를 다시 회복하고, 선도적인 위치로 재진입하는 것을 향후 2~3년 안에 이루어야 할 학문적 과업으로 제언하고 싶다. 줄기세포 연구는 분명 21세기 인류복지 향상을 위하여 반드시 필요하나, 연구 개시가 10여 년에 불과한 신생학문인 만큼 임상적용까지는 많은 시간이 필요하다는 것을 인식하고 연구 성과를 조용히 지켜보고 인내하는 지구력이 필요하다. 동 분야에 대한 보다 적극적이고 장기적 연구전략 수립과 인프라 확충이 세포치료기술 개발을 위하여 반드시 필요하다.
참 고 문 헌
Ambrosi DJ et al. Stem Cells. 2007; 25:1104-13. / Baharvand H et al. Proteomics. 2006; 6:3544-9.
Becker S and Chung Y. Methods Enzymol. 2006; 18:108-16. / Chang IK et al. Cell Biol Int. 1997; 21:495-9.
Choi YS et al. Biochem Biophys Res Commun. 2006; 345:631-7. / Chung Y et al. Nature. 2006; 439:216-9.
Cowan CA et al. Science. 2005; 309:1369-73. / Crigler L et al. FASEB J. 2007; 21:2050-63.
Dvce PW et al. Nat Cell Biol. 2006; 8:384-90. / Eisenberg CA et al. Stem Cells. 2006; 24:1236-45.
Enzmann GU et al. Neurotrauma. 2006; 23:479-95. / Fukushima T et al. Leukemia. 2005. 19:829-34.
Goel et al. Biol Reprod. 2007; 77:127-37. / Guan K et al. Nature. 2006; 440:1199-203.
Habich A et al. Exp Hematol. 2006; 34:914-25. / Han BK et al. Mol Reprod Dev. 2005; 72:521-9.
Hoei-Hansen CE et al. J Pathol. 2006; 209:25-33. / Hu YF et al. Stem Cells. 2006; 24:2692-702.
Inzunza J et al. Stem Cells. 2005; 23:544-9. / Ishikawa F et al.. FASEB J. 2006; 20:950-2.
Jamieson CH et al. N Engl J Med. 2004; 351:657-67. / Jang JH et al.. Acta Pharmacol Sin. 2007; 28:367-74.
Jung JG et al. Stem Cells. 2005; 23:689-98. / Jung JG et al. Biol Reprod. 2007; 76:173-82.
Kanatsu-Shinohara M et al. Biol Reprod. 2005; 72:236-40. / Kang SM et al. Stem Cells. 2007; 25:419-24.
Kattman SJ et al. Dev Cell. 2006; 11:723-32. / Kehat I et al. J Clin Invest. 2001; 108:407-14.
Kim NY et al. Xenotransplantation. 2007; 14:104-11. / Kim SW et al. Stem Cells. 2006; 24:1620-6.
Klimanskaya I et al. Lancet. 2005; 365:1636-41. / Ko JH et al. Transgenic Res. 2000; 9:215-22.
Kucia M et al. Leukemia. 2006; 20:857-69. / Laflamme MA et al. Am J Pathol. 2005; 167:663-71.
Le Blanc K et al. Curr Opin Immunol. 2006; 18:586-91. / Lee E et al. Biophys Res Commun. 2006; 348:1419-28.
Lee SH et al. Cell Physiol Biochem. 2007; 19:269-82. / Lee ST et al. Fertil Steril. 2007; [Epub ahead of print]
Lim JM et al. PCT/KR2006/003187. / Lotem J et al. Oncogene. 2006; 25:7663-72.
Lu SJ et al. Nat Methods. 2007; 4:501-9. / Mantel C et al. Blood. 2007; 109:4518-27.
Marutle A et al. Proc Natl Acad Sci U S A. 2007; [Epub ahead of print].
McGuckin C et al. Acta Neurobiol Exp (Wars). 2006; 66:321-9.
Meissner A et al. Nature. 2005; [Epub ahead of print] / Michejda M et al. Fetal Ther. 1987; 2:129-34.
Moscoso I et al. Transplant Proc. 2005; 37:481-2. / Motlik J et al. Therogenology. 2007; 67:105-11.
Niwa H. Development. 2007; 134:635-46. / Parr AM et al. Bone Marrow Transplant. 2007; [Epub ahead of print]
Perrier AL et al. Proc Natl Acad Sci U S A. 2004; 101:12543-8. / PrimeGen Biotech. 2006;
Raposio E et al. Br J Dermatol. 2007; 155:902-9. / Ratajczak MZ et al. Leukemia. 2007; 21:860-7.
Reubinoff BE et al. Nat Biotechnol. 2001; 19:1134-40. / Rong Rui et al. Theriogenology. 2006; 65:713-20.
Roy NS et al. Nat Med. 2006; 12:1259-68. / Ryu BY et al. Stem Cells. 2006; 24:1505-11.
Sanchez-Ramos J. Semin Reprod Med. 2006; 24:358-69. / Takahashi K et al. Cell. 2006; 126:663-76.
Tang Y et al. Cell Transplant. 2007; 16:159-69. / Tiede S et al. Eur J Cell Biol. 2007; 86:355-76.
Toma C et al. Circulation. 2002; 105:93-8. / van de Lavoir MC et al. NATURE. 2006; 441:766-9.
Verma P, and Fawcett J. Adv. Biochem. Eng. Biotechnol. 2005; 94:43-66.
Vodyanik MA et al. Blood. 2005; 105:617-626.
Vrana KE et al. Proc Natl Acad Sci U S A. 2003; 101:693. / Wakayama S et al. Stem Cells. 2007; 25:986-93.
Watanabe K et al. Nat Biotechnol. 2007; 25:681-6. / Weise A et al. Plant Biotechnol J. 2007; 5:389-401.
Wernig M et al. Nature. 2007; 448:318-24. / Yamamoto Y et al. Biol Reprod. 2007; 77:115-9.
Yang SR et al. Stem Cells. 2006; 24:292-8. / Zambidis ET et al. Blood. 2005; 106:860-70.
Zhang SC et al. Nat. Biotechnol. 2001; 19:1129-33. / Zhu J et al. Blood. 2007; 109:3706-12.

가. 대사체학(Metabolomics) 연구의 개요
(1) 정의
대사체학(metabolomics)은 특정한 생물학적 변화 과정들을 통하여 생성된 저분자 대사체의 프로파일들을 체계적이며 종합적으로 연구하는 것이다(Daviss B, “Growing pains for metabolomics,” The Scientist, 19[8]:25-28, 2005). 대사체학은 유전자 표현형과 단백질체의 분석만으로 해석할 수 없는 세포내 변화 등의 상관관계를 대사네트워크 전체를 통해 고찰하고, 얻어진 결과를 통하여 최종생성물의 변화량에 대한 원인을 해석하는 유일한 학문이다. 최근 유전학, 전사체학 및 단백질체학과 더불어 대사 프로파일링을 통하여 얻은 세포 기능에 대한 정보들을 종합하여 복잡한 생명체의 구조를 규명하려는 연구를 시도하고 있다.
(가) 대사체군(metabolome)
대사체군은 세포, 조직 또는 생체 내에 존재하는 저분자량의 전체 대사체의 집단(대사 중간체, 호르몬, 기타 신호 분자 및 이차 대사체들)으로서 대사 반응 등의 거대한 조직망을 형성한다.
(나) 대사체(metabolite)
대사체는 저분자로서 대사 과정의 중간체 또는 최종 산물이다. 일차 대사체는 직접적으로 정상적인 성장, 분화 및 번식을 포함하고, 이차 대사체는 직접적으로 위와 같은 과정을 포함하지 않지만 생태기능에 중하다. 따라서 대사체는 생체의 phenotype을 가장 잘 나타내는 저분자로서 완전한 대사체 프로파일 그 자체로서 또는 유전인자의 표현(gene expression)과 연관된 지식의 data와 조합하여 생체에서 발현되는 여러 생리학적, 병리학적 발현에 관한 정보를 제공한다.
(다) 메타보노믹스(metabonomics)
메타볼로믹스(metabolomics)와 비슷한 의미인 메타보노믹스는 환경적인 자극이나 유전적 변형에 의한 생체의 역동적인 대사반응 등을 연구하는 분야이다.
(2) 역사
1960년 후반 크로마토그래피를 이용한 분리 및 정제 기술의 발전에 의해 대사체들의 검출이 가능하게 되었다. 대사체학은 1970년 Arthur Robinson이 비타민 B6를 투여한 후, 뇨시료에서 복잡한 크로마토그래피 패턴들을 분석하고, 이러한 패턴은 뇨시료 내에 유용한 정보를 가진 수많은 화합물들을 함유하고 있다고 발표하면서 발전되었다. 1971년 PNAS에 “Quantitative Analysis of Urine Vapor and Breath by Gas-Liquid Partition Chromatography”를 발표한 이후, 생체시료내 대사체들의 정량적 패턴들을 분석함으로써 질병 진단, 질환상태 및 연령에 따른 생체변화 등에 대한 논문들이 다수 발표되었다. 이러한 생체 시료 내에서의 분석은 적은 비용으로 많은 정보를 얻을 수 있으며, 또한 생리 상태에 따른 대사물의 측정이 가능하였다. 1990년대 Oliver SG, Winson MK, Kell DB 및 Baganz F 등이 “Trends Biotechnol. 16, 373-378”에 효모의 기능을 체계적으로 분석함으로써 처음으로 대사체학이란 용어를 사용하였고, 2004년에는 “Metabolomics Society”가 결성이 되어, 대사체학의 연구에 다양한 생화학적 방법들을 적용하게 되었다. 2007년 1월 캐나다의 알버타대 Wishart D는 2500개의 대사체, 1,200개의 약물 및 3,500개의 식품 성분들을 확인한 “Human Metabolome Project”라는 최초의 인간 대사체군을 발표하였다.
최근 대사체학은 다음과 같은 다양한 연구 분야에 활용 되고 있다. 건강 및 질병진단에 있어서 생체지표 선정, 시스템 생물학, 동위원소 이성질체를 활용한 pathway discovery, 신약개발, 그리고 식물, 미생물, 영양학 및 환경 등의 다양한 분야에 그 적용 범위를 넓혀가고 있다.

출처 : http://prime.psc.riken.jp
|
그림 4-1-4-1 |
대사체학의 적용범위
나. 해외 동향
(1) 질병의 조기 진단을 위한 생체지표 도출로서의 대사체학
(가) HUSERMET project(www.husermet.org)
영국 맨체스터대, BBRC(Biotechnology and biological sciences research council), MRC(Medical research council), AstraZeneca 및 GlaxoSmithKline등의 연구팀이 모여 치매 및 난소암에 대한 코호트 연구로서 정상군에 대한 기초 대사체군(background metabolome)을 설정하고 이로부터 생체지표를 도출하였다.
(나) 뇨 중 대사 프로파일(웨인주립대, 미국)
고콜레스테롤혈증에 의한 치매의 원인을 뇨 중 대사 프로파일을 통하여 치매를 조기에 진단할 수 있는 생체지표를 도출하였다.
(다) 당알코올 대사체 분석(맨체스터대)
심장병의 생체지표로서 당알코올을 혈장 대사체 분석을 통하여 도출하였다.
(2) 시스템 생물학
시스템 생물학의 생물학적 모델 검증으로써 대사체학을 이용한 저분자들의 정확한 targeted analysis를 통한 대사체와 기타 전사체 및 단백질체에 대한 자료들을 종합 및 총체적인 연구를 통하여 특정 또는 전체 대사경로를 규명하였다.

출처 : Fourth world Corgress on Allelopathy, 2005
|
그림 4-1-4-2 |
대사체학을 이용한 종합 및 총체적인 연구
(3) 플럭소믹스(Fluxomics) 및 대사경로 발견
(가) 안정동위원소(Stable isotope)를 이용한 대사체 추적 연구
신약의 약효에 대한 작용과 독성 등에 대한 연구 등에 활용하였다(루이스빌대, 미국).

출처 : 루이스빌대, 미국
|
그림 4-1-4-3 |
대사체 추적 연구
(나) 13C-플러소믹스와 전사체학을 통한 대사 네트워크
glucose-6-phosphate dehydrogenase에 의한 당분해와 pentose-phosphate pathway와의 사이에 있어서 탄소의 분배 정도를 정량적으로 평가하고 유전자 발현을 측정함으로써 대사 네트워크의 효과를 연구하였다.

The fractional breakdown rate method. (a) Tracer is infused at a constant rate in order to measure synthesis rate and (b) dilution is measured after infusion is stopped as a measure of breakdown (●), Tracee: (◯), tracer: S, Synthesis: B, breakdown: ↑, sampling times.
출처 : Zhang et al, 1996
|
그림 4-1-4-4 |
대사 네트워크의 예
(4) 신약 개발
(가) 신약의 임상실험
대사체학의 targeted profile을 통하여 신약 투여 후의 변화되는 대사체들을 확인하고, multi- 및 univariate 방법을 이용한 통계분석을 통하여 predisposition biomarker를 선정하였다.
(나) Flux analysis와 신약의 독성연구(FDA 와 SIDMAP사)
특정 장기(신장/간)에 독성을 나타내는 약물을 확인하기 위하여 [U-13C6]-D- glucose를 투여한 후 글루코겐과 뉴클레오티드의 합성과 turnover를 정량화함으로써 생리학적인 대사 흐름과 신약에 의한 독성을 평가하는 방법을 확립하였다.
(5) 환경 대사체학 ; 위해도 평가
서세스대(영국)에서는 내분비 장애물질인 17a-ethinylestradiol(EE2)을 지속적으로 노출시킨 후 스테로이드 호르몬의 항상성을 LC-QTOF로 측정한 후, 통계분석을 통하여 EE2가 성호르몬과 글루코코티코이드를 교란 시킨다는 것을 밝혀냈다.
(6) 식품영양유전체학 및 대사체학
(가) 플라보노이드 함유 식품의 심장질환 예방과의 관계 연구(유니레버, 네델란드)
플라보노이드의 체내 대사과정과 내인성 대사 및 건강에 미치는 영향 등을 뇨, 혈장 및 대변 등의 시료에서 global 및 targeted profiling 한 후, 생체 시료내의 내인성 및 외인성 대사체들의 차이점을 supervised multivariate statistical 분석(PLS-DA, OPLS)을 통하여 bioefficacy를 평가하였다.
(나) 대사증후군 환자에서의 탄수화물 식사에 대한 효과(VTT, 핀란드)
혈장과 지방 조직의 특정 유전자 발현 과정 사이의 종속관계를 대사 프로파일을 통하여 분석하였다.
(7) 대사체학을 위한 신기술 개발
(가) 분석기기의 최적화 및 새로운 software(맨체스터대)
분석장비의 발달에 의한 분석조건의 최적화 및 그것을 수행할 수 있는 software가 발달함으로써 미량성분의 수많은 대사체들을 검출할 수 있게 되었고, 과거 미확인된 대사체들의 구조를 규명할 수 있게 되었다. 즉, 초고성능 분리 기술(ultra- performance chromatography)로부터 복잡한 생체시료내의 대사체들을 분리 및 극미량 검출을 할 수 있다. 또한 MSn 등의 분석이 가능한 질량분석기로부터 정확한 질량 측정이 가능하다. 이러한 기기의 발달은 미생물에서부터 포유동물의 대사체학 연구를 활발하게 하였다.
(8) 대사체학을 위한 생물정보학
질량분석 data의 생물학 및 생리학적 해석과 거대하고 복잡한 mass-based metabolomics datasets를 자동화로 찾을 수 있는 algorithm의 개발 또한 중요하다. 또한 preliminary mass assignment들은 생화학적으로 연관된 상호작용들을 database의 데이터에 따라 처리하는 질문들을 통해 다시 정의해야하며 dataset내에서의 대사체들을 validated하는 표준방법을 설정해야 한다. 대사체학은 분석기술의 발전과 data 분석 및 취급을 위한 computing 기술의 발전에 의존한다.

출처 : http://systbio.vtt.fi/visubiomed/
|
그림 4-1-4-5 |
대사체학을 위한 생물정보학
다양한 통계 프로그램과 clustering 기술과 기기교육 등을 고려할 때, 실험자 및 실험기기에 따른 오차, 시료 오염, 측정 오차, 기타 실험조건과 관련된 요소들이 대사체학 결과에 영향을 주므로 metabolomics data 설정은 일정한 형태로서 정의 및 표준화되어 있어야 한다.
다. 국내 현황
(1) 한국과학기술연구원 생체대사연구센터
(가) 최적의 대사체분석법 개발
고성능 질량분석법을 활용하여, 다양한 생체시료 matrix(뇨, 혈장, 세포, 모발 등)로부터 targeted/global profiling 기법을 확립하였다.
(나) 질환 고유의 진단표지대사체 도출
호르몬 의존성 질환(부인암 등) 및 피부부속기질환(탈모증 등)환자들에 대한 targeted/global profiling 및 통계분석을 통한 질환 고유의 진단표지대사체를 도출하였다.
(다) High throughput screening 기법 개발
최적의 대사체분석법 및 통계분석을 통한 clustering기술과 metabolic pattern 분석을 통해, 약물의 유효성/독성평가를 위한 총체적인 대사 network 확립 및 drug target 발굴을 위한 연구를 수행 중이다.
(2) 질병 조기 진단을 위한 생체지표 도출로서의 대사체학
(가) 인제대학교 의과대학
트립토판 대사체들에 대한 targeted profiling을 수행함으로써 트립토판 대사관련 질병에 대한 진단으로 활용한다.
(나) 인하대학교
NMR을 이용한 담관암과 담석 환자의 담즙을 분석한 후 PCA-score plot과 loading plot을 통하여 새로운 질병진단을 시도하고 있다.
(3) 약물의 효능 검증
인제대학교 의과대학에서는 고성능 질량분석법을 활용하여 특정 enzyme으로부터 생성되는 즉, membrane-bound endogenous fatty acids의 targeted profiling을 수행함으로써 non-steroidal anti-inflammatory drugs의 효능을 확인하였다.
(4) 식품공학 분야의 대사체학
(가) 서울대학교
① 대사체학을 이용한 커피 원산지 확인
커피의 향과 맛은 환경적 요소(기후, 토양)와 유전적 요소(커피콩의 종류)에 커피의 성분인 화학적 성분들이 차이가 나는 것을 근거로 GC-FID를 이용한 profiling과 PCA 분석을 통하여 커피의 원산지별 구별이 가능하였고, 커피의 quality test에 적용이 가능하도록 하였다.
② 유전자 변형 쌀과 일반 쌀에 대한 metabolite profiling 비교 연구
GC-MS, LC-MS 또는 NMR등을 이용한 targeted profiling data를 multi- variate statistical analyse를 이용하여 차이점을 validate하고 NIST와 Max Plank Institue of Molecular Plant Physiology의 database를 이용하여 선정된 대사체를 확인하였다.
③ 고추에서 capsaicinoids의 대사 프로파일링
고추의 주된 bioactive compounds를 GC-MS를 이용하여 profiling 한 후, capsaicinoids biosynthesis의 metabolic networking을 확인하기 위하여 cluster analysis와 PCA 분석을 이용하였다.
(나) 고려대학교
다양한 식중독균을 열처리대신 초임계 CO2로 처리한 후 지방산 프로파일링을 GC-MS를 이용하여 분석한 후 PCA analysis를 통하여 다양한 처리 조건에 따라서 지방산의 프로파일 및 성분들이 변화함을 보여줌으로써 초임계 CO2 처리에 따른 지방산의 독특한 지표 지문(distinct indicative fingerprint)을 제시하였다.
(다) 이화여자대학교
된장이 숙성되는 발효과정 동안의 물에 녹는 성분에 대한 대사 프로파일링을 GC-MS와 PCA 분석을 통하여 특정 대사체들을 확인하였다.
라. 발전 과제
(1) 대사체학을 이용한 생체지표 선정
(가) 질병 조기 진단을 위한 특정한 생체지표를 선정하기 위한 DB화
질환과 관련된 일정한 경향성을 찾기 위한 많은 양의 데이터 축적 및 DB화에 의한 자동 search 기능의 software를 개발하였다.
(나) 대사체 기능 이상 연구 ; MIDA 기법을 이용한 추적연구
질병 유발관련 최근의 연구는 MIDA(Mass Isotopomer Distribution Analysis)를 이용한 대사흐름 분석(metabolic flux analysis)으로써, 생물체 내 대사회로를 구성하고 있는 대사반응들에 관련된 양론적 상관관계를 나타내는 분석기법이다. 특정 대사회로 내부에 안정동위원소(stable isotope)인 13C 또는 2H 등을 탄소기질에 활용함으로써 동위원소이성질체(isotopomer)와 질량분석기(mass spectrometry)를 사용하여, 세포내 흐름 값(flux value)의 분배(distribution)도 측정하였다.
(다) 대사체학과 유전적 다양성(SNPs ; single-nucleotide polymorphism)
관계 연구
데이터 모델링을 이용한 대사체 분석을 태아 또는 영유아에 적용하여 유전적 다양성과의 직간접 관계 규명을 연구하였다.
(2) 환경 대사체학(Environmental metabolomics)
(가) 생활환경에 따른 특정지역의 코호트 조사를 통한 환경 위해도 평가
외부 환경의 오염물들의 자극에 의한 대사체들의 변화를, 오염원 발생 지역과 비오염원 발생 지역의 주민들을 대상으로 오랜 시간 추적 조사함으로써 오염 발생으로 인한 예측 및 정책 결정에 활용하였다.
(나) 특정 오염물질의 독성 영향 평가
(3) 식품(영양)유전학 및 대사체학
대사체학을 통한 metabolic fingerprinting 또는 biological endproduct를 결정짓는 수단으로 활용하였다.
(가) 식품 품질 관리
식품(커피, 와인 등)의 생산지 또는 생산연도별로 품질을 관리하였다.
(나) 유전자 변형 식품의 위해성 평가
유전자 변형 식품으로 인한 심각한 생태계 교란의 심각성이 부각되면서 유전자 변형 식품에 대한 비유전자 식품의 피해 또는 구별 등에 활용하였다.
(4) 맞춤형 의학의 실현
(가) 제약산업의 선도물질 선별 과정에의 적용
약물발견의 초기단계로부터 임상시험까지의 모든 과정 중 선도물질이 선별되기 전에 안전성 데이터를 얻는 데 활용하였다.
(나) 독성 또는 효능에 대한 생리학적 반응 평가
대사 프로파일링은 개인별로 차별화된 약물의 독성 영향으로부터 발생하는 생리학적 변화(간 또는 신장)들을 발견하는 데 활용된다. 따라서 임상 시험에 앞서 신약의 독성을 예측할 수 있다면, 독성 실험에 쓰이는 비용을 절감할 수 있다.

가. 시스템생물학의 개요
시스템생물학(systems biology)은 기존 생물학의 환원주의적인 접근 방식의 한계를 극복하고 생물학적 체제들을 총괄적이고, 체계적으로 이해하는 것을 목적으로 하는 생물학의 새로운 분야이다. 이러한 목적을 달성하기 위한 시스템생물학의 접근 방식은 시스템 내의 모든 구성 인자에 관해 기술하고 그 인자들 간의 정보의 흐름을 살펴본 다음, 실험과 모델링의 유기적인 통합을 통하여 인자들이 서로 관계하는 생체 네트워크들의 구조와 동적 변화 양상을 밝혀 궁극적으로는 생물학적 체제에서 발현되는 창발성에 대한 이해를 추구하는 것이다.
일반적으로 시스템생물학에서 던지는 질문들은 다음과 같다. (1) 생체 네트워크의 기본적인 구조와 특성들은 무엇인가? (2) 생체 시스템은 다양한 환경 안에서 시간에 따라 어떻게 동작하는가? (3) 생체 시스템은 어떻게 안정성(stability)과 견고성(robustness)을 유지하는가? (4) 어떻게 하면 생체 시스템을 우리가 원하는 바람직한 특성을 갖도록 변형하거나 구현할 수 있는가?
비록 시스템생물학이란 개념은 이미 오래 전부터 존재해왔지만 시스템의 구성 인자에 관한 정보 획득 과정의 어려움 때문에 시스템생물학을 본격적으로 추구하게 된 것은 21세기에 들어와서이다. DNA 이중나선의 발견 이후 급속히 발달한 분자생물학적 지식을 기반으로 여러 유전체의 서열이 속속 완성되고 있는 현재에는 ‘omics’로 표현되는 여러 측면에서 대량의 독립적 데이터들을 대량-발굴(high-throughput, HT)하고 있어서, 그 축적된 데이터가 생물학의 시스템적인 접근을 가능케 한 것이다.
이미 시스템생물학이 상대적으로 단순한 시스템인 미생물을 대상으로 구성 요소의 동정 단계를 넘어서 새로운 유전자 회로의 설계와 변경과 같은 합성 생물학(synthetic biology)에 이르는 성과를 거두었다면, 최근 들어 포유류를 대상으로 한 시스템생물학도 비록 그 생명현상의 복잡성 때문에 발전이 늦긴 하지만 보다 효과적인 치료제 개발의 가능성을 염두에 두고 본격적으로 연구들이 속속 진행되고 있다.
나. 해외 동향
[표 4-1-5-1]에서는 해외의 대표적인 시스템생물학 프로그램들을 소개하고 있다. 기타 프로젝트로는 미연방 에너지부가 주관하는 “Microbial Cell Project”가 있으며 일본에서는 게이오대학에서 “E-Cell Project”를 추진하고 있는데 E. coli 세포 내에서 일어나는 모든 생명현상을 전산모델화시키는 작업을 추진하고 있다. 유럽의 경우 “European Systems Biology Consortium”(ESBIGH)을 구성하여 특화된 소규모 과제들을 중심으로 연구가 진행 중인데 독일에서는 간세포 모델시스템 연구가 진행되어 왔고, 영국의 맨체스터대에서는 신호전달기작 등을 대상으로 수학적 모델을 개발하고 있으며, 캠브리지대에서는 세균주화성(bacterial chemotaxis)의 생화학 회로의 시뮬레이션을 해오고 있다. 프랑스에서는 “In silico Cell Simulation Initiative(SiliCell)을 중심으로 신호전달 모델을 개발하고 있다. 아시아-태평양 지역의 시스템생물학 연구자들을 중심으로 공동연구와 정보 공유를 위해 eIMBL-SB (electronic International Molecular Biology Network-Systems Biology)가 2005년에 설립되었고 현재 9개국이 참여하고 있다.
시스템생물학 국제 심포지움(International Conference on Systems Biology, ICSB)이 일본 동경에서 2000년에 시작되어 미국 파사데나(2001), 스웨덴 스톡홀롬(2002), 미국 세인트루이스(2003), 독일 하이델베르그(2004), 미국 보스턴(2005), 일본 요코하마(2006)에서 개최되었다. ICSB는 시스템생물학 분야의 유일한 범세계적 모임으로 그 모임에서 발표되는 논문의 수와 연구내용이 시스템생물학의 당해 연도 세계적 추이로 간주될 수 있어 이곳에 간단히 소개하고자 한다. 2006년 10월에 개최된 요코하마 모임에는 세계 31개국에서 454편의 논문이 발표되었고, [표 4-1-5-2]에 나타난 바와 같이 일본(26.4%)과 미국(22.7%)이 1, 2위를 차지했고 그 뒤를 독일(9.5%), 한국(8.6%), 영국(5.7%), 타이완(4.0%) 그리고 스웨덴(2.4%)이 뒤따르고 있다.
한 가지 특기할 만한 것은 2005년 미국 보스턴 모임에서 5편의 논문을 발표하여 이스라엘과 같이 국가 순위 6위를 차지하였던 한국이, 2006년 모임에서는 논문 39편을 발표하여 국가 순위 4위로 수직 상승한 것은 한국의 시스템생물학의 미래가 매우 밝다는 것을 보여주는 것이다.
|
표 4-1-5-1 |
시스템 생물학 연구의 해외 동향 예
|
관련기관(국가 또는 URL) |
내 용 |
|
Institute for Systems Biology (미국http://www.systemsbiology.org) |
다수의 생물학자, 공학자, 전산학자, 물리학자들이 유전체-단백질체학을 바탕으로 시스템생물학의 선도적 연구를 수행. 성게의 발생 등에 대한 유전자 네트워크를 규명 |
|
Systems Biology Institute (일본 http://www.sbi.jp) |
SBML과 호환되는 Pathway 시각화 표준을 제시하고 EGFR 및 Toll-like 수용체 신호전달계의 지도 작성 |
|
Computational and Systems Biology Initiative at MIT (미국 http://csbi.mit.edu) |
NIH-Center of Excellence program으로 생물학, 공학, 전산학을 연결시켜 복잡한 생명현상을 시스템적으로 분석하며, 현재 줄기 세포 및 암 연구에 중점을 둠 |
|
Department of Systems Biology at Harvard Medical School (미국 http://sysbio.med.harvard.edu) |
세계 최초의 본격적인 시스템생물학과를 표방하고 있으며 M. Kirschner를 중심으로 15명의 faculty를 보유하고 있음 |
|
Receptor Tyrosine Kinase Consortium (일본http://receptorkinase.gsc.riken.jp) |
RIKEN Genomics Sciences Center를 중심으로 인간 및 생쥐의 유전체 정보와 기타 포유동물의 Receptor Tyrosine Kinase 신호 전달 경로의 시스템생물학 연구에 집중 |
|
Yeast Systems Biology Network (http://www.ysbn.org) |
Yeast 신호전달시스템 연구를 위해 생물학자, 수학자, 전산학자들이 모여 모델 시스템과 실험 기법을 공유하고 정량적인 데이터를 얻어 수학적 모델을 만들기 위한 협력체 |
|
Alliance for Cellular Signaling (http://www.signaling-gateway.org) |
A. Gilman의 주도로 산․학․연들이 참여하는 세포 내 신호전달에 대한 선도 사업으로 다양한 실험기법의 개발과 각 단백질에 대한 정보를 종합한 연구 자원 DB를 운영 |
|
SBML (http://www.sbml.org) |
네트워크 모델들을 서술하는 커뮤니티 표준 마크업 언어를 개발하며 일본 JST와 영국 BBSRC에 의해 지원됨. 현재 SBML2가 나와 있으며 다수의 모델링 프로그램에서 지원됨 |
|
The Center for Cardiovascular Bioinformatics and Modeling (http://www.ccbm.jhu.edu/index.php) |
R. L. Winslow 및 9명의 faculty로 구성되고 생물학 데이터를 모델링하는 방법을 개발하고, 개발된 방법을 이용한 심혈관계 생명현상 이해 및 질병 치료를 목표로 함 |
|
HepatoSys (http://www.systembiologie.de/en/) |
독일 정부가 지원하는 간세포의 기능과 간세포 재생을 정량적으로 이해하는 것에 초점을 맞춘 대규모 네트워크 시스템생물학 프로젝트 |
|
BioSim (http://biosim.fysik.dtu.dk) |
European Commission에 의해 설립된 Network of Excellence 프로그램. 산 · 학 · 연이 참여하여 복잡계 이론 등의 전문지식을 이용하여 효율적인 신약개발 개발에 집중 |
출처 : 2005 생명공학백서 내용 수정·보완
|
표 4-1-5-2 |
2006년 ICSB 국가별 논문 발표 수(교신저자 기준)
|
순위 |
국 가 |
논문발표건수 |
비율 (%) |
|
1 |
Japan |
120 |
26.4 |
|
2 |
United States |
103 |
22.7 |
|
3 |
Germany |
43 |
9.5 |
|
4 |
South Korea |
39 |
8.6 |
|
5 |
United Kingdom |
26 |
5.7 |
|
6 |
Taiwan |
18 |
4.0 |
|
7 |
Sweden |
11 |
2.4 |
|
8 |
Denmark |
10 |
2.2 |
|
9 |
France |
9 |
2.0 |
|
10 |
Russia |
8 |
1.8 |
|
11 |
Italy |
7 |
1.5 |
|
India |
7 |
1.5 |
|
|
Spain |
7 |
1.5 |
|
|
14 |
China |
5 |
1.1 |
|
Norway |
5 |
1.1 |
|
|
16 |
Netherlands |
4 |
0.9 |
|
Israel |
4 |
0.9 |
|
|
Turkey |
4 |
0.9 |
|
|
Romania |
4 |
0.9 |
|
|
Brazil |
4 |
0.9 |
|
|
21 |
South Africa |
3 |
0.7 |
|
22 |
Singapore |
2 |
0.4 |
|
Canada |
2 |
0.4 |
|
|
Ireland |
2 |
0.4 |
|
|
Austria |
2 |
0.4 |
|
|
26 |
Finland |
1 |
0.2 |
|
Iran |
1 |
0.2 |
|
|
Oman |
1 |
0.2 |
|
|
Thailand |
1 |
0.2 |
|
|
Egypt |
1 |
0.2 |
|
|
합 계 |
454 |
100.0 |
|
출처 : 2005 생명공학백서 내용 수정·보완
[표 4-1-5-3]은 시스템생물학의 분야별 ICSB 논문발표 수를 나타내고 있는데 기초생물학 분야(Systems biology of basic biological systems)에서는 전체 논문의 33.7%를, 의학 분야(Systems biology for medicine)에서는 17.5%를 점유하였다. 방법론 개척 분야(Fronts in systems biology)에서 47.6%를 점유하여 방법론 개발이 향후 시스템생물학 발전에 큰 기여를 할 것으로 사료된다. 세부 분야별로는 신호전달(Signal transduction), 네트워크생물학(Network biology), 계산방법의 개발(Novel computational environment)에 많은 논문이 발표되었다.
|
표 4-1-5-3 |
2006년 ICSB 분야별 논문 수
|
분 야 |
논문발표건수 |
비율 (%) |
|
|
1. Systems Biology of Basic Biological Systems |
|||
|
1-a |
Cyclic and Dynamic Behaviors |
35 |
7.7 |
|
1-b |
Yeast Systems Biology |
18 |
4.0 |
|
1-c |
Metabolomics and Bioprocess |
24 |
5.3 |
|
1-d |
Developmental Systems Biology |
24 |
5.3 |
|
1-e |
Systems Neurobiology |
11 |
2.4 |
|
1-f |
Signal Transduction |
41 |
9.0 |
|
|
소 계 |
153 |
33.7 |
|
2. Systems Biology for Medcine |
|||
|
2-a |
Systems Biology for Drug Discovery |
12 |
2.6 |
|
2-b |
Cardiovascular Systems Biology |
25 |
5.5 |
|
2-c |
Systems Immunology |
15 |
3.3 |
|
2-d |
Systems Biology of Diabetes |
12 |
2.6 |
|
2-e |
Cancer Systems Biology |
16 |
3.5 |
|
|
소 계 |
386 |
84.9 |
|
3. Fronts in Systems Biology |
|||
|
3-a |
Network Biology |
54 |
11.9 |
|
3-b |
Complex Systems Biology |
36 |
7.9 |
|
3-c |
Control and Systems Theory |
28 |
6.2 |
|
3-d |
Synthetic Biology |
14 |
3.1 |
|
3-e |
Novel Computational Environment |
84 |
18.5 |
|
|
소 계 |
988 |
217.4 |
|
Others |
5 |
1.1 |
|
|
합 계 |
454 |
100 |
|
출처 : 2005 생명공학백서 내용 수정·보완
다. 국내 현황
2002년도에 시스템생물학 연구회 구성으로 그룹화, 상호연계연구, 연구 대상 생체시스템의 체계적인 선정 등이 이루어지기 시작했으며, 2003년 4월에 서울대 문화관에서 국내에서는 처음으로 시스템생물학 국제학술대회(Seoul Symposium on Systems Biology 2003)가 개최되었다. 과학기술부는 시스템생물학을 국책연구사업과제로 설정하여 2003년 6월부터는 “시스템생물학사업단”이 출범하여 11개 세부과제를 중심으로 시스템생물학연구가 시작되었다. 2005년부터는 2단계 사업으로 진핵세포를 대상으로 “칼슘대사 시스템생물학연구(KOSBI)”와 원핵세포를 대상으로한 “대사회로분석 및 가상세포시스템연구”가 선정되어 현재 연구가 진행 중이다. 이들 연구 과제를 통해 신규 인자의 체계적 발굴, 구성인자들 간의 상호작용계측, 네트워크 규명, 수학적 모델링, 미생물 대사회로의 정성적, 정량적 분석, 시스템재설계 기술 및 가상세포 시스템 개발 등이 이루어져, 해당 분야의 국제적 경쟁력이 획기적으로 향상되고 있다.
라. 발전 과제
시스템생물학과 관련된 국제 SCI 논문발표 수를 관찰하면, 과거 2년 동안에 발표된 논문 수(1082편)가 현재까지 발간된 전체 논문 수(1630편)의 66.4%를 차지하고 있어, post-genome 시대의 핵심적 분야로 부각되고 있다. 또한 시스템생물학 연구를 통한 효과적 질병 원인 규명과 타깃 발굴은 신약개발의 새로운 패러다임으로써 기대되는 바가 크다. [표 4-1-5-4]에서는 현재 국제적인 시스템생물학관련 기업에서 추구하는 주요 연구 현황을 보여 주고 있다.
|
표 4-1-5-4 |
신약 관련 기업의 시스템 생물학연구 현황
|
연구센터 |
주 소 |
연 구 내 용 |
|
AstraZeneca |
www.astrazeneca.com |
MIT와 암 및 염증 질환에 대한 컴퓨터 모델 공동 연구 |
|
Beyond Genomics |
www.beyondgenomics.com |
유전자, 단백질, 대사물질 및 임상 정보 통합기술 개발. GlaxoSmithKlein과 협력 |
|
Bioseek |
www.bioseekinc.com |
시스템 생물학 기법을 이용 인간의 주요 세포 질환 모델들을 연구 |
|
Cellnomica |
www.cellnomica.com |
In silico 암 연구 |
|
Cellzome |
www.cellzome.com |
신약 표적의 발굴, 검증 및 신약개발 위한 기능적 단백질체 기술 개발 |
|
CombinatoRx |
www.combinatorx.com |
약물의 조합을 통한 시너지 약효의 크리닝 |
|
CytoPathFinder |
www.cytopathfinder.com |
세포기반 스크리닝을 위한 transfection microarray 개발 |
|
Eli Lilly Center for Systems Biology |
www.lilly.com |
회사의 신약개발 노력을 지원하기 위한 단백질 및 유전체 기술의 통합에 주력 |
|
Entelos |
www.entelos.com |
PhysioLab 기술을 이용한 질병의 컴퓨터 모델 개발. Pfizer와 협력 관계 |
|
Ingenuity |
www.ingenuity.com |
시스템 생물학 통합 소프트웨어 및 지식 DB 개발 |
|
Roche |
www.roche.com |
스위스 SystemX 프로젝트 펀딩에 참여 |
출처 : 자체 자료

가. 구조생물학의 개요
인간의 역사 이래로 질병은 인간과 함께 해 오고 있다. 이것은 인간의 생명을 위협하거나 육체에 고통을 주었다. 질병의 원인은 여러 가지 외부적 환경요인과 내부적 요인이 있다. 외부적으로는 외형적인 육체 손상을 들 수 있고 내부적으로는 우리 몸속의 여러 단백질 효소들이 원래의 기능을 하지 못하는 데 있다. 인간은 질병을 극복하기 위하여 식물이나 동물로부터 질병에 효용이 되는 유기물을 섭취하여 왔다.
20세기 말에 시작한 국제적인 인간 유전체 프로젝트를 통하여 2001년 2월에 인간의 설계도라 할 수 있는 염기서열이 밝혀졌다. 이 염기서열 속에 있는 유전체들이 바로 단백질들을 만든다. 단백질이 생명체 내에서 화학반응을 일으키고, 세포와 세포사이의 신호를 전달하기도 하고, 세포를 성장시키거나 분열시키고, 유전체의 활동을 조절하고, 구조적이고 기계적인 지지, 근육의 수축이나 세포의 이동 및 신경신호를 발생시키고 전달을 하는 등 모든 생명체에서 생명을 유지하는 실질적인 대행자인 것이다. 만약에 우리가 이런 단백질이 수행하는 기능과 작용하는 것을 시간과 공간적으로 알게 된다면 모든 생명현상의 이해와 조절도 가능할 것이다. 그래서 단백질의 3차원 구조로부터 이들의 기능에 대한 정보를 얻는 것이 필요한데 바로 이 학문적 영역이 구조생물학이다.
단백질의 구조를 연구하는 방법은 엑스선, 자기공명, 중성자, 전자빔 등이 있는데 그 중 엑스선 회절결정학 방법이 주를 이루고 있다. 엑스선 회절결정학 방법으로 단백질 구조를 연구하기 위해서는 우선 단백질을 최소 수십 마이크론 이상 크기 결정으로 키워야 한다. 결정으로 키우기 쉬운 단백질은 대부분 구조가 풀렸고, 아직 결정으로 키우기 어려운 막단백질과 결정으로 성장되더라도 크기가 아주 작은 단백질은 아직 구조가 풀리지 않고 있다. 이런 작은 결정이나 결정 성장이 어려운 단백질 구조를 풀기 위하여 세계 각국에서는 새로운 방사광 가속기건설과 더불어 마이크로 빔의 크기를 갖는 빔라인을 건설하고 있다. 또한 단백질의 결정으로 성장시키지 않고 단백질분자 수준에서 바로 구조를 알 수 있는 4세대 방사광 가속기의 건설을 진행하고 있다. 현재 단백질 구조연구를 위해 세계적으로 가속기를 중심으로 진행되고 있는 일과 국내에서 진행되고 있는 상황을 중심으로 소개하고자 한다.
나. 해외 동향
(1) 연구 활동
단백질 구조를 연구하는 전 세계의 과학자들이 2000년에는 2,983개, 2006년에는 무려 7,282개의 단백질 구조를 해석하여 세계 단백질구조 데이터 은행에 등록하였다. 7년 사이에 2.5배로 증가한 것이며, 2000년부터 2007년 7월 3일까지 총 38,622개의 단백질 구조가 밝혀져 이 은행에 등록되었다. 이중 약 71% 정도는 미국에서 등록하였고, 14% 정도는 일본, 나머지 15% 정도는 유럽에서 등록하였다. 특히 일본에서 등록한 단백질 구조의 숫자를 살펴보면, 2000년에는 전체에서 불과 0.3% 정도를 차지하였지만 2007년 7월 현재에는 28%에 해당하는 데이터를 등록하였다. 이것은 2006년까지 일본에서 진행하였던 PROTEIN3000이라는 국가적인 대형 프로젝트에 기인한 것이다.

출처 : www.wwpdb.org/stats.html(2007년 7월 3일)
|
그림 4-1-6-1 |
데이터 은행에 등록된 단백질 결정의 수
(2) 연구시설
세계적으로 단백질의 구조를 연구하기 위한 거대 시설은 크게 3종류로 나눌 수 있다. 첫째는 자기공명장치(NMR)들을 수 십 대 모아 놓은 자기공명장치 파크가 있다. 자기공명장치를 이용하는 방법은 용액상태 단백질 분자의 구조를 연구할 수 있는 장점이 있다. 그렇지만 단백질 분자의 크기가 큰 경우에는 사용할 수 없고 구조를 푸는 데 시간이 오래 걸리는 단점이 있다. 둘째는 중성자 발생장치가 있다. 중성자빔을 사용하는 경우는 단백질을 밀리미터 정도 크기의 결정으로 키워야 구조를 풀 수 있다. 셋째는 강한 엑스선을 발생시키는 방사광 가속기이다. 엑스선을 사용하는 경우 엑스선의 밝기에 따라서 단백질 결정이 크기가 수십 마이크론에서 수 마이크론의 크기만 되어도 단백질구조를 풀 수 있다. 또한 방사광을 이용한 구조 연구는 지금 전 세계적으로 대세를 이루고 있으며 70%이상의 구조가 방사광 가속기 빔라인을 이용한 실험에서 구조가 풀리고 있다.
엑스선을 이용한 구조연구를 위해 새로이 건설하거나 연구되고 있는 주요 시험 시설 등에 대하여 살펴보면 크게 3 분야로 나눌 수 있다. 첫째로 새로운 가속기의 건설을 들 수 있다. 이 가속기는 기존의 3세대 가속기보다 전자빔의 크기를 줄여 시료에서 엑스선의 밝기는 더 밝고, 크기는 작은 엑스선을 방사하는데 이 엑스선은 시료의 위치에서 마이크론으로 줄일 수 있어서 마이크론 크기 결정의 단백질 구조연구가 가능하도록 한다. 최근에 유럽에서 건설된 이와 같은 가속기는 스위스에 있는 2.4 GeV에너지의 SLS, 영국의 3GeV의 DIAMOND, 스페인의 3GeV의 ALBA, 독일의 2.5GeV ANKA 그리고 프랑스 2.75GeV의 SOLEIL 등이 있다. 그리고 호주의 3GeV의 AS, 중국의 3.5GeV의 SSRF 등이 있다. 이들은 3세대 가속기보다 성능이 향상된 3.5세대 정도의 가속기로 현재 운영 중이거나 건설 중에 있다. 이런 가속기와 더불어 2세대, 3세대의 크고 작은 가속기가 세계에 약 69개 정도 존재하고 있다(http://www.lightsources.org/cms/). 아울러 현재 새로운 가속기 건설 계획 등을 고려하면 70개를 훨씬 상회할 것이다.
둘째로 자동화설비이다. 이 실험 장치는 크게 두 부분으로 나눌 수 있는데, 한 부분은 사람의 손이 많이 필요한 단백질을 결정으로 키우는 과정을 자동화하여 이 시스템이 단백질 결정화조건을 검색하고 이 조건에 따라 결정으로 성장하였는지 등을 검사하는 것이다. 세계의 여러 회사와 연구소에서 이런 장비를 제작판매하거나 연구개발을 진행하고 있다.
다른 하나는 빔라인을 자동화하여 로봇이 단백질 결정을 자동적으로 올리고 내리고, 이외의 자동화 장치와 프로그램이 단백질 결정의 회절 이미지를 자동으로 측정하도록 하는 것이다. 현재 대부분의 새로이 건설되는 곳에서는 단백질 결정학 빔라인을 자동화하고 있다.
셋째로 4세대 가속기 건설이다. 이 가속기는 단백질을 결정화하지 않고 분자 수준에서 단백질 구조를 볼 수 있는 새로운 가속기이다. 이미 선진국에서 수년전부터 4세대 가속기를 건설하기 시작하였고 현재 자외선 영역의 빛을 내는 4세대 가속기의 운영을 시작한 곳도 있다. 세계 13곳의 연구소나 대학교에서 총 22개의 자유전자레이저(FEL) 장치가 운영 중에 있고 14개의 장치는 개발 중에 있다. 이외에 5곳에서는 건설을 계획하고 있다(http://sbfel3.ucsb.edu/www/vl_fel.html). 특히 미국과 독일은 분자 수준에서 단백질 구조를 연구할 수 있는 엑스선자유전자레이저(X-FEL)의 건설을 진행하고 있다.
다. 국내 현황
(1) 이용자 분포
국내의 이용자들은 기관별로 크게 4부류로 나누어 볼 수 있다. 크게는 대학으로 가장 많은 이용자수를 가지고 있고 그 다음으로는 연구기관과 산업체를 들 수 있다. 이 외에 외국에서 오는 경우이다.
연도별 포항방사광가속기에서 단백질 결정학 빔라인을 사용한 인원에 대한 기관별 분포도를 [그림 4-1-6-2]에 나타내었다. 2005년과 2006년에 급격하게 빔라인 사용인원이 증가한 것을 볼 수 있는데, 이것은 바로 2005년과 2006년 각각 위글러 삽입장치 빔라인과 일반 휨자석 빔라인의 완성에 의한 것이다. 이용자 증가의 대부분은 대학에서 이루어졌고 연구소의 경우는 약간의 증가를 보였으나 산업체의 경우 약간의 감소를 보이고 있다. 왜냐하면 산업체의 경우에는 자체의 빔타임을 확보하고 있기 때문이다.

출처 : 2001년부터 2006년까지의 방사광가속기 공동이용연구사업 결과보고서 참고
|
그림 4-1-6-2 |
기관별 전 단백질 결정학 빔라인을 사용한 이용자 수
(2) 연구 활동
2001년부터 방사광 이용자수가 매년 꾸준히 증가해 왔다. 이런 이용자수의 증가는 빔라인 수가 늘어나 기존의 이용자들이 실험할 수 있는 기회가 더 많아졌고 또한 새로운 이용자 그룹 수가 늘어났기 때문이다.
이 결과 [그림 4-1-6-3]에 표시된 것과 같이 2005년을 기점으로 방사광을 사용해서 실험하는 과제 수가 급격히 늘어나기 시작했다. 2006년에는 총 126과제가 수행된 것을 볼 수 있다. 이 중에서 50% 정도가 성공적인 실험이라 가정하면 2006년에는 약 60개 정도의 단백질의 구조가 풀렸다고 볼 수 있는데, 이 숫자는 전 세계에서 풀리는 단백질 구조 중 0.8% 정도에 해당하는 것으로 미국과 일본에 비하면 아주 미약한 편이다.
그렇지만 이 결과 중에는 세계 최고의 저널인 Nature, Science, Cell에 결과가 실린 것도 있다. 이것은 국내의 연구 성과가 질적으로 상당한 경쟁력을 가지고 있음을 말해 주고 있다.

출처 : 2001년부터 2006년까지의 방사광가속기 공동이용연구사업 결과보고서 참고
|
그림 4-1-6-3 |
연도별 단백질 결정학 빔라인 수행 과제 수
(3) 국내 연구시설
국내의 주요 연구 시설은 방사광가속기와 자기공명 파크이다. 엑스선을 이용하는 방사광가속기에는 2개의 휨자석 빔라인과 1개의 삽입장치 빔라인이 있다. 2005년부터 삽입장치 빔라인을 가동함으로써 빔의 세기가 강해져 이용자가 외국 가속기로 실험하러 갈 필요가 없어졌다. 특히 이 세 빔라인의 가동으로 인하여 각 이용자그룹의 실험실에 설치되어 있는 엑스선 발생장치의 사용 빈도는 점점 더 줄어가고 있다. 충북 오창과학산업단지 내의 자기공명장치 파크에는 세계에 10여 대 밖에 없는 900MHz 자기공명장치가 있어 2006년부터 제약업체, 대학, 연구기관 등에서 신약 물질 분석 개발에 활용하기 시작하였다. 이들 빔라인과 자기공명장치는 상호 보완적이지만 국내에서 단백질 구조연구 분야의 대부분 이용자들은 주로 엑스선을 이용하고 있다.
이 외에도 단백질 구조를 연구하는 실험실들에서는 단백질 결정을 키우고 검사하는 것을 자동으로 할 수 있는 시스템을 도입하여 사용하고 있거나 개발을 진행하고 있다. 방사광 가속기는 단백질 결정을 자동으로 올렸다 내리고, 데이터를 측정할 수 있는 빔라인 자동화 시스템을 개발하여 현재 시운전 중에 있다[그림 4-1-6-4]. 이 시스템이 정상적으로 활용되면 이용자들이 실험하는 데 드는 노력과 시간을 최소화할 수 있고 또한 양질의 데이터를 얻을 수 있을 것이다.

출처 : 자체 자료
|
그림 4-1-6-4 |
자동화 로봇
라. 발전 과제
2007년 한국에서는 미국과의 FTA 협약 등으로 인하여 국내의 제약회사들이 세계의 대형 제약업체가 개발한 약을 변형․복제․제조하여 판매하기가 점점 어려워지고 있다. 다시 말하면 자신의 신약이 없으면 약을 만들어 팔기가 어렵다는 것이다.
지금까지 대부분 국내 제약회사들은 단백질구조를 기반으로 하는 신약 개발에 관심이나 투자를 거의 하지 않은 상태이다. 그러나 LG생명과학과 중소 벤처회사인 크리스탈지노믹스(주)는 질환 단백질의 3차원 구조를 기반으로 하는 신약개발 연구를 위하여 이미 4~5년 전부터 방사광 가속기의 빔라인을 지속적으로 사용하고 있다.
선진국에서는 단백질의 3차 구조를 통한 신약개발 분야에 집중 투자를 하고 있으며, 특히 새로운 방사광 가속기의 경우 단백질의 3차원 구조를 연구할 수 있는 빔라인 건설을 최우선적으로 추진하고 있다.
국내에는 방사광 가속기와 자기공명장치 등의 기반시설이 잘 갖추어져 있고 국내 여러 대학과 연구소를 중심으로 우수한 인력이 분포하고 있다. 미래의 부와 국민의 건강 증진을 위하여 정부와 제약회사가 연합하여 기존에 잘 갖추어진 인프라와 연구 인력을 종합적으로 활용할 수 있는 단백질 3차 구조를 기반으로 하는 신약개발 대형 연구프로젝트를 빨리 추진하는 것이 바람직할 것이다.

가. 뇌과학의 개요
“나는 누구인가?”, “인간은 무엇인가?”, “생명이란?”
이러한 종교적․철학적 명제를 이해하기 위한 끊임없는 노력은 과학과 문명발전의 원천이라고 해도 과언이 아니다. 이러한 질문과 해답을 생명현상에서 찾으면서 과학적인 방법으로 접근하는 다양한 연구들이 이루어지고 있으며 놀라운 속도로 발전하고 있다.
뇌과학은 생명공학(BT)의 한 분야로써 나노공학(NT) 및 정보기술(IT)과 함께 21세기를 이끌 핵심기반 분야이며 미래지향적인 성장동력 기술이다. 뇌과학은 뇌의 신경생물학적 구조와 기능의 분자세포생물학적 이해를 바탕으로 인지, 사고, 언어 및 행동 등의 고등신경 정신활동에 대한 포괄적인 이해를 통해 궁극적으로 인간의 정체성과 본질을 밝혀내고자 하는 연구 분야이다.
뇌과학은 수학․물리학․화학․생물학 등 기초과학 분야는 물론, 의학․공학․인지과학 등을 복합적으로 적용해 뇌의 신비를 밝히고, 이를 통해 인간이 갖는 물리적․정신적 기능성의 전반을 심층적으로 탐구하는 한편 넓게는 뇌 정보처리 메커니즘의 이해를 바탕으로 모방과 응용을 통해 인간의 두뇌와 유사한 지능형 기계를 개발하는 것까지도 포함하고 있다.
최근 뇌연구 핵심 분야는 크게 뇌기능과 뇌 발달에 관한 분자세포수준의 기초연구와 이를 바탕으로 알츠하이머병, 파킨슨병, 헌팅턴병, 간질 등 뇌질환의 병인규명으로 나눌 수 있다.
또한 최근 급격히 발달한 생물정보학, 유전체학, 단백질체학 등을 뇌연구에 접목하여 신경유전체학, 신경단백질체학 등으로 발전하고 있으며 새로운 뇌질환모델개발, siRNA기법, microarray기법, 뇌영상이미지기법 등의 다양한 뇌연구 기술을 개발하는 것이다.
나. 해외 동향
세계 각국은 21세기 마지막 프론티어로써 평가되고 있는 뇌과학 분야를 새로운 시장을 창출할 수 있는 원천요소기술의 보고로 인식하고 이 분야에 대한 국가적 관심과 지원을 아끼지 않고 있다.
(1) 각국의 뇌연구 동향
정부주도하에 추진되는 것을 그 특징으로 하고 있는 뇌연구에 대한 세계 각국의 주요 추진현황을 보면 다음과 같다[표 4-1-7-1].
|
표 4-1-7-1 |
각국의 뇌연구 동향
|
국 가 |
주 요 기 관 |
특 징 |
비 고 |
|
|
미 국 |
- 국립보건원(NIH) - 국립과학재단(NSF) |
- 새로운 뇌연구 기법 개발, 대형 콘소시움을 통하여 기능적 신경연접과 시냅스의 변화 등의 DB구축 등 대형 사업을 추진 - 신경세포에서 개체에 이르는 시스템연구, 분자이미징기술, 뇌-기계접속기술(Brain- Machine Interface, BMI)을 개발 |
․‘Decade of the Brain’ 선언 (1990년) ․세계적으로 뇌연구의 주도권 보유 |
|
|
일 본 |
- 뇌연구종합연구소 (BSI, 이화학연구소 내) |
-「뇌과학프로젝트(1997~2016)」를 통한 집중적 뇌연구 추진 - “뇌의 이해(뇌기능 및 구조에 대한 기초적 이해)”, “뇌의 보호(뇌질환 치료 및 예방)”, “뇌의 창조(뇌 모방 정보처리시스템)”, 뇌의 양육(건강한 뇌발달)의 4 분야에 대하여 전략적으로 집중 지원 |
․‘뇌의 세기’라고 명명(1993년) |
|
|
유럽 연합 (EU) |
영국 |
- MRC1) - Welcome Trust |
- 새로운 genetic risk factor, 새로운 진단기술 개발, 백신, drug, 치료기술 개발 등을 목표 |
․국가단위를 초월하여 유럽 연합(EU)에서도 범유럽 연구개발 사업을 추진 |
|
프랑스 |
- 프랑스 뇌척수연구소 (Institute for Cerebral and Medullary Disorders) |
- 뇌연구와 치료가 동시에 가능한 국제적 뇌과학연구소를 설립 - 정신질환 환자들에게 새롭게 개발된 혁신적 치료방법을 적용 |
||
|
독일 |
- 막스플랑크연구협회 (MPI) |
- 신경정신의학 분야의 기초과학연구와 임상간의 상호보완적 연구 장려 - 정신과 병원을 부속기관으로 운영 |
||
|
중 국 |
- 상하이에 뇌과학 연구소 (1999년 설립) |
- 뇌과학의 거의 모든 분야 연구 |
․2010년까지 현재 15개의 연구실을 30여 개로 확대 추진 |
|
출처 : 1) 국제 뇌연구 개발과 산업화 관련 해외 기술 및 시장동향 조사, 뇌기능활용및뇌질환치료기술개발연구사업단, 2004. 5
2) 한국뇌연구원 설립·운영에 관한 기획연구, 뇌기능활용및뇌질환치료기술개발연구사업단, 2007. 11
과학기술 및 의료기술의 발달은 인류의 수명을 연장시켜 전 세계적으로 선․후진국 가릴 것 없이 고령화 사회로 가고 있으며, 산업사회화의 급속한 진전으로 2010년 뇌․신경 질환관련 의약품의 세계시장규모는 1,000억 달러를 넘어설 것으로 전망되고 있다[표 4-1-7-2].
|
표 4-1-7-2 |
뇌·신경질환별 세계시장 전망(∼2010)
(단위: 백만 달러)
|
질 병 |
2004년 |
2006년 |
2008년 |
2010년 |
CAGR(%) 2004~2010년 |
|
알츠하이머(Alzhhemer's) |
2,719 |
4,483 |
5,848 |
6,564 |
15.80 |
|
우울증(Depression/Anxiety) |
17,861 |
17,821 |
17,381 |
15,768 |
-2.10 |
|
간질(Epilepsy) |
10,398 |
13,165 |
15,208 |
13,176 |
4.00 |
|
편두통(Migraine) |
2,712 |
2,687 |
2,497 |
2,531 |
-1.10 |
|
통증(Pain) |
13,852 |
15,209 |
15,470 |
16,200 |
2.60 |
|
파킨슨씨(Parkinson's) |
2,137 |
2,463 |
2,504 |
2,350 |
1.60 |
|
정신분열증(Schizophrenia) |
12,476 |
16,219 |
19,469 |
21,839 |
8.20 |
|
기 타 |
14,951 |
17,844 |
20,277 |
22,462 |
7.00 |
|
총 합 계 |
77,106 |
89,892 |
98,654 |
100,890 |
4.60 |
참고 : Business Insight,“The CNS Market Outlook to 2010 - Healthcare”(2005.10) CAGR: Compound Annual Growth Rate, 누적 연평균 성장률
출처 : 뇌연구 및 활용기술, 생명공학정책연구센터 재가공, 2007. 7
전 세계에서 뇌․신경질환 관련 의약품의 시장은 2004년에 770억 달러에 이르고 있으며, 어느 의약품 수요보다도 빠른 성장률을 보이고 있어 2010년에는 1,000억 달러 시장이 될 것으로 예측되고 있다. 이는 현대의학의 발전으로 인한 고령화 인구의 증가, 복지 수준에 대한 관심 제고, 고도의 산업화 사회와 이에 따른 정신적 질환 증가 그리고 뇌과학의 발전과 치료기술의 발전이 뇌․신경관련 의약품의 수요를 크게 늘릴 것이라고 예측하고 있다.
(2) 산업화의 세계적 동향
2005년 세계에서 판매된 상위 10대 치료군별 약품현황을 보면 뇌․신경관련 약품은 3개 부문에 470억 달러로써 전체의 26%를 점유하고 있다. 이는 심혈관질환의약품에 이어 2위에 해당한다[표 4-1-7-3].
|
표 4-1-7-3 |
Leading Therapy Classes by Global Pharmaceutical Sales, 2005
|
Audited World Therapy Class |
2005 Sales (US$B) |
%Sales (US$) |
%Growth Year-over-Year (Constant $) |
비 고 |
|
1. Cholesterol & Triglyceride Reducers |
32.4 |
5.8 |
6.8 |
콜레스톨 및 지질저하제 |
|
2. Cytostatics |
28.5 |
5.1 |
18.6 |
암치료 |
|
3. Antiulcerants |
26.7 |
4.8 |
3.8 |
항궤양제 |
|
4. Antidepressants & Mood Stabilizers |
19.8 |
3.5 |
-3.9 |
항우울제 및 신경안정제 |
|
5. Antipsychotics |
16.2 |
2.9 |
10.7 |
항정신병 |
|
6. Angiotensin-II Inhibitors |
14.2 |
2.5 |
18.1 |
혈압강하제 |
|
7. Erythropoietin Products |
12.3 |
2.2 |
6.3 |
조혈제 |
|
8. Calcium Antagonists Plain |
11.9 |
2.1 |
2.2 |
칼슘 길항제 |
|
9. Anti-Epileptics |
11.6 |
2.1 |
0.9 |
항 간질병 |
|
10. Oral Antidiabetics |
10.7 |
1.9 |
6.9 |
당뇨병약 |
|
Total(Leading Therapy Classes) |
$184.3 |
32.9% |
7.1% |
|
출처 : IMS MIDAS, MAT Dec 2005, All information current as of February 27, 2006.
* Sales cover direct and indirect pharmaceutical channel purchases in U.S. dollars from wholesalers and manufacturers. The figures above include prescription and certain over-the-counter data and represent manufacturer prices. Totals may not add due to rounding.
세계 2위의 의약품 시장이며 완만한 성장을 하여왔던 일본의 2005년도 경우 6.8%의 높은 성장률을 보이고 있는 바, 이는 노인성 뇌질환 치료제(알츠하이머 치료제 Aricept, 파킨슨씨병 치료제 Cabaser 등)를 비롯한 신약의 매출 증대가 크게 기여하였다고 평가되고 있어, 고령화 사회에 접어든 우리나라에도 시사하는 바가 크다.37)
앞으로 우리나라의 뇌과학은 21세기 “미래성장동력의 원천”이 됨은 물론 “삶의 질 향상”에 대한 그 역할이 날로 증대될 것이다.
다. 국내 동향
(1) 그간의 정책 동향
우리나라는 선진국에 비하여 비록 늦게 뇌과학과 관련한 정책들이 시작되었지만 정부차원에서 활발하면서도 내실 있게 추진하여 왔으며, 어느덧 10여 년의 역사를 가지고 있다. 그 결과, 뇌연구 분야에 대한 인력양성, 인프라 구축 등의 성과와 함께 적지 않은 연구실적을 보이고 있다.
뇌과학 분야의 지난 10여 년간의 중요 정책적 추진사항을 요약하면 다음과 같다.
|
표 4-1-7-4 |
주요 정책 동향
|
년 도 |
추 진 내 용 |
|
1998년 |
‘뇌연구촉진법’을 제정 |
|
1999년 |
- 범부처 차원의 ‘뇌연구촉진기본계획(Braintech 21)’을 수립 시행 - ‘뇌신경생물학사업단’, ‘뇌의약학사업단’, ‘뇌신경정보학사업단’ 3개 사업단 발족 |
|
2003년 |
21세기 프론티어연구개발사업의 하나로써「뇌기능 활용 및 뇌질환 치료기술 개발 연구사업단」출범 |
출처 : 국제 뇌연구 개발과 산업화 관련 해외 기술 및 시장동향 조사, 뇌기능활용및뇌질환치료개발연구사업단, 2004. 5
2007년 「제1차 뇌연구촉진기본계획(1994~2007)」이 종료됨에 따라 후속 계획인 「제2차 뇌연구촉진 기본계획(2008~2017)」의 수립이 추진되고 있다. 이를 기반으로 국가 뇌연구기관 설립 검토 등 앞으로 10년 동안 우리나라 뇌과학 분야의 획기적 발전을 위한 정책들을 시행할 계획이다.
(2) 뇌과학 연구 현황과 수준
국내 뇌과학 관련 연구 인력(석사급 연구원 이상)은 1,800여 명으로 이 중 95%가 대학에 집중되어 있다. 이는 아직 뇌과학 분야에 종사할 만한 연구기관이나 관련기업이 거의 없음을 보여주는 것이다. 더욱이 우리나라 이공계 박사학위 소지자의 70% 정도가 대학에 분포하고 있음을 볼 때 집중도의 편중현상은 한층 더 심할 것으로 판단되고 있다.
또한 국제적으로 인정받고 있는 연구기관들의 뇌연구 관련 연구자 집단의 인원이 60명~100명 정도인 것을 볼 때, 우리나라의 대학 중 이런 기준에 맞는 대학은 1개 대학 정도에 불과하다.
한편 국내 뇌연구 투자예산은 일본의 1/15, 미국의 1/80 수준으로 2006년에는 총 491억원, 2007년에는 총 492억원으로 계획되어 있다. 이러한 국내 연구투자예산은 민간부문의 투자를 포함한다면 더 많은 격차가 있을 것이다[표 4-1-7-5, 별첨 1. 참조, 2007, 뇌연구촉진시행계획].
|
표 4-1-7-5 |
뇌연구 투자예산 비교
|
구 분 |
한 국 (2007) |
일 본 (2007) |
미 국 (2006) |
|
예산규모 |
492억원 |
7,500억원* |
3조 8,500억원* |
|
비 율 |
1 |
15 |
80 |
출처 : 한국뇌연구원 설립·운영에 관한 기획연구, 뇌기능활용및뇌질환치료기술개발연구사업단, 2007. 11
그러나 국내의 뇌과학 수준은 짧은 기간과 적은 수의 핵심 인력에도 불구하고, 투자 대비 뛰어난 연구 성과를 보여주고 있으며, 치료제 개발을 중심으로 한 관련 산업계의 잠재역량도 뛰어난 편이라고 할 수 있다.
뇌연구 투자 대비 연구 성과 조사결과에 의하면 국내 뇌연구 투자가 비교적 효율적으로 이루어지고 있는 것으로 나타나고 있다. 특히 1990년대 초반에 비하여 괄목할 만한 성장을 기록하고 있다. 미국과 일본은 연평균 증가율이 4~5%에 지나지 않은 반면에 우리나라는 32%에 이르며, 1991년에는 42편이었는데 2005년 1,847편으로 43배 증가를 보여주고 있다. 또한 정부투자 1억원 당 국내 뇌연구 논문의 수는 1.4편인 반면 일본은 0.7편, 미국은 0.25편으로 집계되고 있다. 이 수치는 민간부문 지원을 감안할 때 미국 또는 일본에 비하여 2배 가량의 논문이 배출되고 있다는 것을 의미한다.
한편 뇌연구는 2000년대에 접어들면서 새로운 접근방법 및 영상기술들이 발전하면서 관련 특허의 출현건수가 1995년의 348건에서 2006년에는 1,378건으로 빠르게 증가하고 있는 상황이다.
전 세계 뇌연구 관련 특허의 50% 이상을 미국이 보유하고 있는 가운데, 우리나라도 89건의 관련 해외 특허를 보유하고 있어 세계에서 6번째의 뇌연구 관련 특허 보유국으로 평가되고 있다[표 4-1-7-6].
|
표 4-1-7-6 |
뇌연구 관련 특허 주요국가 순위
|
순위 |
출원기관 |
특 허 건 수 |
순위 |
출원기관 |
특 허 건 수 |
|
1 |
미국 |
4,876 |
5 |
프랑스 |
170 |
|
2 |
일본 |
1,476 |
6 |
대한민국 |
89 |
|
3 |
영국 |
453 |
7 |
이탈리아 |
87 |
|
4 |
독일 |
376 |
8 |
덴마크 |
78 |
출처 : BT 기술동향 보고서(뇌연구 및 활용기술), 생명공학정책연구센터,
태동기에 있는 국내 뇌질환 관련 기업을 살펴보면, 미국 Johnson&Johnson으로부터 천만 달러 이상 규모의 기술료를 징수한 바 있는 국내 선두그룹 (주)SK를 비롯하여 동아제약 등이 있으며, 이외 두각을 나타내는 뇌질환 관련 벤처기업으로는 (주)뉴로테크, 크리스탈지노믹스(주), (주)디지탈 바이오텍 등이 있다.
신약개발을 추진하고 있는 벤처기업의 경우 상대적으로 뛰어난 기술력에도 불구하고 전 임상, 임상단계의 연구에서의 대규모 투자 및 고위험성 등 신약개발의 기술적․경제적 특성으로 인하여 여러 가지 어려움에 직면하고 있다. 몇몇 벤처기업에서는 새로운 EEG 측정기술, 지능검사 등 뇌신경생리학적 연구와 뇌영상기법을 응용한 뇌-기계접속기술도 활발히 연구개발하고 있으나 역시 많은 어려움을 겪고 있다.
다행스러운 것은 최근 정부차원의 대형실용화 연구 사업을 통해 신약후보물질 발굴이 실용화로 이어질 수 있는 발판이 생긴 것은 매우 바람직하다고 하겠다. 그리고 최근 뇌과학 연구개발이 세계적 규모의 공동연구를 통해 수행되는 경우가 증대되고 있고 2004년에는 선진국 국제협력프로그램인 HFSP(Human Frontier Science Program)에 우리나라가 정식 가입하게 되었다. 뇌기능연구프론티어사업단의 경우 2005년 2월부터 영국의 시냅스가소성 MRC(브리스톨대학)등 협력연구기관과 뇌질환 신약개발을 위한 국제공동연구사업을 추진하고 있어 기대하는 바가 크다.
라. 최근의 정책 동향
그동안 뇌연구촉진법 제정과 이에 의거한 정부지원 등을 지속적으로 추진하여 상당한 수준의 기반이 구축된 것이 사실이다. 그러나 지금까지의 지원이 뇌연구 분야별 기반 구축에 집중된 결과, 다학제적이며 “거대과학(mega-science)”적인 뇌연구의 특성을 만족시키지 못하는 한계를 가지고 있었다.
따라서 투자의 획기적 확대와 함께 시너지(synergy) 효과를 극대화시키며 본격적으로 성과를 창출할 수 있는 새로운 국내 뇌연구 시스템 구축의 필요성이 대두되어 왔다. 이러한 시대적 요청에 따라 국내 뇌연구를 장기적이고 효율적으로 추진할 수 있는「국내 최초 뇌융합 연구원」설립이 추진되고 있다.
지난 2007년 3월부터 “한국뇌연구원설립추진위원회”가 구성․운영되고 있으며, 뇌연구의 특성에 맞도록 투자확대는 물론 국가주도의 뇌연구 중추기관을 통해, 그동안 분산되어 추진하고 있었던 뇌연구 분야를 종합‧포괄하여 효율적으로 육성‧발전시킬 수 있는 새로운 체제의 연구시스템 마련이 모색되고 있다.
마. 발전 과제
뇌과학은 미지의 세계이다. 아직도 해결되지 않은 뇌과학의 제 문제는 실로 무궁무진하다. 신경세포로의 분화와 신호전달 체계, 시냅스의 구조와 기능 및 그 분자적 실체, 학습과 기억의 기전 등 수많은 의문들이 쌓여있다. 병인도 모르고 적합한 실험모델 조차 없는 수많은 뇌 정신질환들, 신약 개발의 보고인 이온 채널들, 시냅스 형성 인자들, 각종 신호전달 분자 네트워크 물질들, 발생유도인자, 전사조절인자 등 수많은 신약 개발의 분자 표적의 발굴이 우리의 도전을 기다리고 있다. 뇌과학에 있어서 근본적이고도 기초적인 연구의 결과는 곧바로 각종 뇌질환의 병인 규명, 진단과 치료에 활용되거나 이용될 수 있다.
또한 뇌과학은 수학․물리학․화학․생물학 등 기초과학 분야와 함께 의학․공학․인지과학 등 다학제 간의 연구가 필요한 대표적인 융합연구 분야로써 대형화 추세로 가고 있다. 미국의 경우에는 단일대학의 뇌과학 관련 프로그램에서도 50~80명의 교수진이 공동연구를 진행하는 것이 일반적인 형태이고 추세이다.
이와 같이 뇌과학은 기술간․학제간 융합화와 함께 대규모 투자가 필요하며 21세기 미래 성장 동력산업 역할을 할 수 있는 분야이므로 선진 각국은 앞다퉈 국가적인 지원을 아끼지 않고 있다.
또한 새로운 연구 분야로써 선진국과의 기술격차가 크지 않으며 선진국과 대등한 수준에 올라와 있는 부문도 있는 등 앞으로 우리나라가 기술적 선점을 통하여 국제 경쟁력을 확보할 수 있는 가능성이 높은 분야이기도 하다.
이미 미국, 일본, 유럽 선진국에서는 뇌질환 및 행동이상 치료를 위해 뇌와 행동 전반의 기초 연구와 이를 실용화하기 위한 장기적 계획을 세워 15년 이상 연구를 수행하여 왔다.
이러한 불리함을 극복하기 위하여 다음과 같은 정책적 추진이 필요하다.
첫째, 뇌과학 분야에 대한 투자가 획기적으로 이루어져야 한다. 앞에서 살펴본 바와 같이 우리나라의 뇌과학 분야에 대한 투자는 일본의 1/15, 미국의 1/80 수준에 불과하다.
둘째, 뇌연구 사업간 또는 인접 학문간 연계성을 강화하여 시너지 효과를 극대화하여야 한다. 뇌연구는 BT, IT 등 기술간 및 과학과 공학 등 학제간의 협력이 전제되어야 하는 융합연구개발 분야로 이를 체계적으로 추진할 수 있는 체제를 갖추어야 한다.
셋째, 국제교류와 협력을 강화하여야 한다. 아직까지 국제교류나 국제협력이 활성화되지 못하고 기관 또는 연구자 개인적 차원에서 관련연구가 이루어지는 경우가 적지 않아 외국의 선진 전문연구기관과의 폭넓은 교류․협력으로 효율적이고도 경쟁력 있는 연구가 되도록 국제협력 체제를 강화할 필요가 있다.
이와 같은 문제들을 해결하기 위해서는 근본적이고도 장기적인 관점에서의 대책이 마련되어야 할 것이다. 뇌연구의 특성에 맞도록 국가의 투자를 획기적으로 확대함을 물론 이에 걸맞은 새로운 뇌연구시스템을 갖추어야 한다.
분야별로 분산되어 추진하고 있는 뇌연구 분야를 종합‧포괄하여 체계적으로 추진함으로써 뇌연구를 효율적으로 육성‧발전시킴과 동시에 빠른 시일 내에 우리나라 뇌과학의 수준을 선진국 수준으로 진입시킬 수 있는 전기의 마련이 절실하다.
이를 위하여 뇌과학에 관한 연구를 일관성을 가지고 체계적으로 추진할 수 있는 국가차원의 독립된 뇌과학연구소의 설립이 추진되고 있어 기대되는 바이다.
현재 세계는 선진국뿐만 아니라 중국, 인도, 이스라엘, 스페인 등 많은 나라에서 최소 1개소 이상의 국립 뇌연구소가 설립되어 있으며, 이를 바탕으로 활발한 뇌연구가 진행되고 있다.
우리에게는 머뭇거릴 시간이 별로 없다.


가. 국내외 의약품시장 현황
2006년 세계 의약품 시장규모는 643조원(6,430억 달러)이고 전년 대비 약 7%의 증가추세를 보이고 있다[표 4-2-1-1].
|
표 4-2-1-1 |
Global Pharmaceutical Sales, 1999~2006
|
|
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
|
Total World Market (Bn $) |
362 |
387 |
427 |
498 |
559 |
601 |
643 |
|
Growth Over Previous Year (%) |
11.7% |
11.8% |
10.6% |
10.4% |
8.0% |
6.8% |
7.0% |
출처 : IMS Health Market Prognosis (includes IMS Audited and Unaudited Markets), All information current as of March 2, 2007
의약품 시장은 지속적으로 성장하여 2010년에는 900조원(9,000억 달러)에 달할 것으로 추정된다.
시장점유율을 살펴보면 미국이 전체 의약품시장의 절반가량인 280조원(47.7%)을 차지하고 있으며 그 다음은 유럽으로 170조원(29.9%)을 차지하고 있다.
2005년 한국은 전체의 1.7% 정도인 11.4조원 정도의 시장규모를 보인다(세계 10위권 규모로 추정). 그러나 전년 대비 10.14% 증가를 보여 세계의약품시장 평균 성장률 6.8%를 훨씬 웃돌고 있다.
국내의약품 시장은 2000년 의약분업 이후 꾸준한 성장을 보이고 있으며, 매년 연평균 10%의 증가추세를 보여 2010년에는 약 15조원에 달할 것으로 추산된다.
나. 국내외 연구개발 현황
(1) 제약 산업 연구개발 투자 현황
전 세계적으로 제약 산업은 자동차, 전자, 소프트웨어 등과 함께 R&D 투자비의 70%를 점유하는 5대 업종에 랭크되었다.
|
표 4-2-1-2 |
영국 통상산업부 선정 R&D ‘Top 톱50’ 주요 기업현황
|
전체 순위 |
업계 순위 |
기업명 |
국가명 |
2005년순위 |
2003년 순위 |
2005 R&D 금액 |
|
1 |
- |
포드자동차 |
미국 |
3 |
1 |
8조 4,113억원 |
|
2 |
1 |
화이자 |
미국 |
2 |
5 |
7조 8,157억원 |
|
7 |
2 |
존슨&존슨 |
미국 |
14 |
13 |
6조 6,424억원 |
|
9 |
- |
삼성전자 |
한국 |
17 |
33 |
5조 7,219억원 |
|
10 |
3 |
글락소스미스클라인 |
영국 |
11 |
8 |
5조 6,677억원 |
|
13 |
4 |
노바티스 |
스위스 |
20 |
25 |
5조 901억원 |
|
16 |
5 |
사노피-아벤티스 |
프랑스 |
12 |
17 |
5조 179억원 |
|
19 |
6 |
로슈 |
스위스 |
19 |
26 |
4조 5,486억원 |
|
21 |
7 |
머크&컴퍼니 |
미국 |
21 |
30 |
4조 432억원 |
|
28 |
8 |
아스트라제네카 |
영국 |
24 |
27 |
3조 5,559억원 |
|
32 |
9 |
일라이릴리 |
미국 |
38 |
44 |
3조 1,768억원 |
|
36 |
10 |
와이어스 |
미국 |
44 |
45 |
2조 8,880억원 |
|
37 |
11 |
브리스톨마이어스 |
미국 |
42 |
40 |
2조 8,880억원 |
|
45 |
12 |
암젠 |
미국 |
50 |
68 |
2조 4,368억원 |
|
46 |
13 |
바이엘 |
독일 |
31 |
31 |
2조 3,465억원 |
출처 : 2006 글로벌 R&D 투자기업보고서, 영국 통상산업부, 2006. 10
영국 통상산업부(DTI)가 2006년 10월에 공개한 ‘2006 글로벌 R&D투자기업’ 보고서에 의하면 화이자(Pfizer)가 포드(Ford)에 이어 2005년에 총 7조 8,157억원을 R&D에 투자해 투자규모에서 전체산업 2위 및 제약부문 1위를 차지하였으며, 존슨&존슨(Johnson&Johnson)이 6조 6,424억원을 R&D에 투자해 전체산업 7위 및 제약부문 2위에 올랐으며, 글락소스미스클라인(GSK)이 5조 6,677억원으로 전체산업 10위, 제약부분 3위를 차지하여 제약 산업은 소프트웨어산업과 함께 R&D 투자의 증가속도가 가장 빠른 양대 업종에 선정되었다[표 4-2-1-2]. 또한 현재 세계 20대 제약기업들이 가장 집중적으로 투자하고 있는 분야는 저분자 합성신약 개발 분야로 전체 연구개발비의 82%가 투자되고 있다.
(2) 신약개발 파이프라인 현황
2006년에 발간된 Pharmaprojects Annual Review에 따르면 전 세계에서 진행 중인 신약개발 파이프라인은 7,400여 개로 나타났다[그림 4-2-1-1].

출처 : Pharmaprojects Annual Review, 2006
|
그림 4-2-1-1 |
신약개발 프로젝트 규모
개발단계별로는 전임상 프로젝트가 총 3,906건으로 가장 큰 비중을 차지했으나 전년 대비 소폭 감소하였고, 임상 2상은 전년 대비 9.9% 상승한 1,309건이었다. 임상 3상도 423건으로 전년 대비 소폭 상승했으나 1상 및 2상에 비해 절대적 수치는 적어, 1상-2상 단계의 프로젝트 중 50% 이하의 프로젝트만 가장 중요한 제3상 단계로 진행되는 것으로 나타났다. 즉 1상-2상 단계의 프로젝트 증가추세가 가장 중요한 제3상 단계로 이어지지 않고 있는 것으로 나타났다[그림 4-2-1-2].

출처 : Pharmaprojects Annual Review, 2006
|
그림 4-2-1-2 |
개발단계별 신약개발 프로젝트 규모
임상진입 건수를 질환별로 살펴보면 종양 및 면역질환 분야가 가장 많았으며 다음으로 염증, 중추신경계 물질에 대한 분야였다[그림 4-2-1-3].

출처 : Tufts Impact Report, 2006
|
그림 4-2-1-3 |
질환별 임상진입 건수
질환별 특허건수는 면역/염증, 중추신경계, 종양 분야의 순으로 나타났다[그림 4-2-1-4].

출처 : Thimpson Dolphin Patent Database, 2006
|
그림 4-2-1-4 |
질환별 특허건수
다. 신약개발 신기술 동향
합성신약을 개발하기 위해 최근에 도입된 신기술로는 조합화학, CADD, ADME/Tox(Absorption, Distribution, Metabolism, Excretion and Toxicology) 평가기술 등이 있다.
(1) 조합화학
조합화학은 고효율(high throughput)로 화합물 라이브러리(library)의 생산을 가능하게 하는 일련의 도구들과 기술들을 포괄하며, 세부적으로는 합성(compound library synthesis), 정제(compound purification) 등의 범주들로 나눌 수 있다.
신약탐색 화합물 라이브러리는 목적, 작용점 유무, 물리화학적 성질, 골격에 따라서 다음과 같이 분류될 수 있으며, 신약탐색의 구체적인 방향에 따라 특정한 화합물 라이브러리가 설계된다[표 4-2-1-3].
|
표 4-2-1-3 |
화합물 라이브러리의 분류 및 설계원리
|
기 준 |
분 류 |
특 성 |
|
목 적 |
primary, secondary, focused, or tuning |
hit generation lead generation 및 optimization |
|
작용점유무 |
random or diverse directed, targeted, biased |
특정한 작용점 없음 특정한 작용점(군) 대상 |
|
물리화학적
성 질 |
drug-like 경구흡수 위한 기준 (rule of five) |
MW ≤ 500 ClogP ≤ 5 (or MlogP ≤ 4.15) HBa ≤ 10, HBd ≤ 5, RB ≤ 7-10 PSA ≤ 110-140 Å2 |
|
lead-like (lead generation 기준) |
MW ≤ 450 -3.5 ≤ ClogP ≤ 4.5, HBa ≤ 8 HBd ≤ 5, RB ≤ 10 |
|
|
fragment-like fragment-based lead generation 기준 (rule of three) |
MW < 300, ClogP ≤ 3 HBa ≤ 3, HBd ≤ 3 RB ≤ 3, PSA ≤ 60 Å2 |
|
|
골 격 |
drug-like |
주로 질소를 포함하는 헤테로고리 |
|
natural product-like or -based |
- 천연물 유래 privileged structure - 특정 천연물의 core scaffold - 특정부류 천연물들의 공통적 structural motif - 천연물의 일반적 구조적 특징 모방 |
출처 : 한국화학연구원 내부자료
[그림 4-2-1-5]는 얻고자 하는 화합물 라이브러리의 구조적 다양성(structural diversity) 측면에서 신약탐색 화합물 라이브러리의 합성전략을 도식적으로 나타낸 것이다. 연구자들은 신약탐색의 구체적인 방향과 단계에 따라 연구목적에 부합하는 특정 화합물 라이브러리 합성전략을 선택할 수 있다.

출처 : Curr. Opin. Chem. Biol. 2005
|
그림 4-2-1-5 |
조합화학 합성전략
신약탐색 화합물 라이브러리의 합성 및 정제기술을 합성방법에 따라 평형합성법(parallel synthesis)과 혼합분리법(split-pool synthesis, mix and split synthesis)으로 분류할 수 있다. 평형합성법과 혼합분리법의 특징들은 [표 4-2-1-4]에 나타내었다.
|
표 4-2-1-4 |
평형합성법과 혼합분리법의 특징
|
평 형 합 성 법 |
혼 합 분 리 법 |
|
분리된 반응용기에서 각 반응 실행 |
합성 중간체들의 혼합 및 분리 과정 반복 |
|
다양한 separation platforms (solid-supported substrates, precipitation tags, fluorous tags, solid-supported reagents, solid-supported scavengers)에 대해 적용 가능 |
solid-supported substrates, precipitation tags, fluorous tags에 대해서만 적용 가능
|
|
반응공정의 속도는 비교적 느림 |
반응공정의 속도는 비교적 빠름 |
|
화합물의 구조 확인 용이
|
화합물의 구조 확인을 위해 encoding이나 recursive deconvolution 과정이 필요 |
출처 : Nature Chem. Biol. 2005
(2) CADD(computer aided drug design)기술
컴퓨터를 이용해 약물의 분자구조를 설계하고 이를 기반으로 약효를 예측하는 기술이다. CADD 기술은 유효 화합물군을 신속하게 발굴할 수 있는 가상탐색기술과 구조-활성 상관관계 분석을 통해 원하는 활성을 예측할 수 있는 분자설계기술로 크게 분류될 수 있다.
(가) 가상탐색 기술
컴퓨터를 통하여 활용 가능한 효율적인 화합물 라이브러리를 구축하고, 구축된 화합물 라이브러리로부터 생물학적 약효 활성 구조에 기초하여 새로운 리간드들을 고속으로 발굴하는 기술이다. 가상탐색기술은 화합물의 신규성뿐만 아니라, 생물리학적・약리학적 성질들을 최적화시키는 일련의 과정들을 병렬적으로 고려하여 초기후보물질로부터 drug-like 선도물질을 창출하는 기술이기도 하다. 가상 스크리닝의 방법으로는 리간드기반과 구조기반 스크리닝이 사용된다. 리간드기반 스크리닝에는 2D 유사도 검색, 정량적 구조-활성 관계(QSAR)와 3D pharmacophore 검색이 있고, 구조 기반 스크리닝에는 docking이 사용될 수 있다[그림 4-2-1-6].

출처 : 한국화학연구원 내부자료
|
그림 4-2-1-6 |
구조기반 가상 스크리닝
(나) 분자설계 기술
가상탐색 기술보다 먼저 태동하여 그 활용도가 매우 다양하며, 미국의 모든 Top 10 거대제약회사들은 질환표적단백질 구조에 기반을 둔 분자설계 기술 연구팀들을 자체적으로 보유하고 있으면서 분자설계 전문 벤처사들과 제휴 혹은 공동연구를 통하여 신약개발과정에 직접적으로 분자설계기술을 활용하고 있다. 또한 Top 20 내의 대부분 제약회사들은 전문 컴퓨터 모델링기술연구 기업 및 대학들과 협력연구를 진행 중이다.
(3) ADME/Tox 평가기술
ADME/Tox(전임상 과정의 물성 및 독성 발생 예측)는 화합물의 활성을 검색하여 유효물질을 도출하는 신약개발 초기단계에서 적용되는 화합물의 약동력학적 특성과 독성을 평가하는 기술이다. 약물이 체내에서 작용하여 질병을 치료하기 위해서는 활성이 있어야 하고, 치료해야 할 약물 타겟에 도달할 수 있어야 하며, 독성이 낮거나 없어서 인체가 견딜 수 있어야 한다.
약동력(Pharmacokinetics, PK)학은 약물의 체내속도론으로, 약물이 체내로 얼마나 흡수되며, 흡수된 약물이 생체 내에서 어떻게 분포되며(compartment), 언제 어떻게 변화하여 체외로 배출되는지에 대한 연구로써 각각의 영어 첫 글자를 따서 ADME라고 일컫는데 이 ADME가 생체이용률(Bioavailability, BA)을 결정하게 된다. Pharmacodynamics(PD)는 체내에서 약물의 활성이 얼마나 빨리 발현되는지 또한 타겟으로 이동한 후, 타겟 receptor와 결합하여 약물로써 나타내는 효과를 Kinetics로 설명하는 것으로 넓은 의미로 PK와 PD를 같은 맥락으로 보기도 한다.
신약개발의 가장 큰 장애 요소 중 하나는 ADME와 독성부분이다. 선진제약회사들은 ADME/Tox평가를 lead optimization 단계부터 도입하고 있다. 특히 lead optimization 단계부터 ADME/Tox평가 도입으로 2000년 이후 후보물질의 PK특성 부적절로 인한 신약개발 실패율을 기존의 40%에서 10%이하로 감소시킬 수 있었다.

가. 바이오신약의 개요
바이오 의약품은 기존의 화학적 의약품과 달리 단백질, DNA 등 생물학적 물질로 구성된 의약품으로 특징적인 치료영역과 효능을 나타낸다. 바이오 의약품의 종류로는 재조합단백질 의약품, 치료용 항체, 예방 및 치료용 백신, 유전자 치료제, 세포 치료제 등이 있다.
바이오신약개발은 화학적 신약과는 달리 전임상에서 요구되는 자료가 적은 편이어서 전임상 시험기간이 짧다. 또한 임상시험에서 독성의 예측이 비교적 쉽다. 이러한 이유로 바이오신약은 실제 제품개발 및 임상에 소요되는 경비가 화학적 신약에 비해 적을 뿐 아니라, 개발 성공률도 높은 편이다. 현재 바이오 의약품은 제품의 발전주기가 도입기, 성장기에 속하기 때문에 부가가치가 높은 제품이 많다. 최근 전 세계적으로 바이오신약 개발이 화학적 신약 개발보다 활발히 진행되고 있으며, 실제로 신약허가 건수도 바이오제품이 화학적 제품을 앞서고 있다.
바이오신약을 다음과 같이 분류하여 정의할 수 있다.
(1) 재조합단백질 의약품
재조합단백질 의약품은 인체에 자연적으로 존재하나, 질환 등으로 인해 부족해질 경우, 체외에서 생산하여 인체에 투여되는 단백질 혹은 당단백질이다. 그 예로, Erythropoietin(EPO), 인간성장호르몬, 인슐린, 인터페론, 콜로니 자극인자 등을 들 수 있다. 이것은 일반적으로 유전자 변형 기술을 이용하여 대장균 및 동물세포 등에서 생산한다.
(2) 치료용 항체
암세포의 사멸, 바이러스 감염의 차단, 염증성 싸이토카인 작용의 차단 등의 질환 치료에 활용하는 단클론 항체를 치료용 항체라 한다. 초기의 제품들은 마우스 항체를 활용하여 왔으나, 현재는 마우스 항체를 인간 항체와 유사한 형태로 만든 카이메릭 항체, 인간화 항체 또는 인간 항체를 사용하고 있다. 치료용 항체는 유전자 재조합 기술을 이용하여 동물세포에서 생산하여 의약품으로 사용하고 있다. 대표적인 제품으로는 리툭산, 허셉턴, 레미케이드 등이 있다.
(3) 예방 및 치료용 백신
백신이란 항원을 인체에 투입하여 항체 및 세포독성 T세포 등을 유도하고, 면역기억반응을 정립하여 질환의 예방(예방백신) 및 치료(치료용 백신)에 활용되는 의약품이다. 항원으로는 단백질, 사멸시키거나 약독화한 병원성 미생물 등이 사용되어져 왔으나, 최근에는 항원을 발현하는 DNA, 벡터, 항원을 적제한 수지상세포 등이 활용되고 있다.
(4) 유전자 치료제
유전자 치료제란 인체 내에 결핍되었거나 손상된 유전자를 보완하기 위해 인체에 투여하는 정상 유전자이다. DNA 혹은 벡터를 활용하여 직접 전달하기도 하고, 특정 인체세포에 정상적인 유전자를 전달한 후 인체에 다시 투여해 주기도 한다. 한편 최근에는 암세포 등에 선택적으로 유전자를 전달하여 암세포를 파괴하는 제품들도 개발되고 있다.
나. 바이오신약개발의 해외 동향
(1) 재조합단백질 의약품
재조합단백질 의약품은 제1세대 바이오 의약품으로 Erythropoietin(EPO), G-CSF, Interferon 등이 속하며 바이오 의약품 시장에서 가장 큰 비중을 차지하고 있다. 제품개발의 발전주기가 성숙기 단계에 접어들고 있어 연간 매출이 약 10% 정도 성장할 것으로 전망된다[표 4-2-2-1].
|
표 4-2-2-1 |
EPO 매출 현황
(단위: 백만 달러)
|
제품명 |
회사 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
2010 |
|
Aranesp |
Amgen |
326 |
1,065 |
1,645 |
2,167 |
2,747 |
4,245 |
6,090 |
|
Epogen |
2,341 |
2,376 |
2,388 |
2,257 |
2,166 |
2,070 |
1,868 |
|
|
Procrit |
J & J |
3,680 |
3,720 |
3,739 |
3,645 |
3,353 |
2,913 |
2,574 |
|
Dynepo |
Shire |
0 |
0 |
165 |
254 |
391 |
915 |
1,264 |
|
Neo- Recormon |
Roche |
507 |
582 |
662 |
699 |
734 |
709 |
488 |
|
Epogin |
Chugai |
548 |
610 |
657 |
681 |
631 |
563 |
482 |
|
Espo |
Sankyo |
196 |
204 |
190 |
179 |
156 |
133 |
109 |
|
Others |
32 |
32 |
32 |
32 |
32 |
32 |
32 |
|
|
Total |
7,631 |
8,589 |
9,478 |
9,913 |
10,212 |
11,581 |
12,907 |
|
출처 : Amgen 발표자료, Datamonitor, 2005
최근의 재조합단백질 의약품 개발동향은 크게 두 가지로 나눌 수 있다. 첫째는 제품의 투여횟수를 줄이고, 체내 반감기를 높이는 새로운 기술개발이 활발하다는 것이다. 서방형 제형(slow-releasing), 지속형 제형(long-acting), DDS 기술을 이용한 투여경로 변경기술 등이 개발되어 있고 Pegylation, hyperglycosylation, encapsulation등의 방법들이 활용되고 있다. EPO(Aranesp) 및 G-CSF(Neulasta)의 경우에는 지속형 제형이 오리지널 제품의 매출을 이미 넘어선 단계이다.
둘째는 일부 재조합 단백질 의약품의 특허가 만료됨에 따라 오리지널 제품의 바이오 복사제품(biogeneric)이 등장한 것이다. 화학적 의약품과 달리 바이오 의약품의 경우 동일한 단백질이라 하더라도 생산하는 세포주의 특징 등에 따라 미세한 당쇄 체인 등에 변화가 있을 수 있고, 이는 최종 제품의 효능 및 체내 동태에 영향을 미칠 수 있기 때문에 이들 제품을 바이오 유사제품(biosimilar)으로 정의하고 있는 실정이다. 따라서 이들 제품의 인허가 관련 규정을 마련하기 위해 세계 각국은 자국의 이익에 부합하는 규정을 마련하고 있다. 유럽연합의 경우는 인허가 제도를 먼저 정립하였으나, 미국의 경우는 아직 규정을 완전히 준비하지 않은 상태이다.
(2) 치료용 항체
치료용 단클론 항체는 최근 몇 년간 해외에서 가장 빠르게 성장하고 있는 치료 의약품으로, 기존의 재조합단백질 관련 바이오 의약품에 이어 거대 제품군으로 주목받고 있다[표4-2-2-2]. 전 세계적으로 개발 중인 바이오 의약품의 1/3 이상이 이에 해당할 정도로 급성장하고 있다. 현재 20종의 치료용 항체가 출시된 상태이며, 전 세계적으로 270개의 회사가 700개의 항체를 개발하고 있다. 이중 400여 개의 항체 제품이 임상시험 중에 있으며, 2010년까지는 100개 이상의 치료용 항체가 시장에 출현할 것으로 예측된다. 치료용 항체 시장규모는 매년 평균 20% 정도 성장하여 2010년까지 약 300억 달러 정도의 시장을 형성할 것으로 보인다.
치료용 항체는 표적물질 및 표적세포의 효과를 차단하거나, 제거함으로써 효과를 나타내는 경우가 대부분이다. 현재는 항암, 항감염, 항염증, 면역억제의 효능으로 많이 사용하고 있으나 최근에는 제품개발 범위를 다양한 질환으로 확대하고 있다. 현재 제품화된 항체는 마우스 항체 3종, 카이메릭(Chimeric) 항체 5종, 인간화 항체 10종, 인간 항체 2종이나, 현재 개발 중인 항체들은 거의 대부분 인간화 항체이거나, 인간 항체이다. 인간 항체의 개발은 예전에는 인간 항체 라이브러리에서 선별하는 방식이었으나, 요즘은 인간화된 유전자 변형 마우스에서 인간 항체를 직접 제조하는 방법 등을 활발히 활용하고 있다.
|
표 4-2-2-2 |
치료용 항체의 매출현황
|
Brand name (Generic name) |
분야 |
개발사 |
매출(백만 달러) |
|||
|
2003 |
2004 |
2007 |
2010 |
|||
|
Rituxan (Rituximab) |
Oncology |
Biogen-IDEC |
2,122 |
2,794 |
2,315 |
4,079 |
|
Remicade (infliximab) |
AIID |
Centocor/ Schering Plough |
2,048 |
2,613 |
- |
4,180 |
|
Herceptin (trastuzumab) |
oncology |
Genentech |
978 |
1,234 |
1,767 |
1,716 |
|
Synagis (palivizumab) |
Infectious disease |
Medimmune |
849 |
1,015 |
- |
1,413 |
|
Humira (adalimumab) |
AIID |
Abbot |
280 |
852 |
2,392 |
4,155 |
|
Avastin (bevacizumab) |
Oncology |
Genentech |
n/l |
545 |
2,674 |
3,911 |
|
ReoPro (abciximab) |
cardio-vascular |
Centocor/ Eli-Lilly |
364 |
363 |
- |
- |
|
Erbitux (cetuximab) |
oncology |
Imclone/ BMS |
n/l |
356 |
- |
1,359 |
|
Xolair (omalizumab) |
Repiratory |
Genentech/ Norvatis |
25 |
189 |
600 |
789 |
|
Campath (alemtuzumab) |
Oncology |
Millenium Ph/ Schering AG |
78 |
84 |
- |
- |
|
Raptiva (efalizumab) |
AIID |
Xoma/ Genentech |
1 |
61 |
362 |
781 |
|
Simulect (basiliximab) |
AIID |
Norvatis |
34 |
46 |
- |
- |
|
Zenapax (daclizumab) |
Oncology |
PDL/ Roche |
27 |
30 |
30 |
27 |
|
Mylotarg (gemtuzumab) |
oncology |
Celltech/ Wyeth -Ayerst |
26 |
26 |
37 |
64 |
|
Zevalin (ibritumomab) |
oncology |
Biogen-IDEC |
20 |
23 |
57 |
79 |
|
Orthoclone (muromonab) |
AIID |
Ortho Biotech/ J&J |
12 |
17 |
- |
- |
|
Cotara (n/a) |
Oncology |
Peregrine Pharmaceuticals inc. |
n/a |
n/a |
- |
- |
|
Bexxar (tositomomab-I131) |
Oncology |
Corixa/GSK |
n/a |
n/a |
- |
- |
출처 : Datamonitor, 2005
* 일부 예측은 2006년 실제 매출과 크게 차이가 남
(※ n/l:not launched, n/a:not available)
(3) 예방 및 치료용 백신
Merck 및 GSK를 비롯한 주요 제약기업들은 최근 자궁경부암 예방백신 개발에 성공하면서 주춤했던 예방백신의 연구개발투자를 확대하고 있는 추세이다. AIDS 백신, 차세대 Influenza 백신, 조류독감 백신, 차세대 결핵 백신, 구제역 백신, 말라리아 백신 등에 많은 관심을 가지고 연구개발에 노력을 기울이고 있다. 성장 잠재력과 고부가가치가 예상되는 치료용 백신의 경우 바이오 전문 벤처기업에서 연구개발이 활발히 진행되고 있다. Avax Technologies사의 melanoma 치료백신, Intracel사의 대장암 치료백신이 상품화되었으나, 아직은 상업화 초기단계에 있다. 2005년 통계에 따르면 치료용 백신개발은 진행 중인 238건 중 128건이 임상연구를 진행하고 있으며, 10여 개의 업체가 임상3상을 진행 중에 있다[표 4-2-2-3].
|
표 4-2-2-3 |
개발 중인 치료용 백신 현황
|
제조사 |
제품명 |
적응증 |
발매 년도 |
예상 판매액 (백만 달러) |
||||
|
2006 |
2007 |
2008 |
2009 |
2010 |
||||
|
Cell Genesys |
Gvax Prostate |
Prostate Cancer |
2007 |
0 |
33 |
57 |
82 |
107 |
|
Dendreon |
Provenge (sipuleucel-T) |
Prostate Cancer |
2007 |
0 |
30 |
52 |
75 |
97 |
|
Medarex |
MDX-1379 MDX-010 |
Metastatic Melanoma |
2007 |
0 |
10 |
35 |
60 |
90 |
|
Therion |
PANVAC/CEA VF-TRICOM |
Pancreatic cancer |
2008 |
0 |
0 |
23 |
35 |
46 |
|
Antigenics |
Oncophage |
kidney cancer |
2008 |
0 |
0 |
12 |
19 |
25 |
|
Genitope |
MyVax |
NHL |
2008 |
0 |
0 |
5 |
15 |
22 |
|
Aphton |
IGN101 |
Colorectal cancer |
2009 |
0 |
0 |
0 |
19 |
38 |
|
Biovest |
BiovaxID |
Follicular lymphoma |
2009 |
0 |
0 |
0 |
9 |
13 |
|
Favrille |
FavID |
NHL |
2009 |
0 |
0 |
0 |
3 |
6 |
|
Progenics |
GMK vaccine |
Melanoma |
2010 |
0 |
0 |
0 |
0 |
5 |
|
VaxGen |
AIDSVAX |
HIV |
2010 |
0 |
0 |
0 |
0 |
0 |
출처 : Therapeutic Vaccines-More Trials and Tribulations, Datamonitor, 2005
치료용 백신 개발기술이 단순히 항원 단백질을 이용하던 수준에서 DNA, 바이러스벡터, 세포백신, combination therapy 등 다양한 기술로 발전하고 있으며, 투여경로도 주사제뿐 아니라 경구용, 흡입용, 패치형 등의 다양한 방법이 개발되고 있다.
현재 치료용 백신개발은 60% 정도가 암을 대상으로 하고 있으나, HIV를 비롯한 감염성 질환에서부터 니코틴 중독, 다발성 경화증, 심혈관계 질환, 당뇨병 등에 이르기까지 다양한 질환의 치료를 위한 백신도 임상단계에 진입하여 그 결과가 주목받고 있다.
(4) 유전자 치료제
1990년 세계 최초로 치료 목적의 유전자 치료제 임상시험이 실시된 이래 유전자 치료제 임상시험은 꾸준히 증가하고 있다. Journal of Gene Medicine에서 제공하는 세계 유전자 치료제 임상시험 데이터베이스(http://www.wiley.co.uk/genmed/ clinical/)에 따르면 2007년 7월 현재 누적기준으로 1,309건의 임상시험이 등록되어 있다. 유전자 치료제 임상시험의 대상 질환에는 암(66.5%), 심혈관 질환(9.1%), 유전 질환(8.3%), 감염성 질환(6.5%)과 같은 난치 및 불치성 질환이 전체 임상시험의 90% 이상을 차지하고 있다.
유전자 치료제 임상시험에 가장 많이 사용되고 있는 유전자 전달체는 아데노바이러스(24.7%)이며, 레트로바이러스(22.8%), Naked 플라스미드 DNA(18%), 리포좀 등의 복합체(7.6%), 백시니아바이러스(6.8%) 등이 많이 사용되고 있다.
아직 유전자 치료제 임상시험의 대부분은 임상시험 1상(61.2%)이 차지하고 있지만 임상시험 2/3상 혹은 3상 단계의 임상시험도 45건 등록이 되어 있어 조만간 선진국 시장에서 제품화가 이루어질 것으로 기대되고 있다.
현재 전 세계적으로 상용화된 유전자 치료제는 두 건으로 2003년 시판이 허가된 Gendicine과 2005년 허가된 H101이다. 두 제품 모두 아데노바이러스 유전자 전달체를 기반으로 하고 있으며 두경부암을 대상으로 중국에서 시판 허가를 받았다[표 4-2-2-4].
선진국 시장의 경우 Gendicine과 동일한 개념의 치료제인 Advexin이 조만간 미국 FDA의 허가를 받게 될 것으로 기대되고 있으며, 최근 일본에서도 폐쇄성 동맥경화증 유전자 치료제가 임상 3상을 성공적으로 마치고 시판 허가를 준비 중에 있다.
|
표 4-2-2-4 |
상용화된 유전자 치료제 현황
|
제품 |
회사명 |
국가 |
대상질환 |
시판허가 |
|
Gendicine |
SiBiono |
중국 |
두경부암 |
2003 |
|
H101 |
Shanghai Sunway |
중국 |
두경부암 |
2005 |
|
Advexin |
Introgen |
미국 |
두경부암 |
시판허가 심사중 |
출처 : 자체조사
다. 바이오신약개발의 국내 현황
(1) 재조합 단백질 의약품
Global 제약기업들은 시판중인 재조합 단백질 의약품의 복용을 간편화하거나 활성을 증강 또는 연장시키기 위한 신(新)제형 개발을 활발히 하고 있다. 특히 기존 개발품의 가장 큰 문제점인 짧은 생리학적 반감기를 극복하고 생체이용률을 높이기 위한 차세대 제품 개발에 주력하고 있다.
이미 동아제약, LG생명과학, 한미약품 등은 EPO, 인터페론, 콜로니자극인자 등 거대 바이오제품을 개발하여 국내 판매뿐만 아니라 해외 수출까지 하고 있으며, 신(新)제형 싸이토카인류의 개발에 박차를 가하고 있다[표 4-2-2-5].
|
표 4-2-2-5 |
국내 주요 재조합 단백질의약품
|
업체명 |
주생산품목과 특징 |
|
동아제약 |
에포론주(EPO) 류코스팀(G-SCF) interferon A(interferon alpha) |
|
녹 십 자 |
Green-alpha(interferon alpha) |
|
LG 생명과학 |
에스포젠주(EPO) 유트로핀(hGH) intermax alpha(interferon alpha) |
|
C J |
에포카인주(EPO) 류코카인(G-CSF) Alphaferon(interferon alpha) |
출처 : 자체조사
최근 선진국 대형사 간의 신규 재조합단백질 의약품 개발 경쟁이 심화되고 있으나, 국내의 경우 재조합 단백질 의약품을 탐색․발굴하는 기초 연구 및 신개념 제품 개발 응용연구가 매우 부족한 상황이다. 하지만 일부 벤처에서 TNF수용체직렬연쇄체-Ig융합단백질을 개발하여 특허를 취득하는 등 신규 면역조절제 개발도 기대되고 있다.
(2) 치료용 항체
국내의 많은 제약사들이 우수 항체 의약품 개발의 중요성을 깊이 인식하고 있으나, 항체 발굴 기술을 비롯한 항체치료제 개발과 관련한 기반 기술이 충분히 구축되어 있지 않은 상태여서 본격적인 개발은 늦춰지고 있는 형편이다.
치료용 항체를 개발함에 있어서 선행되어야 하는 중요한 요건은 항체관련 기반기술의 확보와 아울러 항체 의약품이 치료제로써 효능을 발휘할 수 있는 적합한 난치성 질환의 발굴이다. 이미 선진국에서 주요한 질환 타겟에 대한 치료용 항체 용도에 대해 특허를 출원하였으므로 국내 및 해외 개발이 제한되지 않는 신규 타겟의 발굴이 필요하다. 최근에는 국내에서도 정부 주도하에 유전체 사업 및 기능을 밝히는 유전체학, 단백질체학 등 대규모 단위의 투자로 인해 새로운 타겟에 대한 정보들이 많이 축적되어질 것으로 예측된다.
현재 국내기업 중에서는 녹십자, 에이프로젠, 이수앱지스, LG생명과학, 유한양행 등이 향후 항체 시장의 폭발적인 잠재력을 인식하여 해외 주요시장에서의 특허 만기가 곧 도래하는 항체 의약품을 개발하고, 새로운 항체를 발굴하기 위한 항체 제조의 기반기술로써 항체 디스플레이 및 항체 라이브러리 제조 및 검색 기술을 구축하고 있다.
최근 국내에서 항체 공학 원천기술 개발에 주력한 벤처기업인 에이프로젠이 독자적으로 개발한 ‘SDR-그라프팅’ 항체 인간화 기술에 대한 특허가 한국 및 중국에서 일차 등록됨으로 인해 인간에 부작용이 거의 없는 항체 신약을 개발할 수 있는 ‘CDR-그라프팅’, 형질전환 ‘XenoMouse’ 기술 등을 보유한 다국적 제약사들의 특허 견제를 피해 자유롭게 신약을 개발할 수 있는 입지를 확보하였다.
이것은 국내 기업이 독자적인 항체 인간화 기술을 개발하여 세계 항체 공학 원천기술 무대에서 Protein Design Lab사와 대등한 수준의 기술적 토대를 확보하였음을 시사한다. 또한 단백질 치료제 전문 바이오텍업체인 이수앱지스는 2007년 3월에 국내 최초 항체 의약품으로서 혈전억제제인 ReoPro의 바이오시밀러 제제 ‘클로티냅’에 대한 품목허가를 성공적으로 취득하는 등 국내 항체의약품 개발기술이 제품화 단계에 진입하고 있다.
(3) 예방 및 치료용 백신
이 분야의 연구개발은 전반적으로 초기단계에 머물러 있으나 치료용 백신은 높은 치료 효과를 보이며, 향후 고성장이 예상됨에 따라 동아제약, 녹십자, 보령제약 등의 제약회사와 제넥신 및 바이로메드 등의 일부 바이오 벤처기업을 중심으로 상업화 연구가 활발하게 진행되고 있다.
현재 (주)바이로메드에서는 Her2/neu라는 유방암, 위암 항원유전자를 이용한 DNA백신을, (재)목암생명공학연구소에서는 고효능 에피톱을 이용한 만성C형 간염 치료 DNA 백신을 개발 중이다. 또한, 가톨릭대학 등에서 단백질을 활용하는 암치료 백신을 (주)제넥신과 동아제약(주)이 공동으로 AIDS 및 B형 간염 DNA백신을 (주)엠엔디와 (주)제넥신이 공동으로 결핵백신을 개발 중이며, 포항공대의 바이오텍센터(PBC)에서는 싸이토카인 유전자를 포함하는 DNA 백신의 임상시험을 추진 중이다.
약독화, 균체불활화, 단백질/다당체 정제, 재조합 단백질 생산/정제기술, 재조합 DNA 백신 벡터 설계기술 등은 이미 선진국 수준에 도달해 있다. 제품개발에 필수적인 세포면역 평가기술, 바이러스 안전성 평가기술의 경우 개발 잠재력은 갖추고 있으나, 백신개발과 관련된 연구는 선진국에 비해 아직 부족한 상태이다.
(4) 유전자 치료제
|
표 4-2-2-6 |
국내 유전자 치료제 임상개발현황
|
개발자 |
제품명 |
대상질환(임상시험 단계) |
유전자전달체(치료유전자) |
|
바이로메드/ 동아제약 |
VMDA3601 |
허혈성 지체질환 (임상시험 2상) |
Plasmid DNA (VEGF) |
|
동아의대 |
JX-594 |
간암 (임상시험 1상) |
Vaccinia virus (TK- & CSF) |
|
바이로메드/ 이연제약 |
VM202RY |
허혈성 심장질환 (임상시험 1상) |
Plasmid DNA (HGF) |
|
코오롱 생명공학 |
TissueGene-C |
골관절염 (임상시험 1상) |
Retrovirus (TGF-β) |
|
바이로메드 |
VM106 |
만성 육아종 질환 (임상시험 ½상) |
Retrovirus (gp91) |
|
뉴젠팜 |
Theragene |
전립선암 (임상시험 2상) |
Adenovirus (TK &CD) |
출처 : 자체조사
이 분야의 연구개발은 소수의 기업에서 활발히 진행하고 있다. 현재 바이로메드가 한국과 미국에서 심혈관질환 유전자치료제 임상시험을 진행하는 것을 비롯하여 3개의 제품에서 4건의 임상시험을 수행하고 있으며, 이 외에도 동아제약, 코오롱생명공학 등의 업체가 유전자 치료제 임상시험을 진행 중이다[표 4-2-2-6].
라. 발전과제
국내 바이오신약 관련 기업들의 연구개발은 최근에 활발히 진행되고 있고, 특히 일부 벤처기업의 연구개발 수준은 거의 선진국 수준에 이르고 있다. 그러나 바이오의약산업의 주축이 되는 제약기업들의 연구개발은 신규성이 있는 제품 개발보다 기존의 제품을 모방하거나 개량하는 연구에 많은 투자를 하고 있는 실정이다. 또한 연구개발에 투자하는 규모도 선진기업에 비해 아직 많이 부족한 상황이다.
최근 정부는 바이오의약산업의 중요성을 인식하고, 차세대 성장동력사업으로 바이오신약/장기 사업단을 구성하여 바이오신약의 연구개발에 많은 관심을 기울이고 있으며, 지속적인 지원을 하고 있다.
국내 대학 및 연구소의 생명공학 관련의 연구가 정부지원에 힘입어 급속히 성장해 가고 있으며, 세계적으로 유명한 학술지에 다수의 우수 논문을 내고 있다. 따라서 앞으로 바이오 신약개발에 근원이 되는 원천기술개발과 함께 다수의 신약 타겟이 발굴되리라 기대된다. 그리고 이러한 대학 및 연구소의 연구개발의 활성화는 장기적으로 우수한 연구개발 인력을 배출하게 함으로써 우수한 산업화 인력을 공급하는 데 기여할 것이다.
국내 바이오의약산업의 세계적인 경쟁력을 확보함에 있어 다양한 요소가 요구된다. 기업의 연구개발 투자 확대, 대학과 연구소의 우수한 연구결과 창출 및 우수한 인력배출과 함께 정부의 지속적인 연구개발 지원 및 산업화 지원, 민간자본의 바이오산업에 지속적인 투자 등이 필요하다.
그러나 현 시점에서 바이오산업의 선진화를 앞당기는 데 더욱 절실히 요구되는 것은 이러한 다양한 요소들이 적절히 융화될 수 있는 국가적 시스템 및 효율적 방법을 구축하는 것이다.

가. 바이오장기의 개요
(1) 바이오장기의 정의
장기 이식 수술은 말기 장기부전환자에서 생명을 연장시키고 기능을 회복시킬 수 있는 유일한 치료방법이다. 바이오장기란 생명공학적 기법을 이용하여 바이오장기를 개발 및 생산하여 사람에게 이식할 수 있는 장기, 조직 및 세포를 말한다.
(2) 바이오장기 이식의 필요성
장기 이식 수술은 말기 장기부전환자에서 생명을 연장시키고 기능을 회복시킬 수 있는 유일한 치료방법이다. 최근 평균 수명의 연장으로 말기 장기부전 환자들이 급증하는 추세이나, 타인으로부터 공급되는 장기의 절대수가 매우 부족한 상황이므로 바이오장기의 개발 및 생산은 보건의료 산업에서 중요한 분야라 할 수 있다.
(가) 장기 수요 ․ 공급 현황
전 세계적으로 장기이식 수요는 급증하고 있으나 공급은 제한되어 이식대기자 수가 지속적으로 증가되고 있다[그림 4-2-3-1]. 뇌사자 이식이 활성화 되어 있는 미국의 경우 연간 신규로 발생하는 장기이식 대기자 중 60%는 장기 공여를 통한 이식으로 새로운 삶을 살게 되지만, 매년 6,000여 명 이상은 이식을 받지 못한 채 사망하고 있어 시간이 지날수록 누적 이식대기자 수가 가파르게 증가하고 있다[그림 4-2-3-2].

출처 : UNOS 2007
|
그림 4-2-3-1 |
미국내 장기 이식 수요 및 공급 현황(UNOS38) 2007 현재)

출처 : UNOS 2007
|
그림 4-2-3-2 |
미국내 장기 이식대기자 사망 현황(UNOS 2007 현재)
국내 장기 이식률은 2006년 이식대기자 9,587명 중 1,668명이 이식을 받아 17%의 이식률을 보이고 있다[그림 4-2-3-3]. 특히 국내에서는 성인병의 증가, 사회의 고령화, 유교 문화, 핵가족의 영향으로 외국보다 이식 장기에 대한 수요와 공급이 심한 불균형 현상을 보이고 있다. 이러한 결과로 불법 장기 매매가 성행하고 있으며, 최근에는 국내보다 의료기술 수준이 낮은 국가에서 장기를 이식받는 사례가 증가되어 외교적, 법률적 문제로 비화되고 있다.

출처 : KONOS, 2006
|
그림 4-2-3-3 |
국내 장기 이식 수요 공급 현황(KONOS39) 2006년)
![]() (나) 대체 장기 확보 방안으로 바이오이종장기의 필요성
(나) 대체 장기 확보 방안으로 바이오이종장기의 필요성
장기 부전 환자를 위한 대체 장기 확보방법으로 줄기세포 응용, 생체조직공학 응용, 이종장기 등이 있다[표 4-2-3-1]. 줄기세포를 이용하는 방법은 아직 세포 분화에 대한 이론적 토대가 마련되어 있지 않아 상용화까지는 많은 시간을 기다려야 하는 상황이다. 자가 혹은 타인의 세포를 조직 공학적 방법으로 가공하여 연골, 뼈, 피부로 활용하는 세포이식 제작에 응용되고 있으나, 이런 방법으로는 여러 종류의 세포가 구조를 형성하여 기능을 하는 장기를 제작하는 데 많은 어려움이 있다. 이종 장기는 이식하여 생착될 경우 부전된 기능을 즉시 회복시킬 수 있어 대체 장기로 사용 가능하다.
|
표 4-2-3-1 |
장기를 대체할 수 있는 방법
|
장기 대체방법 |
심장 |
신장 |
간장 |
폐 |
|
동종이식 |
현재적용 중 |
현재적용 중 |
현재적용 중 |
현재적용 중 |
|
인공장기(기계적장기) |
현재적용 중 |
개발 중 |
현재적용 중 |
개발 중 |
|
인공장기(바이오장기) |
- |
개발 중 |
- |
- |
|
이종장기 |
개발 중 |
개발 중 |
개발 중 |
개발 중 |
|
세포이식 |
개발 중 |
- |
개발 중 |
- |
|
조직공학 |
개발 중 |
개발 중 |
개발 중 |
- |
출처 : Yang YG and Sykes M, Xenotransplantation : Current status and a perspective on the future. Nature Reviews Immunology, 7: 519~864, 2007
(3) 바이오장기 공급원
영장류는 번식이 잘 안 되고, 사람에게 치명적인 바이러스를 보유할 위험이 있는 희귀동물이어서 이종장기 제공 대상에서 제외되었다. 바이오장기의 공급원으로 현재 가장 많이 사용되고 있는 것은 미니돼지의 장기이다. 미니돼지는 인간과 비슷한 크기의 장기를 지니고 있으며 생리적 특성에서도 유사점이 많고, 다산성으로 어미 한 두가 연간 20마리 이상의 새끼돼지를 생산할 수 있어 이식용 장기의 대량공급이 가능하다.
또 이식 대기 시간 없이 즉시 수술이 가능하다. 다시 말해 뇌사자 이식과는 달리 환자에게 이식이 적합한 장기를 사전에 준비하여 계획된 이식 수술을 받을 수 있다.
간염이나 AIDS 바이러스와 같은 인체에 치명적인 감염원 회피가 가능하고 무균돼지의 사육기술이 확립되어 인간에게 유해한 병원균이 제거된 장기를 얻을 수 있다는 것이 장점이다.
또한 돼지 세포 표면에 존재하는 당항원(sugar)에 의한 초급성 면역거부 반응이 문제가 되었으나 유전공학 기법을 이용한 형질전환 돼지 생산으로 이를 극복할 수 있게 되었다.
나. 바이오장기의 해외 동향
(1) 바이오장기 산업 출현 및 발전
1990년 들어서면서부터 바이오이종장기 생산 전문 기업들이 활성화되었다. Nex Tran사는 형질전환 돼지를 생산하여 1995년 형질전환 돼지 간 이식 임상시험이 FDA의 허가를 받았다. Alexion사는 척수 손상 환자에게 돼지 신경세포를 이식하였다. PPL-Therapeutics사는 1997년 복제양 ‘Dolly’를 만든 Roslin 연구소의 복제 기술을 상업화하여 2000년에 세계 최초로 형질전환 돼지의 복제에 성공하였다[표 4-2-3-2].
|
표 4-2-3-2 |
바이오장기 생산 기업
|
기 업 명 |
개발 장기 및 세포 |
산업화 내용 및 적용질환 |
|
Advanced Cell Technology |
신장, 심장 |
복제 및 형질전환 기술 |
|
Alexion Pharmaceuticals |
신경세포 |
복제돼지 생산 - 파킨슨씨병과 척수손상 |
|
Modex |
조직공학 |
조직세포와 생체재료를 이용한 조직 공학적 바이오장기 |
|
Circe Biomedical |
간, 췌장 |
돼지세포 생산 : 체외 바이오 인공 간 |
|
Advanced Material Design |
조직공학 |
생체재료를 이용한 인공장기․의료용구 |
|
Immerge Bio Therapeutics |
신장, 심장 |
형질전환 돼지 생산 |
|
Nextran/Baxter |
간 |
형질전환 돼지 생산 |
|
PPL Therapeutics |
신장, 심장 |
형질전환 및 복제기술을 접목한 형질전환 복제돼지 생산 |
출처 : 연구개발동향, 한국보건산업진흥원
(2) 바이오장기 기업의 합병 및 집중화
Revivicor Inc.은 PPL-Therapeutics의 후신으로 2003년 설립되어 1,3-α-Galac- tosyltransferase(GalT) 유전자 적중 돼지를 기본으로 각종 형질전환 돼지를 생산하여 연골, 뼈, 힘줄 등을 상용화하였으며 췌도를 이용한 당뇨병 치료를 위한 임상시험을 예정하고 있다. 이 기업은 Fujisawa Investments로부터 투자를 받고 있으며 University of Pittsburgh Medical Center의 지원을 받고 있다. Living cell Technologies Limited는 미국 FDA 및 뉴질랜드 MedSafe의 승인으로 돼지 유래의 당뇨병 치료 및 난치성신경질환 치료를 위한 DiabeCell, NeurotrophinCell을 생산하여 임상시험을 진행 중에 있다.
다. 바이오장기의 국내 현황
국내의 경우 보건복지부, 과학기술부가 주축이 되어 바이오이종장기개발 사업단, 장기복제이식기술 개발 사업단을 만들어 2004년부터 연구를 시작하였다. 서울대학교 Biomax 산하 특수생명자원연구센터에서는 무균 미니돼지의 생산 및 유지 기술을 확립하고 현재 70두 정도를 유지하고 있다. 2007년 2단계 사업을 시작한 장기복제이식기술 개발 사업단은 초급성거부반응을 극복할 수 있는 1,3-α-GalT 유전자 적중 돼지 및 사람보체수용체(hDAF) 형질전환 돼지 생산에 주력하고 있다. 바이오이종장기개발사업단은 면역거부반응을 최소화할 수 있는 이식용 이종장기의 생산과 면역 거부반응의 극복을 위한 효과적 방법의 모색 및 이를 바탕으로 이종이식 기술을 개발, 적용하여 만성 장기부전 환자의 구제 및 이 기술을 산업화하는 것을 최종 목표로 하고 있다. 2007년 시작된 2단계에서는 당뇨병 치료를 위한 췌도이식, 심장판막 및 각막이식의 임상적용을 위한 원숭이 전임상 실험을 시행 중에 있다. 국내 형질전환돼지 생산 관련 기업으로는 엠젠바이오, 엠티티, 칼로덤, 바이오랜드, 듀플로젠, 이노테크, 리젠바이오텍과 리젠메드 등이 있으나 정확한 현황은 파악되어 있지 않다.
라. 바이오장기의 발전 과제와 전망
(1) 바이오장기 산업의 발전 전망
(가) 바이오장기 산업 수요 증가 및 파급 효과
이식 장기 수요의 폭발적인 증가로 수급 불균형은 점차 심화될 것으로 예상된다. 아울러 장기 이식은 21세기 고부가가치 신(新)산업인 바이오산업의 제 분야가 결집되는 ‘바이오산업의 총체이자 꽃’으로 관련 바이오산업의 동반 발전 및 응용 기회를 제공할 것으로 예상한다.
(나) 시장 규모
현재 장기 이식에 따른 면역억제제의 시장 규모만 해도 2001년 기준으로 3조 4,200억원 규모에 달하고 매년 6%씩 증가되어 2010년 경에는 5조 5,050억원에 이를 것으로 예상하고 있다. 이식용 장기에 대한 수요는 연평균 5% 성장률로 증가하여 2010년 경 세계시장 규모는 760억 달러로 추산되고 있다. 미국의 장기 및 조직 이식 시장 규모는 2007년 현재 205억 달러로 추산하고 있다. 바이오장기의 주요 개발 분야인 당뇨병 치료용 췌도는 미국의 경우 1형 당뇨병 환자 1명의 1년 생존율 연장 비용이 28,700 달러가 소요(미국 UNOS 보고서, 2005년)되며, 호주는 1형 당뇨병 환자 14만 명의 치료비용이 연간 25억 달러(2006)에 이르고 있으며, 전 세계의 1형 당뇨병 환자 700만 명 중 10%가 췌도 이식 대상자라고 가정하고 다시 이 중 10%가 이종 췌도를 이식받는다고 볼 경우, 그 시장 규모는 17억 달러로 추산된다.40)
(2) 바이오장기 산업 발전을 위한 이종이식 거부반응 극복 방안
이식한 복제돼지 장기는 인체에서 초급성, 급성혈관성, 세포매개성 및 만성 거부반응을 유도한다. 이를 극복하는 것이 이종장기 이식의 최우선 과제이다[그림 4-2-3-4].
출처 : Platt JL. Xenotransplantation : Basic research and Clinical application, 2002
|
그림 4-2-3-4 |
이식 복제돼지 장기의 만성 거부반응
(가) 초급성 거부반응
복제돼지 장기를 이식 받은 환자에게서 발생하는 초급성 거부반응은 돼지 세포 표면의 당성분인 1,3-알파-갈락토즈(1,3-α-Galactose)에 대해 면역체계가 반응하여 혈청보체계와 혈액응고계의 활성화가 유발되어 이식 수분 이내에 장기 기능이 정지되는 현상이다. 그러나 초급성 거부반응은 1,3-알파-갈락토즈를 만드는 효소인 1,3-α-GalT 유전자 적중 돼지 및 사람보체수용체(hDAF) 형질전환 돼지를 개발함으로 극복할 수 있다. 이 기술과 관련하여 1,3-알파-갈락토즈 유전자 적중 돼지의 심장 및 신장을 원숭이에 이식하여 180일 이상 생존시킨 결과가 2005년에 보고 된 바 있다.
(나) 급성혈관성 거부반응
자연항체, 자연 살해(nature killer) 세포와 단핵구에 의한 혈관내피세포 활성화에 기인하며 활성화의 주요 원인인 알파-갈에 대한 유전자적중 기술, 혈청보체 조절인자 형질전환 돼지 제작 기술 및 혈관내피세포 안정화, 내피세포유래 면역 매개물질 조절, 혈소판 기능조절로 극복 가능할 것으로 예상된다.
(다) 세포매개성 거부반응
다양한 이종항원이 직ㆍ간접 항원 전달 방법에 의해 면역세포 활성화에 기인하며 동종이식에서 사용되었던 면역억제 방법의 응용이나 면역관용 유도로 극복하려는 노력이 활발히 시도되고 있다.
(3) 형질전환 복제 돼지의 생산
장기이식 관련 유전자의 검색, vector 제작, 체세포 유전자 적중 기술 등을 통하여 이종 장기 이식에 최적인 형질전환 복제 돼지의 생산은 그 기반기술이 확립된 상태이며 산업화가 활발히 진행되고 있다[그림 4-2-3-5].

출처 : De Sousa PA et al, Biol. Reprod., 2002, 66(3)L 642~50
|
그림 4-2-3-5 |
체세포 핵이식 기술을 이용한 형질전환 돼지의 생산


가. 개요
생명정보학(Bioinformatics)은 생물학 실험 자료를 이용하여, 생명현상을 정보처리학적인 현상으로 보고, 전산, 수학, 통계, 화학, 물리학 분야의 방법론과 도구를 사용하여 생명현상을 모사하여 생명현상의 궁극적 이해와 활용을 추구하는 과학학문이다.
인간유전체프로젝트 등의 초대형 생명공학 과제는 생명정보학 없이는 불가능하다. 현재 생물 분야에서 비용 대비 가장 높은 효용을 내는 분야가 생명정보학이다. BLAST 검색을 통한 상동성 비교는 필수적인 과정이 되어가고 있다.
생명정보학의 주 업무는 생물학적 데이터들의 패턴이나 연관관계를 규명하는 것이며 생물학적 정보의 수집, 처리, 저장, 배포, 분석, 해석, 가시화 등의 모든 분야를 포함하는 종합 혹은 융합학문이다. 생명정보학은 생물학과 정보학의 융합으로, IT 기술을 사람의 모든 유전자를 통칭하는 개인유전체학이나 단백질체학, 상호작용체학과 같은 작업 처리량이 많은 대량 발굴(high-throughput) 생물학 연구에 대한 실제적 이용에 초점이 맞추어져 있다. 점차 자료유도(data-driven) 생물학이 원리유도 생물학으로 바뀌어감에 따라 생명정보학은 수학, 물리, 화학, 통계학 등을 포함하는 기반 학문으로 발전하고 있고, 생물학에서의 대뇌기능 역할을 수행하게 될 것이다.
생명정보학의 가장 큰 효과를 보는 생물학 분야는 오믹스(-omics, 체학)로 표현되는 분야들로써 생물학의 연구방법 패러다임을 바꾸는 과정이 일어나고 있다. 이것은 시스템생물학, 합성생물학(synthetic biology)등과 함께 미래 생물학의 주축이 될 것이다.
나. 생명정보학 역사/배경
생명정보학은 1850년대의 다윈의 진화론과 멘델의 유전법칙의 이론적 기반에서 시작된 연구이며 생명정보학의 실질적 시작점으로 볼 수 있다. 1950년대의 DNA 구조 모델링을 통해 이중나선 구조가 제안되었고, 1960년대의 단백질 구조 해석을 위한 많은 수동/자동 전산처리작업과 알고리즘 개발이 실질적인 토대를 낳았다. 1970년대 이르러서 생거(Sanger)의 단백질과 DNA 서열 해석 기술을 이용하여 본격적으로 생물서열, 분자구조 및 그들 사이의 상동성 검색기술들이 개발되었으며, 1980년대에는 단백질 구조 접힘 문제에 대한 생명정보학자들의 연구가 활발했으며 현재 사용되고 있는 많은 통계학적, 수학적 알고리즘들을 개발하였다.
1970년에 Needleman and Wunsch의 다이내믹프로그래밍을 이용한 전산 서열 정열 알고리즘은 전산적 생명정보학의 중요한 계기가 되었다. 그 뒤, 1990년 초 ‘팀 버너즈리’라는 유럽의 CERN 연구소에서 개발된 HTTPD 컴퓨터프로그램과 HTML 양식이 보편화되면서 많은 생명정보학자들이 인터넷을 통해 정보를 유통하고 그에 필요한 기반 기술을 만들어 내면서 생명정보학은 인터넷을 타고 전 세계로 번졌다. 생명정보학자들이 인터넷의 발전에 가장 많은 기여를 했고, 지금도 인터넷의 중요한 문제들 중 생명정보 분야에서 도출된 것이 많다.
영국 케임브리지의 생거의 바이러스와 미토콘드리아 인간 유전체 프로젝트가 90년대의 인간 유전체 프로젝트로 결실을 맺고 그동안 축적된 많은 생명정보학적 기술들이 2000년대에 와서 폭발적인 성장을 하게 된다. 생명정보학은 대량의 실험 데이터를 DB화하고 이를 이용한 개개의 유전자나 단백질의 기능과 용도 분석 등에 주력하였다.
염기서열결정(sequencing) 등에서 생산되는 유전자 서열정보 등 방대한 양의 새로운 생물학 데이터들을 저장하고 관리하기 위한 생거센터의 ACEDB와 같은 유전체 데이터베이스의 개발이 최초로 이루어졌다.
서열 간의 유사성을 분석하기 위한 FASTA와 BLAST 등의 프로그램이 미국의 Needleman and Wunsch의 기술에 더하여 개발되었고, 현재에는 Hidden Markov Model(HMM) 및 SVM과 같은 고급 통계학적 알고리즘도 사용한다.
분자생물학에서 발생하는 자료는 핵심 구성물인 유전자와 단백질에 대한 구조, 발현, 변이, 기능과 상호 작용에 대한 것이다. 생명정보학은 이런 자료에 대하여 데이터베이스를 구축하고 이를 알고리즘에 적용하여 해석하기 위한 도구를 포함한다.

출처 : 한국생명공학연구원 국가생물자원정보관리센터 자체자료
|
그림 4-3-1-1 |
생명정보학의 융합 분야
염기서열결정(Sequencing)과 유전자 발현 개요 작성, 유전형에 대한 연구가 최근의 기술 발달에 힘입어 급속히 발달하였다. Post-genomics은 유전자에 대하여 어떤 단백질이 발현되는지와 세포와 조직에서의 전체적 역할을 연구하여 유전체(genome)상의 모든 유전자의 역할을 이해하는 것을 목표로 하며, 단백질체학, SNP(단일염기변이), 마이크로어레이 등의 기법을 포함한다. Post-genomics의 최종 목표는 복잡한 생물계에 대한 통일된 관점을 보이는 것으로, 그 시작은 유전자 발현과 기능 데이터로부터 유전자 네트워크를 만드는 것이다.
분자생물학의 연구 초점이 유전체학(genomics)에서 기능 유전체학(func-tio-nal geno-mics)으로 바뀜에 따라 생명정보학의 연구방향도 이에 맞추어 확대되고 있다. Post-genomics 분야에서 필요한 여러 분야에 대한 연구가 활발히 진행되고 있다. Post-genomics 분야는 광범위한 분야의 데이터를 통합, 해석하는 것이 필요하며 이를 위한 데이터를 모으고 종합하기 위한 고도화된 체계를 만드는 것이 특정한 분야에서의 새로운 분석 도구를 만드는 것보다 더 중요해졌다.
다. 국외 동향
(1) 주요 연구기관
매우 많은 연구 기관이 존재하며 다음은 그 중 가장 대표적인 기관들이다.
(가) 미국생명공학정보센터 (NCBI : www.ncbi.nih.gov)
미국 NIH의 생명정보학 부서로 컴퓨터를 활용하여 생물학 및 의학 분야의 방대한 데이터를 분석하기 위한 DB를 구축하고 분석도구를 개발하는 것이 주요 임무이다. 가장 널리 쓰이는 분석 도구인 BLAST 서열 검색용 프로그램 등을 개발하였다. 이 센터는 미국에서 생명정보학의 중앙통합의 중추이며, 세계에서 가장 강력한 생명정보기관으로 생물학적으로 중요한 분자의 구조와 기능을 분석하기 위한 컴퓨터 정보 처리 기술 연구, 수학적, 전산학적 방법을 사용한 생물학 및 의
|
표 4-3-1-1 |
생물학 분야에서의 연구 대상, 실험 기법 및 해석 방법
|
Proteins Biology Genes |
Tools & Assays |
Interpretation |
|
Genome sequences Protein structure
|
DNA sequences
Protein sequences Mass Spectrometry X-ray crystallography NMR |
Sequence assembly Hidden Markov model Sequence Homology Genome structure Repeat sequences Protein modeling Structure homology Structure predictions |
|
Genetic variation
Protein variation
|
Genotyping Mutation detection Alternative splicing Post translational modification SNP chips Phase display Protein modification |
SNP association studies CNV association
Protein comparisons
|
|
Gene expression Protein expression
|
EST Microarrays 2-D gels Protein chips Mass Spec Chromatography |
Gene clustering Image comparisons Mass Spec-Protein ID
|
|
Gene function
Protein function
|
Gene knock-ins, knock-outs, knock-downs Monoclonal antibodies Protein-protein interactions |
Gene ontology Comparative genomics Functional annotation Functional prediction
Functional annotation Functional prediction
|
|
Genetic networks Systems biology |
Computational integration Gene regulation network
Protein-Protein Interaction
|
Pathway reconstruction Pathway modeling
Biological models Simulations Comparative Interactomics |
|
Synthetic Biology
|
Genetically engineered machines |
Construction of artificial biological objects |
출처 : 한국생명공학연구원 국가생물자원정보관리센터 자체자료
학적 문제의 분자 수준에서의 연구, 분자생물학, 생화학, 유전학에 대한 지식을 저장, 분석하기 위한 자동화 시스템 개발, DB와 S/W개발, 생명공학 기술 정보 수집, 연구소, 학회, 산업체, 정부 기관 등과의 협력, 과학적 정보교환 강화, 전산생물학의 기초 및 응용 연구 훈련 지원, 다양한 DB와 S/W의 사용 지원, 데이터 축적 및 교환, 생물학적 명명법의 표준 개발 등의 활동을 하고 있다. NCBI에서 개발되는 모든 데이터와 알고리즘은 무료로 소스코드와 함께 배포되고, NCBI는 연구소와 같이 협력하는 기업을 통해서 효율적으로 프로그램개발을 진행하는 방식을 취하고 있다. NCBI의 현재 인원은 약 400명으로 알려져 있고, 2006년 예산은 3,150억원이다. NCBI는 근거법(Public Law 100-607)을 가진 영속적 정보센터이다. 예산은 100% 정부지원(기관운영비)이다.
|
표 4-3-1-2 |
주요국가별 생명정보센터 현황
|
순 위 |
국가 |
기관명 |
주요연구내용 |
|
1 |
미국 |
NCBI (www.ncbi.nlm. nih.gov) |
• 인간, 동식물, 미생물을 총 망라한 각종 생물정보 연구 및 서비스 제공 - 핵산서열: GenBank, dbEST, dbGSS, UniGene 등 데이터 베이스 구축 및 서비스 - 단백질서열 : 분자적 진화과정에서 보존된 단백질 도메인을 나타내는 서열정령과 프로파일 데이터베이스(CDD) - 계통분류(Taxonomy 데이터베이스 제공) • 다양한 분석도구 제공 - 데이터검색(Entrez, Cubby, Citation Matcher 등) - 서열상동성 검색(Blast, PSI 등) - 핵산서열분석(e-PCR, Model Maker, ORF Finder) - 단백질서열분석(CD-Search, COGnitor, DART, TaxPlot 등) - 단백질 3차구조분석(Cn3D, VAST, Threading) |
|
2 |
영국 |
EBI (www.ebi.ac.uk) |
• 분자구조를 이용한 효소활성부위, 단백질-단백질 상호작용, 단백질-리간드 상호작용, 단백질-DNA 상호작용, 단백질 구조 및 모델링 연구 • 염색체 서열의 주석, 단백질 기능분류, 단백질 서열 모티프 발견, 데이터 마이닝, 분자생물학 온톨로지, 대상경로, 계통 생생학, 분자생물학 데이터베이스에서의 지식표현방법, 서열과 전사 패턴 연구 및 서비스 • 진화 연구를 위한 DNA와 아미노산 서열분석 방법 개발 • 마이크로어레이 기술을 이용한 유전자발현분석 및 서비스 • 모든 일차적인 단백질 서열과 핵산서열 데이터베이스들의 종합 • EBI를 운용하는 데 필요한 e-Science와 Grid기술을 연구 |
|
순 위 |
국가 |
기관명 |
주요연구내용 |
|
3 |
미국 |
TIGR (www.tigr.org) |
• 진핵생물 연구와 데이터베이스 구축 및 서비스 • 벼 데이터베이스 구축 및 annotation 정보 제공 • 감자 EST와 전사체 데이터를 종합하여 감자 유전자 데이터 베이스 구축 및 annotation 정보 제공 • TIGR와 기타 연구기관에서 수행한 기생충 유전체 프로젝트로 부터 생산된 데이터 제공 • 전 세계적으로 공개된 모든 EST 데이터에 대한 클러스터링 분석 |
|
4 |
영국 |
Sanger Institute (www.sanger. ac.uk) |
• 인간 유전체서열해독프로젝트 수행 • 유전체 서열정보의 유전자 지도제작, annotation 서비스 • 질병과 관련된 돌연변이연구 • 마이크로어레이 등을 이용한 대규모 유전자 분석연구 |
|
5 |
일본 |
DDBJ (www.cib.nig. ac.jp) |
• DNA 서열, 단백질 변이 데이터베이스 • 인간 유전체지도 및 콘티그 서열 • 여러 생물종의 유전체 데이터 검색 시스템 • 단백질 구조 및 기능 예측결과 검색 데이터베이스 구축 • SRS 통합데이터베이스 검색 시스템 운영 • Taxonomy, PDB 데이터베이스 검색 프로그램 • 단백질 2,3차 구조 예측 |
|
6 |
이스 라엘 |
와이즈만연구소 (www.weizmann. ac.il) |
• 인간 유전체 통합지도(연관지도, 물리지도, hybrid지도 통합) • GeneCards 구축(인간유전자 데이터베이스 종합 정보) • GeneCards 와 UniGene 데이터베이스 연결 • 세포막단백질 구조 예측 • 단백질 소수성/친수성 영역 분석 |
|
7 |
독일 |
MIPS (www.mips. gsf.de) |
• 진균 유전체 주석 및 데이터베이스 구축 • 식물 유전체연구를 위한 생물정보학 자원개발 • 식물 EST의 통합 분석 도구 개발 • 유럽 식물 유전체 데이터베이스 네트워크 개발 • 생물학 데이터 통합검색 시스템 구축 |
|
8 |
스위스 |
EXPASY (http://www. expasy.org) |
• 2-D page와 같은 구조와 단백질 서열의 분석 • Swiss-Prot와 TrEMBL- 단백질 순서 데이터베이스 구축 • PROSITE- 단백질 패밀리 데이터베이스 구축 • ENZYME- 효소 명명법 데이터베이스 구축 |
|
9 |
남아프리카공화국 |
SANBI (http://www. sanbi.ac.za) |
• 인간 질환관련 유전자 발현 분석 프로젝트 • 병원균내 발현유전자 분석 • 질환유전자 탐지 • 국제 생물정보학 네트워크 프로젝트 |
|
10 |
일본 |
GenomeNet (www.genome.jp) |
• 그래프 비교 및 특성탐지 알고리듬, 유전체 서열분석, 유전자 발현 프로파일 분석 • 단백질-단백질 상호작용, 단백질-ligand 상호작용, 세포막 단백질 예측 |
|
11 |
중국 |
북경대 생물정보학 센터(www.cbi. pku.edu.cn) |
• 핵산, 단백질 서열 분석 • 인간 유전체 데이터베이스 구축 |
출처 : 한국생명공학연구원 국가생물자원정보관리센터 자체자료
(나) EBI(www.ebi.ac.uk)
유럽의 대표적인 생명정보 연구기관으로 생명정보학 분야 순수 및 응용연구, 생물학 DB 구축, 관리, 제공, 데이터의 저장 및 개발 지원, 생명공학, 화학, 제약 기업 등의 산업체 지원 등의 활동을 하고 있으며, 자동화된 동시분석 등의 도구를 제공하고 있다. 미국의 NCBI에 대항하기 위해서 정치적으로 EU에서 설립한 기관이며, EMBL의 한 부설 기관으로 되어 있다. 영국 케임브리지에 있으며, 세계에서 가장 강력한 생명정보연구기관 중의 하나로, 미국의 NCBI와 계속해서 경쟁할 기관이다. 2001년 생명정보학 전문가인 Janet Thornton 박사로 교체되면서 연구개발, 운영 면에서 비약적인 발전을 거두고 있다.
현재 연구비 지원 및 수주가 확대되고 있고, 유럽의 생명정보학센터로서의 위상이 확고해지고 있으며, 실용적인 연구개발 이용 건수가 확대되고 있다. 이 연구기관의 기술수준은 5년내 미국의 NCBI를 능가할 수 있는 유럽의 생명정보학 강국이 될 수 있을 정도의 실력이다.

출처 : 유럽생명정보학연구소 홈페이지, 2005
|
그림 4-3-1-2 |
EBI 전경. 영국 케임브리지 소재
(다) DDBJ(www.ddbj.nig.ac.jp)
미국의 NCBI와 유럽의 EBI에 상응하는 일본의 생명정보학 전문 기관으로 많은 양의 생명정보 미러링(mirroring)41)을 하고 있으며 자체적인 DB 구축과 함께 연구도 매우 활발하다. 그러나 DDBJ는 역동적으로 IT를 활용한 연구개발을 못 하고 있어 향후 10년 내에 중국과 한국에 비해 그 역량이 감소될 것으로 판단된다. 가장 큰 문제는 DDBJ의 성격이 데이터의 등록에 맞춰져 있고, 새로운 뛰어난 인력의 수급이 현재 일어나지 않고 있다는 것이다.
(라) TIGR(www.tigr.org)
크레이그 벤터가 주도한 유전체 서열해석 기관이다. 다양한 생물의 유전체 구조와 기능 분석 및 비교유전체학을 연구하고 있다. 많은 종류의 미생물과 진핵 생물에 대한 유전체 DB를 제공하고 있다.
(마) SIB(Swiss institute of bioinformatics)
SIB는 EBI 설립 이전부터 존재한 유럽의 중요한 생물정보 연구 서비스 기관이다. 대표적인 종합적 단백질 분석 서버인 ExPASy(expert protein analysis system)을 운영하고 있으며, Swiss-prot, TrEMBL, Swiss-2D Page 등의 DB를 제공한다.
(2) 연구 분야별 대표적인 웹 사이트
현재 약 1,000여 가지의 거대 생물학 분야 DB가 존재하며 대부분 웹을 이용하여 사용할 수 있도록 되어 있다. 각 웹 사이트는 DB를 제공하거나 DB를 검색, 분석할 수 있는 프로그램을 사용할 수 있는 웹 인터페이스를 제공한다. 또 널리 사용되고 있는 공개 DB나 해석용 프로그램을 구할 수 있다. 제공되는 정보의 활용도를 높이기 위하여 웹 인터페이스뿐 아니라 프로그램적으로 접근할 수 있는 방법, XML형식 등으로 정보를 제공하는 곳이 증가하고 있다. 여러 분야에 걸쳐 포괄적이고 종합적인 정보를 제공하거나, 특정한 분야에 특화되어 있는 사이트도 많다. 특히 유전체학(Genomics) 분야에 대한 많은 DB와 해석용 프로그램이 존재하며 이는 웹을 이용하여 쉽게 구할 수 있다. [표 4-3-1-3]은 각 분야에 대하여 포괄적인 정보를 얻을 수 있는 대표적인 웹 사이트이다.
|
표 4-3-1-3 |
공공 생물정보 데이터베이스들
|
분 야 |
DB 이름 |
U R L |
|
Biomedical Literature |
PubMed |
http://www.nlm.nih.gov/ |
|
Nucleotide |
Genbank |
http://www.ncbi.nih.gov/ |
|
DDBJ |
http://www.ddbj.nig.ac.jp http://www.ddbj.nig.ac.jp |
|
|
EMBL |
http://www.ebi.ac.uk/ |
|
|
MGDB |
|
|
|
GSX |
|
|
|
NDB |
|
|
|
Protein sequence |
Swiss-prot |
http://www.expasy.ch/sprot/sprot-top.html |
|
TrEMBL |
http://www.expasy.ch/srs7 |
|
|
PIR |
http://www-nbrf.georgetown.edu |
|
|
3D structure |
PDB |
http://www.rcsb.org |
|
MMDB |
|
|
|
Enzyme and compounds |
Ligand |
http://www.expasy.ch/sprot/enzyme.html |
|
Protein functional sites |
PROSITE |
http://www.expasy.ch/prosite |
|
BLOCKS |
http://www.blocks.fhcrc.org |
|
|
PRINTS |
http://www.bioinf.man.ac.uk/dbbrowser/PRINTS/ |
|
|
ProDom |
http://prodes.toulouse.inra.fr/prodom/doc/ prodom.html |
|
|
Pfam |
http://pfam.wustl.edu |
|
|
SMART |
http://smart.embl-heidelberg.de |
|
|
TIGRFAMs |
http://www.tigr.org/TIGRFAMs |
|
|
Protein 3D folds |
SCOP |
http://scop.mrc-lmb.cam.ac.uk/scop |
|
CATH |
http://www.biochem.ucl.ac.uk/bsm/cath_new |
|
|
Transcription factor |
TRANSFAC |
http://transfac.gbf.de/TRANSFAC |
|
Protein interactions |
PSIMAP |
http://psimap.org/ |
|
BIND |
http://www.bind.ca |
|
|
DIP |
http://dip.doe-mbi.ucla.edu |
|
|
Protein pathways |
KEGG |
http://www.genome.ad.jp/kegg |
|
EcoCyc |
http://www.ecocyc.org |
|
|
WIT |
http://wit.mcs.anl.gov/WIT2 |
|
|
Metabolic pathway DB |
PathDB |
|
|
Ortholog groups |
COG |
http://www.ncbi.nlm.nih.gov/COG |
|
Microarray |
SWISS-2DPAGE |
http://www.expasy.ch/ch2d/ch2d-top.html |
|
Gene expression |
|
|
|
Controlled vocabulary |
GO |
http://www.geneontology.org |
출처 : 한국생명공학연구원 국가생물자원정보관리센터 자체자료
|
표 4-3-1-4 |
국가별 생명정보 기관 보유수
|
순위 |
국가 |
2006년 보유현황 |
2016년도 예상 |
|
1 |
미국 |
312 |
809 |
|
- |
국제컨소시엄 |
114 |
296 |
|
2 |
영국 |
69 |
179 |
|
3 |
독일 |
57 |
148 |
|
4 |
일본 |
42 |
109 |
|
5 |
유럽컨소시엄 |
29 |
75 |
|
6 |
브라질 |
25 |
65 |
|
7 |
중국 |
22 |
57 |
|
8 |
프랑스 |
19 |
49 |
|
9 |
호주 |
14 |
36 |
|
10 |
한국 |
10 |
100 |
|
11 |
캐나다 |
9 |
23 |
출처 : GOLD: Genomes OnLine Database Homepage, 2006.11
전 세계 생명정보 센터에 대한 데이터베이스인 GOLD를 바탕으로 국내 센터들을 조사한 결과 2006년 현재 총 10개의 거점이 있으며, 향후 10년 뒤 10배 성장을 이룬다면, 100개의 거점을 확보하여 세계 5위에 도달할 것으로 예상됨. 다른 나라들의 성장률은 10%로 산정함
(3) 업계 동향
대표적인 업체로는 Accelrys Inc, Structural Bioinformatics Inc, Compugen, App-lied Biosystems, Incyte Genomics, Lion Bioscience, Gene Logic, IBM Life Sciences, Informax, CuraGen, Affymetrix, Amersham Biosciences, TimeLogic, Sun Microsystems, Silicon Genetics, 3rd Millennium 등을 들 수 있다. 한국에서는 ISTECH(www.istech21.com), OITEK(www. oitek.com)과 Smallsoft(www. small-soft.co.kr) 등의 회사가 있다.
세계적으로 생명정보 포탈 비즈니스가 2006년부터 등장하기 시작하여 구글(Google) 등과 연계하여 많은 인터넷 접속자가 생명공학 회사들의 광고를 클릭하게 만들어서 현금을 마련하는 형태가 생겼다. 예를 들면, http://biodirectory.net/, http://bioinformatics.net/, http://argosbiotech.de/, http://canbiotech.com, http://bioportfolio. com 등이 있다.
앞으로 신약이나 생명정보학의 핵심 알고리즘을 이용한 비즈니스가 성숙하기 전까지 생명정보를 활용/유통 시키는 시장과 회사들이 성장하고, 정보 중개인 역할을 통한 현금 조달이 2010년까지 지속될 것으로 추정된다. 이들 회사들은 기존의 생명정보 공공기관, 대학 교수연구실 등과 경쟁 및 협력을 계속할 것으로 보인다. 그러나 생물학에서의 생명정보 도구와 DB 사용이 점차 증가함에 따라 손쉬운 상업적 이용을 원하는 소비자들이 증가할 것으로 파악되며 2010년 이후 현재의 구글이나 야후와 같은 바이오정보 포탈 업체가 광고 등을 통한 사업을 활발히 할 것으로 예측된다.
한국에서의 생명정보학은 2000년대 초기의 지나친 기대감에서 비롯된 과잉투자 및 전문가에게 제대로 투자되지 못하는 등의 문제로 2004∼5년 연구비와 그 성과가 매우 저조하였으나, 2006년 이후 실수요와 실제적으로 활동하는 전문가의 수가 늘어남에 따라 점차 시장이 새로 형성될 것이며 2007년 이후 상업화에 완전히 진입할 만한 요소들이 나올 것으로 전망된다.
생명정보학 업체가 제공하는 서비스로는 다음과 같은 분야가 있다.
■생명정보 S/W : 생명정보 데이터의 시각화와 번역, 분석에 관한 S/W 패키지 제작 및 판매
■생명정보 서비스 : 생물정보 데이터베이스를 구축, 관리하면서 전 세계의 관련 기업이나 연구자들에게 연구개발 관련 정보 제공
■생명정보 인프라 제공: 초고속의 데이터 처리와 데이터베이스 운영에 필요한 IT 시스템을 구축, 서버, 스토리지 등 생명정보 인프라 제공
■생물정보학 교육 : 국가생물자원정보관리센터(KOBIC)와 같은 전문 생명정보학 연구기관이 지속적으로 교육을 진행해오고 있고 개인수준과 학교에서의 교육이 지속적으로 늘어남
* 참고로, 2008년부터는 과학기술 연합대학에서 “생명정보학과”가 신설되어 생명정보학 연구원의 배출이 가능해질 것으로 파악된다.
기존에는 각 업체들이 대부분 한 분야에 특화되어 있었다. 현재는 유전체학 이외에 마이크로어레이, 단백질체학이나 상호작용체학 등 다른 분야에 대한 도구나 솔루션 개발 등을 확대하고 있다.
Merck & Co-Rosetta Inphar-ma-tics, Lion Bioscience-Trega Biosciences MedImmune-Aviron, Lion Bio-Scinece-Paradigm Genetics, Merck-Celera Genomics 간의 전략적 제휴나 M&A를 통한 연구 개발과정에의 직접 참여가 증가하고 있다. 또 거대 IT 업체인 IBM, Sun Micro-systems, HP, Oracle, Hitachi 등의 업체가 생명공학 분야에 진출하여 IT 인프라 이외에도 tool, solution의 개발 등에 많은 투자를 하고 있다.
계속 진행되고 있는 염기서열분석, 생성되는 데이터의 증가, 마이크로어레이 분석, 단백질체학, 약물유전체학(pharmacogenomics) 연구 등은 생명정보학의 활용을 필요로 하며 이는 생명정보학 시장에 새로운 기회를 제공한다. 보다 광범위한 자체 제품과 역량을 지닌 회사가 생존할 것이며 차후 급격한 성장을 하게 될 것이다.
(4) 최근의 연구 방향
(가) 연구 분야의 변경
많은 대학, 연구소, 회사들은 유전체학의 다음 단계인 오믹스(http://omics.org, 체학), 시스템생물학 등으로 빠르게 연구개발의 초점을 바꾸고 있으며 이 분야에 대한 생명정보학 연구가 진행되고 있다. 앞으로 생물학 전체가 오믹스의 각종 옴(ome)으로 재편되는 날이 올 것으로 기대된다.
(1) 개인 유전체시대 (Personal genomics)
미국은 1990년 말부터 연구비 1,000 달러 상당의 유전체 관련 연구를 진행해 오다가 2000년대 중반에 실질적인 기술과 연구비를 가지게 된다. 2010년 경 모든 개인들의 유전체를 약 100만원에 해석하고 그에 맞는 개인 유전체학과 개인 맞춤의학 프로젝트를 하고 있다.
선두 그룹으로는 하버드의 George Church이다. 이에 따라 생명정보학의 중요한 한 분야로 다시 유전체 서열분석이 대두되고, 이번에는 대량의 정보를 빨리 처리하는 데 초점이 맞춰질 것이다. 아래는 2005년까지의 Genbank의 서열등록 건수를 국가별로 표시한 것이다. 미국은 개인 유전체기술이 실용화되는 2010년부터 현재의 52%에서 거의 대부분을 차지하는 수준으로 그 격차가 벌어질 것으로 전망된다.
|
표 4-3-1-5 |
국가별 서열 데이터베이스(GenBank) 서열 등록 건수 2005년
|
순위 |
국가 |
2005년도 등록 건수 |
점유도 (%) |
2016년도 예상 등록 건수 |
예상 점유도 (%) |
|
1 |
미국 |
5,767,527 |
53.1 |
16,455,428 |
52.4 |
|
2 |
일본 |
2,931,670 |
27.0 |
8,364,397 |
26.6 |
|
3 |
영국 |
641,045 |
5.9 |
1,828,976 |
5.8 |
|
4 |
캐나다 |
426,896 |
3.9 |
1,217,984 |
3.9 |
|
5 |
중국 |
221,469 |
2.0 |
631,877 |
2.0 |
|
6 |
독일 |
207,178 |
1.9 |
591,103 |
1.9 |
|
7 |
브라질 |
106,751 |
1.0 |
304,573 |
1.0 |
|
8 |
프랑스 |
95,416 |
0.9 |
272,233 |
0.9 |
|
9 |
스웨덴 |
88,217 |
0.8 |
251,693 |
0.8 |
|
10 |
한국 |
61,097 |
0.6 |
600,000 |
1.9 |
|
11 |
스페인 |
39,009 |
0.4 |
111,297 |
0.4 |
출처 : Distribution Of Submissions To NSDC(Individual),
* 국제 서열 데이터베이스인 GenBank에 국내 서열등록 건수에 대한 2005년 조사 결과 6,107건으로 세계 10위에 이르고 있으며, 향후 10년 뒤 10배 성장을 이룬다면 600,000만건 등록으로 세계 5위에 도달할 것으로 예상됨. 다른 나라들의 성장률은 10%로 산정함
(2) 변이체학시대(Variomics)
개인유전체시대가 왔을 때, 실질적인 결과물은 각각의 개인이 서로 어떻게 다른가라는 것에 대한 답들이다. 이것을 간단하게 변이체학이라고 말한다. 변이체학은 SNP 정보가 칩을 사용하여 대량으로 유통되면서 형성되었다. 돌연변이들의 차이는 개인 맞춤의학 분야의 기초 데이터이다.
(나) Data의 통합의 필요성
유전체학에서는 주로 염기서열 자료(sequencing data)에 대하여 이를 데이터베이스화하고 정리, 분석하기 위한 정보학으로 다루는 데이터가 비교적 간단하였다. Post-genomics에서는 [그림 4-3-1-3]과 같이 매우 다양한 데이터를 다루어야 하며 이를 통합 운영하고, 여기에서 유용한 지식을 추출하는 것이 중요하다. 이를 위한 지식 관리와 통합 기술에 대한 관심이 증대되고 있으며, 이러한 통합은 아래의 내용을 포함하며, 과학적 연구에 집중할 수 있도록 하여 연구의 최적화를 이룰 수 있게 해 준다.

출처 : 한국생명공학연구원 국가생물자원정보관리센터 자체자료
|
그림 4-3-1-3 |
Data의 통합과 mining(Front Line)
■광범위한 sources로부터의 데이터 접근
■데이터와 여러 종류의 응용 프로그램과 도구의 기능을 통합 사용
■데이터를 안전하게 저장하고 이를 쉽게 관리
■지식 창출을 위한 협력
■새로운 응용 분야의 통합
통합 방법으로 여러 DB에 걸친 질의, hyperlink의 이용, 관절 통합, 자료 저장소 등의 방법이 사용되고 있으며 현재는 XML을 기반으로 하는 웹 서비스가 큰 관심을 받고 있다.
최근에 특이한 현상으로 한국의 국가생물자원정보관리센터(KOBIC)가 가장 먼저 추진한 웹 2.0 형태의 바이오위키(Biowiki: biowiki.net)와 같은 사용자 참여 형태의 데이터베이스 및 정보교환 포탈들이 생겨나고 있다. 앞으로 생명정보는 보다 사용자의 참여를 포함하는 위키, 블로그 등의 형태도 취하는 복합형으로 개발 되어 나갈 것으로 파악된다. 예를 들면, 세계에서 가장 많이 쓰이는 생명정보 분야 단백질 데이터베이스인 Pfam은 Wikipedia와 연계하여, 사용자들이 실시간으로 단백질 정보를 개선할 수 있도록 서비스를 2007년부터 시작했다.
(1) 워크플로42)(Workflow engine)기반의 정보통합
2000년대 중반에 두드러지게 나타난 생명정보 분야의 경향은 Taverna, Biomoby 및 Bioworkbench 등으로 대표되는 다양한 생명정보 인프라의 체계적인 통합기술이다. 생명정보학의 실질 핵심 기술은 대량화 및 통합화에 있는데, Workflow engine은 이러한 문제를 가장 깨끗하게 처리하는 IT 기술 분야이다.
2000년대 말까지 이러한 통합 프레임들이 점차 기존의 산발적인 프로그램과 서버를 능가하기 시작하여, 2010년 이후에는 많은 생명정보서비스가, 웹서비스(webservice) 표준을 따르는 워크플로엔진들에 의할 것으로 판단된다. 이러한 추세에 맞춰서 이미 상용화된 생명정보전문 워크플로가 출시되고 있다
(다) 생명정보학의 분야들
생명정보학의 분야는 생물학의 모든 분야와 다른 학문 분야들과 연관되어 있다고 생각할 수 있는데, 다음과 같은 매트릭스를 사용하면 한눈에 볼 수 있다. [그림 4-3-1-4]에서 알 수 있듯이, 생명정보학은 각종 ‘Omics’로 세분화 및 확장화 되고 있다(www.omics.org). 아래의 영역들에서 작용체, 기능체 및 문헌체는 생명현상의 규명과 활용에 가장 중점적인 체학들이다.

출처 : 한국생명공학연구원 국가생물자원정보관리센터 자체자료
|
그림 4-3-1-4 |
각종 체학들의 집합으로서의 생명정보 매트릭스
(라) 본체학(Ontology)과 표준화
생명정보를 효과적으로 공유하기 위해서는 사용하는 용어의 통일이 필요하다. 각 지식 분야의 주된 개념을 담기 위한 고도로 선택된 용어의 집합을 본체학(Ontology)이라 하는데 유전자 본체학 컨소시엄의 주도 하에 유전체학 분야의 본체학이 만들어졌으며, 다른 분야에 대한 ontology도 개발 중에 있다. Onto-logy의 공유를 통하여 생물학적 객체를 묘사할 수 있으나 각각의 객체에 대한 이름을 부여할 수는 없다. 따라서 LSID(Life Science Identifier) 등 각 객체에 대해 유일한 이름을 부여할 방법이 연구되고 있다.
새로운 적용 분야를 개발하고 배포하는 것은 다른 프로그램과의 연동이나 장시간에 걸친 이용을 위하여 분야별 특성을 반영한 표준에 따라야 한다. 이에 의하여 빠르고 안전하게 자료를 교환할 수 있게 되어 같은 투자에 대하여 더 많을 일을 더 효과적으로 하게 되고, 결론적으로 더 좋은 결과를 얻을 수 있다. 현재 I3C, GO, MGED, PSI와 같은 Informatics 컨소시엄에서 표준화를 위한 노력을 기울이고 있다. 많은 변수가 존재하는 마이크로어레이 실험 데이터의 표준화가 이루어져 마이크로어레이 실험 관련 논문 발표 시 MIAME 표준에 따르는 실험 데이터를 등록하도록 되었다. 분산 시스템인 서열 분야의 주석을 공유하기 위한 DAS(distributed Anno-tation System)가 사용되고 있으며, 이를 다른 분야에 확대 적용하기 위한 BioMOBY나 MyGrid 등의 프로젝트가 수행되고 있다.
|
표 4-3-1-6 |
주요 표준화 기구
|
이 름 |
분 야 |
U R L |
|
Gene Ontology 컨소시엄 |
gene annotation |
www.geneontology.org |
|
Microarray Gene Expression Data society |
마이크로어레이 |
www.mged.org |
|
Proteomics Standards Initiative |
단백질체학 |
www.psidev.sourceforge.net |
|
I3C |
|
www.i3c.org |
출처 : 한국생명공학연구원 국가생물자원정보관리센터 자체자료
라. 국내 동향
한국에서의 생명정보학 관련 관심은 높으나 실질적인 결과가 적다. 전문인 양성 수와 질도 낮다. 현재 숭실대를 비롯한 일부 학교에 생명정보학과가 생겼고, 생명정보학 관련하여 2개의 학회가 있다(유전체학회와 생물정보학회). 2008년부터는 한국생명공학연구원의 국가생물자원정보관리센터에서 주관한 연합대학원 생명정보학이 신설될 것으로 보인다.
국내 생물정보학의 연구는 정보통신부의 IMT2000기금을 바탕으로 2001년 대규모의 연구과제가 시작되었다. 그러나 2007년 현재 연구투자에 비해 그 생산물과 파급효과가 미약하고 생물학자들에게 실질적인 도움이 되는 서비스가 많지 않다. 국내 생물정보학 관련 대표기관으로는 국가생물자원정보관리센터(KOBIC)가 생명정보 전체 분야를 관장하는 국가기관으로 지정되어 있고, 현재 45명의 인원이 그 센터에 있다.
현재 국가생물자원정보관리센터(KOBIC)의 일 년 예산은 총 40억원 정도이고, 30억원이 생명공학연구원의 기관 고유사업 운영비로 지급되고 있다. 그 외에 국립보건원의 중앙유전체연구소에도 약 10명 정도의 생명정보 관련 분석 인원이 있다.
국내 생명정보학은 인프라 구축이나 관련 기업들의 역량 등 여러 면에서 선진기업 및 국가에 크게 뒤져 있으며 분석 기술, 투자 규모, 전문 인력 등의 면에서도 선진 기업에 비하여 매우 취약한 수준이다. 서열생산, SNP생산 등의 결과물을 생명정보학 기법으로 고부가가치화 하여야만 외국회사들과의 경쟁에 승산이 있으나, 그러한 지원을 할 인력과 인프라가 없는 실정이다.
또한 연구결과의 통합 및 관리가 제대로 이루어지지 않아 선진 기업 및 국가에 비해 각종 유전체 및 유전자 데이터베이스 구축에 있어 매우 뒤진 상황이라고 할 수 있다.
핵심역량 확보 노력과 함께 정부차원에서도 인프라 구축 및 관련 인력 양성 등의 지원에 적극 참여하여 흩어져 있는 연구결과를 통합할 수 있는 생명정보 데이터베이스를 개발하고 유전체학 관련 연구기관들 간의 협력과 유기적인 네트워크를 구축하며 인력 부족이 심각한 생명정보학 관련 인력을 양성하는 등의 역할을 해야 할 것이다.
또한 능동적이고 성과 위주의 호전적 경영을 위하여 미국과 유럽처럼 독립된 생명정보 전문기관의 창설도 필요하다.
최근 2005년과 2006년을 기점으로 외국에서 생명정보학과 관련된 전문 훈련을 받은 젊은 교수나 연구원들이 조금씩 국내로 들어오는 상황이지만, 이러한 인력들이 현재 적정한 연구비와 학생 조달을 받지 못하는 실정으로, 이것은 2010년 경 개인유전체 시대가 도래할 때 국내 생명정보학 분야에 심각한 문제를 일으킬 수도 있다.
|
표 4-3-1-7 |
국내 주요 생명정보학 연구 기관
|
기관명 |
주요역할 |
|
농촌진흥청-(농림부) 농업생명공학정보센터 |
○ 농업생명공학정보 데이터베이스 구축 및 서비스 ○ 국내외 생명공학정보 교류 네트워크 구축 및 확대 ○ 하부기관 -농생물유전체정보센터 : 농생물 유전체 종합정보, BLAST 분석 등 -농업유전자원정보센터 : 식물(종자은행), 농용미생물(KACC) -바이오안전성정보센터 : GMO 심사현황, 바이오안정성 정보 DB ○ 인원 : 4~ 명 |
|
한국과학기술정보연구원 (공공기술연구회) |
○ 전산학적인 기술을 이용하여 생명현상연구를 위한 IT 기반의 생명 정보 인프라 구축 ○ 인원 : 5~ 명 |
|
산림청(농림부) 산림생물정보연구실 |
○ 산림생물자원정보화 ○ 식물자원과 곤충자원에 대한 종 정보를 구축 ○ 식물 곤충의 표본정보 및 이미지 정보를 데이터베이스화 ○ 생물자원정보 공유를 위한 통합정보시스템 개발 및 운영 ○ 국가표준식물목록, 희귀식물, 귀화식물, 재배식물 등 각종생물자원정보에 관한 포털사이트 구축 ○ 인원 : 11명 |
|
질병관리본부 (보건복지부) 유전체역학정보실 |
○ 유전체 역학조사 및 역학, 임상, 생명정보 등의 정보를 분석하는 기법개발 ○ 보건복지부 내 바이오과학정보팀(바이오보건의료정보, 바이오안전성정보 등을 수집, 관리, 제공) ○ 대규모 질병건강역학조사 ○ 대량의 한국인 질환지식 정보의 확보, 분석 및 표준화 기법 개발 ○ 유전자 발현 조절 연구 ○ 바이오과학정보 생산수집관리 ○ 인원 : 20~ 명 |
|
국립암센터 (보건복지부, 7개 센터) |
○ 위암, 대장암, 유방암, 간암, 폐암, 자궁암, 특수암센터 등 7개 센터로 구성 |
|
질병유전체연구센터 (보건복지부, 12개 센터) |
○ 질환별 유전체 연구 (간 및 소화기, 근골격계, 뇌질환, 당뇨및 내분비, 면역질환, 생식및 불임, 선천성기형, 심혈관계, 조혈계, 폐 및 호흡기, 폐암유방암, 피부질환 등 12개 질환 유전체 센터) ○ 인원 : 약 600명 |
|
약물유전체사업단 (보건복지부) |
○ 약물유전체연구 |
|
임상연구센터 (보건복지부, 6개 센터) |
○ 6개 만성질환 치료지침 및 가이드 제공 |
|
국가생물자원정보관리센터 (과학기술부) |
○ 국내외 생명정보 수집, 보관, 처리, 분석 및 유통 기능 ○ 유전체정보, 생물다양성정보, 생물소재정보의 연계 추진 ○ 국내 각 부처와 기관별 생명정보의 통합 ○ 국내 각 연구소의 생명정보 처리 분석 DB 및 알고리듬 서비스 제공 ○ 인원 : 40~ 명 |
출처 : 2006년 한국생물정보학백서
아래의 [표 4-3-1-8]은 현재 한국의 유전체 관련 연구센터의 현황을 보여준다. 대부분의 유전체 관련 연구기관에 적절한 생명정보인력을 확보하지 못하여, 정보의 전산화, 처리, 통합, 연계 등에 국가적으로 비효율적인 결과를 초래하고 있다.
국내 생명정보정책에서 특이한 점이 하나 있는데, 그것은 한국이 세계에서 가장 먼저 생물자원, 생물다양성, 생명정보를 총체적으로 같이 개발 관리해야한다는 개념을 가지고 이들 분야들의 통합을 과학기술부가 주도적으로 추진했다는 점이다. 현재, 미국에서는 이러한 필요성을 인식하고 EOL(Encyclopedia of Life) 등의 프로젝트를 통해 이러한 3개의 큰 영역 간의 정보통합에 나서고 있다.
표 4-3-1-8
국내 유전체 관련 연구소 및 회사 현황
|
유전체연구센터명 |
운영기관 |
연구 대상 |
연구내용 |
주관기관 |
설립 |
|
유전체연구단 |
생명연 |
모든생물 |
동/식/미생물의 유전체 |
생명연 |
2006 |
|
식물유전체연구센터 |
생명연 |
고추 |
유전체연구단과 사업협력 |
생명연 |
2006 |
|
의약유전체연구센터 |
생명연 |
사람 |
암과 관련된 유전자연구 |
생명연 |
2006 |
|
축산유전체연구과 |
축산과학원 |
돼지 |
돼지유전체연구 |
농진청 |
2004 |
|
환경재해 극복 신호전달 및 기능유전체 연구 |
경상대 |
환경 |
환경재해 극복 신호전달 및 기능유전체 연구 |
과기부 한국과학재단 |
2004 |
|
이화실험동물유전체연구센터 |
이화여대 |
생쥐 |
형질전환마우스관련연구 |
이화여대 |
2004 |
|
골격계질환 유전체 연구센터 |
경북대병원 |
사람 |
골다공증과 관절염 |
복지부 |
2003 |
|
폐 및 호흡기질환 유전체연구센터 |
순천향의대 부천병원 |
사람 |
천식 등의 호흡기질환 |
복지부 |
2003 |
|
약물수송체유전체 중점연구센터 |
연세대 의과대학 |
사람 |
임상처방 약물의 약동 및 약력과 관계된 약물수송체 유전자 |
복지부 |
2003 |
|
병원성미생물유전체연구센터 |
질병관리본부 |
사람 |
병원성미생물 자원관리 |
복지부 |
2003 |
|
정신작용 약물 유전체 연구센터 |
고려대학교 |
사람 |
정신작용약물의 개별화된 맞춤치료 방법개발 |
복지부 |
2003 |
|
약물대사유전체연구센터 |
인제대학교 |
사람 |
주요임상약물의 이상반응, 약물동태 및 약물효능 |
복지부 |
2003 |
|
배추유전체연구팀 |
농업생명 공학원 |
배추 |
배추 및 벼 유전체연구 |
농진청 |
2003 |
|
유전체연구센터 |
충남대 |
배추 |
배추 유전체 지도 구축 |
충남대 |
2003 |
|
유전체연구센터명 |
운영기관 |
연구 대상 |
연구내용 |
주관기관 |
설립 |
|
한림유전체응용연구소 |
한림대 |
사람 |
질환관련 임상활용성 연구 |
한림 과학원 |
2003 |
|
유전체연구센터 |
충북대 |
일반 |
유전체학 및 생물정보학에 관한 연구 |
충북대 |
2002 |
|
미생물유전체활용연구사업단 |
생명연 |
미생물 |
유용미생물을 이용한 산업화 |
과기부 |
2002 |
|
간 및 소화기질환 유전체연구센터 |
아주대 의료원 |
사람 |
간 및 소화기질환 |
복지부 |
2002 |
|
조혈계질환 유전체연구센터 |
전남대 의대 |
사람 |
한국인의 조혈계 종양특이유전자의 기능 규명과 새로운 진단기법과 신개념의 치료물질개발 |
복지부 |
2001 |
|
선천성 기형 및 유전질환 유전체연구센터 |
서울아산병원 |
사람 |
선천성 기형과 유전질환원인규명 |
복지부 |
2001 |
|
피부질환 유전체 연구센터 |
성균관대 의대 |
사람 |
유전성 피부질환의 진단 및 치료 |
복지부 |
2001 |
|
폐암/유방암/난소암 유전체센터 |
고려대 안암병원 |
사람 |
폐암, 유방암과 난소암 |
복지부 |
2001 |
|
생식의학 및 불임 유전체 연구센터 |
포천중문의대 |
사람 |
불임질환 병인의 규명 및 치료전략의 개발 |
복지부 |
2001 |
|
유전체 코호트센터 |
질병관리본부 |
사람 |
한국인 DNA 수집및보관 |
복지부 |
2001 |
|
작물유전체기능연구사업단 |
서울대 |
작물 |
작물 유전자의 기능연구, 활용 |
과기부 |
2001 |
|
유전체센터 |
국립보건원 |
사람 |
사람의 질병과 관련된 유전적 소인규명 |
복지부 |
2000 |
|
심혈관계질환 유전체 연구센터 |
연세의료원 |
사람 |
허혈성 심질환, 고혈압, 뇌졸증 |
복지부 |
2000 |
|
뇌신경계질환 유전체연구센터 |
가톨릭의대 |
사람 |
뇌신경질환병인규명 |
복지부 |
2000 |
|
당뇨 및 내분비질환 유전체 연구센터 |
서울대병원 |
사람 |
한국인 당뇨병의 유전체 연구 |
복지부 |
2000 |
|
(주)솔젠트 |
대전 |
일반 |
유전체 염기서열 결정 서비스 |
민간 |
2000 |
|
인간유전체기능연구사업단 |
생명연 |
사람 |
사람의 위, 간암연구 및 활용 |
과기부 |
2000 |
|
유전체연구센터 |
삼성연구소 |
일반 |
질병관련 SNP 칩 개발 |
민간 |
1999 |
|
(주) 마크로젠 |
서울 |
일반 |
유전체 염기서열 결정 서비스 |
민간 |
1997 |
|
(주) 제노텍 |
대전 |
일반 |
유전체 염기서열 결정 서비스 |
민간 |
1997 |
|
면역질환 유전체연구센터 |
원광대 의대 |
사람 |
면역질환발병기전 |
복지부 |
1980 |
|
해양극한유전체연구단 |
해양연 |
해양 생물 |
해양극한생물 유용유전자 연구 |
해양 수산부 |
|
출처 : 한국생명공학연구원 국가생물자원정보관리센터 자체자료
마. 전망
생명정보학이 미래 생물학의 핵심 역할을 할 것은 명백하다. 현재 중요 단백질에 대하여 이름, 연관된 유전자의 이름, 반응 속도 등의 물리적 상수와 알려진 물리적, 유전적 상호 작용을 컴퓨터의 도움 없이 추적하는 것은 불가능하다.
이런 면에서 컴퓨터는 보조 두뇌의 역할을 하여 수천 개의 복잡한 분자와 그들의 상호 작용을 다룰 수 있도록 해 준다. 유전자 발현 배열 기술의 경우 컴퓨터의 도움 없이는 많은 실험이 불가능하다.
묘사적인 생물학으로부터 정량적이며 예상 가능한 생물학으로의 변천은 새롭고 막대한 양의 데이터를 발생, 저장, 공유 및 이용을 필요로 한다. 여러 가지 post-genomics 연구과정의 실험 데이터를 정리, 해석하고 실험적으로 검증할 수 있는 가설을 세우는 것에도 더욱 중요한 역할을 할 것이다.
Post-genomics 분야로의 연구 분야 확대, 데이터의 통합의 필요성에 의한 통합 방법이나 표준화 연구, 증가하는 전산 자원요구를 충족하기 위한 분산 com-puting이나 격자(grid) computing 등에 대한 연구가 활발히 진행되고 있다.
생명정보학의 중요성은 매우 크며, 모든 생물학자는 상당한 수준의 생명정보학에 대한 교육 혹은 재교육을 필요로 하게 되고, 생물학 분야에서의 필수 기반 요소 분야가 될 것이다.
산업적으로 2005년에는 많은 실수요의 생물학적 요청이 생겨나기 시작했고, 2006년부터는 기업들의 활동도 향상되었으며, 2007년 이후에는 국제적 경쟁 체제가 필요하다.
미래의 생명정보학은 생물자원정보, 생물다양성정보, 생명정보(유전체정보)등을 포괄하는 분야가 될 것이다. 국내의 IT 기술을 적극적으로 활용한 분야들의 정보통합이 이루어질 것으로 전망된다.

가. 바이오나노기술 개요
(1) 생명공학기술과 나노기술
생명공학기술(BT)은 단백질, DNA/RNA, 세포, 효소, 탄수화물 등 생명체를 구성하고 유지하기 위해 중요한 기능을 담당하는 생체분자들을 연구하는 분야이다. 생명공학기술을 통해 인체의 신비로운 현상을 밝혀내거나 사람의 몸속에서 질병이 발생하는 메커니즘을 분석하여 질병을 치료하는 물질들을 발굴하거나 개발한다. 특히 최근에는 질병에 직접적인 영향을 주는 DNA와 단백질 등의 생체분자에 대한 연구가 활발한데, 이런 분자들은 수∼수 백 나노미터 정도로 매우 작아 다루기가 힘들어 연구하는 데 큰 어려움이 있다.
나노(nano)란 10억분의 1이란 뜻으로 매우 작은 크기를 나타낼 때 사용한다. 1나노미터는 10억분의 1미터로 실리콘 원자 5개, 박테리아 1개 크기의 1,000분의 1, 머리카락의 약 100,000분의 1에 해당할 정도로 매우 작은 크기이다. 따라서 나노기술(NT)은 나노미터 크기의 물질들이 갖는 독특한 성질과 현상을 찾아내고 이러한 성질을 이용하여 매우 유용한 성질의 소재나 디바이스를 연구․개발하는 분야라고 할 수 있다.
나노크기의 세계에서는 양자역학과 고전역학의 특성들이 혼재해 독특한 효과를 볼 수 있다. 반도체 나노입자의 경우, 양자효과에 의해 그 크기에 따라서 다양한 광학적 성질을 나타내는 등 벌크 상태에서는 볼 수 없었던 특성들이 나타난다. 전자공학에서는 전자부품에 들어가는 트랜지스터의 집적도를 획기적으로 늘릴 수 있어 고용량 메모리가 가능하며 작은 크기로도 회로를 구성할 수 있기 때문에 아주 작은 칩을 만드는 것도 가능하다.
또한 크기가 작기 때문에 부피와 무게를 획기적으로 줄일 수 있을 뿐 아니라 디바이스를 움직이는 데 필요한 소비전력을 줄일 수 있다. 또한 크기가 작아질수록 부피에 비해 표면적이 증가하기 때문에 열역학적으로 표면을 구성하는 원자들은 내부에 위치한 원자들 보다 에너지가 높다. 따라서 벌크 상태의 물질들 보다 나노물질들의 단위 원자가 가지는 에너지가 높아 그 반응성이 매우 좋다. 나노표면에서는 다양한 분자들이 표면과의 계면에서 단일막의 형태로 자기조립(self-assembly monolayer)을 하기도 하여 좀 더 향상된 성능을 갖는 표면처리가 가능하다. 이처럼 나노기술은 다양한 영역에서 큰 도움을 주고 있다.
(2) 바이오나노기술
위에서 언급했듯이 사람의 몸속에서 중요한 역할을 하는 생체분자들은 나노크기를 가지고 있다. 따라서 나노크기의 물질을 다루는 나노기술을 이용한다면 효과적인 연구가 이루어질 수 있다. 바이오나노기술은 좀 더 효과적이고 향상된 연구를 가능하게 하는 바이오와 나노의 첨단 융합기술이다.
인체를 이루고 있는 나노크기의 생체분자인 DNA, RNA, 단백질, 세포 등을 연구하고 물질들을 분자 수준에서 분석하고, 인위적인 가공 및 제어과정을 통해 새로운 생물학적, 화학적, 물리적인 특성을 가진 생체 소재와 디바이스의 개발을 가능하게 한다.
이러한 특성을 이용하여 바이오나노기술은 인체의 질병을 진단하거나, 바이러스 또는 암세포를 발견․제거하고, 필요한 약물을 상처 부위로 운반해 치료하는 초소형 나노로봇의 개발 등과 같은 꿈을 실현시켜 줄 수 있는 최첨단 미래기술이라 할 수 있다. 바이오나노기술의 장점은 기존에 바이오에 사용된 도구나 디바이스들이 나노기술의 접목을 통해 소형화가 가능하여 좀 더 효과적으로 기존의 일을 대체할 수 있다는 것이다.
혈액을 채취할 때 사용되는 침을 매우 작게 만들어 통증 없이 혈액을 채취하여 건강을 체크할 수 있으며, 세포에 손상을 주지 않고 단일 세포를 직접 분석할 수 있다.
또한 나노물질의 높은 반응성 때문에 빠른 응답시간, 높은 감도와 높은 선택성을 가지고 있어 단분자 측정도 가능하여 질병을 훨씬 정밀하게 진단할 수 있다. 게다가 바이오나노기술을 통해 환자의 질병 단계를 연속적으로 모니터링 할 수 있고 수술 중 세포의 기능에 대한 실시간 감지도 가능하다. 더 나아가 시간과 장소에 상관없이 진단이 가능한 미래형 의료기기의 기본 소자로 활용되어 질병의 조기 진단 및 지능형 치료를 수행할 것으로 기대된다.
본 자료에서는 미래의 첨단융합기술 분야로 바이오나노기술의 일환인 바이오나노칩/센서, 나노생체재료, 유비쿼터스 헬스케어 시스템 등을 소개하고 향후 연구 및 발전 방향을 제시하고자 한다.
나. 해외 동향
(1) 나노바이오나노칩/센서 기술
(가) 나노바이오나노칩 기술 연구
최근 BT, IT, NT의 융합기술인 바이오나노기술이 세계적으로 주목을 끌고 있다. 이러한 바이오나노 연구 분야의 대표적인 바이오칩 기술은 좁은 면적의 칩 위에서 수많은 바이오샘플들을 동시에 분석할 수 있어 생물학적인 분석에 큰 도움을 주었다.
분석하고자 하는 바이오 콘텐츠의 종류에 따라서 DNA칩, 단백질칩, 세포칩, 조직칩 등으로 다양하게 나누어질 수 있다. 일반적으로 용어에 있어서 바이오칩과 혼용해서 사용되고 있는 바이오센서의 개념은, 특정 반응을 수행하는 바이오 리셉터와 반응의 결과를 전달하는 신호변환기로 구성되어 있다는 원리적인 측면에서 바이오칩과 유사하다고 불 수 있다. 다만 칩은 한꺼번에 많은 시료를 분석한다는 측면에서 편의상 구분을 짓는다고 해도 크게 무리가 없을 것이다.
바이오칩은 1994년 최초로 Affymetrix사에 의해 개발된 DNA 칩을 시작으로, 1990년대 후반부터 바이오칩 기술 개발의 붐이 형성되면서 마이크로/나노 어레이 기술의 비약적인 성장을 보였다. 특히 좁은 면적의 칩에 수십만 개의 DNA를 동시에 분석할 수 있어 DNA를 분석하고 연구하는 데 큰 도움을 주고 있다.
단백질을 분석하는 단백질칩(protein chip)은 수십∼수천 개 또는 수만 개의 단백질을 작은 기판 위에 고정한 후 단백질 사이의 반응을 동시다발적으로 분석하는 자동화 분석 장치로 DNA 칩과는 분석원리, 응용범위 등에서 매우 다른 바이오칩이다. 단백질칩은 인체를 구성하는 단백질이 백만 개가 넘을 것으로 추정되는 것만큼 다양한 응용범위를 가지고 있다. 단백질칩은 최근 생명공학 분야에서 post-genome 시대의 대표적인 연구 분야로 등장한 단백질체(프로테옴, Proteome) 연구의 가장 핵심적인 기술로 인식되고 있으며, 특히 인간의 질병진단을 위한 가장 중요한 기술로 인정되고 있다. 단백질체 연구는 단백질이 인간질환의 진단 및 치료제 개발의 직접적인 연구대상이라는 점, 무한한 활용 가능성 및 시장 잠재력[그림 4-3-2-1] 등 많은 중요성 때문에 대표적인 생명공학 연구 분야로 등장하고 있다. 또한 효소의 활성도 분석, 단백질의 발현 및 기능연구, 신약물질의 초고속 screening 등을 위해 매우 중요한 기술로 이용될 것으로 생각되고 있다.

출처 : Nature. Nanotechnology. 1, 126 (2006)
|
그림 4-3-2-1 |
나노 어레이 패턴
이런 바이오칩 기술을 구현하는 데 반드시 필요한 기술이 원하는 샘플을 배열하는 기술인 어레이 기술이다. 기존에 사용되는 기술은 마이크로 어레이(micro array) 기술로 원하는 단백질이나 DNA 등의 생체분자들을 칩 위에 마이크로 크기와 간격을 갖게 하여 수많은 생체분자들을 하나의 칩 안에서 동시에 분석할 수 있었다. 최근에는 마이크로 어레이에 만족하지 않고 나노 어레이(nano array) 기술이 활발하게 연구되고 있다. 나노 어레이 기술을 통해 기존의 마이크로 어레이의 한계를 넘어 훨씬 많은 생체분자들을 같은 크기의 칩 위에서 동시에 분석할 수 있다. 또한 더 작은 면적에서 반응이 일어나므로 필요한 시료의 양도 획기적으로 줄일 수 있다. 또한 나노 기술을 통해 다양한 모양을 갖는 패턴들을 나노 크기의 면적과 간격을 갖는 나노 어레이[그림 4-3-2-1]를 통해 SPR 현상을 이용하는 바이오칩 경우 나노 어레이 기술을 통해 어레이 패턴의 크기와 간격에 따른 SPR 현상이 나타나는 정도가 달라지기 때문에 칩의 감도를 조절할 수 있다.
이처럼 나노 어레이는 다양한 장점을 가지고 있으나 나노 어레이를 구현하는 것은 쉽지 않다. 현재 나노 어레이를 구현하기 위해 다양한 방법이 이용되고 있다. 주로 사용되는 방법들로는 전자를 이용하여 극미세 패터닝이 가능한 전자 빔 리소그래피(electron beam lithography), AFM tip을 이용하여 패터닝을 하는 딥펜 리소그래피(dip-pen nanolithography), 블록 공중합체를 이용한 방법들이 대표적이다.
이러한 바이오나노 기술로 구현할 수 있는 단백질칩 시스템은 크게 단백질칩과 칩 분석 장치로 구성되며 생명공학, 유기화학, 표면화학, 재료공학 등 다양한 분야의 융합이 필요한 분야이다. 특히 단백질 고정화 방법은 단백질 상호작용의 효율을 높이고 단백질의 비특이적 결합을 방지하는 데 매우 중요하기 때문에 지속적으로 연구개발이 진행되고 있는 분야이다. 칩 분석 장치는 더욱 많은 분야의 공동연구가 요구되는 분야인데, 광물리학, 전산학, 유체역학, 기계공학, 전자공학, 나노공학 등을 대표적인 분야로 들 수 있다. 이와 같은 다양한 분야에 기반을 두고 있는 단백질칩 분석 장치는 표면 플라즈몬 공명(surface plasmon resonance, SPR)을 이용한 분석, 질량분석, 형광분석, 전기화학적 분석 등 크게 4가지 핵심기술을 이용해 개발되고 있다. 최근 형광물질을 이용한 방법이 발표되고 있으나 형광 표지에 의한 입체 구조적 방해현상을 비롯하여 모든 단백질을 형광물질로 균일하게 표지해야 하는 문제점이 있다.
질량분석기술의 경우 다수의 시료를 초고속으로 분석하기 어렵다는 단점이 지적되고 있다. 따라서 단백질을 표지하지 않고 초고속으로 다중분석을 가능하게 하는 단백질칩 분석 시스템 개발을 위해 국제적으로 연구개발에 박차를 가하고 있다. 또한 무한한 가능성을 가지고 있는 단백질칩의 응용기술 개발에도 광범위한 연구가 진행되고 있다. 단백질칩의 응용 분야는 신약개발을 위한 초고속 스크리닝, 질병의 종합 진단, 프로테옴의 종합적 연구가 대표적이며, 전 세계 시장규모는 다음 [그림 4-3-2-2]와 같이 예측되고 있다.
저분자칩은 칩 위에서 직접 합성하는 방식과 별도로 만든 화합물을 칩 위에 spotting하는 방식으로 제작될 수 있다. 셀룰로스 막 위에 시약을 spotting하는 방식으로 8,000개의 저분자 화합물을 합성하고, 막 위에서 단일 클론 항체를 이용한 결합을 측정한 예가 2000년에 보고되었다. 이전에도 이와 유사한 방법이 개발되었지만 수천 개 수준의 칩이 만들어진 것은 최근의 일이다. 인간 유전체 지도가 완성된 이후, 인체의 유전자의 기능과 작용을 규명하고자 하는 구조 유전체학(structural genomics) 및 기능 유전체학(functional genomics) 연구가 중요한 테마가 되고 있다. 따라서 저분자칩과 관련하여 유전자 발현을 조절하는 한 방법으로 단백질에 결합하는 저분자 물질을 빠르게 찾는 일이 post-genome 시대 주요 연구테마라 할 수 있다. 이를 위하여 저분자 물질을 고밀도 칩으로 구성하여, 표적이 될 만한 단백질을 반응시켜 강력한 결합을 하는 짝을 찾을 수 있다. 수만 개의 유전자에 대한 정보가 누적되어 있고, 약 15년 정도의 역사를 가진 조합화학 기법에 의해 수백만 혹은 수천만에 해당하는 저분자들을 합성하는 기술도 구축되어 있다. 따라서 생체 안에서 기능하는 단백질과 선택적으로 결합하여 작용을 조절할 수 있는 저분자들을 빠르게 찾는 일은 post-genome 시대의 가장 중요한 연구테마 중의 하나라고 할 수 있다. 이런 분자들을 찾는 매력적인 방법 중 한 가지는, 저분자를 고밀도의 칩 형태로 만들어 표적이 되는 단백질을 그 위에 반응시켜 강력한 친화력을 갖는 분자를 탐색하는 것이다.

출처 : 보건산업기술동향, 2006
* 위 그림은 총 시장규모이며 아래 그림은 기기와 소모품의 비율을 보여주고 있다
|
그림 4-3-2-2 |
총 단백질칩 시장
세포 마이크로어레이는 단백질칩과 유사하지만 단백질 대신 세포를 고정시킨 것이다. 단백질칩의 경우 단백질 마이크로 어레이와 같은 의미로 사용되는 반면 세포 마이크로 어레이는 세포칩과 약간 다른 의미로 사용되기도 한다(본 자료에서는 유사한 의미로 혼용하여 사용함). 세포 마이크로 어레이의 용도는 신약개발 비용을 획기적으로 감소시킬 수 있는 HTS(High Throughput Screening) 시스템의 구축, 국제적인 동물시험의 적법성 및 임상시험에 대한 논란의 해소 등에서 찾을 수 있다. 세포칩 연구는 세계적으로 비교적 초기단계에 있는 연구 분야라 할 수 있다. 선두 연구그룹으로 미국 Whitehead Institute의 Sabatini 팀으로써 2001년 「Nature」지에 ‘Transfected-Cell Microarrays’에 대한 연구결과를 발표하였다. cDNA/젤라틴 혼합물을 마이크로 어레이어로 어레이를 만든 후, cell line을 흘려 transfected- cell microarray를 형성한다. 발현된 단백질에 의해 나타나는 세포의 phenotype을 관찰하는 것에 의해 단백질의 특성 분석이 가능하다. 이러한 세포 마이크로 어레이의 장점은 cDNA의 동정이 불필요하고, 소형화가 가능하며, 고정화된 cDNA의 안정성이 높아 high-throughput 분석이 가능하다는 점을 들 수 있다. 단점으로는 발현된 세포의 phenotype이 in vivo 유전자 기능과는 다를 수 있다는 점, transfectable cell line이 한정되어 있다는 점 등을 들 수 있다. 여러 가지 관련된 한계점들이 극복될 경우 향후 세포칩은 신약개발 비용을 획기적 감소시킬 수 있으며, 단백질칩의 새로운 대안적 방법으로 사용되며, 인체 질병진단 신기술로 활용될 수 있는 유용한 기술이 될 것이다. [그림 4-3-2-3]은 Tomokazu 팀에서 DNA를 이용한 E. coli cell의 transformation에 대한 프로토콜을 보여주고 있다.

출처 : Kuniaki Nagamine et al. Anal. chem. 2005, 77, 4278-81
|
그림 4-3-2-3 |
대장균 transformation을 위한 세포칩
(나) 나노바이오나노센서 기술 연구
나노기술과 생명공학기술의 융합연구에 많은 연구자들이 관심을 가지는 이유 중 하나는 하향식(Top-down)방식을 취하는 미세가공기술(micromachining technology)의 비약적 발전과 분자의 자기조립과 탄소 나노튜브 등과 같이 자발적인 나노구조 형성체를 이용하는 상향식(bottom-up) 방법의 등장으로 인하여 단일 또는 일련의 생체분자를 감지 또는 그 특성을 측정할 수 있는 고감도 센서의 개발이 가능해졌기 때문이다. 이렇듯 아주 작은 생체분자들을 연구하기 위해서는 생명공학기술과 나노기술과의 융합은 필수 불가결한 요소이다. 중요한 기술영역 중의 하나는 바이오센서(biosensor)로써 생체분자들 사이의 선택적인 반응을 이용하여 측정대상물질을 고감도로 구별해 내는 것이다. 바이오센서란 통상 생체 감지물질(Bioreceptor)과 신호변환 시스템(Signal Transducer System)으로 구성되며 분석하고자 하는 물질을 선택적으로 감지할 수 있는 장치이다.
미국, 일본 등의 선진국에서는 이미 극미량 물질을 검출할 수 있는 센서 개발에 막대한 예산을 투자하고 있으며 집중적인 연구를 통해 일부는 가시화된 결과를 도출하고 있다. 이러한 시대적 흐름에 보조를 맞추어 우리나라에서도 나노바이오센서의 개발에 관심을 기울이기 시작하였다. 물론 우리나라의 경우 선진국과의 기술격차는 있으나, 이 분야가 아직 전 세계적으로 개발의 초기단계에 있으므로 우리의 역량을 집중한다면 선진국과의 경쟁이 충분히 가능할 것이며 세계수준의 반도체 생산 기술력과 소재 분야의 우수 연구자원을 적극 활용함으로써 원천기술 개발을 통한 기술적 선점을 이룰 수 있을 것이다.
생체물질 또는 신호의 검출하는 방법으로는 전기화학적 특성 변화를 측정하거나, 기계적 구조, 광학적 특성(형광, 발색, SPR), 전하(Field Effect Transistor), 질량(Quartz Crystal Microbalance) 등의 변화를 측정하는 다양한 물리 화학적 방법들이 사용되고 있다[표 4-3-2-1].
특히 센서의 민감도를 높이기 위해 좀 더 작은 센서를 만드는 데 심혈을 기울이고 있는데 그 대표적인 예가 나노와이어, 탄소나노튜브, 캔틸레버, 나노갭 등의 나노구조체를 사용하는 센서이다. 이들의 센서는 기존의 센서보다 매우 민감하여 질병을 조기에 진단할 수 있는 가능성을 가지고 있다. 하버드 대학교의 찰리 리버 그룹에서는 실리콘 나노와이어(silicon nanowire)를 이용하여 전립선암 표지 물질인 PSA(prostate specific antigen)를 90fg/ml의 농도까지 측정한 바 있다[그림 4-3-2-4(a)].
|
표 4-3-2-1 |
바이오센서를 위한 나노소재(Nano-material)와 나노소자(Nano-device)의 비교
|
기 술 |
장 점 |
단 점 |
발전추세 |
주요국 추세 |
|
SPR 바이오센서 |
비표지 및 실시간 분석 |
민감도 향상 필요 |
현재 바이오센싱 연구 주류를 형성 |
금 나노입자 및 AFM 적용 연구가 진행 중 |
|
CNT 바이오센서 |
전기전도성 우수 |
전도성의 미세 조절이 어려움 |
CNT 전도성에 대한 이론적 해석이 진행 중 |
FET 제작에는 성공, 바이오 진단용 연구는 진행 중 |
|
전기화학 바이오센서 |
실시간 분석가능 |
재현성 확보 및 측정오류의 문제점 |
초기 연구단계 |
연구 수준에서 진행 중 |
|
형광 바이오센서 |
민감도 우수 및 간편성 |
형광표지 필요 및 동력학적분 분석 불가능 |
기 실용화 |
당분간 주요 생체분자 검출방법으로 지속 |
SPR : Surface Plasmon Resonance CNT : Carbon Nanotube
AFM : Atomic Force Microscope FET : Field Effect Transistor
출처 : Plant Biotechnology. 33(3) 223-231(2006)

출처 : (a) Nat. Biotechnology. 23, 1294, 2005, (b) Nano Lett., 3, 459, 2003 , (c) Appl. Phys. Lett., 64, 1213, 2004
|
그림 4-3-2-4 |
(a) 실리콘 나노와이어, (b) 탄소나노튜브, (c) 나노갭
반도체인 실리콘을 이용하여 나노 크기의 직경을 갖는 나노와이어를 합성하여 표면에 붙은 단백질의 표면 전하의 변화를 측정하였다. 단백질은 pI 값에 따라 표면에 가지고 있는 전하가 다른데, 이 표면의 전하를 나노와이어가 감지한다. 또한 실리콘 나노와이어는 도핑(doping)이 가능하여 n-type 혹은 p-type으로 조절이 가능하다는 장점을 가지고 있다. 탄노나노튜브(carbon nanotube, CNT)는 탄소로만 이루어진 나노 크기의 직경을 갖는 튜브로써 금속의 특성과 반도체 특성을 갖는 탄소나노튜브가 혼재한다. 특히 반도체 특성을 갖는 나노튜브의 경우, 실리콘 나노와이어와 마찬가지로 표면에 붙는 생체분자의 표면전하에 따라 탄소나노튜브의 전기적인 특성이 변하는데 이 특성을 이용하여 생체분자를 측정할 수 있다[그림 4-3-2-4(b)]. 나노갭은 나노미터 간격을 갖는 전극 두 개로 이루어진 가장 간단한 구조의 전자소자이다. 나노갭은 스위치 등의 전자소자에도 이용이 가능하지만 바이오센서로도 좋은 플랫폼을 제공할 수 있다. 전극 사이에 들어가는 생체분자의 양에 따라서 전류의 흐름이 바뀌게 되는데 나노갭 센서는 바뀌는 전류의 흐름을 측정하여 생체분자를 측정할 수 있다[그림 4-3-2-4(c)].
이런 다양한 센서를 이용하여 DNA 염기서열 판독을 위한 센서, 인간 코의 기능 대체를 그 목적으로 하는 센서의 한 종류인 전자코(electronic nose), 이식형 초미세전극 어레이(implantable microelectrode array)를 이용한 말초신경계의 기능적 재생을 위한 신경신호센서, 혈중 포도당 농도를 모니터링 함으로써 당뇨병의 진단 및 검출을 위한 혈당 센서(glucose sensor) 등을 개발하였다. 이와 같이 바이오센서 분야의 연구가 실로 광범위하고 또한 세분화 되어 진행되고 있지만 바이오센서가 지니는 장점은 극대화하면서 시스템의 선택성, 정확성, 신뢰성, 반응시간, 박막의 고정화, 나노구조체 제작 등을 개선하고 초소형화를 이루어야 한다는 과제를 안고 있다. 따라서 최근의 연구 동향은 순수과학과 공학이 융합되면서 이러한 필요충분조건을 만족시키기 위한 방향으로 진행되고 있다.
(2) 나노생체소재 분야
(가) 나노생체소재 기술
나노기술 및 생명공학기술의 비약적 발전에 의해서 생체소재를 이용한 나노소재기술은 생명현상 규명, 질병진단 및 치료, 기능성 의료용 소재 개발 등에 필요한 신기술로 인식되고 있다. 나노소재는 다시 생체 유래의 소재와 비생체 유래의 소재로 나눌 수 있다. 바이오-나노소재는 생물학적 소재로서 나노 레벨에서 기능이 있는 소재로 정의할 수 있다. 여기에는 단백질, DNA/RNA, 지질, 다당류 등에서 유래한 각종 분자모터, 나노캡슐, 나노와이어, polymeric structure들이 포함된다. 비슷한 개념으로 쓰이는 나노-바이오소재는 나노크기의 생물학적 응용이 가능한 소재로 정의할 수 있다. 나노-바이오소재로는 기존의 나노소재 중 생물학적 시스템 분석(예, Quantum Dots), 질병의 진단/치료(예, 약물전달용 나노입자), 인공관절/인공장기용 나노소재 등을 들 수 있다[그림 4-3-2-5]. 현재 생물학적 시스템에 적용되는 거의 대부분의 나노크기의 소재들이 나노-바이오소재의 범주에 든다.

출처 : 보건산업기술동향, 2006
|
그림 4-3-2-5 |
양자점 나노입자를 이용한 cancer targeting.
바이오-나노소재 즉 생체 유래의 소재 중 나노시스템에 적용이 기대되는 소재에 대한 연구는 전통적으로 생화학이나 분자생물학 등의 기초과학 분야에서 많은 연구가 진행되었으며 최근에는 이들을 나노과학 및 공학의 범위 안으로 끌어 들이려는 노력들이 늘어나고 있는 추세이다.
본 보고서에서는 우선 바이오-나노소재로 개발이 가능한 몇 가지 생체 유래소재의 특성들을 소개하고자 한다. 단백질 유래 소재로 생체의 물질이동에 관여하는 여러 가지 모터단백질을 예로 들 수 있으며 여기에는 phage portal protein, kinesin, myosin, dynein, flagella 등이 있다. 이 외에도 DNA 또는 RNA를 합성하는 DNA/RNA polymerase 등도 물질합성에 관여하는 모터단백질로 분류할 수 있다.
이러한 단백질의 생체 내 기능을 나노소재로 이용하려는 시도 외에도 DNA 자체를 하나의 소재로 개발할 수 있는데 이는 장기적으로는 다양한 기술에 접목되어 새로운 형태의 기술융합 제품개발의 기반이 될 것으로 기대되고 있다.
나노-바이오소재 분야에서 가장 주목받는 분야는 약물 전달용 나노소재 분야이다. 약물 전달용 나노소재에 대한 기술 개발은 항암제, 단백질/펩타이드, 유전자 등의 치료용 약물을 생체조직 내로 보다 효율적으로 전달하기 위하여, 약물의 특성에 가장 적합한 생체적합성(biocompatible) 신소재 구조를 디자인하고 생체조직과 합성소재 계면 상에서의 상호작용을 제어함으로써 최적의 나노전달체를 개발하기 위한 ‘약물전달시스템(drug delivery system)’에 대해 초점이 맞춰져 있다. 일반적으로 약물 전달체로서의 나노입자는 특정 목표 부위에 약물을 효과적으로 전달해 줌으로써 약물의 효능을 높임과 동시에 부작용을 최소화하기 위한 것으로서 이러한 연구의 주요 목표는 약리학적으로 적절한 전달 속도와 양을 특정 신체부위에 방출하는 시스템을 만드는 것이다.
현재 다양하게 활용되고 있는 리포좀은 생체 이용률을 촉진시키는 잠재적인 약물 전달체로서 주목을 받았으나 낮은 약물 봉입효율, 수용성 약물의 누출 그리고 낮은 콜로이드 안정성 및 화학적 변성 등과 같은 문제점들로 인해 그 효과적인 사용이 제한되고 있다. 하지만 리포좀과 같은 지질 구조체의 우수한 생체적합성을 활용하기 위해 위의 문제들을 해결하기 위한 기술적 대안이 요구되는 바, 다양한 지질 변형 연구와 그 구조분석에 관한 연구들이 활발히 진행되고 있다. 약물 전달체로서 활용되는 또 다른 대표적인 소재가 합성 고분자인데, 고분자의 경우 지질에 기반을 둔 구조체의 단점들을 보완할 수 있는 물리화학적인 성질들을 지니고 있다.
특히 최근 들어 나노 수준의 약물 전달체에 대한 유용성이 속속 입증되면서 소수성 블록과 친수성 블록을 함께 가지고 있는 다양한 양친성 고분자의 합성을 통해 보다 효과적인 나노전달체를 제조하려는 연구들이 활발히 진행되고 있다. 예를 들어 미국 MIT의 Robert Langer 교수는 생분해성 및 생체적합성 고분자로써 미국 식품의약국(FDA)에서 허가를 받은 poly(lactic acid)(PLA)이나 poly(lactic acid-co-glycolic acid)(PLGA)와 같은 폴리에스테르계 고분자를 소수성 블록으로 사용하고, poly(ethylene oxide) (PEO)를 친수성 고분자로 사용하여 고분자 나노입자를 제조하였다.
이 경우 PEO가 상분리 현상에 의해 나노입자의 표면으로 이동하는 것이 관찰되었고, PEO를 사용하지 않은 경우와 비교하여 나노입자에 봉입되었던 약물의 혈중 농도가 증가하는 것이 관찰되었다. 이러한 나노입자는 매우 안정한 형태로 혈관을 따라 움직이면서, 입자 내에 봉입되었던 약물을 서서히 방출시키는 기능을 나타내게 된다[그림 4-3-2-6].

Poly(β-amino ester) Poly(lactic-co-glycalic acid)
출처 : Mitch Jacoby, Science & Technology, 79(6) 30-35, 2001
|
그림 4-3-2-6 |
치료제를 원하는 조직으로 운반할 수 있는 생분해성 플라스틱 구조체
이러한 종류의 기술은 항암제 전달시스템으로써 가장 많은 주목을 받고 있는데, 이는 암세포가 자기증식을 할 때 과다하게 생성된 혈관의 간극이 다른 일반 세포들에 비해 상대적으로 커진다는 점에 착안하여, 나노입자의 크기를 100nm 정도로 조정함으로써 암세포 조직으로만 나노입자가 흡수될 수 있도록 제어하는 EPR(Enhanced Permeation and Retention) 효과를 이용하는 것이 대표적인 예이다. 이 경우 PEO의 말단기에 특정 세포에만 점착되는 분자를 수식할 경우 약물을 필요로 하는 세포로만 나노입자를 전달시키는 타겟팅 기능을 부여할 수 있어 보다 적은 항암제를 사용하고도 효과적으로 암세포를 억제할 수 있게 되어 흔히 화학약물 항암치료를 받는 환자들이 약물에 의한 전신독성 때문에 받는 고통을 줄여 주는 역할을 기대할 수도 있다.
나노기술을 이용한 의약품 신제형 기술은 약물을 신체에 투여하는 경로를 다양하게 변경시키는 역할도 하고 있다. 예를 들어 우리 신체의 폐조직은 굉장히 넓은 표면적을 지니고 있는데, 이를 잘 이용하면 약물을 인체 내로 보다 쉽게 흡수시킬 수 있다. 하지만 이 경우 약물을 어떻게 폐까지 효과적으로 전달시킬 수 있을 것인가 하는 것이 관건인데, 이를 해결하기 위해 매우 낮은 밀도를 지닌 입자 내에 약물을 봉입하여 폐로 전달시키는 기술에 대한 연구가 관심을 받고 있다. 이 기술을 가장 먼저 적용한 약물은 당뇨병 환자들이 매일 주사를 맞아야 하는 인슐린으로 미국의 Inhale Therapeutics사에서는 이미 인슐린을 대상으로 임상 3상을 진행 중이다. 이 밖에도 미국의 유명한 약물전달 전문회사인 Alkermes사나 Dura Pharmaceuticals사에서는 나노입자를 이용한 폐 흡수 제형 기술을 개발하고 있고, Aradigm사에서도 나노에멀젼 제형을 이용한 기술을 인슐린에 적용하여 임상 2상으로 진행하고 있는 등 이러한 기술을 이용한 새로운 의약제형의 산업화가 빠르게 진전될 것으로 예측된다.
고분자 회합체는 일반적인 저분자량의 분자들로 구성된 회합체와 비교할 때, 고분자 사슬 특유의 얽힘과 결정성이라는 특성을 이용한 안정한 구조체를 형성시킬 수 있어 약물 전달체로서 보다 효과적으로 사용될 수 있다. 특히 나노 수준에서 균일한 구조를 형성하는 것이 가능하기 때문에 표적지향성 약물(특히 항암제) 전달 시스템, 난용성 약물의 가용화 시스템, 유전자 전달시스템으로써의 활용에 대한 연구가 활발히 진행되고 있다.
(나) 나노소재의 활용
나노과학에 바탕을 둔 약물전달법은 연구결과의 단기적인 시장성 면에서 상당한 가치가 있는 분야이다. 특히 유전자 치료 분야에서는 기존의 바이러스 중심의 방법을 극복하기 위하여 다양한 시도가 나노입자를 통하여 이루어지고 있다. Hood et al. 그룹에서 발표한 Science 논문에서는 DNA의 backbone이 phosphate group의 존재로 인하여 음전하로 하전 되는 점을 이용하여 표면이 양전하로 하전된 나노입자를 제작하고 여기에 특정 단백질을 발현하는 plasmid DNA를 부착시켜 암세포 성장의 억제를 보여 주었다. 특히 Plasmid DNA의 조직특이적(Tissue-specific) 발현을 위하여 암세포에서 과발현되는 단백질에 특이적으로 결합하는 리간드를 나노입자의 표면에 삽입하여 plasmid DNA가 결합된 나노입자가 암세포를 찾아갈 수 있게 하여 targeted-gene delivery를 실현하였다. 사용된 나노입자는 Cationic lipid와 리간드가 head group에 결합된 lipid를 10 : 1의 비율로 하여 제작되었으며 40nm의 지름을 가진 구형의 입자이다. Integrin avb3 는 암세포의 성장에 필수적인 신생혈관 생성 시에 그 발현이 증가하는 것이 보고되었다. Mouse knock-out model과 사람에 대한 integrin avb3의 antagonist 실험에서 암세포의 성장을 억제시키는 효과가 없는 것으로 보아 integrin avb3 자체는 항혈관생성제 개발의 표적이 될 수는 없으나 tumour endothelial cell에서의 발현증가는 여전히 cytotoxic agent delivery의 target은 될 수 있음을 보여준다. 본 논문에서는 integrin avb3에 선택적으로 결합하는 ligand를 head group으로 가진 lipid를 cationic lipid와 일정 비율로 혼합하여 나노입자를 제조하였다. 제조된 avb3-NP(nanoparticle)의 효율성을 조사하기 위하여 나노입자에 GFP 발현 벡터를 부착시켜 avb3-positive human melanoma cell과 avb3-negative cell에 transfection한 결과 positive cell에서 4배 이상의 GFP 발현이 관찰되어 avb3- NP의 uptake는 avb3-integrin specific함을 보였다.
미국 존스 홉킨스대 연구진은 지난 2003년 9월, 통증 없이 코를 통해 나노입자를 폐에 넣어 투약하는 기술을 개발했다. 연구진은 머리카락 10분의 1 크기의 나노 구입자(플라스틱 마이크로 스피어)에 약물을 실어 코를 통해 폐에 약물을 전달해 정해진 속도로 서서히 약물을 방출하는 시스템을 개발한 것이다. 이 기술은 일종의 나노기술이 치료 보건의료 분야에 적용된 대표적 기술로써 연구진은 약물을 중합체가 둘러싸게 제조, 치료효과를 내기 전에 손상되지 않으며 동시에 입자들이 서로 달라붙지 않아 기도에도 영향이 없을 것이라고 밝혔다. [표 4-3-2-2]는 약물전달이나 치료 분야의 나노보건기술과 관련하여 최근에 관심의 대상이 되고 있는 대표적인 기업을 보여주고 있다.
|
표 4-3-2-2 |
치료관련 나노보건기술 분야의 대표적 기업
|
Focus |
Company |
Platforma* |
|
Therapeutics |
Alnis Biosciences (Emeryville, CA) |
Polyfunctional nanoparticles |
|
ALZA (Mountain View, CA) |
Lipid nanoparticles with polyethylene glycol coating; Doxil (doxorubicin Liposome) on the market |
|
|
NanoCrystal Technologies (King of Prussia, PA) |
NanoMill technology for creating nanocrystals |
|
|
NanoMed Pharmaceuticals (Kalamazoo, MI) |
Nanotemplate engineering for drug and vaccine delivery systems |
|
|
Alnis Biosciences (Emeryville, CA) |
Polyfunctional nanoparticles |
|
|
StarPharma (Melbourne, Austrailia) |
VivaGel anti-HIV dendrimer (phase I) |
|
|
Drug delivery |
Advectus Life Sciences (West Vancouver, BC, Canada) |
NanoCure system for delivery of anticancer drugs across blood-brain barrier |
|
BioDelivery Sciences (Newark, NJ) |
BioOral nanocochleates cigar-shaped structures comprised of lipid bilayers |
|
|
BioSante Pharmaceuticals (Lincolnshire, IL) |
Nanoparticulate platform (CAP) for drug delivery (phase I) |
|
|
C-Sixty (Houston, TX) |
Fullerene-based drug delivery |
|
|
Cytlmmune Sciences (College Park, MD) |
Tumor necrosis factor bound to colloidal gold nanocrystals for targeting tumors; vector with docking site for gene therapy |
|
|
NanoCarrier (Chiba, Japan) |
NanoCap micellar nanoparticle for water- insoluble drugs (under development) |
|
|
NanoBio (Ann Arbor, MI) |
Antimicrobial nanoemulsions (phase II) |
|
|
NanoSpectra Biosciences (Houston, Texas) |
Nanoshells for optical therapies |
|
|
Targesome (Palo Alto, CA) |
Injectable nanospheres for therapeutic or diagnostic agents |
* Unless otherwise specifield in parentheses, technology in preclinical development. Locations are in United States unless otherwise stated.
출처 : 보건산업기술동향, 2006
(4) 유비쿼터스 헬스케어 융합기술
BT, IT 그리고 NT의 융합을 통해서 만들 수 있는 나노바이오센서의 장점 때문에 많은 연구자들이 보다 나은 나노바이오센서 개발에 심혈을 기울이고 있다. 따라서 나노바이오센서와 유비쿼터스 헬스케어 시스템(U-healthcare system)의 융합 기술이 미래 사회 건강을 책임지는 중요한 기술로 급부상하고 있다. U-healthcare라는 것은 언제, 어디서든지 의료 서비스를 받을 수 있는 환경을 말한다. 즉, 나노바이오센서를 통해 질병을 진단하고 이 결과가 모바일 장비를 통해 지정된 병원의 의사에게로 전송되어 의사가 처방을 내릴 수 있는 것이다. 나노바이오센서 중에서도 전기적 바이오센서는 휴대폰이나 PDA에 내장될 수 있을 만큼 소형화가 가능하다. 또한 모바일 장비의 발달로 인해 시간과 장소에 관계없이 인터넷에 접속이 가능한 모바일 환경을 갖추고 있다. 게다가 우리 사회가 점점 수요자 중심의 시장으로 바뀌고 있어 의료서비스에 있어서도 환자의 편의가 점점 중요시 되고 있다. 이러한 모든 요건들이 U-healthcare 시대의 도래를 앞당기고 있다. U-healthcare의 특징으로는 시간과 장소에 구애 받지 않기 때문에 신속한 의료서비스를 제공할 수 있으며, 나노바이오센서를 통해 얻은 진단 결과가 여러 명의 의사에게로 전달될 수 있기 때문에 진료의 분산화가 가능하여 좀 더 정확한 진단을 받을 수도 있다. 몸을 움직이는 것이 불편한 노약자나 장애인들도 직접 병원에 찾아오지 않아도 되기 때문에 이들을 관리하기가 매우 용이해진다. 조사에 따르면 지방의 의사나 의원의 수가 대도시보다 매우 적어 의료 환경의 양극화를 보이고 있지만 U-healthcare 환경이 이런 양극화 문제를 해결해 줄 수 있다. 또한 자신의 질병을 수시로 진단할 수 있기 때문에 치명적인 질병 단계에 이르는 것을 사전에 방지할 수 있다. 따라서 점점 고령화가 되어가고 있으며 인류의 건강을 중요시하는 사회에 U-healthcare는 매우 필요하다고 할 수 있다.
이런 U-healthcare 시스템은 그 경제적인 가치 또한 중요한데, 프로스트 & 설리반 자료에 따르면 2012년 세계 의료 시장은 5조 9,000억 달러 규모에 이를 전망이며 이 가운데 U-healthcare가 3,800억 달러 규모를 차지할 것으로 기대된다.
무엇보다 U-healthcare 시장의 연평균 성장률이 일반 의료 시장보다 3배 이상 높을 것으로 보여 많은 관련 업계들이 관심을 보이고 있다. 아래에 있는 표는 전 세계 주요 국가의 미래 의료시장 규모를 전망한 것이다.
[표 4-3-2-3]에서 볼 수 있는 것처럼 GDP에서 의료비의 비중이 점점 증가하는 것을 알 수 있다. 미국과 일본과 같은 선진국은 이미 GDP의 상당한 비중을 의료비가 담당하고 있다. 인류가 건강과 복지에 관심을 더 가지면서 앞으로 더욱 의료비의 비중이 증가할 것으로 예상된다.
|
표 4-3-2-3 |
전 세계 의료시장
|
|
U.S.A. |
China |
Japan |
Korea |
||||
|
2003 |
Next 5∼20 years |
2003 |
Next 5∼20 years |
2003 |
Next 5∼20 years |
2003 |
Next 5∼20 years |
|
|
G D P |
$12T |
$16T |
$1.4T |
$4.5T |
$4.3T |
$5.8T |
$0.6T |
$1T |
|
Medical Expense per GDP |
14% |
16% |
5.5% |
8% |
8% |
12% |
6% |
10% |
|
Medical Expense |
$1.7T |
$2.6T |
$77B |
$360B |
$344B |
$696B |
$36B |
$100B |
출처 : World Development Indicators database’ of The World Bank., Data of Next 5∼10 years: Estimated
다. 국내 현황
(1) 분야별 연구개발 현황
(가) 나노바이오칩/센서
현재 단백질칩을 분석하기 위한 측정시스템으로서 가장 널리 이용되고 있는 비표지 방식으로 SPR 단백질칩 분석시스템을 들 수 있다. SPR 시스템은 나노 크기의 두께를 갖는 금 박막 위에서 단백질의 상호작용이나 농도 변화에 의해 변하는 굴절률을 측정하는 방식이다. 특히 SPR 시스템은 단백질을 형광이나 방사성 물질로 표지하지 않고 단백질 간의 상호작용을 실시간으로 모니터링 할 수 있다는 장점을 가지고 있다. 스웨덴의 Biacore AB사에서 SPR 원리를 이용한 BIAcore 제품을 출시하고 있으며, 국내에서도 최근 SPR에 대한 관심이 높아져 활발한 연구가 진행되고 있다. SPR 기술을 이용한 단백질칩 개발은 한국생명공학연구원, 한국전자통신연구원, 강원대 등에서 연구개발을 활발히 진행하고 있으며 단백질 상호작용을 분석하고 있다.
비표지 실시간 분석시스템으로서 SPR의 우수성에도 불구하고 이 시스템은 1-4개 정도의 시료만을 분석할 수 있다는 분석 시료의 양적인 한계를 가지고 있다. 이러한 SPR의 단점을 극복하기 위해 수백-수천 개의 단백질 시료를 동시에 분석할 수 있는 SPR 이미징 기술이 막스-플랑크 연구소의 Knoll 연구팀에 의해 처음 발표되었으며, 그후 위스콘신대 Corn 박사 연구팀뿐만 아니라 국내에서는 한국생명공학연구원 바이오나노연구단 정봉현 박사 연구팀에 의해 연구가 이루어지고 있다. 특히 한국생명공학연구원에서는 수많은 시료를 분석할 수 있는 SPR 이미징 시스템을 자체 개발하였는데, 현재 기술이전을 했던 케이맥(주)에서 SPRi라는 제품으로 출시되었으며, 질병 진단 및 초고속 신약 후보물질 스크리닝 연구에 활용하고 있다.
나노바이오센서의 경우 국내에서도 탄소나노튜브, 나노와이어, 나노갭 등 나노구조체를 이용하는 연구가 활발하게 진행 중이다. 포항공대, 한국화학연구원 등에서 탄소나노튜브를 이용한 바이오센서를 개발하고 있다. 이들은 탄소나노튜브의 문제점을 해결하는 등 감도가 더 좋은 탄소나노튜브를 이용한 바이오센서를 개발하는 데 주력하고 있다. 한국전자통신연구원, 전자부품연구원 등 여러 곳에서는 실리콘 나노와이어를 이용하여 바이오센서에 응용하고 있으며, 한국생명공학연구원, 한국표준과학연구원, 한국과학기술원 등에서는 독특한 나노갭 구조체를 만들어 바이오센서에 응용 중이다.
(나) 나노생체소재
국내에서도 SK 제약이 지난 1996년 이후 지속적인 개선을 거쳐 내놓은 관절염 치료제 ‘트라스트’는 대표적인 DDS 기술 제품이다. 연구진은 세계 최초의 관절염 치료 패치제로서 경피약물전달체계 기술을 통해 48시간 동안 일정한 농도로 피부를 통해 환부조직에 직접 약물을 전달시켜 환부인 관절에만 약물을 전달하고 혈액에서는 혈중농도를 극소화하는 것이 이 기술의 강점이라고 주장했다. 이 약품은 2002년말 필리핀 식품의약국으로부터 판매허가를 받아 이미 수출 길에 나서고 있다. 한편 연세대 의료원 연구팀은 최근 자기장을 이용해 질병이 있는 특정부위에만 약물을 전달하는 나노입자 기술을 개발하였다. “표적지향적 자성 나노 약물전달 캡슐”로 명명된 이 기술은 인체의 특정 부위에 약물을 집중시켜 치료효과를 극대화 하는 한편 항암제등의 약물에 의한 전신 부작용을 최소화 할 수 있었다. 연구팀은 췌장암, 폐암 등의 약제인 항암제를 자성물질과 혼합한 후 생체 친화성 고분자를 이용해 나노입자 크기로 캡슐화, 기존 약물의 15분의 1 분량을 사용해도 동등한 효과를 낼 수 있다고 밝혔다.
(다) 유비쿼터스 헬스케어 융합기술
유비쿼터스 헬스케어(Ubiquitous-healthcare) 시스템은 현재 여러 연구그룹에서 개발되고 있는데, 헬스피아라는 회사에서는 모바일에서 측정할 수 있는 혈당관리 시스템을 개발하였다. 혈당 측정을 위해 스트립센서를 휴대폰에 꽂은 뒤 혈액을 떨어뜨리면 잠시 뒤에 휴대폰 화면을 통해 혈당의 수치가 나타나 현재의 몸속의 혈당이 어느 정도인지 확인할 수 있다.
또한 측정된 혈당 수치는 서버로 전송되어 식습관 등의 생활 패턴을 올바르게 유지될 수 있도록 관리를 받게 된다. 실제로 이 서비스를 받은 그룹과 받지 않은 그룹과의 건강을 확인해본 결과 지속적으로 혈당 관리를 받은 그룹의 건강이 좋은 것으로 알려졌다.
또한 한국생명공학연구원 바이오나노연구단에서는 간 기능을 측정하는 시스템을 개발하였다. 간 기능을 나타내는 GOT(Glutamic oxaloacetic transaminase)와 GPT(Glutamic pyruvic transaminase)는 간염, 간경변, 간암 등의 간 기능을 나타내는 물질로 GOT/GPT 수치가 높게 나온다면 그만큼 간의 건강이 위험하다는 것을 알 수 있다. 혈액을 휴대폰 단말기에 꽂혀진 스트립센서에 떨어뜨리면 전기화학적 반응을 일으키는 효소 반응을 통해 전기적인 신호로 나타내어지는데, 이 신호는 휴대폰 화면을 통해 나타난다. 이렇게 얻어진 신호에 따라 다른 U-healthcare 시스템과 마찬가지로 적절한 관리를 받게 되며, 삶의 질 향상에 이바지할 것으로 기대된다. [그림 4-3-2-7]은 이런 연구결과가 직접적으로 생활에 도입될 가상 도면을 보여주고 있다.

출처 :“U-healthcare의 산업 및 기술전망”(krnet 2006 세미나 자료)
|
그림 4-3-2-7 |
유비쿼터스 헬스케어(U-health care) 시스템의 체계 및 응용
(2) 국내 BT/NT/IT 첨단융합 연구 현황
최근 들어 BT, NT, IT 기술간 융합이 진전되어 신기술 및 서비스 개발의 중요성이 부각되고 있다. 현재 진행되고 있는 차세대 기술혁명은 IT, BT, NT 등 어느 한 분야에 국한되지 않고, 각 기술과 영역 사이의 융합을 통해 시너지 효과를 창출하고자 하는 미래 융합기술이다. 현재 우리나라는 세계 제일의 IT 강국이지만 새로운 성장 모멘텀이 필요한 시기이다. 따라서 BT, NT, IT 등을 융합한 미래 신성장 동력을 얻기 위해 앞다퉈 기술개발에 매진을 하고 있다. 국내에서는 정부와 기업 차원에서 활발하게 융합 연구가 진행되고 있는데, 특히 바이오 융합기술 중 BT와 IT의 융합기술인 BIT 융합기술은 정보통신부의 IMT2000 기금으로 2001년 대규모의 연구과제가 시작되었으며, 최근에는 과학기술부, 산업자원부, 정보통신부 등에서 BT와 IT, NT 등을 융합하는 연구개발 프로그램이 활발히 진행되고 있다. 바이오 융합 분야의 주요 기술 분야의 선진국 대비 우리나라의 기술 수준은 [표 4-3-2-4]와 같다. 또한 국내 IT 기업에서도 BT와 NT를 접목한 첨단융합 연구가 진행되어지고 있으며, 그 현황은 [표 4-3-2-5]와 같다.
|
표 4-3-2-4 |
우리나라의 전반적인 기술 수준
|
주요 기술 분야 |
기술 격차 (년) |
기술 수준 (%) |
우리나라의 기술경쟁력 |
주요연구 분야 |
신기술유망 분야 |
|
|
강점 |
약점 |
|||||
|
차세대 바이오칩/바이오센서 기술 |
5 |
60% |
-나노소자 -나노공정 -MEMS 기반 |
-나노바이오 분야 기술력 -나노바이오 소재 시장의 협소 -바이오칩/센서 |
-나노바이오칩 -나노바이오센서 |
-나노바이오칩 -나노바이오센서 |
|
바이오 나노 소재/ 소자 기술 |
4 |
70% |
-나노소재 -나노소자 -나노공정 |
-융합전문 인력 부족 -바이오소재, 특히 바이오 활성소재 기술 부족 |
-생체 활성 소프트 나노 바이오소재 -마이크로/나노 구조체 제조 기술 -포터블 바이오소자 -바이오센서용 반도체 -나노선 소재 -생활성 소재의 마이크로/나노 패턴화 기술 -고성능 나노바이오소재, 소자, 시스템 기술 -바이오나노 식품/화장품 /생필품 기술 -생체친화성소재 |
-나노바이오 재료기술 -바이오나노 식품/화장품 /생필품 기술 -나노바이오 재료기술 -바이오활성소재기술 -생리활성기능소재기술 -마이크로/나노 구조체 제조 기술 -포터블 바이오소자 |
|
주요 기술 분야 |
기술 격차 (년) |
기술 수준 (%) |
우리나라의 기술경쟁력 |
주요연구 분야 |
신기술유망 분야 |
|
|
강점 |
약점 |
|||||
|
나노 메디컬 진단/ 치료 기술 |
. |
80% |
-세포 적합 성 소재에 대한 기반 기술 확보 -나노치료법 |
-바이오융합 연구 상대적 취약 -산업화 수준이 낮음 -산업체의 영세성 -산·학협력 체제 상대적 미비 |
-바이오 인공장기 -세포배양 인공조직 -지능형 임플랜트 -조직공학 지지체 -나노분자영상기술 -초고감도 질병진단 기술 -약물전달기술/시스템 -나노입자를 이용한 조영제 기술 -나노바이오 생체영상 데이터베이스 구축기술 -디지털 X선, 초고자장 MRI, multi-modal 융합영상 기술 |
-나노분자영상기술 -초고감도 질병 진단 기술 -경피흡수 약물전달 시스템 -임플랜트 기술 -바이오메디컬 센서 -나노입자를 이용한 조영제 기술 |
|
신약 개발 지원을 위한 BINT 기술 |
. |
. |
-나노전달 물질 -약물전달 영상화 분야 |
-전임상, 임상경험 및 인력 부족 |
-선도물질 도출 기술 -후보물질 최적화 기술 -초고속 분석시스템 기술 -유전자 기능규명 및 질병유전자 기능조절 기술 -Cell based HTS 기술 |
-초고속 분석시스템 기술 -나노 구조를 이용한 초미세 이미징 기술 -Cell based HTS 기술 -BINT 융합기술을 이용한 전임상, 임상 바이오칩 기술 개발 |
|
U- 바이오 케어 기술 |
5 |
60% |
-인터넷기술 -무선통신기술 -WPAN (Wireless Personal area Network) 기술 |
-바이오케어센서 -휴대의료기기 기반기술 -의료정보 분석 보안기술 -생체정보 분석기술 |
-바이오 MEMS 기술 -비침습형 혈액 추출기술 -질병진단키트 -바이오 케어 센서 -멀티모달 바이오스캔 기술 |
-비침습형 혈액 추출 기술 -재택 진단을 위한 소형․저가의 나노바이오케어 센서 -USN baased 바이오 케어 센서 -멀티모달 바이오스캔기술 |
출처 : BT산업 동향보고서 편람Ⅰ, 생명공학정책연구센터, 2005
|
표 4-3-2-5 |
국내 기업의 융합기술 개발 현황
|
그룹 |
기업명 |
융합기술 개발 현황 |
|
삼성 그룹 |
삼성 전자 |
- 미래 신수종 사업으로 바이오칩(랩온어칩)을 뽑고 DNA칩 관련 정보 분석 기술과 바이오 정보단말기의 ACICS 기술을 개발 중 - 나노구조의 ITO(In, Sn), 소결체, SET-Memory, MRAM 개발, 플래시 메모리 소자에 대한 전기적 특성 및 신뢰성 연구, 테라비트급 탄소나노튜브 메모리소자, 초고집적/초저소비전력 고속단전자 메모리 개발 중 - U-헬스사업을 씨앗산업으로 지정하고 삼성종기원에서 비즈니스모델연구 |
|
삼성 종기원 |
- 100여 명이 IT-BT 융합기술을 연구( 바이오칩, U-헬스, 랩온어칩 분야) - 탄소나노튜브를 이용한 64GB 대용량 플래시 메모리와 PRAM을 개발 |
|
|
삼성 SDS |
- U-시티 사업의 일환으로 U-헬스케어 사업을 진행 - 비데에 조변검사 장비 부착하여 인터넷으로 환자 상태를 기록하고, 이상 발견시 본인에게 알려주는 모델을 구축해 시험 중 |
|
그룹 |
기업명 |
융합기술 개발 현황 |
|
LG 그룹 |
LG 전자 |
- 나노데이터 저장시스템(NDSS), 테라비트급 정보저장장치, TB급 탄소나노튜브, 하이브리도 나노입자, 탄소나노튜브 이용 디스플레이 기술 개발 - U-헬스 부문으로 인성정보와 홈네트워크 사업 협력을 위한 MOU 체결 - 바이오정보단말기의 ASICS 기술을 1980년대 후반부터 개발 중 |
|
LG 화학 |
- 차세대 항생제(펙티브), 동물용 항생제(엣센트), 젖소산유촉진제(부스틴)의 생산 공장을 신설 혹은 증설 - 인간성장호르몬(유트로핀) 등 6개 유전공학의약품 세계시장 진출 추진 - 유전체학 연구를 위해 미국 현지에 LG BMI을 설립하여 신약개발을 위한 기술과 신약 파이프라인을 확보 |
|
|
LG CNS |
- U-헬스 사업을 신성장동력 모델로 선정하고 병원 정보화 시장을 공략 - U-병원을 통해 차별화된 경쟁력을 갖추기 위해 RFID, 의료스마트카드, 원격진료서비스 등을 고객에게 제안, 사업으로 연결 |
|
|
SK 그룹 |
SK (주) |
- DNA 칩, 생물정보학기술 등을 활용하여 항암제와 중추신경계 분야의 신약후보 발굴을 추진 - 우울증치료제, 정신질환치료제, 혈관 생성 억제제의 임상실험 진행 |
|
SK 텔레콤 |
- 정보통신부와 함께 독거 및 저소득층 노인들 대상 U-헬스 서비스 시범운영 |
|
|
SK 케이컬 |
- 서울대 암연구소, 미 텍사스주립대 등과 제휴하여 바이오벤처기업인 인투젠(In2Gen)을 설립하여 암 진단시스템과 치료제를 개발할 계획 - 나노기술로 PET Nanocomposite, CMP용 나노재료, 담배필터 및 화장품용 Paste를 개발 |
|
|
SK C&C |
- U-비지연구소를 개설하고 U-헬스케어 사업 진출을 검토 |
|
|
KT 그룹 |
KT |
- 분당서울대병원과 U-헬스 서비스를 구현하는 기술을 공동개발 합의 - KT 전남본부는 조선대병원과 협력을 맺고 U-호스피털 환경을 구축 - 가톨릭대학과 NBIT (나노바이오 정보통신기술) 산․학 협력 MOU를 교환 |
|
KTF |
- 모바일용 혈당측정기를 휴대폰에 연결해 자가 혈당측정을 하고 측정수치는 자동으로 주치의에게 연결되어 관리 받는 U-헬스서비스를 제공 - SMS 메시지로 수시로 경고하는 ‘SMS 다이어트 서비스’를 제공 중 |
|
|
통신 사업자 |
하나로 텔레콤 |
- 하나포스 고객을 대상으로 전문의 상담부터 진료예약까지 원스톱으로 가능한 통합헬스케어 서비스인 ‘하나포스 홈탁터’ 개시 |
|
SI 업체 |
현대정 보기술 |
- 비트컴퓨터와 원격진료시스템을 개발하여 안양교도소, 철원지역 청송 OP 등에 구축 및 운영/우크라이나에 원격진료시스템을 수출 |
|
코오롱 정보통신 |
- 신성장동력으로 U-헬스케어를 포함한 유비쿼터스 사업을 선정하고 U-호스피털, 원격진료시스템을 양대 축으로 삼아 사업을 추진 - 서울대병원 U-의료정보시스템 사업자로 선정됨 |
|
|
중외정보기술 |
- 능동형 RFID를 활용한 U-종합건강진단센터를 강남성모병원에 구축 - 건양대병원에 RFID를 활용한 수술정보 매칭시스템, 동아대의료원 U-수진자관리 시스템을 수주하여 U-헬스 사업을 강화 |
출처 : 전황수 (ETRI), 국내외 IT기업의 IT-BT-NT 융합기술 개발 동향, 2007
라. 발전 방향
소형화의 추세는 단지 반도체 산업에만 국한된 것이 아니다. 나노기술은 바이오, 의학 분야에도 큰 파급효과를 일으켜 나노물질의 생물, 의학적으로 적용하는 나노의학(Nanomedicine) 융합기술 분야를 탄생시키기도 하였다. 나노물질에 세포에 선택적으로 반응하는 기능성 생체분자를 도입함으로써 진단과 치료가 동시에 가능한 새로운 개념의 나노-하이브리드(Nano-Hybrid) 물질이 개발되고 있다. 또한 바이오칩/센서 중에서 단백질칩은 DNA칩과는 달리 단백질의 활성, 배향성, 안정성, 비특이적 결합, 측정 민감도, 비표지 분석 기술 등 아직까지 해결해야 될 기술적인 문제가 남아 있으며, 따라서 이러한 한계를 극복하기 위해서는 나노기술이 적용된 새로운 개념의 나노바이오센서의 개발이 반드시 필요하다고 하겠다. 특히 나노기술이 접목된 나노보건기술은 의료보건 산업에 커다란 파급효과를 가져올 것으로 기대된다. 기존 의료보건 기술의 한계를 극복함으로써 질병예측, 진단시간 단축, 효과적 치료, 인공 오감재생 등 삶의 질을 향상시키는 데 기여할 것으로 기대되며, 누구나 쉽게 칩 하나로 질병을 예측, 진단 할 수 있어 제한된 보건산업의 비약적 성장이 기대된다.
이러한 나노보건기술의 진보는 노령인구의 급속한 증가에 따라 늘어나는 건강 보험 지급액을 감소시켜 장기적으로 건강보험 재정 수지 균형에 기여할 것으로 전망된다.
보건의료 분야에서 기술 발전의 세계적인 추세는 정보기술(IT)과 생명공학기술(BT), 나노기술(NT) 사이의 융합현상이다. 이를 바탕으로 보건의료 서비스가 ‘표준화’ 서비스에서 ‘맞춤화’ 서비스로, ‘간헐적’ 서비스에서 24시간 신체 상태를 계측하는 ‘지속적’ 서비스로 전환되는 등 의료 분야의 패러다임 전환이 예상된다. 결과적으로 보건의료 분야뿐만 아니라 그에 관련된 사회구조 및 생활상도 함께 변할 것으로 예상되는데 이러한 가능성을 예측하고 준비하는 국가와 기업에게는 세계의 기술 발전, 사회변혁을 주도해 나갈 기회가 주어질 것이다. 미국의 경우, 우리나라 과학기술부에서 보건, 의료관련 중요과제로 선정한 95개 과제 중 94개에서 이미 선두를 달리고 있는 것으로 평가되고 있어, 이에 맞서 우리나라에서는 이미 확고하게 자리 잡은 정보기술 및 신기술인 나노기술 분야를 바탕으로 인프라를 구축하고 상호 연계적인 네트워크 협동 연구를 통하여 나노보건기술 분야에서 확고한 위치를 자리매김할 수 있어야 할 것이다.
이러한 융합기술에 있어서 중요한 것은 고감도 감지능력이다. 나노바이오센서 기술은 나노기술과 바이오센서를 근간으로 하면서 다양한 측정 방법이 접목된 복합적이면서 미래형 센서기술이다. 나노바이오센서 기술에 기존의 바이오센서 기술의 한계였던 반응, 응답 및 검출 감도를 극복하기 위해 적용된 나노기술은 검출할 수 없었던 아주 적은 양의 물질을 빠르게 검출할 수 있게 되었다. 이러한 고감도 바이오센싱에 있어서 생체결합의 민감도 향상, 생체적합성, 비특이 결합의 최소화, 극소 크기 등을 만족시키는 센서의 개발이 무엇보다도 절실히 요구된다. 따라서 이렇게 구축된 고감도 나노바이오센서는 다양한 방법으로 검출할 수 있게 되는데 그 중에 센서의 소형화 및 재택/자가 진단용을 위해서 전기적인 검출 방법이 널리 연구되고 있다. 전기적 검출 방법은 실시간으로 검출이 가능하다는 장점을 가지고 있지만 재현성 확보 및 측정 오류의 문제점 등을 개선해야 하는 과제도 남아 있다. 이런 난제들을 극복하면서 추진되고 있는 연구 중 그 대표적인 것으로는 나노바이오센서와 모바일 시스템과의 결합인 유비쿼터스 헬스케어 시스템(Ubiquitous Healthcare System)이다. 유비쿼터스 헬스케어 시스템은 생명공학기술과 정보통신 그리고 나노기술이 융합된 기술로써 좀 더 건강한 삶을 바라는 사람들의 바람을 실현시켜 줄 수 있는 미래 첨단기술이라고 할 수 있다. 향후 나노바이오센서 기술의 추이는 통신기술과 데이터 프로세싱 기술이 결합되어 분석의 신속성 및 안정성, 편리성, 분석결과의 신뢰성, 동시 다중분석 등에 있을 것이다. 결국 이렇게 구축된 기술은 다양한 콘텐츠와의 집적화로 조기에 질병의 재택 검사/진단 또는 현장진단을 가능하게 해 주어 인류가 추구하는 건강한 삶의 질을 향상시키는 데 크게 기여할 것으로 기대된다.
각 국가들은 바이오 경제 패권을 선점하기 위해 치열한 경쟁을 벌이고 있다. 특히 생명공학기술을 적용한 다양한 분야의 첨단 융합기술 개발을 위해서 범국가적인 정책을 세워 체계적이면서 효율적인 연구개발에 전력을 다하고 있으며 그 투자도 계속적으로 증가하고 있는 추세이다. 이런 세계적인 흐름에 대처하고 미래 융합기술의 선점을 위해서는 우리나라에서도 보다 적극적인 투자와 관리 시스템이 갖춰져야만 한다.


농업생명공학 연구개발은 농림부․농촌진흥청이 1980년 초부터 정책적, 재정적 지원을 시작하였다. 1983년에는「생명공학육성법」제정에 의한 법률적 지원근거를 마련하였고, 1994년에 생명공학 연구개발을 위하여 수립한「제1차 생명공학육성기본계획(Biotech 2000, 1994~2006」에 근거하여 농업 분야 생명공학 연구개발 육성을 적극적으로 수행하였다. 연구개발 주체인 농림부, 과학기술부, 농촌진흥청, 대학 및 바이오산업체 등이 중심이 되어 수행하였으며, 국․공립연구기관과 산․학․연 공동연구에 의한 농생물 유전체 해독 및 기능유전체 연구 등 기초기반 분야와 유전자변형 생물체 개발 및 실용화를 위한 생명공학 기술의 농업적 이용 연구를 수행하고 있다.
정부는 2006년도에 8개 부처가 참여하여「제2차 생명공학육성기본계획(Bio- Vision 2016, 2007~2016」을 수립하고 농생물 유전체 염기서열 해독 및 기능 유전체 연구를 통한 농업생명공학 원천 자원 및 기술 확립과 생명공학 기반을 확보하여, 유전자변형 동식물과 안전성 평가기술을 개발 및 산업적으로 응용하고 고기능성 식품소재 개발기술 및 안전성 평가관리 기술 연구개발계획을 확정하였다[표 4-4-1-1].
|
표 4-4-1-1 |
「제2차 생명공학육성기본계획(Bio-Vision 2016)」농축산·식품 분야 중점추진 과제
|
구 분 |
중점 추진 과제 |
|
|
기
술 |
농생물 자원 및 유전체 해독 |
생물자원 보존기술 |
|
유전체해독 및 생물정보 기술 |
||
|
유용 신기능 유전자 분석․확보기술 |
||
|
분자표지 개발 및 활용기술 |
||
|
유전체변형 농생물체 개발 및 안전성 |
형질전환체 육종 생산기술 |
|
|
고부가가치 형질전환체 개발기술 |
||
|
동식물 형질전환 기술 |
||
|
동물 이종장기 및 체세포복제 기술 |
||
|
형질전환체 이용한 소재생산 기술 |
||
|
LMO 위해성평가 기술 |
||
|
기능성 식품 |
식품 제조가공 기술 |
|
|
신기능 식품개발 기술 |
||
|
소재탐색 기술 |
||
|
전통 발효식품 가공기술 |
||
|
식품 안전성 평가기술 |
||
|
동물 질병 진단예방 및 축산물 위생 |
동물질병 예방약 개발기술 |
|
|
해외 악성전염병 정밀진단기술 |
||
|
안전축산물 평가기술 |
||
|
인수공통 전염병 예방기술 |
||
|
인 프 라 |
시설․장비 |
기능성 활성물질의 임상기반 구축 |
|
LM 작물에 대한 평가기반 확립 |
||
|
국제 협력 |
생물자원 공동협력연구센터 설치 |
|
출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 농축산식품 분야 자료 재가공

가. Ac/Ds 전이인자 삽입 돌연변이 집단을 활용한
벼 기능유전체 연구
벼 염색체 염기서열 완전해독 국제공동연구단(IRGSP)이 우리나라를 비롯한 11개 국가 국제컨소시엄이 구성되어 니폰바레(Oryza sativa L. ssp. japonica cv. Nipponbare) 품종의 염기서열 완전해독 초안을 2004년에 발표하였으며, 후속 연구로 벼 기능유전체 국제 공동연구(IRFGC)를 통하여 2015년까지 약 4만 개로 추정되는 벼 유전자의 50% 이상 유전자에 대한 기능 규명을 목표로 연구가 수행되고 있다.
벼 유용 유전자 개발을 위한 기능 유전체 연구에 있어서 DNA Chip, Proteomics, 전이인자를 이용한 insertional mutagenesis, 분자생물학적 유전자 지도를 이용한 map-based 클로닝 등 다양한 용도로 이용되고 있다. 벼 기능유전체 연구를 위하여 농업생명공학연구원, 영남농업연구소 및 경상대가 공동으로 옥수수의 Ac/Ds 전이인자 삽입 돌연변이 115,000집단을 2006년말 구축 완료하였으며, 이를 기반으로 농촌진흥청 농업생명공학연구원(책임자 이명철)은 전이인자 삽입집단을 이용한 품질, 환경 내성, 병해충 저항성 형질 관련 유전자 대량개발을 위한 기능유전체 연구를 수행하고 있다.
나. 배추 유전체 해독 사업
농촌진흥청 농업생명공학연구원(책임자 박범석)은 배추(Brassica rapa ssp. pekinensis cv. Chiifu)의 유전체 완전해독을 위한 1단계 사업(2004-2008)을 확정하고 한국, 영국 등 8개 국가들과 협의체를 구성하였다. 배추의 유전체는 약 530Mb로 10개의 염색체로 이루어졌는데, 한국은 배추 염색체 1번과 2번의 염기서열 해독을 수행한다. 2006년말까지 배추의 물리지도를 완성하였고 염색체 해독은 약 34% 진행 중이다.
물리지도 제작 중에 개발된 분자 마커 400여 개는 배추의 뿌리혹병, 노균병, 바이러스병 저항성, 만추대성, 내한성 향상을 위한 육종에 이용되고 있다. 또한 배추의 발현유전자(EST)를 130,000건을 분석하고 정리하여 고유 유전자 32,000개로 구성된 유전자 칩을 제작하고 수분스트레스 내성, 기능성, 영양성 및 병저항성에 관련된 유전자의 기능 연구에 활용하고 있다.
다. 가지과 식물 유전체 해독 연구
과학기술부 21C프론티어 연구개발사업 작물유전체기능연구사업단과 한국생명공학연구원 허철구/최도일 팀은 우리나라를 비롯한 미국, 영국, 일본 등 전 세계 19개국 연구팀으로 2004년 결성된「국제 가지과 유전체 프로젝트(International Solanaceae Genome Project)」에 참여하여 토마토 유전체분석 전체의 12%(2번 염색체)에 해당하는 유전체 염기서열 해독연구를 향후 4년간 수행할 것이다.
토마토는 고추, 감자, 가지, 감자, 담배 등 다른 가지과 식물들과 90% 가량 유전자 배열이 같지만 유전체 규모가 가장 작다는 장점을 가지고 있다. 국내 연구팀이 맡은 토마토 유전체분석 분량은 12Mb의 진정염색체 지역인데 BAC 클론의 contig map 작성과 더불어 BAC을 대상으로 염기서열 분석을 이미 절반이상 수행하고 annotation을 진행하고 있다.
국내 연구팀(허철구, 최도일)은 동시에 고추유전체 분석 연구를 수행하여 2007년 현재 115,598종의 EST sequence(unigene 29,580종)를 발굴하고 DB를 구축하여 공개하였다.
라. 벼흰잎마름병원균 기능유전체 연구
농촌진흥청 농업생명공학연구원은 벼흰잎마름병균의 유전체 염기서열이 완전해독(4.94Mb)됨에 따라 그 후속조치 연구로서 유전체 정보를 이용한 유전자 기능분석 모델시스템을 확립하기 위하여 reverse genetics 방법에 의한 유전자 기능분석용 mutant pool 20,000점을 구축하여 Xoo 돌연변이주에 대한 병원성을 검정한 결과 1차적으로 병원성 소실유전자 40점을 선발하였고, DNA chip을 이용한 유용유전자를 대량 발굴하기 위하여 3,007개의 ORF로부터 50 Oligomer를 이용, Xoo-DNA chip을 완성하여 유전자 기능분석에 활용 중에 있다.
마. 벼도열병원균 기능유전체 연구
2005년 국제 컨소시엄에 의하여 벼도열병균 7개의 염색체에 12,800여 개의 유전자예측이 보고되었다. 그러나 도열병균은 식물병원성 곰팡이 중에서 가장 많은 연구가 수행된 병원균이지만, 현재까지 유전자의 기능이 밝혀진 것은 30여 개 내외 정도이다. 이러한 한계를 극복하기 위해 이용환 교수팀(서울대학교)은 식물체에서 많이 사용하는 Agrobacterium tumefaciens-mediated transformation(ATMT)을 이용한 insertional mutagenesis 실험법으로 벼도열병균의 기능유전체 연구를 위한 시스템 구축을 확립하였다.
ATMT는 곰팡이 형질전환 대상이 원형질체로 제한되던 것을 포자(spore)로 대치하여 형질전환 효율 또한 증가시킬 수 있었으며 총 21,000개의 도열병균 형질전환체를 확보하였다. 실험을 통해 확보한 203개의 병원성 유전자에 대한 생물정보학적 기능분석으로, 이 유전자들이 세포내 신호전달, 물질 대사 및 수송 등 다양한 과정에 관여하는 기능을 가지고 있음을 알 수 있었다. 앞으로 본 과제에서 확립한 기능유전체 연구 방법이 다른 사상성 진균의 기능유전체 연구의 모델이 될 수 있을 것으로 기대한다. 본 과제에서 얻은 모든 형질전환체들은 국가지정 “식물병원성 곰팡이 유전자원은행”(Center for Fungal Genetic Resources, website: www.genebank.snu.ac.kr) 및 벼도열병균 ATMT database(www.atmt.snu.ac.kr)에 저장되어 있다.
바. 돼지 유전체 해독 연구사업
2004년부터 2006년까지 3년간 한국, 미국, 영국, 프랑스, 캐나다, 중국, 독일, 덴마크, 일본 등 9개국 국제컨소시엄이 구성되어 돼지유전체 해독사업을 추진하였다. 우리나라에서는 농촌진흥청 축산과학원이 주축이 되어 경상대, 건국대, 한국생명공학연구원 등이 참여하였다. 한국이 담당하는 300Mb 염기서열 해독을 조기에 완료하여 최소의 기여로 최대의 효과를 창출해 공용 데이터베이스에 등록하였고, 이를 활용하기 위하여 한국 재래돼지의 주요 경제형질 좌위에 대한 유전체 해독도 병행해 진행하였다. 특히 근내지방과 같은 육질 관련 영역에 대한 대단위 유전체 정보를 조기에 확보하여, 이에 대한 분자육종 및 인체 의학 증진을 위한 대량의 유용 기초정보를 본 과제를 통하여 도출하였다.
사. 유전체정보를 이용한 분자마커 개발 및 활용 연구
(1) 분자표지이용 여교잡을 통한 콩 모자이크바이러스병
저항성 신품종 콩 개발
농촌진흥청 작물과학원과 바이오그린21사업단은 국내 최초로 콩 생산을 크게 제한하는 콩 모자이크바이러스병 저항성 유전자 3종(Rsv1, Rsv3, Rsv4)에 대해서 국내 주요 보급종 콩 생산 품종인 소원콩, 태광콩 및 황금콩을 대상으로 목표 유전자 3종을 집적시키기 위한 전단계로서 BC4F1세대에서 단인자 근동질 계통을 위한 분자표지이용선발(marker-assisted selection, MAS)을 실시하였다. 상기의 방법으로 육성된 콩 지역적응시험으로 4계통이 시험개시 5년만에 전국단위의 지역적응시험에서 성공적인 결과를 도출하였다.
(2) 효율적 육종기술 개발을 위한 고추 분자마커 개발
농촌진흥청 원예연구소는 2004년부터 고추역병 저항성 육종재료를 이용하여 집단을 만들고 이를 이용하여 저항성 QTL 표지의 선발 및 유전양식을 구명하기 위한 연구를 수행하여 역병 저항성 QTL 분석 결과 역병 저항성에는 최소한 2개의 유전자가 관여한다는 사실과 1~2개의 주동유전자와 이들의 상호작용에 의해서 저항성 수준이 발현되며 미동유전자의 효과는 크지 않음을 보고하고 신뢰성 있는 QTL 선발을 위하여 190여 개 개체로 구성된 저항성 분리집단을 이용하여 유전자지도를 작성하여 2007년 현재 QTL 분석 및 표지개발에 이용하기 위한 연구를 수행 중이다.
농림기술개발센터(ARPC)는 2007년 분자마커 개발에 필수인 고밀도 유전자연관 지도, 물리지도 및 Integrated Map 작성, 10개 이상의 분자마커를 개발하고 신품종 육성에 활용 및 10개 이상의 유용형질을 보유한 계통과 10개 이상의 신품종 육성을 목표로 고추 분자마커 사업단을 선정하여 2007년부터 지원을 시작하였다.
- 제1핵심과제 : 유전자 지도 작성과 세대단축을 위한 유전 집단육성 및 유지
- 제2핵심과제 : 초고밀도 유전자 연관지도와 물리지도 작성(1cM 커버) 및 분자마커 개발
- 제3핵심과제 : 분자마커를 이용한 내병성 계통 육성(5점 이상) 및 품종개발(10점 이상)
- 제4핵심과제 : 고추 분자육종을 위한 분자마커 분석 및 병리연구 지원
(3) 분자마커를 이용한 콩 육종(작물유전체사업단)
전통 육종기술과 새로운 표지이용선발법(MAS)을 접목시키는 연구는 육종효율을 획기적으로 향상시킬 뿐만 아니라 육종기간을 단축시킬 수 있는 기술로 인식되고 있다.
21C 프론티어 연구개발사업 작물유전체기능연구사업단 지원에 의한 거대배아미 품종 육성(서울대 고희종 교수), 분자표지이용 선발법(MAS)을 이용한 지방산 산화효소(lipoxygenase) 유전자를 결실 비린내 제거 후 경상1, 2호 콩 등(경상대 정종일 교수)을 육성하여 품종보호를 출원하였다.
(4) 분자마커를 이용한 한우 및 수입소고기 판별기술 개발
농촌진흥청 축산과학원은 한우고기 부정유통을 방지하고 농축산물 원산지 표시제 등의 정책지원을 위하여 한우육과 수입우육을 판별할 수 있는 DNA 마커들을 발굴하고 이를 이용한 유전자 감식기법 개발에 착수하여 소 유전체해독프로젝트로 양산된 방대한 DNA 염기서열 정보로부터 Bos indicus와 Bos taurus를 대별할 수 있는 DNA 마커, microsatellite(MS)와 sequence tagged site(STS) 마커 및 SNP 마커를 발굴하였다. 발굴된 각종의 DNA 마커를 이용하여 한우 및 수입우 5,000두 이상의 시료를 대상으로 분석한 결과 100%의 판별률을 보였으며, 원산지 표시제 단속기관인 국립농산물품질관리원과 공동으로 시중 유통 쇠고기 262점에 대한 현장 실증시험에서 완벽한 결과를 도출하였다.

가. 유전자변형 작물 개발 연구
현대 분자생물학 기술을 적용한 작물의 유전적 특성개량을 위한 생명공학연구는 유용 신규 유전자 개발과정과 이들 유전자를 작물에 형질 전환하여 유전자변형 작물을 개발하는 연구와 주요 형질을 효과적으로 선발할 수 있는 분자마커 개발 등으로 구분할 수 있다.
농업생명공학 연구는 주로 농촌진흥청 등 국가연구기관과 대학 그리고 정부부처가 지원하는 연구개발과제 및 특성화연구사업단 등에서 이루어지고 있으며 연구개발 과정 및 성과 등을 효율적으로 관리하고 있다.
(1) 농촌진흥청의 연구개발 현황
농촌진흥청은 생명공학기술을 이용한 우량작물을 개발하기 위하여 농업생명공학연구원을 중심으로 소속기관별로 기반기술 및 실용화를 위한 연구개발을 수행하고 있으며, 동시에 산․학․연 협동연구개발을 지원하기 위하여 바이오그린21 출연금사업을 수행하고 있다.
농촌진흥청 소속연구기관에서 연구개발 중인 형질전환 식물체는 16작물 48종(2007년 현재)이며 이들 작물 중 형질전환 유전자의 기능발현이 확인된 유전자변형 작물은 38종, 환경위해성 평가 7종 그리고 산업체 기술이전 2종류 등으로 집계되고 있다[부표 1].
농촌진흥청이 수행하는 바이오그린21사업은 2005년부터 3년간 제2단계 사업을(사업비 104,828백만원) 대학, 연구기관, 산업체 등 학․연․산 공동연구 중심으로 수행하고 있고 생명공학기술의 농업적 실용화기술연구개발을 지원하여 429여 건의 특허(출원 324건, 등록 55건) 성과를 보이고 있다[부표 2].
(2) 농림기술관리센터 연구개발 현황
농림부 농림기술관리센터가 농특세원을 활용하여 수행하는 특정연구개발사업은 2005년~2007년 3년간 연구개발비 30,295백만원을 활용하여 생명공학 관련 연구개발을 지원하여 31건의 특허(출원 24건, 등록 6건) 성과를 보이고 있다[표 4-4-3-1].
|
표 4-4-3-1 |
농림기술관리센터 농업생명공학 연구 개발사업 주요 성과
|
구 분 |
성 과 명 |
기 능 |
연구개발 단계 |
||
|
실증단계 |
지식재산권 확보 |
기술 이전 |
|||
|
BT
제품 |
당뇨병 예방 치료제 |
AMP-activated protein kinase 활성화 |
|
○ |
|
|
바이오폴리머(버섯이용) |
항당뇨 |
|
○ |
|
|
|
작물바이러스 진단용 chip |
oligonucleotide |
|
○ |
|
|
|
구 분 |
유전자명 |
기 능 |
연구개발 단계 |
||
|
지식재산권 확보 |
실용화 적용 |
기술 이전 |
|||
|
유용
유전자 |
바이러스 저항성 분자표지마커 |
수출용 고추종자생산 |
○ |
|
○ |
|
혈전용해효소 유전자 |
기능성 상추 |
○ |
|
|
|
|
vanilline 생성 유전자 |
바닐라향 생산 |
○ |
|
|
|
|
유용유전자 활용 |
닭 사육환경 및 사양에 활용 |
○ |
|
|
|
출처 : 농림기술관리센터 자료 제공
(3) 작물유전체기능연구사업단 연구개발 현황
과학기술부 21C 프론티어 연구개발사업 작물유전체기능연구사업단은 2005년부터 2007년까지 약 300억원의 연구개발비를 활용하여 제2단계 사업을 수행하였으며 약 150개 세부과제를 수행하여 220건의 특허(출원 141건, 등록 79건) 실적을 달성하고, 건조내성 관련 유전자인 AIA(ABA induced AP2/ERF) 등 34종의 신규 고유유전자를 개발하여 이 중 6종을 기술이전, 9종 유전자에 대한 실용화 적용 연구를 추진하고 있다[표 4-4-3-2].
|
표 4-4-3-2 |
작물유전체기능연구사업단 농업생명공학 주요 연구개발 성과
|
구 분 |
성 과 명 |
기 능 |
연구개발 단계 |
||
|
도입 형질 확인 |
안전성 평가 |
기술 이전 |
|||
|
유전자 변형 생물체 |
수확량 증가 벼 10종 |
NAC, AP2 등 전사인자 과발현 |
○ |
|
○ (독일) |
|
바이러스 내성 고추 |
CMVP0 CP 유전자 과발현 |
○ |
○ |
|
|
|
가뭄에 견디는 벼 |
트레할로스 생합성 유전자 이식 |
○ |
○ |
○ (인도) |
|
|
알마름병 저항성 벼 |
toxoflavin lyase A 유전자 이식 |
○ |
○ |
|
|
|
제초제 저항성 벼 밀양 204호 |
bar 유전자 이식 |
○ |
○ |
|
|
|
구 분 |
성 과 명 |
기 능 |
연구개발 단계 |
||
|
실증단계 |
지적 재산권 확보 |
기술이전 |
|||
|
BT 기술 |
엽록체 형질전환기술 |
이식유전자의 2차 재조합 방지 |
○ |
○ |
○ |
|
MAS 이용 콩 품종 육성기술 |
비린내 없는 소화 용이 생식용 콩 |
○ |
○ |
|
|
|
형질전환식물 선발 기술 |
toxoflavin lyase A 유전자 선발마커 |
○ |
○ |
|
|
출처 : 작물유전체기능연구사업단 자료 제공
나. 축산생명공학 기술 및 유전자변형 동물 연구개발
(1) 체세포 복제 동물 생산
복제소 생산연구 분야에서는 공여핵 조절에 따른 복제 배반포 발달률 및 임신률 향상을 위해 공여세포의 히스톤 아세틸화를 증가시켰다. 그리고 공여세포의 히스톤 탈아세틸화 억제제 처리는 체세포 복제과정에 이용 가능할 것으로 사료된다. 복제소와 일반소의 telomere를 분석한 결과, 복제소의 경우 성장단계별로 서서히 감소되는 추세를 나타내는데, 이것은 일반소와 비슷한 경향치를 보이며, 전체적으로는 복제소의 경우가 다소 낮은 경향을 보이고 있다. 일반소와의 유의적인 차이는 인정되지 않았다. 농촌진흥청 축산과학원은 지금까지 생산된 복제소 및 복제 후대에 대한 검정으로 일반소와 비교하여 복제소 후대 및 3세대 복제소의 송아지를 생산하였다. 복제소는 일반소와 생리작용뿐만 아니라 생산물과 장기기능 등도 동일하여 안전성이 인증된 바 복제소를 이용한 생명공학 연구가 더욱 활기를 띨 것으로 사료된다.
(2) 형질전환 가축을 이용한 바이오신약 생산기술 개발
농촌진흥청 축산과학원은 형질전환 가축을 이용한 신약개발연구 분야에서는 사람의 락토페린 유전자와 계란 특이적 프로모터인 ovalbumin 프로모터와 결합된 viral vector를 구축하고, 재조합 lentivirus를 stage-X 수정란의 배아강에 주입하여 형질전환 병아리를 생산하고, 형질전환 가축의 산업화 연구 성과인 조혈촉진제 생산 형질전환돼지(새롬이) 국유특허를 전용실시하였다(2006년 8월, (주)피엠지바이오).
바이오그린21사업단은 혈우병치료제 폰 윌리브란트 인자 형질전환돼지 개발을 위하여 혈액응고에 중요한 작용을 하는 폰 윌리브란트 인자(von Wilebrand factor, vWF)를 돼지에 형질 전환하여 유즙에서 인체혈중에 비해 약 30배 높은 발현량을 보이는 형질전환돼지를 제작하였다. 2차적으로 유즙 분비된 vWF를 분리 정제하는 체계를 구축하여 정제된 vWF의 약리활성을 검증하여 vWF를 유즙으로 대량 분비하는 형질전환돼지를 세계 최초로 생산하였다.
(3) 바이오장기 생산 연구
체세포복제기법을 이용한 미니돼지 확대 증식 연구에서는 돼지 정자인자를 이용한 새로운 돼지 복제 수정란 생산기술을 개발하였으며, 태아섬유아세포를 이용하여 복제돼지를 생산하였다. 또한, 정상적 복제태아간 발현차이 유전자동정을 실시하여 총 98개의 발현차이 유전자를 확인하였다. 바이오장기생산 연구용으로 하버드의대 미니돼지(MHC inbred miniature minipig) 24두(♀:20두, ♂:4두)를 도입하고, 미니돼지의 귀세포를 채취하여 6주(♀:3두, ♂:3두)의 체세포주를 구축하였다. 도입된 24두를 증식하기 위해 자연종부를 실시하여 2006년말 현재 62두(♀:32, ♂:30)까지 증식하였다.
(4) 농촌진흥청 축산과학원 동물생명공학 연구개발 현황
농촌진흥청 축산과학원에서는 한우, 돼지, 닭 등 가축의 복제 및 형질전환 연구를 1998년부터 수행하고 있다. 2003년도 2과제 11세부과제, 2004년도 2과제 10세부과제, 2005년도 2과제 12세부과제 그리고 2007년도 현재 3과제 15세부과제의 생명공학관련 연구를 수행하고 있으며 그 연구결과를 요약하면 [표 4-4-3-3]과 같다.
|
표 4-4-3-3 |
농촌진흥청 축산과학원 복제동물 및 형질전환 동물 생산 연구결과 요약
|
구 분 |
2005 |
2006 |
2007 |
|
복제 동물 |
우량형질 한우 복제생산 |
복제한우 2세대 송아지 탄생 |
복제한우 3세대 송아지 탄생 |
|
계 1종 23두 보유 |
복제소 및 후대 26두 보유 |
복제소 및 후대 총 29두 보유 |
|
|
형질전환 동물 |
빈혈치료제(EPO) 생산 돼지 |
EPO 생산 돼지 국유특허권 전용실시 |
EPO 생산 돼지 국유특허권 전용실시 |
|
혈우병치료제생산돼지 |
혈우병치료제생산돼지 증식 |
혈우병치료제생산돼지 증식 |
|
|
혈전증치료제생산돼지 |
혈전증치료제생산돼지 증식 |
혈전증치료제생산돼지 증식 |
|
|
형광 닭 증식 |
락토페린 생산 닭 1종 |
락토페린 생산 닭 증식 |
|
|
지식재산권 (출원/등록) |
국내특허출원 2건 |
국내특허출원 2건 국내특허등록 2건 |
국내특허출원1건 국내특허등록1건 |
출처 : 농촌진흥청 축산과학원 자료 제공

생명공학기술을 이용하여 국내에서 개발하여 상업화 승인 및 상품화한 작물 또는 식품․식품소재는 없는 실정이며, 외국에서 개발하여 국내 시장을 겨냥하여 상업화하기 위한 환경위해성 및 식품안전성 심사승인은 2002년에 식품의약품안전청에 의하여 최초로 이루어졌다.
유전자변형 생물체의 환경위해성 심사승인은 농림부장관이 농촌진흥청장에게 위임하여 시행하고 있는「유전자 변형 농산물의 환경위해성 평가심사지침」(농림부고시 제2002-2호)에 의거하여 실시한다. 최초의 승인 신청은 제초제저항성 콩(2003. 8, 몬산토코리아)이며, 2007년 7월 현재 5작물 33건이 신청되어 이중 20건이 승인되었고 13건이 심사 중에 있다[부표 3].
유전자변형 생물체를 이용한 식품 및 첨가물의 상업화를 위해서는 식품의약품안전청이 시행중인「유전자 재조합 식품첨가물 안전성 평가 자료심사지침」(식의약청고시 제2006-19호)에 의하여 안전성 심사를 받아야한다. 2007년 7월 현재 식품의약품안전청의 식품안전성 심사승인 현황을 보면 12종의 유전자재조합 식품첨가물에 대한 심사가 완료된 상태이며[부표 4], 57종의 유전자재조합 원료농산물에 대한 식품안전성 심사신청을 접수하여 이 중 50건을 심사 승인하였다[부표 5].
부 표
|
부표 1 |
농촌진흥청 유전자변형 생물체 연구개발 현황(2007년 7월)
|
성 과 명 |
유전자명 |
소속기관 |
연구개발단계 |
|||
|
도입형질 확인 |
고정계통 육성 |
안전성 평가 |
기술이전 |
|||
|
내재해증진 벼 |
OsEREBP |
생명연 |
○ |
|
|
|
|
병저항증진 벼 |
npr1 |
“ |
○ |
|
|
|
|
병저항증진 벼 |
TGA |
“ |
○ |
|
|
|
|
병저항증진 벼 |
OsDRP |
“ |
○ |
|
|
|
|
내건성 벼 |
OsPK2 |
“ |
○ |
|
|
|
|
병저항증진 벼 |
OsWARKY6 |
“ |
○ |
|
|
|
|
병저항증진 벼 |
OsLRP |
“ |
○ |
|
|
|
|
종자발달 벼 |
OsEOZ |
“ |
○ |
|
|
|
|
비타민A강화 벼 |
Psy:CrtI |
“ |
○ |
|
|
|
|
내병성,내냉성 벼 |
LS28 |
“ |
○ |
|
|
|
|
근사미저항성 벼 |
EPSPS |
“ |
|
○ |
|
|
|
해충저항성 벼 |
CryIAc1 |
“ |
|
|
○ |
|
|
제초제저항성 벼 |
bar(익산483호) |
생명연,호농연 |
|
|
○ |
|
|
제초제저항성 벼 |
bar(밀양204호) |
생명연,영농연 |
|
|
○ |
|
|
문고병저항성 벼 |
NDPK |
작물원 |
○ |
|
|
|
|
Isoflavone 생합성 벼 |
IFS1, 2 |
작물원 |
○ |
|
|
|
|
녹병저항성 밀 |
RLG |
생명연 |
○ |
|
|
|
|
좀나방저항성 배추 |
CryIAc1 |
생명연 |
|
|
○ |
○ |
|
웅성불임성 배추 |
PGR06 |
“ |
○ |
|
|
|
|
웅성불임성 양배추 |
PGR11 |
생명연 |
○ |
|
|
|
|
복합바이러스 토마토 |
scFv |
고농연 |
○ |
|
|
|
|
제초제저항성 고추 |
bar |
생명연 원예연 |
|
|
○ |
○ |
|
전분조절 상추 |
AGP |
생명연 |
○ |
|
|
|
|
카테킨생산 상추 |
LCR |
“ |
○ |
|
|
|
|
내냉성 감자 |
StEREBP |
생명연 |
○ |
|
|
|
|
재해저항성 감자 |
GPD |
“ |
○ |
|
|
|
|
철분강화 감자 |
FBP |
“ |
○ |
|
|
|
|
제초제저항성 감자 |
bar |
고농연 |
|
|
○ |
|
|
내병성 감자 |
Go |
“ |
○ |
|
|
|
|
바이러스저항성 감자 |
CP |
“ |
|
|
○ |
|
|
세균병저항성 감자 |
Shiva |
“ |
○ |
|
|
|
|
숙기조절 감자 |
GA3bOH-1 |
” |
○ |
|
|
|
|
비타민E강화 들깨 |
TMT |
생명연,작물원 |
|
○ |
|
|
|
제초제저항성 박 |
bar |
원예연 |
|
○ |
|
|
|
칼슘이온흡수 박 |
CAX2-B |
“ |
○ |
|
|
|
|
착색증진 사과 |
MdMADS |
“ |
○ |
|
|
|
|
혈전 용해제 알파파 |
t-PA |
생명연 |
○ |
|
|
|
|
내열성 알파파 |
HSP |
축과원 |
○ |
|
|
|
|
제초제저항성 알파파 |
bar |
“ |
○ |
|
|
|
|
뉴캐슬병백신 버즈풋 트레포일 |
HN |
생명연 |
○ |
|
|
|
|
고온내성 버즈풋 트레포일 |
HSP17.6 |
축과원 |
○ |
|
|
|
|
재해냉성 버즈풋 트레포일 |
SOD:APX |
“ |
○ |
|
|
|
|
구제역백신 버즈풋 트레포일 |
VP1 |
생명연 |
○ |
|
|
|
|
콜레라백신 버즈풋 트레포일 |
E2::sf |
“ |
○ |
|
|
|
|
재해저항성 오차드그라스 |
SOD::APX |
축과원 |
○ |
|
|
|
|
내하고성 오차드그라스 |
Hsp17.8 |
“ |
○ |
|
|
|
|
재해저항성 톨페스큐 |
NDPK2 |
“ |
○ |
|
|
|
|
카로티노이드합성 감귤 |
Psy |
난지연 |
○ |
|
|
|
|
16작물 |
48종 |
|
38종 |
3종 |
7종 |
(2종) |
출처 : 농촌진흥청 농업생명공학연구원 자료 제공
|
부표 2 |
농촌진흥청 바이오그린21 제2단계 사업 주요 성과물 현황
|
구 분 |
성 과 명 |
기 능 |
연구개발 단계 |
||
|
도입형질 확인 |
안전성 평가 |
기술 이전 |
|||
|
유전자 변형 생물체 |
벼 분자표지이용 품종 |
병충해 저항성 |
○ |
|
|
|
벼 분자표지이용 품종 |
수량증대 |
○ |
|
|
|
|
병 저항성 콩 |
모자이크바이러스 저항성 |
|
○ |
|
|
|
자가화합성 배추 계통 |
배추자가화합성 계통 |
|
○ |
|
|
|
기능성 강화 사과 |
살충성, 항암성 등 |
○ |
|
|
|
|
음지내성 잔디 |
파이토크롬 과발현 |
○ |
|
|
|
|
2차대사물질 강화 벼 |
플라보노이드 합성 |
○ |
|
|
|
|
구 분 |
성과명 |
기 능 |
연구개발 단계 |
||
|
실증단계 |
지식재산권 확보 |
기술 이전 |
|||
|
BT
기술 |
기능성 요구르트 제조방법 |
고기능 SAM |
|
|
○ |
|
리파제 생산기술 |
리파제 생산 신규 균주 HY-1 |
|
|
○ |
|
|
잔류유기농약 복원 기술 |
잔류농약 생물학적 복원 |
|
|
○ |
|
|
농용 항진균제 |
신규 저독성 항진균제 분리 |
|
○ |
|
|
|
항균활성 미생물 |
채소병 방제(EF067) |
|
○ |
|
|
|
GABA고생산 균주 |
GABA 고생산 치즈starter균주 |
|
○ |
|
|
|
생체분자 검출 칩 |
생체분자 검출용 랩온어칩 |
|
○ |
|
|
|
벼 T-DNA 삽입변이계통 |
벼T-DNA 삽입변이계통(10만) |
|
○ |
|
|
|
항비만 물질 |
항비만물질 PG105 |
|
○ |
|
|
|
미생물 살균제 |
흰가루병 방제 |
|
|
○ |
|
|
구 분 |
유전자명 |
기 능 |
연구개발 단계 |
||
|
지식재산권 확보 |
실용화 적용 |
기술 이전 |
|||
|
유용
유전자 |
병 저항성마커 |
무사마귀병 마커 |
○ |
|
|
|
닭 퍼옥시레독신 |
스트레스 저항성 |
○ |
|
|
|
|
고효율 프로모터 |
고구마 뿌리특이 |
○ |
|
|
|
|
Oslti32 |
비생물성 스트레스 내성 |
○ |
|
|
|
|
P450 환원효소 |
NADPH-사이토크롬 |
○ |
|
|
|
|
기능성 폴리펩타이드 |
혈액응고(Facttor VIII) |
○ |
|
|
|
|
뿌리털 특이 유전자 |
뿌리털 부위 특이 발현 |
○ |
|
|
|
|
pRCV1 벡터 |
식물형질전환용 |
○ |
|
|
|
|
세스퀴터핀 합성 |
세스퀴터핀 합성관련 |
○ |
|
|
|
|
한우 판별마커 |
고품질 관련 분자표지 |
○ |
|
|
|
|
병저항성 분자마커 |
콩 모자이크병 저항성 |
○ |
|
|
|
|
벼도열병균 유전자 |
신호전달, 대사 수송 |
○ |
|
|
|
출처 : 농촌진흥청 바이오그린21 사업단 자료 제공
|
부표 3 |
유전자변형 작물 환경위해성 심사승인 현황(농촌진흥청, 2007년 7월)
|
분류 |
품목명 |
신청자 |
특 성 |
접수일 |
승인일 |
|
콩 |
40-3-2 |
Monsanto Korea |
제초제저항성 |
03.08.18 |
04.03.19 |
|
옥수수 |
MON810 |
Monsanto Korea |
해충저항성 |
03.09.01 |
04.06.04 |
|
면화 |
RR1445 |
Monsanto Korea |
제초제저항성 |
03.09.04 |
04.07.23 |
|
옥수수 |
MON863 |
Monsanto Korea |
해충저항성 |
03.09.22 |
04.09.17 |
|
옥수수 |
NK603 |
Monsanto Korea |
제초제저항성 |
03.09.29 |
04.07.23 |
|
옥수수 |
GA21 |
Monsanto Korea |
제초제저항성 |
03.10.06 |
05.02.18 |
|
면화 |
531 |
Monsanto Korea |
해충저항성 |
03.10.24 |
04.12.10 |
|
면화 |
757 |
Monsanto Korea |
해충저항성 |
03.10.24 |
04.12.10 |
|
면화 |
15985 |
Monsanto Korea |
해충저항성 |
03.10.30 |
04.12.10 |
|
옥수수 |
T25 |
Bayer CropScience |
제초제저항성 |
03.11.06 |
04.11.05 |
|
옥수수 |
TC1507 |
DuPont Korea |
해충+제초제저항성 |
03.11.14 |
04.11.05 |
|
카놀라 |
T45 |
Bayer CropScience |
제초제저항성 |
04.07.30 |
05.06.21 |
|
카놀라 |
Ms8/Rf3 |
Bayer CropScience |
제초제저항성 |
04.07.30 |
05.06.21 |
|
옥수수 |
Bt176 |
Syngenta Seeds |
해충저항성 |
04.09.24 |
06.01.25 |
|
옥수수 |
Bt11 |
Syngenta Seeds |
해충+제초제저항성 |
04.09.24 |
06.01.25 |
|
카놀라 |
RT73 |
Monsanto Korea |
제초제저항성 |
04.10.01 |
05.06.21 |
|
옥수수 |
DAS-59122-7 |
DuPont Korea |
해충+제초제저항성 |
04.11.30 |
05.12.09 |
|
면화 |
LLcotton25 |
Bayer CropScience |
제초제저항성 |
05.01.19 |
05.12.09 |
|
옥수수 |
MON 88017 |
Monsanto Korea |
해충+제초제저항성 |
05.04.02 |
06.10.26 |
|
면화 |
MON 88913 |
Monsanto Korea |
제초제저항성 |
05.04.27 |
06.10.26 |
|
알파파 |
J101,J163 J101×J163 |
Monsanto Korea |
제초제저항성 |
05.05.12 |
심사 중 |
|
옥수수 |
LY038 |
Monsanto Korea |
기능성 강화 |
05.06.23 |
07.05.15 |
|
카놀라 |
MS1/RF1 |
Bayer CropScience |
제초제저항성 |
05.10.10 |
심사 중 |
|
카놀라 |
MS1/RF2 |
Bayer CropScience |
제초제저항성 |
05.10.10 |
심사 중 |
|
카놀라 |
Topas 19/2 |
Bayer CropScience |
제초제저항성 |
05.10.10 |
심사 중 |
|
면화 |
281/3006 |
Dow Agroscience |
해충+제초제저항성 |
05.11.09 |
심사 중 |
|
옥수수 |
MIR604 |
Syngenta Seeds |
해충저항성 |
05.11.30 |
심사 중 |
|
옥수수 |
3272 |
Syngenta Seeds |
기능성 강화 |
06.04.19 |
심사 중 |
|
콩 |
A2704-12 |
Bayer CropScience |
제초제저항성 |
06.10.16 |
심사 중 |
|
옥수수 |
6275 |
Dow Agroscience |
해충+제초제저항성 |
07.01.12 |
심사 중 |
|
콩 |
mon89788 |
Monsanto Korea |
제초제저항성 |
07.01.12 |
심사 중 |
|
옥수수 |
mon89034 |
Monsanto Korea |
해충저항성 |
07.03.05 |
심사 중 |
|
옥수수 |
Bt10 |
Syngenta Seeds |
해충+제초제저항성 |
07.03.28 |
심사 중 |
출처 : 농촌진흥청 바이오그린21 사업단 자료 제공
|
부표 4 |
유전자재조합 식품첨가물 식품안전성 심사 현황(식품의약품안전청, 2007년 7월)
|
번호 |
제 품 |
신청자 |
특 성 |
심사결과 |
용도승인 (식용) |
|
1 |
Maltogenic amylase |
Novo Nordisk |
Amylase |
적합 |
수입 |
|
2 |
Termamyl |
Novo Nordisk |
Amylase |
적합 |
수입 |
|
3 |
PromozymeD |
Novo Nordisk |
pullulanase |
적합 |
수입 |
|
4 |
Lipozyme RM IM |
Novo Nordisk |
lipase |
적합 |
수입 |
|
5 |
Novoshape |
Novo Nordisk |
pectinesterase |
적합 |
수입 |
|
6 |
Riboflavin |
Roche |
Vitamin |
적합 |
수입 |
|
7 |
Maturex L |
Novozymes Korea |
α-acetolactate decarboxylase |
적합 |
수입 |
|
8 |
lecitinase ultra /lipopan H BG |
Novozymes Korea |
lipase |
적합 |
수입 |
|
9 |
lecitinase Novo/lipopan F BG |
Novozymes Korea |
lipase |
적합 |
수입 |
|
10 |
Optimax L-1000 |
(주) 옥전바이오텍 |
pullulanase |
적합 |
수입 |
|
11 |
Lipopan 50BG /lipozyme TL IM |
노보자임스 코리아(주) |
lipase |
적합 |
수입 |
|
12 |
ChyMax |
크리스찬 한센 A/S |
chymosin |
적합 |
식품첨가물 등록절차 중 |
|
13 |
Pentopan Mono BG |
노보자임스코리아(주) |
Xylanase |
심사 중 |
- |
|
14 |
Shearzyme |
노보자임스코리아(주) |
Xylanase |
심사 중 |
- |
출처 : 식품의약품안전청 자료 제공
|
부표 5 |
유전자재조합 원료농산물 식품안전성 심사 현황(식품의약품안전청, 2007. 7. 현재)
|
번호 |
분류 |
제 품 |
신청자 |
특 성 |
심사결과 |
용도승인 (식용) |
|
1 |
콩 |
RRS |
몬산토코리아(주) |
제초제내성 |
적합 |
수입 |
|
2 |
옥수수 |
MON810 |
몬산토코리아(주) |
해충저항성 |
적합 |
수입 |
|
3 |
옥수수 |
1507 |
유한회사 듀퐁 |
해충저항성 및 제초제내성 |
적합 |
수입 |
|
4 |
옥수수 |
GA21 |
몬산토코리아(주) |
제초제내성 |
적합 |
수입 |
|
5 |
옥수수 |
NK603 |
몬산토코리아(주) |
제초제내성 |
적합 |
수입 |
|
6 |
옥수수 |
Bt11 |
신젠타 종묘 |
해충저항성 및 제초제내성 |
적합 |
수입 |
|
번호 |
분류 |
제 품 |
신청자 |
특 성 |
심사결과 |
용도승인 (식용) |
|
7 |
면화 |
531 |
몬산토코리아(주) |
해충저항성 |
적합 |
수입 |
|
8 |
면화 |
757 |
몬산토코리아(주) |
해충저항성 |
적합 |
수입 |
|
9 |
면화 |
1445 |
몬산토코리아(주) |
제초제내성 |
적합 |
수입 |
|
10 |
캐놀라 |
GT73 |
몬산토코리아(주) |
제초제내성 |
적합 |
수입 |
|
11 |
옥수수 |
T25 |
아벤티스 |
제초제내성 |
적합 |
수입 |
|
12 |
면화 |
15985 |
몬산토코리아(주) |
해충저항성 |
적합 |
수입 |
|
13 |
옥수수 |
MON863 |
몬산토코리아(주) |
해충저항성 |
적합 |
수입 |
|
14 |
옥수수 |
Bt176 |
신젠타 종묘 |
해충저항성 |
적합 |
수입 |
|
15 |
감자 |
SPBT02-05 |
몬산토코리아(주) |
콜로라도 감자벌레 저항성 |
적합 |
기타1 |
|
16 |
감자 |
RBBT06 |
몬산토코리아(주) |
콜로라도 감자벌레 저항성 |
적합 |
기타1 |
|
17 |
감자 |
Newleaf Y (RBMT15-101, SEMT15-02, SEMT15-15) |
몬산토코리아(주) |
콜로라도 감자별레 및 감자바이러스 Y저항성 |
적합 |
기타1 |
|
18 |
감자 |
Newleaf PLUS (RBMT21-129, RBMT21-350, RBMT22-82) |
몬산토코리아(주) |
콜로라도 감자벌레 및 leafroll 바이러스저항성 |
적합 |
기타1 |
|
19 |
옥수수 |
DLL25 |
몬산토코리아(주) |
제초제내성 |
적합 |
기타1 |
|
20 |
옥수수 |
DBT418 |
몬산토코리아(주) |
해충저항성 및 제초제내성 |
적합 |
기타1 |
|
21 |
면화 |
281/3006 |
다우아그로사이언스 |
해충저항성 및 제초제내성 |
적합 |
수입 |
|
22 |
옥수수 |
MON863× NK603 |
몬산토코리아(주) |
해충저항성 및 제초제내성 (후대교배종) |
적합 |
수입 |
|
23 |
옥수수 |
MON863× MON810 |
몬산토코리아(주) |
해충저항성 및 제초제내성 (후대교배종) |
적합 |
수입 |
|
24 |
옥수수 |
MON810× GA21 |
몬산토코리아(주) |
해충저항성 및 제초제내성 (후대교배종) |
적합 |
수입 |
|
번호 |
분류 |
제 품 |
신청자 |
특 성 |
심사결과 |
용도승인 (식용) |
|
25 |
옥수수 |
MON810× NK603 |
몬산토코리아(주) |
해충저항성 및 제초제내성 (후대교배종) |
적합 |
수입 |
|
26 |
옥수수 |
1507×NK603 |
유한회사 듀폰 |
해충저항성 및 제초제내성 (후대교배종) |
적합 |
수입 |
|
27 |
옥수수 |
MON810× Mon863× NK603 |
몬산토코리아(주) |
해충저항성 및 제초제내성 (후대교배종) |
적합 |
수입 |
|
28 |
캐놀라 |
Ms8/Rf3 |
바이엘크롭사이언스(주) |
제초제내성 및 웅성불임 |
적합 |
수입 |
|
29 |
캐놀라 |
T45 |
바이엘크롭사이언스(주) |
제초제내성 |
적합 |
기타1 |
|
30 |
옥수수 |
DAS-59122-7 |
유한회사 듀폰 |
해충저항성 및 제초제내성 |
적합 |
수입 |
|
31 |
면화 |
15985×1445 |
몬산토코리아(주) |
해충저항성 및 제초제내성 (후대교배종) |
적합 |
수입 |
|
32 |
면화 |
531×1445 |
몬산토코리아(주) |
해충저항성 및 제초제내성 (후대교배종) |
적합 |
수입 |
|
33 |
면화 |
LLcotton 25 |
바이엘크롭사이언스(주) |
제초제내성 |
적합 |
수입 |
|
34 |
사탕무우 |
H7-1 |
몬산토코리아(주) |
제초제내성 |
적합 |
수입 |
|
35 |
캐놀라 |
MS1/RF1 |
바이엘크롭사이언스(주) |
제초제내성 및 웅성불임 |
적합 |
기타1 |
|
36 |
캐놀라 |
MS1/RF2 |
바이엘크롭사이언스(주) |
제초제내성 및 웅성불임 |
적합 |
기타1 |
|
37 |
캐놀라 |
Topas 19/2 |
바이엘크롭사이언스(주) |
제초제내성 |
적합 |
기타1 |
|
38 |
옥수수 |
MON88017 |
몬산토코리아(주) |
해충저항성 및 제초제내성 |
적합 |
수입 |
|
39 |
면화 |
MON88913 |
몬산토코리아(주) |
제초제내성 |
적합 |
수입 |
|
40 |
옥수수 |
Bt10 |
신젠타 종묘(주) |
해충저항성 및 제초제내성 |
적합 |
기타2 |
|
41 |
알파파 |
J101/J163 |
몬산토코리아(주) |
제초제내성 |
심사 중 |
- |
|
42 |
옥수수 |
LY038 |
몬산토코리아(주) |
라이신 강화 |
심사 중 |
- |
|
43 |
옥수수 |
MIR604 |
신젠타종묘(주) |
해충저항성 |
적합 |
수입 |
|
44 |
옥수수 |
Das-59122-7×1507×NK603 |
유한회사 듀폰 |
해충저항성 및 제초제내성 (후대교배종) |
적합 |
수입 |
|
번호 |
분류 |
제 품 |
신청자 |
특 성 |
심사결과 |
용도승인 (식용) |
|
45 |
옥수수 |
1507×Das- 59122-7 |
유한회사 듀폰 |
해충저항성 및 제초제내성 (후대교배종) |
적합 |
수입 |
|
46 |
옥수수 |
Das-59122- 7×NK603 |
유한회사 듀폰 |
해충저항성 및 제초제내성 (후대교배종) |
적합 |
수입 |
|
47 |
옥수수 |
Bt11×GA21 |
신젠타종묘(주) |
해충저항성 및 제초제내성 (후대교배종) |
적합 |
수입 |
|
48 |
면화 |
BG2XLL (Bollgard II 15985 × LLCotton25) |
바이엘크롭사이언스(주) |
해충저항성 및 제초제내성 (후대교배종) |
적합 |
수입 |
|
49 |
옥수수 |
MON88017× MON810 |
몬산토코리아(주) |
해충저항성 및 제초제내성 (후대교배종) |
적합 |
수입 |
|
50 |
면화 |
Bollgard II 15985×Roundup Ready Flex MON88913 |
몬산토코리아(주) |
해충저항성 및 제초제내성 (후대교배종) |
적합 |
수입 |
|
51 |
면화 |
281/3005 × 88913 |
다우아그로사이언시스 인터내쇼널리미티드 |
해충저항성 및 제초제내성 (후대교배종) |
적합 |
수입 |
|
52 |
면화 |
281/3005 × 1445 |
다우아그로사이언시스 인터내쇼널리미티드 |
해충저항성 및 제초제내성 (후대교배종) |
적합 |
수입 |
|
53 |
옥수수 |
6275 |
다우아그로사이언시스 인터내쇼널리미티 |
나비목 해충 저항성 및 제초제내성 |
심사 중 |
- |
|
54 |
대두 |
A2704-12 |
바이엘크롭사이언스(주) |
제초제내성 |
심사 중 |
- |
|
55 |
옥수수 |
Event 3272 |
신젠타종묘(주) |
전분분해 amylase 유전자 |
심사 중 |
- |
|
56 |
콩 |
MON89788 |
몬산토코리아(주) |
제초제내성 |
심사 중 |
- |
|
57 |
옥수수 |
MON89034 |
몬산토코리아(주) |
해충저항성 |
심사 중 |
- |
출처 : 식품의약품안전청 자료 제공
* 용도승인 종류 : 수입, 개발, 생산, 기타
* 기타1 : 생산중단품목으로 심사승인된 것이므로 다시 생산할 경우 재심사를 받아야 함
* 기타2 : 상업적 목적으로 생산되지 않았으나 일반종자에 혼입사고 등으로 시중 유출 가능성에 따라 소비자에 정확한 안전성 정보를 제공하기 위하여 안전성 평가 심사된 경우이므로 수입 또는 생산의 상업적 재배를 재개할 경우 안전성에 대한 재평가 및 심사를 받아야 함


가. 개요
생물공정기술은 생명공학기술을 이용하여 목적 산물을 대량생산하기 위한 기술로써 “생명공학의 연구발견을 실제제품 및 공정 또는 사회적 수요에 부합하는 시스템으로 변환시키는 기술”을 총칭하는 것으로 정의된다.43) 산업자원부 산업기술 분류체계에 의하면 중분류로 분류된 생물공정/기기(분류번호:4011)는 생물공정기술, 생물전자/정보, 생물엔지니어링기술 및 기타 생물공정/기기로 분류된다.44) 유럽생물연합(European Federation of Biotechnology) 생물화학공학분과의 작업그룹은 다음과 같이 나누어져 활동하고 있다. 즉, 미생물 발효나 동식물 세포 배양에 이은 분리정제기술을 다루는 Downstream processing 그룹, 컴퓨터 기반 공정설계 및 최적화 기술과 생물반응기 유체역학을 연구하는 Bioreactor performance 그룹, 생물촉매 및 생물전환공정을 다루는 Biotransformation 그룹 및 세포 내 주요 성분들 사이 또는 세포와 반응기 사이의 상호연관성을 측정 및 제어하는 M3C(Modelling, Monitoring, Measurement & Control) 그룹으로 나누어 활동하고 있다.45) 위와 같은 국내외 자료들과 최근 연구동향들을 종합하면 생물공정 및 제조 관련 기술들을 다음과 같이 정리할 수 있다[표 4-5-1-1].
수년 전까지만 해도 생물공정기술의 주요 영역은 발효탱크, impeller, compressor, 펌프, 컬럼, 파이프 및 밸브와 같은 발효생물 제품생산에 요구되는 설비들을 설계하고, 이를 이용한 미생물 발효제품 생산 공정 개발과 효소 전환 기술개발 및 대량분리정제기술개발 분야였다.
|
표 4-5-1-1 |
생물공정기술의 분류
|
세부기술 |
핵심기술 |
|
배양공정기술 |
세포배양기술, 대사공학기술, Microarray 분석기술, 공정설계기술 |
|
생물전환 공정기술 |
초고속 효소 탐색기술, 초고속 효소 개량기술, 생체촉매 고정화기술, 생물반응기 설계기술 |
|
생물분리정제 공정기술 |
고순도분리정제기술, 극미량고속분석기술, SMB(Simulated Moving Bed) 분리공정기술, 초임계 분리정제기술 |
|
분자생물공정기술 |
대사공학기술, 시스템 생물학 기술, microarray 기술 |
|
기타 생물공정기술 |
생물전자/정보기술, 생물엔지니어링기술, 생물기기 제조기술 |
출처 : 대한민국, 산업자원부, 2006년 산업기술분류체계
EFB Section on Biochemical Engineering Science(http://www.esbesweb.org/)
생물공정기술의 영역은 1980년대를 전후로 미생물 외에 식물 및 동물세포 배양공정까지 확대 되었으며, 2000년대에 이르러서는 산업적으로 유용한 미생물들의 유전자 서열이 속속 밝혀지고, 생물정보학 및 오믹스(omics)의 발달과 DNA칩 및 단백질칩의 출현으로 유전자 및 단백질의 발현양상을 대량으로 신속 정확히 분석할 수 있게 되면서 거시적 배양조건에서 일어나는 현상들을 미시적인 관점에서 관찰할 수 있게 되었다.
이는 시스템 생물학(systems biology)과 대사공학기술(metabolic engineering)의 발달을 가능하게 하였고, 궁극적으로 이러한 일련의 기술들을 미생물 발효제품 및 재조합 단백질 생산 공정 기술개발에 활용하는 분자생물공정기술(molecular bioprocess engineering)의 발달로 이어지고 있다.
그동안 가장 중요한 생명공학 제품으로 알려진 생물의약품 생산기술은 동물세포 및 재조합 미생물을 사용하여 생산되고 있으며 이에 필요한 세포배양 및 고순도 분리정제 기술은 산업체에서 GMP 규격으로 잘 표준화 되어 있어 더 이상 산업화의 성패를 좌우하지 않는 일반화된 기술로 발전되었다.
반면에 그동안 석유화학을 기반으로 저렴하게 생산되던 화학원료물질들이 화석에너지의 한계성 및 고유가로 인하여 공급에 차질이 예상될 뿐만 아니라 지구온난화 문제로 인한 지속가능한 산업의 필요성이 대두되면서 재생 가능한 생물자원을 기반으로 한 생물공정기술에 의한 화학원료물질들의 생산 공정 기술 개발이 선택이 아닌 필수가 되면서 바이오리파이너리(Biorefinery) 기술개발이 새로운 생물공정기술의 화두로 대두되고 있다.
바이오리파이너리란 생물자원을 원료로 사용하여 이로부터 바이오에탄올, 바이오디젤 등과 같은 바이오 에너지와 각종 화학원료 물질들을 생산하는 공정기술의 총칭이다. 즉, 그동안에는 원유를 완전히 분획 및 정제하여 에너지 및 화학원료들을 생산하였다면, 바이오리파이너리 산업에서는 생물자원을 생물학적 또는 물리화학적으로 완전히 분해 및 정제하여 필요한 에너지와 화학원료물질들을 얻는 것이다[그림 4-5-1-1].46)

출처 : Green Chem., Vol 8, 853~860, 2006
|
그림 4-5-1-1 |
바이오리파이너리를 위한 그린 케미스트리의 응용
바이오리파이너리로 생산 가능한 주요 에너지 및 화학산업 제품들로는 3-hyd- roxypropionic acid, 1,3-propandiol, lactic acid, succinic acid와 같은 화학원료물질과 ethanol, butanol, 바이오디젤과 같은 에너지 및 polyhydroxyalkanoate(PHA), xanthan, dextran과 같은 고분자 등이 있다.
나. 해외 동향
화석에너지의 한계성 및 지구온난화 문제 등 주변 여건들의 변화에 따라 신산업으로서 바이오리파이너리 산업의 도래는 필연적이며, 대부분의 선진 국가들이 2020년 이후 거대 시장의 선점을 위한 기술개발에 매진하고 있다. 즉, 바이오리파이너리를 기반으로 한 산업바이오(White BioTechnology)의 발전과 함께 우리 일상생활에서 사용되고 있는 플라스틱, 섬유, 비닐, 필름, 아크릴, 페인트, 접착제 등 거의 모든 석유화학제품을 바이오매스를 원료로 하여 생산할 계획을 세우고 있다.
2003년에 발간된 미국의 매킨지 보고서에 의하면 2015년 전 세계 화학산업 시장의 25%인 4,300억 달러 규모의 시장이 바이오리파이너리 제품으로 대체될 것으로 예측하고 있으며, 미국은 연평균 5.7%의 바이오제품 시장 확대를 통하여 2030년 화학제품의 25%를 바이오리파이너리 제품으로 대체할 계획이다.
유럽의 경우, 지난 2003년 유럽 바이오산업연합(EuropaBio) 이라는 단체를 구성하고 유럽의 현실에 맞는 바이오 에너지와 바이오 제품의 개발 및 실용화에 나서고 있고, 일본도 2002년 「바이오매스 일본」 전략을 수립하고 2010년 200만 톤의 바이오플라스틱 생산과 5조원의 시장 창출을 목표로 하고 있다.
구체적인 개발 예로써 PHA의 경우 영국의 ICI사는 연간 1000톤 규모의 시험생산 공장을 가동 중이고, 미국의 메타볼릭스사는 ADM사와 함께 상업생산을 추진 중이며, 브라질은 설탕을 이용한 PHA 생산 공정을 개발 중에 있다. 영국의 네트컴포지트(NetComp)사는 정부의 지원을 받아 자동차 문과 보트 선체에 적용하기에 충분한 내구성을 지닌 경량의 친환경 바이오플라스틱 개발을 목표로 PHA 바이오플라스틱과 천연섬유를 혼합한 신세대 플라스틱을 개발하는 컴바인 프로젝트(Combine Project)를 수행하고 있다. 특히 독일의 훔볼트 베를린대학 프리드리히 교수와 뭔스터대학 스타인뷔헬 교수팀은 최근 대표적인 PHA 생산 미생물인 랄스토니아 유트로파(Ralstonia eutropha) 균의 전체 유전체 서열(2개 염색체상에 총 6116개의 유전자)을 밝혔으며, 이를 계기로 보다 효율적인 PHA 생산 균주의 개량이 가능해질 것으로 예측되고 있다.
젖산(L-lactic acid; 2-hydroxypropanoic acid)은 Polylactic acid(PLA)의 합성원료로 각광을 받고 있다. PLA는 Diol/Diacid 등의 원료물질을 화학적으로 축합하여 만든 폴리에스터 고분자의 대표적인 한 예로써, PHA에 비해 기능 조절이 용이한 장점을 지니기 때문에 보다 우수한 바이오플라스틱 소재로 평가되고 있다. PLA 바이오플라스틱 분야의 대표적인 선두주자는 미국 기업 NatureWorks(곡물기업 Cargill의 자회사)이며 이미 옥수수를 기반으로 한 제품을 상용화하여 유기농 우유의 포장재 등으로 공급하고 있으며, 또한 일본의 자동차기업 도요타는 사탕수수를 원료로 한 PLA 바이오플라스틱 생산 연 5만 톤 규모의 공장을 2007년까지 건설할 예정이다.
또한, 일본 NEC와 유니타카사는 공동으로 2006년 PLA와 펄프원료인 케나프(Kenaf) 섬유를 혼합하는 방법으로 충격내성, 성형성 및 내열성이 더욱 강화된 바이오플라스틱을 개발하여 2008년도까지 양산기술을 확립할 예정이며, NTT 도코모가 이 강화 바이오플라스틱을 이용하여 2006년 새로운 휴대전화 단말기인 「N701ECO」를 개발하였고, 일본의 Teijin사와 Musashino 화학연구소는 2006년 젖산의 광학이성질체들(L-, D-lactic acid)을 혼합하는 방법으로 기존의 210도의 고온에서는 견디는 완전히 새로운 타입의 바이오플라스틱을 개발하였다.
1,3-propandiol은 제3세대 신기능 섬유 소재로서 광범위한 시장 규모를 갖고 있는 Poly-Trimethylene Terephthalate(PTT)의 합성 원료로 각광을 받고 있다. PTT 섬유는 이미 1940년대에 개발되었지만, 원료 물질인 1,3-propandiol이 고가인 문제로 해서 상업화되지 못하다가, 1990년대 후반 영국 Shell사가 처음 1,3-propandiol의 대량생산에 성공하여 Corterra라는 PTT 소재 이용 섬유제품을 1999년 출시하였고, 이어서 2006년 말 미국의 화학회사 듀퐁(DuPont)사가 대사공학기법으로 포도당을 원료로 하여 1,3-PDO을 생산하는 재조합 대장균을 개발하여, 테이트앤라일(Tate & Lyle)사와 합작으로 연 45만 톤 생산 규모의 1,3-propandiol 생산 공장을 건설, 소로나(SoronaⓇ)라는 브랜드의 섬유 소재용 PTT를 생산하기 시작하였다.
3-hydroxypropionic acid(3-HP)는 lactic acid, succinic acid에 이어서 세 번째로 중요한 바이오매스 기원 발효제품이다[표 4-5-1-2]47). 3-HP는 1,3-propandiol, acrylic acid, acrylamide, malonic acid와 poly-hydroxypropionic acid의 생산을 위한 building block으로써, 접착제, 폴리머, 플라스틱, 섬유 및 레진 산업 분야 등 약 39억 달러의 시장규모를 갖고 있으며, 매년 5% 수준의 성장이 예상되는 젖산, 숙신산에 이어 세 번째로 산업계의 주목을 받고 있다.
|
표 4-5-1-2 |
주요 발효 생산 화학원료물질 및 유도체
|
Platform Chemicals from Biomass |
Chemical Building Blocks |
|
Lactic acid |
Poly lactic acid, 1,2-Propanediol, Acrylic acid, Acetaldehyde, 2,3-pentanedion, Pyruvic acid, Lactates |
|
Succinic acid |
Alkylidene succinates, 1,4-Butanediol, Tetrahydrofuran, 2-Pyrrolidones, ϒ-Butyrolactone, N-Methylpyrrolidone, |
|
3-Hydroxy propionic acid |
1,3-Propanediol, Malonic acid, Acryl amide, Acrylonitrile, Methyl acrylate |
|
Itaconic acid |
2-methyl-1,4-butanediol, 3-methyltetrahydrofuran, and 3- and 4-ç-butyrolactone, 3-Methyl pyrrolidine, Itaconic diamide |
|
Glutamic acid |
Poly(ç-glutamic acid, Glutaminol, Glutaminol, Pyroglutamic acid, 4-amino-5-hydroxypentanoic acid, Proline, Prolinol, 1,5-Pentanediol, Glucaric acid, |
출처 : Chemical Review, Vol 107, 2411~2502, 2007
아직 3-HP의 상용화 공정은 개발되어 있지 않은 상태이지만, 미국 카길(Cargill)사가 코덱시스(Codexis)사와 공동으로 DOE의 지원(1천 2백만 달러)을 받아 미생물발효 공정 개발을 통하여 상업화를 시도하고 있다. 현재 개발 중인 3-HP 생산 생물공정은 최소 2.5g/L hr의 생산성이 되어야 상업적 경쟁성을 확보할 수 있을 것으로 예측되고 있으며, 카길사가 2003년부터 코덱시스사와 공동으로 대사공학기술과 효소의 인공진화 기술을 조합하여 3-HP 생산성 향상을 위한 생물공정을 개발하고 있다.
이외에도 미국 위스콘신 대학의 Suthers 교수팀은 Klebsiella pneumoniae 유래의 glycerol dehydratase와 Saccharomyces cerevisiae 유래의 aldehyde dehydrogenase를 도입한 재조합 대장균을 사용한 글리세롤로부터 3-HP를 생산하는 공정을 개발하였고, 일본 Nippon Shokubai Kagaku Kogyo는 glycerol dehydrogenase 유전자를 파괴한 Lactobacillus reuteri의 혐기발효로 1,3-propanediol과 3-HP의 생산을 연구하고 있다.
다. 국내 현황
1,3-PD의 경우, CJ사가 Listeria innocua 유래의 glycerol dehydratase 유전자와 Pseudomonase aeruginosa 유래의 1,3-PD oxidoreductase 유전자를 도입한 재조합 대장균을 개발하여 포도당으로부터 1,3-PD를 생산하는 발효공정을 개발하였고, (주)무궁화와 한국생명공학연구원(본 사업의 주관기관)이 Klebsiella pneumoniae를 이용하여 유지 산업 부산물인 폐글리세롤로부터 1,3-PD 생산 기술을 개발한 바 있으나 아직 경제성 있는 생산성 수준에 도달하지 못하고 있다.
3-HP의 경우 발효생산공정에 대한 연구결과는 전무한 상태이며, 최근 CTC바이오사와 부산대학교가 3-HP 생산 효소공정을 개발하기 위한 연구에 착수하였다(산업자원부 차세대 기술개발 사업, 2006. 11~2009. 1).
PLA의 경우 한일 합작회사인 도레이새한사가 PLA 시장의 진입을 준비 중이며, KIST 연구팀이 의료용 PLA에 대한 연구를 수행 중에 있다.
Succinic acid의 경우 KAIST의 이상엽 교수 연구팀이 한우의 반추위에서 분리한 Mannheimia succiniciproducens 균주와 대사공학기술을 이용하여 숙신산을 고효율로 생산하는 세계 최고수준의 생물공정기술을 개발하였다.
라. 전망
지난 세기 동안 항생제 및 라이신 발효를 주축으로 성장기를 누리던 발효산업은 금세기에 와서는 중국, 인도와 같은 저개발 국가들로 생산지가 이동하고 있다. 하지만 앞으로 생물공정 기술은 그동안의 세포배양 및 분리정제로 이어지는 down stream 공정에 중점을 두었던 기술에서 벗어나 genomics, proteomics, metabolomics로 대표되는 “-omics” 기술과 시스템생물학 및 나노생명공학과 같은 엔지니어링을 기반으로 한 새로운 첨단기술이 융합되어 새로운 영역으로 확대, 발전될 것이다.
이러한 새로운 생물공정기술들을 기반으로 지속가능한 통합 바이오리파이너리기술이 개발되어 기존의 석유화학 원료물질들이 생물자원을 기반으로 한 원료물질들로 점진적으로 대체되어 나가는 것이 앞으로 생물공정 분야에서 나타날 가장 큰 패러다임의 변화일 것으로 전망된다.

가. 서론
(1) 환경생명공학기술의 개요
환경생명공학(Environmental Biotechnology)이란 생명공학기술(Biotechnology, BT)을 환경공학(Environmental Technology, ET) 분야에 이용하여 환경오염을 방지하고 환경을 효율적으로 보전하고 관리하는데 활용되는 모든 기술 또는 학문을 의미한다.
이 분야는 21세기 첨단기술로 주목되는 것 중 하나로써 분자생물학, 환경과학, 생태학 등의 분야와 융화하여 빠르게 발전되고 있다. 환경생명공학기술은 오염 환경의 정화(remediation), 오염의 예방(prevention) 그리고 생물학적 방법에 의한 오염의 검출(detection) 분야로 확대되어 환경보존을 위해 큰 역할을 담당 할 것으로 예상되며 전 세계적으로 환경 분야의 핵심기술로 연구개발을 통해 실용화를 추진하고 있다.
(2) 환경생명공학 기술개발의 필요성
환경문제는 21세기 인류생존을 위협하는 최대 현안문제 중 하나로써 기존의 환경문제를 해결하기 위해 물리적, 물리․화학적, 생물학적 방법을 이용하였으나 여기에 첨단기술로 주목받고 있는 생명공학기술까지 도입되어 환경문제를 해결하기 위해서 전 세계적인 노력을 기울이고 있다.
환경생명공학기술은 미생물이나 식물에 의한 난분해성 물질 및 환경오염물질의 분해 촉진 및 생물전환(Biotransformation) 등을 통해 오염물질의 농도가 근본적으로 감소되고, 2차 오염을 방지할 수 있으며, 장기적면에서 고려할 때 물리적, 화학적 또는 물리․화학적 방법보다 환경관리 비용이 적게 든다는 경제적인 장점을 가지고 있다.
나. 연구개발 동향
(1) 국제 동향
국제적으로 활발히 연구가 진행되고 있는 환경생명공학 분야에는 바이오플라스틱, 바이오 디젤(바이오에너지), 기능성섬유(거미줄 단백질생산을 이용한 방탄복 생산 등) 등과 같은 석유화학성분을 대체하기 위한 분야와 식물 및 미생물을 이용해 폐기물 및 오염물질의 저감 또는 제어하는 생물학적 정화(Bioremediation) 분야의 연구가 활발히 진행 중인 것으로 보고되고 있다.
(가) 식물을 이용한 생물학적 정화 분야의 연구개발 동향
환경정화용 형질전환 또는 유전자변형생물체(Living Modified Organisms, LMO) 식물 개발연구의 대부분이 환경에서 중금속을 제거하는데 초점을 두는 것들이다. 이것은 식물이 중금속을 화합물로 체내에 흡착하는 메커니즘을 이용하며(Phytochelation), LM식물을 이용한 중금속 생물학적 정화의 장점은 오염 중금속을 식물체로 축적하여 오염지역에서 제거할 수 있는 것이다. 현재까지는 박테리아 유전자(예:mer A, merB, 수은무독화유전자)를 도입하여 형질 전환된 식물이 많은 부분을 차지하고 있다(Ha S-B et al 1999). 또한 아직까지는 실험실 수준의 연구가 많이 진행되고 있으나 성공적으로 온실 수준까지 발전된 것들도 보고되어졌다[표 4-5-2-1]. 연구개발이 활발히 진행인 것으로 보고되고 있어 머지않은 장래에 환경정화용 LM식물의 상업화가 추진 될 것으로 예상된다.
환경정화용 LM식물의 장점을 살펴보면 첫째, 개발된 환경정화용 LM식물은 대량 배양하는 LM미생물에 비해 비용이 저렴하고 둘째, 미생물처럼 특정한 영양분이나 배양조건이 필요하지 않으며 셋째, 살균처리과정을 생략할 수 있고 넷째, 환경적응력이 미생물에 비해 높다. 이러한 이유들이 환경정화용 LM식물의 개발연구를 증진시키고 있는 것으로 보여 진다. 또한 환경정화용 LM식물 적용에 적합한 환경조건을 살펴보면 토양 표면에서 1m 내외의 깊이로써 식물뿌리가 도달할 수 있는 곳이어야 한다. 반면에 토양표면근처는 뿌리가 도달하지 않아 잘 정화 되지 않고, 적용 토양이 점토층(clay soil)일 경우 중금속들은 토양과 흡착성이 강해 식물뿌리에 잘 흡수되지 않을 수 있다. 그리고 식물은 미생물에 비해 생육속도가 느리기 때문에 오랫 동안 같은 장소에 남아 있는 특성을 가진 오염물질을 정화하는데 효과가 높다. 따라서 환경정화용 LM식물은 용탈되지 않으며 인간이나 환경에 위해성이 낮은 오염물질에 이용하는 것이 효과가 높을 것으로 여겨진다(Pilon-Smits et al 2000, Schnoor et al 1995).
|
표 4-5-2-1 |
식물을 이용한 생물학적 정화 분야의 연구개발 현황
|
|
형질전환 특성 |
도입 유전자 |
대상 식물체 |
|
|
카드뮴 저항성 |
gshⅡ |
Indian mustard(Brassica juncea) (Zhu et al 1999) |
|
온 실 수 준 |
수은저항성 |
merA |
Yellow poplar(Liriodendron tulipifera; 포플러) (Rugh et al 1998), cordgrass (Spartina; 초본), cat-tail (Typha;부들), bulrush (Scirus; 갈대), poplar (Populus, 포플러), willow (Salix; 버드나무) (Pilon-Smits et al 2000, DeWitt 2000) |
|
실 험 실 수 준 |
수은저항성 |
mer operon |
Arabidopsis thalianas (Heaton ACP et al 1998) |
|
아연저항성 |
Zat |
Arabidopsis thalianas (Grotz N et al 1998) |
|
|
중금속 저항성 |
cax1, cax2 |
Arabidopsis thalianas (Hirschi KD et al 2000) |
|
|
중금속 저항성 |
cadⅠ |
Arabidopsis thalianas (Ha S-B et al 1999) |
출처 : 환경정화용 유전자변형생물체(LMO)의 안전관리방안 연구, 환경부 국립환경과학원, 2006
(나) 미생물을 이용한 생물학적 정화 분야의 연구개발 동향
박테리아와 곰팡이는 광범위한 화합물을 분해할 수 있는 것으로 알려져 있기 때문에 오염물질의 생물학적 정화에 이용할 수 있는 좋은 연구 대상이다. 따라서 환경정화용 LM미생물 개발연구가 활발히 이루어지고 있으며, 향후 이용될 분야별로 나누어 보면 다음과 같다.
① 중금속 오염토양 개량 분야 연구개발 동향
중금속 오염 토양개량 분야 연구개발현황을 조사한 결과는 [표 4-5-2-2]와 같으며, 이들 LM미생물이 환경 지속성과 안전성을 확보 할 경우 상업화로 이어질 것으로 고려되어진다.
|
표 4-5-2-2 |
중금속 오염토양 개량 분야 연구개발 현황
|
|
오염물질 |
도입 유전자/효소 |
공여균주 |
|
|
금속화합물 Cu2+, Zn2+ |
mtb gene (metallothioneins) |
Ralstonia eutropha (Cruz N et al 2000) |
|
무 기 오 염 물 질 |
중금속 |
phs ABC (thiosulphate reductase) ppk (polyphosphtase) ppx (phosphate kinase) |
Salmonnella typhimurium (Keasling et al 1998) Alcaligenes eutrophus CH34 (Collard JM et al 1994) |
|
수은 |
merTPABD and R |
P. Putida (Horn JM et al 1994) D. radiodurans (Murray RGE et al 1992) |
|
|
니켈 |
ncc-nre |
Alcaligenes sp 31A (Dong et al 1998) |
출처 : 바이오안전소식지 Vol.6 No 2. p23-31 산업자원부 KBCH, 2007
|
표 4-5-2-3 |
기름유출 토양, 해양 개량 분야 LM미생물개발현황
|
|
오염물질 |
도입 유전자/효소 |
공여균주 |
|
유 기 오 염 물 질 |
유기오염물질 (organic pollutants) |
monooxygenase cytochrome P450cam |
P. Putida (Jones et al 2000) |
|
염소 화합물 (Chlorinated compound) CBAs(chlorbenzoates) DCBs(dichlorobenzoates) PCE(tetrachloroethene) TCE(trichloroethylene) CB(chlorobenzenes) MCPA(2-methyl-4-chloro phenoxyacetae) 2,4-D, atrazine |
toluene monooxygenase gene pheA, pheB, pheC, pheD, pheR |
P. mendocina KR1 (Ward TE et al 1998) P. Putida BH |
|
|
linA |
P. paucimobilus |
||
|
(γ-hexachlorocyclohexane) fcbABC |
Arthrobacter globiformis (Kuritz et al 1995) |
||
|
PCBs (polychlorinated bipheyls) |
bph A1, A2, A3, A4, B, C, K, H, J, I and D |
P. aeruginosa 142 Arthrobacter globiformis (Hrywna et al 1999) Alcaligenes eutrophus (Lajoie et al 1997) |
|
|
탄화수소(Hydrocarbons) PAH, benzene,toluene, ethylbenzene, xylene compounds |
tod C1C2BA (toluene dioxygenase) |
P. fluorescens Strain 5R (Sayler et al 2000) |
출처 : 바이오안전소식지 Vol.6 No 2. p23-31 산업자원부 KBCH, 2007
② 기름유출 토양, 해양 개량 분야 연구개발 동향
유기오염 물질 분해에 관련한 LM미생물을 조사한 결과를 요약하면 [표 4-5-2-3]과 같으며, 이들 LM미생물이 환경 지속성과 안전성을 확보할 경우 상업화로 이어질 것으로 예상되어 진다.
③ 환경오염 모니터링용 미생물 분야 연구개발 동향
미생물은 환경 중 독성오염지역에 방출 및 분해에 이용될 수 있는 좋은 대상이다. 이러한 특성을 이용한 환경오염 지역의 확인을 위한 모니터링 LM미생물 개발이 활발히 추진되고 있다. 여기에 사용되는 리포터 유전자는 초기에는 luc(Photinus sp와 Phyrophourus sp.에서 기원)와 lux(Vibrio fisheri 또는 Photobacterium phosporeum에서 기원) 유전자가 사용되었으며(Layton AC et al 1999) 그 이외에도 Rluc(Renila reniformis 기원)와 gfp(Aequorea victoria와 Renilla reniformis 기원) 유전자(Jansson et al 2000, DETR 1997) 이외에도 다양한 리포트 유전자의 개발이 활발히 진행 중에 있다. 이러한 리포터 유전자들을 환경정화에 이용하기 위해 도입한 목적 유전자 앞뒤로 연결시켜서 유전자가 발현될 때 발광 또는 형광을 나타나게 개발된다.
Sayler와 Ripp(2000) 등은 LM P. fluorescens HK44을 이용해서 나프탈렌 분해미생물의 제한적 환경에서 모니터링을 성공적으로 수행하였고, 그외에도 PAH와 PCBs 오염지역의 모니터링을 위한 LM미생물의 이용 등 환경오염 모니터링을 위한 LM 미생물의 연구개발이 활발히 진행 중이다(Layton et al 1999).
④ 방사성 오염물질 정화 및 곰팡이 이용 연구개발 동향
방사선 오염(radionuclides)과 유기오염물질(chlorobenzene)이 함께 오염된 지역의 정화에도 Deinococcus radiodurans를 이용한 환경정화용 LM미생물 연구개발이 진행되고 있다(Lange CC et al 1998). 곰팡이(fungi)의 경우에도 난분해성물질을 분해하는 능력이 알려져 생물학적 정화에 이용하려는 연구가 진행 중이다(Ow DW et al 1996, Blackwell et al 1999). 그러나 아직까지 형질전환된 곰팡이의 이용사례는 보고된 바 없고 또한 많은 곰팡이가 식물병원체로 알려져 있기 때문에 환경에 방출될 목적으로 개발하는 것이 적절하지 않다는 논란도 제기되고 있다. 그러나 현재 연구개발 현황을 검토 할 때 환경정화용 LM곰팡이도 향후 개발 가능성이 높을 것으로 고려된다.
(2) 국내 연구개발 현황
국내 환경생명공학 분야의 기술 및 연구개발 투자 현황은 아직 다른 분야에 비해 상대적으로 미약한 것으로 평가된다. 2001년부터 차세대 핵심환경기술개발사업이 10년 계획으로 추진되고 있으나 환경생명공학기술로 분류될 수 있는 분야는 대부분 미생물, 식물 등 그 자체의 활용에 그치며 첨단 생명공학기술을 이용한 LMO 개발은 매우 빈약한 실정이다.
한편 위에서 살펴본 바와 같이 환경생명공학 분야의 국제환경이 변화됨에 따라 국내에서도 과학기술부 주관으로 국가 산업경쟁력 확보 및 국가과학기술혁신을 위하여 추진 중인 중점국가연구개발산업 중 생명공학실용화 연구 분야에서 환경생명공학 분야의 연구도 포함되어 중점국가 연구개발 산업 중에 하나로 주목을 받고 있다.
여기에서는 생명공학기술을 통한 환경오염의 사전예방․저감 및 오염․훼손된 환경의 복원․보전하는 분야와 생명공학 연구결과를 실용화할 목적으로 효율적인 생산공정 및 제품개발을 가능케 하는 분야로 크게 분류되어 있으며 향후 국가에서 투자할 중점 분야 중점추진 과제를 [표 4-5-2-4]와 같이 계획하였다.
|
표 4-5-2-4 |
국내 환경생명공학 분야의 중장기 중점 추진 분야
|
구 분 |
중점 추진 과제 (기술) |
|
배양공정 및 분리정제기술 |
○ 미래 자원 확보를 위한 대량생산 공정 기술 |
|
○ 생물의약 대량생산공정 연구 및 공정장비․엔지니어링 기술 |
|
|
청정기술 및 오염제거기술 |
○ BT-ET 융합기술을 이용한 신개념의 환경복원 및 친환경 공정기술 |
|
○ 생물체를 이용한 유해화합물 대체소재 개발 및 폐유기술 처리기술 |
|
|
바이오에너지 활용기술 |
○ 바이오매스, 식물폐기물 등을 활용한 미래자원 확보기술 |
|
○ 기존 화석연료를 대체할 바이오 에탄올/디젤 등 신재생에너지 개발 기술 |
|
|
생태계 보존․활용기술 |
○ 쾌적한 개인 환경 조성 생명공학기술 |
|
○ 환경생명공학을 이용한 건강한 생태환경 조성 기술 |
출처 : “제2차 생명공학육성기본계획(Bio-Vision 2016)”, 과학기술부, 2006
다. 산업현황과 전망
(1) 환경생명공학의 산업화 현황과 전망
전 세계적으로 환경문제가 큰 이슈로 대두되고 이에 따른 엄격한 국제규제 규정제정이 진행됨에 따라 환경생명공학 분야도 산업의 경쟁력 확보차원에서 국제수준의 환경문제 대응기술을 적극적으로 추진 중에 있다.
미국, 캐나다, 호주 등 선진국을 중심으로 경제적이고 자연친화적으로 오염원을 정화할 수 있는 환경생명공학기술들이 활발히 개발되고 있으며 부가가치가 높은 상품으로 만들어지고 있다. 이에 비해 우리나라의 환경생명공학 분야의 산업화는 아직까지 초기단계에 머물러 있는 수준이다.
환경바이오산업은 오염물질의 사후처리와 관련된 산업으로써 바이오산업의 오염 및 자원사용을 최소화시키는 응용 분야로 1990년대 이후 매우 빠른 속도로 성장하고 있는 것으로 보고 있다. 2001년 세계 환경산업의 시장규모는 약 6000억 달러 이상으로 예상되며, 환경바이오산업의 대표적인 예로 볼 수 있는 생물정화 시장의 경우, BCC(Business Communications Company)의 보고자료(2002)에 의하면, 세계적으로 2001년 기준으로 봤을 때 12억 달러로 전체 환경복원 시장의 약 5%에 그쳤으나(전체 250억 달러 규모) 향후 급성장이 가능한 잠재력이 큰 시장으로 분석되고 있다.
환경생명공학 제품별 시장점유율은 미생물혼합제 46%, 영양제 24%, 효소 20%, 미생물 10%로 조사되었다. 세계 환경생명공학 제품의 시장규모는 2001년에서 2006년에 걸쳐 매년 14% 이상의 증가를 보여 2006년에는 약 10억 달러 이상 시장규모로 성장 하였다. 국내 시장규모는 삼성지구환경연구소(2001)의 자료에 의하면 생물학적 정화 분야가 2005년 기준 660억원, 2010년 2,150억원으로 예상되며 환경 분야 바이오칩 시장규모는 2005년 317억원, 2010년 3,725억원으로 급격한 시장 확대가 예측되고 있다48).
21세기 국가 핵심 산업으로 인식되고 있는 BT와 ET가 융합된 환경생명공학기술은 산업화 및 발전 가능성이 높은 분야라 사료된다. 또한 선진국에서도 환경생명공학 분야의 첨단기술이 아직까지 대부분 초기 단계인 점을 감안한다면 우리나라도 이 분야에 적극적인 기술개발 및 산업화를 적극 추진하는 것이 바람직할 것이다.
(2) 환경정화용 LMO의 상업화 전망
자연에 존재하는 식물, 미생물을 이용하여 오염물질을 정화하려는 소위 오염물질 생물학적 정화(Bioremediation)연구는 오래전부터 선진국에서 시도되어 왔으며 최근에는 생명공학기술을 적용한 생물적 정화기술 즉, 환경정화용 LMO 개발연구가 국내외에서 활발하게 진행되고 있다. 환경정화용 LMO의 개발은 식물, 수목류, 미생물 등으로 나눌 수 있는데, 환경정화용 LM미생물의 경우 보통 이용되는 세균의 대사경로를 변화시키는데 따른 시간적, 경제적 제반문제가 제기됨에 따라서 미생물을 이용한 환경정화용 LMO 개발은 식물, 수목류의 경우에서 보다 어려운 것으로 학자들은 내다보고 있다. 따라서 환경정화용 LM미생물 보다는 오히려 식물, 수목류에서 먼저 환경정화용 LMO가 상품화 될 것으로 과학계에서는 전망하고 있으며 이들 환경정화용 LMO의 상품화도 빠르면 앞으로 4-5년에 이루어질 것으로 보고 있다.
현재 LM식물의 개발을 주도 하고 있는 미국의 경우 환경정화용 LMO의 식물, 수목에 대한 연구도 활발히 이루어지고 있는데 환경정화용 LMO의 대상이 되고 있는 식물에는 갓류(Brassica juncea), 해바라기(Helianthus annuus) 그리고 포플러 등이 있다.
환경정화용 LM미생물보다 LM식물이 상업화가 빨리 이루어지리라고 보는 이유는 토양 미생물 보다 형질전환식물의 개발속도가 훨씬 빠르다는 점과 그동안 자연에 존재하는 식물을 이용하여 환경을 정화하려는 연구도 많이 진행이 되어 관련기술에 대한 경험과 기술이 많이 축적되어 있다는 점 그리고 미생물이 실수로 실험실을 벗어나 환경에 방출되었을 경우 예상치 못한 결과를 초래할 수 있다는 일반적인 상식 때문에 환경정화용 LM미생물 보다 LM식물이 오히려 더 안전하다는 인식을 가지고 있는데서 비롯된다. 더욱이 LM식물들에 대해서 이미 1980년대 후반에 이들의 안전성을 감독하는 지침이나 규정이 만들어져 활용되고 있는 점 등이 환경정화용 LM식물이 LM미생물보다 빨리 상업화하지 않을까 예측을 하게 되는 근거이다.
이미 미국의 경우에는 1999년부터 이러한 환경정화용 LM식물의 상업화를 겨냥한 소규모 포장시험이 이루어지고 있어 이들 환경정화용 LM식물에 대한 시장성이 보장되면 수년 내에 상업화가 이루어지리라고 전망되어지고 있다.
참 고 문 헌
Blackwell KJ and Tobin JM (1999). Cadmium accumulation and its effects on intracellular ion pools in a brewing strain of Saccharomyces cerevisiae. Journal of Industrial Microbiology & Biotechnology, 23(3): 204-208
Ha S-B, Smith AP, Howden R, Dietrich WM, Bugg S, O'Connell MJ, Goldsbrough PB and Cobbett CS (1999). Phytochelatin synthase genes from Arabidopsis and the yeast Schizosaccharomyces pombe. Plant Cell, 11: 1153-1164
Heaton ACP, Rugh CL, Wang NJ and Meagher RB (1998). Phytoremediation of mercury and methylmercury polluted soils using genetically engineered plants. Journal of Soil Contamination, 7: 497-509
Jansson JK, Bjorklof K, Elvang AM and Jorgensen KS (2000). Biomarkers for monitoring efficacy of bioremediation by microbial inoculants. Environmental Pollution, 107(2): 217-223
Jones JP, O'Hare EJ and Wong LL (2000). The oxidation of polychlorinated benzenes by genetically engineered cytochrome P450(cam): potential applications in bioremediation. Chemical Communications, 3: 247-248
Keasling JD, Van Dien SJ and Pramanik J (1998). Engineering polyphosphate metabolism in Escherichia coli: Implications for bioremediation of inorganic contaminants. Biotechnology and Bioengineering, 58(2-3): 231-239
Lange CC, Wackett LP, Minton KW and Daly MJ (1998). Engineering a recombinant Deinococcus radiodurans for organopollutant degradation in radioactive mixed waste environments. Biotechnology, 16: 929-933
Layton AC, Gregory B, Schultz TW and Sayler GS (1999). Validation of genetically engineered bioluminescent surfactant resistant bacteria as toxicity assessment tools. Ecotoxicology and Environmental Safety, 43(2): 222-228
Pilon-Smits E and Pilon M (2000). Breeding mercury breathing plants for environmental cleanup. Trends in Plant Science, 5(6): 235-236
Rugh CL, Senecoff JF, Meagher RB and Merkle SA (1998). Development of transgenic yellow poplar for mercury phytoremediation. Nature Biotechnology, 16:925-928
Sayler GS and Ripp S (2000). Field applications of genetically engineered microorganisms for bioremediation processes. Current Opinion in Biotechnology, 11(3): 286-289

가. 개요(서론)
해양생명공학이란 해양생물자원에 생명공학기술을 적용하는 분야를 말하며 최근 일명 청색생명공학(blue biotechnology)이라고도 부른다. Blue 생명공학은 적용 분야에 따라 구분되는 red(보건의료 분야), green(농업식품 분야), white(산업 분야) 생명공학과 같은 기존 생명공학의 모든 분야에 적용될 수 있다는 특징이 있다. 따라서 향후 발전 잠재력이 매우 높은 것으로 평가되고 있으며, 선진외국은 이 분야 연구개발에 대한 투자가 매우 활발하다.
나. 해외동향
해양생물을 활용하는 것을 포함하여 국가적으로 중요한 생명공학 프로그램을 갖고 있는 국가는 노르웨이, 오스트레일리아, 일본이고 미국, 캐나다는 해양생명공학으로부터 유래되는 가치와 기회를 얻는 목적을 갖고 있으나, 이 분야에서 단일 프로그램을 수행하고 있지는 않다.
외국의 경우 공식적이고 종합적인 해양생명공학 국가 프로그램 혹은 전략을 갖고 있는 국가는 매우 드물다. 그럼에도 불구하고 각국에서는 서로 다른 연구기관, 대학에서 중요한 연구 활동을 활발히 진행하고 있으며 해양생명공학을 발전의 최우선 전략으로 정한 지방자치단체들도 많다.
이와 같은 각국의 해양생명공학에서 다루는 연구 테마 중 가장 공통적인 것은 [표 4-5-3-1]과 같고, 이 연구과제들은 대체적으로 각 국가에서 높은 우선순위를 갖고 있다.
|
표 4-5-3-1 |
외국 해양생명공학 분야의 공통 연구주제 및 내용
|
연구개발 주제 |
목적 및 내용 |
대표적 국가 |
|
생물발견 및 탐사 |
해양생물의 추출물로부터 유용화합물 탐색 |
오스트레일리아, 일본, 독일 |
|
수산생물종의 유전체연구 |
양식종의 유전적 신진대사를 이해하는 연구를 통한 건강, 증양식, 수확량 제고 및 형질의 개선 |
프랑스, 오스트레일리아, 노르웨이 |
|
해양생물의 유전체연구 |
해양생물의 분포 및 이동, 집단적 유전을 이해하려는 목적 혹은 침입종의 방지와 어류 등과 같은 제품의 특성을 검중하는데 필요한 유전자 마커를 제공하는 연구 |
캐나다, 미국, 영국, 노르웨이 |
|
식품안정성 |
패류 및 어류 유래의 인체 병원균과 기타 위해성 검출 및 그 것들의 발생제어 방법 개발 등 |
미국, 오스트레일리아 |
|
환경연구 |
환경의 질, 생산총량, 어류와 인간의 안전성을 모니터링 할 수 있는 진단방법 개발 및 해양환경을 이해하는 연구 |
미국, 오스트레일리아 |
출처 : Opportunities for marine biotechnology application in Ireland, 2005
(1) 미국
미국은 생명공학 연구개발과 산업에 있어 세계 선두에 위치하고 있으며 885,000 명 이상이 생명공학에 종사하고 있다. 미국은 해양과학연구에서도 세계 선두자리
에 있고, 세계의 선두 위치에 있는 것과 걸맞게 미국에서 해양생명공학은 중요한 생명공학 분야 중 하나이다. 이 분야에 관련된 정부부처 및 대표 연구기관으로는 NOAA(National Oceanic and Atmospheric Administration), 스크립스 해양연구소(Scripps Institution of Oceanography), 우즈홀 해양연구소(Woods Hole ceanographic Institution, WHOI), 매릴란드 대학의 해양생명공학센터가 있다.
NOAA의 지원으로 수행되는 미국 해양과학의 주요 예산지원 및 조정사업으로 대표적인 Sea Grant Program이 있다.
이 프로그램은 미국 연안의 인간 보호와 환경의 개선을 위한 신(新)해양생명공학의 적용을 위한 연구와 새로운 산업제품과 공정개발을 강화하여 전 국가적으로 경제적 이익을 창출하는 것을 목표로 하고 있다. 한편 NOAA 산하 NMFS(National Marine Fisheries Service)에서 생명공학기술을 활용하고 있는 주요 연구내용은 다음과 같다.
- 어족의 생활사와 현존량을 연구하는 과정에서 이동 및 서식지를 평가하기 위한 DNA 분석의 활용
- 수산 증양식 연구에서 양식 연어 및 기타 어종의 유전적 형질을 평가하기 위한 분자생물학적 기법의 활용
- 수산 증양식 연구에서 병원성미생물의 분류 및 제어방법 개발을 위한 병원성미생물의 유전학적 실험, 숙주와 병원성미생물 간의 상호관계 규명, 민감한 분자기법의 개발
- 식품 안정성연구에서 인체에 감염을 유발하는 Vibrio vulnificus의 병원성 주요 결정요인의 규명을 위하여 비교 유전체학 및 기타 분자유전학적 기법 활용
주정부 차원에서도 다양한 해양생명공학 연구개발을 수행 지원하고 있으며 주요내용은 [표 4-5-3-2]와 같다.
|
표 4-5-3-2 |
주정부 차원의 해양생명공학 연구개발 활동내용
|
주 |
주요 R&D 활동 |
|
Florida |
Centre of Excellence in BioMedical and Marine Biotechnology을 설립하고 해양생물자원으로부터 신약발견이라는 목표달성을 위해 산업체와 공동으로 수행 |
|
Hawaii |
해양생물제품 공정개발 연구 및 훈련 지원 |
|
Maine |
‘Marine Industry & Technology Fund’ 설립과 특히 중소기업 성장펀드를 설립. 해양과학과 생명공학은 주요 분야 중 하나 |
|
Maryland |
매릴란드 대학에 생명공학연구소를 설립하고, 그 중 하나인 해양생명공학센터는 이 분야의 발전을 위한 주의 대표기관 |
|
Mississipi |
Mississippi Technology Alliance에 의해 관리되고 있는 과학기술에 의한 경제개발계획을 추진. 이 기관은 해양과학을 성장의 목표로 한 기술클러스터 |
|
South Carolina |
South Carolina 의과대학에서 수행하고 있는 해양유전체 연구개발 프로그램 지원 |
출처 : Opportunities for marine biotechnology application in Ireland, 2005
(2) 일본
일본은 생명공학을 자국의 미래를 위한 전략적으로 매우 중요한 기술 중 하나로 인식하고 있으며 해양생명공학을 지원하는 국가부처는 [표 4-5-3-3]과 같다.
|
표 4-5-3-3 |
해양생명공학을 지원하는 국가부처 및 연구개발 동향
|
정부부처 및 기관 |
산하 주요연구기관 |
연구개발 동향 |
|
통상산업성 |
Marine Biotechnology Institute (MBI), New Energy and Industrial Technology Development Organization (NEDO) |
- 해양생물자원뱅크 구축(20,000종의 해양미생물 및 1,000여종의 미세조류) - 해양생물로부터 유용화합물 탐색 및 환경오염 제어기술 개발 - 신규 해양생물자원 탐색연구 지원 |
|
농림수산성 |
|
□ 수산업 및 증양식산업의 전통적인 분야 연구 - 일본해 해양생물 배양방법 - 어패류 폐기물 활용기술개발 |
|
문부과학성 |
Japan Agency for Marine-Earth Science and Technology (JAMSTEC) |
□ 잠수정기술을 이용한 해양생명공학 연구 - 심해생물의 배양방법, 생리학, 생태학 - 생물증식을 위한 심해의 활용 - 인공광을 이용한 심해에서의 조류배양 신기술 - 초고압, 초고온 환경과 같은 특이한 조건에서 생존하는 심해생물의 배양 및 탐사기술 |
|
국가양식연구소 |
|
- 어류양식(해수 종 및 담수 종) 산업과 어류생산을 확대하기 위한 기초 및 응용연구 |
출처 : Opportunities for marine biotechnology application in Ireland, 2005
(3) 캐나다
캐나다는 해양 분야에 생명공학기술의 활용에 매우 높은 관심을 갖고 연방 혹은 지역 차원에서 해양생명공학에 대해 광범위하게 투자하고 있다. 특히 어족자원의 관리, 보존, 개선을 위한 유전정보의 활용 분야에 중점을 두고 있다.
|
표 4-5-3-4 |
정부부처 및 관련기관의 해양생명공학 주요동향
|
정부부처 및 관련기관 |
주요 연구동향 |
|
DFO(Department of Fisheries and Oceans) |
□ 4대 주요 분야의 유전체학 및 생명공학을 주도적으로 발전시키는 계획 수립(2004) - 해양자원의 지속가능한 관리를 위한 유전자 프로필 - 수생동물의 건강 - 형질전환 어류를 감시 가능한 과학기술 - 수생환경의 건강 및 정화 □ DFO 과학프로그램의 주요 초점 - 어류 및 오류 서식처의 보존 및 방지와 해양생태계의 보존을 위한 과학적 근간을 제공할 수 있는 환경연구 - 수산사업 및 증양식산업을 지원하는 연구 - Aquaculture Collaborative Research and Development Program: 산업체와 민간부분에서 제안된 증양식 연구개발 과제 지원 □ 관련연구 동향 - 어족자원의 분류에 필요한 상업적 가치 종의 유전정보 규명 - 어획관리 - 멸종위기종의 유전적 다양성 보존 - 증양식개발을 위한 어종 선별 - 수산 동물 질병의 규명 및 제어 - 야생자원의 회복 및 수산서식처의 감시 - 형질전환 오류의 환경영향 잠재력 평가 - 수산가공 분야 : 진단테스트 개발, 수산가공, 폐기물활용 등 |
|
NRC(National Research Council of Canada) |
- NRC 생명공학전략은 Halifax, Nova Scotia에 있는 해양생물과학연구소 (IMB; Institute for Marine Biosciences; www.imb.nrc.ca)를 포함한 6개의 전략 그룹을 통한 연구개발 수행 - 캐나다 전국의 모든 NRC연구소에서 수행하고 있는 GHI(Genomics and Health Initiative) 관리 |
|
(IMB; Institute for Marine Biosciences) |
□ IMB 연구프로그램의 4대 연구주제 - 넙치 및 기타 어종의 유전체 연구와 양식생산 및 영양학적 연구 - 천연 독성물 및 패류 - 수생동물의 건강(특히 Furunculosis 병, 해양벼룩 및 환경문제) - 질량분석/단백질체학 기술 |
|
정부부처 및 관련기관 |
주요 연구동향 |
|
Genome Canada (www.genome canada.ca) |
- 캐나다 유전체학연구의 주정부 연구비 지원기관 - 상용화 목적으로 관심이 있는 생물에 대한 유전체 프로그램 - PLEUROGENE: Genome Canada와 Genoma España (스페인 유전체프로그램)에 의해 250만유로가 지원되는 공동과제. 상업용 넙치인 대서양 넙치와 세네갈 혀넙치 두 종의 유전체연구. 목표는 이들 종의 생식, 영양, 성장 특성을 이해함으로써 증양식 기술개발 - Genomics Research on Atlantic Salmon (GRASP): 대서양 연어의 유전자지도 작성을 위한 과제로써 390만유로가 지원. 오염, 기생, 스트레스에 대한 면역반응에 관련된 유전자와 성별결정과 관련된 유전자의 규명이 주요목적 - Aeromonas Salmonicida Genomics: IMB 수행. 연어질병인 Furunculosis의 발병세균인 Aeromonas salmonicida 의 유전체연구. A. salmonicida의 병원성과 관계있는 유전자 규명 목표 |
|
주정부 (Nova Scotia, New Brunswick, Newfoundland) |
- 지역적 수준에서 추진하고 있는 관련 연구 중 대표적 지역 - 가장 활발한 지역은 Nova Scotia의 대서양 연안지역: 연방 IMB 연구소, Genome Canada 센터, Ocean Nutrition을 포함한 몇몇 성공적인 해양생명공학회사의 거점 - 연구기관 및 관련대학과 산업체가 해양생명공학의 클러스트 형성 |
출처 : Opportunities for marine biotechnology application in Ireland, 2005
(4) 오스트레일리아
오스트레일리아의 국가생명공학전략은 2000년 7월에 수립하여 다양한 범위의 목표를 갖고 2001년부터 2004년까지 3년 동안 1,760만유로를 투자하였다. 2001년 1월, ‘Backing Australia’s Ability’라는 종합적인 프로그램을 통해 3,850만유로를 추가적으로 지원하였으며, 이 프로그램은 2004년 5월 2011년까지 연장되면서 추가적인 재원을 제공하였다. 2001년부터 2011년까지 이와 같은 프로그램들 아래 오스트레일리아 과학기술개발에 계획된 예산은 총 48억유로이다. 2단계(2003~2006)의 연구는 다음과 같은 분야에 우선적으로 지원되었다. 즉 환경적으로 지속가능한 오스트레일리아, 양호한 건강을 유지하고 촉진시키는 분야, 오스트레일리아 산업을 구축하고 전환시킬 수 있는 프론티어 기술개발 분야, 안전한 오스트레일리아를 구축할 수 있는 분야의 연구에 집중하고 있다. 이와 같은 목적을 달성하기 위하여 프로그램은 특히 환경관리, 제약, 산림, 수산산업, 수산 증양식, 농업 분야에 생명공학을 적용하는 것에 초점을 맞추고 있다. 채택된 전략 중 하나가 고유종과 유입종의 생물자원의 활용을 포함한 생명공학에서 요구되는 자원의 분류에 관심을 갖고 연구하는 것이다.
해양생명공학 분야의 대표적 국가 연구기관은 해양환경 및 자원의 관리를 목적으로 설립된 Australian Institute of Marine Science(AIMS)이다. AIMS의 2003~2006 전략계획 우선순위는 증양식산업의 지속가능한 개발 및 제약 및 상용화 목적의 해양생물 유전자원의 활용이며, 세 개의 연구계획 중점 분야를 제시하였는데, 그 중 하나가 해양생명공학이다. 해양생명공학 그룹에는 다시 세 개의 연구팀이 있으며 이들은 [표 4-5-3-5]와 같은 연구를 중점적으로 수행하고 있다.
|
표 4-5-3-5 |
AIMS의 해양생명공학 중점 연구 분야 및 내용
|
연구 분야 |
중점 연구내용 |
|
Bioactive Molecule Discovery |
- 9,000종의 해양미생물 균주 및 8,000종의 해양생물 추출물 확보 - 의약용, 산업용 물질(효소)의 탐색 - 분자분석, 분류, 대사물질의 분석 |
|
Bio-innovation |
- 해양생물의 신규활용 탐색 및 해양의 다양한 문제점 해결방안 연구 - 수질평가 신기술 - 수계환경의 독성물질 및 오염물질 검출 신기술 - 해양질병 및 전염병 진단 신기술 - 해양지표생물의 환경 스트레스 평가 신기술 |
|
Tropical Aquaculture |
- 산업과 지역을 위한 지속가능한 열대생물(예; 스폰지, 새우, 바다 가재) 증양식생산을 제고시키는 기술개발 |
출처 : Opportunities for marine biotechnology application in Ireland, 2005
(5) 뉴질랜드
뉴질랜드의 해양연구 투자액은 2002~2003년에 걸쳐 약 334만유로에 이른다. 국가예산지원 사업의 약 24%가 생물시스템의 이해에 지원되고, 수산양식 및 생리활성물질에 9%, 생물학과 관련 학제는 기술적인 측면에서 전체 분야 중 27%를 차지한다.
뉴질랜드 Nelson에는 지역 개발기구인 Canterbury Development Corporation이 다양한 생물자원으로부터 기능성식품소재 개발, 생산, 판매를 전담하는 클러스터를 발전시켰다. 이 클러스터를 ‘Canterbury and Nelson New Zealand Nutraceuticals Cluster’라고 부르고 해양 기능성식품소재를 개발하며 3개의 연구기관과 이 분야에 관련된 18개 기관이 참여한다.
(6) 이스라엘
이스라엘에서 진행되는 해양생명공학 분야 연구개발은 국가로부터 지원되는 프로그램과 유럽공동체 혹은 다양한 기업체 지원 프로그램에 의해 지원된다. 주요 관련 연구기관은 수계연구, 특히 연근해, 해양, 담수의 생물자원을 지속가능한 활용을 할 수 있는 방법 및 기술을 개발하는 연구소인 IOLR(Israel Oceanographic and Limnological Research)가 있다. IOLR은 해양생명공학과 관계있는 특히 조류 생물접착제에 관한 몇 개의 프로젝트를 수행하고 있다.
(7) EU의 해양생명공학
최근 EU는 해양생명공학, 해양과학의 잠재력에 대한 인식을 높이기 위한 많은 활동이 급격하게 증가하고 있다. 그 중 하나가 2004년 아일랜드, 갤웨이에서 아일랜드 대통령의 후원아래 개최된 EurOCEAN 2004 컨퍼런스이다. 이 컨퍼런스에서는 최종적으로 Galway 선언을 통하여 유럽 각국에 해양과학의 중요성을 인식시킬 필요성에 대한 강조를 하였다.
EC가 지원하는 제5차 Framework Program에는 에너지, 환경, 지속적 개발의 하위 프로그램으로 121개의 해양프로젝트가 수행되었고, 이 중 8개가 생명공학적 접근이다. Quality of Life의 하위프로그램으로는 230개의 해양관련 프로젝트가 지원되었고, 그 중 57개가 생명공학적 접근기술이다.
제6차 Framework Programme에 지원되는 프로그램 중 대표적인 것은 Network of Excellence로써 지원되고 있는 Marine Genomics 프로젝트이며, 공식적인 제목은 ‘Implementation of high-throughput genomic approaches to investigate the functioning of marine ecosystems and the biology of marine organisms’이다. 총 16개 EU국가의 330여명의 과학자가 참여하고 조류, 미생물, 어류, 패류와 같은 종의 유전체를 연구한다. 몇 개의 EU Centres of Excellence로부터 유전체, 단백질체학 및 생물정보학 전문가가 유전체 자료를 활용할 수 있는 해양생물학자와 연계하여 공동수행하고 있다.
|
표 4-5-3-6 |
제5차 Framework Programme의 65개 생명공학 프로젝트의 주요 분야
|
분 야 |
% |
예 시 |
|
식품 및 사료 |
12 |
어류의 대체사료, 해조류의 새로운 식품활용 |
|
어류건강 |
33 |
어류 백신 및 치료 |
|
진 단 |
14 |
건강, 환경 모니터링 |
|
유전적 평가 |
26 |
어류 품질에 관련된 유전학 등 |
|
기타 분야 |
15 |
|
출처 : Opportunities for marine biotechnology application in Ireland, 2005
|
표 4-5-3-7 |
유럽의 최근 해양생명공학연구개발 동향
|
프로그램 |
지원국가 및 기간 |
내 용 |
|
Marine Genomics |
EU (FP6) |
- 해양생태계 및 해양생물의 기능연구를 위한 대용량 유전체학적 접근을 위한 네트워크 |
|
EADGENE |
EU (FP6) |
- 동물건강 및 식품안정성을 위한 유럽 동물질병 유전체 네트워크 |
|
AQUAFIRST |
EU (FP6) |
- 어류 및 패류의 스트레스 및 질병저항성 마커 선별을 위한 유전적, 기능유전체적 접근 |
|
DETECTOX |
EU (FP6) |
- 패류함유 지용성 조류 독성물질 검출용 SPR 기반 센서 개발 |
|
BIOECOTOX |
EU (FP6) |
- 생물인식자 : 화학물질 오염위해성 평가 및 사전경보 감시시스템 |
|
MARBEF |
EU (FP6) |
- 해양생물다양성 및 생태계 기능 |
|
SWORDGEN |
EU (FP5) |
- 지중해 및 대서양 갈치류(Xiphias gladius)의 유전자정밀구조 : microsatellite DNA 마커를 이용하여 개별 유전자인식표 부착연구 |
|
BRIDGE-MAP |
EU (FP5) |
- 유전체의 연결 : 양식어류종의 유전형질 개선을 위한 유전학 통합적 접근 |
|
BASS-MAP |
EU (FP5) |
- 바다농어의 유전형질 개선 방법 |
|
Genomique Marine |
France (2003-2006) |
- 해양생물로부터 단백질 발현 |
|
Salmon traits |
UK (2003-2007) |
- 대서양 연어의 유전자 조절에 관한 연구 |
|
FUGE (Functional Genomics) |
Norway (2002-2011) |
- 해양연구에 유전체학 도입을 통한 수산산업 발전 및 해양생물자원의 지속가능한 개발 목표 |
|
Salmon Genome Project |
Norway (2000-2005) |
- 연어 증양식산업 발전에 필요한 유전체연구 |
FP : Framework Programme
출처 : Background paper No. 10 on Marine Biotechnology, 2005
다. 국내동향
국내에서는 해양수산부에서 지원하고 있는 해양생명공학개발 사업이 유일하며, [표 4-5-3-8]과 같은 추진전략 및 중점 분야를 갖고 있다.
|
표 4-5-3-8 |
해양생명공학개발사업 추진전략 및 중점 분야
|
추진전략 |
- 친환경적 환경정화 기술 확보 및 생태환경 관리․보존 기술 확립 - 해양생물자원을 이용한 기능성․고부가가치 신물질 확보 기반 마련 |
|
중점 분야 |
- 해양수산 생명체의 유전자원 개발 및 응용 - 초기능성 해양수산 신품종 개발 및 대량생산 - 해양수산 신기능성 소재, 해양바이오신약 개발 및 활용 - 해양수산생물환경보존 |
출처 : 2007년도 생명공학육성시행계획, 과학기술부, 2007
한편 해양생명공학 분야 사업 및 인프라시설 내용은 [표 4-5-3-9]와 같다.
|
표 4-5-3-9 |
해양생명공학 분야 사업 및 인프라시설 내용
|
Infra 시설 및 사업명 |
주 요 내 용 |
주관연구기관 |
|
해양극한생물분자유전체연구단 |
해양극한생물 분자유전체를 활용한 기술 개발 |
한국해양연구원 |
|
해양천연물신약연구단 |
해양바이오신약개발 |
서울대 |
|
해양바이오프로세스연구단 |
해양기능성 산업소재 개발 |
부경대 |
|
수산생물유전체연구 및 활용기술 개발 |
주요 수산생물 발현유용유전자 확보로 우량품종 개발과 안정성 확보기술 개발 |
국립수산과학원 |
|
수산물의 산업과학화 연구 |
유용 수산물질의 산업화기술 개발 |
국립수산과학원 |
|
수산생물 육종프로그램개발연구 |
육종프로그램에 의한 넙치, 전복 풀종 개량 |
국립수산과학원 |
|
생물자원 유전정보은행운영 |
|
한국해양연구원, 국립수산과학원 |
출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006
한편 국가생명공학 클러스터 확충의 일환으로 현재 총 24개 바이오센터가 구축되어 진행 중이다. 그 중 해양바이오센터 현황은 부산의 BVC, 지역 센터, 경북 울진, 강원도 강릉의 지역 센터로 총 4개 센터가 지원되어 왔으나 부산 지역 센터를 2008년까지 지원, 나미지 두 곳은 2007년까지 지원계획이며, 부산 BVC는 2003년도 지원이 종료되었다. 기타 출연기관 사업으로 진행되고 있는 해양생명공학 분야는 [표 4-5-3-10]과 같다.
|
표 4-5-3-10 |
해양생명공학 분야의 출연기관사업
|
사 업 명 |
주 요 내 용 |
|
해양유래 항암소재 및 유용효소 개발연구사업 |
- 해양 생물 산업 관련 원천기술 확보 - 응용기술 제공을 통한 해양바이오산업 시장창출 및 확대 |
|
남태평양 열대해양 생물소재 실용화기술개발 |
- 유전자원 확보 및 DNA 칩 개발 - 새로운 바이오소재로부터 의약용 후보물질, 향장품, 기능성 식품 등 실용화 |
출처 : 2007년도 생명공학육성시행계획, 과학기술부, 2007
라. 발전전망
수산양식, 해조류 및 가공 산업 등은 제외된 것으로 과소평가된 측면이 있음에도 불구하고 2004년도에 전 세계의 해양생명공학시장은 22억유로로 추정하고 있고, 2009년도에 26억유로를 초과할 것으로 평가한다.
해양생명공학의 높은 잠재력을 언급할 때에 가장 빈번히 예로 드는 것으로 적은 투자로 연간 20억 달러 정도의 시장잠재력을 갖는 5개의 신약개발을 성공한 US Sea Grant Programme이 있다. UN 대학에 의해 연구한 ‘Bioprospecting of genetic resources in the deep seabed: scientific, legal and policy aspects’(2005) 에 의하면 해양생명공학에 관련된 제품의 전 세계 판매액은 2000년에 1,000억 달러에 이른다는 보고가 있다.
이와 같이 예측자료의 차이는 해양생명공학 내에서도 서로 다른 분야의 포함 여부에 기인하는 것으로 사료된다. 그 예측이 많은 차이가 나기는 하지만 해양생명공학은 2005~2009년 사이 연간 평균성장률 3.8%, 성장률합계 24%로써 가장 흥미를 끄는 신흥기술 분야 중 하나로 평가되고 있다. 영국의 미래예측 보고서에 의하면 2000년도 초반에 연간 성장률 10%를 넘을 것으로 예측하였고, 2003년도에 BCC 연구에 의해 예측한 1999~2007년 사이의 평균성장률은 미국 4.7%, 그 외의 국가 6.4%로 합계 5.9%로 나타났다. 이와 같은 모든 예측치를 종합하여 볼 때 2002~2005년 사이에 총 358억 달러의 수입을 창출한 비(非)해양생명공학활동에 비해 해양생명공학의 장기 잠재력은 매우 큰 것으로 평가받고 있다.


가. 생물자원의 개요
2000년 5월에 발간된 미국 TIME지는 현재의 정보경제시대가 2020년대 말에 끝나게 되면 새로운 바이오 경제시대가 도래될 것이라고 예측하고, 차세대 산업 분야로 주목 받고 있는 생명공학의 중요성을 강조한 바 있다. 바이오산업의 발전을 위하여 그 핵심재료인 생물자원의 확보 및 보급의 중요성을 인식한 OECD는, 2001년 세계 각국에 고품질의 생물자원 및 정보를 관리 보급하는 생물자원센터(Biological Resource Center, BRC)를 설치하도록 권고하였다. 생물자원센터는 생명공학 및 관련 산업의 성장을 견인하는 구동력으로 인식되고 있으며, 국가차원에서 지원해야할 중요 연구기반시설로 평가되고 있다. 전 세계 생물자원센터 네트워크인 GBRCN(Global BRC Network)의 구축도 그 흐름의 연장이라고 할 수 있다. OECD 생물자원센터 태스크포스(TFBRC)는 최근, 그동안 선진적인 생물자원센터 운영의 모범사례들을 선별하여, 모범운영지침(Best Practice Guidelines for BRC, 2007)을 선정하고 이를 각국의 생물자원센터가 품질경영에 이용하도록 보급 하고 있다.49)
최근 다양한 생물자원으로부터 천연물신약이 개발되는 예가 증가하면서, 생물자원의 중요성에 대한 인식이 전 세계적으로 확산되고 있으며, 이에 따라 선진 각국은 산업적으로 유용한 생물자원을 선점하기 위하여 국가 차원의 고부가가치 생물자원발굴(Bioprospecting) 사업을 추진하고 있다. 생물자원의 산업적 가치와 관련하여 생물자원을 활용한 제약, 농업 등 관련 산업의 세계시장 규모는 현재 약 8천억 달러에 이르며, 향후 10년까지는 2조 5천억 달러로 성장할 것으로 전망되고 있다.50) 조류인플루엔자 치료제인 타미플루(스위스 로슈사)는 중국의 토종 식물인 스타아니스에서 추출, 개발된 신약으로, 생물자원을 활용하여 고부가가치 창출(21억 달러 매출액, 2006)을 달성한 대표적인 생물자원 개발사례라 할 수 있다.
생물다양성협약(Convention on Biological Diversity, CBD)은 이러한 고부가가치 생물자원을 보유한 국가에 대하여 생물자원의 주권적 권리를 인정하고 있으며, 생물자원에 대한 접근권 및 전통기술의 보호문제와 생물체의 특허권 인정 여부 등을 주요의제로 다루고 있다. 생물자원의 산업적 가치가 증대되어감에 따라 생물자원 보유국과 개발국 사이에는 생물자원에서 창출되는 개발이익의 공유와 지식재산권 문제, 생물자원의 출처공개 등에 대한 WTO협정(TRIPs)을 둘러싸고 첨예한 대립 양상을 보이고 있다.
나. 생물자원의 정의 및 범위
OECD는 생물자원에 대한 정의를 ‘배양 가능한 생물체(미생물, 식물, 동물, 인간세포)와 생물다양성 부분 중 복제 가능한 부분, 배양 불가능한 생물체 및 이와 관련된 분자, 생리, 구조적 정보를 포함’하며, 또한 이들로부터 유래되는 유전체, 전사체, 단백질체, 대사체, 생물학적 화합물, 추출물, cDNA clone or library, Amplicon, Metagenome 등으로 규정하고 있다.51) 또한 이들을 네 가지 큰 범위(domain)인 1) 미생물(Micro-organisms):세균, 고세균, 미세조류, 진균류, 버섯, 바이러스, 병원성세균 등, 2) 식물(Plants):종자, 조직, 식물세포주 등, 3) 동물(Animals):수정란, 동물의 조직, 세포주(종양, 하이브리도마, 줄기세포) 등, 4) 인체유래물질(Human- derived materials):인체의 조직, 세포, 세포주, 그 외 인체유래성분들(배양가능자원, DNA, RNA, plasmid 등 복제가능자원, 미배양자원) 및 관련 정보(실물정보, 유전정보 등)로 구분하였다.

가. 미생물자원 분야
세계균주은행연맹(World Federation for Culture Collection, WFCC)에는 2007년 7월 현재 67개국 523개의 생물자원센터가 등록되어 있으며, 세계미생물자료센터(World Data Centre for Microorganisms, WDCM)가 운영되고 있다. 세계 최대의 생물자원 보유국인 미국은 200개 이상의 기관이 연계된 NBII(National Biological Information Infrastructure)를 중심으로, 미국 및 아․태 권역의 생물자원을 체계적으로 확보하고 있으며, 약 8만 여주의 공인자원을 보유한 세계최대의 생물자원은행인 미국표준균주은행(American Type Culture Collection, ATCC)을 보유하고 있다.
유럽연합은 생물자원의 주도권 확보를 위해 유럽 내 21개 자원은행의 생물자원 및 정보(약 14만건, 2006년)를 통합 검색하는 CABRI(Common Access to Biological Resources and Information)를 구축, 운영하며 전 세계 생물자원정보 표준화를 주도하고 있다. 독일의 생물자원센터인 DSMZ(Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH)는 세계 최대의 박테리아 표준균주(4,500주) 보유기관이며, 특허자원을 포함하여 24,450주를 보유하고 있다. 이 기관은 특히 고세균 등 특수 환경 자원의 연구와 분자계통분류학 기술에서 세계 최고 수준에 있다.
네덜란드의 CBS(Centraalbureau voor Schimmelcultures)는 곰팡이와 효모자원 확보 분야에서 세계적인 선도기관이며, 특히 곰팡이 분류 분야에서 다양한 서적 및 출판물들을 발간하여 연구자들을 지원하고 있다. 프랑스는 민간주도의 파스퇴르연구소를 중심으로 공인 생물자원의 확보를 추진하여 자원별로 특화된 보존기관을 운영하고 있으며, 500만유로를 투자하여 생물자원은행 네트워크 구축을 추진 중이다. 영국의 국가생물자원센터(UK National Culture Collection, UKNCC)는 자국 내에 분야별로 특화된 10개의 생물자원은행에 대해 장기적 생존유지에 필요한 대외 홍보, 국외 분양, 품질 유지 및 관련 서비스를 지원하고 있다.
생물자원 강국인 일본은 국가 차원의 생물자원 확보・관리 전략을 수립하고 국가생물자원센터(NITE Biological Resource Center)를 설립하여 운영 중이다. 문부과학성은 2002년 National BioResource Project를 시작하여 생물자원의 특성별로 총 25개 BioResource Center를 운영하고 있다. 또한 한국, 중국, 태국 등 12개 아시아 회원국간 생물자원의 공유 및 협력을 위해 ACM(Asian Consortium for the Conservation and Sustainable Use of Microbial Resources)의 운영을 주도하고 있다. 중국의 과학기술부는 생물자원 관련 9개 중점 분야를 선정하여 바이오산업 강국으로 부상하려는 전략에 따라 중국과학원(Chinese Academy of Sciences)을 중심으로, 향후 10년 내 10만주 확보를 목표로 National Framework for Natural Resources 사업, 국가 Microbial Resources Network구축 등 국가중심의 미생물자원 확대사업과 각 지방정부별로 20개 이상의 다양한 생물자원은행을 운영하고 있다.
나. 식물자원 분야
식량, 환경, 의약품 등 인류의 생활에 가장 많은 기여를 한 식물자원은, 최근 식량자원으로서의 전통적인 개념을 탈피하여, 추출물을 의약품산업에 활용하는 현대적 개념의 의약자원으로 진화되고 있다. 선진국들은 연간 3,000억 달러 규모의 세계 의약시장을 겨냥하여 식물로부터 신약 후보물질을 확보하기 위한 생물자원 전쟁을 벌이고 있다. 생물다양성협약 발효 이후 브라질을 비롯한 개발도상국들은 자국 내 생물자원에 대한 관리체제를 정비하는 등 생물자원 주권화 경향이 강해지고 있다. 이로 인하여 해외 생물자원의 도입이 어려워지고, 신약 개발 및 바이오산업의 핵심소재인 생물자원 확보에 장애요인이 될 가능성이 크다. 이에 따라 고부가가치를 지닌 생물자원에 대한 탐색과 확보가 국가의 중요한 의제로 부상하고 있다.
우리나라에서 보유하고 있는 식물자원은 4,911종 193,682점으로 양적으로는 세계 6위 수준이다[표 4-6-2-1]. 그러나 이들 자원은 쌀, 옥수수 등 농업 분야에 사용되는 농업 식량작물로 구성되어 있고, 유전적 다양성의 척도가 되는 종수(미국 12,380종)는 빈약한 편이다.52)53)
|
표 4-6-2-1 |
주요국의 식물자원 보유현황
|
국가 |
한국 |
미국 |
중국 |
러시아 |
일본 |
인도 |
|
보유수(점) |
193,682 |
478,000 |
380,000 |
349,000 |
278,000 |
256,000 |
출처 : OECD 주요국가 및 우리나라의 유전자원 관리현황, 곽재균, 한국환경농학회 춘계전문학술워크샵, 2005. 미국 농무성 농업연구서비스, http://www.ars-grin.gov/npgs
식물 자원 관리에 관계되는 국제기구로는 세계무역기구(World Trade Organization, WTO), 식량농업기구(Food and Agriculture Organization, FAO) 식량농업유전자원위원회(Commission on Genetic Resources for Food and Agriculture, CGRFA), 국제농업연구자문그룹(Consultative Group on International Agricultural Research, CGIAR), 국제식물유전자원연구소(International Plant Genetic Resources Institute, IPGRI) 등이 있다.
미국은 농무성에서 NPGS(National Plant Germplasm System) 프로그램을 운영하여, 동식물 등 생물자원의 탐색, 보존, 활용 전반에 대한 조정 기능을 수행하고 있다. 실행 부서로는 국립식물자원연구소(Grazinglands Research Laboratory, GRL), 국립유전자원보존센터(National Center for Genetic Resources Preservation, NCGRP), 국립식물자원검역소, 열대농업연구소, Active Collection 영양체 자원 저장소(8개소), 주요작물 저장소(대두 등 7개소), Genetic Stocks Center(4개소) 등이 있다.
일본은 국립농업생물자원연구소에서 동식물, 수산생물 등을 보존하고 있다. 식물은 농업생물자원연구소 등 9개 기관이 관리하며, 중앙단위은행에서 수집, 보존, 자료관리 및 관련 연구를 하고 있으며, 중앙단위은행은 산・학・연 등 여러 기관과 연계되어 있다. 중국은 중국농업과학원 작물유전자원연구소를 중심으로 국립종자 은행은 장단기 보존을 담당하고, 25개 지역의 National Field Gene Bank에서는 영양체자원 보존을, 11개 지역농업과학원에서는 12개소의 종자보존소를 운영하고 있다.54)
러시아는 바빌로프식물산업연구소(N.I. Vavilov Institute of Plant Industry, VIR)를 중심으로 식물자원을 보존관리하고 있으며, 수집, 보존, 검역, 대외 협력 등을 수행한다. 지역시험장은 12개 기관이 있으며 자원의 수집, 평가, 단기 보존 및 육종을 담당한다.6)
영국의 경우 영국식물유전자원그룹(UK Plant Genetic Resource Group, UKPGRG)에서 연구 및 관리를 총괄하고 작목별 17개 연구기관에서 품종육성, 수집 보존실(12만점)을 운영하며 작목별 Curator를 지정운영하고 있다.6) 한편 생물자원의 확보 및 활용기반 강화를 위한 정부투자가 증가하고 있는데, 영국의「Millennium Seed Bank」는 10년간(2000∼2010년) 총 5,900만 달러를 투자하여 종자 분야 세계 우위선점(전 세계 10% 확보)을 추진하고 있다.55)
다. 동물자원 분야
최근 식량농업기구(FAO)는 동물종의 멸종을 방지하고 종 다양성 보전 및 복원을 추진하기 위하여 이와 관련된 보고서를 잇달아 발표하였다. FAO는 2007년 6월 식량농업유전자원위원회에서 동물유전자 종의 보존과 국제 식량안보를 위해 국제정책을 개선해야 한다고 밝혔다.
약 169개국의 자료가 실린 “식량 및 농업 동물유전자원의 세계현황” 보고서에 따르면, 산업적인 양농이 대규모로 확산됨에 따라 세계 가축의 종 다양성이 위험에 처해져 있다는 것이다. 지난 20세기 중반부터 홀스타인 프레시안과 Landrace 돼지 등과 같은 유럽 종들이 전 세계로 퍼져나가면서, 각 지역에서 전통적인 종들을 압도하게 되었으며, 이러한 종 다양성의 감소는 유럽과 북미를 비롯하여 많은 개발도상국에서도 발생하고 있다. 동물 유전자원의 효과적인 관리를 위해서 훈련된 인력과 적절한 시설들이 필요하지만 대부분의 개발도상국들은 이를 갖추지 못한 실정이다. 세계의 약 48% 국가들은 현재 보존 프로그램을 보유하지 못하고 있으며, 63%는 그런 프로그램조차 없었다고 보고하였다. 이에 따라 아프리카를 중심으로 멸종야생동물보호, 자연 공원 지정, 재래 가축 보호, 축산 농가 단위의 전통가축 보호가 추진되고 있다.
일본의 농림수산성은 2002년에 시작한 ‘곤충산업창출 프로젝트’를 확충하여 2003년부터 유전체, 유용물질생산, 신소재개발 등 3개 분야 연구를 진행 중이다. 일본은 세계 제일의 누에정보 보유국으로 약 650계통을 보유하고 있다. ICLARM (International Center for Living Aquatic Resources Management)에서는 어류관련 연구기관들이 특정지역 정보를 제공 받아 세계 어류에 관한 정보를 DB화하여 지원하고 있다.
해양생물과 관련된 자원은행은 20여 개에 이르며, 해양세균은 미국 메릴랜드대, 곰팡이는 영국의 PPCC(Portsmouth Polytechnic Culture Collection), 조류는 CCAP (Culture Collection of Algae and Protozoa)에서 관리하고 있다.
실험동물은 국제기구에서 정한 국제지표에 의해 마우스 3,290계통, 랫드 750계통, 토끼 70계통, 개 15계통, 영장류 36계통 등 22종류의 실험동물 계통이 확립되어 있다. 실험동물 관리기관은 현재 전 세계 1,050개 기관이 등록되어 있으며, 미국, 이탈리아, 프랑스, 독일 등은 마우스에 대한 정보를, 랫드와 영장류의 경우 미국, 일본을 중심으로 실험동물과 정보를 제공하고 있다.56)

2000년 들어서 생물자원이 지닌 고부가가치에 대한 인식과 중요성이 강조되면서, 각 부처 차원의 생물자원 확보 및 활용계획이 경쟁적으로 추진하고 있다. 생물자원 사업은 7개 부처, 10여 개의 관련기관 등에서 연구 사업이 수행되고 있다. 최근 생물자원에 관련된 각 부처별 개별 법령 및 제도를 살펴보면, 산업자원부의 바이오산업발전을 위한 3․12프로젝트(2005. 7), 환경부의 생물자원보전종합대책(2004. 12), 보건복지부의 생명윤리 및 안전에 관한 법률 시행(2005. 1), 농림부의 농업유전자원관리 및 이용에 관한 법률(2007), 해양수산부의 ‘마린바이오21사업’(2004) 등이 각각 진행되고 있다.
국내의 생물자원 관련 산업은 생명공학기술의 발전에 힘입어 빠르게 성장하고 있는데, 시장규모는 연평균 27.7%로 증가하는 추세이며, 1994년 1,700억원에서 2005년 2.8조원 규모로 성장하고 있다.57)
산업자원부에서 발표한 바이오산업 현황(2005년)을 보면, 국내 생산규모는 2조 7,714억원으로, 전년 대비 14.5% 증가한 높은 성장세를 유지하고 있다. 산업 분야별로 바이오식품(41%)과 생물의약(40%)이 전체 생산규모 중 대부분(81%)을 차지하고 있으며, 생물화학(7%), 생물환경(5%), 생물검정, 정보서비스 및 연구개발(3%) 순위를 보인다. 또한 생명공학 특허 중 생물자원 탐색 분야 비중이 약 7.9%의 점유율을 차지하고 있을 만큼 성장세가 두드러진다.58)
그러나 생물자원의 국내 보유현황은 미국, 일본 등 선진국에 비하여 미흡한 수준이다. 그중 미생물자원은 약 56,000주(전 세계 대비 4.3%) 수준으로 보유된 양에 비하여 미생물종의 다양성이 매우 적은 실정이다.59) 다행히 미생물 분야의 신종 발굴기술은 세계적 수준으로 전체 515편 중 99편으로 한국이 19%를 점유하고 있다[표 4-6-3-1]. 또 국내 공공기관 등에 확보된 식물자원의 규모는 식물자원(종자) 약 19만점으로 미국(47만점)의 1/3, 중국(38만점)의 1/2.5, 일본(28만점)의 1/1.8수준에 불과한 실정이다[표 4-6-3-1].
|
표 4-6-3-1 |
세계미생물분류학회지(IJSEM)에 보고된 주요국의 신종 발표 현황(2006년)
|
국가 |
한국 |
중국 |
독일 |
인도 |
프랑스 |
|
발표건수(편) |
99 |
41 |
12 |
11 |
10 |
출처 : 한국생명공학연구원 생물자원센터, 2006

국내 생물자원 인프라 기반은 1985년 한국생명공학연구원을 설립하면서 유전자은행(KCTC)이 출범하고 생물자원센터(BRC/KCTC, 2003)로 확대․개편되면서, 부분적으로 확보되고 있으나, 선진 수준의 국가적인 생물자원관리는 아직 미비한 편이다. 선진 주요국의 생물자원센터 대비 연구인력 및 시설의 현저한 열세로 바이오 경쟁력 확보를 위한 지속적인 투자와 예산지원이 필요한 상황이다.
세계 각국은 고부가 생물자원을 발굴하고 이를 통한 지속가능한 바이오 경제기반을 구축하기 위하여, 국가 미래 발전전략의 핵심요소로써 생물자원의 확보 및 활용을 강화하고 있다.
이는 유용자원의 대량 확보를 통한 미래 생물자원을 발굴하고, 기술 선도를 위한 관련학문 및 산・학・연 협력 환경의 활성화로 뒷받침 될 수 있다. 이를 추진하기 위해서는 생물자원에 대한 국가차원의 종합관리 및 조정 시스템 강화가 시급하며, 생물자원의 주도권 확보, 산업화 촉진을 위한 국가적 운영방안 수립과 범부처적 생물자원 종합운영을 위한 법/제도 정비가 필요한 것은 물론이다. 현재는 개개 사업별로 개발된 자원의 공동 활용이 미흡하며, 과학기술부가 특정연구개발사업을 대상으로 실시 중인 연구성과물 등록제 실적도 저조한 실정이다.
생물자원경제를 창출하기 위해서는 유용 생물자원 활용을 지원하는 산업적 활용시스템의 구축과 산업계 수요 및 특성을 반영한 생물자원 발굴 전략이 실천되어야 한다. 또한 미래 바이오 경제시대를 대비하여 치열한 자원 확보경쟁에 따른 대응 전략이 향후 국가경제 패권을 결정짓는 중요한 요소라는 인식 하에, 생물자원 관련 국제법 및 기구에서 지식재산권을 포함한 지식기반의 국가경쟁력 강화가 필요한 시점이다.
최근 과학기술혁신본부를 중심으로 생물자원의 국가적인 종합 관리체계를 구축하기 위하여, 범부처적인「생물․유전자원 국가종합관리 방안」(2005. 9) 마련 및 「국가 생명자원 확보․관리 및 활용 마스터플랜(안)」(2007. 12) 수립을 추진 중에 있으며, 과학기술부를 중심으로 생물자원 분야의 지속적인 육성을 위해 범부처의 의견을 수렴하여 국가적인 법․제도 및 종합계획 수립을 위해 노력하고 있다.


바이오산업의 지속적인 발전을 위해서는 기초 분야 발전을 기반으로 하는 연구개발능력 함양과 지식재산권 확보를 위한 원천기술 개발 그리고 고부가가치의 생물공학제품의 개발 및 생산을 위한 산업화 과정이라는 3단계의 과정을 거치게 된다.
바이오산업은 타 산업 분야와는 다르게 기초연구와 원천기술개발 그리고 산업화단계 과정 모두 다양하고 복잡한 지원체계 즉 인프라의 도움을 받아야만 성공적인 연구개발을 통한 고부가가치의 생물공학제품을 시장에 진입시킬 수 있다. 그러므로 바이오산업의 지속성장을 지원·유도할 수 있는 인프라구축은 연구개발 분야 못지않게 필수적인 분야이다.
생물공학의 인프라 분야는 고가의 실험기자재 공동 활용, 시험분석/평가, 미생물 및 세포주/실험동물/식물추출물 등 생물자원의 관리 및 공급체계는 물론, 생물공학제품의 전임상 및 임상실험을 위한 임상연구센터, 시제품생산을 위한 생물시험공장, 바이오기업 지원 클러스터 등 다양한 분야가 포함된다.
현재 국내 생명공학 인프라구축은 과학기술부와 산업자원부의 지원으로 한국생명공학연구원에 구축된 생물자원센터, 국가생물자원정보관리센터, 바이오평가센터, 국가영장류센터, 바이오안정성정보센터, 생명공학정책연구센터, 해외생물소재허브센터 그리고 생물시험공장 등이 구축되어 있고, 산업자원부의 지역혁신사업과 지역진흥사업을 통하여 전국 3개 권역 12개의 지자체 16개 지역에 지역특화센터와 생물산업지원센터 그리고 지역기술혁신센터가 구축되어 있다.
한편 생물의약의 산업화에 필수적인 임상시험인프라는 2004년 12월 보건복지부의 지역임상시험센터 지원을 시작으로 서울대병원, 서울아산병원, 세브란스병원, 강남성모병원, 아주대병원, 부산백병원, 전남대병원, 전북대병원, 경북대병원 등에 총 9개의 지역임상센터가 설치되어 있고, 제품의 안정성확보를 위한 전임상(GLP) 기관으로는 한국화학연구원 부설 안정성평가연구원등 7개 기관이 운영 중에 있다. [표 4-7-1-1]과 [그림 4-7-1-1]에는 현재 국가 바이오산업 발전을 위한 다양한 인프라구축 현황을 제시하고 있다.
|
표 4-7-1-1 |
국가 바이오산업 발전을 위한 대표적 인프라구축 현황
|
인프라 분류 |
인프라 분야 |
인프라(설치기관) |
주요 역할 |
|
R&D |
연구기자재 공동활용 |
한국기초과학연구원 |
고가 연구기자재 공동활용 |
|
제품분석/평가 |
바이오평가센터(생명연) |
바이오제품의 유용성 및 위해성 평가 |
|
|
생물자원의 관리 및 공급 |
세포주 은행(서울대) |
미생물 및 세포주의 관리 및 공급 |
|
|
해외생물소재허브센터(생명연) |
식물자원 관리 및 공급 |
||
|
영장류자원 관리 및 공급 |
국가영장류센터(생명연) |
영장류자원의 국가적 연구기반 구축 |
|
|
생명공학 정책 및 정보관리 |
국가생물자원정보관리센터 (생명연) |
생명공학정보화사업 |
|
|
바이오안정성정보센터 (생명연) |
바이오안정성 관련 국내외 정보의 관리 |
||
|
생명공학정책연구센터 (생명연) |
국가생명공학정책연구 |
||
|
임상 및 허가 |
전임상 및 임상실험 |
지역임상시험센터(서울대병원 등 총 9개 지역병원) |
생물의약제품의 임상시험기관 |
|
안정성평가연구소(화학연) 등 7개 기관 |
생물의약 및 소재의 안정성 시험기관 |
||
|
시제품 생산 및 산업화 지원 |
생물시험공장 |
생물산업기술실용화센터 (생기연) |
cGMP 수준의 바이오의약 생산시설 |
|
바이오벤처기업지원센터 (생명연등 9개 기관) |
국내 바이오산업의 조기 산업화를 위한 공동 기술개발, 창업 보육 및 기술지도 등 지원 |
||
|
대전 바이오벤처타운 등 11개 지역특화센터 |
지역별 기술혁신체계 구축과 전략산업육성 |
||
|
사업화 |
바이오기업 지원 클러스터 |
생물산업 통합정보시스템 (한국바이오산업협회) 생물산업 지역혁신센터 등 |
기반기술구축, 인력양성, 정보유통 및 네트웍 구축을 통한 바이오기업 지원 인프라 |
* 자체 조사 후 재작성

* 자체 조사 후 재작성
|
그림 4-7-1-1 |
국가 바이오산업 발전을 위한 인프라구축 현황

해외 선진국의 바이오산업 인프라 동향은 미국, 영국, 일본 및 싱가포르 등에 구축된 바이오클러스터를 중심으로 살펴볼 수 있다. 미국의 경우 샌프란시스코만 연안, 보스턴지역과 샌디에고 지역에 모범적인 바이오클러스터가 형성되어 미국 바이오테크기업의 약 30% 가량이 밀집되어 있고, 위의 세 지역 이외에 매릴랜드, 버지니아, 로스앤젤레스, 뉴욕, 필라델피아, 시애틀 등의 지역에도 바이오클러스터가 형성되어 있다. 미국의 바이오 클러스터 가운데 샌디에고 지역의 바이오클러스터에서는 사람과 기술, 자본을 연결시켜 창업을 돕고 기술사업화를 지원하는 비영리기관의 글로벌 커넥트가 운영되고 있다. 일본의 경우 고베 메디컬파크에 사업화지원 기능을 수행하는 고베 바이오메디컬창조센터, 고베 국제비즈니스센터, 고베인큐베이션오피스, KIMEC센터 등이 운영되고 있다. 고베 바이오메디컬창조센터는 세포배양, 동물실험실, 방사성 동위원소시설 등 특수 설비도 갖추고 자금, 인력 등 소프트웨어적인 지원도 수행하여 연구개발에서 실용화까지의 기술 사업화를 지원하고 있다. 독일의 경우 베를린 브란덴부르크 바이오테크놀로지 지역이 독일의 첨단 바이오테크놀로지 지역 중의 한곳으로 알려져 있으며 진단, 치료, 재생의료의 각 분야에서 연구개발프로젝트가 진행되고 있다. 한편 뮌헨 지역에서는 잘 구축된 학계, 경제, 금융, 정치의 네트워크가 기능하고 있는데, 특히 바이오테크놀로지 이노베이션센터(IZB)는 이 지역 바이오산업의 발전에 크게 기여하고 있다. 독일에는 이들 지역 이외에 라인/네커 지역과 하이델베르크에도 잘 구축된 바이오클러스터가 있다. 싱가포르는 바이오산업 특히 바이오메디컬 부문의 해외 기업 및 우수인력을 유치하기 위하여 지식기반 인프라구축을 목적으로 하는 정보통신 및 인터넷, DB 차원의 인프라구축, 기술이전체계 구축, 지식재산권 보호체계 구축 등 종합적인 인프라 패키지 정책을 실시하면서 2003년 6월 첨단 창업보육 시설인 ‘바이오폴리스(Biopolis)’라는 생명공학의 복합단지를 구축하였다. 바이오폴리스에는 유전체, 바이오 엔지니어링 및 바이오 인포매틱스 연구소 등 공공연구기관과 민간의 연구기관이 집적하고 있으며 산학간, 기업 간의 공동개발과 협력을 위한 시설과 바이오 의약 실용화를 위한 의약평가센터, 임상 및 인허가 관련 지원 인프라를 구축하고 있다. 바이오제품의 생산 지원을 위한 시제품 생산 및 산업화지원 인프라 사례로 영국의 Celltech(1980년 설립, 1987년 민영화, 1996년 Lonza사에 일부 매각), 싱가폴의 Bioprocessing Technology Center(1990년 설립), 대만의 Biomedical Engineering Center(1999년 설립) 등이 있다(한국생산기술연구원 자료).

가. 연구 장비 공동 활용 인프라
연구 장비 공동 활용 및 지원을 목적으로 설립된 한국기초과학지원연구원은 국내 최고의 장비와 대형연구시설을 설치하여 기초과학 연구 환경을 갖추고 있다. 대덕본원을 비롯하여 서울(고려대), 부산(부산대), 대구(경북대), 광주(전남대), 전주(전북대), 춘천(강원대) 센터, 순천(순천대) 출장소가 설치되어 전국적인 네트워크를 갖추고 있다.
한국기초과학지원연구원의 연구지원 분야는 크게 생명공학, 나노과학, 환경과학 분야로 구분되어 있으며 생명공학 분야는 단백질체학 분야, 글라이코믹스 분야, 자기공명연구 분야, 메타볼롬분석연구 분야, 광특성분석 분야, 생체영상화 분야 등의 지원체계를 구축하고 있으며, 나노과학지원은 나노소재 분야, 나노바이오시스템 분야, 나노표면기술연구 분야, 전략소재특성 분야, 나노구조분석 및 특성평가 분야, 전자현미경 분야 등 6개 분야로 구성되어 있다. 한편 환경과학 분야는 연대측정 분야, 환경추적자 분야, 유해물질분석연구 분야 등으로 지원체계를 구축하고 있다.
나. 제품분석/평가 인프라
한국생명공학연구원 오창캠퍼스에 중앙연구동, 인체위해성평가동, 격리온실동 등 2,800평 규모로 바이오평가센터가 구축되어 있다. 동 센터는 생명공학 연구개발에 의해 창출될 수 있는 3대 주요제품인 의약품, 유전자변형생물체(식물, 미생물, 동물) 및 질병/기능 유용유전자에 대한 기술적, 시설적, 인적 평가인프라를 구축하여, 산․학․연의 생명공학 연구개발 및 산업화 과정에서 필수적인 제품에 대한 유용성 및 위해성에 관한 평가지원을 하는 것을 목적으로 하는 국가적 차원의 인프라로써 박사급 연구원 16명을 포함한 약 80여 명의 연구원으로 구성되어 있으며, 바이오신약/소재 최적화 및 평가, 질환모델동물 질병․기능유전자평가 및 자원보존․활용, 유전자변형생물체(LMO) 위해성평가 지원업무를 수행하고 있다.
다. 실험동물(영장류) 활용 인프라
영장류자원의 국가적 연구기반 구축을 목적으로 한국생명공학연구원 오창 캠퍼스에 설치된 국가영장류센터는 부지 1만평, 건평 1,400평 규모로 기초연구동, 영장류사육실험동, 검역동 등으로 구성되어 있으며, 국제규격의 SPF 사육시설에서 양질의 실험연구용 영장류를 사육하고 실험에 이용하는 환경을 조성하고 있다. 2007년 현재 국가영장류센터에는 필리핀 원숭이(Cynomolgus monkey), 붉은털 원숭이(Rhesus monkey), 아프리카 녹색원숭이(African green monkey) 등 영장류 3종 100여 마리가 사육되고 있으며, 줄기세포치료, 바이오이종장기 개발, 백신 개발 등을 위한 전임상 시험과 뇌과학 연구 등에 활용하기 위한 SPF 영장류자원 유지뿐만 아니라, 활용을 위한 시설도 보유하고 있다.
라. 전임상 및 임상실험 인프라
보건복지부에서는 국내 신약개발의 활성화 및 임상시험의 산업화를 위한 목적으로 2014년까지 총 1,200억원(정부 : 600억원, 민간 : 600억원)의 예산을 가지고 인구 수 및 행정구역을 고려하여 전국 총 15개의 선진국 수준의 지역임상시험센터 계획을 가지고 있다. 2006년 5월 현재 서울아산병원, 카톨릭대병원, 전북대병원, 서울대병원, 세브란스병원, 아주대병원, 전남대병원, 부산백병원 등 9개 지역임상센터가 선정되어 지원되고 있다.
현재 국내 전임상 인프라의 대표적인 기관으로는 화학 및 생물 산업 분야의 발전에 필요한 국제적 수준의 안전성평가시험 수행 및 기술의 개발을 위하여 1998년부터 한국화학연구원 내 안전성평가센터를 OECD의 GLP(Good Laboratory Practice, 우수실험실운영제도) 수준으로 확충하여 운영 중에 있고 2006년 현재 안전성평가센터를 포함한 16개 기관이 안전성평가시험 수행 및 지원을 하고 있다.
마. 시제품 생산 및 산업화지원 인프라
바이오의약품의 미국시장 진출을 위해서는 미국 FDA의 current GMP(cGMP; 우수의약품제조 및 품질관리기준), 유럽시장 진출을 위하여 유럽연합(EU)의 EU GMP에 따라야 하는 등 소비 및 유통을 하고자 하는 지역의 생산제조 가이드라인에 따라 엄격한 규제가 따르게 된다. 따라서 바이오산업 관련기술의 산업화지원을 위하여 국제적으로 인정된 미국 FDA cGMP기준에 적합한 시설을 구축하여 공동이용을 통한 국내 개발 바이오의약품의 대미 및 대선진국 수출 지원하기 위한 목적으로 구축된 생물산업기술실용화센터에는 500L급의 미생물 발효와 동물세포 배양을 위한 배양조가 각각 설치된 cGMP시설과 미생물 실험실, 동물세포 실험실, 기기분석 실험실 등을 구축한 non-GMP 시설이 구축되어 있다.
한편 98년부터 국내 바이오산업계의 산․학․연이 연계한 연구개발과 실용화 촉진을 위한 공동 기술개발, 창업보육 및 기술지도 등 지역혁신과 중소 바이오벤처기업들을 위한 목적으로 수도권을 제외한 대전, 상주, 영동, 전주, 나주, 진주, 부산, 제주 등 총 9개 지역에 바이오벤처기업지원센터(BVC, 1998년∼2007년, 총사업비 1,271억원, 정부 442억원)를 설립하였다.
이들 지원센터들은 기술 개발 및 시제품 생산에 필요한 고가의 시설 및 장비를 집적하여 지역 거점별 창업 및 성장단계별 집적화, 공동연구, 공동장비활용, 정보제공, 교육훈련 등을 지원하고 있다.
한편 지역균형발전 차원에서의 전국 19개 지역에 구축중인 바이오 지역특화센터(2002년∼2008 이후, 총사업비 4,821억원, 정부 2,792억원)는 바이오산업의 성과도출을 목적으로, 지역여건에 맞는 바이오산업을 기반구축함으로써 기업이 필요로 하는 장비 및 설비지원(CMO, CRO 수행 등), 연구지원, 사업화지원, 혁신주체간 네트워킹 등을 지원하고 기업창업 및 육성, 성장단계별 보육 공간 제공, 산업단지 내 외부기관 유치, 공동연구․가공장비 및 생산 공장(GMP 등) 등 구축하여 지역 내 기업들이 기술개발을 완료한 후 GMP시설에서 신제품을 소량 생산하여 시장진입 가능성을 판단하고자 하는 경우가 많아지면서 실제 제품을 생산할 수 있는 규모 수준의 시설과 장비가 구축되고 있다.
2002년에 시작된 지역특화센터 구축사업은 기존 4개 지역특화사업을 추진 중인 지역과 수도권을 제외한 9개 시․도의 지역별 기술혁신체계 구축과 전략산업육성을 위하여 2002년부터 2007년까지 추진하는 사업으로 총 27개 지원 사업 중 바이오산업 분야가 11개 사업이며, 2001년 한 해 동안 민간전문연구기관과 지자체에서 충분히 검토하여 기존 바이오벤처기업지원센터와의 기능 차별화 및 연계를 전제로 선정되었다. 그리고 2004년부터 2008년까지 추진될 4개시도 2단계 지역진흥사업에도 대구, 경남, 부산이 바이오산업을 지역특화산업으로 추가하고 부산의 해양생물산업육성센터, 대구의 전통생물소재산업화센터, 한방산업지원센터 그리고 경남의 바이오벤처 인프라구축 등이 추가되어 총 15개의 특화센터가 구축중이거나 현재 운영되고 있다.
2007년에는 전북 전주에 바이오파크인프라구축 사업이 추진 중에 있는 한편 경기도에서는 경기바이오센터를 구축 운영 중에 있으며, 전남 화순에 산업자원부와 전라남도가 출연하고 녹십자가 민간사업자로 참여하여는 독감백신생산을 위한 원료생산기반 구축 사업이 추진되어 화순 공업단지 내 2만여 평 부지에 연간 5000만 도스(dose·1도스는 1회 주사 분량) 규모의 독감 백신 원료 생산 공장을 설립하여 2009년부터 백신 원료를 생산할 예정이다.
또한 전남 장성에 구축중인 나노생물방제 실용화센터는 산업자원부의 지역산업혁신기반구축사업으로 추진되어 국비 130억원과 민간자본 228억 등 총 359억원 규모의 사업으로 2009년까지 장성과 곡성 2개 지역에서 추진하게 된다. 이들 지역특화센터들은 지역생명공학진흥협의회, 바이오 클러스터 유관기간 공동 워크샵 및 세미나 등 개최, 성공사례 발굴․홍보 등을 통한 집적화 거점간 상호연계를 강화를 위한 전략적 협력을 하고 있다.

생명공학 인프라 분야는 바이오산업의 발전에 있어 연구개발 단계로부터 개발된 기술을 사업화하는 최종단계까지 지속적으로 필요로 하는 핵심 분야이다. 따라서 바이오 관련 인력, 시설, 정보 인프라의 지속적 구축과 기술 사업화를 위한 전주기적 지원체계의 확립을 위한 부처간 연계도 강화해야 할 것이다.
또한 신속하고 저렴한 국제수준의 전임상과 임상 지원 체제를 강화하기 위한 세계적 수준의 전임상·임상, 생산시설 등 실용화 인프라 확충과 산·학·연·관 커뮤니티를 활성화를 통한 바이오 안전과 윤리에 대한 사회적 합의를 도출해 나가는 과정도 필요할 것이다. R&D, 임상 및 허가, 시제품 생산 및 사업화의 관점에서 본 국내 생명공학 인프라 분야의 현황 중 R&D부분의 인프라는 지난 20여 년간 정부의 꾸준한 생명공학 육성정책에 힘입어 우수하게 구축되어 있다고 평가 할 수 있을 것이다. 그러나 생물학 제제의 임상 및 허가, 시제품 생산 및 사업화의 관점에서의 인프라 특히 산업화 촉진을 위한 선진국 수준의 GXP(GLP, GMP, GCP 등) 인프라, 임상시험 인프라와 기술력이 아직은 미흡하며 이와 관련된 전문인력 공급 구조가 아직 매우 미흡하다고 할 수 있을 것이다. 이는 정부의 지속적인 생명공학 육성정책에 힘입어 이루어진 생명공학 연구 성과를 사업화 단계로 진입시키는데 있어 진입장벽으로 작용할 소지가 있으므로 사업화 인프라 확충과 민간 CMO, CRO 관련 기업의 성장에 다양한 인센티브 정책이 병행되어야 할 것으로 판단된다.
|
표 4-7-4-1 |
한국기초과학연구원 공동 활용 연구 지원 장비
|
지원 분야 |
|
구 축 장 비 |
|
생명 공학 분야 |
단백질체학 분야 글라이코믹스 분야 자기공명연구 분야 메타볼롬분석연구 분야 광특성분석 분야 생체영상화 분야 |
- 7T FT-ICR / MS - Nano-UPLC / ESI / Q-TOF / MS, MALD I / TOF-TOF / MS - FFE and PF2D for protein fractionation - HPLC (High performance liquid chromatography) - Confocal laser microscope - 900 MHz NMR with cryogenic probe - 800 MHz NMR - 600 MHz NMR with microimaging - 500 MHz NMR with cryogenic probe - 4.7 T MRI - 600 MHz LC-MS-NMR - Ion-trap LC-MS - UPLC (Ultra performance liquid chromatography) - Micro UV-VIS - PL / Raman spectroscopy - Multi-photon confocal microscope - In vivo optical scanner |
|
나노 과학 분야 |
나노소재 분야 나노바이오시스템 분야 나노표면기술연구 분야 전략소재특성 분야 나노구조분석 분야 전자현미경 분야 |
- Thermoanalyzer - CD-ORD - Medium pressure preparative liquid chromatograph - SQUID magnetometer - Field emission-SEM - Atomic force microscope - Secondary ion mass spectrometer - Pulsed laser deposition system - X-ray photo electron spectroscopy - 600 MHz solid-state NMR spectrometer - 400 MHz solid state NMR - High resolution XRD - Nanofinder - Micro X-ray / UPS - Electron probe micro-analyzer |
|
환경 과학 분야 |
연대측정 분야 환경추적자 분야 유해물질분석연구 분야 |
- Multi-collector thermal ionization mass spectrometer - Static vacuum mass spectrometer - Optically stimulated luminescence - Multi-collector ICP-MS - GC-stable isotope ratio mass spectrometer - Natural radioactivity measurement system - HR-GC mass spectrometer - LC-ICP-MS - LC ion-trap mass spectrometer |
출처 : 한국기초과학지원연구원 2006 연감 재구성
|
표 4-7-4-2 |
한국생명공학연구원 바이오평가센터의 주요 평가 분야 및 기능
|
분 야 |
주요기능 |
세부내용 |
|
LMO 평가 |
유전자특성분석 |
- 유전적 실질적 동등성평가 - 평가대상 계통선발 - 도입유전자의 수, 위치, 발현, 세대별 안전성 등 분자유전학적 데이터 제공 |
|
인체위해성평가 |
- LMO의 알레르기유발가능성평가 - LMO의 독성유발 가능성평가 - LMO의 영양성분 변화평가 |
|
|
환경위해성평가 |
- LMO의 유전자 이동과 잡초화 가능성 및 농업형질평가 - LMO가 곤충, 토양미생물과 병원성미생물에 미치는 영향평가 - 수입 LMO의 환경방출모니터링 |
|
|
바이오 의약 평가 |
약효평가 |
- 암, 면역질환, 당뇨등 21세기 인류건강을 위협하는 주요 질환의 치료제 개발을 위한 효능평가 |
|
약리연구 |
- 생리활성물질 및 의약품후보물질에 대한 약리기전연구 |
|
|
약동력학평가 |
- 신약후보물질 도출을 위한 약물대사 및 약동력학 평가연구 |
|
|
질환동물 모델평가 |
질병/기능 유전자평가 (Phenome 연구) |
- 실험동물 유전자 및 표현형 분석 - 질환모델/형질전환동물 개발 및 활용성 연구 |
|
실험동물 품종유지 및 품질검정 |
- 실험동물 확보, 유지 및 공급 - 실험동물 영구보존 및 재생 - 키메라마우스 제작용 배아줄기세포 개발 및 보급 |
|
|
실험동물 연구지원 |
- 실험동물정보 데이터베이스 구축 - 실험동물 표준화 - 동물실험연구 지원 - 실험동물 기술자/연구자를 위한 교육 훈련 및 정보전파 |
출처 : 한국생명공학연구원 바이오평가센터 2007년도 내부자료
|
표 4-7-4-3 |
2007년 현재 한국생명공학연구원 영장류센터 현황 비교
|
항 목 |
국내 현황 |
국외 현황 |
|
영장류 연구 센터 수 |
1개소 (국가영장류센터) |
- 미국: 8개소 - 일본: 2개소 - 유럽: 2개소 |
|
보유 영장류 자원 |
3종 100여 마리 |
5종 이상 평균 2,000 마리/센터 |
|
관련 연구 |
- 바이오이종장기 개발연구 - 백신개발을 위한 면역원성연구 - 질환모델개발을 위한 형질전환연구 |
- 결핵, AIDS 등 감염성질환 연구 - 뇌질환, 당뇨 등 퇴행성질환연구 - 세포치료 등 재생의학 관련 연구 |
|
센터당 인원 |
20 명 |
약 100여 명 |
출처 : 한국생명공학연구원 영장류센터 2007년도 내부자료
|
표 4-7-4-4 |
국가생물자원정보관리센터의 주요 기능
|
분 야 |
주 요 기 능 |
|
생물자원정보 수집ㆍ등록사업 |
- 각 부처 생물자원 보유현황조사 및 수집생물자원정보 대상 확정 - 유관기관간 정보교환 및 등록 네트워크 구축 - 생물자원정보 지원 전산시스템 구축 - 데이터 표준화 및 교환 프로토콜 개발 지원 - 생물자원정보 종류별 등록시스템 개발 - 생물자원정보 운영/관리 시스템개발 |
|
생물자원정보 지원ㆍ활용사업 |
- 생물자원 정보 분야 전문 DB 및 검색 유통시스템개발 지원 - 다양성, 소재, 유전체 분야 종합 정보 포털 사이트 개발 지원 - 생물자원별 다양성정보, 소재연구활용정보, 유전체정보 통합 DB 및 유통시스템 개발 지원 |
|
생물자원정보 통합ㆍ분석사업 |
- 생물자원 관련 annotation pipeline 개발 지원 - 생물자원 관련 Text mining 시스템 개발 지원 - 생물자원 정보 분석 알고리즘 개발 지원 - 유용 고부가가치 생물자원정보 통합데이터마이닝 시스템 개발 지원 |
|
생물자원정보 연구ㆍ개발사업 |
- 생물자원 자동 분류시스템 개발 지원 - 주요 생물종 Genome sequence 분석 지원 - 생물자원간 분자적 진화의 종합적 연구 지원 - 생물자원 유전자 발현 조절시스템 연구 지원 - 생물 주요종간 단백질기능 및 상호작용 통합적 연구 지원 - 생물 주요종의 유전체, 세포체, 조직체, 개체간 비교유전체 연구지원 - 생물자원의 시스템스 바이올로지 연구 기반 제공 |
|
생물자원정보 교육ㆍ협력사업 |
- 생물자원정보 분석 소프트웨어 교육 지원 - 생물자원정보 데이터 마이닝 기법 교육 지원 - 생물자원정보 분석 알고리즘 교육 지원 - 생물자원정보 비교유전체 및 기능유전체 연구 기법 교육 - 생물자원정보 동향분석 및 서비스 - 국제기구 및 국내외 기관과의 협력 |
출처 : 한국생명공학연구원 국가생물자원정보관리센터 2007년도 내부자료
|
표 4-7-4-5 |
한국바이오안전성정보센터의 주요 사업내용
|
사 업 |
사업 분야 |
사업 내용 |
|
교육 및 홍보 |
바이오안전성백서 발간 |
- 국내외 바이오안전성 정책추진 현황 및 연구개발 동향 등을 종합적으로 수록 - 산․학․연․관 관계자에 제공 바이오안전성 인식 제고 및 이해 촉진 |
|
계간지 BIOSAFET 발간 |
- 분기별 바이오안전성 및 유전자변형생물체(LMO) 관련 이슈를 기획 |
|
|
바이오안전성 세미나 개최 |
- ‘LMO 바로 알기’, ‘법․제도 설명회’ 등 대국민 대상 교육홍보 세미나 |
|
|
바이오안전성 공모전 |
- 전국 대학(원)생을 대상으로 바이오안전성 논문공모전 - 중․고생을 대상으로 한 논술공모전으로 확대 실시 |
|
|
홍보물 제작 및 배포 |
- 각 단계별(초․중․고급) 홍보책자 및 리플릿 제작 - LMO법․제도를 알리기 위한 홍보동영상 및 해설서 제작 - LMO수출입 매뉴얼 제작 |
|
|
정책지원 |
바이오안전성정책간담회 |
- 관계부처 및 관계기관의 의견 교류, 조율 |
|
LMO관련 법․제도 정비 지원 |
- LMO법률 통합고시 및 산업자원부 LMO고시 제정 작업 지원 - 바이오안전성위원회, 실무위원회, 분과위원회 실무 지원 |
|
|
정책 리포트 |
- 바이오 및 LMO관련 정책 현안 지원 |
|
|
정보 관리 및 유통 체계 |
- 국내외 LMO정보 관리 및 유통 체계 관련 기관간 상호 운용성 확보 - KBCH의 관리대상 정보 |
|
|
정보조사 및 연구 |
공공인식 조사 |
- 소비자, 기업 등의 LMO 및 생명공학에 대한 인식조사를 통해 인지도 파악, 제도 개선 및 홍보활동에 활용 |
|
LMO 및 바이오관련 통계 구축 |
- 전 세계 LMO심사승인 현황 통계 - LMO 및 바이오관련 수출입 현황 통계 - 국내외 논문분석을 통한 LMO연구개발 현황 통계 |
|
|
LMO 및 바이오관련 국내외 동향 분석 |
- 정책/제도, 연구개발, 사회/경제, 공공인식, 위해성평가/심사 등의 동향정보 |
|
|
국제협력 |
관련 국제회의 대응 |
- 바이오안전성의정서 관련회의 - BCH운영 전문가회의 등 |
|
개발도상국 지원 |
- BCH운영 경험 공유 및 지원 (동남아시아 6개국 : 태국, 인도네시아, 몽고, 미얀마, 필리핀, 부탄) - 바이오안전성 전문가 파견을 통한 능력형성 지원(2007년, 파키스탄) |
|
|
공동연구 |
- 한미 공동 소비자인식 조사 등 |
출처 : 한국생명공학연구원 바이오안전성정보센터 2007년도 내부자료
|
표 4-7-4-6 |
국내 GLP 기관의 인증항목 현황(2006년 6월)
|
시험 종류 시험기관 |
단회투여 독성 |
반복투여 독성 |
생식발생 독성 |
유전독성 시험 |
면역독성 시험 |
발암성시험 |
국소독성 시험 |
기 타 |
|
한국화학연구원 안전성평가연구소 |
○ |
○ |
○ |
○ |
○ |
○ |
○ |
○ |
|
(주)유한양행 중앙연구소 |
○ |
○ |
- |
○ |
- |
- |
- |
- |
|
동아제약 중앙연구소 |
○ |
- |
○ |
- |
- |
- |
- |
- |
|
LG생명과학 기술연구원 안전성센터 |
○ |
○ |
○ |
○ |
○ |
- |
○ |
- |
|
제일제당 종합기술원 |
○ |
- |
- |
○ |
- |
- |
- |
- |
|
(주)바이오톡스텍 |
○ |
○ |
○ |
○ |
○ |
○ |
○ |
○ |
|
산업안전연구원 화학물질안전보건센터 |
○ |
○ |
- |
○ |
- |
- |
- |
- |
|
켐온 |
○ |
○ |
○ |
○ |
○ |
○ |
○ |
- |
|
태평양기술연구원 의약견강연구소 전임상연구센타 |
○ |
- |
- |
- |
○ |
- |
○ |
○ |
|
서울대학교병원 임상의학연구소 |
○ |
○ |
- |
○ |
- |
- |
○ |
- |
|
한국화학시험연구원 안전성연구센터 |
○ |
○ |
○ |
○ |
○ |
- |
○ |
- |
|
(주)메드빌 |
- |
- |
- |
○ |
- |
- |
- |
- |
|
바이오코아(주) |
- |
- |
- |
- |
- |
- |
- |
○ |
|
(주)아이바이오팜 |
- |
- |
|
- |
- |
- |
- |
○ |
|
대구가톨릭대학교 바이오안전성센터 |
○ |
- |
- |
- |
- |
- |
- |
- |
|
동아대학교병원 임상시험연구센터 |
○ |
- |
- |
○ |
- |
- |
- |
- |
|
(주)서울의약연구소 |
- |
- |
- |
- |
- |
- |
- |
○ |
출처 : 식품의약품안전청“2006년도 GLP 기관의 인증기관 현황자료”재구성
|
표 4-7-4-7 |
생물산업기술실용화센터 구축 예산
(단위 : 백만원)
|
사 업 명 |
사업비 구 분 |
2005년 이전 |
2006년 |
2007년 |
2008년 이후 |
합계 |
|
생물산업기술실용화센터건립 |
정 부 |
66,618 |
16,500 |
7,500 |
- |
90,618 |
|
민 간 |
4,442 |
720 |
666 |
- |
5,828 |
|
|
소 계 |
71,060 |
17,220 |
8,166 |
- |
96,446 |
출처 : 2007년도 생명공학육성시행계획 부록 부처별·기관별 세부사업
|
표 4-7-4-8 |
생물산업기술실용화센터 주요 사업
|
서비스 분야 |
서비스 내용 |
기술지원 |
|
발효/배양 서비스 |
- 500L Working Volume의 미생물 발효 - 500L Working Volume의 동물세포 배양
|
- Batch는 물론 Fed-batch와 같은 고농축 미생물배양 기술지원 - Perfusion 방식의 연속식 동물세포배양 기술지원 - 배양 및 회수의 Scale-up과 최적화 공정설계지원 - Validation 지원 |
|
정제서비스 |
- Pilot scale, 전임상 시료생산의 소규모 정제 - 전임상, 임상용 및 치료용 의약품 생산의 대규모 정제 |
- 정제공정 개발 및 최적화 지원 - 정제공정 Scheme 지원 - 정제공정 기술이전 (Technical Transfer) 지원 - 정제공정 SOP 및 Validation 지원 |
|
완제 서비스 |
- 액상 vial 제제 생산 (2ml, 6ml, 10ml vial) - 동결건조 vial 제제 생산 (2ml, 6ml, 10ml vial) - Pre-filled syringe 생산 (1ml, 3ml syringe) |
- 완제공정 SOP 및 Validation 지원 - 동결건조 Cycle optimization 지원
|
출처 : 생물산업기술실용화센터 웹사이트 자료 재구성
|
표 4-7-4-9 |
바이오벤처기업 지원센터 현황
(단위:백만원)
|
지원센터 |
전문화 분야 |
사업 기간 |
사업비 구 분 |
2005년 이전 |
2006년 |
합계 |
|
○ 생물의약 TIC (대전BVC) |
생물의약 |
1999~ 2003 |
정 부 |
5,030 |
- |
5,129 |
|
민 간 |
11,707 |
- |
11,707 |
|||
|
소 계 |
16,737 |
- |
16,737 |
|||
|
○ 생물농업,기능성소재 TIC(상주BVC) |
기능성 생물소재 |
2001~ 2006 |
정 부 |
4,207 |
- |
6,208 |
|
민 간 |
7,247 |
- |
7,247 |
|||
|
소 계 |
11,454 |
- |
11,454 |
|||
|
○ 생물의약,식품 TIC (영동BVC) |
생물의약,기능성식품 |
2001~ 2006 |
정 부 |
4,680 |
- |
4,681 |
|
민 간 |
5,998 |
- |
5,998 |
|||
|
소 계 |
10,678 |
- |
10,678 |
|||
|
○ 기능성첨가제, 해양 TIC(제주BVC) |
해양, 바이오 첨가제 |
2001~ 2006 |
정 부 |
4,770 |
- |
4,771 |
|
민 간 |
2,838 |
- |
2,838 |
|||
|
소 계 |
7,608 |
- |
7,608 |
|||
|
○ 생물산업벤처기업 지원센터 (춘천BVC) |
생물환경․ 공정 |
1998~ 2002 |
정 부 |
5,800 |
- |
5,898 |
|
민 간 |
15,510 |
- |
15,510 |
|||
|
소 계 |
21,310 |
- |
21,310 |
|||
|
○ 전북생물벤처센터 (전주BVC) |
천연물 소재 |
2000~ 2004 |
정 부 |
5,062 |
- |
5,062 |
|
민 간 |
9,126 |
- |
9,126 |
|||
|
소 계 |
14,188 |
- |
14,188 |
|||
|
○ 산․학․연협동연구센터 (나주BVC) |
생물농업․ 식품 |
2000~ 2004 |
정 부 |
5,000 |
- |
5,000 |
|
민 간 |
3,444 |
- |
3,444 |
|||
|
소 계 |
8,444 |
- |
8,444 |
|||
|
○ 생물화학소재지원 센터 (진주BVC) |
생물화학 소재 |
2000~ 2004 |
정 부 |
5,000 |
- |
5,000 |
|
민 간 |
16,320 |
- |
16,320 |
|||
|
소 계 |
21,320 |
- |
21,320 |
|||
|
○ 마린바이오산업화 센터 (부산BVC) |
마린바이오산업화 |
2002~ 2007 |
정 부 |
3,550 |
996 |
4,548 |
|
민 간 |
8,895 |
1,919 |
10,814 |
|||
|
소 계 |
12,445 |
2,915 |
15,360 |
|||
|
총 9개 센터 |
정 부 |
43,099 |
996 |
44,104 |
||
|
민 간 |
81,085 |
1,919 |
83,004 |
|||
|
소 계 |
124,184 |
2,915 |
127,099 |
|||
출처 : 2007년도 생명공학육성시행계획 부록 부처별·기관별 세부사업
|
표 4-7-4-10 |
전국 바이오 특화센터 현황(1)
(단위:백만원)
|
사업명 |
사업비 구 분 |
2005년 이전 |
2006년 |
2007년 |
2008년 이후 |
합계 |
|
○ 경기바이오센터 (경기, 수원) |
정 부 |
- |
700 |
1,000 |
3,300 |
5,000 |
|
민 간 |
- |
1,450 |
1,450 |
4,350 |
7,250 |
|
|
소 계 |
- |
2,150 |
2,450 |
7,650 |
12,250 |
|
|
○ 바이오벤처타운조성 (대전) |
정 부 |
24,770 |
1,120 |
176 |
- |
26,066 |
|
민 간 |
8,725 |
2,100 |
1,200 |
- |
12,025 |
|
|
소 계 |
33,495 |
3,220 |
1,376 |
- |
38,091 |
|
|
○ 보건의료산업종합지원센터 (충북, 오창) |
정 부 |
1,990 |
5,420 |
8,480 |
- |
15,890 |
|
민 간 |
2,650 |
900 |
2,950 |
- |
6,500 |
|
|
소 계 |
4,640 |
6,320 |
11,430 |
- |
22,390 |
|
|
○ 전통의약품연구개발지원센터 (충북, 제천) |
정 부 |
5,540 |
2,590 |
4,710 |
- |
12,840 |
|
민 간 |
2,600 |
600 |
2,300 |
- |
5,500 |
|
|
소 계 |
8,140 |
3,190 |
7,010 |
- |
18,340 |
|
|
○ 동물자원사업화지원센터 (충남, 논산) |
정 부 |
2,800 |
1,870 |
120 |
- |
4,790 |
|
민 간 |
3,214 |
200 |
150 |
- |
3,564 |
|
|
소 계 |
6,014 |
2,070 |
270 |
- |
8,354 |
|
|
○ 생물식품사업화지원센터 (전남, 나주) |
정 부 |
22,050 |
5,560 |
2,790 |
- |
30,400 |
|
민 간 |
11,600 |
900 |
1,200 |
- |
13,700 |
|
|
소 계 |
33,650 |
6,460 |
3,990 |
- |
44,100 |
|
|
○ 생물농업산학연구개발 지원센터(전남, 화순) |
정 부 |
11,270 |
4,160 |
2,000 |
- |
17,430 |
|
민 간 |
6,600 |
600 |
500 |
- |
7,700 |
|
|
소 계 |
17,870 |
4,760 |
2,500 |
- |
25,130 |
|
|
○ 바이오사이언스파크조성 (제주) |
정 부 |
17,112 |
3,860 |
7,147 |
- |
28,119 |
|
민 간 |
7,617 |
741 |
3,088 |
- |
11,446 |
|
|
소 계 |
24,729 |
4,601 |
10,235 |
- |
39,565 |
|
|
○ 생물건강산업사업화 지원센터(경북, 안동) |
정 부 |
10,350 |
2,250 |
1,190 |
- |
13,790 |
|
민 간 |
8,500 |
600 |
70 |
- |
9,170 |
|
|
소 계 |
18,850 |
2,850 |
1,260 |
- |
22,960 |
출처 : 2007년도 생명공학육성시행계획 부록 부처별·기관별 세부사업
|
표 4-7-4-11 |
전국 바이오 특화센터 현황(2)
(단위:백만원)
|
사업명 |
사업비 구 분 |
2005년 이전 |
2006년 |
2007년 |
2008년 이후 |
합계 |
|
○ 해양생명환경산업지원센터 (경북, 울진) |
정 부 |
1,800 |
4,000 |
2,350 |
- |
8,150 |
|
민 간 |
10,550 |
3,700 |
750 |
- |
15,000 |
|
|
소 계 |
12,350 |
7,700 |
3,100 |
- |
23,150 |
|
|
○ 바이오타운조성(강원, 춘천) |
정 부 |
16,610 |
310 |
12,320 |
- |
29,240 |
|
민 간 |
9,600 |
5,700 |
6,000 |
- |
21,300 |
|
|
소 계 |
26,210 |
6,010 |
18,320 |
- |
50,540 |
|
|
○ 해양수산자원산업화 지원센터(강원, 강릉) |
정 부 |
10,920 |
3,940 |
6,161 |
- |
21,021 |
|
민 간 |
8,400 |
3,100 |
600 |
- |
12,100 |
|
|
소 계 |
19,320 |
7,040 |
6,761 |
- |
33,121 |
|
|
○ 대구바이오산업지원센터 (경북, 대구) |
정 부 |
2,500 |
3,470 |
2,430 |
2,100 |
10,500 |
|
민 간 |
6,518 |
1,375 |
935 |
980 |
9,808 |
|
|
소 계 |
9,018 |
4,845 |
3,365 |
3,080 |
20,308 |
|
|
○ 한방산업지원센터 (경북, 대구) |
정 부 |
1,800 |
450 |
800 |
400 |
3,450 |
|
민 간 |
3,041 |
566 |
491 |
491 |
4,589 |
|
|
소 계 |
4,841 |
1,016 |
1,291 |
891 |
8,039 |
|
|
○ 바이오벤처프라자 (경남, 진주) |
정 부 |
4,550 |
1,050 |
950 |
800 |
7,350 |
|
민 간 |
11,800 |
3,000 |
1,100 |
1,000 |
16,900 |
|
|
소 계 |
16,350 |
4,050 |
2,050 |
1,800 |
24,250 |
|
|
○ 해양생물산업육성센터 (부산) |
정 부 |
1,000 |
2,090 |
4,000 |
4,500 |
11,590 |
|
민 간 |
1,000 |
4,300 |
4,000 |
3,500 |
12,800 |
|
|
소 계 |
2,000 |
6,390 |
8,000 |
8,000 |
24,390 |
|
|
○ 바이오파크 인프라구축 (전북, 전주) |
정 부 |
1,242 |
2,546 |
3,970 |
- |
7,758 |
|
민 간 |
1,206 |
1,373 |
1,878 |
- |
4,457 |
|
|
소 계 |
2,448 |
3,919 |
5,848 |
- |
12,215 |
|
|
○ 독감백신원료 생산기반 구축 (경남, 화순) |
정 부 |
2,465 |
6,934 |
3,500 |
- |
12,899 |
|
민 간 |
2,000 |
1,000 |
3,250 |
- |
6,250 |
|
|
소 계 |
4,465 |
7,934 |
6,750 |
- |
19,149 |
|
|
○ 나노생물방제실용화 센터(전남, 장성/곡성) |
정 부 |
- |
1,980 |
4,200 |
6,800 |
12,980 |
|
민 간 |
- |
3,450 |
9,500 |
9,900 |
22,850 |
|
|
소 계 |
- |
5,430 |
13,700 |
16,700 |
35,830 |
|
|
총 19개 센터 합계 |
정 부 |
138,769 |
54,300 |
68,294 |
17,900 |
279,263 |
|
민 간 |
105,621 |
35,655 |
41,412 |
20,221 |
202,909 |
|
|
소 계 |
244,390 |
89,955 |
109,706 |
38,121 |
482,172 |
출처 : 2007년도 생명공학육성시행계획 부록 부처별·기관별 세부사업
|
표 4-7-4-12 |
전국 바이오산업 지역특화센터 및 바이오벤처 지원센터
■ 바이오벤처지원센터
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
■ 지역특화센터
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
■ 지역기술혁신센터
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
출처 : 각 센터 웹사이트 자료 재구성



유전자변형기술, 세포융합 등 현대 생명공학기술의 발달로 다양한 유전자변형생물체(Living Modified Organisms, 이하 ‘LMO’)가 개발되어 사용됨에 따라 국제적으로 LMO로 인한 인간건강 및 환경보호에 미칠 위해를 사전에 방지하기 위한 노력이 진행되고 있다.
이와 관련하여 UN 산하 환경전문기구인 유엔환경계획(UNEP: United Nations Environment Programme)은「생물다양성협약」(CBD: Convention on Biological Diversity)의 부속서인「바이오안전성에 관한 카르타헤나의정서」(BSP: Cartagena Protocol on Biosafety, 이하 ‘의정서’)가 2000년 1월 캐나다 몬트리올에서 개최된 CBD 특별당사국총회에서 채택되었다. 의정서는 2003년 6월 팔라우가 50번째로 비준함에 따라 90일 후인 2003년 9월 국제적으로 발효되어, 2007년 10월 기준 142개국이 가입하고 있다[표 5-1-1-1].
의정서 가입 현황에서 눈여겨볼만한 점은 2007년 현재 유전자변형 작물을 재배하고 있는 것으로 파악된 22개 국가 중에서 17개국(브라질, 중국, 파라과이, 인도, 남아공, 멕시코, 루마니아, 스페인, 콜롬비아, 이란, 온두라스, 포르투갈, 독일, 프랑스, 체코, 슬로바키아, 필리핀)은 의정서에 가입하고 있으며, 유전자변형 작물 대다수의 재배면적을 점유하고 있는 나머지 5개국(미국, 아르헨티나, 캐나다, 우루과이, 호주)은 가입하지 않고 있다. 이들 국가가 가입하지 않고 있는 것은 의정서 이행에 따른 유전자변형 작물의 개발 및 수출에 타격을 받을 것을 고려한 조치로 보여 지고 있다.
의정서의 국제적 흐름 속에서 우리나라는 2000년 9월 의정서에 서명하였으며, 시민단체 등 바이오안전성 확보 요구와 더불어 의정서 국내이행체제 구축에 대한 초석을 마련하고자 2001년 3월 산업자원부가 주관이 되어「유전자변형생물체의 국가간 이동 등에 관한 법률」(이하 ‘LMO법률’)을 제정․공포하였다. 이후 각 부처별로 동법 시행에 필요한 하위 법령 제정을 위해 노력해 온 결과, 2007년 8월 LMO법률 통합고시안이 입법예고 되었다.
이에, 본 절에서는 2006년부터 최근까지의 LMO를 둘러싼 국제법적 논의 동향을 살펴보고, 더불어 우리나라가 동 의정서의 이행 및 바이오안전성 확보를 위해 어떠한 노력을 전개해 왔는지를 간략하게 기술해 보고자 한다.
|
표 5-1-1-1 |
바이오안전성의정서 가입 현황(2007년 10월 기준 142개국)
|
구분1) 지역 |
의정서 발효 기준 50개국2) |
발효 기준일 이후 가입국 |
계 |
|
아프리카 |
보츠와나, 카메룬, 지부티, 가나, 케냐, 레소토, 라이베리아, 말리, 모리셔스, 모잠비크, 탄자니아, 튀니지, 우간다(13)
|
나이지리아, 부르키나파소, 남아공, 세네갈, 에티오피아, 마다가스카르, 이집트, 잠비아, 세이셸, 감비아, 토고, 르완다, 알제리, 니제르, 나미비아, 짐바브웨, 베냉, 에리트리아, 콩고, 수단, 리비아, 모리타니, 카보베르데, 스와질란드, 콩고, 차드, 가봉(27) |
40 |
|
아시아․ 태평양 |
부탄, 피지, 인도, 몰디브, 마샬군도, 나우루, 니우에, 오만, 팔라우, 사모아(10)
|
몽고, 북한, 말레이시아, 캄보디아, 통가, 요르단, 이란, 일본, 키프로스, 베트남, 방글라데시, 타지키스탄, 시리아, 키리바시, 스리랑카, 솔로몬, 라오스, 인도네시아, 중국, 파푸아뉴기니, 태국, 예맨, 필리핀, 카타르, 사우디아라비아, 대한민국(26) |
36 |
|
중앙 ․ 동유럽 |
벨로루시, 불가리아, 크로아티아, 체코, 몰도바, 슬로베니아, 우크라이나(7)
|
루마니아, 리투아니아, 슬로바키아, 폴란드, 헝가리, 라트비아, 에스토니아, 아르메니아, 알바니아, 아제르바이잔, 유고, 키르키즈스탄, 세르비아, 몬테네그로(14) |
21 |
|
중남미 ․ 카리브해 |
바베이도스, 볼리비아, 콜롬비아, 쿠바, 에콰도르, 멕시코, 니카라과, 파나마, 세인트키트네비스, 트리니다드토바고, 베네수엘라(11) |
세인트빈센트, 앤티가바부다, 엘살바도르, 브라질, 바하마, 그레나다, 벨리즈, 파라과이, 페루, 도미니카, 과테말라, 세인트루시아, 도미니카공화국, 코스타리카(14) |
25 |
|
서유럽 및 기타 |
오스트리아, 덴마크, 프랑스, 룩셈부르크, 노르웨이, 스페인, 스웨덴, 스위스, 네덜란드(9) |
터키, 아일랜드, 영국, 독일, 이탈리아, 벨기에, 그리스, 핀란드, 포르투갈, 뉴질랜드, 몰타공화국(11) |
20 |
1) UN이 정한 5가지 지역 분류 기준에 따름
2) 2000년 10월 5일 트리니다드토바고가 처음으로 가입한 이후 2003년 6월 13일 팔라우가 50번째로 가입함으로써 그 90일 이후인 2003년 9월 11일부터 의정서가 국제적으로 발효됨
출처 : 바이오안전성의정서 홈페이지(www.biodiv.org/biosafety/) 내용 재구성
* 관례적으로 유럽연합은 제외하게 되어 있어 전체 국가 수는 142개국이나 우리나라는 143번째 국가로 가입되었음

가. 제3차 의정서 당사국총회 논의 동향
바이오안전성의정서의 당사국 및 비당사국 정부, 유엔 기관, 정부간 기구, 비정부기구, 교육계, 산업계 등을 대표하는 1,000명 이상이 참가한 제3차 의정서 당사국총회는 2006년 3월 13일부터 17일까지 5일간 브라질의 환경도시 꾸리찌바에서 개최되었다. 우리나라는 비당사국 자격으로 외교통상부(국가연락기관), 산업자원부(국가책임기관) 등의 정부대표 및 관계 전문가가 참가하였다.
제3차 당사국총회의 가장 큰 의미는 의정서 이행에 있어 최대의 이슈라고 할 수 있었던 식용․사료용․가공용 LMO(LMO-FFP(Food, Feed, Processing) : 식품, 사료로 직접 이용되거나 가공을 목적으로 하는 LMO로써 주로 농산물이 해당)의 수출입에 따른 세부표시사항에 대하여 전격적인 합의가 도출되었다는 점이다. LMO-FFP 세부표시사항을 포함한 제3차 당사국총회의 주요 논의 및 결정내용을 의제별로 정리하면 아래와 같다.
(1) 18조 2(a)항 LMO-FFP 세부표시사항(의제 10)
제3차 당사국총회 기간 내내 연속 개최된 비공식 그룹(Contact Group) 회의에서 수출입 선적물에 포함된 LMO의 존재를 알고 있는 경우에는 ‘포함하고 있음(contain)’을, 그렇지 않은 경우에는 ‘포함가능성 있음(may contain)’을 제6차 당사국총회시까지 사용한다는 결정문 초안을 작성하였다.
당사국총회 마지막 날인 3월 17일 개최된 실무그룹Ⅰ 회의에서 의장은 이 같은 결정문 초안에 대한 멕시코와 파라과이의 반대에도 불구하고, 유럽연합(EU), 아프리칸 그룹, 브라질, 일본 등의 지지를 바탕으로 전체 회의에 직권 상정키로 결정하였다.
이어 개최된 전체 회의에서 이 결정 문안에 대해 멕시코와 파라과이가 다시 강경한 반대 입장을 표명함에 따라, 총회 의장은 실무그룹Ⅰ 의장에게 주요국간 재협의를 지시하였다. 이후 장시간의 협의 끝에 결정 문안을 도출하여 전체 회의에서 최종 채택되는 과정을 거쳤다. 아울러 제5차 당사국총회에서 세부표시사항의 이행 경험을 검토하고, 제6차 당사국총회에서는 ‘선적서류에 화물의 LMO-FFP 포함하고 있음(contain)을 명시’하는 결정 문안을 논의하기로 하였다.
(2) 의무준수위원회 의사규칙(의제 4)
실무그룹Ⅱ 회의는 의무불이행을 판단하기 위한 의무준수위원회의 투표방식과 관련하여 ‘만장일치로 결정하되, 불가능한 경우 다수결로 결정 한다’는 내용의 결정문 초안을 논의했으나, 합의를 도출하지 못하여 제4차 당사국총회에서 재논의 하기로 하였다. 총회 마지막 날인 전체 회의에서는 ‘제4차 당사국총회에서 의무준수제도 및 의사절차의 효과성을 고려하여 투표방식 등에 대해 다시 논의 한다’는 내용의 결정문을 채택하였다.
(3) 위해성 평가 및 관리(의제 11)
식물, 동물 또는 미생물 등의 위해성 평가관련 정보를 BCH를 통하여 제공해야 하며, 제4차 당사국총회에서 위해성 평가와 관리와 관련된 추가 지침의 개발 필요성에 대하여 논의하기로 결정하였다. 또한 당사국은 위해성 평가 및 관리와 관련된 경험과 정보를 전문기관 및 전문가들과 공유하고 국가적․지역적 수준의 협력에 노력하여야 함을 권고하였다.
(4) 평가 및 검토(의제 15)
제4차 당사국총회 6개월 전까지 당사국, 각국 정부, 국제기구, 비정부기구 등에게 의정서의 효율성에 대한 의견을 사무국에 제출할 것을 요청하였다. 사무국은 당사국이 제출한 1차 국가별 보고서에 포함된 정보뿐만 아니라, 의정서의 효율성에 대한 검토 의견을 종합하여 제4차 당사국총회에 보고하기로 하였다. 또한, 의무준수위원회는 의정서의 도입에 따른 문제점에 대해 보고서를 작성하여 제4차 당사국총회에서 보고하기로 결정하였다.
(5) 다른 국제기구와의 협력(의제 8)
당사국들은 사무국에 WTO 등 국제기구와의 협력 강화를 촉구하고, 특히 SPS 및 TBT 위원회에서의 옵서버 지위 확보를 위해 적극 노력할 것을 요청하였다.
(6) 능력형성(의제 6)
지구환경기금(GEF), 선진국 및 관련 국제기구가 바이오안전성의정서의 개발도상국 능력형성을 위한 활동계획(Action Plan)에 대해 재정 및 기술지원을 제공할 것을 요청하였다. 또한 능력형성 활동계획에 대한 종합 검토를 매 5년마다 실시하기로 결정하였다.
(7) 책임 및 복구(의제 12)
책임 및 복구에 관한 전문가 실무그룹 회의를 제4차 당사국총회 이전까지 2년간 5일 간의 일정으로 3회에 걸쳐 개최하기로 합의하고, 개발도상국 전문가의 참가 지원을 위한 선진국의 자발적인 기여금 제공을 요청하였다.
(8) 부속기구(Subsidiary Bodies) 설치문제(의제 13)
제4차 당사국총회에서 상시적인 부속기구 설치 또는 임시(Ad-Hoc) 기구 활용 등에 대하여 논의하며, 사무국은 관련 보고서를 제출토록 촉구하였다.
(9) 차기회의 개최(의제 18)
차기 제4차 당사국총회는 생물다양성협약 제9차 총회와 연계하여 2년 뒤 개최키로 결정하고, 장소는 별도 합의가 없을 경우 사무국 소재지인 캐나다 몬트리올에서 개최하기로 결정하였다. 개최 시기는 의정서 제1차 당사국총회에서 제3차 당사국총회까지만 매년 개최하기로 결정하였고, 생물다양성협약 의사규칙상 총회는 격년 개최한다는 규정을 감안한 것이다.
나. 제3차 의정서 ‘책임 및 복구’ 작업반 회의 논의 동향
제3차 의정서 책임 및 복구 작업반 회의는 생물다양성협약(CBD) 제27조(책임 및 복구)에 명시된 임무를 수행하기 위해 개최된 당사국 간의 국제회의로써, 2007년 2월 19일부터 23일까지 캐나다 몬트리올에서 개최되었다. 본 작업반 회의는 환경과 인체에 대한 적절한 안전조치와 함께 개발․이용되어야 한다는 의정서의 목적에 기여할 수 있는 책임 및 복구에 관한 ‘절차규칙’(Rules and Procedures)을 개발하는 적절한 방법을 모색하는 것을 주된 목적으로 한다.
제3차 작업반 회의에서는 ‘부속서 I’(책임 및 복구 국제규칙에 관한 결정 안)과 ‘부속서 II’(책임 및 복구 절차규칙에 관한 작업초안)를 채택하였는데, 그 핵심 쟁점은 책임배상의 기준(엄격책임과 과실책임), 책임배상의 집중(운영자, 수출업자, 개발자, 운송자, 통지자 등), 재정보증체계(강제적, 임의적), 원고 적격(민중소송의 허용 여부), 최종 합의문서 형식(가이드라인과 조약) 등이 포함되며, 2007년 10월에 개최될 제4차 회의부터 상기 쟁점들에 대한 협상이 본격화 될 것으로 예상된다. 특히 최종합의문 형식에 관한 문제는 선진국(EC, 캐나다, 일본)과 개도국(말레이시아, 에티오피아 등) 간에 첨예하게 의견대립을 보이고 있는 부분으로 향후 협상에서 가장 논란이 많을 것으로 예상된다.
이와 같은 논의 동향으로 LMO의 국가간 이동에 따른 잠재적․실제적 피해가능성을 고려해 볼 때, LMO 제품(농작물 및 식품 등)의 수입국인 우리나라는 국민건강 및 자연환경 보호 차원에서 책임 및 복구에 관한 절차규칙의 제정 논의에 적극 참여할 필요가 있다.
다. 세계무역기구(WTO) 논의 동향
LMO제품에 대한 규제는 소비자보호와 국민건강 및 자연생태계의 보호와 관련된 문제이자 무역 분쟁을 야기할 수 있는 국제통상법 상의 문제이기도 하다. 의정서는 LMO의 국가간 이동을 규제하는 최초의 국제협정으로 위생 및 식물위생조치의 적용에 관한 협정(SPS협정)과 달리 사전주의 원칙(Precautionary Principle)에 입각하여 국가간 이동을 규제할 수 있는 수입국의 권리를 인정하고 있다. 이에 반해 WTO가 관할하는 SPS협정은 원칙적으로 LMO제품에 대한 위생 및 검역 규제 조치가 충분한 과학적 증거와 위해성 평가에 입각할 것을 요구하고 있다. 특히 의정서에 입각한 사전주의적 규제조치가 SPS협정에 합치되는지의 여부가 논란이 되고 있는데, 미국과 유럽연합(EU) 간의 LMO통상 분쟁은 그 대표적인 예이다. 이러한 가운데, 2006년 11월 21일 WTO는 최종판결문을 통해 지난 6년 동안 끌어온 유럽연합(EU)과 미국 간의 LMO통상 분쟁에서 EU회원국의 유전자변형 식품에 대한 금지조치가 국제무역 규정 위반이라는 결정을 내렸다. 또한, 분쟁조정 패널은 EU집행위원회에서 이미 승인을 획득한 LMO제품에 대해서도 자국의 금지령을 이용하여 금지조치를 선언한 EU 6개국(오스트리아, 벨기에, 프랑스, 독일, 이탈리아, 룩셈부르크)에 대해서도 위법 판결을 내렸다.
하지만, 소송 제기국인 미국과 캐나다, 아르헨티나의 주장을 전폭적으로 지지하지는 않았으며, 유전자변형 식품의 안전성, EU의 LMO규제의 기본적 체제 등 현재 논란이 이루어지고 있는 문제에 대해서는 판결문에 다루지 않았다. 이번 WTO의 최종판결 결과는 LMO제품에 대한 수입규제가 유럽연합(EU)과 유사한 WTO 회원국들의 LMO관리정책에 상당한 영향을 미칠 것으로 전망된다. 특히 우리나라를 비롯한 여러 나라와 자유무역협정(FTA) 체결을 협상하고 있는 미국은 미국산 LMO제품의 유통판매에 영향을 미치는 각종 규제 장벽을 WTO판정에 부합되도록 철폐할 것을 요구할 근거로 이용할 수도 있다.
한편 최종보고서 상의 패널판정을 근거가 없는 것으로 반발하는 EU, LMO제품에 대한 유럽공동체 시민의 반감, 그리고 EU의 LMO관련 법․규제 자체가 WTO협정에 위반된다는 것이 아니라 규제 절차를 운용함에 있어 과학적 근거 없는 ‘부당한 지연’(Undue delay)이 있었다는 것이 위반 판결의 핵심 원인이므로 유럽연합은 법․규제 자체를 수정하거나 폐기하지 않을 전망이다.

가. 국내이행법 정비 동향
우리나라는 2000년 9월 의정서에 향후 비준 의사가 있음을 표명하였으며, 이에 따라 의정서 이행의 국가책임기관인 산업자원부는 의정서에 비준할 것에 대비하여 범국가적 차원에서 의정서 국내이행을 위한 법적 기반구축 작업을 진행하였다[표 5-1-3-1].
한편 산업자원부는 2005년 9월 30일 LMO법률 시행령 확정에 이어, 법률 및 시행령에서 위임된 사항과 그 시행에 관하여 필요한 사항을 정하는 시행규칙을 2006년 3월 10일에 산업자원부령 제327호로 관보에 게재되었다. 시행규칙의 주요 내용은 LMO의 수입승인․사전수입동의․생산승인 서식, 위해성평가기관 및 위해성심사대행기관의 지정 서식, 수출통보 및 연구시설의 설치․운영․허가 등에 관한 서식 등이다.
|
표 5-1-3-1 |
의정서 국내이행을 위한 법적 기반구축 과정
|
시 기 |
기반구축 내용 |
|
2000. 1 |
바이오안전성에 관한 카르타헤나의정서 채택 |
|
2000. 8 |
「유전자변형생물체의 국가간 이동 등에 관한 법률(LMO법률)」제정안 입법예고 |
|
2000. 9 |
우리나라의 카르타헤나의정서 서명 |
|
2000. 10 |
LMO법률(안)에 대한 공청회 개최 |
|
2000. 11 |
LMO법률(안)에 대한 토론회 개최 |
|
2001. 2 |
LMO법률(안) 국회 본회의 의결 |
|
2001. 3 |
LMO법률 제정 공포 |
|
2002. 2 |
LMO법률 시행령 및 시행규칙 제정시안 마련 |
|
2002. 6 |
LMO법률 시행령 및 시행규칙(안) 입법예고 |
|
2003. 9 |
카르타헤나의정서의 국제적 발효 |
|
2005. 9 |
LMO법률 시행령 확정(관보 게재) |
|
2005. 10 |
LMO법률 시행규칙 제정안 관계부처 협의 |
|
2005. 11 |
LMO법률 시행규칙 제정안 법제처 심의 |
|
2005. 12 |
제1차 LMO법․제도 설명회 개최 |
|
2006. 3 |
LMO법률 시행규칙 확정(관보 게재) |
|
2007. 4 |
LMO법률 통합고시안 관계부처 협의 |
|
2007. 6 |
제2차 LMO법․제도 설명회 개최 |
|
2007. 8 |
LMO법률 통합고시안 입법예고 |
|
2007. 10 |
한국의 바이오안전성의정서 비준 |
|
2008. 1 |
바이오안전성의정서 및 LMO법률 시행 |
출처 :「2007 바이오안전성백서」, 한국생명공학연구원, 2007
LMO법률 시행규칙을 제정한 이후 산업자원부는 법률 및 시행령에서 위임한 관계 중앙행정기관의 고시를 통합공고 하기 위한 작업을 추진해 왔다. 통합공고 추진의 근거는 시행령 제3조(국가책임기관의 업무) 제4호의 규정, 즉 ‘법 또는 시행령의 규정에 의한 고시․공고의 통합공고’에 의한 것이다. 이러한 통합공고 작업의 결실로 2007년 8월 산업자원부는 통합고시안을 확정해 입법예고 하였다. 이후 2007년 9월 국무회의 의결과 대통령의 재가를 거쳐 지난 10월 3일 바이오안전성의정서를 비준하였다. 이에 따라 의정서 비준 후 90일째인 2008년 1월 1일부터 바이오안전성의정서가 우리나라에 발효되고, 동시에 LMO법도 시행될 예정이다.
나. 관계부처별 동향
LMO법률의 시행을 위한 관계부처별 준비상황을 살펴보면(국가책임기관인 산업자원부는 제외함), 과학기술부는 LMO법률과 동법 시행령 및 시행규칙에 따라 안전관리 1, 2등급의 LMO연구시설의 설치・운영 신고, 안전관리 3, 4등급의 LMO연구시설 중 환경 위해성 시설의 설치・운영 허가, 시험・연구용 LMO의 수입 신고 및 개발・실험 승인, LMO안전관리 계획 수립 등의 업무를 맡고 있다. LMO법률의 시행에 대비하여 과학기술부는 LMO의 인체 및 환경에 대한 위해성 평가에 필요한 기술 개발을 지속적으로 지원하여 LMO위해성 평가에 대한 국가 차원의 기술적 기반을 구축하고자 노력해 왔다. 또한 생명공학 연구개발을 위축시키지 않으면서 시험・연구용 LMO에 대한 안전성을 확보하기 위한 정책과 구체적인 이행 방안의 마련을 추진하고 있다.
농림부는 LMO법률, 농산물품질관리법 및 사료관리법에 근거하여 농업용․임업용․축산업용 LMO의 수출입 등을 단계별로 소속기관별 역할 분담을 통해 농업용 LMO의 효율적인 안전관리체계 구축 방안을 마련 중에 있다. 이에 농림부 소관 농업용 LMO에 대한 안전성을 확보하기 위하여 연구개발 단계부터 국내유통 단계에 이르기까지 체계적으로 관리하기 위하여 농업용 LMO의 국내 안전관리체계를 수립하고, 소속기관별 업무 특성에 맞게 역할을 분담하여 세부추진계획을 수립하고 있다. 구체적으로는 농업용 LMO의 국내 안전관리체계를 크게 ‘사전수입승인 → 국경검사 → 국내 유통관리’ 등 3단계로 나누어, 각 단계별로 전담기관을 지정하고 처리요령을 규정하고 있다.
보건복지부는 생명윤리팀, 질병관리본부 생물안전평가팀, 식품의약품안전청 신소재식품팀, 생물의약품팀 등에서 LMO법률, 시행령 및 시행규칙에 따른 보건의료용 LMO의 수출입 등에 관한 업무, LMO인체위해성 심사 업무, 시험․연구용 등의 LMO수입승인 업무, LMO개발․실험 승인 업무, 인체위해성 3, 4 등급 연구시설 설치․운영의 허가 및 보건복지부 소관 국공립연구기관의 인체위해성 1, 2등급 연구시설 설치․운영 신고 접수 업무를 담당한다. 보건의료용 LMO의 경우 현재 대부분이 식품용 LMO이지만, 향후 의약품 생산을 위한 원료용 LMO, 화장품용 LMO 등이 개발될 가능성도 배제할 수 없다. 식품용 LMO의 경우 식품위생법에 의하여 식품의약품안전청에서 식품안전성 평가 및 표시기준에 대한 안전관리를 수행하고 있고, 향후 LMO법률 시행을 앞두고 필요한 사항들을 점검하고 있다. 아울러, 비식용 LMO의 인체위해성 심사, 유전자변형실험 및 연구시설 관련 업무를 수행하기 위한 고시 등도 정비하였다.
환경부는 의정서 및 LMO법률에 근거하여 환경정화용 LMO의 수출입 등에 관한 업무와 타 부처 소관 LMO의 자연생태계 위해성에 대한 협의 업무를 담당한다. 또한, 야생동식물보호법에 근거한 LMO의 자연생태계 위해성에 대한 지속적인 조사․평가업무도 담당한다. 이에 따라 LMO법률 및 시행령 규정에 근거하여 환경정화용 또는 환경방출용 LMO의 수출입 등에 필요한 평가심사에 관한 사항을 규정함으로써 LMO로 인한 자연환경 상의 위해를 사전에 예방하기 위해 고시안을 작성하였다. 그리고 LMO법률 제7조에 의하여 ‘환경정화용 LMO의 자연환경보전을 위한 안전관리계획(안) 및 세부시행계획(안)’도 관계부처와 공동으로 마련해 나가고 있다.
해양수산부는 해양용 또는 수산용 LMO의 수출입 등에 관한 전반적인 사항과 타 부처 소관 LMO가 해양생태계에 미치는 위해성에 관해 협의심사 하는 책임을 맡고 있다. 이러한 해양용 또는 수산용 LMO의 안전한 이용 및 관리와 LMO법률에 명시된 업무의 효율적인 이행을 위해 각 소속기관의 특성을 고려하여, 환경위해성 심사 및 승인 등에 관한 업무는 국립수산과학원에, 표시․취급관리 및 국경감시는 국립수산물품질검사원에서 담당하도록 할 계획이다. 더불어 해양생태계를 인위적인 훼손으로부터 보호하고 해양생물다양성을 보전하며 해양자산을 보호하기 위하여 2006년 10월 4일 ‘해양생태계의 보전 및 관리에 관한 법률’을 제정, 동 법률은 2007년 4월 5일부터 시행된다.

2001년「유전자변형생물체의 국가간 이동 등에 관한 법률(LMO법률)」이 제정된 이후, 산업자원부는 과학기술부, 농림부, 보건복지부, 환경부, 해양수산부 등 관계중앙행정기관과 협조하여 국내외 바이오안전성 확보를 위한 제도의 구축과 정비에 만전을 기해 왔다. 2005년 9월에 시행령을, 2006년 3월에는 시행규칙을 확정지었고, 관계중앙행정기관의 고시․공고를 통합 공고하는 작업을 거쳐 2007년 8월 1일 입법예고 하였다. 이후 2007년 10월 3일 UN에 바이오안전성의정서 비준서를 기탁하였고, 이에 따라 우리나라는 143번째로 바이오안전성의정서에 가입하게 된 국가가 되었다. 또한, 비준서 기탁 이후 90일에 해당하는 2008년 1월 1일부터 의정서가 발효된다. 이로써 바이오안전성의정서의 이행과 유전자변형생물체의 안전관리를 위해 제정된 LMO법률도 동시에 발효되게 되며, 기존 제도보다 위해성 평가․심사를 비롯해 LMO수출입 절차, 표시제, 취급관리 기준 등이 보다 엄격해질 것으로 예상된다.
이러한 일련의 과정에서 산업자원부를 비롯한 관계중앙행정기관에서는 LMO의 개발, 생산, 수출입 등에 따른 손익, 유전자변형생물체의 수출입 규제에 따른 파급효과, 세계무역기구(WTO)와 같은 기존의 무역규범과의 합치성 등 조화로운 규제를 향한 논의를 지속해 왔다.
향후 의정서 이행의 책임을 지고 있는 산업자원부는 향후 의정서 및 LMO법률의 시행을 위한 준비 상황을 최종 점검하고, 이해당사자 및 일반 국민에 대한 활발한 홍보 활동을 거쳐 2007년 10월 중에는 의정서의 국내 비준 절차를 완료하고, 2008년 1월부터 의정서 및 LMO법률을 시행할 계획에 있다.
참 고 자 료
한국생명공학연구원(2006),「2006 바이오안전성백서」
한국생명공학연구원(2007),「2007 바이오안전성백서」
한국바이오안전성정보센터, “바이오안전성동향(2006년 1분기~2007년 2분기)”
최승환(2006), “미국과 유럽연합간 LMO통상분쟁의 법적 고찰”,「BIOSAFETY」Vol.7 No.1, 통권 26호
최승환(2007), “LMO의 책임 및 복구에 관한 국제회의 동향”,「BIOSAFETY」 Vol.8 No.1, 통권 30호


현재 한국에서 진행되고 있는 생명공학연구 중 생명윤리와 연관성이 큰 분야는 유전체연구, 줄기세포연구, 이종이식연구로 볼 수 있다. 이들 분야들은 각기 독립된 별개의 연구 분야가 아니라 연구진행과정에서 서로 깊은 연관성을 가지고 생명공학이라는 큰 틀에서 발전해 나가고 있다. 예를 들어 유전체연구의 결과로 획득된 인간유전체에 대한 지식은 줄기세포의 연구에 이용되며, 이종이식연구에서 제기되고 있는 면역거부반응이나 수인성감염의 문제의 해결에도 이용될 수 있다. 생명윤리적 검토나 생명공학기술에 대한 정책적 결정을 함에 있어서도 이 분야들에 대한 개별적인 고찰은 서로 연결되어 있다. 유전체연구나 줄기세포연구, 이종이식연구 등 생명공학기술에 대한 윤리적, 법적 검토가 필요한 이유는 이와 같은 연구들이 인간으로부터 유래한 생물학적 물질을 이용하여 수행되며 그 결과가 결국 인간에게 적용된다는 점 때문이다. 따라서 개별적인 분야마다 고려되어야 할 특수한 검토사항들이 존재하기는 하지만 인간으로부터 생물학적 물질을 어떻게 획득할 것인가와 관련된 동의문제나 인간의 존엄성 및 인간의 동일성(identity)의 문제 등은 공통된 검토사항이라고 할 것이다.
최근의 생명공학기술에 대한 윤리적, 법적 고찰의 방향은 과거의 연구의 허용 여부로부터 개별적인 연구를 어떠한 절차 하에서 진행시킬 것인가에 대한 문제로 옮겨져 가고 있다.60) 생명공학기술에 대한 연구 및 임상적 적용이 인간에게 커다란 이익을 가져다 줄 수 있다는 사실을 부인할 수는 없다. 하지만 새로운 분야에 대한 연구는 언제나 그에 따른 예측하기 어려운 위험을 수반하기 때문에 상당한 주의를 기울여 수행하여야 한다. 이하에서는 생명공학기술연구 분야 중 특히 최근에 주목을 받고 있는 유전체연구, 줄기세포연구, 이종이식연구에 대한 윤리적, 법적 논의의 최근 동향에 대하여 간략하게 검토한다.

인간유전체연구와 관련된 윤리적, 법적, 사회적 함의에 대해서는 그동안 많은 논의가 이루어져 왔다.61) 인간유전체연구와 관련된 윤리적, 법적 논의의 핵심은 개인의 유전정보를 어떻게 보호할 것인가의 문제이다.
개인의 유전정보를 보호하기 위하여 유전검체를 획득할 때에 동의절차를 엄격히 준수하도록 함과 더불어 유전정보를 익명화하여 보관토록 하는 방안이 일반적으로 받아들여지고 있다.
이와 같은 개인 유전정보의 보호방안은 상당한 효과를 가짐과 더불어 새로운 학문 분야인 인간유전학에 대한 일반인의 우려를 상당한 정도로 불식시켜 주고 있는 것도 사실이다. 하지만 최근에는 유전검체의 사용에 있어서의 동의와 관련된 윤리적, 법적 절차에 대하여 새로운 논의가 이루어지고 있다.62)
현재 일반적으로 받아들여지고 있는 윤리적, 법적 기준에 의하면 유전검체를 획득할 때에 검체제공자로부터 동의를 받도록 하고 있는데 동의를 획득할 때에 제공되는 정보는 현재 수행하고자 하는 연구에 대한 구체적인 정보이어야 한다. 그런데 유전검체를 획득한 이후 상당기간이 지나서 그 유전검체를 다른 연구에 사용하고자 하는 경우 그때에도 새로운 동의를 받아야 하는가의 문제가 발생하게 된다.63)
피검자의 동의이론을 엄밀하게 적용하면 새로운 연구에 대한 새로운 동의를 받는 것이 당연히 요구된다고 할 수 있을 것이다.64) 하지만 이와 같은 방식은 시간과 비용 면에서 비효율적일 뿐만 아니라, 특히 유전검체의 최초 획득 이후 상당한 기간이 지나서 검체제공자에게 새로운 동의를 받는 것이 현실적으로 불가능하거나 엄청난 시간과 비용이 소요되는 경우에 연구를 진행시킬 수 없다는 문제점을 야기한다.
이와 같은 문제점을 해결하기 위하여 포괄적 동의라는 개념이 최근에 논의되고 있는데 이는 유전검체를 제공할 때에 개별연구에 대하여 동의하는 것뿐만 아니라 앞으로 수행될 가능성이 있는 연구들에 대한 동의도 같이 하는 것을 가능토록하자는 것이다. 이와 같은 포괄적 동의이론은 엄밀한 의미에서의 동의이론의 기준에는 맞지 않지만 현실적 필요성에 의하여 제기되고 있다.
이에 대하여 한편에서는 동의이론을 엄격하게 적용하여야만 개인의 자율성 보호에 충실할 수 있다는 반론이 있다. 또 다른 소수의 견해는 모든 연구에 있어서 포괄적 동의이론을 적용하여야 한다는 주장을 하기도 한다. 하지만 포괄적 동의를 인정하는 경우에도 모든 연구 상황에서 포괄적 동의를 인정하기 보다는 일단 다시 동의를 받기 위한 노력을 하고, 그러한 동의를 획득하는데 너무 많은 비용과 시간이 소요되거나 검체제공자의 사망이나 실종 등으로 다시 동의를 받는 것이 원천적으로 불가능한 경우에, 연구의 필요성이 인정되고 기관생명윤리심의위원회 등의 허가가 있는 경우에 한하여 검체를 사용하도록 하자는 견해가 최근에는 많은 지지를 얻고 있는 것으로 보인다.65)
유전체연구와 관련하여 최근에 또다시 주목을 받고 있는 윤리적, 법적 문제는 유전검체를 제공한 개인의 정보를 어느 정도까지 공개할 수 있는가의 문제이다. 인간 유전체연구를 수행하는 이유는 인간에게 발생하는 질병을 예방, 진단, 치료하기 위한 목적이다.
따라서 그 연구가 진행됨에 따라 유전검체를 제공한 개인의 병력 등 개인정보가 필요함은 당연하다고 할 것이다. 유전검체를 제공한 개인의 의료정보를 모두 익명화하여 접근할 수 없도록 한다면 인간유전자의 물리적 지도를 만든 것과 같은 경우에는 별다른 문제가 없을 수 있겠지만 질병과 유전자의 관련성, 나아가 특정 개인의 유전적 구성과 질병의 관련성을 연구하기에는 매우 어렵다고 할 것이다. 특히 특정 질병이 가계의 유전적 특성과 관련을 가진다고 추정되는 경우에는 그 가계의 구성원들의 유전정보와 의료정보가 필요할 것이다. 이는 결국 개인의 정보보호와 연구로부터 얻어질 수 있는 이익을 형량하여 해결할 문제라고 판단된다. 이 역시 기관생명윤리심의위원회 등의 허가를 얻어 제한된 사람만이 의료정보에 접근하여 연구를 수행함과 동시에 개인 정보를 최대한 보호할 수 있도록 하는 방향으로 해결책이 모색되고 있다.

이종이식연구 혹은 바이오장기연구는 동물의 장기나 조직, 세포 등을 인간에게 이식하여 질병을 치료하고자 하는 목적에서 이루어지는 연구이다.66) 국제적으로 공통되게 관심을 받고 있는 이종이식연구의 윤리적 검토사항은 “(1) 이종이식은 적절한 규율체계 하에서 이루어져야 한다, (2) 동물로부터 인간에게 감염되는 것으로 알려진 혹은 알려지지 않은 위험을 최소화 하여야 한다, (3) 환자에 대한 감시체계가 있어야 한다, (4) 이종이식에 대한 공공의 논의가 촉진되어야 한다.” 등이다.67)
이종이식연구의 윤리적, 법적 문제는 인간의 존엄성이나 인간의 동일성에 대한 문제를 제외하면 사실 연구의 안전성 혹은 임상적 적용의 안전성에 대한 문제로 귀결된다. 동물의 장기나 조직, 세포를 인간에 이식하는 경우에 동물에서 질병을 일으키거나 혹은 잠재하여 있는 감염원이 인간에게 질병을 일으키거나 혹은 인간에게 이식되어 면역거부반응을 일으키는 등의 위험이 발생할 수 있다.
이종이식을 할 경우 동물의 장기 등으로부터 유래하는 유전물질이 인간의 유전물질과 결합할 가능성을 배제할 수 없다.68) 특히 동물의 뇌조직 등을 인간에게 이식하는 경우69)에는 인간의 존엄성과 관련된 문제가 발생할 수 있다. 또한 유전자융합의 경우에는 인간의 동일성과 관련된 문제가 야기될 수 있기 때문에 어떠한 세포나 조직, 장기를 이식할 수 있는가의 문제는 일반적인 합의가 필요한 사항이라고 할 것이다.
수인성감염, 특히 돼지의 내인성 바이러스(PERV)의 감염 가능성은 이종이식을 받은 환자 개인의 건강에 대한 위험에서부터 인류 전체에 대한 위험에 이르기까지 다양한 범위에서 검토되고 있다. 또한 이를 예방하기 위하여 이종이식을 받은 환자와 그 가족을 평생에 걸쳐 감시하고 사망 이후에도 그 사망의 원인을 규명하기 위한 부검을 하도록 하는 등의 의견이 제시되고 있다. 현재 일반적인 견해는 수인성 감염의 위험으로 인하여 이종이식이 금지되는 것은 아니라고 하고 있다.70)
이종이식과 관련하여 검토되고 있는 두 번째 문제는 면역거부반응이다. 동물의 장기나 조직, 세포 등을 인간에게 이식하는 경우에 초급성 면역거부반응, 급성면역거부반응, 지연성 면역거부반응 등 여러 단계의 면역거부반응이 발생할 수 있는데, 이러한 면역거부반응은 이식된 장기나 조직, 세포의 괴사를 야기할 뿐만 아니라 경우에 따라서는 피이식자의 생명을 빼앗아가기도 한다. 면역거부반응을 회피할 수 있는 여러 방안들이 현재 검토되고 있으며 초급성 면역거부반응의 경우에는 어느 정도 극복이 가능한 것으로 예측이 되고 있다. 이종장기가 인간의 장기를 이식하는 전단계로 가교 역할을 한다는 점을 감안하더라도 면역거부반응에 대한 연구가 좀더 이루어질 필요가 있다.
수인성감염의 위험이나 면역거부반응의 위험을 고려할 때 장기, 조직, 세포 중 어느 분야에 연구를 좀더 집중하여야 할 것인가의 문제는 우리나라와 같은 자원이 제한되어 있는 경우에 고려하여야 할 사항이다. 현재 국제적 연구 수준과 여러 위험을 고려할 때 이루어지고 있는 일부 이종조직이식과 더불어 이종세포이식에 대한 임상적 적용을 먼저 고려하여 보는 것이 좋을 것으로 생각된다.
이종이식연구는 동물, 특히 돼지를 장기 등의 공급원으로 사용하는 것이기 때문에 동물복지에 대한 문제도 고려의 대상이 되고 있다. 현재 우리나라에서는 아직 동물복지에 대한 연구가 그리 많이 이루어져 있지 않으며, 이에 대한 연구가 어느 정도 진행된 외국의 경우에도 그 개념이나 구체적인 연구에서의 동물 처리방안에 대한 연구가 많이 진행되고 있지는 아니하다. 일반적으로 말하면 동물연구와 관련된 기관 내 심의위원회에서 동물의 복지를 고려할 수 있는 절차를 마련하여 이를 거쳐 연구를 진행하도록 하는 것이 타당할 것이다.

줄기세포연구는 최근 우리나라에서 생명윤리·연구윤리 측면에서 가장 많은 관심과 논란을 불러일으킨 생명공학기술연구 분야로 <생명윤리 및 안전에 관한 법률>의 제정 및 개정의 주된 원인이 되기도 했다. 2005년 1월 줄기세포연구 등에 대한 제도적 기반의 필요성에 의해 제정·시행된 <생명윤리 및 안전에 관한 법률>은 시행이후 지속적으로 야기된 개정수요 등을 반영하여 개정이 추진되고 있다(참고1). 국제적으로는 호주, 미국 등 그동안 인간배아줄기세포연구를 금지하거나 공적 자금의 투입을 제한하던 여러 국가들이 이제는 적극적으로 인간배아줄기세포연구에 뛰어들고 있으며 연구의 허용범위도 점차 확대하고 있다.71) 우리나라도 보다 현실화된 법적 제도적 기반 및 안정적인 지원을 통해 지속적인 연구발전을 이루고자 노력하고 있다.
줄기세포연구와 관련된 윤리적, 법적 문제에 대한 최근의 논의는 크게 세 가지 정도를 들 수 있다. 첫 번째는 인간배아줄기세포연구를 허용할 것인가에 대한 논의이다. 인간배아줄기세포연구를 수행할 때에 배아가 파괴되는 과정이 수반되기 때문에 인간배아줄기세포연구가 인간의 존엄성을 해하고 인간생명을 파괴하는 연구라는 주장이 특히 종교계를 중심으로 주장되고 있다. 따라서 인간배아줄기세포연구에 대해서는 아직도 찬반논의가 그치지 않고 있다. 최근에는 배아를 파괴하지 아니하는 방식으로 인간배아줄기세포와 그 성질이 유사한 줄기세포를 생성하고자 하는 여러 연구가 진행되고 있다. 하지만 아직까지는 그 결과가 미미하며 이와 같은 연구를 통해서도 여전히 인간배아줄기세포연구로 얻을 수 있는 결과들을 모두 얻을 수 없다는 주장이 상당한 설득력을 얻고 있다.
우리나라는 생명윤리법상으로 불임시술 후 남은 잔여배아를 이용한 인간배아줄기세포연구를 엄격한 심의를 통해 허용하고 있으며, 환자의 체세포핵을 난자에 이식하여 생성된 체세포복제배아를 이용한 체세포복제배아줄기세포연구에 대해서는 생명윤리법 시행령 개정을 통해 동결보존 후 폐기예정인 난자 등에 대해서 제한적으로 허용한 것으로 최근(2007년 10월) 관련 규정을 마련하였다.
줄기세포연구와 관련된 두 번째 윤리적, 법적 논의 사항은 동물난자를 이용한 줄기세포연구의 허용 문제이다. 앞서 언급한 체세포복제배아를 이용한 줄기세포연구의 경우, 인간의 난자가 연구에 이용되는 생명윤리적 심각성에 비해 기술적인 측면에서 매우 낮은 성공률을 보이는 점 등을 고려하여 인간 난자 대신 동물의 난자에 인간 체세포 핵을 이식하여 연구를 하는 방법이 제시되고 있다.72) 현행 <생명윤리 및 안전에 관한 법률>은 제12조에서 이종간 착상 등의 금지에 대한 규정을 하면서 동물의 난자에 인간의 체세포를 이식시키는 행위에 대해서는 금지하고 있지 않으나, 최근 진행되고 있는 개정에서는 이종 간의 핵이식을 금지하고 방향으로 진행되고 있다.73) chimera라고 정의되는 범주 내에는 다양한 형태의 것들이 존재하며 동물 난자에 인간 체세포핵을 이식하는 행위가 진정으로 유전자융합에 있어 안전한지 불분명하며 매우 엄격한 관리 하에 허용해야 한다는 우려의 목소리도 높다.74) 현재 이 문제에 대해서는 분명한 결론이 나고 있는 상태는 아니지만 국제적으로 엄격한 절차와 제한적 범위 내에서 연구를 허용하고자 하는 움직임이 있는 것으로 판단된다.
줄기세포연구와 관련된 세 번째 논의사항은 국제적 공동연구에 대한 규정 적용에 관한 문제이다. 줄기세포를 연구하는 데에 필요한 기술들이 아직 세계적으로 골고루 분포되어 있지 아니하고 그에 대한 법률이나 정책들도 국가마다 상이하기 때문에 줄기세포연구는 국제간 협력을 통한 연구가 필수적인 분야이다. 국제간 협력을 통한 연구의 형태는 인적 교류로부터, 물질의 교류, 그리고 여러 연구기관이 공동으로 연구를 수행하는 등 다양한 형태가 있을 수 있다. 이 경우 가장 문제되는 것을 특정 연구에 대한 허용여부 및 승인 절차 등이 국가마다 다르기 때문에 국제 공동연구 수행 시 이러한 제도적 차이가 연구 진행에 큰 장애물로 작용할 수 있다. 예를 들어 앞에서 언급한 동물난자를 이용한 체세포복제배아줄기세포연구를 금지하는 국가의 연구자가 이를 허용하는 국가에서 수행한 연구 활동에 대한 법률적 해석 및 적용 등이 논란이 될 수 있기 때문이다. 이러한 차원에서 국제줄기세포학회(ISSCR)는 줄기세포연구 중 법적 제도적 연관성이 가장 큰 인간배아줄기세포연구에 대한 지침을 마련하여 올해 2007년 2월에 Science를 통해 발표하고 전 세계 각국이 준수해 줄 것을 권고하는 있으며 줄기세포연구의 발달단계를 고려하여 정기적으로 update해 나갈 계획을 밝혔다.
이러한 생명윤리적 논란과는 별개로 국내 줄기세포연구는 2005년말 Science 저널에 게재되었던 황우석 전 서울대 교수팀의 두 논문(2004, 2005)이 조작으로 밝혀지면서 연구윤리적 측면에서 국내 과학계에 큰 파장을 불러 일으켰다.(참고3) 이를 계기로 줄기세포연구 분야뿐 아니라 우리나라 연구개발 분야 전체에 적용될 수 있는 연구부정행위 방지를 위한「연구윤리·진실성 확보를 위한 지침」(참고4)이 마련되었다. 이 지침은 기본적으로 국가연구개발 사업을 수행하는 연구기관이 연구윤리 및 진실성 확보를 위한 역할과 책임에 대한 기본원칙과 방향을 제시하는 것을 목적으로 하며 연구부정행위에 대한 제보 창구, 연구진실성검증시스템 구축, 내부제보자 보호장치 마련 등에 대한 기본방향과 공통기준을 제시하고 있다.

생명공학기술연구는 궁극적으로는 인간을 그 대상으로 한다는 점에서 윤리적, 법적, 사회적 함의에 대한 연구가 언제나 수반되어야 한다. 하지만 윤리적, 법적, 사회적 논의는 그 판단의 대상이 되는 과학적 발견에 근거하여 이루어져야 한다. 추상적 원리, 특정 신념, 믿음에 근거한 윤리적, 법적 주장은 연구자는 물론 일반인을 설득하기에도 부족함이 있다고 할 것이다. 과학적 지식은 지속적으로 변화하는 것이고 고정된 것이 아니다. 윤리적, 법적 기준도 언제나 변화하는 과학적 지식에 관심을 가져야 하며 실제로 적용 가능한 규율방안이 마련되어야만 할 것이다.
생명공학기술연구의 윤리적, 법적, 사회적 함의연구 특히 제도적 장치를 마련함에 있어서는 국제적 기준과 국제적 연구 상황을 고려하여야 할 것이다. 과학기술연구는 특정 국가에서만 이루어지는 것이 아니라 전 세계적으로 진행되는 것이기 때문에 특정 국가에서 이를 금지하거나 혹은 특수한 절차를 마련한다고 하여도 다른 국가에서는 이를 수행할 가능성이 언제나 열려 있다. 국제적 기준을 제시하고 이를 준수함에 있어서도 상당한 노력을 기울여야 할 것으로 생각된다.
[ 참고 1 ] 생명윤리 및 안전에 관한 법률 개정안 요약 |
□ 이종 간의 체세포 핵 이식행위와 인간의 배아를 융합하는 행위 금지
- 인간의 난자에 동물의 체세포 핵을 이식하거나 동물의 난자에 인간의 체세포 핵을 이식하는 행위 금지.
- 인간의 배아와 동물의 배아를 융합하거나 인간의 배아와 인간의 배아를 융합하는 행위 등을 할 수 없도록 함.
□ 줄기세포주의 이용에 대한 규제 완화
※ 현행 생명윤리법에 따라 배아 또는 체세포복제배아를 직접 연구대상으로 하지 않고, 수립된 배아줄기세포주를 제공 받아 수행하는 줄기세포 연구도 배아 연구와 동일한 수준의 규제를 받아옴.
- 윤리적 문제가 제기되고 있는 잔여배아의 파괴, 복제배아의 생성 등을 통해 줄기세포주를 수립하는 연구와 이미 상기 과정을 통해 수립된 줄기세포주를 이용하는 연구는 구분하여 규제를 완화.
·보건복지부 장관의 승인 없이 기관위원회의 내부 심의로 연구수행토록 함.
·다만, 보건복지부 장관은 연구자들이 이용할 수 있는 줄기세포주에 대해 공적인 보장을 위해 줄기세포주 등록시스템을 운영키로 함.
□ 유전자은행의 검체 이용의 적정화
- 유전자은행은 수집한 모든 검체 등을 익명화하여 보관ㆍ관리
- 유전자은행에 개인정보관리 및 보안을 담당하는 책임자를 두도록 함
□ 연구계획 승인취소의 법적근거 마련
- 등록취소 또는 동 법 위반으로 금고이상의 형 선고를 받은 경우에 연구계획 승인을 취소할 수 있으며, 해당 연구자가 동일 범주의 연구를 신청한 경우 3년간 보건복지부 장관이 연구계획의 승인을 아니 할 수 있는 법적근거를 마련.
[ 참고 2 ] 체세포 핵이식 행위를 할 수 있는 연구의 종류대상범위 규정 마련 - 생명윤리법 시행령 개정 - |
□ 체세포복제배아연구에 대한 재검토 실시
○ 국가생명윤리심의위원회 주관으로 재검토(2007년 2월~11월)
- 찬반양론에 대한 서면의결 실시(2006년 12월)
(1안) 제한적 허용 안 : 폐기예정인 난자에 한하여 연구 이용 허용안
(2안) 한시적 금지 안 : 기술 발전단계에 따라
□ 체세포핵이식행위를 할 수 있는 연구의 종류·대상·범위 규정 마련
○ 연구목적
- 희귀·난치병 치료를 목적으로 하는 연구를 위하여 일정한 연구에 한하여 체세포핵이식연구를 할 수 있도록 함.
○ 체세포복제배아연구에 이용할 수 있는 난자
- 배아생성을 위하여 동결 보존하는 난자로서 임신이 성공되는 사유로 폐기할 예정인 난자
- 미성숙인 난자나 비정상인 난자로서 배아를 생성할 계획이 없어 폐기할 예정인 난자
- 체외수정시술에 사용된 난자로서 수정이 되지 아니하거나 수정을 포기하여 폐기될 예정인 난자
- 불임치료를 목적으로 채취된 난자로서 적절한 수증자가 없어 폐기될 예정인 난자
- 적출한 난소에서 채취한 난자
[ 참고 3 ] 논문조작 사건 관련 주요 경위 |
□ 황우석 교수의 줄기세포관련 연구 성과 발표현황
○ 2004. 2 : 체세포 핵이식을 이용한 인간배아줄기세포 확립
○ 2005. 5 : 다수의 환자유래 맞춤형 인간배아줄기세포 확립
□ 연구성과 진위 관련
○ 2006. 1. 10 : 서울대 조사위원회 최종결과 발표
※ 맞춤형 줄기세포주 없음, 2004년 논문의 줄기세포주는 단성생식에 의한 것
※ “스너피”는 체세포복제 개로 판명
○ 2006. 1. 11 : 정부후속대책 발표(국정홍보처장)
※ 최고과학자지위 취소, 연구비지원체계 감사 요청 등의 후속조치 및 “줄기세포연구 종합추진계획” 수립과 “연구윤리 및 연구진실성 검증장치” 마련
○ 2006. 4. 1 : 서울대학교 징계처분 확정
※ 황우석(파면), 강성근·문신용(정직 3개월), 이병천·안규리(정직 2개월), 백선하·이창규(감봉 1개월)
○ 2006. 5. 12 : 검찰수사결과 발표
※ 6명 불구속 기소 : 황우석(사기, 횡령, 생명윤리법 위반), 김선종(업무방해, 증거인멸교사), 이병천·강성근·윤현수(사기), 장상식(생명윤리법 위반)
□ 생명윤리 관련
○ 2005. 11~2006. 11 : 국가생명윤리심의위원회 정식 회의 3회 및 민간위원 간담회 5회 개최
- 체세포복제배아연구 허용에 대한 재검토 결정(2006. 2. 2)
- 황우석 교수 윤리문제에 대한 보고서 발표(2006. 11. 23)
[ 참고 4 ] 연구윤리가이드라인 주요내용 |
□ 국가연구개발 사업을 수행함에 있어 연구윤리 확보 및 진실성 검증을 위한 연구수행기관과 연구지원기관의 책임 및 역할과 연구진실성 검증 표준절차 등을 규정
○ 각 기관들이 기관 실정에 적합한 자체검증시스템을 효율적으로 구축·운영할 수 있도록 기본방향과 공통기준을 제시
* 연구기관 - 국가연구개발 사업을 수행하는 대학 및 연구소
* 연구지원 기관 - 국가연구개발 사업 관련 부처 및 연구관리 전문기관
| 지침안의 주요내용 |
|
|
| |
□ 동 지침은 총 3가지 부분으로 구성
① 총칙 - 가이드라인의 목적, 적용대상, 적용범위 - 부정행위의 유형* 및 정의 * 위조, 변조, 표절, 부당한 논문저자 표시 등
② 연구기관과 연구지원기관의 책임과 역할 - 합리적이고 자율적인 연구 환경 조성 및 연구윤리 교육 강화 - 연구기관의 연구진실성 자체검증체계 마련 및 연구지원기관의 소관 연구개발 사업에서의 진실성 확보를 위한 권한과 역할 - 연구진실성 검증과정에서의 제보자와 피조사자의 권리보호
③ 연구진실성 검증 원칙과 절차 - 연구 부정행위 발생 시 검증 책임주체, 검증절차 및 검증기구 구성 원칙 - 조사결과의 보고 및 후속조치 등에 대한 기본원칙과 공통기준 등
| ||


생명공학 분야는 살아있는 생물체를 발명의 대상으로 하고 있다는 특성 때문에 다른 기술 분야와는 별도의 독특한 지식재산권 제도를 운영하고 있다. 최근 생명공학 분야의 연구 방법이 지속적으로 개발되어 새로운 유형의 발명이 증대되고 이에 따라 특허 출원의 내용과 수준도 날로 복잡․다양해지고 있는 추세이다. 특히 인간 유전체 연구(Human Genome Project)의 완성 이후 국가 간에 유전자를 선점하기 위한 경쟁이 치열하게 전개되는 양상을 보이고 있다.
그동안 미생물에 특허를 허여(許與)할 수 있는가 하는 문제에서부터 출발해 최근 생물체 자체나 그로부터 분리된 물질에까지 특허 대상을 허여할 것인지에 이르기까지 특허 대상을 놓고 각 국가별로 상당한 논란이 계속되어 왔다. 생명공학의 급속한 발전이 가져온 배아복제나 배아줄기세포 관련 발명 등은 인류의 의료기술에 획기적인 기여를 할 것으로 예상된다. 반면 일각에서는 인간 복제의 가능성 등에 따른 윤리적인 문제도 제기하고 있다.
현재까지도 이 분야는 특허성 판단을 위한 심사 실무나 청구범위의 해석, 침해 여부의 판단에 이르기까지 모든 단계에서 다른 기술과 차별화된 특수성을 보이고 있으며 이에 부합할 심사의 질 제고와 꾸준한 제도변화가 요구되고 있다.
생명공학은 기술의 특성상 장기에 걸친 막대한 연구개발비를 투여하여 특허가 산출되나, 도용은 상대적으로 쉬운 분야이므로 지식재산권을 통한 보호의 강도를 높여 주어야 하는 분야라는 점에서는 국제적인 공감대가 형성되어 있다.
그렇기 때문에, 원천기술에 대한 확보와 이를 위한 장기적 투자가 경쟁력의 핵심으로 자리 잡을 전망이다. 우리나라는 아직 많은 분야에서 기초 기술 단계로 정부의 장기적 로드맵에 따른 집중적인 R&D 투자가 필요하며 개발된 연구 성과에 대하여는 강력한 특허 보호정책을 통하여 국내 산업 발전을 유도할 필요성이 대두되고 있다.

가. 생명공학 분야 특허출원
생명공학 분야 특허는 출원이 본격적으로 증가된 1998년 이래 2006년까지 꾸준한 증가 추세를 보이고 있다. 2006년도 특허출원 수는 3,664건이었다. 그 중 71%를 내국인이 출원하고 있는 것으로 나타났다. 최근 들어서는 특허출원 건수 자체의 증가세는 둔화되고 있으나 이는 지식재산권에 대한 인식이 성숙됨에 따라 특허 출원 전략이 단순한 양적인 증가보다 질적인 증가를 추구하는 쪽으로 수정된 것에 따른 결과로 판단된다.
|
표 5-3-2-1 |
연도별 생명공학 분야 특허출원 현황
(단위 : 건)
|
구 분 |
2000년 |
2001년 |
2002년 |
2003년 |
2004년 |
2005년 |
2006년 |
2007년 7월 |
|
내국인 |
1,540 |
1,908 |
2,025 |
2,045 |
2,026 |
2,295 |
2,606 |
1,607 |
|
외국인 |
1,073 |
1,153 |
1,000 |
1,047 |
1,215 |
1,272 |
1,058 |
652 |
|
계 |
2,613 |
3,061 |
3,025 |
3,092 |
3,241 |
3,567 |
3,664 |
2,259 |
* 나. 생명공학 분야 특허등록
2000~2001년도에 잠시 감소 추세를 보이기도 하였던 생명공학 분야에서 등록특허건수는 출원양의 증가와 지속적인 심사관 증원에 따른 심사양의 증가로 2006년에는 2,700여건에 이르는 등 최근 들어 급속한 증가세를 보이고 있다. 기술 분류별로는 국제특허분류기호(IPC)75) A61K와 C12N에 해당하는 생물의약 관련 발명, 미생물․효소․유전공학에 대한 발명이 많은 비중을 차지하고 있고, 그 다음으로 단백질 관련 발명과 미생물을 이용한 수처리 등이 뒤를 잇고 있다. 특히 외국인의 출원에 의한 등록 건수는 별다른 증가가 이루어지지 않은데 반해, 국내 출원인에 의한 등록 건수가 비약적으로 증가하고 있는 점은 주목할 만한 점이다. 국내 출원은 대부분 원천기술이라기보다는 대부분 개량 응용기술에 집중되어 있다. 따라서 향후 핵심 원천 기술의 특허화가 이루어질 수 있도록 바이오산업 전체의 기술개발 투자를 확대하야여 할 것이다.
|
표 5-3-2-2 |
연도별 생명공학 분야 특허등록 현황
(단위 : 건수)
|
연 도 분 류 |
2000년 |
2001년 |
2002년 |
2003년 |
2004년 |
2005년 |
2006년 |
2007년7월 |
|
|
AO1H (식물 신품종) |
내 |
8 |
17 |
34 |
17 |
27 |
70 |
11 |
33 |
|
외 |
3 |
1 |
3 |
1 |
7 |
4 |
1 |
1 |
|
|
계 |
11 |
18 |
37 |
18 |
34 |
74 |
12 |
34 |
|
|
A01K 67/00~67/04 (신규 동물) |
내 |
5 |
4 |
3 |
8 |
10 |
14 |
25 |
7 |
|
외 |
1 |
2 |
2 |
- |
- |
3 |
12 |
3 |
|
|
계 |
6 |
6 |
5 |
8 |
10 |
17 |
37 |
10 |
|
|
A01N 63/00~65/00 (생물 농약) |
내 |
6 |
13 |
9 |
14 |
19 |
50 |
28 |
23 |
|
외 |
3 |
7 |
5 |
2 |
3 |
6 |
5 |
1 |
|
|
계 |
9 |
20 |
14 |
16 |
22 |
56 |
33 |
24 |
|
|
A61K 7/26, 7/28, 35/12~35/84, 38/00~39/44, 48/00, 51/00~51/10(생물 의약) |
내 |
58 |
97 |
135 |
153 |
128 |
336 |
597 |
225 |
|
외 |
75 |
86 |
71 |
85 |
67 |
90 |
189 |
110 |
|
|
계 |
133 |
183 |
206 |
238 |
195 |
426 |
786 |
335 |
|
|
C02F 3/00~3/34, 11/02~11/04 (미생물 이용 폐수처리) |
내 |
70 |
82 |
117 |
121 |
259 |
191 |
235 |
142 |
|
외 |
6 |
8 |
9 |
7 |
12 |
10 |
18 |
6 |
|
|
계 |
76 |
90 |
126 |
128 |
271 |
201 |
253 |
148 |
|
|
C07H 19/00~21/04 (당류) |
내 |
1 |
3 |
13 |
5 |
5 |
9 |
7 |
3 |
|
외 |
13 |
8 |
23 |
16 |
15 |
22 |
24 |
13 |
|
|
계 |
14 |
11 |
36 |
21 |
20 |
31 |
31 |
16 |
|
|
C07K (단백질) |
내 |
37 |
27 |
45 |
38 |
78 |
133 |
108 |
87 |
|
외 |
56 |
47 |
73 |
71 |
76 |
108 |
167 |
68 |
|
|
계 |
93 |
74 |
118 |
109 |
154 |
241 |
275 |
155 |
|
|
연 도 분 류 |
2000년 |
2001년 |
2002년 |
2003년 |
2004년 |
2005년 |
2006년 |
2007년7월 |
|
|
C12C~M (발효 및 그 장치) |
내 |
22 |
16 |
44 |
50 |
87 |
87 |
91 |
86 |
|
외 |
2 |
4 |
7 |
6 |
6 |
5 |
11 |
8 |
|
|
계 |
24 |
20 |
51 |
56 |
93 |
92 |
102 |
94 |
|
|
C12N (미생물, 효소, 유전공학) |
내 |
173 |
150 |
242 |
235 |
401 |
413 |
458 |
294 |
|
외 |
99 |
54 |
107 |
94 |
104 |
190 |
206 |
147 |
|
|
계 |
272 |
204 |
349 |
329 |
505 |
603 |
664 |
441 |
|
|
C12P (발효 생성물) |
내 |
35 |
33 |
36 |
40 |
71 |
50 |
58 |
28 |
|
외 |
34 |
17 |
22 |
22 |
34 |
37 |
49 |
26 |
|
|
계 |
69 |
50 |
58 |
62 |
105 |
87 |
107 |
54 |
|
|
C12Q,S (시험, 측정, 분리정제) |
내 |
16 |
27 |
24 |
33 |
136 |
101 |
201 |
153 |
|
외 |
14 |
22 |
16 |
15 |
38 |
37 |
42 |
36 |
|
|
계 |
30 |
49 |
40 |
48 |
174 |
138 |
243 |
189 |
|
|
G01N 33/50~33/98 (진단 시약) |
내 |
5 |
15 |
3 |
16 |
22 |
36 |
92 |
51 |
|
외 |
20 |
15 |
12 |
12 |
11 |
20 |
54 |
25 |
|
|
계 |
25 |
30 |
15 |
28 |
33 |
56 |
146 |
76 |
|
|
계 |
내 |
436 |
484 |
705 |
730 |
1,243 |
1,490 |
1,911 |
1,232 |
|
외 |
326 |
271 |
350 |
331 |
373 |
532 |
778 |
444 |
|
|
계 |
762 |
755 |
1,055 |
1,061 |
1,616 |
2,022 |
2,689 |
1,676 |
|
주) 1. 국제특허분류(IPC 8판 기준)에 의함
2. 내:내국인 출원, 외:외국인 출원
출처 : 지식재산통계연보, 특허청, 2007

특허청에서는 급속히 발전하고 있는 생명공학 분야의 새로운 기술을 보호하는 한편 국제화 추세에 발맞추어 생명윤리 문제의 판단기준을 제시하고자 생명공학 특허 심사기준을 제정하여 운용하고 있다. 또한 기술개발 추이에 발맞추어 우수한 특허의 권리를 효율적으로 보호할 수 있도록 심사기준 개정, 심사 전문 인력 확보, 유전자서열 DB 구축 등 지식재산권 제도와 인프라를 확충하고 심사의 전문화를 꾀하고 있다.
가. 생명공학 특허 심사기준의 제정 및 개정
(1) 생명공학 특허 심사기준의 제정(1998년 3월)
생명공학 분야 특허란 직접 또는 간접적으로 자기복제를 할 수 있는 생물학적인 물질(biological material) 즉, 자기 복제력을 갖는「생물」,「유전정보」및 그「복제」에 관련된 발명을 포함하는 특허를 의미한다. 이러한 생명공학 분야 출원기술의 심사에 대한 표준운영절차를 확립하고자 1998년 산재된 생명공학 관련 심사기준을 통합하여 생명공학 분야 산업부문별 심사기준을 제정하였다.「유전공학 관련발명」,「미생물관련 발명」,「식물관련 발명」,「동물관련 발명」으로 크게 네 개의 분야로 나눠서 심사기준을 신설하고 윤리성 기준과 불특허(exclusion from patentability inventions) 요건을 명시하였다.
(2) 생명공학 특허 심사기준 1차 개정(2000년 12월)
인간 유전체 연구(HGP)의 1차 결과가 발표됨에 따라 그의 산물인 DNA 단편, SNP(개체간 단일염기변이) 등 새로운 형태의 발명이 출현되고 있어 이를 보호할 기준 마련을 위해 개정하였다. 주요 내용으로는 HGP의 산물인 EST 등 DNA 단편, SNP 등에 대한 심사기준을 마련하였고, 유전자, 단백질, 모노클로날 항체 등에 대한 포괄적인 청구범위 기재를 인정하고, 안티센스에 대한 기재요건을 추가하는 등 기존의 심사 실무를 반영하였고 대용량 유전정보 출원에 대비한 단일성 판단기준에 대해서 정비하였다.
(3) 생명공학 특허 심사기준 2차 개정(2003년 12월)
생명공학 분야의 새로운 기술을 보호하는 한편, 생명윤리문제의 판단기준을 제시하고 유전공학관련 발명의 실절적인 보호에 중점을 두었다. 이에 따라 유전자 및 단백질 변이체에 대한 청구범위 기재요건을 강화하고 서열로 특정할 수 없는 경우의 단백질의 특정 요건을 구체화하였으며, 모노클로날 항체(monoclonal antibody)의 실시가능성요건 및 청구범위 기재요건을 보호하는 등의 보완이 이루어졌다.
(4) 생명공학 특허 심사기준 3차 개정(2005년 5월)
당초 2차 개정안에서는 생명공학기술의 생명윤리 및 안전을 확보하기 위해 제정될 예정이었던「생명윤리 및 안전에 관한 법률」에 근거하여 생명공학 분야 발명의 생명윤리 문제를 판단하는 내용이 포함되어 있었으나, 법률의 제정 및 시행이 늦어짐에 따라 이 내용이 삭제된 채로 개정되었었다. 3차 개정에서는「생명윤리 및 안전에 관한 법률」의 시행에 연계하여 정부의 공식 승인을 받은 연구 성과물에 대한 발명은 특허등록 대상으로 하는 한편, 동법에서 금지하는 행위 또는 연구 성과물에 대한 발명은 특허법 제32조의 규정에 의거 특허를 받을 수 없는 발명으로 하여 생명공학 분야 발명의 생명윤리 및 안전에 대한 판단 기준을 보완하였다.
|
표 5-3-3-1 |
생명공학 특허 심사기준에 따른 특허 보호대상
|
구분 |
대 상 |
특허여부 |
비 고 |
|
물질 |
유전자 (DNA서열) |
특허가능 |
유용성이 밝혀진 경우만 가능, 단순 유전체 서열만으로는 불가 |
|
단백질 (아미노산서열) |
특허가능 |
||
|
단세포 생명체 (virus, bacteria) |
특허가능 |
관련 미생물 기탁 의무 |
|
|
동물 |
특허가능 (단, 공서양속에 반하지 않는 것) |
동물발명에 대한 심사기준 신설 |
|
|
식물 |
특허가능 |
유성번식 식물의 경우 종자기탁을 통해 재현성 요건 충족 |
|
|
인간의 신체 부분 |
특허불가 |
인체의 존엄성을 해치는 발명은 특허대상에서 배제 |
|
|
방법 |
수술, 치료방법 |
사람불가, 동물가능 |
사람의 치료, 진단 방법은 의료행위에 해당하므로 산업상 이용 가능성이 없는 것으로 봄 (특허법 제29조제1항) |
|
유전자 치료법 |
사람불가, 동물가능 |
||
|
진단방법 |
사람불가, 동물가능 |
출처 : 자체자료
(5) 생명공학 특허 심사기준 4차 개정(2006년 9월)
당초 우리의 특허법에서는 식물관련 발명의 경우는 특허법 제31조에 의해서 무성적으로 반복 생식할 수 있는 식물에 한하여 특허를 허여하여 왔으나, 국내외 특허제도 및 품종보호제도가 발전함에 따라 유성번식 식물도 특허 대상에 포함시키기 위해 특허법 제31조를 삭제(2006. 10. 1 시행)하게 되었다. 이에 따라 4차 개정에서는 식물관련 특허의 대상을 무성번식방법을 갖춘 식물에서 신규식물 자체 또는 일부분 및 그 육종방법으로 확대하였고, 유성번식 식물의 재현성 요건을 충족시키기 위해 종자기탁제도를 도입하였다. 개정된 생명공학 분야 특허심사기준은 특허청 홈페이지(www.kipo.go.kr)의 화학생명공학심사본부 메뉴 내에 심사자료실에서 다운받을 수 있다.
나. 심사 전문인력 확보 및 역량 강화
특허청은 생명공학 분야의 특허출원 증가에 효율적으로 대처하고 심사 전문성을 제고하기 위하여 해당 분야 전문 심사인력을 지속적으로 채용하고 있으며, 이를 통해 2007년 7월말 현재 해당 분야 박사학위소지자 33명을 포함하여 전공 심사관 39명의 생명공학기술 전문 심사인력을 확보하고 있다.
또한 특허청은 기술 간의 융합화 현상이 진전되고 있는 생명공학 분야의 최근 논의를 점검하고, 관련 기술 및 특허 동향을 분석하기 위하여 관련 분야의 청내․외 인사들로 구성된「바이오특허 연구회」를 운영하고 있으며, 본 연구회를 통해 바이오 또는 지재권 분야 전문가 세미나 및 토론회를 개최함으로써 최신 기술과 정보를 습득․교류하는 기회를 마련하고, 연간 활동 보고서를 발간․배포하는 등 심사의 질적 향상과 생명공학 기술의 전파에 적극 노력하고 있다. 게다가 특허청은 생명공학연구원과 업무협정을 맺고 생명공학연구원에서 매년 200개 이상의 소주제로 개최되는 KRIBB Conference에 연인원 190명의 심사관이 참여하여 신기술 습득의 기회로 활용하고 있다.
다. 유전자 서열목록 제출제도 시행 및 관련 DB 구축
특허청은 핵산 또는 아미노산 관련 발명의 신속 정확한 검색 및 서열 DB 구축을 위하여 1999년 이후에 특허 출원된 발명에 대해서는 핵산염기 및 아미노산 서열 데이터의 전자파일 제출을 의무화하였으며, 2004년에는 한국생명공학연구원과 업무협정을 체결하고, 특허 출원된 유전자 서열 데이터를 한국생명공학연구원내 국가유전체정보센터에 제공하고, 유전자서열 검색 시스템을 통합․운영함으로써 검색기능과 속도가 비약적으로 향상된 검색 시스템을 확보하여 운영 중이다. 또한 2007년 9월에는 한․일 특허청간 유전자 서열 DB교환을 통해 검색 DB를 확대 운영하게 되었다.
|
표 5-3-3-2 |
서열목록을 포함한 특허출원 건수
(단위 : 건)
|
구 분 |
1999년 |
2000년 |
2001년 |
2002년 |
2003년 |
2004년 |
2005년 |
2006년 |
2007년 7월 |
|
내국인 |
151 |
248 |
402 |
496 |
584 |
619 |
688 |
903 |
549 |
|
외국인 |
250 |
383 |
528 |
494 |
469 |
577 |
653 |
770 |
535 |
|
계 |
401 |
631 |
930 |
990 |
1,053 |
1,196 |
1,341 |
1,673 |
1,084 |
* 가. 미생물 기탁제도의 취지
미생물에 대한 발명은 살아 있는 생명체를 대상으로 하는 것이어서 특허 명세서에 아무리 상세하게 미생물의 균학적 특질이나 성질을 기재한다 하더라도 제3자는 그 미생물을 입수하는 것이 실질적으로 불가능하다. 이처럼 특허 명세서에 타인이 반복 재현할 수 있도록 기재하는 것이 곤란한 문제를 해결하기 위해 특허 출원된 미생물을 공인기탁기관에 기탁하고, 특허 공개 후에는 제3자가 분양받을 수 있도록 하는 장치가 미생물 기탁제도이다. 그런데 미생물에 관계되는 발명을 특허출원하기 위해서는 특허법 시행령 제2조에 따라 그 미생물을 특허청장이 정하는 기탁기관 또는 특허절차상 미생물 기탁의 국제적인 승인에 관한 부다페스트 조약에 따른 국제기탁기관에 기탁하고 그 수탁증서를 출원서에 첨부하여야 한다.

출처 : 특허청 홈페이지
|
그림 5-3-4-1 |
미생물 기탁 및 출원 절차 개요
나. 미생물 기탁기관 및 관리 현황
국내의 기탁기관은 아래와 같이 4개의 기관이 운영 중이며, 이들 기관은 발명자가 미생물을 기탁하면 고유번호를 부여하고 기탁증서를 발급해 주고 있다. 또한 제3자가 특허관련 미생물의 분양신청을 할 경우 특허청은 미생물 분양자격증명서를 발급하여 기탁미생물의 분양을 허락하고 있으며 기탁된 미생물의 관리 실태를 분기별로 점검하고 있다.
|
표 5-3-4-1 |
국내 미생물 기탁기관 현황
|
구 분 |
한국생명공학연구원 생물자원센터 (KCTC) |
한국미생물 보존센터 (KCCM) |
한국세포주 연구재단 (KCLRF) |
농업생명공학연구원 한국농업미생물 자원센터 (KACC) |
|
국제기탁기관 (지정일) |
자격 있음 (1990. 6. 30) |
자격 있음 (1990. 6. 30) |
자격 있음 (1993. 8. 31) |
자격 없음 |
|
국내기탁기관 (지정일) |
자격 있음 (1981. 8. 25) |
자격 있음 (1981. 8. 25) |
자격 없음 |
자격 있음 (2002. 1. 1) |
출처 : 자체자료
|
표 5-3-4-2 |
기탁기관별 미생물 수탁 및 분양 현황
(단위 : 건)
|
구 분 |
수탁미생물 |
분양미생물 |
비고 (수탁) |
|
한국생명공학연구원 생물자원센터(KCTC) |
3,270 |
286 |
국제(2,187), 국내(1,083) |
|
한국미생물보존센터 (KCCM) |
2,258 |
156 |
국제(870), 국내(1,388) |
|
한국세포주연구재단 (KCLRF) |
163 |
125 |
국제(163), 국내(0) |
|
한국농업미생물 자원센터(KACC) |
443 |
41 |
국제(0), 국내(443) |
|
합 계 |
6,134 |
608 |
국제(3,220), 국내(2,914) |
* 2007년은 7월 31일 기준
출처 : 자체자료
또한 특허청은 미생물 기탁업무에 대한 개선 대책을 추진하여 부다페스트조약에 어긋나던 일부 미생물 기탁기관의 내부 규정을 개정하고, 기탁기관별로 상이하던 서식을 통일화하는 작업을 수행하였으며, 신청자 편의 위주로 미생물 분양 절차를 간소화하고 온라인 신청체계를 마련하여 특허청 홈페이지에서 온라인상으로 신청이 가능하도록 조치를 완료하였다. 그리고 지난 2006년에는 특허 미생물 보존 및 관리 사업을 실시하여 기존 기탁 미생물 보관 장소와는 별도의 장소에 특허 미생물에 대한 백업을 실시하였으며, 2006년 7월에는「미생물 기탁기관 지정 등에 관한 고시」를 개정하여 기탁기관의 특허미생물 복제본 보관 의무화 및 보관시설 요건을 규정함으로써, 미생물 관련 특허자원의 안정적 보존 및 관리를 제고하였다.


바이오산업은 DNA, 단백질, 세포 등을 이용한 생명체 관련기술(Bio Technology)을 직접 활용하여 제품과 서비스를 생산하는 신(新)산업으로 의약, 화학, 환경, 식품, 에너지, 농업, 해양 등 다양한 분야에서 21세기 산업 성장을 주도할 핵심 기술 산업으로 평가받고 있다. 특히 의약(Red BT)부분에서의 연구개발이 가장 활발하게 이루어지고 있으며, 점차 농업(Green BT), 산업(White BT)으로 옮겨가는 추세에 있다.
전 세계적으로 기존 합성신약의 한계를 극복하기 위한 바이오의약품 개발에 정부가 주도적으로 막대한 예산을 투자하고 있으며, 주요 선진국의 의약품 허가․규제기관에서는 고부가가치 바이오신약의 허가를 위해 안전성 및 유효성을 평가하는 가이드라인 개발에 주력하고 있다.
한국의 경우 1983년 생명공학육성법이 제정된 이후「제1차 생명공학육성기본계획(Biotech 2000, 1994~2006)」에 따라 생명공학에 대한 국가차원의 체계적인 연구개발 육성에 착수하여 기술적인 인프라를 구축하여 왔다.
그러나 이러한 기술적 인프라 및 정부의 R&D 지원은 기초연구에 집중되어 있어 세계적인 연구 성과들이 신속하게 상업화(실용화)로 이어지고 있지 않아 이에 대한 범부처 대책방안이 속속 마련되고 있다.
2007년부터 향후 10년 간은 생명공학 분야 세계 7위의 기술 강국 진입을 목표로 「제2차 생명공학육성기본계획(Bio-Vision 2016, 2007~2016)」을 확정하여 생명공학의약품 실용화를 위한 과제를 추진하고 있으며, 신약으로 개발될 가능성이 있는 후보물질에 대하여는 선택과 집중에 의한 전임상․임상시험 R&D 지원을 강화할 예정이다.
한편 유전자재조합기술을 이용한 제1세대 생명공학의약품 ‘유전자재조합 치료용 단백질 의약품(insulin, human growth hormon 등)’이 1980년대 처음 세계 시장에 소개된 이후, 최근 동 의약품의 특허 만료시점이 도래하면서 생명공학의약품에도 Bio-Similar(bio generic, follow-on) 개념을 도입하고자 하는 여건이 형성되고 있으며, 한미 FTA 협상 타결로 국내 제약환경은 큰 변화를 맞고 있다.
이상과 같은 국내외 제약환경의 변화에 발맞추어 생명공학의약품 인허가 과정, 국내외 생명공학의약품 개발동향, 생명공학의약품 실용화와 관련한 식약청의 역할 및 안전관리방안 등에 대하여 살펴보기로 한다.

생명공학의약품은 인체 내에서 유래한 물질을 대상으로 하여 유전자조작, 유전자 이식, 줄기세포 배양 등의 생명공학 기술을 적용하여 개발된 의약품으로써 기존의 합성 화학 의약품과 마찬가지로 인체의 질병을 치료, 처지, 경감, 진단함을 목적으로 한다. 따라서 제품의 실용화를 위해서는 반드시 그 제품에 대한 안전성과 유효성 평가를 거쳐야 한다.
의약품이 개발되어 환자에게 사용되기 까지는 약 10년 이상의 기간이 소요되는데, 이는 대부분 안전성과 유효성을 입증하기 위하여 실시하는 비임상․임상시험에 해당하며 의약품 개발 기간 및 투자비용의 대부분을 차지하고 있다[그림 5-4-2-1].

출처 : 자체자료
|
그림 5-4-2-1 |
의약품의 개발과정
범정부 차원에서 차세대 성장 동력으로서 육성․지원하고 있는 바이오의약품의 실용화는 안전성과 유효성 평가를 위한 자료가 얼마나 과학적이고 합리적인 지에 달려있으며, 신약개발 기간의 대부분을 차지하고 있는 비임상․임상에 대한 지원과 최종 허가 단계에서의 안전성․유효성 심사 과정이 국제 경쟁력을 결정하는 큰 요인으로 작용한다고 해도 과언이 아니다.
생명공학의약품의 안전성․유효성을 입증하는 임상시험이 완료된 후, 실용화를 위한 마지막 단계인 의약품 허가를 위해서는 의약품을 생산할 수 있는 GMP시설이 요구된다. 그러나 생명공학의약품을 연구․개발하는 주체인 벤처업소가 막대한 투자비용이 소요되는 GMP시설을 갖춘다는 것은 바이오신약 개발에 있어 또 하나의 장애 요인이 되고 있다.

출처 : 자체자료
|
그림 5-4-2-2 |
품목허가 절차
이의 해결방안으로 의약품 제조업 허가와 제조품목허가 분리를 위한 약사법 개정을 추진하고 있지만, 현재까지는 허가를 위한 필수 단계로 남아 있다.
한편 AIDS․암 등 생명을 위협하거나 심각한 질병의 치료제나 내성발현 등 기존 치료법으로 치료가 불가능하여 신속 도입이 필요한 의약품, 세포치료제, DNA칩 등 환자 치료 또는 산업발전을 위해 필요한 의약품에 대하여는 안전성․유효성 심사자료 중 일부(제3상 임상시험)를 허가 후 제출토록 조건을 부여하여 허가하거나 우선적으로 신속하게 심사할 수 있도록 규정(생물학적제제 등 허가 및 심사에 관한 규정 제28조, 식약청고시)하고 있어, 허가․심사에 소요되는 시간을 단축하고 실용화를 앞당기는 지원정책을 두고 운영하고 있다.

가. 세계동향
1982년 Eli Lilly사가 미국 FDA로부터 유전자재조합 인슐린의 허가를 받은 것을 시발로 하여 성장호르몬, 항암보조제 G-CSF, 빈혈치료제인 EPO 등 많은 재조합 단백질이 개발, 실용화되었다.
현재까지 바이오의약품은 EPO(erythropoietine, 빈혈치료제), TPA(tissue plas- minogen activator, 혈전용해제) 등의 심혈관계 질환약과 CSF(colony stimulating factor, 골수계 성장인자), 인터페론, 인터루킨 등 암 치료제 제품이 괄목할 만한 성장을 보여주었으며 최근에는 혈액질환, 면역계질환, 호흡기 질환 등 많은 질병의 치료에 목적을 두고 개발되고 있으며, 난치병(불치병)에 대한 치료 가능성 등의 장점에 의하여 활발한 연구가 진행 중이다.
최근 insulin, human growth hormone 등 1세대 유전자 변형 치료용 단백질 의약품의 특허 만료 시점이 도래하면서 바이오 제네릭 시장이 본격 형성될 것으로 전망하고 있다.
세계의 시장조사 전문기간 중 하나인 Datamonitor의 보고서에 따르면 유전자재조합 기술을 바탕으로 한 1세대 바이오의약품에 이어 향후 2010년까지는 단일클론 항체의약품(monoclonal antibody)과 치료용 백신이 바이오산업의 발전 동력이 될 것으로 예측하였다.
2세대 바이오의약품으로 불리는 항체의약품은 암세포에 특이적으로 부착하여 인체의 면역시스템이 암세포를 제거할 수 있도록 설계된 의약품으로 97년 비호지킨성 림프종 치료제인 리툭산(Rituxan)이 허가된 이후 현재까지 미국 FDA로부터 11개 제품이 승인되었으며, 임상단계에 있는 제품만 하여도 350여 개에 달한다고 한다. 유전자치료제는 유전물질을 인체에 투입하여 유전적인 질병을 치료하고자 하는 목적으로 연구가 진행 중이며 아직까지는 대부분 임상시험 단계에 있으나, 지금까지 전 세계적으로 허가된 유전자치료제는 중국에서 Genedicine(2003년 10월, 두경부암) 및 H101(2005년 11월, 두경부암) 2품목뿐이며, 수년 내 제품시장이 본격적으로 형성되기 시작하면 기존 의약품 시장을 대체할 수 있는 막강한 잠재력이 있는 의약품이다.
|
표 5-4-3-1 |
제1세대 단백질 의약품 특허만료 현황
|
단백질 의약품(상품명) |
의약용도 |
개발사 |
특허만료 |
|
인슐린(Humulin) |
당뇨병 |
Eli Lilly |
2002 |
|
인슐린(Novolin) |
당뇨병 |
Novo Nordisk |
2002 |
|
인간성장호르몬(Nutropin) |
성장호르몬 결핍 |
Genentech |
2002 |
|
인간성장호르몬(Humatrope) |
성장호르몬 결핍 |
Eli Lilly |
2002 |
|
인터페론 알파(Intron-A) |
백혈병 |
Schering-Plough |
2002 |
|
에리트로포이에틴(Epogen) |
빈혈 |
Amgen |
2004 |
|
에리트로포이에틴(Procrit) |
빈혈 |
Johnson & Johnson |
2004 |
|
tPA(Activase) |
심부전 |
Genentech |
2005 |
|
인간성장호르몬(Protropin) |
성장호르몬 결핍 |
Genentech |
2005 |
|
G-CSF(Neupogen) |
항암치료 |
Amgen |
2006 |
출처 : LG경제연구소, 특허청, 2006
2007년 현재 전 세계적으로 약 700여 건의 임상시험이 진행 중이며 세계 각국에서 빠른 속도로 개발되고 있다.
세포치료제는 1990년대 초반에 시작되어 중반부터 급속하게 기술개발이 이루어지고 있는데 골수 및 조혈모세포 이식, 수지상세포, 자기 활성화 림프구, 줄기세포 등을 이용한 치료법 연구가 진행 중이며, 배아줄기세포와 관련한 연구도 윤리성 문제와 연계되어 조심스럽게 이루어지고 있는 실정이다.
나. 국내동향
유전자재조합의약품은 인체에서 생리활성을 나타내는 다양한 효소나 호르몬의 정보를 담고 있는 유전자를 대장균이나 효모와 같은 미생물 등에 이입하여, 목적으로 하는 단백질을 합성하여 대량생산으로 제조한 의약품을 말한다. 바이오의약품 중 가장 많이 허가되어 사용되고 있는 의약품으로써 2006년 현재 약 200여 품목이 허가되었다.
항체의약품의 경우 LG생명과학, 녹십자, 이수앱지스 등 56개 바이오 기업에서 연구가 활발히 진행 중인데 2007년 4월말 현재 허가된 항체의약품 17개 제품 중 국내 제조는 이수앱지스의 “클로티냅주(압식시맙)” 1품목이 허가되었다.

출처 : 자체자료
|
그림 5-4-3-1 |
유전자재조합의약품 국내 허가 현황(2006년 12월)
|
표 5-4-3-2 |
세포치료제 허가현황(2007년 6월)
|
연번 |
제품명(업소명) |
특 징 |
대상질환 |
승인사항 |
|
1 |
콘드론 (세원셀론텍) |
자기유래연골세포 |
연골이식 및 재생 |
품목허가(2001. 2) |
|
2 |
아티셀 (듀플로젠) |
자기유래연골세포 |
연골이식 및 재생 |
품목허가(2002. 9) |
|
3 |
홀로덤 (테고사이언스) |
자기유래피부각질세포 |
피부화상치료 |
품목허가(2002. 12) |
|
4 |
칼로덤 (테고사이언스) |
동종유래피부각질세포 |
피부화상치료 |
품목허가(2005. 3) |
|
5 |
케라힐 (엠씨티티) |
자기유래피부각질세포 |
피부화상치료 |
품목허가(2006. 5) |
|
6 |
이노락 (이노메디시스) |
자기유래활성화림프구 |
비소세포폐암 |
품목허가(2007. 2) |
|
7 |
크레아박스-알씨씨 (크레아젠) |
자기유래수지상세포 |
전이성신세포암 |
품목허가(2007. 5) |
출처 : 자체자료
“세포치료제”는 세포와 조직의 기능을 복원시키기 위하여 살아있는 자가(auto- logous), 동종(allogenic) 또는 이종(xenogenic)세포를 체외에서 증식․선별하거나 세포의 생물학적 특성을 변화시키는 등의 일련의 행위를 통하여 치료, 진단 및 예방의 목적으로 사용되는 의약품으로, 통상 환자 자신으로부터 유래한 세포를 직접 이용하기 때문에 불특정 다수를 대상으로 대량 생산하는 보통의 의약품과 대비하여, 소위 “맞춤형 의약품”이라고 불리는 첨단 바이오의약품의 하나이다.
특히 줄기세포나 면역세포를 이용한 세포치료제는 난치병 영역에 대한 치료 가능성을 보여주고 있어 특별한 주목을 받고 있다.
|
표 5-4-3-3 |
세포치료제 연구개발(임상시험) 현황(2007년 6월)
|
연번 |
제품명(업소명) |
특징 |
대상질환 |
승인사항 |
|
1 |
아디포셀 (안트로젠) |
자기유래지방세포 |
함몰흉터부위교정 |
허가신청 중 |
|
2 |
이뮨셀LC (이노셀) |
자기유래활성화림프구 |
간암 |
허가신청 중 |
|
3 |
자기활성화림프구 (바이오쎌) |
자기유래활성화림프구 |
악성림프종 |
허가신청 중 |
|
4 |
마이오쎌 (바이오하트코리아) |
자기유래근모세포 |
심부전증치료 |
2상 임상 |
|
5 |
디씨백이피-엘주 (바이넥스) |
자기유래수지상세포 |
비소세포폐암 |
1, 2상 임상 |
|
6 |
디씨백아이알주 (바이넥스) |
자기유래수지상세포 |
대장암 |
1, 2상 임상 |
|
7 |
이노LC (이노셀) |
자기유래활성화림프구 |
교모세포종 |
3상 임상 |
|
8 |
크레아박스피씨 (크레아젠) |
자기유래수지상세포 |
전립선암 |
1, 2(a)상 임상 |
|
9 |
디씨백이피-비주 (바이넥스) |
자기유래수지상세포 |
유방암 |
1, 2(a)상 임상 |
|
10 |
엠에스씨 1 (에프씨비파미셀) |
골수간엽줄기세포 |
급성뇌경색 |
3상 임상 |
|
11 |
엠에스씨 2 (에프씨비파미셀) |
골수간엽줄기세포 |
심근경색 |
2, 3상 임상 |
|
12 |
카티스템 (메디포스트) |
제대혈간엽줄기세포 |
연골결손 |
1, 2상 임상 |
|
13 |
오스템 (세원셀론텍) |
골수간엽줄기세포 |
골절부위 골형성 |
3상 임상 |
출처 : 자체자료
현재 국내에서 허가되었거나 연구개발(임상시험) 중인 세포치료제는 총 20품목으로, 2001년 1월 30일 최초로 허가된 자기유래연골세포(콘드론)치료제를 필두로 종전까지는 대부분 자기유래연골세포나 자기유래피부각질세포와 같은 조직수복차원의 세포치료제(5종)가 주로 허가되었다.
그러나 최근 기술력의 향상으로 “자기유래활성화림프구”와 “자기유래수지상세포”를 이용한 항암 면역세포치료제가 각각 한 품목씩 허가되었고, 골수나 제대혈에서 유래한 중간엽줄기세포를 이용하여 심근경색, 뇌경색 또는 척수손상 등의 난치병을 치료하기 위한 세포치료제를 포함한 13개 품목이 임상시험을 진행 중이거나 완료단계에 있다.
유전자치료제는 2000년부터 2005년 동안 단 3개 제품만이 임상시험에 진입하였으나 2007년 3월 현재 총 8건의 임상시험이 진행 중이며, 제품 개발을 위한 사전상담 건수도 2004년 3건에서 2005년 9건, 2006년 10건으로 점차 늘어나고 있는 추세이다.
|
표 5-4-3-4 |
국내 유전자치료제의 임상시험 현황(2007년 6월)
|
제품명 |
개발사 |
치료유전자 및 작용기전 |
대상 질환 |
임상단계 (승인연월) |
국외임상 |
|
VMDA-3601 |
동아제약 바이로메드 |
VEGF, 혈관신생유도 |
허혈성 족부궤양증 |
2상 (2003. 12) |
|
|
GX-12 |
동아제약 포항공대 |
HIV항원, IL-12 |
에이즈 치료백신 |
1상 (2005. 1) |
|
|
JX594 |
동아대 제너렉스 |
종양선택적 복제, GM-CSF |
간암 |
1상 (2005. 8) |
미국 임상 진행 |
|
VM-202RY |
바이로메드 |
간세포성장인자, 혈관신생 |
허혈성 심혈관질환 |
1상 (2006. 10) |
미국 임상 동시진행 |
|
티슈진-C |
코오롱 생명공학 |
TGF-β, 동종유래 연골세포 |
퇴행성관절염 |
1상 (2006. 12) |
미국임상 |
|
VM-106 |
바이로메드 |
gp91 결손유전자 |
만성육아종 (유전질환) |
1/2a상 (2007. 1) |
|
|
세라젠 |
뉴젠팜 |
종양선택적 복제, CD/TK자살 유전자 |
전립선암 |
2상 (2007. 3) |
미국 임상 1상 완료 |
|
HB-110 |
동아제약 포항공대 |
HBV항원, IL-12 |
만성B형간염 |
1상 (2007. 3) |
|
출처 : 자체자료

생명공학기술의 발달로 새로운 개념의 의약품이 개발되고, BT산업의 국가성장 동력화 요구에 따라 생명공학의약품의 실용화를 지원하고자 하는 노력은 지속될 것이나, 의약품에 대한 국민의 안전요구도 증가와 각종 규제기준의 국제조화 등 의약품 안전관리체계 선진화도 병행해 나가야 할 과제이다.
식품의약품안전청은 첨단 생명공학의약품의 신속한 제품화를 위해 중간평가제, IGMP 도입, 안전성․유효성 평가를 위한 각종 가이드라인을 지속 발간하는 등 다양한 지원정책을 발굴․적용 하는 한편, 제조업 및 품목허가의 분리, 사전상담법제화 등 약사법령 개정을 통해 의약품 관리제도의 혁신 선진화를 추진해 나갈 계획이다.
향후 전개될 생명공학의약품의 산업화 과정에서 새로운 패러다임을 가진 바이오 분야의 현실과 관련 법령사이의 괴리를 최대한 효율적으로 축소하고, 의약품에 대한 안전성을 동시에 담보할 수 있는 정책이야말로 생명공학의약품의 국제 경쟁력을 확보할 수 있는 길일 것이다.


가. 지속적으로 성장하는 바이오산업 시장규모
2006년도 바이오산업 분야의 세계 시장규모는 1,010억 달러 규모로 추정되는데, Ernst & Young사에 의하면 상장기업(Public Company) 중심의 수입(Revenues)은 735억 달러 규모이다[표 5-5-1-1].
|
표 5-5-1-1 |
2006년도 상장기업 중심의 세계 바이오산업 현황
(단위 : 백만 달러, 명, 개, %)
|
구 분 |
주요 내용 |
2006년 |
2005년 |
증감률 |
|
상장기업 |
수입 |
73,478 |
64,213 |
14 |
|
연구개발비 |
27,782 |
20,934 |
33 |
|
|
순 손실 |
5,446 |
4,039 |
35 |
|
|
종업원 수 |
190,500 |
173,110 |
10 |
|
|
기업 수 |
상장기업 |
710 |
673 |
5 |
|
상장 · 비상장기업 |
4,275 |
4,263 |
0.3 |
출처 : Beyond Borders ; Global Biotechnology Report 2007, Ernst & Young, 2007
나. 국가전략산업 차원에서 지원
미국을 비롯한 선진국뿐만 아니라 개발도상국 또는 저개발국도 바이오산업을 국가전략산업으로 선정하여 중점 육성하고 있으며, 연구개발비 지원은 물론 인프라 구축 등 국가전략산업 차원에서 각종 지원제도를 시행하고 있다. 최근에는 산업 바이오(White-BT)에 대한 관심이 제고되고 있으며, 아시아-태평양 국가에 대한 관심이 증대되고 있다.

가. 미국
(1) 기업 및 제품판매 동향
2006년 미국의 바이오산업 매출(Sales)은 477억 달러, 수입(Revenues)은 588억 달러로 성장하였다[표 5-5-2-1].
|
표 5-5-2-1 |
미국의 2006년도 바이오산업 현황
(단위 : 억 달러, 개사, 명, %)
|
구 분 |
내 용 |
상장기업 (Public Companies) |
산업체 합계 (Industry Total) |
||||
|
2006년 |
2005년 |
증감률 |
2006년 |
2005년 |
증감률 |
||
|
재정 |
제품 매출액 수입 연구개발비 순손실 |
453 555 229 35 |
397 485 166 14 |
14.2 14.3 38.1 151.4 |
477 588 271 56 |
421 518 208 36 |
13.4 13.4 30.2 58.5 |
|
산업 |
시장가치 총 조달자금 상장기업 수 기업 수 종업원 수 |
3,924 170 20 336 130,600 |
4,084 114 13 331 119,000 |
-3.9 49.3 53.8 1.5 9.7 |
- 203 20 1,452 180,800 |
- 147 13 1,475 170,500 |
- 38.2 53.8 -1.6 6.0 |
출처 : Beyond Borders ; Global Biotechnology Report 2007, Ernst & Young, 2007
Pfizer․Johnson & Johnson사 등 대형기업 및 전문기업 중에서 특히, Amgen사는 빈혈치료제 등 5개 바이오의약품을 중심으로 142억 6,800만 달러의 총수입 및 29억 5,000만 달러의 순이익을 기록했으며, Genentech사 등도 순이익을 내는 전문기업으로 부상하였다[표 5-5-2-2].
|
표 5-5-2-2 |
선두 바이오 전문기업 및 대형 제약기업의 2006년도 경영현황
(단위 : 백만 달러, 명)
|
구분 |
회사명 |
수입 (Revenues) |
R&D비 (R&D Expense) |
순이익 (Net Income) |
종업원 (Employ- ees) |
시장가치 (Market Cap.) |
|
선두 바이오 전문 기업 |
Amgen Genentech Genzyme Gilead Sciences Biogen IDEC MedImmune Sepracor Celgene |
14,268 9,284 3,187 3,026 2,683 1,277 1,197 899 |
3,366 1,773 650 384 718 449 163 259 |
2,950 2,113 -17 -1,190 218 49 185 69 |
20,100 10,533 9,000 2,515 3,750 2,538 2,470 1,287 |
79,700 85,500 16,200 29,900 16,600 7,700 6,700 21,400 |
|
대형 제약 기업 |
Johnson & Johnson Pfizer Merck & Co. Bristol Myers Squibb Eli Lilly & Co. |
53,234 48,371 22,636 17,914 15,691 |
7,125 7,599 4,783 3,067 3,129 |
11,053 19,337 4,434 1,585 2,663 |
122,200 98,000 60,000 43,000 41,500 |
191,400 186,800 94,700 51,800 59,000 |
출처 : Beyond Borders ; Global Biotechnology Report 2007, Ernst & Young, 2007
미국 식품의약국(FDA)에서 승인을 획득하여 판매 중인 바이오의약품은 2005년도 기준 366개 제품이며, 동물세포이용 및 치료용 항체 산업화 열기가 확산되고 있는 가운데 La Merie Business Intelligence사의 자료에 의하면 2006년 동물세포배양기술을 활용해 생산된 바이오의약품은 전체 바이오의약품(638억 달러) 중 상위 20종 가운데 13종이며, 판매규모는 458억 달러로 전체의 72%를 차지하고 있다[표 5-5-2-3].
|
표 5-5-2-3 |
2006년도 주요 바이오의약품 판매현황
(단위 : 10억 달러)
|
No. |
제 품 군 |
2006년 매출액 |
전년 대비 성장률 (%) |
주요 상품 (Selected Branded Products) |
|
1 |
Erythropoietins |
11.94 |
6.7 |
Aranesp, Procrit Eprex, Epogen, Neo-Recormon, ESPO |
|
2 |
Major cancer antibodies |
10.62 |
56.8 |
Rituxan/MabThera, Herceptin, Avastin, Erbitux, Vectibix |
|
3 |
Anti-TNF antibodies |
10.28 |
24.8 |
Enbrel, Remicade, Humira |
|
4 |
Insulin and insulin analogs |
8.97 |
24.4 |
Humalog, Humulin, Lantus, Levemir, Novorapid, Actrapid, Novolin |
|
5 |
Rec. coagulation factors |
4.71 |
17.0 |
Novoseven, Kogenate, Helixate, Refacto, Advate, Recombinate, Benefix |
|
6 |
Interferon beta |
4.40 |
14.4 |
Avonex, Rebif, Betaferon/Betaseron |
|
7 |
G-CSF |
4.36 |
11.4 |
Neulasta, Neupogen, Neutrogin, GRAN |
|
8 |
Human growth hormone |
2.47 |
6.9 |
Genotropin, Norditropin, Humatrope, Nutropin, Saizen, Serostim |
|
9 |
Interferon alpha |
2.26 |
6.9 |
Pegasys, Peg-Intron, Intron A |
|
10 |
Enzyme Replacement |
1.71 |
27.5 |
Cerezyme, Fabrazyme, Aldurazyme, Myozyme, Replagal, Naglazyme, Elaprase |
|
11 |
Antiviral antibody |
1.1 |
|
Synagis |
|
12 |
Follicle stimulating hormones |
1.04 |
|
Gonal-f, Puregon |
|
|
합 계 |
63.83 |
|
|
출처 : Top 20 Biologics, LaMerie Business Intelligence(www.lamerie.com), 2007
(2) 지원제도 운영현황
미국은 세계 1위의 기술우위에 있음에도 불구하고 정부차원의 집중적인 육성정책이 지속적으로 추진되고 있다. 이미 2006년도에는 보건 분야에 296억 달러의 연구개발비를 투자하였고, 줄기세포에 대한 연구지원 및 규제완화정책, 2000년 제정된 바이오매스 R&D법에 따른 바이오에너지 개발을 위한 정책도 본격적으로 추진하고 있다. 주정부는 조세지원제도 시행은 물론 기술이전 및 투자유치를 적극적으로 지원하고 있다.
나. 일본 및 유럽
2006년도 일본 바이오산업 분야 총 시장규모는 1조 8,465억엔이다[표 5-5-2-4]. 경제산업성 등 6개 부처에서 투자하고 있는 바이오산업관련 예산은 2,648억엔에 달한다.
|
표 5-5-2-4 |
일본의 2006년도 바이오산업 총 시장규모
(단위 : 억엔)
|
구 분 |
내 용 |
시 장 규 모 |
|
|
2005년 |
2006년 |
||
|
바 이 오 제 품 |
유전자조작 제품 세포융합 제품 세포배양 제품 |
11,039.8 1,012.0 368.0 |
11,538.2 1,001.9 358.9 |
|
소 계 |
12,419.8 |
12,899.0 |
|
|
바 이 오 관련제품 및 서비스 |
의약․정밀화학 제품 식 품 기기․시약 생물정보․서비스․센서․환경․기타 |
1,528.0 1,368.0 1,272.5 1,274.4 |
1,601.0 1,323.5 1,287.5 1,354.0 |
|
소 계 |
5,442.9 |
5,566.0 |
|
|
합 계 |
17,862.7 |
18,465.0 |
|
출처 : 일경BP사, 일경바이오연감 2007, 2006. 12
2006년도 유럽 바이오산업의 수입(Revenues)은 133억유로에 달한다[표 5-5-2-5]. 유럽의 바이오산업은 EU 회원국간 공동협력과 국가별 경쟁을 통해 발전하고 있다.
|
표 5-5-2-5 |
유럽의 2006년도 바이오산업 현황
(단위 : 백만유로, 개사, 명, %)
|
구 분 |
내 용 |
상장기업 |
산업체 합계 |
||||
|
2006년 |
2005년 |
증감률 |
2006년 |
2005년 |
증감률 |
||
|
재정 |
수입 연구개발비 순손실 시장가치 |
9,150 2,892 876 62,165 |
7,993 2,559 1,395 43,374 |
14 13 -37 43 |
13,307 5,695 2,541 - |
11,765 5,259 3,280 - |
13 8 -23 - |
|
산업 |
기업 수 종업원 수 |
156 39,740 |
122 34,250 |
28 16 |
1,621 75,810 |
1,613 68,440 |
0 11 |
출처 : Beyond Borders : Global Biotechnology Report 2007, Ernst & Young, 2007

가. 산업체
산업자원부 기술표준원/산업연구원/한국바이오산업협회가 2006년 실시한 2005년도 국내 바이오산업 실태조사에 응답한 706개사의 바이오산업 분야 참여유형은 연구개발 및 제품판매 509개사, 연구개발 단계 199개사 정도이다. 바이오산업제품 판매기업의 형태는 국산제품 390개사, 수입제품 53개사, 국산 및 수입제품 동시판매 66개사 정도로 파악되고 있다.
산업체 소속의 바이오 전문인력 13,867명 중 연구인력 7,430명(54%), 생산인력 6,437명(46%)인데, 연구인력은 석사급이 48%, 생산인력은 테크니션이 52%를 차지하고 있다.
나. 산업 규모
2005년도 국내 바이오산업 실태조사에 의하면 바이오산업의 총 수급규모는 3조 5,626억원 규모인데[표 5-5-3-1], 이중에서 수요부문은 내수가 2조 3,315억원이고 수출은 1조 2,311억원이며, 공급부문은 생산이 2조 7,714억원이고 수입이 7,012억원 규모이다. 2006년도 총 수급규모는 4조 1,000억원 규모로 추정하고 있다.
|
표 5-5-3-1 |
2005년도 국내 바이오산업 총 수급규모
(단위 : 백만원, %)
|
공 급 |
계 |
수 요 |
||||||
|
생 산 |
수 입 |
내 수 |
수 출 |
|||||
|
금 액 |
비 중 |
금 액 |
비 중 |
금 액 |
비 중 |
금 액 |
비 중 |
|
|
2,771,386 |
77.8 |
791,159 |
22.2 |
3,562,545 |
2,331,475 |
65.4 |
1,231,070 |
34.6 |
출처 : 2005년도 국내 생물산업실태조사, 산업자원부 기술표준원/산업연구원/한국바이오산업협회, 2006
2005년도 국내 시장규모는 2조 3,315억원인데[표 5-5-3-2], 국산제품이 1조 5,403억원(66%), 수입제품이 7,912억원(34%)을 차지하고 있다. 제품별로 보면 바이오의약품이 1조 3,751억원(59%), 기타 9,564억원(41%)으로 구성되어 있다. 2006년도 시장규모는 2조 7,500억원 정도로 추정하고 있다.
|
표 5-5-3-2 |
2005년도 국내 바이오산업 시장규모
(단위 : 억원, %)
|
구 분 |
판 매 규 모 |
|||
|
국내 판매 |
수입 판매 |
계 |
점유율 |
|
|
생물의약 |
8,202 |
5,730 |
13,750 |
59.0 |
|
바이오식품 |
2,971 |
78 |
3,049 |
13.1 |
|
생물공정 및 기기 |
1,497 |
516 |
2,013 |
8.6 |
|
생물화학 |
439 |
1,528 |
1,967 |
8.4 |
|
생물환경 |
1,390 |
24 |
1,414 |
6.1 |
|
생물검정, 정보개발서비스 및 연구개발 |
834 |
0 |
834 |
3.6 |
|
바이오에너지 및 자원 |
147 |
29 |
176 |
0.8 |
|
생물전자 |
105 |
7 |
112 |
0.4 |
|
합 계 |
15,403 |
7,912 |
23,315 |
100.0 |
출처 : 2005년도 국내 생물산업 실태조사, 산업자원부 기술표준원/산업연구원/한국바이오산업협회, 2006
다. 지원제도
2006년 정부는 과학기술부, 보건복지부, 산업자원부 등 8개 관련부처 및 출연기관에서 2006년에 8,270억원을 투자하였고, 2007년에 8,515억원을 투자하였다[표 5-5-3-3].
|
표 5-5-3-3 |
정부의 생명공학 분야 예산
(단위 : 백만원)
|
연도 |
구분 |
교육부 |
과기부 |
농림부 |
산자부 |
정통부 |
복지부 |
환경부 |
해양부 |
출연연 |
총계 |
|
2006 |
R&D |
26,400 |
219,733 |
77,045 |
59,191 |
21,799 |
162,541 |
22,478 |
10,700 |
61,568 |
661,455 |
|
인프라 |
|
12,730 |
11,234 |
91,214 |
4,530 |
|
|
|
9,420 |
129,128 |
|
|
인력양성 |
34,500 |
|
400 |
1,501 |
|
|
22,478 |
|
|
36,401 |
|
|
계 |
60,900 |
232,463 |
88,679 |
151,906 |
26,329 |
162,541 |
206 |
10,700 |
70,988 |
826,984 |
|
|
2007 |
R&D |
27,900 |
235,328 |
84,072 |
73,333 |
22,199 |
149,978 |
22,179 |
11,700 |
63,629 |
690,318 |
|
인프라 |
|
11,922 |
600 |
97,085 |
4,500 |
|
|
|
11,114 |
125,221 |
|
|
인력양성 |
34,500 |
|
500 |
970 |
|
|
|
|
|
35,970 |
|
|
계 |
62,400 |
247,250 |
85,172 |
171,388 |
26,699 |
149,978 |
22,179 |
11,700 |
74,743 |
851,509 |
출처 : 2007년도 생명공학육성시행계획, 과학기술부, 2007
우리나라의 바이오산업관련 지원제도는 크게 기술개발과 인프라구축 지원으로 대별되고 있는데, 2006년의 경우는 연구개발에 6,615억원(80%), 인프라에 1,291억원(16%), 인력양성에 364억원(4%)을 투자하였다.
부처별로는 전체 예산 중 과학기술부가 28%, 보건복지부가 20%, 산업자원부가 18%, 농림부가 11%를 투자하였다. 정부 관련부처 및 관련기관은 또한 생명공학기술의 개발 및 바이오산업의 발전을 촉진할 수 있는 바이오산업관련 시설자금 융자․창업 및 보육 지원․지역 클러스터 및 국제협력사업 등도 지원하고 있다.

가. 선진국의 추진전략 대응
바이오산업 분야의 기술 및 산업화 추세는 매우 빠르고 선진국이 주도하고 있으므로 우리나라는 지속적으로 선진국의 추진전략에 효율적으로 대응해야 하는데, 최근 산업 바이오에 대한 선진국의 산업화 노력이 더욱 가시화되고 있으며, 아시아 및 태평양 국가들에 대한 선진국들의 관심이 제고되고 있는 실정이다.
실질적으로 바이오시장에서 경쟁력을 강화하기 위해 미국은 신속한 특허심사와 시장선점의 경쟁력 강화방안, 일본은 관 주도의 생명공학 전략, 유럽은 공동협력 및 경쟁전략을 중점적으로 추진하고 있다.
나. 성과제고 및 성공사례 창출 촉진
우리나라의 경우 성공사례가 있지만 바이오산업 발전 및 성장을 촉진할 수 있는 획기적인 성과제고 및 성공사례 창출을 통해 산업 전체의 성장을 견인할 수 있는 중요한 시기이므로 LG생명과학이 산업화한 인체성장호르몬의 유럽 및 미국 진출사례처럼 관련 산업체의 중점 노력이 전개되어야 하고, 이를 촉진할 수 있는 각종 뒷받침이 필요하다 하겠다. 내수의 한계를 극복하기 위해 세계시장에 진출해야만 하는 우리 기업으로써는 현재까지 축적된 역량들을 결집하여 시장에서 승부를 낼 수 있는 시장진출 전략이 활성화되어야 한다.
다. 제품개발 및 산업화 추진방향
의약 바이오(Red-BT)의 경우 해외진출이 가능한 바이오시밀러(Biosimilar) 제품을 산업화하여 글로벌 마케팅 능력을 함양하고, 슈퍼제네릭(Supergeneric) 제품 또는 신규제품을 산업화하는 전략의 추진이 필요하다.
산업 바이오(White-BT)의 경우 원유 값 상승 등의 대안으로 바이오매스 원료 및 바이오공정을 활용하여 바이오기반 화학제품 또는 바이오연료를 생산하려는 세계적인 흐름에 대비해야 한다.
융합 바이오(Fusion-BT)의 경우 바이오센서 및 바이오칩, 나노기술과의 융합, 바이오장비의 첨단화 등을 통해 제품개발 및 산업화를 추진하는 것이 필요하다.
기존에 사용되고 있는 제품들에 대한 규제조치에 관한 동향을 지속적으로 모니터링하고, 시장에서의 경쟁력 제고를 통해 바이오제품개발 및 산업화가 이루어지는 것이 바람직하다.
참 고 문 헌
산업자원부/BIO연구개발협의회, BIO산업 세계선도화 포럼 2007 : 바이오산업 현황 및 정책 방향, 2007년 6월
산업자원부/산업연구원, 바이오산업의 투자로드맵, 2007년 3월
과학기술부 등, 2007년도 생명공학육성시행계획, 2007년 3월
산업자원부 기술표준원/산업연구원/한국바이오산업협회, 2005년도 국내 생물산업 실태조사, 2006년
과학기술부 등, 제2차 생명공학육성기본계획(Bio-Vision 2016), 2006년 11월
한국바이오산업협회, 바이오인더스트리 제 44호~47호, 2006년~2007년
Ernst & Young, Beyond Borders : Global Biotechnology Report 2007, 2007
LaMerie Business Intelligence, Top 20 Biologics, Feb. 2007
日經BP社, Nikkei Biotechnology & Business, No. 609/2007年 2月
日經BP社, 日經バイオ年鑑 2007, 2006年 12月
http://www.mocie.go.kr
http://www.bak.or.kr
http://www.bio.org
http://www.jba.or.jp


 생명공학 연표
생명공학 연표
○ 아랍에서 우성 말을 생산하기 위해 최초로 인공수정을 사용
■ 1590년
○ Janssen, 현미경 발명
○ Hooke, 세포의 존재 발견
○ Leeuwenhoek, 박테리아를 발견
○ Koelreuter, 다른 종의 농작물의 성공적인 이종교배를 보고
○ Jenner, 아이들에게 천연두를 막기 위한 바이러스성 백신을 접종
○ 1830년 단백질 발견
○ 1833년 최초로 효소가 발견되고 분리됨
○ Schleiden과 Schwann, 모든 유기체는 세포들로 구성되어 있다고 제안
○ Virchow, “모든 세포는 세포에서 생겼다”고 선언
○ Pasteur, 미생물들이 발효를 유발한다고 제안
○ 찰스 Darwin, 자연 도태의 진화론을 발표(1800년대 후반 유전학의 무지에도 불구하고 선택된 부모와 도태된 다양한 자손에 대한 개념은 동식물 사육사들에게 매우 큰 영향을 줌)
■ 1914년
○ 최초로 박테리아를 영국 멘체스터의 하수처리에 사용
○ Laibach, 최초로 오늘날 이종교배라 알려진 광범위한 교배로부터 잡종을 얻기 위해 배구제(embryo rescue)를 사용
■ 1930년
○ 美의회가 식물 육종 생산의 특허를 가능하게 하는 식물특허법(Plant Patent Act) 통과
○ 유전공학이란 용어가 폴란드 Lwow의 기술연구소에서 효모복제에 관한 강의를 맡고 있는 덴마크의 미생물학자 A. Jost에 의해 최초로 사용
○ 박테리아를 감염시키는 박테리오파지를 규명하고 확인하기 위해 전자 현미경을 사용
○ 페니실린을 미생물에서 생산함
○ Avery와 그 외 다른 사람들에 의해 DNA가 유전정보를 운반한다는 점이 입증됨
○ Waksman, 결핵에 효과적인 항생제인 streptomycin을 분리(추출)
○ 새로운 타입의 바이러스를 형성하기 위해 서로 다른 바이러스로부터의 유전물질이 결합할 수 있다는 일종의 유전자 변형이 발견
○ 유전적 다양성의 상실로 인한 위협을 인식한 미 의회는 식물수집과 보존 그리고 이러한 인식의 홍보에 막대한 자금을 제공함
○ McClintock, 옥수수에서 소위 움직이는 유전자(jumping genes)라 불리는 전이요소를 발견
○ Pauling, 겸상(鎌狀) 적혈구 빈혈증(흑인의 유전병)이 헤모글로빈 내 단백질분자의 돌연변이로 야기된 “분자병”임을 밝혀냄
○ 냉동정액을 사용한 가축의 인공수정이 성공적으로 수행
○ 과학저널 Nature는 현대 유전학의 출발을 상징하는 DNA의 이중 나선구조를 묘사한 James Watson과 Francis Crick의 원고를 출판
■ 1955년
○ 핵산 합성에 관한 효소가 처음으로 추출됨
○ Kornberg, DNA 복제에 필요한 효소 DNA 중합효소Ⅰ(DNA polymeraseⅠ) 발견
○ 겸상 적혈구 빈혈증이 단일 아미노산의 변화 때문에 발생한다고 밝혀짐
○ DNA가 처음으로 시험관에서 만들어짐
○ 조직 살균제가 개발됨
○ 단백질 생합성의 첫 단계가 그려짐
○ 바이러스 증식억제 물질(interferon) 발견
○ 최초 합성 항생 물질 개발
○ 시냅시스(세포의 감수분열 초기에 있는 상동염색체의 병렬접착)를 이용해 DNA- RNA 잡종 분자가 만들어짐
○ 메신저 리보 핵산(Messenger RNA) 발견
○ 美농림부가 최초 미생물 살충제인 Bacillus thuringiensis를 등록함
○ Norman Borlaug에 의해 신품종 밀이 개발됨으로 인해 생산량이 70% 상승함
○ 필리핀의 국제 벼 연구소(The International Rice Research Institute)는 새로운 품종을 개발하여 충분한 비료를 주면 이전의 생산량보다 2배 많은 수확량을 얻을 수 있는 녹색 혁명을 일으킴
○ Harris와 Watkins는 성공적으로 생쥐와 사람 세포를 융합시킴
○ 유전암호가 해독되고 일련의 3개의 뉴클리오티드가 하나의 아미노산을 결정한다는 사실이 밝혀짐
○ 최초로 자동 단백질 서열 분석기 완성
○ 처음으로 효소가 생체 외에서 합성됨
○ 노르만인 Borlaug, 노벨 평화상 수상(1963년 참조)
○ 유전물질을 자르는 제한 효소(두 줄 사슬 DNA를 특정 부위에서 절단하는 효소)의 발견으로 유전자 복제의 장이 열림
○ 처음으로 유전자가 완벽하게 합성됨
○ 인간의 DNA 구성이 침팬지와 고릴라의 DNA와 99% 유사함이 발견됨
○ 최초로 배이식(胚移植)이 시도됨
○ Stanley Cohen와 Herbert Boyer, 제한효소와 리가제(ligases)를 사용해서 DNA를 자르고 붙이는 기술과 박테리아에서 새로운 DNA를 복제하는 기술을 완성함
○ 美國NIH는 유전자 변형 연구를 총괄하기 위해 재조합 DNA 자문위원회(Recombinant DNA Advisory Committee) 구성
○ 최초로 미국 정부가 캘리포니아 Asilomar 회의에서 유전자재조합 실험을 규제하기 위한 가이드라인 개발을 주장함
○ 단일클론항체가 생산됨
○ 유전자 변형 기술이 유전 장애인에 최초로 적용
○ 분자교배가 태아의 alpha thalassemia 진단에 사용됨
○ 효모의 유전자가 대장균(E.coli)에서 발현됨
○ 최초로 특정유전자의 염기쌍 순서가 결정됨(A, C, T, G)
○ 美國재조합 DNA 자문위원회(NIH Recombinant DNA Advisory Committee)에 의해유전자 변형 실험에 대한 가이드라인이 처음으로 발표
○ 인간유전자를 박테리아에서 처음으로 발현시킴
○ 전기영동을 이용해 DNA의 긴 마디를 빠르게 나열하기 위한 연구 수행
○ 바이러스의 고방사선 구조가 최초로 확인됨
○ 재조합 인간 인슐린이 최초로 생산됨
○ 미국 노스캐롤라이나 과학자들이 DNA 분자상의 특정 위치에 특정 돌연변이를 일으키는 것이 가능하다는 것을 보여줌
○ 최초로 인간성장 호르몬이 합성됨
○ 유전공학 제품을 개발하기 위해 최초의 상업적 회사가 설립
○ 중합효소(polymerases)의 발견
○ 뉴클리오티드(nucleotides)의 빠른 나열기술 완성
○ 유전자 표적화
○ RNA splicing
○ Diamond v. Chakrabarty 재판에서 미 연방법원은 유전자재조합 생물형태에 대한 특허를 인정했으며, Exxon 석유회사가 기름 먹는 미생물에 대한 특허 취득
○ 美國정부 유전자복제에 대한 권한을 Cohen과 Boyer에게 부여
○ 최초의 유전자합성 기계 개발
○ 인간인터페론유전자를 박테리아로 형질전환(Transformation) 시킴
○ 노벨 화학상이 유전자 변형분자를 개발한 Berg, Gilbert, Sanger에게 수여됨
○ 오하이오 대학의 과학자들이 다른 동물의 유전자를 쥐에 이식함으로서 최초로 유전자 이식동물을 생산함
○ 중국의 과학자가 최초로 복제 물고기 금 잉어를 만듦
○ 미국의 Applied Biosystems社는 단백질 서열분석에 필요한 샘플의 양을 획기적으로 줄일 수 있는 상업적 가스 상 단백질 서열분석기를 발표
○ 가축을 위한 최초의 유전자 변형 DNA 백신 개발
○ 유전적 변이를 거친 박테리아에서 생산된 인간인슐린이 미국 FDA로부터 최초의 생명공학 기술에 의한 의약품으로 승인 받음
○ 최초의 유전자 변형식물인 피튜니아 생산
○ 중합효소연쇄반응(PCR) 기술이 소개(유전자와 유전자 조각의 복제를 위해 열과 효소를 사용하는 PCR 기술은 이후 유전공학에서의 연구와 개발에 광범위하게 쓰이는 중요한 도구가 됨)
○ TI 플라스미드(plasmid: 염색체와는 따로 증식할 수 있는 유전인자)에 의한 식물 세포들의 유전학적인 변형이 수행됨
○ 최초로 인공염색체 합성
○ 특정 유전병 유발인자 발견
○ 생명공학기술을 이용해 피튜니아를 완전 성장시킴
○ 피튜니아 식물을 통해 유전자변형식물의 새로운 특징이 자손에게 전달됨을 확인함
○ DNA 지문검색 기술이 개발
○ HIV 바이러스의 전체 유전체가 복제되고 서열 결정됨
○ 신장병과 낭포성 섬유증을 유발하는 유전인자 발견
○ 법적 증거로서 유전자 지문법이 도입
○ 최초로 곤충과 박테리아, 바이러스에 저항력이 있는 유전자 변형 식물이 시험됨.
○ 미국 NIH는 인간을 대상으로 하는 유전자 치료법 실험수행에 대한 가이드라인을 정함
○ 유전자 변형 B형 간염 백신 최초 개발
○ 최초의 유전공학 항암치료제 인터페론 생산
○ 미국 정부는 유전자 변형 유기체에 대해 전통적인 유전자재조합 기술로 만들어진 제품에 적용된 규정보다 더 엄격한 “the Coordinated Framework for Regulation of Biotechnology” 규정 확립
○ California Berkeley 대학의 화학자가 신약을 개발하기 위해 항체와 효소를 결합하는 방법(abzymes) 제시
○ 유전자 변형식물(담배)의 실제 실험이 수행됨
○ 최초로 환경 보호국이 유전자변형 담배의 판매를 승인
○ 바이러스에 내성이 있는 토마토의 field test를 최초로 승인함
○ 캘리포니아에서 농작물의 서리 형성을 억제하는 유전자 변형 박테리아인 Frostban을 딸기와 감자를 통해 시험하였는데 이것이 처음으로 공식 승인한 유전자 변형 박테리아 외부 실험임
○ 미국 정부는 하버드 대학 분자 유전학자에게 유전자 변형동물 즉 유전자변형 쥐에 대한 특허권을 부여함
○ 세제에 사용할 수 있는 표백제 내성을 지닌 단백질 분해효소를 만드는 공정에 대한 특허권이 부여됨
○ 미국 의회가 다른 종의 유전체뿐만 아니라 인간 유전자 암호를 해독하고 지도를 만드는 인간 유전체 프로젝트 연구비를 승인함
○ 최초로 유전자변형 해충방지 면화의 field test 승인
○ 식물 유전체 프로젝트 시작
○ 진화의 역사를 밝히기 위한 DNA 연구 시작
○ 유럽에서 유전자 변형 동물백신의 사용 승인
○ 기름 청소에 미생물을 이용한 생물학적 정화기술 사용
○ 미국 최초로 유전자재조합 기술을 이용하여 치즈제조에 쓰이는 인공적으로 제조된 chymosin 효소인 Chy-MaxTM이 소개됨
○ 인체의 모든 유전자 지도를 제작하려는 국제적인 노력인 인간 유전체 프로젝트가 시작됨
○ 면역장애를 앓고 있는 4살 여자 어린이를 대상으로 실시한 유전자 치료가 성공적으로 수행됨
○ 유아 조유용 우유 단백질을 만드는 유전자 변형 젖소 탄생
○ 해충에 강한 옥수수인 Bt 옥수수 생산
○ 영국 최초로 유전자변형 효모식품이 승인됨
○ 유전자 변형 척추동물 송어의 실지실험이 수행됨
○ 미국과 영국의 과학자들이 시험관 내에서 배아에 낭포성 섬유증, 혈우병과 같은 유전적 기형을 테스트하는 기법을 밝힘
○ 미국 FDA는 유전자 이식 음식이 유전적으로 위험하지도 않고 특별한 규정도 필요 없다고 선언함
○ 미국 FDA, 낙농가의 우유생산 촉진을 위해 BST(Borine Somatotropin)를 승인
○ 미국 FDA, 생명공학으로 만들어진 FLAVRSAVRTM tomato 승인
○ 최초로 유방암 유전자 발견
○ CF 환자의 폐에 단백질이 쌓이지 않게 하는 재조합 인간 DNase 승인
○ 소 성장호르몬(POSILAC)이 상용화됨
○ 에이즈 환자에게 최초로 비비의 골수가 이식됨
○ 최초로 바이러스 이외의 살아있는 유기체(Hemophilus Influenzae)의 완벽한 유전자 배열이 완성됨
○ 암 정복을 위해 면역시스템 모듈, 유전자 변형 항체 형성과 같은 유전자 치료가 도입됨
○ 파킨스병과 관련된 유전자의 발견으로 퇴행성 신경질환의 잠재 가능한 치료와 그 원인 연구의 중요한 이정표를 제시함
○ 스코틀랜드에서 어른세포로 복제된 최초의 복제양 Dolly 탄생
○ 해충방지 농작물인 Roundup ReadyTM 콩과 BollgardTM 해충방지 면화와 같은 작물이 상업화됨
○ 아르헨티나, 호주, 캐나다, 중국, 멕시코와 미국 등 전 세계적으로 500만 에이커 면적에서 유전자조작 작물이 재배됨
○ Oregon주 연구자들은 두 마리의 붉은털 원숭이를 복제했다고 주장함
○ 유전병 연구의 새로운 기술을 창조하기 위해 PCR, DNA칩과 컴퓨터를 결합한 새로운 DNA기술 탄생
○ 하와이대학 연구진이 어른의 난소 적(cumulus)세포 핵으로부터 쥐를 복제함
○ 인간 배아줄기세포주가 확립됨
○ 일본 Kinki 대학 연구진은 한 마리 어른암소로부터 얻은 세포를 이용 8마리의 동일 송아지 복제함
○ 최초로 C. elegans 벌레에 대한 동물 유전체 염기서열 해독 완료
○ 30,000개의 이상의 유전자 위치를 보여주는 인간 유전체지도의 초안 완성
○ 동남아시아 다섯개 나라가 병에 강한 파파야 나무를 개발하기 위해 컨소시엄을 구성
○ 최초로 영국에서 유전자 지문법을 이용해 유죄를 판결함
○ 규정 질량의 일반적 융기에 착상된 유전자 분리성공
○ 유전성 대장암이 DNA 치료 유전자의 결핍으로 야기된다는 사실 발견
○ 유전자 변형 광견병 백신을 너구리에 실험
○ 미국에서 농약을 기본으로 한 생명공학 제품판매 승인
○ 특수이식 유전자를 가진 쥐에 관한 특허 허용
○ 최초로 유럽에서 발암물질에 민감한 유전자변형 쥐에 관한 특허 제기
○ 유방암 유전자 복제
○ 최초로 애기장대(학명 Arabidopsis thaliana)의 유전체지도 개발
○ 13개 나라에서 총 1억 89만 에이커 면적에서 생물공학 농작물이 재배됨
○ 최초로 바이러스에 강한 고구마가 케냐에서 실질 시험됨
○ 인간유전체 배열의 초안 발표
○ 최초로 벼 유전체지도 완성
○ 오스트리아 연구진들은 Barley Yellow Dwarf Virus와 같은 바이러스 예방백신에 사용되는 hairpin RNA를 이용한 기술개발을 보고함
○ Chinese National Hybrid 연구진들은 일반 쌀 생산량보다 두 배 많은 super rice종 개발을 보고함
○ 유럽위원회(The European Commission)가 모든 유전자 변형 식품에 라벨을 붙일 것을 제기함
○ 농업적으로 중요한 시노라이조비움 멜리로티(Sinorhizobium meliloti) 박테리아의 DNA배열 완성
○ 염분이 있는 물과 땅에서 성장 가능한 최초의 농작물을 만들기 위해 애기장대로부터 추출된 유전자가 토마토에 이식됨
○ 농업에 중요한 식물병원균 Agrobacterium tumefaciens의 유전체서열이 공표됨
○ 스트레스에 더 강한 농작물 개발의 실마리로서, 손상을 입거나 스트레스를 받았을 때 빛을 발하는 세일 크레스(thale cress)라 불리는 실험용 식물 재배
○ 최초로 땅콩의 종합적 분자지도가 완성됨
○ 완성된 인간 유전체 배열을 과학전문지에 게재함
○ 효모의 프로테옴(Proteome: 단백질간 상호작용과 네트워크의 총합)의 기능 지도(functional map)의 초안 완성(효모의 유전체지도는 1996년에 발표)
○ 줄기세포의 분화에 관여하는 조절인자 연구에 큰 발전이 있었으며, 이에 관여하는 200여 개의 유전자가 밝혀짐
○ 생명공학 농작물이 16개국, 1억 4천 5백만 에이커에서 재배되고 있으며 이는 2001년보다 12% 증가한 것임
○ 자궁경부암에 대한 백신 개발에 성공
○ 인간유전체 완전 해독(4월)
○ 정신분열증과 우울증 등 정신병의 발병 위험을 증가시키는 특정유전자 변형을 확인한 연구결과 발표
○ 美최초의 LMO애완동물로 광고된 붉은 빛 형광물고기 Gold Fish 상업화
○ 세계적으로 생명공학작물 이용의 활성화 증대
○ 영국은 최초로 상업적인 생명공학작물인 제초제 저항옥수수를 인정
○ 미국 환경 보호국은 최초로 형질전환 해충저항성 옥수수를 승인함
○ 2003년 banteng 들소가 최초로 복제되었으며 노새, 말, 사슴도 복제되었음
○ 1997년 포유동물의 최초 복제양 돌리는 폐병연구 후에 안락사 됨
○ 일본 연구팀은 자연적으로 카페인을 제거하는 생명공학 커피를 개발함
○ RNA 형태는 유전자 형식을 지시, 변형시키며 줄기세포와 배(胚)의 성장에 영향을 미침을 밝힘
○ 쥐의 배 세포줄기가 정자나 난자 세포로 성장할 수 있음을 확인
○ 남성을 결정짓는 Y 염색체가 동일한 유전자를 함유하고 있음을 발견
○ 종양으로 하여금 암의 전이에 필요한 혈관을 생성하지 못하도록 하는 약물의 개발
○ 미국 식품의약국(FDA)은 아바스틴이라는 최초의 신세대 항암제를 승인함
○ FDA는 다양한 종류의 약물치료와 질병을 위해 첫 DNA칩 및 유전자칩 개발
○ RNA 방해 제품으로, 임상 시험에 들어가는 첫 번째 RNAi 제품 생산
○ 국제연합 식량농업기구(FAO)의 생명공학 작물 승인
○ 국립과학연구원 산하 의학연구소에서는 ‘생명공학작물이 건강에 해를 끼치지 않는다’라고 밝힘
○ FDA는 식품안전성 검토 후 생명공학 밀의 안전성 밝힘
○ 몬산토사는 지방산을 감소 삭제한 low-linolenic 콩을 소개함
○ 닭 유전체 DNA 완전 해독
○ 최초로 애완 새끼고양이 복제
○ ‘쓸모없는 DNA(junk DNA)’ 규명
○ 인간의 유전자 DNA 중 단백질을 합성하는 DNA는 전체 유전체의 10%에 불과하며 아무런 기능이 없는 DNA에 대한 규명 이루어짐
○ 지난 3월 영국의 과학자들, 지난 20년간 나비 58종의 개체 수가 71% 줄었으며, 조류는 54% 감소했다고 보고
○ 신(新)의약품 개발 활발
○ 유엔(UN), 대학, 민간자선단체, 제약업체 등 공공단체와 민간 기업이 손을 잡고 미개발국의 환자를 위해 의약품을 개발하는 새로운 움직임이 일어남
○ 미생물유전체 추출성공
인간 유전체 프로젝트 주역인 미국 크레이크 벤터 박사는 3월 사이언스에 바닷물에서 미생물 유전체를 추출해 10억 5,000만 염기쌍을 한꺼번에 분석하는 데 성공했다고 밝힘
■ 2005년
○ 유전체지도와 야외 관찰로 진화가 일어나는 복잡한 과정을 밝힘
○ 유럽 호이겐스 탐사선이 토성의 달 타이탄에 착륙하고, NASA의 Deep Impact가 혜성에 충돌한 실험 등
○ 분자 생물학자들이 봄에 꽃이 다양한 색깔을 내게 하는 원리라고 발견
○ 위성과 지상망원경이 도시 크기의 죽은 별들인 중성자별 관찰
○ 정신분열증, 난독증, 안면경련증과 같은 뇌 신경질환 연구
○ 외계에서 온 암석과 지구의 암석을 비교 분석한 결과 지구 생성에 대해 새로운 이론 설립
○ volage-gated potassium channel의 분자 구조 밝힘
○ 인간 활동에 의한 지구 온난화의 증거 추가 발견
○ 분자 생물학자들이 복잡한 시스템의 행태를 이해하기 위해 엔지니어 기술 이용
○ 120억 달러 규모의 국제 핵융합 실험로(International Thermonuclear Ex- perimental Reactor) 위치가 18개월의 논란 끝에 프랑스 Cadarache로 결정
○ Z 나선형 DNA와 B 나선형 DNA의 결합구조 규명, 네이처지 게재
■ 2006년
○ 네안데르탈인 DNA 염기서열 분석
○ 급진전되는 지구 온난화 전망 제기
○ 땅위를 걸어 다닌 물고기 화석 발견
○ 시력감퇴 치료제 개발
○ 생물 다양성의 재발견
○ 최첨단 현미경 기술 개발
○ 기억메커니즘 규명 단초 발견
○ 마이크로 RNA와 siRNA보다 약간 긴 새로운 RNA를 발견
○ 미연방정부 연구비 천만 달러를 받아 일리노이 대학 연구팀이 진행하고 있는 돼지 유전체 해독은 2년 안에 완성될 것으로 기대
○ 미국 부시 대통령이 상하원 합동연설에서 농업 폐기물로부터 바이오에탄올 생산 지원
○ 미국 NIH가 유방암 재발을 예측하기 위해 10년간, 만 명의 환자에 대해 유전자 검사를 실시하는 연구를 개시
○ 미국 당뇨병 협회(ADA)가 농업 및 식량 분야 생명공학에 대한 지원을 재확인
○ 다우사가 최초의 식물 생산 백신에 대한 허가를 취득
○ Renessen사가 생명공학 기술을 이용하여 유용성이 추가된 작물에 대해 최초로 동물 사료로 판매할 수 있는 허가를 취득
○ USDA가 밀의 유전체연구를 위해 18개 대학 밀번식 컨소시엄에 연구비 오백만 달러 지원
○ 오메가-3 지방산을 생산하는 형질전환 돼지 개발
○ 세계무역기구는 EU가 21가지의 농업 생명공학제품에 대해 통상약정을 위반 했다고 발표
○ 프랑스 농무부가 생명공학 옥수수 및 담배 작물에 대해 17가지의 새로운 실지 시험을 허가
○ 마이크로RNA의 초기프로세싱 기전 규명
○ 암 발생 억제기능 SUSP4 유전자의 분리 및 작용 메커니즘 규명
○ 저분자화합물을 이용한 세포노화의 가역적 재프로그래밍
■ 2007년
○ AMPK 효소 항암기능 최초 규명. AMPK 활성화를 통해 대장암 세포가 정상으로 변화
○ 체내 면역반응 조절 ‘브레이크 장치’ 물질 발견
○ ‘스페인감기’ 바이러스를 이용해 조류독감을 치료할 수 있는 길이 열림
○ 화성에 물 존재 증거 발견
○ 자연계에 존재하지 않는 D-아미노산을 손쉽게 합성할 수 있는 신기술 개발
○ 수명이 다하거나 손상을 입은 세포에 죽음의 신호를 보내는 메커니즘 규명
○ 암 발병을 억제하는 유전자의 기능 규명
출처 : 미국 생물산업협회, Science, Nature, Cell

 예산투자
예산투자

출처 : 연도별 생명공학육성시행계획(최종갱신 : 2007년도 시행계획)
* 2006년의 투자실적에는 출연기관의 투자실적 710억원이 포함된 것임
* 2007년도의 정부부문 생명공학 투자 계획 총 예산액은 8,515억원임(2006년 대비 3%증가)
* 1994∼2006 기간 동안의 정부투자는 총 4조 3,659억원(연 증가율 25.6%)
* 동 기간 정부 과학기술예산 증가율 : 11%
|
그림 1-1 |
정부부문 생명공학 투자실적(1994∼2006)
|
표 1-1 |
부처별 생명공학 분야 투자비교(2006년 실적 & 2007년 계획)
(단위 : 백만원)
|
|
과기부 |
교육부 |
농림부 |
산자부 |
복지부 |
환경부 |
해수부 |
정통부 |
출연연 |
총계 |
|
2006년 투자실적 (비율) |
232,463 (28.11) |
60,900 (7.36) |
88,679 (10.72) |
151,906 (18.37) |
162,541 (19.65) |
22,478 (2.72) |
10,700 (1.29) |
26,329 (3.18) |
70,988 (8.58) |
826,984 |
|
2007년 투자계획 (비율) |
247,250 (29.04) |
62,400 (7.33) |
85,172 (10.00) |
171,388 (20.13) |
149,978 (17.61) |
22,179 (2.60) |
11,700 (1.37) |
26,699 (3.14) |
74,743 (8.78) |
851,509 |
|
증감율 |
6%↑ |
3%↑ |
4%↓ |
13%↑ |
8%↓ |
1%↓ |
9%↑ |
1%↑ |
5%↑ |
3%↑ |
출처 :
표 1-2
민간부문 생명공학 투자실적(1994∼2005)
(단위 : 억원)
|
1단계(1994~1997) |
2단계(1998~2001) |
3단계 |
|||||||||||
|
1994 |
1995 |
1996 |
1997 |
소계 |
1998 |
1999 |
2000 |
2001 |
소계 |
2002 |
2003 |
2004 |
2005 |
|
1,260 |
1,537 |
1,769 |
1,863 |
6,429 |
1,876 |
2,353 |
2,695 |
3,481 |
10,405 |
4,095 |
4,749 |
5,661 |
7,366 |
출처 : 산업연구원, 국내생물산업통계(최종갱신 : 2005년도 국내생물산업 통계, 2006년 12월)
* 2005년 총 투자액(7,366억원) = 연구개발투자(4,746억원) + 시설투자(2,620억원)
* IMF시기에는 민간투자가 침체되었으나 점차 회복되어 2005년에는 정부 투자실적을 추월
* 민간부문 투자는 설문조사에 응답한 기업으로 한정된 자료로 정확한 통계 산출은 어려움
 인프라
인프라
|
표 2-1 |
부처별 시설 및 기반구축 사업
|
부처 |
사 업 명 |
사업기간 |
2006실적 |
2007계획 |
주관기관 |
|
과
기
부 |
○ 바이오기술개발사업 - 바이오기반구축사업 |
2001∼계속 |
6,409 |
5,700 |
한국과학재단 |
|
○ 특성화장려사업 - 국가지정연구소소재 은행지원사업 |
1995∼계속 |
2,821 |
2,722 |
과학기술부 |
|
|
○ 국제공동연구사업 - 해외생물소재 확보를 위한 허브형 네트워크 구축‧운영사업 |
2006∼2016 |
3,500 |
3,500 |
한국생명공학연구원 |
|
|
소계 |
|
|
12,730 |
11,922 |
|
|
부처 |
사 업 명 |
사업기간 |
2006실적 |
2007계획 |
주관기관 |
|
농 림 부 |
○ 인프라구축사업 - 지방임업연구기반조성 |
2007∼계속 |
- |
600 |
산림청 |
|
정 통 부 |
○ 정보통신연구기반조성사업 - IT융합기술인프라구축 |
- |
4,530 |
4,500 |
한국전자통신연구원 |
|
산
자
부 |
○ 생물사업 기술기반구축 지원 |
|
16,500 |
7,500 |
한국생산기술연구원 |
|
○ 바이오 분야 국제협약 이행 - 바이오안전성 정보기반구축 - LMO위해성평가센터구축사업 |
2002∼계속 2004∼2007 |
1,100 3,500 |
1,300 2,291 |
생명(연) 생명(연) |
|
|
○ 지역전략산업 진흥 - 바이오클러스터 조성 |
1999∼2009 |
55,296 |
68,294 |
생명(연) 등 20개 기관 |
|
|
○ 생물산업 기술기반 구축 지원 - KOREA 바이오허브구축 등 - 발표미생물종합활용센터 건립 |
2004∼2009 2007∼2010 |
2,200 - |
4,000 4,000 |
서울대 순창군 |
|
|
○산업기술진흥 - 생체적합성의료기기안전성평가 - 기능성식품임상지원센터 - 바이오 분야지역혁신센터 - 바이오기술이전기반구축사업 - 단백질소재의 산업적활용 극대화를 위한 기반구축 - 생물의약의 생산시설표준화기반구축 |
2003∼2007 2004∼2009 2001∼2016 2005∼2010 2005∼2010
2005∼2010 |
1,500 1,000 3,341 327 650
500 |
900 1,000 3,400 500 900
500 |
한국생활환경시험연구원 전북대병원 건국대 외 4곳 바이오벤처협회 생명(연)
생물공학회 |
|
|
○디지털전자산업기반구축 지원 - BIT융합기술산업화지원기반구축 |
2004∼2008 |
5,300 |
2,500 |
전자산업진흥회 |
|
|
소계 |
|
|
91,214 |
97,085 |
|
|
출연 기관 |
○ 전북분원건설사업 ○ LMO위해성평가센터건설 ○ 바이오신약연구동건설 |
2004∼2008 2004∼2007 2005∼2008 |
2,000 3,500 3,920 |
4,000 2,291 4,823 |
생명(연) 생명(연) 생명(연) |
|
소계 |
|
|
9,420 |
11,114 |
|
출처 : 2007년도 생명공학육성시행계획, 과학기술부, 2007
 인력
인력

출처 : 교육인적자원통계서비스(교육통계정보센터(www.std.kedi.re.kr)자료 정리, 2007. 7) * 생명공학 분야 : 교육인적자원통계서비스에 제시된 소계열 분류 중 12개 소계열이 해당 (보건학, 약학, 의료공학, 의학, 재활학, 치의학, 한의학, 농업학, 동물․수의학, 산림‧원예학, 생명공학, 생물학)
|
그림 3-1 |
국내 생명공학 분야 졸업자 현황
|
표 3-1 |
국내 생명공학 분야의 학위별 현황과 전체 분야에서의 비중
(단위 : 명)
|
구분 |
학 사 |
석 사 |
박 사 |
||||||
|
생명공학 분야 |
전체 분야 |
비중 (%) |
생명공학 분야 |
전체 분야 |
비중 (%) |
생명공학 분야 |
전체 분야 |
비중 (%) |
|
|
2003 |
16,949 |
258,126 |
6.57 |
6,262 |
64,259 |
9.74 |
2,345 |
7,240 |
32.39 |
|
2004 |
18,040 |
267,058 |
6.76 |
6,702 |
66,720 |
10.04 |
2,525 |
8,008 |
31.53 |
|
2005 |
18,096 |
268,833 |
6.73 |
7,028 |
68,439 |
10.27 |
2,657 |
8,602 |
30.85 |
|
2006 |
19,201 |
270,546 |
7.10 |
6,980 |
69,834 |
10.00 |
2,494 |
8,909 |
27.99 |
출처 : 교육인적자원통계서비스(교육통계정보센터(www.std.kedi.re.kr)자료 정리,
표 3-2
국내 생명공학 분야 졸업자의 학위별 성별 현황
(단위 : 명)
|
구분 |
학 사 |
석 사 |
박 사 |
총계 |
||||||
|
남자 |
여자 |
소계 |
남자 |
여자 |
소계 |
남자 |
여자 |
소계 |
||
|
2003 |
9,303 |
7,646 |
16,949 |
3,709 |
2,553 |
6,262 |
1,798 |
547 |
2,345 |
25,556 |
|
2004 |
9,534 |
8,506 |
18,040 |
3,923 |
2,779 |
6,702 |
1,896 |
629 |
2,525 |
27,267 |
|
2005 |
9,521 |
8,548 |
18,096 |
3,998 |
3,030 |
7,028 |
1,970 |
684 |
2,657 |
27,781 |
|
2006 |
9,931 |
9,270 |
19,201 |
3,841 |
3,139 |
6,980 |
1,804 |
690 |
2,494 |
28,675 |
출처 : 교육인적자원통계서비스(교육통계정보센터(www.std.kedi.re.kr)자료 정리, 2007. 7)
 논문
논문

출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006(생명공학정책연구센터 재가공)
* SCIE 논문실적 증가 추이는 1994년 29위(420건) ⇨ 2006년 12위(4,539건)[연 22% 증가]
* 세계 유명 저널(NSC) 게재 우수 논문 최근 크게 증가(1994∼2006 : 총 104건)
* NSC : Nature, Science, Cell
|
그림 4-1 |
생명공학 분야 논문 및 NSC 논문 실적(1994∼2006)
|
표 4-1 |
국내의 NSC논문 발표 현황(1994∼2006)
|
|
1994 |
1995 |
1996 |
1997 |
1998 |
1999 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
합계 |
|
NSC 총 합계 |
0 |
2 |
3 |
4 |
7 |
10 |
11 |
14 |
19 |
13 |
18 |
29 |
28 |
158 |
|
생명공학관련 NSC 합계 |
0 |
2 |
1 |
3 |
2 |
7 |
5 |
11 |
11 |
11 |
10 |
23 |
18 |
104 |
|
N(Nature) |
0 |
1 |
1 |
2 |
2 |
3 |
2 |
6 |
4 |
4 |
5 |
14 |
7 |
51 |
|
S(Science) |
0 |
1 |
0 |
1 |
0 |
3 |
2 |
2 |
2 |
5 |
1 |
7 |
4 |
28 |
|
C(Cell) |
0 |
0 |
0 |
0 |
0 |
1 |
1 |
3 |
5 |
2 |
4 |
2 |
7 |
25 |
출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006(생명공학정책연구센터 재가공)
* 전체 NSC(Nature, Sience, Cell) 논문 중 생명공학 관련 논문만을 선별함
* 저자의 소속 국가가 한국(South Korea)으로 표기되어 있는 논문만 포함됨

출처 : KAIST 학술정보처, * 세계 상위 30개 국가간 상대비교에서도 우리의 생명공학 분야 논문 창출 총량 수준이 지속적으로 제고되는 추세
|
그림 4-2 |
전 세계 상위 30개국 논문건수와 한국 논문건수 비교(1994∼2006)
|
표 4-2 |
[SCIE] 게재된 생명공학 분야 논문의 국가별 비교(1994∼2006)
|
국가/연도 |
1단계(1994~1997) |
2단계(1998~2001) |
3단계(2002~2005) |
2006 |
총합계 |
2006순위 |
|
미 국 |
262,050(1위) |
314,652(1위) |
351,928(1위) |
94,481 |
1,023,111 |
1 |
|
영 국 |
54,147 |
63,619 |
64,557 |
16,406 |
198,729 |
2 |
|
일 본 |
51,417 |
66,233 |
66,806 |
16,032 |
200,488 |
3 |
|
독 일 |
43,263 |
55,024 |
58,110 |
15,226 |
171,623 |
4 |
|
프랑스 |
37,551 |
44,076 |
42,853 |
10,927 |
135,407 |
5 |
|
중 국 |
4,190(24위) |
11,571(13위) |
25,527(8위) |
10,685 |
51,973 |
6 |
|
캐나다 |
27,336 |
30,275 |
33,566 |
9,314 |
100,491 |
7 |
|
이탈리아 |
24,043 |
30,147 |
33,424 |
8,917 |
96,531 |
8 |
|
스페인 |
15,001 |
20,638 |
24,484 |
7,020 |
67,143 |
9 |
|
호 주 |
15,569 |
19,922 |
22,093 |
6,184 |
63,768 |
10 |
|
네덜란드 |
16,938 |
19,193 |
20,419 |
5,385 |
61,935 |
11 |
|
대한민국 |
4,175(23위) |
9,103(20위) |
14,155(13위) |
4,539 |
31,972 |
12 |
|
스웨덴 |
13,990 |
16,368 |
17,087 |
4,378 |
51,823 |
13 |
|
브라질 |
4,961(19위) |
9,116(19위) |
13,393(15위) |
4,519 |
31,629 |
14 |
|
인 도 |
8,285(14위) |
10,005(15위) |
12,715(16위) |
4,024 |
35,029 |
15 |
|
스위스 |
11,047 |
13,317 |
13,903 |
3,810 |
42,077 |
16 |
|
벨기에 |
8,271 |
10,477 |
11,467 |
2,964 |
33,179 |
17 |
|
이스라엘 |
7,592 |
9,693 |
10,553 |
2,597 |
30,435 |
18 |
|
덴마크 |
7,385 |
9,107 |
9,815 |
2,566 |
28,873 |
19 |
|
대 만 |
3,766 |
5,723 |
7,611 |
2,415 |
19,515 |
20 |
|
폴란드 |
4,342 |
6,294 |
8,576 |
2,389 |
21,601 |
21 |
|
러시아 |
8,883(13위) |
9,760(16위) |
9,518(20위) |
2,180 |
30,341 |
22 |
|
오스트리아 |
4,856 |
6,799 |
7,654 |
2,007 |
21,316 |
23 |
|
핀란드 |
5,374 |
7,215 |
7,443 |
1,955 |
21,987 |
24 |
|
멕시코 |
3,467 |
5,253 |
6,693 |
1,831 |
17,244 |
25 |
|
그리스 |
2,428 |
2,965 |
5,287 |
1,628 |
13,156 |
26 |
|
노르웨이 |
4,148 |
3,774 |
5,613 |
1,572 |
16,445 |
27 |
|
아르헨티나 |
3,289 |
3,661 |
5,555 |
1,499 |
15,184 |
28 |
|
뉴질랜드 |
3,194 |
3,045 |
4,329 |
1,206 |
12,763 |
29 |
|
홍 콩 |
1,444 |
2,372 |
3,877 |
1,031 |
9,313 |
30 |
출처 : 한국생명공학연구원, 2007
* 미국의 2004∼2006년 결과는 50여개 주별로 3회의 검색결과를 합산하여 일부 중복됨에 따라 다소 증가된 수치
* 1999년 이후 통계는 조사시점 벼로 조금씩 차이가 나며, 특히 2005년은 익년 6월경에 2006년은 익년 2월 말경 조사되어 2006년은 결과 값이 추가될 가능성이 있음
 특허
특허
|
표 5-1 |
국가별 특허건수와 기술력 지수
|
국 가 |
특허건수 |
특허영향지수(PII) |
기술력(TS) |
|||||||||
|
1994∼ 1997 |
1998∼ 2001 |
2002∼ 2006 |
1994∼ 1997 |
1998∼ 2001 |
2002∼ 2006 |
1994∼ 1997 |
순위 |
1998∼ 2001 |
순위 |
2002∼ 2006 |
순위 |
|
|
미 국 |
10,429 |
21,289 |
22,140 |
1.16 |
1.15 |
1.18 |
12,111 |
1 |
24,497 |
1 |
26,107 |
1 |
|
독 일 |
699 |
1,282 |
1,871 |
0.58 |
0.63 |
0.72 |
403 |
3 |
804 |
5 |
1,355 |
2 |
|
영 국 |
459 |
1,031 |
1,012 |
0.84 |
0.92 |
1.29 |
384 |
4 |
948 |
3 |
1,310 |
3 |
|
일 본 |
1,455 |
2,116 |
2,326 |
0.47 |
0.50 |
0.48 |
687 |
2 |
1,050 |
2 |
1,124 |
4 |
|
캐나다 |
368 |
929 |
975 |
0.84 |
0.93 |
0.96 |
311 |
5 |
862 |
4 |
934 |
5 |
|
프랑스 |
403 |
859 |
926 |
0.55 |
0.60 |
0.72 |
223 |
8 |
519 |
6 |
663 |
6 |
|
네덜란드 |
390 |
703 |
1285 |
0.78 |
0.51 |
0.38 |
306 |
6 |
355 |
8 |
483 |
7 |
|
스위스 |
189 |
343 |
522 |
0.62 |
0.79 |
0.86 |
117 |
11 |
271 |
9 |
447 |
8 |
|
덴마크 |
163 |
465 |
669 |
0.74 |
0.88 |
0.52 |
120 |
10 |
408 |
7 |
351 |
9 |
|
벨기에 |
67 |
205 |
352 |
0.63 |
0.60 |
0.92 |
42 |
16 |
123 |
13 |
324 |
10 |
|
호 주 |
142 |
358 |
448 |
0.61 |
0.46 |
0.63 |
87 |
12 |
164 |
12 |
280 |
11 |
|
스웨덴 |
107 |
246 |
289 |
1.23 |
1.08 |
0.89 |
131 |
9 |
265 |
10 |
257 |
12 |
|
이탈리아 |
127 |
186 |
167 |
0.48 |
0.52 |
1.43 |
61 |
14 |
97 |
15 |
239 |
13 |
|
이스라엘 |
112 |
245 |
334 |
0.64 |
0.85 |
0.56 |
71 |
13 |
207 |
11 |
186 |
14 |
|
대한민국 |
47 |
178 |
312 |
0.27 |
0.44 |
0.53 |
13 |
21 |
78 |
17 |
167 |
15 |
|
핀란드 |
49 |
101 |
76 |
0.73 |
0.78 |
1.78 |
36 |
17 |
79 |
16 |
135 |
16 |
|
인 도 |
16 |
65 |
264 |
0.52 |
0.51 |
0.35 |
8 |
23 |
33 |
20 |
92 |
17 |
|
뉴질랜드 |
19 |
43 |
116 |
0.22 |
0.58 |
0.64 |
4 |
28 |
25 |
22 |
75 |
18 |
|
대 만 |
30 |
80 |
193 |
0.50 |
0.36 |
0.38 |
15 |
20 |
29 |
21 |
73 |
19 |
|
오스트리아 |
52 |
84 |
64 |
0.52 |
0.72 |
0.83 |
27 |
18 |
61 |
18 |
53 |
20 |
출처 : 한국특허정보원, 2007
* 특허기술력지수 : 미국등록특허를 이용하여 특허영향지수에 특허건수를 곱한 것

출처 : 한국특허정보원, 2007
* 해당기간에 관련 등록특허가 없거나 특허가 있더라도 피인용이 없는 경우 기술력 지수의 수치가 없음
|
그림 5-1 |
국내 생명공학 세부 분야별 기술력 지수 비교

출처 : 한국특허정보원, 2006
* 2007년 국내 특허자료는 DB 정비관계로 현시점에서는 확인 불가
|
그림 5-2 |
국내 생명공학 특허의 내‧외국인 비교
 산업
산업

출처 : 국내 생물산업 통계(최종갱신 : 2005년도 국내 생물산업 통계), 산업연구원, 2006. 12
* 1994년 이후 2005년까지 생산 규모는 연평균 28.7%의 높은 증가율 기록
|
그림 6-1 |
국내 바이오산업의 시장규모(1994∼2005)

출처 : 국내 생물산업 통계(최종갱신 : 2005년도 국내 생물산업 통계), 산업연구원, 2006. 12
|
그림 6-2 |
국내 바이오산업의 연도별 수요부문(내수와 수출) 규모
|
표 6-1 |
바이오산업의 분야별에 대한 생산규모 연도별 추이(2002∼2005)
(단위: 백만원)
|
구 분 |
2002년 |
2003년 |
2004년 |
2005년 |
평균증가율 (2002~2005) |
|
생산규모(%) |
생산규모(%) |
생산규모(%) |
생산규모(%) |
||
|
생물의약산업 |
638,624(33.7) |
859,955(41.4) |
973,076(40.2) |
1,115,063(40.2) |
20.41% |
|
생물화학산업 |
98,412(5.2) |
100,366(4.8) |
143,029(5.9) |
184,599(6.7) |
23.33% |
|
바이오식품산업 |
888,792(46.9) |
919,049(44.2) |
1,056,073(43.6) |
1,145,259(41.3) |
8.81% |
|
생물환경산업 |
91,487(4.8) |
92,134(4.4) |
112,871(4.7) |
144,373(5.2) |
16.42% |
|
생물공정 및 기기산업 |
61,157(3.2) |
13,440(0.6) |
16,152(0.7) |
18,981(0.7) |
△32.37% |
|
생물전자산업 |
11,609(0.6) |
7,322(0.4) |
45,634(1.9) |
56,454(2.0) |
69.42% |
|
바이오에너지 및 자원산업 |
49,134(2.6) |
43,135(2.1) |
8,891(0.4) |
15,461(0.6) |
△31.98% |
|
생물검정, 정보서비스 및 연구개발업 |
54,167(2.9) |
43,670(2.1) |
64,201(2.7) |
91,196(3.3) |
18.96% |
|
전 체 |
1,893,382(100) |
2,079,070(100) |
2,419,927(100) |
2,771,386(100) |
13.54% |
출처 : 국내 생물산업 통계(최종갱신 : 2005년도 국내 생물산업 통계), 산업연구원,
|
표 6-2 |
바이오산업 분야별 수출입에 대한 연도별 추이(2002∼2005)
(단위: 백만원)
|
구 분 |
2002년 |
2003년 |
2004년 |
2005년 |
||||
|
수출액 |
수입액 |
수출액 |
수입액 |
수출액 |
수입액 |
수출액(%) |
수입액(%) |
|
|
생물의약산업 |
176,717 |
203,041 |
206,320 |
320,244 |
276,832 |
473,760 |
313,012(25.5) |
573,027(72.4) |
|
생물화학산업 |
16,788 |
57,406 |
21,714 |
41,512 |
25,065 |
47,797 |
34,852(2.8) |
51,629(6.5) |
|
바이오식품산업 |
698,504 |
6,180 |
742,012 |
1,468 |
805,284 |
5,092 |
848,204(68.9) |
7,752(1.0) |
|
생물환경산업 |
8,261 |
1,710 |
1,077 |
210 |
1,298 |
2,000 |
5,388(0.4) |
2,370(0.3) |
|
생물공정 및 기기산업 |
10,113 |
174,893 |
11,376 |
146,785 |
12,186 |
141,542 |
8,509(0.7) |
700(0.1) |
|
생물전자산업 |
5,168 |
6,018 |
1,610 |
414 |
7,087 |
171 |
12,540(1.0) |
152,781(19.3) |
|
바이오에너지 및 자원산업 |
1,004 |
60 |
481 |
2,137 |
674 |
2,600 |
756(0.1) |
2,880(0.4) |
|
생물검정, 정보서비스 및 연구개발업 |
2,905 |
24 |
9,258 |
456 |
6,079 |
15 |
7,809(0.6) |
20(0.0) |
|
전 체 |
919,460 |
449,332 |
993,848 |
513,226 |
1,136,509 |
672,977 |
1,231,070 |
791,159 |
출처 : 국내 생물산업 통계(최종갱신 : 2005년도 국내 생물산업 통계), 산업연구원,
그림 6-3
연도별 바이오 벤처기업 창업 추이(1995 이전∼2006)

출처 : 2007 바이오벤처총람, 한국바이오벤처협회, 2007. 7
* 코스닥 등록 벤처 기업 수는 총 61개(2007년 상반기 기준)
* 2000년 이전 8개 기업 등록 → 2000년 이후 53개 기업
|
그림 6-4 |
코스닥 상장 생명공학 기업 추이(1994∼2007. 7)
 시장성과
시장성과
|
표 7-1 |
국내 신약 허가 현황(2007년 4월 기준)
|
No. |
제품명 |
회사명 |
적용증세 |
허가일자 |
유형 |
|
1 |
선플라주 |
SK케미칼 |
위암 |
1999. 7 |
화합물신약 |
|
2 |
EGF외용액 |
대웅제약 |
당뇨성 족부궤양 |
2001. 5 |
바이오신약 |
|
3 |
조인스정 |
SK케미칼 |
관절염 |
2001. 7 |
천연물신약 |
|
4 |
밀리칸주 |
동화약품 |
간암 |
2001. 7 |
방사선약품 |
|
5 |
큐록신정 |
중외제약 |
요로감염증 |
2001. 12 |
화합물신약 |
|
6 |
스티렌캅셀 |
동아제약 |
위염 |
2002. 6 |
천연물신약 |
|
7 |
팩티브정 |
LG생명과학 |
호흡기감염증 |
2002. 12 |
화합물신약 |
|
8 |
캄토벨주 |
종근당 |
난소암, 소세포폐암 |
2003. 10 |
화합물신약 |
|
9 |
맥스마빌정 |
유유 |
골다공증 |
2004. 11 |
복합성분 |
|
10 |
레바넥스정 |
유한양행 |
소화성궤양 |
2005. 9 |
화합물신약 |
|
11 |
자이데나정 |
동아약품 |
발기부전치료제 |
2005. 11 |
화합물신약 |
|
12 |
레보비르캅셀 |
부광약품 |
B형간염치료제 |
2006. 7 |
화합물신약 |
출처 : 한국신약개발연구조합,
표 7-2
미국 FDA 임상허가 취득 국내 신약 현황(2007년 4월 기준)
|
제품명 |
약효명 / 용도 |
기업명 |
개발단계 |
|
FACTIVE |
Quinolone Antibacterial agent |
LG Life Sciences, Ltd. |
Market Launched |
|
hGH |
Growth Deficiency |
LG Life Sciences, Ltd. |
Market Launched |
|
LB80380 |
Anti-HBV therapeutics |
LG Life Sciences, Ltd. |
Phase Ⅱ |
|
Zydena (DA-8159) |
Erectile Dysfunction |
Dong-A Pharmaceutical Co., Ltd. |
Phase Ⅱ |
|
YKP509 |
Antiepilepsy |
SK Corporation |
Phase Ⅱ |
|
YKP10A |
Antideprsssion |
SK Corporation |
Phase Ⅱ |
|
PTH |
Facilitates the formation of bone density |
Vreen Cross Corp. |
Phase Ⅰ |
|
서방형 hGH |
Growth Deficiency |
LG Life Sciences Ltd. |
Phase III |
출처 : 한국신약개발연구조합, 2007. 4
 생명공학육성법
생명공학육성법
제1조 (목적)
이 법은 생명공학연구의 기반을 조성하여 생명공학을 보다 효율적으로 육성․발전시키고 그 개발기술의 산업화를 촉진하여 국민경제의 건전한 발전에 기여하게 함을 목적으로 한다.
제2조 (정의)
이 법에서 “생명공학”이라 함은 다음 각 호의 학문과 기술을 말한다.
1. 산업적으로 유용한 생산물을 만들거나 생산 공정을 개선할 목적으로 생물학적 시스템, 생체, 유전체 또는 그들로부터 유래되는 물질을 연구․활용하는 학문과 기술
2. 생명현상의 기전, 질병의 원인 또는 발병과정에 대한 연구를 통하여 생명공학의 원천지식을 제공하는 생리학․병리학․약리학 등의 학문[이하 “기초의과학”이라 한다]
제3조 (적용범위)
생명공학에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 의한다.
제4조 (생명공학육성기본계획의 수립)
① 제13조의 규정에 의한 관계부처의 장은 소관별로 생명공학육성에 관한 계획을 과학기술부장관에게 제출하여야 한다.
② 과학기술부장관은 제1항의 규정에 의하여 관계부처의 장이 제출한 소관사항에 관한 생명공학육성계획을 종합․조정하여 생명공학육성기본계획(이하 “기본계획”이라 한다)을 수립한다.
③ 제2항의 규정에 의한 기본계획에는 다음의 사항이 포함되어야 한다.
1. 생명공학의 기초연구 및 산업적 응용연구의 육성에 관한 종합계획과 지침
2. 생명공학의 연구에 필요한 인력자원의 개발종합계획과 인력자원의 효율적인 활용에 관한 지침
3. 생명공학의 연구 및 이와 관련된 산업기술 인력의 국제교류와 해외과학기술자의 활용에 관한 계획과 그 지침
④ 과학기술부장관은 기본계획을 수립하고자 할 때에는 제6조의 생명공학종합정책심의회의 심의를 거쳐야 한다.
제5조 (생명공학육성 연차별 시행계획의 수립 등)
① 관계부처의 장은 기본계획에 따라 생명공학육성 연차별 시행계획(이하 “시행계획”이라 한다)을 수립하고 이를 시행하여야 한다.
② 관계부처의 장은 시행계획을 수립하고자 할 때에는 미리 과학기술부장관과 협의하여야 한다.
③ 과학기술부장관은 시행계획의 수립을 위하여 필요한 때에는 그 계획의 수립에 필요한 기본지침을 작성하여 관계부처의 장에게 통보할 수 있다.
④ 시행계획의 수립 및 그 시행에 관하여 필요한 사항은 대통령령으로 정한다.
제6조 (생명공학종합정책심의회)
① 기본계획의 수립과 그 집행 및 조정에 관한 업무를 관장하기 위하여 과학기술부장관소속하에 생명공학종합정책심의회(이하 “심의회”라 한다)를 둔다.
② 심의회는 다음 사항을 심의 결정한다.
1. 생명공학의 기초연구 및 산업적 응용연구의 육성에 관한 계획의 수립 및 그 집행의 조정
2. 생명공학의 연구 및 기술개발에 관한 기본계획의 수립과 이에 따른 중요정책의 수립 및 그 집행의 조정
3. 생명공학 분야 인력개발에 관한 종합계획과 이에 따른 중요정책, 인력활용지침의 수립 및 그 집행의 조정
4. 생명공학의 연구 및 이와 관련된 산업기술 인력의 개발교류와 해외과학기술자의 활용에 관한 계획의 수립 및 그 집행의 조정
5. 유전자원의 이용과 보전을 위한 연구개발계획의 수립 및 그 집행의 조정
6. 기타 생명공학육성에 관하여 과학기술부장관이 필요하다고 인정하는 사항
③ 심의회는 위원장 1인을 포함한 17인 이내의 위원으로 구성한다.
④ 위원장은 과학기술부장관이 되고 위원은 다음 각 호의 자가 된다.
1. 대통령령이 정하는 관계 중앙행정기관의 차관급 공무원
2. 학계․연구기관 또는 산업계에 종사하는 생명공학 관계자 및 생명윤리 전문가
⑤ 이 법에서 규정한 사항 외에 심의회의 조직 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
제7조 삭제 <2003. 12. 30>
제8조 삭제 <2003. 12. 30>
제9조 (연구 및 기술협력)
과학기술부장관은 생명공학의 연구 및 기술에 관한 국제협력의 증진에 노력하고 선진기술의 도입을 위한 효율적인 방안을 강구한다.
제10조 (공동연구의 촉진)
정부는 생명공학연구 및 기술개발의 효율적 육성을 위하여 학계․연구기관 및 산업계간의 공동연구를 촉진하여야 한다.
제11조 (생명공학의 산업적 응용촉진에 대한 지원)
정부는 생명공학 연구개발을 활성화하고 그 결과의 산업적 응용을 촉진하기 위하여 다음 각 호의 사항에 대한 지원시책을 강구하여야 한다.
1. 생명공학관련 신기술제품의 생산지원에 관한 사항
2. 생명공학 연구결과의 산업적 응용을 촉진하기 위한 연구개발 및 지역거점 구축에 관한 사항
3. 생명공학관련 중소․벤처기업의 창업지원에 관한 사항
제12조 (기술정보의 수집과 보급)
정부는 생명공학연구에 관한 정보를 수집, 관계기관에 보급함으로써 연구개발 촉진에 노력하여야 한다.
제13조 (생명공학육성시책강구 등)
① 정부는 생명공학의 효율적인 육성을 위하여 생명공학의 기초연구 및 산업적 응용연구에 관하여 다음 각 호의 시책을 강구한다. 다만, 기초의과학 분야의 연구개발 촉진 및 육성업무는 과학기술부장관 및 보건복지부장관의 소관으로 한다.
1. 교육인적자원부장관은 생명공학 분야의 연구를 촉진시키기 위한 전문 인력의 양성과 생명공학기초 분야의 연구지원
2. 과학기술부장관은 제4조 제2항의 규정에 의한 기본계획의 수립과 부처별 정책수립의 지원 및 종합조정, 생명공학관련 기초기술 및 첨단기술의 개발지원, 과학기술 분야의 유용한 유전자의 확보․분석․이용․보전을 위한 연구의 지원, 생명공학 지원기관의 육성․발전
3. 농림부장관은 동식물 및 미생물의 육종․품종개량 및 식품소재의 개발 등 응용연구의 지원 및 농림 분야의 유용한 유전자의 확보․분석․이용․보존 등 기초연구의 지원 및 연구기관의 육성․발전
4. 산업자원부장관은 생명공학관련 산업공정의 개발과 개선, 신․재생에너지개발, 에너지 및 광물자원의 효율적 활용, 생명공학관련 생산기술개발 등의 지원과 그 개발기술의 산업화 촉진
4의2. 정보통신부장관은 생명공학의 육성․발전을 위한 정보통신기술의 개발 지원
5. 보건복지부장관은 보건․의료․식품위생 등 생명공학과 관련되는 기술에 대한 연구개발의 촉진과 관련 전문 인력 양성, 임상시험 관련사업 육성 및 연구의 지원
6. 환경부장관은 생물다양성의 보전, 그 구성요소의 지속가능한 이용 및 생명공학기술을 이용한 폐수․폐기물의 처리 및 환경오염의 방지 등을 위한 기술개발과 기초연구 및 응용연구의 지원
7. 해양수산부장관은 해양수산생물을 이용한 유용물질의 생산과 해양수산생물의 육종․개량 및 식품소재의 개발 등 응용연구의 지원, 해양수산 분야의 유용한 유전자의 확보․분석․이용․보존 등 기초연구의 지원, 해양오염방지 등을 위한 기술개발 및 연구기관의 육성․발전
② 과학기술부장관과 보건복지부장관은 기초의과학을 육성하기 위한 시책을 수립하고자 하는 때에는 협의하여야 한다.
제14조 (검정 및 임상)
① 정부는 생명공학 관련제품에 대한 임상 및 검정체제를 확립한다.
② 제1항의 임상 및 검정체제 확립에 관하여 필요한 사항은 대통령령으로 정한다.
제15조 (실험지침의 작성․시행 등)
① 정부는 생명공학연구 및 산업화의 촉진을 위한 실험지침을 작성․시행하여야 한다.
② 제1항의 실험지침에서는 생명공학의 연구와 이의 산업화 과정에서 예견될 수 있는 생물학적 위험성, 환경에 미치는 악영향 및 윤리적 문제발생의 사전방지에 필요한 조치가 강구되어야 하며, 유전적으로 변형된 생물체의 이전․취급․사용에 대한 안전기준이 마련되어야 한다.
제16조 (한국생명공학연구원)
① 생명공학연구[다만, 기초의과학 연구를 제외한다. 이하 이 조에서 같다] 및 유전자원의 이용과 보전에 관한 연구의 중추적 기능을 담당하고 생명공학 분야에서의 학계․연구기관 및 산업계간의 상호 유기적 협조체제를 유지․발전시키며, 이들을 지원하기 위하여 재단법인인 한국생명공학연구원(이하 “연구원”이라 한다)을 설립할 수 있다.
② 제1항의 규정에 의한 연구원은 특정연구기관육성법의 적용을 받는 특정연구기관으로 한다.
③ 삭제 <1995. 12. 6>
제17조 (기초의과학육성지원기구)
① 정부는 기초의과학을 육성하기 위하여 기초의과학육성지원기구(이하 “육성지원기구”라 한다)를 지정하여 운영할 수 있다.
② 정부는 예산의 범위 안에서 육성지원기구의 운영에 필요한 경비를 지원할 수 있다.
③ 육성지원기구의 지정 및 운영에 관하여 필요한 사항은 대통령령으로 정한다.
제18조 삭제 <1995. 12. 6>
제19조 (사후승인 통관절차)
① 삭제 <2003. 12. 30>
② 생명공학연구 활동에 필요한 관련 자재․기기 또는 시약 중 국내에서 생산되지 아니하는 품목 중 변질 기타로 인하여 시기적으로 그 안정성의 확보가 어려운 시약 등에 대해서는 관세법의 절차에 불구하고 대통령령이 정하는 바에 의하여 사후 승인의 통관절차로 대신할 수 있다.
제20조 삭제 <2003. 12. 30>
부칙(정부조직법) <제4268호, 1990. 12. 27>
제1조 (시행일) 이 법은 공포한 날부터 시행한다. <단서 생략>
제2조 및 제3조 생략
제4조 (문교부의 명칭변경에 따른 다른 법률의 개정) ①내지 <42>생략
<43>유전공학육성법 중 다음과 같이 개정한다.
제13조 제1호 중 “문교부장관”을 “교육부장관”으로 한다.
<44>내지 <50>생략
제5조 내지 제10조 생략
부칙(정부조직법) <제4541호, 1993. 3. 6>
제1조 (시행일) 이 법은 공포한 날부터 시행한다.
제2조 및 제3조 생략
제4조 (상공자원부 신설에 따른 다른 법률의 개정) ①유전공학육성법 중 다음과 같이 개정한다.
제13조 제3호를 다음과 같이 하고, 동조 제4호를 삭제한다.
3. 상공자원부장관은 유전공학연구를 통한 산업공정의 개발과 개선, 대체에너지 개발, 에너지절약 및 광물자원의 효율적 이용
② 내지 <100>생략
제5조 생략
부칙 <제4938호, 1995. 1. 5>
이 법은 공포 후 6월이 경과한 날부터 시행한다.
부칙(기금관리기본법) <제4980호, 1995. 12. 6>
제1조 (시행일) 이 법은 1996년 1월 1일부터 시행한다. <단서 생략>
제2조 (다른 법률의 개정) ① 생략
② 생명공학육성법 중 다음과 같이 개정한다.
제16조 제3항․제17조 및 제18조를 각각 삭제한다.
③ 내지 <24>생략
부칙 <제5400호, 1997. 8. 28>
이 법은 공포 후 3월이 경과한 날부터 시행한다.
부칙(정부조직법) <제6400호, 2001. 1. 29>
제1조 (시행일) 이 법은 공포한 날부터 시행한다. <단서 생략>
제2조 생략
제3조 (다른 법률의 개정) ①내지 <60>생략
<61>생명공학육성법 중 다음과 같이 개정한다.
제13조 제1호 중 “교육부장관”을 “교육인적자원부장관”으로 한다.
<62>내지 <79>생략
제4조 생략
부칙 <제7014호, 2003. 12. 30>
이 법은 공포 후 6월이 경과한 날부터 시행한다.
부칙(신에너지 및 재생에너지개발․이용․보급촉진) <제7284호, 2004. 12. 31>
제1조 (시행일) 이 법은 공포 후 6월이 경과한 날부터 시행한다.
제2조 및 제3조 생략
제4조 (다른 법률의 개정) ① 내지 ③ 생략
④ 생명공학육성법 중 다음과 같이 개정한다.
제13조 제1항 제4호 중 “대체에너지개발”을 “신․재생에너지개발”로 한다.
⑤ 내지 ⑧ 생략
제5조 생략
 생명윤리 및 안전에 관한 법률
생명윤리 및 안전에 관한 법률
제1장 총칙
제1조 (목적)
이 법은 생명공학기술에 있어서의 생명윤리 및 안전을 확보하여 인간의 존엄과 가치를 침해하거나 인체에 위해를 주는 것을 방지하고, 생명공학기술이 인간의 질병 예방 및 치료 등을 위하여 개발․이용될 수 있는 여건을 조성함으로써 국민의 건강과 삶의 질 향상에 이바지함을 목적으로 한다.
제2조 (정의)
이 법에서 사용하는 용어의 정의는 다음과 같다.
1. “생명공학기술”이라 함은 인간의 배아(胚芽)ㆍ세포ㆍ유전자 등을 대상으로 생명현상을 규명ㆍ활용하는 과학과 기술을 말한다.
2. “배아”라 함은 수정란 및 수정된 때부터 발생학적으로 모든 기관이 형성되는 시기까지의 분열된 세포군을 말한다.
3. “잔여배아”라 함은 인공수정으로 생성된 배아 중 임신의 목적으로 이용하고 남은 배아를 말한다.
4. “체세포핵이식행위”라 함은 핵이 제거된 인간 또는 동물의 난자에 인간의 체세포 핵을 이식하는 것을 말한다.
5. “체세포복제배아(體細胞複製胚芽)”라 함은 체세포핵이식행위에 의하여 생성된 배아를 말한다.
6. “유전자검사”라 함은 개인의 식별, 특정한 질병 또는 소인(素因)의 검사 등의 목적으로 혈액ㆍ모발ㆍ타액(唾液) 등의 검사대상물로부터 염색체ㆍ유전자 등을 분석하는 행위를 말한다.
7. “유전정보”라 함은 유전자검사의 결과로 얻어진 정보를 말한다.
8. “유전자은행”이라 함은 유전정보의 획득을 목적으로 검사대상물ㆍ유전자 또는 개인정보가 포함된 유전정보(이하 “유전정보 등”이라 한다)를 수집ㆍ보존하여 이를 직접 이용하거나 타인에게 제공하는 기관을 말한다.
9. “유전자치료”라 함은 질병의 예방 또는 치료를 목적으로 유전적 변이를 일으키는 일련의 행위를 말한다.
제3조 (적용범위)
생명공학기술에 있어서의 생명윤리 및 안전에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 의한다.
제4조 (책무)
① 국가 또는 지방자치단체는 생명공학기술의 개발ㆍ이용과정에서 일어날 수 있는 생명윤리 및 안전에 관한 문제에 효율적으로 대처할 수 있도록 필요한 시책을 마련하여야 한다.
② 생명공학기술을 연구ㆍ개발 및 이용하고자 하는 자는 생명공학기술이 인간의 존엄과 가치를 침해하지 아니하고 생명윤리 및 안전에 적합하도록 노력하여야 한다.
제5조 (자기결정권)
누구든지 자신이 생명공학기술의 적용대상이 되는 경우 생명윤리 및 안전에 관하여 충분한 설명을 들은 후 이에 관한 동의여부를 결정할 권리를 가진다.
제2장 국가생명윤리심의위원회 및 기관생명윤리심의위원회
제6조 (국가생명윤리심의위원회의 설치 및 기능)
① 생명공학기술에 있어서의 생명윤리 및 안전에 관한 다음 각 호의 사항을 심의하기 위하여 대통령소속하에 국가생명윤리심의위원회(이하 “심의위원회”라 한다)를 둔다.
1. 국가의 생명윤리 및 안전에 관한 정책의 수립에 관한 사항
2. 제17조 제3호의 규정에 따라 잔여배아를 이용할 수 있는 연구의 종류ㆍ대상 및 범위에 관한 사항
3. 제22조 제2항의 규정에 따라 체세포핵이식행위를 할 수 있는 연구의 종류ㆍ대상 및 범위에 관한 사항
4. 제25조 제1항의 규정에 따라 금지되는 유전자검사의 종류에 관한 사항
5. 제36조 제1항 제3호의 규정에 따라 유전자치료를 할 수 있는 질병의 종류
6. 그 밖에 윤리적ㆍ사회적으로 심각한 영향을 미칠 수 있는 생명공학기술의 연구ㆍ개발 또는 이용에 관하여 심의위원회의 위원장이 부의하는 사항
② 심의위원회의 위원장은 제1항 제1호 내지 제5호의 규정에 해당하는 사항으로서 재적위원 3분의 1 이상이 발의한 사항에 관하여는 심의위원회에 이를 부의하여야 한다.
제7조 (심의위원회의 구성)
① 심의위원회는 위원장 1인, 부위원장 1인을 포함한 16인 이상 21인 이하의 위원으로 구성한다.
② 위원장은 위원 중에서 대통령이 임명 또는 위촉하고, 부위원장은 위원 중에서 호선한다.
③ 위원은 다음 각 호의 자가 된다.
1. 교육인적자원부장관ㆍ법무부장관ㆍ과학기술부장관ㆍ산업자원부장관ㆍ보건복지부장관ㆍ여성가족부장관ㆍ법제처장
2. 생명공학 또는 의과학(醫科學) 분야에 전문지식과 연구경험이 풍부한 학계ㆍ연구계 또는 산업계를 대표하는 자중에서 대통령이 위촉하는 7인 이내의 자
3. 종교계ㆍ철학계ㆍ윤리학계ㆍ사회과학계ㆍ법조계ㆍ시민단체(비영리민간단체지원법 제2조의 규정에 의한 비영리민간단체를 말한다) 또는 여성계를 대표하는 자중에서 대통령이 위촉하는 7인 이내의 자
④ 제3항 제2호 및 제3호의 위원의 임기는 3년으로 하되, 연임할 수 있다.
⑤ 심의위원회에 간사위원 2인을 두되, 간사위원은 과학기술부장관과 보건복지부장관으로 하며, 수석간사위원은 보건복지부장관으로 한다.
제8조 (심의위원회의 운영)
① 심의위원회의 효율적인 운영을 위하여 심의위원회에 분야별 전문위원회를 둘 수 있다.
② 심의위원회의 사무는 수석간사위원이 처리한다.
③ 심의위원회의 회의 등 활동은 공개함을 원칙으로 한다.
④ 이 법에서 규정한 것 외에 심의위원회 및 전문위원회의 구성ㆍ운영 그 밖에 필요한 사항은 대통령령으로 정한다.
제9조 (기관생명윤리심의위원회의 설치 및 기능)
① 다음 각 호의 기관은 생명공학기술에 있어서의 생명윤리 및 안전을 확보하기 위하여 당해 기관에 기관생명윤리심의위원회(이하 “기관위원회”라 한다)를 두어야 한다.
1. 제18조의 규정에 따라 보건복지부장관에게 등록한 배아연구기관
2. 제32조 제1항 본문의 규정에 따라 보건복지부장관의 허가를 받은 유전자은행
3. 제37조 제2항의 규정에 의한 유전자치료기관
4. 그 밖에 윤리적ㆍ사회적으로 심각한 영향을 미칠 수 있는 생명공학기술을 연구ㆍ개발 또는 이용하는 기관으로서 보건복지부령이 정하는 기관
② 기관위원회는 제1항 각 호의 기관에서 행하여지는 생명공학기술의 연구ㆍ개발 또는 이용에 관하여 다음 각 호의 사항을 심의한다.
1. 생명공학기술 연구계획서의 윤리적ㆍ과학적 타당성
2. 환자 또는 정자ㆍ난자ㆍ검사대상물의 제공자로부터 적법한 절차에 따라 동의를 받았는지의 여부
3. 환자, 정자ㆍ난자ㆍ검사대상물의 제공자 또는 유전정보의 주체에 대한 안전대책 및 정자ㆍ난자ㆍ검사대상물을 타인에게 제공하는 경우에 성명ㆍ주민등록번호 등 개인을 식별할 수 있는 정보(이하 “개인정보”라 한다)에 대한 보호대책
4. 그 밖에 제1항 각 호의 기관에서 행하여지는 생명공학기술의 연구ㆍ개발 또는 이용에 관한 사항
③ 제1항 각 호의 기관의 장은 당해 기관에서 행하여지는 생명공학기술의 연구ㆍ개발 또는 이용으로 인하여 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있는 경우에는 지체 없이 기관위원회를 소집하여 이를 심의하도록 하고, 그 결과를 보건복지부장관에게 보고하여야 한다.
④ 제1항 각 호의 기관 중 기관의 규모 또는 연구자 수 등이 보건복지부령이 정하는 기준 이하인 기관이 기관위원회를 설치한 동종의 기관과 제2항 각호 및 제3항의 규정에 의한 사항의 심의에 관한 협약을 체결한 경우에는 제1항의 규정에 불구하고 기관위원회를 설치한 것으로 본다.
제10조 (기관위원회의 구성 및 운영)
① 기관위원회는 위원장 1인을 포함하여 5인 이상 9인 이하의 위원으로 구성하되, 생명공학 또는 의과학 분야 외의 종사자 1인과 해당 기관에 종사하지 아니하는 자 1인이 포함되어야 한다.
② 위원은 제9조 제1항 각 호의 기관의 장이 위촉하며, 위원장은 위원 중에서 호선한다.
③ 기관위원회의 심의대상인 연구ㆍ개발 또는 이용에 관여하는 위원은 해당 연구ㆍ개발 또는 이용과 관련된 심의에 참여하여서는 아니 된다.
④ 그 밖에 기관위원회의 구성 및 운영에 관하여 필요한 사항은 대통령령으로 정한다.
제3장 배아 등의 생성ㆍ연구
제1절 인간복제 등의 금지
제11조 (인간복제의 금지)
① 누구든지 체세포복제배아를 자궁에 착상시켜서는 아니 되며, 착상된 상태를 유지하거나 출산하여서는 아니 된다.
② 누구든지 제1항의 규정에 의한 행위를 유인 또는 알선하여서는 아니 된다.
제12조 (이종 간의 착상 등 금지)
① 누구든지 인간의 배아를 동물의 자궁에 착상시키거나 동물의 배아를 인간의 자궁에 착상시키는 행위를 하여서는 아니 된다.
② 누구든지 다음 각 호의 1에 해당하는 행위를 하여서는 아니 된다.
1. 인간의 난자를 동물의 정자로 수정시키거나 동물의 난자를 인간의 정자로 수정시키는 행위. 다만, 의학적으로 인간의 정자의 활동성 시험을 위한 경우를 제외한다.
2. 핵이 제거된 인간의 난자에 동물의 체세포 핵을 이식하는 행위
3. 인간의 배아와 동물의 배아를 융합하는 행위
4. 다른 유전정보를 가진 인간의 배아를 융합하는 행위
③ 누구든지 제2항 각 호의 1에 해당하는 행위로부터 생성된 것을 인간 또는 동물의 자궁에 착상시키는 행위를 하여서는 아니 된다.
제2절 인공수정배아
제13조 (배아의 생성 등)
① 누구든지 임신 외의 목적으로 배아를 생성하여서는 아니 된다.
② 누구든지 임신을 목적으로 배아를 생성함에 있어서 다음 각 호의 1에 해당하는 행위를 하여서는 아니 된다.
1. 특정의 성을 선택할 목적으로 정자와 난자를 선별하여 수정시키는 행위
2. 사망한 자의 정자 또는 난자로 수정시키는 행위
3. 미성년자의 정자 또는 난자로 수정시키는 행위. 다만, 혼인한 미성년자가 그 자녀를 얻기 위한 경우를 제외한다.
③ 누구든지 금전 또는 재산상의 이익 그 밖에 반대급부를 조건으로 정자 또는 난자를 제공 또는 이용하거나 이를 유인 또는 알선하여서는 아니 된다.
제14조 (배아생성의료기관)
① 인공수태시술을 위하여 정자 또는 난자를 채취ㆍ보관하거나 이를 수정시켜 배아를 생성하고자 하는 의료기관은 보건복지부장관으로부터 배아생성의료기관으로 지정받아야 한다.
② 배아생성의료기관으로 지정받고자 하는 의료기관은 보건복지부령이 정하는 시설 및 인력 등을 갖추어야 한다.
③ 배아생성의료기관의 지정기준 및 절차, 제출서류 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제15조 (배아의 생성 등에 관한 동의)
① 제14조의 규정에 따라 배아생성의료기관으로 지정받은 의료기관(이하 “배아생성의료기관”이라 한다)은 배아를 생성하기 위하여 정자 또는 난자를 채취하는 때에는 정자제공자ㆍ난자제공자ㆍ인공수태시술대상자 및 그 배우자(이하 “동의권자”라 한다)의 서면동의를 얻어야 한다.
② 제1항의 규정에 의한 서면동의에는 다음 각 호의 사항이 포함되어야 한다.
1. 배아생성의 목적에 관한 사항
2. 배아의 보존기간 그 밖에 배아의 보관에 관한 사항
3. 배아의 폐기에 관한 사항
4. 임신 외의 목적으로 잔여배아를 이용하는 것에 대한 동의여부
5. 동의의 철회, 동의권자의 권리 및 정보보호 그 밖에 보건복지부령이 정하는 사항
③ 배아생성의료기관은 제1항의 규정에 의한 서면동의를 받기 전에 동의권자에게 제2항 각 호의 사항에 대하여 충분히 설명하여야 한다.
④ 제1항의 규정에 의한 서면동의를 위한 동의서의 서식 및 보존 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제16조 (배아의 보존기간 및 폐기)
① 배아의 보존기간은 5년으로 한다. 다만, 동의권자가 보존기간을 5년 미만으로 정한 경우에는 이를 보존기간으로 한다.
② 배아생성의료기관은 제1항의 규정에 의한 보존기간이 도래한 배아 중 제17조의 규정에 의한 연구의 목적으로 이용하지 아니하고자 하는 배아를 폐기하여야 한다.
③ 배아생성의료기관은 배아의 폐기에 관한 사항을 기록ㆍ보관하여야 한다.
④ 배아의 폐기 절차 및 방법, 배아의 폐기에 관한 사항의 기록ㆍ보관에 관하여 필요한 사항은 보건복지부령으로 정한다.
제17조 (잔여배아의 연구)
제16조의 규정에 의한 배아의 보존기간이 경과된 잔여배아는 발생학적으로 원시선이 나타나기 전까지에 한하여 체외에서 다음 각 호의 1의 목적으로 이용할 수 있다. 다만, 보존기간을 5년 미만으로 정한 잔여배아를 이용하고자 하는 경우에는 동의권자로부터 해당 목적으로의 이용에 대하여 새로이 동의를 받아야 한다.
1. 불임치료법 및 피임기술의 개발을 위한 연구
2. 근이영양증 그 밖에 대통령령이 정하는 희귀ㆍ난치병의 치료를 위한 연구
3. 그 밖에 심의위원회의 심의를 거쳐 대통령령이 정하는 연구
제18조 (배아연구기관)
제17조의 규정에 따라 잔여배아를 연구하고자 하는 자는 보건복지부령이 정하는 시설ㆍ인력 등을 갖추고 보건복지부장관에게 배아연구기관으로 등록하여야 한다.
제19조 (배아연구계획서의 승인)
① 제18조의 규정에 따라 보건복지부장관에게 등록한 배아연구기관(이하 “배아연구기관”이라 한다)이 제17조의 규정에 의한 배아연구를 하고자 하는 때에는 보건복지부령이 정하는 바에 따라 미리 보건복지부장관에게 배아연구계획서를 제출하여 승인을 얻어야 한다. 대통령령이 정하는 중요한 사항을 변경하는 경우에도 또한 같다.
② 제1항의 규정에 의한 배아연구계획서에는 배아연구기관 안에 설치된 기관위원회의 심의결과에 관한 서류가 첨부되어야 한다.
③ 보건복지부장관은 다른 중앙행정기관의 장이 연구비를 지원하는 배아연구기관으로부터 연구계획서를 제출받은 때에는 승인여부를 결정하기 전에 그 중앙행정기관의 장과 협의하여야 한다.
④ 배아연구계획서의 승인기준 및 절차, 제출서류 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제20조 (잔여배아의 제공 및 관리)
① 배아생성의료기관이 제19조 제1항의 규정에 따라 배아연구계획서의 승인을 얻은 배아연구기관에게 연구에 필요한 잔여배아를 제공하는 경우에는 무상으로 하여야 한다. 다만, 배아생성의료기관은 잔여배아의 보관 및 제공에 필요한 경비를 보건복지부령이 정하는 바에 따라 배아연구기관에 요구할 수 있다.
② 제1항의 규정에 의한 잔여배아의 제공절차, 경비의 산출 그 밖에 필요한 사항은 보건복지부령으로 정한다.
③ 배아생성의료기관과 배아연구기관은 잔여배아의 보관 및 제공 등에 관한 사항을 보건복지부령이 정하는 바에 따라 보건복지부장관에게 보고하여야 한다.
④ 제16조 제2항 내지 제4항의 규정은 배아연구기관이 제1항의 규정에 따라 잔여배아를 제공받은 후 연구의 목적으로 이용하지 아니하고자 하는 잔여배아의 폐기에 관하여 이를 준용한다. 이 경우 “배아생성의료기관”은 “배아연구기관”으로 본다.
제21조 (배아생성의료기관 및 배아연구기관의 준수사항)
배아생성의료기관 및 배아연구기관은 다음 각 호의 사항을 준수하여야 한다.
1. 제15조의 규정에 의한 동의서에 기재된 목적으로 배아를 취급할 것
2. 잔여배아의 보관ㆍ취급ㆍ폐기 등의 관리를 철저히 할 것
3. 배아연구기관은 당해 기관에서 행하여지는 연구로 인하여 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있는 경우에는 연구의 중단 등 적절한 조치를 취할 것
4. 그 밖에 제1호 내지 제3호에 준하는 사항으로서 생명윤리 및 안전의 확보를 위하여 필요하다고 인정하여 보건복지부령이 정하는 사항
제3절 체세포복제배아
제22조 (체세포핵이식행위)
① 누구든지 제17조 제2호의 규정에 의한 희귀ㆍ난치병의 치료를 위한 연구목적 외에는 체세포핵이식행위를 하여서는 아니 된다.
② 제1항의 규정에 의한 연구목적에 따라 체세포핵이식행위를 할 수 있는 연구의 종류ㆍ대상 및 범위는 심의위원회의 심의를 거쳐 대통령령으로 정한다.
제23조 (체세포복제배아의 생성 및 연구)
① 체세포복제배아를 생성하거나 연구하고자하는 자는 보건복지부령이 정하는 시설 및 인력 등을 갖추고 보건복지부장관에게 등록하여야 한다.
② 제19조 내지 제21조의 규정은 체세포복제배아의 연구에 관하여 이를 준용한다. 이 경우 “잔여배아”는 “체세포복제배아”로 본다.
제4장 유전자검사
제24조 (유전자검사기관 등)
① 유전자검사를 하고자 하는 자 또는 직접 검사대상물을 채취하여 유전자에 관한 연구를 하고자 하는 자는 유전자검사시설 또는 연구시설의 소재지, 기관장, 유전자검사 또는 연구항목 등의 사항에 대하여 보건복지부령이 정하는 바에 따라 보건복지부장관에게 신고하여야 한다. 다만, 국가기관이 유전자검사 또는 유전자에 관한 연구를 하는 경우에는 그러하지 아니하다.
② 제1항의 규정에 따라 신고한 사항 중 대통령령이 정하는 중요한 사항을 변경하는 경우에도 제1항과 같다.
③ 보건복지부장관은 제1항의 규정에 따라 신고한 유전자검사를 하고자 하는 자(이하 “유전자검사기관”이라 한다)로 하여금 보건복지부령이 정하는 바에 따라 유전자검사의 정확도 평가를 받게 할 수 있고, 그 결과를 공개할 수 있다.
④ 유전자검사기관은 유전자검사의 업무를 폐업하거나 휴업하고자 하는 경우에는 보건복지부령이 정하는 바에 따라 보건복지부장관에게 신고하여야 한다.
제25조 (유전자검사의 제한)
① 유전자검사기관은 과학적 입증이 불확실하여 검사대상자를 오도(誤導)할 우려가 있는 신체외관이나 성격에 관한 유전자검사 그 밖에 심의위원회의 심의를 거쳐 대통령령이 정하는 유전자검사를 하여서는 아니 된다.
② 유전자검사기관은 근이영양증 그 밖에 대통령령이 정하는 유전질환을 진단하기 위한 목적 외에는 배아 또는 태아를 대상으로 유전자검사를 하여서는 아니 된다.
③ 의료기관이 아닌 유전자검사기관에서는 질병의 진단과 관련한 유전자검사를 할 수 없다. 다만, 의료기관의 의뢰를 받아 유전자검사를 하는 경우에는 그러하지 아니하다.
제26조 (유전자검사의 동의)
① 유전자검사기관 또는 유전자에 관한 연구를 하는 자가 유전자검사 또는 유전자연구에 쓰일 검사대상물을 직접 채취하거나 채취를 의뢰하는 때에는 검사대상물을 채취하기 전에 검사대상자로부터 다음 각 호의 사항이 포함된 서면동의를 얻어야 한다.
1. 유전자검사 또는 유전자연구의 목적
2. 제1호의 규정에 의한 목적 외로 검사대상물을 이용하거나 타인에게 제공하는 것에 대한 동의여부 및 그 범위에 관한 사항
3. 제2호의 규정에 따라 검사대상물을 타인에게 제공하는 경우에 개인정보를 포함 시킬 것인지 여부
4. 검사대상물의 보존기간 및 관리에 관한 사항
5. 동의의 철회, 검사대상자의 권리 및 정보보호 그 밖에 보건복지부령이 정하는 사항
② 유전자검사기관외의 자가 검사대상물을 채취하여 유전자검사기관에 유전자검사를 의뢰하는 경우에는 검사대상자로부터 제1항의 규정에 의한 서면동의를 얻어 이를 첨부하여야 한다. 이 경우 보건복지부령이 정하는 바에 따라 개인정보를 보호하기 위한 조치를 취하여야 한다.
③ 검사대상자가 미성년자ㆍ심신박약자 또는 심신상실자인 경우에는 제1항의 규정에 의한 본인의 동의 외에 법정대리인의 동의를 얻어야 한다. 다만, 질병의 진단 또는 치료를 목적으로 유전자검사를 하는 경우에 있어서 심신박약 또는 심신상실 등의 사유로 본인의 동의를 얻을 수 없는 때에는 이를 생략할 수 있다.
④ 제1항 내지 제3항의 규정에 불구하고 다음 각 호의 1에 해당하는 경우에는 서면동의 없이 유전자검사를 할 수 있다.
1. 시체 또는 의식불명의 자에 대하여 개인 식별을 하여야 할 긴급한 필요가 있거나 특별한 사유가 있는 경우
2. 다른 법률에 특별한 규정이 있는 경우
⑤ 제1항 내지 제3항의 규정에 따라 서면동의를 얻고자 하는 자는 미리 검사대상자 또는 법정대리인에게 유전자검사의 목적과 방법, 예측되는 유전자검사의 결과와 의미 등에 대하여 충분히 설명하여야 한다.
⑥ 제1항 내지 제3항의 규정에 의한 동의의 절차 및 동의서의 서식 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제27조 (검사대상물의 제공)
① 유전자검사기관은 제26조의 규정에 따라 검사대상자로부터 연구목적으로 검사대상물을 이용하는 것에 대하여 서면동의를 얻은 경우에는 유전자에 관한 연구를 하는 자 또는 제32조의 규정에 따라 유전자은행의 개설허가를 받은 자에게 검사대상물을 제공할 수 있다.
② 유전자검사기관은 제1항의 규정에 따라 제공하는 검사대상물에 개인정보를 포함시켜서는 아니 된다. 다만, 개인정보를 포함시키는 것에 대하여 검사대상자 또는 법정대리인이 서면으로 동의하는 경우에는 그러하지 아니하며, 이 경우 동의서의 사본을 첨부하여야 한다.
③ 유전자검사기관, 유전자에 관한 연구를 하는 자 또는 제32조의 규정에 따라 유전자은행의 개설허가를 받은 자(이하 “유전자검사기관등”이라 한다)는 제1항의 규정에 따라 검사대상물을 제공하거나 이를 제공받은 때에는 보건복지부령이 정하는 바에 따라 검사대상물의 제공에 관한 기록을 작성하여야 한다.
④ 제1항 내지 제3항의 규정은 검사대상물을 제공받은 자가 다른 연구자 또는 유전자은행에 검사대상물을 제공하는 경우에 이를 준용한다.
제28조 (검사대상물의 폐기)
① 검사대상물의 보존기간은 5년으로 한다. 다만, 검사대상자 또는 법정대리인이 제26조 제1항의 규정에 의한 동의서에 보존기간을 별도로 정한 경우에는 이를 보존기간으로 한다.
② 유전자검사기관 등은 보존기간 경과 후 지체 없이 검사대상물을 폐기하여야 한다. 다만, 검사대상자 또는 법정대리인이 검사대상물을 폐기하지 아니할 것을 서면으로 요청한 경우에는 그러하지 아니하다.
③ 유전자검사기관 등은 검사대상물의 보관 중에 검사대상자 또는 법정대리인이 검사대상물의 폐기를 요청하는 경우에는 이에 응하여야 한다.
④ 유전자검사기관 등은 검사대상물의 폐기에 관한 사항을 기록ㆍ보관하여야 한다.
⑤ 유전자검사기관 등은 휴업ㆍ폐업 그 밖에 부득이한 사정으로 인하여 검사대상물을 보존할 수 없는 경우에는 보건복지부령이 정하는 바에 따라 검사대상물을 처리 또는 이관하여야 한다.
⑥ 검사대상물의 폐기 절차 및 방법, 검사대상물의 폐기에 관한 사항의 기록ㆍ보관 및 제5항의 규정에 의한 검사대상물의 처리 또는 이관에 관하여 필요한 사항은 보건복지부령으로 정한다.
제29조 (기록의 관리 및 열람)
① 유전자검사기관 등은 다음 각 호의 서류를 보건복지부령이 정하는 바에 따라 보존하여야 한다.
1. 제26조의 규정에 의한 동의서
2. 유전자검사 결과
3. 제27조 제3항의 규정에 의한 검사대상물의 제공에 관한 기록
② 유전자검사기관 등은 검사대상자 또는 법정대리인이 제1항 각 호의 규정에 의한 기록의 열람 또는 사본의 교부를 요청하는 경우에는 이에 응하여야 한다.
③ 제2항의 규정에 의한 기록의 열람 또는 사본의 교부에 관한 신청절차 및 서식 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제30조 (유전자검사기관등의 준수사항)
① 유전자검사기관 등은 다음 각 호의 사항을 준수하여야 한다.
1. 제26조의 규정에 의한 서면동의 내용
2. 유전정보의 보호
3. 그 밖에 제1호 및 제2호에 준하는 사항으로서 생명윤리 및 안전의 확보를 위하여 보건복지부령이 정하는 사항
② 유전자검사기관 등은 유전자검사에 관하여 허위표시 또는 과대광고를 하여서는 아니 된다.
③ 제2항의 규정에 의한 허위표시 또는 과대광고의 범위 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제5장 유전정보 등의 보호 및 이용
제31조 (유전정보에 의한 차별금지)
① 누구든지 유전정보를 이유로 하여 교육ㆍ고용ㆍ승진ㆍ보험 등 사회활동에 있어서 다른 사람을 차별하여서는 아니 된다.
② 다른 법률에 특별한 규정이 있는 경우를 제외하고는 누구든지 타인에게 유전자검사를 받도록 강요하거나 유전자검사의 결과를 제출하도록 강요하여서는 아니 된다.
제32조 (유전자은행의 허가 및 신고)
① 유전자은행을 개설하고자 하는 자는 대통령령이 정하는 바에 따라 보건복지부장관의 허가를 받아야 한다. 다만, 국가기관이 직접 유전자은행을 개설하고자 하는 경우를 제외한다.
② 제1항의 규정에 불구하고 다른 법령에 따라 중앙행정기관의 장으로부터 연구비지원의 승인을 얻어 유전자은행을 개설하고자 하는 경우에는 당해 중앙행정기관의 장으로부터 연구비지원의 승인을 얻은 때에 보건복지부장관의 허가를 받은 것으로 본다. 이 경우 해당 중앙행정기관의 장은 미리 보건복지부장관과 협의하여야 한다.
③ 제1항의 규정에 따라 개설된 유전자은행이 개설 장소를 이전하거나 그 개설에 관한 허가사항 중 대통령령이 정하는 중요한 사항을 변경하고자 하는 경우에는 보건복지부령이 정하는 바에 따라 보건복지부장관에게 신고하여야 한다.
④ 유전자은행의 장은 유전자은행의 업무를 폐업하거나 휴업하고자 하는 경우에는 보건복지부령이 정하는 바에 따라 보건복지부장관에게 신고하여야 한다.
⑤ 제1항의 규정에 의한 유전자은행의 시설ㆍ장비 기준 및 허가절차 그 밖에 필요한 사항은 대통령령으로 정한다.
제33조 (유전정보 등의 제공)
① 유전자은행으로부터 유전정보 등을 이용하고자 하는 자는 유전정보 등의 이용계획서를 유전자은행의 장에게 제출하여야 한다.
② 유전자은행의 장은 제1항의 규정에 따라 제출된 이용계획서에 대하여 제9조의 규정에 의한 기관위원회의 심의를 거쳐 유전정보 등의 제공 여부를 결정하고, 그 결과를 보건복지부장관에게 보고하여야 한다.
③ 유전정보 등의 이용계획서 기재내용, 제출절차 그 밖에 유전정보 등의 제공ㆍ관리에 관하여 필요한 사항은 보건복지부령으로 정한다.
제34조 (유전자은행의 장의 준수사항)
① 유전자은행의 장은 제33조의 규정에 따라 유전정보 등을 타인에게 제공함에 있어 개인정보를 포함시켜서는 아니 된다.
② 유전자은행의 장은 유전정보 등을 타인에게 제공하는 경우에는 무상으로 하여야 한다. 다만, 유전자은행의 장은 유전정보 등의 보관 및 제공에 필요한 경비를 보건복지부령이 정하는 바에 따라 요구할 수 있다.
제35조 (유전정보 등의 보호)
① 유전자은행의 장 또는 그 종사자는 직무상 얻거나 알게 된 유전정보 등을 정당한 사유 없이 타인에게 제공하거나 부당한 목적으로 사용하여서는 아니 된다.
② 의료기관은「의료법」제21조 제1항 단서의 규정에 따라 환자 외의 자에게 제공하는 의무기록 및 진료기록 등에 유전정보를 포함시켜서는 아니 된다. 다만, 해당 환자와 동일한 질병의 진단 및 치료를 목적으로 다른 의료기관의 요청이 있고 개인정보의 보호에 관한 조치를 한 경우에는 그러하지 아니하다.
제6장 유전자치료
제36조 (유전자치료)
① 누구든지 유전자치료는 다음 각 호의 1에 해당되는 경우 외에는 하여서는 아니 된다.
1. 유전질환ㆍ암ㆍ후천성면역결핍증 그 밖에 생명을 위협하거나 심각한 장애를 초래하는 질병의 치료
2. 현재 이용 가능한 치료법이 없거나 유전자치료의 효과가 이용 가능한 다른 치료법과 비교하여 현저히 우수할 것으로 예측되는 치료
3. 그 밖에 심의위원회의 심의를 거쳐 보건복지부장관이 정하는 질병의 예방이나 치료를 위하여 필요하다고 인정하는 경우
② 제1항의 규정에 불구하고 정자ㆍ난자ㆍ배아 또는 태아에 대하여 유전자치료를 하여서는 아니 된다.
제37조 (유전자치료기관)
① 유전자치료를 하고자 하는 의료기관은 보건복지부장관에게 신고하여야 한다. 대통령령이 정하는 중요한 사항을 변경하는 경우에도 또한 같다.
② 제1항의 규정에 따라 보건복지부장관에게 신고한 의료기관(이하 “유전자치료기관”이라 한다)은 유전자치료를 하고자 하는 환자에 대하여 다음 각 호의 사항에 관하여 미리 설명한 후 서면동의를 얻어야 한다.
1. 치료의 목적
2. 예측되는 치료결과 및 그 부작용
3. 그 밖에 보건복지부령이 정하는 사항
③ 유전자치료기관의 신고요건 및 절차, 동의서의 서식 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제7장 감독
제38조 (보고와 조사 등)
① 보건복지부장관은 생명윤리 및 안전의 확보와 관련하여 필요하다고 인정할 때에는 배아생성의료기관ㆍ배아연구기관ㆍ유전자검사기관 등ㆍ유전자치료기관(이하 “피감독기관”이라 한다) 또는 그 종사자에 대하여 보건복지부령이 정하는 바에 따라 이 법의 시행에 관하여 필요한 보고 또는 자료의 제출을 명할 수 있고, 생명공학기술의 연구ㆍ개발ㆍ이용으로 인하여 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있는 때에는 그 연구ㆍ개발ㆍ이용의 중단을 명하거나 그 밖에 필요한 조치를 할 수 있다.
② 보건복지부장관은 이 법이 정하고 있는 사항의 이행 또는 위반 여부의 확인을 위하여 필요하다고 인정할 때에는 관계공무원으로 하여금 피감독기관 또는 그 사무소 등에 출입하여 그 시설 또는 장비, 관계 장부나 서류 그 밖의 물건을 검사하게 하거나 관계인에 대한 질문을 하게 할 수 있으며, 시험에 필요한 시료를 최소분량에 한하여 수거하게 할 수 있다. 이 경우 관계공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 내보여야 한다.
③ 피감독기관 또는 그 종사자는 제1항 및 제2항의 규정에 의한 명령ㆍ검사ㆍ질문 등에 대하여 정당한 사유가 없는 한 이에 응하여야 한다.
제39조 (폐기명령)
보건복지부장관은 피감독기관 또는 그 종사자에 대하여 제13조, 제14조, 제15조 제1항, 제16조 제2항, 제17조 내지 제19조, 제20조 제1항ㆍ제4항, 제22조 제1항 또는 제23조의 규정을 위반하여 생성ㆍ보관 또는 제공된 배아 또는 체세포복제배아 및 제24조 제1항, 제25조, 제26조 제1항 내지 제3항, 제27조 제1항ㆍ제2항ㆍ제4항, 제28조 제2항ㆍ제3항 또는 제32조 제1항ㆍ제2항의 규정을 위반하여 채취ㆍ보관 또는 제공된 검사대상물을 폐기할 것을 명할 수 있다. 이 경우 폐기의 절차 및 방법에 관하여는 제16조 제4항 또는 제28조 제6항의 규정을 준용한다.
제40조 (개선명령)
보건복지부장관은 피감독기관에 대하여 그 시설ㆍ인력 등이 제14조 제2항ㆍ제18조ㆍ제23조 또는 제32조 제5항의 규정에서 정하는 시설기준 등에 적합하지 아니하여 연구ㆍ채취ㆍ보관 또는 배아의 생성 등을 하는 경우에 생명윤리나 안전에 중대한 위해가 발생하거나 발생할 우려가 있다고 인정하는 때에는 그 시설의 개선을 명하거나 당해 시설의 전부 또는 일부의 사용을 금지할 것을 명할 수 있다.
제41조 (허가 등의 취소와 업무의 정지)
① 보건복지부장관은 배아생성의료기관ㆍ배아연구기관ㆍ유전자검사기관ㆍ유전자은행ㆍ유전자치료기관이 다음 각 호의 1에 해당하는 때에는 그 지정ㆍ등록 또는 허가를 취소하거나 1년 이내의 기간을 정하여 그 업무의 전부 또는 일부의 정지를 명할 수 있다.
1. 제9조 제1항ㆍ제3항, 제10조 제1항ㆍ제3항, 제11조 내지 제14조, 제15조 제1항ㆍ제3항, 제16조 제2항ㆍ제3항, 제17조, 제19조 제1항, 제20조, 제22조, 제24조 제2항ㆍ제4항, 제25조, 제26조 제1항 내지 제3항ㆍ제5항, 제27조, 제28조 제2항 내지 제5항, 제29조 제1항ㆍ제2항, 제32조 제3항ㆍ제4항, 제33조 제2항, 제35조, 제36조 또는 제37조 제1항 후단ㆍ제2항의 규정을 위반한 때
2. 제21조ㆍ제30조 또는 제34조의 규정에 의한 준수사항을 이행하지 아니한 때
3. 제38조 제1항ㆍ제39조 또는 제40조의 규정에 의한 명령을 이행하지 아니한 때
4. 제38조 제2항의 규정에 의한 검사ㆍ질문ㆍ수거에 불응한 때
② 제1항의 규정에 의한 행정처분의 세부기준은 그 위반행위의 유형과 위반의 정도 등을 고려하여 보건복지부령으로 정한다.
제42조 (청문)
보건복지부장관은 제41조 제1항의 규정에 따라 지정ㆍ등록 또는 허가를 취소하고자 하는 경우에는 청문을 실시하여야 한다.
제43조 (과징금)
① 보건복지부장관은 배아생성의료기관 또는 유전자치료기관이 다음 각 호의 1에 해당하여 업무정지처분을 하여야 할 경우로서 그 업무정지가 당해 사업의 이용자에게 심한 불편을 주거나 그 밖에 공익을 해할 우려가 있는 때에는 대통령령이 정하는 바에 따라 그 업무정지처분에 갈음하여 2억원 이하의 과징금을 부과할 수 있다.
1. 제14조, 제15조 제1항ㆍ제3항, 제16조 제2항ㆍ제3항 또는 제36조의 규정을 위반한 때
2. 제21조의 규정에 의한 준수사항을 위반한 때
3. 제38조 제1항ㆍ제39조 또는 제40조의 규정에 의한 명령을 이행하지 아니한 때
4. 제38조 제2항의 규정에 의한 검사ㆍ질문ㆍ수거에 불응한 때
② 제1항의 규정에 따라 과징금을 부과하는 위반행위의 종별과 정도 등에 따른 과징금의 금액 그 밖에 필요한 사항은 보건복지부령으로 정한다.
③ 보건복지부장관은 제1항의 규정에 의한 과징금을 납부하여야 할 자가 납부기한까지 이를 납부하지 아니하는 때에는 국세체납처분의 예에 따라 이를 징수한다.
제44조 (수수료)
보건복지부장관은 이 법의 규정에 따라 지정ㆍ등록ㆍ허가ㆍ승인을 받고자 하거나 신고를 하는 자 또는 그 내용을 변경하고자 하는 자로 하여금 보건복지부령이 정하는 바에 따라 수수료를 납부하게 할 수 있다.
제8장 보칙
제45조 (성체줄기세포연구의 지원)
국가 또는 지방자치단체는 성체줄기세포의 연구를 육성하기 위하여 필요한 재정지원을 할 수 있다.
제46조 (국고보조)
보건복지부장관은 생명공학기술에서의 생명윤리 및 안전의 확보에 이바지할 수 있는 연구사업 및 교육의 육성ㆍ지원을 위하여 대통령령이 정하는 바에 따라 해당 단체ㆍ연구기관ㆍ생명공학관련종사자 등에게 필요한 연구비의 전부 또는 일부를 보조할 수 있다.
제47조 (위임 및 위탁 등)
① 보건복지부장관은 이 법에 의한 권한의 일부를 대통령령이 정하는 바에 따라 소속기관의 장에게 위임할 수 있다.
② 보건복지부장관은 대통령령이 정하는 바에 따라 다음 각 호의 1에 해당하는 업무의 일부를 관계 전문기관 또는 단체에게 위탁할 수 있다.
1. 제14조의 규정에 의한 배아생성의료기관의 관리에 관한 업무
2. 제18조의 규정에 의한 배아연구기관의 관리에 관한 업무
3. 제24조의 규정에 의한 유전자검사기관의 관리에 관한 업무
4. 제32조의 규정에 의한 유전자은행의 관리에 관한 업무
5. 제37조의 규정에 의한 유전자치료기관의 관리에 관한 업무
③ 보건복지부장관은 제2항의 규정에 따라 관계 전문기관 또는 단체에게 관리업무를 하게 한 때에는 그 관리에 필요한 예산을 보조할 수 있다.
제48조 (비밀누설 등의 금지)
피감독기관 또는 그 종사자나 업무에 종사하였던 자는 그 직무상 알게 된 비밀을 누설하거나 도용(盜用)하여서는 아니 된다.
제9장 벌칙
제49조 (벌칙)
① 제11조 제1항의 규정을 위반하여 체세포복제배아를 자궁에 착상시키거나 착상된 상태를 유지 또는 출산한 자는 10년 이하의 징역에 처한다.
② 제1항의 미수범은 처벌한다.
제50조 (벌칙)
제12조 제1항의 규정을 위반하여 인간의 배아를 동물의 자궁에 착상시키거나 동물의 배아를 인간의 자궁에 착상시킨 자 또는 동조 제3항의 규정을 위반하여 동조 제2항 각 호의 1에 해당하는 행위로부터 생성된 배아를 인간 또는 동물의 자궁에 착상시킨 자는 5년 이하의 징역에 처한다.
제51조 (벌칙)
① 다음 각 호의 1에 해당하는 자는 3년 이하의 징역에 처한다.
1. 제11조 제2항의 규정을 위반하여 체세포복제배아를 자궁에 착상시키거나 착상된 상태를 유지 또는 출산하는 행위를 유인 또는 알선한 자
2. 제12조 제2항 각 호의 1에 해당하는 행위를 한 자
3. 제13조 제1항의 규정을 위반하여 임신 외의 목적으로 배아를 생성한 자
4. 제13조 제2항 각 호의 1에 해당하는 행위를 한 자
5. 제13조 제3항의 규정을 위반하여 금전 또는 재산상 이익 그 밖에 반대급부를 조건으로 정자 또는 난자를 제공하거나 이를 이용한 자
6. 제22조 제1항의 규정을 위반하여 희귀ㆍ난치병의 치료를 위한 연구목적 외에 체세포핵이식행위를 한 자
7. 제48조의 규정을 위반하여 비밀을 누설하거나 도용한 자
② 제17조의 규정을 위반하여 잔여배아를 이용한 자는 3년 이하의 징역 또는 5천만원 이하의 벌금형에 처한다.
③ 제1항 제1호의 미수범은 처벌한다.
제52조 (벌칙)
다음 각 호의 1에 해당하는 자는 2년 이하의 징역 또는 3천만원 이하의 벌금에 처한다.
1. 제13조 제3항의 규정을 위반하여 금전 또는 재산상 이익 그 밖에 반대급부를 조건으로 정자 또는 난자를 제공하도록 유인하거나 알선한 자
2. 제15조 제1항의 규정을 위반하여 배아생성에 관한 서면동의를 얻지 아니하고 정자 또는 난자를 채취한 자
3. 제25조의 규정을 위반하여 유전자검사를 한 자
4. 제26조 제1항 내지 제3항의 규정을 위반하여 유전자검사에 관한 서면동의를 얻지 아니하고 검사대상물을 채취하거나 동의서를 첨부하지 아니하고 유전자검사를 의뢰한 자
5. 제31조 제1항 또는 제2항의 규정을 위반하여 유전정보를 이용하여 다른 사람을 차별한 자 또는 다른 사람에게 유전자검사를 받기를 강요하거나 유전자검사의 결과를 제출하도록 강요한 자
6. 제34조의 규정을 위반하여 유전정보 등을 타인에게 제공함에 있어 개인정보를 포함시킨 자
7. 제35조 제1항의 규정을 위반하여 유전정보 등을 정당한 사유 없이 타인에게 제공하거나 부당한 목적으로 사용한 자
8. 제36조 제1항 또는 제2항의 규정을 위반하여 유전자치료를 한 자
9. 제39조의 규정에 의한 폐기명령을 위반한 자
다음 각 호의 1에 해당하는 자는 1년 이하의 징역 또는 2천만원 이하의 벌금에 처한다.
1. 제14조의 규정을 위반하여 배아생성의료기관으로 지정받지 아니하고 인간의 정자 또는 난자를 채취ㆍ보관하거나 배아를 생성한 자
2. 제16조 제2항 또는 제3항의 규정을 위반하여(제20조 제4항에서 준용하는 경우를 포함한다) 배아를 보건복지부령이 정하는 바에 따라 폐기하지 아니하거나 배아의 폐기에 관한 사항을 기록ㆍ보관하지 아니한 자
3. 제18조의 규정을 위반하여 배아연구기관으로 등록하지 아니하고 잔여배아를 연구한 자
4. 제19조 제1항의 규정을 위반하여(제23조 제2항에서 준용하는 경우를 포함한다) 보건복지부장관의 승인을 얻지 아니하고 배아연구를 한 자
5. 제20조 제1항 또는 제3항의 규정을 위반하여 유상으로 잔여배아를 제공하거나 잔여배아의 보관 및 제공 등에 관한 사항을 보건복지부령이 정하는 바에 따라 보건복지부장관에게 보고하지 아니한 자
6. 제23조 제1항의 규정을 위반하여 등록하지 아니하고 체세포복제배아를 생성하거나 연구한 자
7. 제30조 제1항의 유전자검사기관등의 준수사항을 위반하거나 동조 제2항의 규정을 위반하여 유전자검사에 대하여 허위표시 또는 과대광고를 한 자
8. 제32조 제1항의 규정을 위반하여 허가를 받지 아니하고 유전자은행을 개설한 자
9. 제40조의 규정에 의한 개선명령 등을 위반한 자
제54조 (양벌규정)
법인의 대표자나 법인 또는 개인의 대리인ㆍ사용인, 그 밖의 종업원이 그 법인 또는 개인의 업무에 관하여 제49조 내지 제53조의 규정에 해당하는 위반행위를 한 때에는 그 행위자를 벌하는 외에 그 법인 또는 개인에 대하여도 해당 조의 벌금형을 과한다.
제55조 (과태료)
① 다음 각 호의 1에 해당하는 자는 500만원 이하의 과태료에 처한다.
1. 제24조 제1항ㆍ제2항 또는 제4항의 규정에 의한 신고를 하지 아니한 자
2. 제28조 제2항 내지 제5항의 규정을 위반한 자
3. 제29조 제1항 각 호의 서류를 보존하지 아니하거나 동조 제2항의 규정에 의한 기록의 열람 또는 사본의 교부를 거부한 자
4. 제32조 제3항 또는 제4항의 규정에 의한 신고를 하지 아니한 자
5. 제35조 제2항의 규정을 위반하여 환자의 유전정보를 포함한 기록을 환자 외의 자에게 제공한 자
6. 제37조 제1항의 규정을 위반하여 신고하지 아니하고 유전자치료를 한 자
② 제1항의 규정에 의한 과태료는 대통령령이 정하는 바에 따라 보건복지부장관이 부과ㆍ징수한다.
③ 제2항의 규정에 의한 과태료처분에 불복이 있는 자는 그 처분의 고지를 받은 날부터 30일 이내에 보건복지부장관에게 이의를 제기할 수 있다.
④ 제2항의 규정에 의한 과태료처분을 받은 자가 제3항의 규정에 따라 이의를 제기한 때에는 보건복지부장관은 지체 없이 관할법원에 그 사실을 통보하여야 하며, 그 통보를 받은 관할법원은 비송사건절차법에 의한 과태료의 재판을 한다.
⑤ 제3항의 규정에 의한 기간 이내에 이의를 제기하지 아니하고 과태료를 납부하지 아니한 때에는 국세체납처분의 예에 따라 이를 징수한다.
부 칙
부칙 [2004. 1. 29]
① (시행일) 이 법은 2005년 1월 1일부터 시행한다. 다만 제11조, 제12조, 제49조, 제50조 및 제51조 제1항 제1호ㆍ제2호의 규정은 공포한 날부터 시행한다.
② (잔여배아의 연구에 관한 경과조치) 다음 각 호의 요건에 해당하는 잔여배아는 발생학적으로 원시선이 나타나기 전까지에 한하여 제17조 각 호의 1의 목적으로 이용할 수 있다.
1. 이 법 시행 전에 생성되었을 것
2. 생성 후 5년이 지났을 것
3. 동의권자의 동의를 얻을 것. 다만, 소재불명 등으로 동의권자의 동의를 얻을 수 없는 경우를 제외한다.
③ (체세포복제배아의 연구에 관한 경과조치) 이 법 시행 당시 제17조 제2호의 규정에 의한 연구목적으로 체세포복제배아의 연구를 하고 있는 자는 다음 각 호의 요건에 해당하는 경우에는 보건복지부장관의 승인을 얻어 당해 연구를 계속할 수 있다.
1. 3년 이상 체세포복제배아에 관한 연구를 계속하였을 것
2. 관련 학술지에 1회 이상 체세포복제배아에 관한 연구논문을 게재한 실적이 있을 것
④ (다른 법률의 개정) 장기등이식에관한법률 중 다음과 같이 개정한다.
제2장의 제목 중 “생명윤리위원회”를 “장기등이식윤리위원회”로 한다.
제7조의 제목 “생명윤리위원회”를 “장기등이식윤리위원회”로 하고, 동조 제1항 중 “생명윤리위원회”를 “장기등이식윤리위원회”로 한다.
부칙 [2005. 3. 24 제7413호(정부조직법)]
제1조 (시행일) 이 법은 공포한 날부터 시행한다. 다만, 다음 각 호의 사항은 각 호의 구분에 의한 날부터 시행한다.
1. 제26조 제1항 및 제42조의 개정규정과 부칙 제2조 내지 제4조의 규정은 이 법 공포 후 3월 이내에 제42조의 개정규정에 의한 여성가족부의 조직에 관한 대통령령이 시행되는 날
2. 생략
제2조 생략
제3조 (다른 법률의 개정) ① 내지 ⑤ 생략
⑥ 생명윤리 및 안전에 관한 법률 일부를 다음과 같이 개정한다.
제7조 제3항 제1호 중 “여성부장관”을 “여성가족부장관”으로 한다.
⑦ 내지 ⑭ 생략
제4조 생략
부칙 [2007. 4. 11 제8366호(의료법)]
제1조(시행일) 이 법은 공포한 날부터 시행한다. 단서 생략
제2조 내지 제19조 생략
제20조(다른 법률의 개정) ① 및 ⑧ 생략
⑨ 생명윤리 및 안전에 관한 법률 일부를 다음과 같이 개정한다.
제35조 제2항 본문 중 “의료법 제20조 제1항 단서”를 “「의료법」제21조 제1항 단서”로 한다.
⑩ 내지 <17> 생략
제21조 생략
 뇌연구촉진법
뇌연구촉진법
이 법은 뇌연구 촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성․발전시키고 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 기여함을 목적으로 한다.
이 법에서 사용하는 용어의 정의는 다음과 같다.
1. “뇌연구”라 함은 뇌과학, 뇌의약학, 뇌공학 및 이와 관련된 모든 분야에 대한 연구를 말한다.
2. “뇌과학”이라 함은 뇌의 신경생물학적 구조 및 인지, 사고, 언어심리 및 행동 등의 고등신경 정신활동에 대한 포괄적인 이해를 위한 기초 학문을 말한다.
3. “뇌의약학”이라 함은 뇌의 구조 및 기능상의 결함과 뇌의 노화 등에 기인한 신체적․정신적 질환 및 장애에 대한 원인 규명과 이의 치료, 예방 등에 관한 학문을 말한다.
4. “뇌공학”이라 함은 뇌의 고도의 지적 정보처리 구조와 기능을 이해하고 이의 공학적 응용을 위한 이론 및 기술에 관한 학문을 말한다.
5. “관계중앙행정기관”이라 함은 교육인적자원부, 과학기술부, 산업자원부, 정보통신부, 보건복지부를 말한다.
뇌연구에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 의한다.
① 정부는 뇌연구 촉진을 지원하기 위한 시책을 강구하고, 이를 적극적으로 추진하여야 한다.
② 대학․연구기관․기업 및 개인 등 뇌연구를 수행하는 자는 제1항의 규정에 의한 시책에 적극 협력하여야 한다.
제5조 (뇌연구촉진기본계획의 수립)
① 관계중앙행정기관의 장은 소관별로 뇌연구 촉진을 위한 계획과 전년도 추진실적을 과학기술부장관에게 제출하여야 한다.
② 과학기술부장관은 제1항의 규정에 의하여 관계중앙행정기관의 장이 제출한 소관사항에 관한 뇌연구 촉진을 위한 계획을 종합․조정한 후 제7조의 규정에 의한 뇌연구촉진심의회의 심의를 거쳐 뇌연구촉진기본계획(이하 “기본계획”이라 한다)을 수립하고, 이를 관계중앙행정기관의 장에게 통보하여야 한다. 기본계획을 변경하는 경우에도 또한 같다.
③ 제2항의 규정에 의한 기본계획에는 다음의 사항이 포함되어야 한다.
1. 뇌연구의 중장기적 목표 및 내용
2. 뇌연구에 필요한 투자재원의 확대방안 및 추진계획
3. 교육․산업․보건복지․정보통신․과학기술 등 각 분야의 뇌연구에 관한 계획
4. 뇌연구에 필요한 인력자원의 개발 및 효율적인 활용에 관한 종합계획
5. 뇌연구 결과의 이용과 보전에 관한 계획
6. 기타 뇌연구 촉진을 위하여 필요한 중요사항
제6조 (뇌연구촉진시행계획의 수립)
① 관계중앙행정기관의 장은 기본계획에 따라 매년 뇌연구촉진시행계획(이하 “시행계획”이라 한다)을 수립하고 이를 시행하여야 한다.
② 관계중앙행정기관의 장은 시행계획을 수립하고자 할 때에는 미리 과학기술부장관과 협의하여야 한다.
③ 과학기술부장관은 필요한 때에는 시행계획의 수립에 필요한 기본지침을 작성하여 관계중앙행정기관의 장에게 통보할 수 있다.
④ 시행계획의 수립 및 그 시행에 관하여 필요한 사항은 대통령령으로 정한다.
제7조 (뇌연구촉진심의회)
① 뇌연구에 관한 중요사항을 심의하기 위하여 과학기술부장관소속하에 뇌연구촉진심의회(이하 “심의회”라 한다)를 둔다.
② 심의회는 다음 각 호의 사항을 심의한다.
1. 기본계획의 수립․변경과 이에 따른 중요정책의 수립 및 그 집행의 조정
2. 뇌연구 관련 예산의 확대방안에 관한 사항
3. 뇌연구 분야 인력개발 및 교류에 관한 종합계획과 이에 따른 중요정책, 인력활용지침의 수립 및 집행의 조정
4. 뇌연구 결과의 이용과 보전을 위한 계획의 수립 및 그 집행의 조정
5. 기타 뇌연구에 관하여 위원장이 필요하다고 인정하는 사항
③ 심의회는 위원장 1인을 포함한 20인 이내의 위원으로 구성한다.
④ 위원장은 과학기술부차관이 되고 위원은 위원장이 임명하는 관계중앙행정기관의 공무원과 학계, 연구기관, 산업계에 종사하는 뇌연구 전문가로서 위원장이 위촉하는 자(이하 “위촉위원”이라 한다)가 된다.
⑤ 삭제 <2002. 12. 26>
⑥ 심의회의 구성 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
① 심의회에 상정할 안건의 작성 및 심의회에서 위임한 업무를 처리하게 하기 위하여 과학기술부장관소속하에 뇌연구실무추진위원회(이하 “추진위원회”라 한다)를 둔다.
② 추진위원회는 관계중앙행정기관의 공무원 및 학계, 연구기관, 산업계에 종사하는 뇌연구 전문가로 구성한다.
③ 추진위원회의 구성 및 운영에 관하여 필요한 사항은 대통령령으로 정한다.
① 정부는 제5조 제3항 제2호의 투자재원의 확대방안 및 추진계획에 따라 예산의 범위 안에서 뇌연구 투자의 확대를 위하여 최대한 노력하여야 한다.
② 과학기술부장관은 매년 뇌연구 투자확대계획을 작성하여 심의회의 심의를 거친 후, 이를 국가과학기술자문회의법에 의한 국가과학기술자문회의에 보고하여야 한다.
정부는 뇌연구 및 그 기술개발에 관한 국제협력의 증진에 노력하고 선진기술의 도입을 위한 전문 인력 파견, 해외 전문 인력 유치 등의 방안을 강구하여야 한다.
정부는 뇌연구 및 기술개발의 효율적 육성을 위하여 학계, 연구기관 및 산업계 간의 공동연구를 촉진하고 관련 학회 및 학술활동을 적극 지원하여야 한다.
제12조 (관계 산업체에 대한 지원)
정부는 뇌연구 결과의 산업화를 촉진하기 위하여 신기술제품의 생산을 지원할 수 있다.
제13조 (기술정보의 수집과 보급)
정부는 뇌연구에 관한 정보를 수집하여 이를 관계기관에 보급하도록 노력하여야 한다.
제14조 (뇌연구추진시책강구)
관계중앙행정기관의 장은 뇌연구를 효율적으로 촉진하기 위하여 다음과 같은 시책을 강구한다.
1. 교육인적자원부장관 : 뇌 분야의 연구를 촉진시키기 위한 전문 인력의 양성과 뇌과학 기초 분야의 연구지원
2. 과학기술부장관 : 기본계획의 수립과 시행계획 수립의 지원 및 조정, 뇌 관련 기초기술 및 첨단기술의 개발, 유용한 연구결과의 이용 및 보전을 위한 연구의 지원, 공공적 성격의 뇌연구 지원체제의 육성
3. 산업자원부장관 : 뇌연구 결과를 생산 및 산업공정에 효율적으로 응용하기 위한 응용기술의 개발과 개발기술의 산업화 촉진
4. 정보통신부장관 : 뇌연구 결과의 정보․통신 등 분야에의 응용기술의 개발 및 개발기술의 산업화 촉진
5. 보건복지부장관 : 보건․의료 등에 관련되는 뇌의약연구와 그 결과의 응용기술 개발 및 개발기술의 산업화 촉진
제15조 (임상 및 검정)
① 정부는 뇌연구 관련 제품에 대한 임상 및 검정체제를 확립한다.
② 제1항의 임상 및 검정체제 확립에 관하여 필요한 사항은 대통령령으로 정한다.
제16조 (실험지침의 작성․시행 등)
① 정부는 뇌연구 및 그 산업화의 촉진을 위한 실험지침을 작성․시행하여야 한다.
② 제1항의 실험지침에서는 뇌연구와 그 산업화 과정에서 예견될 수 있는 생물학적 위험성, 인간에 미치는 악영향 및 윤리적 문제 발생의 사전방지에 필요한 조치 및 안전기준이 마련되어야 한다.
제17조 (연구소의 설립)
① 뇌 분야에 관한 연구 및 그 이용과 지원에 관한 기능을 수행하고 뇌 분야에서의 학계, 연구기관 및 산업계 간의 상호 유기적 협조체제를 유지․발전시키기 위하여 정부가 출연하는 연구소를 설립할 수 있다.
② 제1항의 규정에 의한 연구소는 특정연구기관육성법의 적용을 받는 특정연구기관으로 한다.
부칙<제5547호, 1998. 6. 3>
이 법은 공포한 날부터 시행한다.
부칙(정부조직법)<제6400호, 2001. 1. 29>
제1조 (시행일) 이 법은 공포한 날부터 시행한다. <단서 생략>
제2조 생략
제3조 (다른 법률의 개정) ①내지 <59>생략
<60>뇌연구촉진법 중 다음과 같이 개정한다.
제2조 제5호중 “교육부”를 “교육인적자원부”로 한다.
제14조 제1호중 “교육부장관”을 “교육인적자원부장관”으로 한다.
<61>내지 <79>생략
제4조 생략
부칙<제6811호, 2002. 12. 26>
이 법은 공포한 날부터 시행한다.
 유전자변형생물체의 국가간 이동 등에 관한 법률
유전자변형생물체의 국가간 이동 등에 관한 법률
제1장 총칙
제1조 (목적)
이 법은 바이오안전성에 관한 카르타헤나의정서(이하 “의정서”라 한다)의 시행과 유전자변형생물체의 개발․생산․수입․수출․유통 등에 관한 안전성의 확보를 위하여 필요한 사항을 정함으로써 유전자변형생물체로 인한 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 미치는 위해를 사전에 방지하고 국민생활의 향상 및 국제협력을 증진함을 목적으로 한다.
제2조 (정의)
이 법에서 사용하는 용어의 정의는 다음과 같다.
1. “유전자변형생물체”라 함은 다음 각 항목의 현대생명공학기술을 이용하여 얻어진 새롭게 조합된 유전물질을 포함하고 있는 생물체를 말한다.
가. 인위적으로 유전자를 재조합하거나 유전자를 구성하는 핵산을 세포 또는 세포내 소기관으로 직접 주입하는 기술
나. 분류학에 의한 과의 범위를 넘는 세포융합으로써 자연 상태의 생리적 증식이나 재조합이 아니고 전통적인 교배나 선발에서 사용되지 아니하는 기술
2. “환경 방출”이라 함은 유전자변형생물체를 시설․장치 그 밖의 구조물을 이용하여 밀폐하지 아니하고 의도적으로 자연환경에 노출되게 하는 것을 말한다.
3. “관계중앙행정기관”이라 함은 유전자변형생물체의 개발․생산․수입․수출․판매․운반․보관 등(이하 “수출입 등”이라 한다)의 업무에 따라 대통령령이 정하는 기준에 의하여 해당되는 중앙행정기관을 말한다.
이 법은 인체용 의약품으로 사용되는 유전자변형생물체에 대하여는 이를 적용하지 아니한다.
유전자변형생물체를 수출입 등을 함에 있어서 그 취급 및 안전관리에 관하여 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법이 정하는 바에 의한다.
국가와 지방자치단체는 유전자변형생물체로 인한 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 대한 위해를 방지하기 위하여 필요한 시책을 강구하여야 한다.
① 의정서 제19조의 규정에 의한 국가연락기관은 외교통상부로, 국가책임기관은 산업자원부로 한다.
② 국가책임기관의 장은 대통령령이 정하는 바에 따라 국가책임기관으로서 의정서의 이행에 관하여 필요한 업무를 수행한다.
① 관계중앙행정기관의 장은 소관별로 유전자변형생물체 안전관리계획(이하 “안전관리계획”이라 한다)을 수립․시행하여야 한다.
② 안전관리계획에는 다음 각 호의 사항이 포함되어야 한다.
1. 유전자변형생물체의 수출입 등에 따른 안전관리의 기본방침에 관한 사항
2. 유전자변형생물체를 취급하는 시설 및 작업종사자의 안전에 관한 사항
3. 유전자변형생물체에 관한 기술개발 및 지원에 관한 사항
4. 그 밖에 유전자변형생물체의 안전관리와 관련한 중요사항
③ 관계중앙행정기관의 장이 안전관리계획을 수립․시행하고자 하는 경우에는 미리 제31조의 규정에 의한 바이오안전성위원회의 심의를 거쳐야 한다.
④ 관계중앙행정기관의 장은 안전관리계획의 시행을 위한 세부시행계획을 수립․시행하여야 하며, 이를 위하여 필요한 경우에는 안전관리지침을 정하여 고시할 수 있다.
제2장 유전자변형생물체의 수출입 등 및 안전관리
① 유전자변형생물체를 수입(휴대하여 수입하는 경우를 포함한다. 이하 같다)하고자 하는 자는 대통령령이 정하는 바에 따라 관계중앙행정기관의 장의 승인을 얻어야 한다. 승인을 얻은 사항을 변경하고자 하는 경우에도 또한 같다. 다만, 대통령령이 정하는 경미한 사항을 변경하고자 하는 때에는 이를 신고하여야 한다.
② 환경 방출로 사용되는 유전자변형생물체를 수입하고자 하는 자는 제1항의 규정에 불구하고 국가책임기관의 장을 거쳐 관계중앙행정기관의 장에게 수입승인을 신청하여야 한다. 이 경우 국가책임기관의 장 및 관계중앙행정기관의 장은 대통령령이 정하는 바에 따라 의정서 제8조 내지 제10조의 규정에 의한 당해 유전자변형생물체의 국가간 이동에 필요한 절차를 따라야 한다.
③ 제1항 및 제2항의 규정에 의한 승인을 신청하는 자는 당해 유전자변형생물체를 생산 또는 수출하는 자가 작성한 위해성평가서와 유전자변형생물체를 수출하고자 하는 자의 정부기관이 발행하는 위해성심사서를 제출하여야 한다.
④ 제3항의 규정에 불구하고 유전자변형생물체에 대한 위해성심사서를 발행할 수 있는 정부기관이 없거나 그 밖에 대통령령이 정하는 사유가 있는 경우에는 관계중앙행정기관의 장이 대통령령이 정하는 바에 따라 지정하는 위해성평가기관(이하 “위해성평가기관”이라 한다)이 작성한 위해성평가서를 제출하여야 한다.
⑤ 관계중앙행정기관의 장은 제1항 및 제2항의 규정에 의한 승인신청을 받은 경우에는 당해 유전자변형생물체의 위해성을 심사하고 당해 유전자변형생물체가 국내 생물다양성의 가치에 미칠 사회․경제적 영향을 고려하여 그 승인여부를 결정하여야 한다.
⑥ 관계중앙행정기관의 장은 제5항의 규정에 의한 승인여부를 국가책임기관의 장에게 통보하여야 한다.
⑦ 제3항의 규정에 의한 위해성평가서의 평가항목․기준 등에 관하여 필요한 사항은 관계중앙행정기관의 장이 정하여 고시한다.
① 제8조의 규정에 불구하고 시험․연구용으로 사용하거나 박람회 또는 전시회에 출품하기 위하여 유전자변형생물체를 수입하고자 하는 자는 대통령령이 정하는 바에 따라 관계중앙행정기관의 장의 승인을 얻거나 관계중앙행정기관의 장에게 신고하여야 한다.
② 관계중앙행정기관의 장은 제1항의 규정에 의한 승인여부 및 신고내용을 국가책임기관의 장에게 통보하여야 한다.
① 세관장은 국제우편물에 제8조 또는 제9조의 규정에 의한 승인을 얻지 아니하거나 신고를 하지 아니한 유전자변형생물체가 담기어 있거나 담기어져 있다고 의심이 되는 경우에는 지체 없이 그 사실을 관계중앙행정기관의 장에게 통보하여야 한다.
② 제1항의 규정에 의한 세관장의 통지가 있는 때에는 관계중앙행정기관의 장은 당해 국제우편물을 검사한 후 폐기, 반송 등 적절한 조치를 하여야 한다.
③ 유전자변형생물체가 담겨져 있는 국제우편물을 받은 자는 당해 유전자변형생물체가 제8조 또는 제9조의 규정에 의한 승인을 얻지 아니하거나 신고를 하지 아니한 것임을 안 때에는 지체 없이 관계중앙행정기관의 장에게 이를 신고하고, 관계중앙행정기관의 장이 명하는 바에 따라 이를 처리하여야 한다.
① 국가책임기관의 장은 유전자변형생물체의 안전관리를 위하여 필요하다고 인정하는 경우에는 관계중앙행정기관의 장과 협의하여 유전자변형생물체를 수입하는 항구․공항 등을 지정할 수 있다.
② 국가책임기관의 장은 제1항의 규정에 의하여 항구․공항 등을 지정하는 경우에는 지체 없이 이를 공고하여야 한다.
① 유전자변형생물체를 생산하고자 하는 자는 대통령령이 정하는 바에 따라 관계중앙행정기관의 장의 승인을 얻어야 한다. 승인을 얻은 사항을 변경하고자 하는 경우에도 또한 같다. 다만, 대통령령이 정하는 경미한 사항을 변경하고자 하는 때에는 이를 신고하여야 한다.
② 제1항의 규정에 의한 승인을 신청하는 자는 제8조 제3항의 규정에 의한 위해성평가서를 제출하여야 한다.
③ 제8조 제5항 내지 제7항의 규정은 유전자변형생물체를 생산하고자 하는 경우에 이를 준용한다.
① 관계중앙행정기관의 장은 제8조 제5항 또는 제12조 제3항의 규정에 의하여 유전자변형생물체의 위해성 심사를 하는 경우에는 당해 유전자변형생물체가 인체에 미치는 영향에 대하여는 보건복지부장관과, 환경 방출되거나 환경 방출될 우려가 있는 유전자변형생물체의 경우에는 다음 각 호에 정하는 기관의 장과 미리 협의하여야 한다.
1. 당해 유전자변형생물체가 자연생태계에 미치는 영향에 대하여는 환경부장관
2. 작물재배환경에 미치는 영향에 대하여는 농림부장관
3. 해양생태계에 미치는 영향에 대하여는 해양수산부장관
② 제8조 제5항 또는 제12조 제3항의 규정에 의한 위해성 심사의 기준․방법 그 밖에 필요한 사항은 관계중앙행정기관의 장이 이를 정하여 고시한다.
③ 관계중앙행정기관의 장은 제8조 제5항 또는 제12조 제3항의 규정에 의한 유전자변형생물체의 위해성 심사업무를 대통령령이 정하는 바에 따라 지정하는 자(이하 “위해성심사대행기관”이라 한다)로 하여금 대행하게 할 수 있다.
④ 관계중앙행정기관의 장은 제8조 또는 제12조의 규정에 의하여 유전자변형생물체의 수입 또는 생산승인을 함에 있어서는 미리 당해 유전자변형생물체에 관한 정보를 국민에게 알리고 의견을 수렴하여야 한다.
① 관계중앙행정기관의 장은 다음 각 호의 1에 해당하는 유전자변형생물체(제2호의 생물체를 포함한다)의 수입 또는 생산을 금지하거나 제한할 수 있다.
1. 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다고 인정되는 유전자변형생물체
2. 제1호에 해당하는 유전자변형생물체와 교배하여 생산된 생물체
3. 국내 생물다양성의 가치와 관련하여 사회․경제적으로 부정적인 영향을 미치거나 미칠 우려가 있다고 인정되는 유전자변형생물체
② 관계중앙행정기관의 장은 제1항의 규정에 의하여 유전자변형생물체의 수입 또는 생산을 금지하거나 제한하는 경우에는 국가책임기관의 장에게 이를 통보하여야 한다.
③ 국가책임기관의 장은 제1항 각 호의 규정에 의하여 수입 또는 생산을 금지하거나 제한하는 생물체의 품목 등에 관하여 필요한 사항을 공고하여야 한다.
제15조 (위해성이 없는 유전자변형생물체)
① 국가책임기관의 장은 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해가 발생할 우려가 없는 유전자변형생물체에 대하여 그 품목 등을 고시하여야 한다.
② 국가책임기관의 장은 제1항의 규정에 의한 유전자변형생물체의 품목 등을 고시함에 있어서는 미리 제31조의 규정에 의한 바이오안전성위원회의 심의를 거쳐야 한다.
③ 제1항의 규정에 의하여 고시된 품목의 유전자변형생물체를 수입 또는 생산하고자 하는 자는 제8조 또는 제12조의 규정에 불구하고 국가책임기관의 장에게 이를 신고하여야 한다.
제16조 (대외무역법에 의한 수입승인 의제 등)
① 제8조 및 제9조의 규정에 의하여 관계중앙행정기관의 장이 수입승인을 하거나 신고를 수리한 유전자변형생물체에 대하여는「대외무역법」제11조 제2항에 따라 산업자원부장관이 수입승인을 한 것으로 본다.
② 제15조 제3항 및 제20조의 규정에 의한 유전자변형생물체를 수입 또는 수출하고자 하는 자가 국가책임기관의 장에게 그 내용을 신고 또는 통보한 유전자변형생물체에 대하여는「대외무역법」제11조 제2항에 따라 산업자원부장관이 수입 또는 수출에 대한 승인을 한 것으로 본다.
제17조 (승인의 취소)
① 관계중앙행정기관의 장은 다음 각 호의 1에 해당하는 경우에는 제8조․제9조 또는 제12조의 규정에 의한 유전자변형생물체의 수입승인 또는 생산승인을 취소할 수 있다. 다만, 제1호 또는 제2호에 해당하는 경우에는 승인을 취소하여야 한다.
1. 수입승인 또는 생산승인을 얻은 유전자변형생물체가 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다는 사실이 밝혀진 경우
2. 속임수 그 밖에 부정한 방법으로 승인을 얻은 경우
3. 수입승인 또는 생산승인을 얻은 유전자변형생물체를 승인을 얻은 용도와 다르게 사용하는 경우
4. 이 법 또는 이 법에 의한 명령이나 처분을 위반하는 경우
5. 그 밖에 대통령령이 정하는 사유에 해당하는 경우
② 관계중앙행정기관의 장은 제1항의 규정에 의하여 승인을 취소한 경우에는 지체 없이 국가책임기관의 장에게 이를 통보하여야 한다.
제18조 (재심사)
① 제8조․제12조 및 제17조 제1항 제1호의 규정에 의한 처분에 불복이 있는 자는 대통령령이 정하는 바에 따라 관계중앙행정기관의 장에게 재심사를 요청할 수 있다.
② 관계중앙행정기관의 장은 제1항의 규정에 의한 재심사를 요청받은 경우에는 국가책임기관의 장과의 협의 및 제31조의 규정에 의한 바이오안전성위원회의 심의를 거쳐 재심사에 대한 결정을 하여야 한다.
제19조 (폐기처분 등)
① 관계중앙행정기관의 장은 다음 각 호의 1에 해당하는 유전자변형생물체의 소유자에 대하여 대통령령이 정하는 바에 따라 일정한 기간을 정하여 당해 유전자변형생물체의 폐기․반송 등을 명할 수 있다.
1. 제8조․제9조 또는 제12조의 규정에 의한 관계중앙행정기관의 장의 승인 또는 변경승인을 얻지 아니하거나 관계중앙행정기관의 장에게 신고를 하지 아니한 유전자변형생물체
2. 제14조의 규정에 의하여 수입 또는 생산이 금지되거나 제한된 유전자변형생물체
3. 제17조의 규정에 의하여 수입승인 또는 생산승인이 취소된 유전자변형생물체
② 관계중앙행정기관의 장은 유전자변형생물체의 소유자가 제1항의 규정에 의한 폐기․반송 등의 명령에 따르지 아니한 경우에는 대통령령이 정하는 바에 따라 당해 유전자변형생물체의 소유자의 부담으로 소속 공무원으로 하여금 이를 직접 폐기․반송 등을 하게 할 수 있다.
③ 관계중앙행정기관의 장은 수입된 유전자변형생물체에 대하여 제1항의 규정에 의한 유전자변형생물체의 폐기․반송 등을 명한 때에는 관세청장에게 그 내용을 통보하여야 한다.
제20조 (수출통보)
유전자변형생물체를 수출하고자 하는 자는 산업자원부장관에게 품목, 수량, 수출국가 등 대통령령이 정하는 사항을 미리 통보하여야 한다.
제21조 (경유신고)
유전자변형생물체를 국내를 경유하여 다른 국가로 수출하고자 하는 자는 국가책임기관의 장에게 품목, 수량, 수출국가, 수입국가 등 대통령령이 정하는 바에 따라 신고하여야 한다.
제22조 (연구시설의 설치․운영허가 등)
① 유전자변형생물체를 개발하거나 이를 이용하는 실험을 실시하는 시설(이하 “연구시설”이라 한다)을 설치․운영하고자 하는 자는 대통령령이 정하는 바에 따라 연구시설의 안전관리 등급별로 관계중앙행정기관의 장의 허가를 받거나 관계중앙행정기관의 장에게 신고를 하여야 한다. 허가받은 사항을 변경하고자 하는 경우에도 허가를 받아야 한다. 다만, 허가받은 사항 중 대통령령이 정하는 경미한 사항을 변경하고자 하는 때에는 대통령령이 정하는 바에 따라 이를 신고하여야 한다.
② 관계중앙행정기관의 장은 제1항의 규정에 의한 연구시설의 설치․운영의 허가여부 및 신고내용을 국가책임기관의 장에게 통지하여야 한다.
③ 제1항의 규정에 의하여 연구시설의 설치․운영에 대한 허가를 받거나 신고를 한 자는 연구시설의 안전관리 등급별로 대통령령이 정하는 바에 따라 유전자변형생물체를 개발하거나 실험을 실시할 수 있다. 다만, 위해가능성이 큰 유전자변형생물체를 개발하거나 실험하는 경우로서 대통령령이 정하는 경우에는 관계중앙행정기관의 장의 승인을 얻어야 한다.
④ 연구시설의 안전관리의 등급 및 설치․운영에 대한 허가기준 등에 관하여 필요한 사항은 대통령령으로 정한다.
제23조 (허가의 취소 등)
① 관계중앙행정기관의 장은 연구시설의 설치․운영의 허가를 받거나 신고를 한 자가 다음 각 호의 1에 해당하는 경우에는 그 허가를 취소하거나 1년 이내의 기간을 정하여 그 시설의 운영을 정지하도록 명할 수 있다. 다만, 제1호에 해당하는 경우에는 허가를 취소하여야 한다.
1. 속임수 그 밖에 부정한 방법으로 허가를 받은 경우
2. 제22조 제1항 후단의 규정에 의한 변경허가를 받지 아니하고 그 허가내용을 변경한 경우
3. 제22조 제3항 단서의 규정에 의한 승인을 얻지 아니하고 개발 또는 실험을 실시한 경우
4. 제22조 제4항의 규정에 의한 허가기준에 미달한 경우
② 관계중앙행정기관의 장은 제22조 제3항 단서의 규정에 의하여 승인을 얻은 유전자변형생물체의 개발 또는 실험이 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다는 사실이 밝혀진 경우에는 승인을 취소할 수 있다.
제24조 (표시)
① 유전자변형생물체를 개발․생산 또는 수입하는 자는 당해 유전자변형생물체 또는 그 유전자변형생물체의 용기나 포장에 유전자변형생물체의 종류 등 대통령령이 정하는 사항을 표시하여야 한다.
② 누구든지 제1항의 규정에 의한 표시를 허위로 하거나 또는 이를 임의로 변경하거나 삭제하여서는 아니 된다.
③ 제1항의 규정에 의한 표시의 방법 그 밖에 필요한 사항은 관계중앙행정기관의 장이 이를 정하여 고시한다.
제25조 (취급관리)
① 유전자변형생물체의 수출입 등을 하는 자는 유전자변형생물체를 취급 또는 관리함에 있어서 밀폐운송 등 대통령령이 정하는 취급관리기준을 준수하여야 한다.
② 제1항의 규정에 의한 취급관리의 방법 그 밖에 필요한 사항은 관계중앙행정기관의 장이 이를 정하여 고시한다.
제26조 (관리․운영기록의 보존)
유전자변형생물체의 수출입 등을 하는 자 및 연구시설을 설치․운영하는 자는 산업자원부령이 정하는 바에 따라 유전자변형생물체의 수출입 등 및 연구시설의 관리․운영에 관한 기록을 작성하여 보관하여야 한다.
제27조 (위해방지를 위한 비상조치)
① 국가책임기관의 장은 유전자변형생물체로 인한 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 중대한 부정적인 영향이 발생하거나 발생할 우려가 있다고 인정되는 때에는 대통령령이 정하는 바에 따라 지체 없이 필요한 조치를 하여야 한다.
② 유전자변형생물체의 수출입 등을 하는 자가 유전자변형생물체의 부정적인 영향을 알게 된 때에는 관계중앙행정기관의 장 또는 국가책임기관의 장에게 지체 없이 그 내용을 통보하여야 한다.
제3장 유전자변형생물체의 정보보호
제28조 (정보보호)
유전자변형생물체에 대한 정보를 취급하는 관계중앙행정기관, 국가책임기관, 위해성평가기관, 위해성심사대행기관 및 제32조의 규정에 의한 바이오안전성정보센터(이하 “정보취급기관”이라 한다)의 장은 유전자변형생물체의 정보가 도난․누출 또는 훼손되지 아니하도록 정보보호에 필요한 조치를 강구하여야 한다.
제29조 (정보이용 및 제공의 제한)
① 정보취급기관의 장은 대통령령이 정하는 경우를 제외하고는 유전자변형생물체의 정보를 상업적으로 이용하거나 다른 자에게 제공하여서는 아니 된다.
② 정보취급기관의 장은 유전자변형생물체의 정보를 다른 자에게 제공하는 때에는 사용목적․사용방법 등에 관하여 필요한 사항에 대하여 제한을 하거나 정보보호를 위하여 필요한 조치를 강구하도록 요청할 수 있다.
제30조 (정보취급기관의 임원․직원의 의무)
정보취급기관의 임원․직원이나 임원․직원이었던 자는 직무상 알게 된 정보를 누설하거나 타인의 이용에 제공하는 등 부당한 목적을 위하여 사용하여서는 아니 된다.
제4장 바이오안전성위원회 등
제31조 (바이오안전성위원회)
① 유전자변형생물체의 수출입 등에 관한 다음 각 호의 사항을 심의하기 위하여 국무총리 소속하에 바이오안전성위원회(이하 “위원회”라 한다)를 둔다.
1. 의정서의 이행에 관한 사항
2. 안전관리계획의 수립․시행
3. 제15조의 규정에 의한 위해성이 없는 유전자변형생물체의 품목 등의 고시
4. 제18조의 규정에 의한 재심사
5. 유전자변형생물체의 수출입 등과 안전관리에 관련된 법령․고시 등에 관한 사항
6. 유전자변형생물체로 인한 피해예방 및 대책에 관한 사항
7. 그 밖에 위원장 또는 국가책임기관의 장이 심의를 요청하는 사항
② 위원회는 위원장 1인을 포함한 15인 이상 20인 이하의 위원으로 구성한다.
③ 위원회의 위원장은 국무총리가 되고, 위원은 다음 각 호의 자로 한다.
1. 재정경제부장관․교육인적자원부장관․외교통상부장관․과학기술부장관․농림부장관․산업자원부장관․보건복지부장관․환경부장관 및 해양수산부장관
2. 대통령령이 정하는 자 중에서 국가책임기관의 장의 제청으로 위원장이 위촉하는 자
④ 국가책임기관의 장은 제3항 제2호의 규정에 의한 위원을 제청하고자 하는 때에는 미리 관계중앙행정기관의 장과 협의하여야 한다.
⑤ 위원회의 효율적인 운영을 위하여 위원회 밑에 분과위원회 및 실무위원회를 둘 수 있다.
⑥ 위원회에 간사 1인을 두되, 간사는 산업자원부 소속 공무원 중에서 위원장이 지명하는 자가 된다.
⑦ 위원회․분과위원회 및 실무위원회의 구성․기능․운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
제32조 (바이오안전성정보센터)
① 국가책임기관의 장은 유전자변형생물체의 정보관리 및 정보교환에 관한 사항 등을 전문적으로 수행하는 바이오안전성정보센터(이하 “바이오안전성정보센터”라 한다)를 지정할 수 있다.
② 바이오안전성정보센터는 유전자변형생물체의 안전성에 관한 정보를 국민에게 공개하여야 한다.
제5장 보칙
제33조 (자금 등의 지원)
① 정부는 유전자변형생물체의 안전성에 대한 국민의 이해를 증진하고 소비자의 인식을 제고하기 위하여 관련 기관 및 단체가 실시하는 홍보 및 교육사업 등에 필요한 자금 등을 지원할 수 있다.
② 정부는 연구시설의 안전성을 확보하기 위하여 필요한 시설의 설치․운영 등에 필요한 자금 등을 지원할 수 있다.
제34조 (재원의 확보)
국가책임기관의 장은 유전자변형생물체의 수출입등과 관련하여 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 피해가 발생하는 경우에 대비한 안전성 확보를 위한 재원확보 방안을 강구하여야 한다.
제35조 (수수료)
① 다음 각 호의 1에 해당하는 자는 수수료를 납부하여야 한다.
1. 제8조 제1항․제2항의 규정에 의하여 수입승인을 얻고자 하는 자
2. 제9조 제1항의 규정에 의하여 수입승인을 얻고자 하는 자
3. 제12조 제1항의 규정에 의하여 생산승인을 얻고자 하는 자
4. 제22조 제1항의 규정에 의하여 연구시설 설치․운영의 허가를 받고자 하는 자
② 제1항의 규정에 의한 수수료의 금액․납부방법 및 납부기간 등에 관하여 필요한 사항은 대통령령으로 정한다.
제36조 (보고 및 검사)
① 관계중앙행정기관의 장 또는 국가책임기관의 장은 유전자변형생물체의 안전관리를 위하여 다음 각 호의 1에 해당하는 자로 하여금 보고를 하게 하거나 자료 또는 시료의 제출을 요구할 수 있으며, 소속 공무원으로 하여금 당해 사무소․연구시설․사업장․보관 장소 등에 출입하여 관계 서류나 시설․장비 및 보관상태 등을 검사하게 할 수 있다.
1. 제8조 제1항․제2항, 제9조 제1항 또는 제12조 제1항의 규정에 의하여 수입 또는 생산승인을 얻거나 수입신고를 한 자
2. 제15조 제3항의 규정에 의하여 신고를 한 자
3. 위해성평가기관
4. 위해성심사대행기관
5. 제22조의 규정에 의하여 연구시설의 설치․운영허가를 받거나 신고를 한 자
6. 제25조의 규정에 의하여 취급 또는 관리를 하는 자
② 관계중앙행정기관의 장 또는 국가책임기관의 장은 승인을 얻지 아니하거나 신고를 하지 아니한 유전자변형생물체로 판단되는 물품의 수출입 등을 하거나, 허가를 받지 아니하거나 신고를 하지 아니하고 연구시설을 운영하고 있다고 의심되는 자에 대하여는 소속 공무원으로 하여금 당해 사무소․연구시설․사업장․보관 장소 등에 출입하여 관계 서류나 시설․장비 및 보관상태 등을 검사하게 할 수 있다.
③ 제1항 또는 제2항의 규정에 의하여 출입․검사를 하는 공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 내보여야 한다.
제37조 (청문)
관계중앙행정기관의 장은 다음 각 호의 1에 해당하는 처분을 하고자 하는 경우에는 청문을 실시하여야 한다.
1. 제17조의 규정에 의하여 수입승인 또는 생산승인을 취소하는 경우
2. 제23조의 규정에 의하여 연구시설 설치․운영의 허가를 취소하는 경우
제38조 (벌칙적용에 있어서의 공무원 의제)
위해성평가기관, 위해성심사대행기관 및 바이오안전성정보센터의 임원 및 직원은 형법 제129조 내지 제132조의 적용에 있어서는 이를 각각 공무원으로 본다.
제6장 벌칙
제39조 (벌칙)
다음 각 호의 1에 해당하는 자는 5년 이하의 징역 또는 7천만원 이하의 벌금에 처한다.
1. 제14조의 규정에 위반하여 수입 또는 생산이 금지되거나 제한된 유전자변형생물체(제2호의 생물체를 포함한다)를 수입 또는 생산한 자
2. 제17조 제1항 제1호의 규정에 의하여 승인이 취소된 유전자변형생물체를 수입 또는 생산한 자
3. 제19조 제1항의 규정에 의한 폐기․반송 등의 명령에 위반하여 유전자변형생물체를 국내에 유통하게 한 자
제40조 (벌칙)
다음 각 호의 1에 해당하는 자는 3년 이하의 징역 또는 5천만원 이하의 벌금에 처한다.
1. 제8조 제1항․제2항, 제9조 제1항 또는 제12조 제1항의 규정에 의한 승인 또는 변경승인을 얻지 아니하고 유전자변형생물체를 수입 또는 생산한 자
2. 제17조 제1항 제2호 내지 제5호의 규정에 의하여 승인이 취소된 유전자변형생물체를 수입 또는 생산한 자
3. 제22조 제1항 전단의 규정에 의한 허가를 받지 아니하거나 동항 후단 본문의 규정에 의한 변경허가를 받지 아니하고 연구시설을 설치․운영한 자
4. 제22조 제3항 단서의 규정에 의한 승인을 얻지 아니하고 개발 또는 실험을 실시한 자
제41조 (벌칙)
다음 각 호의 1에 해당하는 자는 2년 이하의 징역 또는 3천만원 이하의 벌금에 처한다.
1. 제9조 제1항의 규정에 의한 신고를 하지 아니하고 유전자변형생물체를 수입한 자
2. 제19조 제1항의 규정에 의한 폐기․반송 등의 명령을 이행하지 아니한 자
3. 제20조의 규정에 의한 통보를 하지 아니하고 유전자변형생물체를 수출한 자
4. 제21조의 규정에 의한 신고를 하지 아니하고 유전자변형생물체를 국내 경유한 자
5. 제22조 제1항 전단의 규정에 의한 신고를 하지 아니하고 연구시설을 설치․운영한 자
6. 제23조의 규정에 의한 연구시설의 운영정지명령을 위반한 자
7. 제30조의 규정에 위반하여 직무상 알게 된 정보를 누설하거나 타인의 이용에 제공한 자
제42조 (벌칙)
다음 각 호의 1에 해당하는 자는 1년 이하의 징역 또는 2천만원 이하의 벌금에 처한다.
1. 제24조 제1항 또는 제2항의 규정에 위반하여 유전자변형생물체의 종류 등의 표시를 하지 아니하거나 이를 허위로 표시한 자 또는 표시를 임의로 변경하거나 삭제한 자
2. 제25조의 규정에 의한 취급관리기준을 준수하지 아니한 자
법인의 대표자나 법인 또는 개인의 대리인․사용인 그 밖의 종업원이 그 법인 또는 개인의 업무에 관하여 제39조 내지 제42조의 규정에 의한 위반행위를 한 때에는 행위자를 벌하는 외에 그 법인 또는 개인에 대하여도 각 해당 조의 벌금형을 과한다.
① 다음 각 호의 1에 해당하는 자는 1천만원 이하의 과태료에 처한다.
1. 제8조 제1항 후단 단서의 규정에 의한 변경신고를 하지 아니한 자
2. 제10조 제3항의 규정에 의한 신고를 하지 아니하거나 관계중앙행정기관의 장의 명령을 이행하지 아니한 자
3. 제11조 제1항의 규정에 의하여 지정되지 아니한 수입항구․공항 등의 장소로 유전자변형생물체를 수입한 자
4. 제12조 제1항 후단 단서의 규정에 의한 변경신고를 하지 아니한 자
5. 제15조 제3항의 규정에 의한 신고를 하지 아니한 자
6. 제22조 제1항 후단 단서의 규정에 의한 변경신고를 하지 아니한 자
7. 제26조의 규정에 의한 관리․운영기록을 작성․보관하지 아니한 자
8. 제36조 제1항 또는 제2항의 규정에 의한 출입․보고․검사․자료 또는 시료제출을 거부․방해 또는 기피한 자
② 제1항의 규정에 의한 과태료는 대통령령이 정하는 바에 의하여 관계중앙행정기관 또는 국가책임기관의 장이 부과․징수한다.
③ 제1항의 규정에 의한 과태료처분에 불복이 있는 자는 그 처분의 고지를 받은 날부터 30일 이내에 관계중앙행정기관 또는 국가책임기관의 장에게 이의를 제기할 수 있다.
④ 제1항의 규정에 의한 과태료처분을 받은 자가 제3항의 규정에 의하여 이의를 제기한 때에는 관계중앙행정기관 또는 국가책임기관의 장은 지체 없이 관할법원에 그 사실을 통보하여야 하며, 그 통보를 받은 관할 법원은 비송사건절차법에 의한 과태료의 재판을 한다.
⑤ 제3항의 규정에 의한 기간 이내에 이의를 제기하지 아니하고 과태료를 납부하지 아니한 때에는 국세체납처분의 예에 의하여 이를 징수한다.
부 칙
부칙
이 법은 의정서가 우리나라에 대하여 효력을 발생하는 날부터 시행한다.
부칙 [2007. 4. 11 제8356호(대외무역법)]
제1조(시행일) 이 법은 공포한 날부터 시행한다.
제2조 내지 제5조 생략
제6조(다른 법률의 개정) ① 내지 ⑥ 생략
⑦ 유전자변형생물체의 국가간 이동 등에 관한 법률 일부를 다음과 개정한다.
제16조 제1항 및 제2항 중 “대외무역법 제14조 제2항의 규정에 의하여”를 각각 “「대외무역법」제11조 제2항에 따라”로 한다.
⑧ 내지 ⑩ 생략
제7조 생략

 생명공학과 관련한 총제적(-omics) 학문
생명공학과 관련한 총제적(-omics) 학문
◐ 글라이코믹스(Glycomics)
당쇄를 인위적으로 목적한 기능을 갖게 변화시킴으로써 의약품 개발에 응용하려는 연구 분야
※ 당쇄 : 단당류가 연쇄상으로 다수 결합된 분자로 일반적으로 생체의 세포 표면에 존재하는 당쇄를 지칭. 이러한 당은 당화(Glycosylation)되는 과정에서 단백질의 기능을 결정하거나 안정화시키는 데 중요한 역할을 함
◐ 기능유전체학(Functional genomics)
유전자와 유전자 산물의 기능, 유전자 산물 간의 상호작용을 밝히는 학문 분야. 이러한 연구를 통해 인간 유전자를 기능상으로 분류할 수 있으며, 이를 통해 질병 진단과 예후 예측, 치료제 개발에 유익한 정보를 제공할 수 있음
◐ 단백질체학(Proteomics)
단백질의 3차원 구조분석, 기능 확인, 다른 생체물질과의 상호작용 등에 대한 연구를 통해 질병의 작용 기구를 파악하고, 신약개발에 활용하는 분야
◐ 대사체학(Metabolomics)
세포 내에 존재하는 대사물의 총체인 대사체를 연구하는 학문
◐ 독성유전체학(Toxicogenomics)
독성물질에 의해 발현양성이 변하는 유전자를 유전체학(genomics) 기법을 동원하여 대량으로 동정한 후 이 결과를 활용하여 개체의 독성물질 피폭 여부 등을 조사하는 학문 또는 기술, 이 기술을 이용하면 동물 또는 기타 시험관 내 방법에 비해 신속, 정확하게 독성물질을 스크리닝 할 수 있으며 한 번의 실험으로 다수 유전자의 변화를 분석할 수 있음
◐ 세포체학(cellomics)
생체에 존재하는 세포를 이용하여 치료기술 및 신약을 개발하는 연구 분야
◐ 약리유전체학(Pharmacogenomics)
개체 간에 나타나는 약물 효과, 독성 등의 차이를 개체의 유전적 요인과 관련지어 연구하는 학문 분야로서 목표는 개개인의 유전적인 요인을 파악해 약에 대한 반응성을 예측할 수 있도록 하는 것임
◐ 유전체학(Genomics)
유전체(genome)는 유전자(gene)와 염색체(chromosome)의 합성어로, 염색체에 담긴 유전자를 총칭하는 말이며, Genomics는 유전정보 전체(유전체)를 연구하는 학문 분야를 말함
◐ 화학유전체학(Chemical Genomics)
Genomics와 조합화학이 결합된 분야로 유전자 분석을 통하여 특정 질환에 관련된 단백질 등 생체 내 타깃을 찾고 이와 반응할 수 있는 구조의 화합물들을 대량으로 합성하여 Lead (신약 후보의 구조적 출발물질)를 찾아내는 분야
 생명공학과 관련한 기타 학문
생명공학과 관련한 기타 학문
◐ 구조생물학(Structural biology)
단백질의 3차원 구조로부터 기능의 정보를 얻으려고 하는 학문적 영역
◐ 뇌과학(Brain science)
뇌의 신비를 밝혀냄으로써 궁극적으로는 인간이 갖는 물리적·정신적 기능성의 전반을 심층적으로 탐구하는 응용 학문 분야
◐ 단백질공학(Protein engineering)
기존 단백질 구조와 기능 간의 관계를 규명하고 새로운 단백질을 설계, 창출하는 기술. 아미노산 서열 결정, 유전자조작, 단백질 입체 구조 규명, 단백질의 분리와 정제, 컴퓨터 그래픽스 등의 기술이 요구된다. 신기능 효소, 고활성 효소, 의약용 단백질 개발에 이용됨
◐ 당쇄공학(Glyco engineering)
천연에 존재하는 당쇄 구조 화합물의 기능·활성 규명, 구조 수식, 유도체 합성 등에 관련된 기술 분야. 당쇄 구조 화합물은 세포 간 인식, 정보 전달에 중요한 역할을 하는 것으로 알려져 있음
◐ 대사공학(Metabolic engineering, Metabolomics)
생명체 대사과정의 네트워크를 각종 정보와 유전자조작 기술을 이용하여 유익한 방향으로 조절하려는 기술 분야
◐ 면역유전학(Immunogenetics)
개체간의 면역학적 차이를 연구하는 유전학 분야. 혈액형, 조직적합성, 면역 응답 등에 관련된 정보를 이용함
◐ 생명과학(Life Science)
생명현상의 규명으로부터 생물기능의 응용연구에 이르기까지 생명체에 관련된 모든 연구 분야를 총괄하는 과학군
◐ 생물정보학(Bioinfomatics)
컴퓨터 기술을 활용하여 유전자와 관련된 정보를 해석하고, 기능과 구조를 밝혀내는 학문 분야
◐ 생체공학(Bionics)
생체 기작과 기능에 대한 공학적 지식을 응용하는 학문. 생체의 기능을 모방해 생체와 같이 동작하는 기계를 제작하는 기술 등이 포함됨
◐ 세포공학(Cell engineering)
염색체나 유전자의 인위적인 조작 또는 이전 기술을 통해 유용한 유전자 형질을 발현할 수 있는 새로운 세포를 만들어 내는 기술. 세포융합에 의한 잡종 세포 형성을 이용하는 연구나 하이브리도마세포 제작을 비롯해 돌연변이주의 분리법이나 조직배양, 세포배양 기술 등이 포함됨
◐ 시스템생물학(Systems biology)
생물 시스템을 구성하는 각각 요소의 행동을 해석할 뿐만 아니라, 전 구성 요소의 동적인 상호 관계를 시스템 전체 수준으로 분석해 고차적인 특성을 총체적으로 연구하는 학문
◐ 조직공학(Tissue engineering)
생명공학, 의학, 공학의 기본 개념과 기술을 바탕으로 하여 인공생체조직 또는 기관을 만들어 이용함으로써 생체 기능의 유지, 향상, 복원을 목표로 하는 학문 분야
◐ 혈액학(Hematology)
혈액과 조혈기관에 관련된 사항을 다루는 학문 분야
◐ 환경생명공학(Environmental biotechnology)
생명공학 기술을 이용한 오염물의 제거, 오염지역의 복원, 오염 탐지 및 측정, 생태 시스템 영향 평가 등 환경 관련 기술 분야
 생명공학 용어
생명공학 용어
◐ 계대배양(Subculture)
미생물이나 동식물 세포를 증식 또는 유지할 때 그 일부를 새로운 배지에 계속 옮겨 배양하는 것
◐ 공통서열(Consensus sequence)
DNA, RNA 및 단백질의 일차 구조상에서, 특정 기능에 관계된 영역에 공통적으로 존재하는 염기나 아미노산 서열. DNA와 RNA의 경우, 특정 단백질의 결합 부위인 것이 일반적임
◐ 과변이(Hypervariability)
셋 이상의 대립형이 나타나는 DNA 염기서열의 변화
◐ 광학분할(Optical resolution)
광학 이성질체 혼합물에서 원하는 광학 활성체를 분리하는 것. 광학 활성을 지닌 산 또는 염기를 이용하여 한 가지 광학 활성체에 대해서만 광학 활성염을 만든 다음 분리하는 방법, 광학 활성 분리용 담체에 의한 크로마토그래피법, 또는 미생물이나 효소에 의해 한 가지 광학 활성체에만 반응을 선택적으로 진행시킨 후 분리하는 방법 등이 있음
◐ 균사체(Mycelium)
곰팡이나 버섯 등 균류의 몸체를 구성하는 실 모양의 구조체
◐ 그린 바이오(Green Bio)
유전자변형생물체(LMO), 건강기능식품 등 바이오기술을 농축산 및 식품 분야에 응용한 것
◐ 글루코사민(Glucosamine)
포도당에 아미노기가 결합된 대표적인 아미노당. 자연계에는 키틴을 비롯해 세균의 세포벽, 동물의 연골, 피부를 구성하는 뮤코다당류 등 다당류의 성분으로 널리 분포함
◐ 기능성식품(Functional food)
생체 방어, 생체 리듬 조절, 질병 예방 등 생체 조절 기능을 충분히 발휘할 수 있도록 설계되고 가공된 식품
◐ 나노기술(Nanotechnology)
10억 분의 1 수준의 정밀도를 요구하는 극미세가공 과학기술
◐ 나노바이오테크놀로지(Nanobiotechnology)
나노기술과 생명공학기술이 접합된 형태의 기술 분야. DNA칩, 단백질칩, 초소형 바이오센서, 고속대량스크리닝(HTS) 시스템의 개발과 적용에 핵심적인 분야
◐ 내포체(Inclusion body)
외래 단백질이 숙주세포 내에서 과량 발현될 때 흔히 형성되는 불용성 단백질 덩어리. 내포체를 형성하면 단백질이 활성을 잃게 되므로 재접힘(refolding)을 통해 활성화시켜야 함
◐ 단백질(Protein)
아미노산을 단량체로 하는 고분자 유기화합물의 총칭. 세포의 주요 구성 성분이다. 생명현상에 관여하는 효소, 항체, 호르몬 등이 포함됨
◐ 단백질삼차구조(Tertiary structure of protein)
단백질 사슬 내에서 비교적 멀리 떨어진 기능기 간의 수소 결합, 이황화결합, 소수성 상호작용(hydrophobic interaction)등에 의하여 형성되는 입체 구조. 효소의 활성, 특이성 등 단백질의 기능과 밀접한 관계가 있음
◐ 단백질칩(Protein chip)
실리콘, 유리 등의 표면에 여러 종류의 단백질을 고밀도로 고정화시킨 바이오칩의 일종. 단백질-단백질(항원-항체), 단백질-리간드, 단백질-DNA, 효소-기질 등 단백질이 관여하는 모든 상호작용의 분석에 이용된다. 이를 통해 생명 현상의 이해, 질병의 진단과 원인 규명, 신호 전달 체계의 이해가 가능하며, 궁극적으로 질병의 예방 및 치료법을 개발할 수 있음
◐ 단세포단백질(Single-cell protein, SCP)
세균, 효모, 사상균, 방선균, 곰팡이, 조류 등의 미생물을 대량 배양하여 균체로부터 추출한 단백질, 사료첨가물이나 식품첨가물, 증량제로 사용됨
◐ 단일클론항체(Monoclonal antibody)
단 하나의 항원성결정기에만 작용하는 항체. 하이브리도마 또는 재조합 미생물 배양을 통해 생산된다. 미량 물질의 분리, 감염증이나 암 진단과 치료 등과 같은 의료 분야에 있어서 중요한 역할을 함
◐ 돌연변이(Mutation)
한 개체의 유전체를 구성하는 염색체나 DNA의 일부에 생긴 영구적인 변화, 염기서열 상의 염기 1개가 다른 염기로 치환된 경우를 점 돌연변이라고 함. 여러 개의 염기를 포함하는 DNA 영역에 걸쳐 변화가 일어나는 경우도 있고, 생식세포에 생긴 돌연변이는 후대에 전달되며, 체세포돌연변이는 후대에 전달되지 않음
◐ 동물자원기술(Animal resources technology)
동물이 생산하는 산물 및 축산 동물의 효율적 생산을 위한 자원 동물의 육종, 사육, 관리 등과 관련된 기술
◐ 동형접합체(Homokaryon)
하나의 세포 내에 유전자형이 다른 두 개 이상의 핵이 존재하는 상태. 핵융합이 일어나지 않으므로 세포질 유전 연구에 이용됨
◐ 레드 바이오(Red Bio)
바이오신약, 바이오장기 등 바이오기술을 보건의료 분야에 응용한 것
◐ 루틴(Rutin)
루티노오즈(글루코오즈와 만노오즈가 결합한 이당류)가 결합된 배당체 형태의 플라보노이드. 콩, 팥, 메밀, 토마토, 감귤류 등에 함유되어 있으며, 모세 혈관의 기능을 정상으로 유지하고 혈관을 튼튼히 하는 비타민P의 작용이 있어 고혈압이나 뇌일혈을 예방하는 데 쓰임
◐ 마이코톡신(Mycotoxins)
곰팡이류가 생산하는 독성 물질의 총칭. 사람이나 동물에게 급성 또는 만성 장해를 유발하며, 대표적인 것으로 Aspergillus flavus가 생산하는 aflatoxin류가 있음
◐ 마이크로어레이(Microarray)
기판 위에 DNA나 단백질과 같은 포획 탐침(capture probe)이 미세한 점으로 고정화된 어레이 장치. 특정 DNA나 단백질의 분석을 통해 유전질환의 진단, 유전자 발현 모니터링 등에 사용됨
◐ 면역억제제(Immunosuppressive agents/immunosuppressants)
생체의 면역 반응을 억제하는 활성을 지닌 물질. 대표적으로 사이클로스포린 A(cyclosporin A) 등이 있으며 장기 이식 시 거부반응을 억제하기 위해 사용됨
◐ 면역치료제(Immunotherapeutic agents)
체내의 면역반응에 관여하는 세포. 단백질로서 치료제로 사용되는 물질. 인터페론, 인터루킨 등이 대표적인 예
◐ 미생물(Microorganism)
육안으로는 관찰이 불가능한 미세한 생물체. 일반적으로 크기 0.1 mm 이하인 생물체를 의미함. 주로 단일 세포 또는 균사체로 존재하며, 최소 생활 단위를 유지한다. 세균류, 사상균류, 효모류, 조류, 원생동물류, 바이러스 등이 이에 속함
◐ 바이러스(Virus)
숙주세포 내에서만 증식할 수 있는 비세포성 생물체
DNA나 RNA 중 하나를 유전체로 갖는 감염세포 내에서만 증식하는 감염성 미소구조체
◐ 바이오디젤(Biodiesel)
지방산 메틸에스터. 식물성 또는 동물성 지방과 메탄올의 산 또는 염기촉매반응에 의해 생산됨. 그 자체 또는 석유 디젤과 혼합해 연료로 사용되며, 바이오디젤은 재생가능자원인 바이오매스로부터 생산되므로 에너지 자원의 고갈 문제가 없으며, 연소 시 이산화탄소 및 미세분진의 배출량이 경유에 비해 현저히 낮고, SOx는 전혀 배출되지 않음
◐ 바이오리파이너리(Biorefinery)
석유 대신 바이오매스로부터 연료 및 화학 원료를 제조하는데 필요한 기술의 집합
◐ 바이오매스(Biomass)
식물이나 미생물 등을 에너지원으로 이용하는 생물체
◐ 바이오멤스(BioMEMS)
생물학적 시스템에 극미세 전자 기계 시스템(micro-electro-mechanical systems, MEMS) 기술을 결합한 새로운 기술 분야. 고성능의 극소형 생물 측정 장치나 생화학 반응 장치 등의 제작이 이에 속함
◐ 바이오산업(Bioindustry)
생명공학 기술을 이용하거나 이에 관련된 산업의 총칭
◐ 바이오센서(Biosensor)
생체 물질이 갖는 반응 특성과 그 반응에 의해 발생되는 전기 화학적 또는 광학적 신호 등을 이용해 특정 물질을 검출하거나 정량 분석하는 장치
◐ 바이오에너지(Bioenergy)
바이오매스(biomass) 및 이를 원료로 하여 생물학적 또는 열화학적으로 생산되는 연료로부터 바이오매스(biomass) 및 이를 원료로 하여 생물학적 또는 열화학적으로 생산되는 연로로부터 얻어지는 에너지. 경우에 따라서 바이오매스로부터 생산되는 연료를 지칭하기도 함
◐ 바이오연료(Biofuel)
생물체(바이오매스 자원)에서 만들어지는 연료. 액체 연료로는 에탄올, 메탄올, 바이오디젤, 피셔-트롭쉬(Fischer-Tropsch) 디젤이 있고 기체 연료로는 수소와 메탄이 있음
◐ 바이오칩(Biochip)
1) 유리, 실리콘 등의 재질로 된 작은 고체 기판 위에 DNA, 단백질 등의 생체 물질을 고밀도로 고정화시킨 마이크로어레이칩, 유전자 발현 양상, 유전자 결함, 단백질 분포, 반응 양상 등을 분석하는데 이용됨
2) 단백질이나 지질, 신경세포 등의 생체 물질로 구성되며, 기본적인 연산이나 정보 처리 기능을 갖는 소자, 현재는 싸이토크롬이나 박테리오로돕신 등이 갖는 전자/광 스위치 특성을 이용한 소자들이 개발되고 있음
◐ 바이오필터(Biofilter)
담체에 고정화된 미생물을 이용해 여러 가지 독성 물질이나 악취 물질을 제거하는 환경 처리 장치
◐ 박테리오신(Bacteriocin)
세균에 의해서 생합성 되는 단백질로서 항균 효과가 있는 물질의 총칭
◐ 발현벡터(Expression vector)
목적 유전자의 효율적인 발현을 위해 제작된 벡터. 전사가 효율적으로 이루어지도록 강력한 프로모터와 적절한 조절 유전자를 갖음
◐ 배아(Embryo)
난자와 정자의 수정이 이루어진 후 8주까지(인간의 경우)를 말하며 후에 태아가 됨
◐ 배아줄기세포(Embryonic stem cell, ESC)
발생 초기의 배반포에서 얻어지는 미분화 상태의 세포. 자가 재생산 능력이 뛰어나 대부분의 조직 및 세포로 분화할 수 있음
◐ 복제 DNA(Clined DNA)
공여체로부터 분리, 동정된 후 벡터에 삽입된 DNA
◐ 복제동물(Cloned animal)
무성적으로 복제되어 유전적으로 모체와 동일한 동물 개체. 난세포에서 핵을 제거하고 모체 체세포의 핵을 이식하는 과정을 거쳐서 복제됨
◐ 복제장기(Cloned organ)
인간 또는 동물의 장기의 일부분 또는 세포를 이용하여 장기로서의 기능이 가능하도록 배양된 생물학적 인공장기. 복제동물의 사육을 통하여 얻을 수도 있음
◐ 생명윤리(Bioethics)
생명을 의미하는 바이오(bio)와 윤리를 뜻하는 에식스(ethics)의 합성어로 생명윤리 또는 생물윤리로 번역됨. 생명에 관한 윤리와, 생물학의 기본원칙에 입각한 윤리의 2가지로 생각할 수 있음
◐ 생명자원
생명자원은 지구상에 존재하는 생물(동식물, 미생물, 인간세포 등), 생물의 구성물(DNA, 유전체 등) 및 이들의 정보를 포함하는 것으로 배양 가능한 생물체, 복제 가능한 부분, 유전자원, 배양 불가능한 생물체 및 이와 관련된 분자, 생리, 구조적 정보를 포함(생물자원, 생물다양성, 생명정보 세 분야를 총칭)
◐ 생명정보
생물자원(유전체, 전사체, 단백질체 포함)과 생물다양성으로부터 유래된 정보와 그것의 가공처리 결과물
◐ 생물공정(Bioprocess)
생물체, 또는 생물체로부터 유래된 물질을 이용하거나 대상으로 하는 공정의 총칭
◐ 생물다양성
육상, 해양 등의 수중 생태계 및 이들 유기체가 서식하는 생태계를 말하며, 이는 종과 종 사이, 또는 종과 생태계 사이의 다양성도 포함
◐ 생물다양성보존(Biodiversity conservation)
생태계에 있어서 종 구성의 다양성과 다양한 종들 사이의 상호작용
그 기능과의 상관관계를 활용해 자연 환경을 안정하게 유지하는 것
◐ 바이오안전성(Biosafety)
생명공학 기술과 그 생산물로부터 유래하는 잠재적 위해성을 감소시키기 위한 노력을 지칭하는 용어
◐ 생물융합기술(Biohybrid technology)
생명공학, 마이크로시스템, 센서시스템 등 여러 가지 분야의 기술이 융합된 것
생명공학 연구에 필요한 여러 가지 방법을 자동화, 병렬화, 동기화하기 위해서 개발된 기술
◐ 생물의약품(Biopharmaceutical products)
생물체 또는 이로부터 유래된 물질을 이용해 생산되는 의약품의 총칭
단백질 치료제, 백신, 항생제, 세포 치료제, 유전자치료제 등이 포함됨
◐ 생물자원
배양 가능한 생물체(동식물, 미생물, 인간세포 등), 복제 가능한 부분, 유전자원, 배양 불가능한 생물체 및 이와 관련된 분자, 생리, 구조적 정보를 포함(OECD, 2004)
◐ 생물학적지표(Biological indicator)
생리활성 물질의 효능. 환경오염 또는 독성의 정도를 특정 생물을 대상으로 하여 수량적으로 표시하는 지표
◐ 생체고분자(Biopolymer)
생체 내에서 합성되는 거대분자의 총칭. 단백질, 핵산, 지질, 다당류가 있음
◐ 생체모방기술(Biomimetics)
생체의 기능을 다른 재료로 대체하거나 생체 기능을 모방, 이용하는 기술, 생체모방화학, 바이오일렉트로닉스, 바이오미캐닉스 등이 포함됨
◐ 성체줄기세포(Adult stem cell)
조혈기관 상피조직 등의 세포 재생계에서 세포생산의 기초가 되는 세포 줄기세포를 추출하여 치료목적의 조직 세포로의 분화를 연구
◐ 세포융합(Cell fusion)
두 개의 서로 다른 세포의 원형질체(protoplast)를 융합하는 것. 동시다발적 유전 형질 변환이 가능함. 식물세포에서는 육종 기술로서 동물세포에서는 단일클론항체 생산을 위한 하이브리도마 세포주를 만드는데 사용되며, 미생물 분야에 있어서는 곰팡이와 방선균 등의 균주 개발에 이용됨
◐ 세포치료기술
손상된 조직 또는 기관 부위를 치료할 목적으로 체외에서 세포를 배양하여 체내에 투여하는 치료법
◐ 알츠하이머병(Alzheimer's disease)
퇴행성 뇌질환의 하나. 치매의 원인 중 가장 흔한 형태
병리 조직학적으로는 뇌의 전반적인 위축, 뇌실의 확장, 신경 섬유의 다발성 병변(neurofibrillary tangle)과 초로성 반점(neuriticplaque) 등이 특징임
◐ 약물전달시스템(Drug Eelivery System, DDS)
약물 방출 속도를 조절하거나 약물을 목표 부위에 효율적으로 전달시키는 방법 등을 통해 의약품의 부작용을 최소화하고 효능 및 효과를 극대화시키는 기술 및 시스템
◐ 염기서열
아데닌(A), 구아닌(G), 시토신(C), 티닌(T) 4개의 상이한 코드(염기)로 이루어진 특정 서열로 DNA에 유전정보 저장
◐ 유전공학(Genetic Engineering)
생물체에 주어진 유전형질을 인위적으로 변형·개조시켜 새로운 형질을 가진 생물체를 만들어내는 기술(세포융합핵치환 단백질공학 유전자 변형)
◐ 유전체(Genome)
유전체는 유전자(gene)와 염색체(chromosome)의 합성어로서 한 생물체가 지닌 모든 유전정보(DNA)의 집합체를 뜻함
◐ 인간화항체(Humanized antibody)
항원을 다른 동물에 주입했을 때 생성되는 항체 구조 중 항원이 결합하는 부위인 상보성결정부위(CDR)에 해당되는 유전자 배열만을 인간 항체 유전자에 대체하는 과정을 통하여, 인간 항체와 특징이 유사하도록 제조된 재조합 항체동물로부터 유래된 부분이 적기 때문에 체내 투여용 항체치료제로 사용되기에 적합함
◐ 인공장기(Artificial organ)
장기의 인공적인 대체물, 심장, 신장, 간장 등의 대체 장기 외에도, 인공혈관, 인공혈관 밸브 등도 포함된다. 인공 재료와 배양 세포를 결합시킨 혼성(hybrid)형도 있음
◐ 인터페론(Interferon, IFN)
인체세포 내에서 바이러스 RNA와 단백질의 생성을 억제하는 항바이러스 단백질의 발현을 유도하는 기능을 갖는 당단백질의 총칭, 생성장소와 기능이 각기 다른 3가지가 있는데 IFNα는 주로 백혈구, IFNβ는 섬유모세포 그리고 IFNy는 주로 림프구에서 생성됨
◐ 자가면역질환(Autoimmune disease)
자가 면역에 의해 생체 방어 기능을 담당하는 면역계가 자기 세포를 공격해 발생하는 질병, 만성 류마티스성 질환이 대표적임
◐ 재조합 DNA 기술(Recombinant DNA technology)
목적 유전자를 제한효소를 이용해 잘라내고 이를 벡터에 삽입해 재조합 DNA를 제작한 후, 숙주에 도입해 발현시키는 과정에 관련되는 기술의 총칭
◐ 전임상(Preclinical)
실험실 차원 및 동물을 대상으로 약물의 생리적 특성과 대상 질병에 대한 효능을 검증하는 것
◐ 제대혈(Cord blood)
태반과 탯줄에 있는 혈액으로 백혈구, 적혈구, 혈소판 등을 만드는 조혈모세포를 다량 함유하고, 연골, 뼈, 근육, 신경 등을 만드는 간엽줄기세포를 가지고 있음
◐ 줄기세포(Stem Cell)
조직분화 과정에서 볼 수 있는 미분화된 세포. 줄기세포는 신체 내 모든 조직으로 분화될 수 있는 가능성을 가지고 있음
◐ 진핵생물(Eukaryote)
핵막으로 둘러싸인 핵과 다양한 세포 소기관을 가지는 세포로 구성되어 있는 생물. 원생생물, 조류, 사상곰팡이, 효모, 식물, 동물이 포함됨
◐ 체세포돌연변이(Somatic mutation)
발생이 진행 중인 개체 또는 완전한 개체 내에서 방사선이나 다른 원인들에 의해 일부의 체세포에 변화가 일어나 새로운 형질이 만들어지는 현상
◐ 체세포변이(Somaclonal variation)
한 개체에서 단일세포를 떼어내어 재 배양했을 때 얻어진 새로운 개체가 원래의 개체와 유전적으로 동일하지 않은 현상
◐ 체세포융합(Somatic cell hybridization)
유전자가 다른 체세포를 접합하여 새로운 유전자형의 세포를 만드는 기술
◐ 치료용효소(Therapeutic enzyme)
치료제로 이용되는 효소 또는 그 제제. 혈전용해제로 사용되는 조직플라스미노젠활성인자(tPA:tissue plasminogen activator), 스트렙토카이네이즈(streptokinase), 유로카이네이즈(urokinase)와 항혈액응고제인 안티트롬빈 III(antithrombin III) 등이 대표적인 예임
◐ 캡사이신(Capsaicin)
고추의 매운맛을 내는 성분으로 무색의 휘발성 알칼로이드 화합물. 약용과 향료로 이용되며, 진통작용과 체지방 감소 효과가 있는 것으로 알려져 있음
◐ 클로렐라(Chlorella)
클로렐라과의 비운동성 담수 조류. 건강 보조 식품, 유제품의 원료로 주로 사용됨
◐ 키토산(Chitosan)
키틴을 탈아세틸화한 물질. 의약 분야에서는 인공 피부, 약물전달시스템 등에 응용되며 환경 분야에서는 응집제로도 사용되며, 세포를 활성화해 노화를 억제하고 면역력을 강화해주며 질병을 예방해 주는 것으로 알려져 있어 건강 기능 식품의 소재로 사용됨
◐ 페니실린(Penicillin)
푸른곰팡이(penicillium)가 생산하는 β-락탐계의 4원자 고리화합물의 항생 물질. 세균의 세포벽 구성 성분인 펩티도글리칸의 합성을 저해하는 대표적인 세균 감염증 치료제임
◐ 펙틴(Pectin)
식물의 세포벽이나 세포벽 사이에 존재하는 다당류의 하나. 주성분은 D-갈락투론산이 α-1, 4 결합한 고분자로 팽윤성이 뛰어난 수용성 식이섬유로서 섭취 시 포만감을 주나 칼로리는 매우 낮음. 배변활동을 원활하게 하고, 지방흡수 저하, 지방합성 저해, 체지방 분해 등의 작용을 하므로 다이어트 식품의 원료로 사용됨
◐ 폴리펩타이드(Polypeptide)
대략 10개 이상의 아미노산잔기로 이루어진 펩타이드. 단백질과 같은 뜻으로 쓰기도 하나 보통 분자량이 작은 단백질을 가리킬 때 쓰임
◐ 표지단백질(Marker protein)
특정 질병 진단의 척도로 사용되는 단백질, 특정 질병 상태에서 발현되며, 일례로 간암의 경우 혈액 내의 알파태아단백(AFP: α-fetoprotein)을 표지단백질로 사용함
◐ 표지유전자(Marker gene)
특정 형질에 대한 유전적 해석의 척도로 이용되는 유전자, 유전질환, 약제내성(항생물질 내성 등), 염도 감수성, 영양 요구성 등을 유전적으로 판단하는데 이용됨
◐ 프로바이오틱(Probiotic)
인간의 건강에 이로운 생균제 식이보조물 또는 생균 성분. 유산균 식품과 표모 체제가 대표적이며, Pro(촉진하는) biotic(생명체)의 합성어임
◐ 항상성효소(Constitutive enzyme)
세포의 생존, 성장과 함께 항상 발현되는 효소, 일상적인 배양조건하에서 세포의 일상적인 기능을 수행하기 위한 효소들이 이에 해당되며, 이들의 유전자는 특정 대사물질에 의해 조절되는 작동 유전자(operator)를 가지고 있지 않음
◐ 핵이식
어떤 세포로부터 핵을 떼어낸 뒤 다른 세포(핵을 제거한 것)에 이식하는 조작
◐ 형질전환(Transformation)
어느 주의 유전형질 일부를 다른 주에 옮겨 넣는 유전교배의 한 형태로, 공여체로부터 추출한 고분자 DNA를 직접 수용체에 거두어 넣어 그 세포 중에서 재조합하는 경우
◐ 화이트 바이오(White Bio)
바이오공정, 바이오환경, 바이오에너지 등 바이오기술을 산업공정/생산 및 환경 분야에 응용한 것

 생명공학의 정의
생명공학의 정의
가. OECD에서의 생명공학의 정의
○ 지식, 재화 및 서비스의 생산을 목적으로 생물 또는 무생물을 변형시키는 과정에서 생물체, 생체유래 물질 및 생물학적 모델에 과학과 기술을 적용하는 활동
나. 「생명공학육성법」에서의 생명공학의 정의
○ 산업적으로 유용한 생산물을 만들거나 생산 공정을 개선할 목적으로 생물학적 시스템, 생체, 유전체 또는 유래되는 물질을 연구·활용하는 학문과 기술
○ 생명현상의 기전, 질병의 원인 또는 발병과정에 대한 연구를 통하여 생명공학의 원천지식을 제공하는 생리학, 병리학, 약리학 등의 학문(기초의과학)
다.「제7회 과학기술관계장관회의(2005. 5. 26)」에서의 생명공학의 정의
제7회 과학기술관계장관회의(2005. 5. 26)의「바이오 연구개발의 효율적 추진방향(안)」에 따르면, 생명공학이란 생물체의 기능과 유전정보를 규명하고 이를 이용·활용하여 산업 및 인류복지에 응용하는 과학기술을 총칭
○ 생명공학, 생명공학 및 생명공학 활용 신약개발 관련 화학을 포괄하는 광의의 개념
○ 생물체의 기능과 정보는 생명현상을 일으키는 생체나 생체 유래물질 또는 생물학적 시스템의 탐구로부터 획득 가능
○ 생명공학, 생명공학, 화학의 개념
- 생명공학 : 생명현상이나 생물의 여러 가지 기능을 밝히고 그 성과를 의료 등 인류복지에 응용하는 종합과학
- 생명공학 : 생물체, 생물전자·정보를 이용하여 산업적으로 유용한 생산물을 만들거나, 개선하는 학문과 기술
- 화학 : 물질의 성질, 조성, 구조 등을 다루는 학문과 기술
* 최근, 신소재개발과 생명현상을 탐구하는 부분에 관심 증대
※ 기존의 신약개발과 새로운 신약개발 방법의 융합화 현상
- 화합물 신약 : 전통적인 Chemical drug을 주로 말하며 저분자(기존방법) 화합물 위주
- 바이오신약 : 생명현상의 원리 규명에서부터 시작하며 단백체(새로운 방법), 유전체, 줄기세포 등 새로운 개념을 도입한 치료제
⇒ 바이오신약과 화합물 신약 모두 생명공학 영역으로 포함하는 추세

 생명공학의 범위
생명공학의 범위
생명공학이 다른 첨단 기술 즉 IT, NT등과 융합되고 관련 기반학문들이 통합되면서 생명공학의 범위가 계속 확대되고 동시에 전통적인 경계들이 모호해지는 경향을 가짐
가. 제2차 생명공학육성기본계획(Bio-Vision 2016)에서의 생명공학의 범위
제2차 생명공학육성기본계획(Bio-Vision 2016)에는 생명공학기술을 총 5개 분야 즉, 1) 생명공학, 2) 보건의료, 3) 농축산·식품, 4) 산업공정/환경·해양수산 5) 바이오 융합의 총 5개 분야로 대분류하고 “국가과학기술표준분류”의 세부기술 목록에 따라 재분류함으로써 객관적 기준을 적용
분야 | 기본계획 분류 | 과학기술 표준 분류상의 범위 |
생명공학 | ○유전체·단백체 ○세포체·대사체 ○뇌과학·생체/생화학 ○생체네트워크 | C6 생화학 / D1 생물학 D2 유전공학 D3 단백질· 탄수화물·지(방)질공학 D4 세포·조직공학 등 기타(B91, C17, C21, C27 등) |
보건의료 | ○기초의과학 ○임상의과학 ○제품화기술 ○인허가 | M1 기초의과학 M2 임상의과학 등 기타(C98, C38, C28, D29 등) |
농축산· 식품 | ○농생물자원 및 유전체 정보이용기술 ○기능성식품공학기술 ○유전자변형 농생물체 개발 및 안전성 평가기술 | D8 생물자원 보존·생산·이용기술 L3 축산 / L4 수의학・수의과학 L5 농공기술 / L6 산림관리・조경 L9 식품가공기술 기타(H54, P72 등) |
산업공정/ 환경· 해양수산 | ○산업공정기술 ○환경생명공학기술 - 환경+IT, NT 등 융합기술포함 ○해양수산생명공학기술 | D5 생물공정·대사공학 E6 해양과학 N 환경 등 기타(D93, E63, E74, O53 등) |
바이오 융합 | ○BT-IT 융합기술 ○BT-NT 융합기술 ○BT-IT-NT 융합기술 | D7 나노바이오 M4 의료공학 M6 의료정보학 등 기타(B55, C54, C97, G14 등) |
출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006

출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006
나. 제7회 과학기술관계장관회의에서의 생명공학의 정의
제7회 과학기술관계장관회의「바이오 연구개발의 효율적 추진방향」의 자료에 따르면 생명공학의 범위를 1) 생명의약/의약 2) 농림축산/식품 3) 생물전자/정보 4) 생물공정/화학으로 분류하고 있음

출처 : 바이오 연구개발의 효율적 추진방향(제7회 과학기술관계장관회의), 과학기술혁신본부, 2005
기 술 분 류 | 기 술 내 용 | |
생명의학 /의약 | 생명공학 | 이종장기, 줄기세포 및 세포치료제, 유전체 및 단백체 기반 치료, 뇌신경/인지/정보 등 |
의과학 | 인체장기별 기능·질환, 인체기능별 질환, 암질환, 감염질환, 인간 유전체질환, 노화, 보건환경·역학, 치의학, 임상시험·진단관련 등 | |
의약 | 약물작용점 발굴, 신의약 탐색, 약물유효성 평가, 약물안전성평가, 원료의약 대량제조, 의약품 제제개발, 약물전달시스템, 임상개발, 화장품제조, 화장품 신소재 발굴 등 | |
한의학 | 한의학치료기술, 한의학적 예방·건강증진, 한의학 진단·지표·평가, 한약·한약제제, 침구관련 진단·치료기술, 한방의료기기, 한의학 정보화 기술 등 | |
농림축산 /식품 | 식품안전성·영양 | 영양소 대사, 임상영양학, 공중보건영양, 영양평가, 식품위생, 식품안전성평가, 건강·기능성식품·식품생리활성소재, 조리과학 등 |
생물자원보존 · 생산·이용 | 식물, 동물, 미생물자원의 보존·생산·이용, 유전자원 보존관리, 유전자원 활용, 생물다양성 보존 등 | |
유용유전자· 형질전환 동식물개량 | 유전자기능분석, 유전자발현조절기술, 유용유전자개발, 고부가가치 형질전환동물개발, 고품질작물개발, 다수성작물개발, 친환경성작물개발, 유전자변형생물체 안전성 검증 등 | |
분자육종·대량생산 | 잡종생산·순도검정, 분자탐침이용 육종·검정, 세포공학기술이용 유용농작물 개발, 가축대량번식, 유전자원 저장·평가·증식관리, 유전자변형생물체의 환경안전성 평가 등 | |
신기능 검정·생산 | 기능성 강화 농작물개발, 농작물유래 의료활성물질 개발, 농작물· 미생물유래 천연물질 개발, 인공유전자의 제조·발현시스템 개발, 형질전환동물에 의한 유용단백질 생산, 친환경 생물소재개발 등 | |
생물전자 /정보 | 의료기기 | 생체분석·모델링, 생체현상계측, 영상진단시스템, 인공보조·대체장기, 수술·치료기기, 재활·복지기기, 의료용 재료·기기, 생체정보학, 의료기기 안전성·표준화 등 |
의료정보 | 의료데이터 획득·저장, 의료정보시스템화, 의료정보검색, 의료영상정보처리, 의료 인공지능, 보건의료정보 등 | |
바이오나노 | 바이오칩, 바이오센서, 바이오컴퓨터, 바이오 MEMS, 바이오메카트로닉스 등 | |
생물정보 | 서열분석·검색, 기계학습·마이닝, 패턴인식·시각화, 생물정보 계산·그래픽, 시스템생물학, 생물정보 DB구축·관리 등 | |
생물공정 /화학 | 생물공정·대사공학 | 발효공학, 생물 분리정제, 생물반응기, 효소공학, 생물청정, 대사전달·조절, 세포대사공학, 생태계 보존, 환경모니터링, 환경오염측정, 생분해, 바이오리메디에이션, 생물에너지 등 |
화학·화학공정 | 촉매, 분리·정제, 공정설계, 분자·나노화학공정, 정밀화학물질, 청정 화학공정, 생물화학공정, 석유화학공정, 고분자공정, 정밀제어 중합공정, 섬유·의류제조, 화학제품제조, 유용신소재 대량생산 등 | |
출처 : 바이오 연구개발의 효율적 추진방향(제7회 과학기술관계장관회의), 과학기술혁신본부, 2005





























































