2009 생명공학백서

- 발행일 2009-12-31
- 출처 백서2009(총서 제116권)
- 담당자 김영철 ( 042-879-8379 / yckkr@kribb.re.kr )
- 조회수 16183
-
키워드
#생명공학백서
-
첨부파일
-
 2009_whitebook.pdf
(다운로드 794회)
바로보기
2009_whitebook.pdf
(다운로드 794회)
바로보기
-
개요
< 2009 생명공학백서 개요 >
□ 발간취지
○ 생명공학 분야의 주요 정책 및 R&D 현황, 국내외 동향과 전망 등 우리나라 생명공학 전반의 정보를 체계적으로 종합하여 제공
→ 생명공학 분야 국내외 동향, 성과 등에 대한 종합적 안내서 기능
→ 생명공학 관련 현황에 대한 국민의 이해를 촉진하고 관심 유도
○ 경 과(격년 발간)
- ‘03.12월 2003 생명공학 백서 발간 [창간호]
- ‘05.12월 2005 생명공학 백서 발간
- ‘07.12월 2007 생명공학 백서 발간
- ‘09.12월 2009 생명공학 백서 발간
★ 첨부파일 다운로드가 안되시는 이용자께서는 아래 링크를 클릭하세요~!
□ 2009 생명공학백서 특징
○ 2007년도 생명공학백서 발간 이후 ’09년 상반기까지 진행된 국가 생명공학의 주요 성과 및 발자취를 종합적으로 정리·수록
- 생명공학 중점분야를 중심으로 관련 시책의 추진실적, 현황 및 전망 등을 체계적으로 정리
- 저탄소 녹색성장을 통한 생명공학의 전망을 특집으로 소개

<2009 생명공학백서 표지>
※ 표 지 : 생명의 근본인 자연을 상징하는 해, 구름, 지구 등의 이미지와, 생명공학을 대표하는 유전
자, 인체, 동·식물 등 여러 분야의 이미지들을 아이콘화 하여 녹색 성장의 중심이 될 생명공
학의 중요성을 자연스럽게 전달하였으며, 신비감과 활력이 느껴지는 컬러의 사용으로 깊이
있는 생명력을 시각화하여 생명공학으로부터 비롯될 미래 녹색 성장의 비전을 표현

저탄소 녹색성장을 통한 생명공학의 전망

![]()
1. 저탄소 녹색성장이란?
지구온난화로 인한 기후변화가 심각해지면서 발생하는 환경위기와 자원고갈, 고유가로 발생되는 자원위기를 세계는 지금 직면하고 있다. 이러한 상황을 극복하고자 전 세계는 친환경적이고 지속적인 경제성장을 도모하기 위해 노력하고 있다.
저탄소 녹색성장은 저탄소화1)와 녹색산업화2)를 양대 축으로 환경보호와 경제성장을 이루는 새로운 패러다임이다. 환경기준에 따라 산업이 재편되고 녹색기술이 핵심기술화 되어 지속가능한 경제발전의 주요 성장동력원이 되는 것을 말한다.
[그림 특집-1] 저탄소 녹색성장 개념도

출처: 녹색기술 연구개발 종합대책(안)(2009), 국가과학기술위원회
전통적인 녹색기술은 재생에너지, 청정에너지 등 환경친화적으로 자원을 활용하는 기술을 의미하고 있었으나 최근에는 BT, IT, NT 등 기술간 융합을 지향하는 융합녹색기술로 녹색기술의 개념이 확대되고 있다. 목적․기능․활용 중심으로 전통적 녹색기술의 범주에서 융합기술적 특성을 분석하여 녹색기술의 영역으로 포함하고 있다.
[그림 특집-2] 녹색기술의 범위

녹색산업은 위와 같이 개발된 녹색기술을 활용하여 경제․금융․산업․건설․교통물류․농림수산업․관광 등 경제활동 전반에 걸쳐 자원과 에너지의 효율을 높이고 환경을 개선하는 재화의 생산과 서비스의 제공 등을 통하여 저탄소 녹색성장을 이루는데 이바지하는 1․2․3차 산업을 말한다.
2. 녹색성장이 환경개선과 경제발전의 새로운 패러다임으로 등장
경제발전과 환경보존은 상충된다는 기존의 패러다임에서 환경을 보존하고 개선하여 자원을 활용하고, 환경을 동력화 하여 경제성장에 기여할 수 있다는 새로운 녹색 성장의 패러다임으로 변화하고 있다.
환경과의 조화로운 공존을 이루며 경제 성장을 도모하기 위해서는 기후변화에 대응하고 환경을 개선하는 녹색기술과 그린에너지 개발이 필요하다. 이는 자원과 에너지를 효율적으로 사용함과 동시에 환경 저부하 에너지원을 이용해 새로운 성장동력을 형성하는 것이다. 또한 자원의 효율성을 극대화 하고 오염의 배출을 최소화 하여 각 분야에서 지속적인 녹색성장을 추진하는 일이기도 하다.
세계 주요 국가들은 신 패러다임인 녹색성장에 대한 정책들을 추진하고 있다. 일본은 저탄소사회 달성을 위해 녹색기술 개발에 주력하고 있다. 2007년 이후 저탄소사회를 비전으로 Cool Earth(2007.5)3), Clean Asia Initiative(2008.6)4), 후쿠다비전(2008.6)5) 등을 제시하여 CO2 감축과 신․재생에너지 개발과 관련된 핵심기술을 구체화 하고 있다. 또한 경제산업성 산하 조직인 NEDO(New Energy Development Organization)를 중심으로 녹색산업과 관련된 차세대 기술의 R&D 투자와 산업화를 지원하고 있다.
EU는 강력한 규제를 통해 녹색시장 창출과 시장의 주도권을 장악하고 있다. 온실가스 규제와 같은 환경규제를 강화하여 산업의 경쟁력 강화와 외국기업의 진출을 봉쇄하며, 회원국들의 녹색산업 경쟁력을 강화하기 위해 신․재생에너지법6)에 근거한 Framework 프로젝트를 추진하고 있다. 이는 청정․재생 에너지와 관련된 R&D 확대 등 다양한 프로젝트를 추진하는 것을 골자로 하고 있다.
미국은 차세대 녹색기술 개발에 주력하고 있다. 기후변화협약인 아․태 파트너십(APP, Asia Pacific Partnership)을 2005년에 미국의 주도로 구성하였고 기술개발을 통해 자발적 감축을 주장하고 있다. 특히 대형 태양열발전, 목질계 바이오에탄올 등 차세대 기술분야에 집중적인 연구개발을 통해 차세대 시장을 공략할 계획이다.
우리나라는 국가차원에서 녹색기술의 개념과 투자방향을 제시하여 체계적인 녹색기술 개발을 위해 ‘녹색기술연구개발 종합대책(2009.1)’을 마련하였다. 이 과정에서 경제성장기여도, 저탄소/환경 지속성 기여도, 전략적 중요도 등을 고려하여 27개 중점육성기술을 선정하였다. 또한 미래한국 프로젝트인 ‘신성장동력 비전과 발전전략(2009.1)’에서 녹색기술산업이 3대 분야7)중 하나로 선정되었으며, 신재생에너지, 탄소저감에너지 등 6개의 신성장동력을 발굴하였다.
3. 저탄소 녹색성장과 생명공학의 역할
생명공학은 녹색성장을 선도해 나갈 수 있는 핵심 분야이다. 인류가 당면한 건강, 식량, 환경, 에너지, 안전 등 공통의 문제를 해결할 수 있는 핵심기술이기 때문이다. 2020년 전후로 건강, 자원, 환경 등의 문제 해결로 경제발전의 중요한 성과를 창출하여 세계경제를 바이오경제시대로 진입 가능하게 하는 핵심 기술이다.
저탄소 녹색성장 시대를 맞이하여 인류의 건강 유지와 바이오연료인 신재생에너지 개발, 그리고 오염된 환경을 개선하고 보존하기 위한 생명공학기술이 필수적으로 요구되고 있다. 생명공학기술에 기초한 새로운 보건의료기술은 예방과 치료의 효과를 극대화하고, 제약의 R&D 비용과 생산 비용을 절감하여 경제적 이익을 얻을 수 있게 한다. 특히, 인간의 유전자 정보를 해독하고 분석할 수 있는 생물정보학의 발달로 고령화 사회와 새로운 질병 발생에 대한 효율적인 맞춤형 예방과 진단을 가능하게 하였다.
화석에너지 고갈에 따른 에너지 수요의 증가와 온실가스 감축에 대응하기 위해서는 바이오디젤와 바이오에탄올을 포함한 바이오에너지의 필요성이 커지고 있다. 생명공학기술로 개발되는 바이오연료인 목질계 에탄올의 생산에는 적합한 효소처리가 중요하다. 유전자 재조합을 통해 고기능성 분해효소를 개발하고, 이 효소처리로 분해된 목질계의 분해산물을 영양분으로 한 발효공정과 정제공정을 통해 고품질의 에탄올을 생산할 수 있다.
경제발전이 양산한 공장의 폐수와 화학물질의 유출은 토양과 수질을 오염시켜 인간생활과 건강을 위협하고 있다. 오염된 토지와 수질은 환경정화능이 탁월한 식물이나 미생물 개발로 개선할 수 있으며, 또한 분해가 되지 않는 석유화학제품이나 플라스틱을 대신하는 생분해성 소재를 개발하여 환경보존에 노력하고 있다.
위와 같이 생명공학은 저탄소 녹색성장과 밀접한 관계를 유지하고 있으며, 지속 가능한 경제성장을 위한 핵심기술로 인식되고 있다. 또한 생명공학을 중심으로 IT, NT 등과의 융합은 기존기술의 한계를 극복하는 혁신적인 기술개발로 이어져 보다 나은 인류의 삶을 유지할 수 있는 환경을 만들고 있다.
4. 저탄소 녹색성장과 관련 생명공학의 전망
저탄소 녹색성장으로 생명공학은 식량, 사료, 바이오연료, 바이오플라스틱, 새로운 치료와 진단기술 등에 많은 발전을 이룩하게 될 것이다. OECD에서는 위와 같은 분야를 1차 생산, 산업, 보건 분야로 구분하여 생명공학의 기술과 경제를 전망하고 있다.
먼저 식량과 사료 등을 포함하는 1차 생산 분야에서는 2015년까지 전 세계의 주요 식량, 사료, 공업 원료용 농산물 생산량의 절반 이상이 생명공학기술에 의해 개발된 식물에서 나올 것으로 전망하고 있다. 여기에 활용되는 생명공학기술은 유전자변형기술 뿐만 아니라 intragenics, 유전자 shuffling 기술들이 활용될 것이다.
[표 특집-1] 1차 생산 분야에 대한 생명공학기술의 전망
|
기술 |
현재 상황 |
2015년 전망 |
|
식물 |
||
|
신형 작물과 변형 수목(tree) |
• GM 작물은 1996년부터 시판, OECD 10개 회원국과 비OECD 13개 회원국에서 재배 • 주로 면, 옥수수, 평지씨, 대두 등이며 승인된 변형식물은 75% 이상이 제초제 내성이나 내충성 함유 |
• 전 세계 작물 재배량에서 바이오기술 점유율은 2015년까지 늘어날 전망 • 상용작물과 대다수 수목을 개발하는데 GM 변형기술 대신 MAS(Marker-assisted selection) 기술 사용 전망
|
|
식물진단 |
• 주로 선진국에서 유행하는 병원균에 치중, 현재 단일 병원균에 대해서는 24시간 실시간 진단기술 이용
|
• 다양한 병원균 감지에 사용되는 저비용, 실시간 진단법 개발 위주로 R&D 추진 • DNA 마이크로어레이가 주요 상용작물의 다양한 병원균 진단에 주로 사용 |
|
동물 |
||
|
육종과 번식 |
• MAS는 가축 및 어류육종의 속도와 정확도 개선에 폭넓게 사용 • GM 동물은 합성물 생산을 위해 실험적으로 개발
|
• MAS는 육종을 위한 지배적인 기술로 대다수 육종업으로 확대 • 신규 합성물 생산이나 고가 동물육종을 제외하면, 소비자의 시선과 비용에 대한 우려로 GM과 클로닝 사용에 제약 |
|
동물진단과 치료제 |
• 애완동물이나 경제적으로 중요한 가축 및 어류질환 진단에 바이오 기반 동물진단 검사 수행 • 동물용으로 승인된 바이오치료제나 바이오백신은 소수에 불과
|
• 새로운 동물진단 검사기술 다양하게 개발되어 2015년까지 상용화 • 가축진단은 비전문가가 이용할 수 있는 마이크로어레이로 이동 • 고비용 전염병에 대해 추가 백신 개발, 성장 및 육질 향상용 바이오치료제 출시 |
출처: The Bioeconomy to 2030 : Designing a Policy Agenda(2009), OECD자료를 생명공학정책연구센터에서 요약 및 재작성
두 번째로는 효소, 바이오연료와 바이오플라스틱 등을 포함하는 산업 분야이다. 바이오연료 생산은 전분 기반 바이오에탄올에서 사탕수수로 제조해 에너지 밀도가 높은 연료나 초목, 목재와 같은 리그노셀룰로즈 원료에서 추출하는 바이오에탄올로 전환할 전망이다.
[표 특집-2] 산업 분야에 대한 생명공학기술의 전망
|
기술 |
현재 상황 |
2015년 전망 |
|
화학물질 생산 |
• 전체 화학물질 생산량 중 극히 미량(점유율 약 2%) • 바이오 기반생산은 에너지 투입량, 폐기물, 환경피해 감소 등 여러 가지 장점 보유 • 현재 효율성 제고를 위해 R&D 집중
|
• 바이오 기반 화학물질은 전체 시장의 10% 이상으로 성장 • 이와 같은 성장은 전문 화학제품과 폴리머에서 가장 두드러지게 나타남 • 신규 바이오촉매와 첨단 발효기술, 대사공학의 발전으로 성장 가능 |
|
생체재료 생산 |
• 바이오폴리머 플랜트는 플라스틱 시장 점유율에서 극히 낮지만 현재 생산 및 개발 중인 제품 많음 • 생분해성이 없는 바이오플라스틱 개발 R&D 추진 |
• 바이오플라스틱은 세계 플라스틱 시장에서 중요한 점유율 달성 • 바이오 기반 플라스틱은 생분해성이 없는 플라스틱 포함
|
|
산업용 효소 |
• 바이오 기반으로 생산되는 효소는 식품첨가, 동물사료, 세제로 널리 사용 • 섬유업의 에너지 절감과 펄프제지 불량 완화에도 사용 • 바이오 기반 GM, 분자진화, MAS를 통해 효소 개발 |
• 공업용 효소 사용량은 포화상태이나 성장 지속, 가장 효과적인 효소, 생산공정 개발 • 이는 비용절감, 에너지 감축, 유해 부산물 제거를 통해 생산의 환경피해 완화 |
|
환경 서비스 |
• 바이오기술의 환경 서비스 진출은 지체되는 경향 • 바이오센서는 비용 경쟁력 문제, 생물정화는 고유의 적합한 미생물과 식물 필요성 문제
|
• 타기술과의 경쟁이 환경 서비스에 바이오 기술 진출의 걸림돌 • 바이오센서는 음용수와 같이 지속적인 모니터링이 필요한 분야에 최적의 솔루션 • R&D는 공공지원과 보건, 농업, 바이오 보안 연구의 부작용에 의해 결정 |
출처: The Bioeconomy to 2030 : Designing a Policy Agenda(2009), OECD자료를 생명공학정책연구센터에서 요약 및 재작성
세 번째로는 새로운 치료와 진단을 포함하는 보건 분야이다. 생명공학기술은 모든 종류의 치료제 개발에 중요한 역할을 할 것이며, 제약과 생명공학의 구분은 더 이상 의미가 없어질 것으로 예측하고 있다. 약물유전학기술의 급속한 발전으로 임상시험과 처방에 빠르게 적용되며, 바이오의약품의 생산량이 2005년 전체의약품의 1.8%에서 2015년에는 12~20%로 증가할 것으로 예측하고 있다.
[표 특집-3] 보건 분야에 대한 생명공학기술의 전망
|
기술 |
현재 상황 |
2015년 전망 |
|
치료제 |
• 1990년대 후반 이후 매년 7개 정도의 바이오 의약품이 시장에 출시되고 있으며 중요한 장점 보유 • 유전자치료제, 세포치료제와 같은 실험 치료제가 현재 시장 진출 • 합성신약 개발과정에서도 바이오기술 사용 증가
|
• 매년 바이오의약품의 수는 계속 증가하나 전체 의약품 점유율에 큰 증가는 없음 • 바이오의약품의 가치는 점차 낮아지나 유전자치료제, 세포치료제와 같은 실험치료제 승인으로 분위기 반전 • 바이오기술은 거의 모든 신약개발 과정에서 타겟규명과 같은 중요한 역할 |
|
진단제 |
• 체내진단보다 체외진단 위주, 대부분 유전자 돌연변이, 유전자 발현패턴 감지용 • 유전자 진단 질병은 1,600종 이상이며, 이용률도 크게 증가 |
• 바이오 기반 체외진단 늘어나지만 과거에 비해 성장세 둔화 가능 • 단일 유전자 돌연변이 규명에서 돌연변이 유전자와 관련된 위험요인 규명으로 이행 |
|
약물유전학 |
• 유전자 검사가 필수인 미국의 4개 약물과 함께 20여종의 약물에 유전자 검사 권장 • 약물유전학 정보를 포함하는 약물의 증가는 바이오마커의 수와 함께 증가
|
• 특정 유전자 특성을 공유하는 집단별로 승인되는 약물 수가 증가하지만, 주로 효능개선과 약물부작용 완화에 치중 • 반응군 규명으로 임상실험에 실패한 약물구제에 사용 |
|
기능성 식품 및 식의약품 (FFN) |
• 시장에 출시된 FFN 대다수는 바이오 기반 제품이 아니며 시장점유율이 극히 낮음
|
• 2015년까지 개도국을 위해 영양소가 강화된 작물개발에 바이오기술 사용 가능 • OECD에서 바이오변형식물이 상용화되어 FFN 시장에서 바이오의 점유율 제고 |
|
의료기기 |
• 바이오센서나 조직공학 기반기기를 비롯하여 잠재력이 가장 높은 활용기술은 아직 연구단계 |
• 인슐린을 생산할 수 있는 간단한 조직공학 기반기기가 2015년 시장 출시 |
출처: The Bioeconomy to 2030 : Designing a Policy Agenda(2009), OECD자료를 생명공학정책연구센터에서 요약 및 재작성
제1장
생명공학의 비전


생명공학과 우리의 미래
1. 태동하는 바이오경제
2009년 6월초 프랑스 파리 OECD본부에서 생명공학작업반(Working Party on Biotechnology) 회의가 개최되었다. 이 자리에서는 20∼30년 내에 우리의 일상생활 깊숙이 자리 잡아 IT 영향에 버금가는 커다란 파급효과를 미칠 “바이오경제시대” 도래에 대한 논의가 활발하였다. 2009년, OECD에서 발간한 “2030년 바이오경제시대를 위한 정책 디자인(The Bioeconomy to 2030: Designing a Policy Agenda)”이라는 책자는 다가오는 바이오경제시대를 맞아 사회·경제적 혜택을 최대화 하고 이에 따르는 부작용을 최소화 하기 위한 정책제언들을 제시하고 있다.
[표 1-1-1-1] 2030년 바이오경제시대 주요 견인요인들
|
바이오경제 견인요인 |
2030년 전망 |
|
인구와 경제 |
-세계인구가 83억 명으로 증가, 2005년 세계 GDP가 2배로 상승하고 OECD 국가의 1인당 소득은 세계평균의 3~6배이나 많은 빈곤국 존재 |
|
노동 자원 |
- 세계노동력은 25% 증가, OECD 국가에서의 노동가능 연령과 청년층의 감소 - 교육수준의 상승과 농업에서 제조업, 서비스업으로의 이직 증가 |
|
에너지와 기후변화 |
- 에너지 수요 증가로 화석연료 감소 및 온실가스 배출 증가, 세계적인 기온 상승 및 해수면 상승 |
|
식료품 가격과 물 |
- 높은 식료품 가격 유지와 육류 가격의 상승 - 인구증가로 물 부족 지역 증가와 세계 67%가 하수도 부족 |
|
보건의료 비용 |
- 바이오 기반의 새로운 보건의료 기술은 전 세계 보건의료 경비 증가 영향 |
|
기술개발 |
- 타 기술과의 경쟁이 있지만 IT와 NT가 바이오기술 개발을 촉진 |
출처: OECD, “The Bioeconomy to 2030: Designing a Policy Agenda”, 2009
인구와 경제, 노동자원, 에너지와 기후변화, 식료품 가격과 물, 보건의료 비용, 기술개발 등 다양한 측면에서 바이오기술은 시대의 주요 견인요인으로 부각되고 있으며 이러한 당면과제들에 대해서 바이오기술이 그 해결도구와 방법을 제공할 수 있으리라 기대하고 있다.
2. 2030년 바이오경제 전망
바이오기술의 응용분야는 크게 1차 생산(Primary production), 보건(Health), 산업(Industry)이라는 세 가지로 나뉘며, 독립적으로 개발이 진행되던 이들의 응용분야는 곧 통합되어 개발될 것으로 전망하고 있다. 지금까지 바이오기술에 대한 투자는 보건 분야에 80% 이상 집중되었지만 향후 바이오기술은 농업과 산업 분야에서 75% 이상의 경제적 기여를 하게 될 것으로 예상된다. 따라서 농업과 산업 바이오기술에 대한 중요성이 부각됨에 따라 농업, 어업, 임업 등 1차 생산과 산업 분야에 대한 시각도 바뀌어야 한다. 2030년 바이오경제는 세계적으로 주된 추세로 자리 잡을 것이며, 1차 생산과 대다수 산업바이오의 주요시장은 선진국에서 개도국으로 전환될 것으로 예상하고 있다.
(표 1-1-2-1)은 2030년 시장에 출시될 확률이 높은 바이오기술과 단계별 혁신전망을 1차 생산, 보건, 산업 분야로 나누어 정리한 것이다. 2030년 바이오경제시대에서 급진적인 혁신이 일어나는 경우, 먼저 1차 생산 분야에서는 다양한 바이오매스 공급 원료를 이용하여 폭넓은 최종제품(식량, 연료, 재료, 화학물질 등)을 생산하는 바이오리파이너리가 주된 활동으로 자리 잡을 것이다. 보건 분야에서는 예측과 예방치료를 이용하여 질병 위험인자를 사전에 식별하고 증상이 발현되기 전에 효과적으로 치료할 수 있는 예방의학이, 산업 분야에서는 대사공학이나 합성생물학로 미생물이나 간단한 식물을 개발하고 이들을 이용해 광범위한 화학물질, 고밀도 바이오연료 생산 등과 같은 산업 활동이 활발할 것으로 전망하고 있다.
[표 1-1-2-1] 2030년 시장에 출시될 확률이 높은 바이오기술
|
1차 생산 분야 |
보건 분야 |
산업 분야 |
|
-식물, 가축, 어류와 갑각류 사육에 대한 MAS(Marker Assisted Selection) 이용률 확대 |
-바이오 기반 신약 및 백신이 매년 시장에 진입
|
-화학분야에 응용되는 효소의 증가
|
|
-산업공정 및 전환 생산량 향상을 위해 전분, 유지, 목질소 함량을 개선한 각종 GM 작물 및 수목
|
-임상시험과 처방에 약물유전학 이용률이 늘고 특정 치료제 처치 대상 환자비율 감소
|
-원스텝으로 화학제품 생산수량을 증대시킬 수 있는 미생물, 일부는 생물탐사를 통해 선별된 유전자에 의해 개발 |
|
-약물과 기타 고부가가치 합성물 생산에 사용되는 GM 동식물
|
-약물유전학 데이터와 처방전 자료, 장기 건강 성과로 인한 치료의 안전과 효능 개선 |
-실시간 환경오염 모니터링과 신원 확인용 생체인식을 위한 바이오센서 |
|
-GM, MAS, Intragenics 또는 Cisgenesis를 통해 생산량, 내성, 저항성이 향상된 주요 식용 및 사료용 작물 |
-관절염과 같이 유전적 특징이 주요 원인인 일반 질환의 다양한 유전적 위험요소에 대한 광범위한 검사 |
-사탕수수나 바이오매스 셀룰로즈 원료를 이용하여 생산하는 고에너지 밀도 바이오연료
|
|
-가축, 어류 및 갑각류의 유전적 특성과 질환의 향상된 진단기술
|
-바이오와 나노기술 통합을 통한 약물전달시스템 개선
|
-일부 우위를 점하는 틈새 시장에서 바이오플라스틱과 같은 생체재료의 시장점유율 증대 |
|
-고부가가치 번식용 가축 클로닝
|
-GM 미생물과 식물, 해양 추출물로부터 생산되는 신규 식의약품 |
|
|
-GM기술을 이용하여 비타민이나 미량 영양소를 강화한 개도국의 핵심 필수 작물 |
-관절염, 2형 당뇨, 심장질환, 일부 암 등 만성질환의 위험요소에 대한 저비용 유전자 검사 |
|
|
|
-재생의학은 당뇨관리를 개선하고 일부 손상조직을 대체 및 재생 |
|
[표 1-1-2-2] 2030년 바이오경제시대의 혁신전망
|
|
점진적(Incremental) |
파괴적(Disruptive) |
급진적(Radical) |
|
1차 생산 |
-생산량 및 품질 개선, 스트레스, 병충해 내성 -가축, 양어, 익충의 변종 개선 -동식물 질환에 대한 실시간 및 저렴한 진단 -기능성 식품, 특히 개도국의 필수작물 생산 증진 |
-만성질환 발생위험을 줄이기 위해 유전자가 알맞게 조작된 식의약품 -수산 양식용 GM 식물이나 미생물, 특히 비식용작물 맞춤형 셀룰로오즈 바이오연료 -열대 및 아열대 기후에 맞게 강화된 수목종 |
-다양한 바이오매스 공급 원료를 이용하여 폭넓은 최종제품(식량, 연료, 재료, 화학물질)을 생산하는 바이오리파이너리 -이를 기반으로 하는 1차 생산 및 산업공정의 통합은 새로운 인프라나 조직변화 필요
|
|
보건 |
-신규 합성신약, 바이오의약품, 재 조합형 백신의 꾸준한 출시 -태아의 비정상적인 유전자 돌연변이 식별 -대다수의 만성질환 및 전염병 진단
|
-대다수 약물 및 치료에 사용되는 약물유전학 정보 -새로운 치료법 및 치료제를 제공하는 줄기세포나 조직공학 기반의 재생의료기술
|
-질병 진행을 추적하고 필요한 라이프스타일을 식별하기 위해 검증된 생물표지 -이를 기반으로 예측 및 예방 치료를 이용하여 질병 위험인자를 사전에 식별하여 증상이 발현되기 전에 효과적으로 치료할 수 있는 예방의학 |
|
산업 |
-산업공정용 효소 개선
|
-셀룰로오즈 공급 원료를 이용해 지속가능한 바이오연료 및 화학물질 생산방식과 사탕수수를 이용한 고밀도 에너지 바이오연료 생산 |
-대사공학이나 합성생물학을 이용하여 개발한 미생물이나 간단한 식물을 이용하여 광범위한 화학물질 및 고밀도 에너지 바이오연료 생산 |
출처: OECD,“The Bioeconmy to 2030 : Designing a Policy Agenda”, 2009
다가오는 바이오경제시대에는 사회적․경제적․기술적 요인이 새로운 유형의 사업모델을 요구하기 때문에 바이오기술에 대한 새로운 사업기회를 찾아나가는 대비가 필요하다. 현재까지의 사업모델을 살펴보면 다음과 같다. 먼저 보건 분야는, 연구를 전담하여 대기업에 지식을 판매하는 형식의 소규모 전문 바이오기업(small, dedicated biotechnology firm, DBF)과 R&D를 수행하고 제품을 제조하여 유통하는 대규모 통합기업이 주를 이루었다. 1차 생산 분야에서는 유전자변형기술 개발로 기업 통합을 급속히 촉진하여 범위와 규모의 경제를 조성하였다. 산업 분야는 생산 확대능력에 따라 수익성이 좌우되어 일부 DBF만 활발하게 활동하는 상황으로, 이를 위해 전문 공학지식과 대규모 자본투자가 필요하였다.
[그림 1-1-2-1] 미래의 바이오기술 사업모델

출처: OECD,“The Bioeconmy to 2030 : Designing a Policy Agenda”, 2009
하지만 미래의 사업모델은 지식공유와 연구비용 감소를 위한 협력모델과 시장을 유지하고 새롭게 창조하기 위한 통합모델이 필요하다. 협력과 컨소시엄 사업모델은 전문 분야에서 R&D를 수행하고 이로부터 확보된 지식을 대기업에 파는, 작지만 섬세한 바이오회사가 응용 전 분야에 걸쳐 적용 가능하다. 특히 1차 생산과 산업 분야에서 DBF 활성화를 유도할 것으로 보인다. 예측과 예방이 필요한 보건의료 분야에서도 통합모델은 복잡성을 관리할 수 있는 보건의료 전문 바이오회사에 적용이 가능하며 R&D, 생산, 유통을 동시에 수행할 것으로 전망되고 있다.
3. 바이오경제시대를 준비하는 자세
태동하는 바이오경제는 공공 연구비 지원, 제도 및 규제, 지식재산권과 사회적 태도(포용도)에 주된 영향을 받는다. 여기에 바이오 관련 과학, 기술발전, 바이오제품과 공정의 성공적인 상용화가 중요한 영향 요인이다.
재생의학, 맞춤 예방의학은 의사와 환자의 관계를 새롭게 바꿈과 동시에 인간의 수명을 연장시키고 삶의 질을 높인다. 이렇듯 새로운 서비스를 공급하고 치료법을 개발함으로 보다 나은 바이오 사업모델을 형성할 수 있기 때문에 이에 대한 예측연구가 수반되어야 할 것이다.
그리고 규제와 정책체계로 정의되는 거버넌스(governance)는 바이오기술의 발전과 활용에 영향을 주기 때문에 반드시 그 질을 향상시키는 노력이 필요하다. 정부부처는 전문지식을 토대로 아래와 같이 바이오경제시대로 원활하게 나아가기 위한 정책들을 제시하며 정부활동의 공조를 강조하고 있다.
바이오경제 성공을 위해 위와 같은 정책제언을 고려하여 연구와 산업을 지원하고 민간 기업이 바이오산업에 투자하도록 인센티브를 조성할 수 있는 현명하고 유연한 정부정책과 지도력이 무엇보다 필요하다. 여기에 적절한 정책과 모범적인 지도력이 갖춰진다면 2030년 바이오경제는 우리 국민에게, 더 나아가 전 세계 인류에게 환경적으로 지속가능한 미래 안에서 양질의 삶을 제공할 것으로 기대한다.


생명공학 산업의 장기전망
1. 생명공학산업의 현재
가. 정의 및 범위
OECD는 생명공학기술(Biotechnology, BT)을 지식 재화 및 서비스의 생산을 위한 생물 또는 무생물을 변형시키는 과정에서 생물체 혹은 생물체의 일부, 제품, 제품관련 모델에 과학적인 논리와 기술을 적용하는 활동이라 정의한다.8) 또한 생명공학산업(Bioindustry or Biotechnology industry)의 범위는 OECD 기준에 따르면 의약, 농축수산, 환경, 에너지 시장 등으로 구분한다(표 1-2-1-1). 특히, 의약품 시장의 경우 생명공학기술과 의약화학기술을 동시에 이용한 제품이 의약품 시장의 90% 규모를 차지함에 따라 생명공학산업에서 의약품 시장은 저분자 합성의약을 포함하여 해석하고 있다.
[표 1-2-1-1] 생명공학산업 분야
|
분야 |
범위 |
|
생물의약 |
호르몬제, 항암제, 항생제, 면역제 등 치료제, 백신, 진단시약, 유전자요법 등 |
|
생물화학 |
생분해성 고분자, 아미노산, 유기산, 기능성 다당류, 향료, 색소 등 |
|
생물환경 |
환경정화용 미생물제 및 공정, 대기탈황, 탈취제, 응집제 |
|
바이오 식품 |
저칼로리형 대체감미료, 기능성 지질, 식품첨가물, 발효식품 등 |
|
바이오에너지, 자원 |
연료용 에탄올, 메탄발효, 이산화탄소 고정화, 광합성, 바이오 가스 등 |
|
생물농업, 해양 |
인공종자, 동물백신 및 진단제, 미생물농약, 해양생물자원, 사료제 등 |
|
생물공정, 엔지니어링 |
발효공정, 동식물 세포 배양, 생물반응기, 생물전환기술 |
|
생물학적 측정 시스템 |
안전성과 효능 평가기술, 바이오센서, 바이오칩, 진단기술 등 |
출처: Guide to Biotechnology 2008, BioIndustry Organization, USA, 생명공학 시장현황 및 전망 분석 보고서, 생명공학정책연구센터, 2007
나. 생명공학 산업군 및 세계시장규모
생명공학산업은 다른 산업과는 달리 대표적인 녹색산업으로서 의약산업을 포함하며 농축수산분야에서 식량문제를 해결하고 환경복원과 폐기물처리기술 개발을 포함하고 있다. 또한 환경문제를 해결하고 고갈되고 있는 석유에너지 자원을 대체할 바이오에너지를 개발하여 바이오 전자산업 등, 모든 산업군에 적용될 것으로 예측하고 있다.
전 세계 생명공학산업의 규모(바이오산업 중 가장 규모가 크고 부가가치가 높은 의약품산업 중심 통계임)로는 2004년 5천 4백억 달러에서 2008년 7천 200억 달러, 2020년에는 1조 3천억 달러9)에 육박할 것으로 예상되며, 이 중 의약품시장이 전체 시장의 90%를 차지하고 있다(표 1-2-1-2).
[표 1-2-1-2] 생명공학 산업 및 예상 시장 규모
|
산업 부문 |
주요 제품 |
현재 단계 |
2010년 시장 예상 시장 규모 (억 달러) |
주요 참여 기업 |
|
의약 |
콜레스테롤 저해제, 적혈구 성장 촉진제, 성장호르몬 |
상용화 |
9,700 |
Amgen, Genentech, Pfizer, GSK |
|
생명공학 치료 |
세포치료제, 유전자 치료제, 수혈제품 |
응용 연구 중 |
562 |
Aastrom, ONYX, Vical |
|
U-Health |
바이오칩, 운용체계 |
응용 기술 축적 |
300 |
Affimetrics, Medtronics |
|
유전자변형 생물체 |
작물, 동물, 어류 |
상용화 |
150 |
Monsanto, Syngenta |
|
생명공학 기기 |
영상진단기, 분석기기 |
상용화 |
850 |
HP, GE, Agilent |
|
생명공학 환경, 에너지 |
미생물 분해, 생명공학 연료 |
상용화 초기 |
160 |
Shell, BP |
|
생명공학 공정 |
기존 공정의 대체 |
상용화 초기 |
250 |
Cargill-Dow, BASF, Dupont |
출처: IMS Health, Jain PhrmaBiotech Report 2007, Pricewaterhouse Cooper 2008, 생명공학 시장현황 및 전망 분석 보고서, 생명공학정책연구센터, 2007
다. 생명공학 연구개발 기술동향과 융합기술 발전의 전개 방향
인간게놈프로젝트(Human Genome Project) 이후 동물, 식물, 미생물 등 많은 생물종에 대한 유전체 지도가 완성됨에 따라 생명 현상에 대한 총체적인 접근(시스템 생물학)을 통해 바이오 제품들이 연구 개발되기 시작했다. 이러한 포스트게놈 시대에서 첨단 생명공학기술의 활용범위는 기초 연구개발 단계에서 산업화 단계로 발전하고 있다. 생명공학기술은 IT, NT 등 첨단 기술 간의 융합을 통해 새로운 제품 개발에 기여하여 바이오칩, 바이오센서, 나노바이오기술, 생물정보학 등 새로운 융합기술 제품들이 상업화 되고 있다. 또한 SNP, 약물유전체학(Pharmacogenomics), 줄기세포연구의 결과들 역시 예방의학, 맞춤의약, 재생의약의 관점에서 시장에서 활용되기 시작하여 난치병과 유전병 치료에서 새로운 돌파구가 되었으며, 점차 예방의학에 집중하여 삶의 질을 개선하는 방향으로 진행되고 있다.
생명공학산업, 특히 의약품산업은 첨단 기반기술과 함께 산업화를 위해서는 장기간 막대한 투자가 필요하다는 점에서 미국, 영국, 스위스, 일본, 독일 및 프랑스 등 선진 몇 개국이 산업 발전을 주도하고 있으며, 선도 기업 간의 경쟁이 매우 치열하다. 미국을 포함한 상위 6개국이 전 세계 연구 개발비 투자액의 88%를 차지하고 있으며, 미국, 영국, 스위스, 프랑스, 일본 중심의 상위 20개 기업이 전체 시장의 60%를 점유하고 있다.
미국, 영국과 스위스 중심의 대형 다국적 제약 및 바이오 기업들은 연구개발에 대한 투자를 점차 강화하여, 2008년 미국 정부의 국립보건원이 연구개발에 투자한 약 288억 달러보다 많은 약 500억 달러에 이르는 엄청난 규모의 금액을 투자하고 있다. 그러나 연구개발에 대한 지속적인 투자증가에도 불구하고 임상 개발되어 미국 식약청의 허가를 받아 출시되는 제품의 수는 증가하지 않고 있다. 이에 따라 R&D의 생산성을 높이기 위해 다국적 제약 및 생명공학 기업들은 신기술 확보와 파이프라인 강화를 위해 소규모 벤처와의 전략적 제휴에 투자를 확대하고 있다.
생명공학 산업의 발전과 가장 밀접하게 관계된 사회적 이슈는 인간게놈프로젝트(Human genome project)의 완성이며, 이에 따르는 혜택을 가장 빠르고 직접적으로 받는 분야는 바로 의약품 산업이다. 현재 2008년의 의약품 산업시장은 연간 7천 120억 달러이며, 이것이 앞으로 전개될 포스트 게놈시대(유전자 서열이 밝혀진 이후)에는 얼마나 증가할지 예측하기 어려운 상황이다. 곧 병의 치료개념에서 고령화 시대를 맞이하여 삶의 질을 향상시킬 수 있는 예방의학의 중요성이 대두되고 있다. 또한 알츠하이머, 대머리, 비만 등의 신약 연구개발이 21세기에 인간 유전체 프로젝트의 결과를 이용한 가장 큰 경제적 가치를 창출할 수 있는 의약품들이 될 것으로 예견하고 있다.
인간유전체의 서열이 밝혀진 상황에서 이제 어떠한 연구가 필요할 것인가? 미국과 일본 정부는 선도적으로 구조유전체학(Structural genomics), 단백질체학(Proteomics), 시스템생물학(Systems biology) 및 화학 유전체학(Chemical genomics), 합성생물학(Synthetic biology), 나노생물학(Nanobiology), 및 줄기세포(Stem cell) 연구에 집중투자하고 있다.
라. 생명공학산업의 시장 예측
생명공학 시장은 2008년 약 7천 120억 달러에서 2020년 약 1조 3천억 달러로 성장할 것으로 예상하고 있다. 2020년에 이르면 의약품시장에서 의사보다는 행정부와 수요자들에 의한 가격 결정권한이 강화되고 E7 국가들(브라질, 중국, 인도, 인도네시아, 멕시코, 러시아, 터키)의 경제가 크게 성장하여 이들 국가들이 전 세계 바이오 산업시장의 약 20%를 차지할 것으로 예상된다. 특히 중국의 바이오산업 시장은 연평균 20% 이상의 고성장으로 2015년에는 미국, 일본에 이어 세계에서 3번째로 큰 생명공학시장을 차지할 것으로 예상하고 있다.10) 또한 보건의료분야에서는 치료정책보다는 금연캠페인 등을 통한 예방정책이 강화되고, 주로 서방 선진국에서 수행되어온 초기 연구단계가 고비용 등으로 아시아국가들(주로 중국과 인도)로 크게 이동하고 있다. 이미 중국 상하이에는 세계 10대 다국적 제약사들 대부분이 대규모 투자로 R&D 센터를 설립해 운영 중에 있다.
이와 더불어 바이오 벤처들의 장점인 신속한 의사결정과 연구개발 속도가 다국적 제약 기업들의 복잡하고 느린 의사결정 시스템과 연구개발 문화에 변화를 일으키면서 기존의 다국적 제약사들은 주로 후기 임상개발과 마케팅에 집중하는 방향으로 진행될 것으로 예상하고 있다.11)
한편, 프로테오믹스 연구를 통한 바이오마커들의 발견으로 보다 안전하고 효율적으로 신약을 개발할 수 있을 뿐만 아니라, 허가 후에도 환자 맞춤형 의약처방(Personalyzed medicine)으로 부작용을 줄이는 등 더 효과적인 방법으로서 치료하는 시대가 다가오고 있다. 또한 2020년이면 전 세계가 하나의 임상개발규정(One global regulatory system, ICH guideline)으로 통일되어 막대한 비용과 개발 기간의 감소로 이어질 것이다. 한편, 제조사의 공급사슬은 자동차 부문과 같이 제조와 배송시스템으로 구분되는 혁신이 이루어질 것이다. 공급측면에서는 블록버스터 판매 모델이 사라지고 수요측면에서도 소비자 중심의 맞춤의약(Personalyzed medicine)으로 혁신이 이루어질 것으로 예상하고 있다.
한편, 의약도매상이 사라지고 제조업체에서 직접 소비자에게 배달되는 배송시스템으로 혁신될 것이며, 획기적인 신약이나 백신 등 삶의 질을 높이는 신약들에 대해서는 특허기간을 현재보다 더 길게 조정하여 제조회사들을 보호할 것이다. 모방의약(me-too-medicine)이나 개량 신약들에 대해서는 특허기간을 축소하여 생명공학과 제약사들의 혁신적인 신약 연구개발을 촉진하는 방향으로 전개될 것으로 예상된다.
2. 생명공학산업의 미래 전망
가. 생명공학산업의 미래
생명공학산업시장의 미래 전망은 다음과 같다. 첫째, 지역의 경계가 없이 전 세계 국가들을 상대로 하면서 각국의 강점을 활용하는 생명공학 산업의 성장이다. 중국과 인도가 다국적 제약 바이오사들의 임상 시험과 초기 연구의 장으로 적극 활용되기 시작하는 것이 그 예이다. 이에 따라 국가 간 전략적 제휴와 인수 합병의 경우, 2003년 대비 2005년에는 14% 증가한 480건에 이르고 있다.
둘째, 혁신적인 생명공학분야의 기술개발과 IT와 NT의 융합을 통한 산업의 변화이다. 구조기반 신약발굴기술(Structure-based drug discovery)과 고속약물탐색기술(High throughput screening)은 고유한 선도물질의 발굴시간을 줄이며 상대적으로 부작용이 적고 약효가 뛰어난 신약의 발굴이 크게 증가하고 있다. 또한 기능유전체학(Funtional genomics), 단백질체학(Proteomics), 화학유전체학(Chemical genomics), 시스템생물학(System biology), 합성생물학(Synthetic biology)과 줄기세포(Stem cell) 등의 신기술들은 기존의 연구개발에 혁신을 일으키고 있으며 향후 바이오산업 전반에 지대한 영향을 미칠 것으로 예측된다. 이처럼 생명공학의 혁신적인 신기술들은 유전적으로 변형된 효소개발을 활용한 기존의 전통적인 화학공업의 제조 공정에 혁신을 불러일으키고 있으며, 타 식량자원 개발, 환경오염, 대체 에너지 개발 등 일반적인 굴뚝산업들의 혁신에도 큰 영향을 미칠 것으로 예측하고 있다.
셋째, 신기술을 적용한 제품의 출시로 제품의 한계를 극복하는 경우이다. 무엇보다도 먼저 부가가치가 높은 의약산업에 적용한 맞춤 의약품의 개발은 바이오산업계의 연구개발에 매우 큰 영향을 미치고 있다. 그 예로 특정한 표적 단백질을 목표로 한 백혈병 치료제인 글리벡의 경우, 분자표적 치료제(Molecular-targeted therapeutics)의 대표적인 약물로 현재 만성 백혈병 치료제 시장(2008년 약 26억 달러 매출)에서 확고한 위치를 확보하고 있다. 이와 더불어 인간화 항체기술을 활용한 표적치료제 개발로 부작용이 적은 새로운 항암치료제 등 맞춤의약 개발이 활발하게 전개되고 있다.
전 세계적으로 보았을 때, 의약, 바이오장기, 바이오칩을 포함하는 세계 생명공학산업은 연평균 13%대의 성장률을 보이면서 빠르게 성장하고 있다. 공개시장에 상장된 기업을 기준으로 했을 때 미국은 2008년 전 세계 총 수입의 77%, 고용인력의 75%를 차지하고 있다. 2008년에 발표된 Ernst & Young 보고서에 의하면 2008년 상장기업 기준 세계 생명공학 산업 규모를 7000억 달러라고 했을 때 미국이 76%를 차지하고 있으며, 유럽이 16%, 캐나다가 4%, 아시아, 태평양 국가가 5%를 차지하고 있다.
[그림 1-2-2-1] 생명공학 분야 상장기업 기준 주요국 매출 비중

출처: Ernst & Young社, Global Biotechnology Reports 2009
바이오의약 분야의 주요 제품은 분자 수준의 질병 예방과 진단, 치료, 기능 향상에 활용되는 저분자 의약품, 단백질 치료제, 유전자와 세포 치료제 등이다. 바이오의약이 활용되는 세계 보건의료 서비스 시장은 연평균 10%의 지속적인 성장세를 유지하고 있으며 2010년에는 1조 달러 이상 규모까지 성장할 것으로 예측하고 있다.
생명공학 산업이 성장함에 따라 그 기술적 경제적 기여도는 보건 의료 분야에서 가장 뚜렷하게 나타나고 있다. 생명공학기술의 발전은 보건의료 환경을 총체적으로 혁신시키고 있으며 제약과 의료기기 산업 등 의료산업 내부의 공급산업과 의료산업 내 수요산업인 의료서비스 산업 간 연계성이 크게 강화되고 있다.
현재 우리나라 생명공학 산업의 기술 경쟁력은 선진국 대비 70% 수준이지만, 2020년경에는 현재 가장 앞선 미국과 유사한 수준에 이를 것으로 예상하고 있다. 세부 분야별로는 의약 분야 68%, 바이오장기 75%, 바이오칩 79% 정도로 평가되었다.
국내 바이오의약, 바이오장기, 바이오칩 산업은 향후 2020년까지 생산기준 연평균 성장률 19%로 성장할 것으로 전망되어 세계시장 성장률 13%를 크게 상회할 것으로 예상되고 있다. 향후 유망 생명공학산업이 본격적으로 산업화 되는 시기는 선진국이 2015년 직전인 데 반해 우리나라는 2015년 이후로 전망되고 있다.
나. 생명공학산업의 발전 방향
세계적인 생명공학 산업 동향은 다음과 같다. 우선 역량을 갖춘 다양한 혁신주체 간 네트워킹이 경쟁력의 관건이다. 반면, 우리나라는 개별 혁신주체의 역량뿐 아니라 세계적인 네트워킹(Global networking)이 상대적으로 매우 취약하다. 특히 R&D 결과를 산업화로 연계하는 전임상 및 임상 단계에서 글로벌 신약의 임상시험 후반기를 담당할 기업의 역량이 전무한 편이다. 따라서 생명공학산업을 성공적으로 발전시키기 위해서는 글로벌 네트워킹을 통하여 혁신체계의 취약성을 극복하는 일이 시급하다. 생명공학산업의 첨단기술과 연구개발 성과들을 성공적으로 상업화하기 위해서는 전임상 및 임상단계의 국제규격(ICH guidelines)에 따른 안전성과 신뢰성 확보가 무엇보다 중요하며, 이를 위한 선진 바이오 기업들과의 전략적 연계‧협력 제휴가 필요하다.
그리고 세계 수준의 원천‧핵심‧선도형 기술을 개발하여 세계적인 지적재산권(Intellectual property)을 확보하고 연구개발 가치사슬(R&D value chain)의 단계별 기술이전을 활성화 하여 신속하게 가치를 창출해야 한다. 국가 연구개발사업에서 실질적인 국제 공동연구가 활성화 되어야 하며, 혁신적인 성과 확산을 통한 생명공학산업의 발전을 위하여 연구개발 초기 단계부터 기업의 참여 방안을 마련하여야 한다. 다행히 현재 우리나라는 위험부담이 크고 장기간의 연구개발을 요하는 바이오산업과 장기적인 R&D사업을 창의과제 프런티어사업과 중기거점사업 등 대규모의 연구개발 사업단을 중심으로 국가가 선도하고 있다. 이제 생명공학산업은 굴뚝 산업을 대체할 신산업으로서 대기업들의 과감한 참여와 함께 글로벌 R&D 네트워킹을 통한 세계적인 경쟁력 제고가 절대적으로 필요한 시점에 와있다.
2000년대 들어서면서 완료된 여러 생물종에 대한 유전체 프로젝트의 성과로 인해 인간 유전체 정보에 기반을 둔 새로운 패러다임의 신약‧장기‧칩 개발 연구가 활성화 되었다. 이에 발맞춰 벤처기업과 제약회사, 병원 간의 R&D연계‧협력이 글로벌 수준에서 추진되고 있다. 이는 세계적인 현상으로, 대형 제약사들이 가지는 신약 개발에 있어서 생산성의 저하의 문제를 생명공학 벤처사들의 장점인 효율성을 결합시키는 것이다. 따라서 점차 바이오텍-제약기업 또는 바이오텍-바이오텍기업 간의 인수합병(M&A)과 전략적 제휴가 점점 증가되고 있다.
[표 1-2-2-1] 생명공학 산업의 전략적 제휴 체결 현황
|
회사명 |
전략적 제휴건수(2006~2007) |
|
Roche |
115 |
|
GSK |
90 |
|
Merck&Co |
80 |
|
Astrazeneca |
76 |
|
Bayer |
76 |
|
Novartis |
76 |
|
Pfizer |
74 |
|
J&J |
62 |
|
Eli Lilly |
49 |
|
Sanofi Aventis |
43 |
|
Abbott labs |
42 |
|
BMS |
42 |
|
Schering Plough |
41 |
|
Merck Sereno |
40 |
출처: Current Partnering, 2008
[표 1-2-2-2] 생명공학 기업 간 주요 기술 이전/전략적 제휴
(단위: 백만 달러)
|
기술이전자 |
기술도입자 |
이전기술 |
개발단계 |
기술이전료 |
Upfront (지분투자) |
|
Genmab |
GSK |
혈액암 |
임상3상 |
2,100 |
102 |
|
ISIS |
Genzyme |
심장질환 치료제 |
임상3상 |
1,900 |
325 |
|
Ablynx |
Boehringer Ingelheim |
치매치료 단백질 |
Discovery |
1,800 |
265 |
|
Targacept |
GSK |
CNS |
임상2상 |
1,500 |
35 |
|
Chemocentryx |
GSK |
항염증 |
임상2상 |
1,500 |
63.5 |
|
BMS |
AstraZeneca |
당뇨병 치료제 |
임상3상 |
1,350 |
100 |
|
Coley Pharma |
Pfizer |
항암제 |
임상2상 |
515 |
164 |
|
Adnexus |
BMS |
항암제 |
Dicovery |
2,190 |
415 |
|
Ariad |
Merck |
항암제 |
임상2상 |
1,130 |
75 |
|
Galapagos |
Janssen |
관절염 치료제 |
전임상 |
1,130 |
22 |
|
Alnylam |
Roche |
RNAi 연구 |
Discovery |
1,100 |
331 |
출처: Current Partnering, 2008
다. 우리나라 생명공학 산업의 발전 가능성
전 세계 생명공학 산업은 미국이 주도하고 있으며, 아시아에서는 한국을 비롯해 일본, 중국, 싱가포르와 인도 등이 생명공학산업의 발전에 국가적 역량을 모으고 있다. BioChina2009 Conference(샌프란시스코, 미국)에서 중국은 향후 5년간 12조 달러를 바이오 연구개발과 산업화에 투자하기로 하였다고 전했으며, 향후 수 년 내로 세계에서 미국, 일본 다음으로 3번째 큰 바이오 의약시장을 형성할 것으로 예측하고 있다.
한편, 한국은 의약산업의 경우 미국 FDA 승인을 받은 10번째 국가라는 저력을 가지고 있으며 지적재산권에서는 세계 4대 특허 출원 국가로 인정받고 있다. 특히 국내 과학기술 분야 중 생명과학 분야가 세계최고의 학술지(Science, Nature)에 지난 수년간 가장 많은 연구 성과를 게재하고 있다.
현 단계 우리나라는 우수한 연구 인력의 증가와 함께 첨단 기술들을 확보하고 있는 중이다. 그 바탕은 우수한 생명공학 인력, 특히 분자생물학, 구조생물학, 독성학, 약학, 의약화학과 의학 등의 여러 분야에서 선진국에서의 경험을 가진 인력의 수급과 국가 주도의 적극적이고 장기적인 집중투자의 성과라고 할 수 있다.
이러한 훌륭한 기초과학의 성과를 잘 활용하여 어느 산업보다도 부가가치가 높은 녹색산업인 바이오 분야에 집중투자를 할 경우, 21세기 한국 생명공학산업은 반도체와 정보기술(IT)산업을 잇는 차세대 성장동력 산업으로 충분히 세계적인 경쟁력을 확보할 수 있을 것으로 기대된다.

생명공학 미래전망과 우리의 대응
1. 생명공학 발전 전망
생명공학이 21세기 인류의 건강과 번영, 복지의 발전을 주도할 핵심기술로 부각됨에 따라 세계 각국의 생명공학분야에 있어 기술을 선점하려는 노력과 바이오산업을 육성하기 위한 경쟁은 더욱 치열해 지고 있다. 또한 세계 인구의 고령화 추세에 따라 삶의 질 향상에 대한 요구의 증가로 생명공학분야의 기술개발과 산업에 대한 사회적 요구는 폭발적으로 증가할 것으로 전망된다.
생명공학의 발전 전망을 제시한 미국 Burrill & Company의 “Biotech 2008 LIFE SCIENCES: A 20/20 Vision to 2020”에 의하면 2020년의 생명공학은 타 분야와의 융합(BT-IT, BT-NT, BT-IT-NT)으로 실현되며 맞춤의료는 시스템생물학을 중심으로 이뤄질 전망이다. 또한 기술, 도구 그리고 지식의 합류로 Healthcare의 개념이 재정의 될 것이다. 유전체, 단백체, 조합 합성(combinatorial synthesis), 빠른 분석방법에 따라 진단・신약 개발과 발전을 유도하고 있으며 컴퓨터 시뮬레이션을 통한 특정 신약후보물질의 설계와 개발이 이루어지고 있다. 또한 나노기술발전에 따라 약물전달시스템과 전달방식이 발전하고 생물학적 기능을 유지하며 기존의 장기와 조직의 기능을 회복시켜주는 임플란트와 보철의 등장을 전망하고 있다.
[표 1-3-1-1] 2020년 바이오텍의 세계
|
□ 미국 Burrill & Company의 “Biotech 2008 LIFE SCIENCES: A 20/20 Vision to 2020”에서 전망한 2020년 바이오텍 세계 |
|
-시스템생물학의 진보로 의약품 개발은 대부분 컴퓨터로 수행하게 됨 -부품화: 사람들의 장기를 제품으로 구입하거나 자신의 장기를 생산할 수 있음 -스마트카드(개인 유전정보와 보건기록 내장) 실현으로 치료 및 예방의 중앙 관리화 가능, 생체 정보(유전자, 단백질 등) 데이터 ⇨ 중앙실험실(고성능 컴퓨터) 분석 ⇨ 스마트카드 정보와 비교 분석 ⇨ 의사와 환자에게 정보 제공 -고용주와 정부가 운동 처방 프로그램에 참가하는 종업원들에 보상해 줌으로써 예측과 예방을 중요시 함 -진단, 의약품 및 전달체와의 결합으로 새로운 의약품 개발에 따라 조합요법(combination therapies)의 일상화 -농업생명과학: Transgenic이 주류를 이루며, 각 나라마다 자체 GM기술을 개발하며, 식물유래 의약품 개발의 현실화 -산업생명공학: 환경문제에 따라 바이오연료 경제가 형성되며, 재생 가능 에너지원에 의존하고 에탄올은 과도기 사업이 될 것임 -전 세계 의약품 시장이 두 배로 증가되어 1조 3천억 달러 규모이며, 나노, 바이오, 정보, 재료기술의 융합으로 중국과 인도의 바이오 기술이 진보할 것으로 예상 |
가. 보건의료생명공학
2020년에는 lab-on-a-chip에 의한 분석으로 생성된 생체정보를 고성능컴퓨터로 병력, 유전정보, 건강상태 등을 종합 분석하여 환자와 의사에게 이메일로 보고하는 시스템이 현실화된다. 또 질병 회로 규명과 새로운 의학의 발달로 진단, 의약품 등이 전달체와의 결합으로 새로운 의약품 개발이 가능하다. 이에 따라 조합요법(combination therapies)이 일상화 되고 스마트카드의 실현으로 새로운 의료보장제도가 창출될 것이다. 인구증가, 노령화, 비만 등에 의한 만성 질환과 전염성 질환 증가로 수요 또한 급증할 것으로 전망된다.
웰빙의 세계시장규모는 현재 6천억 달러 규모를 넘어서고 있으며 2020년의 세계시장규모는 1조 달러 규모로, 기능식품산업은 매년 7~9%씩 증가하고 있다. 세계적 식품 제조업체의 포트폴리오는 건강 수요를 뒷받침하는 기능성 제품 쪽으로 기울고 있다. 이에 따라 개인 특성에 맞는 영양을 공급하는 맞춤형 제품 생산이 가능하며, 특히 미생물 유전정보의 해독에 힘입어 유익한 박테리아에서 유래한 제품이 가장 핵심적인 성장영역이다.
[그림 1-3-1-1] 만성질환의 증가 예측(2003~2013)

출처: Burrill & Company, “Biotech2008 LIFE SCIENCES: A 20/20 Vision to 2020”, 2008
[그림 1-3-1-2] 기능성식품 산업의 변화

출처: Burrill & Company, “Biotech2008 LIFE SCIENCES : A 20/20 Vision to 2020”, 2008
2020년 제약시장의 시장규모는 1조 3천억 달러로 2007년에 약 7천억 달러인 것에 비해 50% 증가할 것으로 예측하고 있어, 기존의 제약산업의 구조에 큰 변화가 있을 것으로 기대된다. 맞춤의약으로 대형 판매 모델이 사라지고 치료에서 예방으로 패러다임이 전환될 것이다. 나노 등 새로운 기술에 따라 연구와 개발이 추진될 것이며 변형기술의 변화로 제약회사의 비즈니스 전략이 개편될 것이다. 또한 현행 R&D 프로세스인 임상 1~4상 시험, 의약품 라이선스, 시장 승인이 협동적 인라이프 테스팅(in-life testing)과 product life로 지속되는 약물의 성과에 따라 발급되는 라이브 라이선스로의 대체가 기대되며 국제 규제 협력의 규모가 확대될 전망이다.
나. 농업생명공학
2020년에는 GM(형질전환)식물이 주류를 형성할 것으로 전망된다. 2008년의 2배인 대략 2억 5천만 헥타르의 재배면적으로 46개국에서 옥수수, 콩, 면화뿐 아니라 벼, 밀, 유전자 변형 사탕수수 등 GM작물 재배가 확대될 것이다. 또한 생명공학 기술 발달에 따라 식물유래 약용 물질 개발이 가능해질 것이며, 각국마다의 고유 GM기술 개발로 다국적 기술 지배에서 탈피할 수 있을 것이다.
[그림 1-3-1-3] 농업생명공학의 글로벌 전략 도전 과제
출처: Burrill & Company, “Biotech2008 LIFE SCIENCES : A 20/20 Vision to 2020”, 2008
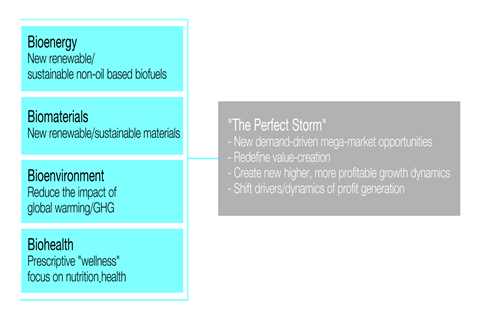
농업관련 과학기술과 식물농업은 새로운 시장 창출의 해결책이자 발굴 도구로서 전략적으로 세계적인 도전 과제를 충족시키고 있다. 농업 바이오테크 포함한 농업 관련 과학 기술은 바이오에너지(Bioenery), 바이오소재(Biomaterials), 바이오환경(Bioenvironment), 바이오보건(Biohealth)의 4가지 글로벌 전략 도전 과제의 시장을 추진하는데 해결책으로 기여할 잠재력을 보유하고 있다. 또한 바이오에너지에 대한 의존도의 상승으로 농업 과학기술이 식량과 에너지 안보, 웰빙과 삶의 질 향상, 환경과 경제의 진보 등 사회의 요구를 강조하는 글로벌 경제 정책의 주요 요인으로 평가되고 있다.
다. 산업생명공학
환경문제와 함께 생산이 제한된 화석연료보다 재생에너지의 중요도가 증가되고 있으며, 유전체, 단백체, 대사체 등의 오믹스 기술과 화학과 엔지니어링의 기술융합으로 새로운 아이디어와 기술 개발이 강화되고 있다. 2020년에는 바이오연료경제가 형성될 것으로 전망된다. 새로운 효소, 전처리와 발효기술을 포함한 생명공학기술의 발달로 바이오에너지(바이오에탄올․디젤)가 수송용으로 상용화될 전망이며 제2세대 바이오 연료12)의 등장으로 2020년경 바이오에너지는 세계 에너지수요의 15%를 충족시킬 것이며 2060년에는 30∼40%에 이를 전망이다.
재생 가능한 에너지와 바이오촉매 사용으로 배출된 탄소를 바이오매스로 전환하여 기업의 추가 이윤을 창출할 수 있다. 2008년 기준 Biorefinery 기업은 60개에서 2020년 200개 이상으로 확대될 전망이다.
[그림 1-3-1-4] 세계 바이오에너지 수요 전망

출처: Burrill & Company, “Biotech2008 LIFE SCIENCES : A 20/20 Vision to 2020”, 2008
[그림 1-3-1-5] Biorefinery 기업의 미래상

출처: Burrill & Company, “Biotech2008 LIFE SCIENCES : A 20/20 Vision to 2020”, 2008
2. 미래를 위한 우리의 대응
우리 정부는 21세기 전 세계적으로 닥친 자원과 환경의 위기와 초고령 사회로 전환하는 미래를 준비하고 녹색성장의 비전을 본격적으로 추진하기 위해 2009년 1월 “신성장동력 비전과 발전 전략”을 발표하였다. 우리 경제의 새로운 성장 비전으로 3대 분야 17개 신성장동력을 선정하였으며 이 중 생명공학은 융합을 통한 산업의 고도화, 신산업 창출이 가능한 첨단융합산업, 고부가가치 창출이 가능한 고부가 서비스산업, 기술변화와 자원위기에 해결능력이 큰 녹색기술산업에 포함되는 등 3대 분야에 걸쳐 그 중요성이 강조되고 있다.
[표 1-3-2-1] 신성장동력의 발굴
|
□ 3대 분야 17개 신성장동력 발굴 |
|
- (녹색기술산업, 6개) 단순한 에너지 절감 분야가 아닌 미래 성장의 바탕이 되고 기후변화․자원위기에 대한 해결능력이 큰 분야 - (첨단융합산업, 6개) 세계시장규모와 우리나라 기술 역량(IT분야)이 높고, 융합을 통해 기존 산업고도화와 신산업 창출이 가능한 분야 - (고부가서비스산업, 5개) 일자리 창출 잠재력이 크고, 서비스업에 경제성을 보완하여 고부가가치 창출이 가능한 분야 |
[표 1-3-2-2] 3대 분야 17개 신성장동력
|
3대 분야 |
17개 신성장동력 |
|
|
녹색기술산업 |
(6) |
신재생에너지, 탄소저감 에너지, 고도 물처리, LED 응용, 그린수송시스템, 첨단 그린도시 |
|
첨단융합산업 |
(6) |
방송통신융합산업, IT융합시스템, 로봇 응용, 신소재․나노 융합, 바이오제약(자원)․의료기기, 고부가 식품산업 |
|
고부가서비스산업 |
(5) |
글로벌 헬스케어, 글로벌 교육서비스, 녹색 금융, 콘텐츠․소프트웨어, MICE․관광 |
출처: 제29회 국가과학기술위원회, 신성장동력 비전과 발전전략, 2009.1.13
다가오는 바이오경제시대를 대비해 미국, 유럽, 일본 등 선진 각국이 대처하는 행보에 발맞춰 우리 정부도 주요 국가계획에서 생명공학을 국가중점전략 분야로 선정하고 국가 발전전략의 핵심기술로서 생명공학을 강화해 전면에 부각시키고 있다. 국가차원의 과학기술분야 최상위계획인 “제2차 과학기술기본계획”(2007.12)에서는 40대 중점전략기술 중 10개를, 60대 전략기술 중 16개를 생명공학 기술로 선정한 바 있으며, 이명박 정부의 과학기술기본계획: 577 Initiative(2008.12~2008.8)에서는 급변하는 사회․경제․과학기술의 환경변화에 대응하고 새로운 성장동력 창출을 위해 7대 중점과제를 선정하였다. 이중 생명공학에 관련된 중점투자 분야는 신산업창출, 현안관련 특정분야, 글로벌 이슈대응, 기초․기반 융합기술로 4개 분야가 포함되어 있다. 또한 차세대 기술혁명을 주도할 융합기술(Converging technology)의 체계적 육성을 위해 “국가융합기술발전 기본계획”(2008.11)을 수립하였으며, 미지의 영역인 “뇌”의 신비를 밝혀내고 뇌 관련 질환의 중추적 역할을 수행할 「한국뇌연구원」 설립을 추진하는 등 미래 성장동력의 확보를 위해 다각적인 노력을 펼치고 있다.
2009년 정부의 생명공학분야의 R&D투자는 총 1조 1천 634억 원으로 전년실적에 대비해 19.2%가 증가될 것으로 예상하고 있다. 생명공학분야의 R&D 투자는 1990년대 본격적으로 증가하기 시작하여 생명공학육성기본계획이 수립된 1994년 이래 매년 24%에 달하는 증가를 보이고 있다.
참여 부처로는 교육과학기술부, 지식경제부, 보건복지가족부, 농림수산식품부 등 6개 부처와 관련 정부출연연구소가 참여하여 기술개발을 주도하고 있다. 이와 같이 생명공학에 대한 높은 관심으로 증가된 R&D 투자를 성공적으로 이끌기 위해서는 여러 부처가 개별적으로 진행하는 투자와 계획을 종합적으로 조정하는 기능의 필요성이 대두되었다. 이에 2008년 12월 범부처 정책을 기획하고 조정하는 Control Tower 역할을 위해 국가과학기술위원회 산하 특별소위원회로 “BT위원회”를 신설했다. BT위원회에서는 부처 BT R&D사업을 점검하고 조정하며 예산 배분방안을 마련해 신규 및 대형 사업을 기획하는 등 전반적으로 정책을 연계하고 조정하는 역할을 수행하고 있다.
마지막으로 국가 R&D사업의 투자 효율성 제고를 위한 정책 시스템 개선도 추진 중에 있다. 생명공학 분야 R&D사업의 투자 효율성을 높이고 원천기술을 창출해 융․복합화 하는 등, 기술 환경변화에 적극적으로 대응하기 위해 “바이오 R&D투자 효율화 및 향후 투자 전략”(2008. 8)을 마련한 바 있으며 “신약 R&D체계화 및 개선방안”(2008. 12)을 정립해 신약 R&D사업 간의 중복성을 확인하고 효율적으로 연계하는 방안을 마련하여 연구의 효율성을 높이고자 하였다. 향후 국가 R&D사업의 연구 효율성을 높이는 정책 시스템을 정착시켜 생명공학 분야에서의 세계적인 R&D 성과물의 창출이 기대된다.
제2장
세계 주요국의 생명공학 동향


미국
1. 미국의 생명과학 투자 동향
미국 연방정부의 R&D 투자는 크게 국가안보와 관련된 연구비와 기타 연구비(비안보 분야) 두 가지로 나뉜다. 연방정부의 비안보 R&D 분야에 대한 지원은 2004년까지 꾸준히 증가하였는데, 이는 1980년대부터 국립보건원(National Health Institute, NIH)이 꾸준히 투자해 온 것이 총비안보분야 R&D 지원의 증대를 가져왔다.
[그림 2-1-1-1] 1976~2009년 연방정부 예산 동향
(단위: 십억 달러, 2008년 화폐기준)


출처: AAAS, 2008, 2009
전 세계 생명과학 R&D의 70%가 미국에 의해 수행되는 것으로 알려져 있다.13) 주요 연구주체로는 민간기업, 대학, 공공 및 민간연구기관, 연방기관이 있으며 미국 전체 투자규모는 연간 약 1,000억 달러 이상(NIH: 290억 달러, 제약회사: 430억 달러, 바이오회사: 300억 달러)으로 추정된다.14) 미국 연방정부차원의 생명과학투자의 대부분은 보건복지부(Department of Health and Human Services, HHS)와 그 산하기관에 의해 이루어진다. NIH는 비국방 연방연구기관 중 가장 큰 규모의 기관으로 바이오메디컬 R&D에 대해 전체 예산의 약 10%는 자체적으로 연구(Intramural)를 수행하며 약 80%는 외부연구(Extramural)를 지원하고 있다.
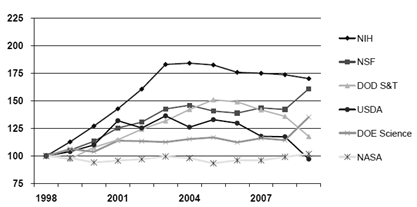
2000년대 후반에 들어서면서 거의 대부분의 연구 분야에 있어서 연방정부의 지원이 점차적으로 감소되어 왔다. 특히 NIH의 생명의학연구에 대한 정부의 지원은 1990년대 이후 급격하게 증가했다가 2004년을 기점으로 정체를 이루고 있으며, 인플레이션을 감안할 경우 오히려 감소하고 있는 추세이다(그림 2-1-1-2 참조).
[그림 2-1-1-2] 1998~2009년 연방정부 예산 동향(1998년을 100으로 가정)
출처: AAAS, 2008
이러한 가운데, 오바마 대통령은 의료시스템 개혁을 위해 보건의료부분의 비용절감을 목표로 향후 5년간 보건의료시스템을 전자건강기록 시스템을 포함한 전자정보시스템으로 전환하는데 100억 달러를 투자할 것 등을 공약으로 내세웠다. 그밖에도 생명과학분야에 대한 투자의 일환으로 줄기세포연구에 대한 연방정부의 지원을 재개하고15), 신기술, 의료서비스 등의 비용․품질 비교연구 및 평가결과를 제공하기 위한 독립된 연구소를 설립하며, 감염자 증가율이 높은 여성을 위해 백신 및 항바이러스제를 통해 예방기술 개발에 연구자금 지원을 확대할 계획이 포함되었다.
2009년 2월 13일, 미 상하원의회는 현 경제위기 극복을 위해 총 7,890억 달러에 해당하는 경기부양 자금을 투자하는 ‘2009 미국 재투자 및 경기회복법안(American Reinvestment and Recovery Act of 2009, ARRA)’을 통과시켰다. 특히 이 법안은 ‘Obama goes ‘all in’ for science’라는 이야기를 들을 정도로 획기적인 것으로 이와 관련하여 새로 배정된 회계연도 2009년 과학기술 최종 예산은 2,150억 달러16)에 달한다.
이는 오바마 정부가 경제부양책 중에서도 과학기술 투자를 현재 경제위기를 극복하기 위한 중요한 수단으로서 생각하고 있기 때문이다. 가장 중점적으로 투자하고 있는 부분은 에너지개발, 정보통신산업인프라, 건강관련 연구, 세 가지로 압축되며 이러한 조치로 2009년 국립보건원(NIH) 예산은 연방정부 산하기관 중 가장 큰 금액인 104억 달러를 추가적으로 지원받으면서 2004년 이래 처음으로 큰 폭으로 증가하였다.17) 그 결과 2009년 NIH 예산은 거의 410억 달러에 육박하였고, 다른 연방기관들의 2009년 예산 또한 상당히 증액되었다(그림 2-1-1-3 참조).
[그림 2-1-1-3] 연방기관의 2008년 예산 및 ARRA에 의한 R&D 자금지원 증가효과

출처: AAAS
그 외에도 질병관리본부(Centers for Disease Control, CDC), 식약청(Food and Drug Administration, FDA), 방위첨단연구프로그램기구(Defense Advanced Research Program Agency), 국립과학재단(National Science Foundation, NSF) 등을 포함한 기타 연방기관들이 생명과학 R&D와 관련되어 예산을 배정받고 연구를 지원하고 있다.
FDA의 경우 2004년 발표된 Critical Path18) 리포트를 계기로 2006년 ‘Critical Path Opportunities’를 발표하였는데 제품개발을 위한 다양한 혁신과 의료제품의 안전성과 유효성 예측의 정확성을 높이기 위한 유전체, 단백체, 이미징, 생물정보학 등의 분야에서 76가지의 새로운 발견을 제시한 바 있다.
AHRQ(The Agency for Healthcare Research and Quality)의 경우 미국의 의료질 향상을 위한 연구를 지원하는 기관으로서 보건의료의 질, 안전성, 효율성, 효과성을 향상시키는 것을 임무로 하고 있다. 2009년 예산은 2008년에 비해 다소 축소된 353백만 달러이지만, ARRA를 통해 300백만 달러를 추가로 배정받았다.
주요 연구지원분야로는 Clinical practices, Outcomes of care and effectiveness, Evidence-based medicine, Primary care and care for priority populations, Health care quality, Patient safety and medical errors, Organization and delivery of care and use of health care resources, Health care costs and financing, Health care system and public health preparedness, Health information technology가 있다.
[표 2-1-1-1] 보건부의 R&D 현황
(단위: 백만 달러)
|
|
2007 (실제) |
2008 (추정) |
2009 (예산) |
변화 금액 |
2008 -2009 (%) |
|
Health |
|||||
|
NIH |
28,350 |
28,676 |
28,666 |
-10 |
0.0% |
|
CDC |
559 |
441 |
441 |
0 |
0.0% |
|
FDA |
138 |
128 |
131 |
3 |
2.3% |
|
Medicare & Medicaid Services |
48 |
31 |
31 |
0 |
0.0% |
|
Health Rserouces & Srvs. Admin. |
11 |
12 |
12 |
0 |
0.0% |
|
Departmental Management |
125 |
122 |
295 |
173 |
141.8% |
|
Healthcare Research and Quality |
319 |
335 |
326 |
-9 |
-2.7% |
|
Total Health R&D |
29,550 |
29,745 |
29,902 |
157 |
0.5% |
|
Human Services |
|||||
|
Admin. For Children and Families |
44 |
44 |
44 |
0 |
0.0% |
|
Total Human Services R&D |
44 |
44 |
44 |
0 |
0.0% |
|
Total HHS R&D |
29,594 |
29,789 |
29,946 |
157 |
0.5% |
자료 : AAAS, 2008. 2
NSF의 경우 2008년 기준으로 생명과학연구예산은 633백만 달러였으며 주요 투자분야는 분자 및 세포 생명과학(116.4백만 달러), 생명과학 인프라(96.1백만 달러), 이머징프론티어(99.2백만 달러) 등이다.
또한, 1억 달러를 초과하는 외부연구 R&D 예산을 가진 모든 연방기관에서는 전체예산의 2.5%를 Small Business Innovation Research(SBIR), 0.3%를 Small Business Technology Transfer(STTR)에 배정하여 소규모사업연구 및 혁신을 촉진하고 있다. NIH의 경우 2008년 기준으로 SBIR에 566백만 달러, STTR에 73백만 달러를 지원하였다. 최근 SBIR 프로그램 20년을 맞이하여 National Research Council(NRC)로부터 평가를 받았으나, 대체적으로 긍정적인 평가를 받았기 때문에 유연성 확보 등의 약간의 보완사항을 제외하고 그 틀은 그대로 유지될 것으로 보인다.
2. NIH 투자 동향
NIH는 최근 맞춤의학을 위한 인간 유전체연구의 중개연구, 공공-민간 파트너십, NIH의 센터와 연구소들이 공동으로 참여하는 범 NIH 차원의 신규 연구사업 등에 중점을 두고 있다. 2009년 예산의 경우 NIH가 재량권한을 가진 예산을 연방정부 과학기술 평균인 31%보다 높은 44%(혹은 89억 달러)까지 허용함으로써 예산집행의 자율성을 확대하였다. 범 NIH 차원의 학제적 연구를 지원하는 NIH Common Fund19)의 예산은 38백만 달러(8%)가 추가되어 534백만 달러에 달한다. 젊은 과학자가 첫 연구지원을 받게 되는 연령을 낮추고 과학연구경력을 키워나갈 수 있게 함으로써 젊은 과학자의 독자적 연구능력을 향상시키기 위한 Pathway to Independence program에 71백만 달러를 배정하였다.
2008년 기준 연구비 상위 10대 연구영역은 임상연구, 유전학, 종양, 생명과학, 신경과학, 예방, 정신질환, 감염성질환, 임상시험, 여성보건 순으로 나타났다(표 2-1-2-1 참조).
[표 2-1-2-1] NIH 지원 상위 10대 연구영역(2008년 기준)
(단위: 백만 달러)
|
구분 |
2005 |
2006 |
2007 (기존방법) |
2007 (신규방법) |
2008 |
2009 (추정) |
2010 (추정) |
|
임상연구 |
$8,719 |
$8,785 |
$9,116 |
$9,862 |
$9,629 |
$9,931 |
$10,086 |
|
유전학 |
$4,840 |
$4,878 |
$4,878 |
$7,000 |
$6,872 |
$7,066 |
$7,173 |
|
종양 |
$5,639 |
$5,575 |
$5,643 |
$5,549 |
$5,570 |
$5,748 |
$6,016 |
|
생명과학 |
$10,889 |
$9,974 |
$9,814 |
$5,344 |
$5,179 |
$5,390 |
$5,468 |
|
신경과학 |
$4,902 |
$4,830 |
$4,809 |
$5,102 |
$5,224 |
$5,372 |
$5,444 |
|
예방 |
$7,100 |
$6,815 |
$6,729 |
$4,596 |
$4,623 |
$4,752 |
$4,822 |
|
정신질환 |
$4,784 |
$4,732 |
$4,670 |
$3,592 |
$3,729 |
$3,835 |
$3,888 |
|
감염성질환 |
$3,188 |
$3,132 |
$3,059 |
$3,433 |
$3,575 |
$3,678 |
$3,725 |
|
임상시험 |
$2,863 |
$2,767 |
$2,949 |
$3,422 |
$3,562 |
$3,663 |
$3,719 |
|
여성보건 |
$3,551 |
$3,498 |
$3,470 |
$3,470 |
$3,514 |
$3,627 |
$3,683 |
출처: http://report.nih.gov/rcdc/categories/
NIH는 27개 산하 기관과 센터를 통해 연구를 수행하고 있으며, 일부 광범위하거나 긴급한 전략이니셔티브에 대한 투자는 NIH Common Fund에 의한 NIH 로드맵을 통해 수행된다. ARRA를 통해 Common Fund는 회계연도 2009년과 2010년에만 130백만 달러를 배정받았는데 이 자금은 NIH의 센터와 연구소들이 공동으로 참여하는 범 NIH 차원의 신규 연구 사업에 주로 지원된다.
NIH 로드맵은 신규약물 표적물질 발굴을 촉진하기 위한 ‘New Pathways to Discovery’, 협력연구와 고위험고수익연구를 촉진하기 위한 ‘Research Teams of the Future’, 중개 및 임상연구를 강화하기 위한 ‘Re-engineering the Clinical Research Enterprise’를 주제로 정하고 있다. 최근에는 무엇보다 창의적인 아이디어를 가진 개인연구자 중심의 고위험 혁신 연구를 촉진하는 데 가장 중점을 두고 있다. 이와 관련된 프로그램으로는 NIH Transformative R01 (T-R01) Awards, NIH Director’s Pioneer Awards, NIH Director’s New Innovator Awards가 있다. 아울러, NIH 로드맵의 2008년 신규지원 분야는 Human microbiome Project, Epigenomics, Genotype-tissue expression으로 NIH가 최근에 관심을 두고 있는 분야를 가늠해 볼 수 있다.
[그림 2-1-2-1] NIH Roadmap
|
NIH Roadmap
New Pathway of Discovery Molecular Libararies and Imaging Building Block, biological Pathways and Networks Structural Biology Bioinformatics and Computational Biology Nanomedicine Human Micorobiome Project(2008년 신규) Epigenomics(2008년 신규) Genotype-tissue expression(2008년 신규)
Research Teams of the Future Interdisciplinary Research High-risk Research NIH Director's Pioneer Award NIH Director's New Innovator Award Transformative R01 Program Public-Private Partnership
Re-engineering the Clinical Research Enterprise Clinical Research Networks and NECTAR Clinical Outcomes Assessment Clinical Research Training Clinical Research Policy Analysis and Coordination Analysis |
출처: VINNOVA, 2009. 6
3. 민간투자 동향
미국에서는 연방정부 외에 민간부문에서도 생명과학에 많은 투자를 하고 있는데, 민간부문의 대표적인 R&D 투자 주체는 제약회사와 바이오벤처들이다. 미국의 거대 제약회사들의 협회인 PhRMA 자료에 따르면 바이오제약회사 R&D 전체로 보면 2008년 기준으로 652억 달러를 투자한 것으로 추정된다(그림 2-1-3-1 참조). 또한 Ernst & Young의 집계에 따르면 미국의 바이오벤처들은 2008년 기준으로 304억 달러(상장회사기준 253억 달러)를 R&D에 투자하였다(표 2-1-3-1 참조). 최근, (표 2-1-3-1)에서 볼 수 있듯이 금융위기로 인해 투자가 급감하고 있는 상황에서도 R&D 투자가 전년 대비 20.5%가 증가하였다는 사실은 국내 바이오제약업계에도 많은 시사점을 주고 있다.
[그림 2-1-3-1] 미국 PhRMA 회원제약사 및 바이오제약회사 투자동향

출처: PhRMA Profile 2009
[표 2-1-3-1] 미국 바이오회사 투자동향
(단위: 10억 달러)
|
|
상장회사 |
산업 전체 |
||||
|
2008 |
2007 |
변화율(%) |
2008 |
2007 |
변화율(%) |
|
|
재무 |
||||||
|
판매액 |
54.1 |
49.9 |
8.4% |
57.0 |
52.7 |
8.0% |
|
매출액 |
66.1 |
61.0 |
8.4% |
70.1 |
64.9 |
8.0% |
|
R&D |
25.3 |
21.0 |
20.5% |
30.4 |
26.1 |
16.8% |
|
순이익(손실) |
0.4 |
(0.1) |
-430.7% |
(3.7) |
(4.2) |
-11.2% |
|
산업 |
||||||
|
시가총액 |
343.8 |
369.2 |
-6.9% |
- |
- |
- |
|
자금조달 총액 |
8.6 |
15.9 |
-46.3% |
13.0 |
21.4 |
-39.2% |
|
IPO 수 |
1 |
22 |
-95.5% |
1 |
22 |
-95.5% |
|
회사수 |
371 |
395 |
-6.1% |
1,754 |
1,758 |
-0.2% |
|
종업원수 |
128,200 |
131,300 |
-2.4% |
190,400 |
192,600 |
-1.1% |
출처: Ernst & Young, 2009

일본
1. 개요
20세기 이후, 다양한 과학기술이 진보하였지만 세계적으로는 경제적, 사회적 문제가 그치지 않고 있다. 미국에서 시작한 버블경제의 붕괴는 글로벌 경기침체의 쓰나미를 유발하였고, 이에 따라 산업경쟁력의 저하, 기업의 구조조정 등 시급히 해결해야 할 난제들이 새롭게 부각되었다. 또한 자원과 에너지의 고갈, 지구 온난화에 따른 환경문제 등은 산업의 구조뿐만 아니라 사회 전반에 걸친 대대적 변혁을 요구하고 있는데, 궁극적인 관심은 인류의 건강과 복지 향상에 맞춰져 있다. 특히, 최근 심각한 글로벌 문제로 제기되고 있는 신종 인플루엔자의 사례에서도 볼 수 있듯이, 각종 유해 병원체의 출현은 일부 지역에 국한된 문제가 아닌, 세계가 함께 해결해 나가야 할 공동의 숙제가 되고 있다.
이와 같은 까닭에 세계 각국은 생명공학기술을 국가전략기술로 선정해 신종 감염질환, 인구 고령화, 식량부족, 환경오염 등의 문제에 대응하는 정책을 수립하고 있는데, 이미 심각한 고령화 사회로 접어든 일본은 “건강한 장수사회의 실현”이란 명제를 제시한 바 있어 생명공학분야를 국가 차원에서 육성하려는 의지를 강력히 표명하고 있다.
2. 일본의 생명공학정책
일본 과학기술 기본계획에는 바이오관련 분야를 “라이프사이언스(life science) 분야”라는 용어로 통일해 사용하고 있다. 일본은 미국보다 뒤떨어져있는 라이프사이언스 분야를 진흥시키기 위해 생명공학기술을 중요도에 따라 분류하였고, 이 중 경쟁력 우위를 확보해야 하는 기술 분야를 핵심과제를 설정하였는데, 그 중심엔 포스트 게놈연구를 두고 있다.
지금까지 해독된 게놈정보로부터 전개되는 포스트 게놈연구는 생명과학의 기초 연구는 물론, 의학․약학․공학 등 광범위한 분야에서 연구개발의 중추 역할을 하고 있다. 특히 각종 질병과 암 발생, 노화현상 등을 규명하고 해석하는 과정에서도 포스트 게놈연구는 중요한 역할을 담당할 것이므로 이를 이용해 새로운 산업의 태동까지 유도한다는 계획이다. 이에 따라 일본은 라이프사이언스 분야의 전략 목표를 설정하였는데, ① 포스트 게놈연구를 통한 의약품 및 조기 진단기술의 개발, ② 의료공학 기술의 개발로 각 환자에 적합한 정밀 의료의 실현, ③ 뇌신경 과학을 비롯한 인간과학 연구를 확대하여 건강 수명의 연장을 실현, ④ 생명체의 기능을 활용한 새로운 생산 공정을 개발함으로써 효율적인 생산 시스템을 확립 ⑤ 의료기기 개발의 실용화 추진 및 바이오산업 경쟁력 강화를 위한 기반 구축 등 5개 연구 분야를 중심축으로 구성하였으며, 2008년도 과학기술 전체예산인 3조 5천 555억 엔 중 약 9.3%인 3,315억 엔을 라이프사이언스 분야에 투자한 바 있다.
3. 일본의 생명공학 현황
2008년도 일본의 전체 생명공학시장은 2조 8천 488억 엔으로 전년 대비 27% 성장한 것으로 보고되었다. 이 중 유전자재조합기술, 세포융합기술, 세포배양기술 등을 이용해 제조하는 이른바 바이오제품은 약 82%에 가까운 2조 3,229억 엔이었고, 특히 유전자재조합기술을 이용한 바이오제품은 약 77%의 비중인 2조 1천 934억 엔으로, 전년 대비 37.5%의 성장을 보였다.
의약품 분야에서는 치료용 항체가 1,340억 엔의 매출로 무려 60%의 성장세를 보여 글로벌 시장의 성장 추세와 흐름을 같이 했는데, 판매 2년째인 결장암․직장암 치료제 아바스틴은 550%의 경이적인 성장률을 기록해 일시에 스타 제품의 반열에 올랐으며, 레미케이드 등의 류마티스 관절염 치료제도 두 자리 성장률을 유지했다.
총 매출 면에서는 유전자조작 곡물의 수입증가가 바이오제품의 성장에 크게 기여하였다. 품목별로는 옥수수가 4,126억 엔에서 8,075억 엔, 대두가 1,597억 엔에서 2,116억 엔, 종자가 952억 엔에서 1,334억 엔으로 증가하여 바이오제품의 시장 성장을 견인한 것으로 나타났다. 이런 유전자조작 곡물의 수입증가는 2007년 이후 세계적으로 바이오에너지의 개발 붐이 일어나 곡물 가격이 급상승했기 때문이다. 일본에서 여러 저항에도 불구하고 유전자조작 곡물의 사용이 증가하는 것은 이제 유전자 곡물의 사용이 거부할 수 없는 대세가 된 것으로 분석할 수 있으며, 앞으로 이런 경향은 더욱 확산될 것으로 전망된다.
[표 2-2-3-1] 2008년도 일본 바이오산업 총 시장규모
(단위: 억 엔)
|
구 분 |
내 용 |
시장규모 |
||
|
2007년 |
2008년 |
|||
|
바이오 제품 |
유전자재조합제품 |
15,950 |
21,934 |
(+37.5%) |
|
세포융합제품 |
992 |
942 |
(-5.0%) |
|
|
세포배양제품 |
347 |
353 |
(+1.7%) |
|
|
소계 |
17,289 |
23,229 |
(+34.4%) |
|
|
바이오 관련 제품 및 서비스 |
5,129 |
5,229 |
||
|
합 계 |
22,418 |
28,488 |
(+27.0%) |
|
출처: Nikkei Biotechnology & Business사, 일경바이오연감, 2009
가. 제약기업의 M&A 전략 확대
불과 10년 전만해도 일본제약시장은 세계시장의 약 20% 정도를 차지할 정도로 호황을 누렸었다. 하지만 일본 정부의 약가인하정책, 신약허가심사의 지체 등으로 인해 성장률이 점차 떨어져 지금은 세계시장에서 약 10%의 비중에 머물러 있다. 2008년에도 전문의약품 분야의 성장률이 겨우 2.1%를 기록해 장기 침체에서 쉽사리 벗어나지 못하는 양상을 보였는데, 2009년엔 4~5%의 성장을 예상하고 있지만 엔화의 가치상승 등 부수적 효과에 힘입은 것이라 회복세로 전환되는 것으로 예단하긴 아직 이르다.
오히려 일본의 대형 제약기업은 지금이 본격적인 전환기라 할 수 있을 만큼 머리 아픈 시기를 보내고 있다. 그 동안 일본의 대형 제약기업들은 주로 미국시장에서의 매출과 이익을 통해 성장을 유지해왔으나, 민주당 오바마 정부가 펼치고 있는 의료개혁 정책으로 시장 환경이 급변함에 따라 더 이상 성장전략을 고수하기 어려운 상황이 되었기 때문이다. 또한, 2011년까지 Top 10의 대형 의약품 중 7개 제품이 미국에서의 물질특허가 만료됨으로 제네릭의 거센 공세를 피할 수 없게 되었다는 문제도 시급한 현안이다.
이와 같이 주력제품의 특허만료로 인해 예상되는 성장 공백을 메우기 위해 일본 제약기업들은 파이프라인 제품의 보강에 적극 나서고 있는데, 그 핵심은 M&A 전략이다. 대표적인 사례로는 미국시장에서 치매치료제 Aricept의 성공으로 비약적 발전을 해온 Eisai사가 Aricept의 미국 특허만료를 대비해 미국 MGI Pharma사를 인수한 것으로, 이를 통해 Eisai사는 항암제 파이프라인 제품을 보강하게 되었다. 또한, 2009년에 위궤양 치료제 Takepron의 미국 특허만료를 앞둔 Takeda사가 미국 Amgen사의 일본법인과 미국 바이오 기업인 Millenium Pharmaceuticals사를 인수한 것도 좋은 사례로서, Takeda사는 취약부문이던 바이오 제품을 일시에 보강하는 효과를 거두었다. 이 밖에 Daiichi Sankyo사는 인도의 Ranbaxy사의 주식 50.1%를 확보해 고도성장을 보이는 국가에서 매출기반을 구축하겠다는 전략을 발빠르게 추진하였다.
[표 2-2-3-2] 일본 제약기업의 주요 M&A 사례
|
체결시점 |
인수회사 |
피인수회사 |
파이프라인 보강 내용 |
|
07.10 |
Kyowa Hakko |
Kirin Hodings |
바이오 제품 |
|
07.10 |
Astells |
Agensys |
치료용 항체 |
|
08. 1 |
Eisai |
MGI Pharma |
항암제 |
|
08. 2 |
Takeda |
Amgen Japanese Unit |
바이오 제품 |
|
08. 4 |
Takeda |
Millenium harmaceuticals |
치료용 항체 |
|
08. 5 |
Daiichi sankyo |
Ranbaxy |
성장시장에서의 제네릭 제품 |
나. 바이오의약품 분야의 성장
세계의약품시장에서 바이오의약품의 매출 비중은 이미 10%를 넘어섰고, 성장률도 기존 소분자 약물에 비해 2배 이상인 것으로 나타나 비중은 더욱 확대될 것으로 예측된다. 한편, 과거 의약품시장이 미국, 유럽, 일본 등 선진 국가에 90% 정도 편중되었듯, 현재 바이오의약품도 선진국 중심으로 성장이 시작된 후 점차 pharmerging 국가로 확산되는 패턴을 보이고 있다. 국가별로 보면, 미국이 약 56%의 시장을 점유하고 있고, 영국․독일․프랑스․스페인․이탈리아 등 유럽 5개국이 약 24%, 일본은 약 5%의 시장을 형성하고 있다. 일본의 전체 의약품시장이 세계 10% 정도임을 감안할 때, 일본에서의 바이오의약품 시장은 2배 이상 성장할 잠재력이 있는 것으로 분석되는데, 작년 일본에서 단백질치료제 등 주요 바이오의약품의 성장률이 약 12%였다는 것이 이를 반영하고 있다.
바이오의약품 성장세에 힘입어 이 분야로 진출하기 위한 일본 제약기업의 R&D도 크게 증가하고 있다. 2007년 1월부터 2008년 10월까지 일본에서 허가된 신약 중 21%가 바이오의약품으로 집계되었는데, 이는 세계적으로도 30% 정도의 신약이 바이오의약품 분야로부터 나오고 있어 기술 흐름의 변화를 쫓아가는 것이라 볼 수 있다. 대다수의 일본 제약기업이 치료용 항체 등 대형 제품에 R&D를 집중하고 있지만, 유전자치료제 등의 미래형 바이오의약품 분야에서도 R&D 성과가 일부 가시화되고 있다. 바이오벤처기업인 AmGes MG사와 Daiichi Sankyo사와 공동으로 개발 중인 HGF(Hepatocyte Growth Factor) 유전자치료제는 폐색성 동맥경화증 등의 치료제로 임상시험에 성공해 2008년에 판매허가 승인을 신청한 바 있으며, 순조롭게 허가를 획득하게 된다면 바이오벤처기업이 개발한 신약으로 의미가 더해질 것이다. 항체의약품 이후 제약 산업의 차세대 성장분야가 될 것이라 주목받고 있는 RNA 의약품 분야에 대해서도 일본 제약기업의 관심은 크게 증폭되고 있다. 2008년 5월, Takeda사는 siRNA 분야의 선두주자인 미국의 Anylam사와 아시아권의 개발 파트너로 전략적 제휴를 체결해 미래시장을 향한 시동을 걸었으며, 일본신약․Dainippon Sumitomo사 등의 기업들도 siRNA 분야의 핵심 기술이 되는 DDS(Drug Delivery System) 개발 경쟁에 나서고 있다.
다. 바이오벤처 기업의 양극화 현상
2008년은 일본 바이오벤처기업에겐 명암이 엇갈린 한 해가 되었다. 투자환경이 엄격해지면서 일부 벤처기업은 자금부족에 따른 어려움이 가중돼 사업이 정지되는 상황을 맞이한 반면, 개발기술에 성공한 벤처기업은 발전의 도약기를 맞기도 했다. 예를 들어 우울증치료제의 도출에 성공한 M's Science사는 Eisai사와 옵션 계약에 성공했으며, 본 계약에 도달한다면 최대 300억 엔을 손에 넣을 수 있는 성과로 평가된다. 또한, 홋카이도 대학으로부터 spin-off된 벤처기업 Evec사는 독자적으로 완전 인간 항체를 제조하는 특허기술을 개발하였다. 이 기술을 이용해 제작한 항체의 개발판매권을 독일 Beohringer Ingelheim사로 넘기면서 5,500만 유로를 손에 넣는 성과를 거두었다. 이런 바이오벤처기업의 성공은 대형 제약기업과의 계약을 통해 이루어졌다는데 더 큰 기술적 의미가 있으며, 작은 벤처기업이 제약기업으로 성장, 발전할 수 있다는 가능성을 보여준 사례가 되고 있다.

유럽연합(EU)
1. 유럽의 바이오산업의 성장
바이오산업(Biotechnology industry)은 선진국들을 중심으로 세계 각국에서 미래성장산업의 하나로 중점 육성되고 있는 분야로, 세계 각국은 다양한 프로그램을 통해 바이오산업의 국가경쟁력 확보를 위해 노력하고 있다. 유럽에서도 Biotechnology는 경제성장과 환경보전, 공공보건 등의 측면에서 지속가능한 개발을 가능하게 하는 핵심적 기술 중의 하나로 여겨지면서, EU는 유럽 내 바이오산업을 장려하기 위한 다양한 육성 정책을 도모하고 있다. 그러나 유럽은 바이오산업에 뒤늦게 관심을 갖기 시작하여 미국과 비교해 볼 때 여러 가지 측면에서 다소 뒤쳐져 있는 실정이다. 2004년 기준으로 유럽의 바이오산업 기업 수는 2,163개로 미국과 큰 차이를 보이지 않지만 종사자 수나 수익, R&D 투자 면에서는 그 규모가 작은 편이다(표 2-3-1-1). 유럽의 Biotechnology 연구 분야는 주로 Genome, Combinatorial chemistry, 바이오 정보학 등에 집중되어 있다.
특히 유럽은 1980년대 초반부터 여러 연구개발 프로그램의 시행을 통해 EU 전체의 공동연구와 국가별 경쟁 형태의 산업화를 추진하는 등 유럽연합을 중심으로 회원국 간의 협력과 경쟁을 병행하며 발전해 나가고 있다. 유럽의 바이오산업 진흥을 꾀하기 위한 EU 전체 공동 협력의 일환으로, EU집행위원회는 지난 2002년 ‘생명과학과 생물공학-유럽의 전략(Life Sciences and Biotechnology-A Strategy for Europe)’을 발표하였다. 이는 농업, 산업, 제약과 의료 분야 등의 바이오기술을 포함하는 광범위한 전략으로서 R&D, 제도적인 측면, 그리고 중소기업의 벤처자금과 같은 비즈니스 거버넌스와 프로모션에 관한 주요 이슈들을 담고 있다.
더불어 EU 회원국가간 공동 연구의 협력과 경쟁은 바이오산업 분야에 있어서도 영국․독일․프랑스 등의 국가별 경쟁으로 이어지면서 유럽 바이오산업 시장의 활성화에 밑거름으로 작용하였다. 이러한 다양한 육성정책과 더불어 2020년까지 자동차용 연료에 대해 최소 10%의 바이오연료 에너지 사용의무화 등 제도적인 측면에서도 바이오산업 육성에 대한 EU의 적극적인 의지를 확인할 수 있다.20)
[표 2-3-1-1] 유럽의 바이오산업 현황
|
Specialised biotechnology companies, 2004 |
||
|
|
Europe* |
US |
|
Number of companies |
2,163 |
1,991 |
|
Number of employees |
96,459 |
190,462 |
|
Number of R&D employees |
42,500 |
79,300 |
|
Revenue |
€ 21.6 bn |
€ 41.5 bn |
|
R&D expenditure |
€ 7.6 bn |
€ 21.0 bn |
|
Venture capital raised |
€ 1.1 bn |
€ 2.5 bn |
|
Equity raised |
€ 2.1 bn |
€ 5.3 bn |
|
Debt raised |
€ 1.8 bn |
€ 6.6 bn |
출처: 유럽연합 집행위원회(http://ec.europa.eu/enterprise/phabiocom/comp_biotech_comp.htm) * EU15 + HU + EE + EFTA
2. 주요국가의 현황
가. 독일
독일은 유럽 내 대표적인 Biotechnology 분야의 선두 국가로, 튼튼한 과학기술기반과 연구기관 인프라가 구축되어 있는 세계적인 바이오산업 분야의 메카로도 알려져 있다. 바이오산업 분야 현황을 보면, 2006년 기준 바이오기술 분야 종사업체 수는 약 500여 개, 종사인원은 약 1만 4천 150명에 달하며, 종사인원의 절반 이상은 학사학위자이다. 독일의 바이오기술 분야 총 매출액은 매년 지속적인 성장세를 기록하며, 2006년도 17억 5,900만 유로, 2007년도에는 전년 대비 약 14% 증가한 약 20억 유로를 기록하였다.21) 주요 연구 분야로는 기업의 대부분이 ‘단백질․유전공학’과 ‘세포․조직 분야’ 등에 집중하고 있다.
[그림 2-3-2-1] 독일 생명공학 기업의 주요 연구 분야(2007)

출처: ‘The German biotechnology sector 2007’, www.biotechnologie.de, 2007
독일의 바이오산업은 초기에 자본의 투자 문제와 유전공학 연구에 비호의적인 정부 정책 등으로 인해 주요 연구플랫폼의 해외 이전 등 다소 어려움을 겪기도 하였다. 이러한 문제들을 타개하고 독일 바이오산업 부흥을 위해 독일 연방정부는 다양한 전략을 발표하였으며, 이 중 하나로 ‘Bio Region Program’을 들 수 있다. 이는 독일 내 17개 주요 지역을 선정해 바이오산업 기술혁신체제가 원활히 진행될 수 있도록 산․학․정 협동연구 시스템을 운영하는 이른바 바이오 클러스터 조성 프로그램이라고 할 수 있다. 2007년 기준 독일 내 29개의 바이오테크 클러스터가 조성되어 있으며, 대표적인 바이오클러스터로는 Muenchen, Berlin-Brandenburg 클러스터를 들 수 있다.
독일은 물론 유럽 내 최고의 바이오테크 클러스터인 뮌헨 바이오클러스터는 1972년 막스플랑크 바이오화학 연구소가 설립된 이후, 대학과 연구기관, 180개의 업체(이중 바이오산업 업체(97개사), 의료/제약업체(47개사), 2만 3,000개의 일자리를 창출하는 독일 바이오산업의 핵심적 위치에 놓여 있다. 이 지역은 Ludwig-Maximilans 대학교, 대학병원(2개), Max-Planck 연구소(3개) 등 유력 대학과 연구소의 우수한 연구개발 인력을 바탕으로 치료의학과 진단의학 분야에 집중하고 있으며, 2003년부터 2007년까지 3억 6천 600만 유로를 투자받는 등 집중적인 지원을 받고 있다.22) 뮌헨 바이오클러스터의 전담 관리 기관인 BioM은 정부, 금융기관, 제약과 화학산업, 바이오테크 업체, 기술이전센터 등 각종 연관산업의 상호보완적 발전을 위한 네트워크 기능 역할을 하며, 뮌헨 바이오클러스터의 성장과 독일 바이오산업의 발전에 기여하고 있다.
최근 10년 사이 독일 내에서 가장 성장성이 두드러지는 바이오클러스터로 주목받고 있는 베를린-브란덴부르크 바이오클러스터는 유럽에서 가장 역동적인 생명공학지역 중 하나로 2006년 기준 170여 개의 생명공학 회사, 350개 이상의 연구단체들이 위치해 있다.23) 핵심연구 대상은 재생의학기술, 프로테옴(Proteome)과 게놈(Genome)연구 및 바이오 하이브리드, 생물정보학 등이다.
이 지역이 바이오클러스터로서 발전하게 된 이유는 풍부한 양질의 인력과 학제적 또는 광범위한 연구영역, 바이오테크놀로지 관련 기능적인 네트워크가 풍부하다는 점을 들 수 있다. 특히 TSB 베를린 과학기술재단이 창안한 BioTOP은 베를린과 브란덴부르크에서 생명공학을 연구, 개발 그리고 상용화 하는 기업과 연구소들을 연결해 주는 중심기관 역할을 함으로써 베를린-브란덴부르크 바이오클러스터 성장에 기여하고 있다. 이를 통해 지역에 산재되어 있는 대학/연구기관, 관련업체, 서비스기관, 금융기관 등을 연결하며, 타지역/국가와의 정보교류 및 협력사업 추진과 양질의 투자환경을 조성하고 있다.
[그림 2-3-2-2] Bio TOP Berlin-Brandenburg의 구성
|
|
|
|
Bio TOP Berlin-Brandenburg |
|
|
|
||||||||||||
|
|
|
|
⇧ |
|
|
|
|
⇧ |
|
|
|
|
⇧ |
|
|
|
||
|
2개 연방주정부 Berlin, Brandenburg |
|
The TSB (Technology Foundation Berlin) |
|
Berlin, Brandenburg 투자은행, 유럽연합 지역발전 기금 |
||||||||||||||
출처: Bio TOP 홈페이지 (www.biotop.de)
바이오산업의 성공 여부는 지속적인 연구개발을 통한 원천기술을 확보하는 것이 관건으로, 독일 역시 이 분야에 지속적인 연구 활동과 집중적인 투자를 하고 있다. 독일 업체들의 경우 총 매출액의 약 50%에 해당하는 금액을 연구개발비로 투자하고 있으며, 바이오기술협회 연례 보고서에 따르면 독일 내 바이오기술 관련 기업들은 2007년도 연구개발비 투입액으로 전년 9억 7천 100만 유로 대비, 약 8% 증가한 약 10억 유로를 투자한 것으로 나타났다.
한편 지역적으로 형성된 클러스터들은 독일 바이오산업 발전의 초석이 되며 기업과 연구 자원 사이의 유기적인 상호작용을 촉진시키는 역할을 한다. 또한 주요 바이오기술 클러스터는 핵심 연구 분야를 선택해 집중적으로 투자하는 경향이 뚜렷하여, 뮌헨 바이오클러스터는 치료와 진단의학 분야에, 베를린-브란덴부르크 바이오클러스터는 유전자 분야와 프로테옴 분야에 핵심을 두고 있다.
독일 생명공학 기업은 효율적인 기술이전을 수용하기 위하여 대학, 연구기관들과 협력적인 파트너십을 개발하고 있는데, 이 중 막스플랑크연구소(MPS)는 “Max Planck Innovation”이라는 기술이전 전담기구를 만들어서 특허를 관리하고 다양한 기술을 상업화하고 있다. 이 전담기구는 28개의 벤처기업 분사를 유도하였으며, 450여 개의 협약체결을 도왔고, 1억 유로 이상의 기술이전 매출을 기록하였다.
또한 프라운호퍼연구소에서는 “Fraunhofer Venture Group”이 기술이전을 담당하고 있고, 헬름홀츠와 라이프니츠의 연구소들은 “Ascenion”이라는 기술이전 전문기업과 파트너십을 통해 기술이전을 활성화 하고 있다.24) 또한 해외 생명공학 기업들과 활발하게 협력하기 위하여 문호 개방에 적극적이다. 진단에서 제약, 녹색 생명공학에서 나노 생명공학까지 외국기업들과 수월하게 파트너십 기회를 찾을 수 있도록 지원하고 있다. 특히 건강․의약 분야 생명공학기업들의 80%가 외국 기업과 협력하고 있으며, 그 다음으로 협력이 많은 분야는 생명공학의 산업응용과 생물공정 분야이다. 이 분야에 독일 생명공학기업의 25%가 관여하고 있다.
이러한 다양하고 효율적인 육성정책과 산․학․연 파트너십은 독일 바이오산업의 우수한 연구 성과들을 만들어 내고 있으며, 특히 생명공학특허에 있어서 독일은 다른 유럽 국가들보다 월등하여 2000년에서 2004년 사이 유럽특허사무소에 등록된 전 세계 생명특허의 30%가 독일에서 등록하는 등 많은 성과를 보이고 있다.
나. 네덜란드
네덜란드의 Biotechnology 정책은 1970년대 후반 이래로 적극적이고 활발히 진행되었고 이는 현재의 공공과 민간 연구의 근간으로 이어졌다. 그 이후로도 바이오산업은 네덜란드의 미래 성장동력산업으로 지속적으로 육성되어 현재 세계에서 가장 빠른 성장세를 지속하고 있다.
네덜란드 산업부에 따르면 2000∼2007년 기간 중 네덜란드 바이오산업의 평균 성장률은 13.5%로 전체산업 평균성장률 2.9.% 대비 4배 이상의 고성장을 지속하고 있는 것으로 나타났다. 고용분야에 있어서도 네덜란드 전체 실업자 수가 매년 늘고 있는 상황에서도 바이오산업은 2000년 이후 평균 20% 이상의 고용증가율을 보임에 따라 네덜란드 일자리 창출에도 높은 기여를 하고 있는 것으로 드러났다.25)
이처럼 네덜란드 바이오산업이 급속히 성장하고 경쟁력을 가질 수 있는 요인은 네덜란드의 높은 연구개발 투자 비중과 클러스터를 통한 집중력을 들 수 있다. 네덜란드 바이오 관련기업들의 R&D 투자규모는 평균 총 매출규모의 약 65% 정도를 차지해 세계에서 가장 높은 R&D 투자비중을 기록하고 있어 네덜란드 바이오산업 경쟁력 유지의 근원인 것으로 분석되고 있다.
네덜란드 바이오산업 경쟁력의 또 다른 원동력으로 평가받는 클러스터는 네트워크 활동을 통한 협력이 바이오산업 성장에 주요한 역할을 하고 있다. 세계 최고 수준의 산-학 클러스터로 불리는 ‘Netherlands Bio-Delta’는 암스테르담, 프리보랜드, 겔더랜드 등 7개 지역을 하나로 묶고 있으며, 22개의 대학과 학부, 300여 개의 과학 관련 기업, 125개의 바이오 관련 기업들이 집중되어 있다. 클러스터 내의 대학과 기업들은 자체 네트워크를 통해 연구결과, 신기술, 관련정보 등을 효율적으로 교환함으로 네덜란드 바이오산업이 매년 급성장을 이루는 근간을 형성하고 있다.26)
아울러 네덜란드 바이오 산업계는 미국, 여타 유럽 국가들과의 공동연구, 기술이전, 생산제휴, 판매협력, M&A 등 다양한 형태의 전략적 제휴를 확대하여 경쟁력을 더욱 강화하고 있다. 이와 같이 네덜란드 바이오산업 발전을 위한 정부의 강력한 지원정책, 효율적인 산․학 협력체제 등으로 인하여 네덜란드 바이오산업은 향후에도 성장세가 지속될 것으로 예상되고 있다.
다. 스페인
스페인의 Biotechnology 시장은 영국, 독일, 프랑스에 비해 뒤쳐져 있기는 하지만 점진적인 발전을 보여 현재 유럽시장의 4% 정도를 차지하고 있고, 유럽연합 15개국의 바이오테크놀로지 시장과 비교했을 때 5배 정도 더 빠른 성장세를 보이고 있다. 이러한 성장으로 최근 5년간 새로운 기업과 연구소가 크게 늘어나 2006년 기준 바이오테크놀로지에 직간접적으로 종사하고 있는 581개 기업들 가운데 216개 기업이 바이오테크놀로지 분야에 주력하고 있다. 이는 2005년에 비해 12% 증가한 수치이며 기업의 증가 속도는 연간 15%에 달할 정도이다. 또한 공공과 민간부문의 바이오 연구개발 투자도 각각 평균 22%, 32% 증가하였으며 특히, Ingenio 2010 프로젝트에는 약 10억 달러의 정부 자금을 연구개발에 투입하여 공공과 민간 연구부문 사이의 협력도 적극 지원하고 있다. 주 연구 분야로는 스페인 내 전체 연구소의 절반 정도가 바이오 의약분야에 집중되어 있다.
스페인의 바이오산업 지원정책으로는 새로 설립되는 바이오 관련기업의 성장을 돕는 인큐베이터 프로그램이 시행되고 있다. 스페인 내에는 약 25개의 과학기술단지가 운영되고 45개 이상이 개발 중에 있는데, 이를 통해 수천 개의 기업들이 인큐베이팅 되거나 스핀오프 되고 있다.
특히 지리적으로 가장 많은 바이오산업 분야 기업이 자리하여 잠재적 가능성이 풍부한 마드리드에는 국제적 수준의 바이오테크놀로지 클러스터 조성정책이 마련되었다. 이로 인해 2001년에 설립된 마드리드 사이언스 파크(Parque Científico de Madrid, PCM) 내에는 45개 이상의 기업이 입주하고 있으며, 이 중 8개 바이오기업들이 사무실과 연구실, 그리고 고가의 기자재를 공유하며 연구개발 활동에 전념하고 있다. 또한 연구소에서 개발된 과학기술의 민간부문 이전을 지원하고, 대학과 기업 간의 산학협동, 초기단계의 연구개발 지원업무 등을 하고 있다.
더불어 마드리드에 소재한 스페인 국립바이오연구소(National Center for Bio- technology, CNB, www.cnb.uam.es)는 첨단 과학기술의 개발과 이전, 스핀오프를 통해 바이오 혁명의 산실 역할을 해왔으며, 현재까지 11개 기업이 CNB 연구소를 통하여 스핀오프 되었다. 이 연구소는 약 700여 명의 연구원을 둔 스페인 최대 연구센터이며, 기술이전에 집중해온 최초의 연구소이다. 연구분야 또한 다양한데, 바이러스 연구와 백신 개발, 미생물을 통한 바이오레메디에이션, 항균제 개발을 위한 병원균과 발병의 메커니즘 연구, 포도를 이용한 식물의 바이러스와 영양결핍에 대처하는 방법 연구 등 여러 분야에 이르고 있다.27)
한편 마드리드가 전통적인 스페인 과학연구의 거점이었다면 바르셀로나는 바이오 연구거점으로 새롭게 주목받고 있다. 까딸루냐 바이오(BioRegion of Catalonia, BIOCAT) 조직은 까딸루냐 주정부의 지원으로 설립된 것으로 정부와 산업계, 학계를 연결해 기술이전과 비즈니스 모델 개발을 지원하는 역할을 수행하고 있다. 또한 2000년에 설립된 바르셀로나 사이언스 파크(Barcelona Science Park, PCB)는 바르셀로나 대학 캠퍼스 내에 위치하고 있으며 독일 Merck의 3개 암연구센터를 포함해서 약 30여 개의 다양한 개발단계 기업들이 입주해 있다. 2006년 5월에는 바이오의약 분야 연구의 최대시설로 바르셀로나 바이오의학연구소(Barcelona Biomedical Research Park, PRBB, www.prbb.org)가 설립되어, 과학자 1,000여명이 연구 가능한 시설을 갖추고, 80개 이상의 연구그룹이 세계 각지의 과학자들을 유치하고 있다. 연구분야도 바이오정보학, 재생의학, 배아, 성장 줄기세포 연구 등 매우 다양하며 특히 배아줄기세포 연구소로는 스페인 내 최초이다.

중국
해당 국가별 정책 제도 투자현황 등
1. 중국의 생명공학정책
1981년에 등소평은 “농업문제의 돌파구는 최종적으로 생명공학이 해결할 수 있으니, 관련 첨단기술에 의지해야 한다.”고 언급하였다. 1986년 중국정부는 ‘863계획’을 발표하고 생명공학을 우선분야로 지정하여 지원을 아끼지 않았다. ‘863계획’은 3가지 주제(▸우수한 품질과 높은 생산량, 병충해 등에 강한 동․식물 신품종 개발 ▸유전자 공학을 이용한 신약, 백신 및 유전자 치료 ▸단백질공학), 6가지 핵심과제를 중심으로 13가지 세부 프로젝트를 국가 전략으로 선택하여 관련 기술을 개발하였다.
또한 1988년 8월 중국 국무원의 비준을 받아 중국 과학기술부에 의해 실시되고 있는 ‘횃불계획(첨단기술산업발전계획)’은 첨단기술성과 상품화, 첨단기술상품 산업화, 첨단기술산업 국제화를 목표로 ▸첨단기술산업 발전을 위한 환경조성 ▸첨단기술산업개발구 건설 ▸첨단기술창업서비스센터 건설 ▸세부프로젝트 실행 ▸과학기술형 중소기업기술창업기금 조성 ▸첨단기술산업의 국제화 ▸인재양성이라는 7대 활동을 통해 중국 첨단기술 산업화의 중추적 역할을 수행하고 있다.
아울러 1997년 3월부터 확정 실시된 중국 국가 중점 연구개발 프로젝트인 ‘973계획’은 미래 기술을 중점 연구하는 정부의 선행 연구 프로젝트로서 중국의 미래 산업 발전에 필요한 최첨단 기술 기초연구와 응용 기초연구를 실행하는 국가 중점 연구개발 프로젝트에 속하며 광학 전기 기능 결정체, 질병 유전자학, 나노 과학기술, 대뇌 과학, 고대 생물학, 화학분야의 국제학술 및 과학연구 분야에서 중요한 영향력을 발휘하고 있다.
2001년부터 2005년까지(“105”기간) 중국정부는 생명공학 연구개발에 총 120억 위엔을 투자하였는데 이는 1996년부터 2000년까지 같은 기간 동안 중국 정부가 생명공학 분야에 투자한 총 연구비(15억 위엔)의 8배 이상 증가한 것이다. 그러나 중국의 생명공학 연구개발은 세계 선진기술 수준과 비교해 볼 때 아직도 상당한 격차가 있다. 주요 원인은 핵심 기술과 우수 인재의 부족이다. 따라서 인재를 기르는 일이 중국 생물산업을 발전시키는 중요한 과제로 보고 인재의 육성, 활용, 유치 등 3가지 측면으로 우수인재팀를 구축하여 첨단기술 인재규모 분야에서 선진국과의 차이를 줄이려 노력하고 있다.
최근 중국 국무원은 “국가생명공학연구개발과 산업화 촉진 지도자 그룹”을 조직하였고 동시에 “중국 생명공학기술 및 산업화 발전 계획” 및 “생물안전법”을 제정하였다. 또한 중국 생명공학산업체협회를 조직하였으며 생명공학 연구개발비에 대한 대대적인 지원을 강화하고 있다. 중국 국가 과학기술부는 2005년 9월 ‘중국의 생명공학 및 생물산업 전략계획’(마스터플랜)을 공식 발표하였다. 그 내용은 농업, 의약, 공업, 환경, 에너지, 해양, 중의약 등 중점 발전분야를 확정하고 기술 축적을 위해 전력을 다한다는 것이다. 이 ‘전략계획’에서는 “향후 2020년도 중국의 생명공학 및 산업화 발전 전략 목표는 중국을 생명공학기술 강국과 생물산업 대국으로 건설하는 것이며, 15년간의 노력을 통해 중국의 생명공학과 산업화 수준을 세계 선진국 수준에 도달시키는 것이 기본 목표이다”라고 정리하고 있다. 중국 국가 과학기술부 산하 ‘중국 국가생명공학발전센터’이 작성한 이 계획에서는 중국이 3단계를 거쳐 2020년 생명공학기술 강국과 생물산업 대국으로 부상하는 전략 목표를 실현할 것이라고 설명하고 있다. 또한 2007년 6월 17일 중국생물산업대회의 ‘생물산업정책 및 생물산업기지발전포럼’에서도 국가발전개혁위원회에서 제정한 ‘생물산업발전 11.5 계획’을 더욱 강조하였다.
[표 2-4-1-1] 중국의‘생명공학 및 생물산업 마스터플랜’에 제시된 전략목표
|
단계 |
기간(년) |
세부목표 |
|
1단계 (기술축적단계) |
2005 ~ 2010 |
◦ 생명공학 연구개발 전체 수준을 개발도상국 중 제일 높은 수준으로 도달시킴 ◦ 논문, 특허 수량 세계 6위 달성 ◦ 생물산업 총생산액 8,000억 위엔 달성 |
|
2단계 (산업발전단계) |
2010 ~ 2015 |
◦ 생명공학 연구개발 전체 수준을 세계 선진수준으로 도달시킴 ◦ 논문, 특허 수량 세계 3~4위 달성 ◦ 생물산업 총생산액 15,000억 위엔 달성 |
|
3단계 (지속발전단계) |
2015 ~ 2030 |
◦ 생명공학 연구개발과 산업화 전체 수준을 세계 선진 국가 수준에 도달시킴 ◦ 세계 생명공학과 기술분야 최우수 인재를 유치하며, 세계 생명공학 연구 혁신의 중심지로 성장 ◦생물산업 총생산액 25,000~30,000억 위엔 달성 및 GDP에서 차지하는 비율 7~8% 으로 향상 ◦ 생명공학산업을 중국의 기간산업으로 육성 |
이 ‘전략계획’에서는 향후 20년간의 중국 생물산업 발전의 9개 중점 분야를 다음과 같이 제시하였다. 첫째, 농업 생명공학으로 제2차 녹색혁명을 추진한다. 둘째, 의약 생명공학으로 제4차 의학혁명을 추진하고 중화 민족의 평균 수명을 연장한다. 셋째, 공업 생명공학으로 ‘녹색 제조업’ 발전을 추진하고 녹색 GDP를 대폭 증가시킨다. 넷째, 에너지 생명공학을 발전시켜 중국의 에너지 부족 상황을 개선시킨다. 다섯째, 환경 생명공학으로 순환(循環) 경제 발전을 추진시킨다. 여섯째, 생물자원의 심층 개발을 통해 새로운 생물산업을 육성한다. 일곱째, 해양 생물산업을 발전시켜 해양경제를 발전시킨다. 여덟째, 생물안전과 생물테러 방지기술 연구개발을 추진하여 생물안전관리시스템을 구축한다. 아홉째, 중의(中醫)와 서의(西醫)를 효과적으로 결합시킨 새로운 의료 보건 체계를 구축하고 중의약(中醫藥) 산업 발전을 추진한다.
가. 생물산업 가속발전을 촉진하는 여러 정책
2009년 6월, 중국 국무원에서《생물산업발전촉진기본정책》을 발표했다. 이는 정책목표, 현대 생물산업 발전의 중요 영역, 생물기업의 발전, 자주적 혁신의 촉진, 우수 인재의 양성, 재정과 세무에 대한 지원의 확대, 융자 경로를 적극적 확대, 양호한 시장 환경의 조성, 생물 유전자원에 대한 보호와 Biosafety의 감독, 그리고 조직과 리더십의 강화 등 총 10부분, 33항으로 구성되어 있다. 《생물산업발전촉진기본정책》에서, 생물산업을 빠르게 육성하는 것은 중국이 신세기의 과학기술 혁명의 전략적인 기회이고, 전면적으로 새로운 국가를 건설하는 중요한 과제가 되었다. 위 정책은 《국가중장기과학기술발전계획요강(2006-2020)》과 《생물산업발전‘11.5’계획》을 관철 실행해, 생물산업을 하이테크기술 영역의 기간산업과 국가의 전략적 신흥산업으로 빠르게 육성하는데 그 목적이 있다. 위 정책은 기술·인재·자금 등의 자원을 생명공학산업으로 유도하여 생명공학기술의 혁신과 산업화를 촉진해, 생명공학산업 규모화·밀집화·국제화로 발전을 가속시킨다. 기업을 주체로 하고 시장을 방향으로 하여 산·학·연이 서로 결합하는 산업기술 혁신체계를 건설하며, 우수 인재를 양성하여 혁신능력을 강화시켜 자주적 지적재산권을 갖고 있는 중요한 생명공학기술·제품과 표준을 파악해야 한다고 요구하고 있다.
《생물산업발전촉진기본정책》에서는 여러 개의 다국적 대형 생명공학기업과 자주적 지적재산권을 보유하는 혁신적 생명공학 중소기업의 육성, 산업 밀집도가 높고 핵심 경쟁력이 강하고 전문화 특색이 현저한 생명공업 산업의 본거지의 형성, 생명공학 기술특허의 보호와 물질특허 생물유전자원의 보호를 강화하여 생물유전자원의 개발·이용 수준을 향상시켜 Biosafety의 보장을 요구하고 있다.
생물의약 분야에서는 중국 인민의 생명 건강을 위협하고 있는 중대 전염병을 예방하고 진단하는 신형 백신과 진단 시약의 개발에 중점을 두고 있다. 흔한 질환과 주요 질환의 치료에 현저한 효과가 있는 생물기술 약물·저분자 약물과 현대 중약을 적극적으로 연구하고 개발한다.
생물농업분야에서 중국은 양질·고수확·고효율·다환경 적응성 농업·임업 신품종과 야생 동식물 번식 종자개발을 중점적으로 발전시키려 한다. 생물농약·생물 사료 및 사료첨가제·생물비료·식물성장조절제·동물백신·진단시약·현대 동물용 중약·동물용 생물치료제·어류용 생물치료제·미생물 완전분해 농업용 박막 등과 같은 친환경 녹색농업용 생물제품을 크게 발전시키고 동식물 바이오리액터의 산업화 개발을 추진하여 고효율 녹색 농업의 발전을 촉진시킬 것이다.
2. 중국의 생명공학기술 및 산업화
중국은 풍부한 생물자원을 보유하고 있다는 장점을 바탕으로 생물산업 발전을 가속화 하고 있다. 관련 통계에 따르면 중국에는 동식물, 미생물이 26만 종이 있으며 세계에서 천연자원과 생물 종류가 가장 풍부한 국가 중의 하나이다. 이미 3,000여 가지의 질병 근원 미생물 수집에 성공하였고, 농작물 재배에 유용한 천연 생물자원도 32만 종이나 확보하여 그 수치는 단연 세계 1위를 차지하고 있다. 그밖에 형질전환기술, 단백질공학, 복제기술 등을 포함한 현대 생명공학기술은 개발도상국가 중 우위를 차지하고 있으며 일부는 세계 수준으로 평가받고 있다. 최근 중국의 BT 관련 특허 및 논문 수가 세계 8위를 차지하면서 관련 연구계로부터 주목을 받고 있다.
중국 전체에는 중앙 정부, 유관 정부부처 및 지방 정부가 지원하는 생명공학중점실험실이 약 200여 개 정도 분포하고 있고, 기술 및 제품 연구인력은 약 2만여 명으로 추정되며 많은 대학이 생명공학 및 생물산업 분야의 전공을 개설하고 있다.
중국의 생명공학 응용연구 및 산업화는 농업 생명공학기술(형질전환 농작물, 현대육종과 슈퍼잡교논벼, 식물조직배양, 생물농약, 사료생물기술, 가축용 백신)과 의약 생명공학기술(생명공학약물, 백신, 혈액제품, 생화약품, 진단시약, 조직장기공학)이 중심이며 중약(천연물)은 중국 정부가 중화민족의 자부심을 가지고 추진하는 BT 산업분야이다. 이밖에 “105(10차5개년)” 기간에 “기능성 게놈과 바이오칩”이라는 중대 과기 전문프로젝트를 실시하여 바이오칩의 초보적인 산업규모를 갖추도록 하였고 인간의 주요 생물기능 및 간암, 위암, 폐암, 식도암, 백혈병, 고혈압 등 질병과 관련된 신규 유전자 1,500개를 성공적으로 연구하였다. 그 중에는 향후 개발 전망이 있는 기능성 유전자 160개, 신제품으로 개발되어 사용되는 유전자 24개, 독점재산권을 보유하고 기업이나 약물연구기관과 공동으로 약물표적이나 생명공학기술약물 전기개발을 진행하고 있는 신규 유전자 8개가 포함되어 있다.
중국발전개혁위원회는 “115(11차5개년, 2006~2010)” 기간에 진행할 발전계획을 편성하고 관련 생물산업정책을 제정하였으며 40억 위엔의 국가자금을 조성하고 약 400억 위엔을 사회투자로 조달받아 400여건의 생명공학기술 산업화 프로젝트를 실시하고 바이오칩, 줄기세포, 조직공정 등 20여개 국가공정연구센터 구축사업과 농작물 유전자자원 중대과학공정 등을 추진하고 있다. 이러한 기술성과가 지속적으로 산업화됨에 따라 2000년 이후 현대생물산업은 연간 약 3배씩 빠르게 성장하고 있다. 그러나 연구개발 기술에 비하여 BT 산업화는 상대적으로 미흡한 실정이다. 하지만 중국의 13억 인구가 식량을 섭취하고 5억 정도가 보건식품을 소비하고, 1.3억의 인구가 환자이며 새로운 품종의 농작물을 재배할 농경지가 20억 무(1畝≒66평)나 되는 등 중국은 세계에서 가장 큰 생물제품 소비시장을 보유하고 있어 향후 발전 가능성이 크게 기대된다. 중국생물산업에 관한 예측 연구에 의하면 생물의약, 형질전환제품, 기능성 식품, 바이오센서기 등 10대 세부 생물산업에서 150개 품목을 연구 개발하였고 연간 총생산액이 15,000억 위엔으로 추정되며, GDP의 15%를 차지하고 있다.
중국내 현대 생명공학 관련 기업은 약 500여 개이고, 종사인력은 약 5만여 명으로 집계되며, 베이징과 상하이, 선전 등지에 이미 20여개 생명공학 클러스터가 설립되어 있다. 중국에서 생명공학 연구개발은 경제, 식량안보, 환경에 큰 기여를 해왔는데, 중국과기부는 이러한 중국 생명공학이 향후 15년 동안 더욱 커다란 발전 잠재력을 보유하고 있고 중국의 생명공학 연구개발은 식량안보, 인구건강, 환경증진, 에너지 안보에 주력하고 경제사회 개발의 병목현상을 해결할 수 있으며, 생물학적 비료 개발, 감염질환의 진단기술 개발, 대기오염 개선 등을 추진할 것이라고 발표하였다.
가. 2008년 중국 생명공학산업의 규모
2008년 중국 생명공학산업의 규모는 8,600억 위엔으로 전년 동기에 비해 25.5% 증가했다. 이 같은 발전추세로 20%의 성장이 실현되면 2009년 1조 위엔의 매출액을 실현할 수 있다(중국의약기업관리협회 부회장 张波). “2020년까지, 중국 의약 위생 상관 산업의 생산액은 4조 위엔 정도에 달할 것이고, 생명공학 관련 산업의 생산액과 합쳐서 6조 위엔을 넘을 것이다.”(全國人大常委會 위원장 桑国卫) 생물의약산업은 전략산업뿐만 아니라 미래의 기간산업이 될 것이고, 앞으로 중국 GDP의 10% 또는 그 이상 차지할 것이다.
생명공학산업 “11.5”계획의 목표에 따라, 생명공학산업을 주요 전략산업으로 발전이 가속화 된다. 매출액이 백억 위엔을 넘는 10개 이상의 대형 생명공학기업을 형성해야 하는데, 중점은 베이징-천진-허베이, 장강 삼각주, 주강 삼각주에서 종합성 생명공학산업 본거지인데, 8개의 생산액이 5백억 위엔을 넘는 생명공학산업 본거지를 형성하는 것이다. 뿐만 아니라 산업 규모도 가속 성장할 것이다. 2010년 생명공학산업 증가치는 5천억 위엔 이상에 달할 것이며, 이 기초 위에 2020년 전국 생명공학산업 증가치는 2조 위엔을 돌파해 국민경제의 선도 산업으로 될 것이다. 베이징, 상하이, 천진, 광동, 가소, 흑룡강 등 성 또는 지역에서 일련의 중요한 조치를 실시해 생명공학 기술 단지를 건설할 예정이다.
중국과기부 장관 완강(万钢)은 각 성(省) 또는 시(市)에서 앞으로 5년 동안 생명공학과 의약산업을 위한 예산이 200억 위엔을 넘는다고 했다. “생명공학 기술을 과학 기술 발전의 5대 전략 중의 하나로 한다.”고 이미 《국가중장기과학기술발전계획요강(2006~2020)》에 명시했다. 국가에서 이미 확정된 16개의 주요 과학기술 전문 프로젝트 중, 주요 신약 개발·이식유전자 식물·주요 전염병 예방/치료 등 3개의 프로젝트는 생명공학 기술과 관련되어 있다.
나. 중국 생명공학산업 현황
중국이 전통적 우위를 보유하는 생물산업에서 중국의 생명공학산업이 강력한 성장동력을 유지하고 있다. 그리고 일부 생명공학기술회사의 상품과 자본이 모두 세계시장에서 신흥 세력이 되었다. 예를 들어, 중국에서 생산된 생명공학의약제품, 진단시약, 백신제품, 생분해 플라스틱 등은 최근 몇 년 동안 발전된 생명공학 수출 제품군이다. 자본 면에서는 중국의 일부 기업이 외국에 진출했다. 현재 중국의 제약 기업이 상하이와 선전 증시(131개), 홍콩 증시(29개) 및 국외의 미국(9개)⋅싱가포르 시장(5개)에 모두 상장되어, 상장된 생물 제약 및 건강식품류 기업이 174개를 넘었다.
다. 생물의약 성장
2007년 중국 생물제약기업의 판매수익은 약 474.14억 원으로 전년 동기에 비해 21.4% 증가되어 순이익 58.53억 원이 실현되고 전년 동기에 비해 41.71% 증가 되었다. 생명공학 제약이 전체 의약공업의 8.24%를 차지하여 의약공업 10.35%의 이익이 실현되었다. 2007~2008년, 중국 생명공학 신약제품도 상당한 진전을 보였다. 바이오텍 제약사(百泰)가 개발한 “타이신성(泰欣生)”은 쿠바 기술을 기반으로 한 포유류 세포의 대규모 배양 신기술을 응용한 것이다. 이것은 단일항체의 산업화 과정의 난제를 해결하고 특허권을 획득함으로써 중국 최초의 유전자공학 인체형 단일항체약이다. 창춘(长春) 바이커(百克) 제약사는 에이즈 백신 연구에서 중대한 성과를 거두면서 1기 임상연구를 순조롭게 완수했고 2기 임상연구단계로 들어갔다. 2008년 4월 SFDA가 북경과흥(北京科兴)생물제품공사에서 유행성 독감 백신의 생산을 비준하였는데, 중국이 미국 다음으로 두 번째 조류독감백신 제조기술과 생산능력을 갖고 있는 국가가 되었다. 2008년 7월, 제3군의대학과 충칭(重庆)강위(康卫)생물과기공사가 공동 개발한 위병 백신(헬리코박터 파일로리 재조합경구백신)도 베이징에서 3기 임상종합평가를 통과했다. 2008년 6월, 장사(长沙)국가생물산업기지는 14억 위엔을 투자해 캐나다 Microbix사의 백신 생산기술을 도입해 전 세계 제3대 규모의 인플루엔자 백신 생산기지가 되었다. Microbix사는 호남생물의약 그룹이 각 50%의 지분을 가지고 있다.
라. 바이오에너지와 바이오매스
에탄올 연료 분야에서 전분이용 에탄올 생산과 관련하여 4개의 프로젝트를 중점적으로 수행하고 있다. 기타 비곡물바이오에너지 분야에서, 하남천관(河南天冠)과 산동택생(山东泽生)과기공사가 농작물의 부산물(줄기)을 이용하여 효소발효방법으로 연료에탄올을 생산하는 라인을 건설하였고 1년 이상 지속적으로 생산했다. 생분해성 폴리머 분야도 상당히 진전했다. 비오커환경보호재료유한공사는 미국 생물분해협회가 승인한 11개 기업 중의 하나이며, 중국 내에 7개의 가공공장이 있고 매년 7,000톤의 생물분해수지를 생산하고 있다. 중국과학원 장춘응용화학연구소와 절강해정그룹이 국내에서 규모가 제일 크고 연 생산 5,000톤의 녹색 분해가능 환경보호형 polylactic 산성수지 생산라인을 건설했다. 중국은 세계적으로 두 번째 polylactic산 산업화 규모가 5,000톤을 넘는 국가가 되었다. 2008년 4월, 총투자액 3,000만 달러의 천진국운(天津国韵)생물과기공사는 만 톤 규모의 PHA(생분해성 고분자재료)를 건설하기 시작해 2009년 4월 생산 개시 후, 세계적으로 가장 큰 PHA 생산공장으로 연 생산량이 1만 톤에 달한다. 2008년 7월, 합작기업인 대풍지새나(大丰地赛诺)제약공사가 강소성 염성에서 건설되어 생산에 들어갔다. 이는 세계적으로 가장 큰 비오틴 제품 생산기지이며 2009년 비오틴 생산은 60톤에 달할 것으로 예상된다.
마. 생물의약산업 발전 상황
2008년 생물의약 생산액은 8,666억 위엔을 실현하여 전년 동기에 비해 25.23% 증가했고 하이테크산업에 비해 11.42% 높으며, 전국 산업에 비해서도 2.42% 높다. 그 중 생물제약의 성장은 30.65%이고 2007년 동기에 비해 성장속도가 8% 증가했다. 의료기기도 동기에 비해 31.43% 증가했고 2007년 동기의 증가속도에 비해 7.28%를 증가함에 따라 경제수익이 대폭 증가하고 있다. 2008년 1~8월, 의약 제조업 누적 이윤은 460.09억 위엔으로 전년 동기보다 39.82% 증가했다. 그 중, 화학약품제조·생물제제 업종의 이윤 성장은 각각 51.43%⋅40.39%에 달한다. 4분기에 생물의약산업의 이윤 증가폭은 내려가는 추세로 보이지만 1~11월의 총 이익은 708.9억 위엔에 달하고 전년 동기에 비해 28.4% 증가했다. 2008년 의약 제조업에 투자가 1055.3억 위엔이었고 전년 동기보다 27.4% 증가했는데 이는 2006년, 2007년 전년의 성장속도보다 18.68%, 15.95% 높다. 이와 동시에 바이오디젤, 볏짚이용전기생산 등의 투자도 빠르게 증가했다. 2008년 중국 생물의약 수출 납품치는 723.24억 위엔으로 전년 동기에 비해 13.75% 증가했다. 의료설비 및 기계 제조업 수출 납품치는 233.13억 위엔이고 전년 동기에 비해 16.58% 증가했다. 금융위기 등 요소의 영향을 받아 증가폭이 2006년, 2007년보다 낮은데, 4분기의 수출성장이 약간 내려갔지만 전체 공업수출성장에 비하면 3% 높다.
현재까지 국가에서 인증을 받은 생물산업기지는 총 22개이다. 2008년 국가 생물산업기지는 빠르게 성장하는 추세를 계속 유지하고 있어 생산치 7,220억 위엔에 달해 전국 생물산업의 평균 성장수준보다 높고 전체 생물산업 생산치의 약 66%를 차지하고 있다.
2009년 1월부터 부가가치세 전환 개혁을 전국적으로 실시했다. 그 주요내용은 기업이 신규설비 구입 시, 부가가치세를 공제하는 것을 허용하는 것이다. 이 개혁을 실시함으로써 바이오기업의 높은 부가가치세 문제가 해결되고 기업자금의 부족을 완화시켰다. 2009년 경제발전추세는 낙관적이지 않지만, 2009년 중국 생물산업은 국내시장 확대, 발전환경의 개선 및 국외산업 가속 이전 등 중요한 기회에 직면할 것이다. 2009년 중국 생물산업은 가속 성장을 계속할 것이고 증가폭이 20% 이상으로 예상된다.
바. 생물산업 국제화 발전 현황
2008년 중국 의약건강제품 총 수출액은 486.9억 달러에 달하고 전년 동기에 비해 26.1% 증가했다. 그 중 수출은 319.7억 달러로 전년에 비해 30% 성장하였다. 수입은 167.2억 달러로 전년 동기에 비해 19.4% 성장하였다. 전년 의약 대외 무역흑자는 152.5억 달러를 기록했다. 2008년 중국 화학종류 제품이 의약 건강제품 총 무역액 비중의 63%를 차지하고 그 중 화학 원료약 총수출입액은 238.9억 원으로 전년 동기에 비해 22.2% 증가하였고, 화학 종류 제품 총무역액의 77.9%를 차지한다. 아시아·유럽·북아메리카는 여전히 중국 의약제품 무역의 3대 시장으로 중국 의약 건강제품 총 수출입액의 91% 정도를 차지한다. 중국 의약제품 국제 무역이 쾌속으로 성장하는 원인을 분석해 보면, 중국 생물의약산업이 요즘 몇 년 동안 전반적 기술 수준이 계속 향상되었으며 신제품이 계속적으로 국외 GMP 인정을 받았다. 중국은 이미 전 세계적으로 생물의약산업 체인 중 중요한 원료약 생산기지로 발전하였다. 2007년 중국 생물의약산업 계약에 외자 사용 총액은 21.72억 달러였고, 실제 사용 외자 총액은 5.98억 달러로 전년 동기에 비해 16.05% 증가했다. 2008년 1~9월 외국자본이 중국 의약제조업에 대한 투자는 5.27억 달러에 달해 전년 동기에 비해 19.28% 성장했다. 2007년 프랑스 Sanofi-Aventis가 선전(深圳)에 설립한 유행성독감 백신공장은 지금까지 중국 최대의 외자유치 생물제약 프로젝트인데, 1기 투자가 7억 위엔에 달하고 모든 생산기술공정을 선전에 두고, 생산제품은 주로 일본 이외의 아시아 지역으로 판매된다. 2008년 6월, 캐나다 Microbix 생물기술회사가 14억 위엔을 투자해 장사(长沙)에서 유행성독감백신 생산기지를 건설했다. 뿐만 아니라, 세계 유수의 거대 제약사 모두가 중국에 연구개발센터를 설립하고 있으며 지난 2년 동안 AstraZeneka는 상해에 중국 혁신센터를 설립했다. GSK는 상해에 자사의 전 세계 32번째 연구개발센터를 설립할 계획을 선포했으며 Covance도 상해에 연구센터를 설립했다. Roche제약개발중국센터는 상해(장강하이테크개발구)에 설립되어 운영을 시작했다.
사. 중국 백신산업
2006년 중국 국내 백신시장의 규모는 약 52억 위엔이었다. 2010년, 중국의 백신시장의 규모는 100~120억 위엔으로 예상된다. 현재 중국 시장 판매액은 유행성독감백신이 가장 많은데 연 판매액이 약 7~8억 위엔(넷백 가격으로 계산)이고, 기타는 광견백신, 수두백신, B형간염백신, A형간염백신, 유행성뇌막염, 유행성B형뇌염, 윤상(轮状)바이러스백신 등의 판매액도 상당히 크다.
중국 정부는 최근 몇 년 동안 백신의 생산과 연구·개발을 중요시하고 있다. 과학기술부와 관련된 부문은 863계획, ‘중대신약창제국가중대과기항목’ 등의 계획에서 백신의 연구개발과 산업화에 대해 중점적으로 배치했다. 이미 시작된 863 계획 ‘백신과 항체 공정’ 주요 프로젝트에 백신의 연구 개발을 위한 약 2억 위엔의 국가 예산을 지원했다. 그 밖에, 주요 전통적 백신 생산과 품질 기술향상에 맞춘 과기지탱계획(科技支撑计划) 주요 프로젝트인 “백신관련 생산기술 연구개발”도 곧 시작할 것이고 예산투입은 약 6,000만 위엔이다. <위생사업발전 ‘11.5’계획개요>에서, “11.5” 기간 아동 국가 면역계획백신 예방접종률이 도시는 95% 이상이고 농촌도 90% 이상에 달해 각각 2005년보다 10% 늘었다. 원자바오(温家宝) 총리는 10차전인대5차회의에서 “국가 면역 계획의 범위를 확대할 예정이고, A형 간염·유행성뇌막염 등 15종의 예방접종을 통해 효과적으로 예방할 수 있는 전염병환자 이외에 무상으로 치료하는 병의 종류를 확대할 예정이다. 이를 위해 중앙 재정에서 25억 위엔을 추가로 지출할 것이다.”라고 말했다.
중국 국내에 백신 생산기업이 43개가 있고, 26종의 전염병을 예방할 수 있는 41종의 백신을 생산할 수 있다. 연생산량은 10억 개의 용량 단위를 초과한다. 백신의 품종·수량·생산능력과 사용으로 보면 중국은 명실상부한 백신 대국이다. 하지만 유전자 공정 백신, HPV 백신 등 새롭게 연구 개발한 제품으로 보면 중국은 선진국과 여전히 일정한 격차가 존재한다.
아. 생물농업
중국의 조류용 백신시장은 438억 도스(羽份), 가축용 백신은 32억 도스(头份), 특별 백신은 50억 밀리리터, 판매액 선도 백신제품은 구제역 백신과 조류독감 백신이다.(牧实기업 연례보고서) 중국의 생물농약의 종류는 생체미생물·농업용 항생제·식물원농약·천적곤충·식물성장조절제로 나뉘어 있다. 2005년 중국 생물농약의 판매액은 25.14억 위엔이고, 농업용 항생제는 생물농약의 80%를 차지한다.(복건농업대학 자료) 2010년 중국 생물농약의 판매액은 28.8억 위엔으로 예상된다.
자. 기타 최근 연구 동향
<중국공공위생>(2009년 9월)에서 “조양(朝阳)바이러스”라고 명명된 새로운 바이러스 품종이 요령성 조양시에서 발견됐다. 이는 Arbovirus의 연구와 질병 관리에 중요한 의미를 가지고 있다. 대련(大连)이공대학 장영순(张永顺)부교수 연구실은 의학용 소형캡슐로봇을 연구하고 있다. 로봇이 장 내로 수직 이동하는 이 기술은 세계적 수준에 도달했다. 우한(武汉)대학 의학바이러스학연구소 소장 양점추(杨占秋)교수 연구실에서 자주지적재산권 신약-Arbidol 유사물을 개발하였다. A형인플푸엔자와 그의 변이 품종에 대한 예방·치료 효과를 증명하였다. 이 약은 타미플루의 시장독점을 타파하여 신종플루 감염환자의 조기치료에 사용될 가능성이 있다. 쥐의 피부세포를 역분화시켜 만든 유도만능줄기세포(iPS)로 쥐를 탄생시키는 데 성공함으로써 iPS가 배아줄기세포와 똑같은 만능세포라는 사실이 과학적으로 증명되었다. 중국 과학원 생식생물학연구실의 저우 치(Zhou Qi) 박사와 상해교통(上海交通)대학 의학유전학연구소의 쩡판이(Zeng Fanyi) 박사는 다 자란 쥐의 피부세포를 iPS로 역분화시켜 모두 37개의 iPS세포주(株)를 만들어 이 중 3개로 27마리의 새끼 쥐를 탄생시키는 데 성공했다고 밝혔다. 이 새끼 쥐들은 자라서 100여 마리의 2세를 낳고 2세는 다시 100여 마리의 3세를 출산했다. iPS 자체는 태반물질을 만들 수 없기 때문에 iPS를 쥐의 초기단계 배아인 포배에 주입하는 이른바 사배체상보(tetraploid complementation)기술을 이용해 배아를 만들어 이를 암쥐의 자궁에 착상시켰다. 이 연구결과는 2009년 7월 ‘네이처(Nature)’에 발표되었다.
심천화대유전자연구원(深圳华大基因研究院)이 중국 미생물분야에서의 첨단 연구기구, 대학교, 기업과 연합하여 구성한 ‘만종미생물게놈프로젝트’가 2009년 8월 선전(深圳)에서 시작되었다. 이 계획은 ‘국제천명게놈프로젝트’ 다음으로 또 하나의 중대한 게놈프로젝트이며, 현재 아시아에서 첫 번째이자 세계에서 세 번째이다. 2009년 ‘난초게놈프로젝트’가 정식 가동됐다. 중국과 타이완 과학자들이 ‘식물계 팬더’라는 난초과 식물에 대한 전체 게놈 염기서열과 생물정보 분석을 진행할 예정이다. 동시에 가장 대표적인 난초과 식물 10종에 대한 게놈 분석을 진행할 것이다. ‘난초게놈프로젝트’는 심천난과(兰科)식물보호센터, 청화대학, 심천화대유전자연구원, 중국과학원식물연구소, 대만성공대학(台湾成功大学) 등의 연구자들이 참여한다. 국가위생부는 2009년 3월 <의료기술 임상응용 가이드라인>을 발표했다. 이종줄기세포 치료기술, 이종유전자 치료기술, 인간체세포 클론기술 등을 당분간 임상에 사용하면 안 된다고 명확하게 하였다.
3. 중국의 생명공학 투자현황
현재 중국에서 진행 중인 국가과기공관계획, “863계획”, “973계획”, 자연과학기금, 횃불계획 등 여러 과학기술 및 산업발전계획은 모두 첨단과학기술 가운데 생명공학을 우선 발전분야로 두고 있다. 하지만 중국 정부가 지원하는 R&D 투자금은 아직까지 상당히 미흡한 실정으로 GDP의 0.5%~1.0% 수준에 불과하다. 이는 개발도상국인 인도보다도 낮은 수치로 해외 선진 BT기업 1개 업체의 연구개발비에도 미치지 못한다고 한다. 2003년 기준 중국의 GDP는 13,000억 달러이고 그 중 단지 5%인 650억 달러가 의료 및 건강사업에 투자되고 있다.
중국의 GDP가 증가함에 따라 의료위생과 건강사업에 투자되는 비율도 점차 증가하고 있으며 2010년까지 관련 연구기관의 예산은 연간 위생과 건강사업 총 투자액의 1%이며 약 50~60여개 연구소 및 연구센터로 확대할 전망이다. 연구기관의 외부과제 연구개발비는 연구원 총예산의 2/3 수준이 되도록 하고 약 4,000여 과제를 지원할 계획이다. 이는 중국 생물의학연구 발전에 상당한 원동력이 될 것이다. 하지만 선진국이나 상위권 개발도상국에 비해 규모가 작은 정부 지원금은 결국 중국의 생명공학 발전을 저해하는 주요 요인으로 작용하기 때문에 중국 정부와 각 성(省) 정부는 화교 자본을 포함한 해외 투자금 유치를 위해 관련 법률을 제정하는 등 정책적으로 적극 장려하여 자금부족의 취약점을 보완하고 있다.
또한 중국은 현대과학연구시스템을 갖추기 위하여 국가 연구기관을 개혁함으로써 새로운 형태의 생명공학연구기관을 설립하고 있다. 예를 들어 중국과기부와 국가발전개혁위원회가 공동 설립한 북경생명과학연구소는 세계 수준의 중국 생명과학 기초분야를 연구 중이며, 2003년 7월에 개원한 중국과학원 광주생물의학건강연구원은 중국과학원과 산동성 정부, 광주시 정부가 공동으로 설립하여 생물의학연구 및 산업화를 촉진하고 있다. 최근에는 상해시 정부도 비슷한 연구기관을 설립할 계획이며 이러한 연구기관은 지역의 우수 조건과 발전 추세에 부합하고 현대과학연구 모델 구축을 위한 새로운 시도로 인식되고 있다.
중국은 지역별로 대규모 생명공학 투자사업을 진행하고 있다. 대표적인 사례로 북경의 중관촌 생명과학단지 조성사업과 해남성 해구(海口)제약밸리 건설사업 등이 있고, 광주(廣州)시 생물첨단기술산업화시범기지는 2006년에 완공되었다. 그리고 심천시, 석가장시, 장춘시의 중국 최대 규모의 3대 생물산업기지와 난링시 영장류실험동물기지 등 크고 작은 시설 투자도 진행되고 있다.
중국 최대의 국가과학기술단지로 건설 중인 빈해과학단지에서도 생물산업을 중점 육성시키려는 계획을 실현시키고자 노력하고 있다. 또한 2006년 북경에서 기공식을 한 생명공학학술센터는 500여 연구팀과 100여개 생물기업을 동시에 수용할 수 있는 아시아 최대 규모의 바이오산업 인큐베이터로 건설되고 있다. 현재 국가 발전개혁위원회는 석가장, 장춘, 심천, 북경, 상해, 광주, 장사, 중경, 성도, 곤명, 무한, 청도 등 12개 국가생물산업기지를 지정하였다.
가. 6,000억 위엔 과학기술 주요프로젝트
2009년 1월 원자바오(温家宝) 총리는 <국가과학기술중장기계획개요(2006~2020)>에서 정한 6,000억 위엔을 투입할 6개의 경제 발전과 밀접한 중요 프로젝트를 앞당겨 가동한다고 언급했다. 2009년 2월, 중국과기부에서 “금융위기대처 과학기술투자 전문가회의”가 개최되었다. 현재까지 검증을 통과해 가동한 주요 프로젝트는 9개인데, 정보통신산업, 장비제조업, 에너지 등 주도산업과, 수리(水利), 의약과 농업 등의 분야를 포함하고 있다.
첫째 주요 전문 프로젝트는 핵심전자부품·첨단 통용 칩 및 기초 소프트웨어, 초대 규모 집적회로 제조 및 관련기술, 신세대 광대역 무선이동통신, 고급 수치제어 선반 및 기초 제조 기술, 대형 석유 가스전 및 석탄층 개발, 수질오염 통제, 거버넌스 유전자 변형 생물체의 새로운 품종 육성, 중대 신약의 창제, 에이즈와 바이러스성 간염, 대형 고급 가압경수로 및 고온 공기냉각 원자력발전소이다. 둘째 과학기술 전문 프로젝트는 “11.5” 계획 중 “주요 신약개발”로 이는 2009년~2010년도, 악성종양, 심뇌혈관질환, 신경퇴행성질환, 당뇨병, 정신성질환, 자가면역질환, 저항성병원성 감염, 폐결핵, 바이러스감염성질환 등 10종의 중대한 질환에 초점을 맞춰 화학약물, 현대중약과 바이오신약을 자주적으로 연구 개발할 계획이다. 이와 동시에 종합신약연구개발을 위한 기술플랫폼을 시작했다. 전문신약연구개발 기술플랫폼 등 프로젝트의 2009년~2010년의 연구개발예산은 63억 위엔이다. 농업 분야, 거버넌스 유전자 변형 생물체의 새로운 품종 육성의 총예산은 200억 위엔에 달한다.
최근 세계의 유수 다국적 기업들은 중국을 ‘글로벌 공장’에서 ‘글로벌 연구중심’으로 인식을 전환하면서 신약 연구개발과 관련된 공동연구사업을 추진하고 있다. 이는 중국의 의약시장이 연간 15% 이상 발전하고 있고 의약시장 매출액이 2005년 140억 달러, 2010년 240억 달러에 달할 것으로 전망하며 향후 미국, 일본, 독일, 프랑스 다음 가는 세계 5대 시장으로 발전할 것으로 예상하고 있기 때문이다. 현재 Pfizer, Novo Nordisk, AstraZeneca, Eli Lily, Roche, GSK, Aventis, Novartis, Wyeth 등 다국적 제약기업들의 중국R&D센터 설립 붐으로 중국은 세계 신약개발의 전진기지로 변모를 기대하고 있다.
중국의 권위 있는 관계자에 따르면, 중국은 향후 10년 안에 농업 및 의약 생명공학 기술과 관련 산업분야에 있어 세계 최고의 생물기술 강국이 될 수 있고, 이 과정에서 약 1,000억 위엔의 투자가 필요할 것이라고 전망하였다. 세계 생명공학 강국으로 성장하고자 하는 중국의 원대한 목표는 앞으로 생명공학 분야에 대한 중국 정부의 관심과 투자가 계속 획기적으로 증대될 것을 단적으로 보여준다.
[표 2-4-3-1] 중국 의약공업 매출 현황
|
|
매출액 |
생산판매율 |
||
|
2007년/억 위엔 |
연 증가율/% |
2007년 |
증가% |
|
|
의약공업 |
6182.3 |
24.2 |
94.5% |
-0.1 |
|
화학의약품 |
3088.0 |
24.0 |
94.7% |
0.0 |
|
중약 |
1624.8 |
19.9 |
93.7% |
1.0 |
|
생물 및 생물화학 의약품 |
571.1 |
41.3 |
94.9% |
1.3 |
|
의료기기 |
859.9 |
24.9 |
96.6% |
0.3 |
출처: 2007년 중국의약통계연보
[표 2-4-3-2] 중국 의약공업 이익 현황
|
|
2007년 주요 영업이익/억 위엔 |
연 성장률% |
|
의약공업 |
6157.5 |
24.9 |
|
화학약품 |
3120.8 |
26.5 |
|
중약 |
1582.3 |
18.4 |
|
생물 및 생물 학 의약품 |
399.3 |
26.2 |
|
의료기기 |
854.7 |
25.3 |
출처: 2007년 중국의약통계연보
[표 2-4-3-3] 중국 의약공업 수출 현황
|
수출종류 |
2007년 수출액/억 달러 |
연 증가율% |
|
의약 수출총액 |
106.9 |
24.8 |
|
화학의약품 (화학원료약 및 제약중간체와 서양의약) |
49.7 |
30.5 |
|
중약(중성약과 중약제) |
4.1 |
6.9 |
|
식물약 및 생물 화학 약품 |
7.3 |
18.6 |
|
의료기기(의료기기와 위생자재) |
44.0 |
21.1 |
출처: 2007년 중국의약통계연보
[표 2-4-3-4] 중국 의약공업 이익 현황
|
업종 유형 |
2007년 총이익/억 위엔 |
연 증가율% |
|
의약공업 |
606.3 |
54.2 |
|
화학의약 |
283.1 |
63.6 |
|
중약 |
173.9 |
50.3 |
|
생물 및 생물화학 약품 |
64.4 |
47.7 |
|
의료기기 |
82.7 |
41.6 |
출처: 2007년 중국의약통계연보
[표 2-4-3-5] 중국 주요 식량유지작물 재배 면적(ha)
|
|
2005년 |
2006년 |
2007년 |
2008년 |
전년대비증가(%) |
|
옥수수 |
2,636 |
2,697 |
2,805 |
2,770 |
-1.25 |
|
밀 |
2,279 |
2,296 |
2,298 |
2,300 |
0.09 |
|
벼 |
2,883 |
2,930 |
2,923 |
2,920 |
-0.10 |
|
대두 |
959 |
922 |
802 |
950 |
18.52 |
|
유채 |
728 |
600 |
560 |
640 |
14.29 |
출처: 국가식량유지정보센터, 2008.7
[표 2-4-3-6] 중국 주요 식량유지작물 생산(만 톤)
|
|
2005년 |
2006년 |
2007년 |
2008년 |
전년대비증가(%) |
|
옥수수 |
13,937 |
15,160 |
15,184 |
15,400 |
1.43 |
|
밀 |
9,745 |
10,847 |
10,986 |
11,250 |
2.40 |
|
벼 |
18,059 |
181,720 |
8,549 |
18,570 |
0.11 |
|
대두 |
1,634 |
1,510 |
1,300 |
1,650 |
26.93 |
|
유채 |
1,305 |
1,100 |
1,038 |
1,150 |
10.80 |
출처: 국가식량유지정보센터, 2008.7
[표 2-4-3-7] 중국 과학기술 예산
|
|
2004년 |
2005년 |
2006년 |
2007년 |
2008년 |
|
과학기술 경비 지출액(억 원) |
4004.4 |
4836.2 |
5757.3 |
7098.9 |
8420 |
|
국가재정 과학기술 지급(억 원) |
1095.3 |
1334.9 |
1688.5 |
2113.5 |
2540 |
|
국가재정총지출에 차지한 비중(%) |
3.84 |
3.93 |
4.18 |
4.25 |
3.9 |
|
R&D 예산(억 원) |
1966.3 |
2450.0 |
3003.1 |
3710.2 |
4400 |
|
국내 총생산에 대한 비율 |
1.23 |
1.34 |
1.42 |
1.49 |
1.5 |
2008년 데이터는 예상수치임.
[표 2-4-3-8] 중국 과학기술 인력
|
|
2004년 |
2005년 |
2006년 |
2007년 |
2008년 |
|
전문 기술 인력(만 명) |
2178.3 |
2197.9 |
2229.8 |
2254.5 |
2280 |
|
과학기술활동 종사인력(만 명) |
348.1 |
381.5 |
413.2 |
454.4 |
500 |
|
과학자 엔지니어(만 명) |
225.2 |
256.1 |
279.8 |
312.9 |
340 |
|
R&D인력(만 명 년) |
115.3 |
136.5 |
150.3 |
173.6 |
190 |
|
과학자 엔지니어(만 명 년) |
92.6 |
111.9 |
122.4 |
142.3 |
160 |
2008년 데이터는 예상수치임.
[그림 2-4-3-1] 2007년 863 계획 기술분야에 따른 신설 프로젝트 분포 상황

출처: 중국과기부 과학기술 계획 연차 보고서, 2008
[그림 2-4-3-2] 2007년 863계획 신설 프로젝트 경비 구성 현황

출처: 중국과기부 과학기술부계획 연차보고서, 2008
[그림 2-4-3-3] 생물제약 2007년 성장분석

출처: 국가정보센터
[그림 2-4-3-4] 2007년 중국 의약 공업 자산 분포
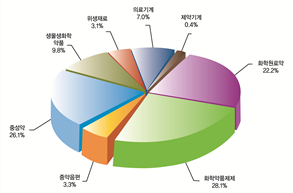
출처: 2007년 중국의약통계년보
[그림 2-4-3-5] 중국내륙생명공학 산업자본 시장투자

출처: 서남증권 연구센터
제3장
국가 생명공학 육성현황


생명공학 육성 정책
1. 생명공학 연구개발 지원정책
가. 개요
정부 차원의 생명공학 육성은 1982년 과학기술부에서 생명공학을 핵심전략기술로 선정하여 특정연구개발사업으로 지원을 시작하면서부터이다. 이후 1983년 「유전공학육성법」(現 「생명공학육성법」)을 제정하여 정부의 생명공학 육성․지원을 위한 법적 기반을 마련하였고, 1985년 동법을 기반으로 한국과학기술연구원(KIST) 부설로 “유전공학센터”(現 “한국생명공학연구원”)를 설립하여 생명공학의 본격적 육성․지원을 시작하였다.
2009년 생명공학 분야의 국제적 경쟁력확보와 initiative 선점을 위하여 기존사업의 전략적인 조정이 이루어졌다. 원천기술개발사업 중 바이오기술개발사업은 나노기술개발사업과 국정과제인 신기술 융합형 성장동력연구와 함께 미래기반기술개발사업으로 개편․통합하여 지원하고 기존의 바이오기술개발사업에 포함되었던 뇌과학원천기술개발사업은 분리하여 운영하고 있다. 또한 21세기프론티어연구개발사업, 바이오신약장기사업을 연구지원프로그램으로 계속해서 추진하고 있다.
[그림 3-1-1-1] 원천기술개발사업 주요 개편사항
출처: 한국연구재단 홈페이지 내용 재가공, 생명공학정책연구센터
기초연구사업은 1989년부터 이공학분야의 기초연구분야 육성을 위해 국가지정연구실사업(NRL), 우수연구센터(SRC, ERC), 국가핵심연구센터(NCRC), 기초의과학연구센터(MRC)를 운영해왔으며, 2009년에는 한국재단(한국연구재단과 한국학술진흥재단 통합)이 설립되면서 크게 2개 그룹(개인 + 집단), 5개 연구사업으로 재편되었다. 개인연구는 일반연구자, 중견연구자, 리더연구자 지원사업으로 구분하여 추진되고 있으며 집단연구는 기초연구실과 선도연구센터의 연구협력센터를 대학 내에 설치하여 연구를 지원하고 있다.
[그림 3-1-1-2] 기초연구사업 개편 현황

출처: 한국연구재단 홈페이지
그리고 2006년에는 급변하는 생명공학기술의 발전과 정책 환경변화에 부응하는 국가 생명공학육성의 새로운 전략을 모색하기 위해 제2차 생명공학육성기본계획(Bio-Vision 2016, 2007~2016)을 수립하여 운영하고 있으며 본 계획의 효율적 추진을 위해 각 부처별로 추진해 온 실적을 점검하고, 대내외적 환경변화를 반영하여 매년 시행계획을 수립하고 있다.
이와 별도로 줄기세포연구 시행계획, 나노기술발전 시행계획, 융합기술 시행계획 등 매년 시행계획을 수립하여 추진하고 있다. 또한 2009년에는 생명연구자원의 활용촉진과 정보관리를 위해 2009년 「생명자원의 확보․관리 및 활용에 관한 법률」을 제정하여 기본계획을 추진 중에 있다.
나. 연구개발 지원 체제
(1) 법적, 제도적 기반
(가) 생명공학육성법
교육과학기술부는 유전공학의 연구기반을 조성하여 유전공학을 보다 효율적으로 육성하고 산업화를 촉진하여 국민경제의 건전한 발전에 기여하기 위하여 1983년 「유전공학육성법」을 제정하였다. 그리고 1995년 생명공학 기술의 발전에 따라 법의 적용범위를 유전공학에서 생명공학으로 확대하는 내용의 제3차 개정을 하고 법률명을 「생명공학육성법」으로 개명하였다.
생명공학육성법은 생명공학 연구의 기반을 조성하여 생명공학을 보다 효율적으로 육성·발전시키고 그 개발기술의 산업화를 촉진하여 국민경제의 건전한 발전에 기여하게 함을 목적으로 하며, 주요내용은 생명공학 육성기본계획 및 연차별 시행계획의 수립, 생명공학종합정책심의회 설치․운영, 5개 부처(교육과학기술부, 농림수산식품부, 지식경제부, 보건복지가족부, 환경부)의 생명공학 육성시책의 강구 등이다.
(나) 뇌연구촉진법
뇌연구촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성․발전시키고 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 기여하기 위하여 ’98년 6월『뇌연구촉진법』을 제정․운영하고 있다.
뇌연구촉진법은 뇌연구 촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성·발전시키고 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 기여함을 목적으로 하며, 주요 내용은 뇌연구촉진기본계획 및 연차별 시행계획의 수립, 뇌연구촉진심의회의 구성․운영, 뇌연구 투자의 확대, 3개 부처의(교육과학기술부, 지식경제부, 보건복지가족부) 뇌연구촉진시책 강구 등이다.
(다) 생명공학종합정책심의회
생명공학육성기본계획을 수립하고, 그 집행 및 조정에 관한 업무를 담당하기 위하여 교육과학기술부장관 소속하에 5개 부처의(농림수산식품부, 지식경제부, 보건복지가족부, 환경부, 국토해양부) 차관 및 민간전문위원으로 구성된 “생명공학종합정책심의회”(위원장: 교육과학기술부장관)를 두어 생명공학에 대한 전반적인 계획수립 및 조정을 하고 있다.
(2) 한국생명공학연구원
교육과학기술부는 「과학기술분야 정부출연연구기관 등의 설립․운영 및 육성에 관한 법률」에 근거하여 1985년 2월 30명의 연구원으로 KIST 부설 유전공학센터를 설립하여 유전공학연구를 본격적으로 지원 육성하기 시작하였다. 이후 1990년 12월 KIST 부설 유전공학연구소로 명칭을 변경하였고, 유전공학육성법이 생명공학육성법으로 개정되어 1995년 3월 KIST 부설 생명공학연구소로 명칭을 변경하고, 1999년 5월 기초기술연구회 산하 생명공학연구소로 독립하였다. 2001년 1월 기초기술연구회 산하 생명공학전문연구원으로 승격하였고 현재는 정부출연연구소로 교육과학기술부에 소속되어 있다. 주요기능으로는 바이오융합, 바이오신약, 바이오소재, 바이오정보분야의 첨단 생명공학기술분야 연구개발 및 원천기술 개발․보급 그리고 공공인프라 구축지원, 국가정책의 Think-tank 및 전문인력 양성이다. 2008년 말 768명(정규직원 292명, 박사 297명)의 연구원 및 직원이 종사하며 총예산은 약 1,130억 원이다.
(3) 생명공학육성기본계획 및 시행계획 수립
(가) 생명공학육성기본계획
교육과학기술부는 「생명공학육성법」 제4조에 근거하여 생명공학 분야의 효율적인 연구개발 촉진을 위하여 ’94년부터 범국가적인 “생명공학육성기본계획(Biotech 2000, 1994~2006)”을 수립하여 시행하였고, 이어서 제2차 생명공학육성기본계획(Bio-Vision2016)을 수립하여 시행하고 있다.
동 계획은 교육과학기술부 주관으로 농림수산식품부․지식경제부․보건복지가족부․환경부․국토해양부 등 5개 부처가 공동 추진하고 있다.
(나) 생명공학육성 연도별 시행계획수립
교육과학기술부는 『생명공학육성법』 제5조에 근거하여 관계부처와 합동으로 생명공학육성기본계획에 따른 연도별 “생명공학육성 연도별 시행계획”을 매년 수립하여 시행하고 있다. 2009년도 시행계획의 주요내용은 교과부 등 6개 부처에서 2008년 실적 대비하여 총 약 9,763억 원을 투입하여 생명과학, 보건의료, 농축산식품, 산업공정/환경해양, 바이오융합의 연구개발과 공공 R&D 인프라 구축을 위한 출연기관의 예산 확대 등의 시설 및 기반구축사업, 인력양성을 지원하며 부처별 연구개발 투자실적 및 계획은 (표 3-1-1-1)과 같다.
[표 3-1-1-1] 부처별 연구개발 투자실적 및 계획
|
구 분 |
'09년 투자계획 |
‘08년 실적 |
증감율 (%) |
|||
|
연구개발 |
시설 및 기반구축 |
인력양성 |
계 |
|||
|
교육과학기술부 |
379,868 |
11,845 |
31,335 |
423,048 |
358,888 |
17.9 |
|
농림수산식품부 |
95,668 |
800 |
500 |
96,968 |
78,620 |
18.9 |
|
지 식 경 제 부 |
78,844 |
61,245 |
2,780 |
142,869 |
133,804 |
6.8 |
|
보건복지가족부 |
225,064 |
102,000 |
|
327,064 |
237,079 |
37.9 |
|
환 경 부 |
27,371 |
|
|
27,371 |
18,390 |
32.8 |
|
국 토 해 양 부 |
16,119 |
24,580 |
|
40,699 |
44,921 |
△9.4 |
|
출 연 기 관 |
92,383 |
12,998 |
|
105,381 |
104,638 |
0.7 |
|
총 계 |
915,317 |
213,468 |
34,615 |
1,163,400 |
976,340 |
19.2 |
출처: 2009년 생명공학육성 시행계획, 2009
다. 주요 연구개발 프로그램
(1) 기초과학육성사업
대학 등의 기초과학분야 연구에 대한 지원사업으로 리더연구자지원사업, 중견연구자지원사업, 선도연구센터육성사업이 있으며, 2008년 생명공학분야에는 약 1,145억 원을 지원하고 있다.
(가) 리더연구자지원사업
세계 수준의 연구리더 육성을 위하여 차세대 연구자를 발굴하여 글로벌 리더로 집중 육성하고, 검증된 세계수준의 연구자가 해당분야의 연구거점으로 성장토록 지원하는 사업이다. 창의적연구와 국가과학자 분야로 지원되며 창의적연구(1997년부터 시행)는 과제당 연간 최대 5~8억 원의 연구비를 9년간, 국가과학자(1999년부터 시행)는 과제당 연간 최대 15억 원의 연구비를 6년간 지원하는 사업으로 2008년도 생명공학분야에는 약 113억 원을 지원하였다.
(나) 중견연구자지원사업
핵심연구와 도약연구의 두 가지 지원분야로 나누어지며, 핵심연구는 기초연구의 전주기적 지원체재구축을 위해 일정 수준의 연구 역량을 갖춘 중견연구자를 중심으로 개인 및 소규모(2~3인) 협동연구를 지원하는 사업이며, 도약연구는 중견연구자의 연구역량 강화를 위해 잠재적 가능성이 높은 영역을 중심으로 상향식 과제와 하향식 과제로 구분하여 지원하는 사업이다. ’86년부터 시행하여 핵심연구는 매년 10~15억 원씩 3년간, 도약연구는 매년 25~40억 원씩 5년간 지원하는 사업이다. 2008년도 생명공학 분야에는 약 561억 원을 지원하였다.
(다)선도연구센터육성사업
이공학분야(SRC/ERC), 기초의과학분야(MRC) 및 학제 간 융합분야(NCRC)의 세 분야로 나누어지며, 이공학분야는 국내대학에 산재되어있는 우수한 연구인력을 특정분야별로 조직․체계화하여 집중 지원함으로써 세계적 수준의 선도과학자 군으로 육성하고, 기초의과학분야는 의과․치과․한의과대학의 기초의학교실과 약학대학을 중심으로 연구인력과 자원을 조직․체계화하여 기초의약학 부문 거점연구조직을 육성하며, 학제간 융합분야는 국가차원의 전략적 육성이 필요한 미래지향적 과학기술분야(중․대분야간 융합과학기술)의 전략적 공동연구 수행을 통해 세계수준의 지식 및 경쟁력을 창출하는 것을 최종 목표로 하고 있다. ’90년부터 시작하여 이공학분야는 센터당 연간 10억 원 내외에서 최장 7년, 기초의과학분야는 최대 18억 원 내외(단계별 차등)에서 최장 9년, 학제간 융합분야는 센터당 연간 20억 원 내외에서 최장 7년까지 지원하는 사업이다. 2008년 생명공학분야에는 약 470억 원을 지원하고 있다.
(2) 미래기반기술개발사업
바이오기술을 통한 미래 핵심 유망분야에 대한 전략적 지원 사업으로 총 10개 사업을 지원하고 있다. 신약타겟디스커버리, 바이오소재연구, 뇌연구, 노화연구, 오믹스연구, 바이오재생연구사업, 바이오인포메틱스, 바이오인터페이스사업, 질환별글로벌신약후보물질 발굴사업을 추진하고 있으며 2008년에 약 600억 원을 지원하고 있다.
(3) 21세기 프론티어연구개발사업
미래원천기술, 공공원천기술 중 강점분야를 전략적으로 선택하여 세계 초일류기술을 확보하고 고부가가치 신산업 창출 기반 마련을 위한 장기 대형 연구개발 사업으로 10년간 매년 사업단별로 약 80~100억 원을 지원하고 있다. 현재 생명공학 분야 사업은 인간유전체기능연구, 자생식물이용기술개발, 작물유전체기능연구, 생체기능조절물질개발, 미생물유전체활용기술, 세포응용연구, 프로테오믹스이용기술개발, 뇌기능활용 및 뇌질환치료기술개발 등 8개 사업이 있으며 2008년에 700억 원을 지원하고 있다.
(4) 차세대성장동력사업(바이오신약․장기사업)
소득 2만 불의 선진경제로 도약하기 위해서 우리에게 강점이 있고 부가가치가 큰 바이오신약․장기 분야의 핵심제품을 개발하는 사업으로 핵심기술의 특허출원 및 제품화가 가능한 분야 위주로 최종목표와 사업범위를 구체화하여 추진하며, 장기복제이식기술개발, 단백질칩 기술개발, 약물전달시스템기술개발, 면역기능제어기술개발 등 4개 분야의 핵심제품을 개발하며 2008년에 약 120억 원을 지원하고 있다.
라. 추진방향 및 발전과제
생명공학은 세계적 관심사인 ‘저탄소 녹색성장’을 선도할 핵심 전략기술이자 기후변화, 노령화 등 글로벌 이슈 대응 및 미래 성장동력 확보를 견인할 분야로 새롭게 각광 받고 있다.
국가 생명공학 분야의 주무부처인 교육과학기술부에서는 생명공학분야의 미래유망 핵심원천기술의 확보 및 선진화 기반을 확충하고자 생명공학 분야의 국제적 경쟁력 확보와 initiative의 선점을 위한 과감하고 전략적인 생명공학 연구개발에 적극적인 투자를 할 계획이다.
또한 주요 9개 질환중심의 글로벌 신약후보물질 개발지원을 통하여 국내 제약기업의 경쟁력 강화 및 혁신적인 신약개발에 역점을 두는 한편 의사-이공계 과학기술자간의 협력연구 활성화를 통한 생명공학분야의 다학제간 창의적인 융합연구의 역량 강화를 적극 추진 할 계획이다.
신약개발에 있어서도 후보물질, 전임상, 임상까지 전 주기적인 분야에서 관련 부처와 효율적인 연계를 통하여 시너지 효과를 창출하기 위해 노력할 예정이다.
한편, 향후 바이오경제의 씨앗이자 미래 무궁한 신시장의 잠재력을 보유하고 있는 생명연구자원의 효율적인 확보․관리 및 활용을 촉진하기 위한 「생명연구자원 확보․관리 및 활용에 관한 법률」이 통과됨에 따라 생명공학 연구개발의 기초소재인 생명자원이 체계적으로 활용될 수 있게 되었기 때문에 국가 생명공학연구가 한층 더 활발해질 것으로 기대된다.
2. 생명공학산업 육성정책
가. 국내 생명공학산업의 가능성과 한계
국내 생명공학산업(바이오산업: Biotechnology Industry)은 1994년 생명공학육성법이 제정된 이래 집중적인 투자를 받았다. 아직은 미국, 일본, 유럽 등 선진국에 비해 시장형성이 미흡하고 글로벌 경쟁력도 취약한 것이 사실이지만, 짧은 역사에 비해 높은 신약개발 성과와 역량을 보유하고 있다. 현재 한국의 생명공학 기술은 선진국 대비 60나. 생명공학산업 육성을 위한 지식경제부의 주요 정책
지식경제부는 산업계가 글로벌 경쟁력을 갖출 때까지 산업화 지원에 중점을 둔다는 기본 정책방향을 가지고 있다. 기술변화와 산업성장 추세를 감안하여 전략적 투자방향을 설정할 것이며, 부처 협조체제 강화와 산업화 촉진을 위한 비즈니스 환경 조성에 주력할 계획이다.
이를 위해 국가 R&D 투자 효율성 제고, 바이오산업 인프라의 활용도 제고, 바이오 스타기업을 육성해 글로벌 경쟁력 제고, 녹색성장을 위한 바이오 화학산업 육성 본격화 등의 정책을 추진하고 있다.
(1) 국가 R&D 투자 효율성 제고
지식경제부는 과거 중기거점기술개발사업, 성장동력기술개발사업, 차세대신기술개발사업, 전략기술개발사업 등으로 분산되어 있던 R&D 사업구조를 2008년부터 산업원천기술개발사업으로 통합하여 일원화 하였다. 이에 생명공학산업 R&D도 바이오의료기기 산업원천기술개발사업으로 일원화 하여 운영하고 있다. 기존의 R&D사업이 정부가 선정한 바이오분야 기술군에 대한 Top-down방식으로 이루어진 반면, 개편된 산업원천기술개발사업에서는 정부의 산업발전전략, 특허연계형 기술, 기술로드맵 등에 기반한 Top-down방식과 함께 기술수요조사에 기반한 Bottom-up방식을 동시에 고려하여 과제를 기획하는 것이 가장 큰 특징이다. 이와 같이 지식경제부는 현장 수요를 고려한 기술 개발을 전략적으로 추진하여 산업화 성공사례를 창출해 나갈 계획이다. 중점 지원 분야는 의약바이오(Global 신개념 치료제), 산업바이오(C-Zero 바이오소재), 융합바이오(Smart 바이오진단․분석), 그린바이오(맞춤 바이오매스) 등 4개 분야이다.
신약개발 분야 R&D 투자는 최소한 후보물질 도출 단계부터 상업화 목표와 연계되도록 전 주기적인 범정부 통합지원 시스템을 구축할 필요가 있다. 이에 정부는 관계부처 간 협의체 구성․운영을 통해 범부처 공동기획 프로그램을 추진할 계획이다. 또한 연구과제에 대한 시장성 검증과 상업적 투자활성화 유도를 위해 창투사, 제약사 등으로 구성된 가칭 ‘바이오 투자기관 협의회’가 각 연구단계별 과제선정․평가에 참여하도록 할 계획이다.
(2) 바이오산업 인프라의 활용도 제고
(가) 지역바이오 활성화 기반 구축
자원, 인력, 기술 등 지역특성을 바탕으로 기 구축된 지역바이오센터를 특성화 하여 이를 통해 창업 보육과 지역 고용 창출(연평균 10개 기업, 50명 목표)을 활성화 하고 ‘1사+1상품’ 성공사례를 발굴해 확산시킬 계획이다. 또한 이와 동시에 충청권에 의약바이오 광역경제권 선도사업을 추진하여 의약 유효물질․후보물질 개발 및 효능검증 지원을 위한 플랫폼 구축사업과 신약 및 의료소재 실용화 지원 사업을 추진할 예정이다.
|
지역 |
성격 |
품목 |
종료 |
지역 |
성격 |
품목 |
종료 |
||
|
강원 |
춘천 |
BVC |
의약 |
'02 |
전남 |
화순 |
지역센터 |
백신 |
'08 |
|
지역센터 |
바이오 |
'07 |
장성/곡성 |
지역센터 |
생물 |
'08 |
|||
|
강릉 |
지역센터 |
해양 |
'07 |
경북 |
상주 |
BVC |
식품 |
'05 |
|
|
충북 |
영동 |
BVC |
식품 |
'05 |
울진 |
지역센터 |
해양 |
'07 |
|
|
오창 |
지역센터 |
보건의료 |
'07 |
안동 |
지역센터 |
건강산업 |
'07 |
||
|
제천 |
지역센터 |
전통의약 |
'07 |
대구 |
1 |
지역센터 |
식품 |
'08 |
|
|
충남 |
논산 |
지역센터 |
동물자원 |
'07 |
2 |
지역센터 |
한방 |
'08 |
|
|
대전 |
1 |
BVC |
의약 |
'03 |
경남 |
진주 |
BVC |
화학소재 |
'03 |
|
2 |
지역센터 |
바이오 |
'07 |
진주 |
지역센터 |
화학소재 |
'08 |
||
|
전북 |
전주 |
BVC |
식품 |
'03 |
부산 |
1 |
BVC |
해양 |
'03 |
|
전주 |
지역센터 |
식품 |
'07 |
2 |
지역센터 |
해양 |
'08 |
||
|
전남 |
나주 |
BVC |
생물 |
'03 |
제주 |
1 |
BVC |
식품 |
'05 |
|
나주 |
지역센터 |
식품 |
'07 |
2 |
지역센터 |
향장 |
'07 |
||
|
화순 |
지역센터 |
농업 |
'07 |
경기 |
판교 |
BVC |
의약 |
'10 |
|
[표 3-1-2-1] 28개 지역 바이오센터 구축 현황
(나) 코리아 바이오허브(Korea Bio-Hub) 구축 사업 개편
기존에 지역바이오센터의 네트워킹 역할 위주였던 코리아 바이오허브 구축 사업을 개편․강화하여 기존 시설의 활용도를 높이는 동시에 글로벌 네트워크 구축을 강화할 계획이다. 이에 따라 아시아-태평양 통합협의체 창립해 아시아 태평양 국가 간 단일 시장 구축과 공동 의제 발굴 등을 추진하는 방안이 기획 중에 있다. 또한 국내 바이오클러스터와 해외 클러스터 간 파트너링을 강화하고 기업 해외마케팅 지원을 확대할 계획이다.
(다) 인프라 자립기반 구축
일부 상업적 활용가치가 큰 인프라들의 경우 공공성과 운영 효율성을 강화하기 위하여 전문경영기법 도입 등 자립기반을 구축할 예정이다. 이에 따라 바이오의약품 위탁생산시설(CMO)인 생물산업기술실용화센터의 민간위탁경영이 추진 중이며, 전임상 시험지원기능(GLP)을 효율화하기 위하여 안전성평가연구소(KIT)를 민영화 하는 방안이 검토 중이다.
(라) 바이오아웃소싱서비스(CRO, CMO) 기반 구축
향후 10년 내 주요 바이오의약품의 특허만료로 국내 임상시험건수가 급증할 것으로 예상되고 있다. 따라서 선진국 수준의 임상시험 인프라․기술을 보유한 바이오아웃소싱서비스 기반 마련이 절실한 상황이다. 또한 한-미 FTA, 한-EU FTA가 체결될 경우 예전처럼 바이오기술의 해외 이전만으로는 미국과 EU시장 진출이 사실상 불가능하다. 결국 위탁연구, 위탁생산을 전문적으로 수행하는 서비스기관들의 활성화를 통해 연구개발의 효율성을 높이고, 나아가 거대시장에 직접 마케팅 할 수 있는 기반을 확보하기 위한 전략이 필요하다. 이를 위하여 CRO, CMO 등 바이오아웃소싱서비스 시설을 구축하고 관련 전문 인력을 적극 양성할 계획이다.
(3) 바이오 스타기업 육성을 통한 글로벌 경쟁력 제고
현재 국내 기업들은 글로벌 제품개발․판매경험이 거의 전무하여 미국, 유럽 등 주요 해외시장에서의 경쟁력이 취약한 상황이다. 이에 따라 지식경제부는 치료제․진단시스템 등 단기 상용화가 가능한 사업 분야에 대해 선도적 집중투자로 글로벌 블록버스터 제품을 생산하는 바이오 스타기업 육성에 주력하고 있다. 우선 바이오 스타 제품 개발과 글로벌 성공사례 창출을 위하여 2005년부터 추진 중에 있는 ‘바이오스타 프로젝트’를 지속적으로 추진할 것이다. 또한 과거 신약개발 능력 및 자본력 등의 부족으로 제품개발 중간단계에서 License-out하던 전략을 재검토하고 해외 임상시험 진출, License-in 등 공격적 R&D에 정부지원을 강화할 계획이다.
이를 위해 올해 1,000억 원 규모로 조성하여 출범한 바이오메디컬펀드와 같은 시장 지향적 지원수단을 확대하여 민간차원의 투자확대를 유도할 예정이다. 또한 해외기업과의 조인트벤처 설립 및 M&A 추진 등 전략적 해외진출을 위해 바이오메디컬펀드 운용사(Burill & Company) 등을 적극 활용할 계획이다. 그리고 바이오코리아 행사를 확대 개편하고, 해외 유명전시회(미국 BIO 등)의 참가 지원, 국내외 투자 설명회 개최 지원 등을 통하여 글로벌 네트워킹을 강화할 예정이다.
(4) 녹색성장을 위한 바이오 화학산업(산업바이오) 육성 본격화
우리나라는 세계 10위의 온실가스 배출국으로 교토의정서 효력이 만료되는 2013년 이후 의무감축 대상국이 될 것이 확실하다. 그러나 현재 석유화학산업은 기술적 포화상태로 그 자체로는 온실가스의 추가 감축이 어려운 상황이다. 바이오 화학산업은 석유화학산업을 대체할 수 있는 친환경 녹색산업으로 부각되고 있으나, 그동안 국가적 관심과 투자가 부족했던 것이 사실이다. 이에 따라 정부는 온실가스 배출 감축뿐만 아니라 석유의존도 감소, 에너지 절약 등이 가능한 바이오 화학산업을 본격 육성할 계획이다. 이를 위해 바이오플라스틱 등 바이오화학제품 개발 관련 R&D 지원을 확대함과 동시에 인증제 도입 등도 검토할 계획이다. 또한 관련 기술의 산학연 공동 R&D 및 기술이전, 실증화 기반(Pilot plant) 구축 등을 위하여 바이오화학실용화센터 건립을 추진하고 있다. 석유화학 집적지인 울산 지역에 건립되는 동 센터는 2012년 완공 예정이며, 2013년부터는 원천기술의 실용화 연구가 가능할 전망이다.
다. 생명공학육성과 지식경제부
생명공학산업(바이오산업)은 고령화, 기후변화, 삶의 질 향상이라는 시대적 메가트렌드에 부응하고 IT혁명의 뒤를 이을 고부가가치 미래 신산업이다. 이에 정부에서도 바이오제약․의료기기 분야를 17대 신성장동력으로 선정한 바 있다. 지식경제부는 2015년 생산 60조 원, 수출 250억 달러, 바이오 7대강국 달성 등을 목표로 생명공학기술의 산업화에 초점을 맞추고 관련 산업 육성을 위해 정책적 지원을 다할 계획이다.
3. 생명공학 기초과학진흥 및 인력양성정책
가. 생명공학분야 기초과학진흥
(1) 필요성
최근 유전체학/단백체학 및 세포체학/대사체학 연구 등에서 급속한 진전을 보이고 있는 생명공학은 우리의 미래 생활에 큰 변화를 예고하고 있다. 기초과학을 응용하여 개인별 유전적 특성을 고려한 의약품 개발 및 진단․세포/유전자 치료법 개발 기술, 유전체 대량 분석과 정보를 활용한 난치병 예방, 진단 및 치료법 개발 기술, 세포 치료제 개발 기술로 인해 많은 질병이 퇴치되고 수명이 연장되고 있다. 이러한 생명공학의 성과는 생물학, 생화학, 생리학, 생물물리학 등 관련 기초과학의 다양한 실험 기술의 성과에서 기인한 것으로 관련분야의 기초과학 발전이 있었기에 가능한 것이었다. 아울러 뇌기능 조절 메커니즘 규명, 뇌기능 향진 기술 개발, 뇌질환 관련 치료제 및 치료기술 개발의 발전에 힘입어 고령화 사회에 따른 실버산업 활성화 등 기술적, 사회적 경제적 파급효과가 클 것으로 기대되며, 융합과학의 발전 추세에 따라 21세기 바이오경제를 주도하여 미래의 국가 경제를 선도할 분야 중 하나이다.
이에 따라 건강한 “생명 중심 사회”와 “풍요로운 바이오 경제” 구현을 비전으로 과학기술 논문 창출과 특허 기술 경쟁력을 2005년 각각 13위와 14위에서 2016년에는 세계 7위라는 목표를 세웠으며, 이를 위해 1) 국가 생명공학 육성 추진계획 혁신, 2) 연구개발 선진화 기반 확충, 3) 바이오 산업의 발전 가속화 및 글로벌화, 4) 법/제도 정비 및 국민 수용성 제고 등의 4대 전략을 수립하였다.
또한, 현 정부가 추진하고 있는 국가연구개발 정책(신성장동력, 녹색기술) 중 생명공학과 관련된 주제는 ‘신성장동력 비전 및 발전전략’ 17개 주제 중 바이오제약(자원), 의료기기, 탄소저감에너지, 고부가 식품사업이 있고, ‘녹색기술 연구개발 종합대책’ 27개 중점육성기술 중에는 바이오에너지 생산요소기술 및 시스템 기술, 친환경 식물성장 촉진기술, 유해성물질 모니터링 및 환경정화 기술 등이 포함되어 있다.
(2) 정부의 기초과학 진흥 추진 과정
2002년 OECD Frascati Manual에 기초연구의 개념이 기술된 바 기초연구란 관찰 가능한 현상과 사실들의 기저에 놓여 있는 근본 원리에 대한 새로운 지식 획득을 목적으로 수행되는 실험적 혹은 이론적 작업으로 순수 기초연구는 자연현상의 원리 규명을 통해 새로운 창조적 지식을 획득하는 연구로, 목적지향적 기초연구는 미래의 광범위한 응용을 위하여 원천지식의 토대를 산출하는 연구라 정의하였다. 이에 비해 응용연구는 이미 알려진 지식을 심화․발전시켜 특정 문제를 해결하거나 특정 상황에 적용하여 활용하는 연구로 연구가 성공적으로 이루어져 기대하는 결과(물)를 얻을 경우, 그 결과(물)가 적용될 분야가 확실한 연구라 하였으며, 개발연구란 실용적이고 유통 가능한 (시)제품, 물질, 장치 또는 제품의 공정 과정을 개발하기 위한 연구라 정의하였다. 2004년 당시 과학기술부에 “과학기술혁신본부” 설치 및 부총리급 격상에 따라, 정부 간 합의를 거쳐 기존 과학기술부에서 추진하던 기초연구 사업을 3개 유형으로 나누어 순수기초 연구와 기초과학기반구축 사업은 당시 교육인적자원부에서 주관하고 목적 기초연구는 과학기술부에서, 응용 연구 부분에 대하여는 산업자원부와 정보통신부에서 주관하도록 조정하였다. 이와 더불어 교육인적자원부는 대학연구의 제도 및 기반을 구축하고 대학의 우수 연구 인력양성 지원 사업을 하도록 학술 진흥 및 학자금대출 신용보증 등에 관한 법률 시행령 제5조에 명시하였다. 정부는 기초과학연구의 진흥을 위한 여건 조성을 위하여 기초과학연구에 관하여 1) 대학교수, 박사후 연구원 등 관계 전문가의 연수 및 연구비 지원, 2) 석사 및 박사과정 학생의 연구장학금 지원, 3) 연구교수(연구조교포함) 제도, 교수의 연구 휴가제도, 객원교수제도 및 객원연구원제도의 활용, 4) 대학의 연구시설 및 기자재 지원, 5) 대학부설연구소 및 우수 연구 집단 형성 지원, 6) 대학, 국공립연구소, 정부출연연구소 및 기업부설연구소와의 공동연구 추진 등 산업계, 학계 및 연구소간 교류 촉진, 7) 기업의 대학 기초과학 연구 활동 지원 추진 8) 기타 연구 환경 조성 및 연구기반 구축에 필요한 사항 등을 강구하도록 기초과학연구진흥법 제9조에 규정하고 있다. 2008년 2월 교육인적자원부와 과학기술부의 통합으로 교육과학기술부가 출범하였다. 두 기관의 통합은 기초과학에 관한 여러 정책이 일관성 있게 정리될 수 있는 기회를 제공하였다. 실제로 2009년 한국연구재단의 출범은 두 기관에서 각각 실시되었던 기초과학에 관한 연구비와 정책을 효율적으로 통합하여 관리할 수 있게 되었다.
(3) 교육과학기술부의 기초과학연구지원 현황
교육과학기술부에서는 2009년 한국과학재단, 한국학술진흥재단, 그리고 국제과학기술협력재단을 합병하여 국내 최대 규모의 연구재단인 한국연구재단을 발족하고 우리나라 연구력의 근본이라 할 수 있는 기초연구를 중점 지원하고 있다. 이에 따라 개인 또는 소규모 공동연구 중심의 기초연구를 지원하여 국가연구역량 토대를 구축하고 국제적 수준의 연구 결과를 도출하여 국가 사회 발전과 학문의 발전을 도모할 수 있도록 지원하고 있다. 한국연구재단은 기존 세 재단의 다양한 연구 지원사업들을 기초연구지원사업으로 통폐합하여 효율적으로 연구자들을 위한 단계적 연구비지원을 수행하고 있다(표 3-1-3-1).
특히 한국연구재단은 기초연구본부에 생명과학단과 의약학단, 그리고 일부의 융합과학단에서 대학과 국책연구기관의 생명과학분야를 지원하고 있으며, 국책연구본부의 생명공학단은 대단위 국책사업을 지원하고 있다. 공학단, 생명과학단 및 일부 복합학단에서 생명공학 분야 연구과제를 지원하고 있다. 기초연구본부의 생명과학단에서는 기초생명과학분야 생화학 및 분자생물학, 유전학 및 유전체학, 암생물학, 미생물학, 식물학, 생태 및 환경학 등의 기초생명과학분야와 농학, 임학, 수산학, 수의학 등의 농수산임학분야를 지원하고 있으며, 의약학단에서는 기초의학, 간호학, 보건학, 약학, 간호학, 한의학 등을 지원하고 있다.
[표 3-1-3-1] 2009~2010년도 기초연구지원사업내용 (단위 백만 원)
|
사업명 |
'09 예산 |
'10 예산 |
'10 신규예산 |
'10 과제수 |
비고 |
||
|
계속 |
신규 |
||||||
|
합계 |
640,650 |
813,060 |
321,952 |
4,414 |
4,576 |
|
|
|
개인연구 지원사업 |
500,000 |
650,000 |
293,073 |
4,065 |
4,287 |
|
|
|
일반연구자 |
소계 |
254,776 |
355,000 |
200,665 |
2,817 |
3,783 |
|
|
신진연구자 |
40,000 |
62,100 |
34,740 |
584 |
549 |
|
|
|
- 신진연구자 |
40,000 |
62,100 |
24,740 |
584 |
449 |
|
|
|
- 장비지원 |
- |
- |
10,000 |
- |
100 |
신규 |
|
|
기본연구 |
188,776 |
258,270 |
152,380 |
1,742 |
2,989 |
|
|
|
- 기본 I 유형 |
188,776 |
258,270 |
113,380 |
1,742 |
1,889 |
|
|
|
- 기본 II 유형 |
- |
- |
35,000 |
- |
1,000 |
신규 |
|
|
- 모험연구 |
- |
- |
4,000 |
- |
100 |
신규 |
|
|
여성과학자 |
12,000 |
18,130 |
7,776 |
240 |
141 |
|
|
|
지역과학자 |
14,000 |
16,500 |
5,769 |
251 |
104 |
|
|
|
중견연구자 |
소계 |
210,000 |
245,000 |
77,658 |
1,200 |
486 |
|
|
핵심연구 |
115,000 |
125,000 |
41,652 |
838 |
346 |
|
|
|
- 개인 |
49,200 |
65,800 |
21,652 |
490 |
244 |
|
|
|
- 공동 |
65,800 |
59,200 |
20,400 |
348 |
102 |
|
|
|
도약연구 |
95,000 |
120,000 |
36,006 |
362 |
140 |
|
|
|
- 도전 |
87,000 |
96,000 |
20,006 |
339 |
97 |
|
|
|
- 전략 |
8,000 |
24,000 |
16,000 |
23 |
43 |
|
|
|
리더연구자 |
소계 |
35,224 |
50,000 |
14,750 |
48 |
18 |
|
|
창의연구 |
30,724 |
39,000 |
8,250 |
45 |
11 |
|
|
|
국가과학자 |
4,500 |
11,000 |
6,500 |
3 |
7 |
|
|
|
집단연구지원사업 |
94,434 |
115,200 |
15,000 |
102 |
20 |
|
|
|
선도센터 |
소계 |
94,434 |
105,200 |
10,000 |
92 |
10 |
|
|
S/ERC |
55,750 |
64,300 |
7,500 |
55 |
6 |
|
|
|
MRC |
19,200 |
26,900 |
500 |
31 |
1 |
|
|
|
NCRC |
15,000 |
14,000 |
2,000 |
6 |
1 |
|
|
|
기초연구실 |
BRL |
- |
10,000 |
5,000 |
10 |
10 |
|
출처: 교육과학기술부, 2010년도 이공분야 기초연구사업 시행계획(안)
(가) 기반구축 사업 현황
한국연구재단에서는 대학연구소 전문화 및 특성화를 위해 대학부설연구소를 지원하는 중점연구소지원사업과 연구를 위한 소재은행구축 및 운영을 위한 연구소재은행 사업, 그리고 신진 연구인력을 지원하기 위한 학문후속세대 사업을 지원하고 있으며, 신규 사업으로서 2010년부터 기초연구 실험데이터 글로벌구축사업을 시행할 예정이다(표 3-1-3-2).
[표 3-1-3-2] 2009~2010년도 기반구축사업 내용(단위 백만 원)
|
사업명 |
'09 예산 |
'10 예산 |
'10 신규예산 |
'10 과제수 |
비고 |
||
|
계속 |
신규 |
||||||
|
기초연구기반구축사업 |
46,216 |
47,860 |
13,879 |
247 |
269 |
|
|
|
연구소재지원 |
4,200 |
5,000 |
1,417 |
26 |
13 |
|
|
|
전문연구정보활용 |
2,800 |
2,800 |
0 |
16 |
0 |
|
|
|
기초연구 역량강화 |
소계 |
39,216 |
39,060 |
11,462 |
205 |
255 |
|
|
학문후속세대 |
16,616 |
13,060 |
7,462 |
170 |
250 |
|
|
|
중점연구소 |
22,600 |
26,000 |
4,000 |
35 |
5 |
|
|
|
기초연구 실험데이터 글로벌구축 (신규) |
- |
1,000 |
1,000 |
- |
1 |
신규 |
|
출처: 교육과학기술부, 2010년도 이공분야 기초연구사업 시행계획(안)
(나) 생명과학분야 사업 지원 현황
정부에서 이공분야에 지원하는 총 R&D 투자액 중 생명과학분야의 범주에 속하는 생명과학, 농림수산, 보건의료 부문에 지원되는 총 투자액수는 1조 6,084억 원으로서 전체 R&D 투자액의 17.5%를 차지하고 있다(표 3-1-3-3).
[표 3-1-3-3] 과학기술표준분류별 투자 추이(2008)
|
분야 |
비율 (%) |
지원 액수 (단위 억원) |
|
생명과학 |
5.6 |
5,482 |
|
농림수산 |
6.4 |
6,266 |
|
보건의료 |
5.5 |
5,458 |
|
수학 |
0.3 |
314 |
|
물리학 |
1.8 |
1,762 |
|
화학 |
1.8 |
1,745 |
|
재료 |
3.6 |
3,541 |
|
화학공정 |
1.7 |
1,693 |
|
지구과학 |
0.9 |
839 |
|
전기전자 |
7.8 |
7,640 |
|
정보 |
6.1 |
5,985 |
|
통신 |
4.1 |
3,988 |
|
기계 |
7.1 |
7,004 |
|
환경 |
3.1 |
3,016 |
|
에너지자원 |
5.6 |
5,555 |
|
원자력 |
4.3 |
4,194 |
|
건설교통 |
5.0 |
4,939 |
|
우주항공천문해양 |
9.7 |
9,578 |
|
기술혁신과학기술정책 |
3.6 |
3,499 |
출처: 2009년도 국가연구개발사업 조사·분석 보고서
이 중 한국연구재단을 통하여 생명과학 분야로 지원된 연구비 현황을 사업별 중분야별로 살펴보면 다음과 같다.
일반연구자지원사업은 기본연구지원사업, 지역과학자지원사업, 여성과학자지원사업, 그리고 신진연구자지원사업으로 구성되어 있다. 2009년에 일반연구자 지원사업으로 생명과학분야에 지원된 연구비 중 생명과학의 중분야별 지원 비율은 (표 3-1-3-4)와 같다.
[표 3-1-3-4] 2009년도 일반연구자지원사업 중 생명과학분야 중분야별 선정현황
|
중분야명 |
신청과제수 |
선정과제수 |
선정율(%) |
|
생태 및 진화 |
81 |
30 |
37 |
|
생화학 및 분자생물학 |
321 |
121 |
37.6 |
|
신경과학 |
105 |
35 |
33.3 |
|
약학 |
21 |
10 |
47.6 |
|
유전학 |
52 |
23 |
44.2 |
|
해부 및 세포생물학 |
180 |
67 |
37.2 |
|
미생물학 |
114 |
44 |
38.5 |
|
노화 및 종양학 |
129 |
47 |
36.4 |
|
식물학 |
79 |
27 |
34.1 |
|
수산학 |
42 |
14 |
33.3 |
|
식품학 |
214 |
76 |
35.5 |
|
임산공학 |
17 |
7 |
41.1 |
|
축산 및 수의 |
72 |
26 |
36.1 |
|
임상의과학 |
15 |
8 |
53.3 |
|
동물학 |
45 |
17 |
37.7 |
|
생물공학 |
67 |
24 |
35.5 |
|
면역학 |
27 |
8 |
29.6 |
|
농림학 |
48 |
17 |
35.4 |
|
총계 |
1,629 |
561 |
34.4 |
[표 3-1-3-5] 2009년도 핵심연구자지원사업 중 생명과학분야 중분야별 선정현황
|
중분야명 |
신청과제수 |
선정과제수 |
선정율(%) |
|
농학 |
10 |
2 |
20 |
|
동물학 |
20 |
2 |
10 |
|
미생물학 |
47 |
6 |
12.7 |
|
생물공학 |
16 |
2 |
12.5 |
|
생태 및 진화 |
12 |
1 |
8.3 |
|
생화학 및 분자생물학 |
106 |
12 |
11.3 |
|
세포생물학 |
58 |
7 |
12 |
|
수산학 |
11 |
1 |
9 |
|
식물학 |
16 |
2 |
12.5 |
|
식품학 |
30 |
3 |
10 |
|
유전학 |
13 |
2 |
15.3 |
|
임산공학 |
4 |
1 |
25 |
|
소계 |
343 |
41 |
11.9 |
[표 3-1-3-6] 2009년도 도약연구자지원사업 중 생명과학분야 중분야별 선정현황
|
중분야명* |
신청과제수 |
선정과제수 |
선정율(%) |
|
생화학 및 분자생물학 |
25 |
2 |
8 |
|
해부 및 세포생화학, 유전학, 노화학 및 종양학, 면역학 |
23 |
5 |
21.7 |
|
동물학, 축산 및 수의 과학, 식품과학, 미생물 및 기생생물, 식물학 |
24 |
5 |
20.8 |
|
분석화학, 유기화학. 신경과학, 임상의과학. 생물공학, 화학공학 |
17 |
2 |
11.7 |
|
소계 |
89 |
14 |
15.7 |
*과제 선정을 위하여 구성된 4개 패널에 속한 중분야들
나. 생명공학 분야 인력 양성
□ 국가전략 분야 인력양성추진
시대적 요청에 따라 2001년 국가전략 분야로 선정하여 범부처 공동으로 인력양성사업을 수립・시행해 오고 있다. 교육과학기술부의 제2단계 BK21사업과 지방대학 혁신역량 강화사업이 대표적인 인력양성사업이다.
(1) BK21 사업
제2단계 BK21(2006~2012년)사업의 경우 생명공학 관련으로 21개 전문서비스(의치의학) 사업단, 과학기술(기초 분야) 14개 사업단과 31개 사업팀, 과학기술(응용) 분야 17개 사업단과 29개 사업팀을 지원하고 있으며, 교수 1,888명, 석사 3,646명, 박사 2,488명이 참여하고 있다.
[표 3-1-3-7] 2007년 생명공학 분야 BK21 지원 현황
|
대분류 |
소분류 |
사업단 (팀) |
참여인력(사업선정시 현황, 명) |
국고지원금 (억 원) |
|||
|
교수 |
석사 |
박사 |
대학원생 |
||||
|
전문서비스 (의치의학) |
사업단 |
21 |
639 |
695 |
729 |
1,424 |
168.46 |
|
과학기술 (기초) |
사업단 |
14 |
391 |
1,041 |
793 |
1,834 |
160.13 |
|
사업팀 |
13 |
103 |
147 |
72 |
219 |
25.39 |
|
|
과학기술 (응용) |
사업단 |
17 |
439 |
1,360 |
723 |
2,083 |
163.14 |
|
사업팀 |
29 |
316 |
403 |
171 |
574 |
57.45 |
|
|
합계 |
94 |
1,888 |
3,646 |
2,488 |
6,134 |
574.57 |
|
출처: 한국연구재단 BK21지원단 BK21사업관리팀
국제 서비스 시장 개방 등에 대비하여 Global standard에 맞는 의학, 치의학 분야 고급 전문 인력 양성을 목적으로 한 의치의학 전문대학원 BK21사업 참여 대학은 의학 계열 16개 사업단과 치의학 5개 사업단이 선정되어 의생명공학 분야에 기여할 수 있게 되었으며 향후 MD/DDS-Ph.D 프로그램을 운영하여 보다 전문적인 의과학자 양성을 하게 될 것이다.
(2) 지방대학혁신역량강화사업(NURI)
인력양성지원의 수도권 집중을 완화하고 국가균형발전을 목표로 지방대학을 육성하기 위하여 2004년 시작된 지방대학혁신역량강화(NURI) 사업 중 생명공학 분야는 2008년도에 강원지역 5개 사업단, 부산/경남지역 4개 사업단, 광주/호남지역 3개 사업단, 대전/충청지역 4개 사업단, 대구/경북지역 1개 사업단, 제주지역 2개 사업단에 407.92억 원을 지원하였다.
[표 3-1-3-8] 2008년도 생명과학 분야 누리사업 지원현황
|
권역 |
사업단수 |
지원액(억원) |
참여교수(명) |
학사과정(명) |
석사과정(명) |
박사과정(명) |
|
강원 |
5 |
76.87 |
284 |
5,186 |
424 |
164 |
|
부산/경남 |
4 |
88.91 |
289 |
5,862 |
215 |
86 |
|
광주/호남 |
3 |
66.52 |
192 |
3,364 |
170 |
70 |
|
대전/충청 |
4 |
103.81 |
386 |
6,874 |
487 |
160 |
|
대구/경북 |
1 |
29.79 |
170 |
3,467 |
0 |
0 |
|
제주 |
2 |
42.02 |
120 |
1,720 |
121 |
51 |
|
계 |
19 |
407.92 |
1,441 |
26,473 |
1,417 |
531 |
출처: 한국연구재단 대학연구지원팀
4. 농식품분야 생명공학 육성정책
가. 농식품생명공학 추진배경
과거 농식품업의 국제경쟁력이 토지, 노동, 자본과 같은 전통적인 투입요소의 효율적 활용에 의해 결정되었던 것과 달리, 근래에는 기술, 지식, 정보와 같은 새로운 투입요소가 경쟁력을 좌우하고 있다. 최근 생명공학기술의 발달과 더불어 “이제 농식품분야에서도 신성장동력 창출의 핵심수단은 농식품생명공학”이라는 인식이 확산되고 있다.
농식품생명공학기술은 생명자원을 이용한 고품질․안전농축수산물 생산, 유전자변형 작물 개발과 안전성 연구, 가축 형질전환과 복제, 농생물유전체 연구, 친환경 농자재 및 기능성 식품 생산, 동물질병 예방․진단․위생 관련 기술 등 그 적용범위가 매우 다양하다.
농식품생명공학기술은 연구개발과 산업화 과정을 거쳐 농식품바이오 상품으로 개발되어 농식품업의 생산성 향상은 물론 잠재실업률이 높은 농식품업 종사자의 소득 향상에도 기여한다.
이러한 농식품생명산업 분야에 대한 수요는 최근 급격한 증가 추세에 있으며, 정부에서도 이에 대한 중요성을 인식하고 농식품생명공학 산업을 국가의 기간산업으로 육성하기 위한 다양한 정책을 추진하고 있다.
나. 육성현황
농식품생명공학 육성은 주로 기술개발과 인프라 구축을 통해 이루어진다. 이를 위해 제1차 생명공학육성계획이 추진된 1994~2006년까지 지난 13년간 농림수산식품부에서는 총 5,556억 원(국가생명공학 투자액의 12.8%)을 투자했다. 지속적인 투자결과 기초/원천 단계의 우수 기술이 꾸준히 개발되어 국내외에서 특허로 출원하거나 주요 저널을 통해 논문으로 발표하였다. 이렇게 축적된 농식품생명공학은 기초과학 역량을 바탕으로 산업적 성과가 가시적으로 도출되고 있다. 현재 농림수산식품부에서 추진하고 있는 주요 농식품생명공학 육성 사업은 다음과 같다.
(1) 농림기술개발사업
농림기술개발사업은 농식품식품생명산업 육성을 위해 산․학․연 합동 연구개발을 통한 농림기술의 실용화 촉진을 목표로 추진되고 있다. 실용화 연구가 진행되고 있는 주요 농림생명공학 분야로서는 바이오매스 증산 및 활용기술, 분자마커, 고부가가치 동식물 신품종 개발 분야 등이 있다.
본 사업은 현장접목이 가능한 농림기술개발을 위해 1994년부터 추진되어 오고 있으며 2006년부터는 생명공학 분야 중 고기능성 농식품, 생물자원 분야에 대한 투자를 강화하는 한편, 산업체의 연구과제 참여를 강화하는 등 농림생명공학의 실용화 성과 실현에 많은 역점을 두고 사업을 추진해 나가고 있다.
[그림 3-1-4-1] 농림기술개발사업 연구성과 주요 활용방안

[표 3-1-4-1] 농식품생명공학 연구개발사업
(단위:백만 원)
|
사 업 명 |
사업기간 |
2008 |
2009계획 |
주관기간 |
|
농림기술개발 |
'94~계속 |
14,427 |
17,370 |
농림수산식품부 |
|
농림바이오기술산업화 지원사업 |
'08~계속 |
- |
8,000 |
농림수산식품부 |
|
수의과학기술개발 |
'98~계속 |
1,500 |
1,600 |
수의과학검역원 |
|
수산업생명공학연구 |
'04~계속 |
876 |
2,253 |
국립수산과학원 |
|
바이오그린21 |
'01~'10 |
44,464 |
50,000 |
농촌진흥청 |
|
바이오장기생산연구 |
'04~'13 |
4,000 |
3,500 |
농촌진흥청 |
|
유용유전자 대량발굴 및 형질전환작물 개발 |
'94~계속 |
7,200 |
4,904 |
농촌진흥청 |
|
농업유전자원의 국가관리체계 확립 및 활용 |
'94~계속 |
1,395 |
4,588 |
농촌진흥청 |
|
임업시험연구 |
'04~'13 |
1,990 |
2,180 |
산림청 |
|
GMO 국가관리 및 안전성평가 |
'04~계속 |
1,368 |
1,273 |
농촌진흥청 |
|
합 계 |
|
77,220 |
95,668 |
|
출처: 2009년도 생명공학육성시행계획 재작성
(2) 수의과학기술개발사업
수의과학기술개발사업은 선진화된 수의과학기술 개발을 목표로 1998년부터 추진되고 있는 사업으로 동물 질병, 검역, 동물의약품 개발 등의 기술연구가 진행되고 있다. 본 사업을 통해 유전자칩․단백질칩 등 첨단기술을 이용한 동물질병 진단․예방 등 가축질병 방역기술 개발, 해외악성전염병(구제역 등), 특수전염병(광우병 등)과 신종유해화학물질 등에 대한 국제적 수준의 검역․방역․검사기술 개발, 동․축산물의 독성평가, 축산가공식품의 성분규격화와 미생물 오염방제기술, 동물용 의약품의 품질관리 및 표준화 기술개발 연구 등을 수행 중에 있다.
(3) 수산생명공학연구
수산생명공학연구사업은 수산과학기술 개발을 목표로 2004년부터 추진되고 있는 사업으로 수산생물 유전체 연구와 생명공학적 이용기술 개발, 분자 표지를 활용한 수산생물 분자육종 기반 기술 확립, 해양ㆍ수산용 LMO 수산생물의 환경위해성 심사업무, 수ㆍ해양생물 유전자원의 수집 및 보존 확대, 첨단 생명공학 기술을 이용한 고부가가치 건강기능성 식품 소재 개발 등을 추진 중에 있다.
(4) 바이오그린21사업
바이오그린21사업은 2001년도부터 2010년까지 10년간 약 3,300억 원의 연구비를 투자하여 농업생명공학 분야의 고부가가치 원천기술 개발을 목표로 추진되고 있는 농림생명공학 분야의 대규모 프로젝트 사업이다. 본 사업은 자원다양성, 유전체분석, 안전성 등의 5개 연구 분야에 대하여 농업생물자원다양성연구단, 동물유전체개발연구단, 분자육종연구단, 기능성소재연구단, GMO안전성연구단 등 8개 연구단 형태로 운영되고 있다. 바이오그린21사업을 통해 기술종속형 모방 중심의 연구에서 탈피하여 독창적인 원천기술을 확보하고 분자육종 기술을 활용하여 주요 작목별 신품종 개발 및 고부가 신소재를 개발해 나갈 계획이다.
(5) 바이오장기생산사업
바이오장기생산사업은 장기 부족에 따른 사회문제를 해결을 통한 의료복지 실현에 기여함을 목표로 추진되고 있다. 본 사업은 바이오장기 제공용 무균돼지를 효율적으로 산업화 시키는데 초점을 맞추고 사업을 3개의 중점 분야(무균돼지 생산시스템 구축에 관한 연구, 바이오장기 생산 무균돼지의 관리기술 개발 연구, 형질전화 복제돼지의 생산효율 증진에 관한 연구)로 특화하여 연구를 진행하고 있다.
(6) 농업유전자원의 국가관리체계 확립 및 활용사업
최근 유전자원은 생명산업의 근간으로서 현재 뿐만 아니라 미래의 농식품업에 무한한 가치를 창출할 수 있는 국가자산으로 인식하고 있다. 따라서 농업유전자원의 다양성 확보, 장기 안전보존 및 종합전산화를 통한 국가관리체계 구축 등 국가의 자원주권 확보차원에서 그 중요성이 커지고 있다. 이러한 측면에서 본 사업은 국내외 농업 유전자원의 수집․보존, 유전자원 증식 및 특성평가, 통합정보시스템 구축을 목표로 추진하고 있다. 2006년 11월에는 ‘국립농업유전자원센터’가 준공되어 농업유전자원을 보다 효율적으로 관리할 수 있는 기틀도 마련되었다.
(7) 임업시험연구사업
임업시험연구사업은 생명공학기술을 적용한 고부가가치 산림자원의 효율적 이용기술 개발을 목표로 추진하고 있다. 2004년도부터 2013년까지 10년간 약 170억 원의 연구비를 투자하여 ‘산림자원 유래 신기능성 물질 개발’, ‘세포공학을 이용한 고부가가치 창출’, ‘임목의 고유유전자 특성 규명 및 신기능 품종 육성’을 실현해 나갈 계획이다.
다. 향후 추진방향
농림업이 직면하고 있는 대내외적인 위기를 극복하고 고부가가치 산업으로 한층 도약하기 위해서는 기술경쟁력 기반의 신성장동력원 창출이 중요하다. 농림분야도 이제는 생명공학 기반의 신성장동력 창출을 통해 기술․지식 집약적 농림업으로 전환될 필요가 있다.
우리나라 농림생명공학은 아직 산업화 태동기이나 성장잠재력이 높아 향후 국가 기간산업으로의 규모 확대가 기대되는 상황이다. 특히 이를 위해 농림생명공학은 전략적이고 체계적으로 육성되어야 한다. 장기간의 기술 개발 소요기간, 복잡한 산업화 과정과 대규모 자본투입을 요하는 점 등을 고려할 때 농림생명공학은 국가 차원의 집중 투자가 요청된다.
농림생명공학 투자는 산업화 실현을 전제로 이루어져야 한다. 독자적인 원천기술을 지속적으로 개발해 나가는 한편, 개발기술의 산업화 촉진을 위한 투자가 뒤따라야 한다. 앞으로 생물다양성 협약으로 생물자원의 이용과 접근에 대한 장벽 강화 추세에 대응하여 작물ㆍ가축ㆍ미생물 유전체 연구를 강화할 계획이며, 분자육종을 통한 지식기반형 고부가가치 동ㆍ식물 및 물질생산을 확대하며, 고부가가치 기능성 식품소재와 개인 맞춤형 기능성 식품 개발에 힘쓸 예정이다. 또한 GM작물의 실용화를 위해 안전성 평가기반도 확립하며 소비자의 인식제고에도 노력할 예정이다.
세계적으로 농림생명공학 분야의 발전은 매우 빠르게 진행되고 있다. 우리나라도 일부 기술은 세계적 수준에 올라 있어 투자 확대에 따라 발전 가능성을 점치고 있다. 정부의 지속적인 기술기반과 인프라 투자 지원, 연구기관의 차별화된 기술 개발, 산업체의 고부가가치 상품 생산을 선순환 체계 구축을 통해 농림생명공학은 국가의 기간산업으로 거듭날 것이다.
※ 농업유전자원 기본계획 수립ㆍ시행
유전자원은 생명산업의 근간으로서 현재 뿐만 아니라 미래의 농업에 무한한 가치를 창출할 수 있는 국가자산으로 인식되어 세계 각국은 유전자원 확보에 주력하고 있으며, 미래학자들은 21세기 국부척도를 유전자원의 양과 질에 의해 결정될 것으로 전망하고 있다.
이에 농림수산식품부는 『농업유전자원 보존ㆍ관리 및 이용 활성화를 위한 기본계획』을 수립하여 국내외 유전자원을 효율적으로 수집ㆍ보존ㆍ활용할 수 있는 종합관리체계를 구축하여 2018년까지 “세계 5대 유전자원 강국 실현”을 위해 노력할 방침이다.
이를 위해 첫째로 국내외 유용 유전자원에 대한 사전조사 강화, 대상 및 지역에 따라 전략적 수집체계 구축을 통한 유전자원의 다양성 확보를 위해 국내 대학, 연구소, 유전자원 책임기관 등이 참여하는 유전자원 조사ㆍ수집팀을 구성ㆍ운영하며, 또한 한반도가 원산지인 토종자원의 반환 추진을 위해 국가 간 협력체계를 강화하고, 국제농업기구 및 그 소속 연구기관과의 협력을 확대할 계획이다.
둘째, 연구자ㆍ육종가 등이 실질적으로 활용할 수 있는 수요자 중심의 유전자원 특성평가를 강화하기 위해, 농진청의 농업유전자원센터를 정밀평가 중심기관으로 운영하며, 관리기관을 유전자원 병ㆍ충ㆍ기능성 성분에 따라 분야별 정밀평가 전문기관으로 육성할 방침이다.
셋째, 소량 및 저활력 유전자원의 안전한 보존 및 지속가능한 이용을 위해 산ㆍ학ㆍ연 및 유전자원 관리기관과 협력체계를 구축, 특별증식사업을 획기적으로 확대할 방침이다.
넷째, 재래종 유전자원 등 국가 중요자원에 대한 DNA뱅크를 구축하여 자원주권 확보 및 생명산업 소재 활용에 더욱 노력하는 한편, 식물, 동물, 미생물 유전자원 정보의 효율적 관리 및 활용도 제고를 위해 종합정보시스템을 구축하여 이용자에게 One-stop 서비스를 제공할 계획이다.
마지막으로 현장에서 실제 활용할 수 있는 유전자원 전문인력 양성을 위해 유전자원 책임기관에 단기전문가과정을 개설ㆍ운영하며, 유전자원 관리기관의 지정을 대학을 중심으로 확대할 예정이다.
5. 보건의료분야 생명공학 육성정책
가. 개요
보건의료분야란 국민의 건강과 생명의 유지․증진에 필요한 상품, 서비스와 관련된 기술로 의약품, 의료기기, 식품, 화장품, 의료서비스 등과 관련된 전반적인 분야를 말하며 이에 대한 관심은 경제가 발달하여 소득이 증가할수록 절대적으로 증가하고 있다.
이에 보건복지가족부는 보건의료기술을 활용한 건강사회구축을 위해 “건강수명의 연장, 삶의 질 향상, 보건의료 산업 경쟁력 강화”의 비전을 가지고 연구개발 투자, 인프라 구축 등을 지원하고 있다.
보건복지가족부는 보건의료연구개발사업을 비롯하여 한의약선도기술개발, 질병관리본부, 국립암연구소운영사업 등으로 매년 약 2,700억 원 가량을 지원하고 있다.
[표 3-1-5-1] 보건복지가족부 R&D 예산
(단위: 억 원)
|
사업명 |
2008년 |
2009년 |
|
보건의료연구개발 |
1,447 |
1,859 |
|
한의약선도기술개발 |
80 |
76 |
|
질병관리본부(기본사업비 등) - 질병관리연구, 유전체실용화 포함 |
262 |
257 |
|
국립암연구소 운영 |
378 |
421 |
|
한국보건산업진흥원 운영 |
102 |
100 |
|
국립병원임상연구사업 등 |
31 |
61 |
|
합 계 |
2,300 |
2,774 |
출처: 보건복지가족부 R&D 예산 현황(2008~2009)
나. 주요 연구개발사업
(1) 보건의료기술연구개발
(가) 개요
보건복지가족부는 21세기 지식기반경제의 핵심 산업으로 등장하고 있는 보건산업을 국민건강 증진과 국가경제 발전에 이바지하는 고부가가치 국가 전략산업으로 육성․발전시키기 위하여 보건의료기술진흥법(1995.12)을 제정하여 『보건의료기술연구개발사업』을 추진해오고 있으며, 지난 1995년부터 2008년까지 14년간 총 1조308억 원의 정부 연구개발 자금을 지원하였다. 아직은 선진국에 비해 보건의료 R&D투자 비율이 미흡하지만 고령화 사회로 접어들면서 투자가 점진적으로 확대되고 있다.
동 사업은 기반기술 분야에 대하여는 연구개발비 전액을, 민간기업이 참여하는 실용화 및 제품화 기술과제에 대하여는 연구개발비의 50% 이내에서 지원한다. 보건복지가족부는 연도별ㆍ분야별 연구개발사업의 추진전략을 수립하고 연구개발사업의 추진 현황을 관리하고 있으며 관리기관인 한국보건산업진흥원에서 연구개발 사업 관리 등의 실무를 담당하고 있다.
[그림 3-1-5-1] 사업추진 절차
|
R&D 사업기획 |
⇒ |
과제선정 |
⇒ |
과제관리 |
⇒ |
과제종료 |
⇒ |
성과관리 |
|
|
|
|
|
|
|
|
|
|
|
◦기획보고서 ◦시행계획수립
|
|
◦사업공고/과제접수 ◦과제선정평가 ◦협약/연구비지급 |
|
◦연차실적․계획서 평가 ◦단계실적․계획서 평가
|
|
◦연구비 정산관리 ◦최종보고서평가
|
|
◦성과보고서 평가 ◦성과활용실태조사 ◦기술료 징수/관리 |
(나) 지원내용
2009년도 보건의료연구개발사업은 ‘보건의료기술연구개발’, ‘연구중심병원구축’ 이외에도 ‘면역백신개발’과 ‘임상연구인프라조성’ 등 사업으로 구성되어 있으며, 지원분야는 의과학, 의약품, 의료기기, 의료정보, 건강기능제품 등 분야를 포함하고 있다.
[표 3-1-5-2] 2009년도 보건의료연구개발사업 지원현황
(단위: 백만 원)
|
사업명 |
지 원 내 용 |
예산 |
||
|
2008 |
2009 |
|||
|
보건의료연구개발사업 |
보건의료기술 연구 개발 |
○ 21세기 대표적 고부가가치산업인 보건의료산업을 육성․발전시켜 국민의 생명․건강을 증진시키고, 사람이 살기 편리한 사회 구현에 기여 - 지원분야: 질병극복 연구역량 강화(중개연구, 희귀질환연구, 병원특성화센터 등), 사회안전망 구축(기후환경변화질환, 재활보조기구), 신산업 창출(신약, 의료기기․정보, 바이오장기/칩, 나노보건기술 등) |
92,217 |
128,127 |
|
연구중심병원구축 |
○기초연구성과의 첫 임상적용(“first in human” trial)을 위해 병원과 산학연간 협력연구 촉진 및 병원이 메디클러스터의 구심점 역할을 수행할 수 있도록 병원의 연구역량 강화 - 지원분야:선도형연구중심병원 육성 |
13,500 |
22,500 |
|
|
면역백신 개발 |
○ FTA에 대비한 의약사업 분야의 국제 경쟁력 확보를 위해 해외 의존성이 절대적인 백신의 자체개발을 통한 독립적 국가 보건체계 구축 및 선진국형 백신 수출사업 양성 |
4,000 |
4,000 |
|
|
임상연구인프라 조성 |
○ 병원의 임상시험 역량을 강화하여 산업적 기반 마련 및 해외 임상유치 확대 등을 통해 임상개발 허브로의 발전 -지원분야:국가임상시험사업단(Ko-NECT), 임상연구네트워크 구축, 의료기기임상시험센터 등 |
35,000 |
31,265 |
|
|
계 |
|
144,717 |
185,892 |
|
① 중개연구
우리나라의 경우 국내 기초의학분야의 연구역량이 우수함에도 불구하고 실용화와 산업화로 연계가 저조하며, 특히 보건의료기술분야의 원천 특허가 미미한 수준으로 기초연구성과의 실용화와 임상적 적용이 가능하도록 연계하는 사업이 부족한 실정이다. 이러한 문제점을 보완하기 위해 2005년부터 추진하고 있는 사업이 질병중심 중개연구(Disease oriented Translational Research)이다. 질병중심 중개연구란, 기초과학 연구를 통해 밝혀진 개념과 지식, 기술을 관련 질병이나 손상의 진단, 치료 및 예방 등에 임상 적용하는 연구로서 임상 또는 실험 모델을 통하여 질병의 진단․예방․치료기술의 생물학적 효과를 규명하는 연구이다. 이와 함께 임상연구에서의 문제점을 기초과학에서 해결할 수 있도록 근거를 제공하기 위한 연구를 아우르는 전반적인 사항을 말한다.
중개연구 프로그램은 질병의 기전규명, 진단, 치료기술 향상을 위한 13개 질환을 대상으로 의과학, 신약, 의료기기 등 보건의료 전 분야에 대한 창의적 연구를 지원하고 있으며, 연구인력 확충을 위한 중개연구자 양성, 개별연구자를 위한 단독중개연구, M.D.-Ph.D. 연계를 위한 협동중개연구, 실용적 성과 달성을 위한 중개연구센터에 이르기까지 단계적 지원의 형태를 띠고 있다.
② 선도형 연구중심병원 육성
선도형 연구중심병원은 2006년부터 보건복지가족부가 추진하고 있는 주요사업 중의 하나이다. 병원은 임상경험을 바탕으로 아이디어를 제공하는 기술개발의 원천이자 개발된 기술의 최종수요처로서 의료산업 발전을 위한 가치사슬의 중심이다. 이러한 역할을 수행할 수 있다는 강점을 살려 병원이 진료뿐만 아니라 R&D에서도 중요한 역할을 수행할 수 있도록 병원의 연구역량을 강화하여 병원을 중심으로 산학연간 협력연구를 활성화함으로써 기초연구성과의 임상적용을 촉진하고자 선도형 연구중심병원 사업을 시작하게 되었다. 병원 내 연구환경 조성을 위한 제도개선, 우수한 연구인력 확충 등으로 연구역량을 강화하여 세계적 수준의 지식과 기술 창출하는 것을 목표로 2006년부터 지금까지 서울대병원(세포치료제 개발), 서울아산병원(항암제 개발), 연세대의료원(뇌심혈관질환 융합연구) 등 총 3개의 병원이 선정되었으며, 2009년 이후에도 계속 확대해 나갈 예정이다.
③ 국가임상시험사업단
임상시험의 해외 의존도를 낮추고 다국가 임상시험을 유치할 수 있는 선진국 수준의 임상시험인프라 구축을 위해 보건복지가족부는 2004년도부터 지역임상시험센터를 선정하여 지원하기 시작하였으며, 2007년에 선도적인 병원의 우수한 시스템 확산과 지방의 인프라 활용으로 지역균형발전의 실효성을 극대화 하고 센터 간 연계를 위해 기존 지역임상시험센터를 통합하여 국가임상시험사업단(Ko-NECT)으로 전환하였다.
국가임상시험사업단은 크게 지역임상시험센터, 임상시험 전문인력 양성센터, 임상시험 기술개발센터로 운영되고 있다. 지역임상시험센터는 기존 9개 지역임상시험센터 외에 2008년에 3개의 지역임상시험센터를 추가로 선정하였고 2009년도까지 전국적으로 총 15개 지역임상시험센터 선정을 목표로 하고 있다.
④ 임상연구 네트워크 구축
임상연구 네트워크 구축사업은 한국인의 특성에 맞는 근거중심의 선진의료기술과 임상진료지침 개발 등 임상연구를 지원하고 있다. 2004년부터 지금까지 총 11개 질환에 대한 임상연구센터를 지원하고 있으며, 지원분야는 성인고형암, 허혈성심질환, 만성기도폐쇄성질환, 간경변증, 제2형 당뇨병, 우울증, 뇌졸중, 노인성치매, 항균제적정사용, 만성신부전, 류마티스관절염이며 2008년에는 11개의 임상연구센터를 지원할 임상연구지원센터도 추가로 선정하였다. 임상연구센터는 국내의 다기관 네트워크를 구축하여 주로 임상시험(주로 IIT, Investigator-Initiated Trial)을 통해 한국인의 임상자료를 바탕으로 한 진료권고안을 개발하고자 하는 데에 그 목적이 있으며, 임상시험(clinical trial)과 임상역학(clinical epidemiology) 및 성과연구(outcome research) 등의 내용을 포함하고 있다.
⑤ 신약 개발
보건의료연구개발사업의 경우, 1995년에 사업이 시작된 이후 신약개발 분야에 지속적으로 지원한 결과 국내 제약기업이 출시한 신약의 다수가 보건복지가족부 지원을 통해 개발에 성공할 수 있었다.
한미 FTA 체결 이후 정부는 시장개방으로 인한 충격을 최소화 하고, 이를 계기로 국내 제약산업의 경쟁력 강화를 통해 새로운 사업기회를 모색하기 위해 제약 인프라 개선, R&D 지원 확충하고 있다. 이는 제약사의 신약개발 역량을 강화시키고 해외진출 지원을 확대하여 제약산업을 수출전략 산업화를 유도하기 위한 노력이다. 이에 보건복지가족부는 한미 FTA 후속대책으로 신약개발 지원 중 비임상․임상시험을 중점 지원하고, 단계별 지원프로그램을 통해 기술적 경제적 성공가능성이 높은 신약후보에 대해 선택․집중 지원하고 있다. 지원분야는 혁신신약, 천연물의약품, 바이오의약품, 개량신약 4개 분야에 대해 임상단계별로 비임상시험부터 필요에 따라 임상3까지 단계별로 지원하고 있다.
⑥ 의료기기 개발
의료기기 분야에서는 차세대 신기술(BT, IT, NT)을 개발하기 위하여 첨단 의료영상, 한국형 인공장기, 첨단 감각기능회복장치 등 인간 중심의 보건의료 환경 조성을 위해 2002년부터 11개 휴먼의료공학센터를 선정하여 지원하였다. 또한, 2006년부터는 신기술 의료기기의 조기 시장진입과 국산의료기기의 과학화를 통해 경쟁력을 강화하기 위하여 의료기기 임상시험(허가용 임상시험, 임상평가시험) 지원을 강화하고 있다. 한편, 임상시험 지원과 더불어 국내 취약한 임상시험 기술, 임상시험 관련 연구자와 의료기기 임상시험인프라 구축을 위하여 2008년에 의료기기임상시험센터 3개를 선정하였고, 공공복지실현 및 소외계층(장애인, 노약자등) 사회안전망 확충을 위하여 장애, 고령인구에 대한 공적급여 지급품 중 시급한 제품이나 고가수입 의료기기를 대체할 수 있는 제품개발을 지원하고 있다.
⑦ 면역백신 개발
세계 백신시장은 고성장을 통해 거대한 시장을 형성할 것으로 예측되고 있으나, 국내에서는 백신인프라 부족, 타의약품에 비하여 마진율이 낮다는 백신사업의 특성상 백신 개발에 대한 투자가 부진한 상황이다. 이에 보건복지가족부에서는 해외 의존성이 절대적인 백신의 자체개발을 위해 독자적으로 국내생산체계를 구축하여 안정적으로 백신을 공급하고자 노력하고 있다. 또한 백신의 국산화로 국민 의료비를 절감하기 위해 2008년부터 면역백신 개발사업을 시작하였으며 면역백신의 제품화와 기존백신의 개량화 등의 분야에 대해 연구비를 지원하고 있다.
⑧ 기후․환경변화질환 대응 연구 등
최근 기후변화에 따른 신·변종 전염병의 확산을 방지하고 외부오염에 노출되어 생기는 대사성질환 등을 극복하기 위한 기후․환경변화질환 대응 연구, 미래 신기술 경쟁력 확보와 신시장 창출을 위한 유전체, 줄기세포 등 분야의 연구, 병원의 경쟁력 있는 특화된 분야의 연구역량을 강화하여 병원의 특성화를 유도하고 브랜드 가치를 창출하기 위한 병원특성화센터, 지속적인 환자상태의 모니터링이 필요한 질병에 대한 의료기관-재택 연계 u-Health 서비스 모델 개발 및 상용화, 치과질환의 예방․진단․치료 기술개발 등을 지원하고 있다.
(2) 한의약 선도기술 개발
(가) 개요
인구의 고령화로 인하여 만성․난치성질환이 증가하고 있으며, 세계적으로는 웰빙에 대한 관심과 친환경주의의 선호로 전통의학과 보완대체의학에 대한 수요가 급증하고 있다. WHO에서는 세계 전통의학 시장이 2000년 600억 달러에서 2008년까지 2,000억 달러 규모로 성장할 것으로 예측하고 있으며, 이용자 또한 급격히 증가하여 세계인구의 60%를 상회할 것으로 추정하고 있다. 현대의학의 한계점을 인식하고 의료비의 증가를 억제하기 위하여 전통의학과 보완대체의학에 대한 관심이 커지고 있어 세계 전통의학 시장이 넓어지고 있다. 따라서 국가별로 투자를 강화하고 있는 실정이다.
이러한 세계적인 관심 속에서 우리의 고유 전통의학인 한의학적 접근방법을 통한 치료기술개발은 높은 경쟁력을 가질 수 있으므로 정부는 오랜 전통을 지닌 한의약의 경험과 지식정보를 이용하여 핵심원천기술과 응용기술을 개발하고, 한의약의 안전성․유효성을 입증하여 국민보건향상과 한방산업에 기여하고자 1998년부터 「한방치료기술연구개발사업(2020 프로젝트)」을 추진하고 있다.
한의약의 과학화․표준화․세계화의 비전을 지닌 한방치료기술연구개발사업의 목적달성을 위하여 단계별 목표를 수립하여 기초연구단계(1998~2002년), 연구심화단계(2003~2007년), 실용화단계(2008~2012년)로 구분하여 추진하고 있으며, 1998년부터 2006년까지 당초 투자계획의 38% 정도인 393.4억 원의 정부예산이 지원되었다.
(나) 지원내용
보건복지가족부는 사업목표를 명확히 하고 새로운 한방치료기술과 한약제제 등의 연구개발을 활성화 해 실효성을 높이기 위해 부처계획인 ‘한방치료기술개발사업 중장기 발전계획(2008~2017)’을 2008년 2월 21일 재수립하였다. 동 계획은 지난 1998년부터 추진한 한방치료기술연구개발사업을 통해 확보된 연구역량을 바탕으로 연구개발 활성화와 한방치료기술과 한약제제 개발 등 실효성 제고에 역점을 두고 있다. 이에 따라 2008년에는 우수한 한약처방을 한약제제로 제품화 하여 한의약 산업의 경쟁력을 확보하기 위한 한약제제개발, 한의학적 임상 유효성을 확보하여 시장에 진출하기위한 한방의료기기개발, 진단 및 치료기술의 과학적 근거 확보를 통한 안전하고 효과적인 한의학 진료시스템 구축을 위한 한의약임상연구, 한의임상진료지침개발을 지원하고 있다.
(3) 질병관리연구
(가) 개요
질병관리연구는 질병관리본부 국립보건연구원에서 수행 중인 연구로서 1999년부터 본격적으로 시작되었다. 국내 질병관리의 실무를 담당하고 있는 질병관리본부에서의 연구사업 수행은 국내 발생 질병에 대한 현안 대응의 측면에서 효율성을 인정받고 있다. 주요 연구 분야는 국내 발생 전염병 및 만성질환에 대한 예방, 진단 및 치료 기술 개발연구와 질환관련 유전체의 분석을 통해 질병을 예측하도록 하고자 하는 유전체사업이다.
(나) 지원내용
질병관리연구는 주로 질병관리본부 국립보건연구원의 자체 수행과제로 이루어져 있다. 그러나 유전체분석과제 등과 같이 기기구입과 관련 전문가 확보 등 부가적 비용이 필요한 경우에는 용역과제의 형태로 외부 연구기관에 위탁하여 수행하고 있다. 연구사업의 주요 내용은 다음과 같다. 주로 감염병에 대한 진단 및 예방치료 연구, 병원감염 원인균을 찾고 그에 대한 해결방법을 찾고자 하는 연구, 생물테러 등에 이용되어 국민 안전을 위협할 수 있는 고위험병원체에 대응하기 위한 기술개발연구, 비만․당뇨 등 생활습관의 변화로 인하여 급증하고 있는 만성질환 예방연구를 수행하고 있다. 또한 한국인의 유전 형질에 따른 질병 발생 추이를 확인하고 그에 따른 질병예측 프로그램 개발을 위한 유전체연구사업을 수행하고 있다. 질병관리본부는 이들 연구사업의 수행을 바탕으로 국민 건강 증진에 기여하는 일선 기관으로서의 역할을 다하고자 노력하고 있다.
(4) 국립암연구소 지원
(가) 개요
보건복지가족부는 국민보건의 향상에 이바지하기 위해 암에 관한 전문적인 연구와 암환자의 진료 등을 위해 2000년에 국립암센터법을 제정하여 국립암센터를 설립․운영하고 있으며, 암의 발생․예방․진단․치료 및 관리 등에 관한 연구로 기관고유연구사업을 추진하고 있다.
아울러, 1996년도에 제1차 암정복 10개년 계획(1996~2006)을 수립하고 암정복추진단을 발족하여 암정복추진연구개발사업을 추진 중에 있으며, 2000년도에 국립암센터로 이관하여 사업을 추진하고 있다.
지난 7년간 국립암센터 기관고유연구사업과 암정복추진연구개발사업으로 총 814억 원의 정부연구개발자금이 지원되었으며, 향후 암에 관한 연구와 투자는 국민의 보건상향에 중요한 만큼 선진국에 버금가는 투자를 할 수 있도록 확대되어야 할 것이다.
(나) 지원내용
국립암센터는 암 발생률과 사망률의 감소 및 치료율 제고와 직결되는 4대 연구분야를 선택하여 집중 수행하고 있으며, 기초연구와 임상연구를 상호 유기적으로 연계해 환자의 치료 수준과 삶의 질 향상에 기여하는 이행성 연구에 중점을 두고 있다. 또한 암 관련 기술개발을 통해 우리나라 생명공학 분야의 국가 경쟁력 향상에 기여하는 실용화 과제 수행을 지원하고 있다.
특히 기관고유연구사업을 통하여 암연구기반구축과 국가암관리 사업 기획․평가를 지원하고 있으며, 암정복추진연구개발사업을 통하여 국내 암연구 수준 향상 및 저변 확대를 위한 암연구를 지원하고 있다.
다. 향후 발전방향
보건복지가족부에서는 최근에 소득수준의 향상, 고령화 사회의 진입 및 질병구조의 변화 등 새로운 정책 수요를 반영한 종합적인 보건의료 R&D 중장기계획을 마련하였고, 국가과학기술위원회의 심의(2008.5.6)를 거쳐 확정되었다. 그동안 정부지원 보건의료 R&D의 문제점인 부처 간 중복․분산지원 등을 해소하기 위해 보건의료 R&D의 통합 조정․관리를 강화하고, 보건의료 R&D의 주무부처인 보건복지가족부가 적극적으로 역할을 수행하겠다는 계획이다. 또한, 기존 공급자 중심의 R&D에서 탈피해 수요자(국민)가 체감할 수 있는 보건의료 R&D지원 체계를 구축하고 보건의료 R&D사업의 목표를 질병극복․건강증진 중심으로 정하였다. 그리고 각 질환별로 필요한 신약, 의료기기, 임상연구 등 제품화 영역까지 예방․진단․치료기술을 개발하기 위해 전 과정의 연구를 지원해 나갈 예정이다. 그와 더불어 R&D 자원 배분 또한 하향식(top-down) 과제와 연구자 육성․창의성 개발을 위한 상향식(bottom-up) 과제의 적절한 배분을 통해 지원해 나갈 계획이다.
[참고] 한국인체자원은행사업
(1) 배경
(가) 포스트지놈 시대에 현저하게 발전하고 있는 유전체연구기술을 통한 예측의학, 맞춤의학 시대의 도래
(나) 인체자원 종합관리 필요성 대두
- 인체자원 확보를 위한 제도적 및 재정적 지원 부족
- 인체자원 종합관리 및 연계 시스템 부재로 인해 분양실적과 연구활용 저조
- 인체자원은행의 운영과 질 관리에 대한 표준관리지침 부재로 인해 자원의 표준화 및 질적 수준 보장 불가
(2) 추진체계
(가) 2012년까지 유전자 정보와 질병과의 관계 분석을 지원하기 위한 양적 측면과 질적 측면을 만족시키는 인체자원 확보
(나) 2016년까지 기 선정된 단위은행의 유지 및 활용성 강화를 통하여 안정적인 국내 인체자원 공급과 관련 정보획득의 편의성 제공
(다) 인체자원 관리의 범부처적 통합관리를 위한 역할분담
- 보건복지가족부: 인체자원(검체+정보) 50만 명 분 확보 및 분양활성화를 목표로 ‘인체유래 생물자원 종합관리 방안’ 수립(’08. 3.)
- 질병관리본부: ‘인체자원중앙은행’ 설립(’08. 4.) 및 인체자원단위은행 지원체계 구축
[그림 3-1-5-2] 사업추진 체계

(3) 사업성과
(가) 은행 간 연계확대 및 종합 관리체계 구축
- 2009년 현재, 12개 인체자원단위은행 선정 및 지원
- 인체자원은행 표준운영매뉴얼, 정도관리 표준 프로토콜 등 운영정책개발 및 도입
- 인체자원 종합관리 및 연계 시스템(Korea Biobank Network; KBN) 구축 및 운영
[표 3-1-5-3] 인체자원 수집 및 분양
(2009년 9월 기준)
|
구분 |
합계 |
건강인 인체자원 |
질환군 인체자원 |
|
수집(명) |
212,983 |
171,851 |
41,132 |
|
분양(건) |
119,635 |
102,574 |
17,061 |
6. 정보통신분야 생명공학 육성정책
가. 추진배경
개인용 컴퓨터의 보급과 인터넷의 발달을 거쳐 와이브로에 이르기까지 고도화 된 정보통신기술(IT)이 생명공학기술(BT)과 접목하여 삶의 질을 향상시키고 인간의 능력을 극대화 하는 데 크게 기여할 것이다.
[그림 3-1-6-1] 정보시대에서 융합시대로의 변화

현재 사회적으로 대두되고 있는 세계적인 고령화문제, 환경․안전문제 등을 해결할 수 있는 핵심기술로서 IT와 BT의 융합기술의 필요성이 강조되고 있다. 미국이나 유럽연합(EU) 등 선진국에서는 이러한 필요성을 토대로 하고 더 나아가 차세대 산업으로서 융합기술의 성장가능성을 인식하여 융합기술 발전전략을 수립하여 다양한 정책을 시행 중에 있다. 우리나라는 2026년 초고령사회로 진입할 것으로 예측하고 있다. 따라서 소비자의 의료에 대한 니즈(needs)가 평생치료 개념으로 확장되고 인구고령화와 만성질환의 증가로 국민건강보험이 부담하는 의료비는 지속적으로 증가할 것으로 예상된다.28) IT에 강한 우리나라는 IT산업을 기반으로 융합기술(IT융합기술)을 선점하여 블루오션 창출과 더불어 초고령화로 치닫는 국내의 사회문제 해결에 앞장 설 필요가 있다.
나. IT융합기술 서비스 현황 및 전망
IT융합기술을 활용하여 가장 두드러지게 활성화 할 수 있는 서비스 분야는 건강․의료 서비스 분야이다. IT의 발전은 의료서비스에도 많은 변화를 불러왔다. 의사가 환자를 대면하여 진료하는 기존의 방식에서 인터넷의 발달로 원격의료, 재택의료가 도입되었고 유비쿼터스(u) 시대에 따라 언제 어디서나 건강관리가 가능한 u-헬스 시대가 열리고 있다.
[그림 3-1-6-2] IT도입에 따른 의료경향의 변화

특히, 당뇨병이나 심장질환 등 만성질환의 경우 혈당폰 등이 세계최초로 국내에서 개발되어 IT 강국의 위상을 높이고 있지만 국내에서는 아직 법제도가 마련되지 않아 사업화에 여전히 문제로 남아있다.
IT를 활용하면 노령화 사회에 진입하면서 노인들의 질병관리나 노령장애를 극복하기 위한 일상생활 관리, 그리고 노인들의 고립감 해소 서비스가 가능하다. 이런 결과물들은 향후 실버시장을 더욱 활성화 시킬 것으로 예상된다.
[그림 3-1-6-3] 건강관리가 가능한 u-헬스서비스 개념도

인터넷을 통한 진료예약 뿐 아니라 RFID(무선인식) 등의 IT가 도입되면서 병원의 의료서비스가 개선되고 있고 전자의무기록이 활성화되면 환자의 기록이 언제나 필요시에 연동되어 맞춤형 진료가 가능하게 될 것이다.
농업, 축산, 수산 등 기존 산업에도 IT가 도입하여 미래에는 산업환경이나 생태를 실시간으로 모니터링하고 조류독감 등 전염병 감지 서비스 및 식품의 이력관리 등 거의 모든 생명공학산업분야의 획기적인 서비스가 가능할 것이다. 이 외에도 건축이나 의류 등 전통산업에도 홈헬스나 바이오셔츠와 같은 신제품이 개발되어 산업의 첨단화를 꾀할 수 있다. 이와 같이 IT융합기술을 활용하여 파생될 수 있는 새로운 서비스는 매우 다양하며 전 산업의 파급효과가 막대할 것으로 예상된다.
[그림 3-1-6-4] IT융합기술 서비스 개념도

다. IT융합기술 국내외 시장 현황 및 전망
IT융합기술시장의 가장 큰 분야인 u-헬스케어 시장규모는 고령화와 만성질환자 증가에 따라 크게 확대될 전망이다. 2010년경 u-헬스케어 국내 시장규모는 서비스와 장비를 포함하여 약 1조 5천억 원으로 추정된다. 이는 연평균 성장률 124%로서 전체의료비의 3.7%에 해당한다. 최근 조사에 따르면 20~60대 인구기준으로 전체 u-헬스케어 서비스 이용 성향은 인구수로 확산하면 약 1,350만 명 정도로서 u-헬스케어 서비스의 수용 성향이 높다고 할 수 있다. u-헬스케어 시장에서는 30~40대가 차지하는 비율이 전체 20~60대의 절반 이상을 차지하고 있는데 이는 IT 활용에 적극적이며 동시에 건강에 관심을 갖는 주 연령인 것으로 분석되고 있다.29)
[그림 3-1-6-5] 국내 u-헬스 시장 전망

IT융합기술의 해외시장은 미국이 가장 큰 시장을 차지하고 있는데, 미국에서는 만성질환자를 주된 대상으로 하는 홈&모바일 헬스케어 시장이 급성장할 전망으로, 2006년 9.7억 달러에서 2010년 57억 달러, 2015년 336억 달러로 성장할 전망이다.30) 미국은 의료비 절감이라는 당면문제를 해결하기 위하여 법제도의 완화 정책을 강력하게 추진 중이므로 관련 시장은 더욱 활성화 될 것으로 예측된다.
[그림 3-1-6-6] 국내 u-헬스 시장 전망

IT융합기술 시장은 기술별로 2010년에 바이오전자 510억 달러, 생물정보 100억 달러, 생체정보인터페이스 70억 달러 등으로 시장규모를 전망하고 있다.31)
라. IT융합기술 산업 현황
국내 업계는 신산업으로서의 가능성과 중요성을 인식하고 있으나 기술의 난이성과 시장개척의 위험성으로 적극적인 투자는 이루어지지 않고 있다. IT융합기술 분야 중 가장 사업화에 가까운 u-헬스케어 분야에 가장 발 빠르게 움직이는 곳은 IT업계로 국내에서는 삼성 SDS, LG CNS, SK C&C, 코오롱정보통신, 현대정보기술 등이 있다. 홈네트워크 사업을 하는 전자업계에도 u-헬스케어 시장은 놓칠 수 없는 분야로 LG전자, 삼성전자 등이 추진 중이다.
KTF와 SK를 중심으로 한 휴대폰업계도 u-헬스케어서비스로 고객잡기 경쟁을 전개하고 있는데, 개인별 금연관리서비스인 ‘금연 길라잡이’도 휴대폰으로 이용이 가능하다. 전반적으로 우리나라는 원격 및 재택 진료에 필수적인 인터넷 또는 무선 통신 인프라는 잘 갖춰져 있지만 바이오센서나 휴대용의료기기 기반기술, 의료정보 분석 및 보안 기술은 상대적으로 낙후되어 있고 현재 상용화 중인 대부분의 휴대용 생체신호계측기기를 수입에 의존하고 있어 이에 대한 기술개발이 시급한 실정이다.
해외에서는 IT기업의 진출이 두드러진다. 주요 진출 분야는 슈퍼컴퓨터, 서버, 소프트웨어 등 연구 인프라 분야, 데이터베이스네트워크 등을 총괄하는 정보인프라 분야, 바이오 칩 및 관련 장비분야, 헬스케어 서비스 분야로서 매우 다양한 분야에 진출하고 있다. 정보인프라 분야에서는 메이저 컴퓨터 제조업체인 HP, IBM, NEC, 히다치 등이 참여하고 있다. 바이오칩 및 관련 장비분야에는 Motorola, HP Agilent, 히다치 등의 IT기업이 참여하고 있다. 글로벌 IT기업의 IT융합기술 분야 진출이 활발하게 이루어지고 있는데 Intel, CISCO, HP, GE, 히다치, Motorola, Philips, Qualcomm 등이 헬스케어에 진출하고 있고 Intel, Agilent, Infinion, Affymetrix 등이 바이오칩에 사업을 추진 중이며 Sun Microsystems, Compaq, IBM, 히다치, 후지쓰 등이 생물정보 분야에 진출하고 있다.
마. IT융합기술 전략분야
미래사회는 건강한 삶, 쾌적하고 안전한 환경 등에 대한 사회적 필요와 이를 충족시키기 위하여 앞서 언급된 서비스 수요가 확대될 것으로 전망하고 정부는 IT융합기술 8개(생물정보분석SW, 바이오센서, 생체이미징, 바이오칩, 유해유기물센서, 생체신호인터페이스, 바이오데이터보호, 생체정보보호) 전략분야를 선정하였다.
도출된 핵심기술을 활용하여 미래사회의 서비스 수요를 최대한 충족할 수 있도록 전략서비스 분야로 건강환경도우미(Pervasive Lifecare Company)를 선정하였다. 건강환경도우미서비스는 개인의 건강상태를 실시간으로 감지하여 상시 건강관리와 응급상태 예방을 지원하는 u-헬스 서비스와 함께 실시간으로 사물 환경정보를 감지하여 환경오염 및 유해식품감지, 재난재해경보 등의 환경관련 서비스를 제공하게 된다.
[그림 3-1-6-7] IT융합기술 전략서비스 분야

바. IT융합기술 연구개발 및 산업화 추진계획
비만, 스트레스 등 건강상태 모니터링, 만성질환 등 질병 스크리닝, 유해환경 감시 등 건강하고 안전한 생활환경 구현을 위해 다양한 맞춤형 라이프케어 서비스를 구현하기 위한 밑바탕을 2015년까지 단계적으로 개발할 계획을 가지고 있다.
또한 단계적으로 개발된 국책연구 결과물을 조기에 산업화 하기 위하여 일부 지자체들을 통하여 사업화 기반을 구축 중이며 일부 제품이 상용화 되어 시판되고 있다.
IT융합기술 사업화 검증을 위한 표준 정형화된 테스트베드 플랫폼을 구현하여 지자체 등 시범단지에서 유그린케어와 유실버케어를 서비스함으로써 사업화 가능성을 체계적으로 확인할 수 있는 기반 조성을 계획하고 있다.
[그림 3-1-6-8] 테스트베드 구축을 통한 사업화 지원

IT융합기술의 기술이전 및 사업화 촉진을 위해서는 많은 시간과 예산지원이 요구되는 관계로 원천기술 개발부터 제품화 R&D, 표준화 선도, 사업화 지원, 국내외 시장창출을 위한 글로벌 마케팅까지 패키지화된 형태로 전주기적인 기업지원 전략수립이 필요하다.
인력양성을 위해서는 IT융합기술 특성에 맞는 맞춤형 현장기술 재교육시스템을 구축할 예정이다. 아울러, IT기업의 IT융합기술분야 투자확대 유도 및 관련 규제 완화를 위해 국책연구소의 기술이전, 공동연구개발 프로젝트 확대 등을 통해 사업화를 지원할 계획이다.
미래 신성장동력으로 주목 받는 ‘유헬스’가 교육에도 도입되어 서울 영락 유헬스고교는 국내 첫 u-헬스 특성화 교육기관으로 인가 받아 2010학년도에 유헬스시스템학과, 유헬스미디어학과에 신입생을 받아 유비쿼터스컴퓨팅, 멀티미디어 정보처리, 의료 데이터베이스 관리, 인체생리학, 의료용어 등 유헬스 전문인력을 양성해 배출할 예정이다. 첨단 IT 기술과 보건의료 서비스를 결합해 가정에서 휴대형단말기로 혈압이나 혈당을 측정하면 곧바로 병원에 자료가 전송되는 원격의료 서비스를 제공한다. 즉 기존 의료시스템에 인터넷, 모바일 등 IT 정보기술을 이용해 환자에게 원격으로 의료정보와 서비스를 제공하거나 환자의 건강상태를 원격으로 점검하여 가까운 병원이나 의사에게 연결시킨다.
IT융합기술의 다양성을 수용하고 사업화하기 위해 정부가 구심점이 되어 새로운 비즈니스관련 법․제도 개선, 융합기술관련 신제품·신기술관련 표준․안전 규격화 등 국내외적으로 표준을 수용하고 선도할 수 있는 토대를 마련하고 추진하는 것이 바람직하다. 유헬스 산업 활성화를 위해 의료법 일부 개정 법률안이 2009년말에 입법 예고되어 의료인과 환자 간의 원격의료서비스가 허용될 예정이다. 현재 금지되어 있는 의료인-환자 간 원격의료서비스를 가까운 미래에 허용함으로써 의료서비스 접근성 제고와 관련 산업이 육성될 것이다.
또한, 원격의료 관련 개인정보 보호규정과 원격의료 시 처방전 대리 수령근거 조항을 마련하여 온라인(on-line) 진단, 처방, 처방약 택배 서비스를 가능하게 할 예정이다. 따라서 도서·벽지, 교정시설 및 선박탑승자, 장애인, 노인 등 거동불편자인 의료사각계층 해소와 의료서비스 산업발전에 획기적으로 이바지할 전망이다. 관련 정부부처에서도 한정된 지역에 오천 명 이상, 일만 명 정도를 선정하고 임상시험을 통하여 원격의료 서비스를 시행하여 유헬스 산업의 신뢰성과 효과성을 검증하여 글로벌 마케팅을 염두에 두고 시행할 예정이다. 또한 경제 저성장과 고령화에 따른 국가재정의 악화에 대처하고 고령자의 건강과 복지를 효율적으로 제공할 수 있는 IT융합을 통한 고령친화산업 발전을 위해 IT융합형 고령친화제품 기술개발과 산업육성체계를 포괄하는 마스터플랜 수립도 추진 중이다.
향후 IT융합기술관련 신제품인 바이오패치, 스마트 약상자, 비채혈 혈당기, 바이오 칩 등 u-헬스관련 신제품․신서비스를 개발하여 제공시 만성질환, 심장질환 등에 대한 효과적인 관리로 건강하고 안전한 삶의 실현에 기여하고 의료비, 보험료 등 사회적 발생 비용의 절감이 예상된다.
7. 환경분야 생명공학 육성정책
가. 기술개발 필요성
(1) 환경생명공학기술
「환경기술 개발 및 지원에 관한 법률」에서는 “환경기술(Environmental Technology, ET)”을 환경의 자정능력을 향상시키고 사람과 자연에 대한 환경피해 유발요인을 억제․제거하는 기술로서 환경오염을 사전에 예방 또는 저감시키거나 오염 및 훼손된 환경을 복원하는 등 환경의 보전과 관리에 필요한 기술이라고 정의하고 있다. 여기에 전통적 환경기술인 환경오염 저감․예방 기술 이외에 친환경 소재․제품 개발, 생태계․생물 다양성 유지, 토양․지하수 복원, 기후변화 저감 및 적응에 필요한 기술 등으로 범위가 확대되고 있다.
환경기술(ET) 중에서도 환경생명공학기술(Enviro Bio Technology, EBT)은 환경오염을 저감․예방․복원시키기 위하여 생물과 생물학적 처리공정을 이용하는 생명공학기술(Biotechnology, BT)을 ET에 접목 또는 융합하는 기술로서 환경과학, 생태학, 분자생물학간의 유기적인 협조가 필요한 기술분야로 정의할 수 있다.
EBT는 BT의 기본적인 핵심기술32) 중에서도 생물공정기술(발효공정제어, 분리정제, 배양기 설계․제작)과 미생물이용기술(미생물분리․배양, 항암물질 탐색기술)을 주로 활용하고 있다. 이러한 EBT는 기존의 환경기술로는 극복하기 어려운 한계를 해결할 수 있다는 점에서 그 중요성이 부각되고 있으며, 근래 각 분야에서 첨단기술이 개발되고 있어 오염 환경 정화(remediation)는 물론 오염예방(prevention), 생물학적 방법에 의한 오염검출(detection)분야로 그 영역이 커질 것으로 전망되고 있다.
(2) 환경기술개발정책 패러다임의 변화
21세기 들어 생명과학, 신물질 개발, 정보기술의 발전 등 과학기술의 급속한 발전에 따라 새로이 등장하는 환경문제에 적극 대응하기 위해 환경기술개발의 중요성이 커지고 있다. 환경문제에 대한 인식이 메조수준의 단위시스템 관점에서 매크로(macro) 수준인 네트워크 개념의 사회통합적 관점으로 접근함에 따라 과학기술적 연구와 사회과학적 연구의 통합적 접근전략이 강화되고 있다. 이와 함께 분자생물학, 나노과학기술, 전자현미경 등의 발전과 맞물려 나노(nano)수준에서 환경문제에 대한 설명이 가능해짐에 따라 나노수준의 과학적 규명에 바탕을 둔 환경정책의 추진이 필요하다.
[그림 3-1-7-1] 환경기술개발 정책 패러다임의 변화

출처: 차세대 핵심환경기술개발사업 10개년(2001~2010) 종합계획, 환경부, 2002
특히, 최근에는 지구 온난화로 인한 기후변화 문제와 고유가 등 자원 위기가 현실적인 위협으로 등장하면서 에너지와 환경문제 해결이 국가 경제의 미래를 결정하는 주요 변수로 부각되었다. 우리나라도 ‘저탄소 녹색성장’을 새로운 국가비전으로 제시33)하면서 녹색기술과 청정에너지 개발을 새로운 성장동력으로 육성하기로 하여, 새로운 과학기술 지식을 바탕으로 한 정책 추진이 불가피해지고 있다. 이에 따라 환경분야에서도 기존의 환경기술(ET)에 생명기술(BT)을 접목 또는 융합한 신기술 개발 수요가 지속적으로 증가하고 있다.
나. 선진국의 ET/BT 융합기술 연구방향
차세대 기술 혁명은 어느 한 분야에 국한되지 않고 신기술 간 또는 이들과 타 분야와의 상승적 결합을 통한 융합기술(Converging Technology)이 주도할 것으로 예측되고 있다. 미, 일 등 주요 선진국들은 이미 국가 주도로 미래 국가 경쟁력 확보를 위해 융합기술에 대한 투자를 가속화하고 있으며 자국 산업의 경쟁력 확보차원에서 국제규모의 환경문제 대응기술 개발을 적극적으로 추진하고 있다.
아울러 생명과학의 발전에 따른 유전자 변형 동․식물을 포함한 유전자변형생물체(LMO)의 환경(인체, 생태계) 위해성 평가 분야와 내분비계 장애물질 문제가 중요한 사안으로 부각되고 있다. 따라서 기존 화학물질은 물론 의약산업․화학 산업의 발전에 따른 새로운 화학물질에 대한 위해성 평가 연구도 중요성이 커지고 있다. 생태계 훼손, 토양․지하수 오염은 장기간에 걸쳐 이루어지기 때문에 오염복원을 위한 비용도 막대하며 장기적으로 대처해야 하는 환경문제이다. 1990년대 이후 이 문제들이 중요하게 부각되면서 이에 대응하기 위한 생태계와 토양․지하수 보전 및 복원 기술도 집중 개발되고 있다.
그 중 가장 핵심적인 분야는 바이오에너지 개발과 폐자원의 에너지화 분야이다. 이는 석유위기 극복을 주목적으로 출발하였으나, 현재는 CO2 배출량 감축 등 지구온난화를 포함한 환경문제의 근본적인 해결방안이라 할 수 있다.
다. 차세대 환경기술개발사업 등 관련 EBT 분야
(1) 차세대 핵심환경기술개발 사업
환경부에서는 환경오염문제를 해결해 국민의 삶의 질을 향상시키기 위하여 2001년부터 2010년까지 총 1조원을 투자할 계획으로 차세대 핵심환경기술개발 사업(Eco-Technopia 21, ET21 사업)을 추진하고 있다.
[표 3-1-7-1] ET21 사업 투자계획
|
구 분 |
1단계 실적 (2001~2003) |
2단계 계획 (2004~2007) |
3단계 계획 (2008~2010) |
||
|
투자 (억 원) |
계 |
14,350 |
2,950 |
6,600 |
4,950 |
|
정부 |
10,000 |
1,950 |
4,600 |
3,450 |
|
|
민간 |
4,350 |
850 |
2,000 |
1,500 |
|
출처: 차세대 핵심환경기술개발사업 2단계(2004~2007) 연구기획, 환경부, 2003
현재까지 환경부에서는 ET21 사업에 총 10,971억 원(정부 출연금 7,788억 원, 민간부담금 3,183억 원)을 투자하여 총 1,225개 과제를 수행하고 있으며 상용화가 완료된 569개 과제에 대하여 409.4억 원의 기술료를 징수하였다.
이러한 기술개발 투자 성과로는 지적재산권 출원․등록 2,803건, 학술지 게재․학술회의 발표 13,023건 등의 과학기술적 성과를 이루었으며, 또한 국내외 제품 판매실적 667건에 6,614억 원, 공사실적 723건 8,942억 원의 성과를 이루었다(2009년 6월 기준).
한편 ET 21사업에서 추진 중인 생명공학 관련 사업은 난분해성 물질이 함유된 지표 유출수를 미생물 복합체를 이용해 관리하는 호소 및 폐쇄성 수역의 수질관리기술 개발과 같은 생태계 복원․관리 분야가 있다. 또 담수 수자원의 오염생물인 남조류, 마이크로시스티스의 게놈 및 전체 발현 유전체를 이용한 유해성 평가 및 관리기반 구축과 같은 위해성 평가․관리 분야가 있으며, 친환경 소재․제품분야와 ET/BT 융합 측정분석 장치 분야 등으로 대별할 수 있다. ET21 사업 중 BT 관련 투자 예산은 총 예산의 약 17% 수준이다.
[표 3-1-7-2] ET21 사업 투자현황(2001~2009)
|
사업년도 |
ET21 |
ET21 과제 중 BT 관련 과제 |
|||
|
협약과제수 |
국고지원금 |
협약과제수 |
국고지원금 |
% |
|
|
계 |
2,734 |
7,788 |
646 |
1,327 |
17 |
(2) 생태계 환경보전 사업
ET21 사업 이외의 생명공학분야로는 기후변화에 따른 과학적이고 장기적인 한반도 생태계 변화 관리체계와 생물다양성 보전대책 수립을 위한 “국가 장기 생태 연구사업”, 생물다양성 협약에 따른 각국의 치열한 생물주권 확보 경쟁에 대비하여 멸종 위기의 야생 동․식물을 복원하는 “생물자원보전종합대책 사업”이 있다. 또한 자생생물과 고유종, 그리고 해외 생물자원의 발굴․확보 관리 인프라를 구축하는 “생물자원 발굴․분류 연구사업”, 유전자변형생물체(LMO)의 환경방출에 따른 잠재적 위해성을 사전 예방하여 국내 자연생태계를 보전하고자 하는 “유전자 변형 생물체의 자연생태계 영향평가 및 안전관리 사업” 등을 추진하고 있다.
[표 3-1-7-3] 국가장기생태연구
|
국가장기생태연구 |
연구기간 |
2004년 12월 ~ 2013년 12월 |
|
연구비 |
396억('09년도 17억) |
|
|
연구목표 |
과학적이고 장기적인 한반도 생태계 변화 관리체계 확립 및 생물다양성보전대책 수립 활용 |
|
|
사업내용 |
기후변화에 따른 한반도 장기 생태계 변화 조사․연구 및 모니터링 기후변화 및 환경오염과 생태계 변화와의 상관관계 규명 생태계 변화에 따른 생물다양성 및 생물자원 보전정책 방안 연구 환경지표종 발굴 선정 및 특성 연구 기후변화와 환경오염에 따른 동물 생태․행동변화 연구 |
[표 3-1-7-4] 생물자원보전 종합대책사업
|
생물자원보전 종합대책사업 |
연구기간 |
2006년 1월 ~ 2014년 12월 |
|
연구비 |
1,078억 원('09년 69억) |
|
|
연구목표 |
생물다양성 협약에 따른 각국의 생물주권 확보 경쟁에 대비하여 국가생물자원 보전 |
|
|
사업내용 |
멸종위기 야생 동․식물 복원 유전자 변형생물체(LMO) 안전관리체계 연구개발 생물자원보전을 위한 대국민 홍보 |
[표 3-1-7-5] 생물자원 발굴분류연구
|
생물자원 발굴․분류 연구 |
연구기간 |
2006년 6월 ~ 계속 |
|
연구비 |
921억 원('09년 40억) |
|
|
연구목표 |
자생생물, 고유종, 해외 생물자원 발굴․확보 및 생물자원 정보 관리 인프라를 구축하여 생물산업 활용기반 마련 |
|
|
사업내용 |
한반도 자생 생물자원 탐색 조사, 표본․기타 생물재료(생체, 종자, DNA) 확보, 미발굴 생물자원 발굴 생물자원 DB 구축 및 국가 생물자원 관리시스템 구축 멸종위기종과 고유종의 유전자 분석 연구 및 유전다양성․유전체 정보 관리시스템 구축 |
[표 3-1-7-6] 제3차 전국자연환경조사
|
제3차 전국자연환경조사 |
연구기간 |
2006년 1월 ~ 2012년 12월 |
|
연구비 |
369억 원('09년 59억) |
|
|
연구목표 |
전국 자연환경현황 조사 및 변화 파악 |
|
|
사업내용 |
전국의 지형, 식생, 동․식물 서식지 및 분포현황 조사 |
[표 3-1-7-7] 유전자변형생물체의 자연생태계 영향평가 및 안전관리사업
|
유전자변형 생물체의 자연생태계 영향평가 및 안전관리사업 |
연구기간 |
2001년 7월 ~ 계속 |
|
연구비 |
'08년까지 26억 원('09년 5억) |
|
|
연구목표 |
LMO의 환경방출에 따른 안전성을 확보하여 국내 자연생태계 보전 |
|
|
사업내용 |
LMO의 자연생태계 위해성 심사 LMO가 자연생태계에 미치는 위해성 영향 연구 환경정화용 유전자변형식물체의 자연생태계 영향 연구 등 |
(3) 환경자원의 에너지화
환경부는 시장성, 성공 가능성이 높은 대규모 전략기술을 발굴하여 사업단 형태로 추진하는 「Eco-STAR Project」의 일환으로, 2007년 「폐자원 에너지화 및 non-CO2 온실가스 사업단」을 구성하여 폐자원 에너지화 분야에 대한 기술 개발에 본격적으로 착수하였다.
[표 3-1-7-8] 폐자원 에너지화 및 non-CO2 온실가스 사업단
|
사업단 |
한양대학교(단장: 윤성규 교수) |
|
사업기간 |
2007 ~ 2013 (6.5년) |
|
총사업비 |
715억 원(2009년 103억 원) |
|
목 표 |
◦유기성 폐기물 등을 대상으로 경제성 있는 친환경 에너지 확보 ◦non-CO2 온실가스의 효율적인 저감기술 개발 및 CDM사업화 |
|
기술개발 내용 |
◦유기성폐기물 에너지화 기술 ◦바이오매스 활용기술 ◦가연성 폐기물 연료화 기술 ◦CH4 포집 및 활용기술 ◦N2O 저감기술 ◦HFC, PFC, SF6 등 저감기술 ◦기타 non-CO2 저감 기술 ◦개발 기술의 CDM 사업 적용 |
이후 2008년 10월에는 관계부처34) 합동으로 “폐자원 및 바이오매스 에너지 대책”을 수립하여, 정부의 저탄소 녹색성장 비전의 ‘신재생 에너지 사용 확대’ 과제의 목표율 20%(’50년) 중 10%를 폐자원․바이오매스 에너지화 사업으로 실현하는 것을 목표로, 2030년까지 에너지화 관련 기술을 선진국의 90~95% 수준으로 달성하기 위해 총 1조 3,414억 원을 투자할 계획이다.
[그림 3-1-7-2] 폐자원 및 바이오매스 에너지 보급목표

출처: 폐자원 및 바이오매스 에너지 대책, 환경부 등 6개 부처 합동, 2008.10
라. 향후 추진방향
2006년 12월 과학기술혁신본부에서 발표한 “국가 R&D 사업 Total RoadMap” 투자 배분 방향에 따르면 “생명․에너지․자원․환경 및 기초과학”분야를 성장 잠재력 확보와 국민의 삶의 질 향상 측면에서 투자확대 분야로 선정하여 2020년까지 점진적으로 투자를 늘려야 하는 분야로 분류한 바 있다. 환경기술(ET)의 중요성이 점차 증대되고 있으며 또한 생명분야 기술과의 접목이나 융합의 필요성이 절실함을 시사하고 있는 대목이다.
21세기에 접어들면서 환경기술 개발은 현안인 환경오염문제를 해결하는 것뿐만 아니라 점증하는 국제 무역환경규제에 효과적으로 대응하기 위해서도 그 중요성이 더욱 증대되고 있는 실정이다. 환경기술 개발이 국가 경쟁력 제고에 필수요소가 되고 있는 것이다. 특히 다변화되고 복잡한 환경시장에서의 경쟁력을 확보하기 위해서는 기존 ET21 사업을 성공적으로 마무리하여 국내 ET 기술수준을 선진국 대비 80%까지 제고하는 한편, 환경기술에 BT/IT 등이 융합된 사전오염예방기술 분야 및 환경복원, 지구환경보전 등 공공 성격의 첨단 환경기술개발 등을 통하여 지속가능하고 신가치를 창출할 수 있는 기술개발에 적극적으로 투자를 확대할 계획이다.
8. 해양수산분야 생명공학 육성정책
가. 개요
해양생명공학기술(Marine Biotechnology, MBT)이란 ‘해양생물체 내에서 일어나는 현상, 구조 및 기능을 이해하고, 그로부터 얻어진 지식을 활용하여 제품을 생산하거나 서비스를 제공함으로써 산업과 인류복지 증진에 응용하는 과학기술’을 총칭한다.
해양생명공학기술의 원천이라 할 수 있는 해양생명자원은 이용 잠재력이 큰 차세대 신물질 개발의 보루이다. 현재까지 지구상에 서식하는 3천 5백만 종의 생명체 가운데 80%가 해양에 존재하며, 지구의 생명력을 유지시키는 2,000억 톤의 광합성량 중 90%가 해양에서 이루어지고 있다. 갯벌과 연안에서부터 심해, 열대, 한대에 이르기까지 다양한 해양환경에 광범위하게 분포하는 해양생물들의 가치는 기후조절, 오염물질 자정 능력만 계산하여도 육상의 2배인 연간 26조 달러에 이르는 경제적 가치를 지니는 것으로 추정된다.
해양생명공학산업은 해양생물체의 시스템, 구성성분, 과정과 기능을 활용한 제품과 서비스를 생산하는 산업을 의미하며, 정보통신산업 이후 국가 경제성장의 핵심 산업이 될 분야이다. 또한 고도성장의 잠재력을 가지고 향후 경제발전을 이끌 부가가치산업으로 기술·정보·지식 집약형 첨단산업이다.
2006년 OECD는 ‘생명과학에 의한 새로운 발견들이 관련 제품의 보급이나 서비스의 향상을 통하여 인류에 편익을 제공하는 다양한 경제활동을 포괄하는 새로운 개념’으로 IT 발전에 버금가는 효과를 갖게 될 것으로 전망하고 ‘바이오경제(Bio-Economy)시대’를 선언하였다.
국토해양부에서는 선진기술강국 진입을 목표로 하는 ‘제2차 생명공학육성기본계획(2007~2016)’ 수립에 따른 능동적 후속조치의 일환으로 국가상위계획과 부합되는 ‘해양생명공학육성기본계획(Blu-Bio 2016)’을 ’08년 10월에 수립하였다. 이로써 2016년까지 국내 BT시장의 10% 규모인 6.8조원의 산업화 시장을 창출하기 위해 해양생명공학기술개발사업에 매진해오고 있다.
[그림 3-1-8-1] 해양생물의 다양성
|
|
|
|
|
긴불레기말 (자료출처: 해양극한생물분자유전체연구단) |
문어다리불가사리 (자료출처: 해양극한생물분자유전체연구단) |
방패연잎성게 (자료출처: 해양극한생물분자유전체연구단) |
|
|
|
|
|
톱니하늘소갯민숭이 (자료출처: KIMST) |
산호군락-독도 (자료출처: KIMST) |
망상어 군집-독도 (자료출처: KIMST) |
해양생물은 육지와는 다른 해양의 높은 수압과 염도, 저온에 적응하며 진화하여 왔기 때문에 육상생물에서는 발견할 수 없는 특이한 대사물질과 생리활성물질 등을 생산한다. 이러한 해양생물이 가진 유용물질들에 대해 식품, 의약, 화학 등의 분야들이 큰 관심을 가지면서 해양생물은 생명공학의 주요 자원으로 급부상하고 있다. 더욱이 생물에 대한 주권을 인정함에 따라 유용한 생물자원을 선점하려는 국제적인 경쟁이 심화되고 있다. 미국, 일본 등은 70년대부터 전략적으로 전 세계 유용생물을 다량 확보하여 고부가가치 성장동력을 창출하고 있다. 그러므로 생명공학을 기반으로 하는 바이오산업 경쟁에서 살아남기 위해서는 원천소재인 생물자원의 안정적인 선점, 관리와 활용이 매우 중요하다고 할 수 있다.
해양생명공학분야는 특징적으로 해양천연물 또는 해양생물에서 기원한 의약재와 고분자물질, 화학소재 등을 생산하며, 원천기술 확보가 용이하여 독점적 물질특허권 확보가 가능하다. 또 유용신물질 발견률과 제품화 비율이 높으며 신제품 개발기간의 단축이 가능하고, 극한환경 미생물의 생체기능을 이용하기 위한 특수기술이 필요하다. 그리고 생물오손, 대량배양 등의 고유한 영역을 지닌다는 특징이 있다. 이러한 특징들은 해양생물자원을 활용하여 창출할 수 있는 분야의 다양성이 매우 높다는 것을 의미한다.
[그림 3-1-8-2] 해양생물의 적용분야

나. 주요국의 육성동향
(1) 미국
해양바이오와 관련된 모든 분야에서 세계 1위를 유지하는 것을 최우선 목표로 삼고 있는 미국에서 정책의 구현은 연방정부와 주정부의 특별집중지원으로 이루어진다. 연방정부는 1988년 생물공학 경쟁조정법을 제정하여 21세기 생물공학 주도정책을 수립한 바 있다. 주요 정책으로는 해양 10개년 계획(1966)을 시작으로 하여 Biotechnology for the 21st Century(1992), 신국가 해양정책(1999) 그리고 최근 An Ocean for the 21st Century(2004)를 새로운 국가 해양 정책으로 채택하고 중점 육성하고 있다.
(2) 유럽연합
유럽연합 내에서는 기본적으로 회원국 간의 경쟁과 화합이 공존하고 있으며, 해양생명공학에 있어서는 선두국인 미국과 일본을 추격하는 것을 목표로 정책을 추진하고 있다. 2000년 3월, 경제성장을 위해 리스본 전략을 채택하였으나 성과가 기대보다 미흡하여 2005년 3월에 신 리스본 전략을 채택하여 추진하고 있다. 유럽 해양생명공학협회(ESMB, European Society for Marine Biotechnology)는 1995년 프랑스에 설립되었으며, 유렵의 해양생명공학 연구를 고무시키고, 해양생명공학 연구와 교육 간의 국제적 협력에 이바지하는 것을 목표로 하고 있다. 또한, 삶의 질 향상과 유지, 부의 생산을 위해 해양생명시스템의 적용에 관한 연구를 증진시키는 한편 유럽 내 해양생명공학의 협동연구와 훈련에 집중하고 있다.
(3) 노르웨이
노르웨이 정부는 자국이 국제적으로 성공할 수 있는 기회를 가진 분야에 R&D를 집중하고 있는데, 성공기회가 있는 분야를 의학, 헬스, 식품, 생산, 해양으로 보고 관련 산업을 발전시키고 있다. R&D 집중을 위해 해양정책을 수산연안부(Ministry of Fisheries and Coastal Affairs)로 일원화 해 해상교통, 항만관리, 해양오염방제 등 해양관련 업무와 함께 수산분야를 통합관리하고 있다.
(4) 중국
중국은 세계에서 가장 많은 인구에게 안정적인 먹거리를 제공하고, 중대한 질병과 전염병 예방을 위한 생물의약 발전과 공공위생안전의 확보를 해양바이오정책의 최우선에 두고 있다. 관련된 정책으로는 해양생물로부터 신물질 개발, 양식기술 개발, 해양생태환경 보호기술, 유해적조 발생 방지, 연근해 해양생태계 및 생물자원의 지속적 이용을 목표로 하는 8, 9차 5개년 계획(1991∼2001)과 해양과학기술발전계획(2006∼2020)이 있다.
(5) 일본
일본은 정부주도하에 집중적인 연구개발 투자를 통하여, 장기적 전망의 해양개발을 구상하는 것을 정책목표로 하고 있다. 역사적으로 해양연구의 중요성을 강조해 온 일본은 2003년 10개년 계획으로 장기적 전망의 해양개발 기본구상 및 추진방안이라는 해양정책을 수립하였고, 국토교통성․문부과학성․농림수산성 등에서 해양과학기술을 주로 지원하고 있다.
일본해양과학기술연구센터(JAMSTEC)와 해양생명공학연구소(MBI) 등을 중심으로 산․학․연 합동연구가 진행되고 있으며, 이중 JAMSTEC은 대양연구 및 기술개발에 중점을 두고 연간 4천억 원 예산규모의 연구를 수행하고 있다. 주요정책으로는 경제산업성(METI)에서 바이오산업을 육성․리드하고 있으며, 2000년부터는 5개 부처에서 공동으로 육성․추진하고 있다.
다. 국내현황
우리나라는 2004년 ‘해양과학기술(MT) 개발계획’ 수립 이후 표면적으로는 선진국에서 추진되고 있는 해양생명공학 연구의 대부분을 수행하는 것으로 나타나 있지만, 실제로는 선진국 기술 수준의 55% 정도로 매우 낮은 수준에 머물러 있다.
지구상 동식물의 대부분이 해양에 집중적으로 서식하고 있으나, BT분야 녹색성장과 신성장동력의 핵심분야인 우리나라의 해양바이오기술 관련 정부 R&D 투자는 430억 원으로 BT 투자규모의 3%에 불과하다(2007년 기준). 이는 해양생태계가 지구생태계에서 차지하는 규모와 생물다양성, 바이오매스 등의 중요성을 고려할 때 매우 낮은 비중이다.
[표 3-1-8-1] 해양바이오 투자 현황
|
구 분 |
2006년 |
2007년 |
||
|
금액(억 원) |
비중(%) |
금액(억 원) |
비중(%) |
|
|
BT 전체 투자 |
13,019 |
100 |
15,063 |
100 |
|
해양바이오투자 |
412 |
3.16 |
430 |
2.85 |
출처: 2008년도 국가연구개발사업 조사․분석보고서, KIMST 분석자료
우리나라는 육지 면적의 4.5배에 달하는 44만 3천㎢의 관할해역을 보유한 천혜의 해양국가로서, 생명공학(BT)과 정보공학(IT) 강국이다. 또한 해양소재에서 제품화 성공률은 1/6,000로서 육상생물소재의 1/12,000보다 그 효율성이 두 배나 높아 해양생명산업의 발전 가능성과 가치는 어느 나라보다도 높다.
세계 각국은 자국의 문화나 특성에 따라서 정책의 방향, 연구기관의 특징, 연구지원 형태 등이 다양하다. 따라서 우리는 우리나라의 문화와 산업 특성에 맞는 정책이 설정되어야 한다. 또한, 한국의 강점을 잘 살릴 수 있는 연구 분야에 집중 지원하되, 해양생명공학의 중요성을 간과하지 않고 전 분야에 고른 지원 육성책이 필요하다. 최근 해양바이오에 대한 범부처 육성정책에 대한 계획이 발표되고 있어 해양바이오에 대한 인식의 전환과 투자의지가 고조되고 있다.
해양바이오기술(MBT, Marine Biotechnology)은 선진일류국가를 향한 정부의 과학기술기본계획(577 Initiative)의 7대 중점투자분야에서 “신산업 창출을 위한 핵심기술개발 강화”과제를 실현하는 핵심기술분야이며, 녹색기술 연구개발 종합대책에서 “녹색기술 선진화를 통한 녹색강국 건설” 실현을 위한 27개 중점육성기술에 해당한다(2009. 01. 국과위). 또한 신성장동력비전 및 발전전략에서 단순한 에너지 절감 분야가 아닌 미래 성장의 바탕이 되고 융합을 통해 기존 산업고도화와 신산업 창출이 가능한 분야로 선정되었다.
[표 3-1-8-2] 17개 신성장동력 분야
|
3대 분야 |
17개 신성장동력 |
|
녹색기술산업(6) |
신재생에너지(해양바이오연료), 탄소저감 에너지, 고도 물처리, LED 응용, 그린수송시스템, 첨단 그린도시 |
|
첨단융합산업(6) |
방송통신융합산업, IT융합시스템, 로봇 응용, 신소재․나노 융합, 바이오제약(자원)․의료기기, 고부가 식품산업 |
|
고부가서비스산업(5) |
글로벌 헬스케어, 글로벌 교육서비스, 녹색 금융, 콘텐츠․소프트웨어, MICE․관광 |
또한, 이명박 대통령은 “해양바이오산업 활성화를 위한 간담회(2009. 2. 10)”에서 해양바이오 R&D 투자확대 후속 조치를 지시한 바 있다. 이에 따라 금년 7월 새로운 국정패러다임인 녹색성장을 견인할 범부처 차원의 ‘해양바이오활성화 대책’을 마련하였다.
[표 3-1-8-3] 해양바이오 활성화 대책 주요목표
|
3대 분야 |
17개 신성장동력 |
|
투자확대 |
핵심연구개발 및 대형연구기반 구축을 위해 향후 5년간('10~'14년) 총 9,155억 원 투자(BT 연구개발의 7%) - 핵심연구개발(6,615억 원) : 해외생물자원확보, 신의약, 해양바이오에너지, 신소재 등 - 대형인프라구축(2,540억 원) : 해양생물자원관 건립, 대형해양과학연구선 건조 등 * (`'05-`'09년간 투자규모 3,277억 원의 2.8배 수준) |
|
기술수준 |
선진국 대비 55%(`'07년)인 기술수준을 80%(`'14년) 수준으로 제고 |
|
부가가치 |
3,185억 원('06년)에서 6조 7천억 원('16년) 규모로 확대 |
해양생명공학사업(舊 마린바이오 21)은 국토해양부의 대표적인 생명분야 R&D사업으로서 ‘건강한 생명사회 지향(신의약․신물질 개발), 해양바이오산업 신소재 개발 등을 위한 해양생명자원의 선행적 확보와 이를 효율적으로 이용하기 위한 핵심기술 개발’을 목표로 2004년부터 계속과제로 추진해 오고 있다. 본 사업은 세계 해양생명 산업시장의 5%(연 1조 원, 2013년 기준) 점유를 목표로 2004년부터 핵심기술 확보와 특화기술의 산업화연구를 수행 중에 있다.
2009년 사업비는 15,019백만 원으로 해양․극한생물분자유전체연구단, 해양바이오프로세스연구단 및 해양천연물신약연구단 등 3대 주요 중점과제를 연구단 규모로 각각 한국해양연구원, 부경대학교, 서울대학교에서 수행 중에 있다. 이 외에도 해양바이오수소 생산기술개발(한국해양연구원), 해양바이오에너지 연구, 해외생물자원 연구 등의 중형과제가 있다. 또한, 해양생명체 유래 산업신소재 개발(포항공과대학교)과 해양생명자원기탁등록기관(서울대학교, 부경대학교, 이화여자대학교, 신라대학교, 한남대학교, 군산대학교) 등의 단위과제도 추진하고 있다.
이를 통해 해양생명공학사업은 해양특이생물과 극한생물의 분자유전체 연구를 통한 해양생물자원의 새로운 이용기술개발과 제품화, 해양산업용 신소재 및 해양기능성 식품․환경성 소재 개발, 신약 후보물질과 질병 치료제 개발 등을 통해 해양바이오기술을 활용한 해양생물자원의 고부가가치 산업화를 실현해 가고 있다.
이러한 해양생명공학사업의 성과를 타 부처의 바이오사업과 단적으로 비교하기는 곤란하나 수치만을 놓고 볼 때, 해양생명공학사업의 투자 금액 대비 성과가 2배 정도에 이른다. 또한 계획 대비 사업목표 달성도(학술적․기술적 연구실적, 상용화․실용화 실적, 연구 인프라 실적, 연구 성과 확산 실적 등)에 있어서도 매우 높은 성과를 내고 있다.
※ 2004∼2008년 까지 - SCI급 논문(423편), 국내특허출원(221건), 국내특허등록(94건), 국외특허출원(81건), 국외특허등록(5건), 시제품(22건), 기술이전(9건)
라. 향후추진계획
해양생명공학사업은 막대한 초기자본이 필요한 분야로 민간차원에서는 추진이 불가능하여 국가차원의 집중적인 육성이 필요하다. 또한 유엔해양법, 생물다양성협약 등 국제적으로 생명자원의 이용을 제한하는 추세에 따라 해양생물자원 확보를 위한 국가 주도의 체계적인 사업을 추진하여야 한다. 미국, 일본과 EU 등은 20~30년 전부터 해외의 생물자원을 확보하여 고부가가치 성장동력을 창출 중이며, 국내의 경우 교과부와 환경부에서 2006년부터 육상생물자원 위주로 사업을 추진하고 있다.
국토해양부에서는 국제적 해양생물자원의 상업화에 대처하고 해양생물에 대한 국가주권을 확보하여 해양생명산업을 21C 국가전략 산업분야로 집중 육성하기 위하여 ‘해양생명자원마스터플랜’ 과 ‘제2차 국가생명공학육성 기본계획 및 시행계획(Bio-Vision 2016)’ 수립에 대한 ‘해양생명공학육성 기본계획(Blue-Bio 2016)’을 수립하였다. 2009년 9월에 ‘해양생명공학 육성을 위한 세부시행계획’을 수립하여 체계적으로 추진할 계획이다. 이 계획은 그 동안 저투자·저인식 되어왔던 해양바이오를 고부가 신성장동력으로 업그레이드 시킬 수 있는 매우 적절한 계획이라 할 수 있다.
또한 지난 2004년부터 실시해오고 있는 해양생명공학사업에 대한 체제를 효율적으로 개편하고 주기가 매우 빠른 생명공학의 세계적 트렌드에 발맞춤은 물론, 미개척 분야에 대한 원천기술을 확보하여 “세계 7대 해양강국을 실현하여 국민소득 4만 달러 시대를 견인”한다는 비전을 제시하고 있다.
이를 기반으로 정부는 해양생명산업이 활성화 될 수 있도록 지원․육성하고 해양바이오기업을 고부가가치 해양바이오산업체로 전환하며, 산․학․연의 연구를 강화하는 등 민간이 할 수 없는 다양한 공공분야의 투자와 인프라 구축을 적극적으로 주도해 나갈 것이다.
[그림 3-1-8-3] Blue-Bio 2016의 비전 및 목표
|
구 분 |
2006년 |
2016년 |
|
|
과학․기술논문 창출 |
24위 |
7위 |
|
|
특허기술경쟁력 |
13위 |
7위 |
|
|
산업화시장창출 |
해양생명공학 분야 |
2,800억원 |
6조원 |
|
해양생명자원 분야 |
385억원 |
6,800억원 |
|
|
핵심 연구개발인력양성(석․박사) |
850명/년 |
2,000명/년 |
|
|
미래생명자원 확보(세계미생물자료센터) |
9,400주 |
30,000주 |
|
|
정보화 및 연계(유전체, 단백질체 등의 정보) |
100,000클론 |
300,000클론 |
|

[그림 3-1-8-4] 단기산업화 성과
|
|
ㅇ 고효율 DNA polymerase - 남태평심해열수구 초고온성 고세균으로부터 인간유전체에 대한 유전자 증폭제 개발 - '07년 (주)바이오니아(기술료:15백만원+국제특허비용), (주)씨젠(기술료:20백만원+국제특허비용)에 기술이전을 통해 제품 생산 ※ '07년 국가연구개발사업 우수성과 100선 ※ '09년 국가연구개발사업 우수성과 총람 |
|
|
ㅇ 홍합유래 생체접착제 세계최초 개발 - 홍합에서 기존의 봉합사를 대체하는 의료용 생체접착제 개발 - 주)Kollodis Bioscience 기술이전('07.4) - 기술이전료 : 주식지분의 10%, 로열티 4%, '09년부터 상품판매예정) - 4,000억 규모의 수입대체 효과 기대 ※ '08년 국가연구개발사업 우수성과 100선 |
|
|
ㅇ 수용성 칼슘흡수 촉진제 개발 - 해양생물부산물부터 칼슘흡수 촉진제 생산기술을 개발하여 기술이전 완료('09) |
|
|
ㅇ 매생이를 이용한 혈청지질 개선 및 간보호 기능성식품 개발 - 기술이전('05.11.)을 통하여 제품 생산 (기술이전료 61백만원, '08년 상품판매액 96백만원) |
|
|
ㅇ 해양한방기능성 화장품 개발 - 항산화, 자외선차단, 미백 등 기능성 화장품을 개발하여 시제품생산 |
|
|
ㅇ 해양천연항암물질 개발 - 세계 최초로 해양미생물(디노피시스) 대량배양기술을 확보하여 천연항암물질인 PTX-2를 대량생산 기반 마련 - 신규바이오 법인에 기술이전 - 해양천연물항암물질 대량생산기술 확보에 따른 고부가가치 창출 |
|
|
ㅇ 흑진주 조개 양식 성공 - 해양에서 가장 높은 생물다양성과 생산성을 지니는 열대 산호초 해역에서 흑진주 대량배양에 성공하여 국내 수입 대체효과와 연간 6천만 불 이상 규모의 수출가능 ※ '08년 국가연구개발사업 우수성과 100선 |
[그림 3-1-8-5] 중장기산업화 성과(5~10년 이내 산업화 가능)
|
|
ㅇ 해양생물이용 바이오에탄올 개발 - 경제성 분석결과, 해조류 총 34만톤을 생산하는 경우 연간 약 1조원의 원유절감 가능 |
|
|
ㅇ 해양생물이용 바이오디젤 개발 - 차세대 바이오에너지 개발을 위한 조류배양공정기술 확립하여 3년 이내 실용화 및 산업화 |
|
|
ㅇ 초고온세균 유래 해양바이오수소 개발 - 심해열수구에 사는 초고온성세균으로부터 해양바이오수소를 개발('08. 10) - 고효율, 경제성을 갖춘(8개의 수소화효소군, 제조단가 수소1kg 당 $0.8) 수소생산 효소발굴로 미래 청정에너지 개발 ※ '09년 국가연구개발사업 우수성과 총람 |
|
|
ㅇ 해양바이오 플라스틱 개발 - 해양생물을 이용하여 석유기반 화학제품을 바이오화학제품으로 전환하여 친환경 소재 개발 |
|
|
ㅇ 해양동물을 이용한 기억조절기작 규명 - 단기기억을 장기기억으로 전환할 수 있는 핵심단백질을 발견 - 치매, 건망증치료와 불행한 기억을 지우는 약재를 개발하기 위한 기초 연구로 세계적 주목 ※ 저명국제학술지 Cell(2007)에 게재 ※ '07년 국가연구개발사업 우수성과 100선 |
|
|
ㅇ 획기적인 동맥경화치료 선도물질 개발 - 혈관내 지방축적을 억제하고 동맥경화발병율을 25% 이상 억제하는 물질개발 ※ 저명국제학술지 PNAS(2008)에 게재 |
|
|
ㅇ 비만치료 원천물질 개발 - 지방을 태워 열로 발출하여 비만을 치료하는 비만치료물질 개발 |
|
|
ㅇ 당뇨치료 원천물질 개발 - 세포내의 과도한 당을 태워 혈당을 낮추는 당뇨치료 원천 물질 개발 ※ 저명국제학술지 PNAS(2008)에 게재 |
|
|
ㅇ 지구력 강화 원천물질 개발 - 운동시간과 거리를 월등히 증가시키는 지구력 강화물질 개발 ※ 저명국제학술지 PLoS(2004)에 게재 |
|
|
ㅇ 슈퍼박테리아용 항생물질 개발 - 세계 최초로 해양미생물에서 분리된 슈퍼박테리아용 항생물질 개발로 신약개발 원천물질 수급 문제 해결 |

Bio-Vision 2016의 추진현황
1. 제2차 생명공학육성기본(Bio-Vision2016) 개요
가. 중점추진 방향
제1차 기본계획으로 확보된 연구기반을 바탕으로 세계적인 원천기술을 확보하고 성과 실용화를 위한 핵심 인프라를 강화하는 일에 중점을 두고 추진한다.
나. 비전과 목표
[그림 참고-1] 비전과 목표

다. 4대 추진전략
[그림 참고-2] 4대 추진전략

2. 제2차 생명공학육성기본계획 추진실적
가. 과학․기술 논문 창출 실적
(1) 논문실적
SCIE 게재논문 세계 순위를 보면 1994년에 420건으로 29위에서 2008년 5,755건으로 11위를 차지했다. 이는 연평균 20.6%의 증가세로 급성장을 하고 있는 추세이며, 세계 상위 국가들과 질적으로도 차이가 감소하고 있다. 평균 피인용 회수 차이는 1994∼1997년에 2.0배에서 2006∼2007년 기간에는 1.7배로 감소하고 있다.
SCIE 게재 논문 건수로 본 2008년 논문게재 세계 순위는 11위로 지속적으로 증가하고 있어 2016년까지 무난하게 7위를 달성할 것으로 예상된다.
[그림 참고-3] 바이오분야 SCIE 논문 실적(1994∼2008)

[표 참고-1] SCIE 게재된 생명공학분야 논문의 국가별 비교
|
국가/연도 |
'94~'97 |
'98~'01 |
'02~'05 |
'06~'08 |
총합계 |
'08순위 |
|
미국 |
188,627 |
205,363 |
223,551 |
184,383 |
801,924 |
1 |
|
일본 |
51,417 |
66,233 |
66,806 |
47,799 |
232,255 |
2 |
|
영국 |
54,147 |
63,619 |
64,557 |
48,057 |
230,380 |
3 |
|
중국 |
4,190 |
11,571 |
25,527 |
38,901 |
80,189 |
4 |
|
독일 |
43,263 |
55,024 |
58,110 |
45,293 |
201,690 |
5 |
|
프랑스 |
37,551 |
44,076 |
42,853 |
32,405 |
156,885 |
6 |
|
캐나다 |
27,336 |
30,275 |
33,566 |
28,456 |
119,633 |
7 |
|
이탈리아 |
24,043 |
30,147 |
33,424 |
27,001 |
114,615 |
8 |
|
스페인 |
15,001 |
20,638 |
24,484 |
21,548 |
81,671 |
9 |
|
오스트리아 |
15,569 |
19,922 |
22,093 |
18,845 |
76,429 |
10 |
|
한국 |
4,175 |
9,103 |
14,155 |
15,203 |
42,636 |
11 |
|
브라질 |
4,961 |
9,116 |
13,393 |
14,358 |
41,828 |
12 |
(2) 특허실적
기술력 지수35)는 1994∼1997년, 21위에서 2006∼2008년, 14위로 상승하고 있으며, 미국등록 특허는 1994∼2006년, 697건 중 472건이 2002∼2008년 간 등록되는 등 점차 상승하는 추세를 보이고 있다. 미국등록 특허건수와 기술력지수는 매년 상승하고 있어 2016년 특허기술 경쟁력 7위 달성이 가능할 것으로 보인다.
[표 참고-2] 미국등록특허의 국가별 기술력지수(TS) 현황
|
국가 |
1994∼1997 |
순위 |
1998∼2001 |
순위 |
2002∼2005 |
순위 |
2006∼2008 |
순위 |
|
미국 |
12,111 |
1 |
24,497 |
1 |
11,808.75 |
1 |
11,367.00 |
1 |
|
독일 |
403 |
3 |
804 |
5 |
837.29 |
2 |
706.76 |
5 |
|
영국 |
384 |
4 |
948 |
3 |
591.44 |
5 |
1,055.29 |
3 |
|
일본 |
687 |
2 |
1,050 |
2 |
738.30 |
3 |
1,131.51 |
2 |
|
캐나다 |
311 |
5 |
862 |
4 |
424.27 |
6 |
591.21 |
6 |
|
프랑스 |
223 |
8 |
519 |
6 |
367.31 |
7 |
371.49 |
7 |
|
네덜란드 |
306 |
6 |
355 |
8 |
608.21 |
4 |
882.54 |
4 |
|
이탈리아 |
61 |
14 |
97 |
15 |
118.34 |
13 |
54.30 |
18 |
|
이스라엘 |
71 |
13 |
207 |
11 |
107.20 |
14 |
150.38 |
13 |
|
대한민국 |
13 |
21 |
78 |
17 |
85.05 |
15 |
138.37 |
14 |
|
핀란드 |
36 |
17 |
79 |
16 |
75.79 |
17 |
55.35 |
17 |
|
인도 |
8 |
23 |
33 |
20 |
76.41 |
16 |
78.84 |
16 |
(3) 인력양성
연구인력은 2005년 9,682명에서 2008년 9,698명으로 크게 증가하지 않았으나, 2016년 목표인 17,300명의 56% 수준을 달성하였다. 석사급 인력의 달성률은 54%이며, 박사급 인력의 달성률이 61%로 박사급 인력의 증가율이 높았다. 이는 바이오산업의 성장으로 고급인력에 대한 수요가 지속적으로 존재하고 있어 석사에서 박사로 많은 인력이 이동하기 때문이다.
[표 참고-3] 핵심연구인력 양성 현황
(단위: 명)
|
|
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
2016 (목표) |
실적 (%) |
|
석사 |
5,943 |
6,262 |
6,702 |
7,028 |
6,980 |
7,048 |
6,887 |
12,700 |
54 |
|
박사 |
2,023 |
2,345 |
2,525 |
2,654 |
2,494 |
2,751 |
2,811 |
4,600 |
61 |
|
합계 |
7,966 |
8,607 |
9,227 |
9,682 |
9,474 |
9,799 |
9,698 |
17,300 |
56 |
※ 실적은 목표대비(2016년) 목표의 달성률을 표기
(4) 정부투자 및 산업화 시장
정부투자는 2005년 6,736억 원에서 2008년 9,763억 원으로 크게 증가하였으며, 2016년 목표인 21,843억 원의 44%를 달성하였다. 산업화 시장창출은 2005년 27,714억 원에서 2007년 37,139억 원으로 크게 증가하였으나, 2016년 목표인 60조의 6%를 달성하였다.
[표 참고-4] 정부투자 및 사업화 시장 현황
(단위: 억 원)
|
|
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
2016 |
실적(%) |
|
정부투자 |
4,497 |
5,302 |
6,016 |
6,736 |
8,270 |
8,793 |
9,763 |
21,843 |
44 |
|
산업화 시장(생산) 창출 |
18,934 |
20,791 |
24,199 |
27,714 |
31,595 |
37,139 |
- |
600,000 |
5 |
※ 실적은 목표대비(2016년) 목표의 달성률을 표기
[표 참고-5] 기본계획 실천과제별 추진실적
|
전 략 |
실천과제 |
2007년도 추진실적 |
2008년도 추진실적 |
|
국가 생명공학 육성 추진체계 혁신 |
1. 생명공학 분야 전략적 투자 강화 및 효율화 |
<교육과학기술부> ○생명공학 중장기 계획 수립 - 생명자원 마스터 플랜 수립 ○평가결과 및 정책조정 결과의 예산 반영 강화 ○기초연구과제 중 생명과학분야 지원 확대(39.3%) |
<교육과학기술부> ○바이오분야효율화전략수립 등 으로 R&D 투자효율성 극대화 추진 |
|
<농림수산식품부> ○생명공학 중장기 계획수립 -생명공학 포함 농림기술로드맵 작성을 위한 연구용역 시행 |
<농림수산식품부> ○농산업R&D로드맵 작성 -생명공학분야를 포함한 기술발전 전망 등 수립 |
||
|
<지식경제부> ○미래전략산업 육성전략 수립에 관한 연구용역 시행 ○바이오기술 해외협력 수요조사 및 기술협력 활성화 방안 연구 |
<지식경제부> ○지식경제통합기술청사진 수립 ○바이오제약․의료기기 분야 신성장동력 발굴 ○바이오화학산업 중장기발전전략 수립(용역) |
||
|
<보건복지가족부> ○중장기 복지부 R&D 로드맵 수립 |
<보건복지가족부> ○2020 보건의료 R&D 전략수립 - 보건의료R&D의 미래전망 및 비전, 유망전략분야 발굴 |
||
|
<국토해양부> ○‘해양생태계의보전및관리에관한 법률’시행 ○해양생명자원종합관리방안 수립 ○해양생명공학육성기본계획 수립 ○해양생태계기본계획 수립 ○해양생물다양성보전대책 수립 |
<국토해양부> ○해양생명공학육성 기본계획 수립 |
||
|
2. 범부처 종합 조정 기능 강화 |
<교육과학기술부> ○바이오 실무협의회 운영 및 분과위원회 설치 |
<교육과학기술부> ○바이오 실무협의회 운영 강화 |
|
|
<지식경제부> ○바이오산업전략회의 운영 |
|
||
|
3. 생명공학 정책 분석평가 체계 확충 |
<교육과학기술부> ○BT의 정의, 범위 및 분류체계 개선 추진 |
<교육과학기술부> ○BT의 정의, 범위 및 분류체계 개선(안) 확정 |
|
|
<지식경제부> ○2007년 국내 바이오산업 통계 발간 |
|||
|
연구개발 선진화 기반 확충 |
1. 국가생명 공학 기초연구 역량의 선진화 |
<교육과학기술부> ○창의적 기초, 원천기술 지원강화 - 생명공학분야 원천기술개발연구 지원 ○한국의 특성화 연구개발 강화 - 전통의학에 기반한 진단 및 약물치료 시스템개발사업 지원 ○기초연구 역량을 위해 생명과학분야 총 460과제 지원 |
<교육과학기술부> ○창의적 기초, 원천기술지원강화 - 생명공학분야 원천기술개발연구지원 ○한국의 특성화연구개발강화 - 전통의학에기반한 진단 및 약물치료시스템개발사업지원 |
|
<농림수산식품부> ○국내 유전자원의 특성화 연구개발 강화 - 유용유전자 대량발굴 및 신기능 형질전환체 개발 |
<농림수산식품부> ○한국의 특성화 연구개발 강화 - 유용유전자 대량발굴 및 신기능 형질전환체 개발 ∙농생물 비교유전체 분석을 위한 DB구축(174,343개) : 배추 23,500개, 벼 59,728개, 애기장대풀 46,115개, 기타 45,000개 ∙유전자기능 및 단백질 정보구축 : 259,126개, 단백질서열 및 기능 정보 53,384개 ∙벼 종자 발현 유전자 DB구축 : 32,628개 ∙바이오연료관련 유전자 DB구축 : 25,588개 |
||
|
<지식경제부> ○바이오스타 창출을 위한 Total Solution지원 |
<지식경제부> ○바이오․의료기기원천기술개발사업 추진 |
||
|
<환경부> ○차세대 핵심 환경기술사업 추진 ○생물자원 발굴․분류 연구 ○국가장기생태 연구 ○유전자변형생물체가 자연 생태계에 미치는 영향 연구
|
<환경부> ○차세대핵심환경기술개발사업 추진 -연구개발비 46억원 지원 -특허등록 3건, 특허 출원 22건, SCI 논문게재 25건 등 ○토양지하수오염방지기술개발 사업추진 -연구개발비 15억원 지원 -특허출원 1건, SCI 게재 2건, 기술료 1건 등 ○국가장기생태연구사업 -논문발표 9편(SCI 3편, 일반논문 6편) ○국가 생물자원의 발굴·확보 및 체계적 보전·관리 기반 구축 ○유전자 변형생물체의 자연생태계 영향평가 및 안전관리 사업 -LMO의 자연생태계에 미치는 영향연구 : 논문 4편 게재(SCI 2, 일반논문 2) |
||
|
<국토해양부> ○해양생물다양성연구사업 ○해양·수산LMO위해성관리방안 연구 |
<국토해양부> ○해양생물 국가주권 확보 기반구축을 위한 국립해양생물자원관 건립 |
||
|
2. 환경변화에 대응한 생명공학 인력 양성 강화 |
<교육과학기술부> ○해당과제 지원을 통해 연구원, 연구 보조원 등 학문후속세대 양성 |
<교육과학기술부> ○신규과제 확대로 다양한 연구인력 양성 지속 추진 |
|
|
<농림수산식품부> ○단기소득산림자원개발 인력양성 |
|
||
|
<지식경제부> ○BT교육시스템 혁신 지원 및 융합화학 기술인력 양성 ○바이오 실용화 장비 운영기술 교육사업 ○경남바이오 혁신을 위한 산업체 인력 재교육 |
<지식경제부> ○산업체 연구역량 강화, 산업수요에 맞는 실용형 인재공급을 위한 수요 조사 ○현장기술인력 재교육 강화 |
||
|
<보건복지가족부> ○국가임상시험사업단 선정 |
<보건복지가족부> ○의료기기임상시험센터 지원 ○국가임상시험사업단 지원 확대 |
||
|
3. 국제공동 연구 및 국제 협력 활동의 내실화 |
|
<농림수산식품부> ○6개국과 12과제 수행 |
|
|
<지식경제부> ○BIO KOREA 2007 개최 |
<지식경제부> ○BIO USA 한국대표단 파견 ○바이오안전성 당사국총회 참석(5월) ○BCH워크샵개최(UNEP와 공동, 20개국) |
||
|
<보건복지가족부> ○아스트라제네카 신약공동개발추진 ○국제협력사업 지원 |
<보건복지가족부> ○아스트라제네카 신약공동개발 추진 |
||
|
<국토해양부> ○2007해양천연물신약 국제학술대회 개최 ○열대해양생물 연구를 위한 기초연구시설 확충
|
<국토해양부> ○2008해양천연물신약 국제학술대회 개최(11.5∼7, 서울 리츠칼튼) ○선진국과의 MOU 체결을 통한 신약개발 노하우 및 해양천연물 확보 ○Asia-Pacific 해양생명공학회 개최(11.12∼15, 부산 벡스코) ○해외 해양생물자원 확보를 위한 국가교류 확대 |
||
|
4. 생명공학 연구개발 인프라의 확충 |
<교육과학기술부> ○국가 생명자원 확보․관리 및 활용 마스터 플랜 수립 ○국가생명자원 종합관리 기반 확충 및 제도 정비 ○첨단연구를 위한 공통기반 및 설비 확충 |
<교육과학기술부> ○국가생명자원 종합관리 기반확충 및 제도정비 -국가생명연구자원정보표준화 및 검색분석시스템구축사업지원 ○첨단연구를 위한 공통기반 및 설비확충 - 생명자원등록활용사업지원 |
|
|
<농림수산식품부> ○농업유전자원의 국가관리체계 확립 및 활용 ○농업생명공학정보 전산화 및 국가 활용 체계 구축 - 농업생명공학 육종정보 연계 활용 시스템 및 생물정보 DB구축 |
<농림수산식품부> ○ 국가 생명자원 종합관리 기반확충 및 제도정비 - 농업유전자원의 국가관리체계 확립 및 활용 ∙농업유전자원 신규 등록 : 1,587점(종자), 1,855점(미생물) ∙농업유전자원 분양 : 3,728점(종자), 2,144점(미생물) ∙유전자원DNA Bank 구축 : 3만점, 22작물 316,000건 DNA 프로파일 구축 |
||
|
<지식경제부> ○생물산업기술실용화센터 준공 - 임상시험용 시료 위탁생산 등 ○Korea Bio Hub 구축 사업 추진 - 지역 바이오클러스터간 네트워크 구축 ○기능성식품 임상시험센터 구축 |
<지식경제부> ○기능성식품 임상시험 센터 설립 |
||
|
<환경부> ○생물자원보전종합대책 ○국립환경과학원 내 환경바이오 안전과 신설 및 연구시설 확충 등 |
|
||
|
<국토해양부> ○국내 해양천연물은행 구축 ○해양극한생물, 환경유전체 확보 ○해양생명자원의 종합관리방안 기획 연구 수행
|
<국토해양부> ○해양생명자원 기탁등록기관(6개)지정 ○해양생명자원 종합관리 기반확충 및 제도정비 ○세계해양천연물은행 구축 ○해양극한생물자원뱅크 운영 및 분양 ○해양극한생물정보 뱅크 구축 |
||
|
바이오 산업의 발전 가속화 및 글로벌화 |
1. 생명공학 실용화/산업화 연구개발 지원 가속 |
<농림수산식품부> ○‘농림바이오기술 산업화지원’기획 ○‘농림바이오 육성 방안 용역연구’ 실시 |
<농림수산식품부> ○바이오상품화를 촉진하는 산업화 기술개발 - 농림BT산업화지원 사업단 선정 |
|
<지식경제부> ○생물산업기술실용화센터 준공 - 임상시험용 시료 위탁생산 등 ○산업화 주도형 바이오클러스터 추진 전략 연구용약 시행 ○해외 사례연구를 통한 국내 클러스터 지원방안 연구용역 |
<지식경제부> ○기업지원기반 확충 - 피부생명공학센터 - 바이오벤처프라자 - 해양생물산업육성센터 - 바이오산업지원센터 - 한방바이오산업 임상지원센터 |
||
|
<보건복지가족부> ○중개연구지원 ○혁신형 연구중심병원 지원 |
<보건복지가족부> ○중개연구 프로그램 확대 -단독중개,협동중개, 중개연구 센터 ○혁신형 연구중심병원 지원 확대 |
||
|
<국토해양부> ○실용적인 홍합유래 생체접착제 세계 최초 개발 ○맞춤형 DNA 중합효소 개발(2건의 기술이전) |
<국토해양부> ○선도물질의 전임상시험 착수 ○생물공정 실용화를 전제로 한 모든 과제의 기업체 참여 추진(기술이전유도) |
||
|
2. 바이오기업 경쟁력 제고 및 글로벌화 |
|
<지식경제부> ○Global BioTech Forum개최 (5월) ○의료산업해외마케팅지원센터 개소 (6월) - 시장개척단 파견, one-stop정보지원시스템 구축 등 ○BIO KOREA 2008 개최(10월) |
|
|
<보건복지가족부> ○신약개발 지원 ○건강기능제품지원 |
<보건복지가족부> ○제약산업의 경쟁력강화를 위한 비임상․임상시험 중점지원 ○건강기능제품지원확대 |
||
|
3. 바이오산업 인프라 확충 |
|
<지식경제부> ○생물산업기술실용화센터 본격 가동 - 임상시료 생산(18건) ○유효성및독성검증사업 추진 ○발효미생물종합활용센터 건립 ○코리아바이오허브구축사업 |
|
|
<보건복지가족부> ○임상연구 활성화를 위한 임상연구 인프라 구축 |
<보건복지가족부> ○임상연구활성화를 위한 임상연구 인프라 구축 확대 -국가임상시험사업단 지원 ○국가생명과학단지조성 -기반조성 완료, 생산시설 분양(96%), 6대 국책기관 이전공사 (공정율 36%) |
||
|
<국토해양부> ○산업화 지원센터 구축을 위한 공정 및 기반 구축 ○해양생물유래 신기능 물질 및 소재은행 구축 |
<국토해양부> ○산업화 지원센터 활성화 ○유용 해양생물자원 DB화 ○국내 해양유전자원보호와 해외 유용해양유전자원 확보전략 연구 ○생물주권확보를 위한 국제협약대응센타 구축 ○해양바이오창업지원센타 및 해양 생물연구센타 건립 지원 |
||
|
4. 기술이전 활성화 및 바이오산업 지원제도 정비 |
|
<지식경제부> ○성공불융자제도 도입 (첨단의료복합 단지특별법) |
|
|
<국토해양부> ○해양생명자원 보존 및 이용을 위한 법제적 지원방안 연구 |
<국토해양부> ○해양생명자원 보존 및 이용을 위한 법제화 연구 |
||
|
법/제도 정비 및 국민 수용성 제고 |
1. 생명공학 연구윤리 및 진실성 문화 정착 |
<보건복지가족부> ○연구자대상 생명윤리 교육실시
|
<보건복지가족부> ○기관생명윤리심의위원회(IRB) 운영지원을 통한 심의 질 제고 ○생명윤리 관련 법규 정비 및 교육프로그램 개발 보급 |
|
2. 생명윤리 및 바이오 안전성 법‧제도 정비 |
<교육과학기술부> ○생명윤리법에 의해 복지부장관의 승인을 얻은 과제에 한하여 지원 |
<교육과학기술부> ○생명윤리법에 의해 복지부장관의 승인을 얻은 과제에 한하여 지원 ○시험․연구용 유전자변형생물체(LMO) 안전관리계획('08~'12)수립 |
|
|
<농림수산식품부> ○형질전환체 안정성 평가기반 구축 ○유전자변형 농산물 환경위해성 심사 규정 제정 |
<농림수산식품부> ○바이오 안전성 및 윤리 관련 법제도의 정비 및 인지도 분석 - 형질전환체 안전성 평가 기반 구축 ∙유전자변형작물 안전성평가 가이드라인 제작 및 배포 : 환경안전성평가, 식품안전성평가 - GMO안전성 대 국민 홍보 ∙청, NGO, 소비자, 농식품부와 GMO위해성 정보교류 ∙TV 매체, GMO책자 및 현장교육 으로 GMO개발과 안전성 홍보 |
||
|
<지식경제부> ○바이오안전성의정서 비준 ○LMO 안전관리체계 마련 -바이오안정성정보기반 구축 등 ○LMO위해성 평가 센터 완공 ○생물작용제 제도 등을 규율하는 생물무기금지법 시행
|
<지식경제부> ○유전자변형생명체 안전관리계획 수립 ○바이오안전성 위원회 구성
<국토해양부> ○해양생명자원의 보전․관리 및 활용에 관한 법률(안) 마련 |
||
|
<환경부> ○‘전국 생태․자연도 고시’ ○바이오안전성의정서 비준 준비를 위한 ‘유전체변형생물체 통합고시’마련 ○‘유전자변형생물체(LMO) 자연환경위해성 심사위원회 운영규정’ 제정 |
<환경부> ○유전자 변형생물체의 자연생태계 영향평가 및 안전관리 사업 - 환경정화용 유전자변형 생물체의 환경위해성 평가기관 지정요건 등에 관한 규정(국립환경과학원 고시 2008-9, 2008.2.12) 마련 -환경정화용 LMO의 위해성에 대한 안전관리계획(안) 수립 ․ 환경정화용 LMO의 개발, 생산, 수출·입, 판매, 운반 및 보관과정에서의 안전관리계획 수립 (환경바이오안전과-156호, 2008.04.28) -환경정화용 유전자변형생물체 취급관리 대상자에 대한 검사 업무처리 매뉴얼 마련 |
||
|
<국토해양부> ○해양·수산LMO 통합고시’마련 ○해양·수산LMO전문가운영규정’제정
|
<국토해양부> ○LMO로 인한 해양생태계위해성 평가·심사기준 및 해양LMO평가·심사기준 마련 ○해양용LMO종합안전관리계획 및 세부 안전관리지침 제정 |
||
|
3. 국민홍보· 인지도·문화 저변 확대 |
|
<지식경제부> ○LMO전국학생논술대회(9월) ○바이오안전성백서발간 |
|
|
<보건복지가족부> ○보건산업기술대전 개최('07.12) |
<보건복지가족부> ○보건산업기술대상 시상식 개최 ○생명윤리 연구 저변확대를 위한 공모실시 |
||
|
<국토해양부> ○홈페이지 운영
|
<국토해양부> ○3개연구단 홈페이지 운영 ○국제수산무역 EXPO 참가 |
출처: 생명공학육성시행계획 (2008, 2009)

생명공학 경쟁력 지표 및 주요연구성과
1. 투자현황
가. 정부의 연구개발 투자 현황
(1) 국가연구개발사업 투자 규모 추이
21세기 지식기반경제가 심화되고 2020년이면 바이오경제(Bioeconomy)가 도래하는 시점에서 세계 각국은 과학기술력을 중심으로 국가경쟁력 향상에 노력하고 있다. 특히 인구가 고령화 되고 건강하게 오래 살고자하는 인류의 기대에 부응한다는 측면에서 생명공학 분야에 대한 투자는 지속적으로 증가하고 있다. 우리나라도 국가연구개발사업 예산규모가 1990년 이후부터 점차 확대되고 있으며, 이명박 정부는 기초과학에 대한 투자를 늘리고 국민의 생명과 안전에 직결된 생명공학에 대한 투자 또한 지속적으로 늘릴 계획이다.
2008년도에는 이명박 정부의 과학기술 정책관련 큰 그림인 「선진일류국가를 향한 이명박 정부의 과학기술기본계획(577 Initiative)」을 수립하여 총 연구개발투자(정부+민간)을 2006년 3.23%에서 2012년 5%까지 늘리고 7대 기술분야(R&D)36)를 중점 육성하며 7대 시스템37)을 선진화․효율화 하여 2012년 과학기술 7대 강국을 달성하기 위한 50개 범부처 중점추진과제를 제시하였다. 이 중 생명분야는 신산업창출, 현안관련 분야 등에 포함되어 향후 투자가 지속적으로 증가될 전망이다. 특히 생명분야에 대한 투자비중의 증가는 2020년을 전후하여 가시화 될 것으로 여겨지는 바이오경제(bioeconomy) 시대를 대비하는데 기여를 할 것으로 보인다.
2009년 예산편성의 특징 중 하나는 예산편성의 권한이 국가과학기술위원회(이하 국과위)와 기획재정부로 이원화 되었다는 것이다. 즉 국과위에서는 예산배분방향을 설정하고 이 결과를 바탕으로 기획재정부는 실제 사업별 예산편성을 하도록 한 것이다.
2008년도 정부 연구개발 총투자는 일반회계, 특별회계 및 기금을 포함해서 11조 784억 원으로 2007년의 9조 7,629억 원에서 1조 3,155억 원(13.5%) 증가하였으며, 2002년부터 2008년까지 연평균 증가율은 10.3%로 나타났다. 일반회계를 기준으로 정부 연구개발예산의 비중은 2008년 5.0%로 2007년에 비하여 0.1% 증가하였다. 2008년도 국가연구개발사업에는 총 10조 9,936억 원이 집행되었는데, 이는 2008년도 정부 연구개발예산에서 848억 원이 미집행 되었음을 의미한다. 최근 7년간 국가연구개발사업 규모 변화 추이는 (표 3-2-1-1)에 나타나 있다.
[표 3-2-1-1] 국가연구개발사업 규모 변화 추이(2002∼2008년)
(단위: 억 원)
|
구분 |
2002년 |
2003년 |
2004년 |
2005년 |
2006년 |
2007년 |
2008년 |
연평균 증감률 |
|
|
일반회계 예산(A) |
1,089,183 |
1,172,229 |
1,182,362 |
1,352,156 |
1,260,843 |
1,353,977 |
1,523,038 |
5.7 |
|
|
R&D 예산 |
일반(B) |
48,501 |
52,678 |
57,418 |
56,612 |
61,094 |
65,907 |
75,716 |
7.7 |
|
(B/A, %) |
4.5 |
4.5 |
4.9 |
4.2 |
4.8 |
4.9 |
5.0 |
|
|
|
일반+특별 |
51,583 |
55,768 |
60,995 |
67,368 |
72,283 |
81,396 |
93,461 |
10.4 |
|
|
기금 |
9,834 |
9,386 |
9,832 |
10,628 |
16,813 |
16,233 |
17,323 |
9.9 |
|
|
총 투자 |
61,417 |
65,154 |
70,827 |
77,996 |
89,096 |
97,629 |
110,784 |
10.3 |
|
|
조사 ․ 분석 대상 |
투자액 |
46,984 |
49,036 |
59,847 |
77,904 |
87,639 |
95,745 |
109,936 |
15.2 |
|
사업수 |
211 |
266 |
314 |
390 |
357 |
426 |
486 |
14.9 |
|
|
과제수 |
22,921 |
25,794 |
26,514 |
30,425 |
31,967 |
33,125 |
37,449 |
8.6 |
|
출처: 2008년도 국가연구개발사업 조사‧분석 보고서(국가과학기술위원회)
(2) 미래유망신기술(6T) 분야별 투자 규모 추이
우리나라는 선진국에 비해 10여년 뒤진 1980년대에 BT(생명공학기술) 연구기반 구축에 착수하였으나38), 2000년대에 들어서 IT(정보통신기술), NT(나노기술), ET(에너지‧환경기술), ST(우주기술), CT(문화기술)과 함께 BT를 미래 성장동력을 창출해 낼 미래유망신기술로 선정하여 집중적으로 투자를 확대하고 있다. 또한 바이오제약․의료기기 분야가 신성장동력으로 선정되는 등 BT 분야에 대한 투자는 지속적으로 확대되고 있다. 2008년도 6T 분야 투자액은 전년 대비 6,473억 원 증가하여 총 6조 1,739억 원으로 정부연구개발 투자 중 56.2%를 차지하였다. 최근 3년간 미래유망신기술에 대한 투자 현황은 (표 3-2-1-2)에 나타나 있다39).
BT 분야에 대한 투자를 살펴보면, 2008년도에 1조 7,257억 원으로 정부 연구개발 투자에서 차지하는 비중은 15.7%로 나타났는데, 이는 전년도 대비 16.1%(2,399억 원) 증가한 액수이다. 최근 3년간의 추이를 살펴보면, BT분야에 대한 투자액이 IT분야에 근접하였으며, IT분야 투자비중은 18.6%(2006년) 에서 15.7%(2008년)로 낮아진 반면에 BT분야는 14.9%(2006년)에서 15.7%(2008년)로 투자비중이 계속 증가하고 있는 것으로 나타났으며 IT분야와 동일한 비중으로 투자된 것을 알 수 있다.
[표 3-2-1-2] 6T별 투자 추이(2006~2008년)
(단위: 억 원)
|
6T |
2006년 |
2007년 |
2008년 |
증감 |
||||
|
금액 |
비중(%) |
금액(A) |
비중(%) |
금액(B) |
비중(%) |
B-A |
비중(%) |
|
|
IT |
16,260 |
18.6 |
19,078 |
20.0 |
17,259 |
15.7 |
-1,819 |
-9.5 |
|
BT |
13,019 |
14.9 |
14,858 |
15.6 |
17,257 |
15.7 |
2,399 |
16.1 |
|
NT |
3,432 |
3.9 |
4,190 |
4.4 |
5,072 |
4.6 |
882 |
21.1 |
|
ST |
6,745 |
7.7 |
5,960 |
6.3 |
8,016 |
7.3 |
2,056 |
34.5 |
|
ET |
9,440 |
10.8 |
10,558 |
11.1 |
13,463 |
12.2 |
2,904 |
27.5 |
|
CT |
483 |
0.6 |
623 |
0.7 |
673 |
0.6 |
50 |
8.0 |
|
소계 |
49,380 |
56.3 |
55,266 |
58.1 |
61,739 |
56.2 |
6,473 |
11.7 |
|
기타 |
38,259 |
43.7 |
39,932 |
41.9 |
48,197 |
43.8 |
8,265 |
20.7 |
|
합계 |
87,639 |
100.0 |
95,198 |
100.0 |
109,936 |
100.0 |
14,738 |
15.5 |
출처: 2008년도 국가연구개발사업 조사‧분석 보고서(국가과학기술위원회)
나. 부처의 BT(생명공학)분야 연구개발 투자 현황
(1) 연구개발단계별 투자 현황
2008년도 BT분야에 대한 부처별 투자현황을 살펴보면, 교육과학기술부가 6,334억 원으로 전체 BT분야의 36.7%를 투자하였고 농촌진흥청 3,198억 원40)(18.5%), 지식경제부 2,511억 원(14.6%), 보건복지가족부 2,213억 원(12.8%) 순으로 투자가 이루어졌다. 연구개발단계별로 살펴보면 기초연구, 응용연구, 개발연구에 각각 35.7%(6,157억 원), 29.3%(5,057억 원), 25.6%(4,420억 원)가 투자된 것으로 나타났다. 기초 및 응용연구는 교육과학기술부가 각각 3,783억 원, 1,685억 원을 투자하였고, 개발연구는 지식경제부가 1,425억 원으로 가장 많은 투자를 한 것으로 나타났다(표 3-2-1-3).
(2) 국가과학기술표준분류별 투자 현황
2008년도 BT분야에 대한 투자를 국가과학기술표준분류 19개 대분류 기준으로 살펴보면 보건‧의료 분야에 5,238억 원(30.4%), 생명과학 분야에 5,029억 원(29.1%), 농림‧수산 분야에 5,043억 원(29.2%) 순으로 투자가 이루어진 것으로 나타났다. 생명과학 분야는 과학기술부가 3,424억 원, 보건‧의료 분야는 보건복지가족부가 1,808억 원, 농림‧수산 분야는 농촌진흥청이 2,839억 원으로 분야별로 가장 많은 투자를 한 것으로 나타났다(표 3-2-1-4).
[표 3-2-1-3] BT분야 부처별 연구개발단계별 투자 현황(2008년)
(단위: 백만 원)
|
|
교육 과학 기술부 |
국방부 |
국토 해양부 |
농림 수산 식품부 |
농촌 진흥청 |
방위 사업청 |
보건 복지 가족부 |
산림청 |
소방 방재청 |
식품 의약품 안전청 |
중소 기업청 |
지식 경제부 |
환경부 |
합 계 |
|
기초 연구 |
378,253 |
- |
8,751 |
24,961 |
76,198 |
170 |
46,941 |
12,860 |
- |
24,079 |
193 |
31,821 |
11,490 |
615,717 |
|
응용 연구 |
168,496 |
- |
3,474 |
32,799 |
118,312 |
155 |
77,720 |
16,639 |
- |
13,272 |
2,618 |
68,131 |
4,112 |
505,728 |
|
개발 연구 |
59,303 |
25 |
286 |
57,986 |
66,646 |
130 |
57,900 |
9,591 |
300 |
4,424 |
42,054 |
142,533 |
844 |
442,022 |
|
기타 |
27,301 |
- |
- |
5,621 |
58,597 |
- |
38,714 |
3,765 |
- |
16,239 |
- |
8,658 |
3,328 |
162,223 |
|
합계 |
633,353 |
25 |
12,511 |
121,367 |
319,753 |
455 |
221,275 |
42,855 |
300 |
58,014 |
44,865 |
251,143 |
19,774 |
1,725,690 |
출처: 2008년도 국가연구개발사업 조사‧분석 보고서(국가과학기술위원회) 관련 자료에서 산출
[표 3-2-1-4] BT분야 부처별 국가과학기술표준분류별 투자현황(2008년)
(단위: 백만 원)
|
|
교육 과학 기술부 |
국방부 |
국토 해양부 |
농림 수산 식품부 |
농촌 진흥청 |
방위 사업청 |
보건 복지 가족부 |
산림청 |
소방 방재청 |
식품 의약품 안전청 |
중소 기업청 |
지식 경제부 |
환경부 |
합계 |
|
수 학 |
2,729 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
23 |
- |
- |
2,752 |
|
물리학 |
6,308 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
359 |
114 |
- |
6,781 |
|
화 학 |
16,882 |
- |
- |
935 |
520 |
- |
135 |
- |
- |
- |
2,527 |
11,455 |
- |
32,454 |
|
생명과학 |
342,390 |
- |
1,074 |
5,657 |
27,376 |
455 |
38,083 |
3,533 |
- |
12,505 |
10,134 |
58,024 |
3,670 |
502,901 |
|
지구과학 |
2,409 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
2 |
- |
- |
2,411 |
|
기 계 |
6,477 |
- |
- |
120 |
- |
- |
- |
- |
- |
70 |
1,939 |
3,601 |
- |
12,207 |
|
재 료 |
2,935 |
- |
- |
330 |
- |
- |
55 |
- |
- |
- |
1,062 |
6,059 |
- |
10,441 |
|
화학공정 |
3,072 |
- |
86 |
842 |
100 |
- |
- |
- |
300 |
- |
1,065 |
4,795 |
- |
10,260 |
|
전기·전자 |
1,770 |
- |
- |
475 |
- |
- |
- |
- |
- |
- |
1,549 |
17,507 |
- |
21,301 |
|
정 보 |
6,832 |
- |
- |
- |
- |
- |
- |
- |
- |
250 |
497 |
1,395 |
- |
8,974 |
|
통 신 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
102 |
2 |
- |
104 |
|
농림·수산 |
29,343 |
- |
75 |
110,141 |
283,883 |
- |
55 |
36,326 |
- |
90 |
6,398 |
38,019 |
- |
504,330 |
|
보건·의료 |
180,782 |
- |
3,735 |
1,502 |
2,090 |
- |
175,564 |
- |
- |
45,044 |
18,574 |
96,486 |
- |
523,777 |
|
환 경 |
2,499 |
- |
1,400 |
275 |
- |
- |
- |
- |
- |
- |
248 |
794 |
16,104 |
21,320 |
|
에너지·자원 |
1,352 |
- |
- |
900 |
305 |
- |
- |
- |
- |
- |
200 |
1,099 |
- |
3,856 |
|
원자력 |
22,411 |
- |
- |
- |
- |
- |
- |
- |
- |
55 |
- |
- |
- |
22,466 |
|
건설·교통 |
205 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
143 |
- |
- |
348 |
|
우주·항공· 천문·해양 |
4,097 |
- |
6,141 |
190 |
- |
- |
- |
- |
- |
- |
- |
1,580 |
- |
12,008 |
|
기술혁신· 과학기술 정책 |
659 |
- |
- |
- |
5,479 |
- |
300 |
2,996 |
- |
- |
- |
10,213 |
- |
19,647 |
|
기타 |
201 |
25 |
- |
- |
- |
- |
7,083 |
- |
- |
- |
43 |
- |
- |
7,352 |
|
합계 |
633,353 |
25 |
12,511 |
121,367 |
319,753 |
455 |
221,275 |
42,855 |
300 |
58,014 |
44,865 |
251,143 |
19,774 |
1,725,690 |
출처: 2008년도 국가연구개발사업 조사‧분석 보고서(국가과학기술위원회) 관련 자료에서 산출
(3) 주요 부처별 투자현황
2006년도 BT분야 투자액을 기준으로 한 4개 주요 부처(청 포함)의 BT분야 주요 연구개발 사업내용을 살펴보면 다음과 같다(표 3-2-1-5).
(가) 교육과학기술부
21C프론티어연구개발사업 사업단에 659억 원, 기초‧원천기술개발을 위한 바이오기술개발사업에 631억 원을 비롯하여, 한국생명공학연구원에 520억 원, 특정기초연구개발사업 지원에 506억 원, 우수연구자 육성을 위한 우수연구센터육성사업에 467억 원, 기초연구과제지원사업에 462억 원, 국가지정연구실사업에 190억 원, 창의적연구진흥사업에 153억 원, 차세대성장동력사업(바이오신약‧장기)에 121억 원, 신진연구자지원사업에 114억 원 등을 투자한 것으로 나타났다.
(나) 농림수산식품부‧농촌진흥청‧산림청
농림수산식품부는 농림기술개발사업에 703억 원, 첨단양식개발사업에 180억 원, 수의과학기술개발연구사업에 163억 원을 투자하였다. 농림․수산 분야에서 가장 많은 투자를 한 농촌진흥청은 농업생명공학기술개발사업(바이오그린21사업)에 367억 원, 원예시험연구에 243억 원, 농업기술공동연구사업에 237억 원, 농업생명공학연구에 188억 원, 작물시험연구사업에 174억 원, 축산생명환경시험연구사업에 149억 원 등을 투자한 것으로 나타났다. 한편, 산림청은 국립산림과학원에 284억 원을 투자한 것으로 나타났다.
(다) 보건복지가족부‧식품의약품안전청
보건복지가족부는 보건의료기술연구개발사업에 914억 원을 투자하였고, 지방국립대병원등혁신적연구기반조성사업에 376억 원, 국립암센터연구소지원사업에 374억 원, 10대질병극복메디클러스터구축사업에 135억 원, 주요 현안 중 하나인 인수공통전염병 대응을 위한 인수공통전염병인체감염대응연구사업에 20억 원 등을 투자하였다. 또한 한의학 R&D(한방치료기술연구개발), 질병관리연구(급만성 질환연구, 항생제 내성연구 등), 코호트연구 중심의 유전체실용화사업 등 질환 중심의 연구개발에 투자하였다. 식품의약품안전청은 식품 등 안전관리사업에 가장 많은 금액인 135억 원을 투자하였고, 안전성관리기반연구사업에 112억 원, 의약품안전연구개발에 120억 원, 독성연구원에 102억 원 등을 투자하였다.
(라) 지식경제부‧중소기업청
지식경제부는 바이오의료기기전략기술개발사업에 585억 원, 지역전략산업진흥사업에 413억 원, 지역연고산업진흥사업에 358억 원, 한국화학연구원에 145억 원, 지역기술혁신센터사업(RIC=TIC+RRC)에 127억 원, 한국식품연구원에 121억 원, 화학연구원부설안전성평가연구소에 118억 원 등 BT분야 관련 연구를 지원하였는데, 신약개발 전임상/임상 지원을 위한 Bio-Star를 위한 Total Solution 지원사업 등 바이오 연구개발의 제품화 관련 사업 등을 통해 주로 제품화 연구개발에 투자하였다. 중소기업청은 중소기업기술혁신개발사업에 310억 원을 투자하였다.
[표 3-2-1-5] 부처별 사업별 투자현황(2008년)
(단위: 백만 원)
|
부처명 |
사업명 |
BT투자액 |
투자액 |
BT투자액비중(%) |
|
교육과학기술부 |
21C프론티어연구개발사업 |
65,880 |
137,700 |
47.8 |
|
바이오기술개발사업 |
63,081 |
65,496 |
96.3 |
|
|
(연구회소관출연기관)한국생명공학연구원<기초> |
51,963 |
52,003 |
99.9 |
|
|
특정기초연구지원사업 |
50,551 |
116,200 |
43.5 |
|
|
우수연구센터육성 |
46,731 |
91,605 |
51.0 |
|
|
이공분야_기초연구과제지원사업 |
46,222 |
100,695 |
45.9 |
|
|
동북아R&D허브기반구축 |
22,200 |
28,900 |
76.8 |
|
|
지방대학혁신역량강화(0.4) |
21,862 |
102,520 |
21.3 |
|
|
2단계연구중심대학육성(0.5) |
19,826 |
135,437 |
14.6 |
|
|
(연구회소관출연기관)한국과학기술연구원<기초> |
19,623 |
97,692 |
20.1 |
|
|
국가지정연구실사업 |
19,022 |
54,366 |
35.0 |
|
|
(직할출연기관)원자력의학원 |
16,671 |
28,137 |
59.2 |
|
|
창의연구 |
15,274 |
40,000 |
38.2 |
|
|
(연구회소관출연기관)한국한의학연구원<기초> |
13,089 |
20,339 |
64.4 |
|
|
이공분야_중점연구소지원사업 |
12,660 |
23,998 |
52.8 |
|
|
바이오신약장기사업 |
12,082 |
12,800 |
94.4 |
|
|
이공분야_신진교수연구지원사업 |
11,350 |
26,874 |
42.2 |
|
|
방사선기술개발사업 |
10,636 |
31,863 |
33.4 |
|
|
국토해양부 |
해양생명공학기술개발(구마린바이오21) |
10,355 |
11,735 |
88.2 |
|
농림수산식품부 |
농림기술개발 |
70,256 |
73,186 |
96.0 |
|
첨단양식개술개발 |
17,959 |
18,308 |
98.1 |
|
|
수의과학기술개발연구 |
13,638 |
14,474 |
94.2 |
|
|
농촌진흥청 |
농업생명공학실용화기술개발 |
36,715 |
44,464 |
82.6 |
|
원예시험연구 |
24,347 |
24,347 |
100.0 |
|
|
농업기술공동연구 |
23,717 |
24,840 |
95.5 |
|
|
농업생명공학연구 |
18,784 |
18,784 |
100.0 |
|
|
작물시험연구 |
17,412 |
17,412 |
100.0 |
|
|
축산생명환경시험연구 |
14,946 |
20,881 |
71.6 |
|
|
농업생물연구 |
13,654 |
13,899 |
98.2 |
|
|
영남작물시험 |
12,601 |
12,601 |
100.0 |
|
|
호남작물시험 |
12,488 |
12,488 |
100.0 |
|
|
난지원예시험연구 |
10,926 |
10,926 |
100.0 |
|
|
고령지농업시험연구 |
10,553 |
10,724 |
98.4 |
|
|
지역전략작목산학연협력사업(제주계정포함) |
10,465 |
14,615 |
71.6 |
|
|
보건복지가족부 |
(보건의료기술연구개발)보건의료기술연구개발 |
91,443 |
92,211 |
99.2 |
|
지방국립대병원등혁신적연구기반조성 |
37,645 |
37,700 |
99.9 |
|
|
국립암센터연구소지원 |
37,376 |
37,766 |
99.0 |
|
|
(보건의료기술연구개발)10대질병극복메디클러스터구축 |
13,500 |
13,500 |
100.0 |
|
|
인수공통전염병인체감염대응연구 |
2,000 |
2,000 |
100.0 |
|
|
산림청 |
국립산림과학원(인건비+기본경비+임업시험연구+ 산림유전자원조성관리) |
28,356 |
50,818 |
55.8 |
|
식품의약품 안전청 |
식품등안전관리 |
13,525 |
13,930 |
97.1 |
|
안전성관리기반연구 |
12,216 |
13,126 |
93.1 |
|
|
의약품등안전관리 |
12,020 |
12,220 |
98.4 |
|
|
독성연구원(인건비+기본사업비) |
10,205 |
10,205 |
100.0 |
|
|
중소기업청 |
중소기업기술혁신개발 |
31,046 |
234,700 |
13.2 |
|
지식경제부 |
바이오의료기기전략기술개발 |
58,476 |
64,500 |
90.7 |
|
지역전략산업진흥 |
41,312 |
208,584 |
19.8 |
|
|
지역연고산업진흥사업 |
35,826 |
79,000 |
45.3 |
|
|
(연구회소관출연기관)한국화학연구원<산업> |
14,477 |
40,018 |
36.2 |
|
|
지역기술혁신센터 |
12,744 |
42,600 |
29.9 |
|
|
(연구회소관출연기관)한국식품연구원<산업> |
12,074 |
19,133 |
63.1 |
|
|
(연구회소관출연기관)화학연구원부설안전성평가연구소<산업> |
11,803 |
26,603 |
44.4 |
|
|
환경부 |
차세대핵심환경기술개발 |
9,200 |
105,759 |
8.7 |
출처: 2008년도 국가연구개발사업 조사‧분석 보고서(국가과학기술위원회) 관련 자료에서 산출
2. 인력현황
가. 바이오산업의 인력 현황
한국바이오협회가 조사 발표한 「2007년도 국내 바이오산업 통계(2008. 12)」에 의하면 산업계 취업자는 총 20,236명이다. 이 중 50.3%가 연구직으로 10,178명이며, 나머지 10,058명이 생산직으로 구성되어 있다(표 3-2-2-1 참조). 이 같은 규모는 2005년의 7,430명(연구직)과 6,437명(생산직)에 비해 각각 37.0%와 56.3% 증가한 것으로 전체적으로는 연평균 20.8% 증가한 것이다.
이들 인력의 학력별 구성을 보면, 박사는 8.1%, 석사는 30.9%, 학사와 기타가 각각 34.6%와 26.3%이다. 이것은 2005년에 비해 박사(2005년 9.2%), 석사(2005년 31.3%), 기타(2005년 29.4%)의 비중은 낮아지고, 학사(2005년 30.1%)의 비중은 높아졌다. 그러나 박·석사가 전체 종사자의 39.0%로 여전히 고학력 인력의 비중이 대단히 높다. 그리고 이들 고학력 인력은 연구직에 주로 종사하고 있는데, 박사의 89.3%, 석사의 77.0%가 연구직이다. 학사인력은 연구직과 생산직 비율이 41:59로 생산직이 많다. 2005년과 비교하면 점차 생산직의 비중이 높아지고 있으며(2005년 46.4%→2007년 49.7%), 생산직에 종사하는 박사와 석사 비중 역시 2005년에 비해 크게 증가했다(2005년 15.3%→2007년 20.5%).
[표 3-2-2-1] 바이오산업부문 인력 규모(2007년)
(단위: 명, %)
|
구 분 |
박 사 |
석 사 |
학 사 |
기 타 |
합 계 |
|||||
|
연구직 |
1,472 |
(14.5) |
4,818 |
(47.3) |
2,870 |
(28.2) |
1,018 |
(10.0) |
10,178 |
(100.0) |
|
생산직 |
176 |
( 1.7) |
1,441 |
(14.3) |
4,128 |
(41.0) |
4,313 |
(42.9) |
10,058 |
(100.0) |
|
합 계 |
1,648 |
( 8.1) |
6,259 |
(30.9) |
6,998 |
(34.6) |
5,331 |
(26.3) |
20,236 |
(100.0) |
출처: 한국바이오협회(2008. 12)
주 1. 연구직은 (바이오산업 연구개발 인력) + (관리직(생물공 전공자))에 해당
2. 생산직은 연구소 이외의 바이오산업에 근무하는 생산직 해당
3. ( )안은 비중임
(표 3-2-2-2)는 산업별로 바이오산업의 인력구성을 살펴본 것이다. 종사자 규모를 볼 때 바이오의약산업이 8,196명(40.5%)으로 가장 크고, 다음으로 바이오식품산업 4,864명(24.0%), 바이오화학산업 2,377명(11.7%) 순으로 이들 세 산업이 전체의 76.3%를 차지한다. 이중 바이오식품산업의 비중은 2005년 37.9%에서 늘어났고, 나머지 두 산업의 비중은 각각 25.6%와 13.2%에서 다소 낮아진 것이다. 이들 주요 산업에서 각각 연구직이 차지하는 비중은 평균 47.9%이며, 각 산업별로는 49.8%, 42.4%, 52.7%로 바이오화학산업이 상대적으로 연구직 비중이 높다. 나머지 산업들의 경우에도 연구직이 절반 이상을 차지하고 있어 바이오산업이 고숙련 산업임을 알 수 있게 한다. 특히 바이오검정 및 기타산업41)과 바이오전자산업의 연구인력 비중은 각각 75.6%와 69.4%로서 바이오산업들 중 가장 높은 편이다.
[표 3-2-2-2] 바이오산업의 산업별 종사인력 구성
(단위: 명, %)
|
바이오의약 |
바이오화학 |
바이오식품 |
바이오환경 |
|
8,196 (40.5) |
2,377 (11.7) |
4,864 (24.0) |
1,775 ( 8.8) |
|
바이오전자 |
바이오공정 및 기기 |
바이오에너지 및 자원 |
바이오검정 및 기타 |
|
304 ( 1.5) |
1,238 ( 6.1) |
618 ( 3.1) |
864 ( 4.3) |
출처: 한국바이오협회(2008. 12)
나. 바이오산업의 고용 추이
한국바이오협회가 조사한 1997~2007년 바이오산업의 고용실태를 분석하면 이 기간 동안 인력규모는 연평균 19.9% 증가한 것으로 나타났다. 이는 매 4년마다 인력규모가 2배 이상 늘어나는 것으로 바이오산업이 급격히 성장하고 있음을 보여준다. 그리고 이것은 1997~2005년의 연평균 고용증가율 19.7%에 비해 다소 높아진 것으로 2005년 이후 고용 증가가 다소 빨라졌음을 반영한다.
이 기간 동안 고용 증가는 연구직보다는 생산직에서 컸는데, 연구직은 연평균 18.3%, 생산인력은 21.9% 늘어났다. 이것은 1997~2005년의 고용 증가율42)과 비교할 때 생산직의 고용 증가가 두드러졌음을 확인해 준다. 학력별로 보면, 이 기간 동안 학사가 평균 25.9% 증가해 석사(19.6%)나 박사의 (18.1%)에 비해 높았다. 그리고 연구직과 생산직을 나누어 학력별로 비교하면 연구직의 경우 학사에서, 생산직의 경우 석사와 학사에 대한 수요가 보다 빠르게 증가하고 있다. 이것은 「2007 생명공학백서(과학기술부, 2007)」에서도 제시되었던 바와 같이 바이오산업의 인력 수요가 연구직에서 점차 생산직 중심으로 이행하고 있음을 보여준다. 또 정부의 인재정책 역시 이 같은 수요 변화에 대응해야 할 과제가 남는다고 하겠다.
[표 3-2-2-3] 바이오산업의 학력별 고용 증가율(1997~2007)
(단위: %, 년)
|
구 분 |
박 사 |
석 사 |
학 사 |
기 타 |
합 계 |
|
연구직 |
17.0% |
17.8% |
20.6% |
17.0% |
18.3% |
|
생산직 |
36.2% |
29.2% |
31.9% |
15.4% |
21.7% |
|
합 계 |
18.1% |
19.6% |
25.9% |
15.7% |
19.9% |
출처: 한국바이오협회(2008. 12), 한국생물산업협회(각 년도)
3. 특허현황
가. 생명공학 특허개요
생명공학분야에 있어서 특허는 매우 중요한 의미를 갖는다. 막대한 연구개발비가 투입되고 장기간의 연구개발기간이 소요되며, 일부 분야는 시장진입을 위해 거치는 법적 승인까지 장시간이 소요되는 특성을 지니고 있어 생명공학분야에서 투자회수를 위한 법적장치인 특허의 획득은 매우 중요하다고 할 수 있다.
특히, 생명공학분야의 연구개발정책 수립을 위해서는 특허정보에 대한 분석이 반드시 필요하다. 이렇듯 특허정보는 연구개발과의 밀접한 연관성을 가지고 있으며, 풍부하고 객관적인 정보를 제공한다. 그리고 데이터에 접근이 용이한 특징 또한 가지고 있다. 그렇기 때문에 특허정보는 연구개발성과를 측정하고 국가의 과학기술정책을 수립하는데 있어 기초자료로 활용되고 있다.
나. 분석기준
생명공학분야의 기술분류는 주로 OECD에서 분류한 기준을 토대로 한국특허청의 전문가 집단에서 세분류한 6개 산업, 13개 기술분류, 27개 세분류로 구분하였다.43)
분석대상국가로는 한국과 세계적 동향을 파악하기 위해 특허를 가장 강하게 보호하고 시장규모도 큰 미국 특허를 대상으로 하였으며, 한국은 출원시점으로 1998~2007년까지를, 미국특허는 등록기준으로 1998~2008년까지의 특허를 가지고 동향을 파악하였다.
[표 3-2-3-1] 생명공학의 기술분류
|
산업 |
기술분류 |
세분류 |
|
공정 |
생물공정 |
동식물 세포배양장치, 분리정제, 생물학적합성, 효소 미생물관련 장치 |
|
측정진단 |
조사․분석, 측정․시험 |
|
|
기초 |
생물자원탐색 |
미생물, 바이러스 |
|
동식물세포배양 |
동식물세포 |
|
|
효소공학 |
효소 |
|
|
유전체 |
당유기함유핵산, 유전공학 |
|
|
단백질체 |
고정화펩티드, 펩티드, 하이브리드펩티드 |
|
|
항체이용 |
면역글로블린 |
|
|
농업 |
생물농약 |
생물농약 |
|
형질전환동식물 |
신규한동물, 신규한식물 |
|
|
식품 |
발효식품 |
알콜발효 및 장치 |
|
의약 |
생물의약 |
단백질치료제, 방사선의약, 신약후보물질, 유전자치료, 치료용 항체 |
|
환경 |
환경생물공학 |
생물학적 수처리, 슬러지처리 |
다. 한국에 출원된 생명공학특허건수 동향
한국에 출원한 생명공학분야의 특허출원건수를 살펴보면 1999년, 2000년과 2006년, 2007년에 급격한 증가세를 보이고 있는 가운데 매년 증감을 반복하면서 꾸준히 증가하고 있는 것으로 나타났다. 세부기술별로 살펴보면, 연평균 200여 건 이상 출원되고 있는 분야는 측정진단의 측정․시험분야, 단백질체의 펩티드분야, 유전체의 유전공학분야, 생물의약의 신약후보물질분야가 있다.
특이한 점은, 가장 많은 특허출원을 보이던 신약후보물질분야는 2004년에 485건을 출원하였으나, 2005년 57건, 2007년 92건으로 급격한 출원감소세를 보이고 있는 것으로 조사되었다. 또한, 생물학적합성, 측정․시험, 유전공학, 치료용항체분야는 2007년도에 급격히 증가한 것으로 나타났다.
[표 3-2-3-2] 한국에 출원한 생명공학분야의 기술분류별 연도별 특허출원건수
|
기술분류 |
1998 |
1999 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
||
|
공정 |
생물 공정 |
동식물세포 배양장치 |
2 |
6 |
5 |
6 |
10 |
8 |
16 |
16 |
39 |
29 |
|
분리정제 |
3 |
0 |
1 |
0 |
0 |
2 |
0 |
1 |
0 |
0 |
||
|
생물학적합성 |
106 |
96 |
135 |
127 |
133 |
150 |
104 |
101 |
91 |
175 |
||
|
효소, 미생물 관련장치 |
17 |
12 |
38 |
34 |
37 |
23 |
38 |
45 |
78 |
83 |
||
|
측정 진단 |
조사분석 |
36 |
55 |
67 |
95 |
117 |
155 |
154 |
150 |
237 |
273 |
|
|
측정, 시험 |
90 |
82 |
137 |
223 |
236 |
278 |
287 |
397 |
321 |
437 |
||
|
기 초 |
단백질체 |
고정화펩티드 |
0 |
2 |
3 |
1 |
0 |
0 |
0 |
3 |
3 |
7 |
|
동식물세포배양 |
158 |
132 |
235 |
247 |
220 |
209 |
267 |
253 |
345 |
347 |
||
|
생물자원탐색 |
0 |
3 |
10 |
18 |
23 |
35 |
19 |
24 |
29 |
38 |
||
|
유전체 |
동식물세포 |
27 |
44 |
40 |
47 |
59 |
67 |
126 |
128 |
181 |
181 |
|
|
항체 |
미생물 |
127 |
87 |
197 |
189 |
218 |
209 |
192 |
209 |
288 |
223 |
|
|
효소공학기술 |
14 |
8 |
24 |
23 |
22 |
12 |
15 |
21 |
14 |
24 |
||
|
생물농약개발 |
당류기함유핵산 |
36 |
44 |
45 |
39 |
50 |
37 |
29 |
46 |
35 |
33 |
|
|
형질전환동식물 |
331 |
322 |
398 |
381 |
313 |
324 |
391 |
427 |
451 |
570 |
||
|
발효식품 |
면역글로블린 |
15 |
21 |
44 |
47 |
52 |
68 |
89 |
87 |
136 |
133 |
|
|
생물의약 |
효소 |
38 |
53 |
70 |
82 |
90 |
76 |
74 |
73 |
107 |
94 |
|
|
농 업 |
환경생물공학 |
생물농약 |
24 |
33 |
29 |
47 |
40 |
38 |
52 |
78 |
84 |
93 |
|
형질 전환 동식물 |
신규한동물 |
11 |
17 |
20 |
14 |
25 |
28 |
29 |
36 |
33 |
39 |
|
|
신규한식물 |
24 |
47 |
34 |
46 |
58 |
68 |
35 |
50 |
43 |
49 |
||
|
식품 |
발효식품 |
알콜발효 및 장치 |
48 |
62 |
82 |
118 |
108 |
87 |
83 |
102 |
149 |
166 |
|
의 약 |
생물 의약 |
단백질치료제 |
96 |
92 |
110 |
140 |
104 |
125 |
161 |
175 |
195 |
243 |
|
방사선의약 |
3 |
8 |
4 |
13 |
6 |
11 |
7 |
14 |
11 |
15 |
||
|
신약후보물질 |
118 |
167 |
314 |
365 |
391 |
459 |
485 |
57 |
104 |
92 |
||
|
유전자치료 |
5 |
16 |
22 |
23 |
17 |
15 |
24 |
26 |
19 |
32 |
||
|
치료용항체 |
44 |
66 |
72 |
104 |
86 |
90 |
87 |
114 |
130 |
203 |
||
|
환 경 |
환경생물공학 |
생물학적수처리 |
173 |
169 |
193 |
251 |
222 |
210 |
188 |
217 |
230 |
257 |
|
슬러지처리 |
2 |
13 |
9 |
12 |
9 |
18 |
5 |
10 |
17 |
25 |
||
|
계 |
1,548 |
1,657 |
2,338 |
2,692 |
2,646 |
2,802 |
2,957 |
2,860 |
3,370 |
3,861 |
||
기준: 제1 IPC, 특허공개공보기준(선등록의 경우 소급적용)
라. 한국특허로 본 생명공학분야 중 기초산업의 선두주자
최근 5년(2003~2007년)동안 생명공학분야 중 기초산업의 기술분류별 Top 3를 조사한 결과, 생명공학연구원이 기초분야 전 분야에서 다출원 상위 3개사에 포함되어 있는 것으로 나타났다. 서울대학교는 동식물세포배양(40건), 효소공학(21건), 단백질체(47건) 3개 세부기술분야에서 가장 많은 특허를 출원한 것으로 나타났다. 생물자원탐색에서는 CJ가 63건을, 유전체에서는 생명공학연구원이 125건을 출원하였으며, 항체이용분야에서는 외국기업인 제넨테크가 50건을 출원함으로써 다출원 1위 기업으로 조사되었다.
[표 3-2-3-3] 한국특허의 생명공학분야 기초 산업의 연구개발 리더
|
세부기술 |
2003∼2007년(최근5년) |
||
|
출원인 |
국적 |
건수 |
|
|
생물자원 탐색 |
CJ |
KR |
63 |
|
한국생명공학연구원 |
KR |
47 |
|
|
농촌진흥청 |
KR |
26 |
|
|
동식물 세포배양 |
서울대학교 |
KR |
40 |
|
고려대학교 |
KR |
19 |
|
|
한국생명공학연구원 |
KR |
14 |
|
|
효소공학 |
서울대학교 |
KR |
21 |
|
한국생명공학연구원 |
KR |
17 |
|
|
한국해양연구원 |
KR |
11 |
|
|
유전체 |
한국생명공학연구원 |
KR |
125 |
|
고려대학교 |
KR |
94 |
|
|
농촌진흥청 |
KR |
74 |
|
|
단백질체 |
서울대학교 |
KR |
47 |
|
한국생명공학연구원 |
KR |
44 |
|
|
메르크 파텐트 (GMBH) |
DE |
30 |
|
|
항체이용 |
제넨테크 (코) |
US |
50 |
|
한국생명공학연구원 |
KR |
20 |
|
|
쥬우가이세이야꾸(가) |
JP |
13 |
|
마. 미국에 등록된 생명공학특허건수 동향
미국의 생명공학 특허는 1990년대 중반이후 급성장, 2000년 이후 주춤세로 요약할 수 있다. 이는 1990년부터 15년간 계획으로 실시된 휴먼게놈프로젝트의 영향과 미국경제의 호황, 미국 정부의 R&D투자에 대한 성과가 나타나면서 급성장44)하였으나, 1998년 이후 휴먼게놈프로젝트의 종료와 시장의 긴축으로 투자자와 생명공학분야 업체들이 수익성을 중시하는 경향이 나타나면서 일종의 기술거품이 빠지는 조정기를 거치는 과정으로 보인다.45) 이러한 조정기는 2005년을 기점으로 특허건수의 증가세를 보여주고 있으며, 이는 생명공학분야의 특허가 조정기 이후 안정기에 접어든 것으로 판단된다.
세부기술별로 살펴보면, 연평균 300여건 이상 등록되고 있는 분야로는 생물공정의 생물학적합성분야, 측정진단의 조사․분석 및 측정․시험분야, 단백질체의 펩티드분야, 유전체의 당류기함유핵산 및 유전공학분야, 효소기술공학분야, 형질전환동식물의 신규한 식물분야, 생물의약의 단백질치료제 및 치료용 항체분야가 있다.
특이한 점은 생물의약의 신약후보물질분야는 한국특허의 생명공학분야 동향에서와 마찬가지로, 2002년 256건이 등록된 이후 2007년 55건, 2008년 43건으로 급격한 감소세를 나타내고 있다는 점이다. 반면에 생물공정의 효소․미생물관련장치분야, 단백질체의 펩티드분야와 생물의약의 치료용 항체분야는 2005년 이후 꾸준히 증가세를 나타내고 있는 것으로 조사되었다.
|
기술분류 |
1998 |
1999 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
||
|
공 정 |
생물 공정 |
동식물세포배양장치 |
70 |
51 |
37 |
16 |
18 |
17 |
5 |
11 |
18 |
16 |
21 |
|
분리정제 |
13 |
18 |
17 |
20 |
10 |
14 |
8 |
4 |
7 |
4 |
2 |
||
|
생물학적합성 |
669 |
615 |
524 |
612 |
546 |
464 |
403 |
374 |
512 |
479 |
416 |
||
|
효소, 미생물 관련장치 |
61 |
50 |
59 |
116 |
134 |
130 |
107 |
85 |
81 |
93 |
135 |
||
|
측정진단 |
조사분석 |
668 |
572 |
465 |
543 |
510 |
489 |
455 |
370 |
539 |
526 |
529 |
|
|
측정, 시험 |
1,111 |
1,121 |
1,087 |
1,329 |
1,122 |
976 |
875 |
730 |
869 |
888 |
824 |
||
|
기 초 |
단백질체 |
고정화펩티드 |
11 |
10 |
9 |
14 |
19 |
15 |
23 |
14 |
18 |
10 |
12 |
|
펩티드 |
528 |
491 |
403 |
425 |
420 |
372 |
312 |
306 |
442 |
542 |
554 |
||
|
하이브리드펩티드 |
10 |
16 |
10 |
6 |
5 |
4 |
2 |
3 |
3 |
3 |
2 |
||
|
동식물 세포배양 |
동식물세포 |
338 |
306 |
276 |
282 |
257 |
238 |
199 |
180 |
216 |
201 |
186 |
|
|
생물자원탐색 |
미생물 |
211 |
213 |
140 |
156 |
122 |
134 |
103 |
107 |
135 |
123 |
120 |
|
|
바이러스 |
46 |
42 |
41 |
35 |
53 |
30 |
31 |
23 |
35 |
33 |
39 |
||
|
유전체 |
당류기함유핵산 |
375 |
417 |
427 |
433 |
486 |
399 |
345 |
316 |
426 |
405 |
433 |
|
|
유전공학 |
688 |
738 |
613 |
644 |
495 |
475 |
456 |
361 |
579 |
579 |
391 |
||
|
항체 |
면역글로블린 |
151 |
126 |
94 |
112 |
104 |
110 |
106 |
100 |
183 |
211 |
212 |
|
|
효소공학기술 |
효소 |
398 |
431 |
373 |
415 |
427 |
366 |
310 |
282 |
374 |
325 |
259 |
|
|
농 업 |
생물농약개발 |
생물농약 |
114 |
122 |
131 |
159 |
153 |
132 |
114 |
79 |
104 |
129 |
114 |
|
형질전환 동식물 |
신규한동물 |
7 |
5 |
21 |
56 |
51 |
51 |
35 |
26 |
58 |
50 |
55 |
|
|
신규한식물 |
328 |
413 |
360 |
328 |
278 |
234 |
318 |
305 |
397 |
485 |
481 |
||
|
식품 |
발효식품 |
알콜발효 및 장치 |
20 |
29 |
17 |
16 |
10 |
19 |
21 |
15 |
26 |
18 |
11 |
|
의 약 |
생물 의약 |
단백질치료제 |
868 |
778 |
671 |
643 |
546 |
535 |
527 |
522 |
701 |
651 |
657 |
|
방사선의약 |
104 |
91 |
82 |
79 |
52 |
65 |
48 |
36 |
43 |
43 |
47 |
||
|
신약후보물질 |
148 |
184 |
146 |
202 |
256 |
244 |
196 |
199 |
176 |
55 |
43 |
||
|
유전자치료 |
65 |
93 |
114 |
96 |
86 |
73 |
70 |
56 |
69 |
71 |
38 |
||
|
치료용항체 |
453 |
500 |
482 |
502 |
480 |
468 |
396 |
323 |
509 |
493 |
561 |
||
|
환 경 |
환경생물공학 |
생물학적수처리 |
109 |
96 |
111 |
109 |
97 |
96 |
121 |
115 |
116 |
152 |
150 |
|
슬러지처리 |
2 |
5 |
1 |
1 |
0 |
2 |
1 |
2 |
0 |
1 |
2 |
||
|
계 |
7,566 |
7,533 |
6,711 |
7,349 |
6,737 |
6,152 |
5,587 |
4,944 |
6,636 |
6,586 |
6,294 |
||
바. 미국특허로 본 생명공학분야의 기술분야별 선두주자
최근 5년(2004~2008년)동안 생명공학분야 중 기초산업의 기술분류별 Top 3를 조사한 결과, 유전체에서는 Pioneer Hi-Bred Int’l, Inc.가 128건, 단백질체 및 항체이용에서는 Genentech Inc.가 각각 262건, 175건의 특허를 보유하고 있는 것으로 나타났다.
[표 3-2-3-5] 미국특허의 생명공학분야 기초 산업의 연구개발 리더
|
세부기술 |
2004~2008년(최근5년) |
||
|
출원인 |
국적 |
건수 |
|
|
생물자원 탐색 |
E I DuPont de Nemours & Co |
US |
21 |
|
Genentech Inc |
US |
15 |
|
|
Degussa AG |
DE |
15 |
|
|
동식물 세포배양 |
Pioneer Hi-Bred Int’l, Inc. |
US |
20 |
|
University of California |
US |
17 |
|
|
US Dept Health & Human Services |
US |
14 |
|
|
효소공학 |
Applera Corporation |
US |
71 |
|
Novozymes A/S |
DK |
65 |
|
|
Genencor International Inc |
US |
52 |
|
|
유전체 |
Pioneer Hi-Bred Int’l, Inc. |
US |
128 |
|
University of California |
US |
109 |
|
|
Isis Pharmaceuticals Inc |
US |
101 |
|
|
단백질체 |
Genentech Inc |
US |
262 |
|
University of California |
US |
42 |
|
|
Human Genome Sciences, Inc. |
US |
36 |
|
|
ZymoGenetics, Inc. |
US |
36 |
|
|
항체이용 |
Genentech Inc |
US |
175 |
|
Human Genome Sciences, Inc. |
US |
52 |
|
|
Arius Research, Inc. |
CA |
17 |
|
사. 고인용(Highly Cited Patent) 특허로 본 우수특허 발굴
2008년도 등록 특허에 인용된 특허 중 고인용 상위 1%의 특허(Highly Cited Patent)를 연도별로 살펴보면 다음과 같다. 특허의 특성상 등록기간이 오래된 특허일수록 많이 인용되는 것으로 볼 수 있는데 대체로 1996년에서 1999년 사이에 등록된 특허가 2008년에 많이 인용되어지는 것으로 조사되었다.
|
년도 |
~1995 |
1996 |
1997 |
1998 |
1999 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
|
건수 |
175 |
63 |
42 |
60 |
44 |
39 |
24 |
19 |
12 |
14 |
16 |
14 |
23 |
2008년도에 가장 많이 인용되어진 고인용 특허 Top 5를 살펴보면, 형질전환동식물 중 신규한 식물분야(US05523520, US05367109), 측정진단기술 중 측정․시험분야(US05536637, US04683195), 생물공정기술 중 생물학적합성분야(US04683202)의 특허들로 조사되었다. Goldsmith Seeds사의 특허가 183회로 가장 많이 인용되었고, Genetics Institute Inc의 특허가 136회로 두 번째로 많이 인용되었다. Cetus Corp의 특허 2건이 3~4위의 다인용특허로 나타났다.
|
등록 번호 |
등록 년도 |
발명의 명칭 |
청구 항수 |
국 가 |
등록권자 대표명 |
인용 회수 |
|
05523520 |
1996 |
Mutant dwarfism gene of petunia |
20 |
US |
Goldsmith Seeds, Inc. |
183 |
|
05536637 |
1996 |
Method of screening for cDNA encoding novel secreted mammalian proteins in yeast |
1 |
US |
Genetics Institute Inc |
136 |
|
04683202 |
1987 |
Process for amplifying nucleic acid sequences |
21 |
US |
Cetus Corp |
108 |
|
04683195 |
1987 |
Process for amplifying, detecting, and/or-cloning nucleic acid sequences |
26 |
US |
Cetus Corp |
100 |
|
05367109 |
1994 |
Inbred corn line PHHB9 |
11 |
US |
Pioneer Hi-Bred Int’l, Inc. |
98 |
4. 논문현황
가. 논문 개요
인간이 행하는 연구와 개발의 목적에는 자연현상에 관한 인과관계와 법칙을 탐구하는 면과 그 현상이나 법칙성을 인간사회에 이용하는 기술을 확립하는 두 가지의 측면이 있다. 전자의 성과는 논문으로 나타나는 것이 많으며 또한 후자의 활동에서 생성되어진 경험이나 지식이 논문의 형태로 나타나는 경우도 있다. 논문으로 발표되는 연구개발의 성과는 인류의 지적 공유재산이 된다. 따라서 논문에 관한 지표는 연구개발 성과의 수준과 인류의 과학기술 지식에 공헌하는 것이기도 하다.
과학기술의 논문에 관한 지표를 작성할 때 직접 방대한 수의 논문지로부터 산출하는 것은 어렵기 때문에 문헌 데이터베이스를 사용한다. 국제적으로 SCI 데이터베이스(Science Citation Index Database, 이하 SCI라 표시)를 많이 활용하는데 이는 과학기술 전반을 대상으로 하고 있으며, 논문의 인용정보를 얻을 수 있고 수록대상 저널의 선정기준을 엄격하게 하고 있는 점이 타 데이터베이스에 비해 우수하다고 할 수 있다. 논문현황자료는 SCI에 근거한 Thomson Reuters의 NSI (National Science Indicators, 1981-2008)를 기반으로 지표를 산출했다.
나. 분석기준
SCI 과학기술 18개 분야 중 생명과학분야인 6개 분야를 대상으로 하고, 한국과 세계평균을 1999년에서 2008년까지 10년을 비교하였다. 국가 간 비교에는 세계 논문 수 상위 10개국과 BRICs국가(브라질, 러시아, 인도, 중국)를 대상으로 조사하였다.
다. 논문현황
2008년 SCI 세계 논문 수는 1,158,247편이며 우리나라 논문 수는 세계논문수의 3.07%인 35,569편으로 세계 순위는 12위를 차지했다.
[표 3-2-4-1] 최근 10년 간 우리나라 논문 발표 수 추이
|
연 도 |
1999년 |
2000년 |
2001년 |
2002년 |
2003년 |
|
논문 발표 수(편) |
12,182 |
13,458 |
15,896 |
17,101 |
21,107 |
|
세계 총 논문 수(편) |
777,872 |
777,734 |
796,755 |
797,471 |
875,242 |
|
세계 점유율(%) |
1.57 |
1.73 |
2.00 |
2.14 |
2.41 |
|
세계 순위 |
16 |
16 |
15 |
14 |
14 |
|
연 도 |
2004년 |
2005년 |
2006년 |
2007년 |
2008년 |
|
논문 발표 수(편) |
22,674 |
27,797 |
28,316 |
27,284 |
35,569 |
|
세계 총 논문 수(편) |
854,158 |
981,781 |
981,747 |
977,792 |
1,158,247 |
|
세계 점유율(%) |
2.65 |
2.83 |
2.88 |
2.79 |
3.07 |
|
세계 순위 |
12 |
11 |
11 |
12 |
12 |
최근 5년 간 우리나라가 발표한 논문 141,640편 중 1회 이상 인용된 논문은 79,062편으로 논문의 피인용 비율은 56%이고, 5년 간 논문의 총 피인용 횟수는 465,022회로 논문 1편당 평균 피인용 횟수는 3.28회로 세계평균(4.62회)의 71% 수준이나 연도별 피인용 횟수를 보면 연도가 누적됨에 따라 피인용도가 높아지는 성향을 보이고 있다.
우리나라 논문의 5년 주기별 1편당 평균 피인용 횟수는 세계 전체평균보다 낮은 수준이나 빠른 속도로 증가하고 있어 논문의 질적인 측면도 향상되고 있음을 보여주고 있다.
[표 3-2-4-2] 년 주기별 논문 1편당 평균 피인용 횟수 현황
(단위: 회)
|
국가명 |
'99-'03 |
'00-'04 |
'01-'05 |
'02-'06 |
'03-'07 |
'04-'08 |
|
한 국 |
2.50 |
2.61 |
2.78 |
2.93 |
3.10 |
3.28 |
|
세계 전체 평균 |
4.11 |
4.15 |
4.30 |
4.40 |
4.51 |
4.62 |
[그림 3-2-4-1] 한국과 세계의 논문 1편당 평균 피인용 횟수 현황

다. 생명공학분야 논문 수
SCI 과학기술 18개 분야 중 최근 5년간(2004~2008) 우리나라가 발표한 생명공학 6개 분야의 논문현황은 다음과 같다.
[표 3-2-4-3] 최근 5년간 생명공학분야 논문 수 점유율
(단위: 편)
|
분야명 |
분야 논문 수 |
분야 논문 수 세계순위 |
국내 점유율 |
우리나라 총 논문 수 |
세계 점유율 |
세계 분야 총 논문 수 |
|
면역학 |
980 |
16 |
0.69% |
141,640 |
1.63% |
60,152 |
|
미생물학 |
3,438 |
8 |
2.43% |
141,640 |
4.22% |
81,508 |
|
분자생물학 & 유전학 |
2,751 |
14 |
1.94% |
141,640 |
1.99% |
138,303 |
|
생물학 & 생화학 |
7,721 |
10 |
5.45% |
141,640 |
2.84% |
272,330 |
|
신경과학 & 행동과학 |
2,419 |
15 |
1.71% |
141,640 |
1.65% |
146,224 |
|
약리학 |
4,085 |
7 |
2.88% |
141,640 |
4.50% |
90,877 |
생명공학 6개 분야 중 3개 분야(약리학, 미생물학, 생물학&생화학)에서 세계 상위 10위권에 포함되는 등 최근 들어 생명공학분야 논문의 세계 점유율이 크게 증가하였다.
최근 5년간 국가별 생명공학분야 논문수를 보면 미국이 6개 분야 모두 월등히 앞서며 일본, 영국, 독일, 프랑스 순으로 뒤를 이었고, BRICs국가(브라질, 러시아, 인도, 중국)는 우리나라와 비슷한 수치를 보였다.
[그림 3-2-4-2] 최근 5년간 국가별 생명공학분야 논문 수 현황

우리나라 생명공학분야 SCI 발표 논문 수는 1990년에는 6개 분야의 합이 112편에 불과하였으나, 1999년에는 면역학(119편)이 39.7배, 미생물학(306편)이 34.0배, 분자생물학&유전학(175편)이 21.9배, 생물학&생화학(794편)이 11.3배, 신경과학&행동과학(187편)이 31.2배, 약리학(291편)이 18.2배로 급속한 성장세를 보였다. 2008년에는 10년 전과 비교하여 면역학(234편)이 2.0배, 미생물학(896편)이 2.9배, 분자생물학&유전학(833편)이 4.8배, 생물학&생화학(1,831편)이 2.3배, 신경과학&행동과학(592편)이 3.2배, 약리학(1,034편)이 3.6배 늘었다.
[표 3-2-4-4] 최근 10년간 우리나라 연도별 생명공학분야 논문현황
|
분야명 |
구분 |
1999 |
2000 |
2001 |
2002 |
2003 |
|
면역학 |
논문 수 |
119 |
123 |
131 |
119 |
131 |
|
피인용수 |
2,583 |
2,262 |
1,974 |
1,643 |
1,916 |
|
|
편당 평균 |
(21.71) |
(18.39) |
(15.07) |
(13.81) |
(14.63) |
|
|
미생물학 |
논문 수 |
306 |
345 |
369 |
410 |
454 |
|
피인용수 |
3,393 |
3,638 |
3,587 |
3,862 |
3,925 |
|
|
편당 평균 |
(11.09) |
(10.54) |
(9.72) |
(9.42) |
(8.65) |
|
|
분자생물학 & 유전학 |
논문 수 |
175 |
238 |
249 |
262 |
323 |
|
피인용수 |
3,583 |
5,300 |
5,345 |
5,572 |
6,069 |
|
|
편당 평균 |
(20.47) |
(22.27) |
(21.47) |
(21.27) |
(18.79) |
|
|
생물학 & 생화학 |
논문 수 |
794 |
903 |
944 |
1,087 |
1,185 |
|
피인용수 |
12,249 |
14,373 |
13,940 |
16,195 |
15,725 |
|
|
편당 평균 |
(15.43) |
(15.92) |
(14.77) |
(14.90) |
(13.27) |
|
|
신경과학 & 행동과학 |
논문 수 |
187 |
252 |
269 |
300 |
387 |
|
피인용수 |
4,284 |
5,006 |
4,622 |
4,692 |
5,106 |
|
|
편당 평균 |
(22.91) |
(19.87) |
(17.18) |
(15.64) |
(13.19) |
|
|
약리학 |
논문 수 |
291 |
358 |
363 |
438 |
601 |
|
피인용수 |
3,780 |
4,971 |
4,736 |
4,968 |
5,528 |
|
|
편당 평균 |
(12.99) |
(13.89) |
(13.05) |
(11.34) |
(9.20) |
|
|
분야명 |
구분 |
2004 |
2005 |
2006 |
2007 |
2008 |
|
면역학 |
논문 수 |
172 |
174 |
194 |
206 |
234 |
|
피인용수 |
2,300 |
1,562 |
1,258 |
777 |
165 |
|
|
편당 평균 |
(13.37) |
(8.98) |
(6.48) |
(3.77) |
(0.71) |
|
|
미생물학 |
논문 수 |
495 |
613 |
707 |
727 |
896 |
|
피인용수 |
3,862 |
3,985 |
3,146 |
1,473 |
253 |
|
|
편당 평균 |
(7.80) |
(6.50) |
(4.45) |
(2.03) |
(0.28) |
|
|
분야명 |
구분 |
2004 |
2005 |
2006 |
2007 |
2008 |
|
분자생물학 & 유전학 |
논문 수 |
373 |
494 |
509 |
542 |
833 |
|
피인용수 |
5,828 |
5,555 |
4,252 |
1,981 |
653 |
|
|
편당 평균 |
(15.62) |
(11.24) |
(8.35) |
(3.65) |
(0.78) |
|
|
생물학 & 생화학 |
논문 수 |
1,304 |
1,545 |
1,539 |
1,502 |
1,831 |
|
피인용수 |
13,744 |
13,072 |
8,016 |
3,873 |
751 |
|
|
편당 평균 |
(10.54) |
(8.46) |
(5.21) |
(2.58) |
(0.41) |
|
|
신경과학 & 행동과학 |
논문 수 |
410 |
479 |
446 |
492 |
592 |
|
피인용수 |
4,580 |
4,725 |
2,778 |
1,200 |
272 |
|
|
편당 평균 |
(11.17) |
(9.86) |
(6.23) |
(2.44) |
(0.46) |
|
|
약리학 |
논문 수 |
644 |
812 |
714 |
881 |
1,034 |
|
피인용수 |
4,961 |
4,563 |
3,026 |
1,632 |
312 |
|
|
편당 평균 |
(7.70) |
(5.62) |
(4.24) |
(1.85) |
(0.30) |
※ 연도별 피인용수는 논문발표시점부터 2008년 말까지 피인용된 누계임.
※ 분야별 편당 평균 = 피인용수 ÷ 논문 수
[그림 3-2-4-3] 우리나라 연도별 생명공학분야 발표 논문 수 추이

라. 생명공학분야 피인용도
최근 5년 간 면역학 분야에서 발표된 논문 980편 중 1회 이상 인용된 논문은 743편으로 논문의 피인용율은 75.82%로, 국내평균 피인용율(55.93%)의 1.36배이며, 생물학&생화학은 71.40%로 1.28배, 신경과학&행동과학은 71.23%로 1.27배, 분자생물학&유전학은 70.23%로 1.26배, 약리학 65.83%로 국내평균의 1.18배이고, 면역학․생물학&생화학, 약리학, 신경과학&행동과학 등 4개 분야에서 같은 분야 세계대비 비율 수치에 근접하게 나타났다.
[표 3-2-4-5] 최근 5년간 생명공학분야 논문 피인용율
|
분야명 |
피인용율 |
피인용된 논문 수 |
분야 논문 수 |
세계대비 비율 |
세계분야 평균 피인용율 |
|
면역학 |
75.82% |
743 |
980 |
0.96 |
79.35% |
|
미생물학 |
66.72% |
2,294 |
3,438 |
0.89 |
75.06% |
|
분자생물학 & 유전학 |
70.23% |
1,932 |
2,751 |
0.89 |
78.85% |
|
생물학 & 생화학 |
71.40% |
5,513 |
7,721 |
0.96 |
74.67% |
|
신경과학 & 행동과학 |
71.23% |
1,723 |
2,419 |
0.93 |
76.41% |
|
약리학 |
65.83% |
2,689 |
4,085 |
0.94 |
69.87% |
최근 5년간 생명공학분야 발표논문에 대한 피인용 현황을 보면 평균 피인용지수는 국내평균지수(3.28)에 비해 분자생물학&유전학이 3.5배 등 6개 분야 모두 높게 나타났다. 또한 같은 분야 세계대비 비율은 매우 저조하지만 지식구조에 있어서 1999년∼2003년의 세계 평균 대비 국내 피인용수에 비해 2004년∼2008년 사이에 우리나라 지식구조가 세계와 유사한 경향으로 개선되고 있음을 알 수 있다.
[그림 3-2-4-4] 생명공학분야의 한국과 세계의 논문 1편당 피인용수 비교


* ( )안의 피인용수는 세계 분야 평균임.
[표 3-2-4-6] BT분야 한국 및 세계의 논문 피인용 추세 상대 비교
|
분야명 |
1996~1999 |
2000~2003 |
2004~2008 |
|||
|
국내평균 (IF) |
세계평균 (IF) |
국내평균 (IF) |
세계평균 (IF) |
국내평균 (IF) |
세계평균 (IF) |
|
|
면역학 |
19.99(2) |
36.65(2) |
15.47(3) |
32.04(2) |
6.19(2) |
11.00(2) |
|
미생물학 |
11.69(5) |
31.24(5) |
9.51(6) |
23.55(5) |
3.70(5) |
7.95(5) |
|
분자생물학 & 유전학 |
18.72(3) |
50.68(1) |
20.79(1) |
40.35(1) |
6.64(1) |
12.55(1) |
|
생물학 & 생화학 |
14.21(4) |
34.03(4) |
14.62(4) |
25.00(4) |
5.11(4) |
8.23(4) |
|
신경과학 & 행동과학 |
23.98(1) |
36.56(3) |
16.08(2) |
28.08(3) |
5.60(3) |
8.88(3) |
|
약리학 |
11.44(6) |
19.86(6) |
11.48(5) |
17.51(6) |
3.55(6) |
5.90(6) |
※ 세계평균: SCIE 상위 10개국과 BRICs(브라질, 러시아, 인도, 중국) 전체 평균
생명공학분야의 5년 주기별 평균 피인용 횟수를 보면 면역학, 미생물학, 신경과학&행동과학, 약리학은 빠른 속도로 증가하고 있음을 볼 수 있다.
[표 3-2-4-7] 5년 주기별 생명공학분야 평균 피인용 횟수 현황
(단위: 회)
|
국가명 |
'99-'03 |
'00-'04 |
'01-'05 |
'02-'06 |
'03-'07 |
'04-'08 |
|
면역학 |
5.11 |
4.53 |
4.65 |
4.99 |
5.64 |
6.18 |
|
미생물학 |
2.66 |
2.77 |
2.99 |
3.24 |
3.49 |
3.70 |
|
분자생물학 & 유전학 |
5.42 |
5.90 |
6.24 |
6.40 |
6.77 |
6.64 |
|
생물학 & 생화학 |
3.90 |
4.13 |
4.43 |
4.76 |
4.95 |
5.11 |
|
신경과학 & 행동과학 |
4.50 |
4.47 |
4.53 |
4.89 |
5.31 |
5.60 |
|
약리학 |
2.45 |
2.68 |
2.79 |
3.11 |
3.27 |
3.55 |
[그림 3-2-4-5] 5년 주기별 생명공학분야 평균 피인용 횟수 추이

5. 인프라현황
가. 개요
일반적으로 실용화기술개발 단계의 세부과정은 ① 순수연구 및 독창적․창의적 기초연구(Biasic research) 과정, ② 개발가능성 확보 및 효능확인의 응용연구(Applied research) 과정, ③ Prototype 및 시제품 제작의 개발(Development) 과정, ④ 대량생산의 가능성 확보 및 제품성능평가의 시생산(Pilot-plant) 과정, ⑤ 대량생산 및 품질관리의 산업화(Manufacturing) 과정으로 세분화 할 수 있으나, 생물산업은 일반 산업분야와 달리 차별성과 특이성이 존재한다. 이는 개발과정, 시생산과정, 산업화과정 등을 거치면서 개발될 제품(식품 및 의약품 등)을 최종적으로 인체에 적용하기 위하여 체내 안전성․유효성 등에 대한 신뢰성평가(비임상, 임상, 우수제조기준 등)를 필수적으로 검증해야 한다는 것이다. 또한 이러한 생물산업의 실용화기술개발 단계에서 R&D 기능뿐 아니라 기술하부구조로 되어 있는 인프라구조(Infra-structure)의 효율적으로 지원하는 체계의 구축은 성공적인 생물산업의 육성과 지속적인 성장을 가능케 하는 필수 요인이다.
생물산업 인프라 분야와 관련해서는 ① 실용화기술개발의 응용연구 과정까지는 주로 한국한의약연구원, 한국표준과학연구원, 한국과학기술연구원, 한국생명공학연구원, 한국전자통신연구원, 한국기초과학연구원 등의 정부출연기관과 서울대학교를 중심으로 R&D 인프라가 구축되어 운영하고 있으며, ② 응용연구 과정 이후부터는 산업화에 특화된 지원을 위해 지식경제부를 중심으로 R&D 및 시제품 제작․생산에 필요한 고가의 시설과 장비, 관련 기업의 창업과 성장 단계별 지원을 위한 인프라인 산학연공동연구기반구축센터 3개, 바이오벤처기업지원센터(Bio Venture Center, BVC) 9개, 지역특화센터 20개, 서울대학교 코리아바이오허브센터(Korea Bio-Hub Center) 등과 우수의약품 제조기준(cGMP)에 맞는 한국생산기술연구원 생물산업기술실용화센터 등이 구축되어 운영하고 있으며, ③ 특히 생물산업 제품의 신뢰성평가에 특화된 인프라는 지식경제부가 지원하는 한국화학연구원 안전성평가연구소를 포함하여 보건복지가족부 식품의약품안전청에서 지정된 비임상(GLP) 기관 15개와 임상(GLP) 기관 228개(임상1상 32개, 임상2상 87개, 임상3상 109개)의 인프라가 운영되고 있다.
[표 3-2-5-1] 실용화기술개발 단계별 생물산업 관련 주요 인프라 현황
|
인프라단계 |
세부구분 |
인프라기관 |
주요역할 |
|
Research
(기초연구 및 응용연구) |
의약 바이오 |
한국한의약연구원 한국표준과학연구원 한국과학기술연구원 |
한의학표준화기반 연구 바이오분야 측정표준 연구 표적지향형 신규항암제 후보물질 연구 |
|
산업/ 그린/ 융합 바이오 |
한국생명공학연구원 한국생명공학연구원 한국생명공학연구원 한국생명공학연구원 한국전자통신연구원 한국과학기술연구원 |
바이오제품 안전성평가 및 정보관리 국가영장류센터 운영 바이오융합 연구 국가생물자원정보 관리 유비쿼터스건강관리모듈/시스템개발 실시간분자영상 스마트센서기술 개발 |
|
|
종합분야 |
한국기초과학연구원 서울대학교 한국생명공학연구원 한국생명공학연구원 |
고가의 연구기자재 활용 미생물 및 세포주은행(관리 및 공급) 해외생물소재(식물) 허브센터 국가생명공학정책연구 및 확산 |
|
|
Development Pilot-plant Manufacturing
(개발, 시생산 및 산업화) |
공동장비지원 |
경기바이오센터 등 3개 |
산학연공동연구기반구축 |
|
벤처기업지원 |
한국생명공학연구원 등 9개 |
바이오벤처기업지원센터(TIC를 포함BVC) 구축 |
|
|
지역 클러스터 |
대전테크노파크 등 20개 (지원기반정비 13개 별도) |
지역특화산업 분야 혁신역량 제고 (시설․장비지원,기술지원,교육훈련,시생산 (Pilot plant, GMP 등) 및 공인검사 수행 등) |
|
|
종합분야 |
한국생산기술연구원 한국생명공학연구원 서울대학교 순창군 장류연구소 |
생물산업기술실용화센터건립(cGMP) 바이오안전성정보센터(LMO관련) 코리아바이오허브구축(Networking) 발효미생물종합활용센터건립(전통식품) |
|
|
GLP(비임상) GCP(임상)
(신뢰성평가) |
GLP (비임상) |
식약청 지정 GLP 15개 (한국화학연구원 등) |
비임상 시험항목별 허가기관 ('06.10) (안전성평가연구소) |
|
GCP (임상) |
식약청 지정 GCP 228개 |
임상1상 32개, 임상2상 87개, 임상3상 109개('07.1) |
* 의약바이오(RedBio): 바이오신약, 바이오장기 등 바이오기술을 보건의료 분야에 응용한 것
* 산업/그린바이오(GreenBio): 유전자변형생물체(LMO), 건강기능식품 등 바이오기술을 농축산 및 식품 분야에 응용한 것
* 융합바이오(WhiteBio): 바이오공정, 바이오환경, 바이오에너지 등 바이오기술을 산업공정/생산 및 환경 분야에 응용한 것
* BVC: 바이오벤처기업지원센터(Bio Venture Center), 전국 바이오벤처기업지원센터 간 협력네트워크 및 전략적 연계운영시스템 구축을 통한 효율적 기업지원시스템 구축, 바이오산업의 지역별 균형발전을 도모하기 위해 설립․운영
* TIC: 지역기술혁신센터(Technology Innovation Center), 지역대학을 중심으로 지역 내 산업기술혁신을 지원하도록 설립․운영
* 지역클러스터(지역특화센터): 지역특화산업 분야의 혁신역량을 제고하기 위하여 지역 내 설치 운영되는 센터이며, 지역의 기획역량, 기술개발역량의 중재자 기능을 수행하는 인프라 역할 수행
나. 현황
(1) 기초․응용연구 단계 인프라
기초․응용연구 단계 인프라는 기초이론과 실험, 실용 목적의 아이디어, 특허 등의 개념을 정립하고 연구실 규모의 기본성능을 검증하고 부품과 시스템의 핵심성능 평가 등을 지원하는 인프라이다. 주로 국책연구원을 중심으로 인프라가 형성되어 기술개발을 지원하고 있다.
특히 기초․응용연구 단계에서 가장 큰 비중을 차지하는 한국생명공학연구원은 바이오제품 안전성평가와 정보관리, 국가영장류센터 운영, 바이오융합 연구, 해외생물소재 허브센터 운영, 국가생명공학정책연구 및 확산 등의 기능을 담당하고 있다. 한국과학기술연구원은 표적지향형 신규항암제 후보물질 연구와 실시간 분자영상 스마트센터기술 연구 등의 기능을 담당하고 있으며, 한국한의약연구원은 한의학표준화연구를, 한국전자통신연구원은 유비쿼터스 건강관리시스템 연구 등의 중요한 인프라 기능을 담당하고 있다.
그러나 기초․응용연구 환경에 종합적으로 필요한 2개의 핵심 인프라로 한국기초과학연구원과 서울대학교에 설치된 한국세포주은행을 꼽을 수 있다. 한국기초과학연구원은 1988년 기초과학의 연구를 지원하고 공동으로 연구를 수행할 목적으로 설립되었다. 국가적으로 대형 공동연구장비를 개발해 운영하고 첨단연구장비에 대한 이용자 교육, 범국가적인 연구장비의 정보수집․분석 등의 기능을 담당하고 있으며, 2008년 현재 대전 본원을 포함한 9개(서울, 부산, 대구, 광주, 전주, 춘천, 순천, 강릉, 오창) 분원에 총 368종의 지원장비(약 1,139억원 규모)를 보유하고 있다.
한국세포주은행은 1982년 전국의 연구기관에 필요한 세포주를 개발하고 공급할 목적으로 설립되어 세포주 자원에 관련된 정보를 수집하고 보존․공급하고 있으며, 세포주와 관련된 각종 교육․연수․학술회의를 맡고 있다. 또한 특허출원 세포주의 기탁과 보존의 기능을 담당하고 있다. 1993년 UN 산하 세계지적재산권기구로부터 특허미생물의 국제기탁기관의 지위를 취득하였고, 현재 자체개발 세포주 330여종(109종 분양가능), 외국도입 세포주 428종을 보유하고 있다.
(2) 개발․시생산 및 산업화 단계 인프라
개발․시생산 및 산업화 단계 인프라는 기초단계 이후의 효능을 검증하는 인프라이다. 확정된 부품과 시스템의 시작품 제작하고 평가하며, Pilot 규모의 시작품을 제작해 성능을 평가하는 업무를 지원한다. 대부분 지식경제부 지원기관을 중심으로 인프라가 형성되어 산업화를 지원하고 있다.
산업화 지원 인프라는 기본적으로 기업성장 단계별 지원(창업보육 등), 시설․장비구축․활용, 교육훈련, 정보교류, 기술지도 등을 담당하고 있다. 인프라 구축의 형태로 크게 구분하면, ① 생물산업실용화기반(cGMP, 발효미생물활용센터), ② 바이오안전성기반(LMO), ③ 연계협력기반(Korea Bio-Hub), ④ 산업기술기반조성(BVC, 산학연공동연구기반), ⑤ 지역클러스터(지역특화센터) 등이며, 국내 생물산업의 여건과 경쟁력을 고려하여 지식경제부를 중심으로 전략적으로 구축되었다.
생물산업실용화기반 부분을 살펴보면 1998년 국내 생물의약 분야의 성장에도 불구하고 미국 FDA의 인증을 받은 우수의약품제조및품질관리기준인 cGMP46)기준의 생산공장이 전무한 실정을 감안하여 선진국 수출지원을 위해 국제적으로 인정된 기준에 맞는 생물의약품 전문생산시설(생물산업기술실용화센터, 1998년~2007년)47)이 구축되었으며, 2007년 국내 발효식품산업 육성과 위해 전통발효식품(고추장, 된장 등)의 안전성 확보 및 발효미생물자원의 허브 구축을 위하여 발효미생물종합활용센터(1998년∼2007년)48)가 구축되었다.
바이오안전성기반 부분을 살펴보면, 2002년 유전자변형생물체(LMO)를 중심으로 대두된 국제무역질서에 대응하기 위한 의무사항의 교육과 홍보를 위해 바이오안전성정보센터(2002년~계속)를 구축하였으며, 연계협력기반 부분에서는 국내외 바이오네트워크의 구축과 활성화, 그리고 웹포털 구축으로 각종 협업기관을 지원하기 위하여 코리아바이오허브센터(2004년~계속)를 구축하였다.
또한, 산업기술기반조성과 지역클러스터 부분으로는, 수도권을 포함한 각 지역에 소재한 중소 바이오벤처기업의 특성화를 유도하고 현장 밀착형 지원을 위해 산업정책 차원에서 바이오벤처기업지원센터(BVC, 1998년∼2007년)49)와 산학연공동연구기반구축(2004년∼2011년)50), 지역균형발전 차원에서 지역 바이오클러스터(지역특화센터, 2002년∼2012년)51)가 구축되었다.
(가) 산업화 인프라 지원 현황
산업화 지원 인프라에 2009년까지 실제 지급한 국비지원금은 25개 기관, 51개 과제에 총 5,152.17억 원이 지원되었으며, 51개 과제는 cGMP 1개, LMO 3개, 산기반 3개, 네트워킹 1개, 발효산업 1개, BVC 9개, 지역특화센터 33개(2단계 13개 포함)로 구성되어 있다.
5+2광역경제권역별 2009년까지의 지원금액(지원과제수 51개 포함) 비중을 살펴본 결과, 호남권이 27.7%(1,424.63억 원, 13개) 지원되었으며, 수도권이 22.6% (1,163.8억 원, 3개), 충청권이 19.0%(979.96억 원, 13개), 대경권이 9.8%(503.27억 원, 9개), 강원권이 9.9%(511.27억 원, 5개), 동남권이 5.9%(302.85억 원, 5개), 제주권이 5.2%(266.39억 원, 3개) 순으로 지원되었다. 지원분야별 지원금액(지원과제수 포함) 비중은, 각각 산업/그린바이오 분야가 52.8%(2,718.88억 원, 33개), 의약바이오 분야가 36.5%(1,881.19억 원, 13개), 복합지원(의약/산업/그린) 분야가 10.7% (552.1억 원, 5개)등의 비중을 차지하고 있다.
지원과제별 지원서비스 분야별 현황(2개 이상 지원 역할 포함)은 Pilot Plant 지원이 47.3%(26개), GMP 지원이 29.1%(16개), GLP 지원이 1.8%(1개), 공인인증검사(식품위생검사 등)이 16.4%(9개), 기타(연구지원, 정보제공 등)가 5.5%(3개) 등으로 구성되어 있다.
[그림 3-2-5-1] 광역경제권역별 산업화 인프라 지원 현황(~2009년)

[그림 3-2-5-2] 지원분야별 산업화 인프라 지원 현황(~2009년)

(나) 산업화 인프라 지원성과
산업화 지원 인프라 구축을 위해 총 197,173평의 부지가 사용되었으며, 행정동, 연구동, 장비지원동, Pilot Plant, 기업입주 공간 등의 건물 규모는 총 74,654평이며, 인프라 지원 상주인력은 총 820명에 다다르고 있다. 구체적으로 5+2광역경제권역별로 구분하면, 수도권이 부지 15,973평, 건물 13,099평, 상주인력 171명, 충청권이 부지 12,306평, 건물 5,511평, 상주인력 95명, 호남권이 부지 106,088평, 건물 26,850평, 상주인력 304명, 동남권이 부지 20,452평, 건물 8,860평, 상주인력 58명, 대경권이 부지 24,499평, 건물 8,675평, 상주인력 98명, 강원권이 부지 12,330평, 건물 8,646평, 상주인력 60명, 제주권이 부지 5,525평, 건물 3,013평, 상주인력 34명 등으로 구성되어 있다. 지원분야별로 비중은, 산업/그린바이오 분야의 부지가 68.1%(134,189평), 건물이 61.1%(45,607평), 상주인력이 47.0%(385명), 의약바이오 분야의 부지가 27.4%(54,076평), 건물이 28.9%(21,555평), 상주인력이 37.7%(309명), 복합지원 분야 부지가 4.5%(8,908평), 건물이 10.0%(7,492평), 상주인력이 15.4%(126명) 등의 비중을 차지하고 있다.
또한, 2009년까지의 산학연 등 지원성과(연도별 누계)를 보면, 입주기업수가 2007년 말 506개, 2008년 말 629개, 2009년 8월 현재까지 739개이다. 장비구축건수는 2007년 말 5,537건, 2008년 말 6,225건, 2009년 8월 현재까지 6,680건이며, 기술지도 및 기술상담 건수는 2007년 말 2,883건, 2008년 말 4,560건, 2009년 8월 현재 5,854건이고 세미나 및 교육훈련은 2007년 말 1,176건, 2008년 말 1,539건, 2009년 8월 말 현재 1,788건이다. 각종 산업화 지원 등을 통한 수익금 현황은 2007년 말 74.1억 원, 2008년 말 147억 원, 2009년 8월 말 현재 194.8억 원에 달하는 우수한 성과를 도출하였다.
지원분야별로 성과 비중을 살펴보면, 산업/그린바이오 분야 입주기업이 72.8% (538개), 장비구축건수가 73.7%(4,921건), 기술지도 및 기술상담 건수가 63.6%(3,722건), 세미나 및 교육훈련 건수가 66.1%(1,182건), 수익금 규모가 46.3%(90.3억 원)이다. 의약바이오 분야는 입주기업이 19.5%(144개), 장비구축건수가 19.6%(1,308건), 기술지도 및 기술상담 건수가 27.0%(1,580건), 세미나 및 교육훈련 건수가 21.0%(376건), 수익금 규모가 40.9% (79.7억 원)이며 복합지원 분야에서는 입주기업이 7.7%(57개), 장비구축건수가 6.8%(451건), 기술지도 및 기술상담 건수가 9.4%(552건), 세미나 및 교육훈련 건수가 12.9%(230건), 수익금 규모가 12.8%(24.9억 원) 등의 비중을 차지하고 있다.
|
[그림 3-2-5-3] 광역경제권역별/연도별(누계) 산업화 인프라 지원성과(입주기업) |
[그림 3-2-5-4] 광역경제권역별/연도별(누계) 산업화 인프라 지원성과(장비구축) |
|
|
|
|
[그림 3-2-5-5] 광역경제권역별/연도별(누계) 산업화 인프라 지원성과(기술지도) |
[그림 3-2-5-6] 광역경제권역별/연도별(누계) 산업화 인프라 지원성과(교육훈련) |
|
|
|
|
[그림 3-2-5-7] 광역경제권역별/연도별(누계) 산업화 인프라 지원성과(수익금 발생) |
[그림 3-2-5-8] 지원분야별 산업화 인프라 지원성과(2009년 8월 말 누계치) |
|
|
|
(3) 신뢰성평가 단계 인프라
신뢰성평가 단계 인프라는 최종 개발제품의 산업화 전후 단계에서 인체에 적용해 체내에서 안전성과 유효성에 대한 신뢰(비임상, 임상 등)를 확보하기 위한 인프라이다. 대부분 보건복지가족부(식품의약품안전청)의 인허가를 획득한 지원기관을 중심으로 인프라가 형성되어 있다.
구체적으로 식품의약품안전청으로부터 비임상시험관리기준(GLP, Good Laboratory Practice) 시험기관으로 지정된 기관은 2006년 현재 15개 기관이 운영 중에 있으며, 임상시험관리기준(GCP, Good Clinical Practice) 기준에 맞는 자격기준을 갖추어 식약청으로부터 임상시험실시기관으로 지정된 국내기관은 2007년 현재 228개(임상1상 32개, 임상2상 87개, 임상3상 109개) 기관이 운영 중이다.
[표 3-2-5-2] 국내 GLP 현황
|
GLP기관 지정순서 |
1호 |
2호 |
3호 |
4호 |
5호 |
6호 |
7호 |
8호 |
9호 |
10호 |
11호 |
12호 |
13호 |
14호 |
15호 |
16호 |
17호 |
|
|
시험기관
시험항목 (세부시험항목) |
한국화학 연구원 |
유한양행 |
동아제약 |
LG CI |
CJ |
바이오톡 스텍 |
산업안전 연구원 |
켐온 |
태평양기술 연구원 |
서울대병원 |
한국화학 시험연구원 |
메드빌 |
바이오코아 |
아이 바이오팜 |
대구카톨릭 대학교 |
동아대병원 |
서울의약 연구소 |
|
|
단회투여독성 |
설치류 |
○ |
○ |
○ |
○ |
○ |
○ |
○ |
○ |
- |
○ |
○ |
- |
- |
- |
○ |
○ |
- |
|
비설치류 |
○ |
- |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
|
|
반복투여독성 |
설치류 |
○ |
○ |
- |
○ |
- |
○ |
○ |
○ |
- |
○ |
○ |
- |
- |
- |
- |
- |
- |
|
비설치류 |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
|
|
영장류 |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
생식발생독성 |
수태능 및 초기배 발생시험 |
○ |
- |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
|
출생전후발생/ 모체기능시험 |
○ |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
|
|
배태자발생시험 |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
|
|
유전독성시험 |
복귀돌연변이 시험 |
○ |
○ |
- |
○ |
- |
○ |
○ |
○ |
- |
○ |
○ |
○ |
- |
- |
- |
○ |
- |
|
체외염색체이상or 쥐림포마tk |
○ |
- |
- |
○ |
○ |
○ |
○ |
○ |
- |
○ |
○ |
○ |
- |
- |
- |
- |
- |
|
|
체내소핵시험 |
○ |
○ |
- |
○ |
- |
○ |
○ |
○ |
- |
○ |
○ |
- |
- |
- |
- |
- |
- |
|
|
면역독성시험 |
아나필락시스 쇼크반응 |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
|
수동피부아나필락시스반응 |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
|
|
피부감작성시험 |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
|
|
기타면역독성시험 |
○ |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
발암성시험 |
○ |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
의존성시험(비GLP) |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
국소독성시험 |
피부자극시험 |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
○ |
○ |
○ |
- |
- |
- |
- |
- |
- |
|
안점막자극시험 |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
○ |
○ |
○ |
- |
- |
- |
- |
- |
- |
|
|
기타 |
광감작성시험 |
○ |
- |
- |
- |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
|
광독성시험 |
○ |
- |
- |
- |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
독성동태시험中 분석시험 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
○ |
- |
- |
○ |
|
|
일반약리시험(비GLP) |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
소재지 |
대전 |
용인 |
용인 |
대전 |
이천 |
청원 |
대전 |
용인 |
용인 |
서울 |
김포 |
서울 |
서울 |
대전 |
경산 |
부산 |
서울 |
|
|
지정 |
최초지정일 |
'88. 7.22 |
'88. 8.11 |
'89. 11.15 |
'95. 5.24 |
'02. 2.22 |
'02. 12.13 |
'02. 6.4 |
'02. 8.12 |
'02. 8.21 |
'03. 1.9 |
'03. 5.30 |
'03. 9.20 |
'05. 5.24 |
'05. 5.27 |
'05. 7.26 |
'05. 11.10 |
'06. 7.21 |
|
지정취하일 |
|
|
'06. 7.15 |
|
'06. 7.5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
출처: 식약청 생물의약품안전팀(2006.6.15) 및 한약관리팀(2006.10.10) 자료를 토대로 작성
[표 3-2-5-3] 국내 GCP 현황
|
지정번호 |
기관명 |
지정일자 |
지정번호 |
기관명 |
지정일자 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
임상1상 |
임상2상 |
임상3상 |
임상1상 |
임상2상 |
임상3상 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
1 |
가톨릭대학교 강남성모병원 |
'97.3.11 |
'97.3.11 |
'97.3.11 |
58 |
경희대학교 한의대부속한방병원 |
|
|
'97.11.7 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2 |
가톨릭대학교 대전성모병원 |
|
'04.4.8 |
'97.3.11 |
59 |
대구가톨릭대학교 병원 |
|
'03.7.29 |
'98.5.28 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
3 |
가톨릭대학교 성가병원 |
|
'05.3.28 |
'97.3.11 |
60 |
제일의료재단 제일병원 |
|
'98.5.28 |
'98.5.28 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
4 |
가톨릭대학교 성모병원 |
'97.3.11 |
'97.3.11 |
'97.3.11 |
61 |
연세대학교 원주기독병원 |
|
'05.6.15 |
'98.8.18 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
5 |
가톨릭대학교 성모자애병원 |
|
'97.3.11 |
'97.3.11 |
62 |
고신대학교 복음병원 |
|
'06.5.22 |
'99.2.6 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
6 |
가톨릭대학교 성바오로병원 |
|
'04.2.9 |
'97.3.11 |
63 |
지방공사 대구의료원 |
|
|
'99.6.26 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
7 |
가톨릭대학교 의정부성모병원 |
'05.10.27 |
'05.1.13 |
'97.3.11 |
64 |
한림대학교 성심병원 |
|
'00.7.22 |
'99.7.19 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
8 |
강동성심병원 |
|
'97.3.11 |
'97.3.11 |
66 |
경상대학교 병원 |
|
'02.9.24 |
'99.9.13 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
9 |
경북대학교 병원 |
'05.12.19 |
'97.3.11 |
'97.3.11 |
67 |
충남대학교 병원 |
|
'99.9.20 |
'99.9.20 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
10 |
경희대학교 의과대 부속병원 |
|
'97.3.11 |
'97.3.11 |
68 |
고려대학교 안산병원 |
'06.2.21 |
'00.1.25 |
'00.1.25 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
11 |
포천중문의과대학 분당차병원 |
|
'97.3.11 |
'97.3.11 |
69 |
국립마산결핵병원 |
|
'00.10.23 |
'00.10.23 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
12 |
계명대학교 동산병원 |
|
'99.6.15 |
'97.3.11 |
70 |
순천향대학교 의대부속부천병원 |
'01.5.22 |
'01.5.22 |
'01.5.22 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
13 |
고려대학교 의대부속구로병원 |
|
'99.11.26 |
'97.3.11 |
71 |
국립암센터 |
'02.3.26 |
'01.7.11 |
'01.7.11 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
14 |
고려대학교 의대부속병원 |
'97.3.11 |
'97.3.11 |
'97.3.11 |
72 |
분당차한방병원 |
|
|
'01.10.25 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
15 |
국립의료원 |
|
|
'97.3.11 |
74 |
인제대학교 일산백병원 |
|
|
'01.10.30 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
16 |
단국대학교 의대부속병원 |
'97.3.11 |
'97.3.11 |
'97.3.11 |
75 |
국민건강보험공단 일산병원 |
|
'01.11.9 |
'01.11.9 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
17 |
동아대학교 병원 |
'03.11.10 |
'97.3.11 |
'97.3.11 |
76 |
영훈의료법인 대전선병원 |
|
'02.5.31 |
'02.5.31 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
18 |
부산대학교 병원 |
'03.11.10 |
'97.3.11 |
'97.3.11 |
77 |
울산대학교 병원 |
'06.2.14 |
'02.9.24 |
'02.9.24 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
19 |
삼성생명공익재단 삼성서울병원 |
'97.3.11 |
'97.3.11 |
'97.3.11 |
78 |
의료법인 을지병원 |
|
'02.9.24 |
'02.9.24 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
20 |
서울대학교 병원 |
'97.3.11 |
'97.3.11 |
'97.3.11 |
79 |
대구파티마병원 |
|
'02.9.24 |
'02.9.24 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
22 |
순천향대학교 의대부속병원 |
'00.10.23 |
'00.10.23 |
'97.3.11 |
80 |
동국대학교 경주병원 |
|
'03.3.31 |
'03.3.31 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
23 |
아산복지사업재단 서울아산병원 |
'97.3.11 |
'97.3.11 |
'97.3.11 |
81 |
조선대학교 부속병원 |
|
'03.7.29 |
'03.7.29 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
24 |
아주대학교 병원 |
'05.2.19 |
'97.3.11 |
'97.3.11 |
82 |
원광대학교 광주한방병원 |
|
'03.9.25 |
'03.9.25 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
25 |
연세대학교 세브란스병원 |
'97.3.11 |
'97.3.11 |
'97.3.11 |
83 |
서울대학교 분당병원 |
|
'03.9.25 |
'03.9.25 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
26 |
연세대학교 연세암센터 |
'97.3.11 |
'97.3.11 |
'97.3.11 |
84 |
순천향대학교 천안병원 |
'04.2.9 |
'04.2.9 |
'04.2.9 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
27 |
연세대학교 영동세브란스병원 |
|
'97.3.11 |
'97.3.11 |
85 |
국립서울병원 |
|
|
'04.2.9 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
29 |
영남대학교 의대부속병원 |
'97.3.11 |
'97.3.11 |
'97.3.11 |
86 |
을지의과대학 부속병원 |
|
'04.4.8 |
'04.4.8 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
30 |
왈레스기념침례병원 |
|
|
'97.3.11 |
87 |
보훈복지의료공단 서울보훈병원 |
|
'05.6.15 |
'04.4.8 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
31 |
원광대학교 의과대학병원 |
|
'97.3.11 |
'97.3.11 |
88 |
제주대학교 병원 |
|
'04.5.13 |
'04.5.13 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
32 |
길의료재단 중앙길병원 |
'99.12.29 |
'99.12.29 |
'97.3.11 |
89 |
동의대학교 부속한방병원 |
|
'04.6.3 |
'04.6.3 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
33 |
삼성의료재단 강북삼성병원 |
|
'97.3.11 |
'97.3.11 |
91 |
건국대학교 충주병원 |
|
|
'04.6.12 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
34 |
이화여자대학교 의대목동병원 |
'97.3.11 |
'97.3.11 |
'97.3.11 |
92 |
전남대학교 화순병원 |
|
'04.11.11 |
'04.6.12 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
35 |
이화여자대학교 의대동대문병원 |
'97.3.11 |
'97.3.11 |
'97.3.11 |
93 |
메리놀병원 |
|
|
'04.6.18 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
36 |
인제대학교 부속부산백병원 |
'97.3.11 |
'97.3.11 |
'97.3.11 |
94 |
청주성모병원 |
|
'06.5.19 |
'04.9.6 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
37 |
인제대학교 상계백병원 |
|
'97.3.11 |
'97.3.11 |
95 |
대동병원 |
|
|
'04.10.12 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
38 |
인제대학교 서울백병원 |
|
'06.10.22 |
'97.3.11 |
96 |
의료법인 한라병원 |
|
'04.11.5 |
'04.11.5 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
39 |
전남대학교 병원 |
'04.10.4 |
'97.3.11 |
'97.3.11 |
97 |
건국대학교 병원 |
|
'06.3.17 |
'04.11.26 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
40 |
전북대학교 병원 |
'06.4.10 |
'97.3.11 |
'97.3.11 |
98 |
건양대학교 병원 |
|
'04.12.1 |
'04.12.1 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
41 |
중앙대학교 병원 |
|
'05.4.15 |
'97.3.11 |
99 |
성광의료재단 차병원 |
|
'05.1.13 |
'05.1.13 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
42 |
중앙대학교 의대부속용산병원 |
|
'97.3.11 |
'97.3.11 |
100 |
명지의료재단 명지병원 |
|
'05.1.19 |
'05.1.19 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
43 |
서울의료원 |
|
|
'97.3.11 |
101 |
강원대학교 병원 |
|
'05.1.20 |
'05.1.20 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
44 |
충북대학교 병원 |
|
'97.3.11 |
'97.3.11 |
102 |
창원파티마병원 |
|
|
'05.5.7 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
45 |
학교법인 인하병원 |
|
'97.3.11 |
'97.3.11 |
103 |
강릉아산병원 |
|
|
'05.8.11 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
46 |
한국원자력연구소 원자력병원 |
|
'97.3.11 |
'97.3.11 |
104 |
길의료재단 경원인천한방병원 |
|
|
'05.8.29 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
47 |
한국전력공사 부속한일병원 |
|
|
'97.3.11 |
105 |
동국대학교 병원 |
'05.9.14 |
'05.9.14. |
'05.9.14 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
48 |
한림대학교 강남성심병원 |
|
'97.3.11 |
'97.3.11 |
106 |
효산의료재단 샘안양병원 |
|
|
'05.10.24 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
49 |
한림대학교 부속춘천성심병원 |
|
'97.3.11 |
'97.3.11 |
107 |
대진의료재단 분당제생병원 |
'05.11.04 |
'05.11.4. |
'05.11.4 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
50 |
한림대학교 한강성심병원 |
|
'97.3.11 |
'97.3.11 |
108 |
대전대학교 부속한방병원 |
|
'05.12.28 |
'05.12.28 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
51 |
한양대학교 구리병원 |
|
|
'97.3.11 |
109 |
삼성의료재단 마산삼성병원 |
|
|
'06.5.23 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
52 |
한양대학교 병원 |
'05.12.13 |
'97.4.29 |
'97.3.11 |
110 |
상지대학교 부속한방병원 |
|
|
'06.6.2 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
53 |
명경의료재단 꽃마을한방병원 |
|
|
'97.6.11 |
111 |
광주기독병원 |
|
'06.6.5 |
'06.6.5 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
54 |
가톨릭대학교 성빈센트병원 |
|
'00.1.25 |
'97.6.11 |
112 |
경희대학교 동서신의학병원 |
'06.8.17 |
'06.8.17 |
'06.8.17 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
55 |
연세대학교 광주세브란스병원 |
|
|
'97.6.11 |
113 |
부산성모병원 |
|
'06.12.26 |
'06.12.26 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
56 |
서울특별시립보라매병원 |
|
|
'97.6.23 |
114 |
원광대학교 한의대 산본한방병원 |
|
'07.1.8 |
'07.1.8 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
57 |
인하대학교 의대부속병원 |
'97.8.12 |
'97.8.12 |
'97.8.12 |
115 |
부산성모병원 |
|
'06.12.26 |
'06.12.26 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
116 |
원광대학교 한의대 산본한방병원 |
|
'07.1.8 |
'07.1.8 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
총 109개 기관에 228개 임상시험실시기관 지정 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
출처: 식약청 임상관리팀(2007.1.8) 자료를 토대로 작성
다. 발전 과제
생명공학 인프라 분야는 생물산업의 발전을 위한 하부구조를 구성하며, 기초연구에서 사업화까지의 실용화 전 과정에 걸쳐 다양한 역할을 수행하는 분야이다. 일반적으로 R&D 지원 인프라를 세부적으로 구분하면, 고가의 장비지원(연구용․분석용․시제품용․검정용 등)과 교육훈련지원, 정보화지원, 표준화지원, 국제협력 지원, 신뢰성평가지원, (비)임상지원, 생산지원, 입주공간 등 공간지원, 마케팅지원, 위탁생산 등으로 구분이 가능하나, 실질적인 R&D 생산성 및 전문성 제고를 위해서는 이러한 다양한 인프라 서비스를 효과적으로 결집하여 운영하는 것이 중요하다. 특히, 전문인력을 안정적으로 확보하여 특성화, 종합화된 인프라의 내실을 기하는 지원은 R&D 활동의 전주기적인 지원체계 확립 차원에서 반드시 필요하다.
이미 구축된 국책연구소와 산업화 및 신뢰성 단계의 인프라 시설은 그 역할이 매우 중요하다. 앞으로도 생명공학 인프라의 발전을 위해서 인프라 간 연계성을 강화하고 관련 주무부처와 긴밀한 협조체계를 이루며 예산을 확대해야 한다. 또한 글로벌 경쟁력을 높이기 위해 인프라 내의 전문인력을 지속적으로 확충하고 지원서비스 개발이 강화될 필요가 있다. 이러한 선진국형 생물제품 평가 인프라(GLP, GCP, GMP 내실화)의 지속적 지원은 생물산업의 성장을 가속화할 것이다.
[그림 3-2-5-9] 바이오산업 인프라 현황도(2009년 8월 현재)

[표 3-2-5-4] 바이오분야 산업화 인프라 지원 현황 및 주요 성과(2009년 8월말 현재)
|
광역 경제권 |
주관기관(URL) |
정부 지원금 (~'09) (억원) |
2009년도 8월말 현재 주요 실적 |
||||||
|
건물 면적 (평) |
인력 (명) |
입주 기업 (개) |
장비 구축 (대) |
기술 지도/ 상담(건) |
교육 훈련 (건) |
수익금 현황 (백만원) |
|||
|
수도권 |
서울대학교 www.kbh.or.kr |
237.80 |
752 |
89 |
5 |
175 |
14 |
101 |
13 |
|
한국생산기술연구원 kbcc.kitech.re.kr |
898.00 |
2,660 |
58 |
|
213 |
28 |
8 |
5,000 |
|
|
(재)경기바이오센터 www.ggbc.or.kr |
28.00 |
9,687 |
24 |
27 |
167 |
74 |
48 |
185 |
|
|
충청권 |
한국생명공학연구원 bvc.kribb.re.kr |
50.30 |
700 |
10 |
55 |
|
320 |
28 |
191 |
|
www.biosafety.or.kr |
86.37 13.40 124.52 |
40 |
15 |
|
2 |
|
34 |
|
|
|
biocat.or.kr |
45.25 |
85 |
2 |
|
37 |
8 |
19 |
189 |
|
|
(재)대전테크노파크 www.dbvt.or.kr |
260.66 45.00 |
549 |
26 |
27 |
202 |
57 |
168 |
1,573 |
|
|
영동대학교 www.biotic.re.kr |
46.80 |
813 |
7 |
11 |
63 |
36 |
73 |
468 |
|
|
(재)충북테크노파크 www.cbtp.or.kr/cbhic www.cbtp.or.kr/cbomc |
124.70 97.97 12.12 |
1,230 747
|
14 14
|
11 8
|
124 179
|
186 571
|
41 30
|
326 346
|
|
|
(재)충남동물자원센터 www.cnasc.or.kr |
47.87 25.00 |
1,347 |
7 |
13 |
187 |
55 |
30 |
234 |
|
|
호남권 |
(재)전라북도생물산업진흥원 www.jib.re.kr |
50.62 143.45 22.50 |
4,365 |
48 |
81 |
382 |
242 |
112 |
1,282 |
|
전북대학교 www.ctcf2.com |
49.73 |
379 |
10 |
|
122 |
734 |
70 |
437 |
|
|
순창군 장류연구소 www.kochujang.go.kr |
234.00 |
3,956 |
30 |
|
|
|
|
|
|
|
동신대학교 www.bic.re.kr |
50.00 |
1,600 |
6 |
131 |
359 |
384 |
191 |
358 |
|
|
(재)전라남도생물산업진흥재단 www.jbio.org www.biohub.re.kr
www.jbf.kr www.jinr.re.kr |
304.00 25.00 173.80 25.60 128.33 128.31 89.29 |
3,480
1,718
3,000 7,140 1,212 |
20
23
130 19 18 |
23
7
11 2 |
602
299
29 55 265 |
270
8
126 34 |
18
24
12 |
1,635
114
|
|
|
동남권 |
신라대학교 mcbi.silla.ac.kr |
45.46 |
1,538 |
14 |
38 |
164 |
105 |
88 |
484 |
|
(재)부산테크노파크 www.mbdc.or.kr |
113.89 20.00 |
2,700 |
20 |
29 |
360 |
262 |
22 |
205 |
|
|
(재)바이오21센터 www.bio21.or.kr |
50.00 73.50 |
4,622 |
24 |
56 |
266 |
|
|
1,045 |
|
|
대경권 |
(재)대구테크노파크 www.dbic.or.kr www.omisc.or.kr |
106.40 4.00 34.46 2.25 |
1,600
1,264 |
25
10 |
9
|
348
95 |
57
336 |
63
29 |
155
230 |
|
경북대학교 sc.knu.ac.kr |
42.07 |
550 |
4 |
7 |
100 |
115 |
61 |
338 |
|
|
(재)경북바이오산업연구원 www.gib.re.kr |
137.48 27.00 |
2,543 |
21 |
50 |
256 |
379 |
146 |
1,010 |
|
|
(재)경북해양바이오산업연구원 www.gimb.or.kr |
80.00 |
1,812 |
33 |
17 |
94 |
59 |
20 |
|
|
|
(재)포항테크노파크 www.pohangtp.org |
69.61 |
906 |
5 |
|
|
1 |
1 |
|
|
|
강원권 |
(재)춘천바이오산업진흥원 www.cbf.or.kr www.cbf.or.kr |
58.00 172.30 37.20 |
5,927 |
30 |
41 |
213 |
502 |
56 |
2,008 |
|
(재)강릉과학산업진흥원 www.gsif.or.kr |
225.87 17.90 |
2,719 |
30 |
31 |
259 |
479 |
63 |
299 |
|
|
제주권 |
제주대학교 chejutic.cheju.ac.kr |
47.70 |
550 |
16 |
14 |
85 |
169 |
189 |
652 |
|
(재)제주하이테크산업진흥원 www.bio.jejuhidi.or.kr |
210.69 8.00 |
2,463 |
18 |
35 |
978 |
243 |
43 |
706 |
|
|
합계 |
5,152.17 |
74,654 |
820 |
739 |
6,680 |
5,854 |
1,788 |
19,482 |
|
|
광역 경제권 |
특화분야 |
사업구분 |
과제명(사업기간)/지원기능 |
주관기관(URL) |
|
수도권 |
복합지원(의약/산업/그린) |
네트워킹 |
코리아바이오허브구축('04~'09)/[기타-연구장비] |
서울대학교 www.kbh.or.kr |
|
의약바이오 |
cGMP |
생물산업기술실용화센터건립('98~'07)/[GMP] |
한국생산기술연구원 kbcc.kitech.re.kr |
|
|
의약바이오 |
산기반 |
바이오개량신약제제화공동연구기반구축('06~'11)/[PP, GMP] |
(재)경기바이오센터 www.ggbc.or.kr |
|
|
충청권 |
의약바이오 |
BVC |
(BVC)생물의약TIC('99~'04)/[PP, GMP] |
한국생명공학연구원 bvc.kribb.re.kr |
|
산업/그린바이오 산업/그린바이오 산업/그린바이오 |
LMO LMO LMO |
바이오안전성정보기반구축('02~계속)/[기타-안전성정보] 바이오안전성의정서운영('08~계속)/[기타-안전성정보] LMO위해성평가센터구축('04~'07)/[기타-안전성정보] |
www.biosafety.or.kr |
|
|
산업/그린바이오 |
산기반 |
단백질소재의산업적활용 극대화를위한기반구축('05~'10)/[기타-연구장비] |
biocat.or.kr |
|
|
의약바이오 의약바이오 |
지역클러스터 지역클러스터 |
바이오벤처타운조성('02~'07)/[GMP] (2단계)바이오의약산업화허브구축사업('08~'10)/[GMP] |
(재)대전테크노파크 www.dbvt.or.kr |
|
|
복합지원(의약/산업/그린) |
BVC |
(BVC)생물의약및식품TIC('01~'06)/[PP, 공인검사] |
영동대학교 www.biotic.re.kr |
|
|
의약바이오 의약바이오 의약바이오 |
지역클러스터 지역클러스터 지역클러스터 |
보건의료산업종합지원센터건립('04~'07)/[PP, GMP] 전통의약품개발지원센터건립('03~'07)/[PP, 공인검사] (2단계)한방산업클러스터고도화사업('08~'10)/[PP, 공인검사] |
(재)충북테크노파크 www.cbtp.or.kr/cbhic www.cbtp.or.kr/cbomc |
|
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
동물자원사업화지원센터건립('03~'07)/[PP, GMP, 공인검사] (2단계)충남농축산바이오산업생산지원인프라구축사업('08~'10)/[PP, GMP, 공인검사] |
(재)충남동물자원센터 www.cnasc.or.kr |
|
|
호남권 |
산업/그린바이오 |
BVC |
(BVC) 생물벤처기업지원센터설립('00~'04)/[PP, GMP, 공인검사] |
(재)전라북도생물산업진흥원 www.jib.re.kr |
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
바이오파크인프라구축('05~'08)/[PP, GMP, 공인검사] (2단계)발효식품소재완제품화일괄지원시스템구축사업('08~'10)/[PP, GMP, 공인검사] |
||
|
산업/그린바이오 |
산기반 |
기능성식품 임상시험지원센터설립('04~'09)/[공인검사] |
전북대학교 www.ctcf2.com |
|
|
산업/그린바이오 |
발효산업 |
발효미생물종합활용센터건립('07~'10)/[PP] |
순창군 장류연구소 www.kochujang.go.kr |
|
|
산업/그린바이오 |
BVC |
(BVC)생물산업산학연협동연구및실용화기반구축('00~'04)/[PP] |
동신대학교 www.bic.re.kr |
|
|
산업/그린바이오 산업/그린바이오 의약바이오 의약바이오 의약바이오 산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 지역클러스터 지역클러스터 지역클러스터 지역클러스터 지역클러스터 |
전남생물식품사업화지원센터건립운영('02~'07)/[PP, GMP] (2단계)건강기능식품소재산업지원기반구축사업('08~'10)/[PP, GMP] 전남생물농업산학공동연구센터건립운영('02~'07)/[PP, GMP] (2단계)생물의약품완제라인구축사업('08~'10)/[PP, GMP] 독감백신원료생산기반구축('05~'08)/[PP, GMP] 친환경생물산업클러스터구축('07~'09)/[PP] 전남특산자원산업화기반구축('07~'10)/[PP] |
(재)전라남도생물산업진흥재단 www.jbio.org www.biohub.re.kr
www.jbf.kr www.jinr.re.kr |
|
|
동남권 |
산업/그린바이오 |
BVC |
(BVC)마린바이오기능성물질연구기반구축('02~'07)/[PP] |
신라대학교 mcbi.silla.ac.kr |
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
해양생물산업육성센터('04~'08)/[PP, GLP, 공인검사] (2단계)해양산업안전성확보기반구축사업('09~'11)/[PP, GLP, 공인검사] |
(재)부산테크노파크 www.mbdc.or.kr |
|
|
산업/그린바이오 산업/그린바이오 |
BVC 지역클러스터 |
(BVC) 생물화학소재산업지원센터설립('00~'04)/[PP] 바이오벤처프라자건립('04~'08)/[PP] |
(재)바이오21센터 www.bio21.or.kr |
|
|
대경권 |
산업/그린바이오 산업/그린바이오 의약바이오 의약바이오 |
지역클러스터 지역클러스터 지역클러스터 지역클러스터 |
전통생물소재산업화센터('04~'08)/[PP, GMP] (2단계)건강기능소재산업육성기반정비사업('09~'12)/[PP, GMP] 한방산업지원센터기반구축('04~'08)/[PP] (2단계)한방산업육성기반정비사업('09~'11)/[PP] |
(재)대구테크노파크 www.dbic.or.kr www.omisc.or.kr |
|
산업/그린바이오 |
BVC |
(BVC)생물농업및식품용생물소재TIC('01~'06)/[PP, GMP] |
경북대학교 sc.knu.ac.kr |
|
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
생물건강산업사업화지원센터건립('02~'07)/[PP, GMP, 공인검사] (2단계)경북기능성바이오소재산업기반정비사업 ('08~'12)/[PP, GMP, 공인검사] |
(재)경북바이오산업연구원 www.gib.re.kr |
|
|
산업/그린바이오 |
지역클러스터 |
해양생명환경산업지원센터건립('04~'07)/[PP] |
(재)경북해양바이오산업연구원 www.gimb.or.kr |
|
|
산업/그린바이오 |
지역클러스터 |
포항테크노(바이오)정보지원센터건립('07~'10)/[공인검사] |
(재)포항테크노파크 www.pohangtp.org |
|
|
강원권 |
복합지원(의약/산업/그린) 복합지원(의약/산업/그린) 복합지원(의약/산업/그린) |
BVC 지역클러스터 지역클러스터 |
(BVC) 생물산업벤처기업지원기반조성('98~'02)/[PP, GMP] 춘천바이오타운조성('02-'07)/[PP, GMP] (2단계)생물의약소재시험생산지원기반정비('08~'11)/[PP, GMP] |
(재)춘천바이오산업진흥원 www.cbf.or.kr www.cbf.or.kr |
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
강릉해양생물산업지원센터('02~'07)/[PP] (2단계)해양의용식품사업화지원기반구축사업('08~'11)/[PP] |
(재)강릉과학산업진흥원 www.gsif.or.kr |
|
|
제주권 |
산업/그린바이오 |
BVC |
(BVC)기능성바이오첨가제및생물자원TIC ('01~'06)/[PP, GMP, 공인검사] |
제주대학교 chejutic.cheju.ac.kr |
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
바이오사이언스파크('02~'07)/[PP, GMP] (2단계)제주건강·뷰티생물산업기반정비사업('08~'12)/[PP, GMP] |
(재)제주하이테크산업진흥원 www.bio.jejuhidi.or.kr |
출처: 자체조사 후 정리
6. 주요연구성과현황
[표 3-2-6-1] 주요연구성과현황(Ⅰ) (2009년 국가연구개발 우수성과 100선
|
|
분류 |
성과명 |
소속 |
부처 |
|
1 |
생명해양 |
항암치료효과를 극대화하는 새로운 치료법 개발 |
서울대학교 |
교육과학기술부 |
|
2 |
생명해양 |
초고온성 해양미생물유래 내열성 DNA 수식효소 개발 |
성균관대학교 |
국토해양부 |
|
3 |
생명해양 |
허혈성심혈관질환단백질치료제 기술개발 |
연세대학교 |
교육과학기술부 |
|
4 |
생명해양 |
세계적인 항궤양 치료제『놀텍정』개발 |
일양약품 |
보건복지가족부 |
|
5 |
생명해양 |
초급속 간편 우유품질분석기 개발 |
국립축산과학원 |
농촌진흥청 |
|
6 |
생명해양 |
혈우병 치료제를 생산하는 형질전환 돼지 개발 |
국립축산과학원 |
농촌진흥청 |
|
7 |
생명해양 |
뇌기능을 향상시키는 비침습적 뇌자극 기법 개발 |
성균관대학교 |
교육과학기술부 |
|
8 |
생명해양 |
국산장미 품종 개발 |
국립원예특작과학원 |
농촌진흥청 |
|
9 |
생명해양 |
동물에게 실질적인 효과를 보이는 새로운 탄수화물 가공공정 개발 |
단국대학교 |
중소기업청 |
|
10 |
생명해양 |
화학물질의 규제독성에 필요한 과학적 근거 제시 |
부산대학교 |
식품의약품안전청 |
|
11 |
생명해양 |
유헬스 구현을 위한 바이오 유비쿼터스 시스템용 다기능 플랫폼장치 개발 |
서울대학교 |
교육과학기술부 |
|
12 |
생명해양 |
부작용이 없는 차세대 염증 및 통증치료제의 개발 |
크리스탈지노믹스 |
지식경제부 |
|
13 |
생명해양 |
제2형 당뇨병 발병 유전자 발굴 |
서울대학교병원 |
보건복지가족부 |
|
14 |
생명해양 |
옥수수 전이유전자를 이용한 세계 최대 벼 게놈연구 기반 구축 |
국립식량과학원 |
농촌진흥청 |
|
15 |
생명해양 |
전 가시광선영역에 걸쳐 발광파장의 조율이 가능한 새로운 형광 골격체의 조합화학적 발견 |
서울대학교 |
교육과학기술부 |
|
16 |
생명해양 |
조사료 자급 달성을 위한 청보리 개발 |
국립식량과학원 |
농촌진흥청 |
|
17 |
생명해양 |
농약사용절감 환경친화형 혹명나방저항성 GM벼 개발 |
국립농업과학원 |
농촌진흥청 |
|
18 |
생명해양 |
뇌-기계 접속 인터페이스 개발 |
한림대학교 |
교육과학기술부 |
|
19 |
생명해양 |
새로운염소채널인 ANOCTAMIN1의클로닝과 필수유전자발견 |
서울대학교 |
교육과학기술부 |
|
20 |
생명해양 |
동종 간엽줄기세포를 이용한 관절연골 재생치료제 개발 |
메디포스트㈜ |
지식경제부 |
|
21 |
생명해양 |
애기장대에서 COP1과 ELF3에 의한 GI 단백질의 분해가 생체주기와 개화시기의 변화에 미치는 영향 규명 |
세종대학교 |
교육과학기술부 |
|
22 |
생명해양 |
백혈구세포 특이적 치료 유전자 전달을 이용하여 에이즈바이러스 치료제 개발 |
한양대학교 |
교육과학기술부 |
|
23 |
생명해양 |
장내 항상성 유지를 위한 공생세균과 장면역 시스템간의 상호작용 메커니즘의 규명 |
이화여자대학교 |
교육과학기술부 |
|
24 |
생명해양 |
천연물을 이용한 관절염 치료제 개발 |
신일제약㈜ |
지식경제부 |
|
25 |
생명해양 |
국화강국 일본을 추월한 국산【名品국화】‘백마’ 개발 |
국립원예특작과학원 |
농촌진흥청 |
|
26 |
생명해양 |
DPP IV억제제를 이용한 신규 당뇨치료제 제품화 |
㈜엘지생명과학 |
지식경제부 |
|
27 |
생명해양 |
뇌/인지과학 연구를 위한 뇌자도 측정 및 해석 기법의 보급 |
서울대학교 |
교육과학기술부 |
|
28 |
생명해양 |
돼지 써코백신 개발 |
서울대학교 |
농림수산식품부 |
|
29 |
생명해양 |
엽록체생성에필수적인엽록체외막단백질의이동기작 규명 |
포항공과대학교 |
교육과학기술부 |
|
30 |
에너지 환경 |
생물학적 변환기술에 의한 수소에너지 생산 |
한국에너지기술연구원 |
교육과학기술부 |
중 발췌)
|
|
분류 |
성과명 |
소속 |
부처 |
|
1 |
생명해양 |
맛좋은 우리 딸기 개발 및 농가 보급 확대 |
원예연구소 |
농촌진흥청 |
|
2 |
생명해양 |
서방출성 성장호르몬 결핍치료제 개발 |
LG생명과학 |
보건복지가족부 |
|
3 |
생명해양 |
울프라이즈 및 유사 후보 물질의 혈당저하 약리현상 발견 |
서울대학교 |
교육과학기술부 |
|
4 |
생명해양 |
기억을 결정하는 글루타메이트 수용체 신호의 장기적인 저하 현상 규명 |
서울대학교 |
보건복지가족부 |
|
5 |
생명해양 |
인슐린양 성장인자 결합단백질에 의한 혈관세포노화 유도 규명 |
영남대학교 |
교육과학기술부 |
|
6 |
생명해양 |
국가농업유전자원 DNA Bank 구축 |
농업생명공학연구원 |
농촌진흥청 |
|
7 |
생명해양 |
돌연변이형 미완성 단백질의 생성 억제기전 발견 |
연세대학교 |
교육과학기술부 |
|
8 |
생명해양 |
전기적비접촉심전도측정 기술개발 |
서울대학교 |
교육과학기술부 |
|
9 |
생명해양 |
버섯내 항암성분 베타글루칸의 초미세 추출기술 개발 |
하나바이오텍 |
농림수산식품부 |
|
10 |
생명해양 |
흑진주 생산기술 개발 |
한국해양연구원 |
국토해양부 |
|
11 |
생명해양 |
우량한우의 체세포를 이용한 복제소 개발 |
국립축산과학원 |
농촌진흥청 |
|
12 |
생명해양 |
당뇨병 치료제 후보물질 도출 |
한국화학연구원 |
교육과학기술부 |
|
13 |
생명해양 |
세포생존에 중요한 AROS 단백질의 발굴 |
세종대학교 |
교육과학기술부 |
|
14 |
생명해양 |
DNA 검사기술을 이용한 한우 판별법 개발 |
식품의약품안전청 |
식품의약품 안전청 |
|
15 |
생명해양 |
버섯으로부터 의약 소재 개발 |
한국생명공학연구원 |
농촌진흥청 |
|
16 |
생명해양 |
밤나무 신품종 시범재배를 통한 조기 보급 |
국립산림과학원 |
산림청 |
|
17 |
생명해양 |
환경친화적 식물병 방제를 위한 유용미생물 활용기술개발 |
농업과학기술원 |
농촌진흥청 |
|
18 |
생명해양 |
기능성 하이드로젤 개발과 줄기세포의 신배양법 개발 |
포천중문의과대학교 |
교육과학기술부 |
|
19 |
생명해양 |
새로운 형태의 식물 바이러스 유전자 분리키트 개발 |
고령지농업연구소 |
농촌진흥청 |
|
20 |
생명해양 |
신호전달체계 조절을 통한 천식의 치료제 개발 |
전북대학교 |
교육과학기술부 |
|
21 |
생명해양 |
벼 도열병균 병원성 유전체 기능분석 |
서울대학교 |
교육과학기술부 |
|
22 |
생명해양 |
부인 암의 진단마커와 치료제 개발 |
성균관대학교 |
교육과학기술부 |
|
23 |
생명해양 |
톨유사수용체(Toll-like receptor)입체구조 규명 |
한국과학기술원 |
교육과학기술부 |
|
24 |
생명해양 |
국제 발기능 지수 1위 엠빅스 개발 |
SK케미칼 |
보건복지가족부 |
|
25 |
생명해양 |
암예방 및 항암효능을 보이는 새로운 식물 성분물질 개발 |
연세대학교 |
교육과학기술부 |
|
26 |
생명해양 |
대사질환 유전자 AMPK의 기능 규명 |
한국과학기술원 |
교육과학기술부 |
|
27 |
생명해양 |
고급돈육 생산용 씨돼지 개발과 재래돼지 복원 |
국립축산과학원 |
농촌진흥청 |
|
28 |
생명해양 |
홍합유래스마트생체접착소재실용화기술개발 |
포항공과대학교 |
국토해양부 |
|
29 |
생명해양 |
다중유전자 동시발현 신기술로 베타카로틴 생성 황금쌀 개발 |
농업생명공학연구원 |
농촌진흥청 |
|
30 |
생명해양 |
IT 기술을 이용한 조직 특이적 유전자 발굴 |
한국생명공학연구원 |
교육과학기술부 |
|
31 |
생명해양 |
박테리아를 이용한 광전도성 황화비소 나노튜브 물질 생성기법 개발 |
광주과학기술원 |
교육과학기술부 |
|
32 |
에너지 환경 |
한반도 식물의 분류학적 특성을 종합한 한반도 식물지 발간 |
국립생물자원관 |
환경부 |
[표 3-2-6-2] 주요연구성과현황(Ⅱ) (2008년 국가연구개발 우수성과 100선 발췌)
출처: KISTEP 국가연구개발 우수성과 100선 (2009, 2008)
제4장
분야별 연구개발 및 관련 산업 현황


생명과학 분야
1. 유전체학
가. 유전체연구의 개요
유전체연구는 생물체의 유전체 염기서열정보를 바탕으로 유전인자의 기능을 총체적으로 조사하여 생명현상을 규명하는 것이다. 지구상에 존재하는 모든 생물종은 유전체 연구의 대상이다. 이 중 인류의 보건의료향상, 환경 보존, 에너지 자원 등과 같이 우리들의 삶과 보다 직접적으로 연관된 유전체 연구 분야에 좀 더 시선이 집중되고 있다.
인간유전체를 완전히 해독하고 이를 이용하여 생명현상의 인과관계를 규명하고 모든 질병의 원인을 모두 파악하게 된다면, 질병의 예방, 진단, 그리고 새로운 치료기술의 개발에 대한 획기적인 전기가 마련될 수 있을 것이다. 이러한 가능성을 바탕으로 1990년, 인간유전체연구(Human Genome Project)가 시작되어 2006년 최초로 한 사람의 유전체가 완전히 해독되었다. 그 이후 초고속, 저비용 유전체 분석기술이 비약적으로 발전하여 이미 한국인을 포함한 수 명의 개인 유전체가 해독되었으며, 조만간에 개인 유전체시대가 도래할 것으로 전망되고 있다.
복잡한 생명현상의 원리를 규명하기 위한 기능유전체 연구가 수행되고 있으며, 고밀도 유전자 칩이 개발되어 인간의 물리적 특성(신장, 머리색, 눈색 등)뿐만이 아니라 암, 당뇨, 고혈압 등과 같은 질병관련 유전인자들이 빠른 속도로 밝혀지고 있다. 이러한 질병관련 유전인자 성과를 바탕으로 유전자 검사가 사업화 되고 있고, 암 환자에 맞는 치료법을 적용하기 위한 유전자 검사가 시도되고 있다, 이제 유전체는 기초연구의 범위를 벗어나 부분적으로 응용단계에 접어들고 있다. 여기에서는 최근 2년 간의 인간 유전체분야의 주요 기술개발성과, 국내외 동향 및 향후 인간유전체 연구의 발전 방향을 간략히 정리한다.
나. 유전체연구의 성과
(1) 고밀도 SNP 칩을 이용한 질병관련 유전자 찾기(Genome-Wide Association Study: GWAS)
사람과 사람 간의 유전체염기서열은 99.9%가 같지만 0.1% 유전형의 차이가 머리색, 질병 감수성 등과 같은 다양한 인간의 표현형을 결정한다. 이 중에서 개개인 사이에 뚜렷한 차이를 보이는 단일염기서열 변이를 SNP라고 한다. SNP는 인간유전체의 염기서열에서 대략 300 염기마다 하나 꼴로 관찰되는데, 이들의 위치와 기능에 따라 유전자의 산물에 영향을 끼침으로써 개인 간 표현형 차이를 유발하는 것으로 보고 있다. 2005년에 ‘국제 HapMap 연구’를 통하여 SNP의 Haplotype(일배체형) 지도가 작성되었고, 이를 바탕으로 인종 간, 또는 집단 내에서 다형성을 나타내는 약 300만종의 SNP가 선별되고 이를 근거로 한 고밀도 SNP 칩이 개발되었다. 3일 정도의 짧은 시간에 한 개인의 유전체에서 50만종 내지 100만종 이상의 SNP에 대한 정보를 얻을 수 있는 칩을 이용하여 노인성 안질환, 제1 및 2형 당뇨병, 비만, 염증성 장질환, 전립선암, 유방암, 대장암, 류마티스성 관절염, 다발성 경화증, 관상동맥질환, 녹내장, 담석, 천식 등과 같은 질환과 신장, 머리색, 눈색, 하일반(주근깨), HIV감수성 등과 연관된 유전인자들을 유전체 수준에서 찾기 위한 연구(Genome-Wide Association Study, GWAS)가 대규모로 수행되고 있다(Science 322, 881-888, 2008).
이미 2007년도에 70종, 2008년도에 130종의 질병 및 인간표현형관련 유전자가 밝혀졌다. 이런 이유로 미국 ‘Science’지는 2007년도에 ‘Human Genetic Variation’을 비약적인 발전을 이룬 분야(breakthrough of the year)로 선정하였다. 그러나 이러한 질병관련 유전인자가 질병에 걸릴 위험성이 있다는 것을 알려주긴 하지만 그 위험성은 대부분의 경우 높지 않다는 비판적인 견해도 있다(Science 324, p.448, 2009). 이러한 발견이 임상적으로 적용되기 위해서는 더 많은 연구가 필요한데 상기한 질병들의 발생과 진행에는 여러 개의 유전자가 관여하며, 각 개인의 생활 습관 등의 환경 요인에 의해 크게 영향을 받기 때문에 더욱 그러하다.
[그림 4-1-1-1] Genetic Variation-Breakthrough of the Year 선정, 인간 염색체 1번의 유전자 지도를 배경으로 한‘Science’표지와 GWAS를 통하여 밝혀진 제2형 당뇨병 연관 유전인자(3, 4, 8, 9, 10, 11, 17번 염색체)의 지도


출처: Science 318, p1842, 2007.
(2) 초고속, 저비용 차세대 염기서열 분석기술
[표 4-1-1-1] 인간유전체해독 소요시간, 비용, 참여인원
|
인간유전체해독 (논문발표년도) |
인간유전체 사업(2003) |
Venter (2007) |
Watson (2008) |
미국 NHGRI 2014 목표 |
|
소요시간 |
13년 |
4년 |
4.5개월 |
|
|
참여연구자수 (논문 저자수) |
>2800명 |
31명 |
27명 |
|
|
비용 |
27억 달러 |
1억 달러 |
150만 달러 |
<1000달러 |
|
참여 기관수 |
16 |
5 |
2 |
|
|
정밀도 |
8~10 × |
7.5 × |
7.4 × |
|
|
참여국수 |
6 |
3 |
1 |
|
출처: Nat 452, p.788, 2008.
인간유전체 사업에서 한 사람의 유전체를 해독하고 염기서열을 결정하는데 13년에 걸쳐 2.7조 원이 소요되었던 것이 2007년에는 4년 동안 1000억 원이면 되었고 2008년에는 4.5개월에 15억 원이 소요되었다. 2014년경에는 백만 원이면 충분할 것으로 예측하고 있다. 이러한 염기서열분석 기술의 발달로 인해 각 개인의 인간유전체의 해독과 유전체 정보의 활용이 일상화 되는 시대를 맞이할 것으로 전망된다. 이러한 목표를 달성하기 위한 초고속, 초정밀, 저비용 차세대 염기서열분석기기의 개발 경쟁이 치열하게 전개되고 있다. 나노기술(biological nanopore)을 이용한 염기서열분석기술이 Oxford Nanopore Tech 및 NABsys에서 개발 중에 있으며 DNA 중합효소를 이용한 기술은 Pacific Biosciences사에서 개발 중인데 DNA의 증폭기술을 사용하지 않고 염기서열을 분석하는 기술이 시장에서 유리한 위치를 가질 것으로 전망하고 있다(Nat 456, p23~25, 2008).
[그림 4-1-1-2] 차세대 염기서열분석기기


출처: Nat 456, 23~25, 2008. http://www.pacificbiosciences.com
(3) 암 유전체 해독에 근거한 맞춤 치료기술의 현실화
유전체해독 기술의 발달, 암 유발/억제인자 및 암 발생 경로의 규명, 암 표적 치료제의 개발은 암환자 개개인에게 맞는 치료법을 적용 가능하게 하고 있다. 미국 보스톤의 MGH (Massachusetts General Hospital)는 모든 암환자를 대상으로 13개(APC, β-catenin, b-Raf, EGFR, JAK2, KIT, FLT3, Notch1, K-Ras, N-Ras, p53, PIK3CA, PTEN)의 발암성 및 암 억제 유전자들의 변이를 조사하고, 미국 뉴욕시의 MSKCC에서는 폐암과 대장암환자의 7개의 암유발 유전자(b-Raf, EGFR, FLT3, JAK2, K-Ras, PIK3CA, MEK1, AKT1, Her2)의 40개의 변이 여부를 조사하여 환자에게 맞는 치료법을 적용할 계획이다. 이러한 개인별 질환별 맞춤치료는 개개인의 염기서열이 초고속, 저비용으로 해독됨과 더불어 가속화될 것이다.
[표 4-1-1-2] 암환자의 맞춤치료를 위한 검사 대상유전자
|
검사 대상 유전자 |
검사 기관 |
관련 암 |
|
APC |
MGH |
뇌암, 대장암, 간암, 갑상선암 |
|
β-Catenin |
MGH |
뇌암, 대장암, 간암, 폐암, 난소암, 피부암 |
|
b-Raf |
MGH. MSKCC |
대장암, 폐암, 피부암, 갑상선암 |
|
EGFR |
MGH. MSKCC |
폐암 |
|
FLT3 |
MGH. MSKCC |
혈액암 |
|
JAK2 |
MGH. MSKCC |
혈액암 |
|
KIT |
MGH |
혈액암, 위장암, germ cell |
|
K-Ras |
MGH. MSKCC |
대장암, 폐암, 췌장암 |
|
Notch1 |
MGH |
혈액암 |
|
N-Ras |
MGH |
혈액암, 대장암, 갑상선암 |
|
TP53 |
MGH |
방광암, bone cancer, 뇌암, 유방암, 자궁암, 대장암, 두부경부암, 간암, 폐암, 피부암, soft tissue, 항문암 |
|
PIK3CA |
MGH. MSKCC |
뇌암, 유방암, 대장암, 간암, 폐암, 난소암, 위암 |
|
PTEN |
MSKCC |
혈액암, 뇌암, 유방암, 자궁암, endometrial cancer, 두경부암, 전립선암, 피부암 |
|
MEK1 |
MSKCC |
폐암 |
|
Akt1 |
MSKCC |
유방암, 대장암, 폐암, 난소암 |
|
Her2 |
MSKCC |
유방암, 난소암 |
출처: Nat 458, 131~132, 2009.
다. 해외동향
[표 4-1-1-3] 유전체 연구의 해외동향
|
유전체 분석기술 |
연구 목적 및 내용 |
기술주도국, 기관 |
|
|
유전체 원천기술연구 |
대규모 염기서열분석 |
다양한 생물체의 유전체 염기서열 분석. 생물체 간의 유사성, 차별성 검증, 인간유전체의 구조, 기능, 진화의 이해. 197종의 생물체 염기서열분석 중. 포유류와 파충류의 특성의 오리너구리(duck-billed platypus) 염기서열분석 완료(Nature 2008) |
미국 NHGRI, 영국 MRC, 독일 DFG, 호주, 스페인 |
|
Medical sequencing |
유전체(염기서열)와 질병간의 상관성 조사를 통한 질병의 예방, 진단 및 치료기술개발. GWAS에서 획득된 질병관련 유전체 영역 염기서열 분석(2007 시작). 말라리아, 수면병 원인생물과 기타 질병 매개생물체의 유전체분석 |
미국 NHGRI, NIAID |
|
|
암유전체 분석 |
The Cancer Genome Atlas (TCGA): 암의 예방, 진단, 치료기술의 개선. 뇌암, 폐암, 난소암의 대규모 유전체 염기서열 분석(Nature 455, 2008) |
미국 NHGRI NCI |
|
|
유전체 기능 (Genomic function) |
인간유전체의 기능 조사. 초파리와 꼬마선충 이용 유전체기능조절인자 찾기 (modENCODE, 2097). 인간과 생쥐의 모든 유전자의 확보(MGC, 2008). 유전자 결실 생쥐 이용 기능 규명(KOMP) |
미국 NHGRI, 유럽, 캐나다. |
|
|
유전체 다양성 (Genomic Variation) |
SNP를 근거로 하여 사람의 표현형(약물반응성, 당뇨, 암, 알츠하이머, 심장질환 등)에 원인 유전인자 연관성 찾기, Phase II HapMap 완성(2007). 1000 Genomes Project 시작(2008) |
미국 NHGRI, 영국 WTSI, 중국 |
|
|
유전체정보 |
대규모 유전체 염기서열 정보의 증가에 따른 유전체 정보기지 구축 및 분석(Computational Genomics) |
미국 NHGRI |
|
|
유전체분석 기술개발 |
초고속, 저비용 DNA염기서열 분석기술의 개발. 개인유전체 정보에 근거한 맞춤치료기술의 현실화 |
미국 NHGRI |
|
|
기타 유전체원천기술연구 |
생명현상과 질병원인 규명연구를 위한 유전체 우수연구팀 육성. 바이러스 감염 및 척추동물 유전체 연구센터 구축(Centers of Excellence in Genomic Science, 2007) |
미국 NHGRI |
|
|
유전체의 임상적 적용 (Translational Genomics) |
유전인자와 환경인자와의 상관성 조사(약물중독, 태아중량, 관상동맥질환, 폐암, 조숙증, 2형 당뇨병 등의 GWAS). 항응고제 Coumadin의 투여용량 관련 유전인자 찾기 |
미국 NHGRI, NIEHS, NHLBI |
|
|
ELSI |
인간유전체 연구의 윤리적, 법적, 사회적 제도 문제 연구 |
미국 NHGRI |
|
출처: 미국국립인간유전체연구소
라. 국내동향
[표 4-1-1-4] 유전체 연구의 국내 동향
|
유전체 분석기술 |
연구 목적 및 내용 |
지원부처, 기관, 연구사업명 |
|
인간유전체 활용 질병관련 유전자 발굴 및 검증 |
인간유전자원 확보 및 위암, 간암 유전체연구(Nat Cell Biol 2007) |
교과부, 21C 프론티어 인간유전체기능연구사업(한국생명공학연구원) |
|
사람의 질병과 관련된 유전적 소인규명 (Nat Genet 2009), 인체시료 채취, 보관 |
복지부, 국립보건원, 질병관리본부, 자체사업 |
|
|
당뇨, 심혈관, 뇌신경계질환 등 각종 질환 유전체연구 |
복지부, 의과대학 및 병원 중심 질환유전체 연구사업 |
|
|
인간 유전체 소재 발굴 |
한국인 고유 유전체 분석 (Nature 2009), 후성유전체 분석(Nat Genet 2009) |
교과부, 국내 벤쳐기업, 각 대학 참여, 동북아 민족 게놈분석,Epigenomics |
|
생물정보 활용기술 |
유전체 정보 수집, 분석 및 지원 |
교과부, 국가유전체정보센터구축사업 |
출처: 교육과학기술부, 보건복지가족부
마. 발전 과제
미국 국립인간유전체연구소(NHGRI, National Human Genome Research Institute)가 초기 인간유전체 해독사업을 주도하였고, 후기 유전체연구 또한, 영국의 Sanger연구소와 함께 세계적으로 주도하고 있다. 미국이 인간유전체연구에 투자하는 연구비 규모를 고려할 때 NHGRI가 전 세계 인간유전체연구의 흐름을 주도하며 선도적인 역할을 하고 있다. GWAS, 1000 genome project, 암 유전체연구 등의 도전적이고 창의적인 연구 사업과 함께 최근 새로운 유전체 연구 방향을 모색하기 위한 기획을 시도하고 있다.
[그림 4-1-1-3] 인간유전체 연구 흐름도

출처: 미국 국립인간유전체연구소
향후 다음과 같은 분야의 유전체 연구가 활성화 될 것으로 보인다. 첫째, 유전체 수준에서 파악된 질병과 관련된 유전인자 또는 유전인자군에 대한 기능연구가 수행되어 질병 발생의 인과관계가 밝혀질 것이다. 둘째, 기능유전체 연구를 통한 질병발생의 원인 규명은 그 경로를 제어할 수 있는 치료기술의 개발로 발전될 것이다. 셋째, 특정 질병과 연관된 바이오마커들은 질병의 발생을 예측하거나 조기에 진단하는 기술개발로 발전되어 질병의 발생을 사전에 차단하는 예방기술이 활성화 될 것이다. 넷째, 개인 간 유전자형의 차이 및 질병발생관련 환경인자의 규명은 개인별 맞춤치료법 개발로 발전할 것이다.
2. 단백질체학(Proteomics)
가. 개요
단백질체학은 세포내의 단백질의 기능과 변화에 관한 연구로서, 생체의 활동, 질병, 노화에 따른 단백질 발현의 정량화뿐 아니라 단백질의 위치와 변화, 단백질의 상호작용과 기능 분석까지를 포함하는 유전체에서 발현된 모든 단백질들에 대한 연구이다. 이 기술은 새로운 치료제와 진단 시약개발에 가장 강력한 분석 기술로 인식되고 있다.
나.단백질체학의 핵심기술
단백질체학의 기술은 크게 프로테옴 분석기술, 단백질기능 규명기술, 단백질체 정보기술로 구분한다. 핵심기술인 프로테옴 분석기술은 2차원 전기영동, 액상크로마토그라피와 같은 프로테옴 분리 기술과 질량분석을 이용한 단백질 동정기술이 주를 이룬다. 단백질 기능분석은 단백질 상호작용과 경로 분석, 단백질 구조 규명과 디자인, 세포와 개체기반 단백질기능 검증기술 등으로 구분하며, 단백질체 정보기술은 단백질체학 모든 과정에서 자료 분석과 결과 해석에 기반이 되는 기술이다.
[그림 4-1-2-1] 단백질체학의 개요도

다. 해외 동향
(1) 최근 기술개발동향
(가) 분리분석기술
2D-PAGE, RPLC(capillary Reverse-Phase Liquid Chromatography), CE(Capillary Electrophoresis) 등의 분리분석기술은 프로테옴 분석에 있어 핵심기술이다. 여기에는 두 개 이상의 분리기술을 결합한 다차원 분리기술이 널리 이용되고 있으며 특히, NPLC(Normal-Phase Liquid Chromatography)를 이용한 분리분석 기술은 현재 PTM(Post-Translational Modification) 연구에 RPLC와 함께 상호 보완적인 분리 분석기술로 활용되고 있다. 최근 LC 기술에서 주목할 만한 것은 고정상 충진물의 소형화와 그로 인해 발생되는 컬럼 내부압력의 증가를 최소화 하는 데 있다. 현재 이러한 것들을 구현할 수 있는 고압 HPLC 시스템(10,000psi)과 소형 충진물이 몇몇 제조 회사로부터 개발되어 보급되고 있다. 2μ 이하의 소형 고정상 충진물 칼럼과 안정적으로 gradient composition과 flow speed를 주는 고압 HPLC 시스템의 결합은 앞으로 바이오 시료의 분리에 주요한 기술로 대두될 것이다. 또한 Label-Free Quantification을 이용한 단백질 시료의 정량에는 반드시 높은 재현성이 요구되는데, 소형 고정상 충진물 칼럼과 안정적인 고압 HPLC의 결합은 재현성이 우수하고 높은 분리분해능을 제공하는 분리분석기술로서 앞으로 활발히 활용될 것으로 예측된다.
(나) 질량분석기술
최근 질량분석기술의 새로운 동향은 다양한 질량분석기술의 혼성화(hybridization)이다. 최근에 출시된 이온트랩-푸리에 변환(FT, Fourier Transform) 질량분석계의 결합, 이온트랩-오비트랩 질량분석계의 결합, 그리고 ion mobility 기기와 후리에 변환 질량분석계, 혹은 Q-TOF와의 결합 등 다양한 혼성 질량분석계가 제품화 되고 있다. FT-ICR은 높은 감도(100amole∼150zmole까지 측정 가능), 높은 질량분해능, 1ppm 이하의 높은 질량측정정확도 등으로 단백질 혼합물의 확인과 peptide sequencing 정보의 향상을 가능하게 하고 있다. 또한 ECD, ETD 등 다양한 펩티드/단백질 분해 기술의 개발로 프로테옴 시료에 대한 좀 더 정확한 화학적 정보를 얻을 수 있게 되었다.
최근에는 보다 큰 펩티드와 단백질 그대로의 질량을 분석하는 Middle-Down과 Top-Down 방식이 시도되고 있다. 이러한 분석에 필수적인 고분해능, 고정확성 푸리에 변환 질량분석계의 보유와 활용은 여전히 몇몇의 선두 그룹에 제한적인 상황이다. 하지만, 고분해능, 고정확성 질량 분석계와 이에 적합한 단백질 분리분석 기술 등이 계속 개발되고 있으며, 추후 동종 단백질의 다양한 단백질 PTM(수식화) 분석에 많은 정보를 제공할 것으로 기대하고 있다. 한편 보다 많은 단백질 동정과 타깃 단백질의 정량 분석을 위해, 감도가 높은 동시에 빠른 scan speed를 가지는 질량 분석기들이 지속적으로 개발되고 있다.
(다) Informatics기술
질량분석에서 얻어진 방대한 데이터를 정확히 분석하고, 생산된 프로테오믹스 결과에서 생물학적 의미를 추출하기 위한 informatics기술은 Scripps(DTAselect), ISB(TPP), PNNL(PRISM), FHCRC(CPAS) 등에서 분석의 자동화와 이를 분석하는 소프트웨어 환경을 구축하여 사용하고 있다. 특히 정량분석 정보를 추출하기 위해 Census, MaxQuant 같은 프로그램 개발과 생물학적으로 매우 중요한 단백질 변형분석을 위한 알고리즘의 개발도 활발히 진행되고 있다. 최근에는 global proteomics를 통해 얻어진 방대한 데이터를 Gene Ontology분석, enriched functional-related gene group의 clusterization, pathway map 작성, network 분석 등을 통해 시스템스바이올로지로 접근하는 informatics기술의 필요성이 대두되고 있다. 여기에 방대한 proteomics데이터를 기반으로 하여 유전자 분석을 보완하는 proteogenomics분야도 활발하게 개척되고 있다.
(라) 단백질체 정량기술
2D PAGE의 단점을 보완한 DIGE(double labeled fluorescence detection)방법이 비교정량기술이 지속적으로 사용되고 있다. 겔을 사용하지 않고 LC와 질량분석기로만 정량하는 방법은 크게 상대정량기술과 절대정량기술로 나눌 수 있는데, 상대정량기술에는 ICAT(isotope coded affinity tags), iTRAQTM(Applied Biosystems, Inc.), SILAC(stable isotope labeling with amino acids in cell culture), IDBESTTM (Target Discovery, Inc.), TMT(Tandem Mass Tag, ThermoFinnagann Inc.)와 같이 동위원소를 이용하는 방법과 spectral counting, extracted ion chromatogram 비교와 같은 label-free quantitation 방법이 바이오마커 발굴에 활발히 적용되고 있다. 절대정량기술에는 SISCAPA(Stable Isotope Standards with Capture Anti- Peptide Antibody), QCAT proteotypic peptide, mTRAQTM(Applied Biosystems, Inc.) 기술 등이 사용되고 있으며 겔을 이용하지 않는 정량법이 증가하는 추세에 있다.
(마) PTM (Post Translational Modification) 분석 기술
PTM이 가지고 있는 특이한 물리화학적 성질을 이용해 특정 PTM 단백질체들만을 enrich하는 기술들(phospho-capture, glyco-capture, cysteine-capture, nitortyrosine-capture)이 활발하게 개발되고 정착되고 있으며 특히 인산화 된 단백질을 선택하는 기술은 DHB, calcium 등을 이용하여 선택성을 높이는 다양한 최적화 방법이 소개되고 있다. proteolytic processing이 일어난 단백질(degradome)을 분석하는 방법이 활발히 개발되어 특정 단백질 분해효소의 기질을 찾는데 활용되고 있는 것과 더불어 top-down proteomics를 이용하여 단백질 하나에 나타나는 복잡한 PTM의 조합을 알아내는 분석기술이 최근 소개되고 있다.
(바) 바이오마커 연구
오믹스 기반 바이오마커는 질병의 조기진단, 예후, 약물치료에 대한 반응, 신약 후보물질에 대한 평가 등에 유용하며 현재 미국 FDA에 의해 허가된 MammaPrint, AlloMap 등 Multiplex 분자진단제 대부분은 지노믹스 기반의 제품이다. 단백질 바이오마커는 Phenotype 바이오마커로서 생리상태를 직접 반영하며, 병원에서 쉽게 분석할 수 있는 혈액이나 소변을 사용하여 분석한다는 이점이 있다. 프로테오믹스 분석기술의 발달로 단백질 바이오마커 후보가 다량으로 나오고 있지만 실제 임상에서 유용성을 평가하는 부분은 시간이 걸리는 단계이다. 현재 단백질 바이오마커로 소변에서 toxicity 바이오마커 패널이 개발되었으며 2008년 미국 FDA와 유럽 EMEA는 C-Path의 PSTC(The Predictive Safety Testing Consortium)에서 제안한 7개 패널의 단백질을 신장 결함에 대한 바이오마커로 인정하였다. 이들은 기존의 간효소들과 함께 toxicity 마커로서 신약의 전임상 단계에서 regulatory decision- making에 사용될 수 있다. 바이오마커 개발에 방해가 되는 요인들로는 표준화 된 시료준비와 측정방법의 결여, 공유되지 못하는 생물정보 체계, 분산된 연구, 연구주체 간의 의사소통 미흡, 검증과정에서 생물․생리학 지식 부족 등이 지적되고 있다. 이에 따라 미국 NCI, FDA, AACR(미국암학회) 등을 중심으로 바이오마커 개발과 적용에 대한 가이드라인의 제정을 추진하고 있다.
(2) 주요국 연구개발 투자 동향
[표 4-1-2-1] 주요국 연구개발 투자동향
|
국가 |
구 분 |
연구개발 투자내용 |
|
미 국 |
NCI(National Cancer Institute) |
▪임상프로테오믹스 선도기술개발사업: 104M(2006-2011) |
|
NHLBI(National Heart, Lung and Blood Institute) |
▪3단계 Clinical Protoemics 프로그램: $80M(2010-2015) |
|
|
NIGMS(National Institute of General Medical Science) |
▪PSI 2단계사업의 단백질 구조결정(2006-2011): $68M (2008) → $37M(2010) |
|
|
NSF(National Science Foundation) |
▪PDB(Protein Data Base) 사업: $31.5M(2007 5년 간) |
|
|
EU |
EU 7th Framework 프로그램 |
▪PROSPECTS(PROteomics SPECification in Time 문 Space) 컨소시엄: €12M, 2008 5년 간 ▪Plasma Biomarker Discovery Platform: €3M, 2009 3년 간 |
|
덴마크 Novo Nordisk 재단 |
▪질환 단백질 연구를 위한 센터(Novo Nordisk Foundation Center) 코펜하겐대학에 설립 (2007): $111M |
|
|
룩셈부르크 |
▪미국 애리조나 TGEN에 폐암바이오마커 프로젝트 지원, €13M, 3년 간 ▪바이오뱅킹 등 맞춤의학을 위한 TGEN과 협력사업 총 €140M, 2008 5년 간 |
|
|
네덜란드 |
▪Translational Molecular Medicine '09, $128M 지원(지노믹스, 프로테오믹스, 메타볼로믹스, 인포메틱스 등) |
|
|
노르웨이 |
▪기능유전체 연구 2단계 $70M 지원 (2007-2011) |
|
|
캐 나 다 |
CFI(Canada Foundation for Innovation) |
▪Quantitative Cell Biology & Proteomics(Mount Sinai Hospital): C$11.5M (2009) ▪Canadian Accelerator Mass Spectrometry(Ottawa 대학): C$8.4M (2009) ▪Integrated Nat'l Technology Platform for Mapping Protein Networks (Montreal 대학): C$9.2M(2009) |
|
Ontario 주 |
▪Ontarion Research Fund (C$625M, 4년 간) 중 C$100M, 오믹스 Global Leadership 프로그램에 투자 |
|
|
일본 |
RIKEN 요코하마연구소 |
▪Protein3000(단백질 구조와 기능해석 프로젝트): 5000억 원(2007년 5년간) |
|
호주 |
교육과학훈련부 |
▪Biotech Initiative로 프로테오믹스 분야에 $40M 지원 |
(3) 단백질체학의 시장 규모
세계 프로테오믹스 시장은 2011년 43억 달러로 예측되며, 연 평균 약 13.7%씩 성장하여 2015년 약 72억 달러로 예측된다.52) 프로테오믹스 시장의 지역별, 기술별 분포는 다음과 같다. 지역별 분포는 미국과 유럽 시장이 현재는 약 40%씩 차지하고 있으며, 성장률은 유럽이 미국보다 높게 예측되고 있다 (15% vs. 12%). 기술분야별로 보면 75% 이상이 Expression Proteomics 분야이며, 나머지를 Functional Proteomics, Structural Proteomics 분야가 차지하고 있다. 성장률로 보면, Functional Proteomics 분야가 지속적으로 증가하고 있는 추세이다(연평균 약 20.6%).
|
[그림 4-1-2-2] 지역별 프로테오믹스 시장 전망 |
[그림 4-1-2-3] 기술별 프로테오믹스 시장 전망 |
|
|
|
라. 국내동향
(1) 연구개발 투자 현황
[표 4-1-2-2] 정부 지원 프로테오믹스 연구 현황
|
부 처 명 |
사 업 명 |
수행 기간 |
2009년 연구비 |
비고 (주관 기관 등) |
|
교육과학기술부 |
프로테오믹스이용기술개발사업 (21세기프론티어사업) |
2002~ 2011 |
79억 |
한국과학기술 연구원 |
|
보건복지가족부 |
질병유전단백체종합연구지원센타 (보건의료연구개발사업) |
2003~ 2010 |
18억 |
연세대학교 |
|
교육과학기술부 |
단백질 칩 기술개발사업 (바이오신약장기개발사업) |
2004~ 2011 |
20억 |
한국생명공학연구원 |
|
교육과학기술부 |
질량분석기반 초고속 분자진단 의료시스템 개발 연구 (신기술융합형성장동력사업) |
2009~ 2013 |
40억 |
한국기초과학지원 연구원 |
출처: 2009년도 연구개발사업종합안내서(2009.3)
(2) 관련 산업 현황
[표 4-1-2-3] 국내 대표적 프로테오믹스 벤처기업 현황
|
기업명 |
주요 업종 |
설립 |
비고 |
|
(주)영인프런티어 |
항체, 진단키트 생산 및 판매, HUPO Antibody Initiative에 참여 (2008. 5. 에이비프론티어 합병) |
1994. 3 |
상장 |
|
(주)팹트론 |
단백질 정제용 레진, 펩타이드 관련 제제 생산 및 판매 |
1997. 11 |
|
|
(주)프로테오젠 |
단백질 칩, 단백질 기능분석 장치개발 및 판매 |
2000 .2 |
|
|
(주)프로테옴텍 |
시료 준비, 젤 이미지 분석, 질량분석 서비스 제공 |
2000. 3 |
|
|
(주)씨그몰 |
생산단백질의 활용성 제고, 신기능 단백질기술개발 |
2000. 6 |
|
|
(주)크리스탈지노믹스 |
질환 단백질의 3차 구조관련 신약 발굴 |
2000. 7 |
상장 |
|
(주)바이오인프라 |
암 조기진단 단백질 칩 개발 |
2001. 2 |
|
|
(주)프로바이온 |
질량분석 기반 분석 서비스 및 질병 진단/치료제 개발 |
2006. 1 |
|
출처: 프로테오믹스 이용기술개발사업단 자체 검색
마. 발전과제
미래 도전분야는 단백질상호작용과 수식화(PTM, Post-Translational Modification) 규명 등이다. 바이오산업의 국제 경쟁력 확보를 위해서 프로테오믹스 기술에 대한 전문가 양성과 인프라 구축에 대한 지속적 지원이 필요하다. 특히 신약개발에서 Companion Diagnostics 전략 구사를 위해서도 바이오마커/질환표적 발굴에 주력할 필요가 있다.
3. 세포생물학
가. 세포생물학의 개요
생물체의 기본 바탕을 이루는 세포의 구조와 기능을 연구하는 생물학의 전문 연구분야로 시작된 세포생물학은, 다양한 단백질 분석기법과 분자생물학의 발전으로 응용기술이 눈부시게 진보하여 인간의 생명현상 규명에 이바지해왔다. 세포의 구조와 세포 상호간에 일어나는 현상을 분자수준에서 관찰하고 분석함으로써 생화학, 유전학, 발생생물학 등의 생물학 분야를 망라하여 의학의 발전에도 이바지하고 있다. 최근 세포생물학 분야에서는 유전자치료법이 가졌던 한계를 극복하는 기술들이 집중적으로 개발되고 있다. 먼저 생체 내에 약물과 유전자 투여 기술, 그리고 면역거부반응극복 세포치료/장기이식기술 개발 등의 연구가 그것이다. 특히 이러한 세포치료기술의 근본이 될 수 있는 줄기세포연구는 현재 가장 주목받고 있으며 발전 가능성이 널리 인정되고 있다. 이에 따라 본 장에서는 세포생물학 연구분야 중 줄기세포학에 관점을 두고 최근의 연구현황에 대해 언급하고자 한다.
나. 줄기세포의 정의와 개요
줄기세포란 외부의 자극에 의해 모든 종류 또는 다양한 종류의 기능세포로 분화 가능하고, 무한 증식이 가능하며, 스스로 동일한 세포를 만들어 낼 수 있는 능력을 가진 세포이다. 줄기세포는 그 기원에 따라 배아줄기세포, 성체줄기세포, 정원줄기세포, 그리고 최근 들어 개발된 역분화줄기세포로 대별할 수 있다. 인간 배아줄기세포는 확립과정에서 배아가 파괴되는 만큼 윤리적인 문제점을 가지고 있어서 이를 피할 수 있는 다른 줄기세포의 연구를 활성화 시켜왔다. 하지만 현재까지 배아줄기세포는 어떤 다른 줄기세포에 비해서도 월등한 증식력과 유전적 안정성을 가지고 있고, 국내외에 걸쳐 많은 세포주가 확립되었다. 여기에 특성이 많이 규명되어 있어 임상적용에 가장 근접된 세포주임에 틀림이 없다. 따라서 역분화줄기세포의 개발과 더불어 향후에도 가장 많은 발전 가능성을 가졌다고 볼 수 있다.
다. 기술 동향
현재 국내의 경우는 줄기세포의 응용분야에 연구가 집중되어 있으나, 세계적인 추세는 줄기세포에 대한 기초연구로 회귀하는 현상을 보이고 있다. 국외의 경우 줄기세포 관련 기술의 특허출원이 전반적으로 증가하고 있으며, 임상적용보다는 응용을 위한 원천기술 확보에 집중되고 있는 추세이다. 줄기세포의 임상적용 가능성을 높이기 위해 면역적합성을 맞추기 위한 여러 가지 노력들이 진행되고 있고, 이에 맞는 여러 종류의 줄기세포들의 분리 또는 확립 기술이 개발되고 있다.
특히 역분화줄기세포주 확립에서 일본은 독보적인 특허기술의 개발에 전력을 쏟고 있다. 하지만 어떤 종류의 줄기세포를 사용하더라도 임상적용과 산업화를 위해서는 줄기세포의 대량 증식법의 개발은 필수적이다. 이에 따라 전세계적으로 효율적인 배양액의 제조분야가 눈부시게 발전하고 있으며, 대부분 지지세포 없는 배양, 혈청 없는 배양을 목표로 하고 있다.
이들 배양액은 국내로 유입되어 사용되고 있으며 기술 종속, 자재 종속을 가속화 시키고 있어 문제점으로 대두되고 있다. 줄기세포의 분화연구는 비교적 신경계세포의 분화에 집중하여 연구가 진행되어, 최근 척수질환에 대한 임상연구가 미국 FDA의 승인 하에 진행되고 있다. 그 외에도 당뇨병, 허혈성 및 간질환의 세포치료에 대한 경제적 가치 및 세계적인 추세에 발맞추어 줄기세포 혹은 전구세포를 이용한 세포치료 연구가 활성화되고 있다. 심혈관 질환에 대한 줄기세포치료연구는 성체분야의 연구가 중심이 되고 있으며, 연구되는 줄기세포가 골수기원의 줄기세포에서 지방조직이나 심장 등 다양한 조직에서 기원하는 줄기세포로 다양화되고 있는 추세이다.
최근 줄기세포강화 기술개발의 동향은 각 기술분야의 원천기술을 개발하고 이를 넓은 범위에서 산업재산권화하여 후진국 개발기술들의 진입을 원천적으로 방해하고 있다. 특히 줄기세포의 안전성 확보라는 측면에서 미국과 일본 등의 선진국에서는 원천기술 확보를 위해 과감하고 집중적으로 투자하고 있어 국내에서도 이에 대한 대처 방법이 강구되고 있다.
[표 4-1-3-1] 세계 최고기술 보유국·기관 및 주요 연구 내용
|
핵심기술명 |
국가명 |
기관명 |
기관분류 |
연구자명 |
주요 연구 활동 |
|
배아줄기세포 분리 및 세포주 확립 기술 |
미국 |
Wicell |
산/학 |
톰슨 |
배아줄기세포 확립 |
|
성체줄기세포 분리 및 세포주 확립 기술 |
미국 |
존스 홉킨스 |
학 |
피텐저 |
중간엽 줄기세포 |
|
정원줄기세포 분리 및 세포주 확립 기술 |
일본 |
교토대 |
학 |
시노하라 |
생식줄기세포 |
|
역분화줄기세포 분리 및 세포주 확립 기술 |
미국/ 일본 |
하버드/WiCel/ 교토대 |
학 |
톰슨/조지델리 /신야 야마나카 |
체세포로부터 역분화를 통한 배아줄기세포 확보 |
|
줄기세포 배양 기술 |
미국 |
Wicell |
산/학 |
Thomson |
줄기세포 관련 전반 |
|
줄기세포 세포주기 및 세포 사멸 조절 기술 |
미국/일본 |
조지아대/니켄연구소 |
학/연 |
스테판 달톤/ 요시키사사이 |
세포 주기/사멸 |
|
배양관련 용품들의 국산화 기술 |
미국 |
invitrogen |
산 |
|
생명 공학 전반 |
|
분화인자 발굴기술 |
독일/미국 |
Scripp/MIT |
연/학 |
Peter G. Schultz/Robert Langer |
분화인자 대량분석 연구 |
|
분화 유도기술 |
미국 |
Sloan- Kettering |
연 |
Lorenz Studer |
신경세포 분화유도 |
|
분화 세포 기능성 분석 기술 |
미국 |
NIH |
연 |
Ron McKay |
신경세포의 생체내외 기능성 분석 |
|
종양형성억제 기술 |
일본 |
Gifu Univ. |
학 |
Hara A 등 |
배아줄기세포에 자살유전자 도입으로 종양형성 억제 |
출처: 2008 BT기술동향보고서(생명공학정책연구센터 간)에서 요약 발췌
라. 국내 현황
저명 학술지에 발표된 인간 배아줄기세포 연구논문의 수에 있어 우리나라가 세계 4위를 차지했고(‘Cell Stem Cell’지 2007년 7월), 국제줄기세포학회에서 발표된 논문 초록 수는 122개로 세계 3위(2007년 6월)를 기록하여 국내의 줄기세포 연구 위상을 반영하고 있다. 줄기세포 분화연구는 아직 국제적으로 태동기에 머물고 있으며, 국내의 경우 국가의 주도적인 연구지원의 도움으로 기술의 고도화를 이룰 수 있는 인적․물적 인프라가 비교적 짧은 기간에 확충되어 있다.
특히 분화유도 기술 중 신경계, 심혈관계, 췌장세포로의 분화 유도기술은 국제적 경쟁력을 확보하고 있으므로, 추후 관련 분야의 기술 선점 가능성이 매우 높다. 하지만 최근 2~3년간 국내 연구비 규모와 연구 업적물의 증가 비율이 정체되고 있어 국제적으로 기술 수준의 하향화가 우려되고 있다.
마. 발전 과제와 전망
1998년 인간 배아줄기세포주의 확립 이후 가열된 줄기세포의 연구는 그 짧은 역사에도 불구하고 비약적으로 발전하여 생명과학으로서 뿐만 아니라 의생명 산업의중요한 축으로 자리매김하였다. 특히 다른 과학 분야에 비해 대한민국의 진입 시기도 늦지 않았고 초기의 정부의 적극적인 지원을 통해 선진국에 비해 크게 뒤떨어지지는 않았다. 하지만 기초과학 전 분야에 축적된 지식과 연계학문의 부족으로 발전의 속도가 점점 늦어지고, 격차가 점점 벌어지고 있다. 따라서 선진국과의 격차를 좁히기 위해서는 정부의 기초분야에 대한 직접지원을 통한 기초과학 기반기술의 확대와 민간과 산업체의 응용부문의 지원과 같은 이원화의 전략이 필요하다.
줄기세포 분화연구 수행은 국가 과학 기술력의 비약적 발전을 도모할 수 있는 전반적인 연구과제 중 가장 많은 원천기술을 창출할 수 있는 획기적 과학기술 프로젝트이다. 이 분야는 향후 줄기세포 기술 경쟁력 확보, 주요 난치질환에서의 임상적용가능 기술경쟁력 확보, 미래 유망성이 모두 높은 것으로 나타난 호발성 난치성질환에 대하여 임상적용 가능한 기술 확보가 기대된다. 특히 윤리적인 문제를 풀 수 있는 역분화 유도기술, 임상적용 가능한 줄기세포 분화유도기술과 종양 억제가 가능한 순수분리법 개발은 추후 줄기세포를 활용하는 다양한 산업화 분야의 핵심적이고 근간이 되는 기술이 될 것이다.
또한 줄기세포는 체내에 존재할 때는 극소수로 존재하며, 이들을 임상적으로 사용하기 위해서는 대량증식을 통해 필요량을 획득하여야 한다. 현재의 과학기술은 이러한 줄기세포의 대량생산에만 집중하고, 이 과정에서 일어날 수 있는 유전적, 유전외적인 변형에 의한 위험성에는 미치지 못하고 있다. 이들을 피할 수 있는 기술의 개발이 줄기세포의 치료효율 증대에 가장 큰 관건으로 작용할 것이다. 추가하여 줄기세포연구는 배양액 뿐만 아니라 기초와 임상연구를 위해 사용되는 각종 항체와 재조합단백질 시장도 이에 못지않게 크게 성장하고 있다. 민간벤처기업에 대한 정책적인 지원과 대기업과의 연계방안의 강구가 필요하다.
4. 대사생물학(대사체학 연구)
가. 대사체학(Metabolomics) 연구의 개론
대사체학은 유전자 표현형과 단백체의 분석만으로 해석할 수 없는 세포내 변화의 상관관계를 대사네트워크 전체를 통해 고찰하고, 얻어진 결과를 통하여 최종생성물의 변화량에 대한 원인을 해석하는 유일한 학문이다. 또한 특정한 생물학적 변화 과정들을 통하여 생성된 저분자 대사체의 프로파일을 체계적이며 종합적으로 연구하는 학문이다. 효소의 농도나 활성이 변하는 것을 원인으로 대사체 흐름은 대사체 농도의 변화에 있어서 중요한 영향을 끼치게 된다. 즉, 대사체들은 transcription과 translation의 하위단계로써 효소의 활성을 나타내는 좋은 지표(indicator)로 작용할 수 있으므로 대사체의 네트워크(metabolic network)에서 관찰된 대사체들의 변화를 통해서, 생물학적 시스템의 변화를 모니터 할 수 있다. 따라서 유전학, 전사체학 및 단백체학과 더불어 대사 프로파일링을 통하여 얻은 세포기능에 대한 정보들을 종합하여 복잡한 생명체의 구조를 규명하려는 연구를 시도하고 있다.
[그림 4-1-4-1] 생명과학의 발전도

나. 대사체학(Metabolomics) 연구의 필요성
대사체학의 연구 분야는 다양한 유전적, 생리적, 환경적 조건에 따라 변화되는 생체 내 저분자량 대사물질군의 구성과 농도를 분석하고 해석함으로써 생명현상의 변화 원인을 규명해 나가는 총체적 연구 분야이다.
○ 질병 등과 같은 다양한 조건에서 변화하는 생물체의 표현형(phenotype)을 가장 잘 반영하는 것은 생체 내에 존재하는 대사체(metabolite)와 대사체군(metabolome)이다.
○ 대사체학 연구의 핵심인 대사 profiling은 특정질환 내의 대사경로 규명, 주요 대사체 발굴, 질환의 조기진단을 위한 표지 대사체 도출에 있어 필수적이다.
○ 대사체 수준에서의 검정이 필수적이며, 질환특유의 관련 대사체들을 대량으로 발굴하고 그 기능을 밝히기 위해 대사체에 대한 총체적인 분석과 기능해석 기술 등의 시스템생물학적 접근이 필요하다.
○ 생체 내에 존재하는 대사체를 분석하는 대사체학과 이들과 생체 내의 거대분자(유전자 및 단백질 등)들과의 상호관련성 연구는 특정질환 내의 대사경로와 인체질환 기전 규명에 매우 중요하고 필수적인 연구 분야이다.
○ 대사체 DB와 네트워크 구축은 질병의 조기진단기술 및 질병의 병인규명기술을 한층 더 발전시키는 계기가 될 것이며 생화학, 의학, 약학, 분석화학 등의 생물산업 전반에 걸친 응용기술의 개발과 발전에 크게 기여할 수 있다.
[그림 4-1-4-2] 대사체학의 연구 분야

출처: Nature 2008.
다. 해외 동향
대사체학 연구는 1960년 후반 크로마토그래피를 이용한 분리 및 정제 기술의 발전에 의해 대사체들의 검출이 가능하게 되면서 본격화되기 시작했다. 1970년 Arthur Robinson이 비타민 B6를 투여한 후, 뇨시료에서 복잡한 크로마토그래피 패턴들을 분석하고, 이러한 패턴은 뇨시료 내에 유용한 정보를 가진 수많은 화합물들을 함유하고 있다고 발표하면서 발전되었다. 1971년 PNAS에 “Quantitative Analysis of Urine Vapor and Breath by Gas-Liquid Partition Chromatography”를 발표한 이후, 생체시료 내 대사체들의 정량적 패턴들을 분석함으로써 질병 진단, 질환상태와 연령에 따른 생체 변화 등에 대한 논문들이 다수 발표되었다. 이러한 생체 시료 내에서의 분석은 적은 비용으로 많은 정보를 얻을 수 있으며, 또한 생리 상태에 따른 대사물의 측정이 가능하게 하였다. 1990년대 Oliver SG, Winson MK, Kell DB 및 Baganz F등이 “Trends Biotechnol. 16, 373~378”에 효모의 기능을 체계적으로 분석함으로써 처음으로 대사체학이란 용어를 사용하였고, 2004년에는 “Metabolomics Society”가 결성이 되어 대사체학의 연구에 다양한 생화학적 방법들을 적용하게 되었다. 2007년 1월 캐나다의 알버타대 Wishart D는 2,500개의 대사체, 1,200개의 약물 및 3,500개의 식품 성분들을 확인한 “Human Metabolome Project”라는 최초의 인간 대사체군을 발표하였다. 최근 대사체학은 다음과 같은 다양한 연구 분야에 활용 되고 있다. 즉, 건강과 질병진단에 있어서 생체지표 선정, 시스템생물학, 동위원소 이성질체를 활용한 pathway discovery, 신약개발, 그리고 식물, 미생물, 영양학 및 환경 대사체학 등의 다양한 분야에 그 적용 범위를 넓혀가고 있다. 이러한 대사체학 연구는 주로 미국, 유럽, 일본 등 선진국 위주로 진행되고 있으며, 2007년 이후로 대사체학 연구에 대한 논문 발표 횟수가 증가되고 있는 추세이다.
[표 4-1-4-1] 국가별 대사체학 관련 SCI급 논문 발표 수

출처: Web of Science
[표 4-1-4-2] 연도별 대사체학 관련 SCI급 논문 발표 수

출처: Web of Science
(1) Metabolomics와 Nutrition 분야
- 일본 RIKEN의 Saito 팀은 arabidopsis model을 이용한 gene과 대사체의 연관성을 예측하는 방법론을 metabolomics 기법을 중심으로 다양한 omics 기법을 확립하고 있다.
- 미국 FDA, National Center for Toxicological Research의 Berger 팀은 감자칩 등의 유해물질인 acrylamide의 만성독성 연구를 rat 뇨시료에서 생체지표로서 2-oxoglutarate, succinate 및 citrate가 감소함을 확인하였으며, 또한 과량의 acrylamide 섭취는 energy metabolism, neural 및 testicular 조직에 영향을 줌을 확인하였다.
- 미국 Harvard Medical School의 Kristal 팀은 탄수화물과 지방 섭취가 미토콘드리아 기능에 어떻게 영향을 주는지에 대한 연구를 혈청 대사프로파일을 통하여 질환발생 생체지표를 도출하였다.
(2) Biomedical Biomarker 분야
- 미국 Michigan대학과 Metabolon사는 prostate cancer 진단 연구를 기반으로 현재 조직 내의 cancer 분포정도를 프로파일링 한 결과, 생체표지자인 sacrosine을 도출하였다.
[그림 4-1-4-3] sacrosine 도출 자료

출처: Nature 2009
- 미국 UC Davis에서는 유전병인 CKD의 생체표지자, 조기 진단법 및 치료에 유용한 생체표지자를 도출하기 위하여 mouse 모델을 이용하여 metabolomics 연구를 진행 중에 있다.
- 일본 Human Metabolome Technologies 사는 lipidomics 방법을 확립하고 hyperlipidemic rabbit 모델을 이용하여 statin의 효과를 증명하였다.
(3) Pharmacometabolomics 분야
- 독일 Helmholz 연구소는 SNP과 metabolite의 상관관계 연구를 human cohort study로 진행 중에 있으며, 혈장에서 363개의 대사체를 분석한 결과 HDL과 관련된 PE, TG는 PC 및 amino acid와 관련이 있음을 확인하였고 이들 대사체들은 심장병과 관련이 있음을 확인하였다.
[그림 4-1-4-4] SNP과 metabolite의 상관관계 연구

출처: PLoS Genetics 2009
- 미국 Mayo Clinic에서는 우울증 치료를 위해 SSRIs와 SNRIs의 response를 metabolomics와 pharmacogenomics기법을 이용하여 연구한 결과 glycine을 함유한 compounds들이 반응함을 확인하였고, biochemical/biological pathway에서의 metabolomic signature를 mapping 하였다.
(4) Plant/Phytochemical Metabolomics 분야
- 영국 Uni Wales Aberystwyth 팀은 벼도열병 연구를 Magnaporte grisea를 주입시켜 대사 변화를 확인하였으며, metabolic re-programming을 통해 벼도열병에 강한 조건을 제시하였다.
- 캐나다 McGill대학에서는 LTQ OrbiTrap을 이용한 보리의 유전자 변형에 따른 대사체 프로파일링을 통해 200개의 resistance related (RR) metabolites를 확인하였고, lipid/faaty acid, phenylpropanoid, flavonoid 및 terpenoid 등 4개의 pathway가 RR과 관련이 있음을 확인하였다.
(5) 시스템생물학 연구를 위한 대사체학
시스템생물학의 생물학적 모델 검증으로써 대사체학을 이용한 저분자들의 정확한 targeted analysis를 통해 대사체와 기타 전사체, 단백체에 대한 자료들을 종합적이고 총체적인 연구를 통하여 특정 또는 전체 대사경로를 규명하였다.
[그림 4-1-4-5] 시스템생물학 연구를 위한 대사체학

출처: http://www.utmem.edu/kotblab/
(6) 플럭소믹스(Fluxomics) 및 대사경로 발견을 통한 대사체학
신약의 약효에 대한 작용과 독성에 대한 연구에 안정동위원소(Stable isotope)를 이용한 대사체 추적 연구(루이스빌대, 미국)를 진행하였으며, glucose-6-phosphate dehydrogenase에 의한 당분해와 pentose-phosphate pathway와의 사이에 있어서 탄소의 분배 정도를 정량적으로 평가하고 유전자 발현을 측정함으로써 대사 네트워크의 효과를 연구하였다.
(7) 신기술 개발을 통한 대사체학
분석기기의 최적화와 새로운 software(맨체스터대) 분석장비의 발달에 의해 분석조건이 최적화되고 그것을 수행할 수 있는 software가 발달함으로 미량성분의 수많은 대사체들을 검출할 수 있게 되었다. 따라서 과거에 확인하지 못한 대사체들의 구조를 규명할 수 있게 되었다. 즉, 초고성능 분리 기술(ultra-performance chromatography)로부터 복잡한 생체시료 내의 대사체들을 분리하고 극미량 검출을 할 수 있다. 또한 MSn 등의 분석이 가능한 질량분석기로부터 정확한 질량을 측정할 수 있으며, 이러한 기기의 발달은 미생물에서부터 포유동물의 대사체학 연구를 활발하게 하였다.
(8) 생물정보학을 통한 대사체학
질량분석 data의 생물학, 생리학적 해석과 거대하고 복잡한 mass-based metabolomics datasets를 자동으로 찾을 수 있는 algorithm의 개발 또한 중요하다. 또한 preliminary mass assignment들은 생화학적으로 연관된 상호작용들을 database의 데이터에 따라 처리하는 질문들을 통해 다시 정의해야 하며 dataset 내에서의 대사체들을 validated하는 표준방법을 설정해야 한다. 대사체학은 분석기술의 발전과 data 분석과 취급을 위한 computing 기술의 발전에 의존하므로, 다양한 통계 프로그램과 clustering 기술과 기기교육 등을 고려할 때, 실험자와 실험기기에 따른 오차, 시료 오염, 측정 오차, 기타 실험조건과 관련된 요소들이 대사체학 결과에 영향을 주므로 metabolomics data 설정은 일정한 형태로써 정의 및 표준화 되어 있어야 한다.
출처: http://www.cellmetabo.jst.go.jp/en/subject/1stoda01.html
다. 국내 현황
(1) Biomedical Biomarker 분야
- 한국과학기술연구원 생체대사연구센터
고성능 질량분석법을 활용하여 다양한 생체시료 matrix(뇨, 혈장, 세포, 모발 등)로부터 targeted/non-targeted profiling 기법을 확립하여 최적의 대사체 분석법과 통계분석이 가능하다. clustering 기술과 metabolic pattern 분석으로는 약물의 유효성/독성평가를 위한 총체적인 대사 network 확립과 drug target 발굴을 위한 연구, 호르몬 의존성 질환(부인암 등) 및 피부 부속기질환(탈모증 등)환자들에 대한 질환고유의 진단 표지대사체 도출 연구를 수행 중에 있다. 최근 Mass spectrometry(MS) Imaging 기술을 활용한 tissue metabolome MS imaging 연구를 접목시켜 대사체의 변화를 한 눈에 확인 할 수 있는 방법론을 구축 중에 있다.
[그림 4-1-4-6] Biomedical Biomarker

출처: Clin Chim Acta 2009
- 기초과학지원연구원
NMR을 활용한 tuberculosis (TB) mouse model로부터 뇨시료에서는 citrate, succinate, 및 2-oxoglutarate의 감소 및 혈청으로 부터는 LDL 및 unsaturated lipids의 감소를 확인함으로써 TB mouse model로부터의 biomarker 도출하였다.
(2) Metabolomics and Nutrition 분야
- 건국대학교
LC-ESI-IT-MS/MS를 활용해서 발아콩을 이용한 동충하초 배양과정에서의 bioactive 한 biomarker 도출과 Pu-erh teas의 ferment 과정의 경과에 따른 성분 변화를 metabolomics 기법을 활용하여 분석한 결과 제조형태, 보존기간 및 항산화 활성도를 예측하는 연구를 진행 중에 있다.
(3) Pharmacometabolomics 분야
- 서울대 약학대학
혈장, 뇨 및 간조직에서 시료 수집방법 및 전처리 과정에 따른 차이점을 GC-MS, LC-MS 및 NMR 등의 기기를 이용하여 metabolomics 연구를 시작하는 단계에 있다.
- 인하대 의과대학
NMR을 이용한 담관암과 담석 환자의 담즙을 분석한 후 PCA-score plot과 loading plot을 통하여 새로운 질병진단을 시도하였다.
- 경북대 의과대학
Tacrolimus 투여 전과 후의 혈액 및 뇨시료에서 객체 차이를 표준화하는 방법인 quantile normalization 법을 확립하였고, tacrolimus 의 반응도를 예측하는 방법을 확립하였다.
(4) Plant/Phytochemical Metabolomics 분야
- 인하대학교
Scrophularia spp.의 QC 방법론을 HPLC-UVD로 확립하였다.
- 건국대학교
식물 및 microbial secondary metabolites dir 5,000 개의 MS/MS in-house DB를 구축하였으며, chrysantheum coronarium L.의 재배 지역별 차이를 확인하였다.
라. 발전 과제와 전망
(1) BT 관련 연구분야의 네트워크 구성으로 시너지 효과 창출
유전체 연구에서 단백체 연구로, 다시 대사체 연구에서 생체기능조절물질 연구(신약개발)로 이어지는 국내 BT 관련 연구개발사업을 체계적으로 연계해서 시너지효과를 창출해야 한다.
(2) 대사체학을 이용한 질병의 원인 규명 및 진단
(가) 대사체 기능 이상 연구; MIDA 기법을 이용한 추적연구
질병 유발관련 최근의 연구는 MIDA(Mass Isotopomer Distribution Analysis)를 이용한 대사흐름 분석(metabolic flux analysis)으로서, 생물체 내 대사회로를 구성하고 있는 대사반응들에 관련된 양론적 상관관계를 나타내는 분석기법이다. 특정 대사회로 내부에 안정동위원소(stable isotope)인 13C 또는 2H등을 탄소기질에 활용함으로써 동위원소이성질체(isotopomer)를 질량분석기(mass spectrometry)를 사용하여, 이를 통해 세포내 흐름값(flux value)의 분배(distribution)를 측정한다.
(나) 대사체학과 유전적 다양성(SNPs; single-nucleotide polymorphism) 관계 연구
데이터 모델링을 이용한 대사체 분석을 태아 또는 영유아 및 쌍둥이에 적용하여 유전적 다양성과의 직간접 관계를 규명하는 연구이다.
(다) 질병 관련 기능 규명 및 대사네트워크 구축
조기 진단을 위해 특정한 생체지표를 선정하기 위한 DB화를 진행하고 있으며 질환과 관련된 일정한 경향성을 찾기 위한 많은 양의 데이터를 축적하고 DB화해서 자동 search 기능의 software를 개발한다. 이에 따르는 질병의 원인 규명과 진단법을 개발한다.
(3) 환경 대사체학(Environmental metabolomics)
(가) 생활환경에 따른 특정지역의 코호트 조사를 통한 건강영향 평가
외부 환경에서 오염물들의 자극에 의한 대사체들의 변화를 오염원 발생 지역과 비오염원 발생 지역의 주민들로 분류해 오랜 시간 추적 조사함으로써 오염 발생으로 인한 위해도 예측과 정책 결정에 활용할 수 있다.
(나) 특정 오염물질의 독성 영향 평가
[그림 4-1-4-7] 특정 오염물질의 독성 영향 평가

출처: Nature Biotechnology 2006
(4) 식품(영양)유전학 및 대사체학
대사체학을 통한 metabolic fingerprinting 또는 biological endproduct를 결정짓는 수단으로 활용한다.
(가) 유전자 조작 식품의 위해성 평가
유전자 조작식품이 심각하게 생태계를 교란한다는 우려가 부각되면서 유전자 조작식품으로 인한 비유전자 식품의 피해를 조사하고 구별하는 데에 활용한다.
(나) 식품 품질관리
식품(커피, 와인 등)의 생산지와 생산연도별 품질 관리에 이용한다.
[그림 4-1-4-8] 식품의 품질관리

출처: Anal Chim Acta 2009
(5) 맞춤형 의학(Personalized Medicine)의 실현을 위한 대사체학
(가) 독성 또는 효능에 대한 생리학적 반응 평가
대사 프로파일링은 개인별로 차별화된 약물의 독성 영향으로부터 발생하는 생리학적 변화(간 또는 신장)들을 발견하는데 활용된다. 따라서 임상시험에 앞서 신약의 독성을 예측할 수 있다면, 독성 실험에 쓰이는 비용을 절감할 수 있다.
(나) 제약산업의 선도물질 선별 과정에의 적용
약물발견의 초기단계로부터 임상시험까지의 모든 과정 중 선도물질이 선별되기 전에 안전성 데이터를 얻는데 활용한다.
[그림 4-1-4-9] 독성 또는 효능에 대한 생리학적 반응 평가

출처: http://www.biosystemix.com/
5. 시스템생물학
가. 개요
시스템생물학(systems biology)은 기존 생물학의 환원주의적인 접근방식의 한계를 극복하고 생물학적 체제들을 총괄적이고 체계적으로 이해하는 것을 목적으로 하는 생물학의 새로운 분야이다. 이러한 목적을 달성하기 위해 시스템생물학은 시스템 내의 모든 구성 인자를 기술하고 그 인자들 사이에 정보의 흐름을 살펴보는 접근 방식을 택하고 있다. 그리고 실험과 모델링을 유기적으로 통합하여 인자들이 서로 관계하는 생체 네트워크들의 구조와 동적 변화양상을 밝혀, 궁극적으로는 생물학적 체제에서 발현되는 창발성에 대한 이해를 추구한다.
일반적으로 시스템생물학에서 던지는 질문들은 다음과 같다. ① 생체 네트워크의 기본적인 구조와 특성들은 무엇인가? ② 생체 시스템은 다양한 환경 안에서 시간에 따라 어떻게 동작하는가? ③ 생체 시스템은 어떻게 안정성(stability)과 견고성(robustness)을 유지하는가? ④ 어떻게 하면 생체 시스템을 우리가 원하는 바람직한 특성을 갖도록 변형하거나 구현할 수 있는가?
[그림 4-1-5-1] 시스템생물학 관련 논문의 연도별 발표현황

출처: 자체 자료
비록 시스템생물학이란 개념은 이미 오래 전부터 존재해왔으나 시스템의 구성인자에 대한 정보를 획득하는 과정이 어렵기 때문에 시스템생물학적 접근법이 본격적으로 사용된 것은 21세기에 들어와서라고 볼 수 있다. DNA 이중나선구조의 발견 이후 급속히 발달한 분자생물학적 지식을 기반으로 여러 유전체의 서열이 속속 완성되고 있는 현재에는 “omics”로 표현되는 여러 측면에서 많은 독립적 데이터들을 대량-발굴(high-throughput, HT)하고 있어서, 그 축적된 데이터가 생물학의 시스템적인 접근을 가능케 한 것이다.
이미 시스템생물학이 상대적으로 단순한 시스템인 미생물을 대상으로 구성요소의 동정 단계를 넘어서 새로운 유전자 회로를 설계하고 변경하는 합성생물학(synthetic biology)에 이르는 성과를 거두었다면, 최근 들어 포유류를 대상으로 한 시스템생물학도-비록 그 생명현상의 복잡성 때문에 발전이 늦긴 하지만-보다 효과적인 치료제 개발의 가능성을 염두에 두고 본격적으로 연구가 진행되고 있다.
나. 해외 동향
(표 4-1-5-1)은 해외의 대표적인 시스템생물학 연구기관과 프로그램을 소개하고 있다. 이 외에도 많은 나라의 여러 연구기관들이 대규모 컨소시엄을 구성하여 공동으로 추진하는 프로젝트도 상당수 존재한다. 그 중 대표적인 것으로는 “European Systems Biology Consortium”(ESBIGH)이 있으며, 이들은 특화된 소규모 과제들을 중심으로 연구를 진행한다. 독일에서는 간세포 모델시스템 연구가 진행되어 왔고, 영국의 맨체스터대에서는 신호전달기작 등을 대상으로 수학적 모델을 개발하고 있으며, 캠브리지대에서는 세균주화성(bacterial chemotaxis)의 생화학 회로의 시뮬레이션을 연구하고 있다. 프랑스에서는 “in silico Cell Simulation Initiative”(SiliCell)을 중심으로 신호전달모델을 개발하고 있다. 아시아․태평양 지역의 시스템생물학 연구자들을 중심으로 공동연구와 정보 공유를 위해 eIMBL- SB(electronic International Molecular Biology Network-Systems Biology)가 2005년에 설립되었고 현재 9개국이 참여하고 있다.
[표 4-1-5-1] 국외 시스템생물학 관련 주요 연구 기관 및 프로그램
|
관련기관(국가 또는 URL) |
내 용 |
|
Institute for Systems Biology (미국, http://www.systemsbiology.org) |
2000년 미국 시애틀에 설립, 다수의 생물학자, 공학자, 전산학자, 물리학자들이 유전체학, 단백체학을 바탕으로 시스템생물학의 선도적인 연구를 수행. 최근 circadian clock, 성게의 발생에 대한 유전자 네트워크를 규명한 대표적 연구소 |
|
Systems Biology Institute (일본, http://www.sbi.jp) |
2000년 일본 동경에 설립, ERATO-SORST Kitano Symbiotic System 프로젝트로 SBML과 호환되는 경로의 시각화 표준을 제시하고 EGRF 및 Toll-like 수용체 신호전달계의 지도를 작성 |
|
Institute of Molecular Systems Biology (스위스, http://www.imsb.ethz.ch) |
2005년 취리히에 설립. 생물학, 화학, 생물정보학의 연구들을 결합하는데 목적을 두고 있음 |
|
Institute for Genomics and System Biology (미국, http://www.igsb.anl.gov) |
2006년 시카고에 설립, 유전체학 연구를 토대로 실제적인 이익의 증대를 위한 연구를 진행. 유방암, 대사성 질환 및 당뇨병 등에 대한 연구가 진행 |
|
Center for Systems Biology at IGSP(미국, http://www.genome.duke.edu/ centers/csb) |
2004년 설립, 효모와 사람의 세포주기, 식물 뿌리와 성게의 발생에 대한 연구와 효모와 성게에서의 진화를 networking하는 연구 진행 |
|
Ottawa Institute of Systems Biology (캐나다, http://www.oisb.ca) |
2004년 오타와에 설립, 인간 질병에 관한 시스템 및 수학적 구축에 집중 |
|
Systems Biology at Hamilton Institute (아일랜드, http://www.hamilton.ie/systemsbiology) |
시스템생물학의 이론과 방법을 사용, 파킨슨씨 병의 모델을 구축 중 |
|
Netherland Institute of Systems Biology (네덜란드, http://www.sysbio.nl) |
2007년 설립. 세포 모양의 형성과 관련된 신호전달, 대사 및 유전자 네트워크에 관한 연구 |
|
Warwick Systems Biology Centre (영국, http://www2.warwick.ac.uk/ fac/sci/systemsbiology) |
NF-kB 신호전달 시스템, 식물에서 다른 종류의 스트레스에 대한 반응 메커니즘을 연구 |
|
Department of Systems Biology at Harvard MedicalSchool (미국, http://sysbio.med.harvard.edu) |
2003년 세계 최초로 본격적인 시스템생물학과를 표방하고 있으며 M. Kirschner를 중심으로 15명의 faculty를 보유하고 있음 |
|
E-cell Project (일본, http://www.e-cell/org) |
1996년 일본 게이오대학에서 시작, E. Coli 세포내에서 일어나는 모든 생명현상을 전산모델화 하는 작업을 추진 |
|
Microbial Cell Project (미국, http://microbialgenomics.energy.gov/microbialcellproject) |
미연방 에너지부의 주관으로 추진 중인 Microbial Cell Project는 친환경적인 에너지 개발을 위해 미생물의 시스템생물학 연구개발을 지원 |
|
맨체스터대학 (영국) |
신호전달 기작 등을 대상으로 수학적 모델을 개발 |
|
캠브리지대학 (영국) |
세균주화성(bacterial chemotaxis)의 생화학 회로의 시뮬레이션 |
|
Science Signaling (http://www.stke.org) |
1999년 구축된 세포 신호전달 경로에 대한 지식 데이터베이스를 갖춘 사이트이며 학술지인 Science STKE (Signal Transduction Knowledge Environment)로 시작하여 2008년 Science Signaling으로 명칭 변경 |
|
Yeast Systems Biology Network (http://www.ysbn.org) |
Yeast 신호전달 시스템 연구를 위한 생물학자, 수학자, 전산학자들이 모여 모델시스템과 실험기법을 공유하고 정량적인 데이터를 얻어 수학적 모델을 만들기 위한 협력체 |
|
Alliance for Cellular Signaling (http://www.signaling-gateway.org) |
A. Gilman의 주도로 대학과 기업들이 참여하는 세포내 신호전달에 대한 정보를 종합한 연구자원 데이터베이스를 운영 |
|
Inbiosis (말레이시아, http://pkukmweb.ukm.my/~inbiosis) |
식물 생산량과 체내에서 유용하게 사용되는 대사 산물의 합성과 생산 증가를 위한 유전자 변형기술 응용 |
|
Institute of Systems Biology And Ecology (체코, http://www.usbe.cas.cz) |
여러 단계에서 일어나는 생물학, 생태학적 시스템에서의 특징들에 초점 |
|
Blood System Biology (미국, http://bloodsystemsbiology.org) |
펜실베이니아대학, 혈소판과 혈장에 초점을 맞추어 혈액 내에서의 질병과 그 치료에 대한 연구가 진행 중 |
|
Berlin Institute for Medical Systems Biology at MDC (독일, http://www.mdc-berlin.de/en/bimsb) |
2008년 공식적으로 연구 시작, 단백체 해석과 central dogma의 조절에 관한 연구가 주로 이루어짐 |
출처: 2007 생명공학백서 내용 수정·보완
범세계적으로 시스템생물학자들이 모이는 시스템생물학 국제 심포지움(International Conference on Systems Biology, ICSB)은 미국, 유럽, 일본을 돌아가며 매년 개최되고 있다. 2008년에는 스웨덴에서 개최되었으며, 발표된 논문의 분야에 대해 살펴보면(표 4-1-5-2) ‘모델링’, ‘세포조절기작(신호전달)’, ‘세포조절기작(대사작용)’ 등이 전체 논문의 약 70%를 차지하고 있으며, 그 뒤를 이어 ‘소프트웨어 개발’ 분야의 논문이 전체 논문의 10%이다. 2006년 ICSB에서 시스템생물학 방법론 개척 분야의 논문이 전체의 약 50%를 차지하였던 것에 반해(2007년 생명공학백서 참고), 2008년 ICSB에서는 더 실제적인 생명현상에 대한 지식이 많이 발표된 것으로 해석할 수 있으며 21세기 시작과 함께 태동한 시스템생물학이 이제는 태동기를 지나 튼실하게 자리 잡은 한 분야로 거듭난 것을 알 수 있다.
[표 4-1-5-2] 2008년 ICSB 분야별 논문 수
|
분 야 |
편수 |
|
Modeling approaches |
133 |
|
Cell-regulation - signaling |
114 |
|
Cell-regulation - metabolism |
62 |
|
Software tools |
50 |
|
Microbial systems |
33 |
|
Plant systems |
21 |
|
Model driven experimental planning |
17 |
|
Diagnostic markers and complex diseases |
14 |
|
Standards and repositories |
12 |
|
Drug discovery |
12 |
|
Cell-to-cell variation |
10 |
|
Synthetic biology |
6 |
|
총 계 |
484 |
출처: 자체 자료
다. 국내 현황
2002년에 시스템생물학 연구회의 구성으로 그룹화, 상호연계연구, 연구 대상 생체시스템의 체계적인 선정 등이 이루어지기 시작했다. 2003년 4월에 서울대 문화관에서는 국내에서 처음으로 시스템생물학 국제학술대회(Seoul Symposium on Systems Biology 2003)가 개최되었다. 과학기술부는 시스템생물학을 국책연구사업과제로 설정하여 2003년 6월부터 “시스템생물학사업단”이 출범하여 11개 세부과제를 중심으로 시스템생물학 연구가 시작되었다. 2005년에는 2단계 사업으로 진핵세포를 대상으로 “칼슘대사 시스템생물학연구(KOSBI)”와 원핵세포를 대상으로 한 “대사회로분석 및 가상세포시스템연구”가 선정되었으며, 2008년부터 3단계 사업으로 이어져 연구가 진행되고 있다.
이들 연구 과제를 통해 신규 인자의 체계적 발굴, 구성인자들 간의 상호작용 계측, 네트워크 규명, 수학적 모델링, 미생물 대사회로의 정성적․정량적 분석, 시스템재설계 기술 및 가상세포 시스템 개발 등이 이루어지고 있다. 또한 2009년 GIST에 시스템생물학연구소가 설립되어 시스템생물학 인프라구축 사업을 통해 국내 시스템생물학 발전을 위한 기반기술을 개발하고 국내 보급을 추진함으로써 우리나라 시스템생물학의 국제적 경쟁력이 획기적으로 향상되고 있다.
[표 4-1-5-3] 2008년 ICSB 국가별 논문 발표 상위 10위(교신저자 기준)
|
순위 |
국가 |
편수 |
백분율 |
|
1 |
독일 |
98 |
20% |
|
2 |
영국 |
67 |
14% |
|
3 |
미국 |
53 |
11% |
|
4 |
스웨덴 |
41 |
8% |
|
5 |
일본 |
39 |
8% |
|
6 |
이탈리아 |
17 |
4% |
|
7 |
네덜란드 |
16 |
3% |
|
8 |
대한민국 |
13 |
3% |
|
9 |
스위스 |
12 |
2% |
|
10 |
덴마크 |
11 |
2% |
출처: 자체 자료
(표 4-1-5-3)에서 ICSB 2008에서 국가별로 발표한 논문 편수에 대한 통계를 살펴보면 대한민국은 개최국인 스웨덴과 그 인접 유럽 국가들, 미국, 일본에 이어 8위의 활발한 연구 성과를 발표해 대한민국의 시스템생물학의 미래가 매우 밝다는 것을 보여주고 있다. (표 4-1-5-4)는 국내 시스템생물학 관련 학술 활동이다. 고무할만한 점은 2006년부터는 국제적인 심포지엄을 국내에서 개최하여 연구 성과를 교류하고 발전시킬 수 있는 장을 만들었다는 점이다.
[표 4-1-5-4] 국내 시스템생물학 관련 주요 학술 대회 및 학술 활동
|
연도 |
내용 |
|
2002년 |
시스템생물학 연구회 구성 |
|
2003년 |
시스템생물학 사업단 시작 |
|
2003년 4월 |
서울국제심포지엄 개최 |
|
2003년 5월 |
IBEC(Integrated Biology of Escherichia coli) 구성 |
|
2004년 |
YSBN(Yeast Systems Biology Network) 구성 |
|
2005년 1월 |
RTKC(Receptor Tyrosin Kinase Consortium) 구성 |
|
2005년 11월 |
eIMBL(Electronic International Molecular Biology Network-Systems Biology) 설립 |
|
2006년 10월 |
시스템생물학의 대장균 관련 국제 학술대회‘제3회 IECA 2006’개최 |
|
2008년 11월 |
시스템 생명정보학 국제 심포지엄 (International Symposium on Systems Bioinformatics) |
|
2009년 1월 |
GIST 시스템생물학연구소 개소식 및 기념 심포지엄 개최 |
|
2009년 1월 |
제2회 한독심포지엄‘시스템생물학: 게놈에서 생명까지’개최 |
출처: 자체 자료
라. 발전 과제
시스템생물학과 관련된 국제 SCI 논문발표 수를 살펴보면(그림 4-1-5-1), 과거 2년 동안에 발표된 논문 수(984편)가 현재까지 발간된 전체 논문 수(1,856편)의 53%를 차지하고 있다. 또한 대표적인 시스템생물학 분야 저널인 Molecular Systems Biology 저널은 impact factor가 산출되기 시작한 첫 해인 2006년에 7점을 기록했으며, 2007년 9.9점, 2008년 12.2점이라는 가파른 증가세를 보이고 있다. 시스템생물학은 급속도로 발전하고 있으며 명실 공히 post-genome 시대의 핵심적 분야로 부각되고 있다.
또한 시스템생물학 연구를 통해 효과적으로 질병의 원인을 규명하기 위한 타깃의 발굴은 신약개발의 새로운 패러다임으로써 기대되는 바가 크다. (표 4-1-5-5)에서는 현재 국제적인 시스템생물학관련 기업에서 추구하는 주요 연구 현황을 보여 주고 있다. 세계 10대 제약업체 중 많은 수가 신약개발에 시스템생물학적 접근법을 직접 도입하거나 시스템생물학 기술을 가진 업체와 협력하여 신약개발에 집중하는 것을 볼 수 있다.
(표 4-1-5-6)은 키워드 “systems biology”로 검색한 논문의 국가별 통계자료이다. 대한민국은 2008년 2월부터 1년 간 7편의 논문을, 지금까지 총 19편의 논문을 발표하여 14위를 기록하고 있다. 또한 1년간 논문 수 증가는 네덜란드에 이어 2위를 차지하고 있다. 현재 전 세계적으로 시스템생물학이라는 새로운 생물학적 기조를 바탕으로 논문의 수가 급속히 증가하는 추세이다. 대한민국의 시스템생물학 연구 성과는 가시적으로 늘어나고 있으나 선진국에 비하면 아직은 인프라를 구축하고 있는 단계이다.
시스템생물학은 Genomics, Proteomics 등의 새로운 기술의 집약과 다양한 학문분야의 협력이 요구되는 자본·기술 집약적인 분야인 만큼, 인프라 구축을 위해 전폭적인 국가적 지원이 필요하다. 미국, 독일, 영국, 일본 등 이 분야 선진국의 경우와 같이 일관성 있고 체계적인 연구가 수행될 수 있도록 국립 시스템생물학 연구소의 설립이 시급하다고 볼 수 있다.
|
연구센터 |
주 소 |
연 구 내 용 |
|
AstraZeneca |
www.astrazeneca.com |
“Pathway program” MIT(Doug Lauffenburger's systems biology lab)와 함께 암 및 염증 질환에 대한 컴퓨터 모델 연구 |
|
Beyond Genomics |
www.beyondgenomics.com |
유전자, 단백질, 대사물질 및 임상정보 통합기술 개발, GlaxoSmithKlein과 협력 |
|
Bioseek |
www.bioseekinc.com |
시스템생물학 기법을 이용 인간의 주요 세포질환 모델들을 연구 |
|
Cellnomicc |
www.cellnomica.com |
in silico 암 연구 |
|
Cellzome |
www.cellzome.com |
신약 표적의 발굴, 검증 및 신약개발을 위한 기능적 단백질체 기술개발 |
|
CombinatoRx |
www.combinatorx.com |
약물의 조합을 통한 시너지 약효의 클리닝 |
|
CytoPathFinder |
www.cytopathfinder.com |
세포기반 스크리닝을 위한 transfection microarray 개발 |
|
Eli LillyCenter for Systems biology |
www.lilly.com |
회사의 신약개발 노력을 지원하기 위한 단백질 및 유전체 기술의 통합에 주력 |
|
Entelos |
www.entelos.com |
PhysioLab 기술을 이용한 질병의 컴퓨터 모델 개발. Pfizer와 협력관계 |
|
Ingenuity |
www.ingenuity.com |
시스템 생물학 통합 소프트웨어 및 지식 DB개발 |
|
Johnson & Johnson |
www.jnj.com |
Georgia Institute of Technology와 연구협력을 체결하고 의과학 연구에 중점을 둔 다학제 간 협력연구를 수행 |
|
Roche |
www.roche.com |
스위스의 systemsX 프로그램과 3년 간 연구협력을 체결하여 베타세포(beta cell) 손상을 진단하는 바이오마커 발굴과 신약개발을 수행 |
[표 4-1-5-5] 신약 관련 기업의 시스템생물학연구 현황(2007년 백서 자료 중심으로 수정)
출처: 2007 생명공학백서 내용 수정·보완
[표 4-1-5-6] 키워드“systems biology”로 검색한 논문의 국가별 통계
|
순위 |
국가 |
2008년 2월 기준 |
2009년 2월 기준 |
1년간 논문 수 증가 |
|
1 |
미국 |
619 |
765 |
23.6% |
|
2 |
독일 |
158 |
215 |
36.1% |
|
3 |
영국 |
160 |
201 |
25.6% |
|
4 |
일본 |
48 |
61 |
27.1% |
|
5 |
네덜란드 |
35 |
57 |
62.9% |
|
6 |
중국 |
38 |
56 |
47.4% |
|
7 |
프랑스 |
33 |
51 |
54.5% |
|
8 |
캐나다 |
35 |
48 |
37.1% |
|
9 |
스위스 |
28 |
42 |
50.0% |
|
10 |
스페인 |
23 |
35 |
52.2% |
|
11 |
이탈리아 |
19 |
30 |
57.9% |
|
12 |
덴마크 |
26 |
29 |
11.5% |
|
13 |
스웨덴 |
18 |
25 |
38.9% |
|
14 |
대한민국 |
12 |
19 |
58.3% |
|
15 |
핀란드 |
16 |
16 |
0.0% |
출처: 자체 자료
6. 구조생물학
가. 구조생물학 분야
생체분자는 살아있는 생명체의 중요한 구성요소로 작은 단백질을 비롯하여 DNA, 리보솜, ATP 신타아제와 같이 복합구조를 가진 것과 더불어 다양한 크기와 모양으로 생체 내에 존재한다. 이들의 기능과 역할은 모양과 크기에 따라서 다르기 때문에 이들의 모양을 아는 것이 생체분자의 기능과 역할을 좀 더 쉽게 이해하는 길이다.
이 분야를 연구하는 과학자들은 이런 구조에 대한 정보로부터 인간의 건강과 질병에 관련된 생체분자들의 역할과 기능을 추론할 수 있다. 연구의 목적은 이런 지식을 바탕으로 인간의 생명현상을 이해하여 인간에게 발생하는 질병의 문제를 해결하는데 있다. 단백질 분자의 이상 발현으로 생기는 질병의 경우는 단백질 분자의 구조를 연구함으로써 질병을 치료할 수 있는 약을 개발할 수 있다. 또한 특정 단백질 분자와 의약품의 화학분자가 어떻게 결합하고 있는지 상태를 봄으로써 의약품의 기능 정도를 이해할 수 있고 또한 의약품의 성능을 개선할 수도 있다.
단백질의 구조를 연구하는 방법은 엑스선, 자기공명, 중성자, 전자빔 등이 있는데 그 중 엑스선 회절결정학 방법으로 확인한 구조가 전체의 85% 이상을 차지하고 있다. 엑스선 회절결정학으로 구조를 연구하는 경우 단백질분자를 어느 정도 크기의 결정으로 키워야하는 과정이 필요하다. 그러나 막 단백질과 같은 경우 결정으로 키우기 어렵고 비록 결정으로 성장시키더라도 크기가 아주 작아 구조를 풀기가 쉽지 않다. 이런 작은 결정의 단백질 구조를 풀기 위하여 세계 각국에서는 새로운 방사광 가속기 건설과 더불어 마이크로 빔의 크기를 갖는 빔라인을 건설하고 있다. 또한 선진국에서는 단백질을 결정으로 성장시키지 않고 단백질분자 수준에서 바로 구조를 알 수 있는 4세대 방사광 가속기의 건설을 진행하고 있다. 이 글은 현재 단백질 구조연구를 위해 세계적으로 진행되고 있는 과정과 국내에서 진행되고 있는 상황을 중심으로 소개하고자 한다.
나. 해외동향
(1) 연구활동
2008년 7월 1일을 기준으로 단백질 데이터은행에 등록된 단백질구조의 수는 총 51,491개인데 이중에서 X-선을 이용한 경우가 47,526개에 달하여 전체의 85% 이상을 차지하고 있다. NMR을 이용한 경우는 전체의 약 14%정도이며, 전자현미경과 기타의 방법으로 풀린 구조는 1% 미만이다. 매년 단백질 데이터은행에 등록된 구조의 통계치는 (그림 4-1-6-1)에 표시되어 있다(http://www.pdb.org; Annual Report July 2008).
[그림 4-1-6-1] 연도별 이용가능한 단백질구조 수

(2) 연구방법 및 시설
세계적으로 단백질의 구조를 연구하기 위한 방법은 크게 3종류로 나눌 수 있다.
첫 번째는 X-선을 사용하는 경우로 아주 밝은 X-선을 내는 방사광 가속기에서 대부분의 실험이 이루어지고 있다. 현재 방사광 가속기에서 나오는 방사광의 밝기에 따라 차이는 있지만 단백질 결정이 크기가 수십 마이크론에서 수 마이크론의 크기만 되면 단백질구조를 풀 수 있다. 두 번째는 자기공명장치(NMR)를 이용하는 것인데 일본의 경우 이 장치를 수십 대를 한 곳에 모아 파크를 형성함으로써 보다 효율적으로 구조 연구가 이루어지고 있다. 자기공명장치를 이용하는 방법은 용액상태 단백질분자의 구조를 연구할 수 있는 장점이 있지만 단백질분자의 크기가 큰 경우에는 구조를 풀기가 어렵고 구조를 풀더라도 시간이 오래 걸리는 단점이 있다. 세 번째는 중성자빔을 사용하는 경우인데 이때 단백질의 결정을 밀리미터 정도의 크기로 만들어야하기 때문에 사용에 많은 제약을 받게 된다. 이 외에도 전자빔을 이용하여 구조를 연구하고 있지만 이것 또한 활용하는데 많은 제약 조건이 따른다.
새로 건설된 3세대 방사광 가속기의 경우 유럽에서는 영국의 3GeV의 DIAMOND, 스페인의 3GeV의 ALBA, 독일의 2.5GeV ANKA 그리고 프랑스 2.75GeV의 SOLEIL등이 현재 운전 중에 있고 아시아 지역에서는 호주의 3GeV의 AS, 중국의 3.5GeV의 SSRF 등이 운전 중에 있다. 또한 미국은 NSLSII의 방사광 가속기를 건설하기 시작했는데 이 가속기는 3세대 가속기 중 최고의 성능을 가지도록 디자인되어 있다.
이런 기존의 3세대 외에도 4세대 가속기가 건설 중이거나 시운전을 시작한 단계에 있다. 특히 현재 시운전 중인 미국의 LCLS의 경우, 2009년 9월에는 실험이 시작될 예정이고 일본의 경우는 2011년 운전을 목표로 건설이 한창 진행 중이다. 유럽에서는 독일 함부르크에 있는 독일입자물리연구소(DESY)가 주축이 되고 유럽의 여러 나라와 공동 출자하여 2012년 완공을 목표로 4세대 가속기 건설을 추진 중에 있다.
이 외에도 단백질 결정이 만들어지더라도 회절하지 않는 경우가 많은데 이런 단백질의 회절 성공률을 높이기 위한 연구가 끊임없이 진행되고 있다. 이 방법 중 하나로 단백질 결정을 고압상태에게 얼려 단백질 결정 내의 물분자의 상태를 바꾸어 줌으로써 물분자의 팽창 때문에 결정의 배열에 영향을 주어 회절을 방해하는 문제를 해결하였다. (그림 4-1-6-2)의 (a)는 보통의 실험 조건으로 상온 상태에서 결정을 액체질소 온도로 동결시켜 얻은 하나의 회절 이미지데이터이고 그림의 (b)는 고압 하에서 액체질소온도로 동결시켜 얻은 회절이미지 데이터이다. 그림에서 알 수 있듯이 비록 결정이 만들어졌더라도 회절을 잘하지 못하는 결정의 경우는 이와 같이 고압 하에서 결정을 동결시켜 보다 좋은 회절이미지 데이터를 얻을 수 있음을 보여준다.
[그림 4-1-6-2] (a)상압상태에서 동결하여 얻은 포도당효소(glucose isomerase) 단백질의 회절이미지 데이터, (b) 고압상태에서 동결하여 얻은 포도당효소(glucose isomerase) 단백질의 회절이미지 데이터
(a) (b)

출처: Chae Un Kim, Raphael Kapfer & Sol M. Gruner ; Acta Cryst. D61, 881-890, 2005
다. 국내현황
(1) 이용자 및 연구 활동
2001년부터 방사광 이용자 수가 매년 꾸준히 증가해 현재까지 등록된 이용자 수는 총 61개의 그룹이 있다. 이 중에서 단백질 구조를 주로 연구하는 그룹은 44개가 등록되어 있다. 이와 같이 이용하는 그룹은 매년 꾸준하게 증가하고 있는 추세이다. (그림 4-1-6-3)은 이런 이용자 그룹들이 원하는 실험 제안수와 실험을 배정 받은 실험수를 나타내고 있다.
그림에서 보는 바와 같이 2004에서 2006년 사이는 새로운 빔라인이 추가되는 기간으로 이용자의 실험 제안수가 많이 증가함을 볼 수 있고 2006년 이후부터는 매년 조금씩 그 숫자가 증가함을 볼 수 있다. 이런 증가 추세에는 국내에서 단백질이 아닌 유기물 합성물의 구조를 연구하는 그룹이 증가하는 요인도 포함되어 있다.
[그림 4-1-6-3] 이용자 요청한 실험 수와 실제 실험 배정을 받은 수

(2) 국내 연구시설
국내의 주요 연구시설에서는 각 그룹과 소속기관에서 보유하고 있는 X-선 발생장치나 NMR 장비가 활용되고 있다. 하지만 이들 실험의 대부분은 국내의 대형 연구시설인 방사광 가속기와 자기공명 파크에서 실험하기 전에 하는 예비 실험의 성격을 띠고 있다.
방사광 가속기의 단백질 구조연구 빔라인은 총 3개로 한 개는 위글러(Wiggler)를 광원으로 하는 빔라인이고 나머지 두 개는 휨자석을 광원으로 하는 빔라인이다. 그런데 이런 단백질 구조를 연구하는 장치 중에서 중요한 장비는 회절이미지를 측정하는 CCD이다. 그동안 단백질 단위분자의 크기가 500Å 이상인 경우는 이 디텍터의 크기 한계 때문에 외국으로 나가 실험하는 경우가 종종 있었다. 이런 문제의 해결을 위하여 포항 가속기에서는 위글러 빔라인에 기존의 크기에 비해 2배 이상 큰 CCD(Q315)를 장치하여 2008년부터 운영 중에 있다.
그리고 포항 가속기연구소에서는 2011년을 목표로 가속기의 성능향상 사업이 진행 중에 있다. 현재 운전 중인 가속장치의 에너지를 2.5GeV에서 3.0GeV로 증가 시키고 삽입장치가 들어갈 수 있는 포트를 현재의 10개에서 20개로 늘림으로써 X-선을 이용하는 빔라인의 경우에는 보다 더 밝은 빛을 얻을 수 있어서 기존의 빔라인 보다 훨씬 강력해진 상황이다. 단백질 구조연구 분야에서는 2개의 휨자석 빔라인을 인베큠 언듈레이터(Invacuum undulator) 빔라인(삽입장치 빔라인)으로 바꿀 예정이다.
이렇게 되면 기존의 빔라인에서 실험하는데 걸리는 시간을 획기적으로 단축시킬 수 있고 보다 좋은 양질의 실험을 수행할 수 있을 것이다.
아울러 포항 가속기 연구소에서는 단백질 결정을 만들지 않고 분자상태의 단백질 구조연구가 가능 4세대 가속기 연구시설의 건립을 추진하고 있다. 이 외에도 포항 가속기에서는 고압상태에서 결정을 동결시켜 구조를 연구할 수 있는 시설을 준비 중에 있고 또한 작은 마이크로 크기의 결정으로도 실험을 가능하게 하기 위한 마이크로 빔 집속기술을 개발 중에 있다.
또한 충북 오창과학산업단지 내의 자기공명장치 파크 세계 최고급의 900MHz NMR, 800MHz NMR/μMRI, 4.7T MRI 등을 설치했고, 2009년에 다시 9.4T급의 MRI를 마저 설치하면 X-선 분야뿐만 아니라 자기공명 연구 분야에서도 세계에서 뒤쳐지지 않는 기반시설을 이룰 것이다.
라. 발전전망
현재 인류는 자연환경의 급속한 변화로 인하여 많은 질병과 자연 재해의 위험에 직면해 있다. 하지만 과학기술의 발달과 생활환경의 개선으로 인간의 수명은 점점 더 길어지고 있다. 이런 과학의 발전은 지금까지 치료하기 어려웠던 질병도 치료할 수 있는 길을 열어 주고 있지만 아직 우리가 이해하고 치료할 수 없는 많은 질병이 존재하고 있다. 국내외의 대형 방사광 가속기는 생물학분야의 발전은 물론 구조를 기반으로 신약을 개발하는데 걸리는 시간을 단축할 수 있는 길을 열어주고 있다.
현재 엘지생명공학연구원과 중소 벤처회사인 크리스탈지노믹스는 질환 단백질의 3차원 구조를 기반으로 하는 신약개발 연구를 위하여 이미 7~8년 전부터 방사광 가속기의 빔라인을 지속적으로 사용해왔다. 이들은 이 분야에서 어느 정도의 성과를 내기 시작했고 앞으로 보다 더 많은 성과를 낼 것으로 기대된다. 또한 정부는 2009년 대구 경북지역과 충북 오창지역을 첨단의료복합단지로 지정함으로 이런 대형 연구기반 시설을 활용한 신약 개발연구가 활발히 진행될 것이다. 아울러 4세대 가속기가 건설된다면 실시간으로 생명현상을 관측할 수 있게 되고 아울러 분자의 구조를 바로 관측할 수 있어 생명과학분야는 비약적으로 발전할 것으로 기대된다.
7. 뇌과학
가. 뇌과학의 개요
뇌과학은 뇌신경계의 구조와 기능에 대해 분자세포생물학과 인지과학적 이해를 바탕으로 다양한 신경과 정신의 활동원리를 파악하고, 궁극적으로는 인간의 정체성과 본질을 규명하고자 하는 학문이다. 현대과학이 뇌에 대한 생물학적 이해를 상당히 진전시켰음에도 불구하고 뇌기능의 이해는 아직 태동기라고 볼 수 있는 수준이다. 뇌의 구조와 기능에 대한 심도 있는 이해와 이를 바탕으로 한 응용기술의 개발은 21세기를 이끌 미래지향적인 성장 동력으로 평가받고 있다.
뇌과학의 가장 큰 특징 중의 하나는 생물학, 화학, 물리학, 수학 등의 기초과학 분야는 물론 의학, 공학, 인지과학 등을 아우르는 융합과학의 성격을 가진다는 것이다. 따라서 현대의 뇌과학은 이러한 다양한 학문 분야를 두루 아우르는 다학제적인 연구를 통해 뇌에 대한 심층적인 탐구를 도모함과 동시에 넓게는 인간 두뇌의 정보처리 기작을 바탕으로 모방과 응용을 통해 지능형 응용기술을 개발하는 것까지도 포괄한다.
특히 우리 사회는 최근 급속히 고령화 사회로 진입하면서, 노년인구 증가로 인한 알츠하이머병, 파킨슨병 등의 만성 퇴행성 뇌질환과 뇌졸중과 같은 급성 노인성 뇌질환이 두드러지게 증가하고 있다. 이들 노인성 뇌질환에 의해 야기되는 사회적, 경제적 비용은 앞으로 국가 의료 재정에 심각한 부담이 될 것으로 예상된다. 아울러 복잡한 현대 산업사회로의 이행과 더불어 우울증, 불면증과 같은 정신질환과 약물 중독의 유병률이 급속히 증가하고 있는 사실은 인류 복지를 위한 핵심 기반기술로서 뇌과학의 중요성을 단적으로 보여준다.
나. 해외 동향
1990년 미국에서 주창된 ‘뇌의 10년’ 선언 이후 세계 각국은 뇌연구 분야의 주도권을 차지하기 위해 치열한 경쟁을 벌여왔다. 특히 뇌과학의 발전과 함께 타 분야와의 융합을 통한 진화 단계에 접어들면서 새로운 연구 분야의 주도권을 확보하기 위한 세계적인 경쟁이 더욱 심화되고 있는 실정이다.
(1) 각국의 뇌연구 동향
뇌과학의 융합학문적인 성격으로 말미암아 각국의 뇌연구 동향에서 크게 두드러지는 특징은 정부가 뇌과학 분야의 연구와 지원 방향을 주도한다는 것인데, 주요 국가의 뇌연구 지원 정책의 추진현황을 요약하면 다음과 같다.
[표 4-1-7-1] 주요국가의 뇌연구 동향
|
국 가 |
주요기관 |
특 징 |
비 고 |
|
|
미 국 |
-국립보건원 (NIH) -국립과학 재단(NSF) |
-‘뇌의 10년’ 프로그램 종료 후, 2005년 국립보건원 산하 16개 연구소를 중심으로 Brueprint for Neuroscience를 제시하고, 신경퇴행(2007), 신경발생(2008), 신경가소성(2009) 등 특정 분야에 연구 역량을 집중하는 정책을 시행 -학제 간 연구의 장려를 위해 NIH는 산하 12개 연구소의 150여 뇌과학 분야 실험실을 연합하여 Neuroscience@NIH 라는 거대한 공동체를 출범 -2009년 NIH 총 예산은 293억 달러인데, 이 중 신경과학 분야가 20% 정도를 차지. 또한 미국 내 각종 질환에 대한 연구비 투자 예산(2009년 기준 1,280억 달러) 중 약 20%가 신경계 질환에 대한 투자 |
-1990년 ‘뇌의 10년’ 선언 이후 세계적으로 뇌연구의 주도권 보유 |
|
|
일 본 |
-이화학연구 소의 뇌연구 종합연구소 (RIKEN BSI) |
-‘뇌과학프로젝트(1997~2016)’를 통한 집중적인 뇌연구 추진 -2003년 뇌연구를 사회과학과 접목하여 건강한 뇌발달을 연구하는 뇌의 양육 프로그램을 시작함 -2004년부터는 융합적 뇌연구 수행을 위한 통합뇌 및 계산뇌 프로그램을 출범하고 NT, IT 등의 학제 간 협력연구를 강화 -2008년 뇌과학 연구를 핵심 연구과제로 신규 선정하고 이후 연간 2조 원 이상 투자 예정 |
-미국에 대응하여 21세기를 ‘뇌의 세기’ 라고 명명 |
|
|
유 럽 |
영 국 |
-MRC (Medical Research Council) -BBSRC -Welcome Trust |
-뇌신경 전 분야에 걸친 투자 및 연구를 통해 미국에 이은 세계 2위의 위치를 고수 -임상의학과 산업화에 적용하기 위한 프로그램의 활성화 -실제 영국에서 발표되는 뇌연구 논문 중 절반 이상이 뇌질환 연구에 집중되는 경향이 있음 |
-국가 단위를 초월하여 유럽연합에서도 범유럽적 연구개발 사업을 추진
-2007년 출범한 EU FP7의 보건 의료 분야 예산 중 약 20%가 뇌 연구에 지원 |
|
프랑스 |
-CNRS -INSERM |
-유럽연합 7차 프레임워크 프로그램(FP7)의 일환으로 NAD(Nanoparticles for the therapy and diagnosis of Alzheimer`s disease) 프로젝트 운영 -신경과학 특화 테마별 연구 네트워크 The Ecole des Neurosciences de Paris-Ile-de-France(ENP) 결성 |
||
|
독 일 |
-막스플랑크 연구협의회 (MPI) |
-신경정신의학 분야의 기초과학연구와 임상연구 간의 상호보완적 연구 장려 -정신과 병원을 부속기관으로 운영 -정부정책에서 자연과학 각 분야 간의 융합이 점차 강조되어 융합학문에 대한 지원이 늘고 있는 추세 |
||
|
중 국 |
-Institute of Neuroscience(ION), Beijing MRI Center for Brain Research(BMCB) 등 세계적인 신경과학 연구소 육성 |
|
||
|
인 도 |
-National Brain Research Center(NBRC), 다학제적인 신경과학 연구 센터(Interdisciplinary Neuroscience Research Center) 등 다수의 국립 연구소를 운영하고 있으며, 해외 유수 기관과 연구 협정 체결 |
|
||
출처: 1) 뇌연구 기술동향 조사, 뇌기능활용및뇌질환치료기술개발연구사업단, 2009. 1
2) 한국뇌연구원 설립-운영에 관한 기획연구, 뇌기능활용및뇌질환치료기술개발연구사업단, 2007. 11
(2) 뇌과학 관련 산업의 세계적 동향
뇌질환 관련 의약품 시장은 전 세계 제약시장의 약 17%를 점유하고 있는데, 이는 순환기계 질환 치료제에 이어 2위에 해당한다. 또한 2005년 세계에서 판매된 상위 10대 치료군 별 의약품 현황에서 뇌질환 관련 약품은 3개 부문에 걸쳐 470억 달러에 달하는데, 이는 10대 주요 분야 매출액의 26%에 해당한다. 특히 뇌질환 관련 의약품 시장은 2004년에 이미 770억 달러에 이르렀으며, 연평균 4.6%의 빠른 성장률을 보이고 있어 2010년에는 1,000억 달러를 돌파할 것으로 예측된다.53)
이러한 급증세는 현대의학의 발전에 의한 고령화 인구의 증가와 경제 성장에 따른 삶의 질에 대한 관심, 산업화에 따른 정신질환 증가, 그리고 뇌과학 연구와 치료기술의 발전에 기인한다고 볼 수 있다. 실제로 뇌질환 의약품 시장에서 질환군 별 순위를 보면 이러한 사실이 더욱 뚜렷하게 드러나는데, 2009년 현재 우울증, 통증, 정신분열증 등에 대한 치료제 시장이 가장 큰 것으로 알려져 있다. 하지만 알츠하이머를 비롯한 퇴행성 뇌질환들에 대한 치료제 시장이 빠른 증가세를 보이고 있으며, 현재까지 시판되는 퇴행성 뇌질환 치료제들이 증세를 완화시키는 수준에 머무르고 있다는 사실을 감안한다면 향후 퇴행성 뇌질환의 발병과 진행을 근본적으로 제어하는 치료제의 개발은 관련 의약품 시장의 폭발적인 확장을 가져올 것으로 예상된다.
이상의 해외 산업 동향은 우리에게도 시사하는 바가 매우 크다. 우리나라 역시 이미 산업화로 인한 정신질환의 증가 현상이 두드러지고 있으며, 고령화 사회로 접어들기 시작했기 때문이다. 앞으로 우리나라의 뇌과학은 21세기 미래 성장 동력의 원천이 됨은 물론 삶의 질 향상에 지대한 역할을 담당할 것이다.
다. 국내 현황
(1) 국내 뇌연구 정책 동향
우리나라에서 본격적으로 뇌과학 분야에 대한 국가 차원의 체계적인 지원이 시작된 것은 1998년 ‘뇌연구 촉진법’의 제정 이후라고 볼 수 있다. 비록 선진국들에 비해서는 늦게 뇌과학 진흥정책들이 시작되었지만 지난 10여 년 간 정부 차원에서 꾸준히 추진되어 왔다. 이미 2007년 ‘제1차 뇌연구 촉진 기본계획(1998~2007)’이 종료되고 후속계획으로 국립뇌연구소 꾸준을 포함한 ‘제2차 뇌연구 촉진 기본계획(2008~2017)’이 추진되고 있다. ‘뇌연구 촉진법’의 제정 이후 뇌연구 분야에 대한 지난 10여 년 간의 주요 정책들을 요약하면 다음과 같다.
[표 4-1-7-2] 주요 정책 동향
|
연 도 |
추 진 내 용 |
|
1998년 |
-‘뇌연구 촉진법’의 제정 |
|
1999년 |
- 범부처 차원의 ‘제1차 뇌연구 촉진 기본계획(Braintech 21)’을 수립, 시행 -‘뇌신경생물학사업단’, ‘뇌의약학사업단’, ‘뇌신경정보사업단’ 3개 사업단 발족 |
|
2003년 |
- 21세기 프론티어연구개발사업의 일환으로‘뇌기능 활용 및 뇌질환 치료기술 개발 연구사업단’ 출범 |
|
2008년 |
-‘제2차 뇌연구 촉진 기본계획’을 수립, 시행 - 연구기반 조성에서 탈피하여 원천기술 확보를 목표로 함 - 기술분야에 있어서 뇌과학 분야의 세계적인 추세를 반영하여 기존의 3개 분과 외에 뇌인지과학 및 뇌 중심 융합연구 분야 신설 - 학제간 융합을 위한 한국 뇌연구원 설립 추진 기획단 발족 |
(2) 국내 뇌과학 연구 현황
1998년 ‘뇌연구 촉진법’의 제정 이후 뇌연구에 대한 정부 투자는 10년 간 총 3,180억 원으로 연평균 15%씩 증가하였으며, 2008년 한 해에만 492.7억원이 지원되었다.
하지만 이는 여전히 일본의 1/20, 미국의 1/80 수준에 불과하며, 특히 이 같은 규모는 국내 생명공학 전체 연구비의 5~6% 수준으로 미국 NIH를 포함한 주요 선진국들이 20% 전후의 비율을 뇌연구에 투자한다는 사실에 비추어보면 턱없이 부족한 실정이다.
하지만 10여 년 간의 꾸준한 투자에 힘입어 국내 뇌연구 인프라와 연구실적은 꾸준한 성장세를 보이고 있다. 연구인력의 경우 여전히 대학에 집중되어 있지만, 1998년 650여 명에서 2008년 3,000여 명으로 4배 이상 증가한 것으로 나타났으며, 고가 첨단장비와 전문 연구센터 등의 인프라가 지속적으로 강화되고 있다. 연구실적의 경우 우선 뇌연구 관련 SCI 논문건수가 1998년 23위(65건)에서 2008년 13위(519건)으로 크게 상승하였으며, 질적으로도 IF 10점 이상, 혹은 해당 분야 상위 10%이내의 우수 논문 발표 역시 증가세이다. 뇌연구 기반 응용기술에 대한 특허도 뇌연구 촉진법의 시행 이후 꾸준히 증가하여 2008년 1년 간 48건의 뇌과학 관련기술이 국제특허로 출원 혹은 등록되었다.54)
라. 발전 과제
뇌과학은 세계적으로도 태동기에 있는 미개척 분야이다. 아직도 해결되지 않은 뇌과학의 문제는 무궁무진하며 수많은 신약 개발의 분자표적이 지속적인 탐색과 개발을 기다리고 있다. 비록 선진국에 비해서는 우리나라가 후발주자이지만 오히려 새로운 분야이기에 많은 기회 역시 우리 앞에 기다리고 있다. 또한 뇌과학은 다양한 기초과학 분야와 함께 의학, 공학, 인지과학 등 다학제적인 연구가 필요한 대표적인 융합연구 분야로서 점차 대형화되는 추세이다. 이와 같이 뇌과학은 기술 간, 학제 간 융합화와 더불어 대규모 투자가 필요하며 21세기 미래 성장 동력 산업으로서의 역할을 할 수 있는 분야이므로 국가적인 계획과 투자가 절실한 분야라고 할 수 있다. 따라서 다음과 같은 정책적 추진이 시급하다고 사료된다.
첫째, 뇌과학 분야에 대한 투자가 더욱 획기적으로 확대되어야 한다. 앞서 살펴본 바와 같이 적어도 국가 경제규모나 연구개발 예산에 걸맞은 수준으로 투자가 확대되어야 할 것이다. 정부투자 1억 원 당 국내 뇌연구 논문의 수는 1.4편으로 미국(0.25편)이나 일본(0.7편) 보다 높은 생산성을 보이고 있다는 사실은 투자 확대의 필요성을 극명히 보여준다.
둘째, 뇌과학의 융합학문으로서의 특성을 고려하여 학제 간 연구를 장려하는 시스템이 구축되어야 한다. 따라서 우선적으로 국내 및 국제 협력 연구들을 강화하고, 산․학 연계를 활성화하는 시스템을 구축하여야 할 것이다. 기초와 응용, 다양한 학제 간 연구를 아우르는 뇌과학의 특성상 대부분의 뇌연구 인력이 대학에 집중되어 있는 우리나라의 구조는 향후 개선의 여지가 있다.
마지막으로 점차 대형화하는 뇌연구의 세계적인 추세에 맞추어 분야별로 분산되어 추진하고 있는 뇌연구를 포괄적이고 체계적으로 추진함으로써 뇌과학을 효율적으로 육성, 발전시킴과 동시에 짧은 시간 내에 우리의 수준을 세계 수준으로 이끌 수 있는 전기를 마련해야 한다. 이런 측면에서 이미 성안된 ‘제2차 뇌연구 촉진 기본계획’을 조속히 실천하고, 뇌기능 프론티어 연구개발 사업이나 현재 설립 추진 중인 국립뇌과학연구소와 같이 선택과 집중의 구심점을 마련하고자 하는 노력이 계속되어야 할 것이다.

보건의료 분야
1. 합성신약
가. 합성신약 연구개요
합성신약은 화학합성에 의해 만들어진 물질을 기반으로 개발된 신약을 일컫는다. 분자량 약 500 내외의 물질로써, 매년 개발되는 신약의 약 80% 이상을 차지하고 있다. 합성신약에 대비되는 신약으로는 단백질, 펩타이드, 항체 등을 통칭하는 바이오신약이 있다.
합성신약의 연구 과정은 (그림 4-2-1-1)에 도해된 바와 같으며 다음과 같은 근원적 속성이 있다. ① 불확실성(평균 성공확률 적용 外 예측 수단 부재), ② 비가역성(연구 과정 중 문제 발생 시 처음 단계부터 다시 시작해야 하는 속성), ③ 장기간의 연구(신약 개발에 10년 이상 소요), ④ 무형자산(승인 이전의 모든 과제의 가치는 성공 확률을 적용한 무형 자산으로만 거래됨), ⑤ 인허가 규제산업. 따라서 연구 생산성을 개선하려면 가능한 빨리 연구단계를 예측이 가능한 연구 범주 안으로 진입시키고, 중간과정에서의 실수를 최소화하며, 진행속도를 가속화하여 축적된 연구자산을 무형에서 유형으로 시급히 전환하는 전략이 필요하다.
[그림 4-2-1-1] 합성신약 연구개요와 성공확률

출처: Valuation in Life Sciences, A practical Guide, Springer, 2007; Leading Pharmaceutical Innovation, 2008, Springer; Biotechnology Valuation, 2008, Wiley
나. 해외동향
(1) 시장동향
2008년 전 세계 의약품 시장은 전년대비 각각 4.8% 성장한 7,731억 달러로 매년 성장률이 둔화되고 있다. 이는 전체적인 경기침체의 영향도 있겠지만 허가당국의 안전성과 관련된 허가규정을 매년 점점 더 까다롭게 바꾸고 있는 데에 영향이 크다고 하겠다.
[표 4-2-1-1] 연도별 전 세계 의약품 시장 규모
(단위: 억 달러, %)
|
|
2004 |
2005 |
2006 |
2007 |
2008 |
|
규모 |
5,600 |
6,500 |
6,460 |
7,120 |
7,731 |
|
성장률 |
8 |
7.3 |
7.1 |
6.4 |
4.8 |
출처: IMS Health Market Prognosis, March 2009
2008년∼2009년에 걸쳐서 대규모 제약기업의 M&A가 활발하여 Pfizer와 Wyeth, MSD와 Schering-Plough 등이 합병하여 거대 기업으로 재탄생 하였고, 이를 통하여 경쟁력을 확보하기 위한 노력을 계속하고 있다.
[표 4-2-1-2] 2008년도 전 세계 상위 제약회사 매출 및 R&D 투자 규모
|
순위 |
회 사 명 |
국가 |
2008년 매출액 |
연구개발비 |
|
1 |
Pfizer (with Wheth) |
미국 |
71,130 |
11,318 |
|
2 |
Johnson & Johnson |
미국 |
61,095 |
N/A |
|
3 |
GlaxoSmithKline |
영국 |
45,477 |
6,373 |
|
4 |
Bayer |
독일 |
44,664 |
3,770 |
|
5 |
Hoffmann-La Roche |
스위스 |
40,315 |
N/A |
|
6 |
Sanofi-Aventis |
프랑스 |
39,997 |
N/A |
|
7 |
Novartis |
스위스 |
39,800 |
N/A |
|
8 |
AstraZeneca |
영국/스웨덴 |
29,559 |
N/A |
|
9 |
Abbott Laboratories |
미국 |
29,527 |
2,688 |
|
10 |
Merck & Co. |
미국 |
23,850 |
4,678 |
출처: Wikipedia.org
(2) 연구개발 동향
분야별 연구개발 파이프라인을 살펴보면 전체 10,000여 종의 파이프라인 중 1) 바이오 제품, 2) 신규제제, 3) 항암제 등의 순으로 많은 연구개발이 이루어지고 있음을 알 수 있다.
[그림 4-2-1-2] 분야별 신약 파이프라인 현황(2009년 9월 현재)

출처: PharmaProeject,2009.9.현재연구상태 Active 분류 10,024 종 대상
(3) FDA 승인 동향
2008년 27개의 합성신약(NME)이 FDA에서 승인되어 2007년 21개 품목에 비해 31% 증가하였으며 바이오신약은 2008년 6개 승인으로 2007년과 동일하였다. 합성신약, 바이오신약 공히 연구비 증대에 비해 허가품목 수가 답보상태를 보여 연구 생산성 향상은 제약산업 전체가 시급히 풀어야 할 난제이다.
[표 4-2-1-3] 연도별 FDA 승인 신약 수
(단위 : 억 원, %)
|
년도 |
1996 |
1997 |
1998 |
1999 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
|
합성신약 |
53 |
39 |
30 |
35 |
27 |
24 |
17 |
21 |
31 |
18 |
18 |
16 |
21 |
|
바이오신약 |
9 |
10 |
9 |
5 |
6 |
8 |
9 |
14 |
7 |
10 |
11 |
6 |
6 |
|
계 |
62 |
49 |
39 |
40 |
33 |
32 |
26 |
35 |
38 |
28 |
29 |
22 |
27 |
|
증감율(%) |
|
-21 |
-20 |
3 |
-18 |
-3 |
-19 |
35 |
9 |
-26 |
4 |
-24 |
23 |
출처: World preview 2014, Evaluate Pharma, 2009
또한 신약 허가 건수만 감소한 것이 아니라 신규 승인 의약품들의 매출액도 감소하는 추세에 있다. 신약의 질적인 저하도 원인이지만 안전성 등, 허가규정의 강화로 연구기간이 길어지면서 상대적 가치가 저하되었고 Primary care를 위한 블록버스터에서 Niche/Orphan 의약품으로의 연구방향 전환도 영향을 주고 있다.
다. 국내 현황
(1) 시장 동향
[표 4-2-1-4] 연도별 국내 의약품 시장 동향
|
구분 |
2004 |
2005 |
2006 |
2007 |
2008 |
전년대비 성장률 |
CAGR |
|
생산 |
96,374 |
105,985 |
114,728 |
125,982 |
137,636 |
9.3 |
9.3 |
|
수출 |
7,803 |
8,738 |
9,934 |
11,209 |
12,529 |
11.8 |
12.6 |
|
수입 |
24,712 |
29,869 |
39,178 |
41,994 |
44,766 |
6.6 |
16.0 |
|
시장규모 |
113,283 |
127,115 |
143,971 |
156,767 |
169,971 |
8.4 |
10.8 |
출처: 한국식약청, 한국의약품수출입협회, IMS Health 외
2008년도 생산 및 수입, 수출실적을 감안한 총 국내 의약품 생산규모는 약 17조 원으로 세계 의약품 시장규모의 약 1.9%를 점유하고 있으며, 전 세계 시장성장률 보다 높은 9.3%의 성장을 보이고 있다.
(2) 연구개발 동향
글로벌 제약산업의 위기상황에서도 국내 제약기업의 신약 R&D 투자 비중과 연구 성과는 증가 추세에 있다. 글로벌 제약사가 연구 생산성 증가 전략으로 자체 연구규모는 줄이면서 아웃소싱을 적극적으로 추진하고 있으므로 후발주자로서 성장, 도약할 수 있는 기회라고 할 수 있다.
[표 4-2-1-5] 주요 제약기업의 R&D 프로젝트 현황(2007)
|
개발단계 |
연구개발 품목 수(개) |
증가율(%) |
||
|
2007년 4월 |
2004년 12월 |
|||
|
제품출시 |
12 |
9 |
+40 |
|
|
발매 허가 완료 |
2 |
1 |
||
|
임상 |
3상 |
11 |
7 |
+57 |
|
2상 |
17 |
10 |
+70 |
|
|
1상 |
16 |
13 |
+23 |
|
|
소계 |
44 |
30 |
+47 |
|
|
전임상 |
69 |
49 |
+41 |
|
|
탐색 |
50 |
23 |
+117 |
|
출처: 2004, 2007 한국신약개발연구조합 조사자료 가공
[그림 4-2-1-3] 2009년 현재 국내 신약개발 파이프라인 현황

출처: 한국신약연구조합 ‘한국 제약산업 연구개발 백서 2009’
2009년 현재 국내 신약개발 파이프라인 수는 임상단계 46개를 비롯하여 총 159건의 신약개발이, 총 32개 사에서 진행 중인 것으로 보고되고 있다. 이 중 임상2상 이상 단계의 제품이 28개로 조만간 많은 우수 신약의 탄생을 예고하고 있다.
라. 발전 과제
합성신약연구는 HTS에서 시작하거나, Me-too 전략을 답습하거나, 초기 Prototype scaffold로부터 특허보호가 가능한 고유의 lead를 발굴하는 “scaffold transformation” 과정과 이를 초고속으로 최적화하는 과정이다. Lead가 발굴된 이후, 다양한 약물성 평가(효력, 독성, 대사, 약동력학 등)를 만족하는 Sustainable lead로의 최적화 과정은 비교적 예측과 판단이 가능하고 의사결정을 할 수 있는 연구 단계인 반면 Lead 발굴 과정은 전적으로 의약화학 연구원의 직관에 의존한 창조적 단계이다. 비록 결정구조 연구와 모델링이 목표화합물의 디자인을 지원하더라도 그 성공 가능성과 발굴 기간은 예측 불허이다. 따라서 이 단계에서의 연구혁신(breakthrough)을 구현하기 위한 차별화된 전략이 필요하다.
신약을 만들기 위해 아래에 기록한 각 섹터의 장단점을 적절히 취사선택하여 시대적으로, 공간적 상황에서의 능률을 극대화하는 것이 필요하다.
1) Best-in-class (Me-too) vs. First-in-class
2) HTS (High-throughput screening) vs. Me-too approach
3) New chemical entity vs. Incrementally modified drug
4) Primary care drug vs Niche/orphan drug
5) Target-based vs. function-based research
6) In-vitro based vs. in vivo based research
대부분 다국적 제약사의 연구 전략인 1)~3) 항목은 양방향이 공존하나 4)~6)항목은 특징적으로 in vitro 약효 검색에 기초한 molecular target 연구를 기반으로 매출을 극대화할 수 있는 primary-care drug 연구 분야에 집중되어 왔다. 그러나 최근의 R&D 생산성의 급격한 저하로 고전적 연구 모델과 전략에서 탈피하려는 노력을 하고 있다. 국내 제약산업이 동일한 전략 공간에서 경쟁한다면 우선 규모의 경제에서도 다국적 제약사에 비해 비교 우위를 유지하기 어려우므로 성공적인 전략실행을 위해서는 경쟁사와 차별화된 진행을 구사하거나 같은 전략이라도 다른 방식으로 진행하면서 취사선택(trade-off) 과정이 필요할 것이다.
전 세계적인 약가인하정책과 인구 노령화, 그리고 Generic drug의 포괄적 파급으로 일본 다국적 제약사의 발전 모델이었던 “Me-better 연구전략”은 사실상 어렵게 되었고 High risk/high return의 혁신적 first-in-class drug만이 차별화된 약가를 보장받는 시대가 도래했다. 그러나 risk가 두 배 이상 높으며 지속적인 비용과 기반 기술의 혁신이 필요한 “신규 target 발굴 연구”는 한국 제약기업의 연구기반을 고려할 때 기업 내부에서 수행하기는 어렵다. 그러므로 국가 연구자산의 공유와 집중화를 통한 기반구축이 필요하다. 또한 장기간의 수련과 데이터 검증이 필요한 특수 질환 약리 모델의 구축이 필수적이다. 차원 높은 선도물질 발굴을 위해서 druggable한 library를 구축, 활용하여 hit to candidate의 과정을 단축시키는 전략도 연구생산성 향상과 경쟁력 확보에 기여할 것이다.
또한 현재까지 국내에서 개발된 신약들은 대부분 국내용으로 개발되어 개발기간이나 노력에 비해 경제적 효과가 미미하였다. 그러나 현재 개발이 진행되는 품목들 중에 상당수는 글로벌 기업에 등록되어 세계시장을 목표로 개발 중에 있어 향후 5년 이내에는 다수의 블록버스터 신약 탄생을 기대할 수가 있다.
현재 국내 신약개발의 가장 큰 문제점은 제한된 자원의 분산투자로 효율성이 크게 떨어진다는 점이다. 회사별로 강점을 갖고 있는 약효군이나 기반기술에 집중적인 투자를 계속하는 경우, 우수한 파급효과로 큰 신약의 개발이 조만간 가능할 것으로 판단된다. 더불어 산-학-연, 산-산 협력의 강화로 시너지를 창출하고 신약개발 과정에서 당면하는 문제점을 기능 간의 효율적인 협력으로 풀어간다면 조만간 신약강국으로 발돋움 할 수 있을 것이다.
또 현재 2008년부터 진행되는 제약산업 육성법 조기 법제화, 신약개발 부처별 협력강화 등을 통하여 미래 성장 동력으로 유망한 분야인 합성신약을 집중 육성하기 위해 총체적으로 노력해 나가야 할 것으로 판단된다.
2. 바이오신약
가. 바이오신약의 개요
바이오신약은 기존의 질병 관리측면에서 생체 내에 존재하는 물질을 의약품으로 사용하는 바이오의약품들뿐만 아니라, 유전자재조합, 세포융합, 세포배양 등 생명체 관련 바이오기술(BT, biotechnology)을 직접 활용하여 생산하는, 보다 싸고 안전한 치료 및 예방 목적의 새로운 의약품을 말한다.
또한, 바이오의약품은 특허 유무와 신규성에 따라 바이오신약, 개량바이오의약품, 바이오시밀러로 구분할 수 있다. 신규 물질로서 특허를 확보하여 높은 사업성이 보장되는 바이오신약과 개량바이오의약품과는 달리, 바이오시밀러는 특허가 만료된 오리지널 바이오의약품과 동일한 성분으로서 그 유효성과 안전성이 동등하지만 상이한 생물공정으로 만들어지는 의약품을 말한다.
화학의약품과 비교할 때 바이오의약품은 전임상 요구 자료가 적고, 제품의 효능과 안전성 예측이 용이하여 제품 개발과 임상 소요 비용이 적을 뿐만 아니라, 그에 따른 산업화 성공 가능성이 높아 전 세계적으로 적극적인 기술개발이 진행되는 상황이다.
바이오의약품은 다음과 같이 분류되며, 물질특성과 제조방법의 신규성에 따라 바이오신약이 될 수 있다.
(1) 단백질 의약품
유전자재조합과 세포배양 등을 통하여 생산된 단백질 중 치료와 예방의 목적으로 사용되는 고부가가치의 의약용 단백질을 말한다. 세포조절 단백질(호르몬, 성장인자, 혈액 관련 효소 등), 면역조절 단백질(Cytokine, chemokine, 항체 등), 예방용 단백질 등으로 나눌 수 있으며, 인슐린, 성장호르몬, 면역조절 사이토카인 등 광범위한 품목으로 개발되고 있다.
구체적인 품목으로 치료의약품 중 호르몬류는 hGH, EPO, 인슐린 등이고, 성장인자는 EGF, bEGF, IGF, PDGF 등이며, 혈액 관련 효소로는 tPA, Factor VIII 등이 있다. 또한 사이토카인류는 interleukin-2, G-CSF, GM-CSF, interferon α, β, γ 등으로 대별되며, 예방의약품으로는 간염 백신, 인플루엔자 백신 등으로 나눌 수 있다.
(2) 항체의약품
면역세포 신호전달체계에 관여하는 단백질 항원이나 암세포 표면에서 발현되는 표지인자를 표적으로 하는 단세포항체를 제작하고, 인체 적용 시 부작용을 최소화할 수 있도록 단백질을 개량해 질병의 개선 및 치료효과를 발휘하는 제품으로 마우스 항체, 키메라 항체, 인간화 항체, 인간 항체 등이 유전자재조합 등의 기술을 이용하여 개발되고 있다. 대부분 항암 치료, 심혈관질환 치료, 난치성 면역질환 치료 등에 사용되고 있으며, 허셉틴, 휴미라, 아바스틴, 벡티빅스, 솔리리스 등이 허가를 받아 시판중인 항체 의약품이다.
(3) 유전자치료제
유전자치료제는 유전자 조작으로 정상 유전자와 치료 유전자를 환자의 세포 안으로 도입시켜 결손 유전자를 교정하거나 세포에 새로운 기능을 추가해 암, 감염성질환, 유전질환 등을 치료, 예방하는 목적으로 이용된다. 특이적 유전자 발현 조절기술이 필요하여 나노 복합체, 바이러스, 세포, 표적지향 리간드, siRNA/Aptamer 등을 이용한 치료제가 개발되고 있으며, Genedicine, H101 등이 시판되고 있다. 현재 대략 41건의 제품에서 임상 3상이 진행되고 있다.
(4) 백신
면역체계의 자극을 통해서 항원에 대한 특이적 반응을 유발하여 다양한 감염성 질병과 암을 예방 또는 치료하는 물질을 백신이라고 하며, 예방용 백신과 치료용 백신으로 구분된다. 기존에는 예방용 백신 개발이 진행되었으나, 최근에는 면역학의 이해를 바탕으로 체내에 존재하는 바이러스나 종양세포 등에 특이적으로 작용하는 면역반응을 활성화시켜 난치성질환을 치료할 수 있는 치료용 백신으로 영역이 확대되고 있다.
나. 바이오신약 개발의 해외 동향
(1) 단백질의약품
1982년 일라이릴리사에 의해 제품화된 인슐린 이래, 재조합 기술을 이용하여 인터페론, hGH, EPO 등의 상용화가 이루어지고 있다. 바이오의약품 시장은 2008년 940억 달러, 2014년 1,550억 달러로 연 9% 급성장이 예상되고 있으며, PhPMA에 따르면 2007년 633개 제품이 임상시험 단계에 있거나 FDA의 승인을 대기하고 있으며, 그 중 단백질의약품이 66개, 인터루킨 10개, 성장인자는 5개 정도로 개발되고 있다.
[표 4-2-2-1] 단백질의약품 제품별 시장전망
[단위: $ m]
|
구분 |
2004년 |
2006년 |
2008년 |
2010년 |
CAGR |
|
erythropoietin |
9,478 |
10,212 |
11,581 |
12,908 |
7.4 |
|
insulin |
5,207 |
6,436 |
7,360 |
8,050 |
8.0 |
|
interferon alpha |
2,714 |
3,715 |
4,573 |
5,518 |
13.0 |
|
blood clothing factor |
3,406 |
3,813 |
4,133 |
4,323 |
5.9 |
|
colony stimulating factor |
2,739 |
3,205 |
3,486 |
3,877 |
6.6 |
|
interferon beta |
3,052 |
3,567 |
3,656 |
3,721 |
6.6 |
|
growth hormone |
1,902 |
2,043 |
2,110 |
2,122 |
2.5 |
|
therapeutic vaccine |
186 |
527 |
944 |
1,442 |
45.3 |
|
plasminogen activator |
678 |
701 |
696 |
684 |
0.7 |
|
growth factor |
243 |
349 |
428 |
502 |
17.8 |
|
interleukin |
242 |
256 |
251 |
245 |
3.2 |
|
other |
2,510 |
3,163 |
3,380 |
3,539 |
6.5 |
출처: Datamonitor, Therapeutic Proteins: Strategic Market Analysis and Forecasts to 2010, 2002.08 재조합 단백질의약품 시장동향, 한국보건산업진흥원
(2) 항체의약품
1990년대 항암제와 류머티스 관절염 치료제 등의 분야에서 다양한 단일클론 항체의약품이 개발되어 오면서, Johnson & Johnson(J&J)사, Roche사, Abbott Laboratories사 및 BMS사 등의 대형 제약회사들을 중심으로 적극적인 투자가 진행 되고 있다. 세계 항체의약품 시장 규모는 2008년 기준 372억 달러로 추산되고 있으며, 연평균성장률(CAGR) 38%의 고속 성장을 거듭하고 있다. 글로벌 매출 상위 10대 바이오의약품 중 1등 엔브렐부터 6등 휴미라까지 모두 항체의약품이 차지하고 있으며, 특히 2007년~2008년 고성장을 지속하여 연간 50억 달러 내외의 매출을 올리고 있다.
[표 4-2-2-2] 시판 중인 항체치료제
|
출시 |
종류 |
개발자/개발업체 |
상품명 |
타깃 |
적응증 |
|
1986 |
마우스 |
J&J |
Orthoclone® |
CD3 |
이식 거부반응 완화 |
|
1994 |
키메릭 |
Centocor/ Eli Lilly |
Reopro® |
GPIIb/IIIa |
PCI |
|
1997 |
키메릭 |
Genentech/ Roche |
Rituxan® |
CD20 |
비호치킨성 림프종 |
|
인간화 |
PDL/Roche |
Zenapax® |
CD25 |
이식 거부반응 완화 |
|
|
1998 |
인간화 |
Genentech |
Herceptin® |
EGFR2/HER |
악성 유방암 |
|
Medimmune |
Synagis® |
RSV |
RSV(호흡기 세포융합 바이러스) 감염 예방 |
||
|
키메릭 |
Centocor/Schering-Plough |
Remicade® |
RA, Crohn's |
류마티스, Crohn병 |
|
|
키메릭 |
Novartis |
Simulect® |
IL2R |
이식 거부반응 완화 |
|
|
2000 |
인간화 |
Celltech/ Wyeth |
Mylotarg® |
CD33 |
급성 골수 백혈병 |
|
2001 |
인간화 |
Millennium/ Schering AG |
Campath® |
CD52 |
급성 임파구성 백혈병 |
|
2002 |
방사면역 접합체 |
IDEC |
Zevalin® |
CD20 |
비 호치킨성 림프종 |
|
인간 |
Abbott Lab. |
Humira® |
TNFa |
류마티스 |
|
|
인간화 |
Croxia&GlaxoSmithKline |
Raptiva® |
CD11a |
만성 중증 건선 완화 |
|
|
2003 |
방사면역 접합체 |
Corixa/GSK |
Bexxar® |
CD20 |
비호치킨성 림프종 |
|
2004 |
키메릭 |
Imclone/BMS |
Erbitux® |
EGFR |
결장직장암 |
|
인간화 |
Genentech |
Avastin® |
VEGF |
결장직장암 |
|
|
인간화 |
Biogen-IDEC/ Elan |
Tysabri® |
A4 integrin |
다발성 경화증 |
|
|
인간화 |
Genentech & Novartis |
Xolair® |
IgE |
중증 지속성 천식완화 |
|
|
2006 |
인간화 |
Genentech |
Lucentis® |
VEGF |
습성 황반변성 |
|
인간 |
Amgen |
Vectibix® |
EGFR |
대장암 |
|
|
2007 |
인간화 |
Alexion |
Soliris® |
보체C5 |
발작성 야간 혈색뇨증 |
출처: Datamonitor, 2007
항체의약품은 난치성질환 치료(암, 면역질환, 감염질환, 호흡기질환, 심혈관질환, 당뇨 및 대사 질환 등)를 위해서 대부분 표적 지향적인 치료제로 개발이 되고 있으며, 항체제조기술도 초기의 키메라 항체 개발에서 인간화항체, 완전 인간항체 기술을 이용한 의약품 개발이 진행되고 있다. 세계 100대 회사들에서 선별된 291개의 항체 개발 프로그램을 기술별(Murine, Chimeric, Humanized, Fully human, Fragment, Payload 등)로 분석한 것을 보면, 미래의 기술 추세는 완전 인간항체 기술이 될 것으로 예측할 수가 있다.
[그림 4-2-2-1] 기술별 항체 개발 프로그램

(3) 유전자치료제
유전자치료제는 1990년 ADA-SCID를 대상으로 첫 임상시험을 시작한 이래, 2008년 9월 현재 전 세계에서 임상 3상이 진행 중인 프로토콜은 41건에 달하며, 이 중 바이러스를 이용한 프로토콜이 총 30건에 해당된다. 또한 183건 이상에서 임상 2상 이상의 연구개발이 진행되고 있다. 현재 Genedicine과 유사 기전으로 작용하는 제품인 Introgen사의 Advecin이 임상 3상 시험을 마치고 허가신청 단계에 들어간 상태이며, 일본의 AnGes사에서는 허혈성 족부질환 치료제인 DS-992의 일본 내 허가를 신청한 상태로 유전자치료제의 상용화가 빠른 시간 내에 급속히 이루어질 전망이다.
[표 4-2-2-3] 임상 3상 진행 중인 유전자치료제 현황(2008년)
|
|
Disease |
Gene |
Vector |
Country |
|
1 |
Infectious (HIV) |
HIV |
Pox virus |
Australia |
|
2 |
Japanese encephalitis |
-- |
Flavivirus |
Australia |
|
3 |
Cancer (glioblastoma) |
HSV-TK |
Retrovirus |
Belgium |
|
4 |
Infectious(HIV) |
vCP-1452 |
Pox virus |
Belgium |
|
5 |
Cancer(SCCHN1) |
p53 |
Adenovirus |
Belgium |
|
6 |
Cancer(SCCHN) |
p53 |
Adenovirus |
Belgium |
|
7 |
Infectious(HIV) |
--- |
Pox virus |
Switzerland |
|
8 |
Cancer(Melanoma) |
HLA-B7 |
Naked/Plasmid DNA |
Switzerland |
|
9 |
Cardiovascular diseases |
FGF |
Naked/Plasmid DNA |
Switzerland |
|
10 |
Cancer(advanced nasopharyngeal carcinoma) |
p53 |
Adenovirus |
China |
|
11 |
Cancer(cervical carcinoma) |
p53 |
Adenovirus |
China |
|
12 |
Cancer(SCCHN) |
p53 |
Adenovirus |
Germany |
|
13 |
Infectious(HIV) |
--- |
--- |
Germany |
|
14 |
Cancer(SCCHN) |
p53 |
Adenovirus |
Germany |
|
15 |
Cancer(clear cell renal adenocarcinoma) |
Oncofoetal antigen 5T4 |
Vaccinia virus |
Spain |
|
16 |
Peripheral arterial disease |
HGF |
Naked/plasmid DNA |
Japan |
|
17 |
Cancer(prostate) |
GM-CSF |
AAV |
Netherlands |
|
18 |
Cancer(metastatic melanoma) |
HLA-B7/Beta 2-Microglobulin |
Naked/Plasmid DNA |
Netherlands |
|
19 |
Cancer(NSCLC) |
LY9000003 |
|
Norway |
|
20 |
Infectious(HIV) |
HIV-env, gag |
Pox virus |
UK |
|
21 |
Cancer(prostate) |
GM-CSF |
AAV |
UK |
|
22 |
Cancer(prostate) |
GM-CSF |
AAV |
UK |
|
23 |
Cancer (glioblastoma) |
--- |
HSV |
UK |
|
24 |
Cancer(colorectal) |
Tumour associated antigen 5T4 |
Vaccinia virus |
UK |
|
25 |
Cancer(NSCLC) |
|
|
UK |
|
26 |
Cancer (glioblastoma) |
HSV-TK |
Retrovirus |
USA |
|
27 |
Cancer(Melanoma) |
HLA-B7/b2-Microglobulin |
Lipofection |
USA |
|
28 |
Cancer(SCCHN) |
p53 |
Adenovirus |
USA |
|
29 |
Cancer(SCCHN) |
p53 |
Adenovirus |
USA |
|
30 |
Cancer(Pancreas) |
CEA, B7.1(CD80), etc |
Pox virus +
|
USA |
|
31 |
Cancer(Prostate) |
GM-CSF |
AAV |
USA |
|
32 |
Cancer (Melanoma) |
HLA-B7/b2-Microglobulin |
Lipofection |
USA |
|
33 |
Cancer (Prostate) |
GM-CSF |
AAV |
USA |
|
34 |
Cancer (Prostate) |
PSA, B7.1, ICAM-1, LFA |
Pox virus + Vaccina virus |
USA |
|
35 |
Cancer (NSCLC) |
TGF |
naked DNA |
USA |
|
36 |
Angina |
FGF-4 |
Adenovirus |
USA |
|
37 |
Cancer (Prostate) |
HSV-tk |
Adenovirus |
USA |
|
38 |
Cancer (Renal) |
VEGF |
Adenovirus |
USA |
|
39 |
Cancer (glioblastoma) |
HSV-tk |
Retrovirus |
multi-country |
|
40 |
Infectious (HIV) |
HIV |
Pox virus |
multi-country |
|
41 |
Critical limb ischaemia |
FGF |
Naked/Plasmid DNA |
multi-country |
1SCCHN: Squamous Cell Carcinoma of the Head and Neck
2NSCLC: Non small cell lung cancer
Updated september 1, 2008 Provided by John Wiley and Sons Ltd.
www.wiley.co.uk/genmed/clinical
또한, 전형적인 유전자치료제 이외에 antisense 약물인 Vitravene(ISIS Pharmaceuticals)과 aptamer 약물 Macugen(Eytech 사)는 이미 시판 허가를 받고 발매되고 있어 DNA/RNA 기반 의약품의 상업화 가능성을 보여주고 있으며, 또한 다양한 방법의 유전자치료제가 개발되고 있다.
(4) 백신
신종플루의 영향으로 백신의 중요성이 부각되고 있는 현재, 2013년 백신시장은 380억 달러 이상 규모로 확대될 것으로 전망하고 있다. 2008년 전 세계 백신시장은 전년대비 21.5% 성장하여 192억 달러에 도달했으며, 의약품 부문에서 가장 빠른 성장세를 띠고 있다. 현재 시판되고 있는 백신제품들의 사용이 늘고 신제품 파이프라인이 지속적으로 유지될 것으로 전망된다.
세계적인 백신 생산업체는 기존 백신이 갖는 안정성, 특이성, 용도 제한 같은 결점을 극복하기 위해 세포배양백신, 유전자재조합 백신, 수지상세포 기반 백신, 플라스미드 DNA 및 바이러스 기반 백신 등의 BT기술을 활용하여 연구하고 있다. 기존의 예방적 방어용 백신 외에도 AIDS, 말라리아, 탄저균 같은 치명적인 질환뿐만 아니라, 알츠하이머, 고혈압, 천식, 동맥경화, 암 등을 대상으로 하는 치료용 백신 개발이 이루어지고 있다. 특히 암 치료 백신의 개발은 Avax Technologies사의 melanoma 치료 백신, Intracel사의 대장암 치료 백신이 상품화된 이후, 지속적인 개발이 진행되고 있으나, 항원에 대한 면역역가가 다소 낮게 나타나거나, 임상 유효성이 다소 낮게 나타나 실패하는 경우가 많아, 다양한 방법의 암 치료 백신 개발을 시도하고 있다.
[그림 4-2-2-2] 암 치료 백신 임상 단계별 현황

출처: 암백신, 항체단편, 백신제제 분야의 최신 기술 트렌드 및 산업동향, 2009. 6. 김태억
2008년까지 27개 질환에 대한 백신이 개발되어 인류 건강에 이바지하고 있다. 최근에는 백일해, 디프테리아, 파상풍, 소아마비, Haemophilus influenza type B를 예방하는 사노피의 Penacel과 백일해, 디프테리아, 파상풍, 소아마비 예방하는 GSK의 Kimrix가 FDA에 승인을 받는 등 복합 백신 개발에도 많은 노력이 진행되고 있다.
다. 바이오신약 개발의 국내 현황
(1) 단백질의약품
200여 개에 이르는 국내 바이오산업 관련기업의 60% 이상이 단백질의약품을 개발해 생산하고 있는데, 대표제품으로는 인간성장호르몬(LG생명과학, 동아제약, 대웅제약), GM-CSF(LG생명과학), G-CSF(동아제약), EPO(CJ제일제당, 녹십자, 동아제약, LG생명과학), 인터페론(LG생명과학, CJ제일제당, 녹십자, 동아제약, 한올제약), 진단시약제제(녹십자, 동아제약, LG생명과학) 등이다.
국내 제약기업들은 특허가 만료되는 바이오시밀러 개발과 복용 편리 및 활성 증강을 위한 신제형 개발연구에 집중하고 있다. 또한, 초기 실험실 연구 단계에서 좋은 결과물을 확보한 신규 타깃 물질에 대하여 전임상 및 임상 관련 연구도 진행되고 있다. 특히, 상위 10대 제약사들의 신약개발 프로젝트 90여 개 가운데 51개가 바이오의약품의 개발을 진행하고 있어, 국내 제약산업 확대와 국가 성장동력 확보를 위한 적극적인 노력이 진행되고 있다.
|
제약사 |
제품명/아이템 |
적응증 |
임상진행 |
|
동아제약 |
DA-3803 |
보조생식술, 무배란증 |
임상1상 |
|
DA-3003 |
왜소증 |
임상1상 |
|
|
DA-3021 |
B형간염, C형간염 |
임상1상 |
|
|
DA-3031 |
호중구감소증 |
임상1상 |
|
|
DA-3051 |
다발성골수증 |
전임상 |
|
|
DA-3607 |
뇌종양 |
전임상 |
|
|
한미약품 지속형약물전달기술인LAPSCOVERY기술기반 |
LAPS-GCSF |
호중구감소증 |
전임상 |
|
LAPS-EPO |
빈혈 |
전임상 |
|
|
LAPS-Exendin |
당뇨 |
전임상 |
|
|
LAPS-hGH |
왜소증 |
전임상 |
|
|
LAPS-IFNα |
간염/암 |
전임상 |
|
|
LAPS-Somatostatin |
말단비대증 |
연구중 |
|
|
유한양행 |
G-CSF |
호중구감소증 |
연구중 |
|
대웅제약 |
EASYEF/Recombinant Human EGF |
Acute wound 구강점막염 |
임상3상 |
|
DWP431/ BMP2 |
뼈형성 |
연구중 |
|
|
LG생명과학 |
Valtropin/hGH |
GHD, TS/CRI |
미국 NDA 유럽허가 |
|
Eutropin/hGH |
SGA |
NDA |
|
|
EPO(Espogen) |
빈혈 |
NDA |
|
|
rFSH(Follitrope) |
무배란증 |
임상3상 |
|
|
LB03002/SR-hGH |
성장호르몬결핍 |
임상3상 |
|
|
SR-IFNα |
C형간염 |
임상2상 |
|
|
종근당 |
CKD-401 |
당뇨병 치료제 |
생산기술 개발 |
|
CKD-403 |
항암 치료제 |
생산기술 개발 |
|
|
CKD-404 |
성장 호르몬 |
생산기술 개발 |
|
|
CKD-406 |
빈혈 치료제 |
전임상 완료 |
|
|
제넥셀세인 |
COMP-Ang1 |
혈관질환 |
전임상 |
|
DAAP |
종양질환, 당뇨성망막질환 |
전임상 |
[표 4-2-2-4] 주요 단백질 의약품 제조업체 파이프라인
출처: 각 제약사 홈페이지, KIS 편집
(2) 항체의약품
국내 제약회사들은 항체의약품 개발에 지속적인 관심을 가지고 있으며, 이에 따라 특허가 만료되는 슈퍼 바이오시밀러 제품에 대한 생산성 증진과 추가 질환 치료를 위한 신규 타깃 확보를 위한 적극적인 노력과 투자가 진행되고 있다. LG생명과학, 이수앱지스, 제넥셀세인, 녹십자, 유한양행, 대웅제약, 삼성전자, 한화 석유화학, 셀트리온 등에서 항체의약품 개발을 진행 중에 있다.
특히, 2009년도 삼성전자의 항체의약품 개발에 대한 참여는 제약업체에 큰 반향을 불러 일으켜, 바이오신약 개발 중 항체의약품 개발의 중요성을 확인해 주었으며, 현재 Rituxan(비호지킨스 림프종 치료제), Remicade(류마티스관절염 치료제) 등에 대한 개발이 진행 중에 있다. 국내 최대의 바이오의약품 생산 시설을 보유한 셀트리온 역시, 개발 중인 9개 항체 바이오시밀러 제품의 판매를 진행하고 있으며, 유방암 치료제인 허셉틴에 대한 개발도 진행 중에 있다. 유한양행은 인간화 TNF-α 항체를 개발하고, 임상시료 생산을 위하여 셀트리온과 공동연구를 진행 중이며, LG생명과학은 Amevive(건선 치료제), TNFmab, TNFcept 등의 면역질환 항체치료제를 개발 중이다. 이수앱지스는 2007년 항혈전 항체 Clotinab을 상업화에 성공한 이후 고셔병 치료제인 세레자임(Cerezyme)의 바이오시밀러 제품인 ISU302를 KFDA로부터 다국가 임상 3상 시험 승인을 받은 상태이다.
한화석유화학은 anti-VCAM1항체를 개발하고 있으며, 대웅제약은 관절염 치료 항체를 개발 중이며, 녹십자는 B형 간염 치료용 인간화 항체를 비임상시험 중이고 anti-CD20 항체인 rituximab에 당쇄 변형기술을 적용해 ADCC가 강화된 개량 항체를 개발 중에 있다.
(3) 유전자치료제
국내의 유전자치료제 관련 연구는 학계 및 산업계에서 레트로바이러스, 아데노 바이러스 등의 바이러스성 벡터를 이용한 표적지향적 치료제 개발 연구가 많으며, 비 바이러스성 벡터의 개발 연구인 리포솜, 폴리머 개발 연구도 다수 진행되고 있고, 최근에는 siRNA, aptamer 이용한 유전자치료제 개발도 적극적으로 진행 중이다.
[표 4-2-2-5] 국내에서 개발 중인 유전자치료제 일반 현황
|
회사 또는 기관 |
개 발 내 용 |
|
동아제약, 서울대 (바이로메드), 삼성서울병원 |
- 혈관내피세포성장인자를 사용한 허혈성 족부궤양(일명 버거씨병) 치료제(VMDA 3601주)가 2001년 2월 공식적인 정부 승인을 받고 임상시험에 착수 - 이로써 우리나라도 이전의 비공식적인 임상시험에서 공개적인 유전자치료제 개발 시대로 접어듦 |
|
코오롱 |
- 미국에 설립한 자회사인 티슈진을 통해 조직성장인자 계열의 치료유전자를 이용하여 인체의 관절연골과 손상된 인대 등을 재생시킬 수 있는 유전자치료제‘티슈진’을 세계 최초로 개발하여 미국특허를 취득한 데 이어 임상시험을 실시 중 |
|
바이로메드 |
- 영국의 ㈜ 옥스퍼드 바이오메디카가 합동으로 ㈜ 바이로테크를 설립하여 헌터증후군 등의 유전자치료제를 개발 중 - MT-gp91 retrovirus를 이용한 만성육아종 질환 유전자치료제 개발 중 - HGF 유전자를 이용한 허혈성 심혈관질환 치료제를 개발 중 |
|
연세대 암센터 김주항, 윤채옥 교수팀 |
- 기존 대비 항종양 효과가 약 100배 이상 증대되고 동시에 종양 내 바이러스 확산이 증대된 종양 선택적 살상 아데노바이러스를 개발하여 (주)대웅제약과 함께 임상 1상 시험을 진행 중 - 종양 내 바이러스 확산이 증대된 아데노바이러스를 이용하여 (주)동아제약과 함께 뇌암 유전자치료제 전임상 진행 중 - 종양 활성화 프로모터를 이용한 종양 선택적 살상 아데노바이러스를 이용하여 (주)녹십자와 함께 폐암 유전자치료제 개발 중 |
|
메디코룩스 |
- 비바이러스성 유전자 운반체를 생산하는 바이오벤처 |
|
에트나진텍 |
- 양이온성 리피드 벡터를 개발하는데 주력 |
|
미코겐㈜ |
- 콜레스테롤에 오르니틴을 붙여 만든 나노입자(오콜)을 개발하여 대량생산에 성공 |
|
굿젠 |
- 유전자치료제 관련제품으로 3세대 리포좀과 EX유전자의 복합체(GG-EX), super p53과의 복합체(GG-Super p53), MVEGF와의 복합체(GG-MVEGF) 등을 생산하여 임상시험․임상치료용으로 판매할 계획 |
|
성균관대 의대 이제호 교수 |
- 사이모신 β-10(thymosin β-10) 유전자를 이용한 난소암 및 형질전환성장인자(TGF)-베타를 이용한 자궁경부암 치료 연구 중 |
|
성균관대 김덕경 교수 |
- 혈관내피세포성장인자(VEGF)를 이용한 말초혈관폐색성질환의 유전자치료를 연구하고 있음 |
|
이화여대 최진호 교수팀 |
- 유전자치료에 주로 이용되어온 유기 고분자 벡터보다 효율이 월등히 높은 무기물 벡터를 사용 |
|
뉴젠팜 |
- 전립선암 치료를 위해 Henry Ford Health System에서 개발한 Ad-tk/cd(double suicide gene therapy)를 국소 투여방법으로 임상 2상을 예정 |
|
동아제약 |
- 뇌암 치료를 위해 Pittsburgh 대학이 개발한 Ad-TRAIL을 종양 내 투여하는 전임상시험을 준비 중 - 연세대학교와 함께 개선된 뇌암 유전자치료제 전임상 연구 완료 |
|
녹십자 |
- 전이암, 폐암, 직장결장암 등을 대상으로 목암연구소와 연세대학교가 공동 개발한 Ad-LK를 근육 또는 간문맥 내 투여하는 전임상시험을 계획 |
최근에 임상시험 승인 받은 제품이 점점 증가하여 2008년 3/4분기 기준 9개의 제품이 약청으로부터 임상 승인을 받았으며, 타깃 및 전달체계의 다양화를 통하여 적극적인 연구가 진행되고 있다.
[표 4-2-2-6] 국내에서 임상 중인 유전자치료제 현황
|
코드명 |
개발회사 |
임상단계 |
대상질환 |
치료유전자 |
전달벡터 |
|
VMDA3601 |
동아제약 |
II |
허혈성 족부질환 |
VEGF |
naked DNA |
|
JX-594 |
녹십자 |
II |
간암 |
TK-, GM-CSF |
Vaccinia virus |
|
Theragene |
뉴젠팜 |
II |
전립선암 |
TK, CD |
Adenovirus |
|
VM106 |
바이로메드 |
I/IIa |
만성육아종 |
gp91 |
Retrovirus |
|
GX-12 |
동아제약 |
I |
HIV감염 |
HIV항원, IL-12 |
naked DNA |
|
VM202RY |
바이로메드 |
I |
허혈성 심혈관질환 |
HGF |
naked DNA |
|
TissueGene-C |
코오롱생명과학 |
I |
퇴행성 관절염 |
TGFb |
Retrovirus |
|
HB-110 |
동아제약 |
I |
B형 간염 |
HBV 항원,IL-12 |
naked DNA |
|
DW-418 |
대웅제약 |
I |
두경부암 |
TERT, relaxin |
Adenovirus |
출처: 유전자치료제 개발현황 및 심사방향, 식약청 생물의약품국, 2008
(4) 백신
국내의 자체 생산이 가능한 백신 종류는 5가지(B형 간염백신, 결핵백신 (BCG), 수두백신, 일본뇌염백신, 신증후군출혈열)에 불과한 상황이며, 주로 기초 예방 접종 대상 연구에 국한되고 있는 상태이나, 2009년도에 녹십자가 신종플루에 대한 백신을 자체 생산할 수 있는 기술을 확보함에 따라 국내 예방 백신 개발 능력은 차츰 선진국 수준에 도달하고 있다.
치료용 백신 개발은 선진국 대비 다소 뒤떨어져 있으나, 많은 바이오벤처기업과 제약업체에서 적극적인 연구가 진행되고 있다. 2009년 코스닥 상장 기업인 제넥신은 AIDS(GX-120 임상1상), B형간염(GX-110, 임상1상), 항암백신(GX-51, 전임상), 자궁경부암 치료백신(GX-160, 동물효력시험), 약제내성 결핵치료백신(GX-140, 동물효력시험) 등을 개발하고 있다. 벤처기업인 스마젠은 에이즈 백신 후보물질 ‘SAV001’의 인체 대상 임상시험을 2009년 미국 FDA에 IND를 신청한 상태이며, 가톨릭대학교는 신장암 치료 백신 개발, 서울대 강창율 교수팀은 NK T 세포 리간드와 항원 펩티드가 적재된 B세포를 항원제시 세포로 이용한 암치료 백신 개발 등을 진행하고 있다.
라. 국내 바이오신약 개발의 발전 전망
선진국 제약회사와 바이오 기업들은 자국이나 전 세계에 R&D 센터를 구축해 우수한 인적 자원과 인프라, 원천 및 응용기술 확보를 기반으로 바이오신약과 개량신약 개발에 적극적으로 투자하고 있다. 또한 막대한 자금이 소요되는 의약품 개발의 특성상 기업 간 M&A를 통하여 최적의 제품 생산을 위한 시너지 효과 창출의 노력이 진행 중에 있다.
정부는 바이오신약을 국가 신성장동력 산업으로 육성하기 위하여 원천기반 물질 확보, 시제품 생산 및 cGMP 수준 의약품 생산시설 구축, 전임상 및 임상 기반시설 확충, 안전성 확보를 위한 의약품 개발 인허가 규정 확보, 관리체제의 표준화 작업 등의 지원뿐만 아니라, 연구개발 및 전임상, 임상 연구 등의 적극적인 지원들이 이루어지고 있다.
정부의 지속적인 지원과 더불어 바이오신약에 대한 고부가가치 제품 창출을 위하여 국내 제약회사와 바이오벤처기업들은 자체 R&D 투자를 확대하고, 정부 R&D 지원금과 세제혜택 및 관련 기반시설을 활용한 바이오신약 후보물질 확보, 개량신약 개발, 생산시설 확충, 글로벌화 된 비즈니스모델 도입, 기술이전 확대 등에 적극적인 노력이 진행되고 있다.
국내 바이오신약을 성공적으로 개발하기 위해서는 국내시장의 다변화에 적응함은 물론, 더 나아가 국부창출이 가능한 세계적인 블록버스터급 신약, 바이오시밀러, 슈퍼제너릭 등의 독자적 기술개발 능력을 확보하고, 각 분야별 글로벌화 개발 전략을 수립하여 보다 융합적인 시너지 효과를 창출할 수 있는 적극적인 노력이 필요하다. 따라서 국내의 바이오신약 개발은 제약회사뿐만 아니라, 바이오벤처를 중심으로 대학과 연구소가 연계하여 연구개발에서 임상연구까지 기초, 응용, 개발 단계에서의 상호 경쟁과 보완, 협조를 통하여 이루어져야 한다. 특히, 바이오시밀러 항체의약품의 경우는 삼성전자, LG생명과학, 한화석유화학 등 대기업의 적극적인 연구개발 의지와 참여에 따라 이 분야의 활성화가 기대된다.
이렇게 글로벌 바이오신약은 정부의 과감한 연구개발 투자와 물적, 인적, 제도적 인프라 구축 등의 노력뿐만 아니라, 대학, 연구소 및 산업체 간의 기초·원천 연구와 병원 중심의 중개연구 및 전임상·임상연구를 보다 적극적으로 활성화하고, 후보물질과 산업화기술을 확보, 선진국과 상용화를 위한 상호 적극적인 공동연구 등을 통하여 가능할 것이다.
3. 바이오장기
가. 바이오장기의 개요
(1) 바이오장기의 정의
장기이식수술은 말기 장기부전환자의 생명을 연장시키고 기능을 회복시킬 수 있는 유일한 치료방법이다. 바이오장기란 생명공학적 기법을 이용하여 개발되거나 생산되어 사람에 이식할 수 있는 장기와 조직, 세포를 말한다. 줄기세포, 조직공학, 바이오인공장기, 바이오이종장기연구 분야들을 포함하며, 필요한 기술적 범위는 세포활용기술, 이종장기생산기술, 면역조절기술, 장기이식기술, 생체조직공학기술이 해당된다.
(2) 바이오장기 이식의 필요성
평균 수명의 연장으로 말기 장기부전환자들이 급증하고 있으며, 장기이식수술은 이들 환자들에게 유일한 치료법이지만, 타인으로부터 공급되는 장기의 절대수가 부족한 상황이다.
(가) 장기의 수요·공급 현황
국내외적으로 장기이식 수요는 급증하는데 비해 공급은 제한되어 이식 대기자 수가 지속적으로 증가하고 있다. 뇌사자 이식이 활성화된 미국의 경우에도 연간 새롭게 발생되는 장기이식 대기자 중 20%만 이식을 받으며, 이식을 못 받은 환자 중 6,000여 명 이상이 매년 사망하고 있어 시간이 지날수록 누적 이식대기자 수가 가파르게 증가하고 있다(그림 4-2-3-1). 국내 장기이식률은 2008년 이식대기자 18,064명 중 1,897명이 이식받아 약 10%의 이식률을 보이고 있다(그림 4-2-3-2).
특히 국내에서는 성인병의 증가, 고령화, 유교문화, 핵가족의 영향으로 외국보다 이식장기 수요 공급의 불균형 현상이 심각하다. 이러한 결과로 불법 장기 매매가 성행하고 있으며, 최근에는 국내보다 낮은 의료기술 수준의 외국에서 장기이식을 받는 사례가 증가하여 외교적, 법률적 문제로 비화되고 있다.
[그림 4-2-3-1] 미국 내 장기 이식 수요 공급 현황

출처: UNOS(United Network for Organ Sharing) 2008
[그림 4-2-3-2] 국내 장기 이식 수요 공급 현황

![]()
![]()
출처: KONOS(Korean Network for Organ Sharing) 2008
(나) 대체 장기 확보 방안으로 바이오이종장기의 필요성
장기부전환자를 위한 대체 장기 확보방법으로 바이오 인공장기, 바이오 이종장기, 줄기세포 분화, 생체조직공학을 이용한 조직재생법 등이 있다. 하지만, 줄기세포를 이용하는 방법은 아직 세포분화에 대한 이론적 토대가 마련되어 있지 않아 상용화까지는 많은 시간이 걸릴 것으로 예상된다. 자기 혹은 타인의 세포를 조직공학적 방법으로 연골, 뼈, 피부 제작에 응용되고 있으나, 이런 방법만으로는 여러 종류의 세포가 구조를 형성하여 기능을 하는 장기를 제작하는데 많은 어려움이 있다. 바이오이종장기는 이식과 치료의 목적으로 다른 종(동물)에서 생산된 장기를 이식하여 생착할 경우 부전된 기능을 즉시 회복시킬 수 있어 대체 장기로 사용하는데 적합하다.
[표 4-2-3-1] 장기 생산 기술 비교
|
|
이종장기 |
조직공학 |
줄기세포 |
|
장점 |
∘주요 기능성 장기를 확보할 수 있음 ∘조직공학과 줄기세포 응용, 개발에 필요한 대량의 세포 공급이 가능 |
∘구조물을 형성할 수 있음
|
∘세포치료에 효과적 ∘거부반응이 약함 ∘반복 치료가 충분히 가능함
|
|
단점 |
∘거부반응이 심함
|
∘조직공학 재료의 생체적합성 ∘기능성 장기 제작이 어려움 |
∘대량 생산이 어려움 ∘분화가 복잡하거나, 복합기능을 가진 장기 생산이 어려움 |
|
대체대상 |
심장, 폐, 신장, 간, 췌도 |
연골, 뼈, 치아 |
신경세포, 피부세포, 베타세포 |
출처: (재)바이오신약장기사업단 (2006.6)
[표 4-2-3-2] 손상된 장기의 기능을 대체할 수 있는 방법
|
장기 대체방법 |
심장 |
신장 |
간장 |
폐 |
췌장 |
|
동종이식 |
현재 적용 중 |
현재 적용 중 |
현재 적용 중 |
현재 적용 중 |
현재 적용 중 |
|
인공장기 (기계적장기) |
현재 적용 중 |
개발 중 |
현재 적용 중 |
개발 중 |
현재 적용 중 (인슐린 펌프) |
|
세포이식 |
개발 중 |
- |
개발 중 |
- |
현재 적용 중 (췌도) |
|
조직공학 |
개발 중 |
개발 중 |
개발 중 |
- |
개발 중 |
|
인공장기 (바이오장기) |
- |
개발 중 |
- |
- |
개발 중 |
|
이종장기 |
개발 중 |
개발 중 |
개발 중 |
개발 중 |
개발 중 (췌도) |
출처: Yang YG and Sykes M, Xenotransplantation: Current status and a perspective on the future. Nature Reviews Immunology, 7: 519~864, 2007를 참고로 수정 재편집함.
(3) 바이오장기 공급원
영장류는 번식이 잘 안되고, 사람에게 치명적인 바이러스를 보유할 위험이 있으며 희귀동물이어서 이종장기 제공 대상에서 제외되었다. 현재는 미니돼지의 장기를 가장 많이 사용하고 있다. 미니돼지는 인간과 비슷한 크기의 장기를 지니고 있으며 생리적 특성에서도 유사점이 많다. 또한 다산성으로 연간 어미 1두가 20마리 이상의 새끼돼지를 생산할 수 있어 이식용 장기의 대량공급이 가능하다. 따라서 재이식은 물론 고령층 등 순위도에서 밀려있던 환자층에도 공급의 제한이 없어질 것으로 예상된다.
이식 대기시간 없이 즉시 수술이 가능하며, 뇌사자 이식과는 달리 미리 준비, 계획된 이식수술을 받을 수 있다. 또한 환자에 이식 적합한 장기를 미리 준비할 수 있다. 간염이나 AIDS 바이러스와 같은 인체에 치명적인 감염원 회피가 가능하고 무균돼지의 사육기술이 확립되어 인간에게 유해한 특정병원균이 제거된 장기를 얻을 수 있다. 문제점으로 돼지 세포 표면에 존재하는 당항원(sugar)에 의한 초급성 면역거부 반응이 대두되어 왔으나 유전공학 기법을 이용한 형질전환 돼지 생산으로 이를 극복할 수 있게 되었다.
(4) 바이오이종장기 산업 발전을 위해 극복되어야 할 난관들
바이오이종장기 이식에 있어 다음의 3가지 문제가 해결되어야 한다. ① 장기이식거부 반응 조절 ② 동물 유래의 감염체 전이에 대한 안정성 확보 ③ 이종장기를 이식 받은 환자에 대한 평생 감시 및 감염모니터링으로 인한 사회, 윤리적 문제 해결
(가) 장기이식거부 반응: 이식한 이종장기는 인체에서 초급성, 급성혈관성, 세포매개성 및 만성 거부반응을 유도한다. 이를 극복하는 것이 이종장기 이식의 최우선 과제이다(그림 4-2-3-3).
[그림 4-2-3-3] 바이오이종이식 관련 이식거부 반응 및 조절

출처: Platt JL Xenotransplantation: Basic research and clinical application, 2002
① 초급성 거부반응의 극복
돼지 세포표면의 당성분인 알파-갈(1,3-α-Galactose)에 대한 자연항체에 의해 혈청보체계와 혈액응고계의 활성화가 유발되어 이식 후 수분 이내에 장기기능이 정지된다. 이는 알파-갈을 만드는 효소인 1,3-α-GalT 유전자 적중 돼지와 사람보체수용체(hDAF) 형질전환돼지를 이용하여 극복이 가능하다. 알파-갈 유전자 적중 돼지의 심장과 신장을 원숭이에 이식하여 심장의 경우 180일 이상, 신장의 경우 80일 이상 생존시킨 결과가 2005년에 보고되었다.55) 또한, 국내에서도 2009년 4월 알파-갈 합성효소 유전자 중 하나가 제거된 미니돼지(지노, 지노 2)의 개발성공으로 외국과 충분히 경쟁할 수 있는 발판이 마련되었다.
② 급성혈관성 거부반응의 극복
자연항체, 자연살해(nature killer) 세포와 단핵구에 의한 혈관내피세포 활성화에 기인하며, 활성화의 주요 원인인 알파-갈에 대한 유전자적중기술, 혈청보체 조절인자 형질전환돼지 제작 기술과 혈관내피세포의 안정화, 내피세포유래 면역 매개물질 조절, 혈소판 기능조절로 극복 가능할 것으로 예상된다.
③ 세포매개성 거부반응(면역학적 조절 및 면역관용 유도)
다양한 이종항원이 직ㆍ간접 항원 전달 방법에 의해 면역세포 활성화에 기인하며 동종이식에서 사용되었던 면역억제방법의 응용이나 면역관용유도로 극복하려는 노력이 활발히 시도되고 있다.
④ 형질전환 복제 돼지의 생산
장기이식 관련 유전자를 검색, vector 제작, 체세포 유전자 적중기술 등을 통하여 이종 장기 이식에 최적인 형질전환 복제돼지의 생산은 그 기반기술이 확립된 상태이며, 산업화가 활발히 진행되고 있다
[그림 4-2-3-4] 체세포 핵이식 기술을 이용한 형질전환 돼지의 생산

출처: De Sousa PA et al., Biol. Reprod., 66(3): 642~650, 2002
(나) 안전성 및 윤리, 사회적 문제
인수공통감염병원체는 돼지의 무균화를 통하여 차단할 수 있다. 그러나 돼지의 내인성레트로바이러스(PERV, porcine endogenous retrovirus)의 경우 바이러스 유전자가 돼지세포의 염색체 내에 삽입되어 유전되므로 무균화 작업을 통하여 제거되지 않는다. 그러나 현재까지 영장류 이식 실험을 통하여 돼지 내인성리트로바이러스 감염이 확인되지 않았고, 예전에 이종이식을 받은 환자에서도 감염의 증거가 확인되지 않고 있다. WHO는 2008년 11월 중국 창샤에서 세계 18개국의 이종이식 관련 전문가 및 정부 관계자와 회의를 열어 안전성과 윤리, 사회적 문제에 대한 가이드라인을 제시하는 의정서를 발표하고 이를 따를 것을 권고하고 있다.
나. 바이오장기의 해외동향
(1) 조직공학
세포이식과 조직공학은 뼈, 연골, 피부 등의 조직을 대체하고 인슐린을 분비하는 베타세포의 분화에 많은 연구가 활발히 진행되고 있지만, 아직 장기의 개발은 걸음마 수준에 머물러 있으며 복잡한 기능을 가지는 여러 세포 집단으로 이루어지는 장기의 개발은 한계가 있을 것으로 전망되고 있다.
1985년 “tissue engineering”이 소개된 이후 일차적 산물인, 뼈, 연골, 피부 등이 생산되어 임상에 사용되고 있다. 1990년에서 2002년 사이 조직공학 분야에 투자된 자본은 45억 달러 정도였으며, 2002년 89개의 생명공학 관련 기업이나 연구소가 생겼고, 현재 “tissue science and engineering”으로 발전하여 진단, 치료, 재생 등 다학제 간 다면적 접근을 통하여 혈관, 적혈구, 사람 림프절 등의 생산 연구를 진행하고 있다.56)
(2) 인공장기
인공장기(기계적 장기)는 심장과 간장에 적용 중이다. 인공심장의 경우 1970년대 후반 유타 대학 인공심장 연구팀에서 치과의사 클라크씨에게 인공심장을 이식하여 100여 일 가량 생존한 기록이 있지만, 그 이후 큰 진전이 없는 상태이고, 현재는 심실의 기능을 보조할 수 있는 보조심장이 임상에 사용되고 있다.
(3) 바이오이종장기
바이오이종장기는 심장, 신장, 간장, 폐, 췌장 등의 장기를 대체할 수 있는 궁극적인 방법이다. 이 중 당뇨병 치료를 위한 췌도 이식이 가장 먼저 사람에 적용될 예정이다. 췌도의 경우 이미 12차례나 사람에 이식된 사례가 있으며57) 미국 미네소타대학의 Hering 박사는 2009년에 FDA의 허가 아래 공식적으로 임상시험을 수행할 것으로 발표하였다.
(가) 바이오장기 산업 출현 및 발전
1990년 들어서면서부터 바이오이종장기 생산 전문 기업들이 활성화되었다.
NexTran사는 형질전환 돼지를 생산하여 1995년 형질전환 돼지 간 이식 임상시험에 대한 FDA의 허가를 받았다. Alexion사는 척수 손상 영장류에게 돼지 신경세포를 이식하였다. PPL-Therapeutics사는 1997년 복제양 ‘Dolly’를 만든 Roslin 연구소의 복제 기술을 상업화하여 2000년에 세계 최초로 형질전환 돼지의 복제에 성공하였다.
[표 4-2-3-3] 바이오장기 관련 기업 현황
|
기업명 |
개발 장기 및 세포 |
산업화 내용 및 적용질환 |
2006 매출액 |
2005~2006 매출증가율 |
|
Alexion Pharmaceuticals |
신경세포 |
- 복제돼지 생산 - 파킨슨씨병과 척수손상 |
1.6 |
136.4% |
|
Advanced Cell Technology |
신장, 심장 |
- 복제 및 형질전환 기술 |
0.4 |
10.0% |
|
Modex |
조직공학 |
- 조직세포와 생체재료를 이용한 조직 공학적 바이오 장기 |
|
|
|
Circe Biomedical |
간, 췌장 |
- 돼지세포 생산: 체외 바이오 인공간 |
|
|
|
Advanced Material Design |
조직공학 |
- 생체재료를 이용한 인공장기․의료용구 |
|
|
|
Immerge BioTherapeutics |
신장, 심장 |
- 형질전환 돼지 생산 |
|
|
|
Nextran/Baxter |
간 |
- 형질전환 돼지 생산 |
|
|
|
PPL Therapeutics |
신장, 심장 |
- 형질전환 및 복제기술을 접목한 형질전환 복제돼지 생산 |
|
|
|
Living Cell Technology, Ltd |
신경, 췌도 |
- 돼지췌도 및 신경세포를 캡슐화 |
|
|
출처: 한국보건산업진흥원, “바이오이종장기 생산 및 관리기술 개발동향”, 2007, 내용 업데이트
(나) 바이오장기 기업의 합병 및 집중화
(표 4-2-3-3)에 표시된 초창기 바이오이종 장기 생산 전문기업들은 현재까지 연구개발 단계에 머물고 있는 경우가 많지만, 이미 가능성이 있는 몇 개의 회사들은 더 큰 회사와의 합병을 통해 안정적인 재정지원을 배경으로 임상실험에 착수하거나 곧 임상실험에 들어갈 예정에 있다.
Diacrin사는 GenVec사와 2003년에 합병하고, 1996년부터 Genzyme사의 후원을 받아 돼지의 신경줄기세포(porcine neural stem cells, NeuroCell-PD)를 이용해 Parkin's 환자를 치료하고 있으며, 현재 임상 2상을 끝낸 상태여서 가장 빠른 임상적용 단계에 진입해 있다.
뉴질랜드의 Living cell Technologies사는 돼지유래의 췌도를 캡슐화하여 제1형 당뇨병 치료제(DiabeCell)로 개발하였으며, 러시아에서 10명의 환자를 대상으로 임상2상 시험을 수행 중에 있으며 2009년 9월 뉴질랜드에서 8명의 제1형 당뇨병 환자에게 임상시험을 수행 할 예정이다. 또한 뇌졸중 및 척수손상환자를 치료할 목적으로 NTCell도 개발 중에 있다.
Revivicor사는 PPL-Therapeutics의 후신으로 2003년 설립되어 1,3-α-Galacto- syltransferase(GalT) 유전자 적중 돼지를 기본으로 각종 형질전환 돼지를 생산하여 췌도를 이용한 당뇨병 치료에 대한 임상시험을 시행할 예정에 있다. 이 회사의 투자자로는 University of Pittsburgh Medical Center(UPMC) health system, Highmark Health Ventures Investment Fund, Fujisawa Investments for Entrepreneurship이 있다.
다. 바이오장기의 국내 현황
국내의 경우 (표 4-2-3-4)에서 볼 수 있듯이 보건복지부(현 보건복지가족부), 과학기술부(현 교과부)가 주축이 되어 바이오이종장기개발 사업단, 장기복제이식기술 개발 사업단을 만들어 2004년부터 3단계(1단계 3년, 총 9년) 연구를 진행 중에 있다.
[표 4-2-3-4] 국내 바이오장기 개발을 위한 부처별 지원 현황
|
보건복지가족부 |
교육과학기술부 |
|
∘ 초급성, 급성 면역거부반응 조절: 면역억제 요법 및 면역관용 유도법 개발 ∘ 이종이식 전임상 및 임상 적용 |
∘ 형질전환 복제돼지 개발 ∘ 형질전환 벡터 제작/유전자 세포내 도입 ∘ 면역억제제 개발 |
출처: (재)바이오신약장기사업단, 2008
서울대학교 Biomax산하 특수생명자원연구센터에서는 무균 미니돼지의 생산과 유지기술을 확립하고 현재 70두 정도를 유지하고 있다. 2007년 2단계 사업을 시작한 장기복제이식기술 개발 사업단은 과학기술부의 지원을 받아, 2009년 초급성거부반응을 극복할 수 있는 1,3-α-GalT 유전자 적중돼지 (그림 4-2-3-5)와 사람보체수용체(hDAF) 형질전환 돼지를 생산하였다. 보건복지가족부의 지원을 받는 바이오이종장기개발사업단은 면이식용 이종장기의 생산과 면역 거부반응의 극복을 위한 효과적 방법의 이종이식 기술을 개발하고 있다. 2009년 현재 당뇨병 치료를 위한 췌도이식과 심장판막, 각막이식의 임상적용을 위해 원숭이 전임상 실험을 시행 중에 있다. 심장판막과 각막이식은 2012년, 췌도이식은 2013년에 임상시험을 실시할 목표로 2008년부터 바이오이종췌도이식 수요자를 파악하기 위한 연구도 같이 수행하고 있다.
[그림 4-2-3-5] 알파갈 생성 효소 유전자적중 복제 미니돼지

출처: (재)바이오신약장기사업단, 2009
(2) 국내업체동향
국내 형질전환 돼지 생산과 관련된 기업으로는 엠젠바이오, 조아제약, PW제네틱스가 있으며, 조직공학을 이용한 세포 치료제를 개발하고 있는 회사들로는 엠티티, 칼로덤, 바이오랜드, 듀플로젠, 이노테크, 리젠바이오텍, 리젠메드 등이 있으나 아직까지 적용이 용이한 인공피부, 연골세포 등에 대한 연구와 제품개발에 매진하고 있다.
[표 4-2-3-5] 바이오장기기술 관련 국내 업체 동향
(단위: 백만 원)
|
기업명 |
치료제 |
주요제품 및 개발내용 |
매출액 (년도) |
자본금 (년도) |
|
마크로젠 |
유전자 조작 동물 복제 |
- “아빠 없는 생쥐” 탄생, 정자 없이 난자로만 수정, 2004년 4월, Nature - 면역결핍 생쥐모델 및 당뇨병 생쥐 모델 개발, 국내동물 특허 1, 2호 - 국내 최초로 마우스복제 성공 |
10,955 (2006) |
2,430 (2006) |
|
PW제네틱스 코리아 |
- 2007년 PW제네틱스는 서울대 동물복제연구팀과 협력으로 의약학 연구용 ‘초미니 복제 돼지’ 생산 - 2007년 PGW는 ‘무균돼지 사육시스템에 대한 국내특허 취득 |
1,009 (2006) |
3,307 (2006) |
|
|
조아제약 |
- 2002년 국내최초 체세포 복제돼지 가돌이 탄생 성공 - 2002년 경상대 김진회 교수팀과 협동으로 체세포 복제돼지 가돌이 1, 2호에 이어 나돌이 1∼6호 탄생 - 2005년 EPO 유전자 형질전환 복제돼지 생산 |
19,207 (2006) |
11,360 (2006) |
|
|
엠젠 바이오 |
- 2005년 엠젠바이오는 농촌진흥청 축산연구소와 공동으로 자연살해세포의 활성을 억제하는 HLA-G 유전자를 발현하는 형질전환 복제돼지 생산 - 2003년에 6월 국내 최초, 세계 두 번째로 형질전환 돼지인 “형광이” 탄생 |
|
6,111 (2006) |
|
|
엠씨티티 |
배양 피부 |
- BASⅠ, BASⅡ, BASⅢ |
102 (2006) |
2,462 (2006) |
|
바이오랜드 |
- AmniSite-Skin |
27,179 (2006) |
3,200 (2006) |
|
|
- AmniSite-Cornea |
||||
|
테고 사이언스 |
- 홀로덤(시판허가), 칼로덤(시판허가 신청) |
|
|
출처: KISTI, “바이오인공장기 기술동향 분석”(2004), 일부 내용 업데이트 및 수정, 생명공학정책연구센터의 2007 바이오 신약 장기 제품군별/주요 질환별 세계 및 국내 시장현황과 전망분석
라. 바이오장기의 발전과제와 전망
(1) 바이오장기 산업의 발전 전망
(가) 바이오장기 산업 수요 및 파급 효과
이식 장기 수요의 폭발적인 증가로 수급 불균형은 점차 심화될 것으로 예상된다. 아울러 장기 이식은 21세기 고부가가치 신산업인 생명공학산업의 모든 분야가 결집되는 ‘생명공학산업의 총체이자 꽃’으로 관련 생명공학산업의 동반 발전과 응용 기회를 제공할 것으로 예상한다.
(나) 시장 규모
현재 장기 이식에 따른 면역억제제의 시장 규모만 해도 2001년 기준으로 3조 4천200억 원 규모에 달하고 매년 6%씩 증가되어 2010년경에는 5조 5천 50억 원에 이를 것으로 예상하고 있다. 국가생명공학정책연구센터의 ‘2007 바이오신약 장기 제품군별/주요 질환별 세계 및 국내 시장현황과 전망분석에 관한 연구’에 따르면 이종장기의 상용화 시점으로 예상되는 2015년에는 세계 장기이식 대기자의 수가 158만 명에 이를 것으로 전망하였다. 이같이 세계 장기이식 대기자 중 이종장기 수요자와 이종장기의 가격으로부터 산출한 세계 이종장기 시장은 2015년 최소 19.8억 달러에서 최대 98.8억 달러 규모를 형성할 것으로 전망된다. 바이오장기의 주요 개발 분야인 당뇨병 치료용 췌도의 경우 미국의 1형 당뇨병환자 1명의 1년 생존율 연장 비용이 28,700달러가 소요(미국 UNOS 보고서, 2005년)되며, 호주의 1형 당뇨병 환자 14만 명의 경제비용이 연간 25억불(2006)에 이르고 있으며 전 세계적인 1형 당뇨병 환자 700만 명 중 10%가 췌도 이식 대상자라고 가정하고 다시 이중 10%가 이종췌도를 이식받는다고 볼 경우, 그 시장 규모는 17억 달러로 추산된다.58)
(다) 이종장기 국내시장 전망분석
국가생명공학정책연구센터의 ‘2007 바이오 신약 장기 제품군별/주요 질환별 세계 및 국내 시장현황과 전망분석에 관한 연구’에 따르면 이종장기의 상용화 시점으로 예상되는 2015년에는 국내 장기이식 대기환자의 수가 29,572명에 이를 것으로 전망된다. 위와 같이 전망한 국내 장기이식 대기자 중 이종장기 수요자와 이종장기의 가격으로부터 산출한 국내 이종장기 시장은 2015년 최소 739억 원에서 최대 2,218억 원의 규모를 형성할 것으로 전망된다.
(라) 이종장기관련 전문연구센터
○ 바이오이종장기개발사업단(http://www.xenokorea.org/)
차세대성장동력사업 바이오신약장기사업 중 “바이오장기” 분야에 바이오이 종장기개발사업단, 장기복제이식기술개발, 무균돼지생산사업단이 있다.
○ 형질전환 복제돼지 연구센터(http://rctcp.cnu.ac.kr/)
첨단 동물발생과학기술을 개발하여 형질전환 복제동물을 효율적으로 생산할 수 있는 시스템을 구축하고자 설립하였다.
4. 바이오마커
가. 바이오마커 개요
(1)바이오마커의 종류
NIH/FDA 정의에 의하면 바이오마커는 “characteristic that is objectively measured and evaluated as an indicator of normal biological processes, pathogenic processes, or pharmacological responses to a therapeutic intervention”이다. 바이오마커 콘텐츠로는 생체분자들(단백질, microRNA, 유전자변이, 대사물질), 생체분자들의 패턴(유전자 또는 단백질 발현, 대사체 프로파일), 또는 생리/해부학적 파라미터(혈압, 암의 크기) 등이 있다.
바이오마커는 용도에 따라 진단을 목적으로 하거나(조기발견, 약물반응, 예후, stratification, 모니터링), 신약개발 툴(PK, Toxicity, Efficacy, Surrogate, Companion Diagnostics)로서 사용되기도 한다. 바이오마커의 분류나 정의는 아직 통일되어 있지 않고 일부 혼용되는 경우가 있으며(context-dependent), 따라서 한 개의 바이오마커가 여러 용도로 분류되기도 한다.
바이오마커를 이용한 분자진단은 다양한 실험실테스트(ELISA, FISH, PCR, 마이크로어레이) 또는 이미징기술 등을 사용하여 분석한다. 시장에서 성공하는데 중요한 요소로는 임상에서 니즈, 개발비용, 보험적용(reimbursement) 등이 중요한 요소이며, 기술적 요소로는 technical performance(sensitivity, specificity), 분석시스템에서 사용가능한 다양한 메뉴, 그리고 자동화(automation) 여부 등이다.
(2) 신약개발 툴로서 바이오마커(Clinical Biomarker) 활용
2006년 미국 FDA의 ‘Critical Path Opportunities Report’에서는 신약개발의 각 단계를 평가할 수 있는 새로운 바이오마커의 개발이 무엇보다 중요하다고 역설하였다. 바이오마커는 약의 mode of action 및 disease pathway를 규명하고, 약의 반응성에 따른 환자의 분류(stratification), 약의 dose selection, efficacy and safety에 대한 정보를 줄 것으로 기대하고 있다. 특히 항암제 개발 분야에서 표적항암치료를 위해서는 동반진단제(Companion Diagnostics) 개발이 필수적인 추세이며, 이를 위해서는 critical한 바이오마커의 발굴과 임상 검증이 핵심이다.
[표 4-2-4-1] 신약개발 관련 바이오마커
|
바이오마커 타입 |
내 용 |
|
Mechanism biomarkers |
약물의 downstream 효과를 측정(예, 신호전달 경로에서 downstream 단백질의 인산화) |
|
Target biomarkers |
약물 타깃의 존재를 측정 |
|
Disease biomarkers |
질환의 존재 또는 가능성을 진단 |
|
Pharmacodynamic biomarkers |
약물의 target 전달 정도 측정 |
|
Translational biomarkers (bridging biomarkers) |
서로 다른 생체 내에서 측정이 가능한 바이오마커(efficacy, toxicity, etc.) 동물모델과 인체 내에서 약물 반응을 연결시켜줌 |
|
Stratification biomarkers (identification biomarkers) |
특정 약물에 대한 임상시험 대상 환자군을 선정하는 바이오마커 |
|
Efficacy biomarkers |
약물 기전에 근거하여 임상효과를 정량적으로 측정함; surrogate marker로는 검증되지 않았지만 POC clinical trial에 사용할 수 있음 |
|
Surrogate markers |
약물 효능을 정량적으로 예측할 수 있는 마커; Phase II/III clinical trial에서 clinical endpoint로 사용 가능 |
|
Toxicity biomarkers |
약물의 독성을 측정함 |
|
Prognostic biomarkers |
질환의 예후를 측정. 마커 양성/음성에 무관하게 약물효능은 있음. 다만 예후가 다를 뿐. |
|
Predictive biomarkers |
약물에 대한 효능을 예측할 수 있는 바이오마커. 마커 음성의 경우 약효능이 없음 |
|
Qualified biomarkers |
마우스 및 인체 연구결과에서 일관성 있게 재현되는 결과를 보이는 마커 |
|
Valid(validated) biomarkers |
임상검증(an adequately statistically-powered prospective clinical trial)을 통과한 마커 |
나. 해외 동향
(1) 최근 연구개발 동향
McKinsey 자료에 의하면 제약산업계에서 바이오마커 분야에 투자한 R&D 비용은 2003년도 2.2B 달러에서 2009년도 5.3B 달러로 두 배 이상 늘어났다. 현재 질환분야별 바이오마커 발굴은 암질환 분야(30%)가 제일 큰 비중을 차지하며, 심혈관(25%), 뇌질환(20%), 자가면역(10%) 등의 순서이지만, 앞으로의 추세는 퇴행성뇌질환 및 정신질환 분야의 연구개발이 활발할 것으로 예상된다59).
(가) 질환의 조기진단, 스크리닝, 발병위험도 예측
조기진단이 매우 중요한 분야임에도 유효한 조기진단 마커들은 매우 부족하다. 특히 진단 후 사망률이 높은 폐암, 췌장암과 치매 등과 같은 퇴행성 뇌질환과 정신질환 분야에서 조기진단이 매우 절실하지만(unmet nees가 큼), 조기진단 바이오마커를 개발하는 것은 매우 어려운 실정이다(High Risk, High Return). 질환의 발병과 상관관계가 있는 잘 연구된 유전자(대부분 질환의 직접 원인인 susceptibility gene은 아님)에 대한 정보(변이, polymorphism, copy number 등)는 질환 발병 위험도를 예측하는 스크리닝 마커들로 현재 사용되고 있다.
[표 4-2-4-2] 질환발병 위험도(Disease Risk) 예측 바이오마커
|
질환 |
진단회사 |
진단 내용 |
|
종양 |
Myriad Genetics |
BRACA1 및 BRACA2 유전자분석을 통한 유방암 발병 위험도 예측 |
|
Gen-Probe |
PCA3유전자의 mRNA를 urine에서 측정하여 전립선암 스크리닝에 적용. PSA보다 더 특이성이 높다고 발표함 |
|
|
LabCorp |
vimentin 유전자에 대한 Stool-based DNA Screening kit(ColoSure) 개발 (methylation-specific PCR) |
|
|
Quiagen 등 |
고위험군 HPV 검출을 이용한 cervical cancer screening |
|
|
deCODE |
SNP를 이용하여 전립선암과 유방암에 대한 발병 위험도 예측 |
|
|
치매 |
Athena Diagnostics |
APOE, PS, APP 유전자를 이용한 알츠하이머 치매 발병 예측 통합 테스트 |
|
Celera |
치매 발병과 상관이 있는 19개 SNP 마커들을 기존의 마커와 통합하여 Genetic Risk Score를 주는 테스트 개발 중 |
|
|
심혈관질환 |
Celera |
KIF6의 변이(Trp719→Arg)를 이용 관상심장병에 대한 Genetic Risk Score를 주는 테스트를 개발하여 임상 검증 중 |
|
deCODE Genetics |
9번 염색체 CDKN2A/2B gene region에 있는 SNP 이용 젊은 나이의 심장마비(myocardial infarction) 발병 위험도 예측 |
|
|
기타 |
Celera |
SNP를 이용하여 C형간염바이러스 감염시 강경변을 일으킬 위험도와 류머티즘성관절염을 일으킬 위험도 예측 |
|
CombiMatrix |
CGH에레이를 이용하여 100곳 이상의 microscopic genomic loci에 copy number status에 따라 자폐증 발병위험도 예측 |
근래에는 Consumer Genomics 회사들에서 Genome-wide Scan을 통해 다수의 질환-감수성에 대한 유전적 형질을 예측하는 테스트를 서비스로 제공하고 있으며, 새롭게 발견되는 마커들을 제품의 메뉴에 지속적으로 추가하고 있다.
[표 4-2-4-3] Genome-wide Scan을 통한 Disease Risk 예측 바이오마커
|
회 사 |
제품명 |
내 용 |
|
23andMe |
23andMe |
Genome-wide Scan, 90개 이상의 질환-감수성 및 유전적 형질 예측 |
|
deCODE Genetics |
deCODEme |
comprehensive genome scan, 현재 34개의 질환-감수성 및 유전적 특성 예측; 각종 질환(2형 당뇨, 심근경색, 전립선암 등)에 대한 키트도 있음 |
|
Navigenics |
Health Compass |
Genome-wide Scan, 20개 이상의 질환-감수성 및 유전적 특성 예측 |
(나) Personalied Medicine 바이오마커
Pharmacogenomics 테스트와 Companion Diagnostics의 많은 부분은 맞춤의약 범주에 속한다. 바이오마커는 약물의 반응성에 따른 환자의 분류(stratification), 약물의 dose 결정, 독성 여부 판단 등 약물 치료에 중요한 지표로 작용한다. 빅파마들은 니치마케 타깃을 위해 바이오마커를 Phamacodynamics 툴로서 개발하여, 임상시험 환자들 선정에 활용하고, 나아가서 동반진단제(theranostics)로 개발하는 전략을 구사하고 있다.
[표 4-2-4-4] 독성 진단 바이오마커
|
진단제 |
진단회사 |
약물 |
제약회사 |
내 용 |
|
AmpliChip CYP450 (FDA) |
Roche/ Affymetrix |
Various |
Various |
Microarray scan, CYP2D6 및 CYP2C19 유전자 polymorphisms을 분석하여 약물 대사 예측 |
|
Invader UGT1A1 (FDA) |
Third Wave |
Irinotecan (Camptosar) |
Pfizer |
UGT1A1의 polymorphisms에 근거하여 Ilrinotecan 화확요법에 대한 부작용 위험군 환자 감별 |
|
CYP2C9/ VKORC1 genetic test (FDA) |
Various |
Coumadin (Warfarin) |
Bristol- Myers Squibb |
IWarfarin 대사에 관여하는 유전자 polymorphisms에 근거하여 Warfarin(쿠마딘) 민감성 환자 감별 및 약물 용량 조정에 이용 |
|
TheraGuide 5-FU (test service) |
Myriad Genetics |
5-FU/ capecitabine |
Various |
DPYD and TYMS 유전자 변형 이용 5-FU/capecitabine 기반의 화학요법에 대한 독성 예측 |
|
TPMT Test |
Prometheus Laboratories |
Thiopurine drugs |
Various |
TPMT activity assay and genotype test to assess the cytotoxicity of thiopurine drugs |
|
HLA-B genotyping |
Various |
Abacavir (Ziagen) |
GlaxoSmithKline |
HLA-B*5701 유전자 테스트, Abacavir (anti-AIDS drug)에 대한 hypersensitivity 예측 |
[표 4-2-4-5] Companion diagnostics for patient Stratification
|
진단제 |
진단회사 |
약물 |
제약회사 |
내 용 |
|
Her2 FISH pharma DX |
Dako |
Herceptin |
Genentech |
HER-2 다량 발현 유방암환자 규명 |
|
EGFR (copy number) Dx kit |
Dako |
Erbitux/ Tarceva |
ImClone/ Genentech |
Erbitux 치료에 효능이 있을 대장암환자 규명/ Tarceva 치료에 효능이 있을 폐암(non-Small cell lung cancer) 환자 규명 |
|
Ventana Dx c-Kit |
Ventana |
Gleevec |
Novartis |
c-Kit 단백질 발현 진단 Gleevec에 효과가 있을 환자 규명 |
|
TheraScreen EGFR 29 mutation |
DxS/ Roche |
Tarceva/ Iressa |
Genentech/ AstraZeneca |
Detect the presence of EGFR mutation that may be susceptible or resistant to treatment with IRESSA in non-Small cell lung cancer patients(a real-time PCR test) |
|
BCR/ABL |
Genzyme Genetics |
Gleevec |
Novartis |
Detects all secondary BCR-ABL mutations and therefore predicts resistance to Gleevec for CML |
|
TheraScreen KRAS mutation |
DxS/ Roche |
Erbitux/ Vectibix |
ImClone, BMS/ Amgen |
Identify metastatic colorectal cancer patients who has KRAS mutations in codon 12 or 13, and thus may not show a treatment benefit |
|
Trofile |
Monogram Biosciences |
Maraviroc (Selzentry/Celsentri) |
Pfizer |
Detection of HIV patients who has CCR5-chemokine C-C motif receptor tropism |
(다) 규제 및 인허가(Regulatory Issues)
미국에서 바이오마커를 진단상품으로 판매하기 위해서는 FDA 승인 또는 허가를 얻어 키트로 개발하거나 CLIA 인증 검사실(Clinical Laboratory Improvement Amendments [CLIA]-cerified laboratories)에서 서비스로 제공하고 있다. FDA로부터 IVD(in vitro diagnostics) 승인을 얻기 위해서는 analytical validity, reliability, clinical validity, utility 등 네 가지 조건을 만족해야 하지만 CLIA 테스트는 clinical service로 간주되어 analytical validity와 reliability 조건만 만족하면 된다. 단일 실험실에서 진행되는 genetic test는 clinical service로 간주되어 FDA의 승인이 필요 없다. 대표적 예로 Genomic Health의 Oncotype Dx가 있다. 한편 FDA는 IVDMIA(in vitro diagnostic multivariate index assay) 지침서 초안을 마련하여 알고리즘을 이용한 multiplex 유전자 테스트를 규제를 강화하고 있다. 현재까지 Agendia의 Mammaprint, Pathwork의 Tissue-of-origin Cancer Test, XDx의 AlloMap 테스트가 FDA는 IVDMIA 인허가 절차를 거쳤다.
2007년 미국 내 종양분자진단시장은 98%가 CLIA-인중 분자진단제이지만 앞으로의 시장성장은 FDA를 거친 multiplex 진단제가 견인할 것으로 보고 있다. 진단제품의 승인 또는 허가 절차는 미국 FDA 산하 CDRH(Center for Devices and Radiological Health) 내 OIVD(Office of In Vitro Diagnostic Device Evaluation and Safety)에서 담당하게 되는데(예외, HIV 테스트 및 혈액 관련 감염 테스트는 CBER[Center for Biologics Evaluation and Research]에서 담당), 제품의 종류 및 위험도에 따라 Class I에서 III로 분류된다. 대부분의 분자진단제들은 ClassII로 분류되어 시판 전 등록(PMN: Pre Market Notification, 510k)을 거처 허가를 받고, HPV 테스트 및 많은 종양 관련 테스트들은 ClassIII로 분류되어 시판전 승인(PMA: Pre Market Approval) 과정을 거치게 된다. 새로운 개념의 진단제나 분석기기는 자동적으로 ClassIII로 분류되었었는데 1997년 FDA Modernization Act의 일환으로 de novo 과정을 만들어 자료는 PMA 수준으로 만들지만 심사과정은 510(k) 수준으로 완화하여 적용하고 있다. 미국 FDA는 신약개발 과정에서 임상시험단계의 실패율을 감소시키기 위해 초기 개발단계에서부터 바이오마커사용을 적극 권장하며, VGDS (Voluntary Genomic Data Submission)를 권고하고 있다.
(2) 주요국 연구개발 투자 동향
바이오마커는 발굴, 검증, 개발을 담당하는 주체들의 각기 다른 discipline을 요구하기 때문에 공공부문의 연구개발 활동도 연구기관, 병원 및 산업체 사이에 네트워크나 컨소시엄을 구성하여 진행되는 추세이다. 대표적 예로 미국 NCI의 Early Detection Research Network(EDRN)이 있다. 특히 바이오마커의 발굴과 검증에 대한 공공부문 및 산업체간의 콘소시움 구성이 활발하다. 대표적으로 BC(Biomarkers Consortium), ADNI(Alzheimer’s Disease Neuroimaging Initiative), HRP(High-Risk Plaque) Initiative, OBQI(Oncology Biomarker Qualification Initiative) 등이 있다.
[표 4-2-4-6] 주요국 연구개발 투자동향
|
국가 |
구 분 |
연구개발 투자내용 |
|
미 국 |
NCI (National Cancer Institute) |
EDRN('04-'15): $26M('10) Cancer Genome Atlas: $90M('09-'14) Clinical Proteomics Tech for Cance('06-'11): $22M('10) |
|
NHLBI |
3단계 Clinical Protoemics 프로그램: $80M('10-'15) |
|
|
NHGRI(National Human Genome Research Institute) |
Post-GWAS Studies: $96M('09-'13) |
|
|
TGen/Biodesign Institute of Arizona University |
Virginia G. Piper Center for Personalized Diagnostics, $45M 주로 Proteomics 쪽 |
|
|
EU |
EU 7th Framework 프로그램 |
Plasma Biomarker Discovery Platform: €3M, '09 3년간 Pan-European Pathogenomics Initiative: €17M, '09 3년간 |
|
영국 Welcome Trust |
25개 질환관련 유전체 국제공동연구, $59.5M |
|
|
룩셈브르크 |
미국 TGEN에 폐암바이오마커 발굴 지원, €13M, 3년간 바이오뱅킹 등 맞춤의학을 위한 TGEN과 협력사업 총 €140M, '08 5년간 |
|
|
네델란드 |
Translational Molecular Medicine '09, €100M 지원 (지노믹스, 프로테오믹스, 메타볼로믹스, 인포메틱스 등) |
|
|
덴마크 Novo Nordisk 재단 |
질환 단백질 연구를 위한 센터(Novo Nordisk Foundation Center) 코펜하겐대학에 설립 ('07): $111M |
(3) 바이오마커의 시장 규모
바이오마커를 포함하는 가장 큰 시장은 In Vitro Diagnostics(IVD)시장이며, 특히 최근에 개발된 바이오마커들을 분자진단(Molecular Diagnostics)시장과 밀접한 관련이 있다. 세계 IVD 시장은 2007년도 39B 달러에서 2012년도 50B 달러로 성장할 것으로 예상되며, 그 중 분자진단 부문은 2007년도 2.7B 달러에서 2012년도 5.1B 달러로 성장할 것으로 예상된다.60)
현재 감염증 분자진단 시장이 가장 큰 부분이지만 암, 맞춤의학, 유전병, 그리고 발병위험도 예측 분야에서 분자진단시장이 급속히 성장하고 있다. 한편, 종양 분자진단시장은 2008년 전체 분자진단시장의 18%에 해당하는 0.685B 달러이다. 종양분자진단 시장의 미국시장(0.361B 달러)의 비중은 50%가 넘으며, 연 평균 30% 이상 성장하여 2014년에 1.83B 달러에 달할 것으로 예측하고 있다.61)
바이오마커 시장(분자진단 시장의 대부분을 포함)은 2007년 5.5B 달러에서 2012년 12.4B 달러로 크게(연 평균 성장률: 17.6%) 성장할 것으로 예측된다.62) 이는 2012년 108.8B 달러로 예상되는 바이오 전체시장(연평균 성장률 11-11.5%)의 11.8% 차지하는 것이다. 2007년 분야별 시장점유율은 암, 심혈관 질환 및 감염 진단 바이오마커가 30% 내외씩 차지하며, 응용분야별로 보면 Discovery 시장이 약 50%를 차지하며, 분자진단 시장이 38%, 임상시험 시장이 12% 정도이다.63)
[그림 4-2-4-1] 질환 분야별 바이오마커 시장 현황 및 전망

다. 국내동향
(1) 연구개발 투자 현황
바이오마커에 대한 국내 투자 규모는 미국에 비하여 매우 작다. 다음 연구개발 사업 중 일부 과제가 바이오마커와 관련이 있다.
[표 4-2-4-7] 정부 지원 프로테오믹스 연구 현황
|
부처명 |
사 업 명 |
수행 기간 |
2009년 연구비 |
비고 (주관 기관 등) |
|
교과부 |
인간유전체기능연구 |
1999~ 2010 |
80억 |
한국생명공학연구원 |
|
교과부 |
인간질병의 후성유전학연구사업 |
2007~ 2012 |
10억 |
연세대학교 |
|
교과부 |
동북아민족기능성게놈연구사업 |
2003~ 2007 |
7.5억('07) |
서울대학교 |
|
교과부 |
한국인 Haplotype 정보 개발 |
2003~ 2007 |
17억('07) |
울산의대/서울아산병원 |
|
교과부 |
프로테오믹스이용기술개발사업 (21세기프론티어사업) |
2002~ 2012 |
79억 |
한국과학기술 연구원 |
|
복지부 |
유전체실용화사업(질병관리본부) |
2002~ |
53억 |
국립보건연구원 |
|
복지부 |
보건의료연구개발사업 (질환군별유전체연구센타 사업 등) |
2003~ 2010 |
140억 |
서울대병원 등 다수 |
|
교과부 |
질량분석의료기술융합연구단 (신기술융합형성장동력사업) |
2009~ 2014 |
37억 |
한국기초과학지원연구원 |
(2) 관련 산업 현황
민간 부문의 투자 및 시장 규모도 선진국에 비하여 크게 못 미치고 있다. 2006년 국내 총 진단시약 관련 국내 총 매출은 약 1천억 원 정도이며, 이 중 Glucose sensor가 약 300억 원(인포피아 200억 원, 아이센스 120억 원), 래피드 전문업체 에스디가 182억 원, Urine 검사 전문업체 영동제약이 70억 원 정도이다.64)
라. 발전과제
바이오마커는 맞춤의학의 주요한 요소로서, 앞으로는 pathway에 기반을 둔 여러 유전자 또는 단백질 세트의 바이오마커 개발이 전망된다. 또한 Unmet needs가 있는 곳에 바이오마커 개발이 활발할 전망인데, 예를 들어 우울증 분야에서는 질환의 요소들(affective, cognitive, and behavioral components)을 구분하고 진단하는 바이오마커의 개발은 환자의 subtype을 분류하고 그에 맞는 치료제 개발에 선행되어야 할 것이다. 바이오마커 분야에서 도전적 과제로는 정부의 규제(인허가), 대량 임상검증, 치료비 환불(Reimbursement), 의사 및 환자들을 상대로 분자진단에 대한 교육, 그리고 바이오마커에 대한 과학적 지식 확보가 미흡하다는 것이다. 특히 환불 여부는 분자진단제 시장전략에 결정적 역할을 할 것이다.

바이오 융합 분야
1. BT + IT
가. 개요
생명정보학(Bioinformatics)은 생물학 실험자료를 이용하여, 생명현상을 정보처리학적인 현상으로 보고, 전산, 수학, 통계, 화학, 물리학 분야의 방법론과 도구를 사용하여 생명현상을 모사하여, 생명현상의 궁극적 이해와 활용을 추구하는 과학학문이다. 2003년에 13년간의 연구가 종결된 인간유전체프로젝트나 2006년 공식 발족된 개인유전체프로젝트(Personal Genome Project), 2008년 최초의 한국인 게놈분석과 2009년 2번째 한국인 게놈분석 등의 초대형 생명공학 프로젝트는 생명정보학이 없이는 불가능하다. 현재 생물분야에서 비용대비 가장 높은 효용을 내는 분야가 생명정보학이다. 블라스트(Blast) 검색을 통한 상동성 비교는 필수적인 과정이 되어가고 있으며, 천 달러($1000) 유전체로 대표되는 대중화된 개인유전체학에도, 맵핑 프로그램(Mapping)이라는 생명정보학 서열정렬 알고리듬이 필수적이다.
생명정보학의 주 업무는 생물학적 데이터들의 패턴이나 연관관계를 규명하는 것이며, 생물학적 정보의 수집, 처리, 저장, 배포, 분석, 해석, 가시화 등의 모든 분야를 포함하는 종합 혹은 융합업무다. 생명정보학은 생물학과 정보학의 융합으로 IT 기술을 사람의 모든 유전자를 통칭하는 유전체학이나, RNA의 발현을 총체적으로 분석하는 전사체학(transcriptomics), 단백질의 총량을 분석하려는 단백질체학(proteomics), 단백질들 간의 상호작용을 해석하는 상호작용체학(interactomics)과 같은 작업처리량이 많은 대량발굴(high-throughput) 생물학 연구에 대한 실제적 이용에 초점이 맞추어져 있다. 점차 자료유도(data-driven) 생물학이 원리유도 생물학으로 바뀌어 감에 따라 생명정보학은 수학, 물리, 화학, 통계학 등을 포함하는 기반 학문으로 발전하고 있으며, 생물학에서의 대뇌기능 역할을 수행하게 될 것이다.
생명정보학의 가장 큰 효과를 보는 생물학 분야는 오믹스(체학)으로 표현되는 분야들로서, 생물학의 연구방법 패러다임을 바꾸는 과정이 일어나고 있다. 이것은 시스템생물학, 합성생물학(synthetic biology)등과 함께 미래 생물학의 주축이다.
최근에 급속히 발전하고 있는 차세대 및 제 3세대 유전체 해독기기들은 단 한번에 3Giga 이상의 염기를 해독할 수 있다. 이것은 게놈혁명의 시작을 알리는 것이다. 영국의 생어센터는 현재 폭발적으로 생산되는 정보의 처리를 위해, 대용량 슈퍼컴퓨터의 이용과 클라우드와 같은 그리드 기반의 전산장치를 고려중이며, 구글, 마이크로 소프트, IBM도 차세대 해독기와 제3세대 정보 해독기술과 분석에 참여하고 있다. 이 모든 기업과 연구소의 공통 문제는 생명정보학적으로 생산된 정보를 어떻게 최대한 깊이 분석하는가 하는 것이다. 생명정보학이 산업화 수준의 대형 문제에 직면함을 의미하기도 한다.
나. 생명정보학의 역사와 배경
생명정보학은 1850년대의 다윈의 진화론과 멘델의 유전법칙의 이론적 기반에서 시작된 연구이며, 이를 생명정보학의 실질적 시작점으로 볼 수 있다. 1950년대의 DNA 구조 모델링을 통해 이중나선구조가 제안되었고, 1960년대의 단백질 구조해석을 위한 많은 수동/자동 전산처리작업과 알고리즘 개발이 실질적인 토대를 나았다. 1970년대 이르러서 영국 케임브리지의 생어(Sanger)박사의 단백질과 DNA 서열해석 기술을 이용하여, 본격적으로 생물서열, 분자구조, 그들 사이의 상동성 검색기술들이 개발되었으며, 1980년대에는 생명정보학자들이 단백질 구조의 접힘 문제에 크게 기여했다. 현재 사용되고 있는 많은 통계학적, 수학적 알고리즘들은 이때에 개발되었다. 1970년에 니들만 원취(Needleman and Wunsch)의 다이내믹프로그래밍을 이용한 전산 서열 정열 알고리즘은 전산적 생명정보학의 중요한 계기가 되었다.
그 뒤, 1990년 초의 팀 버너즈리라는 유럽의 CERN 연구소에서 개발된 HTTPD라는 컴퓨터프로그램과 HTML이라는 양식이 보편화되면서, 많은 생명정보학자들이 인터넷을 통해 정보를 유통하고 그에 필요한 기반 기술을 만들어 내면서 생명정보학은 인터넷을 타고 전 세계로 번진다. 학계에 있어서 생명정보학자들은 인터넷의 발전에 가장 많은 기여를 했고, 지금도 인터넷의 중요한 문제들 중에는 생명정보 분야에서 도출된 것이 많다. 영국 케임브리지대학 생어박사의 바이러스와 미토콘드리아 게놈프로젝트가 1990년대의 인간게놈프로젝트로 결실을 맺고, 그동안 축적된 많은 생명정보학적 기술들이 2000년대에 와서 폭발적인 성장을 하게 된다. 생명정보학은 대량의 실험 데이터를 DB화하고 이를 이용해 개개의 유전자, 단백질의 기능과 용도 분석 등에 주력하였다. 염기서열결정(sequencing) 등에서 생산되는 유전자 서열정보 등 방대한 양의 새로운 생물학 데이터들을 저장하고 관리하기 위한 생어센터의 ACEDB와 같은 유전체 데이터베이스의 개발이 최초로 이루어졌다.
서열간의 유사성을 분석하기 위한 FASTA와 BLAST 등의 프로그램이 미국의 니들만 분취의 기술에 더하여 알출, 피어슨, 립맨 등에 의해 개발되었고, 현재에는 산타크루즈 대학의 데이비드 하우슬러 그룹과 케임브리지의 MRC에서 응용된 생명정보학용 Hidden Markov Model(HMM) 및 SVM과 같은 고급 통계학적 알고리즘도 사용한다. 1988년 데이비드 립맨을 소장으로 한 미국의 NCBI (국가생명공학정보센터)는 다양한 DB 및 알고리즘을 무료로 배포하여, 세계적으로 생명정보학이 큰 발전을 하는데 기여하였고, 생명정보학 역사상 가장 중요한 사회적 업적을 이루었다. 한국도 국가유전체정보센터와 국가생물자원정보관리센터의 지정으로 한 차원 높은 생명정보학 인프라 구축의 계기를 마련하고 최초의 한국인 게놈 분석(2009년 5월 Genome Research 발표) 및 범아시아 다형성 프로젝트(PASNP, 2009년 12월 Science지 발표)에 정보분석에 결정적 기여를 하게 되었다.
[그림 4-3-1-1] 생명정보학의 융합 분야
분자생물학에서 발생하는 자료는 핵심 구성물인 유전자와 단백질에 대한 구조, 발현, 변이, 기능과 상호 작용에 대한 것이다. 생명정보학은 이런 자료에 대하여 데이터베이스를 구축하고 이를 알고리즘에 적용하여 해석하기 위한 도구를 포함한다.
|
Biology Genes Proteins |
Tools & Assays |
Interpretation |
|
Genome sequences Protein structure
|
DNA sequences
Protein sequences Mass Spectrometry X-ray crystallography NMR |
Sequence assembly Hidden Markov model Sequence Homology Genome structure Repeat sequences Protein modeling Structure homology Structure predictions |
|
Genetic variation
Protein variation
|
Genotyping Mutation detection Alternative splicing Post translational modification SNP chips Phase display Protein modification |
SNP association studies CNV association
Protein comparisons
|
|
Gene expression Protein expression
|
EST Microarrays
2-D gels Protein chips Mass Spec Chromatography |
Gene clustering Image comparisons Mass Spec-Protein ID
|
|
Gene function
Protein function
|
Gene knock-ins, knock-outs, knock-downs Monoclonal antibodies Protein-protein interactions |
Gene ontology Comparative genomics Functional annotation Functional prediction
Functional annotation Functional prediction
|
|
Genetic networks Systems biology |
Computational integration Gene regulation network
Protein-Protein Interaction
|
Pathway reconstruction Pathway modeling
Biological models Simulations Comparative Interactomics |
|
Synthetic Biology
|
Genetically engineered machines
|
Construction of artificial biological objects |
다. 국외 동향
(1) 주요 연구기관
매우 많은 연구 기관이 존재하며 다음은 그 중 가장 대표적인 기관들이다.
■ 국가생명공학정보센터(NCBI, www.ncbi.nih.gov)
미국 NIH의 생명정보학 부서로 컴퓨터를 활용하여 생물학 및 의학 분야의 방대한 데이터를 분석하기 위한 DB를 구축하고 분석도구를 개발하는 것이 주요 임무이다. 가장 널리 쓰이는 분석 도구인 BLAST 서열 검색용 프로그램 등을 개발하였다. 이는 미국에서 생명정보학의 중앙통합의 중추이며, 세계에서 가장 강력한 생명정보기관이다. 생물학적으로 중요한 분자의 구조와 기능을 분석하기 위한 컴퓨터 정보처리기술연구, 수학적, 전산학적 방법을 사용한 생물학 및 의학적 문제의 분자 수준에서의 연구, 분자생물학, 생화학, 유전학에 대한 지식을 저장, 분석하기 위한 자동화 시스템 개발, DB와 S/W 개발, 생명공학 기술정보수집, 연구소, 학회, 산업체, 정부 기관 등과의 협력, 과학적 정보교환 강화, 전산생물학의 기초 및 응용 연구 훈련 지원, 다양한 DB와 S/W의 사용지원, 데이터 축적 및 교환, 생물학적 명명법의 표준 개발 등의 활동을 하고 있다. NCBI에서 개발되는 모든 데이터와 알고리즘은 무료로 소스코드와 함께 배포된다. NCBI는 연구소와 같이 협력하는 기업을 통해서 효율적으로 프로그램개발을 진행하는 방식을 취하고 있다.
NCBI의 현재 인원은 약 600명으로 알려져 있고, 2006년 예산은 3,150억 원이다. NCBI는 근거법(Public Law 100-607)을 가진 영속적 정보센터이다. 예산은 100% 정부지원(기관운영비)이다.
[표 4-3-1-2] 주요 국가별 생명정보센터 현황
|
순위 |
국가 |
기관명 |
주요 연구내용 |
|
1 |
미국 |
NCBI (www.ncbi.nlm.nih.gov) |
• 인간, 동식물, 미생물을 총 망라한 각종 생명정보 연구 및 서비스 제공 - 핵산서열: GenBank, dbEST, dbGSS, UniGene 등 데이터베이스 구축 및 서비스 - 단백질서열 : 분자적 진화과정에서 보존된 단백질 도메인을 나타내는 서열정령과 프로파일 데이터베이스(CDD) - 계통분류(Taxonomy 데이터베이스 제공), • 다양한 분석도구 제공 - 데이터검색(Entrez, Cubby, Citation Matcher 등) - 서열상동성 검색(Blast, PSI 등) - 핵산서열분석(e-PCR, Model Maker, ORF Finder) - 단백질서열분석(CD-Search, COGnitor, DART, TaxPlot 등) - 단백질 3차구조분석(Cn3D, VAST, Threading) |
|
2 |
영국 |
EBI (www.ebi.ac.uk) |
• 분자구조를 이용한 효소활성부위, 단백질-단백질 상호작용, 단백질-리간드 상호작용, 단백질-DNA 상호작용, 단백질 구조 및 모델링 연구 • 염색체 서열의 주석, 단백질 기능분류, 단백질 서열 모티프 발견, 데이터 마이닝, 분자생물학 온톨로지, 대상경로, 계통 생생학, 분자생물학 데이터베이스에서의 지식표현방법, 서열과 전사 패턴 연구 및 서비스 • 진화 연구를 위한 DNA와 아미노산 서열분석 방법 개발 • 마이크로어레이 기술을 이용한 유전자발현분석 및 서비스 • 모든 일차적인 단백질 서열과 핵산 서열 데이터베이스들의 종합 • EBI를 운용하는데 필요한 e-Science와 Grid 기술을 연구 |
|
3 |
미국 |
TIGR (www.tigr.org) |
• 진핵생물 연구와 데이터베이스 구축 및 서비스 • 벼 데이터베이스 구축 및 annotation 정보 제공 • 감자 EST와 전사체 데이터를 종합하여 감자 유전자 데이터베이스 구축 및 annotation 정보 제공 • TIGR와 기타 연구기관에서 수행한 기생충 유전체 프로젝트로부터 생산된 데이터 제공 • 전 세계적으로 공개된 모든 EST 데이터에 대한 클러스터링 분석 |
|
4 |
영국 |
Sanger Institute (www.sanger.ac.uk) |
• 인간유전체서열해독프로젝트 수행 • 유전체 서열정보의 유전자 지도제작, annotation 서비스 • 질병과 관련된 돌연변이연구 • 마이크로어레이 등을 이용한 대규모 유전자 분석연구 |
|
5 |
일본 |
DDBJ (www.cib.nig.ac.jp) |
• DNA 서열, 단백질 변이 데이터베이스 • 인간 유전체지도 및 콘티그 서열 • 여러 생물종의 유전체 데이터 검색 시스템 • 단백질 구조 및 기능 예측결과 검색 데이터베이스 구축 • SRS 통합데이터베이스 검색 시스템 운영 • Taxonomy, PDB 데이터베이스 검색 프로그램 • 단백질 2,3차 구조 예측 |
|
6 |
이스 라엘 |
와이즈만연구소 (www.weizmann.ac.il) |
• 인간 유전체 통합지도(연관지도, 물리지도, hybrid지도 통합) • GeneCards 구축(인간유전자 데이터베이스 종합 정보) • GeneCards 와 UniGene 데이터베이스 연결 • 세포막단백질 구조 예측 • 단백질 소수성/친수성 영역 분석 |
|
7 |
독일 |
MIPS (www.mips.gsf.de) |
• 진균 유전체 주석 및 데이터베이스 구축 • 식물 유전체연구를 위한 생물정보학 자원개발 • 식물 EST의 통합 분석 도구 개발 • 유럽 식물 유전체 데이터베이스 네트워크 개발 • 생물학 데이터 통합검색 시스템 구축 |
|
8 |
스 위 스 |
EXPASY (http://www.expasy.org) |
• 2-D page와 같은 구조와 단백질 서열의 분석 • Swiss-Prot와 TrEMBL- 단백질 순서 데이터베이스 구축 • PROSITE- 단백질 패밀리 데이터베이스 구축 • ENZYME- 효소 명명법 데이터베이스 구축 |
|
9 |
남아프리카공화국 |
SANBI (http://www.sanbi.ac.za) |
• 인간 질환관련 유전자 발현 분석 프로젝트 • 병원균내 발현유전자 분석 • 질환유전자 탐지 • 국제 생물정보학 네트워크 프로젝트 |
|
10 |
일본 |
GenomeNet (www.genome.jp) |
• 그래프 비교 및 특성탐지 알고리즘, 유전체 서열분석, 유전자 발현 프로파일 분석 • 단백질-단백질 상호작용, 단백질-ligand 상호작용, 세포막 단백질 예측 |
|
11 |
중국 |
북경대 생물정보학 센터 (www.cbi.pku.edu.cn) |
• 핵산, 단백질 서열 분석 • 인간유전체 데이터베이스 구축 |
|
12 |
중국 |
상하이 생명정보 기술센터 |
• 단백질 상호작용 분석 • 대사회로 모사 패키지 • 인간유전체 데이터베이스 구축 |
|
13 |
네덜란드 |
네덜란드 생명정보센터 |
• 네덜란드 전국의 생명정보학 네트워크 및 연구비지원 |
출처: 한국생명공학연구원 국가유생물자원정보관리센터
■ EBI(www.ebi.ac.uk)
유럽의 대표적인 생명정보 연구기관으로 생명정보학 분야의 순수 및 응용연구, 생물학 DB 구축, 관리, 제공, 데이터의 저장 및 개발 지원, 생명공학, 화학, 제약 기업 등의 산업체 지원활동을 하고 있으며 자동화된 동시분석 등의 도구 또한 제공하고 있다. 미국의 NCBI에 대항하기 위해서 정치적으로 EU에서 설립한 기관이며, EMBL의 한 부설기관으로 되어 있다. 영국 케임브리지에 있으며 세계에서 가장 강력한 생명정보연구기관 중의 하나로 미국의 NCBI와 계속해서 경쟁할 기관이다. 2001년 생명정보학 전문가인 Janet Thornton박사가 과거의 비전문가 출신의 장과 교체되면서 연구개발, 운영 면에서 비약적인 발전을 하고 있다. 연구비지원과 수주가 확대되고 있고 유럽의 생명정보학센터로서의 위상이 확고해지고 있으며, 실용적인 연구개발 이용 건수가 확대되고 있다. 현재의 기술수준을 보면 과거 미국이 NCBI를 설립하기 전의 유럽의 생명정보학 강국의 달성이 5년 내에 이루어질 수도 있을 것으로 기대된다. 2007년 여름, 새로운 건물이 기존 건물 옆에 신설되어 규모가 확장되고 있다. 인원은 약 300명이고, 예산은 300억 원 정도이다.
■ DDBJ(www.ddbj.nig.ac.jp)
미국의 NCBI와 유럽의 EBI에 상응하는 일본의 생명정보학 전문기관이다. 많은 양의 생명정보 미러링(mirroring)을 하고 있으며, 자체적인 DB구축과 함께 연구도 매우 활발하다. 그러나 DDBJ는 지난 수년간 IT를 활용한 연구개발에서 부진을 면치 못했다. 최근에 한국의 국가생물자원정보관리센터와 같은 체제로 바뀌고 있으며 인적 쇄신을 단행했다. 가장 큰 변화는 DDBJ의 기본 성격을 데이터의 등록에서 탈피하여 연구분석과 능동적 자동화시스템을 갖춘다는 것이다. 인원은 61명이고 예산은 약 190억 원 정도이다.
■ SIB(Swiss institute of bioinformatics)
EBI 이전부터 존재한 유럽의 중요한 생물정보 연구 서비스 기관이다. 종합적인 단백질 분석 서버인 ExPASy(expert protein analysis system)을 운영하고 있으며, Swiss- prot, TrEMBL, Swiss-2D Page 등의 DB를 제공한다.
[그림 4-3-1-2] EBI 전경(영국 케임브리지 소재)

(2) 연구 분야별 대표적인 웹 사이트
현재 약 1,000여 가지의 큰 생물학 분야의 DB가 존재하며 대부분 웹을 통해 사용할 수 있다. 각 웹 사이트는 DB를 제공하거나 DB를 검색해 분석할 수 있는 웹 인터페이스를 제공한다. 또 널리 사용되고 있는 공개 DB나 해석용 프로그램을 구할 수 있다. 제공되는 정보의 활용도를 높이기 위하여 웹 인터페이스뿐 아니라 프로그램 적으로 접근할 수 있는 방법과 XML형식 등으로 정보를 제공하는 곳이 증가하고 있다. 여러 분야에 걸쳐 포괄적이고 종합적인 정보를 제공하고 특정한 분야에 특화되어 있는 사이트도 많다. 특히 유전체학(Genomics)분야에 대한 많은 DB와 해석용 프로그램이 존재하며 이는 웹을 이용하여 쉽게 구할 수 있다. (표 4-3-1-3)는 각 분야에 대하여 포괄적인 정보를 얻을 수 있는 대표적인 웹 사이트이다.
|
분야 |
DB 이름 |
URL |
|
Biomedical Literature |
PubMed |
http://www.nlm.nih.gov/ |
|
Nucleotide |
Genbank |
http://www.ncbi.nih.gov/ |
|
DDBJ |
http://www.ddbj.nig.ac.jp http://www.ddbj.nig.ac.jp |
|
|
EMBL |
http://www.ebi.ac.uk/ |
|
|
MGDB |
|
|
|
GSX |
|
|
|
NDB |
|
|
|
Protein sequence |
Swiss-prot |
http://www.expasy.ch/sprot/sprot-top.html |
|
TrEMBL |
http://www.expasy.ch/srs7 |
|
|
PIR |
http://www-nbrf.georgetown.edu |
|
|
3D structure |
PDB |
http://www.rcsb.org |
|
MMDB |
|
|
|
Enzyme and compounds |
Ligand |
http://www.expasy.ch/sprot/enzyme.html |
|
Protein functional sites |
PROSITE |
http://www.expasy.ch/prosite |
|
BLOCKS |
http://www.blocks.fhcrc.org |
|
|
PRINTS |
http://www.bioinf.man.ac.uk/dbbrowser/PRINTS/ |
|
|
ProDom |
http://prodes.toulouse.inra.fr/prodom/doc/prodom.html |
|
|
Pfam |
http://pfam.wustl.edu |
|
|
SMART |
http://smart.embl-heidelberg.de |
|
|
TIGRFAMs |
http://www.tigr.org/TIGRFAMs |
|
|
Protein 3D folds |
SCOP |
http://scop.mrc-lmb.cam.ac.uk/scop |
|
CATH |
http://www.biochem.ucl.ac.uk/bsm/cath_new |
|
|
Transcription factor |
TRANSFAC |
http://transfac.gbf.de/TRANSFAC |
|
Protein interactions |
PSIMAP |
http://psimap.org/ |
|
BIND |
http://www.bind.ca |
|
|
DIP |
http://dip.doe-mbi.ucla.edu |
|
|
Protein pathways |
KEGG |
http://www.genome.ad.jp/kegg |
|
EcoCyc |
http://www.ecocyc.org |
|
|
WIT |
http://wit.mcs.anl.gov/WIT2 |
|
|
Metabolic pathway DB |
PathDB |
|
|
Ortholog groups |
COG |
http://www.ncbi.nlm.nih.gov/COG |
|
Microarray |
SWISS-2DPAGE |
http://www.expasy.ch/ch2d/ch2d-top.html |
|
Gene expression |
|
|
|
Controlled vocabulary |
GO |
http://www.geneontology.org |
출처: 한국생명공학연구원 국가유생물자원정보관리센터
[표 4-3-1-4] 국가별 생명정보 기관 보유수
|
순위 |
국가 |
2006년 보유현황 |
2016년도 예상 |
|
1 |
미국 |
312 |
809 |
|
- |
국제컨소시엄 |
114 |
296 |
|
2 |
영국 |
69 |
179 |
|
3 |
독일 |
57 |
148 |
|
4 |
일본 |
42 |
109 |
|
5 |
유럽컨소시엄 |
29 |
75 |
|
6 |
브라질 |
25 |
65 |
|
7 |
중국 |
22 |
57 |
|
8 |
프랑스 |
19 |
49 |
|
9 |
호주 |
14 |
36 |
|
10 |
한국 |
10 |
100 |
|
11 |
캐나다 |
9 |
23 |
출처: GOLD: Genomes OnLine Database Homepage, 2006.11
(전 세계 생명정보센터에 대한 데이터베이스인 GOLD를 바탕으로 국내 센터들을 조사한 결과 2006년 현재 총 10개의 거점이 있으며, 향후 10년 뒤 10배 성장을 이룬다면 100개의 거점을 확보하여 세계 5위에 도달할 것으로 예상됨. 다른 나라들의 성장률은 10%로 산정함.)
(3) 업계동향
대표적인 업체로는 구글의 23andme.com, Accelrys Inc, Structural Bioinformatics Inc, Compugen, App-lied Biosystems, Incyte Genomics, Lion Bioscience, Gene Logic, IBM Life Sciences, Affymetrix, Amersham Biosciences, Silicon Genetics, 3rd Millennium 등을 들 수 있다. 한국에서는 테라젠(Theragen)이 가장 큰 회사이며 유전체학과 생명정보학 전문 코스닥 상장회사이다. 그 외에 Insilicogen, ISTECH (www.istech21.com), 오믹시스(한국생명공학연구원 내 벤처건물 내), OITEK(www. oitek.com)과 Smallsoft(www. small-soft. co.kr) 등의 순수 정보회사가 있으며, 마크로젠(Macrogen)과 같이 서열해독 위주의 실험에 부수적으로 생명정보학을 하는 회사가 있다.
2006년부터 세계적으로 생명정보 포탈 비즈니스가 등장하기 시작하였다. 구글(Google)등과 연계하여 많은 인터넷 접속자가 생명공학 회사들의 광고를 클릭하게 만들어서 현금을 마련하는 형태가 생겼다. 예를 들면, http://biodirectory.net/, http://bioinformatics.net/, http://argosbiotech.de/, http://canbiotech.com, http://bioportfolio.com 등이 있다. 이중에서 가장 큰 영향력을 행사하는 사이트는 http://bioinformatics.org로서 가장 폭넓은 활동을 하고 있다.
앞으로 신약이나 생명정보학의 핵심 알고리즘을 이용한 비즈니스가 성숙하는 2010년까지 생명정보를 활용하고 유통시키는 시장과 회사들이 성장하고, 정보 중개인 역할을 통한 현금 조달이 지속될 것으로 추정된다. 이들 회사들은 기존의 생명정보 공공기관과, 대학교수연구실 등과 경쟁 및 협력을 계속할 것으로 보인다. 그러나 생물학에서의 생명정보 도구와 DB사용이 점차 증가함에 따라, 손쉬운 상업적 이용을 원하는 소비자들이 늘어날 것으로 파악되며, 2010년 이후, 현재의 구글이나 야후와 같은 바이오정보 포탈 업체가 광고 등을 통한 사업을 활발히 할 것으로 예측된다. 특히 구글은 유전체 전문회사인 23andme.com에 초기 투자 후, 2009년 여름 주식 매입을 통해 최대주주가 되었다. 23andme는 생명정보 전문 회사로, SNP칩 기반의 유전자 정보 서비스를 한다.
한국에서의 생명정보학은 2000년대 초기의 지나친 기대감에서 비롯된 과잉투자와 전문가에게 제대로 투자되지 못하는 등의 문제로 인해 2004년과 2005년은 연구비와 그 성과가 매우 저조하였다. 그러나 2006년 이후 실수요와 실제적으로 활동하는 전문가의 수가 늘어남에 따라 점차 시장이 새로 형성되었으며, 2008년 이후부터는 상업화에 완전히 진입할 만한 요소들이 나왔다. 현재 유전체 정보기반의 테라젠 같은 대형 회사가 있다. 테라젠은 최초의 한국인 게놈 분석 기술을 기초로 한 회사로, 유전체기반 맞춤의학을 최종목표로 하고 있으며, 그 핵심 축의 하나를 생명정보학에 두고 있다.
생명정보학 업체가 제공하는 서비스로는 다음과 같은 분야가 있다.
■생명정보 S/W : 생명정보 데이터의 시각화와 번역, 분석에 관한 S/W 패키지 제작 및 판매
■생명정보 서비스 : 생명정보 데이터베이스를 구축, 관리하면서 전 세계의 관련 기업이나 연구자들에게 연구개발 관련 정보 제공
■생명정보 인프라 제공 : 초고속의 데이터 처리와 데이터베이스 운영에 필요한 IT 시스템을 구축, 서버, 스토리지 등 생명정보 인프라 제공. 특히 초고속 대용량 개인유전체 분석 서비스 제공에 큰 시장이 형성될 것으로 전망
■생명정보학 교육 : 국가생물자원정보관리센터(KOBIC)와 같은 전문 생명정보학 연구기관이 지속적으로 교육을 진행해오고 있고, 개인수준과 학교에서의 교육이 지속적으로 늘어남
*참고로 2008년부터는 과학기술 연합대학에서 “생명정보학과”가 신설되어 일선에서의 생명정보학 연구원의 기업으로의 조달이 가능해질 것으로 파악된다.
기존에는 각 업체들이 대부분 한 분야에 특화되어 있었다. 현재는 유전체학 이외에 게놈서열해독서비스, 마이크로어레이, 단백질체학이나 상호작용체학 등 다른 분야에 대한 도구나 솔루션 개발 등으로 확대하고 있다. Merck & Co-Rosetta Inphar-ma-tics, Lion Bioscience-Trega Biosciences MedImmune-Aviron, Lion Bio-Scinece-Paradigm Genetics, Merck-Celera Genomics 간의 전략적 제휴나 M&A를 통한 연구 개발과정에의 직접 참여가 증가하고 있다. 또, 거대 IT 업체인 IBM, Sun Microsystems, HP, Oracle, Hitachi 등의 업체가 생명과학분야에 진출하여 IT 인프라 이외에도 tool, solution의 개발에 많이 투자하고 있다.
계속 진행되고 있는 초대용량 염기서열분석, 생성되는 데이터의 증가, 마이크로어레이 분석, 단백질체학, 약물유전체학(pharmacogenomics)의 연구 등은 생명정보학의 활용을 필요로 하며 이는 생명정보학 시장에 새로운 기회를 제공한다. 보다 광범위한 자체제품과 역량을 지닌 회사가 생존할 것이며 차후 개인유전체학의 발전과 더불어 급격한 성장을 하게 될 것이다.
(4) 최근의 연구 방향
(가) 연구 분야의 변경
많은 대학, 연구소, 회사들은 유전체학의 다음 단계인 오믹스(http://omics.org, 체학), 시스템생물학, 합성생물학 등으로 빠르게 연구개발의 초점을 바꾸고 있으며 이 분야에 대한 생명정보학 연구가 진행되고 있다. 앞으로 생물학 전체가 오믹스의 각종 옴(ome)으로 재편되는 날이 올 것이다.
① 개인 유전체시대(Personal genomics)
미국은 1990년 말부터 1,000달러 유전체 관련 연구를 진행해 오다가 2000년대 중반에 실질적인 기술과 연구비를 가지게 된다. 2010년경 모든 개인들의 유전체를 약 100만 원에 해석하고 그에 맞는 개인유전체학과 개인 맞춤의학 프로젝트를 진행하고 있다. 선두그룹으로는 하버드의 George Church이다. 이에 따라 생명정보학의 중요한 분야로 다시 유전체 서열분석이 대두되고, 점차 대량의 정보를 빨리 처리하는데 초점이 맞춰질 것이다. (표 4-3-1-5)는 2005년까지, Genbank의 서열등록건수를 국가별로 표시한 것이다. 미국은 개인유전체기술이 실용화되는 2010년부터, 현재의 52%에서 거의 대부분을 차지하는 수준으로 그 격차가 벌어질 것으로 전망된다. 현재는 단일 분자를 읽어 해독을 하는 제 3세대 서열 해독기기의 개발이 본격화된 상태이다.
[표 4-3-1-5] 국가별 서열데이터베이스(GenBank) 서열등록건수 2005년
|
순위 |
국가 |
2005년도 등록건수 |
점유도(%) |
2016년도 예상 등록건수 |
예상 점유도(%) |
|
1 |
미국 |
5,767,527 |
53.1 |
16,455,428 |
52.4 |
|
2 |
일본 |
2,931,670 |
27.0 |
8,364,397 |
26.6 |
|
3 |
영국 |
641,045 |
5.9 |
1,828,976 |
5.8 |
|
4 |
캐나다 |
426,896 |
3.9 |
1,217,984 |
3.9 |
|
5 |
중국 |
221,469 |
2.0 |
631,877 |
2.0 |
|
6 |
독일 |
207,178 |
1.9 |
591,103 |
1.9 |
|
7 |
브라질 |
106,751 |
1.0 |
304,573 |
1.0 |
|
8 |
프랑스 |
95,416 |
0.9 |
272,233 |
0.9 |
|
9 |
스웨덴 |
88,217 |
0.8 |
251,693 |
0.8 |
|
10 |
한국 |
61,097 |
0.6 |
600,000 |
1.9 |
|
11 |
스페인 |
39,009 |
0.4 |
111,297 |
0.4 |
출처: Distribution Of Submissions To NSDC(Individual)
*국제 서열 데이터베이스인 GenBank에 국내 서열등록 건수에 대한 2005년 조사 결과 61,07건으로 세계 10위에 이르고 있으며, 향후 10년 뒤 10배 성장을 이룬다면 600,000만건 등록으로 세계 5위에 도달할 것으로 예상됨. 다른 나라들의 성장률은 10%로 산정함
② 변이체학시대(Variomics)
개인유전체시대가 왔을 때, 실질적인 결과물은 각각의 개인이 서로 어떻게 다른가라는 질문에 대한 답들이다. 이것을 간단하게 변이체학이라고 말한다. 변이체학은 SNP 정보가 칩을 사용하여 대량으로 유통되면서 형성되었다. 돌연변이들의 차이는 개인 맞춤의학 분야에 기초 데이터이다.
(나) Data의 통합의 필요성
유전체학은 주로 방대한 양의 염기서열 자료(sequencing data)들을 데이터베이스화해 정리하고 분석하기 위한 정보학으로, 다루는 데이터가 비교적 간단하였다. 포스트 게노믹스에서는(그림 4-3-1-3)과 같이 매우 다양한 데이터를 다루어야 하며 이를 통합 운영하고, 여기에서 유용한 지식을 추출하는 것이 중요하다. 이를 위한 지식 관리와 통합 기술에 대한 관심이 증대되고 있다. 이러한 통합은 아래의 사항들을 포함하며, 과학적 연구에 집중할 수 있는 환경을 만들어 연구의 최적화를 이룰 수 있게 해 준다.
■광범위한 sources로부터의 데이터 접근
■데이터와 여러 종류의 응용 프로그램과 도구의 기능을 통합사용
■데이터를 안전하게 저장하고 이를 쉽게 관리
■지식 창출을 위한 협력
■새로운 응용분야의 통합
[그림 4-3-1-3] Data의 통합과 mining(Front Line)

출처: 국가생물자원정보관리센터
통합의 방법으로 여러 DB에 걸친 질의, hyperlink의 이용, 관절 통합, 자료 저장소 등의 방법이 사용되고 있으며 현재는 XML을 기반으로 하는 웹 서비스가 큰 관심을 받고 있다.
최근의 특이한 현상으로는, 한국의 코빅(KOBIC)이 가장 먼저 추진한 웹 2.0 형태의 바이오위키(Biowiki: biowiki.net)와 같은 사용자 참여형태의 데이터베이스 및 정보교환 포털들이 생겨나고 있다. 앞으로 생명정보는 사용자가 직접 참여하는 위키, 블로그(blog)등의 형태도 취하는 복합형으로 개발될 것으로 파악된다. 예를 들면, 세계에서 가장 많이 쓰이는 생명정보 분야 단백질 데이터베이스인 Pfam은 위키피디아와 연계하여 사용자들이 실시간으로 단백질 정보를 개선하는 서비스를 2007년부터 시작했다.
① 워크플로(Workflow engine)기반의 정보통합
2000년대 중반에 두드러지게 나타나기 시작한 생명정보 분야의 경향은 Taverna, Biomoby와 Bioworkbench 등으로 대표되는 다양한 생명정보 인프라의 체계적인 통합기술이다. 생명정보학의 실질적인 핵심기술은 대량화와 통합화에 있는데, Workflow engine은 이러한 문제를 가장 깨끗하게 처리하는 IT 분야 기술이다.
2000년대 말까지 이러한 통합 프레임들이 점차 기존의 산발적인 프로그램과 서버를 능가하기 시작하여, 2010년 이후에는 많은 생명정보서비스가 웹서비스(webservice) 표준을 따르는 워크플로엔진들에 의해 좌우될 것이다. 이러한 추세에 맞춰서 이미 상용화된 생명정보전문 워크플로가 출시되고 있다.
② 클라우드컴퓨팅을 이용한 생명정보학
2009년 삼성SDS와 같은 대형 IT기업이 클라우드(Cloud) 기반의 전산처리기술로 생명정보학에 진출을 공식화하였다. 테라젠과 같은 전문 유전체 생명정보학회사와 손을 잡고 2009년 현재 공동으로 8명의 개인유전체를 분석중이며, 이를 바탕으로 한 유전체정보서비스사업을 추진하고 있다. 이것은 초대용량 전산인프라를 활용한 생명정보학의 발전을 의미한다.
(다) 생명정보학의 분야들
생명정보학의 분야는 생물학의 모든 분야와 다른 학문 분야들에 걸쳐있다. 다음과 같은 매트릭스를 사용하면 시각적으로 한눈에 볼 수 있다. (그림 4-3-1-4)에서 알 수 있듯이 생명정보학은 각종 ‘Omics’(체학)으로 세분화되고 확장되고 있다(www.omics.org). 아래의 영역들에서 작용체, 기능체 및 문헌체는 생명현상의 규명과 활용에 가장 중점적인 체학들이다.
[그림 4-3-1-4] 각종 체학들의 집합으로서의 생명정보 매트릭스

출처: 한국생명공학연구원 국가생물자원정보관리센터
(라) 본체학(Ontology)과 표준화
생명정보를 효과적으로 공유하기 위해서는 사용하는 용어의 통일이 필요하다. 각 지식분야의 주된 개념을 담기 위해 고도로 선택된 용어의 집합을 본체학(Ontology)이라 하는데, 유전자 본체학 컨소시엄의 주도하에 유전체학 분야의 본체학이 만들어졌으며, 다른 분야에 대한 Ontology도 개발 중에 있다. Onto-logy의 공유를 통하여 생물학적 객체를 묘사할 수 있으나, 각각의 객체에 대한 이름을 부여할 수는 없다. 따라서 LSID(Life Science Identifier) 등 각 객체에 대해 유일한 이름을 부여하는 방법이 연구되고 있다.
새로운 적용분야를 개발하고 배포하는 것은 다른 프로그램과의 연동이나 장시간 이용을 위해 분야별 특성을 반영한 표준에 따라야 한다. 이에 의하여 빠르고 안전하게 자료를 교환할 수 있는데 같은 투자로 더 많을 일을 더 효과적으로 할 수 있어 결론적으로 더 좋은 결과를 얻을 수 있다. 현재 I3C, GO, MGED, PSI와 같은 Informatics 컨소시엄에서 표준화를 위한 노력을 기울이고 있다. 많은 변수가 존재하는 마이크로어레이 실험 데이터의 표준화가 이루어져 마이크로어레이 실험 관련 논문 발표시 MIAME 표준에 따르는 실험 데이터를 등록하게 되었다.
분산시스템인 서열 분야의 주석을 공유하기 위해 DAS(Distributed Anno-tation System)가 사용되고 있으며, 이를 다른 분야에 확대 적용하기 위해 BioMOBY나 MyGrid 등의 프로젝트가 수행되고 있다.
|
이름 |
분야 |
URL |
|
Gene Ontology 컨소시엄 |
gene annotation |
www.geneontology.org |
|
Microarray Gene Expression Data society |
마이크로어레이 |
www.mged.org |
|
Proteomics Standards Initiative |
단백질체학 |
www.psidev.sourceforge.net |
|
I3C |
|
www.i3c.org |
출처: 한국생명공학연구원 국가생물자원정보관리센터
라. 국내 동향
한국에서 생명정보학에 대한 관심은 2008년 최초의 한국인 게놈 분석을 필두로 급격히 증가하였다. 새로운 회사도 2개 설립이 되었고 코스닥 상장회사인 테라젠은 기존의 LCD장비를 다루는 제약회사에서 유전체 생명정보에 기반한 맞춤의료회사로 생명정보학을 본격적으로 추진하고 있다. 이것은 모두 실험기술의 획기적인 발전에 기인한다. 마크로젠사는 미국의 제3세대 서열해독기 회사인 Lightspeed Genomics의 최대 주주로서 대용량 서열 해독에 투자하고 있다.
그러나 이 분야가 이룬 급격한 발전에 비해 전문인 양성 수와 질은 낮다. 현재 숭실대를 비롯한 일부 학교에 생명정보학과가 있고 생명정보학 관련하여 2개의 학회가 있다(유전체학회와 생물정보시스템학회). 그러나 순수한 생명정보학회는 아직 존재하지 않는다. 2008년부터는 한국생명공학연구원의 국가생물자원정보관리센터에서 주관한 연합대학원의 생명정보학과가 신설되었다.
정통부의 IMT2000기금을 바탕으로 2001년 대규모의 연구과제가 시작되었다. 그러나 2007년 현재 연구투자에 비해 생산물과 파급효과가 미약하고, 생물학자들에게 실질적인 도움을 주는 서비스는 많지 않다. 한국생명공학연구원의 국가생물자원정보관리센터(코빅)가 생명정보 분야에서 가장 큰 센터이며 현재 40여 명의 인원이 활동하고 있다. 코빅의 일년 예산은 총 50억 원 정도이고 생명공학연구원의 기관 고유사업으로의 운영비로 지급되고 있다. 그 외에 국립보건원의 중앙유전체연구소에도 약 20명 정도의 생명정보 관련 분석 인원이 있다.
국내 생명정보학은 인프라 구축이나 관련 기업들의 역량 등 여러 면에서 선진기업과 국가에 비해 크게 뒤져 있으며 분석 기술, 투자 규모, 전문 인력 면에서도 선진기업에 비하여 매우 취약한 수준이다. 유전체 서열생산, SNP생산 등의 결과물을 생명정보학기법으로 고부가가치화 해야만 외국회사들과의 경쟁에 승산이 있다. 그러나 지원사업을 수행할 인력과 인프라는 없는 실정이다.
또한 연구결과의 통합과 관리가 제대로 이루어지지 않아 선진기업과 국가에 비해 각종 게놈, 유전자 데이터베이스 구축에 있어 뒤진 상황이라고 할 수 있다. 기업의 참여를 유도해 시장에서 경쟁하는 미국과 같은 환경이 만들어질 필요가 있다.
2005년과 2006년을 기점으로 생명정보학과 관련하여 외국에서 전문 훈련을 받은 젊은 교수나 연구원들이 조금씩 국내로 들어오는 상황이지만 이러한 인력들이 현재 적정한 연구비와 학생조달을 받지 못하고 있다. 이것은 2008년 한국인 개인유전체 시대가 시작된 시점에 심각한 인력부족 현상을 낳고 있다.
[표 4-3-1-7] 국내 주요 생명정보학 연구기관
|
기관명 |
주요역할 |
|
농진청(농림수산식품부) 농업생명공학정보센터 |
○ 농업생명공학정보 데이터베이스 구축 및 서비스 ○ 국내외 생명공학정보 교류 네트워크 구축 및 확대 ○ 하부기관 -농생물유전체정보센터: 농생물 유전체 종합정보, BLAST 분석 등 -농업유전자원정보센터: 식물(종자은행), 농용미생물(KACC) -바이오안전성정보센터: GMO 심사현황, 바이오안정성 정보 DB ○ 인원: 4명 이상 |
|
한국과학기술정보연구원 (공공기술연구회) |
○ 전산학적인 기술을 이용하여 생명현상연구를 위한 IT 기반의 생명 정보 인프라 구축 ○ 인원: 5명 이상 |
|
산림청(농림수산식품부) 산림생물정보연구실 |
○ 산림생물자원정보화 ○ 식물자원과 곤충자원에 대한 종 정보를 구축 ○ 식물 곤충의 표본정보 및 이미지 정보를 데이터베이스화 ○ 생물자원정보 공유를 위한 통합정보시스템 개발 및 운영 ○ 국가표준식물목록, 희귀식물, 귀화식물, 재배식물 등 각종생물자원정보에 관한 포털사이트 구축 ○ 인원: 11명 |
|
질병관리본부 (보건복지가족부) 유전체역학정보실 |
○ 유전체 역학조사 및 역학, 임상, 생명정보 등의 정보를 분석하는 기법개발 ○ 보건복지가족부 내 바이오과학정보팀(바이오보건의료정보, 바이오안전성정보 등을 수집, 관리, 제공) ○ 대규모 질병건강역학조사 ○ 대량의 한국인 질환지식 정보의 확보, 분석 및 표준화 기법 개발 ○ 유전자 발현 조절 연구 ○ 바이오과학정보 생산수집관리 ○ 인원: 20명 이상 |
|
국립암센터 (보건복지가족부, 7개 센터) |
○ 위암, 대장암, 유방암, 간암, 폐암, 자궁암, 특수 암센터 등 7개 센터로 구성 |
|
질병유전체연구센터 (보건복지가족부, 12개 센터) |
○ 질환별 유전체 연구(간 및 소화기, 근골격계, 뇌질환, 당뇨및 내분비, 면역질환, 생식 및 불임, 선천성기형, 심혈관계, 조혈계, 폐 및 호흡기, 폐암유방암, 피부질환 등 12개 질환 유전체 센터) ○ 인원: 약 600명 |
|
약물유전체사업단 (보건복지가족부) |
○ 약물유전체연구 |
|
임상연구센터 (보건복지가족부, 6개 센터) |
○ 6개 만성질환 치료지침 및 가이드 제공 |
|
국가생물자원정보관리센터 (과학기술부) |
○ 국내외 생명정보 수집, 보관, 처리, 분석 및 유통 기능 ○ 유전체정보, 생물다양성정보, 생물소재정보의 연계적 처리 ○ 국내 각 부처와 기관별 생명정보의 통합 ○ 국내 각 연구소의 생명정보 처리 분석 DB 및 알고리듬 서비스 제공 ○ 인원: 40명 이상 |
출처: 2006년 한국생물정보학백서
아래의 (표 4-3-1-8)은 현재 한국의 유전체 관련 연구센터의 현황을 보여준다. 대부분의 유전체 관련 연구기관이 적절한 생명정보인력을 확보하지 못하고 있으며, 이로 인해 정보의 전산화, 처리, 통합, 연계 등에 있어서 국가적으로 비효율적인 결과를 초래하고 있다.
국내 생명정보정책에는 특이한 점이 있는데, 그것은 한국이 세계에서 가장 먼저 생물자원, 생물다양성, 생명정보를 총체적으로 개발, 관리해야 한다는 개념을 가지고 이들 분야의 통합을 교육과학기술부가 주도적으로 추진했다는 점이다. 현재 미국에서 같은 필요성을 인식하고 EOL(Encyclopedia of Life) 등의 프로젝트를 시행해 3개의 큰 영역을 정보통합에 나서고 있다.
[표 4-3-1-8] 국내 유전체 관련 연구소 및 회사 현황
|
유전체연구센터명 |
운영기관 |
연구 대상 |
연구내용 |
주관 기관 |
설립 |
|
유전체연구단 |
생명연 |
모든생물 |
동/식/미생물의 유전체 |
생명연 |
2006 |
|
식물유전체연구센터 |
생명연 |
고추 |
유전체연구단과 사업협력 |
생명연 |
2006 |
|
의약유전체연구센터 |
생명연 |
사람 |
암과 관련된 유전자연구 |
생명연 |
2006 |
|
축산유전체연구과 |
축산연구소 |
돼지 |
돼지유전체연구 |
농진청 |
2004 |
|
환경재해 극복 신호전달 및 기능유전체 연구 |
경상대 |
환경 |
환경재해 극복 신호전달 및 기능유전체 연구 |
교과부 한국 연구 재단 |
2004 |
|
이화실험동물유전체연구센터 |
이화여대 |
생쥐 |
형질전환마우스관련연구 |
이화 여대 |
2004 |
|
골격계질환 유전체 연구센터 |
경북대병원 |
사람 |
골다공증과 관절염 |
복지부 |
2003 |
|
폐 및 호흡기질환 유전체연구센터 |
순천향의대 부천병원 |
사람 |
천식 등의 호흡기질환 |
복지부 |
2003 |
|
약물수송체유전체 중점연구센터 |
연세대 의과대학 |
사람 |
임상처방 약물의 약동 및 약력과 관계된 약물수송체 유전자 |
복지부 |
2003 |
|
병원성미생물유전체연구센터 |
질병 관리본부 |
사람 |
병원성미생물 자원관리 |
복지부 |
2003 |
|
정신작용 약물 유전체 연구센터 |
고려대학교 |
사람 |
정신작용약물의 개별화된 맞춤치료 방법개발 |
복지부 |
2003 |
|
약물대사유전체연구센터 |
인제대학교 |
사람 |
주요임상약물의 이상반응, 약물동태 및 약물효능 |
복지부 |
2003 |
|
배추유전체연구팀 |
농업생명과학원 |
배추 |
배추 및 벼 유전체연구 |
농진청 |
2003 |
|
유전체연구센터 |
충남대 |
배추 |
배추유전체지도구축 |
충남대 |
2003 |
|
한림유전체응용연구소 |
한림대 |
사람 |
질환관련 임상활용성 연구 |
한림 과학원 |
2003 |
|
유전체연구센터 |
충북대 |
일반 |
유전체학 및 생물정보학에 관한 연구 |
충북대 |
2002 |
|
미생물유전체활용연구사업단 |
생명연 |
미생물 |
유용미생물을 이용한 산업화 |
교과부 |
2002 |
|
간 및 소화기질환 유전체연구센터 |
아주대 의료원 |
사람 |
간 및 소화기질환 |
복지부 |
2002 |
|
조혈계질환 유전체연구센터 |
전남대 의대 |
사람 |
한국인의 조혈계 종양특이유전자의 기능 규명과 새로운 진단기법과 신개념의 치료물질개발 |
복지부 |
2001 |
|
선천성 기형 및 유전질환 유전체연구센터 |
서울 아산병원 |
사람 |
선천성 기형과 유전질환원인규명 |
복지부 |
2001 |
|
피부질환 유전체 연구센터 |
성균관대 의대 |
사람 |
유전성 피부질환의 진단 및 치료 |
복지부 |
2001 |
|
폐암/유방암/난소암 유전체센터 |
고려대 안암병원 |
사람 |
폐암, 유방암과 난소암 |
복지부 |
2001 |
|
생식의학 및 불임 유전체연구센터 |
포천 중문의대 |
사람 |
불임질환 병인의 규명 및 치료전략의 개발 |
복지부 |
2001 |
|
유전체 코호트센터 |
질병 관리본부 |
사람 |
한국인 DNA 수집 및 보관 |
복지부 |
2001 |
|
작물유전체기능연구사업단 |
서울대 |
작물 |
작물 유전자의 기능연구, 활용 |
교과부 |
2001 |
|
유전체센터 |
국립보건원 |
사람 |
사람의 질병과 관련된 유전적 소인규명 |
복지부 |
2000 |
|
심혈관계질환 유전체 연구센터 |
연세의료원 |
사람 |
허혈성 심질환, 고혈압, 뇌졸증 |
복지부 |
2000 |
|
뇌신경계질환 유전체연구센터 |
가톨릭의대 |
사람 |
뇌신경질환병인규명 |
복지부 |
2000 |
|
당뇨 및 내분비질환 유전체 연구센터 |
서울대병원 |
사람 |
한국인 당뇨병의 유전체 연구 |
복지부 |
2000 |
|
(주)솔젠트 |
대전 |
일반 |
유전체 염기서열 결정 서비스 |
민간 |
2000 |
|
인간유전체기능연구사업단 |
생명연 |
사람 |
사람의 위, 간암연구 및 활용 |
교과부 |
2000 |
|
유전체연구센터 |
삼성연구소 |
일반 |
질병관련 SNP 칩 개발 |
민간 |
1999 |
|
(주)마크로젠 |
서울 |
일반 |
유전체 염기서열 결정 서비스 |
민간 |
1997 |
|
(주)제노텍 |
대전 |
일반 |
유전체 염기서열 결정 서비스 |
민간 |
1997 |
|
면역질환 유전체연구센터 |
원광대 의대 |
사람 |
면역질환발병기전 |
복지부 |
1980 |
|
해양극한유전체연구단 |
해양연 |
해양 생물 |
해양극한생물 유용유전자 연구 |
국토 해양부 |
2004 |
출처: 한국생명공학연구원 국가생물자원정보관리센터
마. 전망
생명정보학이 현대 생물학의 핵심적인 역할을 하고 있는 것은 명백하다. 현재 중요한 단백질의 이름, 연관된 유전자의 이름, 반응 속도 등의 물리적 상수와 알려진 물리적, 유전적 상호작용을 컴퓨터의 도움 없이 추적하는 것은 불가능하다. 이런 면에서 컴퓨터는 보조 두뇌의 역할을 하여 수천 개의 복잡한 분자와 그들의 상호작용을 다룰 수 있도록 해 준다. 유전자의 발현, 배열기술의 경우 컴퓨터의 도움 없이는 많은 실험이 불가능하다.
묘사적인 생물학으로부터 정량적이며 예상 가능한 생물학으로의 변천은 막대한 양의 새로운 데이터를 발생시키며 이들의 저장과 공유, 이용을 필요로 하고 있다. 여러 가지 포스트 게노믹스(post-genomics) 연구과정에서 나오는 실험데이터를 정리, 해석하고 검증할 수 있는 가설을 세울 때에도 컴퓨터는 더욱 중요한 역할을 할 것이다. 포스트 게노믹스 분야로 연구 분야가 확대되면서 데이터 통합의 필요성을 충족하는 통합 방법이나 표준화 연구와 함께 증가하는 전산 자원요구를 해결하기 위한 분산 com-puting이나 grid computing 등에 대한 연구가 활발히 진행되고 있다.
생명정보학의 중요성은 매우 크다. 때문에 모든 생물학자들에게 상당한 수준의 생명정보학에 대한 교육과 재교육이 필요하게 되었고 생물정보학은 생물학 분야에서의 필수 기반 요소 분야가 될 것이다.
산업적으로 2005년에는 많은 생물학적 요청이 실수요로 생겨나기 시작했으며 2006년부터는 기업들의 활동도 활발해져 2010년 이후로는 국제적 경쟁체제가 필요하다. 미래의 생명정보학은 초대용량 개인유전체에 기반한 맞춤의학이 필요로 하는 첨단 융합학문이 될 것이다. 또한 그 범위는 생물자원정보, 생물다양성정보, 생명정보(유전체정보) 등을 포괄하는 넓은 분야가 될 것이다. 국내의 IT기술을 적극적으로 활용한 많은 분야들이 상호간에 정보통합이 이루어질 것으로 전망된다.
2. BT + NT
가. 바이오나노기술 개요
바이오나노기술은 단백질, DNA, 세포, 효소 등 생물학적 요소들을 연구하는 바이오분야와 매우 작은 구조체를 다루는 기술인 나노분야의 융합기술이다. 앞에 나열한 생물학적 요소들은 그 크기가 수 나노미터에서 수백 나노미터의 크기를 가지고 있어 나노기술을 이용하여 효율적으로 생물학적 요소들을 다룰 수가 있다.
최근에는 이런 기술을 바탕으로 질병에 직접적인 영향을 주는 DNA와 단백질 등의 생체분자에 대한 연구가 활발하다. 기존의 기술로 다루기 어려웠던 작은 크기의 생물학적 요소들을 나노기술과의 융합을 통해 좀 더 쉽고 효과적으로 연구할 수 있게 되었다. 특히, 나노미터의 크기를 갖는 물질들은 독특한 성질을 가지고 있어 이런 성질을 이용하여 매우 유용한 특성의 소재나 디바이스를 개발할 수 있다.
바이오나노기술의 대표적인 예로는 나노바이오칩/센서기술과 나노생체소재기술이 있다. 나노바이오칩/센서는 매우 작은 소자로 제조하여 그 위에서 수많은 생체분자들의 상호작용을 관찰할 수 있다. 또한 고감도를 가지고 있어서 소량의 분자들도 측정할 수 있는 장점이 있다. 나노생체소재는 나노미터 크기를 갖는 구조체로 주로 생체적합성을 가지고 있어 세포나 생물체 안에 주입하여 분자이미징이나 약물전달 등에 사용된다. 암세포가 있는 부분에 특이적으로 반응하여 빛을 낸다거나 암세포에만 치료약물을 전달하는 개념이 하나의 예라고 할 수 있다. 이처럼 바이오나노기술은 기존에 가능하지 않았던 기술적 한계를 극복할 수 있는 길을 제시해 주었다. 이를 이용하여 생체분자의 상호작용 연구나 메디컬분야 등 다양한 분야에 효과적으로 이용될 수 있다.
나. 해외 동향
(1) 나노바이오칩/센서 기술
바이오칩은 대표적인 융합기술로 IT, BT, NT 등 다양한 분야의 학제 간 연구가 필요하다. 이런 바이오칩은 일반적으로 좁은 영역 위에서 수많은 생체요소들을 동시에 분석할 수 있다. 바이오칩은 분석하고자 하는 생물학적 요소의 종류에 따라 DNA칩, 단백질칩, 세포칩 등으로 다양하게 나뉜다. 바이오칩은 DNA칩을 시작으로 다양하게 연구되어 왔으나 현재에는 단백질칩을 중심으로 연구되고 있다. 단백질칩은 질병의 진단 등의 치료 개발에 직접적인 관련이 있는 단백질 연구를 통해 효소의 활성도 분석, 단백질의 발현과 기능연구, 신약물질의 초고속 스크리닝, 질병 진단 등에 사용될 수 있는 매우 중요한 기술로 보고되고 있다.
바이오칩 기술을 구현하는데 반드시 필요한 기술이 원하는 샘플을 배열하는 기술인 어레이 기술이다. 최근에 칩 기반 기술이 발달하여 기존의 마이크로어레이(micro array)를 대체하는 기술로 많이 개발되어 왔다.
나노어레이기술을 통해 기존의 마이크로어레이의 한계를 넘어 훨씬 많은 생체분자들을 같은 크기의 칩 위에서 동시에 분석할 수 있다. 또한 더 작은 면적에서 반응이 일어나므로 필요한 시료의 양도 획기적으로 줄일 수 있다.
다양한 모양을 갖는 패턴들을 나노 크기의 면적과 간격을 갖는 나노어레이를 통해 다양한 광학적 특성을 분석함으로써 바이오칩의 감도를 조절하기도 한다. 하지만 이런 나노어레이의 단점은 어레이 간격의 크기가 매우 좁기 때문에 원하는 물질을 원하는 영역에 배열하는 것이 어렵다는 것이었다. 하지만 최근에 이런 문제점을 해결하는 기술이 개발되었는데, 이 기술은 원하는 영역에 전기를 가하여 생체분자를 바이오칩 표면에서 탈착시킬 수 있다. 이 기술을 이용하면 원하는 부분에만 생체분자를 고정시킬 수 있다.
[그림 4-3-2-1] 원하는 영역에 생체분자를 고정화시킬 수 있는 나노어레이

출처: Nano Lett. 7, 3116, 2007
바이오칩은 생명공학, 유기화학, 표면화학, 재료공학, 전자공학, 나노기술 등 다양한 분야의 융합이 필요한 분야인데, 바이오칩 표면에 생체분자를 고정하는 방법은 생체분자들의 상호작용 효율을 높이는데 매우 중요하기 때문에 지속적으로 연구개발이 진행되고 있다. 바이오칩의 응용기술 개발에도 광범위한 연구가 진행되고 있는데, 바이오칩의 응용분야는 신약개발을 위한 초고속 스크리닝, 질병의 종합 진단, 유전체의 총체적 연구가 대표적이다.
바이오칩과 더불어 발전하고 있는 분야가 나노바이오센서분야이다. 나노기술을 통해 다양한 나노구조체 제작이 가능해지면서 고감도의 성능을 갖는 나노바이오센서의 개발이 가능해졌다. 그 대표적인 예가 나노와이어, 탄소나노튜브, 캔틸레버, 나노갭 등의 나노구조체를 사용하는 센서이다. 이들 센서는 기존의 센서보다 매우 민감하여 질병을 조기에 진단할 수 있는 기능을 가지고 있다. 이들을 이용한 생체분자 검출 방법으로는 전기화학적 특성 변화를 측정하거나, 기계적 구조, 광학적 특성(형광, 발색, SPR), 전하(Field Effect Transistor), 질량(Quartz Crystal Microbalance) 등의 변화를 측정하는 다양한 물리화학적 방법들이 있다.
나노구조체를 이용한 나노바이오센서의 대표적인 예로 하버드대학에서 개발한 반도체 특성을 갖는 실리콘 나노와이어(silicon nanowire)이다. 수 나노미터의 직경을 갖는 나노와이어를 bottom-up 방식으로 합성하여 표면에 붙은 단백질의 표면전하 변화를 측정하는 방법으로, 전립선암 표지 물질인 PSA(prostate specific antigen)를 90 fg/ml의 농도까지 측정한 바 있다.
[그림 4-3-2-2] CMOS-compatible 실리콘 나노와이어

출처: Nature 445, 519, 2007
Bottom-up 방식으로 제작한 나노와이어, 나노튜브 등은 균일한 크기를 갖고 고감도의 특성 등의 장점을 갖고 있다. 하지만 그 크기가 매우 작기 때문에 다루기가 어렵고 이것들을 이용하여 소자화시키는 데에도 난제가 많다. 이런 단점을 보완하기 위해 미국의 예일대학교에서 silicon-on-insulator에의 구조를 이용하여 CMOS (complementary metal-oxide semiconductor)-compatible 실리콘 나노와이어를 개발하였다. 이것은 기존의 반도체 공정과 접목하여 제조할 수 있기 때문에 대량으로 생산할 수 있고, 소자화도 가능하다는 장점이 있다. 또한 기존의 나노와이어와 비슷한 고감도 특성을 나타낸다.
(2) 나노생체소재 분야
나노생체소재기술은 생물학적 기능을 가진 나노레벨의 소재를 개발하는 기술로써 이러한 나노생체소재를 이용하여 생명현상의 규명, 질병진단과 치료, 그리고 기능성 의료용 소재의 개발이 가능하게 되었다. 나노생체소재는 크게 단백질, DNA/RNA, 지질, 다당류로 구성되어있는 생체유래의 소재와 고분자, 금속나노입자, 카본나노튜브와 풀러렌 등의 탄소 계열의 나노물질 등 비생체유래의 소재로 나눌 수 있다.
생체유래의 소재 중에서는 생체물질의 이동에 관여하는 키네신(kinesin), 미오신(myosin), 디네신(dynein), 플라겔라(flaginla)와 같은 모터단백질, DNA나 RNA를 합성하는 DNA/RNA 폴리머라제 그리고 최근 리튬전지에 이용된 바이러스의 펩티드 등이 있다. 생체유래 소재 중에는 생물학적 기능 외에도 독특한 구조를 이용해 전기, 전자 분야에도 응용하는 시도가 활발히 진행 중이다. 예를 들어, IT의 Angina Binchir 박사 연구팀은 바이러스는 증식속도가 빠르고 유전공학적으로 설계가 가능하다는 점에 착안하여 한쪽에는 전도성이 좋은 탄소나노튜브와 결합하고 다른 한쪽은 인산철(α-FiPO4)의 성장을 촉진하는 바이러스 유래 팹타이드를 설계하였다. 이 연구팀은 유전공학을 이용하여 바이러스의 아미노산을 조절하는 기술을 개발하여 최근 독성이 적으면서 저렴하고 강력한 리튬이온전지의 생산을 가능하도록 만들었다는 평가를 받고 있다.
[그림 4-3-2-3] M13 바이러스를 이용한 리튬전지

출처: Science 324, 1051, 2009
비생체유래의 나노생체소재 중 반도체 혹은 금속 나노입자로 대표되는 무기소재는 광학적 이미징을 통한 질병진단과 광열효과(Photothermal effect)를 이용한 치료 등에 사용되고 있으며 대표적으로 형광이미징을 이용한 암진단을 가능하게 한 양자점(Quantum Dots)과 근적외선 파장을 이용하여 암세포 치료로 활용되는 금 나노입자를 들 수 있다. Bhatia 연구팀은 근적외선의 흡수율이 높고 생체적합성이 좋은 폴리에틸렌 글라이콜로 코팅한 금 나노막대를 개발하여 생체에 장시간 노출하여도 무리가 없는 X-ray CT이미징이 가능하게 하였다. 동시에 근적외선으로 암치료에도 성공했다. 이는 기존에 사용되는 금 나노쉡이나 X-ray CT조영제인 아이오딘(iodine) 에 비해서 매우 우수한 차세대 나노생체소재로 각광받고 있다.
[그림 4-3-2-4] 광열효과를 갖는 금 나노막대

출처: Cancer Research 64, 3892, 2009
나노생체소재분야 중에서 가장 주목받는 분야 중에 하나로 약물 전달용 나노소재를 들 수 있다. 약물 전달용 나노소재는 인체에 사용가능한 폴레라틱 에시드(polylactic acid, PLA)나 폴리라틱에시드-글라이콜릭 에시드 공중합체(polylactic acid-co- glycolic acid, PLGA)와 같은 폴리에스테르계 고분자와 폴리에틸렌 옥사이드(polyethylene oxide, PEO), 친생체고분자, 지질기반의 리포좀성 입자(liposomal particle) 등을 사용한다. 실제로 약물 발견 노력의 결과로 얻어진 약물들은 소수성이 높은 특성을 가지고 있는데 이러한 약물을 가용화 시킴과 동시에 생체 내에서 안정적으로 이동하여 표적부위에 약물을 방출하는 약물전달 시스템의 개발이 활발히 진행되고 있다. 최근엔 고분자 외에 실리카 재질의 나노생체소재 개발이 활발히 진행 중인데, 예를 들어 UCLA의 Tamanoi 교수는 다공성 실리카 나노입자를 개발하여 소수성 항암제인 캄토테신(Camptothecin)을 암세포에 전달하여 세포사를 유도하는데 성공하였다. 수 나노미터에 해당하는 공극 안에는 소수성의 항암제를 보관하고 표면에는 수용성을 높이기 위해 화학적 처리를 하여 수소성과 친수성을 동시에 구현하여 약물이 생체 내에서 효과적으로 이동하게 만들었다.
[그림 4-3-2-5] 수 나노미터의 공극을 갖는 실리카 나노입자

출처: Small 3, 1341, 2007
뿐만 아니라 Salior 교수 연구팀이65) 개발한 생분해성 실리콘 나노입자도 항암제 전달시스템으로서 주목을 받고 있다. 항암제인 독소루비신을 포함한 실리콘 나노입자를 초음파를 이용하여 분해하면 약물이 방출되는 동시에 형광을 나타내어 약물전달과 이미징이 가능하다. 이러한 나노입자는 생분해성 고분자처럼 약물전달이 완료되면 그 부산물들이 신장을 통해 제거되기 때문에 생체안정성이 높은 것으로 평가된다. 나노생체소재를 이용한 약물전달은 신체 전반에 약물을 주입할 때 나타날 수 있는 약물의 부작용을 최소화하고 보다 적은 양으로 효과적으로 암세포를 치료하는데 큰 기여를 한다고 할 수 있다.
다. 국내 현황
나노바이오칩/센서의 경우, 국내에서도 다양한 나노구조체를 이용하여 고감도 바이오센서를 개발하고 있다. 최근에는 단일칩 상에서 만들어 샘플을 분리하고 측정하는 단계를 한꺼번에 수행할 수 있는 랩온어칩(Lab-On-a-Chip)의 개발이 활발하게 이루어지고 있다. 또한 국내의 여러 기관에서 개발한 바이오센서를 상용화 하려는 노력이 활발하게 이루어지고 있다.
최근 한국생명공학연구원은 단백질칩을 분석하기 위한 측정시스템으로서 널리 이용되고 있는 SPR 이미징 단백질칩 분석시스템을 개발한데 이어 세계에서 가장 작은 mini-SPR 바이오칩 분석시스템을 개발하였다. 이 초소형 바이오칩 분석시스템은 손바닥만 한 크기로, SPR 이미징을 통해 보다 용이하게 질병을 진단하고 생체 간 상호작용을 이용해 신약개발에 적용할 수 있다. 그리고 농수산물의 잔류 농약 검출에도 이용해 식품안정성의 평가 등 폭넓은 분야에서 활용될 것으로 전망된다.
나노생체소재 분야에서도 국내 연구진의 활동은 활발한데, 한 예로 한국과학기술원에서 개발한 전도성이 높은 펩타이드 나노막대가 있으며 한국생명공학연구원에서는 탄소계열의 풀러렌과 실리카를 융합한 새로운 형광 나노입자를 개발했다. 서울대 재료학과 연구팀은 다공성 자성나노입자를 제조하여 약물전달과 MRI 이미징이 동시에 가능한 다기능성 나노생체소재를 개발하기도 하였다.
라. 발전 방향
나노바이오기술의 눈부신 발전은 기존 기술로는 불가능했던 부분을 가능하게 만들어 기술의 한계를 극복하는데 큰 기여를 하고 있지만 해결해야 할 문제가 여전히 남아있다. 예를 들어 바이오칩/센서 분야에서는 고감도 진단에 사용하는 나노소재나 나노디바이스의 재현성이 중요한 요소를 차지하고 있다. 또한 의료/보건 분야에서 폭넓게 활용하기 위한 칩/센서 제작비용의 절감을 위해 새로운 나노소재 혹은 기술 개발도 시급한 실정이다. 다기능성 나노생체소재의 개발과 더불어 최근 대두되고 있는 신소재의 독성과 생물학적, 환경적 영향에 대한 연구도 함께 진행되고 있으며 이는 안전한 나노생체소재의 활용에 중요한 역할을 할 것으로 기대한다.

농축산․식품 분야
1. 유전자변형 작물 관련 해외동향66)
가. 재배 및 시장동향
생명공학기술이 농업에 적용되어 산업화에 성공한 대표적인 사례는 유전자변형 작물이다. 유전자변형 작물은 1996년부터 상업적으로 재배되기 시작하여 2008년에는 25개국의 1,330만 농민에 의해 1억 2,500만 헥타르에서 재배되었다. 이는 세계 경작지 면적의 9%, 우리나라 경작지 면적의 68배에 해당한다. 이후 재배면적은 매년 10% 이상 증가되어 왔다(그림 4-4-1-1).
[그림 4-4-1-1] 유전자변형 작물의 전 세계 재배면적
|
출처: ISAAA (2009) Clive James
세계산업분석(Global Industry Analysts, GIA)의 보고서에 따르면 2008년 농업생명공학의 세계 시장가치는 77억 달러로 추산되었다. 대부분 유전자변형 작물의 종자로 이루어진 농업생명공학시장은 매년 10% 가량 성장하고 있으며, 2015년에는 150억 달러에 이를 것으로 예상된다. 2007년 시장동향을 지역별로 보면, 미국(39.5억 달러), 라틴아메리카(15.4억 달러), 아시아-태평양(7.0억 달러), 캐나다(3.3억 달러) 순이다. 연간 성장률은 평균 11%인데, 아시아-태평양 지역은 약 14%로 다른 지역보다 높다. 이는 중국과 인도에서의 유전자변형 작물의 재배가 증가하는 것과 관련이 있다. 동 보고서에 따르면 2007년 시장의 기업별 점유율은 대략 몬산토 85%, 바이어 7%, 신젠타 5% 순이다. 이는 몬산토사가 1990년대 중반부터 형질전환 작물을 개발하는 핵심기술을 보유한 농업벤처회사들을 인수합병하여 강력한 특허포트폴리오를 구축한 것과 관련이 있다. 작물별로 보면, 3대 GM 작물은 콩, 옥수수, 면화이며, 콩의 비중은 점차 감소하고, 옥수수와 면화의 비중이 증가할 것으로 전망된다. 형질별로 보면 현재까지는 제1세대(제초제저항성, 해충저항성) 작물이 주류를 이루고 있다. 영양성분 강화 등 제2세대 GM 작물의 실용화는 본격적으로 이루어지고 있지 않다.
나. 안전성평가 동향 일반적으로 GM 작물의 연구개발은 유전자 발굴(모델식물을 이용한 기능검정 포함), 형질전환 및 우수 계통선발, 안전성 평가의 단계를 거친다. 유전자 발굴과 형질전환 단계의 현황은 통상 개발자들이 공개하지 않으므로 정확하게 파악하기 어려우나, 안전성 평가에 있어서는 대부분의 국가가 GM 작물의 상업화 전 안전성심사를 의무화하고 있고 최소한 그 목록을 공개하기 때문에 비교적 정확한 현황파악이 가능하다. 물론 안전성 심사가 완료된 모든 GM 작물이 상업적으로 재배되는 것은 아니다. 본고에서는 안전성 심사 승인을 기준으로 현황을 정리하였다. 2008년 말 안전성 심사에서 승인된 GM 작물은 후대교배종을 포함하여 19작목 115종이었다(표 4-4-1-1). 재배면적의 대부분을 차지하고 있는 옥수수, 유채, 면화 및 대두가 많이 승인되었다.
[표 4-4-1-1] 2008년 말까지 안전성심사 승인된 유전자변형 작물(작물별, 신규승인 기준)
출처: 바이오안전성백서(2009)
다. 연구개발 동향 1960년대 식량증산에 성공을 거두었던 녹색혁명이 공공연구소에 의해서 이루어진 것과는 달리 지금까지는 농업생명공학기술의 상업화는 주로 대규모의 민간기업에 의해서 주도되었다. 최근 주요 농업생명공학기업은 새로운 형질, 예를 들어 가뭄에 잘 견디는 작물과 관련한 소위 ‘기후 유전자(climate gene)’ 특허를 광범위하게 확보해 나가는데 집중하고 있다. 이러한 기능을 가지는 유전자를 발견하고 작물에 도입하기 위하여 몬산토의 경우 매출의 10%에 해당하는 약 5,000억 원을 연구개발에 투자하고 있으며, 유전자 기능의 개발에서 강점을 가지는 BASF와 전략적 제휴 시스템을 구축하고 있다. 한편 요즘 공공연구소 또는 대학에서 유전자변형 작물을 개발하여 안전성 심사를 마친 사례들이 하나둘씩 등장하고 있다. 또한 정부주도로 강력한 농업생명공학 개발을 추진하는 경우도 있다. 중국은 경작지 감소, 만성적인 농업용수 부족, 인구증가에 직면하여 보다 고강도의 식량공급 정책을 필요로 하고 있다. 따라서 식량 공급의 안정성을 확보하기 위하여 농업생명공학기술을 이용한 녹색혁명에 기대를 걸고 있다. 원자바오 총리는 유전자변형 작물에 대한 연구개발 자금으로 13년간 35억 달러를 투입하겠다고 2008년 9월 말 발표한 바 있다. 브라질과 인도 역시 공공연구소를 통하여 자국 고유의 유전자변형 작물을 개발하겠다는 의사를 밝힌 바 있다. 인도는 해충저항성 면화를 포함하여 15개 작물의 실용화를 위하여 3억 달러의 공공 연구개발비를 추가 조성하겠다고 발표한 바 있다. 이제 다국적기업이든 공공연구소이든 유전자변형 작물의 연구개발을 강화하고 있다.
2. 국내현황 가. 농촌진흥청 (1) GM 작물 연구개발 농촌진흥청은 국립농업과학원 농업생명자원부(과거 농업생명공학연구원)를 중심으로 GM 작물을 개발하기 위한 기반기술 개발과 실용화 연구를 추진하고 있다. 농촌진흥청은 GM 작물 개발단계를 유전자검정, 기능검정, 고정계통육성, 안전성평가로 구분하고 있으며, 2009년 말 기준 18작목 88종이 추진 중에 있다(표 4-4-2-1). 현재 비타민A강화 벼, 해충저항성 벼, 제초제저항성 벼, 제초제저항성 고추, 제초제저항성 감자, 해충저항성 배추 등 6종의 이벤트가 안전성 평가 중에 있다. 현재 우리나라에서 상업적으로 재배되고 있는 GM 작물은 없다. [표 4-4-2-1] 농촌진흥청 개발 GM 작물(18작목 88종)
(2) 축산생명공학기술 및 GM 동물 연구개발 (가) 형질전환 가축을 이용한 바이오 신약 생산기술 개발 형질전환 가축을 이용한 신약개발연구 분야에서는 고가의 유용단백질을 난백과 유즙으로 생산하기 위한 연구를 진행하고 있다. 닭에서는 락토페린과 SOD의 유전자를 계란특이 프로모터와 결합하여 바이러스를 이용하는 유전자도입법을 구축하고, stage-X 수정란 배아강에 주입하여 형질전환 병아리를 생산하였다. 돼지에서는 유즙 특이프로모터를 빈혈치료제, 혈우병 치료제, 희귀혈우병 치료제, 혈전증 치료제 단백질의 유전자와 결합하여 돼지의 수정란에 미세 주입으로 수란돈에 이식하여 형질전환돼지를 생산하였다. 형질전환돼지에서는 혈우병치료제 제8 혈액응고인자(Factor VIII)와 폰 윌리브란트 인자(von Wilebrand factor, vWF)가 유즙으로 발현되어 산업화 가능성을 검증하는 연구를 진행하고 있으며, 유즙으로 분비되는 Factor VIII과 vWF를 분리․정제하는 체계를 구축하는 연구를 진행하고 약리활성을 검증하고자 한다. 정제된 Factor VIII의 약리활성이 성공적으로 검증되면 신약의 원료물질을 가축에서 얻어 이용하는 생명공학의 현실화가 가능할 것으로 추측된다. 특히 형질전환 돼지에서 생산된 Factor VIII과 EPO, tPA는 산업화 검증이 필요한 물질로서 후속연구를 통한 연구성과의 실용화가 기대되는 축종으로 형질전환 계통을 확보하기 위한 연구를 계속 진행하고 있다.
(나) 바이오장기 생산 연구 인체면역거부반응 유전자적중 형질전환 복제돼지 생산 연구는 인간에게 이용 가능한 바이오장기 생산을 목표로 면역거부반응과 관련된 유전자를 발굴하고 유전자적중 벡터를 제작한다. 그리고 이를 체세포에 도입하여 유전자가 적중된 형질전환 체세포주를 만드는 것이 연구의 핵심이다. 현재 국립축산과학원 동물바이오공학과에서는 초급성 또는 급성 면역거부반응 유전자 적중 벡터 3종과 체세포주 1종을 구축하였다. 또한 초급성 면역거부반응 유전자인 alpha-1,3-Galactosyltransferase(GalT) 유전자가 제어된 형질전환 복제돼지(Xeno) 6두를 생산하여 현재 2두가 건강하게 살아 있다. 또한 향후 형질전환 복제동물을 생산하는데 있어 효율을 향상시킬 수 있도록 임신기간의 생리학적, 면역학적 또는 후생학적 유전정보 해석을 통하여 복제발생과정에서 발생하는 태반 및 장기기형에 대한 저수태원인 해석연구를 수행하고 있다. 착상 전후 수태산물에 대하여 프로테오믹스를 이용하여 광범위한 발현 차이를 보이는 단백질 67개를 동정하였고, 탈출배반포와 임신 14일령 수태산물을 이용해 유사태반영양막줄기세포주를 구축하였다. 여기에 태반영양막세포 특이발현 유전자들에 대한 후성학적 발현조절 기작을 해석하였으며 특히 Oct4유전자의 발현과 DNA 메틸화에 의한 후성유전학적 조절메카니즘을 해석한 일은 연구에 중요성을 더한 결과이다.
(다) 체세포 복제 동물 안정성 검증 국립축산과학원에서 생산한 복제소는 일반 수송아지보다 빠르게 체중이 증가하는 양상을 보였다. 이러한 결과는 성장관련 호르몬인 IGF-1이 일반 송아지에 비하여 유의하게 높게 나타나는 것으로 확인되었다. 또한 혈중 웅성호르몬인 testosterone의 농도는 다소 낮게 나타났으나, 성숙 시기를 지나면서 정상적인 호르몬 농도로 회복함을 확인하였다. 한편 동일한 염색체를 가진 공여세포로부터 생산된 복제소들은 동일한 유전적 형태를 가지고 태어나기 때문에 동일한 체세포 공여소로부터 생산된 복제소들은 기존의 유전자형 분석 방법으로는 구분을 할 수 없다. 따라서 복제소 연구팀은 복제 방법을 통해 태어난 개체가 어미(난자)로부터 유래된 미토콘드리아와 공여세포로부터 유래된 미토콘드리아를 동시에 가지는 특성을 이용하여 개체를 식별을 할 수 있는 “한우 복제소 개체 식별을 위한 분자표지인자 및 유전자 분석 기법”을 개발하여 특허출원 중이다. 이러한 결과는 안전한 축산물의 유통과 투명한 복제동물 생산 및 관리에 활용될 수 있을 것으로 기대된다.
(라) GM 동물 연구개발 현황 국립축산과학원에서는 한우, 돼지, 닭 등 가축의 복제와 형질전환 연구를 1998년부터 시작하였다. 2007년도 3과제(15세부), 2008년도 경상 4과제(16세부)와 BG21 5세부과제의 생명공학관련 연구를 수행하고 있으며, 2009년도 현재는 BG21과제를 포함하여 32세부과제를 수행하고 있다(표 4-4-2-2).
[표 4-4-2-2] 농촌진흥청 개발 GM 가축
나. 농림수산식품 연구개발사업(과거 농림기술개발사업) 농림수산식품부 농림수산식품기술기획평가원에서 운영하는 2008년 농림기술개발사업을 통해 국내 특허 출원 44건, 등록 28건, 국외 특허 출원 4건, 기술이전 6건이 이루어졌다.
다. 바이오그린21사업 농촌진흥청이 운영하는 바이오그린21사업은 2005년부터 2007년까지 제2단계를 수행하였고, 2008년부터 제3단계 사업을 추진 중에 있다. 대학, 연구기관, 산업체 등 학연산 공동연구 중심으로 수행하고 있으며, 생명공학기술의 농업적 실용화기술연구개발을 지원하고 있다. 2008년 국내특허 출원 166건, 등록 83건, 국외특허 출원 22건, 등록 6건, 기술이전 23건이 이루어졌다. 농업생명공학 분야 주요 성과는 (표 4-4-2-3)과 같다.
[표 4-4-2-3] 바이오그린21사업의 농업생명공학 관련 주요 성과(2008년)
라. 작물유전체기능연구사업단 연구개발 현황 과학기술부 21C프론티어사업 작물유전체기능연구사업단은 2008년부터 2009년까지 약 200억 원의 연구개발비를 활용하여 제3단계 사업을 수행하였으며, 약 38세부과제를 수행하여 159건의 특허실적(출원 80건, 등록 79건)을 달성하였다. 스트레스 저항성 및 수확량 증가와 관련된 유전자 CaSGT1 등 182종의 신규 고유유전자를 개발하여 이 중 6종을 기술이전, 9종 유전자에 대한 실용화 연구를 추진하고 있다(표 4-4-2-4).
[표 4-4-2-4] 작물유전체기능연구사업단 주요 연구개발 성과
3. 발전과제 GM 작물 산업화의 기술적 요소는 유전자 발굴, 유전자기능분석, 작물형질전환, 이벤트육성 등의 기술이다. 이들 단위기술은 국가연구개발사업 등을 통하여 상당한 수준으로 성장하였다. 그러나 목표작물과 형질의 선정(기획) 등을 포함하여 실용화의 각 단계에서 다음 단계로의 진행을 위한 결정 등의 경영적 요소, 외국 개발사의 경우 100억 원 정도가 소요되는 광범위한 위해성 평가의 효율적 이행 방안, 경작자 및 소비자의 수용성, 특허로 보호되는 기술의 실시자유도 확보 등의 비기술적 요소들에 대한 준비는 체계적이지 않았다. 각각의 요소별로 발전과제를 기술하면 다음과 같다.
가. 실용화 시스템 구축 기존의 GM 작물 실용화의 기획은 다른 연구개발사업 분야와 마찬가지로 상당한 부분을 전문가 직관에 의존하였고, 기술 중심으로 주도되어 왔다. 요즘 수요자 중심의 연구개발기획에 대한 중요성이 인식되고 있으며 따라서 시장분석의 중요성이 높아지고 있다. 또한 GM 작물 실용화를 연구-개발-사업 선상에서 볼 때 연구와 개발의 구분이 모호함은 매우 큰 장애요인으로 작용한다. 예를 들어, 후보유전자의 발굴과 기능분석은 연구의 효율성을 높이기 위하여 비교적 간단한 유전자도입시스템(벡터)과 모델 식물을 대상으로 진행된다. 이러한 기능분석의 결과는 하나의 가능성을 제시할 뿐이며, 다른 목표 작물과 복잡한 도입환경(포장)에서의 세대진전에 따른 지속적인 형질발현의 여부는 다른 양상을 보일 수 있다. 실용화를 목표로 하는 연구의 경우 최종 목표작물과 형질에 대해서 이루어져야 하며 이를 실험실과 온실에서 진행되는 기능검정과 명확히 구분할 필요가 있다. 대부분의 주요 GM 작물 개발사는 연구개발체계에서 검증 및 판단(decision making)을 중시하고 있으며, 데이터의 신뢰도를 높이기 위하여 국제표준 및 GLP를 활용하고 있다.
나. 안전성 관련 규제이행(안전성 평가) 효율화 위해성 평가의 이행은 안전성규제와 밀접하게 관련되어 있다. Kalaitzandonakes 등은 제초제저항성 옥수수와 해충저항성 옥수수의 안전성 관련 규제이행의 비용을 약 100억 원으로 추산한 바 있다. 대부분 위해성평가에 소요되는 이 비용은 시장규모가 작은 작물 또는 형질의 실용화와 소규모 연구기관에 대해서 연구개발의 장벽으로 작용할 수 있다. 따라서 위해성 평가와 개발 시의 안전관리에 대한 규제의 효율적 이행은 GM 작물 산업화의 가속화를 위하여 중요한 요소를 차지한다. 다. 소비자 수용성 향상 현재 안전성에 대한 우려는 과학적인 사실보다는 막연한 불안감에 근거하고 있다. GM 작물에 대한 최종 선택은 경작자 또는 소비자가 하겠지만 수용여부를 고려함에 있어서 선택의 과정은 과학적 사실에 근거를 두어야 할 것이다. 결국 현재까지의 과학적인 결론을 종합할 필요가 있으며, 이에 대한 대중과의 커뮤니케이션이 중요한 요소가 될 것이다.
라. 기술실시 자유도 확보 세계적으로 특허경쟁이 심화되고 있다. 특허의 대상과 범위가 확대되고 있으며(인터넷을 이용한 영업방법, 컴퓨터 프로그램 등), 핵심 또는 원천기술을 보유한 기업들이 사업을 선점하고 유지하는 수단으로 특허를 활용하고 있는 추세이다. 생명공학 분야도 예외가 아니어서 특허보호 영역이 확대되었다. 1980년 유전자변형 미생물에 특허가 부여되었으며(Chakrabarty 사건), 1988년에는 동물에 특허가 부여되었다(Harvard Mouse 사건). R&D 성과를 대학과 민간기업이 소유할 수 있도록 하는 ‘베이-돌(Bayh-Dole)법’, 특허 판결의 통일성과 신속화로 발명자의 권리를 강화할 수 있는 기초를 마련한 연방항소법원(CAFC, Court of Appeals for the Federal Circuit) 등으로 대표되는 미국의 친특허 정책은 생명공학 분야의 연구개발사업화에 큰 변화를 초래하였다. 몬산토사는 1990년대 중반 Calgene, Dekalb Genetics 등 농업생명공학 관련 바이오벤처들을 집중적으로 인수합병하였는데, 이는 상대기업이 보유한 핵심특허를 확보하는 것과 관련이 있다. 몬산토사의 특허활동은 특허포트폴리오의 구축에 그치지 않고 이를 이용하여 적극적으로 침해소송을 일으키고 있다. 몬산토사의 농업생명공학시장 점유율은 2007년 약 85%에 달하였다. 이러한 특허권 보호 환경과 주요 농업생명공학기업의 사례를 볼 때 특허기술은 개발 및 실용화에서는 상당한 제약을 줄 것으로 보인다. 기술실시도(freedom to operate)는 ‘제3자가 소유한 지적재산권 또는 무형자산을 침해할 위험성을 최소화하면서 신규 생산물 또는 프로세스의 연구, 개발, 상업적 생산을 수행할 수 있는 능력’으로 정의된다. 현재 대부분의 국가가 특허기술의 연구에 사용하는데 특별한 제약을 두고 있지 않으나, 상업화에는 상당한 제약을 두고 있다. 따라서 유전자의 기능, 유전자재조합 기술, 유전자도입(형질전환)기술 등 GM 작물의 개발과 관련된 특허기술의 권리성과 실시자유도를 상세히 고찰할 필요가 있다.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

산업공정/환경․해양수산 분야
1. 제조 및 생물공정
가. 생물공정의 개요
생물공정기술은 생명공학기술을 이용하여 목적 산물을 대량생산하기 위한 기술로써 “생명과학의 연구발견을 실제제품 및 공정 또는 사회적 수요에 부합하는 시스템으로 변환시키는 기술”을 총칭하는 것으로 정의할 수 있다. 교육과학기술부에서 제정한 국가과학기술표준분류체계에 의하면 생물공정기술은 대사공학기술과 함께 분류되어 있으며 세부기술로는 발효공학, 생물분리정제기술, 생물반응기, 효소공학, 생물청정기술, 대사전달·조절기술, 세포대사공학, 바이오에너지로 분류된다.67) 또한, 유럽생물연합(European Federation of Biotechnology) 생물화학공학분과 작업그룹은 미생물 발효나 동식물 세포 배양에 이은 분리정제기술을 다루는 Downstream processing 그룹, 컴퓨터 기반 공정설계 및 최적화 기술과 생물반응기 유체역학을 연구하는 Bioreactor performance 그룹, 생물촉매와 생물전환공정을 다루는 Biotransformation 그룹과 세포내 주요 성분들 사이 또는 세포와 반응기 사이의 상호연관성을 측정 및 제어하는 M3C(Modelling, Monitoring, Measurement & Control) 그룹으로 나누어 활동하고 있다.68)
나. 국내·외 연구개발 동향
의약, 식품, 화학, 농업, 환경 및 화장품 분야 등에 유용한 생물소재의 최종생산에 필수적인 생물공정기술개발 연구는 최근에 국내외를 막론하고 바이오에너지를 포함한 바이오리파이너리(Biorefinery) 기술개발에 초점이 맞추어져 있다. 특히 미국은 에너지독립 및 보안법(Energy independence and security act)에서 2022년까지 210억 갤런의 바이오연료를 생산하기로 하고, 이 중 160억 갤런은 반드시 섬유질에서 유래한 원료를 사용하여 생산하도록 규정하고 있다.69)
목질계와 초본계에서 유래한 Cellulose를 주성분으로 하는 바이오매스를 원료로 사용하여 바이오에너지 또는 바이오 화학물질들을 생산할 경우 원료의 전처리공정이 총 시설투자비의 16~19%를 차지하는 주요한 단위조작(Unit operation) 공정이다. 오래전부터 고온‧고압 조건에서 산 또는 알칼리를 사용하는 물리화학적 전처리공정기술들이 개발되어 왔으나 오염을 유발하고 후속공정을 저해하는 부산물들의 생성으로 인하여 아직까지 지속가능한 청정공정 기술이 개발되지 않고 있다.
이의 대안으로 최근에는 이온성 용매를 사용하는 신공정기술 개발이 추진되고 있으며, 이를 통하여 전처리된 바이오매스를 사용하여 효소를 가수분해하면 90% 이상의 분해도를 달성할 수 있다. 그러나 아직 저가 용매의 개발과 사용된 용매의 효율적인 회수기술이 필요하다.70) 오존과 같은 산화제를 사용하여 바이오매스로부터 리그닌과 헤미셀룰로오스를 제거하여 효소를 이용한 셀룰로오스의 가수분해도를 증가시키기 위한 연구도 수행되고 있으나,71) 사용된 산화제가 리그닌, 헤미셀룰로오스 및 셀룰로오스와 반응하여 가수분해 수율을 낮추고 가수분해 효소 저해물질들을 생성하는 문제점들을 가지고 있다.
최근에는 물리화학적 전처리 공정을 생략하고 Lignocellulose의 당화능과 생성된 당의 발효능을 모두 갖고 있는 미생물, 또는 각각의 능력을 갖고 있는 미생물들의 컨소시엄을 이용한 통합생물공정(Consolidated bioprocessing) 기술이 개발되고 있다.72) 이와 관련해서는 현재 통합생물공정에 가장 적합한 미생물 중의 하나로 알려진 Trichoderma reesei를 대상으로 유전체 서열분석 연구 결과가 보고되었다.73)
그동안 대부분의 바이오에너지 생산 연구가 에탄올을 중심으로 이루어져 왔으나 최근에는 Solventogenic clostridia 미생물을 이용한 부탄올 생산공정기술에 관한 연구들이 새롭게 부각되고 있다.74)
이러한 바이오에너지와 바이오리파이너리 생산균주를 개발하기 위한 세부 전략으로는 Systems biology를 사용한 대상 미생물의 대사 재설계 연구가 각광을 받고 있다.75) Systems biology는 바이오에너지와 바이오리파이너리 기술개발 외에도 국내외 발효 산업에서 중요한 위치를 차지하고 있는 아미노산 생산을 위한 공정기술개발에도 적용되고 있다. 대표적인 아미노산 생산균주인 Corynebacterium glutamicum을 대상으로 Genome-scale 대사모델76)과 in silico 모델77)이 개발되었다.
다. 전망
당분간 생물공정기술은 경제·사회적 이슈가 되고 있는 바이오에너지, 그리고 바이오리파이너리와 관련된 융합기술개발이 주요 이슈가 될 것으로 전망된다. 또한, 저가 바이오매스의 확보와 자원의 다양화 차원에서 해양 바이오매스를 이용하기 위한 공정개발 연구가 본격화 될 전망이다.78)
2. 환경 생명공학
가. 환경생명공학기술의 개요와 필요성
환경생명공학(Environmental Biotechnology)이란 생명공학기술(Biotechnology, BT)을 환경공학(Environmental Technology, ET)분야에 이용하여 환경오염을 방지하고 환경을 효율적으로 보전하고 관리하는데 활용되는 모든 기술과 학문을 의미한다. 이 분야는 21세기 첨단기술로 주목받고 있으며 분자생물학, 환경과학, 생태학 등의 분야와 융화하여 빠르게 발전하고 있다. 환경생명공학기술은 오염환경의 정화(remediation), 오염의 예방(prevention) 그리고 생물학적 방법에 의한 오염의 검출(detection) 분야로 확대되어 환경보존을 위해 큰 역할을 담당할 것으로 예상되며 전 세계적으로 환경분야의 핵심기술로 연구개발을 통해 실용화를 추진하고 있다.
환경문제는 21세기 인류생존을 위협하는 최대 현안문제 중 하나로서 기존의 환경문제를 해결하기 위해 물리적, 화학적, 생물학적 방법을 이용할 뿐만 아니라 여기에 첨단기술로 주목받고 있는 생명공학기술을 도입하여 전 세계적인 노력을 기울이고 있다. 환경생명공학기술은 미생물이나 식물에 의한 난분해성 물질과 환경오염물질의 분해를 촉진하고 생물전환(Biotransformation) 등을 이용해 오염물질의 농도를 근본적으로 감소시키며 2차 오염을 방지한다. 장기적면에서 고려할 때 물리적, 화학적 또는 물리․화학적 방법보다 환경관리 비용이 적게 든다는 경제적인 장점을 가지고 있다.
나. 국제 동향
(1) 연구개발 동향
국제적으로 활발히 연구가 진행되고 있는 환경생명공학분야는 바이오플라스틱, 바이오 디젤(바이오에너지), 기능성섬유(거미줄 단백질생산을 이용한 방탄복 생산 등)와 같은 석유화학성분을 대체하기 위한 분야와 식물과 미생물을 이용해 폐기물이나 오염물질을 줄이는 생물학적 정화(Bioremediation) 분야의 연구가 활발히 진행되고 있으며, 이들 중 생물학적 정화의 주요 연구개발 동향을 요약 정리하였다.
[표 4-5-2-1] 생물학적 정화의 주요 연구개발 동향 및 유망기술
|
생물정화 분야 |
기술개발 동향 |
|
토양정화 (미생물 이용) |
-Cellulomonas 균주를 이용하여 독성의 육가크롬을 비독성의 삼가크롬으로 전환하는 연구성과 획득(Montana주립대학 연구팀) -Bacillus pumilus를 이용하여 호기성환경에서 원유 탄화수소 화합물 생분해에 이용기술 획득(스페인 Granada대학 연구팀) -White-rot 곰팡이를 이용하여 탄광지역 오염토양 정화기술 획득(캐나다 Maritime MicroBiologicals사) |
|
지하수/폐수 (미생물 이용) |
-폐수의 경우에는 다양한 산업, 특히 섬유 산업 폐수에서 발생하기 쉬운 염료 및 색소 제거에 초점이 맞추어져 있음 -Bjerkandera adusta의 세 가지 곰팡이를 이용하여 폐수에서 염료를 효과적으로 제거하는 방법 획득(슬로베니아 국립화학연구소) |
|
기타지역 (미생물 이용) |
-저수위 상태 혹은 수증기 상태로 토양에 흡수된 오염물질과 미생물의 접촉을 향상시키는 기술개발(미국 Ivey사) |
|
식물 이용 |
-Phytoremediation을 적용한 사례로는 1986년 우크라이나 체르노빌에서 일어난 방사능 유출지역을 해바라기로 정화한 사례가 대표적임 -포플러 나무와 인디언 겨자의 특성을 이용하여 미국의 무기시험장 및 군사지역의 오염물질 정화에 사용됨 -400종 이상의 중금속 과축적 식물이 발견되었으며, 많은 연구기관과 회사에서 보다 향상된 과축적 식물을 찾기 위해 노력 중임 -과축적 식물들의 기능향상을 위해 형질전환 식물체를 이용한 환경정화 기술개발이 활발하게 진행됨 |
|
유망 기술 |
개념 |
|
형질전환 미생물 이용기술 |
고온생장, 유기독성물질 혹은 방사성 물질 분해 유전자를 도입한 형질전환미생물을 이용하는 기술 |
|
Biowell 및 Biocapping |
Mulch, 곰팡이 균사 혹은 조류(algae)와 같은 생물 재료를 이용한 장벽을 만들고 그 안에 오염물질을 가두어 오염물질의 이동을 방지하고 오염물질을 분해 혹은 무독화 시키는 기술 |
|
Biobeads |
다공성 폴리머에 미생물을 주입하여 오염의 문제가 되는 곳에 이용하는 기술 |
|
전달 및 검출시스템 |
지하수 혹은 균열된 기반암 등 미생물과 영양 첨가물들이 도달하기 어려운 지역의 정화에 전달시스템 개발기술 |
|
Biofilters |
다량의 미생물을 함유한 필터로서 높은 이온교환 능력을 지니며 습한 환경에서도 사용 가능한 기술 |
|
복합기술/Phasic 정화방법 |
하나 이상의 생물정화기술과 함께 다른 정화기술들을 복합적으로 사용하여 오염물질 정화 효율을 높이는 기술 |
|
신규 영양 첨가물을 통한 정화능력향상 |
미생물 생존력 및 생물정화 효율을 높이기 위해서 첨가되는 lactate, 질소 첨가제 등 신규 영양물질 개발기술 |
출처: BT기술동향 보고서-환경생명공학, 생명공학정책연구센터, 2008
다. 국내 현황
국내 환경생명공학에 대한 본격적인 투자는 1994년에 과기부 주관의 국가생명공학 기본계획인 ‘제1차 생명공학육성기본계획’과 G7 프로젝트를 통해 시작되었다. 또한 환경부의 환경공학기술개발사업, 차세대핵심환경기술사업, 농림수산식품부의 농림기술개발사업 등을 통해 환경생명공학 관련 연구개발을 지원하고 있다.
[표 4-5-2-2] 국내 생물정화 관련 주요 과제(2002~2007년)
|
과제명 |
정부투자 (백만 원) |
연구개발사업 |
연구수행 기관 |
주관 부처 |
|
환경생명과학 연구센터 |
3,500 |
국가핵심연구센터육성 |
경상대학교 |
교육과학기술부 |
|
속성수품종육성시험 |
1,743 |
임업시험연구 |
임업연구원 |
산림청 |
|
하천수질개선 및 복원기술개발 |
1,350 |
한국과학기술연구원 |
한국과학기술 연구원 |
교육과학기술부 |
|
유류오염토양 지하수의 저온열처리 및 생물학적 정화기술을 연계한 동시복원기술 개발 |
1,144 |
차세대핵심환경 기술개발 |
(주)오이코스 |
환경부 |
|
독성유기화합물오염 퇴적토의 생물정화기술 개발 |
884 |
차세대핵심환경 기술개발 |
한국해양연구원 |
환경부 |
|
방사선이용 미생물자원 유용화 |
754 |
원자력연구개발 중장기계획 |
한국원자력 연구소 |
교육과학기술부 |
|
Phytoremediation용 유전자 발굴 및 형질전환식 물체개발 |
716 |
국가지정연구실 |
포항공과대학교 |
교육과학기술부 |
|
산림수토 보전 및 Phytoremediation |
482 |
국립산림과학원 |
국립산림과학원 |
산림청 |
|
토착식물을 이용한 중금속 오염 지역의 자연형 장기복원기술 개발 |
450 |
차세대핵심 환경기술개발 |
고려대학교 |
환경부 |
|
Geomicrobiology를 이용한 오염 토양 및 지하수의 자연정화형 복원 및 평가기술 |
450 |
차세대핵심 환경기술개발 |
한국과학기술 연구원 |
환경부 |
|
PCE와 TCE로 오염된 토양 및 지하수의 현장 생물학적 복원기술개발 및 상용화 |
410 |
차세대핵심환경 기술개발 |
(주)그린텍환경컨설팅 |
환경부 |
|
농업환경 오염복원기술 개발 |
377 |
농림기술개발 |
고려대학교 |
농림수산식품부 |
출처: BT기술동향 보고서-환경생명공학, 생명공학정책연구센터, 2008
환경생명공학분야도 국제환경의 변화에 따라 국내에서도 교육과학기술부 주관으로 국가 산업경쟁력 확보와 국가과학기술혁신을 위하여 중점국가연구개발이 추진되고 있으며, 이 가운데 생명공학실용화 연구분야에서 환경생명공학분야의 연구가 포함되어 중점국가 연구개발 산업 중에 하나로 주목을 받고 있다. 특히, 생물정화 기술개발을 위해 정부는 2002부터 2007년까지 다양한 부처의 연구개발사업을 통해 175억 원을 지원하였다(표 4-5-2-2). 여기에는 교육과학기술부가 전체연구비의 48%에 해당하는 85억 원 이상을 투자하였으며 다음으로는 환경부가 22%에 해당하는 38억 원을 투자하였다.
그러나 국내 환경생명공학분야의 기술과 연구개발 투자 현황은 아직 다른 분야에 비해 상대적으로 미약한 것으로 평가된다. 생물정화에 대한 정부투자는 2003년 이후에 증가추세가 둔화되는 양상을 보이고 있으며 환경생명공학기술로 분류될 수 있는 분야는 대부분 미생물, 식물 등 그 자체의 활용에 그치고 있으며 첨단 생명공학기술을 이용한 LMO 개발은 매우 빈약한 실정이다.
국내외 기술수준을 선진국과 비교해 보면 미생물 탐색기술과 대량배양기술은 높은 수준이나 미생물 제제화 기술과 안전성평가 기술 등은 상대적으로 낮은 수준으로 평가되고 있다.
[표 4-5-2-3] 생물정화 관련 선진국 대비 국내 기술 수준
|
기술분야 |
기술 수준 |
기술분야 |
기술 수준 |
|
탐색기술(스크리닝, 균주 보존 등) |
90 |
미생물 고정화 담채 개발 |
80 |
|
개량기술(유전공학, 형질전환 등) |
85 |
생산기술(발효공정, 바이오리액터, 분리정제 등) |
95 |
|
대량배양기술 |
90 |
모델 식물을 이용한 기초연구 |
70 |
|
미생물 제재화기술 |
80 |
오염지역 도입 가능 식물체 개발 |
80 |
|
안전성 평가기술(바이오센서 등) |
70 |
환경정화용 야생식물 발굴 |
50 |
출처: 한국생명공학연구원“생명공학기술의 현재와 미래(2판)-환경생명공학”
출처: BT기술동향 보고서-환경생명공학, 생명공학정책연구센터, 2008
라. 향후전망 및 발전방향
(1) 향후전망(시장분석 및 산업동향)
환경정화 및 설비 서비스 관련 세계시장은 2006년 2,085억 달러 규모로 조사되었다. 2006년과 2011년 사이 연평균 2.9%의 성장률을 달성하여, 2011년 환경정화 및 설비 서비스 관련 세계 시장은 2,409억 달러를 형성할 것으로 전망하고 있다(표 4-5-2-4). 2006년 시장에서 환경정화 및 설비 서비스 분야별로 고체 폐기물 처리가 50% 이상으로 가장 큰 부분을 차지하고 있으며 컨설팅과 공정이 23.2%, 복원 및 산업 서비스가 13.5%, 위험 폐기물 처리가 9.4%, 분석 서비스가 2.0%를 차지하였다. 지역별로는 미국 39.9%, 유럽 31.3%로 환경 산업에서 미국과 유럽이 큰 차이를 보이지 않으며 아시아-태평양이 22.3%의 시장을 형성하고 있다.
[표 4-5-2-4] 환경정화 및 설비 서비스 세계 시장현황 및 전망(2006~2011년)
(단위 : 십억 달러)
|
년도 |
2006 |
2007 |
2008 |
2009 |
2010 |
2011 |
누적연평균성장률 ('06∼'11년) |
|
시장규모 |
208.5 |
215.0 |
221.5 |
227.9 |
234.4 |
240.9 |
|
|
성장률(%) |
3.20 |
3.10 |
3.00 |
2.90 |
2.80 |
2.80 |
2.9 |
출처: Datamonitor, “Global Environmental Services” 2007.3
전 세계적으로 환경문제가 큰 이슈로 대두되면서 이에 따른 엄격한 국제 규정제정이 진행됨에 따라 환경생명공학분야도 산업의 경쟁력 확보차원에서 국제수준의 환경문제 대응기술을 적극적으로 추진 중에 있다. 특히 미국, 캐나다, 호주 등 선진국을 중심으로 경제적이고 자연친화적으로 오염원을 정화할 수 있는 환경생명공학기술들이 활발히 개발되고 있으며, 부가가치가 높은 상품이 개발되고 있는 추세이므로 산업화 정도와 시장규모는 더 커질 것으로 예상된다.
(2) 발전방향
환경생명공학기술은 에너지 절약형이면서 환경 친화형 기술로서 지속가능한 성장과 환경보전을 동시에 추구하는 미래 산업이다. 이 기술은 쾌적한 환경을 만들어나가 삶의 질 향상에 큰 영향을 미칠 것으로 기대된다.
생물정화와 관련된 국내 특허 상황을 살펴보면 해외 출원기관의 특허는 국내에 거의 진입하지 못한 상황으로 국내 기술시장을 보호하기에 상대적으로 유리할 수 있다. 또한, 21세기 국가 핵심산업으로 인식되고 있는 BT와 ET가 융합된 환경생명공학기술은 산업화와 발전 가능성이 높은 분야이다.
따라서, 다음과 같은 점들을 고려하여 국내 환경생명공학의 발전방향을 지속적으로 모색하여야 할 것이다. 첫째, 환경정화의 공익성을 고려하여 효과적인 생물정화를 위한 기초연구부터 산업적 활용까지 총괄적인 전략과 국가차원의 지원이 필요하다. 둘째, 생물정화의 기초연구분야의 국내 기술수준은 높은 수준인 것으로 평가되고 있기 때문에 지속적인 투자와 교육을 통한 관련기술의 축적과 인재 양성 프로그램의 개발이 병행되어야 한다. 셋째, 생물정화를 통한 환경복원기술은 오염지역의 자연환경 특성에 따라 그 세부방법이 달라지기 때문에 국내에서 개발된 기술이 국내 자연환경에 적용되었을 때 성공할 확률이 높으며, 국내 오염지역뿐만 아니라 환경이 유사한 해외의 오염지역에도 적용이 가능할 것이다. 넷째, 탄소배출권 규제와 같은 국제적인 환경보전에 대한 책임이 국가와 기업들에게 부가될 것이므로 이와 관련한 대비와 투자가 필요하다. 다섯째, 환경정화를 위한 최종 산물인 LMO의 위해성 평가 기술 확보와 안전관리 방안 마련을 위한 노력과 투자도 늘려야 한다.
3. 해양 생명공학
가. 개요
최근 생명공학기술은 산업분야와 사회를 급격하게 변화시키는 기술의 집합체로 평가되고 있다. 생명공학기술의 많은 적용 대상 중에서도 특히 해양분야는 대표적인 분야로 인식되고 있다. 그럼에도 불구하고 전 세계적으로 미국, 일본과 일부 급속히 발전하는 아시아 몇몇 국가를 제외하고는 해양생명공학기술이 적극적으로 활용되지 않는 것이 현실이다.
최근 유럽에서는 이와 같은 사실에 우려를 표하고 해양생명공학에 대한 중요성을 새롭게 인식하며 유럽국가 간 네트워크를 구축하는 등 다양한 투자와 계획을 시도하고 있다. 한편 국내에서도 해양생명공학의 중요성에 대한 정부의 인식이 달라지며 정부부문 투자를 활성화하려는 계획을 수립하고 있다. 따라서 국내에서도 해양생명공학의 기초학문 발전은 물론이고 산업화에 대한 새로운 전기가 마련될 것으로 예상된다.
나. 해외동향79)
해양생명공학분야의 국외동향은 (표 4-5-3-1)과 같다.
|
국가 |
대표기관 |
주요 연구동향 |
예산규모 및 비고 |
|
미국 |
매릴란드 대학 해양생명공학센터 (COMB) |
- 해양고세균 연구 - 해양미생물의 기능유전체학 - 해양세균으로부터 신규항생물질 개발 - 해양해면동물 대량중식 기술 개발 - 체사픽만의 청게 보존기술 - 실내 무방류 어류양식 시스템 개발 |
590만 US $ (2008) |
|
플로리다 아틀란틱 대학 (FAU) 생의과학 및 해양생명공학연구센터 하버 브랜치 해양연구소 (해양 생의과학 연구부) |
- 2003년도 설립 - 3500만불 규모의 연구예산 - 신규 의약품 및 진단 - 해양생물 수집 및 탐색 - 산학연계시스템으로 조직 |
|
|
|
스크립스 해양연구소 해양생명공학 및 생의과학센터 (CMBB) |
- 해양으로부터 새로운 치료 - 해양미생물 및 바이러스 - 해양의약품 생산을 위한 신규효소 및 대사과정 이용 - 미생물을 이용한 오염물질제거 - 생물발광 |
|
|
|
캘리포니아 대학 산타바바라 (UCSB) 해양생명공학센터 |
- 해양생물체의 나노스케일 구조형성의 해양생물공학적 연구 - 협동생명공학연구소: 육군연구소의 5000만불 연구지원 예산을 주관 |
|
|
|
광물관리서비스사 (MMS) 해안대연구소 (CMI)) 루이지아나 주립대학 (LSU) 캘리포니아 주립대학 (UCSB) |
- 해양 프랫트폼의 생물상 조사 및 이로부터 신규활성물질 탐색 |
|
|
|
캐나다 |
NRC Institute for Marine Biosciences
해양생명공학연구센터 Fisheries and Oceans Canada
Genome Canada
|
- 최근 어류 증양식 중심연구를 종료시키고 해양산업제품 개발 연구 주력 - Genomic program (Aeromonas salmonicida) - New biofuel from algae program - 2004년 퀘벡에 설립
- 어패류 관련 중점 연구
- 상용화 대상 해양생물에 대한 유전체연구 |
11-12 M Ca $ |
|
중남미 국가 |
브라질 (State University of Campinas) (Oswaldo Cruz Institute (IOC) Rio de Janeiro) |
- 산호서식 균류의 항생 및 항암활성 탐색 - PAHs 분해경로 연구 - 해양조류로부터 항 AIDS 화합물 연구 - dolabelane diterpene을 함유한 gel 개발 |
|
|
칠레 (Catholic University of Valparaso, Sergio Marshall) |
- 최근 정부로부터 적극적 지원 - 칠레의 증양식산업 지원 우선 - 연어 유전체프로그램 참여 - 어류와 어류질병의 분자생물학적 연구 및 백신 개발 |
|
|
|
쿠바 하바나유전공학 및 생물공학센터 (CIGB) Marine Bioproducts Research Center (CEBIMAR) Center for Fisheries Research |
- Tilapia의 형질전환 연구 - 어류 및 새우 성장홀몬 및 면역체계 연구 - 해양천연물연구
- 어류 증양식 및 어류 건강 |
|
|
|
멕시코 Ensenada Center for Scientific Research and Higher Education (CICESE) Autonomous University of Campeche (UAC) |
- 새우 연구 - 하수의 미생물학적 정화
- 미생물막에 관한 연구 |
|
|
|
호주 |
호주해양과학연구소 (AIMS) |
- 생리활성분자 탐색 - 해양생명공학 혁신기술 개발 - 열대생물 양식 |
- 172만 AST $ - 201만 AST $ - 318만 AST $ |
|
일본 |
일본해양과학기술연구독립법인 (JAMSTEC)
대학 및 연구소
|
- 심해생물연구 및 이의 산업적 응용
- 해양생명유전자원을 이용한 생물공학 활성화 및 환경문제 해결 · 지구온난화 · 환경오염 · 의약품 · 바이오에너지 · 식품 · 산업신소재 |
|
|
중국 |
국가제3해양연구소
중국과학아카데미 산하 청도 해양연구소 및 연대 해안대연구소
광주해양연구소
대학 및 산업체
|
- 심해미생물 균주 은행 구축 및 활용연구 - 해양미생물활용기술 - 조류활용기술 - 유류오염정화기술 - 해양바이오에너지
- 신물질탐색 및 개발기술
- 해양생명공학 기반기술 및 산업화기술 |
|
|
전미대륙 |
전미대륙 해양생명공학협회 (PAMBA) |
- 전미대륙 국가의 해양생명공학 네트워크 - 1998년 설립 - 12개국 125명 회원 |
|
|
미국, 영국, 독일, 프랑스, 이태리, 스페인, 벨기에, 호주, 뉴질란드 |
연구기관, 대학, 기업체 |
- 극지 해양생물 연구 - 유용물질 탐색 - 생리활성물질 탐색 |
- MICROMAT consortium (미국 유럽국가간 대표 연구집단 체제) |
[표 4-5-3-1] 국외 해양생명공학기술 연구동향
다. 국내동향
최근 국내에서는 해양생명공학에 대한 중요성을 재인식하고, 기획재정부, 교육과학기술부, 국토해양부, 농림수산식품부, 지식경제부 등 여러 부처가 참여하여 새로운 국가연구계획을 수립하고 있다. 2007년도 해양바이오분야 국가 R&D 예산규모는 430억 원으로 BT분야 총 예산규모 1조 5,063억 원에 대한 비중이 2.85%에 불과하다. 이를 2010년부터 2014년까지 전체 BT연구 예산대비 6% 규모로 확대하여, 총 6,615억 원을 투자할 계획이다. 본 계획에는 해양생명자원의 효율적인 발굴, 개발, 고부가가치화를 견인할 4대 중점추진분야로 해양생물기반, 생물생산, 해양신소재, 해양생태환경보전 분야가 포함되고, 핵심기술개발분야에는 단기집중투자기술, 중․장기투자기술, 지속투자기술 등 세분화된 투자전략 수립을 진행하고 있다.
2007년도 해양바이오분야 연구예산 투자현황은 국토부, 교과부, 지경부 등 3개 부처에서 전체의 96%를 수행하고 있으며 그 중 42%인 180억 원을 집행하는 국토부 해양생명공학기술 개발사업에 대한 현황은 다음과 같다. 국토부는 2008년도에 수립한 해양생명공학육성기본계획에 따라 육상자원 고갈에 대비하여 해양생명공학산업을 고부가가치 신 성장동력 산업으로 창출하려는 의지를 표명하였다. 또한 해양생물기반기술, 해양생물생산기술, 해양신소재개발기술, 해양생태환경보전기술 분야의 40대 중점기술 육성을 통하여 해양생명공학기술 세계 7대 강국 실현을 목표로 제시하였다.
사업내용은 2004년도부터 수행하던 기존의 해양극한생물분자유전체연구, 해양바이오프로세스연구, 해양천연물신약연구 등으로 구성된 해양생명공학기술개발사업에 2009년도 신규 사업으로 해양바이오에너지 개발 및 산업지원화 기술개발을 위한 신소재 개발기술 분야와 해외 해양생물자원 조사 확보를 위한 생물자원활용기술개발분야를 구성하여 추진하고 있다.
[표 4-5-3-2] 국토부 해양생명공학 사업(2009년도 현재)
|
사업분야 |
주요내용 |
주관연구기관 |
|
원천핵심기술분야 |
해양극한생물 분자유전체를 활용한 기술 개발 |
한국해양연구원 해양극한생물분자유전체연구단 |
|
생물공정기술분야 |
해양기능성 산업소재 개발 |
부경대 해양바이오프로세스연구단 |
|
신의약기술분야 |
해양바이오신약개발 |
서울대 해양천연물신약연구단 |
|
신소재개발기술분야 |
해양바이오에너지 개발 및 산업지원화기술 개발 |
한국해양연구원, 인하대 |
|
생물자원활용기술 개발분야 |
해외 해양생물자원 조사 확보 연구 |
한국해양연구원 |
|
인프라구축분야 |
해양생명자원 기탁등록기관 해양생명자원 표준화 및 통합 DB 시스템 구축 |
대학 및 기업체 |
라. 발전과제와 전망
최근에는 해양생명공학의 정의를 좀 더 단순화시켜 “해양생물 전체, 세포 혹은 분자수준에서 활용하여 사회에 이익이 되는 제품 혹은 모델, 문제점 해결을 제공” 하는 것으로 변화하고 있다. 또한 해양생명공학은 생명공학에서 다루는 보건의료 생명공학(red BT), 산업생명공학(white BT), 식량생명공학(green BT)를 포함한 매우 광범위한 활동을 대상으로 하고 있는 것이 특징이다.
해양생명공학은 이미 많은 예에서 인류의 윤택한 삶과 환경의 건강을 향상시키는 기술을 개발하고 제품을 완성하는 성과를 거두었다. 하루가 다르게 발전하는 해양생명공학의 잠재력을 나타내는 또 하나의 증거는 전 세계 시장 규모가 24억 달러에 이르고, 연간 성장률이 10%를 넘는다는 것이다. 이와 같이 해양은 생명공학산업에 많은 이익을 제공하는 것이 분명하지만 이 잠재력을 최대한 현실화시키기 위해서는 아직도 해결해야 할 많은 과제가 남아 있다.
해양생물자원에 접근하고 지속적으로 공급할 수 있는 방법이 필요하며, 해양생명체에 대한 더욱 많은 이해가 전제되어야 한다. 또 해양생물에 적용할 수 있는 분자생물학적 방법의 개발이 이루어져야 하며 탐사와 연구장비의 확보도 필수적이다. 여기에 장비의 집중화, 해양생명공학을 산업화하여 경제적 발전을 도모할 수 있는 정책적 유도 등이 절실하다.
앞으로 해양생명공학산업의 발전적인 목표를 달성하기 위한 우리의 당면과제는 아래와 같이 정리해 보았다.
[표 4-5-3-3] 해양생명공학산업의 당면과제
|
분야별 과제 |
세부사항 |
|
기술적 과제 |
새로운 해양환경을 탐사하고, 해양생물을 발견하기 위해 새로운 플랫폼, 도구, 실험방법을 개발하고, 그 지식들을 활용하여 유용한 제품 개발 및 환경문제를 해결. |
|
규제 및 법체계 |
신약개발 등 해양생물개발에 관련된 규제 및 법체계의 합리화가 선결. |
|
인력양성 |
해양생명공학 연구를 수행할 수 있는 전문인력 양성체계를 수립. |
|
정치적 과제 |
해양생물제품의 상용화로부터 얻어지는 수익과 기술의 공정, 공평한 분배는 물론이고 자연생물자원이 귀속되는 국가의 권리와 관련된 규정에 대한 동의. |
|
환경적 과제 |
상업적 잠재력이 높은 해양생물자원의 지속가능한 이용을 유지 가능케 하기 위해서 해양생물을 지속적으로 확보할 수 있는 대안을 강구. |
|
그 외의 과제 |
해양생명공학의 새로운 발견을 상업화 하기 위해서 학계와 산업계 및 혁신적인 기술벤처들 간의 강력한 협력체제가 필요. 해양생명공학의 최대한의 잠재력을 성취하기 위해서는 산학 공동협력관계 강화 및 기술이전의 용이성을 높이기 위해 관련 규정 및 법의 전면적인 재검토가 필요. |

생물자원 분야
1. 생물자원의 개요
21세기는 바이오경제시대라고 말한다. 현재 우리는 IT경제시대를 지나 바이오경제시대에 살고 있다. 바이오경제시대를 선도할 생명공학의 육성과 관련 산업의 발전을 위해서는 그 기본재료인 생명자원이 잘 활용되어야 한다. 생명자원(Bio-resource)이란 생명공학 연구와 산업에 활용될 수 있는 생물체와 이를 구성하고 있는 구성체를 말하며 이는 바이오경제를 지탱하는 무궁한 가치를 지닌 미래자원이다.
생명자원은 생물자원, 생물다양성자원, 생명정보로 구분할 수 있다. 그 중 생물자원(Biological resource)은 사람을 위하여 가치가 있거나 실제적 또는 잠재적으로 활용할 수 있는 생물체로 정의할 수 있다. OECD에서는 미생물, 식물, 동물, 인체유래물질 등, 배양가능한 생물체, 생물체의 복제 가능한 부분, 미배양 생물체, 그리고 이와 관련된 모든 정보를 포함한다고 정의(2001)하고 있다. 생물다양성(Biological diversity)이란 생태계 내의 생물종과 생물체의 다양성을 말하며 종(種)내·종(種)간 생물서식지와 생태계 다양성 정보를 포함한다(생물다양성협약, 1993). 생명정보(Bio-information)란 생물자원과 생물다양성으로부터 유래된 정보와 그것의 가공 처리된 정보를 말한다.
전 세계적으로도 생물다양성협약과 같은 국제협약에 따라 생명자원의 중요성을 강조하고 있으며 자연스레 생명자원주권에 대한 인식이 높아지고 있다. 특히 생물자원에 대한 접근과 이익 공유, 전통 지식 등을 주요 이슈로 국제적 논의를 지속해 오고 있다. OECD에서는 일찍부터 생명자원의 중요성을 인식하고 각국이 생물자원센터를 설립하여 생명자원을 확보하고 관리하여 효율적으로 활용하기 위해 국가인프라를 운영하도록 권고해 왔다. 대표적인 예로 전 세계 생물자원센터 네트워크(Global BRC Network, GBRCN) 구축에 노력하고 있으며 이를 위하여 OECD 생물자원센터 태스크포스(TFBRC)를 중심으로 생물자원정보 표준화를 추진해 왔다. 그 결과 생물자원센터 모범운영지침(Best Practice Guidelines for BRC, 2007)을 발표하고, 각국이 이를 운영할 수 있도록 권고하고 있다. 미국, 일본, 유럽연합 등 선진국은 물론 중국, 브라질 등의 거대경제 국가들도 생명자원의 확보와 관리에 집중하여 바이오경제 시대에 대비하고 있다.
현재 문제가 되고 있는 신종플루의 치료제인 타미플루도 중국의 토착식물인 스타아니스라는 생물자원으로부터 얻은 것으로 생물자원을 활용한 고부가가치 창출(매출액 9억 3천 800만 달러, 2009 상반기)의 대표적 사례로서, 주위 환경의 모든 생물자원이 농업, 환경, 의약 등 우리 삶의 질 향상과 밀접하게 관련되어 있음을 보여주는 표본이 되고 있다. 이처럼 다양한 생물자원으로부터 새로운 신약 개발과 같은 성공사례가 증가되면서 생물자원의 중요성에 대한 인식이 전 세계적으로 고조되고 있다. 그리고 선진 각국은 유용생물자원 선점을 위해 고부가가치 생물자원발굴(Bioprospecting) 사업을 국가중심으로 추진하고 있다.
생물자원을 활용한 제약, 농업, 환경 등 관련 산업의 세계시장 규모는 2003년에 약 8천억 달러였지만, 향후 10년 안에 2조 5천억 달러로 성장할 것으로 보고 있다. 생물자원에 대한 가치가 증가함에 따라 자원보유국과 자원가치발굴국 간의 지식재산권, 출처공개 등 이익 공유에 대한 대립이 첨예화되고 있다.
우리나라도 2007년 12월에 “국가 생명자원 확보·관리 및 활용 마스터플랜”을 수립하였고, 현 정부도 과학기술하부구조를 고도화하기 위해 577전략의 하나로 국가생명자원의 효율적 관리와 활용체계 확립을 추진하고 있다. 또한 “생명연구자원의 확보․관리 및 활용에 관한 법률”이 2009년 5월에 제정되어 유용생명자원의 확보와 고부가가치 바이오산업의 부흥을 이끌 생명자원 활용 활성화를 추진하고 있다.
2. 해외연구동향
가. 미생물자원
미국은 생물자원 세계 최대보유국으로 전 세계의 생물자원을 지속적이고 체계적으로 확보하며 생명과학과 생명공학분야를 선도하고 있다. 특히 미국미생물자원은행(American Type Culture Collection, ATCC)은 ‘Global Bioresource Center’를 표방하는 세계 최대, 최고의 생물자원관리기관으로 3,600여 주의 세균, 4,100여 주의 진균, 표준균주 등 2008년 현재 약 12만 주 이상의 생물자원을 확보해 관리하고 있으며 미국의 생물자원관리 중앙은행 역할을 담당하고 있다. 또 매년 10만 건 이상을 분양하는 세계 최대 생물자원관리기관을 운영하고 있다. 미국의 NSF는 ‘Microbial Observatory 프로그램’을 실행하여 차세대에 가장 각광 받을 생물자원 연구를 주도하고 있으며, DOE(미국 에너지성) 주도로 해양미생물에 대한 활발한 연구가 진행 중이다.
유럽의 여러 국가에서는 생물자원정보의 통합관리를 위해 생물자원정보네트워크(CABRI)를 설치하고, EU의 연구비 지원으로 유럽연합 각국의 생물자원센터의 정보를 통합해 관리하는 체계를 구축하여 유럽 내 모든 생물자원정보의 검색시스템을 운영하고 있다. 구체적으로 2008년부터 CABRI에 속해 있는 모든 유럽연합 내 생물자원센터가 참여하는 EU F7 프로젝트가 진행되고 있다. 유럽의 대표적 생물자원기관인 독일의 DSMZ는 세계 최고수준의 미생물, 특히 세균표준균주를 보유하고 있는데 보유한 15,000여 미생물 중에서 표준균주는 6,900종으로 세계 최대 규모이다.
일본의 NITE-BRC(NITE 생물자원센터)는 일본생물자원관리의 대표기관이다. NITE(National Institute of Technology and Evaluation)는 생물자원센터(NBRC), 게놈해석센터(GAC), 생물유전자원개발센터(NBDC) 등 3개 센터를 유기적으로 연계하여 생물자원 연구에 집중하고 있다. NBRC는 신종 미생물을 발굴해 수탁, 유전체분석, 단백질체분석까지 일련의 연구활동을 통해 미생물자원의 산업화에 역점을 두어왔으며 총 40,000주의 미생물과 42,000주의 DNA clone을 보유하여 연간 8,000건 이상의 자원을 분양하였다. 또한 생물자원개발을 위해 난배양성, 극한 미생물, 메타게놈의 수집을 위해 거대 프로젝트를 수행하고 있다.
특히 NBRC는 아시아 대부분의 국가들과 협력체계를 구축하고 자원부국인 아시아 각국으로부터 유용미생물 탐색사업을 지속적으로 추진하고 있는데 인도네시아, 태국, 몽고 등의 자원탐색에는 NBRC와 연계된 일본의 제약회사들이 적극적으로 참여하여 유용한 자원을 확보하기 위해 많은 투자를 하고 있다. 일본 이화학연구소 미생물보존센터(RIKEN BRC-JCM)는 2007년 예산 지원이 중단된 동경대의 균주은행 IAM의 자원을 모두 인수해 이화학연구소(RIKEN) 생물자원센터의 미생물부문으로 통합하여 RIKEN BRC-JCM으로 발전하였다. RIKEN_BRC는 미생물, 세포주, 실험동물, 실험식물, 유전공학, 생물정보 등 7개 분야로 구성되어 있고, 일본 내 25개의 생물자원기관을 연계하는 국가생물자원프로젝트(NBRP)를 수행하고 있다.
중국은 ‘국가중장기과학과기술발전기획강요(2006-2020)’에 근거하여 생물산업발전 ‘제11차 5개년 기획’에 따라 생물산업을 집중 육성하고 있으며, 중국과학원(CAS) 등을 위시한 중앙정부 주도로 생물자원을 관리하고 있다. 중국과학원 산하 중국일반미생물보존센터(CGMCC)를 중심으로 60여 개의 단위기관이 수집한 생물자원을 집중관리하기 위해 생물자원 확보와 개발에 연간 약 200억 원을 투자하고 지방정부별 거점센터를 마련하는 등 생물자원 신흥강국을 목표로 생물산업을 진흥시키고 있다.
나. 식물자원 분야
현재 세계적으로 보존 중인 식물자원(현지 외 보존)은 약 600만 점으로 이 중 약 11%인 65만여 점은 국제농업연구자문그룹(CGIAR) 산하 농업연구기관에서 보존하고 있다. 나머지는 각국에서 수집하여 유전자원은행사업으로 보존 중이다. 국가별 현황은 미국 51만 점, 중국 39만 점, 인도 34만 점, 러시아 32만 점, 일본 24만 점으로 알려져 있다.
미국의 유전자원관리는 농무성 산하 농업연구청(USDA ARS)에서 국립식물유전자원 시스템(National Plant Germplasm System)을 구축하여 전국에 걸쳐 20개의 유전자원 보존소를 운영하고 있다. 총 자원 수는 2009년 현재 512,000점(약 2,100속, 13,000종)에 달한다. 연간 약 170,000점의 유전자원 분양(2004~2008 평균)하고 있으며 약 2,000~3,000점(2004~2008 평균)의 유전자원을 매년 수집하고 있다. 그 전체적인 자원정보 관리는 미국 벨츠빌(Beltsville)에 있는 National Germplasm Resources Laboratory에서 하고 있다. 이 조직은 3개 유니트(Unit)로 구성(자원정보관리, 식물자원교환소, 식물병 연구)돼 있으며 자원정보관리(www.ars-grin.gov/) 는 42개 작물 유전자원 위원회의를 통해 운영되고 있다. 식물 유전자원 교환소(Plant Exchange Office)는 식물 유전자원 탐색 프로그램 운영하여 전 세계 유전자원을 도입 및 수집을 하고 있다. 연구용 모델 식물인 애기장대 돌연변이의 경우 Arabidopsis Biological Resource Center(ABRC)에서 종자 약 100,000라인 이상과 DNA은행을 구축하였다.
일본은 25개의 생물자원 연구기관을 연계하는 NBRP(National Biological Resources Program) 프로그램을 통해 연구모델 식물(Arabidopsis), 식량작물(벼, 밀, 보리 등), 가지과 채소작물(토마토), 그리고 화훼작물(나팔꽃, 국화 등) 등 각 작물별로 자국의 식물자원 관리체계를 구축하여 관리하고 있다. RIKEN BRC 식물팀에서는 식물세포주(35라인 개발), 식물 DNA, 추출물, 기타 연구용 식물(담배, 카사바 등), 애기장대 돌연변이 종자(약 47,917라인) 및 full-length clone(251,382클론) 등을 확보하여 보존하고 있다. 농업식물자원은 1983년 설립된 농림수산성 국립농업생물자원연구소 주도로 체계적인 보존과 관리체계를 구축(보존량 243,000점, 2008)하여 식물, 수목과 관련 DNA를 보존하는 중앙기관 역할을 수행하면서 대학, 민간기구, 국립연구기관, 공공기관과 연계협력하고 있으며, 식물자원과 유전자 정보를 지원하고 있다.
독일 Leibniz Institute of Plant Genetics and Crop Plant Research(IPK)는 약 147,000점(2009)의 식물종자와 영양번식체자원을 보유하고 일부는 지구온난화에 대비하기 위한 수단으로 식물종자의 극지보존사업을 진행하였다. 애기장대 돌연변이 종자는 유럽연합과 공동으로 NASC(European Arabidopsis Stock Center)를 운영하고 있으며, 식물세포주는 현재 약 700주가 보존, 관리되고 있는 DSMZ가 세계 최고의 보유기관이다.
중국의 식물자원은 중국 농업과학원 작물유전자원연구소를 중심으로 관리하고 있는데 국립종자은행은 장기 또는 단기보존을 하면서 별도의 중복 보존소를 운영하고 있다(보존량 390,000점, 2009). 또한 국립유전자원포장보존센터(National Field Gene Bank)를 25개 운영하여 영양체자원을 보존하고 있으며, 11개 지역농업과학원에서 12개소의 종자보존소를 운영하고 있다.
러시아는 바빌로프식물산업연구소(VIR)를 중심으로 식물자원을 보존관리하고 있는데 9개 작목별 전담부서와 자원수집, 분류, 보존, 교환(국외교환 포함), 기초연구 및 작물육종을 체계적으로 수행하는 기초연구실을 운영하고 있다. 12개 지역시험장과 연계하여 수집, 평가, 단기보존, 육종연구를 수행하며 전체 보존량은 320,000점(2006)으로 장기보존(Base Collection), 단기보존(Working Collection)으로 구분하여 운영하고 있다.
인도의 경우, 식물유전자원 관리는 국립식물유전자원국(NBPGR)에서 관리하면서 2개의 Councils 및 4개의 Committee를 보조기구로 운영한다. 총 340,000점(2007)을 보존 중이며 국립종자은행을 중심으로 장기보존, 지역시험장별 단기보존하며 영양체는 별도로 보존하는 등 체계화 되어 있다. 여기에 최근 백만 점 보존규모의 새로운 종자은행을 설립하였다. 고유식물자원이 풍부한 국가로서 자원개방은 철저하게 금지되어 있다.
영국은 식물유전자원그룹(UKPGRG)에서 식물자원의 연구와 수집을 총괄하고 있으며 작목별 17개 연구기관을 운영하고 있다. 또한 품종육성과 연계한 수집보존소에서 12만점을 보존하고 World Collection에 한하여 장기저장한다. 자원의 특성평가는 국가연구기관과 대학이 공동으로 실시하고 특수자원은 직접 보존하면서 자유로운 자원교환을 지향한다.
노르딕 4개국(핀란드, 노르웨이, 스웨덴, 덴마크)은 식물자원 공동이용체계를 구축하여 협력하고 있다. 종자자원은 스웨덴에서 2만 7천점을 보존하고, 영양체 유전자원은 핀란드 5개소, 노르웨이 9개소, 스웨덴 11개소, 덴마크 4개소에서 작목 단위별로 연구하고 있다. 국립작목연구기관과 대학이 공동으로 특성을 평가하고 있다. 자원의 접근에 대해서는 개방적이며, 자원 수집을 위하여 공동연구 형태로 동남아와 아프리카 지역 국가들을 지원한다.
다. 동물자원 분야
인간유전자해석프로젝트(Human Genome Project)가 완료된 후 신약개발 경쟁이 가속화 되고 있다. 질환관련 유전자, 그리고 효소타깃 신약개발과 기능해석을 위해서는 유전자변형실험동물의 이용이 필수적이다. 특히 난치성질병과 관련된 특정유전자가 과발현 또는 제거된 유전자변형실험동물의 개발과 이를 이용한 연구는 신약 개발과 인간 질병과 관련된 생물학 연구에 있어서 매우 중요하다. 선진 각국은 실험동물자원기관을 집중적으로 육성하여 연구용 동물자원을 독점하고 있다.
세계 최대 마우스자원센터인 미국의 Jackson연구소는 2007년도 예산이 약 1,500억 원으로 자원의 유지와 관리, 분양뿐만 아니라 실험동물자원관리에 필수적인 실험동물의 유전적 표준화와 병원성 미생물의 감염관리에 대한 기술서비스를 함께 제공하고 있다. 또한 미국은 NCRR과 NIH의 지원을 받는 지역별 마우스자원센터(MMRRC)도 운영하고 있다.
유럽은 국가별 중심마우스센터를 연결한 종합적 마우스자원관리(EMMA)가 대표적 기관이다. 일본은 북부의 RIKEN BRC와 남부의 CARD에 국가거점 마우스자원센터가 운영되고 있는데 아시아 최대의 마우스자원센터인 일본의 RIKEN BioResource Center는 2007년도 실험동물(마우스)분야 연간예산이 160억 원이며 대부분 정부의 지원으로 운영되고 있다. 자원 수집, 청정화, 계통유지, 동결보존 등 특수 마우스 계통의 유지 보존과 품질관리(미생물검사, 유전검사)를 주된 업무로 수행하고 있다. 국제적인 마우스유전자 녹아웃 프로그램이 2006년부터 2010년까지 진행 중이며 연간 3,700만 달러가 투자되고 있다.
선진 각국은 지브라피쉬 자원의 확보에 투자를 증가하고 있다. 미국은 NIH가 오리건대학에 Zebrafish Stock Center를 설치하여 예산을 전액 지원하며 독일은 국가차원의 지브라피쉬 돌연변이주 제조와 유지시설에 투자하고 있다. 일본은 유전발생학연구소를 중심으로 지브라피쉬를 이용한 동물장기 발생연구에 대한 연구비를 집중적으로 지원하며 싱가포르는 전 세계 지브라피쉬 연구자들을 집중적으로 유치하고 있다.
전 세계적으로 여러 형태의 초파리 스탁센터가 있지만 이들이 가지고 있는 초파리 돌연변이의 형태가 서로 달라 상호 보완적인 관계다. 대표적 기관으로는 미국 인디아나대학교의 블루밍톤 초파리 스탁센터(Bloomington Drosophila Stock Center), 일본 국립유전학연구소의 초파리 스탁센터(Fly Stocks of National Institute of Genetics), 오스트리아의 비엔나 초파리 스탁센터(Vienna Drosophila Stock Center)가 있다.
세계 최대의 세포주자원은행은 미국의 ATCC로 80여 생물종의 3,400 cell line과 950여 암세포주도 보유하고 있다. 영국의 ECACC, 독일의 DSMZ, 일본의 JCRB 등도 세계적 세포주자원은행이다.
3. 국내연구현황
가. 미생물자원
우리나라에서 생물자원을 확보하고 관리하는 기관으로는 한국생명공학연구원(KRIBB)의 생물자원센터(KCTC/BRC)가 대표적이다. 생물자원센터는 1985년 한국과학기술연구원(KIST) 유전자은행(KCTC)으로 출범하여 생물자원의 확보와 관리․분양을 시작하였고, 미국의 ATCC, 독일의 DSMZ, 일본의 NBRC에 대응하는 국내 최고이자 최대 자원관리기관이다. 2008년 전 세계에서 보고된 신종미생물자원의 20%(2008년 IJSEM 기준)를 기탁 받아 관리하여 독일의 DSMZ과 일본의 JCM에 이어 세계 3위의 신종미생물기탁기관으로서 명실상부 국가대표 생물기관으로서의 위상을 보여주고 있다.
또한 부다페스트조약에 의한 국제특허미생물보존기관(IDA)로서 국내 특허미생물기탁의 60%를 담당하고 있다. 교육과학기술부가 지원하는 국가지정연구소재은행사업은 1995년에 특수연구소재은행사업으로 시작되었으며, 특수연구소재생물자원을 확보해 관리하는 임무는 대학중심으로 하여 소규모로 수행하고 있다.
21세기프론티어연구개발사업 미생물유전체사업단은 2000년부터 유용생물자원을 발굴하기 위한 응용영역별사업을 추진해왔는데, 특히 신종미생물 발굴과 확보는 세계 1위의 성과를 나타내고 있다. 생물자원을 이용한 특허 출원을 살펴보면, 생명공학 특허(1985∼2004년)에서 생물자원 탐색분야의 비중은 미국특허 대비 약 3.2%이며 한국 전체 특허 대비 약 7.9%를 점유하고 있다. 국내 특허에서 미생물자원탐색 분야의 특허비중이 높은 편이다.
그러나 생물자원의 관리와 활용을 위해 통합시스템 구축과 인프라에 투자하는 선진국에 비교하면 아직 미흡한 수준이다. 국내 최고의 생물자원센터(KCTC/BRC)의 현황을 일본의 대표 생물자원센터인 NBRC와 비교하면 인력은 14%, 시설은 16%, 연구비는 13%, 보유자원은 40% 수준으로 크게 미흡한 수준(2008년)이다.
미생물자원은 세계균주보존연맹(WFCC)에 등록된 건수인 약 67,000주를 근거로 볼 때 전 세계 보유현황, 4.7%를 차지하여 세계 9위의 수준이다. 이를 확대하기 위해 정부에서는 “생명연구자원의 확보․관리 및 활용에 관한 법률”을 제정하고 연구성과물제도의 활성화를 통해 생물자원의 확보와 활용을 강화하고 있다. 즉, 국가생물자원의 확보를 우선으로 하고 이를 관리하며 활용하는 선순환 종합관리체계 구축으로 효율적인 집중 관리와 활용을 추진하고 있다.
나. 동물자원
동물자원은 각종 질환의 새로운 타깃을 발굴하고 신약과 치료법을 개발하는데 필수적이다. 우리나라 생명공학연구에 필요한 동물자원의 인프라는 선진국에 비해 매우 미흡한 실정이다. 1990년대부터 초보적 투자와 인프라가 정비되기 시작했으나 연구용 유전자변형동물자원의 수요가 급격하게 증가하는 데에 비례한 투자확대가 없었다.
마우스는 인간과 같은 포유류로 유전자조작이 가능한 실험동물이며, 유전자기능 연구, 난치성 질병연구 등 질환모델동물로서 신약의 효능평가 및 독성평가 등에 활용되고 있다. 유전자변형마우스의 계통을 수립하는 데에는 많은 시간과 비용이 소요되며, 유지관리에도 고비용이 소요된다. 우리나라에서는 한국생명공학연구원에서 1990년대 초 정부지원 하에 실험동물의 수집, 유지, 보존과 분양을 담당하는 마우스 자원관리사업이 시작되었으나 연구현장의 수요를 반영하지 못한 채 초기 정부지원규모가 그대로 유지되고 있어 자원관리규모는 매우 미흡한 수준이다.
한국생명공학연구원에서는 국제적으로 공인된 모니터링센터(ICLAS Monitoring Subcenter Korea)를 운영하여 국내의 일부 실험동물시설에 대하여 병원성미생물 감염모니터링을 실시하고 있다. 근래에 연구개발에 따른 마우스 자원의 확대로 프론티어사업, 바이오개발사업 등 대형국책연구개발사업의 수행과정에서 유전자변형마우스를 개발 중이며 주요 대학과 연구소, 기업체 등 100여 기관에서도 실험동물시설을 설립하여 운영하고 있다. 최근에는 한국분자세포생물학회 마우스분과를 중심으로 유전자변형마우스의 대량생산 프로그램을 추진하고 있다.
1995년 경북대학교 생명공학부는 미국 NIH로부터 지브라피쉬를 도입하여 연구소재로 이용한 것을 시작으로 2003년 과학기술부의 국가지정 연구소재은행(KNRRC)인 지브라피쉬 장기발생변이주은행(ZOMB)으로 지정되어 현재까지 약 70여 종의 지브라피쉬 변이주를 제조하였고 각종 인체질환 동물모델로서 유지해 오고 있다. 국내에 지브라피쉬를 이용하는 실험실은 대학과 연구소를 포함하여 약 20여 개가 있지만 고가의 연구장비 구입과 체계적인 Zebrafish Stock Center의 확충을 위한 정부지원은 거의 없는 실정이다.
(주)제넥셀-세인은 게놈 수준의 형질전환 초파리 라이브러리를 구축하였다. 2000년부터 3년에 걸쳐 10만 개의 독립개체 형질전환라인을 생산하고 annotation과 유전정보DB 구축을 완료하였다. 현재는 GeniSys 시스템, 관련 DB와 시설을 포함한 라이브러리 Stock Center를 한국과학기술원 의과학연구센터에 무상으로 양도하였고, 정부는 초파리 라이브러리를 유지하기 위해 일부 연구비를 지원하였다.
1987년 서울대학교 의과대학 암연구소가 한국인에서 유래한 대장암세포주를 처음으로 국제 학술지에 보고하였다. 동 연구실에서 각종 암 세포주를 개발한 후, 이들 세포주는 서울대학교에 위치한 한국세포주은행에서 관리되고 있다. 초대세포배양(primary cell culture)을 통해 개발되는 세포주 이외에도 유전자를 도입하여 구축된 세포주들이 많이 보고되고 있으나 제대로 활용되지 못하고 사장되는 경우가 많다. 따라서 이들 세포주들을 개발자로부터 수탁 받아 품질관리, 증식, 보존, 분양하는 일련의 제도적 장치 마련이 시급하다. 한국세포주은행(Korean Cell Line Bank)은 국가지정연구소재은행사업으로 지원을 받고 있으며 미국 ATCC, 영국 ECACC, 독일 DSMZ, 일본 JCRB 등과 함께 세계 5대 세포주은행으로 성장하였다.
1993년부터는 부다페스트조약에 의한 국제특허미생물보존기관(IDA)로서 국제특허세포주 기탁업무를 수행하고 있다. 한국생명공학연구원(KRIBB)의 생물자원센터(KCTC/BRC)에서도 일부 세포주를 관리하고 있으며, 세포주의 특허수탁(국내, 1985부터, 국제, 1990부터)도 수행하고 있다.
다. 식물자원
우리나라의 식물자원의 보유 현황은 8,271종으로 영국 1,550종, 독일 2,600종, 일본 4,700종, 미국 16,302종, 중국 18,000종에 비교하여 결코 적은 종이 아니다. 이 중에서 특산식물이 407종, 자생식물은 4,158종이며 고등식물은 4,662종(선태류 691종 포함), 하등식물(규조류, 편모류, 담수녹조류, 해조류 등)은 3,609종이다. 한국에 존재하는 식물은 전체 세계 식물 자원의 약 3%를 차지하고 있다.
또 농림수산식품부 소속 기관에서 국내 식물 종자와 영양체 2,773종과 삼림 유전자원 3,963종 등 전체 6,736종을 보존하는 관리체계를 구축하였고 기타 식물자원의 보존과 관리체계는 교과부, 환경부 등에서 수행하고 있다. 농촌진흥청 산하 국립농업유전자원센터에서 농업유전자원의 보존 및 관리체계를 구축하여 종자유전자원 1,777종 약 154,695점과 식물영양체(26,175), 미생물(19,027), 가축(47,366), 누에(1,005)등 총 248,268점의 농업유전자원을 보존하고 있다(http://genebank.rda.go.kr/).
그러나 우리나라가 확보한 식물자원(종자)은 약 15만 점으로 미국(50만 점)의 1/3, 중국(38만 점)의 1/2.5, 일본(28만 점)의 1/1.8수준에 불과하다. 전체 보유 종자유전자원 중에서 식량작물이 117,281점으로 비중이 가장 높으며 채소, 특용작물, 사료작물 등 타 작물과 야생 식물의 종자 보유는 상대적으로 저조한 실정이다.
교과부에서 생물다양성지원사업, 국가유전체정보센터구축, 유전자원지원을 비롯한 활용사업을 지원하여 국내 생물자원의 탐색, 수집, 동정, 보존, 분양으로 생물산업의 기반을 확충하고 국내 식물자원의 정보기반을 구축하는 통합 네트워크를 구축하였다. 이를 통해 유용 수생식물의 자원정보은행 구축이 이루어졌다.
연구모델 식물의 경우 국가지정연구소재은행사업에서 지원한 Arabidopsis 돌연변이체은행사업에 한정되어 매우 미비한 수준이다. 현재 애기장대, 벼, 콩, 포플러, 포도 등의 염기서열 분석이 완료되었으며 가지과 작물인 토마토의 염기서열 분석이 국제 컨소시엄을 통해 진행되고 있다. 국내 식물자원의 효율적인 활용을 위하여 정보화 체계구축이 시급하며 다양한 식물자원 인프라가 하나의 기관을 중심으로 컨소시엄 형태로 발전하여 수요자로 하여금 정보에 접근이 용이하도록 통합관리체계가 구축되어야 할 것이다.
4. 생물자원의 발전과제
국내의 생물자원 관련 산업은 생명공학기술의 발전에 힘입어 빠르게 성장하고 있다. 이런 산업의 기반이 되는 생물자원의 국내 보유현황은 미국, 일본 등 선진국에 비하여 미흡한 수준이다. 그 중 미생물자원은 약 67,000주로 전 세계 대비 4.7% 수준이다. 다행히 미생물분야의 신종 발굴기술은 세계적 수준으로 한국이 2006년부터 2009년까지 3년간 세계 1위를 선점하고 있다. 그러나 국내 공공기관에 확보된 식물자원의 규모는 식물자원(종자) 약 19만 점으로 미국(47만 점)의 1/3, 중국(38만 점)의 1/2.5, 일본(28만 점)의 1/1.8수준에 불과한 실정이다.
이와 같은 우리나라의 빈약한 자원보유 현황을 극복하고 생명공학 강국으로 발전하기 위해서는 보유하고 있는 모든 생명자원을 통합해 관리하는 국가중심의 네트워크 구축이 필수적이다. 이를 위하여 우리나라도 “국가 생명자원 확보·관리 및 활용 마스터플랜”을 수립하고, “생명연구자원의 확보․관리 및 활용에 관한 법률”을 제정하여 유용생명자원의 확보와 고부가가치 바이오산업의 부흥을 이끌 생명자원의 활성화를 추진하고 있다. 앞으로 실물자원과 정보의 유기적이며 종합적인 관리시스템을 활용하여 바이오경제시대의 견인차 역할을 담당할 것으로 기대한다.
제5장
생명공학 관련 법제도 현황


바이오 안전성 동향
1. 서론
유전자변형기술, 세포융합 등 현대 생명공학기술의 발달로 다양한 유전자변형생물체(LMO, Living Modified Organisms)가 연구·개발되고 산업화 됨에 따라 LMO로 인해 인간의 건강과 환경에 미칠 위해요소를 사전에 방지하기 위한 노력이 진행되어 왔다. 이와 관련하여 국제연합(UN) 산하 환경전문기구인 유엔환경계획(UNEP, United Nations Environment Programme)은 「생물다양성협약」(CBD, Convention on Biological Diversity)의 부속서인 「바이오안전성에 관한 카르타헤나의정서」(BSP, Cartagena Protocol on Biosafety)가 2000년 1월 캐나다 몬트리올에서 개최된 CBD 특별당사국총회에서 채택되었다. 동 의정서는 2003년 6월 팔라우가 50번째로 비준함에 따라 그로부터 90일 이후인 2003년 9월 국제적으로 발효되었고, 2009년 10월 기준 157개국80)이 가입하고 있다.
한편, 우리나라는 지난 2000년 9월 의정서에 가입 의사를 밝혔으며, 시민단체와 더불어 바이오안전성의 확보를 요구하는 목소리가 커졌다. 이를 위해 의정서 국내 이행체제를 구축하는데 초석을 마련하고자 2001년 3월 지식경제부(舊 산업자원부)가 주관이 되어 「유전자변형생물체의 국가 간 이동 등에 관한 법률」(이하 ‘LMO법’)을 제정․공포하였다. 이후 각 부처별로 동법 시행에 필요한 하위 법령 제정을 위해 노력해 왔고, 2007년 8월 이러한 노력의 마지막 단계로서 LMO법 통합고시안이 입법예고 되었다. 이후 2007년 10월 3일 의정서에 비준함으로써 143번째 가입국이 되었으며, 그로부터 90일 이후인 2008년 1월 1일에 의정서 및 LMO법이 국내에 시행되었다.
이에 본 절에서는 지난 2007년부터 2009년 상반기까지의 LMO를 둘러싼 국제법적 논의 동향과 더불어 우리나라가 동 의정서의 이행과 국내 바이오안전성 확보를 위해 어떠한 노력을 전개해왔는지 등에 대해 기술한다.
2. LMO를 둘러싼 국제법적 논의 동향
가. 의정서 당사국총회 논의 동향
2007년 10월에 의정서 비준서를 유엔사무국에 기탁하고, 의정서와 LMO법이 2008년 1월부터 국내에 발효됨에 따라 우리나라는 비로소 당사국의 자격을 갖추고 의정서 관련 논의에 대응하게 되었다. 2008년 5월 12일부터 16일에 걸쳐 독일 본에서 개최된 제4차 의정서 당사국총회에는 지식경제부 바이오나노과장을 수석대표로 하여 외교통상부, 농림수산식품부, 보건복지가족부, 질병관리본부, 농촌진흥청, 국립수산과학원, 국립산림과학원, 국립환경과학원, 국립수의과학검역원, 한국바이오안전성정보센터 등 관계기관 담당자 총 15명이 참석하였다.
제4차 당사국총회에서는 의무준수위원회, 바이오안전성정보센터, 능력형성 및 전문가명부, 재정메커니즘과 예산, 취급․운송․포장 및 식별, 위해성평가와 관리, 책임 및 피해배상, 보조기구, 모니터링 및 보고, 평가 및 재검토, 사회경제적 고려, 공공인식 및 참여, 통보 요건 등에 대한 제반사항을 논의하였다. 그 중에서도 책임과 피해배상에 관련된 논의는 총 4차례에 걸친 전문가회의의 과정을 거쳐 제4차 당사국총회에서 책임 및 피해배상과 관련한 최종 규칙을 채택하려 시도하였다. 그러나 당사국 간의 의견 차이를 좁히지 못하고 2010년 10월 일본 나고야에서 개최 예정인 제5차 의정서 당사국총회로 그 결정 절차가 연기되었다.
나. 경제개발협력기구(OECD) 논의 동향
경제협력개발기구(Organization for Economic Cooperation and Development, OECD)는 그 임무를 지속가능한 경제성장 지원, 고용창출, 삶의 질 향상, 경제적 안정성 유지, 타국가의 경제개발 지원, 세계 무역신장 기여로 정하고 있다. 이를 위해 OECD는 회원국의 정책 경험을 비교하고, 공통의 문제에 대한 해답을 추구하며, 우수실행방법을 개발하고, 국내외 정책의 조화를 위한 체계를 제공하고 있다. 1960년 20개국에서 출발하여 현재 회원국 수는 30개국이며 우리나라는 1996년 12월 가입하였다.
OECD는 의정서 이행에 있어서, OECD 회원국 간의 생명공학기술 규제법 및 제도와 관련된 국가 간 규제에 대해 조화를 유지하고, 무역마찰을 최소화하기 위하여 1995년 4월 전문가 그룹회의를 처음 구성하여 약 9개월 간격으로 실무회의를 개최하고 있다. 회의의 주요 목표는 워크숍 등을 통해 LMO의 위해성평가 국제표준기술서들의 기초 체계를 구축하고 다음 단계인 바이오트랙 온라인(Bio-Track Online, OECD LMO관련 데이터베이스)을 확립하여 회원국과 비회원국 모두에게 활용토록 하는데 있다. 이에 따라 2008년 6월(제21차)과 2009년 2월(제22차)에 각각 생명공학 규제감시 조화 작업반회의와 신규 식품사료안전성 작업반회의가 개최되었다.
OECD에서는 유전자변형 종자와 농산물의 낮은 수준 혼입(LLP)에 대한 문제가 제21차 회의부터 OECD 차원에서 쟁점화 되고 있다. 실제로 유전자변형 종자와 농산물의 낮은 수준의 혼입에 의한 유통과 환경방출은 현실적으로 통제하기 어려운 사항이며, OECD뿐만 아니라 전 세계 곡물 수입국들의 현실적인 이슈이다. 그러나 OECD 차원의 조사와 공식보고서가 발간될 경우, 이에 대한 영향력을 고려하면 이를 쉽게 허용할 수도 없는 것이 수입국들의 입장이다. 왜냐하면 몇 년간의 조사로 실질적이고 과학적인 위해성을 발견하기는 어렵기 때문이다. OECD의 유전자변형 종자와 농산물의 낮은 수준 혼입이 미치는 영향에 대한 조사사업 추진은 이러한 입장 차이에 의해 상당기간 사업추진에 시간이 걸릴 것으로 전망된다.
또한 우리나라도 의정서 당사국이 됨에 따라 LMO의 연구개발과 관리 현황을 쉽게 파악할 수 있는 데이터베이스 개발이 필요하며, 이를 통해 LMO 안전성 규제의 국제적인 협력에 노력해야 할 것이다. 특히 우리나라는 유전자변형 작물의 수입국으로서 이에 따른 소비자 안전, 환경위해성 등 안전성 관리가 중요한 바, OECD 회원국과 중국, 아르헨티나, 브라질 등 관련국가의 동향을 파악하기 위해서라도 OECD 생명공학관련 작업반회의(WG), 전문가회의(Task Force) 등 관련 워크숍에 대한 국내 각계 전문가의 적극적인 참여와 자발적인 기여가 필요하다.
다. 세계무역기구(WTO) 논의 동향
LMO 제품에 대한 규제는 소비자보호와 국민건강, 자연생태계의 보호와 관련된 문제이자 무역 분쟁을 야기할 수 있는 국제통상법 상의 문제이기도 하다. 의정서는 LMO의 국가 간 이동을 규제하는 최초의 국제협정으로 ‘위생 및 검역협정(SPS 협정)’과 달리 ‘사전주의 원칙(Precautionary Principle)’에 입각하여 국가 간 이동을 규제할 수 있는 수입국의 권리를 인정하고 있다. 이에 반해 WTO가 관할하는 SPS 협정은 원칙적으로 LMO 제품에 대한 위생과 검역 규제 조치가 충분한 과학적 증거와 위해성 평가에 입각할 것을 요구하고 있다.
LMO가 인체와 생태계에 미치는 위해 가능성은 국내외 환경단체에 의해 꾸준히 제기되어 왔으며, LMO의 안전성에 관한 소비자의 불신과 LMO에 대한 국가 간의 상이한 규제는 생산자와 소비자 간의 갈등을 넘어 국제 통상 분쟁으로 확산되고 있다. 특히 의정서에 입각한 사전주의 원칙에 따르는 규제 조치가 SPS 협정에 합치되는지의 여부가 논란이 되고 있는데, 미국과 유럽연합(EU) 간의 LMO 통상 분쟁(이하 ‘EC-LMO 사건’)은 그 대표적인 예이다(표 5-1-2-1).
EC-LMO 사건은 LMO 제품의 안전성과 위해성에 관련된 각국의 규제 차이로 야기된 분쟁이라 할 수 있다. 이는 1998년 이후 지속된 LMO 제품에 대한 EU의 수입규제에 대해 미국이 지금까지의 소극적 자세를 철회하고 2003년 5월 WTO에 정식으로 회부하면서 LMO 제품의 유통승인 정지(Moratorium)와 유통승인 금지 조치 철회를 요구함으로써 촉발된 분쟁이다.
이에 따라 2006년 11월 21일 WTO는 최종판결문을 통해 과거 6년 동안 끌어온 유럽연합(EU)과 미국 간의 LMO 통상 분쟁에서 EU회원국의 유전자변형식품에 대한 금지조치가 국제무역 규정 위반이라는 결정을 내렸다. 또한, 분쟁조정 패널은 EU집행위원회에서 이미 승인을 획득한 LMO 제품에 대해서도 자국의 금지령을 이용하여 금지 조치를 선언한 EU 6개국(오스트리아, 벨기에, 프랑스, 독일, 이탈리아, 룩셈부르크)에 대해서도 위법 판결을 내렸다. 하지만, 소송을 제기한 미국과 캐나다, 아르헨티나의 주장을 전폭적으로 지지하지는 않았으며, 유전자변형식품의 안전성, EU의 LMO 규제의 기본적 체제 등 현재 논란이 이루어지고 있는 문제에 대해서는 판결문에서 다루지 않았다.
이 WTO의 최종판결 결과는 LMO 제품에 대한 수입규제가 유럽연합(EU)과 유사한 WTO 회원국들의 LMO 관리정책에 상당한 영향을 미칠 것으로 예상되었다. 특히, 우리나라를 비롯한 여러 나라와 자유무역협정(FTA) 체결을 협상하고 있는 미국은 미국산 LMO 제품의 유통판매에 영향을 미치는 각종 규제 장벽을 WTO 판정에 부합되도록 철폐할 것을 요구할 근거로 이용할 수도 있다.
[표 5-1-2-1] 미국과 EU간의 LMO 통상 분쟁 사건 경과(2003~2008)
|
시기 |
세부 내용 |
관련 WTO 규정 |
|
2003. 5.12 |
미국의 WTO 제소 결정 |
- |
|
2003. 5.13 |
미국, 캐나다 및 아르헨티나의 협의 요청 |
1994년 GATT 제XXIII조, DSU 제4조, SPS 협정 제11조 |
|
2003. 6.11 |
미국, 캐나다 및 아르헨티나에 의한 협의요청에 대한 EC의 수락 |
DSU 제4.7조 |
|
2003. 7.28 |
미국-EC간 양자협의(제네바, 스위스) 무산 |
- |
|
2003. 8. 7 |
미국, 캐나다 및 아르헨티나 각각 패널설치 공식 요청 |
DSU 제4.7조 |
|
2003. 8.22 |
미국, 캐나다 및 아르헨티나 공동 요청에 따라 단일패널 설치와 동 패널이 표준위임사항 (Standard Terms of Reference)을 가지는 것에 합의 |
DSU 제9.1조, 제7조 |
|
2003. 8.29 |
호주, 칠레, 중국, 콜롬비아, 엘살바도르, 온두라스, 뉴질랜드, 노르웨이, 페루, 대만, 태국, 우루과이, 아르헨티나, 브라질, 캐나다, 멕시코, 파라과이 및 미국이 패널절차에 참여할 제3당사국 지위 획득 |
DSU 제10.2조 |
|
2004. 2.23 |
미국, 캐나다, 아르헨티나에 의한 패널 구성 공식 요청 |
DSU 제8.7조 |
|
2004. 3. 4 |
패널 구성(Mr.Christian Haberlil, Mr. Mohan Kumar, Prof. Akio Shimizu) 결정 |
DSU 제8.7조 |
|
2004. 7.12 |
6개월 내 최종보고서 완성 불가 입장 통보 |
DSU 제10.8조, 제10.9조 |
|
2004. 8.18 |
최종보고서 완성 소요시간 전달 |
- |
|
2004.11. 2 |
최종보고서 완성 소요시간 전망 |
DSU 제12.9조 |
|
2005. 6.15 |
최종보고서 완성 소요시간 연장 |
DSU 제12.9조 |
|
2005. 8.15 |
최종보고서 완성 소요시간 연장 |
DSU 제12.9조 |
|
2005.12.21 |
최종보고서 완성 소요시간 연장 |
DSU 제12.9조 |
|
2006. 2. 7 |
잠정보고서 비공개 회람 |
DSU 제15조 |
|
2006. 3.30 |
최종보고서 완성 소요시간 연장 |
DSU 제12.9조 |
|
2006. 5.10 |
최종보고서 당사국 배포 |
DSU 제16.3조 |
|
2006. 9.29 |
최종보고서 회원국 회람 |
DSU 제16.1조 |
|
2006.11.21 |
최종보고서 채택 |
DSU 제16.4조 |
|
2006.12.19 |
EC, 합리적 이행 기간 연장 요청 |
DSU 제16.4조 |
|
2007. 6.21 |
합리적 이행 기간 합의(최종보고서 채택 후 12개월, 2007.11.21) |
DSU 제21.3조 |
|
2007.11.23 |
합리적 이행 기간 연장(2008.1.11까지) |
DSU 제21.3조 |
|
2008. 1.11 |
EC, 현황보고서(Status Report) 제출 |
DSU 제21.6조 |
|
2008.12.12 |
합리적 이행 기간 연장(아르헨티나 및 캐나다, 2009.3.1까지) 및 추후 다시 논의키로 합의 |
DSU 제21.6조 |
출처: 2009 바이오안전성백서
3. 국내 법제도 동향
가. LMO법 정비 동향
우리나라는 2000년 9월 6일 의정서에 향후 비준 의사가 있음을 표명(의정서 서명)하였으며, 의정서 이행의 국가책임기관인 지식경제부(舊 산업자원부)는 의정서 가입에 대비하여 범국가적 차원에서 의정서의 국내 이행을 위한 법적 기반구축 작업을 진행하였다(표 5-1-3-1).
그 과정을 살펴보면 먼저 2000년 8월 10일부터 29일까지 「유전자변형생물체의 국가 간 이동 등에 관한 법률(LMO법)」 제정안을 입법예고하였으며, 공청회와 규제 심사 등의 절차와 2001년 2월 28일에 국회 본회의의 의결을 거쳐 2001년 3월 28일에 법률 제6448호로 LMO법이 제정․공포되었다. 또한, 2002년 2월에는 LMO법 시행령 및 시행규칙 제정 시안을 마련하여 관계부처 협의를 거쳐 2002년 6월 25일부터 7월 15일까지 입법예고를 실시(舊 산업자원부공고 제2002-127호)하였다. 이후 시행령은 2002년 12월 17일부터 2005년 9월까지 추가적인 관계부처 협의와 법제처의 심사를 거쳐 2005년 9월 30일 대통령령 제19062호로 제정․공포되었으며, 시행규칙은 2006년 3월 10일 舊 산업자원부령 제327호로 관보에 게재되었다.
2007년은 지식경제부를 중심으로 한 관계부처의 법적․제도적 정비과정이 마무리된 해였다. LMO 관계부처는 LMO법 시행의 구체적 절차를 담은 통합고시 제정안을 마련하고, 2007년 6월 ‘LMO법․제도 설명회’를 개최한 후 같은 해 8월 1일부터 8월 21일까지 입안예고를 실시(舊 산업자원부공고 제2007-272호)하였다. 그리고 자구 수정 등의 마지막 수정 작업을 거쳐 2007년 12월 27일 관보에 게재(과학기술부고시 제2007-19호, 농림부고시 제2007-80호, 산업자원부고시 제2007-153호, 보건복지부고시 제2007-105호, 환경부고시 제2007-189호, 해양수산부고시 제2007-115호, 식품의약품안전청고시 제2007-78호)됨으로써 통합고시가 확정되었다. 또한 LMO 수입승인과 취급관리에 관한 사항의 LMO법 적용은 국내 수입 날짜가 아닌 수출국의 선적 날짜를 기준으로 하는 ‘수입승인 등에 관한 적용례’를 골자로 하여 LMO법의 부칙 일부를 2007년 12월에 개정하였다(그림 5-1-3-1).
이와 같이 LMO의 안전성 확보를 위한 제반 법적․제도적 기반을 완료함과 동시에, 우리나라 정부는 의정서 비준서를 유엔사무국에 기탁(2007년 10월 3일)하여 의정서의 이행 계획을 국제사회에 알렸으며, 비준서 기탁 90일 이후인 2008년 1월 1일부터 의정서 및 LMO법이 국내에 발효되었다.
[표 5-1-3-1] LMO법 추진 경위
|
구 분 |
추진 내용 |
|
2000년 1월 |
「바이오안전성에 관한 카르타헤나의정서(바이오안전성의정서)」 채택 |
|
2000년 8월 |
「유전자변형생물체의 국가 간 이동 등에 관한 법률(LMO법)」 제정안 입법예고 |
|
2000년 9월 |
우리나라의 바이오안전성의정서 서명 |
|
2000년 10월 |
LMO법 제정안에 대한 공청회 개최 |
|
2000년 11월 |
LMO법 제정안에 대한 토론회 개최 |
|
2001년 2월 |
LMO법(안) 국회 본회의 의결 |
|
2001년 3월 |
LMO법 제정․공포 |
|
2002년 2월 |
LMO법 시행령 및 시행규칙 제정안 마련 |
|
2002년 6월 |
LMO법 시행령(안) 및 시행규칙(안) 입법예고 |
|
2003년 9월 |
바이오안전성의정서 국제적 발효 |
|
2005년 9월 |
LMO법 시행령 확정(관보 게재) |
|
2005년 10월 |
LMO법 시행규칙 제정안 관계부처 협의 |
|
2005년 11월 |
LMO법 시행규칙 제정안 법제처 심의 |
|
2005년 12월 |
LMO법․제도 설명회 개최 |
|
2006년 3월 |
LMO법 시행규칙 확정(관보 게재) |
|
2007년 4월 |
LMO법 통합고시 제정안 관계부처 협의 |
|
2007년 6월 |
LMO법․제도 설명회 개최 |
|
2007년 8월 |
LMO법 통합고시 제정안 입법예고 |
|
2007년 10월 |
바이오안전성의정서 비준서 유엔사무국 기탁 |
|
2007년 11월 |
LMO법․제도 찾아가는 설명회 개최(서울, 대전, 대구, 광주, 부산) |
|
2007년 12월 |
LMO법 일부 개정안 확정(관보 게재), 통합고시 확정(관보 게재) |
|
2008년 1월 |
바이오안전성의정서 및 LMO법 발효 |
[그림 5-1-3-1] LMO법 부칙 개정내용
|
부칙 제2조(수입승인 등에 관한 적용례) 제8조의 개정규정에 따른 수입승인 및 제25조의 개정규정에 따른 취급관리에 관한 사항은 이 법 시행 이후 수출국에서 선적(船積)한 유전자변형생물체부터 적용한다. |
나. LMO법 시행 및 안전관리계획 수립 동향
2008년 1월 1일부터 시행된 LMO법 및 동법 시행령과 시행규칙에 의하면, 그 용도에 따라 해당 LMO의 안전관리를 책임지고 있는 관계 중앙행정기관이 지정되어 있다. 이에 따라 시험․연구용 LMO는 교육과학기술부, 농업용․수산용 LMO는 농림수산식품부, 산업용 LMO는 지식경제부, 보건의료용 LMO는 보건복지가족부, 환경정화용 LMO는 환경부에서 그 안전관리를 책임지고 있다. 또한 의정서 이행에 대한 국가책임기관 역할은 지식경제부가, 의정서 이행을 위한 국가연락기관 역할은 외교통상부에서 담당하고 있다. 또한 국제바이오안전성정보센터(BCH)와의 정보교류 및 LMO관련 국내외 정보의 수집, 관리, 제공 등의 업무는 LMO법 제32조에 따라 국가책임기관에서 지정한 한국바이오안전성정보센터(Korea Biosafety Clearing House, KBCH)에서 담당하고 있다(그림 5-1-3-2).
[그림 5-1-3-2] 바이오안전성 국가관리 체계
|
|
|
|
|
|
바이오안전성위원회 (최고 심의기구) |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
국가책임기관(지식경제부) (의정서 이행 행정 담당) |
|
|
|
|
|
|
국가연락기관(외교통상부) (의정서 이행 연락담당) |
||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
한국바이오안전성정보센터 (정보 수집, 관리 등) |
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
교육과학기술부 |
|
농림수산식품부 |
|
지식경제부 |
|
보건복지가족부 |
|
환경부 |
|
국토해양부 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
시험․연구용 LMO의 수출입등에 관한 업무 |
|
농업용․수산용 LMO의 수출입등에 관한 업무 |
|
산업용 LMO의 수출입등에 관한 업무 |
|
보건의료용 LMO의 수출입등에 관한 업무 |
|
환경정화용 LMO의 수출입등에 관한 업무 |
|
해양용 LMO의 수출입등에 관한 업무 |
|||||||||||
이러한 관계부처별 역할에 따라 LMO법은 효과적으로 시행되고 있으며, 2008년 한 해 동안 식품용 옥수수(전분․전분당 제조용) 71만여 톤, 식품용 콩(식용유 제조용) 87만여 톤, 사료용 옥수수 704만여 톤, 기타 사료용 곡물(콩, 면실 등) 9만여 톤의 국내 수입이 승인되었다. 시험연구를 목적으로 하는 쥐, 세균 등의 LMO 110건이 수입신고 되었으며, 시험연구용 쥐 등 8건의 수출통보가 있었다. 또한 위해등급이 낮은 1, 2등급에 해당하는 LMO 연구시설 1,255건이 신고 되었으며, 상대적으로 위해등급이 높은 3, 4등급 연구시설은 총 7건이 허가되었다. 이렇게 신고 또는 허가받은 연구시설에서는 LMO관련 연구를 진행할 수 있으나, 환경방출실험 등 위해 가능성이 높은 실험과 연구개발 행위에 대해서는 별도의 승인절차가 필요하다. 이에 따라 41건의 LMO 연구개발이 승인되었다. 그리고 국내 수입 이전단계의 필수 안전관리 절차인 위해성심사 단계에서는 농업용 45종, 식품용 43종이 심사 완료되었으며, 우리나라에서는 이렇게 심사 완료된 LMO만이 국내에 수입될 수 있다(표 5-1-3-2).
[표 5-1-3-2] LMO 수입승인 등 현황(2008년 LMO법 시행 이후)
|
구 분 |
건수, 톤 |
관계기관 |
|
|
위해성심사 |
농업용 |
45종(누계) |
농촌진흥청 |
|
식품용 |
43종(누계) |
식품의약품안전청 |
|
|
수입승인 |
옥수수(식품용) |
716,227톤(38건) |
식품의약품안전청 |
|
콩(식품용) |
876,657톤(47건) |
식품의약품안전청 |
|
|
옥수수(사료용) |
7,044,368톤(2,515건) |
농산물품질관리원 |
|
|
콩, 면실 등(사료용) |
93,833톤(708건) |
농산물품질관리원 |
|
|
수입신고 |
시험연구용(쥐, 세균 등) |
110건 |
교육과학기술부 |
|
수출통보 |
시험연구용 쥐 등 |
8건 |
지식경제부 |
|
연구 시설 ․ 연구 개발 |
시설신고(1․2 등급) |
1,255건 |
교육과학기술부 및 관계기관 |
|
시설허가(3․4 등급) |
7건 |
교육과학기술부, 질병관리본부 |
|
|
연구개발 승인 |
41건 |
교육과학기술부 및 관계기관 |
|
출처: LMO법 시행에 따른 ‘관계기관통합정보망’에 등록된 정보를 기준으로 작성
이와 같이 효과적으로 시행되고 있는 LMO법 및 시행령․시행규칙, 통합고시 등 LMO 안전관리체계를 범부처 차원에서 통합․시스템화하여 안전관리의 효율성을 제고하기 위한 ‘제1차 유전자변형생물체 안전관리계획’이 수립되었다. 이 안전관리계획은 LMO법 제7조 제1항 및 동법 시행령 제4조에 근거하여 관계 중앙행정기관의 장이 소관별로 5년마다 수립․시행하도록 규정되어 있다.
이에 따라 6개의 관계 중앙행정기관에서는 2008년 상반기에 소관 LMO에 대한 안전관리계획 초안을 수립하였고, 이후 부처 간 협의와 전문가 용역 등의 과정을 거쳐 관계부처 통합 안전관리계획(안)을 마련하였다. 동 안전관리계획(안)은 2008년 9월 26일 서울 전경련회관에서 공청회를 개최하여 다양한 국민의견도 수렴하였다. 이러한 절차를 바탕으로 ‘제1차 유전자변형생물체 안전관리계획안’이 마련하였으며, 국무총리를 위원장으로 하는 바이오안전성위원회의 심의를 거쳐 2008년 12월에 최종 확정되어 시행되고 있다.
4. 향후 전망
2008년에 수립된 ‘제1차 유전자변형생물체 안전관리계획’을 바탕으로 관계 중앙행정기관에서는 소관 LMO를 대상으로 한 ‘안전관리 세부시행계획’을 매년 수립하고 시행하여야 한다. 이와 더불어 LMO와 바이오관련 국내외 환경의 변화와 지난 1년간의 LMO법 시행 경험을 고려하여 제정된 지 8년이 지난 LMO법 및 하위 규정의 개선도 2009년 중에 추진되어야 할 필요성이 있다. 이에 따라 2009년 4월 9일에 주요 용어의 정의 수정․보완 및 관계 중앙행정기관의 역할 확대(안 제2조), LMO 수입승인 절차 합리화(안 제8조), 바이오안전성위원회의 정비(안 제31조), 바이오안정성정보센터 예산 출연근거 신설(안 제32조), 권한의 위임․위탁근거 신설(안 제38조의 2) 등을 골자로 한 LMO법 일부개정 법률안이 입법예고 된 바 있다.
또한 LMO 및 바이오안전성과 관련된 국제적인 논의에 적극적으로 대응하기 위하여 관련 전문가를 육성하고 제5차 당사국총회(2010년 10월 일본 나고야 예정)의 주요 안건인 책임 및 피해배상, 위해성평가 및 관리, 사회경제적 고려 등에 대한 분석과 준비를 지식경제부를 비롯한 관계된 기관에서 철저히 수행해 나가고 있다.
2008년 1월 1일부터 LMO법이 시행되고 있고, 2009년은 LMO법 시행 2년차를 맞는 해이다. LMO 관계기관은 LMO로 인한 국민의 건강과 생물다양성의 보전, 그리고 지속적인 이용에 대한 위해를 방지하기 위하여 LMO의 위해성 심사, 수입승인, 운송․보관․유통, 연구개발 등과 관련한 안전관리에 최선을 다하고 있다. LMO 관계기관뿐만 아니라 LMO의 개발․생산․수입․수출․판매․운반 및 보관 등의 관련활동에 종사하고 있는 이해당사자, 그리고 시민단체를 포함한 우리나라 국민 모두가 LMO법의 시행에 적극 협조하여 바이오안전성의 확보 및 바이오산업의 건전한 발전의 토대가 형성될 수 있기를 기대한다.

생명윤리 동향
1. 한국에서의 생명윤리 논의의 전반적 동향
최근 한국에서는 생명윤리와 관련된 두 가지 중대한 사건이 있었다. 하나는 대법원이 무의미한 연명치료를 중단하라는 판결을 내린 것이고, 또 하나는 국가생명윤리위원회가 배아줄기세포연구를 재개하도록 하는 결정한 것이다. 대법원의 이번 판결은 보라매병원사건 이후 많은 논란이 있어왔던 의학적으로 무의미한 연명치료에 대하여 중단이 가능하도록 하는 단초를 제공하였다는 점에 커다란 의의가 있다. 이 판결은 여러 가지 조건이 충족하는 경우에 환자 자신의 자기결정권을 존중하겠다는 취지로 받아들여진다.
배아줄기세포연구는 황우석사건 이후 중단되어 왔다. 외국에서는 다양한 형태의 줄기세포연구가 진행되어 왔으며 배아줄기세포연구를 대체할 가능성이 있는 다양한 형태의 줄기세포연구가 진행되어 왔다. 그럼에도 불구하고 배아줄기세포연구는 여전히 주목을 받고 있으며 미국에서도 제한적인 조건을 전제로 연방차원에서 배아줄기세포연구를 지원할 수 있는 길을 열어 놓았다.
한국에서의 생명윤리에 대한 논의는 몇 가지 특징을 가지고 있다. 첫 번째로 생명윤리에 대한 논의의 중심에 줄기세포연구, 특히 배아줄기세포연구가 놓여있다. 생명윤리는 생명 현상과 관련된 모든 분야의 윤리적 현상을 논의하는 분야이다. 따라서 인공임신중절, 무의미한 치료 중단 등, 삶과 죽음의 문제를 포함하여 의생명과학연구의 모든 분야에 대한 윤리적 탐구이다. 한국에서 생명윤리 논의가 특히 배아줄기세포연구에 초점을 맞추고 있는 것은 최근 한국에서 벌어진 여러 상황을 감안하더라도 충분히 설명하기 어렵다. 두 번째로 한국에서의 생명윤리 논의는 생명윤리학계에서 촉발되기 보다는 시민운동의 일환으로 시작된 점이다. 이러한 특징은 한국에서의 생명윤리라는 학문분야의 역사가 일천한 탓도 있지만 그 동안 시민단체가 한국사회에서 여러 가지 역할을 하여 왔음을 의미하기도 한다. 하지만 생명윤리가 학문적 분야로 발전을 하고자 하는 현재 상황에서는 깊은 논의를 저해하는 측면도 있다. 세 번째 한국에서의 생명윤리 논의는 다양한 형태로 발전하였다기보다는 소수의 학자나 단체에 의하여 주도된 측면이 있다. 생명윤리에 대한 논의가 시작된 지가 이미 10년이 넘었음에도 불구하고 생명윤리를 전공하는 새로운 학자들의 출현을 찾기는 매우 어려우며, 10년 가까이 거의 동일한 집단이나 개인이 의생명과학연구의 윤리적, 법적, 사회적 측면에 대해 논의를 하고 있다. 이러한 사정으로 인해 생명윤리에 대한 새로운 시야의 제시나 국제적 차원에서 학문적 논의를 주도하기보다는 외국의 생명윤리에 대한 논의를 수입하는데 급급한 현상이 나타나고 있다.
그럼에도 불구하고 한국에서는 생명윤리가 제도화되는 데에는 어느 정도 성공한 것으로 생각된다. 많은 논란이 있기는 하지만 “생명윤리및안전에관한법률”의 제정으로 인하여 생명윤리를 법률적 차원에서 논의하게 되었으며, 기관생명윤리심의위원회를 법률에 의하여 운영하게 되었다. 무의미한 연명치료 중단과 관련한 이번 대법원 판결도 그 동안 진료를 담당하는 의사 개인이나 개별 병원에서 관행적으로 이루어져 오던 의료행위에 대하여 대법원이 기준을 제시하였다는 면에서 생명윤리의 제도화라는 한국의 추세와 맥락을 같이 하는 것이라고 볼 수 있다.
매우 급격하게 변화하기 때문에 방향을 제시하기 어려운 의생명과학 분야에 적용하는 생명윤리를 법률적으로 보장하려는 이와 같은 시도가 과연 바람직한가, 현재의 법적 규율의 범위가 과잉은 아닌가에 대한 논란의 여지는 있지만 한국에서 생명윤리의 논의는 법적 논의와 공존하는 것이 지금의 현실이다.
2. 인간유전체연구
인간유전체연구는 인간의 유전체를 연구하여 질병을 예방, 진단하고 치료하고자 하는 목적으로 이루어지는 연구이다. 인간유전체연구는 유전자진단과 유전자기능연구, 유전자치료 등을 포함하는 넓은 의미로 파악할 수 있다.
배아와 태아의 유전자진단과 관련하여 최근 보건복지가족부가 허용하는 유전자검사의 수를 종래의 63종에 76종을 더하여 136종의 유전자검사를 배아나 태아에 대하여 시행할 수 있도록 하였다. 새로 추가된 139종 항목은 시투룰린혈증(Citrulinemia), 단풍당밀뇨병(Maple syrup urine disease), 점액다당질증(Mucopolysaccharidosis), 골연골종증(Osteochondroma), 백색증(Albinism) 등이다. 배아나 태아에 대한 유전자검사의 허용 범위가 증가되는 경향은 유전자이상과 질병의 연관성이 규명되고 병력을 가진 가족들의 요구가 증가하는 것에 비추어 볼 때 당연하다고 할 수도 있다. 그러나 배아나 태아에 대한 유전자검사가 자칫 불필요한 인공임신중절의 원인이 될 수도 있다는 점을 유의하여야 할 것이며 가족 등의 유전정보 보호에도 보다 유의하여야 할 것이다.
유전체기능연구가 보다 효율적으로 진행되기 위해서는 유전정보를 보유하고 있는 생물학적 물질과 유전정보가 통계적으로 유의미할 정도로 충분히 확보되어야 한다. 따라서 유전자은행의 설립과 운영은 인간유전체기능연구에 필수적이라고 할 수 있다. 우리나라에서도 공공 유전자은행을 설립하려는 움직임이 있다. 그런데 유전자은행을 운영할 때 가장 큰 문제는 생물학적 물질을 획득할 때 충분한 설명에 근거한 동의(informed consent)를 어떻게 받아야 하는가이다.
이때 충분한 설명에 근거한 동의는 두 가지 차원에서 문제가 된다. 첫 번째로 구체적인 치료행위나 연구에 관련된 정보를 환자나 연구 참여자에게 제공해야 하는데, 장래에 어떠한 연구에 사용될지가 아직 확정되지 않은 상태에서 유전자은행을 운영하는 경우에는 어떠한 정보를 제공할지 문제가 된다.
이 문제는 일단 생물학적 물질의 획득 및 보관에 대한 동의를 받은 후 구체적인 연구가 개시되는 경우 다시 동의를 받는 방식을 사용할 수 있는데 이러한 방식은 연구 참여자의 자율성을 충분히 보장한다는 장점은 있지만 시간과 비용이 너무 크다는 단점이 있다. 두 번째 방식은 소위 포괄동의를 허용하는 것인데 이 방식은 생물학적 물질을 연구에 제공한다는 동의를 하고 구체적인 연구는 적시하지 아니하는 방식이다. 최근 포괄동의의 필요성이 다양한 형태로 제기되고 있는데 포괄동의를 폭넓게 허용하는 것은 결국 충분한 설명에 근거한 동의를 무의미하게 만드는 결과가 될 것이다.
“생명윤리및안전에관한법률” 제32조 ①항은 유전자은행을 개설하고자 하는 자는 대통령령이 정하는 바에 따라 보건복지가족부장관의 허가를 받도록 하면서 국가기관이 직접 유전자은행을 개설한 경우는 예외로 하고 있는데, 이 경우에도 충분한 설명에 근거한 동의라는 요구는 충족되어야 한다. 두 번째로 여러 가지 형태로 이미 획득되어 있는 생물학적 물질에 대하여 또 다시 동의를 받아야 하는가의 문제이다. 집단 신체검사 등의 방식으로 “생명윤리및안전에관한법률”이 제정되기 이전에 획득되어 보관되고 있는 생물학적 물질을 그대로 유전자은행에 포함할 수 있는가의 문제가 그것인데 이 경우 이미 획득되어 있는 생물학적 물질이 누구로부터 얻어진 것인지를 확인하기가 매우 어렵고, 확인 가능한 경우에도 다시 동의를 받는 것이 매우 곤란한 경우가 많다. 이러한 유형의 생물학적 물질을 사용하지 못하도록 하는 방법도 있겠지만 익명화 된 생물학적 물질의 경우나 재동의가 가능한 경우 등 제한적 요건 하에서 사용토록 하는 것은 고려할만 하다고 생각된다.
3. 바이오장기연구
바이오장기연구는 동물로부터 획득된 세포, 조직, 장기 등을 인체에 이식함으로써 질병을 치료하고자 하는 목적으로 수행되는 연구이다. 최근 우리나라에서도 무균복제돼지가 탄생함으로써 바이오장기의 임상화 가능성에 대한 기대가 커지고 있다. 바이오장기의 임상화의 경우 고려하여야 할 문제로 크게 인간 존엄성의 침해, 수인성 감염, 면역거부반응 등이 있다.
인간 존엄성의 침해에 대한 우려는 인간 유전자와 동물 유전자의 융합으로 인한 소위 키메라의 탄생에 대한 우려인데, 이 문제는 구체적으로 어떠한 세포, 조직, 장기가 이식 대상인가, 그리고 유전자변형의 정도가 어느 정도인가에 따라 판단되어야 할 문제이다.81) 면역거부반응의 경우에는 어느 정도 해결책을 찾고 있는 것으로 보이지만 아직 안전성을 담보할 정도는 아닌 것으로 보인다. 수인성 감염의 경우에는 감염이 발생여부 자체도 중요하지만 어느 정도의 유행성과 중증도의 질병이 발생하는지를 검토하여 이익과 해악을 비교 형량해 판단할 문제라고 생각된다.82) 이러한 점들을 고려할 반응장기 보다는 세포나 조직의 이식을 먼저 시도하는 것이 좋을 것이다.
동물이용연구와 관련하여 2008년 “실험동물에관한법률”이 제정되었다. “동물보호법”과 별도로 “실험동물에관한법률”이 필요한가에 대해서는 많은 논란이 있지만,83) 굳이 양자를 구분한다면 “동물보호법”은 동물 복지에 관한 법률이고 “실험동물에관한법률”은 실험동물의 과학적 관리에 관한 법률이라고 할 수 있을 것이다. 바이오장기연구도 동물을 이용하고 또한 동물로부터 유래한 생물학적 물질을 인체에 이식하는 것이기 때문에 본 법률의 적용대상이 된다.84)
우리나라의 경우 “생명윤리및안전에관한법률”의 일부 규정과 “실험동물에관한법률”의 일부 규정이 있기는 하지만 바이오장기를 규율할 법적 장치가 충분하지 않은 것이 현실이다. 이러한 점을 고려하여 바이오장기를 규율할 법률을 제정하고자 하는 움직임이 상당기간 있어 왔다. 바이오장기연구도 다른 의생명과학연구와 마찬가지로 매우 급속하게 변화하는 분야이고 진행방향을 예측하기 어려운 점을 고려하여 지나친 법적 규율은 타당하지 않다. 법에는 연구의 승인과 진행에 대한 절차에 대한 규정과 금지되어야 할 연구를 규정하고 구체적인 사항은 연구자의 자율적 윤리지침에 맡기는 것이 타당하다.
4. 줄기세포연구
줄기세포연구는 현재 의생명과학분야 중 가장 많은 주목을 받고 있는 분야이다. 최근에 배아줄기세포를 대체하고자 하는 여러 가지 연구방법이 제시되고 있으며 어느 정도의 성과도 나오고 있다. 이러한 상황에서 우리나라에서는 상당기간 동안 사실상 금지되어 왔던 배아줄기세포연구를 재개할 수 있는 길이 열렸으며 미국의 새 행정부도 연방차원에서 배아줄기세포연구를 지원할 수 있는 길을 열어 놓았다.
체세포핵치환방식을 이용한 배아줄기세포의 확립은 몇 가지 윤리적․법적 문제를 야기한다. 먼저 체세포핵치환술에 의하여 형성된 존재를 인간으로 볼 것인가의 문제가 있으며, 현실적으로는 인간의 난자를 이용해야 한다는 문제가 있다. 인간성 여부에 대한 논란은 과학적․윤리적․법적 논의라기보다는 일종의 신념에 대한 문제라고 생각한다. 하지만 난자의 이용 문제는 현실적으로 매우 중요한데, 연구 목적으로 난자를 이용하는 것이 윤리적으로 허용될 수 있는가의 논란과 더불어 어떠한 요건 하에서 난자의 제공을 허용할 것인가의 문제도 해결되어야 한다.
“생명윤리및안전에관한법률”은 난자 제공자에 대한 건강검진(동법 제15조의2), 난자 채취 빈도의 제한(동법 제15조의3), 난자 제공자에 대한 실비 보상(동법 제15조의4) 등의 규정을 통하여 난자 제공에 대한 법적 규율을 하고 있다. 난자 이용으로 인하여 발생하는 문제를 해결하기 위한 방법 중 하나가 동물의 난자를 이용하여 연구를 하고자 하는 시도인데,85) 현재 “생명윤리및안전에관한법률”은 핵이 제거된 동물의 난자에 인간의 체세포 핵을 이식하는 행위를 금지하고 있다(동법 제12조 ②항 2호).
다양한 형태의 줄기세포연구는 각각의 장점과 단점이 있으며, 현재의 단계에서는 어느 한 가지 방법만으로는 줄기세포연구를 하고자 하는 목적을 모두 달성할 수는 없다.86) 특정 연구행위를 금지하기 보다는 제한적 요건 하에서 허용하는 방안을 고려하여 보는 것이 보다 타당하다.
5. 결론
생명윤리는 어떠한 가치관을 따르는가, 그리고 어떠한 이론에 의하여 판단할 것인가에 따라 다양한 결론에 도달할 수 있다. 즉 하나의 생명윤리이론이 존재하는 것이 아니라 복수의 생명윤리이론들이 존재하며 어느 이론이 더 타당한 것인가는 구체적인 상황을 전제로 논의를 통하여 검증되어야 하는 것이지 선험적으로 주어지는 것이 아니다.
의생명과학에 대한 법적 규율은 생명윤리에서의 논의와는 다른 차원의 문제이다. 일단 법률이 제정되면 다양한 형태의 법적 규율들이 아니라 하나의 법적 규율이 존재하게 된다. 따라서 법 규정에 대한 해석의 경우를 제외하면 다양한 형태의 결론에 도달하는 경우는 그리 많지 않다. 생명윤리이론은 법률의 제정 시에 다양한 이론적 근거를 제공하며 법의 해석에도 영향을 미치지만 생명윤리이론이 곧 법적 규율은 아닌 것이다.
인간에 대한 연구와 임상적 적용이라는 의생명과학의 특성 상 생명윤리를 법적으로 강제하는 것은 어느 정도 필요한 문제이다. 하지만 생명윤리의 법제화가 지나쳐서는 안 된다. 의생명과학의 특성 상 법률적 규율이 적합하지 아니한 부분이 많기 때문에 모든 것을 법률에 의하여 규율하고자 할 경우 오히려 법률의 실효성을 담보할 수 없는 상황이 벌어질 가능성이 있다. 전체적인 연구 범위와 일반적인 절차를 법에 규정하고 구체적인 규율은 연구자의 자율적 지침에 맡기는 것이 타당할 것으로 생각된다.
다만 이러한 규율방식이 현실화되기 위해서는 몇 가지 요건이 갖추어져야 한다. 가장 중요한 것은 연구자 자신이 윤리적 연구를 하고자 하는 의지가 있어야 한다는 것이다. 연구자가 연구의 효율성뿐만 아니라 연구의 윤리성을 고려할 수 있도록 하기 위한 연구자에 대한 교육도 필요하다. 또한 연구자 스스로 연구윤리지침을 만드는데 적극적으로 참여하여 실효성 있고 준수 가능한 연구윤리지침이 만들어져야 한다. 반면 생명윤리학자는 구체적인 연구에 대한 충분한 지식을 가지고 연구가 올바른 방향으로 나아갈 수 있도록 함께 노력하여야 할 것이다.
의생명과학의 법적 규율에서 고려하여야 할 또 다른 사안은 형법적 수단에 의한 규율을 가능한 자제하여야 한다는 것이다. 법적 규율의 지나친 형법화는 이론적으로도 바람직하지 않을 뿐 아니라 실효성을 저해하는 요소이다.
생명윤리에 대한 논의는 연구자 자신과 생명윤리학자, 법학자, 사회학자 등 다양한 전공의 사람들뿐만 아니라 일반인의 인식을 바탕으로 이루어져야 하며 그래야만 실효성 있는 규율이 가능할 것이며 의생명과학연구 또한 바람직한 방향으로 진행될 수 있을 것이다.

생명공학 지식재산권 제도동향
1. 개요
생명공학분야는 살아있는 생물체를 발명의 대상으로 하고 있다는 특성 때문에 다른 기술 분야와는 별도의 독특한 지식재산권 제도를 운영하고 있다. 최근 생명공학분야의 연구 방법이 지속적으로 개발되어 새로운 유형의 발명이 증대되고 이에 따라 특허 출원의 내용과 수준도 날로 복잡해지고 다양해지는 추세이며, 특히 인간 유전체 연구(Human Genome Project)의 완성 이후 국가 간에 유전자 혁명을 선점하기 위한 경쟁이 치열하게 전개되는 양상을 보이고 있다.
그동안 미생물에 특허를 허여할 수 있는가 하는 문제에서부터 출발해 최근 생물체 자체나 그로부터 분리된 물질에까지 특허 대상을 허여할 것인지에 이르기까지 특허 대상을 놓고 각 국가별로 상당한 논란이 계속되어 왔다. 생명공학의 급속한 발전이 가져온 배아복제나 배아줄기세포 관련 발명 등은 인류의 의료기술에 획기적인 기여를 할 것으로 예상되는 반면 일각에서는 인간 복제의 가능성에 따른 윤리적인 문제도 제기하고 있다.
현재까지도 이 분야는 특허성 판단을 위한 심사 실무나 청구범위의 해석, 침해 여부의 판단에 이르기까지 모든 단계에서 다른 기술과 차별화된 특수성을 보이고 있으며 이에 부합할 심사의 질 제고와 꾸준한 제도변화가 요구되고 있다.
생명공학은 기술의 특성상 장기간의 연구 개발비를 통해 특허가 산출되지만 특허의 도용은 상대적으로 쉬운 분야이므로 지식재산권을 통한 보호의 강도를 높여 주어야 하는 분야라는 점에서는 국제적인 공감대가 형성되어 있다. 이에 따라 결국 원천기술에 대한 확보와 이를 위한 장기적 투자가 경쟁력의 핵심으로 자리 잡을 전망이다. 우리나라는 아직 많은 분야에서 기초기술 단계로 정부의 장기적 로드맵에 따른 집중적인 R&D 투자가 필요하며 개발된 연구 성과에 대하여는 강력한 특허 보호정책을 통하여 국내 산업 발전을 유도할 필요성이 대두되고 있다.
2. 생명공학관련 특허출원 및 등록 현황
가. 생명공학분야 특허출원 현황
생명공학분야 특허출원은 2008년도에 4,511건으로, 출원이 본격적으로 증가된 1998년 이래 꾸준한 증가 추세를 보이고 있으며, 국내 생명공학 산업이 꾸준히 발전하고 있음에 따라 2008년 내국인의 출원은 68.1%에 이른다. 다만, 최근 들어서는 특허출원 건수 자체의 증가세는 둔화되고 있다. 그러나 이는 지식재산권에 대한 인식이 성숙됨에 따라 특허 출원 전략이 단순한 양적인 증가보다 질적인 증가를 추구하는 쪽으로 수정된 것에 따른 결과로 판단된다.
[표 5-3-2-1] 연도별 생명공학분야 특허출원 현황
(단위: 건)
|
구 분 |
'00년 |
'01년 |
'02년 |
'03년 |
'04년 |
'05년 |
'06년 |
'07년 |
'08년 |
|
내국인 |
1,540 |
1,908 |
2,025 |
2,045 |
2,026 |
2,295 |
2,606 |
3,137 |
3,074 |
|
외국인 |
1,073 |
1,153 |
1,000 |
1,047 |
1,215 |
1,272 |
1,058 |
1,437 |
1,437 |
|
계 |
2,613 |
3,061 |
3,025 |
3,092 |
3,241 |
3,567 |
3,664 |
4,574 |
4,511 |
* '08년은 12월 31일 기준
나. 생명공학분야 특허등록 현황
2000~2001년도에 잠시 감소 추세를 보이기도 했던 생명공학분야에서 등록특허 건수는 출원량의 증가와 지속적인 심사관 증원에 따른 심사량의 증가로 2008년에는 2,474여 건에 이르는 등 최근 들어 급속한 증가세를 나타내고 있다. 기술 분류별로는 국제특허분류기호(IPC)87) A61K와 C12N에 해당하는 생물의약 관련 발명, 미생물․효소․유전공학에 대한 발명이 많은 비중을 차지하고 있음을 알 수 있고, 그 다음으로 단백질 관련 발명과 미생물을 이용한 수처리 등이 뒤를 잇고 있다. 특히 외국인의 출원에 의한 등록 건수는 별다른 증가가 이루어지지 않은데 반해, 국내 출원인에 의한 등록 건수가 비약적으로 증가하고 있는 점은 주목할 만한 점이다. 다만, 국내 출원은 대부분 원천기술이라기보다는 개량 응용기술에 주력하고 있는 경우가 많으므로 앞으로 핵심 원천 기술의 특허화가 이루어질 수 있도록 생명공학 산업 전체의 기술개발 투자가 확대되어야 할 것이다.
[표 5-3-2-2] 연도별 생명공학분야 특허등록 현황
(단위: 건)
|
연도 분류 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
||
|
AO1H (식물 신품종) |
내 |
8 |
17 |
34 |
17 |
27 |
70 |
11 |
40 |
27 |
|
|
외 |
3 |
1 |
3 |
1 |
7 |
4 |
1 |
12 |
1 |
||
|
계 |
11 |
18 |
37 |
18 |
34 |
74 |
12 |
52 |
28 |
||
|
A01K 67/00~67/04 (신규 동물) |
내 |
5 |
4 |
3 |
8 |
10 |
14 |
25 |
14 |
18 |
|
|
외 |
1 |
2 |
2 |
- |
- |
3 |
12 |
7 |
2 |
||
|
계 |
6 |
6 |
5 |
8 |
10 |
17 |
37 |
21 |
20 |
||
|
A01N 63/00~65/00 (생물 농약) |
내 |
6 |
13 |
9 |
14 |
19 |
50 |
28 |
37 |
47 |
|
|
외 |
3 |
7 |
5 |
2 |
3 |
6 |
5 |
2 |
3 |
||
|
계 |
9 |
20 |
14 |
16 |
22 |
56 |
33 |
39 |
50 |
||
|
A61K 7/26, 7/28, 35/12~35/84, 38/00~39/44, 48/00, 51/00~51/10(생물 의약) |
내 |
58 |
97 |
135 |
153 |
128 |
336 |
597 |
565 |
594 |
|
|
외 |
75 |
86 |
71 |
85 |
67 |
90 |
189 |
165 |
179 |
||
|
계 |
133 |
183 |
206 |
238 |
195 |
426 |
786 |
730 |
773 |
||
|
C02F 3/00~3/34, 11/02~11/04 (미생물 이용 폐수처리) |
내 |
70 |
82 |
117 |
121 |
259 |
191 |
235 |
241 |
184 |
|
|
외 |
6 |
8 |
9 |
7 |
12 |
10 |
18 |
23 |
4 |
||
|
계 |
76 |
90 |
126 |
128 |
271 |
201 |
253 |
264 |
188 |
||
|
C07H 19/00~21/04 (당류) |
내 |
1 |
3 |
13 |
5 |
5 |
9 |
7 |
6 |
2 |
|
|
외 |
13 |
8 |
23 |
16 |
15 |
22 |
24 |
20 |
18 |
||
|
계 |
14 |
11 |
36 |
21 |
20 |
31 |
31 |
26 |
20 |
||
|
C07K (단백질) |
내 |
37 |
27 |
45 |
38 |
78 |
133 |
108 |
144 |
142 |
|
|
외 |
56 |
47 |
73 |
71 |
76 |
108 |
167 |
111 |
124 |
||
|
계 |
93 |
74 |
118 |
109 |
154 |
241 |
275 |
255 |
266 |
||
|
C12C~M (발효 및 그 장치) |
내 |
22 |
16 |
44 |
50 |
87 |
87 |
91 |
144 |
122 |
|
|
외 |
2 |
4 |
7 |
6 |
6 |
5 |
11 |
17 |
20 |
||
|
계 |
24 |
20 |
51 |
56 |
93 |
92 |
102 |
161 |
142 |
||
|
C12N (미생물, 효소, 유전공학) |
내 |
173 |
150 |
242 |
235 |
401 |
413 |
458 |
538 |
448 |
|
|
외 |
99 |
54 |
107 |
94 |
104 |
190 |
206 |
241 |
185 |
||
|
계 |
272 |
204 |
349 |
329 |
505 |
603 |
664 |
779 |
633 |
||
|
C12P (발효 생성물) |
내 |
35 |
33 |
36 |
40 |
71 |
50 |
58 |
39 |
44 |
|
|
외 |
34 |
17 |
22 |
22 |
34 |
37 |
49 |
38 |
28 |
||
|
계 |
69 |
50 |
58 |
62 |
105 |
87 |
107 |
77 |
72 |
||
|
C12Q,S (시험, 측정, 분리정제) |
내 |
16 |
27 |
24 |
33 |
136 |
101 |
201 |
224 |
161 |
|
|
외 |
14 |
22 |
16 |
15 |
38 |
37 |
42 |
61 |
30 |
||
|
계 |
30 |
49 |
40 |
48 |
174 |
138 |
243 |
285 |
191 |
||
|
G01N 33/50~33/98 (진단 시약) |
내 |
5 |
15 |
3 |
16 |
22 |
36 |
92 |
97 |
67 |
|
|
외 |
20 |
15 |
12 |
12 |
11 |
20 |
54 |
44 |
24 |
||
|
계 |
25 |
30 |
15 |
28 |
33 |
56 |
146 |
141 |
91 |
||
|
계 |
내 |
436 |
484 |
705 |
730 |
1,243 |
1,490 |
1,911 |
2,089 |
1,856 |
|
|
외 |
326 |
271 |
350 |
331 |
373 |
532 |
778 |
741 |
618 |
||
|
계 |
762 |
755 |
1,055 |
1,061 |
1,616 |
2,022 |
2,689 |
2,830 |
2,474 |
||
|
주) 1. 국제특허분류(IPC 8판 기준)에 의함 2. 내: 내국인 출원, 외: 외국인 출원 |
|
||||||||||
‘
3. 생명공학분야 심사 인프라 확충
특허청에서는 급속히 발전하고 있는 생명공학분야의 새로운 기술을 보호하는 한편 국제화 추세에 발맞추어 생명윤리 문제의 판단기준을 제시하고자 생명공학 특허 심사기준을 제정하여 운용하고 있으며, 기술개발 추이에 발맞추어 우수특허의 권리를 효율적으로 보호할 수 있도록 심사기준 개정, 심사 전문인력 확보, 유전자서열 DB 구축 등 지식재산권 제도와 인프라를 확충하고 심사의 전문화를 꾀하고 있다.
가. 생명공학 특허 심사기준의 제정 및 개정
(1) 생명공학 특허 심사기준의 제정(1998. 3)
생명공학분야 특허란 직접 또는 간접적으로 자기복제를 할 수 있는 생물학적인 물질(biological material) 즉, 자기 복제력을 갖는「생물」,「유전정보」및 그「복제」에 관련된 발명을 포함하는 특허를 의미한다. 이러한 생명공학분야 출원기술의 심사에 대한 표준운영절차를 확립하고자 1998년 산재된 생명공학 관련 심사기준을 통합하여 생명공학분야 산업부문별 심사기준을 제정하였다.「유전공학 관련발명」, 「미생물관련 발명」,「식물관련 발명」,「동물관련 발명」으로 크게 네 개의 분야로 나눠서 심사기준을 신설하고 윤리성 기준과 불특허 요건을 명시하였다.
(2) 생명공학 특허 심사기준 1차 개정(2000. 12)
인간 유전체 연구(HGP)의 1차 결과가 발표됨에 따라 그의 산물인 DNA 단편, SNP(개체간 단일염기변이) 등 새로운 형태의 발명이 출현되고 있어 이를 보호할 기준 마련을 위해 개정하였다. 주요 내용으로는 HGP의 산물인 EST 등 DNA 단편, SNP 등에 대한 심사기준을 마련하였고, 유전자, 단백질, 모노클로날 항체 등에 대한 포괄적인 청구범위 기재를 인정하고, 안티센스에 대한 기재요건을 추가하는 등 기존의 심사 실무를 반영하였고 대용량 유전정보 출원에 대비한 단일성 판단기준에 대해서 정비하였다.
(3) 생명공학 특허 심사기준 2차 개정(2003. 12)
생명공학분야의 새로운 기술을 보호하는 한편, 생명윤리문제의 판단기준을 제시하고 유전공학관련 발명의 실질적인 보호에 중점을 두었다. 이에 따라 유전자 및 단백질 변이체에 대한 청구범위 기재요건을 강화하고 서열로 특정할 수 없는 경우의 단백질의 특정 요건을 구체화하였으며, 모노클로날 항체의 실시가능성요건 및 청구범위 기재요건을 보호하는 등의 보완이 이루어졌다.
(4) 생명공학 특허 심사기준 3차 개정(2005. 5)
당초 2차 개정안에서는 생명과학기술의 생명윤리 및 안전을 확보하기 위해 제정될 예정이었던 「생명윤리및안전에관한법률」에 근거하여 생명공학분야 발명의 생명윤리 문제를 판단하는 내용이 포함되어 있었으나, 법률의 제정 및 시행이 늦어짐에 따라 이 내용이 삭제된 채로 개정되었었다. 3차 개정에서는 「생명윤리및안전에관한법률」의 시행에 연계하여 정부의 공식 승인을 받은 연구 성과물에 대한 발명은 특허등록 대상으로 하는 한편, 동법에서 금지하는 행위 또는 연구 성과물에 대한 발명은 특허법 제32조의 규정에 의거 특허를 받을 수 없는 발명으로 하여 생명공학분야 발명의 생명윤리 및 안전에 대한 판단 기준을 보완하였다.
(5) 생명공학 특허 심사기준 4차 개정(2006. 9)
당초 우리의 특허법에서는 식물관련 발명의 경우는 특허법 제31조에 의해서 무성적으로 반복 생식할 수 있는 식물에 한하여 특허를 허여하여 왔으나, 국내외 특허제도 및 품종보호제도가 발전함에 따라 유성번식 식물도 특허 대상에 포함시키기 위해 특허법 제31조를 삭제(2006. 10. 1. 시행)하게 되었다. 이에 따라 4차 개정에서는 식물관련 특허의 대상을 무성번식방법을 갖춘 식물에서 신규식물 자체 또는 일부분 및 그 육종방법으로 확대하였고, 유성번식 식물의 재현성 요건을 충족시키기 위해 종자기탁제도를 도입하였다. 개정된 생명공학분야 특허심사기준은 특허청 홈페이지(www.kipo.go.kr)의 화학생명공학심사본부 메뉴 내에 심사자료실에서 다운받을 수 있다.
[표 5-3-3-1] 생명공학 특허 심사기준에 따른 특허 보호대상
|
구분 |
대상 |
특허여부 |
비고 |
|
물질 |
유전자 (DNA서열) |
특허가능 |
유용성이 밝혀진 경우만 가능, 단순 게놈 서열만으로는 불가 |
|
단백질 (아미노산서열) |
특허가능 |
||
|
단세포 생명체 (virus, bacteria) |
특허가능 |
관련 미생물 기탁 의무 |
|
|
동물 |
특허가능 (단, 공서양속에 반하지 않는 것) |
동물발명에 대한 심사기준 신설 |
|
|
식물 |
특허가능 |
유성번식 식물의 경우 종자기탁을 통해 재현성 요건 충족 |
|
|
인간의 신체 부분 |
특허불가 |
인체의 존엄성을 해치는 발명은 특허대상에서 배제 |
|
|
방법 |
수술, 치료방법 |
사람불가, 동물가능 |
사람의 치료, 진단 방법은 의료행위에 해당하므로 산업상 이용가능성이 없는 것으로 봄 (특허법 제29조제1항) |
|
유전자 치료법 |
사람불가, 동물가능 |
||
|
진단방법 |
사람불가, 동물가능 |
나. 심사 전문인력 확보 및 역량 강화
특허청은 생명공학분야의 특허출원 증가에 효율적으로 대처하고 심사 전문성을 제고하기 위하여 해당분야 전문 심사인력을 지속적으로 채용하고 있으며, 이를 통해 2007년 7월말 생명공학기술 전문 심사인력은 해당분야 박사학위소지자 33명을 포함하여 전공 심사관 39명을 확보하고 있다.
또한, 특허청은 기술 간의 융합화 현상이 진전되고 있는 생명공학분야의 최근 논의를 점검하고, 관련 기술 및 특허 동향을 분석하기 위하여 관련분야의 청내․외 인사들로 구성된『바이오특허 연구회』를 운영하고 있으며, 본 연구회를 통해 바이오 또는 지재권분야 전문가 세미나 및 토론회를 개최함으로써 최신 기술과 정보를 습득․교류하는 기회를 마련하고, 연간 활동 보고서를 발간․배포하는 등 심사의 질적 향상과 생명공학 기술의 전파에 적극 노력하고 있다.
다. 유전자 서열목록 제출제도 시행 및 관련 DB 구축
특허청은 핵산 또는 아미노산 관련 발명의 신속 정확한 검색 및 서열 DB 구축을 위하여 1999년 이후에 특허 출원된 발명에 대해서는 핵산염기와 아미노산 서열 데이터의 전자파일 제출을 의무화하였으며, 2004년에는 한국생명공학연구원과 업무협정을 체결하고, 특허 출원된 유전자 서열데이터를 한국생명공학연구원내 국가유전체정보센터에 제공하고, 유전자서열 검색 시스템을 통합 운영함으로써 검색기능과 속도가 비약적으로 향상된 검색 시스템을 확보하여 운영 중이다. 또한, 2007년 10월부터 한․일 특허청간 유전자 서열 DB교환을 통해 검색 DB를 확대 운영하게 되었다.
[표 5-3-3-2] 서열목록을 포함한 특허출원 건수
(단위: 건)
|
구 분 |
'99년 |
'00년 |
'01년 |
'02년 |
'03년 |
'04년 |
'05년 |
'06년 |
'07년 |
'08년 |
|
내국인 |
151 |
248 |
402 |
496 |
584 |
619 |
688 |
903 |
1,126 |
1,089 |
|
외국인 |
250 |
383 |
528 |
494 |
469 |
577 |
653 |
770 |
967 |
989 |
|
계 |
401 |
631 |
930 |
990 |
1,053 |
1,196 |
1,341 |
1,673 |
2,093 |
2,078 |
* '08년은 12월 31일 기준
한편, 국가유전체정보센터에서는 매월 특허 공개분에 대한 특허서열을 특허청에서 제공받아 국내외 연구자들이 자유롭게 특허서열을 검색하고 이용할 수 있도록 웹기반의 검색 서비스(http://www.patome.net)를 제공하고 있다.
4. 미생물 기탁제도 운영
가. 미생물 기탁제도의 취지
미생물에 대한 발명은 살아 있는 생명체를 대상으로 하는 것이어서 특허 명세서에 아무리 상세하게 미생물의 균학적 특질이나 성질을 기재한다 하더라도 제3자는 그 미생물을 입수하는 것이 실질적으로 불가능하다. 이처럼 특허 명세서에 타인이 반복 재현할 수 있도록 기재하는 것이 곤란한 문제를 해결하기 위해 특허 출원된 미생물을 공인기탁기관에 기탁하고, 특허 공개 후에는 제3자가 분양받을 수 있도록 하는 제도가 미생물 기탁제도인데, 미생물에 관계되는 발명을 특허출원하기 위해서는 특허법 시행령 제2조에 따라 그 미생물을 특허청장이 정하는 기탁기관 또는 특허절차상 미생물 기탁의 국제적인 승인에 관한 부다페스트 조약에 따른 국제기탁기관에 기탁하고 그 수탁증을 출원서에 첨부하여야 한다.
[그림 5-3-4-1] 미생물 기탁 및 출원 절차 개요

나. 미생물 기탁기관 및 관리 현황
국내에 기탁기관은 아래와 같이 4개의 기관이 운영 중이며, 이들 기관은 발명자가 미생물을 기탁하면 고유번호를 부여하고 기탁증을 발급해 주고 있다. 또한, 제3자가 특허관련 미생물의 분양신청을 할 경우 특허청은 미생물 분양자격증명서를 발급하여 기탁미생물의 분양을 허락하고 있으며 기탁된 미생물의 관리실태를 분기별로 점검하고 있다.
[표 5-3-4-1] 국내 미생물 기탁기관 현황
|
구 분 |
한국생명공학연구원 생물자원센터 (KCTC) |
한국미생물 보존센터 (KCCM) |
한국세포주 연구재단 (KCLRF) |
국립농업과학원 농업유전자원센터 (KACC) |
|
국제기탁기관 (지정일) |
자격 있음 ('90. 6. 30) |
자격 있음 ('90. 6. 30) |
자격 있음 ('93. 8. 31) |
자격 없음 |
|
국내기탁기관 (지정일) |
자격 있음 ('81. 8. 25) |
자격 있음 ('81. 8. 25) |
자격 없음 |
자격 있음 ('02. 1. 1) |
[표 5-3-4-2] 기탁기관별 미생물 수탁 및 분양 현황
(단위: 건)
|
구분 |
수탁미생물 |
분양미생물 |
비고 (수탁) |
|
한국생명공학연구원 생물자원센터(KCTC) |
3,602 |
318 |
국제(2,490), 국내(1,112) |
|
한국미생물보존센터 (KCCM) |
2,412 |
178 |
국제(977), 국내(1,435) |
|
한국세포주연구재단 (KCLRF) |
196 |
144 |
국제(196), 국내(0) |
|
국립농업과학원 농업유전자원센터(KACC) |
597 |
94 |
국제(0), 국내(597) |
|
합계 |
6,807 |
734 |
국제(3,663), 국내(3,144) |
* '08년 12월 31일 기준
또한, 특허청은 미생물 기탁업무에 대한 개선 대책을 추진하여 부다페스트조약에 어긋나던 일부 미생물 기탁기관의 내부 규정을 개정하고, 기탁기관별로 상이하던 서식을 통일화하는 작업을 수행하였으며, 신청자 편의 위주로 미생물 분양 절차를 간소화하고 온라인 신청체계를 마련하여 특허청 홈페이지에서 온라인상으로 신청이 가능하도록 조치를 완료하였다. 그리고 지난 2006년에는 특허 미생물 보존 및 관리 사업을 실시하여 기존 기탁 미생물 보관 장소와는 별도의 장소에 특허 미생물에 대한 백업을 실시하였으며, 2006년 7월에는「미생물 기탁기관 지정 등에 관한 고시」를 개정하여 기탁기관의 특허미생물 복제본 보관 의무화 및 보관시설 요건을 규정함으로써, 미생물 관련 특허자원의 안정적 보존 및 관리를 제고하였다. 아울러, 2008년 11월에는 농업생명공학연구원 한국농업미생물자원센터를 국립농업과학원 농업유전자원센터로 하는 기탁기관 명칭변경 사항을 반영하여 상기 고시를 개정하였다.

생명공학 제품 인허가 현황과 과제
1. 서론
생명공학산업은 DNA, 단백질, 세포 등을 이용한 생명체 관련기술(Bio Technology)을 직접 활용하여 제품과 서비스를 생산하는 신산업으로 의약, 화학, 환경, 식품, 에너지, 농업, 해양 등 다양한 분야에서 21세기 산업성장을 주도할 핵심기술산업으로 평가받고 있다. 특히 의약(Red BT)부분에서의 연구개발이 가장 활발하게 이루어지고 있으며, 점차 농업(Green BT), 산업(White BT)으로 옮겨가는 추세에 있다.
전 세계적으로 기존 합성신약의 한계를 극복하기 위한 생명공학의약품 개발에 정부가 주도적으로 막대한 예산을 투자하고 있으며 주요 선진국의 의약품 허가․규제기관에서는 고부가가치 바이오신약의 허가를 위해 안전성과 유효성을 평가하는 가이드라인 개발에 주력하고 있다.
우리나라의 경우 1983년 생명공학육성법이 제정된 이후 「제1차 생명공학육성기본계획(1994~2006)」에 따라 생명공학에 대한 국가차원의 체계적인 연구개발 육성에 착수하여 기술적인 인프라를 구축하여 왔다. 그러나 이러한 기술적 인프라와 정부의 R&D 지원은 기초연구에 집중되어 있어 세계적인 연구성과들이 신속하게 상업화(실용화)로 이어지고 있지 않아 이에 대한 범부처 대책방안이 속속 마련되고 있다.
2007년부터 향후 10년 간은 생명공학분야 세계7위의 기술 강국 진입을 목표로 「제2차 생명공학육성기본계획(2007~2016)」을 확정하여 생명공학의약품 실용화를 위한 과제를 추진할 계획에 있으며, 신약으로 개발될 가능성이 있는 후보물질에 대하여는 선택과 집중에 의한 비임상․임상시험 R&D 지원을 강화할 예정이다.
한편, 유전자재조합기술을 이용한 제1세대 생명공학의약품 ‘유전자재조합 치료용 단백질 의약품(insulin, human growth hormon 등)’이 1980년대에 처음으로 세계시장에 소개된 이후, 최근 동 의약품의 특허 만료시점이 도래하면서 생명공학의약품에도 Bio-Similar(Bio generic, follow-on) 개념을 도입하고자 하는 여건이 형성되고 있으며, 한미 FTA 협상 타결로 국내 제약환경은 큰 변화를 맞고 있다.
이상과 같은 국내외 제약환경의 변화에 발맞추어 생명공학의약품 인허가 과정, 국내외 생명공학의약품 개발동향, 생명공학의약품 실용화와 관련한 식약청의 역할 및 안전관리방안 등에 대하여 살펴보기로 한다.
2. 생명공학의약품 인허가 과정
생명공학의약품은 인체 내에서 유래한 물질을 대상으로 하여 유전자 조작, 유전자 이식, 줄기세포 배양 등의 생명공학기술을 적용하여 개발된 의약품으로써 기존의 합성 화학의약품과 마찬가지로 인체의 질병을 치료, 경감, 진단을 목적으로 한다. 따라서 제품의 실용화를 위해서는 반드시 그 제품에 대한 안전성과 유효성 평가를 거쳐야 한다.
의약품이 개발되어 환자에게 사용되기 까지는 약 10년 이상의 기간이 소요되는데, 이는 대부분 안전성과 유효성을 입증하기 위하여 실시하는 비임상․임상시험에 해당하며 의약품 개발 기간과 투자비용의 대부분을 차지하고 있다(그림 5-4-2-1).
[그림 5-4-2-1] 의약품의 개발과정

범정부 차원에서 차세대 성장 동력으로서 육성․지원하고 있는 생명공학의약품의 실용화는 안전성과 유효성 평가를 위한 자료가 얼마나 과학적이고 합리적인지에 달려있으며, 신약개발기간의 대부분을 차지하고 있는 비임상․임상에 대한 지원과 최종 허가단계에서의 안전성․유효성 심사과정이 국제 경쟁력을 결정하는 큰 요인으로 작용한다고 해도 과언이 아니다.
생명공학의약품의 안전성․유효성을 입증하는 임상시험이 완료된 후, 실용화를 위한 마지막 단계인 의약품 허가를 위해서는 의약품을 생산할 수 있는 GMP 시설이 요구된다. 그러나 생명공학의약품을 연구․개발하는 주체인 벤처기업이 막대한 투자비용이 소요되는 GMP 시설은 갖춘다는 것은 Bio 신약개발에 있어 또 하나의 장애 요인이 되고 있다. 이에 대해 해결방안으로 의약품 제조업 허가와 제조품목허가 분리를 위한 약사법 개정을 추진하여 제조업 허가와 제조품목허가를 별도로 받을 수 있게 되었다.
[그림 5-4-2-2] 품목허가 절차

한편, AIDS․암 등 생명을 위협하거나 심각한 질병의 치료제, 내성발현 등 기존 치료법으로 치료가 불가능하여 신속 도입이 필요한 의약품, 대유행 인플루엔자백신 등 신종유행 전염병의 예방 또는 치료효과를 기대할 수 있는 의약품에 대하여는 제출자료의 일부를 시판 후 제출하도록 하거나 우선적으로 신속하게 심사하여 허가할 수 있도록 규정(생물학적제제 등의 품목허가․심사 규정 제36조, 식약청고시)하고 있어, 허가․심사에 소요되는 시간을 단축하고 실용화를 앞당기는 지원정책을 두고 운영하고 있다.
3. 국내외 생명공학의약품 개발동향
가. 세계동향
1982년 Eli Lilly사가 미국 FDA로부터 유전자재조합 인슐린의 허가를 받은 것을 시발로 하여 성장호르몬, 항암보조제 G-CSF, 빈혈치료제인 EPO 등 많은 재조합 단백질이 개발, 실용화 되었다.
현재까지 생명공학의약품은 EPO(erythropoietine, 빈혈치료제), TPA(tissue plasminogen activator, 혈전용해제) 등의 심혈관계 질환약과 CSF(colony stimulating factor, 골수계 성장인자), 인터페론, 인터루킨 등 암 치료제 제품이 괄목할 만한 성장을 보여주었으며 최근에는 혈액질환, 면역계질환, 호흡기 질환 등 많은 질병의 치료에 목적을 두고 개발되고 있다. 또한 난치병과 불치병에 대한 치료 가능성 등의 장점에 의하여 활발한 연구가 진행 중이다.
최근 insulin, human growth hormon 등 1세대 유전자 재조합 치료용 단백질 의약품의 특허 만료 시점이 도래하면서 바이오시밀러 시장이 본격 형성될 것으로 전망하고 있다.
[표 5-4-3-1] 제1세대 단백질 의약품 특허만료 현황
|
단백질 의약품(상품명) |
의약용도 |
개발사 |
특허만료 |
|
인슐린(Humulin) |
당뇨병 |
Eli Lilly |
2002 |
|
인슐린(Novolin) |
당뇨병 |
Novo Nordisk |
2002 |
|
인간성장호르몬(Nutropin) |
성장호르몬 결핍 |
Genentech |
2002 |
|
인간성장호르몬(Humatrope) |
성장호르몬 결핍 |
Eli Lilly |
2002 |
|
인터페론 알파(Intron-A) |
백혈병 |
Schering-Plough |
2002 |
|
에리트로포이에틴(Epogen) |
빈혈 |
Amgen |
2004 |
|
에리트로포이에틴(Procrit) |
빈혈 |
Johnson & Johnson |
2004 |
|
tPA(Activase) |
심부전 |
Genentech |
2005 |
|
인간성장호르몬(Protropin) |
성장호르몬 결핍 |
Genentech |
2005 |
|
G-CSF(Neupogen) |
항암치료 |
Amgen |
2006 |
출처: LG경제연구소, 특허청(2006)
세계의 시장조사 전문기관 중 하나인 Datamonitor의 보고서는 유전자재조합 기술을 바탕으로 한 1세대 생명공학 의약품에 이어 향후 2010년까지는 단클론 항체의약품(monoclonal antibody)과 치료용 백신이 생명공학산업의 발전 동력이 될 것으로 예측하였다.
2세대 생명공학 의약품으로 불리는 항체의약품은 암세포에 특이적으로 부착하여 인체의 면역시스템이 암세포를 제거할 수 있도록 설계된 의약품으로 97년 비호지킨성 림프종 치료제인 리툭산(Rituxan)이 허가된 이후 현재까지 미국 FDA로부터 11개 제품이 승인되었으며, 임상단계에 있는 제품만 하여도 350여개에 달한다고 한다.
유전자치료제는 유전물질을 인체에 투입하여 유전적인 질병을 치료하고자 하는 목적으로 연구가 진행 중이며 아직까지는 대부분 임상시험 단계에 있으나, 지금까지 전 세계적으로 허가된 유전자치료제는 중국에서 Genedicine(2003년10월, 두경부암) 및 H101(2005.11월, 두경부암) 2품목뿐이다. 수년 내 제품시장이 본격적으로 형성되기 시작하면 기존의 의약품시장을 대체할 수 있는 막강한 잠재력이 있는 의약품이다. 2007년 현재 전 세계적으로 약 700여 건의 임상시험이 진행 중이며 세계 각국에서 빠른 속도로 개발되고 있다.
세포치료제는 1990년대 초반에 시작되어 중반부터 급속하게 기술개발이 이루어지고 있는데 골수 및 조혈모세포 이식, 수지상세포, 자기 활성화 림프구, 줄기세포 등을 이용한 치료법 연구가 진행 중이다. 배아줄기세포와 관련한 연구도 윤리성 문제와 연계되어 조심스럽게 이루어지고 있다.
나. 국내동향
유전자재조합의약품은 인체에서 생리활성을 나타내는 다양한 효소나 호르몬의 정보를 담고 있는 유전자를 대장균이나 효모와 같은 미생물 등에 이입하여, 목적으로 하는 단백질을 합성해 대량생산으로 제조한 의약품을 말한다. 생명공학의약품 중 가장 많이 허가되어 사용되고 있는 의약품으로서 2008년 현재 약 250여 품목이 허가되었다.
항체의약품의 경우 엘지생명과학, 녹십자, 이수앱지스 등 56개 바이오기업에서 연구가 활발히 진행 중인데 2008년 현재 허가된 항체의약품 23개 제품 중 국내 제조는 이수앱지스의 “클로티냅주(압식시맙)” 1품목이 허가되었다.
“세포치료제”는 살아있는 자가(autologous), 동종(allogenic), 이종(xenogenic) 세포를 체외에서 배양․증식하거나 선별하는 등 물리적, 화학적, 생물학적 방법으로 조작하여 제조하는 의약품으로, 통상 환자 자신으로부터 유래한 세포를 직접 이용하기 때문에 불특정 다수를 대상으로 대량 생산하는 보통의 의약품과 대비해 소위 “맞춤형 의약품”이라고 불리는 첨단 BT의약품의 하나이다.
특히, 줄기세포나 면역세포를 이용한 세포치료제는 난치병 영역에 대한 치료 가능성을 보여주고 있어 특별한 주목을 받고 있다.
[표 5-4-3-2] 세포치료제 허가현황(2008년 현재)
|
연번 |
제품명(업소명) |
특징 |
대상질환 |
승인사항 |
|
1 |
콘드론 (세원셀론텍) |
자기유래연골세포 |
연골이식 및 재생 |
품목허가('01.1) |
|
2 |
홀로덤 (테고사이언스) |
자기유래피부각질세포 |
피부화상치료 |
품목허가('02.12) |
|
3 |
칼로덤 (테고사이언스) |
동종유래피부각질세포 |
피부화상치료 |
품목허가('05.3) |
|
4 |
케라힐 (엠씨티티) |
자기유래피부각질세포 |
피부화상치료 |
품목허가('06.5) |
|
5 |
이노락 (이노메디시스) |
자기유래활성화림프구 |
비소세포폐암 |
품목허가('07.2) |
|
6 |
크레아박스-알씨씨 (크레아젠) |
자기유래수지상세포 |
전이성신세포암 |
품목허가('07.5) |
|
7 |
아디포셀주 (안트로젠) |
자기유래배양한지방세포 |
피부 함몰 |
품목허가('07.8) |
|
8 |
이뮨셀엘씨주 (이노셀) |
자기유래활성화티림프구 |
간세포암 |
품목허가('07.8) |
|
9 |
엔케이엠주 (엔케이바이오) |
자기유래활성화림프구 |
B세포 림프종 |
품목허가('07.8) |
|
10 |
하이알그라프트쓰리디 (핸슨바이오텍) |
자기유래피부섬유아세포 |
당뇨성 족부궤양 |
품목허가('07.9) |
현재 국내에서 허가되었거나 연구개발(임상시험) 중인 세포치료제는 총 36품목으로, 2001. 1. 30. 최초로 허가된 자기유래연골세포(콘드론)치료제를 필두로 종전까지는 대부분 자기유래연골세포나 자기유래피부각질세포와 같은 조직수복차원의 세포치료제(4종)가 주로 허가되었다.
그러나 최근 기술력의 향상으로 “자기유래활성화림프구”와 “자기유래수지상세포”를 이용한 항암 면역세포치료제와 “자기유래지방세포”, “자기유래피부섬유아세포”를 이용한 세포치료제가 허가되었고, 골수나 제대혈에서 유래한 중간엽줄기세포를 이용하여 심근경색, 뇌경색 또는 척수손상 등의 난치병을 치료하기 위한 세포치료제들이 임상시험을 진행 중이거나 완료단계에 있다.
[표 5-4-3-3] 세포치료제 연구개발(임상시험) 현황(2008년 현재)
|
연번 |
제품명(업소명) |
특징 |
대상질환 |
승인사항 (임상단계) |
|
1 |
마이오쎌 (바이오하트코리아) |
자기유래근모세포 |
심부전증치료 |
2상 |
|
2 |
디씨백이피-엘주 (바이넥스) |
자기유래수지상세포 |
비소세포폐암 |
1/2상 |
|
3 |
디씨백아이알주 (바이넥스) |
자기유래수지상세포 |
대장암 |
1/2상 |
|
4 |
이노LC (이노셀) |
자기유래활성화림프구 |
교모세포종 |
3상 |
|
5 |
크레아박스피씨 (크레아젠) |
자기유래수지상세포 |
전립선암 |
1/2(a)상 |
|
6 |
디씨백이피-비주 (바이넥스) |
자기유래수지상세포 |
유방암 |
1/2(a)상 |
|
7 |
엠에스씨 1 (에프씨비파미셀) |
골수간엽줄기세포 |
급성뇌경색 |
3상 |
|
8 |
엠에스씨 2 (에프씨비파미셀) |
골수간엽줄기세포 |
심근경색 |
2/3상 |
|
9 |
카티스템 (메디포스트) |
제대혈간엽줄기세포 |
연골결손 |
1/2상 |
|
10 |
오스템 (세원셀론텍) |
골수간엽줄기세포 |
골절부위 골형성 |
3상 |
|
11 |
티케이셀주사 (바이넥스) |
자기유래활성화림프구 |
위장관암 |
2상 |
|
12 |
세레셀그람 (에프씨비파미셀) |
자기유래중간엽줄기세포 |
만성 척수손상 |
2/3상 |
|
13 |
바스코스템 (알앤엘바이오) |
자기유래지방줄기세포 |
버거씨병 |
1/2상 |
|
14 |
프로모스템 (메디포스트) |
제대혈유래간엽줄기세포 |
이식편대숙주질환 |
1/2상 |
|
15 |
큐어스킨 (에스바이오메딕스) |
자기유래섬유아세포 |
여드름 흉터 |
1/2상 |
|
16 |
알앤엘 조인트스템 (알앤엘바이오) |
자기유래지방줄기세포 |
퇴행성관절염 |
1/2상 |
|
17 |
카티스템 (메디포스트) |
제대혈유래간엽줄기세포 |
무릎연골손상 |
3상 |
|
18 |
이식편대숙주질환치료제 (호미오세라피) |
골수유래성체줄기세포 |
이식편대숙주질환 |
1/2(a)상 |
|
19 |
크레아박스에치씨씨 (크레아젠) |
자기유래수지상세포 |
간세포암 |
1/2(a)상 |
|
20 |
아디포플러스주 (안트로젠) |
자기유래지방줄기세포 |
크론씨병 |
1상 |
|
21 |
디씨백/이피-비 주사 (바이넥스) |
자가유래수지상세포 |
유방암 |
1/2상 |
유전자치료제는 2000년부터 2005년 동안 단 3개 제품만이 임상시험에 진입하였으나, 2008년 현재 총 9건의 임상시험이 진행 중이다. 제품 개발을 위한 사전상담 건수도 2004년 3건에서 2005년 9건, 2006년 10건으로 점차 늘어나고 있는 추세이다.
[표 5-4-3-4] 국내 유전자치료제의 임상시험 현황(2008년 현재)
|
제품명 |
개발사 |
치료유전자 및 작용기전 |
대상 질환 |
임상단계 (승인연월) |
국외임상 |
|
VMDA-3601 |
동아제약 바이로메드 |
VEGF, 혈관신생유도 |
허혈성 족부궤양증 |
2상 ('03.12) |
|
|
GX-12 |
동아제약 포항공대 |
HIV항원, IL-12 |
에이즈 치료백신 |
1상 ('05.1) |
|
|
JX594 |
동아대 제너렉스 |
종양선택적 복제, GM-CSF |
간암 |
1상 ('05.8) |
미국 임상 진행 |
|
VM-202RY |
바이로메드 |
간세포성장인자, 혈관신생 |
허혈성 심혈관질환 |
1상 ('06.10) |
미국 임상 동시진행 |
|
티슈진-C |
코오롱생명과학 |
TGF-β, 동종유래 연골세포 |
퇴행성관절염 |
1상 ('06.12) |
미국임상 |
|
VM-106 |
바이로메드 |
gp91 결손유전자 |
만성육아종 (유전질환) |
1/2a상 ('07.1) |
|
|
세라젠 |
뉴젠팜 |
종양선택적 복제, CD/TK자살 유전자 |
전립선암 |
2상 ('07.3) |
미국 임상 1상 완료 |
|
HB-110 |
동아제약 포항공대 |
HBV항원, IL-12 |
만성B형간염 |
1상 ('07.3) |
|
|
DWP418 |
대웅제약 |
Relaxin |
고형암 |
1상 ('08.1) |
|
4. 향후계획 및 전망
생명공학기술의 발달로 새로운 개념의 의약품이 개발되고, BT 산업의 국가성장 동력화 요구에 따라 생명공학의약품의 실용화를 지원하고자 하는 노력은 지속될 것이다. 그러나 의약품에 대한 국민의 안전요구도 증가와 각종 규제기준의 국제조화 등 의약품 안전관리체계 선진화도 병행해 나가야 할 과제이다.
식품의약품안전청은 첨단 생명공학의약품의 신속한 제품화를 위해 단위별 심사제 도입, 동등생물의약품(바이오시밀러) 허가제도 도입, 안전성․유효성 평가를 위한 각종 가이드라인을 지속적으로 발간하는 등 다양한 지원정책을 발굴․적용하는 한편 제조업과 품목허가의 분리, 사전검토제 법제화 등 약사법령 개정을 통해 의약품 관리제도의 혁신 선진화를 추진해 나갈 계획이다.
향후 전개될 생명공학의약품의 산업화 과정에서 새로운 패러다임을 가진 바이오분야의 현실과 관련 법령사이의 괴리를 최대한 효율적으로 축소하고, 의약품에 대한 안전성을 동시에 담보할 수 있는 정책이야말로 생명공학의약품의 국제 경쟁력을 확보할 수 있는 길이다.

생명공학 기업 현황과 지원제도
1. 개 요
가. 바이오비즈니스의 활성화
Ernst&Young사에 의하면 세계적으로 활동하고 있는 바이오관련 기업 중에서 상장기업(Public Company) 중심의 2008년도 수입규모(Revenues)는 896억 달러로 세계시장 규모는 1,250억 달러 이상으로 추정되는 가운데, 바이오산업분야에서 다양하게 바이오비즈니스가 활성화되고 있다.
[표 5-5-1-1] 상장기업 중심의 2008년도 세계 바이오산업 현황
(단위: 백만 달러, 명, 개)
|
구 분 |
내 용 |
합 계 |
미 국 |
유 럽 |
캐나다 |
아시아/ 태평양 |
|
상장기업 |
수입 |
89,648 |
66,127 |
16,515 |
2,041 |
4,965 |
|
연구개발비 |
31,745 |
25,270 |
5,171 |
703 |
601 |
|
|
순이익(순손실) |
(1,443) |
417 |
(702) |
(1,143) |
(14) |
|
|
종업원 수 |
200,760 |
128,200 |
49,060 |
7,970 |
15,530 |
|
|
기업수 |
상장기업 |
776 |
371 |
178 |
72 |
155 |
|
상장․비상장기업 |
4,717 |
1,754 |
1,836 |
358 |
769 |
출처: Beyond Borders: Global Biotechnology Report 2009, Ernst&Young, 2009
또한, BioWorld사에 의하면 바이오산업분야 중에서 산업화가 제일 활발한 바이오의약품의 경우 1982년~2007년 사이 미국 식품의약국(FDA) 승인을 획득한 바이오신약은 285개 제품으로, 동일 제품에 대한 적응증 확대사례 106건을 합하면 391개 바이오의약품이 승인되어 판매 중에 있다.
나. 의약 바이오의 성장 및 산업 바이오의 등장
단백질의약품과 치료용 항체 등 의약 바이오부문의 성장이 지속적으로 이루어지고 있는 상황에서 La Merie Business intelligence사의 자료에 의하면 2008년도 바이오의약품(항-TNF 항체 등 13개 제품군) 세계시장 규모는 806억 달러이고, RNCOS사에 의하면 단백질 치료제 세계시장을 2006년 505억 달러에서 2010년에는 925억 달러로 전망하고 있으며, Biophoenix사에 따르면 의약 바이오기업의 2006년도 제품시장은 671억 달러에서 2011년 1,176억 달러 규모로 확대를 전망하고 있다.
특히, 최근에는 특허가 만료되는 바이오의약품 대상의 Biosimilar 제품에 대한 산업체의 관심이 크게 늘고 있으며, 유전체 정보에 기초하는 맞춤의학에 대한 산업화 차원의 전략들이 추진되고 있다.
한편, 미국의 NatureWorks사는 PLA(Poly Lactic Acid)를 대량생산 공급할 수 있는 세계 최대의 생산기업으로 성장하여 산업 바이오부문의 산업적 성공 가능성을 제시하고 있어 산업 바이오의 활발한 기술개발과 산업화가 예견되고 있다.
2. 해외 동향
가. 미국 동향
(1) 기업 현황
바이오산업분야에 참여하고 있는 미국 바이오 전문기업과 대형 의약회사들의 비즈니스 활동에 의해 2008년도 미국의 바이오산업 매출규모(Sales)는 570억 달러, 수입규모(Revenues)는 649억 달러를 기록하였다.
이들 기업 중 선도기업인 Amgen사는 단백질과 항체 의약품을 중심으로 2008년도 150억 300만 달러의 총수입과 41억 9,600만 달러의 순이익을 기록하여 바이오산업을 리드하고 있다.
[표 5-5-2-1] 2008년도 미국 바이오산업 현황
(단위: 억 달러, 개, 명, %)
|
구분 |
내 용 |
상장기업 (Public Companies) |
산업체 합계 (Industry Total) |
||||
|
2008년 |
2007년 |
증감률 |
2008년 |
2007년 |
증감률 |
||
|
재정 |
제품 매출액 수입 연구개발비 순이익(순손실) |
541 661 253 4 |
499 610 210 (1) |
8.4 8.4 20.5 -430.7 |
570 649 261 (37) |
527 649 261 (42) |
8.0 8.0 16.8 -11.2 |
|
산업 |
시장가치 총 조달자금 상장기업 수 기업 수 종업원 수 |
3,438 86 1 371 128,200 |
3,692 159 22 395 131,300 |
-6.9 -46.3 -95.5 -6.1 -2.4 |
- 130 1 1,754 195,500 |
- 214 22 1,758 192,600 |
- -39.2 -95.5 -0.2 -1.1 |
출처: Beyond Borders : Global Biotechnology Report 2009, Ernst&Young, 2009
[표 5-5-2-2] 2008년도 미국 Amgen사의 경영현황
(단위: 백만 달러, 명)
|
판매액 |
총수입 |
연구개발비 |
순이익 |
종업원 |
시장가치 |
|
14,687 |
15,003 |
3,030 |
4,196 |
18,000 |
61,300 |
출처: Amgen 2008 Annual Report 등 종합, Amgen, 2009
(2) 지원제도 현황
미국은 세계 바이오경제 시장을 견인하기 위해 기술개발과 산업화를 전략적으로 추진하고 있는데, 연방정부는 보건부, 농무부, 에너지부, 환경보호청, 국립과학재단, 항공우주국 등을 중심으로 300억 달러 내외의 투자를 추진하고 있다.
의약 바이오부문은 줄기세포연구 규제완화와 지원확대정책을 펴고 있으며, 산업 바이오부문은 2000년 마련한 바이오매스 R&D법을 토대로 바이오매스 연구개발 이니셔티브(BRDI)를 수립하여 시행 중이다. 또한 주정부에서는 우수기업들을 유치하기 위해 산업화 기술개발 지원정책은 물론 조세지원과 투자유치를 적극적으로 추진하고 있다.
나. 일본 동향
(1) 기업 현황
일본은 발달된 발효기술을 기반으로 활성도가 강한 바이오의약과 바이오식품회사는 물론 바이오플라스틱 개발회사들이 활동하고 있으며, 최근에는 바이오벤처기업도 급증하여 2008년도 일본 바이오산업분야 총 시장규모는 2조 8,488억 엔으로 성장하였다.
[표 5-5-2-3] 일본의 2008년도 바이오산업 총 시장규모
(단위: 억 엔)
|
구 분 |
내 용 |
시장규모 |
|
|
2007년 |
2008년 |
||
|
바 이 오 제 품 |
유전자조작제품 세포융합제품 조직배양제품 |
15,950 992 347 |
21,934 942 353 |
|
소 계 |
17,289 |
23,229 |
|
|
바 이 오 관련제품 및 서비스 |
식품 기기․시약 의약․정밀화학제품 생물정보․서비스․센서․환경․기타 |
1,446 1,377 978 1,328 |
1,471 1,454 996 1.338 |
|
소 계 |
5,129 |
5,259 |
|
|
합 계 |
22,418 |
28,488 |
|
출처: 일경바이오연감 2009, 일경BP사, 2008
(2) 지원제도 현황
일본은 2010년 바이오산업 시장규모 25조 엔과 신규고용 100만 명 창출 목표로 2002년 바이오기술 전략대강 제정, 2004년 신산업 창조전략에서 산업화 단계를 위한 전략 마련, 2006년 바이오매스 일본종합전략 수립, 2007년 경제산업성의 기술전략로드맵 발표 등이 이루어졌다. 또한 경제산업성, 농림수산성, 후생노동성, 문부과학성, 환경성 등 5개 부처 중심으로 바이오관련 연구개발을 지원하기 위하여 2008년도 정부예산을 2,472억 엔 투자하였다.
다. 유럽 동향
(1) 기업 현황
유럽의 경우 EU 회원국 간 공동협력과 국가별 경쟁을 병행하고 있는 가운데, 대형 의약기업과 화학기업이 의약․산업․그린․해양 바이오 등과 관련된 바이오산업분야에 진출하여 다양한 사업을 추진하고 있으며, 2008년도 유럽 바이오산업의 수입규모(Revenues)는 153억 유로 규모이다.
[표 5-5-2-4] 2008년도 유럽 바이오산업 현황
(단위: 백만 유로, 개, 명, %)
|
구분 |
내 용 |
상장기업 (Public Companies) |
산업체 합계 (Industry Total) |
||||
|
2008년 |
2007년 |
증감률 |
2008년 |
2007년 |
증감률 |
||
|
재정 |
수입 연구개발비 순이익(순손실) |
11,228 3,516 (478) |
9,591 3,409 (1,588) |
17 3 -70 |
15,348 6,812 (1,994) |
13,553 6,571 (3,077) |
13 4 -35 |
|
산업 |
시장가치 총 조달규모 기업 수 종업원 수 |
38,487 833 178 49,062 |
58,727 4,269 185 47,775 |
-34 -80 -4 3 |
- 1,764 1,836 85,612 |
- 5,438 1,869 83,330 |
- -68 -2 3 |
출처: Beyond Borders : Global Biotechnology Report 2009, Ernst&Young, 2009
(2) 지원제도 현황
유럽연합(EU)은 2000년 Lisbon 전략을 채택한 이후 2008년 선도시장 전략을 발표하여 바이오기술과 바이오제품을 중점적으로 개발하고 있으며, 7차 Framework Program(2007년~2013년)에 의해 보건․바이오․식품․농산품개발에 95억 유로를 투자할 계획이다. 또한 지식기반 바이오경제를 추구하여 바이오매스 실행계획과 바이오클러스터 육성정책 추진을 병행하고 있으며, 특히 2009년 영국이 생명과학청(Office for Life Sciences)을 설치하여 바이오산업 통합 추진체계를 마련한 것은 시사하는 바가 크다.
3. 국내 현황
가. 산업체 현황
지식경제부 기술표준원, 산업연구원, 한국바이오협회가 2008년에 실시한 2007년도 국내 바이오산업 통계조사에 응답한 834개 사의 바이오산업분야 참여유형은 연구개발과 제품판매단계 512개 사, 연구개발 단계 322개 사 정도이다. 바이오산업제품 판매기업의 형태는 국산제품 394개 사, 수입제품 52개 사와 국산과 수입제품을 동시에 판매하는 66개 사 정도가 파악되고 있다.
의약 바이오부문이 강한 국내 산업체 소속의 바이오 전문인력 20,236명(연구인력 10,178명: 50%, 생산인력 10,058명: 50%)의 경우 연구인력은 석사급 47%, 생산인력은 테크니션 53%로 각각의 비중이 제일 크다.
나. 산업 규모
상기의 통계조사에 의하면 국내 바이오산업 총 수급규모는 4조 7,347억 원 규모인데, 이중에서 수요부문은 내수가 3조 2,632억 원이고 수출은 1조 4,715억 원이며, 공급부문은 생산이 3조 7,138억 원이고 수입이 1조 209억 원 규모이다. 한편, 2008년도 국내 바이오산업 총 수급규모는 5조 7,400억 원 규모로 추정하고 있다.
[표 5-5-3-1] 2007년도 국내 바이오산업 총 수급규모
(단위: 백만 원, %)
|
공 급 |
계 |
수 요 |
||||||
|
생 산 |
수 입 |
내 수 |
수 출 |
|||||
|
금 액 |
비 중 |
금 액 |
비 중 |
금 액 |
비 중 |
금 액 |
비 중 |
|
|
3,713,865 |
78.4 |
1,020,879 |
21.6 |
4,734,744 |
3,263,215 |
68.9 |
1,471,529 |
31.1 |
출처: 2007년도 국내 바이오산업 통계, 지식경제부 기술표준원/산업연구원/한국바이오협회, 2008
2007년도 국내 시장규모는 3조 2,632억 원(국산제품 2조 2,423억 원: 69%, 수입제품 1조 209억 원 : 31%) 규모인데, 이 중에서 바이오의약품은 2조 581억 원(63%), 기타는 1조 2,051억 원(37%)으로 구성되어 있다. 그리고 2008년도 국내 바이오산업 시장규모는 3조 9,700억 원 규모로 추정하고 있다.
다. 지원제도 현황
정부는 교육과학기술부, 보건복지가족부, 지식경제부 등 6개 관련부처 및 출연기관에서 2007년 8,793억 원을 투자하였고, 2008년 9,304억 원의 투자를 계획하였다.
[표 5-5-3-2] 2007년도 국내 바이오산업 시장규모
(단위: 억 원)
|
구 분 |
주요 제품 |
국산 제품 |
수입 제품 |
합계 |
|
바이오의약 |
항생제, 항암제, 백신 외 |
12,658 |
7,923 |
20,581 |
|
바이오화학 |
바이오고분자, 산업용 효소 외 |
1,879 |
855 |
2,734 |
|
바이오식품 |
건강기능식품, 발효식품 외 |
3,833 |
120 |
3,953 |
|
바이오환경 |
환경처리용 미생물제제 외 |
1,927 |
54 |
1,981 |
|
바이오전자 |
DNA칩, 단백질칩 외 |
228 |
10 |
238 |
|
바이오공정 및 기기 |
바이오반응기 외 |
645 |
1,211 |
1,856 |
|
바이오에너지 및 자원 |
바이오연료 외 |
249 |
35 |
284 |
|
바이오검정, 정보개발 |
바이오정보서비스 외 |
1,004 |
1 |
1,005 |
|
합 계 |
22,423 |
10,209 |
32,632 |
|
출처: 2007년도 국내 바이오산업 통계, 지식경제부 기술표준원/산업연구원/한국바이오협회, 2008
[표 5-5-3-3] 2008년도 부처별 생명공학 투자계획 총괄
(단위: 백만 원)
|
구 분 |
연구개발 |
시설 및 기반구축 |
인력양성 |
계 |
2007년도 실적 |
증감률 (%) |
|
교육과학기술부 |
315,997 |
10,789 |
38,451 |
365,237 |
326,945 |
11.7 |
|
농림수산식품부 |
90,691 |
800 |
600 |
92,091 |
84,988 |
8.4 |
|
지 식 경 제 부 |
77,852 |
54,057 |
430 |
132,339 |
194,149 |
△31.8 |
|
보건복지가족부 |
167,979 |
|
|
167,979 |
129,901 |
29.3 |
|
환 경 부 |
28,330 |
|
|
28,330 |
39,006 |
△27.4 |
|
국 토 해 양 부 |
18,635 |
31,986 |
|
50,621 |
11,100 |
356 |
|
출 연 기 관 |
87,100 |
6,695 |
|
93,795 |
93,208 |
0.6 |
|
계 |
786,584 |
104,327 |
39,481 |
930,392 |
879,297 |
5.8 |
출처: 2008년도 생명공학육성시행계획, 교육과학기술부 등, 2008
국내 바이오산업관련 지원제도는 크게 기술개발과 하부구조구축 지원으로 구별되는데, 2008년의 경우 9,304억 원의 예산 중에서 연구개발 7,866억 원(85%), 인프라 1,043억 원(11%), 인력양성 395억 원(4%)의 구성비를 나타내고 있다.
부처별로는 교육과학기술부 39%, 보건복지가족부 18%, 지식경제부 14%, 출연기관 10%, 농림수산식품부 10%, 기타 9%이며, 지식경제부의 경우 바이오제약 스마트 프로젝트 등 별도의 기술개발과 산업화 기반조성을 위한 하부구조 구축, 지역 클러스터 및 국제협력사업 등을 지원하고 있다.
4. 발전 과제
가. 시장 목표지향적 바이오기술의 산업화 중점 추진
바이오산업이 바이오기술에 기반하여 발전하는 특성이 있으나 연구개발, 생산, 판매의 전형적인 과정을 모두 거쳐 시장에 진출하면 시장 확보에 어려움이 있음을 경험하였다. 따라서 시장 목표지향적 전략(Market-targeted Strategy)을 수립한 이후 목표달성을 위한 추진전략에 의해 사업화가 진행되어야 한다.
지금까지 확보한 기술개발의 성과를 종합적으로 활용하여 상업화를 추진하기 위해서는 모든 바이오 관련 자금과 정책지원 등, 바이오 역량을 기술의 산업화에 집중 투입하여 시장경쟁력을 확보하여야 하며, 자체 또는 협력 추진 등 다양한 전략을 추진할 필요가 있다.
나. 의약 바이오 및 산업 바이오 추진전략의 고도화
우선은 기술혁신이 이루어지고 부가가치의 창출이 입증되고 있는 의약 바이오부문에 중점 투자하는 것이 바람직하다. 그러나 최근의 선진국 동향을 반영하여 재생의학과 단백질의약품에 대한 바이오신약의 개발은 물론 Biosimilar 제품의 사업화도 추진해야 할 것이다.
그리고 유전체 정보와 바이오정보학에 의해 목표 약품타게팅이 변화되는, 맞춤의학의 혁명에 대비하여 산업화 차원에서 기술개발과 산업화를 추진하여 탄력적으로 대응해야 한다. 한편, 산업 바이오부문에서는 바이오플라스틱의 사례와 같이 규제조치에 대응하기 위해 자동차 내장재 및 핸드폰 외장재 등 다양한 용도의 바이오플라스틱 개발이 필요하며, 바이오에너지보다는 바이오기반 화학제품의 개발이 우선 추진되어야 할 것이다.
다. 성과창출 목표의 협력시스템 활성화
현재 우리나라의 바이오산업은 산업규모 면에서 영세한 실정이고, 일부 성공사례들이 있으나 바이오산업계에 파급효과를 미칠 수 있는 성공사례들이 부족하여 어려움을 겪고 있는 것도 사실이다. 하지만 기술축적 등으로 성공 가능성 또한 커지고 있어 성과창출 목표를 달성할 수 있도록 공동 노력해야 한다.
이제는 연구개발 협력․생산 아웃소싱․판매 협력 등 국내기업 또는 해외기업과의 협력을 활성화 하여 결과물을 도출하는데 진력해야 한다. 왜냐하면 전략적인 협력시스템의 활용이나 과감한 M&A 등의 실행 필요성도 높아지고 있기 때문이다.
부 록


생명공학 연표
■ 기원전 8000년
○ 인간이 농작물과 가축을 경작하고 사육하기 시작
○ 최초로 감자를 식용으로 경작
■ 기원전 4000~2000년
○ 이집트에서 효모를 사용해 빵과 맥주의 발효 시작
○ 수메리아, 중국, 이집트에서 치즈를 생산하고 포도주를 발효시킴
○ 바빌로니아인들은 몇 그루 수술 나무의 꽃가루를 가지고 선별적으로 암술나무에 수정하여 대추야자를 생산
■ 기원전 500년
○ 중국에서 항생물질을 가진 곰팡이가 핀 두부로 종기를 치료
■ 서기 100년
○ 중국에서 최초로 살충제를 국화에 살포함
■ 1322년
○ 아랍에서 우성 말을 생산하기 위해 최초로 인공수정을 사용
■ 1590년
○ Janssen, 현미경 발명
■ 1663년
○ Hooke, 세포의 존재 발견
■ 1675년
○ Leeuwenhoek, 박테리아를 발견
■ 1761년
○ Koelreuter, 다른 종의 농작물을 성공적으로 이종교배하였음을 보고
■ 1797년
○ Jenner, 아이들에게 천연두를 막기 위한 바이러스성 백신을 접종
■ 1830~1833년
○ 1830년 단백질 발견
○ 1833년 최초로 효소가 발견되고 분리됨
■ 1835~1855년
○ Schleiden와 Schwann, 모든 유기체는 세포들로 구성되어 있다고 제안
○ Virchow, “모든 세포는 세포에서 생겼다”고 선언
■ 1857년
○ Pasteur, 미생물들이 발효를 유발한다고 제안
■ 1859년
○ Charles Darwin, 자연 도태의 진화론을 발표(1800년대 후반 유전학의 무지에도 불구하고 선택된 부모와 도태된 다양한 자손에 대한 개념은 동식물 사육사들에게 매우 큰 영향을 줌)
■ 1865년
○ 유전학 연구 시작
○ Gregor Mendel, 오스트리아인 수도사인 그는 완두를 연구하여 유전법칙에 의해 유전적 특징이 부모로부터 자손에게 물려진다는 점을 발견함
■ 1870~1890년
○ Darwin의 이론을 이용하여 면화를 이종교배하고 수백 가지의 우성품종을 개발
○ 최초로 농부들이 수확량을 늘리기 위해 농지에 질소고정 박테리아 미생물을 섞음
○ William James Beal, 최초로 실험실에서 실험용 옥수수 잡종 생산
■ 1877년
○ Koch, 박테리아를 염색하고 동정하기 위한 기술 개발
■ 1878년
○ Laval, 최초로 원심분리기 개발
■ 1879년
○ Fleming, 후에 염색체라 불려지는 세포핵 안쪽의 봉모양의 염색질을 발견
■ 1900년
○ 초파리가 유전연구에 사용
■ 1902년
○ 면역학이라는 용어가 처음으로 나타남
■ 1906년
○ 유전학이라는 용어가 소개됨
■ 1911년
○ Rous, 최초로 암을 유발하는 바이러스 발견
■ 1914년
○ 최초로 박테리아를 영국 맨체스터의 하수처리에 사용
■ 1915년
○ Phage(박테리아성 바이러스)발견
■ 1919년
○ 최초로 생명공학(Biotechnology)이라는 단어가 출판물에 사용
■ 1920년
○ Evans와 Long, 인간성장 호르몬 발견
■ 1928년
○ Alexander Fleming, 항생물질인 페니실린 발견
○ 유럽에서 조명충 나방제어를 위한 소규모의 Bacillus thuringiensis(Bt) 테스트 시작
○ 1938년 프랑스에서 미생물 살충제의 상업적 생산 시작
○ Karpechenko, 무와 양배추를 교배하여 서로 다른 속(屬)의 식물 사이에서 번식력이 강한 자손을 만듦
○ Laibach, 최초로 오늘날 이종교배라 알려진 광범위한 교배로부터 잡종을 얻기 위해 배구제(embryo rescue)를 사용
■ 1930년
○ 美의회에서 식물육종생산의 특허를 가능하게 하는 식물특허법(Plant Patent Act) 통과
■ 1933년
○ 1920년대 Henry Wallace에 의해 개발된 잡종옥수수가 상업화 됨(1945년에는 엄청난 매출액은 증가된 연 종자구입비를 능가했고 잡종 옥수수는 미국 전체 옥수수 생산량의 78%를 차지)
■ 1938년
○ 분자 생물학이란 용어가 생김
■ 1941년
○ 유전공학이란 용어가 폴란드 Lwow의 기술연구소에서 효모복제에 관한 강의를 맡고 있는 덴마크의 미생물학자 A. Jost에 의해 최초로 사용
■ 1942년
○ 박테리아를 감염시키는 박테리오파지를 규명하고 확인하기 위해 전자 현미경을 사용
○ 페니실린을 미생물에서 생산함
■ 1944년
○ Avery와 그 외 다른 사람들에 의해 DNA가 유전정보를 운반한다는 점이 입증됨
○ Waksman, 결핵에 효과적인 항생제인 streptomycin을 분리(추출)
■ 1946년
○ 새로운 타입의 바이러스를 형성하기 위해 서로 다른 바이러스로부터의 유전물질이 결합할 수 있다는 일종의 유전자 재조합이 발견
○ 유전적 다양성의 상실로 인한 위협을 인식한 미의회는 식물수집과 보존 그리고 이러한 인식의 홍보에 막대한 자금을 제공함
■ 1947년
○ McClintock, 옥수수에서 소위 움직이는 유전자(jumping genes)라 불리는 전이요소를 발견
■ 1949년
○ Pauling, 겸상(鎌狀) 적혈구 빈혈증(흑인의 유전병)이 헤모글로빈 내 단백질분자의 돌연변이로 야기된 ‘분자병’임을 밝혀냄
■ 1951년
○ 냉동정액을 사용한 가축의 인공수정이 성공적으로 수행됨.
■ 1953년
○ 과학저널 Nature는 현대 유전학의 출발을 상징하는 DNA의 이중나선구조를 묘사한 James Watson과 Francis Crick의 원고를 출판
■ 1955년
○ 핵산 합성에 관한 효소가 처음으로 추출됨
■ 1956년
○ Kornberg, DNA 복제에 필요한 효소 DNA 중합효소Ⅰ(DNA polymeraseⅠ) 발견
■ 1958년
○ 겸상 적혈구 빈혈증이 단일 아미노산의 변화 때문에 발생한다고 밝혀짐
○ DNA가 처음으로 시험관에서 만들어짐
■ 1959년
○ 조직 살균제가 개발됨
○ 단백질 생합성의 첫 단계가 그려짐
■ 1950년대
○ 바이러스 증식억제 물질(interferon) 발견
○ 최초 합성 항생 물질 개발
■ 1960년
○ 시냅시스(세포의 감수분열 초기에 있는 상동염색체의 병렬접착)를 이용해 DNA-RNA 잡종 분자가 만들어짐
○ 메신저 리보 핵산(Messenger RNA) 발견
■ 1961년
○ 美농림부가 최초 미생물 살충제인 Bacillus thuringiensis를 등록함
■ 1963년
○ Norman Borlaug에 의해 신품종 밀이 개발됨으로 인해 생산량이 70% 상승함
■ 1964년
○ 필리핀의 국제 벼 연구소(The International Rice Research Institute)는 새로운 품종을 개발하여 충분한 비료를 주면 이전의 생산량보다 2배 많은 수확량을 얻을 수 있는 녹색 혁명을 일으킴
■ 1965년
○ Harris와 Watkins가 성공적으로 생쥐와 사람 세포를 융합시킴
■ 1966년
○ 유전암호가 해독되고 일련의 3개의 뉴클리오티드가 하나의 아미노산을 결정한다는 사실이 밝혀짐
■ 1967년
○ 최초로 자동 단백질 서열 분석기 완성
■ 1969년
○ 처음으로 효소가 생체 외에서 합성됨
■ 1970년
○ 노르만인 Borlaug, 노벨 평화상 수상(1963년 참조)
○ 유전물질을 자르는 제한 효소(두 줄 사슬 DNA를 특정 부위에서 절단하는 효소)의 발견으로 유전자 복제의 장이 열림
■ 1971년
○ 처음으로 유전자가 완벽하게 합성됨
■ 1972년
○ 인간의 DNA 구성이 침팬지와 고릴라의 DNA와 99% 유사함이 발견됨
○ 최초로 배이식(胚移植)이 시도됨
■ 1973년
○ Stanley Cohen와 Herbert Boyer, 제한효소와 리가제(ligases)를 사용해서 DNA를 자르고 붙이는 기술과 박테리아에서 새로운 DNA를 복제하는 기술을 완성함
■ 1974년
○ 미국 NIH는 유전자 재조합 연구를 총괄하기 위해 재조합 DNA 자문위원회(Recombinant DNA Advisory Committee) 구성
■ 1975년
○ 최초로 미국 정부가 캘리포니아 Asilomar 회의에서 유전자재조합실험을 규제하기 위한 가이드라인 개발을 주장함
○ 단일클론항체가 생산됨
■ 1976년
○ 유전자 재조합 기술이 유전 장애인에 최초로 적용
○ 분자교배가 태아의 alpha thalassemia 진단에 사용됨
○ 효모의 유전자가 대장균(E.coli)에서 발현됨
○ 최초로 특정유전자의 염기쌍 순서가 결정됨(A, C, T, G)
○ 美國재조합 DNA 자문위원회(NIH Recombinant DNA Advisory Committee)에 의해유전자 재조합 실험에 대한 가이드라인이 처음으로 발표
■ 1977년
○ 인간유전자를 박테리아에서 처음으로 발현시킴
○ 전기영동을 이용해 DNA의 긴 마디를 빠르게 나열하기 위한 연구수행
■ 1978년
○ 바이러스의 고방사선 구조가 최초로 확인됨
○ 재조합 인간 인슐린이 최초로 생산됨
○ 미국 노스캐롤라이나 과학자들이 DNA 분자상의 특정 위치에 특정 돌연변이를 일으키는 것이 가능하다는 것을 보여줌
■ 1979년
○ 최초로 인간성장 호르몬이 합성됨
■ 1970년대
○ 유전공학 제품을 개발하기 위해 최초의 상업적 회사가 설립
○ 중합효소(polymerases)의 발견
○ 뉴클리오티드(nucleotides)의 빠른 나열기술 완성
○ 유전자 표적화
○ RNA splicing
■ 1980년
○ Diamond v. Chakrabarty 재판에서 미 연방법원은 유전자재조합생물형태에 대한 특허를 인정했으며, Exxon 석유회사가 기름 먹는 미생물에 대한 특허 취득
○ 美國정부 유전자복제에 대한 권한을 Cohen과 Boyer에게 부여
○ 최초의 유전자합성 기계 개발
○ 인간인터페론유전자를 박테리아로 형질전환(Transformation) 시킴
○ 노벨 화학상이 유전자 재조합분자를 개발한 Berg, Gilbert, Sanger에게 수여됨
■ 1981년
○ 오하이오 대학의 과학자들이 다른 동물의 유전자를 쥐에 이식함으로써 최초로 유전자 이식동물을 생산함
○ 중국의 과학자가 최초로 복제 물고기 금잉어를 만듦
■ 1982년
○ 미국의 Applied Biosystems社는 단백질 서열분석에 필요한 샘플의 양을 획기적으로 줄일 수 있는 상업적 가스 상 단백질 서열분석기를 발표
○ 가축을 위한 최초의 유전자 재조합 DNA 백신 개발
○ 유전적 변이를 거친 박테리아에서 생산된 인간인슐린이 미국 FDA로부터 최초의 생명공학 기술에 의한 의약품으로 승인 받음
○ 최초의 유전자 변형식물인 피튜니아 생산
■ 1983년
○ 중합효소연쇄반응(PCR) 기술이 소개(유전자와 유전자 조각의 복제를 위해 열과 효소를 사용하는 PCR 기술은 이후 유전공학에서의 연구와 개발에 광범위하게 쓰이는 중요한 도구가 됨)
○ TI 플라스미드(plasmid: 염색체와는 따로 증식할 수 있는 유전인자)에 의한 식물 세포들의 유전학적인 변형이 수행됨
○ 최초로 인공염색체 합성
○ 특정유전병 유발인자 발견
○ 생명공학기술을 이용해 피튜니아를 완전 성장시킴
○ 피튜니아 식물을 통해 유전자변형식물의 새로운 특징이 자손에게 전달됨을 확인함
■ 1984년
○ DNA 지문검색 기술이 개발
○ HIV 바이러스의 전체 게놈이 복제되고 서열 결정됨
■ 1985년
○ 신장병과 낭포성 섬유증을 유발하는 유전인자 발견
○ 법적 증거로서 유전자 지문법이 도입
○ 최초로 곤충과 박테리아, 바이러스에 저항력이 있는 유전자 변형식물이 시험됨.
○ 미국 NIH는 인간을 대상으로 하는 유전자 치료법 실험수행에 대한 가이드라인을 정함
■ 1986년
○ 유전자 재조합 B형 간염 백신 최초 개발
○ 최초의 유전공학 항암치료제 인터페론 생산
○ 미국 정부는 유전자 재조합 유기체에 대해 전통적인 유전자재조합기술로 만들어진 제품에 적용된 규정보다 더 엄격한 “The Coordinated Framework for Regulation of Biotechnology” 규정 확립
○ California Berkeley 대학의 화학자가 신약을 개발하기 위해 항체와 효소를 결합하는 방법(abzymes) 제시
○ 유전자 변형식물(담배)의 실제 실험이 수행됨
○ 최초로 환경 보호국이 유전자변형 담배의 판매를 승인
■ 1987년
○ 바이러스에 내성이 있는 토마토의 field test를 최초로 승인함
○ 캘리포니아에서 농작물의 서리 형성을 억제하는 유전자 변형 박테리아인 Frostban을 딸기와 감자를 통해 시험하였는데 이것이 처음으로 공식 승인된 유전자 재조합 박테리아 외부 실험임
■ 1988년
○ 미국 정부는 하버드대학 분자유전학자에게 유전자 변형동물 즉, 유전자변형 쥐에 대한 특허권을 부여함
○ 세제에 사용할 수 있는 표백제 내성을 지닌 단백질 분해효소를 만드는 공정에 대한 특허권이 부여됨
○ 미국 의회가 다른 종의 게놈뿐만 아니라 인간유전자 암호를 해독하고 지도를 만드는 인간 게놈 프로젝트 연구비를 승인함
■ 1989년
○ 최초로 유전자변형 해충방지 면화의 field test 승인
○ 식물 게놈 프로젝트 시작
■ 1980년대
○ 진화의 역사를 밝히기 위한 DNA 연구 시작
○ 유럽에서 유전자 재조합 동물백신의 사용 승인
○ 기름 청소에 미생물을 이용한 생물학적 정화기술 사용
■ 1990년
○ 미국 최초로 유전자재조합 기술을 이용하여 치즈제조에 쓰이는 인공적으로 제조된 chymosin 효소인 Chy-MaxTM이 소개됨
○ 인체의 모든 유전자 지도를 제작하려는 국제적인 노력인 인간 게놈 프로젝트가 시작됨
○ 면역장애를 앓고 있는 4살 여자 어린이를 대상으로 실시한 유전자 치료가 성공적으로 수행됨
○ 유아 조유용 우유 단백질을 만드는 유전자 변형 젖소 탄생
○ 해충에 강한 옥수수인 Bt 옥수수 생산
○ 영국 최초로 유전자변형 효모식품이 승인됨
○ 유전자 변형 척추동물 송어의 실지실험이 수행됨
■ 1992년
○ 미국과 영국의 과학자들이 시험관 내에서 배아에 낭포성 섬유증과 혈우병과 같은 유전적 기형을 테스트하는 기법을 밝힘
○ 미국 FDA는 유전자 이식 음식이 유전적으로 위험하지도 않고 특별한 규정도 필요 없다고 선언함
■ 1993년
○ 미국 FDA, 낙농가의 우유생산 촉진을 위해 BST(Borine Somatotropin)를 승인
■ 1994년
○ 미국 FDA, 생명공학으로 만들어진 FLAVRSAVRTM tomato 승인
○ 최초로 유방암 유전자 발견
○ CF 환자의 폐에 단백질이 쌓이지 않게 하는 재조합 인간 DNase 승인
○ 소 성장호르몬(POSILAC)이 상용화됨
■ 1995년
○ 에이즈 환자에게 최초로 비비의 골수가 이식됨
○ 최초로 바이러스 이외의 살아있는 유기체(Hemophilus Influenzae)의 완벽한 유전자 배열이 완성됨
○ 암정복을 위해 면역시스템 모듈, 유전자 재조합 항체형성과 같은 유전자 치료가 도입됨
■ 1996년
○ 파킨슨병과 관련된 유전자의 발견으로 퇴행성 신경질환의 잠재 가능한 치료와 그 원인 연구의 중요한 이정표를 제시함
■ 1997년
○ 스코틀랜드에서 어른세포로 복제된 최초의 복제양 Dolly 탄생
○ 해충방지 농작물인 Roundup ReadyTM 콩과 BollgardTM 해충방지 면화와 같은 작물이 상업화 됨
○ 아르헨티나, 호주, 캐나다, 중국, 멕시코와 미국 등 전 세계적으로 500만 에이커 면적에서 유전자조작 작물이 재배됨
○ Oregon주 연구자들은 두 마리의 붉은털 원숭이를 복제했다고 주장함
○ 유전병 연구의 새로운 기술을 창조하기 위해 PCR, DNA 칩과 컴퓨터를 결합한 새로운 DNA기술 탄생
■ 1998년
○ 하와이대학 연구진이 어른의 난소 적(cumulus)세포 핵으로부터 쥐를 복제함
○ 인간 배아줄기세포주가 확립됨
○ 일본 Kinki 대학 연구진은 한 마리 어른암소로부터 얻은 세포를 이용하여 8마리의 동일 송아지 복제함
○ 최초로 C. elegans 벌레에 대한 동물 게놈 염기서열 해독 완료
○ 30,000개 이상의 유전자 위치를 보여주는 인간 게놈지도의 초안 완성
○ 동남아시아 다섯 나라가 병에 강한 파파야 나무를 개발하기 위해 컨소시엄을 구성
■ 1990년대
○ 최초로 영국에서 유전자 지문법을 이용해 유죄를 판결함
○ 규정 질량의 일반적 융기에 착상된 유전자 분리성공
○ 유전성 대장암이 DNA 치료 유전자의 결핍으로 야기된다는 사실 발견
○ 유전자 재조합 광견병 백신을 너구리에 실험
○ 미국에서 농약을 기본으로 한 생명공학 제품판매 승인
○ 특수이식 유전자를 가진 쥐에 관한 특허 허용
○ 최초로 유럽에서 발암물질에 민감한 유전자변형 쥐에 관한 특허 제기
○ 유방암 유전자 복제
■ 2000년
○ 최초로 애기장대(학명 Arabidopsis thaliana)의 게놈지도 개발
○ 13개 나라에서 총 1억 89만 에이커 면적에서 생물공학 농작물이 재배됨
○ 최초로 바이러스에 강한 고구마가 케냐에서 실질 시험됨
○ 인간게놈 배열의 초안 발표
■ 2001년
○ 최초로 벼 게놈지도 완성
○ 오스트리아 연구진들은 Barley Yellow Dwarf Virus와 같은 바이러스 예방백신에 사용되는 hairpin RNA를 이용한 기술개발을 보고함
○ Chinese National Hybrid 연구진들은 일반 쌀 생산량보다 두 배 많은 super rice종 개발을 보고함
○ 유럽위원회(The European Commission)가 모든 유전자 변형 식품에 라벨을 붙일 것을 제기함
○ 농업적으로 중요한 시노라이조비움 멜리로티(Sinorhizobium meliloti) 박테리아의 DNA배열 완성
○ 염분이 있는 물과 땅에서 성장 가능한 최초의 농작물을 만들기 위해 애기장대로부터 추출된 유전자를 토마토에 이식함
○ 농업에 중요한 식물병원균 Agrobacterium tumefaciens의 게놈서열이 공표됨
○ 스트레스에 더 강한 농작물 개발의 실마리로서, 손상을 입거나 스트레스를 받았을 때 빛을 발하는 세일 크레스(thale cress)라 불리는 실험용 식물 재배
○ 최초로 땅콩의 종합적 분자지도가 완성됨
■ 2002년
○ 완성된 인간 게놈 배열을 과학전문지에 게재함
○ 효모의 프로테옴(Proteome: 단백질 간 상호작용과 네트워크의 총합)의 기능지도(functional map)의 초안 완성, 효모의 게놈지도는 1996년에 발표되었음
○ 줄기세포의 분화에 관여하는 조절인자 연구에 큰 발전이 있었으며, 이에 관여하는 200여개의 유전자가 밝혀짐
○ 생명공학 농작물이 16개국, 1억 4천 5백만 에이커에서 재배되고 있으며 이는 2001년보다 12% 증가한 것임
○ 자궁경부암에 대한 백신 개발에 성공하였으며 이는 특정 암에 대한 예방백신이 가능함을 처음으로 보여준 성과임
■ 2003년
○ 인간게놈 완전 해독(4월)
○ 정신분열증과 우울증 등 정신병의 발병 위험을 증가시키는 특정유전자 변형을 확인한 연구결과 발표
○ 美최초의 GM 애완동물로 광고된 붉은 빛 형광물고기 GloFish 상업화
○ 세계적으로 생명공학작물 이용의 활성화 증대
○ 영국은 최초로 상업적인 생명공학작물인 제초제 저항옥수수를 인정
○ 미국 환경 보호국은 최초로 형질전환 해충저항성 옥수수를 승인함
○ 2003년 banteng 들소가 최초로 복제되었으며, 노새, 말, 사슴도 복제되었음
○ 1997년 포유동물의 최초 복제양 돌리는 폐병연구 후에 안락사 됨
○ 일본 연구팀은 자연적으로 카페인을 제거하는 생명공학 커피를 개발함
○ RNA 형태는 유전자 형식을 지시, 변형시키며 줄기세포와 배(胚)의 성장에 영향을 미침을 밝힘
○ 쥐의 배 세포줄기가 정자나 난자 세포로 성장할 수 있음을 확인
○ 남성을 결정짓는 Y염색체가 동일한 유전자를 함유하고 있음을 발견
○ 종양으로 하여금 암의 전이에 필요한 혈관을 생성하지 못하도록 하는 약물의 개발
■ 2004년
○ 미국 식품의약국(FDA)은 아바스틴이라는 최초의 신세대 항암제를 승인함.
○ FDA는 다양한 종류의 약물치료와 질병을 위해 첫 DNA칩 및 유전자칩 개발
○ RNA 방해 제품으로, 임상 시험에 들어가는 첫 번째 RNAi 제품 생산
○ 국제연합 식량농업기구(FAO)의 생명공학 작물 승인
○ 국립과학연구원 산하 의학연구소에서는 ‘생명공학작물이 건강에 해를 끼치지 않는다’라고 밝힘.
○ FDA는 식품안전성 검토 후 생명공학 밀의 안전성 밝힘.
○ 몬산토사는 지방산을 감소 삭제한 low-linolenic 콩을 소개함
○ 닭 게놈 DNA 완전 해독
○ 최초로 애완 새끼고양이 복제
○ ‘쓸모없는 DNA(junk DNA)’ 규명
○ 인간의 유전자 DNA 중 단백질을 합성하는 DNA는 전체 게놈의 10%에 불과하며 아무런 기능이 없는 DNA에 대한 규명 이루어짐
○ 지난 3월 영국의 과학자들, 지난 20년간 나비 58종의 개체 수가 71% 줄었으며, 조류는 54% 감소했다고 보고
○ 新의약품 개발 활발
○ 유엔(UN), 대학, 민간자선단체, 제약업체 등 공공단체와 민간기업이 손을 잡고 미개발국의 환자를 위해 의약품을 개발하는 새로운 움직임이 일어남.
○ 미생물게놈 추출성공, 인간게놈프로젝트 주역인 미국 크레이크 벤터 박사는 3월 사이언스에 바닷물에서 미생물 게놈을 추출해 10억 5,000만 염기쌍을 한꺼번에 분석하는 데 성공했다고 밝힘
■ 2005년
○ 게놈지도와 야외 관찰로 진화가 일어나는 복잡한 과정을 밝힘
○ 유럽 호이겐스 탐사선이 토성의 달 타이탄에 착륙하고, NASA의 Deep Impact가 혜성에 충돌한 실험 등
○ 분자 생물학자들이 봄에 꽃이 다양한 색깔을 내게 하는 원리를 발견
○ 위성과 지상망원경으로 도시 크기의 죽은 별들인 중성자별 관찰
○ 정신분열증, 난독증, 안면경련증과 같은 뇌 신경질환 연구
○ 외계에서 온 암석과 지구의 암석을 비교 분석한 결과 지구 생성에 대해 새로운 이론 설립
○ volage-gated potassium channel의 분자 구조 밝힘
○ 인간 활동에 의한 지구 온난화의 증거 추가 발견
○ 분자 생물학자들이 복잡한 시스템의 행태를 이해하기 위해 엔지니어 기술 이용
○ 120억 달러 규모의 국제 핵융합 실험로(International Thermonuclear Ex-perimenta Reactor) 위치가 18개월의 논란 끝에 프랑스 Cadarache로 결정
○ Z 나선형 DNA와 B 나선형 DNA의 결합구조 규명, 네이처지 게재
■ 2006년
○ 네안데르탈인 DNA 염기서열 분석
○ 급진전되는 지구 온난화 전망 제기
○ 땅위를 걸어다닌 물고기 화석 발견
○ 시력감퇴 치료제 개발
○ 생물 다양성의 재발견
○ 최첨단 현미경 기술 개발
○ 기억메커니즘 규명 단초 발견
○ 마이크로 RNA와 siRNA보다 약간 긴 새로운 RNA를 발견
○ 미연방정부 연구비 천만 달러를 받아 일리노이 대학 연구팀이 진행하고 있는 돼지 게놈 해독은 2년 안에 완성될 것으로 기대
○ 미 부시 대통령이 상하원 합동연설에서 농업 페기물로부터 바이오에탄올 생산 지원
○ 미 NIH가 유방암 재발을 예측하기 위해 10년간, 만 명의 환자에 대해 유전자 검사를 실시하는 연구를 개시
○ 미국 당뇨병 협회(ADA)가 농업 및 식량분야 생명공학에 대한 지원을 재확인
○ 다우사가 최초의 식물 생산 백신에 대한 허가를 취득
○ Renessen사가 생명공학 기술을 이용하여 유용성이 추가된 작물에 대해 최초로 동물 사료로 판매할 수 있는 허가를 취득
○ USDA가 밀의 게놈연구를 위해 18개 대학 밀번식 컨소시엄에 연구비 오백만 달러 지원
○ 오메가-3 지방산을 생산하는 형질전환 돼지 개발
○ 세계무역기구는 EU가 21가지의 농업 생명공학제품에 대해 통상약정을 위반 했다고 발표
○ 프랑스 농무부가 생명공학 옥수수 및 담배 작물에 대해 17가지의 새로운 실지 시험을 허가
○ 마이크로RNA의 초기프로세싱 기전 규명
○ 암 발생 억제기능 SUSP4 유전자의 분리 및 작용 메커니즘 규명
○ 저분자화합물을 이용한 세포노화의 가역적 재프로그래밍
■ 2007년
○ AMPK 효소 항암기능 최초 규명. AMPK 활성화를 통해 대장암 세포가 정상으로 변화
○ 체내 면역반응 조절 ‘브레이크 장치’ 물질 발견
○ ‘스페인감기’ 바이러스를 이용해 조류독감을 치료할 수 있는 길이 열림
○ 화성에 물 존재 증거 발견
○ 자연계에 존재하지 않는 D-아미노산을 손쉽게 합성할 수 있는 신기술 개발
○ 수명이 다하거나 손상을 입은 세포에 죽음의 신호를 보내는 메커니즘 규명
○ 암 발병을 억제하는 유전자의 기능 규명
■ 2008년
○ 조류독감 인체 간 감염 유발 경로 찾았다(출처:Nature Biotechnology)
○ 모유수유가 천식 등을 유발하는 항원에 대해 아이들을 어떻게 보호하는지에 대한 기전 규명(출처: Nature Medicine)
○ 장내 세균과의 공생 기제 밝혀냈다(출처: Science)
○ 인간배아줄기세포로 당뇨병 쥐 치료 성공(출처: Nature Biotechnology)
○ 탈모유발 유전자 발견, 새 탈모약 개발기대(출처: Nature Genetics)
○ 암 세포를 무제한 자라게 하는 ‘효소단백질’ 확인(출처: Nature)
○ 비만 원인 ‘유전자 네트워크 이상’(출처: Nature)
○ 루게릭병 유발 ‘유전자’ 찾았다(출처: Nature Genetics)
○ 운동신경세포 분화과정 규명(Developmental Cell)
○ 알즈하이머치매 ‘기억력’ 떨어뜨리는 핵심 단백질 규명(출처: Nature Genetics)
○ 배꼽시계 등 생체회로 조절원리 규명(출처: Science)
○ 예방법 없는 ‘말라리아’ 백신 개발된다(출처: Nature Medicine)
○ 물체 인식과정 규명, 실명치료 도움(출처: Nature)
○ 항생제 ‘페니실린’ 만드는 균 ‘유전자서열’ 규명(출처: Nature Biotechnology)
○ 유전자 제어 마이크로RNA 조절·사멸 메커니즘 규명(출처: Molecular Cell)
○ ‘소리’ 잘 듣게 하는 귀 속 ‘단백질’ 규명(출처: Nature)
○ 인체 세포 죽이는 단백질 규명, 새로운 항암제 개발(출처: Nature)
○ 日 연구팀 ‘암세포’ 추적자 영상촬영물질 개발(출처: Nature Medicine)
■ 2009년
○ 파킨슨병 등 신경퇴행성질환 유발 기전 규명(출처: Nature Medicine)
○ 염색체 응축 ‘단백질 복합체’ 분자구조 규명(출처: Cell)
○ 마이크로 RNA 메커니즘 규명(출처: Cell)
○ ‘고혈압’ 유발 유전자 변이 규명(출처: Nature Genetics)
○ 단백질과 패혈증의 원인 물질인 세균의 내독소가 결합된 복합체의 분자구조를 세계 최초로 규명(출처: Nature)
○ 당뇨 원인 인슐린 저항성 유발인자 발견(출처: Cell Metabolism)
○ 장(腸) 세포의 세균 제거 기전 규명(출처: Developmental Cell)
○ 소 유전자 지도 완성 ‘축산혁명’(출처: Science)
○ 미칠 듯한 가려움증 ‘긁어주면 좋아지는 이유’ 규명(출처: Nature Neurons)
○ 다운증후군 ‘암’ 잘 안 걸리는 이유 규명(출처: Nature)
○ 자도 자도 졸린 ‘기면증’ 면역계 기능 부전이 원인(출처: Nature Genetics)
○ 체내 자연 발생 ‘표백성분’ 상처회복 돕는다(출처: Nature)
○ 사람 줄기세포로 뇌졸중 쥐 치료성공(출처: Gene Therapy)
○ 한국 남성 ‘유전자 서열’ 밝혔다 (출처: Nature)
○ NMR로 생체막 단백질 구조 규명(출처: Science)
○ 줄기세포 분화조절 단백질 발견(출처: Cell)
○ ‘새벽잠 없는 이유 있다’, 적게 자게 하는 유전자 발견(출처: Science)

생명공학 주요통계
1. 예산투자
[그림 부록-2-1-1] 정부부문 생명공학 투자실적(1994∼2008)88)
![]()

출처: 생명공학정책연구센터, 연도별 생명공학육성시행계획 자료 가공
주1) 2006~2008년의 투자실적에는 출연기관의 투자실적(710억 원, 932억 원, 1,046억 원)이 포함됨
주2) 2009년도의 정부부문 생명공학 투자 계획 총 예산액은 11,634억 원임(2008년 대비 19.2%증가)
주3) 1994∼2008 기간 동안의 정부투자는 총 5조 2,452억 원(연증가율 26%)
[표 부록-2-1-1] 부처별 생명공학 투자실적(1994∼2009)
(단위: 억 원)
|
구 분 |
제1차 기본계획
('94~'06) |
제2차 기본계획 1차년도 ('07) |
총계 |
2008년 정부부처 개편 |
제2차 기본계획 2차년도 ('08) |
09년 투자계획 |
총계 |
|
과학기술부 |
17,313 |
2,470 |
19,783 |
교육과학 기술부 |
3,589 |
4,230 |
9,619 |
|
교육인적 자원부 |
2,677 |
800 |
3,477 |
||||
|
농림부 |
5,287 |
842 |
6,129 |
농림수산 식품부 |
786 |
970 |
1,756 |
|
산업자원부 |
7,515 |
1,674 |
9,189 |
지식경제부 |
1,338 |
1,429 |
2,767 |
|
정보통신부 |
523 |
118 |
641 |
||||
|
보건복지부 |
7,414 |
267 |
7,681 |
보건복지 가족부 |
2,371 |
3,271 |
5,642 |
|
환경부 |
1,316 |
1,300 |
2,616 |
환경부 |
184 |
274 |
458 |
|
해양수산부 |
577 |
390 |
967 |
국토해양부 |
449 |
407 |
856 |
|
출연기관 |
710 |
932 |
1,642 |
출연기관 |
1,046 |
1,053 |
2,099 |
|
총 계 |
43,332 |
8,793 |
52,125 |
총 계 |
9,764 |
13,434 |
23,198 |
출처: 생명공학정책연구센터, 연도별 생명공학육성시행계획 자료 가공
[표 부록-2-1-2] 부처별 생명공학분야 투자비교(2008년 실적 & 2009년 계획)
(단위: 억 원)
|
|
교육과학기술부 |
농림수산식품부 |
지식 경제부 |
보건복지가족부 |
환경부 |
국토 해양부 |
출연기관 |
총계 |
|
'08년 투자실적 |
3,589 |
786 |
1,338 |
2,371 |
184 |
449 |
1,046 |
9,764 |
|
'09년 투자계획 |
4,230 |
970 |
1,429 |
3,271 |
274 |
407 |
1,053 |
13,434 |
|
증감률 |
17.9%↑ |
18.9%↑ |
6.8%↑ |
37.9%↑ |
32.8%↑ |
9.4%↓ |
0.7%↑ |
19.2%↑ |
출처: 생명공학정책연구센터, 2009년도 생명공학육성시행계획 자료 가공
[표 부록-2-1-3] 부처별 생명공학분야 세부 투자계획(2009년)
(단위: 백만 원)
|
부처 |
ʼ09년 투자계획 |
계 |
||
|
연구개발 |
시설 및 기반구축 |
인력양성 |
||
|
교육과학기술부 |
379,868 |
11,845 |
31,335 |
423,048 |
|
농림수산식품부 |
95,668 |
800 |
500 |
96,968 |
|
지식경제부 |
78,844 |
61,245 |
2,780 |
142,869 |
|
보건복지가족부 |
225,064 |
102,000 |
- |
327,064 |
|
환경부 |
27,371 |
- |
- |
27,371 |
|
국토해양부 |
16,119 |
24,580 |
- |
40,699 |
|
출연기관 |
92,383 |
12,998 |
- |
105,381 |
|
총계 |
915,317 |
213,468 |
34,615 |
1,163,400 |
출처: 생명공학정책연구센터, ʼ09년도 생명공학육성시행계획 참조
[표 부록-2-1-4] 5대 분야별 연구개발 투자비교(2008년 실적 & 2009년 계획)
(단위: 백만 원)
|
|
생명과학 |
보건의료 |
농축산식품 |
산업공정/ 환경·해양수산 |
바이오융합 |
총계 |
|
'08년 투자실적 |
305,583 |
233,980 |
108,132 |
55,528 |
63,283 |
766,506 |
|
'09년 투자계획 |
373,058 |
283,948 |
124,658 |
70,279 |
63,374 |
915,317 |
|
증감율 |
22.1%↑ |
21.4%↑ |
13.3%↑ |
20.9%↓ |
0.1%↑ |
19.4%↑ |
출처: 2008년도 생명공학육성시행계획
[표 부록-2-1-5] 민간부문 생명공학 투자실적(1994∼2006)
(단위: 억 원)
|
1단계('94∼'97) (소계 6,429) |
2단계('98∼'01) (소계 10,405) |
3단계('02∼'06) (소계 30,411) |
||||||||||
|
'94 |
'95 |
'96 |
'97 |
'98 |
'99 |
'00 |
'01 |
'02 |
'03 |
'04 |
'05 |
'06 |
|
1,260 |
1,537 |
1,769 |
1,863 |
1,876 |
2,353 |
2,695 |
3,481 |
4,095 |
4,749 |
5,661 |
7,366 |
8,540 |
출처: 생명공학정책연구센터, 국내 바이오산업 통계(ʼ07.12)자료 가공
2006년 총 투자액(8,540억 원) = 연구개발투자(5,405억 원) + 시설투자(3,135억 원)
2. 부처별 R&D 사업현황
[표 부록-2-2-1] 부처별 R&D 사업현황
|
기관 |
사업명 |
|
교육과학기술부 |
○ 21세기프론티어연구개발사업 |
|
○ 미래기반기술개발사업 |
|
|
○ 차세대성장동력(바이오신약장기)사업 |
|
|
○ 미래유망파이오니아사업 |
|
|
○ 기초과학육성사업 |
|
|
○ 국제공동연구사업(글로벌연구실사업) |
|
|
○ 일반연구자지원사업(BT분야) |
|
|
○ 뇌과학원천기술개발사업 |
|
|
농림수산식품부 |
○ 농림기술개발정책연구(농특회계) |
|
○ 경쟁력 제고(FTA기금) |
|
|
○ 가축방역검역 및 수의과학연구 |
|
|
○ 수산업생명공학연구 |
|
|
○ 바이오 그린21(2개) |
|
|
○ 농업생명공학연구(4개) |
|
|
○ 산림과학기술개발 |
|
|
지식경제부 |
○ 바이오․의료기기산업원천기술개발 |
|
○ 산업기술융합산업원천기술개발 |
|
|
○ 부품소재기술개발 |
|
|
○ 신재생에너지기술개발 |
|
|
보건복지가족부 |
○ 보건산업육성(3개) |
|
○ 보건의료서비스지원 |
|
|
○ 질병관리본부 지원(3개) |
|
|
○ 암 및 희귀질환지원 |
|
|
환경부 |
○ 상하수도 및 토양지하수관리 |
|
○ 자연환경․생물자원보전(3개) |
|
|
○ 환경보전기반육성(4개) |
|
|
국토해양부 |
○ 해양자원이용기술개발 |
|
○ 해양환경복원기술개발 |
출처: 생명공학정책연구센터, 연도별 생명공학육성시행계획 자료 가공
[표 부록-2-2-2] 부처별 시설 및 기반구축 사업(1)
(단위: 백만 원)
|
부처 |
사업명 |
사업기간 |
'08실적 |
'09계획 |
주관기관 |
|
교육 과학 기술부 |
○ 바이오기술개발사업 - 바이오기반구축사업 |
'01∼계속 |
5,546 |
4,626 |
한국 연구재단 |
|
○ 특성화장려사업 - 국가지정연구소소재은행지원사업 - 국가지정전문연구정보센터지원사업 |
'95∼계속 '95∼계속 |
2,300 |
2,300 |
서울대학교 외 |
|
|
○ 국제공동연구사업 - 해외생물소재 확보를 위한 허브형 네트워크 구축·운영사업 |
'07∼'16 |
4,899 |
4,919 |
한국생명 공학연구원 |
|
|
소계 |
|
|
12,745 |
11,845 |
|
|
부처 |
사업명 |
사업기간 |
'08실적 |
'09계획 |
주관기관 |
|
농림 수산 식품부 |
○ 산림정책관리 - 지방임업연구기반조성 |
'07∼'11 |
800 |
800 |
산림청 |
|
소계 |
|
|
800 |
800 |
|
|
국토 해양부 |
○ 국립해양생물자원관 건립 |
'08∼'12 |
28,186 |
22,680 |
국토해양부 |
|
○ 해양바이오창업지원센터 및 해양생물연구센터 건립 |
'08∼'10 |
3,800 |
1,900 |
국토해양부 및 지자체 |
|
|
소계 |
|
|
31,986 |
24,580 |
|
출처: 생명공학정책연구센터, 연도별 생명공학육성시행계획 자료 가공
[표 부록-2-2-3] 부처별 시설 및 기반구축 사업(2)
|
부처 |
사업명 |
사업기간 |
'08실적 |
'09계획 |
주관기관 |
|
지식 경제부 |
○ 바이오·의료기기산업 원천기술개발 |
'09∼계속 |
6,605 |
5,025 |
지식경제부 |
|
○ 바이오분야국제협약이행 |
'05∼계속 |
2,392 |
2,219 |
지식경제부 |
|
|
○ 바이오분야지역전략산업 진흥 |
'99∼'12 |
32,708 |
33,951 |
지역 TP, 지역센터 |
|
|
○ 발효미생물 종합활용센터 건립 |
'07∼'10 |
7,000 |
12,400 |
순창군 |
|
|
○ 바이오분야지역혁신센터 (RIC) |
'00∼'16 |
7,285 |
7,650 |
대학 |
|
|
소계 |
|
|
55,990 |
61,245 |
|
|
출연 기관 |
○ 바이오신약연구센터 건설사업 ○ 미래형동물자원센터 건설사업 |
'05∼'09 '09∼'11 |
6,695 - |
3,134 1,000 |
한국생명 공학연구원 |
|
○ 퇴행성질환재생연구장비구입․운영사업 ○ 공동활용연구기자재 및 장비확충사업 |
'06~계속 '97~계속 |
1,800 7,140 |
1,800 7,064 |
기초과학 연구원 |
|
|
소계 |
|
|
15,635 |
12,998 |
|
출처: 생명공학정책연구센터, 연도별 생명공학육성시행계획 자료 가공
[표 부록-2-2-4] 부처별 인력양성 사업
(단위: 백만 원)
|
부처 |
사업명 |
사업기간 |
'08실적 |
'09계획 |
주관기관 |
|
교육 과학 기술부 |
○ 2단계 연구중심대학 육성(BK21사업) |
'06∼'13 |
31,878 |
31,335 |
교과부 |
|
소계 |
|
|
31,878 |
31,335 |
|
|
농림 수산 식품부 |
○ 산림과학 기초연구지원 |
'06∼'17 |
600 |
500 |
산림청 |
|
소계 |
|
|
600 |
500 |
|
|
지식 경제부 |
○ 산업진흥고도화(산업기술진흥) |
|
|
|
|
|
- 바이오 기술인력 재교육 |
'08∼'10 |
300 |
300 |
지경부 |
|
|
- 바이오 전문인력 양성 |
'09∼'13 |
|
2,480 |
지경부 |
|
|
소계 |
|
|
300 |
2,780 |
|
출처: 생명공학정책연구센터, 연도별 생명공학육성시행계획 자료 가공
3. 인력
[그림 부록-2-3-1] 국내 생명공학분야 졸업자 현황

출처: 생명공학정책연구센터, 교육통계정보센터(http://.cesi.kedi.re.kr)자료 가공(2009.10)
생명공학분야: 교육인적자원통계서비스에 제시된 소계열 분류 중 12개 소계열이 해당 (보건학, 약학, 의료공학, 의학, 재활학, 치의학, 한의학, 농업학, 동물·수의학, 산림·원예학, 생명과학, 생물학)
[표 부록-2-3-1] 생명공학 산업분야 종사자 인력 연도별 추이
(단위: 명)
|
|
1999 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
|
연구인력 |
2,969 |
3,371 |
4,445 |
5,082 |
5,808 |
6,608 |
7,430 |
8,715 |
10,178 |
|
생산인력 |
1,715 |
1,815 |
2,662 |
3,625 |
5,205 |
5,530 |
6,437 |
8,601 |
10,058 |
|
총인력 |
4,684 |
5,186 |
7,107 |
8,707 |
11,013 |
12,138 |
13,867 |
17,316 |
20,236 |
출처: 생명공학정책연구센터, 국내 바이오산업 통계(2008.12)자료 가공
[표 부록-2-3-2] 생명공학 산업부문 인력의 최종 학위분포
|
구분 |
연구직 |
생산직 |
||||
|
박사 |
석사 |
학사 |
박사 |
석사 |
학사 |
|
|
2003년 |
1 |
2.7 |
1.6 |
1 |
10.4 |
40.1 |
|
2004년 |
1 |
2.7 |
1.6 |
1 |
9.3 |
33.5 |
|
2005년 |
1 |
3.0 |
1.6 |
1 |
7.9 |
23.2 |
|
2006년 |
1 |
3.2 |
1.7 |
1 |
7.9 |
20.3 |
|
2007년 |
1 |
3.3 |
1.9 |
1 |
8.2 |
23.5 |
출처: 생명공학정책연구센터, 국내 바이오산업 통계(2008.12)자료 가공
바이오산업 전체인력에 대한 최종 학위분포 박사 : 석사 : 학사 비중은 10 : 38 : 42임
4. 논문 및 특허
[그림 부록-2-4-1] 바이오분야 논문 및 NSC 논문 실적(1994∼2008)

출처: 생명공학정책연구센터
SCIE 논문실적 증가 추이는 1994년 (420건) ⇨ 2008년 (5,755)[연 22% 증가]
세계 유명 저널(NSC) 게재 우수 논문 최근 크게 증가(1994∼2008: 총 137건)
NSC: Nature, Science, Cell
[그림 부록-2-4-2] 전 세계 상위 30개국 논문건수와 한국 논문건수 비교(1994∼2008)

출처: 생명공학정책연구센터, 한국생명공학연구원 및 KAIST(학술정보처) 자료 협조
세계 상위 30개 국가 간 상대비교에서도 우리의 생명공학 분야 논문 창출 총량 수준이 지속적으로 제고되는 추세
[표 부록-2-4-1] 국내의 NSC논문 발표 현황(1994∼2008)
|
|
'95 |
'96 |
'97 |
'98 |
'99 |
'00 |
'01 |
'02 |
'03 |
'04 |
'05 |
'06 |
'07 |
'08 |
합계 |
|
NSC 총 합계 |
2 |
3 |
4 |
7 |
10 |
11 |
14 |
19 |
13 |
18 |
29 |
28 |
26 |
28 |
212 |
|
생명공학관련 NSC 합계 |
2 |
1 |
3 |
2 |
7 |
5 |
11 |
11 |
11 |
10 |
23 |
18 |
19 |
14 |
137 |
|
N(Nature) |
1 |
1 |
2 |
2 |
3 |
2 |
6 |
4 |
4 |
5 |
14 |
7 |
9 |
6 |
66 |
|
S(Science) |
1 |
0 |
1 |
0 |
3 |
2 |
2 |
2 |
5 |
1 |
7 |
4 |
5 |
4 |
37 |
|
C(Cell) |
0 |
0 |
0 |
0 |
1 |
1 |
3 |
5 |
2 |
4 |
2 |
7 |
5 |
4 |
34 |
출처: 생명공학정책연구센터
전체 NSC(Nature, Science, Cell) 논문 중 생명공학 관련 논문만을 선별함
저자의 소속 국가가 한국(South Korea)으로 표기되어 있는 논문만 포함됨
[표 부록-2-4-2] 생명공학 분야 한국 및 세계의 논문 피인용지수 추세 비교(1994∼2008)
|
분야 |
1단계('94∼'97) |
2단계('98∼'01) |
3단계('02∼'05) |
2차 1단계('06∼'08) |
||||
|
국내 평균 |
세계 평균 |
국내 평균 |
세계 평균 |
국내 평균 |
세계 평균 |
국내 평균 |
세계 평균 |
|
|
면역학 |
21.78 |
36.41 |
17.89 |
37.12 |
12.45 |
24.35 |
3.47 |
5.85 |
|
미생물학 |
10.77 |
23.68 |
10.36 |
29.67 |
7.93 |
18.14 |
2.09 |
4.09 |
|
분자생물학&유전학 |
13.22 |
53.2 |
21.29 |
49.15 |
15.86 |
30.02 |
3.65 |
6.87 |
|
생물학 &생화학 |
13.11 |
38 |
15.18 |
31.37 |
11.47 |
18.98 |
2.59 |
4.21 |
|
신경과학 &행동과학 |
25.94 |
38.68 |
20.53 |
34.83 |
12.12 |
20.62 |
2.78 |
4.69 |
|
약리학 |
8.49 |
20.73 |
13.12 |
20.02 |
8.02 |
13.4 |
1.89 |
3.17 |
출처: 생명공학정책연구센터, KAIST 학술정보처 자료 협조
세계 평균은 SCIE 상위 10개국과 BRICs(브라질, 러시아, 인도, 중국)의 전체 평균
SCIE 과학기술 중분류 18개 분야 중 생명공학 부문 6개 분야가 분석 대상
피인용지수는 해마다 데이터가 업데이트 되므로, 전년도 수치와 다를 수 있음
[표 부록-2-4-3] SCIE 게재된 생명공학분야 논문의 국가별 비교(1994∼2008)
|
국가/연도 |
'94-'97 |
'98-'01 |
'02-'05 |
'06-'08 |
총합계 |
08 순위 |
|
미국 |
262,050(1위) |
314,652(1위) |
351,928(1위) |
184,383(1위) |
1,104,629 |
1 |
|
일본 |
51,417 |
66,233 |
66,806 |
47,799 |
216,419 |
2 |
|
영국 |
54,147 |
63,619 |
64,557 |
48,057 |
214,570 |
3 |
|
중국 |
4,190(24위) |
11,571(13위) |
25,527(8위) |
38,901(5위) |
64,649 |
4 |
|
독일 |
43,263 |
55,024 |
58,110 |
45,293 |
186,856 |
5 |
|
프랑스 |
37,551 |
44,076 |
42,853 |
32,405 |
146,095 |
6 |
|
캐나다 |
27,336 |
30,275 |
33,566 |
28,456 |
110,208 |
7 |
|
이탈리아 |
24,043 |
30,147 |
33,424 |
27,001 |
105,710 |
8 |
|
스페인 |
15,001 |
20,638 |
24,484 |
21,548 |
74,293 |
9 |
|
호주 |
15,569 |
19,922 |
22,093 |
18,845 |
70,091 |
10 |
|
대한민국 |
4,175(23위) |
9,103(20위) |
14,155(13위) |
15,203(12위) |
36,881 |
11 |
|
브라질 |
4,961(19위) |
9,116(19위) |
13,393(15위) |
14,358(13위) |
36,264 |
12 |
|
네덜란드 |
16,938 |
19,193 |
20,419 |
16,507 |
67,502 |
13 |
|
인도 |
8,285(14위) |
10,005(15위) |
12,715(16위) |
13,983(16위) |
39,476 |
14 |
|
스웨덴 |
13,990 |
16,368 |
17,087 |
13,077 |
56,325 |
15 |
|
스위스 |
11,047 |
13,317 |
13,903 |
11,367 |
45,888 |
16 |
|
벨기에 |
8,271 |
10,477 |
11,467 |
8,004 |
35,176 |
17 |
|
대만 |
3,766 |
5,723 |
7,611 |
7,806 |
22,018 |
18 |
|
폴란드 |
4,342 |
6,294 |
8,576 |
7,353 |
23,988 |
19 |
|
덴마크 |
7,385 |
9,107 |
9,815 |
7,755 |
31,488 |
20 |
|
이스라엘 |
7,592 |
9,693 |
10,553 |
7,225 |
32,577 |
21 |
|
러시아 |
8,883(13위) |
9,760(16위) |
9,518(20위) |
6,876(21위) |
32,640 |
22 |
|
멕시코 |
3,467 |
5,253 |
6,693 |
5,660 |
18,956 |
23 |
|
오스트리아 |
4,856 |
6,799 |
7,654 |
6,087 |
23,384 |
24 |
|
핀란드 |
5,374 |
7,215 |
7,443 |
5,891 |
23,963 |
25 |
|
그리스 |
2,428 |
2,965 |
5,287 |
4,854 |
14,704 |
26 |
|
아르헨티나 |
3,289 |
3,661 |
5,555 |
4,622 |
16,695 |
27 |
|
노르웨이 |
4,148 |
3,774 |
5,613 |
4,882 |
18,155 |
28 |
|
뉴질랜드 |
3,194 |
3,045 |
4,329 |
3,681 |
14,018 |
29 |
|
홍콩 |
1,444 |
2,372 |
3,877 |
1,031 |
9,313 |
30 |
출처: 생명공학정책연구센터, 한국생명공학연구원 및 KAIST(학술정보처) 자료 협조
미국의 ʼ04∼ʼ06년 결과는 50여개 주별로 3회의 검색결과를 합산하여 일부 중복됨에 따라 다소 증가된 수치일 수 있으며, 홍콩은 2007년부터 중국에 편입하여 계산
1999년 이후 통계는 조사시점 별로 차이가 나는데, 특히 2005년은 익년 6월 경에, 2006년은 익년 2월 말경 조사되어 2006년은 추가될 가능성이 있음
[표 부록-2-4-4] 국가별 특허건수와 기술력 지수
|
국가 |
특허건수 |
특허영향지수(PII) |
기술력(TS) |
|||||
|
'02~'05 |
'06~'08 |
'02~'05 |
'06~'08 |
'02~'05 |
순위 |
'06~'08 |
순위 |
|
|
미국 |
17,352 |
14,081 |
0.681 |
0.807 |
11808.75 |
1 |
11367.00 |
1 |
|
일본 |
1,702 |
1,851 |
0.434 |
0.611 |
738.30 |
3 |
1131.51 |
2 |
|
영국 |
764 |
640 |
0.774 |
1.649 |
591.44 |
5 |
1055.29 |
3 |
|
네덜란드 |
1,023 |
939 |
0.595 |
0.940 |
608.21 |
4 |
882.54 |
4 |
|
독일 |
1,512 |
1,177 |
0.554 |
0.600 |
837.29 |
2 |
706.76 |
5 |
|
캐나다 |
761 |
647 |
0.558 |
0.914 |
424.27 |
6 |
591.21 |
6 |
|
프랑스 |
712 |
559 |
0.516 |
0.665 |
367.31 |
7 |
371.49 |
7 |
|
덴마크 |
516 |
394 |
0.530 |
0.783 |
273.55 |
9 |
308.59 |
8 |
|
스위스 |
389 |
388 |
0.712 |
0.679 |
277.01 |
8 |
263.37 |
9 |
|
스웨덴 |
236 |
177 |
0.552 |
1.392 |
130.32 |
12 |
246.46 |
10 |
|
벨기에 |
271 |
231 |
0.702 |
0.914 |
190.31 |
10 |
211.08 |
11 |
|
호주 |
333 |
325 |
0.516 |
0.522 |
171.92 |
11 |
169.70 |
12 |
|
이스라엘 |
233 |
256 |
0.460 |
0.587 |
107.20 |
14 |
150.38 |
13 |
|
대한민국 |
207 |
265 |
0.411 |
0.522 |
85.05 |
15 |
138.37 |
14 |
|
대만 |
119 |
188 |
0.328 |
0.627 |
39.00 |
18 |
117.80 |
15 |
|
인도 |
204 |
151 |
0.375 |
0.522 |
76.41 |
16 |
78.84 |
16 |
|
핀란드 |
62 |
53 |
1.222 |
1.044 |
75.79 |
17 |
55.35 |
17 |
|
이탈리아 |
134 |
104 |
0.883 |
0.522 |
118.34 |
13 |
54.30 |
18 |
|
중국 |
60 |
78 |
0.390 |
0.522 |
23.41 |
20 |
40.73 |
19 |
|
뉴질랜드 |
96 |
68 |
0.398 |
0.000 |
38.20 |
19 |
0.00 |
20 |
출처: 생명공학정책연구센터, 한국특허정보원 자료 협조
특허기술력지수: 미국등록특허를 이용하여 특허영향지수에 특허건수를 곱한 것
[표 부록-2-4-5] 국내 생명공학 응용분야별 특허 기술력 지수
|
기술 분류 |
'94~'97 |
'98~'01 |
'02~'05 |
'06~'08 |
||||
|
기술력지수 |
순위 |
기술력지수 |
순위 |
기술력지수 |
순위 |
기술력지수 |
순위 |
|
|
기초 |
3.2 |
18 |
18.7 |
17 |
36.4 |
13 |
56.39 |
9 |
|
의약 |
3.5 |
20 |
20.0 |
17 |
21.1 |
18 |
27.15 |
11 |
|
농업 |
0.0 |
- |
18.4 |
13 |
8.1 |
16 |
0.00 |
- |
|
식품 |
3.8 |
4 |
2.1 |
8 |
0.0 |
- |
0.00 |
- |
|
환경 |
0.3 |
22 |
4.7 |
9 |
12.2 |
4 |
7.83 |
6 |
|
공정 |
8.2 |
17 |
6.4 |
21 |
29.3 |
15 |
40.73 |
10 |
출처: 생명공학정책연구센터, 한국특허정보원 자료 협조
해당기간에 관련 등록특허가 없거나 특허가 있더라도 피인용이 없는 경우 기술력 지수의 수치가 없음
[그림 부록-2-4-3] 국내 생명공학 특허의 내·외국인 비교

분석: 한국특허정보원(2009. 6), 2008년의 경우 6월 말까지 공개된 특허를 포함함
5. 산업
[그림 부록-2-5-1] 국내 바이오산업의 시장규모(1994∼2007)
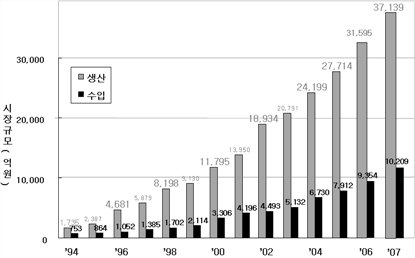
출처: 지식경제부 기술표준원, 국내 바이오산업 통계(ʼ08.12)자료를 사용하여 생명공학정책연구센터 분석
1994년 이후 ʼ07년까지 생산 규모는 연평균 22.5%의 높은 증가율 기록
[그림 부록-2-5-2] 국내 바이오산업의 연도별 수요부문(내수와 수출) 규모

출처: 지식경제부 기술표준원, 국내 바이오산업 통계(ʼ08.12)자료를 사용하여 생명공학정책연구센터 분석
내수는 국내 바이오산업의 국내 판매액과 수입액을 합한 것임
[표 부록-2-5-1] 바이오산업의 분야별에 대한 생산규모 연도별 추이(2004∼2007)
(단위: 백만 원)
|
구분 |
2004년 |
2005년 |
2006년 |
2007년 |
평균증가율 ('04~'07) |
|
생산규모(%) |
생산규모(%) |
생산규모(%) |
생산규모(%) |
||
|
바이오의약산업 |
973,076(40.2) |
1,115,063(40.2) |
1,220,418(38.6) |
1,685,795(45.4) |
21% |
|
바이오화학산업 |
143,029(5.9) |
184,599(6.7) |
202,922(6.5) |
233,895(6.3) |
18% |
|
바이오식품산업 |
1,056,073(43.6) |
1,145,259(41.3) |
1,359,723(43.0) |
1,316,067(35.4) |
8% |
|
바이오환경산업 |
112,871(4.7) |
144,373(5.2) |
162,574(5.2) |
200,771(5.4) |
21% |
|
바이오전자산업 |
16,152(0.7) |
18,981(0.7) |
26,023(0.8) |
57,892(1.6) |
59% |
|
바이오공정 및 기기산업 |
45,634(1.9) |
56,454(2.0) |
74,676(2.4) |
84,765(2.3) |
23% |
|
바이오에너지 및 자원산업 |
8,891(0.4) |
15,461(0.6) |
16,007(0.5) |
25,422(0.7) |
45% |
|
바이오검정, 정보서비스 및 연구개발업 |
64,201(2.7) |
91,196(3.3) |
97,163(3.0) |
109,258(2.9) |
20% |
|
전체 |
2,419,927(100) |
2,771,386(100) |
3,159,506(100) |
3,713,865 |
15% |
출처: 지식경제부 기술표준원, 국내 바이오산업 통계(ʼ08.12)자료를 사용하여 생명공학정책연구센터 분석
[표 부록-2-5-2] 바이오산업 분야별 수출입에 대한 연도별 추이(2004∼2007)
(단위: 백만 원)
|
구분 |
2004년 |
2005년 |
2006년 |
2007년 |
||||
|
수출액 |
수입액 |
수출액 |
수입액 |
수출액 |
수입액 |
수출액 |
수입액 |
|
|
바이오의약산업 |
276,832 |
473,760 |
313,012 |
573,027 |
251,248 |
740,336 |
420,035 |
792,331 |
|
바이오화학산업 |
25,065 |
47,797 |
34,852 |
51,629 |
39,846 |
60,943 |
45,944 |
85,466 |
|
바이오식품산업 |
805,284 |
5,092 |
848,204 |
7,752 |
1,015,628 |
10,589 |
932,813 |
12,016 |
|
바이오환경산업 |
1,298 |
2,000 |
5,388 |
2,370 |
4,116 |
4,756 |
8,053 |
5,367 |
|
바이오전자산업 |
12,186 |
141,542 |
8,509 |
700 |
9,047 |
709 |
35,037 |
954 |
|
바이오공정 및 기기산업 |
7,087 |
171 |
12,540 |
152,781 |
18,592 |
113,572 |
20,289 |
121,108 |
|
바이오에너지 및 자원산업 |
674 |
2,600 |
756 |
2,880 |
816 |
4,386 |
520 |
3,496 |
|
바이오검정, 정보서비스 및 연구개발업 |
6,079 |
15 |
7,809 |
20 |
10,871 |
125 |
8,838 |
141 |
|
전체 |
1,136,509 |
672,977 |
1,231,070 |
791,159 |
1,350,164 |
935,416 |
1,471,529 |
1,020,879 |
출처: 지식경제부 기술표준원, 국내 바이오산업 통계(ʼ08.12)자료를 사용하여 생명공학 정책연구센터 분석
[그림 부록-2-5-3] 바이오산업의 연도별/업종별 기업 수

출처: 지식경제부 기술표준원, 국내 바이오산업 통계(2008.12)자료를 사용하여 생명공학 정책연구센터 분석
[그림 부록-2-5-4] 바이오 벤처기업의 업종별 분포(2007)

출처: 2008 바이오벤처총람(ʼ08), 한국바이오협회
[그림 부록-2-5-5] 연도별 바이오 벤처기업 창업 추이(1995 이전∼2008)

분석: 생명공학정책연구센터, 2008 바이오벤처총람(ʼ08), 한국바이오협회 자료제공
- 매년 설문조사에 의한 집계로 매년 통계치가 달라짐(전년도 통계와 상이)
[그림 부록-2-5-6] 코스닥 상장 생명공학 벤처기업 추이(1994∼2009.10)


코스닥 등록 벤처 기업 수는 총 76개(2009년 하반기 기준)
2000년 이전 8개 기업 등록 → 2000년 이후 68개 기업
|
NO |
구분 |
업체 명 |
분야 |
주력 제품 |
설립일자 |
등록일자 |
|
|
1 |
코스닥 |
네오팜 |
생물의약 |
아토피,여드름 화장품 제조 |
00.09. |
07.01. |
|
|
2 |
코스닥 |
농우바이오 |
생물농업 |
야채 종자(개량형) |
90.06. |
02.04. |
|
|
3 |
코스닥 |
뉴로테크 |
생물의약 |
뇌질환 관련 신약개발 |
96.04. |
00.06. |
|
|
4 |
코스닥 |
대성미생물연구소 |
생물의약 |
동물용 백신 |
66.02. |
00.04. |
|
|
5 |
코스닥 |
대한뉴팜 |
생물농업 |
동물용 항생제 |
84.10. |
02.02. |
|
|
6 |
코스닥 |
도드람B&F |
생물농업 |
동물용 사료 |
91.04. |
96.07. |
|
|
7 |
코스닥 |
라이프코드 |
생물의약 |
제대혈은행, 산업용기계 |
85.10. |
96.07. |
|
|
8 |
코스닥 |
렉스진바이오텍 |
바이오식품 |
건강기능성 식품 |
95.02. |
02.11. |
|
|
9 |
코스닥 |
마크로젠 |
생물검정 |
DNA chip, 유전자분석서비스 |
95.06. |
00.02. |
|
|
10 |
코스닥 |
메가바이온 (제노프라) |
생물의약 |
DNA chip, 암 질병관련 진단시약 개발 |
99.01. |
01.10. |
|
|
11 |
코스닥 |
메디톡스 |
생물의약 |
보톡스 연구 및 치료제 개발 |
00.05. |
09.01. |
|
|
12 |
코스닥 |
메디포스트 |
생물의약 |
제대혈 은행 |
00.06. |
05.07. |
|
|
13 |
코스닥 |
메디프론 |
생물의약 |
치매치료제 및 진통제 개발 |
97.03. |
03.01. |
|
|
14 |
거래소 |
명문제약 |
생물의약 |
의약품 제조 및 판매 |
86.07. |
08.07. |
|
|
15 |
코스닥 |
바이넥스 |
생물의약 |
정장제, 소화제,임신진단시약 |
85.06. |
01.08. |
|
|
16 |
코스닥 |
바이로메드 |
생물의약 |
기술이전, 연구용 시료 |
96.11. |
05.12. |
|
|
17 |
코스닥 |
바이오니아 |
생물기기 |
합성유전자, 시약, 유전자분석장비 |
92.08. |
05.12. |
|
|
18 |
코스닥 |
바이오랜드 |
생물화학 |
화장품 소재, 미생물 배양제품 |
95.09. |
01.05. |
|
|
19 |
코스닥 |
바이오스페이스 |
생물기기 |
정밀체성분 분석기 |
95.05. |
00.12. |
|
|
20 |
코스닥 |
바이오톡스텍 |
생물검정 |
안전성(독성) 및 유효성 평가 서비스 |
00.08. |
07.09. |
|
|
21 |
거래소 |
부광약품 |
생물의약 |
의약용 약제품 제조업 |
60.10. |
88.08. |
|
|
22 |
거래소 |
비에이치케이 |
생물의약 |
심근재생 세포치료제 개발 |
64.08. |
06.08. |
|
|
23 |
코스닥 |
비엔디 |
바이오식품 |
사료첨가제, 기능성소재 |
92.12. |
01.06. |
|
|
24 |
코스닥 |
산성피앤씨 |
생물화학 |
줄기세포이용 화장품개발 |
86.12. |
03.01. |
|
|
25 |
코스닥 |
서린바이오사이언스 |
생물기기 |
연구기기, 시약 |
94.04. |
05.10. |
|
|
26 |
코스닥 |
세실 |
생물화학 |
생물적방제사업 |
91.04. |
07.11. |
|
|
27 |
거래소 |
세원셀론텍 |
생물의약 |
관절염치료제 |
06.07. |
06.07. |
|
|
28 |
코스닥 |
셀트리온 |
생물의약 |
바이오시밀러 연구 및 생산 |
91.02. |
08.09. |
|
|
29 |
코스닥 |
솔고바이오 |
생물기기 |
가정용 온열치료기,의료기구 |
95.07. |
00.08. |
|
|
30 |
코스닥 |
슈프리마 |
생물전자 |
바이오인식시스템 |
00.05. |
08.07. |
|
|
31 |
코스닥 |
스카이뉴팜 |
생물의약 |
의약품 개발.제조,판매 |
01.08. |
01.08. |
|
|
32 |
코스닥 |
쎌바이오텍 |
바이오식품 |
유산균 원말 및 완제품 |
95.02. |
02.12. |
|
|
33 |
코스닥 |
씨티씨바이오 |
생물농업 |
동물항병원성제품,생균효소 |
95.12. |
02.02. |
|
|
34 |
거래소 |
알앤엘바이오 |
생물의약 |
줄기세포치료제, 항균제 등 |
61.07. |
76.06. |
|
|
35 |
코스닥 |
에스디 |
생물화학 |
진단시약 |
99.02. |
03.01. |
|
|
36 |
코스닥 |
에스텍파마 |
생물의약 |
원료의약품 |
99.01. |
04.02. |
|
|
37 |
코스닥 |
에코솔루션 |
생물환경 |
토양오염 진단, 복원 |
98.03. |
01.12. |
|
|
38 |
거래소 |
오리엔트바이오 |
생물의약 |
백신, 생물, 진단, 신약 개발 등 |
59.04. |
76.12. |
|
|
39 |
코스닥 |
오스코텍 |
생물의약 |
뼈치료용 신약개발 |
98.12. |
07.01. |
|
|
40 |
코스닥 |
오스템임플란트 |
생물기기 |
치과용 임플란트 |
97.01. |
07.02. |
|
|
41 |
코스닥 |
이-글벳 |
생물농업 |
사료첨가제(항생,영양) |
83.12. |
00.11. |
|
|
42 |
코스닥 |
이노셀 |
생물의약 |
제대혈은행, 간암치료제 |
92.09. |
98.09. |
|
|
43 |
코스닥 |
이수앱지스 |
생물의약 |
단백질항체 치료제 개발 |
01.03. |
09.02. |
|
|
44 |
코스닥 |
이지바이오시스템 |
바이오식품 |
발효식품,동물사료, 기능성소재 |
88.03. |
99.11. |
|
|
45 |
코스닥 |
이큐스팜 |
생물의약 |
당뇨병 치료제 개발 |
94.01. |
02.02. |
|
|
46 |
코스닥 |
인포피아 |
생물기기 |
바이오센서 및 혈당측정기 |
96.04. |
07.06. |
|
|
47 |
코스닥 |
일신랩 |
생물공정 및 기기 |
실험용, 과학용 실험기자재 개발/생산 |
94.01. |
07.12. |
|
|
48 |
코스닥 |
자원메디칼 |
생물기기 |
의료정밀기기제조 |
93.03. |
00.06. |
|
|
49 |
코스닥 |
제넥셀 |
생물의약 |
항체 및 단백질 치료제 개발 |
90.01. |
99.05. |
|
|
50 |
코스닥 |
제넥신 |
생물의약 |
의학 및 약학 연구개발업 |
99.07. |
09.09. |
|
|
51 |
코스닥 |
제일바이오 |
생물농업 |
사료첨가제 |
89.02. |
02.01. |
|
|
52 |
코스닥 |
조아제약 |
생물의약 |
의약품,의약부외품, 보건보조식품 |
96.03. |
99.08. |
|
|
53 |
거래소 |
종근당바이오 |
생물의약 |
의약용 화합물 및 항생물질제조 |
01.11. |
01.12. |
|
|
54 |
코스닥 |
중앙바이오텍 |
생물농업 |
사료첨가제(항생, 영양) |
80.12. |
00.08. |
|
|
55 |
코스닥 |
중앙백신연구소 |
생물의약 |
동물용 백신 전문 제조업체 |
94.07. |
03.10. |
|
|
56 |
코스닥 |
중외신약 (크레아젠홀딩스) |
생물의약 |
암백신 및 관절염 세포치료제 |
81.08. |
03.02. |
|
|
57 |
코스닥 |
진바이오텍 |
생물의약 |
사료첨가제 및 기능성식품 |
84.06. |
06.04. |
|
|
58 |
코스닥 |
진양제약 |
생물의약 |
의약품, 소부날, 옥티란 |
78.06. |
00.07. |
|
|
59 |
코스닥 |
코미팜 |
생물의약 |
동물용백신/한국미생물연구소 |
72.09. |
01.10. |
|
|
60 |
코스닥 |
코바이오텍 |
생물기기 |
생물 반응기(발효기) |
87.04. |
01.10. |
|
|
61 |
코스닥 |
코오롱생명과학 |
생물의약 |
인대손상치료, 연골재생촉진연구, 개발등 |
00.04. |
09.04. |
|
|
62 |
코스닥 |
크리스탈지노믹스 |
생물의약 |
신개념 항생제 |
00.07. |
06.01. |
|
|
63 |
코스닥 |
폴리플러스 |
생물의약 |
세포 및 유전자 치료제 개발 |
86.04. |
02.12. |
|
|
64 |
거래소 |
한국기술산업 (프로테오젠) |
생물의약 |
단백질 칩 고정화 기술 |
57.05. |
89.09. |
|
|
65 |
코스닥 |
한국콜마 |
생물의약 |
화장품, 연고제류 및 의약품 |
90.05. |
02.04. |
|
|
66 |
거래소 |
한독약품 |
생물의약 |
의약용 약제품 제조업 |
54.04. |
76.06. |
|
|
67 |
코스닥 |
한서제약 |
생물의약 |
고덱스 등 의약품 |
84.12. |
04.11. |
|
|
68 |
코스닥 |
한스바이오메드 |
생물공정 및 기기 |
의료용품 및 기타 의약관련제품 제조 |
99.09. |
09.10. |
|
|
69 |
코스닥 |
헤파호프 |
생물의약 |
인공간 개발 |
96.07. |
00.12. |
|
|
70 |
코스닥 |
화일약품 |
생물의약 |
의약품원료, 암치료제 |
80.11. |
02.04. |
|
|
71 |
코스닥 |
휴온스 |
생물의약 |
전문의약품, 비만치료제, 비타민제품 |
65.07. |
06.12. |
|
|
72 |
코스닥 |
CTC(KMSI) |
바이오식품 |
건강기능식품 개발 |
72.01. |
02.07. |
|
|
73 |
코스닥 |
HS바이오팜 |
생물의약 |
의약품, 화장품 도매업 |
93.02. |
01.11. |
|
|
74 |
거래소 |
LG생명과학 |
생물의약 |
전문의약품, 동물의약품 |
02.08. |
02.08. |
|
|
75 |
코스닥 |
PW제네틱스 |
생물농업 |
무균돼지 생산 |
92.03. |
03.01. |
|
|
76 |
거래소 |
VGX인터 |
생물의약 |
신약개발 및 컨설팅 |
76.01. |
87.11. |
|
[표 부록-2-5-3] 코스닥 등록 바이오벤처 기업 현황(2009.10 현재)
분석: 생명공학정책연구센터, 한국바이오협회 자료 제공
[표 부록-2-5-4] 연도별 의약품 수출/수입실적
|
수출실적(천불) |
2005년 |
2006년 |
2007년 |
2008년 |
전년대비증가율 |
|
원료의약품 |
448,428 |
494,342 |
593,209 |
551,992 |
4.3% |
|
완제의약품 |
345,958 |
408,783 |
489,805 |
685,714 |
40% |
|
한약재 |
6,820 |
8,964 |
9,236 |
8,954 |
-3.1% |
|
합 계 |
801,206 |
912,089 |
1,028,250 |
1,246,660 |
21.2% |
출처: 2008 보건산업백서, 한국보건산업진흥원(2009.8)
원출처: 한국의약품수출입협회 발표자료
[표 부록-2-5-5] 국내 신약 제품화 완료현황(2008)
|
No. |
제품명 |
회사명 |
적용증세 |
허가일자 |
유형 |
|
1 |
선플라주 |
(주)SK제약 |
항암제(위암) |
1999.07 |
화합물신약 |
|
2 |
EGF외용액 |
(주)대웅제약 |
당뇨병성 족부궤양 치료제 |
2001.05 |
바이오신약 |
|
3 |
조인스정 |
(주)SK제약 |
관절염(소염/진통) 치료제 |
2001.07 |
천연물신약 |
|
5 |
큐록신정 |
(주)중외제약 |
요로감염증, 방광염 |
2001.12 |
화합물신약 |
|
6 |
스티렌캅셀 |
(주)동아제약 |
위염치료제 |
2002.06 |
천연물신약 |
|
8 |
캄토벨주 |
(주)종근당 |
소세포폐암 및 난소암 |
2003.10 |
화합물신약 |
|
11 |
자이데나정 |
(주)동아제약 |
발기부전치료제 |
2005.11 |
화합물신약 |
|
12 |
레보비르캡슐 |
(주)부광약품 |
B형간염치료제 |
2006.11 |
화합물신약 |
|
12 |
엠빅스 |
(주)SK케미칼 |
발기부전치료제 |
2007.07 |
화합물신약 |
출처: 2008 보건산업백서, 한국보건산업진흥원(2009.8)
[표 부록-2-5-6] 기술수출 현황(해외 라이센싱)
|
연도 |
제품명 |
기술수출기업 |
계약조건 |
수출대상기업 |
|
'00 |
항암제 CKD-602 |
(주)종근당 |
계약금300만불, 경상기술료매출액50% |
미국 Alza |
|
'01 '04 |
위궤양치료제 |
(주)일양약품 |
계약금250만불, 경상기술료매출액5-10% 계약금350만불, 경상기술료매출액5-10% |
중국 립존 미국 TAP |
|
'04 |
진통제PAC20030 |
(주)태평양 |
계약금325만유로, 경상기술료10,750유로 |
독일 슈바르쯔 |
|
'04 |
B형 간염치료제 |
(주)LG생명과학 |
계약금3000만불, 경상기술료 비공개 |
미국 아나디스 |
|
'04 '05 |
B형 간염치료제 |
(주)부광약품 |
계약금500만불, 경상기술료매출액10-14% 계약금600만불, 경상기술료매출액10-14% |
일본 에자이 미국 파마셋 |
|
'06 |
녹내장치료제 |
동부한농(주) |
계약금100만불, 경상기술료매출액4-13% |
미국 다뉴브 |
|
'07 |
퀴놀론계항생제 |
동화약품공업(주) |
경상기술료 5,650만불 및 로열티(비공개) |
미국 퍼시픽비치 |
|
'07 |
골다공증치료제 |
동화약품공업(주) |
경상기술료 5.11억불 및 로열티(비공개) |
미국 P&G |
|
'07 |
C형간염치료제 |
(주)LG생명과학 |
선급금2,000만불, 마일스톤총2억불, 로열티 |
미국 길리아드 |
출처: 2008 보건산업백서, 한국보건산업진흥원(2009.8), 2000년 이후 사례
[표 부록-2-5-7] 세계 생명공학 시장규모 전망

출처: 생명공학 시장현황 및 전망 분석 보고서(2007 김은중)
Datamonitor 예측 : 2006년 세계 생명공학시장은 1,537억 달러이며, 2011년까지 연평균 12%로 성장하여
2,714억 달러의 시장을 형성할 것으로 전망함.
IBISWorld 예측 : 2007년 세계 생명공학 시장은 1,252억 달러이며, 2012년까지 연평균 12%로 성장하여,
2,288억 달러의 시장을 형성할 것으로 전망함.
[표 부록-2-5-8] 세계 생명공학 시장 현황(2008년, 상장기업 기준)
|
|
세계 |
미국 |
유럽 |
캐나다 |
아시아/태평양 |
|
<상장기업> |
|||||
|
수익(백만$) |
89,648 |
66,127 |
16,515 |
2,041 |
4,965 |
|
R&D비용(백만$) |
31,745 |
31,745 |
5,171 |
703 |
601 |
|
순이익(백만$) |
-1,443 |
417 |
-702 |
1,143 |
-14 |
|
고용인력(명) |
200,760 |
128,200 |
49,060 |
7,970 |
15,530 |
|
<총 기업수> |
|||||
|
기업수(개) |
4,717 |
1,754 |
1,836 |
358 |
769 |
|
- 상 장 |
776 |
371 |
178 |
72 |
155 |
|
- 비상장 |
3,941 |
1,383 |
1,658 |
286 |
614 |
출처: 생명공학정책연구센터, Ernst & Youngʼs Global Biotechnology Report 2009 참조
미국이 세계시장 총수입(상장)의 74%, 고용 인력의 64% 점유
[표 부록-2-5-9] 세계 생명공학 시장의 성장(2007∼2008)
|
구분 |
2008 |
2007 |
증감률(%) |
|
수익(백만$) |
89,648 |
80,344 |
12% |
|
R&D비용(백만$) |
31,745 |
26,881 |
18% |
|
순이익(순손실)(백만$) |
(1,443) |
(3,055) |
-53% |
|
종업원수(명) |
200,760 |
201,690 |
-0.5% |
|
기업수(개) |
4,717 |
4,799 |
-2% |
|
- 상 장 |
776 |
815 |
-5% |
|
- 비상장 |
3,941 |
3,984 |
-1% |
출처: 생명공학정책연구센터, Ernst & Youngʼs Global Biotechnology Report 2008 참조
[표 부록-2-5-10] 세계 시장매출 상위 15개 의약품(2008)
(단위: 백만 달러)
|
구분 |
브랜드명(주성분) |
2008년 판매액 |
세계시장 점유율 |
전년대비 성장률 |
|
1 |
LIPITOR |
13,655 |
1.9% |
-0.9% |
|
2 |
PLAVIX |
8,634 |
1.2% |
16.9% |
|
3 |
NEXIUM |
7,842 |
1.1% |
7.8% |
|
4 |
SERETIDE |
7,703 |
1.1% |
7% |
|
5 |
ENBREL |
5,703 |
0.8% |
5.6% |
|
6 |
SEROQUEL |
5,404 |
0.7% |
14.9% |
|
7 |
ZYPREXA |
5,023 |
0.7% |
-1.8% |
|
8 |
REMICADE |
4,935 |
0.7% |
14 |
|
9 |
SINGULAIR |
4,673 |
0.6% |
3.1 |
|
10 |
LOVENOX |
4,435 |
0.6% |
8.9 |
|
11 |
MABTHERA |
4,321 |
0.6% |
12.9 |
|
12 |
TAKEPRON |
4,321 |
0.6% |
-3.6 |
|
13 |
EFFEXOR |
4,263 |
0.6% |
3.4 |
|
14 |
HUMIRA |
4,075 |
0.6% |
39.5 |
|
15 |
AVASTIN |
4,016 |
0.6% |
37.4 |
|
상위 15개 의약품 전체 |
89,003 |
12.30% |
- |
|
출처: 생명공학정책연구센터, IMS Health. Topline industry data. 2009 참조
[표 부록-2-5-11] 세계 15대 제약기업의 매출
|
구분 |
Global |
2008년 |
2007년 |
2006년 |
세계시장 점유율('08) |
|
1 |
PFIZER |
43,363 |
44,651 |
45,622 |
6.0% |
|
2 |
GLAXOSMITHKLINE |
36,506 |
37,951 |
37,516 |
5.0% |
|
3 |
NOVARTIS |
36,172 |
34,409 |
31,560 |
5.0% |
|
4 |
SANOFI-AVENTIS |
35,642 |
33,819 |
31,460 |
4.9% |
|
5 |
ASTRAZENECA |
32,516 |
30,107 |
27,540 |
4.5% |
|
6 |
ROCHE |
30,336 |
27,578 |
23,354 |
4.2% |
|
7 |
JOHNSON |
29,425 |
29,092 |
27,730 |
4.1% |
|
8 |
MERCK |
26,191 |
27,294 |
25,174 |
3.6% |
|
9 |
ABBOTT |
19,466 |
17,587 |
16,065 |
2.7% |
|
10 |
LILLY |
19,140 |
17,386 |
15,388 |
2.6% |
|
11 |
AMGEN |
15,794 |
16,536 |
16,270 |
2.2% |
|
12 |
WYETH |
15,682 |
15,965 |
14,695 |
2.2% |
|
13 |
TEVA |
15,274 |
13,547 |
12,001 |
2.1% |
|
14 |
BAYER |
15,660 |
14,178 |
12,553 |
2.2% |
|
15 |
TAKEDA |
13,819 |
12,778 |
11,880 |
1.9% |
출처: 생명공학정책연구센터, IMS Health. Topline industry data. 2009 참조
 생명공학 관계법령
생명공학 관계법령
생명공학육성법
[(타)일부개정 2008.2.29 법률 제8852호]
제1조(목적) 이 법은 생명공학연구의 기반을 조성하여 생명공학을 보다 효율적으로 육성·발전시키고 그 개발기술의 산업화를 촉진하여 국민경제의 건전한 발전에 기여하게 함을 목적으로 한다.(개정 1995.1.5)
제2조(정의) 이 법에서 “생명공학”이라 함은 다음 각 호의 학문과 기술을 말한다.
1. 산업적으로 유용한 생산물을 만들거나 생산공정을 개선할 목적으로 생물학적 시스템, 생체, 유전체 또는 그들로부터 유래되는 물질을 연구·활용하는 학문과 기술
2. 생명현상의 기전(起傳), 질병의 원인 또는 발병과정에 대한 연구를 통하여 생명공학의 원천지식을 제공하는 생리학·병리학·약리학 등의 학문[이하 “기초의과학(基礎醫科學)”이라 한다]
[전문개정 2003.12.30]
제3조(적용범위) 생명공학에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 의한다.(개정 1995.1.5)
제4조(생명공학육성기본계획의 수립 (개정 1995.1.5))
① 제13조의 규정에 의한 관계부처의 장은 소관별로 생명공학육성에 관한 계획을 교육과학기술부장관에게 제출하여야 한다.(개정 1995.1.5, 2003.12.30, 2008.2.29)
② 교육과학기술부장관은 제1항의 규정에 의하여 관계부처의 장이 제출한 소관사항에 관한 생명공학육성계획을 종합·조정하여 생명공학육성기본계획(이하 “기본계획”이라 한다)을 수립한다.(개정 1995.1.5, 2003.12.30, 2008.2.29)
③제2항의 규정에 의한 기본계획에는 다음의 사항이 포함되어야 한다.(개정 1995.1.5, 1997.8.28)
1. 생명공학의 기초연구 및 산업적 응용연구의 육성에 관한 종합계획과 지침
2. 생명공학의 연구에 필요한 인력자원의 개발종합계획과 인력자원의 효율적인 활용에 관한 지침
3. 생명공학의 연구 및 이와 관련된 산업기술인력의 국제교류와 해외과학기술자의 활용에 관한 계획과 그 지침
④ 교육과학기술부장관은 기본계획을 수립하고자 할 때에는 제6조의 생명공학종합정책심의회의 심의를 거쳐야 한다.(개정 1995.1.5, 2003.12.30, 2008.2.29)
제5조(생명공학육성 연차별 시행계획의 수립 등 (개정 1995.1.5))
①관계부처의 장은 기본계획에 따라 생명공학육성 연차별 시행계획(이하 “시행계획”이라 한다)을 수립하고 이를 시행하여야 한다.(개정 1995.1.5)
② 관계부처의 장은 시행계획을 수립하고자 할 때에는 미리 교육과학기술부장관과 협의하여야 한다.(개정 2003.12.30, 2008.2.29)
③ 교육과학기술부장관은 시행계획의 수립을 위하여 필요한 때에는 그 계획의 수립에 필요한 기본지침을 작성하여 관계부처의 장에게 통보할 수 있다.(개정 2003.12.30, 2008.2.29)
④시행계획의 수립 및 그 시행에 관하여 필요한 사항은 대통령령으로 정한다.
제6조(생명공학종합정책심의회 (개정 1995.1.5))
① 기본계획의 수립과 그 집행 및 조정에 관한 업무를 관장하기 위하여 교육과학기술부장관소속하에 생명공학종합정책심의회(이하 “심의회”라 한다)를 둔다.(개정 1995.1.5, 2003.12.30, 2008.2.29)
②심의회는 다음 사항을 심의 결정한다.(개정 1995.1.5, 1997.8.28, 2003.12.30, 2008.2.29)
1. 생명공학의 기초연구 및 산업적 응용연구의 육성에 관한 계획의 수립 및 그 집행의 조정
2. 생명공학의 연구 및 기술개발에 관한 기본계획의 수립과 이에 따른 중요정책의 수립 및 그 집행의 조정
3. 생명공학분야 인력개발에 관한 종합계획과 이에 따른 중요정책, 인력활용지침의 수립 및 그 집행의 조정
4. 생명공학의 연구 및 이와 관련된 산업기술인력의 개발교류와 해외과학기술자의 활용에 관한 계획의 수립 및 그 집행의 조정
5. 유전자원의 이용과 보전을 위한 연구개발계획의 수립 및 그 집행의 조정
6. 기타 생명공학육성에 관하여 교육과학기술부장관이 필요하다고 인정하는 사항
③심의회는 위원장 1인을 포함한 17인 이내의 위원으로 구성한다.(신설 2003.12.30)
④ 위원장은 교육과학기술부장관이 되고 위원은 다음 각호의 자가 된다.(신설 2003.12.30, 2008.2.29)
1. 대통령령이 정하는 관계 중앙행정기관의 차관급 공무원
2. 학계·연구기관 또는 산업계에 종사하는 생명공학 관계자 및 생명윤리 전문가
⑤ 이 법에서 규정한 사항외에 심의회의 조직 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.(신설 2003.12.30)
제7조 삭제(2003.12.30)
제8조 삭제(2003.12.30)
제9조(연구 및 기술협력) 교육과학기술부장관은 생명공학의 연구 및 기술에 관한 국제협력의 증진에 노력하고 선진기술의 도입을 위한 효율적인 방안을 강구한다.(개정 1995.1.5, 2003.12.30, 2008.2.29)
제10조(공동연구의 촉진) 정부는 생명공학연구 및 기술개발의 효율적 육성을 위하여 학계·연구기관 및 산업계간의 공동연구를 촉진하여야 한다.(개정 1995.1.5)
제11조(생명공학의 산업적 응용촉진에 대한 지원) 정부는 생명공학 연구개발을 활성화하고 그 결과의 산업적 응용을 촉진하기 위하여 다음 각 호의 사항에 대한 지원시책을 강구하여야 한다.
1. 생명공학관련 신기술제품의 생산지원에 관한 사항
2. 생명공학 연구결과의 산업적 응용을 촉진하기 위한 연구개발 및 지역거점 구축에 관한 사항
3. 생명공학관련 중소·벤처기업의 창업지원에 관한 사항
[전문개정 2003.12.30]
제12조(기술정보의 수집과 보급) 정부는 생명공학연구에 관한 정보를 수집, 관계기관에 보급함으로써 연구개발 촉진에 노력하여야 한다.(개정 1995.1.5)
제13조(생명공학육성시책강구등)
① 정부는 생명공학의 효율적인 육성을 위하여 생명공학의 기초연구 및 산업적 응용연구에 관하여 다음 각호의 시책을 강구한다. 다만, 기초의과학(基礎醫科學)분야의 연구개발 촉진 및 육성업무는 교육과학기술부장관 및 보건복지가족부장관의 소관으로 한다.(개정 1997.8.28, 2001.1.29, 2003.12.30, 2004.12.31, 2008.2.29)
1. 삭제(2008.2.29)
2. 교육과학기술부장관은 제4조제2항의 규정에 의한 기본계획의 수립과 부처별 정책수립의 지원 및 종합조정, 생명공학분야의 연구를 촉진시키기 위한 전문인력의 양성과 생명과학기초분야의 연구지원, 생명공학관련 기초기술 및 첨단기술의 개발지원, 과학기술 분야의 유용한 유전자의 확보·분석·이용·보전을 위한 연구의 지원, 생명공학 지원기관의 육성·발전
3. 농림수산식품부장관은 동·식물 및 미생물의 육종·품종개량 및 식품소재의 개발 등 응용연구의 지원 및 농림분야의 유용한 유전자의 확보·분석·이용·보존 등 기초연구의 지원 및 연구기관의 육성·발전, 해양수산생물을 이용한 유용물질의 생산과 해양수산생물의 육종·개량 및 식품소재의 개발 등 응용연구의 지원, 해양수산분야의 유용한 유전자의 확보·분석·이용·보존 등 기초연구의 지원
4. 지식경제부장관은 생명공학관련 산업공정의 개발과 개선, 신·재생에너지개발, 에너지 및 광물자원의 효율적 활용, 생명공학관련 생산기술개발 등의 지원과 그 개발기술의 산업화 촉진 및 생명공학의 육성·발전을 위한 정보통신기술의 개발 지원 4의2. 삭제(2008.2.29)
5. 보건복지부장관은 보건·의료·식품위생 등 생명공학과 관련되는 기술에 대한 연구개발의 촉진과 관련 전문인력 양성, 임상시험 관련사업 육성 및 연구의 지원
6. 환경부장관은 생물다양성의 보전, 그 구성요소의 지속가능한 이용 및 생명공학기술을 이용한 폐수·폐기물의 처리 및 환경오염의 방지 등을 위한 기술개발과 기초연구 및 응용연구 지원, 해양오염방지 등을 위한 기술개발 및 연구기관의 육성·발전
7. 삭제(2008.2.29)
② 교육과학기술부장관과 보건복지가족부장관은 기초의과학(基礎醫科學)을 육성하기 위한 시책을 수립하고자 하는 때에는 협의하여야 한다.(신설 2003.12.30, 2008.2.29)
[전문개정 1995.1.5]
제14조(검정 및 임상)
①정부는 생명공학 관련제품에 대한 임상 및 검정체제를 확립한다.(개정 1995.1.5)
②제1항의 임상 및 검정체제 확립에 관하여 필요한 사항은 대통령령으로 정한다.
제15조(실험지침의 작성·시행 등)
①정부는 생명공학연구 및 산업화의 촉진을 위한 실험지침을 작성·시행하여야 한다.(개정 1995.1.5)
②제1항의 실험지침에서는 생명공학의 연구와 이의 산업화 과정에서 예견될 수 있는 생물학적 위험성, 환경에 미치는 악영향 및 윤리적 문제발생의 사전방지에 필요한 조치가 강구되어야 하며, 유전적으로 변형된 생물체의 이전·취급·사용에 대한 안전기준이 마련되어야 한다.(개정 1995.1.5)
제16조(한국생명공학연구원 (개정 1995.1.5, 2003.12.30))
①생명공학연구[다만, 기초의과학(基礎醫科學)연구를 제외한다. 이하 이 조에서 같다] 및 유전자원의 이용과 보전에 관한 연구의 중추적 기능을 담당하고 생명공학분야에서의 학계·연구기관 및 산업계간의 상호유기적 협조체제를 유지·발전시키며, 이들을 지원하기 위하여 재단법인인 한국생명공학연구원(이하 “연구원”이라 한다)을 설립할 수 있다.(개정 1995.1.5, 2003.12.30)
②제1항의 규정에 의한 연구원은 특정연구기관육성법의 적용을 받는 특정연구기관으로 한다.(개정 2003.12.30)
③삭제(1995.12.6)
제17조(기초의과학육성지원기구)
①정부는 기초의과학(基礎醫科學)을 육성하기 위하여 기초의과학 육성지원기구(이하 “육성지원기구”라 한다)를 지정하여 운영할 수 있다.
②정부는 예산의 범위 안에서 육성지원기구의 운영에 필요한 경비를 지원할 수 있다.
③육성지원기구의 지정 및 운영에 관하여 필요한 사항은 대통령령으로 정한다.
[본조신설 2003.12.30]
제18조 삭제(1995.12.6)
제19조(사후승인 통관절차 (개정 2003.12.30))
①삭제(2003.12.30)
②생명공학 연구활동에 필요한 관련 자재·기기 또는 시약 중 국내에서 생산되지 아니하는 품목 중 변질 기타로 인하여 시기적으로 그 안정성의 확보가 어려운 시약 등에 대해서는 관세법의 절차에 불구하고 대통령령이 정하는 바에 의하여 사후 승인의 통관절차로 대신할 수 있다.(개정 2003.12.30)
제20조 삭제(2003.12.30)
부 칙 (제3718호, 1983.12.31)
이 법은 공포한 후 2월이 경과한 날로부터 시행한다.
부 칙 (정부조직법) (제4268호, 1990.12.27)
제1조(시행일) 이 법은 공포한 날부터 시행한다. (단서 생략)
제2조 및 제3조 생략
제4조(문교부의 명칭변경에 따른 다른 법률의 개정)
①내지 (42)생략
(43) 유전공학육성법 중 다음과 같이 개정한다.
제13조제1호중 “문교부장관”을 “교육부장관”으로 한다.
(44) 내지 (50)생략
제5조 내지 제10조 생략
부 칙 (정부조직법) (제4541호, 1993.3.6)
제1조(시행일) 이 법은 공포한 날부터 시행한다.
제2조 및 제3조 생략
제4조(상공자원부 신설에 따른 다른 법률의 개정)
①유전공학육성법 중 다음과 같이 개정한다.
제13조제3호를 다음과 같이 하고, 동조 제4호를 삭제한다.
3. 상공자원부장관은 유전공학연구를 통한 산업공정의 개발과 개선, 대체에너지 개발, 에너지절약 및 광물자원의 효율적 이용
②내지 (100)생략
제5조 생략
부 칙 (제4938호, 1995.1.5)
이 법은 공포 후 6월이 경과한 날부터 시행한다.
부 칙 (기금관리기본법) (제4980호, 1995.12.6)
제1조(시행일) 이 법은 1996년 1월 1일부터 시행한다. (단서 생략)
제2조(다른 법률의 개정)
①생략
②생명공학육성법 중 다음과 같이 개정한다.
제16조제3항·제17조 및 제18조를 각각 삭제한다.
③내지 (24)생략
부 칙 (제5400호, 1997.8.28)
이 법은 공포 후 3월이 경과한 날부터 시행한다.
부 칙 (정부조직법) (제6400호, 2001.1.29)
제1조(시행일) 이 법은 공포한 날부터 시행한다. (단서 생략)
제2조 생략
제3조(다른 법률의 개정)
①내지 (60)생략
(61) 생명공학육성법 중 다음과 같이 개정한다.
제13조제1호 중 “교육부장관”을 “교육인적자원부장관”으로 한다.
(62)내지 (79)생략
제4조 생략
부 칙 (제7014호, 2003.12.30)
이 법은 공포 후 6월이 경과한 날부터 시행한다.
부 칙 (신에너지 및 재생에너지개발·이용·보급촉진) (제7284호, 2004.12.31)
제1조(시행일) 이 법은 공포 후 6월이 경과한 날부터 시행한다.
제2조 및 제3조 생략
제4조(다른 법률의 개정)
①내지 ③생략
④생명공학육성법 중 다음과 같이 개정한다.
제13조제1항제4호중 “대체에너지개발”을 “신·재생에너지개발”로 한다.
⑤내지 ⑧생략
제5조 생략
부 칙 (정부조직법) (제8852호, 2008.2.29)
제1조(시행일) 이 법은 공포한 날부터 시행한다. 다만, 제31조제1항의 개정규정 중 “식품산업진흥”에 관한 부분은 2008년 6월 28일부터 시행하고, 부칙 제6조에 따라 개정되는 법률 중 이 법의 시행 전에 공포되었으나 시행일이 도래하지 아니한 법률을 개정한 부분은 각각 해당 법률의 시행일부터 시행한다.
제2조부터 제5조까지 생략
제6조(다른 법률의 개정)
①부터 (132)까지 생략
(133) 생명공학육성법 일부를 다음과 같이 개정한다.
제4조제1항·제2항·제4항, 제5조제2항·제3항, 제6조제1항·제2항 제6호·제4항 각 호 외의 부분 및 제9조 중 “과학기술부장관”을 각각 “교육과학기술부장관”으로 한다.
제13조제1항 각 호 외의 부분 단서 중 “과학기술부장관 및 보건복지부장관”을 “교육과학기술부장관 및 보건복지가족부장관”으로 하고, 같은 항 제1호를 삭제하며, 같은 항 제2호 중 “과학기술부장관은 제4조 제2항의 규정에 의한 기본계획의 수립과 부처별 정책수립의 지원 및 종합조정,”을 “교육과학기술부장관은 제4조 제2항의 규정에 의한 기본계획의 수립과 부처별 정책수립의 지원 및 종합조정, 생명공학분야의 연구를 촉진시키기 위한 전문인력의 양성과 생명과학기초분야의 연구지원,”으로 하고, 같은 항 제3호 중 “농림부장관”을 “농림수산식품부장관”으로, “육성·발전”을 “육성·발전, 해양수산생물을 이용한 유용물질의 생산과 해양수산생물의 육종·개량 및 식품소재의 개발 등 응용연구의 지원, 해양수산분야의 유용한 유전자의 확보·분석·이용·보존 등 기초연구의 지원”으로 하며, 같은 항 제4호 중 “산업자원부장관”을 “지식경제부장관”으로, “촉진”을 “촉진 및 생명공학의 육성·발전을 위한 정보통신기술의 개발 지원”으로 하고, 같은 항 제4호의2를 삭제하며, 같은 항 제6호 중 “응용연구의 지원”을 “응용연구 지원, 해양오염방지 등을 위한 기술개발 및 연구기관의 육성·발전”으로 하고, 같은 항 제7호를 삭제하며, 같은 조 제2항 중 “과학기술부장관과 보건복지부장관”을 “교육과학기술부장관과 보건복지가족부장관”으로 한다.
(134)부터 (760)까지 생략
제7조 생략
생명윤리 및 안전에 관한 법률
[(타)일부개정 2009.1.30 법률 제9386호 시행일 2010.1.31]
제1장 총 칙
제1조(목적) 이 법은 생명과학기술에 있어서의 생명윤리 및 안전을 확보하여 인간의 존엄과 가치를 침해하거나 인체에 위해를 주는 것을 방지하고, 생명과학기술이 인간의 질병 예방 및 치료 등을 위하여 개발·이용될 수 있는 여건을 조성함으로써 국민의 건강과 삶의 질 향상에 이바지함을 목적으로 한다.
제2조(정의) 이 법에서 사용하는 용어의 정의는 다음과 같다.(개정 2008.6.5)
1. “생명과학기술”이라 함은 인간의 배아(胚芽)·세포·유전자 등을 대상으로 생명현상을 규명·활용하는 과학과 기술을 말한다.
2. “배아”라 함은 수정란 및 수정된 때부터 발생학적으로 모든 기관이 형성되는 시기까지의 분열된 세포군을 말한다.
3. “잔여배아”라 함은 인공수정으로 생성된 배아 중 임신의 목적으로 이용하고 남은 배아를 말한다.
4. “체세포핵이식행위”라 함은 핵이 제거된 인간의 난자에 인간의 체세포 핵을 이식하는 것을 말한다.
5. “체세포복제배아(體細胞複製胚芽)”라 함은 체세포핵이식행위에 의하여 생성된 배아를 말한다.
6. “유전자검사”라 함은 개인의 식별, 특정한 질병 또는 소인(素因)의 검사 등의 목적으로 혈액·모발·타액(唾液) 등의 검사대상물로부터 염색체·유전자 등을 분석하는 행위를 말한다.
7. “유전정보”라 함은 유전자검사의 결과로 얻어진 정보를 말한다.
8. “유전자은행”이라 함은 유전정보의 획득을 목적으로 검사대상물·유전자 또는 개인정보가 포함된 유전정보(이하 “유전정보 등”이라 한다)를 수집·보존하여 이를 직접 이용하거나 타인에게 제공하는 기관을 말한다.
9. “유전자치료”라 함은 질병의 예방 또는 치료를 목적으로 유전적 변이를 일으키는 일련의 행위를 말한다.
10. “줄기세포주”란 배양가능한 조건 하에서 지속적으로 증식이 가능하고 다양한 세포로 분화할 수 있는 세포주를 말한다.
제3조(적용범위) 생명과학기술에 있어서의 생명윤리 및 안전에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 의한다.
제4조(책무)
①국가 또는 지방자치단체는 생명과학기술의 개발·이용과정에서 일어날 수 있는 생명윤리 및 안전에 관한 문제에 효율적으로 대처할 수 있도록 필요한 시책을 마련하여야 한다.
②생명과학기술을 연구·개발 및 이용하고자 하는 자는 생명과학기술이 인간의 존엄과 가치를 침해하지 아니하고 생명윤리 및 안전에 적합하도록 노력하여야 한다.
제5조(자기결정권) 누구든지 자신이 생명과학기술의 적용대상이 되는 경우 생명윤리 및 안전에 관하여 충분한 설명을 들은 후 이에 관한 동의여부를 결정할 권리를 가진다.
제2장 국가생명윤리심의위원회 및 기관생명윤리심의위원회
제6조(국가생명윤리심의위원회의 설치 및 기능) ①생명과학기술에 있어서의 생명윤리 및 안전에 관한 다음 각 호의 사항을 심의하기 위하여 대통령소속 하에 국가생명윤리심의위원회(이하 “심의위원회”라 한다)를 둔다.
1. 국가의 생명윤리 및 안전에 관한 정책의 수립에 관한 사항
2. 제17조제3호의 규정에 따라 잔여배아를 이용할 수 있는 연구의 종류·대상 및 범위에 관한 사항
3. 제22조 제2항의 규정에 따라 체세포핵이식행위를 할 수 있는 연구의 종류·대상 및 범위에 관한 사항
4. 제25조제1항의 규정에 따라 금지되는 유전자검사의 종류에 관한 사항
5. 제36조제1항제3호의 규정에 따라 유전자치료를 할 수 있는 질병의 종류
6. 그 밖에 윤리적·사회적으로 심각한 영향을 미칠 수 있는 생명과학기술의 연구·개발 또는 이용에 관하여 심의위원회의 위원장이 부의하는 사항
②심의위원회의 위원장은 제1항제1호 내지 제5호의 규정에 해당하는 사항으로서 재적위원 3분의 1 이상이 발의한 사항에 관하여는 심의위원회에 이를 부의하여야 한다.
제7조(심의위원회의 구성)
①심의위원회는 위원장 1인, 부위원장 1인을 포함한 16인 이상 21인 이하의 위원으로 구성한다.
②위원장은 위원 중에서 대통령이 임명 또는 위촉하고, 부위원장은 위원 중에서 호선한다.
③위원은 다음 각 호의 자가 된다.(개정 2005.3.24, 2008.2.29)
1. 교육과학기술부장관·법무부장관·지식경제부장관·보건복지가족부장관·여성부장관·법제처장
2. 생명과학 또는 의과학(醫科學)분야에 전문지식과 연구경험이 풍부한 학계·연구계 또는 산업계를 대표하는 자중에서 대통령이 위촉하는 7인 이내의 자
3. 종교계·철학계·윤리학계·사회과학계·법조계·시민단체(비영리민간단체지원법 제2조의 규정에 의한 비영리민간단체를 말한다) 또는 여성계를 대표하는 자중에서 대통령이 위촉하는 7인 이내의 자
④ 제3항 제2호 및 제3호의 위원의 임기는 3년으로 하되, 연임할 수 있다.
⑤ 심의위원회에 간사위원 2인을 두되, 간사위원은 교육과학기술부장관과 보건복지가족부장관으로 하며, 수석간사위원은 보건복지가족부장관으로 한다.(개정 2008.2.29)
제8조(심의위원회의 운영)
①심의위원회의 효율적인 운영을 위하여 심의위원회에 분야별 전문위원회를 둘 수 있다.
②심의위원회의 사무는 수석간사위원이 처리한다.
③심의위원회의 회의 등 활동은 공개함을 원칙으로 한다.
④이 법에서 규정한 것 외에 심의위원회 및 전문위원회의 구성·운영 그 밖에 필요한 사항은 대통령령으로 정한다.
제9조(기관생명윤리심의위원회의 설치 및 기능)
① 다음 각 호의 기관은 생명과학기술에 있어서의 생명윤리 및 안전을 확보하기 위하여 해당 기관에 기관생명윤리심의위원회(이하 “기관위원회”라 한다)를 두어야 한다.(개정 2008.6.5)
1. 제14조제1항에 따라 보건복지가족부장관으로부터 지정받은 배아생성의료기관
2. 제18조에 따라 보건복지가족부장관에게 등록한 배아연구기관
3. 제23조에 따라 보건복지가족부장관에게 등록한 체세포복제배아연구기관
4. 제24조제1항에 따라 보건복지가족부장관에게 신고한 유전자검사기관
5. 제32조제1항 본문에 따라 보건복지가족부장관의 허가를 받은 유전자은행
6. 제37조제1항에 따라 보건복지가족부장관에게 신고한 유전자치료기관
7. 그 밖에 윤리적·사회적으로 심각한 영향을 미칠 수 있는 생명과학기술을 연구·개발 또는 이용하는 기관으로서 보건복지가족부령으로 정하는 기관
②기관위원회는 제1항 각호의 기관에서 행하여지는 생명과학기술의 연구·개발 또는 이용에 관하여 다음 각 호의 사항을 심의한다.
1. 생명과학기술 연구계획서의 윤리적·과학적 타당성
2. 환자 또는 정자·난자·검사대상물의 제공자로부터 적법한 절차에 따라 동의를 받았는지의 여부
3. 환자, 정자·난자·검사대상물의 제공자 또는 유전정보의 주체에 대한 안전대책 및 정자·난자·검사대상물을 타인에게 제공하는 경우에 성명·주민등록번호 등 개인을 식별할 수 있는 정보(이하 “개인정보”라 한다)에 대한 보호대책
4. 그 밖에 제1항 각호의 기관에서 행하여지는 생명과학기술의 연구·개발 또는 이용에 관한 사항
③ 제1항 각호의 기관의 장은 당해 기관에서 행하여지는 생명과학기술의 연구·개발 또는 이용으로 인하여 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있는 경우에는 지체없이 기관위원회를 소집하여 이를 심의하도록 하고, 그 결과를 보건복지가족부장관에게 보고하여야 한다.(개정 2008.2.29)
④ 제1항 각호의 기관 중 기관의 규모 또는 연구자 수 등이 보건복지가족부령이 정하는 기준 이하인 기관이 기관위원회를 설치한 동종의 기관과 제2항 각호 및 제3항의 규정에 의한 사항의 심의에 관한 협약을 체결한 경우에는 제1항의 규정에 불구하고 기관위원회를 설치한 것으로 본다.(개정 2008.2.29)
제10조(기관위원회의 구성 및 운영)
① 기관위원회는 위원장 1인을 포함하여 5인 이상의 위원으로 구성한다. 이 경우 생명과학 또는 의과학 분야 외의 종사자와 해당 기관에 종사하지 아니하는 자 1인 이상이 각각 포함되어야 한다.(개정 2008.6.5)
② 위원은 제9조제1항 각호의 기관의 장이 위촉하며, 위원장은 위원 중에서 호선한다.
③ 기관위원회의 심의대상인 연구·개발 또는 이용에 관여하는 위원은 해당 연구·개발 또는 이용과 관련된 심의에 참여하여서는 아니 된다.
④ 그 밖에 기관위원회의 구성 및 운영에 관하여 필요한 사항은 대통령령으로 정한다.
제10조의2(기관위원회의 지원 등)
① 보건복지가족부장관은 기관위원회의 운영을 적정하게 감독·지원하기 위하여 다음 각 호의 업무를 수행한다.
1. 기관위원회에 대한 조사
2. 기관위원회에 대한 평가
3. 기관위원회위원에 대한 교육
4. 그 밖에 기관위원회에 대한 감독 및 지원에 필요한 업무로서 보건복지가족부령으로 정하는 업무
② 보건복지가족부장관은 제1항 제2호에 따라 기관위원회의 운영 실적을 평가하고, 그 결과를 공개할 수 있다.
③ 기관위원회에 대한 평가 및 그 결과의 공개, 교육 등에 필요한 사항은 보건복지가족부령으로 정한다.
[본조신설 2008.6.5]
제3장 배아 등의 생성·연구
제1절 인간복제 등의 금지
제11조(인간복제의 금지)
①누구든지 체세포복제배아를 자궁에 착상시켜서는 아니 되며, 착상된 상태를 유지하거나 출산하여서는 아니 된다.
②누구든지 제1항의 규정에 의한 행위를 유인 또는 알선하여서는 아니 된다.
제12조(이종 간의 착상 등 금지)
① 누구든지 인간의 배아를 동물의 자궁에 착상시키거나 동물의 배아를 인간의 자궁에 착상시키는 행위를 하여서는 아니 된다.
② 누구든지 다음 각 호의 1에 해당하는 행위를 하여서는 아니 된다.(개정 2008.6.5)
1. 인간의 난자를 동물의 정자로 수정시키거나 동물의 난자를 인간의 정자로 수정시키는 행위. 다만, 의학적으로 인간의 정자의 활동성 시험을 위한 경우를 제외한다.
2. 핵이 제거된 인간의 난자에 동물의 체세포 핵을 이식하거나 핵이 제거된 동물의 난자에 인간의 체세포 핵을 이식하는 행위
3. 인간의 배아와 동물의 배아를 융합하는 행위
4. 다른 유전정보를 가진 인간의 배아를 융합하는 행위
③누구든지 제2항 각호의 1에 해당하는 행위로부터 생성된 것을 인간 또는 동물의 자궁에 착상시키는 행위를 하여서는 아니 된다.
제2절 인공수정배아
제13조(배아의 생성 등)
①누구든지 임신외의 목적으로 배아를 생성하여서는 아니 된다.
②누구든지 임신을 목적으로 배아를 생성함에 있어서 다음 각 호의 1에 해당하는 행위를 하여서는 아니 된다.
1. 특정의 성을 선택할 목적으로 정자와 난자를 선별하여 수정시키는 행위
2. 사망한 자의 정자 또는 난자로 수정시키는 행위
3. 미성년자의 정자 또는 난자로 수정시키는 행위. 다만, 혼인한 미성년자가 그 자녀를 얻기 위한 경우를 제외한다.
③누구든지 금전 또는 재산상의 이익 그 밖에 반대급부를 조건으로 정자 또는 난자를 제공 또는 이용하거나 이를 유인 또는 알선하여서는 아니 된다.
제14조(배아생성의료기관)
① 인공수태시술을 위하여 정자 또는 난자를 채취·보관하거나 이를 수정시켜 배아를 생성하고자 하는 의료기관은 보건복지가족부장관으로부터 배아생성의료기관으로 지정받아야 한다.(개정 2008.2.29)
② 배아생성의료기관으로 지정받고자 하는 의료기관은 보건복지가족부령이 정하는 시설 및 인력 등을 갖추어야 한다.(개정 2008.2.29)
③ 배아생성의료기관의 지정기준 및 절차, 제출서류 그 밖에 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제15조(배아의 생성 등에 관한 동의)
①제14조의 규정에 따라 배아생성의료기관으로 지정받은 의료기관(이하 “배아생성의료기관”이라 한다)은 배아를 생성하기 위하여 정자 또는 난자를 채취하는 때에는 정자제공자·난자제공자·인공수태시술대상자 및 그 배우자(이하 “동의권자”라 한다)의 서면동의를 얻어야 한다.
②제1항의 규정에 의한 서면동의에는 다음 각 호의 사항이 포함되어야 한다.(개정 2008.2.29)
1. 배아생성의 목적에 관한 사항
2. 배아의 보존기간 그 밖에 배아의 보관에 관한 사항
3. 배아의 폐기에 관한 사항
4. 임신외의 목적으로 잔여배아를 이용하는 것에 대한 동의여부
5. 동의의 철회, 동의권자의 권리 및 정보보호 그 밖에 보건복지가족부령이 정하는 사항
③배아생성의료기관은 제1항의 규정에 의한 서면동의를 받기 전에 동의권자에게 제2항 각호의 사항에 대하여 충분히 설명하여야 한다.
④ 제1항의 규정에 의한 서면동의를 위한 동의서의 서식 및 보존 등에 관하여 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제15조의2(난자제공자에 대한 건강검진 등)
① 배아생성의료기관은 보건복지가족부령으로 정하는 바에 따라 난자의 채취 전에 난자제공자에 대하여 건강검진을 실시하여야 한다.
② 배아생성의료기관은 보건복지가족부령으로 정하는 건강기준에 미달하는 자로부터 난자를 채취하여서는 아니 된다.
[본조신설 2008.6.5]
제15조의3(난자채취 빈도의 제한) 배아생성의료기관은 대통령령으로 정하는 빈도 이상으로 동일한 난자제공자로부터 난자를 채취하여서는 아니 된다.
[본조신설 2008.6.5]
제15조의4(난자제공자에 대한 실비보상) 배아생성의료기관은 난자제공에 필요한 시술 및 회복에 소요되는 시간에 따른 보상금 및 교통비 등 보건복지가족부령으로 정하는 항목에 관하여 보건복지가족부령으로 정하는 금액을 난자제공자에게 지급할 수 있다.
[본조신설 2008.6.5]
제16조(배아의 보존기간 및 폐기)
①배아의 보존기간은 5년으로 한다. 다만, 동의권자가 보존기간을 5년 미만으로 정한 경우에는 이를 보존기간으로 한다.
②배아생성의료기관은 제1항의 규정에 의한 보존기간이 도래한 배아중 제17조의 규정에 의한 연구의 목적으로 이용하지 아니하고자 하는 배아를 폐기하여야 한다.
③배아생성의료기관은 배아의 폐기에 관한 사항을 기록·보관하여야 한다.
④ 배아의 폐기 절차 및 방법, 배아의 폐기에 관한 사항의 기록·보관에 관하여 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제17조(잔여배아의 연구) 제16조의 규정에 의한 배아의 보존기간이 경과된 잔여배아는 발생학적으로 원시선이 나타나기 전까지에 한하여 체외에서 다음 각 호의 1의 목적으로 이용할 수 있다. 다만, 보존기간을 5년 미만으로 정한 잔여배아를 이용하고자 하는 경우에는 동의권자로부터 해당 목적으로의 이용에 대하여 새로이 동의를 받아야 한다.(개정 2008.2.29)
1. 불임치료법 및 피임기술의 개발을 위한 연구
2. 근이영양증 그 밖에 대통령령이 정하는 희귀·난치병의 치료를 위한 연구
3. 그 밖에 제1호와 제2호에 준하는 연구로서 대통령령으로 정하는 연구
제18조(배아연구기관) 제17조의 규정에 따라 잔여배아를 연구하고자 하는 자는 보건복지가족부령이 정하는 시설·인력 등을 갖추고 보건복지가족부장관에게 배아연구기관으로 등록하여야 한다.(개정 2008.2.29)
제19조(배아연구계획서의 승인)
① 제18조의 규정에 따라 보건복지가족부장관에게 등록한 배아연구기관(이하 “배아연구기관”이라 한다)이 제17조의 규정에 의한 배아연구를 하고자 하는 때에는 보건복지가족부령이 정하는 바에 따라 미리 보건복지가족부장관에게 배아연구계획서를 제출하여 승인을 얻어야 한다. 대통령령이 정하는 중요한 사항을 변경하는 경우에도 또한 같다.(개정 2008.2.29)
②제1항의 규정에 의한 배아연구계획서에는 배아연구기관 안에 설치된 기관위원회의 심의결과에 관한 서류가 첨부되어야 한다.
③ 보건복지가족부장관은 다른 중앙행정기관의 장이 연구비를 지원하는 배아연구기관으로부터 연구계획서를 제출받은 때에는 승인여부를 결정하기 전에 그 중앙행정기관의 장과 협의하여야 한다.(개정 2008.2.29)
④ 배아연구계획서의 승인기준 및 절차, 제출서류 그 밖에 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제20조(잔여배아의 제공 및 관리)
① 배아생성의료기관이 제19조제1항의 규정에 따라 배아연구계획서의 승인을 얻은 배아연구기관에게 연구에 필요한 잔여배아를 제공하는 경우에는 무상으로 하여야 한다. 다만, 배아생성의료기관은 잔여배아의 보관 및 제공에 필요한 경비를 보건복지가족부령이 정하는 바에 따라 배아연구기관에 요구할 수 있다.(개정 2008.2.29)
② 제1항의 규정에 의한 잔여배아의 제공절차, 경비의 산출 그 밖에 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
③ 배아생성의료기관과 배아연구기관은 잔여배아의 보관 및 제공 등에 관한 사항을 보건복지가족부령이 정하는 바에 따라 보건복지가족부장관에게 보고하여야 한다.(개정 2008.2.29)
④제16조제2항 내지 제4항의 규정은 배아연구기관이 제1항의 규정에 따라 잔여배아를 제공받은 후 연구의 목적으로 이용하지 아니하고자 하는 잔여배아의 폐기에 관하여 이를 준용한다. 이 경우 “배아생성의료기관”은 “배아연구기관”으로 본다.
제20조의2(줄기세포주의 등록)
① 줄기세포주를 수립(樹立)하거나 수입한 자는 그 줄기세포주를 제20조의3에 따라 제공하거나 제20조의4에 따라 이용하기 전에 보건복지가족부령으로 정하는 바에 따라 그 줄기세포주를 보건복지가족부장관에게 등록하여야 한다.
② 보건복지가족부장관은 줄기세포주의 등록을 신청한 자가 다른 중앙행정기관의 장으로부터 과학적 검증을 받은 경우에는 제1항에 따른 등록을 하는 데에 그 검증자료를 활용하여야 한다.
③ 보건복지가족부장관은 제1항에 따라 줄기세포주를 등록한 자에게 줄기세포주의 검증 등에 든 비용의 전부 또는 일부를 지원할 수 있다.
[본조신설 2008.6.5] [시행일 2010.1.1]
제20조의3(줄기세포주의 제공)
① 제20조의2에 따라 줄기세포주를 수립하거나 수입한 자가 그 줄기세포주를 제공하려면 보건복지가족부령으로 정하는 바에 따라 기관위원회의 심의를 거쳐야 한다.
② 제1항에 따라 줄기세포주를 제공한 자는 보건복지가족부령으로 정하는 바에 따라 보건복지가족부장관에게 줄기세포주의 제공현황을 보고하여야 한다.
③ 제1항에 따라 줄기세포주를 제공하는 경우에는 무상으로 하여야 한다. 다만, 줄기세포주를 제공하는 자는 이를 제공받는 자로부터 줄기세포주의 보관 및 제공에 필요한 경비를 지급받을 수 있다.
④ 제1항부터 제3항까지의 규정에 따른 줄기세포주의 제공 및 보고, 경비의 산출 방법 등에 필요한 사항은 보건복지가족부령으로 정한다.
[본조신설 2008.6.5] [시행일 2010.1.1]
제20조의4(줄기세포주의 이용)
① 제20조의2에 따라 등록된 줄기세포주는 체외에서 다음 각 호의 연구 목적으로만 이용할 수 있다.
1. 질병의 진단·예방 또는 치료를 위한 연구
2. 줄기세포의 특성 및 분화에 관한 기초연구
3. 그 밖에 심의위원회의 심의를 거쳐 대통령령으로 정하는 연구
② 제1항에 따라 줄기세포주를 이용하려는 자는 해당 연구계획에 대하여 보건복지가족부령으로 정하는 바에 따라 기관위원회의 심의를 거쳐 해당 기관의 장의 승인을 받아야 한다. 승인을 받은 연구계획서의 내용 중 대통령령으로 정하는 중요한 사항을 변경하는 경우에도 또한 같다.
③ 제2항에 따라 승인 또는 변경승인을 받은 자는 보건복지가족부령으로 정하는 바에 따라 그 사실을 보건복지가족부장관에게 보고하여야 한다.
④ 제2항에 따라 승인을 받은 자는 줄기세포주를 제공한 자에게 제공받은 줄기세포주의 이용계획서를 제출하여야 한다.
⑤ 제2항에 따라 연구를 승인한 기관의 장은 연구를 하는 자가 연구계획에 적합하게 연구를 실시하도록 감독하여야 한다.
[본조신설 2008.6.5] [시행일 2010.1.1]
제21조(배아생성의료기관 및 배아연구기관의 준수사항) 배아생성의료기관 및 배아연구기관은 다음 각 호의 사항을 준수하여야 한다.(개정 2008.2.29)
1. 제15조의 규정에 의한 동의서에 기재된 목적으로 배아를 취급할 것
2. 잔여배아의 보관·취급·폐기 등의 관리를 철저히 할 것
3. 배아연구기관은 당해 기관에서 행하여지는 연구로 인하여 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있는 경우에는 연구의 중단 등 적절한 조치를 취할 것
4. 그 밖에 제1호 내지 제3호에 준하는 사항으로서 생명윤리 및 안전의 확보를 위하여 필요하다고 인정하여 보건복지가족부령이 정하는 사항
제3절 체세포복제배아
제22조(체세포핵이식행위)
①누구든지 제17조제2호의 규정에 의한 희귀·난치병의 치료를 위한 연구목적 외에는 체세포핵이식행위를 하여서는 아니 된다.
②제1항의 규정에 의한 연구목적에 따라 체세포핵이식행위를 할 수 있는 연구의 종류·대상 및 범위는 심의위원회의 심의를 거쳐 대통령령으로 정한다.
제23조(체세포복제배아의 생성 및 연구)
①체세포복제배아를 생성하거나 연구하고자하는 자는 보건복지가족부령이 정하는 시설 및 인력 등을 갖추고 보건복지가족부장관에게 등록하여야 한다.(개정 2008.2.29)
②제19조 내지 제21조의 규정은 체세포복제배아의 연구에 관하여 이를 준용한다. 이 경우 “잔여배아”는 “체세포복제배아”로 본다.
제4장 유전자검사
제24조(유전자검사기관 등)
① 유전자검사를 하고자 하는 자 또는 직접 검사대상물을 채취하여 유전자에 관한 연구를 하고자 하는 자는 유전자검사시설 또는 연구시설의 소재지, 기관장, 유전자검사 또는 연구항목 등의 사항에 대하여 보건복지가족부령이 정하는 바에 따라 보건복지가족부장관에게 신고하여야 한다. 다만, 국가기관이 유전자검사 또는 유전자에 관한 연구를 하는 경우에는 그러하지 아니하다.(개정 2008.2.29)
②제1항의 규정에 따라 신고한 사항 중 대통령령이 정하는 중요한 사항을 변경하는 경우에도 제1항과 같다.
③ 보건복지가족부장관은 제1항의 규정에 따라 신고한 유전자검사를 하고자 하는 자(이하 “유전자검사기관”이라 한다)로 하여금 보건복지가족부령이 정하는 바에 따라 유전자검사의 정확도 평가를 받게 할 수 있고, 그 결과를 공개할 수 있다.(개정 2008.2.29)
④ 유전자검사기관은 유전자검사의 업무를 폐업하거나 휴업하고자 하는 경우에는 보건복지가족부령이 정하는 바에 따라 보건복지가족부장관에게 신고하여야 한다.(개정 2008.2.29)
제25조(유전자검사의 제한)
①유전자검사기관은 과학적 입증이 불확실하여 검사대상자를 오도(誤導)할 우려가 있는 신체외관이나 성격에 관한 유전자검사 그 밖에 심의위원회의 심의를 거쳐 대통령령이 정하는 유전자검사를 하여서는 아니 된다.
②유전자검사기관은 근이영양증 그 밖에 대통령령이 정하는 유전질환을 진단하기 위한 목적 외에는 배아 또는 태아를 대상으로 유전자검사를 하여서는 아니 된다.
③의료기관이 아닌 유전자검사기관에서는 질병의 진단과 관련한 유전자검사를 할 수 없다. 다만, 의료기관의 의뢰를 받아 유전자검사를 하는 경우에는 그러하지 아니하다.
제26조(유전자검사의 동의)
①유전자검사기관 또는 유전자에 관한 연구를 하는 자가 유전자검사 또는 유전자연구에 쓰일 검사대상물을 직접 채취하거나 채취를 의뢰하는 때에는 검사대상물을 채취하기 전에 검사대상자로부터 다음 각 호의 사항이 포함된 서면동의를 얻어야 한다.(개정 2008.2.29)
1. 유전자검사 또는 유전자연구의 목적
2. 제1호의 규정에 의한 목적 외로 검사대상물을 이용하거나 타인에게 제공하는 것에 대한 동의여부 및 그 범위에 관한 사항
3. 제2호의 규정에 따라 검사대상물을 타인에게 제공하는 경우에 개인정보를 포함 시킬 것인지 여부
4. 검사대상물의 보존기간 및 관리에 관한 사항
5. 동의의 철회, 검사대상자의 권리 및 정보보호 그 밖에 보건복지가족부령이 정하는 사항
② 유전자검사기관외의 자가 검사대상물을 채취하여 유전자검사기관에 유전자검사를 의뢰하는 경우에는 검사대상자로부터 제1항의 규정에 의한 서면동의를 얻어 이를 첨부하여야 한다. 이 경우 보건복지가족부령이 정하는 바에 따라 개인정보를 보호하기 위한 조치를 취하여야 한다.(개정 2008.2.29)
③검사대상자가 미성년자·심신박약자 또는 심신상실자인 경우에는 제1항의 규정에 의한 본인의 동의 외에 법정대리인의 동의를 얻어야 한다. 다만, 질병의 진단 또는 치료를 목적으로 유전자검사를 하는 경우에 있어서 심신박약 또는 심신상실 등의 사유로 본인의 동의를 얻을 수 없는 때에는 이를 생략할 수 있다.
④제1항 내지 제3항의 규정에 불구하고 다음 각 호의 1에 해당하는 경우에는 서면동의 없이 유전자검사를 할 수 있다.
1. 시체 또는 의식불명의 자에 대하여 개인 식별을 하여야 할 긴급한 필요가 있거나 특별한 사유가 있는 경우
2. 다른 법률에 특별한 규정이 있는 경우
⑤제1항 내지 제3항의 규정에 따라 서면동의를 얻고자 하는 자는 미리 검사대상자 또는 법정대리인에게 유전자검사의 목적과 방법, 예측되는 유전자검사의 결과와 의미 등에 대하여 충분히 설명하여야 한다.
⑥ 제1항 내지 제3항의 규정에 의한 동의의 절차 및 동의서의 서식 그 밖에 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제27조(검사대상물의 제공)
①유전자검사기관은 제26조의 규정에 따라 검사대상자로부터 연구목적으로 검사대상물을 이용하는 것에 대하여 서면동의를 얻은 경우에는 유전자에 관한 연구를 하는 자 또는 제32조의 규정에 따라 유전자은행의 개설허가를 받은 자에게 검사대상물을 제공할 수 있다.
②유전자검사기관은 제1항의 규정에 따라 제공하는 검사대상물에 개인정보를 포함시켜서는 아니 된다. 다만, 개인정보를 포함시키는 것에 대하여 검사대상자 또는 법정대리인이 서면으로 동의하는 경우에는 그러하지 아니하며, 이 경우 동의서의 사본을 첨부하여야 한다.
③ 유전자검사기관, 유전자에 관한 연구를 하는 자 또는 제32조의 규정에 따라 유전자은행의 개설허가를 받은 자(이하 “유전자검사기관등”이라 한다)는 제1항의 규정에 따라 검사대상물을 제공하거나 이를 제공받은 때에는 보건복지가족부령이 정하는 바에 따라 검사대상물의 제공에 관한 기록을 작성하여야 한다.(개정 2008.2.29)
④제1항 내지 제3항의 규정은 검사대상물을 제공받은 자가 다른 연구자 또는 유전자은행에 검사대상물을 제공하는 경우에 이를 준용한다.
제28조(검사대상물의 폐기)
①검사대상물의 보존기간은 5년으로 한다. 다만, 검사대상자 또는 법정대리인이 제26조제1항의 규정에 의한 동의서에 보존기간을 별도로 정한 경우에는 이를 보존기간으로 한다.
②유전자검사기관등은 보존기간 경과 후 지체 없이 검사대상물을 폐기하여야 한다. 다만, 검사대상자 또는 법정대리인이 검사대상물을 폐기하지 아니할 것을 서면으로 요청한 경우에는 그러하지 아니하다.
③유전자검사기관등은 검사대상물의 보관 중에 검사대상자 또는 법정대리인이 검사대상물의 폐기를 요청하는 경우에는 이에 응하여야 한다.
④유전자검사기관등은 검사대상물의 폐기에 관한 사항을 기록·보관하여야 한다.
⑤ 유전자검사기관등은 휴업·폐업 그 밖에 부득이한 사정으로 인하여 검사대상물을 보존할 수 없는 경우에는 보건복지가족부령이 정하는 바에 따라 검사대상물을 처리 또는 이관하여야 한다.(개정 2008.2.29)
⑥ 검사대상물의 폐기 절차 및 방법, 검사대상물의 폐기에 관한 사항의 기록·보관 및 제5항의 규정에 의한 검사대상물의 처리 또는 이관에 관하여 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제29조(기록의 관리 및 열람)
① 유전자검사기관등은 다음 각 호의 서류를 보건복지가족부령이 정하는 바에 따라 보존하여야 한다.(개정 2008.2.29)
1. 제26조의 규정에 의한 동의서
2. 유전자검사 결과
3. 제27조제3항의 규정에 의한 검사대상물의 제공에 관한 기록
②유전자검사기관등은 검사대상자 또는 법정대리인이 제1항 각호의 규정에 의한 기록의 열람 또는 사본의 교부를 요청하는 경우에는 이에 응하여야 한다.
③ 제2항의 규정에 의한 기록의 열람 또는 사본의 교부에 관한 신청절차 및 서식 등에 관하여 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제30조(유전자검사기관등의 준수사항)
①유전자검사기관등은 다음 각 호의 사항을 준수하여야 한다.(개정 2008.2.29)
1. 제26조의 규정에 의한 서면동의 내용
2. 유전정보의 보호
3. 그 밖에 제1호 및 제2호에 준하는 사항으로서 생명윤리 및 안전의 확보를 위하여 보건복지가족부령이 정하는 사항
②유전자검사기관등은 유전자검사에 관하여 허위표시 또는 과대광고를 하여서는 아니 된다.
③ 제2항의 규정에 의한 허위표시 또는 과대광고의 범위 그 밖에 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제5장 유전정보 등의 보호 및 이용
제31조(유전정보에 의한 차별금지)
①누구든지 유전정보를 이유로 하여 교육·고용·승진·보험 등 사회활동에 있어서 다른 사람을 차별하여서는 아니 된다.
②다른 법률에 특별한 규정이 있는 경우를 제외하고는 누구든지 타인에게 유전자검사를 받도록 강요하거나 유전자검사의 결과를 제출하도록 강요하여서는 아니 된다.
제32조(유전자은행의 허가 및 신고)
① 유전자은행을 개설하고자 하는 자는 대통령령이 정하는 바에 따라 보건복지가족부장관의 허가를 받아야 한다. 다만, 국가기관이 직접 유전자은행을 개설하고자 하는 경우를 제외한다.(개정 2008.2.29)
② 제1항의 규정에 불구하고 다른 법령에 따라 중앙행정기관의 장으로부터 연구비지원의 승인을 얻어 유전자은행을 개설하고자 하는 경우에는 당해 중앙행정기관의 장으로부터 연구비지원의 승인을 얻은 때에 보건복지가족부장관의 허가를 받은 것으로 본다. 이 경우 해당 중앙행정기관의 장은 미리 보건복지가족부장관과 협의하여야 한다.(개정 2008.2.29)
③ 제1항의 규정에 따라 개설된 유전자은행이 개설장소를 이전하거나 그 개설에 관한 허가사항 중 대통령령이 정하는 중요한 사항을 변경하고자 하는 경우에는 보건복지가족부령이 정하는 바에 따라 보건복지가족부장관에게 신고하여야 한다.(개정 2008.2.29)
④ 유전자은행의 장은 유전자은행의 업무를 폐업하거나 휴업하고자 하는 경우에는 보건복지가족부령이 정하는 바에 따라 보건복지가족부장관에게 신고하여야 한다.(개정 2008.2.29)
⑤제1항의 규정에 의한 유전자은행의 시설·장비 기준 및 허가절차 그 밖에 필요한 사항은 대통령령으로 정한다.
제33조(유전정보 등의 제공)
①유전자은행으로부터 유전정보 등을 이용하고자 하는 자는 유전정보 등의 이용계획서를 유전자은행의 장에게 제출하여야 한다.
② 유전자은행의 장은 제1항의 규정에 따라 제출된 이용계획서에 대하여 제9조의 규정에 의한 기관위원회의 심의를 거쳐 유전정보 등의 제공 여부를 결정하고, 그 결과를 보건복지가족부장관에게 보고하여야 한다.(개정 2008.2.29)
③ 유전정보등의 이용계획서 기재내용, 제출절차 그 밖에 유전정보등의 제공·관리에 관하여 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제34조(유전자은행의 장의 준수사항)
①유전자은행의 장은 제33조의 규정에 따라 유전정보 등을 타인에게 제공함에 있어 개인정보를 포함시켜서는 아니 된다.
② 유전자은행의 장은 유전정보 등을 타인에게 제공하는 경우에는 무상으로 하여야 한다. 다만, 유전자은행의 장은 유전정보 등의 보관 및 제공에 필요한 경비를 보건복지가족부령이 정하는 바에 따라 요구할 수 있다.(개정 2008.2.29)
제35조(유전정보 등의 보호)
①유전자은행의 장 또는 그 종사자는 직무상 얻거나 알게 된 유전정보 등을 정당한 사유 없이 타인에게 제공하거나 부당한 목적으로 사용하여서는 아니 된다.
②의료기관은 「의료법」 제21조 제2항의 규정에 따라 환자외의 자에게 제공하는 의무기록 및 진료기록 등에 유전정보를 포함시켜서는 아니 된다. 다만, 해당 환자와 동일한 질병의 진단 및 치료를 목적으로 다른 의료기관의 요청이 있고 개인정보의 보호에 관한 조치를 한 경우에는 그러하지 아니하다.(개정 2007.4.11, 2009.1.30)
제35조의2(유전정보 등의 관리 등)
① 유전자은행은 수집한 모든 유전정보 등을 익명화하여 보관·관리하여야 한다.
② 유전자은행은 개인정보 보호를 위하여 정보관리 및 보안을 담당하는 책임자를 두어야 한다.
③ 제1항에 따른 유전정보 등의 보관·관리와 제2항에 따른 보안책임자의 업무 등에 필요한 사항은 보건복지가족부령으로 정한다.
[본조신설 2008.6.5]
제35조의3(유전자은행에 대한 지원) 국가나 지방자치단체는 예산의 범위에서 유전자은행의 운영에 필요한 비용을 지원할 수 있다.
[본조신설 2008.6.5]
제6장 유전자치료
제36조(유전자치료)
①누구든지 유전자치료는 다음 각 호의 1에 해당되는 경우 외에는 하여서는 아니된다.(개정 2008.2.29)
1. 유전질환·암·후천성면역결핍증 그 밖에 생명을 위협하거나 심각한 장애를 초래하는 질병의 치료
2. 현재 이용 가능한 치료법이 없거나 유전자치료의 효과가 이용 가능한 다른 치료법과 비교하여 현저히 우수할 것으로 예측되는 치료
3. 그 밖에 보건복지가족부장관이 정하는 질병의 예방이나 치료를 위하여 필요하다고 인정하는 경우
②제1항의 규정에 불구하고 정자·난자·배아 또는 태아에 대하여 유전자치료를 하여서는 아니 된다.
제37조(유전자치료기관)
① 유전자치료를 하고자 하는 의료기관은 보건복지가족부장관에게 신고하여야 한다. 대통령령이 정하는 중요한 사항을 변경하는 경우에도 또한 같다.(개정 2008.2.29)
② 제1항의 규정에 따라 보건복지가족부장관에게 신고한 의료기관(이하 “유전자치료기관”이라 한다)은 유전자치료를 하고자 하는 환자에 대하여 다음 각 호의 사항에 관하여 미리 설명한 후 서면동의를 얻어야 한다.(개정 2008.2.29)
1. 치료의 목적
2. 예측되는 치료결과 및 그 부작용
3. 그 밖에 보건복지가족부령이 정하는 사항
③ 유전자치료기관의 신고요건 및 절차, 동의서의 서식 그 밖에 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제7장 감 독
제38조(보고와 조사 등)
①보건복지가족부장관은 생명윤리 및 안전의 확보와 관련하여 필요하다고 인정할 때에는 배아생성의료기관·배아연구기관·유전자검사기관등·유전자치료기관(이하 “피감독기관”이라 한다) 또는 그 종사자에 대하여 보건복지가족부령이 정하는 바에 따라 이 법의 시행에 관하여 필요한 보고 또는 자료의 제출을 명할 수 있고, 생명과학기술의 연구·개발·이용으로 인하여 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있는 때에는 그 연구·개발·이용의 중단을 명하거나 그 밖에 필요한 조치를 할 수 있다.(개정 2008.2.29)
②보건복지가족부장관은 이 법이 정하고 있는 사항의 이행 또는 위반 여부의 확인을 위하여 필요하다고 인정할 때에는 관계공무원으로 하여금 피감독기관 또는 그 사무소 등에 출입하여 그 시설 또는 장비, 관계장부나 서류 그 밖의 물건을 검사하게 하거나 관계인에 대한 질문을 하게 할 수 있으며, 시험에 필요한 시료를 최소분량에 한하여 수거하게 할 수 있다. 이 경우 관계공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 내보여야 한다.(개정 2008.2.29)
③피감독기관 또는 그 종사자는 제1항 및 제2항의 규정에 의한 명령·검사·질문 등에 대하여 정당한 사유가 없는 한 이에 응하여야 한다.
제39조(폐기명령) 보건복지가족부장관은 피감독기관 또는 그 종사자, 제20조의2부터 제20조의4까지의 규정에 따라 줄기세포주를 등록·제공 또는 이용한 자에 대하여 제13조, 제14조, 제15조제1항, 제15조의2, 제15조의3, 제16조제2항, 제17조 내지 제19조, 제20조제1항·제4항, 제20조의2제1항, 제20조의3제1항·제3항, 제20조의4제2항, 제22조제1항 또는 제23조의 규정을 위반하여 생성·보관 또는 제공된 배아·체세포복제배아·줄기세포주 또는 난자 및 제24조제1항, 제25조, 제26조제1항 내지 제3항, 제27조제1항·제2항·제4항, 제28조제2항·제3항 또는 제32조제1항·제2항의 규정을 위반하여 채취·보관 또는 제공된 검사대상물을 폐기할 것을 명할 수 있다. 이 경우 폐기의 절차 및 방법에 관하여는 제16조제4항 또는 제28조제6항의 규정을 준용한다.(개정 2008.2.29, 2008.6.5)
제40조(개선명령) 보건복지가족부장관은 피감독기관에 대하여 그 시설·인력 등이 제14조제2항·제18조·제23조 또는 제32조제5항의 규정에서 정하는 시설기준 등에 적합하지 아니하여 연구·채취·보관 또는 배아의 생성 등을 하는 경우에 생명윤리나 안전에 중대한 위해가 발생하거나 발생할 우려가 있다고 인정하는 때에는 그 시설의 개선을 명하거나 당해 시설의 전부 또는 일부의 사용을 금지할 것을 명할 수 있다.(개정 2008.2.29)
제41조(허가 등의 취소와 업무의 정지)
① 보건복지가족부장관은 배아생성의료기관·배아연구기관·유전자검사기관·유전자은행·유전자치료기관이 다음 각 호의 1에 해당하는 때에는 그 지정·등록 또는 허가를 취소하거나 1년 이내의 기간을 정하여 그 업무의 전부 또는 일부의 정지를 명할 수 있다.(개정 2008.2.29, 2008.6.5)
1. 제9조제1항·제3항, 제10조제1항·제3항, 제11조 내지 제14조, 제15조제1항·제3항, 제15조의2, 제15조의3, 제16조제2항·제3항, 제17조, 제19조제1항, 제20조, 제22조, 제24조제2항·제4항, 제25조, 제26조제1항 내지 제3항·제5항, 제27조, 제28조제2항 내지 제5항, 제29조제1항·제2항, 제32조제3항·제4항, 제33조제2항, 제35조, 제35조의2제1항·제2항, 제36조 또는 제37조제1항 후단·제2항의 규정을 위반한 때
2. 제21조·제30조 또는 제34조의 규정에 의한 준수사항을 이행하지 아니한 때
3. 제38조제1항·제39조 또는 제40조의 규정에 의한 명령을 이행하지 아니한 때
4. 제38조제2항의 규정에 의한 검사·질문·수거에 불응한 때
② 제1항의 규정에 의한 행정처분의 세부기준은 그 위반행위의 유형과 위반의 정도 등을 고려하여 보건복지가족부령으로 정한다.(개정 2008.2.29)
제42조(청문) 보건복지가족부장관은 제41조제1항의 규정에 따라 지정·등록 또는 허가를 취소하고자 하는 경우에는 청문을 실시하여야 한다.(개정 2008.2.29)
제43조(과징금)
① 보건복지가족부장관은 배아생성의료기관 또는 유전자치료기관이 다음 각 호의 1에 해당하여 업무정지처분을 하여야 할 경우로서 그 업무정지가 당해 사업의 이용자에게 심한 불편을 주거나 그 밖에 공익을 해할 우려가 있는 때에는 대통령령이 정하는 바에 따라 그 업무정지처분에 갈음하여 2억원 이하의 과징금을 부과할 수 있다.(개정 2008.2.29)
1. 제14조, 제15조제1항·제3항, 제16조제2항·제3항 또는 제36조의 규정을 위반한 때
2. 제21조의 규정에 의한 준수사항을 위반한 때
3. 제38조제1항·제39조 또는 제40조의 규정에 의한 명령을 이행하지 아니한 때
4. 제38조제2항의 규정에 의한 검사·질문·수거에 불응한 때
② 제1항의 규정에 따라 과징금을 부과하는 위반행위의 종별과 정도 등에 따른 과징금의 금액 그 밖에 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
③ 보건복지가족부장관은 제1항의 규정에 의한 과징금을 납부하여야 할 자가 납부기한까지 이를 납부하지 아니하는 때에는 국세체납처분의 예에 따라 이를 징수한다.(개정 2008.2.29)
제44조(수수료) 보건복지가족부장관은 이 법의 규정에 따라 지정·등록·허가·승인을 받고자 하거나 신고를 하는 자 또는 그 내용을 변경하고자 하는 자로 하여금 보건복지가족부령이 정하는 바에 따라 수수료를 납부하게 할 수 있다.(개정 2008.2.29)
제8장 보 칙
제45조(성체줄기세포연구의 지원) 국가 또는 지방자치단체는 성체줄기세포의 연구를 육성하기 위하여 필요한 재정지원을 할 수 있다.
제46조(국고보조) 보건복지가족부장관은 생명과학기술에서의 생명윤리 및 안전의 확보에 이바지할 수 있는 연구사업 및 교육의 육성·지원을 위하여 대통령령이 정하는 바에 따라 해당 단체·연구기관·생명과학관련종사자 등에게 필요한 연구비의 전부 또는 일부를 보조할 수 있다.(개정 2008.2.29)
제47조(위임 및 위탁 등)
① 보건복지가족부장관은 이 법에 의한 권한의 일부를 대통령령이 정하는 바에 따라 소속기관의 장에게 위임할 수 있다.(개정 2008.2.29)
② 보건복지가족부장관은 대통령령으로 정하는 바에 따라 다음 각 호의 어느 하나에 해당하는 업무의 일부를 관계 전문기관 또는 단체에 위탁할 수 있다.(개정 2008.6.5)
1. 제10조의2에 따른 기관위원회 평가 및 기관위원회위원에 대한 교육에 관한 업무
2. 제14조에 따른 배아생성의료기관의 관리에 관한 업무
3. 제18조에 따른 배아연구기관의 관리에 관한 업무
4. 제20조의2제1항에 따른 줄기세포주 등록에 관한 업무
5. 제24조에 따른 유전자검사기관의 관리에 관한 업무
6. 제32조에 따른 유전자은행의 관리에 관한 업무
7. 제37조에 따른 유전자치료기관의 관리에 관한 업무
③ 보건복지가족부장관은 제2항의 규정에 따라 관계 전문기관 또는 단체에게 관리업무를 하게 한 때에는 그 관리에 필요한 예산을 보조할 수 있다.(개정 2008.2.29)
제48조(비밀누설 등의 금지) 피감독기관 또는 그 종사자나 업무에 종사하였던 자는 그 직무상 알게 된 비밀을 누설하거나 도용(盜用)하여서는 아니 된다.
제9장 벌 칙
제49조(벌칙)
①제11조제1항의 규정을 위반하여 체세포복제배아를 자궁에 착상시키거나 착상된 상태를 유지 또는 출산한 자는 10년 이하의 징역에 처한다.
②제1항의 미수범은 처벌한다.
제50조(벌칙) 제12조제1항의 규정을 위반하여 인간의 배아를 동물의 자궁에 착상시키거나 동물의 배아를 인간의 자궁에 착상시킨 자 또는 동조제3항의 규정을 위반하여 동조제2항 각호의 1에 해당하는 행위로부터 생성된 배아를 인간 또는 동물의 자궁에 착상시킨 자는 5년 이하의 징역에 처한다.
제51조(벌칙)
①다음 각호의 1에 해당하는 자는 3년 이하의 징역에 처한다.(개정 2008.6.5)
1. 제11조제2항의 규정을 위반하여 체세포복제배아를 자궁에 착상시키거나 착상된 상태를 유지 또는 출산하는 행위를 유인 또는 알선한 자
2. 제12조제2항 각호의 1에 해당하는 행위를 한 자
3. 제13조제1항의 규정을 위반하여 임신외의 목적으로 배아를 생성한 자
4. 제13조제2항 각호의 1에 해당하는 행위를 한 자
5. 제13조제3항의 규정을 위반하여 금전 또는 재산상 이익 그 밖에 반대급부를 조건으로 정자 또는 난자를 제공하거나 이를 이용한 자
6. 제13조제3항을 위반하여 금전 또는 재산상의 이익, 그 밖에 반대급부를 조건으로 정자 또는 난자를 제공하도록 유인하거나 알선한 자
7. 제22조제1항의 규정을 위반하여 희귀·난치병의 치료를 위한 연구목적 외에 체세포핵이식행위를 한 자
8. 제48조의 규정을 위반하여 비밀을 누설하거나 도용한 자
②제17조의 규정을 위반하여 잔여배아를 이용한 자는 3년 이하의 징역 또는 5천만 원 이하의 벌금형에 처한다.
③제1항제1호의 미수범은 처벌한다.
제52조(벌칙) 다음 각 호 의 1에 해당하는 자는 2년 이하의 징역 또는 3천만 원 이하의 벌금에 처한다.(개정 2008.6.5)
1. 삭제(2008.6.5)
2. 제15조제1항의 규정을 위반하여 배아생성에 관한 서면동의를 얻지 아니하고 정자 또는 난자를 채취한 자
2의2. 제15조의2제1항을 위반하여 난자제공자에 대하여 건강검진을 실시하지 아니한 자
2의3. 제15조의2제2항을 위반하여 난자를 채취한 자
2의4. 제15조의3을 위반하여 난자를 채취한 자
3. 제25조의 규정을 위반하여 유전자검사를 한 자
4. 제26조제1항 내지 제3항의 규정을 위반하여 유전자검사에 관한 서면동의를 얻지 아니하고 검사대상물을 채취하거나 동의서를 첨부하지 아니하고 유전자검사를 의뢰한 자
5. 제31조제1항 또는 제2항의 규정을 위반하여 유전정보를 이용하여 다른 사람을 차별한 자 또는 다른 사람에게 유전자검사를 받기를 강요하거나 유전자검사의 결과를 제출하도록 강요한 자
6. 제34조의 규정을 위반하여 유전정보 등을 타인에게 제공함에 있어 개인정보를 포함시킨 자
7. 제35조제1항의 규정을 위반하여 유전정보 등을 정당한 사유 없이 타인에게 제공하거나 부당한 목적으로 사용한 자
8. 제36조제1항 또는 제2항의 규정을 위반하여 유전자치료를 한 자
9. 제39조의 규정에 의한 폐기명령을 위반한 자
제53조(벌칙) 다음 각 호의 1에 해당하는 자는 1년 이하의 징역 또는 2천만 원 이하의 벌금에 처한다.(개정 2008.2.29, 2008.6.5)
1. 제14조의 규정을 위반하여 배아생성의료기관으로 지정받지 아니하고 인간의 정자 또는 난자를 채취·보관하거나 배아를 생성한 자
2. 제16조제2항 또는 제3항의 규정을 위반하여(제20조제4항에서 준용하는 경우를 포함한다) 배아를 보건복지가족부령이 정하는 바에 따라 폐기하지 아니하거나 배아의 폐기에 관한 사항을 기록·보관하지 아니한 자
3. 제18조의 규정을 위반하여 배아연구기관으로 등록하지 아니하고 잔여배아를 연구한 자
4. 제19조제1항의 규정을 위반하여(제23조제2항에서 준용하는 경우를 포함한다) 보건복지가족부장관의 승인을 얻지 아니하고 배아연구를 한 자
5. 제20조제1항 또는 제3항의 규정을 위반하여 유상으로 잔여배아를 제공하거나 잔여배아의 보관 및 제공 등에 관한 사항을 보건복지가족부령이 정하는 바에 따라 보건복지가족부장관에게 보고하지 아니한 자
6. 제23조제1항의 규정을 위반하여 등록하지 아니하고 체세포복제배아를 생성하거나 연구한 자
7. 제30조제1항의 유전자검사기관등의 준수사항을 위반하거나 동조제2항의 규정을 위반하여 유전자검사에 대하여 허위표시 또는 과대광고를 한 자
8. 제32조제1항의 규정을 위반하여 허가를 받지 아니하고 유전자은행을 개설한 자
8의2. 제35조의2제1항을 위반하여 유전정보등을 익명화하여 보관·관리하지 아니한 자
9. 제40조의 규정에 의한 개선명령 등을 위반한 자
제54조(양벌규정) 법인의 대표자나 법인 또는 개인의 대리인·사용인, 그 밖의 종업원이 그 법인 또는 개인의 업무에 관하여 제49조 내지 제53조의 규정에 해당하는 위반행위를 한 때에는 그 행위자를 벌하는 외에 그 법인 또는 개인에 대하여도 해당 조의 벌금형을 과한다.
제55조(과태료)
①다음 각 호의 1에 해당하는 자는 500만 원 이하의 과태료에 처한다.(개정 2008.6.5)
1. 제20조의2제1항을 위반하여 줄기세포주를 등록하지 아니하고 해당 줄기세포주를 제공하거나 이용한 자
2. 제20조의3제3항 본문을 위반하여 줄기세포주를 유상으로 제공한 자
3. 제20조의4제1항을 위반하여 줄기세포주를 이용한 자
4. 제24조제1항·제2항 또는 제4항의 규정에 의한 신고를 하지 아니한 자
5. 제28조제2항 내지 제5항의 규정을 위반한 자
6. 제29조제1항 각호의 서류를 보존하지 아니하거나 동조제2항의 규정에 의한 기록의 열람 또는 사본의 교부를 거부한 자
7. 제32조제3항 또는 제4항의 규정에 의한 신고를 하지 아니한 자
8. 제35조제2항의 규정을 위반하여 환자의 유전정보를 포함한 기록을 환자외의 자에게 제공한 자
9. 제35조의2제2항을 위반하여 정보관리 및 보안을 담당하는 책임자를 두지 아니한 자
10. 제37조제1항의 규정을 위반하여 신고하지 아니하고 유전자치료를 한 자
② 제1항의 규정에 의한 과태료는 대통령령이 정하는 바에 따라 보건복지가족부장관이 부과·징수한다.(개정 2008.2.29)
③ 제2항의 규정에 의한 과태료처분에 불복이 있는 자는 그 처분의 고지를 받은 날부터 30일 이내에 보건복지가족부장관에게 이의를 제기할 수 있다.(개정 2008.2.29)
④ 제2항의 규정에 의한 과태료처분을 받은 자가 제3항의 규정에 따라 이의를 제기한 때에는 보건복지가족부장관은 지체없이 관할법원에 그 사실을 통보하여야 하며, 그 통보를 받은 관할법원은 비송사건절차법에 의한 과태료의 재판을 한다.(개정 2008.2.29)
⑤제3항의 규정에 의한 기간 이내에 이의를 제기하지 아니하고 과태료를 납부하지 아니한 때에는 국세체납처분의 예에 따라 이를 징수한다.
부 칙 <제7150호, 2004.1.29>
①(시행일)이 법은 2005년 1월 1일부터 시행한다. 다만 제11조, 제12조, 제49조, 제50조 및 제51조제1항제1호·제2호의 규정은 공포한 날부터 시행한다.
②(잔여배아의 연구에 관한 경과조치) 다음 각 호의 요건에 해당하는 잔여배아는 발생학적으로 원시선이 나타나기 전까지에 한하여 제17조 각호의 1의 목적으로 이용할 수 있다.
1. 이 법 시행 전에 생성되었을 것
2. 생성 후 5년이 지났을 것
3. 동의권자의 동의를 얻을 것. 다만, 소재불명 등으로 동의권자의 동의를 얻을 수 없는 경우를 제외한다.
③(체세포복제배아의 연구에 관한 경과조치) 이 법 시행 당시 제17조제2호의 규정에 의한 연구목적으로 체세포복제배아의 연구를 하고 있는 자는 다음 각 호의 요건에 해당하는 경우에는 보건복지부장관의 승인을 얻어 당해 연구를 계속할 수 있다.
1. 3년 이상 체세포복제배아에 관한 연구를 계속하였을 것
2. 관련학술지에 1회 이상 체세포복제배아에 관한 연구논문을 게재한 실적이 있을 것
④(다른 법률의 개정) 장기등이식에관한법률 중 다음과 같이 개정한다.
제2장의 제목중 “生命倫理委員會”를 “장기등이식윤리위원회”로 한다.
제7조의 제목 “(生命倫理委員會)”를 “장기등이식윤리위원회)”로 하고, 동조제1항중 “生命倫理委員會”를 “장기등이식윤리위원회”로 한다.
부 칙 (정부조직법) (제7413호, 2005.3.24)
제1조(시행일) 이 법은 공포한 날부터 시행한다. 다만, 다음 각 호의 사항은 각호의 구분에 의한 날부터 시행한다.
1. 제26조…부칙 제2조 내지 제4조의 규정은 이 법 공포 후 3월 이내에 제42조의 개정규정에 의한 여성가족부의 조직에 관한 대통령령이 시행되는 날
2. 생략
제2조 생략
제3조(다른 법률의 개정)
①내지 ⑤생략
⑥생명윤리및안전에관한법률 일부를 다음과 같이 개정한다.
제7조제3항제1호중 “여성부장관”을 “여성가족부장관”으로 한다.
⑦내지 ⑭생략
제4조 생략
부 칙 (의료법) (제8366호, 2007.4.11)
제1조(시행일) 이 법은 공포한 날부터 시행한다. (단서 생략)
제2조 내지 제19조 생략
제20조(다른 법률의 개정)
①내지 ⑧ 생략
⑨생명윤리및안전에관한법률 일부를 다음과 같이 개정한다.
제35조제2항 본문 중 “의료법 제20조제1항 단서”를 “「의료법」 제21조제1항 단서”로 한다.
⑩내지 (17) 생략
제21조 생략
부 칙 (정부조직법) <제8852호, 2008.2.29>
제1조(시행일) 이 법은 공포한 날부터 시행한다. 다만, 제31조제1항의 개정규정 중 “식품산업진흥”에 관한 부분은 2008년 6월 28일부터 시행하고, 부칙 제6조에 따라 개정되는 법률 중 이 법의 시행 전에 공포되었으나 시행일이 도래하지 아니한 법률을 개정한 부분은 각각 해당 법률의 시행일부터 시행한다.
제2조부터 제5조까지 생략
제6조(다른 법률의 개정)
①부터 (468)까지 생략
(469) 생명윤리및안전에관한법률 일부를 다음과 같이 개정한다.
제7조제3항제1호 중 “교육인적자원부장관”을 “교육과학기술부장관”으로 하고, “과학기술부장관”을 삭제하며, “산업자원부장관”은 “지식경제부장관”으로 하고, “보건복지부장관”을 “보건복지가족부장관”으로 하고, “여성가족부장관”을 “여성부장관”으로 하며, 같은 조 제5항 중 “과학기술부장관”을 “교육과학기술부장관”으로 하고, “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제9조제1항제1호 및 제2호 중 “보건복지부장관”을 각각 “보건복지가족부장관”으로 하고, 같은 항 제4호 중 “보건복지부령”을 “보건복지가족부령”으로 하며, 같은 조 제3항 중 “보건복지부장관”을 “보건복지가족부장관”으로 하고, 같은 조 제4항 중 “보건복지부령”을 “보건복지가족부령”으로 한다.
제14조제1항 중 “보건복지부장관”을 “보건복지가족부장관”으로 하고, 같은 조 제2항 및 제3항 중 “보건복지부령”을 각각 “보건복지가족부령”으로 한다.
제15조제2항제5호 및 제4항 중 “보건복지부령”을 각각 “보건복지가족부령”으로 한다.
제16조제4항 중 “보건복지부령”을 “보건복지가족부령”으로 한다.
제17조제3호를 다음과 같이 한다.
3. 그 밖에 제1호와 제2호에 준하는 연구로서 대통령령으로 정하는 연구
제18조 중 “보건복지부령”을 “보건복지가족부령”으로, “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제19조제1항 전단 중 “보건복지부장관”을 각각 “보건복지가족부장관”으로, “보건복지부령”을 “보건복지가족부령”으로 하고, 같은 조 제3항 중 “보건복지부장관”을 “보건복지가족부장관”으로 하며, 같은 조 제4항 중 “보건복지부령”을 “보건복지가족부령”으로 한다.
제20조제1항 단서 및 제2항 중 “보건복지부령”을 각각 “보건복지가족부령”으로 하고, 같은 조 제3항 중 “보건복지부령”을 “보건복지가족부령”으로, “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제21조제4호 중 “보건복지부령”을 “보건복지가족부령”으로 한다.
제23조제1항 중 “보건복지부령”을 “보건복지가족부령”으로, “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제24조제1항 본문 중 “보건복지부령”을 “보건복지가족부령”으로, “보건복지부장관”을 “보건복지가족부장관”으로 하고, 같은 조 제3항 중 “보건복지부장관”을 “보건복지가족부장관”으로, “보건복지부령”을 “보건복지가족부령”으로 하며, 같은 조 제4항 중 “보건복지부령”을 “보건복지가족부령”으로, “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제26조제1항제5호, 제2항 후단 및 제6항 중 “보건복지부령”을 각각 “보건복지가족부령”으로 한다.
제27조제3항 중 “보건복지부령”을 “보건복지가족부령”으로 한다.
제28조제5항 및 제6항 중 “보건복지부령”을 각각 “보건복지가족부령”으로 한다.
제29조제1항 각 호 외의 부분 및 제3항 중 “보건복지부령”을 각각 “보건복지가족부령”으로 한다.
제30조제1항제3호 및 제3항 중 “보건복지부령”을 각각 “보건복지가족부령”으로 한다.
제32조제1항 본문 중 “보건복지부장관”을 “보건복지가족부장관”으로 하고, 같은 조 제2항 전단 및 후단 중 “보건복지부장관”을 각각 “보건복지가족부장관”으로 하고, 같은 조 제3항 중 “보건복지부령”을 “보건복지가족부령”으로, “보건복지부장관”을 “보건복지가족부장관”으로 하며, 같은 조 제4항 중 “보건복지부령”을 “보건복지가족부령”으로, “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제33조제2항 중 “보건복지부장관”을 “보건복지가족부장관”으로 하고, 같은 조 제3항 중 “보건복지부령”을 “보건복지가족부령”으로 한다.
제34조제2항 단서 중 “보건복지부령”을 “보건복지가족부령”으로 한다.
제36조제1항제3호를 다음과 같이 한다.
3. 그 밖에 보건복지가족부장관이 정하는 질병의 예방이나 치료를 위하여 필요하다고 인정하는 경우
제37조제1항 전단 및 제2항 각 호 외의 부분 중 “보건복지부장관”을 각각 “보건복지가족부장관”으로 하고, 같은 항 제3호 및 제3항 중 “보건복지부령”을 각각 “보건복지가족부령”으로 한다.
제38조제1항 중 “보건복지부장관”을 “보건복지가족부장관”으로, “보건복지부령”을 “보건복지가족부령”으로 하고, 같은 조 제2항 전단 중 “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제39조 전단 중 “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제40조 중 “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제41조제1항 각 호 외의 부분 중 “보건복지부장관”을 “보건복지가족부장관”으로 하고, 같은 조 제2항 중 “보건복지부령”을 “보건복지가족부령”으로 한다.
제42조 중 “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제43조제1항 각 호 외의 부분 중 “보건복지부장관”을 “보건복지가족부장관”으로 하고, 같은 조 제2항 중 “보건복지부령”을 “보건복지가족부령”으로 하며, 같은 조 제3항 중 “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제44조 중 “보건복지부장관”을 “보건복지가족부장관”으로, “보건복지부령”을 “보건복지가족부령”으로 한다.
제46조 중 “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제47조제1항·제2항 각 호 외의 부분 및 제3항 중 “보건복지부장관”을 각각 “보건복지가족부장관”으로 한다.
제53조제2호 중 “보건복지부령”을 “보건복지가족부령”으로 하고, 같은 조 제4호 중 “보건복지부장관”을 “보건복지가족부장관”으로 하며, 같은 조 제5호 중 “보건복지부령”을 “보건복지가족부령”으로, “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제55조제2항부터 제4항까지 중 “보건복지부장관”을 각각 “보건복지가족부장관”으로 한다.
(470)부터 (760)까지 생략
제7조 생략
부 칙 (제9100호, 2008.6.5)
①(시행일)이 법은 공포 후 6개월이 경과한 날부터 시행한다. 다만, 제20조의2부터 제20조의4까지의 개정규정은 2010년 1월 1일부터 시행한다.
②(이미 수립되거나 수입된 줄기세포주의 등록에 관한 경과조치) 제20조의2부터 제20조의4까지의 개정규정의 시행일 전에 이미 줄기세포주를 수립하거나 수입한 자는 제20조의2의 개정규정에 따라 수립하거나 수입한 것으로 본다. 이 경우 등록신청은 2010년 6월 30일까지 하여야 한다.
부 칙 (의료법) (제9386호, 2009.1.30)
제1조(시행일) 이 법은 공포 후 1년이 경과한 날부터 시행한다. 다만, 제27조제1항, 제33조, 제43조제5항 단서, 제77조제2항 단서, 제87조제1항제2호의 개정규정 및 부칙 제4조는 공포한 날부터 시행하고, 제27조제3항·제4항, 제27조의2, 제56조, 제63조(제27조의2제1항·제2항·제3항·제5항의 개정규정을 위반한 경우에 대한 시정명령에 한한다) 및 제88조의 개정규정은 공포 후 3개월이 경과한 날부터 시행하며, 제3조의5의 개정규정은 공포 후 2년이 경과한 날부터 시행한다.
제2조부터 제5조까지 생략
제6조(다른 법률의 개정)
①부터 ⑤까지 생략
⑥ 생명윤리 및 안전에 관한 법률 일부를 다음과 같이 개정한다.
제35조제2항 본문 중 “「의료법」 제21조제1항 단서”를 “「의료법」 제21조제2항”으로 한다.
⑦부터 ⑫까지 생략
제7조 생략
생명연구자원의 확보·관리 및 활용에 관한 법률
[제정 2009.5.8 법률 제9639호]
제1장 총 칙
제1조(목적) 이 법은 생명연구자원의 효율적인 확보와 체계적인 관리를 통하여 지속가능한 활용을 도모하고 생명공학의 발전 기반을 조성함으로써 국민의 삶의 질 향상과 국가경제 발전에 기여하는 것을 목적으로 한다.
제2조(정의) 이 법에서 사용하는 용어의 뜻은 다음과 같다.
1. “생명연구자원”이란 생명공학연구의 기반이 되는 자원으로서 산업적으로 유용한 동물, 식물, 미생물, 인체유래 연구자원 등 생물체의 실물(實物)과 정보를 말한다.
2. “국가연구개발사업”이란 「과학기술기본법」 제11조에 따른 국가연구개발사업을 말한다.
3. “연구기관”이란 다음 각 목의 연구기관을 말한다.
가. 국공립 연구기관
나. 「특정연구기관 육성법」의 적용을 받는 연구기관
다. 「과학기술분야 정부출연연구기관 등의 설립·운영 및 육성에 관한 법률」에 따라 설립된 연구기관
라. 「기술개발촉진법」 제7조제1항제2호에 따른 기업부설연구소
마. 「산업기술연구조합 육성법」에 따른 산업기술연구조합
제3조(국가 등의 책무)
① 국가와 지방자치단체는 생명연구자원의 효율적인 확보·관리 및 활용을 위하여 노력하여야 한다.
② 다음 각 호의 기관 등은 생명연구자원의 확보·관리 및 활용에 관하여 국가와 지방자치단체가 수행하는 업무에 적극 협력하여야 한다.
1. 국가연구개발사업을 수행하는 「고등교육법」 제2조에 따른 학교
2. 국가연구개발사업을 수행하는 연구기관
3. 그 밖에 생명연구자원을 관리·이용하는 자
제4조(다른 법률과의 관계) 생명연구자원의 확보·관리 및 활용에 관하여 다른 법률에 특별한 규정이 있는 경우 외에는 이 법에서 정하는 바에 따른다.
제2장 생명연구자원의 관리 등
제5조(생명연구자원 관리의 기본원칙)
① 관계 중앙행정기관의 장은 소관 분야의 생명연구자원과 국가연구개발사업의 연구 결과 생산된 생명연구자원을 관리한다.
② 교육과학기술부장관은 제1항에 따라 관계 중앙행정기관이 관리하는 생명연구자원에 관한 정보를 종합적으로 관리한다.
제6조(기본시책의 마련) 정부는 이 법의 목적을 효율적으로 달성하기 위하여 생명연구자원의 확보·관리 및 활용을 도모하기 위한 다음 각 호의 시책을 마련하여야 한다.
1. 교육과학기술부장관은 생명연구자원의 통합정보시스템 구축 및 통계 유지와 소관 분야의 생명연구자원의 확보·관리 및 활용체제를 조성하고 생명연구자원 분야의 전문인력 양성 및 기초 연구를 지원한다.
2. 농림수산식품부장관은 농업·수산업 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 이를 지원한다.
3. 지식경제부장관은 산업 분야 생명연구자원의 확보·관리 및 활용체계를 조성하고 생명연구자원의 산업적 활용 및 생명연구자원의 관리와 활용을 위한 정보통신기술의 확보를 지원한다.
4. 보건복지가족부장관은 보건·의료 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 이를 지원한다.
5. 환경부장관은 야생생물 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 이를 지원한다.
6. 국토해양부장관은 해양 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 이를 지원한다.
제7조(생명연구자원 관리 기본계획의 수립·시행 등)
① 정부는 생명연구자원의 활용촉진과 정보관리를 위하여 5년마다 생명연구자원 관리 기본계획(이하 “기본계획”이라 한다)을 수립·시행하여야 한다.
② 기본계획에는 다음 각 호의 사항이 포함되어야 한다.
1. 생명연구자원의 확보·관리 및 활용의 기본방향
2. 생명연구자원의 조사, 연구, 개발 및 확보
3. 생명연구자원의 보존·관리 및 활용
4. 생명연구자원 관련 인프라의 구축
5. 생명연구자원 정보유통체계 구축
6. 생명연구자원의 확보·관리 및 활용을 위한 투자의 확대
7. 생명연구자원 전문인력 양성
8. 그 밖에 생명연구자원 분야의 육성 및 관리 등에 필요한 사항
③ 관계 중앙행정기관의 장은 제2항 각 호의 사항에 대하여 소관 분야별로 계획을 세우고 이를 교육과학기술부장관에게 통보하여야 한다.
④ 교육과학기술부장관은 제3항에 따라 통보받은 관계 중앙행정기관의 계획을 종합하여 기본계획안을 작성하고 「과학기술기본법」 제9조제1항에 따른 국가과학기술위원회의 심의를 거쳐 이를 확정한다.
⑤ 관계 중앙행정기관의 장은 기본계획에 따라 연도별 시행계획을 수립·시행하여야 한다.
⑥ 기본계획과 시행계획의 수립·시행에 필요한 사항은 대통령령으로 정한다.
제8조(생명연구자원 기탁등록보존기관의 지정 등)
① 관계 중앙행정기관의 장은 생명연구자원 기탁등록보존기관을 지정할 수 있다.
② 제1항에 따라 지정된 생명연구자원 기탁등록보존기관(이하 “기탁등록보존기관”이라 한다)은 다음 각 호의 업무를 수행한다.
1. 생명연구자원의 수탁, 등록 및 평가
2. 생명연구자원의 보존과 관리
3. 생명연구자원 정보시스템의 구축과 운영
4. 소관 정보시스템, 제10조제2항제2호에 따른 정보시스템 및 제11조제2항제1호에 따른 통합정보시스템 간의 상호 연계
5. 국내외 생명연구자원 관련 기관과의 협력
6. 그 밖에 생명연구자원의 관리와 활용 등에 필요한 사항
③ 기탁등록보존기관은 생명연구자원의 안정적 보존을 위하여 복수의 시설에서 생명연구자원을 보존 및 관리할 수 있다.
④ 정부는 기탁등록보존기관의 운영에 필요한 경비의 전부 또는 일부를 지원할 수 있다.
⑤ 기탁등록보존기관의 지정기준과 운영 등에 필요한 사항은 대통령령으로 정한다.
제9조(기탁 및 등록 등)
① 생명연구자원을 관리·이용하고 있는 자는 기탁등록보존기관에 생명연구자원을 기탁·등록할 수 있다.
② 국가연구개발사업을 수행한 자는 사업수행 결과에 따라 생산된 생명연구자원을 기탁등록보존기관에 기탁·등록하여야 한다. 다만, 대통령령으로 정하는 사유로서 관계 중앙행정기관의 장이 인정하는 경우에는 그러하지 아니하다.
③ 정부는 제2항에 따른 생명연구자원의 기탁 및 등록실적을 해당 사업의 평가 등에 반영할 수 있다.
④ 생명연구자원의 기탁 및 등록의 방법 등에 필요한 사항은 대통령령으로 정한다.
제10조(책임기관 및 생명연구자원정보센터의 지정 등)
① 관계 중앙행정기관의 장은 기탁등록보존기관 중에서 다음 각 호의 업무를 수행하는 기관을 책임기관으로 지정할 수 있다.
1. 기탁등록보존기관의 관리
2. 기탁등록보존기관 간의 정보 교류
② 관계 중앙행정기관의 장은 필요한 경우 소관 분야의 생명연구자원의 관리와 유통을 촉진하기 위하여 다음 각 호의 업무를 수행하는 생명연구자원정보센터를 지정할 수 있다.
1. 소관 분야의 생명연구자원과 관련된 정보의 수집
2. 소관 분야의 생명연구자원 정보시스템의 구축과 운영
3. 그 밖에 소관 분야의 생명연구자원의 관리와 유통에 필요한 사항
③ 관계 중앙행정기관의 장은 제2항에 따라 지정된 생명연구자원정보센터(이하 “생명연구자원정보센터”라 한다)와 제11조제1항에 따른 국가생명연구자원정보센터 간의 정보유통을 촉진하여야 한다.
④ 정부는 제1항에 따라 지정된 책임기관(이하 “책임기관”이라 한다)과 생명연구자원정보센터의 운영에 필요한 경비의 전부 또는 일부를 지원할 수 있다.
⑤ 책임기관과 생명연구자원정보센터의 지정기준과 운영 등에 필요한 사항은 대통령령으로 정한다.
제11조(국가생명연구자원정보센터의 지정 등)
① 교육과학기술부장관은 관계 중앙행정기관이 관리하는 생명연구자원의 통합적 관리와 유통을 위하여 국가생명연구자원정보센터를 지정할 수 있다.
② 제1항에 따라 지정된 국가생명연구자원정보센터(이하 “국가생명연구자원정보센터”라 한다)는 다음 각 호의 업무를 수행한다.
1. 생명연구자원 통합정보시스템의 구축과 운영
2. 생명연구자원과 관련된 정보의 분석 및 제공
3. 생명연구자원과 관련된 자동화시스템의 설계, 개발, 구축과 관리
4. 생명연구자원과 관련된 연구기관 및 기탁등록보존기관의 정보관리 지원 및 교육
5. 국내외 생명연구자원 정보관리기관과의 협력
6. 그 밖에 생명연구자원의 통합적 관리와 유통에 필요한 사항
③ 교육과학기술부장관은 관계 중앙행정기관의 장 및 지방자치단체의 장에게 생명연구자원과 관련된 정보 및 현황 등 생명연구자원의 관리에 필요한 자료 등에 관하여 협조를 요청할 수 있다.
④ 정부는 국가생명연구자원정보센터의 운영에 필요한 경비의 전부 또는 일부를 지원할 수 있다.
⑤ 국가생명연구자원정보센터의 지정기준과 운영 등에 필요한 사항은 대통령령으로 정한다.
제12조(지정의 취소 등)
① 관계 중앙행정기관의 장은 기탁등록보존기관, 책임기관 또는 생명연구자원정보센터의 지정을 받은 자가 다음 각 호의 어느 하나에 해당하는 경우에는 지정을 취소하거나 6개월 이내의 기간을 정하여 사업의 정지를 명할 수 있다. 다만, 제1호에 해당하는 경우에는 그 지정을 취소하여야 한다.
1. 거짓이나 그 밖의 부정한 방법으로 지정을 받은 경우
2. 제8조제5항 또는 제10조제5항에 따른 지정기준을 충족하지 못하게 된 경우
② 교육과학기술부장관은 국가생명연구자원정보센터의 지정을 받은 자가 다음 각 호의 어느 하나에 해당하는 경우에는 지정을 취소하거나 6개월 이내의 기간을 정하여 사업의 정지를 명할 수 있다. 다만, 제1호에 해당하는 경우에는 그 지정을 취소하여야 한다.
1. 거짓이나 그 밖의 부정한 방법으로 지정을 받은 경우
2. 제11조제5항에 따른 지정기준을 충족하지 못하게 된 경우
③ 제1항 및 제2항에 따른 처분의 기준과 절차 등에 필요한 사항은 대통령령으로 정한다.
제3장 생명연구자원 관련 분야의 육성
제13조(관련 기관의 육성·지원) 정부는 생명연구자원의 확보·관리 및 활용을 촉진하기 위하여 생명연구자원의 연구, 기탁, 등록 또는 보존 등의 업무를 수행하는 기관 또는 단체 등을 육성·지원하여야 한다.
제14조(투자재원의 마련) 정부는 생명연구자원의 확보·관리 및 활용을 위한 시책을 추진하는 데에 필요한 투자재원을 지속적이고 안정적으로 마련하기 위하여 노력하여야 한다.
제15조(전문인력의 양성) 정부는 생명연구자원의 효과적인 확보·관리 및 활용에 필요한 전문인력을 체계적으로 양성하기 위하여 다음 각 호의 시책을 마련하여야 한다.
1. 생명연구자원 분야의 중·장기 전문인력 양성
2. 전문인력 교육프로그램의 확보 및 보급 지원
제16조(공동연구의 지원 등)
① 정부는 생명연구자원의 효율적인 확보·관리 및 활용을 위하여 산업계, 학계, 연구기관 간의 공동연구 및 관련 학술활동을 지원하여야 한다.
② 정부는 외국 및 국제기구 등과 생명연구자원의 확보·관리 및 활용에 관한 기술협력, 정보교환, 공동조사, 연구 등 효율적인 국제협력의 증진을 촉진하기 위하여 적극 노력하여야 한다.
제17조(생명연구자원의 활용)
① 정부는 국민이 생명연구자원에 대한 연구개발 및 산업화를 위하여 생명연구자원을 적극적으로 활용할 수 있도록 필요한 시책을 마련하여야 한다.
② 정부는 산업계, 학계, 연구기관이 필요한 생명연구자원을 효과적으로 활용할 수 있도록 홍보 및 교육 등의 시책을 추진하여야 한다.
제18조(생명연구자원의 정보유통)
① 관계 중앙행정기관의 장은 소관 분야의 생명연구자원과 관련된 정보를 디지털화된 형태로 수집·확보할 수 있도록 필요한 시책을 마련하여야 한다.
② 정부는 생명연구자원의 효율적인 관리와 유통을 촉진하기 위하여 생명연구자원과 관련된 정보의 수집·보존 및 전송에 관한 표준화를 추진하여야 한다.
제19조(통계간행물의 발간 등)
① 교육과학기술부장관은 생명연구자원의 종류와 보유기관 등 생명연구자원의 현황이 파악될 수 있도록 관계 중앙행정기관의 장 및 통계청장과의 협의를 거쳐 매년 통계간행물을 발간·보급하여야 한다.
② 교육과학기술부장관은 제1항에 따른 통계간행물의 발간을 위하여 관계 중앙행정기관의 장에게 필요한 자료를 제출하도록 요청할 수 있다.
제4장 보 칙
제20조(청문) 관계 중앙행정기관의 장과 교육과학기술부장관은 제12조제1항 또는 제2항에 따라 기탁등록보존기관, 책임기관, 생명연구자원정보센터 또는 국가생명연구자원정보센터의 지정을 취소하려면 청문을 하여야 한다.
제21조(위임 및 위탁)
① 이 법에 따른 관계 중앙행정기관의 장과 교육과학기술부장관의 권한은 그 일부를 대통령령으로 정하는 바에 따라 특별시장·광역시장·도지사·특별자치도지사, 시장·군수·구청장(자치구의 구청장을 말한다) 또는 소속 기관의 장에게 위임할 수 있다.
② 이 법에 따른 관계 중앙행정기관의 장과 교육과학기술부장관의 업무는 그 일부를 대통령령으로 정하는 바에 따라 관련 법인·단체에 위탁할 수 있다.
부 칙 (제9639호, 2009.5.8)
이 법은 공포 후 6개월이 경과한 날부터 시행한다.
실험동물에 관한 법률
[제정 2008.3.28 법률 제9025호]
제1장 총 칙
제1조(목적) 이 법은 실험동물 및 동물실험의 적절한 관리를 통하여 동물실험에 대한 윤리성 및 신뢰성을 높여 생명과학 발전과 국민보건 향상에 이바지함을 목적으로 한다.
제2조(정의) 이 법에서 사용하는 용어의 정의는 다음과 같다.
1. “동물실험”이란 교육·시험·연구 및 생물학적 제제(製劑)의 생산 등 과학적 목적을 위하여 실험동물을 대상으로 실시하는 실험 또는 그 과학적 절차를 말한다.
2. “실험동물”이란 동물실험을 목적으로 사용 또는 사육되는 척추동물을 말한다.
3. “재해”란 동물실험으로 인한 사람과 동물의 감염, 전염병 발생, 유해물질 노출 및 환경오염 등을 말한다.
4. “동물실험시설”이란 동물실험 또는 이를 위하여 실험동물을 사육하는 시설로서 대통령령으로 정하는 것을 말한다.
5. “실험동물생산시설”이란 실험동물을 생산 및 사육하는 시설을 말한다.
6. “운영자”란 동물실험시설 혹은 실험동물생산시설을 운영하는 자를 말한다.
제3조(적용 대상) 이 법은 다음 각 호의 어느 하나에 필요한 실험에 사용되는 동물과 그 동물실험시설의 관리 등에 적용한다.
1. 식품·건강기능식품·의약품·의약외품·생물의약품·의료기기·화장품의 개발·안전관리·품질관리
2. 마약의 안전관리·품질관리
제4조(다른 법률과의 관계) 실험동물의 사용 또는 관리에 관하여 이 법에서 규정한 것을 제외하고는 「동물보호법」으로 정하는 바에 따른다.
제5조(식품의약품안전청의 책무)
① 식품의약품안전청장은 제1조의 목적을 달성하기 위하여 다음 각 호의 사항을 수행하여야 한다.
1. 실험동물의 사용 및 관리에 관한 정책의 수립 및 추진
2. 동물실험시설의 설치·운영에 관한 지원
3. 동물실험시설 내에서 실험동물의 유지·보존 및 개발에 관한 지원
4. 실험동물의 품질향상 등을 위한 연구 지원
5. 실험동물 관련 정보의 수집·관리 및 교육에 대한 지원
6. 동물실험을 대체할 수 있는 방법의 개발·인정에 관한 정책의 수립 및 추진
7. 그 밖에 실험동물의 사용과 관리에 필요한 사항
② 제1항을 수행하기 위하여 필요한 사항은 보건복지가족부령으로 정한다.
제2장 실험동물의 과학적 사용
제6조(동물실험시설 운영자의 책무) 동물실험시설의 운영자는 동물실험의 안전성 및 신뢰성 등을 확보하기 위하여 다음 각 호의 사항을 수행하여야 한다.
1. 실험동물의 과학적 사용 및 관리에 관한 지침 수립
2. 동물실험을 수행하는 자 및 종사자에 대한 교육
3. 동물실험을 대체할 수 있는 방법의 우선적 고려
4. 동물실험의 폐기물 등의 적절한 처리 및 작업자의 안전에 관한 계획 수립
제7조(실험동물운영위원회 설치 등)
① 동물실험시설에는 동물실험의 윤리성, 안전성 및 신뢰성 등을 확보하기 위하여 실험동물운영위원회를 설치·운영하여야 한다.
② 제1항의 실험동물운영위원회의 기능 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
제3장 동물실험시설 등
제8조(동물실험시설의 등록)
① 동물실험시설을 설치하고자 하는 자는 식품의약품안전청장에게 등록하여야 한다. 등록사항을 변경하는 경우에도 또한 같다.
② 동물실험시설에는 해당 시설 및 실험동물의 관리를 위하여 대통령령으로 정하는 자격요건을 갖춘 관리자(이하 “관리자”라 한다)를 두어야 한다.
③ 제1항에 따른 등록기준 및 절차 등에 관하여 필요한 사항은 보건복지가족부령으로 정한다.
제9조(실험동물의 사용 등)
① 동물실험시설에서 대통령령으로 정하는 실험동물을 사용하는 경우에는 동물실험시설 또는 제15조제1항에 따른 우수실험동물생산시설에서 생산된 실험동물을 우선적으로 사용하도록 노력하여야 한다.
② 외국으로부터 수입된 실험동물을 사용하고자 하는 경우에는 보건복지가족부령으로 정하는 기준에 적합한 실험동물을 사용하여야 한다.
제10조(우수동물실험시설의 지정)
① 식품의약품안전청장은 실험동물의 적절한 사용 및 관리를 위하여 적절한 인력 및 시설을 갖추고 운영상태가 우수한 동물실험시설을 우수동물실험시설로 지정할 수 있다. 이 경우 지정기준, 지정사항 변경 등에 관한 사항은 보건복지가족부령으로 정한다.
② 제1항에 따른 우수동물실험시설로 지정받고자 하는 자는 보건복지가족부령으로 정하는 바에 따라 지정신청을 하여야 한다.
③ 식품의약품안전청장은 실험동물을 사용하는 관련 사업자 또는 연구 용역을 수행하는 자에게 제1항에 따라 지정된 우수동물실험시설에서 그 업무를 수행하도록 권고할 수 있다.
제11조(동물실험시설 등에 대한 지도·감독)
① 제8조 또는 제10조에 따라 동물실험시설로 등록 또는 우수동물실험시설로 지정 받은 자는 식품의약품안전청장의 지도·감독을 받아야 한다.
② 제1항에 따른 지도·감독의 내용·대상·시기·기준 등에 관하여 필요한 사항은 식품의약품안전청장이 정한다.
제4장 실험동물의 공급 등
제12조(실험동물공급자의 등록)
① 대통령령으로 정하는 실험동물의 생산·수입 또는 판매를 업으로 하고자 하는 자(이하 “실험동물공급자”라 한다)는 보건복지가족부령으로 정하는 바에 따라 식품의약품안전청장에게 등록하여야 한다. 다만, 제8조의 동물실험시설에서 유지 또는 연구 과정 중 생산된 실험동물을 공급하는 경우에는 그러하지 아니하다.
② 제1항에 따른 등록사항을 변경하고자 할 때에는 보건복지가족부령으로 정하는 바에 따라 변경등록을 하여야 한다.
제13조(실험동물공급자의 준수사항) 실험동물공급자는 실험동물의 안전성 및 건강을 확보하기 위하여 다음 각 호의 사항을 준수하여야 한다.
1. 실험동물생산시설과 실험동물을 보건위생상 위해(危害)가 없고 안전성이 확보되도록 관리할 것
2. 실험동물을 운반하는 경우 그 실험동물의 생태에 적합한 방법으로 운송할 것
3. 그 밖에 제1호 및 제2호에 준하는 사항으로서 실험동물의 안전성 확보 및 건강관리를 위하여 필요하다고 인정하여 보건복지가족부령으로 정하는 사항
제14조(실험동물 수입에 관한 사항) 실험동물의 수입과 검역에 관하여는 「가축전염병예방법」 제32조, 제34조, 제35조 및 제36조의 규정에 따른다.
제15조(우수실험동물생산시설의 지정 등)
① 식품의약품안전청장은 실험동물의 품질을 향상시키기 위하여 충분한 인력 및 시설을 갖추고 관리상태가 우수한 실험동물생산시설을 우수실험동물생산시설로 지정할 수 있다. 이 경우 지정기준, 지정사항 변경 등에 관한 사항은 보건복지가족부령으로 정한다.
② 제1항에 따른 우수실험동물생산시설로 지정받고자 하는 자는 보건복지가족부령으로 정하는 바에 따라 지정신청을 하여야 한다.
③ 제1항에 따라 우수실험동물생산시설로 지정된 경우가 아니면 실험동물의 운송용기나 문서 등에 우수실험동물생산시설 또는 이와 유사한 표지를 부착하거나 이를 홍보하여서는 아니 된다.
제16조(실험동물공급자 등에 대한 지도·감독)
① 제12조에 따라 실험동물공급자로 등록하거나 제15조에 따라 우수실험동물생산시설로 지정받은 자는 식품의약품안전청장의 지도·감독을 받아야 한다.
② 제1항에 따른 지도·감독의 대상·시기·기준 등에 관하여 필요한 사항은 식품의약품안전청장이 정한다.
제5장 안전관리 등
제17조(교육)
① 다음 각 호의 자는 실험동물의 사용·관리 등에 관하여 교육을 받아야 한다.
1. 제8조제1항에 따른 동물실험시설 설치자
2. 제8조제2항에 따른 관리자
3. 제12조에 따른 실험동물공급자
4. 그 밖에 동물실험을 수행하는 자
② 식품의약품안전청장은 제1항에 따른 교육을 수행하여야 하며, 교육 위탁기관, 교육내용, 소요경비의 징수 등에 관하여 필요한 사항은 보건복지가족부령으로 정한다.
제18조(재해 방지)
① 동물실험시설의 운영자 또는 관리자는 재해를 유발할 수 있는 물질 또는 병원체 등을 사용하는 동물실험을 실시하는 경우 사람과 동물에 위해를 주지 아니하도록 필요한 조치를 취하여야 한다.
② 동물실험시설 및 실험동물생산시설로 인한 재해가 국민 건강과 공익에 유해하다고 판단되는 경우 운영자 또는 관리자는 즉시 폐쇄, 소독 등 필요한 조치를 취한 후 그 결과를 식품의약품안전청장에게 보고하여야 한다. 이 경우 「가축전염병예방법」 제19조를 준용한다.
③ 동물실험 및 실험동물로 인한 재해가 국민 건강과 공익에 유해하다고 판단되는 경우 운영자 또는 관리자는 살처분 등 필요한 조치를 취한 후 그 결과를 식품의약품안전청장에게 보고하여야 한다. 이 경우 「가축전염병예방법」 제20조를 준용한다.
제19조(생물학적 위해물질의 사용보고)
① 동물실험시설의 운영자는 보건복지가족부령으로 정하는 생물학적 위해물질을 동물실험에 사용하고자 하는 경우 미리 식품의약품안전청장에게 보고하여야 한다.
② 제1항의 보고에 관한 사항은 보건복지가족부령으로 정한다.
제20조(사체 등 폐기물)
① 동물실험시설의 운영자 및 관리자 또는 실험동물공급자는 해당 시설에서 나온 실험동물의 사체가 외부에 유출되어 재이용되거나 재해가 발생되지 아니하도록 처리하여야 한다.
② 동물실험시설과 실험동물생산시설에서 배출된 실험동물의 사체 등의 폐기물은 「폐기물관리법」에 따라 처리한다.
제6장 기록 및 정보의 공개
제21조(기록) 동물실험을 수행하는 자는 보건복지가족부령으로 정하는 바에 따라 실험동물의 종류, 사용량, 수행된 연구의 절차, 연구에 참여한 자에 대하여 기록하여야 한다.
제22조(동물실험 실태보고)
① 식품의약품안전청장은 동물실험에 관한 실태보고서를 매년 작성하여 발표하여야 한다.
② 제1항에 따른 실태보고서에는 다음 각 호의 사항이 포함되어야 한다.
1. 동물실험에 사용된 실험동물의 종류 및 수
2. 동물실험 후의 실험동물의 처리
3. 동물실험시설 및 실험동물공급시설의 종류 및 수
4. 제11조에 따른 동물실험시설 등에 대한 지도·감독에 관한 사항
5. 제18조에 따른 재해유발 물질 또는 병원체 등의 사용에 관한 사항
6. 제19조에 따른 위해물질의 사용에 관한 사항
7. 제24조에 따른 지정취소 등에 관한 사항
8. 그 밖에 보건복지가족부령으로 정하는 사항
제7장 보 칙
제23조(실험동물협회)
① 동물실험의 신뢰성 증진 및 실험동물산업의 건전한 발전을 위하여 실험동물협회(이하 “협회”라 한다)를 둘 수 있다.
② 협회는 법인으로 한다.
③ 다음 각 호에 해당하는 자는 협회의 회원이 될 수 있다.
1. 제8조제1항에 따른 등록을 한 자
2. 제8조제2항에 의한 관리자
3. 실험동물분야에 관한 지식과 기술이 있는 자 중 협회의 정관으로 정하는 자
④ 협회를 설립하고자 하는 경우에는 대통령령으로 정하는 바에 따라 정관을 작성하여 식품의약품안전청장의 설립인가를 받아야 한다.
⑤ 협회의 정관 기재 사항과 업무에 관하여 필요한 사항은 대통령령으로 정한다.
⑥ 협회에 관하여 이 법에 규정되지 아니한 사항은 「민법」 중 사단법인에 관한 규정을 준용한다.
⑦ 국가는 협회가 제1항에 따라 사업을 하는 때에 필요하다고 인정하는 경우 재정 등의 지원을 할 수 있다.
제24조(지정 등의 취소 등)
① 식품의약품안전청장은 제8조 또는 제12조에 따라 동물실험시설 또는 실험동물공급자로 등록한 자가 다음 각 호의 어느 하나에 해당하는 때에는 해당 시설 또는 공급자의 등록을 취소하거나 6개월 이내의 범위에서 시설의 운영 또는 영업을 정지할 수 있다.
1. 속임수나 그 밖의 부정한 방법으로 등록한 것이 확인된 경우
2. 동물실험시설로부터 또는 실험동물공급과 관련하여 국민의 건강 또는 공익을 해하는 질병 등 재해가 발생한 경우
3. 제11조 또는 제16조에 따른 지도·감독을 따르지 아니하거나 기준에 미달한 경우
② 식품의약품안전청장은 제10조 또는 제15조에 따라 우수동물실험시설 또는 우수실험동물생산시설로 지정을 받은 자가 다음 각 호의 어느 하나에 해당하는 때에는 그 지정을 취소하거나 또는 6개월 이내의 범위에서 시설의 운영을 정지할 수 있다.
1. 속임수나 그 밖의 부정한 방법으로 지정을 받은 것이 확인된 경우
2. 우수동물실험시설 또는 우수실험동물생산시설로부터 국민의 건강 또는 공익을 해하는 질병 등 재해가 발생한 경우
3. 제11조 또는 제16조에 따른 지도·감독을 따르지 아니하거나 기준에 미달한 경우
③ 제1항 및 제2항에 따른 처분의 기준은 보건복지가족부령으로 정한다.
제25조(결격사유) 다음 각 호의 어느 하나에 해당하는 자는 동물실험시설의 운영자 또는 관리자 및 실험동물공급자가 될 수 없다.
1. 「정신보건법」제3조제1호에 따른 정신질환자. 다만, 전문의가 운영자 또는 관리자로서 적합하다고 인정하는 사람은 그러하지 아니하다.
2. 금치산자·한정치산자로서 복권되지 아니한 자
3. 마약이나 그 밖의 유독물질의 중독자
4. 이 법을 위반하여 금고 이상의 실형을 선고받고, 집행이 종료(집행이 종료된 것으로 보는 경우를 포함한다)되거나 집행이 면제된 날부터 2년이 지나지 아니한 자
5. 이 법을 위반하여 금고 이상의 형의 집행유예 선고를 받고 그 유예기간 중에 있는 자
6. 제24조제1항에 따라 시설의 운영정지를 받거나 등록이 취소된 후 2년이 지나지 아니한 자
제26조(청문) 식품의약품안전청장은 제24조에 따라 해당 시설의 등록 취소, 운영정지, 지정 취소 등을 하고자 하는 때에는 미리 청문을 실시하여야 한다.
제27조(지도·감독 등)
① 식품의약품안전청장은 제11조 및 제16조에 따른 지도 및 감독을 위하여 관계 공무원으로 하여금 현장조사를 하게 하거나 필요한 자료의 제출을 요구할 수 있다.
② 제1항에 따라 조사를 하는 공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 제시하여야 한다.
제28조(과징금)
① 식품의약품안전청장은 시설의 운영자가 제24조에 해당하는 경우에는 해당 시설의 운영정지에 갈음하여 5천만 원 이하의 과징금을 부과할 수 있다.
② 제1항에 따라 과징금을 부과하는 위반행위의 정도 등에 따른 과징금의 금액 등에 관하여 필요한 사항은 대통령령으로 정한다.
③ 식품의약품안전청장은 제1항에 따른 과징금을 기한 이내에 납부하지 아니한 때에는 국세 체납처분의 예에 따라 징수한다.
제29조(수수료) 다음 각 호의 어느 하나에 해당하는 자는 보건복지가족부령으로 정하는 바에 따라 수수료를 납부하여야 한다.
1. 제8조에 따른 등록 또는 제10조에 따른 지정을 받고자 하는 자
2. 제12조에 따른 등록 또는 제15조에 따른 지정을 받고자 하는 자
제30조(벌칙) 제12조제1항 또는 제2항을 위반하여 등록 또는 변경등록을 하지 아니한 자는 500만 원 이하의 벌금에 처한다.
제31조(벌칙) 제27조제1항에 따른 현장조사를 정당한 사유 없이 거부·기피·방해한 자 또는 자료제출 요구에 응하지 아니하거나 거짓의 자료를 제출한 자는 200만 원 이하의 벌금에 처한다.
제32조(양벌규정) 법인의 대표자나 법인 또는 개인의 대리인·사용인 및 그 밖의 종업원이 그 법인 또는 개인의 업무에 대하여 제31조에 해당하는 행위를 한 때에는 행위자를 벌하는 외에 그 법인 또는 개인에 대하여도 각 해당 조의 벌금형을 과한다.
제33조(과태료)
① 다음 각 호의 어느 하나에 해당하는 자에게는 100만 원 이하의 과태료를 부과한다.
1. 제8조에 따른 등록을 하지 아니한 자
2. 제15조제3항을 위반하여 우수실험동물생산시설 또는 이와 유사한 표지를 부착하거나 이를 홍보한 자
3. 제17조제1항을 위반하여 교육을 받지 아니한 동물실험시설 설치자, 관리자 또는 실험동물공급자
4. 제18조제2항 및 제3항 또는 제19조제1항에 따른 보고를 하지 아니하거나 거짓으로 보고한 자
② 제1항에 따른 과태료는 대통령령으로 정하는 바에 따라 식품의약품안전청장이 부과·징수한다.
③ 제2항에 따른 과태료 처분에 불복하는 자는 30일 이내에 식품의약품안전청장에게 이의를 제기할 수 있다.
④ 제2항에 따라 과태료 처분을 받은 자가 제3항에 따라 이의를 제기한 때에는 식품의약품안전청장은 지체 없이 관할 법원에 그 사실을 통보하여야 하며, 그 통보를 받은 관할 법원은 「비송사건절차법」에 따른 과태료 재판을 한다.
⑤ 제3항에 따른 기간 이내에 이의를 제기하지 아니하고 과태료를 납부하지 아니한 때에는 국세 체납처분의 예에 따라 징수한다.
부 칙 <제9025호, 2008.3.28>
①(시행일)이 법은 공포 후 1년이 경과한 날부터 시행한다.
②(동물실험시설 운영자에 대한 경과조치) 이 법 시행 당시 동물실험시설을 설치·운영하는 자는 이 법에 따른 운영자로 본다. 이 경우 이 법 시행 후 1년 이내에 제8조에 따라 등록하여야 한다.
③(실험동물공급자에 대한 경과조치) 이 법 시행 당시 실험동물을 공급하는 자는 이 법에 따른 실험동물공급자로 본다. 이 경우 이 법 시행 후 1년 이내에 제12조에 따라 등록하여야 한다.
뇌연구촉진법
[(타)일부개정 2008.6.5 법률 제9089호]
제1조(목적) 이 법은 뇌연구 촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성·발전시키고 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 기여함을 목적으로 한다.
제2조(정의) 이 법에서 사용하는 용어의 정의는 다음과 같다.(개정 2001.1.29, 2008.2.29)
1. “뇌연구”라 함은 뇌과학, 뇌의약학, 뇌공학 및 이와 관련된 모든 분야에 대한 연구를 말한다.
2. “뇌과학”이라 함은 뇌의 신경생물학적 구조 및 인지, 사고, 언어심리 및 행동 등의 고등신경 정신활동에 대한 포괄적인 이해를 위한 기초 학문을 말한다.
3. “뇌의약학”이라 함은 뇌의 구조 및 기능상의 결함과 뇌의 노화 등에 기인한 신체적·정신적 질환 및 장애에 대한 원인 규명과 이의 치료, 예방 등에 관한 학문을 말한다.
4. “뇌공학”이라 함은 뇌의 고도의 지적 정보처리 구조와 기능을 이해하고 이의 공학적 응용을 위한 이론 및 기술에 관한 학문을 말한다.
5. “관계중앙행정기관”이라 함은 교육과학기술부, 지식경제부, 보건복지가족부를 말한다.
제3조(적용범위) 뇌연구에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 의한다.
제4조(정부 등의 책무)
①정부는 뇌연구 촉진을 지원하기 위한 시책을 강구하고, 이를 적극적으로 추진하여야 한다.
②대학·연구기관·기업 및 개인 등 뇌연구를 수행하는 자는 제1항의 규정에 의한 시책에 적극 협력하여야 한다.
제5조(뇌연구촉진기본계획의 수립)
① 관계중앙행정기관의 장은 소관별로 뇌연구 촉진을 위한 계획과 전년도 추진실적을 교육과학기술부장관에게 제출하여야 한다.(개정 2008.2.29)
② 교육과학기술부장관은 제1항의 규정에 의하여 관계중앙행정기관의 장이 제출한 소관사항에 관한 뇌연구 촉진을 위한 계획을 종합·조정한 후 제7조의 규정에 의한 뇌연구촉진심의회의 심의를 거쳐 뇌연구촉진기본계획(이하 “기본계획”이라 한다)을 수립하고, 이를 관계중앙행정기관의 장에게 통보하여야 한다. 기본계획을 변경하는 경우에도 또한 같다.(개정 2008.2.29)
③제2항의 규정에 의한 기본계획에는 다음의 사항이 포함되어야 한다.
1. 뇌연구의 중장기적 목표 및 내용
2. 뇌연구에 필요한 투자재원의 확대방안 및 추진계획
3. 교육·산업·보건복지·정보통신·과학기술 등 각 분야의 뇌연구에 관한 계획
4. 뇌연구에 필요한 인력자원의 개발 및 효율적인 활용에 관한 종합계획
5. 뇌연구 결과의 이용과 보전에 관한 계획
6. 기타 뇌연구 촉진을 위하여 필요한 중요사항
제6조(뇌연구촉진시행계획의 수립)
①관계중앙행정기관의 장은 기본계획에 따라 매년 뇌연구촉진시행계획(이하 “시행계획”이라 한다)을 수립하고 이를 시행하여야 한다.
② 관계중앙행정기관의 장은 시행계획을 수립하고자 할 때에는 미리 교육과학기술부장관과 협의하여야 한다.(개정 2008.2.29)
③ 교육과학기술부장관은 필요한 때에는 시행계획의 수립에 필요한 기본지침을 작성하여 관계중앙행정기관의 장에게 통보할 수 있다.(개정 2008.2.29)
④시행계획의 수립 및 그 시행에 관하여 필요한 사항은 대통령령으로 정한다.
제7조(뇌연구촉진심의회)
① 뇌연구에 관한 중요사항을 심의하기 위하여 교육과학기술부장관소속하에 뇌연구촉진심의회(이하 “심의회”라 한다)를 둔다.(개정 2008.2.29)
②심의회는 다음 각 호의 사항을 심의한다.
1. 기본계획의 수립·변경과 이에 따른 중요정책의 수립 및 그 집행의 조정
2. 뇌연구 관련 예산의 확대방안에 관한 사항
3. 뇌연구 분야 인력개발 및 교류에 관한 종합계획과 이에 따른 중요정책, 인력활용지침의 수립 및 집행의 조정
4. 뇌연구 결과의 이용과 보전을 위한 계획의 수립 및 그 집행의 조정
5. 기타 뇌연구에 관하여 위원장이 필요하다고 인정하는 사항
③심의회는 위원장 1인을 포함한 20인 이내의 위원으로 구성한다.
④ 위원장은 교육과학기술부차관이 되고 위원은 위원장이 임명하는 관계중앙행정기관의 공무원과 학계, 연구기관, 산업계에 종사하는 뇌연구 전문가로서 위원장이 위촉하는 자(이하 “위촉위원”이라 한다)가 된다.(개정 2002.12.26, 2008.2.29)
⑤삭제(2002.12.26)
⑥심의회의 구성 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
제8조(뇌연구실무추진위원회)
① 심의회에 상정할 안건의 작성 및 심의회에서 위임한 업무를 처리하게 하기 위하여 교육과학기술부장관 소속 하에 뇌연구실무추진위원회(이하 “추진위원회”라 한다)를 둔다.(개정 2008.2.29)
②추진위원회는 관계중앙행정기관의 공무원 및 학계, 연구기관, 산업계에 종사하는 뇌연구 전문가로 구성한다.
③추진위원회의 구성 및 운영에 관하여 필요한 사항은 대통령령으로 정한다.
제9조(뇌연구 투자의 확대)
①정부는 제5조제3항제2호의 투자재원의 확대방안 및 추진계획에 따라 예산의 범위 안에서 뇌연구투자의 확대를 위하여 최대한 노력하여야 한다.
② 교육과학기술부장관은 매년 뇌연구투자확대계획을 작성하여 심의회의 심의를 거친 후, 이를 「국가교육과학기술자문회의법」에 따른 국가교육과학기술자문회의에 보고하여야 한다.(개정 2008.2.29, 2008.6.5)
제10조(연구 및 기술협력) 정부는 뇌연구 및 그 기술개발에 관한 국제협력의 증진에 노력하고 선진기술의 도입을 위한 전문인력 파견, 해외 전문인력 유치 등의 방안을 강구하여야 한다.
제11조(공동연구 및 학술활동 촉진) 정부는 뇌연구 및 기술개발의 효율적 육성을 위하여 학계, 연구기관 및 산업계간의 공동연구를 촉진하고 관련 학회 및 학술활동을 적극 지원하여야 한다.
제12조(관계산업체에 대한 지원) 정부는 뇌연구 결과의 산업화를 촉진하기 위하여 신기술제품의 생산을 지원할 수 있다.
제13조(기술정보의 수집과 보급) 정부는 뇌연구에 관한 정보를 수집하여 이를 관계기관에 보급하도록 노력하여야 한다.
제14조(뇌연구추진시책강구) 관계중앙행정기관의 장은 뇌연구를 효율적으로 촉진하기 위하여 다음과 같은 시책을 강구한다.(개정 2001.1.29, 2008.2.29)
1. 삭제(2008.2.29)
2. 교육과학기술부장관 : 기본계획의 수립과 시행계획 수립의 지원 및 조정, 뇌분야의 연구를 촉진시키기 위한 전문인력의 양성과 뇌과학 기초분야의 연구지원, 뇌 관련 기초기술 및 첨단기술의 개발, 유용한 연구결과의 이용 및 보전을 위한 연구의 지원, 공공적 성격의 뇌연구 지원체제의 육성
3. 지식경제부장관 : 뇌연구 결과를 생산 및 산업공정에 효율적으로 응용하기 위한 응용기술의 개발과 개발기술의 산업화 촉진, 뇌연구 결과의 정보·통신 등 분야에의 응용기술의 개발 및 개발기술의 산업화 촉진
4. 삭제(2008.2.29)
5. 보건복지가족부장관 : 보건·의료 등에 관련되는 뇌의약연구와 그 결과의 응용기술 개발 및 개발기술의 산업화 촉진
제15조(임상 및 검정)
①정부는 뇌연구 관련 제품에 대한 임상 및 검정체제을 확립한다.
②제1항의 임상 및 검정체제확립에 관하여 필요한 사항은 대통령령으로 정한다.
제16조(실험지침의 작성·시행 등)
①정부는 뇌연구 및 그 산업화의 촉진을 위한 실험지침을 작성·시행하여야 한다.
②제1항의 실험지침에서는 뇌연구와 그 산업화 과정에서 예견될 수 있는 생물학적 위험성, 인간에 미치는 악영향 및 윤리적 문제 발생의 사전방지에 필요한 조치 및 안전기준이 마련되어야 한다.
제17조(연구소의 설립)
①뇌분야에 관한 연구 및 그 이용과 지원에 관한 기능을 수행하고 뇌분야에서의 학계, 연구기관 및 산업계간의 상호유기적 협조체제를 유지·발전시키기 위하여 정부가 출연하는 연구소를 설립할 수 있다.
②제1항의 규정에 의한 연구소는 특정연구기관육성법의 적용을 받는 특정연구기관으로 한다.
부 칙 (제5547호, 1998.6.3)
이 법은 공포한 날부터 시행한다.
부 칙 (정부조직법) (제6400호, 2001.1.29)
제1조(시행일) 이 법은 공포한 날부터 시행한다. (단서 생략)
제2조 생략
제3조(다른 법률의 개정)
①내지 (59)생략
(60) 뇌연구촉진법 중 다음과 같이 개정한다.
제2조제5호중 “교육부”를 “교육인적자원부”로 한다.
제14조제1호중 “교육부장관”을 “교육인적자원부장관”으로 한다.
(61)내지 (79)생략
제4조 생략
부 칙 <제6811호, 2002.12.26>
이 법은 공포한 날부터 시행한다.
부 칙 (정부조직법) <제8852호, 2008.2.29>
제1조(시행일) 이 법은 공포한 날부터 시행한다. 다만, 제31조제1항의 개정규정 중 “식품산업진흥”에 관한 부분은 2008년 6월 28일부터 시행하고, 부칙 제6조에 따라 개정되는 법률 중 이 법의 시행 전에 공포되었으나 시행일이 도래하지 아니한 법률을 개정한 부분은 각각 해당 법률의 시행일부터 시행한다.
제2조부터 제5조까지 생략
제6조(다른 법률의 개정)
①부터 (129)까지 생략
(130) 뇌연구촉진법 일부를 다음과 같이 개정한다.
제2조제5호 중 “교육인적자원부, 과학기술부, 산업자원부, 정보통신부, 보건복지부”를 “교육과학기술부, 지식경제부, 보건복지가족부”로 한다.
제5조제1항·제2항 전단 및 제6조제2항·제3항 중 “과학기술부장관”을 각각 “교육과학기술부장관”으로 한다.
제7조제1항 중 “과학기술부장관”을 “교육과학기술부장관”으로 하고, 같은 조 제4항 중 “과학기술부차관”을 “교육과학기술부차관”으로 한다.
제8조제1항 및 제9조제2항 중 “과학기술부장관”을 각각 “교육과학기술부장관”으로 한다.
제14조제1호를 삭제하고, 같은 조 제2호 및 제3호를 각각 다음과 같이 한다.
2. 교육과학기술부장관 : 기본계획의 수립과 시행계획 수립의 지원 및 조정, 뇌분야의 연구를 촉진시키기 위한 전문인력의 양성과 뇌과학 기초분야의 연구지원, 뇌 관련 기초기술 및 첨단기술의 개발, 유용한 연구결과의 이용 및 보전을 위한 연구의 지원, 공공적 성격의 뇌연구 지원체제의 육성
3. 지식경제부장관: 뇌연구 결과를 생산 및 산업공정에 효율적으로 응용하기 위한 응용기술의 개발과 개발기술의 산업화 촉진, 뇌연구 결과의 정보·통신 등 분야에의 응용기술의 개발 및 개발기술의 산업화 촉진
제14조제4호를 삭제하고, 같은 조 제5호 중 “보건복지부장관”을 “보건복지가족부장관”으로 한다.
(131)부터 (760)까지 생략
제7조 생략
부 칙 (국가과학기술자문회의법) (제9089호, 2008.6.5)
제1조(시행일) 이 법은 공포 후 3개월이 경과한 날부터 시행한다.
제2조(다른 법률의 개정)
① 생략
② 뇌연구촉진법 일부를 다음과 같이 개정한다.
제9조제2항 중 “국가과학기술자문회의법에 의한 국가과학기술자문회의”를 “「국가교육과학기술자문회의법」에 따른 국가교육과학기술자문회의”로 한다.
유전자변형생물체의 국가 간 이동 등에 관한 법률
[일부개정 2009.2.6 법률 제9428호]
제1장 총 칙
제1조(목적) 이 법은 「바이오안전성에 관한 카르타헤나 의정서」의 시행에 필요한 사항과 유전자변형생물체의 개발·생산·수입·수출·유통 등에 관한 안전성의 확보를 위하여 필요한 사항을 정함으로써 유전자변형생물체로 인한 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 미치는 위해(危害)를 사전에 방지하고 국민생활의 향상 및 국제협력을 증진함을 목적으로 한다.
[전문개정 2007.12.21]
제2조(정의) 이 법에서 사용하는 용어의 뜻은 다음과 같다.
1. “유전자변형생물체”란 다음 각 목의 현대생명공학기술을 이용하여 얻어진 생물체로서 새롭게 조합된 유전물질을 포함하고 있는 생물체를 말한다.
가. 인위적으로 유전자를 재조합하거나 유전자를 구성하는 핵산을 세포 또는 세포 내 소기관으로 직접 주입하는 기술
나. 분류학에 의한 과(科)의 범위를 넘는 세포융합으로서 자연상태의 생리적 증식이나 재조합이 아니고 전통적인 교배나 선발(選發)에서 사용되지 아니하는 기술
2. “환경 방출”이란 유전자변형생물체를 시설, 장치, 그 밖의 구조물을 이용하여 밀폐하지 아니하고 의도적으로 자연환경에 노출되게 하는 것을 말한다.
3. “관계중앙행정기관”이란 유전자변형생물체의 개발·생산·수입·수출·판매·운반·보관 등(이하 “수출입 등”이라 한다)의 업무에 따라 대통령령으로 정하는 기준에 해당하는 중앙행정기관을 말한다.
[전문개정 2007.12.21]
제3조(적용 범위) 인체용 의약품으로 사용되는 유전자변형생물체에 대하여는 이 법을 적용하지 아니한다.
[전문개정 2007.12.21]
제4조(다른 법률과의 관계) 유전자변형생물체를 수출입 등을 할 때에 그 취급 및 안전관리에 관하여 다른 법률에 특별한 규정이 있는 경우 외에는 이 법으로 정하는 바에 따른다.
[전문개정 2007.12.21]
제5조(국가 등의 책무) 국가와 지방자치단체는 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 대하여 유전자변형생물체가 끼칠 위해를 방지하기 위하여 필요한 시책을 마련하여야 한다.
[전문개정 2007.12.21]
제6조(국가책임기관 등)
① 「바이오안전성에 관한 카르타헤나 의정서」(이하 “의정서”라 한다) 제19조에 따른 국가연락기관은 외교통상부로 하고, 국가책임기관은 지식경제부로 한다.(개정 2008.2.29)
② 국가책임기관의 장은 대통령령으로 정하는 바에 따라 국가책임기관으로서 의정서를 이행하는 데에 필요한 업무를 수행한다.
[전문개정 2007.12.21]
제7조(유전자변형생물체 안전관리계획의 수립·시행)
① 관계중앙행정기관의 장은 소관별로 유전자변형생물체 안전관리계획(이하 “안전관리계획”이라 한다)을 수립·시행하여야 한다.
② 안전관리계획에는 다음 각 호의 사항이 포함되어야 한다.
1. 유전자변형생물체의 수출입 등에 따른 안전관리의 기본방침에 관한 사항
2. 유전자변형생물체를 취급하는 시설 및 작업 종사자의 안전에 관한 사항
3. 유전자변형생물체에 관한 기술 개발 및 지원에 관한 사항
4. 그 밖에 유전자변형생물체의 안전관리와 관련한 중요 사항
③ 관계중앙행정기관의 장은 안전관리계획을 수립·시행하려면 미리 제31조에 따른 바이오안전성위원회의 심의를 거쳐야 한다.
④ 관계중앙행정기관의 장은 안전관리계획의 시행을 위한 세부시행계획을 수립·시행하여야 하며, 이를 위하여 필요하면 안전관리지침을 정하여 고시할 수 있다.
[전문개정 2007.12.21]
제2장 유전자변형생물체의 수출입 등 및 안전관리
제8조(수입승인 등)
① 유전자변형생물체를 수입(휴대하여 수입하는 경우를 포함한다. 이하 같다)하려는 자는 대통령령으로 정하는 바에 따라 관계중앙행정기관의 장의 승인을 받아야 한다. 승인을 받은 사항을 변경하려는 경우에도 또한 같다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려는 경우에는 이를 신고하여야 한다.
② 환경 방출로 사용되는 유전자변형생물체를 수입하려는 자는 제1항에도 불구하고 국가책임기관의 장을 거쳐 관계중앙행정기관의 장에게 수입승인을 신청하여야 한다. 이 경우 국가책임기관의 장과 관계중앙행정기관의 장은 대통령령으로 정하는 바에 따라 의정서 제8조부터 제10조까지에 따른 그 유전자변형생물체의 국가 간 이동에 필요한 절차를 따라야 한다.
③ 제1항 및 제2항에 따라 승인을 신청하는 자는 해당 유전자변형생물체를 생산하거나 수출하는 자가 작성한 위해성평가서와 유전자변형생물체를 수출하려는 자가 속한 국가의 정부기관이 발행하는 위해성심사서를 제출하여야 한다.
④ 제3항에도 불구하고 유전자변형생물체에 대한 위해성심사서를 발행할 수 있는 정부기관이 없거나 그 밖에 대통령령으로 정하는 사유가 있는 경우에는 관계중앙행정기관의 장이 대통령령으로 정하는 바에 따라 지정하는 위해성평가기관(이하 “위해성평가기관”이라 한다)이 작성한 위해성평가서를 제출하여야 한다.
⑤ 관계중앙행정기관의 장은 제1항 및 제2항에 따른 승인신청을 받으면 해당 유전자변형생물체의 위해성을 심사하고 그 유전자변형생물체가 국내 생물다양성의 가치에 미칠 사회·경제적 영향을 고려하여 승인 여부를 결정하여야 한다.
⑥ 관계중앙행정기관의 장은 제5항에 따른 승인 여부를 국가책임기관의 장에게 통보하여야 한다.
⑦ 제3항에 따른 위해성평가서의 평가항목과 평가기준 등에 관하여 필요한 사항은 관계중앙행정기관의 장이 정하여 고시한다.
[전문개정 2007.12.21]
제9조(시험·연구용 등의 유전자변형생물체의 수입)
① 제8조에도 불구하고 시험·연구용으로 사용하거나 박람회·전시회에 출품하기 위하여 유전자변형생물체를 수입하려는 자는 대통령령으로 정하는 바에 따라 관계중앙행정기관의 장의 승인을 받거나 관계중앙행정기관의 장에게 신고하여야 한다.
② 관계중앙행정기관의 장은 제1항에 따른 승인 여부 및 신고내용을 국가책임기관의 장에게 통보하여야 한다.
[전문개정 2007.12.21]
제10조(우편물로 수입되는 유전자변형생물체의 수입검사)
① 세관장은 국제우편물에 제8조 또는 제9조에 따른 승인을 받지 아니하거나 신고를 하지 아니한 유전자변형생물체가 담겨 있거나 담겨 있다고 의심되면 지체 없이 그 사실을 관계중앙행정기관의 장에게 통보하여야 한다.
② 제1항에 따라 세관장이 통지하면 관계중앙행정기관의 장은 해당 국제우편물을 검사한 후 폐기, 반송 등 적절한 조치를 하여야 한다.
③ 유전자변형생물체가 담겨 있는 국제우편물을 받은 자는 그 유전자변형생물체가 제8조 또는 제9조에 따른 승인을 받지 아니하거나 신고를 하지 아니한 것임을 알았을 때에는 지체 없이 관계중앙행정기관의 장에게 이를 신고하고, 관계중앙행정기관의 장이 명하는 바에 따라 처리하여야 한다.
[전문개정 2007.12.21]
제11조(수입항구 등의 지정)
① 국가책임기관의 장은 유전자변형생물체의 안전관리를 위하여 필요하다고 인정하면 관계중앙행정기관의 장과 협의하여 유전자변형생물체를 수입하는 항구·공항 등을 지정할 수 있다.
② 국가책임기관의 장은 제1항에 따라 항구·공항 등을 지정하는 경우에는 지체 없이 이를 공고하여야 한다.
[전문개정 2007.12.21]
제12조(생산승인 등)
① 유전자변형생물체를 생산하려는 자는 대통령령으로 정하는 바에 따라 관계중앙행정기관의 장의 승인을 받아야 한다. 승인을 받은 사항을 변경하려는 경우에도 또한 같다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려는 경우에는 이를 신고하여야 한다.
② 제1항에 따른 승인을 신청하는 자는 제8조제3항에 따른 위해성평가서를 제출하여야 한다.
③ 유전자변형생물체를 생산하려는 경우에는 제8조제5항부터 제7항까지의 규정을 준용한다.
[전문개정 2007.12.21]
제13조(위해성 심사 절차 및 대행 등)
① 관계중앙행정기관의 장은 제8조제5항 또는 제12조제3항에 따라 유전자변형생물체의 위해성 심사를 하는 경우에 그 유전자변형생물체가 인체에 미치는 영향에 대하여는 보건복지부장관과, 환경 방출되거나 환경 방출될 우려가 있는 유전자변형생물체의 경우에는 다음 각 호에서 정하는 기관의 장과 미리 협의하여야 한다.(개정 2008.2.29)
1. 해당 유전자변형생물체가 자연생태계에 미치는 영향: 환경부장관
2. 작물재배 환경에 미치는 영향: 농림수산식품부장관
3. 해양생태계에 미치는 영향: 국토해양부장관
② 제8조제5항 또는 제12조제3항에 따른 위해성 심사의 기준·방법, 그 밖에 필요한 사항은 관계중앙행정기관의 장이 정하여 고시한다.
③ 관계중앙행정기관의 장은 제8조제5항 또는 제12조제3항에 따른 유전자변형생물체의 위해성 심사 업무를 대통령령으로 정하는 바에 따라 지정하는 자(이하 “위해성심사대행기관”이라 한다)로 하여금 대행하게 할 수 있다.
④ 관계중앙행정기관의 장은 제8조 또는 제12조에 따라 유전자변형생물체의 수입 또는 생산 승인을 할 때에는 미리 그 유전자변형생물체에 관한 정보를 국민에게 알리고 의견을 수렴하여야 한다.
[전문개정 2007.12.21]
제14조(수입 또는 생산의 금지 등)
① 관계중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 유전자변형생물체(제2호의 생물체를 포함한다)의 수입이나 생산을 금지하거나 제한할 수 있다.
1. 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다고 인정하는 유전자변형생물체
2. 제1호에 해당하는 유전자변형생물체와 교배하여 생산된 생물체
3. 국내 생물다양성의 가치와 관련하여 사회·경제적으로 부정적인 영향을 미치거나 미칠 우려가 있다고 인정하는 유전자변형생물체
② 관계중앙행정기관의 장은 제1항에 따라 유전자변형생물체의 수입이나 생산을 금지하거나 제한하는 경우에는 국가책임기관의 장에게 통보하여야 한다.
③ 국가책임기관의 장은 제1항 각 호에 따라 수입이나 생산을 금지하거나 제한하는 생물체의 품목 등에 관하여 필요한 사항을 공고하여야 한다.
[전문개정 2007.12.21]
제15조(위해성이 없는 유전자변형생물체)
① 국가책임기관의 장은 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해가 발생할 우려가 없는 유전자변형생물체에 대하여 그 품목 등을 고시하여야 한다.
② 국가책임기관의 장은 제1항에 따라 유전자변형생물체의 품목 등을 고시할 때에는 미리 제31조에 따른 바이오안전성위원회의 심의를 거쳐야 한다.
③ 제1항에 따라 고시된 품목의 유전자변형생물체를 수입하거나 생산하려는 자는 제8조 또는 제12조에도 불구하고 국가책임기관의 장에게 신고하여야 한다.
[전문개정 2007.12.21]
제16조(「대외무역법」에 따른 수입승인 의제 등)
① 제8조 및 제9조에 따라 관계중앙행정기관의 장이 수입승인을 하거나 신고를 수리한 유전자변형생물체에 대하여는 「대외무역법」 제11조제2항에 따른 지식경제부장관의 수입승인을 받은 것으로 본다.(개정 2008.2.29)
② 제15조제3항 및 제20조에 따른 유전자변형생물체를 수입하거나 수출하려는 자가 국가책임기관의 장에게 그 내용을 신고하거나 통보한 유전자변형생물체에 대하여는 「대외무역법」 제11조제2항에 따른 지식경제부장관의 수입승인이나 수출승인을 받은 것으로 본다.(개정 2008.2.29)
[전문개정 2007.12.21]
제17조(승인취소)
① 관계중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 경우에는 제8조, 제9조 또는 제12조에 따른 유전자변형생물체의 수입승인이나 생산승인을 취소할 수 있다. 다만, 제1호 또는 제2호에 해당하는 경우에는 수입승인이나 생산승인을 취소하여야 한다.
1. 수입승인이나 생산승인을 받은 유전자변형생물체가 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다는 사실이 밝혀진 경우
2. 속임수나 그 밖의 부정한 방법으로 수입승인이나 생산승인을 받은 경우
3. 수입승인이나 생산승인을 받은 유전자변형생물체를 승인을 받은 용도와 다르게 사용하는 경우
4. 제8조제1항 또는 제12조제1항을 위반하여 변경승인을 받지 아니하거나 변경신고를 하지 아니하고 유전자변형생물체를 수입하거나 생산한 경우
5. 제24조제1항 또는 제2항을 위반하여 유전자변형생물체의 종류 등의 표시를 하지 아니한 경우 또는 거짓으로 표시하거나 표시를 임의로 변경 또는 삭제한 경우
6. 제25조제1항을 위반하여 취급관리기준을 지키지 아니한 경우
7. 제26조를 위반하여 유전자변형생물체의 수출입등에 관한 기록을 작성·보관하지 아니한 경우
8. 제27조제2항을 위반하여 유전자변형생물체의 부정적인 영향을 알면서도 관계중앙행정기관의 장이나 국가책임기관의 장에게 그 내용을 통보하지 아니한 경우
9. 정당한 사유 없이 제36조제1항에 따른 보고나 자료 또는 시료(試料)의 제출을 거부하거나 출입·검사를 거부·방해 또는 기피한 경우
10. 그 밖에 대통령령으로 정하는 사유에 해당하는 경우
② 관계중앙행정기관의 장은 제1항에 따라 수입승인이나 생산승인을 취소한 경우에는 지체 없이 국가책임기관의 장에게 통보하여야 한다.
[전문개정 2007.12.21]
제18조(재심사)
① 제8조·제12조 및 제17조제1항에 따른 처분에 불복하는 자는 대통령령으로 정하는 바에 따라 관계중앙행정기관의 장에게 재심사를 요청할 수 있다.
② 관계중앙행정기관의 장은 제1항에 따른 재심사를 요청받은 경우에는 국가책임기관의 장과 협의하고 제31조에 따른 바이오안전성위원회의 심의를 거쳐 재심사에 대한 결정을 하여야 한다.
[전문개정 2007.12.21]
제19조(폐기·반송 등의 명령)
① 관계중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 유전자변형생물체의 소유자에게 대통령령으로 정하는 바에 따라 일정한 기간을 정하여 그 유전자변형생물체의 폐기·반송 등을 명할 수 있다.
1. 제8조, 제9조 또는 제12조에 따른 관계중앙행정기관의 장의 승인 또는 변경승인을 받지 아니하거나 관계중앙행정기관의 장에게 신고를 하지 아니한 유전자변형생물체
2. 제14조에 따라 수입이나 생산이 금지되거나 제한된 유전자변형생물체
3. 제17조에 따라 수입승인이나 생산승인이 취소된 유전자변형생물체
② 관계중앙행정기관의 장은 유전자변형생물체의 소유자가 제1항에 따른 폐기·반송 등의 명령을 따르지 아니한 경우에는 대통령령으로 정하는 바에 따라 그 유전자변형생물체 소유자의 부담으로 소속 공무원에게 직접 폐기·반송 등을 하게 할 수 있다.
③ 관계중앙행정기관의 장은 수입된 유전자변형생물체에 대하여 제1항에 따른 유전자변형생물체의 폐기·반송 등을 명하였을 때에는 관세청장에게 그 내용을 통보하여야 한다.
[전문개정 2007.12.21]
제20조(수출 통보) 유전자변형생물체를 수출하려는 자는 지식경제부장관에게 품목, 수량, 수출국가 등 대통령령으로 정하는 사항을 미리 통보하여야 한다.(개정 2008.2.29)
[전문개정 2007.12.21]
제21조(경유 신고) 유전자변형생물체를 국내를 경유하여 다른 국가로 수출하려는 자는 국가책임기관의 장에게 품목, 수량, 수출국가, 수입국가 등 대통령령으로 정하는 사항을 신고하여야 한다.
[전문개정 2007.12.21]
제22조(연구시설의 설치·운영허가 등)
① 유전자변형생물체를 개발하거나 이를 이용하여 실험을 하는 시설(이하 “연구시설”이라 한다)을 설치·운영하려는 자는 대통령령으로 정하는 바에 따라 연구시설의 안전관리 등급별로 관계중앙행정기관의 장의 허가를 받거나 관계중앙행정기관의 장에게 신고를 하여야 한다. 허가받은 사항을 변경하려는 경우에도 허가를 받아야 한다. 다만, 허가받은 사항 중 대통령령으로 정하는 경미한 사항을 변경하려는 경우에는 대통령령으로 정하는 바에 따라 신고하여야 한다.
② 관계중앙행정기관의 장은 제1항에 따른 연구시설의 설치·운영의 허가 여부 및 신고내용을 국가책임기관의 장에게 통보하여야 한다.
③ 제1항에 따라 연구시설의 설치·운영에 대한 허가를 받거나 신고를 한 자는 연구시설의 안전관리 등급별로 대통령령으로 정하는 바에 따라 유전자변형생물체를 개발하거나 실험을 할 수 있다. 다만, 위해 가능성이 큰 유전자변형생물체를 개발하거나 실험하는 경우로서 대통령령으로 정하는 경우에는 관계중앙행정기관의 장의 승인을 받아야 한다.
④ 제1항에 따른 연구시설의 안전관리의 등급 및 설치·운영에 대한 허가기준 등에 관한 사항은 대통령령으로 정한다.
[전문개정 2007.12.21]
제23조(허가취소 등)
① 관계중앙행정기관의 장은 제22조제1항에 따라 연구시설의 설치·운영의 허가를 받거나 신고를 한 자가 다음 각 호의 어느 하나에 해당하는 경우에는 그 허가를 취소하거나 1년 이내의 기간을 정하여 그 시설의 운영을 정지하도록 명할 수 있다. 다만, 제1호에 해당하는 경우에는 허가를 취소하여야 한다.
1. 속임수나 그 밖의 부정한 방법으로 허가를 받은 경우
2. 제22조제1항 후단에 따른 변경허가를 받지 아니하고 그 허가내용을 변경한 경우
3. 제22조제3항 단서에 따른 승인을 받지 아니하고 개발 또는 실험을 한 경우
4. 제22조제4항에 따른 허가기준에 미달한 경우
② 관계중앙행정기관의 장은 제22조제3항 단서에 따라 승인을 받은 유전자변형생물체의 개발 또는 실험이 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다는 사실이 밝혀진 경우에는 승인을 취소할 수 있다.
[전문개정 2007.12.21]
제24조(표시)
① 유전자변형생물체를 개발·생산 또는 수입하는 자는 그 유전자변형생물체 또는 그 유전자변형생물체의 용기나 포장에 유전자변형생물체의 종류 등 대통령령으로 정하는 사항을 표시하여야 한다.
② 누구든지 제1항에 따른 표시를 거짓으로 하거나 이를 임의로 변경하거나 삭제하여서는 아니 된다.
③ 관계중앙행정기관의 장은 제1항에 따른 표시의 방법, 그 밖에 필요한 사항을 정하여 고시한다.
[전문개정 2007.12.21]
제25조(취급관리)
① 유전자변형생물체의 수출입등을 하는 자는 유전자변형생물체를 취급하거나 관리할 때에 밀폐운송 등 대통령령으로 정하는 취급관리기준을 지켜야 한다.
② 제1항에 따른 취급관리의 방법과 그 밖에 필요한 사항은 관계중앙행정기관의 장이 정하여 고시한다.
[전문개정 2007.12.21]
제26조(관리·운영기록의 보존) 유전자변형생물체의 수출입 등을 하는 자와 연구시설을 설치·운영하는 자는 지식경제부령으로 정하는 바에 따라 유전자변형생물체의 수출입등 및 연구시설의 관리·운영에 관한 기록을 작성하여 보관하여야 한다.(개정 2008.2.29)
[전문개정 2007.12.21]
제27조(위해 방지를 위한 비상조치)
① 국가책임기관의 장은 유전자변형생물체로 인하여 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 중대한 부정적인 영향이 발생하거나 발생할 우려가 있다고 인정되면 대통령령으로 정하는 바에 따라 지체 없이 필요한 조치를 하여야 한다.
② 유전자변형생물체의 수출입 등을 하는 자가 유전자변형생물체의 부정적인 영향을 알게 되었을 때에는 관계중앙행정기관의 장 또는 국가책임기관의 장에게 지체 없이 그 내용을 통보하여야 한다.
[전문개정 2007.12.21]
제3장 유전자변형생물체의 정보 보호 (개정 2007.12.21)
제28조(정보 보호) 유전자변형생물체에 대한 정보를 취급하는 관계중앙행정기관, 국가책임기관, 위해성평가기관, 위해성심사대행기관 및 제32조에 따른 바이오안전성정보센터(이하 “정보취급기관”이라 한다)의 장은 유전자변형생물체의 정보가 도난·누출 또는 훼손되지 아니하도록 정보 보호에 필요한 조치를 마련하여야 한다.
[전문개정 2007.12.21]
제29조(정보 이용 및 정보 제공의 제한)
① 정보취급기관의 장은 대통령령으로 정하는 경우 외에는 유전자변형생물체의 정보를 상업적으로 이용하거나 다른 자에게 제공하여서는 아니 된다.
② 정보취급기관의 장은 유전자변형생물체의 정보를 다른 자에게 제공할 때에는 사용목적·사용방법 등에 관하여 제한을 하거나 정보 보호를 위하여 필요한 조치를 마련하도록 요청할 수 있다.
[전문개정 2007.12.21]
제30조(정보취급기관 임직원의 의무) 정보취급기관의 임직원이거나 임직원이었던 자는 직무상 알게 된 정보를 누설하거나 타인이 이용하도록 제공하는 등 부당한 목적을 위하여 사용하여서는 아니 된다.
[전문개정 2007.12.21]
제4장 바이오안전성위원회 등
제31조(바이오안전성위원회)
① 유전자변형생물체의 수출입 등에 관한 다음 각 호의 사항을 심의하기 위하여 국무총리 소속으로 바이오안전성위원회(이하 “위원회”라 한다)를 둔다.
1. 의정서의 이행에 관한 사항
2. 안전관리계획의 수립·시행
3. 제15조에 따른 위해성이 없는 유전자변형생물체의 품목 등의 고시
4. 제18조에 따른 재심사
5. 유전자변형생물체의 수출입등과 안전관리에 관련된 법령·고시 등에 관한 사항
6. 유전자변형생물체로 인한 피해 예방 및 대책에 관한 사항
7. 그 밖에 위원장 또는 국가책임기관의 장이 심의를 요청하는 사항
② 위원회는 위원장 1명을 포함한 15명 이상 20명 이하의 위원으로 구성한다.
③ 위원회의 위원장은 국무총리가 되고, 위원은 다음 각 호의 자로 한다.(개정 2008.2.29)
1. 기획재정부장관, 교육과학기술부장관, 외교통상부장관, 농림수산식품부장관, 지식경제부장관, 보건복지가족부장관, 환경부장관 및 국토해양부장관
2. 대통령령으로 정하는 자 중에서 국가책임기관의 장의 제청으로 위원장이 위촉하는 자
④ 국가책임기관의 장은 제3항제2호에 따라 위원을 제청하려면 미리 관계중앙행정기관의 장과 협의하여야 한다.
⑤ 위원회를 효율적으로 운영하기 위하여 위원회에 분과위원회 및 실무위원회를 둘 수 있다.
⑥ 위원회에 간사 1명을 두되, 간사는 지식경제부 소속 공무원 중에서 위원장이 지명하는 자가 된다.(개정 2008.2.29)
⑦ 위원회·분과위원회 및 실무위원회의 구성·기능·운영 등에 관한 사항은 대통령령으로 정한다.
[전문개정 2007.12.21]
제32조(바이오안전성정보센터)
① 국가책임기관의 장은 유전자변형생물체의 정보관리 및 정보교환에 관한 사항 등을 전문적으로 수행하는 바이오안전성정보센터(이하 “바이오안전성정보센터”라 한다)를 지정할 수 있다.
② 바이오안전성정보센터는 유전자변형생물체의 안전성에 관한 정보를 국민에게 공개하여야 한다.
[전문개정 2007.12.21]
제5장 보 칙
제33조(자금 등의 지원)
① 정부는 유전자변형생물체의 안전성에 대한 국민의 이해를 증진하고 소비자의 인식을 제고하기 위하여 관련 기관 및 단체가 실시하는 홍보 및 교육사업 등에 필요한 자금 등을 지원할 수 있다.
② 정부는 연구시설의 안전성을 확보하기 위하여 필요한 시설의 설치·운영 등에 드는 자금 등을 지원할 수 있다.
[전문개정 2007.12.21]
제34조(재원 확보) 국가책임기관의 장은 유전자변형생물체의 수출입등과 관련하여 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 피해가 발생하는 경우에 대비하여 안전성 확보를 위한 재원 확보 방안을 마련하여야 한다.
[전문개정 2007.12.21]
제35조(수수료)
① 다음 각 호의 어느 하나에 해당하는 자는 수수료를 내야 한다.
1. 제8조제1항 및 제2항에 따라 수입승인을 받으려는 자
2. 제9조제1항에 따라 수입승인을 받으려는 자
3. 제12조제1항에 따라 생산승인을 받으려는 자
4. 제22조제1항에 따라 연구시설 설치·운영의 허가를 받으려는 자
② 제1항에 따른 수수료의 금액, 납부방법 및 납부기간 등에 관한 사항은 대통령령으로 정한다.
[전문개정 2007.12.21]
제36조(보고 및 검사)
① 관계중앙행정기관의 장 또는 국가책임기관의 장은 유전자변형생물체의 안전관리를 위하여 다음 각 호의 어느 하나에 해당하는 자에게 보고를 하게 하거나 자료 또는 시료의 제출을 요구할 수 있으며, 소속 공무원으로 하여금 해당 사무소·연구시설·사업장·보관장소 등에 출입하여 관계 서류나 시설·장비 및 보관상태 등을 검사하게 할 수 있다.
1. 제8조제1항·제2항, 제9조제1항 또는 제12조제1항에 따라 수입승인 또는 생산승인을 받거나 수입신고 또는 생산신고를 한 자
2. 제15조제3항에 따라 신고를 한 자
3. 위해성평가기관
4. 위해성심사대행기관
5. 제22조에 따라 연구시설의 설치·운영허가를 받거나 신고를 한 자
6. 제25조에 따라 취급하거나 관리하는 자
② 관계중앙행정기관의 장 또는 국가책임기관의 장은 승인을 받지 아니하거나 신고를 하지 아니한 유전자변형생물체로 판단되는 물품의 수출입 등을 하거나, 허가를 받지 아니하거나 신고를 하지 아니하고 연구시설을 운영하고 있다고 의심되는 자에 대하여는 소속 공무원으로 하여금 그 사무소·연구시설·사업장·보관장소 등에 출입하여 관계 서류나 시설·장비 및 보관상태 등을 검사하게 할 수 있다.
③ 제1항 또는 제2항에 따라 출입·검사를 하는 공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 내보여야 한다.
[전문개정 2007.12.21]
제37조(청문) 관계중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 처분을 하려면 청문을 하여야 한다.
1. 제17조에 따라 수입승인이나 생산승인을 취소하는 경우
2. 제23조에 따라 연구시설 설치·운영의 허가를 취소하는 경우
[전문개정 2007.12.21]
제38조(벌칙 적용 시의 공무원 의제) 위해성평가기관, 위해성심사대행기관 및 바이오안전성정보센터의 임직원은 「형법」 제129조부터 제132조까지의 규정을 적용할 때에는 공무원으로 본다.
[전문개정 2007.12.21]
제6장 벌 칙
제39조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 5년 이하의 징역 또는 7천만 원 이하의 벌금에 처한다.
1. 제14조를 위반하여 수입이나 생산이 금지되거나 제한된 유전자변형생물체(같은 조 제1항제2호의 생물체를 포함한다)를 수입하거나 생산한 자
2. 제17조제1항제1호에 따라 승인이 취소된 유전자변형생물체를 수입하거나 생산한 자
3. 제19조제1항에 따른 폐기·반송 등의 명령을 위반하여 유전자변형생물체를 국내에 유통하게 한 자
[전문개정 2007.12.21]
제40조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 3년 이하의 징역 또는 5천만원 이하의 벌금에 처한다.
1. 제8조제1항·제2항, 제9조제1항 또는 제12조제1항에 따른 승인 또는 변경승인을 받지 아니하고 유전자변형생물체를 수입하거나 생산한 자
2. 제17조제1항제2호부터 제10호까지의 규정에 따라 승인이 취소된 유전자변형생물체를 수입하거나 생산한 자
3. 제22조제1항 전단에 따른 허가를 받지 아니하거나 같은 항 후단 본문에 따른 변경허가를 받지 아니하고 연구시설을 설치·운영한 자
4. 제22조제3항 단서에 따른 승인을 받지 아니하고 개발하거나 실험한 자
[전문개정 2007.12.21]
제41조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 2년 이하의 징역 또는 3천만원 이하의 벌금에 처한다.
1. 제9조제1항에 따른 신고를 하지 아니하고 유전자변형생물체를 수입한 자
2. 제19조제1항에 따른 폐기·반송 등의 명령을 이행하지 아니한 자
3. 제20조에 따른 통보를 하지 아니하고 유전자변형생물체를 수출한 자
4. 제21조에 따른 신고를 하지 아니하고 유전자변형생물체를 국내 경유한 자
5. 제22조제1항 전단에 따른 신고를 하지 아니하고 연구시설을 설치·운영한 자
6. 제23조에 따른 연구시설의 운영정지명령을 위반한 자
7. 제30조를 위반하여 직무상 알게 된 정보를 누설하거나 타인이 이용하도록 제공한 자
[전문개정 2007.12.21]
제42조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 1년 이하의 징역 또는 2천만원 이하의 벌금에 처한다.
1. 제24조제1항 또는 제2항을 위반하여 유전자변형생물체의 종류 등을 표시하지 아니하거나 거짓으로 표시한 자 또는 표시를 임의로 변경하거나 삭제한 자
2. 제25조에 따른 취급관리기준을 지키지 아니한 자
[전문개정 2007.12.21]
제43조(양벌규정) 법인의 대표자나 법인 또는 개인의 대리인, 사용인, 그 밖의 종업원이 그 법인 또는 개인의 업무에 관하여 제39조부터 제42조까지의 어느 하나에 해당하는 위반행위를 하면 그 행위자를 벌하는 외에 그 법인 또는 개인에게도 해당 조문의 벌금형을 과(科)한다. 다만, 법인 또는 개인이 그 위반행위를 방지하기 위하여 해당 업무에 관하여 상당한 주의와 감독을 게을리 하지 아니한 경우에는 그러하지 아니하다.
[전문개정 2008.12.26]
제44조(과태료)
① 다음 각 호의 어느 하나에 해당하는 자에게는 1천만 원 이하의 과태료를 부과한다.
1. 제8조제1항 후단 단서에 따른 변경신고를 하지 아니한 자
2. 제10조제3항에 따른 신고를 하지 아니하거나 관계중앙행정기관의 장의 명령을 이행하지 아니한 자
3. 제11조제1항에 따라 지정되지 아니한 수입항구·공항 등의 장소로 유전자변형생물체를 수입한 자
4. 제12조제1항 후단 단서에 따른 변경신고를 하지 아니한 자
5. 제15조제3항에 따른 신고를 하지 아니한 자
6. 제22조제1항 후단 단서에 따른 변경신고를 하지 아니한 자
7. 제26조에 따른 관리·운영기록을 작성·보관하지 아니한 자
8. 제36조제1항 또는 제2항에 따른 보고나 자료 또는 시료의 제출을 거부하거나 출입·검사를 거부·방해 또는 기피한 자
② 제1항에 따른 과태료는 대통령령으로 정하는 바에 따라 관계중앙행정기관 또는 국가책임기관의 장이 부과·징수한다.
③ 삭제(2009.2.6)
④ 삭제(2009.2.6)
⑤ 삭제(2009.2.6)
[전문개정 2007.12.21]
부 칙 (제6448호, 2001.3.28)
이 법은 의정서가 우리나라에 대하여 효력을 발생하는 날부터 시행한다.
부 칙 (대외무역법) (제8356호, 2007.4.11)
제1조(시행일) 이 법은 공포한 날부터 시행한다.
제2조 내지 제5조 생략
제6조(다른 법률의 개정)
①내지 ⑥ 생략
⑦유전자변형생물체의국가간이동등에관한법률 일부를 다음과 같이 개정한다.
제16조제1항 및 제2항 중 “대외무역법 제14조제2항의 규정에 의하여”를 각각 “「대외무역법」 제11조제2항에 따라”로 한다.
⑧내지 ⑩ 생략
제7조 생략
부 칙 <제8762호, 2007.12.21>
제1조(시행일) 이 법은 의정서가 우리나라에 대하여 효력을 발생하는 날부터 시행한다.
제2조(수입승인 등에 관한 적용례) 제8조의 개정규정에 따른 수입승인 및 제25조의 개정규정에 따른 취급관리에 관한 사항은 이 법 시행 이후 수출국에서 선적(船積)한 유전자변형생물체부터 적용한다.
제3조(경과조치)
① 유전자변형생물체를 수입하려는 자는 이 법 시행 전에 제8조제5항의 개정규정에 따라 위해성심사를 신청할 수 있으며, 관계중앙행정기관의 장은 같은 항 및 제13조제1항의 개정규정에 따른 위해성심사를 할 수 있다.
② 연구시설을 설치·운영하려는 자는 이 법 시행 전에 제22조제1항의 개정규정에 따라 허가 신청 또는 신고를 할 수 있으며, 관계 중앙행정기관의 장은 같은 항의 개정규정에 따라 허가를 하거나 신고를 접수할 수 있다.
제4조(다른 법률의 개정)
① 야생동·식물보호법 일부를 다음과 같이 개정한다.
제25조제2항 단서 중 “「유전자변형 생물체의 국가간 이동 등에 관한 법률」 제2조”를 “「유전자변형생물체의 국가간 이동 등에 관한 법률」 제2조”로 한다.
② 해양생태계의 보전 및 관리에 관한 법률 일부를 다음과 같이 개정한다.
제23조제2항 단서 중 “「유전자변형 생물체의 국가간 이동 등에 관한 법률」 제2조”를 “「유전자변형생물체의 국가간 이동 등에 관한 법률」 제2조”로 한다.
부 칙 (정부조직법) (제8852호, 2008.2.29)
제1조(시행일) 이 법은 공포한 날부터 시행한다. 다만, 제31조제1항의 개정규정 중 “식품산업진흥”에 관한 부분은 2008년 6월 28일부터 시행하고, 부칙 제6조에 따라 개정되는 법률 중 이 법의 시행 전에 공포되었으나 시행일이 도래하지 아니한 법률을 개정한 부분은 각각 해당 법률의 시행일부터 시행한다.
제2조부터 제5조까지 생략
제6조(다른 법률의 개정)
①부터 (385)까지 생략
(386) 유전자변형생물체의 국가 간 이동 등에 관한 법률 일부를 다음과 같이 개정한다.
제6조제1항, 제31조제6항 중 “산업자원부”를 각각“ 지식경제부”로 한다.
제13조제1항제2호 중 “농림부장관”을 “농림수산식품부장관”으로 하며, 같은 항 제3호 중 “해양수산부장관”을 “국토해양부장관”으로 한다.
제16조제1항·제2항, 제20조 중 “산업자원부장관”을 각각 “지식경제부장관”으로 한다.
제26조 중 “산업자원부령”을 각각 “지식경제부령”으로 한다.
제31조제3항제1호를 다음과 같이 한다.
1. 기획재정부장관, 교육과학기술부장관, 외교통상부장관, 농림수산식품부장관, 지식경제부장관, 보건복지가족부장관, 환경부장관 및 국토해양부장관
(387)부터 (760)까지 생략
제7조 생략
부 칙 <제9241호, 2008.12.26>
이 법은 공포한 날부터 시행한다.
부 칙 <제9428호, 2009.2.6>
이 법은 공포한 날부터 시행한다.

생명공학 용어정리
■ 생명공학과 관련한 총제적(-omics) 학문
❍ 글라이코믹스(Glycomics)
당쇄를 인위적으로 목적한 기능을 갖게 변화시킴으로써 의약품 개발에 응용하려는 연구 분야이다.
※ 당쇄 : 단당류가 연쇄상으로 다수 결합된 분자로 일반적으로 생체의 세포 표면에 존재하는 당쇄를 지칭한다. 이러한 당은 당화(Glycosylation)되는 과정에서 단백질의 기능을 결정하거나 안정화시키는 데 중요한 역할을 한다.
❍ 기능유전체학(Functional genomics)
유전자와 유전자 산물의 기능, 유전자 산물 간의 상호작용을 밝히는 학문 분야이다. 이러한 연구를 통해 인간 유전자를 기능상으로 분류할 수 있으며, 이를 통해 질병 진단과 예후 예측, 치료제 개발에 유익한 정보를 제공할 수 있다.
❍ 단백질체학(Proteomics)
단백질의 3차원 구조분석, 기능 확인, 다른 생체물질과의 상호작용 등에 대한 연구를 통해 질병의 작용기구를 파악하고 신약개발에 활용하는 분야이다.
❍ 대사체학(Metabolomics)
세포 내에 존재하는 대사물의 총체인 대사체를 연구하는 학문이다.
❍ 독성유전체학(Toxicogenomics)
독성물질에 의해 발현양성이 변하는 유전자를 유전체학(genomics) 기법을 동원하여 대량으로 동정한 후 이 결과를 활용하여 개체의 독성물질 피폭 여부 등을 조사하는 학문 또는 기술이다. 이 기술을 이용하면 동물 또는 기타 시험관 내 방법에 비해 신속하고 정확하게 독성물질을 스크리닝할 수 있으며 한 번의 실험으로 다수 유전자의 변화를 분석할 수 있다.
❍ 약리유전체학(Pharmacogenomics)
개체 간에 나타나는 약물 효과, 독성 등의 차이를 개체의 유전적 요인과 관련지어 연구하는 학문 분야로, 개개인의 유전적인 요인을 파악해 약에 대한 반응성을 예측할 수 있도록 하는 것이 목표이다.
❍ 유전체학(Genomics)
게놈(genome)은 유전자(gene)와 염색체(chromosome)의 합성어로, 염색체에 담긴 유전자를 총칭하는 말이며, Genomics는 유전정보 전체(유전체)를 연구하는 학문분야를 말한다.
❍ 화학유전체학(Chemical Genomics)
Genomics와 조합화학이 결합된 분야로 유전자 분석을 통하여 특정 질환에 관련된 단백질 등 생체 내 타깃을 찾고 이와 반응할 수 있는 구조의 화합물들을 대량으로 합성하여 Lead(신약 후보의 구조적 출발물질)를 찾아내는 분야이다.
■ 생명공학과 관련한 기타 학문
❍ 구조생물학(Structural biology)
단백질의 3차원 구조로부터 기능의 정보를 얻으려고 하는 학문적 영역이다.
❍ 나노바이오
생명공학과 나노기술 상호간의 접목을 통하여 생명현상에 대해 분자수준의 이해를 증진시키며, 생명체 유래의 각종 물질들을 나노소재로 응용하는 연구이다.
❍ 뇌과학(Brain science)
뇌의 신비를 밝혀냄으로써 궁극적으로는 인간이 갖는 물리적·정신적 기능성의 전반을 심층적으로 탐구하는 응용 학문분야이다.
❍ 단백질공학(Protein engineering)
기존 단백질 구조와 기능 간의 관계를 규명하고 새로운 단백질을 설계하고 창출하는 기술이다. 아미노산 서열 결정, 유전자조작, 단백질 입체 구조 규명, 단백질의 분리와 정제, 컴퓨터 그래픽스 등의 기술이 요구된다. 신기능 효소, 고활성 효소, 의약용 단백질 개발에 이용된다.
❍ 당쇄공학(Glyco engineering)
천연에 존재하는 당쇄 구조 화합물의 기능․활성 규명, 구조 수식, 유도체 합성 등에 관련된 기술 분야이다. 당쇄 구조 화합물은 세포 간 인식, 정보 전달에 중요한 역할을 하는 것으로 알려져 있다.
❍ 대사공학(Metabolic engineering, Metabolomics)
생명체 대사과정의 네트워크를 각종 정보와 유전자조작 기술을 이용하여 유익한 방향으로 조절하려는 기술분야이다.
❍ 면역유전학(Immunogenetics)
개체간의 면역학적 차이를 연구하는 유전학 분야. 혈액형, 조직적합성, 면역 응답 등에 관련된 정보를 이용한다.
❍ 생명과학
생명현상의 규명으로부터 생물기능의 응용연구에 이르기까지 생명체에 관련된 모든 연구분야를 총괄하는 과학군이다.
❍ 생물정보학(Bioinfomatics)
컴퓨터 기술을 활용하여 유전자와 관련된 정보를 해석하고, 기능과 구조를 밝혀내는 학문분야이다.
❍ 생체공학(Bionics)
생체 기작과 기능에 대한 공학적 지식을 응용하는 학문이다. 생체의 기능을 모방해 생체와 같이 동작하는 기계를 제작하는 기술 등이 포함된다.
❍ 세포공학(Cell engineering)
염색체나 유전자의 인위적인 조작 또는 이전 기술을 통해 유용한 유전자 형질을 발현할 수 있는 새로운 세포를 만들어 내는 기술이다. 세포융합에 의한 잡종 세포 형성을 이용하는 연구나 하이브리도마세포 제작을 비롯해 돌연변이주의 분리법이나 조직배양, 세포배양 기술 등이 포함된다.
❍ 시스템생물학(Systems biology)
생물 시스템을 구성하는 각각 요소의 행동을 해석할 뿐만 아니라, 전 구성 요소의 동적인 상호 관계를 시스템 전체 수준으로 분석해 고차적인 특성을 총체적으로 연구하는 학문이다.
❍ 조직공학(Tissue engineering)
생명과학, 의학, 공학의 기본 개념과 기술을 바탕으로 하여 인공생체조직 또는 기관을 만들어 이용함으로써 생체 기능의 유지, 향상, 복원을 목표로 하는 학문 분야이다.
❍ 환경생명공학(Environmental biotechnology)
생명공학 기술을 이용한 오염물의 제거, 오염지역의 복원, 오염 탐지 및 측정, 생태 시스템 영향 평가 등 환경 관련 기술분야이다.
❍ 혈액학(Hematology)
혈액과 조혈기관에 관련된 사항을 다루는 학문분야이다.
■ 생명공학 용어
❍ 게놈(Genome)
게놈은 유전자(gene)와 염색체(chromosome)의 합성어로서 한 생물체가 지닌 모든 유전정보(DNA)의 집합체를 뜻한다.
❍ 계대배양(Subculture)
미생물이나 동식물 세포를 증식 또는 유지할 때 그 일부를 새로운 배지에 계속 옮겨 배양하는 것을 말한다.
❍ 공통서열(Consensus sequence)
DNA, RNA 및 단백질의 일차 구조상에서, 특정 기능에 관계된 영역에 공통적으로 존재하는 염기나 아미노산 서열이다. DNA와 RNA의 경우, 특정 단백질의 결합 부위인 것이 일반적이다. 예를 들면, RNA중합효소의 결합 부위인 프로모터나 각종 전사 조절 단백질의 결합 부위에서, 각각의 단백질이 결합하는 특정 공통서열을 볼 수 있다.
❍ 과변이(Hypervariability)
셋 이상의 대립형이 나타나는 DNA 염기서열의 변화를 뜻한다.
❍ 광학분할(Optical resolution)
광학 이성질체 혼합물에서 원하는 광학 활성체를 분리하는 것이다. 광학 활성을 지닌 산 또는 염기를 이용하여 한 가지 광학 활성체에 대해서만 광학 활성염을 만든 다음 분리하는 방법이다. 광학 활성 분리용 담체에 의한 크로마토그래피법, 또는 미생물이나 효소에 의해 한 가지 광학 활성체에만 반응을 선택적으로 진행시킨 후 분리하는 방법 등이 있다.
❍ 균사체(Mycelium)
곰팡이나 버섯 등 균류의 몸체를 구성하는 실 모양의 구조체이다.
❍ 글루코사민(Glucosamine)
포도당에 아미노기가 결합된 대표적인 아미노당이다. 자연계에는 키틴을 비롯해 세균의 세포벽, 동물의 연골, 피부를 구성하는 뮤코다당류 등 다당류의 성분으로 널리 분포한다. 혈액이나 점액 속에도 이것과 결합한 당단백질, 당지질이 존재한다. 관절염 치료를 위한 건강식품으로 널리 사용된다.
❍ 기능성식품(Functional food)
생체 방어, 생체 리듬 조절, 질병 예방 등 생체 조절 기능을 충분히 발휘할 수 있도록 설계되고 가공된 식품을 말한다.
❍ 나노기술(Nanotechnology)
10억 분의 1 수준의 정밀도를 요구하는 극미세가공 과학기술분야이다.
❍ 나노바이오테크놀로지(Nanobiotechnology)
나노기술과 생명공학기술이 접합된 형태의 기술 분야. DNA칩, 단백질칩, 초소형 바이오센서, 고속대량스크리닝(HTS) 시스템의 개발과 적용에 핵심적인 분야이다.
❍ 내포체(Inclusion body)
외래 단백질이 숙주세포 내에서 과량 발현될 때 흔히 형성되는 불용성 단백질 덩어리이다. 내포체를 형성하면 단백질이 활성을 잃게 되므로 재접힘(refolding)을 통해 활성화시켜야 한다.
❍ 단백질(Protein)
아미노산을 단량체로 하는 고분자 유기화합물의 총칭으로 세포의 주요 구성 성분이다. 생명현상에 관여하는 효소, 항체, 호르몬 등이 포함된다.
❍ 단백질삼차구조(Tertiary structure of protein)
단백질 사슬 내에서 비교적 멀리 떨어진 기능기 간의 수소 결합, 이황화결합, 소수성 상호작용(hydrophobic interaction)등에 의하여 형성되는 입체 구조. 효소의 활성, 특이성 등 단백질의 기능과 밀접한 관계가 있다.
❍ 단백질칩(Protein chip)
실리콘, 유리 등의 표면에 여러 종류의 단백질을 고밀도로 고정화시킨 바이오칩의 일종이다. 단백질-단백질(항원-항체), 단백질-리간드, 단백질-DNA, 효소-기질 등 단백질이 관여하는 모든 상호작용의 분석에 이용된다. 이를 통해 생명 현상의 이해, 질병의 진단과 원인 규명, 신호 전달 체계의 이해가 가능하며, 궁극적으로 질병의 예방 및 치료법을 개발할 수 있다.
❍ 단세포단백질(Single-cell protein(SCP))
세균, 효모, 사상균, 방선균, 곰팡이, 조류 등의 미생물을 대량 배양하여 균체로부터 추출한 단백질, 사료첨가물이나 식품첨가물, 증량제로 사용된다.
❍ 단일클론항체(Monoclonal antibody)
단 하나의 항원성결정기에만 작용하는 항체로 하이브리도마 또는 재조합 미생물 배양을 통해 생산된다. 미량 물질의 분리, 감염증이나 암 진단과 치료 등과 같은 의료 분야에 있어서 중요한 역할을 한다.
❍ 돌연변이(Mutation)
한 개체의 유전체를 구성하는 염색체나 DNA의 일부에 생긴 영구적인 변화, 염기서열 상의 염기 1개가 다른 염기로 치환된 경우를 점 돌연변이라고 한다. 여러 개의 염기를 포함하는 DNA 영역에 걸쳐 변화가 일어나는 경우도 있다. 생식세포에 생긴 돌연변이는 후대에 전달된다. 체세포돌연변이는 후대에 전달되지 않는다.
❍ 동물자원기술(Animal resources technology)
동물이 생산하는 산물 및 축산 동물의 효율적 생산을 위한 자원 동물의 육종, 사육, 관리 등과 관련된 기술이다.
❍ 동형접합체(Homokaryon)
하나의 세포 내에 유전자형이 다른 두 개 이상의 핵이 존재하는 상태이다. 핵융합이 일어나지 않으므로 세포질 유전 연구에 이용된다.
❍ 루틴(Rutin)
루티노오즈(글루코오즈와 만노오즈가 결합한 이당류)가 결합된 배당체 형태의 플라보노이드. 콩, 팥, 메밀, 토마토, 감귤류 등에 함유되어 있다. 모세혈관의 기능을 정상으로 유지하고 혈관을 튼튼히 하는 비타민P의 작용이 있어 고혈압이나 뇌일혈을 예방하는 데 쓰인다.
❍ 마이코톡신(Mycotoxins)
곰팡이류가 생산하는 독성 물질의 총칭이다. 사람이나 동물에게 급성 또는 만성 장해를 유발한다. 대표적인 것으로 Aspergillus flavus가 생산하는 aflatoxin류가 있다.
❍ 마이크로어레이(Microarray)
기판 위에 DNA나 단백질과 같은 포획 탐침(capture probe)이 미세한 점으로 고정화된 어레이 장치이다. 특정 DNA나 단백질의 분석을 통해 유전질환의 진단, 유전자 발현 모니터링 등에 사용된다.
❍ 면역억제제(Immunosuppressive agents/immunosuppressants)
생체의 면역 반응을 억제하는 활성을 지닌 물질이다. 대표적으로 사이클로스포린 A(cyclosporin A) 등이 있으며 장기 이식 시 거부반응을 억제하기 위해 사용된다.
❍ 면역치료제(Immunotherapeutic)
체내의 면역반응에 관여하는 세포로 단백질로서 치료제로 사용되는 물질이다. 인터페론, 인터루킨 등이 대표적인 예이다.
❍ 미생물(Microorganism)
육안으로는 관찰이 불가능한 미세한 생물체. 일반적으로 크기 0.1mm 이하인 생물체를 의미한다. 주로 단일 세포 또는 균사체로 존재하며, 최소 생활 단위를 유지한다. 세균류, 사상균류, 효모류, 조류, 원생동물류, 바이러스 등이 이에 속한다.
❍ 바이러스(Virus)
숙주세포 내에서만 증식할 수 있는 비세포성 생물체이다. DNA나 RNA 중 하나를 게놈으로 갖는 감염세포 내에서만 증식하는 감염성 미소구조체이다.
❍ 바이오디젤(Biodiesel)
지방산 메틸에스터. 식물성 또는 동물성 지방과 메탄올의 산 또는 염기촉매반응에 의해 생산된다. 그 자체 또는 석유 디젤과 혼합해 연료로 사용되며, 바이오디젤은 재생가능자원인 바이오매스로부터 생산되므로 에너지 자원의 고갈 문제가 없으며, 연소 시 이산화탄소 및 미세분진의 배출량이 경유에 비해 현저히 낮고, SOx는 전혀 배출되지 않는다.
❍ 바이오리파이너리(Biorefinery)
석유 대신 바이오매스로부터 연료와 화학 원료를 제조하는데 필요한 기술의 집합이다.
❍ 바이오매스(Biomass)
식물이나 미생물 등을 에너지원으로 이용하는 생물체를 말한다.
❍ 바이오멤스(BioMEMS)
생물학적 시스템에 극미세 전자 기계 시스템(micro-electro-mechanical systems, MEMS) 기술을 결합한 새로운 기술 분야. 고성능의 극소형 생물 측정 장치나 생화학 반응 장치 등의 제작이 이에 속한다.
❍ 바이오센서(Biosensor)
생체 물질이 갖는 반응 특성과 그 반응에 의해 발생되는 전기 화학적 또는 광학적 신호 등을 이용해 특정 물질을 검출하거나 정량 분석하는 장치이다.
❍ 바이오에너지(Bioenergy)
바이오매스(biomass)와 이를 원료로 하여 생물학적 또는 열화학적으로 생산되는 연료로부터 얻어지는 에너지를 말한다. 경우에 따라서 바이오매스로부터 생산되는 연료를 지칭하기도 한다.
❍ 바이오연료(Biofuel)
생물체(바이오매스 자원)에서 만들어지는 연료이다. 액체 연료로는 에탄올, 메탄올, 바이오디젤, 피셔-트롭쉬(Fischer-Tropsch) 디젤이 있고 기체 연료로는 수소와 메탄이 있다.
❍ 바이오칩(Biochip)
1) 유리, 실리콘 등의 재질로 된 작은 고체 기판 위에 DNA, 단백질 등의 생체 물질을 고밀도로 고정화시킨 마이크로어레이칩이다. 유전자 발현 양상, 유전자 결함, 단백질 분포, 반응 양상 등을 분석하는데 이용된다.
2) 단백질이나 지질, 신경세포 등의 생체 물질로 구성되며, 기본적인 연산이나 정보 처리 기능을 갖는 소자이다. 현재는 싸이토크롬이나 박테리오로돕신 등이 갖는 전자/광 스위치 특성을 이용한 소자들이 개발되고 있다.
❍ 바이오필터(Biofilter)
담체에 고정화된 미생물을 이용해 여러 가지 독성 물질이나 악취 물질을 제거하는 환경 처리장치이다.
❍ 박테리오신(Bacteriocin)
세균에 의해서 생합성되는 단백질로서 항균 효과가 있는 물질의 총칭이다.
❍ 발현벡터(Expression vector)
목적 유전자의 효율적인 발현을 위해 제작된 벡터이다. 전사가 효율적으로 이루어지도록 강력한 프로모터와 적절한 조절 유전자를 갖는다.
❍ 배아
난자와 정자의 수정이 이루어진 후 8주까지(인간의 경우)를 말하며 후에 태아가 된다.
❍ 배아줄기세포(Embryonic stem cell(ESC))
발생 초기의 배반포에서 얻어지는 미분화 상태의 세포로 자가 재생산 능력이 뛰어나 대부분의 조직과 세포로 분화할 수 있다.
❍ 복제 DNA(Cloned DNA)
공여체로부터 분리, 동정된 후 벡터에 삽입된 DNA를 말한다.
❍ 복제동물(Cloned animal)
무성적으로 복제되어 유전적으로 모체와 동일한 동물 개체를 말한다. 난세포에서 핵을 제거하고 모체 체세포의 핵을 이식하는 과정을 거쳐서 복제된다.
❍ 복제장기(Cloned organ)
인간 또는 동물의 장기의 일부분 또는 세포를 이용하여 장기로서의 기능이 가능하도록 배양된 생물학적 인공장기이다. 복제동물의 사육을 통하여 얻을 수도 있다.
❍ 생명윤리(Bioethics)
생명을 의미하는 바이오(bio)와 윤리를 뜻하는 에식스(ethics)의 합성어로 생명윤리 또는 생물윤리로 번역된다. 생명에 관한 윤리와 생물학의 기본원칙에 입각한 윤리의 2가지로 생각할 수 있다. 생명에 관한 윤리는 이제까지 ‘의사의 윤리’, 또는 ‘의료의 윤리’라고 일컬어왔는데, 의료의 발전과 인권의식이 서로 연관되어 넓은 입장에서 생명, 특히 인간의 생명에 대한 간섭의 시비를 검토하게 되었다.
❍ 생명자원
생명자원은 지구상에 존재하는 생물(동·식물, 미생물, 인간세포 등), 생물의 구성물(DNA, 유전체 등) 및 이들의 정보를 포함하는 것으로 배양 가능한 생물체, 복제 가능한 부분, 유전자원, 배양 불가능한 생물체 및 이와 관련된 분자, 생리, 구조적 정보를 포함한다.
❍ 생명정보
생물자원(유전체, 전사체, 단백질체 포함)과 생물다양성으로부터 유래된 정보와 그것의 가공처리 결과물을 말한다.
❍ 생물공정(Bioprocess)
생물체, 또는 생물체로부터 유래된 물질을 이용하거나 대상으로 하는 공정의 총칭이다.
❍ 생물다양성
육상, 해양 등의 수중 생태계와 이들 유기체가 서식하는 생태계를 말하며, 이는 종과 종사이, 또는 종과 생태계 사이의 다양성도 포함한다.
❍ 생물다양성보존(Biodiversity conservation)
생태계에 있어서 종 구성의 다양성과 다양한 종들 사이의 상호작용, 그리고 그 기능과의 상관관계를 활용해 자연 환경을 안정하게 유지하는 것이다.
❍ 생물산업(Bioindustry)
생명공학 기술을 이용하거나 이에 관련된 산업의 총칭이다.
❍ 생물안전성(Biosafety)
생명공학기술과 그 생산물로부터 유래하는 잠재적 위해성을 감소시키기 위한 노력을 지칭하는 용어이다.
❍ 생물융합기술(Biohybrid technology)
생명공학, 마이크로시스템, 센서시스템 등 여러 가지 분야의 기술이 융합된 것이다. 생명공학 연구에 필요한 여러 가지 방법을 자동화, 병렬화, 동기화하기 위해서 개발된 기술이다.
❍ 생물의약(Biopharmaceutical)
생물체 또는 이로부터 유래된 물질을 이용해 생산되는 의약품의 총칭이다. 단백질 치료제, 백신, 항생제, 세포 치료제, 유전자치료제 등이 포함된다.
❍ 생물학적지표(Biological indicator)
생리활성 물질의 효능을 말한다. 환경오염 또는 독성의 정도를 특정 생물을 대상으로 하여 수량적으로 표시하는 지표이다.
❍ 생체고분자(Biomolecule)
생체 내에서 합성되는 거대분자의 총칭이다. 단백질, 핵산, 지질, 다당류가 있다.
❍ 생체모방기술(Biomimetics)
생체의 기능을 다른 재료로 대체하거나 생체 기능을 모방, 이용하는 기술이다. 생체모방화학, 바이오일렉트로닉스, 바이오미캐닉스 등이 포함된다.
❍ 성체줄기세포(Adult stem cell)
조혈기관 상피조직 등의 세포재생계에서 세포생산의 기초가 되는 세포의 줄기세포를 추출하여 치료목적의 조직 세포로 분화한 것.
❍ 세포융합(Cell fusion)
두 개의 서로 다른 세포의 원형질체(protoplast)를 융합하는 것을 말한다. 동시다발적 유전 형질 변환이 가능하다. 식물세포에서는 육종 기술로서 동물세포에서는 단일클론항체 생산을 위한 하이브리도마 세포주를 만드는 데 사용된다. 미생물 분야에 있어서는 곰팡이와 방선균 등의 균주 개발에 이용된다.
❍ 세포치료기술
손상된 조직 또는 기관 부위를 치료할 목적으로 체외에서 세포를 배양하여 체내에 투여하는 치료법이다.
❍ 알츠하이머병(Alzheimer's disease)
퇴행성 뇌질환의 하나로 치매의 원인 중 가장 흔한 형태이다. 병리 조직학적으로는 뇌의 전반적인 위축, 뇌실의 확장, 신경 섬유의 다발성 병변(neurofibrillary tangle)과 초로성 반점(neuriticplaque) 등이 특징이다.
❍ 약물전달시스템(Drug delivery system(DDS))
약물 방출 속도를 조절하거나 약물을 목표 부위에 효율적으로 전달시키는 방법 등을 통해 의약품의 부작용을 최소화하고 효능 및 효과를 극대화시키는 기술 및 시스템이다.
❍ 염기서열
아데닌(A), 구아닌(G), 시토신(C), 티닌(T) 4개의 상이한 코드(염기)로 이루어진 특정 서열로 DNA에 유전정보를 저장한다.
❍ 유전공학(Genetic Engineering)
생물체에 주어진 유전형질을 인위적으로 변형․개조시켜 새로운 형질을 가진 생물체를 만들어내는 기술(세포융합핵치환 단백질공학 유전자 재조합)이다.
❍ 인간화항체(Humanized antibody)
항원을 다른 동물에 주입했을 때 생성되는 항체 구조 중 항원이 결합하는 부위인 상보성결정부위(CDR)에 해당되는 유전자 배열만을 인간 항체 유전자에 대체하는 과정을 통하여, 인간 항체와 특징이 유사하도록 제조된 재조합 항체동물로부터 유래된 부분이 적기 때문에 체내 투여용 항체치료제로 사용하기에 적합하다.
❍ 인공장기(Artificial organ)
장기의 인공적인 대체물을 말한다. 심장, 신장, 간장 등의 대체 장기 외에도 인공혈관, 인공혈관 밸브 등도 포함된다. 인공 재료와 배양 세포를 결합시킨 혼성(hybrid)형도 있다.
❍ 인터페론(Interferon(IFN))
인체세포 내에서 바이러스 RNA와 단백질의 생성을 억제하는 항바이러스 단백질의 발현을 유도하는 기능을 갖는 당단백질의 총칭이다. 생성장소와 기능이 각기 다른 3가지가 있는데 IFNα는 주로 백혈구, IFNβ는 섬유모세포 그리고 IFNy는 주로 림프구에서 생성된다. 항바이러스 작용 외에 면역조절작용도 갖는다. IFNα와 IFNβ는 주로 항바이러스활성을 나타내는 반면 IFNy는 주로 면역조절작용을 한다. IFNα는 자연살해세포의 활성을 증강시키는 작용도 지니고 있다. 산업적으로는 유전공학적인 방법으로 생산이 가능해졌으며, 바이러스 간염의 치료에 사용되며 IFNα는 모발상세포 백혈병의 치료에도 유효하게 사용된다.
❍ 자가면역질환(Autoimmune disease)
자가면역에 의해 생체방어기능을 담당하는 면역계가 자기 세포를 공격해 발생하는 질병. 만성 류마티스성 질환이 대표적인 예이다.
❍ 재조합 DNA 기술(Recombinant DNA technology)
목적 유전자를 제한효소를 이용해 잘라내고 이를 벡터에 삽입해 재조합 DNA를 제작한 후, 숙주에 도입해 발현시키는 과정에 관련되는 기술의 총칭이다.
❍ 전임상(Preclinical)
실험실 차원 및 동물을 대상으로 약물의 생리적 특성과 대상 질병에 대한 효능을 검증하는 것이다.
❍ 제대혈(Cord blood)
태반과 탯줄에 있는 혈액으로 백혈구, 적혈구, 혈소판 등을 만드는 조혈모세포를 다량 함유하고, 연골, 뼈, 근육, 신경 등을 만드는 간엽줄기세포를 가지고 있다.
❍ 줄기세포(Stem Cell)
조직분화 과정에서 볼 수 있는 미분화된 세포. 줄기세포는 신체 내 모든 조직으로 분화될 수 있는 가능성을 가지고 있다.
❍ 줄기세포치료(Stem cell therapy)
미분화된 줄기세포를 적당한 조건 하에서 특정 세포나 조직으로 분화하도록 유도해 손상된 조직이나 장기를 치료하는 기술이다.
❍ 진세노사이드(Ginsenoside)
인삼 사포닌을 구성하는 물질의 총칭으로 현재 약 30여 종이 알려져 있으며 건조 인삼 중 약 3.2% 정도 함유되어 있다. 화학구조의 특성에 따라 프로토파낙사디올(protopanaxadiol, PD)계, 프로토파낙사트리올(protopanaxatriol, PT)계, 올레안(oleanane)계 사포닌으로 구분되며 항암, 혈액 순환 개선, 당뇨의 예방 및 치료, 신장 보호, 치매 예방, 간장 보호, 동맥 경화, 고지혈증, 체질 개선, 피로 회복, 면역 기능 증진과 노화 방지 등에 효과가 있다고 알려져 있다.
❍ 진핵생물(Eukaryote)
핵막으로 둘러싸인 핵과 다양한 세포 소기관을 가지는 세포로 구성되어 있는 생물을 말한다. 원생생물, 조류, 사상곰팡이, 효모, 식물, 동물이 포함된다. 원핵생물과 대응된다.
❍ 체세포돌연변이(Somatic mutation)
발생이 진행 중인 개체 또는 완전한 개체 내에서 방사선이나 다른 원인들에 의해 일부의 체세포에 변화가 일어나 새로운 형질이 만들어지는 현상이다.
❍ 체세포변이(Somaclonal variation)
한 개체에서 단일세포를 떼어내어 재배양했을 때 얻어진 새로운 개체가 원래의 개체와 유전적으로 동일하지 않은 현상이다.
❍ 체세포융합(Somatic cell hybridization)
유전자가 다른 체세포를 접합하여 새로운 유전자형의 세포를 만드는 기술이다.
❍ 치료용효소(Therapeutic enzyme)
치료제로 이용되는 효소 또는 그 제제이다. 혈전용해제로 사용되는 조직플라스미노젠활성인자(TPA: tissue plasminogen activator), 스트렙토카이네이즈(strep-tokinase), 유로카이네이즈(urokinase)와 항혈액응고제인 안티트롬빈 III(antithrombin III) 등이 대표적인 예이다.
❍ 캡사이신(Capsaicin)
고추의 매운맛을 내는 무색의 휘발성 알칼로이드 화합물로 약용과 향료로 이용된다. 진통작용과 체지방 감소 효과가 있는 것으로 알려져 있다.
❍ 클로렐라(Chlorella)
클로렐라과의 비운동성 담수 조류로 건강 보조 식품, 유제품의 원료로 주로 사용된다.
❍ 키토산(Chitosan)
키틴을 탈아세틸화한 물질로 의약 분야에서는 인공 피부, 약물전달시스템 등에 응용되며 환경 분야에서는 응집제로도 사용된다. 세포를 활성화해 노화를 억제하고 면역력을 강화해 주며 질병을 예방해 주는 것으로 알려져 있어 건강 기능 식품의 소재로 사용된다.
❍ 페니실린(Penicillin)
푸른곰팡이(penicillium)가 생산하는 β-락탐계의 4원자 고리화합물의 항생 물질로 세균의 세포벽 구성 성분인 펩티도글리칸의 합성을 저해하는 대표적인 세균 감염증 치료제이다. 모핵은 6-아미노페니실란산(6-amino peni-cillanic acid, 6-APA)으로, 치환기를 화학적으로 수식한 많은 종류의 유도체(반합성 페니실린)가 개발되었다. Flemming(1928)에 의해서 최초로 발견된 후, 생물공학기술에 의해 대량 생산이 가능하게 된 대표적인 생물산업 제품이다.
❍ 펙틴(Pectin)
식물의 세포벽이나 세포벽 사이에 존재하는 다당류의 하나로 주성분은 D-갈락투론산이 α-1,4 결합한 고분자이다. 팽윤성이 뛰어난 수용성 식이섬유로서 섭취 시 포만감을 주나 칼로리는 매우 낮다. 배변활동을 원활하게 하고, 지방흡수 저하, 지방합성 저해, 체지방 분해 등의 작용을 하므로 다이어트 식품의 원료로 사용된다.
❍ 폴리펩타이드(Polypeptide)
대략 10개 이상의 아미노산잔기로 이루어진 펩타이드이다. 단백질과 같은 뜻으로 쓰기도 하나 보통 분자량이 작은 단백질을 가리킬 때 쓰인다.
❍ 표지단백질(Marker protein)
특정 질병 진단의 척도로 사용되는 단백질로 특정 질병 상태에서 발현된다. 일례로 간암의 경우 혈액 내의 알파태아단백(AFP: α-fetoprotein)을 표지단백질로 사용한다.
❍ 표지유전자(Marker gene)
특정 형질에 대한 유전적 해석의 척도로 이용되는 유전자, 유전질환, 약제내성(항생물질 내성 등), 염도 감수성, 영양 요구성 등을 유전적으로 판단하는데 이용된다.
❍ 프로바이오틱(Probiotic)
인간의 건강에 이로운 생균제 식이보조물 또는 생균 성분이다. 유산균 식품과 표모 체제가 대표적이다. Pro(촉진하는) biotic(생명체)의 합성어이다.
❍ 항상성효소(Constitutive enzyme)
세포의 생존, 성장과 함께 항상 발현되는 효소. 일상적인 배양조건 하에서 세포의 일상적인 기능을 수행하기 위한 효소들이 이에 해당된다. 이들의 유전자는 특정 대사물질에 의해 조절되는 작동 유전자(operator)를 가지고 있지 않다.
❍ 항체(Antibody)
생체 내에 들어온 항원에 반응해 만들어지는 당단백질이다. 해당 항원에 특이적으로 결합하며 면역글로블린(Ig)이라고도 한다.
❍ 핵산(Nucleic acid)
푸린 또는 피리미딘 염기, 오탄당(디옥시리보오스 또는 리보오스), 인산기로 이루어진 뉴클레오타이드 중합체이다. 당부분이 디옥시리보오스인 DNA와 당부분이 리보오스인 RNA 두 종류로 대별된다.
❍ 핵이식
어떤 세포로부터 핵을 떼어낸 뒤 다른 세포(핵을 제거한 것)에 이식하는 조작이다.
❍ 형질전환(Transformation)
어느 주의 유전형질 일부를 다른 주에 옮겨 넣는 유전교배의 한 형태로, 공여체로부터 추출한 고분자 DNA를 직접 수용체에 거두어 넣어 그 세포 중에서 재조합하는 경우이다.
❍ 형질전환생물(Transgenic organism)
인위적인 방법에 의하여 외래 유전자가 도입된 동식물과 미생물의 총칭이다. 보통 교잡육종으로는 얻어질 수 없는 형질을 가진 생물체를 말한다.
❍ 호르몬(Hormone)
미량으로도 효능을 나타내는 생리활성 조절 물질이다. 척추동물의 호르몬은 펩타이드계(인슐린, 글루카곤, 뇌하수체 호르몬, 부갑상선 호르몬), 아미노산 유도체계(아드레날린, 갑상선 호르몬), 스테로이드계(성 호르몬, 부신피질 호르몬)로 나누어진다.
❍ 효모(Yeast)
구형의 단세포로 존재하며 주로 출아법에 의해 증식하는 진균류(fungi)의 한 종류로 양조, 제빵 등에 이용되는 Saccharomyces cerevisiae가 대표적이다. Saccharomyces, Hansenula, Pichia 속에 속하는 효모는 재조합 단백질 생산에 이용한다.
❍ 효소(Enzyme)
생체 내에서 만들어지는 단백질 생촉매. 생체 내의 화학반응은 거의 모두가 효소 반응에 의해 촉진된다. 산화환원효소, 전이효소, 가수분해효소, 라이에이즈, 이성질화효소, 라이게이즈의 여섯 가지 종류로 분류한다.
❍ 효소공학(Enzyme engineering)
효소 촉매의 특성, 관련 기술, 물질, 장비를 수단으로 하는 방법과 기술의 총체이다.
❍ 휴면세포(Resting cell)
살아 있기는 하나 증식은 하지 않는 상태의 세포를 말한다. 배양액으로부터 세포를 수확하여 적당한 완충액에 현탁시킬 경우 세포들이 분열 증식을 하지 않는 상태로 상당기간 유지될 수 있다. 포자 등의 휴면형의 세포나 핵분열 사이클의 간기에 있는 세포를 지칭하는 경우도 있다.
❍ B-세포(B-cell)
골수 모세포로부터 유래한 림프구의 일종이다. 일반적으로 골수에서 면역세포로 성숙한다. 항원과 반응해 체액성 면역에 관여하는 항체를 분비하는 형질 세포(plasma cell)가 된다. B-림프구라고도 한다.
❍ DNA중합효소(DNA polymerase)
DNA 중합을 촉진하는 효소이다. 주형(template)DNA의 염기 배열 순서에 맞추어서 이에 서로 상보적인 염기를 지닌 디옥시리보뉴클레오타이드(deoxyribonucleotide, dNTP)를 인산이중 에스터(phosphodiester) 결합으로 연결함으로써 새로운 DNA 사슬을 5’에서 3’ 방향으로 합성한다. DNA의 복제와 회복에 관여하는 중요한 효소이다.
❍ RNA(Ribonucleic acid (RNA))
리보오스, 염기(구아닌, 아데닌, 시토신, 우라실), 인산기로 이루어진 뉴클레오타이드의 중합체로 DNA와 함께 핵산의 일종이다. 전령RNA, 운반RNA, 리보좀RNA(rRNA: ribosomal RNA)의 세 종류가 대표적이다.
❍ T-세포(T-cell (T-lymphocyte))
흉선에서 유래하는 면역 관련 림프구이다. B-세포의 항체생산을 촉진하는 헬퍼 T-세포, 억제하는 억제 T-세포, 특이적으로 표적세포를 상해하는 킬러 T-세포 등으로 나누어진다.

생명공학의 정의 및 범위
1. 생명공학의 정의
가. OECD에서의 생명공학의 정의
지식, 재화 및 서비스의 생산을 목적으로 생물 또는 무생물을 변형시키는 과정에서 생물체, 생체유래 물질 및 생물학적 모델에 과학과 기술을 적용하는 활동을 말한다.
나. Biotechnology Industry Organization(BIO)에서의 생명공학의 정의
생명공학산업기구(Biotechnology Industry Organization, BIO)에서는 생명공학을 “문제해결 혹은 유용제품 생산을 위한 세포 및 생물분자적 과정의 이용”으로 정의하고 있다.
다. 「생명공학육성법」에서의 생명공학의 정의(2008.2.29)
산업적으로 유용한 생산물을 만들거나 생산 공정을 개선할 목적으로 생물학적 시스템, 생체, 유전체 또는 그들로부터 유래되는 물질을 연구․활용하는 학문과 기술을 말한다. 생명현상의 기전, 질병의 원인 또는 발병과정에 대한 연구를 통하여 생명공학의 원천지식을 제공하는 생리학, 병리학, 약리학 등의 학문(기초의과학)을 통칭하고 있다.
라.「제7회 과학기술관계장관회의(2005. 5. 26)」에서의 생명공학의 정의
제7회 과학기술관계장관회의(2005. 5. 26)의「바이오 연구개발의 효율적 추진방향(안)」에 따르면, 생명공학이란 생물체의 기능과 유전정보를 규명하고 이를 이용․활용하여 산업 및 인류복지에 응용하는 과학기술을 총칭한다.
이는 생명과학, 생명공학 및 생명공학 활용 신약개발 관련 화학을 포괄하는 광의의 개념이다. 생물체의 기능과 정보는 생명현상을 일으키는 생체나 생체 유래물질 또는 생물학적 시스템의 탐구로부터 획득이 가능하다.

























