2011 생명공학백서

- 발행일 2012-01-20
- 출처 백서2011(총서 제169권)
- 담당자 오민정 ( 042-879-8378 / mjoh@kribb.re.kr )
- 조회수 16006
-
키워드
#생명공학백서
-
첨부파일
-
 2011생명공학백서.pdf
(다운로드 926회)
바로보기
2011생명공학백서.pdf
(다운로드 926회)
바로보기
-
개요
교육과학기술부에서는 ‘2011 생명공학백서’를 발간하였습니다.
교육과학기술부는 1월19일 국가 생명공학 정책과 국내외 최신 연구동향 및 기술동향, 산업화 등을 살펴볼 수 있는 바이오 관련 종합 정보지인 2011 생명공학백서를 발간했습니다.
생명공학백서는 생명공학분야의 정책 및 기술 동향 등을 국민에게 알리기 위하여 2003년부터 격년으로 발행하고 있으며, 이번이 다섯 번째로 발간되는 해입니다.
2011 생명공학백서에서는 2011년이 제2차 생명공학육성기본계획(Bio-Vision2016)의 2단계 계획을 수립하는 해인만큼 Bio-Vision2016(제2차 생명공학육성기본계획(’07~’16)) 추진성과 및 전망을 특집으로 정부의 지난 5년간 (’06~’11)의 성과를 점검하고, 향후 5년(’12~’16)을 전망하는 내용을 수록하였습니다.
또한 이번 생명공학백서의 새로운 점은, 생명공학이 국가의 신성장 동력으로써 그 성과를 창출하고, 바이오경제 시대를 준비하기 위하여 기술 분야별 산업화 현황을 새롭게 추가하였습니다.
향후, 2011 생명공학백서는 주요부처 및 공공기관 도서관을 통하여 책자로 만날 수 있으며, 보다 손쉬운 활용과 확산을 위하여 온라인과 모바일에서도 제공할 예정입니다.
※생명공학정책연구센터 Bioin사이트와 교육과학기술부사이트에서 전자책(PDF)형태로도 제공

특집 : Bio-Vision 2016(제2차 생명공학육성기본계획(’07~’16)) 추진성과 및 전망
관계부처별 추진성과 및 노력
1.Bio-Vision 2016 1단계(’07~’11) 추진 성과
가. 연구개발 자원(투자, 인력)
정부는 다가오는 바이오경제시대를 대응하고 육성정책을 추진하기 위해 생명공학분야의 투자를 지속적으로 증가하고 있다. 1994년 제1차 생명공학육성기본계획(Biotech 2000)수립 이후 17년간(’04~’10) 정부투자는 총 8조 9,756억원으로 연평균 23.2%의 증가율을 보이고 있다. 특히, 제2차 기본계획 1단계(’07~’10)에는 계획 대비 106%를 초과 투자하여 4조 6.346억원을 투자하였다.
<단계별 투자 실적> (단위 : 억원)
|
1차 기본계획 |
2차 기본계획 |
||||||||||
|
1단계 (ʼ94~ʼ97) |
2단계 (ʼ98~ʼ01) |
3단계(ʼ02~ʼ06) |
1단계(ʼ07~ʼ10) |
||||||||
|
계획 |
실적 |
비율 |
계획 |
실적 |
비율 |
계획 |
실적 |
비율 |
계획 |
실적 |
비율 |
|
5,000 |
3,856 |
77% |
6,149 |
8,976 |
146% |
38,020 |
30,578 |
80.4% |
43,837 |
46,346 |
105.7% |
* 출처 : 연도별 생명공학육성시행계획(생명공학정책연구센터 자료 가공)
부처별 투자는 주관부처인 교육과학기술부가 43.7%(2조238억원)으로 가장 많은 투자를 하고 있으며, 보건복지부 24.4%(1조 1.301억원), 지식경제부 15.6%(7,221억원), 농림수산식품부 8.7%(4,020억원), 국토해양부 5.1% (2,386억원), 환경부 2.5%(1,18억원) 순으로 투자하고 있다.
생명공학분야의 졸업자 배출은 2005년 30,653명, 2007년 35.347명, 2010년 49,111명으로 양적인 측면에서 지속적으로 증가하고 있다. 배출 인력 중에서 고급인력인 석․박사는 양적으로는 증가하였으나, 전체 대비 석사의 비중은 2007년 25.8%에서 2010년 20.3%로, 박사의 경우 2007년 30.3%에서 2010년 27%로 점차 감소하고 있다. 또한, 산업부문에 종사는 산업인력(연구직, 생산직 포함)도 2007년 20,236명에서 2009년 22,817명으로 점차 증가하고 있으며, 고학력자 위주의 인력 구조를 형성하고 있다. 산업현장에서도 마찬가지로 고급인력인 석박사의 비중이 점차 감소하고 있는 추세이다.
나. 공공인프라 구축 및 제도 개선
정부는 제1차 생명공학육성기본계획(Biotech 2000)이후 지속적으로 민간에서 자체적으로 추진하기 어려운 대형 공공인프라 구축을 위해 지속적인 투자를 증가하여 바이오시설 및 구축사업을 확대하고, 지역 산업을 활성화하고 산업화지원을 추진하였다. 정부의 인프라(시설 및 투자) 투자는 2006년 1,291억원에서 2010년 3,426억으로 약 2.5배 증가하였으며, 4년간(’07~’10)에 6개 부처 및 출연연의 시설 및 기반 구축사업으로 총 13개 사업을 신설하였다.
국가 주도의 대규모 생명공학 클러스터 구축을 통해 지역의 산학연관 공동연구 활성화를 지원하고 있다. 오송 보건의료 행정타운의 구축과 운영, 송도 바이오단지 구축, 첨단의료복합단지 구축, 해양바이오산업육성단지 구축 등을 통해 지역 클러스터의 연계를 위해 정부의 지원행태가 다양화되고 확대되고 있다.
생명공학의 산업화 추세에 따라 생명공학의 안전성 확보, 타 분야의 융합 및 산업화 촉진, 바아오산업 및 제약산업의 육성을 위한 제도를 마련하고 있다. LMO 안정성 확보 및 생물다양성 이용에 대한 국가관리 체계 확립으로 ‘유전자변형생물체의국가간이동에관한법률(’08)’발효와 국제협약인 생물다양성협약(CBD)의 능동적인 이해을 위한 제도적 기반인 ‘생물다양성보전및이용에관한법률(’10)’을 제정 추진하고 있다. 또한, 생명공학 발전의 기반을 조성하기 위해 생명연구자원의 효율적인 확보와 체계적인 관리를 통해 지속가능한 활용을 도모하고자 ‘생명연구자원의 확보․관리 및 활용에 관한법률(’09)’을 제정하였다. 바이오산업의 촉진과 제약산업의 경쟁력을 강화하기 위한 제도 정비로 ‘산업융합촉진법(’11)’ 제정과 바이오융합 산업지원 방안을 마련하였고, 제약산업이 체계적인 육성 지원과 국제협력 강화 등을 통한 제약산업의 발전기반인 ‘제약사업 육성 및 지원에 관한 특별법(’11)’을 제정하였다.
다. 국제협력
정부는 국제 연구개발 네트워크 구축, 국제행사 개최 및 민간분야 해외 기술이전 등 국제 협력강화를 추진하였다. 바이오전문인인력 양성 프로그램(’11) 및 한국-말레시아간 기술협정(’09), 국제공동(중미국가) 연구사업(’08~), 해외 생물소재 거점 구축 및 공동연구센터 운영 등을 통해 외국정부 또는 관련 기관 간 생명공학 관련 분야의 협력 협정 체결과 협력 센터 구축을 통한 활발한 연구를 수행하였다.
또한, 바이오코리아(’11) 등 국제 행사를 개최하여 바이오산업의 최신기술을 교류하였고, 휴먼 프론티어(HFSP), 유전체 확보, 해독 및 데이트베이스 구축 등을 위한 인간프로테움(HUPO) 등의 국제공동연구사업 참여와 정보교류를 추진하였다.
라. 과학․기술경쟁력 제고
생명공학 분야의 SCIE 논문 수는 1994년 이후 지속적으로 연평균 19.3%로 급격한 증가를 하여, 제2차 기본계획 1단계(’07~’10)는 23,875건(연평균 12.9% 증가)으로 제1차 3단계(’03~’06) 대비 약 1.5배 증가하였다. 또한 동 시기에 상위 7개국과의 논문 창출역량에서 논문창출 건수의 격차는 있으나, 선진국에 비해 논문창출 역량이 급속하게 성장하였다. 주요 분야의 논문 피인용수 비교에서 지속적으로 증가하였고, 특히 면약학, 얄리학, 미생물학 순으로 논문 피인용수의 증가로 질적 수준향상과 세계 논문경향과 유사한 구조를 형성하였다.
<상위 7개국과의 논문 창출 건수 비교>
|
주요국 |
ʼ07~ʼ10년간 논문 창출(건)(a) |
ʼ03~06년간 논문창출(건)(b) |
증가 (a/b) |
주요국 |
ʼ07~ʼ10년간 논문 창출(건)(a) |
ʼ03~06년간 논문창출(건)(b) |
증가 (a/b) |
|
한국 |
23,875 |
15,819 |
1.5배 |
독일 |
62,277 |
59,129 |
1.05배 |
|
미국 |
298,439 |
363,854 |
0.82배 |
프랑스 |
43,761 |
43,033 |
1.02배 |
|
일본 |
62,859 |
66,127 |
0.95배 |
중국 |
68,903 |
31,766 |
2.17배 |
|
영국 |
62,820 |
64,841 |
0.97배 |
|
|
|
|
* 출처 : 한국생명공학연구원 문헌정보팀(2011)
<국내외 논문 1편당 피인용수(’01~’05)> <국내외 논문 1편당 피인용수(’06~’10)>
|
|
|
|
* 출처 : KAIST 학술정보처(2011)
특허성과는 미국 등록 특허 기준으로 한국특허는 지속적으로 증가 추세를 유지하여 최근 5년간(’06~’10)에 총 418건의 특허가 들록 되었다. 상위 7개국가의 기술력지수의 증가 비교시 특허의 양적․질적 수준이 가장 높게 향상되었다. 선진국 대비 특허 등록 건수는 현저한 차이를 보이나. 특허의 양적․질적 수준인 기술력지수가 가장 급속하게 성장하였다.
또한 주요 응용기술별에서 1차 1단계(’02~’06) 대비 항체이용기술 11.6배, 형질전환동식물개발기술 10.8배, 유전체기술 2.4배, 효소공학기술 2배의 기술력지수가 증가하였고, 2차 1단계(‘’07~‘’10) 동안은 생물공정기술 30, 생물의약개발기술 29.5, 측정진단기술 26.5 순으로 기술력지수가 가장 높았다.
<주요 7개국과의 특허 기술력지수 비교>
|
주요국 |
ʼ07~ʼ10년간 기술력지수(a) |
ʼ02~ʼ06년간 기술력지수(b) |
증가 (a/b) |
주요국 |
ʼ07~ʼ10년간 기술력지수(a) |
ʼ03~ʼ06년간 기술력지수(b) |
증가 (a/b) |
|
한국 |
144 (418건) |
102 (313건) |
1.41배 |
독일 |
754 (1,670건) |
784 (1,876건) |
0.96배 |
|
미국 |
260,092 (19,760건) |
296,000 (22,230건) |
0.88배 |
프랑스 |
287 (743건) |
470 (934건) |
0.61배 |
|
일본 |
863 (2,501건) |
900 (2,349건) |
0.96배 |
중국 |
54 (136건) |
40 (87건) |
1.35배 |
|
영국 |
529 (820건) |
625 (1,012건) |
0.85배 |
|
|
|
|
*기술력지수(TS, Technology Strength) : 특허의 양적수준과 질적수준을 고려한 지표(특허건수*PII)
*PII(Patent impact index) : 특허 기술영향력지수(그 기간의 특허당 피인용수/전체 기간의 특허당 피인용수)
<미국특허로 본 한국의 응용분야별 특허현황>
|
기술분류 |
ʼ02~ʼ06 |
ʼ07~ʼ10 |
증가 (b/a) |
||
|
기술력지수(a) |
순위 |
기술력지수(b) |
순위 |
||
|
생물공정기술 |
18.46 |
10 |
30 |
9 |
1.6배 |
|
측정진단기술 |
17.2 |
16 |
26.51 |
15 |
1.5배 |
|
단백질체기술 |
5.31 |
16 |
7.34 |
16 |
1.4배 |
|
동식물세포배양기술 |
2.66 |
18 |
5.18 |
10 |
1.9배 |
|
생물자원탐색기술 |
4.2 |
12 |
4.4 |
9 |
1.0배 |
|
유전체기술 |
6.57 |
18 |
15.85 |
14 |
2.4배 |
|
항체이용기술 |
0.42 |
14 |
4.89 |
11 |
11.6배 |
|
효소공학기술 |
2.94 |
15 |
5.97 |
11 |
2.0배 |
|
생물농약개발기술 |
4.34 |
10 |
3.33 |
9 |
0.8배 |
|
형질전환동식물개발기술 |
0.28 |
26 |
2.84 |
14 |
10.1배 |
|
생물의약개발기술 |
23.64 |
17 |
29.45 |
17 |
1.2배 |
|
환경생물공학기술 |
16.5 |
5 |
7.73 |
8 |
0.5배 |
* 출처 : 한국특허정보원(2011)
마. 바이오산업 활성화 측면
국내 바이오산업과 의약품 시장규모는 지속적으로 증가하고 있다. 바이오산업의 생산규모는 최근 3년간(’07~’09) 연평균 21.3%의 급격한 증가를 하여 2009년에 5조 6.362억원 규모를 형성하였고, 의약품 시장규모는 2009년 대비 5.1% 성장하여 2010년에 19조 1,437억원 규모을 형성하였다. 2010년도 세계 의약품 시장규모(8,560억달러) 대비 국내 시장규모가 1.9%로 추산되어 전년 대바 시장 점유율이 0.2% 상승하였다.
바이오산업의 업종별 기업 분포에서 2009년에 바이오의약기업이 31.9%(315개), 바이오식품기업 22.4%(241개), 바이오화학기업 14.5%(187개) 순으로 비중을 차지하고 있다. 또한 국내 대기업이 바이오분야에 본격적으로 참여하여 바이오산업의 생태계를 형성하였다. 최근 삼성, LG, SK, 한화 등 대기업들의 바이오 및 의료기기 등 헬스케어 사업에 본격적으로 참여하여 대기업-제약사-바이오벤처-대학 및 연구소간의 교류를 활성화 할 수 잇는 바이오산업의 생태계를 형성하였다.
|
※ 삼성 : 지경부 스마트 프로젝트 참여(’09), 바이오- 헬스분야 신수종사업으로 선정(’10), 바이오시밀러 사업을 위한 벤처 설립(’11), 의료기기 회사인 메디슨 인수(’11), 삼성바이오 로직스 출범(’11) 등 ※ LG : LG생명과학을 중심으로 바이오사업 추진, 바이오시밀러 투자 본격화, 오송첨단의료복합단지 내 바이오시밀러 공장 건설 중, 성장호르몬 ‘벨트로핀’ 미 FDA 임상시험 신청 등 ※ SK : SK에너지의 해양 바이오연료 사업 진출(’08), SK홀딩스의 라이프사이언스 부분을 독립 자회사로 출범(’11), SK케미칼의 바이오화학, 바이오의약품 개발 주력 등 ※ 한화 : 바이오-태양광 등 미래성장동력 사업으로 선정(’09), 오송첨단의료 복합단지 내 바이오시밀러 공장 건설 계획 등 |
|
산업화 성과로는 주요 바이오제품군의 수출액 규모가 꾸준히 증가하고 있으며, 첨단 바이오의약품에 대한 국내 개발 제품의 임상 비중 또한 증가하고 있다.
주요 바이오제품군의 수출액 규모는 4년간(’06~’09)간 연평균 19.8%의 증가로 2009년에 2조646억원의 수출액을 달성하였고, 2006년 대비 사료첨가제는 214배(7,225억원) 동물의약품은 20배(2,660억원)로 수출액 규모가 증가하였다.
국내에서 개발한 첨단 바이오의약품인 유전자재조합의약품, 세포치료제, 유전자치료제의 2010년도 임상시험건수가 전년도 대비 70.6% 증가하여 유전자재조합의약품(단일클론 항체 포함)의 임상건수가 14건, 세포치료제 12건 순으로 가장 많았다.
<주요 바이오제품군별 수출액 규모(’06~’09)>
|
중분류명 |
2006년 |
비중(%) |
2007년 |
비중(%) |
2008년 |
비중(%) |
2009년 |
비중(%) |
|
항생제 |
79,444 |
6.6 |
96,461 |
7.9 |
67,352 |
4.9 |
129,628 |
6.3 |
|
백신 |
63,328 |
5.3 |
136,115 |
11.1 |
216,345 |
15.6 |
349,216 |
16.9 |
|
동물약품 |
13,020 |
1.1 |
15,484 |
1.3 |
17,239 |
1.2 |
266,048 |
12.9 |
|
연구실험용 효소 및 시약류 |
16,842 |
1.4 |
19,078 |
1.6 |
19,227 |
1.4 |
25,056 |
1.2 |
|
아미노산 |
710,829 |
59.3 |
651,862 |
53.1 |
20,774 |
1.5 |
33,900 |
1.6 |
|
식품첨가물 |
289,903 |
24.2 |
261,892 |
21.3 |
274,289 |
19.8 |
296,639 |
14.4 |
|
사료첨가제 |
3,382 |
0.3 |
3,546 |
0.3 |
629,131 |
45.3 |
722,474 |
35.0 |
|
환경오염 측정시스템 |
2,324 |
0.2 |
4,910 |
0.4 |
5,103 |
0.4 |
7,004 |
0.3 |
|
세포칩 |
6,213 |
0.5 |
27,678 |
2.3 |
30,446 |
2.2 |
32,497 |
1.6 |
|
바이오공정 및 분석기기 |
9,049 |
0.8 |
11,114 |
0.9 |
16,596 |
1.2 |
19,908 |
1.0 |
|
연구개발서비스 |
5,078 |
0.4 |
463 |
0.0 |
91,904 |
6.6 |
172,433 |
8.4 |
|
총계 |
1,199,412 |
100.0 |
1,228,603 |
100.0 |
1,388,406 |
100.0 |
2,064,803 |
100.0 |
* 출처 : 연도별 국내 바이오산업 통계(지식경제부 기술표준원)
바. 제2차 기본계획 1단계의 4대전략 14개 실천과제별 계획 수립 및 사업추진 실적
제2차 생명공학육성기본계획(Bio-Vision 2016) 수립 이후 실천과제별 관계부처에서 추진한 계획 및 사업 추진실적을 연도별 시행계획 수립을 통해 지속적으로 관리하였다. 이에 근거하여 관계부처별 계획수립과 사업 추진 실적으로 총 71개의 계획 및 사업을 추진하였다. 추진실적이 가장 높은 실천과제는 추진전략 2에 해당하는 ‘국가 생명공학기초역량 선진화’ 실천과제로 차세대 핵심 환경기술사업 외 16건을 추진하였고, 그 다음은 ‘생명공학연구개발 인프라 확충’ 실천과제로 농생명공학정보 전산화 및 국가 활용 체계 구축외 12건을 추진하였고, 추진전략 3에 해당하는 ‘바이오산업 인프라 확충’ 실천과제로 임상연구 활성화를 위한 임상연구 인프라 구축 외 8건을 추진하였다.
관계부처에서 추진한 이러한 계획 및 사업에서 제2차 기본계획 1단계 기간에서는 기초연구역량을 강화하였고, 연구개발과 산업인프라 확충에 집중하여 원천기술력을 확보하고 산업화 기반을 구축하였다고 판단 할 수 있다.
<실천과별 관계부처 계획수립 및 사업추진 실적(’07~’10)>
|
추진 전략 |
실천 과제 |
부처별 계획 수립과 사업 추진 실적 |
|
국가생명공학육성 추진체계혁신 |
①생명공학분야 전략적 투자 강화 및 효율화 |
생명공학중장기계획 수립 외 9건 추진 |
|
②범부처종합 조정 기능 강화 |
줄기세포 종합계획 추진계획 수립 |
|
|
연구개발 선진화기반 확충 |
③국가생명공학 기초연구 역량의 선진화 |
차세대 핵심 환경기술사업 외 16건 추진 |
|
④환경변화에 대응한 생명공학 인력 양성 강화 |
바이오 실용화 장비 운영기술 교육 사업 외 1건 추진 |
|
|
⑤국제공동연구 및 국제 협력 활동의 내실화 |
국제협력사업 지원 |
|
|
⑥생명공학 연구개발 인프라의 확충 |
농생명공학정보 전산화 및 국가 활용 체계 구축 외 12건 추진 |
|
|
바이오산업의 발전 가속화 및 글로벌화 |
⑦생명공학 실용화/산업화 연구개발 지원 가속 |
2단계 지역전략진흥사업 외 3건 추진 |
|
⑧바이오기업겅쟁력 제고 및 글로벌화 |
의료산업해외마케팅지원센터 해외 핵심검점 4개소 구축 외 1건 추진 |
|
|
⑨바이오산업 인프라 확충 |
임상연구 활성화를 위한 임상연구 인프라 구축 외 8건 |
|
|
⑩기술이전 활성화 및 바이오산업 지원제도 정비 |
바이오시밀러 임상CRO 기반 구축 외 1건 추진 |
|
|
법/제도 정비 및 국민 수용성제고 |
⑪생명윤리 및 바이오 안전성 법·제도 정비 |
형질전환체 안전성 평가기반 구축 외 8건 추진 |
2. 제2차 생명공학육성기본계획 2단계 계획(’12~’16) 수립
가. 추진배경 및 중점 추진 방향
제2차 생명공학육성기본계획의 1단계(’07~’11)가 종료됨에 따라 추진실적을 종합하고, 바이오기술의 급변과 바이오산업의 급성장에 대응하기 위해 국가차원의 중점분야와 산업화를 위한 육성방향을 설정하기 위한 새로운 전략을 모색하기 위해 2단계 계획(’2~’16)을 수립하였다.
2단계 계획의 중점 추진 방향은 1단계의 추진실적과 성과인 원천기술력 확보와 산업화 지원 인프라 구축에 기반하여 중점분야 육성과 바이오산업의 활성화 여건을 마련하는 것이다.
<제2차 생명공학육성기본계획 2단계 계획(’07~’16) 중점 추진 방향>

나. 추진전략과 실천과제
1단계 추진전략과 실천과제를 국내외 환경변화와 국가 차원의 육성 방향에 기반하여 ‘부처 간의 효율적 협력강화’, ‘강점분야의 전략적인 질적 성과 창출’, ‘바이오사업 생태계 활성화 여건 마련’, ‘안전하고 안정된 바이오문화 구축’인 세부적인 추진 방향에 근거하여 2단계 계획에서 4대 추진전략과 15개 실천과제를 수정 보완하였다.
<제2차 생명공학육성기본계획 2단계 계획(’07~’16) 추진전략과 실천과제>
|
추진 전략 |
1단계 실천과제 |
실천과제 보완 방향 |
2단계 실천과제 |
|
1. 국가 생명공학 육성 추진체계 혁신 |
1. 전략적 예산 편성 및 배분 체계 효율화 정비 |
전략적 투자확대 부처간 연계 및 협력강화 기획평가 기능 제고 |
1. 생명공학분야 전략적 투자 강화 및 효율화 |
|
2. 범부처 종합․조정 기능과 실질적 협력 체제 강화 |
|||
|
2. 범부처 종합․조정 기능 강화 |
|||
|
3. 생명공학 정책 분석 평가 및 기획․평가․연계 체계 확충 |
|||
|
3. 생명공학 정책 분석 평가 체계 확충 |
|||
|
4. 생명공학 관련 다부처 통합 대형 사업 추진 확대 |
|||
|
2. 연구개발 선진화 기반 확충 |
1. 국가 생명공학 기초 역량의 선진화 |
수요 맞춤형 R&D 및 인력양성 ABS 대응 등의 국제협력 강화 연구 인프라 활용 제고 |
1. 국가 생명공학 원천기술 역량의 글로벌화 |
|
2. 환경변화에 대응한 생명공학 인력 양성 강화 |
2. 환경변화에 대응한 생명공학 전문 고급인력 양성 |
||
|
3. 국제공동연구 및 국제 협력 활동의 내실화 |
3. 국제공동연구 및 국제 협력 활동의 내실화 |
||
|
4. 생명공학 연구개발 인프라의 확충 |
4. 생명공학 연구개발 인프라의 확충 및 체제 정비 |
||
|
3. 바이오산업의 발전 가속화 및 글로벌화 |
1. 생명공학 실용화 /산업화 연구개발 지원 가속 |
중개연구 확대 산업인프라 기능 강화 기업경쟁력 제고 |
1. 생명공학 실용화 /산업화 연구개발 지원 강화 |
|
2. 바이오기업 경쟁력 제고 및 글로벌화 |
2. 바이오기업 경쟁력 제고 및 글로벌화 |
||
|
3. 바이오산업 인프라 확충 |
3. 바이오산업 인프라 확충 및 연계 활성화 |
||
|
4. 기술이전 활성화 및 바이오 산업 지원제도 정비 |
4. 기술이전 활성화 및 바이오 산업 지원제도 개선 |
||
|
4. 법/제도 정비 및 국민 수용성 제고 |
1. 국민홍보 인지도 문화 저변 확대 |
법령개선 연구진실성 확립 국민수용성 제고 |
1. 생명공학육성법의 정비 및 관련 법령 제도 개선 |
|
2. 생명윤리 및 바이오안정성 법․제도 정비 |
2. 생명공학 연구윤리, 진실성 문화 활성화 |
||
|
3. 국민홍보․인지도․ 문화 저변 확대 |
3. 국민 홍보․인지도 확대 및 생명공학 문화 형성 |
제1장 생명공학의 비전
제2장 세계 주요국의 생명공학 동향
제1절 미국
김현철
한국보건산업진흥원
1. 미국의 생명과학 투자 동향
전세계 생명과학 R&D의 70%가 미국에 의해 수행되는 것으로 알려져 있으나,1) 최근에는 중국, 인도와 같은 신흥국의 역할이 점점 증대되고 있는 추세이다. 주요 연구주체로는 민간기업, 대학, 공공 및 민간연구기관, 연방기관이 있으며 미국 전체 투자규모는 2010년 기준으로 약 1,000억달러(NIH2): 312억달러, 바이오제약회사: 674억달러3))로 추정된다.
미국 연방정부의 R&D 투자는 크게 국가 안보와 관련된 연구비와 기타 연구비 (비안보분야) 두 가지로 나뉜다. 연방정부의 비안보 R&D 분야에 대한 지원은 2004년까지 꾸준히 증가하였는데, 이는 1980년대부터 NIH 예산의 증가가 총비안보분야 R&D 지원의 증대를 가져왔던 것이다. 미국 연방정부차원의 생명과학투자의 대부분은 보건성(Department of Health and Human Services; HHS)의 NIH를 비롯한 그 산하기관에 의해 이루어진다.
NIH의 예산은 1998년부터 2003년 까지 꾸준히 증가하여 2배까지 증가하였다. 하지만, 2003년부터 NIH 연구비는 미국 경제회복 및 재투자법(American Recovery and Reinvestment Act of 2009; ARRA)에 의해 2009년 일시적으로 상승한 것 외에는 실질적으로 정체상태이다. 이에 따라 비국방분야 R&D 투자도 2004년 정점에 이른 후 정체상태에 머물러 있다.

<그림1> 1976-2012년 연방정부 R&D 예산 동향(단위 : 십억달러)
자료: AAAS, 2011
2012년 NIH 요구예산은 320억불로 2010년 대비 7.45억불(2.4%)가 증가된 금액으로 2004년 이후 ARRA에 의한 지원을 제외하고는 2번째로 높은 예산 증가율을 보이고 있다.

<그림2> 1976-2012년 부처별 R&D 예산 동향(단위 : 십억달러)
자료: AAAS, 2011
2. NIH 투자동향
NIH의 주요 예산 요구는 국가선진중개과학센터(National Center for Advancing Translational Sciences; NCATS)의 설립에 관한 것이었다. NIH 예산의 97.5%는 R&D 시설을 비롯한 R&D이며 나머지는 간접비와 연구훈련비이다. 2012년 NIH R&D 예산은 31.2억불에 달할 것으로 추정되는 데 이는 2010년 예산 30.2억불보다 3.3% 증가한 수치이다.

<그림3> NIH의 지원메커니즘별 예산(단위 : 십억달러)
자료: AAAS, 2011
NIH 예산은 주로 경쟁과 동료평가에 의해 선정된 연구자 주도의 Research Project Grants(RPG)를 통해 외부에서 수행된다. NIH 프로젝트의 수는 36,809개(2010년)에서 36,852개(2012년)로 소폭 증가할 것으로 예상된다. 2012년 SBIR 및 STTR 프로그램을 제외한 연구과제 수는 35,177개로 예상된다. NIH는 2012년에 9,158개의 신규 RPG가 지원되는데 이는 228개가 감소한 결과이다. 이 숫자는 2003년과 2004년에 신규 지원된 과제수 10,000개 이상보다 적은 규모이다. RPG에 대한 전체 지원금은 169억불이다. NIH의 최근 몇 년간 과제 경쟁률은 약 20% 수준이나, 최근 신규과제의 감소로 인해 2012년에는 19%정도로 낮아질 것으로 예상된다. R&D contracts 예산은 11.1%이며 2012년에는 2.6% 증가한 35억불까지 증가할 것이다. 연구센터에 대한 지원은 1,440개 센터에 대해 1.3%가 감소한 30억불을 지원할 것이다. NIH의 내부연구(Intramural research)는 2012년 34억불로 1.5% 증가할 것으로 예상되지만 이는 NIH 예산의 1/20 수준이다. NIH는 2012년 후속세대 바이오메디컬 연구자 연구훈련 프로그램에 2.5% 증가한 798백만달러를 배정할 예정이다. Common Fund의 학제간 연구훈련프로그램(Interdisciplinary Research Training Program)의 종료에 따라 330명이 감소된 16,831명의 전일제 훈련과정을 운영하고, 박사전 및 박사후 훈련생들에 대한 지원은 4.0% 증가할 것이다.
2009년 8월 16대 NIH director로 Francis Collins가 되었는데, 그는 국가유전체연구소(National Genome Research Institute)의 전임기관장이었다. Collins가 선정한 5대 우선순위분야는 유전체 및 기타 고효율기술, 중개연구, 글로벌보건, 교육적인 보건의료 혁신, 바이오메디컬연구사회의 활성화이었다. Collins는 2010년 후반 중개연구 이슈를 최우선순위로 두고 신규 NCATS를 제안하였다. 신규센터들은 의료제품의 혁신을 위한 초점(focal point)으로서 기여하게 된다. 이러한 아이디어는 바이오메디컬 연구의 최근 발전에도 불구하고, 최근 수십년간 FDA 승인 신약 수가 감소하고, 바이오기업은 여러 분야의 R&D에 대한 투자를 축소해온 것에 대한 우려로부터 시작되었다.
NCATS는 NIH 내에서 다양한 분야를 함께 포괄하는 프로그램으로 다음을 포함하고 있다.
- 임상 및 중개과학 어워드(Clinical and Translational Science Awards; CTSAs) 임상연구와 연구자훈련에 있어 지역사회를 연계하고 치료제 개발을 가속화하는데 초점을 맞춘 바이오메디컬 연구소 컨소시움 지원
- 희귀질환치료제 프로그램(Therapeutics for Rare and Neglected Diseases(TRND) program): 기초과학적 발견과 인간 임상시험 사이의 격차를 연결함으로써 희귀질환 치료제개발을 가속화함
- 중재적 개발에 대한 신속한 접근 프로그램(Rapid Access to Interventional Development(RAID) program) : 새로운 치료제 개발을 위한 핵심자원에 대한 접근성 제고
- 분자 라이브러리 프로그램(Molecular Libraries Program; MLP) : 연구자들에게 발전하는 biomedical assays에서 사용된 기술에 대한 접근성 제공
- 규제과학에 대한 NIH-FDA 파트너쉽 : 실험적 치료제, 예방제, 진단제에 대한 새로운 지식과 도구를 생성하는 연구

<그림4> NCATS의 추진체계
자료: http://officeofbudget.od.nih.gov
2012년의 핵심추구사항은 선진 바이오메디컬 기술(예: DNA 시퀀싱, 나노기술, 이미징)을 채택 및 촉진하고, 보건의료분야의 판단을 위한 근거기반(예: 비교효과연구)을 발전시키고, 새로운 바이오메디컬 연구자를 유인하는 것이다.
2012년 예산요구 중 기타 주요 분야로는 알쯔하이머병 뿐만 아니라 오바마 행정부 출범시 중점을 둬왔던 암과 자폐증이 있다. 또한, NIH는 인간 유전체 시퀀싱 비용을 지속적으로 낮추려고 노력하고 있는 데 2010년 5만불에서 2012년에는 1만5천불까지 낮추는 것을 목표로 하고 있다.
아울러, 금액은 적지만 정책적 관심 분야였던 인간배아줄기세포연구는 2009년 3월 오바마 대통령이 연방정부의 지원을 2001년 8월 9일 이전에 생성된 배아줄기세포주에 대한 연구로만 제한했던 전임대통령의 2001년 정책을 변경하였다. 인간배아줄기세포연구를 위한 수정된 NIH 가이드라인은 불임 치료 이후 남는 기증된 인간배아로부터 생성된 세포주에 대한 연구도 허용하고 있다. 오바마의 정책시행 2년 만에 91개의 줄기세포주가 NIH 인간배아줄기세포 레지스트리에 대해 승인받게 되었다. 그러나, 최근 법원의 줄기세포 정책에 대한 법원의 이의제기에서 볼 수 있듯이 배아줄기세포연구에 대한 연방정부지원에 대해 의문을 갖게 만들었고 아직도 해결되지 않은 채로 남아있다.
3. 기타 기관 투자동향
미국 농무성의 경우 2012년 예산으로 농업 및 음식 이니셔티브(Agriculture and Food Research Initiative, AFRI)에 325백만달러를 제안하였는데 이는 2010년 262.5백만달러보다 62.2백만달러가 증가된 금액이다. 주요 우선순위 분야는 바이오에너지, 글로벌 기후변화, 국제음식안전, 통합된 음식 안정성연구프로그램, 영양 및 비만예방, 대학원생교육 등이 있다.
미국 과학재단의 경우 생물과학(BIO) 분야 2012년 요구예산은 794.49백만달러로 이는 2010년 예산 714.54백만달러보다 79.95백만달러(11.2%) 증가한 금액이다. 2012년 주요 지원 분야와 요구예산은 분자 및 세포과학(Molecular & Cellular Biosciences; MCB) 20.13백만달러, 통합 유기체 시스템(Integrative Organismal Systems; OS) 15.40백만달러, 환경생물학(Environmental Biology; DEB) 13.85백만달러, 생물학적 인프라(Biological Infrastructure; DBI) 9.09백만달러, 신생 프론티어(Emerging Frontiers; EF) 21.48백만달러가 있다.
세계 주요국의 생명공학 동향: 일본
2011년 9월 30일
산업연구원 최윤희
1. 개요
20세기에 들어서면서 생명공학기술은 급격히 발전하여 왔다. 전 세계적으로 직면하고 있는 자원과 에너지의 고갈, 지구 온난화에 따른 환경 변화, 급속한 고령화 등의 문제들은 장기전으로 돌입하고 있는 경기 침체와 경제 위기 속에서도 생명공학기술의 경제사회적 역할 확대를 더욱 기대하고 있다. 대표적인 고령화 사회인 일본 역시 “건강한 장수사회의 실현”이라는 목표에 이어 “성장형 장수사회의 실현”을 위해 생명공학 분야의 정책적 육성에 더욱 매진하고 있다.
일본은 전 세계가 함께 겪고 있는 여러 가지 환경 변화와 위기에 더하여 2011년 3월 동일본 대지진과 원자력 발전 사고라는 커다란 시련을 경험하면서 지금까지 효율 우선의 경제 지상주의에서 벗어나 “국민이 안심할 수 있는 질 높은 생활의 실현”을 목표로 하도록 국가 정책 초점을 전환하고 있다. 2010년부터 논의가 시작되어 2011년 수립되어 향후 5년간 시행될 제4기 과학기술기본계획에서 제시하고 있는 일본의 과학기술 정책이 중장기적으로 지향해야 할 5가지 국가 모습에도 이러한 내용이 잘 나타나고 있다. 자원 및 에너지의 제약과 고령화와 같은 범 지구적 문제를 극복하고 이를 새로운 산업과 고용 창출로 연결하고자 하는 “지속적인 성장을 이룰 나라”에 이어 사회구조 변화에 대응하면서 “안전하고 풍부하며 질 높은 국민생활을 실현하는 나라”가 그것이다. 이를 위하여 녹색 혁신(Green Innovation), 생명 혁신(Life Innovation)의 2대 핵심 혁신 추진에 더하여 안전․안심 혁신(Safe․Security Innovation)을 3대 핵심 혁신으로 제안하고 있으며, 이중 생명 혁신이 생명공학 분야에 해당된다.
2. 일본의 생명공학정책
일본 정부는 과학기술기본계획과 신성장전략기본정책 등을 통해 생명공학 분야의 경쟁력을 강화하는 정책을 실시하고 있다. 2011년 5월에 각의 결정된 정책 추진 지침에서는 생명공학 분야의 혁신 활성화를 위해 ①개별화된 의료 추진계획, ②재생의료 추진계획, ③바이오벤처 재활성화 계획이 3대 핵심전략으로 제시되고 있다. 이와 연관된 주요과제로 연구개발 체제 부문에서는 게놈 연구와 같은 신약 개발 방법의 세계적인 경쟁력 확보, 관계 부처간 제휴를 강화하고 자금 투입 및 예산 배분을 전략적으로 개선, 국제 경쟁력을 갖춘 임상시설의 공통 기반을 통합 및 집약하여 글로벌화 대응, PMDA(의약품 의료기기 종합기구) 체제 강화와 상담 기능의 확충 등이 도출되었다. 또한 평가 및 관련 제도 부분에서는 진료 과정에서 혁신 성과를 적절히 평가하여 연구개발에 대한 투자 회수가 이루어질 수 있도록 하며, 환자의 신약 접근 기회 확대, 바이오뱅크와 같은 인프라와 유전자 차별 금지를 포함하는 법․제도를 재정비하여야 한다고 정책 과제가 제안되었다. 2009년 12월에 수립된 신성장전략 기본정책(Basic Policy for New Growth Strategy)에서는 2020년 시장규모 45조엔 및 신규고용 280만명 창출을 목표로 의료․간호 및 보건관련 산업을 성장산업으로 육성하고, 연구개발 성과의 제약 및 의료기기 분야 응용을 촉진하며, 아시아와 여타 해외시장 진출을 촉진하고자 하는 3대 추진방향이 설정되어 있음을 확인할 수 있다.
일본 생명공학정책의 최상위 기구는 내각총리대신이 위원장으로 있는 바이오기술전략위원회이며, 위원 구성은 내각총리대신, 내각총리장관, 과학기술정책장관, 교육, 농업, 산업, 보건, 환경의 5개 관계부처장관, 그리고 12명의 민간 전문가로 이루어져 있다.
2009년 기준 일본 과학기술 분야 예산 중 생명공학 분야 예산은 3,461억엔이었으며, 경제산업성, 문부과학성, 후생노동성, 농림수산성 등 4개 부처가 관련 예산의 대부분을 집행하면서 민간과의 협력을 추진하고 있다.우선 문부과학성(MEXT)은이화학연구소(RIKEN), 정보시스템연구기구(ROIS) 등 국책연구소와 대학에서에 연구개발을 지원하고 있다. 경제산업성(METI)은 신에너지․산업기술총합개발기구(NEDO),일본산업기술총합연구소(AIST) 등 연구소를 지원하고 있으며, 일본바이오인더스트리협회(JBA) 및 바이오테크놀러지개발기술연구조합(RBA) 등과 같은 산업계 단체와 협력하고 있다. 후생노동성(MHLW)은제약, 의료기기, 진단제의 개발을 지원함과 동시에 관련 제품의 규제를 담당하고 있으며, 휴먼사이언스진흥재단(JHSF)을 통해 산업계를 지원하고 있다.
일본은 지방정부 차원에서 산업클러스터 설립을 적극 지원하고 있으며 생명공학에 초점을 맞춘 산업 클러스터로는 홋카이도, 간토, 긴키 지역을 들 수 있다. 수도권에 해당하는 간토지역에는 도쿄와 요코하마 클러스터에 다수의 대학과 연구소가 연계되어 신약개발과 의료장비, 게놈 등 분야의 핵심기술을 보유하고 있다. 대표적인 기관으로는 도쿄대학 의과학연구소, AIST 츠쿠바 임해부도심센터, RIKEN 요코하마연구소, 카즈사 DNA연구소 등이 있다. 관서지방을 대표하는 긴키지역에는 고베의 KTI(Kobe Tissue Engineering Initiative) 클러스터가 인공피부 등 조직재생 분야에서 두각을 나타내고 있다. 홋카이도 클러스터에는 홋카이도 대학과 오비히로 대학에서 차세대 포스트 게놈 연구를 추진하고 있으며, 동식물 관련 생명공학 분야의 핵심역량을 보유하고 있다.
생명공학 분야의 인허가 기구로는 우리나라의 식약청 기능에 해당하는 의약품의료기기총합기구(PMDA)가 후생노동성 산하에 있다. 후생노동성은 의료산업의 경쟁력 강화를 위한 규제 개혁의 일환으로 신약승인 기간 단축, 해외 임상시험 자료 인정요건 공식화, 임상시험 관련 국제 협력 강화 등을 위해 노력하고 있다.
3. 일본의 생명공학 연구개발 및 산업 현황
가. 일본의 생명공학 연구개발 현황
일본의 생명공학 연구는 크게 생명과학 분야와 임상의학 분야로 나누어 이루어지고 잇다. 이 중 생명과학 분야에 해당하는 세부 분야로는 ①게놈과학 및 융합, ②뇌신경, ③발생 및 재생, ④면역, ⑤암, ⑥그린테크놀로지, ⑦건강, ⑧생명윤리의 8개 분야가 있으며, 임상의학 분야에는 ①의약품 개발, ②의료기기 개발, ③재생의료, ④유전자 치료, ⑤이미징, ⑥규제의 6개 하위 분야가 있다. 일본은 대부분의 세부 분야에서 미국에 뒤이어 유럽과 유사한 수준의 경쟁력을 보유하고 있는 것으로 평가되고 있다4). 특히 발생 및 재생 분야, 면역 관련 분야, 임상의학 분야에서는 국제적 우위를 점유하는 높은 기술력과 기초연구 수준을 점유하고 있다. 재생의료의 경우, 세포치료제의 연구수준이 매우 높고 줄기세포 관련 기초연구와 임상연구에서 국제적 경쟁력을 보유하고 있다. 반면, 상업화 및 실용화를 위한 응용기술개발이나 산업 기술력 수준은 미국에 비해 낮은 경향을 나타내고 있다고 자체적으로 평가하고 있으며, 우리나라의 신속한 기술 도입와 실용화 경쟁력에 대해서 관심을 표명하고 있다.
최근 발생한 후쿠시마 원전 사고와 같은 재해에 대한 생명공학의 기여, 환경다양성과 국민의 건강 향상에의 기여 등 생명공학 연구개발에 대한 다양한 요구가 일본 내부적으로 나타나고 있다. 이러한 다양한 요구에 부합하면서 기존의 한계를 극복하고 융합기술 시대에 적합한 연구개발 이루어 질 수 있도록 향후의 정책적 지원, 제도 개선, 연구체제 개편 등이 구상되고 있다. 재생의료 분야의 경우, 일본이 세계적 경쟁력을 보유하고 있는 iPS 세포(인공 다능성 줄기세포)의 기초 연구개발 성과를 토대로 전임상 및 임상 연구까지 연계하는 연구개발이 2011년부터 계획되고 있다. 또한 고속 DNA Sequencer나 이미징 기술의 급속한 진전으로 패러다임 변화에 직면하고 있는 게놈 및 융합 분야에 대해서는 생명공학의 기반이 되는 연구개발인 “기반 및 융합 분야”와 의료로의 응용을 지향하는 “응용 분야”로 나누어 2011년 6월 주요 연구과제를 도출한 바 있다5).
나. 일본의 생명공학산업 현황과 전망
일본 내에서 조사되는 2010년 일본 생명공학산업의 시장 규모6)는 2조 4,322억엔으로 2009년 대비 4.5% 증가한 것으로 나타났다. 이 중 유전자재조합기술, 세포융합기술 등을 이용해 제조하는 이른바 유전자공학제품 시장은 전체 생명공학시장의 62%를 차지하는 1조 4,966억엔으로 2009년 대비 7.2% 성장하였다. 유전자공학제품을 제외한 생명공학 제품 및 서비스시장은 9,355.7억엔으로 2009년 대비 성장률이 0.4%로 답보 상태로 보여진다.
<표 1> 2010년 일본 생명공학산업 시장 규모
(단위: 억엔, 비중)
|
년도 |
2009년 |
2010년 |
증가율 (%) |
|
유전자공학제품 |
13,959.50 (60%) |
14,966.00 (62%) |
7.2 |
|
그 외 제품 및 서비스 |
9,320.50 (40%) |
9,355.70 (38%) |
0.4 |
|
생명공학산업 전체 |
23,280.00 (100%) |
24,321.70 (100%) |
4.5 |
자료: Nikkei Biotechnology & Business사, 일경바이오연감, 2011
국제적으로 평가되는 일본 생명공학산업 시장은 일본 내 조사 결과와 차이를 나타내는데, Datamonitor에 따르면 2009년도 기준 일본의 생명공학시장 규모는 337억 달러로 2008년 대비 6.3% 증가하였으며, 2005년부터 2009년간 연평균 증가율은 13%로 나타나고 있다7). 여기에서 일본 내 평가 자료와의 차이는 생명공학산업 시장에 대한 정의의 차이에서 기인하는 것으로 추정된다.
<표 2> 해외에서 보는 일본 생명공학산업 시장 규모
(단위: 억 달러)
|
년도 |
시장 규모 |
증가율(%) |
연평균 증가율(%) |
|
2005년 |
207 |
- |
13% |
|
2006년 |
223 |
7.9% |
|
|
2007년 |
247 |
10.6% |
|
|
2008년 |
317 |
28.7% |
|
|
2009년 |
337 |
6.3% |
자료 : Biotechnology: Global Industry Guide, Aug. 2010, Datamonitor
Datamonitor에 의하면 2005년부터 2009년간 일본 생명공학산업 시장 중 보건의료 분야는 40% 수준을 차지하고 있으며, 식품 및 농업 분야가 29%로 뒤를 잇고 있다. 일경바이오연감에는 2009년도 일본의 생물학적 의약품 시장은 7천억 엔으로 전체 생명공학산업의 30% 수준으로 나타나고 있는데, 이 역시 시장의 범위에 대한 차이에서 기인한다고 본다.
일본 유전자공학제품 중 가장 비중을 크게 차지하고 있는 제품은 항체의약품과 유전자조합농작물(GMO)이다. GMO의 경우, 미국을 중심으로 경작면적이 확대되면서 전 세계적 생산량이 크게 증가하였고 이와 동반하여 일본의 수입량도 증가한 것으로 보인다. 하지만 2010년의 경우, GMO의 일본 수입량이 양적 증가에도 불구하고 실질 수입 금액은 엔고의 영향을 받아 2009년과 유사하게 나타나고 있다. 일본 내부적으로는 2009년에 산토리사가 개발한 유전자조합 장미의 상업적 재배가 시작되면서 일본이 명실상부한 GMO 생산국으로 진입하였다.
유전자공학제품 중에서 2010년 시장에서 가장 큰 폭으로 성장한 제품은 항체의약품이다. 일본의 항체의약품 시장은 2009년 1,850억엔에서 2010년 2,750억엔으로 증가하여 48.6%의 급성장세를 나타냈으며, 주요제품으로는 타나베미츠비시제약(田辺三菱製藥)의 인간TNFα단일클론항체, 항혈관내피세포성장인자 항체 등이 있다.
<표 3> 일본 생명공학산업 시장 구분(2005년-2009년)
|
구 분 |
비중 |
|
보건의료 (Medical/Health Care) |
40.0% |
|
식품 및 농업 (Food & Agriculture) |
29.0% |
|
기술 서비스 (Technology Service) |
10.0% |
|
환경 및 공정 (Environment & Industrial Processing) |
19.0% |
|
서비스 제공 (Service Provider) |
2.0% |
|
합 계 |
100% |
자료 : Biotechnology: Global Industry Guide, Aug. 2010, Datamonitor
생명공학산업을 구성하는 중요한 축이라고 할 수 있는 바이오벤처기업의 경우, 1994년 102개사에서 2006년 586개사로 연평균 15.7%로 성장하여 왔으나 2007년 577사로 소폭 감소하였고 이후 괄목할만한 증가세는 나타내고 있지 않다. 일본 생명공학산업의 주역이라고 할 수 있는 제약기업의 경우, 해외 시장 진출을 위해 지속적으로 노력하고 있다. 1990년 해외에 진출한 일본 제약기업은 91개사였는데, 2006년에는 290개 제약회사가 해외에 진출한 것으로 조사되었다8). 특히 주목되는 점은 중국에의 진출 비중이 크게 증가하였다는 것으로 1990년에는 전혀 없었던 중국 진출 제약기업의 수가 2006년 32개사로 조사되어, 향후 더욱 성장할 것으로 예측되는 중국 시장에 일본기업들의 진입 노력을 확인할 수 있다.
<표 4> 일본 제약기업 해외 진출 현황
단위: 개사
|
|
미국 |
영국 |
독일 |
프랑스 |
중국 |
대만 |
기타지역 |
총 계 |
|
1990년 |
22 |
3 |
8 |
7 |
0 |
16 |
35 |
91 |
|
2006년 |
65 |
29 |
16 |
9 |
32 |
17 |
122 |
290 |
자료: Yano Economic Research Institute 및 일본바이오인더스트리협회(JBA), 2009년
일본의 생명공학 기업공개(IPO)는 2002년 시작되었고,9) 2009년 기준 IPO 기업은 총 27개사에 이른다. 이 중 16개사는 Mothers시장, 11개사는 Centrex, Hercules 및 Jasdaq NEO에 상장되었다. 2009년의 기업공개 사례로는 JCL Bioassay, Tella Inc., CanBas Co. Ltd., D. Western Therapeutics 등의 4개사를 들 수 있다10).
세계시장의 약 10%를 차지하고 있는 일본 제약산업은 주요 수출국이었던 미국의 제도 및 환경 변화, 주력제품의 물질 특허 만료로 인한 어려움 등을 극복하기 위해 노력하고 있다. 그 일환으로 생명공학 제품 파이프라인의 확보와 인도 등 신규 해외 거점 마련 등을 위해 해외기업들과의 M&A나 전략적 제휴 역시 지속적으로 추진하고 있다. 특히, 일본의 시장 점유율이 64%11)에 달하고 있는 아시아태평양지역의 생명공학산업에서의 경쟁력을 제고하기 위하여 일본은 중국과 인도 시장에의 진출에 박차를 가하고 있다. 이러한 노력을 통해 향후 일본 생명공학산업은 2009년부터 2014년간 연평균 성장률 8.8%로 성장할 것으로 전망되고 있으며 2014년에는 515억 달러 규모의 시장이 예측된다12).
<표 5> 일본 제약기업의 주요 M&A 사례
|
시 기 |
일본기업 |
해외기업 |
금액 |
|
2007년 3월 |
Eisai |
Morphotek |
$325 m |
|
2007년 12월 |
MGI Pharma |
$4.1 m |
|
|
2007년 11월 |
Astellas |
Agensys |
$430 m |
|
2008년 1월 |
Takeda |
Amgen |
$900 m |
|
2008년 4월 |
Millennium |
$8.8 b |
|
|
2008년 5월 |
Daiichi Sankyo |
U3 Pharma |
$235 m |
|
2008년 6월 |
Ranbaxy |
$4.9 b |
|
|
2009년 8월 |
Hisamitsu |
Nove |
$413 m |
|
2009년 10월 |
Dainippon Sujmitomo |
Sepracor |
$2.6 b |
자료 : BioJapan 2009, 2009년
제 3절 유럽연합(EU)
1. 유럽연합의 생명공학 주요정책동향
유럽 생명공학 동향 관련 주요정책 및 과제는 “연구와 기술개발을 위한 프레임워크 프로그램(Framework Programme for Research & Technological Development)”에 나타나 있다. 현재 7차 프레임워크 프로그램(FP7)이 2007년부터 시작되어 2013년까지 진행되며, 전체 예산은 505억 유로이다.
FP7의 4개의 특정 프로그램들과 1개의 핵연구프로그램 중 생명공학과 관련이 있는 프로그램은 협력 프로그램으로써, 총 10개의 세부 프로그램이 있고, 그중 건강과 식품․농업․생명공학 세부 프로그램들이 생명공학 관련분야에 해당된다.

[그림] FP7 협력 프로그램의 중점추진분야별 예산 (백만 유로)
그 첫번째로 건강 세부 프로그램은 협력 프로그램의 주요주제이며, FP7 기간 동안 60억 유로의 예산이 배정되었으며 이는 전체 협력 프로그램 예산(324억 유로)의 18.5%에 해당한다. 이와 관련된 대표적 연구는 미생물 저항, HIV/AIDS, 말라리아, 결핵, 유행병 등이다.
주요 지원 분야는 기초적 발견들의 임상적용, 새로운 치료법의 개발과 확인, 연구결과의 커뮤니케이션, 건강증진과 질병예방 방법, 진단기법과 기술, 지속가능하고 효율적인 헬스케어 시스템의 개발 등이고, 주요 연구사업은 인류건강을 위한 생명공학 및 유전공학기술, 인류 건강을 위한 전이연구, 헬스케어를 유럽시민들에게 파급 최적화 등이다.
두 번째로, 식품․농업․바이오테크놀로지 세부 프로그램의 목적은 유럽 지식기반 바이오 경제를 구축하는 것으로, 유럽연합국가들은 FP7 기간 동안 19억 유로(전체협력과제 대비 5.9%) 이상을 배정하기로 하였다.
FP7에 이어 FP8은 유럽이 직면하고 있는 도전과제와의 연관성, 연구경영 및 관리 개선, 상호보완적 접근, 로드맵 기반의 연구 수행 등에 중점을 두고 2014년부터 2020년까지 진행 될 예정이다. 이를 위해 2011년 현재, 전문가 미팅과 consultation 및 연구주제의 우선순위에 대한 토의가 유럽연합과 유럽국가 차원에서 이루어지고 있다.
이 외에도 2010년에 지속가능한 포괄적 성장을 위해 발표된 유럽 2020 전략은 기술과 제품의 영역을 넘어 서비스 혁신이 갖는 의미와 정책적 권고사항 및 응용서비스 개발 추진 필요성 등을 세부전략으로 제시하였다. 유럽연합 GDP 대비 3%를 R&D에 투자하는 것을 목표로 삼고 있으며, 생명공학 관련 기술을 유럽의 지속적 경제성장을 위해 필수적인 기술로 정의 하고 있다.
참고자료
1. FP7-factsheets www.cordis.europa.eu/fp7
2. EUROPE 2020 - A European strategy for smart, sustainable and inclusive growth, European Commision
2. 주요국가의 현황
가. 영국
영국 내에서 생명과학 산업은 세계적으로 성공한 산업의 일례로, 현재 유럽에서 선두에 있으며 또한 미국의 뒤를 이은 세계에서 두 번째라는 위치를 차지하고 있다. 2003년에 발표한 장기발전 계획 BIOSCIENCE 2015에 따르면, 영국 정부는 생명과학 분야에서 global leader 로서의 현재의 위치를 확고히 다지고자 정부차원에서 적극적으로 나서고 있다.
또한, 이를 위해 영국 정부는 기존의 Department of Trade and Industry (DTI)에서 2009년 6월 28일 새로운 Department for Innovation, Universities and Skills (DIUS)을 분리하여 조직했다.
주요 동향의 실제적인 예로, 기초적인 줄기세포 연구를 실제치료에 적용시키는 것을 실현시키고자 2006년 7월에 발족된 영국 줄기세포 네트워크에 3년 동안 매년 30만 달러 (150K pounds), 조류 독감 연구에 920만 달러 (4.6M pounds), 작물연구에 2천 660만 달러 (13.3M pounds)가 지원되었다. 그리고 2009년 3월, DTI 장관은 실제 이용될 수 있는 바이오 에너지 분야의 주도권을 잡기위해서 바이오에너지 프로그램에 4천만 달러 (20M pounds)를 지원하겠다고 발표한바 있다.
2010년 1월에 발표된 The Age of Bioscience-Strategic Plan 2010-2015에 따르면, 집중 연구되어야 할 주요 주제는 크게 식량안보, 바이오에너지 및 산업생명공학, 건강유지를 위한 기초생명공학의 3가지이며, 영국은 향후 인류가 맞이하고 있는 주요 도전과제에 대한 해결책 제시를 중심으로 생명공학 연구를 이어나갈 전략을 마련하였다. 이에 따라, 2010년 3월에는 Global Food Security programme이 마련되었으며, 혁신 및 기술 개발과 국제협력 등에 대한 지원을 강화하였다.
영국은 국내의 독자적 연구 외에도 기존의 유럽연합, 미국, 중국, 일본, 인도 그리고 2009년 3월 새롭게 맺은 브라질과의 연구협력을 통해서도 과학기술의 발전을 꾀하려 적극적으로 노력하고 있다.
참고자료
1. Annual Review 2006/07, Annual Delivery Plan Report 2006-07 by Research Council UK (RCUK)
2. Annual Report & Accounts 2006-2007/2009-2010, International 2007 (report), The Age of Bioscience-Strategic Plan 2010-2015 by BBSRC (Biotechnology and Biological Sciences Research Council)
3. Bioscience 2015 (2003) by the Bioscience Innovation and Growth Team
4. Annual Report and Accounts 2006-2007 by EPSRC (Engineering and Physical Sciences Research Council)
5. Homepage of "Department for Innovation, Universities and Skills (DIUS)" http://www.dius.gov.uk/pressreleases/press-release-20070720.htm
나. 독일
독일은 유럽국가들 중에서 가장 많은 약 500개의 생명공학 관련 회사들이 있으며, 20개 이상의 기업이 주식 시장에 상장되어 있고, 59개의 기업이 혁신적인 기업으로 분류되어 있다. 또한 매출의 거의 50%를 연구개발에 재투자하며 이 금액이 2005년도에 1억 유로를 넘어섰다.
2010년도 생명공학분야에 투자된 금액은 급격히 증가하여 7억유로에 달했는데, 이는 전년에 비해 벤처 자본 126% 증가, 공공지원금 12% 감소된 금액이다.

[표] 독일 생명공학 기업의 재원(2011)
www.biotechnologie.de 또한 독일은 해외 생명공학 기업들에게 협력을 위한 문호를 개방하고 있다. 진단에서 제약, 녹색생명공학에서 나노생명공학까지 외국기업들은 수월하게 파트너쉽 기회를 찾을 수 있으며 특히 건강/의약 분야 생명공학기업들의 80%가 외국 기업과 협력하고 있다.
2000년부터 2004년 사이에 유럽특허사무소에 등록된 전세계 생명특허의 30%가 독일에서 나온 것으로, 다른 유럽국가들보다 월등히 많은 특허를 보유하고 있다. 과학적 발견을 상업화하는 기술이전 분야에서도 유연한데, 기업은 효율적인 기술이전을 수용하기 위하여 대학과 연구기관들과 협력적인 파트너쉽을 개발하고 있다.
독일 생명공학 기업에서는 의료관련 분야의 활동이 가장 활발히 이루어지고 있으며, 약품 또는 진단법 개발에 중점을 두고 있는 것으로 나타났다.
1995년부터 2011년 사이에 독일에서는 생명공학 기업이 70개에서 약 500여개로 증가하였는데, 독일 생명공학산업의 성장은 신기술을 지원하는 정부의 전례 없는 지원을 얻어서 더욱 가속되고 있다. 독일연방교육연구부는 "BioChance", “Bioindustries 2021", "GO-Bio"등의 프로그램을 통해 생명공학기술 활성화를 지원한다.
참고자료
1. Biotech "Made in Germany", Invest in Germany 社
다. 프랑스
프랑스의 생명공학 연구는 처음에 제약회사에서 시작되었으나 갈수록 생명공학관련 회사로 확대되고 있다. 15%의 신약이 제약회사가 아닌 생명공학 회사에서 개발되고 있으며, 2010년도에는 40%에 육박할 것으로 예상된다. 제약분야를 넘어서, 생명공학은 생명산업, 환경 및 농업분야에서 갈수록 중요한 역할을 하고 있다.
생명공학관련 회사는 대부분 최근에 만들어진 중소기업이며, 연구개발 과제에 중요하게 참여를 하고 있다. 2011년 현재 약 356개의 기업에서 10000명의 직원이 일하고 있는 것으로 추정된다. 기업의 생명공학관련 분야는 크게 13개로 나뉘며, 법률연구와생산(18%)> 진단과 분석서비스(17%)> 치료법(12%)> 유전체학과단백체학(6%)> 생물정보학, 생물전자공학(5%)순이다.
[그림] 프랑스 생명공학기업의 10개 주요 분야(2011)
프랑스 정부는 생명공학분야수준이 세계적 수준보다 뒤쳐진 것으로 판단하고 전략적으로 관련 기업들을 지원 및 발전시키려고 하고 있다. 건강환경국가계획(PNSE, Plan National Santé Environment)은 2004년부터 2008년까지 환경악화에 기인한 건강의 피해를 줄이는 것이 목표로, 이와 관련하여 2007년 7월에 발간된 중간평가보고서에 의하면, PNSE를 통해서 주변 유럽국가들에 비해서 뒤쳐져 있는 부분들을 따라잡고 있는 것으로 있는 것으로 나타났다. 이 계획을 통해 정부차원에서는 범부처간에 상호 협력하여 적극적으로 움직일 뿐만 아니라 지방도 활성화되고 있다.
참고자료
1. “Evaluation à mi-parcours du Plan national santé environnement”
2. Venture Valuation (www.frenchbiotech.com)
제4절 중국
1. 중국의 생명공학정책
1981년에 등소평은 “농업문제의 돌파구는 최종적으로 생명공학이 해결할 수 있으니, 관련 첨단기술에 의지해야 한다.”고 언급하였다. 1986년 중국 정부는 ‘863계획’을 발표하고 생명공학을 우선분야로 하여 집중 지원하였다. 또한 1988년 8월 중국 국무원의 비준을 받아 중국 과학기술부에 의해 실시되고 있는 ‘횃불계획(첨단기술산업발전계획)’은 첨단기술성과 상품화, 첨단기술상품 산업화, 첨단기술산업 국제화를 목표로 ▸첨단기술산업 발전을 위한 환경조성 ▸첨단기술산업개발구 건설 ▸첨단기술창업서비스센터 건설 ▸세부프로젝트 실행 ▸과학기술형 중소기업기술창업기금 조성 ▸첨단기술산업의 국제화 ▸인재양성이라는 7대 활동을 통해 중국 첨단기술 산업화의 중추적 역할을 수행하고 있다. 아울러 1997년부터 실시된 중국 국가 중점 연구개발 프로젝트인 ‘973계획’은 미래 기술을 중점 연구하는 정부의 선행 연구 프로젝트로서 중국의 미래 산업 발전에 필요한 최첨단 기술 기초연구와 응용 기초연구로써 질병유전자학 등을 수행하고 있다.
2001년부터 2005년까지(“105”기간) 중국 정부는 생명공학 연구개발에 총 120억위엔을 투자하였는데 이는 1996년부터 2000년까지 같은 기간동안 중국 정부가 생명공학 분야에 투자한 총 연구비(15억위엔)의 8배 이상 증가한 것이다. 그러나 핵심 기술과 우수 인재는 여전히 부족하여 인재를 배양하는 것이 중국 생물산업을 발전시키는 중요한 과제이다. 따라서 중국은 인재의 육성, 활용, 유치 등 3가지 측면으로 우수 인재팀를 구축하여 첨단기술 인재규모 분야에서 선진국과의 차이를 축소하려 노력하고 있다.
중국 과학기술부는 2005년 9월 ‘중국의 생명공학 및 생물산업 전략계획’(마스터플랜)을 공식 발표하고 농업, 의약, 공업, 환경, 에너지, 해양, 중의약 등 중점 발전분야를 확정하고 기술 축적을 위해 전력을 다하고 있다. 이 ‘전략계획’에서 “향후 2020년도 중국의 생명공학 및 산업화 발전 전략 목표는 중국을 생명공학기술 강국과 생물산업 대국으로 건설하는 것이며, 15년간의 노력을 통해 중국의 생명공학과 산업화 수준을 세계 선진국 수준에 도달시키는 것이 기본 목표이다”라고 정리하고 있다. 중국 국가 과학기술부 산하 ‘중국 국가생명공학발전센터’에서 작성한 이 계획에서 중국은 3단계를 거쳐 2020년 생명공학기술 강국 및 생물산업 대국으로 부상하는 전략 목표를 실현하고자 한다. 또한 2007년 6월 중국생물산업대회의 ‘생물산업정책 및 생물산업기지발전포럼’에서도 국가발전개혁위원회에서 제정한 ‘생물산업발전 11.5 계획’을 더욱 강조하였다.
2009년 중국 국무원은 “국가생명공학연구개발과 산업화 촉진 지도자 그룹”을 조직하였고 동시에 “중국생명공학기술 및 산업화 발전 계획” 및 “생물안전법”을 제정하였다. 또한 중국 생명공학산업체협회를 조직하였으며 생명공학 연구개발비에 대한 대대적인 지원을 강화하고 있다.
표 1. ‘중국의 생명공학 및 생물산업 마스터플랜’에 제시된 전략목표
|
단계 |
기간(년) |
세부목표 |
|
1단계 (기술축적단계) |
2005 ~ 2010 |
◦ 생명공학 연구개발 전체 수준을 개발도상국 중 제일 높은 수준으로 도달시킴 ◦ 논문, 특허 수량 세계 6위 달성 ◦ 생물산업 총생산액 8,000억위엔 달성 |
|
2단계 (산업발전단계) |
2010 ~ 2015 |
◦ 생명공학 연구개발 전체 수준을 세계 선진수준으로 도달시킴 ◦ 논문, 특허 수량 세계 3~4위 달성 ◦ 생물산업 총생산액 15,000억위엔 달성 |
|
3단계 (지속발전단계) |
2015 ~ 2030 |
◦ 생명공학 연구개발과 산업화 전체 수준을 세계 선진 국가 수준에 도달시킴 ◦ 세계 생명공학과 기술분야 최우수 인재를 유치하며, 세계 생명공학 연구 혁신의 중심지로 성장 ◦ 생물산업 총생산액 25,000~30,000억위엔 달성 및 GDP에서 차지하는 비율 7~8% 으로 향상 ◦ 생명공학 산업을 중국의 기간산업으로 육성 |
이 ‘전략계획’에서는 향후 20년간의 중국 생물산업 발전의 9개 중점 분야를 다음과 같이 제시하였다. 첫째, 농업 생명공학으로 제2차 녹색혁명을 추진한다. 둘째, 의약 생명공학으로 제4차 의학혁명을 추진하고 중화 민족의 평균 수명을 연장한다. 셋째, 공업 생명공학으로 ‘녹색 제조업’ 발전을 추진하고 녹색 GDP를 대폭 증가시킨다. 넷째, 에너지 생명공학을 발전시켜 중국의 에너지 부족 상황을 개선시킨다. 다섯째, 환경 생명공학으로 순환(循環) 경제 발전을 추진시킨다. 여섯째, 생물자원의 심층 개발을 통해 새로운 생물산업을 육성한다. 일곱째, 해양 생물산업을 발전시켜 해양경제를 발전시킨다. 여덟째, 생물안전과 생물테러 방지기술 연구개발을 추진하여 생물안전관리시스템을 구축한다. 아홉째, 중의(中醫)와 서의(西醫)를 효과적으로 결합시킨 새로운 의료 보건 체계를 구축하고 중의약(中醫藥) 산업 발전을 추진한다.
생물산업의 발전을 촉진하는 여러 정책 : 2009년 6월, 중국 국무원에서 《생물산업발전촉진기본정책》을 발표했다. 이는 정책목표, 현대 생물산업 발전의 중요 영역, 생물 기업의 발전, 자주적 혁신의 촉진, 우수 인재의 양성, 재정과 세무에 대한 지원의 확대, 융자 경로를 적극적 확대, 양호한 시장 환경의 조성, 생물 유전자원에 대한 보호와 생물안전성의 감독, 그리고 조직과 리더십의 강화 등 총 10부분, 33항으로 구성되어 있다. 《생물산업발전촉진기본정책》에서, 생물 산업을 빠르게 육성하는 것은 중국의 신세기 과학기술 혁명의 전략적인 기회이고, 새로운 국가를 전면적으로 건설하는 중요한 과제가 되었다. 위 정책은 《국가중장기과학기술발전계획요강(2006-2020)》과 《생물산업발전‘11.5’계획》을 관철 실행해, 생물산업을 하이테크 기술 영역의 기간산업과 국가의 전략적 신흥 산업으로 빠르게 육성하는데 그 목적이 있다. 위 정책은 기술⋅인재⋅자금 등 자원을 생명공학 산업으로 유도하여 생명 공학 기술의 혁신과 산업화를 촉진해, 생명공학 산업 규모화⋅밀집화⋅국제화 발전을 가속시킨다. 기업을 주체로, 시장을 방향으로 하고 산⋅학⋅연이 서로 결합하는 산업 기술 혁신 체계를 건설하며, 우수 인재를 양성하여 자주적 혁신 능력을 강화시켜 자주적 지적 재산권을 갖고 있는 중요한 생명공학 기술⋅제품과 표준을 파악한다고 요구하고 있다.
《생물산업발전촉진기본정책》에서, 여러 개의 다국적 대형 생명공학 기업과 자주적 지적재산권을 보유하는 혁신적 생명공학 중소기업의 육성; 여러 개의 산업 밀집도가 높고 핵심 경쟁력이 강하고 전문화 특색이 현저한 생명공업 산업의 본거지의 형성, 생명공학 기술 특허의 보호와 물질특허 생물유전자원의 보호를 강화하여, 생물유전자원의 개발⋅이용 수준을 향상시켜 생물안전성의 보장을 요구하고 있다.
생물 의약 분야에서, 중국 국민의 생명 건강을 위협하고 있는 중대 전염병을 예방하고 진단하는 신형 백신과 진단 시약의 개발에 중점을 두고 있다. 흔한 질환과 주요 질환의 치료에 현저한 효과가 있는 생물기술 약물⋅저분자 약물과 현대 중약을 적극적으로 연구하고 개발한다.
생물 농업 분야에서 중국은, 양질⋅고수확⋅고효율⋅다환경적응성 농업⋅임업 신품종과 야생 동식물 번식 종자개발을 중점적으로 발전시키고 있다. 생물농약⋅생물 사료 및 사료첨가제⋅생물비료⋅식물성장조절제⋅동물백신⋅진단시약⋅현대 동물용 중약⋅동물용 생물치료제⋅어류용 생물치료제⋅미생물 완전분해 농업용 박막 등과 같은 친환경 녹색농업용 생물제품을 크게 발전시켜, 동식물 바이오리액터의 산업화 개발을 추진하여 고효율 녹색 농업의 발전을 촉진시키고 있다.
2010년 10월, 《국무원의 신흥산업의 배양교육과 발전 전략에 대한 결정》은 생물산업을 중국의 전략산업으로 제시하고, 신일류정보기술 등 4대산업의 배양교육발전을 국민경제중심산업으로 제안하였고, 새로운 정보 등 3대산업 배양교육을 선도산업의 발전목표와 정책지표로 삼았다.
2011년 4월, 국가중점기초연구발전계획(973계획)과 국가주요과학연구계획의 2011년 프로젝트 추진회의가 천사오야(陳小婭) 과기부 차관, 저우광자오(周光召) 973계획 고문팀장 등이 참석하며 북경에서 개최되었다. 이는 ‘12.5계획’(2011-2015)기간 국가과기계획으로 추진하는 최초의 프로젝트로서 ‘고온초전도 소재와 물리학 연구’를 비롯한 11개 주요과학과제를 수행하는 프로젝트를 시범 가동하는데 영역별 배분 구도를 고도화하고 제조 및 공정과학 분야를 새로이 포함시켰다. 국가주요과기전문프로젝트와 연계강화 분야는 전염병 신약개발 등 20개, 전략적 차세대사업의 이론적 지원확대 분야로 신에너지, 바이오기술 등 30개를 수행한다. 농업과 민생분야 지원확대를 위해 곡물의 핵심암수개체, 벼 분자설계 육종, 동맥경화와 II형 당뇨병의 발병메카니즘 등 40개 프로젝트 입안에 10억위안, 국가주요과학연구계획의 금년도 계속과제로 단백질 연구, 나노과학 연구, 발육과 생식연구, 줄기세포 연구 등 6개 계획 64개 프로젝트를 15억6,000만위안을 투입하여 수행하고 있다.
2011년 7월, 《국무원 판공실의 ‘과학기술부, 재정부의 과기형 중소기업 기술혁신기금 관련 잠정규정’ 전달 통지》,《과기형 중소기업 기술혁신기금 재무관리 잠정방법》의 관련 규정에 근거해 과기부 과기형 중소기업 기술혁신기금 관리센터의 심사를 거쳐 과기부와 재정부의 2011년도 과기형 중소기업 기술혁신기금 프로젝트 심사사업이 마무리되었다. 입안 프로젝트는 총 2,707건으로 전부 무상지원 되는데, 중앙재정예산은 19억8,791만위안, 최초 지원금은 15억3,881만위안이며, 그 중 기술혁신프로젝트가 2,009건이고 예산이 14억9,701만위안이다. 공공기술서비스기관 보조금은 517건이고 예산은 3억409만위안이며, 창업투자유도기금은 181건이고 예산은 1억5,000만위안이다.
2011년 10월, 중국 과기부는 《국가 중장기 과학기술 발전계획(2006-2020년)요강》의 시행을 구체화하고 ‘대사관련 단백질 수식화의 종양발생과정에서의 역할 및 메카니즘’ 등 2012년도에 수행할 70개 프로젝트의 지원을 결정하였다.
2. 중국의 생명공학기술 및 산업
중국은 풍부한 생물자원을 보유하고 있다는 장점을 바탕으로 생물산업 발전을 가속화하고 있다. 관련 통계에 따르면 중국에는 동식물, 미생물이 26만종이 있으며 세계에서 천연자원과 생물 종류가 가장 풍부한 국가 중의 하나이다. 이미 3,000여 가지의 질병 근원 미생물 수집에 성공하였고, 농작물 재배에 유용한 천연 생물자원도 32만종이나 확보하여 그 수치는 단연 세계 1위를 차지한다. 그밖에 형질전환기술, 단백질공학, 복제기술 등을 포함한 현대 생명공학기술은 개발도상국가 중 우위를 차지하고 있으며 일부는 세계 수준으로 평가받고 있다. 최근 중국의 생명공학 관련 특허 및 논문 수가 세계 6위를 차지하면서 관련 연구계로부터 주목을 받고 있다.
중국 전체에는 중앙 정부, 유관 정부부처 및 지방 정부가 지원하는 생명공학중점실험실이 약 200여개 정도 있고, 많은 대학이 생명공학 및 생물산업 분야의 전공을 개설하고 있다. 중국의 생명공학 응용연구 및 산업화는 농업 생명공학기술(형질전환 농작물, 현대육종과 슈퍼잡교논벼, 식물조직배양, 생물농약, 사료생물기술, 가축용 백신)과 의약 생명공학기술(생명공학약물, 백신, 혈액제품, 생화약품, 진단시약, 조직장기공학)이 중심이며, 중약(천연물)은 중국 정부가 중화민족의 자부심을 가지고 추진하는 생명공학산업 분야이다. 이밖에 “105(10차5개년)” 기간에 “기능성 게놈과 바이오칩” 중대 과기 전문프로젝트의 실시를 통해 바이오칩이 기초적인 산업규모를 갖추도록 하였고 인간의 주요 생물기능 및 간암, 위암, 폐암, 식도암, 백혈병, 고혈압 등 질병과 관련된 신규 유전자 1,500개를 성공적으로 연구하였다. 그 중에는 향후 개발 전망이 있는 기능성 유전자 160개, 신제품으로 개발되어 사용되는 유전자 24개, 독점재산권을 보유하고 기업이나 약물연구기관과 공동으로 약물표적이나 생명공학기술약물 전기개발을 진행하고 있는 신규 유전자 8개가 포함되어 있다.
중국발전개혁위원회는 “11.5(11차5개년, 2006~2010)” 기간에 진행할 발전계획을 편성하고 관련 생물산업정책을 제정하였으며 40억위엔의 국가자금을 조성하고 약 400억위엔을 사회투자로 조달받아 400여건의 생명공학기술 산업화 프로젝트를 실시하고 바이오칩, 줄기세포, 조직공정 등 20여개 국가공정연구센터 구축사업과 농작물 유전자자원 중대과학공정 등을 추진하였다. 이러한 기술성과가 지속적으로 산업화됨에 따라 2000년 이후 생물산업은 연간 약 3배씩 빠르게 성장하였지만, 연구개발 기술에 비하여 생명공학 산업화는 아직 상대적으로 미흡한 실정이다. 그러나 중국의 13억 인구가 식량을 섭취하고 5억 정도가 건강기능식품을 소비하고, 1.3억의 인구가 환자이며 새로운 품종의 농작물을 재배할 농경지가 20억무(1畝≒667㎡, 200평)나 되는 등 중국은 세계에서 가장 큰 생물제품 소비시장을 보유하고 있어 향후 발전 가능성이 크게 기대된다. 중국 생물산업에 관한 분석 연구에 의하면 생물의약, 형질전환제품, 기능성 식품, 바이오센서 등 10대 세부 생물산업에서 150개 품목을 연구 개발하였고 연간 총생산액이 약 15,000억위엔으로 GDP의 15%를 차지하고 있다.
중국내 현대 생명공학 관련 기업은 약 500여개이고, 종사인력은 약 5만여명으로 집계되며, 베이징과 상하이, 선전 등지에 이미 20여개 생명공학 클러스터가 설립되어 있다. 중국에서 생명공학 연구개발은 경제, 식량안보, 환경에 큰 기여를 해왔는데, 중국과기부는 이러한 중국 생명공학이 향후 더욱 커다란 발전 잠재력을 보유하고 있고 중국의 생명공학 연구개발은 식량안보, 인구건강, 환경증진, 에너지 안보에 주력하고 경제사회 개발의 병목현상을 해결할 수 있으며, 생물학적 비료 개발, 감염질환의 진단기술 개발, 대기오염 개선 등을 추진 할 것이라고 발표하였다.
중국생명공학 산업 규모 : "2020년까지, 중국 의약 위생 관련 산업의 생산액은 4만억위엔 정도에 달할 것이고, 생명공학 관련 산업의 생산액과 합쳐서 6만억 위엔을 넘을 것이다"(全國人大常委會 위원장 桑国卫). 생물 의약 산업은 전략 산업 뿐만 아니라 미래의 기간산업이 될 것이고, 앞으로 중국 GDP의 10% 또는 그 이상 차지할 것이다. 중국과기부 장관 완강(万钢)은 "생명공학 기술을 과학 기술 발전의 5대 전략 중의 하나로 한다."고 이미 《국가중장기과학기술발전계획요강(2006~2020)》에 명시했다. 국가 전략적으로 이미 확정된 16개의 주요 과학 기술 전문 프로젝트 중, 주요 신약 개발⋅이식유전자 식물⋅주요 전염병 예방/치료 등 3개의 프로젝트는 생명공학 기술과 관련되어 있다.
2010년 10월, 《국무원의 신흥산업의 배양교육과 발전 전략에 대한 결정》은 생물산업을 중국의 전략산업으로 제시하고, 신일류정보기술 등 4대산업의 배양교육발전을 국민경제중심산업으로 제안하였고, 새로운 정보 등 3대산업 배양교육을 선도산업의 발전목표와 정책지표로 삼았다. 이것은 중국이 새로운 상황의 전략으로 경제발전방식을 전환하고 산업구조를 격상시키며, 경제사회를 추진시켜 지속적인 발전을 이루게 한다. 또한 국제 경쟁에서 경쟁력 있는 전략을 수립할 수 있는 중국생물산업발전의 방향을 제시한다.
“11.5”(2006-2010) 시기에, 중국 생물산업은 급속히 발전하였다. 첫째, 산업규모가 지속적으로 성장하여 새로운 목표를 달성했다. 2005년 중국생물산업은 약 6000억 위엔에서 2010년 16000억 위엔의 규모로 연평균 21.6% 성장하였다. 특히 세계적인 금융 위기였던 시기에도 생물산업은 지속적으로 성장하여 하이테크산업발전의 중요 분야로 자리 잡았다. 둘째, 독자적 창의개발능력이 뚜렷이 강화되었다. 유전자 분석, 줄기세포, 항체공정, 단백질 약물, 의료기구, 생물합성, 이식 유전자 육종, 동물반응기, 효소 공정, 신약개발과 백신개발 등 생명공학 기술의 최전방 영역에서, 국가공정연구센터, 국가공정연구소, 국가중점실험실, 기업기술센터를 설치하고 이를 중심으로 관련분야에서 커다란 성과를 얻었으며, 중소기업 연구개발 활동을 활발하게 수행하여 산업 핵심경쟁력의 성장을 확실하게 달성하였다. 셋째, 창의적 혁신연구개발 성과는 상업화를 도출하였다. 백신과 시약진단, 새로운 약물 개발, 현대 중약, 생물의약공정, 생물육종, 녹색농용생물제품, 생물자원, 생물소재, 미생물이용 분야의 새로운 성과를 통해 산업화 실현 및 현대농업의 발전을 달성하였다. 넷째, 관련 산업은 발전적 형세를 갖추었다. 북경, 상해, 장춘, 창사, 선전, 덕주, 태주 등 국가생물산업기지는 발전단계로 빠르게 진입하여 경제사회발전의 새로운 성장엔진으로 거듭났다.
2011년 5월, 후진타오 국가주석은 중국중앙정치국의 제29회 집단학습에서 전략적 신흥산업을 본격적으로 육성하는 것은 경제사회의 전면적이고 조화적이며 지속가능한 발전 실현, 전면적 소강사회 건설, 사회주의 현대화 본격추진에 대해 중요한 전략적 의미를 지닌다고 강조했다. 이와 관련하여 중국 소강사회(小康社會)(의식주를 걱정하지 않을 정도의 중산층 생활)의 전면 건설이 관건인 ‘12.5’(2011-2015)기간에는 개혁개방을 가속화하고 경제발전방식의 난관을 극복하여 변화를 도모하고, 미래 《전략신흥산업 ‘12.5’계획》, 《생물산업발전‘12.5’계획》의 출현, 의료위생체제개혁과 새로운 농합, 주민사회보장제도의 지속적인 개선, 녹색기술의 발전과 ‘양형사회’(兩型社會) 건설에 따라 생물산업은 발전 범위를 넓히고 있다. ‘12.5’기간, 중국은 생물산업발전기술의 기반강화에 주력하고 중대성과의 산업화를 추진하며, 한 단계 업그레이드된 재정과 세무, 금융정책의 지원, 기술혁신과 인재정책의 개선, 양질의 시장 환경 조성, 중요 분야와 중점 개혁의 추진 등으로 중국 생물산업을 빠르게 발전시킬 계획이다.
중국 생명공학 산업 현황 : 전 세계 생명공학 산업이 금융위기로 충격을 받았던 2009년 이후 시기에도 중국 생명공학 산업은 상대적으로 왕성한 성장력을 보였으며, 바이오제약, 생물농업, 생물공정 등 모든 분야에서 발전하였다. 산업이 빠르게 성장하고, 기업이윤이 높아졌으며, 국내외 자금 유치능력도 높아졌고, 생산기지 건설이나 연구기지 건설 모두 호황을 보였다. 특히 주된 두 가지 이유는 국내의료위생개혁과 중국의 신흥기업이 창업하는데 유리한 자본조달 시장 때문이다.
의료위생개혁, 이익급증 : 2009년 중국은 《생물산업발전정책추진》에서, 생물산업을 하이테크분야의 중심산업으로 규정하였다. 국무원이 발표한 《생물산업발전정책의 보고》에서는 생물산업의 빠른 발전을 요구하고 있다. 업계 분석가들은 생물 의약 산업은 산업구조를 격상시키고, 기술혁신을 추진하고, 국가과학기술경쟁력을 높이는 중대한 업무를 가지고 있고, 국가는 재정, 세금, 은행신용 등과 같은 방면에서 지지를 해주어야 하며, 기금 투입을 확대하면 미래의 생물의약은 발전의 황금시대를 맞이할 수 있다고 판단하고 있다.
2009년 중국은 공공위생의료체계개혁을 추진하였다. 전염성 질병 백신 공정을 확대하고, 15세 이하의 아이들에게 간염백신 접종 공정을 완성하였고, 농촌 부녀자들의 무료검진을 확대하고, 농촌부녀자 유방암과 자궁암검사를 전면 실시하였는데 이는 면역백신과 진단시약의 수요를 증가시켰다. 이에 따라 의료보험 제정과 의료체계의 복구를 도모하고 의료시장에서 거대한 수요를 창출하여 이를 통해 생명공학 제약산업의 발전을 기대하고 있다.
자본차입창업기업 : 2009년 중국 생물산업은 여전히 자본이 풍부하였고, 특히 창업 허가 설립과 초기 융자가 확대되었으며, 사회자본의 투자가 활발했다. 2009년 중국자본시장은 의약과 생명공학산업에 139.8억위안을 투자하였는데, 그 중 초기 투자 76.38억위안, 재투자 28.42억위안, 채권투자 35억위안이 사용되었다. 그 중 생명공학분야의 투자액은 15.18억위안으로 2008년보다 24.2% 증가하였다. 유전자기술, 인간장수프로그램 개발과 제품생산 분야에 28개의 자본차입창업기업이 진출하였고, 동시에 의약 시장기업인 동보의료, 채미약업, 북정약업과 애얼안과 등도 진출하였고 금부약업은 3.51억위안을 투자하여 신약을 개발하였다. 2009년 자본시장 공개는 특히 창업기업을 대거 등장시키는 큰 원동력이 되었다.
또한 최근 합성생물학, 해양생명공학, 유전자변형식물의 안전성평가, 효소이용 기술 분야에서도 매우 큰 발전과 산업적 성장이 기대되고 있다.
2010년은 중국 “11.5”계획의 마지막 1년이었고, 2011년의 “12.5”계획에서는 생물산업이 전략적 신흥산업과 국가미래의 기간산업으로서 더욱 좋은 발전 환경을 지니고 있다. 산업정책이 날로 완화되고 있으며 중국생명공학은 전면적으로 발전추세이고, 특히 창업기업의 출현이후 중국 생물산업은 이미 기술과 자본촉진으로 접어들어 시장이 빠르게 발전하는 추세이기에 최근 20년간 가장 좋은 황금발전단계로 진입하였다.
생물의약 : 거대시장의 수요는 여전히 제약분야가 가장 큰 관심을 받고 있으며, 최근 중국 정부차원에서 재산권보호, 약품시장의 정비와 기술혁신체계 구축을 중시하면서 글로벌 제약기업의 연구개발 및 시험기구 기능이 중국으로 이전하는 것이 전 세계 생물의약분야의 주요 추세이며, 2009년 금융위기에도 영향이 없었다. 2009년 Norvatis가 10억달러로 제3의 글로벌 연구 센터를 설립하고, Merck가 15억위안으로 국제약품연구개발센터를 설립하였다. Pfizer가 북경대학에 건립한 세계 일류급의 생명공학 및 약물연구센터에서는 생물의학 창의혁신개발 전략으로 심혈관, 대사질환 및 신경변성 등 3대 질병의 치료법 개발이 주요 분야이다. 이 센터를 건립함으로서 생물의학연구전략합작네트워크를 구축하여 미국 스크립스연구소, 캘리포니아대 정량생물과학연구센터와 중국과학원 상해생명과학원이 연계하는 중국대학 최초로 글로벌 선도그룹으로 성장하는 기회를 가졌다. 중국은 이미 전 세계 3대 생명공학연구기지가 되었다. 세계적 경쟁력을 지닌 중국기업은 유명 글로벌 기업들의 관심을 받고 있는데 2010년 2월, 미국에 진출한 중국생명공학기업-심양산생은 Panacor Bioscience의 제안을 받고 Nephoxil의 중국내 생산권리를 얻었다.
세계적으로 크게 성장한 중국생물의약서비스기업이 중국 생명공학 연구개발 기관에 지속적으로 도움을 주고, 적극적으로 스스로의 생존 무대를 개척하기 시작하면서 기술과 인력자원을 얻기 시작하였다. 2009년 2월, 청화대유전자연구원과 유명 대학 연구기관이 협력하여 덴마크에 암연구센터를 설립하여 150명의 과학자들과 직원을 채용하였다. 이것은 중국 생명공학연구개발기관이 최초로 국제시장을 개척한 것으로, 중국 유전자의 선도자는 물론 인류유전자측정을 통해 국제경쟁력을 가진 생명공학연구혁신기관이 된 것이다. 국제수준의 과학연구기관의 진출은 중국이 전 세계 생명공학분야에서 경시할 수 없는 수준이 된 것이며, 따라서 중국 생산 제품의 수출과 국제자본시장의 투자가 활발히 이루어질 것을 기대할 수 있다. 연구개발센터 설립이외에 생산라인 건설과 투자계획도 진행되고 있다. Sanofi-Aventis는 2008년 7억위안을 투자하여 세계 최대의 간염백신기지를 건설, 2010년 7월에 준공하여 생산단계에 들어갔다. 중국생물기술공사는 20억위엔을 투자하여 길림성에 생산과 연구개발기지를 건설하였다. 천은신용과 약업유한공사는 생물의약서비스외에 5억위안을 투자하여 대형 줄기세포 연구센터와 산업화 센터를 건설하였고, 줄기세포의 추출, 연구, 줄기세포의 감정, 치료와 신약개발을 수행하고 있다.
2009년 12월, 1.5억위안을 투자한 보아오(博奧)생물생산연구개발기지가 정식으로 사천성 성도국제의학단지에 건설되어 유전자 연구개발 및 측정서비스를 수행하고 있다. 중국화치에기업(化纖行業)은 biopolymer의 산업적 생산기술 분야에서 큰 성과를 이루었다. 중국 biopolymer가공섬유산업은 빠른 발전을 이루어 2009년 생산능력이 191만톤으로 세계 총생산의 77%를 점하고 있다. 2009년 천진생물재료유한공사는 천진경제기술개발구에서 세계 최대의 PHA생산라인을 건설하고 매년 5억위안의 매출을 얻고 있다. 산동차오린(山東澣霖)생물기술유한공사는 30억위안을 투자하여 중국산 화공원료를 이용해 중국이 자체개발한 생물발효방법을 산업화하여 생산에 착수하였으며, 2014년까지 모든 건설이 끝나면 세계에서 가장 큰 생물발효방법을 이용한 생산기지가 될 것이라고 발표하였다. 주력 제품인 DC11~DC18은 국가 특허제품으로 화공, 경공업, 농약, 의약, 액정재료, 항공우주산업 등 광범위한 분야에 이용된다.
생물농업 : 최근 중국은 분자마커보조육종, 유전자재조합육종, 세포공학기술육종, 염색체기술 등을 다양하게 활용하고 조합하여 생산량이 높은 고품질 벼, 염색체교잡 옥수수, 유전자변형 내충성 면화, ‘쌍띠(双低)’유채, 유전자변형 돼지, 소, 양, 물고기, 밀, 콩, 나무 등으로 양질의 농림수산품종을 개발하여 국민의 경제적 발전을 가속화하고자 하고 있다. 생물비료산업은 국가식량안전을 확보하고, 농업생태계 환경을 보호하며, 농업생산성을 향상시키면서도 지속가능한 발전을 할 수 있는 전략자원산업이다. 생물비료산업은 중국의 부족한 녹색농산품 생산을 촉진시키고 현재 농어발전을 가속화하여 관련 산업에 큰 영향을 준다. 현재 생물비료산업의 규모는 년간 1,000~5,000만톤으로 최근 5년간 빠르게 성장하고 있고 등록된 제품이 500여개에 달한다. 중국의 생물비료시장 잠재규모는 18억무의 경작지를 대상으로 년간 약 1억2,222만톤으로 추산된다.
생물사료는 동물사료에서 인공합성첨가제이외의 사료원료 및 사료첨가제를 말하는데 넓은 의미에서는 식물줄기, 우모(羽毛), 곤충단백질 등이 있으며 좁은 의미로는 유전자공정, 단백질공정, 발효공정 등 하이테크 방법으로 미생물을 이용한 발효공정에 의해 제조되는 새로운 사료자원과 사료첨가제이다. 최근 세계적으로 사료원료가격이 상승하고 삶의 질이 높아지면서, 안전하면서도 고품질의 축산물을 경제적으로 생산하려는 시장의 수요가 중국에도 영향을 주기 시작하고 있다. 가장 많이 사용하고 효과적인 생물사료로는 효소(酶), 유산균, 식물유래 천연추출물, 생물색소, 신형 사료단백질, 생물약물사료첨가제 등이 있다.
중국의 생물농약 연구개발은 1950년대 초부터로 약 60년의 역사를 지니고 있으며, 과학연구소, 대학, 국가중점연구실, 공정센터 등을 중심으로 수행해 왔고, 규모나 수준 등이 인정되는 연구기관은 30여개이다. 2010년 3월 기준, 중국내 미생물농약, 식물유래 농약 및 생물생화학농약 생산기업은 200개가 넘으며, 항생물질 생산기업은 1,700에 달한다. 공식 등록된 생물농약 유효성분은 50개, 제품수는 모두 2489개이며, 현재 시장규모는 28.8억위안에 달하고 미생물농약이 90%이상을 차지하고 있다. 동물용 생물제품은 가축의 질병을 예방, 진단하는 제제이다. 최근 중국은 가축 질병예방용 면역접종이 급격히 증가하고 있으며, 산양약독화백신, 돼지 O형 구제역백신, 고병원성 조류독감백신을 비롯한 많은 종류의 백신을 생산하고 있으며 품질도 향상되었다. 중국내 동물생물제품은 현재 451종이며, 그 중 백신이 155종(가금 88종, 기타동물 67종)을 차지하고 있고 GMP 생물제품기업이 72개이고, 연간 매출이 60억위안 이상이다.
바이오에너지 : 중국에서는 지금까지도 주로 연료용 에탄올을 생산하기 위해 전분으로 고구마와 옥수수를 사용하고 있으나 식량원료자원의 제한적 특성으로 최근에는 기타 비곡물을 이용하여 바이오에너지를 생산하려는 움직임도 함께 활발하다. 하남천관(河南天冠)과 산동택생(山东泽生)과기공사가 농작물의 줄기 등 부산물을 이용하여 효소발효방법으로 연료에탄올을 생산하는 라인을 건설하고, 3년 이상 지속적 생산을 하고 있다. 내몽고 중흥능원(中興能源)유한공사는 2009년 수수(高粱)액상발효 시험생산연구를 수행하고 있는데, 2010년 국가개발위원회를 거쳐 연간 3만톤의 수수줄기를 이용하여 바이오연료를 생산하고, 2011년 현재 생산성과 섬유소비율이 높은 수수종자를 개발, 이용하는 사업도 추진하고 있기에 잠재력이 매우 크다. 중국에서는 중량집단(中糧集團), 중국석화(中國石化) 등을 중심으로 국가생물액체연료개발센터 사업을 통해 산업화를 실현하고 있다. 2010년 해남성 중국해유공사(海油公司)는 연간 6만톤 규모의 바이오디젤 생산항목을 결정하였는데 시험기지 크기는 35만무이다. 현재 중국은 생물연료 생산이 가능한 바이오매스가 매우 풍부하며 적합한 관련기술 개발을 위해 많은 노력을 집중하고 있다.
생물 의약 산업 발전 상황 : 국내생활수준이 개선됨에 따라, 중국은 건강수요가 급증하는 시대로 들어섰다. 2008년 위생조사통계조사에서 볼 수 있듯이: 주민 만성병 전염율은 20%였다. 전국 진단소의 만성병은 2.6억명에 달했다. 그 중, 1993년부터 2008년의 15년간, 중국의 고혈압환자는 1.19%에서 5.49%로 4.6배 증가하였고, 당뇨법은 0.19%에서 1.07%로 5.6배 증가하였고, 이는 도시생활수준이 향상된 것과 농촌의 변화가 매우 빠른 것으로 볼 수 있다. 최근 15년의 통계수치에 따르면, 농촌의 고혈압환자는 6.5배 증가하였고, 당뇨병은 12배, 특히 최근 5년간, 증가속도는 각각 2.3배와 2.5배였고, 10년전보다 명백히 빨라졌다.
2010년 중국의 백신 시장 규모는 약 120억 위안이며, 중국 현재 시장 판매액이 유행성 독감 백신이 가장 많은데 년 판매액이 약 10억 위엔(넷백 가격)이고, 기타 광견 백신, 수두 백신, B형 간염 백신, A형 간염 백신, 유행성 뇌막염, 유행성 B형 뇌염, 윤상(轮状)바이러스 백신 등의 판매액도 상당히 크다.
중국 정부는 최근 몇 년 동안 백신의 생산과 연구⋅개발을 매우 중요시하고 있다. 과학기술부와 관련 부문은 863계획, ‘중대신약창제국가중대과기항목’ 등 계획에서, 백신의 연구 개발과 산업화에 대해 중점을 두었다. 이미 시작된 863 계획 ‘백신과 항체 공정’ 주요 프로젝트에 백신의 연구 개발을 위한 약 2억 위엔의 국가 예산을 지원했다. 그 밖에, 주요 전통적 백신 생산과 품질 기술 향상에 맞춘 과기지탱계획(科技支撑计划) 주요 프로젝트인 "백신관련 생산기술 연구개발"도 수행하고 예산투입은 약 6000만 위엔이다. <위생사업발전 ‘11.5’계획개요>에서, "11.5" 기간 아동 국가 면역 계획 백신 예방 접종률이 도시 95% 이상, 농촌 90% 이상에 달했다.
3. 중국의 생명공학 투자현황
2011년 9월, 중국 국가통계국, 과기부, 재정부는 《2010년 중국 과학기술 예산투입 통계공보》를 발표했다. 2010년 중국의 R&D 투입액은 전년대비 1,260억5,000만위안(21.7%) 증가한 7,062억6,000만위안이고, R&D투자 집중도(GDP대비 비율)는 1.76%로 전년도의 1.70%보다 약간 증가했다. R&D인력(FTE기준)에 따라 계산할 경우 1인당 경비가 전년대비 2만3,000위안이 증가한 27만7,000위안이다.
현재 중국에서 진행 중인 국가과기공관계획, “863계획”, “973계획”, 자연과학기금, 횃불계획 등 여러 과학기술 및 산업발전계획은 모두 첨단과학기술 가운데 생명공학을 우선 발전분야에 두고 있다. 하지만 중국 정부가 지원하는 생명공학 분야 R&D 예산은 아직까지 상당히 미흡한 실정이기에 중국 정부와 각 성(省) 정부는 해외 투자자금 유치를 위해 관련 법률을 제정하는 등 정책적으로 적극 장려하여 자금부족의 취약점을 보완하고 있다. 중국은 경쟁력이 높은 과학연구시스템을 갖추기 위하여 기존 국가연구기관을 재정비, 개혁하여 새로운 형태의 생명공학연구기관을 설립하고 있다. 중국과기부와 국가발전개혁위원회가 공동 설립한 북경생명과학연구소는 세계 수준의 중국 생명과학 기초분야연구를 수행 중이며, 중국과학원 광주생물의학건강연구원은 중국과학원과 산동성 정부, 광주시 정부가 공동으로 설립하여 생물의학연구 및 산업화를 촉진하고 있다. 상해시 정부 등 다른 지역에서도 지역별 대규모 생명공학 투자사업을 진행하고 있다. 대표적인 사례로 북경의 중관촌 생명과학단지 조성과 해남성 해구(海口)제약밸리 건설, 광주(廣州)시 생물첨단기술산업화시범기지, 그리고 심천시, 석가장시, 장춘시의 중국 최대 규모의 3대 생물산업기지와 난링시 영장류실험동물기지 등 크고 작은 시설 투자도 수행하였다. 중국 최대의 국가과학기술단지로 건설한 빈해과학단지에서도 생물산업을 중점 육성시키려는 계획을 실현시키고자 노력하고 있다. 또한 북경 생명공학학술센터에는 500여 연구팀과 100여개 생물기업을 동시에 수용할 수 있는 아시아 최대 규모의 바이오산업 인큐베이터가 있다. 현재 북경(北京), 곤명(昆明), 석가장(石家庄), 통화(通化), 장춘(長春), 무한(武漢), 장사(長沙), 항주(抗州), 서안(西安), 제남(濟南), 덕주(德州) 등에 건설된 국가생물산업기지를 중심으로 활발한 연구개발 및 산업화가 진행되고 있다.
생물의약기업 투자현황 : 2009년 11월 생물의약기업은 2008년과 비교했을 때, 107개 증가하여 증가폭은 16.2%이며, 관련 기업들은 매출 752억위안, 이익 104억위안으로 각각 27%, 44% 증가하였다. 1999년부터 2009년까지 10년 간, 중국생물생화제약기업은 529개 늘어나 수입은 9.18배, 이윤은 11.64배 증가하였고 산업 자산 총액은 933억위안이 넘었다. 그 중 중국의 10대 생물기술제약회사는 2009년 매출과 이익이 각각 56.69%, 72.29% 증가했으며, 산업평균증가속도 또한 매우 빨랐다. 그 중 혈액제품과 백신산업은 천운생물을 추월해 업계 1위로 올라선 화란생물이 10대 상장 기업 중 가장 빠른 증가속도를 보였으며, 2009년 매출 156.8%, 이윤 225%가 증가했다. 그 내용은 혈액제품과 새로운 백신 서비스 수요의 증가이며, 그 중 A형 간염 백신의 생산 및 정부의 구매가 기업에게 매출증대를 가져왔다. 화란생물은 2009년 9월 H1N1 전염성 백신 심사비준을 받고, 4000만 인분의 주문을 받아 7.14억위안의 매출과 6억위안의 영업이익을 냈다. 미국 나스닥의 북경과흥은 전세계 H1N1백신을 생산하는 업체인데 미국 OTCBB로 시장에 나와 Sinovac의 지주 자회사가 되었고, 모회사인 Sinovac은 AMEX로 전환하였다. 이는 중국생물기업의 미국자본시장에 성공적인 진입을 보여주는 것인데, 전환 전 주가는 금융위기 때 0.4달러였던 것이 7달러 이상으로 올랐다. 이로써 중국생명공학기업이 미국 나스닥시장에 성공적으로 진출하는 제3자 생물기술제약기업이 되었고, 연속하여 선양삼생과 선성약업이 시장에 진출하였고, 2009년 북경과흥은 5.75위엔의 수입으로 중국 10대 생물기업 중 5위를 차지하였다. 선성약업 또한 나스닥 상장기업이며, ‘은도’(恩度)-혈관내피억제제로 2007년 미국자본시장에 진출하였다. 2009년 5월 2억위안의 이익을 낸 장수생물과학유한공사는 Chinavax와 장수연신(江蘇延申)을 인수하여 지주회사가 되었고, 2009년 9월 H1N1감염백신의 새로운 생산 허가를 얻고 631만 인분의 주문을 받아냈다. 그러나 2010년 일부 백신제품의 품질 문제로 자본시장에 영향을 미쳤다.
최근 천운생물이 용생약업유한공사를 매입하여 중국 생명공학분야의 가장 큰 합병이 이루어졌고, 2009년 광동천보와 명원의료가 합병을 하여 홍콩증시 상장과 함께 DNA기술과 제품을 연구개발하고, SNIPER HPV DVA 제품을 출시하였다. M&A시장의 발달과 함께 주식투자시스템은 생명공학과 건강산업에 큰 기회를 제공했다. 2009년 중국창투시장은 46개의 투자건수가 생물과 건강분야에 집중되면서, 투자액은 1.89억달러를 넘었다. 투자액은 2008년의 283억달러보다 적지만, 투자건수는 3개 많았다. 이와 같은 추세는 창업의 가장 큰 매력인 거대자본이 존재하기에 현재까지도 계속되고 있다. 최근 큰 투자 건은 혈당측정기기 기업인 생물완성융자로 홍임자본중국기금, 우세자본의 주식투자 7000만달러, 충칭기금투자 1000만달러, 보건다통의 6960만달러를 유치하였다. 이와 같은 관점에서 이러한 기업은 모두 실증적 기업 가치와 위험 평가를 통과했다고 볼 수 있다.
생명공학 분야 주요프로젝트 : <국가과학기술중장기계획개요(2006-2020)>에 기반하고, 2009년 2월, 중국과기부에서 개최된 "금융위기대처 과학기술투자 전문가회의“의 검증을 통과해 가동한 주요 프로젝트는 의약과 농업 등 9개 분야인데, 주요 전문프로젝트에는 유전자 변형 생물체의 새로운 품종 육성, 주요 신약 개발, 에이즈와 바이러스성 간염 등이 포함되어 있다. 또한 "11.5" 계획 중 "주요 신약개발"은 2009-2010년도에 악성종양, 심뇌혈관질환, 신경퇴행성질환, 당뇨병, 정신성질환, 자가면역질환, 저항성병원성 감염, 폐결핵, 바이러스감염성질환 등 10종의 중대한 질환에 초점을 맞춰 화학약물, 현대중약과 바이오신약을 자주적으로 연구 개발하였다. 이와 동시에 종합신약연구개발을 위한 기술플랫폼을 시작했는데, 해당 프로젝트의 2010년 연구개발예산은 63억위안이었다. 농업 분야, 거버넌스 유전자변형 생물체의 새로운 품종 육성의 총예산은 200억위엔에 달한다.
최근 세계의 유수 다국적 기업들은 중국을 ‘글로벌 공장’에서 ‘글로벌 연구중심’으로 인식을 전환하면서 신약 연구개발 관련 공동연구사업을 추진하고 있다. 이는 중국의 의약시장이 향후 미국, 일본, 독일, 프랑스 다음가는 세계 5대 시장으로 빠르게 발전할 것이 예상되고 있기 때문이다. 현재 Pfizer, Novo Nordisk, AstraZeneca, Eli Lily, Roche, GSK, Aventis, Novartis, Wyeth 등 다국적 제약기업들의 중국R&D센터 설립 붐으로 중국은 세계 신약개발의 전진기지로 변모를 기대하고 있다. 향후 10년 안에 농업 및 의약 생명공학 기술과 관련 산업분야에 있어 세계 최고의 생명공학 강국으로 성장하고자 하는 중국의 원대한 목표는 앞으로 생명공학 분야에 대한 중국 정부의 관심과 투자가 계속 획기적으로 증대될 것을 단적으로 보여준다.
|
참고자료 |
|
《새로운 상황을 파악하고, 중국 생물산업 발전을 가속화하자》 - 국가발전및개혁위원회 부주석 장사오강(張曉强) 제4차 중국생물산업대회 고위정책포럼 강연요지 |
|
최근 당중앙 국무원의 일련의 조치는 중국 생명과학, 생물기술연구 및 생물산업 발전을 지향하고 있다. 국무원이 발표한 <생물산업발전 “11.5”계획>,<생물산업의 쾌속발전 추진 정책>과 국가 중장기 과학기술계획 등으로, 국가는 생명공학기술 분야에서 농작물유전자자원과 유전자개량 등을 주요 프로그램으로 정하고, 유전자변형농작물 안전평가와 측정센터, 서남야생종자원은행, 단백질기술, 고급생물안전실험실 등 과제와 국가 중대 실험실 건설로 중국의 생물산업 발전의 기반을 강화시켰다. 또한 신약개발, 주요 전염병 예방, 유전자변형제품 개발 등도 수행하고 있다. 현재 중국 산업발전은 끊임없이 기술설비를 제공하고 있으며, 생물기술혁신구축분야에서는 생물정보, 줄기세포, 바이오칩, 항체공학, 조직공학, 신형면역과 현대 중약 등 국가공정연구센터와 국가공정실험실, 그리고 제약과 육종 산업을 발전시켜, 국가의 생물산업구조를 기업이 주체가 되어 기술혁신 시스템을 구축할 수 있도록 하였다. 생명공학기술 혁신 성과 분야에서는, 생물의약, 현대중약, 녹색농업제품, 미생물생산 등 산업화를 실현시켰고, 이는 H1N1 유행성독감백신, 유전자변형 내충성면화, 생물연료 등 천 여개 주요 성과의 산업화로 이어져 중국에서 생물산업이 중요분야로 자리매김하는데 큰 역할을 하였다. 지난 5년여 간의 중국의 생물산업의 발전을 돌아보면, 정부의 거시정책 아래, 중국의 생명과학과 생명공학기술 능력은 현저히 성장하였고, 대부분은 독자적인 지식특허를 보유하고, 세계적 수준의 연구결과는 광범위한 응용을 창출하였다. 국가생물산업기지는 날로 발전하였고, 2006-2009년, 중국 생물산업은 년간 25%의 빠른 속도로 발전하여, SMS산업 다음으로 중국 하이테크산업의 중요한 분야로 중국의 경제사회발전에 크게 기여하는 주요 산업으로 되었다. 향후 중국 생물산업 발전은 인재자원, 과학기술연구개발, 산업시스템, 생물자원 등 경쟁 우위력을 지니며 전략적인 기회를 맞을 것이다. 첫째, 보건위생의 수요와 국내의약시장의 거대한 규모는 중국 생물의약산업의 빠른 발전을 보장할 것이다. 중국은 13억 인구의 대국이며, 노령화 사회로 진입하고 있다. 또한 생활수준이 나날이 나아지고 있으며, 국민의 보건위생에 대한 관심은 나날이 증가하고 있다. 최근 10년 간, 중국인 평균 약품 소비지출은 연간 18.7% 증가하였고, 머지않아 10.8%가 더 증가할 것으로 예상된다. 그러나 2008년 중국 국민의 약품 소비는 460위안으로, 선진국의 개인별 연간 약품소비량 300달러에 비해 매우 낮은 수준이다. 따라서 의약보건 시스템이 개선되고, 환자의 지불능력이 향상되어 중국의 개인별 소비시장은 아직 성장 여지가 많다. 둘째, 식량 안전의 보장은 중국 생물 농업의 쾌속발전을 위한 동력이다. 중국은 공업화가 매우 빠르게 이루어졌으며, 도시화 공정 중, 비록 중국이 전 세계의 가장 엄격한 경지보호제도가 있음에도 불구하고, 지속적으로 이용 가능한 경지는 제한적이다. 중국은 사람은 많고 땅은 적다. 2030년까지 중국 개인별 경지는 1.25묘로 줄어든다. 세계에서 가장 안전하게 식량을 보유한 나라라는 목표를 실현시키기 위해, 반드시 국내자급을 충족시켜야 하고, 정책, 자금, 가격 등의 지원 역량을 강화하고, 식량의 단위면적당 생산량을 향상시켜야 한다. 동시에, 국민의 생활수준을 높여, 양질의 농산품에 대해 시장 수요가 있게 해야 한다. 이는 또한 선진생명공학기술 발전이 요구되며, 더 나아가 소비자의 “잘 먹고, 안전하게 먹기”라는 요구를 만족시키게 된다. 셋째, 에너지 절약과 저탄소 녹색성장은 중국 생물산업 발전을 가져온다. 에너지를 절약하고 온실가스 배출을 줄이는 것은 중국이 장기적으로 반드시 추진해야할 국가정책이며 생물산업 발전을 가속화 한다. 선진생명공학기술은 오수 처리 등 환경보호 공정에 광범위하게 응용된다. 또한 생명공학기술은 식품, 제약, 제지, 방직, 채광, 에너지 등 분야에 이용되고, 전통화학공업 등 많은 산업을 안정적으로 추진 가능하게 하여, 에너지 절약과 온실가스 배출 감소를 실현시켜, 환경보호와 경제발전이 함께 진행되도록 한다. 5-10년 후, 우리는 생명공학분야의 주요기술을 발전시켜 경제사회발전을 달성하고, 세계생명공학 및 생물산업 발전 방향을 파악하여, 지속적으로 생물산업의 발전을 지원하며, 생물의약, 신형백신 및 진단시약, 화학신약 등의 발전을 추진하며, 신품종 동식물의 재배와 적용을 널리 보급하고, 녹색농용생물제품의 발전을 추진하며, 해양생물기술과 제품을 발전시키고, 생물제조기술을 개발하여 널리 보급하고 응용해야 한다. 우리는 다음과 같은 큰 결심이 필요하다. 중대한 조치를 취하여, 중국생물기술의 자주혁신능력을 강화하고, 주요제품의 창의적 혁신능력을 실현하며, 기업이 주체가 되어 시장을 이끌어 나가게 하여야 하며, 산학연 결합형의 기술혁신 시스템과 기술연구개발을 강화하고, 핵심기술 파악과 창의적 혁신성과의 산업화를 추진하고, 산업의 핵심 경쟁력을 키우고, 시장의 수요에 따른 기능을 충분히 발휘하고, 적극적인 인력배양을 지원하고, 생물산업 발전을 위한 양질의 시장 환경을 조성하고, 지속적으로 국제화 발전을 이끌어나가야 하며, 광범위하게 국제합작과 교류를 해야 하며, 국제 생물산업 협력에 참여하며, 생물산업 발전의 특징을 잘 활용하여, 재무, 세금과 같은 금융환경을 개선을 통하여 생물산업발전 역량이 더 커질 수 있도록 해야 한다. |
표 2. 중국 과학기술예산
|
|
2003년 |
2004년 |
2005년 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
|
국가재정 과기지출 (억위안) |
945 |
1095 |
1335 |
1689 |
2114 |
2582 |
3225 |
3860 |
|
국가재정 총지출비중(%) |
3.8 |
3.8 |
3.9 |
4.2 |
4.3 |
4.1 |
4.2 |
4.3 |
|
R&D예산(억위안) |
1540 |
1966 |
2450 |
3003 |
3710 |
4616 |
5802 |
6980 |
|
GDP비중(%) |
1.13 |
1.23 |
1.32 |
1.39 |
1.40 |
1.47 |
1.70 |
1.75 |
|
기업R&D경비(억위안) |
960 |
1314 |
1674 |
2135 |
2682 |
3382 |
4249 |
4890 |
표 3. 중국 과학기술인력
|
|
2003년 |
2004년 |
2005년 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
|
과학기술인력(만명) |
3000 |
3250 |
3500 |
3800 |
4200 |
4600 |
5100 |
5700 |
|
전문기술사(만명) |
2174 |
2178 |
2198 |
2230 |
2255 |
2310 |
2321 |
2343 |
|
R&D인력(FTE,1만명/년) |
110 |
115 |
137 |
150 |
174 |
197 |
229 |
255 |
|
1만명당 취업자 중 R&D인력(명/년) |
15 |
15 |
18 |
20 |
23 |
25 |
29 |
33 |
표 4. 중국 과학기술성과
|
|
2003년 |
2004년 |
2005년 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
|
특허출원량(만건) |
30.8 |
35.4 |
47.6 |
57.3 |
69.4 |
82.8 |
97.7 |
122.2 |
|
발명특허출원량(만건) |
10.5 |
13.0 |
17.3 |
21.0 |
24.5 |
29.0 |
31.5 |
39.1 |
|
특허등록량(만건) |
18.2 |
19.0 |
21.4 |
26.8 |
35.2 |
41.2 |
58.2 |
81.5 |
|
발명특허등록량(만건) |
3.7 |
4.9 |
5.3 |
5.8 |
6.8 |
9.4 |
12.8 |
13.5 |
|
SCI수록중국과기논문(만편) |
5.0 |
5.7 |
6.8 |
7.1 |
8.9 |
9.6 |
12.0 |
- |
|
중국내 과기논문(만편) |
27.5 |
31.2 |
35.5 |
40.5 |
46.3 |
47.2 |
52.1 |
- |
표 5. 중국 첨단기술산업 및 기술무역
|
|
2003년 |
2004년 |
2005년 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
|
첨단기술산업 생산총액 (억위안)* |
20556 |
27769 |
34367 |
41996 |
50461 |
57087 |
60430 |
76156 |
|
제조업 중 비중(%) |
16.1 |
15.8 |
15.8 |
15.3 |
14.3 |
12.9 |
12.6 |
- |
|
첨단기술제품 수출액 (억달러) |
1103 |
1654 |
2182 |
2815 |
3478 |
4156 |
3769 |
4927 |
|
상품수출총액중 비중 (%) |
25.2 |
27.9 |
28.6 |
29.0 |
28.6 |
29.1 |
31.4 |
31.2 |
|
기술시장 기술계약 체결건수(만건) |
26.8 |
26.5 |
26.5 |
20.6 |
22.1 |
22.6 |
21.4 |
22.9 |
|
기술계약금 |
1085 |
1334 |
1551 |
1818 |
2227 |
2665 |
3039 |
3906 |
*는 규모이상기업(전체 국유기업 및 연간 제품매출액이 500만위안 이상인 비국유기업)수치
표 6. 중국 국가첨단기술산업구
|
|
2003년 |
2004년 |
2005년 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
|
국가첨단기술구 수(개) |
53 |
53 |
53 |
53 |
54 |
54 |
56 |
83 |
|
기술구내 기업수(만개) |
3.3 |
3.9 |
4.2 |
4.6 |
4.8 |
5.3 |
5.4 |
6.4 |
|
총영업이익(조위안) |
2.1 |
2.8 |
3.4 |
4.3 |
5.5 |
6.6 |
7.9 |
10.6 |
|
순이익(억위안) |
1029 |
1423 |
1603 |
2129 |
3159 |
3304 |
4465 |
6052 |
|
납세액(억위안) |
990 |
1240 |
1616 |
1977 |
2614 |
3199 |
3995 |
5133 |
|
수출액(억달러) |
510 |
824 |
1117 |
1361 |
1728 |
2015 |
2007 |
2460 |
표 7. 중국 주요 과학기술지표의 세계위치
|
|
2003년 |
2004년 |
2005년 |
2006년 |
2007년 |
2008년 |
2009년 |
|
R&D경비의 세계 비중(%) |
2.5 |
2.9 |
3.4 |
4.0 |
4.6 |
5.7 |
7.1 |
|
R&D경비의 세계 순위 |
6 |
6 |
6 |
6 |
6 |
4 |
4 |
|
발명특허 등록량 세계 비중(%) |
6.0 |
7.9 |
8.4 |
7.7 |
8.8 |
12.1 |
16.9 |
|
발명특허 등록량의 세계 순위 |
4 |
3 |
4 |
4 |
4 |
3 |
3 |
|
SCI수록 중국논문 세계 비중(%) |
4.5 |
5.4 |
5.3 |
5.9 |
7.0 |
6.6 |
8.3 |
|
SCI수록 중국논문 세계 순위 |
6 |
5 |
5 |
5 |
5 |
4 |
2 |
|
EI수록 중국논문 세계 비중(%) |
8.0 |
10.5 |
12.6 |
14.6 |
18.9 |
22.5 |
22.7 |
|
EI수록 중국논문 세계 순위 |
3 |
2 |
2 |
2 |
2 |
1 |
1 |
|
ISTP수록중국논문 세계비중(%) |
4.5 |
5.3 |
6.2 |
9.0 |
9.6 |
13.2 |
12.2 |
|
ISTP수록 중국논문 세계 순위 |
6 |
2 |
5 |
2 |
2 |
2 |
2 |
* 중국과기통계자료집 (과학기술부 2011.2)
표 8. 2011년 중국과학기술부 주요예산
|
구분 |
예산(위안) |
비고 |
|
과학기술지출: 국가과기계획(전문프로젝트) |
241억974만5,800 |
전년대비 14.08% 증가(주로 기초연구,응용연구,기술연구개발 등 프로젝트지출 증가) |
|
외교지출: 해외기관,대외원조,국제기구회비,국제기구기부금 등 |
9,150만6,000 |
전년대비 49.34% 증가 (해외기관 3.94%증가, 대외원조 71.43%증가, 국제기구 14.95%증가, 대외협력교류 신규60만위안, 기타외교 165만위안 감소) |
|
자원탐사 전력정보 등 사무지출: 과기형 중소기업의 발전과 관리 |
2억7,335만 |
신규예산: 전년도 없음 (과기형 중소기업 창업투자유도기금의 단계적 주식참여프로젝트) |
|
사회보장과 취업지출 |
2,115만9,000 |
전년대비 14.52% 증가 |
|
주택보장지출 |
2,968만300 |
전년대비 5.54% 감소 |
* 중국과기부 자료, 2011.4
표 9. 2009년도 중국 의약공업 기업 현황
|
분류 |
2009년 업체수 |
전년대비 증감율(%) |
|
중성약(한약재로 만든 의약) |
1,469 |
-0.20 |
|
화학약품 제제 |
1,267 |
1.04 |
|
의료기기 |
1,238 |
4.65 |
|
화학약품 원료 |
1,190 |
1.88 |
|
생물약품 |
816 |
8.80 |
|
중약(원료) |
668 |
8.97 |
|
위생자재 및 의약용품 |
655 |
6.85 |
|
제약설비 |
161 |
-0.62 |
|
총계 |
7,464 |
3.45 |
|
* 출처 : 2009년 중국의약통계연보 |
||
표 10. 2009년도 중국 의약공업 생산액
|
분류 |
의약공업 총생산(만위안) |
전년대비 증감율(%) |
비율(%) |
|
화학약품 제제 |
27,452,388 |
20.88 |
28.67 |
|
중성약(한약재로 만든 의약) |
19,455,283 |
19.83 |
20.32 |
|
화학약품 원료 |
18,780,384 |
11.20 |
19.61 |
|
생물약품 |
10,392,179 |
25.14 |
10.85 |
|
의료기기 |
9,419,178 |
16.69 |
9.84 |
|
위생자재 및 의약용품 |
5,131,099 |
28.19 |
5.36 |
|
중약(원료) |
4,531,260 |
24.17 |
4.73 |
|
제약설비 |
586,564 |
15.64 |
0.61 |
|
총계 |
95,748,355 |
19.13 |
100.00 |
|
* 출처 : 2009년 중국의약통계연보 |
|||

그림 1. 2009~2012년 중국 의약산업구조 예측
*출처 : CCID Consulting(賽迪顧問), 2010.2

그림 2. 2000-2009년 중국 의료 기기 시장 규모
(출처 : 중국 의료기기 기업협회, 2010)

그림 3. 중국내 내충성 형질전환 면화 재배 현황
(출처 : 2010년 중국생물산업발전보고서)
표 11. 중국 생물비료 시장 규모
|
제품유형 |
년 수요량 (만톤) |
사용면적 (억무1) |
사용량 (무/Kg) |
|
질소 고정균 관련 |
2,000 |
10.00 |
20.0 |
|
근권류 관련 |
22.5 |
2.25 |
1.0 |
|
인(P) 관련 생물비료 |
3,600 |
18.00 |
20.0 |
|
칼륨(K) 관련 생물비료 |
2,000 |
10.00 |
20.0 |
|
생장촉진 생물비료 |
3,600 |
18.00 |
20.0 |
|
토양유래 질병방제 생물비료 |
1,000 |
5.00 |
20.0 |
|
총계 |
12222.5 |
|
|
|
1) 무 : 면적의 단위, 1무(畝)≑666.7㎡, 약 200평 * 출처 : 2010년 중국생물산업발전보고서 |
|||
표 12. 2007-2010년도 중국내 바이오에탄올 생산
|
단위 : 만톤 |
||||
|
생산기업 |
2007년 |
2008년 |
2009년 |
2010년 |
|
COFCO Bio-Chemical Energy Co., Ltd. |
16 |
18 |
19 |
20 |
|
Jilin Fuel Ethanol Co., Ltd. |
42 |
47 |
48 |
51 |
|
Anhui Fengyuan Pharmaceutical Co., Ltd. |
36 |
40 |
40 |
44 |
|
Henan Tianguan Fuel Ethanol Co., Ltd |
43 |
40 |
49 |
52 |
|
Guangxi COFCO Bio-enery Co., Ltd |
0 |
13 |
16 |
17 |
|
총계 |
137 |
158 |
172 |
184 |
|
* 출처 : 2010년 중국생물산업발전보고서 |
||||
표 13. 2009년도 중국 바이오 디젤 시장 수요
|
바이오 디젤 함량 (%) |
5 |
10 |
20 |
|
수요량 (만톤/년) |
693 |
1386 |
2772 |
|
* 출처 : 2010년 중국생물산업발전보고서 |
|||

그림 4. 중국내 생물의약기술 특허 출원 현황


그림 5. 중국내 생물의약기술 특허출원 신청자 유형

그림 6. 연도별 중국 생명공학 산업 투자
(출처 : 서남증권연구센터)

그림 7. 중국 생명공학기술 벤처 투자
(출처 : 서남증권연구센터)
제3장 국가 생명공학 육성현황
제1절 생명공학 육성정책
1. 생명공학 연구개발 지원정책
가. 개요
정부 차원의 생명공학 육성은 1982년 과학기술부에서 생명공학을 핵심전략기술로 선정하여 특정연구개발사업으로 지원을 시작하면서부터이다. 이후 1983년 「유전공학육성법」(現 「생명공학육성법」)을 제정하여 정부의 생명공학 육성․지원을 위한 법적 기반을 마련하였고, 1985년 동법을 기반으로 한국과학기술연구원(KIST) 부설로 “유전공학센터”(現 “한국생명공학연구원”)를 설립하여 생명공학의 본격적 육성․지원을 시작하였다.
2009년 정부는 선진일류국가를 향한 과학기술 기본계획(577 initiative)을 통하여 2012년까지 총연구개발 투자를 국내총생산(GDP) 대비 5% 수준으로 확대하며, 정부 R&D투자 중에서 기초원천연구의 비중을 50%로 확대하기로 하고 이를 추진하고 있다.
1994년 제1차 생명공학육성기본계획을 통하여 창의적 연구개발의 저변을 확대하고 제도적 뒷받침 등을 통한 연구기반을 조성하였으며 지난 2007년 제2차 생명공학육성기본계획을 수립하여 2012년까지 원천기술 확보 및 산업화로 가기 위한 인프라 구축을 목표로 추진하고 있다. 또한 뇌연구촉진기본계획(‘08~’17), 줄기세포 연구활성화방안(‘10~’15), 생명연구자원관리기본계획(‘11~’20) 등 세부연구분야별 기본계획 등을 수립하였으며, 글로벌프론티어연구개발사업 및 바이오신약장기사업을 연구지원프로그램으로 계속해서 추진하고 있다.
[그림 ] BT 분야 중점추진방향의 변화

기초연구사업은 「기초연구진흥 및 기술개발지원에 관한 법률」제6조, 「학술진흥 및 학자금 대출 신용보증 등에 관한 법률」제12조의 2, 「국가연구개발사업의 관리 등에 관한 규정」및 「교과부 소관 연구개발사업처리규정」에 근거하여 추진되고 있으며, 연구발전 단계에 따라 전주기적 지원을 추진하고 있다. 대상사업으로 크게 개인연구로는 일반연구자지원사업, 중견연구자지원사업, 리더연구자지원사업을 통하여 창의성 높은 개인 연구를 지원하고 있으며 집단연구로는 선도연구센터지원사업(S/ERC, MRC, NCRC) 및 기초연구실지원사업(BRL)을 추진하고 있다. 또한 기초연구역량강화사업, 전문연구정보활용사업, 기초연구실험데이터글로벌허브구축사업 등 기초연구 역량 강화에 초점을 둔 기반 구축사업을 통하여 지원하고 있다.
지속적 연구를 통한 기초연구의 저변확대와 학문의 다양성 등이 고려된 연구비의 효율적 배분, 여성과학자 신규과제 점유율 제고등에 대한 강화 정책을 추진하고 있으며 미래 연구리더 육성을 위한 인재 양성 강화에도 초점을 두고 있다. 또한 선택과 집중, 투명한 연구비 집행 및 평가시스템을 통하여 지속적 연구비 확대에 준하는 사업의 효율성 실현할 수 있도록 지원하고 있다.
[그림 3-1-1-2] 2010년 기초연구사업 예산 투자 실적

출처: 2011년도 이공분야 기초연구사업 시행계획
나. 연구개발 지원 체제
(1) 법적, 제도적 기반
법적 성과로써 2009년 생명연구자원에 대한 국가차원의 관리 및 지원체계를 구축하고자 「생명연구자원의 확보․관리 및 활용에 관한 법률」를 제정하였고 2006년 시행한 「연구실안전법」에 있어서 미비점을 보완한 개정을 추진하였다. 그리고 2009년 국가과학기술위원회 안건 상정을 통한 원천연구 개념 및 비중 산정(안)을 마련하고 줄기세포연구 활성화 방안을 마련하였다.
또한 나노기술발전시행계획, 국가융합기술발전시행계획, 생명공학육성시행계획, 줄기세포연구 시행계획 수립 등 범부처 시행계획을 통한 제도적 지원 체계를 갖추고 있다. 특히 이번 2011년에는 범부처 공동으로 지난 2006년 수립된 제2차 생명공학육성기본계획(Bio-Vision 2016, 2007~2016) 2단계 계획 수립을 진행하고 있다. 그밖에도 7대 중점 연구분야를 집중 지원하고, 4대 인프라를 강화하여 ‘14년까지 나노분야 선진 3대 강국 실현을 목표로 하는 나노 기초․원천 중기발전전략(’10~‘14)를 수립하여 지원하고 있다.
(가) 생명공학육성법
생명공학육성법은 생명공학연구의 기반을 조성하여 생명공학을 보다 효율적으로 육성․발전시키고 그 개발기술의 산업화를 촉진하여 국민경제의 건전한 발전에 기여하게 함을 목적으로 1983년 「유전공학육성법」으로 제정되었으며 1995년 유전공학에서 생명공학으로 확대하는 내용의 제3차 개정을 통하여 「생명공학육성법」으로 개명하였다.
주요내용은 생명공학 육성기본계획 및 연차별 시행계획의 수립, 생명공학종합정책심의회 설치․운영, 5개 부처(교육과학기술부, 농림수산식품부, 지식경제부, 보건복지가족부, 환경부)의 생명공학 육성시책의 강구 등이다.
(나) 뇌연구촉진법
뇌연구촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성․발전시키고 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 기여하기 위하여 ’98년 6월『뇌연구촉진법』을 제정․운영하고 있다.
뇌연구촉진법은 뇌연구 촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성·발전시키고 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 기여함을 목적으로 하며, 주요 내용은 뇌연구촉진기본계획 및 연차별 시행계획의 수립, 뇌연구촉진심의회의 구성․운영, 뇌연구 투자의 확대, 3개 부처의(교육과학기술부, 지식경제부, 보건복지부) 뇌연구촉진시책 강구 등이다.
(다) 생명공학종합정책심의회
생명공학육성기본계획의 수립과 그 집행 및 조정에 관한 업무를 관장하기 위하여 교육과학기술부 장관 소속하에 생명공학종합정책심의회를 둔다. 생명공학종합정책심의회는 ① 생명공학의 기초연구 및 산업적 응용연구의 육성에 관한 계획의 수립 및 그 집행의 조정, ② 생명공학의 연구 및 기술개발에 관한 기본계획의 수립과 이에 따른 중요 정책의 수립 및 그 집행의 조정, ③ 생명공학분야 인력개발에 관한 종합계획과 이에 따른 중요 정책, 인력활용지침의 수립 및 그 집행의 조정, ④ 생명공학의 연구 및 이와 관련된 산업기술인력의 개발교류와 해외과학기술자의 활용에 관한 계획의 수립 및 그 집행의 조정, ⑤ 유전자원의 이용과 보전을 위한 연구개발계획의 수립 및 그 집행의 조정 등의 사항을 심의·결정한다.
(2) 한국생명공학연구원
교육과학기술부는 「과학기술분야 정부출연연구기관 등의 설립․운영 및 육성에 관한 법률」에 근거하여 1985년 2월 30명의 연구원으로 KIST 부설 유전공학센터를 설립하여 유전공학연구를 본격적으로 지원 육성하기 시작하였다. 이후 1990년 12월 KIST 부설 유전공학연구소로 명칭을 변경하였고, 유전공학육성법이 생명공학육성법으로 개정되어 1995년 3월 KIST 부설 생명공학연구소로 명칭을 변경하고, 1999년 5월 기초기술연구회 산하 생명공학연구소로 독립하였다. 2001년 1월 기초기술연구회 산하 생명공학전문연구원으로 승격하였고 현재는 정부출연연구소로 교육과학기술부에 소속되어 있다. 한국생명공학연구원은 생명과학기술 분야의 연구개발 및 이를 지원하는 연구사업과 국내외 연구기관, 학계, 산업계와 그 협동연구수행 및 성과보급을 목적으로 하고 있다.
주요기능으로는 학․연․산 역량의 결집 역할로써 조직화된 융․복합 연구 추진과 국가정책의 Think-tank 및 축적된 기초연구성과의 산업계 연계를 통한 바이오 경제 창출이다. 현재 대덕본원 외에 충북 오창캠퍼스, 전북분원(5본부, 1분원, 4지원부)를 두고 있으며 2011년 총 1,100명(정규직원 344명)의 직원이 종사하고 있으며 총예산은 약 1,417억 원이다.
(3) 생명공학육성기본계획 및 시행계획 수립
(가) 생명공학육성기본계획
교육과학기술부는 「생명공학육성법」 제4조에 근거하여 생명공학 분야의 효율적인 연구개발 촉진을 위하여 ’94년부터 범국가적인 “생명공학육성기본계획(Biotech 2000, 1994~2006)”을 수립하여 시행하였고, 이어서 제2차 생명공학육성기본계획(Bio-Vision2016, 2007~‘16)을 수립하여 시행하고 있으며 2011년 제2차 생명공학육성기본계획 2단계 계획을 수립하고 있다.
동 계획은 교육과학기술부 주관으로 농림수산식품부․지식경제부․보건복지부․환경부․국토해양부 등 5개 부처가 공동 추진하고 있다.
(나) 생명공학육성 연도별 시행계획수립
교육과학기술부는 『생명공학육성법』 제5조에 근거하여 관계부처와 합동으로 생명공학육성기본계획에 따른 연도별 “생명공학육성 연도별 시행계획”을 매년 수립하여 시행하고 있다. 2011년도 정부 부문에서 총 1조 5,012억원을 투입하여 생명과학, 보건의료, 농축산식품, 산업공정/환경해양, 바이오융합의 연구개발과 공공 R&D 인프라 구축을 위한 출연기관의 예산 확대 등의 시설 및 기반구축사업, 인력양성을 지원하며 부처별 연구개발 투자실적 및 계획은 아래와 같다.
[표 3-1-1-1] 부처별 연구개발 투자실적 및 계획
|
구 분 |
'11년 투자계획 |
'10년 계획 (B) |
'10년 실적 (C) |
달성율 (%) (C/B) |
||||
|
연구 개발 |
인프라 |
인력 양성 |
합계 (A) |
증가율 (%) ((A-B)/B) |
||||
|
교육과학기술부 |
487,852 |
32,083 |
72,407 |
592,342 |
9.5 |
541,012 |
539,213 |
99.7 |
|
농림수산식품부 |
161,663 |
1,000 |
3,500 |
166,163 |
47.3 |
112,799 |
135,539 |
120.2 |
|
지 식 경 제 부 |
110,287 |
36,532 |
2,600 |
149,419 |
△3.0 |
153,979 |
168,424 |
109.4 |
|
보 건 복 지 부 |
280,230 |
64,472 |
1,250 |
345,952 |
△14.8 |
405,994 |
429,942 |
105.9 |
|
환 경 부 |
33,606 |
|
|
33,606 |
6.1 |
31,685 |
32,686 |
103.2 |
|
국 토 해 양 부 |
32,691 |
40,529 |
|
73,220 |
△21.0 |
92,690 |
89,850 |
96.9 |
|
출 연 기 관 |
122,300 |
18,169 |
|
140,469 |
40.2 |
100,227 |
121,849 |
121.6 |
|
총 계 |
1,228,629 |
192,785 |
79,757 |
1,501,171 |
4.4 |
1,438,386 |
1,517,503 |
105.6 |
출처: 2011년 생명공학육성 시행계획, 2011
다. 주요 연구개발 프로그램
(1) 기초과학육성사업
대학 등의 기초과학분야 연구에 대한 지원사업으로 일반연구자지원사업, 중견연구자지원사업, 리더연구자지원사업, 선도연구센터육성사업 등이 있다.
(가) 일반연구자지원사업
이공학분야 기초연구활동 지원을 통해 연구자의 연구역량 제고 및 연구저변 확대를 위하여 신진, 여성, 지역우수대학우수과학자 등 특정 그룹과 일반 연구자를 지원하는 사업이다. 「기초연구진흥 및 기술개발지원에 관한 법률」제6조에 근거하며 2010년 3,550억원에서 2011년 3,980억원으로 예산을 증액하였다.
(나) 중견연구자지원사업
기초연구지원사업 등의 국가연구개발사업에서 우수한 연구성과를 이룬 중견연구자들을 지속적으로 지원하는 사업이며 2009년 기초연구지원사업 구조 개편을 통해 특정기초, 국가지정연구실, 우수학자, 창의도약연구가 중견연구자지원사업으로 개편하였고 지난 2010년 핵심연구(협동연구)를 핵심연구(공동연구)로 사업명을 변경하였다. 지원 규모는 핵심연구(개인연구 100백만원 이내, 공동 200백만원 이내) 3년간, 도약연구(도전연구 300백만원 이내, 전략연구 300백만원 이내) 5년간(3+2) 지원하는 사업이다.
(다)리더연구자지원사업
창의적 아이디어 및 지식을 지닌 차세대연구자를 발굴하여 세계수준의 우수 연구리더로 집중 육성하는 창의적연구사업과 세계적 수준의 독창적 연구성과를 창출한 선도연구자를 발굴하여 자신의 연구를 심화․발전시켜 나가도록 지원하는 국가과학자지원사업으로 구분으로 지원하고 있다.
(라)선도연구센터육성사업
이공학분야(SRC/ERC), 기초의과학분야(MRC) 및 학제 간 융합분야(NCRC)의 세 분야로 나누어지며, 이공학분야는 국내대학에 산재되어있는 우수한 연구인력을 특정분야별로 조직․체계화하여 집중 지원함으로써 세계적 수준의 선도과학자 군으로 육성하고, 기초의과학분야는 의과․치과․한의과대학의 기초의학교실과 약학대학을 중심으로 연구인력과 자원을 조직․체계화하여 기초의약학 부문 거점연구조직을 육성하며, 학제간 융합분야는 국가차원의 전략적 육성이 필요한 미래지향적 과학기술분야(중․대분야간 융합과학기술)의 전략적 공동연구 수행을 통해 세계수준의 지식 및 경쟁력을 창출하는 것을 최종 목표로 하고 있다. 1991년 3월부터 2010년 9월까지 연구센터 139개 선정(SRC 63, ERC 76)하였고 총152개 선정, 62개(SRC 30, ERC 32) 운영중이다. (90개 종료/지원중단 4개 포함)
(2) 원천기술개발사업
미래 성장잠재력 확보 및 국민의 삶의 질 향상에 기여하는 바이오, 나노, 에너지․환경 및 융합기술등 미래유망 분야 핵심 원천 기술의 전략적 개발을 목표로 하고 있으며 과학기술기본법 및 기술개발촉진법에 근거하고 있다. 생명공학육성법, 나노기술개발촉진법 등에 의해 수립된 분야별 기본계획 등과 연계하여 추진하고 있다.
(가) 21세기 프론티어 연구개발사업
바이오, 나노, 에너지․환경 기술 분야별 세계 정상급 기술력을 확보 및 고부가가치 신산업 창출 기반 마련에 목적으로 두고 있으며 2010년 12개 사업단 1,052억원을 지원하고 있다.
(나) 미래기반기술개발사업
바이오기술, 나노기술 및 신기술융합형 성장동력사업을 통한 미래핵심 유망 분야에 대한 전략적 지원 사업이다.
(다) 바이오신약․장기사업
소득 2만 불의 선진경제로 도약하기 위해서 우리에게 강점이 있고 부가가치가 큰 바이오신약․장기 분야의 핵심제품을 개발하는 사업으로 핵심기술의 특허출원 및 제품화가 가능한 분야 위주로 최종목표와 사업범위를 구체화하여 추진하며, 장기복제이식기술개발, 단백질칩 기술개발, 약물전달시스템기술개발, 면역기능제어기술개발 등 4개 분야의 핵심제품을 개발하며 2010년에 약 120억 원을 지원하고 있다.
(라) 글로벌프론티어사업
2021년까지 미래 전략기술 분야의 기초원천 연구에 집중할 연구단을 선정, 연구단별로 매년 50억~200억 원을 투자하는 사업으로써 세계 최고 수준의 기초․원천연구를 수행하는 연구 거점 구축 및 대한민국 대표 원천기술 확보를 목표로 하고 있다.
이외에도 계속사업으로 나노팹시설구축사업, 미래유망파이오니어사업, 기후변화대응기술개발사업, 뇌과학원천기술개발사업, 연구실안전환경구축사업을 추진중이며, 신규추진 사업으로 신약개발지원센터설립사업, 사이버융합연구․교육고도화사업, 기반형융합녹색연구, 공공복지안전연구사업을 추진하고 있다.
라. 추진방향 및 발전과제
최근 기후변화 및 고령화 등 미래 메가트랜드에 따른 수요증가에 따라 세계는 생명공학에 대한 중요성을 강조하고 바이오산업을 국가 중요 전략 산업으로 선정하여 경쟁력을 키우고 있다. 생명공학은 인류 난제를 극복하는 생명 중심 사회의 핵심 기술이며 타 기술과의 융합이 활발해지면서 응용분야가 확대되는 추세이다.
이러한 흐름에 맞추어 국가 생명공학 분야의 주무부처인 교육과학기술부에서는 생명공학분야의 미래 메가트랜드를 반영한 핵심 원천기술 확보 및 선진화 기반 확충에 적극적 투자와 지원을 추진하여 곧 다가올 바이오경제 시대를 준비하고 있다. 2011년 범부처 종합 계획인 제2차 생명공학육성기본계획 2단계 계획 수립은 2016년 이후 바이오산업화로 가는 준비단계로써 그 기반 확보를 탄탄히 하는 것에 초점을 두고 있다.
뇌과학을 포함한 차세대바이오원천기술 및 주요 9개 질환중심의 글로벌 신약후보물질 개발 지원을 통한 신약개발 및 범부처 신약개발지원사업을 통한 다각적 지원에 역점을 두고 있다. 또한 바이오경제의 무한한 잠재력을 보유하고 있는 생명연구자원의 효율적 확보․관리 및 활용에 관한 법률 제정을 통한 제도적 기반 마련에도 힘쓰고 있다.
이러한 생명공학 육성 지원 정책들이 국가 생명공학의 기틀을 확고히 하여 글로벌 경쟁력을 갖추고 나아가 풍요로운 바이오 경제 구현을 이루는 결실이 될 것으로 전망한다.
2. 생명공학산업 육성정책
가. 생명공학산업화 현황
생명공학기술(Biotechnology, BT : 바이오기술)은 생물체의 기능과 정보를 이용하여 제품을 만들거나 유전적인 구조를 변형하여 생명체에서 우리가 원하는 특별한 성질을 나타내게 하는 복합적인 기술이다. 생명공학기술은 대표적인 신규기술(Emerging Technology)로서 기술의 난이도, 복합성, 확장성 등에 있어서 기존의 여타 기술과는 많은 차이를 보이고 있다. 또한, 산업화 및 부가가치의 창출에 있어서 원천 핵심기술이나 지적 재산권의 확보가 결정적인 영향력을 갖는다는 특징이 있다.
산업적인 응용에 있어서는 생명공학기술 자체에 기초한 생명공학 신산업의 육성은 물론, 기존의 여러 기술과 융합함으로써 의약·화학·전자·에너지·농업·식품 등의 산업을 질적으로 변화시킨다는 특징을 갖는다. 생명공학기술에 기초한 생명공학산업은 IT에 이어 세계 경제의 견인차가 될 것으로 기대되는 기술집약적인 고부가가치 지식기반 산업이다. 그러나 생명공학 핵심기술의 개발이나 생명공학산업의 육성에는 장기적인 대규모의 투자(Long Term Investment) 및 위험(High Risk and High Return)이 따른다. 이러한 투자규모와 위험성을 민간이 단독으로 감당하기에는 어려움이 많으므로 세계 각국에서는 정부가 앞장서서 생명공학관련 기술개발을 주도하고 있으며, 또한 생명공학산업을 국가 전략산업으로 선정하여 집중 육성하고 있다.
나. 생명공학산업 육성을 위한 지식경제부의 주요 정책
지식경제부는 산업계가 글로벌 경쟁력을 갖출 때까지 산업화 지원에 중점을 둔다는 기본 정책방향을 가지고 있다. 기술변화와 산업성장 추세를 감안하여 전략적 투자방향을 설정할 것이며, 부처 협조체제 강화와 산업화 촉진을 위한 비즈니스 환경 조성에 주력할 계획이다.
이를 위해 국가 R&D 투자 효율성 제고, 바이오시밀러 글로벌 수출산업화, 의료기기산업 육성 등을 통한 생명공학산업화의 정책적 육성을 추진하고 있다.
(1) 국가 R&D 투자 효율성 제고
지식경제부는 과거 중기거점기술개발사업, 성장동력기술개발사업, 차세대신기술개발사업, 전략기술개발사업 등으로 분산되어 있던 R&D 사업구조를 2008년부터 산업원천기술개발사업으로 통합하여 일원화 하였다. 이에 생명공학산업 R&D도 바이오 산업원천기술개발사업으로 일원화 하여 운영하고 있다. 기존의 R&D사업이 정부가 선정한 바이오분야 기술군에 대한 Top-down방식으로 이루어진 반면, 개편된 산업원천기술개발사업에서는 정부의 산업발전전략, 특허연계형 기술, 기술로드맵 등에 기반한 Top-down방식과 함께 기술수요조사에 기반한 Bottom-up방식을 동시에 고려하여 과제를 기획하는 것이 가장 큰 특징이다. 이와 같이 지식경제부는 현장 수요를 고려한 기술 개발을 전략적으로 추진하여 산업화 성공사례를 창출해 나갈 계획이다. 중점 지원 분야는 의약바이오(천연물신약), 산업바이오(바이오화학산업), 융합바이오(Smart 바이오진단·분석), 그린바이오(맞춤 바이오매스) 등 4개 분야이다.
특히 산업원천기술개발사업에서 집중 지원을 하고 있는 의약바이오분야의 신약개발사업은 최소한 후보물질 도출 단계부터 상업화 목표와 연계되도록 전주기 범부처 통합지원 시스템을 구축할 필요가 있다. 이에 정부는 신약개발 R&D 투자는 후보물질 도출 단계부터 산업화 목표와 전주기적으로 연계하여 중복성 탈피 및 투자효율화를 도모하기 위한 관계기관간 협의체 구성 및 운영을 위한 범부처 공동프로그램을 구축할 계획이다. 이렇게 부처간 협의체계를 구축하여 공동기획 및 운영·관리를 통해 3개 이상의 글로벌 블록버스터 신약 개발, 세계 50위권 제약사 육성 등을 목표로 사업을 추진하고 있다.
(2) 바이오시밀러 글로벌 수출산업화
전 세계적으로 블록버스터급 바이오의약품의 특허 만료가 ‘13년을 전후로 도래하여, 바이오시밀러 新시장이 급성장할 전망이다. Biophoenix에 따르면 바이오시밀러의 시장은 ’10년 22억불에서 ‘15년 143억불, ’20년 905억불로 연평균 성장률이 40%이상일 것으로 예상하고 있다.
이러한 新시장의 성장에 대비하여 지식경제부에서는 바이오시밀러 제품의 수출경쟁력 제고를 위해 글로벌 수준에 걸맞은 인프라·인력·제도 등의 완비에 정책적 역량을 집중하고 있으며, 기업들의 높은 해외시장 진출 의지와 단계별 시장공략전략을 뒷받침하는 맞춤형 수출지원 시스템 구축에 역점을 두고 있다.
(3) 의료기기산업 육성
고령사회 도래와 웰빙확산 등에 따른 의료서비스 수요증가로 의료기기 국내시장은 세계에서 가장 빠르게 성장하는 국가중의 하나(연 13%, ’09년 3.6조원)가 되었다.
“의료기기원천기술개발사업”을 통하여 국내 의료기기 업체의 기술경쟁력 강화를 도모하고, 한-미, 한-EU FTA 체결에 따른 의료기기산업 경쟁력 강화대책의 일환으로 ‘12년도부터는 “핵심의료기기 제품화 개발사업”을 추진할 예정이다.
경북대구와 충북오송의 첨단의료복합단지 내에 “첨단의료기기개발지원센터 조성”사업을 진행중에 있다. 대구첨복단지는 의료영상진단, 생체진단, 및 의료로봇 등 IT기술기반 육성을 오송첨복단지는 바이오진단, 이식형인공심장박동기 등 BT기술기반 육성으로 각 단지별 차별화를 영역에 역량을 집중하여 생명공학산업화에 기여하고자 노력하고 있다.
또한 의료서비스와 IT 기술의 강점을 활용한 의료기기+병원운영시스템+의료서비스+건설 등 패키지 형태의 “IT 융합 디지털병원 수출”사업을 추진하고 있다.
이와 더불어, 미국, EU 등 선진국의 의료기기 규격강화에 대응하시 위해 “국내 시험인증기반 강화사업”을 추진하고 있으며, ’12년도부터는 “의료기기 국제인증평가기술 개발사업”도 병행하여 의료기기 업체들의 수출활성화를 위해 적극 지원할 예정이다.
(4) 생명공학전문인력 양성
지식기반산업인 생명공학산업에 있어 우수인력의 확보는 산업경쟁력 확보의 관건이다. 특히 IT·NT 등과의 융합현상 가속화로 새로운 응용분야로의 기술혁신이 급속히 진행되고 있어 이에 부응할 전문인력의 질적 부족현상이 심화되고 있는 실정이다. 이에 미래산업 핵심인재 10만 양성계획 및 신성장동력 비전과 발전전략에 따라 생명공학전문 인력육성을 추진 중이며 생명공학 특성화 대학원·GMP전문인력 및 생명공학핵심기술 전문인력 교육을 통하여 ‘10년 23억원 지원으로 498명을 양성하였다.
(5) 유전자변형생물체(LMOs)의 대응시스템 구축
지식경제부는 바이오안전성의정서의 이행을 위한 국가책임기관으로서 LMO의 개발․생산․수입․수출․유통 등에 관한 안전성을 확보하고 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 미치는 위해를 사전에 방지하고자 2001년 국내이행법인 「유전자변형생물체의국가간이동등에관한법률(LMO법)」을 제정하여 2008년 1월부터 시행하고 있다.
또한 관계부처 통합으로 LMOs의 개발․생산․수출입․유통 등 종합적인 안전관리 계획을 수립하고 LMO의 안전성평가를 위한 LMO위해성평가센터를 설립하여 수입․생산․연구개발 중인 모든 LMO에 대해 보다 엄격한 안전관리를 진행하고 있다
향후 바이오안전성의정서의 원활한 이행 및 LMO의 수요증가에 대비하여 국내외 동향 및 향후전망을 파악하여, 국내환경에 적합한 안전관리 시스템을 마련하고 LMO의 안전성 확보를 위한 안전관리 전문능력 향상 및 위해성 평가․관리 등 관련 기술개발을 지원해 나갈 계획이다.
(6) 바이오화학실용화센터 건립
글로벌 경기회복, 중동사태, 개도국의 경제성장으로 유가상승이 지속될 것으로 예상되는 가운데, 바이오매스(생물자원)를 기반으로 한 바이오화학산업이 기존 석유화학산업을 대체할 신산업으로 주목받고 있다. 또한, 온실가스 감축부담과 함께 환경친화적 제품 요건이 무역규제로 작용하면서 친환경 바이오화학제품의 중요성이 더욱 부각되고 있는 실정이다. 하지만, 바이오화학분야의 높은 기술적 수요에도 불구하고, 초기 투자 부담 등의 요인으로 현재 기업 투자는 매우 미흡한 상황이다.
이에 바이오화학산업의 조기정착과 기술적 우위선점을 위하여 정부는 다양한 시책을 강구할 예정이며, 그 일환으로 바이오화학관련 원천기술의 산업화 촉진을 위하여 울산 테크노산업단지 내에 Pilot 규모의 바이오화학실용화센터 건립(‘10년~’13년, 정부지원 200억원, 지방비 100억원), 산학연 공동 R&D, 개발된 기술의 실증화, 및 기업으로의 기술이전 등을 촉진할 계획이다.
(7) 지역바이오 활성화 기반 구축
지식경제부는 생명공학산업의 저변 확대 등을 목적으로 ‘98년~’10년까지 지역특성을 바탕으로 총20개의 지역바이오산업 인프라(특화센터)를 구축하였으며, 바이오센터별 차별화, 특성화하여 지역경제 활성화를 유도하였다. ‘08년부터는 이미 구축된 바이오 인프라시설을 보완하면서 기술지원·인력양성·마케팅에 집중지원하고 있다.
최근 바이오산업이 급속히 성장함에 따라 지역에서도 신규사업에 대한 사업검토 및 예산 지원요청 등이 증가하고 있으며, 이러한 지역의 바이오산업 진흥을 위한 수요에 맞추어 특화센터가 행정적·제도적 지원을 제공하여 지역바이오 활성화에 기여하고 있다.
< 지역 바이오 특화센터 구축 현황 >
|
분 류 |
사 업 명 |
특화분야 |
기 간 |
|
충청권 |
ㅇ바이오센터(대전) |
생물의약, 분자진단, 기능성식품 |
02~07 |
|
ㅇ보건의료산업센터(충북오창) |
노인용 건강보조․노인성질환약품 |
04~07 |
|
|
ㅇ전통의약산업센터(충북제천) |
한약제제 및 한약제 품질검사 |
03~07 |
|
|
ㅇ충남동물자원센터(충남논산) |
동물사료 첨가제, 동물백신 |
03~07 |
|
|
호남권 |
ㅇ천연자원연구원(전남장흥) |
천연물소재 |
07~09 |
|
ㅇ식품산업연구센터(전남나주) |
기능성식품 |
02~07 |
|
|
ㅇ생물의약연구센터(전남화순) |
단백질의약품, 세포․유전자치료제 |
02~07 |
|
|
ㅇ독감백신원료생산공장(전남화순) |
백신(신종플루 등) |
05~07 |
|
|
ㅇ나노바이오연구센터(전남장성/곡성) |
생물방제, 생물농약 등 |
06~08 |
|
|
ㅇ생물산업진흥원(전북전주) |
발효․건강기능식품 |
05~07 |
|
|
동남권 |
ㅇ바이오21센터(경남진주) |
바이오식품, 생물화학, 의약 |
04~08 |
|
ㅇ해양생물산업육성센터(부산) |
해양생물유래 기능성식품 |
04~08 |
|
|
대경권 |
ㅇ바이오산업지원센터(대구) |
전통생물소재 연계 액상제품 |
04~08 |
|
ㅇ한방산업지원센터(대구) |
한방임상시험, 한방임상평가 |
04~08 |
|
|
ㅇ바이오산업연구원(경북안동) |
기능성식품 |
02~07 |
|
|
ㅇ해양바이오산업연구원(경북울진) |
해양식품, 식품소재 |
04~07 |
|
|
ㅇ정보지원센터(경북포항) |
생물의약 |
07~09 |
|
|
강원권 |
ㅇ바이오산업진흥원(강원춘천) |
생물의약, 건강기능식품 |
02~07 |
|
ㅇ해양바이오사업단(강원강릉) |
기능성식품, 바이오화장품 |
02~07 |
|
|
제주권 |
ㅇ제주TP 바이오융합센터(제주) |
건강․뷰티생물산업 |
02~07 |
다. 생명공학육성과 지식경제부
과거 우리나라의 고도성장시기에는 생산규모의 확대와 부가가치 창출에 집중하여 왔다면, 21세기에 접어들면서 건강한 삶, 편리한 삶, 쾌적한 환경, 그리고 산업 발전의 지속성 강화 등으로 옮겨지고 있다. 이러한 요구들은 모두 생명공학기술 내지는 생명공학산업과 분리해서 생각할 수 없다.
이러한 시대적 메가트렌드에 부응하고 IT혁명의 뒤를 이을 고부가가치 미래 신산업인 생명공학산업은 정부에서도 그 중요성을 인식하고 있으며, 생명공학의 한 분야인 바이오제약·의료기기 분야를 17대 신성장동력으로 선정한 바 있다. 이에 따라 지식경제부는 2015년 생산 60조 원, 수출 250억 달러, 바이오 7대강국 달성 등을 목표로 생명공학기술의 산업화에 초점을 맞추고 관련 산업 육성을 위해 정책적 지원을 다할 계획이다.
3. 생명공학 기초과학진흥 및 인력양성정책
가. 생명공학분야 기초과학진흥
(1) 필요성
최근 유전체학/단백체학 및 세포체학/대사체학 연구 등에서 급속한 진전을 보이고 있는 생명공학은 우리의 미래 생활에 큰 변화를 예고하고 있다. 기초 생명공학은 다가오는 제4의 물결, 바이오테크 혁명 시대를 견인할 필수적인 분야이다. 이러한 기초 생명공학 기술을 응용하여 개인별 유전적 특성을 고려한 맞춤의약 개발 및 맞춤의료서비스가 실현되고 있으며 유전체 대량 분석과 정보를 활용한 난치병 예방, 진단 및 치료법 개발 기술, 세포 치료제 개발 기술로 인해 많은 질병이 퇴치되고 수명이 연장되고 있다.
이러한 생명공학의 성과는 생물학, 생화학, 생리학, 생물물리학 등 관련 기초과학의 다양한 실험 기술의 성과에서 기인한 것으로 관련분야의 기초과학 발전이 있었기에 가능한 것이었다. 아울러 뇌기능 조절 메커니즘 규명, 뇌기능 향진 기술 개발, 뇌질환 관련 치료제 및 치료기술 개발의 발전에 힘입어 고령화 사회에 따른 실버산업 활성화 등 기술적, 사회적 경제적 파급효과가 클 것으로 기대되며, 줄기세포 원천기술 및 응용기술 개발로 난치성질환 치료기반을 확립하게 되었다. 또한 기초연구 성과를 조기에 산업화로 갈수 있도록 견인하는 중개연구 지원 역시 확대되는 추세이다. 이렇듯 미래 국가 경제를 선도할 중요한 분야라는 국내외의 공통된 인식으로 인하여 해외 선진국들의 바이오 경제 시대 선점을 위하여 바이오 관련 육성 정책을 강화하고 미래 유망 기술 분야에 대한 지원을 강화하고 있는 추세이다.
이런한 추세에 맞추어 우리나라는 21세기 바이오 경제시대를 선도하기 위하여 건강한 “생명 중심 사회”와 “풍요로운 바이오 경제” 구현을 비전으로 과학기술 논문 창출과 특허 기술 경쟁력을 2005년 각각 13위와 14위에서 2016년에는 세계 7위라는 목표를 세웠으며, 이를 위해 1) 국가 생명공학 육성 추진계획 혁신, 2) 연구개발 일류화 기반 확충, 3) 바이오 산업의 발전 가속화 및 글로벌화, 4) 법/제도 정비 및 국민 수용성 제고 등의 4대 전략을 수립하여 추진하고 있다. 또한 국가 주도로 기초 연구의 진흥을 위하여 기초연구사업 관련 종합계획을 수립하고 기초원천 분야의 투자 확대를 추진해 오고 있다. 최근 국가과학기술위원회의 출범(‘11.3)과 과학비지니스밸트 등 정책적 변화를 보면 빠르게 변화하는 생명공학 분야의 글로벌 패러다임에 대응하는 국가적 의지를 알 수 있다.
(2) 정부의 기초과학 진흥 추진 과정
OECD Frascati Manual(2002)에서 제시한 연구개발 단계는 기초연구, 응용연구, 개발연구로 구분된다. 이 기준에 따라 제시된 개념으로 기초연구란 특수한 응용 또는 사업을 직접적 목표로 하지 않고, 자연현상 및 관찰 가능한 사물에 대한 새로운 지식을 획득하기 위하여 최초로 행해지는 이론적 또는 실험적 연구로, 목적지향적 기초연구는 미래의 광범위한 응용을 위하여 원천지식의 토대를 산출하는 연구라 정의하였다.
이에 비해 응용연구는 이미 알려진 지식을 심화․발전시켜 특정 문제를 해결하거나 특정 상황에 적용하여 활용하는 연구로 연구가 성공적으로 이루어져 기대하는 결과(물)를 얻을 경우, 그 결과(물)가 적용될 분야가 확실한 연구라 하였으며, 개발연구란 실용적이고 유통 가능한 (시)제품, 물질, 장치 또는 제품의 공정 과정을 개발하기 위한 연구라 정의하였다.
2004년 당시 과학기술부에 “과학기술혁신본부” 설치 및 부총리급 격상에 따라, 정부 간 합의를 거쳐 기존 과학기술부에서 추진하던 기초연구 사업을 3개 유형으로 나누어 순수기초 연구와 기초과학기반구축 사업은 당시 교육인적자원부에서 주관하고 목적 기초연구는 과학기술부에서, 응용 연구 부분에 대하여는 산업자원부와 정보통신부에서 주관하도록 조정하였다. 이와 더불어 교육인적자원부는 대학연구의 제도 및 기반을 구축하고 대학의 우수 연구 인력양성 지원 사업을 하도록 학술 진흥 및 학자금대출 신용보증 등에 관한 법률 시행령 제5조에 명시하였다.
정부는 기초과학연구의 진흥을 위한 여건 조성을 위하여 기초과학연구에 관하여 1) 대학교수, 박사후 연구원 등 관계 전문가의 연수 및 연구비 지원, 2) 석사 및 박사과정 학생의 연구장학금 지원, 3) 연구교수(연구조교포함) 제도, 교수의 연구 휴가제도, 객원교수제도 및 객원연구원제도의 활용, 4) 대학의 연구시설 및 기자재 지원, 5) 대학부설연구소 및 우수 연구 집단 형성 지원, 6) 대학, 국공립연구소, 정부출연연구소 및 기업부설연구소와의 공동연구 추진 등 산업계, 학계 및 연구소간 교류 촉진, 7) 기업의 대학 기초과학 연구 활동 지원 추진 8) 기타 연구 환경 조성 및 연구기반 구축에 필요한 사항 등을 강구하도록 기초과학연구진흥법 제9조에 규정하고 있다. 2008년 2월 교육인적자원부와 과학기술부의 통합으로 교육과학기술부가 출범하였다. 두 기관의 통합은 기초과학에 관한 여러 정책이 일관성 있게 정리될 수 있는 기회를 제공하였다. 실제로 2009년 한국연구재단의 출범은 두 기관에서 각각 실시되었던 기초과학에 관한 연구비와 정책을 효율적으로 통합하여 관리할 수 있게 되었다. 교육과학기술부는 “새로운 지식창출”과 “창조적 인력양성”을 통해 국가 경쟁력의 근본 원천인 ‘과학 기초(Science Base)' 제공을 목표로 기초과학진흥법 제6조에 근거하여 이공분야 기초연구사업 시행계획을 추진하고 있다.
(3) 교육과학기술부의 기초과학연구지원 현황
교육과학기술부에서는 2009년 한국과학재단, 한국학술진흥재단, 그리고 국제과학기술협력재단을 합병하여 국내 최대 규모의 연구재단인 한국연구재단을 발족하고 우리나라 연구력의 근본이라 할 수 있는 기초연구를 중점 지원하고 있다. 이에 따라 개인 또는 소규모 공동연구 중심의 기초연구를 지원하여 국가연구역량 토대를 구축하고 국제적 수준의 연구 결과를 도출하여 국가 사회 발전과 학문의 발전을 도모할 수 있도록 지원하고 있다. 한국연구재단은 기존 세 재단의 다양한 연구 지원사업들을 기초연구지원사업으로 통폐합하여 효율적으로 연구자들을 위한 단계적 연구비지원을 수행하고 있다.
특히 한국연구재단은 기초연구본부에 생명과학단과 의약학단, 그리고 일부의 융합과학단에서 대학과 국책연구기관의 생명과학분야를 지원하고 있으며, 국책연구본부의 생명공학단은 대단위 국책사업을 지원하고 있다. 공학단, 생명과학단 및 일부 복합학단에서 생명공학 분야 연구과제를 지원하고 있다. 기초연구본부의 생명과학단에서는 기초생명과학분야 생화학 및 분자생물학, 유전학 및 유전체학, 암생물학, 미생물학, 식물학, 생태 및 환경학 등의 기초생명과학분야와 농학, 임학, 수산학, 수의학 등의 농수산임학분야를 지원하고 있으며, 의약학단에서는 기초의학, 간호학, 보건학, 약학, 간호학, 한의학 등을 지원하고 있다.
(가) 기초연구지원 사업 현황
한국연구재단에서는 개인연구지원사업인 일반․중견․리더 연구자 지원사업에 대하여 꾸준히 신규과제 규모를 증가하여 지원할 계획이며 선도 및 기초연구실 육성과 같은 집단연구지원사업도 지속적으로 신규 예산을 편성하여 지원하고 있다. 그 외에 대학연구소 전문화 및 특성화를 위해 대학부설연구소를 지원하는 중점연구소지원사업과 연구를 위한 소재은행구축 및 운영을 위한 연구소재은행 사업, 그리고 신진 연구인력을 지원하기 위한 학문후속세대 사업을 지원하고 있으며, 2010년 신규 추진사업으로서 기초연구 실험데이터 글로벌구축사업을 계속해서 지원할 예정이다.(표 3-1-3-1).
[표 3-1-3-1] 2010~2011년도 기초연구지원사업 예산 현황 (단위 백만 원)
|
사 업 명 |
'10 예산 (A) |
'11 예산 (B) |
증 감 |
||||
|
(B-A) |
% |
||||||
|
합 계 |
813,060 |
913,960 |
100,900 |
12.4% |
|||
|
개인연구지원사업 |
650,000 |
750,000 |
100,000 |
15.4% |
|||
|
|
-일반연구자지원 |
355,000 |
398,000 |
43,000 |
12.1% |
||
|
|
기본연구 |
258,270 |
271,910 |
13,640 |
5.3% |
||
|
신진연구자 |
62,100 |
78,970 |
16,870 |
27.2% |
|||
|
여성과학자 |
18,130 |
24,700 |
6,570 |
36.2% |
|||
|
지역대학우수과학자 |
16,500 |
22,420 |
5,920 |
35.9% |
|||
|
-중견연구자지원 |
245,000 |
299,000 |
54,000 |
22.0% |
|||
|
|
핵심연구 |
125,000 |
149,000 |
24,000 |
19.2% |
||
|
도약연구 |
120,000 |
150,000 |
30,000 |
25.0% |
|||
|
-리더연구자지원 |
50,000 |
53,000 |
3,000 |
6.0% |
|||
|
|
창의적연구 |
39,000 |
42,000 |
3,000 |
7.7% |
||
|
국가과학자 |
11,000 |
11,000 |
- |
0.0% |
|||
|
집단연구지원사업 |
115,200 |
120,200 |
5,000 |
4.3% |
|||
|
|
-선도연구센터 |
105,200 |
105,200 |
- |
0.0% |
||
|
-기초연구실 |
10,000 |
15,000 |
5,000 |
50.0% |
|||
|
기초연구기반구축사업 |
42,860 |
43,760 |
900 |
2.0% |
|||
|
|
-전문연구정보활용 |
2,800 |
2,800 |
- |
0.0% |
||
|
-기초연구역량강화 |
39,060 |
39,460 |
400 |
1.0% |
|||
|
|
학문후속세대 |
13,060 |
16,060 |
3,000 |
23.0% |
||
|
중점연구소 |
26,000 |
23,400 |
△2,600 |
△10.0% |
|||
|
-기초연구실험데이터글로벌허브구축 |
1,000 |
1,500 |
500 |
50.0% |
|||
출처: 교육과학기술부, 2011년도 이공분야 기초연구사업 시행계획(안)
(나) 생명과학분야 사업 지원 현황
정부에서 이공분야에 지원하는 총 R&D 투자액 중 생명과학분야의 범주에 속하는 생명과학, 농림수산, 보건의료 부문에 지원되는 총 투자액수는 2조 1,604억 원으로서 전체 R&D 투자액의 19.05%를 차지하고 있다(표 3-1-3-2).
[표 3-1-3-2] 과학기술표준분류별 투자 추이(2009년)
|
분야 |
비율 (%) |
지원 액수 (단위 억원) |
|
생명과학 |
4.9 |
5,578 |
|
농림수산식품 |
6.8 |
7,693 |
|
보건의료 |
7.3 |
8,333 |
|
수학 |
0.3 |
360 |
|
물리학 |
2.2 |
2,527 |
|
화학 |
1.9 |
2,200 |
|
재료 |
3.8 |
4,297 |
|
화공 |
2.8 |
3,150 |
|
지구과학 |
1.9 |
2,150 |
|
전기전자 |
9.7 |
10,979 |
|
정보/통신 |
12.1 |
13,726 |
|
기계 |
13.5 |
15,309 |
|
환경 |
3.1 |
3,547 |
|
에너지/자원 |
6.1 |
6,885 |
|
원자력 |
4.3 |
4,835 |
|
건설/교통 |
7.4 |
8,364 |
|
과학기술과인문사회 |
5.5 |
6,214 |
|
기타1) |
6.4 |
7,289 |
|
합계 |
100.0 |
113,434 |
출처: 2010년도 국가연구개발사업 조사·분석 보고서
이 중 한국연구재단을 통하여 생명과학 분야로 지원된 연구비 현황을 사업별 중분야별로 살펴보면 다음과 같다.
일반연구자지원사업은 기본연구지원사업, 지역과학자지원사업, 여성과학자지원사업, 그리고 신진연구자지원사업으로 구성되어 있다. 2010년에 일반연구자 지원사업으로 생명과학분야에 지원된 연구비 중 생명과학의 중분야별 지원 비율은 (표 3-1-3-3)와 같다.
[표 3-1-3-3] 2010년도 일반연구자지원사업 중 생명과학분야 중분야별 선정현황
|
중분야명 |
신청과제수 |
선정과제수 |
선정율(%) |
|
융합바이오 |
131 |
34 |
26.0% |
|
유전학/유전공학 |
152 |
43 |
28.3% |
|
생화학/구조생물학 |
126 |
34 |
27.0% |
|
생물위해성 |
10 |
1 |
10.0% |
|
생물공학 |
68 |
23 |
33.8% |
|
산업바이오 |
139 |
38 |
27.3% |
|
분자세포 생물학 |
427 |
134 |
31.4% |
|
분류/생태/환경생물학 |
110 |
38 |
34.5% |
|
발생/신경생물학 |
265 |
73 |
27.5% |
|
바이오공정/기기 |
4 |
2 |
50.0% |
|
면역학/생리학 |
160 |
43 |
26.9% |
|
기타 생명과학 |
13 |
8 |
61.5% |
|
총계 |
1,605 |
471 |
29.3% |
중견연구자지원사업은 핵심연구지원사업, 도약연구지원사업으로 구성되어 있다. 2010년에 중견연구자 지원사업으로 핵심 및 도약연구지원 사업중 생명과학분야에 지원된 연구비 중 생명과학의 중분야별 지원 비율은 (표 3-1-3-4, 3-1-3-5)와 같다.
[표 3-1-3-4] 2010년도 핵심연구자지원사업 중 생명과학분야 중분야별 선정현황
|
중분야명 |
신청과제수 |
선정과제수 |
선정율(%) |
|
융합바이오 |
74 |
6 |
20 |
|
유전학/유전공학 |
47 |
2 |
10 |
|
생화학/구조생물학 |
45 |
5 |
12.7 |
|
생물위해성 |
3 |
- |
12.5 |
|
생물공학 |
32 |
2 |
8.3 |
|
산업바이오 |
30 |
4 |
11.3 |
|
분자세포 생물학 |
126 |
14 |
12 |
|
분류/생태/환경생물학 |
26 |
3 |
9 |
|
발생/신경생물학 |
69 |
4 |
12.5 |
|
바이오공정/기기 |
4 |
- |
10 |
|
면역학/생리학 |
38 |
6 |
15.3 |
|
기타 생명과학 |
7 |
- |
25 |
|
총계 |
501 |
46 |
11.9 |
[표 3-1-3-5] 2010년도 도약연구자지원사업 중 생명과학분야 중분야별 선정현황
|
중분야명* |
신청과제수 |
선정과제수 |
선정율(%) |
|
융합바이오 |
27 |
5 |
18.5% |
|
유전학/유전공학 |
20 |
2 |
10.0% |
|
생화학/구조생물학 |
21 |
2 |
9.5% |
|
생물위해성 |
3 |
- |
0.0% |
|
생물공학 |
5 |
1 |
20.0% |
|
산업바이오 |
7 |
1 |
14.3% |
|
분자세포 생물학 |
43 |
5 |
11.6% |
|
분류/생태/환경생물학 |
15 |
2 |
13.3% |
|
발생/신경생물학 |
21 |
1 |
4.8% |
|
바이오공정/기기 |
2 |
- |
0.0% |
|
면역학/생리학 |
6 |
3 |
50.0% |
|
기타 생명과학 |
1 |
- |
0.0% |
|
총계 |
171 |
22 |
12.9% |
*과제 선정을 위하여 구성된 4개 패널에 속한 중분야들
나. 생명공학 분야 인력 양성
□ 국가전략 분야 인력양성추진
생명공학 패러다임의 변화와 시대적 요청에 따라 창조적 과학기술인력 양성에 대한 필요성이 강조되면서 국가적 아젠다로 대두되고 있다. 그럼에도 불구하고 현재 양적 인력수준은 증가하고 있으나 연구개발과 산업분야에서의 고급 인력의 비중은 감소하고 있는 추세이다. 대학의 경우 생명공학관련 졸업자 수는 꾸준히 증가하고 있으나 신규 배출인력 중 석․박사 비중은 학사 대비 지속적 감소 추세를 보이고 있다. 이를 해소할 방안으로 2001년 국가전략 분야로 선정하여 범부처 공동으로 인력양성사업을 수립・시행해 오고 있다. 교육과학기술부의 제2단계 BK21사업과 대학 혁신역량 강화사업이 대표적인 WCU 사업이다.
(1) 이공계 대학(원)의 전략적 육성
제2단계 BK21(2006~2012년)사업의 경우 효과적 인력양성 및 연구력 증대를 위하여 ‘09년 70개 대학 244개 사업단, 323개 사업팀에 연구 장학금 및 인건비를 지원하고 있다. 그중 과학기술 분야는 총 128개 사업단(팀)에 1,587억원의 예산 지원을 추진하였다. 세계적 수준의 연구중심대학을 지원하는 WCU 사업은 2009년도 32개 대학에서 130개 사업과제를 받아 연구활동을 펼치고 있다. 그러나 BK21사업과 WCU사업간에 투자의 분산 우려 및 효율화에 대한 논의가 필요한 바 대학(원) 재정지원사업에 대한 체계화된 육성 전략이 필요하다. 이에 제2차 과학기술인재 육성․지원 기본계획을 통하여 정부는 BK21사업이 WCU사업과 GPS(Global Ph.D Scholarship)시스템으로 연계된 통합 체계화 시스템 구축을 추진 예정이다.
(2) 출연(연) 및 기업연구인력의 연구몰입환경 조성
고급 과학기술 자원을 활용한 현장성 높은 인력양성 기능을 강화하고 산학연 연구 협력 프로그램을 통한 인력 교류의 활성화를 추진하고 있다. 즉 산학협력촉진법령 개선을 통해 학-연 교수제를 도입하고 대학-출연(연)간 교차 파견 근무 등 활성화 대책을 강구하고 있다. 또한 기업 연구 인력의 수요 대응력을 제고하여 범부처 차원의 산업전문인력 강화 방안이 강구되어야 할 것이다.
(3) 여성과학자 지원 방안 마련
생명공학 분야의 경우 여성 졸업자 수와 비중이 점진적으로 증가 추세를 보이고 있다. 교육통계서비스에 따르면 ‘07년 17,484명(49.5%)에서 ’10년에 25,037명(51.0%)로 증가하였다. 이에 지속적 연구역량을 향상시키고 단계별 복지 지원을 강화하는데 초점을 두고 있다.
□ 기초연구 분야 인력양성추진
(1) 개인연구지원사업
개인연구 지원사업의 경우 2010년 281개(393억원)의 생명과학분야 과제를 지원하였으며, 박사 160명, 석사 323명, 학사 20명 등 총 503명의 생명공학 분야 인력이 개인기초 연구에 참여하였다.
[표 3-1-3-6] 2010년 개인연구 지원사업 생명과학분야 인력양성 현황
|
소분류 |
과제수 |
인력양성실적(명) |
국고지원금 (백만원) |
|||
|
박사 |
석사 |
학사 |
계 |
|||
|
분자세포 생물학 |
100 |
73 |
105 |
6 |
184 |
15,171 |
|
유전학/유전공학 |
25 |
15 |
24 |
|
39 |
2,920 |
|
발생/신경생물학 |
34 |
17 |
34 |
4 |
55 |
3,932 |
|
면역학/생리학 |
23 |
16 |
25 |
1 |
42 |
3,186 |
|
분류/생태/환경생물학 |
16 |
3 |
27 |
5 |
35 |
1,176 |
|
생화학/구조생물학 |
22 |
13 |
34 |
2 |
49 |
3,897 |
|
융합바이오 |
37 |
16 |
47 |
1 |
64 |
6,838 |
|
생물공학 |
12 |
4 |
13 |
1 |
18 |
1,294 |
|
산업바이오 |
3 |
|
3 |
|
3 |
102 |
|
기타 생명과학 |
9 |
3 |
11 |
|
14 |
753 |
|
|
281 |
160 |
323 |
20 |
503 |
39,269 |
출처: 한국연구재단 기초연구총괄팀
(2) 집단연구지원사업
집단연구 지원사업의 경우 2010년 104개(214억원)의 생명과학분야 과제를 지원하였으며, 박사 85명, 석사 193명, 학사 3명 등 총 281명의 생명공학 분야 인력이 집단 연구에 참여하였다.
[표 3-1-3-7] 2010년도 집단연구사업 생명과학분야 인력양성 현황
|
소분류 |
과제수 |
인력양성실적(명) |
국고지원금 (백만원) |
|||
|
박사 |
석사 |
학사 |
계 |
|||
|
분자세포 생물학 |
39 |
33 |
61 |
3 |
97 |
7,763 |
|
유전학/유전공학 |
15 |
9 |
18 |
|
27 |
1,412 |
|
발생/신경생물학 |
10 |
7 |
10 |
|
17 |
1,326 |
|
면역학/생리학 |
11 |
16 |
20 |
|
36 |
3,007 |
|
생화학/구조생물학 |
7 |
4 |
24 |
|
28 |
2,341 |
|
융합바이오 |
10 |
10 |
35 |
|
45 |
4,132 |
|
생물공학 |
1 |
1 |
1 |
|
2 |
50 |
|
산업바이오 |
1 |
|
3 |
|
3 |
60 |
|
바이오공정/기기 |
2 |
|
2 |
|
2 |
128 |
|
생물위해성 |
1 |
|
3 |
|
3 |
42 |
|
기타 생명과학 |
7 |
5 |
16 |
|
21 |
1,164 |
|
합계 |
104 |
85 |
193 |
3 |
281 |
21,425 |
출처: 한국연구재단 기초연구총괄팀
4. 농식품분야 생명공학 육성정책
가. 개요
저탄소 녹색성장시대에 맞춰 산업의 기본소재로서 생명자원의 가치가 재해석되고 이를 활용한 산업의 중요성이 증대되고 있다. 또한 농식품생명공학기술은 생명자원을 이용한 고품질·안전농축수산물 생산, 유전자변형 작물 개발과 안전성 연구, 가축 형질전환과 복제, 농생물유전체 연구, 친환경 농자재 및 기능성식품 생산, 동물질병 예방·진단·위생 관련기술 등 그 적용범위가 매우 다양하다. 이러한 생명공학기술의 발달과 더불어 “이제 농식품분야에서도 신성장동력 창출의 핵심수단은 농식품생명공학”이라는 인식이 확산되고 있다.
이러한 변화에 맞춰 정책방향을 정립하고 새로운 수요를 충족하는 생명산업으로 변화를 해나가기 위해 농식품산업도 생명자원을 활용하는 고부가가치 생명산업으로 육성해 나갈 계획이다.

그림 1 농림수산 생명자원을 활용한 고부가가치 생명산업 예시
나. 현황
농림수산식품부는 동식물, 곤충, 미생물 등 생명자원을 활용한 기술 개발을 통해 새로운 시장을 개척하고 기후변화 등 미래수요를 대비한 기술개발 투자 확대 및 핵심기술을 선도할 수 있는 우수 인력을 양성 등 생명산업 육성을 위해 2011년 생명공학 관련예산으로 167,479백만원을 투자하고 있다.
지속적인 투자결과 기초·원천 단계의 우수 기술이 꾸준히 개발되어 바이오 및 선도 식품가공기술을 이용한 곡류의 고도이용, 넙치 미세위성 마커를 이용한 개체식별 및 친자확인 방법 개발, 가축질병진단키트 및 예방기술 산업화를 위한 기술이전 등 기초과학 역량을 바탕으로 산업적 성과가 가시적으로 도출되고 있다. 농림수산식품부에서 추진하고 있는 주요 생명공학 육성사업은 다음과 같다.
< 농림수산식품분야 생명공학사업 >
(단위 : 백만원)
사 업 명 | 사업기간 | 2010실적 | 2011계획 | 주관기관 |
생명산업기술개발사업 ((구)농림기술개발사업) | ‘94~계속 | 21,981 | 27,195 | 농식품부 |
기술사업화지원사업 ((구)농림바이오기술산업화지원사업) | ‘08~계속 | 5,840 | 8,000 | 농식품부 |
고부가가치 식품기술개발 | ‘10~계속 | 15,948 | 21,626 | 농식품부 |
융복합연구센터지원 | ‘10~계속 | 3,000 | 3,000 | 농식품부 |
수의과학기술개발연구 | ‘98~계속 | 19,797 | 21,583 | 농림수산검역검사본부 |
수산업생명공학연구 | ‘04~계속 | 2,054 | 3,589 | 국립수산과학원 |
차세대바이오그린 21 ((구)바이오그린 21 후속사업) | ‘11~’20 | 50,800 | 65,000 | 농진청 |
유용유전자 대량발굴 및 형질전환작물 개발 | ‘94~계속 | 7,071 | 7,156 | 농진청 |
GMO국가관리 및 안전성 평가 | ‘04~계속 | 1,407 | 1,316 | 농진청 |
농업유전자원의 국가관리체계 확립 및 활용 | ‘94~계속 | 6,482 | 6,167 | 농진청 |
산림과학기술개발사업 | ‘07~’13 | 1,266 | 1,347 | 산림청 |
산림정책관리 (지방임업연구기반조성) | ‘07~’12 | 800 | 1,000 | 산림청 |
산림정책관리(인력양성) | ‘06~’17 | 500 | 500 | 산림청 |
소 계 |
| 136,946 | 167,479 |
|
* 출처 : 2011년도 생명공학육성시행계획
⑴ 생명산업기술개발사업
농림수산물의 부가가치 향상 및 저탄소 녹색성장을 실현하고 생명산업 기술개발을 중추 사업으로 확대하기 위해 기존의 ‘농림기술개발사업’을 ‘생명산업기술개발사업’, ‘첨단생산기술개발사업’, ‘수출전략기술개발사업’, ‘융복합연구센터지원사업’ 4개 사업으로 분리하여 추진하고 있다.
본 사업을 통해 농림수산식품부는 동식물, 미생물 등 생명자원의 생산·응용·유지관리에 대한 연구개발을 통해 차세대 핵심산업인 ‘생명산업’을 육성할 계획이다.
지정공모 방식의 기획과제(top-down) 비중을 확대하여 농정현안 해결을 위한 과제중심으로 사업을 선발하고, 자유응모 방식의 일반과제(bottom-up)는 기후변화대응, 농식품고품격화, 식량안보 등 미래 대응을 위한 분야에 중점투자하고 있다.
⑵ 기술사업화지원사업
농림수산식품분야의 생명공학산업은 생명현상과 관련된 상품 및 서비스를 생산하는 것으로 복잡한 산업화 과정 및 대규모투자, 고위험 등이 동반되는 반면 관련 민간산업체는 대부분이 영세하여 개발된 기술의 산업화를 위한 후속 투자에는 매우 소극적이다.
이에 연구개발로 얻어진 우수한 원천 기술에 대한 과학기술의 사업화 연구(R&BD ; Research and Business Development)를 통해 개발된 원천기술의 사장화를 방지하고 산업화단계로 진입하여 고부가가치의 상품이 개발될 수 있도록 기술사업화지원사업을 추진하고 있다.
개발대상분야는 생물자원 및 유전체 정보 이용기술, 기능성 식품, 유전자변형농생물체, 융합기술 활용 신물질·신소재, 동물질병 예방·진단기술, 바이오에너지 등이다.
⑶ 고부가가치 식품기술개발사업
농림수산식품부가 식품산업 진흥업무를 담당하게 되어 본격적인 식품산업 R&D 추진을 위해 수립한 「식품산업 R&D 중장기계획」(‘09.6)에 따라 기존 농림기술개발사업에서 식품부문을 분리·확대하여 고부가가치 식품기술개발사업을 2010년부터 추진하였다.
기능성강화식품, 전통웰빙식품, 식품 안전·품질관리, 식품 핵심소재, 식품 기자재, 저탄소·신가공 등 6대 부문으로 구분하여 식품산업의 고부가가치화를 위한 사업을 추진하고 있다.
농수산물 연계품목 가공 및 기능성소재 개발 기술지원을 통하여 농수산업과 식품산업의 동반성장을 도모하고 식품산업 핵심 응용기술을 개발하여 식품산업의 국제경쟁력을 향상시켜 나갈 것이다.
⑷ 융복합연구센터지원
첨단 융합형 R&D 장기지원으로 농업분야 산업을 견인할 핵심기술을 확보하고 우수 연구집단을 육성하고자 융복합연구센터지원 사업을 2010년부터 시작하였다.
미래유망 분야 기술을 보유한 대학을 선발하여 기초연구부터 산업화연구까지 전주기적으로 지원하고 해당분야의 핵심기술을 선도할 수 있는 우수 연구집단을 육성하여 기존 기술의 한계를 극복하고 고부가 신산업 핵심기술을 확보하고자 한다. 기초, 응용·개발, 산업화 등 3단계로 구분하여 추진한다.
⑸ 수의과학기술개발연구사업
1998년부터 추진되고 있는 본 사업은 국가재난형 동물질병 및 구제역과 광우병 등 해외 악성 가축전염병의 유입방지를 위한 방역 및 검역기술개발로 축산업을 보호하고 인수공통 전염병 방제기술개발 및 축산물 안전성 관리기술을 개발하여 국민 보건 향상을 통한 국민의 안전한 삶 보장을 목표로 한다.
해외전염병 검역검사기술 개발, 동물질병 예방 및 치료제 개발, 기후변화대응 신종질병 방제기술 개발, 동물보호 및 동물용의약품 관리기술 개발 연구 등을 수행중에 있다.
⑹ 수산업생명공학연구사업
수산과학기술 개발을 목표로 2004년부터 시작되었고 수산생명자원을 수집·관리하고, 유용유전자의 기능연구를 통해 수산업을 고부가가치 첨단산업으로 육성을 목표로 한다.
수산유전자원 분석·보존 및 활용 연구, 수산생물 유용 유전자 개발 및 산업화, 메타게놈 분석법에 의한 양식생물 대량 폐사연구, 형질전환어류 개발 및 수산용 LMO(Living Modified Organisms)의 환경위해성 심사, 수산생물 육종 연구 및 육종 품종의 브랜드화 및 산업화를 사업내용으로 한다.
⑺ 차세대바이오그린21사업
농업생명공학 분야의 대규모 프로젝트 사업인 본 사업은 2001년부터 10년간 약 3,300억원의 연구비를 투자한 바이오그린 21사업을 마치고, 2011년부터 차세대바이오그린 21사업을 시작하였다.
국가원천기술 기반분야, 생명공학 실용화분야, 미래선도 기술분야 등 7개사업단을 구성하여 운영하는 차세대 바이오그린 21사업은 1세대 바이오그린 21사업을 확대 발전시켜 농생명 연구실용화를 촉진하고 원천기술 강화·확대 연구를 지원하여 원천 특허보유 선진국으로의 도약을 목표로 한다.
바이오장기 개발을 통해 장기이식 필요자의 생명연장과 장기부족의 사회문제를 해결하여 인간의 삶의 질 향상과 의료복지 실현에 기여하기 위한 바이오장기생산사업은 2011년부터는 차세대 바이오그린 21사업에 이관되어 통합관리되고 있다. 바이오장기 생산용 무균돼지의 산업화를 위해 무균돼지 생산시스템 구축에 관한 연구, 바이오장기 생산 무균돼지의 관리기술 개발, 형질전환 복제돼지의 생산효율 증진에 관한 연구를 중점적으로 추진하고 있다.
⑻ 산림과학기술개발사업
생명공학 관련 기술개발을 통한 산림자원 활용도를 제고하고 임업의 첨단산업화가 목표인 본 사업은 임목 분자육종 기술개발, 신기능 유용물질 탐색 및 지원화, 세포공학을 이용한 고부가가치 창출, 유용유전자 분리·구명 등을 내용으로 한다.
산림과학기술개발 사업을 통하여 대사물질을 이용한 임목성장 우량가계 조기선발법 등 생명공학 관련 기술을 개발하여 산림자원의 활용도를 제고하고 산업재산권을 확보해 나갈 것이다.
또한 산림과학 기초연구 지원사업과 지방임업 연구기반 확충사업을 통하여 생물다양성에 대한 전문인력을 양성하고 산림 관련 유효시책을 개발하고 있다.
다. 생명자원 분야의 육성 및 관리정책
농어업 유전자원은 신품종 개발, 신품질 탐색 등에 활용되는 등 생명산업의 기본소재로 그 중요성이 증대되고 있다. 이에 국가 차원의 농어업 유전자원 이용활성화 등을 위해『농어업유전자원 보존·관리 및 이용 활성화를 위한 기본계획』을 수립하였고(‘09.9), 국내외 유전자원을 효율적으로 수집·보존·활용할 수 있는 종합관리체계를 구축하여 2018년까지 “세계 5대 유전자원 강국 실현”을 위해 노력할 것이다.
또한 정부 조직개편으로 수산에 대한 관리업무가 농림수산식품부로 통합됨에 따라 수산자원의 보존·관리방안을 보완하여『농업유전자원의 보존·관리 및 이용에 관한 법률』을 『농수산생명자원의 보존·관리 및 이용에 관한 법률』(’11.7.25 공포)로 개정하여 국내외 농수산생명자원을 종합적·체계적으로 확보·관리 및 이용할 수 있는 제도적 근거를 마련하였다.
농림수산식품분야 생명자원은 각 기관별로 유전자원 DB를 관리하고 있어 수요자 입장에서 농림수산 유전자원 정보에 대한 종합적인 접근·이용이 어렵다. 또한 생물다양성협약(CBD ; Convention on Biological Diversity)에서 논의되고 있는 유전자원에 대한 접근 및 이익공유(ABS ; Access and Benefit-Sharing)에 관련한 국제규범 제정 논의에 대응이 필요하다. 이에 2011년부터 농촌진흥청, 산림청, 농림수산검역검사본부, 국립수산과학원, 국립종자원이 보유한 생명자원을 연계·통합관리 하기위해 생명자원 통합 DB구축사업을 추진하고 있다.
이를통해 생명산업 정보화를 기반으로 하는 생명공학 연구 및 산업화를 촉진하고 생명자원의 다양성을 확보하여 우리 고유자원의 주권보호를 위한 생명자원의 국가 관리체계를 확립해 나가고자 한다.
< 생명자원 통합 DB 구축체계 >

라. 향후 추진방향
농림수산식품분야 생명공학은 기술개발에 장기간이 소요되고, 복잡한 산업화 과정과 대규모 자본투입이 필요하여 국가 차원의 집중 투자가 필요하고 산업화 실현을 전제로 이루어져야 한다. 또한 독자적인 원천기술을 지속적으로 개발해 나가는 한편, 개발기술의 사업화촉진을 위한 투자가 뒤따라야 한다.
생물다양성 협약으로 생물자원의 이용과 접근에 대한 장벽이 강화되는 추세에 대응하여 작물·가축·미생물 유전체 연구를 강화할 계획이며 분자육종을 통한 지식기반형 고부가가치 동·식물 및 물질생산을 확대하고 고부가가치 기능성 식품소재 개발에 힘쓸 예정이다. 또한 GM작물의 실용화를 위해 안전성 평가기반도 확립하며 소비자의 인식제고에도 노력할 예정이다.
이에 농림수산식품부는 먹을거리를 생산하는 농어업에서 동·식물 등 생명자원을 활용하는 고부가가치 생명산업으로 영역을 확장하고 육성·발전할 수 있는 계기를 마련하고자 『농림수산식품 생명산업 2020+ 발전전략』(‘10.10)을 수립하였고, 이에 맞춰 생명산업, 식품산업 등 차세대 성장동력 분야에 투자를 확대해 나갈 계획이다.

그림 2 농림수산식품 생명산업 2020+ 발전전략 개요
5. 보건의료분야 생명공학 육성정책
가. 개요
보건의료기술(Health Technology, HT)이란 BT, IT, NT와 같은 요소기술을 융합하여 인체적용을 목적으로 활용하는 기술을 총칭하며 궁극적으로 질병극복 및 국민건강증진을 목적으로 하는 기술이다. BT는 요소 기술에 중점을 둔 반면에, HT는 활용 목적에 중점을 두어 개념상 큰 차이점을 보인다. HT와 BT는 일부 중첩관계로, BT의 응용 범위 중 인체와 건강 관련된 제반 영역을 HT 관련 분야로 정의내릴 수 있으며, 대표적인 분야로는 제약, 의료기기, 의료서비스가 해당되며 최근에는 의료전달체계와 같은 보건의료 시스템과 관련된 분야를 포괄하는 개념으로 발전하고 있다(표 3-1-5-1 참조).
HT분야의 개발은 산·학·연·병과 같은 다양한 연구주체가 협력을 통해 기초원천연구-중개연구-임상연구-신약·의료기기개발을 유기적으로 연계하여 이루어지는 특징이 있다. 특히 HT를 기반으로 한 HT 산업은 대표적인 기술집약적 산업으로 국가 미래 성장 동력으로 그 중요성이 부각되고 있으며, 타 산업 분야에 비해 고용 및 산업 파급효과가 높은 산업이다. 또한 전 세계적으로 고령화에 따른 만성질환 증가로 인한 의료비 부담 증대 및 기후변화에 따른 신·변종 전염병 창궐로 인한 국민 건강과 사회 안전 위협 등 HT분야 개발에 대한 사회적·경제적 수요가 폭발적으로 증가하는 추세이다.
이에 세계 각국은 21세기 주력산업으로 HT 산업을 육성하기 위해 총력을 기울이고 있다. 특히 EU에서는 제7차 Framework Program(`07~`13, EP7)을 통해 Health를 `생명과학(life science)`에서 독립분야로 분리하였으며, 협력프로그램 9대 분야 중 하나로 7년 동안 61억 유로를 배정하여(전체 투자규모의 18%), 농림, 해양, 식품을 포괄한 BT분야 투자 규모(19억 유료)의 3배가 넘는 규모를 투자하고 있다. 우리 정부에서도 ‘09년 이후 HT의 개념 정립과 연구개발 투자를 지속적으로 확대하는 등 다양한 노력을 기울이고 있으나 선진국에 비해 아직 미미한 수준에 그치고 있다(’09년 국가연구개발사업 총 투자규모는 12.4조원 수준이며, 이중 보건의료의 비중은 8,333억원으로 전체의 7.3% 수준) .
[그림 3-1-5-1] HT의 개념 및 범주
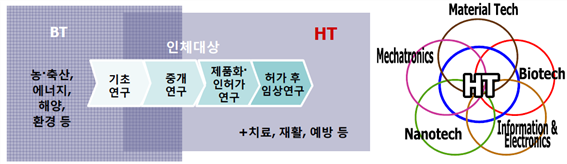
보건복지부는 HT를 활용한 건강사회구축을 위해 “건강수명의 연장, 삶의 질 향상, 보건의료 산업 경쟁력 강화”의 비전을 가지고 연구개발 투자, 인프라 구축 등을 지원하고 있다. 사업으로는 보건의료연구개발사업을 비롯하여 한의약선도기술개발사업, 암정복추진사업, 질병관리연구사업, 식품의약연구개발사업 등으로 2011년 약 3,465억 원을 지원하고 있다.
[표 3-1-5-2] 보건복지부 R&D 예산
(단위: 억 원)
|
기관명 |
사업명 |
2010년 |
2011년 |
|
한국보건산업진흥원 |
보건의료연구개발사업 |
2121 |
2365 |
|
한의약선도기술개발사업 |
68 |
68 |
|
|
국립암센터 |
기관고유사업 |
147 |
147 |
|
암정복추진사업 |
118 |
140 |
|
|
질병관리본부 |
질병관리연구사업 |
155 |
162 |
|
식품의약품안전청 |
식품의약연구개발사업 |
543 |
583 |
|
|
합 계 |
3,152 |
3,465 |
나. 주요 연구개발사업
(1) 보건의료연구개발
(가) 개요
보건복지부는 21세기 지식기반경제의 핵심 산업으로 등장하고 있는 HT를 국민건강 증진과 국가경제 발전에 이바지하는 고부가가치 국가 전략산업으로 육성․발전시키기 위하여 보건의료기술진흥법(1995.12)을 제정하여 『보건의료연구기술개발사업』을 추진해오고 있으며, 지난 1995년부터 2011년까지 17년간 총 1조7,345억 원의 정부 연구개발 자금을 지원하였다. 아직은 선진국에 비해 HT R&D투자 비율이 미흡하지만 사회경제적 필요에 의해 투자가 점진적으로 확대하고 있다.
동 사업은 기반기술 분야에 대하여는 연구개발비 전액을, 민간기업이 참여하는 실용화 및 제품화 기술과제에 대하여는 연구개발비의 50% 이내에서 지원한다. 보건복지부는 연도별ㆍ분야별 연구개발사업시행계획을 수립, 관리기관인 한국보건산업진흥원에서 연구개발 사업 관리 등의 실무를 담당하고 있으며, 사업 추진절차는 다음과 같다.
[그림 3-1-5-3] 사업추진 절차

(나) 지원내용
2011년도 보건의료연구개발사업은 ‘보건의료기술연구개발’, ‘선도형 특성화 연구(구, 연구중심병원 구축)’ 이외에도 ‘감염병 위기대응 기술개발’과 ‘임상연구인프라조성’ 등 9개 단위사업으로 구성되어 있으며, 지원 분야는 의과학, 의약품, 의료기기, 의료정보, 건강기능제품 등 분야를 포함하고 있다.
[표 3-1-5-4] 2011년도 보건의료연구개발사업 지원현황
(단위: 억 원)
|
사업명 |
지 원 내 용 |
예산 |
|
|
2010 |
2011 |
||
|
보건의료기술연구개발 |
○ 21세기 대표적 고부가가치산업인 보건의료산업을 육성․발전시켜 국민의 생명․건강을 증진시키고, 사람이 살기 편리한 사회 구현에 기여 - 지원분야 : 질병극복 연구역량 강화(중개연구, 희귀질환진단치료기술사업단, 병원특성화센터 등), 사회안전망 구축(노인․장애인 보조기구, 기후환경변화질환 대응기술, 알레르기질환 표준화 연구센터), 신산업 창출(신약, 의료기기․정보, 바이오장기/칩, 나노보건기술 등) |
1281 |
1385 |
|
선도형 특성화 연구 (구, 연구중심병원 구축) |
○ 의료산업 성장을 위해 병원 중심의 의료 연구개발 및 사업화 과정을 촉진시키고 전방위 산업간 연계강화를 목표로 하며 이러한 목표를 달성하기 위한 병원 중심의 산․학․연 연계 클러스터 구축 |
225 |
217 |
|
감염병 위기대응 기술개발 |
○ 해외 의존성이 절대적인 백신의 자체개발을 위해 독자적인 국내 생산체계를 구축하여 안정적인 백신을 공급하고 백신 국산화로 국민 의료비 경감 - 지원분야 : 면역백신개발, 신종인플루엔자 범부처 사업단 |
150 |
150 |
|
의료기기 산업육성 |
○ 2010년 한-EU FTA 채결에 따른 국내산업 경쟁력 강화대책으로 ’14년 융복합 의료기기 TOP5 강국 진입을 목표로 25개 첨단의료기기 국산화 개발전략 - 지원분야 : 임상시험진입용 시제품개발, 허가용 임상시험, 임상평가시험 |
- |
40 |
|
임상연구 인프라조성 |
○ 신약 및 의료기기 개발 활성화를 위한 선진국 수준의 임상시험 인프라 구축 및 의료기술의 과학적 근거를 확보하기 위한 임상연구 지원 - 지원분야 : 국가임상시험사업단(Ko-NECT), 근거창출임상연구국가사업단지원, 의료기기인프라지원, HT고속화시범사업, HT인프라조성사업지원 |
393 |
392 |
|
임상의과학자양성 |
○ 임상과 기초역량을 모두 갖춘 미래 임상 의과학 연구의 핵심 인력 양성을 위해 독자적인 연구기반이 없는 신진 의과학자에게 연구 경력이 풍부한 중견 연구자의 지도하에 연구를 수행할 수 있는 기회 제공 - 지원분야 : 임상의과학자 양성 |
12 |
12 |
|
글로벌 화장품 신소재·신기술 개발 |
○ 내수 위주의 화장품 산업을 글로벌 경쟁력을 갖춘 새로운 수출전략산업으로 육성하기 위해 글로벌 수준의 화장품 신소재․융합기반기술의 개발에 필요한 R&D 지원 - 지원분야 : 기능성 화장품 신소재 개발센터, 그린코스메틱 연구개발센터, 글로벌코스메틱연구개발사업단 |
60 |
69 |
|
범부처전주기 신약개발 |
○ 9년간 신약개발 관련 3개 부처(교과부, 지경부, 복지부)가 공동 투자하여 10개 이상의 글로벌 신약을 개발하고 최종 3개 이상의 글로벌 Blockbuster 신약 창출 -세계적 신약개발을 위한 글로벌 네트워크 구축·운영을 통해 세계 50위권 이내의 제약사 창출을 지원하여 신성장 동력화 |
- |
50 |
|
시스템통합적 항암신약개발 |
○ 국가 주도의 항암 신약개발을 위하여 최적의 조직, 인프라, 운영 시스템을 확보하여 신약개발의 병목 단계인 임상단계에 투자 -물질개발 단계를 거친 항암 후보물질의 전임상과 임상 1상, 2상 시험을 직접 수행하여 항암제 개발 가속화 |
- |
50 |
|
계 |
|
2,121 |
2,365 |
① 보건의료기술연구개발
①-1 질병중심 중개연구
우리나라의 경우 국내 기초의학분야의 연구역량이 우수함에도 불구하고 산업화 연계가 저조하며, 특히 보건의료기술분야의 원천 특허가 미미한 수준으로 기초연구성과의 실용화와 임상적 적용이 가능하도록 연계하는 사업이 부족한 실정이다. 이러한 문제점을 보완하기 위해 2005년부터 추진하고 있는 사업이 질병중심 중개연구(Disease oriented Translational Research)이다. 질병중심 중개연구란, 기초과학 연구를 통해 밝혀진 개념과 지식, 기술을 관련 질병이나 손상의 진단, 치료 및 예방 등에 임상 적용하는 연구로서 임상 또는 실험 모델을 통하여 질병의 진단․예방․치료기술의 생물학적 효과를 규명하는 연구이다. 이와 함께 임상연구에서의 문제점을 기초과학에서 해결할 수 있도록 근거를 제공하기 위한 연구를 아우르는 전반적인 사항을 말한다.
중개연구 프로그램은 질병의 기전규명, 진단, 치료기술 향상을 위한 주요 13개 질환을 대상으로 의과학, 신약, 의료기기 등 보건의료 전 분야에 대한 창의적 연구를 지원하고 있으며, 2011년부터는 이전의 단순 진화론적 프로그램 구성을 탈피하여 목적지향성 및 최종 HT(Health Technology)산출물 중심의 질병중심 중개연구 세부프로그램으로 개편하였다. 미래 HT R&D 분야의 독창적인 아이디어 공급원으로써 신진의과학자 육성(신진연구), 경쟁력 있고 창의적인 성과창출을 통해 중점연구로 이행될 수 있는 HT 지식기반 확보(기반연구), 최종 HT 산출물 개발로 이행될 수 있는 기초연구 성과의 임상적용가능성 검증 및 개념증명을 확보하는 다학제 연구 또는 임상적 중요발견에 대한 원리나 기전 탐구를 위한 다학제 연구(중점연구) 지원의 형태를 띠고 있다.
①-2 신약 개발
보건의료연구개발사업의 경우, 1995년에 사업이 시작된 이후 신약개발 분야에 지원을 지속한 결과 국내 제약기업이 출시한 신약의 다수가 보건복지부 지원을 통해 개발에 성공할 수 있었다.
한미 FTA 체결 이후 정부는 시장개방으로 인한 충격을 최소화하고, 이를 계기로 국내 제약산업의 경쟁력 강화를 통해 새로운 사업기회를 모색하기 위해 제약 인프라 개선, R&D 지원 확충 등을 통하여 제약사의 신약개발 역량을 강화시키고 해외진출 지원을 확대하여 제약산업의 수출전략 산업화를 유도하기 위해 노력하고 있다. 이에 보건복지부는 한미 FTA 후속대책으로 신약개발 지원 중 혁신신약, 천연물의약품, 바이오의약품, 개량신약 4개 분야에 대해 비임상․임상시험을 중점 지원하고, 단계별 지원프로그램을 통해 기술적 경제적 성공가능성이 높은 신약후보에 대해 선택․집중 지원하고 있다. 한편 2009년부터 제약기업이나 벤처의 신약개발 아이템 지원에서 더 나아가 신약개발 플랫폼 기술인 표적단백질 구조정보, DDS, 동물모델, 스크리닝시스템에 대한 기반기술 센터 설립을 통해 제약사 및 벤처의 기술난관을 해결하는데 일조하고 있다. 또한 2010년 이후에는 의료기관을 중심으로 종양, 심순환계질환, 대사성질환, 소화기질환에 대한 유효성평가 기반구축센터 지원을 통해 신약 후보물질에 대한 심도 있는 유효성평가를 통해 후보물질의 임상 진입을 앞당기고, 더 나아가 임상 2상에서의 실패를 최소화 하고자 노력하고 있다.
①-3 의료기기 개발
보건복지부는 국가 신성장동력산업인 의료기기산업의 육성‧발전이라는 비전을 가지고 첨단 공학(BT․IT․NT)을 활용, 신 의료기기 개발을 지원하고 있다. 새로운 의료기기의 원천기술 확보하고, 산업화의 bottleneck을 해소하기 위하여 미래융합의료기기개발지원 및 의료기기 임상시험지원(임상시험용 시제품개발, 허가용 임상시험, 임상평가시험)을 강화하고 있다.
①-4 기후․환경변화질환 대응 연구 등
최근 기후변화에 따른 신․변종 전염병의 확산을 방지하고 외부오염 노출에 기인한 대사성 질환 등을 극복하기 위한 기후․환경변화질환 대응 연구, 미래 신기술 경쟁력 확보와 신시장 창출을 위한 유전체, 줄기세포 등의 분야 연구, 병원의 경쟁력 있는 특화된 분야의 연구역량을 강화하여 병원의 특성화를 유도하고 브랜드 가치를 창출하기 위한 병원특성화센터, 지속적인 환자상태의 모니터링이 필요한 질병에 대한 의료기관-재택 연계 u-Health 서비스 모델 개발 및 상용화, 치과질환의 예방․진단․치료 기술개발 등을 지원하고 있다.
② 선도형 특성화 연구 (구, 연구중심병원 구축)
선도형 연구중심병원은 2006년부터 보건복지부가 추진하고 있는 주요사업 중의 하나이다. 병원은 임상경험을 바탕으로 아이디어를 제공하는 기술개발의 원천이자 개발된 기술의 최종수요처로서 의료산업 발전을 위한 가치사슬의 중심이다. 이러한 역할을 수행할 수 있다는 강점을 살려 병원이 진료뿐만 아니라 R&D에서도 중요한 역할을 수행할 수 있도록 병원의 연구역량을 강화하여 병원을 중심으로 산학연간 협력연구를 활성화함으로써 기초연구성과의 임상적용을 촉진하고자 선도형특성화 연구를 시작하게 되었다. 병원의 연구역량을 강화하여 세계적 수준의 지식과 기술 창출하는 것을 목표로 2006년부터 현재까지 서울대병원(세포치료제 개발), 서울아산병원(항암제 개발), 연세대의료원(뇌심혈관질환 융합연구), 삼성서울병원(난치암 정복 바이오신약개발), 서울성모병원(면역질환 융합연구) 등 총 5개의 병원이 선정되어 연구를 진행 중이다.
③ 감염병 위기대응 기술개발
조류인플루엔자(2003년), 신종인플루엔자(2009년) 등 인플루엔자 대유행이 반복적으로 발생하여 국민 건강 및 국가경제에 심각한 위협으로 작용하고 있으나, 국내에서는 백신인프라 부족, 타의약품에 비하여 마진율이 낮다는 백신사업의 특성상 백신 개발에 대한 투자가 부진한 상황이다. 이에 보건복지부에서는 해외 의존성이 절대적인 백신의 자체개발을 위해 독자적으로 국내생산체계를 구축하여 안정적으로 백신을 공급하고자 노력하고 있다. 백신의 국산화로 국민 의료비를 절감하기 위해 2008년부터 면역백신 개발사업을 시작하였으며 면역백신의 제품화와 기존백신의 개량화 등의 분야에 대해 연구비를 지원하고 있다. 또한 신종인플루엔자의 재유행 위험에 대해 근본적으로 대처하고자 2010년도부터 신종인플루엔자 범부처 사업단을 선정하여 국가적 위기 대응체계를 구축하고 있다.
④ 의료기기 산업육성
2010년 한-EU FTA 체결에 따라 보건복지부는 2014년 융복합 의료기기 TOP5 강국 진입을 목표로 유망치료재료 개발 분야에 대한 전략적 지원을 하고 있다.
⑤ 임상시험 인프라 조성
신약 및 의료기기 개발 활성화를 위한 선진국 수준의 임상시험 인프라 구축 및 의료기술의 과학적 근거를 확보하기 위한 임상연구 지원의 일환으로 보건복지부는 국가임상시험사업단과 근거창출임상연구국가사업단 이외에도 의료기기 인프라지원, HT 고속화 시범사업, HT 인프라조성사업에 대해 지원하고 있다.
국가임상시험사업단(Ko-NECT)은 임상시험 해외 의존도를 낮추고 선진국 수준의 임상시험인프라 구축을 위해 2004년도부터 지역임상시험센터를 선정하여 지원하기 시작하였다. 2007년에 선도적인 병원의 우수한 시스템 확산과 지방의 인프라 활용으로 지역균형발전의 실효성을 극대화 하고 센터 간 연계를 위해 기존 지역임상시험센터를 통합·전환하였다.
근거창출임상연구국가사업단은 세계적 수준의 근거 중심 보건의료체계 구축을 위해 지원하며, 2010년에 기존 질환별 임상연구센터 11개소 및 임상연구지원센터, 근거창출 선진의료 기술 연구 과제를 통합하여 추진되었다.
의료기기 인프라지원은 선진국 수준의 의료기기 임상시험 인프라 구축을 위하여 전국적으로 총 6개의 의료기기임상시험센터를 선정‧지원하고 있다. 또한 보건복지부 고유 미션인 공공복지실현 및 사회안전망 확충을 위하여 공적급여 지급품 중 시급히 필요한 제품이나 고가수입 의료기기를 대체할 수 있는 보조기구개발 지원을 하고 있으며, 의료현장의 우수한 아이디어를 흡수, 신속히 실현화할 수 있는 기반을 구축하기 위하여 2010년부터 의료기기개발촉진센터를 지원하고 있다.
HT R&D 기초성과의 신속한 개발단계 진입 및 부처간 R&D 성과 연계 사업 강화를 위해 보건복지부에서는 2010년도부터 질환중심 유효성평가센터를 선정하여 지원하고 있다. 질환중심 유효성평가센터는 해당질환 전문의가 기초 및 산업체 연구자들의 초기 연구 성과물들을 대상으로 질환에 대한 임상적 유효성을 검정하는 것을 목표로 사업을 추진하고 있다.
⑥ 임상의과학자 양성
독자적인 연구기반이 없는 신진의과학자(M.D., D.D.S., 또는 Ph.D.)에게 연구경력이 풍부한 중견연구자의 지도하에 연구를 수행할 수 있는 기회를 제공함으로써 임상과 기초역량을 모두 갖춘 미래 임상의과학자 연구의 핵심 인력 양성을 하기 위해 2009년도부터 임상의과학자 양성 사업을 시작하였다. 이 사업을 통해 신진연구자가 연구 활동의 공백 없이 자연스럽게 「학생→신진의과학자→우수연구자」로 넘어감으로써, 궁극적으로는 우수 중개연구자 인력 양성 효과가 극대화 될 수 있다. 이 사업은 2012년도에 프로그램의 효율성 증대를 위해 신진연구 과제로 개편·통합하여 지원할 예정이다.
⑦ 글로벌 화장품 신소재·신기술개발
보건복지부는 한-미‧한-EU FTA 등 시장개방과 급변하는 세계 화장품 트랜드 대응 및 화장품산업을 글로벌 경쟁력을 갖춘 수출전략산업으로 육성하기 위해 화장품 신소재‧융합기반기술‧화장용품‧한방화장품 등 개발을 위한 R&D 지원을 하고 있다. 2013년 세계 10위 화장품 강국으로 도약하기 위한 글로벌 제품과 신기술의 확보를 위해 민간이 감당하기 힘든 신소재·융합기반기술 등의 개발 및 전문적·통합적 사업관리 시스템 구축을 목표로 기능성 화장품 신소재 개발센터, 그린코스메틱 연구개발센터, 글로벌코스메틱 연구개발사업단, 총 3개 센터를 지원하고 있다. 이를 통해 우리나라 화장품 산업을 미래 녹색신성장사업으로 육성하고 새로운 고부가가치 및 일자리 창출에 기여하고자 한다.
⑧ 범부처 전주기 신약개발
글로벌 신약은 대규모의 R&D 투자를 동반하는 high-risk, high-return 프로젝트로, 평균 2,000억 원 이상의 대규모 자금이 필요 되어 국내 단일 기업이 투자하기 어려운 영역이며 시장기능에 맡겨둘 경우 글로벌 신약의 탄생이 어렵다. 또한 현재 우리나라 정부와 민간의 신약개발 R&D 투자 총액을 모두 합하더라도 4,000억 원 규모에 불과하며 글로벌 신약개발을 위한 임계규모 대비 역량이 절대적으로 부족하다. 2011년부터 2019년까지 9년의 사업기간에 걸쳐 10개 이상의 글로벌 신약을 개발하고, 최종 3개 이상의 글로벌 Blockbuster 신약 창출을 목표로 신약개발 관련 3개 부처(교과부, 지경부, 복지부)가 공동으로 투자하여 범부처 전주기 신약개발사업을 추진하고 있다.
⑨ 시스템통합적 항암신약개발
신약개발은 고비용·고위험 사업으로 투자액 대비 성과가 보장되지 않기 때문에 안정성이 높은 사업 모델 구축이 필요하다. 또한 기존 국가 R&D 투자와 민간 연구를 통해 항암신약 후보물질로 개발되었으나 후속연구가 진행되지 못한 우수한 후보물질들이 존재할 가능성이 높다. 따라서 최적의 조직, 인프라, 운영시스템을 확보한 사업단을 통해 기존에 개발된 국내 항암후보물질의 비임상과 임상1상/2상 시험을 직접 수행함으로써 신약개발의 병목 단계인 비임상, 초기임상 단계를 해소시켜 항암제 개발을 가속화하고 국산 글로벌 항암신약 개발․촉진에 기여하고자 한다.
(2) 한의약 선도기술 개발
(가) 개요
인구의 고령화로 인하여 만성․난치성질환이 증가하고 있으며, 세계적으로는 웰빙에 대한 관심과 친환경주의의 선호로 전통의학과 보완대체의학에 대한 수요가 급증하고 있다. WHO에서는 세계 전통의학 시장이 2000년 600억 달러에서 2008년까지 2,000억 달러 규모로 성장할 것으로 예측하고 있으며, 이용자 또한 급격히 증가하여 세계인구의 60%를 상회할 것으로 추정하고 있다. 현대의학의 한계점을 인식하고 의료비의 증가를 억제하기 위하여 전통의학과 보완대체의학에 대한 관심이 커지고 있어 세계 전통의학 시장이 넓어지고 있다. 따라서 국가별로 투자를 강화하고 있는 실정이다.
이러한 세계적인 관심 속에서 우리의 고유 전통의학인 한의학적 접근방법을 통한 치료기술개발은 높은 경쟁력을 가질 수 있으므로 정부는 오랜 전통을 지닌 한의약의 경험과 지식정보를 이용하여 핵심원천기술과 응용기술을 개발하고, 한의약의 안전성․유효성을 입증하여 국민보건향상과 한방산업에 기여하고자 1998년부터「한방치료기술연구개발사업(2020 프로젝트)」을 추진하고 있다.
한의약의 과학화․표준화․세계화의 비전을 지닌 한방치료기술연구개발사업의 목적달성을 위하여 단계별 목표를 수립하여 기초연구단계(1998~2002년), 연구심화단계(2003~2007년), 실용화단계(2008~2012년)로 구분하여 추진하고 있으며, 1998년부터 2011년까지 755.4억 원의 정부예산이 지원되었다.
(나) 지원내용
보건복지부는 사업목표를 명확히 하고 새로운 한방치료기술과 한약제제 등의 연구개발을 활성화 해 실효성을 높이기 위해 부처계획인 ‘한방치료기술개발사업 중장기 발전계획(2008~2017)’을 2008년 2월 27일 재수립하였다. 동 계획은 지난 1998년부터 추진한 한방치료기술연구개발사업을 통해 확보된 연구역량을 바탕으로 연구개발 활성화와 한방치료기술과 한약제제 개발 등 실효성 제고에 역점을 두고 있다. 제품화․세계화 촉진사업, 근거중심 한의학구축 사업, 혁신인프라지원사업 등 3개 세부사업을 전략지원하고 있다.
(3) 암연구사업
(가) 개요
보건복지부는 국민보건의 향상에 이바지하기 위해 암에 관한 전문적인 연구와 암환자의 진료 등을 위해 2000년에 국립암센터법을 제정하여 국립암센터를 설립․운영하고 있으며, 암의 발생․예방․진단․치료 및 관리 등에 관한 연구로 기관고유연구사업을 추진하고 있다.
아울러, 1996년도에 제1차 암정복 10개년 계획(1996~2006)을 수립하고 암정복추진단을 발족하여 암정복추진연구개발사업을 추진하였으며, 현재는 제2기 암정복 10개년계획(2006~2015) 기간으로 지난 1기 기간 동안 축적된 기반을 바탕으로 국민의 암발생률 및 암사망률을 감소시키고 치료하는데 주력하고 있다.
2003년부터 2011년까지 국립암센터 기관고유연구사업과 암정복추진연구개발사업으로 총 1,586억 원의 정부연구개발자금이 지원되었으며, 향후 암에 관한 연구와 투자는 국민의 보건상향에 중요한 만큼 선진국에 버금가는 투자를 할 수 있도록 확대되어야 할 것이다.
(나) 지원내용
국립암센터는 국립암센터 기관고유연구사업(intramural program)과 암정복추진연구개발사업(extramural program)을 상호보완적으로 추진하여 연구개발성과를 극대화하고자 노력하고 있다. 특히 한국인의 주요암(한국인 주요암(위․간․폐․대장․자궁․유방암)의 발생률 및 사망률을 낮추고 치료율을 제고시킬 수 있도록, 단순 기초 연구를 지양하고 기초연구와 임상연구 결과를 상호 유기적으로 연계할 수 있는 이행성 연구(중개연구) 에 중점을 두고 있다. 그리고 암 관련 기술개발을 통해 우리나라 생명공학 분야의 국가 경쟁력 향상에 기여하는 실용화 과제 수행을 지원하고 있다.
[그림 3-1-5-5] 국립암센터 R&D 주요사업

(4) 질병관리연구
(가) 개요
질병관리연구는 질병관리본부 국립보건연구원에서 수행 중인 연구로서 1999년부터 본격적으로 시작되었다. 국내 질병관리의 실무를 담당하고 있는 질병관리본부에서의 연구사업 수행은 국내 발생 질병에 대한 현안 대응의 측면에서 효율성을 인정받고 있다. 주요 연구 분야는 국내 발생 전염병 및 만성질환에 대한 예방, 진단 및 치료 기술 개발연구와 질환관련 유전체의 분석을 통해 질병을 예측하도록 하고자 하는 유전체사업이다.
(나) 지원내용
질병관리연구는 주로 질병관리본부 국립보건연구원의 자체 수행과제로 이루어져 있다. 그러나 유전체분석과제 등과 같이 기기구입과 관련 전문가 확보 등 부가적 비용이 필요한 경우에는 용역과제의 형태로 외부 연구기관에 위탁하여 수행하고 있다. 연구사업의 주요 내용은 다음과 같다. 주로 감염병에 대한 진단 및 예방치료 연구, 병원감염 원인균을 찾고 그에 대한 해결방법을 찾고자 하는 연구, 생물테러 등에 이용되어 국민 안전을 위협할 수 있는 고위험병원체에 대응하기 위한 기술개발연구, 비만․당뇨 등 생활습관의 변화로 인하여 급증하고 있는 만성질환 예방연구를 수행하고 있다. 또한 한국인의 유전 형질에 따른 질병 발생 추이를 확인하고 그에 따른 질병예측 프로그램 개발을 위한 유전체연구사업을 수행하고 있다. 질병관리본부는 이들 연구사업의 수행을 바탕으로 국민 건강 증진에 기여하는 일선 기관으로서의 역할을 다하고자 노력하고 있다.
[그림 3-1-5-6] 질병관리본부 R&D 주요사업
다. 향후 발전방향
보건복지부에서는 ‘11년 소득수준의 향상, 고령화 사회의 진입 및 질병구조의 변화 등 새로운 정책 수요를 반영한 HT R&D 범부처 기본계획 수립을 추진 중에 있다. 이를 통해 그동안 정부지원 보건의료 R&D의 문제점인 부처 간 중복․분산지원 등을 해소하기 위해 보건의료 R&D의 통합 조정․관리를 강화하고, 주무부처인 보건복지부가 보건의료 R&D 발전에 주도적인 역할을 수행할 계획이다. 또한, 기존 공급자 중심의 R&D에서 탈피해 수요자(국민)가 체감할 수 있는 보건의료 R&D지원 체계를 구축하고 보건의료 R&D사업의 목표를 질병극복․사회안전망확충․신산업창출 중심으로 강화할 예정이다. 또한 개별 질환 특성을 반영한 진단․치료․예방․재활․관리기술을 개발하기 위해 보건의료 전반의 R&D 지원을 강화해 나아갈 예정이다. 그와 더불어 R&D 자원 배분 또한 하향식(top-down) 과제와 연구자 육성․창의성 개발을 위한 상향식(bottom-up) 과제의 적절한 배분을 통해 지원해 나갈 계획이다.
제3장 : 국가생명공학육성현황
6. 환경분야 생명공학 육성정책
가. 기술개발 필요성
(1) 환경생명공학기술
「환경기술 개발 및 환경산업 지원법」에서는 “환경기술(Environmental Technology, ET)"을 환경의 자정능력을 향상시키고 사람과 자연에 대한 환경피해 유발요인을 억제·제거하는 기술로서 환경오염을 사전에 예방 또는 저감시키거나 오염 및 훼손된 환경을 복원하는 등 환경의 보전과 관리에 필요한 기술이라고 정의하고 있다. 여기에 전통적 환경기술인 환경오염 저감·예방 기술 이외에 친환경 소재·제품 개발, 생태계·생물 다양성 유지, 토양·지하수 복원, 기후변화 저감 및 적응에 필요한 기술 등으로 범위가 확대되고 있다.
환경기술(ET) 중에서도 환경생명공학기술(Enviro-Bio-Technology, EBT)은 환경오염을 저감·예방·복원시키기 위하여 생물과 생물학적 처리공정을 이용하는 생명공학기술(Bio-technology, BT)을 ET에 접목 또는 융합하는 기술로서 환경과학, 생태학, 분자생물학간의 유기적인 협조가 필요한 기술분야로 정의할 수 있다.
EBT는 BT의 기본적인 핵심기술13) 중에서도 생물공정기술(발효공정제어, 분리정제, 배양기 설계·제작)과 미생물이용기술(미생물분리·배양, 항암물질 탐색기술)을 주로 활용하고 있다. 이러한 EBT는 기존의 환경기술로는 극복하기 어려운 한계를 해결할 수 있다는 점에서 그 중요성이 부각되고 있으며, 근래 각 분야에서 첨단기술이 개발되고 있어 오염 환경 정화(remediation)는 물론 오염예방(prevention), 생물학적 방법에 의한 오염검출(detection)분야로 그 영역이 커질 것으로 전망되고 있다.
(2) 환경기술개발정책 패러다임의 변화
21세기 들어 생명과학, 신물질 개발, 정보기술의 발전 등 과학기술의 급속한 발전에 따라 새로이 등장하는 환경문제에 적극 대응하기 위해 환경기술개발의 중요성이 커지고 있다. 환경문제에 대한 인식이 메조수준의 단위시스템 관점에서 매크로(macro) 수준인 네트워크 개념의 사회통합적 관점으로 접근함에 따라 과학기술적 연구와 사회과학적 연구의 통합적 접근전략이 강화되고 있다. 이와 함께 분자생물학, 나노과학기술, 전자현미경 등의 발전과 맞물려 나노(nano)수준에서 환경문제에 대한 설명이 가능해짐에 따라 나노수준의 과학적 규명에 바탕을 둔 환경기술개발 정책의 추진이 필요하다.
[그림 3] 환경기술개발 정책 패러다임의 변화

![]()
특히, 최근에는 지구 온난화로 인한 기후변화 문제와 고유가 등 자원 위기가 현실적인 위협으로 등장하면서 에너지와 환경문제 해결이 국가 경제의 미래를 결정하는 주요 변수로 부각되었다. 우리나라도 ‘저탄소 녹색성장’을 새로운 국가비전으로 제시14)하면서 녹색기술과 청정에너지 개발을 새로운 성장동력으로 육성하기로 하여, 새로운 과학기술 지식을 바탕으로 한 정책 추진이 불가피해지고 있다. 이에 따라 환경분야에서도 기존의 환경기술(ET)에 생명기술(BT), 정보기술(IT), 나노기술(NT) 등을 접목하여 융합한 환경융합 신기술 개발 수요가 지속적으로 증가하고 있다.
나. 선진국의 ET/BT 융합기술 연구방향
차세대 기술 혁명은 어느 한 분야에 국한되지 않고 타 분야와의 상승적 결합을 통한 융합기술(Converging Technology)이 주도할 것으로 예측되고 있다. 미국, 일본 등 주요 선진국들은 이미 국가 주도로 미래 국가 경쟁력 확보를 위해 융합기술에 대한 투자를 가속화하고 있으며 자국 산업의 경쟁력 확보차원에서 국제규모의 환경문제 대응기술 개발을 적극적으로 추진하고 있다.
아울러 생명과학의 발전에 따른 유전자 변형 동·식물을 포함한 유전자변형생물체(LMO)의 환경(인체, 생태계) 위해성 평가 분야와 내분비계 장애물질 문제가 중요한 사안으로 부각되고 있다. 따라서 기존 화학물질은 물론 의약산업·화학 산업의 발전에 따른 새로운 화학물질에 대한 위해성 평가 연구도 중요성이 커지고 있다. 생태계 훼손, 토양·지하수 오염은 장기간에 걸쳐 이루어지기 때문에 오염복원을 위한 비용도 막대하며 장기적으로 대처해야 하는 환경문제이다. 1990년대 이후 이 문제들이 중요하게 부각되면서 이에 대응하기 위한 생태계와 토양·지하수 보전 및 복원 기술도 집중 개발되고 있다.
그 중 가장 핵심적인 분야는 바이오에너지 개발과 폐자원의 에너지화 분야이다. 이는 석유위기 극복을 주목적으로 출발하였으나, 현재는 CO2 배출량 감축 등 지구 온난화를 포함한 환경문제의 근본적인 해결방안이라 할 수 있다.
다. 차세대 환경기술개발사업 등 관련 EBT 분야
(1) 차세대 핵심환경기술개발 사업
환경부에서는 환경오염문제를 해결을 통한 국민의 삶의 질을 향상시키기 위하여 ET21 사업에 총 12,367억 원(정부 출연금 8,791억 원, 민간부담금 3,576억 원)을 투자하여 총 1,238개 과제를 수행하고 있으며, 상용화가 완료된 773개 과제에 대하여 652.9억 원의 기술료를 징수 하였다.
이러한 기술개발 투자 성과로는 지적재산권 출원·등록 4,372건, 학술지 게재·학술회의 발표 17,058건 등의 과학기술적 성과를 이루었으며, 또한 국내외 제품 판매실적 1,761건에 1조 2,233억원, 공사실적 1,111건 1조 6,450억 원의 성과를 이루었다(2011년 8월 기준).
한편 ET21 사업에서 추진했던 생명공학 관련 사업은 대기노출형 생물막과 미생물 복합체를 융합한 수질관리기술 개발과 같은 생태계 복원·관리 분야, 한국산 양서류 배아를 이용한 생태독성시험법 개발 및 수서환경 생태위해성평가 체계 구축과 같은 위해성 평가·관리 분야, 식물 추출물을 이용한 생태계 친화형 살충제 및 향균제 개발과 같은 친환경 소재·제품분야, 나노-효소 복합체 기반의 휴대용 잔류농약 검출용 바이오센서 개발과 같은 ET/BT 융합 측정분석 장치 분야 등으로 대별할 수 있으며, ET21 사업 중 BT분야로 추진된 투자 예산은 총 예산의 약21%에 달하였다.
또한 2010년으로 종료된 차세대 핵심환경기술개발 사업 (Eco-Technopia 21, ET21 사업)의 후속사업인 에코이노베이션기술개발사업(Eco-Innovation, EI사업)에서는 국내환경기술 및 산업 경쟁력을 향상시키고, 환경기술을 집중 개발하여 국민 삶의 질을 향상 및 지속가능한 발전을 위한 환경질 개선을 위하여 2011년부터 2020년까지 총 1조 5,530억 원을 투자할 계획에 있으며, 미세조류를 이용한 하폐수 고도처리 및 Bio-Fuel 생성기술 개발, 돈분뇨의 바이오에너지 회수 및 퇴비화 실증 기술 등 환경선진화기술개발 및 환경정책기반 공공기술개발사업의 투자예산(‘11년 1,260억원)중 20%이상을 BT분야의 사업을 지원할 예정이다.
|
사업년도 (‘01~’10년) |
ET21 |
ET21 과제 중 BT 관련 과제 |
|||
|
과제수 |
국고지원금 |
과제수 |
국고지원금 |
% |
|
|
계 |
1,238 |
8,791 |
371 |
1,883 |
21 |
(2) 생태계 환경보전 사업
ET21 사업 이외의 생명공학분야로는 기후변화에 따른 과학적이고 장기적인 한반도 생태계 변화 관리체계와 생물다양성 보전대책 수립을 위한 “국가 장기 생태 연구사업”, 생물다양성 협약에 따른 각국의 치열한 생물주권 확보 경쟁에 대비하여 멸종 위기의 야생 동·식물을 복원하는 “생물자원보존종합대책 사업”이 있다. 또한 자생생물과 고유종, 그리고 해외 생물자원의 발굴·확보 관리 인프라를 구축하는 “생물자원 발굴·분류 연구사업”, 유전자변형생물체(LMO)의 환경방출에 따른 잠재적 위해성을 사전 예방하여 국내 자연생태계를 보전하고자 하는 “유전자 변형 생물체의 자연생태계 영향평가 및 안전관리 사업”등을 추진하고 있다. 또한 ET21 후속사업인 EI사업에서는 유용생물자원 기능별 실용화기술개발로 생물자원주권확립 및 생물자원 산업화 육성기반마련을 위하여 “생물자원이용기술연구단”이 추진 중에 있다
|
국가장기생태연구 |
연구기간 |
2004년 12월 ~ 2013년 12월 |
|
연구비 |
396억(’11년도 17억) |
|
|
연구목표 |
과학적이고 장기적인 한반도 생태계 변화 관리체계 확립 및 생물다양성보전대책 수립 활용 |
|
|
사업내용 |
■ 기후변화에 따른 한반도 장기 생태계 변화 조사·연구 및 모니터링 ■ 기후변화 및 환경오염과 생태계 변화와의 상관관계 규명 ■ 생태계 변화에 따른 생물다양성 및 생물자원 보전정책 방안 연구 ■ 환경지표종 발굴 선정 및 특성 연구 ■ 기후변화와 환경오염에 따른 동물 생태·행동변화 연구 |
|
생물자원보전종합대책사업 |
연구기간 |
2006년 1월 ~ 2014년 12월 |
|
연구비 |
1,078억 원(’11년도 62억) |
|
|
연구목표 |
생물다양성 협약에 따른 각국의 생물주권 확보 경쟁에 대비하여 국가생물자원 보전 |
|
|
사업내용 |
■ 멸종위기 야생 동·식물 복원 ■ 유전자 변형생물체(LMO) 안전관리체계 연구개발 ■ 생물자원보전을 위한 대국민 홍보 |
|
생물자원발굴·분류 연구 |
연구기간 |
2006년 6월 ~ 계속 |
|
연구비 |
927억 원(’11년 85억) |
|
|
연구목표 |
자생생물, 고유종, 해외 생물자원 발굴·확보 및 생물자원 정보 관리 인프라를 구축하여 생물산업 활용기반 마련 |
|
|
사업내용 |
■ 한반도 자생 생물자원 탐색 조사, 표본·기타 생물재료(생체, 종자, DNA) 확보, 미발굴 생물자원 발굴 ■ 생물자원 DB 구축 및 국가 생물자원 관리시스템 구축 ■ 멸종위기종과 고유종의 유전자 분석 연구 및 유전다양성·유전체 정보 관리시스템 구축 |
|
제3차 전국자연환경조사 |
연구기간 |
2006년 1월 ~ 2012년 12월 |
|
연구비 |
339억 원(’11년 62억) |
|
|
연구목표 |
전국 자연환경현황 조사 및 변화 파악 GIS-DB 등 환경공간정보 수집ㆍ괸리 생태ㆍ자연도 갱신 |
|
|
사업내용 |
■ 전국의 지형, 식생, 동·식물 서식지 및 분포현황 조사 |
|
유전자변형생물체의 자연생태계 영향평가 및 안전관리사업 |
연구기간 |
2001년 7월 ~ 계속 |
|
연구비 |
’10년까지 33억 원(’11년 7억) |
|
|
연구목표 |
LMO의 환경방출에 따른 안전성을 확보하여 국내 자연생태계 보전 |
|
|
사업내용 |
■ LMO의 자연생태계 위해성 심사 ■ LMO가 자연생태계에 미치는 위해성 영향 연구 ■ 환경정화용 유전자변형식물체의 자연생태계 영향 연구 등 |
|
유용생물자원 첨단탐색기술개발사업 |
연구기간 |
2011년 5월 ~ 2016년 3월 |
|
연구비 |
66억(’11년도 13.2억) |
|
|
연구목표 |
유용생물자원 기능별 실용화기술개발 및 생물자원산업 육성기반마련 |
|
|
사업내용 |
■ 자생식물 대용량 초고속 탐색기술개발 및 실용화 ■ 유용 자생식물의 친환경 기능성 탐색 및 소재활용 웰니스 홀푸드제품 개발 ■ 토종난이용 고부가가치 신품종 개발, 향장소재개발 및 germplasm보존기술 개발 ■ 미세조류이용 환경오염물질반응 바이오센서개발 및 생분해성 Agar마스크팩 개발 ■ 수생태건강성 평가 Kit개발 및 횡적생태계회복기술 |
(3) 환경자원의 에너지화
환경부는 시장성, 성공 가능성이 높은 대규모 전략기술을 발굴하여 사업단 형태로 추진하는「Eco-STAR Project」의 일환으로, 2007년 「폐자원 에너지화 및 non-CO2 온실가스 사업단」을 구성하여 폐자원 에너지화 분야에 대한 기술 개발에 본격적으로 착수하였다.
|
사업단 |
한양대학교(단장: 윤성규 교수) |
|
사업기간 |
2007 ~ 2013 (6.5년) |
|
총사업비 |
1,050억 원(정부558억원, 민간 492억원) |
|
목 표 |
■ 유기성 폐기물 등을 대상으로 경제성 있는 친환경 에너지 확보 ■ non-CO2 온실가스의 효율적인 저감기술 개발 및 CDM사업화 |
|
기술개발 내용 |
■ 유기성폐기물 에너지화 기술 ■ 바이오매스 활용기술 ■ 가연성 폐기물 연료화 기술 ■ CH4 포집 및 활용기술 ■ N2O 저감기술 ■ HFC, PFC, SF6 등 저감기술 ■ 기타 non-CO2 저감 기술 ■ 개발 기술의 CDM 사업 적용 |
이후 2008년 10월에는 관계부처15) 합동으로 “폐자원 및 바이오매스 에너지 대책”을 수립하여, 정부의 저탄소 녹색성장 비전의 ‘신재생 에너지 사용 확대’과제의 목표율 20%(’50년) 중 10%를 폐자원·바이오매스 에너지화 사업으로 실현하는 것을 목표로, 2030년까지 에너지화 관련 기술을 선진국의 90~95% 수준으로 달성하기 위해 총 1조 3,414억 원을 투자할 계획이다.
또한, 정부는 2009년 11월 17일 국무회의 의결을 거쳐 ‘2020년 온실가스 배출전망치(BAU) 대비 30% 감축’을 국제사회에 공약하였고, 온실가스 감축목표를 핵심지표로 한 저탄소 녹색성장 추진에 '09~'13년간 총 107조원 수준(GDP의 2%)을 투입할 계획이며, 이를 통해 총 182~206조원(GDP의 약 3.5~4.0% 수준)의 추가 생산유발효과가 발생할 것으로 예상하고 있다
환경부, 교육과학기술부 등 저탄소 녹색성장관련 6개 정부부처들은 저탄소에너지 생산·보급을 위한 ‘폐자원 및 바이오매스 에너지 대책’ 으로 ‘13년까지 국가 신재생에너지 보급 목표율 3.78% 달성을 위해 폐자원 및 바이오매스로 83.0%에 해당하는 3.17% 실현, ‘20년까지 에너지화 관련기술을 선진국의 95% 수준으로 끌어올리고 ’30년에는 세계시장을 주도할 수 있는 “최첨단 글로벌 기술력 확보” 및 “녹색뉴딜사업”으로 ‘13년까지 신규일자리 약 14만 3천개, ’20년까지 약 33만개를 창출할 계획이다.
[그림] 폐자원 및 바이오매스 에너지 보급목표

출처: 폐자원 및 바이오매스 에너지 대책, 환경부 등 6개 부처 합동, 2008.10
라. 생명자원 분야의 육성 및 관리정책
환경부는 생물자원 관리 선도국가 건설을 목표로 국가적 차원에서의 생물다양성에 대한 체계적인 관리기반 마련을 위해 「생물다양성 보전 및 이용에 관한 법률」제정을 추진하여 왔다. 지난 5월 제정법률의 정부안을 최종 확정하여 국회에 제출하였다.
관계부처 별로 소관사항에 따라 생물다양성 관리 및 확보 관련 업무들을 각기 추진해 오고 있는 상황에서, 본 법안의 제정으로 국가 생물다양성의 총괄 관리체계가 구축되면 생물다양성 증진에도 기여할 것으로 기대된다.
한편, 정부는 생물자원의 보전․관리 및 이용을 종합적으로 연계하여, 생물자원의 활용을 극대화하기 위한 전략 및 실천계획으로 『생물자원 보전ㆍ관리 및 이용 마스터플랜』을 수립하여 지난해 10월 국무회의에 보고하고 확정하였다.
마스터플랜의 시행은 한반도 고유 생물자원 확보, 생물자원의 관리능력 배양 및 국가 생물주권 기반확립 등을 목표로 하며, 이를 달성하기 위해 선정한 5대 전략 및 47개 추진과제에 향후 10년간 총 1조5천여 억원을 투자할 계획이다.
|
|
주요 추진과제를 살펴보면, 첫째 국가 생물자원을 체계적으로 조사ㆍ발굴하여 한반도 생물지 및 생물도감을 발간하고, 생물자원 확보ㆍ수장시스템 등 관련 정보를 표준화하는 한편, 생물자원 인벤토리 및 생물종 확증표본 시스템 등을 구축함으로써 생물주권을 확보해 나가고자 한다.
둘째, 멸종위기종 증식ㆍ복원, 야생동물 질병관리 및 외래종ㆍLMO 안전관리 강화, 생물자원 국외반출 승인제도 개선 등을 통하여 생물자원을 효율적으로 보전․관리하는 한편, 기후변화 생태계 적응기술 및 기후변화 대응형 도시생태계 조성ㆍ관리기술을 개발하고자 한다.
셋째, 야생생물 유전자원센터, 대국민 생물종 동정서비스 및 DNA 바코드시스템 운영을 통하여, 생물자원의 활용인프라를 구축하고 자생생물에 대한 검색시스템 및 분류ㆍ검색체계를 표준화할 계획이다.
넷째, 자생생물 탐색기술, 생물자원 증식ㆍ배양 및 보전기술, 고유 생물자원을 이용한 생태계 복원기술 등을 개발하여, 각종 생물소재를 국산화하고 야생생물 추출물질의 산업적 활용기반을 마련하여 생물자원산업을 체계적으로 육성할 계획이다.
끝으로, 국가생물다양성법 제정을 추진하고, 생태원․생물자원관․습지센터 등 네트워크 형성으로 생물자원 관리기반을 강화하는 한편, 생물자원 DB 통합정보시스템 구축과 생물다양성 통합정보센터 운영 등을 중점 추진한다.
마. 향후 추진방향
2006년 12월 과학기술혁신본부에서 발표한 “국가 R&D 사업 Total RoadMap” 투자 배분 방향에 따르면 “생명·에너지·자원·환경 및 기초과학”분야를 성장 잠재력 확보와 국민의 삶의 질 향상 측면에서 투자확대 분야로 선정하여 2020년까지 점진적으로 투자를 늘려야 하는 분야로 분류한 바 있다. 환경기술(ET)의 중요성이 점차 증대되고 있으며 또한 생명분야 기술과의 접목이나 융합의 필요성이 절실함을 시사하고 있는 대목이다.
21세기에 접어들면서 환경기술 개발은 현안인 환경오염문제를 해결하는 것뿐만 아니라 점증하는 국제 무역환경규제에 효과적으로 대응하기 위해서도 그 중요성이 더욱 증대되고 있는 실정이다. 환경기술 개발이 국가 경쟁력 제고에 필수요소가 되고 있는 것이다. 특히 다변화되고 복잡한 환경시장에서의 경쟁력을 확보하기 위해서는 기존 ET21 사업을 성공적으로 마무리 및 ET21 후속사업을 통하여 국내 ET 기술수준을 선진국 대비 80%까지 제고하는 한편, 환경기술에 BT/IT 등이 융합된 사전오염예방기술 분야 및 환경복원, 지구환경보전 등 공공 성격의 첨단 환경기술개발 등을 통하여 지속가능하고 신가치를 창출할 수 있는 기술개발에 적극적으로 투자를 확대할 계획이다.
해양생명공학기술 육성정책
가. 해양생명공학기술 육성 추진배경
해양생명공학기술(Marine Biotechnology, MBT)이란 ‘해양생물체 내에서 일어나는 현상, 구조 및 기능을 이해하고, 그로부터 얻어진 지식을 활용하여 제품을 생산하거나 서비스를 제공함으로써 산업 및 인류복지 증진에 응용하는 과학기술’을 총칭한다.
(1) 해양생명자원의 가치
해양생명자원은 해양생명공학기술의 원천 소재이자 활용 가능성이 큰 차세대 신물질 개발의 보루로, 현재 지구상에 서식하는 3천5백만 종의 생명체 가운데 80%가 해양에 존재하고, 지구의 생명력을 유지시키는 2,000억 톤의 광합성량 중 90%가 해양에서 이루어지고 있다. 갯벌 및 연안에서 심해까지, 열대에서 한대에 이르기까지 다양한 해양환경에 광범위하게 분포하는 해양생물의 가치는 기후조절, 오염물질 자정 능력만 계산하여도 육상의 2배인 연간 26조 달러에 이르는 경제적 가치를 지닌다고 추정된다.
해양생물은 육지에서와는 달리 해양의 높은 수압과 염도, 저온에 적응하고 진화하며 살아 왔기 때문에 육상생물에서 발견할 수 없는 특이한 대사물질 및 생리활성물질 등을 생산한다. 이러한 해양생물의 유용물질은 식품, 의약 및 화학 등의 분야에서 관심을 받으며, 해양생물은 생명공학의 주요 자원으로 급부상하고 있다.
더욱이 나고야의정서 채택으로 해양생물에 대한 주권이 인정됨에 따라 유용한 생물자원을 선점하려는 경쟁이 국제적으로 심회되고 있다. 미국, 일본 등은 70년대부터 전략적으로 전 세계 유용생물을 다량 확보하여 고부가가치 성장 동력을 창출하고 있다. 그러므로 생명공학을 기반으로 하는 바이오산업 경쟁에서 살아남기 위해서는 원천소재인 생물자원의 안정적인 선점, 관리 및 활용이 매우 중요하다고 할 수 있다.
그림 1. 국내에서 발굴된 신종 해양생물
|
|
Bicellariella fragilis Seo, 2009 | Chelonaplysilla supjiensis |
(2) 해양생명공학산업의 중요성
해양생명공학산업은 해양생물체의 시스템, 구성성분, 과정 및 기능을 활용한 제품과 서비스를 생산하는 산업을 의미한다. 정보통신산업 이후 국가 경제성장의 핵심 산업이 될 분야로 향후 경제발전의 중요한 요소가 될 고도성장이 가능한 부가가치산업이자, 기술·정보 및 지식 집약형 첨단산업이다.
2006년 OECD는 ‘생명과학에 의한 새로운 발견들이 관련 제품의 보급이나 서비스의 향상을 통하여 인류에 편익을 제공하는 다양한 경제활동을 포괄하는 새로운 개념’으로 IT 발전에 버금가는 효과를 갖게 될 것으로 전망했다. 또한 다가오는 미래를 ‘바이오경제(Bio-Economy)시대’로 선언했으며, OECD 생명공학분과에서는 2011년부터 주요 논의 주제로 “해양생명공학”을 다루고 있다.
해양생명공학 분야는 특징적으로 해양천연물 또는 해양생물에서 기원한 의약재 혹은 고분자물질, 화학소재 등을 생산한다. 또한 원천기술 확보가 용이하여 독점적 물질특허권 확보가 가능하고, 유용신물질 발견율, 제품화 비율이 높으며, 신제품 개발기간 단축이 가능하다는 이점이 있다. 특히 극한환경 미생물의 생체기능을 이용하기 위한 특수기술이 필요하고, 생물오손, 대량배양 등의 고유한 영역을 지닌다는 특징을 지니는데, 이러한 고유 영역이 있다는 것은 해양생물자원을 활용하여 창출할 수 있는 분야의 다양성이 매우 높다는 것을 의미한다.
국토해양부에서는 선진기술강국 진입을 목표로 하는 ‘제2차 생명공학육성기본계획(’07∼‘16)’ 수립에 따라 능동적 후속조치의 일환으로 국가상위계획과 부합되는 ‘해양생명공학육성기본계획(Blu-Bio 2016)’을 ’08년 10월에 수립하여 세계 해양바이오 산업시장의 5%(1조원 규모) 점유 및 특허기술경쟁력 7위 달성을 목표로 해양생명공학기술개발사업에 앞장서고 있다.
| |||||||||||||||||||||||||||||||||||||
그림 4. Blue-Bio 2016의 비전 및 목표
나. 해양생명공학 국내 주요 육성정책
(1) 해양생명공학 육성 필요성
우리나라는 육지 면적의 4.5배에 달하는 44만 3천 평방 km의 관할해역을 보유한 천혜의 해양국가로서, 생명공학(BT) 및 정보공학(IT) 강국으로 해양생명공학에 강점을 지나고 있다. 또한 해양소재에서 제품화 성공률은 1/6,000로, 육상생물소재의 1/12,000보다 두 배나 높으므로 해양생명산업의 발전 가능성과 가치는 그 어느 나라보다도 높다고 할 수 있다.
세계 각국은 자국의 문화나 특성에 따라서 정책의 방향, 연구기관의 특징, 연구지원 형태 등이 다양하다. 한국의 강점을 잘 살릴 수 있는 연구 분야에 집중 지원하되, 해양생명공학의 중요성을 간과하지 않고 전 분야에 고른 지원 육성책이 필요하다.
해양바이오기술(MBT,Marine Biotechnology)은 선진일류국가를 향한 이명박 정부의 과학기술기본계획(577 Initiative)의 7대 중점투자분야에서 “신산업 창출을 위한 핵심기술개발 강화”과제를 실현하는 핵심기술분야이며, 녹색기술 연구개발 종합대책에서 “녹색기술 선진화를 통한 녹색강국 건설”실현을 위한 27개 중점육성기술에 해당한다(‘09.01 국과위). 또한 신성장동력비전 및 발전전략에서 단순한 에너지 절감 분야가 아닌 미래 성장의 바탕이자 기존 산업고도화와 신산업 창출이 가능한 분야로 선정되었다. 또한, 이명박 대통령은 해양바이오 R&D 투자확대의 필요성을 지적한 바 있으며(‘09.2), 이에 따라 ‘해양바이오활성화방안’을 수립·시행해 오고 있다(‘09.7).
(2) 해양생명공학기술개발사업의 목적
해양생명공학사업(구 마린바이오 21)은 국토해양부의 대표적인 생명분야 R&D사업으로서 ’건강한 생명사회 지향(신의약·신물질 개발), 해양바이오산업 신소재 개발 등을 위한 해양생명자원의 선행적 확보와 이를 효율적으로 이용하기 위한 핵심기술 개발‘을 목표로 2004년부터 추진해오고 있다. 2004∼2010년 기간 동안 논문(846편), 특허출원(405건), 특허등록(145건), 시제품(24건), 기술이전(11건)의 높은 성과를 내고 있다.
2011년의 경우, 사업비는 26,191백만원으로, 해양특이생물 및 극한생물의 분자유전체 연구를 통한 해양생물자원의 새로운 이용기술개발 및 제품화, 해양산업용 신소재 및 해양기능성 식품·환경성 소재 개발, 신약 후보물질 및 질병 치료제 개발 등을 통해 해양바이오기술을 활용한 해양생물자원의 고부가가치 산업화를 실현해 가고 있다.

그림 3. 해양생명공학기술개발사업의 범위
(3) 육성정책의 주요 내용
ㅇ 해양·극한생물분자유전체기술개발 |
- 주관연구기관/책임자 : 한국해양연구원/이정현박사 - 연구내용 : 해양극한생물 대상으로 유전자 및 단백질 수준에서 생명기능과 현상을 해석하고 자원정보를 DB화하여 효율적으로 관리·활용하며, 유용 우전자 및 단백질 발굴·활용 기술개발 |
ㅇ 해양 천연물신약 기술개발 |
-주관연구기관/책임자 : 서울대/강헌중교수 - 연구내용 : 해양생물 유래 대사성 질환치료제(비만, 당뇨 등), 면역질환치료제(면역억제제 등), 퇴행성질환치료제(골다공증 등), 감염성질환치료제(항생제 등)의 세계적 신약 후보물질 도출 및 기술개발 |
ㅇ 해양바이오프로세스 기술개발 |
- 주관연구기관/책임자 : 부경대/김세권교수 - 연구내용 : 해양생물 유래 기능성화장품 및 기능성식품 소재 등 고부가가치 유용 신물질·소재를 발굴하고, 산업화에 필요한 대량생산 공정기술개발 |
ㅇ 해양바이오에너지 생산 기술개발(바이오디젤 및 알콜) |
- 주관연구기관/책임자 : 인하대/이철균교수 - 연구내용 : 화석에너지 고갈 및 온실가스 감축의무에 대비하여 우수한 해양생물자원을 탐색·확보하여 500ℓ규모의 해양광생물반응기 개발 및 대량생산 기술개발을 통해 경제성 있는 해양바이오디젤과 알콜 생산 |
ㅇ 해양바이오에너지 생산 기술개발(바이오수소) |
- 주관연구기관/책임자 : 해양연/강성균박사 - 연구내용 : 해양초고온성 고세균의 수소생산기작 분석 및 우수 균주 개발, 폐가스로부터 CO공급방안 및 공급장치 개발, 고농도의 생물반응기를 통한 실증생산 |
ㅇ 해양바이오산업신소재 기술개발 |
- 주관연구기관/책임자 : 포항공대/차형준교수 - 연구내용 : 해양생물이 생산하는 대사물질 또는 생체기능을 이용하여 섬유복합소재(천연섬유소재, 조직재생유도소재, 복합지지체)와 바이오플라스틱소재(정밀화학소재, 플라스틱소재)를 개발 |
ㅇ 해외해양생물자원 확보 기술개발 |
- 주관연구기관/책임자 : 해양연/이희승박사 - 연구내용 : 열대, 심해, 극지에 서식하는 고활성 고부가가치 해외 해양생물자원을 목적지향적으로 확보·관리·보존·활용함으로서 지속가능한 원천소재물질 지원 |
ㅇ 해양바이오인프라 구축(해양생명자원 기탁등록보존기관 등) |
- 주관연구기관/책임자 : 서울대외 7개 기관 - 연구내용 : 기탁등록보존기관 및 해양바이오정책지원센터를 통해 국내 해양생명자원을 확보하고 네트워크를 구축하여 자생자원의 효율적 관리·보존·분양 체계 운영 |
다. 향후추진계획
해양생명공학사업은 막대한 초기자본 소요로 민간에서 추진이 어려우며, 국가차원의 집중적 육성과 지원이 필요하다. 또한 유엔해양법, 생물다양성 협약 등 생물자원 주권화 강화 추세에 따라 국내외 해양생물자원 확보와 보존을 위한 국가 주도의 체계적 사업추진이 필요할 것으로 전망된다.
국토해양부에서는 국제적 해양생물자원의 상업화에 대처하고 해양생물에 대한 국가주권을 확보하여 해양생명산업을 21C 국가전략 산업분야로 집중 육성하기 위하여 ‘해양생명자원마스터플랜’ 과 ‘제2차 국가생명공학육성 기본계획 및 시행계획(Bio-Vision 2016)’ 수립에 대한 ‘해양생명공학육성 기본계획(Blue-Bio 2016)’을 수립하였으며 2011년 말까지 해양생명공학 중장기 추진계획을 수정 보완할 계획이다. 본 계획을 통해 그 동안 저투자·저인식 되어왔던 해양바이오를 고부가 신성장동력으로 업그레이드 시키고자 한다. 또한 지난 2004년부터 실시해오고 있는 해양생명공학사업 체제를 효율적으로 개편하고, 변화의 주기가 매우 빠른 생명공학의 세계적 트렌드에 발맞춤은 물론, 미개척 분야에 대한 원천기술을 확보하여 세계 7대 해양강국을 실현하고자 박차를 가하고 있다.
국토해양부는 해양생명공학사업 지원을 통해 해양바이오기업을 고부가가치 해양바이오산업체로 전환하며, 산·학·연의 연구를 강화하는 등 민간이 할 수 없는 다양한 공공분야의 투자와 인프라 구축을 적극적으로 주도하여 해양생명자원을 보존 및 활용하고, 해양생명산업이 활성화 될 수 있도록 지속적으로 지원하고 육성해 나갈 것이다.
해양생명공학사업의 성과
□ 대표성과
| ㅇ 해양초고온고세균이용 바이오수소 대량생산 기술개발
- 해양 초고온 고세균(NA1)의 수소생산 기작 및 대사경로 규명 - 해양 초고온 고세균(NA1) 이용 바이오수소 생산을 위한 생물반응기(5L) 개발 및 실증생산 |
| ㅇ 초고온 극한미생물의 에너지 대사 및 바이오수소 생성기작 세계최초 규명(Nature 게재)
- 심해 초고온성 고세균인 써모코커스 온누리누스의 개미산을 이용한 새로운 에너지 대사작용 규명 |
| ㅇ 바이오칩 이용 해양무척추동물의 바이오마커 개발
- 해양 무척추동물의 cDNA칩을 제조하고 물리적, 화학적, 생물학적 스트레스에 반응하는 유전자발견 및 바이오마커를 개발 - 해양오염 발생을 사전에 경보할 수 있는 조기경보체계 구축 가능 |
| ㅇ 막효소 반응기를 이용한 생리기능성 펩타이드 개발
- 막효소 반응기를 이용하여 해양생물의 부산물을 활용한 고부가가치 기능성 펩타이드 생산공정 개발 - 이들 펩타이드의 다양한 생리 기능 활성 규명 |
| ㅇ 해양유래 생체촉매 및 생리활성 물질의 반응동력학적 분석을 위한 미세유체역학 디바이스 개발
- 세계 최초로 개발한 동력학 분석용 미세유체역학칩은 multi-step 분석 및 시료의 병렬처리 가능 - 11개 채널 미세유체역학 칩의 설계, 제작 및 작동시험 완료(국제특허 출원) |
| ㅇ 홍합유래 생체접착소재 실용화 기술 개발
- 세계 최초 홍합접착단백질의 대량생산, 소재기술 및 실제로 활용 가능한 실용화 기술 개발 - 생체적합성이 우수하고 무해하여 조직공학이나 세포배양연구에서의 세포접착제로 활용이 가능, 기존의 봉합사를 대체하는 수술용 및 상처봉합용 의료접착소재로 활용이 가능 |
8. 생명연구자원관리 육성 정책
생명연구자원은 에너지고갈, 환경오염 및 식량부족 등 인류가 직면하게 될 난제를 해결하는 바이오 연구의 필수 자원으로서 그 중요성이 증대되고 있다. 2010년 나고야 ABS 의정서(ABS:Access to Genetic Resources and Benefit-Sharing) 체결 등 급변하는 생명연구자원 확보에 관한 국제 정세에 적극적으로 대응하고 생명연구자원 주권 확보에 대한 노력이 필요하다. 또한 2009년 「생명연구자원의 확보․관리 및 활용에 관한 법률」제정에 따라 국가 차원의 체계적인 전략이 필요하다.
1993년 생물다양성 협약을 시작으로 2010년 ABS의정서체결 등 자원 주권 관련하여 국제협약 강화와 선진국을 중심으로 한 자국의 자원 확보를 위한 정책이 강화되고 있는 추세이다. 우리나라의 경우 식물자원 확보 순위는 226개국 중 72위, 미생물자원 확보 순위는 10개국 중 8위이나 확보량은 최대보유국인 미국의 14.3%이며, 염기서열 순위는 16개국 중 11위이나 확보량은 전체의 0.47% 수준에 있다. 이러한 상황을 보더라도 생명연구자원에 대한 선점과 확보를 위한 국가적 차원의 대응 전략이 필요한 시점이다.
이에 부처간 협력 강화를 통한 국내 생명연구자원의 정확한 현황 파악과 안정적 관리체계, 자원보존․관리 기술 및 인프라 구축이 이뤄져야 한다. 2009년 정부의 생명연구자원 분야 투자 규모는 987.16억원으로 생명공학 총 투자액(12,614.73억원) 대비 7.8%에 그치고 있다. 기초원천연구 활성화를 통한 생명연구자원의 산업적 활용을 극대화하고 또 이를 실현하기 위한 정부 예산 확대 및 전문 인력 양성 또한 함께 해결해야 할 과제이다.
[그림] 생명연구자원관리기본계획(‘11~’20) 비전 및 목표

생명연구자원관리기본계획상의 중점 추진과제를 보면 생명연구자원의 전략적 발굴․확보 강화, 생명연구자원의 안정적 보존 및 관리 효율화, 수요자 맞춤형 생명연구자원 활용 극대화, 지원체제 강화로 구분하고 있다.
가. 생명연구자원의 전략적 발굴․확보 강화
○ 국내 보유자원의 현황 및 관리 실태를 정기적으로 파악하고 국가차원의 생명연구자원 발굴ㆍ확보를 위한 로드맵 수립
○ 생명연구자원의 발굴ㆍ확보를 위한 거점을 ’20년까지 20개로 확충하고, 연구성과물 기탁을 활성화시키며, 확보 관련 기반기술 개발
○해외자원 확보를 위한 거점을 ’20년까지 20개로 확충하고, 국제기구 및 해외기관과 공동연구 등을 통하여 전략적 협력 강화
나. 생명연구자원의 안정적 보존 및 관리
○ 국제적 기준에 부합하는 생명연구자원의 보존ㆍ관리 프로토콜을 개발하고 관련 정보의 통합관리를 위한 시스템 구축
○ 생명연구자원의 안정적 보존ㆍ관리를 위해 시설 및 장비 등 인프라를 확충하고 장기적인 보존․관리 등 관련 기술개발 추진
다. 수요자 맞춤형 생명연구자원 활용 극대화
○생명연구자원의 부가가치를 제고하기 위해 국가차원의 생명연구자원 정보 분석·지원 시스템을 강화
○생명연구자원의 활용도를 제고하기 위해 수요자 중심의 서비스를 강화하고 ABS의정서 발효에 대응하기 위한 지원센터를 설치
라. 지원체제 강화
○’20년까지 생명연구자원 관련 투자를 약 3.5배 확대하고(’09년 987억원→’20년 3,500억원), 전문인력을 총 19,000여명 양성
○부처간 협력강화를 통하여 생명연구자원 현황을 정확히 파악하고, 자원보존·관리 기술 개발 및 안정적 관리체계, 인프라 확충
○생명연구자원 관련 법・제도의 지속적인 정비 및 홍보를 통하여 국제 환경변화에 신속히 대응하고 대국민 이해 제고(’10. 12월 기준)
제2절 생명공학 경쟁력 지표 현황
1. 투자현황
가. 정부의 연구개발 투자 현황
(1) 국가연구개발사업 투자 규모 추이
21세기 지식기반경제의 심화와 함께, 가까운 미래에 바이오 기술·산업이 경제활동 전반에 변화를 가져오는 범용기술(General Purpose Technology : GPT)로서의 정보통신기술을 대체하고, 바이오 기술이 경제적 산출량의 상부분에 기여하고 있는 바이오경제(Bioeconomy) 시대16)가 도래할 것으로 전망되고 있다. 특히 바이오 기술은 삶의 질 향상(보건의료, 식량 등)에 대한 인류의 욕구를 충족시켜 줄 수 있는 핵심적인 기술로, 고령화 및 인구 증가 등 우리 사회에서 대두되고 있는 주요 현안에 대한 해결책을 제시해줄 수 있을 것으로 기대되고 있으며, 이를 위해 세계 각국은 생명공학 분야에 대한 집중적인 투자를 통해 국가경쟁력 향상을 도모하고 있다.
우리나라 또한 2008년 과학기술 정책 관련 큰 그림인 「선진일류국가를 향한 이명박정부의 과학기술기본계획(577 Initiative)」의 수립을 통해 국가 총 연구개발투자(정부+민간)의 확대(2006년 3.23%에서 2012년 5%) 및 7대 기술분야(R&D)17)의 중점육성, 7대 시스템18) 선진화․효율화를 목표로 하는 50개 범부처 중점추진과제를 제시하였다. 생명분야는 이중 신산업창출(신약개발, 의료기기 등), 현안관련 분야(먹거리 안전, 국가 재난형 질병 등)에 포함되어 향후 투자를 지속적으로 확대할 예정이며, 이를 통해 2020년을 전후하여 가시화될 것으로 여겨지는 바이오경제(bioeconomy) 시대를 대비하는데 기여를 할 것으로 기대된다.
이명박정부의 과학기술기본계획 마지막 해에 해당하는 2012년 예산편성의 특징 중 하나는 국가과학기술위원회(이하 국과위)의 확대개편과 함께 예산배분·조정 권한이 강화되어, 국가연구개발사업 중 국방·인문 R&D를 제외한 주요 연구개발사업19)에 대한 국과위의 배분조정(안)과 기타 사업(31개)에 대한 배분방향(검토의견)을 기획재정부에 통보하고, 기획재정부의 예산 편성에 적극 반영하도록 한 것이다. 이에 따라 국과위에서는 투자중점 분야로 기초·원천연구, 녹색·신성장 R&D 등 국정과제와 중소기업 지원, 재난·재해에 대비한 공공 R&D를 선정하였고, 바이오 분야에서는 질병극복, 보건의료 산업 육성을 위한 주요 전략기술20)에 대한 투자를 확대·강화하였다.
2010년도 정부 연구개발 총투자는 일반회계, 특별회계 및 기금을 포함해서 13조 6,827억원으로 2009년의 12조 4,145억원에서 1조 2,682억원(10.2%) 증가하였으며, 2004년부터 2010년까지 연평균 증가율은 14.8%로 나타났다. 일반회계를 기준으로 정부 연구개발예산의 비중은 2010년 5.5%로 2009년에 비하여 0.4% 증가하였다. 2010년도 국가연구개발사업에는 총 13조 6,827억원이 집행되었는데, 이는 2010년도 정부 연구개발예산에서 187억원이 미집행 되었음을 의미한다. 최근 7년간 국가연구개발사업 규모 변화 추이는 <표 1>에 나타나 있다.
<표 1> 국가연구개발사업 규모 변화 추이(2004∼2010년)
(단위 : 억원)
|
구분 |
2004년 |
2005년 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
연평균 증감률 |
|
|
일반회계 예산(A) |
1,182,362 |
1,352,156 |
1,260,843 |
1,353,977 |
1,523,038 |
1,688,922 |
1,772,835 |
7.0 |
|
|
R&D 예산 |
일반(B) |
57,418 |
56,612 |
61,094 |
65,898 |
75,705 |
85,857 |
97,711 |
9.3 |
|
(B/A, %) |
4.9 |
4.2 |
4.8 |
4.9 |
5.0 |
5.1 |
5.5 |
|
|
|
일반+특별 |
60,995 |
67,368 |
72,283 |
81,396 |
93,461 |
106,300 |
119,576 |
11.9 |
|
|
총 투자 (기금포함) |
70,827 |
77,996 |
89,096 |
97,629 |
110,784 |
123,437 |
137,014 |
11.6 |
|
|
조사 ∙ 분석 대상 |
투자액 |
59,847 |
77,904 |
87,639 |
95,745 |
109,936 |
124,145 |
136,827 |
14.8 |
|
사업수 |
314 |
390 |
357 |
426 |
486 |
473 |
483 |
7.4 |
|
|
과제수 |
26,514 |
30,425 |
31,967 |
33,125 |
37,449 |
39,471 |
39,179 |
6.7 |
|
출처: 2010년도 국가연구개발사업 조사‧분석(국가과학기술위원회)
(2) 미래유망신기술(6T) 분야별 투자 규모 추이
우리나라는 2000년대 이래 미래 성장동력을 창출해 낼 미래유망신기술(6T : IT(정보통신기술), BT(생명공학기술), NT(나노기술), ET(에너지‧환경기술), ST(우주기술), CT(문화기술))을 선정하여 집중적으로 투자를 확대하고 있다. 특히, 정부는 신약개발, 의료기기개발 등 BT 분야를 미래 신성장동력으로 선정하고 정부 R&D 투자를 ‘08년 17,257억원에서 ’10년 20,112억원으로 크게 확대하여 3년간 연평균 증가율이 16.1%에 달하고 있다. 2010년도 6T 분야 투자액은 전년 대비 8,227억원 증가하여 총 8조 2,562억원으로 정부연구개발 투자 중 66.1%를 차지하였다. 최근 3년간 미래유망신기술에 대한 투자 현황은 <표 2>에 나타나 있다21).
BT 분야에 대한 투자를 살펴보면, 2010년도에 2조 3,252억원으로 정부 연구개발 투자에서 차지하는 비중은 18.6%로 나타났는데, 이는 전년도 대비 15.6%(3,141억원) 증가한 액수이다. 최근의 추이를 살펴보면, 2008년을 기점으로 BT분야에 대한 투자액이 IT분야에 근접하였고, 두 분야 모두 최근 3년간 6T 기술 중 투자비중이 꾸준히 상승하고 있음을 알 수 있다.
※ BT 분야 투자비중 : ‘08년 17.5% -> ’09년 17.7% -> ‘10년 18.6%
※ IT 분야 투자비중 : ‘08년 17.5% -> ’09년 18.3% -> ‘10년 18.9%
<표 2> 6T별 투자 추이(2008~2010년)
(단위 : 억원)
|
6T |
2008년 |
2009년 |
2010년 |
증감 |
||||
|
금액(B) |
비중(%) |
금액(A) |
비중(%) |
금액(B) |
비중(%) |
B-A |
% |
|
|
IT |
17,259 |
17.5 |
20,804 |
18.3 |
23,571 |
18.9 |
2,767 |
13.3 |
|
BT |
17,257 |
17.5 |
20,112 |
17.7 |
23,252 |
18.6 |
3,141 |
15.6 |
|
NT |
5,072 |
5.2 |
5,735 |
5.1 |
5,947 |
4.8 |
213 |
3.7 |
|
ST |
8,016 |
8.1 |
8,806 |
7.8 |
6,846 |
5.5 |
-1,960 |
-22.3 |
|
ET |
13,463 |
13.7 |
18,052 |
15.9 |
21,873 |
17.5 |
3,821 |
21.2 |
|
CT |
673 |
0.7 |
825 |
0.7 |
1,071 |
0.9 |
246 |
29.8 |
|
소계 |
61,739 |
62.8 |
74,335 |
65.5 |
82,562 |
66.1 |
8,227 |
11.1 |
|
기타 |
36,624 |
37.2 |
39,100 |
34.5 |
42,336 |
33.9 |
3,236 |
8.3 |
|
합계 |
98,363 |
100.0 |
113,434 |
100.0 |
124,898 |
100.0 |
11,464 |
10.1 |
출처: 2010년도 국가연구개발사업 조사‧분석(국가과학기술위원회)
나. 부처의 BT(생명공학)분야 연구개발 투자 현황
(1) 연구개발단계별 투자 현황
2010년도 BT분야에 대한 부처별 투자현황을 살펴보면, 교육과학기술부가 8,468억으로 전체 BT분야의 36.4%를 투자하였고 농촌진흥청 4,166억원(17.9%), 지식경제부 3,828억원(16.5%), 보건복지가족부 3,023억원(13.0%) 순으로 투자가 이루어졌다. 연구개발단계별로 살펴보면 기초연구, 응용연구, 개발연구에 각각 44.8%(8,624억원), 24.9%(4,788억원), 30.4%(5,852억원)가 투자22)된 것으로 나타났다. 기초 및 응용연구는 교육과학기술부가 각각 5,588억원, 1,712억원을 투자하였고, 개발연구는 지식경제부가 2,327억원으로 가장 많은 투자를 한 것으로 나타났다(<표 3>).
(2) 국가과학기술표준분류별 투자 현황
2010년도 BT분야에 대한 투자를 국가과학기술표준분류 25개 대분류 기준으로 살펴보면 보건‧의료 분야에 8,457억원(36.4%), 생명과학 분야에 5,173억원 (22.2%), 농림‧수산 분야에 6,671억원(28.7%) 순으로 투자가 이루어진 것으로 나타났다. 생명과학 분야는 과학기술부가 3,639억원, 보건‧의료 분야는 보건복지가족부가 2,744억원, 농림‧수산 분야는 농촌진흥청이 3,681억원으로 분야별로 가장 많은 투자를 한 것으로 나타났다(<표 4>).
<표 3> BT분야 부처별 연구개발단계별 투자 현황(2010년)
(단위 : 백만원)
|
|
교육과학기술부 |
국토해양부 |
기상청 |
농림수산식품부 |
농촌진흥청 |
문화체육관광부 |
방위사업청 |
보건복지부 |
산림청 |
소방방재청 |
식품의약품안전청 |
중소기업청 |
지식경제부 |
행정안전부 |
환경부 |
총합계 |
|
기초 연구 |
558794 |
11564 |
20 |
29099 |
94043 |
0 |
380 |
54010 |
18620 |
0 |
22300 |
61 |
58396 |
60 |
15028 |
862374 |
|
응용 연구 |
171217 |
10824 |
0 |
33762 |
73425 |
200 |
700 |
106844 |
17131 |
0 |
11000 |
74 |
51959 |
500 |
1118 |
478754 |
|
개발 연구 |
57245 |
3810 |
0 |
60347 |
57262 |
2469 |
0 |
82139 |
15887 |
70 |
7185 |
63309 |
232707 |
1156 |
1635 |
585220 |
|
기타 |
59550 |
800 |
0 |
30471 |
191844 |
0 |
0 |
59271 |
315 |
0 |
10922 |
21 |
39700 |
0 |
5999 |
398894 |
|
합계 |
846805 |
26998 |
20 |
153678 |
416575 |
2669 |
1080 |
302265 |
51952 |
70 |
51407 |
63466 |
382762 |
1716 |
23780 |
2325242 |
출처: 2010년도 국가연구개발사업 조사‧분석(국가과학기술위원회) 관련 자료에서 산출
<표 4> BT분야 부처별 국가과학기술표준분류별 투자현황(2010년)
(단위 : 백만원)
|
|
교육과학기술부 |
국토해양부 |
기상청 |
농림수산식품부 |
농촌진흥청 |
문화체육관광부 |
방위사업청 |
보건복지부 |
산림청 |
소방방재청 |
식품의약품안전청 |
중소기업청 |
지식경제부 |
행정안전부 |
환경부 |
총합계 |
|
건설/교통 |
633 |
1681 |
0 |
600 |
0 |
0 |
0 |
0 |
180 |
0 |
0 |
96 |
0 |
0 |
0 |
3190 |
|
경제/경영 |
14 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
14 |
|
과학기술과 인문사회 |
1570 |
0 |
0 |
0 |
6093 |
0 |
0 |
0 |
85 |
0 |
0 |
0 |
12894 |
0 |
0 |
20642 |
|
교육 |
199 |
0 |
0 |
0 |
0 |
0 |
0 |
30 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
229 |
|
기계 |
6612 |
0 |
0 |
460 |
198 |
0 |
30 |
0 |
0 |
70 |
0 |
1040 |
8548 |
0 |
0 |
16958 |
|
농림수산식품 |
49775 |
780 |
0 |
136314 |
368064 |
0 |
0 |
465 |
48377 |
0 |
2935 |
8763 |
51590 |
20 |
0 |
667084 |
|
뇌과학 |
31855 |
0 |
0 |
0 |
0 |
0 |
0 |
4473 |
0 |
0 |
0 |
0 |
1200 |
0 |
0 |
37528 |
|
문화/예술/체육 |
360 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
25 |
0 |
0 |
0 |
385 |
|
물리학 |
10721 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1055 |
0 |
0 |
11776 |
|
보건의료 |
285356 |
6634 |
0 |
1470 |
2454 |
2469 |
170 |
274420 |
0 |
0 |
47047 |
27821 |
196440 |
1407 |
0 |
845688 |
|
사회/인류/복지/여성 |
20 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
20 |
|
생명과학 |
363892 |
3923 |
0 |
12404 |
37828 |
0 |
180 |
22364 |
3310 |
0 |
790 |
14577 |
50226 |
289 |
7517 |
517300 |
|
수학 |
1996 |
0 |
0 |
270 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
33 |
0 |
0 |
0 |
2299 |
|
에너지/자원 |
2397 |
0 |
0 |
400 |
213 |
0 |
0 |
0 |
0 |
0 |
0 |
666 |
2515 |
0 |
0 |
6191 |
|
원자력 |
29812 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2298 |
0 |
0 |
32110 |
|
인지/감성과학 |
499 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1000 |
0 |
0 |
1499 |
|
재료 |
3257 |
0 |
0 |
0 |
0 |
0 |
0 |
513 |
0 |
0 |
95 |
2079 |
8038 |
0 |
0 |
13982 |
|
전기/전자 |
2509 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1365 |
9793 |
0 |
0 |
13666 |
|
정보/통신 |
6760 |
400 |
0 |
0 |
80 |
0 |
0 |
0 |
0 |
0 |
0 |
860 |
2121 |
0 |
0 |
10221 |
|
정치/행정 |
0 |
0 |
0 |
0 |
90 |
0 |
0 |
0 |
0 |
0 |
0 |
24 |
150 |
0 |
0 |
264 |
|
지구과학(지구/대기/해양/천문) |
4785 |
13480 |
20 |
150 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
18435 |
|
지리/지역/관광 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
4850 |
0 |
0 |
4850 |
|
화공 |
4431 |
0 |
0 |
120 |
96 |
0 |
0 |
0 |
0 |
0 |
0 |
2091 |
14767 |
0 |
0 |
21504 |
|
화학 |
31810 |
0 |
0 |
1090 |
715 |
200 |
0 |
0 |
0 |
0 |
540 |
3654 |
11950 |
0 |
0 |
49959 |
|
환경 |
7541 |
100 |
0 |
400 |
743 |
0 |
700 |
0 |
0 |
0 |
0 |
373 |
3327 |
0 |
16263 |
29447 |
|
합계 |
846805 |
26998 |
20 |
153678 |
416575 |
2669 |
1080 |
302265 |
51952 |
70 |
51407 |
63466 |
382762 |
1716 |
23780 |
2325242 |
출처: 2010년도 국가연구개발사업 조사‧분석(국가과학기술위원회) 관련 자료에서 산출
(3) 주요부처별 투자현황
2010년도 BT분야 투자액을 기준으로 한 4개 주요 부처(청 포함)의 BT분야 주요 연구개발 사업내용23)을 살펴보면 다음과 같다(<표 5>).
(가) 교육과학기술부
21C프론티어연구개발사업 사업단에 477억원, 기초‧원천기술개발을 위한 미래기반기술개발사업에 1,034억원을 비롯하여, 한국생명공학연구원에 553억원, 한국한의학연구원에 200억원, 일반연구자지원사업에 1,484억원, 중견연구자지원사업에 934억원, 리더연구자지원사업에 240억원, 선도연구센터지원사업에 575억원, 세계수준의연구중심대학육성사업에 340억원, 2단계연구중심대학육성사업에 216억원, 바이오신약‧장기사업에 116억원, 글로벌프론티어사업에 71억원 등을 투자한 것으로 나타났다.
(나) 농림수산식품부‧농촌진흥청‧산림청
농림수산식품부는 농림기술개발사업에 686억원, 수의과학기술개발연구사업에 191억원, 고부가가치식품기술개발사업에 180억원을 투자하였다. 농림․수산 분야에서 가장 많은 투자를 한 농촌진흥청은 농업생명공학기술개발사업(바이오그린21사업)에 458억원, 국책기술개발사업에 452억원, 농업현장실용화기술개발사업에 290억원, 원예시험연구사업에 169억원, 축산생명환경시험연구사업에 121억원, FTA대응경쟁력향상기술개발사업에 111억원 등을 투자한 것으로 나타났다. 한편, 산림청은 국립산림과학원에 363억원을 투자한 것으로 나타났다.
(다) 보건복지가족부‧식품의약품안전청
보건복지가족부는 보건의료기술연구개발사업에 1,275억원을 투자하였고, 임상연구인프라조성사업에 392억원, 국립암연구소운영사업에 434억원, 연구중심병원구축(舊 10대질병극복메디클러스터구축)사업에 225억원, 한-EU FTA 대응을 위한 그린코스메틱연구개발지원사업에 신규로 60억원 등을 투자하였으며, 한의약선도기술개발, 질병관리연구지원, 코호트연구 중심의 유전체실용화사업 등 질환중심의 연구개발에 투자하였다. 식품의약품안전청은 식품등안전관리사업에 가장 많은 금액인 179억원을 투자하였고, 안전성관리기반연구사업에 99억원, 의약품등안전관리사업에 139억원, 유해물질안전관리과학화사업에 신규로 102억원 등을 투자하였다.
(라) 지식경제부‧중소기업청
지식경제부는 바이오의료기기산업원천기술개발사업에 787억원, 지역특화산업육성사업에 523억원, 광역경제권선도산업육성사업에 467억원, 지역전략산업육성사업에 415억원, 한국화학연구원에 174억원, 화학연구원부설안전성평가연구소에 186억원, 한국식품연구원에 89억원 등 BT분야 관련 연구를 지원하였는데, 바이오 연구개발의 제품화 관련 사업(바이오의료기기산업원천기술개발사업 등)을 통해 신약개발 전임상/임상 지원 및 의료기기 개발 지원 등 주로 제품화 연구개발에 투자하였다. 중소기업청은 중소기업기술혁신개발사업에 352억원을 투자하였다.
<표 5> 부처별 사업별 투자현황(2010년)
(단위 : 백만원)
|
부처명 |
사업명 |
BT투자액 |
전체 투자액 |
BT투자액비중(%) |
|
교육과학기술부 |
일반연구자지원 |
148358 |
354936 |
41.8 |
|
미래기반기술개발 |
103355 |
152250 |
67.9 |
|
|
중견연구자지원 |
93367 |
245000 |
38.1 |
|
|
선도연구센터지원 |
57458 |
105200 |
54.6 |
|
|
한국생명공학연구원연구운영비지원 |
55268 |
56675 |
97.5 |
|
|
21세기프론티어연구개발사업 |
47715 |
105200 |
45.4 |
|
|
세계수준의연구중심대학육성(일반-이공계) |
33997 |
116210 |
29.3 |
|
|
리더연구자지원 |
23950 |
50000 |
47.9 |
|
|
2단계연구중심대학육성(0.5) |
21554 |
118500 |
18.2 |
|
|
한국한의학연구원연구운영비지원 |
19962 |
27049 |
73.8 |
|
|
바이오신약장기사업 |
11589 |
12000 |
96.6 |
|
|
글로벌프론티어사업 |
7140 |
15000 |
47.6 |
|
|
미래유망융합기술파이오니어사업 |
6430 |
16000 |
40.2 |
|
|
연구소재지원사업 |
4699 |
5000 |
94 |
|
|
공공복지안전연구사업 |
4049 |
5000 |
81 |
|
|
뇌과학원천기술개발 |
3693 |
4600 |
80.3 |
|
|
해양바이오기초원천기술개발['10신규] |
1826 |
2000 |
91.3 |
|
|
국토해양부 |
해양생명공학기술개발 |
20820 |
25000 |
83.3 |
|
농림수산식품부 |
농림기술개발 |
68621 |
72421 |
94.8 |
|
수산시험연구 |
20141 |
23826 |
84.5 |
|
|
수의과학기술개발연구 |
19139 |
19797 |
96.7 |
|
|
고부가가치식품기술개발['10신규] |
17979 |
18079 |
99.4 |
|
|
농림바이오기술산업화지원 |
6000 |
6000 |
100 |
|
|
농촌진흥청 |
바이오그린21 |
45790 |
47500 |
96.4 |
|
국책기술개발 |
45229 |
60982 |
74.2 |
|
|
국립농업과학원(인건비+기본경비) |
32976 |
32976 |
100 |
|
|
농업현장실용화기술개발 |
29025 |
30737 |
94.4 |
|
|
국립식량과학원(인건비+기본경비) |
24624 |
24624 |
100 |
|
|
국립원예특작과학원(인건비+기본경비) |
23293 |
23293 |
100 |
|
|
국립축산과학원(인건비+기본경비) |
21426 |
21426 |
100 |
|
|
원예시험연구 |
16905 |
17499 |
96.6 |
|
|
축산생명환경시험연구 |
12137 |
13041 |
93.1 |
|
|
FTA대응경쟁력향상기술개발 |
11070 |
11070 |
100 |
|
|
바이오장기생산기술개발 |
3305 |
3325 |
99.4 |
|
|
농업공학연구 |
4922 |
5971 |
82.4 |
|
|
보건복지가족부 |
보건의료기술연구개발 |
127534 |
128127 |
99.5 |
|
국립암연구소운영 |
43350 |
43440 |
99.8 |
|
|
임상연구인프라조성 |
39174 |
39264 |
99.8 |
|
|
연구중심병원구축(舊 10대질병극복메디클러스터구축) |
22500 |
22500 |
100 |
|
|
면역백신개발 |
14416 |
14416 |
100 |
|
|
한의약선도기술개발 |
6804 |
6804 |
100 |
|
|
그린코스메틱연구개발지원['10신규] |
6000 |
6000 |
100 |
|
|
질병관리연구지원 |
4632 |
6800 |
68.1 |
|
|
유전체실용화 |
3956 |
5132 |
77.1 |
|
|
인수공통전염병인체감염대응기술개발 |
3297 |
3560 |
92.6 |
|
|
산림청 |
국립산림과학원(인건비+기본경비+산림과학연구+시험림조성관리) |
36309 |
55611 |
65.3 |
|
식품의약품안전청 |
식품등안전관리 |
17925 |
18275 |
98.1 |
|
의약품등안전관리 |
13900 |
14580 |
95.3 |
|
|
안전성관리기반연구 |
9915 |
9915 |
100 |
|
|
유해물질안전관리과학화['10신규] |
5025 |
5025 |
100 |
|
|
의료기기안전관리 |
3710 |
3780 |
98.1 |
|
|
중소기업청 |
중소기업기술혁신개발 |
35169 |
279700 |
12.6 |
|
지식경제부 |
바이오의료기기산업원천기술개발사업 |
78667 |
92603 |
85 |
|
지역특화산업육성 |
52344 |
109200 |
47.9 |
|
|
광역경제권선도산업육성 |
46713 |
210000 |
22.2 |
|
|
지역전략산업육성 |
41482 |
157488 |
26.3 |
|
|
안전성평가연구소연구운영비지원 |
18636 |
38533 |
48.4 |
|
|
한국화학연구원연구운영비지원 |
17387 |
47249 |
36.8 |
|
|
한국식품연구원연구운영비지원 |
8890 |
26088 |
34.1 |
|
|
QoLT기술개발['10신규] |
1830 |
9000 |
20.3 |
|
|
바이오화학실용화센터건립['10신규] |
500 |
500 |
100 |
|
|
환경부 |
생물자원발굴및분류연구 |
7000 |
7000 |
100 |
|
환경보건조사연구 |
6277 |
6277 |
100 |
|
|
생물자원보전종합대책 |
5999 |
5999 |
100 |
출처: 2010년도 국가연구개발사업 조사‧분석(국가과학기술위원회) 관련 자료에서 산출
2. 인력현황
가. 바이오산업의 인력 현황 및 추이
2009년 12월말 현재 국내 바이오산업에 종사하는 종사자 수는 22,605명으로 전년도 종사자 수 20,547명에 비해 약 10.0%가 증가한 것으로 나타났다.(「2009년도 국내 바이오산업 통계」, 한국바이오협회) 이 중 약 48.2%인 10,884명이 연구직에 종사하고 있으며, 51.8%인 11,721명이 생산직에 종사하고 있다.
연구직 종사자 수의 학력별 구성을 보면, 석사가 47.8%(5,206명)로 가장 많은 비중을 차지하고 있으며 학사(30.3%, 3,298명)와 박사(13.4%, 1,462명)가 그 뒤를 따르고 있다. 생산직 종사자의 비중에서는 학사가 48.6%(5,694명)로 가장 높았으며, 기타가 37.6%(4,403명)를 차자하고 있다.
[그림 ] 바이오산업부문의 연구직 및 생산직 인력 비중(2009년)

출처: 한국바이오협회(2009. 12)
주 1. 연구직은 (바이오산업 연구개발 인력) + (관리직(생물공 전공자))에 해당
2. 생산직은 연구소 이외의 바이오산업에 근무하는 생산직 해당
지난 3년간(’07~’09) 연구직 종사자 수의 추이를 보면, 석사의 경우 2007년 4,818명에서 2009년 5,206명으로 점차 증가하고 있으며, 학사의 경우도 2,870명에서 3,298명으로 증가하고 있다. 반면에 박사인력은 1,472명에서 1,462명으로 거의 정체되어 있음을 알 수 있다. 생산직의 경우 학사가 4,128명에서 5,694명으로 약 31.0% 증가하였으며, 석사나 박사인력은 큰 변화가 없는 것으로 나타났다.
[그림 ] 연구직 인력의 규모 추이(07~09)

출처: 한국바이오협회(2009. 12)
[그림 ] 생산직 인력의 규모 추이(07~09)

출처: 한국바이오협회(2009. 12)
나. 바이오산업의 산업별 인력 현황
바이오산업별 인력구성을 보면 바이오의약산업에 종사하는 인력이 전체 중 41.3%(9,327명)로 가장 많았으며, 그 다음 바이오식품산업 22.2%(5,024명), 바이오화학산업 13.5%(3,055명) 순이었다. 이 세 산업에 종사하는 인력이 17,406명으로 전체 인력의 77.0%를 차지하고 있다.
바이오산업별 연구직 인력은 바이오검정산업 및 기타(82.5%), 바이오전자산업(72.5%)에서 높은 비중을 차지하고 있으며, 생산직 인력은 바이오식품산업(59.7%), 바이오의약산업(54.7%)에서 높은 비중을 나타내고 있음을 알 수 있다.
[그림 ] 바이오산업의 산업별 종사인력 구성

(단위: 명)
출처: 한국바이오협회(2009. 12)
[그림 ] 바이오산업의 산업별 연구직ㆍ생산직 인력 구성

출처: 한국바이오협회(2009. 12)
바이오산업의 산업별 연구직 인력 구성을 보면 바이오의약산업이 4,228명(38.9%)으로 가장 많았으며, 바이오의약산업 내에서는 석사가 2,211명(52.3%)으로 가장 높은 비중을 차지하고 있음을 알 수 있다. 바이오전자산업에서는 연구직 인력이 253명(2.3%)으로 가장 적은 인력을 보유하고 있다.
[그림 ] 바이오산업의 산업별 연구직 인력 구성

(단위: 명)
출처: 한국바이오협회(2009. 12)
바이오산업의 산업별 생산직 인력 구성에서도 바이오의약산업이 5,099명(43.5%)으로 가장 많았으며, 바이오의약산업 내에서는 학사가 2,800명(54.9%)으로 가장 높은 비중을 차지하고 있다. 바이오전자산업의 생산직 인력은 96명(0.8%)으로 바이오산업 내에서 가장 적은 것으로 나타났다.
[그림 ] 바이오산업의 산업별 생산직 인력 구성

(단위: 명)
출처: 한국바이오협회(2009. 12)
3. 특허현황
가. 생명공학 특허개요
생명공학분야에 있어서 특허는 매우 중요한 의미를 갖는다. 막대한 연구개발비가 투입되고, 장기간의 연구개발기간이 소요되며, 일부 분야는 시장진입을 위해 거치는 법적 승인까지 장시간이 소요되는 특성을 가지고 있어 생명공학분야에서 투자회수를 위한 법적장치인 특허의 획득은 매우 중요하다고 할 수 있다.
특허통계정보는 국가와 기업의 연구개발활동의 결과 및 혁신과정의 움직임과 밀접한 연관성을 가지고 있다. 또한, 데이터의 접근이 용이한 특징도 가지고 있다. 그렇기 때문에 특허정보는 연구개발의 성과를 측정하고 국가의 과학기술정책을 수립하는데 있어 기초자료로 중요하게 활용되고 있다.
나. 분석기준
생명공학 분야의 기술분류는 주로 OECD에서 분류한 기준을 토대로 한국특허청의 전문가 집단에서 세분류한 6개 산업, 13개 기술분류, 27개 세분류로 구분하였다.24)
분석대상 국가로는 한국과 세계적 동향을 파악하기 위해 특허를 가장 강하게 보호하고 시장규모도 큰 미국특허를 대상으로 하였으며, 시간적 기준으로 한국은 출원시점으로 2000~2010년까지25)를, 미국특허는 등록기준으로 2000~2010년까지의 특허를 가지고 동향을 파악하였다.
또한, 기술분류는 IPC 8판 기준으로 그간의 누락 데이터를 보완하고 수정하여 최종적으로 데이터 셑을 완성하였다.
표 1 생명공학의 기술분류
|
산업 |
기술분류 |
세분류 |
|
공정 |
생물공정 |
동식물 세포배양장치, 분리정제, 생물학적합성, 효소 미생물관련 장치 |
|
측정진단 |
조사․분석, 측정․시험 |
|
|
생물자원탐색 |
미생물, 바이러스 |
|
|
기초 |
동식물세포배양 |
동식물세포 |
|
효소공학 |
효소 |
|
|
농업 |
유전체 |
당유기함유핵산, 유전공학 |
|
단백질체 |
고정화펩티드, 펩티드, 하이브리드펩티드 |
|
|
식품 |
항체이용 |
면역글로블린 |
|
생물농약 |
생물농약 |
|
|
의약 |
형질전환동식물 |
신규한 동물, 신규한 식물 |
|
발효식품 |
알콜발효 및 장치 |
|
|
환경 |
생물의약 |
단백질치료제, 방사선의약, 신약후보물질, 유전자치료, 치료용 항체 |
|
환경생물공학 |
생물학적 수처리, 슬러지처리 |
다. 한국에 출원된 생명공학 특허건수 동향
한국에 출원한 생명공학분야의 특허출원건수를 살펴보면, 2000년 이후 꾸준히 증가하고 있는 것으로 나타났다. 특히, 2006년~2008년까지는 매년 1,000여건씩 특허출원건수가 증가하였으나, 2009년에는 전년대비 약 2,000여건의 특허출원건수가 감소하여 2006년 수준으로 회귀한 것으로 나타났다.
세부기술별로는, 측정진단의 조사․분석과 측정․시험분야의 특허출원건수가 꾸준히 늘고 있으며, 유전체의 유전공학, 단백질체의 펩티드, 생물자원탐색의 미생물, 의약분야의 치료용 항체와 단백질치료제 등도 특허출원건수가 많은 분야로 나타나고 있다.
2005년까지 가장 많은 특허출원을 보였던 신약후보물질분야는 2004년을 정점으로 점차 감소하여 2009년에는 97건만이 출원된 것으로 나타났다. 2009년에는 전 세부기술분야에서 특허출원건수가 감소하고 있음을 보여주고 있다.
표 2 한국에 출원한 생명공학분야의 기술분류별 연도별 특허출원건수
|
기술분류 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
2009 |
2010 |
||
|
공 정 |
생물 공정 |
분리정제 |
1 |
0 |
0 |
2 |
0 |
1 |
0 |
0 |
1 |
3 |
0 |
|
생물학적합성 |
135 |
130 |
134 |
152 |
106 |
101 |
95 |
189 |
212 |
172 |
13 |
||
|
동식물세포 배양장치 |
5 |
6 |
10 |
8 |
16 |
16 |
39 |
30 |
40 |
28 |
5 |
||
|
효소,미생물관련장치 |
38 |
34 |
37 |
23 |
38 |
47 |
78 |
84 |
110 |
76 |
12 |
||
|
측정 진단 |
조사,분석 |
67 |
96 |
118 |
155 |
154 |
153 |
237 |
301 |
391 |
314 |
24 |
|
|
측정,시험 |
137 |
227 |
240 |
281 |
289 |
399 |
327 |
472 |
381 |
345 |
38 |
||
|
기 초 |
유전체 |
유전공학 |
398 |
384 |
322 |
332 |
394 |
428 |
459 |
618 |
820 |
461 |
34 |
|
당류기함유 핵산 |
45 |
39 |
50 |
37 |
29 |
47 |
35 |
39 |
46 |
23 |
0 |
||
|
단백질체 |
펩티드 |
240 |
251 |
231 |
213 |
274 |
258 |
348 |
403 |
468 |
249 |
16 |
|
|
고정화펩티드 |
3 |
1 |
0 |
0 |
0 |
3 |
3 |
9 |
7 |
6 |
2 |
||
|
하이브리드 펩티드 |
10 |
18 |
24 |
39 |
19 |
24 |
29 |
46 |
62 |
51 |
7 |
||
|
항체 이용 |
면역글로불린 |
47 |
50 |
58 |
72 |
91 |
93 |
141 |
188 |
386 |
174 |
5 |
|
|
효소 공학 |
효소 |
70 |
82 |
90 |
77 |
75 |
75 |
107 |
109 |
138 |
117 |
12 |
|
|
생물자원탐색 |
미생물 |
197 |
189 |
219 |
213 |
192 |
211 |
288 |
247 |
291 |
243 |
27 |
|
|
바이러스 |
24 |
23 |
23 |
15 |
16 |
21 |
15 |
25 |
36 |
23 |
0 |
||
|
동식물세포배양 |
동식물세포 |
40 |
48 |
70 |
68 |
127 |
129 |
184 |
199 |
267 |
149 |
24 |
|
|
농 업 |
생물농약개발 |
생물농약 |
29 |
47 |
40 |
38 |
52 |
78 |
84 |
93 |
70 |
92 |
9 |
|
형질전환동식물개발 |
신규한동물 |
20 |
14 |
25 |
28 |
30 |
36 |
33 |
41 |
33 |
32 |
7 |
|
|
신규한식물 |
34 |
46 |
58 |
69 |
35 |
51 |
44 |
51 |
74 |
55 |
11 |
||
|
식 품 |
발효식품개발 |
알코올발효 및 장치 |
82 |
118 |
108 |
87 |
83 |
102 |
149 |
166 |
169 |
158 |
37 |
|
의 약 |
생물의약개발 |
방사선의약 |
4 |
13 |
6 |
11 |
8 |
14 |
11 |
17 |
14 |
5 |
0 |
|
유전자치료 |
22 |
24 |
18 |
15 |
24 |
28 |
20 |
35 |
38 |
23 |
1 |
||
|
치료용항체 |
76 |
106 |
107 |
108 |
88 |
116 |
134 |
244 |
332 |
150 |
5 |
||
|
단백질치료제 |
112 |
143 |
116 |
134 |
163 |
178 |
204 |
282 |
448 |
191 |
11 |
||
|
신약후보물질 |
314 |
365 |
394 |
465 |
486 |
57 |
104 |
101 |
163 |
97 |
9 |
||
|
환 경 |
환경생물공학 |
슬러지처리 |
9 |
12 |
9 |
18 |
5 |
10 |
17 |
25 |
62 |
51 |
26 |
|
생물학적 수처리 |
193 |
251 |
222 |
210 |
188 |
217 |
230 |
259 |
273 |
207 |
97 |
||
|
계 |
2352 |
2717 |
2729 |
2870 |
2982 |
2893 |
3415 |
4273 |
5332 |
3495 |
432 |
||
라. 한국에 출원된 생명공학 특허의 상위 10대 다출원 국가현황
생명공학특허의 상위 10대 출원국가의 2000년 이후 누적출원건수를 살펴보면, 한국이 19,281건으로 전체 생명공학특허의 57.6%를 차지하고 있으며, 그 다음으로 미국이 5,524(16.5%) 일본이 2,837(8.5%), 독일이 1148(3.4%) 순으로 나타났다. 상위 10대 출원국가의 특허출원점유율은 전체 생명공학 국내특허의 94.1%를 차지하고 있는 것으로 나타났다.
국내 전체특허에서 한국이 차지하는 비율은 약 74.4%를 차지하고 있는데 반해 생명공학 특허에서는 57.6%를 차지하고 있어 외국의 국내특허출원 점유율이 높은 분야로 나타났다.
마. 한국특허로 본 생명공학분야 중 기초산업의 선두주자
2006년~2010년까지 생명공학 분야 중 기초산업의 기술 분류별 Top3를 조사한 결과, 단백질체와 생물자원탐색, 효소공학기술은 한국생명공학연구원이 가장 많은 특허출원건수를 보이는 것으로 나타났다. 서울대학교는 동식물세포배양기술에선 54건으로 가장많은 특허출원건수를 보였고, 단백질체기술에서도 42건의 특허를 출원하고 있는 것으로 나타났다. 항체이용기술은 외국기업들이 Top 3 모두를 차지하고 있는 것으로 조사되었다. 제넨테크(코)가 79건, 에프호프만라로슈(AG)가 36건, 메다렉스(코)가 25건 순으로 나타났다.
표 3 한국특허의 생명공학 분야 기초산업의 연구개발 리더
|
세부기술 |
출원인 |
국적 |
건수 |
|
단백질체기술 |
한국생명공학연구원 |
KR |
55 |
|
서울대학교 |
KR |
42 |
|
|
에프호프만라로슈(AG) |
CH |
31 |
|
|
동식물세포배양기술 |
서울대학교 |
KR |
54 |
|
고려대학교 |
KR |
20 |
|
|
전남대학교 |
KR |
12 |
|
|
한국생명공학연구원 |
KR |
12 |
|
|
생물자원탐색기술 |
한국생명공학연구원 |
KR |
62 |
|
CJ제일제당 |
KR |
46 |
|
|
CJ |
KR |
32 |
|
|
항체이용기술 |
제넨테크 (코) |
US |
79 |
|
에프호프만라로슈(AG) |
CH |
36 |
|
|
메다렉스 (코) |
US |
25 |
|
|
효소공학기술 |
한국생명공학연구원 |
KR |
27 |
|
다니스코 유에스 인크. |
US |
25 |
|
|
한국해양연구원 |
KR |
17 |
바. 미국에 등록된 생명공학특허건수 동향
미국의 생명공학특허는 1990년대 중반이후 급성장, 2000년대 중반 조정기를 거쳐 2006년 이후 안정기를 거치고 있는 것으로 요약되어진다.
세부기술별로 살펴보면, 한국의 특허출원동향과 유사하게 측정진단의 조사・분석, 측정・시험, 의약의 단백질치료제, 치료용 항체, 유전체의 유전공학 등의 특허등록건수가 많은 것으로 나타났다. 또한, 의약의 신약후보물질분야는 한국특허출원동향과 마찬가지로 2002년 257건이 등록된 이후로 2008년 44건, 2009년 52건 등으로 급격한 감소를 보이고 있다.
한국의 특허출원 동향과 차이점은 한국에 특허출원이 적은 유전체의 당류기함유핵산분야와 형질전환동식물개발의 신규한 식물과 관련된 특허등록건수가 매우 많음을 보이고 있고, 환경생물공학의 생물학적 수처리 분야는 특허등록건수가 그다지 많지 않음을 보여주고 있다.
표 4 미국에 등록된 생명공학분야의 기술분류별 연도별 특허등록건수
|
기술분류 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
2009 |
2010 |
||
|
공 정 |
생물 공정 |
분리정제 |
17 |
20 |
10 |
14 |
8 |
4 |
7 |
4 |
2 |
0 |
4 |
|
생물학적합성 |
526 |
614 |
551 |
470 |
403 |
377 |
518 |
481 |
417 |
483 |
568 |
||
|
동식물세포배양장치 |
37 |
16 |
18 |
17 |
5 |
11 |
18 |
16 |
21 |
15 |
32 |
||
|
효소,미생물관련장치 |
59 |
116 |
134 |
131 |
107 |
85 |
81 |
94 |
136 |
143 |
261 |
||
|
측정 진단 |
조사,분석 |
465 |
544 |
512 |
490 |
457 |
372 |
539 |
535 |
529 |
546 |
876 |
|
|
측정,시험 |
1087 |
1332 |
1125 |
981 |
876 |
732 |
878 |
894 |
827 |
834 |
1099 |
||
|
기 초 |
유전체 |
유전공학 |
615 |
645 |
495 |
478 |
456 |
361 |
585 |
581 |
392 |
458 |
601 |
|
당류기함유핵산 |
427 |
433 |
489 |
399 |
346 |
316 |
427 |
407 |
434 |
483 |
590 |
||
|
단백질체 |
펩티드 |
403 |
426 |
423 |
373 |
312 |
306 |
446 |
544 |
555 |
453 |
452 |
|
|
고정화 펩티드 |
9 |
14 |
19 |
15 |
23 |
14 |
18 |
10 |
12 |
16 |
8 |
||
|
하이브리드펩티드 |
10 |
6 |
5 |
4 |
2 |
3 |
3 |
3 |
2 |
5 |
5 |
||
|
항체 이용 |
면역글로불린 |
94 |
112 |
104 |
110 |
106 |
101 |
184 |
211 |
213 |
183 |
240 |
|
|
효소 공학 |
효소 |
373 |
417 |
428 |
366 |
310 |
284 |
375 |
325 |
259 |
235 |
274 |
|
|
생물자원탐색 |
미생물 |
140 |
157 |
123 |
135 |
103 |
107 |
135 |
125 |
120 |
104 |
151 |
|
|
바이러스 |
41 |
35 |
53 |
30 |
31 |
23 |
35 |
33 |
39 |
47 |
27 |
||
|
동식물세포배양 |
동식물세포 |
278 |
283 |
257 |
238 |
200 |
180 |
216 |
202 |
186 |
206 |
268 |
|
|
농 업 |
생물농약개발 |
생물농약 |
131 |
159 |
153 |
133 |
115 |
79 |
105 |
130 |
115 |
106 |
134 |
|
형질전환동식물개발 |
신규한동물 |
21 |
56 |
51 |
51 |
35 |
26 |
59 |
50 |
55 |
43 |
50 |
|
|
신규한식물 |
909 |
911 |
1411 |
1226 |
1333 |
1020 |
1547 |
1534 |
1720 |
1591 |
1643 |
||
|
식 품 |
발효식품개발 |
알코올발효 및 장치 |
18 |
16 |
10 |
19 |
21 |
15 |
26 |
18 |
11 |
8 |
10 |
|
의 약 |
생물의약개발 |
방사선의약 |
82 |
79 |
53 |
65 |
48 |
36 |
43 |
44 |
47 |
44 |
61 |
|
유전자치료 |
114 |
96 |
86 |
73 |
71 |
56 |
70 |
72 |
38 |
55 |
99 |
||
|
치료용항체 |
483 |
504 |
482 |
470 |
396 |
323 |
511 |
496 |
561 |
679 |
857 |
||
|
단백질치료제 |
672 |
644 |
547 |
538 |
528 |
524 |
707 |
653 |
660 |
724 |
995 |
||
|
신약후보물질 |
146 |
203 |
257 |
245 |
197 |
199 |
179 |
56 |
44 |
52 |
84 |
||
|
환 경
|
환경생물공학 |
슬러지처리 |
1 |
1 |
0 |
2 |
1 |
2 |
0 |
1 |
2 |
5 |
4 |
|
생물학적 수처리 |
113 |
110 |
97 |
96 |
121 |
115 |
117 |
152 |
150 |
140 |
142 |
||
|
계 |
7271 |
7949 |
7893 |
7169 |
6611 |
5671 |
7829 |
7671 |
7547 |
7658 |
9535 |
||
사. 미국에 등록된 생명공학특허의 상위 10대 다등록 국가현황
미국에 등록된 특허의 상위 10대 다등록 국가의 특허건수는 전체 미국등록특허건수의 91.6%를 차지하고 있다.
생명공학 등록특허에서 미국은 52,306건으로 63.2%를 차지하고 있으며, 그 다음으로 일본이 5,854건으로 7.1%, 독일이 4,195건으로 5.1% 순으로 나타났다. 한국은 다등록 순위 11위이며 특허건수는 523건(0.6%)를 차지하고 있는 것으로 조사되었다.
아. 미국특허의 생명공학분야 기초산업의 연구개발 리더
2006년~2010년 동안 생명공학분야 중 기초산업의 기술분류별 Top 3를 조사한 결과, 단백질체기술과 항체이용기술에서는 Genentech Inc가 각각 272건, 57건으로 가장 많은 등록건수를 보유하고 있는 것으로 나타났으며, 동식물세포배양기술에서는 Wisconsin Alumni Research Foundation이 21건, 효소공학기술에서는 Novozimes A/S가 92건, 생물자원탐색기술에서는 E I Dupont de Nemours & Co가 27건의 특허를 보유하고 있는 것으로 나타났다.
표 1 미국특허의 생명공학 분야 기초산업의 연구개발 리더
|
세부기술 |
출원인 |
국적 |
건수 |
|
단백질체기술 |
Genentech Inc |
US |
272 |
|
ZymoGenetics, Inc. |
US |
60 |
|
|
University of California |
US |
46 |
|
|
동식물세포배양기술 |
Wisconsin Alumni Research Foundation |
US |
21 |
|
University of California |
US |
18 |
|
|
Pioneer Hi-Bred Int'l, Inc. |
US |
17 |
|
|
생물자원탐색기술 |
E I DuPont de Nemours & Co |
US |
27 |
|
Ajinomoto Co Inc |
JP |
22 |
|
|
Genentech Inc |
US |
16 |
|
|
항체이용기술 |
Genentech Inc |
US |
206 |
|
Human Genome Sciences, Inc. |
US |
57 |
|
|
Amgen Inc. |
US |
27 |
|
|
효소공학기술 |
Novozymes A/S |
DK |
92 |
|
Genencor International Inc |
US |
52 |
|
|
Applera Corporation |
US |
37 |
4. 논문현황
가. 논문 개요
인간이 행하는 연구와 개발의 목적에는 자연현상에 관한 인과관계나 법칙을 탐구하는 면과 그 현상이나 법칙성을 인간사회에 이용하는 기술을 확립하는 두 가지의 측면이 있다. 전자의 성과는 논문으로 나타나는 것이 많으며 또한 후자의 활동에서 생성되어진 경험이나 지식이 논문의 형태로 나타나는 경우도 있다. 논문으로 발표되는 연구개발 성과는 인류의 지적 공유재산이 된다. 따라서 논문에 관한 지표는 연구개발 성과의 수준과 인류의 과학기술 지식에의 공헌하는 것이기도 하다.
과학기술의 논문에 관한 지표를 작성할 때 직접 방대한 수의 논문지로부터 산출하는 것은 어렵기 때문에 문헌 데이터베이스를 사용한다. 국제적으로 SCI 데이터베이스(Science Citation Index Database, 이하 SCI라 표시함.)를 많이 활용하는데 이는 과학기술 전반을 대상으로 하고 있으며, 논문의 인용정보를 얻을 수 있고 수록대상 저널의 선정기준을 엄격하게 하고 있는 점이 타 데이터베이스에 비해 우수하다고 할 수 있다. 논문현황자료는 SCI에 근거한 Thomson Reuters의 NSI(National Science Indicators, 1981-2010)를 기반으로 지표를 산출했다.
나. 분석기준
SCI 과학기술 18개 분야 중 생명과학분야인 6개 분야를 대상으로 하고, 한국과 세계평균을 2001년에서 2010년까지 10년을 비교하였다. 국가간 비교에는 세계 논문수 상위 10개국과 BRICs국가(브라질, 러시아, 인도, 중국)를 대상으로 조사하였다.
다. 논문현황
2010년 SCI 세계논문수는 118만 761편이며 우리나라 논문수는 세계논문수의 3.37%인 39,843편으로 세계 순위는 11위를 차지했다.
<표 3-2-4-1> 최근 10년간 우리나라 논문 발표수 추이
|
연 도 |
2001년 |
2002년 |
2003년 |
2004년 |
2005년 |
|
논문발표수(편) |
15,896 |
17,101 |
21,111 |
22,684 |
27,809 |
|
세계 총 논문수(편) |
797,067 |
798,006 |
876,004 |
855,475 |
983,100 |
|
세계 점유율(%) |
1.99 |
2.14 |
2.41 |
2.65 |
2.83 |
|
세계 순위 |
15 |
14 |
14 |
12 |
11 |
|
연 도 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
|
논문발표수(편) |
28,430 |
27,407 |
35,624 |
38,647 |
39,843 |
|
세계 총 논문수(편) |
984,541 |
985,692 |
1,166,488 |
1,191,376 |
1,180,761 |
|
세계 점유율(%) |
2.89 |
2.78 |
3.05 |
3.24 |
3.37 |
|
세계 순위 |
11 |
12 |
12 |
11 |
11 |
최근 5년간 우리나라가 발표한 논문 169,951편 중 1회 이상 인용된 논문은 99,768편으로 논문의 피인용 비율은 59%이고, 5년간 논문의 총 피인용 횟수는 606,425회로 논문 1편당 평균 피인용 횟수는 3.57회로 세계평균(4.79회)의 75% 수준이나 연도별 피인용 횟수를 보면 연도가 누적됨에 따라 피인용도가 높아지는 성향을 보이고 있다.
우리나라 논문의 5년 주기별 1편당 평균 피인용 횟수는 낮은 수준이나 세계전체 평균보다 빠른 속도로 증가하고 있어 논문의 질적인 측면도 향상되고 있음을 보여주고 있다.
<표 3-2-4-2> 5년 주기별 논문 1편당 평균 피인용횟수 현황
(단위: 회)
|
국가명 |
'01-'05 |
'02-'06 |
'03-'07 |
'04-'08 |
'05-'09 |
'06-'10 |
|
한 국 |
2.79 |
2.93 |
3.11 |
3.29 |
3.48 |
3.57 |
|
세계 전체 평균 |
4.31 |
4.4 |
4.52 |
4.63 |
4.78 |
4.79 |
<그림 3-2-4-1> 한국과 세계의 논문 1편당 평균 피인용횟수 현황
다. 생명공학분야 논문수
SCI 과학기술 18개 분야 중 최근 5년간(2006~2010) 우리나라가 발표한 생명공학 6개 분야의 논문현황은 다음과 같다.
<표 3-2-4-3> 최근 5년간 생명공학분야 논문수 점유율
|
분야명 |
분야 논문수 |
분야 논문수 세계순위 |
국내 점유율 |
우리나라 총 논문수 |
세계 점유율 |
세계 분야 총 논문수 |
|
면역학 |
1,242 |
15 |
0.73% |
169,951 |
1.94% |
64,054 |
|
미생물학 |
3,912 |
8 |
2.30% |
169,951 |
4.29% |
91,155 |
|
분자생물학 & 유전학 |
3,533 |
13 |
2.08% |
169,951 |
2.34% |
150,909 |
|
생물학 & 생화학 |
8,844 |
11 |
5.20% |
169,951 |
3.07% |
287,663 |
|
신경과학 & 행동과학 |
2,843 |
15 |
1.67% |
169,951 |
1.81% |
157,138 |
|
약리학 |
4,831 |
8 |
2.84% |
169,951 |
4.59% |
105,338 |
생명공학 6개 분야 중 2개 분야(약리학, 미생물학)에서 세계 상위 10위권에 포함되는 등 최근 들어 생명공학 분야 논문의 세계 점유율이 크게 증가하였다.
최근 5년간 국가별 생명공학분야 논문수를 보면 미국이 6개 분야 모두 월등히 앞서며 영국, 일본, 독일, 중국 순으로 뒤를 이었고, BRICs국가(브라질, 러시아, 인도, 중국)는 우리나라와 비슷한 수치를 보였다.
<그림 3-2-4-2> 최근 5년간 국가별 생명공학분야 논문수 현황
우리나라 생명공학분야 SCI 발표 논문수는 1990년에는 6개 분야 합이 112편에 불과하였으나, 2001년에는 면역학(132편)이 44배, 미생물학(370편)이 41배, 분자생물학&유전학(248편)이 31배, 생물학&생화학(946편)이 14배, 신경과학&행동과학(272편)이 45배, 약리학(363편)이 23배로 급속한 성장세를 보였다. 2010년에는 10년 전과 비교하여 면역학(332편)이 2.5배, 미생물학(797편)이 2.2배, 분자생물학&유전학(816편)이 3.3배, 생물학&생화학(2,038편)이 2.2배, 신경과학&행동과학(665편)이 2.4배, 약리학(1,107편)이 3.0배 늘었다.
<표 3-2-4-4> 최근 10년간 우리나라 연도별 생명공학분야 논문현황
|
분야명 |
구분 |
2001년 |
2002년 |
2003년 |
2004년 |
2005년 |
|
면역학 |
논문수 |
132 |
120 |
132 |
174 |
177 |
|
피인용수 |
2,463 |
2,158 |
2,603 |
3,531 |
2,691 |
|
|
편당 평균 |
(18.66) |
(17.98) |
(19.72) |
(20.29) |
(15.20) |
|
|
미생물학 |
논문수 |
370 |
411 |
454 |
495 |
614 |
|
피인용수 |
4,558 |
4,878 |
5,365 |
5,459 |
6,355 |
|
|
편당 평균 |
(12.32) |
(11.87) |
(11.82) |
(11.03) |
(10.35) |
|
|
분자생물학 & 유전학 |
논문수 |
248 |
258 |
324 |
371 |
493 |
|
피인용수 |
6,206 |
6,217 |
7,644 |
7,900 |
8,951 |
|
|
편당 평균 |
(25.02) |
(24.10) |
(23.59) |
(21.29) |
(18.16) |
|
|
생물학 & 생화학 |
논문수 |
946 |
1,093 |
1,186 |
1,311 |
1,553 |
|
피인용수 |
17,390 |
21,256 |
21,708 |
20,492 |
22,269 |
|
|
편당 평균 |
(18.38) |
(19.45) |
(18.30) |
(15.63) |
(14.34) |
|
|
신경과학 & 행동과학 |
논문수 |
272 |
303 |
389 |
412 |
480 |
|
피인용수 |
6,075 |
6,027 |
7,074 |
6,828 |
8,095 |
|
|
편당 평균 |
(22.33) |
(19.89) |
(18.19) |
(16.57) |
(16.86) |
|
|
약리학 |
논문수 |
363 |
438 |
602 |
644 |
812 |
|
피인용수 |
6,141 |
6,618 |
8,107 |
7,756 |
8,043 |
|
|
편당 평균 |
(16.92) |
(15.11) |
(13.47) |
(12.04) |
(9.91) |
|
분야명 |
구분 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
|
면역학 |
논문수 |
198 |
211 |
237 |
264 |
332 |
|
피인용수 |
2,644 |
2,792 |
2,542 |
833 |
196 |
|
|
편당 평균 |
(13.35) |
(13.23) |
(10.73) |
(3.16) |
(0.59) |
|
|
미생물학 |
논문수 |
707 |
727 |
895 |
786 |
797 |
|
피인용수 |
5,695 |
4,693 |
3,374 |
1,595 |
250 |
|
|
편당 평균 |
(8.06) |
(6.46) |
(3.77) |
(2.03) |
(0.31) |
|
|
분자생물학 & 유전학 |
논문수 |
508 |
544 |
837 |
828 |
816 |
|
피인용수 |
8,533 |
5,975 |
5,699 |
3,203 |
455 |
|
|
편당 평균 |
(16.80) |
(10.98) |
(6.81) |
(3.87) |
(0.56) |
|
|
생물학 & 생화학 |
논문수 |
1,557 |
1,515 |
1,840 |
1,894 |
2,038 |
|
피인용수 |
16,717 |
12,809 |
10,094 |
4,669 |
844 |
|
|
편당 평균 |
(10.74) |
(8.45) |
(5.49) |
(2.47) |
(0.41) |
|
|
신경과학 & 행동과학 |
논문수 |
445 |
500 |
596 |
637 |
665 |
|
피인용수 |
5,500 |
5,034 |
3,644 |
1,616 |
265 |
|
|
편당 평균 |
(12.36) |
(10.07) |
(6.11) |
(2.54) |
(0.40) |
|
|
약리학 |
논문수 |
715 |
881 |
1,034 |
1,094 |
1,107 |
|
피인용수 |
6,736 |
5,911 |
4,974 |
2,446 |
303 |
|
|
편당 평균 |
(9.42) |
(6.71) |
(4.81) |
(2.24) |
(0.27) |
※ 연도별 피인용수는 논문발표시점부터 2010년말까지 피인용된 누계임.
※ 분야별 편당 평균 = 피인용수 ÷ 논문수
<그림 3-2-4-3> 우리나라 연도별 생명공학분야 발표논문수 추이
라. 생명공학분야 피인용도
최근 5년간 생물학&생화학 분야 발표논문 8,844편 중 1회 이상 인용된 논문은 6,426편으로 논문의 피인용율은 72.66%로, 국내평균 피인용율(58.70%)의 1.24배이며, 면역학은 72.06%로 1.23배, 신경과학&행동과학은 71.90%로 1.22배, 분자생물학&유전학은 70.87%로 1.21배, 약리학 67.87%로 국내평균의 1.20배이고, 면역학, 약리학, 분자생물학&유전학, 신경과학&행동과학 등 4개 분야에서 동분야 세계대비 비율 수치에 근접하게 나타났다.
<표 3-2-4-5> 최근 5년간 생명공학분야 논문 피인용율
|
분야명 |
피인용율 |
피인용된 논문수 |
분야 논문수 |
세계대비 비율 |
세계분야 평균 피인용율 |
|
면역학 |
72.06% |
895 |
1,242 |
0.96 |
75.08% |
|
미생물학 |
70.53% |
2,759 |
3,912 |
0.88 |
80.17% |
|
분자생물학 & 유전학 |
70.87% |
2,504 |
3,533 |
0.95 |
74.61% |
|
생물학 & 생화학 |
72.66% |
6,426 |
8,844 |
0.92 |
79.12% |
|
신경과학 & 행동과학 |
71.90% |
2,044 |
2,843 |
0.94 |
76.78% |
|
약리학 |
67.87% |
3,279 |
4,831 |
0.96 |
70.40% |
최근 5년간 생명공학분야 발표논문에 대한 피인용 현황을 보면 평균 피인용지수는 국내평균지수(3.57)에 비해 분자생물학&유전학가 3.1배 등 6개 분야 모두 높게 나타났다. 또한 같은 분야 세계대비 비율은 매우 저조하지만 지식구조에 있어서 2001∼2005년의 세계 평균 대비 국내 피인용수에 비해 2006∼2010년 사이에 우리나라 지식구조가 세계와 유사한 경향으로 개선되고 있음을 알 수 있다.
<그림 3-2-4-4> 생명공학분야의 한국과 세계의 논문 1편당 피인용수 비교
* ( )안의 피인용수는 세계 분야 평균임.
⇓
* ( )안의 피인용수는 세계 분야 평균임.
<표 3-2-4-6> BT분야 한국 및 세계의 논문 피인용 추세 상대 비교
|
분야명 |
1998-2001 |
2002-2005 |
2006-2010 |
|||
|
국내평균 (IF) |
세계평균 (IF) |
국내평균 (IF) |
세계평균 (IF) |
국내평균 (IF) |
세계평균 (IF) |
|
|
면역학 |
21.18(3) |
45.23(2) |
18.21(2) |
34.69(2) |
7.25(1) |
11.59(2) |
|
미생물학 |
12.44(6) |
34.30(5) |
11.17(6) |
25.66(5) |
3.99(6) |
7.83(5) |
|
분자생물학 & 유전학 |
24.33(2) |
54.29(1) |
21.24(1) |
39.42(1) |
6.75(2) |
12.61(1) |
|
생물학 & 생화학 |
18.02(4) |
35.48(4) |
16.67(4) |
26.07(4) |
5.10(4) |
8.23(4) |
|
신경과학 & 행동과학 |
24.60(1) |
41.35(3) |
17.69(3) |
29.47(3) |
5.65(3) |
9.21(3) |
|
약리학 |
16.41(5) |
23.73(6) |
12.23(5) |
19.28(6) |
4.22(5) |
6.19(6) |
※ 세계평균 : SCIE 상위 10개국과 BRICs(브라질, 러시아, 인도, 중국) 전체 평균
생명공학분야의 5년 주기별 평균 피인용횟수를 보면 면역학, 미생물학, 신경과학&행동과학, 약리학은 빠른 속도로 증가하고 있음을 볼 수 있다.
<표 3-2-4-7> 5년 주기별 생명공학분야 평균 피인용횟수 현황
(단위: 회)
|
국가명 |
'01-'05 |
'02-'06 |
'03-'07 |
'04-'08 |
'05-'09 |
'06-'10 |
|
면역학 |
4.79 |
5.14 |
5.80 |
6.50 |
6.80 |
7.25 |
|
미생물학 |
2.98 |
3.24 |
3.49 |
3.71 |
3.94 |
3.99 |
|
분자생물학 & 유전학 |
5.83 |
5.97 |
6.52 |
6.44 |
6.72 |
6.75 |
|
생물학 & 생화학 |
4.47 |
4.82 |
5.01 |
5.17 |
5.33 |
5.10 |
|
신경과학 & 행동과학 |
4.67 |
4.93 |
5.33 |
5.64 |
6.01 |
5.65 |
|
약리학 |
2.79 |
3.11 |
3.28 |
3.56 |
3.87 |
4.22 |
<그림 3-2-4-5> 5년 주기별 생명공학분야 평균 피인용횟수 추이
제4장 분야별 연구개발 및 관련산업 현황
제1절 생명과학 분야
1. 유전체연구
가. 유전체연구의 개요
유전체연구(Genomics)란, 한 개체 내에 존재하는 유전자(Gene)들의 총합체인 유전체(Genome) 및 관련정보를 종합적․체계적으로 분석(-omics)하는 연구 분야이다. 따라서 생명체, 조직 또는 세포내의 유전체를 DNA (genotype), mRNA, 단백질, 대사체 수준으로 연구하는 구조유전체학(structural genomics), 발현체학(transcriptomics), 단백체학(proteomics), 대사체학(metabolomics) 등으로 구분 지을 수 있다.
1990년대 말부터 미국을 중심으로 시작된 유전체연구는 모델생물의 전체 유전체 해독연구 (genome sequencing project)를 기점으로 시작되어 2000년대 초반부터 완성된 유전체 정보가 제공되며 눈부시게 발전되어오고 있다. 현재, 유전체연구는 생명공학연구의 패러다임을 변화시키며 보건의료, 환경, 에너지, 화학, 농식품 등 광범위한 분야에서 활용중이며 산업은 물론 국민의 삶의 질 제고에도 막대한 파급 효과를 줄 것으로 기대되어지고 있다.
(1) 유전체 염기서열 고속해독기술 개발 가속화
2003년 한사람의 유전체 염기서열을 해독하는 데에 27억불/13년이 소요되었으나, 2007년부터 본격적으로 도입된 차세대염기서열해독 (NGS: Next Generation Sequencing) 기술의 발달로 유전체 해독 비용과 시간이 획기적으로 감소하여 2014년경에는 한사람 염기서열해독에 불과 1,000불(백만원)/1시간이 소요될 것으로 전망하고 있다. 반면, 결정된 유전체 염기서열 정보의 2차 분석 비용이 급격히 상승될 것으로 예측하고 있다(그림 1).
(Nature Apr. 2010)

NGS 기술을 이용한 유전체 연구를 통해 촉진될 수 있는 연구개발 분야의 다양화와 사업화를 통한 고부가가치 창출 가능 영역이 확대되고, 개인유전체를 이용한 맞춤형 의료 서비스 시장과 맞춤형 바이오 의약품 시장의 급속한 발달이 예상되고 있다. 이와 관련한 유전체 관련 세계 시장 규모는 2015년 기준 약 200억 달러로 예상하고 있으며, 유전체 염기서열 장비 시장 규모는 2010년 말 기준 약 1,100대 이상의 NGS 보급으로 6억 달러 시장을 형성하고 있어, 연평균 25%의 성장률을 감안하면 2015년에는 3,000대 이상이 보급되어 약 20억 달러의 시장을 형성할 것으로 예상하고 있다.
(2) 유전체 염기서열 분석 기술의 발달
장비의 발달과 더불어 장비에서 생산되어 나오는 엄청난 양의 정보를 처리하기 위한 분석기술도 비약적인 발전을 거듭하고 있다. 최근 개발되어 나오는 염기서열 해독 장비들은 DNA methylation, SNP, microsatellite 분석, linkage mapping, DNA fingerprinting, 유전자 발현조절연구 등 다양한 분야에 적용이 가능한 형태의 정보를 제공해 주고 있다. 이러한 정보를 분석하기 위한 정보 분석 서비스 시장의 규모는 연평균 25% 성장률을 감안하면 총 86억 달러에 달할 것으로 예상하고 있다(그림 2).
그림 5. 생명정보 분석 시장 규모
(Business Insights, 2009)
그림 6. 연구 분야별 유전체 분석 시장 규모
(Business Insights, 2009)


2010년 기준 개인유전체 시장은 상대적으로 작은 시장 규모를 차지하고 있으나 매년 97.4%의 연평균 성장률을 보여, 2015년에는 4.64억 달러 시장을 형성할 것으로 예상하고 있다. 또한 유전체에 기반한 신약 개발 시장 분야가 2015년에 8,7억 달러 시장을 형성할 것으로 보여 연구 개발 분야에서 가장 큰 비중을 자치할 것으로 예상하고 있다(그림 3).
나. 해외 동향
주요 선진국(미국, 영국, 캐나다, 일본 등)은 유전체 연구의 국가 역량결집을 위해 중장기 계획을 수립하고, 대형 유전체 연구 거점을 중심으로 전략적 투자를 확대하고 있다. 미국은 NIH, JGI를 중심으로, 일본은 유전체연구의 3대 추진 방향으로 시스템유전체, 의학유전체, 환경유전체를 제시(종합과학기술회의, 2010년)하고, RIKEN 유전체과학센터(GSC) 등 연구거점을 중심으로 집중적으로 지원하고 있다. 최근 들어 중국은 BGI를 세계 유전체 염기서열 결정 시장의 50%를 점유할 정도의 거대 조직으로 키워 집중 지원하고 있다.
2011년 8월 22일 현재, Genomes Online Database v3.0에 등록되어 있는 유전체연구 생물은 11,448종으로 1,876종은 이미 완료가 되었고 나머지는 진행 중이다. 이들 중 미생물에 대한 유전체 연구가 80% 이상을 차지하고 있고 동물은 15% 정도로 식물에 대한 연구가 상대적으로 부족한 실정이다(그림 4).
현재, NGS 기술을 기반으로 한 대형 국제컨소시엄은 1,000 Genome Project(미국, 영국, 중국, 2,500명), ICGC(International Cancer Genome Consortium, 10개국, 25,000개 암 조직) 등이 있으며, UK 10K Project(영국 생어연구소), ClinSeq Project(미국 NHGRI), 1,000 유전질환 유전체 프로젝트, 1,000 병원성 균주 유전체 프로젝트, 10,000 미생물 유전체 프로젝트(중국 BGI) 등이 있으며, 개별 국가 혹은 단일 기관 차원의 대형 프로젝트도 활발하게 진행 중이다.
다. 국내 현황 국내는 교육과학기술부(21C 프론티어기술개발사업 등), 농림수산식품부(차세대 바이오그린 21 사업 등), 보건복지부(질환유전체연구, 유전체 실용화 사업 등) 등 여러 부처에서 유전체연구에 투자를 하고 있으나 기능연구에 편중 투자되고 있어 유전체연구의 기반인 정보 생산 및 분석에 대한 투자가 절대적으로 부족한 상황이다. 현재 국내에서 진행되고 있는 유전체 해독 연구는 넙치, 돼지, 한우, 개, 고추, 무, 참외, 녹두, 인삼, 양배추 등의 동․식물과 김치미생물 등 다양한 종류의 미생물 전체 유전체 해독 연구가 뒤 늦게 진행되고 있다. 국내에서 NGS 기술을 보유하고 있는 곳은 총 14개 기관(표 1)으로 게놈연구재단, 테라젠이텍스 및 KT가 공동으로 한국인 개인 게놈프로젝트를 수행 중이며, 마크로젠이 한국인 게놈 연구를 수행 하는 등 개인 유전체해독 연구는 민간에서 주도하고 있는 양상이다. 급격한 유전체 시대의 도래와 더불어 유전체 기반 연구 개발 및 기술 확보, 이의 사업화 등을 통합적으로 수행할 수 있는 국가 기관의 부재로 대형 유전체해독 프로젝트 착수 및 국제컨소시엄 참여 등에 적극적이고도 선제적인 대응이 어려운 실정이다.
표 9. 국내 NGS 장비 보유 현황(2011년 1월)
기관명 Illumina GAII Illumina GAIIx Illumina HiSeq2000 SOLiD Roche GS FLX 마크로젠 2 10 2 1 데라젠이텍스 1 1 디엔에이링크 1 1 1 나이셈 1 1 솔젠트 1 젠닥스 1 KRIBB 1 1 삼성종합기술원 1 광주과기원 1 1 서울의대 유전체의학연구소 4 1 포항공대 1 가천의대 1 3 연세대 1 서울대 약대 1 합계 2 13 14 6 6
우리나라가 고유 생명자원의 주권 확보나 멸종위기종의 관리․복원 등을 위해서도 유전체 데이터의 초고속 생산 능력의 확보, 유전체 염기서열의 신속 정확한 맞춤형 분석 능력 확보, 유전체 연구 결과물의 산업화 촉진 인프라 구축, 융복합 유전체응용기술 전문 인력 양성 체계 구축 등을 종합적으로 수행할 수 있는 국가차원의 전문연구기관이 반드시 필요하다.
라. 발전 전망
유전체해독정보를 기반으로 유전학적 기술개발과 생명공학적 활용이 이루어지며, 이는 의약품, 식품, 에너지, 산업소재 등 다양한 분야에서 활용 가능한 기술뿐 아니라 기후변화, 환경보전, 자원고갈 등의 인류가 당면한 난제를 해결할 핵심영역으로 부각되고 있다.
최근에 제3세대 유전체염기서열 해독 장비(PacBio RS; Pacific Biosciences, Ion PGM sequencer; Life technologies 등)가 출시되면서 개인유전체시대가 앞당겨 질 것으로 예상되며, DNA 정보를 이용한 간단 진단 시장, 분자육종 및 분석기기 시장 확대, 종간/개체간 유전체 정보의 비교/분석에 의한 생물의 고유한 특성을 결정짓는 핵심 인자 규명, NIT기반 가상세포의 구현으로 산업기술개발 시간 단축 및 비용 절감, 컴퓨터 기술을 접목한 유전체정보 분석시간 단축 및 예측정보 정확도가 상승할 것으로 전망한다. 또한, 이들 분석 수요의 증대에 따라 HP, IBM, Google, Microsoft 등의 IT 기업들도 유전체정보 시장에 진입하여 분석 소프트웨어 산업에도 엄청난 발전이 있을 것으로 예상된다.
결론적으로, 유전체연구는 NGS 기기 등 대형인프라 및 IT 전문 인력으로 포진된 거점을 활용한 미래 생명과학 분야의 새로운 패러다임 창출의 핵심 기반기술이 될 것으로 예상되고 있다.
2. 단백질체 연구
가. 단백질체학 (Proteomics: 프로테오믹스) 개요
(1)단백질체학(Proteomics)이란?
단백질체학은 세포에 의해 발현되는 모든 단백질의 총합인 단백질체에 대한 총체적인 연구로, 생체의 활동, 질병, 노화 등에 따른 단백질 발현 정량화뿐 아니라 단백질의 위치와 변화, 상호작용, 기능과 구조 분석까지를 포함하며, 유전체 서열과 생명 현상 사이를 연결하는 정보를 제공하여 새로운 치료제 및 진단 시약개발에 있어서의 가장 강력한 분석 기술로 인식되고 있다.
(2)단백질체학의 핵심기술
단백질체학의 기술은 크게 프로테옴 분석기술, 단백질기능 규명기술, 단백질체 정보기술로 나뉘며, 핵심기술인 프로테옴 분석 기술은 2차원 전기영동과 액상크로마토그라피와 같은 프로테옴 분리 기술과 질량분석을 이용한 단백질 동정 및 정량 기술이 주를 이룬다. 단백질기능 분석은 단백질 상호작용 및 경로 분석, 단백질구조 규명 및 디자인, 세포 및 개체 기반 단백질 기능 검증 기술 등으로 구분되며, 단백질체 정보기술은 프로테오믹스 모든 과정에서 자료 분석 및 결과 해석에 기반이 되는 기술이다.

나. 해외 동향
(1) 최근 기술개발동향
(가) 분리분석기술
Two-dimensional polyacrylamide gel electrophoresis (2D-PAGE), capillary Reverse-Phase Liquid Chromatography (RPLC), Ultra High Pressure Liquid Chromatography (UPLC), Capillary Electrophoresis (CE) 등의 분리분석기술은 프로테옴 분석에 핵심 기술이다. 두 개 이상의 분리기술을 결합한 다차원 분리기술이 널리 이용되고 있다. 특히, Normal-Phase Liquid Chromatography (NPLC)를 이용한 분리분석 기술은 현재 Post-Translational Modification (PTM) 연구에 RPLC와 함께 상호 보완적인 분리 분석기술로 활용되고 있다. 최근 LC 기술에서 주목할 만한 것은 고정상 충진물의 소형화와 그로 인해 발생되는 컬럼 내부 압력 증가의 최소화에 있으며, 현재 이러한 것들을 구현할 수 있는 고압 HPLC 시스템 (15,000psi) 및 소형 충진물이 몇몇의 제조 회사로부터 개발되어 보급되고 있다. 2 μm 이하의 소형 고정상 충진물 컬럼과, gradient composition과 flow speed를 안정적으로 주는 고압 HPLC 시스템의 결합은 앞으로 바이오 시료 분리에 주요한 기술로 대두되고 있고, 특히 이러한 결함 기술은 높은 재현성이 요구되는 단백질 시료의 비표지 정량에 우수한 재현성과 높은 분리분해능을 제공하는 분리분석기술로서 앞으로 활발히 활용될 것으로 예측된다. 높은 실험 재현성을 위해 최근 시판되는 칩 LC를 이용한 이중 컬럼 (dual column) 방식도 프로테옴 분석분야에 적용되고 있다. 칩 LC는 고정상 충진 과정에서 실험자에 의해 야기될 수 있는 문제들을 해결함과 동시에 간단히 칩 형식의 컬럼을 LC장비에서 교체하여 분석시간 절약을 가능케 한다. 또한, 동일 조건의 두 개의 칩 컬럼을 교대로 사용함으로써, 전 실험 단계에서 제거되지 않은 컬럼 내부의 잔존물 (carryover)을 다른 칩 컬럼으로 제거할 수 있다.
(나) 질량분석기술
최근 질량분석기술의 새로운 동향은 다양한 질량분석기술의 혼성화(hybridization)이다. 이온트랩-후리에 변환(Fourier transform: FT) 질량분석계의 결합, 이온트랩-오비트랩 질량분석계의 결합, 그리고 ion mobility 기기와 후리에 변환 질량분석계 혹은 Q-TOF와의 결합 등 다양한 혼성 질량분석계가 제품화되고 있다. FT-ICR은 높은 감도(100 amole - 150 zmole 까지 측정 가능), 높은 질량분해능, 1 ppm 이하의 높은 질량측정정확도 등으로 단백질 혼합물의 확인 및 peptide sequencing 정보의 향상을 가능하게 하고 ECD, ETD 등 다양한 펩티드/단백질 분해 기술의 개발로 프로테옴 시료에 대한 좀 더 정확한 화학적 정보를 얻을 수 있게된다. 최근, 보다 큰 펩티드 및 단백질 그대로의 질량을 분석하는 Middle-down 혹은 Top-down 방식이 시도되고 있는데 이러한 분석에 필수적인 고분해능, 고정확성 후리에 변환 질량분석계의 보유와 활용은 여전히 몇몇의 선두 그룹에 제한적인 상황이다. 그러나, 고분해능, 고정확성 질량분석계 및 이에 적합한 단백질 분리분석 기술 등이 계속 개발되고 있으며, 추후 동종 단백질의 다양한 PTM 분석에 많은 정보를 제공할 것으로 기대된다. 한편, 보다 많은 단백질 동정과 타겟 단백질의 정량 분석을 위해, 감도가 높은 동시에 빠른 scan speed를 가지는 질량 분석기들이 지속적으로 개발되고 있다. 최근 개발된 Triple Quadrupole 질량분석계는 향상된 감도와 선형 구간을 지니며 Selected Reaction Monitoring (SRM) 기법을 적용하여 다종 단백질들을 동시에 1 - 100 amole까지 분석할 수 있게 한다.
(다) Informatics기술
질량분석에서 얻어진 방대한 데이터를 정확히 분석하고, 생산된 프로테오믹스 결과에서 생물학적 의미를 추출하기 위한 informatics 기술은 Scripps (DTAselect), ISB (TPP), PNNL (PRISM), FHCRC (CPAS) 등에서 분석의 자동화와 생산된 결과의 분석을 위한 소프트웨어 환경을 구축하여 사용하고 있다. 특히 정량분석 정보를 추출하기 위해 Census, MaxQuant같은 프로그램 개발과 생물학적으로 매우 중요한 단백질 변형분석을 위한 알고리즘의 개발도 활발히 진행되고 있다. 최근에는 global proteomics를 통해 얻어진 방대한 데이터를 Gene Ontology 분석, enriched functional-related gene group의 clusterization, pathway map 작성, network 분석 등을 통해 시스템스바이올로지 접근의 informatics 기술 개발 필요성이 대두되고 있음. 방대한 프로테오믹스 데이터를 기반으로 하여 유전체 분석을 보완하는 proteogenomics분야도 활발하게 개척되고 있다.
(라) 단백질체 정량기술
2D-PAGE의 단점을 보완한 DIGE (double labeled fluorescence detection) 방법이 비교정량기술로 지속적으로 사용되고 있다. 겔을 사용하지 않는 정량법이 증가 추세에 있는데, 겔을 사용하지 않고 LC와 질량분석기로만 정량하는 방법은 크게 상대정량기술과 절대정량기술로 나눌 수 있다. 상대정량기술에는 ICAT (isotope coded affinity tags), iTRAQTM (Applied Biosystems, Inc.), SILAC (stable isotope labeling with amino acids in cell culture), IDBESTTM (Target Discovery, Inc.), TMT (Tandem Mass Tag, ThermoFinnagann Inc.)와 같이 동위원소를 이용하는 방법과 spectral counting, extracted ion chromatogram 비교와 같은 비표지 정량방법이 바이오마커 발굴에 활발히 적용된다. 절대정량기술에는 SISCAPA (Stable Isotope Standards with Capture Anti-Peptide Antibody), QCAT proteotypic peptide, mTRAQTM (Applied Biosystems, Inc.) 기술 등이 사용되고 있으며, 최근 SIS (stable isotope labeled standard)를 사용한 SRM에 대한 많은 연구가 진행되고 있다.
(마) PTM (Post Translational Modification) 분석 기술
PTM이 가지고 있는 특이적인 물리화학적 성질을 이용하여 특정 PTM 단백질체들만 enrich하는 기술들 (phospho-capture, glyco-capture, cysteine-capture, nitortyrosine-capture)이 활발하게 개발되어 정착되고 있다. 특히 인산화된 단백질을 선택하는 기술은 DHB, calcium 등을 이용하여 선택성을 높이는 다양한 최적화 방법이 소개되고 있다. Proteolytic processing 이 일어난 단백질 degradome을 분석하는 방법이 활발히 개발되어 특정 단백질 분해효소의 기질을 찾는데 활용되고 있고 Top-down 프로테오믹스를 이용하여, 단백질 하나에 나타나는 복잡한 PTM의 조합을 알아내는 분석기술이 최근 소개되고 있다.
(바) 바이오마커 연구
오믹스 기반 바이오마커는 질병의 조기진단, 예후, 약물치료에 대한 반응, 신약 후보물질에 대한 평가 등에 유용하며, 현재 미국 FDA에 의해 허가된 MammaPrint, AlloMap 등 Multiplex 분자진단제는 대부분은 유전체 기반의 제품이다. 단백질 바이오마커는 Phenotype 바이오마커로서 생리 상태를 직접 반영하며, 병원에서 쉽게 분석할 수 있는 혈액이나 소변을 사용하여 분석한다는 이점이 있다. 프로테오믹스 분석기술의 발달로 단백질 바이오마커 후보가 다량으로 나오고 있지만, 실제 임상에서 유용성을 평가하는 부분은 시간이 걸리는 단계이다. 2008년 미국 FDA와 유럽 EMEA에서 C-Path의 PSTC(The Predictive Safety Testing Consortium)에서 제안한 7개 패널의 단백질을 신장 결함에 대한 독성 바이오마커로 인정한 이래로 다양한 단백질 바이오마커 후보군들이 도출되고 있으며, 미국 NCI의 EDRN (Early Detection Research Network)에서는 각종 암에 대한 수백 개의 단백질 바이오마커에 대해 평가를 진행 중이다. 최근 EDRN에서는 폐암 관련 12개 단백질을 포함한 의약업체들의 단백질 기반 바이오마커의 유효성을 평가하기로 결정하였다. 바이오마커 개발에 방해가 되는 요인들로, 표준화 된 시료준비 및 측정방법의 결여, 공유되지 못하는 생물정보 체계, 분산된 연구, 연구 주체간의 의사소통 미흡, 검증과정에서 생물․생리학 지식 부족 등이 지적되면서, 미국 NCI, FDA, AACR(미국암학회) 등을 중심으로 바이오마커 개발 및 적용에 대한 가이드라인의 제정을 추진하고 있다.
(2) 주요국 연구개발 투자 동향
<표 4-1-2-1 주요국 연구개발 투자동향>
|
국가 |
구 분 |
연구개발 투자내용 |
|
미 국 |
NCI (National Cancer Institute) |
▪ Clinical Proteomic Tumor Analysis Consortium (CPTAC): $75-120M (‘11-’16) |
|
NHLBI (National Heart, Lung and Blood Institute) |
▪ 3단계 Clinical Protoemics 프로그램: $80M (‘10-’15) |
|
|
NIGMS (National Institute of General Medical Science) |
▪ PSI 2단계사업의 단백질 구조결정(‘06-’11): $37M (‘10) →PSI 3단계사업: $290M (’11-‘16) |
|
|
NSF (National Science Foundation) |
▪ PDB (Protein Data Base) 사업 ('09 시작 5년간): $31.5M (‘09) ▪ NSF awards in proteomics & protein research: $7.1M (‘11 신규 1-3년간, 26 grants) |
|
|
NIH (National Health Institute) |
▪ NIH grants in proteomics: $52.7M (‘11, 107 grants) |
|
|
EU |
EU 7th Framework 프로그램 |
▪ PROSPECTS (PROteomics SPECification in Time and Space) 콘소시움: €12M, (‘08-’13) ▪ Plasma Biomarker Discovery Platform: €3M, (‘09-’12) ▪ PRIME-XS consortium (Proteomics Services): €8M (‘11 시작 4년간) |
|
덴마크 Novo Nordisk 재단 |
▪ 질환 단백질 연구를 위한 센터 (Novo Nordisk Foundation Center) 코펜하겐대학에 설립 (‘07): $111M |
|
|
룩셈브르크 |
▪ 미국 애리조나 TGEN과 ‘08년 설립된 Integrated Biobank of Luxembourg 간의 바이오뱅킹 등 맞춤의학을 위한 협력사업: €140M (‘09 시작 5년간) |
|
|
네델란드 |
▪ Translational Molecular Medicine ‘10, €275M 지원 (지노믹스, 프로테오믹스, 메타볼로믹스, 인포메틱스 등) |
|
|
노르웨이 |
▪ 기능유전체 연구 2단계 $70M 지원 (‘07-’11) |
|
|
캐 나 다 |
CFI (Canada Foundation for Innovation) |
▪ Quantitative Cell Biology & Proteomics (Mount Sinai Hospital): C$12M ('09 시작) ▪ Canadian Accelerator Mass Spectrometry (Ottawa 대학): C$8.4M ('09 시작) ▪ Integrated Nat'l Technology Platform for Mapping Protein Networks (Montreal 대학): C$9.2M ('09 시작) ▪ A Multi-Site, Integrated National Technology Platform for Mapping Protein Interaction Networks in Health and Disease: C$9.2M (‘11 까지 총액) |
|
Ontario 주 |
▪ Ontario Research Fund (C$625M, 4년간) 중 C$114.6M, 오믹스 Global Leadership 프로그램에 투자 |
|
|
일본 |
RIKEN 요코하마연구소 |
▪ Protein 3000 (단백질 구조와 기능해석 프로젝트): 5000억원('07년 5년간) |
|
호주 |
교육과학훈련부 |
▪ Biotech Initiative로 프로테오믹스 분야에 $40M 지원 |
(3) 단백질체학의 시장 규모
세계 프로테오믹스 시장은 2010년 35억불이고, 2011년 39억불 정도로 예측되며, 년 평균 약 11.2%씩 성장하여 2015년 약 61억불로 예측된다.26) 프로테오믹스 시장의 지역별, 기술별 분포는 다음과 같다. 지역별 분포는 미국과 유럽 시장이 약 40%씩 차지하고 있으며, 성장률은 유럽이 미국보다 약간 높게 예측되고 있다 (11.5% vs. 11.1%). 기술분야별로 보면 77%가 Expression Proteomics 분야이며, 나머지를 Functional Proteomics, Structural Proteomics 분야가 차지하고 있다. 성장률은 Expression Proteomics 분야가 년 평균 9.7%, Functional Proteomics 분야가 19%로 Functional Proteomics 분야가 가장 빠르게 증가하고 있는 추세이다.
<그림 4-1-2-2>

<그림 4-1-2-2 지역별 프로테오믹스 시장 전망>
<그림 4-1-2-3>

<그림 4-1-2-3 기술별 프로테오믹스 시장 전망>
다. 국내동향
(1) 연구개발 투자 현황27)
<표 4-1-2-2>
|
부 처 명 |
사 업 명 |
수행 기간 |
2011년 연구비 |
비고 (주관 기관 등) |
|
교육과학기술부 |
프로테오믹스이용기술개발사업 (21세기프론티어사업) |
2002~ 2012 |
74억 |
한국과학기술 연구원 |
|
보건복지부 |
맞춤의료단백체센터 (보건의료연구개발사업) |
2011~ 2015 |
12.6억 |
차세대맞춤의료유전체사업단 |
|
교육과학기술부 |
단백질 칩 기술개발사업 (바이오신약장기개발사업) |
2004~ 2012 |
19.64억 |
한국생명공학연구원 |
|
교육과학기술부 |
질량분석기반 초고속 분자진단 의료시스템 개발 연구 (신기술융합형성장동력사업) |
2009~ 2014 |
45억 |
한국기초과학지원연구원 |
<표 4-1-2-2 정부 지원 프로테오믹스 연구 현황>
(2) 관련 산업 현황28).
|
기업명 |
주요 업종 |
설립 |
비고 |
|
(주)영인프런티어 |
항체, 진단키트 생산 및 판매, HUPO Antibody Initiative에 참여 (2008. 5. 에이비프론티어 합병) |
1994. 3 |
상장 |
|
(주)팹트론 |
단백질 정제용 레진, 펩타이드 관련 제제 생산 및 판매 |
1997. 11 |
|
|
(주)프로테오젠 |
단백질 칩, 단백질 기능분석 장치개발 및 판매 |
2000 .2 |
|
|
(주)프로테옴텍 |
시료 준비, 젤 이미지 분석, 질량분석 서비스 제공 |
2000. 3 |
|
|
(주)노바셀테크놀로지 |
분비단백질, 세포막단백질 프로파일링, 임상시료 프로테옴 분석 [전 ㈜씨그몰] |
2006. 6 |
|
|
(주)크리스탈지노믹스 |
질환 단백질의 3차 구조관련 신약 발굴 |
2000. 7 |
상장 |
|
(주)바이오인프라 |
암 조기진단 단백질 칩 개발 |
2001. 2 |
|
|
(주)프로바이온 |
질량분석 기반 분석 서비스 및 질병 진단/치료제 개발 |
2006. 1 |
|
|
(주)다이아텍코리아 |
각종 세균 및 바이러스 질병 등의 분자진단 검사 개발 |
2000. 1 |
|
|
(주)프로탄바이오 |
폐암 진단 예후 검중 단백질 마커 및 키트 개발 |
2006. 1 |
|
<표4-1-2-3>
<표 4-1-2-3 국내 대표적 프로테오믹스 벤처기업 현황>
라. 발전과제
미래 도전분야는 단백질상호작용 및 PTM 규명, 그리고 맞춤의학을 위한 propteogenomics 기반의 유전자 및 단백질 바이오마커군 발굴 분야 등이다. 바이오산업의 국제 경쟁력 확보를 위해서 프로테오믹스 기술에 대한 전문가 양성 및 인프라 구축에 대한 지속적 지원이 필요하다. 특히 신약개발에서 Companion Diagnostics 전략 구사를 위해서도 바이오마커/질환표적 발굴에 주력할 필요가 있다.
3. 세포체학
가. 세포생물학의 개요
인체에 발생하는 감염성질환은 외부로부터 침입하는 병원성 세균, 진균 혹은 바이러스와 인체의 면역세포간의 균형이 깨어졌을 때 발생하게 된다. 이를 치료 혹은 예방하기 위하여 약물, 수술 등의 치료법이 사용되거나 예방접종이 이용되고 있다. 외부 병원체의 침입이 아닌 인체의 내적요인에 의한 질병도 생리적인 균형이 그 근본 원인으로 생각할 수 있다. 하지만 최근 발생하고 있는 선천적 혹은 후천적 질병들은 현재까지 사용되고 있는 치료법으로는 완치가 어려운 것이 현실이다. 특히 식생활의 변화와 수명의 증가로 인한 노령인구의 증가로 난치성 질병들이 증가하고 있어 이러한 질병에 대한 치료법을 연구하는 노력이 최근의 질병치료에 대한 관점이며, 그 시장규모도 급속히 증가하고 있다 (그림 4-1-3-1). 이를 위하여 최근 “세포치료제“를 이용한 치료적 접근이 각광받고 있으며, 유전자치료법이 가졌던 한계를 극복하는 생체내 약물 및 유전자 투여 기술 및 면역거부반응 극복 세포치료/장기이식기술 개발 등의 연구가 집중적으로 이루어지고 있다. 특히 이러한 세포치료기술의 근본이 될 수 있는 줄기세포 연구는 현재 가장 주목받고 있으며 발전 가능성이 널리 인정되고 있다. 이에 따라 본 장에서는 세포생물학 연구분야 중 줄기세포학에 관점을 두고 최근의 연구현황에 대해 기술하고자 한다.

나. 줄기세포의 정의
줄기세포란 인체를 구성하는 모든 세포로 분화할 수 있는 만능세포로서, 이론적으로 줄기세포는 모든 종류의 기능세포로 분화 가능하고, 무한 증식이 가능하며, 스스로 동일한 세포를 만들어 낼 수 있는 능력이 있어, 손상된 각종 장기의 기능을 근본적으로 재생할 수 있다. 줄기세포는 그 기원에 따라 배아줄기세포, 성체줄기세포, 정원줄기세포 및 최근 들어 개발된 역분화 줄기세포로 대별할 수 있다. 인간 배아줄기세포는 확립과정에서 배아의 파괴가 필요한 만큼 윤리적인 문제점을 가지고 있어서 이를 피할 수 있는 다른 줄기세포의 연구를 활성화 시켜왔다. 하지만 현재까지 배아줄기세포는 어떤 다른 줄기세포에 비해서도 월등한 증식력과 유전적 안정성을 가지고 있고, 또한 국내외에 걸쳐 많은 세포주가 확립되었고, 특성이 많이 규명되어 있어 임상적용에 가장 근접된 세포주임에 틀림이 없다. 따라서 배아줄기세포에서 연구된 내용을 역분화 줄기세포에 적용함으로서 앞으로 역분화 줄기세포가 세포치료제로서 가장 많은 발전가능성을 가졌다고 본다.
다. 기술 동향
인간배아줄기세포가 확립된 이후 강력한 증식능과 분화능을 바탕으로 집중적으로 연구되어 왔다. 국내에서도 인간배아줄기세포 수립이 활발하게 진행되어 2011년 현재 4개 기관에서 총 67개의 인간배아줄기세포주가 질병관리본부에 등록되어 있다. 특히 최근에 수립되고 있는 인간배아줄기세포주는 임상적용이 가능한 세포주로서, 세포주 수립 단계에서부터 인간유래의 지지세포, 지지세포 없이 배양 가능한 임상적용 배양 배지를 사용하여 향후 임상에 적용할 수 있는 기반을 다지고 있다. 2006년에 역분화줄기세포가 처음 발표된 이후 이 분야의 연구발전은 가히 눈부시다 할 정도이다. 2006년 Yamanaka 박사(일본 교토대)에 의해 발표된 4가지 역분화 인자에서 시작하여, 세포에 넣어주는 역분화인자의 수를 1개까지 줄이는데 성공하였으며, 바이러스를 이용하지 않아 염색체에 이상을 초래하지 않는 단백질 혹은 mRNA를 이용하는 방법까지 다양한 방법들이 개발되고 있다. 여기에 덧붙여 저분자 (small molecule) 물질을 이용한 방법이 성공함에 따라 안전한 역분화 줄기세포 수립 방법이 발표되고 있다 (그림 4-1-3-2).

최근에는 인간배아줄기세포 및 역분화줄기세포 적용에서 나타낼 수 있는 기형종 형성 위험성을 줄이기 위하여, 섬유아세포에서 역분화줄기세포를 거치지 않고 직접 다양한 세포로 분화시키는 기술이 개발되고 있는데, 심근세포, 혈액세포, 신경세포 및 간세포 등이 그 예이다. 이러한 교차분화방법에 의한 세포치료제 개발이 앞으로의 연구개발의 중심축이 될 것으로 보인다.
라. 국내 현황
국내에서는 세계적인 줄기세포 연구에 발맞추고자 범부처 차원에서의 줄기세포 연구 육성계획을 시행하는 등 체계적인 지원이 이루어지고 잇으며, 특히 2011년도에 줄기세포연구의 중요성을 다시 부각하여 국가 연구비 규모를 70%이상 상향시키기로 결정하는 등 선진국 수준을 넘어서기 위하여 노력하고 있다. 다만 국가연구비 투자 규모에 비하여 민간투자는 상대적으로 미미한 수준으로서 안정적인 줄기세포 연구를 추진하기 위해서는 민간투자와 산업체-의료기관과의 협력연구의 강화가 필요하다. 국가 차원에서 줄기세포연구 활성화를 위하여 줄기세포주은행을 구축중에 있으며, 줄기세포주은행에서는 인간배아줄기세포주 뿐만아니라 역분화줄기세포주도 구비하여 국내 연구자들에게 분양하고 잇는 상태이다. 국내의 줄기세포 기술수준은 분야별로 편차가 나타나고 있는데, 줄기세포의 확립 및 생산기술과 신경계 분화연구는 그 수준이 높은편이나, 역분화 관련 기술력은 상대적으로 낮은 것으로 보여 이 분야의 집중 투자가 더 필요해 보인다. 하지만 성체줄기세포를 이용한 세포치료제 개발은 세계에서 처음으로 임상시험 허가가 나올 만큼 세계적으로 앞서있다고 볼 수 있으며, 이러한 중간엽줄기세포를 이용한 임상치료 시도는 더욱 확대될 것으로 보인다. 산업적으로도 국내 줄기세포 시장은 연평균 약 25%의 높은 성장세를 지속하여, 2005년 1억달러 규모에서 2012년 5억달러 규모까지 발전할 것으로 보인다. 그럼에도 불구하고 이러한 규모는 세계시장의 1.5%에 불과하여 좀더 적극적인 세계시장 점유를 위하여 핵심원천기술 확보가 절실해 보인다.
마. 발전 과제와 전망
줄기세포를 활용한 파킨슨병, 알츠하이머병, 골관절염, 심근경색증, 사지허혈 등 난치질환 치료제 개발 분야의 산업매력이 증가 추세에 있으며, 역분화줄기세포 개발 등 줄기세포분야 연구성과가 가시화됨에 따라 기존 치료기술 및 치료제로 해결할 수 없었던 난치질환의 해결책으로 기대되면서 고부가가치를 창출할 것으로 전망된다. 줄기세포 치료제는 합성신약인 저분자 (small molecule) 신약에 비해 적용질환 범위는 좁지만 특화된 질병에 적용 가능하여 고부가가치를 창출할 것으로 기대된다. 특히 윤리적인 문제와 면역거부반응의 문제를 해결 할 수 있는 역분화줄기세포 유도기술, 교차분화를 이용한 세포분화기술, 임상적용 가능한 줄기세포 분화유도기술 및 종양 억제가 가능한 순수분리법 개발은 추후 줄기세포를 활용하는 다양한 산업화 분야의 핵심적이고 근간이 되는 기술이 될 것이다. 또한 줄기세포는 체내에 존재할 때는 극소수로 존재하며, 이들을 임상적으로 사용하기 위해서는 대량증식을 통해 필요량을 획득하여야 한다. 현재의 과학기술은 이러한 줄기세포의 대량생산에만 집중하고, 이 과정에서 일어날 수 있는 유전적, 유전외적인 변형에 의한 위험성에는 미치지 못하고 있다. 이들을 피할 수 있는 기술의 개발이 줄기세포의 치료효율 증대에 가장 큰 관건으로 작용할 것이다. 추가하여 줄기세포연구는 배양액 뿐 만아니라 기초와 임상연구를 위해 사용되는 각종 항체와 재조합단백질 시장도 이에 못지않게 크게 성장하고 있다. 줄기세포를 이용한 신약개발 및 임상개발 효율화의 효과는 향후 7~10년 이내에 나타날 것으로 전망되며, 세포치료제는 향후 5~10년 이내에 상용화되어 판매될 것으로 기대되고 있다. 줄기세포 기반기술은 전반적인 의료 산업에 막대한 영향을 미쳐 신약 및 임상의학 기술개발에 소요되는 비용과 시간을 획기적으로 개선할 것으로 기대되는 바, 국가 차원에서의 연구지원과 더불어 민간벤처기업에 대한 정책적인 지원과 대기업과의 연계방안을 통한 투자확대를 강구해야할 필요가 있다고 본다.
4. 대사체학 연구
가. 대사체학(Metabolomics) 연구의 개론
대사체학은 유전자 표현형과 단백체의 분석만으로 해석 할 수 없는 세포내 변화 등의 상관관계를 대사네트워크 전체를 통해 고찰하고, 얻어진 결과를 통하여 최종생성물의 변화량에 대한 원인을 해석하는 유일한 학문으로서, 특정한 생물학적 변화 과정들을 통하여 생성된 저분자 대사체의 프로파일을 체계적이며 종합적으로 연구하는 학문이다. 효소의 농도나 활성이 변하면 이 영향을 받은 대사체 흐름은 대사체 농도의 변화에 있어서 중요한 영향을 끼치게 된다. 즉, 대사체들은 transcription과 translation의 하위단계로써 효소의 활성을 나타내는 좋은 지표(indicator)로써 작용할 수 있으므로 대사체의 네트웍 (metabolic network)에서 관찰된 대사체들의 변화를 통해서, 대사체들은 생물학적 시스템에서의 변화에 대해 모니터 할 수 있다. 따라서, 유전학, 전사체학 및 단백체학과 더불어 대사 프로파일링을 통하여 얻은 세포 기능에 대한 정보들을 종합하여 복잡한 생명체의 구조를 규명하려는 연구를 시도하고 있다.

나. 대사체학(Metabolomics) 연구의 필요성
대사체학 연구 분야는 다양한 유전적, 생리적 또는 환경적 조건에서 변화되는 생체 내 저분자량 대사물질군의 구성과 농도를 분석하고 해석함으로써 생명현상의 변화 원인을 규명해 나가는 총체적 연구 분야이다.
ㅇ 질병 등과 같은 다양한 조건에서 변화하는 생물체의 표현형 (phenotype)을 가장 잘 반영하는 것은 생체 내에 존재하는 대사체 (metabolite) 및 대사체군 (metabolome)임.
ㅇ 생체 내에 존재하는 대사체를 분석하는 대사체학 및 이들과 생체내의 거대분자 (유전자 및 단백질 등)들과의 상호 관련성연구는 특정질환내의 대사경로와 인체질환 기전 규명에 매우 중요하고 필수적인 연구 분야임.
다. 해외 동향
대사체학 연구는 1960년 후반 크로마토그래피를 이용한 분리 및 정제 기술의 발전에 의해 대사체들의 검출이 가능하게 되면서 본격화되기 시작했으며, 1970년 Arthur Robinson이 비타민 B6를 투여한 후, 뇨시료에서 복잡한 크로마토그래피 패턴들을 분석하고, 이러한 패턴은 뇨 시료 내에 유용한 정보를 가진 수많은 화합물들을 함유하고 있다고 발표하면서 발전되었다. 1971년 PNAS에 “Quantitative Analysis of Urine Vapor and Breath by Gas-Liquid Partition Chromatography"를 발표한 이후, 생체시료 내 대사체들의 정량적 패턴들을 분석함으로써 질병 진단, 질환상태 및 연령에 따른 생체 변화 등에 대한 논문들이 다수 발표되었으며 이러한 생체 시료 내에서의 분석은 적은 비용으로 많은 정보를 얻을 수 있으며, 또한 생리 상태에 따른 대사물의 측정이 가능하게 하였다. 1990년대 Oliver SG, Winson MK, Kell DB 및 Baganz F등이 ”Trends Biotechnol. 16, 373-378“에 효모의 기능을 체계적으로 분석함으로써 처음으로 대사체학이란 용어를 사용하였고, 2004년에는 ”Metabolomics Society"가 결성이 되어, 대사체학의 연구에 다양한 생화학적 방법들을 적용하게 되었다. 2007년 1월 캐나다의 알버타대 Wishart D는 2500개의 대사체, 1200개의 약물 및 3500개의 식품 성분들을 확인한 “Human Metabolome Project"라는 최초의 인간 대사체군을 발표하였으며, 최근 대사체학은 다음과 같은 다양한 연구 분야에 활용 되고 있다. 즉, 건강 및 질병진단에 있어서 생체지표 선정, 시스템 생물학, 동위원소 이성질체를 활용한 pathway discovery, 신약개발, 그리고 식물, 미생물, 영양학 및 환경 대사체학 등의 다양한 분야에 그 적용 범위를 넓혀가고 있다. 이러한 대사체학 연구는 주로 미국, 유럽, 일본 등 선진국 위주로 진행되고 있으며, 2007년 이후로 대사체학 연구에 대한 논문 발표 횟수가 증가되고 있는 추세이다.
* 출처: Web of Science

* 출처: Web of Science
(1) System biology Metabolomics 분야
- 영국 Cambridge 대학의 Julian L. Griffin 교수팀은 NMR spectrometry와 Mass spectrometry의 분석기기를 사용하여 type II diabetes/obesity, cancer and neuroscience와 같은 질병을 포유동물 model에서 metabolomics 기법을 중심으로 연구를 진행하고 있다.

* 출처 : Chem. Soc. Rev. 2011
(2) Pharmacometabolomics
- 프랑스의 Mathilde Bayet-Robert 팀은 human MCF7 breast carcinoma cell에 고/저농도의 docetaxel을 투여한 뒤, Proton NMR을 이용하여 그 결과를 관찰하였다. Pharmacometabolomics에 의해 평가된 생화학적 변화를 비교하였으며, 30개의 metabolites가 동정 및 정량되었다. (Breast. Cancer Res. Treat. (2010) 120, 613–626)
(3) Environmental Metabolomics 분야
- 영국 Birmingham대학의 Mark R. Viant 교수팀은 Fish와 수생 무척추동물이 toxicants와 diseases에 의해 나타나는 대사적 스트레스 반응을 metabolomics 기법으로 확인하고, 더 나아가 Chemical risk assessment와 Environmental monitoring에 응용하고자 하였다. (Environmental Health Perspectives, (2010), 118(1))
(4) Bioinformatics Metabolomics 분야
- 미국 California 대학의 O. Fiehn 팀은 대사적 구성의 심층적 이해를 위해 Enzyme pathway와 metabolome database에 대해 중심적으로 연구를 진행하고 있다. 또한, 휘발성 화합물 database를 작성함으로써 식물, 동물에 화학적 생태계 안에 필수적인 많은 기관들의 2차 대사산물의 주된 pathway를 이해하는데 중요한 역할을 하고자 한다.

* 출처 : J. BIOLOGICAL CHEM. 2011
(5) Plant/Phytochemical Metabolomics 분야
- 영국 맨체스터 대학의 R. Goodacre 교수팀은 고성능 LTQ Orbitrap을 이용하여 B. cinerea에서 ethylene-mediated 저항의 sources를 성공적으로 동정하였으며, 대사체적 접근법에 의해 key metabolites를 확인하였다.

* 출처 : The Plant Journal 2011
- 일본 RIKEN의 K. Saito 팀은 arabidopsis model을 이용한 환경요인(UV-B light 등) 에 따른 metabolites의 연관성을 예측하는 방법론을 metabolomics 분석법을 토대로 포괄적인 metabolic pathway의 경향을 연구하고 있다.

* 출처 : The Plant Journal 2011
라. 국내 현황
각 분야별 연구내용은 다음과 같다.
(1) Biomedical Biomarker 분야
- 한국과학기술연구원 생체대사연구센터
고성능 질량분석법을 활용하여, 다양한 생체시료 matrix (뇨, 혈장, 세포, 모발 등)로부터 targeted/non-targeted profiling 기법을 확립하여 최적의 대사체 분석법 및 통계분석을 통한 clustering 기술과 metabolic pattern 분석을 통해, 약물의 유효성/독성평가를 위한 총체적인 대사 network 확립 및 drug target 발굴을 위한 연구와 호르몬 의존성 질환(부인암 등) 및 피부부속기질환(탈모증 등)환자들에 대한 질환고유의 진단표지 대사체 도출 연구를 수행 중에 있으며, 최근 MS Imaging 기술을 활용한 tissue metabolome MS imaging 연구를 접목시켜 대사체의 변화를 한눈에 확인 할 수 있는 방법론을 구축 중에 있다.

* 출처: Clin. Chim Acta. 2009
- 서울대학교
중심부생검술(core needle biopsy)에 의해 채취한 31명의 sample(13명 유방암 환자군, 18명 정상군)을 HR-MAS MR spectroscopy를 활용하여 대사체를 분석하였다. 그 결과, taurine과 choline을 포함한 화합물이 OPLS-DA에 의해 두 그룹을 구별하게 하여 대사체학적 접근이 유방암 환자의 조기진단 가능성을 보여 주었다. (PLoS one, (2011) 6(10), e25563)
- 기초과학지원연구원
NMR을 활용하여 뇌경색 환자로부터 대사체를 분석한 결과, 혈장 시료에서 lactate, pyruvate, glycolate, formate가 증가하였고, glutamine과 methanol이 감소하였다. 또한, 뇨 시료에서는 citrate, hippurate, glycine이 감소하였으며, PCA와 OPLS-DA에 의해 두 그룹이 차이를 보여 대사체학 분석법이 뇌경색 환자의 조기진단법으로 유용할 것을 예상하였다. (Stroke, (2011) 42, 1282-1288)
(2) Pharmacometabolomics 분야
- 인하대 의과대학
Simvastatin 약물에 의한 독성을 평가하기 위해 NMR을 이용하여 약물투여 전과 후의 뇨시료에서 대사체를 분석한 후, OPLS-DA를 통하여 약물독성 진단 marker의 가능성을 확인하였다. (PLoS one, (2011) 6(2), e16641)
(3) Plant/Phytochemical Metabolomics 분야
- 고려대학교
제주도에서 생산되는 녹차를 NMR로 분석하여 기후의 다양성과 함께 대사체 함량의 차이를 비교하였다. 녹차의 품질평가 전략에 대사체학적 접근이 생산에 도움을 줄 것으로 예상하였다. (J. Agric. Food Chem. (2010) 58, 10582-10589)
(4) Metabolomics and Nutrition 분야
- 건국대학교
다양한 Fungi에 의해 Rice Koji 발효의 대사체의 변화를 GC-MS로 분석하였다. 발효시간에 따라 대사체의 증가/감소를 확인하였고 이를 토대로 발효 시간을 최적화 하였다. (Biosci. Biotechnol. Biochem. (2010) 74(11), 2267-2272)
라. 발전 과제 (전망)
(1) BT 관련 연구분야의 네트워크 구성으로 시너지 효과 창출
유전체 연구 → 단백체 연구 → 대사체 연구 → 생체기능조절물질 연구(신약개발)로 이어지는 국내 BT 관련 연구개발사업의 체계적 연계 및 시너지효과 창출.
(2) 대사체학을 이용한 질병의 원인 규명 및 진단
대사체학과 유전적 다양성(SNPs; single-nucleotide polymorphism) 관계 연구
데이터 모델링을 이용한 대사체 분석을 태아 또는 영유아 및 쌍둥이에 적용하여 유전적 다양성과의 직간접 관계 규명 연구
(3) 환경 대사체학(Environmental metabolomics)
환경오염에 의한 건강영향를 통한 건강영향 평가:
환경유출 사건에 의한 수용체 중심의 대사체들의 변화를 오염원 발생 지역과 비오염원 발생 지역의 주민들을 오랜 시간 추적 조사함으로써 오염 발생으로 인한 위해도 예측 및 정책 결정에 활용.

* 출처: Chemoecology 2011
(4) 식품 대사체학
대사체학을 통한 metabolic fingerprinting 또는 biological endproduct를 결정짓는 수단으로 활용 및 바이오마커 선정 연구에 활용.
(5) 맞춤형 의학의 실현을 위한 대사체학
(가) 독성 또는 효능에 대한 생리학적 반응 평가
대사 프로파일링은 개인별로 차별화된 약물의 독성 영향으로부터 발생하는 생리학적 변화(간 또는 신장)들을 발견하는데 활용됨. 따라서 임상 시험에 앞서 신약의 독성을 예측할 수 있다면, 독성 실험에 쓰이는 비용을 절감할 수 있음.
(나) 제약산업의 선도물질 선별 과정에의 적용
약물발견의 초기단계로부터 임상시험까지의 모든 과정 중 선도물질이 선별되기 전에 안전성 데이터를 얻는데 활용.
2011 생명공학백서 시스템생물학
가. 시스템생물학의 개요
하게
나. 해외 동향
시스템생물학은 선진국에서도 2000년대에 들어와 새롭게 연구가 시작되었지만, 현재 선진국을 중심으로 매우 활발한 연구가 진행되고 있으며, 그 중요도에 대한 인식이 급격히 확산되고 있다. 포스트 게놈시대에 축적된 방대한 데이터와 기술의 진보로 향후 인간의 질병메카니즘에 대한 새로운 이해와 체계적인 신약후보물질 발굴에 중요한 역할을 하게 될 것으로 판단된다.
시스템생물학은 최근 개인수준의 인식을 넘어서 연구기관과 대학, 그리고 국가주도의 연구프로그램으로 확대되고 있는데, 일본에서는 Systems Biology Institute (SBI, http://sbi.jp)가 설립 운영되고 있으며 ERATO-SORST Kitano Symbiotic Systems Project (http://www.symbio.jst.go.jp)를 통해 향후 시스템생물학이 정립된 이후 여러 생명체의 모델개발이 이루어질 때를 대비하여 세계적 표준안을 만듦으로써 기술우위를 선점하기 위한 투자와 노력을 경주하고 있다. 미국도 댈러스(Dallas)의 AfCS (Allliance for Cellular Signalling), 시애틀의 시스템생물학연구소(Institute for Systems Biology, ISB), 그리고 버클리의 분자과학연구소(Molecular Sciences Institute) 등을 설립하고 시스템생물학 연구를 주도해 나가기 위한 투자를 해오고 있다. AfCS는 미국과 영국의 7개 연구소가 공동으로 2000년 설립하였고, 노벨상 수상자인 Alfred Gilman을 회장으로 한 운영이사회가 이끌고 있다. ISB도 2000년 초 유전자 염기서열 자동분석법의 개발자 가운데 한 사람인 Leroy Hood가 Reudi Aebersold, Alan Aderem과 함께 설립하여 현재는 전산, 소프트웨어, 데이터베이스, 생물학, 물리학, 화학, 수학, 의학, 유전학 등 다양한 분야의 약 300여명의 전문가들이 모여서 연구하며, 시스템생물학 관련 우수 연구성과를 산출하고 있다. 버클리 분자과학연구소는 1996년 노벨상 수상자인 Sidney Brenner에 의해 설립되어 생물정보학과 컴퓨터 모델링을 바탕으로 한 예측 생물학 (Predictive biology)을 선도하고 있다.
유럽에서는 독일이 가장 먼저 정부(BMBF) 차원의 시스템생물학 연구과제를 주도하고 있으며 2003년부터 매년 막대한 연구비를 투자하고 있다 (http://www.systembiologie.de). 영국 또한 다양한 시스템생물학 연구 주제를 선정하여 여러 정부기관 (BBSRC, EPSRC 등)과 사설재단의 연구비를 수주하고 있다.
표1. 국외 시스템생물학 관련 주요 연구 기관 및 프로그램
|
관련기관(국가 또는 URL) |
내 용 |
|
Institute for Systems Biology (미국, http://www.systemsbiology.org) |
2000년 미국 시애틀에 설립됨. 다수의 생물학자, 공학자, 전산학자, 물리학자들이 유전체학, 단백체학 기법을 통해 당뇨병, 헌팅턴병, 프리온병 등을 타겟으로 시스템생물학의 선도적인 연구를 수행하고 있음. 또한 cytoscape, Systems Biology Markup Language 등의 시스템생물학 연구를 위한 소프트웨어 개발에 앞장서고 있음. |
|
Systems Biology Institute (일본, http://www.sbi.jp) |
2000년 일본 동경에 설립됨. ERATO-SORST Kitano Symbiotic System 프로젝트로 SBML과 호환되는 경로의 시각화 표준을 제시하고 EGFR 및 Toll-like 수용체 신호전달계의 지도를 작성함. Luxembourg Centre for Systems Biomedicine 과 함께 파킨슨병 공동연구를 수행하고 있음. |
|
Luxembourg Centre for Systems Biomedicine (룩셈부르크, http://wwwen.uni.lu/lcsb) |
Institute for Systems Biology, Systems Biology Institute 등과 협력하여 난치성 질병에 관한 연구 (주로 파킨슨병과 같은 신경질환)를 수행 |
|
Institute of Molecular Systems Biology (스위스, http://www.imsb.ethz.ch) |
2005년 취리히에 설립. 생물학, 화학, 생물정보학의 연구들을 결합하는데 목적을 두고 있음. |
|
Institute for Genomics and Systems Biology (미국, http://www.igsb.anl.gov) |
2006년 시카고. 유전체학 연구를 토대로, 실제적인 이익의 증대를 위한 연구. 유방암, 대사성 질환 및 당뇨병, 염증성 장 질환 등에 대한 연구가 진행 중. |
|
Center for Systems Biology at IGSP (미국, http://www.genome.duke.edu/centers/csb) |
2004년. 효모와 사람의 세포주기, 식물 뿌리와 성게의 발생에 대한 연구가 진행되고 있으며, 효모와 성게에서의 진화를 networking하는 연구도 진행 중임. |
|
Ottawa Institute of Systems Biology (캐나다, http://www.oisb.ca) |
2004년 오타와. 인간 질병에 관한 시스템 이해 및 고속 대용량 실험 테크닉 개발에 집중. |
|
Netherland Institute of Systems Biology (네덜란드, http://www.sysbio.nl) |
2007년 설립. 세포의 모양의 형성과 관련한 신호전달, 대사 및 유전자 네트워크에 관한 연구에 중점. |
|
Warwick Systems Biology Centre (영국, http://www2.warwick.ac.uk/fac/sci/systemsbiology) |
NF-kB 신호전달 시스템, 식물에서의 다른 종류의 스트레스에 대한 반응 메카니즘을 연구하고 있으며, 애기장대의 interactome 분석을 통한 네트워크 진화를 연구. |
|
Department of Systems Biology at Harvard Medical School (미국, http://sysbio.med.harvard.edu) |
2003년 세계 최초의 본격적인 시스템생물학과를 표방하고 있으며 M. Kirschner를 중심으로 약 20명의 faculty를 확보하고 있음. |
|
E-cell Project (일본, http://www.e-cell.org/ecell) |
1996년 일본 게이오대학에서 시작. E. Coli 세포내에서 일어나는 모든 생명현상을 전산모델화 시키는 작업을 추진. |
|
Microbial Cell Project (미국, http://microbialgenomics.energy.gov/MicrobialCellProject) |
미연방 에너지부의 주관으로 추진 중인 Microbial Cell Project는 친환경적인 에너지 개발을 위해 미생물의 시스템생물학 연구개발을 지원. |
|
Manchester Centre for Integrative Systems Biology (영국, http://www.mcisb.org) |
2005년 맨체스터 대학에서 시작. 전체 유전체를 커버하는 정량 데이터를 산출을 목표로 새로운 기술 개발과 오믹스 데이터 생산에 집중. 정량적 데이터 생산과 더불어 대사과정 모델링과 데이터 통합 기술 개발. |
|
Cambridge Systems Biology Centre (영국, http://www.sysbiol.cam.ac.uk) |
2006년 캠브리지 대학에서 시작. 세균주화성 (bacterial chemotaxis)의 생화학 회로의 시뮬레이션. 마이크로어레이 기반의 유전체학 기술, 질량분석 등 단백질체학 고속대용량 기술, 데이터 분석 기법 연구의 선두. |
|
Science Signaling (http://stke.sciencemag.org) |
1999년 세포 신호전달 경로에 대한 지식 데이터베이스를 갖춘 사이트이며 학술지인 Science STKE (Signal Transduction Knowledge Environment)로 시작하여 2008년 Science Signaling으로 명칭 변경 |
|
Alliance for Cellular Signaling (http://www.signaling-gateway.org) |
A. Gilman의 주도로 대학과 기업들이 참여하는 세포내 신호전달에 대한 정보를 종합한 연구자원 데이터 베이스를 운영 |
|
INBIOSIS institute of systems biology (말레이시아, http://pkukmweb.ukm.my/~inbiosis) |
다양한 오믹스 데이터를 통합하여 식물 생산량 및 체내에서 유용하게 사용되는 대사 산물의 합성과 생산 증가를 위한 유전자 변형기술 개발. |
|
Institute of Systems Biology And Ecology (체코, http://www.usbe.cas.cz) |
여러 단계에서 일어나는 생물학, 생태학적 시스템에서의 특징들에 초점. |
|
Berlin Institute for Medical Systems Biology at MDC (독일, http://www.mdc-berlin.de/en/bimsb) |
2008년 공식적으로 연구 시작. 단백체 해석과 central dogma의 조절에 관한 연구가 주로 이루어지고 있음. |
|
HapatoSys (독일, http://www.hepatosys.de/en) |
2004년 독일 정부의 대규모 지원으로 연구 시작. 해독작용, endocytosis, 철분 조절, 재생 등의 간세포 특이적 세포 활성에 대한 정량적, 총체적 이해를 목표. |
출처: 2009 생명공학백서 내용 수정·보완
범세계적인 시스템생물학자들이 모이는 시스템생물학 국제 심포지움 (International Conference on Systems Biology, ICSB)은 미국, 유럽, 일본을 돌아가며 매년 개최되고 있는데, 2010년에는 영국 에딘버러에서 개최되었으며 총 52개국의 연구자들이 참가하여 시스템생물학 분야 세계 최대의 학회로서의 면모를 보여주었다. 한국에서는 21명의 과학자가 참석하여 43편의 연구결과를 발표하였는데 이는 구두발표와 포스터발표를 포함한 ICSB 전체 1,688여편 중 약 2.55%에 해당하며, 국가별로는 6위에 해당한다 (표2). 2010년 ICSB에는 특히, AstraZeneca, Norvatis, Pfizer 등의 Big Pharma 를 비롯하여 Genstruct와 같은 시스템생물학 업체가 Parallel 세션에 참여하여 학계와 대형 제약업체가 긴밀한 교류를 나누는 장이 되기도 하였다.
표2. 2010년 ICSB 국가별 포스터 발표 상위 10위 (교신저자 기준)
|
순위 |
국가 |
편수 |
백분율 |
|
1 |
영국 |
242 |
14.34% |
|
2 |
독일 |
212 |
12.56% |
|
3 |
미국 |
168 |
9.95% |
|
4 |
일본 |
66 |
3.91% |
|
5 |
네덜란드 |
49 |
2.90% |
|
6 |
한국 |
43 |
2.55% |
|
7 |
프랑스 |
42 |
2.49% |
|
8 |
스위스 |
39 |
2.31% |
|
9 |
스웨덴 |
35 |
2.07% |
|
10 |
스페인 |
32 |
1.90% |
출처: 자체 자료
다. 국내 현황
표3. 국내 시스템생물학 관련 주요 학술 대회 및 학술 활동
|
연도 |
내용 |
|
2002년 |
시스템생물학 연구회 구성 |
|
2003년 |
시스템생물학 사업단 시작 |
|
2003년 4월 |
서울국제심포지움 개최 |
|
2003년 5월 |
IBEC (Integrated Biology of Escherichia coli) 구성 |
|
2004년 |
YSBN (Yeast Systems Biology Network) 구성 |
|
2005년 1월 |
RTKC (Receptor Tyrosin Kinase Consortium) 구성 |
|
2005년 11월 |
Electronic International Molecular Biology Network-Systems Biology (eIMBL) 설립 |
|
2006년 10월 |
시스템생물학의 대장균 관련 국제 학술대회 ‘제3회 IECA2006’ 개최 |
|
2007년 11월 |
제 304회 학연산 연구성과교류회 (주제: 시스템생물학) |
|
2008년 11월 |
시스템 생명정보학 국제 심포지엄 (International Symposium on Systems Bioinformatics) |
|
2009년 1월 |
GIST 시스템생물학연구소 개소식 및 기념 심포지움 개최 |
|
2009년 1월 |
제2회 한독심포지움 (‘시스템생물학: 게놈에서 생명까지’) 개최 |
|
2009년 12월 |
한국분자세포생물학회 시스템생물학분과 심포지움 개최 |
|
2010년 12월 |
한국분자세포생물학회 시스템생물학분과 심포지움 개최 |
|
2011년 1월 |
The 9th Asia Pacific Bioinformatics Conference 개최 |
|
2011년 8월 |
the 5th Asian Young Researchers Conference on Computational and Omics Biology 개최 |
|
2011년 9월 |
20th Korea Genome Organization (KOGO) Annual Conference 개최 |
출처 : 자체 자료
라. 발전 과제
2003년 IEEE Control Systems Magazine에 첫 리뷰논문이 등장하고, 2004년 IEEE에서 시스템생물학 저널이 최초로 발간된 이래로 (현재는
시스템생물학은 생명과학, 정보과학, 컴퓨터 기술 등의 새로운 기술의 집약과 다양한 학문 분야의 협력이 요구되는 자본·기술 집약적인 분야인 만큼, 인프라 구축을 위한 국가의 전폭적인 지원이 필요하다. 또한, 미국, 독일, 영국, 일본 등, 이 분야 선진국의 경우와 같이 일관성 있고 체계적인 연구가 수행될 수 있도록 국가차원의 시스템생물학 연구소의 설립이 시급하다고 볼 수 있다. 뿐만 아니라, 시스템생물학이 실효를 거두어 나가기 위해서는 무엇보다 실험생물학자가 전통적인 접근방법의 고수에서 벗어나 실험계획의 단계에서부터 시스템과학 전공자와 의논할 수 있는 학문적 분위기가 조성되어야 하고, 열린 생각(Open-mind)과 진정한 공동연구수행을 위한 상호노력이 이루어져야 할 것이다.
표4. 키워드 “systems biology”로 검색한 국가별 누적논문 통계
|
순위 |
국가 |
~2009년 |
~2010년 |
1년간 논문 증가율 |
|
1 |
미국 |
1601 |
2101 |
23.80% |
|
2 |
영국 |
426 |
569 |
25.13% |
|
3 |
독일 |
382 |
494 |
22.67% |
|
4 |
프랑스 |
160 |
204 |
21.57% |
|
5 |
중국 |
127 |
198 |
35.86% |
|
6 |
일본 |
143 |
183 |
21.86% |
|
7 |
스페인 |
108 |
141 |
23.40% |
|
8 |
캐나다 |
108 |
141 |
23.40% |
|
9 |
이탈리아 |
95 |
134 |
29.10% |
|
10 |
네덜란드 |
97 |
126 |
23.02% |
|
11 |
스위스 |
79 |
96 |
17.71% |
|
12 |
스웨덴 |
59 |
82 |
28.05% |
|
13 |
대한민국 |
44 |
61 |
27.87% |
|
14 |
이스라엘 |
34 |
48 |
29.17% |
|
15 |
벨기에 |
29 |
43 |
32.56% |
출처: 자체 자료
표5. 신약 관련 기업의 시스템생물학연구 현황 (2009년 백서 자료 중심으로 수정)
|
연구센터 |
주 소 |
연 구 내 용 |
|
AstraZeneca |
“Pathway program” MIT (Doug Lauffenburger's systems biology lab)와 함께 암 및 염증 질환에 대한 컴퓨터 모델 연구 |
|
|
Beyond Genomics |
시스템생물학을 적용한 신약 및 바이오마커 발굴 |
|
|
Bioseek |
시스템생물학 기법을 이용 인간의 주요 세포 질환 모델들을 연구 |
|
|
Cellnomica |
in silico 암 연구 |
|
|
Cellzome |
신약 표적의 발굴, 검증 및 신약개발을 위한 기능적 단백질체 기술 개발 |
|
|
CombinatoRx zalicus |
http://www.zalicus.com |
시스템생물학 기법을 통한 면역 및 대사질환 치료 약물 개발 |
|
CytoPathFinder |
세포기반 스크리닝을 위한 transfection microarray 개발 |
|
|
Eli Lilly Center for Systems biology |
회사의 신약개발 노력을 지원하기 위한 단백질 및 유전체 기술의 통합에 주력 |
|
|
Entelos |
PhysioLab 기술을 이용한 질병의 컴퓨터 모델 개발. Pfizer와 협력관계 |
|
|
Ingenuity |
시스템생물학 통합 소프트웨어 및 지식 DB 개발 (omics data와 model biological system 을 분석하는 툴 제공) |
|
|
Johnson & Johnson |
Georgia Institute of Technology와 연구협력을 체결하고 의과학 연구에 중점을 둔 다학제간 협력연구를 수행 |
|
|
Roche |
스위스의 SystemsX 프로그램과 3년간 연구협력을 체결하여 베타세포(beta cell) 손상을 진단하는 바이오마커 발굴과 신약개발을 수행 |
출처: 2009 생명공학백서 내용 수정·보완
6. 구조생물학
가. 구조생물학 연구의 개요
생명현상을 원자수준에서 관찰하여 원천적인 기작의 이해에 공헌하여 온 구조생물학은 단백질 대량발현 및 정제 기술, 결정화로봇의 진보, 방사광가속기를 이용한 위상의 결정 등 관련기술의 비약적인 발전으로 구조규명이 가능한 단백질의 범위가 넓어지고 구조 규명의 속도도 빨라지게 되었다. 따라서 기존에는 단순한 원자수준 구조규명을 통한 생명 현상의 이해 자체에 의의를 두는 경우가 많았으나 최근에는 구조규명을 통해 얻어진 결과를 바탕으로 신약개발에 응용하는 연구가 더욱 활기를 띠게 되었다.
또한 기술적인 측면으로 4세대 가속기가 대두되어 구조생물학 분야에 또 다른 혁신을 가져오게 되었다. 원형의 저장링에서 방사형으로 나오는 엑스선을 이용하는 3세대 가속기와는 달리 직선의 가속기에서 생산되는 엑스선을 이용하는 4세대 가속기는 3세대 가속기와 비교하여 10억배 이상 강한 빛을 얻을 수 있고 펨토초의 펄스빔을 생산하여 순간에 일어나는 생명현상을 원자수준에서 관찰할 수 있게 해 준다.
본 소고에서는 구조생물학의 신약개발응용에 대한 최근 경향을 알 수 있는 G-단백질 복합 수용체 (G-protein coupled receptor, GPCR), 단백질인산화효소 (protein kinase, PK), 단백질탈인산화효소 (protein phosphatase, PP) 를 표적으로 한 구조연구 및 신약개발 동향과 4세대 가속기를 이용한 단백질 구조규명기술 개발 동향을 조망해 보고자 한다.
나. 해외동향
(1) GPCR 구조 및 응용
세포막의 바깥쪽에 일부분이 노출되어 있는 막단백질들을 자극함으로써 세포 안의 기능을 조절할 수 있는 막단백질들은 질병치료제 개발의 좋은 표적 단백질들이 되곤 하는데 그중 대표적인 막단백질이 GPCR 이다. GPCR 은 인체에 약 800 여종 존재하며 지질막을 가로지르는 일곱 개의 헬릭스를 중심으로 하는 막단백질이다. GPCR 은 현재 사용되고 있는 질병치료제의 약 30% 이상이 표적으로 하고 있는 매우 중요한 치료제 표적 단백질군이다.
그런데 GPCR 의 구조가 좀체로 규명되지 않았던 것은 GPCR 이 지질막에 뭍혀 있는 integral 막단백질이기 때문이다. 그런데 최근에 항체와의 복합체 형성, T4-라이소자임 융합단백질의 이용 등으로 몇 개의 GPCR 의 경우 결정화가 가능해져서 구조규명이 수행되었다. 최초로 규명된 신약표적 GPCR 은 베타-2-아드레너직 수용체로서 이 수용체의 기능조절제는 베타 블로커 (beta-blocker) 라고 불리우며 심장병, 고혈압 등에 널리 사용되어 왔다.
최근 연구의 결과로 베타-2-아드레너직 수용체의 아고니스트인 carazolol 및 timolol 과 수용체의 복합체 구조가 규명되어 GPCR 과 리간드의 상호작용에 대한 자세한 정보가 밝혀졌고 새로운 조절제의 설계에 공헌할 것으로 기대되고 있다. 이들의 결정화에 사용된 것과 비슷한 기술들을 사용하여 베타-1-아드레너직 수용체와 cyanopindolol 의 복합체도 구조가 규명되었고 A2A 아데노신 수용체의 구조도 규명되었다.
(2) PK의 구조 및 응용
PK의 구조를 사용한 신약개발의 대표적인 예로서 백혈병의 치료제로서 최근 각광받고 있는 글리벡을 들 수 있는데 글리벡은 지금까지 개발된 암치료제와는 달리 선택적인 표적만을 조절함에 의해서 부작용이 적은 효과적인 치료제이다. 글리벡의 성공으로 다른 PK 를 이용하여 신약을 개발하려는 노력이 최근에 활발하게 진행되고 있다 (표 1).
PK 의 구조는 활성 도메인 (catalytic domain) 의 구조가 대부분인데 이 활성 도메인 중에서도 ATP 결합부위가 신약의 결합부위로서 가장 많이 사용되고 있다. 그러나 ATP 결합부위를 표적으로 하는 것은 모든 PK 가 동일한 ATP 결합 포켓을 갖고 있다는 것 때문에 리간드 선택성 문제에서 어려움을 갖고 있다. 글리벡의 경우에는 다행히 결합포켓을 이루고 있는 아미노산의 차이를 이용하여 선택적인 저해제를 개발할 수 있었지만 이것이 모든 PK 마다 적용되는 것이 아니어서 최근에는 알로스테릭 부위를 이용하려는 노력도 함께 진행되고 있다.
PK의 알로스테릭 부위는 활성부위와는 좀 떨어져 있으면서 활성에 영향을 미치게 되는데 좋은 예는 PKC isoform 에 존재하는 알로스테릭 부위가 해당된다. 이러한 알로스테릭 부위에는 칼슘이온, 다이아실글리세롤, 포스파티딜세린 등이 결합하여 활성부위의 활성도를 조절하게 되는데 이런 알로스테릭 부위들은 각 PK마다 어느정도 독특한 분자표면을 갖고 있으므로 선택적인 저해제를 설계하는 데 많이 사용되고 있다.
표 1. PK를 이용한 신약의 개발 현황
|
신약명 |
표적 PK |
허가여부 |
표적질환 |
|
Gleevac |
ABL |
Approved |
CML |
|
Iressa |
EGFR |
" |
non-small cell lung cancer |
|
Tarceva |
EGFR |
" |
metastatc non-small cell lung cancer |
|
Erbitux |
EGFR |
" |
metastatic colorectal cancer |
|
Vectibix |
EGFR |
" |
Colorectal cancer |
|
Sutent |
VEGFR2 |
" |
Kidney cancer |
|
Fasudel |
Rho kinase |
" |
Cerebral vasospasm following surgery |
|
Rapamune |
mTor kinase |
" |
organ rejection in renal transplants |
|
Roscovitine |
CDK2 |
Phase II |
cancers |
|
BAY-43-9006 |
RAF1 |
Phase III |
melanoma, solid tumors |
|
Vatalanib |
VEGFR2 |
Phase III |
Colorectal cancers |
|
ZD-6474 |
VEGFR2, EGFR |
Phase II |
cancers |
|
Ruboxistaurin |
PKC |
Phase III |
diabetes |
|
BIRB-796 |
p38alpha |
Phase III |
Rheumatoid arthritis |
(3) 4세대 가속기 기술의 개발
4세대 가속기에서는 매우 강한 빛이 펨토초의 펄스로 생산되는데 단분자 상태의 원자수준 구조규명을 위해 다음 두가지의 조건을 충족하고 있다. 첫째, 강한 빛에 의해 단분자에서 나타나는 회절도 측정이 가능하게 되고 둘째, 강한 빛에 의해 시료에 damage 가 일어나게 되나 펨토초의 펄스이므로 방사선에 의한 damage 가 일어나는 것 보다 빠른 시간에 회절이 일어나고 detector에서 측정이 가능하다.
4세대 가속기에 의한 단분자 단백질의 회절자료 측정은 한번의 펄스에 의한 회절만 측정하고 나서는 시료가 분해되어 버리므로 결정에 의한 회절 측정에서와 같이 한 결정을 여러 가지 위치로 돌려 가면서 측정을 할 수 없다. 즉 구조규명을 위한 회절공간의 자료를 모두 얻을 수 없으므로 동일한 시료를 여러개 사용하여 측정하는 방법 밖에 없다. 이를 위하여 시료를 한 분자씩 분무하는 기술이 개발되었다. 이때 단분자들의 상대적 위치를 효과적으로 찾아내는 기술도 또한 개발되었다.
위상결정에는 단분자 시료와 배경사이의 영상차이를 이용한 반복적 에러최소화 방법을 이용하여 위상정보를 점차적으로 향상시키는 방법을 사용하면 원자수준 해상도의 전자밀도지도를 계산할 수 있음이 증명되었다. 본격적인 단분자의 구조규명기술을 적용하기 위한 시도들이 계속되고 있는 가운데 단분자는 아니지만 나노 크기의 결정을 이용하여 삼차구조를 규명하는 시도가 성공적으로 진행되었다. 광합성의 막단백질인 PS1 단백질의 나노결정을 이용하여 삼차구조를 규명할 수 있음을 성공적으로 입증하였다 (그림 1).

그림 1. 4세대가속기를 이용한 나노결정의 회절자료 측정 (Nature 470, 73-77 (2011))
다. 국내현황
(1) PP의 구조 및 응용
세포신호전달에서 단백질에 인산화를 하는 PK 와 아울러서 인산화된 단백질의 인산기를 띠어내는 PP 도 세포기능에 필수적인 역할을 하며 암, 당뇨병, 면역질환의 치료제 표적으로 알려져 있다. PP 는 인체에 약 100여종 존재하며 국내 연구자들은 세계에서 규명된 PP 구조의 약 반 정도인 20여개의 PP 구조를 규명하여 이분야 연구를 선도하고 있다. 또한 구조기반 신약설계를 통하여 다양한 골격의 저해제 화합물들을 선별하였다.
(2) 중요 단백질의 구조규명
세포내 단백질 대사에 관여하는 유비퀴틴 라이게이즈의 구조규명을 통한 작용기작의 설명, ATP 의존 단백질분해효소의 활성화 기작, 암관련 단백질인 MDM2 와 바이러스 단백질의 복합체 구조규명 등의 국내연구가 최고수준의 학술지에 발표되었고 이외에도 다수의 우수한 연구결과가 발표되었다.
(3) 4세대 가속기의 건설
4세대 가속기는 미국의 스탠포드에 최초의 설비가 구축되어 2010년부터 가동되기 시작하였고 일본의 Spring-8 에 두 번째의 설비가 2011년에 완공되어 2012년부터 가동될 예정이다. 그리고 유럽의 설비가 건설중에 있다. 우리나라도 학계와 정부의 적극적인 노력으로 4세대가속기 건설예산이 마련되어서 올해부터 건설이 시작되었고 2014년 완공을 앞두고 있으며 유럽의 설비보다 앞서서 완공될 예정으로 세계 3번째의 설비를 갖게 될 예정이다.
라. 발전과제
구조생물학을 이용한 신약개발 및 생명현상의 원천적 규명은 혁신적인 새로운 기술들의 개발로 인해 더욱 가속화 될 것으로 보인다. 특히 4세대 가속기를 이용하면 단백질의 결정을 만들지 않고도 단백질의 구조를 원자수준에서 규명하는 것이 가능해져서 기존의 단백질 결정학으로는 매우 제한적인 경우에만 구조규명이 가능했던 막단백질의 구조규명이 가능해 질 것으로 예상되어 막단백질의 구조를 활용한 신약개발에 공헌할 것으로 보인다.
국내의 4세대 가속기의 건설이 2010년 말에 승인된 이후 4세대 가속기를 활용한 연구분야를 활성화 하기 위한 노력이 시작되었다. 특히 구조생물학 분야에서의 응용가능성이 높은 설비이므로 구조연구 대상의 시료 제작과 아울러서 자료 측정 및 분석 소프트웨어 확립 및 개발 등의 인프라 구축이 시급하게 추진되어야 할 것으로 보인다.
우리나라의 구조생물학 분야는 짧은 역사에도 불구하고 세계최고수준의 연구결과들을 발표해 왔고 산학연의 여러 영역에서 저변을 확충하여 왔다. 여기에 세계 3번째의 4세대 가속기가 완공되어 4세대 가속기를 응용한 관련기술을 선도할 수 있게 된다면 구조생물학을 응용한 생명현상연구와 신약개발에 더욱 큰 공헌을 할 수 있을 것으로 생각된다.
7. 뇌과학
(1) 뇌과학의 개요
뇌는 생명현상을 조절, 제어, 유지하는 중심축으로써 감각, 운동과 같은 유형의 실체를 제어하는 것은 물론 사고, 기억, 감정, 언어에 이르는 고등 인지기능을 총괄적으로 관장한다.
이러한 뇌를 연구하는 뇌과학은 뇌신경계의 구조와 기능에 대해 분자세포생물학과 인지 과학적 이해를 바탕으로 다양한 신경과 정신의 활동원리를 파악하고, 궁극적으로는 인간의 정체성과 본질을 규명하고자 하는 학문이다.
현대과학이 뇌에 대한 생물학적 이해를 상당히 진전시켰음에도 불구하고 블랙박스라고 여겨지는 뇌에 대한 과학적 설명은 아직까지 풀리지 않고 있는 부분이 많으며 뇌의 구조와 기능에 대한 심도 깊은 이해와 그 응용기술의 개발은 21세기를 이끌 미래지향적인 성장 동력으로 평가되고 있다.
최근 성공적으로 상영되었던 일련의 영화에서 볼 수 있는 것처럼 오늘날 뇌에 대한 관심은 그 어느 때보다도 폭발적이라고 하겠다. 타인의 꿈에 접속하여 생각을 훔치고 인위적으로 새로운 정보를 입력시키는 내용을 담은 <인셉션(Inception, 2010)>, 뇌사자의 뇌에 접속하여 마지막 8분간의 기억을 재구성하는 <소스코드(Source Code, 2011)>, 뇌의 기능을 100% 사용하게 만드는 알약을 복용하여 180도 다른 삶을 살수 있다는 내용의 영화 <리미트리스(Limitless, 2011)>. 오늘날의 과학이 과거 우리 선조들이 꿈꾸고 발전시켜 온 상상력의 결과이듯이 이러한 뇌에 대한 영화 속의 상상도 현실로 다가올 수 있을 것이며 미래의 뇌과학은 우리의 삶을, 그리고 과학의 패러다임을 새롭게 바꾸어 갈 것이다.
(2) 해외 동향
1990년 미국에서 주창된 ‘뇌의 10년(Decade of the Brain)’ 선언 이후 뇌연구는 인류에게 남은 마지막 프론티어 분야로 전 세계적인 화두가 되었고 그 결과 뇌과학은 비약적으로 발전 하였다고 평가된다. 그러나 안타깝게도 10년에서 20년내에 획기적인 치료법이 개발될 것으로 보였던 만성 신경질환(치매, 파킨슨병 등)이나 정신질환(우울증, 편집증 등)에서 아직까지 기대했던 만큼의 반가운 소식은 들리지 않는다. 뇌연구가 우리들 삶에 직접적인 도움을 줄 수 있으려면 아직까지 헤쳐 나가야 할 길이 멀다는 뜻이기도 하다.
이러한 뇌과학의 풀리지 않는 문제를 해결하기 위해 전 세계적으로 뇌연구가 국가연구개발의 주요 연구분야로 강조되고 있는데 주요국가의 뇌연구 동향을 보면 다른 분야와 대비하여 정부가 뇌과학 분야의 연구와 지원방향을 주도한다는 점이 특징으로 나타나고 있다.
[표7-1] 주요국가의 뇌연구 동향
|
국가 |
주요기관 |
특징 |
비고 |
|
|
미국 |
-국립보건원(NIH) -국립과학재단 (NSF) |
-‘뇌의 10년’ 프로그램 종료 후, 2005년 국립보건원 산하 16개 연구소를 중심으로 Blueprint for Neuroscience를 제시하고, 신경퇴행(2007), 신경발생(2008), 신경가소성(2009) 등 특정분야에 연구역량을 집중하는 정책 시행 -학제간 연구의 장려를 위해 NIH는 산하 12개 연구소의 150여 뇌과학 분야 실험실을 연합하여 Neuroscience@NIH라는 거대한 공동체를 출범 -2011년 NIH 총예산은 320억 달러이며 이 중 신경과학 분야는 52억달러로 전체예산의 16% 정도를 차지 |
1990년 ‘뇌의 10년’ 선언 이후 세계적으로 뇌연구의 주도권 보유 |
|
|
일본 |
-이화학연구소의 뇌연구종합연구소(RIKEN BSI) |
-‘뇌과학프로젝트(1997~2016)’를 통한 집중적인 뇌연구 추진 -2003년 뇌연구를 사회과학과 접목하여 건강한 뇌발달을 연구하는 뇌의 양육 프로그램 시작 -2004년부터는 융합적 뇌연구 수행을 위한 통합뇌 및 계산뇌 프로그램을 출범하고 NT, IT 등의 학제간 협력연구를 강화 -2008년 뇌과학 연구를 핵심 연구과제로 신규 선정 -2011년 일본의 과학기술관계 예산은 36,485억엔이며 이 예산의 대부분은 문부과학성이 67.1%를 차지, 경제산업성이 16.1%를 차지. 문부과학성은 연구개발에 3조엔 정도를 사용하고 있으며, 뇌 관련예산은 1,000만엔(1조원) 규모로 추정됨 |
미국에 대응하여 21세기를 ‘뇌의 세기’라고 명명 |
|
|
유럽 |
영국 |
-MRC (Medical Research Council) -Welcome Trust |
-뇌신경 전 분야에 걸친 투자 및 연구를 통해 미국에 이은 세계 2위의 위치를 고수 -임상의학과 산업화에 적용하기 위한 프로그램의 활성화 -실제 영국에서 발표되는 뇌연구 논문 중 절반이상이 뇌질환 연구에 집중되는 경향 |
국가단위를 초월하여 범유럽적 연구개발사업 추진 |
|
프랑스 |
-CNRS -INSERM |
-유럽연합 7차 프레임워크 프로그램(FP7)의 일환으로 NAD(Nanoparticles for the therapy and diagnosis of Alzheimer's disease)프로젝트 운영 -신경과학 특화 테마별 연구 네트워크 The Ecole des Neuroscience de Paris-lle-de-France(ENP) 결성 |
||
|
독일 |
-막스플랑크연구협의회 (MPI) |
-신경정신의학 분야의 기초과학연구와 임상연구 간의 상호보완적 연구 장려 -정신과 병원을 부속기관으로 운영 -정부정책에서 자연과학 각 분야 간의 융합이 점차 강조되어 융합학문에 대한 지원이 늘고 있는 추세 |
||
|
중국 |
-Institute of Neuroscience(ION), Beijing MRI Center for Brain Research(BMCB) 등 세계적인 신경과학 연구소 육성 |
|
||
|
인도 |
-National Brain Research Center(NBRC), 다학제적인 신경과학 연구센터(Interdisciplinary Neuroscience Research Center) 등 다수의 국립 연구소를 운영하고 있으며, 해외 유수 기관과 연구협정 체결 |
|
||
* 국제뇌연구개발과 산업화 관련 해외기술 및 시장동향 조사, 뇌기능활용및뇌질환치료기술개발연구사업단, 2009.11, 2011.3
(3) 국내 현황
우리나라의 뇌과학에 대한 국가차원의 지원은 1998년 ‘뇌연구촉진법’의 제정으로부터 시작된다. 정부는 ‘뇌연구촉진법’에 근거하여 10년마다 뇌연구촉진기본계획을 수립․시행하고 있는데 1998년 시작된 ‘제1차 뇌연구촉진기본계획(1998~2007)’은 2007년 종료되었고, 2008년부터 국립뇌연구소 설립을 포함한 ‘제2차 뇌연구촉진기본계획(2008~2017)’에 따른 뇌연구 지원이 시행되고 있다.
[표 7-2] 주요 정책 동향
|
연도 |
추진내용 |
|
1998년 |
-‘뇌연구촉진법’ 제정 |
|
1999년 |
-범부처 차원의 ‘제1차 뇌연구촉진기본계획(BRAINTECH21)’ 수립, 시행 -‘뇌신경생물학사업단’, ‘뇌의약학사업단’, ‘뇌신경정보학사업단’ 3개 국책사업단 발족 |
|
2003년 |
-21세기 프론티어연구개발사업의 일환으로 ‘뇌기능활용및뇌질환치료기술개발연구사업단’ 출범 |
|
2008년 |
-‘제2차 뇌연구촉진기본계획(2008~2017)’ 수립, 시행 -연구기반 조성에서 탈피하여 원천기술 확보를 목표로 함 -뇌과학 분야의 세계적인 추세를 반영하여 연구분야에 있어서 기존의 뇌신경생물, 뇌의약학, 뇌신경정보학 외에 뇌인지과학 및 뇌융합연구 분야 신설 -학제간 융합을 위한 ‘한국 뇌연구원 설립추진기획단’ 발족 |
|
2011년 |
-‘한국뇌연구원’ 설립 유치기관 선정(대구․경북-DGIST 컨소시움) -‘한국뇌연구원’을 대구경북과학기술원(DGIST) 부설(연)으로 설립 추진토록하여 2014년 개원 예정 -‘한국뇌연구원’의 운영은 내․외부간 연계연구를 활성화하기 위하여 Hub-Spoke 개념을 적용한 유연한 개방형 연구시스템 도입 |
2011년 국내 뇌연구 투자규모는 전년 대비 0.5%증가한 633억원으로 교육과학기술부가 전체의 62%(395억원)를 차지하고 있으며, 지식경제부 2%(15억원), 보건복지부 24%(152억원), 정부출연연구기관이 11%(70억원)순으로 투자될 예정이다.
[표 7-3] 2010/2011 뇌연구 투자 실적 및 계획
*( )는 민간/ 단위 : 백만원
|
기관 |
사업명 |
사업기간 |
’10년 실적 |
’11년 계획 |
|
교육 과학 기술부 |
◦집단 연구자 지원사업 - 선도연구센터 지원 ◦21세기프론티어연구개발사업 -뇌기능활용및뇌질환치료기술개발연구사업 ◦뇌과학원천기술개발사업 - 뇌과학원천기술개발 -한국뇌연구원 설립운영 -뇌영상용 초고자장(7.0T) MRI 연구개발 -초고자장 MRI-PET 복합영상기반 뇌질환 치료기술개발 ◦신약개발지원센터 -신약개발지원센터 ◦개인 연구지원 사업 -일반연구자 지원 -중견연구자 지원 -리더연구자 지원 |
’02~계속
’03.9~’13.3
’06.11~’15.9 ’09.6~’14.5 ’05.4~’12.3 ’08.8~’13.7
’09~’38
’99~계속 ’99~계속 ’99~계속 |
1,005 1,005 9,450 (975) 5,928 4,000 600 720 608 2,389 2,389 21,649 8,913 8,562 4,174 |
1,000 1,000 9,000 (888) 7,360 6,000 - 720 640 2,093 2,093 20,036 7,300 8,562 4,174 |
|
소 계 |
|
40,421 (975) |
39,489 (888) |
|
|
지식 경제부 |
◦산업원천기술개발사업 -차세대분자영상시스템개발사업
|
’07.9~’14.8
|
1,527 (970) |
1,527 (970) |
|
소 계 |
|
1,527 (970) |
1,527 (970) |
|
|
보건 복지부 |
◦보건의료 연구개발사업 -뇌의약학 분야사업 -질병관리연구 |
’98~계속 ’10~계속 |
13,381 (1,631) 597 |
14,600 (1,700) 597 |
|
소 계 |
|
13,978 (1,631) |
15,197 (1,700) |
|
|
출연 연구 기관 |
◦한국생명공학연구원 -전사단계에서 도파민 신경세포의 발생 및 유지에 관한 연구: 파킨슨병 새로운 치료전략 탐색 -초파리 모델을 이용한 신경 펩타이드 기전 연구 |
’09.6~’11.12
’09.1~’13.12 |
901 610
291 |
800 600
200 |
|
◦한국과학기술연구원 -복합기술을 이용한 뇌기능 연구 |
’05.11~’14.12 |
2,179 2,179 |
2,500 2,500 |
|
|
◦한국표준과학연구원 -차세대 뇌인지 측정기술개발 |
’10.1~’12.12 |
1,700 1,700 |
1,480 1,480 |
|
|
◦한국한의학연구원 -한의학기반 뇌혈관질환 원천기술 개발 |
’05.3~’13.12 |
1,369 1,369 |
1,287 1,287 |
|
|
◦한국전자통신연구원 -생체내장형 신경계 인터페이스 시스템 개발사업 |
’08.1~’11.12 |
700 700 |
700 700 |
|
|
◦한국과학기술정보연구원 -기초연구실험데이터 글로벌 허브 구축사업 |
’10.3~’11.9 |
200 200 |
300 300 |
|
|
소 계 |
|
7,049 |
7,067 |
|
|
총 계 |
|
62,975 (3,576) |
63,280 (6,558)* |
|
* 2011년 뇌연구촉진시행계획, 교육과학기술부, 2011.6
이러한 뇌연구의 투자규모는 국내 생명공학 전체연구비의 5~6% 수준으로 미국 NIH를 포함한 주요 선진국들이 전체 R&D예산의 16% 전후의 비율을 뇌연구에 투자한다는 사실에 비추어보면 턱없이 부족한 실정이다. 그러나 열악한 투자여건 속에서도 우리나라의 뇌연구는 꾸준한 성장을 이루어 왔다.
2010년 국내 뇌연구 성과는 SCI 논문수는 719건으로 1998년 65건, 2008년 519건에 대비하여 크게 상승하였으며, 지적재산권 확보에 있어서도 국내 출원 112건, 등록 32건, 국외출원 41건, 등록 21건을 확보하였고 기술이전도 6건이 성사되었다.
(4) 발전과제 및 전망
뇌기능의 이해, 뇌질환의 극복 등 뇌과학의 해결되지 않은 문제 해결은 인류의 고령화 현상과 맞물려 더욱 그 중요성이 증가하고 있다. 반면에 수많은 신약개발의 분자표적이 지속적인 탐색과 개발을 기다리고 있다. 비록 선진국에 비해서 우리가 후발주자이긴 하지만 융합과 분화를 가속하고 있는 뇌과학의 특성으로 인하여 오히려 더 많은 기회가 우리 앞에 기다리고 있다.
뇌연구는 BT, IT, NT 및 CS(인지과학) 융합을 통한 신산업 창출의 블루오션으로, 고령화 사회 진입과 함께 전 세계적으로 그 중요성이 더욱 강조되고 있으며 앞서 살펴 본 것처럼 정부에서도 1998년 ‘뇌연구촉진법’ 제정이후 1, 2차 뇌연구촉진기본계획 수립․시행으로 뇌연구의 촉진을 위해 노력해 오고 있다.
최근 뇌과학에 있어서 중요한 국가정책이 결실을 맺어 앞으로의 미래가 기대되고 있다. 지난 2007년 부터 추진되어 온 국립뇌연구소인 ‘한국뇌연구원’ 설립이 올해 6월 드디어 유치기관 선정이 확정됨으로써 대구경북지역에 설립되게 된 것이다. 정부의 발표에 따르면 한국뇌연구원은 대구경북과학기술원(DGIST) 부설(연)으로 2012년에 착공하여 2014년에 개원할 예정이며 정부는 설계비, 운영비, 연구개발비 등 총 638억원을 지원하며 지자체는 부지 제공 및 건축비를 부담할 계획이라고 한다.
우리 모두가 주지하다시피 ‘한국뇌연구원’이 국가를 대표하는 뇌연구소가 되어 뇌연구의 획기적 발전을 견인하기 위해서는 단순히 연구소 설립에 그쳐서는 안되며 세계적 수준의 내실있는 운영이 뒤따라야만 한다. 특히 국내 뇌연구 능력을 선진국 수준으로 도약시키기 위해서는 장기적인 안목으로 안정적인 R&D 예산을 지속적으로 투자해야만 할 것이다.
우리나라가 ‘한국뇌연구원’의 설립을 기점으로 인류의 최후 도전이자 21세기의 블루오션인 뇌연구의 경쟁대열에서 선두에 설 수 있기를 기대한다.
8. 산업현황
생명과학산업 (바이오산업, bioindustry)이란 생명과학기술(biotechnology)을 바탕으로 생물체의 기능과 정보를 활용하여 인류가 필요로 하는 유용한 물질과 서비스를 생산하는 산업을 총칭하는 것으로 산업연구원이 정한 표준산업분류와 기술 분류 기준을 적용하여 바이오의약산업 등 8개 세부업종으로 분류된다. 본 생명과학 분야 산업현황에서는 2009년 말 기준 전체 생명과학산업분야의 국내현황을 리뷰하고 본 생명공학백서 제 4장 1절에서 다루는 7개 생명과학(오믹스, omics) 연구분야에 관련된 산업현황을 기술하고자 한다.
가. 생명과학기업 일반현황
(1) 생명과학산업체의 주 업종 분포
2010년 9월 기준 국내 지역별 바이오클러스터관련 기업, 한국바이오협회의 등록기업 자료 등을 활용하여 선정된 1,100여개 기업 중 853개 기업의 조사결과 한국표준산업분류 상 농업, 제조업에서 서비스업까지 다양한 분포를 보이고 있다. 이중 의약품 제조업 29.1%, 기타 식품 제조업 18.5%, 기타 화학제품 제조업 13.6%, 자연과학 연구개발업 8.1% 상위 4개 업종이 전체의 70%를 차지하고 있으며 나머지 32개 업종 대부분이 1% 미만의 비율로 산술적으로 다양성을 보이나 실질적으로는 4가지 업종에 집중된 분포를 보인다.
(2) 생명과학산업 활동 및 생명공학기술 이용현황
생명공학기술을 이용하여 산업활동을 하는 분야는 업종분포와 비슷하게 바이오의약산업이 31.9%로 가장 큰 부분을 나타내며 이어서 바이오식품산업 22.4%, 바이오화학산업 14.5%, 바이오환경산업이 13.0%의 순서로 활동비중이 크게 나타나고 있다.
현재 연구개발 중인 분야가 있는 기업은 전체의 93.2%이며 임상/필드테스트 단계인 기업은 19.2%, 조정/인허가 단계 기업이 15.1%, 승인/제조판매(서비스제공) 단계인 기업이 66.7%로 나타났다.
생명공학기술 중 생물공정기술이 45.1%의 기업에서 사용되며 그 다음으로 생물자원 생산 및 이용기술(33.0%), 단백질공학기술(24.8%), 유전공학기술(22.5%) 등이 기업들에 널리 사용되고 있다. 한편 조사기업의 94.6%가 생명공학기술을 연구하거나 연구개발에 이용하고 있으며 47.9%가 제조 생산에 이용하고 있다.
(3) 생명과학산업 기업규모, 투자 현황 및 매출발생 현황
생명과학기업 중 총 종사가 규모가 50인 이하 기업이 전체의 62.1%, 1996년 이후 창업기업이 61.1%로 소규모이며 1990년대 후반 이후 창업한 기업이 많다.
금융감독원 등 공시된 기업 정보에 따르면 국내 바이오기업 자본금 규모는 평균 130억원이며 업종별로 볼때 바이오화학산업이 평균 258억원으로 가장 크다. 반면 바이오검정, 정보서비스 및 연구개발업이 17억원으로 가장 작은 자본금 규모를 가지고 있다. 한편 국내 바이오산업체의 자기자본비율은 평균 50.8%이다.
2009년도 조사기업의 바이오산업 총 투자액은 1조 1,809억원으로 연구개발 투자 8,761억원, 시설 투자 3,048억원으로 구성되어 있다. 한편 2008년도 총 투자액은 1조 1,972억원이며 이 중 연구개발 투자는 7,293억원, 시설투자는 4,679억원이어서 연구개발 투자는 전년대비 20.1% 증가하였고 시설투자는 34.8% 감소한 것으로 나타났다.
국내 생명과학 산업체 중 34.2%가 2009년 말 기준 매출이 발생하지 않고 있으며 개발한 제품을 판매하여 매출이 발생한 64%의 기업 중 손익분기점을 넘긴 기업은 18.5%에 불과하여 현재까지 많은 생명과학기업이 개발된 제품/기술을 통한 이익실현 보다는 기술/제품 개발 및 투자확대의 단계이다
(4) 생명과학산업 생산 및 수입규모
2009년 국내 바이오산업 생산 규모는 5조 6,362억원으로 2008년도의 4조 5,120억원 대비 24.9% 증가하였으며 이중 국내 판매액 증가율을 10.9%, 수출액 증가율은 43.3%로 나타났다. 2007년도 생산규모는 3조 7,139억원으로 2008년도 생산규모 증가율은 21.5%였으며 이중 국내판매액 증가율은 36.3%, 수출액 증가율은 33.1%로 최근 수출부문의 성장이 빠르게 이루어지고 있다.
분야별 생산 비중은 바이오의약 (49.2%), 바이오식품(27.2%)이 대부분을 차지하고 있으며, 바이오검정, 정보서비스 및 연구개발(6.1%), 바이오화학(5.9%), 바이오환경(4.0%) 바이오공정 및 기기(3.8%)의 순서를 보이고 있다.
나. 오믹스관련 생명과학산업 현황
(1) 오믹스관련 산업과 맞춤의학
(가) 개인별 맞춤의학과 산업현황
최근 개인별 맞춤의학이 전 세계적으로 사회·경제·정책적 이슈들과 함께 현재 보건의료산업의 메가트렌드로 급부상하고 있다. 이러한 현상은 최근 비약적인 발전을 보이고 있는 게놈분석기술과 이에 따른 급격한 시퀀싱 비용 하락에 힘입은 바 크다. 2005년부터 상용화가 된 차세대 염기서열 분석 장치(Next Generation Sequencing)의 발전으로 인해 유전체 해독 비용은 10년 전에 비해 십만 배 이상 줄어들어 현재 1명 분석에 필요한 비용이 4,000달러 이내에 가능하게 되었으며 머지않아 1,000 달러 게놈시대를 맞이하게 될 것으로 예상된다. 세계적으로 이 분야에서 치열한 경쟁이 이루어지고 있으며 대표적 기업으로 Illumina, Life Technologies, Pacific Biosciences 등의 NGS 장비회사와 Complete Genomics, Illumina, BGI (Beijing Genome Institute) 등의 시퀀싱 서비스 제공회사 등이 있다.
국내의 경우 장비부문에서 삼성종합기술원과 마크로젠이 2010년부터 지식경제부 지원과제를 통하여 3세대 염기서열분석기 개발을 진행하고 있으며 유전체 분석 분야에서는 마크로젠이 20여대의 NGS 기기를 가지고 IGN(Illumina Genome Network)에 참여하여 국내외에 유전체분석 서비스를 활발히 하고 있다. 특히 마크로젠은 최근 몇 년간 서울의대 유전체의학연구소와 공동으로 Nature지 등에 여러편의 유전체분석 논문을 발표하여 이 분야에서 세계적 수준의 능력을 가지고 있음을 증명하였다. 또한 최근 테라젠과 디엔에이링크사 등도 본격적으로 유전자 염기서열분석 사업에 참여하고 있다. 그럼에도 불구하고 이는 현재 약 200여 대의 차세대 염기서열 분석 장치를 보유하고 있으며 운영비로만 매년 4~5,000억 원을 사용하고 있는 중국의 BGI에 비해 양적인 면에서 많이 부족한 상황이고 질적인 면에서도 미국, 영국 등 선진국은 물론 유전체연구의 같은 후발주자인 중국에게조차 뒤쳐질 상황이다.
(나) 바이오마커 (Biomarker)
개인별 맞춤의학의 도래와 함께 가장 중요한 것 중 하나가 바이오마커이다. 바이오마커는 유전자와 유전적 변이, 그로 인한 RNA, 단백질, 대사물질 발현의 차이를 모두 아우르는 분자적, 생물학적 지표로 현재의 치료 위주의 의료시스템에서 질병의 조기 발견 및 치료 모니터링을 통한 예방의학으로 패러다임이 변화를 유도할 핵심이다.
Business Insights(2006)에 의하면 세계 바이오마커 시장은 2005년 54억 달러에서 연평균 21.6% 성장하여 2012년에는 212억 달러의 시장을 형성할 것으로 전망하고 있다. 특히 proteomics를 기반으로 하는 바이오마커 시장은 연평균 30.8% 성장하여 2012년 105억 달러 시장 규모로 바이오마커 전체 시장의 50%를 육박할 것으로 예상되고 있으며, metabolomics를 기반으로 한 바이오마커 시장도 연평균 48.5%의 매우 빠른 성장할 것으로 예상된다.
그러나 국내에서의 바이오마커 개발에 대한 투자는 다른 선진국에 비해 미미한 실정으로 주로 학계와 마크로젠, 디앤피바이오텍, 지노믹트리, SNP Genetics, 프로탄바이오, 씨젠, 바이오메드랩 등 바이오벤처 기업에서 국가 과제들과 연계한 질환 마커 발굴과 유용성 검증 및 임상검증을 추진하고 있다
<국내 분자진단 기업의 연구개발 현황>
|
기업명 |
개발내용 |
|
마크로젠 |
간염 발생 관련 유전자 질환 마커, 유방암 관련 유전자 발현을 이용한 질환 마커 개발 |
|
지노믹트리 |
장암, 폐암, 위암, 자궁경부암, 간암에 대한 메틸레이션 질환 마커 개발 및 유용성검증, 임상검증 |
|
씨젠 |
ACP와 DPO 기반 동시 다중 진단법 개발 |
|
엠지메드 |
감염성/유전성 질환관련 분자진단 서비스 사업 및 분자진단키트 개발, 암유전자 검사, 신규 유전자마커 발굴 및 신규 분자진단법 개발 |
|
진매트릭스 |
RFMP 임상진단 시스템, RFMP 유전자마커 개발, HIV/ADIS-Theranostics 시스템 |
|
서린 바이오 사이언스 |
질병예측 DNA진단키트 개발, 암 진단키트 개발, 유전자 다형성을 이용한 본태성 고혈압의 진단 |
|
SNP 제네틱스 |
당뇨합병증 관련 SNP 질환 마커 |
|
디앤피바이오텍 |
폐암감수성유전자 마커 개발, 폐암예후예측 마커 개발 |
|
프로탄바이오 |
폐암진단 예후검증 단백질 마커 개발 및 유용성과 임상 검증, 진단 키트 개발 |
|
차바이오메드 |
HLA typing 검사, 혈전 및 혈액 특수검사 |
|
DNA Link |
심혈관 질환 관련 SNP 바이오 마커, 아토피 피부염관련 치료반응 예측용 질환 마커 |
|
바이오메드랩 |
자궁경부암 진단용 HPV DNA칩 개발, 장바이러스 진단용, 약제내성분석 결핵군 진단용, 성병진단용 DNA microarray 개발 |
|
디지털지노믹스 |
위염 관련 유전자 발현 질환 마커, 백혈병 진단 질환 마커 |
출처: 지식경제부 암진단기획보고서 (2011)
(다) 단백질체연구와 신약개발현황
단백질체학을 기반으로한 해외산업현황은 거대 제약사를 중심으로 대부분 신약개발과 바이오마커발굴과 연관되어 있으며 특히 단백질 구조 예측을 통한 신약후보물질을 찾아내고 이를 확인하는 것이 핵심 사항이다. 국내의 경우 학계를 중심으로 연구가 집중되고 있으며 국내 제약업계의 단백질 구조분석 연구는 매우 저조한 실정이다. 단백질 구조분석을 핵심기술로 신약을 개발하는 전문 바이오벤처로 크리스탈지노믹스사가 있으며 2010년말 기준 관절염치료제가 유럽에서 임상2상 전기완료, 수퍼박테리아 항생제가 임상1상 후기 진행중이며 분자표적 항암제도 아산병원과 연계해 임상1상 진행중이다.
(2) 세포치료제
2001년 세원셀론텍이 자가 연골세포치료제인 콘드론(Chondron)을 국내 처음으로 시판허가 받은 이후 국내에서는 2010년 8월 기준, 10개 품목의 세포치료제가 허가되어 있고 13개 품목이 임상시험을 진행 중이거나 완료단계에 있으며, 개발 중인 제품은 29개 품목에 달하고 있다. 이 중 암세포를 공격하는 면역세포치료제는 우리나라가 강점을 보이고 있는 분야로 현재 세계적으로 면역세포치료제를 허가한 나라는 미국과 우리나라뿐이다. 이노셀의 간암 세포치료제 이뮨셀-LC, 이노메디시스의 폐암치료제 이노락, 엔케이바이오의 악성림프종치료제 앤케이엠주, 크레아젠의 신장암치료제 크레아박스-알씨씨주 등 현재 국내에서는 4개 기업이 암 치료제로서 면역세포치료제의 허가를 승인받았다.
<국내에서 임상중인 세포치료제, 출처: 식약청 (2010. 12)>
|
종류 |
회사 |
적용분야 |
진행상황 |
|
줄기세포치료제 |
에프시파미셀 |
급성 뇌경색 |
임상3상 |
|
급성 심근경색 |
임상3상 |
||
|
만성 척수손상 |
임상2,3상 |
||
|
메디포스트 |
무릅연골 |
임상3상 |
|
|
비혈연조혈모세포 이식보조 |
임상1,2상 |
||
|
미숙아 폐질환 |
임상1상 |
||
|
알앤엘바이오 |
버거씨병 |
임상1,2상 |
|
|
퇴행성관절염 |
임상1,2상 |
||
|
척수손상 |
임상1상 |
||
|
안트로젠 |
변실금 |
임상2상 |
|
|
크론병누공 |
임상1,2상 |
||
|
치루 |
임상1상 |
||
|
호미오세라피 |
이식편대숙주질환 |
임상2상 |
|
|
면역세포치료제 |
이노셀 |
간암 면역세포 |
임상3상 |
|
뇌종양 면역세포 |
임상3상 |
||
|
크레아젠 |
신장암 |
임상3상 |
|
|
전립선암 |
임상2상 |
||
|
엔케이바이오 |
NKM 항암면역세포 |
임상3상 |
|
|
젬백스앤카엘 |
췌장암백신 |
임상3상 |
참고문헌
1. 지식경제부 바이오나노과, 한국바이오협회 (2010) 2009년도 국내 바이오산업 통계
2. 생명공학정책연구센터 (2011) 2010년 생명공학 주요 통계자료 모음
3. 바이오경제연구센터 (2010) Personalized Medicine의 도래
4. 바이오경제연구센터 (2010) Personalized Medicine의 실현을 위한 Biomarker
5. 이철주 (2011) 바이오마커 개발현황. Bioin 스페셜: 맞춤의학
6. 생명공학정책연구센터 (2010) 구조 단백질체학 연구 및 신약개발 활용기술
7. 바이오경제연구센터 (2010) 세포치료제: 새로운 기술의 시작
제 2절 보건의료 분야
1. 합성신약
가. 합성신약 연구의 새로운 변화
과거 제약회사들은 거대시장이 가능한 적응증을 목표로 1차 치료제를 개발하여 블록버스터를 발굴하는데 집중하였으며, Pfizer의 고지혈증 치료제 arovastatin (125억 USD), Sanofu-Aventis의 항혈전제 clopiogrel (98억 USD), Novartis의 고혈압 치료제 valsartan (60억 USD), AstraZeneca의 정신병치료제 quetiapine (51억 USD), AstraZeneca의 프로톤 펌프 저해제 esomeprazole (51억 USD) 등은 2009년에도 50억 USD 이상의 매출(자료: www.scrip100.com)을 기록하였다. 하지만, FDA의 허가기준 특히 안전성 기준이 높아지고, 유전체분석 기술이 발전함에 따라 합성신약의 경우에도 항체 치료제에 적용되었던 개인 맞춤형 치료 및 특정 환자군을 대상으로 하는 orphan drug 시장으로 관심이 옮겨가고 있다. 항암제의 맞춤 치료제 개발이 활발히 이루어지고 있으며, 다른 치료군으로도 확산되고 있다. 또한 최근 제약산업의 급속히 저하된 연구생산성을 향상시키는 대안으로 산▪학▪연 협동연구 즉 개방형 연구(open innovation)가 확대되고 있다.
나. 해외동향
(1) 연도별 FDA 신약 승인 건수
|
년도 |
1996 |
1997 |
1998 |
1999 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
2009 |
2010 |
|
합성 신약 |
53 |
39 |
30 |
35 |
27 |
24 |
17 |
21 |
31 |
18 |
18 |
16 |
21 |
19 |
15 |
|
바이오신약 |
9 |
10 |
9 |
5 |
6 |
8 |
9 |
14 |
7 |
10 |
11 |
6 |
6 |
6 |
6 |
|
계 |
62 |
49 |
39 |
40 |
33 |
32 |
26 |
35 |
38 |
28 |
29 |
22 |
27 |
25 |
21 |
<표 4-2-1-1. 연도별 FDA 승인 신약 수>
자료: Nature Reviews/ Drug Discovery 2011, p82
(2) 2010년 FDA 승인 합성 신약
<표 4-2-1-2. 2010 FDA 승인 합성신약>
|
일반명 (상품명) |
회사 |
적응증 |
기전 |
승인일 (심사형태) |
|
Dalfampridine (Ampyra) |
Acorda Thera. |
다발성 경화증 환자의 보행개선 |
potassium channel bloker |
01, 22 (P, O) |
|
Liraglutide (Victoza) |
Novo Nordisk |
2형 당뇨 |
GLP-1 agonist |
01, 25 (P) |
|
Velaglucerase α (Vpriv) |
Shire |
고세병 |
재조합 인 β-glucoserebrosidase |
02, 26 (P) |
|
Carglumic acid (Carbalgu) |
Orphan Europe |
급성 고암모니아혈증 |
carbamoyl synthetase 1 activator |
03, 18 (P, O) |
|
Polidocanol (Asclera) |
Chemisch FBRK |
거미양 정맥류, 망상 정맥 |
sclerosing agent |
03, 30 (S) |
|
Oestradiol valerate (Natazia) |
Bayer |
경구용 피임제 |
Oestrogen, Progestin 복합제 |
05, 06 (S) |
|
Carbazitaxel (Jevtana) |
Sanofi- Aventis |
전립선암 |
microtuble inhibitor |
06, 17 (P) |
|
Alcafutadine (Lastacaft) |
Vistacon Pharm. |
알러지성 결막염 |
H1 히스타민 수용체 길항제 |
07, 28 (S) |
|
Ulipristal (Ella) |
HRA Pharma |
피임제 |
progesterone 수용체 조절제 |
08, 13 (S) |
|
Fingolimod (Gilenya) |
Novartis |
다발성 경화증 |
Sphingosine 1-phosphate 수용체 조절제 |
09, 21 (P) |
|
Dabigatran (Pradaxa) |
Boehringer Ingelheim |
뇌졸중 예방 |
Direct thrombin inhibitor |
10, 10 (P) |
|
Lurasidone (Latuda) |
Sunovion |
정신질환 |
항정신병 약 |
10, 28 (S) |
|
Ceftroline (Teflaro) |
Cerexa |
피부 감염증 |
광범위 cepha 항생제 |
10, 29 (S) |
|
Tesamorelin (Egrifta) |
Theratechnologies |
HIV지방이영양증 |
성장호르몬 분비 인자 |
11, 10 (S) |
|
Eribulin (Halaven) |
Eisai |
유방암 |
microtubule inhibitor |
11, 15 (P) |
자료: Nature Reviews/ Drug Discovery 2011, p84
(P: Priority review, O: Orphan designation, S: standard review)
○ 15개 승인 합성신약 중 8종이 우선 심사 대상이었으며, 전체 환자를 대상으로 하는 약물보다는 일부 특화된 질환을 표적으로하는 약물이 다수였다.
○ 2011년 8월 26일에 FDA 승인된 ALK (anaplastic lymphoma kinase)와 EML4 (echinoderm microtuble associated protein like 4) 저해제인 Pfizer의 Xalkori (crizotinib)도 전체 비소세포성폐암 환자의 3~5% 만이 ALK-양성으로서 소수를 위한 맞춤형 치료제이다.
(3) 개인 맞춤형 치료제
<표 4-2-1-2. 맞춤형 치료를 위한 유전자 검사>
|
유전자 |
약물 |
변이 검사 |
|
ABL1 |
imatinib, dasatinib |
BCR-ABL |
|
BCR |
imatinib, dasatinib |
BCR-ABL |
|
CYP2C9 |
warfarin |
CYP2C9*2, CYP2C9*3 |
|
CYP2C19 |
clopidogrel, esomeprazole, omeprazole, phenytoin |
CYP2C19*1, *2, *3, *4, *5, *6 |
|
CYP2D6 |
codeine, fluozetine, metropolo, risperidone, tamoxifen |
CYP2D6*1, *2ABD, *3, *4ABDJK, *5, *6ABC |
|
DPYD |
capecitabine, 5-FU |
IVS14+1 G→A, DPYD*2A |
|
EGFR |
erlotinib, gefitinib |
T79M, L858R, L861Q, G719X |
|
ERBB2 |
trastuzumab |
ERBB2 |
|
HLA-B |
abacavir, carbamazepine, phenytoin |
HLA-B*5701, HLA-N*1502 |
|
HLA-DQB1 |
clozapine |
HLA-DQB1: G6672C |
|
KRAS |
cetuximab, panitumumab |
KRAS: Gly12Asp, Gly12Ala, Gly12Val, Gly12Ser, Gly12Arg |
|
TPMT |
azethiopine, mercaptopurine |
TPMT*2, *3A, *3C |
|
TYMS |
capecitabine, 5-FU |
TYMS:2R, 3R, 4R |
|
UGT1A1 |
irinotecan |
UGT1A1*28 |
|
VKORC1 |
warfarin |
VKORC1:G-639A |
자료: www.frost.com
○ 2007년, FDA는 Novartis사의 골관절염 치료제인 선택적 COX-2 저해제 lumiracoxib (plexige)을 중증 간 손상 위험성의 이유로 시장에서 철수토록 하였다. 최근 lumiracoxib으로부터 간과 관련된 부작용을 일으키는 유전자 마커가 발견되었고, 이들 마커를 소지하고 있는 환자를 대상에서 제외시켜 안전성을 확보하여 재승인을 받기 위한 연구가 현재 진행 중에 있다.
○ 특정 유전자의 과발현 및 변이검사 후 적합한 치료제와 용량 등을 환자 맞춤형으로 설정함으로서 치료효과를 높이고 안전성도 확보할 수 있다.
(4) 2010 기술계약 현황
○ 2010년 저분자 화합물의(small molecule) 기술계약 건수가 생물학적 제제(biologics)보다 2 배 이상 높다.
<그림 4-2-1-1. 생뮬학적 제제/저분자화합물 기술계약 건수>

자료: www.scrip100.com
○ 항암제가 2010년 전체 기술계약 건수의 24%, 감염증이 18%, 중추신경계가 14%로 보고되었다.
<그림 4-2-1-2. 질환군별 기술계약>

자료: www.scrip100.com
(4) 개방형 협동연구(Open innovation)의 확대
○ 블록버스터 모델이 한계에 달하고, 혁신형 신제품의 파이프라인이 고갈됨에 따라 제약회사들은 대학, 연구소 및 벤처사의 다양한 아이디어 및 신기술을 필요로 하고, 제약회사는 이들의 아이디어를 혁신 신약으로 개발할 수 있는 기술 및 노하우를 제공할 수 있으므로 개방형 협동연구가 미래의 성공 모델로 확대되고 있다.
○ 아카데미에 산재된 가설을 검증하여 산업화를 성공시키기 위한 다양한 협동모델이 진행 중이다.
- Bayer Healthcare: Grants4Targets (G4T)
Bayer의 4개 연구분야(종양, 부인과, 심혈관, 분자영상)에 대해 website에서 신청 받아 심사 후, 연구 진행상황에 따라 연구비 규모 및 지적소유권 분배 등을 결정. 제안된 target은 약물성(drugability) 및 특정 질환과의 상관성이 입증되어야 한다.
drugable target: 약물에 의해 활성이 조절될 수 있는 단백질과 연계된 유전자. 약물은 효소활성 및 단백질-단백질 상호작용을 조절하는 저분자 화합물 또는 항체나 재조합 단백질 같은 생물학적 제제 validated target: in vitro 또는 in vivo 모델에서 질환과 기전적 상관성을 나타내는 타겟. siRNA (shRNA) knowdown 또는 유전자 과발현 및 변이 효소의 in vitro 실험에서 약물에 의한 기전 조절이 증명되어야 한다. in vivo는 특정 질환모델, knockout 또는 transgenic mouse 모델을 활용한다.
- MRC Technology: Call for Targets
http://www.callfortargets.org
- Eli Lilly: Phenotypic Drug Discovery Scheme
http://www.pd2.lilly.com
- GSK: Pharma in Partnership Program (PiP)
http://www.phramainpartnership.gsk.com
- Innovative Medicine Initiative: EU 교육 프로그램
○ 맞춤형 치료제 연구 증대에 따라 제약회사와 진단회사와의 합작 및공동연구도 급격히 증가하고 있다.
<표 4-2-1-3. Roche 합작 제약/진단 항암제 프로그램>
|
파이프라인 약물 |
바이오마커 |
파이프라인 Assay |
|
RG7204 BRAF 저해제/PLX4032 RG7167 MEK 저해제/CIF |
BRAF |
cobas 4800 BRAF V600E test |
|
RG7112 MDM2 길항제 |
p53 |
AmpliChip p53 assay |
|
RG7112 MDM2 길항제 |
MDM2 |
cobas MDM2 발현 |
|
Tarceva |
EGFR |
TheraScreen EGFR 변이실험 |
|
RG7167 MEK 저해제/CIF |
KRAS |
TheraScreen KRAS 변이실험 |
|
RG1273 pertuzumab RG3502 T-DM1 |
HER1, 2, 3 AREG, BTC |
cobas 4800 HER family 발현 |
|
RG7321 PI3K 저해제 RG7422 PI3K 저해제 |
PIK3CA |
PCR PIK3A 변이 FISH PIK3CA copy number assay |
자료: www.scrip100.com
다. 국내 현황
특정 유전자 변이를 가는 환자에 대한 맞춤 치료제에 대한 연구가 진단기술의 변화에 따라 활성화되고 있다. 신약 개발 연구의 연속성을 보장하고 성공 가능성을 높이기 위해 초기 discovery부터 임상까지의 전주기적 연구가 수행되고 있으며, 글로벌 시장 진출을 위해 정부 및 산․학․연 각 분야에서 연구 효율성을 제고하기 위한 노력을 하고 있다.
라. 발전 과제
○ 신약개발에는 10~15년의 시간과 1조 이상의 개발비가 소요되므로, 제약회사는 보다 많은 환자를 대상으로 처방될 수 있는 블록버스터를 개발하여 이윤을 창출코자 하였다. 그러나 모든 질환자를 대상으로 투약 시 환자 유전형에 따라 유효성 및 안전성의 차이가 나타나므로 치료효과의 유의성을 얻기가 어렵고, 부작용 발현에 의해 까다로운 FDA의 심사기준을 만족하기 어렵게 되었다. 특정 유전형의 환자에게만 적용하여 치료효과를 극대화하는 표적 치료제의 개발 및 부작용을 일으킬 수 있는 특정 유전형의 환자를 치료대상에서 제외하여 안전성을 확보하기 위한 맞춤형 치료가 증대되고 있다.
○ 맞춤형 치료로 시장이 변화하고 있지만, 고가의 약가로 인해 환자 및 보험 부담금이 증대되는 사회적 문제점이 제시되고 있다. 임상 대상 및 기간 등의 단축을 통한 연구개발비의 경감으로 약가를 낮출 수 있는 제도적 뒷받침이 마련되어야, 환자 개개인에 특화되어 부작용 없이 치료효과가 높은 치료제의 개발이 활성화될 것이다.
○ 신약개발에 필요한 연구 내용이 다양화, 다변화되어 개방형 연구(open innovation)는 선택이 아니라 필수이다. 협동연구가 성공하기 위해서는 연구 초기부터 목표 및 역할, 지적 소유권 둥 결과물에 대한 분배에 대해서도 명확한 성정이 필요하다. 무엇보다도 파트너를 존중하고, 실패를 허용할 수 있는 신뢰가 중요할 것이다.
2. 바이오신약
가. 바이오신약의 개요
의약품은 화학합성 의약품을 중심으로하는 저분자 (small molecule) 치료제와 단백질 및 백신을 중심으로 하는 생물학적 의약품 (biologics)으로 구분된다. 바이오의약품은 바이오기술의 의약적 활용을 의미하며, 기존의 생체 내에 존재하는 물질을 의약품으로 사용하는 것은 물론, 유전자재조합, 세포융합, 세포배양 등 생명체 관련 바이오기술(BT, biotechnology)을 직접 활용하여 생산하는 치료 및 예방 목적의 의약품을 말한다.
바이오의약품은 크게 치료용 단백질, 백신, 단클론 항체로 구분할 수 있으며, 이 중에서 단클론 항체의 성장률이 가장 클 것으로 예측되고 있다 (표. 가-1). 이외에도 유전자 치료제와 세포치료제 등이 새로운 분야로 개발되고 있으나 현재까지 바이오의약품에서 이 둘의 비중은 크지 않다.
[표. 가-1] 각 분야별 의약품의 시장 예측 (2009-2015) (출처: Datamonitor)

화학의약품과 비교할 때 바이오의약품은 제품의 효능과 안전성 예측이 용이하여 제품 개발과 임상 소요 비용이 적을 뿐만 아니라, 그에 따른 산업화 성공 가능성이 높아 전 세계적으로 적극적인 기술개발이 진행되는 상황이다. 2015년을 전후하여 바이오의약품이 합성의약품을 넘어 세계적인 주력의약품으로 등장할 것으로 예상되며, 그 중에서도 각종 항체와 치료백신이 주류를 구성할 것으로 예상된다.
또한, 바이오의약품은 특허 유무와 신규성에 따라 바이오신약, 개량바이오의약품 (바이오베터), 바이오시밀러 (동등생물의약품)로 구분할 수 있다. 신규 물질로서 특허를 확보하여 높은 사업성이 보장되는 바이오신약과 개량바이오의약품과는 달리, 바이오시밀러는 특허가 만료된 오리지널 바이오의약품과 동일한 성분으로서 그 유효성과 안전성이 동등한 의약품을 말한다.
대표적인 바이오의약품인 단백질 의약품, 항체의약품, 유전자치료제, 백신에 대해 국내외의 현황을 살펴보고자 한다.
(1) 단백질 의약품
유전자 재조합 기술, 세포배양 기술, 바이오공정기술을 바탕으로 미생물이나 동물세포시스템을 이용한 대량 생산을 통해 생산된 의약용 단백질로서 질환 치료 목적에 사용되는 고부가가치제품을 말한다. 세포조절 단백질(호르몬, 성장인자, 혈액 관련 효소 등), 면역조절 단백질(Cytokine, chemokine, 항체 등), 예방용 단백질, 효소대체 단백질( beta-glucocerebrosidase, alpha-galactosidase 등) 등으로 나눌 수 있으며, 인슐린, 성장호르몬, 면역조절 사이토카인, 효소대체 치료용 등 광범위한 품목으로 개발되고 있다. 최근에 항체를 제품화한 항체의약품과 예방용 단백질인 백신 제품은 별도록 구분하는 추세이다.
구체적인 품목으로 치료의약품 중 호르몬류는 hGH, EPO, 인슐린 등이고, 성장인자는 EGF, bEGF, IGF, PDGF 등이며, 혈액 관련 효소로는 tPA, Factor VIII 등이 있다. 또한 사이토카인류는 interleukin-2, G-CSF, GM-CSF, interferon α, β, γ 등으로 대별되며, 효소 대체 치료용 단백질은 beta-glucocerebrosidase, alpha-galactosidase, iduronate-2-sulfatase, laronidase 등이 있다.
(2) 항체의약품
1975년 Köller and Milstein에 의해 단클론 항체 [monoclonal antibody (mAb)] 생산기법이 확립되어서 특이성이 높은 항체를 제한 없이 생산할 수 있게 된 이후, 마우스 유래 항체의 항원성을 줄여 치료목적으로 사용하려는 연구가 지속되어 1970년대의 마우스 항체에서 1980년대의 카이메릭 (chimeric mAb) 항체, 1990년대 인간화 항체 (humanized mAb)를 거쳐 2000년대 인간항체 개발로 발전하였다 (그림. 가-2-1).
[그림. 가-2-1] 항체 기술의 발전

항체의약품은 난치성질환 치료(암, 면역질환, 감염질환, 호흡기질환, 심혈관질환, 당뇨 및 대사 질환 등)를 위해서 대부분 표적 지향적인 치료제로 개발이 되고 있으며, 항체제조기술도 초기의 키메라 항체 개발에서 인간화항체, 완전 인간항체 기술을 이용한 의약품 개발이 진행되고 있다.
(3) 유전자치료제
유전자 치료는 유전자의 이상으로 발생하는 질병을 유전자를 투입해 치료하는 방법이다. 유전자 이상과 관련된 질병은 보통 어떤 단백질의 과다 발현 혹은 적은 발현으로 일어나게 된다. 이때 치료 유전자를 환자의 체내로 도입시켜 결손 유전자를 교정하거나 세포에 새로운 기능을 추가하여 암․감염성 질환․유전질환 등을 치료하거나 예방하는 방법을 말하는데, 이처럼 질병 치료를 목적으로 인체에 투여하기 위하여 제조된 유전물질 또는 유전물질을 이입한 세포로 구성된 의약품을 유전자 치료제라고 한다. 유전자 치료제는 특이적 유전자 발현 조절기술이 필요하여 나노 복합체, 바이러스, 세포, 표적지향 리간드, siRNA/Aptamer 등을 이용한 치료제가 개발되고 있으며, Genedicine, H101 등이 시판되고 있다. 현재 대략 1,537건의 임상시험이 진행되고 있다.
(4) 백신
백신은 다양한 감염성 질병과 암을 예방 또는 치료할 목적으로 독성을 줄인 병원체 자체나 구성분의 일부를 이용하여 면역체계의 자극을 통해 항원에 대한 특이적 반응을 유발하여 생체 내에서 항체를 유도할 수 있는 생물학적 제제를 의미하며, 예방용 백신과 치료용 백신으로 구분된다. 기존에는 감염성 질환에 대한 예방용 백신이 주종이었으나, 최근에는 면역학에 대한 이해를 바탕으로 체내에 존재하는 바이러스나 종양세포 등에 특이적으로 작용하는 면역반응을 활성화시켜 난치성질환을 치료할 수 있는 치료용 백신으로 영역이 확대되고 있다.
나. 바이오신약 개발의 해외 동향
(1) 단백질의약품
단백질 의약품은 천연단백질과 동일한 구조의 단백질을 사용하던 1세대 제품(generic), 단백질 재설계나 단백질 공학기술을 응용하여 신규 효능 또는 개선된 효능의 단백질을 사용하는 2세대 제품(개량신약)으로 분류할 수 있다. 2002년 이후 1세대 단백질 의약품의 특허만료와 함께 단백질 공학 및 분석, 제형연구의 발전으로 초기 제품의 단점을 극복한 제형이 2세대 제품으로 출시되어 성공적으로 시장에 안착함으로써 기존 단백질의약품 시장을 확대시키는 효과를 보이고 있다. 현재까지 개발된 2세대 단백질의약품은 Aranesp(hyperflycosylated-EPO, Amgen), Neulasta (N-term pegylated G-CSF, Amgen), PEG-intron A(pegylated interferon alpha-2b, Schering-Plough), Pegasys(pegylated-interferon alpha-2a, Roche) 등이 있다. 2010년 단백질 의약품 주요 제품의 시장규모는 561억 달러 규모이며, 연평균 7%의 성장률을 보이고 있다 (표. 나-1-1).
[표. 나-1-1] 단백질 의약품 제품별 2010년도 세계 시장규모 (출처 : Lamerie Business Intelligence)

PEGylation을 이용하여 지속성을 증가시켰던 2세대 제품에 이어 최근에는 polysialic acid, albumin 접합 기술, non-natural D-amino acid가 포함된 peptide 접합 기술 등을 이용하여 체내 반감기를 증가시켜려는 기술이 개발되고 있으며, 또한 생리활성물질이나 독소단백질과 융합된 단백질을 제작하여 신규 기능을 부여하는 기술 등이 개발 되고 있다. 특히 단백질의약품 대부분이 주사제임으로 통증 유발을 줄이기 위해 경구나 경피, 비강이나 폐 흡입 같은 경로로 투여하는 기술개발이 선진국 중심으로 이루어지고 있다. Momenta Pharmaceuticals의 경우 Sandoz와 함께 hGH, insulin, EPO, IFN-beta 등에 대한 폐흡입 제품개발에 노력하고 있으며, Seragen/Ligand 사는 디프테리아 독소 단백질과 IL-2 를 융합한 항암제 제품인 Ontak 을 출시하였다. 이러한 차세대 단백질 의약품들은 신규시장을 창출하며 점점 시장규모를 넓혀가고 있다 (그림. 나-1-1).
(2) 항체의약품
[그림. 나-1-1] 세대별 단백질 의약품의 발전 단계 전망 (출처: 바이오제품 시장 및 바이오기술개발 동향 - 바이오 산업원천기술개발사업)

현재까지 30여종의 항체가 암세포 표면에 발현되는 세포성장인자 수용체, 염증 유발 단백질, 신생혈관 유도 단백질, 면역세포 신호전달 수용체 등에 결합하여 이들의 작용을 억제 혹은 중화하는 항체 등이 항암 치료, 난치성 면역질환 치료, 장기이식거부반응 억제 등에 사용되고 있으며, 리툭산, 허셉틴, 휴미라, 아바스틴, 어비툭스, 엔브렐 등이 허가를 받아 시판 중에 있다 (표. 나-2-1).
세계 단클론항체 시장은 2010년 480억달러에서 2015년 800억달러로 급성장이 예견되고 있는 가운데 현재 전 세계적으로 314개의 단클론 항체 제품이 임상시험 중에 있는 것으로 알려져 있다[터프츠 약물개발 연구센터(CSDD)].
연간 세계에서 임상시험에 들어가는 단클론항체의 수는 2010년 53개로 지속적 증가를 보이고 있고, 아울러 현재 임상연구 중인 단클론항체의 51%가 항암제이고 27%가 면역질환 치료제로 집계됐다. 그리고 연평균 FDA의 허가를 받는 단클론항체의 수는 2005~2011년 사이에 13개 정도인데, 전체적으로 인간화 단클론항체가 임상시험을 완료하고 FDA의 승인을 받는 성공률은 17%에 달하다. 종류별로는 면역질환 치료 단클론항체의 개발 성공률이 26%로 가장 높은 반면, 항암제 후보의 성공률은 13%로 가장 낮았다.
[표. 나-2-1] 미국과 유럽에서 시판 중 및 심사 중에 있는 항체치료제 (출처: Reichert JM. MAbs. 3 (3):223-40. 2011)

치료용 항체는 2011년 현재까지는 인간화 항체 및 카이메릭 항체가 시장을 주도하고 있으나 향후에는 인간항체가 시장의 주류를 이룰 것으로 예측되며, 항체와 합성 약물을 결합시킨 ADC (Antibody Drug Conjugate)형태의 치료제가 시장에서 급부상할 것으로 예측 된다. 다양한 질환에 대해 치료항체가 개발되고 있는 가운데 항암 (oncology), 면역 및 염증성 질환 (immunology & inflammation) 분야의 항체가 가장 큰 부분을 차지하고 있고, 항체개발 회사로는 Genentech, Roche, Abbott, Johnson & Johnson, Merck, Novartis 등의 회사가 항체시장을 주도해 왔으며 향후에도 이 추세가 계속될 것으로 예측 된다 (표. 나-2-2).
[표. 나-2-2] 회사별 치료항체 매출 규모 (2003-2009, $m) (출처: Datamonitor)

(3) 유전자치료제
유전자치료제는 지난 50여 년간 괄목할 만한 성장을 이룬 분자생물학 및 재조합 DNA기술에 기반을 두고 있으며 1970년대 이론적인 토대가 마련되었는데, 1980년대에 레트로바이러스를 비롯한 벡터시스템에 대한 연구가 활발해지면서 유전자 치료제 개발이 가시화되었고, 1989년 최초의 유전자치료제 임상허가를 시작으로 본격적인 개발에 돌입하였다.
2009년 보고에 따르면, 진행 중에 있는 유전자치료제 임상연구 가운데 미국에서 이루어지는 연구가 975건(63.4%)으로 가장 높은 비율을 차지하고 있다. 1,537건의 임상시험 유전자치료제 가운데 종양관련치료제가 대부분을 차지하였으며(993건), 심혈관계 질환 치료제가 137건으로 그 뒤이고, 그 외에 감염성 질환 치료제와 단일 유전자 질환(Monogenic disease) 등이다 (그림. 나-3-1).
[그림. 나-3-1] 국가별 유전자치료제 임상 현황
(출처 : Gene therapy clinical trials worldwide http://www.wiley.co.uk/ genetherapy/clinical)

현재까지 이미 2건의 유전자치료제가 시판 허가를 받은 중국을 제외한 국가, 특히 선진국에서 곧 발매될 것으로 여겨지는 유전자치료제 3개 제품에 대한 현황을 소개하였다 (표. 나-3-1).
전형적인 유전자치료제 이외에 antisense 약물인 Vitravene(ISIS Pharmaceuticals)과 aptamer 약물 Macugen (Eytech 사)는 이미 시판 허가를 받고 발매되고 있어 DNA/RNA 기반 의약품의 상업화 가능성을 보여주고 있으며, 또한 다양한 방법의 유전자치료제가 개발되고 있다. 이러한 결과로 DNA/RNA 기반의 의약품의 상업화 가능성을 보여주고 있으며, DNA/RNA 기반 의약품 전체로 볼 때 현재 임상3상 시험 또는 NDA 단계에 있는 제품이 13건으로 앞으로 발매사례는 꾸준히 증가할 것으로 전망 된다 (표. 나-3-2).
단기적으로 볼 때, 이미 발매된 aptamer 제품인 Macugen이 DNA/RNA 의약품 시장의 절반 정도를 차지하여 한동안 aptamer와 antisense 제품이 전체 제품 중 상당한 비중을 차지할 것으로 예상되나 임상개발 파이프라인의 경향으로 볼 때 중장기적으로는 유전자 전달체를 기반으로 한 유전자치료제가 시장을 주도할 것으로 전망되며, RNAi의 경우 아직 기술적으로 극복되어야 할 점이 많아 당분간은 임상개발 사례가 적을 것으로 예상되나 RNAi는 전달기술이 성숙단계에 이르면 상업적 잠재성이 매우 클 것으로 전망된다.
현재 유전자치료제 등 DNA/RNA 의약품관련 연구개발은 대형 의약회사나 바이오 회사보다는 비교적 소규모의 전문화된 회사를 중심으로 이루어지고 있는데, 이들 기업들은 아직 연구․개발․판매를 전반적으로 수행할 수 있는 종합적인 의약회사나 바이오회사(FIPCO/FIBio) 형태로 성장하지 못하고 주로 특정한 기반기술(platform technology)에 집중하고 있으므로 DNA/RNA관련 기술 동향의 변화에 따라 기업의 성쇠가 민감하게 좌우되는 특징을 지니고 있으며, 임상개발 후기 단계(late-stage development)에 대한 경험이 부족한 것이 특징이므로 취약한 구조를 제휴를 통하여 보완하는 전략을 추구하고 있다.
Datamonitor의 2005년 보고서에 따르면 DNA/RNA 의약품연구개발 프로그램 중 절반 정도는 제휴나 공동개발의 형태를 취하고 있으며, 전체 제휴 중 80% 정도는 후보물질 도출 이후의 제품개발과 상업화와 관련된 제휴이나 대형 의약회사나 바이오회사가 임상개발 및 상업화단계에 가담한 경우는 전체 제휴 중 10% 수준으로 아직 저조하여 DNA/RNA 의약품이 눈에 띄는 수익창출을 보여야 대형 의약회사에 의한 본격적인 투자가 이루어질 것으로 예상된다.
아직까지 대형 의약회사에서의 본격적인 진출이 이루어지지는 않지만 세계시장은 미국을 중심으로 고성장할 것으로 예상되며, 의료시장 예측기관들은 세계 유전자치료제 시장이 2010년대에 본격적으로 확대되고, 연평균 100% 이상의 초고도 성장을 지속할 것으로 평가된다.
(4) 백신
글로벌 정보제공업체
[그림. 나-4-1] 글로벌 소아용 백신 시장 전망 (출처 : Kalorama Information)

[그림. 나-4-1] 글로벌 성인용 백신 시장 전망 (출처: Kalorama Information)

|
제약사, 개발기관 |
백신 |
적응증 |
임상현황 |
|
AFFiRiS |
PD01 |
파킨슨 질환 |
I |
|
Bavarian Nordic |
MVA-BN HIV |
HIV/AIDS |
II |
|
Bayhill Therapeutics |
BHT-3009 |
다발성 경화증 |
II |
|
Bayhill Therapeutics |
BHT-3021 |
제일형 당뇨 |
I |
|
Cytos Biotechnology |
CAD106 |
알츠하이머 |
II |
|
Cytos Biotechnology |
CYT006-AngQb |
고혈압 |
II |
|
Cytos Biotechnology |
CYT013-IL1bQb |
제이형 당뇨 |
I |
|
Diamyd Medical |
Diamyd |
제일형 당뇨 |
III |
|
GSK |
PentaStaph |
MRSA(슈퍼 박테리아) |
I |
|
Nabi Biopharmaceuticals |
NicVAX |
Smoking addiction |
III |
|
Opexa Therapeutics |
Tovaxin |
다발성 경화증 |
II |
특히 치료용 백신 시장의 가장 큰 부분인 암 치료 백신 시장은 115.3%의 연평균성장률을 기록하며 2014년 29억 달러의 시장을 형성할 전망이다. 대표적인 암치료 백신으로 작년 미국 FDA의 승인을 획득한 전립선암 치료백신인 프로벤지(Provenge, Sipuleucel-T)를 들 수 있는데, 암 치료 백신의 경우 기존 치료법과 달리 환자의 면역세포를 이용하기 때문에 일정부분 개인별 맞춤치료가 가능하며 그 결과 안전성이 높고, 암의 치료뿐 아니라 전이도 줄여 줄 수 있다는 평가를 받고 있어, 여러 회사들이 다양한 방법의 암 치료 백신 개발을 시도하고 있다.
|
제약사 |
백신 |
적응증 |
임상현황 |
|
Accentia Biopharmaceuticals |
BiovaxID |
Lymphoma(NHL) |
III |
|
Advaxis |
ADXS-HPV |
Cervical cancer |
II |
|
Bavarian Nordic |
PROSTVAC |
Prostate cancer |
III |
|
Bavarian Nordic |
MVA-BN-HER2 |
Breast cancer |
II |
|
Celldex Therapeutics |
Rindopepimut |
Glioblastoma |
II |
|
Dendreon Corp |
Neuvenge |
Breast cancer |
I |
|
Dendreon Corp |
D-3263 HCl |
Prostate cancer |
I |
|
Galena Biopharm |
Neuvax |
Breast cancer |
III |
|
Generex Biotechnology |
AE-37 |
Breast cancer |
II |
|
Generex Biotechnology |
AE-O |
Ovarian cancer |
I |
|
Generex Biotechnology |
AE-M |
Melanoma |
I |
|
Geron Corp |
GRNVAC1 |
Leukemia(AML) |
II |
|
GlobeImmune |
GI-4000 |
Colorectal cancer |
II |
|
Immatics Biotechnologies |
IMA901 |
Renal cancer |
III |
|
Immatics Biotechnologies |
IMA910 |
Colon cancer |
II |
|
Immatics Biotechnologies |
IMA950 |
Brain cancer |
I |
|
Merck |
Stimuvax |
Lung cancer(NSCLC) |
III |
|
Scancell |
SCIB2 |
Melanoma |
II |
다. 바이오신약 개발의 국내 현황
(1) 단백질의약품
국내 재조합 단백질의약품 시장은 미국과 비교해 보면 상당히 미약한 실정이며, 국내시장규모는 세계시장의 약 1.1%, 미국 시장의 약 2.7% 에 머물고 있으나, 소득 및 경제규모의 지속적인 증가로 인하여 시장규모가 급격히 증가하고 있다. 국내제약 기업들이 생산하는 대표제품으로는 인간성장호르몬(LG생명과학, 동아제약, 대웅제약, 종근당, 에스케이 케미컬), GM-CSF(LG생명과학), G-CSF(동아제약), EPO(CJ제일제당, 녹십자, 동아제약, LG생명과학, 대한제당), 인터페론(LG생명과학, CJ제일제당, 녹십자, 동아제약, 한올제약), 진단시약제제(녹십자, 동아제약, LG생명과학) 등이 있으며, 주로 1세대 제품이 대부분을 차지하고 있다.
최근 연구동향을 보면, 국내 제약기업들은 단순히 바이오 의약품을 복제하는 1세대 단백질 의약품 보다 개량된 2세대 제품을 개발하는 전략을 추진 중이다. 이와 관련 하여 단백질의약품 관련 제제의 투약 편리성을 위하여 체내에서 서서히 분비되는 서방형제제 개발연구 및 활성 증강을 위한 신제형 개발연구에 집중하고 있으며, 이를 기반으로 기존 제품보다 효능이나 복용 편리성이 강화된 제품 개발에 힘쓰고 있다. LG 생명과학의 경우 제제의 투약 편리성을 위하여 체내에서 서서히 분비되는 서방형 인성장 호르몬 제품을 개발하여 산업화 하였으며, 한올제약의 경우 아미노산 치환 기술을 이용하여 기존 단백질 의약품의 효능과 안정성이 개량된 바이오베터 개발에 집중하고 있다. 녹십자 또한 기존 단백질 의약품의 투약 편리성을 위하여 체내 반감기를 늘린 G-CSF와 EPO의 바이오 베터를 개발하여 현재 임상 준비 중에 있다 (표. 다-1-1).
|
제약사 |
제품명 |
적응증 |
진행 상황 |
|
LG 생명과학 |
SR-hGH |
서방형 인성장 호르몬 |
미국 FDA 품목허가 신청 |
|
LG 생명과학 |
디크라제 |
서방형 인성장 호르몬 |
국내출시 |
|
녹십자 |
헌터라제 |
헌터증후군 |
한국 식약청 품목허가 신청 |
|
한미약품 |
LAPS-Exendin4 |
지속형 당뇨병 치료제 |
미국,유럽 임상 2상 진행 |
|
한올바이오파마 |
HL-143 |
C형 간염치료제 |
미국 임상 2상 진행 |
(2) 항체의약품
항체의약품의 주요 적응증이 항암 및 면역질환이므로 점차 고령인구 증가로 인해 동 분야의 질환이 급속히 증가되고 있어 시장규모는 확대될 전망이다. 항체의약품의 국내 시장은 2006년 약 300억 원, 2010년 약 830억 원 규모로 성장할 것으로 전망하고 있으며, 2016년경 3,000억 원 규모로 성장할 전망이므로 만약 국내 개발 신규 항체 의약품의 제품화가 가속화될 경우 시장규모는 예측을 상회 할 가능성이 매우 높다.
국내 제약회사들은 항체의약품 개발에 지속적인 관심을 가지고 있으며, 이에 따라 특허가 만료되는 항체 치료제의 바이오시밀러 개발, 기존 항체 제품의 단점 (면역원성, 짧은 PK, 낮은 효능 등)을 향상시킨 바이오베터, 신규 타깃 확보를 통한 신규 항체 치료제 개발 등 항체 치료제 개발에 적극적인 노력과 투자가 진행되고 있다. 삼성전자, 한화, LG생명과학 등 대기업이 항체 사업에 참여하였고, 녹십자, 동아제약, 유한양행, 대웅제약, 종근당, 유영제약 등 많은 제약 기업과 셀트리온, 이수앱지스, 파맵신, 앱자인, 앱클론, 다이노나 등 많은 벤처기업에서 항체의약품 개발을 진행 중에 있다.
특히, 2009년도 삼성전자의 항체의약품 개발에 대한 참여는 제약업체에 큰 관심을 불러 일으켜, 바이오신약 개발 중 항체의약품 개발의 중요성을 확인해 주었으며, 2011년 한화의 엔브렐 바이오 시밀러가 머크사에 기술이전하는 성과도 있었다. 아울러 동아제약이 항체 바이오시밀러 사업에 참여하여 송도에 생산공장을 신설하는 것을 발표하였다. 국내 최대의 바이오의약품 생산 시설을 보유한 셀트리온은 다수의 항체 바이오시밀러를 개발하고 있는데 최근 레미케이드 바이오시밀러의 임상을 완료하였다.
항체신약 개발에서 가장 앞서가고 있는 녹십자는 B형 간염 치료용 인간 항체의 임상 1상을 완료하고 임상 2/3상을 준비 중이고, EGFR를 중화하는 인간항체 및 리툭산 바이오 시밀러는 비임상 시험 중에 있다. 이수앱지스는 2007년 항혈전 항체 Clotinab을 상업화에 성공한 이후 희귀질환 치료제 개발에 집중하면서 신규 항체 개발을 진행하고 있다.
한화는 앞에서 언급한 Enbrel biosimilar를 Merck사에 기술 이전한 것과 더불어 anti-VCAM1항체 등 다수의 항체를 개발하고 있으며, 대웅제약은 췌장암 치료항체를 개발 중이며, 앱자인은 HGF (hepatocyte growth factor)를 차단하는 암치료항체를 비롯한 다수의 항체, 파맵신은 VEGR2를 차단하는 암치료항체를 비롯한 다수의 항체를 개발하고 있다.
이외에도 서울대, KAIST, 강원대, 아주대, 이화여대, 생명공학연구소, SKAI (스크립스 코리아 항체 연구소) 등의 대학 및 국공립 연구소 등에서도 항체연구개발을 활발하게 진행하고 있다.
(3) 유전자치료제
국내의 유전자치료제는 1990년대 학계를 중심으로 3건의 임상시험이 진행된 바가 있으며, 1998년 식품의약품안전청의 유전자치료제관련 규정이 확립된 후 2001년 동아제약과 바이로메드가 공동으로 개발한 허혈성 족부질환 유전자치료제가 국내에서는 최초로 임상시험 승인을 취득하였다.
2005년 이후부터 본격적으로 의약회사와 바이오기업들의 임상시험 진입이 활발하게 이루어지고 있다. 대상 질환으로 암이 3건으로 가장 많으며, 허혈성 질환과 감염성 질환이 그 뒤를 이어 전반적으로 세계적인 동향과 유사하다. 전달벡터의 경우 plasmid DNA를 이용한 사례가 가장 많아 전체의 절반 정도 차지하고 있다. 현재까지 임상에 진입한 후보물질들은 주로 치료유전자나 항원유전자를 벡터를 이용하여 전달하는 전형적인 유전자치료제 또는 DNA 백신의 형태이며, 일부 oncolytic virus를 통하여 항암효과를 보는 표적지향성 후보물질도 있는 상황이다. 반면에 antisense나 RNAi, aptamer, ribozyme 등의 기술들은 아직 임상개발사례가 없는 실정이다.
현재 유전자치료제의 임상개발은 기업을 중심으로 이루어지고 있는데, 유명 의약회사와 함께 바이오분야에 특화된 중소기업과 바이오벤처들이 눈에 띄는 활약을 보이고 있으며, 국내 주요 유전자치료제 관련 회사들의 개발동향은 다음과 같다 (표. 다-3-1).
[표.다-3-1] 유전자치료제관련 국내기업 현황(2009년 2/4분기 기준)
(출처: 바이오제품 시장 및 바이오기술개발 동향 - 바이오 산업원천기술개발사업)

전달벡터의 경우 지금까지는 naked DNA를 이용한 경우가 다수를 차지했으나, 향후에는 아데노바이러스를 비롯한 바이러스벡터 비중이 증가할 것으로 예상된다. 이와 같이 향후 몇 년 동안 유전자치료제의 국내 임상개발 사례가 꾸준히 증가할 것으로 전망되며, 중소 바이오기업과 의약회사의 라이센싱을 통한 수익창출모델이 주를 이룰 것으로 예상된다. 한편, 글로벌 신약개발 필요성이 확대되어 해외임상개발 추진사례도 증가할 것으로 보이나, 국내 의약회사와 바이오기업들이 아직 자체적으로 글로벌수준 임상 및 마케팅 수행능력이 부족해 임상2상 시험 후 라이센싱에 주력할 것으로 예상된다.
현재 임상시험 중인 후보물질들은 아직 임상1상~2상 시험 단계로 비교적 초기단계에 있어 상업화가 가시화될 때까지 상당기간이 소요될 것으로 예상되며, 이들 제품들 중 상당수는 선도물질로서의 성격이 강하여 실제로 임상2상 시험 이후에 개발이 지속될 지는 미지수이다. 그러나 위의 제품 개발사례들은 국내 기업의 유전자치료제 개발을 위한 인프라 구축에 크게 기여하고 있으며, 지금까지 축적된 연구개발 경험과 국내 허가체계의 개선으로 향후에는 보다 최적화된 유전자치료제의 개발에 더욱 박차가 가해질 것으로 전망된다.
(4) 백신
국내의 자체 생산이 가능한 백신 종류는 5가지(B형 간염백신, 결핵백신 (BCG), 수두백신, 일본뇌염백신, 신증후군출혈열)에 불과한 상황이며, 주로 기초 예방 접종 대상 연구에 국한되고 있는 상태이나, 2009년도에 녹십자가 신종플루에 대한 백신을 자체 생산할 수 있는 기술을 확보하고, 2011년에는 SK케미컬과 LG생명과학이 세포배양기반의 독감백신 생산설비를 구축하는 등 국내 예방 백신 개발 능력은 차츰 선진국 수준에 도달하고 있다.
치료용 백신 개발은 선진국 대비 다소 뒤떨어져 있으나, 많은 바이오벤처기업과 제약업체에서 적극적인 연구가 진행되고 있다. CJ 제일제당은 국내 바이오벤쳐기업 바이오리더스사와 치료용 백신 개발을 공동연구중이며, 크레아젠은 자가유래 수지상 세포와 신장암세포를 활용하여 CreaVax-RCC라는 치료용 백신을 개발하였다. 코스닥 상장 기업인 젬백스앤카엘의 100% 자회사인 카엘젬백스사는 최초의 췌장암 치료용 백신인 GV1001을 개발하여 현재 영국에서 임상 3상을 진행중이고, 또다른 코스닥 상장 기업인 제넥신은 만성 B형 간염(GX-110, 임상 1상), 자궁경부 상피내종양(GX-188E, 전임상)에 대한 유전자 백신을 개발하고 있으며, 바이로메드에서는 이연제약과 더불어 유방암 치료 백신(VM206RY)를 개발하여 국내 임상 1상을 진행중이다. 벤처기업인 스마젠은 에이즈 백신 후보물질 ‘SAV001-H’의 임상 1상 시험을 2009년 미국 FDA에 신청한 상태이다.
라. 국내 바이오신약 개발의 발전 전망
한국의 바이오의약품 시장은 전 세계 시장의 1% 수준인데, 바이오의약품 신약후보 물질 자체확보 및 바이오의약품 개발과 관련된 인프라가 부족하고, 바이오신약 개발경험이 부족한 것이 선진시장 진입의 애로사항으로 부각되고 있는 실정이다. 대기업은 투자위험이 많은 혁신적인 신약개발보다는 바이오시밀러 개발에 더 많은 관심을 나타내며 단기적 성과에 주력하고 있다.
선진국 제약회사와 바이오 기업들은 자국이나 전 세계에 R&D 센터를 구축해 우수한 인적 자원과 인프라, 원천 및 응용기술 확보를 기반으로 바이오신약과 개량신약 개발에 적극적으로 투자하고 있다. 또한 막대한 자금이 소요되는 의약품 개발의 특성상 기업 간 M&A를 통하여 최적의 제품 생산을 위한 시너지 효과 창출의 노력이 진행 중에 있다.
정부는 바이오신약을 국가 신성장동력 산업으로 육성하기 위하여 원천기반 물질 확보, 시제품 생산 및 cGMP 수준 의약품 생산시설 구축, 전임상 및 임상 기반시설 확충, 안전성 확보를 위한 의약품 개발 인허가 규정 확보, 관리체제의 표준화 작업 등의 지원뿐만 아니라, 연구개발 및 전임상, 임상 연구 등의 적극적인 지원들이 이루어지고 있다.
정부의 지속적인 지원과 더불어 바이오신약에 대한 고부가가치 제품 창출을 위하여 국내 제약회사와 바이오벤처기업들은 자체 R&D 투자를 확대하고, 정부 R&D 지원금과 세제혜택 및 관련 기반시설을 활용한 바이오신약 후보물질 확보, 개량신약 개발, 생산시설 확충, 글로벌화 된 비즈니스모델 도입, 기술이전 확대 등에 적극적인 노력이 진행되고 있다.
국내 바이오신약을 성공적으로 개발하기 위해서는 국내시장의 다변화에 적응함은 물론, 더 나아가 국부창출이 가능한 세계적인 블록버스터급 신약, 바이오시밀러, 슈퍼제너릭 등의 독자적 기술개발 능력을 확보하고, 각 분야별 글로벌화 개발 전략을 수립하여 보다 융합적인 시너지 효과를 창출할 수 있는 적극적인 노력이 필요하다. 따라서 국내의 바이오신약 개발은 제약회사뿐만 아니라, 바이오벤처를 중심으로 대학과 연구소가 연계하여 연구개발에서 임상연구까지 기초, 응용, 개발 단계에서의 상호 경쟁과 보완, 협조를 통하여 이루어져야 한다. 특히, 바이오시밀러 항체의약품의 경우는 삼성전자, LG생명과학, 한화 등 대기업의 적극적인 연구개발 의지와 참여에 따라 이 분야의 활성화가 기대된다.
이렇게 글로벌 바이오신약은 정부의 과감한 연구개발 투자와 물적, 인적, 제도적 인프라 구축 등의 노력뿐만 아니라, 대학, 연구소 및 산업체 간의 기초·원천 연구와 병원 중심의 중개연구 및 전임상·임상연구를 보다 적극적으로 활성화하고, 후보물질과 산업화기술을 확보, 선진국과 상용화를 위한 상호 적극적인 공동연구 등을 통하여 가능할 것이다.
3. 바이오장기
가. 바이오장기의 개요
(1) 바이오장기의 정의
바이오장기란 기능을 잃은 인간의 조직과 장기를 복원, 재생, 대체하기 위해 생명공학적 기법을 이용하여 인간생체의 장기와 같은 기능을 갖는 기기를 인공적으로 만든 것을 말한다. 줄기세포, 조직공학, 바이오인공장기, 바이오이종장기연구 분야 등을 포함하며, 이를 위해서는 세포활용기술, 이종장기생산기술, 면역조절기술, 장기이식기술, 생체조직공학기술 등의 생명공학 핵심기술이 요구된다.
(2) 바이오장기 이식의 필요성
고령화로 인한 장기부전환자의 수가 급증하고 있으며, 장기이식수술은 이들 환자에게 유일한 치료법이지만, 타인으로부터 공급되는 장기의 절대수가 부족한 상황이다.
(가) 장기이식 수요 및 공급 현황
국내외 적으로 장기이식 대기자 수는 매년 증가하고 있는데 반해 장기공급은 제한적이다(그림 4-2-3-1, 4-2-3-2). 2009년 국내에서 장기이식을 대기 중인 환자는 약 17만 명 인 반면 이식건수는 2천여 건에 그쳐 이식률이 18%에 머물고 있다. 이 같은 현상은 미국을 비롯하여 전 세계적으로 나타나고 있어 이식대기 중 사망하는 환자 또한 증가하고 있는 실정이다. 특히 국내에서는 성인병의 증가, 고령화, 유교문화, 핵가족화의 영향으로 외국보다 이식 장기 수요, 공급의 불균형 현상이 심각하다. 이러한 결과로 불법 장기 매매가 성행하고 있으며, 최근에는 국내보다 의료기술 수준이 낮은 외국에서 장기이식을 받는 사례가 증가하여 외교적, 법률적 문제로 비화되고 있다.

출처 : 국립장기이식관리센터(KONOS) 2011
|
Organs |
Year of Waiting List Registration |
|
All organs |
52,285 |
|
Kidney |
33,051 |
|
Pancreas Transplant Alone |
412 |
|
Pancreas After Kidney |
334 |
|
Kidney-Pancreas |
1,603 |
|
Liver |
11,176 |
|
Intestine |
267 |
|
Heart |
3,384 |
|
Lung |
2,005 |
|
Heart-Lung |
53 |
그림 4-2-3-1. 연도별 국내 장기이식대기자 추이
출처 : The U.S. Organ Procurement and Transplantation Network and the Scientific Registry of Transplant Recipients(OPTN/SRTR) 2011 발췌
그림 4-2-3-2. 2008년 미국 내 장기이식대기자 수
(나) 대체장기로서의 바이오 이종장기
장기부전환자를 위한 대체장기의 확보방법으로 줄기세포 분화, 생체조직공학을 이용한 조직재생, 바이오 이종장기 등이 있다. 하지만 줄기세포는 아직 복잡한 세포분화과정을 조작하는 것에 대한 이론적 토대가 마련되어 있지 않고, 대량생산이 어렵기 때문에 상용화까지 많은 시간이 걸릴 것으로 예상된다. 그리고 사람의 조직을 생체조직공학적 방법을 이용해 연골, 뼈, 피부로 제작하는 방법이 응용되고 있으나, 복잡한 기능을 하는 장기를 제작하는 데에는 많은 어려움이 있다. 이에 반해 바이오 이종장기는 이식을 목적으로 사람이 아닌 다른 종의 동물로부터 생산된 장기를 사람에게 이식하여 부전된 기능을 즉시 회복시킬 수 있기 때문에 대체장기로 적합하다.
표 4-2-3-1. 부족한 장기를 대체할 수 있는 방법
|
장기 대체방법 |
심장 |
신장 |
간장 |
폐 |
|
동종이식 |
현재 적용 중 |
현재 적용 중 |
현재 적용 중 |
현재 적용 중 |
|
인공장기 (기계적장기) |
현재 적용 중 |
개발 중 |
현재 적용 중 |
개발 중 |
|
세포치료 |
개발 중 |
- |
개발 중 |
- |
|
조직공학 |
개발 중 |
개발 중 |
개발 중 |
- |
|
인공장기 (바이오장기) |
- |
개발 중 |
- |
- |
|
이종장기 |
개발 중 |
개발 중 |
개발 중 |
개발 중 |
출처 : J Korean Soc Transplant 2009;23: 203-213
표 4-2-3-2. 장기부족에 대처하기 위한 해결책
|
해결책 |
적용 가능한 장기 |
현재 상태 |
|
돼지 이종장기 이식 |
대부분의 장기 ; 간은 더 많은 연구가 필요함 |
전임상 ; 돼지 췌도 이식의 임상시험 |
|
기계적 장치 |
심장에서 가장 성공적 |
이식대상환자의 bridge therapy |
|
바이오 인공 신장 |
급성신부전증 환자의 세뇨관 보조기구 |
체외 투석 |
|
줄기세포에서 분화된 조직 |
모든 장기 |
세포치료에 대한 연구, 임상단계 ; 고형장기 부분에서는 아직 초기연구단계 |
출처 : J Korean Soc Transplant 2009;23: 203-213
(3) 바이오장기 공급원
사람에게 제공될 장기를 공급하기 위해서는 사람과 생리적인 면에서 유사점이 많아야하고, 또한 대량 공급을 위해 번식이 잘 되어야한다. 사람과 가장 유사한 영장류는 그러나 번식에 오랜 시간이 걸리고, 사람에게 치명적인 바이러스를 보유할 위험이 있으며, 전 세계 적으로 희귀동물로 지정되었기 때문에 이종장기 제공 대상에서 제외되었다.
현재는 미니돼지를 가장 많이 사용하고 있는데, 인간과 비슷한 크기의 장기를 갖고 있으며, 생리적으로 유사점이 많다. 또한 어미 1두가 연간 20마리 이상의 새끼돼지를 생산할 수 있어, 이식용 장기의 대량공급이 가능하여 이식 대기시간이 단축된다. 간염이나 AIDS 바이러스와 같은 치명적인 감염원의 회피가 가능하기 때문에 미리 철저한 분석과 계획 하에 이식수술을 받을 수 있다.
미니돼지를 이용할 때의 문제점으로 돼지 세포 표면에 존재하는 당(sugar)에 의한 초급성 면역거부 반응이 대두되었으나 유전공학기법을 이용한 형질전환돼지 생산이 가능하게 됨으로 인해 이를 극복할 수 있게 되었다.
(4) 바이오 이종장기 산업 발전을 위해 극복되어야 할 난관
(가) 장기이식 거부반응 및 복제 기술의 불안정성
사람에게 이식한 이종장기는 장기 수혜자의 체내에서 초급성 거부반응, 급성혈관성 거부반응, 세포매개성 거부반응, 만성 거부반응을 유도하기 때문에, 이를 극복하는 것이 이종장기 이식의 최우선 과제이다.
돼지 세포 표면에 존재하는 당(sugar)성분인 알파-갈(1,3-α-Galactose)에 의해 혈청보체계와 혈액응고계가 활성화되어 이식 후 수 분 이내에 초급성 거부반응이 나타난다. 이것을 극복하는 방법이 활발히 연구 중인데, 알파-갈 전이효소가 제거된 형질전환돼지가 2002년 미국에서 개발되어 초급성 거부반응이 극복되었다(Science 2002;295:1089). 국내에서도 2009년 4월 알파-갈 합성효소 유전자 중 하나가 제거된 미니돼지 지노, 지노 2의 개발이 성공하였다.
자연항체, 자연살해세포, 단핵구에 의해 혈관내피세포가 활성화되어 나타나는 급성혈관성 거부반응은 혈청보체 조절인자를 형질전환한 돼지제작기술과 혈관내피세포의 안정화, 내피세포유래 면역 매개물질 조절, 혈소판 기능조절로 극복 가능할 것으로 예상된다.
다양한 이종항원에 의해 면역세포가 활성화되어 나타나는 세포매개성 거부반응은 동종이식에 사용되고 있는 면역억제방법을 응용하거나 면역관용유도로 극복하려는 노력이 시도되고 있다.
복제된 동물들이 유산, 사산, 태어난지 며칠 되지 않아 죽는 등 복제효율이 떨어지는 불안정성을 극복하기 위해 형질전환 복제동물의 생산효율을 증진하기 위한 기술을 개발 중이다.
위와 같이 장기이식 관련 유전자를 탐색하고 체세포 유전자 적중기술 등을 통하여 이종장기 이식에 최적인 형질전환 복제돼지 생산은 기반기술이 확립된 상태이며, 현재의 문제점을 극복하고 산업화를 위한 연구가 활발히 진행되고 있다.
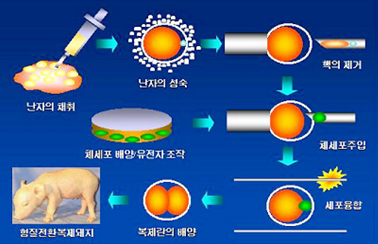
그림 4-2-3-3. 체세포복제에 의한 형질전환동물 제조과정
(나) 안전성 문제
인수공통감염병원체는 돼지의 무균화를 통해 차단할 수 있다. 그러나 돼지의 내인성레트로바이러스의 경우 바이러스 유전자가 돼지세포의 염색체내에 삽입되어 유전되므로 무균화 작업을 통해서 제거되지 않는다. 그러나 현재까지 영장류 이식실험을 통해 돼지 내인성레트로바이러스 감염이 확인되지 않았고, 이전에 이종이식을 받은 환자에서도 감염의 증거가 확인되지 않고 있다.
(다) 사회적, 생명윤리적 문제
생명연장, 환자 인권의 신장 등 긍정적인 면과 함께 장기이식의 빈부 격차 등의 사회적 문제와 동물학대, 인간 복제 가능성과 같은 생명윤리적 문제를 풀어나가야 한다.
나. 바이오장기의 국내 기술 동향
국내에서는 교육과학기술부, 지식경제부, 보건복지부가 협력하여 바이오신약장기사업단을 통해 이종장기 생산용 복제 돼지를 생산하기위한 노력을 하고 있다.
이를 위해 바이오이종장기개발사업단에서는 2004년부터 2013년 까지 3단계에 걸쳐 이종장기용 돼지생산과 면역거부반응조절을 통해 이종장기의 전임상 및 임상적용 연구를 하고 있다.

출처 : 바이오이종장기개발사업단 www.xenokorea.org
그림 4-2-3-4. 바이오신약장기 사업개요
(1) 형질전환 미니돼지 개발
농촌진흥청 바이오장기연구단에서 이종 간 장기이식 시 면역거부반응을 연구 중인 충남대 진동일 교수와 ㈜엠젠은 인간의 면역기능 유전자 중 'FasL(Fas Ligand)' 유전자를 발현시킨 형질전환 복제 미니돼지를 개발하여 2009년 5월 11일 태어났다. 2009년 5월 탄생한 형질전환 돼지 ‘지노’의 경우 돼지에게만 존재하는 초급성 거부반응 물질인 알파-갈 유전자를 제거한 것이라면, 이번 복제돼지는 인체의 면역세포 관련 유전자 중 하나를 돼지에게 발현시킨 것으로 장기를 이식할 때 돼지가 아닌 인체의 장기로 인식, 세포 독성 효과를 크게 감소시킬 수 있을 것으로 기대된다.
2010 년 8월에는 농촌진흥청에서 초급성 및 급성 면역거부반응 유전자 2개를 동시에 제어한 다중 유전자 제어 형질전환 복제 미니돼지 '믿음이'를 생산했다. '믿음이'는 면역거부반응을 일으키는 알파-갈 유전자를 제거하고 초급성과 급성 거부반응에 관여하는 유전자인 MCP와 CD46를 삽입해 생산한 것으로, 유전자를 조작한 미니돼지 체세포를 일반돼지 난자에 주입시켜 탄생시켰다.
이후 2011년 7월에는 급성 혈관성 면역거부반응을 제어할 수 있는 인간 유전자(CD73)가 도입된 복제 미니돼지 '소망이 1, 2'를 생산하는데 성공했다. 혈액응고현상을 감소시키는 중요한 역할을 하는 인간유전자 CD73이 돼지에서 나타나도록 개발된 것이다.
바이오신약장기사업에서 형질전환 미니돼지를 생산 중인 이왕재 교수 연구팀은 2011년 현재 알파-갈 유전자가 제거된 무균 미니돼지를 유지해오고 있으며, 복합형질전환 세포주 개발과 개발된 세포 및 조직의 당질 분석과 혈액 응고 분석 기술을 확보해 나가는 중이다.
서울대 의대 안규리 교수와 수의대 이병천 교수 연구팀은 종양괴사인자(TNF-α)를 차단하는 sTNFRI-Fc 단백질을 가진 형질전환 복제돼지를 세계에서 처음으로 확보하고 2011년 7월 해외 유명 저널인 Transplantation 에 개제했다(Transplantation 2011 27;92(2):139-47). 종양괴사인자는 이종장기 이식거부반응에서 중요한 역할을 하기 때문에 형질전환 돼지를 이용함으로써 거부반응을 극복할 수 있을 것으로 기대된다.
(2) 돼지 췌도 이식 전임상 시험
서울대 의대 병리학과 박성회 교수 연구팀은 돼지 췌도세포를 원숭이에 이식하는 전임상 시험 결과를 2011년 10월 해외 유명 저널인 The Journal of Experimental Medicine 에 개재하였다(JEM 2011 208;12:2477-2488). 무균돼지에서 분리한 췌도세포를 당뇨병 원숭이에 이식하고 자체 개발한 항원 선택적 면역억제제와 2종의 기존 보조억제제를 투여했다. 4개월 후 면역억제제 등 모든 약제의 투입을 중단했음에도 현재 7개월째 거부반응 없이 혈당을 조절하고 있다. 이 같은 성과가 나온 데에는 박성회 교수팀이 개발한 새로운 면역조절항체가 결정적인 역할을 했다. 이 항체로 인해 면역세포인 T세포가 돼지 췌도를 이물질로 인지하지 못하게 한다.

출처 : MK 뉴스 2011년 10월 31일
다. 바이오장기의 발전과제와 전망
(1) 바이오장기의 발전과제
이종장기이식은 인공장기 및 줄기세포 분화에 의한 장기이식에 비해 빠르게 임상에 적용할 수 있는 기술이다. 형질전환돼지 개발, 이식거부반응의 기전규명, 새로운 면역억제요법의 개발로 이식된 장기가 장기간 생존하고 기능을 유지할 수 있음이 영장류 실험을 통해 입증되고 있다. 향후 보체 활성, 응고증, 세포 매개성 거부반응과 같은 남아있는 장벽을 하나씩 극복해 간다면 머지않은 장래에 이종장기이식은 생명을 구하는 중요한 치료수단으로 자리 잡을 것이다.
이러한 과학기술의 발달과 더불어 안정성 확보와 윤리적 문제도 함께 해결되어야한다. 모든 연구자가 이종장기이식이 가져올 수 있는 위험성을 염두에 두고 세계이종이식학회나 World Health Organization(WHO)에서 제시하는 국제적인 가이드라인에 따라 이종장기의 임상시험이 이루어져야한다. 우리나라도 최근의 연구성과에 따라 이종장기이식 임상연구가 수행될 가능성에 대비하기 위해 임상가이드라인 등 제도화를 추진하고 있다.
(2) 바이오장기의 전망
이식장기 수요의 폭발적 증가로 인한 수급 불균형은 앞으로 더욱 심화될 것으로 예상된다. 따라서 바이오장기의 시장규모도 급속도로 커질 것으로 전망된다. 국가생명공학정책연구센터의 ‘2007 바이오 신약 장기 제품군별/주요 질환별 세계 및 국내 시장현황과 전망분석에 관한 연구’에 따르면 이종장기의 상용화 시점으로 예상되는 2015년에는 국내 장기이식 대기환자의 수가 29,572명에 이를 것으로 전망된다.
4. 산업현황
가. 한국 제약산업의 지표
한국은 아시아에서 일본, 중국, 인도에 뒤이어 4번째로 큰 제약시장을 형성하고 있다. IMS Health의 자료에 따르면 한국의 처방약 시장은 2009년 92.8억불에서 2010년 108.8억불 로 증가 하며 빠른 성장세를 보이고 있으며 세계에서 13번째로 큰 제약 시장을 형성하게 되었다. 2009년에서 2014년 사이의 국내 시장규모는 고령화 되어가는 사회구조와 성인 만성질병의 증가로 약 10.2%의 성장률을 보일 것으로 예상되지만, 정부의 계속적인 약가 인하 정책으로 인해 그 성장률이 다소 감소할 가능성을 가지고 있다. 한국 제약시장의 약 74%는 국내 제약사들이 점유하고 있으며, 전체 시장의 3분의 1을 상위 10개 제약사가 점유 하고 있다. 현재는 이시장의 대부분을 복제약 (generic)이나 개량신약 (super generic) 이 차지하고 있으나 2009년 도입된 바이오시밀러 (biosimilar)에 대한 허가기준에 의해 바이오시밀러도 그 점유율을 늘려갈 전망이다.
국내에서는 심혈관계 질환 (고혈압, 동맥경화)등에 대한 약의 처방이 가장 많이 이루어 지고 있으며 위궤양등 소화기계 질환에 대한 약이 그 뒤를 따르고 있다. 약 71% 정도의 처방이 외래환자들에 대한 약국을 통한 처방이며 나머지가 입원환자를 대상으로 한 병원내 처방이다.

그림 1. 2011년 세계 제약 시장 규모 순서
나. 한국 제약산업의 연구개발 동향
한국 제약산업에서 가장 우수한 인프라는 임상시험 능력라 할 수 있다. 한국에서 얻어진 임상 데이터는 미국이나 유럽에서 시행된 임상보다 다른 아시아 국가들에서 더 쉽게 허가를 요청할 수 있으며, 임상시험의 수준도 높아 한국은 국제적으로도 신흥 아시아시장 진출을 위한 좋은 발판으로 인식되고 있다. 이러한 추세에따라 2010년 한국에서는 676건의 임상시험이 진행되었으며 이는 세계에서 7번째로 많은 규모이다 (그림 2) 이는 2007년말 280건이였던 임상 시험건수에 비해 뚜렷한 증가며 연 약 28%의 증가를 보이고 있다.

한국에서의 임상 시험수요 증가는 우수한 임상시험 환경뿐만 아니라 빠르고 투명한 임상시험 승인절차와 유럽이나 미국에 비해 낮은 비용등으로 꼽히며 현재 많은 다국적 제약사가 한국에서 신약 임상시험을 진행중이다.
임상 시험의 진행건수를 보면 한국의 임상 개발능력이 단연 돋보이나, 많은 임상시험의 디자인과 프로젝트 관리가 임상시험을 의뢰한 다국적 회사에서 이루어지고 있는것이 현실이며, 진정한 임상시험 인프라를 갖추기 위해서는 임상시험 전분야를 아우를 수 있는 전문가들의 확보가 필요하다.
임상시험 이외의 다른 신약연구개발 능력에 있어서는 한국의 제약산업은 아직 태동기라 할 수 있다. 근래까지 국내 제약사들은 대부분 복제약 및 개량신약 개발에 주력하여 왔으나, 복제약시장의 경쟁과열, 다국적제약사들의 국내 진출 등의 새로운 환경에 적응하기 위하여 신약개발에 많은 투자를 하기 시작하였다. 2010년 국내에서 약 2억불 정도가 제약 연구개발에 투입된 것으로 나타나지만 이는 단일 다국적 기업의 1년 연구개발비용 (Merck & Co., Inc., 2010년 약 5천억불)에도 턱없이 부족한 실정이다. 이러한 환경 속에서 2010년 국내 17번째 신약인 고혈압치료제 fimasartan이 보령제약에 의해 개발되었으며 이로 한국은 세계 10위의 신약개발 국가가 되었다. 이러한 국내 신약개발 성과에서 아쉬운 점은 아직 국내에서 새로운 타겟에 대한 ‘First-in-Class’ 신약이 나오지 않고 있다는 점이다. 세계 시장을 선도할 수 있는 ‘First-in-Class’신약개발은 신약개발에 대한 인프라 뿐만 아니라 새로운 질병에 대한 연구를 신약개발 과정과 잘 연결시키는 신약 후보물질 탐색기능을 비롯한 중개연구가 필수적으로 필요한 부분이며, 이에 대한 위험부담도 큰 ‘High Risk, High Return’ 이라는 특성을 가지고 있다. 현재 국내 제약산업의 규모가 위험부담이 큰 분야에 과감한 투자를 할 수 있을 정도의 규모가 되지 않는 상황에서 정부주도의 공공부문 연구가 이러한 기능을 어느 정도로 뒷받침 해줄 수 있는지가 국내 신약개발산업 발전에 큰 변수가 될 것으로 보인다. 또한 정부의 제약연구에 대한 조세 지원 정책 및 기업의 연구개발 투자도에 따른 차등적 약가 정책이 실제 연구개발 투자에 어떻게 반영될지도 주목하여 볼 부분이다.
최근 한국의 신약연구개발에서 가장 두드러지는 점은 바이오시밀러 (biosimilar) 개발이다. 한국은 이미 2009년에 바이오시밀러 개발에 대한 가이드라인을 제정하였고, 2011년중에 바이오베터 (bio-better)에 대한 기준 마련이 예정되어 있는 등 정부가 적극적으로 움직이며 환경을 조성하고 있다. 이러한 빠른 움직임에 힘입어 2009년 대만 회사인 Mycenex Biotech이 이미Enbrel (etanercept, Amgen/Pfizer)에 대한 바이오시밀러 임상을 한국에서 완료하였고, 셀트리온은 다국적 바이오 회사인 Hospira와 바이오시밀러 개발에 대한 계약을 체결하였다. 2011년2월에는 삼성전자가 바이오시밀러 개발에 1조9천억원 투자와 다국적 CRO/CMO (contract research organization/contract manufacturing organization)인 Quintiles사와 합작회사 설립을 발표하였다. 이러한 움직임 속에서 한국은 2020년까지 세계 바이오시밀러 시장의 22%를 점유하는 것을 목표로 하고 있다.
다. 한국 제약제조 부분의 동향
1984년 KGMP(Korean good manufacturing practices)를 도입한 이후, 한국은 주변 아시아 국가에 비하여 우수한 의약품 제조 시설을 가지고 있으며, 2010년에 cGMP (current good manufacturing practices)제도가 도입되었다. 이로서 국내의 많은 제약사들은 세계적으로 가장 까다로운 심사기관들인 US FDA(Food and Drug Administration)이나 EMA (European Medicines Agency)등의 기준을 통과할 수 있는 의약품 제조사가 되었다. 2010년 국내에 889개의 의약품 제조사가 보고되어 있으며 이들 중 많은 회사가 API (active pharmaceutical ingredient)나 그 중간체를 제조해 수출하는 모델을 가지고 있다. 이러한 합성신약 제조설비 및 기술과 cGMP기준에 따라 설립된 바이오의약품 (biopharmaceutical) 제조 인프라는 한국이 신약개발 강국으로 도약하는데 중요한 기반이 될 것으로 보인다.
라. 한국 CRO (Contract research organization) 동향
질병에 대한 이해와 사회의 치료제의 안전성과 효능의 대한 기대가 높아지고 있는 21세기 신약개발은 각 제약사들이 자금과 필요한 기능을 얼마나 유동적으로 운용할 수 있는가에 따라 성패가 좌우된다 할 수 있다. 이러한 새로운 환경에서 최근 급성장하는 부분이 신약개발에 필요한 기능을 서비스로 제공하는 CRO 산업이다. CRO는 연구단계부터 임상 개발단계까지 필수적인 기능을 갖추고 신약을 개발하는 회사에서 각 단위 프로젝트를 수주하여 수행하는 역할을 한다. 따라서 최근 국내에도 전임상부터 임상시험을 대행하는 다양한 CRO가 생겨나게 되었으며 과거 복제약의 국내 허가를 위한 실험을 주로 담당하던 서비스에서 점진적으로 신약개발을 위한 서비스로 진화하고 있다. 하지만 국내 CRO들은 아직 중국, 인도 등에 있는 CRO들과 가격 경쟁력에서 어려움을 격으며 그 규모나 경험면에서도 아직 열세를 보이는게 현실이다. 임상 CRO의 경우도 대부분 임상시험의 수행 서비스에만 강세를 보이며 임상시험 프로토콜 디자인이나 프로젝트 관리 등 창의적인 신약개발에 도움을 줄 수 있는 CRO들이 아직 태동하고 있는 상황이다. 국내 신약개발의 효과적 수행을 위해서는 국내 CRO 산업의 발전이 시급한 것으로 보인다.
마. 요약
현재 다국적 제약사들이 연구개발 생산성 저하 등 구조적인 문제를 격으며 새로운 운영모델을 찾고 있는 시점에서 한국의 신약개발 산업은 좋은 기회를 맞이하고 있다. 다국적 제약사들이 겪었던 조직 비대화에 따른 효율성, 생산성 저하를 본보기로 삼아 한국만의 새로운 산업 모델을 도모해야 한다. 위에서 정리한 바와 같이 국내에는 이미 많은 인프라가 갖추어져 있으며 정부 및 산업계의 신약개발에 대한 의지도 매우 강하다. 중요한 점은 이렇게 산재되에 있는 인프라를 얼마나 효과적으로 관리, 운영하는 시스템을 갖추느냐에 있는 것으로 보인다. 예를 들어 기초연구 단계와 초기 개발단계를 매끄럽게 연결해 줄 수 있는 연결고리를 만들거나, 임상 시험을 단순히 수행하는 능력 뿐 아니라 디자인, 관리할 수 있는 능력을 키우는 것 등이다. 이미 실패한 모델인 다국적 제약사들의 연구개발 경영방식을 답습하는 0것이 아니라, 그 운영과 기술적 노하우만을 배워 한국 실정에 맞는 연구개발 경영을 실현하는 것이 앞으로의 한국 신약개발 산업 발전의 열쇠라 생각된다.
제3절 농림수⦁축산식품 분야
1. 유전자변형 작물 관련 해외동향
가. 재배 동향
GM작물 개발로 대표되고 있는 농업생명공학은 이제 실용화의 논란을 떠나서 이미 상용화 시대에 돌입되었다고 보는 것이 적합할 것이다. 새로운 형질을 도입한 GM작물의 상업화가 급속히 증대되어, GM종자의 세계적 가치는 2008년도에 75억불 수준에서 2015년에는 200억불로 증가할 것으로 예상되고 있다. 그 예상은 세계적으로 GM작물의 재배국가 및 면적을 중가로 확인될 수 있다. ISAAA의 연례보고에 따르면 2010년 현재 상업화된 GM작물을 재배학고 있는 국가는 29개국이며, 재배면적은 1억4,800만 헥타르에 이른다고 하였다. 이는 2009년 대비하여 10%가 증가된 것이다. (그림 4-4-1-1)
[그림4-4-1-1] 유전자변형 작물의 전 세계 재배면적

(2) 연구개발 동향
최근까지의 농업생명공학기술을 활용하여 개발되어 상용화된 유전자변형 GM작물은 생산성향상을 목적으로 최종 작물의 수확에 가장 크게 영향을 미치는 병·해충에 대한 저항성을 갖도록 만들어졌으나, 최근에는 가뭄 또는 냉해 등의 무생물적인 원인에 대응하는 GM종자개발이 이루어지고 있다. 한편, GM작물의 이용 범위가 확대된 새로운 용도의 GM작물이 개발되고 있는데 이들은 크게 제2세대는 영양성분 변형, 제3세대는 의료물질 생산, 제4세대는 바이오에너지 생산으로 분류를 할 수 있다. 향후 출시될 유전자변형 작물들은 내재해성 뿐만 아니라, 소위 분자약농(Molecular Pharming) 기술로 만든 것들로 옥수수, 콩 등을 이용하여 의료산업에 이용되는 특수 단백질 또는 각종 질병 치료제를 생산하도록 만든 작물들이 주를 이룰 것으로 보인다. [표4-4-1-2]는 제2세대 GM작물의 승인현황으로 이미 산업화가 진행되고 있음을 보여주고 있으며, 미국 농무부(USDA) 산하 동식물검역소(APHIS)에서 포장시험 승인된 현황을 특성별로 분리해 보면, 불량환경 내성 27%, 제초제저항성 22%, 영양성분 및 의료용 물질 18%, 병해충저항성 15, 기타 9%로 나타나 GM작물의 개발 경향을 알 수 있다.
표4-4-1-1, 영양학적가치가 증진된 유전자변형 작물 승인현황
|
OECD고유번호 |
숙주작물 |
도입형질 |
최초승인국가 |
승인 년도 |
|
CGN-89465-2 |
유채 |
올레인산 함량증가 |
미국 |
1994.10.31. |
|
CGN-89111-8 |
유채 |
올레인산 함량증가 |
미국 |
1994.10.31. |
|
CGN-89564-2 |
토마토 |
올레인산 함량증가 |
미국 |
1994.9.19. |
|
REN-ØØØ38-3 |
옥수수 |
라이신 함량중가 |
미국 |
2005.9.30. |
|
DD-Ø26ØØ5-3 |
콩 |
올레인산 함량증가 |
미국 |
1997.3.14. |
|
BPS-25271-9 |
감자 |
전분질 변화 |
유럽 |
2010.3.2. |
(3) 안전성평가 동향
GM작물의 연구개발단계에서 최종 안전성 승인까지는 공개되지 않은 많은 실패사례가 있다. 즉 전 세계 많은 연구실에서 형질전환 작물개발이 진행되고 있으나 그 수는 개발자가 공개하지 않으므로 알 수가 없는 상황이다. 다만 대부분의 국가가 GM작물의 상업화 전 안전성심사를 의무화하고 있고 최소한 그 목록을 공개하기 때문에 비교적 정확한 현황파악이 가능하나, 각국에서 제공하는 정보에 의존하다보니 정보를 제공하는 기관에 따라 수치의 차이가 있다. 그림 4-4-1-2는 OECD가 제공하는 통계에 따른 국가별 승인된 유전자변형작물의 현황을 보여준다. 한편 ISAAA에서 제공하고 있는 database에 따르면 전 세계적으로 24개 작물 189개 품종이 승인된 것으로 보고되고 있다.
한국바이오안전성정보센터(KBCH)에서 제공하고 있는 자료에 의하면 승인된 품종 중 세계적으로 재배되고 이용되고 있는 주요작물은 6개 작물이며, 용도별 심사승인 현황은 표 4-4-1-2과 같다.
 [그림 4-4-1-2] OECD에 보고된 국가별 승인된 유전자변형작물 현황
[그림 4-4-1-2] OECD에 보고된 국가별 승인된 유전자변형작물 현황
[표4-4-1-2] 주요 GM작물의 용도별 심사승인 현황
|
작물 |
식용 |
사료용 |
재배용 |
기타 |
|
옥수수 |
55 |
56 |
46 |
1 |
|
면화 |
23 |
23 |
17 |
|
|
유채 |
20 |
25 |
17 |
|
|
대두 |
13 |
11 |
12 |
1 |
|
감자 |
24 |
24 |
20 |
|
|
토마토 |
19 |
6 |
15 |
|
나. 국내동향
(1) 농촌진흥청
(가) GM 작물개발
국내에서 개발 중인 GM작물은 49작물 171종으로 추정되고 있다. 2011년 7월 현재 국가로부터 승인을 받아 21개 기관에서 환경방출실험이 16작물에 대하여 223건이 진행되고 있다(표 4-4-2-1).
농촌진흥청에서는 GM작물 개발단계를 유전자검정, 기능검정, 고정계통육성, 안전성 평가로 구분하고 있으며, 2011년 8월 현재 국립농업과학원, 국립식량과학원, 국립원예특작과학원 및 국립축산과학원에서 19작물 128종의 GM작물을 개발 중에 있으며, 각 단계별로 보면 유전자검정 단계가 30종, 기능검정 단계가 70종, 고정계통육성 단계에 이른 것이 23종이며, 혹명나방저항성 벼, 좀나방저항성 배추 등 5종이 안전성평가 단계에 있다. 이들에 대하여는 조만간에 안전성 심사를 신청할 예정이다(표 4-4-2-2).
표 4-4-2-1. 2011년도 LMO 환경방출실험 승인현황(2011년 8월 현재)
|
연번 |
기 관 |
계 속 |
신 규 |
총 계 |
|
1 |
고려대학교 |
|
1 |
1 |
|
2 |
단국대학교 |
1 |
|
1 |
|
3 |
제주대학교 |
3 |
5 |
8 |
|
4 |
한국생명공학연구원 |
5 |
12 |
17 |
|
5 |
경상대학교 |
8 |
2 |
10 |
|
6 |
중앙대학교 |
|
2 |
2 |
|
7 |
경북대학교 |
3 |
4 |
7 |
|
8 |
국립농업과학원 |
17 |
15 |
32 |
|
9 |
국립축산과학원 |
5 |
1 |
6 |
|
10 |
국립식량과학원 |
33 |
17 |
50 |
|
11 |
국립산림과학원 |
31 |
5 |
36 |
|
12 |
전북농업기술원 |
1 |
|
1 |
|
13 |
국립원예특작과학원 |
12 |
|
12 |
|
14 |
경기도농업기술원 |
|
1 |
1 |
|
15 |
에프앤피사 |
2 |
|
2 |
|
16 |
명지대학교 |
2 |
2 |
4 |
|
17 |
충북대학교 |
2 |
4 |
6 |
|
18 |
경희대학교 |
8 |
15 |
23 |
|
19 |
서강대학교 |
|
1 |
1 |
|
20 |
전남대학교 |
|
1 |
1 |
|
21 |
서울대학교 |
|
2 |
2 |
|
총계 |
133 |
90 |
223 |
|
|
작목별 분류 |
벼120, 고추6, 잔디2, 벤트그라스6, 콩15, 들잔디2, 배추1, 양배추1, 톨페스큐4, 알파파1, 감자4, 고구매4, 유채6, 포플러38, 수박1, 사과12 <16작물> |
|||
표 4-4-2-2. 농촌진흥청 GMO 작물개발 현황(2011년 8월 현재)
|
작물 |
GMO 실험단계 |
계 |
|||
|
유전자검정 |
기능검정 |
고정계통육성 |
안전성평가 |
||
|
벼 |
20 |
27 |
14 |
3 |
63 |
|
고추 |
|
|
|
1 |
1 |
|
감자 |
1 |
6 |
|
|
7 |
|
고구마 |
|
4 |
|
|
4 |
|
담배 |
1 |
3 |
|
|
4 |
|
배추 |
2 |
6 |
1 |
1 |
10 |
|
유채 |
2 |
7 |
|
|
9 |
|
알팔파 |
1 |
2 |
|
|
3 |
|
콩 |
|
4 |
|
|
6 |
|
선인장 |
|
|
1 |
|
1 |
|
국화 |
|
2 |
2 |
|
4 |
|
벤트그라스 |
|
1 |
|
|
1 |
|
토마토 |
|
1 |
|
|
1 |
|
박 |
1 |
|
1 |
|
2 |
|
마늘 |
1 |
1 |
|
|
2 |
|
사과 |
|
3 |
|
|
3 |
|
페튜니아 |
|
1 |
1 |
|
2 |
|
장미 |
|
1 |
|
|
1 |
|
톨페스큐 |
1 |
2 |
1 |
|
4 |
|
계 |
30 |
70 |
23 |
5 |
128 |
(나) GM 동물개발
국립축산과학원과 국립농업과학원 농업생물부을 중심으로 형질전환동물을 이용한 바이오신약을 생산하는 형질전환 동물을 개발하고 있다. 형질전환 돼지 10종, 형질전환 닭 5종, 형질전환 누에14 종이 개발되었으나, 아직까지 안전성평가단계에 이르지는 못하였다.
형질전환 가축을 이용한 신약개발 분야는 고가의 유용단백질을 난백과 유즙으로 생산하기 위한 연구를 진행하고 있다. 형질전환 돼지에서는 유즙 특이프로머터를 빈혈치료제, 혈우병치료제, 혈전증치료제 등의 단백질 유전자와 결합을 시켜서 돼지의 수정란에 미세주입 후 수란돈에 이식하여 형질전환 돼지를 생산하였다. 형질전환 돼지는 고정계통육성과 더불어 유즙으로부터 치료용 유용단백질만을 분리·정제하는 체계가 같이 추진되며, 이후 약리활성을 검증이 진행된다.
한편 미니돼지를 이용한 형질전환 돼지의 경우는 바이오장기를 생산하기 위한 용도로 개발되고 있으며, 이를 위해서는 장기 이식시 발생할 수 있는 인체면역 유발 유전자인자가 제거된 유전자 적중 형질전환 세포주 구축이 선행되어야하며, 이를 세포주의 핵이식을 통하여 형질전환 돼지를 생산하게 된다. 2011년 현재 3종의 형질전환 미니돼지(Xeno, 믿음이, 소망이)가 생산되었다.
다양한 형광단백질을 다양한 조직에서 특이적으로 발현되게 하는 고도로 정밀화된 형질전환 누에가 개발되어 다양한 색깔의 천연형광실크의 생산 및 이 기술을 바탕으로 인체의 치료제를 생산할 수 있는 형질전환 누에 개발의 길을 열었다..
표4-4-2-3. 농촌진흥청 GMO 동물개발 현황(2011년 8월 현재)
|
작 목 (가 축) |
기 능 |
GMO실험단계 |
|||
|
유전자 검정 |
기능 검정 |
고정계통 육성 |
안전성 평가 |
||
|
돼지 (10종)
|
조혈촉진 |
|
|
○ |
|
|
혈전용해 |
|
○ |
|
|
|
|
혈액응고 |
|
|
○ |
|
|
|
혈우병 치료 |
|
|
○ |
|
|
|
당뇨질환모델 |
|
○ |
|
|
|
|
항바이러스 |
○ |
|
|
|
|
|
면역거부 억제 |
○ |
|
|
|
|
|
항암치료 보조 |
○ |
|
|
|
|
|
왜소증 치료 |
○ |
|
|
|
|
|
면역억제 |
○ |
|
|
|
|
|
닭 (5종)
|
활성산소억제 |
○ |
|
|
|
|
녹색형광물질 |
|
|
○ |
|
|
|
면역물질 |
|
○ |
|
|
|
|
질병조기식별 |
○ |
|
|
|
|
|
항바이러스 |
○ |
|
|
|
|
|
누에 (14종)
|
적색형광단백질 (눈 및 신경발현) |
|
|
○ |
|
|
녹색형광단백질 (눈 및 신경발현) |
|
|
○ |
|
|
|
적색형광단백질 (온몸 발현) |
|
|
○ |
|
|
|
녹색형광단백질 (온몸 발현) |
|
|
○ |
|
|
|
녹색형광단백질 (발 및 날개발현) |
|
|
○ |
|
|
|
뼈형성 |
|
|
○ |
|
|
|
조혈촉진 |
|
|
○ |
|
|
|
녹색형광실크 (피브로인 내 발현) |
|
|
○ |
|
|
|
조혈촉진 |
|
|
○ |
|
|
|
인슐린성장인자 |
|
|
○ |
|
|
|
상피세포 보호 및 재생 |
|
|
○ |
|
|
|
골수 및 림프구 분화 촉진 |
|
|
○ |
|
|
|
녹색형광실크 (세리신 내 발현) |
|
|
○ |
|
|
|
혈전용해 |
|
|
○ |
|
|
|
3가축 |
|
8종 |
3종 |
18종 |
- |
(다) 국내의 위해성 심의 동향
국내의 GMO 안전관리는 ‘유전자변형생물체의 국가간 이동 등에 관한 법’ (LMO법)을 기본법으로하여 LMO의 용도별로 구분하여 관계 중앙행정기관에서 담당하도록 규정되어 있다. 농림수산식품부는 농수산용과 임업용에 대하여 위해성 심사를 진행하고 있다. 2011년 8월 현재 농업용 LMO의 환경위해성 심사신청 건수는 97건이 접수되어 62건이 심사가 완료되었고, 27건이 진행 중에 있으며, 재배용으로 승인된 LMO는 없는 상황이다(표 4-4-2-4). 재배용 GM작물의 경우 농촌진흥청(주관기관), 환경과학원, 수산과학원, 질병관리본부 등 4개 기관의 검토결과를 바탕으로 승인여부를 결정하고 있다.
표 4-4-2-4 농업용 LMO환경 위해성 심사현황
|
|
신청건수 |
심사완료건수 |
심사진행건수 |
기타 |
|
사료용 |
57 |
36 |
18 |
신청철회 3건 |
|
재배용 |
2 |
- |
1 |
부적합 1건 |
|
후대교배종 |
34 |
26 |
8 |
- |
|
기타 농업용 |
4 |
- |
- |
신청철회 4건 |
|
합계 |
97 |
62 |
27 |
8 |
(2) 농림수산분야 산학연 공동연구사업
국가 R&D사업에서 산학연 공동연구사업으로 농업생명공학분야에 투자된 사업은 교육과학기술부의 작물유전체기능연구사업단, 농림수산식품부 의 농림기술개발사업과 농촌진흥청에서 운영하고 있는 바이오그린21사업이 있다.
농림기술개발사업은 기존의 사업을 구체화 세분화하였으며, 농업생명공학분야는 ‘생명산업기술개발사업’으로 분리되어 2011년도 총 522억원의 예산을 지원하고 있다.
작물유전체기능연구사업단은 2001년에 시작하여 2010년을 끝으로 10년간의 사업이 종료가 되었다. 10년간 국내외 총 439편의 논문을 게재하였고, 특허도 국내외 228건을 출원하고, 이중 192건이 등록이 되었다. 이를 통한 총 기술료 수입은 15억원이었으며, 향후 87억원이 추가로 징수될 계획이다.
바이오그린21사업도 2010년도를 끝으로 사업이 종료되었으며, 총 3,516편의 논문이 국내외에 게재되었고, 특허도 1,831건이 국내외에 출원/등록되었다. 종료되는 사업의 후속으로 차세대바이오그린21사업이 출범함에 따라 그간 추진된 농업생명공학분야의 연구사업을 지속할 수 있게 되었다.
차세대바이오그린21사업은 농업생명공학 원천기술 확보 및 국가 전략적 대응을 위한 농업생명공학기술 개발을 통한 미래 성장동력확보를 목적을 추진되고 있으며, 7개 사업단장 중심체제의 운영방식을 취하고 있다. 사업단별 주용 사업내용은 표 4-4-2-5 같다.
표 4-4-2-5. 차세대바이오그린21 7개 사업단 주요사업내용
|
사업단명 |
사업 주요 사업내용 |
|
차세대유전체 연구사업단 |
▪토종 농작물, 미생물 유전체 해독 및 정보분석을 통한 유전자 대량 개발 ▪유전체 기능분석을 통한 유용유전자 및 생물소재 개발 ▪농작물, 농용 미생물 오믹스 정보 종합 및 활용 인프라 구축 |
|
동물유전체 육종사업단 |
▪동물 유전체 해독 및 정보분석을 통한 유전자 대량 발굴 ▪유전체 정보이용 가축분자육종 신품종 개발 ▪생명공학기술을 이용한 고효율, 고품질 및 항병성 가축품종 개발 |
|
식물분자육종 사업단 |
▪유용 농업형질 연관 분자표지 개발 및 유전자 분리 ▪관행육종/분자육종 접목을 통한 신품종 개발 ▪식량안보 및 기후변화에 대응한 형질전환작물 개발 |
|
GM작물실용화 사업단 |
▪ GM작물 기획 개발 및 실용화 ▪ GMO의 안전성 평가 및 관리기술 개발 |
|
농생명 바이오식의약 소재개발사업단 |
▪농생물자원이용 기능성 물질 개발 및 대량생산 기술개발 ▪작물, 미생물 및 곤충활용 유용물질 생산시스템 기반 구축 및 활용 ▪식의약 신소재의 현장적용 기술개발을 통한 실용화 |
|
시스템합성 농생명 공학사업단 |
▪ 농생물 기반의 시스템생물학 해석 및 응용기술 개발 ▪ 농생물 대사제어에 의한 고부가가치 물질생산 원천기술 개발 ▪ 신규 화학물질의 합성 및 생산을 위한 합성생물소재 탐색 및 응용기술 개발 |
|
동물 바이오 신약, 장기 개발사업단 |
▪이종면역 관련 유전자 도입 돼지 생산 ▪바이오장기 인체적용 전 면역거부반응 특성 및 독성 검정 ▪바이오신약 생산용 형질전환 동물 개발 |
다. 발전과제
지난 10여년간 국내에서는 GM 작물 개발에 적극적으로 투자하여 있으나 상업화 사례가 없는 현실이다. 이는 국제적 수준에 부합하는 안전성평가가 이루어지지 못했기 때문이며, 특히 안전성평가 분야에 대한 투자 비중이 상대적으로 낮은데 원인이 있다고 볼 수 있다.
안전성 평가란 개발된 GM작물이 환경 및 인체에 미치는 영향이 기존 작물과 비교하여 다르지 않음을 증명하는 것을 의미하며, 잡초화 가능성, 농업적 형질특성, 근연종과의 교잡성, 곤충 등 타생물에 대한 영향, 독성 및 알레르기 유발 가능성 등 다양한 항목에 걸쳐 수년간 실험을 통해 평가서를 작성한다.
우리나라의 GM작물 안전성평가기술 수준은 최고 기술 보유국인 미국에 비해 72.2%로 약 7.1년의 기술격차가 있는 것으로 보고되고 있다(한국과학기술기획평가원, 2011). 다국적 종자회사의 보고에 따르면 개발한 GM작물을 상업화하기 위해 실시하는 안전성평가에 1개 이벤트 당 100억원 정도 소요된다고 하며, 안전성평가를 통해 심사서를 작성하고 관련 규제 절차를 통과하기까지 3∼5년의 기간이 걸린다고 한다.
국내에서도 이러한 점을 생각하여 안전성평가 부분에 과감한 투자가 있어야 국내 최초의 GM작물의 승인이 이루어질 수 있을 것이다.
2. 산업현황
OECD에서는 2030년경 생명공학기술 응용분야별 발전 전망에서 1차 생산(농업, 어업, 임업 등)과 산업 응용분야의 중요성이 증대 할 것으로 예상하고 있으며 특히, 향후 생명공학기술은 보건산업 분야의 비중은 감소(87%, 2003 ⇨ 25%, 2030)하고, 1차 생산(4% ⇨ 36%)과 산업(2% ⇨ 39%) 분야가 75% 이상의 경제적 기여를 할 것으로 예상하고 있다
< 표. 바이오기술 응용분야별 현재 R&D 투자와 향후 산업규모 점유율 변화>

(출처 : “The Bioeconomy to 2030 :
식물이나 작물을 이용하여 농업 생명공학적으로 사업화가 되어 있는 분야는 크게 몇 가지로 나눌 수 있다. 첫째 종자회사를 통한 일반 종자 또는 GM종자, 둘째는 배양세포를 이용한 특정 단백질 및 의약품, 셋째는 배양세포조직 자체, 넷째는 바이오에너지, 다섯째는 기능성식품 또는 건강기능성제품이다. 외국에서는 각 분야별로 이미 시장이 형성이 되어 있다.
포괄적으로 산업측면에서 본다면 바이오산업이 상위에 있으며 바이오산업 중에서 농업생명공학산업이 하나의 줄기이자 여러 산업으로 나누어지는데 1) 사료, 식량, 식품 등 먹거리산업 2) 친환경, 바이오에너지 등 친환경사업3) 천연물 등 신소재 산업 그리고 4) 건강기능보조제 등 의약품 산업 등이다.
최근 들어서 상기 식물농업에 관련된 산업들이 꾸준히 성장하고 있는데 기술적 성장 이외에도 기업 규모의 대형화로 되고 있다. 예전부터 운영된 단일회사가 생존하기 보다는 화학이나 비료를 생산하는 다국적 기업들이 종자회사 등 농산업기업을 M&A 함으로서 기업가치를 제고하고 있다.
외국에 비해 국내의 농업생명공학산업은 매우 저조한 상황이다. 국내 농작물관련 산업은 대부분이 영세하며 대부분 종자회사가 주를 이루고 있고, 소위 생명공학기술을 이용한 농업기업은 극소수라고 해도 과언이 아니다. 농작물 관련 농업생명공학산업은 향후 매우 크게 발전할 분야인데 비해 국가에서 아직 중요성을 모르고 있으며 이에 산업인프라 구축이 시급하다.
가. 국내 농업생명공학기업 현황
(1) 종자회사
세계 농산업 시장의 주요 핵심 분야인 종자시장의 경우, 2008년 기준으로 세계 종자시장 규모는 약 695억불이며, 2020년에는 약 1,650억불에 이를 것으로 전망되고 있다.
이에 비해, 국내 종자시장 규모는 세계 시장의 약 1.5% 수준인 10.5억불에 불과하나, 2012년 글로벌 수출 종자 개발 및 민간육종 활성화를 위한 ‘Golden Seed Project'가 추진 될 예정으로 생명공학기술의 접목을 통하여 육종부터 종자 개량에까지 큰 역할이 기대되고 있다. 또한, 농식품부에서는 지속적인 농업 바이오산업의 발전을 도모하기 위하여 CRO*․CMO** 사업을 통하여 고부가가치 산업을 창출하고자 국가 전략산업으로 육성 할 예정이다.
* CRO(Contract Research Organization) : 전문연구대행 조직
** CMO(Contract Manufaturing Organization) : 위탁생산 전문조직
<분야별 세계 종자시장 규모>
|
구분 |
계 |
농산 |
축산(종축) |
수산 |
산림 |
|
세계시장 규모(A) |
695 |
367 |
171 |
157 |
- |
|
한국시장 규모(B) |
10.5 |
4 |
4.76 |
1.58 |
0.18 |
|
B/A |
1.5% |
1.1% |
2.8% |
1.0% |
- |
출처 : 'Golden Seed Project' 농과위 보고자료, 농림수산식품부, 2011
국내엔 약 100여개의 종자회사가 있다. 한국종자협회에 등록된 회사는 약 48개 이며 나머지는 등록하지 않은 회사들이다(표 1). 주로 채소종자를 파는 종자회사가 그 주를 이루며 대부분 영세이다. 임직원 수가 300명인 대기업은 1개회사(농우바이오) 뿐이며 대부분의 회사가 20명 이하의 임직원 수를 가지고 있다. 종자회사의 특징은 육종연구를 통해서 종자를 개발하고(F1 hybrid), 생산하고, 판매하게 되어 있어서, 종자를 개발할 수 있는 육종연구원이 있어야 운영을 할 수 있다. 그러나 임직원 극소수인 업체들은 육종연구원 없는 경우가 많아서 종자를 개발하다기 보다는 생산만 해서 종자를 공급한다.
표 1. 국내 종자기업 현황

종자를 개발하기 위한 육종연구는 우장춘박사 이후 장족의 발전을 하여 국내의 육종기술이 세계 top 수준에 와 있다. 그러나 3D업종으로 여겨 산업 성장기반에서 밀리고 국가 신성장동력에도 포함되어 있지 않다. 설상가상으로 1997-1999년 간 IMF 시대를 고비로 주요 종자회사들이 다국적기업들에 의해서 M&A가 됨으로서 50년간 육성해 왔던 종자주권을 잃어버렸다(표 2). 2000년대에 들어오면서 세미니스는 몬산토에 의해, 그리고 노바티스는 신젠타에 의해 또 다시 M&A가 됨으로서 종자회사들이다국적 화학-제약-비료회사들에 의해 합병․ 정리되었다.
 표 2. 외국자본의 국내 종자시장 진출
표 2. 외국자본의 국내 종자시장 진출
다국적기업들이 한국에 진입하면서 생명공학기술을 이용한 첨단 육종방법을 소개함으로서 기술적으로 한국농업생명공학 전반에 걸쳐 큰 변화가 오기 시작하였으며 가장 큰 역할을 한 기술은 DNA 마커를 이용한 분자육종이었다. 국내종자회사의 (주)농우바이오 경우는 외국기업과의 경쟁에서 살아남기 위해서 10여년간 엄청나게 첨단 생명공학분야에 투자를 하여 나름 국가경쟁력을 갖추게 되었고 이어서 (주)동부한농도 생명공학에 투자를 하였다(표 3).
표 3. 생명공학 활용 기업
국내 대기업인 농우바이오와 동부한농외에도 종자회사 중에서 생명공학기술을 갖추고 육종을 하고 있는 벤처 종자회사도 있다(표 4). 벤처기업들은 DNA 마커를 개발하여 기술이전을 하거나 개발된 마커들을 이용하여 검정 service를 하고 있다.
표 4. 종자벤처 회사
|
회사명 |
기술 |
작물 |
|
F&P |
DNA 마커개발 및 육종 |
고추 |
|
비이오브리딩 |
DNA 마커개발 및 육종 |
십자화과 |
|
고추와 육종 |
DNA 마커개발 및 육종 |
고추 |
(2) GM작물 개발 기업
세계 종자시장 규모는 약 380억불 정도 되며 몬산토나 신젠타같은 다국적 기업들이 석권하고 있다(표 5). 이중에서 GM종자 규모가 약 110억불이며 매년 증가하고 있다. 지난 15년간 GM작물의 재배면적과 재배농가의 수가 빠른 속도로 증가하고 있으며 또한 GM작물의 재배를 허가하고 참여하는 국가가 총 61개로 역시 늘고 있어서 GM작물의 산업적 가치가 매우 큰 것으로 재평가되고 있다.
표 5. 세계종자시장 및 GM종자시장
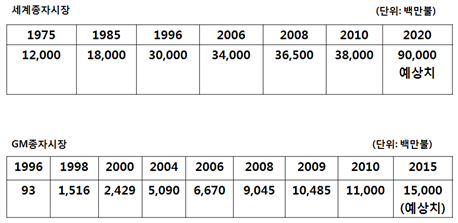
국내 GMO 개발의 역사는 약 20년 정도 되며 기술적, 재정적 부담 때문에 국가연구기관인 농촌진흥청 산하기관에서 가장 활동적으로 연구를 하고 있고 기업에서의 연구는 몇 곳을 제외하곤 전무한 상태이다. 선진국에서는 GM종자 개발의 중심지가 기업인 반면에 한국에서는 국가기관이나 대학에서 상업적 value를 목표로 한 연구보다는 시스템구축 내지는 학문적 연구가 더 많았다. 따라서 그동안 많은 시간과 연구비를 소진하면서 GM작물 개발관련 인프라를 구축했지만 그럼에도 불구하고 GM작물의 품종화는 고사하고 아직 안전성 평가를 완료하여 심사청구를 한 작물이 없는 것이 국내 현실이다.
그럼에도 불구하고 GM작물개발을 계속 연구하고 투자하는 회사는 다음과 같다. 그러나 그 투자금액이 너무 적어 국가 연구 과제를 이용한 운영시스템에 국한되어 있는 실정이다.
표 6. GM작물을 개발하는 회사
|
회사명 |
기술 |
작물 |
|
농우바이오 |
GMO 개발, 유전자선발, 벡터개발, 위해성평가 |
고추, 수박, 양배추, 배추, 브로컬리 등 |
|
F&P |
위해성평가 |
유채 |
|
에버그린바이오텍 |
GMO 개발, 위해성평가 |
잔디 |
GMO는 향후 먹거리, 의약품, 신소재, 친환경 등 미래 산업의 역할과 그 유용 가치와 매우 큰 소재임에도 불구하고 국내에서는 개발에 대한 문제점이 많다. 크게 3가지로 볼 수 있는데, 첫째는 아직도 우리의 전반적인 역량이 부족하다. 즉 형질전환 기술을 산업적으로 응용하는 실력이 부족하고, 인력과 연구비가 선진국에 비하면 턱없이 부족하다는 것이다. 한 예로 중국은 일년에 4500억원을 GMO 개발 연구에 투자하고 있는데 한국은 일년에 고작 80억원을 투자하고 있다. 둘째는 상업성을 위한 정확한 유전자를 선발하여 형질전환작물을 개발하고 이에 따른 품종화, 위해성 심사 그리고 상업화가 추진되어야 하는데 그렇지 못하다. 상업성 가치가 없는 것들이 대부분이며 많은 시행착오로 완전한 형질전환작물을 개발 못하고 있는 것이다. 시작서부터 상업화전까지 최소 10년이 걸리는 작업이니 개발자는 처음 설계서부터 상업성을 참고해야 한다. 셋째는 GM계통과 품종을 만들 수 있는 육종가가 부족하여 상업적으로 가는 로드맵이 병목으로 되어 있다.
(3) 조직배양 산물을 이용한 산업
약성 식물체의 세포들을 인위적으로 배양하여 식물 배양체를 그대로 상품화 하든지, 이를 가공해서 다른 상품의 소재로 공급하고 있다. 예를 들어서 CBNBIOTECH은 산삼 등 귀한 약제 안에 있는 약리성분들을 대량 확보하기 위하여 10톤 규모의 생물반응기를 개발하여 유효물질의 함량을 대량 높인 배양공정 방법으로 산업화에 성공하였다. 이런 배양기를 통해서 식물의 phytochemical을 대량 분리하여 건강기능제품을 개발할 수 있어서 이런 사업들은 향후 매우 각광을 받을 것으로 기대하고 있다. 다만 기업 규모가 영세이어서 지속적인 투자가 요구된다.
표 7. 식물조직배양 기업
|
회사명 |
기술 |
작물 |
|
CBNBIOTECH |
생물반응기를 설계·제작하여 대량 조직배양 |
인삼, 산삼, 장뢰삼 등 고부가성 약용실물의 부정근 배양체 |
|
마이크로프랜츠 |
위해성평가 |
가시오갈피 배양체, 산삼배양근 |
|
운하 |
식물줄기세포분리 |
줄기세포 대량생산을 통한 제약, 식품, 화장품 소재 |
(4) 분자농업 기업
현재 상업화가 되고 있는 GM해충저항성, 제초제내성 GM작물들은 제 1세대라고 말하며 제 1세대의 주요 목적은 생산성 증대이다. 즉 해충, 잡초, 병, 환경스트레스에 의해 매년 생산량이 타격을 받는 것을 해결하기 위해서 저항성 또는 내성작물을 개발하는 차원이다. 지금까지 성공을 했다고 평가할 수 있으며 향후 환경스트레스(가뭄, 염, 냉, 고온 등)에 내성을 갖는 작물이 시장에 나오면 더 한층 생산성 증가를 가져올 것으로 기대한다.
또한 수확량 보다는 기능성을 강조한 제 2세대 형질전환 농산물들은 상품화되기 시작하였다. 현재로는 그 상업성, 재배면적 및 유통 규모가 미약한 상황이지만 관심은 점점 커지고 있는 있으며 예를 들어서 숙기지연, 고펙틴 토마토; 숙성조절 딸기, 바나나; 고당도 고추, 토마토; 전분함량증진 감자; 지방산 조성이 변화된 대두, 유채, 해바라기, 땅콩 등이다.
제 3세대는 분자농업(molecular farming)을 통해서 고부가가치 생체활성물질, 의약제품, 유용단백질 등을 생산을 말하는데 크게 2가지를 나눈다. 첫째는 특정 고부가가치 소재를 함유하고 있는 작물(GMO)을 대량 재배, 수확하고 그 소재를 분리, 정제하여 제품화 하는 것이고, 둘째는 그런 GMO 세포를 실험실내 배양기에서 키워 배양체에서 고부가가치 유용물질을 대량 생산하고 추출하여 제품화한다는 것이다. 그동안 담배를 중심으로 당뇨병, 탄저병 백신, B형 간염 백신 등 여러 작물에 인간의 건강을 위해서 개발된 것 뿐 만 아니라 상추, 알팔파에서 돼지 콜레라균 항체, 토마토의 조류독감 백신 등이 개발되어 동물 질병치료에 근접하여 있다. 과일, 채소로 만든 식물 백신에 대한 동물 실험에서 보여준 백신의 효능도 사람을 대상으로 한 임상 시험을 통해 입증되고 있는 상태다. 식물을 이용하여 이런 고부가가치 물질을 생산할 경우 제조비용이 적게 들어서 획기적이기는 하나 단백질이나 활성물질 자체의 activity 조절 및 임상실험 관련해서 아직도 많은 연구가 되어야 하기 때문에 시간이 더 필요한 것으로 보인다.
이 모든 분자농업의 현황은 Protalix 같은 외국기업에서 plant-made phamaceuticals라고 다양한 高價의 단백질 또는 백신을 식물조직배양체에서 추출하고 있다. 최근에 백신을 중심으로 의약품시장에 선을 보이고 있으며 엄청난 시장을 창출할 것으로 기대하고 있다. 반면, 국내에서는 이런 사업자체가 거의 전무한 상태이다. 국내에는 제약회사만 수십개가 넘지만 어느 기업도 이런 연구를 하지 않고 대부분 제네릭 약품만 집중하고 있다. 그럼에도 불구하고 식물체에서 유용물질을 추출하고 산업화를 하고 있는 극 소수의 기업이 있다. 넥스젠은 국내 처음으로 GM담배에서 EGF를 생산하여 판매를 하여 식물을 이용한 국내 분자농업기업 제 1호이다. 엔비앰은 생리활성물질인 cytokine을 식물에서 대량 확보하여 질병치료 사용에 소재로 제공하고 있다. 문제는 투자 등 산업적 취약성으로 이런 기업들이 더 이상 도출이 되지 않고 있다는 것이다.
표 8. 재조합단백질 개발 기업
|
회사명 |
기술 |
작물 |
|
넥스젠 |
미생물, 식물을 이용한 단백질 재조합기술 |
진단용 항원, 항체, 재조합단백질 (예: plant made human epidermal growth factor) |
|
엔비엠 |
단백질 생산기술 |
enterokinase, cytokine |
나. 결론
농작물은 품종화할 때까지 시간, 노동인력, 비용이 많이 드는 3D 업종이어서 첨단 BT 분야가 접목하기 쉽지 않다. 그러나 융복합 산업화가 또 다른 차원의 신산업을 창출하듯이 농업생명공학기술이 먹거리산업, 친환경사업, 신소재 산업, 의약품 산업 등으로 발전하고 있다. 즉 농업생명공학 발전만이 수량증대, 품질향상, 생산비절감, 노동절감, 농가소득증대, 친환경자연과 생태계보호, 기능성, 인류건강 향상과 의약품개발 등을 이룰 수 있다. 이 분야들이 각 해외 산업별 시장규모가 빠른 속도로 증가하고 있는 반면 동종의 국내 산업은 아직 걸음마 상태 내지는 시작을 하지 못하고 있는 실정이다.
산업화 가치가 있는 제품생산은 오랜 연구를 통해서 기업이 육성을 하는데 기업들이 영세이다 보니 감히 투자를 하지 못하고 있다. 더욱이 국가에서 정책적으로도 투자를 하지 않는 부분이다 보니 비전이 보이지 않고 있다.
해당 연구자들과 학회, 정책입안자들이 정부에 이 분야가 국가 미래 신성장동력이 될 것이라는 점을 각인시켜서 정부의 역할이 표면화 될 수 있도록 했으면 한다.
제4절 산업공정/환경⦁해양수산 분야
1. 제조 및 생물공정
가. 개 요
생물공정기술은 생명공학기술을 이용하여 목적 산물을 대량생산하기 위한 기술로써 “생명과학의 연구발견을 실제제품 및 공정 또는 사회적 수요에 부합하는 시스템으로 변환시키는 기술“을 총칭하는 것으로 정의 할 수 있다. 이러한 생물공정기술이 추구하는 최종목표는 생명공학기술을 활용하여 산업적으로 필요한 원료 또는 최종 물질을 대량으로 제조하는 것으로써 가장 대표적인 것이 미생물을 이용한 발효산업으로 현재 식품 및 사료 원료, 효소, 바이오 에너지, 바이오 화학 소재 등의 제조에 폭넓게 적용되고 있다.
나. 해외 동향
2010년도 발효를 기반으로 한 화학제품의 세계시장 규모는 389억 달러로 추정되며 2007-2015년 동안 연평균 성장률은 4.7% 예상되며 이를 기준으로 2015년에는 485억의 시장이 형성될 것으로 예측된다29). 가장 큰 시장을 형성하고 있는 미국의 2010년 시장 규모는 세계시장의 36.8%에 해당하는 143억 달러로 추정되며, 2007-2015년 동안 평균 성장률이 4.1%에 이룰 것으로 보아 2015년에는 171억 달러에 이를 것으로 예상된다 (표1).
특히 가격 경쟁력이 있는 친환경 바이오 에탄올의 경우 2007-2015년 연 평균 성장률 5.1%를 기준으로 2015년 세계시장 규모가 257억 달러로 전망된다. 다음으로는 2010년 현재 년 51억 달러의 시장을 갖고 있는 발효 유기산(예; 젖산, 유기산 등)으로 연평균 5.4%씩 성장하여 2015년에는 63억 달러의 시장을 형성할 것으로 전망된다(표2).
발효 화학 물질의 생산은 중국에서 폭발적으로 증가 하고 있다. 중국은 약 700 여개의 전문회사와 수백의 작은 회사들을 중심으로 아미노산, 메티오닌, 비타민 C, 구연산 및 기타 발효화학 물질들을 생산하는 바이오텍 산업의 제조 허브가 되고 있다. 이 회사들 중에서 1/3정도는 제약 제품을 생산하고 있고, 1/3은 아미노산과 관련제품들을 생산하고 있고, 나머지 1/3 정도의 기업은 식품 및 음료와 기타 화학 물질들을 생산하고 있다. 지난 3년간 중국의 생명공학 제품 생산량은 두배로 증가하였으며 각 기업체들은 공격적으로 생산 능력을 확대하고 있다. 중국은 최대 항생제 생산국으로 전 세계 생산량의 50%를 담당하고 있고, 효소와 아미노산도 주요 생산국이 되고 있다.
표1) 국가별 발효 화학 물질 시장 현황 및 전망1)
(백만불)
|
지역/ 국가 |
2010 |
2011 |
2012 |
2013 |
2014 |
2015 |
평균 성장율 (%) |
|
미국 |
14295 |
14892 |
15476 |
16044 |
16578 |
17071 |
4.12 |
|
카나다 |
1027 |
1061 |
1095 |
1128 |
1162 |
1194 |
3.47 |
|
일본 |
916 |
954 |
992 |
1030 |
1068 |
1105 |
4.2 |
|
유럽 |
8764 |
9089 |
9407 |
9720 |
10027 |
10329 |
3.73 |
|
아태 |
7328 |
7754 |
8222 |
8723 |
9288 |
9891 |
6.02 |
|
중동 |
1052 |
1106 |
1165 |
1231 |
1303 |
1382 |
5.31 |
|
중남미 |
5524 |
5847 |
6206 |
6604 |
7043 |
7527 |
6.1 |
|
총계 |
38905 |
40702 |
42564 |
44489 |
46467 |
48499 |
4.71 |
표2) 제품별 세계 발효 화학물질 시장 현황 및 전망1)
(백만불)
|
발효제품 |
2010 |
2011 |
2012 |
2013 |
2014 |
2015 |
평균 성장율 (%) |
|
항생제 |
5876 |
6105 |
6343 |
6590 |
6845 |
7107 |
3.95 |
|
알코올 |
20594 |
21613 |
22673 |
23770 |
24898 |
26056 |
5.06 |
|
효소 |
2843 |
2947 |
3050 |
3151 |
3250 |
3346 |
3.60 |
|
유기산 |
5120 |
5345 |
5576 |
5813 |
6056 |
6308 |
4.45 |
|
비타민 |
1599 |
1696 |
1799 |
1911 |
2030 |
2159 |
6.29 |
|
폴리머/검 |
1098 |
1143 |
1189 |
1237 |
1287 |
1338 |
4.20 |
|
기타 |
1775 |
1854 |
1935 |
2017 |
2100 |
2185 |
4.51 |
|
총계 |
38905 |
40702 |
42564 |
44489 |
46467 |
48499 |
4.71 |
2008-2009년에 발효 에탄올 소비는 가장 큰 소비국인 미국의 수요 감소에 기인하여 감소하였으나 2010년 이후부터는 꾸준히 증가하고 있다. 특히 바이오 에탄올은 가솔린 첨가제로 사용하는 MTBE 대체하는 가장 빠르게 성장하는 발효 화학 물질로 각광을 독차지하고 있다. 최근 전 세계적으로 생산되고 있는 에탄올의 86%는 바이오 연료로 소비되고 있다. 사탕수수와 당밀(브라질), 옥수수(미국), 사탕무우(프랑스), 밀(케나다), 고구마와 카사바(중국) 같은 식품원료들이 주요 에탄올 생산원료로 사용되고 있다. 에탄올 외에도 폴리머 원료인 1,3-propanediol의 사용량 증가는 향후 발효 화학물질 시장의 전망을 밝게 하고 있다.
세계 효소 시장은 전체적으로는 최근 안정적인 성장을 하고 있으나 분야에 따라서는 부침이 있다. 즉, 식품 및 사료용 효소 시장은 침체되어 있는 반면 세제용 및 산업용 효소 시장은 미미한 성장을 나타내고 있다(표3). 산업용 효소 시장의 구조는 굳혀진 형태를 갖고 있다. 즉, Novozyme과 Genenco/Danisco로 양분되어 거의 세계시장의 2/3를 이들이 차지하고 있고, 기타 DMS, BASF, ABF, AB Enzymes, Amano Enzyme 이 주요 효소 기업으로 활동하고 있다(표4).
표3) 국가별 발효 효소 시장 현황 및 전망1)
(백만불)
|
지역/ 국가 |
2010 |
2011 |
2012 |
2013 |
2014 |
2015 |
평균 성장율 (%) |
|
미국 |
1432 |
1506 |
1579 |
1651 |
1720 |
1785 |
5.06 |
|
카나다 |
45 |
45 |
46 |
47 |
47 |
48 |
1.65 |
|
일본 |
60 |
61 |
61 |
62 |
63 |
64 |
1.37 |
|
유럽 |
756 |
772 |
787 |
803 |
818 |
833 |
2.17 |
|
아태 |
325 |
333 |
341 |
350 |
359 |
368 |
2.45 |
|
중동 |
76 |
78 |
80 |
82 |
84 |
86 |
2.42 |
|
중남미 |
150 |
152 |
154 |
157 |
159 |
162 |
1.55 |
|
총계 |
2843 |
2946 |
3049 |
3151 |
3250 |
3346 |
3.60 |
표4) 주요 효소 기업별 시장 점유율1)
|
기 업 |
점유율(%) |
|
Novozyme |
46.21 |
|
Genenco/Danisco |
21.48 |
|
DMS, |
6.39 |
|
기타 |
25.92 |
|
총 계 |
100 |
대표적인 유기산인 구연산 시장은 최종 소비처인 식품, 음료 및 세제의 수요 감소에 따라 구미에서는 미미한 성장을 하고 있지만 아태 및 중동과 같은 개도국에서는 크게 성장 하고 있다(표5).
젖산은 최근 생분해성 고분자인 polylactic acid (PLA) 합성 원료로 각광을 받으며 시장이 빠르게 성장하고 있다. 특히 미국과 유럽에서 PLA는 커트레이(cutlery), 보존용기, 플라스틱 포장 마켓에서 사용이 크게 증가하고 있다(표6).
표5) 국가별 발효 구연산 시장 현황 및 전망1)
(백만불)
|
지역/ 국가 |
2010 |
2011 |
2012 |
2013 |
2014 |
2015 |
평균 성장율 (%) |
|
미국 |
548 |
565 |
581 |
595 |
608 |
619 |
2.97 |
|
카나다 |
49 |
50 |
52 |
54 |
55 |
57 |
3.42 |
|
일본 |
59 |
61 |
63 |
64 |
6 |
68 |
3.04 |
|
유럽 |
635 |
655 |
674 |
692 |
709 |
726 |
3.12 |
|
아태 |
443 |
464 |
488 |
515 |
543 |
573 |
5.13 |
|
중동 |
101 |
106 |
112 |
119 |
126 |
134 |
5.64 |
|
중남미 |
142 |
146 |
152 |
157 |
163 |
170 |
3.58 |
|
총계 |
1975 |
2048 |
2121 |
2195 |
2270 |
2346 |
3.71 |
표6) 국가별 발효 젖산 시장 현황 및 전망1)
(백만불)
|
지역/ 국가 |
2010 |
2011 |
2012 |
2013 |
2014 |
2015 |
평균 성장율 (%) |
|
미국 |
118 |
127 |
135 |
144 |
152 |
160 |
7.03 |
|
카나다 |
29 |
30 |
30 |
31 |
32 |
32 |
2.73 |
|
일본 |
26 |
27 |
28 |
28 |
29 |
30 |
3.51 |
|
유럽 |
321 |
334 |
347 |
359 |
371 |
382 |
4.18 |
|
아시아/태평양 |
340 |
357 |
374 |
394 |
415 |
438 |
4.92 |
|
중동 |
61 |
66 |
71 |
77 |
83 |
89 |
7.76 |
|
중남미 |
116 |
123 |
132 |
140 |
150 |
161 |
6.43 |
|
총계 |
1010 |
1063 |
1117 |
1174 |
1232 |
1292 |
5.10 |
아미노산 시장의 대표적인 품목인 라이신은 주로 양돈 사료로 사용된다. 따라서 지난 10년간 구제역으로 인하여 시장이 침체된 경험도 있으나 유럽에서의 동물성 사료 사용금지에 힘입어 시장이 회복되었다. 더욱이 중국, 동유럽, 중남미 등 개도국에서의 높은 수요증가로 시장이 크게 개선되고 있다(표7).
표7) 국가별 발효 아미노산 시장 현황 및 전망1)
(백만불)
|
지역/ 국가 |
2010 |
2011 |
2012 |
2013 |
2014 |
2015 |
평균 성장율 (%) |
|
미국 |
342 |
353 |
362 |
371 |
379 |
385 |
2.94 |
|
카나다 |
43 |
45 |
47 |
49 |
51 |
52 |
5.22 |
|
일본 |
43 |
44 |
46 |
48 |
49 |
51 |
4.05 |
|
유럽 |
528 |
547 |
566 |
584 |
602 |
619 |
3.70 |
|
아태 |
475 |
505 |
537 |
572 |
611 |
653 |
6.37 |
|
중동 |
83 |
89 |
97 |
105 |
114 |
125 |
8.07 |
|
중남미 |
140 |
147 |
156 |
165 |
175 |
186 |
5.64 |
|
총계 |
1653 |
1730 |
1811 |
1894 |
1981 |
2073 |
4.78 |
다. 국내 현황
일본을 제외한 한국을 포함한 아시아-태평양 국가 (호주, 중국, 인도, 인도네시아, 말레이시아, 뉴질랜드, 필리핀, 싱가폴, 타이완, 태국)의 발효화학 시장은 2010년에 73억 달러로 연 6% 이상의 성장률로 2015년에는 99억 달러로 전망된다(표8). 국내의 경우 주요 발효산업인 라이신 및 MSG 산업 생산시설의 해외이전으로 국내 생산은 감소되었으나 비타민을 위주로한 소비량은 크게 증가하고 있는 추세이다.
라. 발전 과제
생물공정 기술에 의한 원료 및 제품 생산은 고부가 의약품을 제외하고는 핵심기술이 개발된 이후부터는 원료가격에 경제성이 크게 좌우 된다. 즉, 무엇보다도 저렴하고 풍부한 탄소원의 확보가 관건이다. 특히 최근 바이오 에탄올의 생산 증가에 기인한 곡류 및 설탕 가격의 급등으로 발효산업의 경쟁력이 저하되고 있는 추세이다. 따라서 이를 극복하기 위한 대안으로 섬유질계 바이오매스 원료를 사용한 발효성 당 생산 기술개발이 당면과제가 되고 있다.
표8) 아시아/태평양 지역 발효 화학물질별 시장 현황 및 전망1)
(백만불)
|
발효제품 |
2010 |
2011 |
2012 |
2013 |
2014 |
2015 |
평균 성장율 (%) |
|
항생제 |
1666 |
1768 |
1880 |
2001 |
2133 |
2276 |
6.27 |
|
알코올 |
2607 |
2757 |
2921 |
3098 |
3290 |
3497 |
5.94 |
|
에탄올 |
2566 |
2714 |
2875 |
3049 |
3237 |
3440 |
5.94 |
|
기타알코올 |
41 |
43 |
46 |
49 |
53 |
57 |
6.22 |
|
효소 |
325 |
333 |
341 |
350 |
359 |
368 |
2.45 |
|
유기산 |
1356 |
1428 |
1508 |
1594 |
1687 |
1789 |
5.50 |
|
아미노산 |
475 |
505 |
537 |
572 |
611 |
653 |
6.37 |
|
구연산 |
443 |
464 |
488 |
515 |
543 |
573 |
5.13 |
|
젖산 |
340 |
357 |
374 |
394 |
415 |
438 |
4.92 |
|
기타유기산 |
98 |
102 |
107 |
113 |
119 |
125 |
4.95 |
|
비타민 |
678 |
731 |
791 |
858 |
933 |
1017 |
8.26 |
|
폴리머/껌류 |
270 |
284 |
301 |
319 |
340 |
362 |
5.89 |
|
기타 |
426 |
452 |
480 |
511 |
545 |
581 |
6.32 |
|
총계 |
7327 |
7754 |
8222 |
8732 |
9288 |
9891 |
6.02 |
2. 환경 생명공학
가. 서론
(1) 환경생명공학기술의 개요
환경생명공학(Environmental Biotechnology)이란 생명공학기술(Biotechnology, BT)을 환경공학(Environmental Technology, ET)분야에 이용하여 환경오염을 방지하고 환경을 효율적으로 보전하고 관리하는데 활용되는 모든 기술 또는 학문을 의미한다. 이 분야는 21세기 첨단기술로 주목되는 것 중 하나로써 분자생물학, 환경과학, 생태학 등의 분야와 융화하여 빠르게 발전되고 있다.
환경생명공학기술은 기술표준원의 기술분류에 따라 표 1과 같이 청정기술, 환경오염제어 및 관리기술, 바이오에너지 기술 및 기타 환경생명공학 기술로 나누어져 있다. 이러한 기술들은 전세계적으로 환경분야의 핵심기술로 연구개발을 통해 실용화를 추진하고 있다.
본 장에서는 환경생명공학기술 중 환경오염제어 및 관리기술에 해당하는 생물정화(Bioremediation)를 중심으로 관련 내용을 조사하여 정리하였다.
(2) 환경생명공학 기술개발의 필요성
환경문제는 21세기 인류생존을 위협하는 최대 현안문제 중 하나로써 기존의 환경문제를 해결하기 위해 물리적, 물리․화학적, 생물학적 방법을 이용하였으나 여기에 첨단기술로 주목받고 있는 생명공학기술까지 도입되어 환경문제를 해결하기 위해서
전 세계적인 노력을 기울이고 있다. 생물정화기술은 미생물이나 식물에 의한 난분해성 물질 및 환경오염물질의 분해 촉진 및 생물전환(Biotransformation) 등을 통해 오염물질의 농도가 근본적으로 감소되고, 2차 오염을 방지할 수 있으며, 장기적면에서 고려할 때 물리적, 화학적 또는 물리․화학적 방법보다 환경관리 비용이 적게 든다는 경제적인 장점을 가지고 있다.
표 1. 환경생명공학기술 분류표 (기술표준원, 2004)
|
환경생명공학기술 (Environmental Biotechnology) 오염의 측정, 처리, 복원 등 환경분야와 바이오에너지 분야에 응용되는 생명공학기술 |
|
|
중분 류 |
청정기술(Clean Technology) 에너지나 자원의 소비량을 저감할 수 있거나 환경오염물질의 배출을 저감할 수 있는 환경친화적 대체 원료 및 공정을 이용하는 생산·관리기술 |
|
세부 분 류 |
○공정관련 청정기술(Process-related clean technology) |
|
○생물농약개발기술 (Biological agrochemicals development) |
|
|
○생분해성 소재 생산기술 (Biodegradable material production) |
|
|
○청정 유기용매 개발기술 (Bio-based solvent technology) |
|
|
중분 류 |
환경오염제어 및 관리기술 (Environmental pollution control and management technology) 수질,대기, 토양 등의 자연환경으로 환경오염물질의 배출을 억제하거나 오염된 자연환경을 복원할 수 있는 저감 및 관리기술 |
|
세부 분 류 |
○대기오염제어 및 처리기술(Air pollution control and processing) |
|
○수질오염제어 및 처리기술(Water pollution control and processing) ○토양오염제어 및 복원기술(Soil pollution control and remediation) |
|
|
○폐기물 처리기술(Waste processing) |
|
|
○환경계측 및 제어기술(Environmental assessment and control) |
|
|
○생태계 복원기술(Ecosystem restoration) |
|
|
○환경오염 측정 분석기술(Environmental measurement and analysis) |
|
|
중분 류 |
바이오 에너지 기술 (Bioenergy Technology) 바이오매스와 같은 재생 가능한 자원을 이용하여 전기,연료, 열, 화학물질, 기타 물질들을 포함하는 에너지 관련 산물의 생산 및 이용 기술 |
|
세부 분 류 |
○전분질 이용 바이오에탄올 생산기술(Bioethanol production using Starch biomass) |
|
○섬유소 이용 바이오에탄올 생산기술(Bioethanol production using Lignocellulosic biomass) |
|
|
○바이오디젤 생산기술(Biodiesel production) |
|
|
○바이오가스 생산기술(Biogas production) |
|
|
○바이오가스 이용기술(Biogas production) |
|
|
○바이오수소 생산기술(Biohydrogen production) |
|
|
○바이오부탄올 생산기술(Biobutanol producion) |
|
|
중분 류 |
기타 환경생명공학 및 바이오에너지 기술 (Environmental biotechnology and bioenergy technology, n.e.s.) |
나. 국제 동향
(1) 연구개발 동향
국제적으로 활발히 연구가 진행되고 있는 환경생명공학분야에는 바이오플라스틱, 바이오 디젤(바이오에너지), 기능성섬유(거미줄 단백질생산을 이용한 방탄복 생산 등) 등과 같은 석유화학성분을 대체하기위한 분야와 식물 또는 미생물을 이용해 폐기물 및 오염물질의 저감하거나 제어 하는 생물정화분야의 연구가 활발히 진행 되고 있으며, 이들 중 생물정화의 주요 연구개발 동향을 요약정리 하였다(표 2).
생물정화는 주로 미생물 또는 식물을 이용하는 두 가지로 크게 구분되어 진다. 미생물을 이용하는 분야의 최근 연구는 생물정화를 효율을 높이는 미생물의 복잡한 대사과정을 파악하고 이해하는 연구가 활발히 진행되고 있으며, 저비용이고 환경 친화적으로 생각되는 오염대상을 바로 그 오염장소(in-situ)에서 처리 또는 in-situ와 ex-situ(오염된 대상을 다른장소로 이동하여 처리)에서의 미생물과 영향분석의 효율적인 공급방법 개발에 노력 중인 것으로 조사되었다. 식물을 이용한 생물정화(Phytoremediation)는 환경 친화적이며, 비용 절감적이며, 다양한 오염물질 정화 그리고 지하수로의 오염물질 누출을 방지하는 등의 2차 오염이 없는 장점을 지니며, Phytoremediation 최근연구는 식물의 독성 금속물질 수송기작과 특정식물의 독성금속 흡수와 저항성 연구 분야 및 기능이 규명된 유전자를 식물에 삽입․발현시켜 금속오염에 저항성을 보이는 형질전환 식물체를 개발하는 분야가 활발히 진행 중이다.
표 2. 생물학적 정화의 주요 연구개발 동향
|
정화 분야 |
기술개발 동향 |
|
미생물을 이용한 생물정화 |
․중금속 저항성, 금속 분해능을 도입한 생물정화용 형질전환 미생물 개발 ․PCB 분해용 신규미생물 분리 ․생체물질 진단도구 및 방법 개발 ․독성물질 검출도구 및 수질 모니터링 시스템 개발 ․생분해성․환경친화적 필름 및 용도 ․미생물 분해성 폴리머 조성에 대한 연구 ․유기물질 고속 분해 방법 |
|
식물을 이용한 생물정화 |
․수경식물 재배방법 및 재배구조 ․식물생장 촉진 인자 탐색 연구 ․Phytoremediation을 적용한 사례로는 1986년 우크라이나 체르노빌에서 일어난 방사능 유출지역을 해바라기를 정화에 이용 ․포플러 나무와 인디언 겨자의 특성을 이용하여 미국의 무기 시험장 및 군사지역의 오염물질 정화에 적용 ․400종 이상의 중금속 과축적 식물이 발견되었으며, 많은 연구기관과 회사에서 보다 향상된 과축적 식물을 찾기 위해 연구 진행 ․과축적 식물들의 기능향상을 위한 형질전환 식물체를 이용한 환경정화 기술개발이 활발히 진행 |
생물정화에서는 형질전환 미생물 이용기술, 생물학적 투과장벽(Biowell) 및 Biocapping 기술, Biobeads 기술, 복합기술/Phasic 정화방법, 신규 영양 첨가물를 통한 정화능력향상 기술 등이 향후 유망기술도 발전할 것으로 여겨진다.
|
○ 형질전환 미생물 이용기술 : 고온생장, 유기독성물질 또는 방사성 물질 분해 유전자를 도입한 형질전환미생물을 이용하는 기술 ○ Biowell 및Biocapping : Mulch,곰팡이 균사 혹은 조류(algae)와 같은 생물 재료를 이용한 장벽을 만들고 그 안에 오염물질을 가두어 오염물질의 이동을 방지 하고 오염물질의 분해 혹은 무독화 시키는 기술 ○ Biobeads : 다공성 폴리머에 미생물을 주입하여 오염의 문제가 되는 곳에 이용하는 기술 ○ 전달 및 검출시스템 : 지하수 혹은 균열된 기반암 등 미생물과 영양 첨가 물들이 도달하기 어려운 지역의 정화에 전달시스템 개발기술 ○ Biofilters : 다량의 미생물을 함유한 필터로서 높은 이온교환 능력을 지니며 습한 환경에서도 사용 가능한 기술 ○ 복합기술/Phasic : 정화방법 하나 이상의 생물정화기술과 함께 다른 정화 기술들을 복합적으로 사용하여 오염물질 정화 효율을 높이는 기술 ○ 신규 영양 첨가물을 통한 정화능력향상 : 미생물 생존력 및 생물정화 효율을 높이기 위해서 첨가되는 lactate, 질소 첨가제 등 신규 영양물질 개발기술 |
전세계 적으로 생물정화관련 특허을 가장 많이 보유한 출원기관은 일본의 캐논사로 64건의 관련특허를 보유하고 있으며, 이외 산업기술연구소, 히타치사, 토시바사 등 일본의 산업체와 국립 연구소에서 관련 기술개발을 활발히 수행하고 있는 것으로 조사되었다. 이렇게 전자, 기계 관련회사로 알려진 기업들이 생물정화에 대한 기술노력이 주목되면서 생물정화와 전자 및 기계공학 기술의 융합연구가 주목받을 것으로 기대된다.
(2) 시장성 분석 및 관련 산업동향
환경정화 및 설비 서비스 관련 세계 시장은 2006년 2,085억 달러 규모로 조사되었다. 2006년과 2011년 사이 연평균 2.9%의 성장률을 달성하여, 2011년 환경정화 및 설비 서비스 관련 세계 시장은 2,409억 달러를 형성할 것으로 전망하고 있다(표 3).
2006년 시장에서 환경정화 및 설비 서비스 분야별로 고체 폐기물 처리가 50% 이상으로 가장 큰 부분을 차지하고 있으며 컨설팅 및 공정이 23.2%, 복원 및 산업 서비스가 13.5%, 위험 폐기물 처리가 9.4%, 분석 서비스가 2.0%를 차지하였다. 지역별로는 미국 39.9%, 유럽 31.3%로 환경 산업에서 미국과 유럽이 큰 차이를 보이지 않으며 아시아-태평양이 22.3%의 시장을 구성하고 있다.
표 3. 환경정화 및 설비 서비스 세계 시장현황 및 전망(2006∼2011년)
[단위 : 십억달러]
|
년도 |
2006 |
2007 |
2008 |
2009 |
2010 |
2011 |
누적연평균성장률 (‘06∼‘11년) |
|
시장규모 |
208.5 |
215.0 |
221.5 |
227.9 |
234.4 |
240.9 |
|
|
성장률(%) |
3.20 |
3.10 |
3.00 |
2.90 |
2.80 |
2.80 |
2.9 |
※ Datamonitor, “Global Environmental Services” (2007.3)
전세계적으로 환경문제가 큰 이슈로 대두되고 이에 따른 엄격한 국제규제 규정제정이 진행됨에 따라 환경생명공학분야도 산업의 경쟁력 확보차원에서 국제수준의 환경문제 대응기술을 적극적으로 추진 중에 있다. 특히, 미국, 캐나다, 호주 등 선진국을 중심으로 경제적이고 자연친화적으로 오염원을 정화할 수 있는 환경생명공학기술들이 활발히 개발되고 있으며 부가가치가 높은 상품이 개발되고 있는 추세이므로 산업화 및 시장규모는 더 커질 것으로 예상된다.
다. 국내 현황
우리나라의 생물정화에 관련된 연구는 1990년대 중반까지 매우 미미한 결과가 논문에 발표되었다. 그러나 1990년대 중반 이후에는 최근까지 빠르게 증가하고 있으나, 그 다양성면에서는 국제동향과 달리 균주 특성규명 및 활용성 높은 균주 분리 등의 기초연구에 많이 집중되어 있으며 오염된 현장에 적용하는 응용기술 개발은 아직 미미한 수준이다.
국내 환경생명공학에 대한 본격적인 투자는 1994년에 과기부 주관의 국가생명공학 기본계획인 「제1차 생명공학육성기본계획」과 G7 프로젝트를 통해 시작되었다. 또한 환경부의 환경공학기술개발사업, 차세대핵심환경기술사업, 농림부의 농림기술개발사업 등을 통해 환경생명공학 관련 연구개발을 통해 지원하고 있다.
환경생명공학분야도 국제환경이 변화됨에 따라 국내에서도 과학기술부 주관으로 국가 산업경쟁력 확보 및 국가과학기술혁신을 위하여 추진 중인 중점국가연구개발산업 중 생명공학실용화 연구분야에서 환경생명공학분야의 연구도 포함되어 중점국가 연구개발 산업 중에 하나로 주목을 받고 있다. 특히, 생물정화 기술개발을 위해 정부는 2002부터 2007년까지 다양한 부처의 연구개발을사업을 통해 175억원을 지원하였다. 여기에는 과기부가 전체연구비의 48%에 해당하는 85억 이상을 투자하였으며 다음으로는 환경부가 38억원(22%)을 투자하였다.
이러한 연구사업들을 통해 진행된 국내의 생물정화 관련 주요연구와 성과를 다음과 같이 조사되었다.
|
- 다 음 - |
|
□ 학계 ○ 생물정화를 위한 중금속 오염 내성 및 축적성 향상 형질전환 식물체 개발(포항공대 이 영숙 교수 연구팀) ○ 토양오염을 복원에 이용할 수 있는 중금속 흡수 쑥 개발(고려대 김정규 교수 연구팀) ○ 유용미생물 균주의 생분해 활성을 이용한 재배지의 잔류독성 화합물 제거(안동대 권기석 교수 연구팀) ○ 세라믹 가스센서를 이용한 디젤오염토양의 모니터링 방법 구축(한국과학기술연구원 양기원 교수 연구팀) □ 연구계 ○ 중금속 내성 포플러 개발 (임업연구원 노은운 박사 연구팀) ○ 방사선 돌연변이체로부터 농약분해 및 중금속 흡착성 높은 미생물 분리 및 유전자 탐색(한국원자력연구소 이창연 박사 연구팀) ○ 환경오염물질과 결합할 수 있는 펩타이드 포자 발현 미생물 개발(한국생명공학연구원 정흥채 박사 연구팀) ○ 난분해성 유독물질 분해 가능한 신종해양 미생물 발견 및 특성연구(한국해양연구원 김상진 박사 연구팀) □ 산업계 ○ 공장폐수를 식물정화 방법을 이용한 식물정화시스템 개발 및 적용(삼성에버랜드) ○ 유류오염 토양정화에 사용하는 에코톰(ECOTM) 제품 개발((주) 에코솔루션) ○ 폐광산 지역의 산림복구용 토양복합제 및 식물활착성을 높이는 식재법 개발((주) 화이젠) ○ 오폐수 처리 활착제 및 미생물 혼합제 개발 ((주) 에코바이오) ○ 토양정화용 및 폐수처리용 미생물 제제 개발 ((주) 코엔바이오)
|
그러나 국내 환경생명공학분야의 기술 및 연구개발 투자 현황은 아직 다른 분야에 비해 상대적으로 미약한 것으로 평가된다. 생물정화에 대한 정부투자는 2003년 이후에 투자증가 추세가 둔화되는 있는 양상을 보이고 있으며 환경생명공학기술로 분류될 수 있는 분야는 대부분 미생물, 식물 등 그 자체의 활용에 그치며 첨단 생명공학기술을 이용한 LMO 개발은 매우 빈약한 실정이다.
국내외 기술수준을 선진국과 비교해 보면 미생물 탐색기술 및 대량배양기술은 높은 수준이나 미생물 제재화 기술과 안전성평가 기술 등은 상대적으로 낮은 수준으로 평가되고 있다.
라. 향후전망 및 발전방향
환경생명공학기술은 에너지 절약형이면서 환경 친화형 기술로서 지속가능한 성장과 환경보전을 동시에 추구하는 미래 산업으로 쾌적한 환경을 확보하여 삶의 질 향상에 큰 영향을 미칠 것으로 기대되어 진다.
생물정화 관련 국내 특허 상황을 살펴보면 해외 출원기관의 특허는 국내에 거의 진입하지 못한 상황으로 국내 기술 시장을 보호하기에 상대적으로 유리 할 수 있다. 또한, 21세기 국가 핵심 산업으로 인식되고 있는 BT와 ET가 융합된 환경생명공학기술은 산업화 및 발전 가능성이 높은 분야라 사료된다.
따라서, 다음과 같은 점들을 고려하여 국내 환경생명공학의 발전방향을 지속적으로 모색하여야 할 것이다. 첫째, 환경정화의 공익성을 고려하여 효과적인 생물정화를 위한 기초연구부터 산업적 활용까지 총괄적인 전략과 국가차원의 지원이 필요할 것이다. 둘째, 생물정화의 기초연구분야의 국내 기술수준은 높은 수준 인 것으로 평가되고 있기 때문에 지속적인 투자와 교육을 통한 관련 기술의 축적과 인재 양성 프로그램의 개발이 병행되어져야 한다. 셋째, 생물정화를 통한 환경복원 기술은 오염지역의 자연환경 특성에 따라 그 세부방업이 달라지기 때문에 국내에서 개발된 기술이 국내 자연환경에 도입하여 성공할 확률이 높을 것이며, 국내 오염지역뿐만 아니라 환경이 유사한 해외의 오염지역에도 적용이 가능할 것이다. 넷째, 탄소배출권 규제와 같은 국제적인 환경보전에 대한 책임이 국가와 기업들에게 부가되어 질 것이므로 이와 관련한 대비와 투자가 필요 할 것이다. 다섯째, 환경정화를 위한 최종 산물인 LMO의 위해성 평가 기술 확보 및 안전관리 방안 마련을 위한 노력과 투자도 늘려야 할 것이다.
참고 문헌
1. BT기술동향 보고서 환경생명공학(Bioremidiation을 중심으로) 생명공학정책연구센터 (총서 68권, 2008)
2. 2011 바이오안전성백서 한국바이오안전성정보센터
3. 이영숙, 송원용, 박점옥, 정은화, 심동환, 이주현, 김유영, 김도영, 이미영, 노은운. 2003. 31p. 환경정화용 식물개발 기술. 과학기술부
4. 과학기술부, “2009 생명공학백서” (2009.12)
5. “환경정화용 식물개발의현황과 전망” 바이오안전성정보센터(Biosafety Vol 8 No 3),(2007)
3. 해양 생명공학
가. 개요
해양생물은 육상생물에 앞서 10억년 이상의 진화역사를 가지고 있으며 지구 생물다양성의 대부분을 차지하는 것으로 알려져 있다. 생명체 서식처의 90%를 차지하는 해양 영역 중 95%는 탐사되지 않은 새로운 가능성을 지닌 미지의 영역이다. 또한 2010년 나고야의정서30) 체결은 생물자원에 대한 소유권 (생물주권)을 인정하는 것으로 국가 간 생물자원 확보 및 특허 경쟁이 치열해질 것으로 예상되고 특히 해양생물자원은 ABS협정에 따라 자원보유국의 주권이 인정되어 바이오산업의 원천자원으로 육상생물에 비해 높은 해양생명자원의 가치는 더욱 상승할 것이다.
해양 생명 자원은 전 세계적으로 직면하고 있는 환경, 식량, 에너지, 보건 문제를 해결할 수 있는 실마리라 할 수 있으며 빠르게 고갈되고 있는 육상 자원의 대체제로 해양이 유일한 해결책이라 할 수 있다. 그럼에도 불구하고 지금까지는 급격히 발전된 생명공학기술이 해양 분야로의 접목이 미진하였고 미국과 노르웨이 등 일부 국가를 제외하고는 연구 개발 투자 및 산업화가 제대로 이루어지고 있지 않았다.
최근 이와 같은 사실에 우려를 표하고 해양생명공학에 대한 중요성을 새롭게 인식하며 세계 각국이 다양한 투자와 계획을 시도하고 있다. 한편 국내에서도 해양생명공학의 중요성에 대한 정부의 인식이 달라져, 2000년대 초반부터 작은 규모로 시작되었던 정부부문 투자를 확대하고 관련 분야를 활성화하려는 계획이 수립되었다. 따라서 국내에서도 해양생명공학의 기초학문 발전은 물론이고 산업화에 대한 새로운 전기가 마련될 것으로 예상된다. 특히, 생명유전자원의 중요성이 더해가고 있으며, 전 세계적으로 차세대 유전체 해독기술 (Next Generation Sequencing, NGS)과 같은 첨단생명공학기술 개발에 힘입어 해양생물자원 기반 새로운 연구 영역 도출 및 해양생물산업화가 가속화될것으로 예측되고 있다.
나. 해외동향31)
미국, 일본, 유럽 등 해양선진국들은 일찍부터 해양생명공학기술의 중요성을 인식하고 기술개발에 힘썼고 특히 기초기술 확보에 주력하였다. 이런 기술력을 바탕으로 산업화를 적극 추진하여 화장품, 신의약, 신소재 등 신제품이 실용화 단계에 접어들기 시작하였다. 주요 연구 개발 주제는 새로운 해양생명체 발견 및 탐사, 수산생물종 및 유전자 연구, 식품안정성 확보기술, 환경복원연구 등이 주류를 이루고 있으며 최근에는 기초기술 개발을 위한 유전체 연구와 산업화가 가능한 생물 발견 및 탐사와 해양바이오에너지 기술 개발 등도 포함되어 있다. 각 국가별 해양생명공학분야의 연구동향은 〔표 1〕과 같다.
┃국외 해양생명공학기술 연구동향┃
[표1]
|
국가 |
대표기관 |
주요 연구동향 |
|
|
미 국 |
매릴란드 대학 해양생명공학센터(COMB) |
- 해양고세균 연구 - 해양미생물의 기능유전체학 - 해양세균으로부터 신규항생물질 개발 |
- 해양해면동물 대량중식 기술 개발 - 체사픽만의 청게 보존기술 - 실내 무방류 어류양식 시스템 개발 |
|
플로리다 아틀란틱 대학 (FAU) 생의과학 및 해양생명공학연구센터 하버 브랜치 해양연구소 (해양 생의과학 연구부) |
- 2003년도 설립 - 3500만불 규모의 연구예산 - 신규 의약품 및 진단 |
- 해양생물 수집 및 탐색 - 산학연계시스템으로 조직
|
|
|
스크립스 해양연구소 |
- 해양으로부터 새로운 치료 - 미생물을 이용한 오염물질제거 - 해양미생물 및 바이러스 - 생물발광 - 해양의약품 생산을 위한 신규효소 및 대사과정 이용 |
||
|
캘리포니아 대학 산타바바라 (UCSB) |
- 해양생물체의 나노스케일 구조형성의 해양생물공학적 연구 - 협동생명공학연구소: 육군연구소의 5000만불 연구지원 예산을 주관 |
||
|
광물관리서비스사 (MMS) 해안대연구소 (CMI)) 루이지아나 주립대학 (LSU) 캘리포니아 주립대학 (UCSB) |
- 해양 프랫폼의 생물상 조사 및 이로부터 신규활성물질 탐색 |
||
|
J. Crag Venter Institute (JCVI) |
- 대량의 해양미생물 유전체 프로그램 |
||
|
Department of Energy - Joint of Genome Institute (DOE-JGI) |
- 바이오 에너지의 개발을 위한 다양한 생물종의 유전체 해독 - 65종의 조류, 36종의 해양 동물, 다수의 해양미생물의 유전체 해독 진행 중 |
||
|
캐나다 |
NRC Institute for Marine Biosciences |
- 최근 어류 증양식 중심연구를 종료시키고 해양산업제품 개발 연구 주력 - Genomic program (Aeromonas salmonicida) - New biofuel from algae program |
|
|
Fisheries and Oceans Canada |
- 2004년 퀘벡에 설립 - 어패류 관련 중점 연구 |
||
|
Genome Canada |
- 상용화 대상 해양생물에 대한 유전체연구 |
||
|
중남미 국 가 |
브라질 (State University of Campinas) (Oswaldo Cruz Institute (IOC) Rio de Janeiro) |
- 산호서식 균류의 항생 및 항암활성 탐색 - PAHs 분해경로 연구 - 해양조류로부터 항 AIDS 화합물 연구 - dolabelane diterpene을 함유한 gel 개발 |
|
|
칠레 (Catholic University of Valparaso, Sergio Marshall) |
- 최근 정부로부터 적극적 지원 - 칠레의 증양식산업 지원 우선 - 연어 유전체프로그램 참여 - 어류와 어류질병의 분자생물학적 연구 및 백신 개발 |
||
|
쿠바 하바나유전공학 및 생물공학센터 (CIGB) Marine Bioproducts Research Center (CEBIMAR) Center for Fisheries Research |
- Tilapia의 형질전환 연구 - 어류 및 새우 성장홀몬 및 면역체계 연구 - 해양천연물연구 - 어류 증양식 및 어류 건강 |
||
|
멕시코 Ensenada Center for Scientific Research and Higher Education (CICESE) Autonomous University of Campeche (UAC) |
- 새우 연구 - 하수의 미생물학적 정화 - 미생물막에 관한 연구 |
||
|
국가 |
대표기관 |
주요 연구동향 |
|
호 주 |
호주해양과학연구소 (AIMS) |
- 생리활성분자 탐색 - 해양생명공학 혁신기술 개발 - 열대생물 양식 |
|
일 본 |
일본해양과학기술연구 독립법인 (JAMSTEC) |
- 심해생물연구 및 이의 산업적 응용 |
|
대학 및 연구소 |
- 해양생명유전자원을 이용한 생물공학 활성화 및 환경문제 해결 · 지구온난화 · 환경오염 · 의약품 · 바이오에너지 · 식품 · 산업신소재 |
|
|
중 국 |
국가제3해양연구소 |
- 심해미생물 균주 은행 구축 및 활용연구 |
|
중국과학아카데미 산하 청도 해양연구소 및 연대 해안대연구소 |
- 해양미생물활용기술 - 조류활용기술 - 유류오염정화기술 - 해양바이오에너지 |
|
|
광주해양연구소 |
- 신물질탐색 및 개발기술 |
|
|
대학 및 산업체 |
- 해양생명공학 기반기술 및 산업화기술 |
|
|
BGI (Beijing Genome Institute) |
- 세계 최고수준의 유전체 해독 기술을 보유 - 다양한 해양 생물 유전체 해독 |
|
|
프랑스 |
로스콥해양연구소 Genoscope |
- 해양 해조류의 유전체 분석 |
|
전 미 대 륙 |
전미대륙 해양생명공학협회 (PAMBA) |
- 전미대륙 국가의 해양생명공학 네트워크 - 1998년 설립 - 12개국 125명 회원 |
|
유 럽 8개국 |
European Marine Biological Resources Centre (15개 센터 연합체) |
- 분자생물학과 신약 개발에 이용될 해양 모델 생물 개발 - 5년간 100만 유로씩 투자 |
|
미 국 호 주 뉴질랜드 유 럽 6개국 |
MICROMAT Consortium 연구기관, 대학, 기업체 |
- 극지 해양생물 연구 - 유용물질 탐색 - 생리활성물질 탐색 |
다. 국내동향
국내에서는 2009년 해양생명공학에 대한 중요성을 인식하고, 교육과학기술부, 국토해양부, 농림수산식품부, 지식경제부 등 4개 부처가 참여하여 새로운 국가연구계획을 수립하였다. 2007년도 해양바이오분야 국가 R&D 예산규모는 430억 원으로 BT분야 총 예산규모 1조 5,063억 원에 대한 비중이 2.85%에 불과하다. 이를 2010년부터 2014년까지 전체 BT연구 예산대비 6% 규모로 확대하여, 총 6,615억 원을 투자하기로 하였다. 2010년 해양바이오기술 분야에 정부투자는 총 1,489억원이며, 부처별로는 국토부 58.8%(875억원), 교과부 14.5%(215억원), 지경부 13.6%(203억원) 농식품부 11.7%(174억원)을 차지하였다. 부문별 투자 비중은 기반구축(41.0%, 610억원)이 가장 높고 연구개발(25%, 373억원), 산업화(18.0%, 268억원), 해외자원(9.6%,143억원) 순이다. 총 투자액은 2009년 1,371억원에 비해 8.6% 증가하였으며, 연구개발(46%), 산업화(12.5%)는 증가하였으나 인력양성(-6.4%), 해외자원(-6.4%), 기반구축(-2.7%)의 경우는 감소하였다〔표2〕.
┃2010년 부처별 해양바이오 투자실적┃
[표2] (단위 : 백만원)
|
구분 |
해외자원 |
연구개발 |
산업화 |
기반구축 |
인력양성 |
제도정비 |
합계 |
|
교육과학기술부 |
2,927 |
5,025 |
- |
4,000 |
9,576 |
- |
21,528 |
|
농림수산식품부 |
430 |
16,924 |
- |
- |
- |
- |
17,354 |
|
지식경제부 |
- |
- |
20,254 |
- |
- |
- |
20,254 |
|
국토해양부 |
10,967 |
15,340 |
6,500 |
56,700 |
- |
303 |
89,810 |
|
합계 |
14,324 |
37,289 |
26,754 |
60,700 |
9,576 |
303 |
148,946 |
|
(‘09년) |
15,252 |
25,500 |
23,775 |
62,380 |
10,228 |
- |
137,135 |
이와 같이 꾸준한 투자의 증가에도 불구하고 우리나라의 해양생명공학분야 기술수준은 세계 최고국 대비 생물공정 63.2%, 원천기반 43.6%, 신소재가공 42.5% 정도이며 이에 따른 기술 격차는 생물공정 5.1년, 원천기반 6.7년, 신소재가공 8.6년 차이를 보이고 있다. 이 같은 통계를 바탕으로 볼 때 세계 최고기술 보유국과 비교하여 상대적으로 발전 추세가 느린 것으로 분석된다.
연구개발 투자분야는 국토부, 교과부, 농식품부 등 3개 부처에서 수행하고 있는데 교과부에서는 해양극지 기초원천기술개발, 개별 연구자들에 의한 해양바이오 기초연구 지원, 해양바이오 인력양성사업에 농식품부는 수산생명공학 기술개발, 독도 주변해역 생태계 기반 수산자원 연구, 바다 숲 조성사업, 수산유전자원의 분석·보존 및 활용, 수산생물 유용유전자 개발 및 산업화에, 국토해양부는 연구단 형태로연구과제를 지원하고 있다. 2004년도부터 수행하던 기존의 해양극한생물분자유전체연구, 해양바이오프로세스연구, 해양천연물신약연구 등으로 구성된 해양생명공학기술개발사업에 2009년도 신규 사업으로 해양바이오에너지 연구단 및 산업소재 기술개발을 위한 신소재 개발기술 분야와 해외 해양생물자원 조사 확보를 위한 해외생물자원확보 연구단을 구성하였다. 그러나 기술선진국에서는 오믹스 기술을 기반으로 해양생명체를 시스템 생물학, 합성생물학 등의 원천 연구와 의약소재 산업화에 접근하는 단계에 이르렀으나 아직 우리나라에서는 응용 및 실용화 연구가 미진한 실정이다.
라. 투자 계획 및 전망
2014년까지 전체 BT연구 예산 대비 6%까지 해양생물공학 연구 투자를 늘린다는 계획이지만 2011년 정부 투자 계획은 총 1,325억원으로 전년(1,489억원)대비 오히려 11.0% 감소하는 것으로 나타났다. 부문별 투자 비중은 기반구축(36.2%, 480억원)이 가장 높고 연구개발(R&D)(30.9%, 409억원), 산업화 (16.1%, 213억원), 해외자원(9.2%, 122억원) 순이다. 부처별로는 국토해양부 52% (689억원), 교육과학기술부 20.5% (272억원), 지식경제부 14,4% (191억원), 농수산식품부 13.1% (173억원)을 차지하여 국토해양부가 가장 많은 비중을 차지하고 있다.〔표3〕 다음과 같이 각 부처는 중점 추진방향을 설정하고 이에 따른 예산을 투자할 계획을 세웠다.
┃2011년 부처별 해양바이오 투자계획┃
[표3] (단위 : 백만원)
|
구 분 |
‘11년 투 자 계 획 |
‘10년 실적 |
증감률 (%) |
||||||
|
해외 자원 |
연구 개발 |
산업화 |
기반 구축 |
인력양성 |
제도 정비 |
계 |
|||
|
교과부 |
6,120 |
7,017 |
- |
4,463 |
9,576 |
- |
27,176 |
21,528 |
26.2 |
|
농식품부 |
430 |
16,904 |
- |
- |
- |
- |
17,334 |
17,354 |
|
|
지경부 |
- |
- |
19,081 |
- |
- |
- |
19,081 |
20,254 |
|
|
국토부 |
5,687 |
16,975 |
2,250 |
43,529 |
- |
503 |
68,944 |
89,810 |
|
|
합 계 |
12,237 |
40,896 |
21,331 |
47,992 |
9,576 |
503 |
132,535 |
148,946 |
|
교과부의 중점 추진방향은 열대 태평양기지 및 극지기지를 통한 글로벌 해양자원 확보, 해양바이오의 기초 원천 핵심 연구개발 역량강화, 시료보관 시설 같은 연구기반구축 및 인력양성이며 세부사업별 투자계획은 다음과 같다.〔표4〕
┃교과부 세부사업별 투자계획┃
[표4] (단위 : 백만원)
|
사 업 명 |
‘10 계획 |
’10 실적 |
‘11 계획 |
|
열대 태평양기지 운영 및 기본 연구활동 지원 |
1,500 |
1,500 |
3,200 |
|
해양극지 기초원천기술 개발사업 |
2,000 |
2,000 |
5,500 |
|
해양극한생물 유전체활용 질병표적 단백질기능연구 |
770 |
770 |
770 |
|
해양바이오 관련 기초연구과제 추진* |
3,682 |
3,682 |
3,667 |
|
해양 시료도서관 구축 |
4,000 |
4,000 |
4,463 |
|
해양바이오 관련 연구중심대학 육성사업 등 인력양성* |
9,576 |
9,576 |
9,576 |
|
합계 |
21,528 |
21,528 |
27,176 |
* 교과부 기초연구 및 인력양성 과제는 대부분이 계속과제이며 별도 ‘11년 예산안 분리가 불가능하기에 ’10.10.7 기준으로 ‘11년도 연구비 추정
농식품부의 중점 추진방향은 육종기술, 형질전환 기술, 소재개발 등의 연구개발 역량강화 및 산업화이며 세부사업별 투자계획은 다음과 같다.〔표5〕
┃농식품부 세부사업 투자계획┃
[표5] (단위 : 백만원)
|
사 업 명 |
‘10 계획 |
’10 실적 |
‘11 계획 |
|
독도 주변해역 생태계 기반 수산자원 연구 |
195 |
150 |
150 |
|
수산생명공학기술개발(수산업신성장동력) |
2,575 |
1,350 |
3,350 |
|
수산유전자원의 분석·보존 및 활용 |
- |
280 |
280 |
|
수산생물 유용유전자 개발 및 산업화 |
- |
574 |
580 |
|
바다 숲 조성 사업 |
15,000 |
15,000 |
12,974 |
|
합 계 |
17,770 |
17,354 |
17,334 |
지경부는 해양생명자원을 활용한 산업화, 지역 기반의 지원 사업 그리고 지역 센터간 산학연간 네트워크를 강화하는 해양바이오 산업화 촉진을 중점 추진방향으로 설정하였다.〔표6〕
┃지경부 세부사업 투자계획┃
[표6] (단위 : 백만원)
|
사 업 명 |
‘10 계획 |
’10 실적 |
‘11 계획 |
|
지역전략산업진흥사업 |
13,417 |
13,797 |
11,157 |
|
지역혁신센터사업 |
2,000 |
2,800 |
2,800 |
|
지방기술혁신사업 |
2,130 |
2,457 |
2,457 |
|
바이오의료기기산업 원천기술 개발사업 |
900 |
1,200 |
2,667 |
|
합 계 |
18,447 |
20,254 |
19,081 |
국토부는 글로벌 해양자원 확보, 연구개발 역량강화, 산업화 촉진, 연구기반 강화에 중점적으로 예산을 배정하여 해양생명공학을 육성하고자 한다.〔표7〕
┃국토부 세부사업 투자계획┃
[표7] (단위 : 백만원)
|
사 업 명 |
‘10 계획 |
’10 실적 |
‘11 계획 |
|
|
독도의 지속가능 이용 및 관리(해양생태 등 자연환경조사 및 D/B 구축) |
2,000 |
2,000 |
1,500 |
|
|
중남미 국가와의 해양자원공동연구 |
250 |
250 |
- |
|
|
해양자원연구센터 건립 |
4,540 |
4,540 |
- |
|
|
해양생명공학기술개발사업 |
해외자원 확보연구단 |
23,000 |
20,820 |
22,515 |
|
해양천연물신약연구단 |
||||
|
해양극한분자유전체연구단 |
||||
|
해양바이오프로세스연구단 |
||||
|
해양바이오신소재연구단 |
||||
|
기타 등록기관사업 |
||||
|
해양바이오정책지원 센터 |
||||
|
해양훤경기술개발사업(해양생태계 복원·보전 및 교란생물 등 환경위해성 평가) |
1,5000 |
1,500 |
1,400 |
|
|
해양바이오정책지원 센터 건립 |
4,000 |
4,000 |
- |
|
|
해양생물자원관 건립 및 해양생물자원 표본 확보 |
25,700 |
25,700 |
13,000 |
|
|
대형해양과학조사선 건조 |
2,000 |
2,000 |
8,000 |
|
|
연구장비개발 및 인프라 구축 - 종합해양과학조사선 건조 - 남극 제2기지 건설 등 극지 인프라 구축 - 적도 태평양 연구 인프라 구축 - 해양장비 기술개발 |
32,000 (5,000) (19,000) - (8,000) |
29,000 (5,000) (15,000) - (9,000) |
22,529 - (12,029) (1000) (9,500) |
|
|
합 계 |
94,900 |
89,910 |
68,944 |
|
이 같은 연구 개발 투자가 지속적으로 이루어지면 핵심 연구개발 역량의 확보, 해양생명자원의 확보 및 국제협력강화, 해양바이오 산업화의 촉진 등이 추진되어 2014년 선진국 대비 80%의 기술력을 확보하고 해양생명공학 산업의 부가가치도 전체 생명공학산업의 10% 수준으로 확대되어 2016년에는 6조 7천억원의 해양바이오 시장을 창출할 것으로 기대한다.
마. 발전 과제
해양생명공학에 대해 대체로 다음과 같은 3가지 공통된 견해를 가지고 있다. 첫째, 해양생명공학은 인류의 건강, 식량, 에너지, 환경과 전 지구적인 문제를 지속적으로 해결, 성장할 수 있다. 둘째, 해양생물자원은 육상생물자원에 비해 조사조차 제대로 되어 있지 않으며 따라서 새로운 소재, 식량자원, 생리활성물질, 생물학적 생화학적 시스템과 공정의 개발을 위한 원천 소재의 가능성이 높다. 마지막으로 다양하고 복잡한 해양생태계 내에 존재하는 해양생물자원에 대한 접근성이 해양생명공학의 중요한 요인이다. 이 같은 요소들은 해양생명공학의 기회인 동시에 장벽이기도 하다. 따라서 해양생명공학은 다양하고 복잡한 해양생태계 내에 분포하는 해양생물자원을 보존하고 보호하면서 잘 활용해야 성장 지속 가능한 분야로 발전할 수 있다.
해양생물자원을 효과적으로 연구개발하기 위한 인프라이지만 아직까지 국내에서는 주목받지 못해서 투자되고 있지 못한 분야가 있다. 첫 번째 분야는 고효율스크린기법의 개발이다. 이를 위해서는 오믹스 기술과 생물정보학적 기술이 필요하며 특히 해양 생물의 다양성과 복잡함 때문에 메타유전체 분석이 가능한 더욱 발전된 바이오정보 관련 기반구조가 필요하다. 이는 생명공학적 가치가 높은 유전자 또는 단백질 분석을 포함한 유전체 분석을 위한 필수 기술이다. 두 번째 분야는 모든 해양생물에 대한 심층 연구가 불가능하므로 연어나 성게 같이 산업적으로 유용하거나 학술적인 연구를 위해 많은 모델 해양생물의 개발이다. 특히 기존의 모델 생물이 없는 새로운 문이나 강에 속하는 생물군과 새로운 기능을 가진 극한 생물을 대상으로 하는 모델 생물 발굴 및 개발은 진화적 유연관계가 높고 산업적 이용가치가 높은 해양 생물 연구에 유용하다. 세 번째는 난배양성 해양 생물과 공생관계에 있는 해양 생물을 배양할 수 있는 배양방법 개발이다. 배양은 그 자체를 통해 그 생물의 생화학적인 네트워크와 대사 경로에 대해 이해할 수 있고 해양생물자원을 보존하는 것도 가능하게 한다. 또한 생산과 관련하여 배양은 지속적으로 수확이 가능하도록 하여 많은 새로운 화합물, 분자, 효소의 생산에 필수적인 요소이다. 마지막으로 생물 시료 또는 그 일부를 모으고 생물 다양성을 보존하고 보호하며 생물자원을 공유하고 모델생물을 개발할 수 있는 생물자원은행의 설립 및 운영이다. 이와 관련된 사업은 현재 국내에서도 생물종에 따라 몇 개 기관에서 수행하고 있으며 해양생물자원관 건립도 추진되고 있다. 이와 같은 4가지 인프라 사업은 가시적 성과물을 기대할 수 없어서 투자하기가 어렵지만 해양생명공학의 발전을 가속화시키는 주요한 기반으로 지속적인 사업 추진이 필요하다.
해양생명공학의 발전은 좋은 해양생명자원의 확보가 그 관건이라 할 수 있다. 따라서 대양, 심해, 극지 생태계에 대한 대대적인 탐사 프로그램을 추진하고 이를 뒷받침할 첨단 해양탐사 기술을 개발 혹은 확보하여야 하며 동남아·태평양, 대서양 연안국과의 협력 체계를 구축하여 해양생명자원을 확보하기 위한 네트워크를 구축·운영하여야 한다.
4. 산업현황
가. 생물산업공정
생물 산업 공정은 바이오매스를 원료로 바이오기술(생촉매)을 이용해 화학제품(유기산, 아미노산, 폴리올, 바이오폴리머 등) 또는 수송용 연료 (바이오에탄올, 바이오디젤, 바이오부탄올 등) 를 생산하는 분야이다.
이와 같은 바이오 공정은 화석연료에 대한 의존성 감소, CO2문제 해결 및 Sustainable society를 만들고자 대두되었고 최근의 급격한 기술적 진보에 힘입어 케미칼 분야는 몇 개의 제품이 상용화를 이루었고 연료 분야는 상용화를 눈앞에 두고 있다. 바이오연료 중에서는 Bioethanol이 가장 앞서가고 있으며, 현재 추정되는 시장은 약 50billion $/yr 이고 향후 10년 동안 약 2배 이상의 성장이 예상되고 있으며, 증가되는 생산량은 대부분 현재의 Crop based ethanol이 아닌 생물 공정을 통하여 생산된 Cellulosic Ethanol 위주로 형성될 것으로 예측하고 있다. a)
미국과 유럽은 1) 기존 제품과 동일한 성능 2) 동일한 가격 3) 충분한 양이 지속적으로 생산가능해야 함 과 같은 기준을 세우고 바이오 분야의 성장을 지원하고 있다. b)
1) 바이오연료의 생산 기술 및 업계 현황
바이오 산업 공정 (Biorefinery)을 단위 공정별로 살펴 보면 다음과 같다. 바이오매스 생산 기술, 전처리 기술, 당화 및 발효 기술, 분리 정제 기술, 전환/합성 기술, 용도개발 및 제품화기술 이다.
그림 1 Biorefinery 기술 체계도 c)

전처리 기술은 효소 반응이 원활히 이루어지도록 바이오 매스의 구조를 변화시키는 공정이다. 전통적으로 펄프 생산에 사용되던 기술들을 변화시켜 적용하고 있으며 최근 발효 공정에서의 기술 발달로 인해 5탄당/6탄당을 동시에 회수/이용 할 수 있는 공정으로 개발하는 것이 trend 이다. 여러 전처리 공정의 장단점을 다음의 표로 정리하였다.
표 1. Comparison of biomass pre-treatment processes d)

이 외 바이오매스를 가스화 하여 Syngas로 만드는 기술도 개발되어 상업화 되어 있으나 이러한 Syngas를 생명공학적인 기술로 전환하는 기술은 아직 pilot-plant 수준에 머물러 있으며 그 생산물도 대부분 Ethanol, Butanediol, Butanol 등 몇 개의 Chemical 에 한정되어 있다. 특히 이 route는 mass transfer limitation 때문에 발효 공정 scale-up 검증이 필요하다.e)현재 Lanzatech, Coskata, INEOS 등이 이와 같은 gas to fermentation route의 상업화를 위하여 노력하고 있다.
전처리 된 Biomass는 효소처리를 통하여 C5 (Xylose, Arabinose 등) 및 C6 (Glucose, Mannose 등) 당이 만들어 지게 된다. 효소 공정은 공정 자체의 특이성 보다는 사용 효소의 양을 줄이는 것이 중요하며 전체 생산 비용에서 효소가 차지하는 비율도 아직 높은 편이다. 근래 여러 효소 회사들의 연구에 의해 그 투입량이 현저하게 감소가 되었으나 보다 많은 연구를 통하여 진보를 이루어야 할 분야라고 할 수 있다. Novozymes와 Genencor는 Trichoderma reesei를 개량하는 방향으로 연구를 진행하고 있으나 Novozymes 사는 자체 개발된 효소를 사용자가 주입량을 조절하는 형태를 선호하며 이에 반해 Genencor는 효소 cocktail형태를 개량하는 방식을 택하고 있다. Verdezyme 과 같이 extreme 환경에서 작용하는 효소를 찾는 회사, Süd-chemie와 같이 기존 효소를 개량하려는 회사 등이 노력을 경주하고 있다. 효소 투입량의 문제를 공정으로 해결하려 하는 CBP (Consolidated BioProcess) 연구도 많은 관심을 받았으나 상업적 수준의 시도는 근래에 와서야 Mascoma 와 Qteros 등의 venture 회사를 중심으로 시도되었으며 장기적으로 효소 투입량을 절감 할 수 있는 potential 이 있는 것으로 판단된다.
발효 기술은 크게 2가지의 방향으로 개발이 진행되고 있는데 첫번째는 육상 Biomass를 전처리 함으로써 얻어지는 C5 (Xylose) 당을 Glucose 만큼 고효율로 빠르게 이용할 수 있는 균주를 만드는 것과, 다른 하나는 당으로부터 다양한 chemical들을 높은 효율로 만들도록 균주를 개량하는 연구이다. Xylose metabolism의 경우 산업계 및 학계를 통해 꾸준한 진보가 있어 왔으며 각기 특징을 갖는 균주들이 개발되어 사용되고 있다. Dupont, Cargill 과 같은 회사와 Purdue University, EBI(Energy Biosciences Institute) 균주가 두각을 나타내고 있으며 다양한 partnering을 통하여 자사 기술들의 적용을 넓히고 있다.
후자의 기술은 원래 균주가 갖지 못한 pathway를 인위적으로 도입하여 artificial 한 물질 (natural or non-natural)도 생산 할 수 있는 가능성을 열었다는 점에서 (Synthetic biotechnology) 주목 받고 있다. f)
이와 같은 새로운 대사과정 혹은 기존의 경로를 개선하는 연구에서 가장 중요한 것은 높은 효율로 목적 산물로 변화를 시키는 것과 그 변화 속도가 높아야 한다는 점이다. 현재 발전된 Genetic engineering 기술을 통하여 어느 정도는 이에 대한 보완이 가능하여 졌으나 근본적으로 높은 Moleucular weight를 갖는 물질의 생산 속도를 세포 수준에서 높이는 것은 난이도가 높은 연구로 이보다는 고정화/농축발효와 같이 미생물의 농도를 높여서 발효 속도를 높이려는 연구가 많이 수행되었으나 Commercial plant에서의 적용은 농축발효를 이용한 Sugarcane ethanol에 한정되어 있는 실정이다. g)
발효 공정을 통하여 생산된 제품들은 자체로 직접 final product가 되거나 (Ethanol, Butanol) 다른 물질로 전환시켜 사용한다. 따라서 효율적으로 이를 전환할 수 있는 촉매 기술 및 반응시키기 위해 농축 분리하는 공정이 매우 중요하게 되는데 특히 농축 분리 기술의 경우 발효의 특성을 고려 때 일반적인 화학 공정과는 다른 몇 가지의 특성이 있다. 첫 번째는 발효액에 존재하는 높은 농도의 단백질 및 salt 농도로써 부반응 및 반응 저해를 일으키기에 공정 개발에서 반드시 고려해야 한다. 두 번째는 by-product 를 효율적으로 제거해야 하는 것인데 대부분 원하는 primary product 와 유사하기에 쉽게 분리하기는 어렵다. 정제에서 가장 많이 사용하는 기술은 침전과 distillation 이며 이와 함께 최근 추출 및 막 기술 적용 시도도 많이 되고 있다. 추출의 경우 Merrick & Company와 KMPS와 같은 중소 기업 위주로 개발이 되고 있다. PLA 와 같은 경우는 추가로 반응 공정을 통하여 기존의 분리 효율을 크게 증가하고 비용을 감소시켜 상업화를 성공시킨 경우도 있다. h)
바이오 연료의 상업화에는 많은 요소 기술이 필요할 뿐 아니라 이러한 요소기술을 잘 결합하여 package 화 하면서 생산 설비에 투자를 할 수 있는 자금력도 같이 필요하다. 따라서 현재 commercial plant를 계획중인 많은 회사들은 자신들만의 기술에 다른 요소기술을 가진 회사들과 전략적 제휴 혹은 M&A를 통한 기술 내재화 및 강력한 투자 회사와 함께 JV를 설립하여 Biofuel 사업을 만드는 것이 일종의 trend 로 되어 있다.
표 2 상업 생산을 준비중인 cellulosic ethanol 회사들의 전략적 partnering 예
|
회사명 |
전처리 공정 |
효소 |
발효균주 |
투자회사 |
|
DDCE |
Ammonia |
Genencor |
Dupont |
Dupont |
|
Iogen |
Dilute acid |
Iogen Codexis |
Purdue university |
Shell Petro Canada Goldman Sachs |
|
Abengoa |
Steam explosion, Dilute acid |
Novozymes Genencor |
Cargill |
Antares Corp; Taylor Eng. |
|
BP-Verenium |
Dilute acid |
Verenium |
Energy Biosciences Institute |
BP |
2) Biochemical 시장 및 업계 현황
Chemical 시장은 2010년 PLA(Poly lactide), PDO(Propanediol), PHA(Poly hydroxyl alkanoate), Bio-butanol 와 같은 intermediate chemical 시장이 570 million $ 이며 Glycerin, Lactic acid 등과 같은 platform chemical 시장이 1,800 million $로 현재 큰 시장은 아니나 향후 매년 20~30% 의 폭발적인 성장세를 유지할 것으로 생각되고 있다. i)
PLA 경우는 분리 공정에 드는 비용을 Natureworks LLC가 혁신적인 반응 공정을 통하여 효율을 크게 증가하고 비용을 감소시켜 상업화를 성공시킨 경우이다. h)이와 같이 개발된 Ingeo biopolymer (polylactid (PLA)) 는 현재 가장 성공한 생물 공정의 product가 되었으며 세계시장의 대부분은 Natureworks 사에 의하여 점유되고 있다. 최근에는 L-lactic acid보다 성능이 좋은 D-form 의 lactic acid를 Purac등이 매우 높은 가격으로 공급하고 있어서 미국과 일본에서 이의 생산을 확대하려는 시도가 되고 있다.
최근에는 1,4 BDO와 같은 specialty chemical의 원료로 사용되는 succinic acid를 발효를 통하여 생산 할 수 있는 균주도 Bioamber (ORNL 과 ANL의 기술), Dupont, Myriant, DSM, DNP Green technology 등에 의하여 개발되어 상업화 되었으며 생산시설을 증설 중이다.
References
a. Technology roadmap : Biofuels for transport, International Energy Agency, OECD/IEA 2011.
b.http://www.biopreferred.gov/FederalProcurementPreference.aspx?SMSESSION=NO
c. 바이오 제품 시장 및 바이오 기술 개발 동향 - 바이오 산업 원천 기술 개발 산업, 지식 경제부, 2010
d. Literature review of physical and chemical pretreatment processes for lignocellulosic biomass, Biosynergy, Report 1184, Sep 2010.
e. Microbiology of synthesis gas fermentation for biofuel production, Current opinion in Biotechnology, 18, 200-206, 2007.
f. Synthetic metabolism : Engineering biology at the protein and pathway scales, Chemistry and Biology review, 16, 277-286, 2009.
g. Yeast selection for fuel ethanol production in Brazil, FEMS Yeast Res 8, 1155–1163, 2008.
h. Biodegradable and sustainable fibres, Chp. 6 Poly(lactic acid) fibres, 191-220
i. Biorenewable chemicals world market, SBI Energy report, 2010.
각 회사 homepage를 이용한 본문 기술은 ref. 로 추가 하지 않음.
나. 환경 생명공학
(1) 국내 바이오환경산업 분류
바이오환경산업은 생물체에서 유래된 물질, 혹은 생명공학기술을 연구개발 또는 생산 과정에 이용하여 환경정화, 환경복원, 환경오염 저감 및 방지 목적의 물질이나 시스템을 제조하거나 이를 이용한 오염진단 및 측정서비스, 시설을 건설하는 활동으로 다음과 같은 제품이나 서비를 제공하는 산업이다. 바이오산업 분류표 (국내바이오산업 통계, 2009, 한국바이오협회)에 따르면 바이오환경산업은 환경처리용 미생물제제 (microbial treatment agents), 미생물 고정화 소재 및 설비 (microbe-immobilized materials and equipments), 바이오환경제제 및 시스템 (bioenvironmental agents and systems), 환경오염 측정시스템 (측정 기구 및 진단, 서비스) (measuring apparatus for environmental pollution (service for pollution assessment))산업과 바이오환경제품 및 서비스 (other bioenvironmental productions and services) 산업으로 분류된다.
표 1. 바이오환경산업 분류
|
분류명 |
세부기술 |
|
환경처리용 미생물제제 |
- 환경정화 (폐수처리, 폐기물처리 등) - 환경오염 저감 및 방지 (바이오탈황, 바이오크랙킹, 바이오채취, 생물 펄핑 등) - 환경복원을 목적으로 한 미생물 처리제 - 제품판매에 따른 시공 및 설치 서비스포함 |
|
미생물 고정화소재 및 설비 |
- 환경정화 (폐수처리, 폐기물 처리, 악취/VOC처리 등)를 목적으로 한 미생물 이용 여과기 등의 고정화 소재 및 설비 - 제품판매에 따른 시공 및 설치 서비스포함 |
|
바이오환경제제 및 시스템 |
- 폐기물처리, 폐수처리, 악취/VOC 처리, 환경복원, 자원재활용 등 목적의 제제 및 장치, 시스템 - 제품 판매에 따른 시공 및 설치 서비스 포함 |
|
환경오염 측정시스템 |
- 수질, 토양오염도, 대기 오염도 등을 측정할 수 있는 기구 (제품 판매에 따른 시공 및 설치 서비스 포함) - 고객의 요구에 따른 오염원 진단 및 오염도 측정 서비스 |
|
기타 바이오환경제품 및 서비스 |
- 위에 분류되지 않은 기타 바이오환경제품 (위에 분류되지 않은 원료 및 중간체 등 포함) 및 관련서비스 |
(2) 국내 바이오환경산업 현황
바이오환경산업은 바이오의약산업 (31.8%), 바이오식품산업 (23.7%), 바이오화학산업 (14.2%)에 이어 13.1%로 산업별 활동 비중이 큰 산업이다. 바이오환경산업체는 1950년 이후 계속 증가하여 1996~2000년 사이에 45개 업체가 새로 창업하였고 계속 증가 추세에 있다. 바이오환경 산업체는 500명 이상의 사업체가 1개, 51~500명 사이가 20개, 11~50명 사이가 63개 업체이고 10명 미만의 업체가 25개 존재하고 있다. 바이오환경산업에서 생명공학 기술의 이용현황은 환경생명공학 및 바이오에너지기술에 관련된 기업이 가장 많이 존재하였으며, 생물자원 생산 및 이용 기술이 그 뒤를 잇고 있다. 다른 기술은 표 2에 표기하였다.
표 2. 바이오환경산업에서 생명공학기술 이용 현황 (2008)
|
주력업종 |
생명공학기술분야 |
활동 기업수 |
기술 이용 방식 |
||
|
기술을 적용한 원재료 이용 |
기술을 연구하거나, 연구개발에 이용 |
기술을 제조 생산에 이용 |
|||
|
바이오 환경산업 |
유전공학기술 |
5 |
3 |
3 |
2 |
|
단백질공학기술 |
4 |
3 |
2 |
2 |
|
|
기타 거대분자공학기술 |
5 |
1 |
4 |
2 |
|
|
세포 및 조직공학기술 |
4 |
0 |
4 |
1 |
|
|
시스템 생물학기술과 생물정보학기술 |
3 |
1 |
2 |
0 |
|
|
대사공학기술 |
4 |
2 |
2 |
1 |
|
|
생물공정기술 |
18 |
3 |
16 |
7 |
|
|
생물자원 생산 및 이용 기술 |
38 |
11 |
28 |
9 |
|
|
환경생명공학 및 바이오에너지기술 |
100 |
27 |
97 |
57 |
|
|
나노바이오기술 |
1 |
1 |
0 |
0 |
|
|
생물전자공학기술 |
2 |
0 |
2 |
1 |
|
|
생물안전성 및 효능평가기술 |
3 |
2 |
1 |
0 |
|
|
달리 분류되지 않는 생명공학기술 |
2 |
0 |
1 |
1 |
|
|
생명공학기술 전체 |
109 |
39 |
105 |
62 |
|
바이오환경산업 인력 규모는 전체 바이오산업 종사자의 16%가 바이오환경 산업에서 종사하였으며, 연구직에서는 석사가 가장 많고 생산직에서는 학사출신이 가장 많이 존재하였다. 전체적인 인력구성으로는 학사출신 인력이 가장 많이 존재하였다 (표 3).
표 3. 바이오환경산업 인력 규모 (2008)
|
|
응답 기업수 |
박사 |
석사 |
학사 |
기타 |
계 |
|||||
|
총수 |
평균 |
총수 |
평균 |
총수 |
평균 |
총수 |
평균 |
총수 |
평균 |
||
|
연구직 |
112 |
118 |
1 |
390 |
4 |
307 |
3 |
106 |
1 |
921 |
8 |
|
생산직 |
112 |
8 |
0 |
106 |
1 |
378 |
3 |
349 |
3 |
841 |
8 |
|
총계 |
112 |
126 |
1 |
496 |
5 |
685 |
6 |
455 |
4 |
1762 |
16 |
평균은 전체 바이오산업 인력에 대한 평균임.
바이오환경산업에서 환경 처리용 미생물제제 산업이 가장 큰 비중을 차지하고 있고 국내 판매액과 수출액이 가장 높았다 (표 4).
표 4. 바이오환경 산업 중분류별 국내 판매 및 수출 규모 (2008) (단위:백만원)
|
대분류명 |
중분류명 |
국내판매액 |
수출액 |
총합계 |
|
바이오환경 |
환경 처리용 미생물제제 |
84,068 |
4,625 |
88,693 |
|
미생물 고정화소재 및 설비 |
22,622 |
0 |
22,622 |
|
|
바이오환경제제 및 시스텝 |
40,300 |
1,018 |
41,318 |
|
|
환경오염 측정시스템 |
40,962 |
5,103 |
46,065 |
|
|
기타 바이오환경 제품 및 서비스 |
15,462 |
0 |
15,462 |
|
|
합계 |
203,414 |
10,746 |
214,160 |
국내 바이오환경산업 관련 기업은 시스템 및 설비가 위주인 대기업과 제제 및 컨설팅 사업이 주인 중소기업으로 나눌수 있고, 주요제품은 수처리용 미생물제제가 큰 비중을 차지하고 있으며, 오염토양처리용 제품이 뒤를 따르고 있다 (표 5).
표 5. 국내 바이오환경기업과 주요제품
|
회사명 |
주요 제품 |
|
대우건설 |
- 미생물제제 - 상하수도 미생물 정수 및 하수처리 시스템 및 설비 |
|
코오롱환경서비스 |
- 미생물제제 - 상하수도 미생물 정수 및 하수처리 시스템 및 설비 |
|
GS건설 |
- 미생물제제 - 상하수도 미생물 정수 및 하수처리 시스템 및 설비 |
|
코엔바이오 |
- 미생물 제제 |
|
에코솔루션 |
- 토양오염 진단 및 환경경영시스템 컨설팅 |
|
자연과 환경 |
- 환경생태복원 전문기업 |
|
케너텍 |
- 목질계 바이오매스 활용 재생에너지 업체 |
|
바이오메디아 |
- 인공토양 제조업체 |
|
인바이오넷 |
- 생물제제 및 생물의약품 제조업체 |
|
디케이케미칼 |
- 폐수처리, 수처리제 환경 약품 제조 업체 |
|
바이오세인트 |
- 담체교반기술을 이용한 무막힘 바이오필터 기술 |
(3) 국외 바이오환경산업 시장현황
바이오환경산업 및 설비 서비스 관련 세계시장은 2006년 2,085억 달러 규모로 조사되었다. 2006년과 2011년 사이 연평균 2.9%의 성장률을 달성하여, 2011년 환경정화 및 설비 서비스 관련 세계 시장은 2,409억 달러를 형성할 것으로 전망하고 있다. 2006년 시장에서 환경정화 및 설비 서비스 분야별로 고체 폐기물 처리가 50% 이상으로 가장 큰 부분을 차지하고 있으며 컨설팅과 공정이 23.2%, 복원 및 산업 서비스가 13.5%, 위험 폐기물 처리가 9.4%, 분석 서비스가 2.0%를 차지하였다. 지역별로는 미국 39.9%, 유럽 31.3%로 환경 산업에서 미국과 유럽이 큰 차이를 보이지 않으며 아시아-태평양이 22.3%의 시장을 형성하고 있다.
표 6. 환경정화 및 설비 서비스 세계 시장현황 및 전망(2006~2011년) (단위 : 십억 달러)
|
년도 |
2006 |
2007 |
2008 |
2009 |
2010 |
2011 |
누적연평균성장률 ('06∼'11년) |
|
시장규모 |
208.5 |
215.0 |
221.5 |
227.9 |
234.4 |
240.9 |
|
|
성장률(%) |
3.20 |
3.10 |
3.00 |
2.90 |
2.80 |
2.80 |
2.9 |
출처: Datamonitor, “Global Environmental Services” 2007.3
(4) 국내 바이오환경산업 시장현황
2008년도 바이오환경산업 분야 국내시장의 규모는 약 2,173억원의 시장이 형성되어 있다. 이중 국내제품은 2,141억원이며, 수입제품은 32억원으로 전체 바이오산업에서 바이오환경산업의 점유률은 약 4%를 차지하고 있다. 국내 바이오환경산업 시장은 세계 바이오환경시장에 비해 성장속도가 최고 5배 정도 빠르며 국내시장의 성장률은 매년 15%의 증가률을 보이고 있으며, 향후 급성장이 가능한 잠재력이 큰 시장으로 분석되고 있다. 세계의 바이오환경산업은 수질과 대기, 폐기물 처리등의 사후처리 기술에서 환경친화적 제품 설계와 환경위해성평가 등 사전오염 예방기술로 전환되는 추세를 보이고 있다. 또한, 지구온난화와 오존층파괴, 해양오염 등의 범 지구환경문제에 대한 공동대처를 위한 지구환경보호기술과 생태계 복원기술에 대한 수요가 커지고 있으나, 우리나라 바이오환경산업 시장은 대부분 미생물제제와 사후 처리시스템이 대부분을 차지하고 있는 실정이다.
표 7. 국내바이오산업 현황과 전망 (단위: 억원)
|
|
2007 |
2008 |
2009 |
2010 |
2011 |
2012 |
2013 |
2014 |
|
바이오환경산업 |
2,008 |
2,173 |
2,639 |
3,756 |
5,693 |
8,633 |
13,089 |
19,844 |
자료: 연도별 국내 바이오산업 실태조사 등 종합, 분야별 최근 3~5년간의 연평균 성장률과 비중을 분석하여 추정
21세기에 들어서면서 삶의 질 향상을 지향하는 의식의 급속한 성장으로 인하여, 친환경적인 의식주에 관한 관심 증가가 바이오환경산업 시장의 확대로 이어지고 있다. 친환경적인 삶을 누리기 위해 바이오환경산업은 자연친화적 처리, 오염원의 근본적 제거 및 2차 오염원의 감소, 가격 경쟁력 측면에서 기존의 환경기술에 대해 장점을 갖고 있기 때문이다.
바이오환경산업 중에 미생물기술을 이용한 환경미생물처리제 (bioremediation)를 사용하여 대기오염, 토양오염, 폐기물 등을 정화하거나 완하시키는 제품이 시장성이 높은 부분으로 부상되고 있다. 또한, 생물학적 폐수처리 시스템의 경우 일분 난분해성 물질과 중금속 처리분야에서 기술개발이 진행되고 있으며, 대기오염 배출허용 기준강화에 따라 미생물을 이용한 탈황 및 탈질기술도 지속적으로 기술개발되고 있다. 특히, 세계적인 CO2배출규제강화에 따른 CO2고정화 시스템 개발이 지구환경 보존의 관점에서 요구되며, 시스템 개발시 새로운 시장을 형성할 것으로 예측된다.
(5) 향후 전망
바이오환경산업은 인간, 환경과 조화를 이루는 환경친화형 산업으로 지속적 개발과 환경보호를 동시에 추구하는 미래지향적인 산업이다. 또한 청정기술로서 환경오염을 근원적으로 해결할 수 있으며, 과학적이고 체계적인 환경보전기술을 개발 할 수 있는 다학제간 융합기술을 기초로 하고 있다. 바이오환경산업의 특징은 종합적으로 환경의 영향을 관찰하고, 장기간 그리고 광역에 걸친 평가 및 진단이 가능하며, 사회에 대한 호소력이 강한 산업으로 자리매김하고 있다.
전세계 바이오환경산업을 주도하고 있는 미국은 미생물이나 미생물개선제품의 생산업체, 오염정화를 기획 수행하는 엔지니어링 및 컨설팅업체, 화학 생물학적 분석을 수행하는 첨단연구소, 생물공학적 환경복원공정에서의 도구 개발 및 분석을 수행하는 기업등이 미생물 처리공정을 이용한 환경복원 기술을 공동개발하고 있다. 또한, 범 세계적으로 환경문제가 큰 이슈로 대두되면서 이에 따른 엄격한 국제 규정제정이 진행됨에 따라 바이오환경산업의 경쟁력 확보차원에서 국제수준의 환경문제 대응기술을 적극적으로 추진 중에 있다. 특히 미국, 캐나다, 호주 등 선진국을 중심으로 경제적이고 자연친화적으로 오염원을 정화할 수 있는 바이오환경산업기술들이 활발히 개발되고 있으며, 부가가치가 높은 상품이 개발되고 있는 추세이므로 산업화에 따른 시장규모는 증가 될 것으로 예상된다.
우리사회의 지속가능한 경제체제를 이루기 위해서는 바이오환경산업을 육성하고 청정기술을 개발·산업화에 역량이 집중하여 녹색산업혁명을 이루는데 기반이 될 것이다. 종래의 사후처리기술개선과 함께 사전예방, 환경복원, 재생기술의 발전이 전망되어진다. 또한, 바이오환경산업은 에너지 절약, 비공해 기술로 국제환경협약의 제약조건을 벗어날 수 있는 미래산업의 선도적인 역할을 담당하는 산업으로, 새로운 환경보전형 산업군을 유도하며, 지속적인 성장, 환경보전, 삶을 질향상을 함께 추구하는 이상적 미래산업을 창출하게 될 것이다.
제5절 바이오 융합 분야
1. BT + IT
가. 개요
"과학기술미래비젼" 보고서에 따르면 융합기술은 정보통신기술(Information Technology, IT), 나노기술(Nano-Technology, NT), 바이오기술(Bio-Technology, BT), 인지과학(Cognitive Science, CS) 등으로 대별되는 신기술 간의 결합 또는 다른 기술 분야와의 상승적 결합을 의미한다고 정의하고 있다. 또한 국가융합기술발전 기본계획에 따르면 “융합기술이란 NT, BT, IT등의 신기술간 또는 이들과 기존 산업, 학문간의 상승적 결합을 통해 새로운 창조적 가치를 창출함으로써 미래 경제와 사회, 문화의 변화를 주도하는 기술이다” 라고 정의하고 있다. 새로운 기술분야의 생성과 소멸 그리고 이합집산의 속도가 점점 빨라지고 있고, 이러한 과정을 통해 탄생한 새로운 신기술은 또 다른 기술간의 융합을 통해 새로운 가치를 만들어 냄으로써 21세기의 차세대 기술 혁명을 이끌어 나갈 것으로 기대된다. 미국 랜드연구소(RAND Corporation, http://www.rand.org/) 보고서에 따르면, 2020년 이후로는 IT・BT・NT 등의 융합에 따른 기술개발이 두드러질 것으로 예상하고 있으며, 이러한 융합 기술의 발전을 위해서 새로운 연구혁신 체제를 제도화시키는 것이 정부 정책의 중요한 이슈가 될 것으로 전망하고 있다(출처: 2040년을 향한 대한민국의 꿈과 도전 과학기술미래비젼).
융합기술은 향후 인간의 인지 능력과 소통 능력을 확장하고, 인간의 건강 증대와 수명 연장, 사회의 경제적 효율성 향상을 가능하게 할 전망이며, 나아가 지구 온난화, 전염병, 에너지 및 식량문제 등 전 인류가 직면한 문제 해결할 새로운 돌파구를 제시할 것으로 기대하고 있다. 또한 융합기술에 따른 신산업 창출 및 구조 변화 등은 경제・사회에 지대한 변화를 초래할 것으로 예측하고 있다(출처: 과학기술미래비젼). 이러한 변화에 선제적으로 대응하기 위해서는 타 분야 기술 지식의 획득과 소화, 결합・창출을 내재화할 수 있는 새로운 혁신 체제의 구축과 필요한 인력양성 체제에 상응하는 고등 교육정책 수립과 같은 기본적인 준비가 필요할 것이다.
여기에서 다루는 바이오융합은 바이오 분야를 중심으로 IT, NT, ET 등 다양한 분야와의 융합중 바이오와 IT, 더 한정적으로 정의하자면 BT-IT 융합(생명정보학, Bioinformatics) 중심으로 내용을 작성하고자 한다. 왜냐하면 바이오융합의 분석이나 연구의 대상이 넓어 대상을 구체화할 필요가 있고, 참고할 만한 기준, 분류체계, 보고서, 통계 자료 등이 부족해 일관성 있는 자료 작성에 한계가 있다. 이러한 이유로 각 분야별로 참고한 데이터의 기준이나 분류가 제각각이어서 제시된 데이터로부터 의미를 추론할 수밖에 없는 한계가 있음을 미리 적시하고자 한다.
생명정보학(Bioinformatics)은 생물학 데이터를 바탕으로, 생명현상의 일련 과정을 정보처리학적인 현상 혹은 과정으로 보고, 전산, 수학, 통계, 화학, 물리학 분야의 방법론과 도구를 사용하여 생명현상을 모사하여, 생명현상의 궁극적 이해와 활용을 추구하는 연구분야다.
생명정보학의 주 업무는 생물학적 데이터들의 패턴이나 연관관계를 규명하는 것이며, 생물학적 정보의 수집, 처리, 저장, 배포, 분석, 해석, 가시화 등의 모든 분야를 포함하는 종합 혹은 융합학문이다. 생명정보학 연구는 IT 기술을 기반으로 생명체가 가진 모든 유전정보를 통칭하는 유전체학(Genomics)이나, RNA의 생성 혹은 발현을 총체적으로 분석하는 전사체학(Transcriptomics), 단백질의 총량을 분석하는 단백질체학 (Proteomics), 단백질들 간의 상호작용을 해석하는 상호작용체학(Interactomics)과 같이 대량발굴(high-throughput) 생물학 연구에 초점이 맞추어져 있다.
생물학 분야 자료유도(data-driven)의 핵심은 유전체정보로 염기서열 분석 기술의 발전으로 인해 분석비용이 급격하게 줄어들게 되어 다양한 유전체 분석이 이루어지고 있다. 유전체 분석기술은 Lynx Therapeutics' Massively Parallel Signature Sequencing(MPSS), Polony sequencing, 454 pyrosequencing, Illumina (Solexa) sequencing, SOLiD sequencing, Ion semiconductor sequencing, DNA nanoball sequencing등 다양한 기술이 개발되어 각 회사마 다 독자 분석 플랫포움을 구축하고 있다. 최근에 Life Technologies에서는 광학적으로 서열을 읽어내는 Ion Torrent Personal Genome Machine을 49,500 달러에 시판하고 있다(출처: http://www.nature.com/news/2010/101214/full/news.2010.674.html). 뿐만 아니라 RNA를 타겟으로 한 전사체 분석기술, RNA-Seq, Methylation-Seq, Chip-Seq등 다양한 기술이 개발되고 있어 분석이 필요한 데이터 양이 엄청나게 증가하고 있다. 이러한 대량의 서열 데이터를 근간으로 다양한 측면에서 분석이 이루어지고 있는 것은 물론, 분석 데이터간의 상호관계 및 시스템생물학(Systems Biology, 그림 1) 측면에서 총제적인 접근이 진행되고 있다.
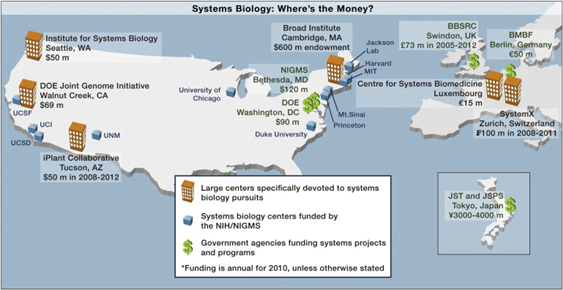
그림 1. 세계 주요 시스템생물학연구 기관 및 예산[출처: Cell, Volume 144, Issue 6, 839-841, 18 March 2011].
이러한 컨텐츠나 정보를 IT 측면에서 소프트웨어라고 보면 분석에 필요한 시스템이나 장비와 같은 하드웨어 역시 생명정보에 핵심적인 요소라고 할 수 있다. 초기 하드웨어 분야는 슈퍼컴퓨터와 같은 대용량 시스템에 의존하다가 병렬컴퓨팅으로 비용과 처리속도 문제를 부분적으로 해결했다. 최근에는 개인 PC 크기에 슈퍼컴퓨터 수준의 처리능력을 갖춘 하드웨어 장비까지 개발되고 있으며, 그리드 기반의 협력적 High-computing 이나 크라우드 기반의 데이터 처리 및 저장기술이 본격적으로 도입이 되기 시작했다. 구글, 마이크로 소프트, IBM도 차세대 해독기와 제 3세대 정보 해독기술과 분석에 참여하고 있는데, 이는 선도적인 기술확보를 통해 산업화를 염두에 두고 있다는 것이다.
생명정보학의 활용을 통한 산업적인 가치 구현은 다양한 분야에서 시도되고 있지만 가장 현실적으로 빠르게 결과를 도출 할 수 있는 분야가 의학이나 약학분야라는 것은 누구나 인정하고 현제 부분적으로나마 그 가치를 만들어내고 있다. 대표적으로 맞춤의학(Personal Medicine)과 중개연구(Translational Research)가 가장 핵심적인 분야라고 할 수 있다. 먼저 맞춤의학은 기존의 코흐트(Cohort) 조사를 통해 평균값을 기반으로 표준화시킨 프로토콜에 따른 의학적 행위를 대신해서 Genome Wide Association Study(GWAS), Single Nucleotide Polymorphism(SNP), Copy Number Variation(CNV) 등을 통해 각 개인이 가지고 있는 유전적 차이를 기반으로 진단하고 처방해야 한다는 것으로 미국 대통령 산하 국가과학기술자문위원회 (President’s Council of Advisors on Science and Technology)에서 2008년 9월에 당시 부시 대통령에게 “Priorities for Personalized Medicine” 라는 보고서를 통해 체계적으로 미래 개인맞춤의학 시대를 준비할 것을 자문하고 있다. 2011년 미국의 맞춤의학 시장규모는 2,250억~2,320억 달러로 추정되며 2015년까지 연평균 11% 성장해 3,440억~4,520억 달러 규모에 이를 전망이다(출처: 프라이스워터하우스쿠퍼, PwC).
또 다른 하나가 중개연구로 표현되는 Translation Research 혹은 Translational Medicine이고 생명정보학의 측면에서는 Translational bioinformatics라고 불려 지기도 한다. 이는 기초연구를 의학에 적용하기 위해 신약후보물질 개발 및 임상정보를 통합함으로써 신약개발의 속도와 효율성을 높이기 위한 목적으로 제시되었으나 현재는 기초연구와 임상자료 및 다양한 기술을 통합함으로써 환자 치료에 사용되어 질 수 있는 신약이나 치료기기 개발 등 특정 목적을 달성하기 위한 프로세스 전반을 의미하는 것으로 확장되고 있다.

그림 2. 바이오 기술이 접목되고 있는 산업 및 응용분야(출처: 바이오융합기술-정봉현, 생명공학정책연구센터 WebZine)
그림 2에서 볼 수 있듯이 생명정보학은 의료분야 이외에도 바이오-헬스 식품/농림분야, 해양수산, 기계/전자, 에너지등 거의 모든 분야에 활용이 가능하다. 에너지/환경분야는 석유와 석탄과 같은 화석에너지 가격상승과 향후 자원 고갈을 대비해 바이오매스를 활용하는 방안이 지구환경 환경문제와 연계되어 주목받고 있는 분야다. 식품/농림분야는 자원무기화에 대비해 새로운 품종개발, 질병진단, 그리고 자원관리에 적극적으로 생명정보 기술을 활용하고 있다. 이런 이유로 생명정보 시장규모는 전체적으로 연평균성장률이 20% 내외로 다른 분야보다 빠른 성장세를 보여주고 있어 주목받고 있다.
나. 생명정보학의 역사 및 세계동향
1950년대의 DNA 구조 모델링을 통해, 이중나선구조가 제안되었고, 1960년대의 단백질 구조 해석을 위한 많은 수동/자동 전산처리작업과 알고리즘(Algorithm) 개발이 생명정보학 발전의 실질적인 토대가 되었다. 1970년대 이르러서 영국 캠브리지의 프레데릭 생어(Frederick Sanger)박사의 단백질과 DNA 서열해석 기술을 이용하여, 본격적으로 염기서열 사이의 상동성(Homology) 검색기술들이 개발되었으며, 1980년대에는 단백질 구조 접힘 문제 연구에 많은 생명정보학자들이 기여를 했다. 현재 사용되고 있는 많은 통계학적, 수학적 알고리즘들은 이때에 개발되었다. 1970년에 니들만-원취(Needleman-Wunsch)의 다이내믹프로그래밍(Dynamic Programing)을 이용한 염기서열 정열 알고리즘은 전산생물학(Computational Biology)의 중요한 계기가 되었다. 서열간의 유사성을 분석하기 위한 FASTA와 BLAST 등의 프로그램이 미국의 니들만 분취의 기술에 더하여 알출, 피어슨, 립맨 등에 의해 개발되었고, 현재에도 산타크루즈 대학의 데이비드 하우슬러 (David Haussler) 그룹과 케임브리지의 Medical Research Council (MRC)에서 Hidden Markov Model(HMM) 및 Support Vector Machine (SVM)과 같은 응용된 생명정보학용 알고리즘이 여전히 많이 사용되고 있다. 한편으로 개별 연구에서 집단 연구, 더 나아가 동시대에 전 세계 연구(Global Research)가 가능했던 것은 1990년 초의 팀 버너즈-리(Tim Berners-Lee)가 유럽의 Conseil European pour la Recherche Nucleaire (CERN) 연구소에서 개발한 HTTPD라는 컴퓨터 프로그램과 HTML이라는 양식이 보편화 되면서, 많은 생명정보학자들이 인터넷을 통해 정보를 유통하고 그에 필요한 기반 기술을 만들어 내면서 생명정보학은 인터넷을 기반으로 새로운 시대를 맞이하게 되었다.
데이터 저장과 웹을 통한 서비스는 National Center for Biotechnology Information (NCBI), European Bioinformatics Institute (EBI) 그리고 DNA Data Bank of Japan (DDBJ)가 중심이 되어 전 세계 생명정보데이터의 등록(그림 3, 표5)과 관리 그리고 서비스 담당하고 있으며, 데이터 등록 도구개발은 물론 다양한 분석 도구 개발과 서비스를 제공하고 있다. 이들 기관들은 다양한 DB 개발 및 다양한 알고리듬을 무료로 배포하여, 생명정보학 발전에 큰 기여하였고, 지금도 그 역할은 진행형이다. 현재는 International Nucleotide Sequence Databases (INSD, http://insdc.org/) 협력체가 데이터 표준이나 관리 그리고 공유 정책을 이끌어 가고 있다.

그림 3. 전 세계 염기서열 등록 현황. 2010에 약 1억3천개의 서열이 등록됨 (출처: Curr. Protoc. Bioinform. 34:1.1.1-1.1.6)
2001년 2월 인간유전체정보 발표(Nature 409, 860-921., Science 291(5507), 1219-1220)를 정점으로 다양한 염기서열 분석기술의 발전과 비용이 급격하게 줄어들게 됨으로써 대규모 유전체 연구 프로젝트가 추진되었고(그림 4) 현재 약 1만종 이상의 게놈 분석이 완료되었거나 진행중에 있다(출처: Genome Online Database). 포스트-유전체학(post-genomics)은 유전체상의 모든 유전자의 기능과 역할을 이해하는 것을 목표로 유전자 발현과 다양한 기능 데이터로부터 유전자 네트워크를 만드는 것으로 시스템생물학, Systems Biology으로 불리고 있다.

그림 4. 생명과학의 역사 (출처: 2010년도 국가 생명연구자원 통계자료집)
분자생물학의 연구의 초점이 유전체학(genomics)에서 전반적 기능 분석으로 확대되면서, 각종 생물학분야의 오믹스(Omics, 체학)가 확장 되고 있다. 따라서 생명정보학의 연구방향도 이에 맞추어 다양한 오믹스 데이터 생산과 이들 데이터간의 총체적 관계분석을 통해 생명현상의 문제를 시스템생물학 관점에서 이해하려는 시도가 진행중에 있다(Cell, Volume 144, Issue 6, 839-841, 18 March 2011).
(1) 시장동향
○ 기업환경의 변화
-개인유전체 시대 도래, 전 세계적으로 환경/생태/식품 분야에 투자확대, 급속한 지구인구 노령화, 변화된 융합연구, 융합문화에 대한 필요성 및 당위성에 대한 인식, 각 국가들이 경제위기를 극복하기 위해 벌이는 막대한 투자 등 기업의 투자환경이 급속하게 변하고 있음.
-기존의 의학진단이나 신약개발 분야 연구는 지속적으로 확대 될 것으로 생각되며, 특히 서서히 부상하고 있는 개인유전체 사업 분야중 질병진단이나 예측 분야에 수많은 분석도구 개발이 이루어 질 것으로 생각됨.
-개인 유전체 정보를 기반으로 한 웹 기반의 다양한 서비스 컨텐츠가 개발될 것으로 생각되지만 오픈 소스들과 상생할 수 있는 방법모색이 필요할 것으로 예측됨.
-컨텐츠 비밀유지나 보안에 대해 폐쇄성이 강한 바이오분야의 연구자들의 속성상 in-house에 Hardware 시스템을 구축에 대한 욕구가 강해 당분간 하드웨어 시장은 현재 상태를 유지하겠지만 장기적으로는 시스템 구축에 대한 수요는 줄어들 것으로 보임.
-단 분석을 위한 연산 처리 시스템 수요는 그리드 개념의 클라우드컴퓨팅과 같은 새로운 개념이 적용되면서 새로운 수요를 만들 것으로 예측됨.
-주목할 만한 것은 외장하더의 용량이 커지고 가격이 급속하게 떨어지고 있어 외장하더를 활용하여 바이오컨텐츠를 저장하는 기능외에 분석프로그램이 연결된 형태의 소규모 장비 개발도 이루어 질 것임.
-다른 분야도 마찬가지겠지만 대용량 외장하더가 일반화됨으로써 특히 바이오 컨텐츠에 대한 정보유출과 보안 문제가 이슈화 될 수도 있음.
○ 생명정보 시장예측은 분류기준 및 범위 그리고 예측 방법에 따라 그 결과가 다양해서 대표적인 세계적 시장컨설팅 전문업체인 Business Insights Ltd에서 2010년에 발표한 보고서 “The Global Bioinformatics Market”에서 언급된 핵심 내용을 소개하고자 함.
-본 보고서에서는 생명정보학분류를 그림 와 같이 3개의 대분야(Molecular Biology, Information Technology 그리고 Algorithm/Statistics Computation 으로 구분하고 시장은 분석도구(Tools), 컨텐츠/데이터베이스(Contents/Database) 그리고 서비스(Service)로 나누어 예측하고 있음(그림 13).

그림 13. 생명정보 시장 분석 시 Business Insights Ltd사에서 정의한 생명정보 분류
-5개의 활용 분야별로 현재상황과 미래시장을 예측하고 있는데, 현재는 분자의학(Molecular Medicine) 시장이 가장 중요한 위치를 차지하고 있고 향후에는 유전자치료(Gene therapy)와 약제개발(Drug development) 분야 역시 생명정보 시장이 매우 중요시 될 것으로 예측하고 있음(표23).
표23. 생명정보(bioinformatics) 적용분야별 시장 비교분석(출처: Business Insights Ltd., The Global Bioinformatics Market)
|
구분 |
Molecular Medicine |
Preventive Medicine |
Gene Therapy |
Drug development |
Others |
|
현재 분석도구시장 |
매우 높음 |
매우 낮음 |
중간 |
중간 |
매우 낮음 |
|
현재 서비스 시장 |
높음 |
중간 |
중간 |
낮음 |
매우 낮음 |
|
미래 분석도구 및 서비스 시장 |
매우 높음 |
높음 |
매우 높음 |
매우 높음 |
높음 |
-3개 분야 평균 연평균 성장률은 25.1%로 매우 빠른 성장세를 예측하고 있으며, 현재는 컨텐츠/데이터베이스 분야가 시장을 리더하고 있지만 향후 2014년에는 분석도구 시장이 약 40억 달러 수준으로 성장 할 것으로 예측하고 있음(표24).
표24. 세부 분야별 전세계 생명정보(bioinformatics) 시장(2007~2014, 백만 달러, 출처: Business Insights Ltd., The Global Bioinformatics Market)
|
구분 |
2007년 |
2008년 |
2009년 |
2014년 |
CAGR(%) |
|
Tools |
659.1 |
850.3 |
1,099.2 |
4,071.9 |
29.9 |
|
Contents/Database |
948.4 |
1,133.7 |
1,358.5 |
3,439.2 |
20.4 |
|
Service |
222.2 |
276.5 |
345.1 |
1,093.0 |
25.9 |
|
Total |
1,829.7 |
2,260.5 |
2,802.8 |
8,604.1 |
25.1 |
-세부 분야별로 분석도구 시장은 가장 기본적인 분야로 NGS의 영향으로 대량 데이터의 분석이 필요할 것으로 예상되어 평균 29.9%의 고속 연평균성장률을 기록할 것으로 예측하고 있음(표25).
|
Product |
2007 |
2008 |
2009 |
2014 |
CAGR(%) |
|
Sequence analysis |
198.0 |
258.1 |
336.9 |
1,309.8 |
31.2 |
|
Sequence alignment |
164.4 |
211.5 |
271.9 |
980.8 |
29.3 |
|
Sequence manipulation |
131.7 |
171.2 |
222.2 |
847.3 |
30.7 |
|
Structural analysis |
131.9 |
166.9 |
212.9 |
729.7 |
27.9 |
|
Others |
33.1 |
42.6 |
55.3 |
204.3 |
29.9 |
|
Total |
659.1 |
850.3 |
1,099.2 |
4,071.9 |
29.9 |
- 컨텐츠 및 데이터베이스 시장은 NGS의 영향으로 고객맞춤형 시장이 연평균성장률 21.4%로 성장할 것으로 보고 있으며, 전체적으로는 20.4%로 분석도구시장에 비해 약간 떨어질 것으로 예측(표26).
표26. 전 세계 컨텐츠/데이터베이스 시장 규모(2007~2014년., 백만 달러, 출처: Business Insights Ltd., The Global Bioinformatics Market)
|
Product |
2007 |
2008 |
2009 |
2014 |
CAGR(%) |
|
Specialized |
663.5 |
800.9 |
968.3 |
2,557.5 |
21.4% |
|
General |
284.9 |
332.8 |
390.2 |
881.7 |
17.4% |
|
Total |
948.4 |
1133.7 |
1358.5 |
3439.2 |
20.4% |
- 서비스 시장은 오픈소스의 성장으로 가장 예측하기 힘든 분야지만 수요 역시 큰 시장의 하나로 전체 연평균성장률이 25.9%로 고속 성장을 예측하고 있음(표27).
표27. 전 세계 생명정보 서비스시장(2007~2014년., 백만 달러, 출처: Business Insights Ltd., The Global Bioinformatics Market)
|
Product |
2007 |
2008 |
2009 |
2014 |
CAGR(%) |
|
Data analysis |
88.8 |
110.2 |
136.5 |
416.4 |
25% |
|
Sequence services |
66.6 |
83.0 |
102.8 |
326.3 |
26% |
|
Data & management |
55.4 |
69.5 |
88.2 |
294.7 |
27.3% |
|
Other service |
11.4 |
13.8 |
17.6 |
55.6 |
25.9% |
|
Total |
222.2 |
276.5 |
345.1 |
1,093.0 |
25.9% |
-시장규모를 지역별로 보면 아시아 시장이 북아메리카나 유럽에 비해 현재는 규모가 작지만 점차 아시아 시장의 성장과 함께 유럽시장의 고속 성장을 예측하고 있음(표28).
표28. 지역별 생명정보 시장 분석(2007~2014년., 백만 달러, 출처: Business Insights Ltd., The Global Bioinformatics Market)
|
|
2007 |
2008 |
2009 |
2014 |
CAGR(%) |
|
North America |
821.5 |
997.6 |
1,215.9 |
3,395.3 |
22.8 |
|
Europe |
619.1 |
792.6 |
1,017.0 |
3,624.6 |
28.9 |
|
Asia |
265.6 |
330.3 |
412.4 |
1,287.2 |
25.6 |
|
ROW |
123.5 |
140.0 |
157.5 |
297.0 |
13.5 |
|
Total |
1,829.7 |
2,260.5 |
2,802.8 |
8,604.1 |
25.1 |
-Business Insights Ltd 보고서(출처: Business Insights Ltd., The Global Bioinformatics Market, 2009)에 따르면 생명정보 시장을 활성화 시키는 요소로 신약개발을 위한 데이터분석도구의 통합, 지노믹스 및 프로테오믹스 산업의 성장, 폭넓은 신약후보물질 발굴과 개발, 연구개발을 위한 정보지원, 안전한 신약개발이 가능한 바이오마커 발굴, 인터넷과 IT의 발전, 그리고 대량데이터 스크리닝 기술 등을 지적하고 있음.
○ Business Insights Ltd 보고서 이외의 생명정보 시장 예측보고서는 다음과 같음.
-전 세계 생물정보학 시장(13개의 하부 카테고리로 분류)은 2009에서 2014년까지 연평균성장률 24.8%(CAGR) 성장하여 83억 달러에 달할 것으로 예측하고 있으며 특히, 생물정보 플랫포움 시장(bioinformatics platforms market)은 2009년 13억 달러에서 2004년 39억 달러에 이를 것으로 예측하고 있음[출처: Bioinformatics Market - Advanced Technologies, -Global Forecast and Winning Imperatives (2009 - 2014) by marketsandmarkets.com].
-Global Industry Analysts, Inc(http://www.strategyr.com GIA)는 전세계 생물정보학 시장이 2015년에 50억 달러에 이를 것으로 예측
-"Global Bioinformatics Market Outlook," 보고서는 2011~2013년까지 연평균성장률 26%의 성장으로 2013년에 62억 달러에 달할 것으로 예측(출처: http://www.rncos.com/Report/IM554.htm) 하고 있으며, 2010년 일본의 생물정보학 시장이 380억엔으로 나타남.
-Bioinformatics – A Global Market Overview'(Bioinformatics Content, Bioinformatics Analysis Software & Services and Bioinformatics IT Infrastructure & Other Services로 구분)에 따르면 2011년 24억 달러로 예측하고 있으며 2007년부터 2017까지 18.3% 연평균성장률로 2017년에 760억 달러에 이를 것으로 전망(출처: Industry Experts, http://industry-experts.com/., Bioinformatics – A Global Market Overview').
○ 생명정보 분야를 이끌 대표적인 분야중에 하나가 개인 맞춤의학시장(personalized medicine market)으로 수년 내에 급속한 성장이 예상되며, 시컨싱 비용과 시간이 획기적으로 줄어든다는 가정을 전제로 하고 있지만 점점 현실화 되어가고 있음(표29).
표29. 개인유전체 100달러 시대. (출처: http://scienceroll.com/2008/04/26/personalized-genetics-towards-the-100-genome/)
|
년도 |
2003년 |
2007년 |
2008년 |
2012년 |
|
비용 |
$437,000,000 |
$10,000,000 |
$100,000 |
$100* |
|
시간 |
13 years to map |
4 years |
4 weeks |
2 days |
-개인 맞춤의학시장은 11% 연평균성장률로 2015년에 4,520억 달러 시장으로 성장할 것으로 예측(출처: PricewaterhouseCoopers, http://www.pwc.com/)하고 있다. 핵심적인 진단과 치료시장은 장비를 포함해서 2009년 240억 달러에서 10%의 연평균성장률로 2015년 420억 달러로 성장하고 Telemedicine, health IT 그리고 질병관리서비스를 포함한 개인의료캐어(personalized medical care) 시장은 Telemedicine이 본격화된다면 2015년에 1천억 달러에 이를 것으로 예측.
-대체의학을 포함한 영양 및 웰빙 시장은 1,960억 달러로 평가하고 있는데, 7%의 연평균성장률로 2015년에 2,900억 달러로 성장할 것으로 예측.
-BCC-Market Research Reports는 개인맞춤의학 기술시장(personalized medicine technology)이 2009년 144억 달러에서 15.2%의 연평균성장률로 2014년에 292억 달러로 성장(출처: BCC-Market Research Reports., http://www.bccresearch.com/report/personalized-medicine-phm044b.html)할 것으로 예측. 이중에 주요 수익원인 Pharmacogenomics는 맞춤의학 기술시장에서 28.7%를 차지하는데 2009년 41억 달러에서 18%의 연평균성장률로 2014년에 950억 달러에 이를 것으로 전망. 그리고 두 번째로 큰 point-of-care 시장은 2009년 270억 달러로 평가되는데 18%의 연평균성장률로 2014년에 510억 달러에 이를 것으로 전망.
-Research and Markets-Personalized Medicine Market Worldwide 보고서에 따르면 지노믹스와 프로테오믹스의 성장에 힘입어 11.56%의 연평균성장률로 2015년에 1,484억 달러로 성장(출처: Research and Markets: Personalized Medicine Market Worldwide (2010 - 2015)
표30. 맞춤의학 관련 시장의 분야별 규모와 향후 성장 전망(출처: Jain KK, Personalized Medicine, Jain PharmaBiotech Report, Switzerland., 2010 단위-억 달러)
|
구분 |
2009년 |
2014년 |
2019년 |
|
분자진단 |
90 |
155 |
425 |
|
약물유전체 |
21 |
28 |
41 |
|
SNP분석 |
10 |
26 |
39 |
|
약물유전학 |
12 |
23 |
38 |
|
약물단백질체 |
9 |
18 |
42 |
|
바이오칩 |
21 |
34 |
105 |
|
맞춤의료진단(POC) |
108 |
177 |
260 |
|
유전자스크리닝 |
14 |
29 |
75 |
○ 신약개발과정에서 DNA sequencing 분야의 세계 생명정보 시장은 17.6%의 연평균성장률을 통해 2014년 약 1.8억 달러 규모로 성장할 것으로 예측(표30).
-특히, Data mining and proprietary database와 Statistical and data analysis software 분야가 각각 20.1%, 18.4%의 연평균 성장률을 보일 것으로 예측(표31).
표31. 품목별 전 세계 생명정보 시장(Global bioinformatics market, by products(M$), 출처: Business Insights., DNA sequencing in Drug Discovery)
|
Product |
2007 |
2008 |
2009 |
2014 |
CAGR(%) |
|
DNA analysis software |
11.4 |
13.9 |
16.9 |
45.6 |
22 |
|
Data mining and proprietary database |
9.8 |
11.6 |
13.9 |
34.7 |
20.1 |
|
Statistical and data analysis software |
8.7 |
10.2 |
12.1 |
28.2 |
18.4 |
|
Cluster and visualization software |
7.3 |
8.3 |
9.1 |
15.4 |
11.1 |
|
Data collection software |
5.3 |
5.9 |
6.9 |
12.2 |
13.1 |
|
Data conversion software |
4.0 |
4.7 |
5.3 |
10.5 |
14.7 |
|
Design software |
2.9 |
3.1 |
3.4 |
5.3 |
9.3 |
|
Other integrated software |
1.7 |
2.0 |
2.3 |
4.9 |
16.3 |
|
Total |
57.5 |
67.0 |
78.2 |
175.7 |
17.6 |
(2) 연구예산
○ 부분적이나마 생명정보 예산을 세계 주요 국가 시스템생물학 연구기관 예산(2010년)을 통해 추정해볼 수 있음(표35).
-미국은 Department of Energy(DOE)와 National Institute of General Medical Sciences(NIGMS), 유럽의 경우 영국은 BBSRC, 독일은 BMBF 그리고 일본의 경우 JST/JSPS가 정부기관의 시스템생물학 연구 프로젝트로 추진.
-NIGMS의 Center for Bioinformatics and Computational Biology가 주도하고 있으며 대부분의 예산이 시스템생물학 연구에 집중.
-미국의 iPlant Collaborative는 National Science Foundation(NSF, 미과학재단)에서 지원하는 프로그램으로 computational plant biology 연구를 수행.
-정부기구와는 별도로 대학이나 비영리기관에서 시스템생물학연구센터를 설치해서 연구를 수행.
-표35 이외에도 영국의 경우 BBSRC 이외에 5년간 23M£이 투자되었으며, 100개 정규 연구프로젝트가 지원된 것으로도 알 수 있듯이 각 국가별로 추진하는 프로젝트 단위가 아닌 정규 연구 예산 역시 상당한 규모일 것으로 추정됨.
표35. 세계 주요 시스템생물학 연구기관 및 예산[출처: Cell, Volume 144, Issue 6, 839-841, 18 March 2011].
|
구분 |
국가 |
기관명 |
2010년 예산 |
|
정부기관 (프로젝트 혹은 프로그램 지원) |
미국 |
Department of Energy (DOE) |
90M$ |
|
미국 |
National Institute of General Medical Sciences (NIGMS) |
120M$ |
|
|
영국 |
Biotechnology and Biological Sciences Research Council (BBSRC) |
73M£(2005~2012) |
|
|
독일 |
des Bundesministeriums für Bildung und Forschung(BMBF) |
50€ |
|
|
일본 |
JST/JSPS |
3000~4000M¥ |
|
|
시스템생물학 대규모 센터 |
미국 |
Institute for Sytems Biolo효 Seattle |
50M$ |
|
미국 |
DOE Joint Genome Initative |
69M$ |
|
|
미국 |
iPlant Collaborative Tucson |
50M$ |
|
|
미국 |
Broad Institute |
600M$ |
|
|
스위스 |
SystemX Zurich |
100M₣ |
|
|
룩셈부르크 |
Center for Systems Biomedicine |
15M€ |
다. 국내현황 및 동향
(1) 학술논문
국내 생명정보 분야의 학술적인 연구동향을 분석하기 위해 먼저 바이오-의학분야의 대표적인 문헌 데이터베이스인 PubMed에 대표 키워드를 사용하여 검색한 결과는 그림 15와 같다. 최근 10년 (2001년~2010년) 이 분야의 대표키워드가 포함된 논문 발표 수는 매년 빠르게 증가하는 양상을 보여주고 있다. 2010년을 기준으로 보면 Bioinformatics라는 키워드가 포함된 논문이 250여 편으로 가장 많이 발표되었고, 다음으로 Genomics, Computational Biology 순으로 나타났다(그림 15).
그림 15. 생명정보분야 대표키워드로 검색한 국내 논문발표 현황 (PubMed에 대표 키워드를 활용해 논문 발표 현황조사., 2011년 7월). 이 데이터는 논문 발표 현황을 통해 간접적으로 관련분야의 연구현황을 유추해 볼 수 있음.
(2) 분석 리소스
생명정보학분야의 데이터베이스 구축, 알고리즘 개발과 같은 정보분석 웹 리소스 개발현황은 Informatics Tools in PubMed (http://into.kobic.re.kr)을 사용해서 분석한 결과, 10년 사이에 꾸준한 성장세를 보이고 있다(그림 16). 2008년 가장 활발하게 연구가 진행된 것으로 나타났고, 2009년과 2010년은 35편으로 정체되어 있음을 보여주고 있다.
그림 16. 최근 10년 (2001~2010년)간 국내 생명정보 웹 리소스 논문 발표 현황 (출처: http://into.kobic.re.kr 가로-년도, 세로-논문 편수)
국내 웹 리소스는 한국생명공학연구원이 10년간 38편의 논문을 발표해 가장 많았고, 다음으로 한국과학기술원과 서울대 그리고 인하대 순서로 나타났다(표48). 부분적인 데이터이지만 첨단연구뿐만 아니라 기초연구 산업화의 교량역할을 수행하는 국가출연연구소가 논문 수로 보았을 때 가장 활발한 연구 활동이 이루어지고 있다는 것은 매우 바람직하다고 하겠다. 그리고 생명정보학 분야 대표 저널중에 하나인 Bioinformatics (Oxford, England) 저널에 가장 많은 51편이 발표되었고, 다음으로 Nucleic Acids Research 저널에 47편이 발표되어 두 저널이 전체 56%를 차지한 것으로 나타났다(표49).
표48. 국내 주요 단체별 생명정보 웹 분석도구 논문 발표 현황 (2001~2010년 http://into.kobic.re.kr)
|
단체명 |
논문 수 |
단체명 |
논문 수 |
|
한국생명공학연구원 |
38 |
한국과학기술원 |
27 |
|
서울대 |
20 |
인하대 |
16 |
|
이화여대 |
7 |
연세대 |
7 |
|
고려대 |
6 |
농촌진흥청 |
6 |
|
포항공대 |
6 |
부산대 |
5 |
|
카톨릭대 |
3 |
경북대 |
3 |
|
숙명여대 |
3 |
숭실대 |
3 |
표49. 국내 논문이 발표 된 주요 저널리스트(2001~2010년, http://into.kobic.re.kr)
|
저널 |
논문 수 |
저널 |
논문 수 |
|
Bioinformatics (Oxford, England) |
51 |
Nucleic Acids Research |
47 |
|
BMC bioinformatics |
18 |
BMC genomics |
14 |
|
Bioinformation |
7 |
Mol Cells |
5 |
국내만 보았을 때는 매년 꾸준한 성장세를 보여주지만 아시아 주요 국가와 비교했을 때는 비교대상국(중국, 일본, 인도, 대만 그리고 한국) 중에 가장 저조한 연구활동을 나타내고 있다. 중국은 2005년을 기준으로 일본보다 많은 연구 성과를 냈으며, 인도, 대만 그리고 우리나라가 비슷한 것으로 나타났다(그림 17).
그림 17. 주요 아시아국가(한국, 중국, 일본, 대만, 그리고 인도) 10년간 생명정보 웹 분석도구 논문발표 현황(세로-논문 편수, 가로-년도)
(3) 주요 공공 연구기관
국내 생명정보관련 전담기관은 국가생명연구자원정보센터가 유일하고 나머지 연구단체는 생명정보관련 기술의 필요에 의해 업무가 확장된 경우이거나 기존의 업무에 생명정보관련 기술을 접목한 형태로 운영되고 있다. 예를 들면 농촌진흥청의 경우 가축이나 식물의 유전체 분석을 통해 품질개선이나 질병진단 등에 활용하기위해 생명정보 연구를 추진하고 있고, 국립보건연구원 유전체센터의 경우 유전 정보를 기반으로 한 코흐트 연구와 인간유전체 연구가 진단과 치료 연구에 핵심적인 요소로 부각되면서 생명정보 연구를 추진하고 있다(표51).
배추게놈국제컨소시움(The Brassica rapa Genome Sequencing Project Consortium)에 참여하고 있는 농촌진흥청 국립농업과학원은 최근, 배추 게놈 해독에 참여해서 Nature Genetics(28 August 2011)에 결과를 발표 하였다. 국립생물자원관은 국내 야생생물자원의 마이토콘드리아 게놈분석을 확대하고 있으며, 생물자원 바코드 시스템 구축에 활용하고 있다. 또한 극지연구소의 경우 Pyrosequencing을 활용하여 극지생태 연구를 진행중에 있다.
표51. 국내주요 공공 생명정보연구기관 및 관련 업무
|
구분 |
세부구분 |
생명정보관련 업무 |
|
농촌진흥청 |
국립축산과학원 동물유전체과 |
-한우판별 이동형 진단 시스템 개발 -우량돼지 조기 선발을 위한 육질진단 chip 개발 -반려동물 활성화를 위한 유전체 연구 |
|
국립농업과학원 농업유전자원부 유전자분석개발과 |
-배추 유전체 구조 분석 -배흰잎마름병균 유전체 구조 및 기능 분석 -벼 삽입돌연변이주 집단을 이용한 기능유전체 |
|
|
국립보건연구원 유전체센터 |
유전체역학과 |
-한국인 유전체·역학 코호트 구축 및 운영 -한국인유전체역학조사사업 수집 자료의 질 관리 및 표준화 -한국인유전체역학조사사업 수집 자료 분양 -코호트 축적자료를 이용한 만성질환 관련 지표 산출 및 연구 |
|
바이오과학정보과 |
-역학, 임상, 유전체 통합정보를 이용한 유용 질환지표 발표 및 대사 네트워크 연구 -MPI 병렬 프로그래밍을 활용한 SVM 계산의 고속화 -한국인 유전체분석 -질병 예측 프로그램 개발을 통한 예방ㆍ예측의학 구현 |
|
|
한국해양연구원 |
극지연구소 극지생명과학연구부 |
-극지생물 다양성 및 진화연구 -극지생물 및 생태계 연구 -유용 극지생물자원 발굴 |
|
해양바이오연구센터 |
-해양생물의 분자 오믹스 연구 |
|
|
한국화학연구원 |
신물질연구본부 신약플랫포움기술팀 |
-통합적 데이터베이스 구축/분석 -구조기반/리간드기반 분자설계 -초고속 가상탐색 -in silico 약물성/약동력학적/독성 예측 |
|
한국생명공학연구원 |
국가생명연구자원정보센터 |
-생명정보학 연구 및 인프라 센터로서 국내·외 네트워크 구축 -생명정보 통합 -생명정보학 연구지원 및 인력양성 |
|
유전체의학연구센터 |
-인체질병 관련 유전체의 구조 및 기능 고속분석 -질병유전자의 분자세포생물학적 기능 및 모델생물체에서의 생체내 기능 검증 -질병유전자를 이용한 표적화 치료기술 연구 -질병진단의 지표유전자 발굴 및 임상 검증 |
|
|
오믹스융합연구센터 |
-Genomics 기반의 유전자 조작 균주 개발 -Proteomics 기반 치료용 인간항체 개발 -Glycomics 기반 세포 재설계 기술 개발 |
|
|
단백체의학연구센터 |
-Proteomics에 의한 Biomarker들의 발굴 및 검증 -발굴 Biomarker에 대한 구조 및 기능적 연구를 통한 신약 타겟 후보 발굴, 개발 |
|
|
국립암센터 |
융합기술연구부 기능유전체연구과 |
-유전체학(genomics)을 이용한 새로운 패러다임의 암 진단, 치료 연구 -대용량, 초고속 분석 방법(High through-put analysis)을 활용한 암 관련 유전자 및 약효 효능 관련 유전적 요인의 발굴 -유전체 분자 표적 발굴 -Technical Core lab 운영: Genomics Core Lab 운영을 통한 암센터 내 연구의 핵심기반기술 제공 |
|
국립생물자원관 |
야생생물유전자원센터 |
- 야생생물 유전자원의 체계적 탐색·수집·목록화 - 유전자원의 안정적 보존 및 관리 - 유전자원 공인화를 위한 분자생물학적 분류 및 동정기술 개발 - 통합정보시스템을 통한 대국민 서비스 제공 |
(4) 기술수준
○ 2011년 1월에 발표된 2010년도 기술수준평가 결과(안)에 융합분야, 의료분야 그리고 바이오분야에 포함된 생명정보관련 기술에 대한 기술수준은 다음과 같다(출처: 2010년도 기술수준평가 결과(안). 11개 대분야중 바이오 분야(5개), 의학분야(3개) 그리고 융합분야(1개) 에서 대표적으로 융합기술의 성격을 띈 것으로 판단되는 중점과학기술을 선택 (표52)., 분야에 따라 분석이나 평가 결과가 없는 경우도 있음).
표52. 2010년도 기술수준평가 결과에 포함된 생명정보 관련 기술분야 (출처: 2010년도 기술수준평가 결과(안). 11개 대분야중 바이오 분야(5개), 의학분야(3개) 그리고 융합분야(1개) 에서 대표적으로 융합기술의 성격을 띈 것으로 판단되는 중점과학기술을 선택(국가과학기술위원회, 2011/01/19).
|
분야 |
관련기술 |
|
융합분야 |
나노기반융합소재 |
|
의료분야 |
유전자치료기술/ 신약개발기술/ 암질환진단 및 치료기술 |
|
바이오분야 |
세포기능조절기술/ 생체정보응용·분석기술/ 바이오칩·센서기술/ 유전체응용기술/ 단백체·대사체 응용기술 |
-11대 분야별 최고기술 보유국 및 기술수준평가 그리고 기술격차 비교는 표54와 같다. 분야 전체로 보았을 때 바이오분야와 융합분야는 의료분야에 비해 기술격차가 작지만 전체적으로 5~6년의 기술격차를 보여주고 있음.
표53. 분야별 최고기술보유국 현황 및 기술격차(출처: 2010년도 기술수준평가 결과(안). 국가과학기술위원회, 2011/01/19).
|
분야 |
융합분야 |
의료분야 |
바이오분야 |
|
최고기술보유국 및 수준(%) |
미국 (73.2%) |
미국(78.7%) |
미국(79.2%) |
|
우리나라 수준(%) |
55.0% |
57.6% |
57.4% |
|
기술격차(최고수준 대비) |
5.4년 |
6.2년 |
5.6년 |
-세부기술별로 최고기술보유국과 비교해보면 표54와 같다. 바이오칩·센서기술 기술분야가 최고기술보유국, 미국대비 71.9%로 6.1년의 기술의 격차를 보였고, 유전체 응용기술은 최고기술 보유국 미국대비 63.9%로 5.7년의 기술 격차를 보이고 있다. 그리고 단백체·대사체 응용기술은 최고기술보유국, 미국대비 73.1%로 6.8년의 기술의 격차를 보였음.
표54. 세부 기술분야 중점과학기술별 최고기술국 및 기술수준[출처: 2010년도 기술수준평가 결과(안)]
|
중점과학기술 |
최고기술 보유국 |
최고기술 보유국 수준(%) |
우리 기술수준(%) |
최고기술대비 우리 기술수준 (기술격차) |
|
세포기능조절기술 |
미국 |
82.2 |
63.1 |
76.8(5.5년) |
|
생체정보응용·분석기술 |
미국 |
72.3 |
46.6 |
64.4(5.0년) |
|
바이오칩·센서기술 |
미국 |
78.2 |
56.2 |
71.9(6.1년) |
|
유전체응용기술 |
미국 |
82.2 |
52.5 |
63.9(5.7년) |
|
단백체·대사체응용기술 |
미국 |
76.7 |
56.1 |
73.1(6.8년) |
|
나노기반융합소재 |
미국 |
73.9 |
49.4 |
66.9(3.0년) |
|
유전자치료기술 |
미국 |
84.6 |
62.7 |
74.1(4.8년) |
|
신약개발기술 |
미국 |
79.2 |
58.8 |
74.2(5.4년) |
|
암질환진단 및 치료기술 |
미국 |
78.4 |
57.0 |
72.7(8.6년) |
○ 대표적인 연구성과라고 할 수 있는 논문과 특허를 미국, 중국, 일본 그리고 EU와 비교한 결과는 표55와 같음.
-각 세부 분야별 기술별로 논문수준지수는 0.376~0.658로 비교적 비슷했지만 이를 특허화 시키는 특허수준지수는 0.077~0.581로 비교적 큰 차이를 보여주고 있음.
-세포 기능조절 기술에서는 논문수준지수(0.526) 대비 특허수준지수(0.581)에서 미국보다는 낮지만 다른 국가들에 비해 높은 결과를 보여 주고 있음.
-유전체 응용기술분야는 논문수준지수가 0.385 임에도 불구하고 특허수준지수가 0.077로 매우 낮은 것으로 나타남.
표55. 바이오 분야 세부 논문·특허 수준 지수(출처: 2010년도 기술수준평가 결과(안). 바이오 분야중 대표적인 융합기술의 성격을 띈 5개 분야. 논문수준지수와 특허수준지수는 출처자료 참고)
|
구분 |
국가 |
논문수준지수 |
특허수준지수 |
지수평균 |
순위 |
|
세포 기능조절 기술
|
한국 |
0.526 |
0.581 |
0.5535 |
4 |
|
미국 |
1.339 |
1.465 |
1.402 |
1 |
|
|
일본 |
0.744 |
0.425 |
0.5845 |
3 |
|
|
중국 |
0.395 |
0.015 |
0.205 |
5 |
|
|
EU |
1.048 |
1.023 |
1.0355 |
2 |
|
|
생체정보 응용·분석 기술 |
한국 |
0.503 |
0.133 |
0.318 |
4 |
|
미국 |
1.332 |
1.642 |
1.487 |
1 |
|
|
일본 |
1.264 |
0.253 |
0.7585 |
3 |
|
|
중국 |
0.536 |
0.021 |
0.2785 |
5 |
|
|
EU |
1.046 |
0.782 |
0.914 |
2 |
|
|
바이오 칩·센서 기술 |
한국 |
0.658 |
0.171 |
0.4145 |
4 |
|
미국 |
1.421 |
1.736 |
1.5785 |
1 |
|
|
일본 |
0.827 |
0.338 |
0.5825 |
3 |
|
|
중국 |
0.715 |
0.103 |
0.409 |
5 |
|
|
EU |
0.765 |
0.801 |
0.783 |
2 |
|
|
유전체 응용기술 |
한국 |
0.385 |
0.077 |
0.231 |
4 |
|
미국 |
1.463 |
1.271 |
1.367 |
1 |
|
|
일본 |
0.776 |
0.268 |
0.522 |
3 |
|
|
중국 |
0.394 |
0.009 |
0.2015 |
5 |
|
|
EU |
1.109 |
0.984 |
1.0465 |
2 |
|
|
단백체·대사체 응용기술 |
한국 |
0.376 |
0.189 |
0.2825 |
4 |
|
미국 |
1.289 |
2.062 |
1.6755 |
1 |
|
|
일본 |
0.806 |
0.489 |
0.6475 |
3 |
|
|
중국 |
0.441 |
0.004 |
0.2225 |
5 |
|
|
EU |
0.975 |
1.341 |
1.158 |
2 |
(5) 연구개발사업
융합학문의 성격을 가진 생명정보 분야는 독립적인 연구개발 예산이 별도로 마련된 것이 없어 국가융합기술 발전 기본계획과 국가연구개발 다부처 공동기획사업 추진 방안, 그리고 기타 관련 연구개발사업을 통해 간접적으로 추론하고자 한다.
○「국가융합기술 발전 기본계획」은 ‘융합기술’의 종합적·체계적 육성을 위해 국가과학기술위원회(운영위) 심의․의결(’08.11.18)로 5개년(’09~’13) 계획이 수립됨.
-2011년도 시행계획은 NBIC 국가융합기술지도(‘10.9, 국과위)와 2011년 제정된 산업융합촉진법(’11.4, 국회)을 통해 법적·제도적 기반이 마련됨 [NBIC : Nano(나노), Bio(생명), Info(정보), Cogno(인지) 분야의 융합, 그림 18]

그림 18. 바이오-의료분야의 원천융합기술지도(5개 우선추진과제별 28개 원천융합기술, 출처:NBIC 국가융합기술지도., 교육과학기술부)
-미래주도형 기초․원천융합기술 조기 확보를 위한 창의적․도전적 아이디어 발굴에 주로 투자하고, 창조적 융합기술 전문인력 양성과 아울러 로봇․콘텐츠․농생명공학기술 등 신산업 창출을 위한 전략분야 선도산업에도 투자할 계획(표56).
-그리고 과학기술과 인문사회․문화 등 학제 간 연구를 비롯해 국내․외 융합연구 프로그램 참여를 활성화하고, 융합정책연구센터 및 산업융합지원센터를 지정․운영하는 등 범부처 연계․협력체계를 구축함으로써 동 분야 정책지원과 산업발전 촉진을 위한 지원도 강화할 예정.
표56. 융합기술 발전 목표 및 추진전략(출처: 국가융합기술발전시행계획안)
|
목표 |
주요 추진전략 |
|
원천융합기술의 조기확보 |
-기초원천 융합기술의 개발 강화 -연구자의 창의적 아이디어 발굴 지원 및 기획 강화 -국제표준화 선도 및 지식재산권 관리 강화 |
|
창조적 융합기술 전문인력 양성 |
-융합기술 관련 교육 및 연구개발 프로그램 추진확대 -수요지향적 융합기술 인력양성 -융합기술 관련 전문인력에 대한 중장기 수요 조사․예측 강화 |
|
융합 신산업 발굴·지원 강화 |
-융합 신산업 창출을 위한 전략분야 발굴 및 선도사업 추진 -융합 신산업 인터클러스터 육성 및 국제과학비즈니스 벨트 활용 |
|
융합기술 기반 산업 고도화 |
-기존 산업의 고도화를 위한 융합 신기술 개발 -글로벌 경쟁력 제고와 양질의 일자리 창출효과가 큰 융합 서비스 산업 발굴 및 육성 |
|
개방형 공동연구 강화 |
-인문사회, 문화, 예술 등과의 융합연구 지원 강화 -융합기술 분야의 전문가 네트워킹 및 커뮤니티 활성화 -국내외 융합연구프로그램 참여 활성화 |
|
범부처 연계·협력체계 구축 |
-범부처적 융합기술 종합발전 추진체계 확립 -융합원천기술 육성과 신산업 창출을 뒷받침하는 관련법․제도․인프라 지원 -융합기술 연구성과의 실용화/산업화 지원 강화 |
-2010년도 용합기술분야 예산은 1조 5,674억원으로 ’09년 대비 202억원(1.3%) 증가(2011년도 시행계획에 따르면 정부는 올해 융합기술 분야에 ’10년도 대비 15.3% 증가한 총 1조 8,180억 원).
-부처별로 교육과학기술부가 전체의 29.1%(4,557억원), 지식경제부가 전체의 37.4%(5,865억원), 국토해양부가 전체의 10.4%(1,625억원)을 점유하는 등 3개 부처가 전체 투자계획의 76.9% 차지(그림 19).
-융합신산업 발굴·지원에 4,688억원(29.9%), 원천융합 기술 확보에 4,307억원(27.5%), 융합기술 기반 산업 고도화에 3,767억원(24%), 창조적 전문인력 양성에 2,625억원(16.7%)을 투자(표57).

그림 19. 부처별 투자 계획(10년) 및 투자 전략별 투자 분포 (출처: 2010년도 국가융합기술발전시행계획안)
표57. 2010년 주요 융합과학기술 추진계획(출처: 2010년도 국가융합기술발전시행계획안)
|
분야 |
예산(계획) |
주요 추진내용 |
|
원천융합기술의 조기확보 |
4,307억원 |
미래 주도형 기초․원천융합 기술 강화 및 창의적․도전적 아이디어 발굴 |
|
창조적 융합기술 전문인력 양성 |
2,625억원 |
융합 전문인력 양성 프로그램 확대 및 수요지향적 융합기술 인력양성 등 |
|
융합 신산업 발굴·지원 강화 |
4,688억원 |
신산업을 창출하는 전략 분야 발굴 및 선도사업 추진 등 |
|
융합기술 기반 산업 고도화 |
3,767억원 |
융합기술 기반 기존 주력/전통 산업의 고도화 및 지식 서비스산업 발굴․육성 |
|
개방형 공동연구 강화 |
288억원 |
과학기술과 인문사회․문화 등 학제간 연구 및 국내․외 융합연구 프로그램 참여 활성화 |
|
범부처 연계·협력체계 구축 |
- |
부처간 연계․협력․조정 강화 및 융합기술 육성정책의 상시지원추진 등 |
-표58의 융합과학기술 부처별 성과는 본 보고서에서 다루는 생명정보학 분야와 범위와 내용에서 상당한 차이가 있어 참고 자료로 활용하는 것이 바람직함.
표58. 융합과학기술 부처별 성과(출처: 2010년도 국가융합기술발전 시행계획안)

○ 과학기술 전반의 융복합화에 체계적으로 대응하고 국가 R&D 투자효율성 극대화를 위해, 부처 간 R&D 연계 강화를 목표로 ‘11년부터 본격적 착수를 추진 중인「국가연구개발 다부처 공동기획사업」의 기본 추진방안이 수립.
-정부 부처별로 추진되었던 연구 사업이 대상 기술이나 연구방법, 연구대상 자원, 연구인력 등이 융복합화 되면서 다부처 공동으로 추진해야할 연구 사업이 늘어남에 따라 국가연구개발 다부처 공동기획사업 추진 방안(안)이 마련(표59).
-국가적 차원의 공동대응이 시급한 분야와 신기술 융복합미래 신산업 창출분야FFM 우선적으로 적용 사업대상으로 선정
-2010년 .9월부터 추진 중인 6개 시범사업은 현재 선행기획연구 중이며, 일부 사업은 필요시 ’11년 상반기 예비타당성 조사 실시
-6대 시범사업은 4세대 IT 혁신프로그램 첨단융복합, 자립형 센서기반 지능형 환경관리시스템 개발, 대형 화산활동예측·대응, 범부처-health 산업화 촉진, 미래융합 산업창출을 위한 지능형 로봇, 그리고 공공연구기관 R&D 성과확산 및 사업화촉진위한 부처간 협력모델 개발임.
표59. 다부처 공동기획 시범 사업 추진 현황(출처: 국가연구개발 다부처 공동기획사업 추진 방안(안)., 2010년 10월., 국가과학기술위원회)

○ 국가 연구개발사업 지원 다양화
-5개 부처 공동으로 바이오정보기술(BIT)산업의 핵심인 유전체(게놈) 정보와 콘텐츠를 산업기술로 응용해 사업화를 촉진하는 민관합동기구를 설립하기 위해 정부와 대학, 기업이 매칭(일대일)해 출자하는 가칭 유전체정보콘텐츠센터(Genome Information Computation Center ,GICC)를 설립키로 협의가 진행 중이며, 예산은 2020년까지 3단계(인프라-기술개발-사업모델개발) 사업기간 중 총사업비는 2,800억원(민관 50%매칭)이 필요한 것으로 예측(출처: 아시아경제, 2011/04).
-제주특별자치도는 한국의 포항공대, KOBIC(국가생명연구자원정보센터), 중국 SCBIT(상하이생물정보연구소), 일본 NIG(일본국립유전학연구소)등 3국의 i-Biology 연구소를 제주에 유치 계획 발표했는데 2011년부터 2015년까지 총사업비 771억원이 투자되는 사업으로 연구소 부지면적은 1만6500㎡~3만3000㎡(5000평~1만평)의 규모로 조성될 예정(출처: 동아일보. 2011/02).
-지식경제부는 산업융합원천기술개발사업으로 차세대 생명정보를 활용한 유전체 연구 및 상용화 사업에 2011년 6월 1일부터 오는 2016년 5월 31일까지 5년에 걸쳐 총 208억원 규모의 연구비(정부출연금 147억 5천만원)가 지원되며 항체 특성분석 기반기술 및 분자재설계를 통한 항체 바이오베터 의약품 개발사업도 추진.
-대구시와 (재)대구테크노파크는 대구지역 연구개발 활성화 및 연구개발 역량강화를 위하여 융합기술 기초R&D과제로 ‘항정신성 약물개발을 위한 전임상 동물반응 모니터링 시스템 개발’ 등을 포함 20개 과제를 선정(출처: 뉴스 와이어. 2011/08).
(6) 기업 및 시장동향
○ 삼성SDS, KT, 이노그리드, 클루닉스 같은 IT 기반 클라우드 컴퓨팅 서비스 회사들이 본격적으로 생명정보시장에 본격적으로 진출.
-대표적인 클라우드 컴퓨팅 분야 거대 기업인 이노그리드는 IT기술과 바이오기술(BT)이 융합된 프로테오믹스(단백질분석기술)에 클라우드 인프라를 사용하기 위해 바이오기술 전문기업인 이노테라피, 프로바이온과 업무 제휴를 추진.
-KT는 게놈연구재단과 테라젠이텍스가 진행하는 한국인 개인 게놈 프로젝트(KPGP : Korean Personal Genome Project)에 클라우드 컴퓨팅서비스를 제공하기로 협약(KT 헬스인포메틱스 사업 2011년 3월 주총에서 승인).
○ KT, 삼성SDS, LG 전자등 대기업이 맞춤의학 분야 및 게놈 연구 시장에 투자(출처: 2011/05, 서울경제)
-삼성 SDS는 삼성의료원, 라이프테크놀로지 등과 ‘인간 유전체 시퀀싱 및 유전자 기반의 진단/치료 글로벌 서비스 사업’을 위해 협력 체결로 바이오인포메틱스 기술 개발을 통해 예방의학 및 맞춤진료의 시대를 준비.
-삼성은 2011년 2월에 전략적인 해외 투자자로 세계 Top 바이오제약 서비스업체인 Quintiles사(퀸타일즈)와 자본금 3000억원 규모의 합작사를 설립하기로 결정.
○ 세계최고 수준의 생명정보 분석도구나 알고리즘 개발보다는 공개소스나 이를 변형시켜 자체 분석 플랫포움 구축하여 국외의 주요 기업에서 개발한 분석도구를 기반으로 고객의 니드에 맞춘 시스템을 구축하는 서비스나 맞춤형 데이터 분석서비스를 제공.
-인실리코젠(http://www.insilicogen.com/)은 SI업체의 성격을 띄고 있는데 세계적인 NGS 데이터 분석 플랫포움을 가진 CLC bio, BIOBASE, Agilent Technologies, 그리고 Invitrogen등 국외의 주요 분석 도구를 국내에 시판하거나 자체에서 개발한 솔루션을 추가해서 서비스와 교육을 추진하고 있음.
-이즈텍(http://www.istech21.com)은 기업내에서 자체적으로 개발한 Chip이나 SNP 분석 소프트웨어 개발, 업체나 공공기관에 생명정보 시스템을 구축 서비스 그리고 고객의 데이터 분석 서비스 등을 중심으로 추진하고 있음.
-테라젠이텍스(http://www.thera-gen.com/)는 의학분야와 기기분야로 나뉘어져 있으며, 기기분야에 바이오연구소가 맞춤의학을 비롯한 유전체 지놈분석, 분석도구개발 및 데이터 분석 서비스가 주종을 이루며 최근에 지식경제부 지원사업인 '차세대 생명정보를 활용한 유전체 연구 및 상용화 사업'에 최종 선정됨.
-신테카바이오(http://www.syntekabio.com/)는 워크플로우(workflow) 기반의 NGS 데이터 분석 서비스와 분석도구 개발이 중심이며, Bio anayltics service와 High-computing 기반의 System biology service를 제공하고 있음.
○ 생명정보 기술을 활용한 바이오마커 혹은 신약개발 후보물질 발굴과 같은 활용적인 측면이 구체화되고 있음.
-엔솔테크(http://www.ensoltek.co.kr/)는 축적된 기술을 기반으로 구축한 인실리코 (in silico) 기술을 실제 신약 후보물질 발굴이나 개발에 적용시키고 있는 대표적인 기업이면서 데이터 속성에 따른 차이를 분석해 데이터 맞춤형 분석 도구 개발을 추진하고 있음.
-지노믹트리(http://www.genomictree.com)는 생명정보 기술을 활용한 분자진단 전문업체로 바이오마커, 마이크로어레이 및 바이러스분자 진단시스템을 개발하고 있으며, 다양한 마이크로어레이 데이터 분석 서비스를 제공하고 있음.
라. 전망 및 제언
생명정보학이 현대 생물학에 핵심 역할을 하고 있다는 것은 명백한 사실이다. 단적으로 생명현상을 연구하는데 컴퓨터의 도움 없이 데이터관리, 분석은 거의 불가능하다. 이런 면에서 컴퓨터는 보조 두뇌의 역할을 하고 있으며, 더 나아가 복잡한 분자와 그들의 상호 작용을 다룰 수 있도록 해 준다. 특히, 유전자 발현 배열 기술의 경우 컴퓨터의 도움 없이는 많은 실험이 불가능하다. 묘사적인 생물학으로부터 정량적이며 예상 가능한 생물학으로의 변천은 새롭고 막대한 양의 데이터를 발생, 저장, 공유 및 이용을 필요로 한다. 더 나아가 이런 기본적인 요구를 더욱 적극적으로 수용하고 새로운 발전을 모색기위해 포스터-제노믹스(post-genomics) 연구 분야 확대, 데이터의 통합방법, 표준화 연구, 고성능 컴퓨팅에 대한 연구 등이 활발히 진행되고 있다.
급속하게 변화하는 생명정보 분야에 새로운 방향을 가지고 선택과 집중을 통해 연구개발에 매진하기 위해서는 우리의 현황을 분석하고 발전방안을 제시하는 것이 중요하다. 이른 측면에서 몇 가지 보고서에 언급된 내용을 소개하고 자 한다.
먼저 2010년도 기술수준평가 결과(안)에 따라 분야별 최고기술 확보 및 추격방안을 표63 과 같이 제시하고 있다. 융합분야는 산학연 협력과 기초원천연구확대를 의료분야는 산학연 협력과 기초원천연구확대 그리고 전문인력양성을 마지막으로 바이오분야는 기초원천연구확대와 전문인력양성에 많은 노력을 기우릴 것을 제안하고 있다.
표63. 분야별 최고기술 확보 및 추격방안(출처: 2010년도 기술수준평가 결과(안). 2가지 방안을 선택하게 하여 전체 합은 200%임)
|
구분 |
융합분야 |
의료분야 |
바이오분야 |
11대 전체평균 |
|
전문인력양성(%) |
31 |
47 |
52 |
50 |
|
기술관련정보인프라제공(%) |
11 |
21 |
29 |
20 |
|
국제협력(%) |
20 |
6 |
11 |
16 |
|
산학연협력(%) |
51 |
43 |
18 |
31 |
|
실용화지원(%) |
20 |
23 |
22 |
29 |
|
기초원천연구확대(%) |
63 |
56 |
63 |
47 |
|
민간투자유치(%) |
3 |
3 |
4 |
7 |
|
기타 |
0 |
0 |
1 |
0 |
○ 보고서, 2010년도 기술수준평가 결과(안)에서 제시하고 있는 생명정보분야(9개) 발전방안을 정리하면 다음과 같음.
-향후 우리나라 기술발전 방안에서 기술발전의 주체로 바이오 분야는 정부주도로 기술개발이 이루어져야 한다는 생각이 77%로 나타났고 세부 중점과학기술로 보면 생체정보 응용, 분석기술은 100% 정부주도 그리고 단백체, 대사체 응용기술은 92%로 나타났음(표64).
표64. 중점과학기술별 기술발전을 위한 투자주체 및 연구주체. 11개 대분야중 바이오 분야(5개), 융합분야(1개) 그리고 의학분야(3개)에서 대표적으로 융합기술의 성격을 띈 것으로 판단되는 중점과학기술을 선택하여 분석함. (출처: 2010년도 기술수준평가 결과. 2가지 방안을 선택하게 하여 전체 합은 200%임)
|
중점과학기술 |
민간주도(%) |
정부주도(%) |
|
산업계(%) |
학계(%) |
연구계(%) |
|
세포기능조절기술 |
41 |
59 |
|
32 |
50 |
18 |
|
생체정보응용·분석기술 |
0 |
100 |
|
0 |
63 |
37 |
|
바이오칩·센서기술 |
36 |
64 |
|
74 |
9 |
17 |
|
유전체응용기술 |
34 |
66 |
|
44 |
24 |
31 |
|
단백체·대사체응용기술 |
8 |
92 |
|
32 |
38 |
31 |
|
나노기반융합소재 |
0 |
100 |
|
0 |
11 |
89 |
|
유전자치료기술 |
44 |
56 |
|
22 |
45 |
34 |
|
신약개발기술 |
49 |
51 |
|
52 |
19 |
29 |
|
암질환진단 및 치료기술 |
23 |
77 |
|
37 |
48 |
15 |
-생체정보응용·분석기술은 학계에서 연구주체가 되어야 한다는 의견이 63%로 바이오 평균에 2배정도 높았고, 바이오칩·센서기술(U-Health)은 산업계가 연구주체가 되어야 한다는 의견이 바이오 평균에 비해 2배 이상 높게 나타났음(표64).
표65. 중점과학기술별 최고기술 확보 및 추격 방안(출처: 2010년도 기술수준평가 결과(안). 11개 대분야중 바이오 분야(5개), 융합분야(1개) 그리고 의학분야(3개)에서 대표적으로 융합기술의 성격을 띈 것으로 판단되는 중점과학기술을 선택하여 분석함)
|
중점과학기술 |
전문인력양성(%) |
정보인프라제공(%) |
국제협력(%) |
산학연협력(%) |
실용화지원(%) |
기초원천연구확대(%) |
민간투자유치(%) |
기타(%) |
|
세포기능조절기술 |
70 |
17 |
4 |
20 |
28 |
58 |
3 |
0 |
|
생체정보응용·분석기술 |
69 |
0 |
37 |
0 |
0 |
89 |
5 |
0 |
|
바이오칩·센서기술 |
61 |
16 |
18 |
6 |
43 |
56 |
0 |
0 |
|
유전체응용기술 |
27 |
53 |
0 |
7 |
37 |
76 |
0 |
0 |
|
단백체·대사체응용기술 |
25 |
25 |
8 |
26 |
15 |
92 |
10 |
0 |
|
나노기반융합소재 |
33 |
22 |
22 |
44 |
11 |
67 |
0 |
0 |
|
유전자치료기술 |
61 |
4 |
2 |
28 |
26 |
76 |
2 |
0 |
|
신약개발기술 |
21 |
28 |
8 |
76 |
0 |
65 |
3 |
0 |
|
암질환진단 및 치료기술 |
43 |
27 |
0 |
36 |
30 |
64 |
0 |
0 |
-중점과학기술분야별로 보면 세포기능조절기술과 생체정보응용·분석기술은 전문인력양성(각각 70%, 69%)과 기초원천연구확대(각각 58%, 89%)가 필요한 것으로 나타났고, 바이오칩·센서기술(U-Health)은 두 분야 외에 실용화 지원(43%)도 중요한 것으로 나타남(표65).
-유전체응용기술유전체 응용기술은 기술정보인프라제공(53%)과 기초원천연구확대(92%)가 필요성이 높게 나왔으며, 단백체·대사체 응용기술은 기초원천 연구확대(92%)가 가장 필요한 것으로 나타났음.
-전문인력양성은 세포기능조절기술과 생체정보응용기술 그리고 바이오칩 센서기술분야가 평균이상 높게 나타났고, 기술정보인프라제공에는 유전체응용기술이 분야가 평균의 2배로 상대적으로 중요한 것으로 나타났음.
-국제협력을 통한 기술확보에 주력해야 분야는 생체정보응용분석기술이 37%로 평균 11%에 비해 높게 나타났고, 단백질체 대사체응용기술은 산학연 협력이 26%로 가장 높게 나타났음.
-실용화 지원은 바이오칩·센서기술(U-Health) 분야가 43%로 가장 높게 나타났고, 기초원천연구확대는 전분야별로 50% 이상으로 나타났으며, 단백체·대사체응용기술(92%), 생체정보응용·분석기술 (89%)로 상대적으로 높게 나타났음.
-전반적으로 융합기술의 성격을 띈 대부분의 중점과학기술 분야는 현재는 산업화보다는 기초원천연구에 집중이 필요하고 전반적으로 민간투자유치 10% 이하로 큰 의미를 두지 않고 있음.
다음은 산업육성전략 (출처: 전자통신동향분석 21권 2호) 보고서에 언급된 IT-BT-NT 기술 융합 발전을 위해 제시된 내용이다. IT-BT-NT 기술 융합에 따른 산업육성전략(출처: 전자통신동향분석 21권 2호) 보고서는 융합기술의 산업화 육성 전략을 10가지를 제시하고 있는데, 1. 연구개발 예산의 확대와 자금지원, 2. 종합적인 IT-BT-NT 융합기술 개발 전략의 수립, 3. 관련 부처간, 정부/민간간 역할분담과 조정, 4. 법/제도 정비 및 역기능 방지, 5. 표준화 및 인력양성, 6. 상용화 촉진 및 수익성 있는 비즈니스 모델 발굴, 7. 장기적 투자와 연구의 지속성 확보, 8. 학제간 융합연구, 9. 융합 관련 벤처기업의 지원, 10. 융합기술 클러스터의 조성 및 정비 등이다.
마지막으로 좀 더 구체적으로 앞에서 언급한 보고서 (생명중심의 미래과학기술 발전전략, 안두현) 중에 중개연구의 결론 및 정책적 시사점에서 부분적이지만 5가지를 융합연구의 큰 방향을 제시하고 있다. 첫 번째가 한국의 상황에 맞는 연구 범위를 설정하는 것이다. 선진국에 비해 국내의 열악한 연구네트워크나 인프라, 기술수준 등을 고려할 때 비교적 빠른 시간내에 성과를 도출하기 위해서는 연구 방향성을 가지고 효율성을 근거로 집중과 선택을 해야 한다. 두 번째는 연구지원 대상을 철저하게 개인연구지원이 아닌 컨소시움 형태의 집단이나 그룹에 지원하는 방식으로 전환하여 중개 연구가 가진 정체성에 부합되도록 지원해야 한다. 세번째로 중개의 연구의 핵심 연구 인프라인 구축을 제시하고 있다. 네번째로 협력연구 활성화를 위한 성과 배분체계의 연구가 필요하고, 마지막으로 연구중심 병원으로 체질 개선을 제시하고 있다.
다섯 가지중에 가장 눈여겨 보아야 할 항목은 연구성과의 배분 문제로 융합이라는 키워드가 의미하는 것처럼 여러 개인 혹은 단체간의 협력이 융합연구의 필수조건이다. 현실적으로 협력의 전제는 성과를 어떻게 배분할 것인가에 대한 체계가 시스템적으로 확립되지 않고서는 제대로 된 협력을 기대하기란 어려울 것으로 생각된다.
이러한 제언들은 융합이라는 시대조류와 새로운 가치를 만들어내려는 정부의 과학기술정책 그리고 융합기술이 가지고 있는 속성을 잘 반영하고 있다. 거시적인 측면에서 세 가지 제언이 담고 있는 메시지는 현재 우리가 처한 현실과 세계 동향에 대한 면밀한 분석을 근거로 정부 및 관련 단체들 간의 협력을 통해 우리 현실에 맞는 융합 기술분야별 발전전략을 도출하여 추진해야 한다는 것이다.
결론적으로 융합기술은 우리의 의지와는 상관없이 벌써 어느 순간 우리 곁에 다가와 있고, 조만간 새로운 가치 구현을 통해 21세기를 이끌어갈 원동력으로 자리매김할 것이다.
2. BT+ NT
가. 나노바이오기술 개요
나노바이오기술은 분자수준에서 자연계에 존재하는 단백질, DNA, 세포 등 생물학적 요소들을 연구하는 바이오분야와 나노 스케일에서 개체 및 구조체를 다루는 기술인 나노분야가 융합된 신개념의 기술이다. DNA, 단백질 같은 생체물질들은 단일 분자가 나노 크기이기 때문에 분자생물학 및 의학 분야에서 나노기술을 응용한 다양한 연구들이 진행 중이다. 특히, 나노미터의 크기를 갖는 소재들은 독특한 물리적인 성질을 가지고 있어서 이를 바탕으로 새로운 특성의 소재나 장비를 개발할 수 있다. 이러한 나노융합 기술의 발전이 가속화됨에 따라서, 기존의 기술적 한계를 극복하고 규명하기 힘들었던 생물학적인 현상을 좀 더 효율적이고 쉽게 연구할 수 있게 되었다. 또한, 이러한 기초적인 연구뿐만이 아니라, 질병의 진단, 이미징화, 치료가 가능한 새로운 나노 시스템의 개발은 전 세계적인 이슈이다.
나노바이오기술로는 대표적으로 나노바이오칩/센서 기술과 나노메디슨 기술 등이 있다. 나노바이오칩/센서기술은 소량의 시료를 이용하여 생체 분자들을 효율적으로 결합시키고, 그들 간의 상호작용을 관찰할 수 있어서 경제적이며 고감도를 가질 수 있는 큰 장점이 있다. 최근 나노 크기의 제작기술이 획기적으로 향상되어 반도체 산업 및 다양한 산업 분야에 이용되고 있다. 이러한 연구 결과를 바탕으로 나노기술을 이용하여 바이오칩 혹은 바이오센서의 성능을 향상시키고자 많은 연구들이 진행 중이다. 나노메디슨 기술은 나노미터 크기의 나노입자, 나노포어, 나노스피어 등의 나노생체소재를 이용하여 분자 이미징이나 약물전달을 하는 것이다. 나노생체소재들은 주로 생체적합성 소재를 이용하여 제조하며, 세포내로의 도입이 용이하고, 혈관을 통해 쉽게 이동할 수 있다. 특히, 200나노미터 크기 이하의 나노소재의 경우는 암세포가 있는 부분에 특이적으로 전달이 가능하여 암세포 선택적으로 치료 약물을 전달하거나 이미징할 수 있는 좋은 소재라고 할 수 있다. 이러한 나노바이오기술은 생체분자의 상호작용 연구나 질병의 원인 규명 연구와 같은 기초 바이오연구 분야 뿐만 아니라 메디컬분야 등 다양한 분야에 이용될 수 있다.
나. 국내외 연구 동향
(1) 나노 바이오칩
 바이오칩은 DNA칩, 단백질칩, 저분자칩, 세포칩 등으로 구분되며 수십 ~ 수만 개의 프로브(Probe)들을 작은 기판 위에 고정시켜 동시에 많은 정보들을 분석 할 수 있는 기술이다. 반면 나노바이오칩(nanobiochip) 은 다양한 나노입자(금나노입자(gold nanoparticles), 은나노입자(silver nanoparticles), 양자점(quantum dot), 카본나노튜브(carbon nanotube, CNT) 플러렌(fullerene), 그래파이트(Graphite))를 이용하여 기존 바이오칩의 성능을 향상시키거나 atomic force microscopy(AFM), 이빔리소그래피(E-beam lithography)와 같은 최첨단 나노기술을 이용하여 극한의 민감도를 가진 바이오칩 제작 및 기존 마이크로칩에서 불가능했던 새로운 형태의 바이오칩 개발을 가능케 하는 기술을 말한다.
바이오칩은 DNA칩, 단백질칩, 저분자칩, 세포칩 등으로 구분되며 수십 ~ 수만 개의 프로브(Probe)들을 작은 기판 위에 고정시켜 동시에 많은 정보들을 분석 할 수 있는 기술이다. 반면 나노바이오칩(nanobiochip) 은 다양한 나노입자(금나노입자(gold nanoparticles), 은나노입자(silver nanoparticles), 양자점(quantum dot), 카본나노튜브(carbon nanotube, CNT) 플러렌(fullerene), 그래파이트(Graphite))를 이용하여 기존 바이오칩의 성능을 향상시키거나 atomic force microscopy(AFM), 이빔리소그래피(E-beam lithography)와 같은 최첨단 나노기술을 이용하여 극한의 민감도를 가진 바이오칩 제작 및 기존 마이크로칩에서 불가능했던 새로운 형태의 바이오칩 개발을 가능케 하는 기술을 말한다.

그림 1. AFM 및 dip-pen nanolihography를 이용한 나노 어레이
[출처 : Science 325, 1110 (2009), Science 295, 1702 (2002)]
나노바이오칩의 가장 대표적인 모델로는 딥펜 나노리소그래피 (dip-pen nanolithography)를 이용한 나노어레이(nanoarray)가 있다. 생체 물질을 고 배율로 관측하기 위해 개발된 AFM을 이용한 기술로써 AFM에 사용되는 팁과 시료 표면 사이에 생기는 작은 모세관 현상을 이용하여 기판 위에 특정 물질을 나노 스케일로 자가조립(self-assembly) 시키고 DNA 혹은 단백질과 같은 프로브를 단분자 수준까지 고정화시킬 수 있는 기술이다. 이는 기존의 마이크로 어레이를 이용한 칩기술과 비교했을 때 매우 소량의 프로브를 고정시킬 수 있기 때문에 단분자 수준의 상호작용을 분석할 수 있어 매우 획기적인 기술이라 할 수 있다. 또한 기존의 나노패턴닝(nano-patterning)을 위한 포토리소그래피(photolithography), E-beam lithography와 같은 복잡하고 고비용의 공정을 거치지 않고 원하는 곳에 선택적으로 프로브를 고정할 수 있는 장점을 가지고 있다.
최근 한국생명공학연구원은 양전하를 가진 금나노 입자를 이용하여 타겟 DNA를 grayscale로 분석한 연구를 진행하였다. 전하가 없는 PNA를 프로브로 고정시키고 타겟 DNA가 혼성화 되었을때 DNA에 존재하는 음전하에 의해 금나노입자가 결합된다. 그리고 결합된 금나노입자는 간단한 금속환원과정을 통해 입자가 커지고 궁극적으로 눈으로 바로 확인 할 수 있을 정도의 크기가 형성된다. 이 밖에도 MALDI-TOF를 이용한 단백질 연구, protein-domain microarray, rolling circle amplification (RCA), protein in situ array(PISA)등 다양한 바이오칩 기술들이 나노기술을 이용하여 성능을 향상시키는 연구가 진행되고 있다.

그림2. 금 나노입자를 이용한 그래이스케일 DNA칩 분석
[출처 : Chemical Communication 46, 3315 (2010)]
(2) 나노 바이오센서
 그림3. 바이오센서 모식도
그림3. 바이오센서 모식도
[출처 : NPG Asia Mater 3, 17 (2011)]
바이오센서(biosensor)는 물리화학적 검출기를 이용하여 DNA, 단백질pProtein), 바이러스(virus)와 같은 생체물질을 쉽고 빠르게 검출하고 이를 분석 및 진단할 수 있는 기술로 생체 물질을 결합시킬 수 있는 바이오리셉터(bioreceptor), 변환기(transducer), 검출 및 분석기 (detector)등으로 크게 세 가지의 구성요소를 필요로 한다.
 바이오센서는 극고감도(ultra sensitivity), 선택성, 신속한 검출 및 저비용 센서제작이 중요한 요인으로써 보다 효율적으로 개선시키기 위해 다양한 나노기술이 접목되고 있으며 나노크기를 가진 단일분자들을 label-free 방식으로 검출할 수 있는 획기적인 센서개발을 위하여 다양한 나노구조체 제작기술이 요구된다. 최근에는 형광물질과 양자점을 이용하여 높은 민감도와 선택성을 가진 바이오센서 기술들이 많이 개발되고 있지만 궁극적으로 고가의 형광분석 장비를 이용해야 하는 한계가 있기 때문에 최근에는 field effect transistor(FET) 센서와 다양한 나노구조체를 이용한 전기적 검출이 가능한 바이오센서 제작에 많은 관심이 모아지고 있다 (그림 4). 바이오리셉터로써 효소(enzyme), 항체(antibody), PNA, DNA, 세포(cell) 등으로 결합된 FET센서는 나노바이오센서의 대표적 모델로써 다양한 타겟 물질과 결합되었을 때 형성되는 전기적 신호를 검출할 수 있다. 글루코스 FET센서의 경우 농도별 실시간으로 전기적 검출을 할 수 있고 신경 세포로부터 유발되는 action potentials 와
바이오센서는 극고감도(ultra sensitivity), 선택성, 신속한 검출 및 저비용 센서제작이 중요한 요인으로써 보다 효율적으로 개선시키기 위해 다양한 나노기술이 접목되고 있으며 나노크기를 가진 단일분자들을 label-free 방식으로 검출할 수 있는 획기적인 센서개발을 위하여 다양한 나노구조체 제작기술이 요구된다. 최근에는 형광물질과 양자점을 이용하여 높은 민감도와 선택성을 가진 바이오센서 기술들이 많이 개발되고 있지만 궁극적으로 고가의 형광분석 장비를 이용해야 하는 한계가 있기 때문에 최근에는 field effect transistor(FET) 센서와 다양한 나노구조체를 이용한 전기적 검출이 가능한 바이오센서 제작에 많은 관심이 모아지고 있다 (그림 4). 바이오리셉터로써 효소(enzyme), 항체(antibody), PNA, DNA, 세포(cell) 등으로 결합된 FET센서는 나노바이오센서의 대표적 모델로써 다양한 타겟 물질과 결합되었을 때 형성되는 전기적 신호를 검출할 수 있다. 글루코스 FET센서의 경우 농도별 실시간으로 전기적 검출을 할 수 있고 신경 세포로부터 유발되는 action potentials 와
그림 4. 실리콘 나노와이어를 이용한 FET센서 모식도
[출처 : Nano Today 6, 131 (2011)]
같은 생화학 물질들을 살아있는 세포로부터 cellular response를 실시간으로 검출할 수 있는 세포를 기반으로 하는 FET센서도 개발되었다. 가장 많이 연구되고 있는 FET센서로는 항체를 기반으로 하는 FET(immunologically functionalized FETs) 센서로써 다양한 질병 마커 단백질들을 검출할 수 있다. 뿐만 아니라 나노 와이어에 PNA를 고정시켜 target DNA를 검출할 수도 있고 더 나아가 저분자물질까지 검출할 수 있는 FET센서 시스템이 개발되고 있다. 최근에는 카본을 기반으로 하는 반도체물질들이 FET센서로 이용되고 있으며 가장 대표적으로 single wall carbon nanotube(SW-CNT)를 이용한 FET센서가 많은 관심을 모으고 있다.
나노구조체를 이용한 나노바이오센서는 나노갭(nanogap), 나노채널(nanochannel), 나노포어(nanopore)등 세 가지 타입으로 나눌 수 있다. 나노갭센서는 두 개의 전극 사이가 약 100 nm 이하의 구조를 가지는

그림 5. PSA 검출을 위한 나노갭 바이오센서
[출처 : Chemical Communication 20, 455502 (2009)]
센서를 말하며 최근 DNA 혹은 단백질 등을 label-free로 전기적으로 검출할 수 있는 획기적인 연구가 되고 있다. DNA와 단백질의 경우 전자 전도성이 미미하기 때문에 기존의 마이크로 단위의 센서에서는 생체물질을 label-free로 전기적으로 검출하는 것은 불가능한 일이지만 나노구조체를 이용한 센서는 마이크로 단위에서 검출할 수 없었던 매우 약한 전기적 신호도 검출이 가능하기 때문에 획기적인 바이오센서라고 할 수 있다. 그림 5는 prostate-specific antigen(PSA)을 검출하기 위해 약 10 nm의 나노갭 전극의 제작 과정을 보여주고 있다. 특히, 기존의 나노갭과 나노구조를 제작하기 위해서는 고비용의 e-beam lithography 과정을 통해 만들지만 대량생산시스템이 가능한 반도체 공정을 이용한 나노갭 구조체를 성공적으로 제작한 연구결과를 보여주고 있다. 나노채널을 이용한 바이오센서는 DNA 혹은 단백질을 실시간으로 측정할 수 있으며 최근에는 제 3세대 DNA 서열분석 기술개발을 위해 나노채널을 이용한 연구들이 진행되고 있다. 그림 3은 두 개의 전극 사이가 약18 nm 이하인 나노채널에서 DNA가 지나갈 때 변하는 전기적 신호를 보여주고 있다. 나노채널의 가장 큰 장점은 높은 민감도뿐만 아니라 DNA stretching기술이다. 길이가 긴 DNA는 다양한 구조로 존재하기 때문에 나노크기의 구조물에 인위적으로 유도하기가 쉽지 않다. 하지만 나노채널을 통해서 보다 쉽게 스트레칭이 되기 때문에 보다 정확한 정보를 얻을 수 있다.


그림 6. 나노채널과 나노 포어를 이용한 DNA 검출
[출처 : Nano Lett 8, 1472 (2008), Nano Lett 6, 779 (2006)]
3세대 DNA 서열분석기술로써 나노채널은 매우 효과적이지만 아직까지 나노채널을 통과하는 DNA 속도를 조절하기 쉽지 않기 때문에 이를 해결하기 위한 연구들이 많이 진행되고 있다. 특히, 나노 포어를 이용한 기술들이 제 3세대 DNA 서열분석기술 개발에 유력한 후보 연구 분야로써 가장 많은 연구가 진행되고 있다. 나노 포어는 α-hemolysin과 같은 자연에 존재하는 단백질막(membrane)으로 만든 나노포어와 실리콘 웨이퍼를 기반으로 해서 제작되는 나노포어 등으로 나눌 수 있으며 최근에는 실리콘공정기술이 많이 발달하면서 실리콘 웨이퍼로 만든 나노포어를 이용한 연구가 활발히 진행되고 있다. 측정시스템으로 일반적으로 ionic current를 실시간으로 측정함으로써 DNA나 단백질, 바이러스들을 검출하지만 최근 나노공정기술이 계속적으로 발전해감에 따라 나노포어에 직접 연결된 전극을 제작함으로써 tunneling current를 측정함으로써 보다 정확한 정보를 얻을 수 있다. 최근 생명공학분야에서는 PCR을 이용한 DNA 서열분석시스템에서 보다 저비용으로 많은 양의 정보를 얻을 수 있는 3세대 DNA 서열분석기술로써 나노구조체를 이용한 바이오센서가 많은 기대를 모으고 있다.
(3) 나노메디슨
나노메디슨은 개발된 나노기술들 (생체소재, 나노소재, 나노디바이스 등)을 이용하여 질병의 진단 및 모니터링, 치료를 하는 것으로, 기존 의료기술의 한계를 나노기술을 통해서 극복함과 동시에 신개념의 치료 및 분석 기술을 개발하는 것이다. 즉, 나노미터 크기의 소재들을 이용하여 약물이나 이미징용 조영제를 전달하여 기존에 찾아내지 못했던 질병들을 조기진단하고, 효율적인 치료 방법을 제공하고, 더 나아가서 치료 후에는 예후를 정확하고 손쉽게 모니터링하는 전반적인 기술이다. 2000년대 초반이후 나노메디슨분야의 시장규모는 기하급수적으로 증가하고 있으며, 이러한 추세는 앞으로도 계속될 전망이다. 나노메디슨의 분야는 크게 약물전달(Drug Delivery), 임상 진단 및 의료용 영상(Diagnostics/Imaging), 재생의료를 위한 나노 소재 분야(Nano-biomaterials), 그리고 나노 소자 (Nano-device) 등으로 나눌 수 있다.
나노약물전달시스템은 나노소재, 나노구조체, 나노입자의 표면이나 내부에 약물을 봉입하거나 부착시켜 원하는 곳으로만 효율적으로 약물이 전달되도록 하는 것이다. 이러한 연구는 약물을 원하는 곳으로만 효율적으로 전달하여, 약물의 부작용을 줄이고, 최소한의 약물로도 원하는 치료효과를 얻어내어 치료의 질적 및 경제적 향상을 가져올 수 있는 연구분야이다. 기존의 화학약물인 항암제들(독소루비신(doxorubicin), 시스플라틴(cisplatin), 탁솔(taxol), 5-fluoro -uracil 등)은 세포에 비특이적으로 도입되어 암세포뿐만 아니라 정상세포에서도 세포사멸을 유도하여 치료 과정 중에 부장용이 심각하였다. 또한, 약물 자체의 독성 때문에 오랫동안 과량의 약물을 투여할 수 없어서 원하는 치료효과를 얻기에 힘들었다. 이러한 기존 약물전달시스템의 문제점을 극복하고자, 이러한 약물들을 나노소재를 이용하여 전달을 할 경우에 세포독성 등의 부작용을 현저히 줄일 수 있다. 그림 7. 의료용 영상과 치료가 동시에 가능한
다기능성 나노입자의 모식도
출처: Adv Drug Deliv Rev, 62, 284 (2010)

나노소재의 큰 장점중의 하나는 암조직에 선택적으로 약물을 전달할 수 있다는 것이다. 암조직에서는 정상조직부위와는 다르게 세포들이 빠르게 성장하고 주변의 혈관들도 혈관벽이 느슨하고 엉성하게 형성된다. 따라서, 정상조직에서는 수백나노크기의 나노입자들이 빠져나가지 못하지만, 암조직 주변의 혈관에서는 이러한 입자들이 혈관 밖으로 빠져나가게 되어서 암조직에만 선택적으로 전달이 될 수 있는데, EPR(enhanced permeability and retention)효과라고 한다. 이러한 효과를 이용하면 나노입자표면이나 나노입자내에 봉입된 약물들을 정상세포가 아닌 암세포들에만 전달할 수 있어서 약물독성에 따른 부작용을 현저히 줄일 수 있다. 특히, 나노소재의 경우 부피당 표면적이 넓기 때문에 표면에 약물뿐만 아니라 다양한 생체소재들을 부착할 수 있다는 큰 장점을 가진다. 최근에는 크기에 의한 수동적인 나노약물전달체의 전달뿐만이 아니라 나노소재에 다양한 리간드들(펩타이드, 단백질, 앱타머, 고분자 등)을 수식하여, 이러한 리간드들이 원하는 세포들에만 부착하여 세포내로 도입됨으로써 선택적으로 약물을 전달하려는 연구들이 활발히 진행되고 있다. 또한, 자기공명영상이 가능한 산화철나노입자를 사용하거나 가돌리늄과 같은 조영제를 나노입자 표면에 부착하여 치료와 영상이 동시에 가능한 다기능성 나노입자들도 많이 연구되고 있다.
나노바이오 이미징의 경우, 국내에서도 다양한 나노입자 및 이미징 프로브를 이용하여 치료용 세포인 면역세포 및 줄기세포들의 생체내 이미징 및 세포 추적 연구들이 활발히 진행되고 있다. 특히, 근적외선 형광물질이나 자기공명영상이 가능한 나노 프로브를 이용해서 생체내에 주입된 세포의 이동 경로나 분화 등을 실시간으로 이미징 하려는 연구들이 활발하게 이루어지고 있다.

그림 8. perfluorocarbon 나노입자를 이용하여 수지상세포를 자기공명영상기법을 이용하여 마우스 동물모델에서 추적 실험
[출처: Chem Commun (Camb) 45, 6952 (2009)]
최근 한국생명공학연구원은 난치성 질병인 암을 극복하기 위한 새로운 치료법으로 각광을 받고 있는 수지상세포(dendritic cell)의 이미징 연구를 진행하였다. 환자의 혈액에서 추출한 수지상세포를 개조하여 특정한 항원에 선택적으로 인식하도록 조작한 후에 다시 환자의 몸에 주입할 경우 다른 면역세포들이 조작된 특정 항원에 대한 면역반응을 활성화하도록 할 수 있다. 특히 T세포를 활성화시켜서 인체 내에서 자발적으로 암세포를 공격하여 암치료 효과를 얻는 것이다. 세포치료기법을 기반으로 한 항암치료법은 기존의 화학약품들의 문제점이었던 비특이적인 독성 문제가 없고, 특정 항원에만 반응하도록 조작할 수 있어 치료 효과가 클 것으로 기대된다. 그러나 이러한 세포를 인체 내에 주입한 뒤 어떤 경로로 세포가 이동하는 지에 대한 연구가 함께 병행되어야 한다. 본 연구진에서는 자기공명영상 기법을 이용하여 수지상세포를 추적할 수 있는 나노 프로브인 과불화탄소(perfluorocarbon, PFC) 나노입자를 개발하여 수지상세포를 효과적으로 이미징화하는 연구를 진행하였다.
또한, 근적외선 영역에서 형광을 내는 나노 프로브인 양자점 나노입자 (Quantum dot, QD)를 이용하여 수지상세포가 생체내 주입후에 슬하림프절로 이동하는 경로를 실시간으로 이미징하는 연구를 진행하였다 [출처: Faseb J 2008, 22(11),3908-18.]. 수지상세포 등과 같은 치료용 세포들의 이동 경로를 비침습적 이미징 기법에 의해서 실시간 추적할 수 있는 연구는 최근 세포치료제에 대한 관심과 함께 활발히 진행되고 있다. 나노 프로브를 이용하여 임상에서 세포 치료제의 이동 경로 및 치료 과정을 모니터링할 수 있다면 세포치료제를 평가하고 안전하게 적용하는데 활용될 수 있을 것이다.

그림 8. 근적외선 양자점 나노 입자를 이용하여 수지상세포의 이동 경로를 실시간 추적 영상을 관찰
[출처: Faseb J. 2008, 22, 3908 (2008)]
라. 발전 방향
나노와 바이오기술의 융합을 통하여, 기존 기술로는 불가능하게 생각되었던 영역에 눈부신 발전이 이루어지고 있다. 그러나 아직까지 나노바이오기술들이 상용화되기 위해서는 몇 가지 기술적인 한계와 해결해야 할 문제들이 남아있다. 예를 들어 나노 약물 전달이나 나노센서 분야에서는 사용되는 나노소재나 나노디바이스 제조의 재현성이나 대량 생산 가능성이 고려되어야 할 중요한 요소이다. 또한, 다양한 시료 및 병원균 등을 고감도로 검지하고, 개발된 기술들을 폭넓게 활용하기 위해서는 나노소재 및 나노 구조체의 제작비용의 절감도 시급한 실정이다. 마지막으로, 새롭게 개발되고 있는 다기능성 나노생체소재들의 생체 독성, 생물학적·환경적 파급 효과에 대한 철저한 연구들이 선행되어야 개발된 나노바이오 기술들이 실제로 상용화되어 활용될 수 있을 것으로 생각된다.
3. 산업현황
가. 개요
융합산업은 기술, 제품, 서비스 전 분야의 재조합으로 새로운 가치와 시장을 창출하는 활동으로 규정할 수 있다. 이와 같은 융합산업은 가치사슬에 따라 둘 이상의 가치사슬을 융합하여 새로운 가치사슬을 만들어 내는 경우와 성격이 다른 두 개의 가치를 새로운 가치로 창출해내는 경우로 구분되며, 컨버전스형 신사업은 아래 세가지 유형으로 구분된다.(서기만, LG business Insight, 2010. 11)
<그림1> 융합형 신사업 유형

자료 : LGERI, 컨버전스형 신사업, 2010. 11
BT(Bio-Technology)산업을 비롯한 IT(Information Technology)와 NT(Nono Technology)산업은 2000년대 들어 융합이 가속화 되었다. 특히 BT산업은 생명공학기술을 기반으로 생체 기능 및 정보를 활용하여 질병예방, 진단, 치료에 유용한 물질과 서비스를 제공하는 산업으로써 여러 신기술과의 융합을 통해 다양한 융합산업이 창출되었다.
BIT(Bio-information)산업과 BNT(Bio-Nano)산업은 주로 BT 분야의 니즈를 해결하기 위해 IT분야(전자, 전기, 정보 등)와 NT(소재, 정밀기계 등) 분야가 BT산업과 융합된 형태로 나타나 Bioelectronics, BioMEMS, Bioinformatics 등 새로운 기술 및 산업영역을 창출하였으며, 각 융합기술·산업영역은 바이오센서, 바이오칩, U-Health, 영상의료기기 등의 세부 산업을 창출시켰다. 그리고 이러한 세부 융합산업의 등장은 융복합화의 가속을 촉진시켜 기술혁신주기를 단축시키고 있다.
<그림2> BT 기술과 IT, NT 기술 융합 프로세스

본 장에서는 BIT와 BNT 기술의 성과 활용을 통해 주요 산업으로 자리매김하고 있으며, 성장산업인 바이오칩, U-Health, 의료기기 분야를 중심으로 바이오 융합 산업을 조사하여 분석하고자 한다.
나. 해외동향
(1) 바이오칩
바이오칩은 고체기판 위에 생체분자의 고정 후 고정 생체분자의 생물학적 특성을 이용하여 생물체의 정보를 탐색할 수 있는 생명과학적 탐색용 소형도구이다. 현재 바이오칩 산업은 진단분야에서 암, 에이즈와 같은 유전자 돌연변이를 검출하여 진단할 수 있는 제품을 중심으로 개발이 이루어지고 있으며, 크게 Micro Array와 Microfluidics 칩으로 구분한다.
Micro Array는 수천, 수만 개 이상의 DNA, 단백질을 일정 간격으로 붙이고 분석 대상물질을 처리하여 결합양상을 분석하는 칩을 말하며, 분석하는 방법에 따라 DNA칩과 단백질칩으로 구분한다.
DNA칩은 500~5,000개의 염기로 이루어진 cDNA를 유리와 같은 고체에 붙이고 mRNA를 분석하는 형태의 칩과 20~80개 염기로 이루어진 올리고 뉴클레오타이드나 펩타이드 핵산을 염기 하나씩 합성하여 붙이는 방식으로 구분된다. DNA칩 중 하나인 Affy Metrix는 칩 제조기술을 반도체 제조방식을 응용하여 DNA를 합성하는 단계마다 빛을 제어하는 마스크를 제조한다. 이는 고밀도 집적과 높은 정확성이 있으나 합성시간과 비용이 많이 드는 단점이 있다. 또한 Wisconsin대학 Nano Technology Center에서는 Texas Instrument가 개발한 Digital Micromirror Device 기술을 응용하여 DNA칩을 개발하였다. 이와 같은 대표적인 바이오칩 개발기업으로는 Zyomix, Com biMatrix, Packard BioScience, Ciphergen Biosystems 등이 있다.
Microfluidics 칩은 LOC(Lap on a Chip)라고 하며 미량의 분석 대상 물질을 흘려보내 칩에 집적된 생물분자, 센서반응을 통해 분석한다. LOC는 실험 및 분석과정에 활용되며 검사비용을 크게 줄이는 장점이 있으나 실용화까지는 2년 이상의 시간이 걸릴 것으로 예상된다. 대표적인 기업으로는 Aclara BioSciences, Caliper Technologies, Cepheid, Orchid Biocomputers 등이 있다.
세계 바이오칩 시장은 연평균 36.5% 성장으로 2015년 203억 달러의 시장을 형성할 전망이다. 현재 가장 많은 개발을 보이는 DNA칩이 시장의 대부분을 주도하고 있으나 단백질칩과 LOC가 높은 성장률로 2015년 이후 주류 시장으로 성장할 것으로 전망된다.
|
구 분 |
2005 |
2010 |
2015 |
CAGR(%) |
|
DNA칩 |
657 |
2,075 |
6,015 |
25.0 |
|
단백질칩 |
54 |
858 |
6,015 |
60.4 |
|
LOC |
194 |
1,579 |
8,140 |
45.3 |
|
Total |
905 |
4,510 |
20,350 |
36.5 |
자료 : 지식경제부, 바이오칩 산업 및 표준화 동향, 2009
<그림3> 바이오칩 분류별 세계 시장 전망

바이오센서 산업은 시장 진입단계에서 성장단계로 이동하는 추세이다. 가장 높은 성장이 예측되는 제품으로 J&J, Bayer, Roche, Meditronics 등 다국적 기업들이 용도별 세계시장의 80% 이상을 점유하고 있다. 향 후 수십 년간 바이오센서 시장은 90%가 의료용으로 이용될 것으로 전망되는 가운데 식품, 환경, 산업, 군사용으로 확산될 것으로 본다. 환경감지센서의 경우 2001년 19억 달러에서 2011년 43억 달러로 연평균 8.51% 성장할 것으로 전망되어 지속적 성장이 예측된다.
(2) u-Health
u-Health 산업은 IT기술과 의료기술과의 융합을 통해 Home&Mobile Healthcare, Wellness를 중심으로 발전하고 있다. 미국, 유럽, 일본 등의 선진 국가들은 u-Health 산업 활성화에 정책적 지원을 진행하고 있다.
|
국가 |
프로젝트 |
추진동향 |
|
EU |
AAL |
- 고령자에게 IT기기와 서비스를 제공하여 의료, 건강관리, 안전.보안 응급시스템, 사외참여 등 독립적인 생활 지원 - EU 12개국 참여, 2007년부터 7년간 약 3.5억 유로 투입 |
|
영국 |
Telecare |
- 만성질환 및 고령자에게 IT 활용한 건강관리 및 독립적 생활지원 - 혈압측정, 사이렌 등 경고 알람, 응급상황 알림 정보 등 - NHS 전자의료기록소를 통해 의사와 간호사에 연결 |
|
일본 |
u-Japan |
- 2010년까지 보편적 디자인이 가능한 사회구현 - 센서 및 정보가전을 통해 독립적 생활이 가능한 주택 |
|
싱가포르 |
iN2015 |
- 2015년까지 IT기반의 개인 맞춤형 의료제계 전환 - 질병치료 → 예방/건강 증진, 의자신당 → 자가진단 - 공급자중심 → 환자중심 통합서비스(의료정보교류, EHR등) |
자료 : 한국보건산업진흥원, u-Healthcare R&D 기본계획 수립, 2010
현재까지 u-Health 산업이 가장 발달한 국가는 미국으로 의료, 통신, IT 분야 기업을 중심으로 성장하고 있다.
|
기업 명 |
주요 내용 |
|
인텔 |
- 80대 노인 3백명을 대상으로 원격 헬스케어 임상실험 진행 - 의료기기 및 시스템의 컴퓨팅 성능을 높여주는 듀얼코어 프로세서 개발 - 효율성과 커뮤니케이션을 향상시켜주는 무선통합기술, 가상화 기술 개발 - 가정용 원격 모니터링, 진단, 원격의약 처방기능 제품 공급 - 태블릿 PC 전문기업은 모션 컴퓨팅과 의료용 태블릿 모션 C5 공동개발 |
|
IBM |
- 모바일 환경에서 건강진단을 위한 헬스케어 솔루션 발표 - 인터넷 기반 의료영상전송저장시스템(PACS) 개발, 도입 - 3차원 시각화 S/W인 “SWME“ 개발 |
|
Microsoft |
- 인터넷 기반의 환자 기록 DB S/W인 Health Vault 개발 |
|
Phillips |
- 심부전증 환자의 원격 모니터링 시스템 및 서비스 제공 |
|
Honeywell |
- Automation and Control Solution 개발 - 측정장치들이 연결된 중앙장치 통하여 얻은 환자 생체신호 측정정보 모니터링 - 충혈성 심부전, 고혈압, 관상동맥증, 당뇨, 만성폐쇄성폐질환 등의 질병의 서비스 운영 - 3,500여개의 파트너를 통해 서비스 제공 |
|
Viterion |
- 원격 즉정기기 이용, 환자 자신의 신체와 병세 변화 관측 - 저장 자료 활용하여 환자에게 알맞은 치료법 제공 |
|
COMMWELL |
- Telemedicine을 이용한 원격 환자 감시 장치 - Health e-chair와 Control Center로 구성되며 e-chair측정 정보를 원격 진단 가능 |
|
MIT Arbellof Lab |
- Wearable Life Shirts를 통해 비침습적 휴대 모니터링 가능 - 호흡, 심장활동 및 자세와 운동 상태를 감지하고 데이터를 무선으로 전송하여 분석하는 방법 |
자료 : 하나금융그룹, u-Health산업 동향, 2009 / KETI, u-Health 서비스 사례, 2011
미국의 Home&Mobile 시장은 2006년 9.7억 달러 규모에서 2010년 57억 달러, 2015년에는 336억 달러로 성장할 것으로 전망되고 있다.
유럽의 u-Health는 EU가 주축이 되어 추진 중에 있으나 일본과 미국대비 활성화 되지 않았다. EU차원에서는 Public Health, Healthcare, e-Health 등 다양한 이슈의 정책을 추진 중이며, 2010년 완료 예정으로 국가별 건강 의료 네트워크 구축을 기반으로 개인화된 u-Health 시스템 개발을 진행하였다. 또한 EU는 2008년 7월부터 해외여행 중이거나 거주 시 필요한 의료지원이 필요한 유럽국가 국민들에게 의료서비스를 제공하기 위한 e-Health 이니셔티브 프로젝트를 착수하였다. 본 프로젝트는 전자건강기록(EHR : Electronic Health Record) 시스템의 국가 간 상호 호환성 및 스마트 개방형 서비스 실시를 골자로 하고 있으며 EU 국가 내 의사들의 환자에 대한 건강정보 접근성을 높이려는데 목적이 있다.
일본의 u-Health 산업은 정부부처인 후생노동성과 총무성 등에서 추진하고 있다. 후생노동성은 2001년 “의료정보시스템 개혁위원회”를 통해 보건의료의 IT화를 추진하였으며 총무성 역시 2006년 4월 u-Health에 대한 미래상과 구체적 활용계획을 발표하고 “중점계획 2006”을 마련하였다. 민간의료기관으로는 NTT병원이 대표적이다. 일본 통신서비스기업인 NTT가 설립한 병원인 NTT병원은 NTT가 제공하는 “Creatice Mobile” 서비스를 무선인터넷 기반으로 한 유료서비스화 하여 체중, 혈압, 체온 등의 데이터를 개인이 직접적으로 관리할 수 있도록 하였다. NTT도코모 이외 KDDI AU, Softbank등을 통해서도 본 서비스를 이용할 수 있다.
(3) 의료기기
의료기기산업은 고객의 요구와 BT-IT기술의 융합, 기술의 혁신 등의 요인으로 발전해가고 있다. 건강의 유지에 대한 기대와 관심은 의료서비스 및 기기분야에 영향을 주고 있으며, 치료의 정확성, 신속성, 편의성 등의 요인을 중심으로 개발되고 있다.
의료기기는 전자공학을 중심으로 물리학, 기계공학, 전산학 등을 의료분야에 적용한 장치, 기기, 소프트웨어로 발전하고 있다. 특히 의료영상진단기기의 경우 CT, MRI, PET, PET-CT, 초음파 측정기 등 의료영상장비 등이 있으며 이의 지멘스, GE, 필립스 등과 같은 기업이 독점하고 있는 산업이다.
첨단영상의료기기의 세계시장규모는 2008년 2,102억 달러에서 2013년 까지 2,862억 달러로 연평균 6.4% 성장할 것으로 전망되었다. 성장 요인은 인구고령화에 따른 노인성질환의 치료 수요 증가, 소득증대 및 생활패턴의 변화 등을 이유라 할 수 있다. 이와 같은 환경 변화는 세계의료기기 시장의 지속적인 성장을 예측할 수 있는 중요요인으로 볼 수 있다.
<그림4> 세계 의료기기 시장 규모
(단위 : M$)

자료 : Espicom, The World Medical Market Fact Book, 2008
의료기기 시장은 미국이 2008년 979억 달러에서 2013년 1,228억 달러, 연평균 4.6% 성장으로 가장 큰 규모를 점유하고 있다. 이어 서유럽과 아시아가 2008년 각 각 581억 달러, 393억 달러에서 2013년 825억 달러, 589억 달러로 연평균 7.3%, 8.4% 증가할 것으로 전망되었다. MRI 분야의 경우 Foner, Hitachi Medical System, Siemens Medical Solutions, GE Healthcare 및 Philips Medical Systems, Toshiba Medical Systems 등이 대부분의 시장을 점유하고 있으며 GE와 Siemens, Toshiba Philips 등의 기업이 3대 메이커를 형성하고 있다.
|
구분 |
2008 |
2009 |
2010 |
2011 |
2012 |
2013 |
CAGR |
|
미국 |
97,914 |
102,400 |
107,131 |
112,099 |
117,364 |
122,825 |
4.6% |
|
아시아 |
39,324 |
42,577 |
46,101 |
49,992 |
54,346 |
58,945 |
8.4% |
|
동유럽 |
9,342 |
10,529 |
11,267 |
12,363 |
13,588 |
14,873 |
9.7% |
|
중동/아프리카 |
5,452 |
5,719 |
6,014 |
6,327 |
6,657 |
6,999 |
5.1% |
|
서유럽 |
58,160 |
62,308 |
66,776 |
71,613 |
76,898 |
82,538 |
7.3% |
|
Total |
210,192 |
223,262 |
237,289 |
252,394 |
268,853 |
286,181 |
6.4% |
자료 : Espicom, The World Medical Market Fact Book, 2008
다. 국내현황
(1) 바이오칩
국내 바이오칩 산업은 신생 벤처기업관련 연구소 중심의 DNA칩 개발이 주도적이다. 주도적인 기업으로는 마크로젠, 디지털지노믹스, 지노믹트리가 3강으로 국내 대부분 시장을 점유하고 있으며, 지노첵, 바이오메드랩, 마이진, 바이오니아, 굿젠, 메디제네스 등의 벤처기업도 바이오칩 산업분야에 참여기업으로 자리 잡았다.
국내 바이오칩 시장은 2005년 232억 원에서 2015년 5,220억원으로 연평균 36.5% 증가할 것으로 전망되었다. 국내시장 역시 LOC 시장이 2015년 2,088억 원으로 전체 시장의 40%를 점유함에 따라 해외시장과 유사하게 LOC 중심의 시장이 형성될 것으로 전망된다.
|
구 분 |
2005 |
2010 |
2015 |
CAGR(%) |
|
DNA칩 |
168 |
531 |
1,566 |
25.0 |
|
단백질칩 |
14 |
219 |
1,566 |
60.5 |
|
LOC |
50 |
404 |
2,088 |
45.3 |
|
Total |
232 |
1,155 |
5,220 |
36.5 |
자료 : 지식경제부, 바이오칩 산업 및 표준화 동향, 2009
<그림5> 바이오칩 분류별 국내 시장 전망

자료 : 지식경제부, 바이오칩 산업 및 표준화 동향, 2009
바이오센서는 의료부분에서 가장 많은 수요가 이루어지고 있다. 자유로운 이동과 즉각적 감지가 가능함에 따라 신속한 진료를 가능하게 하는 것이 장점으로 부각되어 국내 시장의 의료, 영양분야의 신규 서비스의 확대가 전망되고 있다.
국내 바이오센서 산업은 90% 이상이 의료용 바이오센서로 식품의 분석, 환경용 등의 분야는 상대적으로 점유가 낮은 편이다. 자가 의료검진기 시장의 성장으로 의료용을 중심으로 한 바이오센서 시장이 형성될 것으로 전망된다. 제약용 바이오센서 시장은 2007년 15억 달러에서 2010년 27억 달러, 환경용 바이오센서는 2005년 7,000만 달러에서 2010년 9,000만 달러 정도 예측이 될 것으로 전망되었다. 전체 시장은 2005년 300억 원 규모에서 2010년 약 700억 원으로 세계시장 성장률과 비슷한 9% 대의 성장이 이루어졌으나, 국내 시장이 도입기임을 감안한다면 국내 바이오센서 시장은 높은 성장잠재력을 보유한 것으로 예측된다.
(2) u-Health
국내 u-Health 서비스는 2005년 이후 IT 기술의 향상과 보건의료에 대한 필요성이 증가하면서 정부주도의 시범서비스 사업 형태로 진행되었으며 점차 확산되는 추세이다. 병원 내 원무 정보화는 95%이상 달성되었으며 PACS(의료영상정보시스템)은 대학병원 88%, 일반병원 12%의 보급률을 코이고 있다. 또한 U-병원으로의 전환 기본 인프라인 EMR(전자의무기록)에 대한 도입도 진행되어 2005년 50% 이상의 도입목표가 달성되었다.
|
기업 |
의료기관 |
협력내용 |
구분 |
|
유비케어, 이지케어텍 |
분당 서울대병원 |
- 진료정보교류시스템 개발 및 운용 |
u-병원정보 |
|
LG-CNS |
경희의료원 원주기독병원 |
- 환자병상에 맞춤형 IPTV서비스 제공 - 신생아 정보시스템구축 등 모바일 RFID, 스마트카드 활용 서비스 구축 |
u-병원정보 |
|
현대정보기술 |
중앙응급 의료센터 |
- 응급지료정보 및 이송시스템 구축 |
u-병원정보 |
|
인성정보 |
가톨릭 대학병원 |
- u-Health Joint Venture(C&I헬스케어) - 임산부 당뇨환자 당뇨관리서비스 |
u-Healthcare |
|
삼성전자 외 8개사 컨소시엄 |
길의료재단 |
- 맞춤형 u-Health 서비스 개발 - 정부 프로젝트 참여(09년 6월 종료) - 바텍과 초정밀 디지털 엑스레이 디렉터 양산 |
u-Healthcare u-Wellbeing |
|
유라클 |
서울대학교병원 강남센터 |
- 예방의학프로그램 응용 u-Healthcare 서비스 2008년부터 송파구 213가구 시범 제공 |
u-Healthcare |
|
코오롱 정보통신 |
강원도, 경찰대 서울대학병원 |
- u-원격진료시스템 - 서울대 유비쿼터스 의료정보시스템 구축(EMR에 RFID 적용) |
u-병원정보 |
|
KT |
분당제생병원 |
- 뇌졸중 환자 24시간 영상진단서비스 |
u-Healthcare |
|
분당서울대병원, 조선대병원, 경기도 |
- 스마트폰, 인터넷을 통한 진료정보공유기술 개발 진행 - 휴대용 혈당기와 심전도기를 이용 주기적 생체정보 전송 - 조선대 u-병원정보서비스 구축 - 경기도와 u-건강지킴이 시범서비스(05년 7월~08년 6월) |
u-병원정보 |
|
|
SKT |
대구시, 부산시 |
- u-건강모니터링 서비스(대구, 부산) - 웨어러블 컴퓨터 기반 u-Health Service(대구) - u-원격 의료서비스(부산) |
u-Healthcare |
자료 : 하나금융그룹, u-Health산업 동향, 2009
u-Health 산업은 u-병원을 도입하기 위한 무선통신, RFID, 스마트카드 관련 기업을 중심으로 발전되었다. 연세 세브란스 병원은 스마트카드 기능을 탑재한 진료카드를 이용하고 있으며 원외에서도 온라인 증명서, 내원정보 등을 조회할 수 있는 서비스를 제공하고 있다. 뿐만 아니라 태블릿 PC와 무선 인터넷 서비스를 이용한 병원 내 의료정보의 실시간 제공은 환자 병력에 대한 정보가 의료 전문가들이 쉽게 공유할 수 있도록 하여 원활한 의료서비스를 제공할 수 있는 환경으로 발전시켰다.
(3) 의료기기
국내 의료기기산업은 GE와 Siemens, Philips의 해외기업이 독점하고 있는 추세이다. 국내 기업인 메디슨은 이에 대응하여 여러 개의 컨소시엄을 구성하고 독점시장 내 틈새시장공략을 기반으로 시장점유율을 넓히고 있는 추세이다.
국내 의료기기시장은 2004년 2조 2,969억 원에서 2008년 3조 6,179억 원으로 연평균 12% 성장하였으며 생산액은 2004년 1조 4,782억 원에서 2008년 2조 5,252억 원으로 연평균 14.3% 성장하였다. 이와 같은 추세가 지속 될 경우 2011년 국내 의료기기 시장은 5조원, 생산액 기준으로 3조원 이상의 성장으로 예측 가능하다.
|
구분 |
2007 |
2008 |
2009 |
2010 |
2011 |
2012 |
CAGR |
|
시장규모 |
32,592 |
36,179 |
40,520 |
45,383 |
50,829 |
56,928 |
12.0% |
|
생산액 |
22,170 |
25,252 |
28,863 |
32,990 |
37,708 |
43,100 |
14.3% |
자료 : 한국의료기기산업협회, 한국보건산업진흥원, 2009
<그림6> 국내 의료기기 시장규모 및 생산액 현황 및 전망

자료 : 한국의료기기산업협회, 한국보건산업진흥원, 2009
라. 발전전망
융합산업은 “기회”라는 평가가 절대적이다. 산업연구원의 설문에 따르면 전문가의 약 87%, 기업의 약 48%가 시급한 것으로 조사되었다. 이는 융합산업이 창출할 제품차별화와 신규시장 창출이 산업 내 높은 영향을 줄 것으로 전망되기 때문이다.
<그림7> 융합산업의 시급성 정도

자료 : 산업연구원 설문조사, 2010. 4
특히, 성숙기와 쇠퇴기 산업에 종사하는 기업은 신규 산업으로의 진출을 위한 전략분야의 선점이 필요함에 따라 융합산업에 대한 높은 관심을 보이고 있다. 이는 소비자 니즈에 따라 제품의 차별화 및 고부가가치화에 대한 압력이 산업 내 발생하였기 때문으로 분석할 수 있다. 제품의 차별화는 기존 산업의 기술혁신 속도가 둔화되고 후발기업 간 기술격차가 줄어듦에 따라 산업 전반적인 다각화 전략이 필요한 것에 기인한다. 그리고 고부가가치화 역시 첨단의료기기, 바이오칩 등과 같이 원가 대비 높은 기능 효율을 제공하는 제품으로서 소비자 니즈에 부응하기 위한 제품으로 출시되고 있다. 따라서 세계경쟁력을 갖는 연구개발로 글로벌화에 대응하는 첨단융합기술이 활성화 될 것으로 전망된다.
향후, 바이오 융합 산업은 현재의 시작되어 급속히 성장 중인 바이오칩, u-health 및 의료기기 분야에서 뿐 아니라 태동중인 유전체분석 서비스 산업 등 신산업의 창출에도 가속화가 붙을 전망이다. 현재까지의 융합이 주로 IT와 NT 각 각의 BT융합에 가까웠다면, 앞으로는 BT-NT-IT 세 기술이 모두 융합된 산업이 발전될 것으로 전망할 수 있다. 이는 인간 질병 통합유전체의 분석을 통한 맞춤형 의료서비스 제공과 신약개발, Healthcare, Wellness 등의 서비스가 u-Health System으로 통합 운영될 것으로 전망되기 때문이다.
이미 융합산업은 시장 내 반영되어 사업화 진행 중에 있다. 또한 특정 분야가 아닌 소비자의 니즈에 따른 다양한 제품의 공급은 산업 내 기술융합의 필요성을 가중시켜왔고 기업들의 투자방향도 소비자의 다양한 니즈에 따라 융합산업 중심으로 기술개발이 이루어지고 있다. 따라서 향후 바이오 융합산업은 소비자의 다양한 니즈의 세분화와 IT, NT 경계 없는 기술개발로 제품 차별화와 다각화된 첨단융합제품으로 발전될 것으로 전망된다.
제6절 생물자원 분야
1. 생물자원의 개요
생물자원은 에너지 고갈, 환경오염, 식량 부족 등 인류의 당면 난제를 해결할 바이오 연구 및 관련 산업의 필수 핵심자원으로 인식되어 그 중요성이 높아지고 있다. 그래서 생물자원은 도래하는 바이오경제 시대를 지탱하는 무궁한 가치를 지닌 미래자원으로 여기고 있다.
전 세계적으로도 생물다양성협약 이후 생물자원의 중요성을 재인식하고 자원주권을 강조하고 있으며, 이에 따라 국가별 전략적 자원관리 정책들이 추진되어 오고 있다. 2010년 일본 나고야에서 개최된 제10차 생물다양성협약 당사국 총회에서 [생물유전자원에 대한 접근과 이익 공유(ABS, Access to genetic resources and Benefit Sharing)에 관한 나고야 의정서]가 채택되어 자원이용에 따른 공정하고 공평한 이익공유에 대한 국제적 인식변화의 새로운 장이 열리게 되었다. 경제협력개발기구인 OECD(Organization for Economic Cooperation and Development)에서도 일찍부터 생물자원의 중요성을 인식하여 국가인프라로서의 생물자원센터 설립을 권고하였고, 이를 통한 국가자원의 효율적 관리체계 구축을 언급해 왔다. 또한 세계생물다양성정보기구(GBIF, Global Biodiversity Information Facility)를 통해서 국제적으로 생물다양성정보를 공유하여 효율적인 이용과 보존체계를 구축하자는 노력이 진행되어 왔다. 브라질, 인도, 중국 등 거대 생물자원 보유국들은 자국자원의 효율적 보호 및 유용성 발굴을 위한 법․제도 정비와 동시에 전폭적인 투자를 확대하고 있다. 생물자원의 가치발굴과 관련 기술의 증가로 자원보유국과 자원이용국 간의 이익 공유에 대한 대립은 첨예화되고 있다. 앞으로는 자원주권강화에 따라 자원이용에 따른 이익공유의 분쟁사례가 증가할 것으로 예측된다.
우리나라도 577 과학기술기본계획, 생명공학육성기본계획 등 생물자원 육성정책에 따라 각 부처별로 육성전략이 수립되어 다양한 사업들이 추진되고 있다. 각 2007년 12월에 “국가 생명자원 확보·관리 및 활용 마스터플랜”을 수립하였고, 현 정부도 과학기술하부구조를 고도화하기 위해 577전략의 하나로 국가생명자원의 효율적 관리와 활용체계 확립을 추진하고 있다. 또한 “생명연구자원의 확보․관리 및 활용에 관한 법률”이 2009년 5월에 제정되어 유용생명자원의 확보와 고부가가치 바이오산업의 부흥을 이끌 생명자원 활용 활성화를 추진하고 있다.
2. 해외연구동향
가. 미생물자원
미국은 세계 최대의 생물자원 보유국으로 연구용자원의 적극적 확보 추진을 백안관에서 직접 독려하고 있다. 특히 미국국립보건원(NIH)에서 지원하고 있는 미국생물자원은행(American Type Culture Collection, ATCC)은 ‘Global Bioresource Center’를 전면에 내세우고 세계 최대의 생물자원관리기관으로의 위상을 공고히 하고 있다. ATCC는 세균 18,000여주, 동물바이러스 2,000여주, 식물바이러스 1,000여주, 효모와 곰팡이 등 진균 49,000여주, 원생생물 2,000여주, 동물, 식물, 인체유래 세포주 3,400여주 등 전 세계적으로 가장 많은 자원을 보유하고 있으며, 매년 10만 건 이상을 분양하는 미국의 생물자원관리 중앙은행 역할을 담당하고 있다. 또 미국의 NSF(연구재단)는 소규모 생명공학 연구소재나 특수자원의 관리를 위해서도 지원을 아끼지 않고 있다.
유럽은 7차 연구개발기본계획의 4대 중점분야 중 하나로 생물자원 인프라의 확충 및 공동활용을 추진해 오고 있다. 또 유럽연합은 생물자원정보의 통합관리를 위해 생물자원정보네트워크(CABRI)를 구축하여 운영하고 있다. 유럽의 대표 미생물자원기관인 독일의 DSMZ는 세계 최고수준의 표준미생물, 특히 세균표준자원의 보유기관으로 20,000여주의 미생물을 관리하고 있다..
일본 문부과학성은 세계최고수준의 생물자원 인프라 정비를 목표로 국가생물자원프로젝트(NBRP)에 1,100억원 이상을 투자하고 있는데 이는 총 BT 예산의 12%에 해당한다. 또, 경제산업성은 NITE-BRC(NITE 생물자원센터)를 중심으로 미생물을 관리하여 산업계를 지원하고 있다. 특히 NITE는 아시아 여러 국가들과 MOU 체결 및 공동연구를 추진하여 아시아 유용미생물 탐색사업을 지속적으로 수행하고 있는데, 이 사업에는 일본 내 제약, 식품 등 생물 관련 산업체들이 함께 참여하고 있다.
중국은 바이오산업 육성을 위한 생물자원 신흥강국을 추진하겠다는 목표아래 중국과학원 미생물연구소를 중심으로 전국 60여개 자원관리기관을 통한 유용미생물 확보를 강력하게 추진하고 있다.
나. 식물자원 분야
미국은 농무성 산하 농업연구청(USDA ARS)에서 국립식물유전자원시스템(National Plant Germplasm System)을 구축하여 자원을 관리하고 있는데, 전국적으로 20여개의 유전자원보존기관을 운영하고 있다. 현재까지 보유하고 있는 총자원 수는 542,000여점에 달한다. 관련자원정보는 국가유전자원연구소(National Germplasm Resources Laboratory)에서 관리하고 있으며, 웹사이트(www.ars-grin.gov/)를 통해 자원정보를 검색할 수 있다. 식물 유전자원 교환소(Plant Exchange Office)는 식물 유전자원 탐색 프로그램 운영하여 전 세계 유전자원을 수집하고 있다.
유럽연합의 독일은 라이프니츠식물연구소(Leibniz Institute of Plant Genetics and Crop Plant Research, IPK)를 중심으로 식물종자와 영양번식체자원을 관리하고 있으며, 특히 지구온난화에 대비한 식물종자 극지보존사업을 진행하였다. 애기장대 돌연변이 종자는 유럽연합과 공동으로 유럽애기장대스,톡센터(NASC, European Arabidopsis Stock Center)를 운영하고 있으며, DSMZ는 세계 최대 식물세포주 관리기관으로 현재 약 700여주를 관리하고 있다. 영국은 식물유전자원그룹(UKPGRG)에서 식물자원의 연구와 수집을 총괄하고 있으며 작목별 17개 연구기관을 운영하고 있다. 또한 품종육성과 연계한 수집보존소에서 12만여점을 관리하고 World Collection에 한정하여 장기보존한다. 자원의 특성평가는 국가연구기관과 대학이 공동으로 실시하고 자유로운 자원교환을 수행하고 있다. 핀란드, 노르웨이, 스웨덴, 덴마크 등 노르딕 4국은 식물자원 공동이용체계를 구축하여 협력하고 있다. 러시아는 바빌로프식물산업연구소(VIR)를 중심으로 식물자원을 관리하고 있으며, 9개 작목별 전담부서와 기초연구 및 작물육종을 수행하는 기초연구실을 운영하고 있다.
아시아에서 일본은 국가생물자원프로젝트(NBRP)를 통해 연구모델 식물(Arabidopsis), 식량작물(벼, 밀, 보리 등), 가지과 작물(토마토), 화훼작물(나팔꽃, 국화 등) 등 작물별로 관리하고 있으며, 이화학연구소 생물자원센터(RIKEN BRC)의 식물팀은 식물세포주, 식물 DNA, 추출물, 기타 연구용 식물, 애기장대 돌연변이 종자 및 full-length clone 등을 관리하고 있다. 또 농림수산성 국립농업생물자원연구소는 농업식물자원의 중앙관리기관으로서 대학, 민간기구, 국립연구기관, 공공기관과 연계협력하고 있다. 중국은 중국 농업과학원 작물유전자원연구소를 중심으로 식물자원을 관리하고 있으며 국립종자은행은 중복조존기관도 운영하고 있다. 또한 25개 국립유전자원포장보존센터(National Field Gene Bank)를 통하여 영양체자원을 관리하고, 11개 지역농업과학원에서 12개 종자보존소를 운영하고 있다. 인도는 국립식물유전자원국(NBPGR)에서 식물자원을 관리하고 있다. 2007년까지 약 340,000여점이 보존 중인 것으로 알려져 있는데 최근 백만 점 보존규모의 새로운 종자은행을 설립하였다. 고유 식물자원이 풍부한 자원부국으로 철저하게 보호되고 있다.
다. 동물자원 분야
2001년 인간게놈프로젝트 완료 후 유전자 기능에 대한 특허가 바이오 신약기술개발의 원천기술로 부각되게 되었다. 이에 따라 유전자조작기술을 이용하여 특정 유전자를 변형한 마우스를 이용한 유전자 기능 확인이 신약 연구의 핵심요소로 활용되면서 유전자변형마우스(GEM)의 중요성이 더욱 부각되게 되었다. 현재 선진 각국은 실험동물자원기관을 집중적으로 육성하고 있으며, 유전자변형마우스 생산 기반 및 분석 표준화, 고속화를 위해 국제적 컨소시엄을 확대하고 있다. 미국잭슨연구소(The Jackson Laboratory)는 세계 최대 마우스자원센터로 NIH에서 집중지원을 받고 있는데, 자원 유지, 관리, 분양 및 실험동물의 유전적 표준화와 병원성 미생물의 감염관리에 대한 기술서비스도 제공하고 있다. 이 외에도 NIH의 지원을 받는 지역마우스자원센터(MMRRC)도 운영하고 있다. 유럽연합은 각 국가별로 중심마우스센터를 운영하고 있으며, 이 센터들은 상호 연결되어 종합적 마우스자원관리인 유럽연합마우스센터(EMMA, European Mouse Mutant Archive)로 운영되고 있다. 일본은 북부중심인 이화학연구소 생물자원센터(RIKEN BRC)와 남부중심인 구마모토대학의 동물자원 및 발생센터(CARD, Center for Animal Resources and Development)에 국가거점 마우스자원센터를 운영하고 있다. RIKEN BRC의 마우스센터는 아시아 최대 마우스자원관리 기관으로, 자원 수집, 청정화, 계통유지, 동결보존 등 특수 마우스 계통의 유지 보존과 품질관리(미생물검사, 유전검사)를 수행하고 있다.
초파리자원은 전 세계적으로 여러 형태의 초파리 스톡센터가 있지만 보유하고 있는 초파리 돌연변이체가 상이하여 상호 보완적이다. 미국 블루밍톤초파리스톡센터(Bloomington Drosophila Stock Center, 인디애나대학교), 일본초파리스톡센터(Fly Stocks of National Institute of Genetics, 국립유전학연구소), 비엔나초파리스톡센터(Vienna Drosophila Stock Center, 오스트리아)가 대표적인 기관이다.
지브라피쉬 자원에 대한 선진국의 투자가 최근 증가하고 있는 추세다. 미국은 NIH지원으로 오리건대학에 지브라피쉬 스톡센터(Zebrafish Stock Center)를 운영하고 있으며, 독일은 지브라피쉬 돌연변이주 제조와 유지에 국가차원의 지원을 하고 있다. 또 일본은 유전발생학연구소를 중심으로 지브라피쉬 이용 동물장기 발생연구를 지원하고 있고, 싱가포르는 전 세계 지브라피쉬 연구자들을 유치하고 지브라피쉬를 활용한 연구를 추진하고 있다.
세계 최대의 미생물자원 보유기관인 ATCC는 관리분야에서도 세계 최대기관으로서의 명성을 유지하고 있다. 그 외 ECACC(영국), DSMZ(독일), JCRB(일본) 등도 대표적인 동물 및 인체유래 세포주관리기관이다.
3. 국내연구현황
가. 미생물자원
국내 미생물자원의 대표관리기관은 한국생명공학연구원(KRIBB)의 생명자원센터(KCTC)이다. 생명자원센터는 1985년 한국과학기술연구원(KIST)의 유전자은행으로 시작하여 미생물자원의 확보, 보존관리 및 분양지원을 수행해왔으며. 국내 최대 미생물자원관리기관으로 발전해 왔다. 매년 PubMed에 등재되는 논문에서 KCTC자원이 활용된 인용지수를 살펴보면 세계 미생물자원센터 중 독일 DSM, 미국 ATCC, 네덜란드 CBS, 일본 JCM에 이어 세계 5위를 차지하고 있다. 또 전 세계에서 매년 보고되는 신종미생물자원의 기탁관리 면에서 살펴보면, 독일 DSMZ, 일본 JCM에 이어 세계 3위의 신종미생물기탁기관으로서 국제적 위상이 높아지고 있음을 보여주고 있다. KCTC는 부다페스트조약에 의한 국제특허미생물보존기관(IDA)로서 국내 특허미생물기탁의 절반 이상을 담당하고 있다.
이 외에도 교육과학기술부가 지원하는 국가지정연구소재은행사업을 통해 대학중심으로 특화된 여러 미생물자원이 관리되고 있다. 2012년 종결되는 21세기 프론티어연구개발사업 미생물유전체사업단은 유용 미생물자원을 발굴하고, 활용하는 다양한 사업을 추진해왔는데, 특히 신종미생물 발굴 분야에서 한국이 세계 1위의 성과를 나타내는데 크게 기여했다.
또한 각 처에서도 부처소관분야에 따라 미생물자워늘 관리하고 있다. 복지부 질병관리본부는 병원선미생물자원을, 농림수산식품부에서는 농진청, 산림청, 수산과학원 등 산하 기관을 통하여 농림수산식품 미생물자원을, 국토해양부는 해양미생물자원을 관리하고 있으며, 환경부도 최근 미생물분야에 관심을 갖고 사업을 추진 중이다.
그러나 미생물자원의 고품질 관리와 활용을 위한 시스템, 인력, 시설, 장비 등 인프라는 선진국 대비 매우 부족한 수준이다. 향후 지속적인 확대 지원이 필요하며, 이를 통하여 국내 바이오연구자의 수요에 부응하는 맞춤형 자원을 지원할 수 있는 국가기반으로 성장할 수 있을 것이다.
나. 식물자원
한국은 전 세계 식물 자원의 약 3%를 차지하고 있는데, 국내 식물자원 보유 현황은 8,271종으로 영국 1,550종, 독일 2,600종, 일본 4,700종, 미국 16,302종, 중국 18,000종에 비교했을 때 적은 편은 아니다. 이 중에서 특산식물이 407종, 자생식물은 4,158종이며 고등식물은 4,662종(선태류 691종 포함), 하등식물(규조류, 편모류, 담수녹조류, 해조류 등)은 3,609종이다.
농림수산식품부 산하 기관에서는 국내 식물 종자 및 영양체 2,773종과 삼림 유전자원 3,963종 등 전체 6,736종을 보존하고 있고, 그 외 교과부, 환경부 등에서도 자원관리를 수행하고 있다. 농촌진흥청 산하 국립농업유전자원센터에서 농업유전자원의 보존 및 관리체계를 구축하여 종자유전자원 1,777종 약 154,695점과 식물영양체 26,175점 등 농업식물유전자원을 관리하고 있다(http://genebank.rda.go.kr/). 그러나 우리나라가 확보한 식물자원(종자)은 약 15만 점으로 미국(50만 점)의 1/3, 중국(38만 점)의 1/2.5, 일본(28만 점)의 1/1.8수준에 불과하다. 전체 보유 종자유전자원 중에서 식량작물이 117,281점으로 비중이 가장 높으며 채소, 특용작물, 사료작물 등 타 작물과 야생 식물의 종자 보유는 상대적으로 저조한 실정이다.
교과부에서는 프론티어사업 등 고유식물자원확보를 위한 사업을 통하여 국내 자생자원을 탐색, 수집, 동정, 보존하여 분양 지원하는 인프라 체계를 구축하였다. 그러나 연구모델 식물의 경우 국가지정연구소재은행사업에서 지원하는 Arabidopsis 돌연변이체은행사업에만 한정되어 있어 현재는 매우 미비한 수준이다. 2011년 현재 애기장대, 벼, 콩, 포플러, 포도 등 20여종 이상의 작물에서 염기서열 분석이 완료되었다. 따라서 국내 식물자원의 효율적인 활용을 위하여 정보화 체계구축이 시급하며 다양한 식물자원 인프라가 하나의 기관을 중심으로 컨소시엄 형태로 발전하여 수요자로 하여금 정보 접근이 편리하도록 지원할 수 있는 통합관리체계가 구축되어야 할 것이다.
다. 동물자원
국내 동물자원 인프라는 선진국에 비해 매우 미흡하며, 증가하는 수요에 대응하는 투자확대가 이루어지지 못했다. 그러나 2010년 유전자변형마우스기반구축사업 등이 시작되면서 동물자원에 대한 인프라지원의 새로운 출발이 시작되었다.
한국생명공학연구원은 국제공인 모니터링센터(ICLAS Monitoring Subcenter Korea)를 운영하여 국내 실험동물시설에 대한 병원성미생물 감염모니터링을 지원하고 있다. 2010년 시작된 유전자변형마우스기반구축사업을 통해 국내 바이오연구개발의 필수재료인 유전자변형마우스(GEM)의 생산, 활용 및 공유 기반구축이 추진되고 있다.
한국과학기술원 의과학연구센터가 유지관리 및 지원하고 있는 25,000 line의 형질전환 초파리 라이브러리는 동일한 유적적 백그라운드를 가진 돌연변이체로 유전자기능 및 게놈 전체 스크린 연구에도 활용될 수 있는 유용자원으로 국내외 많은 연구실에서 활용하여 다양한 우수 논문으로 발표되었다.
지브라피쉬자원은 국가지정연구소재은행사업의 하나로 지정되어 경북대 지브라피쉬 장기발생변이주은행(ZOMB)이 운영되고 있다. 최근에는 다양한 인체질환 동물모델로서 활용도가 높아지고 있다. 현재 국내 지브라피쉬 이용 연구실은 20여 개이며 체계적인 지브라피쉬 스톡센터(Zebrafish Stock Center)의 유지 및 확대를 위한 투자 확대가 필요하다.
국내에서 돔울 및 인체유래 세포주를 관리하는 대표적인 기관은 서울대 한국세포주은행으로 국가지정연구소재은행사업의 하나로 지정되어 운영되고 있다. 한국세포주은행에서는 한국인유래 암세포주 개발을 수행해왔으며, 미국 ATCC, 영국 ECACC, 독일 DSMZ, 일본 JCRB 등과 함께 세계 5대 세포주은행으로 발전하였다. 또한 부다페스트조약에 의한 국제특허미생물보존기관(IDA)로서 국제특허세포주(동물 및 인체유래 세포주) 기탁업무를 수행하고 있다. 한국생명공학연구원(KRIBB) 생명자원센터(KCTC)에서도 일부 동물 및 인체유래 세포주를 관리하고 있으며, 국내외 특허수탁업무도 수행하고 있다.
4. 생물자원의 발전과제
OECD에서는 바이오 신기술이 타 기술들과 융합을 지속하여 2030년 경에는 글로벌 경제가 대규모 변화를 가져오는 바이오경제 시대로 진입할 것이라는 전망을 보고하였다(The Bioeconomy to 2030, OECD, 2007). 이처럼 바이오 관련 연구 및 산업은 급속히 발전하고 있다. 이러한 바이오 연구 및 산업을 위해서는 그 핵심재료인 생물자원이 매우 중요하다. 향후 ‘생물유전자원의 접근 및 이익공유(ABS)에 대한 나고야의정서`가 발효되면 국외자원의 원활한 활용에 대한 어려움에 봉착하게 된다. 그러므로 국내 유용자원의 발굴․확보 및 관리, 국외 유용자원의 전략적 도입이 그 어느 때보다도 중요한 시대가 되었다.
그러나 국내 생물자원의 보유량은 선진국 대비 매우 미흡한 수준이고, 활용도 면에서도 낮은 수준이다. 그러므로 국가수요자원의 실태파악을 통한 전략적 자원 발굴․확보가 필요하며, 연구자들의 활용성을 높이기 위한 유전체 정보해독, 특성분석들 자원의 가치발굴 및 정보화가 매우 중요하다.
국내 자원보유규모의 절대적 부족이라는 현실을 넘어 바이오경제시대를 위한 바이오 연구 및 산업을 지원하기 위해서는 범국가적 생물자원 연계시스템 구축이 필요하며, 국가중심의 생물자원 확보․관리 및 활용지원 전략이 필수적이다. 이러한 국가전략을 통하여 바이오경제시대의 견인차 역할을 담당할 생물자원 인프라의 발전을 기대한다.
제9절 생명공학 인프라
가. 개요
일반적으로 실용화기술개발 단계의 세부과정은 ① 순수연구 및 독창적·창의적 ‘기초연구(Biasic research)’ 과정, ② 개발가능성 확보 및 효능확인의 ‘응용연구(Applied research)’ 과정, ③ Prototype 및 시제품 제작의 ‘개발(Development)’ 과정, ④ 대량생산의 가능성 확보 및 제품성능평가의 ‘시생산(Pilot-plant)’ 과정, ⑤ 대량생산 및 품질관리의 ‘산업화(Manufacturing)’ 과정으로 세분화 할 수 있으나, 생물산업은 일반산업 분야와 달리 차별성 및 특이성이 존재하며, 이는 개발과정→ 시생산과정→ 산업화과정 등을 거치면서 개발될 제품(의약품 및 식품 등)을 최종적으로 인체에 적용하기 위하여 체내 안전성·유효성 등에 대한 신뢰성평가(비임상 GLP, 임상 GCP, 우수제조기준 GMP 등)를 필수적으로 검증해야 한다는 것이다. 또한 이러한 생물산업의 실용화기술개발 단계에서 ‘R&D 기능’ 뿐 만 아니라 기술하부구조로 되어 있는 ‘인프라구조(Infra-structure)’의 효율적인 지원체계 구축은 성공적인 생물산업 육성 및 지속적 성장을 가능케 하는 필수 요인이다.
생물산업 인프라 분야와 관련하여, ① 실용화기술개발의 ‘응용연구’ 과정까지는 주로 한국한의약연구원, 한국표준과학연구원, 한국과학기술연구원, 한국생명공학연구원, 한국전자통신연구원, 한국기초과학지원연구원, 한국세포주은행 등의 정부출연기관 등을 중심으로 R&D 인프라가 구축·운영되고 있고, ② ‘응용연구’ 과정 이후부터는 산업화에 특화된 지원을 위해 지식경제부를 중심으로 R&D 및 시제품 제작·생산에 필요한 고가의 시설·장비, 관련 기업의 창업~성장 단계별 지원을 위한 인프라인 산학연공동연구기반구축센터 3개, 바이오벤처기업지원센터(BVC; Bio Venture Center) 9개, 지역특화센터 20개, 한국바이오협회 코리아바이오허브센터(Korea Bio-Hub Center) 등과 우수의약품 제조기준(cGMP)에 맞는 한국생산기술연구원 생물산업기술실용화센터(현재 민간위탁 운영) 등이 구축·운영되고 있으며, ③ 특히 생물산업 제품의 신뢰성평가에 특화된 인프라는 지식경제부 지원 한국화학연구원 안전성평가연구소를 포함하여 보건복지부 식품의약품안전청에서 지정된 비임상(GLP) 기관 15개와 임상(GLP) 기관 147개 인프라가 구축·운영되고 있다. 또한, 의약품 개발 R&D 비용 중 2/3 정도의 비용이 임상시험 비용 등에 소요되고 있고, 그 중 30% 이상이 CRO에서 사용되는 것으로 추정되고 있으며, CRO의 주요 성장기반이 되는 제약분야가 지속적으로 확대32)에 따라, 최근 바이오산업 글로벌 진출을 위한 CRO 육성의 중요성도 강조되고 있다.
< 실용화기술개발 단계별 생물산업 관련 주요 인프라 현황 >
인프라단계 | 세부구분 | 인프라기관 | 주요역할 |
Research
(기초연구 및 응용연구) | 의약바이오 | 한국한의약연구원 한국표준과학연구원 한국과학기술연구원 | 한의학표준화기반 연구 바이오분야 측정표준 연구 표적지향형 신규항암제 후보물질 연구 |
산업/그린/융합바이오 | 한국생명공학연구원 한국생명공학연구원 한국생명공학연구원 한국생명공학연구원 한국전자통신연구원 한국과학기술연구원 | 바이오제품 안전성평가 및 정보관리 국가영장류센터 운영 바이오융합 연구 국가생물자원정보 관리 유비쿼터스건강관리모듈/시스템개발 실시간분자영상 스마트센서기술 개발 | |
종합분야 | 한국기초과학지원연구원 한국세포주은행 한국생명공학연구원 한국생명공학연구원 | 고가의 연구기자재 활용 미생물 및 세포주은행(관리 및 공급) 해외생물소재(식물) 허브센터 국가생명공학정책연구 및 확산 |
(계속)
인프라단계 | 세부구분 | 인프라기관 | 주요역할 |
Development Pilot-plant Manufacturing
(개발, 시생산 및 산업화) | 공동장비지원 | 경기바이오센터 등 3개 | 산학연공동연구기반구축 |
벤처기업지원 | 한국생명공학연구원 등 9개 | 바이오벤처기업지원센터(TIC를 포함BVC) 구축 | |
지역클러스터 | 대전테크노파크 등 20개 (지원기반정비 13개 별도) | 지역특화산업 분야 혁신역량 제고 (시설·장비지원, 기술지원, 교육훈련, 시생산(Pilot plant, GMP 등) 및 공인검사 수행 등) | |
종합분야 | 한국생산기술연구원 한국생명공학연구원 한국바이오협회 순창군 장류연구소 | 생물산업기술실용화센터건립(cGMP) 바이오안전성정보센터(LMO관련) 코리아바이오허브구축(Networking) 발효미생물종합활용센터건립(전통식품) | |
GLP(비임상) GCP(임상)
(신뢰성평가) | GLP(비임상) | 식약청 지정 GLP 15개 (한국화학연구원 등) | 비임상 시험항목별 허가기관 (‘10.12) (안전성평가연구소) |
GCP(임상) | 식약청 지정 GCP 147개 | 임상1상, 임상2상, 임상3상(‘11.7) |
* 의약바이오(RedBio): 바이오신약, 바이오장기 등 바이오기술을 보건의료 분야에 응용한 것
* 산업/그린바이오(GreenBio): 유전자변형생물체(LMO), 건강기능식품 등 바이오기술을 농축산 및 식품 분야에 응용한 것
* 융합바이오(WhiteBio): 바이오공정, 바이오환경, 바이오에너지 등 바이오기술을 산업공정/생산 및 환경 분야에 응용한 것
* BVC : 바이오벤처기업지원센터(Bio Venture Center), 전국 바이오벤처기업지원센터간 협력네트워크 및 전략적 연계운영시스템 구축을 통한 효율적 기업지원시스템 구축, 바이오산업의 지역별 균형발전을 도모하기 위해 설립·운영
* TIC : 지역기술혁신센터(Technology Innovation Center), 지역대학을 중심으로 지역내 산업기술혁신을 지원하도록 설립·운영
* 지역클러스터(지역특화센터): 지역특화산업 분야의 혁신역량을 제고하기 위하여 지역내 설치 운영되는 센터이며, 지역의 기획역량, 기술개발역량의 중재자 기능을 수행하는 인프라 역할 수행
나. 현황
(1) 기초·응용연구 단계 인프라
기초·응용연구 단계 인프라는 기초이론 및 실험, 실용 목적의 아이디어 특허 등 개념 정립, 연구실 규모의 기본성능 검증, 연구실 규모의 부품 및 시스템 핵심성능 평가 등을 지원하는 인프라에 해당되며, 주로 국책연구원을 중심으로 인프라가 형성되어 기술개발을 지원하고 있다.
특히 기초·응용연구 단계에서 가장 큰 비중을 차지하는 한국생명공학연구원은 바이오제품 안전성평가 및 정보관리, 국가영장류센터 운영, 바이오융합 연구, 해외생물소재 허브센터 운영, 국가생명공학정책연구 및 확산 등의 기능을 담당하고 있고, 한국과학기술연구원은 표적지향형 신규항암제 후보물질 연구, 실시간 분자영상 스마트센터기술 연구 등의 기능을 담당하고 있으며, 기타 한국한의약연구원의 한의학표준화연구, 한국전자통신연구원의 유비쿼터스 건강관리시스템 연구 등도 중요한 인프라 기능을 담당하고 있다.
그러나, 기초·응용연구 환경에 종합적으로 필요한 2개의 핵심인프라로 한국기초과학지원연구원과 서울대학교 의과대학 암연구소 내에 설치된 한국세포주은행을 꼽을 수 있다. 한국기초과학연구원은 1988년 기초과학 진흥을 위한 연구지원 및 공동연구 수행을 목적으로 설립되어 국가적 대형공동연구장비 개발·설치·운영, 첨단연구장비 이용자 교육, 범 국가적 연구장비 정보수집·분석 등의 기능을 담당하고 있으며, 2011년 현재 대전 본원 및 10개(서울, 부산, 대구, 광주, 전주, 춘천, 순천, 강릉, 오창, 제주) 분원에 총 181명의 인력 및 368종의 지원장비(약 1,139억원 규모)를 보유하고 있으며, 한국세포주은행은 1982년 전국의 연구기관에 필요한 세포주 개발·공급을 목적으로 설립되어 세포주 자원에 관련 정보 수집·보존·공급, 세포주 관련 각종 교육·연수·학술회의 실시, 특허출원 세포주의 기탁 및 보존 등의 기능을 담당하고 있으며, 1993년 UN 산하 세계지적재산권기구로부터 특허미생물의 국제기탁기관의 지위를 취득하였고, 현재 자체개발 세포주 330여종(109종 분양가능), 외국도입 세포주 428종을 보유하고 있다.
(2) 개발·시생산 및 산업화 단계 인프라
개발·시생산 및 산업화 단계 인프라는 기초단계 이후의 효능검증 연구·확인, 확정된 부품·시스템의 시작품 제작·평가, Pilot 규모의 시작품 제작 및 성능 평가 등을 지원하는 인프라에 해당되며, 대부분 지식경제부 지원기관을 중심으로 인프라가 형성되어 산업화를 지원하고 있다.
산업화 지원 인프라는 기본적으로 기업성장 단계별 지원(창업보육 등), 시설·장비구축·활용, 교육훈련, 정보교류, 기술지도 등을 담당하고 있고, 인프라구축 형태로 크게 구분하면, ① 생물산업실용화기반(cGMP, 발효미생물활용센터), ② 바이오안전성기반(LMO), ③ 연계협력기반(Korea Bio-Hub), ④ 산업기술기반조성(BVC, 산학연공동연구기반), ⑤ 지역클러스터(지역특화센터) 등으로 구분될 수 있으며, 국내 생물산업의 여건 및 경쟁력을 고려하여 지식경제부를 중심으로 전략적으로 구축되었다.
생물산업실용화기반 부분을 살펴보면, 1998년 국내 생물의약 분야의 성장에도 불구하고 미국 FDA의 인증을 받은 우수의약품제조및품질관리기준인 cGMP33)기준의 생산공장이 전무한 취약한 실정을 감안하여 선진국 수출지원을 위하여 국제적으로 인정된 기준에 맞는 생물의약품 전문생산시설(생물산업기술실용화센터(1998년~2007년)34)이 구축되었으며 현재 바이넥스에서 위탁운영을 하고 있으며, 2007년 국내 발효식품산업 육성을 위해 전통발효식품(고추장, 된장 등)의 안전성 확보 및 발효미생물자원의 허브 구축을 위하여 발효미생물종합활용센터(1998년~2007년)35)가 구축되었다.
바이오안전성기반 부분을 살펴보면, 2002년 LMO(유전자변형생물체) 를 중심으로 대두된 국제무역질서에 대응하기 위한 의무사항·교육·홍보 등을 위하여 바이오안전성정보센터(2002년~계속)가 구축되었으며, 연계협력기반 부분을 살펴보면, 국내외 바이오네트워크 구축·활성화 및 웹포털 구축·운영을 통한 각종 협업기관 지원을 위하여 코리아바이오허브센터(2004년~계속)가 구축되었다.
또한, 산업기술기반조성 및 지역클러스터 부분을 살펴보면 수도권을 포함한 각 지역에 소재한 중소 바이오벤처기업 등의 특성화 지원 및 현장 밀착형 지원을 위해 산업정책 차원에서의 바이오벤처기업지원센터(BVC, 1998년~2007년)36)와 산학연공동연구기반구축(2004년~2011년)37), 지역균형발전 차원에서의 지역 바이오클러스터(지역특화센터, 2002년~2012년)38)가 구축되었다.
(가) 산업화 인프라 지원 현황
산업화 지원 인프라에 2010년까지 실제 지급한 국비지원금은 25개 기관, 51개 과제에 총 5,379.62억원이 지원되었으며, 51개 과제는 cGMP 1개, LMO 3개, 산기반 3개, 네트워킹 1개, 발효산업 1개, BVC 9개, 지역특화센터 33개(2단계 13개 포함)로 구성되어 있다.
5+2광역경제권역별 2010년까지의 지원금액(지원과제수 51개 포함) 비중을 살펴본 결과, 호남권이 26.5%(1,424.63억원, 13개) 지원되었으며, 수도권이 21.6%(1,163.8억원, 3개), 충청권이 18.3%(983.96억원, 13개), 대경권이 9.4%(506.02억원, 9개), 강원권이 9.5%(511.27억원, 5개), 제주권이 9.1%(487.09억원, 3개), 동남권이 5.6%(302.85억원, 5개) 순으로 지원되었으며, 지원분야별 지원금액(지원과제수 포함) 비중을 살펴본 결과, 각각 산업/그린바이오 분야가 54.6%(2,939.58억원, 33개), 의약바이오 분야가 35.1%(1,887.94억원, 13개), 복합지원(의약/산업/그린) 분야가 10.3%(552.1억원, 5개)등의 비중을 차지하고 있다.
지원과제별 지원서비스 분야별 현황(2개 이상 지원 역할 포함)을 살펴보면, Pilot Plant 지원이 47.3%(26개), GMP 지원이 29.1%(16개), GLP 지원이 1.8%(1개), 공인인증검사(식품위생검사 등)이 16.4%(9개), 기타(연구지원, 정보제공 등)가 5.5%(3개) 등으로 구성되어 있다.

< 광역경제권역별 산업화 인프라 지원 현황 (~2010년) >

< 지원분야별 산업화 인프라 지원 현황 (~2010년) >
(나) 산업화 인프라 지원 성과
산업화 지원 인프라 구축을 통해 2011년 8월 현재 총 197,771평의 부지가 사용되었으며, 행정동, 연구동, 장비지원동, Pilot Plant, 기업입주 공간 등의 건물 규모는 총 78,532평이며, 인프라 지원 상주인력은 총 848명에 다다르고 있다.
구체적으로 5+2광역경제권역별로 구분하면, 수도권이 부지 15,973평, 건물 13,099평, 상주인력 171명, 충청권이 부지 12,306평, 건물 8,389평, 상주인력 104명, 호남권이 부지 106,088평, 건물 26,850평, 상주인력 304명, 동남권이 부지 20,452평, 건물 8,860평, 상주인력 56명, 대경권이 부지24,499평, 건물 8,675평, 상주인력 103명, 강원권이 부지 12,330평, 건물 8,646평, 상주인력 60명, 제주권이 부지 5,525평, 건물 4,013평, 상주인력 50명 등으로 구성되어 있으며, 지원분야별로 비중을 살펴보면, 산업/그린바이오 분야 부지가 68.2%(134,787평), 건물이 59.3%(46,607평), 상주인력이 47.1%(399명), 의약바이오 분야 부지가 27.3%(54,076평), 건물이 31.1%(24,433평), 상주인력이 38.1%(323명), 복합지원 분야 부지가 4.5%(8,908평), 건물이 9.5%(7,492평), 상주인력이 14.9%(126명) 등의 비중을 차지하고 있다.
또한, 2011년 8월까지의 산학연 등 지원 성과(연도별 누계)를 보면, 입주기업수가 2008년말 629개, 2009년말 739개, 2011년 8월 현재까지 764개, 장비구축건수가 2008년말 6,225건, 2009년말 6,680건, 2011년 8월 현재까지 7,167건, 기술지도 및 기술상담 건수가 2008년말 4,560건, 2009년말 5,854건, 2011년 8월 현재 6,799건, 세미나 및 교육훈련 건수가 2008년말 1,539건, 2009년말 1,788건, 2011년 8월말 현재 2,101건, 각종 산업화 지원 등을 통한 수익금 현황이 2008년말 147억원, 2009년말 194.8억원, 2011년 8월말 현재 222.4억원 등에 달하는 우수한 성과를 도출하였으며, 지원분야별로 성과 비중을 살펴보면, 산업/그린바이오 분야 입주기업이 73.2%(559개), 장비구축건수가 73.2%(5,249건), 기술지도 및 기술상담 건수가 60.4%(4,107건), 세미나 및 교육훈련 건수가 58.9%(1,238건), 수익금 규모가 46.8%(104억원), 의약바이오 분야 입주기업이 19.4%(148개), 장비구축건수가 20.5%(1,467건), 기술지도 및 기술상담 건수가 31.5%(2,140건), 세미나 및 교육훈련 건수가 30.1%(633건), 수익금 규모가 42.0% (93.4억원), 복합지원 분야 입주기업이 7.5%(57개), 장비구축건수가 6.3%(451건), 기술지도 및 기술상담 건수가 8.1%(552건), 세미나 및 교육훈련 건수가 10.9%(230건), 수익금 규모가 11.2%(24.9억원) 등의 비중을 차지하고 있다.

< 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과 (입주기업) >

< 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과 (장비구축) >

< 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과 (기술지도) >

< 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과 (교육훈련) >

< 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과 (수익금발생) >

< 지원분야별 산업화 인프라 지원 성과 (2011년 8월말 누계치) >
(3) 신뢰성평가 단계 인프라
신뢰성평가 단계 인프라는 최종 개발제품의 산업화 전후 단계에서의 인체 적용을 통하여 체내 안전성·유효성 등에 대한 신뢰성(비임상, 임상 등) 확보를 지원하는 인프라에 해당되며, 대부분 보건복지부(식품의약품안전청)의 인허가를 득한 지원기관을 중심으로 인프라가 형성되어 지원하고 있다. 구체적으로 식품의약품안전청으로부터 GLP(비임상시험관리기준, Good Laboratory Practice) 시험기관으로 지정된 기관은 2010년 12월 현재 15개 기관이 운영 중에 있으며, GCP(임상시험관리기준, Good Clinical Practice) 기준에 맞는 자격기준을 갖추고 있고 식약청에서 임상시험실시기관으로 지정된 국내기관은 2011년 7월 현재 147개 기관이 운영 중에 있다. 특히, 지식경제부에서는 2010년부터 대규모 투자가 이루어지고 있는 의약품에 관한 임상 수요를 국내 임상 CRO(전문연구용역기관, Contracted Research Organization)를 통해 충족시킴으로써 국내 개발사에 대한 신속하고 저비용의 전문 서비스 제공과 아울러 국내 임상 CRO산업의 육성을 위해 (주)드림씨아이에스, (주)씨엔알리서치, (주)지디에프아이, (주)파마크로, (주)엘에스케이글로벌파마서비스 등 5개의 국내 대표적인 임상 CRO 회사를 중심으로 핵심 인프라 구축을 지원하고 있다. 이를 통해 국내 CRO관련 산업의 성장과 발전을 도모하고 국내 임상 CRO의 활성도를 제고하여 바이오의약품의 해외진출 지원하고자 하는 것이다. 주요 인프라 구축 내용으로는 ① 글로벌 기준에 맞는 임상시험자료 관리시스템(CDM) 구축, ② 다국적 임상시험 진행시 원활한 진행을 위한 임상시험 관리시스템(PM) 구축, ③ 글로벌수준의 임상시험 신뢰성보증시스템(QA)구축과 임상시험 모니터요원(CRA) 교육, ④ 구축된 기반을 활용한 바이오시밀러 제품에 대한 임상시험 시범수행 등이 있다.
< 국내 GLP 현황 (2010년 12월 현재) >
GLP기관 지정순서 | 1호 | 2호 | 3호 | 4호 | 5호 | 6호 | 7호 | 8호 | 9호 | 10호 | 11호 | 12호 | 13호 | 14호 | 15호 | 16호 | 17호 | 18호 | 19호 | 20호 | |
시험기관
시험항목 (세부시험항목) | 한국 화학 연구원 | 유한 양행 | 동아 제약 | LG 생명과학 | CJ | 바이오 톡스텍 | 산업안전 보건 연구원 | 켐온 | 태평양 기술연구원 | 서울대 병원 | 한국화학 융합시험 연구원 | 메드빌 | 바이오 코아 | 아이 바이오팜 | 대구 카톨릭 대학교 | 동아대 병원 | 서울 의약 연구소 | 한국건설 생활환경 시험연구원 | 바이오 인프라 | 한국원자 력의학원 | |
단회투여독성 | 설치류 | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ | - | ○ | ○ | - | - | - | ○ | ○ | - | ○ | - | ○ |
비설치류 | ○ | - | ○ | ○ | - | ○ | - | ○ | - | - | ○ | - | - | - | - | - | - | ○ | - | - | |
반복투여독성 | 설치류 | ○ | ○ | - | ○ | - | ○ | ○ | ○ | - | ○ | ○ | - | - | - | - | - | - | ○ | - | - |
비설치류 | ○ | - | - | ○ | - | ○ | - | ○ | - | - | ○ | - | - | - | - | - | - | - | - | - | |
영장류 | ○ | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
생식발생독성 | 수태능 및 초기배 발생시험 | ○ | - | ○ | ○ | - | ○ | - | ○ | - | - | ○ | - | - | - | - | - | - | - | - | - |
출생전후발생/ 모체기능시험 | ○ | - | - | - | - | ○ | - | ○ | - | - | ○ | - | - | - | - | - | - | - | - | - | |
배태자발생시험 | ○ | - | - | ○ | - | ○ | - | ○ | - | - | ○ | - | - | - | - | - | - | - | - | - | |
유전독성시험 | 복귀돌연변이 시험 | ○ | ○ | - | ○ | - | ○ | ○ | ○ | - | ○ | ○ | ○ | - | - | - | ○ | - | ○ | - | - |
체외염색체이상 or쥐림포마tk | ○ | - | - | ○ | ○ | ○ | ○ | ○ | - | ○ | ○ | ○ | - | - | - | - | - | ○ | - | - | |
체내소핵시험 | ○ | ○ | - | ○ | - | ○ | ○ | ○ | - | ○ | ○ | - | - | - | - | - | - | - | - | - | |
면역독성시험 | 아나필락시스 쇼크반응 | ○ | - | - | ○ | - | ○ | - | ○ | - | - | ○ | - | - | - | - | - | - | - | - | - |
수동피부아나 필락시스반응 | ○ | - | - | ○ | - | ○ | - | ○ | - | - | ○ | - | - | - | - | - | - | - | - | - | |
피부감작성시험 | ○ | - | - | ○ | - | ○ | - | ○ | ○ | - | ○ | - | - | - | - | - | - | ○ | - | - | |
기타면역독성시험 | ○ | - | - | - | - | ○ | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
발암성시험 | ○ | - | - | - | - | ○ | - | ○ | - | - | - | - | - | - | - | - | - | - | - | - | |
의존성시험(비GLP) | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
국소독성시험 | 피부자극시험 | ○ | - | - | ○ | - | ○ | - | ○ | ○ | ○ | ○ | - | - | - | - | - | - | ○ | - | - |
안점막자극시험 | ○ | - | - | ○ | - | ○ | - | ○ | ○ | ○ | ○ | - | - | - | - | - | - | ○ | - | - | |
기타 | 광감작성시험 | ○ | - | - | - | - | ○ | - | - | ○ | - | - | - | - | - | - | - | - | - | - | - |
광독성시험 | ○ | - | - | - | - | ○ | - | - | ○ | - | - | - | - | - | - | - | - | - | - | - | |
독성동태시험 中 분석시험 | - | - | - | - | - | - | - | - | - | - | - | - | ○ | ○ | - | - | ○ | - | ○ | - | |
일반약리시험 (비GLP) | ○ | - | - | - | - | ○ | - | ○ | - | - | - | - | - | - | - | - | - | - | - | - | |
소재지 | 대전 | 용인 | 용인 | 대전 | 이천 | 청원 | 대전 | 용인 | 용인 | 서울 | 김포 | 서울 | 서울 | 대전 | 경산 | 부산 | 서울 | 인천 | 경기 | 서울 | |
지정 | 최초지정일 | ‘88. 7.22 | ‘88. 8.11 | ‘89. 11.15 | ‘95. 5.24 | ‘02. 2.22 | ‘02. 12.13 | ‘02. 6.4 | ‘02. 8.12 | ‘02. 8.21 | ‘03. 1.9 | ‘03. 5.30 | ‘03. 9.20 | ‘05. 5.24 | ‘05. 5.27 | ‘05. 7.26 | ‘05. 11.10 | ‘06. 7.21 | ‘06. 11.6 | ‘09. 1.15 | ‘09. 3.2 |
지정취하일 |
| ‘10. 12.14 | ‘06. 7.15 |
| ‘06. 7.5 |
|
|
| ‘09. 12.31 |
|
|
|
|
|
| ‘10. 6.1 |
|
|
|
| |
* 식약청 임상제도과 자료를 토대로 필자 작성
< 국내 GCP 현황 (2011년 7월 현재) >
지정번호 | 기관명 | 지정일자 | 지정번호 | 기관명 | 지정일자 | ||||
임상1상 | 임상2상 | 임상3상 | 임상1상 | 임상2상 | 임상3상 | ||||
1 | 가톨릭대학교 강남성모병원 | ‘97.3.11 | ‘97.3.11 | ‘97.3.11 | 58 | 인하대학교 의대부속병원 | ‘97.8.12 | ‘97.8.12 | ‘97.8.12 |
2 | 가톨릭대학교 대전성모병원 |
| ‘04.4.8 | ‘97.3.11 | 59 | 경희대학교 치과병원 |
|
| ‘97.11.7 |
3 | 가톨릭대학교 성가병원 |
| ‘05.3.28 | ‘97.3.11 | 60 | 경희대학교 한의대부속한방병원 |
|
| ‘97.11.7 |
4 | 가톨릭대학교 성모병원 | ‘97.3.11 | ‘97.3.11 | ‘97.3.11 | 61 | 대구가톨릭대학교 병원 |
| ‘03.7.29 | ‘98.5.28 |
5 | 가톨릭대학교 성모자애병원 |
| ‘97.3.11 | ‘97.3.11 | 62 | 제일의료재단 제일병원 |
| ‘98.5.28 | ‘98.5.28 |
6 | 가톨릭대학교 성바오로병원 |
| ‘04.2.9 | ‘97.3.11 | 63 | 연세대학교 원주기독병원 |
| ‘05.6.15 | ‘98.8.18 |
7 | 가톨릭대학교 의정부성모병원 | ‘05.10.27 | ‘05.1.13 | ‘97.3.11 | 64 | 고신대학교 복음병원 |
| ‘06.5.22 | ‘99.2.6 |
8 | 한림대학교 강동성심병원 |
| ‘97.3.11 | ‘97.3.11 | 67 | 한림대학교 평촌성심병원 |
| ‘00.7.22 | ‘99.7.19 |
9 | 경북대학교 병원 | ‘05.12.19 | ‘97.3.11 | ‘97.3.11 | 68 | 경상대학교 병원 |
| ‘02.9.24 | ‘99.9.13 |
10 | 경희대학교 의과대 부속병원 |
| ‘97.3.11 | ‘97.3.11 | 69 | 충남대학교 병원 |
| ‘99.9.20 | ‘99.9.20 |
11 | 포천중문의과대학 분당차병원 |
| ‘97.3.11 | ‘97.3.11 | 70 | 고려대학교 안산병원 | ‘06.2.21 | ‘00.1.25 | ‘00.1.25 |
12 | 계명대학교 동산병원 |
| ‘99.6.15 | ‘97.3.11 | 71 | 국립마산결핵병원 |
| ‘00.10.23 | ‘00.10.23 |
13 | 고려대학교 의대부속구로병원 |
| ‘99.11.26 | ‘97.3.11 | 72 | 순천향대학교 의대부속부천병원 | ‘01.5.22 | ‘01.5.22 | ‘01.5.22 |
14 | 고려대학교 의대부속병원 | ‘97.3.11 | ‘97.3.11 | ‘97.3.11 | 73 | 단국대학교 치과병원 |
|
| ‘01.7.11 |
15 | 국립중앙의료원 |
|
| ‘97.3.11 | 74 | 국립암센터 | ‘02.3.26 | ‘01.7.11 | ‘01.7.11 |
16 | 단국대학교 의대부속병원 | ‘97.3.11 | ‘97.3.11 | ‘97.3.11 | 76 | 인제대학교 일산백병원 |
|
| ‘01.10.30 |
17 | 동아대학교 병원 | ‘03.11.10 | ‘97.3.11 | ‘97.3.11 | 77 | 국민건강보험공단 일산병원 |
| ‘01.11.9 | ‘01.11.9 |
18 | 부산대학교 병원 | ‘03.11.10 | ‘97.3.11 | ‘97.3.11 | 78 | 영훈의료법인 대전선병원 |
| '02.5.31 | '02.5.31 |
19 | 삼성생명공익재단 삼성서울병원 | ‘97.3.11 | ‘97.3.11 | ‘97.3.11 | 79 | 울산대학교 병원 | ‘06.2.14 | ‘02.9.24 | ‘02.9.24 |
20 | 서울대학교 병원 | ‘97.3.11 | ‘97.3.11 | ‘97.3.11 | 80 | 의료법인 을지병원 |
| ‘02.9.24 | ‘02.9.24 |
22 | 순천향대학교 의대부속병원 | ‘00.10.23 | ‘00.10.23 | ‘97.3.11 | 81 | 대구파티마병원 |
| ‘02.9.24 | ‘02.9.24 |
23 | 아산복지사업재단 서울아산병원 | ‘97.3.11 | ‘97.3.11 | ‘97.3.11 | 82 | 동국대학교 경주병원 |
| ‘03.3.31 | ‘03.3.31 |
24 | 아주대학교 병원 | ‘05.2.19 | ‘97.3.11 | ‘97.3.11 | 83 | 조선대학교 부속병원 |
| ‘03.7.29 | ‘03.7.29 |
25 | 연세대학교 세브란스병원 | ‘97.3.11 | ‘97.3.11 | ‘97.3.11 | 84 | 원광대학교 광주한방병원 |
| ‘03.9.25 | ‘03.9.25 |
27 | 연세대학교 강남세브란스병원 |
| ‘97.3.11 | ‘97.3.11 | 85 | 분당서울대병원 |
| ‘03.9.25 | ‘03.9.25 |
28 | 연세대학교 치과병원 | ‘97.3.11 | ‘97.3.11 | ‘97.3.11 | 86 | 순천향대학교 천안병원 | ‘04.2.9 | ‘04.2.9 | ‘04.2.9 |
29 | 영남대학교 의대부속병원 | ‘97.3.11 | ‘97.3.11 | ‘97.3.11 | 87 | 국립서울병원 |
|
| ‘04.2.9 |
30 | 왈레스기념침례병원 |
|
| ‘97.3.11 | 88 | 을지의과대학 부속병원 |
| ‘04.4.8 | ‘04.4.8 |
31 | 원광대학교 의과대학병원 |
| ‘97.3.11 | ‘97.3.11 | 89 | 보훈복지의료공단 서울보훈병원 |
| ‘05.6.15 | ‘04.4.8 |
32 | 길의료재단 중앙길병원 | ‘99.12.29 | ‘99.12.29 | ‘97.3.11 | 90 | 강릉원주대학교 치과병원 |
|
| ‘04.5.13 |
33 | 삼성의료재단 강북삼성병원 |
| ‘97.3.11 | ‘97.3.11 | 91 | 제주대학교 병원 |
| ‘04.5.13 | ‘04.5.13 |
34 | 이화여자대학교 의대목동병원 | ‘97.3.11 | ‘97.3.11 | ‘97.3.11 | 92 | 동의대학교 부속한방병원 |
| ‘04.6.3 | ‘04.6.3 |
36 | 인제대학교 부속부산백병원 | ‘97.3.11 | ‘97.3.11 | ‘97.3.11 | 93 | 건국대학교 충주병원 |
|
| ‘04.6.12 |
37 | 인제대학교 상계백병원 |
| ‘97.3.11 | ‘97.3.11 | 94 | 전남대학교 화순병원 |
| ‘04.11.11 | ‘04.6.12 |
38 | 인제대학교 서울백병원 |
| ‘06.10.22 | ‘97.3.11 | 95 | 메리놀병원 |
|
| ‘04.6.18 |
39 | 전남대학교 병원 | ‘04.10.4 | ‘97.3.11 | ‘97.3.11 | 96 | 청주성모병원 |
| ‘06.5.19 | ‘04.9.6 |
40 | 전북대학교 병원 | ‘06.4.10 | ‘97.3.11 | ‘97.3.11 | 97 | 대동병원 |
|
| ‘04.10.12 |
41 | 중앙대학교 병원 |
| ‘05.4.15 | ‘97.3.11 | 98 | 의료법인 한라병원 |
| ‘04.11.5 | ‘04.11.5 |
43 | 서울의료원 |
|
| ‘97.3.11 | 99 | 건국대학교 병원 |
| ‘06.3.17 | ‘04.11.26 |
44 | 충북대학교 병원 |
| ‘97.3.11 | ‘97.3.11 | 100 | 건양대학교 병원 |
| ‘04.12.1 | ‘04.12.1 |
46 | 한국원자력연구소 원자력병원 |
| ‘97.3.11 | ‘97.3.11 | 101 | 성광의료재단 차병원 |
| ‘05.1.13 | ‘05.1.13 |
47 | 한국전력공사 부속한일병원 |
|
| ‘97.3.11 | 102 | 명지의료재단 명지병원 |
| ‘05.1.19 | ‘05.1.19 |
48 | 한림대학교 강남성심병원 |
| ‘97.3.11 | ‘97.3.11 | 103 | 강원대학교 병원 |
| ‘05.1.20 | ‘05.1.20 |
49 | 한림대학교 부속춘천성심병원 |
| ‘97.3.11 | ‘97.3.11 | 104 | 창원파티마병원 |
|
| ‘05.5.7 |
50 | 한림대학교 한강성심병원 |
| ‘97.3.11 | ‘97.3.11 | 105 | 강릉아산병원 |
|
| '05.8.11 |
51 | 한양대학교 구리병원 |
|
| ‘97.3.11 | 106 | 경원대학교부속 길한방병원 |
|
| ‘05.8.29 |
52 | 한양대학교 병원 | ‘05.12.13 | ‘97.4.29 | ‘97.3.11 | 107 | 동국대학교 병원 | ‘05.9.14 | ‘05.9.14. | ‘05.9.14. |
53 | 원광대학교 치과병원 |
|
| ‘97.6.11 | 108 | 효산의료재단 샘안양병원 |
|
| ‘05.10.24 |
55 | 가톨릭대학교 성빈센트병원 |
| ‘00.1.25 | ‘97.6.11 | 109 | 대진의료재단 분당제생병원 | ‘05.11.04 | ‘05.11.4. | ‘05.11.4. |
56 | 연세대학교 광주세브란스병원 |
|
| ‘97.6.11 |
|
|
|
|
|
57 | 서울특별시립보라매병원 |
|
| ‘97.6.23 |
|
|
|
|
|
(계속)
지정번호 | 기관명 | 지정일자 | 지정번호 | 기관명 | 지정일자 | ||||
임상1상 | 임상2상 | 임상3상 | 임상1상 | 임상2상 | 임상3상 | ||||
110 | 대전대학교 부속한방병원 |
| ‘05.12.28 | ‘05.12.28 | 133 | 용인정신병원 |
| ‘09.3.6 | ‘09.3.6 |
111 | 성균관대학교 삼성창원병원 |
|
| ‘06.5.23. | 134 | 동국대학교 한의대 분당한방병원 |
| ‘09.6.3 | ‘09.6.3 |
112 | 상지대학교 부속한방병원 |
|
| ‘06.6.2. | 135 | 국립공주정신병원 |
| ‘09.7.9 | ‘09.7.9 |
113 | 광주기독병원 |
| ‘06.6.5 | ‘06.6.5 | 136 | 대전대학교 둔산한방병원 |
| ‘09.7.22 | ‘09.7.22 |
114 | 경희대학교 동서신의학병원 | ‘06.8.17 | ‘06.8.17 | ‘06.8.17 | 137 | 한국보훈복지의료공단 대구보훈병원 |
| ‘09.7.24 | ‘09.7.24 |
115 | 부산성모병원 |
| ‘06.12.26 | ‘06.12.26 | 138 | 대항병원 |
| ‘09.7.30 | ‘09.7.30 |
116 | 원광대학교 산본한방병원 |
| ‘07.1.8 | ‘07.1.8 | 139 | 의료법인 동강의료재단 동강병원 |
| ‘09.8.19 | ‘09.8.19 |
117 | 경희대학교 강동한방병원 |
| ‘07.2.9 | ‘07.2.9 | 140 | 서울특별시 은평병원 |
| ‘09.11.9 | ‘09.11.9 |
118 | 동국대학교 일산 한방병원 |
| ‘07.2.9 | ‘07.2.9 | 141 | 부산보훈병원 |
| ‘09.12.15 | ‘09.12.15 |
119 | 국립부곡병원 |
| ‘07.8.23 | ‘07.8.23 | 142 | 의료법인 영서의료재단 천안충무병원 |
| ‘09.12.24 | ‘09.12.24 |
120 | 김원묵기념봉생병원 |
| ‘07.10.29 | ‘07.10.29 | 143 | 글로리병원 |
| ‘10.3.9 | ‘10.3.9 |
121 | 국립나주병원 |
| ‘07.12.4 | ‘07.12.4 | 144 | 대전대학교부속천안한방병원 |
| ‘10.3.23 | ‘10.3.23 |
122 | 자생한방병원 |
| ‘08.2.27 | ‘08.2.27 | 145 | 차의과대학교부속구미차병원 |
| ‘10.3.31 | ‘10.3.31 |
123 | 대구한의대학교 대구한방병원 |
| ‘08.3.28 | ‘08.3.28 | 146 | 베데스다병원 |
| ‘10.4.20 | ‘10.4.20 |
124 | 세명대학교 부속 제천한방병원 |
| ‘08.3.28 | ‘08.3.28 | 147 | 서울송도병원 |
| ‘10.5.28 | ‘10.5.28 |
125 | 세명대학교 부속 충주한방병원 |
| ‘08.5.20 | ‘08.5.20 | 148 | 의료법인혜원의료재단 세종병원 |
| ‘10.5.31 | ‘10.5.31 |
126 | 동신대학교 부속 한방병원 |
| ‘08.7.3 | ‘08.7.3 | 149 | 인제대학교 해운대백병원 |
| ‘10.6.14 | ‘10.6.14 |
127 | 건양의료재단 김안과병원 |
| ‘08.7.30 | ‘08.7.30 | 150 | 동남권원자력의학원 |
| ‘11.3.8 | ‘11.3.8 |
128 | 베스티안병원 |
| ‘08.8.7 | ‘08.8.7 | 151 | 동신대학교 부속 순천한방병원 |
| ‘11.3.28 | ‘11.3.28 |
129 | 누네안과병원 |
| ‘08.8.20 | ‘08.8.20 | 152 | 칠곡경북대학교병원 |
| ‘11.4.4 | ‘11.4.4 |
130 | 우석대학교 전주한방병원 |
| ‘08.12.23 | ‘08.12.23 | 153 | 예수병원유지재단 예수병원 |
| ‘11.4.29 | ‘11.4.29 |
131 | 양산부산대학교병원 |
| ‘08.12.24 | ‘08.12.24 | 154 | 부산대학교한방병원 |
| ‘11.5.24 | ‘11.5.24 |
132 | 광주보훈병원 |
| ‘09.1.9 | ‘09.1.9 | 155 | 순천성가롤로병원 |
| ‘11.7.6 | ‘11.7.6 |
총 147개 임상시험실시기관 지정 | |||||||||
* 식약청 임상제도과 자료를 토대로 필자 작성
< 국내 대표적인 2개 비임상 CRO 회사 현황 (2011년 8월 현재) >

* 바이오의료기기산업융합원천기술개발사업 추진현황조사(2011.7, KEIT)
< 국내 대표적인 5개 임상 CRO 회사 현황 (2011년 8월 현재) >

* 바이오의료기기산업융합원천기술개발사업 추진현황조사(2011.7, KEIT)
라. 발전 과제
생명공학 인프라 분야는 생물산업의 발전을 위한 하부구조를 구성하며, 기초연구에서 사업화까지의 실용화 전 과정에 걸쳐 다양한 역할을 통해 필요한 분야이다. 일반적으로 R&D 지원 인프라를 세부적으로 구분하면, 고가의 장비지원(연구용·분석용·시제품용·검정용 등), 교육훈련지원, 정보화지원, 표준화지원, 국제협력 지원, 신뢰성평가지원, (비)임상지원, 생산지원, 입주공간 등 공간지원, 마케팅지원, 위탁생산 등으로 구분이 가능하나, 실질적인 R&D 생산성 및 전문성 제고를 위해서는 이러한 다양한 인프라 서비스가 효과적으로 결집된 형태로 운영되는 것이 중요하다. 특히, 전문인력의 안정적인 확보를 통한 특성화, 종합화된 인프라의 내실화 지원은 R&D 활동의 전주기적인 지원체계 확립 차원에서 특히 필요하다.
기 구축된 국책연구소, 산업화 및 신뢰성 단계의 인프라 시설은 그 역할이 매우 중요하며, 앞으로도 생명공학 인프라의 발전을 위해서 인프라간 연계성 강화, 관련 주무부처간 협조체계 강화 및 예산 확대, 글로벌 경쟁력 제고를 위한 인프라 내 전문인력의 지속적인 확보 및 지원서비스 개발이 강화될 필요가 있으며, 선진국형 생물제품평가 인프라(GLP, GCP, GMP 내실화)의 지속적 지원은 생물산업의 성장을 가속화할 것이다.
특히, GLP, GCP 등과 관련하여 글로벌 수준의 (비)임상 CRO 인프라 확충을 위해서는 국내 민간 CRO 시스템의 선진화를 통한 역량강화, CRO 기관간 원활한 정보 교류를 통한 네트워킹 활성화와 상호협력 강화, 정부차원의 추가적인 공공 CRO 인프라 조성, 전문인력 개발, 국내외 특허 및 가이드라인 등에 대한 정보제공 등 강화를 위해 산·학·연·관이 함께 노력해야 할 것이다.
제5장 생명공학 관련 법제도 현황
제5장 생명공학 관련 법제도 현황
제1절 바이오안전성 동향
1. 서론
유전자변형기술, 세포융합 등 현대 생명공학기술의 발달로 다양한 유전자변형생물체(Living Modified Organisms, LMO)가 연구․개발되고 산업화됨에 따라 LMO로 인해 인간의 건강과 환경에 미칠 위해요소를 사전에 방지하기 위한 노력이 진행되어왔다. 이와 관련하여 국제연합(UN) 산하 환경전문기구인 유엔환경계획(United Nations Environment Programme, UNEP)은 「생물다양성협약」(Convention on Biological Diversity)의 부속서인 「바이오안전성에 관한 카타르헤나의정서」(Cartagena Protocol on Biosafety, CPB)가 2001년 1월 캐나다 몬트리올에서 개최된 CBD 특별당사국총회에서 채택되었다. 동 의정서는 2003년 6월 팔라우가 50번째로 비준함에 따라 그로부터 90일 이후인 2003년 9월 국제적으로 발효되었고, 2011년 6월 기준, 160개국39)(우리나라포함)이 가입하고 있다<표1>.
<표1> 바이오안전성의정서 가입현황(2011년 6월 기준 160개국)
|
구분2) 지역 |
의정서 발효 기준 50개국3) |
발효 기준일 이후 가입국 |
국가 수 |
|
아프리카 |
보츠와나, 카메룬, 지부티, 가나, 케냐, 레소토, 라이베리아, 말리, 모리셔스, 모잠비크, 탄자니아, 튀니지, 우간다(13) |
나이지리아, 부르키나파소, 남아공, 세네갈, 에티오피아, 마다가스카르, 이집트, 잠비아, 세이셸, 감비아, 토고, 르완다, 알제리, 니제르, 나미비아, 짐바브웨, 베냉, 에리트레아, 콩고민주공화국, 수단, 리비아, 모리타니, 카보베르데, 스와질란드, 콩고, 차드, 가봉, 기니, 부룬디, 중앙아프리카공화국, 말라위, 코모로, 앙골라, 기니비사우, 소말리아, 모로코(36) |
49 |
|
아시아 ․ 태평양 |
부탄, 피지, 인도, 몰디브, 마샬군도, 나우루, 니우에, 오만, 팔라우, 사모아(10) |
몽고, 북한, 말레이시아, 캄보디아, 통가, 요르단, 이란, 일본, 키프로스, 베트남, 방글라데시, 타지키스탄, 시리아, 키리바시, 스리랑카, 솔로몬, 라오스, 인도네시아, 중국, 파푸아뉴기니, 태국, 예맨, 필리핀, 카타르, 키르키즈스탄, 사우디아라비아, 대한민국, 미얀마, 투르크메니스탄, 카자흐스탄, 파키스탄(31) |
41 |
|
중남미 ․ 카리브해 |
바베이도스, 볼리비아, 콜롬비아, 쿠바, 에콰도르, 멕시코, 니카라과, 파나마, 세인트키트네비스, 트리니다드토바고, 베네수엘라(11) |
세인트 빈센트, 앤티카바부다, 엘살바도르, 브라질, 바하마, 그레나다, 벨리즈, 파라과이, 페루, 도미니카, 과테말라, 세인트루시아, 도미니카공화국, 코스타리카, 가이아나, 수리남, 온두라스(17) |
28 |
|
중앙․동유럽 |
벨로루시, 불가리아, 크로아티아, 체코, 몰도바, 슬로베니아, 우크라이나(7) |
루마니아, 리투아니아, 슬로바키아, 폴란드, 헝가리, 라트비아, 에스토니아, 아르메니아, 알바니아, 아제르바이잔, 유고, 세르비아, 몬테네그로, 그루지야, 보스니아(15) |
22 |
|
서유럽 ․ 기타 |
오스트리아, 덴마크, 프랑스, 룩셈부르크, 노르웨이, 스페인, 스웨덴, 스위스, 네덜란드(9) |
터키, 아일랜드, 영국, 독일, 이탈리아, 벨기에, 그리스, 핀란드, 포르투갈, 뉴질랜드, 몰타공화국(11) |
20 |
출처 : 바이오안전성의정서 홈페이지(www.biodiv.org/biosafety/)내용 재구성
한편 우리나라는 지난 2000년 9월 의정서에 가입의사를 밝혔으며, 시민단체와 더불어 바이오안전성의 확보를 요구하는 목소리가 커졌다. 이를 위해 의정서 국내이행체제를 구축하는데 초석을 마련하고자 2001년 3월 지식경제부(舊 산업자원부)가 주관이 되어 「유전자변형생물체의 국가 간 이동 등에 관한 법률」(이하 ‘LMO법’)을 제정․공포하였다. 이후 각 관계기관별로 동법 시행에 필요한 하위 법령 제정을 위해 노력해 왔고, 2007년 8월 이러한 노력의 마지막 단계로서 LMO법 통합고시안이 입법예고 되었다. 이후 2007년 10월 3일 의정서에 비준함으로써 143번째 가입국이 되었으며 그로부터 90일 이후인 2008년 1월 1일에 의정서 및 LMO국내법이 시행되었다.
이에 본 절에서는 2009년 하반기에서부터 2011년 상반기까지의 LMO를 둘러싼 국제법적 논의 동향과 더불어 우리나라가 동 의정서의 이행과 국내 바이오안전성 확보를 위해 어떠한 노력을 전개해왔는지 등에 대해 기술한다.
2. LMO를 둘러싼 국제법적 논의 동향
가. 의정서 당사국총회 논의 동향
2008년 1월 의정서와 LMO법이 국내 발효됨에 따라 우리나라는 비로소 당사국의 자격을 갖추고 의정서 관련 논의에 대응하게 되었다. 2010년에는 제5차 당사국총회가 일본 나고야에서 약 120여 개 당사국 대표, 8개 국제기구 관계자, 그린피스를 포함한 NGO 대표 등 약 1,600여명이 참석한 가운데 개최되었으며 우리나라는 외교통상부 정해욱 아태경제협력대사를 단장으로 지식경제부 강명수 과장 등 17명의 대표단을 파견하여 총회 의제에 대하여 의견을 적극적으로 개진하였다.
이번 당사국총회에서는 이전 당사국총회의 최대 쟁점으로 많은 논쟁 속에 매듭짓지 못했던 책임 및 구제관련 이슈가 총회 첫날 새벽 극적으로 타결되었으며 이외에도 여러 가지 특징적인 면이 있었다. 첫째, 기존의 지루한 협상대립구도를 벗어나 보다 실용적인 협상이 진행되었으며 둘째, LMO의 정보공유를 담당하고 있는 BCH의 위상을 다시 한 번 재확인 할 수 있었다. 셋째, 공공인식․교육․참여, 사회경제적 고려, 능력형성 등 새로운 이슈가 본격적으로 부각되었다. 마지막으로 생명공학기술을 바라보는 당사국들의 입장변화가 있었는데 생명공학기술 개발을 옹호하는 소수의 국가, 사전예방을 강조하는 개발도상국 등이 의견대립 구도를 벗어나 의견 차이를 좁혀 책임 및 구제에 관한 추가 의정서 채택과 같이 현재 논쟁중인 현안들의 타협가능성을 높인 것이 있다.
이번 당사국총회의 가장 큰 이슈는 Nagoya-Kuala Lumpur Supplementary Protocol on Liability and Redress to the Cartagena Protocol on Biosafety로 공식 명명된 ‘나고야- 쿠알라룸푸르 LMO 책임 및 구제 추가의정서’(이하 ‘추가의정서’)가 채택된 것으로 LMO의 국가간 이동으로 생물다양성의 보전과 지속가능한 이용에 피해가 발생할 경우 책임 및 구제를 위한 당사국의 대응조치에 관한 국제절차규칙을 규정하였다는 점이다. 이번에 채택된 추가의정서는 생명다양성협약의 바이오안전성의정서의 내용을 추가하고 보충하는 성격의 의정서로 유전자변형생물체로 인한 사후적인 피해에 대해 배상하고 국가기관에 일정한 조치를 요구할 수 있는 민사절차를 마련하는 것을 핵심 내용으로 하고 있다. 이는 LMO 관련 국제규범을 완결하고 유전자변형생물체와 관련된 법적 체계를 완성한 측면에서 의미를 가진다.
나. 경제개발협력기구(OECD) 논의 동향
경제협력개발기구(Organization for Economic Cooperation and Development, OECD)는 그 임무를 지속가능한 경제성장 지원, 고용창출, 삶의 질 향상, 경제적 안정성 유지, 타국가의 경제개발 지원, 세계 무역신장 기여로 정하고 있다. 이를 위해 OECD는 회원국의 정책 경험을 비교하고, 공통의 문제에 대한 해답을 추구하며, 우수실행방법을 개발하고, 국내외 정책의 조화를 위한 체계를 제공하고 있다. 1960년 20개국에서 출발하여 현재 회원국 수는 34개국이며 우리나라는 1996년 12월 가입하였다. OECD는 생물다양성협약의 부속서인 바이오안전성의정서(Biosafety Protocol) 이행에 있어서 회원국 간의 생명공학기술 규제법 및 제도와 관련한 국가 간 규제에 대해서 조화를 유지하고 무역마찰을 최소화하기 위하여 1995년 4월 전문가 그룹회의를 처음 구성하여 약 9개월 간격으로 실무회의를 개최하고 있다. 회의의 주요 목표는 워크샵 등을 통해 LMO의 위해성 평가 국제표준기술서들의 초기 체계를 구축하고 다음 단계인 바이오트렉 온라인(Bio-Track Online, OECD LMO관련 데이터베이스)을 확립하여 회원국과 비회원국 모두에게 활용토록 하는데 있다. 이에 따라 2009년 10월(제23차)과 2010년 6월(제24차)에 ‘생명공학 규제감시조화 실무 작업반 회의’와 ‘신규식품 및 사료의 안전성 작업반회의’가 개최되었다.
GM종자와 농산물의 저수준 혼입(Low Level Presence, LLP)에 대한 문제가 제21차 회의부터 OECD차원에서 쟁점화 되었고 제22차 회의에서는 ‘GM종자와 농산물의 저수준 혼입이 환경에 미치는 영향 사업(산업계를 대표하는 BIAC에서 제안)’에 대한 사업제안서가 제출되었지만 추진이 지연되었다. 제23차 회의에서는 의장단이 설문지(안) 작성을 위한 세부사항을 작성하여 회원국에게 설문지의 답변을 요청하였지만 우리나라를 포함한 13개국만이 제출하여 미제출 회원국에게 답변서를 추가 제출토록 요청하였다. 제24차 회의에서 개발국과 사무국은 적극적 사업계획(안) 마련을 추진키로 하고, 차기회의에서 논의하기로 하였다. 이렇게 GM종자 및 농산물의 LLP 문제는 당분간 합의를 이루기가 매우 어려운 민감한 문제로 인식되어 지속적인 회의를 통해 검토 및 합의 방안을 모색하는 데 시간이 걸릴 것으로 판단된다.
GM종자와 농산물의 LLP에 대한 사업진행이 주요 이슈로 논의되고 있는 상황에서 우리나라는 LLP사업의 사전질의서를 관련행정기관의 사전협의를 통하여 적극 대응하였으며, LMO법의 규정에 따라 관계중앙행정기관은 1년 단위의 안전관리 세부시행계획을 준비 중에 있음을 알렸고 GM식품 표시제 개정의 진행과, 개정표시제는 식용유, 시럽 등의 가공식품까지 GM포함여부를 표시하도록 확대할 예정임을 전달하였다.
GM작물의 수입국인 우리나라는 소비자 안전, 환경위해성 등 안전성 관리가 중요한 바, OECD회원국 및 아르헨티나, 브라질 등 관련 국가의 동향을 파악하기 위해서라도 OECD 생명공학 관련 작업반회의(WG), 전문가회의(Task Force), 관련 워크샵에 우리나라 각계 전문가의 적극적인 참여, 자발적 기여가 필요하다 할 수 있다.
다. WTO 논의동향
세계화에 따른 국가간 교역확대로 수입식품이 증가하고 LMO식품 등 새로운 기술발전에 따른 신소재 식품이 등장하여 전반적인 위해요소의 증대를 가져왔으며 국내 규제조치가 국제 통상분쟁으로 확대될 가능성이 발생하게 되었다. WTO 위생 및 검역조치(Agreement on the Application of Sanitary and Phytosanitary Measures, SPS)관련 분쟁은 크게 동물, 식물, 식품안전에 관한 SPS조치로 나누어 볼 수 있으며 SPS에 관련된 대부분의 무역분쟁은 식품과 관련하여 제기되고 국민건강과 식품안전을 확보하려는 각국의 노력에 의해 발생한다. SPS 관련 분쟁해결의 핵심은 소극적으로는 WTO 협정상의 의무를 이행함으로써 통상분쟁을 사전에 예방하고 적극적으로는 한국산 농산물 및 식품의 국제 경쟁력 강화와 국민건강의 보호라는 주권국가의 위생․검역주권을 어느 정도를 관철시키느냐의 문제라고 할 수 있다.
LMO제품에 대한 국내․외 규제는 국민건강 및 환경보호와 밀접한 관련이 있으며 LMO제품의 안전성 문제는 국가간 인식의 차이 및 규제의 차이로 인한 국제통상분쟁의 주요원인 중의 하나이다. 즉 LMO제품의 안전에 대한 소비자의 불신과 LMO제품에 대한 국가간 상이한 규제는 생산자와 소비자간 갈등을 넘어 이제 국제통상의 주요이슈 중의 하나이다. EC(European Community)-생명공학제품 분쟁사례는 LMO제품의 안전성과 위해성에 관련된 각국의 규제차이로 야기된 분쟁으로 EC의 LMO제품에 대한 일시적 유통승인중단(Moratorium) 조치에 대하여 미국, 캐나다, 아르헨티나가 WTO분쟁해결기구에 제소한 사건이다. LMO제품의 안전에 관한 수입국인 EC와 수출국인 미국, 캐나다, 아르헨티나의 국내규제의 차이로 인하여 분쟁이 발생하였으며 1998년 이후 지속된 LMO제품에 대한 EC의 수입규제에 대해 미국이 지금까지의 소극적인 자세를 철회하고 2003년 5월 WTO에 정식으로 회부하면서 LMO제품의 유통승인 정지(Moratorium)와 유통승인 금지 조치 철회를 요구함으로 촉발되어 현재까지 WTO 분쟁해결을 위한 절차가 진행 중이다<표2>.
이에 2003년 8월 WTO 분쟁해결기구(DSB, Dispute Settlement Body)는 패널을 설치하였고 2006년 2월 잠정보고서를 채택하여 분쟁당사국에 회람하였다. 2009년 6월 EC가 제출한 분쟁해결기구 권고 및 규정의 이행에 관한 현황보고서에서 캐나다와 아르헨티나는 WTO 패널보고서(RPT) 합리적 이행 기간을 7월 31일, 12월 31일로 각각 연장하였고 몇 차례 논의가 진행되고 2009년 7월 합리적 이행기간이 2010년 1월 31일로 연장되었다. EC는 2010년 1월부터 명칭을 EU로 바꾸고 미국과 아르헨티나와의 분쟁 해결을 위한 건설적인 논의를 계속적으로 할 준비가 있음을 분쟁해결기구에 통보하였다. 2010년 7월 EU와 미국은 생명공학문제를 다루는 기술협의를 개최하기로 합의하였고, 2010년 7월 생명공학문제를 다룬 기술협의의 개최 사실을 분쟁해결기구에 통보하였다. 2010년 8월부터 2011년 2월까지 EU는 7차례에 걸쳐서 분쟁해결기구 권고 및 규정의 이행에 관한 현황보고서를 제출하였다.
<표2> EC(EU)-생명공학제품 분쟁경과(2009.6~2011.2)
|
시 기 |
세부내용 |
관련 WTO규정 |
|
2009.6 |
EC, DSB4) 권고 및 규정 이행에 관한 현황보고서 제출 - WTO 패널보고서(RPT) 합리적 이행기간 연장 |
DSU 제21.6조 |
|
2009.7 |
EC/아르헨티나, DSB 권고 및 규정 합리적 이행기간 수정 협정 체결 |
DSU 제21.3(b)조 |
|
2009.7 |
EC/캐나다, 농업생명공학제품 시장접근에 관한 양자협의 채널 설치 합의 |
DSU 제21.6조 |
|
2009.8 |
EC, DSB 권고 및 규정 이행에 관한 현황보고서 제출 - EC, 캐나다와 합의 도달(WT/DS/292) |
DSU 제21.6조 |
|
2009.9 |
EC, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 |
DSU 제21.6조 |
|
2009.10 |
EC, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 |
DSU 제21.6조 |
|
2009.11 |
EC, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 |
DSU 제21.6조 |
|
2009.12 |
EU, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 |
DSU 제21.6조 |
|
2010.1 |
EU, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 |
DSU 제21.6조 |
|
2010.2 |
EU/아르헨티나, DSB 권고 및 규정의 합리적 이행기간 수정을 위한 협정 체결 개정 |
DSU 제21.3(b)조 |
|
2010.2 |
EU, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 - DSB 권고 및 규정의 합리적 이행기간 연장 |
DSU 제21.6조 |
|
2010.3 |
EU, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 - DSB 권고 및 규정의 합리적 이행기간 연장 |
DSU 제21.6조 |
|
2010.3 |
EU/아르헨티나, 상호합의된 해결방안(Mutually Agreed Solution)을 분쟁해결기구에 통보 |
DSU 제3.6조 |
|
2010.4 |
EU, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 - EU, 아르헨티나와 합의 도달(WT/DS293) |
DSU 제21.6조 |
|
2010.5 |
EU, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 |
DSU 제21.6조 |
|
2010.6 |
EU, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 |
DSU 제21.6조 |
|
2010.7 |
EU, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 - 미국/EU, 생명공학에 관한 기술협의 개최 합의 |
DSU 제21.6조 |
|
2010.8 |
EU, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 - 미국/EU, 생명공학에 관한 기술협의 개최 |
DSU 제21.6조 |
|
2010.9 |
EU, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 |
DSU 제21.6조 |
|
2010.10 |
EU, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 |
DSU 제21.6조 |
|
2010.11 |
EU, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 |
DSU 제21.6조 |
|
2010.12 |
EU, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 |
DSU 제21.6조 |
|
2011.1 |
EU, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 |
DSU 제21.6조 |
|
2011.2 |
EU, DSB 권고 및 규정의 이행에 관한 현황보고서 제출 |
DSU 제21.6조 |
3. 국내 법제도 동향
가. LMO법 정비동향
우리나라는 2000년 9월 6일 의정서에 향후 비준 의사가 있음을 표명(의정서 서명)하였으며, 의정서 이행의 국가책임기관인 지식경제부는 의정서 가입에 대비하여 범국가적 차원에서 의정서의 국내 이행을 위한 법적 기반구축 작업을 진행하였다<표 3>.
그 과정을 살펴보면 먼저 2000년 8월 10일부터 29일까지 「유전자변형생물체의 국가간 이동 등에 관한 법률(이하 ‘LMO법’)」 제정안을 입법예고하였으며, 공청회와 규제 심사 등의 절차와 2001년 2월 28일에 국회 본회의의 의결을 거쳐 2001년 3월 28일에 법률 제6448호로 LMO법이 제정․공포되었다. 또한 2002년 2월에는 LMO법 시행령 및 시행규칙 제정 시안을 마련하여 관계기관 협의를 거쳐 2002년 6월 25일부터 7월 15일까지 입법예고를 실시(舊 산업자원부 공고 제2002-127호)하였다. 이후 시행령은 2002년 12월 17일부터 2005년 9월까지 추가적인 관계기관 협의와 법제처의 심사를 거쳐 2005년 9월 30일 대통령령 제19062호로 제정․공포되었으며, 시행규칙은 2006년 3월 10일 舊 산업자원부령 제327호로 관보에 게재되었다.
2007년은 지식경제부를 중심으로 한 관계기관의 법적․제도적 정비과정이 마무리된 해였다. LMO 관계기관은 LMO법 시행의 구체적 절차를 담은 통합고시 제정안을 마련하고, 2007년 6월 ‘LMO법․제도 설명회’를 개최한 후 같은 해 8월 1일부터 8월 21일까지 입안예고를 실시(산업자원부공고 제2007-272호)하였다. 그리고 자구 수정 등의 마지막 수정 작업을 거쳐 2007년 12월 27일 관보에 게재(과학기술부고시 제2007-19호, 농림부고시 제2007-80호, 산업자원부고시 제2007-153호, 보건복지부고시 제2007-105호, 환경부고시 제2007-189호, 해양수산부고시 제2007-115호, 식품의약품안전청고시 제2007-78호)됨으로써 통합고시가 확정되었다. 또한 LMO 수입승인 및 취급관리에 관한 사항의 LMO법 적용은 국내 수입 날짜가 아닌 수출국의 선적 날짜를 기준으로 하는 ‘수입승인 등에 관한 적용례’를 골자로 하여 LMO법의 부칙 일부를 2007년 12월에 개정하였다.
이와 같이 LMO의 안전성 확보를 위한 제반 법적․제도적 기반을 완료함과 동시에, 우리나라 정부는 의정서 비준서를 유엔사무국에 기탁(2007년 10월 3일)하여 의정서의 이행 계획을 국제사회에 알렸으며, 비준서 기탁 90일 이후인 2008년 1월 1일부터 의정서 및 LMO법이 국내에 발효되어, 현재까지 시행하고 있다.
<표 3> LMO법 추진 경위
|
구 분 |
추진 내용 |
|
2000년 1월 |
「바이오안전성에 관한 카르타헤나의정서(바이오안전성의정서)」 채택 |
|
2000년 8월 |
「유전자변형생물체의 국가간 이동 등에 관한 법률(LMO법)」 제정안 입법예고 |
|
2000년 9월 |
우리나라의 바이오안전성의정서 서명 |
|
2000년 10월 |
LMO법 제정안에 대한 공청회 개최 |
|
2000년 11월 |
LMO법 제정안에 대한 토론회 개최 |
|
2001년 2월 |
LMO법(안) 국회 본회의 의결 |
|
2001년 3월 |
LMO법 제정․공포 |
|
2002년 2월 |
LMO법 시행령 및 시행규칙 제정안 마련 |
|
2002년 6월 |
LMO법 시행령(안) 및 시행규칙(안) 입법예고 |
|
2003년 9월 |
바이오안전성의정서 국제적 발효 |
|
2005년 9월 |
LMO법 시행령 확정(관보 게재) |
|
2005년 10월 |
LMO법 시행규칙 제정안 관계기관 협의 |
|
2005년 11월 |
LMO법 시행규칙 제정안 법제처 심의 |
|
2005년 12월 |
LMO법․제도 설명회 개최 |
|
2006년 3월 |
LMO법 시행규칙 확정(관보 게재) |
|
2007년 4월 |
LMO법 통합고시 제정안 관계기관 협의 |
|
2007년 6월 |
LMO법․제도 설명회 개최 |
|
2007년 8월 |
LMO법 통합고시 제정안 입법예고 |
|
2007년 10월 |
바이오안전성의정서 비준서 유엔사무국 기탁 |
|
2007년 11월 |
LMO법․제도 찾아가는 설명회 개최(서울, 대전, 대구, 광주, 부산) |
|
2007년 12월 |
LMO법 일부 개정안 확정(관보 게재), 통합고시 확정(관보 게재) |
|
2008년 1월 |
바이오안전성의정서 및 LMO법 발효 |
|
2009년 12월 |
LMO법 일부 개정 |
|
2011년 6월 |
LMO법 및 통합고시 일부 개정 추진 |
나. LMO법 시행 및 안전관리계획 수립동향
LMO법 및 동법 시행령과 시행규칙에 의하면 그 용도에 따라 해당 LMO의 안전관리를 책임지고 있는 관계 중앙행정기관이 지정되어 있다. 이에 따라 시험․연구용 LMO는 교육과학기술부, 농업용․수산용 LMO는 농림수산식품부, 산업용 LMO는 지식경제부, 보건의료용 LMO는 보건복지부, 환경정화용 LMO는 환경부에서 그 안전관리를 책임지고 있다. 또한 의정서 이행에 대한 국가책임기관 역할은 지식경제부가, 의정서 이행을 위한 국가연락기관 역할은 외교통상부에서 담당하고 있다. 또한 국제바이오안전성정보센터(BCH, Biosafety Clearing House)와의 정보 교류 및 LMO관련 국내외 정보의 수집, 관리, 제공 등의 업무는 LMO법 제32조에 따라 국가책임기관에서 지정한 한국바이오안전성정보센터(KBCH, Korea Biosafety Clearing House)에서 담당하고 있다<그림 1>.
이러한 관계기관별 역할에 따라 연구개발, 수입, 수출, 생산, 유통 등 전반에 걸쳐 LMO법은 현재까지 효과적으로 시행되어 왔다. 그리고 이와 같이 효과적으로 시행되고 있는 LMO법 및 시행령․시행규칙, 통합고시 등 LMO 안전관리 체계를 범부처 차원에서 통합․시스템화하여 안전관리의 효율성을 제고하기 위한 ‘제1차 유전자변형생물체 안전관리계획’이 수립된 바 있다. 이 안전관리계획은 LMO법 제7조제1항 및 동법 시행령 제4조에 근거하여 관계 중앙행정기관의 장이 소관별로 5년마다 수립․시행하도록 규정되어 있다. 이에 따라 6개의 관계 중앙행정기관에서는 2008년 상반기 중에 소관 LMO에 대한 안전관리계획 초안을 수립하였고, 이후 부처간 협의와 전문가 용역 등의 과정을 거쳐 관계기관 통합 안전관리계획(안)을 마련하였다. 동 안전관리계획(안)은 2008년 9월 26일 서울 전경련회관에서 공청회를 개최하여 다양한 국민의견도 수렴하였다. 이러한 절차를 바탕으로 ‘제1차 유전자변형생물체 안전관리계획안’이 마련되었으며, 국무총리를 위원장으로 하는 바이오안전성위원회의 심의를 거쳐 2008년 12월에 최종 확정되어 시행되고 있다. 이후 제1차 안전관리계획을 근거로 각 부처에서는 세부시행계획을 매년 수립하여 시행하고 있다.
<그림 1> 바이오안전성 국가관리 체계
|
|
|
|
|
|
바이오안전성위원회 (심의기구, 위원장:국무총리) |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
국가책임기관(지식경제부) (의정서 이행 행정 담당) |
|
|
|
|
|
|
국가연락기관(외교통상부) (의정서 이행 연락담당) |
||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
한국바이오안전성정보센터 (정보 수집, 관리 등) |
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
교육과학기술부 |
|
농림수산식품부 |
|
지식경제부 |
|
보건복지부 |
|
환경부 |
|
국토해양부 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
시험․연구용 LMO의 수출입등에 관한 업무 |
|
농업용․․수산용 LMO의 수출입등에 관한 업무 |
|
산업용 LMO의 수출입등에 관한 업무 |
|
보건의료용 LMO의 수출입등에 관한 업무 |
|
환경정화용 LMO의 수출입등에 관한 업무 |
|
해양용 LMO의 수출입등에 관한 업무 |
|||||||||||
2008년 1월 1일부터 LMO법이 시행됨에 따라 해당 관계기관을 통해 시험연구용․식품용․사료용 LMO에 대한 수입승인 또는 수입신고가 이루어지고 있다. LMO법이 시행되기 시작한 2008년과 비교하자면 2009년, 2010년은 시험연구용 LMO의 수입신고는 계속 증가하는 반면, 식품용․사료용 LMO의 수입승인은 국제 곡물가격의 변화에 따라 변화하는 추세를 보이고 있다.
2009년 한 해 동안 국내에 수입승인 또는 수입신고된 LMO는 총 2,601건이었다. 이 중 시험연구용 LMO는 183건으로 주로 마우스(쥐)와 대두 등이 수입되었으며, 식품용 LMO는 50건으로 옥수수와 콩이 수입 승인되었다. 사료용 LMO는 옥수수와 면화 등이 2,366건 수입승인되었으며, 비료용으로 2건이 수입승인되었다. 국내 수입 승인된 국내 수입승인된 전체 식품용․사료용 LMO는 약 728만 톤으로 2008년 대비 약 15% 감소하였으며 주된 수입국은 미국이었다.
2010년에 국내에 수입승인 또는 수입신고된 LMO는 총 3,075건이었다. 시험연구용 LMO는 마우스와 대두 등이 총 201건 수입신고되었고, 1건이 수입승인되었다. 식품용 LMO는 총 90건으로 옥수수와 콩이 수입 승인되었으며, 사료용 LMO는 옥수수, 면화, 콩 등이 총 2,781건, 비료용 LMO는 총 2건이 수입승인 되었다. 국내 수입 승인된 전체 식품용․사료용 LMO는 약 849만 톤으로 2009년 대비 약 16.5% 증가하여 2008년 수준으로 회복하였으며 주된 수입국은 역시 미국이었다.
2008년 연구개발과제 조사를 통해 1,200여 개 LMO 연구시설이 신고된 이후, 자율적인 신고를 유도한 2009~2010년에는 445개의 연구시설이 신고되어 2010년 12월 기준으로 1654개의 1·2등급 LMO 연구시설이 교육과학기술부 및 관계기관에 신고되었으며, 2008년부터 신고된 연구시설 중 연구 과제의 종료 또는 연구시설의 이전 등으로 인한 설치·운영 변경사항 및 연구시설의 폐쇄가 발생하였다. 허가가 필요한 3·4등급 연구시설은 2010년 12월 기준 23건이 허가되어 운영되고 있다. 이렇게 신고 또는 허가받은 연구시설에서는 LMO관련 연구를 진행할 수 있으나, 환경방출실험 등 위해가능성이 높은 실험과 연구개발 행위에 대해서는 별도의 승인절차가 필요하다. 2010년 12월 기준으로 고추, 벼, 감자, 콩 등 193건의 LMO 연구개발을 승인하였고, 실험 종료 후 안전관리 이행 실태에 대한 점검을 수행하였다. 그리고 국내 수입 이전단계의 필수 안전관리 절차인 위해성 심사단계에서 농업용 59종, 식품용 76종이 심사 완료되었으며, 우리나라에서는 이렇게 심사완료된 LMO만이 국내에 수입될 수 있다<표4>.
<표4> LMO수입승인 등 현황(2008년 1월 ~ 2010년 12월)
|
구 분 |
건수, 천톤 |
관계기관 |
|
|
위해성심사 |
농업용 |
59건 |
농촌진흥청 |
|
식품용 |
76건 |
식품의약품안전청 |
|
|
수입승인 |
옥수수(식품용) |
2,180천톤 |
식품의약품안전청 |
|
콩(식품용) |
2,661천톤 |
식품의약품안전청 |
|
|
옥수수(사료용) |
19,186천톤 |
농산물품질관리원 |
|
|
콩, 면실 등(사료용) |
309천톤 |
농산물품질관리원 |
|
|
수입신고 |
시험연구용(쥐, 세균등) |
496건 |
교육과학기술부 |
|
수출통보 |
시험연구용 쥐등 |
13건 |
지식경제부 |
|
연구시설 연구개발 |
시설신고 |
1654건 |
교육과학기술부 및 관계기관 |
|
시설허가 |
23건 |
교육과학기술부 및 질병관리본부 |
|
|
연구개발 승인 |
193건 |
교육과학기술부 및 관계기관 |
|
4. 바이오안전성 정보관리
LMO의 안전한 이용을 위한 경험 및 정보 공유를 위해 바이오안전성의정서 제20조에서는 국제바이오안전성정보센터(이하 ‘BCH’)를 설치하도록 규정하고 있으며, 각 회원국들이 자국의 BCH(National BCH)를 설치하여 BCH로 정보를 제공하도록 권고하고 있다. 이에 우리나라의 BCH인 한국바이오안전성정보센터(KBCH)는 국내외 LMO 관련정보를 수집․관리․제공․홍보하기 위한 업무를 정식적으로 수행하고 있으며, 이를 위하여 관계기관통합정보망, 바이오안전성포탈, 영문포탈 등의 LMO 정보관리 체계를 구축하여 운영하고 있다.
LMO법에 따른 관계중앙행정기관인 교육과학기술부, 농림수산식품부, 지식경제부, 보건복지부, 환경부, 국토해양부에서도 행정기관의 업무에 따라 LMO관련 정보를 제공하고 있다. 교육과학기술부는 ‘시험․연구용 LMO정보시스템’(http://biosafety.mest.go.kr)을 통해 LMO 연구시설, 시험·연구용 LMO 수입 및 개발·실험과 관련된 신고·허가·승인 신청을 편리하게 할 수 있도록 하고 있고, 농림수산식품부는 ‘농식품 안전․품질 통합정보시스템’(http://www.agrin.go.kr)을 통해 사료용 LMO 수입업자들이 직접 인터넷상에서 수입승인 신청을 할 수 있도록 하였다. 보건복지부 식품의약품안전청에서는 ‘유전자재조합식품(GMO) 정보 홈페이지’(http://www.kfda.go.kr/gmo)를 통해 식품용 LMO에 대한 정보를 제공하고 있으며, 환경부는 ‘LMO환경안전성센터’(LESC, Environmental safety center, http://ecosystem.nier.go.kr/lesc)를 운영하여 유전자변형생물체의 생태계 안전관리를 위한 정책수립, 연구현황 등 관련 정보와 국내 LMO 자연환경위해성 심사협의 내용을 투명하게 국민에게 공개하고 있다.
KBCH의 관계기관통합정보망은 LMO법에 따른 6개 관계기관의 소관 LMO의 연구개발, 위해성평가 및 심사, 생산 및 수출입과 관련된 안전관리 등에 필요한 정보를 국가 전체 차원에서 통합관리하기 위해 구축된 폐쇄 형태의 관계기관 간 정보 네트워크로 정기적인 LMO 정보담당자 회의를 통해 원활한 시스템 연동을 협의하고 있다.
KBCH의 국문 바이오안전성포털은 LMO 및 바이오안전성에 관한 정보를 국민(산·학·연·관·민)에게 제공하는 오픈형 정보시스템으로서 LMO에 대한 국민의 인식 제고를 목적으로 운영되고 있다 2008년, 2010년 두 차례에 걸쳐 개편을 실시, 사용자의 다양한 요구에 부응하고자 하였으며, 이를 통해 일반 대중들이 LMO의 연구개발 단계에서부터 소비․이용에 이르는 전 과정에 대한 이해를 돕고 LMO관련 전문가들이 최신 뉴스․동향을 바이오안전성포탈에서 모두 확인할 수 있도록 관련 정보를 제공하고 있다.
5. 바이오안전성 커뮤니케이션
바이오안전성의정서 제23조에서는 LMO에 대한 일반대중의 적극적인 참여를 위한 커뮤니케이션 활동을 규정하고 있다. 한국바이오안전성정보센터(KBCH) 및 LMO 관계기관은 포털사이트를 통해 LMO관련 정보를 제공해 오고 있으며, 정기간행물과 연구사업 보고서, 교육 및 홍보자료 등을 발간하고 있다. 또한 LMO관련 정보의 공유와 이를 바탕으로 사회적 합의를 위한 소통의 필요성이 대두됨에 따라 ‘LMO포럼’을 기획하여 2010년 2차례의 국내세미나와 1차례의 국제세미나를 진행하여 일반국민들의 참여를 이루어 내기도 하였다.
청소년들의 폭넓은 이해와 관심을 제고하고자 ‘전국 학생 바이오안전성 논술대회’를 2007년부터 매년 개최하고 있으며, 2010년도에는 전국의 고등학교 학생들을 대상으로 바이오안전성(Biosafety) 및 바이오산업(Bioindustry)을 주제로 다양한 생각을 자유롭게 교환할 수 있는 기회를 제공하는 토론대회를 함께 개최하였다.
또한 LMO법 시행과 함께 LMO법(제32조)에 근거하여 관계기관 등으로부터 수집·정리된 자료를 바탕으로 LMO 연구개발, 위해성심사, 수입승인, 작물재배, 공공인식 등 LMO의 개발에서부터 소비에 이르는 주요 통계를 언론에 발표하여 정보 접근성을 제고하였다. 한겨레신문사의 과학웹진 ‘사이언스온(http://scienceon.hani.co.kr)’과 공동으로 LMO에 대한 찬반논란에 대해 진지하게 접근할 수 있는 기획특집인 “GMO의 ‘논쟁상자’를 다시 열다”를 추진하여 신문특집지면을 통한 정보의 제공과 이 내용을 바탕으로 단행본을 출판하였다. 이 밖에도 LMO포럼(www.lmoforum.org)과 논술대회(//essay.biosafety.or.kr), 토론대회(//debate.biosafety.or.kr), 다음(DAUM)과 네이버(NAVER)에 ‘LMO맨 블로그’와 같은 패밀리 사이트를 개설 운영함으로 일반인과 이해당사자를 대상으로 각 계층별 수준에 맞는 콘텐츠를 제작·제공하였다.
2000년부터 바이오안전성에 관한 분기별 주요 동향과 이슈를 균형 잡힌 시각에서 정리하여 주요 여론 주도층의 인식 및 이해를 증진시키고자 계간지「BIOSAFETY」를 발간하고 있으며 LMO관련 정보 전달을 목적으로 다양한 홍보책자를 발간․배포하고 있다.
6. 향후전망
바이오안전성의정서와 LMO법이 시행된 지 4년의 시간이 흘렀다. 그동안 관계기관에서는 국제협약과 국내법, 2008년에 수립된 ‘제1차 유전자변형생물체 안전관리계획’을 근거로 LMO안전관리를 위해 노력을 다해왔으며 변화된 국내외 사정에 적합한 LMO법 체제 구축을 위하여 최선을 다할 예정이다. 우선 LMO법 시행의 최일선 제도라고 할 수 있는 통합고시 개정 절차를 마무리하며, 동시에 LMO법 개정 행정 절차를 추진하여 금년 중에는 국회 통과까지 마무리할 계획이다. 이후 시행령, 시행규칙, 통합고시 개정을 통하여 2012년 중에는 LMO 및 바이오안전성과 관련한 최근 상황이 합리적으로 반영된 LMO법 및 하위 규정 체제를 갖추어 시행할 수 있을 것으로 예상한다.
또한 금년과 내년에 걸쳐서는 추가의정서 국내 입법 및 시행을 준비하기 위한 절차를 진행할 계획이다. 2012년 말에는 추가의정서의 국제적 발효가 예상됨에 따라 금년 하반기부터 바이오안전성정보센터에서는 가칭 “나고야․쿠알라룸푸르 추가의정서 전문가 포럼”을 구축하여 추가의정서 주요 내용과 이슈, 국내외 동향을 분석하고, 국내 입법체제를 마련하기 위한 기초 작업을 수행할 것이다. 이러한 분석 결과를 바탕으로 관계기관과 협의하여 2012년 중에는 국내 입법안을 마련하고, 국민 의견 수렴 및 국제적 진행상황에 맞추어 입법 절차를 진행할 계획이다. 또한 금년 9월까지는 바이오안전성의정서 국내이행보고서를 작성하여 의정서 사무국에 제출할 예정이며, 2012년 10월 인도에서 개최될 제6차 바이오안정성의정서 당사국총회 준비에도 최선을 다할 계획이다.
2008년 1월 LMO법이 시행된 이후 관계기관에서는 LMO로 인한 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 대한 위해를 방지하기 위하여 LMO의 위해성 심사, 수입승인, 운송․보관․유통, 연구개발 등과 관련한 안전관리에 최선을 다하고 있다. LMO 관계기관뿐만 아니라 LMO의 개발․생산․수입․수출․판매․운반 및 보관 등의 관련활동에 종사하고 있는 이해당사자, 그리고 시민단체를 포함한 우리나라 국민 모두가 LMO법의 시행에 적극 협조하여 바이오안전성의 확보 및 바이오산업의 건전한 발전의 토대가 형성될 수 있기를 기대한다.
제2절 생명윤리 동향
1. 한국에서의 생명윤리 논의의 전반적 동향
우리나라도 다른 여러 국가와 마찬가지로 국가 발전의 원동력 중 하나인 생명과학 및 의료 분야의 발전에 기대하는 바가 크다. 인간의 의식주 문제가 어느 정도 해결되고 생존 기간이 증가함에 따라 오랜 기간 동안 질병 없이 건강하게 살아가고자 하는 인간의 욕망은 당연한 것이다. 이러한 인간의 본능적인 욕망을 충족하기 위해서는 인간 생명 현상에 대한 규명과 더불어 질병 현상을 규명하고 질병의 예방과 진단 및 치료 방법을 개발하는 것이 매우 중요한 과제 중 하나이다. 따라서 의생명과학연구는 인간에게 직접적인 영향을 미칠 뿐만 아니라 거의 모든 의생명과학연구가 인간을 대상으로 이루어진다.40) 이러한 의생명과학연구의 특성으로 인하여 의생명과학에 대한 윤리적, 법적 논의는 필수적인 것이다.
한국은 의생명과학연구에서 문제가 될 수 있는 윤리적 사안들을 <생명윤리및안전에관한법률>이라는 법적 장치를 통하여 규율하는 방식을 선택하고 있다. 매우 전문적인 분야인 의생명과학연구의 많은 영역을 법적 수단을 통하여 규율하는 방식이 과연 효과적일 수 있는지 또한 바람직한 방식인지 대해서는 논란이 있다. 의생명과학연구의 일차적 규율을 법적 수단을 통하여 하고자 하는 시도에 대한 회의적인 시각 중 하나는 빠르게 변화하는 의생명과학 분야를 경직된 법이 대처하기 어렵다는 사실에 근거하고 있다. <생명윤리및안전에관한법률>이 제정되게 된 가장 큰 이유가 인간 배아줄기세포연구라는 것은 주지의 사실이다. 인간 배아줄기세포연구가 인간 생명에 대한 침해인가 혹은 인간 존엄성을 해하는 것인가에 대한 논의가 <생명윤리및안전에관한법률>을 제정하는 기폭제가 되었는데, 이러한 논의는 당시의 유효한 과학적 사실과 윤리적․ 법적 신념을 바탕으로 이루어진 것이다.41) 하지만 현재 우리가 가지고 있는 과학적 지식과 기술은 당시와는 많이 다르고 윤리적 기준과 법적 기준도 완전히 동일하다고는 말할 수 없을 것이다. 특히 새로운 기술의 발달은 우리가 예상하지 못하였던 사안들에 대한 논의가 필요함을 알려주고 있다. 또한 의생명과학연구는 한국에서 고립되어 수행되는 것이 아니라 국제간의 협력과 경쟁을 통하여 진행되는 측면이 있기 때문에 다른 나라의 상황도 우리의 논의에 많은 영향을 미치게 된다. 이와 같은 의생명과학의 발달과 기술의 변화는 윤리적, 법적 논의에도 영향을 미쳐 새로운 고려사항들이 나타남과 더불어 기존의 고려사항들의 논점도 달라지게 할 수 있다.
2. 인간 유전학연구
인간 유전학연구는 인간 유전체의 염기서열정보를 바탕으로 유전인자의 기능을 총체적으로 조사하여 인간의 생명현상을 규명하고자 하는 연구 분야이다. 인간 유전학연구는 유전자가 모든 것을 결정한다는 유전자결정론이라는 위험성을 야기할 수 있다는 비판도 있지만, 인간의 생명현상을 규명하는 데에 매우 유용한 연구일 뿐만 아니라 인간에게 발생하는 질병의 기전을 규명하여 질병을 예방하고 진단법 및 치료방법을 개발하는 데에 매우 큰 도움을 주는 연구이다. 인간 유전학연구는 유전자의 물리적 지도를 규명해내는 것으로부터 출발하여 인간 유전체의 기능을 규명하는 유전체연구, 유전자치료42)로까지 확대되고 있다.
인간 유전학연구가 효율적으로 이루어지기 위해서는 유전정보43)의 데이터베이스화가 필수적이다. 이러한 유전정보의 데이터베이스화를 위해서 유전자은행44)이 필요하며 유전자은행에는 유전자검사로 얻어진 유전정보뿐만 아니라 유전검체도 보관·관리되고 있다. <생명윤리및안전에관한법률>은 인간 유전학연구를 규율하는 여러 규정들을 두고 있는데, 특히 제32조는 유전자은행의 허가와 신고에 대하여 규정하고 있다.
유전자검사기관이나 유전자은행은 보관하고 있는 유전검체나 유전정보를 다른 연구자나 타기관에 제공할 수 있다. 그런데 이와 같은 유전정보 및 유전검체의 제공은 유전검체를 제공한 사람의 동의의 효력 범위와 관련하여 검토를 필요로 한다. <생명윤리및안전에관한법률>은 제26조에서 유전자검사의 동의에 대하여 규정하고 있는데, 동조 1항 1호에는 유전자검사 또는 유전자연구의 목적에 대한 서면동의를 규정하고 2호에서는 1호의 규정에 의한 목적 외로 검사대상물을 이용하거나 타인에게 제공하는 것에 대한 동의 여부 및 그 범위에 대한 사항을 서면동의 받도록 하고 있다. 또한 3호에서는 2호의 규정에 따라 검사대상물을 타인에게 제공하는 경우에 개인정보를 포함시킬 것인지 여부에 대해서도 서면동의를 받도록 하고 있다. 한편 동법률 제33조는 유전자은행이 유전정보 등을 제공하는 경우에 대하여 규정하고 있는데, 이러한 경우에 대해서는 동의에 대한 규정은 존재하지 않고 다만 제35조에 유전정보 등의 보호에 대한 규정을 두고 있다. 하지만 개인의 유전정보 보호는 사생활의 비밀에 속하는 헌법상의 권리임을 고려할 때 유전검체나 유전정보의 제공자의 동의 없이 타인에게 유전검체나 유전정보를 제공하여서는 안 된다는 것은 당연하다고 할 것이다. 문제는 처음 유전검체나 유전정보를 제공받을 때 설명되지 아니하였던 연구 목적으로 당해 유전검체나 유전정보를 제공하는 경우이다. 특히 유전자은행에서 유전검체를 보관하다가 타 기관에 분양하는 경우 처음 유전검체를 제공받을 때 명시한 사용 목적 이외의 경우에도 유전검체를 분양할 수 있는가는 검토가 필요한 사항이다. 개인식별을 할 수 없는 익명화 상태로 제공되는 경우에는 비교적 문제가 적다고 할 것이지만, 개인식별이 가능한 경우에도 유전검체의 제공이 무제한적으로 가능하다면 이는 실질적으로는 충분한 설명에 근거한 동의라는 요구가 무의미하게 되거나 혹은 포괄동의를 인정하는 것과 같은 결과가 발생할 수 있다고 할 것이다. 예를 들어 제공되는 유전검체가 유전자연구에 이용될 수 있다는 내용을 고지하고 동의를 받는 것은 연구의 목적이나 내용을 특정하는 것이 아니기 때문에 유효한 동의라고 보기 어렵다. 그런데 특정 연구에 대한 동의를 얻은 후 유전자검사기관이나 유전자은행에서 보관 중인 유전검체를 유전검체 제공자에게 설명되지 않은 연구에 이용하기 위하여 분양하는 것은 동의 규정을 우회하여 이용하는 경우에 해당한다고 할 것이다. 이에 대하여 보건복지부가 “검사의 목적의 동일성이 인정되는 한도에서 여러 가지 종류의 검사대상물을 사용하는 것, 여러 가지 종류의 유전자검사를 시행하는 것에 대하여 하나의 유전자검사 동의서가 유효”하다는 유권해석45)을 하고 있음을 근거로 새로운 동의 없이 유전검체를 분양할 수 있다고 해석할 가능성도 있지만, 이러한 유권해석은 연구의 동일성이 인정되는 범위 내에서 새로운 동의가 필요하지 않다는 것을 의미하는 것이지 언제나 유전검체를 제공할 수 있다는 의미는 아니다.46) 동일성 여부에 대한 판단을 기관생명심의위원회 등에서 엄격하게 한 후 동일성이 인정되지 않는다면 새로운 동의를 받거나 개인의 사생활을 침해하지 않도록 엄격한 익명화를 위한 조치를 요구하여야 할 것이다.
3. 줄기세포연구
줄기세포연구는 크게 배아줄기세포연구와 성체줄기세포연구, 유도만능줄기세포연구로 크게 나눌 수 있다. 각각의 줄기세포연구는 장점과 단점을 가지고 있기 때문에 서로 보완적으로 연구가 진행되어야 할 필요가 있다.47)
줄기세포연구와 관련하여 고려하여야 할 윤리적, 법적 사항들 중 최근에 문제가 되는 것 중 하나는 임상화 단계에서의 문제이다. 줄기세포가 실제 임상적으로 이용될 경우 어떠한 기준에 의하여 임상적 적용을 허용할 것인가가 문제가 될 수 있다. 줄기세포의 임상적 적용은 아직 초기 단계이기 때문에 보다 엄격한 기준이 필요하리라고 생각된다. 아직 통상적인 의료행위로 인정받기는 어려운 새로운 의료행위의 경우에는 의생명과학연구와 의료행위의 중간 영역에 존재하는 행위이다. 따라서 과학적·의학적으로 유효하고(유효성), 시행 당시의 지식과 기술에 의할 때 안전하다고 여겨지며(안전성), 다른 치료방법으로는 치료효과를 기대하기 어려운 경우에(보충성), 충분한 설명에 근거한 동의를 받아서 이해관계의 충돌이 없는 상태에서 시행되어야 할 것이다.48)
최근 많은 주목을 받고 있는 줄기세포연구 방법은 유도만능줄기세포연구이다. 유도만능줄기세포연구는 역분화줄기세포연구라고도 하는데, 이미 분화가 끝난 세포를 미분화상태로 되돌려 줄기세포를 생성하는 기술이다. 유도만능줄기세포연구는 배아줄기세포에서 논란이 있는 난자의 사용이나 생명의 침해 등의 논란은 발생할 가능성이 적지만 역분화를 시키기 위하여 사용하는 벡터로 이용되는 레트로바이러스 등으로 인하여 암이 발생하거나 돌연변이가 발생할 가능성이 있다.49) 또한 바이러스의 유전자가 인간의 세포와 융합되는 유전자융합 현상이 발생할 가능성이 있다. 이와 같은 유전자융합이 인간의 존엄성을 해한다는 주장이 있을 수 있다. <생명윤리및안전에관한법률>은 유전자융합 전반을 규율하는 규정을 두고 있지는 않지만 유전자융합의 경우에 적용될 수 있는 규정들이 있다. 예를 들어 동법률 제12조 1항은 인간의 배아를 동물의 자궁에 착상시키는 행위나 동물의 배아를 인간의 자궁에 착상시키는 행위를 금지하고 있으며, 동조 2항 1호는 인간의 난자를 동물의 정자로 수정시키거나 동물의 난자를 인간의 정자로 수정시키는 행위를 금지하고 있다. 또한 동조 2항 2호는 핵이 제거된 인간의 난자에 동물의 체세포 핵을 이식하거나 핵이 제거된 동물의 난자에 인간의 체세포 핵을 이식하는 행위를 금지하고 있으며 동조 2항 3호는 인간의 배아와 동물의 배아를 융합하는 행위를 금지하고 있다. 이상과 같은 규정들은 생식세포나 배아 단계에서의 인간과 동물의 유전자가 융합되는 경우를 금지하고자 하는 목적을 가진 규정들로 생각된다. 의생명과학연구에 있어서 동물이나 바이러스 등으로부터 유래한 생물학적 물질들을 이용하는 한 유전자융합의 문제는 언제나 발생 가능한 것이다. 또한 유전자융합은 다양한 단계에서 이루어지기 때문에 모든 유전자융합이 인간의 정체성 혹은 존엄성을 해한다고 할 수도 없다. 인간의 정체성에 본질적인 변화를 주지 아니하는 범위 내에서의 동물이나 바이러스로부터 유래한 생물학적 물질의 이용행위는 윤리적 문제를 일으키지 않는 것으로 생각된다.50)
4. 바이오장기연구
바이오장기연구는 동물의 세포, 조직, 장기를 인간에게 이식함으로써 질병을 치료하고자 하는 연구이다. 우리나라에서 이루어지는 바이오장기연구는 형질전환 복제 미니돼지로부터 인간에게 이식 가능한 세포, 조직, 장기를 생산하여 이를 이식하는 것을 목표로 하고 있다. 바이오장기가 임상적으로 적용되어 환자의 치료에 이용되기 위해서는 면역거부반응과 수인성 감염의 문제가 먼저 해결되어야 한다.
환자에게 바이오장기를 이식할 경우 발생할 수 있을 것으로 우려되는 면역거부반응과 수인성 감염을 관리하기 위해서 바이오장기를 이식받은 환자나 환자와 밀접한 생활관계에 있는 사람들을 일정 기간 혹은 평생 동안 관리할 필요가 있다는 견해가 지배적이다. 바이오장기연구와 관련된 가이드라인들도 대부분 이에 대한 규정을 두고 있다. 바이오장기이식을 받은 환자나 그와 밀접한 관련을 가지고 생활하고 있는 가족 등에 대한 관리는 만일의 경우에 발생할 수 있는 수인성 감염 등의 위험을 사전에 예방하고 바이오장기이식을 받은 환자에서 발생하는 여러 가지 생리적·병리적 기전들을 규명할 수 있다는 점에서 그 필요성이 인정된다. 반면에 환자뿐만 아니라 가족 등 밀접한 생활관계를 영위하고 있는 사람들을 지속적인 관리 하에 두는 것은 헌법상 보장되고 있는 사생활의 비밀 및 자유에 대한 중대한 침해가 될 수 있다. 또한 신체의 자유 및 주거의 자유에 대한 지나친 제한이라는 비판을 받을 수 있다. 바이오장기의 임상적 적용 초기에는 수인성 감염 등의 위험을 예방하기 위하여 환자 및 그와 밀접한 관련을 가지는 사람들에 대한 지속적인 감시가 필요하다. 하지만 그러한 관리는 막연한 공포가 아니라 과학적·의학적 근거에 의하여 정당화될 수 있어야 할 것이다. 한편 바이오장기가 이식될 경우 환자 자신에게 나타날 수 있는 장기적 부작용이나 그 기전을 규명하기 위하여 환자나 가족 등을 지속적으로 관리하는 것은 기본권에 대한 중대한 침해가 될 수 있으므로 충분한 설명에 근거한 동의에 근거하여 이루어져 할 것이다.51)
환자에게 바이오장기를 이식하는 경우에 충분한 설명에 근거한 동의는 통상적인 의료행위와 마찬가지로 요구되는 윤리적·법적 요건이다. 그런데 바이오장기의 이식과 같이 의생명과학연구로부터 의료행위로 이행하는 행위의 경우에는 충분한 설명에 근거한 동의에 있어서 통상적인 의료행위와는 다른 고려사항들이 있는 것으로 생각된다. 바이오장기를 이식받고자 하는 환자는 통상적인 치료방법으로는 질병을 치료할 수 없는 상태에 놓여 있는 환자일 가능성이 큰데, 환자 자신 및 환자와 밀접한 관계에 있는 사람들이 지속적인 관리를 받는데 대한 자발적 동의가 가능할 것인가의 문제가 있다. 또한 바이오장기의 임상화 초기에는 적절한 정보가 충분히 존재하지 않기 때문에 충분한 설명에 근거하여 동의할 수 있는가의 문제도 발생한다. 이러한 점들을 고려할 때 충분한 설명에 근거한 동의라는 의료행위에서 요구되는 요건을 바이오장기의 임상화 초기와 같은 실험적 치료행위에 그대로 적용하기는 어려울 것으로 생각된다. 또한 충분한 설명에 근거한 동의가 뿌리를 두고 있는 자율성 존중의 원칙뿐만 아니라 다른 의료윤리의 원칙들, 특히 선행의 원칙 등을 통하여 자율성 존중의 원칙을 보완할 필요가 있을 것으로 생각된다.52)
5. 결론
생명윤리는 의생명과학연구나 의료행위를 수행함에 있어서 논란이 있을 수 있는 윤리적 고려사항들을 사전에 검토함으로써 의생명과학연구나 의료행위가 윤리적으로 바람직하게 수행되도록 하고자 하는 목적을 가지고 있다. 우리나라의 경우에는 윤리적 논의의 수준을 넘어서서 이미 법률에 의하여 생명윤리의 여러 고려사항들을 규율하고 있다.
윤리적 논의나 법적 규율은 특정한 대상에 대한 옳고 그름의 판단을 하는 것이다. 따라서 판단 대상에 대상 정확한 이해가 전제되어야 한다. 생명윤리나 의생명법적 규율은 그 판단 대상이 의생명과학연구 혹은 의료행위이기 때문에 그 분야에 대한 적절한 이해를 바탕으로 이루어져야만 실효성 있는 규율이 될 수 있다. 그런데 의생명과학이나 의료행위는 매우 빠르게 변화하는 분야이기 때문에 이 분야의 최신 지식 습득과 이해는 매우 어려운 경우가 대부분이다.
현재 의생명과학연구를 규율하는 <생명윤리및안전에관한법률>은 개별적인 연구 분야에 대한 규율의 틀을 마련하고 구체적인 심의의 첫 단계는 기관생명윤리심의위원회가 맡도록 하고 있다. 하지만 바이오장기연구와 같은 분야는 규율할 수 있는 규정이 없으며 기존의 규정들이 예상하지 못하였던 연구 분야들이 속속 나타나고 있는 것도 현실이다. 이러한 법적 규율의 공백을 메우기 위해서는 기관생명윤리심의위원회의 역할이 매우 중요하다. 기관생명윤리심의위원회가 적절하게 기능하기 위해서는 몇 가지 사항들이 고려되어야 할 것으로 생각된다. 첫째, 기관생명윤리위원회에 참여하고 있는 위원들이 의생명과학 분야를 이해할 수 있는 기본적인 소양을 갖추고 있어야 할 것이다. 기관생명윤리위원회에서 특정한 의생명과학연구에 대한 검토를 하는 경우 많은 경우는 과학적·의학적 타당성에 대한 검토가 선행되어야 하는데 이러한 검토는 충분히 이루어지지 않은 채 추상적 윤리원칙만을 주장하는 경우에는 규율의 실효성을 담보할 수 없을 것이다. 두 번째 기관생명윤리심의위원회는 의생명과학연구를 규제하는 기구가 아니라 의생명과학연구가 적절하게 이루어지도록 도와주는 기구라는 점을 인식하는 것이 매우 중요할 것이다. 개인의 신념이나 특정한 종교적 가치관을 전제로 타협 없는 규제만을 주장하는 것은 실제로는 기관생명윤리심의위원회의 존재를 무용하게 만드는 행위이다. 다양한 가치관을 가진 위원들이 자신의 가치관에 근거한 의견을 제시하고 이를 통하여 합리적인 결론을 도출하여 의생명과학연구가 바람직한 방향으로 나아갈 수 있도록 하는 것이 기관생명윤리심의위원회의 역할임을 망각하여서는 안 될 것이다.
의생명과학연구가 윤리적으로, 법적으로 바람직하게 수행될 수 있도록 하는 데에 가장 중요한 역할을 하는 사람들은 연구자들이다. 연구자 스스로가 자신의 연구의 윤리적, 법적 함의들을 충분히 고려하여 사전에 자기검열을 하는 것이 가장 바람직하고 중요하다. 이를 위해서 연구자들에 대한 지속적인 교육이 필요하다.
제3절 생명공학 지식재산권 제도동향
1. 개요
생명공학 분야는 살아있는 생물체를 발명의 대상으로 하고 있다는 특성 때문에 다른 기술 분야와는 별도의 독특한 지식재산권 제도를 운영하고 있다. 최근 생명공학 분야의 연구 방법이 지속적으로 개발되어 새로운 유형의 발명이 증대되고 이에 따라 특허 출원의 내용과 수준도 날로 복잡․다양해지고 있는 추세이며, 특히, 인간 유전체 연구(Human Genome Project)의 완성 이후 국가간에 유전체 관련 핵심기술을 선점하기 위한 경쟁이 치열하게 전개되는 양상을 보이고 있다.
그동안 미생물에 특허를 허여할 수 있는가 하는 문제에서부터 출발해 최근 생물체 자체나 그로부터 분리된 물질에까지 특허 대상을 허여할 것인지에 이르기까지 특허 대상을 놓고 각 국가별로 상당한 논란이 계속되어 왔다. 생명공학의 급속한 발전이 가져온 배아복제나 배아줄기세포 관련 발명 등은 인류의 의료기술에 획기적인 기여를 할 것으로 예상되는 반면 일각에서는 인간 복제의 가능성 등에 따른 윤리적인 문제도 제기하고 있다.
현재까지도 이 분야는 특허성 판단을 위한 심사 실무나 청구범위의 해석, 침해 여부의 판단에 이르기까지 모든 단계에서 다른 기술분야와 차별화된 특수성을 보이고 있으며 이에 부합할 심사의 질 제고와 꾸준한 제도변화가 요구되고 있다.
생명공학 분야는 기술의 특성상 장기간의 연구 개발비를 통해 특허가 산출되므로 지식재산권을 통한 보호가 필수적인 분야라는 점에서는 국제적인 공감대가 형성되어 있으며, 앞으로 원천․핵심기술의 확보 및 이를 위한 장기적 투자가 경쟁력의 핵심으로 자리 잡을 전망이다. 우리나라는 아직 이 분야에서 기초 기술 개발 단계이므로 정부의 장기적 로드맵에 따라 집중적으로 R&D에 투자하고, 개발된 연구 성과물들은 강력한 지식재산권으로 보호․활용하는 등의 산업 육성 전략을 통해 국내 산업 발전을 지속적으로 유도할 필요성이 대두되고 있다.
2. 생명공학관련 특허출원 및 등록 현황
가. 생명공학 분야 특허출원 현황
생명공학 분야 특허출원은 매년 꾸준히 증가하여 2008년에는 5,067건이 출원되었으나, 글로벌 금융위기의 여파 등으로 2009년에는 외국인 출원이 큰폭으로 감소(전년대비 약 29% 감소)함에 따라 2009년 전체 출원건수도 4,644건으로 감소하였으나, 2010년에는 특허출원이 다시 증가하여 5,376건에 이르렀다. 생명공학 분야 전체 특허출원 중 내국인 출원 비중은 2000년 59%, 2005년 64%에서 2010년에는 74%로 증가하였다.
연도별 생명공학분야 특허출원 현황
(단위 : 건)
|
구 분 |
‘00년 |
‘01년 |
'02년 |
'03년 |
‘04년 |
‘05년 |
‘06년 |
‘07년 |
‘08년 |
‘09년 |
‘10년 |
|
내국인 |
1,540 |
1,908 |
2,025 |
2,045 |
2,026 |
2,295 |
2,606 |
3,137 |
3,398 |
3,453 |
3,953 |
|
외국인 |
1,073 |
1,153 |
1,000 |
1,047 |
1,215 |
1,272 |
1,058 |
1,437 |
1,669 |
1,191 |
1,423 |
|
계 |
2,613 |
3,061 |
3,025 |
3,092 |
3,241 |
3,567 |
3,664 |
4,574 |
5,067 |
4,644 |
5,376 |
* ‘10년은 12월 31일 기준
나. 생명공학 분야 특허등록 현황
특허청은 2007년까지 심사대상물량의 증가에 따라 심사관을 꾸준히 증원하고 심사처리기간을 큰폭으로 단축시킨 결과, 생명공학 분야의 특허등록 건수도 매년 꾸준히 증가하여 2007년에는 2,830건에 이르렀다. 그러나 이후 특허심사정책이 심사품질 중심으로 패러다임이 전환됨에 따라 심사처리물량 및 특허등록 결정률이 감소하여 생명공학 분야 특허등록 건수도 2010년에는 1755건으로 감소하였다. 기술 분류별로는 국제특허분류기호(IPC)53) A61K와 C12N에 해당하는 생물의약 관련 발명, 미생물․효소․유전공학에 대한 발명이 대부분을 차지하고 있고, 그 다음으로 미생물 이용 폐수처리와 단백질 관련 발명 등이 뒤를 잇고 있다. 생명공학 분야 전체 등록특허 중 내국인 등록특허 비중은 2000년 57%에서 매년 꾸준히 증가하여 2010년에는 79%에 이르렀다. 내국인 등록특허는 대부분 원천기술에 관한 것이라기보다는 개량․응용기술에 대한 것이 대부분이므로 이러한 문제를 개선하기 위해서는 앞으로 국내에서도 원천․핵심기술을 개발하고 이를 특허출원하여 등록받을 수 있도록 생명공학 산업 전체의 기술개발 투자가 확대되어야 할 것이다.
연도별 생명공학분야 특허등록 현황
|
(단위 : 건수) |
||||||||||||
|
연도 분류 |
2000 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
2009 |
2010 |
|
|
AO1H (식물 신품종) |
내 |
8 |
17 |
34 |
17 |
27 |
70 |
11 |
40 |
27 |
13 |
10 |
|
외 |
3 |
1 |
3 |
1 |
7 |
4 |
1 |
12 |
1 |
2 |
0 |
|
|
계 |
11 |
18 |
37 |
18 |
34 |
74 |
12 |
52 |
28 |
15 |
10 |
|
|
A01K 67/00~67/04 (신규 동물) |
내 |
5 |
4 |
3 |
8 |
10 |
14 |
25 |
14 |
18 |
5 |
15 |
|
외 |
1 |
2 |
2 |
- |
- |
3 |
12 |
7 |
2 |
1 |
2 |
|
|
계 |
6 |
6 |
5 |
8 |
10 |
17 |
37 |
21 |
20 |
6 |
17 |
|
|
A01N 63/00~65/00 (생물 농약) |
내 |
6 |
13 |
9 |
14 |
19 |
50 |
28 |
37 |
47 |
1 |
21 |
|
외 |
3 |
7 |
5 |
2 |
3 |
6 |
5 |
2 |
3 |
2 |
2 |
|
|
계 |
9 |
20 |
14 |
16 |
22 |
56 |
33 |
39 |
50 |
3 |
23 |
|
|
A61K 7/26, 7/28, 35/12~35/84, 38/00~39/44, 48/00, 51/00~51/10(생물 의약) |
내 |
58 |
97 |
135 |
153 |
128 |
336 |
597 |
565 |
594 |
309 |
370 |
|
외 |
75 |
86 |
71 |
85 |
67 |
90 |
189 |
165 |
179 |
95 |
86 |
|
|
계 |
133 |
183 |
206 |
238 |
195 |
426 |
786 |
730 |
773 |
404 |
456 |
|
|
C02F 3/00~3/34, 11/02~11/04 (미생물 이용 폐수처리) |
내 |
70 |
82 |
117 |
121 |
259 |
191 |
235 |
241 |
184 |
140 |
189 |
|
외 |
6 |
8 |
9 |
7 |
12 |
10 |
18 |
23 |
4 |
3 |
5 |
|
|
계 |
76 |
90 |
126 |
128 |
271 |
201 |
253 |
264 |
188 |
143 |
194 |
|
|
C07H 19/00~21/04 (당류) |
내 |
1 |
3 |
13 |
5 |
5 |
9 |
7 |
6 |
2 |
4 |
1 |
|
외 |
13 |
8 |
23 |
16 |
15 |
22 |
24 |
20 |
18 |
7 |
8 |
|
|
계 |
14 |
11 |
36 |
21 |
20 |
31 |
31 |
26 |
20 |
11 |
9 |
|
|
C07K (단백질) |
내 |
37 |
27 |
45 |
38 |
78 |
133 |
108 |
144 |
142 |
43 |
83 |
|
외 |
56 |
47 |
73 |
71 |
76 |
108 |
167 |
111 |
124 |
51 |
93 |
|
|
계 |
93 |
74 |
118 |
109 |
154 |
241 |
275 |
255 |
266 |
94 |
176 |
|
|
C12C~M (발효 및 그 장치) |
내 |
22 |
16 |
44 |
50 |
87 |
87 |
91 |
144 |
122 |
86 |
100 |
|
외 |
2 |
4 |
7 |
6 |
6 |
5 |
11 |
17 |
20 |
8 |
14 |
|
|
계 |
24 |
20 |
51 |
56 |
93 |
92 |
102 |
161 |
142 |
94 |
114 |
|
|
C12N (미생물, 효소, 유전공학) |
내 |
173 |
150 |
242 |
235 |
401 |
413 |
458 |
538 |
448 |
228 |
379 |
|
외 |
99 |
54 |
107 |
94 |
104 |
190 |
206 |
241 |
185 |
114 |
89 |
|
|
계 |
272 |
204 |
349 |
329 |
505 |
603 |
664 |
779 |
633 |
342 |
468 |
|
|
C12P (발효 생성물) |
내 |
35 |
33 |
36 |
40 |
71 |
50 |
58 |
39 |
44 |
42 |
41 |
|
외 |
34 |
17 |
22 |
22 |
34 |
37 |
49 |
38 |
28 |
35 |
16 |
|
|
계 |
69 |
50 |
58 |
62 |
105 |
87 |
107 |
77 |
72 |
77 |
57 |
|
|
C12Q,S (시험, 측정, 분리정제) |
내 |
16 |
27 |
24 |
33 |
136 |
101 |
201 |
224 |
161 |
87 |
102 |
|
외 |
14 |
22 |
16 |
15 |
38 |
37 |
42 |
61 |
30 |
37 |
28 |
|
|
계 |
30 |
49 |
40 |
48 |
174 |
138 |
243 |
285 |
191 |
124 |
130 |
|
|
G01N 33/50~33/98 (진단 시약) |
내 |
5 |
15 |
3 |
16 |
22 |
36 |
92 |
97 |
67 |
46 |
80 |
|
외 |
20 |
15 |
12 |
12 |
11 |
20 |
54 |
44 |
24 |
13 |
21 |
|
|
계 |
25 |
30 |
15 |
28 |
33 |
56 |
146 |
141 |
91 |
59 |
101 |
|
|
계 |
내 |
436 |
484 |
705 |
730 |
1,243 |
1,490 |
1,911 |
2,089 |
1,856 |
1,004 |
1,391 |
|
외 |
326 |
271 |
350 |
331 |
373 |
532 |
778 |
741 |
618 |
368 |
364 |
|
|
계 |
762 |
755 |
1,055 |
1,061 |
1,616 |
2,022 |
2,689 |
2,830 |
2,474 |
1,372 |
1,755 |
|
|
주) 1. 국제특허분류(IPC 2011.01 기준)에 의함 2. 내: 내국인 출원, 외: 외국인 출원 |
||||||||||||
3. 생명공학 분야 심사 인프라 확충
특허청은 급속히 발전하고 있는 생명공학 분야의 새로운 기술을 보호하는 한편 국제화 추세에 발맞추어 생명윤리 문제 등의 판단기준을 제시하고자 생명공학 특허 심사기준을 제정하여 운용하고 있으며, 기술개발 추이에 발맞추어 우수특허의 권리를 효율적으로 보호할 수 있도록 심사기준 개정, 심사 전문인력 확보, 유전자서열 DB 구축 등 지식재산권 제도와 인프라를 확충하고 심사의 전문화를 꾀하고 있다.
가. 생명공학 특허 심사기준의 제정 및 개정
(1) 생명공학 특허 심사기준의 제정 (1998. 3월)
생명공학 분야 특허란 직접 또는 간접적으로 자기복제를 할 수 있는 생물학적인 물질(biological material) 즉, 자기 복제력을 갖는「생물」,「유전정보」및 그「복제」에 관련된 발명을 포함하는 특허를 의미한다. 이러한 생명공학 분야 출원기술의 심사에 대한 표준운영절차를 확립하고자 1998년 산재된 생명공학 관련 심사기준을 통합하여 생명공학 분야 산업부문별 심사기준을 제정하였다.「유전공학 관련발명」, 「미생물관련 발명」,「식물관련 발명」,「동물관련 발명」으로 크게 네 개의 분야로 나눠서 심사기준을 신설하고 윤리성 기준과 불특허 요건을 명시하였다.
(2) 생명공학 특허 심사기준 1차 개정 (2000. 12월)
인간 유전체 연구(HGP)의 1차 결과가 발표됨에 따라 그의 산물인 DNA 단편, SNP(개체간 단일염기변이) 등 새로운 형태의 발명이 출현되고 있어 이를 보호할 기준 마련을 위해 개정하였다. 주요 내용으로는 HGP의 산물인 EST 등 DNA 단편, SNP 등에 대한 심사기준을 마련하였고, 유전자, 단백질, 모노클로날 항체 등에 대한 포괄적인 청구범위 기재를 인정하며, 안티센스에 대한 기재요건을 추가하는 등 기존의 심사 실무를 반영하였고 대용량 유전정보 출원에 대비한 단일성 판단기준에 대해서 정비하였다.
(3) 생명공학 특허 심사기준 2차 개정 (2003. 12월)
생명공학 분야의 새로운 기술을 보호하는 한편, 생명윤리문제의 판단기준을 제시하고 유전공학관련 발명의 실질적인 보호에 중점을 두었다. 이에 따라 유전자 및 단백질 변이체에 대한 청구범위 기재요건을 강화하고 서열로 특정할 수 없는 경우의 단백질의 특정 요건을 구체화하였으며, 모노클로날 항체의 실시가능성요건 및 청구범위 기재요건을 보호하는 등의 보완이 이루어졌다.
(4) 생명공학 특허 심사기준 3차 개정 (2005. 5월)
당초 2차 개정안에서는 생명과학기술의 생명윤리 및 안전을 확보하기 위해 제정될 예정이었던 「생명윤리및안전에관한법률」에 근거하여 생명공학 분야 발명의 생명윤리 문제를 판단하는 내용이 포함되어 있었으나, 법률의 제정 및 시행이 늦어짐에 따라 이 내용이 삭제된 채로 개정되었었다. 3차 개정에서는 「생명윤리및안전에관한법률」의 시행에 연계하여 정부의 공식 승인을 받은 연구 성과물에 대한 발명은 특허등록 대상으로 하는 한편, 동법에서 금지하는 행위 또는 연구 성과물에 대한 발명은 특허법 제32조의 규정에 의거 특허를 받을 수 없는 발명으로 하여 생명공학분야 발명의 생명윤리 및 안전에 대한 판단 기준을 보완하였다.
(5) 생명공학 특허 심사기준 4차 개정 (2006. 9월)
당초 우리 특허법에서는 식물관련 발명의 경우는 특허법 제31조에 의해서 무성적으로 반복생식할 수 있는 식물에 한하여 특허를 허여하여 왔으나, 국내외 특허제도 및 품종보호제도가 발전함에 따라 유성번식 식물도 특허 대상에 포함시키기 위해 특허법 제31조를 삭제(2006. 10. 1. 시행)하게 되었다. 이에 따라 4차 개정에서는 식물관련 특허의 대상을 무성번식방법을 갖춘 식물에서 신규식물 자체 또는 일부분 및 그 육종방법으로 확대하였고, 유성번식 식물의 재현성 요건을 충족시키기 위해 종자기탁제도를 도입하였다.
(6) 생명공학 특허 심사기준 5차 개정 (2010. 1월)
인간 유전자 지도의 완성으로 관련 발명의 출원이 증가되고 다양화되고 있는 상황에서 이를 심사기준에 반영하기 위한 5차 개정에서는, 기능으로 한정한 공지의 유전자 또는 단백질에 대한 신규성 판단기준, 폴리뉴클레오티드 단편이나 안티센스의 진보성 판단기준, 다수의 유전자나 단백질을 마커로 청구하는 경우의 단일성 판단기준을 보완하고 이에 대한 구체적 예시를 부가하였으며, 공지의 미생물과 동일종이면서 기탁번호를 달리하는 미생물의 진보성 판단기준에 대한 예시와 설명을 부가하였다. 개정된 생명공학 분야 특허심사기준은 특허청 홈페이지(www.kipo.go.kr)의 화학생명공학심사국 메뉴 내의 심사자료실에서 다운받을 수 있다.
생명공학 특허 심사기준에 따른 특허 보호대상
|
구분 |
대상 |
특허여부 |
비고 |
|
물질 |
유전자 (DNA서열) |
특허가능 |
유용성이 밝혀진 경우만 특허가능, 단순 게놈 서열만으로는 불가 |
|
단백질 (아미노산서열) |
특허가능 |
||
|
단세포 생명체 (virus, bacteria) |
특허가능 |
관련 미생물 기탁 의무 |
|
|
동물 |
특허가능 (단, 공서양속에 반하지 않는 것) |
동물발명에 대한 심사기준 신설 |
|
|
식물 |
특허가능 |
유성번식 식물의 경우 종자기탁을 통해 재현성 요건 충족 |
|
|
인간의 신체 부분 |
특허불가 |
인체의 존엄성을 해치는 발명은 특허대상에서 배제 (인체에서 旣 분리․배출된 것은 가능) |
|
|
방법 |
수술, 치료방법 |
사람불가, 동물가능 |
사람의 치료․진단 방법은 의료행위에 해당하므로 산업상 이용가능성이 없는 것으로 봄 (특허법 제29조제1항) |
|
유전자 치료법 |
사람불가, 동물가능 |
||
|
진단방법 |
사람불가, 동물가능 |
나. 심사 전문인력 확보 및 역량 강화
특허청은 생명공학 분야의 특허출원 증가에 효율적으로 대처하고 심사 전문성을 제고하기 위하여 해당분야 전문 심사인력을 지속적으로 채용하고 있으며, 기술간의 융합화 현상이 진전되고 있는 생명공학 분야의 최근 논의를 점검하고, 관련 기술 및 특허 동향을 분석하기 위하여 관련분야의 청내․외 인사들로 구성된『바이오특허연구회』를 운영하고 있다. 본 연구회를 통해 바이오 또는 지재권분야 전문가 세미나 및 토론회를 개최함으로써 최신 기술과 정보를 습득․교류하는 기회를 마련하고, 연간 활동 보고서를 발간․배포하는 등 심사의 질적 향상과 생명공학 기술의 전파에 적극 노력하고 있다.
다. 유전자 서열목록 제출제도 시행 및 관련 DB 구축
특허청은 핵산 또는 아미노산 관련 발명의 신속 정확한 검색 및 서열 DB 구축을 위하여 1999년 이후에 특허 출원된 발명에 대해서는 핵산염기 및 아미노산 서열 데이터의 전자파일 제출을 의무화하였으며, 2004년에는 한국생명공학연구원과 업무협정을 체결하고, 특허 출원된 유전자 서열 데이터를 한국생명공학연구원내 국가생명연구자원정보센터에 제공하고, 유전자서열 검색 시스템을 통합운영함으로써 검색기능과 속도가 비약적으로 향상된 검색 시스템을 확보하여 운영중이다. 또한, 2007년 10월부터 한․일 특허청간 유전자 서열 DB교환을 통해 검색 DB를 확대 운영하게 되었다.
서열목록을 포함한 특허출원 건수
(단위 : 건)
|
구 분 |
'00년 |
'01년 |
‘02년 |
‘03년 |
‘04년 |
‘05년 |
‘06년 |
‘07년 |
‘08년 |
‘09년 |
‘10년 |
|
내국인 |
248 |
402 |
496 |
584 |
619 |
688 |
903 |
1,126 |
1,089 |
1,277 |
1,421 |
|
외국인 |
383 |
528 |
494 |
469 |
577 |
653 |
770 |
967 |
989 |
924 |
1,145 |
|
계 |
631 |
930 |
990 |
1,053 |
1,196 |
1,341 |
1,673 |
2,093 |
2,078 |
2,201 |
2,566 |
* ‘10년은 12월 31일 기준
한편, 국가생명연구자원정보센터에서는 매월 특허 공개분에 대한 특허서열을 특허청에서 제공받아 국내외 연구자들이 자유롭게 특허서열을 검색하고 이용할 수 있도록 웹기반의 검색 서비스(http://patome.kr)를 제공하고 있다.
4. 미생물 기탁제도 운영
가. 미생물 기탁제도의 취지
미생물에 대한 발명은 살아 있는 생명체를 대상으로 하는 것이어서 특허 명세서에 아무리 상세하게 미생물의 균학적 성질이나 그 외의 다른 특성을 기재한다 하더라도 통상의 기술자가 그 미생물을 재현하여 실시하는 것이 실질적으로 불가능하다. 이처럼 미생물 발명에서 특허 명세서 내에 통상의 기술자가 반복 재현할 수 있도록 기재하는 것이 불가능한 경우가 발생하기 때문에, 이를 보완하기 위한 제도가 미생물 기탁제도이다.
미생물 기탁제도는 출원인으로 하여금 해당 미생물을 공인기관에 기탁하도록 하고, 제3자가 일정조건(기탁자 또는 특허청 허락)하에 분양을 받아 당해 발명을 용이하게 실시할 수 있도록 하는 제도이다.
미생물에 관계된 발명을 특허출원하기 위해서는 특허법시행령 제2조에 따라 그 미생물을 특허청장이 정하는 기탁기관 또는 특허절차상 미생물 기탁의 국제적인 승인에 관한 부다페스트 조약에 따른 국제기탁기관에 기탁하고 그 수탁증을 출원서에 첨부하여야 한다.
미생물 기탁 및 출원 절차 개요

나. 미생물 기탁기관 및 관리 현황
국내의 기탁기관은 아래와 같이 4개의 기관이 운영 중이며, 이들 기관은 발명자가 미생물을 기탁하면 고유번호를 부여하고 수탁증을 발급해 주고 있다. 이와 관련하여, 특허청은 제3자가 연구 또는 시험을 위해 특허관련 미생물의 분양을 신청할 경우 미생물분양자격증명서를 발급하여 기탁미생물의 분양을 허락하고 있으며, 기탁된 미생물의 관리실태를 분기별로 점검하고 있다.
국내 미생물 기탁기관 현황
|
구 분 |
한국생명공학연구원 생물자원센터 (KCTC) |
한국미생물 보존센터 (KCCM) |
한국세포주 연구재단 (KCLRF) |
국립농업과학원 농업유전자원센터 (KACC) |
|
국제기탁기관 (지정일) |
자격있음 (‘90. 6. 30) |
자격있음 (‘90. 6. 30) |
자격있음 (‘93. 8. 31) |
자격없음 |
|
국내기탁기관 (지정일) |
자격있음 (‘81. 8. 25) |
자격있음 (‘81. 8. 25) |
자격없음 |
자격있음 (‘02. 1. 1) |
기탁기관별 미생물 수탁 및 분양 현황
(단위 : 건)
|
구분 |
수탁미생물 |
분양미생물 |
비고 (수탁) |
|
한국생명공학연구원 생물자원센터(KCTC) |
4,043 |
367 |
국제(2,880), 국내(1,163) |
|
한국미생물보존센터 (KCCM) |
2,657 |
229 |
국제(1,158), 국내(1,499) |
|
한국세포주연구재단 (KCLRF) |
253 |
177 |
국제(253), 국내(0) |
|
국립농업과학원 농업유전자원센터(KACC) |
860 |
115 |
국제(0), 국내(860) |
|
합계 |
7,813 |
888 |
국제(4,291), 국내(3,522) |
* ‘10년 12월 31일 기준
특허청은 미생물 기탁업무에 대한 개선 대책을 추진하여 부다페스트조약에 어긋났던 일부 미생물 기탁기관의 내부 규정을 개정하고, 기탁기관별로 상이하던 서식을 통일화하였으며, 신청자 편의 위주로 미생물 분양 절차를 간소화하고 온라인 신청체계를 마련하여 특허청 홈페이지에서 온라인상으로도 신청이 가능하도록 하였다(‘http://www.kipo.go.kr/kpo/user.tdf?a=user.minform.BoardApp&c=1000’, 서식번호 제19호).
또한, 특허청은 미생물 관련 특허자원의 안정적 보전 및 관리를 위해 지난 2006년에 기존 기탁 미생물 보관 장소와는 별도의 장소에 특허 미생물에 대한 백업을 실시하였으며, 「미생물 기탁기관 지정 등에 관한 고시」를 개정하여 기탁기관의 특허미생물 복제본 보관 의무화 및 보관시설 요건을 규정하였다. 2010년에는 전쟁, 지진 등 비상시에도 미생물 관련 특허자원의 안정적 보존을 담보하기 위해서 각 기탁기관에 비상시 특허 미생물 관리계획을 마련하도록 하였다. 현재 특허청은 기탁기관별로 상이한 비상시 특허미생물 관리계획에 대해 기탁기관과 함께 종합화, 통일화를 진행 중에 있다.
제5장 생명공학 관련 법제도 현황
제4절 생명공학 제품 인허가 현황과 과제
1. 서론
생명공학산업은 DNA, 단백질, 세포 등을 이용한 생명체 관련기술(Bio Technology)을 직접 활용하여 제품과 서비스를 생산하는 신산업으로 의약, 화학, 환경, 식품, 에너지, 농업, 해양 등 다양한 분야에서 21세기 산업성장을 주도할 핵심기술산업으로 평가받고 있다. 특히 의약(Red BT)부분에서의 연구개발이 가장 활발하게 이루어지고 있으며, 점차 농업(Green BT), 산업(White BT)으로 확산되는 추세에 있다.
전 세계적으로 기존 합성신약의 한계를 극복하기 위한 생명공학의약품 개발에 정부가 주도적으로 막대한 예산을 투자하고 있으며 주요 선진국의 의약품 허가․규제기관에서는 고부가가치 바이오신약의 허가를 위해 안전성과 유효성을 평가하는 가이드라인 개발에 주력하고 있다.
우리나라의 경우 1983년 생명공학육성법이 제정된 이후 「제1차 생명공학육성기본계획(1994~2006)」에 따라 생명공학에 대한 국가차원의 체계적인 연구개발 육성에 착수하여 기술적인 인프라를 구축하여 왔다. 그러나 이러한 기술적 인프라와 정부의 R&D 지원은 기초연구에 집중되어 있어 세계적인 연구성과들이 신속하게 상업화(실용화)로 이어지고 있지 않아 이에 대한 범부처 대책방안이 속속 마련되고 있다.
2007년부터 향후 10년 간은 생명공학분야 세계7위의 기술 강국 진입을 목표로 「제2차 생명공학육성기본계획(2007~2016)」을 확정하여 생명공학의약품 실용화를 위한 과제를 추진할 계획에 있으며, 신약으로 개발될 가능성이 있는 후보물질에 대하여는 선택과 집중에 의한 비임상․임상시험 R&D 지원을 강화할 예정이다.
한편, 유전자재조합기술을 이용한 제1세대 생명공학의약품 ‘유전자재조합 치료용 단백질 의약품(insulin, human growth hormon 등)’이 1980년대에 처음으로 세계시장에 소개된 이후, 최근 동 의약품의 특허 만료시점이 도래하면서 생명공학의약품에도 Bio-Similar(Bio generic, follow-on) 개념을 도입하고자 하는 여건이 형성되고 있으며, 한미 FTA 협상 타결로 국내 제약환경은 큰 변화를 맞고 있다.
이상과 같은 국내외 제약환경의 변화에 발맞추어 생명공학의약품 인허가 과정, 국내외 생명공학의약품 개발동향, 생명공학의약품 실용화와 관련한 식약청의 역할 및 안전관리방안 등에 대하여 살펴보기로 한다.
2. 생명공학의약품 인허가 과정
생명공학의약품은 인체 내에서 유래한 물질을 대상으로 하여 유전자 조작, 유전자 이식, 줄기세포 배양 등의 생명공학기술을 적용하여 개발된 의약품으로써 기존의 합성 화학의약품과 마찬가지로 인체의 질병을 치료, 경감, 진단을 목적으로 한다. 따라서 제품의 실용화를 위해서는 반드시 그 제품에 대한 안전성과 유효성 평가를 거쳐야 한다.
의약품이 개발되어 환자에게 사용되기 까지는 약 10년 이상의 기간이 소요되는데, 이는 대부분 안전성과 유효성을 입증하기 위하여 실시하는 비임상․임상시험에 해당하며 의약품 개발 기간과 투자비용의 대부분을 차지하고 있다(그림 5-4-2-1).
[그림 5-4-2-1] 의약품의 개발과정

범정부 차원에서 차세대 성장 동력으로서 육성․지원하고 있는 생명공학의약품의 실용화는 안전성과 유효성 평가를 위한 자료가 얼마나 과학적이고 합리적인지에 달려있으며, 신약개발기간의 대부분을 차지하고 있는 비임상․임상에 대한 지원과 최종 허가단계에서의 안전성․유효성 심사과정이 국제 경쟁력을 결정하는 큰 요인으로 작용한다고 해도 과언이 아니다.
생명공학의약품의 안전성․유효성을 입증하는 임상시험이 완료된 후, 실용화를 위한 마지막 단계인 의약품 허가를 위해서는 의약품을 생산할 수 있는 GMP 시설이 요구된다. 그러나 생명공학의약품을 연구․개발하는 주체인 벤처기업이 막대한 투자비용이 소요되는 GMP 시설은 갖춘다는 것은 Bio 신약개발에 있어 또 하나의 장애 요인으로 작용하였으나, 의약품 제조업 허가와 제조품목허가 분리를 위한 약사법 개정이 이루어짐으로써 제조업 허가와 제조품목허가를 별도로 받을 수 있게 되었다.
[그림 5-4-2-2] 품목허가 절차

의약품 허가를 받기 위해서는 1상, 2상 및 3상시험을 모두 수행하여야 하나, 희귀난치성 환자에 신속히 사용할 필요가 있는 희귀의약품 또는 항암제 등의 경우에는 시판후 3상 임상시험자료 제출을 조건으로 2상 임상시험 완료 후 품목허가 할 수 있으며, 유전자치료제, 세포치료제, 동등생물의약품(바이오시밀러)에 대해서는 준비된 허가심사자료부터 먼저 제출하여 심사받을 수 있는 단위별 심사제도를 운영하고 있다.
한편, 2011년 약사법의 개정으로 의약품을 개발하는 업체나 연구자들은 임상단계나 품목허가 단계에서 사전상담을 통해 제품개발에 필요한 기술적 지원을 받을 수 있는 사전검토제도가 법제화되었다.
3. 국내외 생명공학의약품 개발동향
가. 세계동향
1982년 Eli Lilly사가 미국 FDA로부터 유전자재조합 인슐린의 허가를 받은 것을 시발로 하여 성장호르몬, 항암보조제 G-CSF, 빈혈치료제인 EPO 등 많은 재조합 단백질이 개발, 실용화 되었다.
현재까지 생명공학의약품은 EPO(erythropoietine, 빈혈치료제), TPA(tissue plasminogen activator, 혈전용해제) 등의 심혈관계 질환약과 CSF(colony stimulating factor, 골수계 성장인자), 인터페론, 인터루킨 등 암 치료제 제품이 괄목할 만한 성장을 보여주었으며 최근에는 혈액질환, 면역계질환, 호흡기 질환 등 많은 질병의 치료에 목적을 두고 개발되고 있다. 또한 난치병과 불치병에 대한 치료 가능성 등의 장점에 의하여 활발한 연구가 진행 중이다.
2세대 생명공학 의약품으로 불리는 항체의약품은 암세포에 특이적으로 부착하여 인체의 면역시스템이 암세포를 제거할 수 있도록 설계된 의약품으로 97년 비호지킨성 림프종 치료제인 리툭산(Rituxan)이 허가된 이후 엔브렐(Enbrel), 레미케이드(Remicade), 허셉틴(Herceptin), 아바스틴(Avastin) 등 현재까지 미국 FDA와 유럽 EMA로부터 30품목 이상이 허가되었다.
[표 5-4-3-1] 주요 바이오신약 특허만료 현황
|
상품명 |
성분명 |
의약용도 |
개발사 |
특허만료 (미국) |
|
엔브렐(Enbrel) |
에타너셉트(etanercept) |
류마티스관절염 |
Amgen |
2012 |
|
에포젠(Epogen) |
에포에틴알파(epoetin-α) |
빈혈 |
Amgen |
2013 |
|
레미케이드 (Remicade) |
인플릭시맙(infliximab) |
류마티스관절염 |
Johnson & Johnson |
2013 |
|
리툭산(Rituxan) |
리툭시맙(rituximab) |
비호지킨성 림프종 |
Genentech |
2015 |
|
란투스(Lantus) |
인슐린글라진 (insulin glargine) |
당뇨병 |
Sanofi-Aventis |
2015 |
|
휴미라(Humira) |
아달리무맙(adalimumab) |
류마티스관절염 |
Abbott |
2016 |
|
허셉틴(Herceptin) |
트라스트주맙(trastzumab) |
유방암 |
Genentech |
2019 |
|
아바스틴(Avastin) |
베바시주맙(bebacizumab) |
대장암 등 |
Genentech |
2019 |
|
루센티스(Lucentis) |
라니비주맙(ranibizumab) |
황반변성 |
Novartis |
2019 |
출처: EvaluatePharma, Company Reports(2007)
세계적 시장조사 전문기관 중 하나인 Datamonitor는 단클론 항체의약품(mAb 제제, monoclonal antibodies)이 2009-2015 사이 6년 동안 연평균 9.5% 성장률로 생명공학의약품 산업을 주도할 것이라고 예측하였다.
아울러, 위의 표와 같이 항체의약품을 중심으로 블록버스터 바이오신약의 특허만료가 도래함에 따라, 국내․외 업체들이 바이오시밀러 시장에 뛰어들면서 향후 바이오시밀러 신시장이 본격 형성될 것으로 전망되고 있다.
유전자치료제는 유전물질을 인체에 투입하여 유전적인 질병을 치료하고자 하는 목적으로 연구가 진행 중이며 아직까지는 대부분 임상시험 단계에 있으나, 지금까지 전 세계적으로 허가된 유전자치료제는 중국에서 Genedicine(2003년10월, 두경부암) 및 H101(2005.11월, 두경부암) 2품목뿐이다. 수년 내 제품시장이 본격적으로 형성되기 시작하면 기존의 의약품시장을 대체할 수 있는 막강한 잠재력이 있는 의약품이다. 2007년 현재 전 세계적으로 약 700여 건의 임상시험이 진행 중이며 세계 각국에서 빠른 속도로 개발되고 있다.
세포치료제는 1990년대 초반에 시작되어 현재까지 골수 및 조혈모세포 이식, 수지상세포, 자기 활성화 림프구, 줄기세포 등을 이용한 치료법 연구가 활발하게 진행 중이다. 배아줄기세포와 관련한 연구도 여전히 윤리성 논란이 있긴 하지만 희귀난치성 치료 및 글로벌 산업화에 대한 잠재력 때문에 미국을 비롯한 각 국 정부의 지원이 확대되고 있다.
나. 국내동향
유전자재조합의약품은 인체에서 생리활성을 나타내는 다양한 효소나 호르몬의 정보를 담고 있는 유전자를 대장균이나 효모와 같은 미생물 등에 이입하여, 목적으로 하는 단백질을 합성해 대량생산으로 제조한 의약품을 말한다. 생명공학의약품 중 가장 많이 허가되어 사용되고 있는 의약품으로서 2011년 6월까지 총 285 품목이 허가되었다.
항체의약품의 경우 엘지생명과학, 녹십자, 이수앱지스 등 50개 이상의 바이오기업에서 연구가 활발히 진행 중이며, 현재까지 우리나라에서 항체의약품 2여개 품목이 허가되었고, 그 중 국내 제조는 이수앱지스의 “클로티냅주(압식시맙)” 1품목이다.
세포치료제는 2001년 1월 연골이식 및 조혈 적응증으로 허가된 자가(自家)유래 세포치료제 “콘드론”을 필두로, 현재까지 국내에서 16품이 허가되었으며, 이 중 환자 자신의 세포를 이용한 자가유래 세포치료제가 15품목, 다른 사람의 세포를 이용한 동종(同種)유래 세포치료제가 1품목이다.
2011년 7월 심근경색치료용 자가유래 줄기세포치료제 “하티셀그램-에이엠아이”가 세계 최초로 우리나라에서 허가되었다.
국내 임상시험 현황을 보면, 22개 업체에서 심근경색, 뇌경색 또는 척수손상 등의 난치병 치료제를 포함하여 총 61건의 세포치료제 임상시험이 완료되었거나 진행 중이며, 이 중 줄기세포치료제 임상시험은 총 22건으로 이는 미국, 유럽 등과 함께 세계적으로 많은 수치이다.
[표 5-4-3-2] 세포치료제 허가현황(2011.9월 현재, 줄기세포치료제 1건 포함)
|
연번 |
제품명(업체명) |
특징 |
대상질환 |
품목허가 일자 |
|
1 |
콘드론(세원셀론텍) |
자가유래 연골세포 |
연골이식 및 재생 |
'01년 1월 |
|
2 |
홀로덤(테고사이언스) |
자가유래 피부각질세포 |
피부화상치료 |
'02년 12월 |
|
3 |
칼로덤(테고사이언스) |
동종유래 피부각질세포 |
피부화상치료 |
'05년 3월 |
|
4 |
케라힐(엠씨티티) |
자가유래 피부각질세포 |
피부화상치료 |
'06년 5월 |
|
5 |
이노락(이노메디시스) |
자가유래 활성화림프구 |
비소세포폐암 |
'07년 2월 |
|
6 |
크레아박스-알씨씨 (크레아젠) |
자가유래 수지상세포 |
전이성신세포암 |
'07년 5월 |
|
7 |
아디포셀주(안트로젠) |
자가유래 배양지방세포 |
피부 함몰 |
'07년 8월 |
|
8 |
이뮨셀엘씨주(이노셀) |
자가유래 활성화T림프구 |
간세포암 |
'07년 8월 |
|
9 |
엔케이엠주 (엔케이바이오) |
자가유래 활성화림프구 |
B세포 림프종 |
'07년 8월 |
|
10 |
하이알그라프트쓰리디 (핸슨바이오텍) |
자가유래 피부섬유아세포 |
당뇨성 족부궤양 |
'07년 8월 |
|
11 |
알엠에스오스론 (세원셀론텍) |
자가유래 뼈세포 |
국소 골형성 촉진 |
'09년 8월 |
|
12 |
오토스템 (차바이오앤디오스텍) |
자가유래 최소조작지방세포 |
피하지방 결손 |
'10년 2월 |
|
13 |
퀸셀(안트로젠) |
자가유래 최소조작지방세포 |
피하지방 결손 |
'10년 3월 |
|
14 |
큐어스킨 (에스바이오메딕스) |
자가유래 섬유아세포 |
여드름 치유과정에 수반된 함몰 흉터개선 |
'10년 5월 |
|
15 |
엘에스케이오토그라프트 (차바이오앤디오스텍) |
자가유래 피부각질세포 |
피부화상 치료 |
'10년 9월 |
|
15 |
하티셀그램-에이엠아이 (에프씨비파미셀) |
자가유래 골수 중간엽줄기세포 |
급성심근경색환자에서 좌심실구혈율 개선 |
'11년 7월 |
[표 5-4-3-3] 줄기세포치료제 연구개발(임상시험) 현황(2011년 현재)
|
연번 |
제품명(업체명) |
특징 |
대상질환 |
승인사항 (임상단계) |
|
1 |
카티스템(메디포스트) |
동종 제대혈유래 중간엽줄기세포 |
무릎연골결손 |
1/2상 |
|
2 |
엠에스씨 1 (에프씨비파미셀) |
자가 골수유래 중간엽줄기세포 |
급성뇌경색 |
3상 |
|
3 |
엠에스씨 2 (에프씨비파미셀) |
자가 골수유래 중간엽줄기세포 |
심근경색 |
2/3상 |
|
4 |
세레셀그람(에프씨비파미셀) |
자가유래 중간엽줄기세포 |
만성 척수손상 |
2/3상 |
|
5 |
바스코스템(알앤엘생명과학) |
자가유래 지방줄기세포 |
버거씨병 |
1/2상 |
|
6 |
프로모스템(메디포스트) |
동종 제대혈유래 중간엽줄기세포 |
이식편대숙주질환 |
1/2상 |
|
7 |
알앤엘 조인트스템 (알앤엘바이오) |
자가유래 지방줄기세포 |
퇴행성관절염 |
1상 |
|
8 |
카티스템(메디포스트) |
동종 제대혈유래 중간엽줄기세포 |
무릎연골손상 |
3상 |
|
9 |
이식편대숙주질환치료제 (호미오세라피) |
동종 골수유래 성체줄기세포 |
이식편대숙주질환 |
1/2상 |
|
10 |
아디포플러스주 (안트로젠) |
자가유래 지방줄기세포 |
크론씨병 |
1상 |
|
11 |
ANT-SM(안트로젠) |
자가유래 지방줄기세포 |
변실금 |
1상 |
|
12 |
알앤엘-아스트로스템 (알앤엘생명과학) |
자가유래 지방줄기세포 |
척수손상 |
1상 |
|
13 |
아디포플러스주(안트로젠) |
자가유래 지방줄기세포 |
크론병성 치루 |
2상 |
|
14 |
아디포플러스주(안트로젠) |
자가유래 지방줄기세포 |
크론병성 치루 (연장임상) |
2상 |
|
15 |
ANTG-ASC(안트로젠) |
자가유래 지방줄기세포 |
복잡성 치루 |
2상 |
|
16 |
뉴모스템(메디포스트) |
동종 제대혈유래 중간엽줄기세포 |
미숙아 기관지폐이형성증 |
1상 |
|
17 |
Homeo-GH(호미오세라피) |
동종 골수유래 줄기세포 |
이식편대숙주질환 |
1상 |
|
18 |
ANTG-ASC (안트로젠) |
자가유래 지방줄기세포 |
복잡성 치루 (연장임상) |
2상 |
|
19 |
뉴로스템(메디포스트) |
동종 제대혈유래 중간엽줄기세포 |
알츠하이머형 치매 |
1상 |
|
20 |
HYNR-CS주(코아스템) |
자가골수유래 줄기세포 |
근위축성측삭경화증 |
1/2상 |
|
21 |
ALLO-ASC(안트로젠) |
동종 지방유래 줄기세포 |
크론성누공 |
1상 |
|
22 |
제대혈유래간엽줄기세포치료제(제대혈줄기세포응용사업단) |
동종 제대혈유래 중간엽줄기세포 |
하지허혈증 |
1상 |
유전자치료제는 현재까지 우리나라에서 허가받은 유전자치료제는 없으나, 2003년 동아제약에서 허혈성 족부궤양 치료용 유전자치료제 국내 임상시험을 처음으로 승인받은 이후 2011년 현재까지 총 19건의 임상시험이 진행 중에 있다.
[표 5-4-3-4] 국내 유전자치료제의 임상시험 현황(2011년 9월 현재)
|
|
제품명 (개발사) |
대상 유전자 |
벡터 |
대상질환 |
단계 |
승인연월 |
|
1 |
VMDA-3601 (동아제약) |
VEGF |
플라스미드 |
허혈성 족부궤양 |
2상 |
‘03.12 |
|
2 |
GX-12(동아제약) |
HIV, IL-12 |
플라스미드 |
에이즈 치료백신 |
1상 |
‘05.01 |
|
3 |
JX-594(녹십자) |
GM-CSF |
백시니아 |
간암 |
1상 |
‘05.09 |
|
4 |
VM202RY (바이로메드) |
HGF |
플라스미드 |
허혈성 심혈관질환 |
1상 |
‘06.10 |
|
5 |
티슈진-C(코오롱) |
TGF-β1 |
유전자변형 세포 |
퇴행성관절염 |
1상 |
‘06.12 |
|
6 |
VM106(바이로메드) |
gp91 |
유전자변형 세포 |
만성육아종 |
1/2상 |
‘07.01 |
|
7 |
쎄라젠(뉴젠팜) |
CD/TK 자살 유전자 |
아데노 |
전립선암 |
2상 |
‘07.03 |
|
8 |
HB-110(제넥신) |
HBV, IL-12 |
플라스미드 |
만성B형간염 치료백신 |
1상 |
‘07.03 |
|
9 |
JX-594(녹십자) |
GM-CSF |
백시니아 |
간암 |
2상 |
‘08.01 |
|
10 |
DWP-418(대웅제약) |
mTERT, Relaxin |
아데노 |
불응성 고형암 |
1상 |
‘08.01 |
|
11 |
XRP0038 (사노피아벤티스) |
FGF |
플라스미드 |
급박하지 허혈증 |
3상 |
‘09.01 |
|
12 |
티슈진-C(코오롱) |
TGF-β1 |
유전자변형세포 |
퇴행성관절염 |
2a상 |
‘09.02 |
|
13 |
DA-3607(동아제약) |
Trail |
아데노 |
뇌종양 |
1상 |
‘09.04 |
|
14 |
VGX-3400 (VGX인터내셔날) |
AI 항원 |
플라스미드 |
AI 예방 DNA백신 |
1상 |
‘10.02 |
|
15 |
VM202RY (바이로메드) |
HGF |
플라스미드 |
중증하지 허혈질환 |
2상 |
‘10.04 |
|
16 |
티슈진-C(코오롱) |
TGF-β1 |
유전자변형세포 |
퇴행성관절염 |
2b상 |
‘10.12 |
|
17 |
VM206RY(이연제약) |
Her-2 |
플라스미드+ 아데노 |
유방암 |
1상 |
‘11.02 |
|
18 |
HB-110(제넥신) |
B형 간염바이러스 + IL-12m |
플라스미드 |
만성B형 간염 |
1상 |
‘10.02 |
|
19 |
VGX-3100 (VGX인터내셔날) |
HPV 16, 18의 E6, E7항원 |
플라스미드 |
CIN 2/3, CIN3 |
2상 |
‘11.09 |
4. 향후계획 및 전망
현재 의약품 시장의 성장률은 점차 둔화되는 반면, 바이오의약품 시장은 점점 증가하고 있어 점차 세계 의약품 시장은 바이오의약품으로 대체되어 나갈 것으로 전망된다. 특히, 세계 100대 의약품 중에서 바이오의약품이 차지하는 비중이 2014년에는 50%까지 확대될 것으로 예상되고 있다.
향후, 줄기세포치료제, 바이오시밀러 등의 첨단 바이오의약품의 개발로 인한 새로운 시장의 형성, 이머징 마켓54)의 등장, 융합기술 등 신기술의 발전에 따라, 세계시장 선점을 위한 바이오의약품 업체들의 경쟁이 더욱 치열하게 전개될 것이다.
식약청은 사전검토제도의 내실있는 운영, 첨단제품의 특성에 맞는 허가심사 기준 마련, 안전성․유효성 평가를 위한 각종 가이드라인의 발간 등을 통해 지속적으로 첨단 생명공학의약품의 제품개발을 지원해 나갈 계획이다.
제5장 생명공학 관련 법제도 현황
제5절 생명공학기업 현황과 지원제도
1. 개 요
가. 바이오산업 성장 및 전략적 제휴 활성화
Datamonitor사에 의하면 2009년 세계 바이오산업 시장규모는 2,009억 달러이고 <표 5-5-1> 2005년-2009년 연평균 증가율은 10.2%로 메디컬/헬스케어부문이 전체의 66.2%인 1,330억 달러를 차지해 가장 높은 비중을 보이고 있으며, 2009년 세계 상장기업의 수입(Revenues)은 791억 달러로 전년 대비 9% 감소하였고 상장기업 수나 연구개발비 등도 모두 감소하였다.
<표 5-5-1> 세계 바이오산업 시장규모(2005년-2009년)
(단위 : 10억 달러, 10억 유로, %)
|
연 도 |
10억 달러 |
10억 유로 |
증가율 |
연평균 증가율 |
|
2005년 |
136.4 |
98.1 |
- |
10.2% |
|
2006년 |
153.7 |
110.5 |
12.7% |
|
|
2007년 |
171.8 |
123.6 |
11.8% |
|
|
2008년 |
193.2 |
138.9 |
12.4% |
|
|
2009년 |
200.9 |
144.5 |
4.0% |
출처 : Datamonitor, Biotechnology : Global Industry Guide, Aug. 2010
또한, 거대 제약회사들은 오리지널의약품의 특허 만료, 제네릭의약품과의 경쟁 과열, 신약개발 R&D 비용 증가 등으로 인해 Licensing-in․공동협력 및 M&A 등 다양한 전략들을 추진하고 있는데, 2009년 대표적 M&A는 세계 제1의 제약회사인 Pfizer사가 세계적인 백신기업인 Wyeth사를 680억 달러에 인수한 사례이다.
나. 헬스케어산업 및 바이오화학산업 관심 제고
Datamonitor사 자료에 의하면 의약품(전문의약품)․바이오․생명과학(Tool & Service)을 포함하는 헬스케어산업은 유전체분석과 맞춤의학에 대한 관심이 높아지면서 2008년 세계 시장규모 9,170억 달러 중 의약품이 전체의 74.6%인 6,842억 달러를 기록하여 가장 높은 비중을 차지하고 있으며, 국내에서도 대기업을 중심으로 기술개발 및 산업화에 대한 투자를 확대하고 있는 추세이다.
한편, 미국 NatureWorks사는 세계 최대의 PLA(Poly lactic acid) 생산기업으로 성장하여 성공사례가 되고 있으며, 자동차․전기전자․정유석유․섬유․산업재 등 주력산업에 바이오플라스틱소재 사용이 증대됨에 따라 화학기업의 바이오화학관련 기술개발이 활발해지고, 화학기업과 바이오기업의 전략적 제휴에 의한 협력사례가 늘어나는 등 바이오화학산업에 대한 관심이 고조되고 있다.
2. 해외 동향
가. 미국 동향
(1) 기업 현황
Datamonitor사에 의하면 2009년 미국의 바이오산업 시장규모는 972억 달러(세계시장의 48%)이며, Ernst & Young사에 의하면 2010년 미국의 바이오산업 매출규모(Sales)는 526억 달러, 수입규모(Revenues)는 616억 달러를 기록하였다<표 5-5-2>.
이들 기업 중 선도기업인 Amgen사는 단백질 및 항체 의약품을 중심으로 2010년도 151억 달러의 총 수입 및 46억 달러의 순이익을 기록하여 바이오산업을 리드하고 있다<표 5-5-3>.
<표 5-5-2> 2010년도 미국 바이오산업 현황
(단위 : 10억 달러, 명, 개, %)
|
구분 |
2010년 |
2009년 |
증감률 |
|
제품 판매액(Product sales) |
52.6 |
48.1 |
9% |
|
수입(Revenues) |
61.6 |
56.2 |
10% |
|
연구개발비(R&D expense) |
17.6 |
17.1 |
3% |
|
순이익(Net income) |
4.9 |
3.7 |
33% |
|
시장가치(Market capitalization) |
292.0 |
271.6 |
8% |
|
종업원 수(Number of employees) |
112,200 |
106,600 |
5% |
|
기업 수(Number of companies) |
1,726 |
1,703 |
1% |
출처 : Ernst&Young, Beyond borders : Global biotechnology report 2011, 2011
<표 5-5-3> 2010년도 미국 Amgen사의 경영현황
(단위 : 백만 달러, 명)
|
판매액 |
총수입 |
연구개발비 |
순이익 |
종업원 |
|
14,660 |
15,053 |
2,894 |
4,627 |
17,400 |
출처 : Amgen, Amgen 2010 Annual Report, 2011
(2) 지원제도 현황
미국은 세계 1위의 기술우위를 바탕으로 바이오경제를 리드하기 위해 연방정부 차원에서 2011년도 국립보건원 예산으로 322억 달러를 배정하였으며, 중소기업청은 중소기업의 산업화 촉진 및 기술이전 활성화를 위하여 SBIR 및 STTR 프로그램을 지원하고 있고, 주정부는 기술개발 및 산업화 촉진을 위해 뉴욕․매릴랜드․버지니아 등 28개 주가 미국 BIO 2011 국제행사 전시회에 참가하여 홍보활동을 전개하였다.
미국 바텔연구소 및 바이오산업협회는 북미표준산업분류시스템에 근거해 생명과학산업을 농업사료 및 화학품, 의약품, 의료기기, 연구검사의학실험실 등 4개 부문으로 분류하고 있다.
의약바이오부문은 바이오시밀러 및 백신시장에 대한 관심이 증가되고 있는 상황에서 2010년 바이오신약에 대한 권리를 12년간 보장하는 특허보호법안을 마련하였으며, 산업바이오부문은 6대 혁신기술로 선정하여 에너지부에서 미국 전역에 걸쳐 27개 바이오리파이너리(biorefinery 생물활용 정제) 프로젝트를 추진하고 있다.
나. 일본 동향
(1) 기업 현황
Nikkei Biotech사에 의하면 2009년 일본의 바이오산업 총 시장규모는 2조 4,140억 엔 규모인데, 바이오의약품관련 시장이 약 39%이고, 바이오농업 및 식품이 32%를 차지하고 있다
일본은 제약기업․식품기업․화학기업 등이 바이오산업분야에 참여하여 산업 활동을 전개하고 있으나, 약 600개의 바이오벤처기업도 활동하고 있다.
(2) 지원제도 현황
일본은 관 주도로 바이오산업을 육성하고 있는데, 2009년 12월 수립된 바이오성장전략에 따라 2020년 45조 엔의 시장규모를 창출하고 280만 명의 신규 고용창출을 목표로 바이오산업(Medical/Nursing care 및 기타 보건관련 산업을 성장산업으로 육성, R&D 및 혁신보건기술․제약 및 의료기기 응용 촉진, 아시아 및 기타 해외시장 진출 촉진)을 육성하고 있다.
일본은 바이오산업 정책의 최상위 기구인 바이오기술전략위원회에서 관련 정책을 결정하며, 경제산업성․문부과학성․후생노동성․농림수산성 등 4개 부처에서 대부분의 예산을 집행하고 있는데, 바이오관련 연구개발을 지원하기 위하여 2009년도 정부예산 3,461억 엔을 투자하였다.
다. 유럽 동향
(1) 기업 현황
Datamonitor사에 의하면 2009년 유럽의 바이오산업 시장규모는 506억 달러(세계시장의 25%)이며, Ernst & Young사에 의하면 2010년 유럽의 바이오산업 수입규모(Revenues)는 130억 4백만 유로로 차이가 있다.
유럽의 경우 EU 체제 하에서 회원국간 협력 및 경쟁을 통해 의약기업 및 화학기업들을 중심으로 의약바이오․산업바이오뿐만 아니라 바이오관련 분야에서 다양한 사업을 추진하고 있다.
(2) 지원제도 현황
2010년 3월 EU 집행위원회는 현재의 경제․금융위기를 극복하고 지속 성장을 달성하기 위해 Europe 2020 전략(Europe Strategy for 2020), 유럽바이오산업연합(EuropaBio)은 동 전략의 이행을 위한 바이오분야 추진전략을 발표하였는데, 동 전략의 Agenda는 Smart growth(지적 성장), Sustainable growth(지속가능 성장), Inclusive growth(동반 성장)이다.
그리고 제7차 Framework Program(2007년~2013년)에 의해 보건․바이오․식품․농산품개발에 95억 유로를 투자하고 있으며, 지속가능 화학품에 관한 유럽기술 플랫폼 및 프레임워크 프로그램을 구성하여 연구개발 지원과 투자를 확대하면서 회원국마다 자체 R&D 지원 프로그램을 수립하고 있다.
3. 국내 현황
가. 기업 현황
지식경제부/한국바이오협회가 2010년에 실시한 2009년도 국내 바이오산업 통계조사에 응답한 853개사의 바이오산업분야 참여유형은 연구개발 및 제품판매단계 546개사, 연구개발단계 307개사 정도이다.
의약바이오부문의 활성도가 강한 국내 산업체 소속의 바이오 전문인력 22,817명(연구인력 11,096명 : 49%, 생산인력 11,721명 : 51%)의 경우 연구인력은 석사급 47%, 생산인력은 학사급 47%로 각각의 비중이 제일 크다.
상기의 통계조사에 의하면 국내 바이오산업 총 수급규모는 6조 9,654억 원 규모인데<표 5-5-4>, 이중에서 수요부문은 내수가 4조 2,367억 원이고 수출은 2조 7,287억 원이며, 공급부문은 생산이 5조 6,362억 원이고 수입이 1조 3,292억 원 규모이다. 한편, 2010년도 국내 바이오산업 총 수급규모는 8조 원 이상으로 추정하고 있다.
<표 5-5-4> 2009년도 국내 바이오산업 총 수급규모
(단위 : 백만 원, %)
|
공 급 |
계 |
수 요 |
||||||
|
생 산 |
수 입 |
내 수 |
수 출 |
|||||
|
금 액 |
비 중 |
금 액 |
비 중 |
금 액 |
비 중 |
금 액 |
비 중 |
|
|
5,636,197 |
80.9 |
1,329,247 |
19.1 |
6,965,444 |
4,236,695 |
60.8 |
2,728,749 |
39.2 |
출처 : 지식경제부/한국바이오협회, 2009년도 국내 바이오산업 통계조사, 2010
2009년도 국내 시장규모는 4조 2,367억 원(국산제품 2조 9,075억 원 : 69%, 수입제품 1조 3,292억 원 : 31%) 규모인데, 이중에서 바이오의약품은 2조 5,363억 원(60%), 기타는 1조 7,004억 원(40%)으로 구성되어 있다<표 5-5-5>. 그리고 2010년도 국내 바이오산업 시장규모는 5조 원 이상으로 추정하고 있다.
<표 5-5-5> 2009년도 국내 바이오산업 시장규모
(단위 : 억 원)
|
구 분 |
주요 제품 |
국산 제품 |
수입 제품 |
합계 |
|
바이오의약 |
항생제, 항암제, 백신 외 |
15,642 |
9,721 |
25,363 |
|
바이오화학 |
바이오고분자, 산업용 효소 외 |
2,604 |
1,117 |
3,721 |
|
바이오식품 |
건강기능식품, 발효식품 외 |
4,811 |
337 |
5,148 |
|
바이오환경 |
환경처리용 미생물제제 외 |
2,152 |
40 |
2,192 |
|
바이오전자 |
DNA칩, 단백질칩 외 |
328 |
41 |
369 |
|
바이오공정 및 기기 |
바이오반응기 외 |
1,029 |
1,923 |
2,952 |
|
바이오에너지 및 자원 |
바이오연료 외 |
1,107 |
109 |
1,216 |
|
바이오검정, 정보개발 |
바이오정보서비스 외 |
1,402 |
4 |
1,406 |
|
합 계 |
29,075 |
13,292 |
42,367 |
|
출처 : 지식경제부/한국바이오협회, 2009년도 국내 바이오산업 통계조사, 2010
나. 지원제도 현황
정부는 교육과학기술부, 보건복지부, 지식경제부 등 6개 관련부처 및 출연기관에서 2009년 1조 5,175억 원을 투자하였고, 2011년 1조 5,012억 원 투자를 계획하고 있다<표 5-5-6>.
국내 바이오산업관련 지원제도는 크게 기술개발 및 하부구조구축 지원으로 구별되는데, 2010년의 경우 1조 5,175억 원 예산 중에서 연구개발 1조 969억 원(72%), 인프라 3,426억 원(23%), 인력양성 780억 원(5%)의 구성비를 나타내고 있다.
부처별로는 교육과학기술부 35.5%, 보건복지부 28.3%, 지식경제부 11.1%, 농림수산식품부 8.9%, 국토해양부 5.9%, 환경부 2.2%의 순이다.
<표 5-5-6> 2011년도 부처별 생명공학 투자계획 총괄
(단위 : 백만 원, %)
|
구 분 |
연구개발 |
인프라 |
인력양성 |
계 |
2010년도 실적 |
|
교육과학기술부 |
487,852 |
32,083 |
72,407 |
592,342 |
539,213 |
|
농림수산식품부 |
161,663 |
1,000 |
3,500 |
166,163 |
135,539 |
|
지 식 경 제 부 |
110,287 |
36,532 |
2,600 |
149,419 |
168,424 |
|
보 건 복 지 부 |
280,230 |
64,472 |
1,250 |
345,952 |
429,942 |
|
환 경 부 |
33,606 |
|
|
33,606 |
32,686 |
|
국 토 해 양 부 |
32,691 |
40,529 |
|
73,220 |
89,850 |
|
출 연 기 관 |
122,300 |
18,169 |
|
140,469 |
121,849 |
|
계 |
1,228,629 |
192,785 |
79,757 |
1,501,171 |
1,517,503 |
출처 : 교육과학기술부 등, 2011년도 생명공학육성시행계획, 2011
또한, 2011년 3월 국가과학기술위원회가 출범하여 국가 R&D에 대한 종합조정기능을 강화하고 있으며, 2010년 범부처 전주기 신약개발사업 연구기획을 개시하여 2011년부터 본격적으로 추진할 계획이고, 2010년 11월 바이오시밀러 글로벌 수출산업화 전략을 발표하였으며, 2011년 8월 천연물신약 개발을 추진하고 있다.
그리고 제약산업 육성 및 지원에 관한 특별법 제정(2011년 3월), 산업융합촉진법 제정(2011년 4월) 및 BT융합 산업지원방안 마련, 재생의학연구개발촉진법안 마련(2011년 1월) 등을 통해 바이오관련 연구개발 및 산업화를 지원하고 있다.
4. 발전 과제
가. 시장 경쟁력 확보 및 목표 지향적 산업화 추진
이제 세계적으로 바이오산업은 시장 경쟁력 확보가 최우선과제이므로 철저한 시장 목표지향적 전략(Market-targeted Strategy) 하에서 산업화 및 사업화를 추진하여야 한다.
시장 경쟁력을 확보하고 목표 지향적 산업화를 추진하기 위해서는 보유하고 있는 기술개발 성과를 바탕으로 바이오관련 자금 및 정책 지원의 집중을 통해 자체 또는 전략적 제휴 등 다양한 전략을 추진하여야 한다.
나. 의약바이오 및 헬스케어의 연계 및 동반성장
부가가치 의약바이오부문은 단백질의약품 및 항체의약품에 대한 중점 투자하여 바이오신약 개발은 물론 바이오신밀러 및 바이오베터 의약품의 사업화도 추진해야 할 것이다. 그리고 유전자치료제 및 세포치료제 등에 대한 투자도 중장기적으로 이루어져야 한다.
한편, 유전체 정보 및 바이오정보학을 기반으로 의약품 타게팅이 변화되는 맞춤의학과 진단시스템 등 헬스케어부문에 대해 산업화 차원에서 기술개발과 산업화를 추진하여야 한다.
다. 규제 및 인증에 대비한 산업바이오 육성 필요
유럽에서 BASF사․Cargill사 등은 2005년 2월 폴리머 친환경 생산을 보장하는 자율협약을 체결한 이후 이탈리아는 2011년 1월부터 폴리에틸렌 쇼핑 백이나 포장재 금지를 통해 연간 CO2 배출량을 연간 180,000 MT 저감시키고 있다. 그리고 일본은 BiomassPla 및 GreenPla 바이오플라스틱에 대한 인증시스템을 적용하고 있다.
세계 6대 자동차 메이커의 자동차 제조에 사용되는 다양한 고분자 소재에 대한 현재 및 향후 전략은 지속성장형 플라스틱 사용인데, 2020년까지 무독성․재생 가능 그린카본 기반 플라스틱을 사용하는 것이다.
2011년 1월 거대 화학기업인 미국의 DuPont사는 효소 및 식품 소재부문 생산회사인 덴마크의 Danisco사를 63억 달러 규모로 인수하여 바이오화학분야에 집중하고 있는 것은 시사하는 바가 크며, 산업바이오부문에 본격적으로 대비해야 하는 상황이라 하겠다.


생명공학 연표
■ 기원전 8000년
○ 인간이 농작물과 가축을 경작하고 사육하기 시작
○ 최초로 감자를 식용으로 경작
■ 기원전 4000~2000년
○ 이집트에서 효모를 사용해 빵과 맥주의 발효 시작
○ 수메리아, 중국, 이집트에서 치즈를 생산하고 포도주를 발효시킴
○ 바빌로니아인들은 몇 그루 수술 나무의 꽃가루를 가지고 선별적으로 암술나무에 수정하여 대추야자를 생산
■ 기원전 500년
○ 중국에서 항생물질을 가진 곰팡이가 핀 두부로 종기를 치료
■ 서기 100년
○ 중국에서 최초로 살충제를 국화에 살포함
■ 1322년
○ 아랍에서 우성 말을 생산하기 위해 최초로 인공수정을 사용
■ 1590년
○ Janssen, 현미경 발명
■ 1663년
○ Hooke, 세포의 존재 발견
■ 1675년
○ Leeuwenhoek, 박테리아를 발견
■ 1761년
○ Koelreuter, 다른 종의 농작물을 성공적으로 이종교배하였음을 보고
■ 1797년
○ Jenner, 아이들에게 천연두를 막기 위한 바이러스성 백신을 접종
■ 1830~1833년
○ 1830년 단백질 발견
○ 1833년 최초로 효소가 발견되고 분리됨
■ 1835~1855년
○ Schleiden와 Schwann, 모든 유기체는 세포들로 구성되어 있다고 제안
○ Virchow, “모든 세포는 세포에서 생겼다”고 선언
■ 1857년
○ Pasteur, 미생물들이 발효를 유발한다고 제안
■ 1859년
○ Charles Darwin, 자연 도태의 진화론을 발표(1800년대 후반 유전학의 무지에도 불구하고 선택된 부모와 도태된 다양한 자손에 대한 개념은 동식물 사육사들에게 매우 큰 영향을 줌)
■ 1865년
○ 유전학 연구 시작
○ Gregor Mendel, 오스트리아인 수도사인 그는 완두를 연구하여 유전법칙에 의해 유전적 특징이 부모로부터 자손에게 물려진다는 점을 발견함
■ 1870~1890년
○ Darwin의 이론을 이용하여 면화를 이종교배하고 수백 가지의 우성품종을 개발
○ 최초로 농부들이 수확량을 늘리기 위해 농지에 질소고정 박테리아 미생물을 섞음
○ William James Beal, 최초로 실험실에서 실험용 옥수수 잡종 생산
■ 1877년
○ Koch, 박테리아를 염색하고 동정하기 위한 기술 개발
■ 1878년
○ Laval, 최초로 원심분리기 개발
■ 1879년
○ Fleming, 후에 염색체라 불려지는 세포핵 안쪽의 봉모양의 염색질을 발견
■ 1900년
○ 초파리가 유전연구에 사용
■ 1902년
○ 면역학이라는 용어가 처음으로 나타남
■ 1906년
○ 유전학이라는 용어가 소개됨
■ 1911년
○ Rous, 최초로 암을 유발하는 바이러스 발견
■ 1914년
○ 최초로 박테리아를 영국 맨체스터의 하수처리에 사용
■ 1915년
○ Phage(박테리아성 바이러스)발견
■ 1919년
○ 최초로 생명공학(Biotechnology)이라는 단어가 출판물에 사용
■ 1920년
○ Evans와 Long, 인간성장 호르몬 발견
■ 1928년
○ Alexander Fleming, 항생물질인 페니실린 발견
○ 유럽에서 조명충 나방제어를 위한 소규모의 Bacillus thuringiensis(Bt) 테스트 시작
○ 1938년 프랑스에서 미생물 살충제의 상업적 생산 시작
○ Karpechenko, 무와 양배추를 교배하여 서로 다른 속(屬)의 식물 사이에서 번식력이 강한 자손을 만듦
○ Laibach, 최초로 오늘날 이종교배라 알려진 광범위한 교배로부터 잡종을 얻기 위해 배구제(embryo rescue)를 사용
■ 1930년
○ 美의회에서 식물육종생산의 특허를 가능하게 하는 식물특허법(Plant Patent Act) 통과
■ 1933년
○ 1920년대 Henry Wallace에 의해 개발된 잡종옥수수가 상업화 됨(1945년에는 엄청난 매출액은 증가된 연 종자구입비를 능가했고 잡종 옥수수는 미국 전체 옥수수 생산량의 78%를 차지)
■ 1938년
○ 분자 생물학이란 용어가 생김
■ 1941년
○ 유전공학이란 용어가 폴란드 Lwow의 기술연구소에서 효모복제에 관한 강의를 맡고 있는 덴마크의 미생물학자 A. Jost에 의해 최초로 사용
■ 1942년
○ 박테리아를 감염시키는 박테리오파지를 규명하고 확인하기 위해 전자 현미경을 사용
○ 페니실린을 미생물에서 생산함
■ 1944년
○ Avery와 그 외 다른 사람들에 의해 DNA가 유전정보를 운반한다는 점이 입증됨
○ Waksman, 결핵에 효과적인 항생제인 streptomycin을 분리(추출)
■ 1946년
○ 새로운 타입의 바이러스를 형성하기 위해 서로 다른 바이러스로부터의 유전물질이 결합할 수 있다는 일종의 유전자 재조합이 발견
○ 유전적 다양성의 상실로 인한 위협을 인식한 미의회는 식물수집과 보존 그리고 이러한 인식의 홍보에 막대한 자금을 제공함
■ 1947년
○ McClintock, 옥수수에서 소위 움직이는 유전자(jumping genes)라 불리는 전이요소를 발견
■ 1949년
○ Pauling, 겸상(鎌狀) 적혈구 빈혈증(흑인의 유전병)이 헤모글로빈 내 단백질분자의 돌연변이로 야기된 ‘분자병’임을 밝혀냄
■ 1951년
○ 냉동정액을 사용한 가축의 인공수정이 성공적으로 수행됨.
■ 1953년
○ 과학저널 Nature는 현대 유전학의 출발을 상징하는 DNA의 이중나선구조를 묘사한 James Watson과 Francis Crick의 원고를 출판
■ 1955년
○ 핵산 합성에 관한 효소가 처음으로 추출됨
■ 1956년
○ Kornberg, DNA 복제에 필요한 효소 DNA 중합효소Ⅰ(DNA polymeraseⅠ) 발견
■ 1958년
○ 겸상 적혈구 빈혈증이 단일 아미노산의 변화 때문에 발생한다고 밝혀짐
○ DNA가 처음으로 시험관에서 만들어짐
■ 1959년
○ 조직 살균제가 개발됨
○ 단백질 생합성의 첫 단계가 그려짐
■ 1950년대
○ 바이러스 증식억제 물질(interferon) 발견
○ 최초 합성 항생 물질 개발
■ 1960년
○ 시냅시스(세포의 감수분열 초기에 있는 상동염색체의 병렬접착)를 이용해 DNA-RNA 잡종 분자가 만들어짐
○ 메신저 리보 핵산(Messenger RNA) 발견
■ 1961년
○ 美농림부가 최초 미생물 살충제인 Bacillus thuringiensis를 등록함
■ 1963년
○ Norman Borlaug에 의해 신품종 밀이 개발됨으로 인해 생산량이 70% 상승함
■ 1964년
○ 필리핀의 국제 벼 연구소(The International Rice Research Institute)는 새로운 품종을 개발하여 충분한 비료를 주면 이전의 생산량보다 2배 많은 수확량을 얻을 수 있는 녹색 혁명을 일으킴
■ 1965년
○ Harris와 Watkins가 성공적으로 생쥐와 사람 세포를 융합시킴
■ 1966년
○ 유전암호가 해독되고 일련의 3개의 뉴클리오티드가 하나의 아미노산을 결정한다는 사실이 밝혀짐
■ 1967년
○ 최초로 자동 단백질 서열 분석기 완성
■ 1969년
○ 처음으로 효소가 생체 외에서 합성됨
■ 1970년
○ 노르만인 Borlaug, 노벨 평화상 수상(1963년 참조)
○ 유전물질을 자르는 제한 효소(두 줄 사슬 DNA를 특정 부위에서 절단하는 효소)의 발견으로 유전자 복제의 장이 열림
■ 1971년
○ 처음으로 유전자가 완벽하게 합성됨
■ 1972년
○ 인간의 DNA 구성이 침팬지와 고릴라의 DNA와 99% 유사함이 발견됨
○ 최초로 배이식(胚移植)이 시도됨
■ 1973년
○ Stanley Cohen와 Herbert Boyer, 제한효소와 리가제(ligases)를 사용해서 DNA를 자르고 붙이는 기술과 박테리아에서 새로운 DNA를 복제하는 기술을 완성함
■ 1974년
○ 미국 NIH는 유전자 재조합 연구를 총괄하기 위해 재조합 DNA 자문위원회(Recombinant DNA Advisory Committee) 구성
■ 1975년
○ 최초로 미국 정부가 캘리포니아 Asilomar 회의에서 유전자재조합실험을 규제하기 위한 가이드라인 개발을 주장함
○ 단일클론항체가 생산됨
■ 1976년
○ 유전자 재조합 기술이 유전 장애인에 최초로 적용
○ 분자교배가 태아의 alpha thalassemia 진단에 사용됨
○ 효모의 유전자가 대장균(E.coli)에서 발현됨
○ 최초로 특정유전자의 염기쌍 순서가 결정됨(A, C, T, G)
○ 美國재조합 DNA 자문위원회(NIH Recombinant DNA Advisory Committee)에 의해유전자 재조합 실험에 대한 가이드라인이 처음으로 발표
■ 1977년
○ 인간유전자를 박테리아에서 처음으로 발현시킴
○ 전기영동을 이용해 DNA의 긴 마디를 빠르게 나열하기 위한 연구수행
■ 1978년
○ 바이러스의 고방사선 구조가 최초로 확인됨
○ 재조합 인간 인슐린이 최초로 생산됨
○ 미국 노스캐롤라이나 과학자들이 DNA 분자상의 특정 위치에 특정 돌연변이를 일으키는 것이 가능하다는 것을 보여줌
■ 1979년
○ 최초로 인간성장 호르몬이 합성됨
■ 1970년대
○ 유전공학 제품을 개발하기 위해 최초의 상업적 회사가 설립
○ 중합효소(polymerases)의 발견
○ 뉴클리오티드(nucleotides)의 빠른 나열기술 완성
○ 유전자 표적화
○ RNA splicing
■ 1980년
○ Diamond v. Chakrabarty 재판에서 미 연방법원은 유전자재조합생물형태에 대한 특허를 인정했으며, Exxon 석유회사가 기름 먹는 미생물에 대한 특허 취득
○ 美國정부 유전자복제에 대한 권한을 Cohen과 Boyer에게 부여
○ 최초의 유전자합성 기계 개발
○ 인간인터페론유전자를 박테리아로 형질전환(Transformation) 시킴
○ 노벨 화학상이 유전자 재조합분자를 개발한 Berg, Gilbert, Sanger에게 수여됨
■ 1981년
○ 오하이오 대학의 과학자들이 다른 동물의 유전자를 쥐에 이식함으로써 최초로 유전자 이식동물을 생산함
○ 중국의 과학자가 최초로 복제 물고기 금잉어를 만듦
■ 1982년
○ 미국의 Applied Biosystems社는 단백질 서열분석에 필요한 샘플의 양을 획기적으로 줄일 수 있는 상업적 가스 상 단백질 서열분석기를 발표
○ 가축을 위한 최초의 유전자 재조합 DNA 백신 개발
○ 유전적 변이를 거친 박테리아에서 생산된 인간인슐린이 미국 FDA로부터 최초의 생명공학 기술에 의한 의약품으로 승인 받음
○ 최초의 유전자 변형식물인 피튜니아 생산
■ 1983년
○ 중합효소연쇄반응(PCR) 기술이 소개(유전자와 유전자 조각의 복제를 위해 열과 효소를 사용하는 PCR 기술은 이후 유전공학에서의 연구와 개발에 광범위하게 쓰이는 중요한 도구가 됨)
○ TI 플라스미드(plasmid: 염색체와는 따로 증식할 수 있는 유전인자)에 의한 식물 세포들의 유전학적인 변형이 수행됨
○ 최초로 인공염색체 합성
○ 특정유전병 유발인자 발견
○ 생명공학기술을 이용해 피튜니아를 완전 성장시킴
○ 피튜니아 식물을 통해 유전자변형식물의 새로운 특징이 자손에게 전달됨을 확인함
■ 1984년
○ DNA 지문검색 기술이 개발
○ HIV 바이러스의 전체 게놈이 복제되고 서열 결정됨
■ 1985년
○ 신장병과 낭포성 섬유증을 유발하는 유전인자 발견
○ 법적 증거로서 유전자 지문법이 도입
○ 최초로 곤충과 박테리아, 바이러스에 저항력이 있는 유전자 변형식물이 시험됨.
○ 미국 NIH는 인간을 대상으로 하는 유전자 치료법 실험수행에 대한 가이드라인을 정함
■ 1986년
○ 유전자 재조합 B형 간염 백신 최초 개발
○ 최초의 유전공학 항암치료제 인터페론 생산
○ 미국 정부는 유전자 재조합 유기체에 대해 전통적인 유전자재조합기술로 만들어진 제품에 적용된 규정보다 더 엄격한 “The Coordinated Framework for Regulation of Biotechnology” 규정 확립
○ California Berkeley 대학의 화학자가 신약을 개발하기 위해 항체와 효소를 결합하는 방법(abzymes) 제시
○ 유전자 변형식물(담배)의 실제 실험이 수행됨
○ 최초로 환경 보호국이 유전자변형 담배의 판매를 승인
■ 1987년
○ 바이러스에 내성이 있는 토마토의 field test를 최초로 승인함
○ 캘리포니아에서 농작물의 서리 형성을 억제하는 유전자 변형 박테리아인 Frostban을 딸기와 감자를 통해 시험하였는데 이것이 처음으로 공식 승인된 유전자 재조합 박테리아 외부 실험임
■ 1988년
○ 미국 정부는 하버드대학 분자유전학자에게 유전자 변형동물 즉, 유전자변형 쥐에 대한 특허권을 부여함
○ 세제에 사용할 수 있는 표백제 내성을 지닌 단백질 분해효소를 만드는 공정에 대한 특허권이 부여됨
○ 미국 의회가 다른 종의 게놈뿐만 아니라 인간유전자 암호를 해독하고 지도를 만드는 인간 게놈 프로젝트 연구비를 승인함
■ 1989년
○ 최초로 유전자변형 해충방지 면화의 field test 승인
○ 식물 게놈 프로젝트 시작
■ 1980년대
○ 진화의 역사를 밝히기 위한 DNA 연구 시작
○ 유럽에서 유전자 재조합 동물백신의 사용 승인
○ 기름 청소에 미생물을 이용한 생물학적 정화기술 사용
■ 1990년
○ 미국 최초로 유전자재조합 기술을 이용하여 치즈제조에 쓰이는 인공적으로 제조된 chymosin 효소인 Chy-MaxTM이 소개됨
○ 인체의 모든 유전자 지도를 제작하려는 국제적인 노력인 인간 게놈 프로젝트가 시작됨
○ 면역장애를 앓고 있는 4살 여자 어린이를 대상으로 실시한 유전자 치료가 성공적으로 수행됨
○ 유아 조유용 우유 단백질을 만드는 유전자 변형 젖소 탄생
○ 해충에 강한 옥수수인 Bt 옥수수 생산
○ 영국 최초로 유전자변형 효모식품이 승인됨
○ 유전자 변형 척추동물 송어의 실지실험이 수행됨
■ 1992년
○ 미국과 영국의 과학자들이 시험관 내에서 배아에 낭포성 섬유증과 혈우병과 같은 유전적 기형을 테스트하는 기법을 밝힘
○ 미국 FDA는 유전자 이식 음식이 유전적으로 위험하지도 않고 특별한 규정도 필요 없다고 선언함
■ 1993년
○ 미국 FDA, 낙농가의 우유생산 촉진을 위해 BST(Borine Somatotropin)를 승인
■ 1994년
○ 미국 FDA, 생명공학으로 만들어진 FLAVRSAVRTM tomato 승인
○ 최초로 유방암 유전자 발견
○ CF 환자의 폐에 단백질이 쌓이지 않게 하는 재조합 인간 DNase 승인
○ 소 성장호르몬(POSILAC)이 상용화됨
■ 1995년
○ 에이즈 환자에게 최초로 비비의 골수가 이식됨
○ 최초로 바이러스 이외의 살아있는 유기체(Hemophilus Influenzae)의 완벽한 유전자 배열이 완성됨
○ 암정복을 위해 면역시스템 모듈, 유전자 재조합 항체형성과 같은 유전자 치료가 도입됨
■ 1996년
○ 파킨슨병과 관련된 유전자의 발견으로 퇴행성 신경질환의 잠재 가능한 치료와 그 원인 연구의 중요한 이정표를 제시함
■ 1997년
○ 스코틀랜드에서 어른세포로 복제된 최초의 복제양 Dolly 탄생
○ 해충방지 농작물인 Roundup ReadyTM 콩과 BollgardTM 해충방지 면화와 같은 작물이 상업화 됨
○ 아르헨티나, 호주, 캐나다, 중국, 멕시코와 미국 등 전 세계적으로 500만 에이커 면적에서 유전자조작 작물이 재배됨
○ Oregon주 연구자들은 두 마리의 붉은털 원숭이를 복제했다고 주장함
○ 유전병 연구의 새로운 기술을 창조하기 위해 PCR, DNA 칩과 컴퓨터를 결합한 새로운 DNA기술 탄생
■ 1998년
○ 하와이대학 연구진이 어른의 난소 적(cumulus)세포 핵으로부터 쥐를 복제함
○ 인간 배아줄기세포주가 확립됨
○ 일본 Kinki 대학 연구진은 한 마리 어른암소로부터 얻은 세포를 이용하여 8마리의 동일 송아지 복제함
○ 최초로 C. elegans 벌레에 대한 동물 게놈 염기서열 해독 완료
○ 30,000개 이상의 유전자 위치를 보여주는 인간 게놈지도의 초안 완성
○ 동남아시아 다섯 나라가 병에 강한 파파야 나무를 개발하기 위해 컨소시엄을 구성
■ 1990년대
○ 최초로 영국에서 유전자 지문법을 이용해 유죄를 판결함
○ 규정 질량의 일반적 융기에 착상된 유전자 분리성공
○ 유전성 대장암이 DNA 치료 유전자의 결핍으로 야기된다는 사실 발견
○ 유전자 재조합 광견병 백신을 너구리에 실험
○ 미국에서 농약을 기본으로 한 생명공학 제품판매 승인
○ 특수이식 유전자를 가진 쥐에 관한 특허 허용
○ 최초로 유럽에서 발암물질에 민감한 유전자변형 쥐에 관한 특허 제기
○ 유방암 유전자 복제
■ 2000년
○ 최초로 애기장대(학명 Arabidopsis thaliana)의 게놈지도 개발
○ 13개 나라에서 총 1억 89만 에이커 면적에서 생물공학 농작물이 재배됨
○ 최초로 바이러스에 강한 고구마가 케냐에서 실질 시험됨
○ 인간게놈 배열의 초안 발표
■ 2001년
○ 최초로 벼 게놈지도 완성
○ 오스트리아 연구진들은 Barley Yellow Dwarf Virus와 같은 바이러스 예방백신에 사용되는 hairpin RNA를 이용한 기술개발을 보고함
○ Chinese National Hybrid 연구진들은 일반 쌀 생산량보다 두 배 많은 super rice종 개발을 보고함
○ 유럽위원회(The European Commission)가 모든 유전자 변형 식품에 라벨을 붙일 것을 제기함
○ 농업적으로 중요한 시노라이조비움 멜리로티(Sinorhizobium meliloti) 박테리아의 DNA배열 완성
○ 염분이 있는 물과 땅에서 성장 가능한 최초의 농작물을 만들기 위해 애기장대로부터 추출된 유전자를 토마토에 이식함
○ 농업에 중요한 식물병원균 Agrobacterium tumefaciens의 게놈서열이 공표됨
○ 스트레스에 더 강한 농작물 개발의 실마리로서, 손상을 입거나 스트레스를 받았을 때 빛을 발하는 세일 크레스(thale cress)라 불리는 실험용 식물 재배
○ 최초로 땅콩의 종합적 분자지도가 완성됨
■ 2002년
○ 완성된 인간 게놈 배열을 과학전문지에 게재함
○ 효모의 프로테옴(Proteome: 단백질 간 상호작용과 네트워크의 총합)의 기능지도(functional map)의 초안 완성, 효모의 게놈지도는 1996년에 발표되었음
○ 줄기세포의 분화에 관여하는 조절인자 연구에 큰 발전이 있었으며, 이에 관여하는 200여개의 유전자가 밝혀짐
○ 생명공학 농작물이 16개국, 1억 4천 5백만 에이커에서 재배되고 있으며 이는 2001년보다 12% 증가한 것임
○ 자궁경부암에 대한 백신 개발에 성공하였으며 이는 특정 암에 대한 예방백신이 가능함을 처음으로 보여준 성과임
■ 2003년
○ 인간게놈 완전 해독(4월)
○ 정신분열증과 우울증 등 정신병의 발병 위험을 증가시키는 특정유전자 변형을 확인한 연구결과 발표
○ 美최초의 GM 애완동물로 광고된 붉은 빛 형광물고기 GloFish 상업화
○ 세계적으로 생명공학작물 이용의 활성화 증대
○ 영국은 최초로 상업적인 생명공학작물인 제초제 저항옥수수를 인정
○ 미국 환경 보호국은 최초로 형질전환 해충저항성 옥수수를 승인함
○ 2003년 banteng 들소가 최초로 복제되었으며, 노새, 말, 사슴도 복제되었음
○ 1997년 포유동물의 최초 복제양 돌리는 폐병연구 후에 안락사 됨
○ 일본 연구팀은 자연적으로 카페인을 제거하는 생명공학 커피를 개발함
○ RNA 형태는 유전자 형식을 지시, 변형시키며 줄기세포와 배(胚)의 성장에 영향을 미침을 밝힘
○ 쥐의 배 세포줄기가 정자나 난자 세포로 성장할 수 있음을 확인
○ 남성을 결정짓는 Y염색체가 동일한 유전자를 함유하고 있음을 발견
○ 종양으로 하여금 암의 전이에 필요한 혈관을 생성하지 못하도록 하는 약물의 개발
■ 2004년
○ 미국 식품의약국(FDA)은 아바스틴이라는 최초의 신세대 항암제를 승인함.
○ FDA는 다양한 종류의 약물치료와 질병을 위해 첫 DNA칩 및 유전자칩 개발
○ RNA 방해 제품으로, 임상 시험에 들어가는 첫 번째 RNAi 제품 생산
○ 국제연합 식량농업기구(FAO)의 생명공학 작물 승인
○ 국립과학연구원 산하 의학연구소에서는 ‘생명공학작물이 건강에 해를 끼치지 않는다’라고 밝힘.
○ FDA는 식품안전성 검토 후 생명공학 밀의 안전성 밝힘.
○ 몬산토사는 지방산을 감소 삭제한 low-linolenic 콩을 소개함
○ 닭 게놈 DNA 완전 해독
○ 최초로 애완 새끼고양이 복제
○ ‘쓸모없는 DNA(junk DNA)’ 규명
○ 인간의 유전자 DNA 중 단백질을 합성하는 DNA는 전체 게놈의 10%에 불과하며 아무런 기능이 없는 DNA에 대한 규명 이루어짐
○ 지난 3월 영국의 과학자들, 지난 20년간 나비 58종의 개체 수가 71% 줄었으며, 조류는 54% 감소했다고 보고
○ 新의약품 개발 활발
○ 유엔(UN), 대학, 민간자선단체, 제약업체 등 공공단체와 민간기업이 손을 잡고 미개발국의 환자를 위해 의약품을 개발하는 새로운 움직임이 일어남.
○ 미생물게놈 추출성공, 인간게놈프로젝트 주역인 미국 크레이크 벤터 박사는 3월 사이언스에 바닷물에서 미생물 게놈을 추출해 10억 5,000만 염기쌍을 한꺼번에 분석하는 데 성공했다고 밝힘
■ 2005년
○ 게놈지도와 야외 관찰로 진화가 일어나는 복잡한 과정을 밝힘
○ 유럽 호이겐스 탐사선이 토성의 달 타이탄에 착륙하고, NASA의 Deep Impact가 혜성에 충돌한 실험 등
○ 분자 생물학자들이 봄에 꽃이 다양한 색깔을 내게 하는 원리를 발견
○ 위성과 지상망원경으로 도시 크기의 죽은 별들인 중성자별 관찰
○ 정신분열증, 난독증, 안면경련증과 같은 뇌 신경질환 연구
○ 외계에서 온 암석과 지구의 암석을 비교 분석한 결과 지구 생성에 대해 새로운 이론 설립
○ volage-gated potassium channel의 분자 구조 밝힘
○ 인간 활동에 의한 지구 온난화의 증거 추가 발견
○ 분자 생물학자들이 복잡한 시스템의 행태를 이해하기 위해 엔지니어 기술 이용
○ 120억 달러 규모의 국제 핵융합 실험로(International Thermonuclear Ex-perimenta Reactor) 위치가 18개월의 논란 끝에 프랑스 Cadarache로 결정
○ Z 나선형 DNA와 B 나선형 DNA의 결합구조 규명, 네이처지 게재
■ 2006년
○ 네안데르탈인 DNA 염기서열 분석
○ 급진전되는 지구 온난화 전망 제기
○ 땅위를 걸어다닌 물고기 화석 발견
○ 시력감퇴 치료제 개발
○ 생물 다양성의 재발견
○ 최첨단 현미경 기술 개발
○ 기억메커니즘 규명 단초 발견
○ 마이크로 RNA와 siRNA보다 약간 긴 새로운 RNA를 발견
○ 미연방정부 연구비 천만 달러를 받아 일리노이 대학 연구팀이 진행하고 있는 돼지 게놈 해독은 2년 안에 완성될 것으로 기대
○ 미 부시 대통령이 상하원 합동연설에서 농업 페기물로부터 바이오에탄올 생산 지원
○ 미 NIH가 유방암 재발을 예측하기 위해 10년간, 만 명의 환자에 대해 유전자 검사를 실시하는 연구를 개시
○ 미국 당뇨병 협회(ADA)가 농업 및 식량분야 생명공학에 대한 지원을 재확인
○ 다우사가 최초의 식물 생산 백신에 대한 허가를 취득
○ Renessen사가 생명공학 기술을 이용하여 유용성이 추가된 작물에 대해 최초로 동물 사료로 판매할 수 있는 허가를 취득
○ USDA가 밀의 게놈연구를 위해 18개 대학 밀번식 컨소시엄에 연구비 오백만 달러 지원
○ 오메가-3 지방산을 생산하는 형질전환 돼지 개발
○ 세계무역기구는 EU가 21가지의 농업 생명공학제품에 대해 통상약정을 위반 했다고 발표
○ 프랑스 농무부가 생명공학 옥수수 및 담배 작물에 대해 17가지의 새로운 실지 시험을 허가
○ 마이크로RNA의 초기프로세싱 기전 규명
○ 암 발생 억제기능 SUSP4 유전자의 분리 및 작용 메커니즘 규명
○ 저분자화합물을 이용한 세포노화의 가역적 재프로그래밍
■ 2007년
○ AMPK 효소 항암기능 최초 규명. AMPK 활성화를 통해 대장암 세포가 정상으로 변화
○ 체내 면역반응 조절 ‘브레이크 장치’ 물질 발견
○ ‘스페인감기’ 바이러스를 이용해 조류독감을 치료할 수 있는 길이 열림
○ 화성에 물 존재 증거 발견
○ 자연계에 존재하지 않는 D-아미노산을 손쉽게 합성할 수 있는 신기술 개발
○ 수명이 다하거나 손상을 입은 세포에 죽음의 신호를 보내는 메커니즘 규명
○ 암 발병을 억제하는 유전자의 기능 규명
■ 2008년
○ 조류독감 인체 간 감염 유발 경로 찾았다(출처:Nature Biotechnology)
○ 모유수유가 천식 등을 유발하는 항원에 대해 아이들을 어떻게 보호하는지에 대한 기전 규명(출처: Nature Medicine)
○ 장내 세균과의 공생 기제 밝혀냈다(출처: Science)
○ 인간배아줄기세포로 당뇨병 쥐 치료 성공(출처: Nature Biotechnology)
○ 탈모유발 유전자 발견, 새 탈모약 개발기대(출처: Nature Genetics)
○ 암 세포를 무제한 자라게 하는 ‘효소단백질’ 확인(출처: Nature)
○ 비만 원인 ‘유전자 네트워크 이상’(출처: Nature)
○ 루게릭병 유발 ‘유전자’ 찾았다(출처: Nature Genetics)
○ 운동신경세포 분화과정 규명(Developmental Cell)
○ 알즈하이머치매 ‘기억력’ 떨어뜨리는 핵심 단백질 규명(출처: Nature Genetics)
○ 배꼽시계 등 생체회로 조절원리 규명(출처: Science)
○ 예방법 없는 ‘말라리아’ 백신 개발된다(출처: Nature Medicine)
○ 물체 인식과정 규명, 실명치료 도움(출처: Nature)
○ 항생제 ‘페니실린’ 만드는 균 ‘유전자서열’ 규명(출처: Nature Biotechnology)
○ 유전자 제어 마이크로RNA 조절·사멸 메커니즘 규명(출처: Molecular Cell)
○ ‘소리’ 잘 듣게 하는 귀 속 ‘단백질’ 규명(출처: Nature)
○ 인체 세포 죽이는 단백질 규명, 새로운 항암제 개발(출처: Nature)
○ 日 연구팀 ‘암세포’ 추적자 영상촬영물질 개발(출처: Nature Medicine)
■ 2009년
○ 파킨슨병 등 신경퇴행성질환 유발 기전 규명(출처: Nature Medicine)
○ 염색체 응축 ‘단백질 복합체’ 분자구조 규명(출처: Cell)
○ 마이크로 RNA 메커니즘 규명(출처: Cell)
○ ‘고혈압’ 유발 유전자 변이 규명(출처: Nature Genetics)
○ 단백질과 패혈증의 원인 물질인 세균의 내독소가 결합된 복합체의 분자구조를 세계 최초로 규명(출처: Nature)
○ 당뇨 원인 인슐린 저항성 유발인자 발견(출처: Cell Metabolism)
○ 장(腸) 세포의 세균 제거 기전 규명(출처: Developmental Cell)
○ 소 유전자 지도 완성 ‘축산혁명’(출처: Science)
○ 미칠 듯한 가려움증 ‘긁어주면 좋아지는 이유’ 규명(출처: Nature Neurons)
○ 다운증후군 ‘암’ 잘 안 걸리는 이유 규명(출처: Nature)
○ 자도 자도 졸린 ‘기면증’ 면역계 기능 부전이 원인(출처: Nature Genetics)
○ 체내 자연 발생 ‘표백성분’ 상처회복 돕는다(출처: Nature)
○ 사람 줄기세포로 뇌졸중 쥐 치료성공(출처: Gene Therapy)
○ 한국 남성 ‘유전자 서열’ 밝혔다 (출처: Nature)
○ NMR로 생체막 단백질 구조 규명(출처: Science)
○ 줄기세포 분화조절 단백질 발견(출처: Cell)
○ ‘새벽잠 없는 이유 있다’, 적게 자게 하는 유전자 발견(출처: Science)
■ 2010년
○ 배아줄기세포 치매치료제 국내서 첫 임상 실시
○ 혈관치료용 마이크로 로봇 개발 (세계 최초로 살아있는 미니돼지의 혈관에 주입돼 이동하는 실험 성공)
○ 0.3mm 핏줄까지 보이는 세계에서 가장 선명한 사람 뇌지도『7.0 Tesla MRI Brain Atlas』 발간
○ 나노 소재로 인공 광합성 성공
○ 세계 최초 암 관련 신규 유전자 발굴
○ 암 진행과 전이 매커니즘 규명
■ 2011년
○ 인체면역결핍바이러스 예방 치료 네트워크(HPTN) 052
○ 밝혀진 인간의 기원 : 현생 인류의 DNA 일부가 네안데르탈인 게놈과 연관되었다는 사실 발견
○ 식물광합성 촉매 구조 규명 : 물 분해 촉매가 되는 막단백질 복합체의 구조 규명
○ 말라리아 백신 : ‘RTS,S' 말라리아 백신이 아프리카 영유아의 말라리아 감염률을 50% 이상 감소시킴
○ 인간 장 속 미생물 : 인간의 장속 미생물이 혈액형과 같이 크게 3가지로 나뉨. 군집 종류에 따라 질병, 체질, 식습관이 달라짐
○ 노화세포제거 : 실험쥐의 노화세포를 제거하자 백내장, 근육 손실 등의 현상이 사라지고 나이 들어도 운동능력 저하되지 않는다는 사실 발견
1. 생명공학 주요통계
1. 예산투자
[그림 부록-] 정부부문 생명공학 투자실적(1994∼2011년)1)

![]()
출처: 생명공학정책연구센터, 연도별 생명공학육성시행계획 자료가공
주1) ʼ07~ʼ11년의 투자실적에는 출연기관의 투자실적(932억원, 1,046억원, 913억원, 1,218억원, 1,404억원)이 포함됨
주2) ʼ94∼ʼ10년 기간 동안의 정부투자는 총 8조 9,243억원(연증가율 23%)
주3) ʼ11년도 정부투자는 실적치가 아닌 ʼ10년도 생명공학육성시행계획상의 계획치임
[표 부록-] 부처별 생명공학 투자실적(‘10∼’11년)
(단위: 백만원, %)
|
구 분 |
'11년 투자계획 |
'10년 계획 (B) |
'10년 실적 (C) |
달성율 (%) (C/B) |
||||
|
연구 개발 |
인프라 |
인력 양성 |
합계 (A) |
증가율 (%) ((A-B)/B) |
||||
|
교육과학기술부 |
487,852 |
32,083 |
72,407 |
592,342 |
9.5 |
541,012 |
539,213 |
99.7 |
|
농림수산식품부 |
161,663 |
1,000 |
3,500 |
166,163 |
47.3 |
112,799 |
135,539 |
120.2 |
|
지 식 경 제 부 |
110,287 |
36,532 |
2,600 |
149,419 |
△3.0 |
153,979 |
168,424 |
109.4 |
|
보 건 복 지 부 |
280,230 |
64,472 |
1,250 |
345,952 |
△14.8 |
405,994 |
429,942 |
105.9 |
|
환 경 부 |
33,606 |
|
|
33,606 |
6.1 |
31,685 |
32,686 |
103.2 |
|
국 토 해 양 부 |
32,691 |
40,529 |
|
73,220 |
△21.0 |
92,690 |
89,850 |
96.9 |
|
출 연 연 |
122,300 |
18,169 |
|
140,469 |
40.2 |
100,227 |
121,849 |
121.6 |
|
총 계 |
1,228,629 |
192,785 |
79,757 |
1,501,171 |
4.4 |
1,438,386 |
1,517,503 |
105.6 |
출처 : 2011년도 생명공학육성시행계획, 교육과학기술부, 2011. 6. 자료가공
[그림 부록-] 부처별 생명공학분야 연구개발비 점유율(‘11)

출처: 2011년도 생명공학육성시행계획, 교육과학기술부, 2011. 6. 자료가공
[표 부록-] 부처별 생명공학분야 투자비교(‘10년 실적&’11년 계획)
(단위: 백만 원)
|
구 분 |
교육과학기술부 |
농림수산식품부 |
지식 경제부 |
보건 복지부 |
환경부 |
국토 해양부 |
출연연 |
총 계 |
|
ʼ10년 투자실적 |
539,213 |
135,539 |
168,424 |
429,942 |
32,686 |
89,850 |
121,849 |
1,517,503 |
|
ʼ11년 투자계획 |
592,342 |
166,163 |
149,419 |
345,952 |
33,606 |
73,220 |
140,469 |
1,501,171 |
|
증감율 |
9.8%↑ |
22.5%↑ |
11.2%↓ |
19.5%↓ |
2.8%↑ |
18.5%↓ |
15.2%↑ |
1.0%↓ |
출처: 2011년도 생명공학육성시행계획, 교육과학기술부, 2011. 6. 자료가공
주1) 증감율 = (ʼ11년 투자계획 - ʼ10년 투자실적)/ʼ10년 투자실적
[표 부록-] 5대 분야별 연구개발 투자비교(‘10년 실적 & ’11년 계획)
(단위: 백만 원)
|
구 분 |
생명과학 |
보건의료 |
농축산식품 |
산업공정/ 환경해양 |
바이오융합 |
합 계 |
|
ʼ10년 투자실적 |
444,438 |
363,429 |
126,093 |
89,699 |
73,223 |
1,096,882 |
|
ʼ11년 투자계획 |
496,548 |
394,779 |
154,875 |
102,974 |
79,453 |
1,228,629 |
|
증감율 |
11.7%↑ |
8.6%↑ |
22.8%↑ |
14.8%↑ |
8.5%↑ |
11.9%↑ |
출처: 2011년도 생명공학육성시행계획, 교육과학기술부, 2011. 6. 자료가공
주1) 증감율 = (ʼ11년 투자계획 - ʼ10년 투자실적)/ʼ10년 투자실적
2. 시설 및 인프라
[표 부록-2] 부처별 시설 및 기반구축 투자비교(‘10 실적&’11년 계획)
(단위: 백만 원)
|
구 분 |
교육과학기술부 |
농림수산식품부 |
지식 경제부 |
보건 복지부 |
국토 해양부 |
출연연 |
총 계 |
|
ʼ10년 투자 실적 |
30,346 |
800 |
63,516 |
175,798 |
60,500 |
11,668 |
342,628 |
|
ʼ11년 투자 계획 |
32,083 |
1,000 |
36,532 |
64,472 |
40,529 |
18,169 |
192,785 |
|
증감율 |
5.7%↑ |
25.0%↑ |
42.4%↓ |
63.3%↓ |
33.0%↓ |
55.7%↑ |
43.7%↓ |
출처: 2011년도 생명공학육성시행계획, 교육과학기술부, 2011. 6. 자료가공
주1) 증감율 = (ʼ11년 투자계획 - ʼ10년 투자실적)/ʼ10년 투자실적
[표 부록-2-2-2] 부처별 시설 및 기반구축 사업(1)
(단위: 백만 원)
|
부처 |
사업명 |
ʼ10 실적 |
ʼ11 계획 |
|
교육과학 기술부 |
○ 생명연구자원 확보·관리 및 활용사업 |
7,946 |
8,946 |
|
○ 생명공학정책연구기반사업 |
1,000 |
917 |
|
|
○ 연구소재지원사업 |
5,000 |
5,720 |
|
|
○ 전문연구정보활용사업 |
2,800 |
2,800 |
|
|
○ 동북아R&D기반구축사업 |
13,000 |
13,700 |
|
|
소계 |
|
29,746 |
32,083 |
|
부처 |
사업명 |
ʼ10 실적 |
ʼ11 계획 |
|
농림수산 식품부 |
○ 산림정책관리(지방임업연구기반조성) |
800 |
1,000 |
|
소계 |
|
800 |
1,000 |
|
부처 |
사업명 |
ʼ10 실적 |
ʼ11 계획 |
|
지식 경제부 |
○ 산업진흥고도화 |
7,550 |
6,820 |
|
○ 지역전략산업진흥 |
33,533 |
19,379 |
|
|
○ 생물산업기술기반구축지원(비R&D) |
14,400 |
2,300 |
|
|
○ 산업기술진흥(지역혁신센터) |
8,033 |
8,033 |
|
|
소계 |
|
63,516 |
36,532 |
|
부처 |
사업명 |
ʼ10 실적 |
ʼ11 계획 |
|
국토 해양부 |
○ 해양자원연구센터 건립 |
4,500 |
- |
|
○ 대형 해양과학연구선 건조 |
2,000 |
8,000 |
|
|
○ 해양생물자원관 건립 |
25,000 |
10,000 |
|
|
○ 연구개발장비 및 인프라 구축 |
29,000 |
22,529 |
|
|
소계 |
|
60,500 |
40,529 |
출처: 2011년도 생명공학육성시행계획, 교육과학기술부, 2011. 6. 자료가공
3. 인력
[표 부록-2] 부처별 인력양성 사업
(단위: 백만 원)
|
부처 |
사업명 |
ʼ10 실적 |
ʼ11 계획 |
|
교육과학 기술부 |
○ 세계수준의 연구중심대학 육성사업 |
42,230 |
42,230 |
|
○ 2단계 연구중심대학(BK21) 육성사업 |
28,413 |
30,177 |
|
|
소계 |
|
70,643 |
72,407 |
|
부처 |
사업명 |
ʼ10 실적 |
ʼ11 계획 |
|
농림수산 식품부 |
○ 산림정책관리(인력양성) |
500 |
500 |
|
○ 융복합연구센터지원 |
3,000 |
3,000 |
|
|
소계 |
|
3,500 |
3,500 |
|
부처 |
사업명 |
ʼ10 실적 |
ʼ11 계획 |
|
지식 경제부 |
○ 산업진흥고도화 |
2,600 |
2,600 |
|
소계 |
|
2,600 |
2,600 |
|
부처 |
사업명 |
ʼ10 실적 |
ʼ11 계획 |
|
보건 복지부 |
○ 임상의과학자 양성 |
1,250 |
1,250 |
|
소계 |
|
1,250 |
1,250 |
출처: 2011년도 생명공학육성시행계획, 교육과학기술부, 2011. 6. 자료가공
 [그림 부록-2-3-1] 국내 생명공학분야 졸업자 현황(‘07~’10년)
[그림 부록-2-3-1] 국내 생명공학분야 졸업자 현황(‘07~’10년)
출처: 생명공학정책연구센터, 교육통계정보센터(http://.cesi.kedi.re.kr)자료 가공(2010.9)
생명공학분야: 교육인적자원통계서비스에 제시된 소계열 분류 중 12개 소계열이 해당 (보건학, 약학, 의료공학, 의학, 재활학, 치의학, 한의학, 농업학, 동물·수의학, 산림·원예학, 생명과학, 생물학)
[표 부록-2-3-1] 국내 생명공학분야의 학위별 현황과 전체분야에서의 비중(‘07~’10년)
(단위: 명)
|
구분 |
학사(전문대포함) |
석사 |
박사 |
전체 |
||||||||
|
생명 공학 분야 |
전체 분야 |
비중1) (%) |
생명 공학 분야 |
전체 분야 |
비중 (%) |
생명 공학 분야 |
전체 분야 |
비중 (%) |
생명 공학 분야 |
전체 분야 |
비중 (%) |
|
|
2007 |
26,351 |
342,058 |
7.7 |
6,245 |
24,190 |
25.8 |
2,751 |
9,082 |
30.3 |
35,347 |
375,330 |
9.4 |
|
2008 |
27,403 |
338,404 |
8.1 |
6,057 |
24,835 |
24.4 |
2,811 |
9,346 |
30.0 |
36,271 |
372,585 |
9.7 |
|
2009 |
37,674 |
478,480 |
7.9 |
8,383 |
38,029 |
22.0 |
2,850 |
9,912 |
28.8 |
48,907 |
526,421 |
9.3 |
|
2010 |
37,906 |
470,374 |
8.1 |
8,358 |
41.136 |
20.3 |
2,847 |
10,542 |
27.0 |
49,111 |
522,052 |
9.4 |
출처: 생명공학정책연구센터, 교육통계정보센터(http://.cesi.kedi.re.kr)자료 가공(ʼ10.09)
[표 부록-2-3-2] 국내 생명공학분야 졸업자의 학위별 성별 현황(‘07~’10년)
(단위: 명)
|
구분 |
학사(전문대포함) |
석사 |
박사 |
총계 |
||||||
|
남자 |
여자 |
소계 |
남자 |
여자 |
소계 |
남자 |
여자 |
소계 |
||
|
2007 |
11,817 |
14,534 |
26,351 |
4,074 |
2,171 |
6,245 |
1,972 |
779 |
2,751 |
35,347 |
|
2008 |
12,470 |
14,933 |
27,403 |
3,944 |
2,113 |
6,057 |
1,960 |
851 |
2,811 |
36,271 |
|
2009 |
17,462 |
20,212 |
37,674 |
5,164 |
3,219 |
8,383 |
1,996 |
854 |
2,850 |
48,907 |
|
2010 |
17,315 |
20,591 |
37,906 |
4,906 |
3,452 |
8,358 |
1,853 |
994 |
2,847 |
49,111 |
출처: 생명공학정책연구센터, 교육통계정보센터(http://.cesi.kedi.re.kr)자료 가공(ʼ10.09)
4. 논문 및 특허
[그림 부록-2-4-1] 한인과학자 NSC 논문 발표 현황(‘94~’10년)
|
|
ʼ94년 |
ʼ95년 |
ʼ96년 |
ʼ97년 |
ʼ98년 |
ʼ99년 |
ʼ00년 |
ʼ01년 |
ʼ02년 |
|
NSC 총합계 |
0 |
2 |
3 |
4 |
7 |
10 |
11 |
14 |
19 |
|
BT관련 NSC 논문 합계 |
0 |
2 |
1 |
3 |
2 |
7 |
5 |
11 |
11 |
|
BT 비중(%) |
- |
100 |
33.3 |
75.0 |
28.6 |
70.0 |
45.5 |
78.6 |
57.9 |
|
|
ʼ03년 |
ʼ04년 |
ʼ05년 |
ʼ06년 |
ʼ07년 |
ʼ08년 |
ʼ09년 |
ʼ10년 |
합계 |
|
NSC 총합계 |
13 |
18 |
29 |
28 |
26 |
28 |
38 |
47 |
297 |
|
BT관련 NSC 논문 합계 |
11 |
10 |
23 |
18 |
19 |
15 |
21 |
28 |
187 |
|
BT 비중(%) |
84.6 |
55.6 |
79.3 |
64.3 |
73.1 |
53.5 |
55.2 |
59.5 |
62.9 |

주1) 전체 NSC 논문 중 생명공학 관련 논문은 총 187건으로 약 63%의 비중을 차지
출처: 생명공학정책연구센터
[그림 부록-2-4-2] 생명공학분야 한국 및 세계 논문의 논문평균 피인용수 (‘01~’10년)

⇩

출처: KAIST 학술정보처 (2011)
[표 부록-2-4-1] 주요국의 생명공학분야 논문수 및 건당 피인용 횟수 (‘05~’09년)
(단위 : 건수)
|
분야명 |
한국 |
미국 |
일본 |
중국 |
||||
|
논문수 |
건당피인용수 |
논문수 |
건당피인용수 |
논문수 |
건당피인용수 |
논문수 |
건당피인용수 |
|
|
물리․화학 지구과학 |
49,199 |
4.12 |
343,010 |
7.08 |
130,641 |
4.97 |
228,622 |
3.44 |
|
생명과학 |
23,586 |
5.15 |
311,022 |
11.28 |
74,488 |
7.16 |
49,158 |
4.52 |
|
의학 |
24,039 |
3.87 |
378,237 |
8.23 |
79,750 |
4.91 |
37,499 |
4.14 |
출처: KISTEP, 「우리나라 과학기술논문 현황 분석」통계브리프 2010-24호
[표 부록-2-4-2] 생명공학분야 특허출원 현황 (‘06~’10)
|
구 분 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
|
내국인 |
2,606 |
3,295 |
3,398 |
3,789 |
4,339 |
|
외국인 |
1,058 |
1,587 |
1,669 |
1,380 |
1,648 |
|
계 |
3,664 |
4,882 |
5,067 |
5,169 |
5,987 |
출처: 특허청, 「2010년도 지식재산통계연보」(2011. 6)
5. 산업
[그림 부록-2-5-1] 주요 국가별 바이오 기업 수
(단위 : 개)

출처: OECD, 「OECD Scoreboard 2011 - Biotehcnology R&D」 (2011)
[그림 부록-2-5-2] 글로벌 생명공학 시장현황 및 전망 (‘08~’13년)
(단위: $bn)
|
No. |
국가명 |
2008년 |
2009년 |
2010년 |
2011년 |
2012년 |
2013년 |
CAGR ('08∼'13) |
|
1 |
미국 |
91.9 |
93.7 |
101 |
108.9 |
117.3 |
126.4 |
6.6% |
|
2 |
유럽 |
46.1 |
49 |
51.8 |
54.7 |
57.6 |
60.5 |
5.6% |
|
3 |
스페인 |
7.6 |
8 |
8.3 |
8.8 |
9.2 |
9.8 |
5.0% |
|
4 |
영국 |
7 |
7.2 |
7.3 |
7.5 |
7.7 |
7.9 |
2.3% |
|
5 |
이탈리아 |
6.2 |
6.7 |
7.3 |
7.9 |
8.6 |
9.3 |
8.5% |
|
6 |
독일 |
5.3 |
5.6 |
6 |
6.4 |
6.8 |
7.3 |
6.6% |
|
7 |
프랑스 |
4.3 |
4.6 |
5 |
5.5 |
5.9 |
6.4 |
8.0% |
|
8 |
네델란드 |
0.34 |
0.35 |
0.79 |
0.40 |
0.42 |
0.45 |
5.9% |
|
9 |
벨기에 |
4.9 |
5.4 |
6 |
6.5 |
7.1 |
7.7 |
9.4% |
|
10 |
캐나다 |
4.5 |
4.7 |
4.9 |
5.2 |
5.4 |
5.6 |
4.4% |
|
11 |
아시아-태평양 |
45.1 |
48.6 |
52.1 |
55.7 |
59.2 |
62.8 |
10.1% |
|
12 |
일본 |
18.6 |
20 |
21.5 |
23.1 |
24.8 |
26.5 |
7.4% |
|
13 |
중국 |
6.3 |
7.3 |
8.3 |
9.5 |
10.9 |
12.3 |
14.3% |
|
14 |
한국1) |
4.03 |
5.04 |
|
|
|
|
|
|
합계2) |
216.3 |
227.1 |
244.7 |
263.5 |
283.8 |
305.7 |
7.2% |
|
출처: 생명공학정책연구센터, 「총서 144권 생명공학 시장 현황 및 전망 분석 보고서 Ser.1」
주1) 지식경제부 ʻʻ2009년도 국내 바이오산업 통계ʼʼ에 제시된 시장규모를 US dollars로 환산함
(환율은 2011년 2월 21일 기준 : 1달러 = 1,117원)
주2) 글로벌 생명공학 시장 규모의 합계는 상기 표에서 제시된 국가 이외에 그 외 나머지 국가들의 생명공학 시장규모가 포함되어 있음
[표 부록-2-5-1] 우리나라 제약 및 생명공학 시장 현황 및 전망 (‘09~’12년)
(단위: $ bn, %)


2012년 예상 시장규모 기준
출처: 생명공학정책연구센터, 「총서 156권 국내외 주요 바이오제약기업의 R&D 현황 분석」
[표 부록-2-5-2] 우리나라 바이오산업 수급규모(‘09년)
(단위: 억원, %)
|
|
공급 |
계 |
수요 |
계 |
||||||
|
생산 |
수입 |
내수 |
수출 |
|||||||
|
금액 |
비중 |
금액 |
비중 |
금액 |
비중 |
금액 |
비중 |
|||
|
2007년 |
37,139 |
78.4 |
10,208 |
21.6 |
47,347 |
32,632 |
68.9 |
14,715 |
31.1 |
47,347 |
|
2008년 |
45,120 |
79.7 |
11,469 |
20.3 |
56,589 |
37,551 |
66.4 |
19,038 |
33.6 |
56,589 |
|
2009년 |
56,362 |
80.9 |
13,292 |
19.1 |
69,654 |
42,367 |
60.8 |
27,287 |
39.2 |
69,654 |
출처: 지식경제부 보도자료 (2011. 1. 20)
[그림 부록-2-5-3] 우리나라 생명공학산업 분야별 생산규모 동향(‘07~’09년)
(단위: 억원, %)
|
구 분 |
2007년 |
2008년 |
2009년 |
|||
|
생산액 |
비중 |
생산액 |
비중 |
생산액 |
비중 |
|
|
바이오의약품 |
16,858 |
45.4 |
20,245 |
44.9 |
27,734 |
49.2 |
|
바이오화학 |
2,339 |
6.3 |
2,767 |
6.1 |
3,303 |
5.9 |
|
바이오식품 |
13,161 |
35.4 |
13,564 |
30.0 |
15,593 |
27.7 |
|
바이오환경 |
2,007 |
5.4 |
2,141 |
4.7 |
2,281 |
4.0 |
|
바이오전자 |
579 |
1.6 |
622 |
1.4 |
699 |
1.2 |
|
바이오공정 및 기기 |
848 |
2.3 |
2,640 |
5.9 |
2,127 |
3.8 |
|
바이오에너지 및 자원 |
254 |
0.7 |
632 |
1.5 |
1,208 |
2.1 |
|
검정, 정보서비스 및 연구개발 |
1,092 |
2.9 |
2,509 |
5.5 |
3,417 |
6.1 |
|
계 |
37,138 |
100 |
45,120 |
100 |
56,362 |
100 |
출처: 지식경제부 보도자료 (2011. 1. 20)
[그림 부록-2-5-4] 국내 바이오산업 활동 분포(‘09년)

출처: 한국바이오협회, 「바이오사업통계 조사결과 분석」 (2010. 12)
주 1 : 한 가지 주력 업종을 기준으로 함
[그림 부록-2-5-5] 우리나라 지역별 바이오산업체 수 현황
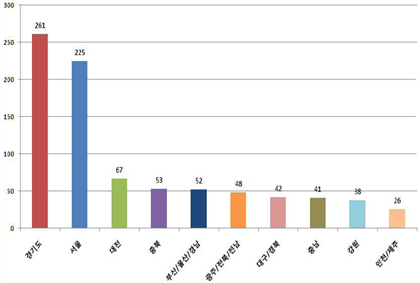
분석: 한국바이오협회, 「바이오사업통계 조사결과 분석」(2010. 12)
[그림 부록-2-5-5] 국내 바이오산업 포지셔닝 분석 (‘09년)

출처: 한국산업마케팅연구소「2011 바이오의약 산업 동향과 바이오시밀러 비즈니스 성공 전략」(2011. 4)
[그림 부록-2-5-5] 국내 바이오의약품 생산현황 (‘05~’09년)

출처: 지식경제부 (2011)
주1. 우리나라 제네릭 시장 규모는 ’10년 40억 달러임(생명공학정책연구센터; BioINdustry No.38)
[그림 부록-2-5-5] 국내 의약품산업 수출입 현황 (ʼ06~ʼ09년)

출처: 식품의약품안전청, 「식품의약품통계연보」(2010)
[그림 부록-2-5-5] 국내 의약품 품목수 및 생산액 (ʼ06~ʼ09년)

출처: 식품의약품안전청, 「식품의약품통계연보」(2010)
[표 부록-2-5-3] 코스닥 등록 바이오벤처 기업 현황(‘10년)
|
순 |
구분 |
업체 명 |
분야 |
주력 제품 |
설립 일자 |
등록 일자 |
|
21 |
거래소 |
부광약품 |
바이오의약 |
의약용 약제품 제조업 |
60.10. |
88.08. |
|
22 |
코스닥 |
산성피앤씨 |
바이오화학 |
줄기세포이용 화장품개발 |
86.12. |
03.01. |
|
23 |
코스닥 |
서린바이오 사이언스 |
바이오기기 |
연구기기, 시약 |
94.04. |
05.10. |
|
24 |
코스닥 |
세실 |
바이오화학 |
생물적방제사업 |
91.04. |
07.11. |
|
25 |
거래소 |
세원셀론텍 |
바이오의약 |
관절염치료제 |
06.07. |
06.07. |
|
26 |
코스닥 |
셀트리온 |
바이오의약 |
바이오시밀러 연구 및 생산 |
91.02 |
08.09 |
|
27 |
코스닥 |
솔고바이오 |
바이오기기 |
가정용 온열치료기,의료기구 |
95.07. |
00.08. |
|
28 |
코스닥 |
슈프리마 |
바이오전자 |
바이오인식시스템 |
00.05. |
08.07. |
|
29 |
코스닥 |
스카이뉴팜 |
바이오의약 |
의약품 개발.제조,판매 |
01.08. |
01.08. |
|
30 |
코스닥 |
쎌바이오텍 |
바이오식품 |
유산균 원말 및 완제품 |
95.02. |
02.12. |
|
31 |
코스닥 |
씨젠 |
바이오의약 |
분자진단 제품 개발 |
00. 9 |
10.09 |
|
32 |
코스닥 |
씨티씨바이오 |
바이오농업 |
동물항병원성제품,생균효소 |
95.12. |
02.02. |
|
33 |
거래소 |
알앤엘바이오 |
바이오의약 |
줄기세포치료제, 항균제 등 |
61.07. |
76.06. |
|
34 |
코스닥 |
에스텍파마 |
바이오의약 |
원료의약품 |
99.01 |
04.02 |
|
35 |
코스닥 |
에코솔루션 |
바이오환경 |
토양오염 진단, 복원 |
98.03. |
01.12. |
|
36 |
거래소 |
오리엔트바이오 |
바이오의약 |
백신, 생물, 진단, 신약 개발 등 |
59.04. |
76.12. |
|
37 |
코스닥 |
오스코텍 |
바이오의약 |
뼈치료용 신약개발 |
98.12. |
07.01. |
|
38 |
코스닥 |
오스템 임플란트 |
바이오기기 |
치과용 임플란트 |
97.01. |
07.02. |
|
39 |
코스닥 |
이-글벳 |
바이오농업 |
사료첨가제(항생,영양) |
83.12. |
00.11. |
|
40 |
코스닥 |
이노셀 |
바이오의약 |
제대혈은행, 간암치료제 |
92.09. |
98.09. |
|
순 |
구분 |
업체 명 |
분야 |
주력 제품 |
설립 일자 |
등록 일자 |
|
61 |
코스닥 |
하이텍팜 |
바이오의약 |
경구용 및 주사제 항생제 의약품 생산 |
98. 9 |
10. 7 |
|
62 |
코스닥 |
한국콜마 |
바이오의약 |
화장품, 연고제류 및 의약품 |
90.05. |
02.04. |
|
63 |
거래소 |
한독약품 |
바이오의약 |
의약용 약제품 제조업 |
54.04. |
76.06. |
|
64 |
코스닥 |
한스바이오메드 |
바이오공정 및 기기 |
의료용품 및 기타 의약관련제품 제조 |
99.09 |
09.10. |
|
65 |
코스닥 |
헤파호프 |
바이오의약 |
인공간 개발 |
96.07. |
00.12. |
|
66 |
코스닥 |
화일약품 |
바이오의약 |
의약품원료, 암치료제 |
80.11. |
02.04. |
|
67 |
코스닥 |
휴온스 |
바이오의약 |
전문의약품, 비만치료제, 비타민제품 |
65.07. |
06.12. |
|
68 |
거래소 |
LG생명과학 |
바이오의약 |
전문의약품, 동물의약품 |
02.08. |
02.08. |
|
69 |
거래소 |
SK케미칼 |
바이오의약 |
항암제, 천연물의약, 발기부전치료제 |
69.07 |
|
|
70 |
거래소 |
VGX인터 |
바이오의약 |
신약개발 및 컨설팅 |
76.01. |
87.11. |
출처: 한국바이오벤처협회, 「2010 바이오벤처총람」

생명공학 관계법령
생명공학육성법
[(타)일부개정 2008.2.29 법률 제8852호]
제1조(목적) 이 법은 생명공학연구의 기반을 조성하여 생명공학을 보다 효율적으로 육성·발전시키고 그 개발기술의 산업화를 촉진하여 국민경제의 건전한 발전에 기여하게 함을 목적으로 한다.(개정 1995.1.5)
제2조(정의) 이 법에서 “생명공학”이라 함은 다음 각 호의 학문과 기술을 말한다.
1. 산업적으로 유용한 생산물을 만들거나 생산공정을 개선할 목적으로 생물학적 시스템, 생체, 유전체 또는 그들로부터 유래되는 물질을 연구·활용하는 학문과 기술
2. 생명현상의 기전(起傳), 질병의 원인 또는 발병과정에 대한 연구를 통하여 생명공학의 원천지식을 제공하는 생리학·병리학·약리학 등의 학문[이하 “기초의과학(基礎醫科學)”이라 한다]
[전문개정 2003.12.30]
제3조(적용범위) 생명공학에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 의한다.(개정 1995.1.5)
제4조(생명공학육성기본계획의 수립 (개정 1995.1.5))
① 제13조의 규정에 의한 관계부처의 장은 소관별로 생명공학육성에 관한 계획을 교육과학기술부장관에게 제출하여야 한다.(개정 1995.1.5, 2003.12.30, 2008.2.29)
② 교육과학기술부장관은 제1항의 규정에 의하여 관계부처의 장이 제출한 소관사항에 관한 생명공학육성계획을 종합·조정하여 생명공학육성기본계획(이하 “기본계획”이라 한다)을 수립한다.(개정 1995.1.5, 2003.12.30, 2008.2.29)
③제2항의 규정에 의한 기본계획에는 다음의 사항이 포함되어야 한다.(개정 1995.1.5, 1997.8.28)
1. 생명공학의 기초연구 및 산업적 응용연구의 육성에 관한 종합계획과 지침
2. 생명공학의 연구에 필요한 인력자원의 개발종합계획과 인력자원의 효율적인 활용에 관한 지침
3. 생명공학의 연구 및 이와 관련된 산업기술인력의 국제교류와 해외과학기술자의 활용에 관한 계획과 그 지침
④ 교육과학기술부장관은 기본계획을 수립하고자 할 때에는 제6조의 생명공학종합정책심의회의 심의를 거쳐야 한다.(개정 1995.1.5, 2003.12.30, 2008.2.29)
제5조(생명공학육성 연차별 시행계획의 수립 등 (개정 1995.1.5))
①관계부처의 장은 기본계획에 따라 생명공학육성 연차별 시행계획(이하 “시행계획”이라 한다)을 수립하고 이를 시행하여야 한다.(개정 1995.1.5)
② 관계부처의 장은 시행계획을 수립하고자 할 때에는 미리 교육과학기술부장관과 협의하여야 한다.(개정 2003.12.30, 2008.2.29)
③ 교육과학기술부장관은 시행계획의 수립을 위하여 필요한 때에는 그 계획의 수립에 필요한 기본지침을 작성하여 관계부처의 장에게 통보할 수 있다.(개정 2003.12.30, 2008.2.29)
④시행계획의 수립 및 그 시행에 관하여 필요한 사항은 대통령령으로 정한다.
제6조(생명공학종합정책심의회 (개정 1995.1.5))
① 기본계획의 수립과 그 집행 및 조정에 관한 업무를 관장하기 위하여 교육과학기술부장관소속하에 생명공학종합정책심의회(이하 “심의회”라 한다)를 둔다.(개정 1995.1.5, 2003.12.30, 2008.2.29)
②심의회는 다음 사항을 심의 결정한다.(개정 1995.1.5, 1997.8.28, 2003.12.30, 2008.2.29)
1. 생명공학의 기초연구 및 산업적 응용연구의 육성에 관한 계획의 수립 및 그 집행의 조정
2. 생명공학의 연구 및 기술개발에 관한 기본계획의 수립과 이에 따른 중요정책의 수립 및 그 집행의 조정
3. 생명공학분야 인력개발에 관한 종합계획과 이에 따른 중요정책, 인력활용지침의 수립 및 그 집행의 조정
4. 생명공학의 연구 및 이와 관련된 산업기술인력의 개발교류와 해외과학기술자의 활용에 관한 계획의 수립 및 그 집행의 조정
5. 유전자원의 이용과 보전을 위한 연구개발계획의 수립 및 그 집행의 조정
6. 기타 생명공학육성에 관하여 교육과학기술부장관이 필요하다고 인정하는 사항
③심의회는 위원장 1인을 포함한 17인 이내의 위원으로 구성한다.(신설 2003.12.30)
④ 위원장은 교육과학기술부장관이 되고 위원은 다음 각호의 자가 된다.(신설 2003.12.30, 2008.2.29)
1. 대통령령이 정하는 관계 중앙행정기관의 차관급 공무원
2. 학계·연구기관 또는 산업계에 종사하는 생명공학 관계자 및 생명윤리 전문가
⑤ 이 법에서 규정한 사항외에 심의회의 조직 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.(신설 2003.12.30)
제7조 삭제(2003.12.30)
제8조 삭제(2003.12.30)
제9조(연구 및 기술협력) 교육과학기술부장관은 생명공학의 연구 및 기술에 관한 국제협력의 증진에 노력하고 선진기술의 도입을 위한 효율적인 방안을 강구한다.(개정 1995.1.5, 2003.12.30, 2008.2.29)
제10조(공동연구의 촉진) 정부는 생명공학연구 및 기술개발의 효율적 육성을 위하여 학계·연구기관 및 산업계간의 공동연구를 촉진하여야 한다.(개정 1995.1.5)
제11조(생명공학의 산업적 응용촉진에 대한 지원) 정부는 생명공학 연구개발을 활성화하고 그 결과의 산업적 응용을 촉진하기 위하여 다음 각 호의 사항에 대한 지원시책을 강구하여야 한다.
1. 생명공학관련 신기술제품의 생산지원에 관한 사항
2. 생명공학 연구결과의 산업적 응용을 촉진하기 위한 연구개발 및 지역거점 구축에 관한 사항
3. 생명공학관련 중소·벤처기업의 창업지원에 관한 사항
[전문개정 2003.12.30]
제12조(기술정보의 수집과 보급) 정부는 생명공학연구에 관한 정보를 수집, 관계기관에 보급함으로써 연구개발 촉진에 노력하여야 한다.(개정 1995.1.5)
제13조(생명공학육성시책강구등)
① 정부는 생명공학의 효율적인 육성을 위하여 생명공학의 기초연구 및 산업적 응용연구에 관하여 다음 각호의 시책을 강구한다. 다만, 기초의과학(基礎醫科學)분야의 연구개발 촉진 및 육성업무는 교육과학기술부장관 및 보건복지가족부장관의 소관으로 한다.(개정 1997.8.28, 2001.1.29, 2003.12.30, 2004.12.31, 2008.2.29)
1. 삭제(2008.2.29)
2. 교육과학기술부장관은 제4조제2항의 규정에 의한 기본계획의 수립과 부처별 정책수립의 지원 및 종합조정, 생명공학분야의 연구를 촉진시키기 위한 전문인력의 양성과 생명과학기초분야의 연구지원, 생명공학관련 기초기술 및 첨단기술의 개발지원, 과학기술 분야의 유용한 유전자의 확보·분석·이용·보전을 위한 연구의 지원, 생명공학 지원기관의 육성·발전
3. 농림수산식품부장관은 동·식물 및 미생물의 육종·품종개량 및 식품소재의 개발 등 응용연구의 지원 및 농림분야의 유용한 유전자의 확보·분석·이용·보존 등 기초연구의 지원 및 연구기관의 육성·발전, 해양수산생물을 이용한 유용물질의 생산과 해양수산생물의 육종·개량 및 식품소재의 개발 등 응용연구의 지원, 해양수산분야의 유용한 유전자의 확보·분석·이용·보존 등 기초연구의 지원
4. 지식경제부장관은 생명공학관련 산업공정의 개발과 개선, 신·재생에너지개발, 에너지 및 광물자원의 효율적 활용, 생명공학관련 생산기술개발 등의 지원과 그 개발기술의 산업화 촉진 및 생명공학의 육성·발전을 위한 정보통신기술의 개발 지원 4의2. 삭제(2008.2.29)
5. 보건복지부장관은 보건·의료·식품위생 등 생명공학과 관련되는 기술에 대한 연구개발의 촉진과 관련 전문인력 양성, 임상시험 관련사업 육성 및 연구의 지원
6. 환경부장관은 생물다양성의 보전, 그 구성요소의 지속가능한 이용 및 생명공학기술을 이용한 폐수·폐기물의 처리 및 환경오염의 방지 등을 위한 기술개발과 기초연구 및 응용연구 지원, 해양오염방지 등을 위한 기술개발 및 연구기관의 육성·발전
7. 삭제(2008.2.29)
② 교육과학기술부장관과 보건복지가족부장관은 기초의과학(基礎醫科學)을 육성하기 위한 시책을 수립하고자 하는 때에는 협의하여야 한다.(신설 2003.12.30, 2008.2.29)
[전문개정 1995.1.5]
제14조(검정 및 임상)
①정부는 생명공학 관련제품에 대한 임상 및 검정체제를 확립한다.(개정 1995.1.5)
②제1항의 임상 및 검정체제 확립에 관하여 필요한 사항은 대통령령으로 정한다.
제15조(실험지침의 작성·시행 등)
①정부는 생명공학연구 및 산업화의 촉진을 위한 실험지침을 작성·시행하여야 한다.(개정 1995.1.5)
②제1항의 실험지침에서는 생명공학의 연구와 이의 산업화 과정에서 예견될 수 있는 생물학적 위험성, 환경에 미치는 악영향 및 윤리적 문제발생의 사전방지에 필요한 조치가 강구되어야 하며, 유전적으로 변형된 생물체의 이전·취급·사용에 대한 안전기준이 마련되어야 한다.(개정 1995.1.5)
제16조(한국생명공학연구원 (개정 1995.1.5, 2003.12.30))
①생명공학연구[다만, 기초의과학(基礎醫科學)연구를 제외한다. 이하 이 조에서 같다] 및 유전자원의 이용과 보전에 관한 연구의 중추적 기능을 담당하고 생명공학분야에서의 학계·연구기관 및 산업계간의 상호유기적 협조체제를 유지·발전시키며, 이들을 지원하기 위하여 재단법인인 한국생명공학연구원(이하 “연구원”이라 한다)을 설립할 수 있다.(개정 1995.1.5, 2003.12.30)
②제1항의 규정에 의한 연구원은 특정연구기관육성법의 적용을 받는 특정연구기관으로 한다.(개정 2003.12.30)
③삭제(1995.12.6)
제17조(기초의과학육성지원기구)
①정부는 기초의과학(基礎醫科學)을 육성하기 위하여 기초의과학 육성지원기구(이하 “육성지원기구”라 한다)를 지정하여 운영할 수 있다.
②정부는 예산의 범위 안에서 육성지원기구의 운영에 필요한 경비를 지원할 수 있다.
③육성지원기구의 지정 및 운영에 관하여 필요한 사항은 대통령령으로 정한다.
[본조신설 2003.12.30]
제18조 삭제(1995.12.6)
제19조(사후승인 통관절차 (개정 2003.12.30))
①삭제(2003.12.30)
②생명공학 연구활동에 필요한 관련 자재·기기 또는 시약 중 국내에서 생산되지 아니하는 품목 중 변질 기타로 인하여 시기적으로 그 안정성의 확보가 어려운 시약 등에 대해서는 관세법의 절차에 불구하고 대통령령이 정하는 바에 의하여 사후 승인의 통관절차로 대신할 수 있다.(개정 2003.12.30)
제20조 삭제(2003.12.30)
부 칙 (제3718호, 1983.12.31)
이 법은 공포한 후 2월이 경과한 날로부터 시행한다.
부 칙 (정부조직법) (제4268호, 1990.12.27)
제1조(시행일) 이 법은 공포한 날부터 시행한다. (단서 생략)
제2조 및 제3조 생략
제4조(문교부의 명칭변경에 따른 다른 법률의 개정)
①내지 (42)생략
(43) 유전공학육성법 중 다음과 같이 개정한다.
제13조제1호중 “문교부장관”을 “교육부장관”으로 한다.
(44) 내지 (50)생략
제5조 내지 제10조 생략
부 칙 (정부조직법) (제4541호, 1993.3.6)
제1조(시행일) 이 법은 공포한 날부터 시행한다.
제2조 및 제3조 생략
제4조(상공자원부 신설에 따른 다른 법률의 개정)
①유전공학육성법 중 다음과 같이 개정한다.
제13조제3호를 다음과 같이 하고, 동조 제4호를 삭제한다.
3. 상공자원부장관은 유전공학연구를 통한 산업공정의 개발과 개선, 대체에너지 개발, 에너지절약 및 광물자원의 효율적 이용
②내지 (100)생략
제5조 생략
부 칙 (제4938호, 1995.1.5)
이 법은 공포 후 6월이 경과한 날부터 시행한다.
부 칙 (기금관리기본법) (제4980호, 1995.12.6)
제1조(시행일) 이 법은 1996년 1월 1일부터 시행한다. (단서 생략)
제2조(다른 법률의 개정)
①생략
②생명공학육성법 중 다음과 같이 개정한다.
제16조제3항·제17조 및 제18조를 각각 삭제한다.
③내지 (24)생략
부 칙 (제5400호, 1997.8.28)
이 법은 공포 후 3월이 경과한 날부터 시행한다.
부 칙 (정부조직법) (제6400호, 2001.1.29)
제1조(시행일) 이 법은 공포한 날부터 시행한다. (단서 생략)
제2조 생략
제3조(다른 법률의 개정)
①내지 (60)생략
(61) 생명공학육성법 중 다음과 같이 개정한다.
제13조제1호 중 “교육부장관”을 “교육인적자원부장관”으로 한다.
(62)내지 (79)생략
제4조 생략
부 칙 (제7014호, 2003.12.30)
이 법은 공포 후 6월이 경과한 날부터 시행한다.
부 칙 (신에너지 및 재생에너지개발·이용·보급촉진) (제7284호, 2004.12.31)
제1조(시행일) 이 법은 공포 후 6월이 경과한 날부터 시행한다.
제2조 및 제3조 생략
제4조(다른 법률의 개정)
①내지 ③생략
④생명공학육성법 중 다음과 같이 개정한다.
제13조제1항제4호중 “대체에너지개발”을 “신·재생에너지개발”로 한다.
⑤내지 ⑧생략
제5조 생략
부 칙 (정부조직법) (제8852호, 2008.2.29)
제1조(시행일) 이 법은 공포한 날부터 시행한다. 다만, 제31조제1항의 개정규정 중 “식품산업진흥”에 관한 부분은 2008년 6월 28일부터 시행하고, 부칙 제6조에 따라 개정되는 법률 중 이 법의 시행 전에 공포되었으나 시행일이 도래하지 아니한 법률을 개정한 부분은 각각 해당 법률의 시행일부터 시행한다.
제2조부터 제5조까지 생략
제6조(다른 법률의 개정)
①부터 (132)까지 생략
(133) 생명공학육성법 일부를 다음과 같이 개정한다.
제4조제1항·제2항·제4항, 제5조제2항·제3항, 제6조제1항·제2항 제6호·제4항 각 호 외의 부분 및 제9조 중 “과학기술부장관”을 각각 “교육과학기술부장관”으로 한다.
제13조제1항 각 호 외의 부분 단서 중 “과학기술부장관 및 보건복지부장관”을 “교육과학기술부장관 및 보건복지가족부장관”으로 하고, 같은 항 제1호를 삭제하며, 같은 항 제2호 중 “과학기술부장관은 제4조 제2항의 규정에 의한 기본계획의 수립과 부처별 정책수립의 지원 및 종합조정,”을 “교육과학기술부장관은 제4조 제2항의 규정에 의한 기본계획의 수립과 부처별 정책수립의 지원 및 종합조정, 생명공학분야의 연구를 촉진시키기 위한 전문인력의 양성과 생명과학기초분야의 연구지원,”으로 하고, 같은 항 제3호 중 “농림부장관”을 “농림수산식품부장관”으로, “육성·발전”을 “육성·발전, 해양수산생물을 이용한 유용물질의 생산과 해양수산생물의 육종·개량 및 식품소재의 개발 등 응용연구의 지원, 해양수산분야의 유용한 유전자의 확보·분석·이용·보존 등 기초연구의 지원”으로 하며, 같은 항 제4호 중 “산업자원부장관”을 “지식경제부장관”으로, “촉진”을 “촉진 및 생명공학의 육성·발전을 위한 정보통신기술의 개발 지원”으로 하고, 같은 항 제4호의2를 삭제하며, 같은 항 제6호 중 “응용연구의 지원”을 “응용연구 지원, 해양오염방지 등을 위한 기술개발 및 연구기관의 육성·발전”으로 하고, 같은 항 제7호를 삭제하며, 같은 조 제2항 중 “과학기술부장관과 보건복지부장관”을 “교육과학기술부장관과 보건복지가족부장관”으로 한다.
(134)부터 (760)까지 생략
제7조 생략
생명윤리 및 안전에 관한 법률
[(타)일부개정 2009.1.30 법률 제9386호 시행일 2010.1.31]
제1장 총 칙
제1조(목적) 이 법은 생명과학기술에 있어서의 생명윤리 및 안전을 확보하여 인간의 존엄과 가치를 침해하거나 인체에 위해를 주는 것을 방지하고, 생명과학기술이 인간의 질병 예방 및 치료 등을 위하여 개발·이용될 수 있는 여건을 조성함으로써 국민의 건강과 삶의 질 향상에 이바지함을 목적으로 한다.
제2조(정의) 이 법에서 사용하는 용어의 정의는 다음과 같다.(개정 2008.6.5)
1. “생명과학기술”이라 함은 인간의 배아(胚芽)·세포·유전자 등을 대상으로 생명현상을 규명·활용하는 과학과 기술을 말한다.
2. “배아”라 함은 수정란 및 수정된 때부터 발생학적으로 모든 기관이 형성되는 시기까지의 분열된 세포군을 말한다.
3. “잔여배아”라 함은 인공수정으로 생성된 배아 중 임신의 목적으로 이용하고 남은 배아를 말한다.
4. “체세포핵이식행위”라 함은 핵이 제거된 인간의 난자에 인간의 체세포 핵을 이식하는 것을 말한다.
5. “체세포복제배아(體細胞複製胚芽)”라 함은 체세포핵이식행위에 의하여 생성된 배아를 말한다.
6. “유전자검사”라 함은 개인의 식별, 특정한 질병 또는 소인(素因)의 검사 등의 목적으로 혈액·모발·타액(唾液) 등의 검사대상물로부터 염색체·유전자 등을 분석하는 행위를 말한다.
7. “유전정보”라 함은 유전자검사의 결과로 얻어진 정보를 말한다.
8. “유전자은행”이라 함은 유전정보의 획득을 목적으로 검사대상물·유전자 또는 개인정보가 포함된 유전정보(이하 “유전정보 등”이라 한다)를 수집·보존하여 이를 직접 이용하거나 타인에게 제공하는 기관을 말한다.
9. “유전자치료”라 함은 질병의 예방 또는 치료를 목적으로 유전적 변이를 일으키는 일련의 행위를 말한다.
10. “줄기세포주”란 배양가능한 조건 하에서 지속적으로 증식이 가능하고 다양한 세포로 분화할 수 있는 세포주를 말한다.
제3조(적용범위) 생명과학기술에 있어서의 생명윤리 및 안전에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 의한다.
제4조(책무)
①국가 또는 지방자치단체는 생명과학기술의 개발·이용과정에서 일어날 수 있는 생명윤리 및 안전에 관한 문제에 효율적으로 대처할 수 있도록 필요한 시책을 마련하여야 한다.
②생명과학기술을 연구·개발 및 이용하고자 하는 자는 생명과학기술이 인간의 존엄과 가치를 침해하지 아니하고 생명윤리 및 안전에 적합하도록 노력하여야 한다.
제5조(자기결정권) 누구든지 자신이 생명과학기술의 적용대상이 되는 경우 생명윤리 및 안전에 관하여 충분한 설명을 들은 후 이에 관한 동의여부를 결정할 권리를 가진다.
제2장 국가생명윤리심의위원회 및 기관생명윤리심의위원회
제6조(국가생명윤리심의위원회의 설치 및 기능) ①생명과학기술에 있어서의 생명윤리 및 안전에 관한 다음 각 호의 사항을 심의하기 위하여 대통령소속 하에 국가생명윤리심의위원회(이하 “심의위원회”라 한다)를 둔다.
1. 국가의 생명윤리 및 안전에 관한 정책의 수립에 관한 사항
2. 제17조제3호의 규정에 따라 잔여배아를 이용할 수 있는 연구의 종류·대상 및 범위에 관한 사항
3. 제22조 제2항의 규정에 따라 체세포핵이식행위를 할 수 있는 연구의 종류·대상 및 범위에 관한 사항
4. 제25조제1항의 규정에 따라 금지되는 유전자검사의 종류에 관한 사항
5. 제36조제1항제3호의 규정에 따라 유전자치료를 할 수 있는 질병의 종류
6. 그 밖에 윤리적·사회적으로 심각한 영향을 미칠 수 있는 생명과학기술의 연구·개발 또는 이용에 관하여 심의위원회의 위원장이 부의하는 사항
②심의위원회의 위원장은 제1항제1호 내지 제5호의 규정에 해당하는 사항으로서 재적위원 3분의 1 이상이 발의한 사항에 관하여는 심의위원회에 이를 부의하여야 한다.
제7조(심의위원회의 구성)
①심의위원회는 위원장 1인, 부위원장 1인을 포함한 16인 이상 21인 이하의 위원으로 구성한다.
②위원장은 위원 중에서 대통령이 임명 또는 위촉하고, 부위원장은 위원 중에서 호선한다.
③위원은 다음 각 호의 자가 된다.(개정 2005.3.24, 2008.2.29)
1. 교육과학기술부장관·법무부장관·지식경제부장관·보건복지가족부장관·여성부장관·법제처장
2. 생명과학 또는 의과학(醫科學)분야에 전문지식과 연구경험이 풍부한 학계·연구계 또는 산업계를 대표하는 자중에서 대통령이 위촉하는 7인 이내의 자
3. 종교계·철학계·윤리학계·사회과학계·법조계·시민단체(비영리민간단체지원법 제2조의 규정에 의한 비영리민간단체를 말한다) 또는 여성계를 대표하는 자중에서 대통령이 위촉하는 7인 이내의 자
④ 제3항 제2호 및 제3호의 위원의 임기는 3년으로 하되, 연임할 수 있다.
⑤ 심의위원회에 간사위원 2인을 두되, 간사위원은 교육과학기술부장관과 보건복지가족부장관으로 하며, 수석간사위원은 보건복지가족부장관으로 한다.(개정 2008.2.29)
제8조(심의위원회의 운영)
①심의위원회의 효율적인 운영을 위하여 심의위원회에 분야별 전문위원회를 둘 수 있다.
②심의위원회의 사무는 수석간사위원이 처리한다.
③심의위원회의 회의 등 활동은 공개함을 원칙으로 한다.
④이 법에서 규정한 것 외에 심의위원회 및 전문위원회의 구성·운영 그 밖에 필요한 사항은 대통령령으로 정한다.
제9조(기관생명윤리심의위원회의 설치 및 기능)
① 다음 각 호의 기관은 생명과학기술에 있어서의 생명윤리 및 안전을 확보하기 위하여 해당 기관에 기관생명윤리심의위원회(이하 “기관위원회”라 한다)를 두어야 한다.(개정 2008.6.5)
1. 제14조제1항에 따라 보건복지가족부장관으로부터 지정받은 배아생성의료기관
2. 제18조에 따라 보건복지가족부장관에게 등록한 배아연구기관
3. 제23조에 따라 보건복지가족부장관에게 등록한 체세포복제배아연구기관
4. 제24조제1항에 따라 보건복지가족부장관에게 신고한 유전자검사기관
5. 제32조제1항 본문에 따라 보건복지가족부장관의 허가를 받은 유전자은행
6. 제37조제1항에 따라 보건복지가족부장관에게 신고한 유전자치료기관
7. 그 밖에 윤리적·사회적으로 심각한 영향을 미칠 수 있는 생명과학기술을 연구·개발 또는 이용하는 기관으로서 보건복지가족부령으로 정하는 기관
②기관위원회는 제1항 각호의 기관에서 행하여지는 생명과학기술의 연구·개발 또는 이용에 관하여 다음 각 호의 사항을 심의한다.
1. 생명과학기술 연구계획서의 윤리적·과학적 타당성
2. 환자 또는 정자·난자·검사대상물의 제공자로부터 적법한 절차에 따라 동의를 받았는지의 여부
3. 환자, 정자·난자·검사대상물의 제공자 또는 유전정보의 주체에 대한 안전대책 및 정자·난자·검사대상물을 타인에게 제공하는 경우에 성명·주민등록번호 등 개인을 식별할 수 있는 정보(이하 “개인정보”라 한다)에 대한 보호대책
4. 그 밖에 제1항 각호의 기관에서 행하여지는 생명과학기술의 연구·개발 또는 이용에 관한 사항
③ 제1항 각호의 기관의 장은 당해 기관에서 행하여지는 생명과학기술의 연구·개발 또는 이용으로 인하여 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있는 경우에는 지체없이 기관위원회를 소집하여 이를 심의하도록 하고, 그 결과를 보건복지가족부장관에게 보고하여야 한다.(개정 2008.2.29)
④ 제1항 각호의 기관 중 기관의 규모 또는 연구자 수 등이 보건복지가족부령이 정하는 기준 이하인 기관이 기관위원회를 설치한 동종의 기관과 제2항 각호 및 제3항의 규정에 의한 사항의 심의에 관한 협약을 체결한 경우에는 제1항의 규정에 불구하고 기관위원회를 설치한 것으로 본다.(개정 2008.2.29)
제10조(기관위원회의 구성 및 운영)
① 기관위원회는 위원장 1인을 포함하여 5인 이상의 위원으로 구성한다. 이 경우 생명과학 또는 의과학 분야 외의 종사자와 해당 기관에 종사하지 아니하는 자 1인 이상이 각각 포함되어야 한다.(개정 2008.6.5)
② 위원은 제9조제1항 각호의 기관의 장이 위촉하며, 위원장은 위원 중에서 호선한다.
③ 기관위원회의 심의대상인 연구·개발 또는 이용에 관여하는 위원은 해당 연구·개발 또는 이용과 관련된 심의에 참여하여서는 아니 된다.
④ 그 밖에 기관위원회의 구성 및 운영에 관하여 필요한 사항은 대통령령으로 정한다.
제10조의2(기관위원회의 지원 등)
① 보건복지가족부장관은 기관위원회의 운영을 적정하게 감독·지원하기 위하여 다음 각 호의 업무를 수행한다.
1. 기관위원회에 대한 조사
2. 기관위원회에 대한 평가
3. 기관위원회위원에 대한 교육
4. 그 밖에 기관위원회에 대한 감독 및 지원에 필요한 업무로서 보건복지가족부령으로 정하는 업무
② 보건복지가족부장관은 제1항 제2호에 따라 기관위원회의 운영 실적을 평가하고, 그 결과를 공개할 수 있다.
③ 기관위원회에 대한 평가 및 그 결과의 공개, 교육 등에 필요한 사항은 보건복지가족부령으로 정한다.
[본조신설 2008.6.5]
제3장 배아 등의 생성·연구
제1절 인간복제 등의 금지
제11조(인간복제의 금지)
①누구든지 체세포복제배아를 자궁에 착상시켜서는 아니 되며, 착상된 상태를 유지하거나 출산하여서는 아니 된다.
②누구든지 제1항의 규정에 의한 행위를 유인 또는 알선하여서는 아니 된다.
제12조(이종 간의 착상 등 금지)
① 누구든지 인간의 배아를 동물의 자궁에 착상시키거나 동물의 배아를 인간의 자궁에 착상시키는 행위를 하여서는 아니 된다.
② 누구든지 다음 각 호의 1에 해당하는 행위를 하여서는 아니 된다.(개정 2008.6.5)
1. 인간의 난자를 동물의 정자로 수정시키거나 동물의 난자를 인간의 정자로 수정시키는 행위. 다만, 의학적으로 인간의 정자의 활동성 시험을 위한 경우를 제외한다.
2. 핵이 제거된 인간의 난자에 동물의 체세포 핵을 이식하거나 핵이 제거된 동물의 난자에 인간의 체세포 핵을 이식하는 행위
3. 인간의 배아와 동물의 배아를 융합하는 행위
4. 다른 유전정보를 가진 인간의 배아를 융합하는 행위
③누구든지 제2항 각호의 1에 해당하는 행위로부터 생성된 것을 인간 또는 동물의 자궁에 착상시키는 행위를 하여서는 아니 된다.
제2절 인공수정배아
제13조(배아의 생성 등)
①누구든지 임신외의 목적으로 배아를 생성하여서는 아니 된다.
②누구든지 임신을 목적으로 배아를 생성함에 있어서 다음 각 호의 1에 해당하는 행위를 하여서는 아니 된다.
1. 특정의 성을 선택할 목적으로 정자와 난자를 선별하여 수정시키는 행위
2. 사망한 자의 정자 또는 난자로 수정시키는 행위
3. 미성년자의 정자 또는 난자로 수정시키는 행위. 다만, 혼인한 미성년자가 그 자녀를 얻기 위한 경우를 제외한다.
③누구든지 금전 또는 재산상의 이익 그 밖에 반대급부를 조건으로 정자 또는 난자를 제공 또는 이용하거나 이를 유인 또는 알선하여서는 아니 된다.
제14조(배아생성의료기관)
① 인공수태시술을 위하여 정자 또는 난자를 채취·보관하거나 이를 수정시켜 배아를 생성하고자 하는 의료기관은 보건복지가족부장관으로부터 배아생성의료기관으로 지정받아야 한다.(개정 2008.2.29)
② 배아생성의료기관으로 지정받고자 하는 의료기관은 보건복지가족부령이 정하는 시설 및 인력 등을 갖추어야 한다.(개정 2008.2.29)
③ 배아생성의료기관의 지정기준 및 절차, 제출서류 그 밖에 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제15조(배아의 생성 등에 관한 동의)
①제14조의 규정에 따라 배아생성의료기관으로 지정받은 의료기관(이하 “배아생성의료기관”이라 한다)은 배아를 생성하기 위하여 정자 또는 난자를 채취하는 때에는 정자제공자·난자제공자·인공수태시술대상자 및 그 배우자(이하 “동의권자”라 한다)의 서면동의를 얻어야 한다.
②제1항의 규정에 의한 서면동의에는 다음 각 호의 사항이 포함되어야 한다.(개정 2008.2.29)
1. 배아생성의 목적에 관한 사항
2. 배아의 보존기간 그 밖에 배아의 보관에 관한 사항
3. 배아의 폐기에 관한 사항
4. 임신외의 목적으로 잔여배아를 이용하는 것에 대한 동의여부
5. 동의의 철회, 동의권자의 권리 및 정보보호 그 밖에 보건복지가족부령이 정하는 사항
③배아생성의료기관은 제1항의 규정에 의한 서면동의를 받기 전에 동의권자에게 제2항 각호의 사항에 대하여 충분히 설명하여야 한다.
④ 제1항의 규정에 의한 서면동의를 위한 동의서의 서식 및 보존 등에 관하여 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제15조의2(난자제공자에 대한 건강검진 등)
① 배아생성의료기관은 보건복지가족부령으로 정하는 바에 따라 난자의 채취 전에 난자제공자에 대하여 건강검진을 실시하여야 한다.
② 배아생성의료기관은 보건복지가족부령으로 정하는 건강기준에 미달하는 자로부터 난자를 채취하여서는 아니 된다.
[본조신설 2008.6.5]
제15조의3(난자채취 빈도의 제한) 배아생성의료기관은 대통령령으로 정하는 빈도 이상으로 동일한 난자제공자로부터 난자를 채취하여서는 아니 된다.
[본조신설 2008.6.5]
제15조의4(난자제공자에 대한 실비보상) 배아생성의료기관은 난자제공에 필요한 시술 및 회복에 소요되는 시간에 따른 보상금 및 교통비 등 보건복지가족부령으로 정하는 항목에 관하여 보건복지가족부령으로 정하는 금액을 난자제공자에게 지급할 수 있다.
[본조신설 2008.6.5]
제16조(배아의 보존기간 및 폐기)
①배아의 보존기간은 5년으로 한다. 다만, 동의권자가 보존기간을 5년 미만으로 정한 경우에는 이를 보존기간으로 한다.
②배아생성의료기관은 제1항의 규정에 의한 보존기간이 도래한 배아중 제17조의 규정에 의한 연구의 목적으로 이용하지 아니하고자 하는 배아를 폐기하여야 한다.
③배아생성의료기관은 배아의 폐기에 관한 사항을 기록·보관하여야 한다.
④ 배아의 폐기 절차 및 방법, 배아의 폐기에 관한 사항의 기록·보관에 관하여 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제17조(잔여배아의 연구) 제16조의 규정에 의한 배아의 보존기간이 경과된 잔여배아는 발생학적으로 원시선이 나타나기 전까지에 한하여 체외에서 다음 각 호의 1의 목적으로 이용할 수 있다. 다만, 보존기간을 5년 미만으로 정한 잔여배아를 이용하고자 하는 경우에는 동의권자로부터 해당 목적으로의 이용에 대하여 새로이 동의를 받아야 한다.(개정 2008.2.29)
1. 불임치료법 및 피임기술의 개발을 위한 연구
2. 근이영양증 그 밖에 대통령령이 정하는 희귀·난치병의 치료를 위한 연구
3. 그 밖에 제1호와 제2호에 준하는 연구로서 대통령령으로 정하는 연구
제18조(배아연구기관) 제17조의 규정에 따라 잔여배아를 연구하고자 하는 자는 보건복지가족부령이 정하는 시설·인력 등을 갖추고 보건복지가족부장관에게 배아연구기관으로 등록하여야 한다.(개정 2008.2.29)
제19조(배아연구계획서의 승인)
① 제18조의 규정에 따라 보건복지가족부장관에게 등록한 배아연구기관(이하 “배아연구기관”이라 한다)이 제17조의 규정에 의한 배아연구를 하고자 하는 때에는 보건복지가족부령이 정하는 바에 따라 미리 보건복지가족부장관에게 배아연구계획서를 제출하여 승인을 얻어야 한다. 대통령령이 정하는 중요한 사항을 변경하는 경우에도 또한 같다.(개정 2008.2.29)
②제1항의 규정에 의한 배아연구계획서에는 배아연구기관 안에 설치된 기관위원회의 심의결과에 관한 서류가 첨부되어야 한다.
③ 보건복지가족부장관은 다른 중앙행정기관의 장이 연구비를 지원하는 배아연구기관으로부터 연구계획서를 제출받은 때에는 승인여부를 결정하기 전에 그 중앙행정기관의 장과 협의하여야 한다.(개정 2008.2.29)
④ 배아연구계획서의 승인기준 및 절차, 제출서류 그 밖에 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제20조(잔여배아의 제공 및 관리)
① 배아생성의료기관이 제19조제1항의 규정에 따라 배아연구계획서의 승인을 얻은 배아연구기관에게 연구에 필요한 잔여배아를 제공하는 경우에는 무상으로 하여야 한다. 다만, 배아생성의료기관은 잔여배아의 보관 및 제공에 필요한 경비를 보건복지가족부령이 정하는 바에 따라 배아연구기관에 요구할 수 있다.(개정 2008.2.29)
② 제1항의 규정에 의한 잔여배아의 제공절차, 경비의 산출 그 밖에 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
③ 배아생성의료기관과 배아연구기관은 잔여배아의 보관 및 제공 등에 관한 사항을 보건복지가족부령이 정하는 바에 따라 보건복지가족부장관에게 보고하여야 한다.(개정 2008.2.29)
④제16조제2항 내지 제4항의 규정은 배아연구기관이 제1항의 규정에 따라 잔여배아를 제공받은 후 연구의 목적으로 이용하지 아니하고자 하는 잔여배아의 폐기에 관하여 이를 준용한다. 이 경우 “배아생성의료기관”은 “배아연구기관”으로 본다.
제20조의2(줄기세포주의 등록)
① 줄기세포주를 수립(樹立)하거나 수입한 자는 그 줄기세포주를 제20조의3에 따라 제공하거나 제20조의4에 따라 이용하기 전에 보건복지가족부령으로 정하는 바에 따라 그 줄기세포주를 보건복지가족부장관에게 등록하여야 한다.
② 보건복지가족부장관은 줄기세포주의 등록을 신청한 자가 다른 중앙행정기관의 장으로부터 과학적 검증을 받은 경우에는 제1항에 따른 등록을 하는 데에 그 검증자료를 활용하여야 한다.
③ 보건복지가족부장관은 제1항에 따라 줄기세포주를 등록한 자에게 줄기세포주의 검증 등에 든 비용의 전부 또는 일부를 지원할 수 있다.
[본조신설 2008.6.5] [시행일 2010.1.1]
제20조의3(줄기세포주의 제공)
① 제20조의2에 따라 줄기세포주를 수립하거나 수입한 자가 그 줄기세포주를 제공하려면 보건복지가족부령으로 정하는 바에 따라 기관위원회의 심의를 거쳐야 한다.
② 제1항에 따라 줄기세포주를 제공한 자는 보건복지가족부령으로 정하는 바에 따라 보건복지가족부장관에게 줄기세포주의 제공현황을 보고하여야 한다.
③ 제1항에 따라 줄기세포주를 제공하는 경우에는 무상으로 하여야 한다. 다만, 줄기세포주를 제공하는 자는 이를 제공받는 자로부터 줄기세포주의 보관 및 제공에 필요한 경비를 지급받을 수 있다.
④ 제1항부터 제3항까지의 규정에 따른 줄기세포주의 제공 및 보고, 경비의 산출 방법 등에 필요한 사항은 보건복지가족부령으로 정한다.
[본조신설 2008.6.5] [시행일 2010.1.1]
제20조의4(줄기세포주의 이용)
① 제20조의2에 따라 등록된 줄기세포주는 체외에서 다음 각 호의 연구 목적으로만 이용할 수 있다.
1. 질병의 진단·예방 또는 치료를 위한 연구
2. 줄기세포의 특성 및 분화에 관한 기초연구
3. 그 밖에 심의위원회의 심의를 거쳐 대통령령으로 정하는 연구
② 제1항에 따라 줄기세포주를 이용하려는 자는 해당 연구계획에 대하여 보건복지가족부령으로 정하는 바에 따라 기관위원회의 심의를 거쳐 해당 기관의 장의 승인을 받아야 한다. 승인을 받은 연구계획서의 내용 중 대통령령으로 정하는 중요한 사항을 변경하는 경우에도 또한 같다.
③ 제2항에 따라 승인 또는 변경승인을 받은 자는 보건복지가족부령으로 정하는 바에 따라 그 사실을 보건복지가족부장관에게 보고하여야 한다.
④ 제2항에 따라 승인을 받은 자는 줄기세포주를 제공한 자에게 제공받은 줄기세포주의 이용계획서를 제출하여야 한다.
⑤ 제2항에 따라 연구를 승인한 기관의 장은 연구를 하는 자가 연구계획에 적합하게 연구를 실시하도록 감독하여야 한다.
[본조신설 2008.6.5] [시행일 2010.1.1]
제21조(배아생성의료기관 및 배아연구기관의 준수사항) 배아생성의료기관 및 배아연구기관은 다음 각 호의 사항을 준수하여야 한다.(개정 2008.2.29)
1. 제15조의 규정에 의한 동의서에 기재된 목적으로 배아를 취급할 것
2. 잔여배아의 보관·취급·폐기 등의 관리를 철저히 할 것
3. 배아연구기관은 당해 기관에서 행하여지는 연구로 인하여 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있는 경우에는 연구의 중단 등 적절한 조치를 취할 것
4. 그 밖에 제1호 내지 제3호에 준하는 사항으로서 생명윤리 및 안전의 확보를 위하여 필요하다고 인정하여 보건복지가족부령이 정하는 사항
제3절 체세포복제배아
제22조(체세포핵이식행위)
①누구든지 제17조제2호의 규정에 의한 희귀·난치병의 치료를 위한 연구목적 외에는 체세포핵이식행위를 하여서는 아니 된다.
②제1항의 규정에 의한 연구목적에 따라 체세포핵이식행위를 할 수 있는 연구의 종류·대상 및 범위는 심의위원회의 심의를 거쳐 대통령령으로 정한다.
제23조(체세포복제배아의 생성 및 연구)
①체세포복제배아를 생성하거나 연구하고자하는 자는 보건복지가족부령이 정하는 시설 및 인력 등을 갖추고 보건복지가족부장관에게 등록하여야 한다.(개정 2008.2.29)
②제19조 내지 제21조의 규정은 체세포복제배아의 연구에 관하여 이를 준용한다. 이 경우 “잔여배아”는 “체세포복제배아”로 본다.
제4장 유전자검사
제24조(유전자검사기관 등)
① 유전자검사를 하고자 하는 자 또는 직접 검사대상물을 채취하여 유전자에 관한 연구를 하고자 하는 자는 유전자검사시설 또는 연구시설의 소재지, 기관장, 유전자검사 또는 연구항목 등의 사항에 대하여 보건복지가족부령이 정하는 바에 따라 보건복지가족부장관에게 신고하여야 한다. 다만, 국가기관이 유전자검사 또는 유전자에 관한 연구를 하는 경우에는 그러하지 아니하다.(개정 2008.2.29)
②제1항의 규정에 따라 신고한 사항 중 대통령령이 정하는 중요한 사항을 변경하는 경우에도 제1항과 같다.
③ 보건복지가족부장관은 제1항의 규정에 따라 신고한 유전자검사를 하고자 하는 자(이하 “유전자검사기관”이라 한다)로 하여금 보건복지가족부령이 정하는 바에 따라 유전자검사의 정확도 평가를 받게 할 수 있고, 그 결과를 공개할 수 있다.(개정 2008.2.29)
④ 유전자검사기관은 유전자검사의 업무를 폐업하거나 휴업하고자 하는 경우에는 보건복지가족부령이 정하는 바에 따라 보건복지가족부장관에게 신고하여야 한다.(개정 2008.2.29)
제25조(유전자검사의 제한)
①유전자검사기관은 과학적 입증이 불확실하여 검사대상자를 오도(誤導)할 우려가 있는 신체외관이나 성격에 관한 유전자검사 그 밖에 심의위원회의 심의를 거쳐 대통령령이 정하는 유전자검사를 하여서는 아니 된다.
②유전자검사기관은 근이영양증 그 밖에 대통령령이 정하는 유전질환을 진단하기 위한 목적 외에는 배아 또는 태아를 대상으로 유전자검사를 하여서는 아니 된다.
③의료기관이 아닌 유전자검사기관에서는 질병의 진단과 관련한 유전자검사를 할 수 없다. 다만, 의료기관의 의뢰를 받아 유전자검사를 하는 경우에는 그러하지 아니하다.
제26조(유전자검사의 동의)
①유전자검사기관 또는 유전자에 관한 연구를 하는 자가 유전자검사 또는 유전자연구에 쓰일 검사대상물을 직접 채취하거나 채취를 의뢰하는 때에는 검사대상물을 채취하기 전에 검사대상자로부터 다음 각 호의 사항이 포함된 서면동의를 얻어야 한다.(개정 2008.2.29)
1. 유전자검사 또는 유전자연구의 목적
2. 제1호의 규정에 의한 목적 외로 검사대상물을 이용하거나 타인에게 제공하는 것에 대한 동의여부 및 그 범위에 관한 사항
3. 제2호의 규정에 따라 검사대상물을 타인에게 제공하는 경우에 개인정보를 포함 시킬 것인지 여부
4. 검사대상물의 보존기간 및 관리에 관한 사항
5. 동의의 철회, 검사대상자의 권리 및 정보보호 그 밖에 보건복지가족부령이 정하는 사항
② 유전자검사기관외의 자가 검사대상물을 채취하여 유전자검사기관에 유전자검사를 의뢰하는 경우에는 검사대상자로부터 제1항의 규정에 의한 서면동의를 얻어 이를 첨부하여야 한다. 이 경우 보건복지가족부령이 정하는 바에 따라 개인정보를 보호하기 위한 조치를 취하여야 한다.(개정 2008.2.29)
③검사대상자가 미성년자·심신박약자 또는 심신상실자인 경우에는 제1항의 규정에 의한 본인의 동의 외에 법정대리인의 동의를 얻어야 한다. 다만, 질병의 진단 또는 치료를 목적으로 유전자검사를 하는 경우에 있어서 심신박약 또는 심신상실 등의 사유로 본인의 동의를 얻을 수 없는 때에는 이를 생략할 수 있다.
④제1항 내지 제3항의 규정에 불구하고 다음 각 호의 1에 해당하는 경우에는 서면동의 없이 유전자검사를 할 수 있다.
1. 시체 또는 의식불명의 자에 대하여 개인 식별을 하여야 할 긴급한 필요가 있거나 특별한 사유가 있는 경우
2. 다른 법률에 특별한 규정이 있는 경우
⑤제1항 내지 제3항의 규정에 따라 서면동의를 얻고자 하는 자는 미리 검사대상자 또는 법정대리인에게 유전자검사의 목적과 방법, 예측되는 유전자검사의 결과와 의미 등에 대하여 충분히 설명하여야 한다.
⑥ 제1항 내지 제3항의 규정에 의한 동의의 절차 및 동의서의 서식 그 밖에 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제27조(검사대상물의 제공)
①유전자검사기관은 제26조의 규정에 따라 검사대상자로부터 연구목적으로 검사대상물을 이용하는 것에 대하여 서면동의를 얻은 경우에는 유전자에 관한 연구를 하는 자 또는 제32조의 규정에 따라 유전자은행의 개설허가를 받은 자에게 검사대상물을 제공할 수 있다.
②유전자검사기관은 제1항의 규정에 따라 제공하는 검사대상물에 개인정보를 포함시켜서는 아니 된다. 다만, 개인정보를 포함시키는 것에 대하여 검사대상자 또는 법정대리인이 서면으로 동의하는 경우에는 그러하지 아니하며, 이 경우 동의서의 사본을 첨부하여야 한다.
③ 유전자검사기관, 유전자에 관한 연구를 하는 자 또는 제32조의 규정에 따라 유전자은행의 개설허가를 받은 자(이하 “유전자검사기관등”이라 한다)는 제1항의 규정에 따라 검사대상물을 제공하거나 이를 제공받은 때에는 보건복지가족부령이 정하는 바에 따라 검사대상물의 제공에 관한 기록을 작성하여야 한다.(개정 2008.2.29)
④제1항 내지 제3항의 규정은 검사대상물을 제공받은 자가 다른 연구자 또는 유전자은행에 검사대상물을 제공하는 경우에 이를 준용한다.
제28조(검사대상물의 폐기)
①검사대상물의 보존기간은 5년으로 한다. 다만, 검사대상자 또는 법정대리인이 제26조제1항의 규정에 의한 동의서에 보존기간을 별도로 정한 경우에는 이를 보존기간으로 한다.
②유전자검사기관등은 보존기간 경과 후 지체 없이 검사대상물을 폐기하여야 한다. 다만, 검사대상자 또는 법정대리인이 검사대상물을 폐기하지 아니할 것을 서면으로 요청한 경우에는 그러하지 아니하다.
③유전자검사기관등은 검사대상물의 보관 중에 검사대상자 또는 법정대리인이 검사대상물의 폐기를 요청하는 경우에는 이에 응하여야 한다.
④유전자검사기관등은 검사대상물의 폐기에 관한 사항을 기록·보관하여야 한다.
⑤ 유전자검사기관등은 휴업·폐업 그 밖에 부득이한 사정으로 인하여 검사대상물을 보존할 수 없는 경우에는 보건복지가족부령이 정하는 바에 따라 검사대상물을 처리 또는 이관하여야 한다.(개정 2008.2.29)
⑥ 검사대상물의 폐기 절차 및 방법, 검사대상물의 폐기에 관한 사항의 기록·보관 및 제5항의 규정에 의한 검사대상물의 처리 또는 이관에 관하여 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제29조(기록의 관리 및 열람)
① 유전자검사기관등은 다음 각 호의 서류를 보건복지가족부령이 정하는 바에 따라 보존하여야 한다.(개정 2008.2.29)
1. 제26조의 규정에 의한 동의서
2. 유전자검사 결과
3. 제27조제3항의 규정에 의한 검사대상물의 제공에 관한 기록
②유전자검사기관등은 검사대상자 또는 법정대리인이 제1항 각호의 규정에 의한 기록의 열람 또는 사본의 교부를 요청하는 경우에는 이에 응하여야 한다.
③ 제2항의 규정에 의한 기록의 열람 또는 사본의 교부에 관한 신청절차 및 서식 등에 관하여 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제30조(유전자검사기관등의 준수사항)
①유전자검사기관등은 다음 각 호의 사항을 준수하여야 한다.(개정 2008.2.29)
1. 제26조의 규정에 의한 서면동의 내용
2. 유전정보의 보호
3. 그 밖에 제1호 및 제2호에 준하는 사항으로서 생명윤리 및 안전의 확보를 위하여 보건복지가족부령이 정하는 사항
②유전자검사기관등은 유전자검사에 관하여 허위표시 또는 과대광고를 하여서는 아니 된다.
③ 제2항의 규정에 의한 허위표시 또는 과대광고의 범위 그 밖에 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제5장 유전정보 등의 보호 및 이용
제31조(유전정보에 의한 차별금지)
①누구든지 유전정보를 이유로 하여 교육·고용·승진·보험 등 사회활동에 있어서 다른 사람을 차별하여서는 아니 된다.
②다른 법률에 특별한 규정이 있는 경우를 제외하고는 누구든지 타인에게 유전자검사를 받도록 강요하거나 유전자검사의 결과를 제출하도록 강요하여서는 아니 된다.
제32조(유전자은행의 허가 및 신고)
① 유전자은행을 개설하고자 하는 자는 대통령령이 정하는 바에 따라 보건복지가족부장관의 허가를 받아야 한다. 다만, 국가기관이 직접 유전자은행을 개설하고자 하는 경우를 제외한다.(개정 2008.2.29)
② 제1항의 규정에 불구하고 다른 법령에 따라 중앙행정기관의 장으로부터 연구비지원의 승인을 얻어 유전자은행을 개설하고자 하는 경우에는 당해 중앙행정기관의 장으로부터 연구비지원의 승인을 얻은 때에 보건복지가족부장관의 허가를 받은 것으로 본다. 이 경우 해당 중앙행정기관의 장은 미리 보건복지가족부장관과 협의하여야 한다.(개정 2008.2.29)
③ 제1항의 규정에 따라 개설된 유전자은행이 개설장소를 이전하거나 그 개설에 관한 허가사항 중 대통령령이 정하는 중요한 사항을 변경하고자 하는 경우에는 보건복지가족부령이 정하는 바에 따라 보건복지가족부장관에게 신고하여야 한다.(개정 2008.2.29)
④ 유전자은행의 장은 유전자은행의 업무를 폐업하거나 휴업하고자 하는 경우에는 보건복지가족부령이 정하는 바에 따라 보건복지가족부장관에게 신고하여야 한다.(개정 2008.2.29)
⑤제1항의 규정에 의한 유전자은행의 시설·장비 기준 및 허가절차 그 밖에 필요한 사항은 대통령령으로 정한다.
제33조(유전정보 등의 제공)
①유전자은행으로부터 유전정보 등을 이용하고자 하는 자는 유전정보 등의 이용계획서를 유전자은행의 장에게 제출하여야 한다.
② 유전자은행의 장은 제1항의 규정에 따라 제출된 이용계획서에 대하여 제9조의 규정에 의한 기관위원회의 심의를 거쳐 유전정보 등의 제공 여부를 결정하고, 그 결과를 보건복지가족부장관에게 보고하여야 한다.(개정 2008.2.29)
③ 유전정보등의 이용계획서 기재내용, 제출절차 그 밖에 유전정보등의 제공·관리에 관하여 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제34조(유전자은행의 장의 준수사항)
①유전자은행의 장은 제33조의 규정에 따라 유전정보 등을 타인에게 제공함에 있어 개인정보를 포함시켜서는 아니 된다.
② 유전자은행의 장은 유전정보 등을 타인에게 제공하는 경우에는 무상으로 하여야 한다. 다만, 유전자은행의 장은 유전정보 등의 보관 및 제공에 필요한 경비를 보건복지가족부령이 정하는 바에 따라 요구할 수 있다.(개정 2008.2.29)
제35조(유전정보 등의 보호)
①유전자은행의 장 또는 그 종사자는 직무상 얻거나 알게 된 유전정보 등을 정당한 사유 없이 타인에게 제공하거나 부당한 목적으로 사용하여서는 아니 된다.
②의료기관은 「의료법」 제21조 제2항의 규정에 따라 환자외의 자에게 제공하는 의무기록 및 진료기록 등에 유전정보를 포함시켜서는 아니 된다. 다만, 해당 환자와 동일한 질병의 진단 및 치료를 목적으로 다른 의료기관의 요청이 있고 개인정보의 보호에 관한 조치를 한 경우에는 그러하지 아니하다.(개정 2007.4.11, 2009.1.30)
제35조의2(유전정보 등의 관리 등)
① 유전자은행은 수집한 모든 유전정보 등을 익명화하여 보관·관리하여야 한다.
② 유전자은행은 개인정보 보호를 위하여 정보관리 및 보안을 담당하는 책임자를 두어야 한다.
③ 제1항에 따른 유전정보 등의 보관·관리와 제2항에 따른 보안책임자의 업무 등에 필요한 사항은 보건복지가족부령으로 정한다.
[본조신설 2008.6.5]
제35조의3(유전자은행에 대한 지원) 국가나 지방자치단체는 예산의 범위에서 유전자은행의 운영에 필요한 비용을 지원할 수 있다.
[본조신설 2008.6.5]
제6장 유전자치료
제36조(유전자치료)
①누구든지 유전자치료는 다음 각 호의 1에 해당되는 경우 외에는 하여서는 아니된다.(개정 2008.2.29)
1. 유전질환·암·후천성면역결핍증 그 밖에 생명을 위협하거나 심각한 장애를 초래하는 질병의 치료
2. 현재 이용 가능한 치료법이 없거나 유전자치료의 효과가 이용 가능한 다른 치료법과 비교하여 현저히 우수할 것으로 예측되는 치료
3. 그 밖에 보건복지가족부장관이 정하는 질병의 예방이나 치료를 위하여 필요하다고 인정하는 경우
②제1항의 규정에 불구하고 정자·난자·배아 또는 태아에 대하여 유전자치료를 하여서는 아니 된다.
제37조(유전자치료기관)
① 유전자치료를 하고자 하는 의료기관은 보건복지가족부장관에게 신고하여야 한다. 대통령령이 정하는 중요한 사항을 변경하는 경우에도 또한 같다.(개정 2008.2.29)
② 제1항의 규정에 따라 보건복지가족부장관에게 신고한 의료기관(이하 “유전자치료기관”이라 한다)은 유전자치료를 하고자 하는 환자에 대하여 다음 각 호의 사항에 관하여 미리 설명한 후 서면동의를 얻어야 한다.(개정 2008.2.29)
1. 치료의 목적
2. 예측되는 치료결과 및 그 부작용
3. 그 밖에 보건복지가족부령이 정하는 사항
③ 유전자치료기관의 신고요건 및 절차, 동의서의 서식 그 밖에 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
제7장 감 독
제38조(보고와 조사 등)
①보건복지가족부장관은 생명윤리 및 안전의 확보와 관련하여 필요하다고 인정할 때에는 배아생성의료기관·배아연구기관·유전자검사기관등·유전자치료기관(이하 “피감독기관”이라 한다) 또는 그 종사자에 대하여 보건복지가족부령이 정하는 바에 따라 이 법의 시행에 관하여 필요한 보고 또는 자료의 제출을 명할 수 있고, 생명과학기술의 연구·개발·이용으로 인하여 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있는 때에는 그 연구·개발·이용의 중단을 명하거나 그 밖에 필요한 조치를 할 수 있다.(개정 2008.2.29)
②보건복지가족부장관은 이 법이 정하고 있는 사항의 이행 또는 위반 여부의 확인을 위하여 필요하다고 인정할 때에는 관계공무원으로 하여금 피감독기관 또는 그 사무소 등에 출입하여 그 시설 또는 장비, 관계장부나 서류 그 밖의 물건을 검사하게 하거나 관계인에 대한 질문을 하게 할 수 있으며, 시험에 필요한 시료를 최소분량에 한하여 수거하게 할 수 있다. 이 경우 관계공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 내보여야 한다.(개정 2008.2.29)
③피감독기관 또는 그 종사자는 제1항 및 제2항의 규정에 의한 명령·검사·질문 등에 대하여 정당한 사유가 없는 한 이에 응하여야 한다.
제39조(폐기명령) 보건복지가족부장관은 피감독기관 또는 그 종사자, 제20조의2부터 제20조의4까지의 규정에 따라 줄기세포주를 등록·제공 또는 이용한 자에 대하여 제13조, 제14조, 제15조제1항, 제15조의2, 제15조의3, 제16조제2항, 제17조 내지 제19조, 제20조제1항·제4항, 제20조의2제1항, 제20조의3제1항·제3항, 제20조의4제2항, 제22조제1항 또는 제23조의 규정을 위반하여 생성·보관 또는 제공된 배아·체세포복제배아·줄기세포주 또는 난자 및 제24조제1항, 제25조, 제26조제1항 내지 제3항, 제27조제1항·제2항·제4항, 제28조제2항·제3항 또는 제32조제1항·제2항의 규정을 위반하여 채취·보관 또는 제공된 검사대상물을 폐기할 것을 명할 수 있다. 이 경우 폐기의 절차 및 방법에 관하여는 제16조제4항 또는 제28조제6항의 규정을 준용한다.(개정 2008.2.29, 2008.6.5)
제40조(개선명령) 보건복지가족부장관은 피감독기관에 대하여 그 시설·인력 등이 제14조제2항·제18조·제23조 또는 제32조제5항의 규정에서 정하는 시설기준 등에 적합하지 아니하여 연구·채취·보관 또는 배아의 생성 등을 하는 경우에 생명윤리나 안전에 중대한 위해가 발생하거나 발생할 우려가 있다고 인정하는 때에는 그 시설의 개선을 명하거나 당해 시설의 전부 또는 일부의 사용을 금지할 것을 명할 수 있다.(개정 2008.2.29)
제41조(허가 등의 취소와 업무의 정지)
① 보건복지가족부장관은 배아생성의료기관·배아연구기관·유전자검사기관·유전자은행·유전자치료기관이 다음 각 호의 1에 해당하는 때에는 그 지정·등록 또는 허가를 취소하거나 1년 이내의 기간을 정하여 그 업무의 전부 또는 일부의 정지를 명할 수 있다.(개정 2008.2.29, 2008.6.5)
1. 제9조제1항·제3항, 제10조제1항·제3항, 제11조 내지 제14조, 제15조제1항·제3항, 제15조의2, 제15조의3, 제16조제2항·제3항, 제17조, 제19조제1항, 제20조, 제22조, 제24조제2항·제4항, 제25조, 제26조제1항 내지 제3항·제5항, 제27조, 제28조제2항 내지 제5항, 제29조제1항·제2항, 제32조제3항·제4항, 제33조제2항, 제35조, 제35조의2제1항·제2항, 제36조 또는 제37조제1항 후단·제2항의 규정을 위반한 때
2. 제21조·제30조 또는 제34조의 규정에 의한 준수사항을 이행하지 아니한 때
3. 제38조제1항·제39조 또는 제40조의 규정에 의한 명령을 이행하지 아니한 때
4. 제38조제2항의 규정에 의한 검사·질문·수거에 불응한 때
② 제1항의 규정에 의한 행정처분의 세부기준은 그 위반행위의 유형과 위반의 정도 등을 고려하여 보건복지가족부령으로 정한다.(개정 2008.2.29)
제42조(청문) 보건복지가족부장관은 제41조제1항의 규정에 따라 지정·등록 또는 허가를 취소하고자 하는 경우에는 청문을 실시하여야 한다.(개정 2008.2.29)
제43조(과징금)
① 보건복지가족부장관은 배아생성의료기관 또는 유전자치료기관이 다음 각 호의 1에 해당하여 업무정지처분을 하여야 할 경우로서 그 업무정지가 당해 사업의 이용자에게 심한 불편을 주거나 그 밖에 공익을 해할 우려가 있는 때에는 대통령령이 정하는 바에 따라 그 업무정지처분에 갈음하여 2억원 이하의 과징금을 부과할 수 있다.(개정 2008.2.29)
1. 제14조, 제15조제1항·제3항, 제16조제2항·제3항 또는 제36조의 규정을 위반한 때
2. 제21조의 규정에 의한 준수사항을 위반한 때
3. 제38조제1항·제39조 또는 제40조의 규정에 의한 명령을 이행하지 아니한 때
4. 제38조제2항의 규정에 의한 검사·질문·수거에 불응한 때
② 제1항의 규정에 따라 과징금을 부과하는 위반행위의 종별과 정도 등에 따른 과징금의 금액 그 밖에 필요한 사항은 보건복지가족부령으로 정한다.(개정 2008.2.29)
③ 보건복지가족부장관은 제1항의 규정에 의한 과징금을 납부하여야 할 자가 납부기한까지 이를 납부하지 아니하는 때에는 국세체납처분의 예에 따라 이를 징수한다.(개정 2008.2.29)
제44조(수수료) 보건복지가족부장관은 이 법의 규정에 따라 지정·등록·허가·승인을 받고자 하거나 신고를 하는 자 또는 그 내용을 변경하고자 하는 자로 하여금 보건복지가족부령이 정하는 바에 따라 수수료를 납부하게 할 수 있다.(개정 2008.2.29)
제8장 보 칙
제45조(성체줄기세포연구의 지원) 국가 또는 지방자치단체는 성체줄기세포의 연구를 육성하기 위하여 필요한 재정지원을 할 수 있다.
제46조(국고보조) 보건복지가족부장관은 생명과학기술에서의 생명윤리 및 안전의 확보에 이바지할 수 있는 연구사업 및 교육의 육성·지원을 위하여 대통령령이 정하는 바에 따라 해당 단체·연구기관·생명과학관련종사자 등에게 필요한 연구비의 전부 또는 일부를 보조할 수 있다.(개정 2008.2.29)
제47조(위임 및 위탁 등)
① 보건복지가족부장관은 이 법에 의한 권한의 일부를 대통령령이 정하는 바에 따라 소속기관의 장에게 위임할 수 있다.(개정 2008.2.29)
② 보건복지가족부장관은 대통령령으로 정하는 바에 따라 다음 각 호의 어느 하나에 해당하는 업무의 일부를 관계 전문기관 또는 단체에 위탁할 수 있다.(개정 2008.6.5)
1. 제10조의2에 따른 기관위원회 평가 및 기관위원회위원에 대한 교육에 관한 업무
2. 제14조에 따른 배아생성의료기관의 관리에 관한 업무
3. 제18조에 따른 배아연구기관의 관리에 관한 업무
4. 제20조의2제1항에 따른 줄기세포주 등록에 관한 업무
5. 제24조에 따른 유전자검사기관의 관리에 관한 업무
6. 제32조에 따른 유전자은행의 관리에 관한 업무
7. 제37조에 따른 유전자치료기관의 관리에 관한 업무
③ 보건복지가족부장관은 제2항의 규정에 따라 관계 전문기관 또는 단체에게 관리업무를 하게 한 때에는 그 관리에 필요한 예산을 보조할 수 있다.(개정 2008.2.29)
제48조(비밀누설 등의 금지) 피감독기관 또는 그 종사자나 업무에 종사하였던 자는 그 직무상 알게 된 비밀을 누설하거나 도용(盜用)하여서는 아니 된다.
제9장 벌 칙
제49조(벌칙)
①제11조제1항의 규정을 위반하여 체세포복제배아를 자궁에 착상시키거나 착상된 상태를 유지 또는 출산한 자는 10년 이하의 징역에 처한다.
②제1항의 미수범은 처벌한다.
제50조(벌칙) 제12조제1항의 규정을 위반하여 인간의 배아를 동물의 자궁에 착상시키거나 동물의 배아를 인간의 자궁에 착상시킨 자 또는 동조제3항의 규정을 위반하여 동조제2항 각호의 1에 해당하는 행위로부터 생성된 배아를 인간 또는 동물의 자궁에 착상시킨 자는 5년 이하의 징역에 처한다.
제51조(벌칙)
①다음 각호의 1에 해당하는 자는 3년 이하의 징역에 처한다.(개정 2008.6.5)
1. 제11조제2항의 규정을 위반하여 체세포복제배아를 자궁에 착상시키거나 착상된 상태를 유지 또는 출산하는 행위를 유인 또는 알선한 자
2. 제12조제2항 각호의 1에 해당하는 행위를 한 자
3. 제13조제1항의 규정을 위반하여 임신외의 목적으로 배아를 생성한 자
4. 제13조제2항 각호의 1에 해당하는 행위를 한 자
5. 제13조제3항의 규정을 위반하여 금전 또는 재산상 이익 그 밖에 반대급부를 조건으로 정자 또는 난자를 제공하거나 이를 이용한 자
6. 제13조제3항을 위반하여 금전 또는 재산상의 이익, 그 밖에 반대급부를 조건으로 정자 또는 난자를 제공하도록 유인하거나 알선한 자
7. 제22조제1항의 규정을 위반하여 희귀·난치병의 치료를 위한 연구목적 외에 체세포핵이식행위를 한 자
8. 제48조의 규정을 위반하여 비밀을 누설하거나 도용한 자
②제17조의 규정을 위반하여 잔여배아를 이용한 자는 3년 이하의 징역 또는 5천만 원 이하의 벌금형에 처한다.
③제1항제1호의 미수범은 처벌한다.
제52조(벌칙) 다음 각 호 의 1에 해당하는 자는 2년 이하의 징역 또는 3천만 원 이하의 벌금에 처한다.(개정 2008.6.5)
1. 삭제(2008.6.5)
2. 제15조제1항의 규정을 위반하여 배아생성에 관한 서면동의를 얻지 아니하고 정자 또는 난자를 채취한 자
2의2. 제15조의2제1항을 위반하여 난자제공자에 대하여 건강검진을 실시하지 아니한 자
2의3. 제15조의2제2항을 위반하여 난자를 채취한 자
2의4. 제15조의3을 위반하여 난자를 채취한 자
3. 제25조의 규정을 위반하여 유전자검사를 한 자
4. 제26조제1항 내지 제3항의 규정을 위반하여 유전자검사에 관한 서면동의를 얻지 아니하고 검사대상물을 채취하거나 동의서를 첨부하지 아니하고 유전자검사를 의뢰한 자
5. 제31조제1항 또는 제2항의 규정을 위반하여 유전정보를 이용하여 다른 사람을 차별한 자 또는 다른 사람에게 유전자검사를 받기를 강요하거나 유전자검사의 결과를 제출하도록 강요한 자
6. 제34조의 규정을 위반하여 유전정보 등을 타인에게 제공함에 있어 개인정보를 포함시킨 자
7. 제35조제1항의 규정을 위반하여 유전정보 등을 정당한 사유 없이 타인에게 제공하거나 부당한 목적으로 사용한 자
8. 제36조제1항 또는 제2항의 규정을 위반하여 유전자치료를 한 자
9. 제39조의 규정에 의한 폐기명령을 위반한 자
제53조(벌칙) 다음 각 호의 1에 해당하는 자는 1년 이하의 징역 또는 2천만 원 이하의 벌금에 처한다.(개정 2008.2.29, 2008.6.5)
1. 제14조의 규정을 위반하여 배아생성의료기관으로 지정받지 아니하고 인간의 정자 또는 난자를 채취·보관하거나 배아를 생성한 자
2. 제16조제2항 또는 제3항의 규정을 위반하여(제20조제4항에서 준용하는 경우를 포함한다) 배아를 보건복지가족부령이 정하는 바에 따라 폐기하지 아니하거나 배아의 폐기에 관한 사항을 기록·보관하지 아니한 자
3. 제18조의 규정을 위반하여 배아연구기관으로 등록하지 아니하고 잔여배아를 연구한 자
4. 제19조제1항의 규정을 위반하여(제23조제2항에서 준용하는 경우를 포함한다) 보건복지가족부장관의 승인을 얻지 아니하고 배아연구를 한 자
5. 제20조제1항 또는 제3항의 규정을 위반하여 유상으로 잔여배아를 제공하거나 잔여배아의 보관 및 제공 등에 관한 사항을 보건복지가족부령이 정하는 바에 따라 보건복지가족부장관에게 보고하지 아니한 자
6. 제23조제1항의 규정을 위반하여 등록하지 아니하고 체세포복제배아를 생성하거나 연구한 자
7. 제30조제1항의 유전자검사기관등의 준수사항을 위반하거나 동조제2항의 규정을 위반하여 유전자검사에 대하여 허위표시 또는 과대광고를 한 자
8. 제32조제1항의 규정을 위반하여 허가를 받지 아니하고 유전자은행을 개설한 자
8의2. 제35조의2제1항을 위반하여 유전정보등을 익명화하여 보관·관리하지 아니한 자
9. 제40조의 규정에 의한 개선명령 등을 위반한 자
제54조(양벌규정) 법인의 대표자나 법인 또는 개인의 대리인·사용인, 그 밖의 종업원이 그 법인 또는 개인의 업무에 관하여 제49조 내지 제53조의 규정에 해당하는 위반행위를 한 때에는 그 행위자를 벌하는 외에 그 법인 또는 개인에 대하여도 해당 조의 벌금형을 과한다.
제55조(과태료)
①다음 각 호의 1에 해당하는 자는 500만 원 이하의 과태료에 처한다.(개정 2008.6.5)
1. 제20조의2제1항을 위반하여 줄기세포주를 등록하지 아니하고 해당 줄기세포주를 제공하거나 이용한 자
2. 제20조의3제3항 본문을 위반하여 줄기세포주를 유상으로 제공한 자
3. 제20조의4제1항을 위반하여 줄기세포주를 이용한 자
4. 제24조제1항·제2항 또는 제4항의 규정에 의한 신고를 하지 아니한 자
5. 제28조제2항 내지 제5항의 규정을 위반한 자
6. 제29조제1항 각호의 서류를 보존하지 아니하거나 동조제2항의 규정에 의한 기록의 열람 또는 사본의 교부를 거부한 자
7. 제32조제3항 또는 제4항의 규정에 의한 신고를 하지 아니한 자
8. 제35조제2항의 규정을 위반하여 환자의 유전정보를 포함한 기록을 환자외의 자에게 제공한 자
9. 제35조의2제2항을 위반하여 정보관리 및 보안을 담당하는 책임자를 두지 아니한 자
10. 제37조제1항의 규정을 위반하여 신고하지 아니하고 유전자치료를 한 자
② 제1항의 규정에 의한 과태료는 대통령령이 정하는 바에 따라 보건복지가족부장관이 부과·징수한다.(개정 2008.2.29)
③ 제2항의 규정에 의한 과태료처분에 불복이 있는 자는 그 처분의 고지를 받은 날부터 30일 이내에 보건복지가족부장관에게 이의를 제기할 수 있다.(개정 2008.2.29)
④ 제2항의 규정에 의한 과태료처분을 받은 자가 제3항의 규정에 따라 이의를 제기한 때에는 보건복지가족부장관은 지체없이 관할법원에 그 사실을 통보하여야 하며, 그 통보를 받은 관할법원은 비송사건절차법에 의한 과태료의 재판을 한다.(개정 2008.2.29)
⑤제3항의 규정에 의한 기간 이내에 이의를 제기하지 아니하고 과태료를 납부하지 아니한 때에는 국세체납처분의 예에 따라 이를 징수한다.
부 칙 <제7150호, 2004.1.29>
①(시행일)이 법은 2005년 1월 1일부터 시행한다. 다만 제11조, 제12조, 제49조, 제50조 및 제51조제1항제1호·제2호의 규정은 공포한 날부터 시행한다.
②(잔여배아의 연구에 관한 경과조치) 다음 각 호의 요건에 해당하는 잔여배아는 발생학적으로 원시선이 나타나기 전까지에 한하여 제17조 각호의 1의 목적으로 이용할 수 있다.
1. 이 법 시행 전에 생성되었을 것
2. 생성 후 5년이 지났을 것
3. 동의권자의 동의를 얻을 것. 다만, 소재불명 등으로 동의권자의 동의를 얻을 수 없는 경우를 제외한다.
③(체세포복제배아의 연구에 관한 경과조치) 이 법 시행 당시 제17조제2호의 규정에 의한 연구목적으로 체세포복제배아의 연구를 하고 있는 자는 다음 각 호의 요건에 해당하는 경우에는 보건복지부장관의 승인을 얻어 당해 연구를 계속할 수 있다.
1. 3년 이상 체세포복제배아에 관한 연구를 계속하였을 것
2. 관련학술지에 1회 이상 체세포복제배아에 관한 연구논문을 게재한 실적이 있을 것
④(다른 법률의 개정) 장기등이식에관한법률 중 다음과 같이 개정한다.
제2장의 제목중 “生命倫理委員會”를 “장기등이식윤리위원회”로 한다.
제7조의 제목 “(生命倫理委員會)”를 “장기등이식윤리위원회)”로 하고, 동조제1항중 “生命倫理委員會”를 “장기등이식윤리위원회”로 한다.
부 칙 (정부조직법) (제7413호, 2005.3.24)
제1조(시행일) 이 법은 공포한 날부터 시행한다. 다만, 다음 각 호의 사항은 각호의 구분에 의한 날부터 시행한다.
1. 제26조…부칙 제2조 내지 제4조의 규정은 이 법 공포 후 3월 이내에 제42조의 개정규정에 의한 여성가족부의 조직에 관한 대통령령이 시행되는 날
2. 생략
제2조 생략
제3조(다른 법률의 개정)
①내지 ⑤생략
⑥생명윤리및안전에관한법률 일부를 다음과 같이 개정한다.
제7조제3항제1호중 “여성부장관”을 “여성가족부장관”으로 한다.
⑦내지 ⑭생략
제4조 생략
부 칙 (의료법) (제8366호, 2007.4.11)
제1조(시행일) 이 법은 공포한 날부터 시행한다. (단서 생략)
제2조 내지 제19조 생략
제20조(다른 법률의 개정)
①내지 ⑧ 생략
⑨생명윤리및안전에관한법률 일부를 다음과 같이 개정한다.
제35조제2항 본문 중 “의료법 제20조제1항 단서”를 “「의료법」 제21조제1항 단서”로 한다.
⑩내지 (17) 생략
제21조 생략
부 칙 (정부조직법) <제8852호, 2008.2.29>
제1조(시행일) 이 법은 공포한 날부터 시행한다. 다만, 제31조제1항의 개정규정 중 “식품산업진흥”에 관한 부분은 2008년 6월 28일부터 시행하고, 부칙 제6조에 따라 개정되는 법률 중 이 법의 시행 전에 공포되었으나 시행일이 도래하지 아니한 법률을 개정한 부분은 각각 해당 법률의 시행일부터 시행한다.
제2조부터 제5조까지 생략
제6조(다른 법률의 개정)
①부터 (468)까지 생략
(469) 생명윤리및안전에관한법률 일부를 다음과 같이 개정한다.
제7조제3항제1호 중 “교육인적자원부장관”을 “교육과학기술부장관”으로 하고, “과학기술부장관”을 삭제하며, “산업자원부장관”은 “지식경제부장관”으로 하고, “보건복지부장관”을 “보건복지가족부장관”으로 하고, “여성가족부장관”을 “여성부장관”으로 하며, 같은 조 제5항 중 “과학기술부장관”을 “교육과학기술부장관”으로 하고, “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제9조제1항제1호 및 제2호 중 “보건복지부장관”을 각각 “보건복지가족부장관”으로 하고, 같은 항 제4호 중 “보건복지부령”을 “보건복지가족부령”으로 하며, 같은 조 제3항 중 “보건복지부장관”을 “보건복지가족부장관”으로 하고, 같은 조 제4항 중 “보건복지부령”을 “보건복지가족부령”으로 한다.
제14조제1항 중 “보건복지부장관”을 “보건복지가족부장관”으로 하고, 같은 조 제2항 및 제3항 중 “보건복지부령”을 각각 “보건복지가족부령”으로 한다.
제15조제2항제5호 및 제4항 중 “보건복지부령”을 각각 “보건복지가족부령”으로 한다.
제16조제4항 중 “보건복지부령”을 “보건복지가족부령”으로 한다.
제17조제3호를 다음과 같이 한다.
3. 그 밖에 제1호와 제2호에 준하는 연구로서 대통령령으로 정하는 연구
제18조 중 “보건복지부령”을 “보건복지가족부령”으로, “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제19조제1항 전단 중 “보건복지부장관”을 각각 “보건복지가족부장관”으로, “보건복지부령”을 “보건복지가족부령”으로 하고, 같은 조 제3항 중 “보건복지부장관”을 “보건복지가족부장관”으로 하며, 같은 조 제4항 중 “보건복지부령”을 “보건복지가족부령”으로 한다.
제20조제1항 단서 및 제2항 중 “보건복지부령”을 각각 “보건복지가족부령”으로 하고, 같은 조 제3항 중 “보건복지부령”을 “보건복지가족부령”으로, “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제21조제4호 중 “보건복지부령”을 “보건복지가족부령”으로 한다.
제23조제1항 중 “보건복지부령”을 “보건복지가족부령”으로, “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제24조제1항 본문 중 “보건복지부령”을 “보건복지가족부령”으로, “보건복지부장관”을 “보건복지가족부장관”으로 하고, 같은 조 제3항 중 “보건복지부장관”을 “보건복지가족부장관”으로, “보건복지부령”을 “보건복지가족부령”으로 하며, 같은 조 제4항 중 “보건복지부령”을 “보건복지가족부령”으로, “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제26조제1항제5호, 제2항 후단 및 제6항 중 “보건복지부령”을 각각 “보건복지가족부령”으로 한다.
제27조제3항 중 “보건복지부령”을 “보건복지가족부령”으로 한다.
제28조제5항 및 제6항 중 “보건복지부령”을 각각 “보건복지가족부령”으로 한다.
제29조제1항 각 호 외의 부분 및 제3항 중 “보건복지부령”을 각각 “보건복지가족부령”으로 한다.
제30조제1항제3호 및 제3항 중 “보건복지부령”을 각각 “보건복지가족부령”으로 한다.
제32조제1항 본문 중 “보건복지부장관”을 “보건복지가족부장관”으로 하고, 같은 조 제2항 전단 및 후단 중 “보건복지부장관”을 각각 “보건복지가족부장관”으로 하고, 같은 조 제3항 중 “보건복지부령”을 “보건복지가족부령”으로, “보건복지부장관”을 “보건복지가족부장관”으로 하며, 같은 조 제4항 중 “보건복지부령”을 “보건복지가족부령”으로, “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제33조제2항 중 “보건복지부장관”을 “보건복지가족부장관”으로 하고, 같은 조 제3항 중 “보건복지부령”을 “보건복지가족부령”으로 한다.
제34조제2항 단서 중 “보건복지부령”을 “보건복지가족부령”으로 한다.
제36조제1항제3호를 다음과 같이 한다.
3. 그 밖에 보건복지가족부장관이 정하는 질병의 예방이나 치료를 위하여 필요하다고 인정하는 경우
제37조제1항 전단 및 제2항 각 호 외의 부분 중 “보건복지부장관”을 각각 “보건복지가족부장관”으로 하고, 같은 항 제3호 및 제3항 중 “보건복지부령”을 각각 “보건복지가족부령”으로 한다.
제38조제1항 중 “보건복지부장관”을 “보건복지가족부장관”으로, “보건복지부령”을 “보건복지가족부령”으로 하고, 같은 조 제2항 전단 중 “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제39조 전단 중 “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제40조 중 “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제41조제1항 각 호 외의 부분 중 “보건복지부장관”을 “보건복지가족부장관”으로 하고, 같은 조 제2항 중 “보건복지부령”을 “보건복지가족부령”으로 한다.
제42조 중 “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제43조제1항 각 호 외의 부분 중 “보건복지부장관”을 “보건복지가족부장관”으로 하고, 같은 조 제2항 중 “보건복지부령”을 “보건복지가족부령”으로 하며, 같은 조 제3항 중 “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제44조 중 “보건복지부장관”을 “보건복지가족부장관”으로, “보건복지부령”을 “보건복지가족부령”으로 한다.
제46조 중 “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제47조제1항·제2항 각 호 외의 부분 및 제3항 중 “보건복지부장관”을 각각 “보건복지가족부장관”으로 한다.
제53조제2호 중 “보건복지부령”을 “보건복지가족부령”으로 하고, 같은 조 제4호 중 “보건복지부장관”을 “보건복지가족부장관”으로 하며, 같은 조 제5호 중 “보건복지부령”을 “보건복지가족부령”으로, “보건복지부장관”을 “보건복지가족부장관”으로 한다.
제55조제2항부터 제4항까지 중 “보건복지부장관”을 각각 “보건복지가족부장관”으로 한다.
(470)부터 (760)까지 생략
제7조 생략
부 칙 (제9100호, 2008.6.5)
①(시행일)이 법은 공포 후 6개월이 경과한 날부터 시행한다. 다만, 제20조의2부터 제20조의4까지의 개정규정은 2010년 1월 1일부터 시행한다.
②(이미 수립되거나 수입된 줄기세포주의 등록에 관한 경과조치) 제20조의2부터 제20조의4까지의 개정규정의 시행일 전에 이미 줄기세포주를 수립하거나 수입한 자는 제20조의2의 개정규정에 따라 수립하거나 수입한 것으로 본다. 이 경우 등록신청은 2010년 6월 30일까지 하여야 한다.
부 칙 (의료법) (제9386호, 2009.1.30)
제1조(시행일) 이 법은 공포 후 1년이 경과한 날부터 시행한다. 다만, 제27조제1항, 제33조, 제43조제5항 단서, 제77조제2항 단서, 제87조제1항제2호의 개정규정 및 부칙 제4조는 공포한 날부터 시행하고, 제27조제3항·제4항, 제27조의2, 제56조, 제63조(제27조의2제1항·제2항·제3항·제5항의 개정규정을 위반한 경우에 대한 시정명령에 한한다) 및 제88조의 개정규정은 공포 후 3개월이 경과한 날부터 시행하며, 제3조의5의 개정규정은 공포 후 2년이 경과한 날부터 시행한다.
제2조부터 제5조까지 생략
제6조(다른 법률의 개정)
①부터 ⑤까지 생략
⑥ 생명윤리 및 안전에 관한 법률 일부를 다음과 같이 개정한다.
제35조제2항 본문 중 “「의료법」 제21조제1항 단서”를 “「의료법」 제21조제2항”으로 한다.
⑦부터 ⑫까지 생략
제7조 생략
생명연구자원의 확보·관리 및 활용에 관한 법률
[제정 2009.5.8 법률 제9639호]
제1장 총 칙
제1조(목적) 이 법은 생명연구자원의 효율적인 확보와 체계적인 관리를 통하여 지속가능한 활용을 도모하고 생명공학의 발전 기반을 조성함으로써 국민의 삶의 질 향상과 국가경제 발전에 기여하는 것을 목적으로 한다.
제2조(정의) 이 법에서 사용하는 용어의 뜻은 다음과 같다.
1. “생명연구자원”이란 생명공학연구의 기반이 되는 자원으로서 산업적으로 유용한 동물, 식물, 미생물, 인체유래 연구자원 등 생물체의 실물(實物)과 정보를 말한다.
2. “국가연구개발사업”이란 「과학기술기본법」 제11조에 따른 국가연구개발사업을 말한다.
3. “연구기관”이란 다음 각 목의 연구기관을 말한다.
가. 국공립 연구기관
나. 「특정연구기관 육성법」의 적용을 받는 연구기관
다. 「과학기술분야 정부출연연구기관 등의 설립·운영 및 육성에 관한 법률」에 따라 설립된 연구기관
라. 「기술개발촉진법」 제7조제1항제2호에 따른 기업부설연구소
마. 「산업기술연구조합 육성법」에 따른 산업기술연구조합
제3조(국가 등의 책무)
① 국가와 지방자치단체는 생명연구자원의 효율적인 확보·관리 및 활용을 위하여 노력하여야 한다.
② 다음 각 호의 기관 등은 생명연구자원의 확보·관리 및 활용에 관하여 국가와 지방자치단체가 수행하는 업무에 적극 협력하여야 한다.
1. 국가연구개발사업을 수행하는 「고등교육법」 제2조에 따른 학교
2. 국가연구개발사업을 수행하는 연구기관
3. 그 밖에 생명연구자원을 관리·이용하는 자
제4조(다른 법률과의 관계) 생명연구자원의 확보·관리 및 활용에 관하여 다른 법률에 특별한 규정이 있는 경우 외에는 이 법에서 정하는 바에 따른다.
제2장 생명연구자원의 관리 등
제5조(생명연구자원 관리의 기본원칙)
① 관계 중앙행정기관의 장은 소관 분야의 생명연구자원과 국가연구개발사업의 연구 결과 생산된 생명연구자원을 관리한다.
② 교육과학기술부장관은 제1항에 따라 관계 중앙행정기관이 관리하는 생명연구자원에 관한 정보를 종합적으로 관리한다.
제6조(기본시책의 마련) 정부는 이 법의 목적을 효율적으로 달성하기 위하여 생명연구자원의 확보·관리 및 활용을 도모하기 위한 다음 각 호의 시책을 마련하여야 한다.
1. 교육과학기술부장관은 생명연구자원의 통합정보시스템 구축 및 통계 유지와 소관 분야의 생명연구자원의 확보·관리 및 활용체제를 조성하고 생명연구자원 분야의 전문인력 양성 및 기초 연구를 지원한다.
2. 농림수산식품부장관은 농업·수산업 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 이를 지원한다.
3. 지식경제부장관은 산업 분야 생명연구자원의 확보·관리 및 활용체계를 조성하고 생명연구자원의 산업적 활용 및 생명연구자원의 관리와 활용을 위한 정보통신기술의 확보를 지원한다.
4. 보건복지가족부장관은 보건·의료 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 이를 지원한다.
5. 환경부장관은 야생생물 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 이를 지원한다.
6. 국토해양부장관은 해양 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 이를 지원한다.
제7조(생명연구자원 관리 기본계획의 수립·시행 등)
① 정부는 생명연구자원의 활용촉진과 정보관리를 위하여 5년마다 생명연구자원 관리 기본계획(이하 “기본계획”이라 한다)을 수립·시행하여야 한다.
② 기본계획에는 다음 각 호의 사항이 포함되어야 한다.
1. 생명연구자원의 확보·관리 및 활용의 기본방향
2. 생명연구자원의 조사, 연구, 개발 및 확보
3. 생명연구자원의 보존·관리 및 활용
4. 생명연구자원 관련 인프라의 구축
5. 생명연구자원 정보유통체계 구축
6. 생명연구자원의 확보·관리 및 활용을 위한 투자의 확대
7. 생명연구자원 전문인력 양성
8. 그 밖에 생명연구자원 분야의 육성 및 관리 등에 필요한 사항
③ 관계 중앙행정기관의 장은 제2항 각 호의 사항에 대하여 소관 분야별로 계획을 세우고 이를 교육과학기술부장관에게 통보하여야 한다.
④ 교육과학기술부장관은 제3항에 따라 통보받은 관계 중앙행정기관의 계획을 종합하여 기본계획안을 작성하고 「과학기술기본법」 제9조제1항에 따른 국가과학기술위원회의 심의를 거쳐 이를 확정한다.
⑤ 관계 중앙행정기관의 장은 기본계획에 따라 연도별 시행계획을 수립·시행하여야 한다.
⑥ 기본계획과 시행계획의 수립·시행에 필요한 사항은 대통령령으로 정한다.
제8조(생명연구자원 기탁등록보존기관의 지정 등)
① 관계 중앙행정기관의 장은 생명연구자원 기탁등록보존기관을 지정할 수 있다.
② 제1항에 따라 지정된 생명연구자원 기탁등록보존기관(이하 “기탁등록보존기관”이라 한다)은 다음 각 호의 업무를 수행한다.
1. 생명연구자원의 수탁, 등록 및 평가
2. 생명연구자원의 보존과 관리
3. 생명연구자원 정보시스템의 구축과 운영
4. 소관 정보시스템, 제10조제2항제2호에 따른 정보시스템 및 제11조제2항제1호에 따른 통합정보시스템 간의 상호 연계
5. 국내외 생명연구자원 관련 기관과의 협력
6. 그 밖에 생명연구자원의 관리와 활용 등에 필요한 사항
③ 기탁등록보존기관은 생명연구자원의 안정적 보존을 위하여 복수의 시설에서 생명연구자원을 보존 및 관리할 수 있다.
④ 정부는 기탁등록보존기관의 운영에 필요한 경비의 전부 또는 일부를 지원할 수 있다.
⑤ 기탁등록보존기관의 지정기준과 운영 등에 필요한 사항은 대통령령으로 정한다.
제9조(기탁 및 등록 등)
① 생명연구자원을 관리·이용하고 있는 자는 기탁등록보존기관에 생명연구자원을 기탁·등록할 수 있다.
② 국가연구개발사업을 수행한 자는 사업수행 결과에 따라 생산된 생명연구자원을 기탁등록보존기관에 기탁·등록하여야 한다. 다만, 대통령령으로 정하는 사유로서 관계 중앙행정기관의 장이 인정하는 경우에는 그러하지 아니하다.
③ 정부는 제2항에 따른 생명연구자원의 기탁 및 등록실적을 해당 사업의 평가 등에 반영할 수 있다.
④ 생명연구자원의 기탁 및 등록의 방법 등에 필요한 사항은 대통령령으로 정한다.
제10조(책임기관 및 생명연구자원정보센터의 지정 등)
① 관계 중앙행정기관의 장은 기탁등록보존기관 중에서 다음 각 호의 업무를 수행하는 기관을 책임기관으로 지정할 수 있다.
1. 기탁등록보존기관의 관리
2. 기탁등록보존기관 간의 정보 교류
② 관계 중앙행정기관의 장은 필요한 경우 소관 분야의 생명연구자원의 관리와 유통을 촉진하기 위하여 다음 각 호의 업무를 수행하는 생명연구자원정보센터를 지정할 수 있다.
1. 소관 분야의 생명연구자원과 관련된 정보의 수집
2. 소관 분야의 생명연구자원 정보시스템의 구축과 운영
3. 그 밖에 소관 분야의 생명연구자원의 관리와 유통에 필요한 사항
③ 관계 중앙행정기관의 장은 제2항에 따라 지정된 생명연구자원정보센터(이하 “생명연구자원정보센터”라 한다)와 제11조제1항에 따른 국가생명연구자원정보센터 간의 정보유통을 촉진하여야 한다.
④ 정부는 제1항에 따라 지정된 책임기관(이하 “책임기관”이라 한다)과 생명연구자원정보센터의 운영에 필요한 경비의 전부 또는 일부를 지원할 수 있다.
⑤ 책임기관과 생명연구자원정보센터의 지정기준과 운영 등에 필요한 사항은 대통령령으로 정한다.
제11조(국가생명연구자원정보센터의 지정 등)
① 교육과학기술부장관은 관계 중앙행정기관이 관리하는 생명연구자원의 통합적 관리와 유통을 위하여 국가생명연구자원정보센터를 지정할 수 있다.
② 제1항에 따라 지정된 국가생명연구자원정보센터(이하 “국가생명연구자원정보센터”라 한다)는 다음 각 호의 업무를 수행한다.
1. 생명연구자원 통합정보시스템의 구축과 운영
2. 생명연구자원과 관련된 정보의 분석 및 제공
3. 생명연구자원과 관련된 자동화시스템의 설계, 개발, 구축과 관리
4. 생명연구자원과 관련된 연구기관 및 기탁등록보존기관의 정보관리 지원 및 교육
5. 국내외 생명연구자원 정보관리기관과의 협력
6. 그 밖에 생명연구자원의 통합적 관리와 유통에 필요한 사항
③ 교육과학기술부장관은 관계 중앙행정기관의 장 및 지방자치단체의 장에게 생명연구자원과 관련된 정보 및 현황 등 생명연구자원의 관리에 필요한 자료 등에 관하여 협조를 요청할 수 있다.
④ 정부는 국가생명연구자원정보센터의 운영에 필요한 경비의 전부 또는 일부를 지원할 수 있다.
⑤ 국가생명연구자원정보센터의 지정기준과 운영 등에 필요한 사항은 대통령령으로 정한다.
제12조(지정의 취소 등)
① 관계 중앙행정기관의 장은 기탁등록보존기관, 책임기관 또는 생명연구자원정보센터의 지정을 받은 자가 다음 각 호의 어느 하나에 해당하는 경우에는 지정을 취소하거나 6개월 이내의 기간을 정하여 사업의 정지를 명할 수 있다. 다만, 제1호에 해당하는 경우에는 그 지정을 취소하여야 한다.
1. 거짓이나 그 밖의 부정한 방법으로 지정을 받은 경우
2. 제8조제5항 또는 제10조제5항에 따른 지정기준을 충족하지 못하게 된 경우
② 교육과학기술부장관은 국가생명연구자원정보센터의 지정을 받은 자가 다음 각 호의 어느 하나에 해당하는 경우에는 지정을 취소하거나 6개월 이내의 기간을 정하여 사업의 정지를 명할 수 있다. 다만, 제1호에 해당하는 경우에는 그 지정을 취소하여야 한다.
1. 거짓이나 그 밖의 부정한 방법으로 지정을 받은 경우
2. 제11조제5항에 따른 지정기준을 충족하지 못하게 된 경우
③ 제1항 및 제2항에 따른 처분의 기준과 절차 등에 필요한 사항은 대통령령으로 정한다.
제3장 생명연구자원 관련 분야의 육성
제13조(관련 기관의 육성·지원) 정부는 생명연구자원의 확보·관리 및 활용을 촉진하기 위하여 생명연구자원의 연구, 기탁, 등록 또는 보존 등의 업무를 수행하는 기관 또는 단체 등을 육성·지원하여야 한다.
제14조(투자재원의 마련) 정부는 생명연구자원의 확보·관리 및 활용을 위한 시책을 추진하는 데에 필요한 투자재원을 지속적이고 안정적으로 마련하기 위하여 노력하여야 한다.
제15조(전문인력의 양성) 정부는 생명연구자원의 효과적인 확보·관리 및 활용에 필요한 전문인력을 체계적으로 양성하기 위하여 다음 각 호의 시책을 마련하여야 한다.
1. 생명연구자원 분야의 중·장기 전문인력 양성
2. 전문인력 교육프로그램의 확보 및 보급 지원
제16조(공동연구의 지원 등)
① 정부는 생명연구자원의 효율적인 확보·관리 및 활용을 위하여 산업계, 학계, 연구기관 간의 공동연구 및 관련 학술활동을 지원하여야 한다.
② 정부는 외국 및 국제기구 등과 생명연구자원의 확보·관리 및 활용에 관한 기술협력, 정보교환, 공동조사, 연구 등 효율적인 국제협력의 증진을 촉진하기 위하여 적극 노력하여야 한다.
제17조(생명연구자원의 활용)
① 정부는 국민이 생명연구자원에 대한 연구개발 및 산업화를 위하여 생명연구자원을 적극적으로 활용할 수 있도록 필요한 시책을 마련하여야 한다.
② 정부는 산업계, 학계, 연구기관이 필요한 생명연구자원을 효과적으로 활용할 수 있도록 홍보 및 교육 등의 시책을 추진하여야 한다.
제18조(생명연구자원의 정보유통)
① 관계 중앙행정기관의 장은 소관 분야의 생명연구자원과 관련된 정보를 디지털화된 형태로 수집·확보할 수 있도록 필요한 시책을 마련하여야 한다.
② 정부는 생명연구자원의 효율적인 관리와 유통을 촉진하기 위하여 생명연구자원과 관련된 정보의 수집·보존 및 전송에 관한 표준화를 추진하여야 한다.
제19조(통계간행물의 발간 등)
① 교육과학기술부장관은 생명연구자원의 종류와 보유기관 등 생명연구자원의 현황이 파악될 수 있도록 관계 중앙행정기관의 장 및 통계청장과의 협의를 거쳐 매년 통계간행물을 발간·보급하여야 한다.
② 교육과학기술부장관은 제1항에 따른 통계간행물의 발간을 위하여 관계 중앙행정기관의 장에게 필요한 자료를 제출하도록 요청할 수 있다.
제4장 보 칙
제20조(청문) 관계 중앙행정기관의 장과 교육과학기술부장관은 제12조제1항 또는 제2항에 따라 기탁등록보존기관, 책임기관, 생명연구자원정보센터 또는 국가생명연구자원정보센터의 지정을 취소하려면 청문을 하여야 한다.
제21조(위임 및 위탁)
① 이 법에 따른 관계 중앙행정기관의 장과 교육과학기술부장관의 권한은 그 일부를 대통령령으로 정하는 바에 따라 특별시장·광역시장·도지사·특별자치도지사, 시장·군수·구청장(자치구의 구청장을 말한다) 또는 소속 기관의 장에게 위임할 수 있다.
② 이 법에 따른 관계 중앙행정기관의 장과 교육과학기술부장관의 업무는 그 일부를 대통령령으로 정하는 바에 따라 관련 법인·단체에 위탁할 수 있다.
부 칙 (제9639호, 2009.5.8)
이 법은 공포 후 6개월이 경과한 날부터 시행한다.
실험동물에 관한 법률
[제정 2008.3.28 법률 제9025호]
제1장 총 칙
제1조(목적) 이 법은 실험동물 및 동물실험의 적절한 관리를 통하여 동물실험에 대한 윤리성 및 신뢰성을 높여 생명과학 발전과 국민보건 향상에 이바지함을 목적으로 한다.
제2조(정의) 이 법에서 사용하는 용어의 정의는 다음과 같다.
1. “동물실험”이란 교육·시험·연구 및 생물학적 제제(製劑)의 생산 등 과학적 목적을 위하여 실험동물을 대상으로 실시하는 실험 또는 그 과학적 절차를 말한다.
2. “실험동물”이란 동물실험을 목적으로 사용 또는 사육되는 척추동물을 말한다.
3. “재해”란 동물실험으로 인한 사람과 동물의 감염, 전염병 발생, 유해물질 노출 및 환경오염 등을 말한다.
4. “동물실험시설”이란 동물실험 또는 이를 위하여 실험동물을 사육하는 시설로서 대통령령으로 정하는 것을 말한다.
5. “실험동물생산시설”이란 실험동물을 생산 및 사육하는 시설을 말한다.
6. “운영자”란 동물실험시설 혹은 실험동물생산시설을 운영하는 자를 말한다.
제3조(적용 대상) 이 법은 다음 각 호의 어느 하나에 필요한 실험에 사용되는 동물과 그 동물실험시설의 관리 등에 적용한다.
1. 식품·건강기능식품·의약품·의약외품·생물의약품·의료기기·화장품의 개발·안전관리·품질관리
2. 마약의 안전관리·품질관리
제4조(다른 법률과의 관계) 실험동물의 사용 또는 관리에 관하여 이 법에서 규정한 것을 제외하고는 「동물보호법」으로 정하는 바에 따른다.
제5조(식품의약품안전청의 책무)
① 식품의약품안전청장은 제1조의 목적을 달성하기 위하여 다음 각 호의 사항을 수행하여야 한다.
1. 실험동물의 사용 및 관리에 관한 정책의 수립 및 추진
2. 동물실험시설의 설치·운영에 관한 지원
3. 동물실험시설 내에서 실험동물의 유지·보존 및 개발에 관한 지원
4. 실험동물의 품질향상 등을 위한 연구 지원
5. 실험동물 관련 정보의 수집·관리 및 교육에 대한 지원
6. 동물실험을 대체할 수 있는 방법의 개발·인정에 관한 정책의 수립 및 추진
7. 그 밖에 실험동물의 사용과 관리에 필요한 사항
② 제1항을 수행하기 위하여 필요한 사항은 보건복지가족부령으로 정한다.
제2장 실험동물의 과학적 사용
제6조(동물실험시설 운영자의 책무) 동물실험시설의 운영자는 동물실험의 안전성 및 신뢰성 등을 확보하기 위하여 다음 각 호의 사항을 수행하여야 한다.
1. 실험동물의 과학적 사용 및 관리에 관한 지침 수립
2. 동물실험을 수행하는 자 및 종사자에 대한 교육
3. 동물실험을 대체할 수 있는 방법의 우선적 고려
4. 동물실험의 폐기물 등의 적절한 처리 및 작업자의 안전에 관한 계획 수립
제7조(실험동물운영위원회 설치 등)
① 동물실험시설에는 동물실험의 윤리성, 안전성 및 신뢰성 등을 확보하기 위하여 실험동물운영위원회를 설치·운영하여야 한다.
② 제1항의 실험동물운영위원회의 기능 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
제3장 동물실험시설 등
제8조(동물실험시설의 등록)
① 동물실험시설을 설치하고자 하는 자는 식품의약품안전청장에게 등록하여야 한다. 등록사항을 변경하는 경우에도 또한 같다.
② 동물실험시설에는 해당 시설 및 실험동물의 관리를 위하여 대통령령으로 정하는 자격요건을 갖춘 관리자(이하 “관리자”라 한다)를 두어야 한다.
③ 제1항에 따른 등록기준 및 절차 등에 관하여 필요한 사항은 보건복지가족부령으로 정한다.
제9조(실험동물의 사용 등)
① 동물실험시설에서 대통령령으로 정하는 실험동물을 사용하는 경우에는 동물실험시설 또는 제15조제1항에 따른 우수실험동물생산시설에서 생산된 실험동물을 우선적으로 사용하도록 노력하여야 한다.
② 외국으로부터 수입된 실험동물을 사용하고자 하는 경우에는 보건복지가족부령으로 정하는 기준에 적합한 실험동물을 사용하여야 한다.
제10조(우수동물실험시설의 지정)
① 식품의약품안전청장은 실험동물의 적절한 사용 및 관리를 위하여 적절한 인력 및 시설을 갖추고 운영상태가 우수한 동물실험시설을 우수동물실험시설로 지정할 수 있다. 이 경우 지정기준, 지정사항 변경 등에 관한 사항은 보건복지가족부령으로 정한다.
② 제1항에 따른 우수동물실험시설로 지정받고자 하는 자는 보건복지가족부령으로 정하는 바에 따라 지정신청을 하여야 한다.
③ 식품의약품안전청장은 실험동물을 사용하는 관련 사업자 또는 연구 용역을 수행하는 자에게 제1항에 따라 지정된 우수동물실험시설에서 그 업무를 수행하도록 권고할 수 있다.
제11조(동물실험시설 등에 대한 지도·감독)
① 제8조 또는 제10조에 따라 동물실험시설로 등록 또는 우수동물실험시설로 지정 받은 자는 식품의약품안전청장의 지도·감독을 받아야 한다.
② 제1항에 따른 지도·감독의 내용·대상·시기·기준 등에 관하여 필요한 사항은 식품의약품안전청장이 정한다.
제4장 실험동물의 공급 등
제12조(실험동물공급자의 등록)
① 대통령령으로 정하는 실험동물의 생산·수입 또는 판매를 업으로 하고자 하는 자(이하 “실험동물공급자”라 한다)는 보건복지가족부령으로 정하는 바에 따라 식품의약품안전청장에게 등록하여야 한다. 다만, 제8조의 동물실험시설에서 유지 또는 연구 과정 중 생산된 실험동물을 공급하는 경우에는 그러하지 아니하다.
② 제1항에 따른 등록사항을 변경하고자 할 때에는 보건복지가족부령으로 정하는 바에 따라 변경등록을 하여야 한다.
제13조(실험동물공급자의 준수사항) 실험동물공급자는 실험동물의 안전성 및 건강을 확보하기 위하여 다음 각 호의 사항을 준수하여야 한다.
1. 실험동물생산시설과 실험동물을 보건위생상 위해(危害)가 없고 안전성이 확보되도록 관리할 것
2. 실험동물을 운반하는 경우 그 실험동물의 생태에 적합한 방법으로 운송할 것
3. 그 밖에 제1호 및 제2호에 준하는 사항으로서 실험동물의 안전성 확보 및 건강관리를 위하여 필요하다고 인정하여 보건복지가족부령으로 정하는 사항
제14조(실험동물 수입에 관한 사항) 실험동물의 수입과 검역에 관하여는 「가축전염병예방법」 제32조, 제34조, 제35조 및 제36조의 규정에 따른다.
제15조(우수실험동물생산시설의 지정 등)
① 식품의약품안전청장은 실험동물의 품질을 향상시키기 위하여 충분한 인력 및 시설을 갖추고 관리상태가 우수한 실험동물생산시설을 우수실험동물생산시설로 지정할 수 있다. 이 경우 지정기준, 지정사항 변경 등에 관한 사항은 보건복지가족부령으로 정한다.
② 제1항에 따른 우수실험동물생산시설로 지정받고자 하는 자는 보건복지가족부령으로 정하는 바에 따라 지정신청을 하여야 한다.
③ 제1항에 따라 우수실험동물생산시설로 지정된 경우가 아니면 실험동물의 운송용기나 문서 등에 우수실험동물생산시설 또는 이와 유사한 표지를 부착하거나 이를 홍보하여서는 아니 된다.
제16조(실험동물공급자 등에 대한 지도·감독)
① 제12조에 따라 실험동물공급자로 등록하거나 제15조에 따라 우수실험동물생산시설로 지정받은 자는 식품의약품안전청장의 지도·감독을 받아야 한다.
② 제1항에 따른 지도·감독의 대상·시기·기준 등에 관하여 필요한 사항은 식품의약품안전청장이 정한다.
제5장 안전관리 등
제17조(교육)
① 다음 각 호의 자는 실험동물의 사용·관리 등에 관하여 교육을 받아야 한다.
1. 제8조제1항에 따른 동물실험시설 설치자
2. 제8조제2항에 따른 관리자
3. 제12조에 따른 실험동물공급자
4. 그 밖에 동물실험을 수행하는 자
② 식품의약품안전청장은 제1항에 따른 교육을 수행하여야 하며, 교육 위탁기관, 교육내용, 소요경비의 징수 등에 관하여 필요한 사항은 보건복지가족부령으로 정한다.
제18조(재해 방지)
① 동물실험시설의 운영자 또는 관리자는 재해를 유발할 수 있는 물질 또는 병원체 등을 사용하는 동물실험을 실시하는 경우 사람과 동물에 위해를 주지 아니하도록 필요한 조치를 취하여야 한다.
② 동물실험시설 및 실험동물생산시설로 인한 재해가 국민 건강과 공익에 유해하다고 판단되는 경우 운영자 또는 관리자는 즉시 폐쇄, 소독 등 필요한 조치를 취한 후 그 결과를 식품의약품안전청장에게 보고하여야 한다. 이 경우 「가축전염병예방법」 제19조를 준용한다.
③ 동물실험 및 실험동물로 인한 재해가 국민 건강과 공익에 유해하다고 판단되는 경우 운영자 또는 관리자는 살처분 등 필요한 조치를 취한 후 그 결과를 식품의약품안전청장에게 보고하여야 한다. 이 경우 「가축전염병예방법」 제20조를 준용한다.
제19조(생물학적 위해물질의 사용보고)
① 동물실험시설의 운영자는 보건복지가족부령으로 정하는 생물학적 위해물질을 동물실험에 사용하고자 하는 경우 미리 식품의약품안전청장에게 보고하여야 한다.
② 제1항의 보고에 관한 사항은 보건복지가족부령으로 정한다.
제20조(사체 등 폐기물)
① 동물실험시설의 운영자 및 관리자 또는 실험동물공급자는 해당 시설에서 나온 실험동물의 사체가 외부에 유출되어 재이용되거나 재해가 발생되지 아니하도록 처리하여야 한다.
② 동물실험시설과 실험동물생산시설에서 배출된 실험동물의 사체 등의 폐기물은 「폐기물관리법」에 따라 처리한다.
제6장 기록 및 정보의 공개
제21조(기록) 동물실험을 수행하는 자는 보건복지가족부령으로 정하는 바에 따라 실험동물의 종류, 사용량, 수행된 연구의 절차, 연구에 참여한 자에 대하여 기록하여야 한다.
제22조(동물실험 실태보고)
① 식품의약품안전청장은 동물실험에 관한 실태보고서를 매년 작성하여 발표하여야 한다.
② 제1항에 따른 실태보고서에는 다음 각 호의 사항이 포함되어야 한다.
1. 동물실험에 사용된 실험동물의 종류 및 수
2. 동물실험 후의 실험동물의 처리
3. 동물실험시설 및 실험동물공급시설의 종류 및 수
4. 제11조에 따른 동물실험시설 등에 대한 지도·감독에 관한 사항
5. 제18조에 따른 재해유발 물질 또는 병원체 등의 사용에 관한 사항
6. 제19조에 따른 위해물질의 사용에 관한 사항
7. 제24조에 따른 지정취소 등에 관한 사항
8. 그 밖에 보건복지가족부령으로 정하는 사항
제7장 보 칙
제23조(실험동물협회)
① 동물실험의 신뢰성 증진 및 실험동물산업의 건전한 발전을 위하여 실험동물협회(이하 “협회”라 한다)를 둘 수 있다.
② 협회는 법인으로 한다.
③ 다음 각 호에 해당하는 자는 협회의 회원이 될 수 있다.
1. 제8조제1항에 따른 등록을 한 자
2. 제8조제2항에 의한 관리자
3. 실험동물분야에 관한 지식과 기술이 있는 자 중 협회의 정관으로 정하는 자
④ 협회를 설립하고자 하는 경우에는 대통령령으로 정하는 바에 따라 정관을 작성하여 식품의약품안전청장의 설립인가를 받아야 한다.
⑤ 협회의 정관 기재 사항과 업무에 관하여 필요한 사항은 대통령령으로 정한다.
⑥ 협회에 관하여 이 법에 규정되지 아니한 사항은 「민법」 중 사단법인에 관한 규정을 준용한다.
⑦ 국가는 협회가 제1항에 따라 사업을 하는 때에 필요하다고 인정하는 경우 재정 등의 지원을 할 수 있다.
제24조(지정 등의 취소 등)
① 식품의약품안전청장은 제8조 또는 제12조에 따라 동물실험시설 또는 실험동물공급자로 등록한 자가 다음 각 호의 어느 하나에 해당하는 때에는 해당 시설 또는 공급자의 등록을 취소하거나 6개월 이내의 범위에서 시설의 운영 또는 영업을 정지할 수 있다.
1. 속임수나 그 밖의 부정한 방법으로 등록한 것이 확인된 경우
2. 동물실험시설로부터 또는 실험동물공급과 관련하여 국민의 건강 또는 공익을 해하는 질병 등 재해가 발생한 경우
3. 제11조 또는 제16조에 따른 지도·감독을 따르지 아니하거나 기준에 미달한 경우
② 식품의약품안전청장은 제10조 또는 제15조에 따라 우수동물실험시설 또는 우수실험동물생산시설로 지정을 받은 자가 다음 각 호의 어느 하나에 해당하는 때에는 그 지정을 취소하거나 또는 6개월 이내의 범위에서 시설의 운영을 정지할 수 있다.
1. 속임수나 그 밖의 부정한 방법으로 지정을 받은 것이 확인된 경우
2. 우수동물실험시설 또는 우수실험동물생산시설로부터 국민의 건강 또는 공익을 해하는 질병 등 재해가 발생한 경우
3. 제11조 또는 제16조에 따른 지도·감독을 따르지 아니하거나 기준에 미달한 경우
③ 제1항 및 제2항에 따른 처분의 기준은 보건복지가족부령으로 정한다.
제25조(결격사유) 다음 각 호의 어느 하나에 해당하는 자는 동물실험시설의 운영자 또는 관리자 및 실험동물공급자가 될 수 없다.
1. 「정신보건법」제3조제1호에 따른 정신질환자. 다만, 전문의가 운영자 또는 관리자로서 적합하다고 인정하는 사람은 그러하지 아니하다.
2. 금치산자·한정치산자로서 복권되지 아니한 자
3. 마약이나 그 밖의 유독물질의 중독자
4. 이 법을 위반하여 금고 이상의 실형을 선고받고, 집행이 종료(집행이 종료된 것으로 보는 경우를 포함한다)되거나 집행이 면제된 날부터 2년이 지나지 아니한 자
5. 이 법을 위반하여 금고 이상의 형의 집행유예 선고를 받고 그 유예기간 중에 있는 자
6. 제24조제1항에 따라 시설의 운영정지를 받거나 등록이 취소된 후 2년이 지나지 아니한 자
제26조(청문) 식품의약품안전청장은 제24조에 따라 해당 시설의 등록 취소, 운영정지, 지정 취소 등을 하고자 하는 때에는 미리 청문을 실시하여야 한다.
제27조(지도·감독 등)
① 식품의약품안전청장은 제11조 및 제16조에 따른 지도 및 감독을 위하여 관계 공무원으로 하여금 현장조사를 하게 하거나 필요한 자료의 제출을 요구할 수 있다.
② 제1항에 따라 조사를 하는 공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 제시하여야 한다.
제28조(과징금)
① 식품의약품안전청장은 시설의 운영자가 제24조에 해당하는 경우에는 해당 시설의 운영정지에 갈음하여 5천만 원 이하의 과징금을 부과할 수 있다.
② 제1항에 따라 과징금을 부과하는 위반행위의 정도 등에 따른 과징금의 금액 등에 관하여 필요한 사항은 대통령령으로 정한다.
③ 식품의약품안전청장은 제1항에 따른 과징금을 기한 이내에 납부하지 아니한 때에는 국세 체납처분의 예에 따라 징수한다.
제29조(수수료) 다음 각 호의 어느 하나에 해당하는 자는 보건복지가족부령으로 정하는 바에 따라 수수료를 납부하여야 한다.
1. 제8조에 따른 등록 또는 제10조에 따른 지정을 받고자 하는 자
2. 제12조에 따른 등록 또는 제15조에 따른 지정을 받고자 하는 자
제30조(벌칙) 제12조제1항 또는 제2항을 위반하여 등록 또는 변경등록을 하지 아니한 자는 500만 원 이하의 벌금에 처한다.
제31조(벌칙) 제27조제1항에 따른 현장조사를 정당한 사유 없이 거부·기피·방해한 자 또는 자료제출 요구에 응하지 아니하거나 거짓의 자료를 제출한 자는 200만 원 이하의 벌금에 처한다.
제32조(양벌규정) 법인의 대표자나 법인 또는 개인의 대리인·사용인 및 그 밖의 종업원이 그 법인 또는 개인의 업무에 대하여 제31조에 해당하는 행위를 한 때에는 행위자를 벌하는 외에 그 법인 또는 개인에 대하여도 각 해당 조의 벌금형을 과한다.
제33조(과태료)
① 다음 각 호의 어느 하나에 해당하는 자에게는 100만 원 이하의 과태료를 부과한다.
1. 제8조에 따른 등록을 하지 아니한 자
2. 제15조제3항을 위반하여 우수실험동물생산시설 또는 이와 유사한 표지를 부착하거나 이를 홍보한 자
3. 제17조제1항을 위반하여 교육을 받지 아니한 동물실험시설 설치자, 관리자 또는 실험동물공급자
4. 제18조제2항 및 제3항 또는 제19조제1항에 따른 보고를 하지 아니하거나 거짓으로 보고한 자
② 제1항에 따른 과태료는 대통령령으로 정하는 바에 따라 식품의약품안전청장이 부과·징수한다.
③ 제2항에 따른 과태료 처분에 불복하는 자는 30일 이내에 식품의약품안전청장에게 이의를 제기할 수 있다.
④ 제2항에 따라 과태료 처분을 받은 자가 제3항에 따라 이의를 제기한 때에는 식품의약품안전청장은 지체 없이 관할 법원에 그 사실을 통보하여야 하며, 그 통보를 받은 관할 법원은 「비송사건절차법」에 따른 과태료 재판을 한다.
⑤ 제3항에 따른 기간 이내에 이의를 제기하지 아니하고 과태료를 납부하지 아니한 때에는 국세 체납처분의 예에 따라 징수한다.
부 칙 <제9025호, 2008.3.28>
①(시행일)이 법은 공포 후 1년이 경과한 날부터 시행한다.
②(동물실험시설 운영자에 대한 경과조치) 이 법 시행 당시 동물실험시설을 설치·운영하는 자는 이 법에 따른 운영자로 본다. 이 경우 이 법 시행 후 1년 이내에 제8조에 따라 등록하여야 한다.
③(실험동물공급자에 대한 경과조치) 이 법 시행 당시 실험동물을 공급하는 자는 이 법에 따른 실험동물공급자로 본다. 이 경우 이 법 시행 후 1년 이내에 제12조에 따라 등록하여야 한다.
뇌연구촉진법
[(타)일부개정 2008.6.5 법률 제9089호]
제1조(목적) 이 법은 뇌연구 촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성·발전시키고 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 기여함을 목적으로 한다.
제2조(정의) 이 법에서 사용하는 용어의 정의는 다음과 같다.(개정 2001.1.29, 2008.2.29)
1. “뇌연구”라 함은 뇌과학, 뇌의약학, 뇌공학 및 이와 관련된 모든 분야에 대한 연구를 말한다.
2. “뇌과학”이라 함은 뇌의 신경생물학적 구조 및 인지, 사고, 언어심리 및 행동 등의 고등신경 정신활동에 대한 포괄적인 이해를 위한 기초 학문을 말한다.
3. “뇌의약학”이라 함은 뇌의 구조 및 기능상의 결함과 뇌의 노화 등에 기인한 신체적·정신적 질환 및 장애에 대한 원인 규명과 이의 치료, 예방 등에 관한 학문을 말한다.
4. “뇌공학”이라 함은 뇌의 고도의 지적 정보처리 구조와 기능을 이해하고 이의 공학적 응용을 위한 이론 및 기술에 관한 학문을 말한다.
5. “관계중앙행정기관”이라 함은 교육과학기술부, 지식경제부, 보건복지가족부를 말한다.
제3조(적용범위) 뇌연구에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 의한다.
제4조(정부 등의 책무)
①정부는 뇌연구 촉진을 지원하기 위한 시책을 강구하고, 이를 적극적으로 추진하여야 한다.
②대학·연구기관·기업 및 개인 등 뇌연구를 수행하는 자는 제1항의 규정에 의한 시책에 적극 협력하여야 한다.
제5조(뇌연구촉진기본계획의 수립)
① 관계중앙행정기관의 장은 소관별로 뇌연구 촉진을 위한 계획과 전년도 추진실적을 교육과학기술부장관에게 제출하여야 한다.(개정 2008.2.29)
② 교육과학기술부장관은 제1항의 규정에 의하여 관계중앙행정기관의 장이 제출한 소관사항에 관한 뇌연구 촉진을 위한 계획을 종합·조정한 후 제7조의 규정에 의한 뇌연구촉진심의회의 심의를 거쳐 뇌연구촉진기본계획(이하 “기본계획”이라 한다)을 수립하고, 이를 관계중앙행정기관의 장에게 통보하여야 한다. 기본계획을 변경하는 경우에도 또한 같다.(개정 2008.2.29)
③제2항의 규정에 의한 기본계획에는 다음의 사항이 포함되어야 한다.
1. 뇌연구의 중장기적 목표 및 내용
2. 뇌연구에 필요한 투자재원의 확대방안 및 추진계획
3. 교육·산업·보건복지·정보통신·과학기술 등 각 분야의 뇌연구에 관한 계획
4. 뇌연구에 필요한 인력자원의 개발 및 효율적인 활용에 관한 종합계획
5. 뇌연구 결과의 이용과 보전에 관한 계획
6. 기타 뇌연구 촉진을 위하여 필요한 중요사항
제6조(뇌연구촉진시행계획의 수립)
①관계중앙행정기관의 장은 기본계획에 따라 매년 뇌연구촉진시행계획(이하 “시행계획”이라 한다)을 수립하고 이를 시행하여야 한다.
② 관계중앙행정기관의 장은 시행계획을 수립하고자 할 때에는 미리 교육과학기술부장관과 협의하여야 한다.(개정 2008.2.29)
③ 교육과학기술부장관은 필요한 때에는 시행계획의 수립에 필요한 기본지침을 작성하여 관계중앙행정기관의 장에게 통보할 수 있다.(개정 2008.2.29)
④시행계획의 수립 및 그 시행에 관하여 필요한 사항은 대통령령으로 정한다.
제7조(뇌연구촉진심의회)
① 뇌연구에 관한 중요사항을 심의하기 위하여 교육과학기술부장관소속하에 뇌연구촉진심의회(이하 “심의회”라 한다)를 둔다.(개정 2008.2.29)
②심의회는 다음 각 호의 사항을 심의한다.
1. 기본계획의 수립·변경과 이에 따른 중요정책의 수립 및 그 집행의 조정
2. 뇌연구 관련 예산의 확대방안에 관한 사항
3. 뇌연구 분야 인력개발 및 교류에 관한 종합계획과 이에 따른 중요정책, 인력활용지침의 수립 및 집행의 조정
4. 뇌연구 결과의 이용과 보전을 위한 계획의 수립 및 그 집행의 조정
5. 기타 뇌연구에 관하여 위원장이 필요하다고 인정하는 사항
③심의회는 위원장 1인을 포함한 20인 이내의 위원으로 구성한다.
④ 위원장은 교육과학기술부차관이 되고 위원은 위원장이 임명하는 관계중앙행정기관의 공무원과 학계, 연구기관, 산업계에 종사하는 뇌연구 전문가로서 위원장이 위촉하는 자(이하 “위촉위원”이라 한다)가 된다.(개정 2002.12.26, 2008.2.29)
⑤삭제(2002.12.26)
⑥심의회의 구성 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
제8조(뇌연구실무추진위원회)
① 심의회에 상정할 안건의 작성 및 심의회에서 위임한 업무를 처리하게 하기 위하여 교육과학기술부장관 소속 하에 뇌연구실무추진위원회(이하 “추진위원회”라 한다)를 둔다.(개정 2008.2.29)
②추진위원회는 관계중앙행정기관의 공무원 및 학계, 연구기관, 산업계에 종사하는 뇌연구 전문가로 구성한다.
③추진위원회의 구성 및 운영에 관하여 필요한 사항은 대통령령으로 정한다.
제9조(뇌연구 투자의 확대)
①정부는 제5조제3항제2호의 투자재원의 확대방안 및 추진계획에 따라 예산의 범위 안에서 뇌연구투자의 확대를 위하여 최대한 노력하여야 한다.
② 교육과학기술부장관은 매년 뇌연구투자확대계획을 작성하여 심의회의 심의를 거친 후, 이를 「국가교육과학기술자문회의법」에 따른 국가교육과학기술자문회의에 보고하여야 한다.(개정 2008.2.29, 2008.6.5)
제10조(연구 및 기술협력) 정부는 뇌연구 및 그 기술개발에 관한 국제협력의 증진에 노력하고 선진기술의 도입을 위한 전문인력 파견, 해외 전문인력 유치 등의 방안을 강구하여야 한다.
제11조(공동연구 및 학술활동 촉진) 정부는 뇌연구 및 기술개발의 효율적 육성을 위하여 학계, 연구기관 및 산업계간의 공동연구를 촉진하고 관련 학회 및 학술활동을 적극 지원하여야 한다.
제12조(관계산업체에 대한 지원) 정부는 뇌연구 결과의 산업화를 촉진하기 위하여 신기술제품의 생산을 지원할 수 있다.
제13조(기술정보의 수집과 보급) 정부는 뇌연구에 관한 정보를 수집하여 이를 관계기관에 보급하도록 노력하여야 한다.
제14조(뇌연구추진시책강구) 관계중앙행정기관의 장은 뇌연구를 효율적으로 촉진하기 위하여 다음과 같은 시책을 강구한다.(개정 2001.1.29, 2008.2.29)
1. 삭제(2008.2.29)
2. 교육과학기술부장관 : 기본계획의 수립과 시행계획 수립의 지원 및 조정, 뇌분야의 연구를 촉진시키기 위한 전문인력의 양성과 뇌과학 기초분야의 연구지원, 뇌 관련 기초기술 및 첨단기술의 개발, 유용한 연구결과의 이용 및 보전을 위한 연구의 지원, 공공적 성격의 뇌연구 지원체제의 육성
3. 지식경제부장관 : 뇌연구 결과를 생산 및 산업공정에 효율적으로 응용하기 위한 응용기술의 개발과 개발기술의 산업화 촉진, 뇌연구 결과의 정보·통신 등 분야에의 응용기술의 개발 및 개발기술의 산업화 촉진
4. 삭제(2008.2.29)
5. 보건복지가족부장관 : 보건·의료 등에 관련되는 뇌의약연구와 그 결과의 응용기술 개발 및 개발기술의 산업화 촉진
제15조(임상 및 검정)
①정부는 뇌연구 관련 제품에 대한 임상 및 검정체제을 확립한다.
②제1항의 임상 및 검정체제확립에 관하여 필요한 사항은 대통령령으로 정한다.
제16조(실험지침의 작성·시행 등)
①정부는 뇌연구 및 그 산업화의 촉진을 위한 실험지침을 작성·시행하여야 한다.
②제1항의 실험지침에서는 뇌연구와 그 산업화 과정에서 예견될 수 있는 생물학적 위험성, 인간에 미치는 악영향 및 윤리적 문제 발생의 사전방지에 필요한 조치 및 안전기준이 마련되어야 한다.
제17조(연구소의 설립)
①뇌분야에 관한 연구 및 그 이용과 지원에 관한 기능을 수행하고 뇌분야에서의 학계, 연구기관 및 산업계간의 상호유기적 협조체제를 유지·발전시키기 위하여 정부가 출연하는 연구소를 설립할 수 있다.
②제1항의 규정에 의한 연구소는 특정연구기관육성법의 적용을 받는 특정연구기관으로 한다.
부 칙 (제5547호, 1998.6.3)
이 법은 공포한 날부터 시행한다.
부 칙 (정부조직법) (제6400호, 2001.1.29)
제1조(시행일) 이 법은 공포한 날부터 시행한다. (단서 생략)
제2조 생략
제3조(다른 법률의 개정)
①내지 (59)생략
(60) 뇌연구촉진법 중 다음과 같이 개정한다.
제2조제5호중 “교육부”를 “교육인적자원부”로 한다.
제14조제1호중 “교육부장관”을 “교육인적자원부장관”으로 한다.
(61)내지 (79)생략
제4조 생략
부 칙 <제6811호, 2002.12.26>
이 법은 공포한 날부터 시행한다.
부 칙 (정부조직법) <제8852호, 2008.2.29>
제1조(시행일) 이 법은 공포한 날부터 시행한다. 다만, 제31조제1항의 개정규정 중 “식품산업진흥”에 관한 부분은 2008년 6월 28일부터 시행하고, 부칙 제6조에 따라 개정되는 법률 중 이 법의 시행 전에 공포되었으나 시행일이 도래하지 아니한 법률을 개정한 부분은 각각 해당 법률의 시행일부터 시행한다.
제2조부터 제5조까지 생략
제6조(다른 법률의 개정)
①부터 (129)까지 생략
(130) 뇌연구촉진법 일부를 다음과 같이 개정한다.
제2조제5호 중 “교육인적자원부, 과학기술부, 산업자원부, 정보통신부, 보건복지부”를 “교육과학기술부, 지식경제부, 보건복지가족부”로 한다.
제5조제1항·제2항 전단 및 제6조제2항·제3항 중 “과학기술부장관”을 각각 “교육과학기술부장관”으로 한다.
제7조제1항 중 “과학기술부장관”을 “교육과학기술부장관”으로 하고, 같은 조 제4항 중 “과학기술부차관”을 “교육과학기술부차관”으로 한다.
제8조제1항 및 제9조제2항 중 “과학기술부장관”을 각각 “교육과학기술부장관”으로 한다.
제14조제1호를 삭제하고, 같은 조 제2호 및 제3호를 각각 다음과 같이 한다.
2. 교육과학기술부장관 : 기본계획의 수립과 시행계획 수립의 지원 및 조정, 뇌분야의 연구를 촉진시키기 위한 전문인력의 양성과 뇌과학 기초분야의 연구지원, 뇌 관련 기초기술 및 첨단기술의 개발, 유용한 연구결과의 이용 및 보전을 위한 연구의 지원, 공공적 성격의 뇌연구 지원체제의 육성
3. 지식경제부장관: 뇌연구 결과를 생산 및 산업공정에 효율적으로 응용하기 위한 응용기술의 개발과 개발기술의 산업화 촉진, 뇌연구 결과의 정보·통신 등 분야에의 응용기술의 개발 및 개발기술의 산업화 촉진
제14조제4호를 삭제하고, 같은 조 제5호 중 “보건복지부장관”을 “보건복지가족부장관”으로 한다.
(131)부터 (760)까지 생략
제7조 생략
부 칙 (국가과학기술자문회의법) (제9089호, 2008.6.5)
제1조(시행일) 이 법은 공포 후 3개월이 경과한 날부터 시행한다.
제2조(다른 법률의 개정)
① 생략
② 뇌연구촉진법 일부를 다음과 같이 개정한다.
제9조제2항 중 “국가과학기술자문회의법에 의한 국가과학기술자문회의”를 “「국가교육과학기술자문회의법」에 따른 국가교육과학기술자문회의”로 한다.
유전자변형생물체의 국가 간 이동 등에 관한 법률
[일부개정 2009.2.6 법률 제9428호]
제1장 총 칙
제1조(목적) 이 법은 「바이오안전성에 관한 카르타헤나 의정서」의 시행에 필요한 사항과 유전자변형생물체의 개발·생산·수입·수출·유통 등에 관한 안전성의 확보를 위하여 필요한 사항을 정함으로써 유전자변형생물체로 인한 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 미치는 위해(危害)를 사전에 방지하고 국민생활의 향상 및 국제협력을 증진함을 목적으로 한다.
[전문개정 2007.12.21]
제2조(정의) 이 법에서 사용하는 용어의 뜻은 다음과 같다.
1. “유전자변형생물체”란 다음 각 목의 현대생명공학기술을 이용하여 얻어진 생물체로서 새롭게 조합된 유전물질을 포함하고 있는 생물체를 말한다.
가. 인위적으로 유전자를 재조합하거나 유전자를 구성하는 핵산을 세포 또는 세포 내 소기관으로 직접 주입하는 기술
나. 분류학에 의한 과(科)의 범위를 넘는 세포융합으로서 자연상태의 생리적 증식이나 재조합이 아니고 전통적인 교배나 선발(選發)에서 사용되지 아니하는 기술
2. “환경 방출”이란 유전자변형생물체를 시설, 장치, 그 밖의 구조물을 이용하여 밀폐하지 아니하고 의도적으로 자연환경에 노출되게 하는 것을 말한다.
3. “관계중앙행정기관”이란 유전자변형생물체의 개발·생산·수입·수출·판매·운반·보관 등(이하 “수출입 등”이라 한다)의 업무에 따라 대통령령으로 정하는 기준에 해당하는 중앙행정기관을 말한다.
[전문개정 2007.12.21]
제3조(적용 범위) 인체용 의약품으로 사용되는 유전자변형생물체에 대하여는 이 법을 적용하지 아니한다.
[전문개정 2007.12.21]
제4조(다른 법률과의 관계) 유전자변형생물체를 수출입 등을 할 때에 그 취급 및 안전관리에 관하여 다른 법률에 특별한 규정이 있는 경우 외에는 이 법으로 정하는 바에 따른다.
[전문개정 2007.12.21]
제5조(국가 등의 책무) 국가와 지방자치단체는 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 대하여 유전자변형생물체가 끼칠 위해를 방지하기 위하여 필요한 시책을 마련하여야 한다.
[전문개정 2007.12.21]
제6조(국가책임기관 등)
① 「바이오안전성에 관한 카르타헤나 의정서」(이하 “의정서”라 한다) 제19조에 따른 국가연락기관은 외교통상부로 하고, 국가책임기관은 지식경제부로 한다.(개정 2008.2.29)
② 국가책임기관의 장은 대통령령으로 정하는 바에 따라 국가책임기관으로서 의정서를 이행하는 데에 필요한 업무를 수행한다.
[전문개정 2007.12.21]
제7조(유전자변형생물체 안전관리계획의 수립·시행)
① 관계중앙행정기관의 장은 소관별로 유전자변형생물체 안전관리계획(이하 “안전관리계획”이라 한다)을 수립·시행하여야 한다.
② 안전관리계획에는 다음 각 호의 사항이 포함되어야 한다.
1. 유전자변형생물체의 수출입 등에 따른 안전관리의 기본방침에 관한 사항
2. 유전자변형생물체를 취급하는 시설 및 작업 종사자의 안전에 관한 사항
3. 유전자변형생물체에 관한 기술 개발 및 지원에 관한 사항
4. 그 밖에 유전자변형생물체의 안전관리와 관련한 중요 사항
③ 관계중앙행정기관의 장은 안전관리계획을 수립·시행하려면 미리 제31조에 따른 바이오안전성위원회의 심의를 거쳐야 한다.
④ 관계중앙행정기관의 장은 안전관리계획의 시행을 위한 세부시행계획을 수립·시행하여야 하며, 이를 위하여 필요하면 안전관리지침을 정하여 고시할 수 있다.
[전문개정 2007.12.21]
제2장 유전자변형생물체의 수출입 등 및 안전관리
제8조(수입승인 등)
① 유전자변형생물체를 수입(휴대하여 수입하는 경우를 포함한다. 이하 같다)하려는 자는 대통령령으로 정하는 바에 따라 관계중앙행정기관의 장의 승인을 받아야 한다. 승인을 받은 사항을 변경하려는 경우에도 또한 같다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려는 경우에는 이를 신고하여야 한다.
② 환경 방출로 사용되는 유전자변형생물체를 수입하려는 자는 제1항에도 불구하고 국가책임기관의 장을 거쳐 관계중앙행정기관의 장에게 수입승인을 신청하여야 한다. 이 경우 국가책임기관의 장과 관계중앙행정기관의 장은 대통령령으로 정하는 바에 따라 의정서 제8조부터 제10조까지에 따른 그 유전자변형생물체의 국가 간 이동에 필요한 절차를 따라야 한다.
③ 제1항 및 제2항에 따라 승인을 신청하는 자는 해당 유전자변형생물체를 생산하거나 수출하는 자가 작성한 위해성평가서와 유전자변형생물체를 수출하려는 자가 속한 국가의 정부기관이 발행하는 위해성심사서를 제출하여야 한다.
④ 제3항에도 불구하고 유전자변형생물체에 대한 위해성심사서를 발행할 수 있는 정부기관이 없거나 그 밖에 대통령령으로 정하는 사유가 있는 경우에는 관계중앙행정기관의 장이 대통령령으로 정하는 바에 따라 지정하는 위해성평가기관(이하 “위해성평가기관”이라 한다)이 작성한 위해성평가서를 제출하여야 한다.
⑤ 관계중앙행정기관의 장은 제1항 및 제2항에 따른 승인신청을 받으면 해당 유전자변형생물체의 위해성을 심사하고 그 유전자변형생물체가 국내 생물다양성의 가치에 미칠 사회·경제적 영향을 고려하여 승인 여부를 결정하여야 한다.
⑥ 관계중앙행정기관의 장은 제5항에 따른 승인 여부를 국가책임기관의 장에게 통보하여야 한다.
⑦ 제3항에 따른 위해성평가서의 평가항목과 평가기준 등에 관하여 필요한 사항은 관계중앙행정기관의 장이 정하여 고시한다.
[전문개정 2007.12.21]
제9조(시험·연구용 등의 유전자변형생물체의 수입)
① 제8조에도 불구하고 시험·연구용으로 사용하거나 박람회·전시회에 출품하기 위하여 유전자변형생물체를 수입하려는 자는 대통령령으로 정하는 바에 따라 관계중앙행정기관의 장의 승인을 받거나 관계중앙행정기관의 장에게 신고하여야 한다.
② 관계중앙행정기관의 장은 제1항에 따른 승인 여부 및 신고내용을 국가책임기관의 장에게 통보하여야 한다.
[전문개정 2007.12.21]
제10조(우편물로 수입되는 유전자변형생물체의 수입검사)
① 세관장은 국제우편물에 제8조 또는 제9조에 따른 승인을 받지 아니하거나 신고를 하지 아니한 유전자변형생물체가 담겨 있거나 담겨 있다고 의심되면 지체 없이 그 사실을 관계중앙행정기관의 장에게 통보하여야 한다.
② 제1항에 따라 세관장이 통지하면 관계중앙행정기관의 장은 해당 국제우편물을 검사한 후 폐기, 반송 등 적절한 조치를 하여야 한다.
③ 유전자변형생물체가 담겨 있는 국제우편물을 받은 자는 그 유전자변형생물체가 제8조 또는 제9조에 따른 승인을 받지 아니하거나 신고를 하지 아니한 것임을 알았을 때에는 지체 없이 관계중앙행정기관의 장에게 이를 신고하고, 관계중앙행정기관의 장이 명하는 바에 따라 처리하여야 한다.
[전문개정 2007.12.21]
제11조(수입항구 등의 지정)
① 국가책임기관의 장은 유전자변형생물체의 안전관리를 위하여 필요하다고 인정하면 관계중앙행정기관의 장과 협의하여 유전자변형생물체를 수입하는 항구·공항 등을 지정할 수 있다.
② 국가책임기관의 장은 제1항에 따라 항구·공항 등을 지정하는 경우에는 지체 없이 이를 공고하여야 한다.
[전문개정 2007.12.21]
제12조(생산승인 등)
① 유전자변형생물체를 생산하려는 자는 대통령령으로 정하는 바에 따라 관계중앙행정기관의 장의 승인을 받아야 한다. 승인을 받은 사항을 변경하려는 경우에도 또한 같다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려는 경우에는 이를 신고하여야 한다.
② 제1항에 따른 승인을 신청하는 자는 제8조제3항에 따른 위해성평가서를 제출하여야 한다.
③ 유전자변형생물체를 생산하려는 경우에는 제8조제5항부터 제7항까지의 규정을 준용한다.
[전문개정 2007.12.21]
제13조(위해성 심사 절차 및 대행 등)
① 관계중앙행정기관의 장은 제8조제5항 또는 제12조제3항에 따라 유전자변형생물체의 위해성 심사를 하는 경우에 그 유전자변형생물체가 인체에 미치는 영향에 대하여는 보건복지부장관과, 환경 방출되거나 환경 방출될 우려가 있는 유전자변형생물체의 경우에는 다음 각 호에서 정하는 기관의 장과 미리 협의하여야 한다.(개정 2008.2.29)
1. 해당 유전자변형생물체가 자연생태계에 미치는 영향: 환경부장관
2. 작물재배 환경에 미치는 영향: 농림수산식품부장관
3. 해양생태계에 미치는 영향: 국토해양부장관
② 제8조제5항 또는 제12조제3항에 따른 위해성 심사의 기준·방법, 그 밖에 필요한 사항은 관계중앙행정기관의 장이 정하여 고시한다.
③ 관계중앙행정기관의 장은 제8조제5항 또는 제12조제3항에 따른 유전자변형생물체의 위해성 심사 업무를 대통령령으로 정하는 바에 따라 지정하는 자(이하 “위해성심사대행기관”이라 한다)로 하여금 대행하게 할 수 있다.
④ 관계중앙행정기관의 장은 제8조 또는 제12조에 따라 유전자변형생물체의 수입 또는 생산 승인을 할 때에는 미리 그 유전자변형생물체에 관한 정보를 국민에게 알리고 의견을 수렴하여야 한다.
[전문개정 2007.12.21]
제14조(수입 또는 생산의 금지 등)
① 관계중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 유전자변형생물체(제2호의 생물체를 포함한다)의 수입이나 생산을 금지하거나 제한할 수 있다.
1. 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다고 인정하는 유전자변형생물체
2. 제1호에 해당하는 유전자변형생물체와 교배하여 생산된 생물체
3. 국내 생물다양성의 가치와 관련하여 사회·경제적으로 부정적인 영향을 미치거나 미칠 우려가 있다고 인정하는 유전자변형생물체
② 관계중앙행정기관의 장은 제1항에 따라 유전자변형생물체의 수입이나 생산을 금지하거나 제한하는 경우에는 국가책임기관의 장에게 통보하여야 한다.
③ 국가책임기관의 장은 제1항 각 호에 따라 수입이나 생산을 금지하거나 제한하는 생물체의 품목 등에 관하여 필요한 사항을 공고하여야 한다.
[전문개정 2007.12.21]
제15조(위해성이 없는 유전자변형생물체)
① 국가책임기관의 장은 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해가 발생할 우려가 없는 유전자변형생물체에 대하여 그 품목 등을 고시하여야 한다.
② 국가책임기관의 장은 제1항에 따라 유전자변형생물체의 품목 등을 고시할 때에는 미리 제31조에 따른 바이오안전성위원회의 심의를 거쳐야 한다.
③ 제1항에 따라 고시된 품목의 유전자변형생물체를 수입하거나 생산하려는 자는 제8조 또는 제12조에도 불구하고 국가책임기관의 장에게 신고하여야 한다.
[전문개정 2007.12.21]
제16조(「대외무역법」에 따른 수입승인 의제 등)
① 제8조 및 제9조에 따라 관계중앙행정기관의 장이 수입승인을 하거나 신고를 수리한 유전자변형생물체에 대하여는 「대외무역법」 제11조제2항에 따른 지식경제부장관의 수입승인을 받은 것으로 본다.(개정 2008.2.29)
② 제15조제3항 및 제20조에 따른 유전자변형생물체를 수입하거나 수출하려는 자가 국가책임기관의 장에게 그 내용을 신고하거나 통보한 유전자변형생물체에 대하여는 「대외무역법」 제11조제2항에 따른 지식경제부장관의 수입승인이나 수출승인을 받은 것으로 본다.(개정 2008.2.29)
[전문개정 2007.12.21]
제17조(승인취소)
① 관계중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 경우에는 제8조, 제9조 또는 제12조에 따른 유전자변형생물체의 수입승인이나 생산승인을 취소할 수 있다. 다만, 제1호 또는 제2호에 해당하는 경우에는 수입승인이나 생산승인을 취소하여야 한다.
1. 수입승인이나 생산승인을 받은 유전자변형생물체가 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다는 사실이 밝혀진 경우
2. 속임수나 그 밖의 부정한 방법으로 수입승인이나 생산승인을 받은 경우
3. 수입승인이나 생산승인을 받은 유전자변형생물체를 승인을 받은 용도와 다르게 사용하는 경우
4. 제8조제1항 또는 제12조제1항을 위반하여 변경승인을 받지 아니하거나 변경신고를 하지 아니하고 유전자변형생물체를 수입하거나 생산한 경우
5. 제24조제1항 또는 제2항을 위반하여 유전자변형생물체의 종류 등의 표시를 하지 아니한 경우 또는 거짓으로 표시하거나 표시를 임의로 변경 또는 삭제한 경우
6. 제25조제1항을 위반하여 취급관리기준을 지키지 아니한 경우
7. 제26조를 위반하여 유전자변형생물체의 수출입등에 관한 기록을 작성·보관하지 아니한 경우
8. 제27조제2항을 위반하여 유전자변형생물체의 부정적인 영향을 알면서도 관계중앙행정기관의 장이나 국가책임기관의 장에게 그 내용을 통보하지 아니한 경우
9. 정당한 사유 없이 제36조제1항에 따른 보고나 자료 또는 시료(試料)의 제출을 거부하거나 출입·검사를 거부·방해 또는 기피한 경우
10. 그 밖에 대통령령으로 정하는 사유에 해당하는 경우
② 관계중앙행정기관의 장은 제1항에 따라 수입승인이나 생산승인을 취소한 경우에는 지체 없이 국가책임기관의 장에게 통보하여야 한다.
[전문개정 2007.12.21]
제18조(재심사)
① 제8조·제12조 및 제17조제1항에 따른 처분에 불복하는 자는 대통령령으로 정하는 바에 따라 관계중앙행정기관의 장에게 재심사를 요청할 수 있다.
② 관계중앙행정기관의 장은 제1항에 따른 재심사를 요청받은 경우에는 국가책임기관의 장과 협의하고 제31조에 따른 바이오안전성위원회의 심의를 거쳐 재심사에 대한 결정을 하여야 한다.
[전문개정 2007.12.21]
제19조(폐기·반송 등의 명령)
① 관계중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 유전자변형생물체의 소유자에게 대통령령으로 정하는 바에 따라 일정한 기간을 정하여 그 유전자변형생물체의 폐기·반송 등을 명할 수 있다.
1. 제8조, 제9조 또는 제12조에 따른 관계중앙행정기관의 장의 승인 또는 변경승인을 받지 아니하거나 관계중앙행정기관의 장에게 신고를 하지 아니한 유전자변형생물체
2. 제14조에 따라 수입이나 생산이 금지되거나 제한된 유전자변형생물체
3. 제17조에 따라 수입승인이나 생산승인이 취소된 유전자변형생물체
② 관계중앙행정기관의 장은 유전자변형생물체의 소유자가 제1항에 따른 폐기·반송 등의 명령을 따르지 아니한 경우에는 대통령령으로 정하는 바에 따라 그 유전자변형생물체 소유자의 부담으로 소속 공무원에게 직접 폐기·반송 등을 하게 할 수 있다.
③ 관계중앙행정기관의 장은 수입된 유전자변형생물체에 대하여 제1항에 따른 유전자변형생물체의 폐기·반송 등을 명하였을 때에는 관세청장에게 그 내용을 통보하여야 한다.
[전문개정 2007.12.21]
제20조(수출 통보) 유전자변형생물체를 수출하려는 자는 지식경제부장관에게 품목, 수량, 수출국가 등 대통령령으로 정하는 사항을 미리 통보하여야 한다.(개정 2008.2.29)
[전문개정 2007.12.21]
제21조(경유 신고) 유전자변형생물체를 국내를 경유하여 다른 국가로 수출하려는 자는 국가책임기관의 장에게 품목, 수량, 수출국가, 수입국가 등 대통령령으로 정하는 사항을 신고하여야 한다.
[전문개정 2007.12.21]
제22조(연구시설의 설치·운영허가 등)
① 유전자변형생물체를 개발하거나 이를 이용하여 실험을 하는 시설(이하 “연구시설”이라 한다)을 설치·운영하려는 자는 대통령령으로 정하는 바에 따라 연구시설의 안전관리 등급별로 관계중앙행정기관의 장의 허가를 받거나 관계중앙행정기관의 장에게 신고를 하여야 한다. 허가받은 사항을 변경하려는 경우에도 허가를 받아야 한다. 다만, 허가받은 사항 중 대통령령으로 정하는 경미한 사항을 변경하려는 경우에는 대통령령으로 정하는 바에 따라 신고하여야 한다.
② 관계중앙행정기관의 장은 제1항에 따른 연구시설의 설치·운영의 허가 여부 및 신고내용을 국가책임기관의 장에게 통보하여야 한다.
③ 제1항에 따라 연구시설의 설치·운영에 대한 허가를 받거나 신고를 한 자는 연구시설의 안전관리 등급별로 대통령령으로 정하는 바에 따라 유전자변형생물체를 개발하거나 실험을 할 수 있다. 다만, 위해 가능성이 큰 유전자변형생물체를 개발하거나 실험하는 경우로서 대통령령으로 정하는 경우에는 관계중앙행정기관의 장의 승인을 받아야 한다.
④ 제1항에 따른 연구시설의 안전관리의 등급 및 설치·운영에 대한 허가기준 등에 관한 사항은 대통령령으로 정한다.
[전문개정 2007.12.21]
제23조(허가취소 등)
① 관계중앙행정기관의 장은 제22조제1항에 따라 연구시설의 설치·운영의 허가를 받거나 신고를 한 자가 다음 각 호의 어느 하나에 해당하는 경우에는 그 허가를 취소하거나 1년 이내의 기간을 정하여 그 시설의 운영을 정지하도록 명할 수 있다. 다만, 제1호에 해당하는 경우에는 허가를 취소하여야 한다.
1. 속임수나 그 밖의 부정한 방법으로 허가를 받은 경우
2. 제22조제1항 후단에 따른 변경허가를 받지 아니하고 그 허가내용을 변경한 경우
3. 제22조제3항 단서에 따른 승인을 받지 아니하고 개발 또는 실험을 한 경우
4. 제22조제4항에 따른 허가기준에 미달한 경우
② 관계중앙행정기관의 장은 제22조제3항 단서에 따라 승인을 받은 유전자변형생물체의 개발 또는 실험이 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다는 사실이 밝혀진 경우에는 승인을 취소할 수 있다.
[전문개정 2007.12.21]
제24조(표시)
① 유전자변형생물체를 개발·생산 또는 수입하는 자는 그 유전자변형생물체 또는 그 유전자변형생물체의 용기나 포장에 유전자변형생물체의 종류 등 대통령령으로 정하는 사항을 표시하여야 한다.
② 누구든지 제1항에 따른 표시를 거짓으로 하거나 이를 임의로 변경하거나 삭제하여서는 아니 된다.
③ 관계중앙행정기관의 장은 제1항에 따른 표시의 방법, 그 밖에 필요한 사항을 정하여 고시한다.
[전문개정 2007.12.21]
제25조(취급관리)
① 유전자변형생물체의 수출입등을 하는 자는 유전자변형생물체를 취급하거나 관리할 때에 밀폐운송 등 대통령령으로 정하는 취급관리기준을 지켜야 한다.
② 제1항에 따른 취급관리의 방법과 그 밖에 필요한 사항은 관계중앙행정기관의 장이 정하여 고시한다.
[전문개정 2007.12.21]
제26조(관리·운영기록의 보존) 유전자변형생물체의 수출입 등을 하는 자와 연구시설을 설치·운영하는 자는 지식경제부령으로 정하는 바에 따라 유전자변형생물체의 수출입등 및 연구시설의 관리·운영에 관한 기록을 작성하여 보관하여야 한다.(개정 2008.2.29)
[전문개정 2007.12.21]
제27조(위해 방지를 위한 비상조치)
① 국가책임기관의 장은 유전자변형생물체로 인하여 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 중대한 부정적인 영향이 발생하거나 발생할 우려가 있다고 인정되면 대통령령으로 정하는 바에 따라 지체 없이 필요한 조치를 하여야 한다.
② 유전자변형생물체의 수출입 등을 하는 자가 유전자변형생물체의 부정적인 영향을 알게 되었을 때에는 관계중앙행정기관의 장 또는 국가책임기관의 장에게 지체 없이 그 내용을 통보하여야 한다.
[전문개정 2007.12.21]
제3장 유전자변형생물체의 정보 보호 (개정 2007.12.21)
제28조(정보 보호) 유전자변형생물체에 대한 정보를 취급하는 관계중앙행정기관, 국가책임기관, 위해성평가기관, 위해성심사대행기관 및 제32조에 따른 바이오안전성정보센터(이하 “정보취급기관”이라 한다)의 장은 유전자변형생물체의 정보가 도난·누출 또는 훼손되지 아니하도록 정보 보호에 필요한 조치를 마련하여야 한다.
[전문개정 2007.12.21]
제29조(정보 이용 및 정보 제공의 제한)
① 정보취급기관의 장은 대통령령으로 정하는 경우 외에는 유전자변형생물체의 정보를 상업적으로 이용하거나 다른 자에게 제공하여서는 아니 된다.
② 정보취급기관의 장은 유전자변형생물체의 정보를 다른 자에게 제공할 때에는 사용목적·사용방법 등에 관하여 제한을 하거나 정보 보호를 위하여 필요한 조치를 마련하도록 요청할 수 있다.
[전문개정 2007.12.21]
제30조(정보취급기관 임직원의 의무) 정보취급기관의 임직원이거나 임직원이었던 자는 직무상 알게 된 정보를 누설하거나 타인이 이용하도록 제공하는 등 부당한 목적을 위하여 사용하여서는 아니 된다.
[전문개정 2007.12.21]
제4장 바이오안전성위원회 등
제31조(바이오안전성위원회)
① 유전자변형생물체의 수출입 등에 관한 다음 각 호의 사항을 심의하기 위하여 국무총리 소속으로 바이오안전성위원회(이하 “위원회”라 한다)를 둔다.
1. 의정서의 이행에 관한 사항
2. 안전관리계획의 수립·시행
3. 제15조에 따른 위해성이 없는 유전자변형생물체의 품목 등의 고시
4. 제18조에 따른 재심사
5. 유전자변형생물체의 수출입등과 안전관리에 관련된 법령·고시 등에 관한 사항
6. 유전자변형생물체로 인한 피해 예방 및 대책에 관한 사항
7. 그 밖에 위원장 또는 국가책임기관의 장이 심의를 요청하는 사항
② 위원회는 위원장 1명을 포함한 15명 이상 20명 이하의 위원으로 구성한다.
③ 위원회의 위원장은 국무총리가 되고, 위원은 다음 각 호의 자로 한다.(개정 2008.2.29)
1. 기획재정부장관, 교육과학기술부장관, 외교통상부장관, 농림수산식품부장관, 지식경제부장관, 보건복지가족부장관, 환경부장관 및 국토해양부장관
2. 대통령령으로 정하는 자 중에서 국가책임기관의 장의 제청으로 위원장이 위촉하는 자
④ 국가책임기관의 장은 제3항제2호에 따라 위원을 제청하려면 미리 관계중앙행정기관의 장과 협의하여야 한다.
⑤ 위원회를 효율적으로 운영하기 위하여 위원회에 분과위원회 및 실무위원회를 둘 수 있다.
⑥ 위원회에 간사 1명을 두되, 간사는 지식경제부 소속 공무원 중에서 위원장이 지명하는 자가 된다.(개정 2008.2.29)
⑦ 위원회·분과위원회 및 실무위원회의 구성·기능·운영 등에 관한 사항은 대통령령으로 정한다.
[전문개정 2007.12.21]
제32조(바이오안전성정보센터)
① 국가책임기관의 장은 유전자변형생물체의 정보관리 및 정보교환에 관한 사항 등을 전문적으로 수행하는 바이오안전성정보센터(이하 “바이오안전성정보센터”라 한다)를 지정할 수 있다.
② 바이오안전성정보센터는 유전자변형생물체의 안전성에 관한 정보를 국민에게 공개하여야 한다.
[전문개정 2007.12.21]
제5장 보 칙
제33조(자금 등의 지원)
① 정부는 유전자변형생물체의 안전성에 대한 국민의 이해를 증진하고 소비자의 인식을 제고하기 위하여 관련 기관 및 단체가 실시하는 홍보 및 교육사업 등에 필요한 자금 등을 지원할 수 있다.
② 정부는 연구시설의 안전성을 확보하기 위하여 필요한 시설의 설치·운영 등에 드는 자금 등을 지원할 수 있다.
[전문개정 2007.12.21]
제34조(재원 확보) 국가책임기관의 장은 유전자변형생물체의 수출입등과 관련하여 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 피해가 발생하는 경우에 대비하여 안전성 확보를 위한 재원 확보 방안을 마련하여야 한다.
[전문개정 2007.12.21]
제35조(수수료)
① 다음 각 호의 어느 하나에 해당하는 자는 수수료를 내야 한다.
1. 제8조제1항 및 제2항에 따라 수입승인을 받으려는 자
2. 제9조제1항에 따라 수입승인을 받으려는 자
3. 제12조제1항에 따라 생산승인을 받으려는 자
4. 제22조제1항에 따라 연구시설 설치·운영의 허가를 받으려는 자
② 제1항에 따른 수수료의 금액, 납부방법 및 납부기간 등에 관한 사항은 대통령령으로 정한다.
[전문개정 2007.12.21]
제36조(보고 및 검사)
① 관계중앙행정기관의 장 또는 국가책임기관의 장은 유전자변형생물체의 안전관리를 위하여 다음 각 호의 어느 하나에 해당하는 자에게 보고를 하게 하거나 자료 또는 시료의 제출을 요구할 수 있으며, 소속 공무원으로 하여금 해당 사무소·연구시설·사업장·보관장소 등에 출입하여 관계 서류나 시설·장비 및 보관상태 등을 검사하게 할 수 있다.
1. 제8조제1항·제2항, 제9조제1항 또는 제12조제1항에 따라 수입승인 또는 생산승인을 받거나 수입신고 또는 생산신고를 한 자
2. 제15조제3항에 따라 신고를 한 자
3. 위해성평가기관
4. 위해성심사대행기관
5. 제22조에 따라 연구시설의 설치·운영허가를 받거나 신고를 한 자
6. 제25조에 따라 취급하거나 관리하는 자
② 관계중앙행정기관의 장 또는 국가책임기관의 장은 승인을 받지 아니하거나 신고를 하지 아니한 유전자변형생물체로 판단되는 물품의 수출입 등을 하거나, 허가를 받지 아니하거나 신고를 하지 아니하고 연구시설을 운영하고 있다고 의심되는 자에 대하여는 소속 공무원으로 하여금 그 사무소·연구시설·사업장·보관장소 등에 출입하여 관계 서류나 시설·장비 및 보관상태 등을 검사하게 할 수 있다.
③ 제1항 또는 제2항에 따라 출입·검사를 하는 공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 내보여야 한다.
[전문개정 2007.12.21]
제37조(청문) 관계중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 처분을 하려면 청문을 하여야 한다.
1. 제17조에 따라 수입승인이나 생산승인을 취소하는 경우
2. 제23조에 따라 연구시설 설치·운영의 허가를 취소하는 경우
[전문개정 2007.12.21]
제38조(벌칙 적용 시의 공무원 의제) 위해성평가기관, 위해성심사대행기관 및 바이오안전성정보센터의 임직원은 「형법」 제129조부터 제132조까지의 규정을 적용할 때에는 공무원으로 본다.
[전문개정 2007.12.21]
제6장 벌 칙
제39조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 5년 이하의 징역 또는 7천만 원 이하의 벌금에 처한다.
1. 제14조를 위반하여 수입이나 생산이 금지되거나 제한된 유전자변형생물체(같은 조 제1항제2호의 생물체를 포함한다)를 수입하거나 생산한 자
2. 제17조제1항제1호에 따라 승인이 취소된 유전자변형생물체를 수입하거나 생산한 자
3. 제19조제1항에 따른 폐기·반송 등의 명령을 위반하여 유전자변형생물체를 국내에 유통하게 한 자
[전문개정 2007.12.21]
제40조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 3년 이하의 징역 또는 5천만원 이하의 벌금에 처한다.
1. 제8조제1항·제2항, 제9조제1항 또는 제12조제1항에 따른 승인 또는 변경승인을 받지 아니하고 유전자변형생물체를 수입하거나 생산한 자
2. 제17조제1항제2호부터 제10호까지의 규정에 따라 승인이 취소된 유전자변형생물체를 수입하거나 생산한 자
3. 제22조제1항 전단에 따른 허가를 받지 아니하거나 같은 항 후단 본문에 따른 변경허가를 받지 아니하고 연구시설을 설치·운영한 자
4. 제22조제3항 단서에 따른 승인을 받지 아니하고 개발하거나 실험한 자
[전문개정 2007.12.21]
제41조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 2년 이하의 징역 또는 3천만원 이하의 벌금에 처한다.
1. 제9조제1항에 따른 신고를 하지 아니하고 유전자변형생물체를 수입한 자
2. 제19조제1항에 따른 폐기·반송 등의 명령을 이행하지 아니한 자
3. 제20조에 따른 통보를 하지 아니하고 유전자변형생물체를 수출한 자
4. 제21조에 따른 신고를 하지 아니하고 유전자변형생물체를 국내 경유한 자
5. 제22조제1항 전단에 따른 신고를 하지 아니하고 연구시설을 설치·운영한 자
6. 제23조에 따른 연구시설의 운영정지명령을 위반한 자
7. 제30조를 위반하여 직무상 알게 된 정보를 누설하거나 타인이 이용하도록 제공한 자
[전문개정 2007.12.21]
제42조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 1년 이하의 징역 또는 2천만원 이하의 벌금에 처한다.
1. 제24조제1항 또는 제2항을 위반하여 유전자변형생물체의 종류 등을 표시하지 아니하거나 거짓으로 표시한 자 또는 표시를 임의로 변경하거나 삭제한 자
2. 제25조에 따른 취급관리기준을 지키지 아니한 자
[전문개정 2007.12.21]
제43조(양벌규정) 법인의 대표자나 법인 또는 개인의 대리인, 사용인, 그 밖의 종업원이 그 법인 또는 개인의 업무에 관하여 제39조부터 제42조까지의 어느 하나에 해당하는 위반행위를 하면 그 행위자를 벌하는 외에 그 법인 또는 개인에게도 해당 조문의 벌금형을 과(科)한다. 다만, 법인 또는 개인이 그 위반행위를 방지하기 위하여 해당 업무에 관하여 상당한 주의와 감독을 게을리 하지 아니한 경우에는 그러하지 아니하다.
[전문개정 2008.12.26]
제44조(과태료)
① 다음 각 호의 어느 하나에 해당하는 자에게는 1천만 원 이하의 과태료를 부과한다.
1. 제8조제1항 후단 단서에 따른 변경신고를 하지 아니한 자
2. 제10조제3항에 따른 신고를 하지 아니하거나 관계중앙행정기관의 장의 명령을 이행하지 아니한 자
3. 제11조제1항에 따라 지정되지 아니한 수입항구·공항 등의 장소로 유전자변형생물체를 수입한 자
4. 제12조제1항 후단 단서에 따른 변경신고를 하지 아니한 자
5. 제15조제3항에 따른 신고를 하지 아니한 자
6. 제22조제1항 후단 단서에 따른 변경신고를 하지 아니한 자
7. 제26조에 따른 관리·운영기록을 작성·보관하지 아니한 자
8. 제36조제1항 또는 제2항에 따른 보고나 자료 또는 시료의 제출을 거부하거나 출입·검사를 거부·방해 또는 기피한 자
② 제1항에 따른 과태료는 대통령령으로 정하는 바에 따라 관계중앙행정기관 또는 국가책임기관의 장이 부과·징수한다.
③ 삭제(2009.2.6)
④ 삭제(2009.2.6)
⑤ 삭제(2009.2.6)
[전문개정 2007.12.21]
부 칙 (제6448호, 2001.3.28)
이 법은 의정서가 우리나라에 대하여 효력을 발생하는 날부터 시행한다.
부 칙 (대외무역법) (제8356호, 2007.4.11)
제1조(시행일) 이 법은 공포한 날부터 시행한다.
제2조 내지 제5조 생략
제6조(다른 법률의 개정)
①내지 ⑥ 생략
⑦유전자변형생물체의국가간이동등에관한법률 일부를 다음과 같이 개정한다.
제16조제1항 및 제2항 중 “대외무역법 제14조제2항의 규정에 의하여”를 각각 “「대외무역법」 제11조제2항에 따라”로 한다.
⑧내지 ⑩ 생략
제7조 생략
부 칙 <제8762호, 2007.12.21>
제1조(시행일) 이 법은 의정서가 우리나라에 대하여 효력을 발생하는 날부터 시행한다.
제2조(수입승인 등에 관한 적용례) 제8조의 개정규정에 따른 수입승인 및 제25조의 개정규정에 따른 취급관리에 관한 사항은 이 법 시행 이후 수출국에서 선적(船積)한 유전자변형생물체부터 적용한다.
제3조(경과조치)
① 유전자변형생물체를 수입하려는 자는 이 법 시행 전에 제8조제5항의 개정규정에 따라 위해성심사를 신청할 수 있으며, 관계중앙행정기관의 장은 같은 항 및 제13조제1항의 개정규정에 따른 위해성심사를 할 수 있다.
② 연구시설을 설치·운영하려는 자는 이 법 시행 전에 제22조제1항의 개정규정에 따라 허가 신청 또는 신고를 할 수 있으며, 관계 중앙행정기관의 장은 같은 항의 개정규정에 따라 허가를 하거나 신고를 접수할 수 있다.
제4조(다른 법률의 개정)
① 야생동·식물보호법 일부를 다음과 같이 개정한다.
제25조제2항 단서 중 “「유전자변형 생물체의 국가간 이동 등에 관한 법률」 제2조”를 “「유전자변형생물체의 국가간 이동 등에 관한 법률」 제2조”로 한다.
② 해양생태계의 보전 및 관리에 관한 법률 일부를 다음과 같이 개정한다.
제23조제2항 단서 중 “「유전자변형 생물체의 국가간 이동 등에 관한 법률」 제2조”를 “「유전자변형생물체의 국가간 이동 등에 관한 법률」 제2조”로 한다.
부 칙 (정부조직법) (제8852호, 2008.2.29)
제1조(시행일) 이 법은 공포한 날부터 시행한다. 다만, 제31조제1항의 개정규정 중 “식품산업진흥”에 관한 부분은 2008년 6월 28일부터 시행하고, 부칙 제6조에 따라 개정되는 법률 중 이 법의 시행 전에 공포되었으나 시행일이 도래하지 아니한 법률을 개정한 부분은 각각 해당 법률의 시행일부터 시행한다.
제2조부터 제5조까지 생략
제6조(다른 법률의 개정)
①부터 (385)까지 생략
(386) 유전자변형생물체의 국가 간 이동 등에 관한 법률 일부를 다음과 같이 개정한다.
제6조제1항, 제31조제6항 중 “산업자원부”를 각각“ 지식경제부”로 한다.
제13조제1항제2호 중 “농림부장관”을 “농림수산식품부장관”으로 하며, 같은 항 제3호 중 “해양수산부장관”을 “국토해양부장관”으로 한다.
제16조제1항·제2항, 제20조 중 “산업자원부장관”을 각각 “지식경제부장관”으로 한다.
제26조 중 “산업자원부령”을 각각 “지식경제부령”으로 한다.
제31조제3항제1호를 다음과 같이 한다.
1. 기획재정부장관, 교육과학기술부장관, 외교통상부장관, 농림수산식품부장관, 지식경제부장관, 보건복지가족부장관, 환경부장관 및 국토해양부장관
(387)부터 (760)까지 생략
제7조 생략
부 칙 <제9241호, 2008.12.26>
이 법은 공포한 날부터 시행한다.
부 칙 <제9428호, 2009.2.6>
이 법은 공포한 날부터 시행한다.
생명공학 용어정리
■ 생명공학과 관련한 총제적(-omics) 학문
❍ 글라이코믹스(Glycomics)
당쇄를 인위적으로 목적한 기능을 갖게 변화시킴으로써 의약품 개발에 응용하려는 연구 분야이다.
※ 당쇄 : 단당류가 연쇄상으로 다수 결합된 분자로 일반적으로 생체의 세포 표면에 존재하는 당쇄를 지칭한다. 이러한 당은 당화(Glycosylation)되는 과정에서 단백질의 기능을 결정하거나 안정화시키는 데 중요한 역할을 한다.
❍ 기능유전체학(Functional genomics)
유전자와 유전자 산물의 기능, 유전자 산물 간의 상호작용을 밝히는 학문 분야이다. 이러한 연구를 통해 인간 유전자를 기능상으로 분류할 수 있으며, 이를 통해 질병 진단과 예후 예측, 치료제 개발에 유익한 정보를 제공할 수 있다.
❍ 단백질체학(Proteomics)
단백질의 3차원 구조분석, 기능 확인, 다른 생체물질과의 상호작용 등에 대한 연구를 통해 질병의 작용기구를 파악하고 신약개발에 활용하는 분야이다.
❍ 대사체학(Metabolomics)
세포 내에 존재하는 대사물의 총체인 대사체를 연구하는 학문이다.
❍ 독성유전체학(Toxicogenomics)
독성물질에 의해 발현양성이 변하는 유전자를 유전체학(genomics) 기법을 동원하여 대량으로 동정한 후 이 결과를 활용하여 개체의 독성물질 피폭 여부 등을 조사하는 학문 또는 기술이다. 이 기술을 이용하면 동물 또는 기타 시험관 내 방법에 비해 신속하고 정확하게 독성물질을 스크리닝할 수 있으며 한 번의 실험으로 다수 유전자의 변화를 분석할 수 있다.
❍ 약리유전체학(Pharmacogenomics)
개체 간에 나타나는 약물 효과, 독성 등의 차이를 개체의 유전적 요인과 관련지어 연구하는 학문 분야로, 개개인의 유전적인 요인을 파악해 약에 대한 반응성을 예측할 수 있도록 하는 것이 목표이다.
❍ 유전체학(Genomics)
게놈(genome)은 유전자(gene)와 염색체(chromosome)의 합성어로, 염색체에 담긴 유전자를 총칭하는 말이며, Genomics는 유전정보 전체(유전체)를 연구하는 학문분야를 말한다.
❍ 합성생물학(Synthetic Biology)
새로운 생물학적 부분(Part), 장치(Device), 시스템(System)을 디자인하고 구축하기 위해 또는 기존에 존재하는 자연 상태의 생물학적 시스템을 새로운 생물학적 시스템이나 인공생명체를 만드는 등 특정 목적으로 재설계(Redesign)하기 위해 사용하는 기술이다.
❍ 화학유전체학(Chemical Genomics)
Genomics와 조합화학이 결합된 분야로 유전자 분석을 통하여 특정 질환에 관련된 단백질 등 생체 내 타깃을 찾고 이와 반응할 수 있는 구조의 화합물들을 대량으로 합성하여 Lead(신약 후보의 구조적 출발물질)를 찾아내는 분야이다.
■ 생명공학과 관련한 기타 학문
❍ 구조생물학(Structural biology)
단백질의 3차원 구조로부터 기능의 정보를 얻으려고 하는 학문적 영역이다.
❍ 나노기술(Nanotechnology)
10억 분의 1 수준의 정밀도를 요구하는 극미세가공 과학기술분야이다.
❍ 나노바이오
생명공학과 나노기술 상호간의 접목을 통하여 생명현상에 대해 분자수준의 이해를 증진시키며, 생명체 유래의 각종 물질들을 나노소재로 응용하는 연구이다.
❍ 뇌과학(Brain science)
뇌의 신비를 밝혀냄으로써 궁극적으로는 인간이 갖는 물리적·정신적 기능성의 전반을 심층적으로 탐구하는 응용 학문분야이다.
❍ 단백질공학(Protein engineering)
기존 단백질 구조와 기능 간의 관계를 규명하고 새로운 단백질을 설계하고 창출하는 기술이다. 아미노산 서열 결정, 유전자조작, 단백질 입체 구조 규명, 단백질의 분리와 정제, 컴퓨터 그래픽스 등의 기술이 요구된다. 신기능 효소, 고활성 효소, 의약용 단백질 개발에 이용된다.
❍ 당쇄공학(Glyco engineering)
천연에 존재하는 당쇄 구조 화합물의 기능․활성 규명, 구조 수식, 유도체 합성 등에 관련된 기술 분야이다. 당쇄 구조 화합물은 세포 간 인식, 정보 전달에 중요한 역할을 하는 것으로 알려져 있다.
❍ 대사공학(Metabolic engineering, Metabolomics)
생명체 대사과정의 네트워크를 각종 정보와 유전자조작 기술을 이용하여 유익한 방향으로 조절하려는 기술분야이다.
❍ 면역유전학(Immunogenetics)
개체간의 면역학적 차이를 연구하는 유전학 분야. 혈액형, 조직적합성, 면역 응답 등에 관련된 정보를 이용한다.
❍ 생명공학
생명공학은 생명과학으로부터의 과학적 발견에 기반하여 응용기술을 창출하여 산업에 적용하는 분야를 말한다. 생명공학은 농업에서의 품종개량 유전자공학등에 뿌리를 두고 있다.
❍ 생명과학
생명현상의 규명으로부터 생물기능의 응용연구에 이르기까지 생명체에 관련된 모든 연구분야를 총괄하는 과학군이다.
❍ 생물정보학(Bioinfomatics)
컴퓨터 기술을 활용하여 유전자와 관련된 정보를 해석하고, 기능과 구조를 밝혀내는 학문분야이다.
❍ 생체공학(Bionics)
생체 기작과 기능에 대한 공학적 지식을 응용하는 학문이다. 생체의 기능을 모방해 생체와 같이 동작하는 기계를 제작하는 기술 등이 포함된다.
❍ 세포공학(Cell engineering)
염색체나 유전자의 인위적인 조작 또는 이전 기술을 통해 유용한 유전자 형질을 발현할 수 있는 새로운 세포를 만들어 내는 기술이다. 세포융합에 의한 잡종 세포 형성을 이용하는 연구나 하이브리도마세포 제작을 비롯해 돌연변이주의 분리법이나 조직배양, 세포배양 기술 등이 포함된다.
❍ 시스템생물학(Systems biology)
생물 시스템을 구성하는 각각 요소의 행동을 해석할 뿐만 아니라, 전 구성 요소의 동적인 상호 관계를 시스템 전체 수준으로 분석해 고차적인 특성을 총체적으로 연구하는 학문이다.
❍ 의약 바이오(Red Biotechnology)
질병 치료 등에 활용되는 의약품을 개발하는 분야로 재조합 바이오 의약품(단백질의약품, 치료용 항체, 백신, 유전자의약품 등), 재생 의약품(세포치료제, 조직 치료제, 바이오 인공장기 등), 저분자 및 천연물의약품, 바이오 의약 기반 구축 기술 등을 포함한다.
❍ 조직공학(Tissue engineering)
생명과학, 의학, 공학의 기본 개념과 기술을 바탕으로 하여 인공생체조직 또는 기관을 만들어 이용함으로써 생체 기능의 유지, 향상, 복원을 목표로 하는 학문 분야이다.
❍ 진화생물학(Tissue engineering)
지구 상의 생물의 진화를 연구하는 학문으로서, 찰스 다윈의 진화론의 영향으로 현대 생물학에서 빼놓을 수 없는 분과이다. 다윈의 진화론에 따르면 생물의 진화란 생물의 발전 과정을 뜻하며, 이 발전 과정을 더듬어 보는 일은 우선 생물이 무엇에서 발생하였는가를 밝히는 데에서부터 시작하여야 할 것이다.
❍ 해양생명공학(Marine biotechnology)
식량으로서의 어패류, 해조류의 이용, 조류 등의 에너지원으로서의 이용, 해양 생물로부터의 화학제품, 의약품 등의 추출, 정제 등이 포함되며, 이러한 목적을 위해 조직배양, 세포융합, 재조합DNA 기술 등을 활용하는 것을 해양생명공학이라 한다.
❍ 환경생명공학(Environmental biotechnology)
생명공학 기술을 이용한 오염물의 제거, 오염지역의 복원, 오염 탐지 및 측정, 생태 시스템 영향 평가 등 환경 관련 기술분야이다.
❍ 혈액학(Hematology)
혈액과 조혈기관에 관련된 사항을 다루는 학문분야이다.
■ 생명공학 용어
❍ 게놈(Genome)
게놈은 유전자(gene)와 염색체(chromosome)의 합성어로서 한 생물체가 지닌 모든 유전정보(DNA)의 집합체를 뜻한다.
❍ 계대배양(Subculture)
미생물이나 동식물 세포를 증식 또는 유지할 때 그 일부를 새로운 배지에 계속 옮겨 배양하는 것을 말한다.
❍ 공통서열(Consensus sequence)
DNA, RNA 및 단백질의 일차 구조상에서, 특정 기능에 관계된 영역에 공통적으로 존재하는 염기나 아미노산 서열이다. DNA와 RNA의 경우, 특정 단백질의 결합 부위인 것이 일반적이다. 예를 들면, RNA중합효소의 결합 부위인 프로모터나 각종 전사 조절 단백질의 결합 부위에서, 각각의 단백질이 결합하는 특정 공통서열을 볼 수 있다.
❍ 과변이(Hypervariability)
셋 이상의 대립형이 나타나는 DNA 염기서열의 변화를 뜻한다.
❍ 광학분할(Optical resolution)
광학 이성질체 혼합물에서 원하는 광학 활성체를 분리하는 것이다. 광학 활성을 지닌 산 또는 염기를 이용하여 한 가지 광학 활성체에 대해서만 광학 활성염을 만든 다음 분리하는 방법이다. 광학 활성 분리용 담체에 의한 크로마토그래피법, 또는 미생물이나 효소에 의해 한 가지 광학 활성체에만 반응을 선택적으로 진행시킨 후 분리하는 방법 등이 있다.
❍ 균사체(Mycelium)
곰팡이나 버섯 등 균류의 몸체를 구성하는 실 모양의 구조체이다.
❍ 글루코사민(Glucosamine)
포도당에 아미노기가 결합된 대표적인 아미노당이다. 자연계에는 키틴을 비롯해 세균의 세포벽, 동물의 연골, 피부를 구성하는 뮤코다당류 등 다당류의 성분으로 널리 분포한다. 혈액이나 점액 속에도 이것과 결합한 당단백질, 당지질이 존재한다. 관절염 치료를 위한 건강식품으로 널리 사용된다.
❍ 기능성식품(Functional food)
생체 방어, 생체 리듬 조절, 질병 예방 등 생체 조절 기능을 충분히 발휘할 수 있도록 설계되고 가공된 식품을 말한다.
❍ 나노바이오센서(Nano-Biosensor)
IT, NT 기술과 BT기술을 융합한 U-헬스케어의 핵심 기반으로 나노바이오센서 기술은 대부분의 건강정보가 담겨 있는 혈액을 채취해 실시간으로 심근경색 등의 질환을 검사하고 조기에 예방할 수 있는 3세대 U-헬스케어 기술을 의미한다.
❍ 나노바이오테크놀로지(Nanobiotechnology)
나노기술과 생명공학기술이 접합된 형태의 기술 분야. DNA칩, 단백질칩, 초소형 바이오센서, 고속대량스크리닝(HTS) 시스템의 개발과 적용에 핵심적인 분야이다.
❍ 나선포자(helicospore)
1개의 주축으로 이루어지는데 180。이상 만곡되어 많은 경우 2~3회 소용돌이모양 또는 나선형으로 감겨 있는 포자. 모기향처럼 평면적으로 감는 것과 스프링처럼 입체적으로 감는 것이 있다. 무격벽 또는 유격벽으로 단실포자와 사상포자가 소용돌이모양으로 된 것이다.
❍ 내포체(Inclusion body)
외래 단백질이 숙주세포 내에서 과량 발현될 때 흔히 형성되는 불용성 단백질 덩어리이다. 내포체를 형성하면 단백질이 활성을 잃게 되므로 재접힘(refolding)을 통해 활성화시켜야 한다.
❍ 다기능효소(multifunctional enzyme)
하나의 효소가 2개 또는 3개 이상의 반응을 촉매하는 효소의 총칭. E.coli의 트립토판에서 유도 형성한 균체로부터 정제한 결정효소는 인돌+L-세린→L-트립토판+H2O, L-트립토판+H2O→인돌+피루브산+NH3, L-세린→피루브산+NH3, L-시스테인+H2O→피루브산+NH3+H2S, 인돌+L-시스테인→L-트립토판+H2S의 여러 가지 반응을 촉매하는 것이다.
❍ 다운증후군(Down syndrome)
상염색체 중에서 가장 소형인G군에 속하는 제21염색체가 정상보다 1개가 많아 합계 3개 존재하는 것(21=염색체성)에서 나타나는 선천성 이상증후군. 정신지체, 낮은 코, 몸통에 비해 사지가 짧아 땅달막한 체형, 수지가 짧은 심기형 합병이 빈도 높게 나타나는 것이 특징이다.
❍ 다당류(Polysaccharide)
다수의 단당이 글리코시드결합에 의해 탈수축합한 고분자화합물. 여러 가지 방법으로 분류한다. 예를 들면 1종류의 구성당으로 된 단순다당(호모다당), 2종류 이상의 구성당으로 구성한 복합다당(헤테로다당), 중성당만으로 구성된 중성다당, 우론산이나 황산기를 포함하는 산성다당 등이다.
❍ 단백질(Protein)
아미노산을 단량체로 하는 고분자 유기화합물의 총칭으로 세포의 주요 구성 성분이다. 생명현상에 관여하는 효소, 항체, 호르몬 등이 포함된다.
❍ 단백질삼차구조(Tertiary structure of protein)
단백질 사슬 내에서 비교적 멀리 떨어진 기능기 간의 수소 결합, 이황화결합, 소수성 상호작용(hydrophobic interaction)등에 의하여 형성되는 입체 구조. 효소의 활성, 특이성 등 단백질의 기능과 밀접한 관계가 있다.
❍ 단백질칩(Protein chip)
실리콘, 유리 등의 표면에 여러 종류의 단백질을 고밀도로 고정화시킨 바이오칩의 일종이다. 단백질-단백질(항원-항체), 단백질-리간드, 단백질-DNA, 효소-기질 등 단백질이 관여하는 모든 상호작용의 분석에 이용된다. 이를 통해 생명 현상의 이해, 질병의 진단과 원인 규명, 신호 전달 체계의 이해가 가능하며, 궁극적으로 질병의 예방 및 치료법을 개발할 수 있다.
❍ 단세포단백질(Single-cell protein(SCP))
세균, 효모, 사상균, 방선균, 곰팡이, 조류 등의 미생물을 대량 배양하여 균체로부터 추출한 단백질, 사료첨가물이나 식품첨가물, 증량제로 사용된다.
❍ 단일클론항체(Monoclonal antibody)
단 하나의 항원성결정기에만 작용하는 항체로 하이브리도마 또는 재조합 미생물 배양을 통해 생산된다. 미량 물질의 분리, 감염증이나 암 진단과 치료 등과 같은 의료 분야에 있어서 중요한 역할을 한다.
❍ 돌연변이(Mutation)
한 개체의 유전체를 구성하는 염색체나 DNA의 일부에 생긴 영구적인 변화, 염기서열 상의 염기 1개가 다른 염기로 치환된 경우를 점 돌연변이라고 한다. 여러 개의 염기를 포함하는 DNA 영역에 걸쳐 변화가 일어나는 경우도 있다. 생식세포에 생긴 돌연변이는 후대에 전달된다. 체세포돌연변이는 후대에 전달되지 않는다.
❍ 동물자원기술(Animal resources technology)
동물이 생산하는 산물 및 축산 동물의 효율적 생산을 위한 자원 동물의 육종, 사육, 관리 등과 관련된 기술이다.
❍ 동형접합체(Homokaryon)
하나의 세포 내에 유전자형이 다른 두 개 이상의 핵이 존재하는 상태이다. 핵융합이 일어나지 않으므로 세포질 유전 연구에 이용된다.
❍ 루틴(Rutin)
루티노오즈(글루코오즈와 만노오즈가 결합한 이당류)가 결합된 배당체 형태의 플라보노이드. 콩, 팥, 메밀, 토마토, 감귤류 등에 함유되어 있다. 모세혈관의 기능을 정상으로 유지하고 혈관을 튼튼히 하는 비타민P의 작용이 있어 고혈압이나 뇌일혈을 예방하는 데 쓰인다.
❍ 마이코톡신(Mycotoxins)
곰팡이류가 생산하는 독성 물질의 총칭이다. 사람이나 동물에게 급성 또는 만성 장해를 유발한다. 대표적인 것으로 Aspergillus flavus가 생산하는 aflatoxin류가 있다.
❍ 마이크로어레이(Microarray)
기판 위에 DNA나 단백질과 같은 포획 탐침(capture probe)이 미세한 점으로 고정화된 어레이 장치이다. 특정 DNA나 단백질의 분석을 통해 유전질환의 진단, 유전자 발현 모니터링 등에 사용된다.
❍ 맞춤의료(order-made medicine, tailored medicine)
개인의 체질·약물에 대한 반응에 따라 각각 다른 투약이나 치료하는 의료 행위.
❍ 면역억제제(Immunosuppressive agents/immunosuppressants)
생체의 면역 반응을 억제하는 활성을 지닌 물질이다. 대표적으로 사이클로스포린 A(cyclosporin A) 등이 있으며 장기 이식 시 거부반응을 억제하기 위해 사용된다.
❍ 면역세포(Immunocyte)
면역담당세포의 총칭. 림프구계 면역세포의 유약형(幼若型)은 대형 호피로닌세포이며 면역아구라고 한다.
❍ 면역치료제(Immunotherapeutic)
체내의 면역반응에 관여하는 세포로 단백질로서 치료제로 사용되는 물질이다. 인터페론, 인터루킨 등이 대표적인 예이다.
❍ 미생물(Microorganism)
육안으로는 관찰이 불가능한 미세한 생물체. 일반적으로 크기 0.1mm 이하인 생물체를 의미한다. 주로 단일 세포 또는 균사체로 존재하며, 최소 생활 단위를 유지한다. 세균류, 사상균류, 효모류, 조류, 원생동물류, 바이러스 등이 이에 속한다.
❍ 바이러스(Virus)
숙주세포 내에서만 증식할 수 있는 비세포성 생물체이다. DNA나 RNA 중 하나를 게놈으로 갖는 감염세포 내에서만 증식하는 감염성 미소구조체이다.
❍ 바이오디젤(Biodiesel)
지방산 메틸에스터. 식물성 또는 동물성 지방과 메탄올의 산 또는 염기촉매반응에 의해 생산된다. 그 자체 또는 석유 디젤과 혼합해 연료로 사용되며, 바이오디젤은 재생가능자원인 바이오매스로부터 생산되므로 에너지 자원의 고갈 문제가 없으며, 연소 시 이산화탄소 및 미세분진의 배출량이 경유에 비해 현저히 낮고, SOx는 전혀 배출되지 않는다.
❍ 바이오리파이너리(Biorefinery)
석유 대신 바이오매스로부터 연료와 화학 원료를 제조하는데 필요한 기술의 집합이다.
❍ 바이오매스(Biomass)
식물이나 미생물 등을 에너지원으로 이용하는 생물체를 말한다.
❍ 바이오멤스(BioMEMS)
생물학적 시스템에 극미세 전자 기계 시스템(micro-electro-mechanical systems, MEMS) 기술을 결합한 새로운 기술 분야. 고성능의 극소형 생물 측정 장치나 생화학 반응 장치 등의 제작이 이에 속한다.
❍ 바이오센서(Biosensor)
생체 물질이 갖는 반응 특성과 그 반응에 의해 발생되는 전기 화학적 또는 광학적 신호 등을 이용해 특정 물질을 검출하거나 정량 분석하는 장치이다.
❍ 바이오에너지(Bioenergy)
바이오매스(biomass)와 이를 원료로 하여 생물학적 또는 열화학적으로 생산되는 연료로부터 얻어지는 에너지를 말한다. 경우에 따라서 바이오매스로부터 생산되는 연료를 지칭하기도 한다.
❍ 바이오연료(Biofuel)
생물체(바이오매스 자원)에서 만들어지는 연료이다. 액체 연료로는 에탄올, 메탄올, 바이오디젤, 피셔-트롭쉬(Fischer-Tropsch) 디젤이 있고 기체 연료로는 수소와 메탄이 있다.
❍ 바이오플라스틱(Bioplastic)
생물체(바이오매스 자원)에서 만들어지는 연료이다. 액체 연료로는 에탄올, 메탄올, 바이오디젤, 피셔-트롭쉬(Fischer-Tropsch) 디젤이 있고 기체 연료로는 수소와 메탄이 있다.
❍ 바이오칩(Biochip)
1) 유리, 실리콘 등의 재질로 된 작은 고체 기판 위에 DNA, 단백질 등의 생체 물질을 고밀도로 고정화시킨 마이크로어레이칩이다. 유전자 발현 양상, 유전자 결함, 단백질 분포, 반응 양상 등을 분석하는데 이용된다.
2) 단백질이나 지질, 신경세포 등의 생체 물질로 구성되며, 기본적인 연산이나 정보 처리 기능을 갖는 소자이다. 현재는 싸이토크롬이나 박테리오로돕신 등이 갖는 전자/광 스위치 특성을 이용한 소자들이 개발되고 있다.
❍ 바이오필터(Biofilter)
담체에 고정화된 미생물을 이용해 여러 가지 독성 물질이나 악취 물질을 제거하는 환경 처리장치이다.
❍ 박테리오신(Bacteriocin)
세균에 의해서 생합성되는 단백질로서 항균 효과가 있는 물질의 총칭이다.
❍ 발현벡터(Expression vector)
목적 유전자의 효율적인 발현을 위해 제작된 벡터이다. 전사가 효율적으로 이루어지도록 강력한 프로모터와 적절한 조절 유전자를 갖는다.
❍ 배아
난자와 정자의 수정이 이루어진 후 8주까지(인간의 경우)를 말하며 후에 태아가 된다.
❍ 배아줄기세포(Embryonic stem cell(ESC))
발생 초기의 배반포에서 얻어지는 미분화 상태의 세포로 자가 재생산 능력이 뛰어나 대부분의 조직과 세포로 분화할 수 있다.
❍ 복제 DNA(Cloned DNA)
공여체로부터 분리, 동정된 후 벡터에 삽입된 DNA를 말한다.
❍ 복제동물(Cloned animal)
무성적으로 복제되어 유전적으로 모체와 동일한 동물 개체를 말한다. 난세포에서 핵을 제거하고 모체 체세포의 핵을 이식하는 과정을 거쳐서 복제된다.
❍ 복제장기(Cloned organ)
인간 또는 동물의 장기의 일부분 또는 세포를 이용하여 장기로서의 기능이 가능하도록 배양된 생물학적 인공장기이다. 복제동물의 사육을 통하여 얻을 수도 있다.
❍ 생명윤리(Bioethics)
생명을 의미하는 바이오(bio)와 윤리를 뜻하는 에식스(ethics)의 합성어로 생명윤리 또는 생물윤리로 번역된다. 생명에 관한 윤리와 생물학의 기본원칙에 입각한 윤리의 2가지로 생각할 수 있다. 생명에 관한 윤리는 이제까지 ‘의사의 윤리’, 또는 ‘의료의 윤리’라고 일컬어왔는데, 의료의 발전과 인권의식이 서로 연관되어 넓은 입장에서 생명, 특히 인간의 생명에 대한 간섭의 시비를 검토하게 되었다.
❍ 생명자원
생명자원은 지구상에 존재하는 생물(동·식물, 미생물, 인간세포 등), 생물의 구성물(DNA, 유전체 등) 및 이들의 정보를 포함하는 것으로 배양 가능한 생물체, 복제 가능한 부분, 유전자원, 배양 불가능한 생물체 및 이와 관련된 분자, 생리, 구조적 정보를 포함한다.
❍ 생명정보
생물자원(유전체, 전사체, 단백질체 포함)과 생물다양성으로부터 유래된 정보와 그것의 가공처리 결과물을 말한다.
❍ 생물공정(Bioprocess)
생물체, 또는 생물체로부터 유래된 물질을 이용하거나 대상으로 하는 공정의 총칭이다.
❍ 생물다양성
육상, 해양 등의 수중 생태계와 이들 유기체가 서식하는 생태계를 말하며, 이는 종과 종사이, 또는 종과 생태계 사이의 다양성도 포함한다.
❍ 생물다양성보존(Biodiversity conservation)
생태계에 있어서 종 구성의 다양성과 다양한 종들 사이의 상호작용, 그리고 그 기능과의 상관관계를 활용해 자연 환경을 안정하게 유지하는 것이다.
❍ 생물산업(Bioindustry)
생명공학 기술을 이용하거나 이에 관련된 산업의 총칭이다.
❍ 생물안전성(Biosafety)
생명공학기술과 그 생산물로부터 유래하는 잠재적 위해성을 감소시키기 위한 노력을 지칭하는 용어이다.
❍ 생물융합기술(Biohybrid technology)
생명공학, 마이크로시스템, 센서시스템 등 여러 가지 분야의 기술이 융합된 것이다. 생명공학 연구에 필요한 여러 가지 방법을 자동화, 병렬화, 동기화하기 위해서 개발된 기술이다.
❍ 생물의약(Biopharmaceutical)
생물체 또는 이로부터 유래된 물질을 이용해 생산되는 의약품의 총칭이다. 단백질 치료제, 백신, 항생제, 세포 치료제, 유전자치료제 등이 포함된다.
❍ 생물학적지표(Biological indicator)
생리활성 물질의 효능을 말한다. 환경오염 또는 독성의 정도를 특정 생물을 대상으로 하여 수량적으로 표시하는 지표이다.
❍ 생체고분자(Biomolecule)
생체 내에서 합성되는 거대분자의 총칭이다. 단백질, 핵산, 지질, 다당류가 있다.
❍ 생체모방기술(Biomimetics)
생체의 기능을 다른 재료로 대체하거나 생체 기능을 모방, 이용하는 기술이다. 생체모방화학, 바이오일렉트로닉스, 바이오미캐닉스 등이 포함된다.
❍ 성체줄기세포(Adult stem cell)
조혈기관 상피조직 등의 세포재생계에서 세포생산의 기초가 되는 세포의 줄기세포를 추출하여 치료목적의 조직 세포로 분화한 것.
❍ 생체지표(Biomarker)
발암, 유전질환, 노화 등이 진행되는 단계 중 특징적으로 나타나는 형태학적·생화학적·분자생물학적 변화. 생체지표를 검색함으로써 물질의 위해성을 판단할 수 있다.
❍ 세포융합(Cell fusion)
두 개의 서로 다른 세포의 원형질체(protoplast)를 융합하는 것을 말한다. 동시다발적 유전 형질 변환이 가능하다. 식물세포에서는 육종 기술로서 동물세포에서는 단일클론항체 생산을 위한 하이브리도마 세포주를 만드는 데 사용된다. 미생물 분야에 있어서는 곰팡이와 방선균 등의 균주 개발에 이용된다.
❍ 세포치료기술
손상된 조직 또는 기관 부위를 치료할 목적으로 체외에서 세포를 배양하여 체내에 투여하는 치료법이다.
❍ 알츠하이머병(Alzheimer's disease)
퇴행성 뇌질환의 하나로 치매의 원인 중 가장 흔한 형태이다. 병리 조직학적으로는 뇌의 전반적인 위축, 뇌실의 확장, 신경 섬유의 다발성 병변(neurofibrillary tangle)과 초로성 반점(neuriticplaque) 등이 특징이다.
❍ 약물전달시스템(Drug delivery system(DDS))
약물 방출 속도를 조절하거나 약물을 목표 부위에 효율적으로 전달시키는 방법 등을 통해 의약품의 부작용을 최소화하고 효능 및 효과를 극대화시키는 기술 및 시스템이다.
❍ 염기서열
아데닌(A), 구아닌(G), 시토신(C), 티닌(T) 4개의 상이한 코드(염기)로 이루어진 특정 서열로 DNA에 유전정보를 저장한다.
❍ 유전공학(Genetic Engineering)
생물체에 주어진 유전형질을 인위적으로 변형․개조시켜 새로운 형질을 가진 생물체를 만들어내는 기술(세포융합핵치환 단백질공학 유전자 재조합)이다.
❍ 유전자 재조합(Genetic recombination)
DNA나 RNA와 같이 유전자를 이루는 요소가 해체와 재조립 과정에서 원래의 서열과는 다르게 뒤바뀌는 과정을 가리키는 유전학 용어이다. 진핵생물의 경우 DNA 수리의 과정에서 유사 분열이 발생하는 경우, 그리고 감수 분열의 과정에서 일어나는 염색체 접합에 의해 이루어진다.
❍ 인간화항체(Humanized antibody)
항원을 다른 동물에 주입했을 때 생성되는 항체 구조 중 항원이 결합하는 부위인 상보성결정부위(CDR)에 해당되는 유전자 배열만을 인간 항체 유전자에 대체하는 과정을 통하여, 인간 항체와 특징이 유사하도록 제조된 재조합 항체동물로부터 유래된 부분이 적기 때문에 체내 투여용 항체치료제로 사용하기에 적합하다.
❍ 인공장기(Artificial organ)
장기의 인공적인 대체물을 말한다. 심장, 신장, 간장 등의 대체 장기 외에도 인공혈관, 인공혈관 밸브 등도 포함된다. 인공 재료와 배양 세포를 결합시킨 혼성(hybrid)형도 있다.
❍ 인터페론(Interferon(IFN))
인체세포 내에서 바이러스 RNA와 단백질의 생성을 억제하는 항바이러스 단백질의 발현을 유도하는 기능을 갖는 당단백질의 총칭이다. 생성장소와 기능이 각기 다른 3가지가 있는데 IFNα는 주로 백혈구, IFNβ는 섬유모세포 그리고 IFNy는 주로 림프구에서 생성된다. 항바이러스 작용 외에 면역조절작용도 갖는다. IFNα와 IFNβ는 주로 항바이러스활성을 나타내는 반면 IFNy는 주로 면역조절작용을 한다. IFNα는 자연살해세포의 활성을 증강시키는 작용도 지니고 있다. 산업적으로는 유전공학적인 방법으로 생산이 가능해졌으며, 바이러스 간염의 치료에 사용되며 IFNα는 모발상세포 백혈병의 치료에도 유효하게 사용된다.
❍ 자가면역질환(Autoimmune disease)
자가면역에 의해 생체방어기능을 담당하는 면역계가 자기 세포를 공격해 발생하는 질병. 만성 류마티스성 질환이 대표적인 예이다.
❍ 자가생식(Selfing)
동일 개체 또는 동일 계통에 유래하는 배우자간의 교배. 교배형에 의한 자웅이체성이 확인되고있는 미생물의 일부 계통으로, 동일 교배형의 클론 내에서 한정적으로 교배가 일어나는 것이다.
❍ 자살유전자(Suicide gene)
발생과정의 어느 시기에 특정한 세포 내에서 발현하여 그 세포를 세포예상사시키는치사유전자의 일종. 이 유전자의 작용으로 살생단백질을 합성하고, 이것이 어떤 기작으로 세포를 죽게 하는 기능을 하는 것으로 보고 있는데 아직도 불분명한 점이 많다. 자살유전자는초기에는 그 발현이 억제되지만 특정한 사이에 발현하는데 그방아쇠가 되는 요인은 다양한 것으로 알려져 있다.
❍ 자세포(Cnidoblast)
자포동물에서 자포를 만들고 대부분의 경우 이를 마지막까지 내장하는 세포. 간세포(I세포)에서 유래하는 것으로 알려져 있다. 자세포는 1개의 독립효과기로 기능하는 것으로, 특정한 지질성분에 대한 접촉화학적 반응이 종종 그 원래의 흥분형태가 된다.
❍ 재구성핵(Restitution nucleus)
유사분열의 중기 또는 후기에 핵분열의 착오에 의해 딸 염색체가 분배되지 않고하나로 된 핵. 그 결과, 염색체수가 배가된 핵이 형성된다. 감수분열에서는 1가염색체, 염색분체다리 등에 의한 염색체 지체가 원인이 된다.
❍ 재조합 DNA 기술(Recombinant DNA technology)
목적 유전자를 제한효소를 이용해 잘라내고 이를 벡터에 삽입해 재조합 DNA를 제작한 후, 숙주에 도입해 발현시키는 과정에 관련되는 기술의 총칭이다.
❍ 전임상(Preclinical)
실험실 차원 및 동물을 대상으로 약물의 생리적 특성과 대상 질병에 대한 효능을 검증하는 것이다.
❍ 제대혈(Cord blood)
태반과 탯줄에 있는 혈액으로 백혈구, 적혈구, 혈소판 등을 만드는 조혈모세포를 다량 함유하고, 연골, 뼈, 근육, 신경 등을 만드는 간엽줄기세포를 가지고 있다.
❍ 줄기세포(Stem Cell)
조직분화 과정에서 볼 수 있는 미분화된 세포. 줄기세포는 신체 내 모든 조직으로 분화될 수 있는 가능성을 가지고 있다.
❍ 줄기세포치료(Stem cell therapy)
미분화된 줄기세포를 적당한 조건 하에서 특정 세포나 조직으로 분화하도록 유도해 손상된 조직이나 장기를 치료하는 기술이다.
❍ 제네릭(Generic) 약품
특허 보호중인 의약품에 반대되는 개념으로 특허가 만료됐거나 특허보호를 받지 않는 의약품을 통칭한다.
❍ 진세노사이드(Ginsenoside)
인삼 사포닌을 구성하는 물질의 총칭으로 현재 약 30여 종이 알려져 있으며 건조 인삼 중 약 3.2% 정도 함유되어 있다. 화학구조의 특성에 따라 프로토파낙사디올(protopanaxadiol, PD)계, 프로토파낙사트리올(protopanaxatriol, PT)계, 올레안(oleanane)계 사포닌으로 구분되며 항암, 혈액 순환 개선, 당뇨의 예방 및 치료, 신장 보호, 치매 예방, 간장 보호, 동맥 경화, 고지혈증, 체질 개선, 피로 회복, 면역 기능 증진과 노화 방지 등에 효과가 있다고 알려져 있다.
❍ 진핵생물(Eukaryote)
핵막으로 둘러싸인 핵과 다양한 세포 소기관을 가지는 세포로 구성되어 있는 생물을 말한다. 원생생물, 조류, 사상곰팡이, 효모, 식물, 동물이 포함된다. 원핵생물과 대응된다.
❍ 체세포돌연변이(Somatic mutation)
발생이 진행 중인 개체 또는 완전한 개체 내에서 방사선이나 다른 원인들에 의해 일부의 체세포에 변화가 일어나 새로운 형질이 만들어지는 현상이다.
❍ 체세포변이(Somaclonal variation)
한 개체에서 단일세포를 떼어내어 재배양했을 때 얻어진 새로운 개체가 원래의 개체와 유전적으로 동일하지 않은 현상이다.
❍ 체세포융합(Somatic cell hybridization)
유전자가 다른 체세포를 접합하여 새로운 유전자형의 세포를 만드는 기술이다.
❍ 치료용효소(Therapeutic enzyme)
치료제로 이용되는 효소 또는 그 제제이다. 혈전용해제로 사용되는 조직플라스미노젠활성인자(TPA: tissue plasminogen activator), 스트렙토카이네이즈(strep-tokinase), 유로카이네이즈(urokinase)와 항혈액응고제인 안티트롬빈 III(antithrombin III) 등이 대표적인 예이다.
❍ 카로티노이드(Carotenoid)
녹색식물과 어떤 종의 곰팡이, 효모, 버섯, 세균 등이 만드는 황색, 적색, 자색(흡수극대 400~550nm) 등의 불용성 폴리엔색소. 대부분 탄소수가 40(때로는C30, C45, C50 등)이고 좌우대칭에 가까운 구조인 테트라테르페노이드이다. 토마토과실에 많은 리코펜(φ,φ-카로틴)을 원형(原型)으로 하여 그 분자의 양끝폐환(閉環), 산소화 등으로 생기는 500종 이상의 색소가 알려져 있다.
❍ 캡사이신(Capsaicin)
고추의 매운맛을 내는 무색의 휘발성 알칼로이드 화합물로 약용과 향료로 이용된다. 진통작용과 체지방 감소 효과가 있는 것으로 알려져 있다.
❍ 클로렐라(Chlorella)
클로렐라과의 비운동성 담수 조류로 건강 보조 식품, 유제품의 원료로 주로 사용된다.
❍ 키토산(Chitosan)
키틴을 탈아세틸화한 물질로 의약 분야에서는 인공 피부, 약물전달시스템 등에 응용되며 환경 분야에서는 응집제로도 사용된다. 세포를 활성화해 노화를 억제하고 면역력을 강화해 주며 질병을 예방해 주는 것으로 알려져 있어 건강 기능 식품의 소재로 사용된다.
❍ 타닌(Tannin)
다가페놀을 포함하며 유피성(鞣皮性)의 복잡한조성을 가진 식물 성분. 식물계에는 농도의 차이는 있으나 널리 분포하며 물관부, 수피, 잎, 과실, 뿌리 등에 들어 있다. 유혁작용의 주체는 다가페놀로서 단백질, 특히 콜라겐과 결합하여 동물의 생피를 안정된 가죽으로 변성하게 한다. 알칼로이드와 침전반응을 하고 3가의 철이온과 결합하여 녹색 또는 흑자색의 착화합물을 형성한다.
❍ 페니실린(Penicillin)
푸른곰팡이(penicillium)가 생산하는 β-락탐계의 4원자 고리화합물의 항생 물질로 세균의 세포벽 구성 성분인 펩티도글리칸의 합성을 저해하는 대표적인 세균 감염증 치료제이다. 모핵은 6-아미노페니실란산(6-amino peni-cillanic acid, 6-APA)으로, 치환기를 화학적으로 수식한 많은 종류의 유도체(반합성 페니실린)가 개발되었다. Flemming(1928)에 의해서 최초로 발견된 후, 생물공학기술에 의해 대량 생산이 가능하게 된 대표적인 생물산업 제품이다.
❍ 펙틴(Pectin)
식물의 세포벽이나 세포벽 사이에 존재하는 다당류의 하나로 주성분은 D-갈락투론산이 α-1,4 결합한 고분자이다. 팽윤성이 뛰어난 수용성 식이섬유로서 섭취 시 포만감을 주나 칼로리는 매우 낮다. 배변활동을 원활하게 하고, 지방흡수 저하, 지방합성 저해, 체지방 분해 등의 작용을 하므로 다이어트 식품의 원료로 사용된다.
❍ 폴리펩타이드(Polypeptide)
대략 10개 이상의 아미노산잔기로 이루어진 펩타이드이다. 단백질과 같은 뜻으로 쓰기도 하나 보통 분자량이 작은 단백질을 가리킬 때 쓰인다.
❍ 표지단백질(Marker protein)
특정 질병 진단의 척도로 사용되는 단백질로 특정 질병 상태에서 발현된다. 일례로 간암의 경우 혈액 내의 알파태아단백(AFP: α-fetoprotein)을 표지단백질로 사용한다.
❍ 표지유전자(Marker gene)
특정 형질에 대한 유전적 해석의 척도로 이용되는 유전자, 유전질환, 약제내성(항생물질 내성 등), 염도 감수성, 영양 요구성 등을 유전적으로 판단하는데 이용된다.
❍ 프로바이오틱(Probiotic)
인간의 건강에 이로운 생균제 식이보조물 또는 생균 성분이다. 유산균 식품과 표모 체제가 대표적이다. Pro(촉진하는) biotic(생명체)의 합성어이다.
❍ 플랫폼 기술(Platform Technology )
신제품 개발과 생산 시스템에 범용적으로 활용되는 표준화된 하드웨어 및 소프트웨어 기술. 핵심 기술을 표준화, 모듈화, 공용화 함으로써 개방형 혁신 활동을 촉진하는 기술.
❍ 항상성효소(Constitutive enzyme)
세포의 생존, 성장과 함께 항상 발현되는 효소. 일상적인 배양조건 하에서 세포의 일상적인 기능을 수행하기 위한 효소들이 이에 해당된다. 이들의 유전자는 특정 대사물질에 의해 조절되는 작동 유전자(operator)를 가지고 있지 않다.
❍ 항체(Antibody)
생체 내에 들어온 항원에 반응해 만들어지는 당단백질이다. 해당 항원에 특이적으로 결합하며 면역글로블린(Ig)이라고도 한다.
❍ 핵산(Nucleic acid)
푸린 또는 피리미딘 염기, 오탄당(디옥시리보오스 또는 리보오스), 인산기로 이루어진 뉴클레오타이드 중합체이다. 당부분이 디옥시리보오스인 DNA와 당부분이 리보오스인 RNA 두 종류로 대별된다.
❍ 핵이식
어떤 세포로부터 핵을 떼어낸 뒤 다른 세포(핵을 제거한 것)에 이식하는 조작이다.
❍ 형질전환(Transformation)
어느 주의 유전형질 일부를 다른 주에 옮겨 넣는 유전교배의 한 형태로, 공여체로부터 추출한 고분자 DNA를 직접 수용체에 거두어 넣어 그 세포 중에서 재조합하는 경우이다.
❍ 형질전환생물(Transgenic organism)
인위적인 방법에 의하여 외래 유전자가 도입된 동식물과 미생물의 총칭이다. 보통 교잡육종으로는 얻어질 수 없는 형질을 가진 생물체를 말한다.
❍ 호르몬(Hormone)
미량으로도 효능을 나타내는 생리활성 조절 물질이다. 척추동물의 호르몬은 펩타이드계(인슐린, 글루카곤, 뇌하수체 호르몬, 부갑상선 호르몬), 아미노산 유도체계(아드레날린, 갑상선 호르몬), 스테로이드계(성 호르몬, 부신피질 호르몬)로 나누어진다.
❍ 효모(Yeast)
구형의 단세포로 존재하며 주로 출아법에 의해 증식하는 진균류(fungi)의 한 종류로 양조, 제빵 등에 이용되는 Saccharomyces cerevisiae가 대표적이다. Saccharomyces, Hansenula, Pichia 속에 속하는 효모는 재조합 단백질 생산에 이용한다.
❍ 효소(Enzyme)
생체 내에서 만들어지는 단백질 생촉매. 생체 내의 화학반응은 거의 모두가 효소 반응에 의해 촉진된다. 산화환원효소, 전이효소, 가수분해효소, 라이에이즈, 이성질화효소, 라이게이즈의 여섯 가지 종류로 분류한다.
❍ 효소공학(Enzyme engineering)
효소 촉매의 특성, 관련 기술, 물질, 장비를 수단으로 하는 방법과 기술의 총체이다.
❍ 휴면세포(Resting cell)
살아 있기는 하나 증식은 하지 않는 상태의 세포를 말한다. 배양액으로부터 세포를 수확하여 적당한 완충액에 현탁시킬 경우 세포들이 분열 증식을 하지 않는 상태로 상당기간 유지될 수 있다. 포자 등의 휴면형의 세포나 핵분열 사이클의 간기에 있는 세포를 지칭하는 경우도 있다.
❍ B-세포(B-cell)
골수 모세포로부터 유래한 림프구의 일종이다. 일반적으로 골수에서 면역세포로 성숙한다. 항원과 반응해 체액성 면역에 관여하는 항체를 분비하는 형질 세포(plasma cell)가 된다. B-림프구라고도 한다.
❍ DNA중합효소(DNA polymerase)
DNA 중합을 촉진하는 효소이다. 주형(template)DNA의 염기 배열 순서에 맞추어서 이에 서로 상보적인 염기를 지닌 디옥시리보뉴클레오타이드(deoxyribonucleotide, dNTP)를 인산이중 에스터(phosphodiester) 결합으로 연결함으로써 새로운 DNA 사슬을 5’에서 3’ 방향으로 합성한다. DNA의 복제와 회복에 관여하는 중요한 효소이다.
❍ RNA(Ribonucleic acid (RNA))
리보오스, 염기(구아닌, 아데닌, 시토신, 우라실), 인산기로 이루어진 뉴클레오타이드의 중합체로 DNA와 함께 핵산의 일종이다. 전령RNA, 운반RNA, 리보좀RNA(rRNA: ribosomal RNA)의 세 종류가 대표적이다.
❍ T-세포(T-cell (T-lymphocyte))
흉선에서 유래하는 면역 관련 림프구이다. B-세포의 항체생산을 촉진하는 헬퍼 T-세포, 억제하는 억제 T-세포, 특이적으로 표적세포를 상해하는 킬러 T-세포 등으로 나누어진다.
생명공학의 정의 및 범위
1. 생명공학의 정의
가. OECD에서의 생명공학의 정의
지식, 재화 및 서비스의 생산을 목적으로 생물 또는 무생물을 변형시키는 과정에서 생물체, 생체유래 물질 및 생물학적 모델에 과학과 기술을 적용하는 활동을 말한다.
나. Biotechnology Industry Organization(BIO)에서의 생명공학의 정의
생명공학산업기구(Biotechnology Industry Organization, BIO)에서는 생명공학을 “문제해결 혹은 유용제품 생산을 위한 세포 및 생물분자적 과정의 이용”으로 정의하고 있다.
다. 「생명공학육성법」에서의 생명공학의 정의(2008.2.29)
산업적으로 유용한 생산물을 만들거나 생산 공정을 개선할 목적으로 생물학적 시스템, 생체, 유전체 또는 그들로부터 유래되는 물질을 연구․활용하는 학문과 기술을 말한다. 생명현상의 기전, 질병의 원인 또는 발병과정에 대한 연구를 통하여 생명공학의 원천지식을 제공하는 생리학, 병리학, 약리학 등의 학문(기초의과학)을 통칭하고 있다.
라.「제7회 과학기술관계장관회의(2005. 5. 26)」에서의 생명공학의 정의
제7회 과학기술관계장관회의(2005. 5. 26)의「바이오 연구개발의 효율적 추진방향(안)」에 따르면, 생명공학이란 생물체의 기능과 유전정보를 규명하고 이를 이용․활용하여 산업 및 인류복지에 응용하는 과학기술을 총칭한다.
이는 생명과학, 생명공학 및 생명공학 활용 신약개발 관련 화학을 포괄하는 광의의 개념이다. 생물체의 기능과 정보는 생명현상을 일으키는 생체나 생체 유래물질 또는 생물학적 시스템의 탐구로부터 획득이 가능하다.
[표 부록-5-1-1] 생명과학, 생명공학, 화학의 개념
|
분야 |
개념 |
비고 |
|
생명과학 |
생명현상이나 생물의 여러 가지 기능을 밝히고 그 성과를 의료 등 인류복지에 응용하는 종합과학 |
|
|
생명공학 |
생물체, 생물전자․정보를 이용하여 산업적으로 유용한 생산물을 만들거나, 개선하는 학문과 기술 |
|
|
화학 |
물질의 성질, 조성, 구조 등을 다루는 학문과 기술 |
-최근 신소재개발과 생명현상을 탐구하는 부분에 관심 증대 -기존의 신약개발과 새로운 신약개발 방법의 융합화 현상 |
|
화합물 신약 |
전통적인 Chemical drug을 주로 말하며 저분자(기존방법) 화합물 위주 |
|
|
바이오신약 |
생명현상의 원리 규명에서부터 시작하며 단백체(새로운 방법), 유전체, 줄기세포 등 새로운 개념을 도입한 치료제 |
바이오신약과 화합물 신약 모두 생명공학 영역으로 포함하는 추세 |
[표 부록-5-1-2] 바이오기술의 개념
|
바이오기술 〓 생명과학 + 생명공학 + 화학(신약) |
2. 생명공학의 범위
생명공학이 다른 첨단 기술 즉 IT, NT등과 융합되고 관련 기반학문들이 통합되면서 생명공학의 범위가 계속 확대되고 동시에 전통적인 경계들이 모호해지는 경향을 가진다.
가. 제2차 생명공학육성기본계획(Bio-Vision 2016)에서의 생명공학의 범위
제2차 생명공학육성기본계획(Bio-Vision 2016)에는 생명공학기술을 총 5개 분야 즉 1) 생명공학 2) 보건의료 3) 농축산․식품 4) 산업공정/환경․해양수산 5) 바이오 융합의 총 5개 분야로 대분류하고 “국가과학기술표준분류”의 세부기술 목록에 따라 재분류함으로써 객관적 기준을 적용하였다.
[표 부록-5-2-1] 제2차 생명공학육성기본계획(Bio-Vision 2016)에서 분류한 생명공학기술
|
분야 |
기본계획 분류 |
과학기술 표준 분류상의 범위 |
|
생명과학 |
◦유전체, 단백체 ◦세포체, 대사체 ◦뇌과학, 생체기능 ◦생체네트워크 |
C06 생화학, E01분자세포생물학, E02유전학/유전공학, E03발생/신경생물학, E04면역학/생리학, E05분류/생태/환경생물학, E06생화학/구조생물학 등 기타(B0901, C0107, C0201, C0207 등) |
|
보건의료 |
◦기초의과학 ◦임상의과학 ◦제품화기술 ◦인허가 |
G01의생명과학, G02 임상의학, G03 의약품/의약품개발기술, G04 치료/진단기기, G06 의료정보/시스템, G07 한의과학, G08 보건학, G09 간호과학, G10 치의과학, G15 독성/안정성관리 기반기술 등 기타(G1206 등) |
|
농림수축산 ․ 식품 |
◦농림수축산 생명연구자원 확보 및 오믹스 활용 기술 ◦농림수축산 자원 활용 바이오에너지 개발 ◦기능성 식품 및 소재 개발 ◦신품종 육종기술 및 유전자변형 농림수축산 생물개발 ◦안정성 평가 기반 |
F01식량작물과학, F02원예작물과학, F03농생물학, F06동물자원과학, F07 수의과학, F13수산양식, F17식품과학, F18식품영양과학 기타(F0401, F0506 등) |
|
산업공정/ 환경 ․ 해양 |
◦생물산업공정 ◦환경생명공학 ◦해양생명공학 |
E05분류/생태/환경생물학, E08 생물공학, E09 산업바이오, E10 바이오공정/기기, J04생물화학공정기술, D10 해양생명, O04생태계 복원/관리, O06해양환경, E11 생물위해성 등 기타(C1002, D0803, D1109, M0603 등) |
|
바이오 융합 |
◦BT-IT 융합기술 ◦BT-NT 융합기술 ◦BT-IT-NT 융합기술 ◦BT-타기술(BT-RT, GT, CS) |
E07 융합바이오 기타(C1006, E1002 등) |
출처: 제2차 생명공학육성기본계획(Bio-Vision 2016), 교육과학기술부, 2008
[그림 부록-5-2-1] 제2차 생명공학육성기본계획(Bio-Vision 2016)에서 분류한 생명공학기술

출처: 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006
나. 제7회 과학기술관계장관회의에서의 생명공학의 범위
제7회 과학기술관계장관회의「바이오 연구개발의 효율적 추진방향」의 자료에 따르면 생명공학의 범위를 1) 생명의약/의약 2) 농림축산/식품 3) 생물전자/정보 4) 생물공정/화학으로 분류하고 있다.
[그림 부록-5-2-2] 제7회 과학기술관계장관회의에서의 생명공학의 범위

출처: 바이오 연구개발의 효율적 추진방향(제7회 과학기술관계장관회의), 과학기술혁신본부, 2005
다. 「생명공학육성법」에서의 생명공학의 범위
생명공학에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법(생명공학육성법 : 국회법률지식정보시스템 공개)에 의한다.

![]() ㄱ
ㄱ
게놈(Genome) ∙ 19, 20, 48, 56, 65, 72, 130, 173, 200, 212, 243, 301, 303, 304, 305, 314, 315, 320, 321, 363, 369, 398, 434, 435, 436, 437, 438, 439, 440, 441, 536, 540, 544
계대배양(subculture) ∙ 540
공통서열(consensus sequence) ∙ 540
과변이(hypervariability) ∙ 540
광학분할(optical resolution) ∙ 540
구조생물학(Structural biology) ∙ 26, 246, 537, 570
균사체(mycelium) ∙ 540, 544
그린바이오(Green Bio) ∙ 91, 186, 189, 190, 199
글라이코믹스(Glycomics) ∙ 535
글루코사민(glucosamine) ∙ 541
기능성식품(functional food) ∙ 29, 143, 155, 199, 462, 541, 559
기능유전체학(Functional genomics) ∙ 22, 356, 535
![]() ㄴ
ㄴ
나노기술(Nanotechnology) ∙ 13, 27, 85, 161, 210, 325, 326, 327, 328, 537, 541
나노바이오 ∙ 19, 326, 328, 331, 332, 537, 541, 559
나노바이오테크놀로지(Nanobiotechnology) ∙ 541
내포체(inclusion body) ∙ 541
녹색성장 ∙ 1, 2, 3, 4, 5, 7, 33, 90, 91, 94, 128, 133, 138, 139, 569
뇌과학(Brain science) ∙ 83, 252, 253, 254, 255, 256, 257, 448, 514, 516, 518, 537, 559, 570
뇌연구촉진기본계획(Brain Tech 21) ∙ 86, 514
![]() ㄷ
ㄷ
단백질(Protein) ∙ 20, 22, 23, 25, 28, 51, 55, 61, 65, 89, 106, 142, 145, 153, 170, 171, 172, 173, 174, 175, 199, 200, 201, 202, 214, 215, 216, 217, 218, 219, 220, 224, 226, 244, 245, 246, 247, 248, 249, 250, 251, 259, 266, 267, 268, 274, 292, 293, 297, 299, 301, 303, 304, 305, 307, 308, 309, 310, 315, 318, 320, 325, 326, 328, 329, 332, 337, 340, 341, 343, 344, 350, 363, 395, 396, 397, 398, 403, 404, 406, 407, 414, 419, 420, 426, 429, 430, 431, 434, 435, 436, 439, 440, 442, 443, 462, 535, 536, 537, 540, 541, 542, 543, 545, 546, 547, 548, 550, 553, 554, 555, 559, 570
단백질공학(Protein engineering) ∙ 61, 65, 537, 550
단백질삼차구조(Tertiary structure of protein) ∙ 541
단백질의약품 ∙ 267, 268, 274, 414, 420
단백질체학(Proteomics) ∙ 20, 22, 214, 219, 303, 307, 315, 320, 535
단백질칩(Protein chip) ∙ 89, 106, 326, 332, 419, 541, 542
단세포단백질(Single-cell protein(SCP)) ∙ 542
단일염기변이(SNP) ∙ 307, 397
단일클론항체(Monoclonal antibody) ∙ 432, 542
당쇄공학(Glyco engineering) ∙ 537
대사공학(Metabolic engineering, Metabolomics) ∙ 6, 12, 14, 347, 537, 559
대사체학(Metabolomics) ∙ 95, 225, 226, 227, 228, 231, 232, 235, 236, 237, 536
독성유전체학(Toxicogenomics) ∙ 536
돌연변이(Mutation) ∙ 7, 13, 192, 201, 309, 316, 364, 365, 367, 429, 433, 538, 542, 552
동물자원기술(animal resources technology) ∙ 542
동형접합체(homokaryon) ∙ 543
![]() ㄹ
ㄹ
루틴(rutin) 543
![]() ㅁ
ㅁ
마이코톡신(mycotoxins) ∙ 543
마이크로어레이(Microarray) ∙ 5, 6, 307, 308, 309, 315, 319, 320, 326, 327, 543, 545
맞춤의학 ∙ 43, 117, 218, 299, 300, 301, 314, 315, 316, 325, 414
맞춤의료
면역억제제(Immunosuppressive agents/immunosuppressants) ∙ 288, 291, 543
면역유전학(Immunogenetics) ∙ 538
면역치료제(Immunotherapeutic) ∙ 543
미생물(Microorganism) ∙ 4, 6, 12, 13, 14, 18, 19, 29, 31, 59, 64, 65, 71, 72, 89, 97, 100, 101, 106, 108, 109, 127, 130, 136, 142, 144, 145, 155, 156, 170, 171, 173, 174, 179, 180, 182, 183, 184, 185, 186, 187, 188, 199, 200, 202, 227, 232, 238, 240, 242, 308, 321, 323, 346, 347, 348, 349, 350, 351, 352, 353, 356, 357, 361, 363, 364, 366, 367, 368, 369, 370, 371, 393, 394, 395, 396, 397, 398, 400, 401, 402, 407, 419, 426, 427, 428, 429, 431, 433, 436, 440, 450, 453, 460, 461, 462, 470, 500, 540, 542, 544, 545, 547, 549, 555, 572
![]() ㅂ
ㅂ
바이러스(virus) ∙ 59, 70, 71, 74, 170, 174, 201, 202, 212, 267, 269, 271, 273, 276, 282, 283, 285, 295, 305, 329, 338, 339, 340, 343, 344, 356, 426, 427, 428, 429, 430, 433, 434, 435, 437, 438, 442, 544, 550
바이오 경제 95
바이오디젤(biodiesel) ∙ 4, 69, 144, 544, 545
바이오리파이너리(Biorefinery) ∙ 13, 348, 349, 544,
바이오마커 ∙ 7, 21, 213, 216, 217, 218, 220, 245, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 570
바이오매스 (biomass) ∙ 12, 13, 31, 68, 104, 132, 133, 138, 348, 349, 415, 416, 417, 544, 545
바이오멤스(bioMEMS) ∙ 544
바이오센서(Biosensor) ∙ 6, 7, 13, 18, 19, 66, 123, 124, 328, 331, 332, 353, 462, 541, 545
바이오시밀러
바이오식품
바이오신약 ∙ 83, 86, 89, 164, 165, 186, 219, 259, 262, 266, 267, 274, 275, 278, 279, 282, 288, 289, 291, 292, 343, 359, 403, 420, 448, 450, 463, 558, 570
바이오안전성 ∙ 154, 157, 158, 187, 188, 199, 321, 335, 375, 376, 379, 380, 381, 382, 384, 519, 520, 523, 525, 527, 528, 529, 530, 571
바이오에너지(Bioenergy) ∙ 4, 18, 31, 32, 49, 68, 95, 129, 140, 144, 168, 186, 347, 348, 349, 350, 357, 358, 359, 419, 420, 457, 458, 545
바이오연료(Biofuel) ∙ 4, 5, 6, 12, 13, 14, 28, 31, 54, 139, 153, 348, 419, 545
바이오융합 ∙ 86, 87, 185, 186, 447
바이오장기 ∙ 22, 23, 105, 106, 107, 111, 186, 279, 282, 285, 286, 287, 288, 290, 291, 292, 341, 388, 389, 570
바이오칩(Biochip) ∙ 18, 19, 19, 22, 23, 65, 124, 326, 327, 328, 331, 332, 542, 545
바이오필터(Biofilter) ∙ 545
박테리오신(bacteriocin) ∙ 546
발현벡터(Expression vector) ∙ 546
배아 ∙ 15, 41, 60, 71, 72, 221, 223, 224, 385, 386, 387, 389, 393, 407, 436, 437, 442, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 489, 490, 491, 492, 493, 494, 495, 546
배아줄기세포(Embryonic stem cell(ESC)) ∙ 41, 60, 71, 221, 223, 224, 385, 386, 389, 393, 407, 437, 442, 546
보건의료 ∙ 4, 11, 12, 15, 20, 23, 28, 40, 42, 87, 92, 99, 109, 110, 111, 112, 113, 117, 126, 152, 164, 166, 186, 199, 207, 219, 259, 301, 322, 359, 382, 447, 448, 559, 569, 570
복제 ∙ 103, 107, 202, 284, 286, 287, 288, 289, 290, 292, 341, 342, 361, 393, 397, 402, 410, 429, 430, 431, 432, 433, 434, 437, 438, 439, 440, 475, 477, 478, 483, 484, 490, 492, 493, 495, 546, 556
복제 DNA(Cloned DNA) ∙ 546
복제동물(Cloned animal) ∙ 292, 546
복제장기(Cloned organ) ∙ 546
분자생물학 ∙ 26, 97, 100, 101, 127, 179, 180, 182, 183, 184, 220, 238, 305, 307, 308, 349, 357, 453
![]() ㅅ
ㅅ
생명과학 ∙ 26, 39, 40, 42, 43, 44, 45, 48, 73, 87, 97, 99, 100, 101, 103, 127, 129, 134, 151, 152, 156, 162, 163, 177, 201, 207, 224, 225, 251, 274, 275, 279, 315, 347, 363, 397, 407, 417, 447, 451, 462, 463, 464, 474, 475, 476, 477, 478, 489, 491, 506, 538, 539, 558, 559, 570, 572
생명윤리(bioethics) ∙ 157, 158, 385, 386, 387, 388, 389, 390, 391, 396, 397, 398, 469, 475, 476, 477, 478, 483, 486, 489, 490, 491, 495, 496, 499, 547, 571
생명자원 ∙ 85, 90, 103, 134, 140, 141, 142, 151, 152, 154, 155, 157, 288, 336, 358, 359, 361, 362, 371, 547
생명정보 ∙ 243, 303, 304, 305, 307, 308, 309, 310, 313, 314, 315, 316, 318, 319, 320, 321, 322, 325, 361, 547
생물공정(bioprocess) ∙ 18, 57, 127, 156, 170, 173, 176, 347, 348, 349, 359, 462, 547, 559, 560, 570
생물농업
생물다양성 ∙ 108, 130, 131, 138, 141, 144, 152, 153, 322, 325, 361, 370, 375, 384, 470, 519, 520, 521, 523, 524, 526, 527, 529, 547, 548
생물다양성보존(Biodiversity conservation) ∙ 548
생물산업(Bioindustry) ∙ 62, 63, 64, 65, 66, 67, 69, 73, 93, 131, 155, 156, 161, 168, 184, 185, 186, 187, 188, 196, 198, 199, 364, 548, 553
생물안전성(Biosafety) ∙ 548
생물융합기술(Biohybrid technology) ∙ 548
생물의약(Biopharmaceutical) ∙ 17, 64, 66, 67, 68, 69, 70, 137, 170, 171, 173, 187, 188, 193, 199, 277, 394, 411, 460, 461, 462, 463, 506, 548
생물전자공학
생물정보학(Bioinfomatics) ∙ 4, 19, 42, 56, 232, 239, 309, 322, 323, 325, 538
생물학적지표(Biological indicator) ∙ 548
생물화학
생물환경
생체고분자(Biomolecule) ∙ 330, 548
생체공학(bionics) ∙ 538
생체모방기술(Biomimetics) ∙ 549
성체줄기세포(Adult stem cell) ∙ 221, 223, 410, 491, 549
세포공학(Cell engineering) ∙ 107, 127, 538
세포융합(Cell fusion) ∙ 48, 49, 266, 269, 375, 416, 519, 538, 549, 550, 552
세포치료기술 ∙ 549
시스템생물학(Systems biology) ∙ 20, 22, 27, 28, 226, 227, 231, 237, 238, 239, 240, 241, 242, 243, 244, 315, 538, 570
신재생에너지
![]() ㅇ
ㅇ
안전성 ∙ 18, 24, 42, 93, 103, 105, 106, 108, 132, 157, 164, 166, 185, 186, 188, 192, 199, 222, 237, 262, 266, 278, 285, 333, 335, 336, 337, 338, 339, 340, 344, 345, 346, 353, 377, 378, 388, 403, 404, 405, 411, 440, 461, 507, 508, 519, 520, 529, 559
알츠하이머병(Alzheimer's disease) ∙ 252, 549
약리유전체학(Pharmacogenomics) ∙ 536
약물전달시스템(Drug delivery system(DDS)) ∙ 13, 27, 89, 549, 553, 560
염기서열 ∙ 72, 207, 208, 209, 210, 211, 212, 305, 307, 315, 317, 324, 370, 437, 441, 540, 550
예방의학
유전공학(Genetic Engineering) ∙ 55, 83, 85, 86, 127, 170, 173, 174, 283, 329, 353, 357, 364, 395, 396, 397, 429, 433, 434, 435, 471, 472, 550, 559
유전체학(Genomics) ∙ 20, 95, 97, 207, 239, 303, 307, 311, 313, 315, 317, 319, 323, 536, 536
인간화항체(Humanized antibody) ∙ 270, 550
인공장기(Artificial organ) ∙ 113, 279, 281, 282, 286, 287, 290, 546, 550
인터페론(Interferon(IFN)) ∙ 274, 406, 433, 435, 550
![]() ㅈ
ㅈ
자가면역질환(Autoimmune disease) ∙ 74, 551
재생의약
재조합 DNA 기술(Recombinant DNA technology) ∙ 551
저분자
전임상(Preclinical) ∙ 24, 25, 90, 156, 164, 217, 263, 266, 274, 275, 276, 277, 278, 279, 288, 289, 551
제대혈(Cord blood) ∙ 409, 410, 461, 462, 551
조직공학(Tissue engineering) ∙ 7, 279, 281, 282, 285, 286, 287, 289, 539
줄기세포(Stem Cell) ∙ 13, 20, 22, 40, 41, 60, 65, 71, 72, 85, 114, 201, 202, 221, 222, 223, 224, 279, 281, 282, 287, 341, 385, 386, 388, 389, 390, 393, 404, 407, 408, 409, 410, 415, 437, 439, 442, 443, 461, 475, 482, 483, 489, 490, 491, 494, 498, 546, 549, 551, 558, 570
줄기세포치료[stem cell therapy] ∙ 222, 461, 551
중개연구
진세노사이드[ginsenoside] ∙ 551
진핵생물(Eukaryote) 308, ∙ 552
진핵생물[eucaryote] 308, ∙ 552
![]() ㅊ
ㅊ
천연물신약
체세포돌연변이(Somatic mutation) ∙ 542, 552
체세포변이(Somaclonal variation) ∙ 552
체세포융합(Somatic cell hybridization) ∙ 552
치료용효소(Therapeutic enzyme) ∙ 552
캡사이신(Capsaicin) ∙ 552
![]() ㅋ
ㅋ
클로렐라(Chlorella) ∙ 553
키토산(Chitosan) ∙ 553
![]() ㅍ
ㅍ
페니실린(Penicillin) ∙ 428, 429, 443, 553
펙틴(Pectin) ∙ 553
폴리펩타이드(Polypeptide) ∙ 553
표지단백질(Marker protein) ∙ 554
표지유전자(Marker gene) ∙ 554
프로바이오틱(probiotic) ∙ 554
![]() ㅎ
ㅎ
합성신약 ∙ 7, 13, 259, 260, 262, 264, 265, 403, 570
항상성효소(Constitutive enzyme) ∙ 554
항체[antibody] ∙ 22, 48, 50, 51, 67, 70, 170, 171, 172, 173, 174, 175, 220, 224, 259, 266, 267, 269, 270, 273, 275, 276, 279, 284, 397, 407, 414, 432, 435, 437, 462, 541, 542, 549, 550, 554, 556
해양바이오
핵산[nucleic acid] ∙ 170, 171, 173, 174, 308, 309, 399, 430, 519, 548, 554, 556
핵이식 ∙ 285, 475, 476, 483, 554
혈액학(hematology) ∙ 539
형질전환(transformation) ∙ 30, 65, 66, 103, 105, 153, 157, 170, 171, 173, 174, 176, 200, 283, 284, 285, 286, 287, 288, 289, 290, 292, 323, 334, 335, 340, 341, 342, 343, 344, 346, 351, 352, 353, 357, 369, 433, 439, 441, 555
형질전환생물[transgenic organism] ∙ 555
호르몬[hormone] ∙ 17, 18, 188, 201, 232, 266, 274, 275, 337, 341, 406, 407, 428, 433, 436, 541, 555
화학유전체학(Chemical Genomics) ∙ 22, 536
환경생명공학(environmental biotechnology) ∙ 127, 349, 350, 351, 352, 353, 354, 539, 559
효모[yeast] ∙ 227, 240, 407, 425, 429, 432, 436, 439, 542, 544, 552, 555
효소(enzyme) ∙ 4, 6, 12, 14, 22, 31, 68, 127, 144, 156, 170, 171, 172, 173, 174, 175, 200, 210, 217, 225, 248, 266, 284, 289, 308, 309, 325, 326, 347, 348, 356, 366, 395, 396, 407, 419, 426, 430, 431, 432, 433, 434, 435, 436, 442, 461, 537, 540, 541, 542, 551, 552, 554, 555, 556
효소공학(enzyme engineering) ∙ 127, 170, 171, 172, 175, 347, 555
휴면세포[resting cell] ∙ 556
![]() B
B
B-세포[B-cell] ∙ 556
![]() D
D
DNA중합효소[DNA polymerase] ∙ 556
![]() R
R
RNA[ribonucleic acid (RNA)] ∙ 51, 272, 303, 329, 430, 433, 438, 439, 440, 441, 442, 443, 540, 544, 550, 554, 556
![]() T
T
T-세포[T-cell (T-lymphocyte)] ∙ 556













