2013 생명공학백서

- 발행일 2014-01-07
- 출처 생명공학백서2013(총서 제 214권)
- 담당자 오민정 ( 042-879-8378 / mjoh@kribb.re.kr )
- 조회수 26063
-
키워드
#생명공학백서
-
첨부파일
-
 2013생명공학백서.pdf
(다운로드 4659회)
바로보기
2013생명공학백서.pdf
(다운로드 4659회)
바로보기
-
-
차트+
개요
미래창조과학부에서는 ‘2013 생명공학백서’를 발간하였습니다.
바이오의 국가 정책 비전
생명의 신비를 알고자 했던 인류의 오랜 기원과 노력이 21세기에 들어서 유전정보에 기반 하면서 타 기술과 융합한 바이오기술을 통해 사회 경제 전반적이 분야에 그 파급효과를 나타내면서, 제품을 생산하거나 서비스를 제공하는 바이오산업이 차세대 가장 유망한 사업으로 주목받고 있는 이유는 고부가가치 및 고성장 산업으로의 잠재성을 가지고 있다고 평가될 뿐 아니라, 다른 산업에 미치는 파급효과가 매우 클 것이라는 예상 때문이다.
2013년 글로벌 바이오 산업시장은 2008년(2,163억 달러)보다 41.3% 증가한 3,057억 달러 규모로 성장할 것으로 전망되고 있으며, 국내 바이오산업 생산규모 역시 현재 23억 달러 규모로 2007년부터 2009년까지 연평균 23.2%씩 빠르게 증가하고 있으며, 글로벌 경제 위기 등의 불안정한 요소에도 불구하고 바이오 분야의 성장세는 가파르게 이어져 가고 있다. 장년기로 접어든 국내의 바이오기술투자에 대한 성과확산을 위한 정책과 전략을 점검하고, 바이오투자전략을 재정립하여 비전을 제시할 필요가 있다.
1. 바이오정책 - 창조경제 시대의 견인
2000년 6월 26일 미국의 빌 클린턴 대통령은 15년간 30억 달러를 투자하기로 한 정책결정에 의해 1990년 시작된 인간게놈지도 초안 작성결과를 발표하였다. 또한 프로젝트의 완성이 임박했음을 알리는 기자회견을 통해 미래지향적인 리더십을 세계에 과시하면서 생명공학 산업에서 미국의 선도적인 지위를 굳건히 하기 위한 포석을 공개하였다. 인간게놈프로젝트 성과에 대한 많은 불확실성이 있었음에도 불구하고 정책결정자의 안목과 전문가들의 노력에 의해 수행된 인간게놈프로젝트의 성과가 현 시점에 이르러 경제적 가치로 환산되어 발표되고 있다. 네이처(Nature)지는 2013년 6월 12일자 지면을 통해 미국 배틀메모리얼 연구소의 자료를 인용하며, 정확성에 대한 논란의 여지는 있지만, 염기서열분석에 투자된 공적자금 1달러로부터 178달러의 경제적 효과를 창출하고 있다고 보도하였다. 여기에 사람들에게 돌아가는 보건혜택과 같은 가치평가가 어려운 효과까지 더하면 그 성과규모는 더욱 커질 수 있다고 평가된다...........계속

![]()




1. 세계는 지금
국내·외 주요 기관에서 발표한 ʻ미래 예측 보고서ʼ에 따르면 생태계 파괴, 기후변화, 식량·물·에너지 부족, 인구의 고령화 등이 미래 주요 현안으로 대두되고 있다. 이러한 가운데 인류가 안고 있는 다양한 문제를 해결하기 위해 가까운 미래에 중요한 영향을 미칠 것으로 예상되는 유망 기술들로 약물전달 기술, 나노바이오의료센서 등 자연과 함께 건강하고 풍요로운 삶의 질 향상을 위한 바이오 연구개발 기술들이 주요 이슈로 떠오르고 있다.
이러한 미래 환경에 대한 예측과 더불어 세계 경제 위기 상황에서 전 세계적으로 새롭게 떠오른 화두가 ʻ창조경제ʼ이다. 박근혜 정부의 첫 번째 국정 목표이기도 한 ʻ창조경제ʼ와 관련하여 세계 각국도 여러 전략을 마련하고 있다. 미국의 경우 백악관과학기술정책처(OSTP)와 국가경제위(NEC)에서 지속 가능한 성장과 양질의 일자리 창출 촉진을 위해 ʻ국가혁신전략 개정안ʼ을 발표(2011.2) 하였다. 또한 오바마 대통령 취임사(2013.1) 및 국정연설(2013.2)을 통하여 산업 및 일자리 창출을 통하여 경제활력 유지를 강조하고 있다. 일본의 경우는 2020년까지 핵심 경제정책 방향을 담은 ʻ신성장 전략ʼ을 발표하였으며, 신성장 주도 전략분야로 환경 및 에너지, 의료 및 건강산업 등이 포함되어 있으며, 특히 경제성장 전략으로 성장동력과 창조산업 중심의1) ʻCool Japan Strategyʼ를 발표하여 추진하고 있다. 그밖에 유럽집행위원회는 경제성장 전략으로 ʻEUROPE 2020ʼ을 발표하였으며, 스마트 성장, 지속가능한 성장, 포용적 성장을 비전으로 제시하고 있다. 또한 EUROPE 2020 실현과 경제 성장 및 일자리 창출을 위해2) Creative Europe(2014~2020)을 추진하여 지원하고 있다.
2. 창조경제와 바이오경제시대
미래창조과학부의 ʻ창조경제의 개념 및 창조경제 실현ʼ을 위한 정부의 역할과 과학기술 분야의 정책과제를 제시한 ʻ창조경제 실현계획ʼ(ʼ13.6)에 따르면, 창조경제는 국민의 상상력과 창의성을 과학기술과 ICT에 접목하여 새로운 산업과 시장을 창출하고, 기존 산업을 강화함으로써 좋은 일자리를 만드는 새로운 경제 전략이라고 정의하고 있다. 또한 창조경제 실현을 위하여 과학기술의 역할을 강조하고 있으며, 과학기술부문에 대한 정부의 역할을 3대 정책과제로 제시하고 있다.

[그림 특집 1-1] 창조경제 실현을 위한 정부의 역할: 4대분야
이 가운데 생명공학 분야는 기아 및 질병, 에너지 문제 해결 등 인류 생존과 더불어 글로벌 경제 위기의 출구로서 핵심적인 역할을 수행할 것으로 기대되고 있다.

출처 : 생명공학정책연구센터. ʼ13.4
[그림 특집 1-2] 바이오 트랜드에 따른 바이오 연구개발 이슈 도출
세계 BT의 산업 시장 규모가 2010년 1,535억불에서 2015년 3,090억불로 예상되는 가운데 다양한 융합기술의 등장으로 에너지, 환경, 화학 및 전자산업 등으로 그 영역이 확산되고 있는 추세이다. 최근 BT 기술과 IT, NT 기술의 융합을 통해 다양한 형태의 응용연구가 활발하게 진행되고 있다. 이러한 추세속에 전 세계적으로 바이오경제시대를 준비하기 위한 정부의 육성정책이 활발히 추진되고 있으며, 바이오 R&D 예산은 지속적으로 증가 추세에 있다. 우리 정부의 바이오 R&D 예산은 1994년 536억원에서 2012년 1조 6,814억원으로 약 30배 예산이 증가 추세를 보이고 있다.

출처 : 생명공학정책연구센터
[그림 특집 1-3] 한·미 정부투자 비교
생명공학육성기본계획에 따르면 1차 생명공학육성기본계획(ʼ94~ʼ06)을 연구 기반 조성단계로, 제2차 생명공학육성기본계획(ʼ07~ʼ16)에 해당되는 시기를 원천기술 확보 및 산업인프라 구축 단계로, 그리고 2017년부터 시작되는 제3차 기본계획 단계에 핵심분야 산업화 달성 및 경쟁력 유지 강화를 목표로 하고 있다.

[그림 특집 1-4] 생명공학육성기본계획 중점 추진방향
이러한 생명공학 분야의 산업화 달성은 세계 바이오 경제시대를 극복할 수 있는 미래와 창조경제 달성이라는 긍정적 효과를 기대할 수 있을 것이다.
3. 창조경제 실현을 위한 BT분야 투자전략
미래창조과학부는 그간 BT R&D 지원을 위하여 생명공학육성법 제정(ʼ83년), 생명공학육성기본계획 수립(ʼ94년~)·집행 등의 노력을 기울였으며 현재 창조경제 실현이라는 미래부 특성에 맞는 새로운 BT분야 R&D 지원체계를 마련하고자 BT 분야 투자전략을 발표(ʼ13.11)하였다.
주요 추진 방향으로는 BT분야 실용화 지원 강화, 질병 및 고령화 등 주요 이슈 대응형 R&D 투자 확대 그리고 BT R&D 투자 효율화를 위한 추진체계 마련을 제시하였고, 그 중 BT분야 실용화 지원 강화와 관련하여 기초부터 실용화까지 체계적으로 지원할 수 있도록 BT사업의 재편을 추진하고 있다.
첫 번째로 기존의 미래부 국책사업 분석을 통한 기초·중장기 원천·실용화 R&D인프라 등의 성격을 명확히 구분하고 향후 투자 비중을 재설정하며, 실용화 가능성이 있는 과제 중심으로 지원하되 기초 성격이 강한 과제는 기초연구 사업으로 일원화 하는 등의 추진전략을 제시하였다. 또한 성과 창출 촉진을 위한 기획·평가 방식을 개선하고 지원 체제를 구축할 예정이다. 이를 위해 병원․기업의 수요를 반영한 신규 사업을 발굴·기획하고 수요자 중심의 R&D로 전환 및 유도할 수 있는 평가체계를 구축하는 등의 전략을 제시하였다.
두 번째로 질병, 고령화 등 주요 이슈 대응형 R&D 투자 확대이다. 이는 주요 이슈 해결을 위하여 치매, 노화, 법과학, 인수공통감염병, 희귀난치성 질환 등 의생명 난제극복 기술(solution형)과 의료현장에서 필요한 공백기술, 예를 들어 진단·치료 로봇기술, 약물전달 최적화 기술, 인지과학 등과 같은 연구개발에 대한 투자를 확대함을 의미한다. 또한 사회이슈 해결형 과제에 대한 수요자, 관계기관, 이해당사자의 참여를 유도하여 기술개발, 제도정비, 상용화를 위한 솔루션 마련을 제시하였다.
마지막으로 BT R&D 투자 효율화를 위한 추진체계 마련이다. 이를 위하여 ‘범부처 BT분야 협의체를 구성을 통하여 산업화 역량을 제고하고 BT분야 R&D 투자 효율화를 위한 BT 법령 체계 개선을 주요 전략으로 제시하고 있다.
이러한 추진전략과 더불어 단․장기적 관점에서의 창조경제 실현에 기여할 수 있는 영역을 도출하여 분야별 중점 투자전략을 제시하였으며, 크게 신약개발, 줄기세포, 뇌연구, 유전체 연구, 차세대 의료기기 개발을 중심으로 중점 투자 전략을 마련하여 추진할 예정이다.

[그림 특집 1-5] 기술수준평가보고서 중 산업화 가능성 기술분야 분석자료
신약개발은 각종 질병의 치료 및 진행을 억제하기 위해서 인위적으로 투여하는 신물질을 의미하며, 높은 기술 진입 장벽 및 부가가치로 인해 선진국 위주의 개발이 이루어지고 있다. 신약개발은 미래부, 복지부, 산업부 3개 부처가 역할을 분담하여 단계별로 지원하고 있으며, 특히 미래부가 주로 지원하고 있는 단계는 신약개발에서도 성공확률이 가장 낮은(유효물질 과제가 개발이 진행되어 임상2상을 통과할 확률은 6%) ʻ시장실패 영역ʼ으로 국가 차원의 전략적 투자가 절실한 영역이다.
미래부는 신약개발에 있어 기초연구에서 임상단계까지 단절 없는 R&D 연계를 통한 사업화 성공 제고 및 신약개발의 우수 역량과 유전체, 줄기세포, 뇌연구 분야의 성과가 결합된 새로운 영역 개척, 관련 기관과의 효율적 연계를 통한 산학협력체계 강화 등을 추진할 계획이다.
줄기세포는 세포치료제 및 신약개발 효율화, 생체 조직공학 및 바이오 장기 등 다양한 분야에 활용이 가능하며 ʼ05년 69억 달러에서 ʼ12년 323억 달러(추정) 규모로 성장하였으며 ʼ15년 약 704억 달러 성장이 전망되는 분야이다. 우리나라는 ʼ12년 약 5억달러의 시장규모를 형성하며 줄기세포 치료의 시장 출시도 증가 추세를 보이고 있다. 미래부는 ʼ12년 수립된 ʻ줄기세포 R&D 투자 효율화 방안(국과위)ʼ 등에 따라 단기적으로 성체줄기세포치료제의 기능강화 등을 지원하고, 차세대 유전자 치료제 개발을 위한 유도만능줄기세포(iPS) 기술 및 ʻ직접교차분야ʼ 등 신기술 분야에 대한 중장기 원천기술 확보에 주력할 계획이다.
뇌연구는 뇌신경계의 신경생물학 및 인지 과학적 이해를 바탕으로 뇌의 구조 및 기능의 근본 원리를 파악하고자 하는 연구 분야로 뇌분야(뇌질환 치료, 뇌기능 모방·활용, 뇌능력 증진·개발) 등에 활용 가능한 핵심 원천 융합기술을 제공한다. 사회적으로도 노령화 추세에 따라 그 시장 규모도 점진적으로 증가세에 있는 분야이다. 뇌연구 분야에 대한 정부 R&D 투자는 미래부를 중심으로 뇌신경질환과 뇌신경생물분야에 중점적으로 지원되고 있다.
미래부는 이러한 인구의 고령화와 더불어 증가하는 노인성 질환(치매 등)과 뇌 관련 사회현안 해결에 필요한 뇌과학 핵심 원천기술을 조기 확보할 예정이다. 단기적으로 ʻ치매 예측 뇌지도 구축ʼ을 통한 치매 조기진단 원천기술개발, 뇌-ICT 융합 기반 실용화 연구, 중독 등 사회 이슈에 적극적으로 대응하고, 뇌연구 4대분야(뇌질환, 뇌신경생물, 뇌인지, 뇌공학)별 핵심 요소기술 발굴 및 뇌연구 저변확대 및 대규모 융합연구, 뇌연구 거점 기관과의 협력 강화를 통하여 중장기 원천기술 확보에 주력할 계획이다.
유전체(genome)는 유전자를 의미하는 ʻgeneʼ과 염색체를 의미하는 ʻchromosomeʼ의 합성어로, 세포내 유전물질의 총체를 의미한다. 유전체 관련 글로벌 시장은 국제 유전체 분석 시장이 연간 14.5% 이상 급성장하였으며 우리나라도 NGS 보급으로 국내 유전체 정보 분석 시장이 2011년 983억원에서 연평균 25%로 빠르게 성장하는 추세이다.
미래부는 ʻ다부처 유전체 R&D사업ʼ 착수(2014년)를 계기로 맞춤의료 서비스 제공을 위한 유전체 정보분석 기술개발 및 이를 위한 전문인력 양성과 국제협력 등 인프라 구축에 주력하고, 질병 조기 진단 및 개발 환자의 특성에 맞는 치료(맞춤의료) 구현에 필요한 ʻ개인 유전체 정보 분석 기술ʼ개발 지원과 정부 R&D 사업으로 생산된 유전체 정보를 국가생명연구자원정보센터(KOBIC)에 기탁할 수 있는 체계를 구축하여 유전체 DB 구축·관리의 중심기관으로 운영할 계획이다.
의료기기는 사람이나 동물에게 의료적 행위를 목적으로 사용되는 기구·장비·재료 또는 이와 유사한 모든 제품을 칭하며 전 세계적으로 고령사회 및 웰빙 확산 등의 이유로 세계 의료기기 시장은 크게 확대되고 있는 추세이다. 우리나라 역시 2004년 23억 달러에서 2010년 39억 달러로 연평균 9% 성장률로 급격하게 성장하고 있는 상황이다. 국내 정부투자의 경우 미래부, 복지부, 산업부 등 5개 부처·청을 중심으로 진행되었으며, 최근 3년(ʼ09~ʼ11년)간 총 6,247억원이 투자되었다.
미래부는 차세대 의료기기기반기술 분야에 단기적으로 BT-ICT 융합을 기반으로 한 모바일 의료기기 개발에 주력할 예정이며, 개발에 장시간 소요되지만 고부가 가치 창출이 가능한 영상진단장비 등 기술집약적 의료기기 기술개발에 장기적으로 집중 투자할 계획이다. 또한 신산업 창출 지원을 위한 ʻOpen Innovation 플랫폼ʼ 구축 등 산업화 연계체계를 마련할 계획이다.
4. 창조경제 실현을 위한 BT분야 산업화 전략
미래창조과학부는 창조경제 실현계획(ʼ13.6) 및 국정과제 이행 등을 위하여 BT 분야의 R&D 산업화 전략(안)을 수립할 계획이다. BT 분야는 IT 등과 같은 타산업과는 달리 고비용, 장기간 R&D, 임상장기화, 안전성 및 생명윤리 등과 같은 제품개발의 불확실성이 높은 분야이다. 이러한 특수성을 반영하여 ʻBT분야 산업화 전략ʼ을 수립하고 추진할 계획이다. 미래부 영역을 기존 R&D에서 비즈니스 개념이 도입된 R&BD로 확장되었다.
이에 따라 전주기적인 차원에서의 추진전략이 필요하다. 기존의 BT 사업을 기획에서 기술 확산까지 기술개발 전 단계에서 실용화 성과가 창출되도록 R&BD형으로 사업 관리체계를 개선해야 할 것이다. 단기간 산업화 가능한 기술에 대한 지원, 연계협력, 전략 수립, 체계적인 평가시스템 마련 등 전주기 차원에서의 추진 방향과 전략이 수립될 예정이다.
앞서 투자 전략(안)에 제시된 내용과 같이 신약, 줄기세포, 뇌연구, 유전체, 의료기기 분야가 중점적으로 추진될 예정이다. 신약분야의 경우 시장수요가 높은 질환 및 틈새시장인 감염성 질환 분야에, 줄기세포 분야는 시장성이 낮은 성체줄세포 치료제의 기술제고 및 희귀난치질환에 대한 세포치료제 개발, 뇌연구 분야는 뇌질환(치매 등) 정밀 진단을 위한 실용화 기반 기술 개발, 유전체 분야는 ʻ맞춤의료ʼ 염두한 기술개발, 마지막으로 의료기기 분야는 기술집약적 의료기기 상용화(ʼ17년~)를 위한 기술 개발에 중점 지원될 계획이다.

1. 왜 융합인가?
ʻʻ이미 세상에 존재하는 산업만으로는 일자리 창출과 경제 성장에 한계가 있다.ʼʼ 2013년 출범한 박근혜 정부의 국정 핵심 키워드는 ʻ창조경제ʼ이며 창조경제란 ʻʻ창의성을 핵심 가치로 두고 과학기술과 ICT(정보통신기술) 융합을 통해 산업과 산업이 융합하고 산업과 문화가 융합해서 새로운 부가가치를 창출하고 일자리를 만들어내는 것ʼʼ이다. 과학기술과 ICT를 세계 최고 수준으로 육성하여 신산업을 창출하고 각 산업에 융합·확산시켜 창조경제를 실현해야 함을 강조하고 있다. 이미 수많은 기술의 개발과 융합의 가속화로 인류사회의 패러다임이 변화하고 있다. 기존 기술·산업·학문 간의 상승적인 결합을 통해 새로운 창조적 가치를 창출함으로써 미래 경제 뿐 아니라 사회·문화의 변화를 주도하고 있다.

[그림 특집 2-1] 기술개발과 융합 가속화로 인한 인류 패러다임의 변화
2. 우리나라 BT-ICT 융합
이러한 추세속에 우리나라는 2008년 국가융합기술발전기본계획의 수립을 시작으로 국가융합기술발전계획을 수립하면서 전략적인 국가 융합 정책 및 사업을 추진하게 되었다. 2012년 국가융합기술발전시행계획에 따르면 11개 부처·청에서 66개 사업을 추진(ʼ12년 기준)하고 있으며 당시 교과부 21개, 지경부 13개, 농림수산식품부 10개 순으로 사업을 추진하였다. 생명공학육성기본계획 2단계 계획을 보면 5대 분야에서 바이오 융합 분야를 별도 분류하여 구분하였다.

[그림 특집 2-2] 제2차 생명공학육성기본계획의 5대 분야

[그림 특집 2-3] 바이오융합분야의 적용범위
최근 3년간(2009~2011)간 NTIS 기준으로 부처(미, 농, 산, 복)의 BT-ICT 융합사업의 총 투자액은 8,220억원으로 BT 투자의 16.5%를 차지한 것으로3) 조사되었다.
[표 특집 2-1] BT, BT-ICT 수행과제 추이
(단위 : 건(과제수))
|
|
2009년 |
2010년 |
2011년 |
|
BT 과제(a) |
6,515 |
8,227 |
8,520 |
|
BT-ICT 과제(b) |
1,032 |
1,529 |
1,654 |
|
비중(b/a, %) |
15.8 |
18.5 |
19.4 |
2011년 4개 부처 투자를 기준으로 정부 BT-ICT 융합 투자 포트폴리오를 분석한 결과 2011년도 BT-ICT 융합과제 대부분이 도입기(1,016개)와 성장기(540개)에 집중하였으며 성숙기(45개)는 미비함을 알 수 있다. 융합기술은 바이오칩센서, 생체신호처리, 생체영상처리, 생체정보분석활용, 생체정보생성저장 기술에 집중됨을 알 수 있고 미래부(전 교과부)의 융합기술의 스팩트럼이 타부처에 비해 가장 넓음을 알 수 있다.

[그림 특집 2-4] 정부 BT-ICT융합 투자 포트폴리오
3. BT-ICT 융합을 통한 창조경제 실현
건강한 생명 중심 사회, 풍요로운 바이오 경제구현되기 위한 BT와 ICT의 융합은 대용량의 개인 유전체 해석, 유전체화적인 질병관리, 개인맞춤형 진단 및 치료 시대가 도래 하면서 가속화 되고 있다. 유전체 해독 시장(의약, 식품, 바이오에너지 및 소비제품)은 11조원 규모이다. 포스트게놈 시대는 휴먼게놈프로젝트 이후 과학사에 새로운 전환점이 되었다. 개인 게놈 해독 비용과 데이터량 등 인간 유전체 분석에 있어 과학자의 고민이 시작되었던 것이다. 중요한 정보를 어떻게 찾을 것인가를 두고 볼 때 필요한 것은 바이오인포메틱스 전문가와 분석 알고리즘, 분석S/W 그리고 IT인프라였다. 이렇듯 많은 바이오 분야에서 IT와의 융합은 어쩌면 당연한 만남이었을 것이고 BT+ICT 융합은 신산업 창조에 핵심적 역할을 하여 창조경제 실현에 기여하게 될 것이라 기대하는 충분한 원인이었다고 할 수 있다. 즉 BT와 ICT 등 기술의 진보, 고객의 의식변화, 비용 효율 추구 정책 등으로 인하여 헬스케어 산업의 패러다임 혁신이 본격화될 전망이다.

1) D. J. Galas & L. Hood, Systems Biology and Emerging Technologies Will Catalyze the Transition from Reactive Medicine to P4 Medicine, IBC
출처 : SKT 성장기술원
[그림 특집 2-5] BT-ICT 융합 방향
그러기 위해서 BT-ICT 융합기술 개발의 전략적 지원체계구축, 이종기술분야의 기관간 소통 및 교류체계 구축, 산・학・연 다자간 연구사업 추진 및 장비 공동 활용 제도등이 마련되어야 할 것이다. 또한 융합형 연구조직 구축 및 조직문화 개선을 위한 시스템 도입, 융합 전문 인력 양성, 글로벌 표준화 선도 등을 통하여 새로운 성장동력화하는 노력이 필요할 것이다. BT-ICT 융합을 통한 새로운 기능 창출로 융합 서비스와 제품 시장을 선점하여 창조경제에 선순환이 이뤄지길 기대한다.
1) Cool Japan Strategy : 애니메이션, 패션, 먹거리 등의 문화산업을 ‘돈을 벌기 위한’ 중심 수단으로 육성하고 일본 문화의 인기를 비즈니스로 연결해 문화 부가가치 창출을 확대하기 위한 전략
2) Creative Europe(2014~2020) : 투자금액은 18억 유로이며, 문화, 음악, 공연예술, 문화유산 등 관련 산업 경쟁력 제고를 목표로 하고 있음
3) 조사대상 및 방법 : 최근 3년간(2009-2011)간 NTIS에 BT과제를 대상으로 BT-ICT 융합기술에 해당하는 11개 선정하여 분석



생명의 신비를 알고자 했던 인류의 오랜 기원과 노력이 21세기에 들어서 유전정보에 기반 하면서 타 기술과 융합한 바이오기술을 통해 사회 경제 전반적이 분야에 그 파급효과를 나타내면서, 제품을 생산하거나 서비스를 제공하는 바이오산업이 차세대 가장 유망한 사업으로 주목받고 있는 이유는 고부가가치 및 고성장 산업으로의 잠재성을 가지고 있다고 평가될 뿐 아니라, 다른 산업에 미치는 파급효과가 매우 클 것이라는 예상 때문이다.
2013년 글로벌 바이오 산업시장은 2008년(2,163억 달러)보다 41.3% 증가한 3,057억 달러 규모로 성장할 것으로 전망되고 있으며, 국내 바이오산업 생산규모 역시 현재 23억 달러 규모로 2007년부터 2009년까지 연평균 23.2%씩 빠르게 증가하고 있으며, 글로벌 경제 위기 등의 불안정한 요소에도 불구하고 바이오 분야의 성장세는 가파르게 이어져 가고 있다. 장년기로 접어든 국내의 바이오기술투자에 대한 성과확산을 위한 정책과 전략을 점검하고, 바이오투자전략을 재정립하여 비전을 제시할 필요가 있다.
1. 바이오정책 - 창조경제 시대의 견인
2000년 6월 26일 미국의 빌 클린턴 대통령은 15년간 30억 달러를 투자하기로 한 정책결정에 의해 1990년 시작된 인간게놈지도 초안 작성결과를 발표하였다. 또한 프로젝트의 완성이 임박했음을 알리는 기자회견을 통해 미래지향적인 리더십을 세계에 과시하면서 생명공학 산업에서 미국의 선도적인 지위를 굳건히 하기 위한 포석을 공개하였다. 인간게놈프로젝트 성과에 대한 많은 불확실성이 있었음에도 불구하고 정책결정자의 안목과 전문가들의 노력에 의해 수행된 인간게놈프로젝트의 성과가 현 시점에 이르러 경제적 가치로 환산되어 발표되고 있다. 네이처(Nature)지는 2013년 6월 12일자 지면을 통해 미국 배틀메모리얼 연구소의 자료를 인용하며, 정확성에 대한 논란의 여지는 있지만, 염기서열분석에 투자된 공적자금 1달러로부터 178달러의 경제적 효과를 창출하고 있다고 보도하였다. 여기에 사람들에게 돌아가는 보건혜택과 같은 가치평가가 어려운 효과까지 더하면 그 성과규모는 더욱 커질 수 있다고 평가된다.
[표 1-1-1] Cumulative Economic Impact of Human Genome Sequencing, 1988~2012
(단위 : 백만달러)
|
lmpact |
Employment (Job Years) |
Personal lncome |
Value Added |
Output |
State/Local Tax Revenue |
Federal Tax Revenue |
|
Direct Effect |
780,665 |
$ 86,656.6 |
$ 116,738.6 |
$ 333,401.8 |
$ 4,259.7 |
$ 16,100.9 |
|
Indirect Impacts |
1,504,671 |
$ 107,760.5 |
$ 170,397.3 |
$ 320,525.8 |
$ 12,742.5 |
$ 21,682.9 |
|
Indirect Impacts |
2,066,137 |
$ 98,310.0 |
$ 174,552.3 |
$ 311,696.1 |
$ 17,805.3 |
$ 21,146.0 |
|
Total Impacts |
4,351,472 |
$ 292,727.1 |
$ 461,688.2 |
$ 965,623.6 |
$ 34,807.6 |
$ 58,929.7 |
|
Impacts Multiplier |
5.57 |
3.38 |
3.95 |
2.90 |
|
|
출처 : Battelle data analysis and estimations:IMPLAN U.S. Economic Impact Models
2013년 2월, 미국 오바마 대통령은 의회연설에서 ʻʻ인간게놈프로젝트에 투자한 비용은 달러 당 140달러(배틀메모리얼연구소의 2011년 발표자료)의 경제적 효과로 돌아왔다ʼʼ고 밝히면서 백지상태라고 비판 받고 있던 미국의 미래성장전략을 위한 정책분야의 공백상태를 채울 투자분야로 뇌연구 프로젝트를 언급하였다. 그로부터 2개월이 지난 4월 3일, 성공여부도 불투명하지만 성공했을 때의 기대되는 경제효과도 산출하기 어려운 이 프로젝트에 대한 투자를 발표한 오바마 정부의 정책결정은 정부재정지출에 대한 이견으로 공박을 벌이고 있는 공화당 뿐 만 아니라 월스트리트의 경제분석가들에게도 긍정적인 평가를 받았을 뿐 아니라, 이로 인해 오바마 대통령은 글로벌 금융위기 이후 주요국 정치 리더 중 가장 앞서 차세대 성장엔진을 제시한 지도자로 떠올랐다.

[그림 1-1-1] 뇌연구 주요국 동향
위 두 가지 사례에서 볼 수 있듯이 기술의 특성상 그 성공여부와 성과가치를 가늠하기 어려운 혁신적이고 장기적인 전략이 필요한 바이오 분야에 대한 투자는, 거의 모든 산업분야의 기반이 가장 잘 구축되어 있는 미국에서 조차도 민간자본이 주축이 된 투자보다는 국가정책결정이 선행된 공공자본 투자에 의해서 견인되고 추진되는 사례가 일반적이다. 이는 바이오경제의 장기적인 발전은 경제·환경적으로 지속가능한 기술 및 제품에 대한 시장 창출과 유지 등 장기간 지속될 수 있는 후속연구와 정책을 필요로 하기 때문에 미래 바이오기술 응용의 기반이 될 다양한 정책 및 기획들이 필수적으로 수립되어야 하기 때문이다.

[그림 1-1-2] Bio-economy 시대를 준비하는 세계 주요국
2013년은 우리나라에서 정책적으로 바이오 투자가 시작된지 30년이 되는 해이다. 1983년에 처음 제정된 생명공학육성법에 기반하여 본격적인 투자가 시작되었고, 지난해 제2차 생명공학육성기본계획 2단계 계획이 수립되었다. 정부의 투자의지와 연구자들의 노력이 지속되어 바이오분야의 연구 및 산업화 역량의 비약적 발전을 이루어 내며 현 정부의 국정목표 추진을 위해 필요한 핵심적인 분야 중 하나로 자리매김 할 수 있는 토대를 마련하게 된 것이다. 이를 기반으로 삶의 질 향상에 기여하는 서비스화와 바이오경제를 견인할 산업화에 대한 바이오 투자전략이 마련되면 행복성장에 기여하는 과학기술로서의 역할을 충분히 수행할 수 있을 것이다.

[그림 1-1-3] 바이오 투자 전략
2. 바이오기술 - 행복성장에 기여하는 과학기술
바이오기술이 과학기술융합기반의 창조경제시대에 주목받는 이유는 질병, 에너지, 환경, 식량 등 인류가 직면한 4대 난제를 동시에 해결할 수 있기 때문이다. 세계 인구와 인간 활동의 증가는 지구촌 전체의 식량부족과 기아·빈곤, 환경·에너지 및 지구온난화, 고령화와 질병대책 및 예방 등의 문제를 해결해야 할 상황에 직면하고 있는데, 이러한 문제는 세계 전체가 직면한 해결해야할 과제이지만 자원 소국이면서 저출산·고령화가 매우 빠르게 진행되고 있는 우리나라에서 보다 현저하게 나타날 가능성이 높다. 바이오기술은 상기의 범지구적 과제 해결에 있어서 꼭 필요한 기술이면서 미래 성장전략의 한 축을 담당할 수 있는 핵심기술분야로 평가되고 있다. 상기의 문제들은 서로 연결되어 있어 개별적으로 해결할 수 없다. 해결책도 서로 연결되어 있다. 생명시스템 위에 복잡하게 얽혀있는 답을 찾기 위해서는 바이오기술(BT)은 물론 IT, NT, 수학 등 다학제 융합이 반드시 필요하다. 이와 같이 인류의 안전한 지속성장을 위해 해결해야 할 문제(그림1-1-4)들을 도출하고 과학기술융합을 통해 해결책을 찾는 과정을 창조경제활동이라고 정의할 수 있다. 이제 성장기에 들어선 우리나라의 바이오기술은, 성숙기/안정기에 접어들었다고 평가되는 ICT 기술이라는 고속도로 위를 달리면서, 성과의 다양화와 효율화를 증대·확산 시킬 수 있는 핵심 파트너기술이라고 볼 수 있다.

출처 : 국과위 창조도약 2020(안)
[그림 1-1-4] 국가 창조도약을 위한 핵심트랜드
바이오기술은 생산과 고용유발 효과는 크지만 대신 산업화 기간이 길다. IT는 그 반대다. 삼성전자와 암젠을 비교하면 확연히 그 차이가 드러난다. 두 회사는 지난 1983년 같은 해 출발했다. 시가총액은 삼성전자가 2,150억 달러, 암젠은 786억 달러로 삼성전자가 훨씬 높다. 하지만 제품 수는 삼성전자가 수백 개인데 비해 암젠은 10여 개에 불과하다. 제품 수명주기도 스마트폰이 3개월에 불과하지만 신약은 20년이다(표 1-1-2). 그러나 본격적으로 바이오기술과 ICT 기술 간의 융합을 통해 새로운 제품들이 개발된다면 기존의 산업이 가지고 있던 약점들이 해결된 신산업시장이 형성될 수 있어 미래성장전략의 핵심분야가 될 것이라는 기대를 받고 있다. 이러한 기술융합의 가속화와 확장은 기존에 독립적으로 이루어져 왔던 레드(의약·보건), 화이트(산업), 그린(농식품)바이오 분야 간 연구개발이 통합될 것으로 예측되며 관련 시장도 새로운 개념의 의약·보건, 산업, 농식품 시장으로 확대되고, 기존에 존재하지 않은 새로운 융합산업이 태동될 것으로 예측되고 있다.
[표 1-1-2] BT와 IT 산업의 비교
|
분야 |
BT 산업 |
IT 산업 |
|
제품수명주기 |
▪제품 수명주기가 긴 특징 *아스피린은 개발 100여 년이 지난 현재도 판매 중 ▪건강과 직결되어 소비자 기호가 반영되기 어려운 특징 |
▪제품 수명주기가 짧음 (국내 경우, 스마트폰 6~9개월) ▪소비자 기호 변화가 빠르며, 이에 대한 제품개발 역동적 *스마트폰은 소비자 기호와 직결 |
|
제품개발기간 |
▪제품 개발시간이 긴 특징 *(신약)후보물질 발굴 이후 비임상 포함 7~9년 소요 ▪안정성, 생명윤리 등으로 개발 장기화 *의약품은 안정성 검증 위해 5~6년 소요 |
▪제품 개발기간이 짧고 소비자에게 전달되는 속도 빠름 *국내 경우, 스마트폰 신제품 개발 기간은 1~2년 |
|
연구개발특징 |
▪연구개발에 장기간 소요 ▪기초연구(질환 규명 등)에 의존성 높으며, 기초연구 성과가 사업화로 직접 연계 가능 |
▪단기간의 연구개발 가능 ▪응용 및 실용화 중심의 연구성과에 의존성 높음 |
|
산업진흥법 |
▪생명공학육성법에서 포괄하고 있으나, 별도의 산업진흥법 부재 *제약산업육성특별법 제정(2012년) |
▪정보통신산업진흥법, SW 진흥법 등 IT를 포괄하는 산업진흥을 위한 법률 존재 |
|
관련규제 |
▪생명윤리법 등에 의한 엄격한 규제 *인체유래 연구, 배아나 유전자 취급 시 IRP의 승인과 감독 하에 규제 |
▪개인정보보호법 등에 의하여 규제를 받으나, 제품 생산 자체보다는 활용 측변의 규제 |
|
인프라 |
▪임상시험센터, GMP 등 정부차원의 인프라 투자 필요 |
▪민간의 인프라 투자 활발 |
3. 바이오투자전략 - 혁신기술의 선순환 산업구조 정착
바이오산업은 타 산업과 다른 특성을 가지고 있다. 신약개발의 경우 최종생산물의 과학적인 검증에서부터 사업화에 이르는 기간이 평균 10년 이상이며, 개발물질의 사업화 가능성은 이만분의 일에 불과하다. 이는 기술개발에 대한 위험은 물론 막대한 투자비가 동반되는 지식산업을 의미하며, 그 어떤 글로벌 기업도 R&D부터 사업화에 이르는 전 과정을 독자적으로 실행하기가 쉽지 않다는 의미다. 더구나 최종산물의 산업화의 성공여부 추정이 더욱 어려웠던 인간게놈프로젝트나 뇌연구프로젝트의 경우는 민간이 주도하여 투자전략을 마련하기란 매우 어려울 것이다. 이러한 이유로 바이오분야의 발전에는 지속적인 지원 시스템을 필요로 하며, 기초에서 상품화에 이르는 멀티 단계의 발전 원동력을 유지하기 위한 바이오분야 내에서의 협력 연구와 융합이 절대적으로 필요하다. 즉, 바이오산업의 발전을 위해 보다 체계적인 연구역량의 집중과 구체적인 협력방안이 필요할 수밖에 없다. 글로벌 경쟁시대에서 한국의 바이오산업이 안정적으로 발전하고 경쟁력을 갖추기 위해서는 기초에서 응용에 이르는 각 단계별로 기술개발 및 지원 전략이 필요로 할 뿐 아니라, 산·학·연 네트워크 및 파트너링, 기술 요소 분야 간의 광범위한 협력 연구가 필요하고, 이러한 일을 담당하고 수행하는 우수 전문 인력 양성이 절대적인 요소이다.
또한, 바이오산업 관련 부처 간의 연계 및 관련 법규를 제·개정하는 작업은 성과확산을 실현하기 위해 필수적인 작업이다. 우리나라는 이미 바이오분야를 국가의 기간기술 및 산업이라고 지정하고 오픈 이노베이션을 촉진하기 위한 범부처 국가과학기술전략로드맵 수립을 위한 작업이 진행 중이다. 앞서 언급한 기술 간 융합의 중요성 및 바이오기술의 특성들이 이러한 일련의 정책들을 수립하고 컨트롤타워의 기능을 수행하는 정책부처의 역할이 매우 중요하게 인식되고 있다.
앞서 언급한 미국의 인간게놈프로젝트 및 뇌연구프로젝트와 같은 바이오분야 투자정책결정과 이스라엘 와이즈만연구소와 기술지주회사 예다의 효율적인 연구성과 기술이전과 사업화의 예를 들면서 ʻ정부 투자만이 해결책이다ʼ라고 주장하는 오류에 빠지기 쉽다. 미국과 이스라엘이 바이오분야의 투자에서 성공적으로 성과를 얻는 이유(그림 1-1-5)를 찾아내지 못하고, 우리의 현실과 역량을 분석하지 못한다면 세계를 선도할 수 있는 투자성과는 앞으로도 거두기 힘들 수밖에 없을 것이다.

[그림 1-1-5] 이스라엘 와이즈만연구소 성과 사업화 전략 분석의 필요성
기술을 이전받아 사업화 및 글로벌 마켓팅 능력이 있는 수요자가 없는 산업구조를 가지고는 아무리 혁신기술을 공급하는 연구자가 많더라도 성과의 사업화를 기대하기는 어렵다. 다시 말하자면 바이오산업 육성정책 목표는 바이오기술혁신의 선순환구조를 가지는 연구개발기반 및 산업기반을 정착시키는 것이 필수적이다. 지금까지 투자의 대부분은 연구개발기반을 정착시키는데 집중하여 왔다. 이제는 연구개발기반의 정착 뿐 아니라 바이오산업기반을 정착시키는 정책적 고려가 필요한 시점이다. 현 정부의 벤처기업 및 중소기업을 육성하고자 하는 정책은 이에 대한 차선책이 될 수 있을 것이다. 보다 근본적인 대책 중 하나는 글로벌 시장에 진입할 수 있는 바이오산업의 제품화 능력과 마켓팅 능력을 보유한 기업들이 늘어나는 것이다(예 : 대기업의 해외기업 M&A 전략 등을 통해). 바이오 관련 정책부서와 전문가들은 이러한 과제에 대한 해결을 위한 전략을 가능한 한 조속하게 제시함으로써 바이오경제시대에 대비한 국가경쟁력을 확보하는 동시에 바이오기술을 통한 국제사회에 대한 공헌도를 제고할 수 있는 기반을 마련해야 한다.
4. 바이오경제시대 - 절제와 균형
위에서 언급한 사실들만으로 볼 때, 바이오산업이 인류의 지속적이며 안정적 성장에 지대한 공헌을 하리라고 쉽게 예측할 수 있다. 그러나 이러한 인류의 희망이 실현되기 위해서는 앞으로 해결해야 할 여러 가지 난제들이 나타나고 있다. 바이오기술의 비약적인 발전과 오‧남용은 윤리 도덕적 문제, 인간의 존엄성 파괴 논란, 생태계 혼란 가능성, 기술의 독점을 이용한 대기업의 횡포 등 많은 부정적인 파장들이 예견되고 있다. 바이오기술이 인류발전에 기여하기 위해서는 바이오기술에 대한 올바른 이해가 전제되어야 하며, 그 기술들의 실행이 미칠 수 있는 다양한 파장들에 대한 장기적이고 심도 있는 연구가 병행될 필요가 있다.
금세기 최고의 철학자이며 지성으로 평가되는 리프킨과 샤르딩은 그들의 저서에서 바이오기술의 발전으로 인한 물질적 풍요와 질병 없는 삶이 인류에게 가져다 줄 서로 상이한 운명에 대해 경고하고 있다. 즉 물질적 풍요 속의 정신적 나락으로의 추락을 통한 인간성의 상실과 그에 따른 거대 조직 속의 부속품으로의 전락이라는 부정적 경고의 메시지가 담겨있다. 또한 절제와 하모니로 개개인이 신의 경지에 도달하게 되는 초인류로의 진화라는 긍정적 기대 등 바이오기술은 미래의 희망인 동시에 함정일 수도 있는 우리 인류가 직면한 현실인 것이다. 인간에게 새로운 기술을 창조할 수 있는 능력을 부여한 것은 신이지만, 그 기술을 어떻게 사용하느냐 하는 결정권은 우리 인간의 몫이다.

- 의생명과학기술을 중심으로 -
1. 국민행복시대의 초석, 바이오기술
과학기술이 경제성장을 위한 수단이라는 패러다임에서 벗어나 국민에게 건강·안전·풍요를 가져다주는 수단이라는 인식의 전환이 확대되고 있다. 특히 바이오기술은 인류의 보건, 식량, 에너지, 환경 문제 해결을 위한 주요 수단으로, 그 필요성이 강조되고 있으며 각 나라에서는 차세대 성장 동력으로서의 중요성을 인식하고 범 국가적인 투자에 나서고 있다. 바이오기술은 국민의 삶의 질에 영향을 미치는 실질적인 요소인 건강, 안전 등의 사회문제 해결을 위한 핵심요소인데, 질병 극복을 위한 기술뿐만 아니라 사회적 취약 분야인 고령자·장애인을 위한 공공복지, 식품안전·감염병 등의 공공안전 등의 부분까지 해결 가능한 영역으로 인식되면서, 이에 대한 관심이 더욱 높아지고 있다. 우리나라 국민의 경우에도 과학기술이 삶의 질 향상에 많은 기여를 할 것으로 인식하고 있다.
[표 1-2-1] 과학기술이 삶의 질을 높일 것이라고 인식하는 정도(일반시민)
|
국가 |
한국 |
영국 |
핀란드 |
독일 |
스웨덴 |
프랑스 |
스위스 |
|
동의 |
73% |
82% |
80% |
75% |
74% |
69% |
55% |
출처 : 국민의 삶의 질에 관한 설문조사, STEPI, 2007
바이오기술은 삶의 질을 추구하는 패러다임 변화를 견인하는 중요한 이슈로, 新정부 국정목표인 ʻʻ일자리 중심의 창조경제ʼʼ 실현의 핵심 아젠다이다. 지난 2007년부터 2010년 사이에 세계 바이오산업 시장규모는 1,123억달러에서 1,535억달러로 14.8%의 성장률을 보였고 2015년에는 3,090억달러까지 확대 될 전망이다. 같은 기간 자동차산업은 6.4%, IT산업은 9.5%로 바이오기술 분야가 더 높은 성장이 전망되는 것은 바이오기술의 지속적 수요 증가와 높은 부가가치 창출 잠재력 때문이다. 2009년 OECD는 2030년에는 바이오기술이 타 기술과의 융합을 통하여 글로벌 경제에 큰 변혁을 가져올 것이라고 전망하였다. 특히, 신약개발에 소요되는 연구개발 투자는 지속적으로 증가하는 반면, 승인되는 신약의 수는 오히려 감소하고 있는 시점에서 바이오기술은 신약 R&D 생산성 향상의 핵심요소로 부상하고 있다. 조사에 따르면 바이오기술은 혁신적 신약 개발을 가속화하여 신약개발의 효율을 최대 5배까지 향상시키고, 개발기간도 2∼3년까지 단축시킬 수 있다.1)

출처 : 제2차 생명공학육성기본계획, 생명공학정책연구센터, 2013
[그림 1-2-1] 바이오기술 기반의 신약개발 R&D 생산성 향상
바이오기술을 기반으로 한 산업이 미래 환경 변화에 큰 영향을 줄 수 있다는 전망 가운데, 주요 선진국에서는 다양한 분야에 바이오기술을 접목하여 신성장동력 창출 및 국민 삶의 질 향상 제고를 위한 국가 차원의 전략을 추진하고 있다.
미국은 2012년 ʻ국가 바이오 경제 청사진ʼ 5대 전략을 제시하고 바이오기술 R&D 지원 강화, 산업화 촉진 및 인력양성 등의 계획을 발표한 바 있다. 영국의 경우는 생명공학 및 생물과학 연구회(BBSRC)2)의 Bioscience 2015를 중심으로 식품안전, 바이오에너지 및 바이오산업화, 바이오헬스 부분에 총 4.4억 파운드를 투자(2012년)하고 있다.
[표 1-2-2] 해외 주요국의 바이오 분야 중장기 전략 수립
|
국가 |
주요 전략 |
중점투자기술 |
|
미국 |
▪바이오기술의 성장잠재력과 사회적 편익을 반영한 2012년 국가 바이오 경제 청사진 발표 |
▪식품안전 및 건강 ▪바이오에너지 ▪생명의학(줄기세포) |
|
영국 |
▪BBSRC(Bioscience 2015)는 식품안전, 바이오 에너지 및 바이오산업화, 바이오헬스 부분에 총 4.4억 파운드 투자(2012년) |
▪생명과학 ▪바이오에너지 ▪산업바이오기술 |
|
EU |
▪신성장동력 정책사업인 Horizon 2020(2014년~2020년)은 보건, 식량, 에너지 증 바이오기술 기반 분야에 270억 유로 투자 |
▪식품안전 ▪비식품 바이오기술 (에너지, 소재, 촉매) |
|
독일 |
▪국가연구전략 바이오경제 2030(2011년) 수립으로 바이오기술을 통한 당면 과제 해결과 미래 비전 및 연구전략 발표 |
▪식량안보 ▪지속가능 농업생산 ▪바이오매스 기반 에너지 |
|
일본 |
▪제2기 과학기술기본계획(2011~2015년)의 그린‧라이프 이노베이션 정책을 통한 바이오기술 분야 투자 확대 |
▪재생의료, 바이오인포매틱스 ▪줄기세포(역분화중심) ▪고령사회 대응 포스트게놈 |
출처 : 2013년도 생명공학육성 시행계획, 생명공학정책연구센터, 2013
우리 정부도 국민행복 실현 및 바이오 경제 시대를 대비하여 바이오기술 분야의 육성을 강화하고 있다. 박근혜정부의 창조경제 실현을 위한 140개 국정과제 중 10%인 14개 과제가 바이오기술과 관련되어 있다. 특히 보건산업의 미래성장산업 및 고령친화산업 육성 등 국민의 삶의 질 향상과 일자리 창출을 위한 성장 동력 강화 부문에서 바이오분야의 역할을 기대하고 있다.3)
2. 바이오기술 추진전략
바이오기술은 삶의 질을 추구하는 패러다임 변화와 높은 부가가치를 견인하는 중요한 이슈이다. 이와 같은 바이오기술을 국가의 신성장동력 산업으로 중점 육성하기 위해서는 다음과 같은 전략이 필요하다.
가. 정부 바이오기술 R&D 분야의 장기 투자 전략
정부 바이오기술 R&D 예산은 제1차 생명공학육성기본계획이 수립된 1994년 536억원에서 2012년 1조 6,814억원으로 약 30배 이상의 예산이 증가하였다. 그러나 주요 선진국 대비(2013년 NIH 307억 달러, 일본 4,052억엔) 바이오기술 R&D 예산은 절대적으로 부족한 실정이다. 바이오기술분야의 경우 기초·원천기술 개발 이후 산업화까지 비교적 오랜 시간이 소요되므로 장기적 비전을 가지고 육성 및 투자가 필요하다.
(단위 : 억원)

출처 : 연도별 생명공학육성시행계획, 생명공학정책연구센터, 2013
[그림 1-2-2] 바이오기술 분야 정부 R&D 예산 현황(ʼ94년~ʼ12년)
정부 바이오기술 R&D예산을 선진국 수준으로 확대하기 위해서는, 정부 R&D 투자 우선순위 조정을 통해 정부 총 R&D에서 바이오기술 R&D가 차지하는 비중을 점차 늘려 나가야 한다. 특히 세입 확충, 기부금 제도 등을 통해 신규 R&D 재원 확보 방안을 모색해야 할 것이다. 민간투자 활성화를 위하여 투자를 저해하는 규정 및 제도를 발굴·개선하는 등 민간 투자 장벽을 완화하는 것이 우선되어야 하고, 민간 투자의 Death Valley 해소를 위해서 기술창업기업의 직접 금융 조달기회 확대 방안으로 엔젤매칭펀드 조성 및 보증연계투자 등의 추진이 필요하다.
나. 바이오기술 R&D의 거버넌스 체계 개편 및 부처 간 연계 강화
바이오기술 R&D 성과 제고를 위하여 전주기적 융합 연구를 통한 연구기간의 단축과 개방적인 산·학·연·관의 협력 체계 구축이 시급하다. 국내 여건상 제한된 투자 여건 하에서 효율을 극대화하기 위해서는 범부처 차원의 리더십을 발휘하여 기술의 수요자와 공급자가 함께 참여하는 상생적 R&D 생태계 마련이 필요하며, 여러 부처에 산재되어 있는 바이오기술 R&D 관련 예산을 범부처 차원에서 통합관리가 요구되고 있다. 기술 중심의 바이오기술은 동종기술간의 융합을 넘어 이종기술간 융합으로 변화해야만 시너지를 낼 수 있으며, 이를 위해서는 정부 예산도 부처 간 장벽을 넘어 운영되어야 한다.

[그림 1-2-3] 다부처공동기획사업 추진방향(미래창조과학부)
따라서 특정 부처 이해관계에서 벗어나 부처별 분산된 투자 및 지원체계를 총괄 지원하는 컨트롤 타워의 기능 확보를 통하여 일원화된 전략 수립과 의사결정 거버넌스 구축이 절실한 시점이다.
R&D 생산성 향상을 위해서 부처 간 연계사업 발굴, 실용화 관점에서의 기초·원천과제 발굴 및 제안, 연구기초·원천부터 산업화까지의 전주기적 성과 연계체계가 구축되어야 한다. 이를 위하여 미국, 일본, 영국 등 선진국의 거버넌스 통합 관리 사례와 연구지원 시스템에 대한 심층 고찰과 국가 연구기관 및 연구지원기관의 체계적 정리가 요구된다.
다. 공공인프라 확충 및 바이오기술 전문 인력 양성
국내 바이오기술산업의 가장 큰 난제는 산업체의 규모와 기술개발 능력의 취약함이다. 바이오기술 연구개발 성과 특성상 개발과정에서 다양한 핵심 요소기술을 요구하고, 실패율이 높기 때문에 국내 기업의 규모로 전 과정을 감당하기는 역부족이다. 따라서 산·학·연 및 국가 인프라의 긴밀한 연계를 통해 초기 파이프라인을 제공하고, 핵심 기술의 유기적 지원을 통하여 작지만 강한 기업을 육성하는 국가차원의 시스템 구축이 절실하다. 즉, 바이오 기반확충과 지역산업 활성화 지원을 위한 인프라 투자 확대 및 기존 인프라 연계를 통한 효율성 제고가 우선되어야 한다.

출처 : 국민건강을 위한 범부처 R&D 중장기 추진계획(안), 국가과학기술심의위원회, 2013
[그림 1-2-4] 산·학·연·병원 연구개발 협력 체계도
우리나라 바이오기술 인력의 양적수준은 증가한 반면에 연구개발과 산업분야에서 석·박사급의 고급 인력 비중이 감소하고 있다. 특히 산업계는 고학력 인력을 요구하고 있으나, 대학에서의 고학력 공급체계는 상대적으로 부족한 여건이다. 따라서 바이오기술 연구인력 공급-수요 불일치 극복과 연구-산업 현장의 수요에 적합한 고급인력 확보가 필요한 실정이다.
미국의 경우 바이오기술 분야의 융합연구인력 양성을 전략적인 국가연구개발 육성분야로 선정하여 생명공학에 대한 정부의 지속적인 관심과 투자가 이루어지고 있다. 국립보건원(NIH), 국립과학재단(NSF)을 중심으로 연구개발 및 산업분야의 연구를 촉진하고 우수 연구 인력을 창출하고 있다. 이와 같은 정부의 집중적인 투자를 바탕으로 대학·연구기관·기업의 상호 협력과 세계의 고급 인력의 유치 등으로 지속적인 연구역량을 제고하고 있다.
우리 정부도 첨단 기술 분야의 신생 융합 인력, 기초 의약학 분야의 산업현장 맞춤 인력 등 최근의 환경변화에 따른 수요 중심의 전략적 인력 육성을 추진해야 한다. 특히 유전정보의 분석 가공 기술을 제고할 수 있는 고급 연구 인력의 양성을 위해 KOBIC 등 출연(연)에서 관련 프로그램이 활성화 되어야 한다. 또한 연구 전문인력(MD-PhD, PhD) 양성 및 융합연구를 위한 다학제 프로그램 개발을 통해 산·학·연·병원간 협력연구를 활성화해야 할 것이다.
3. 바이오기술 발전 방향
삶의 질이 높아지고 건강과 생명 연장에 대한 수요가 높아질수록 바이오기술은 국민행복 시대를 여는 가장 기본적이고 최우선시 되는 과학 기술이 될 수밖에 없다. 바이오기술이 접목된 다양한 융합 산업을 미래 전략산업으로 육성하여 세계 시장을 선점하고자 하는 국가간 경쟁이 치열한 상황에서, 선진국의 격차를 줄이기 위해서는 적극적인 투자와 효율적 집행구조 재정비와 함께 산·학·연·병원의 협력을 통하여 국내외 관련 우수 인력 간의 유기적 협력 연구 환경을 조성하는 대책이 시급하다. 바이오기술 기술뿐만 아니라 다양한 분야의 기술들을 융복합적으로 적용하여 새로운 분야를 창출하고 경쟁력을 키워가는 것이야말로 국민행복시대를 실현하는 열쇠라 하겠다.

1. 바이오경제시대 의미와 환경 변화
바이오기술이 발전하고 IT 및 NT 등 여타 신기술과의 융합이 급속히 진전되면서 바야흐로 바이오경제시대가 도래하고 있다. OECD(2006)는 바이오경제를 ʻʻ바이오기술에 의한 새로운 발견들이 관련 제품의 보급이나 서비스의 향상을 통하여 인류에 편익을 가져다주는 다양한 경제활동을 포괄하는 개념ʼʼ으로 정의하고, 바이오경제가 IT경제에 버금가는 효과를 나타낼 것으로 예상하였다. 여기서는 바이오경제를 ʻ바이오기술 혁신을 통해 생산되는 다양한 제품과 서비스의 바이오산업이 창출해내는 국민(수요자)의 편익과 효용 전체ʼ로 정의한다.
바이오경제시대를 유도하는 주요한 환경변화로는 과학기술의 획기적 발전, 산업 구조의 질적 변화, 인구 고령화, 자원과 환경 문제 확대, 세계 경제질서 개편 등 5가지를 들 수 있다.
이중 가장 중요한 환경 변화는 물론 바이오기술의 발전이다. 바이오기술의 혁신적인 발전을 통해 유전체와 단백질체 등 소위 오믹스(omics) 연구에서 생산되는 거대한 바이오정보가 농업, 의료, 산업 분야에서 다양한 혁신을 촉발시키고 있다. 바이오정보에 ICT기술이 융합되고, 디지털화된 의료 및 건강정보까지 연계되는 바이오빅데이터는 바이오경제시대 혁신의 핵심도구이다. 여기에 더해서, 글로벌 수준의 개방형 혁신 시스템(Global Open Innovation System)은 국가와 지역 경계를 넘어 기술혁신 속도를 가속화시키고 있으며, 바이오기술의 사회경제적 효과를 전 지구적으로 확대시키고 있다.
이러한 기술적 융합은 산업간 경계를 무너뜨리고 산업구조에 질적 변화를 가져오고 있다. 기업들은 제약, 의료서비스, 의료기기산업과 농업 등 산업간 경계를 넘나들며 활동하고 있고, 다양한 주체들과의 수평적인 네트워크를 통해 성장하고 있다. 이로 인해 기술과 제품, 서비스 등 산업 전 분야에서 이종기술간 재조합 또는 산업간 재조합으로 새로운 가치와 시장이 창출되고 있는 것을 볼 수 있는데, 이는 기업이 다변화되는 소비자의 니즈에 대응하기 위해 융합을 통해 다양한 제품과 서비스를 개발하기 때문이다. 예를 들어 유전자 분석기를 만들던 바이오벤처기업은 유전정보를 활용한 체외진단기기와 치료기기를 개발하고 있으며 더 나아가 유전정보와 의료정보를 활용한 맞춤형 건강관리서비스까지 제공한다.
인구고령화, 그리고 이로 인한 의료와 식량에 대한 경제사회적 부담은 바이오경제에 대한 니즈를 증폭시키고 있다. 미국 등 세계 각국은 바이오정보와 IT를 융합하여 활용함으로써 고령화 시대의 의료비용 절감에 노력하고 있고, 세계적인 식량 부족을 해결하기 위해서 바이오기술이 적극적으로 사용되고 있다. 또한, 세계 각국은 범세계적인 환경오염과 석유자원 고갈, 석유자원 가격 급등에 대응하기 위해 바이오플라스틱 등 환경친화적인 바이오화학산업을 육성하고 바이오연료를 개발하고 있다. 마지막으로 바이오경제는 중국 등 신시장, 경제위기 극복을 위한 각국의 성장동력에서 커다란 비중을 차지한다.
2. 글로벌 경제위기와 바이오경제
글로벌 경제 위기와 저성장 추세는 바이오경제에도 영향을 미치고 있다. Ernst & Young에 의하면, 2003년∼2007년간 세계 바이오기업4) 수는 연평균 6.2%로 증가하다가 2008년∼2012년간 연평균 3.9%로 감소하였다. 세계 바이오기업 매출 역시 2003년∼2007년간 연평균 14.6%로 증가하다가 2008년∼2012년간 연평균 0.9%로 증가 폭이 크게 둔화된 것을 볼 수 있다.
이러한 바이오경제 성장의 둔화 추세는 세계 바이오산업 규모의 절반 수준을 차지하는 미국의 영향이 크다. 미국 바이오산업은 2008년∼2009년간 매출이 급격히 감소하였으며, 2009년 이후 점차 회복 추세를 보이고 있다. 한편, 유럽 바이오산업은 전반적인 성장 둔화와 몇몇 국가의 경제 위기에도 불구하고 2003년 이후 지속적인 성장 추세를 유지하고 있다.
(단위 : 백만달러, 개)

출처 : ERNST&YOUNG.
주 : 2003년~2007년 세계 공개기업 기준, 2008년~2012년 미국, 유럽, 캐나다, 호주 공개기업 기준
[그림 1-3-1] 세계 바이오산업 매출과 기업 수
(단위 : 백만달러)

출처 : ERNST&YOUNG.
주 : 공개기업 기준
[그림 1-3-2] 미국과 유럽의 바이오산업 매출 현황
3. 바이오경제의 지속적 확대 전망
우리나라와 일본이 선도하고 있는 글로벌 고령화 추세는 향후 바이오경제가 더욱 확대될 것을 전망하게 한다. 2009년 기준 미국의 GDP 대비 의료비 비중은 17.4%이며, 미국을 제외한 선진국 대부분도 GDP 대비 의료비 비중이 10% 내외로 국가 재정에서 큰 비중을 차지하고 있다. 미국을 포함한 대부분의 선진국에서 GDP 대비 의료비 비중이 지속적으로 증가하여 왔으며 이로 인한 국가적 재정 부담 역시 크게 확대되어 왔다. 이러한 추세는 앞으로 더욱 가속화될 전망이며, 세계 각국은 의료비에 대한 국가재정 부담을 낮추기 위해 보건의료 분야 연구개발에 적극 투자하고 있다. 바이오기술의 발전과 바이오-IT간 융합 현상은 의료재정 부담에 대한 대응에 활용되고 있다. 예를 들어 고령화와 환경변화로 인해 확대되고 있는 난치성 질병이나 만성질환에 대한 신약의 개발, 질병 예방과 관리를 위한 진단 및 치료기기 개발보다 효율적인 의료서비스 개발 등에 첨단 바이오기술과 IT가 적극적으로 활용되고 있다.

출처 : OECD(2013)
[그림 1-3-3] OECD 국가의 GDP 대비 의료비 비중
고령화 사회로의 진입 뿐 아니라 건강한 삶에 대한 다양한 욕구의 증가는 바이오경제에 대한 수요를 지속적으로 확대시키고 있다. 개인 맞춤형 의약품(peraonalized drug)과 현장 관리(point of care; 이하 POC) 진단기기, 원격진료와 온라인 건강관리 프로그램 등이 이러한 수요에 대응하는 제품과 서비스라고 할 수 있다.
바이오정보는 IT기술, 클라우드 컴퓨팅과 같은 통신 네트워킹 기술 등을 활용하는 모바일기기를 통해 활용범위를 넓히고 있다. 미국 등 선진국에서는 수요자(환자)가 모바일기기로 자신의 건강관리, 진단기록과 자료 열람, 진료예약 등에 간편하게 접근할 수 있다. Juniper Research(2012)는 2012년 건강관리앱이 4,400만건 다운로드 되었으며 2016년에는 다운로드 양이 14,200만 건까지 증가할 것으로 예상하였다. 휴대폰을 활용한 원격 건강관리와 의료는 미국 등 선진국 뿐 아니라 개발도상국에서 의료 접근성을 개선하는데 커다란 영향을 미칠 것으로 예상된다.
개인의 유전체 정보와 함께 임상 등 의료정보, 의약품 처방정보, 건강보험 정보, 모바일앱을 통한 실시간 건강모니터링 정보 등이 통합된 바이오빅데이터는 미래 바이오경제의 핵심자원이다. 바이오빅데이터를 분석하여 수요자(환자)에게 적합한 맞춤형 치료가 가능해지고 사전 진단 및 예방 중심의 건강관리 체계를 구축함으로서 보건의료 비용 효율성을 제고 할 수 있을 것이다.
농식품 분야에서도 바이오경제는 비약적으로 확대될 전망이다. 2040년 세계 인구 중 75%를 아시아・태평양 지역과 아프리카 지역에서 차지할 것으로 예상되는 가운데, 식량 부족 문제의 해결과 효율적인 식량 생산을 위한 바이오산업의 역할이 증대할 것으로 보인다. 병충해에 강한 작물의 개발, 영양소 기능이 증대된 작물의 개발 등에 바이오기술이 활용되고 있으며, 유전체학, 바이오인포메틱스 기업은 바이오빅데이터를 활용하여 경작 효율성을 높이고자 하고 있다.
바이오경제는 글로벌 경제 침체 속에서도 고품질의 일자리를 창출하고 있다. 미국에서는 대부분 경제 분야에서 2001년~2010년간 고용이 감소한데 반해, 바이오 관련 고용은 6.4% 증가한 것으로 나타났다. 물론, 이러한 고용 증가는 미국이 바이오경제에 대한 선도적인 경쟁력을 보유하고 있기에 가능하였을 것이다. 하지만, 세계 경제를 주도하는 미국에서 IT 관련 고용이 급속히 감소하고 바이오 관련 고용이 증가하는 추세는 ʻ신기술 기반 글로벌 경제ʼ의 무게 중심이 바이오경제로 이동하고 있음을 반증한다.

출처 : Battelle(2012)
[그림 1-3-4] 미국 주요 경제 분야의 고용율 변화
4. 바이오경제 구현을 위한 정책 효율성
미국, 아일랜드, 덴마크 등 일부 국가를 제외한 대부분 OECD 국가에서 바이오경제에 대한 연구개발 투자는 정부 중심으로 이루어지고 있다. 우리나라의 바이오경제에 대한 민간투자는 정부투자 대비 44%에 불과하지만, 일본(33%)과 독일(20%), 폴란드(17%)에 비해서 높은 것으로 나타난다. 이처럼 일본, 독일 등 주요 선진국에서조차 바이오경제 연구개발에 대한 민간투자 비중이 낮은 이유는 바이오산업의 특수성에서 기인한다. 바이오산업은 보건의료, 식량, 환경 등 공공성이 높은 분야를 대상으로 하고 있어 법, 제도, 규제로 인한 시장 진입 장벽이 높고 이를 극복하기 위해서 개발자가 지불해야 하는 비용과 기간 부담이 매우 크다. 즉, 미국과 같이 민간 연구개발 역량과 시장진입 역량이 확보되어 있지 않은 대부분 국가에서는 민간이 독자적으로 연구개발에 투자하기에 위험 부담을 크기 때문에 정부의 적극적이고도 효율적인 연구개발 정책이 매우 중요하다.
바이오경제시대를 위한 효율적인 연구개발 정책을 추진하기 위해서는 세부 바이오산업의 경제사회적 중요도와 미래 역할 비중에 따라 자원의 배분과 정책 지원이 균형적으로 이루어져야 한다. OECD(2009)는 2030년 세계 바이오경제에서 산업바이오의 기여 비중이 가장 클 것으로 전망하면서, 이에 대한 공공부분의 연구개발 투자가 균형적으로 이루어져야 한다고 지적한 바 있다. 우리나라에서도 바이오산업 세부 분야별 연구개발 지원 비중이 적절한가에 대해 지속적인 점검과 개선이 필요하다.
우리나라에서 바이오경제를 구현하기 위해서는 바이오경제 생태계의 공급 역량과 수요 역량을 균형적으로 제고하여야 한다. 지금까지 바이오경제에 대한 우리나라 정책의 초점은 연구개발 투자 확대와 공급 역량을 높이는 쪽에 치중되어 왔으며, 사회적 수용성 장벽을 극복하고 수요 역량을 제고하기 위한 정책적 논의와 지원은 미흡했다. 바이오경제 생태계에는 신기술을 활용한 제품과 서비스를 제공하는 기업들이 지속적으로 진입하여 기존 공급자와 발전적인 경쟁을 할 수 있어야 한다. 그리고 바이오경제 인력은 산업 현장의 수요에 맞도록 효율적으로 공급되는 것이 바람직하다.
바이오경제 생태계에서는 신제품과 신서비스에 대한 소비자 선택권이 확대되면서, 새로운 수요에 대응하는 시장이 지속적으로 창출·확산되어야 한다. 그리고 시장에서 생산된 부가가치가 생태계에 재투자되어 경제의 활기가 선순환되어야 한다. 이러한 선순환을 촉진하기 위해서는 생태계 안의 이해당사자간 갈등 구조를 조절하고, 혁신적 바이오기술과 제품에 대한 사회적 수용도를 높이기 위한 정책적 노력이 매우 중요하다.
균형감 있는 정책의 추진, 그리고 공급자와 수요자의 적극적인 참여를 통해 우리나라의 바이오경제시대가 구현되고, 우리나라가 글로벌 경제 침체와 저성장 시대를 극복해 나가기를 기대한다.
[표 1-3-1] 글로벌 바이오경제 연구개발 투자 현황
(단위 : PPP 기준 백만달러, %)
|
국가명(년도) |
민간투자 (백만달러) |
정부투자 (백만달러) |
민간/정부 투자비율 |
|
미국(2009년) |
22,030.0 |
4,605.0 |
4.78 |
|
독일(2011년) |
1,221.5 |
5,972.1 |
0.20 |
|
일본(2010년) |
1,230.1 |
3,706.0 |
0.33 |
|
한국(2010년) |
1,082.7 |
2,468.4 |
0.44 |
|
스페인(2010년) |
794.1 |
1,396.0 |
0.57 |
|
덴마크(2009년) |
463.7 |
199.1 |
2.33 |
|
아일랜드(2011년) |
380.5 |
67.9 |
5.60 |
|
노르웨이(2010년) |
158.6 |
177.6 |
0.89 |
|
핀란드(2011년) |
110.4 |
118.0 |
0.94 |
|
체코(2011년) |
80.4 |
146.9 |
0.55 |
|
폴란드(2011년) |
40.8 |
241.5 |
0.17 |
|
포르투갈(2010년) |
38.0 |
41.5 |
0.92 |
출처 : OECD, Biotechnology Statistics Database(2012)

1. 국가과학기술심의회
2013년 박근혜 정부가 출범하면서 과학기술 정책과 연구개발 사업 등을 총괄· 조정하는 컨트롤 타워의 역할을 수행하는 ʻʻ국가과학기술심의회ʼʼ(이하 국과심)가 새롭게 출범하였다. 국과심은 과학기술기본법 9조에 근거하여 1999년 1월 대통령을 위원장으로 설치된 국가과학기술위원회를 거쳐 2011년 3월 상설행정위원회로 개편되었다. 이후 종전의 상설 국과회(사무처+심의회의체)에서 수행하던 과학기술정책 및 R&D 사업 종합·조정 기능(사무처)이 미래부로 이관되고 최고 심의의결기구로서의 심의회의체 역할 수행을 위한 국과심을 2013년 4월 신설하게 되었다.
|
2011년~2013년.3) |
|||
|
과학기술정책의 종합·조정체계 구축 |
과기부총리에게 예산 배분‧조정기능 부여 |
BH 중심의 종합·조정체계 구축 |
상설 행정위원회로 독립 |
|
▪위원장: 대통령 ▪부위원장: - ▪위원 : 정부(14명), 민간(3→ 10명) |
▪위원장: 대통령 ▪부위원장: 과기부총리 ▪위원 : 정부(13명), 민간(8명) |
▪위원장: 대통령 ▪부위원장: 교과부장관 ▪위원 : 정부(10명), 민간(13명) |
▪위원장 : 장관급 ▪부위원장 : - ▪위원 : 정부(2명), 민간(7명) |
|
운영위원회, 특별위원회(2), 전문위원회(3) 협의회(1) |
운영위원회, 특별위원회(2), 전문위원회(2) 협의회(2) |
운영위원회, 분야별 민간 전문위원회(7) 협의회(2) |
운영위원회, 특별위원회(2), 전문위원회(7), 협의회(2) |
|
과학기술부장관 |
과학기술혁신본부장 |
BH 교육과학문화수석 |
국과위 사무처장 |
[그림 1-4-1] 국가과학기술위원회 연혁(ʼ99.1.∼ʼ13.3)
국과심의 구성은 위원장(2명) + 위원(23명)으로 총 25명으로 구성되며 위원장은 국무총리(의장)와 민간 공동위원장(대통령 위촉)으로 구성되며 관계부처 장관을 포함한 당연직 13명과 위촉직 민간 위원 10명으로 총 23명으로 구성되어 있다. 이로써 국과심의 위상을 재고하고 민간위원을 통한 전문성을 보강하여 현장의 목소리 정책을 적극적으로 수용할 수 있는 체계를 갖추게 되었다. 또한 총 7개의 전문위원회 중 생명복지전문위원회가 구성되어 위원장 포함 18명의 전문위원회 간사위원으로 구성·운영되고 있으며 생명보건의료, 농림수산식품 R&D 등 사업에 대한 예산 배분·조정 역할을 수행하고 있다. 현재 생명복지전문위원회의 소위원회는 의료기기, 유전체, 종자 분야의 3개 소위원회가 구성되어 운영중에 있다.

[그림 1-4-2] 국과과학기술심의회
2. 2014년 R&D분야 예산조정·배분
우리 경제는 세계 경제 여건의 완만한 개선과 여러 정책노력 등으로 회복세를 시현할 것으로 예상되며 2013년 2.7%에서 2014년 3.9% 수준의 성장세를 나타낼 것으로 전망된다.5)
2014년 국가연구개발사업 예산 편성 결과에 따르면 2014년도 R&D예산 편성 규모는 전년대비 6,718억원(4.0%) 증가한 17조 5,496억원이다. 2014년도 R&D분야 재원배분에 주요 내용은 창조경제와 국민행복 실현을 위한 R&D투자를 강화하고 신산업·신시장 개척 지원을 통해 일자리 창출에 기여하며 정부의 R&D 투자의 효율성을 극대화하는데 초점을 두고 있다.
[표 1-3-2] 2014년 R&D분야 재원배분 정부(안)
(단위 : 억원 %)
|
구 분 |
'13년 예산 |
'14년 예산안 (C) |
증 감 |
||
|
본예산 (A) |
추경 포함 |
’13년 대비 (C-A) |
|
||
|
% |
|||||
|
합 계 |
168,777 |
171,471 |
175,496 |
6,718 |
4.0 |
|
ㅇ 예산 |
150,044 |
152,138 |
157,115 |
7,071 |
5.0 |
|
-일반회계 |
123,417 |
125,235 |
129,258 |
5,841 |
5.0 |
|
-특별회계 |
26,629 |
26,903 |
27,857 |
1,228 |
5.0 |
|
ㅇ 기금 |
18,734 |
19,334 |
18,380 |
-354 |
▽2.0 |
|
기초과학 |
12,533 |
13,089 |
15,730 |
3,197 |
26.0 |
|
정보전자 |
24,575 |
25,443 |
25,649 |
1,074 |
4.0 |
|
생명 |
21,335 |
21,553 |
23,265 |
1,930 |
9.0 |
|
기계/제조/공정 |
16,345 |
16,483 |
16,705 |
360 |
2.0 |
|
에너지/자원 |
17,673 |
17,708 |
17,979 |
306 |
2.0 |
|
우주/항공/해양 |
15,982 |
16,549 |
16,966 |
984 |
6.0 |
|
환경 |
6,933 |
6,994 |
7,294 |
361 |
5.0 |
|
소재/나노 |
8,307 |
8,466 |
8,510 |
203 |
2.0 |
|
건설/교통/안전 |
6,158 |
6,174 |
6,425 |
267 |
4.0 |
|
기타 |
38,935 |
39,012 |
36,971 |
-1,964 |
▽5.0 |
출처 : 기획재정부
창조경제의 기반이 되는 과학기술과 기초연구 역량 강화를 위해 기초연구 투자를 지속적으로 확대하고, 창의적이고 도전적 연구 활성화를 지원하는 한편 과학밸트 등 대규모 국책사업에 대해서는 차질 없이 추진할 계획이다. 또한 국민의 안전과 행복한 삶을 위한 국민체감형 R&D의 투자를 확대하여 재난․재해 예방 및 대응, 치안 등 국민안전 확보를 위한 선제적이고 맞춤형 대응기술 개발에 지속적으로 투자하는 한편 고령자·장애인 등 사회적 약자를 지원하고 국민건강 증진 및 만성질환 극복을 위하여 R&D 투자를 중점 추진할 계획이다. 이 밖에도 창조·혁신을 바탕으로 신산업·신시장 개척 및 일자리 창출을 위하여 과학기술 융합 및 범부처 R&D 협력사업 강화 등을 통하여 혁신적인 연구성과 도출을 도모할 계획이다.
생명복지 분야의 예산배분 정부(안)에 따르면 2013년 1조 7,817억원에서 2014년 1조 9,300억원으로 증가하였으며, 아래와 같이 중점 분야를 추진할 계획이다.
○ 식·의약 안전, 치안유지 등 국민 생활과 밀접한 안전관리 분야 기술개발 지원 강화
※ 식품등 안전관리 : (ʼ13년) 177 → (ʼ14년안) 245억원(38.1% 증)
※ 중장기과학수사감정기법연구개발 : (ʼ13년) 40 → (ʼ14년안) 42억원(5.9% 증)
○ 고령화 대응 맞춤·예방의학 및 바이오 고부가 가치 신산업 창출을 위한 원천·융합기술개발 투자 확대
※ 뇌과학원천기술개발 : (ʼ13년) 91 → (ʼ14년안) 141억원(54.3% 증)
※ 바이오화학산업화촉진기술개발 : (ʼ14년안) 신규 50억원(순증)
○ 농·림·식품산업 고도화를 위한 BIT 융합기반 기술개발 지원강화
※ 첨단생산기술개발 : (ʼ13년) 188 → (ʼ14년안) 210억원(11.9% 증)
○ 신종 진드기 바이러스 등 기후변화유래 질병 극복 및 정신건강 연구 등 새로운 트랜드 대응 연구개발 지원 강화
※ 기후변화급만성질환연구 : (ʼ13년) 15 → (ʼ14년안) 25억원(66.7% 증)
※ 정신건강기술개발 : (ʼ14년안) 신규 20억원(순증)
또한 차세대 유전체 연구관련 신규사업의 전략적 지원을 위해 유사한 성격의 기존 사업을 이관·통합하여 생명복지 분야 예산의 효율화를 추진할 예정이다(표 1-3-3).
[표 1-3-3] 2014년 생명복지분야 예산(안)
(단위 : 백만원)
|
사업명 |
’13년 예산(A) |
’14년(안)(B) |
증감(B-A) |
% |
|
[생명복지분야 총계] |
1,781,741 |
1,930,074 |
123,575 |
6.9 |
|
▪정신건강기술개발(신규) |
0 |
2,000 |
2,000 |
순증 |
|
▪뇌과학원천기술개발 |
9,110 |
14,060 |
4,950 |
54.3 |
|
▪식품 등 안전관리 |
17,740 |
24,498 |
6,758 |
38.1 |
|
▪첨단생산기술개발 |
18,750 |
20,978 |
2,228 |
11.9 |
|
▪포스트게놈다부처유전체사업(신규) |
0 |
45,500 |
45,500 |
순증 |
출처 : 생명복지 2014 예산안_정부안 (생명복지조정과)
3. 발전 전망
경기둔화로 인하여 세입 여건이 계속해서 어려울 전망이나 복지수요 및 지방재정 지원 등 지출소요는 지속적으로 증가할 것이다. 경기회복세를 공고히 하기 위하여 일자리 창출 등 경제 활성화의 노력이 필요하다.
2013년은 새정부 출범과 더불어 생명공학육성기본계획이 수립 된지 20년이 된 해이다. 생명복지 분야가 기존의 기술을 갖고 어떻게 창조경제에 기여할 수 있을지 고민이 필요한 시점이다. 새로운 국가 과학기술 행정체계의 정착과 변곡점에 이른 이 분야의 성공적인 도약을 위해 국가과학기술심의회의 역할은 매우 중요하다. 국가연구개발사업에 대한 조정방안 및 제도들이 명확하게 자리 잡고 정교하게 작동되어야 할 것이다. 2015년 3,982억 달러 규모로 전망되는 바이오 경제시대를 맞이하는 시점에서 창조경제 실현을 뒷받침하고 바이오 R&D를 통한 국민행복이 실현될 수 있도록 효율적인 정책 조정에 국가과학기술심의회가 그 역할을 다할 것이다.
1) 출처 : McKinsey Quarterly, SRI Consulting
2) BBSRC : Biotechnology and Biological Sciences Research Council
3) 박근혜 정부의 창조경제 실현을 위한 바이오 R&D 정책이슈(2013년), 한국과학기술평가원
4) Ernst & Young사는 공개기업 기준 바이오기업 통계를 매년 발표하고 있다.
5) 국내외 주요기관 ‘14년 성장률 전망(평균) : 3.8%~3.9% 수준 (OECD, 한은, IB 등)
![]()



1. 정부투자 동향
가. 국립보건원(NIH : National Institutes of Health)
미국의 생명과학 투자는 전 세계에서 여전히 높은 비중을 차지하고 있지만 경기침체, 중국 등 아시아 국가의 부상, NIH 연구비의 축소로 인해 점차 감소하고 있는 추세에 있다. 미국 NIH(National Institute of Health) 연구비는 2003년 331억 달러를 정점으로 미국 경제회복 및 재투자법(American Recovery and Reinvestment Act of 2008; ARRA)에 의해 일시적으로 증가한 2009년을 제외하고는 지속적으로 감소하여 2013년에는 300억 달러 이하인 283억 달러까지 감소할 것으로 추정하고 있다(http://www.aaas.org). 이는 전년과 비교해도 5.5% 감소한 금액이며 2003년과 비교할 경우 14.3% 감소한 수치이다.
(단위 : 달러)

주 : 2013년도 회계연도 수치는 최근 추정치
출처 : AAAS Report: Research and Development, agency budget documents, and appropriations reports, 2013
[그림 2-1-1] NIH 예산(1998~2014년)
이는 Sequestration이라고 불리는 미국 정부의 자동예산삭감제도에 기인한 것으로 2012년 회계연도 기준 예산보다 17억달러 감소한 수치이며 700개의 신규 연구 그랜트(Grant)가 감소한 것을 의미한다. 이로 인해 R&D과제에 선정되기 위한 성공률(Success Rate)1)도 낮아지고, 최초로 R01이라고 불리는 연구 프로젝트 그랜트을 받는 연구자의 평균 연령도 약 42세에 이른다. 2014년 회계연도 NIH예산의 경우 313억달러를 요구하고 있으며, 이는 2012년 회계연도 기준 예산보다 4억7천1백만달러(1.5%) 증가한 금액이다.2) 이중에서 NIH의 순수 R&D예산은 97.3% 수준인 305억달러에 해당한다.

[그림 2-1-2] Funding 메커니즘에 의한 2014년 회계연도 기준 예산현황
NIH 산하기관 중 2014년 예산의 주요 증액 소요는 2년차를 맞이하는 국가중개고등과학센터(National Center for Advancing Translational Sciences; NCATS)가 15.9%, Common Fund의 Trans-NIH initiatives가 2012년 회계연도 기준 예산보다 5.1% 증가한 5억7천3백만달러에 이른다. 다학제 협력연구를 위해 설계된 Common Fund는 NIH 예산의 1.8%에 해당한다.
2014년 회계연도 기준으로 NIH 예산의 우선순위 영역은 기초연구, 중개연구, 과학인재의 확보 및 유지, 미국 경쟁력 등 4개의 주제(Theme)에 대해 강조하고 있다.
기초연구
인간의 뇌, 단일세포 생물학, 후성유전체학(Epigenomics)을 포함한 기초연구를 포함한다. NIH는 실시간으로 뇌안에 있는 수백만개의 신경세포, 네트워크, 경로의 활동을 관찰하기 위한 새로운 장비을 통해 뇌 기능에 대한 더 깊은 이해를 발전시키기 위한 새로운 BRAIN(Brain Research through Application of Innovative Neurotechnologies) Initiative를 지원하고 있는 3대 기관 중에 하나이다. Big Data는 또 하나의 핵심 주제인데 생의과학 연구자들이 진보된 기술적이고 계산적인 능력을 가지고 생성할 수 있는 방대한 양의 데이터로서 유전체 시퀀싱 장비, 고해상도 의료 이미징 장비, 전자의료기록, 환자 건강을 모니터하는 스마트폰 앱 등에서 생성된 데이터세트 등을 말한다. 복잡한 데이터세트들의 공유 및 사용에 있어 고유한 도전들을 다루기 위해서 NIH는 2014년 회계연도 기준으로 Common Fund를 통해 4천만 달러를 투자하는 Big Data to Knowledge(BD2K)를 시작할 계획에 있다.
중개연구
의료제품의 개발에 혁신을 위한 구심점으로서 역할을 하고 있는 NCATS는 2011년 12월에 설립되었다. 기본적인 아이디어는 생의과학 연구의 급속한 진보에도 불구하고 최근 10년간 FDA 승인 신약 건수는 감소해온 반면, 바이오기업들은 다양한 R&D 영역에 대한 예산을 삭감해왔다. NCATS는 전국적으로 수행중인 임상 및 중개 연구 방법을 개선하는데 중점을 두고 있는 생의과학 연구 기관들의 컨소시움에 자금을 지원하는 Clinical and Translational Science Awards(CTSAs)3)를 포함한 NIH 내에 다양한 종횡단적 프로그램(Cross-cutting program)을 합친 것이다. NCATS는 또한 신약 테스트를 위한 3차원 조직칩을 개발하고 화학적 독성을 평가하기 위한 다른 기관들과 협력을 하고 있다. 2012년 5월에는 소유권이 있는 중단된 신약 후보물질에 대한 생의과학 연구 커뮤니티와 제약기업 파트너들간의 협력 프로그램인 Discovering New Therapeutic Uses for Existing Molecules Program 신설을 발표하였다. 2014년 회계연도기준으로 강조되고 있는 중개연구의 다른 분야는 induced Pluripotent stem(iPS) cells, 성인 피부 혹은 혈액 세포를 포함한 재생의학과 중추신경계를 위한 치료제 전달을 위한 수단으로서 나노기술을 탐색하는 분야이다. 이외에도 NIH는 임상연구에 참여하기 위한 수천만의 환자를 모으기 위해 국가임상연구네트워크(National Clinical Research Network)를 설립하기도 하였다.
과학인재의 확보 및 유지
NIH는 새로운 생의과학 연구자 다양성 이니셔티브(Biomedical Research Workforce Diversity Initiative)를 통해 생의과학 연구자들의 다양한 플을 확보하고 유지하기 위해 노력해왔다. 이 이니셔티브의 핵심은 NIH 산하 기관을 지원하기 위한 멘토링 자원, 장학금, 인프라를 제공하기 위해 설계된 Building Infrastructure Leading to Diversity(BUILD) 프로그램이다. 이 이니셔티브는 NIH 훈련원의 추적과 편향 및 다양성 인식연구에 초점을 맞추고 있을 뿐만 아니라 National Research Mentoring Network, NIH의 신규 Chief Officer for Scientific Workforce Diversity를 포함한다. 연구자의 다양성을 강화하기 위한 노력과 함께 생의과학 연구자들을 강화하기 위한 다양한 다른 노력을 하고 있다. 이것은 혁신적 훈련 방법을 촉진시키기 위한 그랜트 프로그램을 신설하고, 박사후 연구원 급여를 인상하고, 개별연구를 촉진시키기 위한 연구비 지원을 늘리고, 훈련생들에 대한 단순하고 총체적인 추적 시스템을 개발하고, 다양한 경력 선택에 대해 설명하기 위한 훈련 그랜트 검토 프로세스를 보완하며, 생의과학 연구자의 지속적인 평가에 중점을 두고 있는 NIH 내 단위조직(units)을 신설하는 것 등을 포함한다.
미국 경쟁력 및 기타
NIH의 연구는 전국적으로 수십만명의 일자리를 지원하고 NIH의 공공 펀드는 상호보완적인 민간 투자를 촉진시키며 미국 경제에 상당한 이익을 가져다 줌으로써 미국 경쟁력 강화에 기여하고 있다.
인간배아줄기세포연구는 자금지원은 적지만 역사적으로 정치적 관심이 높은 분야이다. 오바마 대통령이 인간배아줄기세포연구에 연방자금지원을 확대한다고 발표한 이래 NIH 인간 줄기세포 레지스트리에 200개 이상의 줄기세포주가 승인되었다. 2003년 1월 미국 대법원은 2010년 여름 미국 지방 판사가 NIH로 하여금 인간배아줄기세포 실험을 중지하라는 사전 명령을 내렸던 행정부 정책에 도전하는 사례에 대한 청문을 거절하였다. 지방 판사는 이후에 소송을 기각했고, 대법원의 결정은 수년간 지속된 법률 사건에 종지부를 찍었다.
이외에도 2012년 11월 NIH 수장인 Collins는 National Institute on Drug Abuse와 National Institute on Alcohol Abuse and Alcoholism을 통합해서 한걸음 물러나는 대신 물질 사용, 남용, 중독 관련 연구기관을 더 잘 조정하기 위한 체계를 만들기로 결정하였다.
나. 국가과학재단(NSF : National Science Foundation)
NSF는 대학과 비영리 연구기관의 64%를 지원하는 기초 및 비의학 생물학 연구의 1차적인 연구자금지원기관이다. NSF의 생물과학 부서(Directorate for Biological Sciences; BIO)는 기후변화, 식품 안전성 및 보안, 생명기술 및 나노기술, 인간 행복과 같은 복잡한 이슈에 대해 대응하고 이해하기 위한 연구에 자금을 지원한다.
NSF의 BIO에 대한 2014년 회계연도 기준 예산요구는 7억6천6십만달러로 2012년 수준보다 4천8백3십만달러(6.8%) 증가한 수준이다. BIO는 5개 분야에 대한 연구를 지원하고 있다. 분자 및 세포 생화학은 1억3천6백4십만달러(8.6% 증가), 통합 생물체 시스템은 2억2천5백4십만달러(6.1% 증가), 환경 생물학 및 생물학적 인프라는 각각 1억4천9백만달러(4.5% 증가), 1억3천3백7십만달러(5.7% 증가), Emerging Frontiers는 1억1천6백2십만달러(10.4% 증가)이다.
BIO는 범 NSF 이니셔티브에도 참여하고 있는데 대표적으로 지속가능한 과학, 공학, 교육(Science, Engineering, and Education for Sustainability; SEES) 8백5십만달러, 생물학, 수학, 물리 과학(Biological, Mathematical and Physical Sciences; BioMaPS) 프로그램 1천8백1십만달러를 신규 투입하고, 청정 에너지 연구에는 7백만달러를 증액시킬 계획이다.
통합 생물체 시스템 분야의 경우 다양한 생물체의 행동을 유발하는 맵핑 회로에 초점을 맞추어 5백만달러를 증액시키고, 지속가능한 혁신을 위한 소프트웨어와 생명과학 내 사이버인프라에 4천5백만달러를 신규투입할 계획이다. 또한, 생물학적 시료 및 수집 데이터와 장기 행성 생물다양성 데이터를 연결하는 새로운 프로그램에 2백만달러를 요구하고 있다. 아울러, 국가 생물학적 관찰 네트워크(National Ecological Observatory Network; NEON)에 3천7백9십만 달러를 증액한 9천8백2십만 달러를 요구하고 있다.
2. 민간투자 동향
민간 분야 바이오산업은 경기침체에 의한 R&D 투자 감소와 더불어 바이오신약의 부상, 신약생산성 저하 등에 기인한 주요 다국적 제약기업의 R&D 투자 형태와 분포에 주요한 변화가 있어왔다. Battelle(2012)에 따르면 주요 미국 바이오회사의 지속적인 R&D 감소에도 불구하고, 2013년 미국 민간 바이오 R&D 투자는 총 827억달러로 2012년 815억달러 대비 1.4% 증가할 것으로 예상된다. 이는 2010년 852억달러에서 2012년 815억달러까지 지속적으로 감소추세와 비교시 다소 회복된 수치이다. 반면, 중국 등 아시아 바이오기업의 급속한 성장으로 인해 2013년 전 세계 민간 바이오 R&D 투자는 1,892억달러에 이르러 2012년의 1,816억달러 대비 4.2% 성장할 것으로 예상된다.
Centers for Medicare & Medicare Services에서의 인센티브 및 페널티와 함께 미국 회복 및 재투자법(American Recovery and Reinvestment) 펀드에 의해 지원되는 미국에서의 전자보건기록의 시행은 현재 절반이상 진행되었다. 통합된 보건의료 정보 시스템은 효율성, 질, 임상적 결정 지원을 향상시키고, 가치 중심 성과를 전달하기 위한 Accountable Care Organizations와 같은 새로운 공급자 모델들 관련 기술을 가능하게 하게 할 것으로 예상된다. 보안 및 개인정보 보호와 함께 이러한 시스템으로부터의 데이터 분석은 치료제와 진단제의 R&D를 가이드하고 검증하며, 임상에서의 예측 및 진단을 향상시키고, ʻʻConnected healthʼʼ 기술들의 개발 및 채택을 가속화하기 위한 상당한 잠재력을 제공할 것으로 기대된다. 바이오 연구 및 성과에서 이러한 개선은 Big data 분석 분야에서 지속적인 기술 개발을 중심으로 다양한 시장에서 응용되면서 Big data 분석을 위한 기술과 서비스가 신산업이 될 것으로 예상된다. ʻʻConnected healthʼʼ는 보건의료 정보 기술의 환자 중심적인 모바일 영역이다. 예를 들어 건강 및 순응행태 모니터링에 기반한 심장질환 환자에 대한 재입원 위험도를 계층화하는 프로젝트와 같은 데이터 분석이 이미 진행중이다.
보건의료정보에 대한 접근은 특히, 고속(High-Throughput) 생물학 장비로부터의 급증하는 데이터 세트와 통합될 때 제약 R&D를 가속화시킬 것으로 기대된다. Genome-wide association study와 같은 기술은 새로운 신약 타겟과 연관된 바이오마커의 발굴을 가능하게 하고 있다. Phenotype data와 통합된 총체적인 Post-marketing Surveillance(PMS)는 약물 안전성에 새로운 인사이트를 제공할 것이다. 중개연구 또한 바이오제약 연구의 새로운 핵심 분야로서 NIH NCATS는 민간 영역 R&D를 촉진하게 될 것으로 기대된다. 질병모델과 Systems Biology와 같은 새로운 중개연구는 의약품 안전성 및 유효성을 조기에 더 정확하게 예측하고 치료제의 반응의 진단 및 예측을 위한 임상 바이오마커를 제공한다.
초기 단계 혁신에 자금지원을 주로 하는 벤처캐피털의 경우 전통적으로 의료기기 산업에 투자해왔다. 그러나, 2012년 초기 9개월의 의료기기 벤처 투자는 이전 5년간 평균의 단지 76%에 불과하며 2013년에도 비슷할 것으로 전망된다. 반면, GE나 Medtronic과 같은 글로벌 의료기기 기업은 상대적으로 지속적인 투자를 유지하고 있다. 그래서, 다양한 영역에서부터 점차 복잡한 의료기기까지 통합한 위험 관리 방법으로서 파트너링이 각광을 받고 있다.

1. 개요
일본은 2011년 3월 동일본 대지진과 원자력 발전 사고라는 커다란 시련을 경험하면서 지금까지 효율 우선의 정책에서 ʻʻ국민이 안심할 수 있는 질 높은 삶의 실현ʼʼ으로 정책 초점을 전환하고 있다. 특히, 세계에서 가장 급속하게 진행되고 있어 심각한 사회문제로 대두되고 있는 고령화 문제에 대응하고 해결하기 위한 방안을 찾아내는 것을 매우 중요한 과학기술 정책 과제의 하나로 인식하고 있다.
이에 따라 일본 정부는 2011년 8월 수립된 5개년 제4차 과학기술기본계획에서 생명과학 혁신(라이프 이노베이션)을 통한 국민의 건강한 신체와 정신, 풍요로운 삶을 영위할 수 있는 사회 구현을 중점목표의 하나로 제시하였다. 생명과학 혁신을 통해 의료, 간호, 건강 서비스 등의 산업을 창출하고 활성화하며, 이를 통해 국가의 지속적 성장과 사회의 발전을 실현하겠다는 목표이다. 이와 함께 선진국이 직면하고 있는 고령사회에 대응하고 개발도상국에 만연하고 있는 질병퇴치를 위한 의약품, 의료기기 개발 등을 통해 국제적인 공헌을 하겠다는 목표도 포함되어 있다.
2. 일본의 바이오정책
일본 정부는 생명과학 분야의 연구개발을 개별적·요소적 분야에서부터 통합적·종합적으로 추진하고 있다. 생명과학 분야에서는 게놈과학 및 융합, 뇌신경, 발생 및 재생, 면역, 암, 녹색기술, 보건, 생명윤리 등 8개 분야를 중점 지원하고 있다. 임상분야에서는 국민 건강 유지 및 향상을 위해 의료 산업을 발전시키는 것을 목표로 하고 있고 의약품개발, 의료기기 개발, 재생의료, 유전자치료, 이미징, 규제(Regulation) 등 6개 분야를 중점적으로 육성하고 있다4).
일본의 바이오분야 연구개발 투자액은 2011년 총 2.77조엔으로 지속적으로 증가하고 있다. 공공기관 및 비영리단체, 대학의 연구개발비는 점증하고 있으나 기업의 투자액은 큰 변화를 보이지 않고 있다는 특징을 가지고 있다.
(단위 : 억엔)

출처 : 일본 총무성 과학기술연구조사, 2012
[그림 2-2-1] 일본 바이오 연구개발 투자 추이(2002~2011년)
제4차 과학기술기본계획은 바이오 혁신을 구현하기 위한 중점 연구개발 정책으로 혁신적 예방법 개발, 새로운 조기진단법 개발, 시스템 혁신을 제시하고 있다.
혁신적 예방법 개발
국민 건강상태의 장기간 추적, 생활 습관 및 환경 영향 조사, 코호트 연구(임상정보, 전사체, 유전체 서열 해석 등), 생활습관병 발병 및 진행 구조 규명을 통해 객관적 근거를 바탕으로 예방법 개발을 추진한다. 사회적 파급효과가 큰 감염증이나 자연재해 발생시 급속하게 확산되는 감염증 등을 대상으로 예방효과가 큰 백신 연구개발을 추진하고 국내·외에 성과확산을 촉진한다. 그리고 치매와 같이 사회적, 경제적 손실이 큰 질병의 예방, 조기진단 등의 기술개발을 위한 연구를 추진한다.
새로운 조기진단법 개발
질환의 조기 발견을 위한 진단기술 개발을 위한 미량 물질의 동정 기술 등 새로운 검출방법과 검출기기를 개발하고 새로운 마커 탐색이나 동정 등 정밀 조기 진단 기술 개발을 추진한다. 또한 보다 소형이면서 침습이 적은 고성능 내시경과 같은 기술·기기의 개발, 3차원 영상기법 등 새로운 이미징 기술개발을 추진한다.
시스템 혁신
연구개발 성과를 의약품, 의료기기로 신속하게 실용화로 연계시키기 위한 구조를 정비한다. 특히 의약품 관련 연구성과를 임상 연구, 임상 실험, 제품화로 연계하는 기간을 단축하기 위해 승인심사와 관련된 규제·제도를 혁신하고 연구개발 환경을 정비한다.
3. 일본의 바이오 연구개발 및 산업 현황
가. 바이오 연구개발 현황
일본은 제2기 과학기술 기본계획 이후 생명과학 분야에 중점적으로 투자해 왔다. 지원방식도 개별 연구실 수준의 small science뿐만 아니라 다수의 연구실이 협력하여 실시하는 2000년 이전에는 볼 수 없었던 대형 프로젝트(big science)도 지원하고 있다. 일본에서 생명과학 연구의 대형화가 시작된 것은 1999년에 시작된 밀레니엄 프로젝트이다. 이 프로젝트에 2000년 경제신생특별 기준예산 중 640억엔이 게놈연구를 중심으로 한 생명과학 관련 연구에 투자 되었다(밀레니엄게놈프로젝트). 이를 통해 이화학연구소 등 연구거점을 중심으로 기초기반 사업들이 수행되었다. 최근에는 관련 3개 부처(문부과학성, 후생노동성, 경제산업성)에서 응용까지 고려한 대형 연구사업이 지원되고 있다.
[표 2-2-1] 주요 기초기반 분야 사업
|
분야 |
주요 사업 |
소관 부처 |
|
기초기반 |
단백 3000 프로젝트(2002~2006년) |
문부과학성 |
|
타겟 단백 연구 프로그램(2007~2011년) |
||
|
게놈 네트워크 프로젝트(2004~2008년) |
||
|
뇌과학 연구 전략 추진 프로그램(2008년) |
||
|
세포·생체 기능 시뮬레이션 프로젝트(2003~2007년) |
||
|
통합 데이터베이스 프로젝트(2006~2010년) |
||
|
내셔널 바이오리소스 프로젝트(2007~2011년) |
출처 : 연구개발부감보고서, 과학기술진흥기구 연구개발전략센터, 2013
[표 2-2-2] 부처별 주요 응용 연계 사업
|
분야 |
주요 사업 |
소관 부처 |
|
암 |
암 전문가 양성 계획(2007~2011년) |
문부과학성 |
|
차세대 암연구 전략 추진 프로젝트(2011~2015년) |
||
|
분자 이미징 연구 전략 추진 프로그램(2010년) |
||
|
후생노동과학연구비(제3차 암 종합전략연구)(2004년) |
후생노동성 |
|
|
후생노동과학연구비 (난치병·암등 질환분야 의료실용화 연구) |
||
|
암 조기 진단·치료 기기 종합 연구 개발 프로젝트 (2010~2014년) |
경제산업성 |
|
|
임상ㆍ임상 중개 |
첨단 의료 개발특구(슈퍼특구)(2008~2012년) |
내각부 |
|
문부과학성 |
||
|
후생노동성 |
||
|
경제산업성 |
||
|
중개연구지원추진 프로그램(2007~2011년) |
문부과학성 |
|
|
중개연구가속네트워크 프로그램(2012년) |
||
|
맞춤의료 실현화 프로젝트(2002~2012년) |
||
|
임상 거점 병원 활성화 사업(2007~2011년) |
|
|
|
후생노동과학연구비(임상연구기반정비추진연구사업) |
||
|
기초-임상 연구 중개촉진 기술개발(2007~2012년) |
경제산업성 |
|
|
재생의료 |
재생의료 실현화 프로젝트(2003~2012년) |
문부과학성 |
|
후생노동과학연구비(재생의료실용화연구사업) |
후생노동성 |
|
|
줄기세포 실용화 평가 기반기술 개발 프로젝트 |
경제산업성 |
|
|
재생의료 실현화 하이웨이 |
문부과학성 |
|
|
후생노동성 |
||
|
경제산업성 |
||
|
감염증연구 |
신흥·재흥 감염증 연구 거점 형성 프로그램(2005~2009년) |
문부과학성 |
|
감염증 연구 국제 네트워크 추진 프로그램(J-GRID) (2010~2014년) |
||
|
후생노동과학연구비(감염증 대책 종합 연구 사업) |
후생노동성 |
|
|
신형 인플루엔자 백신 개발·생산체제 정비 임시 특례 교부금(2010~2014년) |
출처 : 연구개발부감보고서, 과학기술진흥기구 연구개발전략센터, 2013
일본의 기초연구는 미국, 유럽과 함께 삼대 축을 형성할 정도로 우수한 국제 경쟁력을 보유하고 있다. 특히 발생·재생 분야의 연구수준이 높다. 2012년 야마나카 신야 교수(쿄토 대학)가 iPS 세포 제작과 관련되어 노벨생리의학상을 수상하였고, 줄기세포로부터의 난자 제작을 성공하여 사이언스지에서 선정하는 「Breakthrough of the year 2012」에 포함되었다.
최근 일본 정부는 미국이 신약개발, 세계 50대 제약사 보유 순위에서 선두를 달리고 있는 것은 예산, 인력 등 제약산업 지원을 총괄하는 국립보건원(NIH)이 존재하기 때문이라고 인식하고 ʻ일본판 NIHʼ 설립을 추진하고 있다. 인류가 경험한 적이 없는 초고령화 사회를 맞아 범국가 차원에서 통합된 생명공학 연구개발 체제를 구축하여 국민의 건강수명 연장과 일본형 선진의료모델을 구축하기 위해서는 보다 기동적인 연구개발 체제를 구축하고, 미국에 비해 연구개발 예산이 크게 부족한 현실을 고려하고, 후생노동성, 문부과학성, 경제산업성 등 관련 부처의 바이오 연구개발 예산을 확대하는 한편 의료 관련 연구개발 정책을 총괄 조정하는 사령탑을 설립해야 한다고 인식하고 있다. 특히 기초연구는 문부과학성, 임상·응용은 후생노동성, 산업육성은 경제산업성이 각각 담당하고 있어 부처간 협력이 부족하고 예산이 중복되는 등 전반적 의료전략 추진에 문제가 많다고 진단하고 있다. 이를 위해 일본 정부는 2014년(ʼ14년 4월∼ʼ15년 3월) 내에 의료분야 연구개발의 컨트롤타워 역할을 담당할 일본판 NIH 설립을 위한 관련 법을 정비 중에 있다. 이를 통해 연구개발과 임상시험, 신약개발 심사와 승인 등을 총괄하는 국가 차원의 신약개발 지원체제를 구축하고, 의료 관련 R&D 예산(ʼ12년 3천5백억엔) 집행을 일원화함으로써 예산낭비를 막는 동시에 첨단 의료 기술·기기 개발을 가속화한다는 계획이다.
나. 산업 현황과 전망
일본의 바이오산업은 2012년 현재 2조 7,500억 엔(약 340.5억 달러) 규모로5), 500개 이상의 바이오기업들을 보유하고 있다. 이 중 바이오의약품, 백신, 의약품원료 등 제약산업이 41.5%로 가장 큰 비중을 차지하고 있고, 이어 농업·식품 31.5%, 화학제품 9.8%, 진단 7.2%, 기기·시약 6.0% 등이 비교적 큰 시장을 형성하고 있다6).
[표 2-2-3] 2011년 일본 바이오산업 시장 규모
(단위 : 비중)
|
생명공학산업 |
2011년 |
|
|
제약 |
바이오의약품 |
31.6% |
|
백신 |
6.6% |
|
|
의약품 원료 |
3.3% |
|
|
농업·식품 |
31.5% |
|
|
화학제품 |
9.8% |
|
|
기기·시약 |
6.0% |
|
|
서비스 |
1.3% |
|
|
생물정보학 |
1.1% |
|
|
기타 |
1.5% |
|
출처 : Nikkei Biotechnology & Business사, 일경바이오연감, 2012
이처럼 일본은 세계 상위 50대 제약기업 중 11개 기업을 보유하고 있는 제약산업 강국이다. 일본 의약품 시장 규모는 약 9.3조엔(2011년)으로 이 중 90%이상이 의료용 의약품이다. 2011년 현재 세계 의약품 시장 규모는 9,529억 달러(2011년)이며, 미국(38%)에 이어 세계 2위(11.7%)의 시장점유율을 차지하다. 또한 2005년 이후 연평균 11% 증가율을 보이고 있으며,7) 시장 점유율이 64%8)에 달하고 있는 아시아태평양 지역에서의 시장경쟁력을 제고하기 위하여 중국, 인도 시장 진출에 박차를 가하고 있다.
[표 2-2-4] 세계 상위 50대 제약기업 중 일본기업 목록(2010년)
|
순위 |
기업명 |
매출(백만 달러) |
종업원수 |
순익(백만 달러) |
|
14 |
Takeda Pharmaceutical |
15,800 |
18,527 |
3,200 |
|
19 |
Otsuka Holdings |
11,700 |
24,589 |
727.3 |
|
20 |
Astellas Pharma |
10,500 |
16,120 |
1,300 |
|
22 |
Daichi Sankyo |
10,300 |
30,423 |
451.3 |
|
23 |
Eisai |
8,700 |
11,653 |
551.7 |
|
29 |
Kyowa Hakko Kirin |
4,700 |
7,499 |
253.6 |
|
31 |
Mitsubushi Tanabe Pharma |
4,400 |
9,294 |
326.2 |
|
32 |
Chugai Pharmaceutical |
4,400 |
6,723 |
489.4 |
|
43 |
Dainippon Sumitomo Pharma |
3,200 |
7,513 |
226.0 |
|
44 |
Shionogi Co. |
3,000 |
5,486 |
416.5 |
|
46 |
Taisho Pharmaceutical |
2,800 |
5,664 |
210.1 |
출처 : IMAP Pharmaceutical & Biotech Industry Global Report, 2011
일본의 바이오산업 경쟁력은 PCT 출원 특허 중 바이오 특허의 비중, 기업의 바이오 분야 R&D 투자 규모 측면에서 설명될 수 있다. 2008년부터 2010년까지 3년 동안 PCT 출원된 총 특허 중 바이오 분야 특허의 비중을 국가별로 비교해 보면, 일본은 미국(41%)에 이어 세계 2위(11.5%)를 기록하고 있다.

출처 : OECD, Patent Database, 2012.12
[그림 2-2-2] 국가별 PCT 출원특허 대비 바이오 분야 특허 비중
일본은 또한 기업의 제약 및 바이오 연구개발 투자(2011년) 규모 측면에서 미국, 스위스에 이어 세계 3위를 차지하고 있다. 기업의 제약 및 바이오 연구개발 집중도 면에서도 일본은 16.3%로 미국(15.3%), EU(14.7%)보다 높은 것으로 나타났다.

출처 : The 2012 EU Industrial R&D Investment Scoreboard, European Commission, JRC/DG RTD, 2012
[그림 2-2-3] 국가별 기업의 제약 및 바이오 연구개발 투자(2011년)
일본은 지방정부 차원에서 산업클러스터 설립을 적극 지원하고 있으며 바이오에 초점을 맞춘 산업 클러스터로는 홋카이도, 간토, 긴키 지역을 들 수 있다. 수도권에 해당하는 간토지역에는 도쿄와 요코하마 클러스터에 다수의 대학과 연구소가 연계되어 신약개발과 의료장비, 유전체 등 분야의 핵심기술을 보유하고 있다. 대표적인 기관으로는 도쿄대학 의과학연구소, AIST 츠쿠바 임해부도심센터, RIKEN 요코하마연구소, 카즈사 DNA연구소 등이 있다. 관서지방을 대표하는 긴키지역에는 고베의 KTI(Kobe Tissue Engineering Initiative) 클러스터가 인공피부 등 조직재생 분야에서 두각을 나타내고 있다. 홋카이도 클러스터에는 홋카이도 대학과 오비히로 대학에서 차세대 포스트 유전체 연구를 추진하고 있으며, 동식물 관련 바이오 분야의 핵심역량을 보유하고 있다.

1. 유럽연합의 바이오정책
2020년을 대비하여 유럽 경제위기 극복 및 재건을 목적으로 작성된 「유럽 2020 전략」(Europe 2020 strategy), 그리고 이를 달성하기 위한 추진방안에 해당하는 7개 중점계획(Flagship Initiative)이 동시에 발표되었으며, 2011년 「Horizon 2020」을 통해 차기(ʼ14~ʼ20년) EU 프레임워크 사업의 명칭이 변경되어 발표되었다. 「Horizon 2020」을 통해 유럽연합(EU)은 혁신의 관점에서 연구개발을 포괄하고 예산 운영의 탄력성을 높이는 방향으로 기존 제7차 프레임워크와 경쟁력향상사업을 통합하여 혁신과정상 연계를 사업차원에서 강화하였다. 바이오 동향 관련 주요정책 및 과제는 이러한 전략 및 사업에서 중점추진영역으로 많은 예산이 투입되고 있다.
[표 2-3-1] EU 주요 혁신 정책 관련 문서
|
구분 |
발간년도 |
관련 기관 |
비고 |
|
유럽 2020 전략 |
2010년 |
EU 집행위원회 (EU Commission) |
주요 정책 - smart growth - sustainable growth - Inclusive growth |
|
유럽 2020 혁신공동체 중점계획 |
2010년 |
EU 집행위원회 (EU Commission) |
혁신 공동체 관련 실행계획으로서 지식기반강화 및 분산화 방지, 창의적 아이디어 상업화, 사회적지역적 결합성 최대화 등 |
|
Horizon 2020 |
2011년 |
EU 집행위원회 (EU Commission) |
대표사업 - 유럽과학의 우수성 강화 - ICT, NT, BT, AM, ST 중심으로 산업기술분야 주도적 역할 강화 |
2013년까지 진행되고 종료되는 제7차 프레임워크 프로그램(FP7)은 2007년부터 시작되었으며, 전체 예산은 505억 유로이다. FP7의 4개의 특정 프로그램들과 1개의 핵연구프로그램 중 바이오와 관련이 있는 프로그램은 협력 프로그램으로서, 총 10개의 세부 프로그램으로 구성되고, 그중 건강과 식품·농업·생명공학 세부 프로그램들이 바이오 관련분야에 해당된다. 대표적으로 건강 세부 프로그램은 협력 프로그램의 주요 주제이며, FP7 기간 동안 60억 유로의 예산이 배정 되었으며 이는 전체 협력 프로그램 예산(324억 유로)의 18.5%에 해당하고 이와 관련된 대표적 연구 분야는 미생물 저항, HIV/AIDS, 말라리아, 결핵, 전염병 등이다.
2010년에 지속가능한 포괄적 성장을 위해 발표된「유럽 2020 전략」은 기술과 제품의 영역을 넘어 서비스 혁신이 갖는 의미와 정책적 권고사항 및 응용서비스 개발 추진 필요성 등을 세부전략으로 제시하였다. 유럽연합 GDP 대비 3%를 R&D에 투자하는 것을 목표로 삼고 있으며, 바이오 관련 기술을 유럽의 지속적 경제성장을 위해 필수적인 기술로 정의 하고 있다. FP7에 이어 「Horizon 2020」은 유럽이 직면하고 있는 도전과제와의 연관성, 연구경영 및 관리 개선, 상호보완적 접근, 로드맵 기반의 연구 수행 등에 중점을 두고 2014년부터 2020년까지 진행 될 예정이다.「Horizon 2020」의 세부적인 내용을 살펴보면, 사회적 과제에서 ʻʻ보건 및 인구통계학적 변화와 웰빙ʼʼ 부분에 가장 많은 예산인 대략 77억 유로가 배정되어 향후 유럽의 인구구조 변화 및 삶의 질 향상 요구 증대, 산업구조변화에 직접적으로 대비하고 있는 것으로 판단된다. 특히 유럽은 천연자원 활용을 확대함과 동시에 에너지활용을 최소화하고, 나아가 폐기물을 에너지로 활용함으로써 폐기물 발생을 억제하는 에코시스템에 기반을 두는 ʻʻ바이오기반경제(Bio-Based Economy)ʼʼ 건설에 대한 전략을 구체화하고 있어 향후 세부적인 프로그램 진행 등 지속적인 사업 추진 상황을 모니터링하여 우리나라도 이에 적극 협력하여 참여하는 것을 고려할 필요성이 제기된다.
2. 주요국가의 현황
가. 영국
영국 정부는 치열한 R&D 경쟁에서 선도적 위치를 차지하기 위한 성장계획 및 전략들을 2011년 이후 적극적으로 제시해오고 있다. 영국 내에서 생명과학 산업은 세계적으로 성공한 산업의 일례로, 현재 유럽에서 선두에 있으며 또한 미국의 뒤를 이은 세계에서 두 번째라는 위치를 차지하고 있다. 따라서, 이들 정부 정책에서 기초과학과 바이오 분야는 매우 중요한 위치를 차지하고 있으며 실제로 예산 비중이 매우 높은 상황이다. 영국의 경제사회 목적별 정부 R&D 예산 비중 추이를 살펴보면 기초과학 등 지식증진 부문이 25%(2011년 기준)로 가장 높게 나타나고 다음으로 보건 분야가 20%(2011년 기준)이며 지속적으로 증가하고 있는 경향을 나타낸다. 뿐만 아니라 연구회별 정부연구개발예산을 살펴보아도 의학연구회가 21.2%(2011년 기준) 679백만 파운드로 높은 비중을 나타내고 있으며 특히 전년대비 증가율은 7.1%로 가장 높은 상황이다. The Age of Bioscience-Strategic Plan 에서 집중 연구되어야 할 주요 주제로 식량안보, 바이오에너지 및 산업생명공학, 건강유지를 위한 기초 생명공학의 3가지 과제가 2010년 발표된 이후, 전체 계획 중 중간 시점에 도달하였다. 이에 따라 최근 로드쇼 등 다양한 이해관계자 모임을 통해 향후 방향성에 대한 논의가 진행 중이다. 특히 최근에는 ʻʻ화이트 바이오테크놀로지ʼʼ를 지향하는 산업적 바이오기술, 바이오에너지 및 합성생물학 분야에 관심이 집중되어지고 있다. 이는 유럽의 바이오경제 건설과 무관하지 않은 것으로 판단된다.
나. 독일
독일은 연구개발 투자를 확대하여 혁신적인 기술개발 토대를 구축하고자 많은 노력을 기울이는 나라이며 범부처 차원의 첨단기술전략 프로그램(HTS 2020)을 발표하고 5대 중점기술 분야를 지정하여 육성하고 있다. 이들 중 건강 및 먹거리가 바이오 분야와 직접적으로 관련된다고 할 수 있다. 특히, 정부 연구개발 투자 중 건강 및 바이오 분야가 차지하는 비중은 26%를 넘어서고 있으며(2009~2012년) 이는 전 세계적으로도 매우 높은 상황이라 할 수 있다. 독일은 유럽국가들 중에서 가장 많은 약 500개의 바이오 관련 회사들이 있으며, 20개 이상의 기업이 주식 시장에 상장되어 있고, 59개의 기업이 혁신적인 기업으로 분류되어 있다. 또한 매출의 거의 50%를 연구개발에 재투자하며 이 금액이 2005년도에 1억 유로를 넘어섰다. 독일 정부의 바이오 보건의료 연구는 독일 사회에 빈번하게 발생하는 6대 질병(퇴행성 신경질환, 당뇨, 심혈관 질환, 감염질환, 암, 폐질환)에 연구 역량을 결집시키고 있으며 실용화 촉진을 위한 중개연구 및 전략적 연구 파트너쉽을 구축하는데 집중하고 있다. 이를 지원하기 위한 대표적인 프로그램으로는 ʻʻ독일 6대 다발질환 연구센터ʼʼ, ʻʻ독일 유전자 연구네트워크ʼʼ, ʻʻ의약학 연구 네트워크ʼʼ, ʻʻ희귀질환 연구연합ʼʼ, ʻʻ보건의료 지역클러스터ʼʼ, ʻʻ제약기술 콘소시움ʼʼ, ʻʻ고령화 대응 기술개발ʼʼ 등이 있으며 다른 나라들과 더불어 유럽의 바이오기반 경제 건설에 주력하고 있는 것으로 분석된다. 또한 독일은 해외 바이오기업들에게 협력을 위한 문호를 개방하고 있다. 진단에서 제약, 녹색생명공학에서 나노생명공학까지 외국기업들은 수월하게 파트너쉽 기회를 찾을 수 있으며 특히 건강/의약 분야 생명공학기업들의 80%가 외국 기업과 협력하고 있다. 독일 바이오기업에서는 의료관련 분야의 활동이 가장 활발히 이루어지고 있으며, 약품 또는 진단법 개발에 중점을 두고 있는 것으로 조사되었다.
다. 프랑스
정부 연구개발 예산 중 생명공학 분야에 대한 투자(1174백만 유로) 비중 (~23%, 2012년 기준)이 가장 높게 나타나고 있으며 정책방향은 유럽의 바이오기반 경제 건설과 맥락을 같이 하고 있는 것으로 판단된다. 특히 프랑스 정부는 바이오분야 기술수준이 세계적 수준보다 뒤쳐진 것으로 판단하고 전략적으로 관련 기업들을 지원 및 발전시키려 노력하고 있다. 기업의 바이오관련 분야는 크게 13개 분야로 구분하고 있으며, 중점 추진분야는 연구와 생산, 진단과 분석서비스, 치료법, 유전체학과 단백체학 순으로 나타난다.

출처 : www.frenchbiotech.com
[그림 2-3-1] 프랑스 바이오기업의 주요 분야(2013년)

1. 개요
2013년, 중국 바이오분야 규모와 성과는 날로 높은 수준으로 발전하고, 국제협력 목표도 달성하였으며 어떤 분야의 시작단계에서 세계 경쟁에서도 뒤지지 않는 실력을 갖추게 되었다. 또한 국내시장은 치열한 국제적 경쟁에 직면하고 있고, 지속적인 발전을 거듭해온 제약 산업의 기술혁신과 구조개혁은 한 단계 발전하는 계기를 필요로 하고 있다. 바이오는 중국의 국가 전략 분야 중 하나이며, 국무원이 발표한 <ʻ12·5ʼ 국가전략신생산업의 발전규획>에서 2020년까지 바이오산업 양성을 국민경제 기간산업의 목표로 하였다. 2012년 12월, 중국 국무원은 ʻ12·5ʼ의 <생물산업발전규획>에서 중국 바이오산업의 미래 발전은 고품질 발전, 기업 주체의 발전, 연관 산업의 상호 발전, 국제화 발전의 요구와 이념 수용, 생물의약 발전을 제시하고, 생물의학공정, 생물농업, 생물제조, 바이오에너지, 생물환경보호, 생물서비스 등의 중대 방향을 설정하고 11개 행동계획의 구체적 임무와 미래 중국 바이오 발전의 새로운 경로를 표현했다. 수 년 내로 혁신 추진, 수요공급 상호작용, 정책 선도로 바이오 분야의 투자와 발전이 매우 활발하여 산업규모도 한 단계 더 심도 있게 성장할 것이다. 2013년 10월, 중국 국무원은 민간과 해외자본에 의료시장을 대폭 개방해 건강서비스산업을 2020년까지 8조위엔(약 1,400조원) 규모로 육성하는 계획을 발표하였고, 2013년 11월 중국공산당 제18기 중앙위원회 제3차 전체회의에서 ʻ중국의 꿈(中國夢)ʼ을 실현하기 위해 향후 10년의 청사진을 제시하는 개혁방안으로 녹색성장, 민생개선, 대외개방 등을 제시하여 친환경 산업인 헬스케어, 스포츠서비스, 식료품 분야 등에서 빠른 성장이 기대된다.
2. 중국의 바이오정책
1981년 덩샤오핑이 ʻʻ농업문제 해결은 최종적으로 바이오분야가 해결할 수 있으니, 관련 첨단기술에 의지해야 한다.ʼʼ고 언급한 이래, 1986년 중국 정부는 ʻ863계획ʼ을 발표하고 바이오분야를 우선분야로 하여 집중 지원하였다. 또한 1988년 중국 국무원의 비준을 받아 중국 과학기술부에 의해 실시되고 있는 ʻ횃불계획(첨단기술산업발전계획)ʼ은 첨단기술성과 상품화, 첨단기술상품 산업화, 첨단기술산업 국제화를 목표로 ▸첨단기술산업 발전을 위한 환경조성 ▸첨단기술산업 개발구 건설 ▸첨단기술창업서비스센터 건설 ▸세부프로젝트 실행 ▸과학기술형 중소기업기술창업기금 조성 ▸첨단기술산업의 국제화 ▸인재양성이라는 7대 활동을 통해 중국 첨단기술 산업화의 중추적 역할을 수행하고 있다. 아울러 1997년부터 실시된 ʻ973계획ʼ은 미래 기술을 중점 연구하는 정부의 선행 연구 프로젝트로서 중국의 미래 산업 발전에 필요한 최첨단 기술 기초연구와 응용 기초연구로써 질병유전자학 등을 수행하고 있다.
ʻ9·5ʼ기간(1996∼2000년) 15억위엔, ʻ10·5ʼ기간(2001∼2005년) 120억위엔으로 중국 정부는 바이오 연구개발 투자 규모를 빠르게 늘여왔으며, 2005년 9월 ʻ중국의 생명공학 및 생물산업 전략계획ʼ(마스터플랜)을 공식 발표하고 농업, 의약, 공업, 환경, 에너지, 해양, 중의약 등 중점 발전분야를 확정하고 기술 축적을 위해 전력을 다하고 있다. 이 ʻ전략계획ʼ에서 ʻʻ향후 2020년도 중국의 생명공학 및 산업화 발전 전략 목표는 중국을 바이오기술 강국과 바이오산업 대국으로 건설하는 것이며, 15년간의 노력을 통해 중국의 바이오기술 분야와 산업화 수준을 세계 선진국 수준에 도달시키는 것이 기본 목표이다ʼʼ라고 정리하고 있다. 중국 국가 과학기술부 산하 ʻ중국 국가생명공학발전센터ʼ에서 작성한 이 계획에서 중국은 3단계를 거쳐 2020년 바이오기술 강국 및 바이오산업 대국으로 부상하는 전략 목표 실현 의지를 표명했다. 또한 2007년 중국생물산업대회의 ʻ생물산업정책 및 생물산업기지발전포럼ʼ에서도 국가발전개혁위원회에서 제정한 ʻ생물산업발전 11·5 계획ʼ을 더욱 강조하였다.
2009년 중국 국무원은 ʻʻ국가생명공학연구개발과 산업화 촉진 지도자 그룹ʼʼ을 조직하였고 동시에 <중국생명공학기술 및 산업화 발전 계획> 및 <생물안전법>을 제정하였다. 또한 중국 바이오산업체협회를 조직하였으며 바이오 연구개발비에 대한 대대적인 지원을 강화하고 있다.
[표 2-4-1] ʻ중국의 생명공학 및 생물산업 마스터플랜ʼ에 제시된 전략목표
|
단계 |
기간(년) |
세부목표 |
|
1단계 (기술축적단계) |
2005년~2010년 |
▪생명공학 연구개발 전체 수준을 개발도상국 중 제일 높은 수준으로 도달시킴 ▪논문, 특허 수량 세계 6위 달성 ▪생물산업 총생산액 8,000억위엔 달성 |
|
2단계 (산업발전단계) |
2010년~2015년 |
▪생명공학 연구개발 전체 수준을 세계 선진수준으로 도달시킴 ▪논문, 특허 수량 세계 3~4위 달성 ▪생물산업 총생산액 15,000억위엔 달성 |
|
3단계 (지속발전단계) |
2015년~2030년 |
▪생명공학 연구개발과 산업화 전체 수준을 세계 선진 국가 수준에 도달시킴 ▪세계 생명공학과 기술분야 최우수 인재를 유치하며, 세계 생명공학 연구 혁신의 중심지로 성장 ▪생물산업 총생산액 25,000~30,000억위엔 달성 및 GDP에서 차지하는 비율 7~8% 으로 향상 ▪생명공학 산업을 중국의 기간산업으로 육성 |
이 ʻ전략계획ʼ에서 향후 20년간의 중국 바이오산업 발전의 9개 중점 분야를 다음과 같이 제시하였다. 농업 생명공학으로 제2차 녹색혁명 추진, 의약 생명공학으로 제4차 의학혁명 추진 및 민족 평균 수명 연장, 공업 생명공학으로 ʻ녹색 제조업ʼ 발전 추진 및 녹색 GDP 대폭 증가, 에너지 생명공학으로 중국의 에너지 부족 상황 개선, 환경 생명공학으로 순환(循環) 경제 발전 추진, 생물자원의 심층 개발로 새로운 바이오산업 육성, 해양 바이오산업 및 해양경제 발전, 생물안전과 생물테러 방지기술 연구개발 추진으로 생물안전관리시스템 구축, 중의(中醫)와 서의(西醫)를 효과적으로 결합시킨 새로운 의료 보건 체계 구축 및 중의약(中醫藥) 산업 발전 추진이 9개 중점 분야로 제시되었다.
생물산업의 발전을 촉진하는 여러 정책 : 2009년 중국 국무원이 발표한 <생물산업발전촉진기본정책>은 정책목표, 현대 바이오산업 발전의 중요 영역, 바이오기업의 발전, 자주적 혁신의 촉진, 우수 인재의 양성, 관련예산 및 세금 지원의 확대, 투융자 방법의 적극적 확대, 양호한 시장 환경의 조성, 생물 유전자원에 대한 보호와 바이오안전성의 감독, 그리고 조직과 리더십의 강화 등 총 10부분, 33항으로 구성되어 있다. <생물산업발전촉진기본정책>에서, 바이오 산업을 빠르게 육성하는 것은 중국의 신세기 과학기술 혁명의 전략적인 기회이고, 새로운 국가를 전면적으로 건설하는 중요한 과제가 되었다. 위 정책은 <국가중장기과학기술 발전계획요강(2006~2020)>과 <생물산업발전 ʻ11·5ʼ 계획>을 실행하여, 바이오산업을 하이테크 기술 영역의 기간산업과 국가의 전략적 신흥 산업으로 빠르게 육성하는데 그 목적이 있다. 위 정책은 기술·인재·자금 등 자원을 바이오산업으로 유도하여 바이오기술의 혁신과 산업화를 촉진해, 생명공학 산업 규모화·집적화·국제화 발전을 가속시킨다. 기업을 주체로, 시장수요 중심 방향으로 산·학·연이 서로 결합하는 산업 기술 혁신 체계를 건설하며, 우수 인재를 양성하여 자주적 혁신 능력을 강화시켜 자주적 지적 재산권을 갖고 있는 중요한 바이오기술·제품과 표준을 파악한다고 요구하고 있다.
<생물산업발전촉진기본정책>에서, 여러 개의 다국적 대형 바이오기업과 자주적 지적재산권을 보유하는 혁신적 생명공학 중소기업의 육성, 여러 개의 산업 밀집도가 높고 핵심 경쟁력이 강하고 전문화 특색이 현저한 바이오산업의 본거지의 형성, 생명공학 기술 특허의 보호와 물질특허 생물유전자원의 보호를 강화하여, 생물유전자원의 개발·이용 수준을 향상시켜 바이오안전성의 보장을 요구하고 있다.
의약생명공학 분야에서, 중국 국민의 생명 건강을 위협하고 있는 중대 전염병을 예방하고 진단하는 신형 백신과 진단 시약의 개발에 중점을 두고 있다. 흔한 질환과 주요 질환의 치료에 현저한 효과가 있는 생물기술 약물·저분자 약물과 현대 중약을 적극적으로 연구하고 개발한다.
농업생명공학 분야에서 중국은, 양질·고수확·고효율·다환경적응성 농업·임업 신품종과 야생 동식물 번식 종자개발을 중점적으로 발전시키고 있다. 생물농약·생물 사료 및 사료첨가제·생물비료·식물성장조절제·동물백신·진단시약·현대 동물용 중약·동물용 생물치료제·어류용 생물치료제·미생물 완전분해 농업용 박막 등과 같은 친환경 녹색농업용 생물제품을 크게 발전시켜, 동식물 바이오 리액터의 산업화 개발을 추진하여 고효율 녹색 농업의 발전을 촉진시키고 있다.
2010년 국무원은 바이오산업을 중국의 전략산업으로 제시하여 국민경제중심산업으로 선도산업의 발전목표와 정책지표로 구분하였다. 2012년 ʻ12.5계획ʼ(2011~2015)기간 국가과기계획으로 추진하는 11개 주요 시범 수행과 함께 시작된 국가 주요 과학기술전문 프로젝트와 연계강화 분야는 전염병 신약개발 등 20개, 전략적 차세대사업의 이론적 지원확대 분야로 신에너지, 바이오기술 등 30개이다. 농업과 민생분야 지원확대를 위해 작물의 핵심암수개체, 벼 분자설계 육종, 동맥경화와 II형 당뇨병의 발병메카니즘 등 40개 및 국가주요과학연구계획과제로 단백질 연구, 나노과학 연구, 발육과 생식연구, 줄기세포 연구 등 64개 프로젝트가 수행되고 있다.
2011년 <국무원 판공실의 ʻ과학기술부, 재정부의 과기형 중소기업 기술혁신기금 관련 잠정규정ʼ 전달 통지>, <과기형 중소기업 기술혁신기금 재무관리 잠정방법>의 관련 규정에 근거해 과기부 과기형 중소기업 기술혁신기금을 지원하고 있다. 또한 중국과기부는 <국가 중장기 과학기술 발전계획(2006~2020년)요강>의 시행을 구체화하고 70개 관련 프로젝트를 2012년부터 지원하고 있다.
3. 중국의 바이오 연구개발 및 산업 현황
중국은 풍부한 생물자원을 보유하고 있다는 장점을 바탕으로 바이오산업 발전을 가속화하고 있다. 중국에는 동식물, 미생물이 26만종이 있으며 세계에서 천연자원과 생물다양성이 가장 풍부한 국가 중의 하나이다. 이미 3,000여 가지의 질병 근원 미생물 수집에 성공하였고, 농작물 재배에 유용한 천연 생물자원도 32만종이나 확보하여 그 수치는 단연 세계 1위를 차지한다. 그밖에 형질전환기술, 단백질공학, 복제기술 등을 포함한 현대 바이오기술은 개발도상국가 중 우위를 차지하고 있으며 일부는 세계 수준으로 평가받고 있다. 최근 중국의 생명공학 관련 특허 및 논문의 빠른 증가는 관련 연구계로부터 크게 주목 받고 있다.
중국에는 중앙 정부, 유관 정부부처 및 지방 정부가 지원하는 바이오중점실험실이 약 200여개 정도 있고, 많은 대학이 바이오기술 및 바이오산업 분야의 전공을 개설하고 있다. 중국의 생명공학 응용연구 및 산업화는 농업 생명공학기술(형질전환 농작물, 현대육종과 슈퍼교잡벼, 식물조직배양, 생물농약, 사료생물기술, 가축용 백신)과 의약 생명공학기술(생명공학신약, 백신, 혈액제품, 생화약품, 진단시약, 조직장기공학)이 중심이며, 중약(천연물)은 중국 정부가 중화민족의 자부심을 가지고 추진하는 바이오산업 분야이다.
중국발전개혁위원회가 ʻ11·5ʼ 기간에 400여건의 바이오기술 산업화 프로젝트와 중대과학프로젝트 등을 추진한 기술성과가 지속적으로 산업화됨에 따라 2000년 이후 생물산업은 연간 약 3배씩 빠르게 성장하였지만, 연구개발 기술에 비하여 바이오분야 산업화는 아직 상대적으로 미흡한 실정이다. 그러나 중국의 13억 인구가 식량을 섭취하고 5억 정도가 건강기능식품을 소비하고, 1.3억의 인구가 환자이며 새로운 품종의 농작물을 재배할 농경지가 20억무(1畝=200평)나 되는 등 중국은 세계에서 가장 큰 생물제품 소비시장을 보유하고 있어 향후 발전 가능성이 크게 기대된다.
중국내 바이오 관련 기업과 종사인력은 계속 증가하고 있고, 베이징과 상하이, 선전 등지에 이미 20여개 생명공학 클러스터가 설립되어 있다. 중국정부는 중국 바이오분야의 향후 더욱 커다란 발전 잠재력을 보유하고 있고 중국의 바이오연구개발이 식량안보, 인구건강, 환경증진, 에너지 안보에 주력하고 경제사회 개발의 병목현상을 해결할 수 있을 것이라고 확신하고 있다.
중국 바이오산업 규모 : ʻʻ2020년까지, 중국 의약 위생 관련 산업의 생산액은 4만억위엔 정도에 달할 것이고, 생명공학 관련 산업의 생산액과 합쳐서 6만억 위엔을 넘을 것이다ʼʼ(全國人大常委會 위원장 桑国卫). 의약바이오 산업은 전략 산업 뿐만 아니라 미래의 기간산업이 될 것이고, 앞으로 중국 GDP의 10% 또는 그 이상 차지할 것이다. 2010년 국무원은 바이오산업을 중국의 전략산업으로 제시하고, 경제발전방식 전환과 산업구조 격상 및 경제사회 추진으로 지속적인 발전을 이루게 하고, 또한 세계적으로 경쟁력을 가진 전략을 수립할 수 있는 중국 바이오산업발전의 방향을 제시하였다.
ʻʻ11·5ʼʼ(2006~2010년) 시기에, 중국 바이오산업은 급속히 발전하였다. 첫째, 산업규모가 지속적으로 성장하여 새로운 목표를 달성했다. 중국 바이오산업은 2005년 약 6000억 위엔에서 2010년 16000억 위엔의 규모로 연평균 21.6% 성장하였다. 특히 세계적인 금융 위기였던 시기에도 바이오산업은 지속적으로 성장하여 하이테크산업발전의 중요 분야로 자리 잡았다. 둘째, 독자적 창의개발능력이 뚜렷이 강화되었다. 유전자 분석, 줄기세포, 항체공정, 단백질 약물, 의료기구, 생물합성, 이식 유전자 육종, 동물반응기, 효소 공정, 신약개발과 백신개발 등 바이오기술의 최전방 영역에서, 국가공정연구센터, 국가공정연구소, 국가중점실험실, 기업기술센터를 설치하고 이를 중심으로 관련분야에서 커다란 성과를 얻었으며, 중소기업 연구개발 활동을 활발하게 수행하여 산업 핵심경쟁력의 성장을 확실하게 달성하였다. 셋째, 창의적 혁신연구개발 성과는 상업화를 도출하였다. 백신과 시약진단, 새로운 약물 개발, 현대 중약, 바이오의약공정, 바이오육종, 녹색농용바이오제품, 생물자원, 바이오소재, 미생물이용 분야의 새로운 성과를 통해 산업화 실현 및 현대농업의 발전을 달성하였다. 넷째, 관련 산업은 발전적 형세를 갖추었다. 북경, 상해, 장춘, 창사, 선전, 덕주, 태주 등 국가 바이오산업기지는 발전단계로 빠르게 진입하여 경제사회발전의 새로운 성장엔진으로 거듭났다.
2011년 후진타오 국가주석이 중국중앙정치국의 제29회 집단학습에서 전략적 신흥산업을 본격적으로 육성하는 것을 강조한 것과 관련하여 중국 ʻ소강사회ʼ(小康社會)의 전면 건설이 관건인 ʻ12·5ʼ(2011~2015)기간에는 개혁개방을 가속화하고 경제발전방식의 난관을 극복하여 변화를 도모하고, 미래 <전략신흥산업 ʻ12·5ʼ 계획>, <생물산업발전 ʻ12·5ʼ 계획>의 출현, 의료위생체제개혁과 새로운 농합, 주민사회보장제도의 지속적인 개선, 녹색기술의 발전과 ʻ양형사회ʼ(兩型社會) 건설에 따라 바이오산업은 발전 범위를 넓히고 있다. ʻ12·5ʼ 기간, 중국은 바이오산업발전기술의 기반강화에 주력하고 중대성과의 산업화를 추진하며, 한 단계 업그레이드된 재정과 세무, 금융정책의 지원, 기술혁신과 인재정책의 개선, 양질의 시장 환경 조성, 중요 분야와 중점 개혁의 추진 등으로 중국 바이오산업을 빠르게 발전시킬 계획이다.
[표 2-4-2] 중국 첨단기술산업 및 기술무역
|
|
2003년 |
2004년 |
2005년 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
2011년 |
|
첨단기술산업 생산총액 (억위안)* |
20,556 |
27,769 |
34,367 |
41,996 |
50,461 |
57,087 |
60,430 |
74,709 |
88,434 |
|
제조업 중 비중(%) |
16.1 |
15.8 |
15.8 |
15.3 |
14.3 |
12.9 |
12.6 |
- |
- |
|
첨단기술제품 수출액 (억달러) |
1,103 |
1,654 |
2,182 |
2,815 |
3,478 |
4,156 |
3,769 |
4,924 |
5,488 |
|
상품수출총액중 비중 (%) |
25.2 |
37.9 |
28.6 |
29.0 |
28.6 |
29.1 |
31.4 |
31.2 |
28.9 |
|
기술시장 기술계약 체결건수(만건) |
26.8 |
26.5 |
26.5 |
20.6 |
22.1 |
22.6 |
21.4 |
22.9 |
- |
|
기술계약금 |
1,085 |
1,334 |
1,551 |
1,818 |
2,227 |
2,665 |
3,039 |
3,906 |
- |
*는 규모이상기업(전체 국유기업 및 연간 제품매출액이 500만위엔 이상인 비국유기업)수치
중국 바이오산업 현황 : 전 세계 바이오산업이 금융위기로 충격을 받았던 2009년 이후 시기에도 중국 바이오산업은 상대적으로 왕성한 성장력을 보였으며, 바이오제약, 농업생명공학, 생물공정 등 모든 분야에서 발전하였다. 산업이 빠르게 성장하고, 기업이윤이 높아졌으며, 국내외 자금 유치능력도 높아졌고, 생산기지 건설이나 연구기지 건설 모두 호황을 보였다. 특히 주된 두 가지 이유는 국내의료위생개혁과 중국의 신흥기업이 창업하는데 유리한 자본조달 시장 때문이다.
중국은 2009년 <생물산업발전정책추진>에서 바이오산업을 하이테크분야의 중심산업으로 규정하고 빠른 발전을 요구하고 있다. 업계 분석가들은 의약 생명공학산업은 산업구조를 격상시키고, 기술혁신을 추진하고, 국가과학기술경쟁력을 높이는 중대한 업무를 가지고 있고, 국가는 재정, 세금, 은행신용 등과 같은 방면에서 지원을 해주어야 하며, 기금 투입을 확대하면 미래의 의약생명공학은 발전의 황금시대를 맞이할 수 있다고 판단하고 있다. 2009년부터 추진하고 있는 중국 공공위생의료체계개혁에 따라 면역백신과 진단 시약의 수요가 증가했고, 이를 통해 의료시장에서 거대한 수요를 창출하여 바이오제약산업의 발전을 기대하고 있다.
중국 바이오산업은 여전히 자본이 풍부하고, 특히 창업 허가 설립과 초기 융자가 확대되었으며, 사회자본의 투자가 활발하다. 또한 최근 합성생물학, 해양생명공학, 유전자변형식물의 안전성평가, 효소이용 기술 분야에서도 매우 큰 발전과 산업적 성장이 기대되고 있다. 2011년부터 시작된 ʻ12·5ʼ 계획에서는 바이오산업이 전략적 신흥산업과 국가미래의 기간산업으로서 더욱 좋은 발전 환경을 지니고 있다. 산업정책 지원으로 중국의 바이오분야는 전면적으로 발전추세이고, 특히 창업기업의 출현이후 중국 바이오산업은 이미 기술과 자본촉진으로 접어들어 시장이 빠르게 발전하는 추세이기에 최근 20년간 가장 좋은 황금발전단계로 진입하였다.
의약생명공학 : 2012년도 통계에 의하면 중국 의약생명공학 기업 수는 6,440개로 전년대비 17.2% 감소하였는데, 소형기업 수는 줄어들고 대형기업 수가 크게 증가하였다. 총 매출액은 15,191억위엔으로 전년대비 25.8%, 총자산은 14,019억위엔으로 18.8% 증가하였다. 면역백신은 국민건강을 위해 매우 중요한 분야로 정부의 적극적인 정책과 지원으로 지속적 발전을 하고 있고, 줄기세포 연구개발도 미국, 캐나다, 한국과 경쟁할 수준으로 많은 노력을 하고 있다. 중의약은 중국의 전략적 분야로 ʻ11·5ʼ 기간 중 총매출액이 22% 성장하였는데 2005년 1,192억위엔에서 2011년엔 3,933억위엔까지 증가했고, 2015년에는 5,000억위엔 규모로 예상하고 있다. 2012년 1월 공업정보부가 발표한 <의약공업 ʻ12·5ʼ 계획>, 2012년 5월 상무부의 <중약재중점품종유통보고>, 2012년 6월 <중의약사업 ʻ12·5ʼ계획>을 통해 2015년의 중의약의료자원 및 이용 등에 관한 목표를 제시하였다. 주요 품목은 2012년도 통계기준 심혈관 중성약으로 약38.3%의 시장집중도를 보였다.
[표 2-4-3] 2011년도 중국 의약공업 기업 현황
|
분류 |
기업체수 (2011년) |
전년대비 증감율(%) |
총생산액 (만위엔) |
전년대비 증감율(%) |
|
대형 |
246 |
143.6 |
54,287 |
85.6 |
|
중형 |
1,249 |
7.3 |
45,140 |
-3.0 |
|
소형 |
4,819 |
-26.1 |
56,561 |
16.6 |
|
초소형 |
126 |
- |
950 |
- |
|
총계 |
25.8 |
-17.2 |
156,939 |
26.3 |
|
출처 : 2012년 중국의약통계연보 |
||||

출처 : 중국생물산업발전보고서, 2013
[그림 2-4-1] 2009년~2012년 중국 의약산업구조
최근 중국 정부차원에서 재산권보호, 약품시장의 정비와 기술혁신체계 구축을 중시하면서 글로벌 제약기업의 연구개발 및 임상시험 기능을 중국으로 이전하는 것이 전 세계 의약생명공학분야의 주요 추세이며, Norvatis, Merck, Pfizer 등이 북경, 상해 등에 각각 설립한 세계 수준의 생명공학 및 약물연구센터에서는 심혈관, 대사질환 및 신경변성 등의 질병의 치료법 개발이 주요 분야이다. 또한 중국과학원 상해생명과학원을 중심으로 글로벌 협력네트워크도 확보하는 등 세계 3대 바이오연구기지가 되었다. 세계적으로 크게 성장한 중국의약생명공학 서비스 기업은 중국 바이오연구개발 기관에 지속적으로 도움을 주고, 적극적으로 스스로의 생존 무대를 개척하기 시작하면서 기술과 인력자원을 확보하기 시작 하였다. 2009년 청화대가 연구기관과 협력하여 덴마크에 설립한 암연구 센터는 중국 바이오연구개발기관이 최초로 국제시장을 개척한 사례로, 중국의 바이오 분야 수준 발전과 함께 중국 생산 제품의 수출과 국제자본시장의 투자가 활발히 이루어질 것을 기대할 수 있다. 연구개발센터 설립이외에 생산라인 건설과 투자도 계속 진행되고 있다. Sanofi-Aventis의 세계 최대의 간염백신 기지건설, 중국생물기술공사의 길림성 생산 및 연구개발기지, 사천성성도국제 의학단지의 보아오(博奧)생물생산연구개발기지, 화치에기업(化纖行業)의 세계 총생산 80% 점유 biopolymer 생산시설, 천진생물재료유한공사의 세계 최대PHA 생산라인, 산동차오린(山東澣霖)생물기술유한공사의 중국 자체 개발 세계 최대 규모 생물발효시설 등도 가동을 시작했거나 2014년까지 계속 확대 건설할 계획이다.
농업생명공학 : 최근에도 중국 생물종자, 생물사료, 생물농약, 생물비료, 생물백신 등 농업녹색산업은 여러 분야에서 고르게 빠른 발전을 계속하고 있다. 생물종자 산업은 중국 국가 전략 핵심 산업으로 과학기술적으로 쾌속 발전하며 2012년 우량품종의 중국농업에 대한 기여율이 45%에 달하여 국가 식량안보 및 농업발전에 크게 기여하고 있다. 종자시장도 2000년 250억위엔에서 2012년 1,000억위엔으로 성장하여 미국에 이어 세계 2위의 규모로 종자기업이 8,700개이고 2012년 10월 기준 사업허가증이 11,138개에 달하였다. 그 중 95%이상이 전통육종기술을 이용하고 염색체교잡벼, 유전자조작 항충면화 등은 세계 수준이다. 2012년 농업부, 과기부 등 16개부처가 <전국현대농작물종자산업발전계획 (2011∼2020)>을 마련하여 생산기지 건설, 정책 등을 실현하고 있다.
생물사료 분야는 국민경제수준이 향상되면서 동물성 식품 수요가 증대하며 빠르게 성장하고 있다. 2011년 전국사료 총생산량은 1.81억톤으로 2010년 1.62억톤보다 11.7% 증가하여 세계 1위 규모이며, 2012년 상반기 사료생산량은 약 1억톤이다. 2011년 10월 중국농업부가 발표한 <사료공업 ʻ12·5ʼ 발전계획>에는 2015년 중국 사료 총생산량은 2억톤에 달하고 사료효율을 향상시키는 우수한 사료첨가제 개발을 중점 지원할 계획이다. 2011년 일정규모이상 사료가공기업의 총매출은 7,275.8억위엔으로 35.5%, 영업이익은 375억위엔으로 51.7% 증가하였다. 주요 제품으로 사료용 효소가 가장 주목 받고 있으며 이는 안전하고 고품질 축산물을 경제적으로 생산 가능하기 때문이다. 중국의 사료용 효소제 총생산량은 2006년 2.6만톤에서 2010년 8.5만톤에 달하여 연평균 33.8% 성장했고, 매출액은 2006년 6.3억위엔에서 2010년 15.2억위엔에 달해 연평균 24.6% 성장하였다. 생물사료는 동물사료에서 인공합성첨가제 이외의 사료원료 및 사료첨가제를 말하는데, 최근 세계적으로 사료원료 가격이 상승하고 삶의 질이 높아지면서, 안전하면서도 고품질의 축산물을 경제적으로 생산하려는 시장의 수요가 중국에도 영향을 주기 시작하였다.
중국의 생물농약은 2012년 기준 Bt살충제를 비롯하여 독자적 지적재산권과 중국특색의 생물농약이 200여종, 활성성분 기준 140여종, 연생산량은 12∼13만톤으로 전체 농약의 12%를 차지하고 있다. 중국에는 90여개의 연구소, 대학에서 미생물농약을 개발하고 있으며, 200여개의 생물농약 생산기업이 있다. 2012년 10월 국가생물농약공정기술연구센터가 우한에 설립되었다.
동물용 백신은 가축생산성에 중요한 역할을 하며, 최근 중국은 가축 질병예방용 면역접종이 급격히 증가하고 있다. 산양약독화백신, 돼지 O형 구제역백신, 고병원성 조류독감백신을 비롯한 많은 종류의 백신을 생산하고 있으며 품질도 향상되었다. 2012년 중국에는 유전자조작백신 생산기업 14개를 포함하여 200여개 생산기업에서 29개 가축질병에 대해 179개 제품을 생산하고 있으며, 매출액은 80억위엔이다. 2012년 1월 <중화인민공화국 동물방역법> 제정으로 관련 연구개발 및 시장 규모가 급성장하고 있다.
세계에서 가장 많은 화학비료를 사용하고 있는 중국의 생물비료시장은 다양한 작물, 지역, 토양에 적합한 유형별 고효율생물비료제품이 필요하다. 최근 10년간 중국 생물비료 산업은 빠르게 발전하였는데 2005년말 기업수 450개, 총생산량 400만톤, 제품유형 11개, 등록제품수 420개, 매출액 150억위엔에서, 2011년 말 기업수 850개, 연간생산량 900만톤, 등록제품 1,650개, 매출액 500억위엔으로 증가했다. 생물비료산업은 국가식량안전을 확보하고, 농업생태계 환경을 보호하며, 농업생산성을 향상시키면서도 지속가능한 발전을 할 수 있는 전략자원산업이다. 생물비료산업은 중국의 부족한 녹색농산품 생산을 촉진시키고 현재 농업발전을 가속화하여 관련 산업에 큰 영향을 준다. 중국의 생물비료시장 잠재규모는 18억무의 경작지를 대상으로 년간 약 1억2,222만톤으로 추산된다.
중국의 형질전환작물육종은 콩, 옥수수, 밀, 벼, 면화를 대상으로 병충해저항성 및 생산성 향상 목적으로 수행해 왔다. 현재 형질전환 벼 육종은 세계 수준이며 150여개의 유전자 발현시스템을 보유하고 있고, 2012년 형질전환 옥수수 품종 199개 중 76개는 안전성평가 시험을 거쳤다. 형질전환 밀은 내병성과 내한성을 강화하고 있다. 소, 돼지, 양 등을 대상으로 한 형질전환 동물도 내병성, 품질 및 생산성 향상을 목적으로 개발되고 있다.
바이오에너지, 생물제조(발효산업), 바이오환경 : 중국에서는 지금까지도 주로 연료용 에탄올을 생산하기 위해 전분으로 고구마와 옥수수를 사용하고 있으나 식량원료자원의 제한적 특성으로 최근에는 기타 비곡물을 이용하여 바이오 에너지를 생산하려는 움직임도 함께 활발하다. 2011년 전국인민대회 11기 4차 회의에서 ʻ12·5ʼ 규획요강 중 바이오에너지를 6대 중점산업으로 육성한다고 명확하게 하고 <재생가능에너지법>과 <재생가능에너지중장기발전계획> 등의 지원으로 2020년까지 바이오에탄올 연간 1,000만톤, 바이오디젤 연간 200만톤 생산을 목표하고 있다. 2012년 중국 바이오에탄올 생산량은 200만톤인데 원료의 80%를 옥수수로 사용하고 있다. 2011년 중국 바이오디젤 생산량은 약 50만톤이며 시장에서의 규격은 BD100과 BD5이다.
2012년 7월 중국 국무원이 발표한 <ʻ12·5ʼ 국가전략성신흥산업발전계획>에서 육성할 바이오산업분야를 생물의약, 생물의약공정, 생물농업, 생물제조산업 (발효산업) 4개의 구체적 방향을 제시하였다. 중국 발효산업의 주요품목으로 전통발효제품은 2011년 중국 전체 발효식품기업 45,000개, 규모이상 4,000개이고 백주, 장유, 식초 생산량은 전년대비 15%, 11%, 32% 증가했다. 총 매출액은 4,200억위엔이고 직접종사인원 150여만명, 관련산업 10,000억위엔 규모이다. 아미노산 생산은 세계 제1위 수준이며 세계 평균 성장률보다 2배의 빠른 성장을 보였다. 유기산 생산도 세계 수준이며, 전분당 생산은 주로 80%를 옥수수, 나머지를 고구마 등으로 사용하고 있다. 산업용 효소는 2001∼2011년 동안 세계 시장규모가 연간 6.8% 성장하고 있고 중국은 세계 10% 시장을 가지고 있으며 연간 10%의 성장을 보이고 있으나 중국내 산업용 효소 생산능력이 상대적으로 낙후되어 있어 현재 외국 브랜드 제품이 대부분 시장을 차지하고 있다.
2013년 11월 3중전회에서도 강조하듯 중국은 환경보호와 오염방지 관련 대책이 현재 가장 시급한 과제 중 하나이다. ʻ12·5ʼ기간 시작인 2011년 중국 환경오염방지 제조업 매출은 1,273억위엔으로 전년대비 32.4% 증가, 영업이익도 88.8억위엔으로 전년대비 26.3% 증가했다. 2012년 <환경보호 ʻ12·5ʼ 발전계획> 등 관련정책의 시행으로 2012년 상반기 760.9억위엔의 매출을 보였다. 중국 정부는 미국에서 2009년 통과된 <청정에너지와안전법안(ACESA)>은 물론, 특히 한국에서 2010년 제정된 <녹색성장기본법>, <녹색발전국가전략 및5개년 계획>, ʻ한강의 기적ʼ 등 관련 상황과 함께 한국이 2020년 세계 제7대 ʻ녹색 강국ʼ을 목표로 하고 있다는 내용을 심도 있는 정책 및 홍보자료로 활용하고 있다.
4. 중국의 바이오분야 투자 현황
2012년 9월, 중국 국가통계국은 <2011년 중국 과학기술 예산투입 통계공보>를 발표했다. 2010년 중국의 R&D 투입액은 전년대비 1,707억위엔(23%) 증가한 8,687억위엔이고, R&D투자 집중도(GDP대비 비율)는 1.84%로 전년도의 1.75%보다 약간 증가했다. 국가재정 과기지출은 4,902억위엔으로 국가재정 총지출비중의 4.3%를 차지하였고, 기업R&D 경비는 6,579억위엔이었다.
[표 2-4-4] 중국 과학기술 예산
|
|
2003년 |
2004년 |
2005년 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
2011년 |
|
국가재정 과기지출 (억위엔) |
945 |
1,095 |
1,335 |
1,689 |
2,114 |
2,582 |
3,225 |
4114 |
4,903 |
|
국가재정 총지출비중 (%) |
3.8 |
3.8 |
3.9 |
4.2 |
4.3 |
4.1 |
4.2 |
4.3 |
4.5 |
|
R&D예산(억위엔) |
1,540 |
1,966 |
2,450 |
3,003 |
3,710 |
4,616 |
5,802 |
6,980 |
8,687 |
|
GDP비중(%) |
1.13 |
1.23 |
1.32 |
1.39 |
1.40 |
1.47 |
1.70 |
1.75 |
1.84 |
|
기업 R&D경비(억위엔) |
960 |
1,314 |
1,674 |
2,135 |
2,682 |
3,382 |
4,249 |
4,890 |
6,579 |
출처 : 중국과학기술부 자료, 2012
[그림 2-4-2] 중국 생물건강산업 투자 현황
현재 중국에서 진행 중인 국가과기공관계획, ʻ863계획ʼ, ʻ973계획ʼ, 자연과학기금, 횃불계획 등 여러 과학기술 및 산업발전계획은 모두 첨단과학기술 가운데 바이오분야를 우선적 발전분야로 중요시 하고 있다. 하지만 중국 정부가 지원하는 바이오분야 R&D 예산은 아직까지 상당히 미흡한 실정이기에 중국 정부와 각 성(省) 정부는 해외 투자자금 유치를 위해 관련 법률을 제정하는 등 정책적으로 적극 장려하여 자금부족의 취약점을 보완하고 있다. 중국과기부와 국가발전개혁위원회가 공동 설립한 북경생명과학연구소는 세계 수준의 중국 바이오기초분야연구를 수행 중이며, 중국과학원 광주생물의학건강연구원은 중국과학원과 산동성 정부, 광주시 정부가 공동으로 설립하여 의학생명공학연구 및 산업화를 촉진하고 있다. 상해시 정부 등 다른 지역에서도 지역별 대규모 바이오투자사업을 진행하고 있다. 북경의 중관촌 생명과학단지, 해남성 해구(海口)제약밸리, 광주(廣州)시 생물첨단기술산업화시범기지, 그리고 중국 최대 규모의 3대 바이오산업기지(심천, 석가장, 장춘) 및 난링시 영장류실험동물기지와 함께, 중국 최대 규모인 빈해과학단지에서도 바이오산업을 중점 육성하는 계획을 실현시키고자 노력하고 있다. 또한 북경 바이오학술센터에는 500여 연구팀과 100여개 바이오기업을 동시에 수용할 수 있는 아시아 최대 규모의 바이오산업 인큐베이터가 있다. 현재 북경(北京), 곤명(昆明), 석가장(石家庄), 통화(通化), 장춘(長春), 무한(武漢), 장사(長沙), 항주(抗州), 서안(西安), 제남(濟南), 덕주(德州) 등에 건설된 국가바이오산업기지에서도 연구개발, 기술이전 및 사업화가 활발히 진행되고 있다.
2013년 10월, 중국 국무원은 민간자본과 해외자본에 의료시장을 대폭 개방하여 건강산업을 2012년까지 8조위엔(약 1,400조원) 규모로 육성하기 위한 ʻ건강서비스산업 발전 촉진에 관한 의견ʼ을 발표했다. 여기에 언급된 건강서비스산업은 의료와 건강관리, 건강보험 등을 포괄하는 것으로 의약품과 의료기기, 보건용품, 건강식품 등 제조업 기반과도 연관된다. 따라서 향후 한국, 미국, 유럽 등의 선진의료기관들의 중국진출이 크게 늘어날 수 있을 것으로 예상된다. 세부 실행 방안은 의료시장 민간자본에 개방(명시되지 않은 모든 분야 진출 가능, 해외자본도 국내자본과 동일하게 적용, 각종 심사권한 하부기관으로 이양), 공공의료 민간에 허용(비영리 의료기관 가격통제 철폐, 첨단신기술 도입 시 세제혜택 부여, 전기 가스 수도 난방 등 가격 우대), 금융서비스 강화(건강서비스산업에 맞는 금융 상품 개발, 상장과 융자, 채권발행 적극지원, 금융과 산업자본을 통한 건강산업기금 조성) 등으로 구성되어 있다. 이는 2013년 11월 중국공산당 18기 3중전회에서 ʻ중국몽(中國夢)ʼ을 실현하는 향후 10년의 청사진 제시를 통하여 함께 이루어질 것이다.
최근 세계의 유수 다국적 기업들은 중국을 ʻ글로벌 공장ʼ에서 ʻ글로벌 연구중심ʼ으로 인식을 전환하면서 신약 연구개발 중국R&D센터 설립 및 관련 공동연구사업 추진하면서 중국은 세계 신약개발의 전진기지로 변모를 기대하고 있다. 수 년 내로 농업 및 의약 생명공학 기술과 관련 산업분야에 있어 세계 최고의 생명공학 강국으로 성장하고자 하는 중국의 원대한 목표는 앞으로 바이오분야에 대한 중국 정부의 관심과 투자가 계속 획기적으로 증대될 것을 명확하게 보여준다.
1) NIH 연구자금을 받는 검토된 그랜트 신청건의 비율로 10년 전 초기에는 평균 3건 중 1건이 선정되었으나, 최근 몇 년간은 평균 5건 중 1건에 불과하다(AAAS, 2013)
2) 대통령 예산안 시점 기준
3) Cures Acceleration Network(CAN) : 기초과학발견과 임상시험 간의 격차를 메우기 위한 프로그램, the Office of Rare Diseases Research : 희귀질환 연구를 조정하기 위한 부서, Therapeutics for Rare and Neglected Diseases(TRND) 프로그램 : 희귀 및 소외 질환에 대한 치료제 개발을 가속하기 위한 프로그램 등이 포함되어 있다.
4) 과학기술 및 연구개발에 대한 국제비교 조사결과, 연구개발전략센터, 2011
5) JETRO, 2013
6) NIKKEI Bio, 2012
7) IMS Market Prognosis, 2011.4
8) Biotechnology: Global Industry Guide, Aug. 2010, Datamonitor
![]()



1. 생명공학 연구개발 지원 정책
가. 개요
세계 미래학회 ʻ20대 미래예측분야ʼ 및 유엔 ʻ미래보고서ʼ 등과 같은 ʻ미래 예측보고서ʼ에 따르면 건강·의료·식품 등 BT 관련 이슈가 중요하게 부각되고 있다. 또한 OECD는 BT와 타기술이 융합하여 2030년경에 글로벌 경제에 대규모 변화를 가져오는 바이오경제시대로 진입할 것으로 전망하고 있다. 이러한 전망과 함께 전 세계 BT 관련 시장 규모는 빠른 속도로 증가하고 있다. 세계 바이오 시장은 연평균 9.8%로 성장하여 2015년에는 3,982억 달러 규모로 예상되고 있다. 우리나라에서도 박근혜 정부 국정과제인 ʻ창조경제 실현계획(ʼ13.6월)ʼ, 제2차 과학기술기본계획(ʼ13~ʼ18) 등에 BT관련 정책이 다수 포함되어 있으며, ICT와 융복합 등을 통해 신산업 및 일자리 창출에 기여할 것으로 전망하고 있다.

출처 : Burrill-KB Investment PPT, Oxford Bioscience Partners(2012) 수정
[그림 3-1-1] 주력산업군 변화와 GDP 성장률 추이
정부 차원의 생명공학 육성은 1982년 과학기술부에서 생명공학을 핵심전략기술로 선정하여 특정연구개발사업으로 지원을 시작하면서부터이다. 이후 1983년 「유전공학육성법」(現 「생명공학육성법」)을 제정하여 정부의 생명공학 육성·지원을 위한 법적 기반을 마련하였고, 1985년 동법을 기반으로 한국과학기술연구원(KIST) 부설로 ʻʻ유전공학센터ʼʼ(現 ʻʻ한국생명공학연구원ʼʼ)를 설립하여 생명공학의 본격적 육성·지원을 시작하였다.
1994년 제1차 생명공학육성기본계획을 통하여 창의적 연구개발의 저변을 확대하고 제도적 뒷받침 등을 통한 연구기반을 조성하였으며 지난 2007년 제2차 생명공학육성기본계획(ʼ07~ʼ16년)을 수립하여 2012년까지 원천기술 확보 및 산업화로 가기 위한 인프라 구축을 추진하였다. 또한 뇌연구촉진기본계획(ʼ08~ʼ17년), 줄기세포연구활성화방안(ʼ10~ʼ15년), 생명연구자원관리기본 계획(ʼ11~ʼ20년) 등 세부 연구 분야별 기본계획 등을 수립하여 육성·지원하고 있다.
2013년 새정부 출범과 함께 미래창조과학부는 그 소관영역이 확대됨에 따라 BT분야 사업화를 위한 기초연구부터 연계된 전주기 차원의 지원 전략을 수립하고 연구개발 프로그램을 추진하고 있다.
기초연구사업은「기초연구진흥 및 기술개발 지원에 관한 법률」제6조, 「국가연구개발사업의 관리 등에 관한 규정」및「미래창조과학부 소관 과학기술분야 연구개발사업 처리규정」에 근거하여 추진되고 있으며, 대상사업으로 크게 개인연구로는 일반연구자지원사업, 중견연구자지원사업, 리더연구자지원사업을 추진하고 이를 통하여 창의성이 높은 개인연구 및 여성과학자 육성 등을 지원하고 있다. 집단 연구로는 기초연구실, 글로벌 연구실사업, 선도연구센터 사업을 통하여 대학의 소규모 연구그룹, 국제공동연구 및 이공학·의과학· 융합분야 전문연구인력 양성을 지원하고 있다. 연구기반 구축사업으로 전문연구 정보활용, 기초연구실험데이터글로벌허브구축 및 한-CERN 협력사업을 통하여 정보 관리(수집·가공·분석)를 통한 기초연구활성화 및 세계 과학자들의 공동연구를 지원하고 있다.
대형국책사업으로 신산업 창출과 일자리를 창출하는 창조경제 구현을 위한 국가 대표적 창조·선도형 R&D 사업 육성을 위해 글로벌프론티어 사업을 추진하고 있으며 이는 G7프로젝트(ʼ92~ʼ02년), 21세기프론티어(ʼ99~ʼ13년) 글로벌프론티어 사업(ʼ10~ʼ22년)순으로 진행되고 있다. 2010년에 사업을 착수하여 2013년 현재 총 9개 연구단을 선정·지원하고 있으며 바이오 분야는 2010년 의약바이오 컨버전스 연구단, 2011년 바이오시스템 설계·합성 연구단, 2013년 BINT 융·복합 헬스가드 연구단을 선정·지원하고 있다(ʼ13.8월 기준). 또한 첨단융합기술개발사업의 일환으로 신산업 창조 프로젝트를 추진하고 있으며 2017년까지 신산업을 견인할 융합형 신제품·서비스 10개 창출을 목표로 ʼ13~ʼ17년간 15개 과제에 450억원을 지원하는 사업이다.
이밖에 고령친화, 장애극복, 사회·재해안전 분야의 핵심 기초·원천기술개발을 통해 국민의 삶의 질 향상에 기여하고자 공공복지안전연구사업을 추진하고 있다. 공공복지안전연구사업(ʼ10~ʼ17년)은 연구단별 5~14억원 내외로 5년(3+2)간 지원하며 있으며, 고령친화 분야는 고령인의 건강한 신체활동의 지속을 위한 지원 기술로 고령자 질환 예방 및 조기진단, 면역증가 및 활동성 향상 관련 기술개발 등이 포함된다. 장애극복 분야는 장애인의 재활 및 신체 활동 자립 보조기술로 선천성 장애예방 및 극복, 장애인 활동 자립 관련 기술개발 등을 추진하고 있다. 사회·재해안전 분야는 인위적·자연적 재해로 인한 국민불안 해소기술로써 식중독, 환경유해물질, 테러·범죄 예방 및 조기탐지 기술 등을 포함하고 있다.
나. 연구개발 지원 체제
(1) 법적, 제도적 기반
법적 성과로써 2009년 생명연구자원에 대한 국가차원의 관리 및 지원체계를 구축하고자 「생명연구자원의 확보·관리 및 활용에 관한 법률」를 제정하였고 2006년 시행한「연구실 안전환경 조성에 관한 법률」에 있어서 미비점을 보완하여 개정을 추진하였다. 그리고 2009년 국가과학기술위원회 안건 상정을 통한 원천연구 개념 및 비중 산정(안)을 마련하고 줄기세포연구 활성화 방안을 마련하였다.
또한 나노기술발전시행계획, 국가융합기술발전시행계획, 생명공학육성시행계획, 줄기세포연구 시행계획, 생명연구자원관리 시행계획 수립 등 범부처 시행계획을 통한 제도적 지원 체계를 갖추고 있다. 2011년에는 범부처 공동으로 지난 2006년 수립된 제2차 생명공 학육성기본계획(Bio-Vision 2016, 2007~2016) 2단계 계획 수립하였다.
(가) 생명공학육성법
생명공학육성법은 생명공학연구의 기반을 조성하여 생명공학을 보다 효율적으로 육성·발전시키고 그 개발기술의 산업화를 촉진하여 국민경제의 건전한 발전에 기여하게 함을 목적으로 1983년 「유전공학육성법」으로 제정되었으며 1995년 유전공학에서 생명공학으로 확대하는 내용의 제3차 개정을 통하여 「생명공학육성법」으로 개명하였다.
주요내용은 생명공학육성기본계획 및 연차별 시행계획의 수립, 생명공학종합정책 심의회 설치·운영, 생명공학의 산업적 응용촉진에 대한 지원, 생명공학 육성시책의 강구 등이다.
(나) 뇌연구촉진법
뇌연구촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성·발전시키고 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 기여하기 위하여 1998년 6월『뇌연구촉진법』을 제정·운영하고 있다.
뇌연구촉진법은 뇌연구 촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성·발전시키고 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 기여함을 목적으로 하고 있다. 주요 내용은 뇌연구촉진기본계획 및 연차별 시행계획의 수립, 뇌연구실무추진위원회의 구성·운영, 뇌연구 투자의 확대, 3개 부처의(미래창조과학부, 산업통산자원부, 보건복지부) 뇌연구촉진시책 강구 등이다. 또한, 제2차 뇌연구 촉진 2단계 기본계획(ʼ13~ʼ17)을 수립하여 뇌연구 실용화 촉진 연구개발을 강화하고 있다.
(다) 생명공학종합정책심의회
생명공학육성기본계획의 수립과 그 집행 및 조정에 관한 업무를 관장하기 위하여 미래창조과학부장관 소속하에 생명공학종합정책심의회가 있으며, ① 생명공학의 기초연구 및 산업적 응용연구의 육성에 관한 계획의 수립 및 그 집행의 조정, ② 생명공학의 연구 및 기술개발에 관한 기본계획의 수립과 이에 따른 중요 정책의 수립 및 그 집행의 조정, ③ 생명공학분야 인력개발에 관한 종합계획과 이에 따른 중요 정책, 인력활용지침의 수립 및 그 집행의 조정, ④ 생명공학의 연구 및 이와 관련된 산업기술인력의 개발교류와 해외과학기술자의 활용에 관한 계획의 수립 및 그 집행의 조정, ⑤ 유전자원의 이용과 보전을 위한 연구개발계획의 수립 및 그 집행의 조정 등의 사항을 심의·결정하는 기능을 가지고 있다.
(2) 한국생명공학연구원
미래창조과학부는 「과학기술분야 정부출연연구기관 등의 설립·운영 및 육성에 관한 법률」 제8조에 근거하여 1985년 2월 30명의 연구원으로 KIST 부설 유전공학센터를 설립하여 유전공학연구를 본격적으로 지원 육성하기 시작하였다. 이후 1990년 12월 KIST 부설 유전공학연구소로 명칭을 변경하였고, 유전공학육성법이 생명공학육성법으로 개정되어 1995년 3월 KIST 부설 생명공학연구소로 명칭을 변경하고, 1999년 5월 기초기술연구회 산하 생명공학연구소로 독립하였다. 2001년 1월 기초기술연구회 산하 생명공학전문연구원으로 승격하였고 현재는 정부출연연구소로 미래창조과학부에 소속되어 있다. 한국생명공학연구원은 생명 과학기술 분야의 연구개발 및 이를 지원하는 연구사업과 국내외 연구기관, 학계, 산업계와 그 협동연구수행 및 성과보급을 목적으로 하고 있다.
학·연·산 역량의 결집 역할로써 조직화된 융·복합 연구 추진과 국가정책의 Think-tank 및 축적된 기초연구성과의 산업계 연계를 통한 바이오 경제 창출이다.
현재 대덕본원 외에 충북 오창분원, 전북분원(2분원, 2연구소, 4본부, 1총괄단, 2지원본부)을 두고 있으며, 인력은 2013년 기준 정규직원 총 349명(박사: 239명)이고, 총 예산은 158,584백만 원이다.
(3) 생명공학육성기본계획 및 시행계획 수립
(가) 생명공학육성기본계획
미래창조과학부는 「생명공학육성법」 제4조에 근거하여 생명공학 분야의 효율적인 연구개발 촉진을 위하여 1994년부터 범국가적인 ʻʻ생명공학육성 기본계획(Biotech 2000, 1994~2006년)ʼʼ을 수립하여 시행하였고, 이어서 제2차 생명공학육성기본계획 (Bio-Vision2016, 2007~2016년)을 수립하여 시행하고 있으며 2011년 제2차 생명공학육성기본계획 2단계 계획(ʼ12~ʼ16)을 수립하였다.
동 계획은 미래창조과학부 주관으로 교육부, 농림축산식품부, 산업통상자원부, 보건복지부, 환경부, 해양수산부 등 7개 부처가 공동 추진하고 있다.
(나) 생명공학육성 연도별 시행계획
미래창조과학부는 『생명공학육성법』 제5조에 근거하여 관계부처와 합동으로 생명공학육성기본계획에 따른 연도별 ʻʻ생명공학육성 연도별 시행계획ʼʼ을 매년 수립하여 시행하고 있다. 2013년도 정부 부문에서 총 1조 9,201억원을 투입하여 전년계획 대비 14.2% 증가하였다. 생명과학, 보건의료, 농축산식품, 산업공정/환경해양, 바이오융합의 연구개발과 공공 R&D 인프라 구축을 위한 예산 확대 등 시설 및 기반구축사업, 인력양성에 대한 지원을 추진하고 있다. 부처별 연구개발 투자실적 및 계획은 아래와 같다.
[표 3-1-1] 부처별 연구개발 투자실적 및 계획
(단위 : 백만원, %)
|
구 분 |
’13년 투자계획 |
’12년 계획 (B) |
’12년 실적 (C) |
달성율 (%) (C/B) |
||||
|
연구 개발 |
인프라 |
인력 양성 |
합계 (A) |
증가율 (%) ((A-B)/B) |
||||
|
미래창조과학부 |
575,148 |
29,470 |
3,012 |
607,630 |
1.3% |
600,016 |
595,131 |
99.2% |
|
교 육 부 |
- |
- |
17,835 |
17,835 |
Δ60.0% |
44,548 |
44,651 |
100.2% |
|
농림축산식품부 |
232,888 |
800 |
4,290 |
237,978 |
20.2% |
198,041 |
232,708 |
117.5% |
|
산업통상자원부 |
117,672 |
17,145 |
2,298 |
137,115 |
Δ14.3% |
159,952 |
158,246 |
98.9% |
|
보 건 복 지 부 |
357,641 |
239,902 |
- |
597,543 |
62.0% |
368,959 |
380,727 |
103.2% |
|
환 경 부 |
46,103 |
150 |
- |
46,253 |
13.9% |
40,593 |
42,015 |
103.5% |
|
해 양 수 산 부 |
39,858 |
74,510 |
- |
114,368 |
3.4% |
104,178 |
81,828 |
78.5% |
|
출 연 기 관 |
134,311 |
27,091 |
- |
161,402 |
Δ2.2% |
165,104 |
167,618 |
101.5% |
|
총 계 |
1,503,621 |
389,068 |
27,435 |
1,920,124 |
14.2% |
1,681,391 |
1,702,924 |
101.3% |
※ 해양수산부(구 국토해양부)는 12년 시행계획 수립 이후 소관사업 재조정으로 실적 미달성
출처 : 2013년 생명공학육성시행계획, 2013
다. BT 주요 분야별 투자전략
미래창조과학부는 창조경제 실현이라는 미래부의 특성에 맞도록 BT분야에 대한 R&D 지원체계를 마련하고 그에 맞는 산업화 및 투자전략을 수립하여 추진하고 있다.
(1) 신약개발
2011년 신약개발 정부 R&D 투자는 총 3,000억원 규모로, 미래부, 산업부, 복지부 등을 중심으로 인프라·임상시험 등에 집중 지원되고 있다.
미래부는 기초연구부터 임상단계까지 단절 없는 R&D 연계로 사업화 성공을 제고하고 신약개발의 우수 역량과 유전체, 줄기세포, 뇌연구 분야의 성과를 결합하여 새로운 영역을 개척하는데 지원하고 있으며, 또한 신약개발 관련기관의 산학협력체계 강화하는 한편 복제약, 개량신약 등의 산업화 경쟁력을 높이기 위해 시장 수요 분석을 통한 특허 만료제품에 대한 선택과 집중을 통한 기술개발 지원을 강화할 계획이다.
(2) 줄기세포
2011년 미래부(舊. 교과부)와 복지부가 공동 추진한 ʻ줄기세포 R&D 활성화 및 산업경쟁력 확보방안ʼ을 계기로 ʼ12년 예산이 대폭 증액되어(총 1,000억여원, ʼ11년 대비 67.1%상승) 영국, 일본 등 주요 선진국과 유사한 규모의 국내 투자가 이뤄지고 있다. 미래부는 단기적으로 기 개발된 ʻ성체줄기세포 치료제ʼ의 효능강화와 개발비용 절감을 지원하고, ʻ희귀난치질환ʼ에 대한 세포치료제의 선도적 개발을 추진할 예정이다. 또 줄기세포기술과 질환치료기술이 연계된 ʻ세포유전자치료제ʼ 개발 및 줄기세포를 활용한 신약개발의 효율성 증대를 제고하고, 기초·원천 R&D 우수성과에 대한 부처간 연계도 추진할 예정이다. 중장기적으로 희귀 및 난치병 치료를 위하여 줄기세포기반 차세대 유전자 치료제 개발을 위하여 유도만능줄기세포(iPS)기술 및 ʻ직접교차분화(Direct Conversion)ʼ 등 신기술분야의 원천기술을 확보할 수 있도록 투자를 확대할 계획이다.
(3) 뇌연구
뇌연구분야의 R&D 정부 투자는 미래부를 중심으로 뇌신경질환과 뇌신경생물 분야에 집중되어 투자되고 있다. 단기적으로 ʻ치매 예측 뇌지도 구축ʼ을 통한 치매 조기 진단 원천기술 개발 및 뇌-ICT 융합 기반 실용화 연구, 인터넷·게임 중독 등 사회 이슈에 적극 대응하고, 심각한 사회 문제인 중독 및 자살의 주요 원인으로 대두되고 있는 우울증, 불안 등 ʻ감정장애ʼ 제어기술 개발을 추진하고, 중장기적으로는 뇌연구 4대분야(뇌질환, 뇌신경생물, 뇌인지, 뇌공학)별 핵심 요소기술 발굴 및 뇌연구 저변 확대를 지원하고 한국뇌연구원을 통하여 뇌연구 4대분야 대규모 융합 연구 및 지역 뇌연구 거점 기관과 협력을 강화할 계획이다.
(4) 유전체 연구
2011년 유전체분야 정부 R&D투자는 총 1,180억원 규모로 미래부는 ʻ다부처 유전체 R&D 사업ʼ(5개부처 공동 예타사업) 착수(ʼ14)를 계기로 맞춤의료(예방·진단·치료) 서비스 제공하기 위하여 질병 조기진단 및 치료 등을 위한 유전체 원천기술 개발, 유전체 정보분석 기술개발, 인력양성 및 국제협력 등 인프라 구축에 주력하고, 또한, 정부 R&D 사업으로 생산된 유전체 정보를 국가생명연구자원 정보센터(KOBIC)에 기탁할 수 있는 체계를 구축하여 유전체 DB 구축․관리의 중심기관으로 운영할 계획이다.
(5) 차세대 의료기반기술
차세대 의료기반기술은 미래부, 복지부, 산업부 등 5개 부처·청을 중심으로 ʼ11년 2,357억원이 투자된 분야이다. 미래부는 차세대 의료기반기술에 단기적으로는 BT-ICT 융합을 기반으로 한 스마트 의료기술 개발 및 중장기적으로는 개발에 장시간이 소요되나 고부가가치 창출이 가능한 분자영상진단장비·의료용 로봇 등에 필요한 원천기술 개발, 노령화와 만성질환 확산 추세에 부합한 고혈압 치료 관련기기, MRI핵심 부품 및 영상화 기술 국산화를 통한 초고자장 진단기기 개발에 집중 지원하고, 또한 기술이전 및 사업화 활성화를 위하여 R&D 수행 주체간 ʻOpen Innovation 플랫폼ʼ 구축을 통한 신산업 창출 지원을 위한 산업화 연계체계를 마련할 계획이다.
(6) 생명연구자원
생명연구자원 분야는 2012년 1,301.6억원의 정부 예산이 투자되었으며 생명연구자원의 확보·관리 및 활용에 관한 법률(제6조)에 따라 각 부처별 역할이 구분되어 범부처적으로 추진되고 있는 분야이다. 미래부는 ʻ생명연구자원 및 통합정보시스템 총괄ʼ 부처로서「생명연구자원의 확보·관리 및 활용에 관한 법률(ʼ09.5)」의 개정을 통해 미래부의 범부처 생명자원 R&D 총괄 관리역할을 강화하고, 부처별 사업범위 및 목적지향적 연구 역량 강화에 집중할 예정이다. 또한 기 확보된 생명연구자원의 고품질화를 통한 활용성을 극대화하는 등 생명자원의 발굴․확대 및 활용의 측면에서도 적극적으로 지원할 예정이다.
라. 추진방향 및 발전과제
최근 고령화·전염병 등 인류 공통의 난제를 극복하기 위한 해결책 및 경제성장의 핵심 열쇠로서 BT 분야의 중요성이 대두되고 있다. 이러한 가운데 바이오는 기아 및 질병, 에너지 문제 등 인류 생존과 더불어 글로벌 경제위기의 출구로서 핵심적인 역할 수행이 기대되는 분야이며 타 기술과의 융합이 활발해 지면서 IT, 에너지·환경, 화학 등과의 융합이 가능한 응용분야가 확대되는 추세이다. 또한 앞서 말한바와 같이 2013년 새롭게 출범한 박근혜 정부에서도 국정과제, 창조경제 실현계획, 제3차 과학기술기본계획 등에 BT 관련 정책이 다수 포함되면서 그 중요성이 더욱 강조되고 있다.
이러한 흐름에 맞추어 국가 생명공학 분야의 주무부처인 미래창조과학부에서는 생명공학분야의 미래 메가트랜드를 반영한 핵심 원천기술 확보 및 선진화 기반 확충에 적극적 투자와 지원을 추진하여 곧 다가올 바이오경제 시대를 준비하고 있다. 범부처 종합계획인 제2차 생명공학육성기본계획 2단계 계획(ʼ12~ʼ16)에 맞추어 산업화로 가기 위한 기반 확보를 탄탄히 하는 것에 초점을 두고 있다. 또한 앞서 소개한 신약개발을 포함한 유전체, 뇌과학, 줄기세포, 차세대 의료기반 기술에 대한 중점 지원에 역점을 두고 있다.
BT분야 산업화 성과 창출을 위한 기술사업화 전략 마련에도 힘쓰고 있다. 국내 바이오 시장은 글로벌 시장보다 높은 성장률을 보이나 그 규모는 세계 시장 대비 매우 협소한 실정이다. 이러한 상황에서 의료기기 분야, 신약분야 등과 같은 정부 R&D 투자를 통해 사업화가 가장 활발한 분야를 통하여 사업화를 활성화하는 전략과 지원 정책을 강구하는 것이 중요할 것이다.
이러한 생명공학 육성 지원 정책들이 국가 생명공학의 기틀을 확고히 하여 글로벌 경쟁력을 갖추고 나아가 풍요로운 바이오 경제 구현을 이루는 결실이 될 것으로 전망한다.
2. 생명공학산업 육성 정책
가. 개요
생명공학기술(Biotechnology, BT : 바이오기술)은 생물체의 기능과 정보를 이용하여 제품을 만들거나 유전적인 구조를 변형하여 생명체에서 우리가 원하는 특별한 성질을 나타내게 하는 복합적인 기술이다. 생명공학기술은 대표적인 신생기술(Emerging Technology)로서 기술의 난이도, 복합성, 확장성 등에 있어서 기존의 여타 기술과는 많은 차이를 보이고 있다. 또한, 산업화 및 부가가치의 창출에 있어서 원천 핵심기술이나 지적 재산권의 확보가 결정적인 영향력을 갖는다는 특징이 있다.
산업적인 응용에 있어서는 생명공학기술 자체에 기초한 생명공학 신산업의 육성은 물론, 기존의 여러 기술과 융합함으로써 의약·화학·전자·에너지·농업·식품 등의 산업을 질적으로 변화시킨다는 특징을 갖는다. 생명공학기술에 기초한 생명공학산업은 IT에 이어 세계 경제의 견인차가 될 것으로 기대되는 기술 집약 적인 고부가가치 지식기반 산업이다. 그러나 생명공학 핵심기술의 개발이나 생명공학산업의 육성에는 장기적인 대규모의 투자(Long Term Investment) 및 위험(High Risk)이 따른다. 이러한 투자규모와 위험성을 민간이 단독으로 감당하기에는 어려움이 많으므로 세계 각국에서는 정부가 앞장서서 생명공학관련 기술개발을 주도하고 있으며, 생명공학산업을 국가 전략산업으로 선정하여 집중 육성하고 있다.
나. 산업통상자원부의 주요 정책
산업통상자원부는 산업계가 글로벌 경쟁력을 갖출 때까지 산업화 지원에 중점을 둔다는 기본 정책방향을 가지고 있다. 기술변화와 산업성장 추세를 감안하여 전략적 투자방향을 설정할 것이며, 부처 협조체제 강화와 산업화 촉진을 위한 비즈니스 환경 조성에 주력할 계획이다.
이를 위해 국가 R&D 투자 효율성 제고, 성공적인 기술산업화 전략 추진, 사업화를 위한 전략적 R&D 추진 등을 통한 생명공학산업화의 정책적 육성을 추진하고 있다.
(1) 국가 R&D 투자 효율성 제고
산업통상자원부는 과거 중기거점기술개발사업, 성장동력기술개발사업, 차세대신기술 개발사업, 전략기술개발사업 등으로 분산되어 있던 R&D 사업구조를 2008년부터 산업핵심기술개발사업으로 통합하여 일원화하였다. 이에 생명공학산업 R&D도 바이오의료기기 산업핵심기술개발사업으로 일원화 하여 운영하고 있다. 기존의 R&D사업이 정부가 선정한 바이오분야 기술군에 대한 Top-down방식으로 이루어진 반면, 개편된 산업핵심기술개발사업에서는 정부의 산업발전전략, 특허연계형 기술, 기술로드맵 등에 기반한 Top-down방식과 함께 기술수요조사에 기반한 Bottom-up방식을 동시에 고려하여 과제를 기획하는 것이 가장 큰 특징이다. 이와 같이 산업통상자원부는 현장 수요를 고려한 기술 개발을 전략적으로 추진하여 산업화 성공사례를 창출해 나갈 계획이다. 중점 지원 분야는 의약바이오(천연물신약, 줄기세포 기반연구, 바이오베터 등), 산업바이오(바이오화학산업), 융합바이오(Smart 바이오진단·분석, u-헬스 등), 그린바이오(고기능성식물 등) 등 4개 분야이다. 동 사업을 위해 산업부의 역할에 걸맞는 R&D 지원 기준을 마련하여 국내 바이오의약산업의 중장기적 발전 및 신성장동력화를 위한 R&D를 발굴하여 지원중이며 2014년에는 단기간에 글로벌 시장에 진입할 수 있으며, 민간의 과감한 투자를 유도할 수 있는 산업핵심기술을 적극 발굴·지원하여 글로벌 의약바이오 시장 점유율을 확대할 수 있는 기조아래 R&D를 기획하고 있다. 이에 따라 오리지날 1세대 바이오의약품 대비 효능을 개선한 고부가가치 바이오베터와 글로벌 진출을 위한 DDS 기반 혁신형 제품 개발을 꾀하고 있다. 또한 임상의학, 약학 및 의료공학 등의 융합기반기술 개발로 의료현장의 unmet need를 충족, 새로운 의료 기술 및 시장을 창출코자 한다.
특히 의약분야 중 범부처 공동으로 중점을 두고 있는 신약개발을 위해 최소한 후보물질 도출 단계부터 상업화 목표와 연계되도록 전주기 범부처 통합지원 시스템을 구축하였다. 신약개발 R&D 투자는 후보물질 도출 단계부터 산업화 목표와 전주기적으로 연계하여 중복성 탈피 및 투자효율화를 도모하기 위한 범부처신약개발사업을 추진하고 있다. 동 사업을 위해 범부처신약개발사업단을 보건복지부, 미래창조과학부, 산업통상자원부 3개 부처가 공동으로 예산을 지원하여 설립하였으며 공동기획 및 운영·관리를 통해 글로벌 블록버스터 신약 개발, 세계 50위권 제약사 육성 등을 목표로 하였다.
(2) 수요자중심 정책지원
바이오산업을 향후 국가의 주력산업으로 자리매김할 수 있는 정책적 지원을 강화하고자, 산업통상자원부는 기업들의 의견을 바탕으로 바이오산업 분야 대형 프로젝트 발굴, 바이오산업 통계, 바이오비즈니스 및 바이오경제 활성화 등 수요자 중심의 지원을 꾀하고 있다. 우선 바이오산업 성장의 핵심 축인 벤처 활성화를 이끌기 위해 창업에서 벤처로 이어지는 창업 비즈니스를 촉진하고 일자리 창출 및 확대를 위한 전문 채용박람회를 운영하며, IPO 등을 통한 산업활동을 활성화하여 지속적 벤처 비즈니스 생태계 기반을 구축하고 있다. 또한 기업군별 경쟁력을 강화하기 위해 벤처·중소기업과 중견·대기업간 정례적인 기술이전, 공동협력 프로그램 등 지원을 통해 실질적 동반성장 비즈니스 생태계 기반을 마련하고 있다. 그리고, 바이오산업 구조 고도화를 위한 바이오산업 통계시스템을 구축하여 Global 시장에 진출하려는 국내 바이오기업 및 정책관련 부서에 대한 다양한 정보서비스를 제공하고 있다. 이외에, 국내 바이오기술·제품의 Global 시장 진출을 지속적으로 촉진하기 위해 바이오산업의 가치사슬 및 부문별 다양한 해외 마케팅 비즈니스를 지원하고 있다.
(3) 생명공학전문인력 양성
지식기반산업인 생명공학산업에 있어 우수인력의 확보는 산업경쟁력 확보의 관건이다. 특히 IT·NT 등과의 융합현상 가속화로 새로운 응용분야로의 기술혁신이 급속히 진행되고 있어 이에 부응할 전문인력의 질적 부족현상이 심화되고 있는 실정이다. 이에 미래산업 핵심인재 10만 양성계획 및 신성장동력 비전과 발전전략에 따라 생명공학전문 인력육성을 추진 중이며 생명공학 특성화 대학원·GMP전문인력 및 생명공학핵심기술 전문인력 교육을 통하여 ʼ12년 27.5억원 지원으로 1,193명을 양성하였다.
(4) 유전자변형생물체(LMOs)의 대응시스템 구축
산업통상자원부는 바이오안전성의정서의 이행을 위한 국가책임기관으로서 LMO의 개발·생산·수입·수출·유통 등에 관한 안전성을 확보하고 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 미치는 위해를 사전에 방지하고자 2001년 국내이행법인 「유전자변형생물체의국가간이동등에관한법률(LMO법)」을 제정하여 2008년 1월부터 시행하고 있다.
또한 관계부처 통합으로 LMOs의 개발·생산·수출입·유통 등 종합적인 안전관리 계획을 수립하고 LMO의 안전성평가를 위한 LMO위해성평가센터를 설립하여 수입·생산·연구개발 중인 모든 LMO에 대해 보다 엄격한 안전관리를 진행하고 있다
향후 바이오안전성의정서의 원활한 이행 및 LMO의 수요증가에 대비하여 국내외 동향 및 향후전망을 파악하여, 국내환경에 적합한 안전관리 시스템을 마련하고 LMO의 안전성 확보를 위한 안전관리 전문능력 향상 및 위해성 평가·관리 등 관련 기술개발을 지원해 나갈 계획이다. 또한 내년 중 우리나라에서 개최될 예정인 바이오안전성의정서 당사국 총회를 대비하여 개최국으로서 의제를 주도하기 위해 관계부처와 협동하여 다양한 준비를 하고 있다.
(5) 바이오화학실용화센터 건립 및 데모플랜트 건설
글로벌 경기회복, 중동사태, 개도국의 경제성장으로 유가상승이 지속될 것으로 예상되는 가운데, 바이오매스(식물자원)를 기반으로 한 바이오화학산업이 기존 석유화학산업을 대체할 신산업으로 주목받고 있다. 또한, 온실가스 감축부담과 함께 환경친화적 제품 요건이 무역규제로 작용하면서 친환경 바이오화학제품의 중요성이 더욱 부각되고 있는 실정이다. 하지만, 바이오화학분야의 높은 기술적 수요에도 불구하고, 초기 투자 부담 등의 요인으로 현재 기업 투자는 매우 미흡한 상황이다.
이에 바이오화학산업의 조기정착과 기술적 우위선점을 위하여 정부는 다양한 시책을 강구할 예정이며, 그 일환으로 바이오화학관련 원천기술의 산업화 촉진을 위하여 울산 테크노산업단지 내에 Pilot 규모의 바이오화학실용화센터 건립 (ʼ10년~ʼ14년, 정부지원 200억원, 지방비 167억원), 산학연 공동 R&D, 개발된 기술의 실증화, 및 기업으로의 기술이전 등을 촉진할 계획이다. 동 바이오화학실용화 센터는 2013년 11월 착공하였으며 내년 중 완공을 목표로 하고 있다.
또한 2013년 초, 예비타당성 조사를 마친 ʻ바이오화학 산업화 촉진 기술개발 사업ʼ을 통해 바이오화학 산업의 실용화를 위한 데모플랜트를 건설할 예정이다. 이미 선진국을 중심으로 상용화단계에 들어선 범용 바이오 플라스틱 소재를 중심으로 다양한 원료로부터 다양한 생산물을 만들어 낼 수 있는 데모급 콤비나트 플랜트와 PLA 생산 플랜트를 기획중에 있다.
산업통상자원부는 바이오의료기기산업핵심기술개발 사업의 산업바이오 분야 R&D, 울산의 바이오화학실용화센터(파일롯 규모), 그리고 바이오화학 산업화 촉진기술개발 사업의 데모플랜트 조성 등을 통해 원천기술부터 실증화까지 전주기적으로 정책적 지원을 강화할 계획이다.
(6) 지역바이오 활성화 기반 구축
산업통상자원부는 생명공학산업의 저변 확대 등을 목적으로 ʼ98년~ʼ10년까지 지역특성을 바탕으로 총20개의 지역바이오산업 인프라(특화센터)를 구축하였으며, 바이오센터별 차별화, 특성화하여 지역경제 활성화를 유도하였다. ʼ08년부터는 이미 구축된 바이오 인프라 시설을 보완하면서 기술지원·인력양성·마케팅에 집중지원하고 있다.
최근 바이오산업이 급속히 성장함에 따라 지역에서도 신규 사업에 대한 사업검토 및 예산 지원요청 등이 증가하고 있으며, 이러한 지역의 바이오산업 진흥을 위한 수요에 맞추어 특화센터가 행정적·제도적 지원을 제공하여 지역바이오 활성화에 기여하고 있다.
[표 3-1-2] 지역 바이오 특화센터 구축 현황
|
분 류 |
사 업 명 |
특화분야 |
기 간(년) |
|
충청권 |
▪바이오센터(대전) |
생물의약, 분자진단, 기능성식품 |
’02년~’07년 |
|
▪보건의료산업센터(충북오창) |
노인용 건강보조․노인성질환약품 |
’04년~’07년 |
|
|
▪전통의약산업센터(충북제천) |
한약제제 및 한약제 품질검사 |
’03년~’07년 |
|
|
▪충남동물자원센터(충남논산) |
동물사료 첨가제, 동물백신 |
’03년~’07년 |
|
|
호남권 |
▪천연자원연구원(전남장흥) |
천연물소재 |
’07년~’09년 |
|
▪식품산업연구센터(전남나주) |
기능성식품 |
’02년~’07년 |
|
|
▪생물의약연구센터(전남화순) |
단백질의약품, 세포․유전자치료제 |
’02년~’07년 |
|
|
▪독감백신원료생산공장(전남화순) |
백신(신종플루 등) |
’05년~’07년 |
|
|
▪나노바이오연구센터(전남장성/곡성) |
생물방제, 생물농약 등 |
’06년~’08년 |
|
|
▪생물산업진흥원(전북전주) |
발효․건강기능식품 |
’05년~’07년 |
|
|
동남권 |
▪바이오21센터(경남진주) |
바이오식품, 생물화학, 의약 |
’04년~’08년 |
|
▪해양생물산업육성센터(부산) |
해양생물유래 기능성식품 |
’04년~’08년 |
|
|
대경권 |
▪바이오산업지원센터(대구) |
전통생물소재 연계 액상제품 |
’04년~’08년 |
|
▪한방산업지원센터(대구) |
한방임상시험, 한방임상평가 |
’04년~’08년 |
|
|
▪바이오산업연구원(경북안동) |
기능성식품 |
’02년~’07년 |
|
|
▪해양바이오산업연구원(경북울진) |
해양식품, 식품소재 |
’04년~’07년 |
|
|
▪정보지원센터(경북포항) |
생물의약 |
’07년~’09년 |
|
|
강원권 |
▪바이오산업진흥원(강원춘천) |
생물의약, 건강기능식품 |
’02년~’07년 |
|
▪해양바이오사업단(강원강릉) |
기능성식품, 바이오화장품 |
’02년~’07년 |
|
|
제주권 |
▪제주TP 바이오융합센터(제주) |
건강․뷰티생물산업 |
’02년~’07년 |
다. 생명공학육성과 산업통상자원부
과거 우리나라의 고도성장시기에는 생산규모의 확대와 부가가치 창출에 집중하여 왔다면, 21세기에 접어들면서 건강한 삶, 편리한 삶, 쾌적한 환경, 그리고 산업 발전의 지속성 강화 등으로 옮겨지고 있다. 이러한 요구들은 모두 생명공학기술 내지는 생명공학산업과 분리해서 생각할 수 없다.
이러한 시대적 메가트렌드에 부응하고 IT혁명의 뒤를 이을 고부가가치 미래 신산업인 생명공학산업은 정부에서도 그 중요성을 인식하고 있으며, 생명공학의 한 분야인 바이오제약·의료기기 분야를 17대 신성장동력으로 선정한 바 있다. 산업통상자원부는 제2차 생명공학육성 기본계획(Bio-Vision 2016)에 따라 2016년 생산 23조 원, 바이오 7대강국 달성 등을 목표로 생명공학기술의 산업화에 초점을 맞추고 관련 산업 육성을 위해 정책적 지원을 다할 계획이다.
3. 생명공학 기초과학진흥 정책
가. 개요
최근 유전체학/단백체학 및 세포체학/대사체학 연구 등에서 급속한 진전을 보이고 있는 생명공학은 우리의 미래 생활에 큰 변화를 예고하고 있다. 기초과학을 응용하여 개인별 유전적 특성을 고려한 의약품 개발 및 진단·세포/유전자 치료법 개발 기술, 유전체 대량 분석과 정보를 활용한 난치병 예방, 진단 및 치료법 개발 기술, 세포 치료제 개발 기술로 인해 많은 질병이 퇴치되고 수명이 연장되고 있다. 이러한 생명공학의 성과는 생물학, 생화학, 생리학, 생물물리학 등 관련 기초과학의 다양한 실험 기술의 성과에서 기인한 것으로 관련분야의 기초과학 발전이 있었기에 가능한 것이었다.
이를 통해 볼 때, 미래유망 분야에 대한 핵심원천기술개발 확보 및 선진화 기반 확충을 위해 추진되고 있는 바이오 및 첨단의료기반기술개발 등과 같은 연구개발사업도 기초연구의 선행이 전제되어야 한다고 할 수 있다.
창조적 융합을 통한 바이오·생명 공학 분야의 중요성이 강조되고 있는 세계적 흐름 속에서 생명공학 분야에서의 기초과학의 진흥 역시 그 역할이 더욱 증대되고 있는데, 위와 같은 맥락에서 볼 때 희귀·난치질환 치료를 위한 줄기세포치료제 개발, 유전체 정보분석기술 및 질병기전규명기술 개발 등도 기초과학이 제 역할을 해낼 때 비로소 가능한 것이기 때문이다.
나. 정부의 기초과학진흥 추진 과정
OECD Frascati Manual(2002년)에 기초연구의 개념이 기술된 바 기초연구란 관찰 가능한 현상과 사실들의 기저에 놓여 있는 근본 원리에 대한 새로운 지식 획득을 목적으로 수행되는 실험적 혹은 이론적 작업으로 순수 기초연구는 자연현상의 원리 규명을 통해 새로운 창조적 지식을 획득하는 연구로, 목적지향적 기초연구는 미래의 광범위한 응용을 위하여 원천지식의 토대를 산출하는 연구라 정의하고 있다.
반면에, 알려진 지식을 심화·발전시켜 특정 문제를 해결하거나 특정 상황에 적용하여 활용하는 연구로 연구가 성공적으로 이루어져 기대하는 결과(물)를 얻을 경우, 그 결과(물)가 적용될 분야가 확실한 연구라 하였으며, 개발연구란 실용적이고 유통 가능한(시)제품, 물질, 장치 또는 제품의 공정 과정을 개발하기 위한 연구는 응용연구라고 정의하였다.
2004년 당시 과학기술부에 ʻʻ과학기술혁신본부ʼʼ 설치 및 부총리급 격상에 따라, 정부 간 합의를 거쳐 기존 과학기술부에서 추진하던 기초연구 사업을 3개 유형으로 나누어 순수기초 연구와 기초과학기반구축 사업은 당시 교육인적자원부에서 주관하고 목적 기초연구는 과학기술부에서, 응용 연구 부분에 대하여는 산업자원부와 정보통신부에서 주관하도록 조정하였다. 이와 더불어 교육인적자원부는 대학연구의 제도 및 기반을 구축하고 대학의 우수 연구 인력양성 지원 사업하도록 하였다.
정부는 기초연구의 진흥을 위한 여건 조성을 위하여 기초연구에 관하여 1) 대학교수, 연구원 등 관계 전문가의 연수 및 연구비 지원, 2) 석사 및 박사 과정 학생의 연구장학금 지원, 3) 연구교수(연구조교를 포함한다)제도, 교수의 연구휴가제도, 객원교수제도 및 객원연구원제도의 활용, 4) 대학의 연구시설 및 기자재 지원, 5) 대학부설연구소 및 우수연구집단 형성 지원, 6) 대학, 국공립 연구기관기업부설 연구소와의 공동연구, 인력교류, 연구 시설·장비 공동활용 등 산업계·학계 및 연구소 간의 교류 촉진, 7) 기업 등의 대학 기초연구 지원 촉진, 8)그 밖에 기초연구환경 조성 및 기초연구기반 구축에 필요한 사항 등을 정책추진에 있어서 의무적으로 마련하도록 기초연구진흥 및 기술개발지원에 관한 법률 제7조에 명시하고 있다. 또한 동 법에 따라, 기초연구진흥종합계획 및 시행계획을 수립하여 국가의 기초연구진흥을 위한 정책적 노력을 계속해 나가고 있다.
2008년 2월 교육인적자원부와 과학기술부의 통합으로 교육과학기술부가 출범하였다. 두 기관의 통합은 기초과학에 관한 여러 정책이 일관성 있게 정리될 수 있는 기회를 제공하였으며, 2013년 미래창조과학부 출범으로 창조적 기초연구 추진전략이 마련되고, 상상력·창의력을 기반으로 한 과학기술과 ICT의 융합을 바탕으로 그 어느때 보다도 기초연구에 대한 기대가 높아지고 있다고 할 수 있다.
다. 미래창조과학부의 기초과학연구지원 현황
미래창조부에서는 2009년 한국과학재단, 한국학술진흥재단, 그리고 국제과학기술 협력재단을 합병하여 발족한 국내 최대의 연구기관인 한국연구재단과 함께 우리나라 연구력의 근본이라 할 수 있는 기초연구를 중점 지원하고 있다. 이에 따라 개인 또는 소규모 공동연구 중심의 기초연구를 지원하여 국가연구역량 토대를 구축하고 국제적 수준의 연구 결과를 도출하여 국가 사회 발전과 학문의 발전을 도모할 수 있도록 지원하고 있다. 한국연구재단은 기존 세 재단의 다양한 연구 지원사업들을 기초연구지원사업으로 통폐합하여 효율적으로 연구자들을 위한 단계적 연구비지원 및 연구 관리를 위탁수행하고 있다
특히 한국연구재단은 기초연구본부에 생명과학단과 의약학단, 그리고 융합연구단에서 대학과 국책연구기관의 생명과학분야를 지원하고 있으며, 국책연구본부의 생명공학단은 대단위 국책사업을 지원하고 있다. 공학단, 생명과학단 및 일부 복합학단에서 생명공학 분야 연구과제를 지원하고 있다. 기초연구본부의 생명과학단에서는 기초생명과학분야 생화학 및 분자생물학, 유전학 및 유전체학, 암생물학, 미생물학, 식물학, 생태 및 환경학 등의 기초생명과학분야와 농학, 임학, 수산학, 수의학 등의 농수산임학분야를 지원하고 있으며, 의약학단에서는 기초의학, 간호학, 보건학, 약학, 간호학, 한의학 등을 지원하고 있다.
(1) 기초연구지원 사업 현황
미래창조과학부는 개인연구지원사업인 신진·중견·리더 연구자 지원사업을 통해 꾸준히 신규과제를 지원할 계획이며, 선도연구센터 및 기초연구실 육성과 같은 집단연구지원사업에서도 신규 예산을 편성하여 지원해 나갈 예정이다. 그 외에도 전문연구 정보 활용 및 기초연구실험데이터 글로벌허브구축 사업을 통해 기초연구기반 구축에도 박차를 가하고 있다(표 3-1-3).
[표 3-1-3] 2012년~2013년도 기초연구지원사업내용
(단위 : 백만 원)
|
사 업 명 |
’12년 예산 (A) |
’13년 예산 (B) |
’13년 예산 |
|||
|
증감(B-A) |
% |
|||||
|
합 계 |
975,004 |
1,003,084 |
28,080 |
2.9 |
||
|
개인연구지원사업 |
800,000 |
822,500 |
22,500 |
2.8 |
||
|
|
일반 연구자 |
소 계 |
427,000 |
449,600 |
22,600 |
5.3 |
|
기본연구 |
281,547 |
300,600 |
19,053 |
6.7 |
||
|
신진연구자 |
90,970 |
91,000 |
30 |
0.0 |
||
|
여성과학자 |
28,700 |
30,000 |
1,300 |
4.5 |
||
|
지역과학자 |
25,783 |
28,000 |
2,217 |
8.6 |
||
|
중견 연구자 |
소 계 |
316,000 |
322,000 |
6,000 |
1.9 |
|
|
핵심연구 |
159,000 |
160,000 |
1,000 |
0.6 |
||
|
도약연구 |
157,000 |
162,000 |
5,000 |
3.2 |
||
|
리더 연구자 |
소 계 |
57,000 |
50,900 |
-6,100 |
-10.7 |
|
|
창의연구 |
44,500 |
45,700 |
1,200 |
2.7 |
||
|
국가과학자 |
12,500 |
5,200 |
-7,300 |
-58.4 |
||
|
집단연구지원사업 |
127,000 |
129,500 |
2,500 |
2.0 |
||
|
|
선도연구센터지원 |
109,000 |
109,000 |
0 |
0.0 |
|
|
기초연구실지원 |
18,000 |
20,500 |
2,500 |
13.9 |
||
|
기초연구기반구축사업 |
48,004 |
51,084 |
3,080 |
6.4 |
||
|
|
전문연구정보활용 |
2,800 |
2,280 |
-520 |
-18.6 |
|
|
학문후속세대 |
16,080 |
16,080 |
0 |
0.0 |
||
|
대학중점연구소 |
26,624 |
26,624 |
0 |
0.0 |
||
|
기초연구실험데이터 글로벌허브구축 |
2,500 |
3,100 |
600 |
24.0 |
||
|
연구장비엔지니어양성 |
- |
3,000 |
3,000 |
순증 |
||
출처 : 교육과학기술부, 2013년도 이공분야 기초연구사업 시행계획
* `ʼ13년 정부조직개편으로 일반연구지원사업 및 기초연구기반구축사업의 일부는 교육부로 이관됨
(2) 생명과학분야 사업 지원 현황
정부에서 이공분야에 지원하는 총 R&D 투자액 중 생명과학분야의 범주에 속하는 생명과학, 농림수산, 보건의료 부문에 지원되는 총 투자액수는 2조 7,869억 원으로서 전체 R&D 투자액의 19%를 차지하고 있다(표 3-1-4).
[표 3-1-4] 과학기술표준분류별 투자 추이(2012년)
(단위 : 억원)
|
구 분 |
금 액 |
비 중(%) |
|
수학 |
572 |
0.4 |
|
물리학 |
3,297 |
2.2 |
|
화학 |
3,221 |
2.2 |
|
지구과학 |
4,723 |
3.2 |
|
생명과학 |
7,167 |
4.9 |
|
농림수산식품 |
9,659 |
6.6 |
|
보건의료 |
11,043 |
7.5 |
|
기계 |
21,028 |
14.3 |
|
재료 |
5,619 |
3.8 |
|
화공 |
3,589 |
2.4 |
|
전기/전자 |
16,759 |
11.4 |
|
정보/통신 |
15,752 |
10.7 |
|
에너지/자원 |
9,202 |
6.3 |
|
원자력 |
6,946 |
4.7 |
|
환경 |
4,190 |
2.9 |
|
건설/교통 |
6,694 |
4.6 |
|
과학기술과 인문사회 |
4,127 |
2.8 |
|
기타 |
13,208 |
9.0 |
|
합계 |
146,795 |
100 |
출처 : 2012년도 국가연구개발사업 조사·분석 보고서
이 중 한국연구재단을 통하여 생명과학 분야로 지원된 연구비 현황을 사업별 중분야별로 살펴보면 다음과 같다.
일반연구자지원사업은 기본연구지원사업, 지역과학자지원사업, 여성과학자지원사업, 그리고 신진연구자지원사업으로 구성되어 있다. 2012년에 일반연구자 지원사업으로 생명과학분야에 지원된 연구비 중 생명과학의 중분야별 지원 비율은 표 3-1-5와 같다.
[표 3-1-5] 2012년도 일반연구자지원사업 중 생명과학분야 중분야별 선정현황
|
중분야명 |
신청과제수 |
선정과제수 |
|
분자세포생물학 |
105 |
30 |
|
노화/종양학 |
165 |
40 |
|
신경발생/줄기세포 |
90 |
22 |
|
분자유전학 |
72 |
19 |
|
발생학 |
44 |
11 |
|
신경생물학 |
70 |
17 |
|
면역학/생리학 |
95 |
23 |
|
생화학/구조 생물학 |
104 |
22 |
|
유전자발현조절/치료 |
79 |
23 |
|
분류/생태/환경생물학 |
113 |
35 |
|
미생물/기생 생물학 |
114 |
25 |
|
생물공학 |
172 |
41 |
|
식물학 |
89 |
25 |
|
식량작물 및 원예작물 |
63 |
17 |
|
응용생물화학 |
58 |
15 |
|
농림생태환경 |
96 |
25 |
|
동물학/수의학 |
152 |
36 |
|
수산학 |
64 |
18 |
|
식품/영양학 |
254 |
71 |
|
총계 |
1,999 |
515 |
중견연구자지원사업은 핵심연구지원사업, 도약연구지원사업으로 구성되어 있다. 2012년에 중견연구자지원사업으로 핵심 및 도약연구지원 사업 중 생명과학분야에 지원된 연구비 중 생명과학의 중분야별 지원 비율은 표 3-1-6, 표 3-1-7과 같다.
[표 3-1-6] 2012년도 핵심연구자지원사업 중 생명과학분야 중분야별 선정현황
|
중분야명 |
신청과제수 |
선정과제수 |
|
분자세포생물학 |
42 |
5 |
|
노화/종양학 |
90 |
11 |
|
신경발생/줄기세포 |
34 |
3 |
|
분자유전학 |
39 |
2 |
|
발생학 |
15 |
2 |
|
신경생물학 |
34 |
4 |
|
면역학/생리학 |
35 |
5 |
|
생화학/구조 생물학 |
46 |
5 |
|
유전자발현조절/치료 |
16 |
2 |
|
분류/생태/환경생물학 |
36 |
4 |
|
미생물/기생 생물학 |
57 |
6 |
|
생물공학 |
75 |
7 |
|
식물학 |
23 |
3 |
|
식량작물 및 원예작물 |
18 |
2 |
|
응용생물화학 |
17 |
4 |
|
농림생태환경 |
25 |
1 |
|
동물학/수의학 |
70 |
9 |
|
수산학 |
13 |
1 |
|
식품/영양학 |
51 |
7 |
|
총계 |
736 |
83 |
[표 3-1-7] 2012년도 도약연구자지원사업 중 생명과학분야 중분야별 선정현황
|
중분야명 |
신청과제수 |
선정과제수 |
|
분자세포생물학 |
12 |
4 |
|
노화/종양학 |
14 |
1 |
|
신경발생/줄기세포 |
5 |
- |
|
분자유전학 |
5 |
1 |
|
발생학 |
2 |
- |
|
신경생물학 |
10 |
- |
|
면역학/생리학 |
11 |
1 |
|
생화학/구조 생물학 |
10 |
1 |
|
유전자발현조절/치료 |
6 |
1 |
|
분류/생태/환경생물학 |
2 |
- |
|
미생물/기생 생물학 |
10 |
3 |
|
생물공학 |
11 |
- |
|
식물학 |
8 |
1 |
|
식량작물 및 원예작물 |
3 |
- |
|
응용생물화학 |
4 |
2 |
|
농림생태환경 |
1 |
- |
|
동물학/수의학 |
9 |
- |
|
수산학 |
- |
- |
|
식품/영양학 |
3 |
- |
|
총계 |
126 |
15 |
4. 생명공학 인력양성 정책
가. 생명공학분야 고급인력 양성정책의 현주소 및 비전
2013년 3월 정부조직개편으로 미래창조과학부와 교육부가 신설됨에 따라 (舊)교육과학기술부가 추진하던 생명공학 분야 기초연구지원 업무와 전문인력양성 업무도 각 부처에서 나누어 추진할 수밖에 없는 환경에 직면하였다. 연구현장에서는 두 부처로 업무가 분리됨에 따라 중복지원 등 연구지원정책의 효율성 저해에 대해 우려하는 목소리가 있었다.
연구현장의 의견에 귀를 기울이고 우려를 미연에 방지하는 차원에서 미래창조과학부와 교육부는 기초연구와 인력양성 정책의 효율성을 높이기 위한 두 부처의 긴밀한 협조체제 구축이 필요하다는 데 뜻을 같이하였다. 이에 두 부처는 「기초연구진흥종합계획(ʼ13∼ʼ17)」에서 각 부처의 특성을 심도 있게 고려하여 합리적으로 역할을 분담하고 긴밀한 협조 체제를 마련하였다.
[표 3-1-8] 기초연구진흥종합계획 내 부처별 역할분담
|
구분 |
미래창조과학부 |
교육부 |
|
역할 |
전략적 기초연구 지원 및 수월성 위주의 기초연구 경쟁력 강화 |
이공학분야 학술연구 등 순수기초연구 지원 및 학문후속세대 육성 |
|
주요 사업 |
▪일반(신진, 여성, 모험, 커리어) ▪중견, 리더, 집단연구, 기반구축 ▪미래원천, 원자력, 거대과학, IBS ▪과학기술인력양성, 과학기술국제협력 |
▪일반(기본, 지역, 보호, 리서치펠로우) ▪학문후속세대, 중점연구소 ▪우수연구인력 육성(BK21플러스) ▪대학교육역량강화, LINC 등 |
교육부는 생명공학 분야의 경쟁력 확보를 위해서는 장기적 관점에서 연구의 지속가능성이 필요하다고 판단하고, 기초연구 분야에 대한 저변 확대와 우수 연구인력의 양성에 보다 정책 역량을 집중하고자 하였다. 교육부는 다양한 생명공학 분야에 대한 개인 및 대학 연구소 단위의 균형잡힌 기초연구를 지원하여 연구 저변을 지속적으로 넓혀 나감과 동시에 석·박사 연구인력에 대한 연수기회 부여, 연구경험 제공 및 장학금 지원을 통해 미래 한국을 책임질 학문후속세대를 육성해 나가고 있다.
특히 이러한 장기적 관점의 연구역량 제고에서는 무엇보다 생명공학 분야의 선진국과 같이 대학이 연구와 인력 양성에 핵심적인 역할을 담당할 필요가 있기 때문에 대학의 연구역량을 강화하기 위해 노력하고 있다.
나. 기초연구지원사업
교육부는 2013년 기준 3,035억원 규모의 일반연구자지원사업과 427억원 규모의 이공학 학술연구기반조성사업을 추진하여 기초연구가 보다 활성화될 수 있도록 노력하고 있다.
[표 3-1-9] 교육부 기초연구지원사업
(단위 : 백만원, %)
|
사업명 |
2012년 예산 (A) |
2013년 예산 (B) |
증감 |
||
|
차액 (B-A) |
증감률 (%) |
||||
|
일반연구자지원 |
291,651 |
303,500 |
11,849 |
4.1 |
|
|
|
기본연구 |
259,955 |
240,827 |
△19,128 |
△7.4 |
|
리서치펠로우 |
4,792 |
32,500 |
27,708 |
578.2 |
|
|
보호연구 |
1,121 |
2,173 |
1,052 |
93.8 |
|
|
지역대학 우수과학자 |
25,783 |
28,000 |
2,217 |
8.6 |
|
|
이공학학술연구 기반구축 |
42,704 |
42,704 |
0 |
0 |
|
|
|
대학중점연구소 |
26,624 |
26,624 |
0 |
0 |
|
학문후속세대 |
16,080 |
16,080 |
0 |
0 |
|
|
합계 |
334,355 |
346,204 |
11,849 |
3.5 |
|
(1) 일반연구자지원
교육부는 일반연구자지원사업을 통해 개인연구자에게 5천만원의 정액연구과제를 폭넓게 지원하여 생명공학 분야 연구자가 창의적이고 혁신적인 연구에 전념할 수 있는 환경을 제공하고 있다.
특히 2012년부터는 대학의 리서치펠로우(장기계약직 박사후연구원)에 대한 지원을 신설함으로써 잠재력 있는 연구인력이 안정적 환경에서 연구에 몰입할 수 있는 환경을 조성하고 책임급 연구과제를 수행할 수 있는 기회를 제공하여 장래에 우수연구인력으로 성장할 수 있도록 지원하고 있다. 또한 지역대학우수과학자 사업을 통해 연구역량은 뛰어나지만 수도권에 비해 연구환경이 상대적으로 열악한 지역대학의 우수과학자도 뛰어난 연구성과를 창출할 수 있도록 지원하고 있다.
실제로 2013년 9월 생명공학분야 지역대학우수과학자지원사업의 과제를 수행한 연구팀이 ʻʻ기존 항암제와 비교하여 10%만 사용하고도 뛰어난 항암능력을 가진 나노항암제를 개발ʼʼ 하는 등 탁월한 연구성과가 나타나는 등 생명공학 분야에서 우수한 연구성과가 속속 나타나고 있다.
[표 3-1-10] 일반연구자지원사업 생명공학분야 지원 현황
(단위 : 개, 백만원)
|
분야 |
2012년 |
2013년 |
||
|
지원 과제수 |
사업비 |
지원 과제수 |
사업비 |
|
|
융합바이오 |
25 |
1,392 |
13 |
641 |
|
유전학/유전공학 |
22 |
1,223 |
20 |
988 |
|
생화학/구조생물학 |
17 |
941 |
13 |
631 |
|
생물위해성 |
- |
- |
1 |
50 |
|
생물공학 |
13 |
738 |
10 |
502 |
|
산업바이오 |
6 |
338 |
8 |
395 |
|
분자세포생물학 |
75 |
4,165 |
53 |
2,654 |
|
분류/생태/환경생물학 |
28 |
1,574 |
15 |
744 |
|
발생/신경생물학 |
40 |
2,228 |
27 |
1,333 |
|
바이오공정/기기 |
2 |
112 |
- |
- |
|
면역학/생리학 |
25 |
1,363 |
15 |
737 |
|
기타 생명과학 |
2 |
110 |
5 |
252 |
|
계 |
255 |
14,184 |
180 |
8,927 |
※ 신규과제 선정 기준이며, 2013년도는 상반기까지의 실적임
(2) 이공학 학술연구기반조성
교육부는 생명공학분야의 연구 기반을 확충하기 위한 이공학 학술연구기반조성 사업도 수행하고 있다.
대학중점연구소지원사업을 통해 대학의 연구역량 제고에 핵심적인 역할을 담당하는 대학연구소를 지원하고 있다. 특히 지역의 특성과 연계하여 대학중점연구소를 특화시킴으로서 생명공학 분야에 역량이 뛰어난 우수한 연구소로 성장시킴과 동시에 미래창조과학부의 기초연구실사업 등과 차별화를 도모하고 있다. 국내 최초로 ʻGM작물 환경위해성 평가기술ʼ을 확립한 ʻʻ제주대 아열대원예산업연구소ʼʼ, 고품질 한국형 종돈 경제형질과 관련한 유전자원 확보를 위해 유전체, 후성유전체 및 전사체 분석에 특화한 ʻʻ경남과학기술대 양돈과학기술센터ʼʼ와 생식 및 배아줄기세포, 만능줄기세포 등을 이용한 세포치료 기술 개발에 뛰어난 경쟁력을 가진 ʻʻCHA 의과대학 기초의학연구소ʼʼ 등의 생명공학 분야 대학중점연구소에서는 괄목할만한 성과를 창출하고 있다.
기반 조성을 위한 학문후속세대 육성 사업도 함께 추진하고 있다. 매년 약 240여명의 박사급 연구인력에게 국내외 우수 기관에서의 연구경험을 제공하고 있으며, 20명 내외의 최고 수준의 박사급 연구인력을 선발하여 국가차원의 대통령 Post. Doc. 펠로우십(매년 1.5억원씩 5년 지원)을 지원함으로써 이들이 세계를 선도할 우수연구자로 커 나갈 수 있도록 하고 있다.
[표 3-1-11] 이공학학술연구기반조성사업 생명공학분야 지원 현황
(단위 : 개, 백만원)
|
분야 |
2012년 |
2013년 |
||
|
지원 과제수 |
사업비 |
지원 과제수 |
사업비 |
|
|
융합바이오 |
4 |
249 |
2 |
66 |
|
유전학/유전공학 |
11 |
1,429 |
8 |
1,462 |
|
생화학/구조생물학 |
5 |
165 |
1 |
33 |
|
생물위해성 |
- |
- |
- |
- |
|
생물공학 |
5 |
759 |
1 |
557 |
|
산업바이오 |
- |
- |
- |
- |
|
분자세포생물학 |
33 |
2,661.25 |
9 |
1,378 |
|
분류/생태/환경생물학 |
7 |
465 |
1 |
33 |
|
발생/신경생물학 |
14 |
1021 |
5 |
654 |
|
바이오공정/기기 |
1 |
33 |
- |
- |
|
면역학/생리학 |
9 |
297 |
3 |
99 |
|
기타 생명과학 |
- |
- |
- |
- |
|
계 |
89 |
7,079.25 |
30 |
4,282 |
※ 신규과제 선정 기준이며, 2013년도는 상반기까지의 실적임
다. 고급인력 양성사업
교육부는 인력양성 총괄 부처로서 다양한 초·중등에서 대학에 걸쳐 전주기적 인재 양성을 지원하고 있다. 특히 최근에는 생명공학 등 과학기술 분야에 대한 중요성이 높아짐에 따라 초·중등교육에서 융합교육(STEAM; Science, technology, engineering, arts and mathematics)을 통해 어려서부터 과학기술에 흥미와 관심을 가질 수 있도록 노력하고 있다.
이와 함께 고등교육 단계에서도 고급인력을 양성하기 위한 노력을 기울이고 있다. 특히 WCU(World Class University)사업과 2단계 BK21사업을 추진하여 대학원 단계에서의 석·박사급 전문인력을 양성하고 있다. 2013년부터는 기존의 BK21사업과 WCU사업을 계승·발전시켜 새롭게 BK21플러스 사업을 수립·추진함으로써 대학원의 교육·연구의 질이 한 단계 높아질 것으로 기대되고 있다. 동 사업에서 생명공학 분야에 대한 투자는 2013년 기준 587억원 규모로 2012년 360억원 대비 약 227억원이 증가(62.9%)하였다.
[표 3-1-12] BK21 및 BK21플러스 사업 지원 현황
(단위 : 개, 백만원)
|
분야 |
2012년 |
2013년 |
||
|
지원 과제수 |
사업비 |
지원 과제수 |
사업비 |
|
|
농생명 분야 |
30 |
3,232 |
15 |
11,794 |
|
생물학 분야 |
15 |
12,317 |
23 |
14,615 |
|
약학 등 분야 |
22 |
2,862 |
15 |
9,955 |
|
응용생명 분야 |
17 |
14,972 |
17 |
4,385 |
|
의학/치의/한의학 분야 |
18 |
2,645 |
22 |
17,931 |
|
계 |
102 |
36,028 |
92 |
58,680 |
※ 2012년은 BK21사업, 2013년은 BK21플러스 사업 기준임
의약학 및 생명과학 분야에 특화한 의과학자 육성지원 사업도 추진 중이다. 의과학자 과정(의사면허증(M.D/DDS)과 박사학위(Ph.D)를 동시에 또는 연계하여 취득하는 과정)을 이수하는 138명의 우수 전문대학원생에 등록금 전액과 연간 5백만원의 교육연구비를 최대 7년간 장기 지원하여 전문 임상경험과 기초의학 연구력을 겸비한 신진 의과학자로 양성하고 있다.
라. 추진방향 및 발전과제
교육부는 학술진흥과 인력양성을 담당하는 부처로서 생명공학 분야의 연구와 인력양성을 위한 지원을 확충하는 것이 무엇보다 필요하다. 아울러 기초연구와 인력양성 간 긴밀한 연계를 통해 시너지를 창출하기 위한 노력을 강구해야 하고 있다. 예를 들어 BK21플러스 등 인력양성 사업과 일반연구자지원 등 기초연구지원사업을 효과적으로 연계할 수 있는 방안에 대해 모색하는 것이 생명공학 분야의 장기적 연구역량 제고를 위해서는 필수적인 조건이라 할 수 있다. 특히 이러한 시너지가 가장 효과적으로 나타날 수 있는 현장이 대학이므로 대학에 대한 지원을 확대할 필요가 있다.
아울러 교육부는 생명공학 분야 중에서 장래에 성장가능성이 있으나 현재 투자가 미흡한 분야나 다른 분야의 성장을 위해서는 반드시 필요한 기반 분야 등 민간에서 투자가 소홀할 수 있는 부분을 적극적으로 발굴하고 정책적인 배려를 해 나갈 예정이다.
5. 농식품분야 생명공학 육성 정책
가. 개요
바이오경제시대가 도래함에 따라 산업의 기본소재로서 생명자원의 가치가 재해석되고 이를 활용한 산업의 중요성이 증대되고 있다. 즉, 생명자원을 식품공급뿐만 아니라 기능성·의약 소재, 바이오에너지 등 고부가가치 제품으로 활용하는 생명산업이 주목 받고 있다. 또한 농업생명공학의 발달 및 IT·NT의 접목으로 농식품 분야도 새로운 가능성과 중요성이 새롭게 재발견되고 있다.
특히, 생명공학기술의 발달과 더불어 농업은 창조경제를 견인할 신성장동력 생명산업으로, 먹을거리 단순생산·가공산업에서 고부가치 기능성·맞춤형 산업으로, 에너지 문제해결의 보완산업으로 그 가능성을 확인하고 있다. 특히, 농식품 산업의 미래 가능성과 경쟁력은 바로 농업생명공학에서 찾을 수 있을 것이라 전망된다.
농림축산식품부는 농식품 산업을 인간의 생명과 직결되는 생명산업인 동시에 새로운 가치를 창조하여 경제적 부를 창출해 낼 수 있는 고부가 미래 전략산업으로 육성해 나갈 계획이다.
나. 주요 연구개발 사업
농림축산식품부는 생명자원을 활용한 기술 개발 및 실용화를 위하여, 골든시드프로젝트 사업, 고부가가치식품기술개발사업, 기술사업화지원사업 등 2013년 생명공학 관련 예산으로 237,978백만원을 투자하고 있다.
지속적인 투자결과 농업생명공학 우수 기술이 꾸준히 개발되어 분자육종 기술을 이용한 탄저병 저항성 고추, 탈모예방 단백질 벼 등 기능성 GM작물 개발, 곤충 항생 펩타이드 이용 염증치료물질 개발, 세계 최초 브루셀라균 10종 모두를 동시 감별 가능한 진단키트 개발 등 가시적인 성과가 도출되고 있다.
농림축산식품부는 농식품 산업을 최첨단 과학기술을 접목한 고부가가치 융복합 산업으로 발전시키기 위하여 다음과 같은 주요 생명공학 육성사업들을 추진하고 있다.
[표 3-1-13] 농림축산식품분야 생명공학사업 투자계획
|
기관명 |
사 업 명 |
사업기간 |
2012년 실적 |
2013년 예산 |
|
농림축산식품부 |
▪고부가가치식품기술개발 |
2010년~계속 |
24,930 |
18,291 |
|
▪기술사업화지원 |
2008년~계속 |
8,070 |
7,200 |
|
|
▪생명산업기술개발사업 |
1994년~계속 |
52,274 |
44,282 |
|
|
▪수출전략기술개발사업 |
2011년~계속 |
5,405 |
5,605 |
|
|
▪골든시드프로젝트 |
2012년~계속 |
1,650 |
33,471 |
|
|
▪첨단생산기술개발사업 |
2011년~계속 |
11,510 |
13,320 |
|
|
▪가축질병대응기술 |
2012년~계속 |
775 |
775 |
|
|
▪융복합연구센터 지원 |
2010년~계속 |
3,000 |
3,000 |
|
|
▪농림수산검역검사기술개발 사업 |
1998년~계속 |
24,547 |
24,380 |
|
|
농진청 |
▪차세대바이오그린 21사업 |
2011년~-2020년 |
70,000 |
69,900 |
|
▪유용유전자 대량 발굴 및 형질전환 작물 개발 |
1994년~계속 |
6,050 |
5,992 |
|
|
▪GMO 국가관리 및 안전성 평가 |
2004년~계속 |
1,320 |
1,396 |
|
|
▪농업유전자원 국가관리체계 확립 및 활용 |
1994년~계속 |
7,104 |
7,016 |
|
|
산림청 |
▪산림과학기술개발 |
1949년~계속 |
1,250 |
1,260 |
|
▪지방임업연구기반조성 (지방임업연구기반조성) |
2007년~계속 |
800 |
800 |
|
|
▪인력양성(산림정책관리) |
2006년~계속 |
1,220 |
1,290 |
|
|
|
계 |
219,906 |
237,978 |
|
출처 : 농림축산식품부
(1) 고부가가치 식품기술개발사업
농림축산식품부가 식품산업 진흥업무를 담당하게 되어 본격적인 식품산업 R&D 추진을 위해 수립한 「식품산업 R&D 중장기계획」(ʼ09.6)에 따라 기존 농림기술개발사업에서 식품부문을 분리·확대하여 고부가가치 식품기술개발사업을 2010년부터 추진하였다.
2012년 주요 성과로는 녹차의 등외품 또는 부산물을 이용한 기능성 식품 소재 개발에 관한 기술이전이 있었다.
기능성강화식품, 전통웰빙식품, 식품 안전·품질관리, 식품 핵심소재, 식품 기자재, 저탄소·신가공 기술개발을 지원하고 있으며, 농업과 식품산업의 동반 성장을 도모하고 식품산업의 국제 경쟁력을 향상시켜 나갈 계획이다
(2) 기술사업화지원사업
연구개발로 얻어진 우수한 원천 기술에 대한 사장을 방지하고 산업화 단계로 진입할 수 있도록 기술사업화지원사업을 추진하고 있다. 기술사업화지원 사업은 2008년에 농림바이오기술산업화지원사업이라는 명칭으로 시작되었으며, 2011년 기술사업화지원사업으로 변경되었다.
2013년에는 잉여 수산자원을 활용한 기능성 소재 및 건강기능식품 개발사업단, 생활습관병 개선 기능성 가공제품개발 및 산업화, 항비만 바이오 신소재 사업단. 난대성 특화작물 산업화 연구단, 황토가공나노신소재 이용 친환경식품 개발사업단 등 5개 과제를 집중 추진하고 있다.
(3) 생명산업기술개발사업
농림수산물의 부가가치 향상 및 저탄소 녹색성장을 실현하고 생명산업 기술개발을 중추 사업으로 확대하기 위해 기존의 ʻ농림기술개발사업ʼ을 2011년부터 ʻ생명산업기술 개발 사업ʼ, ʻ첨단생산기술개발사업ʼ, ʻ수출전략기술개발사업ʼ, ʻ융복합연구센터 지원사업ʼ 4개 사업으로 분리하여 추진하고 있다.
본 사업을 통해 농림축산식품부는 동식물, 미생물 등 생명자원의 생산·응용· 유지관리에 대한 연구개발을 통해 차세대 핵심산업인 ʻ생명산업ʼ을 육성할 계획이다.
(4) 골든시드프로젝트
종자산업의 기반을 구축하고 이를 토대로 종자산업을 수출전략산업으로 육성하기 위해 농식품부 등 4개 부·청 R&BD사업인 골든시드 프로젝트 사업을 추진 중이다.
골든시드는 금값 이상의 가치를 가진 고부가가치 종자를 의미한다.
2012년도에는 본격적인 사업추진에 앞서 사전기획과 품목별 상세기획을 추진하였으며, 2013년도에는 관리지침을 제정하고 GSP 채소종자사업단, GSP 원예종자사업단, GSP 식량종자사업단, GSP 종축사업단, GSP 수산종자사업단 5개의 사업단을 이끌고 갈 사업단장 및 프로젝트 연구기관을 선정하고 본격적인 연구를 시작하였다.
(5) 농림수산검역검사기술개발 사업(검역검사 R&D)
1998년부터 추진되고 있는 본 사업은 국가 재난형 동물질병 및 구제역과 광우병 등 해외 악성 가축전염병의 유입방지를 위한 방역 및 검역기술개발로 축산업을 보호하고 인수공통 전염병 방제기술개발 및 축산물 안전성 관리기술을 개발하여 국민 보건 향상을 통한 국민의 안전한 삶 보장을 목표로 한다.
해외전염병 검역검사기술 개발, 동물질병 예방 및 치료제 개발, 기후변화대응 신종질병 방제기술 개발, 동물보호 및 동물용의약품 관리기술 개발 연구 등을 수행 중에 있다.
(6) 차세대바이오그린21사업
2001년부터 10년간 약 3,300억원의 연구비를 투자한 바이오그린 21사업을 마치고, 2011년부터 차세대바이오그린 21사업을 시작하였다.
차세대바이오그린21사업은 그린 바이오 기술 선진강국 도약을 목표로 하여 농생명 바이오 식의약 소재 개발 사업단. 동물 바이오 신약 장기 개발 사업단, 차세대 유전체 연구 사업단, 시스템 합성 농생명공학 사업단, 식물 분자육종 사업단, 동물유전체 육종 사업단, GM작물 실용화사업단 7개 사업단을 구성 운영하여 사업단별로 70~100억원을 지원하고 있다.
본 사업은 농업생명공학 원천기반기술 및 실용화 정착을 통한 농산업 경쟁력을 강화하고 융복합을 통한 기후변화, 식량안보 등 국가주도 현안기술을 적극 개발함으로써 우리 농업의 신성장동력 창출과 농업생명공학강국 진입을 목표로 하고 있다.
농업생명공학 기술을 이용한 GM작물 실용화, 식물분자육종, 바이오식의약 소재개발 및 기후변화, 식량안보, GMO 안전성 확보 등 국가주도 현안기술 개발을 중점적으로 추진하고 있다. 또한, 동·식물·미생물 유전체 해석, 대사제어에 의한 고부가가치 물질 생산, 바이오신약장기기술개발, 농생명 자원 다양성 확보 등 유용유전자 발굴을 통한 국내 고유 유전자 및 원천특허 확대를 위해 노력하고 있다.
(7) 산림과학기술개발사업
본 사업의 목표는 창조적 생명공학 기술개발을 통하여 산림자원의 활용도를 제고하고 임업을 첨단산업화 하는 것이다. 사업의 주요 내용은 임목 분자육종 기술개발, 신기능 유용물질 탐색 및 자원화, 세포공학을 이용한 고부가가치 창출, 유용유전자 분리·규명이다.
또한 산림청에서는 지방임업연구 기반조성, 대학연구역량 강화 및 우수인력 양성을 위하여 지방임업연구 기반조성 및 인력양성사업을 추진하고 있다. 주요 사업내용은 지방임업 소득사업 및 연구기반 구축, 기초연구지원사업을 통한 생명공학기술 이용 산림소득 자원개발 인력양성이다.
다. 추진방향 및 발전과제
세계 주요 선진국들은 생명자원이 미래 강국의 중요 조건임을 인식하고 농업의 패러다임을 발 빠르게 바꾸고 있으며, 생명자원에 대한 주권을 강화하고 있다. 우리나라도 기존의 먹을거리를 생산하는 농업에서 미래성장가능한 산업으로 전환이 필요한 바, 생명자원의 보고(寶庫)인 농식품 분야를 과학기술과의 융복합을 통해 차세대 핵심산업으로 육성하고자 한다.
우리나라는 세계 6위의 생명자원 보유국으로 이를 적극 활용한다면 국가경쟁력을 갖출 수 있을 것이다.
이를 위해서 농식품 분야 생명공학 기술개발은 품종개량 등 전통적인 연구 외에도 기능성소재, 바이오에너지, 동물의약품 등 다양한 분야로 연구개발을 확대할 필요가 있다.
특히, 생명공학기술은 기술개발에 장기간이 소요되고, 복잡한 산업화 과정과 대규모 자본투입이 필요하다. 독자적인 원천기술을 지속적으로 개발해 나가는 한편, 산업화 실현이 전제로 이루어져야 하며, 농업소득과의 연계도 필요하다.
앞으로 농림축산식품부는 그동안 먹을거리 생산으로 여겨졌던 농업을 동·식물, 미생물 등 생명자원을 활용하는 고부가가치 산업으로 육성하고자 하며, 이를 위하여 차세대 성장동력 분야에 투자를 확대해 나갈 계획이다.
6. 보건의료분야 생명공학 육성 정책
가. 개요
전 세계적으로 인구의 고령화 경향 및 생활습관 변화 등에 기인한 만성질환 증가로 의료비 부담 증대와 기후변화에 기인한 신·변종 감염병 창궐로 인하여 보건의료분야 개발에 대한 사회·경제적 수요가 폭발적으로 증가하고 있다. 우리나라에서도 신정부가 제시한 140대 국정과제 안에 ʻʻ보건산업을 미래 성장산업으로 육성ʼʼ 한다는 내용이 포함되어 있다. 이를 위하여 보건의료 R&D를 강화하고, 부가가치 높은 첨단보건의료기술 개발 분야(맞춤의료, 줄기세포·재생의료, 신약·의료기기, 양·한방 융합)에 집중 투자 등을 목표로 제시하고 있다. 이와 더불어 과학기술의 패러다임이 국가 경제 성장 중심에서 삶의 질 향상 추구로 변화하면서 건강·의료 등 사회적 문제 해결을 위한 보건의료기술 개발의 필요성 또한 함께 대두되고 있다.
보건의료기술(Health Technology, HT)이란 BT, IT, NT와 같은 요소기술을 융합하여 인체적용을 목적으로 활용하는 기술을 총칭하며 궁극적으로 질병극복 및 국민건강증진을 목적으로 하는 기술이다. BT는 요소 기술에 중점을 둔 반면에, HT는 활용 목적에 중점을 두어 개념상 큰 차이점을 보인다. HT와 BT는 일부 중첩관계로, BT의 응용 범위 중 인체와 건강 관련된 제반 영역을 HT 관련 분야로 정의내릴 수 있으며, 대표적인 분야로는 제약, 의료기기, 의료서비스가 해당되며 최근에는 의료 전달체계와 같은 보건의료 시스템과 관련된 분야를 포괄하는 개념으로 발전하고 있다(그림 3-1-3).
HT분야의 개발은 산·학·연·병과 같은 다양한 연구주체가 협력을 통해 기초 원천연구-중개연구-임상연구-신약·의료기기개발을 유기적으로 연계하여 이루어지는 특징이 있다. 특히 HT를 기반으로 한 HT 산업은 대표적인 기술집약적 산업으로 국가 미래 성장 동력으로 그 중요성이 부각되고 있으며, 타 산업 분야에 비해 고용 및 산업 파급효과가 높은 산업이다.

[그림 3-1-2] HT의 개념 및 범주
이에 세계 각국은 21세기 주력산업으로 HT 산업을 육성하기 위해 총력을 기울이고 있다. 특히 EU의 경우, 제7차 Framework Program(2007∼2013년, EP7)을 통해 Health를 생명과학(life science)에서 독립분야로 분리하였으며, 협력프로그램 9대 분야 중 하나로 7년 동안 약 61억 유로를 배정하여(전체 투자규모의 18%), 농림, 해양, 식품을 포괄한 BT분야 투자 규모(약 19억 유로)의 3배가 넘는 규모를 투자하고 있다(그림 3-1-4).
(단위 : 백만 유로)

[그림 3-1-3] EU FP7, Cooperation Programme의 분야별 투자 현황(년도)
우리 정부 에서도 2009년 이후 HT의 개념 정립과 연구개발 투자를 지속적으로 확대하는 등 다양한 노력을 기울이고 있으나 선진국에 비해 아직 미미한 수준에 머물고 있다(2013년 국가연구개발사업 총 투자규모는 16조 9천억 원 수준이며, 이중 보건의료의 비중은 1조 344억 원으로 전체의 6.1%).
보건복지부는 HT를 활용한 건강사회구축을 위해 ʻʻ건강수명의 연장, 삶의 질 향상, 보건의료 산업 경쟁력 강화ʼʼ의 비전을 가지고 연구개발 투자, 인프라 구축 등을 지원하고 있다. 사업으로는 보건의료연구개발사업을 비롯하여 한의약선도기술 개발사업, 암정복추진사업, 질병관리연구사업 등으로 2013년 기준 약 3,732억 원을 지원하고 있다.
[표 3-1-14] 보건복지부 R&D 예산
(단위 : 억 원)
|
기관명 |
사업명 |
2012년 |
2013년 |
|
한국보건산업진흥원 |
보건의료연구개발사업 |
2,893 |
3,093 |
|
한의약선도기술개발사업 |
68 |
90 |
|
|
국립암센터 |
기관고유사업 |
151 |
153 |
|
암정복추진사업 |
145 |
147 |
|
|
질병관리본부 |
질병관리연구사업 |
195 |
249 |
|
합계 |
3,452 |
3,732 |
|
나. 주요 연구개발사업
(1) 보건의료연구개발
(가) 개요
보건복지부는 21세기 지식기반경제의 핵심 산업으로 등장하고 있는 HT를 국민건강 증진과 국가경제 발전에 이바지하는 고부가가치 국가 전략산업으로 육성·발전시키기 위하여 보건의료기술진흥법(1995년.12월)을 제정하여「보건의료연구 기술개발사업」을 추진해오고 있으며, 지난 1995년부터 2013년까지 19년간 총 2조 3,331억 원의 정부 연구개발 자금을 지원하였다. 아직은 선진국에 비해 HT R&D 투자 비율이 미흡 하지만 사회경제적 필요에 의해 투자가 점진적으로 확대하고 있다.
동 사업은 기반기술 분야에 대하여는 연구개발비 전액을, 민간기업이 참여하는 실용화 및 제품화 기술과제에 대하여는 연구개발비의 50% 이내에서 지원한다. 보건복지부는 연도별·분야별 연구개발사업 시행계획을 수립, 관리기관인 한국보건산업 진흥원에서 연구개발 사업관리 등의 실무를 담당하고 있으며, 사업 추진절차는 다음과 같다(그림 3-1-5).

[그림 3-1-4] 사업추진 절차
(나) 지원내용
2013년도 보건의료연구개발사업은 주요 질병 극복을 위한 R&D 강화, 첨단의료 조기실현 및 신산업 창출을 위한 연구개발 확대, 보건복지 위기대응 R&D 투자 강화, 보건의료 R&D 인프라 구축에 중점을 두고 있다. 또한 기존의 복잡·다기화된 사업구조를 목적중심으로 개편하여 ʻ첨단의료기술개발ʼ 등 11개 단위사업으로 구성하였으며, 지원 분야는 의과학, 의약품, 의료기기, 의료정보, 건강기능제품 등의 분야를 포함하고 있다.
① 첨단의료기술개발
미래의 의료는 개인 맞춤형 평생 건강관리 시스템으로 변화하여 가고 있으며, 이에 따라 첨단의료 수요 증가가 예상된다. 국내 HT산업은 세계 HT산업 시장에서 1.21% 수준(10∼14위권, 2009년 기준)으로 국내 시장이 매우 협소하여 세계시장 진출이 필수이다. 또한 국산화율이 저조하여 향후 FTA 등 시장 개방 시 위기 초래가 예상된다. 그러나 우수한 ICT 인프라와 연구개발 인력을 기반으로 전략적 투자가 이뤄질 경우 HT 산업의 국제경쟁력 확보가 가능할 것으로 예상된다. 또한 우리나라 첨단의료 기술별 기술수준은 최고기술 보유국인 미국에 비해 67.7∼88.6% 수준(기술격차 1.5년∼6.5년)으로1), 시급한 전략적 투자가 필요할 것으로 보인다.2)
이에 대하여 고령화, 건강한 삶에 대한 욕구 증가, 과학기술 융합화 등 미래사회 메가트랜드와 이에 따른 보건의료 R&D 패러다임 변화에 대응이 요구된다. 바이오·헬스케어산업이 글로벌 성장엔진으로 자리매김할 수 있도록 관련 핵심기술 개발 투자 강화가 필요하다. 또한 세계적 수준의 블록버스터 혁신신약, 첨단 융합의료기기 개발을 가속화할 수 있도록 전주기 연구개발 지원 확대하고, 줄기세포, 유헬스, 뇌과학, 한의학 등 생명·보건의료 분야 미래 트렌드를 겨냥한 유망 신기술 개발 지원 본격화해야 할 시점이다.
이에 보건복지부는, ʻ재생의료기술, 질환유전체기술, 신약 개발, 의료정보·u-Health 기술, HT 융합기술ʼ 등 경쟁우위 선점이 가능한 첨단의료 분야의 기술개발 지원을 통해 보건의료 산업 경쟁력을 확보하고자 노력하고 있다. ʻ재생의료기술ʼ은 바이오기술기반 미래사회 발전전략3)의 핵심 기술 분야로 국내기술과 선진국과의 기술격차가 크지 않아 산업화 및 의료산업분야에서 경쟁우위 선점이 가능한 분야이다. 또한, 질환유전자 규명을 통한 질병 예측이 가능해지는 4P 시대(Personalized, Predictive, Preventive, Participatory)의 도래로, 한국인 맞춤형 호발 질병에 대한 유전체 치료, 질병예방을 위한 유전 정보의 확보와 이를 극대화하기 위한 시스템 구축 수요 확산4)을 촉진하기 위하여 ʻ질환유전체기술ʼ 개발을 지원하고 있다. ʻ신약 개발ʼ의 경우, 한-미 및 한-EU FTA 체결로 보건의료시장이 개방되어 다국적 제약사의 국내 점유율 증가5)가 예상되나, 국내 제약사의 글로벌 신약개발 경험이 미비한 실정으로 이에 대한 지원이 이루어지고 있다. 더욱이, 개인 건강관리 욕구 증대와 급속한 고령화 사회진입, 만성질환 증가 등으로 전주기적이고 효율적인 의료정보 및 ʻu-Healthʼ 서비스 수요가 증대6)함에 따라 신성장동력 분야인 u-Health 산업에 대한 투자의 필요성을 인지하고 지원하고 있다. 여기에, 국내의 높은 ICT 기술력으로 인해 선진국과의 기술격차가 크지 않고, 향후 HT 기술혁신에 있어 가장 큰 원동력7)이 되는 HT 융합기술 분야로 글로벌 선도8) 및 부가가치 창출을 위한 혁신체제 구축을 위해 지원하고 있다.
이에 해당되는 보건복지부의 대표적인 사업으로는 ʻ줄기세포·재생의료, 보건의료 유전체, 융복합 보건의료기술, 신약개발지원ʼ이 있다. 줄기세포·재생의료 사업은, 줄기세포·재생의료 실용화를 위한 중개·임상 연구를 지원하여 줄기세포 등을 활용한 신개념 세포치료제 개발 및 글로벌 줄기세포·재생의료 연구개발 촉진센터를 지원하고 있다. 보건의료유전체 사업은, 맞춤의료 구현을 위한 한국형 예방·진단·치료기술 개발을 목표로 차세대 맞춤의료 유전체 사업단을 운영하고 있다. 융복합 보건의료기술 사업은, 첨단 HT 기술개발 지원 및 나노기술의 임상적 적용 확대를 위한 보건의료 기술개발을 목표로, 보건의료 정보 및 u-Health, 나노의학 등 유망보건의료기술개발을 지원하고 있다. 신약개발지원 사업은, 국내외 혁신 신약, 바이오의약품, 개량신약 등을 개발하는 것을 목표로 신약개발 비임상·임상시험 지원, 신약개발기반구축센터를 지원하고 있다.
② 줄기세포
줄기세포기술, 조직 재생기술이 상용화로 연결되기 위해서는 target 질환 또는 조직손상을 중심으로 임상적용을 전제로 하는 실용화 개발단계(중개연구, 임상적용) 지원이 필요하며, 재생의료 분야는 선진국의 개발 경쟁이 치열한 분야이므로 글로벌 경쟁력을 확보하는 것이 매우 중요하다. 또한, 난치성 질환 극복을 통한 국민 삶의 질 향상에 기여할 수 있는 기술이며, 치매, 당뇨병, 심근경색 등 난치성 질환 치료를 위해 재생의학적 관점에서 근본적 치료방안을 모색할 수 있다. 재생의료 분야의 국내 기술 경쟁력은, 미국 내 관련 특허 점유율이 0.6%로서 세계 12위 수준이며, 주요 연구자의 수적인 면에서도 미국, 스위스, 오스트레일리아, 캐나다와 함께 상위 5개국에 포함되는 것으로 평가되고 있다.9)
이에 보건복지부는 (舊)과학기술부 주관 범정부10) 차원으로 수립된 「줄기세포연구 종합추진계획」11)에 따라 2007년부터 줄기세포연구의 연차별 시행계획을 수립하고 이를 시행하여 오고 있다. 2013년도 보건복지부 줄기세포 투자 금액은 448억 원으로 참여 부처 전체 중 44.7%로 가장 많은 금액을 투자하고 있다. 줄기세포 투자의 추진방향은, 기초연구 성과의 임상 활용성을 높이기 위한 줄기세포 중개연구를 지원하고, 임상적 근거확보 및 실용화 성과를 조기에 창출하기 위하여 지원, 국립줄기세포」재생센터 건립을 통한 연구 인프라를 구축 및 제공하는데 중점을 두고 있다. 시행 사업으로는, ʻ첨단의료기술개발ʼ 사업 중 줄기세포연구 일부 분야를 현재까지 지원하여오고 있으며, 만성병관리기술개발(舊질병관리연구지원), 선도형특성화연구, 줄기세포은행 운영 및 표준화 기반구축, 줄기세포재생연구센터 건립, 줄기세포주 등록 체계 구축·운영, 생명윤리 및 안전정책 사업을 통하여 지원하여오고 있다. 주요 연구 성과로는 SCI급 게재 논문 74건이 있으며, 실용화 성과로는 줄기세포 치료제인 안트로젠 큐피스템(크론성 누공)(2012년.1월) 개발이 있다.
③ 다부처 유전체 사업
유전체연구는 생명공학연구의 패러다임을 변화시키며 보건의료, 환경, 에너지, 화학, 농식품 등 광범위한 분야에서 활용중이며 산업은 물론 국민의 삶의 질 제고에도 막대한 파급효과를 줄 것으로 기대되어지고 있다. 폭발적인 유전체 정보량 증가로 정보 분석이 산업적 활용의 병목이 되고 있으며, 이를 해결하기 위한 정보처리 인프라와 원천기술 개발이 시급한 실정이다. 유전체 기술이 가져올 미래사회 변화에 적극적으로 대비하고 우리나라의 글로벌 경쟁력을 높이기 위하여 보건복지부, 미래창조과학부, 산업통상자원부, 농림축산식품부, 농촌진흥청, 해양수산부와 함께 ʻ다부처 유전체 사업ʼ을 기획하였으며, 본 사업을 통해 개인별 맞춤의료를 실현하기 위한 새로운 차원의 신약 및 진단치료기술 개발과 동·식물, 식품기반 미생물, 해양 생물 등 각종 생명체의 유전 정보를 활용한 고부가가치 생명 자원개발, 그리고 이를 위해 필요한 유전체 분석 기술 등 연구 기반 확보 및 조기산업화를 목표로 추진하고 있다. 다부처 유전체 사업은 총 17개 사업으로 구성되어 있으며, 보건복지부는 ʻ맞춤의료를 위한 인간유전체 이행연구ʼ, ʻ유전체 이행연구 지원 사업ʼ, ʻ한국인 유전체 연구자원·정보생산 및 활용 사업ʼ에 중점 지원할 예정이며, 부처 공동사업으로 질병기전 유전체 연구, 국제협력 연구, 표준게놈지도 작성, Host-microbe interaction 연구에 지원할 예정이다. 각 사업별 주요 지원내용을 살펴보면 맞춤의료를 위한 인간유전체 이행연구 사업은 대규모 인구집단 및 환자유래 유전체 정보를 최신 기술에 적용하여 분석하거나, 임상 현장에 조기 적용할 수 있는 실용화 연구 및 확증연구와 중요 질환별 유전체 기반 중개연구 및 임상연구 등을 지원한다. 유전체 이행연구 지원 사업은 질환유전체 전략연구 사업과 중개․임상연구 사업을 지원하는 핵심 기반시설(Core Facility) 구축 및 운영을 위해 지원하며, 한국인 유전체 연구자원·정보생산 및 활용 사업은 국제적 수준의 연구 성과 창출을 위한 표준화되고 질 높은 유전체 연구자원 및 정보 DB를 확보하는 연구에 지원한다. 보건복지부는 다부처 유전체 사업을 통해 맞춤의료 구현을 위한 국제적 수준의 질환유전체 연구 자원·정보를 확보하고, 통합적 개방형 정보 이용시스템을 구축하여 한국형 맞춤형 진단·예방· 치료기술의 개발을 견인하고자 한다.
④ 신약개발
1995년에 보건의료연구개발사업이 시작된 이후 신약개발 분야에 지원을 지속한 결과 국내 제약기업이 출시한 신약의 다수가 보건복지부 지원을 통해 개발에 성공할 수 있었다. 한미 FTA 체결 이후 정부는 시장개방으로 인한 충격을 최소화하고, 이를 계기로 국내 제약산업의 경쟁력 강화를 통해 새로운 사업기회를 모색하기 위해 제약 인프라 개선, R&D 지원 확충 등을 통하여 제약사의 신약개발 역량을 강화시키고 해외진출 지원을 확대하여 제약산업의 수출전략 산업화를 유도하기 위해 노력하고 있다.
이에 보건복지부는 한미 FTA 후속대책으로 신약개발 지원 중 혁신신약, 천연물 의약품, 바이오의약품, 개량신약 4개 분야에 대해 비임상·임상시험을 중점 지원하고, 단계별 지원프로그램을 통해 기술적 경제적 성공가능성이 높은 신약후보에 대해 선택·집중 지원하고 있다. 한편 2009년부터 제약기업이나 벤처의 신약개발 아이템 지원에서 더 나아가 신약개발 플랫폼 기술인 표적단백질 구조정보, DDS, 동물모델, 스크리닝 시스템에 대한 기반기술 센터 설립을 통해 제약사 및 벤처의 기술난관을 해결하는데 일조하고 있다. 또한 2010년 이후에는 의료기관을 중심으로 신약 후보물질에 대한 심도 있는 유효성평가를 통해 후보물질의 임상 진입을 앞당기고, 더 나아가 임상 2상에서의 실패를 최소화 하고자 노력하고 있다.
⑤ 의료기기
의료기기산업은 제약 산업과 더불어 HT(Health Technology) 산업의 핵심 분야이자 차세대 신성장 동력 산업으로 파급 효과가 매우 큰 산업이다. 보건복지부는 국가 신성장 동력 산업인 의료기기 산업의 육성·발전이라는 비전을 가지고 첨단 공학(BT·IT·NT)을 활용, 신 의료기기 개발을 지원하고 있다. 새로운 의료기기의 원천기술을 확보하고, 산업화의 ʻ병목 현상ʼ을 해소하기 위하여 미래시장 수요 중심의 기술개발로 응용·개발연구 이후의 중개임상연구, 인허가 및 제품화까지 의료기기 R&D를 전주기적으로 관리하는 미래융합의료기기개발 지원과 국내 주력제품의 기술경쟁력 강화를 위한 안전성·유효성 확보가 필요한 임상시험 비용을 지원하는 의료기기 임상지원 사업(임상시험용 시제품개발, 허가용 임상시험, 임상평가시험)을 강화하고 있다.
(2) 한의약선도기술개발
(가) 개요
인구의 고령화로 인하여 만성·난치성질환이 증가하고 있으며, 세계적으로는 웰빙에 대한 관심과 친환경주의의 선호로 전통의학과 보완대체의학에 대한 수요가 급증하고 있다. 세계 전통의학 시장은 10년 후 약 420조 규모로 성장 할 것으로 예측하고 있으며, 이용자 또한 급격히 증가하여 세계인구의 60%를 상회할 것으로 추정하고 있다. 현대의학의 한계점을 인식하고 의료비의 증가를 억제하기 위하여 전통의학과 보완대체의학에 대한 관심이 커지고 있어 세계 전통의학 시장이 넓어지고 있다. 따라서 국가별로 투자를 강화하고 있는 실정이다.
이러한 세계적인 관심 속에서 우리의 고유 전통의학인 한의학적 접근방법을 통한 치료기술개발은 높은 경쟁력을 가질 수 있으므로 정부는 오랜 전통을 지닌 한의약의 경험과 지식정보를 이용하여 핵심원천기술과 응용기술을 개발하고, 한의약의 안전성·유효성을 입증하여 국민보건향상과 한방산업에 기여하고자 1998년부터「한의약선도기술개발사업」을 추진하고 있다.
한의약의 과학화·표준화·세계화의 비전을 지닌 한의약선도기술개발사업의 목적달성을 위하여 단계별 목표를 수립하여 기초연구단계(1998∼2002년), 연구심화단계(2003∼2007년), 실용화단계(2008∼2012년)로 구분하여 추진하고 있으며, 1998년부터 2013년까지 총 913억 원의 정부 예산이 지원되었다.
(나) 지원내용
보건복지부는 사업목표를 명확히 하고 새로운 한방치료기술과 한약제제 등의 연구 개발을 활성화하여 실효성을 높이기 위해 부처계획인 ʻ한방치료기술연구 개발사업 중장기 발전계획(2008∼2017년)ʼ을 2008년 2월 27일 재수립하였다. 동 계획은 지난 1998년부터 추진한 한의약선도기술개발사업을 통해 확보된 연구역량을 바탕으로 연구개발 활성화와 한방치료기술과 한약제제 개발 등 실효성 제고에 역점을 두고 있다. 제품화·세계화 구축사업, 근거중심 한의약 구축 사업, 혁신 인프라지원 사업 등 3개 세부 사업을 전략지원하고 있다.
(3) 암연구사업
(가) 개요
보건복지부는 국민보건의 향상에 이바지하기 위해 암에 관한 전문적인 연구와 암환자의 진료 등을 위해 2000년에 국립암센터법을 제정하여 국립암 센터를 설립·운영하고 있으며, 암의 발생·예방·진단·치료 및 관리 등에 관한 연구로 기관고유 연구사업을 추진하고 있다.
아울러, 1996년도에 제1차 암정복 10개년 계획(1996∼2006년)을 수립하고 암정복 추진단을 발족하여 암정복추진연구개발사업을 추진하였으며, 현재는 제2기 암정복 10개년계획(2006∼2015년) 기간으로 지난 1기 기간 동안 축적된 기반을 바탕으로 국민의 암발생률 및 암 사망률을 감소시키고 치료하는데 주력하고 있다.
2003년부터 2013년까지 국립암센터 기관고유연구사업과 암정복추진 연구개발사업으로 총 2,181억 원의 정부연구개발 자금이 지원되었으며, 향후 암에 관한 연구와 투자는 국민의 보건상향에 중요한 만큼 선진국에 버금가는 투자를 할 수 있도록 확대 되어야 할 것이다.
(나) 지원내용
국립암센터는 국립암센터 기관고유 연구사업(intramural program)을 통하여 암연구기반구축 및 국가암관리 사업 기획·평가를 수행하고 있고, 암정복추진 연구개발사업(extramural program)을 통하여 국내 암연구 수준 향상 및 저변 확대를 위한 암연구자의 연구활동을 지원하는 등 기관 자체 연구자원과 외부 연구자원의 상호보완적 활용으로 연구개발 성과를 극대화하고자 노력하고 있다. 특히 한국인의 주요 암(위·간·폐·대장·자궁·유방암)의 발생률 및 사망률을 낮추고 치료율을 제고시킬 수 있도록, 단순 기초 연구를 지양하고 기초연구와 임상연구 결과를 상호 유기적으로 연계할 수 있는 ʻ중개연구(Translational Research)ʼ에 중점을 두고 있다. 그리고 암 관련 기술개발을 통해 우리나라 생명공학 분야의 국가 경쟁력 향상에 기여하는 실용화 과제 수행을 지원하고 있다.

[그림 3-1-5] 국립암센터 중점 연구분야
(4) 질병관리연구
(가) 개요
질병관리연구는 질병관리본부 국립보건연구원에서 수행중인 연구로서 1999년부터 본격적으로 시작되었다. 국내 질병관리의 실무를 담당하고 있는 질병관리본부에서의 연구사업 수행은 국내 발생 질병에 대한 현안 대응의 측면에서 효율성을 인정받고 있다. 주요 연구 분야는 국내 발생 전염병 및 만성질환에 대한 예방, 진단 및 치료 기술 개발 연구와 질환관련 유전체의 분석을 통해 질병을 예측하도록 하고자 하는 유전체사업이다.
(나) 지원내용
질병관리연구는 주로 질병관리본부 국립보건연구원의 자체 수행과제로 이루어져 있다. 그러나 유전체분석과제 등과 같이 기기구입과 관련 전문가 확보 등 부가적 비용이 필요한 경우에는 용역과제의 형태로 외부 연구기관에 위탁하여 수행하고 있다. 연구 사업의 주요 내용은 다음과 같다. 주로 감염병에 대한 진단 및 예방치료 연구, 병원 감염 원인균을 찾고 그에 대한 해결방법을 찾고자 하는 연구, 생물테러 등에 이용되어 국민 안전을 위협할 수 있는 고위험병원체에 대응하기 위한 기술개발연구, 비만·당뇨 등 생활습관의 변화로 인하여 급증하고 있는 만성질환 예방연구를 수행하고 있다. 또한 한국인의 유전 형질에 따른 질병 발생 추이를 확인하고 그에 따른 질병예측 프로그램 개발을 위한 유전체연구사업을 수행하고 있다. 질병관리본부는 이들 연구사업의 수행을 바탕으로 국민 건강 증진에 기여하는 일선 기관으로서의 역할을 다하고자 노력하고 있다.

[그림 3-1-6] 질병관리본부 중점 연구분야
다. 추진방향 및 발전과제
보건복지부에서는 국민의 건강을 위한 범부처 차원의 노력을 확대하고 있다. 이를 위하여 2013년 관계부처12)와 함께「국민건강을 위한 범부처 R&D 중장기 추진계획」을 수립하였다. 이는 ʻ국민의 건강한 삶ʼ에 기여할 수 있는 R&D 투자를 활성화하고 건강 R&D 성과 창출 및 산업화를 촉진하고자함이다. 건강 전반에 대한 지속적 투자 확대와 글로벌 수준의 기술개발을 위한 선택과 집중, 성과 창출형 R&D 지원시스템 고도화, 연구생태계 조성, 건강산업 발전 촉진을 위한 제도 개선을 통해 Health 산업을 촉진시키는데 보건복지부가 주무부처로서 주도적인 역할을 수행할 계획이다.
또한, 목적중심으로 사업을 재개편하여 전략적 R&D 투자를 강화하고 있으며, 전략적 과제발굴을 위하여 연구자의 창의적 아이디어를 중심으로 하는 수요자 중심의 상향식(Bottom-up) 과제와 국가적으로 전략적 추진이 필요한 미충족 의료수요(unmet medical needs)를 해결하기 위한 하향식(Top-down) 과제를 발굴·확대하고 있다. 도전성 강화의 일환으로는 도전적 R&D 사업을 지원하기 위해 선정 평가 시 도전성, 창의성 비중을 확대하고, 성실한 연구 수행 시 실패를 용인하는 제도적 장치를 도입하는 등 높은 목표에 대한 도전과 성실실패가 가능한 연구풍토를 확대하고 있다. 이와 더불어 R&D 사업관리 효율성 확보를 위하여, 보건복지부 R&D 통합전산시스템을 구축 중에 있으며, 보건복지부 R&D 산하기관의 전문가 pool 및 성과정보를 공유하고, 단일 DB화, 연구자 업적정보 대외기관(NTIS, KRI)과의 통합·연계를 진행하는 등 연구과제 관리 및 사업효율성을 높여 나갈 계획이다.
7. 환경분야 생명공학 육성 정책
가. 개요
(1) 환경생명공학기술
환경생명공학기술(Environmental Bio Technology, EBT)이란 환경공학기술 (Environmental Technology, ET)과 생명공학기술(Bio Technology, BT)이 융합된 기술 분야로 생물, 분자생물학적기법과 생물학적 처리공정을 이용하여 환경오염을 예방(prevention) 및 감시(monitoring)하고 오염된 환경을 복원(restoration) 및 정화(remediation)하는 기술을 의미한다. 환경생명공학기술은 환경과학, 생태학, 분자생물학간의 유기적인 협조가 필요한 기술 분야로 생명공학기술의 기본적인 핵심기술13) 중에서 생물공정기술(발효공정제어, 분리정제, 배양기 설계·제작)과 미생물이용기술(미생물분리·배양, 항암물질 탐색기술)을 주로 활용하고 있다.
환경생명공학기술은 청정기술, 환경오염제어 및 관리기술, 바이오에너지기술 분야를 포함하며 이외에 생물학적 방법에 의한 오염의 검출(detection), 친환경 소재·제품 개발, 생태계·생물 다양성 유지, 토양·지하수 복원, 기후변화 저감 및 적응에 필요한 기술 등으로 범위가 확대되고 있다. 환경생명공학기술은 근래 각 분야에서 개발되고 있는 첨단기술과 융합하며 기존의 환경기술로는 극복하기 어려운 한계를 해결할 수 있다는 점에서 그 중요성이 부각되고 있으며 전 세계적으로 추구하고 있는 지속가능한 성장(sustainable growth)의 핵심기술이라 할 수 있다.
(2) 환경산업 및 환경기술의 변화
환경기술14)의 개발목적은 현안환경문제의 해결이라는 수요와 이러한 환경정책의 요구에 부응하기 위한 환경산업15)의 발전과 상호 연관되어 있다. 1960년대부터 형성되기 시작한 환경산업은 주로 발생한 환경오염물질을 처리하는 사후처리 중심의 산업이었다. 그러나 1990년대 이후부터 환경오염물질을 사전에 예방하는 사전저감 중심의 산업으로 범위가 확대되었고, 최근에는 환경복원 및 재생에너지 관련 분야로 산업의 성장축이 이동하고 있다. 이에 따라 환경기술의 개발 방향도 사후처리기술 중심에서 청정공정기술, 신·재생 에너지 개발기술로 변화하게 되었다.

출처 : 환경부, 2012 환경백서
[그림 3-1-7] 환경기술개발 정책 패러다임의 변화
21세기에 접어들어 지구환경 문제가 국제사회에서 중요한 의제로 대두되면서 환경과학 분야에 대한 수요가 증대되고 있다. 특히, UN을 중심으로 지구 온난화로부터 파생되고 있는 기후변화, 생물종 다양성 감소, 사막화 확산으로 발생하는 황사 등 복합적인 환경문제를 해결하고 자연환경 보전을 위해 세계 3대 환경협약16)을 체결하는 등 국제사회의 공동 대응 요구가 지속되고 있다. 이와 함께 전 세계적으로 신·재생 에너지 산업지원이 확대되고 환경 규제가 강화되고 있어, 기존 환경기술 및 환경산업으로는 새로운 환경변화에 적절히 대응하기 어려운 실정이다. 이를 극복하기 위해 환경융합 신기술(환경기술(ET), 생명기술(BT), 정보기술(IT) 및 나노기술(NT) 융합) 개발 촉진 및 환경바이오산업 분야 활성화에 대한 중요성이 증가하고 있다.
나. 기술개발 연구 동향
(1) 세계 동향
1990년대 이후, 기후변화 및 환경오염으로 인한 생태계 훼손으로 인해 자연보전 및 복원의 중요성이 부각되었고, 토양과 지하수의 환경적 순기능에 대한 중요성이 강조되었다. 또한 생태계 및 토양․지하수는 한번 오염되면 개선이 어려울 뿐만 아니라, 복원하는데 많은 시간과 비용을 필요로 한다. 이런 문제들이 중요하게 부각되면서 이에 대응하기 위해 생태계 복원기술 개발, 토양․지하수 보전·복원을 위한 자연친화적 정화기술도 집중 개발되고 있다. 생명과학 발전에 따른 유전자변형생물체(LMO), 내분비계 장애물질의 환경(인체, 생태계) 위해성이 부각됨에 따라 새로운 화학물질에 대한 위해성 평가 연구도 중요성이 커지고 있다.
유럽의 청정에너지 기술정책 이슈와 아울러 미국, 일본, 독일 등은 폐자원 및 바이오매스 에너지화 정책을 강화하고 있다. 유럽연합은 2020년의 최종에너지 소비에서 차지하는 재생에너지 도입목표 의무달성(전력·열·수송의 3부분)을 위해 바이오매스 자원을 적극 활용하는 것을 지원 및 추진하고 있다. 미국 에너지부(DOE)는 2022년까지 선도 바이오연료를 연간 210억 갤런(약 137만BPD)제조 및 공급을 목표로 한 바이오리파이너리 프로젝트(Bio-refinery project)를 진행하고 있고, 중국은 2020년까지 신재생에너지를 전체 에너지 소비량의 15%까지 확대하겠다는 목표 하에 2008년에 생물연료(Biomass)에 대한 연구개발과 실증을 위해 2.9억 달러를 투자하였다. 이처럼 선진국들은 이미 국가 주도로 미래 국가 경쟁력 확보를 위해 융합기술에 대한 투자를 가속화하고 있으며 자국 산업의 경쟁력 확보차원에서 국제규모의 환경문제 대응기술 개발을 적극적으로 추진하고 있다.
또한 생물자원을 활용하여 환경을 복원하고 정화하기 위한 기술개발도 활발하게 진행되고 있다. 환경오염물질을 분해할 수 있는 세균 등 미생물에 대한 기능 연구를 통해 친환경 환경산업이 성장하고 있으며, 천적 생물종 연구를 통해 환경생태계 보전 기반도 강화되고 있다. 생물-생물간, 생물-무생물환경 간 상호작용 연구를 통해 훼손 환경‧생태계 복원 사업의 시장 규모도 점차 증대하고 있다.
(2) 국내 동향
우리나라의 환경기술 관련 연구개발은 1992년 6월에 수립된 ʻʻ선도기술 개발사업(G-7프로젝트)ʼʼ의 환경공학기술개발사업으로 시작되었고, 이를 통해 1994년부터 유해 화합물 생물정화 기술개발, 침출수의 생물학적 처리기술개발, 환경오염물질의 생물학적 검출기법개발 등 환경생명공학분야의 연구개발을 추진하였다. 이어 환경부는 2001년부터 2011년까지 ʻʻ차세대핵심환경기술 개발 사업 (이하 차세대사업)ʼʼ을 통해 환경생명공학 관련 연구개발을 지원하였다. 차세대사업 예산은 총 12,367억원(정부 출연금 8,791억원, 민간부담금 3,576억원)이였고 그중 환경생명공학기술 분야에 지원된 투자규모는 총 예산의 약 22%인 1,940억원을 차지했다.
2001년에서 2011년 사이 환경생명공학 관련 연구개발 과제는 생물정화 기술개발, 생태독성시험법 개발, 식물 추출물을 이용한 살충제 및 향균제 개발, 나노-효소 복합체 기반의 휴대용 잔류농약 검출용 바이오센서 개발 등이었다. 지금까지의(2013년 8월초 기준) 차세대사업의 생명공학관련 추진실적을 보면, 지식재산권 출원·등록 4,705건, 국내·국외 학술지 게재 4,666건 등의 과학적 성과를 달성하였다. 또한, 기술실시계약을 통해 1,709억원, 국내·외 공사수주 및 제품판매 3조 8,062억 원 등의 산업 경제적 성과를 보였다. 이후, 환경부는 2011년부터 ʻʻ차세대 에코이노베이션기술개발사업(이하 차세대 EI사업)ʼʼ을 시작하여 2020년까지 총 1조 5,530억 원을 투자할 계획이며, 그 중 총 예산의 20%이상을 환경생명공학기술 분야의 사업에 지원할 예정이다. 그간(2011년부터 2013년 8월초 기준) 차세대 EI사업을 통해 지식재산권 출원·등록 35건, 국내·국외 학술지 게재 36건의 성과를 내었다. 또한 환경융합신기술개발사업, 생활공감 환경보건기술개발사업, 폐자원 에너지화기술개발사업 및 토양·지하수오염방지 기술개발사업을 통해 다양한 환경생명공학기술 분야를 육성 하고 있다.
이처럼 여러 지원 사업을 통해 환경생명공학기술은 단순히 연구개발에 그치는 것이 아니라 고부가가치 창출을 이루고 있고 종래 환경기술의 경제성, 지속가능성 및 경쟁력 향상을 이루고 있다.
[표 3-1-15] 환경기술개발사업 관련 투자현황
(집계기준 : 2013년 8월초)
|
사업명 |
사업년도 |
전체 사업과제 |
전체 중 BT관련 과제 |
|||
|
과제수 |
국고지원금* (단위: 억원) |
과제수 |
국고지원금 (단위: 억원) |
% |
||
|
차세대사업 |
’01년~’10년 |
1,238 |
8,791 |
378 |
1,940 |
22 |
|
차세대EI사업 |
’11년~’20년 |
435 |
3,770 |
43 |
383 |
10 |
|
환경융합신기술 개발사업 |
’09년~ |
32 |
443 |
16 |
191 |
43 |
|
생활공감 환경보건 기술개발사업 |
’12년~’21년 |
28 |
97 |
2 |
4 |
4 |
|
폐자원 에너지화 기술개발사업 |
’13년~’20년 |
2 |
18 |
- |
- |
- |
|
토양․지하수오염방지기술개발사업 |
’08년~’17년 |
120 |
759 |
9 |
132 |
17 |
* 집계기준으로 완료 또는 진행중인 사업과제의 총 지원금
- 폐자원 에너지화 기술개발사업에서는 2013년 10월부터 BT과제 2건 추진예정
○ 폐식물성오일 기반 바이오 탄성체의 제조기술 개발 - 연구기간 : 2009년 6월~2014년 5월 - 연구목표 : 고분자물질과 폐식물성 오일을 결합시켜 기존 석유 고분자재료를 대체할 수 있는 바이오 탄성체(elastomer) 제조 기술 개발 ○ 비스페놀A 대체 친환경 폴리카보네이트 소재 개발 - 연구기간 : 2011년 5월~2014년 3월 - 연구목표 : Bio-derived Diol계 단량체의 합성 및 상용화 기술을 확보하고, 이의 적용을 통하여 환경 위해 물질인 비스페놀A의 사용량을 저감시킨 환경 친화적인 폴리카보네이트 수지의 제조 및 양산화 기술의 개발 ○ 폐 작물부산물을 이용한 젖산 및 생분해성 수지 대량 생산기술 개발 - 연구기간 : 2011년 5월~2014년 3월 - 연구목표 : 친환경 바이오매스를 이용하여 선도기업 수준의 PLA 중합기술을 개발하고, 이를 이용하여 자동차 내장재용 부품에 적용 가능한 streocomplex-PLA 컴퍼지트 기술 개발
(2) 환경오염제어 및 관리
신환경오염물질(미량 유해 물질 포함)에 대한 새로운 환경모니터링 기술17)이 요구됨에 따라 세포 칩 개발 등 세포내 유해성 관리 모니터링까지 그 범위가 확대되고 있다. NT, IT가 융합한 환경 바이오모니터링에 의해 나노수준의 환경문제 기작 규명이 가능해 지고 있다. 환경오염제어 및 관리기술에는 식· 생물 정화기술, 환경오염측정 기술, 생태계복원 기술 등이 포함된다. 현재 수행하고 있는 연구과제의 예는 아래와 같다.
|
○ 실제 환경에서 인간에 대한 VOCs 노출 사전예측 생체 지표 개발 및 활용 연구 |
|
- 연구기간 : 2010년 6월~2015년 5월 - 연구목표 : 유전체 분석기법과 단백질 지표를 활용하여 환경위해물질에 대한 인체 위해성 예측 시스템 개발 |
|
○ 하천 및 습지 등 생태계복원을 위한 생물소재 개발 |
|
- 연구기간 : 2011년 5월~2016년 3월 - 연구목표 : 하천 및 습지의 식물생장 조절활성 미생물 제재를 개발하여 훼손된 하천 및 습지에 적용하여 친환경적으로 생태계를 관리·보호하며, 훼손된 생태환경을 복원하는데 적용할 수 있는 방법 개발 |
|
○ 매몰지 오염토양 모니터링 및 환경친화형 정화처리기술 개발 |
|
- 연구기간 : 2012년 4월~2017년 3월 - 연구목표 : 매몰지 오염토양에 적용 가능한 목본식물, black carbon 및 토양미생물의 유기오염원 처리효율 검증 및 최적화를 통해 환경친화형 토양 정화처리기술 개발 |
|
○ 알레르기 질환 환경유해인자 통합 검출 센서 개발 |
|
- 연구기간 : 2013년 4월~2015년 3월 - 연구목표 : 알레르기질환 유발 오염인자에 대한 나노바이오센서 개발 및 최적화, 나노스케일 트랜스듀서 어레이를 이용한 2종 이상의 진균 검출 센서 개발, 상시모니터링 시스템 개발 및 환경진단 시스템 개발 |
|
○ 슬러지 감량 및 바이오가스 생산 증대를 위한 나노기술 응용 장치 개발 |
|
- 연구기간 : 2013년 5월~2015년 3월 - 연구목표 : 나노 융합 기술을 이용한 소화조 효율개선 및 에너지 생산 증대 장치 개발, 가용화 실증설비 최적 운전조건 도출, 상용화 설비 설계기술 확보 |
|
○ 열가용화 시스템을 기반으로 한 친환경 음폐수 처리기술의 실증사업화 |
|
- 연구기간 : 2013년 5월~2015년 3월 - 연구목표 : 음폐수 자원화시설에서의 효율적인 오염부하량 저감을 위해 열가용화 기술을 도입한 시스템과 고효율혐기성소화조에 대한 구축 및 개발 |
(3) 폐자원 에너지화
폐자원 에너지화 기술은 가연성 폐기물, 유기성 폐기물, 매립가스, 산업 폐가스 등을 열화학적 또는 생물학적 방법으로 열, 전력, 수송연료 등으로 에너지화 하거나 폐화학제품의 화학전환에 의해 화학원료로 전환하는 기술이다. 혐기성 폐수 처리과정에서 발생하는 바이오가스는 대체에너지로 사용하는 연구와 친환경적인 바이오소재를 이용하여 금속을 제거 회수하는 연구가 증가 하고 있는데 이는 촉매 사용량을 최소화하고 오염물질은 효과적으로 제어할 수 있는 기술이다. 뿐만 아니라 회수된 자원을 다시 ET, IT, NT 분야에 활용하여 고부가가치 소재를 만들어 낼 수 있다. 현재 수행하고 있는 연구과제의 예는 아래와 같다.
|
○ 재생 귀금속 기반 나노입자 제조를 위한 바이오 융합기술 개발 |
|
- 연구기간 : 2009년 6월~2014년 5월 - 연구목표 : 바이오물질을 이용하여 금속 폐액으로부터 나노금속입자 제조기술 개발 |
|
○ NT기반 촉매공정에 의한 폐바이오매스의 저탄소형 고급 연료화 전환기술 개발 |
|
- 연구기간 : 2009년 6월~2014년 5월 - 연구목표 : 폐바이오매스로부터 단일공정의 직접 전환반응을 통해 퓨란계 화합물 제조기술 개발 |
|
○ 하이브리드 공정을 이용한 음식물 쓰레기의 유용자원화 |
|
- 연구기간 : 2010년 6월~2015년 5월 - 연구목표 : 이온성 액체 추출공정을 이용하여 음식물 쓰레기로부터 바이오 디젤 생산 |
|
○ 목질계 폐자원을 원료로 한 유기산 발효산물 기반 석유대체원료 생산 공정기술 개발 |
|
- 연구기간 : 2010년 6월~2015년 5월 - 연구목표 : 폐바이오매스로부터 생물학적 공정으로 생산된 유기산의 화학촉매 전환반응을 통하여 바이오연료(혼합알코올) 제조 기술 개발 |
|
○ 유기성폐자원 하이브리드 바이오가스화 기술개발 |
|
- 연구기간 : 2013년 10월~2019년 5월 - 연구목표 : 음식물폐기물(음폐수 포함), 축산분뇨 등 다양한 유기성폐자원의 처리 및 고효율 바이오가스 생산을 위한 하이브리드 혐기소화 플랜트 개발 및 핵심 바이오가스 미생물기반 제어모델 시스템 패키지화 |
(4) 생물자원을 활용한 환경복원·정화
기후변화에 따른 과학적이고 장기적인 한반도 생태계 변화 관리체계와 생물다양성 보전대책 수립을 위해 2004년부터 최근까지 ʻʻ국가 장기 생태 연구사업ʼʼ 및 ʻʻ생물자원 보존 종합대책 사업ʼʼ을 통해 생태변화 모니터링, 생태계 변화 예측모델 개발 및 영향평가를 수행하였고, 생태계 위해 외래생물종의 피해 저감 관리 강화 및 국내 고유생태계를 보호하기 위해 ʻʻ생물자원 발굴·분류 연구사업ʼʼ을 통해 자생생물과 고유종, 그리고 해외 생물자원의 발굴·확보 관리 인프라를 구축하였다. 근래에는 한반도 생물종/생물자원 다양성 관리 및 생물자원 산업화 육성기반 마련을 위해 유용생물자원 기능별 실용화기술개발에 투자하고 있다. 현재 수행하고 있는 연구과제의 예는 아래와 같다.
|
○ 조류 생물소재 산업화 |
|
- 연구기간 : 2011년 5월~2016년 3월 - 연구목표 : 미세조류를 이용한 항산화 물질 개발 및 항산화 기작 유전자를 이용한 Biosensor 개발, 홍조류 섬유 개발에 이용 가능한 50종류의 생물 자원 탐색 및 Haplotype 분석, Agar와 홍조류 섬유를 이용하여 친환경적이고, 기능성과 인체 친화성을 높인 생분해성 Agar 마스크 팩을 개발 |
|
○ 고부가가치 토종 난과 식물의 이용기술개발 및 산업화 |
|
- 연구기간 : 2011년 5월~2016년 3월 - 연구목표 : 우리나라 토종 난과 식물종을 대상으로 부가가치를 창출할 수 있는 신품종 개발, 멸종위기 난과 식물종의 대량증식기술을 개발하여 생태계 복원, 이들 난과 자원으로부터 향장소재를 개발하여 제품화하고, 유용 난과 식물 이용기반 구축 |
|
○ 유용 생물자원 첨단 탐색 기술 개발 |
|
- 연구기간 : 2011년 5월~2016년 3월 - 연구목표 : 자생 난과식물과 기능성 소재로서 중요한 생리활성물질 식물자원을 대상으로 유용 생물자원의 첨단 사이버 탐색․ 동정 시스템 개발 |
|
○ 도심하천 양서류 생태친화적 서식지조성 기술개발 |
|
- 연구기간 : 2013년 5월~2016년 3월 - 연구목표 : 실험실 수준의 양서류 종 특이적 사육기술 개발하며, 연중 안정적으로 개체를 사육하고 배란유도할 수 있는 기술을 개발, 연구대상종의 실제 서식지를 모방한 독립형 인공서식지 조성기술 개발, 양서류 야외 입식을 목적으로 인공증식하며, 이를 위한 대량 인공증식 및 사육기술 개발, 질병분석 및 유전적 다양성을 고려한 야외 입식 수행, VIE표지방법을 이용한 적응도모니터링 수행 |
라. 향후 추진방향
환경기술 개발은 현안인 환경오염문제를 해결하는 것뿐만 아니라 점증하는 국제 무역환경규제에 효과적으로 대응하기 위해서도 그 중요성이 더욱 증대되고 있다. 환경기술 개발이 국가 경쟁력 제고에 필수요소가 되고 있는 것이다. 특히 다변화되고 복잡한 환경시장에서의 경쟁력을 확보하기 위해서 국내 환경공학기술 수준을 선진국 대비 80%까지 제고하는 한편, 신 환경융합기술 개발에 적극적으로 투자해야 한다. 이에 환경부는 차세대 에코이노베이션 기술개발 사업 내 ET-BT 융합기술 지원 및 생명공학 분야 강화를 위한 신규과제(RFP)도출 및 투자규모를 확대할 것이고, 생명공학 원천기술 후속으로 사업화를 위한 실용연구를 지원할 계획이다. 또한 기존 토양·지하수 실용화 연구 지속 추진 및 기존 ET-BT 융합 원천기술 분야 신규과제 지원을 확대할 예정이다.
8. 해양수산분야 생명공학 육성 정책
가. 개요
해양수산생명공학기술(Marine Biotechnology, MBT)란 ʻ해양 생물체 내에서 일어나는 현상, 구조 및 기능을 이해하고, 그로부터 얻어진 지식을 활용하여 제품을 생산하거나 서비스를 제공함으로써 산업 및 인류복지 증진에 응용하는 과학기술ʼ을 총칭한다.
(1) 해양수산생명자원의 가치
해양수산생명공학기술의 원천이라 할 수 있는 해양수산생명자원은 이용 잠재력이 큰 차세대 신물질 개발의 보루이다. 해양은 지구 표면적의 70%정도를 차지하고 있으며, 지구 생물종의 80% 정도가 서식하고 있다. 한편 매년 지구상에서 생산되는 2,000억 톤의 광합성량 중 90%가 해양에서 이루어지고 있다. 갯벌 및 연안에서부터 심해, 열대, 한대에 이르기까지 다양한 해양공간에 광범위하게 분포하는 해양생물들의 가치는 기후조절, 오염물질 자정능력만 계산되어도 육상의 2배인 연간 26조 달러에 이르는 경제적 가치를 지니는 것으로 추정된다.
해양생물은 육지에서와는 달리 높은 수압과 염도, 저온에 적응하고 진화하며 살아 왔기 때문에 육상생물에서 발견할 수 없는 특이한 대사물질 및 생리활성 물질 등을 생산한다. 이러한 해양생물의 유용물질은 식품, 의약 및 화학 등의 분야에서 관심을 받으며, 해양생물은 생명공학의 주요 자원으로 급부상하고 있다. 특히 육상생명자원의 경우 이미 기작이 밝혀져 있는 경우가 대부분이고, 대다수 선진국들이 특허를 보유하고 있는 경우가 많다. 그러나 해양수산생명자원의 경우 아직 국제적으로 연구가 미진한 분야이므로 우리의 노력 여하에 따라 원천기술 확보의 가능성이 높은 분야이다. 산업화 측면에서도 해양수산생명자원은 가능성이 매우 높은 분야이다. 일반적으로 육상생명자원의 산업소재화 성공률은 1/13,000 정도이나, 해양수산생명자원의 산업소재화 성공률은 1/6000 정도로 성공률이 두배 정도 높게 나타나고 있다.
해양수산생명자원의 가치가 높아짐에 따라 해양수산생명자원을 확보하려는 국가간 경쟁이 치열해지고 있다. 더욱이 나고야의정서 채택으로 해양생물에 대한 주권이 인정됨에 따라 유용 해양수산생명자원을 확보하려는 경쟁이 국제적으로 심화되고 있는 추세이다.
(2) 해양생명공학산업의 개요
해양생명공학산업은 해양생물체의 시스템, 구성성분, 과정 및 기능을 활용한 제품과 서비스를 생산하는 산업을 의미하며, 정보통신산업 이후 국가 경제성장의 핵심산업이 될 분야이다. 또한 고도성장의 잠재력을 가지고 향후 경제발전을 이끌 부가가치산업으로 기술·정보·지식 집약형 첨단산업이다.
해양생명공학분야는 특징적으로 해양천연물 또는 해양생물에서 기원한 의약재와 고분자물질, 화학소재 등을 생산하며, 원천기술 확보가 용이하여 독점적 물질특허권 확보가 가능하다. 또 유용신물질 발견률과 제품화 비율이 높으며 신제품 개발기간의 단축이 가능하고, 극한환경 미생물의 생체기능을 이용하기 위한 특수기술이 필요하다. 그리고 대량배양 등의 고유한 영역을 지닌다는 특징을 가지고 있다. 이러한 특징들은 해양생물자원을 활용하여 창출할 수 있는 분야의 다양성이 매우 높다는 것을 의미한다.
해양생명공학의 세부 분류군을 살펴보면 해양생명공학산업의 범위와 중요성을 알 수 있다. 해양생명과학기술은 다음과 같은 다섯 가지 응용산업 분야를 총칭하여 포함하고 있다.
[표 3-1-16] 해양생명공학 응용산업 분야
|
대분류 분야 |
세부 응용산업 분야 |
|
Health/Medicine |
항생제, 항산화제, 항암제, 항혈전제, 치매질환예방, 효소저해제 |
|
Energy |
바이오에탄올, 바이오부탄올, 바이오디젤, 바이오가솔린, 바이오수소, 바이오매스 |
|
Functional Life form |
해양식품, 미세조류, 저서동물, 어류, 해조류 |
|
Industrial Metarial |
고분자 바이오센서, 천연색소, 화장품, 바이오세라믹 |
|
Environment |
적조방제, 유류오염, 중금속 |
출처 : 한국해양과학기술진흥원. (2012). 해양생명공학사업 성과분석 및 미래예측을 통한 중장기 추진계획 수립 연구. p3.
해양생명공학의 중요성이 증가함에 따라 2006년 OECD는 ʻ생명과학에 의한 새로운 발견들이 관련 제품의 보급이나 서비스의 향상을 통하여 인류에 편익을 제공하는 다양한 경제활동을 포괄하는 새로운 개념ʼ으로 IT발전에 버금가는 효과를 갖게 될 것으로 전망했다. 또한 다가오는 미래를 ʻ바이오경제(Bio-Economy)시대ʼ로 선언했으며, OECD 생명공학분과에서는 2011년부터 주요 논의 주제로 ʻʻ해양생명공학ʼʼ을 다루고 있다.

[그림 3-1-8] 해양생물의 적용분야
(3) 수산생명공학산업의 개요
수산생명공학기술은 수산생물의 현상 및 기능을 이해하고 이를 활용함으로써 수산업의 가치 창출에 이용되는 과학기술이다. 수산생명공학기술이 추구하는 목적은 체계적으로 수집·관리된 수산생명자원을 활용하여 수산업을 고부가가치 생명산업으로 육성하는 것이다. 기술의 범위는 원천기반기술, 식량·식품자원 개발기술, 첨단 수산소재 개발기술이며, 원천기반기술에는 수산유전자원 보존 및 이용 연구, 수산생물 유전체 연구, 식량·식품자원 개발기술에는 수산생물 육종연구, 수산생물 형질전환 연구, 첨단 수산소재개발기술에는 친환경 수산 바이오소재 개발, 수산생물 유래 고부가가치 기능성 물질 개발이 포함된다. 최근 수산생명자원의 중요성이 증대되면서 자국에서 중요한 수산생물 유전체 해독, 특수 환경에 서식하는 수산생물에서 바이오 소재 개발 등 수산생물자원 기반의 새로운 연구 영역이 가속화될 것으로 예상된다.
나. 주요국의 해양수산생명공학 육성 동향
(1) 미국
미국은 세계 해양바이오산업의 약45%를 점유하고 있는 세계 최고의 해양바이오 강국이다. 미국은 해양정책(Our Nation and Sea, 1969) 수립을 통하여 해양과학기술 개발에 주력하였으며, An Ocean Blueprint for the 21st Century(2004)를 새로운 국가 해양정책으로 채택하여 7개 중점과제를 선정하여 기술개발을 추진하고 있다.
미국정부의 해양바이오 관련 연구 및 기술개발을 위한 프로그램은 해양대기청(NOAA), (미)국립과학재단(NSF)에서 중점적으로 추진하고 있다. NOAA는 해양 및 수산과학, NSF는 기초 해양과학 기술 등을 중점적으로 지원하고 있다. NOAA의 경우 대표적 해양생명공학 정책인 씨그랜트 프로그램(Sea grant program)을 통해 200개 이상의 대학과 기관에 해양생명공학 프로젝트 자금을 지원하고 있다. 전 세계 해양 미생물의 환경 유전체분석 프로젝트를 진행하고 있으며, 해양생명공학 분야의 벤처기업을 적극 육성하고 있다. 1천여건 이상의 해양신약물질 특허를 보유하고 있으며 활발한 산업화를 촉진하고 있다.
(2) 일본
일본은 해양생명공학 기술개발을 꾸준히 추진함으로써 해양생명공학 분야의 전통적인 강국으로 자리매김하고 있다. 해양관련 정책을 총괄하는 종합해양정책본부의 ʻʻ제2차 해양기본계획(2013~2017)ʼʼ의 경우 해양바이오를 활용한 산업 창출을 강조하고 있다. 해양 미이용 바이오매스자원의 활용을 도모하기 위한 미이용 바이오매스자원 수집을 추진하고, 이를 활용한 산업적 연구개발사업을 실시한다. 특히 해저 미생물권에 대해 미지의 생명기능을 탐색하고 유효이용으로 이어가는 것을 목표로 한 연구개발을 실시한다.
대표적 연구기관인 해양과학기술연구센터(JAMSTEC)와 해양생명공학연구소(MBI) 등을 중심으로 산·학·연의 합동연구가 활발히 진행되고 있다. 특히 JAMSTEC은 심해미생물 분야를 중점분야로 선정하고 최근 10년간 5천여억원을 지원하여 심해미생물 분야에서 세계 최고의 위치를 선점하고 있다.
(3) 유럽연합
유럽연합 내에서는 기본적으로 회원국 간의 경쟁과 화합이 공존하고 있으며, 해양생명공학에 있어서 선두국인 미국과 일본을 추격하는 것을 목표로 정책을 추진하고 있다. 미국경제를 추격하기 위해 마련한 신 리스본전략(2005)을 실현하기 위한 ʻ제7차 프레임워크 프로그램(FP7)에서 중점 육성분야에 해양바이오 관련기술을 포함시키고 있다. 유럽연합집행위원회(European Commission, EC)는 성장과 고용창출을 위한 해양부문의제로서 제출한 청색성장보고서(2012)ʼ 에서는 유럽의 해양산업 5대 중점육성분야로 해양생명공학을 선정하여 관련연구의 중점지원을 추진하고 있다.
국가별 해양생명공학 정책을 살펴보면 영국은 ʻBioscience 2015ʼ 장기발전계획에 맞추어 연도별로 정부의 강력한 지원을 통해 해양바이오 분야를 육성하고 있으며, 독일은 ʻBioIndurtry 2021ʼ을 추진함으로써 산·학·연 협력을 통해 해양생명공학 분야의 산업기반을 확대하고자 노력하고 있다. 프랑스는 해양연구소(IFREMER)의 주도로 심해 생태계 조사 및 심해열수 조사를 진행하였으며, 미생물의 분리와 효소류, 다당류 등을 미생물에서 분리하여 유용 물질을 발효 생산하기 위한 연구를 중점적으로 추진하고 있다.
(4) 노르웨이
노르웨이는 풍부한 해양생물 다양성을 가진 국가이며, 세계적인 수산업 강국으로 해양생명공학 분야의 높은 잠재력을 가지고 있는 국가이다. 노르웨이는 국제적으로 성공할 수 있는 기회를 가진 분야에 대해서 투자정책 및 연구정책을 수립하여 추진하고 있는데, 정부차원에서 해양산업을 미래 선도산업으로 지원하고 있다. 해양자원, 단백질, 신약, 식품 등 7개 센터에 연간 300억원 이상의 R&D 예산을 투입하고 있다. 해양소재를 활용한 DHA 및 EPA를 의학소재로 개발하여 연간 2천억원 이상의 매출을 달성하고 있다.
(5) 중국
중국은 식량자원 확보에서 시작하여 연해→근해→대양(심해, 극지)로의 단계적 해양진출을 모색하여 왔다. 중국 해양정책의 특징은 철저한 실용주의로 정책, 제도, 투자 등이 모두 해양산업의 육성에 직접적으로 관여하고 있다. 관련된 정책으로는 해양생물로부터 신물질 개발, 양식기술 개발, 해양생태환경 보호기술, 유해적조 발생 방지, 연근해 해양생태계 및 생물자원의 지속적 이용을 목표로 하는 해양과학기술발전계획(2006~2020년)이 있다.
(6) 주요국의 수산생명공학 육성 동향
미국, 일본, 중국, 노르웨이 등 국가들은 수산생명공학기술의 중요성을 인식하여 수산생명산업을 선점하기 위해 적극적인 투자 확대 정책으로 차세대 성장동력 창출을 추진하고 있으며, 가시적인 산업화 결과 도출을 위해 신품종 개발, 신소재, 신기능성 물질 개발 등의 분야에 핵심기술 개발에 주력하고 있다. 최근에는 기초 기술 개발을 위해 주요 수산생물의 유전체 연구 등도 수행하고 있다. 각 국가별 수산생명공학기술의 연구동향은(표3-1-16)과 같다.
[표 3-1-17] 국외 수산생명공학기술 연구동향
|
국가 |
주요 연구내용 |
|
미국 |
○ 국가과학재단(NSF) - 수산생물 오믹스 분석을 통한 IT․BT 융합기술 및 신소재 개발 ○ NOAA의 Sea Grant 사업 - 무척추생물과 해면생물에서 수해양천연물 추출 - 담수어류(차넬메기등), 굴, 전복, 새우 선발육종 |
|
일본 |
○ 농림수산성 산하 수산청과 수산연구종합센터(FRA) - 주요 수산생물(참다랑어 등) 유전체 해독 연구 ○도립연구소, 대학 등 연구연합그룹 - 수산생물(참돔, 비단잉어, 전복, 굴 등) 육종연구 |
|
중국 |
○ 중국수산과학연구원(CAFS) - 집단유전, 육종기술개발, 바이오 소재 개발 ○ 중국과학원(CAS) - 고속성장 형질전환 잉어 개발 ○ 중국게놈연구소(CGI) - 수산생물 유전체 해독 연구 |
|
유럽 |
○ EU 공동체 프로그램(ECMB) - 연어 및 틸라피아 육종 기술 개발 및 산업화(노르웨이) - 틸라피아 전수컷 집단 개발 (영국) - Halibut, turbot, 대서양 대구 등의 육종 연구(유럽연합) ○ 포르투칼 해양수산연구소(IPIMAR) - 양식업 관련 생명공학연구 |
|
호주 |
○ 호주연방과학산업연구기구(CSIRO) - 집단유전, 새우와 전복 선발 육종 - 바이오 소재 개발, 유전체 연구 |
|
캐나다 |
○ 국가연구위원회(NRC) 산하연구소 Institute for Marine Bioscience - 유전체 연구, 바이오 소재 개발 |
다. 해양수산생명공학사업 현황
(1) 세계 해양생명공학 현황
세계 해양산업 전체 규모와 비교하여 볼 때 해양생명공학 산업 시장의 상대규모는 아직 미미한 수준에 불과하다. 2005년 발간된 Douglas-Westwood에서 발간한 보고서에 의하면 2005년~2009년 사이의 해양생명공학 시장 총 가치는 120억 유로에 불과하나, 규모가 작고 성장초기단계인 만큼 높은 성장률을 보여 성장잠재력이 높은 산업중의 하나이다.
(단위 : 백만유로)

출처 : Douglas-Westwood Limited, Marine industries global market analysis, 2005
[그림 3-1-9] 세계 해양산업 규모(2005년~2009년)
또한 해양생명공학은 현재 산업발전상 초창기로 전체 생명공학 시장에서 차지하는 비중은 2009년을 기준으로 약2.3%로 매우 미약한 수준이다. 그럼에도 불구하고 해양생명공학 시장은 꾸준한 성장을 통해 시장규모가 확대되어 가고 있다.
해양생명공학의 세계 시장규모에 대한 추정치는 조사기관에 따라 다양한 견해를 보이고 있는데 이는 해양생명공학 산업에 대한 정의의 차이에서 기인하는 것으로 추정된다. 과거 해양생명공학 세계 시장규모를 추정한 연구결과를 살펴보면 민간 시장조사 기관인 biz Acumen에서 2009년 발간한 Marine Biotechnology(worldwide trend, 2009)에서는 해양생명공학 세계시장은 연평균 4.28%의 성장세를 보여 2012년 기준으로 약 36억 달러의 글로벌 시장 규모를 보일 것으로 예측하였다. 이 기관의 보고서에 따르면 해양생명공학 산업 시장의 50%는 생체활성물질(bioactive substance) 시장으로 추정되고 있다(호르몬, 효소, 억제제, 해양천연물신약 등). 한편 최근의 국내 한국해양과학기술원의 연구결과에 따르면 2010년 기준의 세계 해양생명공학 산업시장 규모는 약 219.7억 달러 수준이며, 2024년에는 769억 달러 수준으로 증가할 것으로 예상된다(Ocean and Polar Research, Vol.35, No.2, 2013.6).
[표 3-1-18] 지역별 해양생명공학 세계시장(GIA 추정)
(단위 : 백만불, %)
|
지 역 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
2011년 |
2012년 |
성장율 |
|
미국 외 |
1,979.4 (67.6) |
2,054.0 (67.5) |
2,154.4 (67.7) |
2,256.5 (67.9) |
2,361.7 (68.2) |
2,466.9 (68.4) |
2,575.0 (68.7) |
39.2 |
|
미국 |
947.9 (32.4) |
987.0 (32.5) |
1,025.9 (32.3) |
1,064.4 (32.1) |
1,102.3 (31.8) |
1,139.0 (31.6) |
1,175.4 (31.3) |
29.5 |
|
전체시장 |
2,927.3 |
3,041.0 |
3,180.3 |
3,320.9 |
3,463.9 |
3,605.9 |
3,750.4 |
36.0 |
|
한국 |
44.3 (1.5) |
49.1 (1.6) |
52.9 (1.7) |
56.9 (1.7) |
62.9 (1.8) |
69.1 (1.9) |
73.7 (2.0) |
89.0 |
출처 : Global Industry Analysts, a global strategic budiness report : marine biotechnology, 2008
주) ( )안의 값은 연도별 총 세계시장규모에서 지역이 차지하는 비중
biz Acumen과 유사한 형태로 해양생명공학 산업분야의 세계 시장규모를 측정하고 있는 기관으로는 GIA(Global Industry Analysts)가 있다. 이 기관에서는 2008년 해양생명공학분야의 글로벌 전략 비즈니스 레포트(A Global Strategic Business Report : Marine Biotechnology, 2008)를 통해 세계 해양생명공학 시장에서 우리나라의 점유율을 추정하고 있다. GIA의 추정에서도 biz Acumen과 유사하게 2012년 세계 해양생명공학 산업영역의 시장규모를 36억달러 규모로 추정하였다. 미국의 산업규모는 점차 감소하고 있는 추세로 추정되었으며, 2012년 기준으로 전체 시장의 약 31.3%를 점유할 것으로 추정하고 있다.
GIA의 추정에 따르면, 한국은 2012년 기준으로 세계 산업시장의 약 2.0% 정도를 점유할 것으로 추정하였으며, 2005년~2012년의 7년 사이 약 1.9배의 시장 규모가 증가할 것으로 전망하고 있다. 우리나라의 해양생명공학 시장 성장률은 전 세계에 비해 비약적으로 높아지고 있으며, 전 세계 대비 약 53% 높은 것으로 나타나고 있다.
(2) 국내 해양생명공학 정책 현황
해양수산부에서는 2004년 ʻ마린바이오21 사업(2004~2013)ʼ을 시작으로 해양생명공학분야를 꾸준히 육성하고 있다. 또한 2008년 ʻ해양생명공학육성 기본계획(2008~2016)ʼ을 수립하였으며, 2009년 ʻ해양바이오 연구개발 활성화 대책ʼ을 수립하여 장기적인 관점에서 해양생명공학을 육성해 나가고 있다. 한편 2012년 「해양생명자원의 보존·관리 및 이용 등에 관한 법률」을 제정하여 해양생명자원을 통한 해양생명공학의 체계적 육성을 추진하고 있다.
|
|
|
해양수산부 |
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
해양생명자원 확보 및 기초인프라 구축 |
|
해양생명공학 기초 및 산업화 기술개발 |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
기탁 등록 기관 |
|
해외생물자원연구 |
|
통합DB구축 |
|
산업 신소재 |
|
바이오 에너지 |
|
분자 유전체 |
|
천연물 신약 |
|
바이오 프로세스 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Marine Bio 21 사업 |
|
|||||||||||||||||||||||
[그림 3-1-10] 해양생명공학사업 추진체계
2004년부터 현재까지 총 1,591억원을 해양생명공학 R&D사업에 투자하였다. 이중 276억원은 ʻ생명자원 확보 및 기초인프라 구축사업ʼ에 투자하였고, 1,315억원은 ʻ해양생명공학 기초 및 산업화 기술 개발ʼ에 투자하였다. 이러한 10년간은 투자를 통해 해양생명공학 분야에서 많은 성과를 이룰 수 있었다. 우선, 국내외의 해양생명자원 15,000여종 100,000여점을 발굴하여 해양생명공학기술의 소재를 확보하였고, 다양한 분야에서 SCI 논문 1,008편, 특허 등록 224건(국내 175건, 국외 49건), 기술이전 20건을 달성하였다. 주요 성과로는 홍합 유래 의학용 접착소재 개발, 신약 후보물질 개발, 미세조류를 이용한 바이오디젤 생산기술개발, 해양 고세균을 이용한 바이오수소 생산기술개발 등이 있다.
(3) 국내 수산생명공학 정책 현황
수산생명공학연구는 해양수산부 국립수산과학원에서 2004년부터 국가 R&D 사업으로 수행되고 있으며, 예산은 2012년 36억, 2013년 38억원(표 3-1-18)으로, 해양생명공학기술개발사업(230억)의 16%수준에 불과하다. 주요 연구내용은 수산 유전자원의 분석·보존 및 활용, 수산생물 유전체 및 기능 연구, 수산 바이오 소재 개발, 육종기술 개발, 형질전환생물의 안전관리 기술 개발 및 심사이다. 최근 3년간 국내외 총 88건의 논문을 게재하였고, 특허도 25건을 출원하고 이중 10건을 등록하여 매년 논문과 특허 건수가 증가하고 있다. 대학 등에서는 해양수산부의 수산실용화기술개발사업을 통하여 수산생명공학 연구를 수행하고 있다.
[표 3-1-19] 수산생명공학기술사업 투자실적
(단위 : 백만원)
|
사업명 |
2012년 |
2013년 |
|
수산업생명공학연구 |
3,685 |
3,887 |
라. 추진방향 및 발전과제
해양바이오 산업은 전 세계적으로 신생산업 분야이다. 그리고 해양바이오 산업영역은 대표적인 하이리스크 하이리턴(High Risk, High Return) 분야이다. 따라서 이윤추구를 근본 목적으로 하는 기업에 R&D 투자를 맡겨둘 경우 필연적으로 과소공급에 따른 시장실패가 예상된다는 한계점이 존재한다. 그러나 해양바이오 산업은 미래 성장동력 산업으로 미래 우리나라의 경쟁력 제고를 위해 반드시 필요한 산업이다. 그리고 현재 해양바이오 산업은 초기 단계에 있기 때문에 기초원천기술 분야에 대한 투자가 무엇보다 필요한 시점이다. 따라서 국가 차원의 집중적인 육성 및 지원이 절실하다. 또한 UN해양법, 나고야의정서 등 국제적으로 생명자원 이용제한 추세에 따라 국내외 해양생물자원 확보와 보존을 위한 국가 주도의 체계적인 사업 추진이 필요할 것으로 전망된다.
해양수산부에서는 2004년 시작되었던 ʻ마린바이오21사업ʼ이 2013년을 끝으로 종료됨에 따라 이 사업의 성과를 계승하고, 새로운 해양생명공학 사업분야를 발굴하기 위한 ʻ차세대 해양생명공학 추진전략(2014~2023)ʼ을 수립하고 있다. 한편 해양생물에 관한 수집·연구 및 활용기반 구축 등의 업무를 전담할 해양생물자원관을 개관(2014년)하여 해양생명공학에 대한 체계적인 정책운영을 추진해나갈 계획이다.
이러한 정책들을 바탕으로 연간 4조원대의 해양생명공학산업 시장을 육성하고, 1만명의 취업효과를 창출할 계획이다. 현재 선진국의 70% 수준인 해양생명공학 기술수준을 90% 수준까지 끌어올릴 것이며, 세계 해양생명공학산업 시장 점유율을 현행 1.6%에서 5%까지 확대할 것이다. 이러한 성과들을 바탕으로 해양생명공학산업 세계 7대강국으로 도약해 나갈 것이다.
해양수산부는 해양생명공학사업 지원을 통해 해양바이오기업을 고부가가치 해양바이오산업체로 전환하며, 산·학·연의 연구체계를 강화하는 등 민간이 할 수 없는 다양한 공공분야의 투자와 인프라 구축을 적극적으로 주도하여 해양생명자원을 보존 및 활용하고, 해양생명공학산업이 활성화 될 수 있도록 지속적으로 지원하고 육성해 나갈 것이다.
9. 생명자원 분야의 육성 및 관리 정책
가. 개요
생명자원은 지구상에 존재하는 생물(동․식물, 미생물, 인간세포 등), 생물의 구성물(DNA, 유전체 등) 및 이들의 정보를 포함하는 것으로 생명자원의 구체적인 대상으로는 생물자원, 생물다양성, 생명정보(국가 생명자원 확보․관리 및 활용 마스터플랜, 2007.12.20 국과심 심의)가 있다.
자원의 종류는 미생물, 동물, 식물, 인체유래, 생물다양성, 생물정보로 구분되고 생명연구자원은 질병, 에너지, 환경, 농업, 식량 등 인류난제 해결은 물론 바이오 경제 창출을 위한 핵심 열쇠라고 볼 수 있다.
해외 동향으로는 미국이 1960년대부터 생명연구자원 관리를 위한 국가 차원의 체계를 마련하였다. NIH 산하 국립연구자원센터(NCRR, ʼ10년 예산 3조원)는 미국유전자은행(ATCC), Jackson Laboratory 등 세계적 자원 거점을 지원하고 있다. 유럽은 1970년대부터 역내 협력을 위한 지침 및 제도 수립에 노력을 기울이고 있다. 2011년 1월 바이오뱅킹·생물분자자원 연구 인프라사업(BBMRI) 착수 및 유럽생명정보네트워크(EBI), 유럽생물자원센터네트워크(EBRCN) 등을 통한 생명연구자원 및 정보 네트워크를 구축하였다. 일본의 경우는 2000년 초부터 세계 최고 수준의 생명연구자원 정비에 착수하였다. 2001년 이화학연구소 바이오자원센터를 설립하였으며(ʼ10년 412억원) 문부과학성은 2002년부터 내셔널 바이오리소스 프로젝트(NBRP)를 지원하고 있다(ʼ10년 181억원). 또한 2005년부터 범부처 차원의 생명과학 데이터베이스 정비 및 통합을 추진하고 있다(ʼ10년 100억원).
우리나라의 경우 2012년 총 투자액은 1,301.6억원이다. 미래부가 256.7억원(19.7%), 농식품부 199.9억원(15.4%), 산업부 210.3억원(16.2%), 복지부 111.1억원(8.5%), 환경부 175.5억원(13.5%), 해수부 348.2억원(26.7%) 순으로 투자되었다.
부처의 역할은 생명연구자원의 확보·관리 및 활용에 관한 법률 제6조에 따라 미래부가 생명연구자원 및 통합정보시스템 총괄하고, 교육부가 인력양성분야, 농식품부가 농업분야, 산업부가 산업분야, 복지부가 보건·의료분야, 환경부가 야생생물분야, 해수부가 해양·수산분야 생명연구자원을 담당하고 있다.
[표 3-1-20] 부처별/분야별 투자실적(2012년 성과 기준)
(단위 : 백만원)
|
부처명 |
생물자원 |
생물다양성 |
생명정보 |
소계 |
|
미래창조과학부 |
20,275 |
333 |
5,057 |
25,665 |
|
농림축산식품부 |
15,473 |
2,029 |
2,487 |
19,989 |
|
산업통상자원부 |
18,269 |
0 |
2,760 |
21,029 |
|
보건복지부 |
11,114 |
0 |
0 |
11,114 |
|
환경부 |
12,930 |
4,620 |
0 |
17,550 |
|
해양수산부 |
12,285 |
21,830 |
700 |
34,815 |
|
합계 |
90,346 |
28,812 |
11,004 |
130,162 |
※ 복지부는 식약처, 산업부는 중기청, 농식품부는 농진청, 산림청 포함
나. 생명연구자원 및 통합정보시스템 관리(미래부)
(1) 범부처 생명자원 총괄 관리 역할 강화
생명자원의 기본법 위상 확립, 나고야 의정서(ABS) 대응 체계 수립 등을 위한 ʻ생명연구자원의 확보·관리 및 활용에 관한 법률ʼ 개정을 통해 생명자원의 총괄 관리 역할 강화 추진하는 한편 목표 지향적 바이오 인프라 확보 및 산학연 지원체제 강화를 위한 범부처 통합 생명자원 인프라 지원 체계를 구축할 방침이다.
생명연구자원은 국가의 생존과 번영을 위해 필수적인 연구소재로서 ʻʻ생명공학연구의 기반이 되는 자원으로서 산업적으로 유용한 동물, 식물, 미생물, 인체유래 연구자원등 생물체의 실물(實物)과 정보ʼʼ를 의미한다(생명연구자원의 확보·관리 및 활용에 관한 법률 제2조제1항, 2009. 11 시행).
(2) 생명연구자원의 발굴·확보 및 활용 확대
기 확보된 생명연구자원의 고품질화를 통한 활용성을 극대화하여 가치를 제고하고 가치제고된 생명자원의 산업적 활용지원을 통한 바이오산업 경쟁력 강화 및 신규 일자리 창출을 유도할 것이다.
|
자원 확보/보존 |
산업적 활용을 위한 미생물자원 가치제고 |
연구용 활용 |
|
<미래부> ∙바이오의료기술개발사업 ∙KRIBB주요사업 |
공백 영역
- 기확보 자원의 산업적 활용을 위한 미생물 자원 가치제고
- 가치제고된 미생물 자원의 산학연 공급 |
∙타부처 장기대형사업 |
|
<타부처> ∙미생물자원 특성평가 (농식품부) - 분류학적 특성 평가 및 보존/관리 중점 ∙생물자원 활용지원 기반 구축(환경부) - 활용기반 구축으로 자원의 보존/관리 집중 |
산업용 활용 |
|
|
∙의료 ∙바이오화학 ∙환경 ∙에너지 ∙식품소재 등 |
[그림 3-1-11] 미래부 생명자원의 발굴․확보 및 활용 확대
또한 미래유망 생명자원 및 융복합 연구소재에 대한 전망분석을 통해 국가 전략형 중점자원을 선택·발굴하는 등 전략적 생명연구자원의 발굴·확보에 중점을 둘 예정이다. 마지막으로 생명연구자원 관리·인프라 구축에 있어서 융복합 바이오 연구소재 개발을 위한 생명자원 응용기술 및 전문인력양성 지원 프로그램을 구축하고, 빅데이터 기반 데이터 분석기술, 진단기술 지원 인프라 구축을 통한 맞춤의료, 산업지원 등 목적형 수요에 기반을 둔 정보 지원 인프라를 창출하는데 지원할 방침이다.
(3) 국제협력강화
국제협력에 있어서는 전략적 해외 생명자원 및 연구소재 확보를 위한 정보분석 및 기획기능을 강화하고 지역별 거점 구축 및 범부처적 활용 강화 등 이익공유 모델을 개발하는 한편 국제 컨소시엄 활동을 활성화 하는 등 해외 생명자원 확보를 위한 국제협력을 강화할 방침이다. 또한 주요 선진국과의 협력을 통한 핵심 고부가가치 자원을 확보하는데 주력할 방침이다.
다. 농업분야의 육성 및 관리정책(농식품부)
농업 유전자원은 신품종 개발, 신물질 탐색 등에 활용되는 등 생명산업의 기본소재로 그 중요성이 증대되고 있다. 이에 국가 차원의 농업 유전자원 이용활성화 등을 위해『농업유전자원 보존·관리 및 이용 활성화를 위한 기본계획』을 수립하였고(ʼ09년.8월), 국내외 유전자원을 효율적으로 수집·보존·활용할 수 있는 종합관리체계를 구축하여 2018년까지 ʻʻ세계 5대 유전자원 강국 실현ʼʼ을 위해 노력할 것이다.
또한 농수산생명자원을 체계적으로 관리하기 위한 조사·등재·분양에 관한 내용, 무분별한 해외반출 방지를 위한 취득·해외반출 허가, 농수산생명산업의 발전을 위한 지원 내용 등을 보완하여 『농업유전자원의 보존·관리 및 이용에 관한 법률』을 『농수산생명자원의 보존·관리 및 이용에 관한 법률』(ʼ11년.7월.25일 공포)로 개정하여 국내외 농수산생명자원을 종합적·체계적으로 확보·관리 및 이용할 수 있는 제도적 근거를 마련하였다.
농림축산식품분야 생명자원은 각 기관별로 DB를 관리하고 있어 수요자 입장에서 농림축산 생명자원 정보에 대한 종합적인 접근·이용이 어렵다. 또한 생물다양성협약(CBD ; Convention on Biological Diversity)에서 논의되고 있는 유전자원에 대한 접근 및 이익공유(ABS ; Access and Benefit-Sharing)에 관련한 국제규범 제정 논의에 대응이 필요하다. 이에 2011년부터 농촌진흥청, 산림청, 농림축산검역본부, 국립종자원이 보유한 생명자원을 연계·통합관리 하기위해 생명자원 통합 DB구축사업을 추진하고 있다.
이를 통해 생명산업 정보화를 기반으로 하는 생명공학 연구 및 산업화를 촉진하고 생명자원의 다양성을 확보하여 우리 고유자원의 주권보호를 위한 생명자원의 국가 관리체계를 확립해 나가고자 한다.

[그림 3-1-12] 생명자원 통합 DB 구축체계
라. 보건·의료분야의 육성 및 관리정책(복지부)
미래보건의료연구의 인프라, 인체자원의 확보 및 분양을 위한 한국인체자원은행사업 (Korea Biobank Project) 2기 추진
(1) 추진배경
(가) 개인별 유전체 연구의 급속한 발전에 따라 보건의료연구 및 산업계의 대량 인체자원 필요성 증가
(나) 한국인체자원은행사업(KBP) 1기의 성공적 운영(ʼ08~ʼ12년)에 따라 확보한 50만 명분 인체자원의 가치 극대화 필요
(2) 추진전략
(가) 기 확보한 50만 명분의 인체자원을 적극 활용할 수 있는 수요자 중심의 분양시스템을 구축
(나) 맞춤의료, 예방치료 등 보건의료 신 성장 분야를 지원하기 위한 고부가가치 자원을 적극 확보하고 분양
(다) 대규모 인체자원이 필요한 R&D과제의 기획 단계부터 인체자원은행이 함께하는 협력체계 구축
(라) 인체자원은행에서 분양된 자원으로 수행된 연구 성과 및 결과의 기탁을 활성화하여 자원에 대한 고부가가치화를 지속적으로 추진 R&D 선순환 체계 마련

[그림 3-1-13] 한국인체자원은행사업(KBP) 중장기 발전전략
(3) 추진현황 및 성과
(가) 제1기 한국인체자원은행사업(ʼ08~ʼ12년)의 성공적 운영 및 아시아 최대 규모의 국립중앙인체자원은행(이하 ʻʻ중앙은행ʼʼ) 공식 출범(ʼ12년.4월)
(나) 중앙은행과 17개 인체자원단위은행(지역거점은행12개, 협력은행 5개)가 네트워크를 구성하여 다양한 코호트 및 질환군 인체자원 수집
|
|
중앙은행(질본) |
안산/안성 코호트, 국민건강영양조사 농촌/도시 코호트 등 |
|
강원대학교병원 |
내분비 및 신경계 질환 등 |
|
|
충북대학교병원 |
비뇨기계 질환 등 |
|
|
충남대학교병원 |
심혈관계 질환 등 |
|
|
원광대학교병원 |
면역질환 및 소화기 질환 등 |
|
|
전북대학교병원 |
소화기 및 신경계 질환 등 |
|
|
계명대동산병원 |
만성 간질환 등 |
|
|
경북대학교병원 |
심혈관 및 소화기계 질환 등 |
|
|
전남대학교화순병원 |
백혈병 및 림프종 |
|
|
경상대학교병원 |
소화기 및 소아청소년 질환 등 |
|
|
부산대학교병원 |
소화기 및 심혈관 질환 등 |
|
|
인제대부산백병원 |
심혈관 및 조혈계 질환 등 |
|
|
제주대학교병원 |
심혈관 및 근골격계 질환 등 |
|
|
서울대학교병원 |
신경계 및 신장 질환 등 |
|
|
서울아산병원 |
종양성 질환 등 |
|
|
고려대구로병원 |
신경계 및 내분비 질환 등 |
|
|
순천향대부천병원 |
호흡기 및 알레르기 질환 등 |
|
|
아주대병원 |
조혈계 및 소화기계 질환 등 |
|
|
< 인체자원단위은행 > |
< 단위은행별 주요수집분야 > |
|
[그림 3-1-14] 인체자원단위은행 현황 및 주요수집분야
(다) 2012년 12월 기준 질병관리본부 중앙은행과 17개 인체자원단위은행을 통해 인체자원 52만 여명 확보(중앙은행 364,857명, 단위은행 156,459명) 및 657건(345,432 vials)의 연구과제에 인체자원을 분양
(단위 : 명(바이알))

[그림 3-1-15] 중앙은행 및 인체자원단위은행 수집현황
(단위 : 연구과제(Unit : Number of Studies))

[그림 3-1-16] 중앙은행 및 인체자원단위은행 분양현황
(4) 향후 추진계획
(가) 분양 활성화를 위한 맞춤형 분양시스템(온라인 분양포털) 구축 및 분양제도 개선
(나) 질환별로 다양한 실물 자원과 관련 정보가 포함된 고부가가치 인체자원 확보
(다) 한국인 표준 유전체 확보를 위해 5만명분의 전장 유전체를 ʼ14년부터 지속적으로 분석하고, 암, 호흡기질환, 노인성질환 등 특화자원을 은행별로 특성화하여 집중 수집하는 체계 구축
(라) R&D 선순환 체계 마련 및 운영
(마) ISBER(International Society for Biorepository and Environmental Repository), BRIF(Biospecimen Resource Impact Factor)등 초기 단계 국제 바이오뱅크 네트워크에 적극 참여하고, 국내 주도 국제포럼 추진
마. 야생생물자원 분야의 육성 및 관리 정책(환경부)
(1) 「생물다양성 보전 및 이용에 관한 법률」제정 및 시행
(가) 추진 경과
환경부는 생물다양성의 종합적·체계적인 보전과 생물자원의 지속가능한 이용을 도모하고「생물다양성협약」의 이행에 관한 사항을 정함으로써 국민생활을 향상시키고 국제협력을 증진하기 위한 목적으로 「생물다양성 보전 및 이용에 관한 법률」을 제정하였고(2012년.2월.1일), 동 법은 2013년 2월 2일 시행되었다.
(나) 기대 효과
관계부처 별로 소관사항에 따라 생물다양성 관리 및 확보 관련 업무들을 각기 추진해 오고 있는 상황에서, 동 법의 시행으로 국가 생물다양성의 총괄 관리체계를 구축할 수 있게 되었고, 생물다양성 보전 정책을 실효적 추진을 할 수 있게 되었다.
(2) 「생물자원 보전ㆍ관리 및 이용 마스터플랜」수립 및 시행
(가) 추진 경과
한편, 정부는 생물자원의 보전·관리 및 이용을 종합적으로 연계하여, 생물자원의 활용을 극대화하기 위한 전략 및 실천계획으로「생물자원 보전·관리 및 이용 마스터플랜」을 수립하여 2010년 10월 국무회의에 보고하고 확정하였다.
(나) 기대 효과
마스터플랜의 시행은 한반도 고유 생물자원 확보, 생물자원의 관리능력 배양 및 국가 생물주권 기반확립 등을 목표로 하며, 이를 달성하기 위해 선정한 5대 전략 및 47개 추진과제에 향후 10년간 총 1조5천여 억원을 투자할 계획이다.

[그림 3-1-17] 생물자원 보전ㆍ관리 및 이용 마스터플랜의 추진체계
(3)「국가생물자원 종합관리시스템」구축 및 운영
(가) 추진 배경
환경부는 2013년으로 예상되는 ʻ유전자원의 접근과 이용에 관한 나고야의정서ʼ 발효에 대비하여 국가 생물자원의 주권 확립 및 종합적 관리를 위한 「국가생물자원 종합관리시스템」*을 구축하였다.(2012년.12월)
* 국가생물자원 종합관리시스템(http://www.kbr.go.kr)
이 시스템을 통하여 부처별로 분산 관리중인 생물자원 정보를 연계하고 관련 정보를 표준화하여 체계적 관리 기반을 마련하였다.
(나) 추진 경과
2011년 7월 ʻ생물자원 DB 구축 추진단ʼ을 구성하여 운영하였으며, 그 성과로 ʻ국가 생물자원 DB 현황 분석 및 통합화 방안ʼ을 마련하였다(2011년.12월). 그리고, 환경부 등 관계부처 합동으로 ʻ나고야 의정서 범정부 대책ʼ을 마련하여 국무회의를 거쳐 본 대책을 확정하였으며, 동 대책에는 ʻ국가 생물자원 종합관리시스템 구축ʼ 등 7개 추진과제가 포함되었다. 더불어, 국가생물자원 종합관리시스템의 본연의 역할의 원활한 수행을 위해 부처간 생물자원정보의 연계를 확대할 필요하며 이를 위해 2012년 농림축산식품부와 생물자원 정보 연계에 합의하여 현재 정보 연계를 위한 실무 작업을 진행중이고, 타 부처와도 정보 연계를 추진하고 있다. 2012년 12월 ʻ국가생물자원 종합관리시스템ʼ을 구축하여 2013년 2월까지 시범운영을 거쳐 현재 정상 운영중이다. 부처간 정보 연계와 함께 환경부 내 관련기관* 간 생물다양성·생물자원 정보 연계를 추진하여 실무 작업을 진행하고 있다.
* 국립환경과학원, 국립공원관리공단(2013년.4월)
(다) 주요 내용
「국가생물자원 종합관리시스템」은 2012년 말까지 발굴한 39,150종의 국내 생물종 가운데 종분류 최종 검증을 완료한 1만 여종에 대한 생물다양성 정보 DB를 포함하고 있다. 이러한 정보에는 학명, 분류체계, 표본사진, 발굴 시기, 보관 및 분양 정보, DNA 등 유전자원 정보 등 생물종 정보 외에 서식지, 생활사, 주요 특징, 유용성 등 생물다양성 정보가 포함되어 있다.
(라) 향후 계획
ʻ생물종 목록 사업ʼ을 통해 2012년 말까지 구축된 자생생물 39,150종 전체에 대한 종목록서비스를 2013년 말까지 구축하여 제공할 계획이며, 국립생물자원관, 국립환경과학원*, 국립공원관리공단* 등에 분산관리 중인 생물자원정보를 통합할 예정이다.
* 국토생태탐방포털(http://ecosystem.nier.go.kr), 한국의 외래생물 종합검색시스템, 전국자연환경조사 DB, 국립공원 자원정보(http://reinfo.knps.or.kr/kpark)
또한, 2013년 10월 지정한 환경부 기탁등록보존기관의 생물자원 정보를 통합할 계획이며(2014년), 국외반출승인대상종, 외래생물종, 생태계교란종 등의 현황 및 수출입·반입 관리 기능을 추가하여, 생물자원의 종합적인 관리 체계를 구축할 예정이다.
(4) 생물자원 관리 기관 설치 및 운영
환경부는 생물자원을 체계적으로 관리하기 위하여 관련법 제개정을 통하여 유형별 생물자원 관리 기관을 설치하여 운영·관리중이다. 2007년 국립생물자원관이 개원하여, 생물종 발굴 및 생물다양성 기초 연구 활동을 수행하고 있으며, 국립환경과학원에서도 수인성 질병, 생태계위해우려종 및 수생태계 관련 연구를 활발하게 수행하고 있다. 2013년 11월 충청남도 서천시에 국립생태원이 개원하여 우리나라 생태계 연구 역량을 크게 확장할 것으로 기대된다. 또한 경상북도 상주시에 ʻ낙동강생물자원관ʼ을 건립중이며, 권역별 생물자원관 건립을 추진중이다. 지자체 또는 학계 등 민간 분야의 생물자원 보전 및 분양 체계를 구축하기 위하여 「야생생물 보호 및 관리에 관한 법률」에 근거하여 서식지외 보전기관(멸종위기종 증식, 복원 연구), 생물자원 보전시설(지역별 특화 자생생물 연구 및 전시, 교육), 야생동물 구조관리센터를 지정하여 관리하고 있다.
(5) 생물종 발굴 및 주요 기능 분석 사업
(가) 생물주권 강화
국립생물자원관은 국내 최대의 생물 표본 수장 기관이자 최고 수준의 분류 전문 인력을 확보하고 있다.
국립생물자원관의 생물분류 전문 인력은 자원관 58명으로 전체 연구직 직원 61명의 95%를 차지하며 단일 기관으로 국내 최다 분류 인력이 다양한 연구 활동을 확대하고 있다. 국립생물자원관은 아시아 최고 수장시설(6,686㎡, 20개실) 및 생물자원 관리 표준화 시스템에 의한 표본의 영구적·학술적 관리 기반을 갖추고 있으며, 개원 이래 신종 및 미기록종(후보종) 6,377종을 발굴하여(2012년 말 현재) 국가 생물자원 인벤토리를 구축하고 있다. 또한 국내 최다인 생물표본 220만 여점을 확보하여(2012년 말 현재) 자생생물 실체규명, 생물종 인증을 위한 생물자원 도서관 역할을 수행하고 있다.
(나) 유용생물자원 기능 연구
환경부는 ʻ의미 있는 발굴ʼ로의 전환을 통해 유용한 생물종의 기능을 연구하여 산업계 활용의 기반을 넓혀 가고 있다. 환경오염물질을 분해할 수 있는 세균과 난분해성(자연 상태에서 잘 분해되지 않는) 물질을 분해할 수 있는 균류(버섯 등)를 탐색하고 그 기능을 연구하고 있으며, 천적자원으로서 자생 곤충을 연구하여 가시적인 성과를 거두고 있다.
국립환경과학원과 국립생태원도 생태계 기초 연구를 통하여 건강한 환경을 조성하고, 환경 오염을 저감할 수 있는 유용 생물자원에 대한 연구를 확대하고 있다.
(6) 멸종위기종 증식·복원 사업
환경부는 자생생물 보전·복원을 위해 법정관리종(멸종위기종, 국외반출 승인대상종 등)에 대한 증식, 복원 연구를 확대하고 있다. 주요 멸종위기종 (반달가슴곰, 여우, 산양, 장수하늘소 등)의 생활사, 증식 방법 등에 대한 기초 연구 및 서식지 확보를 통한 자연 방사를 계속하고 있다.
(7) 생물자원 전문인력 양성사업 운영
환경부는 2012년부터 생물다양성 및 생물자원 관련 석박사급 전문 인력을 양성하고 있다. 그간 발굴이 더디었던 미개척 분류군에 대한 발굴, 분류 전문 인력을 양성하기 위하여 해외 유수 대학과의 교류를 통해 국내 11개 대학(10개 사업단)에 지원을 하고 있다. 2013년에는 우수 인력의 산업계 진입 확산을 위하여 생물자원 전문 인력의 산업계 취업을 지원하는 프로그램을 운영하고 있다. 또한 2014년부터 생태계 보전 및 생태계 서비스 평가를 위한 전문 인력의 양성 프로그램을 운영할 계획이다.
(8) 야생생물자원 이용기반구축 사업
환경부는 2014년부터 야생생물자원의 산업계 및 학계의 활용기반을 확대하기 위하여 ʻ야생생물자원 이용기반구축ʼ 사업을 시행할 계획이다.

[그림 3-1-18] ʻ야생생물자원 이용기반구축ʼ 추진 체계도
바. 해양·수산분야의 육성 및 관리 정책(해수부)
(1) 해양생명자원의 확보 현황
생명자원의 주권화 및 이익공유를 인정하는 나고야의성서의 비준 및 공해상에서의 해양생명자원의 이용에 관한 국제레짐 마련의 움직임 등 세계적으로 해양생명자원의 중요성이 날로 증가하는 추세이다. 세계 각국은 더 많은 해양생명자원을 확보하기 위해 치열한 경쟁을 벌이고 있다. 우리나라 또한 이러한 세계적 흐름에 발 맞추어 해양생명자원을 확보·관리 및 이용하기 위한 다양한 정책을 추진하고 있다.
해양수산부는 2008년부터 현재까지 해양생명자원 확보 및 활용기반 구축에 263억원을 투자하였다. 2008년 해양생명자원 기탁등록보존기관 사업으로 해양생명자원에 대한 관리 사업을 시작하였다. 국내 대학 및 연구기관 등에 해양생명자원 기탁등록보존기관을 지정하여 주요 해양생명자원 분류군별 자원의 채집·기탁 및 활용기반 구축이 이루어지도록 하였다. 이를 통해 현재까지 국내 해양생명자원 9,364종 70,855점을 확보하였으며, 국내 10개 대학 및 연구기관을 해양생명자원 기탁등록보존기관으로 지정하여 운영하고 있다.
한편 해외 해양생명자원에 대해서도 지속적인 확보 사업을 펼쳐 나가고 있다. 2009년부터 해외 해양생물자원 개발 및 활용기반 구축 사업을 추진해나가고 있다. 이 사업을 통해 마이크로네시아, 필리핀, 인도양, 통가해역, 동중국해 등지에서 해양생명자원을 채집하고 있으며, 인도네시아(LIPI). 러시아(PIBOC), 베트남(IMBC), 필리핀(UPV) 등의 해외연구기관과 MOU를 체결하였다. 한편 현재까지 3,600여종, 10,000여점의 해외 해양생명자원을 확보하고 있다.
해양수산부는 해양생명자원의 확보에 그치지 않고, 확보한 해양생명자원의 표준화 및 통합DB 구축을 통해 분산된 실물정보 연계 및 통합검색에 의한 국가 해양생명자원 관리기반 구축을 추진하고 있다. 해양생명자원 정보표준화 및 통합DB 구축사업을 2011년부터 추진해오고 있다. 이 사업을 통해 해양생명자원 통합정보시스템을 구축하고 7,240종, 374,385점의 자원을 정보화하였다.
2012년에는「해양생명자원의 확보·관리 및 이용 등에 관한 법률」을 제정하여 해양생명자원의 체계적인 관리를 추진해나가고 있다.
(2) 해양생명자원 육성 및 관리 정책
해양수산부는 해양생명자원의 중요성을 인식하고 이에 대한 체계적인 육성 및 관리를 더욱 강화해나갈 계획이다. 해양생명자원에 대한 육성 및 관리정책에 대한 총괄 기관인 해양생물자원관을 2014년 개관하여, 해양생명자원 관리체계를 확립할 것이다. 해양생명자원관을 「해양생명자원의 확보·관리 및 이용 등에 관한 법률」상의 해양생명자원 책임기관으로 지정할 예정이다. 해양생명자원 책임기관의 경우 해양생명자원의 확보·관리 및 연구, 통합정보시스템 운영, 기탁등록기관 간의 정보교류 등의 업무를 수행하게 된다. 한편 해양생명자원 기탁등록보존기관을 현행 10개 기관에서 2013년에 14개 기관으로 확대할 것이며, 장기적으로 지속적인 확대를 추진해 나갈 계획이다. 해외 해양생명자원의 확보에 관한 부분에 있어서도 현재의 남태평양 중심의 자원 확보에서 벗어나 극지 등 그 영역을 확대시켜 나갈 것이다.
위와 같은 일련의 정책들을 통하여 우리나라가 세계적으로 경쟁이 가속화되고 있는 해양생명자원 확보에서 우위를 선점할 수 있도록 할 계획이다. 이를 통해 2025년까지 해양생명자원 분야 7대 강국으로 도약해 나갈 것이다.

1. 투자 현황
가. 정부의 연구개발 투자 현황
(1) 국가연구개발사업과 창조경제
박근혜정부의 핵심 국정과제는 창조경제 실현을 통한 경제·사회·문화 등 다방면에 걸친 문제 해결과 이를 통한 성장과 도약을 목표로 한다. 그리고 국정과제의 상당수가 바이오와 관련이 있다. 이는 바이오가 저출산·고령화, 맞춤의료, 식량안보 등 건강하고 윤택한 삶을 살고자하는 국민의 기대와 부흥하기 때문인 것으로 보인다.
이러한 현상을 우리나라에만 국한된 것이 아닌 전 세계가 공통으로 당면하고 있는 이슈이다. 바이오경제 시대18)의 도래를 통한 삶의 질 향상은 인류 전체가 희망하고 있고 이를 바이오기술이 해결해 줄 것이라고 기대하면서 각국은 이에 대한 투자를 적극적으로 때로는 공격적으로 하고 있다.
최근 정부는 「제3차 과학기술기본계획(2013~2017)」을 수립하여 ʻ창조적 과학기술로 여는 희망의 새 시대ʼ를 비전으로 설정하고, 과학기술 5대 전략분야의 고도화(High Five)를 통해 2017년까지 1인당 국민소득 3만 달러를 이끌고, 64만 개의 신규 일자리를 창출한다는 목표를 세웠다.
이를 달성하기위해 국가전략기술 경쟁력 제고(77.8%→85%), 과학기술 혁신역량 순위 향상(9위→7위), 과학기술인력 일자리 창출(605만명→669만명), 연구개발 경제성장 기여율 제고(35.4%→40.0%), 삶의 질 투자 확대(15.0%→20.0%) 등을 주요 성과목표로 설정했다.
박근혜 정부 예산편성의 특징 중 하나는 (舊)국가과학기술위원회의 기능이 신설 부처인 미래창조과학부로 이관된 것이나 예산배분·조정에 대한 절차, 범위 등은 그대로 유지되었다.
바이오 분야 정부연구개발 투자의 주요 키워드는 안전관리 강화, 고부가가치 신산업 창출, 신종질병 대응, 식량안보 확보, 종자주권 확립 등이고 이를 중심으로 중점 투자방향을 수립하였다.
2012년도 정부 연구개발 총투자는 일반회계, 특별회계 및 기금을 포함해서 15조 9,064억원으로 2008년의 10조 9,936억원에서 4조 9,128억원이 증가하여 1.45배 확대된 것으로 나타났다. 이는 당초 편성된 2012년 예산 16조 244억원 대비 99.3%의 집행실적을 나타냈고 전체 사업 수는 529개, 과제수는 49,948개가 지원된 것으로 조사되었다.
최근 5년간(ʼ08~ʼ12년) 연평균 증가율은 9.7%로 정부예산의 통합재정규모 증가율 5.7%를 상회한 것으로 나타났다.
2004년부터 2010년까지 연평균 증가율은 14.8%로 나타났다. 일반회계를 기준으로 정부 연구개발예산의 비중은 2010년 5.5%로 2009년에 비하여 0.4% 증가하였다. 2010년도 국가연구개발사업에는 총 13조 6,827억원이 집행되었는데, 이는 2010년도 정부 연구개발 예산에서 187억원이 미집행 되었음을 의미한다. 최근 7년간 국가연구개발사업 규모 변화 추이는 표 3-2-1에 나타나 있다.
[표 3-2-1] 국가연구개발사업 규모 변화 추이(2006년∼2012년)
(단위 : 억원)
|
구 분 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
2011년 |
2012년 |
최근 5년간 (’08년~’12년) |
|
|
연평균 증가율(%) |
|||||||||
|
정부 예산 |
일반회계 예산(A) |
1,260,843 |
1,353,977 |
1,523,038 |
1,688,922 |
1,772,835 |
1,874,484 |
1,969,735 |
6.6% |
|
일반+특별회계 예산(B) |
1,755,431 |
1,767,561 |
1,951,003 |
2,174,723 |
2,259,413 |
2,355,574 |
2,486,125 |
6.2% |
|
|
통합재정 규모(C) |
2,059,276 |
2,098,100 |
2,357,740 |
2,573,360 |
2,642,770 |
2,795,133 |
2,943,190 |
5.7% |
|
|
R&D 예산 |
일반(D) |
61,094 |
65,898 |
75,705 |
85,857 |
97,721 |
106,361 |
116,336 |
11.3% |
|
(D/A) |
4.8% |
4.9% |
5.0% |
5.1% |
5.5% |
5.7% |
5.9% |
||
|
일반+특별(E) |
72,283 |
81,396 |
93,461 |
106,300 |
119,576 |
130,456 |
141,218 |
10.9% |
|
|
(E/B) |
4.1% |
4.6% |
4.8% |
4.9% |
5.3% |
5.5% |
5.7% |
||
|
일반+특별+기금(F) |
89,096 |
97,629 |
110,784 |
123,437 |
137,014 |
148,902 |
160,244 |
9.7% |
|
|
(F/C) |
4.3% |
4.7% |
4.7% |
4.8% |
5.2% |
5.3% |
5.4% |
||
|
조사‧분석 대상 |
투자액 |
87,639 |
95,745 |
109,936 |
124,145 |
136,827 |
148,528 |
159,064 |
9.7% |
|
사업수(건) |
357 |
426 |
486 |
473 |
483 |
493 |
529 |
2.1% |
|
|
과제수(건) |
31,967 |
33,125 |
37,449 |
39,471 |
39,179 |
41,619 |
49,948 |
7.5% |
|
출처 : 2012년도 국가연구개발사업 조사‧분석 보고서(미래창조과학부/KISTEP)
(2) 미래유망신기술(6T) 분야별 투자 규모 추이
미래유망신기술(6T) 분야에서는 미래 핵심기술 확보와 신규 시장 개척을 위해 주력 사업인 IT 분야와 시장 잠재력이 큰 BT 분야에 대한 투자 강화 기조를 유지하였다.
2012년도 6T 분야 투자액은 전년 대비 5.4%(4,831억원) 증가하여 총 9조 4,219억원으로 정부연구개발 투자 중 64.2%를 차지하였다. 최근 3년간 미래유망신기술에 대한 투자 현황은 표 3-2-2에 나타나 있다19).
BT 분야에 대한 투자를 살펴보면, 2012년도에 2조 7,509억원으로 전년 대비 6.6% 증가하였고, 정부 연구개발 투자에서 차지하는 비중은 18.7%로 나타났는데, 이는 IT 분야의 2조 8,856억원(19.7%) 다음으로 많은 투자가 이루어진 것이다.
최근의 추이를 살펴보면, BT분야에 대한 투자액이 IT분야에 근접하였고, 두 분야 모두 최근 3년간 6T 기술 중 투자가 꾸준히 증가하고 있음을 알 수 있다.
※ BT : ’08년 1.7조원 → ’09년 2.0조원 → ’10년 2.3조원 → ’11년 2.6조원 → ’12년 2.8조원
※ IT : ’08년 1.7조원 → ’09년 2.1조원 → ’10년 2.4조원 → ’11년 2.6조원 → ’12년 2.9조원
[표 3-2-2] 6T별 투자 추이(2010년~2012년)
(단위 : 억원)
|
6T |
2010년 |
2011년 |
2012년 |
증감 |
||||
|
금액 |
비중 |
금액(A) |
비중 |
금액(B) |
비중 |
B-A |
% |
|
|
IT |
23,571 |
18.9 |
26,468 |
19.4 |
28,856 |
19.7 |
2,388 |
9.0 |
|
BT |
23,252 |
18.6 |
25,808 |
19.0 |
27,509 |
18.7 |
1,701 |
6.6 |
|
NT |
5,947 |
4.8 |
6,415 |
4.7 |
6,436 |
4.4 |
21 |
0.3 |
|
ST |
6,846 |
5.5 |
7,015 |
5.2 |
6,553 |
4.5 |
-461 |
-6.6 |
|
ET |
21,873 |
17.5 |
22,533 |
16.6 |
23,455 |
16.0 |
921 |
4.1 |
|
CT |
1,071 |
0.9 |
1,148 |
0.8 |
1,411 |
1.0 |
262 |
22.8 |
|
소계 |
82,562 |
66.1 |
89,387 |
65.7 |
94,219 |
64.2 |
4,831 |
5.4 |
|
기타 |
42,336 |
33.9 |
46,720 |
34.3 |
52,576 |
35.8 |
5,856 |
12.5 |
|
합계 |
124,898 |
100.0 |
136,107 |
100.0 |
146,795 |
100.0 |
10,688 |
7.9 |
출처 : 2012년도 국가연구개발사업 조사‧분석 보고서(미래창조과학부/KISTEP)
BT 분야 전체 사업수는 2011년 213개에서 2012년 228개 사업으로 증가했고 과제수는 2011년 11,718개에서 2012년 17,366개로 증가하였다.
나. BT 분야 상세 투자 현황
(1) 부처/연구개발 단계별 투자 현황
2012년도 BT분야에 대한 부처별 투자현황을 살펴보면, 교육과학기술부가 1조 96억원으로 전체 BT분야의 36.7%를 투자하였고 지식경제부 4,317억원(15.7%), 농촌진흥청 4,272억원(15.5%), 보건복지부 3,835억원(13.9%) 순으로 투자가 이루어졌다.
전년 대비 투자액 증가는 보건복지부(758억원), 교육과학기술부(542억원), 지식경제부(140억원), 농림수산식품부(92억원) 순으로 나타났다.
연구개발단계별로 살펴보면 기초연구, 응용연구, 개발연구에 각각 50.1%(9,973억원), 20.6%(4,096억원), 29.3%(5,840억원)가 투자20)된 것으로 나타났다.
교육과학기술부는 기초연구(7,147억원, 64.6%), 지식경제부는 개발연구(2,374억원, 34.5%), 보건복지부는 응용연구(1,243억원, 38.9%)와 개발연구(1,204억원, 37.6%), 농촌진흥청은 기초연구(1,415억원, 49.6%)의 비중이 큰 것으로 나타났다.
(단위 : 억원)

출처 : 2012년도 국가연구개발사업 조사‧분석 보고서 재가공
[그림 3-2-1] 주요 부처의 연구개발단계별 투자 현황
(2) 연구수행 주체별 투자 현황
연구수행주체별로는 대학 1조 1,503억원(41.8%), 출연연구소 5,946억원(21.6%), 국공립연구소 4,718억원(17.2%), 중소기업 3,187억원(11.6%), 대기업 926억원(3.4%)의 순으로 많은 투자가 이루어졌다.
교육과학기술부는 대학과 출연연구소, 지식경제부는 중소기업과 출연연구소를 중심으로 지원하였고, 농촌진흥청은 국공립연구소, 보건복지부와 농림수산식품부는 대학에 가장 많은 지원을 하였다.
(단위 : 억원)

출처 : 2012년도 국가연구개발사업 조사‧분석 보고서 재가공
[그림 3-2-2] 주요 부처의 연구수행주체별 투자 현황
(3) 지역별 투자 현황
지역별 투자는 수도권 1조 4,807억원(55.0%), 대전 3,651억원(13.6%), 지방 8,446억원(31.4%) 순으로 많이 이루어졌다. 전년 대비 증가율은 수도권 4.0%(563억원), 지방 8.0%(626억원), 대전 14.4%(460억원) 순으로 높았다. 16개 시·도 중 투자액 기준 상위 3개 지역은 서울특별시(7,713억원), 경기도(6,736억원), 대전광역시(3,651억원) 순으로 나타났다. 지방의 경우, 충청북도가 1,569억원으로 투자액이 가장 많았으며, 다음으로 전라북도 877억원, 강원도 842억원, 부산광역시 831억원 순으로 나타났다.
(단위 : 억원)
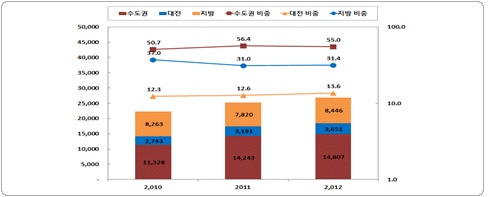
출처 : 2012년도 국가연구개발사업 조사‧분석 보고서 재가공
[그림 3-2-3] 주요 부처의 지역별 투자 현황
(4) 국가과학기술표준분류별 투자 현황
2012년 BT분야에 대한 투자를 국가과학기술표준분류 25개 대분류 기준으로 살펴보면 보건의료 1조 232억원(37.2%), 농림수산식품 7,327억원(26.6%), 생명과학 6,477억원(23.5%) 순으로 투자가 이루어졌다.
전년 대비 투자 증가는 보건의료(960억원), 생명과학(624억원), 기계(192억원) 순이었고, 농림수산식품 분야는 감소한 것으로 나타났다.
(단위 : 억원)

출처 : 2012년도 국가연구개발사업 조사‧분석 보고서 재가공
[그림 3-2-4] BT의 과학기술표준분류별 투자 현황
융합과제 및 단일과제에 대한 투자를 살펴보면, 전체 대비 융합과제 비중은 23.9%(6,562원)로 전년 대비 2.1%P 증가했으며, 세부 분야별로는 생명과학이 35.5%로 가장 많은 융합과제를 수행하였고, 보건의료 28.0%, 농림수산식품 20.2% 순으로 수행하였다.
(5) 협동연구 투자 현황
2012년 협력유형별 투자를 살펴보면, 산학 협동연구 1,128억원(44.3%), 산학연 협동연구 437억원(17.2%), 산산 협동연구 218억원(8.6%) 순으로 많아 대학과 기업의 협력이 가장 많았음을 알 수 있다.
(단위 : 억원)

출처 : 2012년도 국가연구개발사업 조사‧분석 보고서 재가공
[그림 3-2-5] 협력유형별 협동연구 투자 현황
(6) 연구책임자 현황
2012년 BT 분야 과제에 참여한 연구책임자는 11,196명으로 2011년 8,342명에 비해 34.2% 많은 연구자가 참여했다. 연구책임자의 성별 분포를 살펴보면, 남성이 80.9%(9,057명), 여성이 19.1%(2,139명)인 것으로 나타났다.
(단위 : 억원)

출처 : 2012년도 국가연구개발사업 조사‧분석 보고서 재가공
[그림 3-2-6] 연구책임자 추이
BT 분야 연구책임자의 평균 연령은 47.2세로, 전체 평균연령(47.3세)와 비슷하며, 남성의 경우 48.0세(전체 47.7세), 여성의 경우 43.9세(전체 43.6세)로 여성의 연령이 낮은 것으로 나타났다.
성별 연령별 연구책임자 현황을 살펴보면, 여성 연구책임자는 40세 이하의 연령대에서 상대적으로 높은 비중을 보였다.
(단위 : 억원, 명)

출처 : 2012년도 국가연구개발사업 조사‧분석 보고서 재가공
[그림 3-2-7] 성별 연령별 연구책임자 현황(2012년)
연구책임자의 전공별 분포를 살펴보면, 이학 전공자가 27.0%(3,021명)로 가장 많았고, 의학 26.6%(2,978명), 농학 19.9%(2,228명), 공학 15.6%(1,741명) 순으로 나타났다. 전체 연구책임자를 대상으로 살펴보면, 공학 전공자가 45.7%(13,596명), 이학(6,365명, 21.4%), 의학(3,227, 10.9%) 순으로 나타난 것을 볼 때, 이학의 비중이 높고, 공학의 비중이 낮음을 알 수 있다.
(7) 주요 부처·사업별 투자 현황
2012년도 BT분야 투자액 기준 50대 연구개발사업을 부처별로 살펴보면 다음과 같다(표 3-2-3).
(가) 교육과학기술부
일반연구자지원사업에 1,835억원, 중견연구자지원사업에 1,288억원, 바이오· 의료기술개발사업에 1,159억원을 투자하였다. 특이사항은 일반연구자지원사업과 중견연구자지원사업 등 다분야 사업에서 바이오 분야에 대한 투자가 많이 이루어진 것으로 보아 바이오 분야에서 정부연구개발사업의 수요가 많은 것을 알 수 있다.
(나) 국토해양부
대표사업인 해양생명공학기술개발사업에 203억원을 투자하였다.
(다) 농림수산식품부·농촌진흥청·산림청
농림수산식품부는 생명산업기술개발사업에 510억원, 고부가가치식품기술개발사업에 280억원, 수의과학기술개발연구사업에 240억원을 투자하였다. 농림·수산 분야에서 가장 많은 투자를 한 농촌진흥청은 차세대바이오그린21사업에 698억원, 국책기술개발사업에 453억원, 농업과학원사업(인건비+기본경비)에 329억원을 투자하였다. 한편, 산림청은 국립산림과학원에 353억원을 투자하였다.
(라) 보건복지부·식품의약품안전청
보건복지부는 보건의료기술연구개발사업에 1,653억원을 투자하였고, 암연구소 및 국가암관리사업본부운영사업(舊, 국립암연구소운영)(연구개발사업비)에 488억원, 임상연구인프라조성사업에 391억원을 투자하였다. 식품의약품안전청은 식품 등 안전관리사업에 가장 많은 금액인 179억원을 투자하였고, 의약품 등 안전관리사업에 168억원을 투자하였다.
(라) 지식경제부·중소기업청
지식경제부는 바이오의료기기산업원천기술개발사업에 763억원, 광역경제권선도산업 육성사업에 561억원, 지역특화산업육성사업에 386억원을 투자하였다. 중소기업청은 중소기업기술혁신개발사업에 352억원을 투자하였다.
[표 3-2-3] 부처·사업별 투자 현황(2012년)
(단위 : 백만원)
|
부처 |
사업명 |
BT 투자액(A) |
전체 투자액(B) |
A/B(%) |
|
교육과학 기술부 |
일반연구자지원 |
183,507 |
426,918 |
43.0 |
|
중견연구자지원 |
128,798 |
316,399 |
40.7 |
|
|
바이오·의료기술개발 |
115,922 |
118,972 |
97.4 |
|
|
한국생명공학연구원연구운영비지원 |
76,659 |
76,806 |
99.8 |
|
|
선도연구센터지원 |
56,936 |
108,054 |
52.7 |
|
|
첨단융합기술개발 |
38,817 |
101,700 |
38.2 |
|
|
국제과학비즈니스벨트조성 (기초과학연구원연구운영비지원) |
34,010 |
122,149 |
27.8 |
|
|
한국과학기술연구원연구운영비지원 |
30,004 |
151,070 |
19.9 |
|
|
한국한의학연구원연구운영비지원 |
28,323 |
39,022 |
72.6 |
|
|
글로벌프론티어사업 |
26,033 |
69,691 |
37.4 |
|
|
리더연구자지원 |
25,516 |
58,083 |
43.9 |
|
|
한국원자력의학원연구운영비지원 |
22,922 |
48,324 |
47.4 |
|
|
방사선기술개발사업 |
17,630 |
38,117 |
46.3 |
|
|
기초연구기반구축 |
16,539 |
44,014 |
37.6 |
|
|
2단계연구중심대학육성(0.5) |
16,033 |
101,540 |
15.8 |
|
|
국토 해양부 |
해양생명공학기술개발 |
20,348 |
25,898 |
78.6 |
|
농림수산 식품부 |
생명산업기술개발 |
50,949 |
53,819 |
94.7 |
|
고부가가치식품기술개발 |
27,981 |
28,870 |
96.9 |
|
|
수의과학기술개발연구 |
23,944 |
24,547 |
97.5 |
|
|
수산시험연구 |
19,947 |
24,871 |
80.2 |
|
|
수출전략기술개발 |
16,201 |
17,511 |
92.5 |
|
|
농촌 진흥청 |
차세대바이오그린21 |
69,770 |
70,000 |
99.7 |
|
국책기술개발 |
45,304 |
66,965 |
67.7 |
|
|
농업과학원(인건비+기본경비) |
32,867 |
32,867 |
100.0 |
|
|
농업현장실용화기술개발 |
31,543 |
33,250 |
94.9 |
|
|
원예특작시험연구 |
25,606 |
45,845 |
55.9 |
|
|
식량과학원(인건비+기본경비) |
24,202 |
24,202 |
100.0 |
|
|
원예특작과학원(인건비+기본경비) |
23,787 |
23,787 |
100.0 |
|
|
축산시험연구(R&D,책임운영) |
22,823 |
37,670 |
60.6 |
|
|
작물시험연구 |
22,476 |
37,527 |
59.9 |
|
|
축산과학원(인건비+기본경비) |
20,842 |
20,842 |
100.0 |
|
|
보건 복지부 |
보건의료기술연구개발 |
165,282 |
170,050 |
97.2 |
|
암연구소및국가암관리사업본부운영 (구.국립암연구소운영)(연구개발사업비) |
48,843 |
50,657 |
96.4 |
|
|
임상연구인프라조성 |
39,130 |
41,130 |
95.1 |
|
|
선도형특성화연구개발사업(구.연구중심병원구축) |
23,500 |
23,500 |
100.0 |
|
|
감염병위기대응기술개발(구.면역백신개발) |
17,500 |
17,500 |
100.0 |
|
|
산림청 |
국립산림과학원(인건비+기본경비+운영지원),산림과학연구,산림과학연구공적개발원조(ODA),산림과학연구기반구축,산림분야기후변화대응연구사업 |
35,306 |
57,811 |
61.1 |
|
식품의약품안전청 |
식품등안전관리 |
17,850 |
18,500 |
96.5 |
|
의약품등안전관리 |
16,811 |
16,811 |
100.0 |
|
|
중소 기업청 |
중소기업기술혁신개발 |
35,234 |
232,500 |
15.2 |
|
산학연협력기술개발 |
21,865 |
132,212 |
16.5 |
|
|
지식 경제부 |
바이오의료기기산업원천기술개발사업 |
76,264 |
85,076 |
89.6 |
|
광역경제권선도산업육성 |
56,070 |
286,088 |
19.6 |
|
|
지역특화산업육성 |
38,610 |
87,157 |
44.3 |
|
|
안전성평가연구소연구운영비지원 |
23,888 |
23,888 |
100.0 |
|
|
한국식품연구원연구운영비지원 |
23,124 |
31,023 |
74.5 |
|
|
지역전략산업육성 |
21,350 |
86,050 |
24.8 |
|
|
한국화학연구원연구운영비지원 |
17,633 |
60,527 |
29.1 |
|
|
부품소재산업경쟁력향상(소재부품기술개발) |
16,949 |
350,251 |
4.8 |
|
|
환경부 |
차세대에코이노베이션기술개발사업 |
17,336 |
130,000 |
13.3 |
출처 : 2012년도 국가연구개발사업 조사‧분석 보고서 재가공
(8) BT 분야 투자 현황 요약

출처 : 2012년도 국가연구개발사업 조사‧분석 보고서 재가공
(9) BT 분야 수행 상위 기관
1. Top 50
|
순위 |
연구수행기관 |
금액(억원) |
비중(%) |
|
1 |
서울대학교 |
1,576 |
5.7 |
|
2 |
한국생명공학연구원 |
1,305 |
4.7 |
|
3 |
국립농업과학원 |
882 |
3.2 |
|
4 |
연세대학교 |
835 |
3.0 |
|
5 |
국립원예특작과학원 |
660 |
2.4 |
|
6 |
한국과학기술연구원 |
603 |
2.2 |
|
7 |
국립식량과학원 |
580 |
2.1 |
|
8 |
고려대학교 |
576 |
2.1 |
|
9 |
국립축산과학원 |
521 |
1.9 |
|
10 |
국립암센터 |
490 |
1.8 |
|
11 |
한국과학기술원 |
480 |
1.7 |
|
12 |
한국식품연구원 |
388 |
1.4 |
|
13 |
한국원자력의학원 |
368 |
1.3 |
|
14 |
한국화학연구원 |
365 |
1.3 |
|
15 |
국립산림과학원 |
354 |
1.3 |
|
16 |
경북대학교 |
353 |
1.3 |
|
17 |
경희대학교 |
346 |
1.3 |
|
18 |
기초과학연구원 |
340 |
1.2 |
|
19 |
이화여자대학교 |
328 |
1.2 |
|
20 |
한국한의학연구원 |
318 |
1.2 |
|
21 |
한양대학교 |
305 |
1.1 |
|
22 |
서울대학병원 |
299 |
1.1 |
|
23 |
전남대학교 |
296 |
1.1 |
|
24 |
농림수산검역검사본부 |
295 |
1.1 |
|
25 |
가톨릭대학교 |
287 |
1.0 |
|
26 |
국립수산과학원 |
286 |
1.0 |
|
27 |
울산대학교 |
285 |
1.0 |
|
28 |
건국대학교 |
283 |
1.0 |
|
29 |
부산대학교 |
277 |
1.0 |
|
30 |
전북대학교 |
272 |
1.0 |
|
31 |
충북대학교 |
263 |
1.0 |
|
32 |
한국화학연구원부설안전성평가연구소 |
262 |
1.0 |
|
33 |
성균관대학교 |
254 |
0.9 |
|
34 |
포항공과대학교 |
239 |
0.9 |
|
35 |
질병관리본부 |
232 |
0.8 |
|
36 |
한국보건산업진흥원 |
227 |
0.8 |
|
37 |
충남대학교 |
226 |
0.8 |
|
38 |
경상대학교 |
200 |
0.7 |
|
39 |
한국해양과학기술원 |
192 |
0.7 |
|
40 |
한국원자력연구원 |
183 |
0.7 |
|
41 |
한국기초과학지원연구원 |
182 |
0.7 |
|
42 |
식품의약품안전평가원 |
182 |
0.7 |
|
43 |
아주대학교 |
173 |
0.6 |
|
44 |
중앙대학교 |
166 |
0.6 |
|
45 |
동국대학교 |
164 |
0.6 |
|
46 |
삼성서울병원 |
164 |
0.6 |
|
47 |
한국표준과학연구원 |
156 |
0.6 |
|
48 |
농촌진흥청 |
152 |
0.6 |
|
49 |
강원대학교 |
152 |
0.6 |
|
50 |
한국파스퇴르연구소 |
145 |
0.5 |
|
합 계 |
18,467 |
|
|
출처 : 2012년도 국가연구개발사업 조사‧분석 보고서 재가공
2. 대기업 Top 20
|
순위 |
연구수행기관 |
금액(억원) |
비중(%) |
|
1 |
에스케이바이오팜 |
138 |
14.9 |
|
2 |
동아제약 |
88 |
9.5 |
|
3 |
SK케미칼 |
60 |
6.5 |
|
4 |
녹십자 |
57 |
6.1 |
|
5 |
한올바이오파마 |
45 |
4.8 |
|
6 |
삼성전자 |
40 |
4.3 |
|
7 |
대웅제약 |
37 |
4.0 |
|
8 |
한미약품 |
37 |
4.0 |
|
9 |
CJ제일제당 |
32 |
3.4 |
|
10 |
유한양행 |
25 |
2.7 |
|
11 |
LG전자 |
22 |
2.4 |
|
12 |
현대중공업 |
20 |
2.2 |
|
13 |
코오롱인더스트리 |
20 |
2.1 |
|
14 |
일동제약 |
19 |
2.0 |
|
15 |
LG생명과학 |
18 |
1.9 |
|
16 |
한화케미칼 |
16 |
1.7 |
|
17 |
동국제약 |
15 |
1.6 |
|
18 |
제이더블유중외제약 |
14 |
1.5 |
|
19 |
한국콜마 |
12 |
1.3 |
|
20 |
GS칼텍스 |
12 |
1.3 |
|
합 계 |
727 |
|
|
출처 : 2012년도 국가연구개발사업 조사‧분석 보고서 재가공
3. 중소기업 Top 20
|
순위 |
연구수행기관 |
금액(억원) |
비중(%) |
|
1 |
제넥신 |
52 |
1.6 |
|
2 |
차바이오앤디오스텍 |
42 |
1.3 |
|
3 |
안국약품 |
39 |
1.2 |
|
4 |
메디포스트 |
38 |
1.2 |
|
5 |
바이로메드 |
28 |
0.9 |
|
6 |
고영테크놀러지 |
26 |
0.8 |
|
7 |
미래컴퍼니 |
25 |
0.8 |
|
8 |
아미노로직스 |
23 |
0.7 |
|
9 |
루트로닉 |
22 |
0.7 |
|
10 |
대상 |
22 |
0.7 |
|
11 |
메디톡스 |
20 |
0.6 |
|
12 |
덴티움 |
19 |
0.6 |
|
13 |
한풍제약 |
18 |
0.6 |
|
14 |
네오팜 |
18 |
0.6 |
|
15 |
레고켐바이오사이언스 |
18 |
0.6 |
|
16 |
클레어픽셀 |
18 |
0.6 |
|
17 |
알피니언메디칼시스템 |
18 |
0.6 |
|
18 |
이디 |
18 |
0.6 |
|
19 |
바이오넷 |
16 |
0.5 |
|
20 |
멕아이씨에스 |
16 |
0.5 |
|
합 계 |
496 |
|
|
출처 : 2012년도 국가연구개발사업 조사‧분석 보고서 재가공
4. 대학 Top 20
|
순위 |
연구수행기관 |
금액(억원) |
비중(%) |
|
1 |
서울대학교 |
1,576 |
13.7 |
|
2 |
연세대학교 |
835 |
7.3 |
|
3 |
고려대학교 |
576 |
5.0 |
|
4 |
한국과학기술원 |
458 |
4.0 |
|
5 |
경북대학교 |
353 |
3.1 |
|
6 |
경희대학교 |
346 |
3.0 |
|
7 |
이화여자대학교 |
328 |
2.8 |
|
8 |
한양대학교 |
305 |
2.7 |
|
9 |
서울대학병원 |
299 |
2.6 |
|
10 |
전남대학교 |
296 |
2.6 |
|
11 |
가톨릭대학교 |
287 |
2.5 |
|
12 |
울산대학교 |
285 |
2.5 |
|
13 |
건국대학교 |
283 |
2.5 |
|
14 |
부산대학교 |
277 |
2.4 |
|
15 |
전북대학교 |
272 |
2.4 |
|
16 |
충북대학교 |
263 |
2.3 |
|
17 |
성균관대학교 |
254 |
2.2 |
|
18 |
포항공과대학교 |
239 |
2.1 |
|
19 |
충남대학교 |
226 |
2.0 |
|
20 |
경상대학교 |
200 |
1.7 |
|
합 계 |
7,958 |
|
|
2. 인력 현황
가. 바이오산업의 인력 현황 및 추이
2011년 12월말 현재 국내 바이오산업에 종사하는 종사자 수는 35,596명으로 전년도 종사자 수 32,647명에 비해 약 9%가 증가한 것으로 나타났다. (「2011년도 국내 바이오산업 통계」, 한국바이오협회) 이 중 약 32.2%(11,470명)가 생산직에 종사하고 있으며, 29.8%(10,622명)가 연구직에, 37.9%(13,504명)가 영업 및 관리직에 종사하고 있다.
연구직 종사자 수의 학력별 구성을 보면, 석사가 46.2%(4,912명)로 가장 많은 비중을 차지하고 있으며, 학사(29.5%)와 박사(13.7%)가 그 뒤를 따르고 있다. 생산직 종사자의 경우 학사가 30.0%(3,440명)로, 석사(6.7%)와 박사(0.9%)보다 많았으며, 영업 및 관리직의 경우에도 학사가 51.8%(6,997명)로 석사(7.7%)와 박사(1.8%)보다 많은 것으로 나타났다.
(단위 : 명)

출처 : 한국바이오협회(2013)
[그림 3-2-8] 바이오산업의 연구직, 생산직, 영업 및 관리직 인력의 구성(2011년)
지난 3년간(ʼ09~ʼ11년) 연구직 종사자 수의 추이를 보면, 석사의 경우 2009년 5,206명에서 2011년 4,912명으로 점차 감소 추세이며, 학사의 경우도 3,298명에서 3,135명으로 약간 감소하고 있다. 반면, 박사인력은 1,462명에서 1,453명으로 거의 정체되어 있음을 알 수 있다. 생산직의 경우, 학사가 5,694명에서 3,440명으로 큰 폭으로 감소(39.6%)하였으며, 석사도 1,454명에서 774명으로 46.8%나 감소한 것으로 나타났다. 박사인력도 계속 감소 추세를 보여 생산진 인력이 크게 감소하고 있음을 알 수 있다.
(단위 : 명)

출처 : 한국바이오협회(2013)
[그림 3-2-9] 연구직 인력의 규모 추이(ʼ09~ʼ11년)
(단위 : 명)

출처 : 한국바이오협회(2013)
[그림 3-2-10] 생산직 인력의 규모 추이(ʼ09~ʼ11년)
나. 바이오산업의 산업별 인력 현황
바이오산업의 산업별 인력구성을 보면 바이오의약산업에 종사하는 인력이 전체 중 45.0%(16,009명)로 가장 많았으며, 그 다음 바이오식품산업 23.5%, 바이오화학산업 14.0% 순이었다. 이 세 산업에 종사하는 인력이 29,352명으로 전체 인력의 82.5%를 차지하고 있다.
(단위 : 명, %)

출처 : 한국바이오협회(2013)
[그림 3-2-11] 바이오산업의 산업별 종사인력 구성
바이오산업별 연구직 인력은 바이오검정산업 및 기타산업(60.5%), 바이오화학 산업(46.4%)에서 높은 비중을 차지하고 있으며, 생산직 인력은 바이오전자산업(45.8%), 바이오에너지 및 자원산업(39.9%)에서 높은 비중을 나타내고 있음을 알 수 있다. 영업 및 관리직 인력은 바이오의약산업(44.7%)에서 가장 많았으며, 바이오환경산업(38.7%)과 바이오식품산업(37.8%)이 그 다음 순으로 많았다.
(단위 : %)

출처 : 한국바이오협회(2013)
[그림 3-2-12] 바이오산업의 산업별 연구직, 생산직, 영업 및 관리직 인력 구성
바이오산업의 산업별 연구직 인력 구성을 보면 바이오의약산업이 4,144명(39.0%)으로 가장 많았으며, 바이오의약산업 내에서는 석사가 2,033명(49.1%)으로 가장 높은 비중을 차지하고 있다. 바이오전자산업에서는 연구직 인력이 310명(7.5%)으로 가장 적은 인력을 보유하고 있다.
(단위 : 명)

출처 : 한국바이오협회(2013)
[그림 3-2-13] 바이오산업의 산업별 연구직 인력 구성
바이오산업의 산업별 생산직 인력 구성에서도 바이오의약산업이 4,716명(41.1%)으로 가장 많았으며, 바이오의약산업 내에서는 기타인력이 3,066명(65.0%)으로 가장 높은 비중을 차지하고 있다.
(단위 : 명)

출처 : 한국바이오협회(2013)
[그림 3-2-14] 바이오산업의 산업별 생산직 인력 구성
바이오산업의 산업별 영업 및 관리직 인력 구성에서도 바이오의약산업이 7,149명 (52.9%)으로 가장 많았으며, 바이오의약산업 내에서는 기타인력이 3,750명(52.5%)으로 가장 높은 비중을 차지하고 있다.
(단위 : 명)

출처 : 한국바이오협회(2013)
[그림 3-2-15] 바이오산업의 산업별 영업 및 관리직 인력 구성
3. 특허 현황
가. 개요
생명공학분야에 있어 특허는 원천기술 확보 이상의 의미를 갖는다. 타 분야에 비해 연구개발기간과 개발비용이 막대하고, 상용화 준비단계에 승인 및 허가 제도가 도입되어 있어 투자회수 뿐만 아니라 단계별 자금 확보를 위한 법적 장치로서 특허권 획득은 매우 중요하다고 할 수 있다.
특허정보에는 기술적 내용과 더불어 기술의 흐름 및 실용적 사례 등이 내포되어 있으며, 특허의 수치적 분석은 관련 분야의 경제 및 산업 동향 파악에 접목될 수 있다. 따라서 특허통계정보는 연구개발 성과를 측정하고 국가의 과학기술정책을 수립하는 기초자료인 동시에 기획 단계부터 지식재산권을 고려한 전략적 R&D 수행을 위한 중요한 자료로 활용되고 있다.
나. 분석기준
생명공학 분야의 기술분류는 OECD에서 분류한 기준을 토대로 한국특허청의 전문가 집단에서 세분류한 6개 산업, 13개 기술분류, 27개 세분류로 구분하였다.21)
분석대상 국가로는 한국과 세계적 동향을 파악하기 위해 특허를 가장 강하게 보호하고 시장규모도 큰 미국특허를 대상으로 하였으며, 시간적 기준으로 한국은 출원시점으로 2000~2012년까지를22), 미국특허는 등록기준으로 2000~2012년까지의 특허를 가지고 동향을 파악하였다.
또한, 기술분류는 IPC 8판 기준으로 그간의 누락데이터를 보완하고 수정하여 최종적으로 데이터 셀을 완성하였다
[표 3-2-4] 생명공학의 기술분류
|
산업 |
기술분류 |
세분류 |
|
공정 |
생물공정 |
동식물 세포배양장치, 분리정제, 생물학적합성, 효소 미생물관련 장치 |
|
측정진단 |
조사․분석, 측정․시험 |
|
|
생물자원탐색 |
미생물, 바이러스 |
|
|
기초 |
동식물세포배양 |
동식물세포 |
|
효소공학 |
효소 |
|
|
농업 |
유전체 |
당유기함유핵산, 유전공학 |
|
단백질체 |
고정화펩티드, 펩티드, 하이브리드펩티드 |
|
|
식품 |
항체이용 |
면역글로블린 |
|
생물농약 |
생물농약 |
|
|
의약 |
형질전환동식물 |
신규한동물, 신규한 식물 |
|
발효식품 |
알콜발효 및 장치 |
|
|
환경 |
생물의약 |
단백질치료제, 방사선의약, 신약후보물질, 유전자치료, 치료용 항체 |
|
환경생물공학 |
생물학적 수처리, 슬러지처리 |
다. 한국에 출원된 생명공학 특허 동향
한국에 출원한 생명공학분야의 특허출원건수를 살펴보면, 2000년 이후 꾸준히 증가하고 있는 것으로 나타났다. 2007년 이후에는 매년 특허출원건수의 증가와 감소를 반복하고 있는 것으로 조사되었다.
세부기술별로는, 측정진단의 조사·분석과 측정·시험분야의 특허출원건수가 가장 많으며, 단백질체의 팹티드, 생물자원탐색의 미생물분야, 생물의약개발의 치료용항체와 단백질 치료제와 관련된 분야의 특허출원건수가 많이 분포되어 있는 것으로 나타났다.
[표 3-2-5] 한국에 출원한 생명공학분야의 기술분류별-연도별 특허출원건수
|
기술분류 |
’00년 |
’01년 |
’02년 |
’03년 |
’04년 |
’05년 |
’06년 |
’07년 |
’08년 |
’09년 |
’10년 |
’11년 |
’12년 |
||
|
공정 |
생물공정 |
분리정제 |
1 |
0 |
0 |
2 |
0 |
1 |
0 |
0 |
1 |
4 |
0 |
0 |
0 |
|
생물학적합성 |
135 |
130 |
134 |
152 |
106 |
101 |
95 |
189 |
212 |
210 |
215 |
169 |
21 |
||
|
동식물세포 배양장치 |
5 |
6 |
10 |
8 |
16 |
16 |
39 |
30 |
40 |
37 |
63 |
61 |
22 |
||
|
효소, 미생물 관련장치 |
38 |
34 |
37 |
23 |
38 |
47 |
78 |
84 |
110 |
90 |
131 |
104 |
35 |
||
|
측정진단 |
조사, 분석 |
67 |
96 |
118 |
155 |
154 |
153 |
237 |
301 |
391 |
369 |
498 |
399 |
129 |
|
|
측정, 시험 |
137 |
227 |
240 |
281 |
289 |
399 |
327 |
472 |
381 |
412 |
541 |
353 |
113 |
||
|
기초 |
유전체 |
유전공학 |
398 |
384 |
322 |
332 |
394 |
428 |
459 |
618 |
820 |
567 |
697 |
627 |
163 |
|
당류기함유핵산 |
45 |
39 |
50 |
37 |
29 |
47 |
35 |
39 |
46 |
31 |
47 |
20 |
0 |
||
|
단백질체 |
펩티드 |
240 |
251 |
231 |
213 |
274 |
258 |
348 |
403 |
468 |
322 |
435 |
273 |
39 |
|
|
고정화펩티드 |
3 |
1 |
0 |
0 |
0 |
3 |
3 |
9 |
7 |
8 |
10 |
2 |
2 |
||
|
하이브리드펩티드 |
10 |
18 |
24 |
39 |
19 |
24 |
29 |
46 |
62 |
68 |
71 |
54 |
12 |
||
|
항체이용 |
면역글로불린 |
47 |
50 |
58 |
72 |
91 |
93 |
141 |
188 |
386 |
220 |
374 |
203 |
21 |
|
|
효소공학 |
효소 |
70 |
82 |
90 |
77 |
75 |
75 |
107 |
109 |
138 |
144 |
176 |
131 |
22 |
|
|
생물자원탐색 |
미생물 |
197 |
189 |
219 |
213 |
192 |
211 |
288 |
247 |
291 |
311 |
412 |
338 |
78 |
|
|
바이러스 |
24 |
23 |
23 |
15 |
16 |
21 |
15 |
25 |
36 |
24 |
45 |
46 |
7 |
||
|
동식물 세포배양 |
동식물세포 |
40 |
48 |
70 |
68 |
127 |
129 |
184 |
199 |
267 |
196 |
281 |
193 |
44 |
|
|
농업 |
생물농약개발 |
생물농약 |
29 |
47 |
40 |
38 |
52 |
78 |
84 |
93 |
70 |
105 |
90 |
76 |
31 |
|
형질전환동식물 개발 |
신규한동물 |
20 |
14 |
25 |
28 |
30 |
36 |
33 |
41 |
33 |
43 |
60 |
45 |
10 |
|
|
신규한식물 |
34 |
46 |
58 |
69 |
35 |
51 |
44 |
51 |
74 |
57 |
176 |
139 |
24 |
||
|
식품 |
발효식품개발 |
알코올발효 및 장치 |
82 |
118 |
108 |
87 |
83 |
102 |
149 |
166 |
169 |
186 |
261 |
181 |
58 |
|
의약 |
생물의약개발 |
방사선의약 |
4 |
13 |
6 |
11 |
8 |
14 |
11 |
17 |
14 |
6 |
19 |
8 |
0 |
|
유전자치료 |
22 |
24 |
18 |
15 |
24 |
28 |
20 |
35 |
38 |
36 |
29 |
17 |
10 |
||
|
치료용항체 |
76 |
106 |
107 |
108 |
88 |
116 |
134 |
244 |
332 |
198 |
346 |
214 |
11 |
||
|
단백질치료제 |
112 |
143 |
116 |
134 |
163 |
178 |
204 |
282 |
448 |
230 |
510 |
232 |
41 |
||
|
신약후보물질 |
314 |
365 |
394 |
465 |
486 |
57 |
104 |
101 |
163 |
127 |
193 |
146 |
33 |
||
|
환경 |
환경생물공학 |
슬러지처리 |
9 |
12 |
9 |
18 |
5 |
10 |
17 |
25 |
62 |
58 |
74 |
61 |
33 |
|
생물학적수처리 |
193 |
251 |
222 |
210 |
188 |
217 |
230 |
259 |
273 |
245 |
269 |
189 |
96 |
||
|
계 |
2,352 |
2,717 |
2,729 |
2,870 |
2,982 |
2,893 |
3,415 |
4,273 |
5,332 |
4,304 |
6,023 |
4,281 |
1,055 |
||
라. 한국에 출원된 생명공학 특허 상위 10대 국가 현황
생명공학특허의 상위 10대 출원국가의 2000년 이후 누적출원건수를 살펴보면, 한국이 25,481건으로 가장 많고, 그 다음으로 미국이 6,938건, 일본이 3,353건 순으로 나타났다.
다출원 상위 10대 국가들을 보면 4~10위까지는 모두 유럽국가가 차지하고 있는 것으로 나타나, 유럽국가에서 생명공학관련 특허가 국내에 많이 들어오고 있음을 알 수 있다.

[그림 3-2-16] 한국특허의 상위 10개 출원국가의 최근12년 누적출원건수(2000~2011년)
최근 5년(2007~2011년)의 상위10대 국가별 분포현황을 국내전체특허동향과 비교하여 살펴보면, 한국전체특허에서는 한국출원건수가 652,970건으로 76.3%를 차지하는데 반해, 생명공학분야 특허에서는 13,323건(55.0%)로 다른 기술분야에 비해 적은 부분을 차지하고 있는 것으로 나타났다. 또한, 일본도 전체기술분야에 비해 생명공학분야의 국내 특허출원건수 비중이 높지 않은 것으로 조사되었다.
반면에, 미국과 다른 유럽국가들은 생명공학분야의 특허비중이 높게 나타나, 국내 특허출원에 상당부분을 생명공학분야가 차지하고 있음을 보여주고 있다.

[그림 3-2-17] 한국전체 다출원국가동향(최근5년)

[그림 3-2-18] 생명공학분야 다출원국가동향(최근5년)
마. 한국특허로 본 생명공학분야 중 기초산업의 선두주자
최근 5년(2007~2011년) 동안 생명공학 분야 중 기초산업의 기술분류별 Top 3를 조사한 결과, 단백질체와 생물자원탐색, 효소공학기술은 한국생명공학연구원이 가장 많은 특허출원건수를 보이는 것으로 나타났다. 서울대학교는 동식물세포배양 기술에서 51건으로 가장 많은 특허출원건수를 보였고, 단백질체 기술에서도 40건의 특허를 출원하고 있는 것으로 나타났다. 항체이용기술은 외국기업들이 Top 3 모두를 차지하고 있는 것으로 조사되었다. 제넨테크(코)가 95건, 에프호프만라로슈(AG)가 58건, 메다렉스(코)가 29건 순으로 나타났다.
[표 3-2-6] 한국특허의 생명공학 분야 기초산업의 연구개발 리더(2007~2011년)
|
세부기술 |
출원인 |
국적 |
건수 |
|
단백질체기술 |
한국생명공학연구원 |
KR |
49 |
|
서울대학교 |
KR |
40 |
|
|
에프호프만라로슈(AG) |
CH |
31 |
|
|
동식물세포배양기술 |
서울대학교 |
KR |
51 |
|
고려대학교 |
KR |
28 |
|
|
연세대학교 |
KR |
19 |
|
|
한국생명공학연구원 |
KR |
19 |
|
|
생물자원탐색기술 |
한국생명공학연구원 |
KR |
74 |
|
CJ제일제당 |
KR |
64 |
|
|
농촌진흥청 |
KR |
44 |
|
|
항체이용기술 |
제넨테크 (코) |
US |
95 |
|
에프호프만라로슈(AG) |
CH |
58 |
|
|
노파르티스 (AG) |
CH |
29 |
|
|
효소공학기술 |
한국생명공학연구원 |
KR |
37 |
|
농촌진흥청 |
KR |
28 |
|
|
다니스코 유에스 인크. |
US |
27 |
바. 미국에 등록된 생명공학 특허 동향
미국의 생명공학특허는 1990년대 중반이후 급성장, 2000년대 중반 조정기를 거쳐 2006년 이후 안정기를 거치고 있는 것으로 요약되어진다.
세부기술별로 살펴보면, 한국의 특허출원동향과 유사하게 측정진단의 조사·분석, 측정・시험, 의약의 단백질치료제, 치료용 항체, 유전체의 유전공학 등의 특허등록건수가 많은 것으로 나타났다.
그리고, 한국특허에는 많지 않은 유전체 분야의 당류기함유 핵산 분야와 형질전환동식물개발의 신규한 식물분야의 특허등록건수가 많은 것이 특징으로 나타나고 있다.
[표 3-2-7] 미국에 등록된 생명공학분야의 기술분류별 연도별 특허등록건수
|
기술분류 |
’00년 |
’01년 |
’02년 |
’03년 |
’04년 |
’05년 |
’06년 |
’07년 |
’08년 |
’09년 |
’10년 |
’11년 |
’12년 |
||
|
공정 |
생물공정 |
분리정제 |
17 |
20 |
10 |
14 |
8 |
4 |
7 |
4 |
2 |
0 |
4 |
1 |
1 |
|
생물학적합성 |
526 |
614 |
551 |
470 |
403 |
377 |
518 |
481 |
417 |
483 |
568 |
666 |
702 |
||
|
동식물세포배양장치 |
37 |
16 |
18 |
17 |
5 |
11 |
18 |
16 |
21 |
15 |
32 |
33 |
24 |
||
|
효소, 미생물관련장치 |
59 |
116 |
134 |
131 |
107 |
85 |
81 |
94 |
136 |
143 |
261 |
270 |
229 |
||
|
측정진단 |
조사, 분석 |
465 |
544 |
512 |
490 |
457 |
372 |
539 |
535 |
529 |
546 |
876 |
798 |
764 |
|
|
측정, 시험 |
1,087 |
1,332 |
1,125 |
981 |
876 |
732 |
878 |
894 |
827 |
834 |
1,099 |
1,104 |
1,077 |
||
|
기초 |
유전체 |
유전공학 |
615 |
645 |
495 |
478 |
456 |
361 |
585 |
581 |
392 |
458 |
601 |
587 |
589 |
|
당류기함유핵산 |
427 |
433 |
489 |
399 |
346 |
316 |
427 |
407 |
434 |
483 |
590 |
618 |
541 |
||
|
단백질체 |
펩티드 |
403 |
426 |
423 |
373 |
312 |
306 |
446 |
544 |
555 |
453 |
452 |
422 |
376 |
|
|
고정화펩티드 |
9 |
14 |
19 |
15 |
23 |
14 |
18 |
10 |
12 |
16 |
8 |
12 |
11 |
||
|
하이브리드펩티드 |
10 |
6 |
5 |
4 |
2 |
3 |
3 |
3 |
2 |
5 |
5 |
7 |
4 |
||
|
항체이용 |
면역글로불린 |
94 |
112 |
104 |
110 |
106 |
101 |
184 |
211 |
213 |
183 |
240 |
236 |
221 |
|
|
효소공학 |
효소 |
373 |
417 |
428 |
366 |
310 |
284 |
375 |
325 |
259 |
235 |
274 |
285 |
280 |
|
|
생물자원탐색 |
미생물 |
140 |
157 |
123 |
135 |
103 |
107 |
135 |
125 |
120 |
104 |
151 |
142 |
183 |
|
|
바이러스 |
41 |
35 |
53 |
30 |
31 |
23 |
35 |
33 |
39 |
47 |
27 |
31 |
41 |
||
|
동식물세포배양 |
동식물세포 |
278 |
283 |
257 |
238 |
200 |
180 |
216 |
202 |
186 |
206 |
268 |
290 |
327 |
|
|
농업 |
생물농약개발 |
생물농약 |
131 |
159 |
153 |
133 |
115 |
79 |
105 |
130 |
115 |
106 |
134 |
179 |
257 |
|
형질전환동식물 개발 |
신규한동물 |
21 |
56 |
51 |
51 |
35 |
26 |
59 |
50 |
55 |
43 |
50 |
31 |
43 |
|
|
신규한식물 |
909 |
911 |
1,411 |
1,226 |
1,333 |
1,020 |
1,547 |
1,534 |
1,720 |
1,591 |
1,643 |
760 |
1,047 |
||
|
식품 |
발효식품개발 |
알코올발효 및 장치 |
18 |
16 |
10 |
19 |
21 |
15 |
26 |
18 |
11 |
8 |
10 |
13 |
16 |
|
의약 |
생물의약개발 |
방사선의약 |
82 |
79 |
53 |
65 |
48 |
36 |
43 |
44 |
47 |
44 |
61 |
54 |
99 |
|
유전자치료 |
114 |
96 |
86 |
73 |
71 |
56 |
70 |
72 |
38 |
55 |
99 |
118 |
131 |
||
|
치료용항체 |
483 |
504 |
482 |
470 |
396 |
323 |
511 |
496 |
561 |
679 |
857 |
846 |
993 |
||
|
단백질치료제 |
672 |
644 |
547 |
538 |
528 |
524 |
707 |
653 |
660 |
724 |
995 |
907 |
1,002 |
||
|
신약후보물질 |
146 |
203 |
257 |
245 |
197 |
199 |
179 |
56 |
44 |
52 |
84 |
78 |
109 |
||
|
환경 |
환경생물공학 |
슬러지처리 |
1 |
1 |
0 |
2 |
1 |
2 |
0 |
1 |
2 |
5 |
4 |
2 |
1 |
|
생물학적수처리 |
113 |
110 |
97 |
96 |
121 |
115 |
117 |
152 |
150 |
140 |
142 |
108 |
122 |
||
|
계 |
7,271 |
7,949 |
7,893 |
7,169 |
6,611 |
5,671 |
7,829 |
7,671 |
7,547 |
7,658 |
9,535 |
8,598 |
9,190 |
||
사. 미국에 등록된 생명공학특허 상위 10대 국가 현황
미국에 등록된 특허의 상위 10대 국가의 특허건수를 살펴보면 미국이 59,869건으로 가장 많고, 일본이 7,215건, 독일이 3,961건 순으로 나타났다.
한국은 생명공학분야 미국특허 등록건수가 1,210건으로 조사되었다.

[그림 3-2-19] 미국특허의 상위 10대 등록국가의 최근13년 누적출원건수(2000~2012년)
최근 5년(2008~2012년)의 상위10대 국가별 분포현황을 미국전체특허동향과 비교하여 살펴보면, 미국전체특허에서는 미국이 497,323건으로 48.6%를 차지하고 있는데 반해 생명공학분야 특허는 23,883건(56.2%)를 차지해, 생명공학분야의 특허가 다른 기술분야에 비해 많은 부분을 차지하고 있는 것으로 조사되었다. 프랑스, 스위스 네델란드, 덴마크도 다른 기술분야에 비해 생명공학분야의 특허비중이 높은 것으로 나타났고, 일본과, 독일, 한국은 다른 기술분야에 비해 생명공학분야의 비중이 낮은 것으로 조사되었다.

[그림 3-2-20] 미국전체 다등록국가동향(최근5년)

[그림 3-2-21] 생명공학분야 다등록국가동향(최근5년)
아. 미국특허의 생명공학분야 기초산업 연구개발 리더
2008년~2012년 동안 생명공학분야 중 기초산업의 기술분류별 Top 3를 조사한 결과, 단백질체기술과 항체이용기술에서는 Genentech Inc가 각각 122건, 123건으로 가장 많은 등록건수를 보유하고 있는 것으로 나타났으며, 동식물세포 배양기술에서는 Wisconsin Alumni Research Foundation이 24건, 효소공학기술 에서는 Novozimes A/S가 112건, 생물자원탐색기술에서는 Ajinomoto Co가 19건의 특허를 보유하고 있는 것으로 나타났다.
[표 3-2-8] 미국특허의 생명공학 분야 기초산업의 연구개발 리더(2008~2012년)
|
세부기술 |
출원인 |
국적 |
건수 |
|
단백질체기술 |
Genentech Inc |
US |
122 |
|
ZymoGenetics, Inc. |
US |
42 |
|
|
University of California |
US |
35 |
|
|
동식물세포 배양기술 |
Wisconsin Alumni Research Foundation |
US |
24 |
|
Geron Corporation |
US |
20 |
|
|
University of California |
US |
14 |
|
|
생물자원탐색기술 |
Ajinomoto Co Inc |
JP |
19 |
|
E I DuPont de Nemours & Co |
US |
19 |
|
|
CJ Cheiljedang Corp. |
KR |
15 |
|
|
항체이용기술 |
Genentech Inc |
US |
123 |
|
Amgen Inc. |
US |
38 |
|
|
Human Genome Sciences, Inc. |
US |
25 |
|
|
효소공학기술 |
Novozymes A/S |
DK |
112 |
|
Verenium Corporation |
US |
30 |
|
|
Codexis, Inc. |
US |
30 |
4. 논문 현황
가. 개요
연구개발 결과는 논문을 통해 전파되고 이를 통해 학문이 발전하며 응용으로 연결된다. 연구자는 논문발표를 통해 연구결과에 대한 객관적인 비판과 평가를 받으며, 자신의 축적된 연구역량을 확인해주는 주요 수단이 되기도 한다. 이러한 논문의 현황분석은 우리나라 바이오의 수준과 역량을 보다 객관적으로 진단하는데 유용하다. 특히, 질적성과 중심의 선도형 R&D체계로 전환23)을 위해서는 논문의 양적수준 뿐 아니라 질적 수준에 대한 객관적인 분석이 필요하다.
논문분석을 위해서는 논문 데이터베이스(DB)를 활용한다. Thomson Reuters에서 발간하는 SCI(Science Citation Index) DB는 학계에 널리 알려진 DB로써 SCI 등재 학술지 논문수는 한 나라의 국제적인 연구개발 활동의 지표로서 널리 인식되고 있다. SCI DB는 30년 이상 엄정한 심사를 통과한 학술지에 대한 DB를 구축하여 제공함으로써 세계적인 권위를 인정받고 있다. 논문현황 분석은 SCI DB의 일종인 NSI(National Science Indicators, 1981~2012년)와 ESI(Essential Science Indicators, 2002~2012년)를 기반으로 하였다. 바이오분야 논문분석을 위해 SCI 과학기술 18개 분야 중 관련 6개 분야를 대상으로 하였다.
나. SCI논문 현황
2012년 우리나라 SCI논문수는 49,174편으로 세계 11위 수준이다(표 3-2-9). 세계 점유율도 2003년 대비 1.2% 증가하는 등 매년 양적으로 점진적인 증가 추세를 나타내고 있다.
[표 3-2-9] 최근 10년간 한국의 SCI논문 발표수 추이
|
연 도 |
2003년 |
2004년 |
2005년 |
2006년 |
2007년 |
|
논문발표수(편) |
21,133 |
22,726 |
27,896 |
28,475 |
27,441 |
|
세계 총 논문수(편) |
877,869 |
858,601 |
987,468 |
987,428 |
989,002 |
|
세계 점유율(%) |
2.41% |
2.65% |
2.83% |
2.88% |
2.77% |
|
세계 순위 |
14위 |
12위 |
11위 |
11위 |
12위 |
|
연 도 |
2008년 |
2009년 |
2010년 |
2011년 |
2012년 |
|
논문발표수(편) |
35,683 |
38,862 |
40,002 |
44,760 |
49,174 |
|
세계 총 논문수(편) |
1,172,959 |
1,208,182 |
1,190,523 |
1,260,891 |
1,363,608 |
|
세계 점유율(%) |
3.04% |
3.22% |
3.36% |
3.55% |
3.61% |
|
세계 순위 |
12위 |
12위 |
12위 |
11위 |
11위 |
우리나라 SCI논문의 최근 5년간(2008~2012년) 평균 피인용 횟수는 4.08회로 세계 평균(5.04회)과 비교했을 때 질적 수준에서 다소 차이를 보이고 있다(표 3-2-10). 하지만 우리나라의 평균 피인용 횟수의 연 평균 증가율은 5.6%로 세계 평균(2.2%) 대비 빠른 속도로 증가하고 있어 질적 수준이 점진적으로 개선될 것으로 기대된다.
[표 3-2-10] 5년 주기별 한국의 SCI논문 1편당 평균 피인용횟수 추이
|
국가명 |
’03~’07년 |
’04~’08년 |
’05~’09년 |
’06~’10년 |
’07~’11년 |
’08~’12년 |
|
한 국 |
3.11 |
3.30 |
3.49 |
3.58 |
3.84 |
4.08 |
|
세계 평균 |
4.52 |
4.64 |
4.79 |
4.81 |
4.93 |
5.04 |
다. 바이오분야 SCI논문 현황
우리나라 바이오 6개 분야의 최근 5년간(2008~2012년) SCI논문수는 표 3-2-11과 같다. 미생물학과 약리학 분야가 논문수로 세계 8위 수준이며, 점유율도 우리나라 평균(3.61%) 보다 높은 것으로 나타났다. 국가별로는 미국이 6개 분야 모두 월등히 앞서 있으며, 중국, 영국, 독일, 일본, 프랑스 순으로 나타났다(그림 3-2-22).
[표 3-2-11] 최근 5년간(2008~2012년) 한국의 바이오분야 SCI논문 수 점유율
|
분야명 |
분야 논문수 |
분야 논문수 세계순위 |
국내 점유율 |
한국 총 논문수 |
세계 점유율 |
세계분야 총 논문수 |
|
면역학 |
2,240 |
16위 |
1.08% |
208,119 |
2.15% |
104,346 |
|
미생물학 |
3,724 |
8위 |
1.79% |
208,119 |
4.48% |
83,198 |
|
분자생물학 & 유전학 |
5,259 |
12위 |
2.53% |
208,119 |
3.01% |
174,796 |
|
생물학 & 생화학 |
10,655 |
10위 |
5.12% |
208,119 |
3.44% |
309,366 |
|
신경과학 & 행동과학 |
4,866 |
14위 |
2.34% |
208,119 |
2.26% |
215,455 |
|
약리학 |
6,990 |
8위 |
3.36% |
208,119 |
4.24% |
164,783 |
|
생명공학 합계 |
33,734 |
11위 |
16.21% |
208,119 |
3.21% |
1,051,944 |

[그림 3-2-22] 최근 5년간(2008~2012년) 국가별 바이오분야 SCI논문수
연도별로는 분자생물학 및 유전학 분야의 SCI논문수가 최근 10년간 14.3%의 연평균 증가율을 보이며 가장 빠르게 증가하였으며, 면역학(13.8%), 신경과학 및 행동학(11.1%), 약리학(9.9%), 미생물학(8.9%) 순으로 SCI논문이 증가하고 있는 것으로 나타났다(표 3-2-12).
[표 3-2-12] 최근 10년간 한국의 연도별 생명공학분야 SCI논문수 추이
|
분야명 |
구분 |
2003년 |
2004년 |
2005년 |
2006년 |
2007년 |
|
면역학 |
논문수 |
179 |
218 |
232 |
273 |
294 |
|
피인용수 |
4,282 |
5,242 |
4,505 |
4,950 |
6,394 |
|
|
편당 평균 |
23.92 |
24.05 |
19.42 |
18.13 |
21.75 |
|
|
미생물학 |
논문수 |
397 |
455 |
552 |
621 |
646 |
|
피인용수 |
5,934 |
5,690 |
7,067 |
6,396 |
6,841 |
|
|
편당 평균 |
14.95 |
12.51 |
12.8 |
10.3 |
10.59 |
|
|
분자생물학 & 유전학 |
논문수 |
366 |
402 |
519 |
484 |
575 |
|
피인용수 |
10,352 |
11,638 |
12,803 |
12,146 |
13,001 |
|
|
편당 평균 |
28.28 |
28.95 |
24.67 |
25.1 |
22.61 |
|
|
생물학 & 생화학 |
논문수 |
1,223 |
1,379 |
1,625 |
1,647 |
1,572 |
|
피인용수 |
27,410 |
27,744 |
32,763 |
27,034 |
22,484 |
|
|
편당 평균 |
22.41 |
20.12 |
20.16 |
16.41 |
14.3 |
|
|
신경과학 & 행동과학 |
논문수 |
459 |
498 |
611 |
579 |
654 |
|
피인용수 |
10,085 |
10,786 |
13,542 |
10,241 |
9,349 |
|
|
편당 평균 |
21.97 |
21.66 |
22.16 |
17.69 |
14.3 |
|
|
약리학 |
논문수 |
678 |
717 |
919 |
817 |
1,006 |
|
피인용수 |
11,834 |
12,104 |
13,963 |
12,058 |
11,919 |
|
|
편당 평균 |
17.45 |
16.88 |
15.19 |
14.76 |
11.85 |
|
분야명 |
구분 |
2008년 |
2009년 |
2010년 |
2011년 |
2012년 |
|
면역학 |
논문수 |
320 |
364 |
423 |
562 |
571 |
|
피인용수 |
5,757 |
3,308 |
3,115 |
1,795 |
306 |
|
|
편당 평균 |
17.99 |
9.09 |
7.36 |
3.19 |
0.54 |
|
|
미생물학 |
논문수 |
807 |
678 |
646 |
739 |
854 |
|
피인용수 |
6,384 |
4,068 |
2,833 |
1,555 |
337 |
|
|
편당 평균 |
7.91 |
6 |
4.39 |
2.1 |
0.39 |
|
|
분자생물학 & 유전학 |
논문수 |
956 |
965 |
964 |
1153 |
1221 |
|
피인용수 |
12,191 |
11,257 |
7,390 |
3,768 |
738 |
|
|
편당 평균 |
12.75 |
11.67 |
7.67 |
3.27 |
0.6 |
|
|
생물학 & 생화학 |
논문수 |
1,920 |
1,972 |
2,128 |
2,247 |
2,388 |
|
피인용수 |
22,903 |
15,916 |
11,835 |
6,112 |
1,187 |
|
|
편당 평균 |
11.93 |
8.07 |
5.56 |
2.72 |
0.5 |
|
|
신경과학 & 행동과학 |
논문수 |
872 |
881 |
947 |
986 |
1,180 |
|
피인용수 |
10,071 |
7,475 |
5,056 |
2,590 |
511 |
|
|
편당 평균 |
11.55 |
8.48 |
5.34 |
2.63 |
0.43 |
|
|
약리학 |
논문수 |
1,230 |
1,331 |
1,361 |
1,487 |
1,581 |
|
피인용수 |
12,713 |
10,294 |
6,460 |
3,130 |
656 |
|
|
편당 평균 |
10.34 |
7.73 |
4.75 |
2.1 |
0.41 |

[그림 3-2-23] 한국의 연도별 바이오분야 SCI논문수 추이
최근 5년간 우리나라에서 발표한 바이오 6개 분야 SCI논문 33,734편 중 1회 이상 피인용된 논문은 24,107편으로 논문의 피인용율은 71.46%로 나타났다. 분야별로는 생물학 및 생화학, 약리학 분야의 피인용율이 세계 평균 대비 98% 수준으로 세계 평균 수준에 근접하였다(표 3-2-13).
[표 3-2-13] 최근 5년간(2008~2012년) 한국의 바이오분야 SCI논문 피인용율
|
분야명 |
피인용율 |
피인용된 논문수 |
분야 논문수 |
세계대비 비율 |
세계분야 평균 피인용율 |
|
면역학 |
73.17% |
1,639 |
2,240 |
0.93 |
78.55% |
|
미생물학 |
70.41% |
2,622 |
3,724 |
0.95 |
74.32% |
|
분자생물학 & 유전학 |
67.47% |
3,548 |
5,259 |
0.85 |
79.09% |
|
생물학 & 생화학 |
74.50% |
7,938 |
10,655 |
0.98 |
76.06% |
|
신경과학 & 행동과학 |
71.09% |
3,459 |
4,866 |
0.94 |
75.81% |
|
약리학 |
70.11% |
4,901 |
6,990 |
0.98 |
71.47% |
|
생명공학 합계 |
71.46% |
24,107 |
33,734 |
0.94 |
75.90% |
최근 5년간 우리나라 SCI논문의 바이오 6개 분야 평균 피인용수는 5.39회로 세계 평균(8.02)대비 67% 수준으로 나타났다. 10년전(1998~2002년) 46% 수준과 비교했을 때 질적으로 빠르게 성장하고 있는 것으로 나타났다. 최근 5년간 6개 분야 중 약리학 분야의 평균 피인용수가 세계 평균 대비 84% 수준으로 가장 높았다.
[표 3-2-14] 생명공학분야 한국 및 세계의 SCI논문 피인용 추세
|
분야명 |
1998~2002년 |
2003~2007년 |
2008~2012년 |
||||||
|
국내 평균 |
세계평균대비 |
세계평균 |
국내 평균 |
세계평균대비 |
세계 평균 |
국내 평균 |
세계평균대비 |
세계 평균 |
|
|
면역학 |
4.52 |
0.53 |
8.60 |
5.4 |
0.59 |
9.21 |
6.38 |
0.69 |
9.25 |
|
미생물학 |
2.5 |
0.37 |
6.79 |
3.41 |
0.46 |
7.38 |
4.08 |
0.59 |
6.93 |
|
분자생물학 & 유전학 |
4.61 |
0.40 |
11.5 |
6.65 |
0.58 |
11.39 |
6.72 |
0.59 |
11.36 |
|
생물학 & 생화학 |
3.58 |
0.50 |
7.22 |
5.02 |
0.67 |
7.47 |
5.44 |
0.74 |
7.37 |
|
신경과학 & 행동과학 |
4.03 |
0.60 |
6.69 |
4.9 |
0.67 |
7.28 |
5.28 |
0.67 |
7.86 |
|
약리학 |
2.33 |
0.56 |
4.18 |
3.38 |
0.66 |
5.14 |
4.76 |
0.84 |
5.68 |
|
생명공학 합계 |
3.44 |
0.46 |
7.53 |
4.67 |
0.59 |
7.92 |
5.39 |
0.67 |
8.02 |
라. 바이오분야 SCI 고피인용(상위1%) 논문 현황
최근 11년간 우리나라의 바이오 6개 분야 피인용 상위1% SCI논문수는 226편으로 세계 18위 수준이며, 피인용 상위1% SCI논문 비율은 0.44%로 세계 평균(1%)에 미치지 못하는 것으로 나타났다. 하지만, 연도별 현황을 분석하면 피인용 상위1% 논문비율은 2002~2006년 0.36%에서 2008~2012년 0.47%로 점진적으로 증가하고 있는 것으로 나타났다. 최근 5년간 분야별로는 면역학 분야가 피인용 상위1% SCI논문 비율이 0.75%로 세계 평균(1%)에 가장 근접한 것으로 나타났다. 반면, 분자생물학 및 유전학, 신경과학 및 행동과학 분야는 피인용 상위1% SCI논문 비율이 점차 감소하는 것으로 나타났다.
[표 3-2-15] 최근 11년간(2002~2012년) 한국의 바이오분야 피인용 상위1% SCI논문 비율
|
분야명 |
분야 1%논문수 |
분야 1%논문수 순위 |
분야 전체논문수 |
분야 1%논문 비율 |
|
면역학 |
14 |
19위 |
2,626 |
0.53% |
|
미생물학 |
21 |
21위 |
7,580 |
0.28% |
|
분자생물학 & 유전학 |
46 |
20위 |
7,005 |
0.66% |
|
생물학 & 생화학 |
79 |
17위 |
18,267 |
0.43% |
|
신경과학 & 행동과학 |
17 |
22위 |
5,847 |
0.29% |
|
약리학 |
49 |
15위 |
9,673 |
0.51% |
|
생명공학 합계 |
226 |
18위 |
50,998 |
0.44% |
[표 3-2-16] 5년 주기별 한국의 바이오분야 피인용 상위1% SCI논문 비율
|
분야명 |
’02~’06년 |
’03~’07년 |
’04~’08년 |
’05~’09년 |
’06~’10년 |
’07~’11년 |
’08~’12년 |
|
면역학 |
|
0.22% |
0.60% |
0.74% |
0.74% |
0.87% |
0.75% |
|
미생물학 |
0.11% |
0.20% |
0.24% |
0.30% |
0.34% |
0.41% |
0.36% |
|
분자생물학 & 유전학 |
0.87% |
0.80% |
0.70% |
0.73% |
0.72% |
0.63% |
0.53% |
|
생물학 & 생화학 |
0.32% |
0.41% |
0.48% |
0.43% |
0.44% |
0.52% |
0.46% |
|
신경과학 & 행동과학 |
0.55% |
0.50% |
0.42% |
0.34% |
0.25% |
0.20% |
0.18% |
|
약리학 |
0.31% |
0.36% |
0.52% |
0.53% |
0.63% |
0.67% |
0.63% |
|
생명공학 합계 |
0.36% |
0.41% |
0.48% |
0.48% |
0.49% |
0.53% |
0.47% |

[그림 3-2-24] 연도별 한국의 바이오분야 피인용 상위1% SCI논문 비율 추이
5. 산업 현황
산업통상자원부와 한국바이오협회가 국가표준 KS J 1009(바이오산업 분류체계)에 따라 국내 바이오기업 921개사를 조사한「2011년도 기준 국내 바이오산업 실태조사」결과, 국내 바이오산업 생산·판매 및 수출입이 지속적인 증가세를 보이고 있는 것으로 나타났다.
가. 바이오산업체의 지역 분포
국내 바이오기업은 본사와 바이오사업장 모두 서울·경기 지역에 많이 위치하며, 본사는 서울에 309개, 바이오사업장은 경기에 302개가 있다.
종업원 수 50인 미만의 기업이 전체의 58%를 차지하고, 50인~300인 미만이 25%를 차지하는 등 83%의 기업이 300인 미만의 중소기업이다.
(단위 : 개)

* 바이오사업장의 경우 공장 > 연구소 > 본사의 순서로 소재지 분석
[그림 3-2-25] 바이오산업체의 소재지별 분포
나. 바이오산업 수급 현황
2009년~2011년 바이오산업의 수급변화 추이를 보면 생산과 내수 모두 지속적인 성장을 보이고 있으며, 2009년 이후 연평균 증감률은 수급 10.1%, 생산 11.0%, 내수 11.5%로 매년 증가세를 보이고 있다.
2011년 기준 바이오산업 수급 규모는 총 8조 996억 원이며, 공급 시장에서의 생산 비중은 81.5%인 6조 6,019억원이며, 수입 비중은 18.5%인 1조 4,978억원 이다.
반면, 수요 시장에서의 내수 규모는 총 수급 규모의 65.1%인 5조 2,718억원이며, 수출 규모는 2조 8,278억원으로 총 수급 규모의 34.9%로 나타났다.
바이오산업의 내수시장에서 가장 큰 비중을 차지하고 있는 산업은 바이오의약 산업이며, 전체 시장의 53.7%인 2조 8,306억원 규모로 나타났다.
(단위 : 억원)

[그림 3-2-26] 2009년~2011년 바이오산업 생산 및 내수 변화
다. 바이오산업 국내판매 현황
2011년 기준 국내 바이오산업의 국내판매 규모는 3조 7,741억원으로 2010년 3조 3,985억원 대비 3,756억원(11.1%)이 증가하였다.
바이오의약산업이 1조 6,468억원으로 국내판매 규모에서 가장 큰 비중(43.6%)을 차지하고 있으며, 다음으로는 바이오식품산업이 1조 1,867억원(31.4%), 바이오화학산업이 3,924억원(10.4%)으로 이들 3개 분야가 전체 시장 중 85.4%(2010년에는 83.4%)를 차지하고 있다.
국내판매 비중이 높은 제품군은 사료첨가제 5,836억원으로 전체 바이오산업 국내판매액의 15.5%의 비중을 차지하였으며, 다음으로는 혈액제제(13.0%), 기타 바이오의약제품(12.8%) 순으로 나타났다.
(단위 : 백만원, %)

[그림 3-2-27] 2011년 기준 바이오산업 분야별 국내판매 규모
라. 바이오산업 수출 현황
바이오산업 수출액은 2009년 2조원을 넘어선 이후 2010년에 0.3% 감소하였으나, 2011년에는 2조 8,278억원을 기록하여 2010년 대비 15.9% 증가하였다.
2011년 분야별 수출규모를 보면, 바이오식품산업이 1조 5,377억원(54.4%)으로 가장 높고, 다음으로 바이오의약산업이 9,609억원(34.0%)이다.
가장 많은 수출규모를 나타낸 제품은 사료첨가제로 1조 885억원(38.5%)의 높은 수출 비중을 차지했으며, 다음으로 식품첨가물(13.2%), 백신(8.9%), 항암제(8.7%) 순으로 나타났다.
수출규모 기준으로, 수출 상위 10개 제품 중 6개가 바이오의약이며, 바이오식품과 바이오전자가 각각 2개 제품이다.
[표 3-2-17] 2011년 기준 주요 바이오제품 수출 현황
(단위 : 백만 원, %)
|
순위 |
제 품 명 |
수출액 |
구성비 |
|
1 |
사료첨가제 |
1,088,476 |
38.5 |
|
2 |
식품첨가물 |
373,617 |
13.2 |
|
3 |
백신 |
251,849 |
8.9 |
|
4 |
항암제 |
245,145 |
8.7 |
|
5 |
진단키트 |
133,110 |
4.7 |
|
6 |
바이오센서 |
89,843 |
3.2 |
|
7 |
항생제 |
85,959 |
3.0 |
|
8 |
혈액제제 |
70,614 |
2.5 |
|
9 |
기타바이오의약제품 |
69,374 |
2.5 |
|
10 |
기타바이오전자제품 |
68,069 |
2.4 |
마. 바이오산업 수입 현황
2011년 기준 국내 바이오산업의 수입액은 1조 4,978억원으로 2010년 1조 3,883억원 보다 1,095억원(7.9%) 증가하였으며, 바이오의약산업이 1조 1,839억원으로 전체 수입액의 79.0%로 가장 높은 비중을 보였다.
전체 수입액 중 항암제가 2,886억원(19.3%)으로 2011년 가장 많은 수입 규모를 나타났으며, 다음으로는 백신 2,745억원(18.3%), 바이오공정 및 분석기기 2,027억원(13.5%), 혈액제제 1,359억원(9.1%) 순으로 나타났다.
수입규모 기준으로, 상위 10개 제품 중 8개가 바이오의약제품이었으며, 바이오의약제품 수입액이 전체 수입액의 77.4%를 차지하고 있다.
[표 3-2-18] 2011년 기준 주요 바이오제품 수입 현황
(단위 : 백만 원, %)
|
순위 |
제 품 명 |
수입액 |
구성비 |
|
1 |
항암제 |
288,576 |
19.3 |
|
2 |
백신 |
274,505 |
18.3 |
|
3 |
바이오공정 및 분석기기 |
202,691 |
13.5 |
|
4 |
혈액제제 |
135,867 |
9.1 |
|
5 |
기타바이오의약제품 |
125,652 |
8.4 |
|
6 |
호르몬제 |
117,904 |
7.9 |
|
7 |
면역제제 |
98,873 |
6.6 |
|
8 |
동물약품 |
88,147 |
5.9 |
|
9 |
연구․실험용 효소 및 시약류 |
37,530 |
2.5 |
|
10 |
진단키트 |
29,162 |
1.9 |
1) 「2012년 기술수준평가」, 미래창조과학부, 2013
2) 의료 분야 17개 전략기술의 기초연구 수준은 62.7∼89.5%에 분포, 응용·개발연구 수준은 67.9∼89.3%에 분포
3) 세계 시장규모 약 69억 달러(2009년) → 약 320억 달러(2018년) 규모로 성장 예상, 선진국의 연구개발 투자 강화 (MedMarket Diligence, LLC, 2010)
4) ’09년 유전체 기술을 활용한 맞춤의학의 세계 시장 규모는 약 2250~2320억불 규모 수준이며 매년 약 20%의 고성장 지속 전망(Nature Genetics, 2010)
5) 시장점유율(2010년) : 북미(38.3%), 유럽(29.0%), 아시아 등(14.8%), 중남미(6.2%) 시장성장률(2011∼2015년) : 북미(0∼3%), 유럽(2∼5%), 아시아 등(11∼14%), 중남미(11∼14%)
6) 국내 u-Health 시장 규모는 3,800억 원(2010년) → 7,880억 원(2014년)으로 연평균 20% 성장 예상 (생명공학백서, 舊과학기술부, 2007)
7) 2020년 이후 IT·BT·NT 등의 융합에 따른 기술개발이 두드러질 것으로 예상(The Global Technology Revolution 2020, RAND, 2006)
8) 10년 이내 상용화 가능 분야에 대한 세계 전문가 대상 조사결과, 나노표적 약물전달체‧바이오센서‧분자영상진단 등 포함 (EU 'Nano-to-Life' 프로젝트, 2006)
9) 우리나라 재생의학의 기술경쟁력 평가, STEPI, 2006.10
10) 미래창조과학부, 교육부, 농림축산식품부, 산업통상자원부, 보건복지부, 식품의약품안전처
11) 생명공학종합정책심의회, 2006.5.29
12) 미래창조과학부, 산업통상자원부, 농림축산식품부, 환경부, 식품의약품안전처, 농촌진흥청
13) 유전자 조작기술(유전공학), 세포 융합기술(세포공학), 세포 대량 배양기술(세포배양공학), 생물공정기술(효소공학), 미생물 이용기술(미생물공학)
14) 환경의 자정능력을 향상시키고 사람과 자연에 대한 환경피해유발요인을 억제․제거하는 기술로서 환경오염을 사전에 예방․저감하고 오염 및 훼손된 환경을 복원하는 등 환경의 보전 및 관리에 필요한 기술 (「환경기술개발 및 지원에 관한 법률」)
15) 대기, 수질, 상․하수도, 폐기물, 소음․진동 등과 같은 환경적 유해요인을 측정․예방․제어․복구하거나 환경피해를 최소화하기 위한 제품 생산 또는 서비스를 제공하는 산업 활동
16) 생물다양성협약, 기후변화협약, 사막화방지협약
17) 물리적, 화학적, 생물학적, 광학적 정보를 센서에서 인식하여 전기적 신호나 소리, 광 등을 이용하여 대상 오염물질을 감지하는 기술
18) “The Bioeconomy to 2030 - designing a policy agenda" OECD 2009
19) 기술분야별 투자현황 분석은 과학기술계열 및 국방 연구개발사업(인문사회계열 제외)을 분석대상으로 하며, 2012년에는 14조 6,795억원이 대상금액임
20) 기초연구비
22) 한국특허의 경우 출원 이후 18개월 후 공개되기 때문에 2012년 특허출원건수는 2013년 8월 31일까지 공개된 건수로 전체 출원건수를 반영하고 있지는 않음
![]()



1. 유전체연구
가. 개요
유전체(Genome)는 유전자(Gene)와 염색체(Chromosome)의 합성어로서 총 염색체 DNA의 전체 서열을 의미하며, 유전체 연구(Genomics)는 유전체에 존재하는 모든 유전자의 분석 및 구조와 기능을 파악하는 학문을 뜻한다.
유전체연구는 연구 성격에 따라 유전체정보 생산 및 분석에 초점을 맞추는 염기서열 해독연구(기초 유전체연구 또는 구조유전체연구)와 분석된 정보를 토대로 신약개발 등 응용이 가능한 유전체기능 규명연구(응용유전체연구 또는 기능유전체연구)로 구분 지을 수 있다.
2000년에 종료된 인간게놈 프로젝트를 기점으로 현재까지 유전체 연구는 각 분야에서 눈부신 발전을 이루어 오고 있으며, 유전체 연구를 기반한 생명공학 연구는 보건의료, 환경, 농업, 에너지 등 현대인류가 직면한 문제 해결의 실마리가 될 것으로 기대되고 있다.
(1) 유전체 해독 기술의 급격한 발전
NGS(Next-Generation Sequencing)로 불리는 차세대염기서열해독기술의 발전을 통해 유전체 레벨에서 다양한 생명현상 탐구가 가능하게 되었으며, 해독 기술의 응용은 현재 진행 중인 연구 패러다임의 급격한 변화를 가져오게 하였다.
2007년에 도입된 NGS의 눈부신 발전은 인간 1명의 유전체 분석 비용을 2000년 30억 달러에서, 2010년 6천 달러로 급감하였으며, 3세대 염기서열 해독기술의 발전으로 인해 2014년 이후에는 1천불 이하로 낮아질 것으로 예측되어 진다. 그리고 인간 1명의 전체 유전체를 해독하기 위해 2007년에는 약 15일이 걸렸으나, 현재는 단 하루 만에 전체 유전체 해독이 가능하게 되었으며, 2014년 이후에는 약 4시간으로 줄어들 것으로 예측되고 있다.
|
구 분 |
보급 연도 |
해독염기 길이 |
해독총염기수 |
30억 염기 서열해독/대 |
|
|
3세대 |
PacBio |
2014년 |
~1,500 |
~1,000억/시 |
약 4시간 |
|
2세대 |
Illumina HiSeq2500 |
2012년 |
100 |
~30억/일 |
약 1일 |
|
HeliScope |
2008년 |
20~45 |
~10억/일 |
약 3일 |
|
|
ABI SOLiD |
2007년 |
25~35 |
~20억/10일 |
약 15일 |
|
|
Solexa |
2007년 |
25~50 |
~10억/5일 |
약 15일 |
|
|
454FLX |
2006년 |
~250 |
~1억/일 |
약 30일 |
|
|
DeNOVA |
2006년 |
~1,000 |
~0.05억/일 |
약 600일 |
|
|
1세대 |
ABI3730xl |
2002년 |
~800 |
~0.02억/일 |
약 1,500일 |
따라서, NGS의 발달에 따른 인간 유전자 해독비용의 감소는 NGS의 보편화를 촉진시켜 ʻʻ개인유전체해독ʼʼ 시대를 예측할 수 있게 한다. 또한 동물, 식물, 미생물까지 유전체 해독 연구가 확대되면서 현재 인류가 직면한 환경, 식량, 에너지, 자원 등의 문제 해결을 위한 실마리 제공 및 막대한 산업적 파급효과가 예상된다.
(2) 유전체 염기서열 분석 시장의 급성장
최근 NGS 기술의 발전을 통한 유전체 해독시간 및 분석비용의 혁신적인 감소는 개인유전체분석 수요를 증가 시켰으며, 이에 대응하는 유전체정보 해독 및 분석 시장은 빠르게 증가하는 추세이다.
NGS를 이용한 유전체정보 활용 시장은 연평균 48.9%의 급증세를 나타내며, 유전체정보 분석 산업 시장은 2014년 총 86억 달러에 달할 것으로 예측되고 있다. 또한 세계 유전자 치료제 시장 규모는 2015년 4.8억 달러, 개인 유전체 분석시장은 8.7억달러 규모로 커질 것으로 예상되고 있다. 국내 개인 유전체 서비스 시장은 아직 초기 단계지만 2014년에는 3000억원, 2015년에는 6000억원으로 급증할 것으로 기대되고 있다.
(3) 유전체 연구를 통한 질병 조기진단 및 맞춤의료 실현
개인유전체 해독 기술의 발전을 통해 개별 환자 특성에 맞는 개인맞춤치료 (tailored personalized medicine)가 대두되고 있다. 3세대 염기서열분석기술의 발달은 1천불 이하로 개인의 DNA 정보 습득을 가능하게 하였으며, 이는 각 개인의 맞춤형 질병치료로 이어져 현재의 치료 방법보다 더욱더 효과적인 치료 및 치료비 절감효과까지 가능하게 할 것으로 예상되고 있다. 또한 개인유전체 해독 기술은 각 개인에게 발생할 질병의 조기 진단을 가능하게 하여 환자별 특정 유전자 유무에 따라 특정 질환의 발병 가능성을 예측하게 할 것이다.
현재 맞춤의료 시장 및 분자진단 시장은 빠르게 성장하고 있다. Research and Markets사의 보고에 따르면 2015년 맞춤의료 시장은 1,484억 달러 규모로 확장될 것이며, Datamonitor 자료는 2016년 세계 분자진단 시장은 53억 달러 규모로 성장할 것으로 전망하였다. 따라서 유전체 관련 산업은 국가 산업 발전의 중요한 축을 담당하게 될 것으로 기대되고 있다.

출처 : 동아일보, 2010. 5. 7, ʻ염기서열 분석기술의 발달ʼ
[그림 4-1-1] 개인유전체 해독비용 및 유전체정보 데이터 양의 증가추이
나. 해외 동향
세계 주요 선진국은 NGS를 기반으로 ʻ1000 Genome Projectʼ, ʻICGCʼ (International Cancer Genome Consortium), ʻGenome 10K Projectʼ 등의 다양한 공동연구를 진행하고 있다. 주요 연구영역으로는 인간유전체를 중심으로 한 유전체 기능분석 및 질병과의 상관관계 분석연구이며, 이는 의료/제약 산업에의 실용을 목적으로 하고 있다.
미국은 NHGRI(National Human Genome Research Institute) 및 JGI (Joint Genome Institute)를 중심으로 264개소의 유전체 센터를 운영하여 질병의 치료와 진단을 위한 실용적 연구를 추진하고 있으며, 영국은 Wellcome Sanger Institute와 BBSRC, TGAC외 45개소를 운영하며 유전체와 질병의 상관관계 규명을 위한 국가 주도의 대규모 프로젝트를 추진하고 있다, 중국은 BGI외 11개소, 일본은 오믹스과학센터(OSC)외 10개소 유전체 거점센터를 운영하고 있다. 특히 중국은 유전체 정보산업의 중요성을 인식하고 1999년 BGI(Beijing Genomics Institute)를 설립한 후 세계 최고 수준의 유전체 분석 센터를 목표로 하고 있다. 현재 단일 센터로는 가장 많은 166대의 NGS를 보유하고 있으며, 매년 4,000~5,000억 원을 투자함으로써 세계 유전체 연구 중심으로 급부상하고 있다.
|
국가 |
센터명 |
NGS 기기수 |
|
중국 |
BGI |
166 |
|
미국 |
Broad Institute |
101 |
|
미국 |
The Genome Center at Washington University |
62 |
|
영국 |
Wellcome Trust Sanger Institute |
38 |
|
미국 |
Human Genome Sequencing Center, BCM |
28 |
|
미국 |
Yale Center for Genome Analysis |
20 |
|
캐나다 |
Ontario Institue for Cancer Research |
17 |
|
캐나다 |
McGill University and Genome Quebec Innovation Center |
16 |
|
중국 |
Beijing Institute of Genomics |
15 |
|
캐나다 |
Michael Smith Genokme Sciences Center |
13 |
|
출처 : 한국과학기술기획평가원, 2012, 「포스트게놈 신산업육성을 위한 다부처 유전체 사업」 |
||
다. 국내 현황
국내 유전체 연구는 (舊)교육과학기술부의 21세기 프런티어사업을 통해 시작되었으며, 이후 각 부처의 특성에 따라 확대 추진되고 있다
미래창조과학부는 21C프론티어연구개발사업과 바이오기술개발사업을 통해 유전체 연구의 인프라구축 및 유전체 관련 제품화 연구를 추진하였으며, 보건복지부는 한국인유전체분석기반연구사업, 보건의료유전체사업, 차세대맞춤 의료유전체사업을 추진하여 주요 질병 연관성 분석을 통한 질병의 예방, 진단 및 치료 연구를 진행하고 있다, 농림축산식품부는 농업생명공학연구 및 농업생명공학기술 개발사업(구 바이오그린21사업)을 통해 농업관련 식물 및 미생물 유전체 연구를, 해양수산부는 해양생명공학기술개발사업(구 마린바이오21)을 통해 해양생물의 유전체 연구 및 활용에 대한 연구를 진행하고 있다.
또한 유전체 기술이 가져올 미래사회 변화에 적극적으로 대비하고 우리나라의 글로벌 경쟁력을 높이기 위하여 ʻ포스트게놈 신산업 육성을 위한 다부처 유전체 사업ʼ을 기획하였으며, 2012년 본 사업의 예비타당성을 인정받아 2014년부터 2021년까지 5,788억원을 유전체 연구에 투자할 예정이다. 본 사업은 범정부적 차원에서 진단치료 개발, 고부가가치 생명자원, 유전체 분석기술 등 연구기반 확보를 목표로 하고 있다.
|
기관 |
Illumina GAII |
Illumina HiSeq2000/2500 |
SOLiD4 |
Roche GS FLX |
활용 |
|
마크로젠 |
|
19 |
1 |
3 |
민간기업 |
|
테라젠이텍스 |
|
5 |
|
|
민간기업 |
|
디엔에이링크 |
1 |
4 |
|
1 |
민간기업 |
|
나이셈 |
1 |
1 |
|
1 |
대학 |
|
한국생명공학연구원 |
1 |
1 |
|
1 |
출연연 |
|
서울의대 유전체의학 연구소 |
1 |
2 |
1 |
|
대학 |
|
GIST |
1 |
|
|
|
대학 |
|
DGIST |
|
1 |
|
|
대학 |
|
포항공대 |
1 |
|
|
|
대학 |
|
가천의대 |
1 |
|
2 |
|
대학 |
|
연세대 |
1 |
|
|
|
대학 |
|
한양대 |
|
2 |
|
|
대학 |
|
서울대약대 |
|
|
1 |
|
대학 |
|
삼성메디칼센터 |
|
1 |
|
2 |
병원 |
|
합계 (57) |
8 |
36 |
5 |
8 |
|
국내의 유전체 관련 시장은 유전체 분석 중심으로 형성되고 있으며 유한양행, SK케미칼과 같은 주요 제약회사와 유전체 분석업체가 전략적 협약을 맺고 유전체 분석 서비스를 판매하는 등 상위 제약업체들의 시장 진입이 가속화되고 있다.
현재 대한민국은 세계 10위권 내의 NGS 보유국으로 총 57대(2013년 4월 기준)를 운용하고 있는 것으로 파악되고 있다. 그 중 Illumina HiSeq2000 /2500은 총 36대가 운용되고 있으나, 이중 28대는 마크로젠 등 민간기업에서 운용되고 있다. 이는 국가 정부 중심의 유전체 거점기반을 구성하고 있는 선진국에 비해 민간기업 중심의 유전체 기반 구축이 이루어져 유전체 정보 생산, 데이터 관리 및 이용의 문제점이 대두되고 있는 실정이다.
따라서 향후 도래할 맞춤의료시대에 대비하기 위해서는 국가 주도형 유전체 연구개발 전략 정책이 필요하며, 폭발적인 증가가 예상되어지는 유전체정보 분석에 대응하기 위한 국가 주도형 정보처리 인프라와 유전체 분석 기반이 구축되어야 될 것이다.
라. 발전 전망
유전체 해독 정보 및 기술의 발전은 의약품, 식품, 에너지, 산업소재 등의 다양한 분야로의 적용을 가능하게 할 뿐만 아니라 현재 인류가 직면하고 있는 난제를 해결할 수 있는 중요한 요소가 될 것 이다.
1,000달러 게놈분석이 가능해짐에 따라 개인 맞춤의료 시장이 급격히 증가하게 될 것이며, 그 결과 개인유전체 정보기반의 미래의학시대가 도래할 것으로 예상되고 있다. 즉, 예측의학, 맞춤의료, 예방의학의 개념이 보편화 되는 등 질병치료 및 신약개발에서 커다란 패러다임 변화가 일어날 것으로 예상된다.
또한, 폭발적인 유전체정보량 증가로 대량의 유전체 정보 분석 능력이 산업적 활용에 있어서 병목이 되고 이를 해결하기 위한 정보처리 인프라와 관련 원천기술 개발이 주요한 분야로 대두될 것이다.
그리고 학문간 유기적 협조가 가능해져서 질병기전 연구, 기초생명과학, 임상의학과 같은 기초 의과학분야 뿐만 아니라 새로운 치료기술 개발에 따른 의학기술의 동반 발전이 가능할 것이며, 자동화와 대용량화에 의한 기계, 재료, 컴퓨터, 전자공학 등의 분야로 기술파급효과가 클 것으로 기대되고 있다.
따라서 유전체 연구는 국가경쟁력 강화 및 국민 복지 증진을 위한 핵심 기반 기술로서, 유전체 연구의 혁신적인 발전은 신약 개발을 포함한 국가연구에 전반적으로 영향을 줄 것으로 예상되고 있다.
2. 단백질체 연구
가. 개요
(1) 단백질체학(Proteomics : 프로테오믹스)이란?
단백질체학은 세포, 조직, 혈액 등에서 발현되는 모든 단백질의 총합인 단백질체에 대한 총체적인 연구로, 생체의 활동, 질병, 노화 등에 따른 단백질 발현 정량화뿐 아니라 단백질의 위치와 변화, 상호작용, 기능과 구조 분석까지를 포함하며, 유전체 서열과 생명 현상을 연결하는 정보를 제공하여 새로운 질병 치료제 및 진단 시약개발에 있어서의 가장 강력한 연구 분야로 인식되고 있다.
(2) 단백질체학의 핵심기술
단백질체학 기술은 크게 프로테옴 분석기술, 단백질기능 규명기술, 단백질체 정보기술로 나뉘며, 핵심기술인 프로테옴 분석 기술은 2차원 전기영동과 액상크로마토그라피와 같은 프로테옴 분리분획 기술과 질량분석을 이용한 단백질 동정 및 정량 기술이 주를 이룬다. 단백질기능 분석은 단백질 상호작용 및 경로 분석, 단백질구조 규명 및 디자인, 세포 및 개체 기반 단백질기능 검증 기술 등으로 구분되며, 단백질체 정보기술은 프로테오믹스 전과정에서 자료 분석 및 결과 해석에 기반이 되는 기술이다.

[그림 4-1-2] 단백질체학 핵심기술
나. 해외 동향
(1) 최근 기술개발 동향
(가) 분리분획기술
폭넓은 프로테옴 분석범위를 확보하기 위해 프로테옴 분리분획 기술이 필요함에 따라 단백질과 펩티드 수준에서 다양한 크로마토그래피적 분획법이 개발되어 사용되고 있다. 이 분획법들은 역상크로마토그래피와 결합된 다차원 분리기술로 적용되어 검출의 다이내믹레인지를 크게 증가시키고 있다. 단백질 분획법으로는 일반적인 gel 기반의 기술, PF2D automated chromotofocusing, Reversed-phase liquid chromatography(RPLC) 등의 LC 기반의 기술, FFE나 IEF, 특히 Off-gel electrophoresis나 Rotofor 등의 액체상 IEF 기술들이 사용되고 있다. 펩티드 수준에서의 분획법으로는 역시 Off-gel electrophoresis, SCX나 basic pH RP의 LC 기술 등 액체상 분리 기술이 다양한 형태로 사용되고 있다.
질량분석계와 온라인 연계되는 분리기술은 미세관 RPLC 기술이 지배적으로 사용되고 있다. 최근 개발되고 있는 주목할 만한 미세관 RPLC 기술은 고정상 충진물의 소형화, 극소 내경의 미세관 충진컬럼기술, 두 개 이상의 다른 분리원리를 온라인으로 병합한 혼성화 혹은 온라인 다차원 분리, 다양한 분리기능을 하나의 LC에 구현하는 다기능 LC 기술, 그리고 다중 컬럼의 채용으로 분리실험의 효율성을 극대화하는 기술 등이다. 또한 시료 분획화 기술(High-pressure, high-resolution separations coupled with intelligent selection and multiplexing, PRISM)과 농축기술(Stable isotope standards with capture anti-peptide antibody, SISCAPA)의 발달로, 소형화된 충진물이 아닌 일반 LC를 활용해 미량의 타겟에 대한 실험 재현성을 극대화시키는 연구도 진행되고 있다.
(나) 질량분석기술
최근 질량분석기술의 지배적인 동향은 다양한 질량분석기술의 혼성화 (hybridization)이다. 이온트랩-후리에 변환(Fourier transform, FT) 질량분석계의 결합, 이온트랩-오비트랩 질량분석계의 결합, 그리고 ion mobility 기기와 후리에 변환 질량분석계 혹은 Q-TOF와의 결합 등 다양한 혼성 질량분석계가 제품화되고 있다. 최근에는 사중극자 이온필터와 오비트랩이 C-트랩과 HCD 분해기법으로 연계된 질량분석 장비, 더 나아가 사중극자 이온필터, 오비트랩, 사중극자 선형이온트랩이 혼성화된 질량분석 장비 등이 다양한 실험에 활용되고 있다. 트랩 기반의 FT-MS 기술의 발전과 더불어 사중극자 이온필터와 TOF의 혼성화 기술은 데이터 획득 속도의 획기적 개선과 이온검출기의 신호 처리 기술 및 감도 개선, 그리고 DIA 등의 MS/MS 실험기법 개발에 따라 프로테오믹스 실험의 정량성 개선에 기여하고 있다.
FT-ICR은 높은 감도(100 amole ~ 150 zmole), 높은 질량분해능, 1 ppm 이하의 높은 질량측정정확도 등으로 단백질 혼합물의 확인 및 펩티드 sequencing 정보의 향상을 가능하게 한다. 또한 ECD, ETD 등 다양한 펩티드/단백질 분해 기술 개발로 프로테옴 시료에 대한 더 정확한 화학적 정보를 얻고 있다. 펩티드 수준의 Bottom-up 분석의 한계를 극복하기 위해 보다 큰 펩티드 및 단백질 그대로의 질량을 분석하는 Middle-down 혹은 Top-down 방식이 지속적으로 시도되고 있다. 이러한 분석에 필수적인 고분해능/고정확성 FT 질량분석계의 보유와 활용은 여전히 몇몇의 선두 그룹에 제한적이나, 관련 질량분석계 및 이에 적합한 Gel-eluted liquid rraction entrapment electrophoresis(GELFrEE)와 같은 단백질 분리 기술 등이 계속 개발되고 있으며, 추후 동종 단백질의 다양한 Post-translational modification(PTM) 분석에 대한 정보를 제공할 것으로 기대되고 있다.
최근 개발된 Triple quadrupole 질량분석계는 Dual ion funnel 기술과 Multiple inlet 기술 등의 진보된 이온전달체계를 채용하여 향상된 검출감도와 정량 선형 구간을 지니며, Scheduled SRM 혹은 MRM 기술의 개발로 다중 펩티드를 동시에 높은 감도로 정량할 수 있게 되었다. 이외에도 matrix 영향을 줄이기 위해 고농도 단백질 제거법, 단백질 균등 분획법 등과 연계된 PRISM 기법, transition의 동시성과 선택성을 획기적으로 개선한 PRM 기술 등이 개발되었다.
(다) Informatics기술
질량분석에서 얻어진 방대한 데이터로부터 펩티드의 서열정보를 정확히 해석하고, 생물학적 의미를 추출하는 informatics 기술은 Scripps, ISB, PNNL, MPI 등의 유수 연구기관에서 분석의 자동화와 생산된 질량스펙트럼의 해석을 위한 소프트웨어 환경을 구축하여 사용하고 있으며, 이를 공개하여 문제점 개선을 위해 노력하고 있다(DTAselect, MS-GF+, Andromeda, PeptideProphet/ ProteinProphet 등). 특히 펩티드 서열로부터 단백질을 동정하고, 정량적으로 해석하는 데 필요한 다양한 프로그램의 개발과 단백질의 PTM 분석을 위한 알고리즘(MODi, ascore, debunker 등)의 개발도 활발히 진행되고 있다. 최근에는 글로벌 프로테옴 프로파일링을 통해 얻어진 방대한 데이터를 Gene ontology 분석, Enriched functional-related gene group의 clusterization, pathway map 작성, network 분석 등을 통해 시스템 생물학적인 접근의 informatics 기술과 연계하는 연구가 진행되고 있다. 질량분석계의 발전으로 단위 시간에 생산되는 프로테오믹스 데이터의 양적 증가로 인해, 데이터분석을 분산 컴퓨팅 환경에서 빠르게 수행할 수 있도록 하는 소프트웨어 분석 환경이 중요해졌고, 특히 프로테오믹스 데이터를 이용해 유전체 분석을 보완하는 프로테오 지노믹스 분야에서 더욱 중요한 이슈가 되고 있다. 또한 다국적 제약회사에서는 항체 치료제 개발에 있어 질량분석을 이용한 항체 서열 및 PTM 분석에 대한 요구가 증대되고 있다.
(라) 단백질체 정량기술
최근 단백질체 정량은 gel을 사용하지 않고 LC와 질량분석기로만 정량하는 추세이다. 정량 프로테오믹스에는 약간의 변형은 있으나, 일반적으로 두 가지 접근법이 있다. 안정 동위원소 치환 펩티드를 내부 표준물질로 사용하여 상대정량하거나 절대정량을 하는 접근법은 주로 무거운 동위원소 치환 펩티드가 동일한 이온화 효율을 갖는 가정 하에 실시된다. 상대정량기술에는 ICAT(isotope coded affinity tags), iTRAQTM(isobaric tags for relative and absolute quantitation, Applied Biosystems사), SILAC(stable isotope labeling with amino acids in cell culture), IDBESTTM(isotope-differentiated binidng energy shift tags, Target Discovery사), TMT(tandem mass tag, Thermo Scientific사) 등이 있다. 이러한 방법은 불완전 표지, 반응 부산물 발생, 시료의 복잡성 증가와 같은 문제점을 보이기도 하였으나, 최근에는 사용법의 표준화가 상당히 진행되어 정량성이 개선되고 있으며, 특히 프로테오믹스 연구의 효율성을 크게 개선함으로써 그 적용 사례가 증가하고 있다. 또 다른 정량법인 비표지 정량법은 펩티드들의 상이한 이온화 효율, 존재량과 peak 세기 간의 비선형 관계, 데이터 처리 부분에서 여러 가지 난제를 안고 있으나, 변형된 알고리즘이 개발된 spectral counting, extracted ion chromatogram 비교와 같은 방법이 바이오마커 발굴에 적용되고 있다. 절대정량기술에는 SISCAPA, QCAT proteotypic peptide, mTRAQTM(Applied Biosystems사) 기술 등이 사용되고 있으며, 최근 SIS를 사용한 Triple quadrupole 질량분석 기반 MRM 기술 이용이 크게 증가하고 있다.
(마) PTM(Post-translational modification) 분석 기술
PTM 분석의 난제는 낮은 stoichiometry이므로, 각 PTM이 지닌 특이적인 물리화학적 성질을 이용하여 특정 PTM 단백질 혹은 펩티드를 농축하는 기술이 활발하게 개발되어 정착되고 있다. 인산화 펩티드 농축기술로는 가장 널리 쓰이는 IMAC이나 TiO2를 이용한 affinity 분리 기술과 SCX 크로마토그래피 활용기술, 그리고 인산화자리의 화학적 변환을 이용한 분리 기술이 있다. 당쇄화에서는 주로 N-linked glycoprotein 분석이 진행되고 있으며, hydrazide resin을 이용한 화학적 농축법과 lectin을 이용한 affinity 기반의 농축법이 대표적으로 활용되고 있다. 특히 최근에는 membrane filter와 lectin affinity 분리를 결합한 FACE 기법이 개발되어 다양한 당쇄화 프로테옴 분석에 적용되고 있다. 최근 소개된 하나의 단백질에 나타나는 복잡한 PTM의 조합을 알아내는 Top-down 프로테오믹스 분석기술이 다양한 PTM 분석에 활용되고 있다.
(바) 바이오마커 연구
오믹스 기반 바이오마커는 질병의 조기진단, 예후, 약물치료에 대한 반응, 신약 후보물질에 대한 평가 등에 유용한데, 현재 미국 FDA에 의해 허가된 MammaPrint, AlloMap 등 다중마커 분자진단제의 대부분은 유전체 기반의 제품이다. 단백질 바이오마커는 Phenotype 바이오마커로서 생리상태를 직접 반영하며, 병원에서 쉽게 분석할 수 있는 혈액이나 소변을 사용한다는 이점이 있다. 프로테오믹스 분석기술의 발달로 단백질 바이오마커 후보가 속속 도출되고 있으나, 실제 임상에서 유용성을 평가하는 부분이 시간이 걸리는 단계라 할 수 있다. 2008년 미국 FDA와 유럽 EMEA에서 C-Path의 PSTC(Predictive Safety Testing Consortium)에서 제안한 7개 단백질 패널을 신장 결함에 대한 독성 바이오마커로 인정한 이래로 다양한 단백질 바이오마커 후보군들이 도출되고 있으며, 미국 NCI의 EDRN(Early Detection Research Network)에서는 각종 암에 대한 수백 개의 단백질 바이오마커에 대해 지속적으로 평가를 하고 있다. 바이오마커 개발에 방해가 되는 요인들로, 표준화된 시료준비 및 측정방법의 결여, 공유되지 못하는 생물정보 체계, 분산된 연구, 연구 주체간의 의사소통 미흡, 검증과정에서 생물·생리학 지식 부족 등이 지적되면서, 미국 AACR-FDA-NCI Cancer Biomarker Collaborative(CBC)를 중심으로 바이오마커 개발, 중개 및 임상적용에 대한 FDAʼs Critical Path Initiative를 가속화하고 있다.
(2) 주요국 연구개발 투자 동향
[표 4-1-4] 주요국 연구개발 투자 동향
|
국가 |
구 분 |
연구개발 투자내용 |
|
미 국 |
NCI(National Cancer Institute) |
▪Clinical Proteomic Tumor Analysis Consortium(CPTAC): $75-120M(’11~’16년) |
|
NHLBI(National Heart, Lung and Blood Institute) |
▪3단계 Clinical Proteomics 프로그램: $80M(’10~’15년) |
|
|
NIGMS(National Institute of General Medical Science) |
▪PSI 2단계사업의 단백질 구조결정(’06~’11년): $37M(’10년) →PSI 3단계사업: $290M(’11~’16년) |
|
|
NSF(National Science Foundation) |
▪PDB(Protein Data Base) 사업(’09년 시작 5년간) ▪NSF awards in proteomic & protein research: 년 ~$7M |
|
|
NIH(National Health Institute) |
▪NIH grants in proteomics: 년 ~$50M |
|
|
EU |
EU 7th Framework 프로그램 |
▪PROSPECTS(PROteomics SPECification in Time and Space) 콘소시움: €12M, (’08~’13년) ▪PRIME-XS consortium (Proteomics Services): €8M(’11년 시작 4년간) |
|
덴마크 Novo Nordisk 재단 |
▪질환 단백질 연구를 위한 센터(Novo Nordisk Foundation Center) 코펜하겐대학에 ’07년 설립 및 지원 |
|
|
룩셈브르크 |
▪미국 애리조나 TGEN과 ’08년 설립된 Integrated Biobank of Luxembourg 간의 바이오뱅킹 등 맞춤의학을 위한 협력사업: €140M(’09년 시작 5년간) |
|
|
네델란드 |
▪Translational Molecular Medicine ’10년, €275M 지원 (지노믹스, 프로테오믹스, 메타볼로믹스, 인포메틱스 등) |
|
|
노르웨이 |
▪기능유전체 연구 2단계 $70M 지원(’07~’11년) |
|
|
캐 나 다 |
CFI(Canada Foundation for Innovation) |
▪Quantitative Cell Biology & Proteomics (Mount Sinai Hospital): C$12M(’09년 시작) ▪Canadian Accelerator Mass Spectrometry(Ottawa 대학): C$8.4M(’09년 시작) ▪Integrated Nat'l Technology Platform for Mapping Protein Networks(Montreal 대학): C$9.2M(’09년 시작) ▪A Multi-Site, Integrated National Technology Platform for Mapping Protein Interaction Networks in Health and Disease: C$9.2M(’11년 까지 총액) |
|
Ontario 주 |
▪Ontario Research Fund(C$625M, 4년간) 중 C$114.6M, 오믹스 Global Leadership 프로그램에 투자 |
|
|
호주 |
교육과학훈련부 |
▪Biotech Initiative로 프로테오믹스 분야에 $40M 지원 |
(3) 단백질체학의 시장 동향 및 규모
세계 단백질체 관련 산업은 초기의 연구소 기반 시장에서 점차적으로 신약개발, 진단 및 응용 분야로 변화하고 있다. 크게 질량분석과 바이오칩의 두 가지 단백질체 기술이 대용량의 유전체 및 단백질체 이니셔티브에서 생산된 새로운 프로테오믹 콘텐츠의 폭발적인 증가로 득을 보고 있다. 이러한 프로테오믹 콘텐츠는 질병에 중요한 새로운 바이오마커 발굴 가속화에 기여하고 있으며, 프로테오믹스 기술의 발전은 다양한 응용에의 동력이 되고 있다. 질량분석 워크플로우 및 기기의 개선과 바이오칩의 소형화 및 통합으로 신약개발과 진단의 새로운 응용 분야가 점차적으로 증가하고 있다.
세계 단백질체학 시장은 2012년 약 42억불이고, 연평균 약 16.1%씩 성장하여 2017년 약 89억불로 예측된다.1) 질량분석 기반 프로테오믹스 시장은 2012년 약 34억불로 가장 큰 비중을 차지하는 기술 플랫폼으로 연평균 12.6%씩 성장하여 2017년 약 62억불의 시장을 형성할 것으로 보인다. 단백질체학 시장은 최종 소비자에 따라 연구, 신약개발, 진단, 응용 분야로 분류될 수 있는데, 2012년 전체 시장의 43%를 차지하고 있는 연구 분야 시장 규모는 18억불이고 년 평균 약 9.7%씩 성장하여 2017년 약 29억불로 전체시장의 32.5%를 차지할 것으로 예상된다. 전통적으로 연구 분야 시장이 단백질체학의 주요 초점으로 크게 성장해 왔는데, 최근에는 점차적으로 신약개발, 진단 등의 응용 시장으로 변화하고 있다. 특히 진단 프로테오믹스 시장은 가장 크게 성장하고 있어서, 2012년 불과 2.46억불에서 연평균 약 43.5%씩 성장하여 2017년에는 15억불에 이를 것으로 예측된다. 이러한 진단 프로테오믹스 시장의 가파른 성장은 프로테오믹스 기반 다중 진단 시험의 증가, 단백질 바이오마커의 높은 발굴율, 자동화된 신속하고 저렴한 시험에 대한 필요성에 기인한 것으로 해석될 수 있다.
(단위 : 백만달러)

[그림 4-1-3] 최종 소비자 분류에 따른 프로테오믹스 시장 전망
다. 국내 현황
(1) 연구개발 투자 현황2)
[표 4-1-5] 정부 지원 프로테오믹스 연구 현황
|
부 처 명 |
사 업 명 |
수행 기간 |
2013년 연구비 |
비고 (주관 기관 등) |
|
미래창조 과학부 |
다중오믹스신기술사업 (바이오·의료기술개발사업) |
2012년~2017년 |
40억원 |
한국과학기술 연구원 |
|
보건복지부 |
맞춤의료단백체센터 (차세대맞춤의료유전체사업) |
2011년~2015년 |
8.7억원 |
차세대맞춤의료 유전체사업단 |
|
미래창조 과학부 |
질량분석 의료기술 융합연구 (신기술융합형성장동력사업) |
2009년~2014년 |
39억원 |
한국기초과학지원연구원 |
(2) 관련 산업 현황3)
[표 4-1-6] 국내 대표적 프로테오믹스 벤처기업 현황
|
기업명 |
주요 업종 |
설립 |
비고 |
|
(주)영인프런티어 |
항체, 진단키트 생산 및 판매, HUPO Antibody Initiative에 참여(2008. 5. 에이비프론티어 합병) www.abfrontier,com |
1994년. 3월 |
상장 |
|
(주)팹트론 |
주문형 펩타이드 제조 서비스, 기능성 및 의약용 펩타이드 개발 및 생산 www.peptron.co.kr |
1997년. 11월 |
|
|
(주)프로테오젠 |
단백질 칩, 단백질 기능분석 장치개발 및 판매 www.proteogen.co.k |
2000년. 2월 |
|
|
(주)프로테옴텍 |
시료 준비, 젤 이미지 분석, 질량분석 서비스 제공, 진단키트 개발 www.proteometech.com |
2000년. 3월 |
|
|
(주)노바셀테크놀로지 |
분비단백질, 세포막단백질 프로파일링, 임상시료 프로테옴 분석 바이오마커 발굴 및 바이오소재 개발 www.novacelltech.com |
2000년 |
구 ㈜씨그몰 |
|
(주)바이오인프라 |
프로테옴분석을 위한 바이오인포메틱스 기술 개발, 암 진단 바이오인포메틱스 기술 개발 www.bio-infra.com |
2001년. 2월 |
|
|
다이아텍코리아(주) |
질량분석 기반 단백질의약품 특성 분석, 정량적 프로테오믹스 분석 서비스 및 질량분석 기반 질병 진단 키트 개발 www.biomedms.co.kr |
2000년. 1월 |
|
|
(주)아스타 |
MALDI-TOF 개발, maldi plate 생산 판매, 시료전처리 기기 개발 생산 www.maldiplate.com |
2006년. 1월 |
|
|
바이오앤시스템즈(주) |
단백질의약품 특성 분석 서비스 www.bionsystems.co.kr |
2009년. 7월 |
|
|
프로테인웍스 |
프로테옴분석, 단백질의약품 분석 서비스 proteinworks.co.kr |
2008년 |
|
|
(주)한국질량분석기술 |
단백질분석서비스, LC/MS/MS 분석 서비스 N-말단서열분석 서비스 www.proteinlab.co.kr |
|
|
|
(주)진메트릭스 |
MALDI-TOF를 이용한 바이러스 및 미생물 유전자 진단 기술 개발 및 서비스 www.genematrix.net |
2000년. 12월 |
상장 |
라. 발전 전망
미래 도전분야는 인간 질병 문제를 해결할 수 있는 주요 수단으로 인간 프로테옴의 이해와 생명시스템에서의 유효적절할 assay 개발이다. 그 방법으로 MRM 방법이 제안되어 그 장점이 검증되었으나, 민감도 개선을 위한 대안으로 immuno-MRM의 개발, 정착 및 생물학이나 임상에서의 응용이 시급하여 국제적인 공동 노력이 제안되어 왔다. Immuno-MRM에 필요한 리소스 (펩티드나 항체와 같은 reusable reagents) 마련에 엄청난 비용이 들고 표준방법을 확립하는 과정이 매우 더디고 단조롭기 때문에 기초연구나 중개연구에 접목시킬 수 있는 동력은 국제 네트워크 기반으로 확보되어야 할 필요가 있다. 단백질체학 산업은 지극히 다양하고 다른 시장 분야와의 경쟁관계에 있으나, 프로테오믹스 기술은 생명과학 산업에서 없어서는 안 될 기반 기술임이 증명되고 있다. 특히 유전체와 단백질체 콘텐츠를 포함하는 프로테오지노믹스 기반의 유전자 및 단백질 바이오마커군 발굴 분야가 점점 활성화되고 있으며 신약개발과 진단 분야에의 응용성이 매우 큰 유망한 분야이다.
3. 세포체학(줄기세포 포함)
가. 개요
세포는 생명체를 구성하는 가장 기본적인 단위로써 인체의 경우 약 230여 종류의 세포가 있으며, 전체적으로는 약 50조개의 세포로 구성되어 있다. 이렇게 다양하고 많은 수의 세포는 여러 가지 조직과 기관을 구성하고 있으며, 수명을 다한 세포는 사멸하게 된다. 각 조직과 기관에서 손실되는 세포들은 성체줄기세포 혹은 조직특이적 줄기세포에 의해서 재생되어 각 조직과 기관이 원래의 기능을 지속적으로 수행하도록 한다. 세포체학은 생체에서 일어나는 위와 같은 세포의 생성과 사멸을 연구하는 학문이며, 줄기세포를 활용하여 재생의학적 치료 또한 연구하게 된다.
줄기세포는 인체의 조직에 있는 성체줄기세포와 발생단계의 배반포에서 분리하여 in vitro 환경에 적응시킨 배아줄기세포로 나누어 질 수 있다. 배아줄기세포는 인체를 구성하는 모든 세포로 분화할 수 있는 전분화능을 가지고 있기 때문에 만능줄기세포로도 불린다. 2006년 일본의 Shinya Yamanaka는 섬유아세포에 4개의 유전자를 도입함으로써 세포의 운명을 리프로그래밍시켜 유도만능줄기세포 (induced pluripotent stem cells, iPSCs)를 만들 수 있는 발견을 하였고, 이러한 공로로 2012년에 노벨 생리의학상을 수상하였다. iPSC 기술은 세포체학 및 재생의학분야에서 패러다임을 전환하는 기술로 여겨지고 있으며 google scholar기준 현재 8,500여 건의 인용도를 보이고 있다. 최근에는 이러한 리프로그래밍 기술을 응용하여 iPSC의 생성없이 직접 목표하는 세포로 세포를 전환시키는 직접교차분화(direct conversion, direct reprogramming, transdifferentiation) 기술이 새롭게 주목을 받고 있다.
또한 iPSC 기술과 직접교차분화 기술을 통해서 재생의학적 치료 뿐 만아니라 환자의 세포를 리프로그래밍시켜 만능줄기세포와 특정 분화세포를 얻어냄으로써, 신약개발에 직접적으로 환자의 세포를 활용하는 것이 가능해 지게 되었고, 이는 신약후보물질의 안전성과 유효성을 획기적으로 높이는데 기여할 것으로 기대되고 있다.
나. 해외 동향
(1) 기술개발 동향
(가) 유도만능줄기세포의 제작 기술의 발전
iPSC를 제작하는 전통적인 방법인 virus vector의 경우 세포의 염색체에 삽입되는 문제가 있었다. 이 문제를 해결하기 위해서 현재까지 단백질, mRNA, miRNA, episomal vector등을 사용하는 방법들이 개발되어져 왔다. 2013년 중국의 Hongkui Deng 그룹은 최초로 유전적인 물질없이 7개의 화합물만을 이용하여 iPSC를 제작할 수 있음을 보여주었다4). 비록 생쥐의 세포를 이용한 것이지만, 곧 인간세포에서도 성공할 수 있을 것이라는 전망하게 한다.
iPSC를 제작하는 효율은 인간의 경우 평균 0.01%로 매우 낮기 때문에 이를 증진시키기 위하여 다양한 화합물과 추가적인 유전자등을 활용하는 방법들이 개발되어져 왔다. 이스라엘의 Jacob Hanna 그룹은 2013년의 논문에서 Mbd3라는 유전자의 기능을 손실시켰을 때, iPSC의 효율이 거의 100%에 이를 수 있음을 보여줌5)으로써 iPSC의 실용성을 극대화했다는 평가를 받고 있다.
(나) 직접교차분화 기술의 발전
2010년 Marious Wernig 그룹에서 중배엽유래의 섬유아세포로부터 외배엽세포인 신경을 만들어 냄으로써 직접교차분화 연구가 활발해지는 계기가 되었으며, 이로부터 다양한 종류의 신경세포와 심근세포, 간세포 등을 직접교차분화를 통해서 제작할 수 있게 되었다. 2012년에는 생쥐와 인간세포에서 SOX2 유전자 하나만을 이용하여 유도신경줄기세포를 만들 수 있음이 보고되었으며6), 2013년에는 염색체상에 외부유전자의 삽입없이 유도신경줄기세포를 제작하는 방법이 보고되었다7)8).
(다) 새로운 개념의 분화 방법의 제시
목적하는 세포를 얻기 위해서 줄기세포를 분화시키는 기술은 그 효율을 높이고, 시간을 단축시키는 방향으로 진행되어 왔다. 더불어 최근에 들어서는 목적하는 한 종류의 세포가 아니라 조직의 형태로 줄기세포를 분화시키는 기술이 새롭게 대두되고 있다. 2012년에는 인간배아줄기세포로부터 눈의 발생단계를 재현하는 optic-cup을 만들 수 있었고9), 2013년에는 인간의 뇌10)와 간11)을 만들 수 있는 가능성을 보여주었다. 이와 같은 조직으로의 분화는 인간조직을 연구할 수 있는 재료를 제공한다는 점에서 획기적이라고 할 수 있다.
(라) 핵치환 인간배아줄기세포
2013년 미국 오레곤 대학교의 Mitalipov 그룹은 핵치환 기술을 이용하여 리프로그래밍된 인간배아줄기세포를 획득하는데 성공하였다12). 이것은 황우석 교수가 성공하지 못했던 일을 성공시킨 결과로 동결되지 않는 난자를 이용한 것이어서 동결난자만을 사용하도록 규제하고 있는 우리나라의 생명윤리법의 제약에 대한 논의가 있었다.
(2) 연구개발 투자 현황
미국은 줄기세포 분야의 최고기술 보유국으로써 인간배아줄기세포 연구를 허용하였고, 2012년에는 National Bioeconomy Blueprint를 통해 iPSC분야를 중점과제로 지정하였다. 일본은 iPSC의 선도국으로써 자국내 줄기세포연구의 80%를 iPSC 연구에 지원하고 있으며 iPSC 치료제를 개발하기 위해 4대 연구거점기관을 선정하여 10년간 총 439억엔을 투자할 계획이다. 중국은 국가 중대과학연구계획을 수립하여 줄기세포 연구의 본격화 및 임상능력 촉진을 추구하고 있다. 유럽은 제7차 Framework program을 통해 줄기세포 연구에 3.4억달러를 투자하여 지원 중에 있다.
(3) 산업 현황
글로벌 줄기세포 시장은 2011년 기준 262.3억 달러에서 2018년 1195억 달러의 규모로 연평균 24.2%의 성장률을 보일 것으로 전망되고 있다(그림 4-1-4). 2011년 기준으로 세포종류별로 보았을 때, 성체줄기세포가 84.2%로 압도적인 점유율을 보이고 있고, 북아메리카 시장이 59%로 대다수를 차지하고 있다. 하지만, 아시아 시장이 빠르게 성장할 것으로 전망되고 있다.
(단위 : 억달러)

출처 : 생명공학정책연구센터(원본출처: Transparency Market Research, Stem Cells Market(2012))
[그림 4-1-4] 글로벌 줄기세포 시장 현황 및 전망
다. 국내 현황
(1) 기술개발 동향
(가) 리프로그래밍 및 줄기세포 분화기술 개발
2012년 생명연의 조이숙 박사팀은 리프로그래밍 효율을 증진시키는 신규 저분자 화합물을 개발하였고13), 건국대학교의 한동욱 교수팀은 독일 연구팀과 함께 직접교차분화를 통하여 유도신경줄기세포를 제작하는 기술을 발표하였다14). 2013년에는 서강대학교의 차혁진 교수팀이 미분화줄기세포를 제거하는 화합물을 개발하여15) iPSC를 포함한 만능줄기세포를 치료제로 사용할 때의 위험성을 최소화할 수 있게 되었다. 서울대학교의 김빛내리 교수팀은 줄기세포 단백질인 Lin28a의 새로운 기능을 발견함으로써 줄기세포 관련 기전의 이해를 증진시킬 수 있었다16).
(나) 연구개발 활성화를 위한 인프라 확충
국립보건연구원은 줄기세포·재생의료 연구지원을 위한 국가 인프라 구축을 목적으로 오송 첨단의료복합단지에 ʻ국립줄기세포·재생센터ʼ를 설립하여 2015년 개소를 목표로 하고 있으며, 줄기세포주 등록제 시행, 국가줄기세포은행(2012년 10월 개소) 운영, 핵심연구지원시설 확보, GMP 컨소시엄 구축, 줄기세포 임상연구 관리를 주요 사업으로 하고 있다.
(2) 연구개발 투자 현황
정부는 줄기세포 연구에 지속적으로 투자를 증진시키고 있으며, 특히 2012년의 경우 범부처 ʻ줄기세포 R&D 투자효율화 방안ʼ을 수립하여 전년대비 67%의 연구비를 증액하여 조속한 산업화 성과창출을 기대하고 있다. 증액된 연구비는 부처별로 역할을 분담하고 상호 연계성을 강화하기 위하여 미래부는 기초·원천기술 및 기반기술·플랫폼 기술연구에, 복지부는 중개·임상연구의 실용화 연구에, 산업부는 산업화·대중화 연구에, 농식품부는 축산·수의용 동물줄기세포 연구에 중점을 두고 투자되고 있다.
[표 4-1-7] 줄기세포 정부 R&D 투자 동향
(단위 : 억원)
|
부 처 |
2008년 |
2009년 |
2010년 |
2011년 |
2012년 |
총계 |
연평균 증가율(%) |
|
교과부 |
218 |
223 |
327 |
398 |
485 |
1,651 |
21.1 |
|
복지부 |
119 |
116 |
143 |
156 |
427 |
961 |
37.6 |
|
농림부 |
26 |
28 |
33 |
35 |
55 |
177 |
20.5 |
|
지경부 |
23 |
38 |
28 |
28 |
14 |
131 |
△11.7 |
|
합계 |
387 |
406 |
531 |
617 |
981 |
2,922 |
26.2 |
*복지부·농림부 수치에는 식약청·농진청 포함
출처 : 2013년도 줄기세포시행계획
위와 같은 투자에 대한 전략적 운영을 위하여 미래부에서는 ʻ줄기세포 원천기술 확보 촉진지원사업ʼ(KoNSCRT, http://konscrt.bioin.or.kr)을, 복지부에서는 ʻ글로벌 줄기세포·재생의료 연구개발촉진센터ʼ (GSRAC, http://www.gsrac.org) 사업을 별도로 추진하여 R&D 정책·기획을 강화하기 위한 전문 조직을 구성 및 운영하고 있다.
(3) 국내 산업 현황
국내 줄기세포치료제의 경우 파미셀의 ʻ하티셀그램-AMIʼ이 세계최초로 품목허가를 획득한 이후로 메디포스트의 ʻ카티스템ʼ, 안트로젠의 ʻ큐피스템ʼ이 2012년 1월에 허가를 획득하여 향후 높은 성장을 보일 것으로 전망된다.

출처 : 생명공학정책연구센터(원본출처: GBI Research, Stem Cell Therapy Market in Asia-Pacific to 2018(2012.12))
[그림 4-1-5] 국내 줄기세포치료제별 환자 집단 전망
특히, 2013년 7월말 기준으로 8개 업체에서 총 18개의 품목이 임상승인을 받아 연구를 진행하고 있으며, 식약처는 2017년까지 줄기세포치료제 6개 품목을 확보 및 글로벌 진출을 목표로 지원을 추진하고 있다. 현재까지 임상을 진행하고 있는 세포는 모두 골수 또는 지방, 제대혈 유래의 성체줄기세포에 국한되는 것이 특징이다.
라. 발전 전망
일본은 iPS 기술을 바탕으로 세계 줄기세포연구개발 및 산업화를 선도하기 위한 계획을 진행 중이며, 미국의 경우 탄탄한 기초연구를 바탕으로 줄기세포 전분야에 걸쳐 연구개발을 진행하고 있다. 특히, 중국은 최근 줄기세포를 비롯한 과학기술에 대한 집중적인 투자를 진행 하여 그로 인한 성과를 뚜렷하게 보이고 있다. 우리나라는 주요 국가들에 비하여 줄기세포 연구개발이 다소간 지체된 만큼, 우리가 역량을 발휘할 수 있는 분야를 선정하여 원천기술을 확보하는 목적 지향의 중장기적인 전략을 추진할 필요가 있다. 현재 성체줄기세포 분야는 최초로 치료제 허가를 낸 만큼 적극적인 지원을 통하여 효능에 대한 국제적 인증을 받고 관련 산업의 국제적인 초기시장을 선점할 수 있도록 해야 하며, 리프로그래밍 기술의 경우 산업화를 위한 기본 기술의 개발이 거의 완성단계에 이른 만큼 이를 활용하는 기술에 주안점을 두어야 할 것이다. 특히, 환자의 세포를 이용한 in vitro 질환 모델의 경우 생명의료연구의 획기적인 전환을 유도할 것으로 전망되는 만큼, 이를 활용하기 위한 분화기술 연구개발과 신약개발에 활용하기 위한 협력방안을 모색할 필요가 있다.
향후의 줄기세포를 활용하는 기술은 2차원적인 세포 군집을 생산하는 것에서 벗어나 3차원적인 조직(tissue)이나 특정 기관(organ)을 생산하는 방향으로 진행될 것으로 전망된다. 3D 프린팅이나 조직공학적 기술의 접목을 통한 원천기술의 개발이 기대되고 있으며, 이를 위해서 3차원적인 세포간 상호작용에 대한 기초연구가 필요할 전망이다. 3차원적인 조직이나 기관의 생산은 재생의학적 치료의 새로운 차원을 제시할 것으로 전망되며, 화합물이나 생화합물 치료제를 개발하는데 소요되는 동물실험의 최소화와 개인 맞춤형 치료제를 개발하는데 효과적으로 활용될 것으로 전망된다.
향후의 재생의학적 치료는 in vitro에서 세포나 조직을 생산하여 환자에 이식하는 기술을 개발하는 것과 더불어 인체 내에서 직접적으로 손상된 조직을 재생시키거나 기능성을 부가하는 방향으로 기술의 발전이 이루어질 것으로 전망되는 만큼 창의적인 기술의 개발을 위해 국가차원의 연구지원과 함께 실질적인 산업적 응용을 위해서 다양한 규모의 기업체가 연구개발 초기에 적극적으로 참여할 수 있도록 정책적인 지원 및 재생의료 산업의 가능성에 대한 적극적인 설득과 홍보가 이루어지기를 기대한다.
4. 대사체학
가. 개요
대사체학(Metabolomics)은 유전자 표현형과 단백체의 분석만으로 해석 할 수 없는 세포내 변화 등의 상관관계를 대사네트워크 전체를 통해 고찰하고, 얻어진 결과를 통하여 최종생성물의 변화량에 대한 원인을 해석하는 유일한 학문으로서, 특정한 생물학적 변화 과정들을 통하여 생성된 저분자 대사체의 프로파일을 체계적이며 종합적으로 연구하는 학문이다.
대사체학 연구는 1960년 후반 크로마토그래피를 이용한 분리 및 정제 기술의 발전에 의해 대사체들의 검출이 가능하게 되면서 본격화되기 시작했으며, 1970년 Arthur Robinson이 비타민 B6를 투여한 후, 뇨시료에서 복잡한 크로마토그래피 패턴들을 분석하고, 이러한 패턴은 뇨 시료 내에 유용한 정보를 가진 수많은 화합물들을 함유하고 있다고 발표하면서 발전되었다. 1971년 PNAS에 ʻʻQuantitative Analysis of Urine Vapor and Breath by Gas-Liquid Partition Chromatographyʼʼ를 발표한 이후, 생체시료 내 대사체들의 정량적 패턴들을 분석함으로써 질병 진단, 질환상태 및 연령에 따른 생체 변화 등에 대한 논문들이 다수 발표되었으며 이러한 생체 시료 내에서의 분석은 적은 비용으로 많은 정보를 얻을 수 있으며, 또한 생리 상태에 따른 대사물의 측정이 가능하게 하였다.
1990년대 Oliver SG, Winson MK, Kell DB 및 Baganz F등이 ʻʻTrends Biotechnol. 16, 373-378ʼʼ에 효모의 기능을 체계적으로 분석함으로써 처음으로 대사체학이란 용어를 사용하였다. 대사체학은 효소의 농도나 활성이 변하면 이 영향을 받은 대사체 흐름은 대사체 농도의 변화에 있어서 중요한 영향을 끼치게 된다. 즉, 대사체들은 transcription과 translation의 하위단계로써 효소의 활성을 나타내는 좋은 지표(indicator)로 작용할 수 있으므로 대사체의 네트웍(metabolic network)에서 관찰된 대사체들의 변화를 통해서, 대사체들은 생물학적 시스템에서의 변화에 대해 모니터 할 수 있다. 따라서, 유전학, 전사체학 및 단백체학과 더불어 대사 프로파일링을 통하여 얻은 세포 기능에 대한 정보들을 종합하여 복잡한 생명체의 구조를 규명하려는 연구를 시도하고 있다.

[그림 4-1-6] 대사체학의 개념 및 연구 절차
대사체학의 연구는 Imperial College의 Nichilson 교수팀이 NMR을 활용한 생체시료내의 대사체 변화를 연구한 논문이 2000년에 ʻʻmetabonomicsʼʼ라는 용어를 사용하면서 생명공학 연구 분야에 적용되기 시작했다. 2004년에는 전 세계 학자들이 ʻʻMetabolomics Societyʼʼ가 결성하여 대사체학의 연구에 다양한 생화학적 방법 및 생명정보학 등을 적용한 연구가 활성화되는 계기가 되었다. 2007년 캐나다의 알버타대 Wishart 교수는 2500개의 대사체, 1200개의 약물 및 3500개의 식품 성분들을 확인한 ʻʻHuman Metabolome Projectʼʼ라는 최초의 인간 대사체군을 발표하였으며, 최근 대사체학은 다음과 같은 다양한 연구 분야에 활용 되고 있다. 즉, 건강 및 질병진단에 있어서 생체지표 선정, 시스템 생물학, 동위원소 이성질체를 활용한 pathway discovery, 신약개발, 그리고 식물, 미생물, 영양학 및 환경 대사체학 등의 다양한 분야에 그 적용 범위를 넓혀가고 있다. 이러한 대사체학 연구는 주로 미국, 유럽, 일본 등 선진국 위주로 연구가 진행되었고, 2007년 이후로 대사체학 연구에 대한 논문 발표 횟수가 증가되고 있는 추세이다.

출처 : Web of Science
[그림 4-1-7] 연도별 대사체학 관련 SCI급 논문 발표 수
국가별 대사체학 연구는 미국, 영국 등이 주로 대사체학 연구를 진행해오고 있으며 최근 중국에서는 한약연구에 대사체학을 활용한 연구가 활발히 진행되고 있으며 우리나라 역시 대사체학 연구가 증가하고 있는 추세이다.

출처 : Web of Science
[그림 4-1-8] 국가별 대사체학 관련 SCI급 논문 발표 수
나. 대사체학(Metabolomics) 연구의 필요성
대사체학 연구 분야는 다양한 유전적, 생리적 또는 환경적 조건에서 변화되는 생체 내 저분자량 대사물질군의 구성과 농도를 분석하고 해석함으로써 생명현상의 변화 원인을 규명해 나가는 총체적 연구 분야이다.
ㅇ 질병 등과 같은 다양한 조건에서 변화하는 생물체의 표현형(phenotype)을 가장 잘 반영하는 것은 생체 내에 존재하는 대사체(metabolite) 및 대사체군 (metabolome)이며,
ㅇ 생체 내에 존재하는 대사체를 분석하는 대사체학 및 이들과 생체내의 거대분자(유전자 및 단백질 등)들과의 상호 관련성 연구는 특정질환내의 대사경로와 인체질환 기전 규명에 매우 중요하고 필수적인 연구 분야이다.
다. 해외 동향
(1) Disease Biomarker 분야
- 영국 Imperial College Nicholson 교수팀은 노령화에 따른 생체대사 과정을 연구하였다. 개에게 칼로리 제한식, 일반식 군으로 나누어 키운 후, 혈청에서의 대사체 변화를 NMR을 이용하여 분석하였다. 음식물 섭취 방법에 따라서 노령기의 에너지 대사에 관여하는 대사체들이 차이가 있음을 확인하였다.

출처 : J. Proteome Res. 2013
[그림 4-1-9] Sparse metabolic network relationships for Canis familiariz based on KEGG pathway data. 노화에 따른 대사체들의 변화
- 프랑스 Lunam 대학 Courant 교수팀은 젊은 남성의 혈청을 분석한 결과 정자의 숫자에 따른 대사체 패턴의 차이를 관찰하였으며, 이 결과는 임상 결과 및 펩타이드 biomaker들과도 밀접한 연관성을 보여 주었다. 이 연구는 불임 연구에 대사체학과 단백체학을 융합한 연구로서 불임진단의 가능성을 나타내었다.

출처 : J. Proteome Res. 2013
[그림 4-1-10] T-predicted score plot and peptide HWESASLL observed from patients with low or high sperm concentration.
- 미국 University of Minnesota의 Lusczek팀은 NMR을 이용하여 hemorrhagic shock 와 traumatic injury 환자들의 뇨시료를 profiling한 결과 shock (pathophysiology 상태)에 의한 대사과정의 진행을 PLS-DA model과 metabolite network를 통해 확인함.

출처 : Metabolomics 2013
[그림 4-1-11] Urinary metabolite dendrogram and a visualization of the metabolic network in hemorrtagic shock and trauma. TCA와 연계한 metabolite들은 강하게 상호연관성이 있음
- 중국 Chongqing Medical University의 Xie group은 조울증 환자의 뇨시료에서 NMR을 이용한 대사체군의 차별화를 통해 통합 biomarker를 선정하였고 조울증 진단 기법을 확립하였다.

출처 : Metabolomics 2013
[그림 4-1-12] Assessment of metabolic phenotype homogeneity in unmedicated and medicated BD subjects. OPLS-DA model 적용후 조울증 환자군에서의 약물투여군과 비투여군의 예측
(2) Pharmacometabolomics
- 영국 Imperial College Nicholson 교수팀은 환자에게 약물을 투여하기 전에 미리 그 효능을 예측할 수 있는 pharmacometabonomics 방법 절차를 확립하였다. 이 방법은 pharmacogenomics와 gut microbiome의 상태 등을 포함한 연구로서 신약개발의 전임상연구 적용이 가능하며 정밀한 분석기기 및 통계학적인 software가 개발될 경우, 환자를 실시간 monitoring하고 치료할 수 있음을 시사하였다.

출처 : Expert Opin. Drug Metab. Toxicol. 2012
[그림 4-1-13] A schematic diagram indicating how longitudinal pharmacometabonomics. 환자의 metabolic trajectory 결과는 질병의 진행과정과 치료 예측
- 독일 Bayer Schering Parma AG의 Ellinger-Ziegelbauer팀은 InnoMed TredTox consortium(전사체학, 단백체학, 대사체학을 활용)을 구성하여 전임상연구를 수행하고 있으며, 쥐를 이용한 급성독성연구에서 전사체를 통해 cholestasis를 예측하였고, 대사체학을 활용하여 BILE ACIDFML 변화를 측정함으로써 hepatobiliary toxicity를 확인하였다.

출처 : Toxico. Applied Pharmacol. 2011
[그림 4-1-14] Omics analysis in early assessment of drug-induced hepatobiliary injury. Omics 기술을 활용한 toxicity assessment
(3) Environmental Metabolomics 분야
- 프랑스 Research Institute for Environmental and Occupational Health의 Bonvallot 박사팀은 농약 등 환경유해물질 노출되었을 경우 임산부에 대한 위해도 평가를 metabolomics를 이용하여 평가하였다. 임산부가 농약에 노출되었을 경우 oxidative stressdp 관여된 대사체들이 증가하였으며, energy metabolim에 이상이 있음을 확인하였다. 이 연구는 임산부 cohort를 실시한 민감군에 대한 결과로서 metabolomics를 활용한 위해도 평가의 가능성을 얻었다.

출처 : PLOS ONE. 2013
[그림 4-1-15] PLS-DA score plot from the urinary metabolic profiles from pregnant women. Metabolomics 기술을 활용한 pesticide 노출 평가
- 중국 Nanjing University의 Cheng 교수팀은 다양한 유해물질에 오염된 양쯔강을 식수로 사용하는 주민들에 대한 건강영향 평가로서 mice를 양쯔강에서 정수한 물을 9일간 섭취시킨 후의 전사체와 대사체를 비교한 결과 변형된 전사체와 대사체를 확인함. 이 연구는 전사체학과 대사체학을 접목해서 건강영향평가를 가능하게 하였다.

출처 : Environ. Sci. Technol. 2012
[그림 4-1-16] Evaluating the transcriptomic and metabolic profile of mice exposured to source drinking water. 전사체분석과 대사체분석을 통한 유해물질에 오염된 음용수 섭취후의 변화
- 중국 Harbin Medical University Sun 교수팀은 미량의 acephate를 장기간 쥐에게 투여 한 후 그 독성 효과를 UPLC-MS로 대사체변화를 관찰하였다. 미량의 acephate에 노출이 되어도 신장 손상과 내인성 대사과정에 이상이 생성됨을 확인하였고, 이결과는 유해물질의 위해도 평가에 적용할 수 있는 가능성을 보여준 결과였다.

출처 : Ecotox. Environ. Safety 2012
[그림 4-1-17] 미량의 노출에 의한 대사체변화(trajectory analysis)
(4) Bioinformatics Metabolomics 분야
- 영국 Imperial College의 Montana 교수팀은 COMET(Consortium for Metabolomic Toxicology) 통해 얻어진 많은량의 data에서 bioinformatics를 활용한 data mining을 하고, 시간에 따른 대사체 변화를 각 개체 사이의 변화 및 개체군내의 변화들을 통계학적인 기법을 통해 단순화 한 SME(smoothing spines mixed effects) model과 대사체의 기능을 연계하여 biomakrer를 도출하는 연구를 하였다.

출처 : Bioinformatics 2011
[그림 4-1-18] Biomarker selection using the SEM model. Data mining을 통한 biomarker 도출 Mapping metabolome regulation on biochemical networks. (생화학적 네트워크에서 대사조절지도)
(5) Plant/Phytochemical Metabolomics 분야
- 일본 오사카 대학의 Fukusaki 교수팀은 녹차 추출물로부터 얻은 대사체들을 LC-MS를 이용한 non-targeted metabolic profiling 방법으로부터 ID하는 방법을 체계적으로 개발하였다. MS의 정확도, 대용량 DB로부터 대사체 확인, mass isotope의 패턴으로부터 대사체들의 구조를 확인하였다.

출처 : J. Chromatogr. A 2013
[그림 4-1-19] Non-targeted metabolic profiling으로부터의 대사체 ID 방법
라. 국내 현황
(1) Biomedical Biomarker 분야
- 부산대학교 : 대장암 환자의 조직에서 high-resolution magic angle spinning (HR-MAS) NMR spectroscopy을 활용한 암환자군과 정상군의 대사체를 분석한 결과, 암환자군에서의 arginine, betaine, glutamate, lysine, taurine 등의 농도가 높았으며, glutamine, hypoxanthine, isoleucine, lactate, methionine, pyruvate, tyrosine 등의 농도는 정상군에 비해서 그 농도가 낮음을 확인하였다. 또한 OPLS-DA 분석을 통해 두군간의 대사체의 차이를 확인하였다(Bull. Korea Chem. Soc. 2013).
- 한국한의학연구원 : 급성뇌경색 환자의 증상별 대사체 변화를 LC-MS를 활용하여 연구하였다. 혈장내 lysophosphatidylcholines의 지방산의 포화도 및 불포화도에 따라서 급성뇌경색 환자의 증상별 차이가 있음을 확인하였다(Evidence-based Complementary and Alternative Medicine, 2013).
- 서울대학교 의과대학 : NMR을 이용한 과민성대장증후군 환자에서 생균제의 효능을 혈청 및 변에서 평가하였다. 에너지 항상성(serum glucose) 및 간기능이 향상(serum tyrosine) 됨을 확인하였고, 장질환 및 증상을 평가하는데 대사체학적 접근이 활용할 수 있음을 보여 주었다(J. Clin. Gastroenterol. 2011).
(2) Pharmacometabolomics 분야
- 이화여자대학교 : NMR을 활용하여 indomethacin을 쥐에게 투여한 후, 위 손상 정도를 대사체학 기법으로 예측하였고, 위 손상정도에 따라서 2-oxoglutarate, acetate, taurine, hippurate 등의 대사체들의 차이가 있음을 확인하였다.

출처 : Anal. Chim. Acta 2012
[그림 4-1-20] Nuclear magnetic resonance-based metabolomics for prediction of gastric damage induced by indomethacin in rats. (쥐 뇨시료내의 대사체 변화 및 위 손상 biomakeremf의 변화)
- 경북대학교 : Metformin 투여 후 대사체들의 변화와 트립토판 대사과정과 organic cation transporter 2(OCT2) 활성도와의 상관관계를 확인하였고, metformin PK와 트립토판 대사과정과의 상관성이 있음을 확인한 연구로서 약물유전체와 약물대사체학을 접목하여 약물역학 연구의 가능성을 나타내었다.
출처 : PLoSONE 2012
[그림 4-1-21] Network visualization of rCCA results. (쥐 뇨시료내의 대사체 변화 및 위 손상 biomakeremf의 변화)
- 한국기초과학지원연구원 : Naproxene 투여량에 따른 대사체 변화를 NMR을 활요하여 분석하였다. 투여량에 따라서 대사체 패턴의 변화를 관찰하였고 naproxene에 의한 위장장애의 경우 에너지대사과정에 이상이 있음을 확인하였다. 또한 트립토판이 kynurenate로 대사되면서 궤양을 일으키는 것을 증명함으로써, 약물 독성 평가 연구에 대사체학이 활용될 수 있음을 확인하였다.

출처 : Toxicology Letters 2011
[그림 4-1-22] Metabolic pattern analysis and trajectory after naproxen administration.
(3) Plant/Phytochemical Metabolomics 분야
- 한국기초과학지원연구원 : 한국내에서 생산되는 참당귀를 NMR과 UPLC-MS를 이용하여 대사체 변화를ᅟ분석한 결과 원산지에 따른 대사체의 함량차이를 확인하였고 원산지 판별법에 대사체학적 접근이 제룸 품질 평가에 도움을 줄 것으로 예상하였다.

출처: J. Agric. Food Chem. 2011
[그림 4-1-23] Metabolite patterns from a non-targeted metabolomic approach. (non-targeted 대사적 접근에 의한 대사체 패턴)
(4) Metabolomics and Nutrition 분야
- 한국식품연구원 : 쥐의 연령별 대사체의 변화를 UPLC-QTOF-MS로 분석하였다. 간대사와 연관이 있는 120여종의 대사체들의 변화, 즉 지방대사체들, 에너지대사에 관여하는 대사체들 및 nucleic acid 대사체들의 변화를 관찰하였고, energy dysregulation, hypoxanthine 및 xanthine 대사체는 나이에 따라서 증가했다. 이 결과는 energy dysregulation 및 free radicals이 노화와 연관이 있다는 이론을 입증하였다.

출처: J. Proteome Res. 2012
[그림 4-1-24] Metabolite difference with aging and the metabolic pathway of aging based on liver metabolites.
라. 발전 전망
대사체학 연구의 기본은 크게 세 개의 분야로 발전 가능성이 있다.
- 시료 채취 시 각 연구 주제에 알맞은 시료 채취 절차의 표준화, 보관, 운송 등에 대한 표준화 절차가 필요하며,
- 시료분석 단계에서 시료 전처리 방법 및 초정밀 기기분석법의 표준화,
- 대용량의 데이터를 단순화하고 상관성을 찾을 수 있는 data mining 기술의 발전과 통계기법의 발전 등의 가능성이 있다.
대사체학 연구를 통해 얻어진 결과들을 기존의 생화학적인 이론에 적용함으로써 질병의 원인 규명과 기전을 규명함으로써 맞춤의학 발전이 활발해질 전망이며, Metabolic fingerprinting을 통한 원산지 판별 및 GMO 식품의 위해도 평가 연구 및 미량의 환경유해물질 노출에 의한 질환 연구등에 적용 가능성이 있다.
5. 시스템생물학
가. 개요
시스템생물학(systems biology)은 시스템이론을 생명과학에 응용하여 생체구성 인자간의 상호관계와 상호작용의 원리를 이해하게 하고 나아가 동역학적 특성을 규명함으로써 생명현상의 창발적 현상과 그 속에 잠재된 지배원리를 시스템 차원에서 이해하게 하는 학제간 신기술 융합분야이다.
시스템생물학이 기본적으로 주장하는 것은 ʻʻ전체기능계(whole functional system)는 그것을 이루는 구성인자들 (components) 사이의 상호관계 (relationship)를 통해 이해할 수 있고, 역으로 각각의 구성인자들의 기능은 전체기능계 안에서 다른 구성인자들과의 관계성에 의해 이해할 수 있다ʼʼ는 것이다. 따라서, 일반적으로 시스템생물학에서 던지는 질문들은 다음과 같다. (1) 생체 네트워크의 기본적인 구조와 특성은 무엇인가? (2) 생체 시스템은 다양한 환경 안에서 시간에 따라 어떻게 동작하는가? (3) 생체 시스템은 어떻게 안정성(stability)과 견고성(robustness)을 유지하는가? (4) 어떻게 하면 생체 시스템을 우리가 원하는 바람직한 특성을 갖도록 변형하거나 구현할 수 있는가?
비록 시스템생물학이란 개념은 이미 오래 전부터 존재해왔으나 시스템의 구성인자에 관한 정보획득과정의 어려움 때문에 시스템생물학적 접근법이 본격적으로 사용된 것은 21세기에 들어와서라고 볼 수 있다. 이는 복잡한 생물체를 단순화된 실험적 재현의 틀 안에서 이해하려는 기존 환원주의적 접근법의 한계성에 대한 인식과 더불어, 그 동안 축적되어온 소위 오믹스 (omics)로 표현되는 다층적인 대량의 데이터발굴(high-throughput, HT)과 컴퓨팅능력의 조합이 시스템적 접근을 가능케 한 것이다.

[그림 4-1-25] 학제간 융합연구를 통한 시스템생물학 연구
2000년 초부터 일본과 미국을 중심으로 새롭게 시작된 시스템생물학은 불과 10여년 사이에 세계적 학술대회와 주요 연구기관 및 연구그룹을 중심으로 그 중요도에 대한 인식이 급격히 확산되고 있으며, Pubmed에 등록된 시스템 생물학관련 연구결과를 보더라도 과거 3년간 발표된 논문 수(8,275건)가 현재까지 발간된 전체 논문 수(15,711편)의 절반이상(52.7%)을 차지할 만큼 관련연구가 전 세계적으로 급격히 증가하고 있음을 알 수 있다.
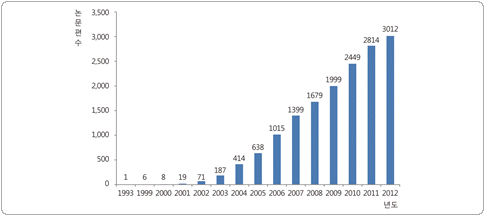
출처 : 자체 자료(검색키워드: ʻʻSystems Biologyʼʼ)
[그림 4-1-26] 시스템생물학 관련 논문의 연도별 발표 현황
시스템생물학 연구 분야는 급격히 성장하여 미생물을 대상으로 새로운 유전자 회로 설계 및 변경과 같은 엔지니어링 기술을 이용한 실용적 목적을 추구하는 합성생물학(synthetic biology)의 발전을 아울러 가져왔고, 최근에는 다세포 동식물체를 대상으로 유전자의 신기능 예측과 더불어 효과적인 치료제 개발에도 박차를 가하고 있다.
나. 해외 동향
시스템생물학은 선진국에서도 2000년대에 들어와 새롭게 연구가 시작되었지만, 현재 선진국을 중심으로 매우 활발한 연구가 진행되고 있으며, 그 중요도에 대한 인식이 날로 더해가고 있다. 포스트 게놈시대에 축적된 방대한 데이터와 기술의 진보로 향후 인간의 질병메카니즘에 대한 새로운 이해와 체계적인 신약후보물질 발굴에 중요한 역할을 하게 될 것으로 판단된다.
시스템생물학은 최근 개인수준의 인식을 넘어서 연구기관과 대학, 그리고 국가주도의 연구프로그램으로 확대되고 있는데, 일본에서는 Systems Biology Institute(SBI, http://sbi.jp)가 설립 운영되고 있으며 ERATO-SORST Kitano Symbiotic Systems Project(http://www.symbio.jst.go.jp)를 통해 향후 시스템생물학이 정립된 이후 여러 생명체의 모델개발이 이루어질 때를 대비하여 세계적 표준안을 만듦으로써 기술우위를 선점하기 위한 투자와 노력을 하고 있다. 미국도 댈러스(Dallas)의 AfCS(Allliance for Cellular Signalling), 시애틀의 시스템생물학연구소(Institute for Systems Biology, ISB), 버클리의 분자과학연구소 (Molecular Sciences Institute) 등을 설립하고 시스템생물학 연구를 주도해 나가기 위한 투자를 해오고 있다. AfCS는 미국과 영국의 7개 연구소가 공동으로 2000년 설립하였고, 노벨상 수상자인 Alfred Gilman을 회장으로 한 운영이사회가 이끌고 있다. ISB도 2000년 초 유전자 염기서열 자동분석법의 개발자 가운데 한 사람인 Leroy Hood가 Reudi Aebersold, Alan Aderem과 함께 설립하여 현재는 전산, 소프트웨어, 데이터베이스, 생물학, 물리학, 화학, 수학, 의학, 유전학 등 다양한 분야의 전문가들이 공동연구를 통하며, 시스템생물학 관련 우수 연구성과를 산출하고 있다. 버클리 분자과학연구소는 1996년 노벨상 수상자인 Sidney Brenner에 의해 설립되어 생물정보학과 컴퓨터 모델링을 바탕으로 한 예측생물학(Predictive biology)을 선도하고 있다.
유럽에서는 독일이 가장 먼저 정부(BMBF) 차원의 시스템생물학 연구과제를 주도하여 2003년부터 매년 큰 단위의 연구비를 투자하고 있으며(http://www.systembiologie.de), 스위스는 스위스 정부 역대 가장 큰 연구단(SystemsX)을 구성하여 시스템생물학 연구를 지원하고 있다. 영국 또한 다양한 시스템생물학 연구주제를 선정하여 여러 정부기관(BBSRC, EPSRC 등)과 사설재단이 연구비를 지원하고 있다.
[표 4-1-8] 국외 시스템생물학 관련 주요 연구 기관 및 프로그램
|
관련기관(국가 또는 URL) |
내 용 |
|
Institute for Systems Biology (미국, http://www.systemsbiology.org) |
2000년 미국 시애틀에서 설립되었고, 다수의 생물학자, 공학자, 전산학자, 물리학자들이 유전체학, 단백체학 기법을 통해 당뇨병, 헌팅턴병, 프리온병 등을 타겟으로 시스템 생물학의 선도적인 연구를 수행하고 있음. 또한 cytoscape, Systems Biology Markup Language 등을 선도. |
|
Systems Biology Institute (일본, http://www.sbi.jp) |
2000년 일본 동경에 설립되었으며, Luxembourg Centre for Systems Biomedicine과 함께 파킨슨병 공동연구를 수행하여 왔고 SBI Australia 를 설립하여 불임에 관한 시스템생물학 연구를 수행. |
|
Luxembourg Centre for Systems Biomedicine (룩셈부르크, http://wwwen.uni.lu/lcsb) |
Institute for Systems Biology, Systems Biology Institute 등과 협력하여 난치성 질병 (주로 파킨슨병과 같은 신경질환과 대사 질환)에 관한 연구수행. |
|
SystemsX.ch (스위스, http://www.systemsx.ch) |
스위스 최대 연구과제로 기초연구 분야에서 학제간 연구까지 다양한 시스템생물학 연구과제를 지원. |
|
Institute of Molecular Systems Biology (스위스, http://www.imsb.ethz.ch) |
2005년 취리히에 설립되었으며, 생물학, 화학, 생물 정보학적 연구를 통합하는데 목적을 두고 있음. SystemsX.ch의 한 파트. |
|
Institute for Genomics and Systems Biology (미국, http://www.igsb.anl.gov) |
2006년에 발족되었고 기존 시카고유전체학 연구 프로젝트를 토대로 유방암, 대사성 질환, 당뇨병, 염증성 장 질환 등에 초점을 맞추고 있음. |
|
Center for Systems Biology at IGSP (미국, http://www.genome. duke.edu/centers/csb) |
2004년에 발족되었고 효모와 사람의 세포주기, 식물 뿌리와 성게의 발생에 대한 연구, 효모와 성게의 진화 과정을 networking하는 연구 수행. |
|
Ottawa Institute of Systems Biology (캐나다, http://www.oisb.ca) |
2004년 오타와에서 창립되었으며, 인간의 질병에 관한 시스템적 이해와 고속대용량 실험 테크닉개발에 집중. |
|
Netherland Institute of Systems Biology (네덜란드, http://www.sysbio.nl) |
2007년에 설립되었고, 세포 모양의 형성과 신호전달, 대사 및 유전자 네트워크에 관한 연구에 중점을 두고 있음. |
|
Department of Systems Biology at Harvard Medical School (미국, http://sysbio.med.harvard.edu) |
2003년 세계 최초로 Harvard Medical School에 시스템 생물학과를 설립하였으며 현재 M. Kirschner를 중심으로 20 여명의 faculty로 구성됨. |
|
Manchester Centre for Integrative Systems Biology (영국, http://www.mcisb.org) |
2005년 맨체스터대학에서 시작하였고, 유전체 전체를 대상으로 정량적 데이터 산출, 기술개발, 대사과정 모델링 및 데이터 통합을 추구하고 있음. |
|
Cambridge Systems Biology Centre (영국, http://www.sysbiol.cam.ac.uk) |
2006년 캠브리지 대학에서 시작하였으며, 세균주화성의 생화학적 회로 시뮬레이션, 마이크로어레이 기반의 유전체학 기술개발, 질량분석법, 단백질체학, 고속대용량 분석기술, 대용량 데이터 분석 기술개발. |
|
INBIOSIS institute of systems biology (말레이시아, http://www.inbiosis.ukm.my) |
다양한 오믹스 데이터를 통합하여 식물 생산량 및 체내에서 유용하게 사용되는 대사 산물의 합성과 생산 증가를 위한 유전자 변형기술 개발. |
|
Berlin Institute for Medical Systems Biology at MDC (독일, http://www.mdc-berlin.de/en/bimsb) |
2008년 공식적으로 연구 시작. 전사 조절 메커니즘, 신호전달계, 단백질-단백질 결합 네트워크에 관한 연구가 이루어짐. |
|
HapatoSys (독일, http://www.hepatosys.de/en) |
2004년 독일 정부의 대규모 지원으로 연구 시작. 해독작용, endocytosis, 철분조절, 재생 등의 간세포 특이적 세포 활성에 대한 정량적, 시스템적 이해를 목표. |
출처 : 2011 생명공학백서 내용 수정‧보완
범세계적인 시스템생물학자들이 모이는 시스템생물학 국제심포지움(International Conference on Systems Biology, ICSB)은 북미, 유럽, 아시아(현재까지는 일본에서만 개최)를 돌아가며 매년 열리는데, 2013년에는 덴마크 코펜하겐에서 개최 되었으며 총 44개국 776명(사전등록 기준)의 연구자들이 참가하여 479편의 논문을 발표하였다. 이것은 2010년 영국 에딘버러 모임 때 발표된 논문 수 1,688편과 비교했을 때 현저히 줄어든 숫자이다. 한국에서는 이번에 8명의 과학자가 7편의 연구결과를 발표하였는데 이 또한 에딘버러 미팅 때 발표한 논문 수 43편에 비하면 현저히 줄어들었다. 이번 미팅에서 한국과학자가 발표한 논문 수는 국가별로 16위에 해당한다(표 4-1-9). ICSB의 참가자수가 전 세계적으로 줄어드는 현상은 시스템생물학이 점차 보편화되어 시스템생물학 관련 컨퍼런스가 점차 늘어나고 있으며, 기존 생물학 관련 대규모 학회에서 시스템생물학 관련 세션을 늘리고 있는 것과 연관된 것 같다.
[표 4-1-9] 2013년 ICSB 국가별 발표 상위 20위(제1저자 기준)
|
순위 |
국가 |
편수 |
백분율 |
|
1 |
독일 |
93 |
19.42% |
|
2 |
영국 |
61 |
12.73% |
|
3 |
미국 |
49 |
10.23% |
|
4 |
일본 |
32 |
6.68% |
|
5 |
네덜란드 |
31 |
6.47% |
|
6 |
덴마크 |
27 |
5.64% |
|
7 |
스웨덴 |
19 |
3.97% |
|
8 |
스위스 |
19 |
3.97% |
|
9 |
핀란드 |
16 |
3.34% |
|
10 |
이탈리아 |
15 |
3.13% |
|
11 |
프랑스 |
13 |
2.71% |
|
12 |
체코 |
12 |
2.51% |
|
13 |
스페인 |
10 |
2.09% |
|
14 |
룩셈부르크 |
8 |
1.67% |
|
15 |
캐나다 |
7 |
1.46% |
|
16 |
대한민국 |
7 |
1.46% |
|
17 |
대만 |
6 |
1.25% |
|
18 |
중국 |
6 |
1.25% |
|
19 |
호주 |
5 |
1.04% |
|
20 |
벨기에 |
5 |
1.04% |
출처 : 자체 자료
다. 국내 현황
국내에서는 2002년도에 시스템생물학 연구회 구성으로 그룹화, 상호연계연구, 연구대상 생체시스템의 체계적인 선정 등이 이루어지기 시작했으며, 2003년 4월에 서울대 문화관에서 국내에서는 처음으로 시스템생물학 국제학술대회(Seoul Symposium on Systems Biology 2003)가 개최되었다. 2003년 6월부터는 시스템생물학을 국책연구사업과제로 선정하여 ʻʻ시스템생물학사업단ʼʼ을 출범시켰으며 11개 세부과제를 중심으로 시스템생물학연구가 시작되었다. 2005년에 2단계 사업으로 진핵세포를 대상으로 ʻʻ칼슘대사 시스템생물학연구(KOSBI)ʼʼ와 원핵세포를 대상으로 한 ʻʻ대사회로분석 및 가상세포시스템연구ʼʼ가 선정되었으며, 2008년부터 3단계, 2010년부터 4단계 사업으로 이어져 연구가 마무리 되었다. 이들 연구 과제를 통해 신규 인자의 체계적 발굴, 구성인자들 간의 상호작용 계측, 네트워크 규명, 수학적 모델링, 미생물 대사회로의 정성적, 정량적 분석, 시스템재설계 기술 및 가상세포 시스템 개발 등이 이루어졌다. 또한 2009년에는 GIST에 시스템생물학연구소가 설립되어, 이화여대시스템생물학연구소, 국가생명연구자원 정보센터(KOBIC)와 함께 시스템생물학 인프라구축사업을 추진하고 있다. 이를 통해 국내 시스템생물학 연구를 위한 기반기술을 개발하고 인프라를 구축함으로써 우리나라 시스템생물학의 국제적 경쟁력 향상을 위해 노력하고 있다. 2011년부터는 한국생물정보시스템생물학회에서 매년 시스템바이오 정보의학 국제학술대회 (Translational Bioinformatics Conference)를 개최하여 유전체학, 생물정보학, 의료정보학 분야의 핵심현안에 대한 활발한 학술적 교류가 이루어지고 있다.
표 4-1-10은 국내 시스템생물학 관련 주요 학술대회 및 학술 활동을 보여주고 있는데, 2006년부터 국내 시스템생물학 관련 학술 활동이 꾸준히 활성화되고 있고, 다양한 국제심포지움도 개최되어 연구성과의 교류와 공동연구의 활성화를 도모하고 있다.
[표 4-1-10] 국내 시스템생물학 관련 주요 학술 대회 및 학술 활동
|
연 도 |
내 용 |
|
2002년 |
시스템생물학 연구회 구성 |
|
2003년 |
시스템생물학 사업단 시작 |
|
2003년 4월 |
서울국제심포지움 개최 |
|
2003년 5월 |
IBEC(Integrated Biology of Escherichia coli) 구성 |
|
2004년 |
YSBN(Yeast Systems Biology Network) 구성 |
|
2005년 1월 |
RTKC(Receptor Tyrosin Kinase Consortium) 구성 |
|
2005년 11월 |
Electronic International Molecular Biology Network-Systems Biology(eIMBL) 설립 |
|
2006년 10월 |
시스템생물학의 대장균 관련 국제 학술대회 ‘제3회 IECA2006’ 개최 |
|
2007년 11월 |
제 304회 학연산 연구성과교류회(주제: 시스템생물학) |
|
2008년 11월 |
시스템 생명정보학 국제 심포지엄 (International Symposium on Systems Bioinformatics) |
|
2009년 1월 |
GIST 시스템생물학연구소 개소식 및 기념 심포지움 개최 |
|
2009년 1월 |
제2회 한독심포지움(‘시스템생물학: 게놈에서 생명까지’) 개최 |
|
2009년 12월 |
한국분자세포생물학회 시스템생물학분과 심포지움 개최 |
|
2010년 12월 |
한국분자세포생물학회 시스템생물학분과 심포지움 개최 |
|
2011년 1월 |
The 9th Asia Pacific Bioinformatics Conference 개최 |
|
2011년 8월 |
the 5th Asian Young Researchers Conference on Computational and Omics Biology 개최 |
|
2011년 9월 |
20th Korea Genome Organization(KOGO) Annual Conference 개최 |
|
2011년 11월 |
1st Translational Bioinformatics Conference 개최 |
|
2012년 10월 |
2nd Translational Bioinformatics Conference 개최 |
라. 발전 전망
2003년 IEEE Control Systems Magazine에 첫 리뷰논문이 등장한 이래 전 세계적으로 시스템생물학이라는 새로운 생물학적 기조를 바탕으로 관련논문 수가 급증하였고, 시스템생물학을 적용한 질병 진단 및 치료와 관련 시장의 규모도 급격한 성장이 예상되고 있다. 우리나라의 경우도 연구 성과는 가시적으로 늘어나고 있으나 이미 10여 년 전부터 막대한 연구비투자를 해온 선진국에 비하면 그 중요도의 인식이나 투자규모 면에서 아직 미미한 수준에 있으며 시스템생물학 관련 인프라를 구축하는 단계에 있다.
시스템생물학은 생명과학, 정보과학, 컴퓨터 기술 등의 새로운 기술의 집약과 다양한 학문 분야의 협력이 요구되는 자본·기술 집약적인 분야인 만큼, 연구자 중심의 Bottom-up 방식의 아이디어 발굴보다는 정부차원에서의 Top-down 방식의 기획이 필요할 것으로 판단되며, 특히, 미국, 독일, 영국, 일본 등, 이 분야 선진국의 경우와 같이 일관성 있고 체계적인 연구가 수행될 수 있도록 국가차원의 시스템생물학 연구소의 설립이 시급하다고 볼 수 있다. 뿐만 아니라, 시스템생물학이 실효를 거두어 나가기 위해서는 무엇보다 실험생물학자가 전통적인 접근방법의 고수에서 벗어나 실험계획의 단계에서부터 시스템과학 전공자와 의논할 수 있는 학문적 분위기가 조성되어야 하고, 열린 생각(Open-mind)과 진정한 공동연구수행을 위한 상호노력이 이루어져야 할 것이다.
키워드 ʻʻSystems Biologyʼʼ로 검색한 논문의 국가별 통계 자료(표 4-1-11)를 보면, 2012년 기준 시스템생물학 관련 국가별 누적 SCI 논문발표 수가 미국이 5,157편으로 여전히 전체 상위 16개국 누적 논문 수(12,472편)의 41.3%를 차지 할 만큼 압도적임을 알 수 있다. 한편, 최근 1년간 논문 증가율은 중국이 42.2%로 가장 높은 증가율을 보였고, 이탈리아가 38.7%로 그 뒤를 이었다. 우리나라는 누적 SCI 논문 수는 16위지만, 최근 1년간 논문 증가율은 35.3%로 전체 3위를 차지하여 시스템생물학 연구 분야에서 매우 고무적인 성과를 내고 있다.
[표 4-1-11] 키워드 ʻʻSystems Biologyʼʼ로 검색한 국가별 누적논문 순위
|
순 위 |
국 가 |
2011년 |
2012년 |
1년간 논문증가율 |
|
1 |
미국 |
4,273 |
5,157 |
20.7% |
|
2 |
영국 |
1,357 |
1,629 |
20.0% |
|
3 |
독일 |
809 |
1,016 |
25.6% |
|
4 |
중국 |
585 |
832 |
42.2% |
|
5 |
캐나다 |
549 |
683 |
24.4% |
|
6 |
벨기에 |
462 |
540 |
16.9% |
|
7 |
일본 |
361 |
407 |
12.7% |
|
8 |
덴마크 |
301 |
355 |
17.9% |
|
9 |
스페인 |
242 |
307 |
26.9% |
|
10 |
스위스 |
224 |
293 |
30.8% |
|
11 |
프랑스 |
247 |
283 |
14.6% |
|
12 |
이탈리아 |
186 |
258 |
38.7% |
|
13 |
네덜란드 |
180 |
228 |
26.7% |
|
14 |
대만 |
152 |
185 |
21.7% |
|
15 |
스웨덴 |
130 |
161 |
23.8% |
|
16 |
대한민국 |
102 |
138 |
35.3% |
출처 : 자체 자료
시스템생물학적 연구를 통한 효과적 질병원인 규명, 약물의 효과 예측, 신약후보물질 및 바이오마커 발굴은 신약개발의 새로운 패러다임으로써 기대되는 바가 크다. 따라서 비용과 시간이 많이 소모되고 위험부담이 많은 신약개발에 큰 영향을 미치고 있는데, 이미 세계 10대 제약업체 중 많은 수가 신약개발에 있어 시스템생물학적 접근법을 직접 도입하거나 시스템생물학 기술을 가진 업체와 협력 또는 인수·합병하여 신약개발에 시스템생물학 연구 활용을 본격화하고 있다.
아래 표 4-1-12는 현재 국제적인 시스템생물학관련 기업에서 추구하는 주요 연구 현황을 보여 주고 있다.
[표 4-1-12] 신약 관련 기업의 시스템생물학연구 현황
|
연구센터 |
주 소 |
연 구 내 용 |
|
AstraZeneca |
www.astrazeneca.com |
MIT(Doug Lauffenburger's systems biology lab)와 함께 암 및 염증 질환에 대한 컴퓨터 모델 연구 |
|
Bioseek |
www.bioseekinc.com |
시스템생물학 기법을 이용 인간의 주요 세포 질환 모델들을 연구하여 안전한 신약 후보물질 개발 |
|
Cellnomica |
www.cellnomica.com |
조직, 기관 등에 대한 모델링을 통해 암과 같은 조직 단위의 질병 연구 |
|
CombinatoRx zalicus |
http://www.zalicus.com |
시스템생물학 기법을 통해 통증, 면역 및 대사질환 치료 약물 개발. 약물 조합에 따른 결과와 유전적 백그라운드에 따른 약물 저항성 등을 연구 |
|
CytoPathFinder |
www.cytopathfinder.com |
세포기반 스크리닝을 위한 transfection microarray 개발 |
|
Eli Lilly Center for Systems Biology |
www.lilly.com |
회사의 신약개발 노력을 지원하기 위한 단백질 및 유전체 기술의 통합에 주력 |
|
Entelos |
www.entelos.com |
PhysioLab 기술을 이용한 질병의 컴퓨터 모델 개발. Pfizer와 협력관계 |
|
GSK |
http://www.gsk.com/ |
신약 표적 발굴, 검증 기술을 가진 Chemical proteomics 전문 연구업체인 Cellzome을 인수하여 신약 개발 능력을 확충 |
|
Ingenuity |
www.ingenuity.com |
시스템생물학 통합 소프트웨어 및 지식 DB 개발 (omics data와 model biological system을 분석하는 툴 제공) |
|
Johnson & Johnson |
www.jnj.com |
Georgia Institute of Technology와 연구협력을 체결하고 의과학 연구에 중점을 둔 다학제간 협력연구를 수행 |
|
Roche |
www.roche.com |
스위스의 SystemsX 프로그램과 3년간 연구협력을 체결하여 베타세포(beta cell) 손상을 진단하는 바이오마커 발굴과 신약개발을 수행 |
출처 : 2011 생명공학백서 내용 수정‧보완
마. 산업 현황
약 10여년의 역사를 가진 시스템생물학은 주로 복잡한 생체시스템을 이해하는데 역점을 두고 발전하였고, 의약 및 바이오산업을 위한 활용에는 아직 걸음마 단계에 있다. 그러나 최근 차세대 염기서열분석기(Next Generation Sequencing, NGS)의 개발로 1000 달러 게놈시대가 도래하며 시스템생물학의 활용 가치가 급증하게 되었다. 최근에는 질병의 치료보다는 질병이 발생하기 전에 발병 가능성을 가늠케 하는 예측진단(Predictive testing)과 약물에 대한 환자의 민감도를 시뮬레이션하는 의약 맞춤처방이 확대될 것으로 전망되어, 시스템생물학을 주요 기술로 하는 맞춤의료(Personalized medicine) 사업이 향후 제약시장에서 큰 비중을 차지할 것으로 사료된다. 또한, 산업 미생물 개발 분야에서도 시스템생물학의 활용 가치가 대두되고 있다. 시스템생물학 기술은 이미 이론상 가능한 최대 수율에 근접한 산업 미생물 개발에 가상세포 시뮬레이션을 도입하여 효율을 획기적으로 끌어올리는가 하면, 미생물 균주를 이용한 바이오 대체에너지 생산기술에도 전통적 대사공학 기법과 더불어 시스템생물학 기법이 활용되어 효율을 최적화하는 기술로 활용되어 자원 고갈문제를 해결하는데도 큰 역할을 할 것으로 기대된다.
6. 구조생물학
가. 개요
생명현상을 원자수준에서 관찰하여 원천적인 기작의 이해에 공헌해 온 구조생물학은 단백질 대량발현 및 정제기술, 결정화 로봇의 진보, 방사광가속기를 이용한 위상의 결정 등 관련기술의 비약적인 발전으로 구조 규명이 가능한 단백질의 범위가 넓어지고 구조규명의 속도도 빨라지게 되었다. 또한 기술적인 측면으로 엑스선자유전자(X-ray free electron laser, XFEL)를 이용한 4세대 가속기가 대두되어 구조생물학 분야에 또 다른 혁신을 가져오게 되었다. 4세대 가속기는 3세대 가속기보다 10억배 이상 강한 빛을 얻을 수 있고 펨토초의 펄스빔을 생산하여 순간에 일어나는 생명현상을 원자수준에서 관찰할 수 있다.
기존에는 단순한 원자수준 구조규명을 통한 생명현상의 이해 자체에 의의를 두는 경우가 많았으나 최근에는 구조규명을 통해 얻어진 결과를 바탕으로 신약개발, 바이오센서, 생체신소재, 항원항체설계 등 여러 가지 응용분야로 구조생물학 연구가 확장되고 있다. 특히 국내의 신약개발에서 경쟁력 있는 분야로 간주되어 대기업에서 대규모 투자를 진행하고 있는 바이오시밀러의 경우 항체의 구조를 기반으로 하여 안정성 및 효능의 향상이 경쟁력 있는 제품생산에 중요한 역할을 담당하고 있어 관련분야 전문가의 육성이 시급하다.
기술개발이 적극적으로 진행되고 있는 XFEL을 사용하면 궁극적으로 단백질의 결정성장 과정 없이 고해상도의 원자수준 규명이 가능해질 것이다. 이것이 현실화 되면 결정화의 어려움 때문에 지금까지 아주 일부분만 구조규명이 가능했던 막단백질 구조연구 분야에 혁신을 가져올 것이며 이러한 구조적인 정보는 암, 당뇨병, 신경질환 등의 난치병 치료에 새로운 전기를 마련할 것이다. 여기에 그치지 않고 단분자 구조규명 기술은 살아있는 세포의 구성성분도 순간적인 구조규명이 가능할 수 있게 할 것이다.
나. 해외 동향
(1) 기술의 진보
가속기 기술의 발전으로 수년전에는 불가능했던 실험들이 가능해지고 있다. 삽입장치와 마이크로초점 기술을 활용하여 매우 작은 결정을 가지고도 구조규명에 필요한 회절자료를 얻을 수 있게 되어 결정이 잘 안생기는 막단백질의 연구에 많은 도움이 되고 있다. 아직 태동기이기는 하지만 현재 사용이 가능한 미국 스탠포드의 LCLS에서 운영하는 XFEL 광원을 이용하여 마이크로-나노 크기의 결정을 이용한 구조규명 연구가 여러 가지 시료에서 진행되고 있다. XFEL 광원은 순간적인 노출로도 시료를 파괴할 정도로 강한 빛이지만 방사능손상에 의한 시료의 파괴가 회절자료 생성보다 약간 늦게 일어나기 때문에 구조규명에 의한 회절자료를 얻을 수 있다.
구조생물학 측면에서 XFEL 기술의 궁극적인 목표는 결정성장 없이 단분자의 상태로 구조규명을 하는 것이지만 이를 위하여는 광원이 100배 이상 강해져야 한다. 빔 시딩 등의 기술로 이를 실현하고자 노력하고 있지만 광원의 세기와 함께 회절자료 측정 및 분석기술도 함께 개선되어야 하므로 앞으로 많은 연구가 집중될 것으로 예측된다. 하지만 현재의 광원으로도 결정이 잘 안생기는 막단백질들을 마이크로-나노 크기의 결정성장을 통하여 구조를 규명할 수 있다. 기존에는 이러한 미세결정을 얻었다 하더라고 회절실험을 하기 위한 크기로 만드는데 수십년이 필요하기도 했다. 최근 2~3년 간 이러한 마이크로-나노 결정을 이용한 구조규명이 XFEL로서 가능하다는 것을 광합성 단백질, 바이러스 등을 이용하여 증명하였다.
(2) GPCR 구조연구로 노벨상 수상
세포막의 바깥쪽에 일부분이 노출되어 있는 막단백질들을 자극함으로써 세포안의 기능을 조절할 수 있는 막단백질들은 질병치료제 개발의 좋은 표적 단백질이 되곤 하는데 그중 대표적인 막단백질이 GPCR이다. GPCR은 인체에 약 800 여종 존재하며 지질막을 가로지르는 일곱 개의 헬릭스를 중심으로 하는 막단백질이다. GPCR은 현재 사용되고 있는 질병치료제의 약 30% 이상의 표적으로 하고 있는 매우 중요한 치료제 표적 단백질이다. 표 4-1-13에서는 최근에 진행되고 있는 GPCR을 표적으로 한 신약개발 현황을 나타내었다.
2012년 노벨화학상은 GPCR 의 구조연구를 성공적으로 수행한 과학자들에게 돌아갔는데 이들은 오랜기간 GPCR의 생화학적 기능을 연구하여 회절실험이 가능한 결정성장에 어떠한 접근방법을 사용해야 하는가를 발견하였다. 우선 세포막 바깥부분의 고리 구조들이 유동적이라는 것을 발견하였다. 단백질의 유동적 구조부분은 결정성장시 단백질 분자들이 일정한 방향으로 배열되어 상호작용하는 것을 어렵게 해서 결정성장을 방해하는 것이 알려져 있다. 그래서 이러한 유동성을 줄이기 위해 GPCR에 결합하는 저분자물질인 기능촉진제를 사용하여 이러한 유동성을 줄이는 것이 가능했다. 또한 라이소자임을 융합한다던가 항체의 Fab 부분을 GPCR에 결합시킴에 의해서 결정접촉을 향상시켜서 회절이 가능한 결정을 얻는데 성공하였다.
GPCR의 노벨상은 최근 10년간 구조생물학 분야에서 배출한 4번의 노벨상 중 하나이다. 2003년에는 세포막상의 포타지움 채널의 구조를 규명한 과학자들에게 노벨화학상이 수여되었고, 2006년에는 세포의 전사인자 복합체 구조를 규명한 과학자들에게, 그리고 2009년에는 리보솜의 구조를 규명한 과학자들에게 수여되었다. 포타지움 채널과 GPCR은 둘 다 막단백질로서 막단백질의 구조기능 연구가 과학의 발전에 어느정도 공헌하는지를 말해 준다. 전사인자 복합체와 리보솜은 보통의 단백질 크기의 수십배에 이르는 복합체로서 막단백질과 아울러서 구조연구가 어려웠던 부분이다. 이러한 분야에의 노벨상 수여는 구조생물학의 중요성과 향후 발전방향을 시사하고 있다.
[표 4-1-13] 구조기반 설계를 통한 GPCR 신약개발의 예
|
표적 GPCR |
화합물 데이터베이스 |
히트 화합물 비율 (활성화합물/시험화합물) |
적응질환 |
|
β2-AR(a) |
Combination |
20% (30/150) |
폐질환 |
|
β2-AR(b) |
Zinc |
24% (6/25) |
폐질환 |
|
Adenosine A2A |
MolSoft ScreenPub |
41% (23/56) |
신경퇴행질환, 심혈관질환 |
|
CXCR4 |
Zinc |
17% (4/23) (crystal structure 4% (1/24) (homology model) |
HIV, 암 |
|
Dopamine D3 |
Zinc |
20% (5/20) (crystal structure 23% (6/26) (homology model) |
파킨슨병, 정신분열증 |
|
Histamine H1 |
Zinc |
73% (19/26) |
알레르기 |
|
Histamine H4 |
Zinc |
6% (16/255) (homology model) |
알레르기, 염증 |
출처 : ASBMB Showcase on research, Structure-based drug design and drug discovery for GPCRs (2013. 8)
(3) 통합적 구조생물학(Integrative structural biology)
최근 2~3년간 구조생물학 분야의 새로운 트렌드로서 자리를 잡아가고 있는 것은 하나이상의 구조연구기법을 융합하는 통합적 구조생물학 접근방법이다. 예를 들어 최근에 규명된 바 있는 26S 프로테아좀의 전체복합체 구조는 우선 저온전자현미경으로 전체의 윤곽을 규명한 후에 결정학적 방법으로 규명된 각 부분의 원자구조를 전체윤곽에 끼워 맞추고 분자역학적 계산으로 안정한 구조를 찾는 방식으로 전체복합체의 구조를 원자수준으로 구축하는데 성공하였다.
이러한 통합적 구조생물학의 수단으로서 프로테아좀 구조규명에 사용된 엑스선결정학 및 저온전자현미경 뿐 아니라 핵자기공명분광학, 저각엑스선산란 (SAXS), 수소-중수소교환 질량분석(HDXMS), 단분자형광, 원자힘현미경(AFM), 분석분광학을 비롯한 다양한 생화학적, 분석생물학적인 방법들을 동원해서 생체고분자의 원자수준 구조정보와 기능정보를 알아내는데 사용되고 있다. 이러한 다중모드의 기법에서 생산된 구조정보를 통합하기 위하여 각각의 정보에 대한 적절한 가공과 통합계산의 방법들이 개발되고 있다.
다. 국내 현황
(1) XFEL 건설
미국, 일본에 이어서 포항가속기연구소 내에 국제수준의 사양을 갖는 4세대 가속기가 건설되고 있다. 미국의 스탠포드에 있는 LCLS의 설비는 2010년부터 가동되기 시작하였고 일본의 오사카에 있는 SACLA 설비는 2011년에 완공되어 2012년부터 가동되고 있다. 유럽에서도 독일의 DESY 연구소에 설비를 구축하고 있는데 이 설비는 포항의 설비보다 늦게 완공될 예정이다. 포항의 설비는 2015년 가동을 목표로 건설이 진행되고 있다. 구조생물학 분야의 이용을 위해 결맞음엑스선이미징 빔라인을 구축하고 있으며 광학장비, 시료처리장비, 회절검출장비 등을 준비하고 있다. 이 설비가 완공되면 마이크로-나노 크기의 결정을 이용한 단백질 구조규명이 가능할 것이며 효소반응이나 단백질기계기작을 연구하기 위해 시분해 회절 실험도 가능할 것이다. 표 4-1-14에서는 각국의 4세대 가속기 사양을 나타내었다.
[표 4-1-14] 각국의 XFEL 사양
|
건설기간/사양 |
LCLS(미국) |
Euro XFEL(EU) |
SACLA(일본) |
PAL-XFEL(한국) |
|
기간 |
2005~2009년 |
2009~2015년 |
2007~2011년 |
2011~2015년 |
|
길이(Km) |
1.6 |
3.4 |
0.7 |
0.9 |
|
빔에너지(GeV) |
13.64 |
17.5 |
8 |
10 |
|
파장(nm) |
1.5-0.15 |
6-0.085 |
6-0.08 |
10-0.1 |
|
펄스반복수(Hz) |
120 |
10/180k |
60 |
60 |
|
피크 밝기1) |
3.0 x 1032 |
6.0 x 1033 |
6.0 x 1031 |
1.2 x 1032 |
1) photons/sec mrad2 mm2 0.1% bandwidth
(2) 질병단백질 및 단백질패밀리 연구
인간의 질병에 관련하는 중요단백질의 구조가 국내연구진에 의해 규명되어 최고 수준의 학술지에 논문이 발표되었으며 신약개발에 공헌할 정보를 제공하였다. 산소대사에 관여하는 철함유효소의 반응중간체를 규명함으로써 합성체를 만드는 길을 제시하였으며 GPCR의 하나인 메타로돕신 II 및 어레스틴의 구조를 규명하여 시각 신호전달의 원천적 이해에 공헌하였다. 세포의 단백질대사에 중추적 역할을 하는 유비퀴틴 경로의 Atg8 및 단백질분해효소의 구조 연구를 통하여 세포자식작용, 허피스바이러스 조절작용의 기작을 규명하였으며 박테리아가 발효와 산소호흡 사이에서 의사결정을 하는데 관여하는 단백질의 구조를 규명하여 산업적 응용에 중요한 정보를 제공하였다. 또한 진핵생명체의 크로모좀 구조를 유지시키는 중요단백질의 구조가 규명되었다.
중요단백질의 구조적 정보를 활용하여 in vivo에서 단백질의 역동적인 기능을 설명하기 위하여 단분자 FRET 형광기술을 활용한 중요 연구결과들이 발표되었다. 유전자 결손수선 단백질이 유전자를 스캔하면서 형성하는 clamp 의 기작을 설명하였고 단백질의 구조적 역동성이 분자인식에 관여하여 리간드 결합에 필수적인 상승작용을 한다는 것을 규명하였다. 시분해 엑스선 결정학을 이용하여 광활성을 갖는 황색단백질의 발색단에서 일어나는 트랜스-시스 구조변환을 규명하여 발색단과 주변 아미노산 잔기의 수소결합을 규명하였다. 또한 다양한 인간질환에 관여하는 탈인산화 단백질패밀리에 대한 전체적인 구조-기능 연구가 수행되어 선택적인 저해제 및 질병 치료제 개발에 필요한 정보를 제공하였다.
(3) 한국구조생물학회 창립과 인접 분야와의 연결
국내의 구조생물학 연구를 활성화하고 인접분야와의 교류와 접목을 통하여 새로운 연구분야 창출 및 창의적인 연구결과 생산을 도모하기 위하여 국내 구조생물학 분야 및 인접분야 전문가들이 참여하는 한국구조생물학회가 2012년 창립되었다. 구조생물학의 세계적인 추세가 다양한 기술의 장점을 융합하기 위하여 통합적 구조생물학을 추구하고 있는 것과 발맞추어 전통적으로 구조연구분야를 대표하여 온 단백질결정학, 자기공명분광학 분야의 전문가뿐만 아니라 단분자 형광학, 분자역학계산, 단백질설계, 질량분석의 분야 전문가들을 망라한 학회를 구성하여 통합적 구조생물학의 발전을 가능하게 하였다.
라. 산업 현황
구조생물학은 중요단백질의 구조를 규명해서 생물학적 기능을 설명하는 것에서 발전해서 최근에는 단백질의 기능을 산업적으로 이용하는 바이오신약, 바이오센서, 신소재, 단백질설계 분야에 중요하게 응용되고 있다. 단백질의 기능을 이용하고 유용하게 설계 또는 변형하기 위하여는 원자수준 정보의 확보가 필수적이며 이는 구조생물학의 기법을 이용하는 것에 의해 가능하다. 단백질의 구조분석을 위해서는 결정성장 등을 위해 연구대상 단백질의 물리-화학적 특성, 기능적 특성을 분석하는 것이 선행되어야 할 경우가 많은데 이러한 과정은 항체치료제 등 단백질 치료제/신약을 개발하는 데 필수적인 전문성이어서 제약 및 생명공학 기업에서 적극적으로 활용하고 있다.
최근 국내의 대기업 및 벤처기업에서 바이오시밀러를 필두로 해서 단백질을 기반으로 한 질병치료제를 대량생산 및 산업화 하는데 많은 투자를 진행하고 있다. 이때 필수적인 기술이 단백질의 구조-기능을 최적화 하는 것이다. 이때 구조생물학적인 지식 및 전문성을 활용해서 개발대상 단백질을 변형시킴에 의해 새로운 기능을 도입하거나 기존기능을 최적화 하는 노력이 많이 진행되고 있고 제품생산 및 quality control에서 단백질의 안정성을 유지시키는데도 구조적인 정보를 활용하고 있다. 또한 단백질의 효소기능을 저해하는 저분자 화합물의 구조기반 발굴 및 효능 최적화를 위해서 구조적인 정보를 적극적으로 활용하고 있다.
7. 뇌과학
가. 개요
뇌는 생명체의 다양하고 복잡한 생명현상을 조절, 제어, 유지하는 중심축으로써 감각, 운동과 같은 유형의 실체를 제어하는 것은 물론 사고, 기억, 감정, 언어에 이르는 고등 인지기능을 총괄적으로 관장한다.
이러한 뇌를 심층적으로 연구하는 뇌과학(neuroscience, brain science)은 뇌신경계의 구조와 기능에 대해 분자세포생물학적 연구는 물론 인지과학적 이해를 바탕으로 고등인지기능의 모델링에 이르기까지 폭넓은 스팩트럼을 가지고 있으며, 신경과 정신의 활동원리를 파악하고, 각종 뇌질환의 병인 규명과 치료제 개발을 가능하게하며 궁극적으로는 인간의 정체성과 본질을 규명하고자 하는 종합학문이다.
최근 뇌과학 분야에서는 뇌의 정교한 유전자 발현 지도가 완성되고(Allen brain atlas), 빛을 이용하여 특정 신경세포만을 선택적으로 활성화시킬 수 있는 광유전학(optogenetics)과 뇌를 투명화하여 3차원적으로 뇌의 신경세포 연결망(connectome)을 정교하게 탐색할 수 있는 CLARITY 등의 새로운 뇌연구 기술이 활발히 개발, 활용되고 있다. 또한 줄기세포 기술의 발달은 뇌질환 환자의 피부세포에서 유래한 줄기세포에서 질환 신경세포를 만들어 낼 수 있게 해줌으로써 불치의 뇌질환 치료가능성을 가속화시켜주고 있다.
그러나 이러한 기술의 발달이 뇌에 대한 생물학적 이해를 상당히 진전시켰음에도 불구하고 블랙박스라고 여겨지는 뇌에 대한 과학적 설명은 아직까지 풀리지 않고 있는 부분이 많다. 따라서 뇌의 구조와 기능에 대한 심도 깊은 이해와 그 응용기술의 개발은 21세기를 이끌 미래지향적인 성장 동력으로 평가되고 있다. 최근 삶의 질을 중시하는 사회적 분위기에서 우울증, 수면장애의 만연과 노년층 인구의 증가에 따른 퇴행성 뇌질환의 증대는 뇌과학에 대한 사회적 관심을 촉발시키고 있다. 실제로 신경계 질환에 의한 경제적 비용은 작년 한해만 세계적으로 2조 달러 규모로 추정되고 있다. 이러한 현실에서 뇌연구를 통한 각종 뇌질환의 적절한 예방, 치료법의 발견은 학문적으로 뿐만 아니라, 산업적으로나 사회적으로도 매우 중요한 가치를 지닌다고 할 수 있다.
나. 해외 동향
1990년 미국에서 주창된 ʻ뇌의 10년(Decade of the Brain)ʼ 선언 이후 뇌연구는 인류에게 남은 마지막 프론티어 분야로 전 세계적인 화두가 되었고 그 결과 뇌과학은 비약적으로 발전하였다고 평가된다. 그리고 20여년이 지난 지금까지의 뇌연구 지식의 축적과 기술적 진보를 바탕으로, 2013년 현재 미국과 유럽은 각각 BRAIN INITIATIVE와 Human Brain Project를 추진하여 인간 뇌기능의 비밀을 밝히기 위한 대규모 연구 프로젝트(향후 10년간 각각 3.2조원과 1.7조원의 연구비 투입할 예정)에 착수한 상태이다.
이렇듯 뇌과학의 풀리지 않는 문제를 해결하기 위해 전 세계적으로 뇌연구가 국가연구개발의 핵심 연구개발분야로 강조되고 있다. 주요국가의 뇌연구 동향을 보면 다른 분야와 대비하여 정부가 뇌과학 분야의 연구개발을 주도하여 장기적인 뇌연구정책을 수립, 진행하고 있으며 전문적인 뇌연구기관을 운영한다는 점이 특징이다.
[표 4-1-15] 주요국가의 뇌연구 동향
|
국가 |
주요기관 |
특징 |
비고 |
|
|
미국 |
▪국립보건원(NIH) ▪국립과학재단 (NSF) |
▪NIH 뇌연구기관 연합체인 ‘Blueprint for Neuroscience Research’를 중심으로 뇌연구 진행 (Blueprint Grand Challenge를 통해 통증연구(’09년), 신경계질환 신약 전임상개발(’10년) 등 중점지원) ▪‘BRAIN INITIATIVE’ 프로젝트 추진(’13년), 인간의 뇌기능 연구 및 뇌활동 지도 작성을 위한 첨단기술 개발을 위해 향후 10년간 30억 달러 투입 예정 ▪2011년 NIH 총예산은 622억 달러이며 이 중 신경과학 예산은 161억 달러로 전체예산의 25% 정도를 차지함 |
1990년 ‘뇌의 10년’ 선언 이후 세계적으로 뇌연구의 주도권 보유 |
|
|
일본 |
▪이화학연구소의 뇌과학종합연구소 (RIKEN BSI) |
▪‘뇌과학프로젝트(1997~2016년)’를 통한 집중적인 뇌연구 추진 ▪2003년 뇌연구를 사회과학과 접목하여 건강한 뇌발달을 연구하는 뇌의 양육 프로그램 시작 ▪2004년부터는 융합적 뇌연구 수행을 위한 통합뇌 및 계산뇌 프로그램을 출범하고 NT, IT 등의 학제간 협력연구를 강화 ▪2008년 뇌과학 연구를 핵심 연구과제로 신규 선정 ▪2009년 문부과학성이 내놓은 ‘뇌과학 연구 기본 구상’에 따라 뇌 연구에 매년 약 300억엔 규모로 지원 |
미국에 대응하여 21세기를 ‘뇌의 세기’라고 명명 |
|
|
유럽 |
영국 |
▪MRC (Medical Research Council) ▪Welcome Trust |
▪뇌신경 전 분야에 걸친 투자 및 연구를 통해 미국에 이은 세계 2위의 위치를 고수 ▪2008년 Welcome Trust-MRC 공동 퇴행성 뇌질환 연구 진흥을 위해 3천만 파운드(한화 6백억원) 지원계획 발표 ▪임상의학과 산업화에 적용하기 위한 프로그램의 활성화 ▪실제 영국에서 발표되는 뇌연구 논문 중 절반이상이 뇌질환 연구에 집중되는 경향 |
유럽연합 차원에서 인간 뇌 프로젝트 (Human Brain Project, HBP) 추진 |
|
프랑스 |
▪CNRS ▪INSERM |
▪유럽연합 7차 프레임워크 프로그램(FP7)의 일환으로 NAD(Nanoparticles for the therapy and diagnosis of Alzheimer's disease)프로젝트 운영 ▪신경과학 특화 테마별 연구 네트워크 The Ecole des Neuroscience de Paris-lle-de-France(ENP) 결성 ▪뇌과학 연구 집중 분야로서 알츠하이머병에 대한 연구 및 치료에 많은 예산을 투자 |
||
|
독일 |
▪막스 플랑크 연구소(MPI) |
▪신경정신의학 분야의 기초과학연구와 임상연구 간의 상호보완적 연구 장려 ▪지역별 산학연 뇌과학 연구 클러스터의 형성으로 공동연구 활성화 ▪정신과 병원을 부속기관으로 운영 ▪정부정책에서 자연과학 각 분야 간의 융합이 점차 강조되어 융합학문에 대한 지원이 늘고 있는 추세 |
||
|
중국 |
▪국책연구소인 Shanghai Institutes of Biological Sciences(SIBS)에서 주도적으로 신경과학연구 수행 ▪Institute of Neuroscience(ION), Beijing MRI Center for Brain Research(BMCB) 등 세계적인 신경과학 연구소 육성 ▪기능성 질환군(신경통, 통증)에 대한 연구에 집중투자 |
|
||
|
인도 |
▪National Brain Research Center(NBRC), 다학제적인 신경과학 연구센터(Interdisciplinary Neuroscience Research Center) 등 다수의 국립 연구소를 운영하고 있으며, 해외 유수 기관과 연구협정 체결 |
|
||
출처 : 국제뇌연구개발과 산업화 관련 해외기술 및 시장동향 조사, 뇌기능활용및뇌질환치료기술개발연구사업단, 2011.3; 2013년도 뇌연구촉진시행계획, 미래창조과학부, 2013. 6
다. 국내 현황
우리나라의 뇌과학에 대한 국가차원의 지원은 1998년 ʻ뇌연구촉진법ʼ의 제정으로 부터 시작되었다. 정부는 ʻ뇌연구촉진법ʼ에 근거하여 10년마다 뇌연구촉진기본계획을 수립·시행하고 있는데 1998년 시작된 ʻ제1차 뇌연구촉진기본계획(1998~2007)ʼ은 2007년 종료되었고, 2008년부터 국립뇌연구소 설립을 포함한 ʻ제2차 뇌연구촉진기본계획 (2008~2017)ʼ에 따른 뇌연구 지원이 시행되고 있다. 2013년에는 R&D 핵심역량 강화, 연구개발시스템 혁신 및 산학연 협력, 인프라 기반구축의 3대 추진전략 하에 연구개발 지원이 이뤄지고 있다.
[표 4-1-16] 주요 정책 동향
|
연도 |
추진내용 |
|
1998년 |
▪‘뇌연구촉진법’ 제정 |
|
1999년 |
▪범부처 차원의 ‘제1차 뇌연구촉진기본계획(BRAINTECH21)’ 수립, 시행 ▪‘뇌신경생물학사업단’, ‘뇌의약학사업단’, ‘뇌신경정보학사업단’ 3개 국책사업단 발족 |
|
2003년 |
▪21세기 프론티어연구개발사업의 일환으로 ‘뇌기능활용및뇌질환치료기술개발연구사업단’ 출범 |
|
2008년 |
▪‘제2차 뇌연구촉진기본계획(2008~2017년)’ 수립, 시행 ▪연구기반 조성에서 탈피하여 원천기술 확보를 목표로 함 ▪뇌과학 분야의 세계적인 추세를 반영하여 연구분야에 있어서 기존의 뇌신경생물, 뇌의약학, 뇌신경정보학 외에 뇌인지과학 및 뇌융합연구 분야 신설 ▪학제간 융합을 위한 ‘한국 뇌연구원 설립추진기획단’ 발족 |
|
2011년 |
▪‘한국뇌연구원’ 설립 유치기관 선정(대구․경북-DGIST 컨소시움) ▪‘한국뇌연구원’을 대구경북과학기술원(DGIST) 부설(연)으로 설립 추진토록하여 2014년 개원 예정 ▪‘한국뇌연구원’의 운영은 내․외부간 연계연구를 활성화하기 위하여 Hub-Spoke 개념을 적용한 유연한 개방형 연구시스템 도입 |
|
2013년 |
▪‘뇌기능활용및뇌질환치료기술개발연구사업단’ 종료(’13.9) ▪기초과학지원연구원(IBS) 뇌연구분야 지원 개시(시냅스 뇌질환 연구단, 인지 및 사회성 연구단에 총 200억원 지원, 성균관대 뇌영상 연구단 신규 선정) ▪뇌과학원천개발사업 점진적 증대 |
2013년 국내 뇌연구 투자규모는 전년 대비 29.3%증가한 864억원으로 미래창조과학부가 전체의 40.4%(349억원)를 차지하고 있으며, 출연(연)이 33.9%(293억원), 보건복지부 17.4%(150억원), 교육부 6.7%(58억원), 산업통상자원부 1.8%(15억원)순으로 투자될 예정이다.
[표 4-1-17] 2012/2013 뇌연구 투자 실적 및 계획
*( )는 민간/ 단위 : 백만원
|
기관 |
사업명 |
사업기간 |
’12년 실적 |
’13년 계획 |
|
미래 창조 과학부 |
◦ 집단 연구자 지원사업 - 선도연구센터 지원 |
’02년~계속 |
2,000 2,000 |
2,000 2,000 |
|
◦ 21세기프론티어연구개발사업 - 뇌기능활용및뇌질환치료기술개발연구사업 |
’03년.9월~ ’13년.3월 |
8,900 (888) |
- - |
|
|
◦ 뇌과학원천기술개발사업 - 뇌과학원천기술개발 - 뇌영상용 초고자장(7.0T) MRI 연구개발 ◦ 한국뇌연구원 설립운영 |
’06년.11월~ ’15년.9월 ’08년.8월~ ’13년.7월 ’09년.6월~계속 |
7,360 6,640 720 2,500 |
9,110 9,110 - 10,300 |
|
|
◦ 개인 연구지원 사업 - 일반연구자 지원* - 중견연구자 지원 - 리더연구자 지원 |
’99년~계속 ’86년~계속 ’97년~계속 |
20,277 8,799 7,629 3,849 |
13,461 3,525 7,700 2,236 |
|
|
소 계 |
|
41,037 (888) |
34,871 (-) |
|
|
교육부 |
◦ 개인 연구지원 사업 - 일반연구자 지원* |
’99년~계속 |
8,799 8,799 |
5,750 5,750 |
|
소 계 |
|
8,799 |
5,750 |
|
|
산업 통상 자원부 |
◦ 산업원천기술개발사업 - 차세대 분자영상시스템 기술개발사업 |
’07년.9월~ ’14년.8월 |
1,517 (567) |
1,517 (970) |
|
소 계 |
|
1,517 (567) |
1,517 (970) |
|
|
보건 복지부 |
◦ 보건의료연구개발사업 ◦ 만성병관리기술개발연구 |
’98년~계속 ’10년~계속 |
14,703 (2,070) 351 |
14,696 (1,570) 320 |
|
소 계 |
|
15,054 (2,070) |
15,016 (1,570) |
|
|
출연 연구 기관 |
◦ 한국과학기술연구원 - 복합 기술을 이용한 뇌기능 연구 등 |
’06년.1월~ ’14년.12월 |
5,784 5,784 |
5,716 5,716 |
|
◦ 한국과학기술정보연구원 - 기초연구실험데이터 글로벌 허브 구축사업 등 |
’12년.3월~ ’13년.9월 |
200 200 |
300 300 |
|
|
◦ 한국생명공학연구원 - 뇌신경기반 대사질환연구 - 뇌신경 발달 및 분화조절 인자 단백체 분석 등 |
’12년.1월~ ’14년.12월 ’12년.1월~ ’14년.12월 |
703 419 284 |
703 419 284 |
|
|
◦ 한국전자통신연구원 - 뉴런 및 수용체와 반도체 소자의 하이브리드 인터페이스 |
’12년.8월~ ’13년.7월 |
373 373 |
434 434 |
|
|
◦ 한국표준과학연구원 - 차세대 생체자기공명 측정기술개발 |
’13년.1월~ ’15년.12월 |
980 980 |
1,000 1,000 |
|
|
◦ 한국한의학연구원 - 한의학기반 뇌혈관질환 원천기술 개발 |
’05년.4월~ ’13년.12월 |
1,193 1,193 |
1,112 1,112 |
|
|
◦ 한국기초과학연구원 |
’12년.4월~계속 |
- |
20,000 |
|
|
소 계 |
|
9,233 |
29,265 |
|
|
총 계 |
|
66,841 (3,525) |
86,419 (2,540) |
|
* 일반연구자사업의 ʼ12년 실적은 (구)교과부 실적으로 미래부, 교육부 동일하기 표시함
출처 : 2013년도 뇌연구촉진시행계획, 미래창조과학부, 2013.6
이러한 뇌연구 투자규모는 ʼ08년 이후 매년 증가되고 있는 추세이나, 여전히 국내 생명공학 전체연구비의 3% 수준으로 주요 선진국들의 전체 생명공학 분야 대비 투자비율(미국(18%), 일본(7%), 영국(20%) 등)에 비해 턱없이 부족한 실정이다. 분야별로는 뇌신경생물학 및 뇌질환 분야에 65% 정도가 투자되었으며, 그 외 뇌인지, 뇌공학, 뇌융합 분야에 각각 10% 내외의 연구비가 투자되었다.
이러한 열악한 투자여건 속에서도 우리나라의 뇌연구는 꾸준한 성장세를 이어왔다.
과학기술 경쟁력 측면에서 국내 뇌연구 성과는 SCI 논문 수에 있어 ʼ06년 13위에서 ʼ11년 세계 11위로 상승하였다. 실제로 2차 뇌연구촉진기본계획의 1단계 기간 동안(ʼ08~ʼ11년) 총 7,541편을 발표하여 1차 3단계(ʼ04~ʼ07년)의 4,611편에 비해 대략 1.6배가 증가했으며 세계 2위에 해당하는 성장세를 보이고 있다. 응용기술에 대한 특허성과의 경우 꾸준히 상승하고 있으며, 2011년까지 미국시장에서 313건의 특허를 보유하여 세계 6위권을 차지하고 있으나 점유율은 아직 미미한 수준이다(1.92%).
라. 산업 현황
뇌산업은 신성장 동력으로서 학문적 성과와 산업의 활성화가 상호 시너지를 일으키는 미래지향적 융합기술의 결정체이며, 큰 부가가치를 창출하는 분야이다. 뇌산업은 크게 4개 분야, 즉 신경제약산업(neuropharmaceuticals), 신경소자 (neurodevices), 신경진단(neurodiagnostics), 신경세포치료(neural cell therapy) 영역으로 나눌수 있는데, 현재 세계적으로 신경제약산업 분야가 뇌산업 규모의 대부분을 차지하며, 신경진단, 신경소자 및 세포치료 분야가 새로이 성장을 시작하거나 예비하고 있는 단계이다.
[표 4-1-18] 뇌산업 분야 현황
|
주요 뇌산업 분야 |
범위 |
세계시장규모(2011년) |
|
신경제약산업 (neuropharmaceuticals) |
▪신경과질환 ▪정신과질환 ▪감각신경계질환 |
1,343억 달러 |
|
신경소자 (neurodevices) |
▪신경보철장비 ▪신경조절장치 ▪신경수술장치 ▪신경소프트웨어 |
86.2억 달러 |
|
신경진단 (neurodiagnostics) |
▪뇌영상촬영 ▪체외진단기술 ▪뇌신경정보학 |
150억 달러 |
|
신경세포치료 (neural cell therapy) |
▪세포이식(engrafting) ▪세포비이식(non-engrafting) ▪약물전달 |
기술개발단계, 시장형성관망 |
출처 : 뇌과학기술 및 뇌산업 동향 보고서, 뇌기능활용및뇌질환치료기술개발연구사업단, 2013.2
NeuroInsights(2012)에 따르면 전 세계적으로 신경계 질환으로 인한 경제적 비용이 2.2조 달러 규모에 달하는 것으로 추정되고 있다. 그동안 한국의 주요 제약기업들은 중추신경계 약물 개발에 매우 소극적으로 64건의 개발성과 중 1건에 그치는 실정이었으나, 2012년 현재 전체 개발 과정 약물의 8.1%(38건)가 중추신경계 약물로서 향후 발전 가능성이 기대되고 있다(한국제약산업연구 개발백서, 2012). 신경소자 분야의 경우 미국 등 세계 의료기기 회사들을 중심으로 뇌관련 장비들이 활발히 개발되고 있으나, 국내 연구 및 산업화는 그에 비해 미미한 실정이다. 그러나 최근 국내연구진에 의해 개발된 펄스레이져 활용 신경약물전달기술(KAIST)이나 뇌-기계접속기술(락싸), 인공와우(뉴로바이오시스, 엠아이텍), 심부뇌자극술(엠아이텍) 등 국제적으로 선도적인 기술력을 갖춘 국내 중소기업들이 출현하고 있으며, 다양한 신경보철기 개발 및 상용화의 노력을 꾀하고 있다. 그러나 현재의 미미한 국내 뇌산업 분야의 발전을 위해서는 전략적으로 성장과 투자를 가능케 하는 환경, 즉 기술의 발달뿐만 아니라 기초 및 관련연구에 대한 지속적인 정부와 기업의 투자가 필요할 것으로 사료된다.
마. 발전 전망
뇌기능의 이해, 뇌질환의 극복 등 뇌과학의 해결되지 않은 문제 해결은 인류의 고령화 현상과 맞물려 더욱 그 중요성이 증가하고 있다. 반면에 수많은 신약개발의 분자표적이 지속적인 탐색과 개발을 기다리고 있다. 뇌과학은 신성장 동력으로서 학문적인 성과와 산업의 활성화가 상호 시너지를 일으키는 미래지향적 융합학문의 결정체이며, 산업적으로도 큰 부가가치를 창출하는 분야이다. 이 때문에 세계 각국은 뇌산업 시장의 80% 이상을 차지하는 신경제약산업 이외에도 뇌연구 성과의 산업적 활용을 위해 많은 투자를 아끼지 않고 있는 실정이다. 뇌와 관련한 기술은 건전한 정신생활과 교육, 문화에 이르기까지 큰 영향을 미쳐 인류 복지 향상에도 크게 기여할 것으로 사료된다.
이처럼 뇌연구는 BT, IT, NT 및 CS(인지과학) 융합을 통한 신산업 창출의 블루오션으로, 고령화 사회 진입과 함께 전 세계적으로 그 중요성이 더욱 강조되고 있으며 앞서 살펴 본 것처럼 정부에서도 1998년 ʻ뇌연구촉진법ʼ 제정이후 1, 2차 뇌연구촉진기본계획 수립·시행으로 뇌연구의 촉진을 위해 노력해 오고 있다.
최근 한국 최초의 뇌전문 연구기관으로서 ʻ한국뇌연구원ʼ이 설립되고 있으며, 기초과학지원연구원(IBS)으로서 시냅스 뇌질환 연구단과 인지 및 사회성 연구단 등이 수립되어 뇌과학에 대한 집중적인 투자가 이뤄지고 있다. 우리 모두가 주지하다시피 이러한 연구기관이 국가를 대표하는 뇌연구 성과를 내며, 국내 뇌연구의 획기적 발전을 견인하기 위해서는 단순히 연구소 설립에 그쳐서는 안되며 세계적 수준의 내실있는 운영이 뒤따라야만 한다. 특히 국내 뇌연구 능력을 선진국 수준으로 도약시키기 위해서는 장기적인 안목으로 보다 넓은 연구범위에 대해 안정적인 R&D 예산을 지속적으로 투자해야만 할 것이다.

1. 합성신약
가. 개요
블록버스터의 특허만료 및 제네릭 의약품의 치열한 경쟁으로 어려운 상황이었지만 2011년 세계 100대 제약기업의 총 매출액은 6,870억달러로 2010년의 6,370억달러에 비해 7.8% 성장하여 타 업종대비 성장률이 높았으며, FDA 신약허가수도 수년간의 부진에서 벗어나고 있다. 혁신 합성신약개발의 위험을 분산하고 성공률을 제고하기 위한 노력들이 진행되어, 개방형 연구가 지속적으로 증대되고 있으며 아카데믹 연구의 성공적 사업화를 위한 translation 연구의 중요성이 부각되고 있다. 신약개발뿐 아니라 생물학적 시스템의 규명을 위한 화학생물학(chemica biology) tool 또는 probe로서의 저분자 화합물 연구도 활발하다.
나. 해외 동향
(1) FDA 신약 승인
2012년 합성신약(NME, New Molecular Entity)의 미국 FDA 승인 수는 33개로 1999년 이래로 가장 많았으며 2013년도에도 좋은 성과가 기대된다. 2012년 생물학적 제제는 6개가 승인을 받았다.
[표 4-2-1] 연도별 FDA 승인 신약 수
|
년도 |
1998년 |
1999년 |
2000년 |
2001년 |
2002년 |
2003년 |
2004년 |
2005년 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
2011년 |
2012년 |
|
합성 신약 |
30 |
35 |
27 |
24 |
17 |
21 |
31 |
18 |
18 |
16 |
21 |
19 |
15 |
24 |
33 |
|
바이오신약 |
9 |
5 |
6 |
8 |
9 |
14 |
7 |
10 |
11 |
6 |
6 |
6 |
6 |
6 |
6 |
|
계 |
39 |
40 |
33 |
32 |
26 |
35 |
38 |
28 |
29 |
22 |
27 |
25 |
21 |
30 |
39 |
출처 : Nature Reviews/ Drug Discovery 2013, p87
(2) 화학 생물학(chemical biology) 연구
chemical probes는 특정 단백질 타겟의 작용을 이해하는데 사용될 뿐 아니라 생물학적 현상을 측정할 수 있는 물질을 총칭한다. 또한 직접적인 약물 개발과는 다를지라도 chemical probe는 약물 개발을 위한 좋은 출발점이 될 수 있다.
(가) 활성산소류의 측정을 위한 chemcial probes
세포내 활성산소류(reactive oxygen species, ROS)와 활성질소류(reactive nitrogen species, RNS)의 존재는 산화적 인산화 경로를 통한 에너지(ATP) 생산의 필요성과 전이금속원소의 생화학적 기능사이의 균형을 반영한다. 가장 적합한 ROS는 
출처 : Free Radical Bio. Med. 2009, p1439
[그림 4-2-1] Cytochrome c의 유리를 통한 ROS의 세포사멸 유도
대부분의 세포내 ROS는 미토콘드리아에서 생성되고, 방사선, 출혈성 쇼크, 노화, 또는 죽음 수용체의 활성화에 의해 야기될 수 있다. 일례로 FAS-associated protein with death domain(FADD)는 caspase 8과 BH3-interacting domain death agonist(BID)를 활성화시킨다. 절단된 BID(tBID)는 cytochrome c를 cytosol로의 이동, apoptosome의 형성, 비가역적 세포사멸을 매개한다. FOS는 cardiolipin과 결합한 cytochrome c를 산화시킴으로써 미토콘드리아 내막으로부터 cytochrome c의 유리를 증폭시킨다.
세포분열, 24시간 주기의 리듬, 면역반응, 세포사멸의 조절과 산화환원 환경과의 상관성은 ROS의 검출과 조절 연구의 산업화 가능성을 증대시켰다. 대부분의 센서는 형광신호(fluorescent sitnaling)에 기초하며, 일부 센서는 ROS외에 다른 세포내 물질을 표적할 수도 있다. 형광 프로브에 양전하를 부여함으로서 에너지를 생산하는 소기관의 형태, 수, 막전위 등에 대한 정보를 제공할 수 있는 미토콘드리아 특이 ROS 센서를 개발할 수 있다. 일례로 BODIPY 염료 OBP 의 피리딜 그룹 4가화는 광에 안정한 미토콘드리아 redox probe 1(OBEP)를 제공하고, 그것은 Mito Tracker Red CXMRos와 비교하여 염색능력은 비슷하고 세포독성은 매우 낮다.

출처 : Org. Biomol. Chem. 2013, p555
[그림 4-2-2] 미토콘드리아 표적 형광염료
O2·_의 가장 널리 쓰이는 세포내 probe는 hydroethidium으로 triphenylphosphonium(TPP) 에 붙여서(MitoSOX) 미토콘드리아를 표적할 수 있다. TPP 그룹을 fluorescein/rhodamine 구조에 붙여서 probe 물질 2 (MitoPY1)를 제공하고, 이것은 표유류 세포내 미토콘드리아
[그림 4-2-3] 삼중 감지 형광Probe 디자인
(나) 분자 샤프롱 probe: Heat Shock Protein 70(Hsp 70)의 조절물질
분자 샤프롱은 단백질 성숙에 필수인자로서, 많은 인체 질환의 발병뿐 아니라 단백질 folding, 분해, 수송을 포함한 세포반응에 주요한 역할을 한다. heat shock protein(HSP)은 세포의 열처리에 의해 유도되며, 단백질의 misfolding과 원하지 않은 단백질 응집을 막음으로써 세포보호 반응 기전에 참여하여, 세포사멸(apoptosis) 및 자식작용(autophagy)과 반대로 작용한다. 세포 죽음을 억제하는 HSP는 종종 종양세포에서 과발현되어 있으며, Hsp를 저해함으로써 암세포에 대한 항암제의 감수성을 증진시킬 수 있다.
Hsp는 분자량에 따라 Hsp110, Hsp90, Hsp70, Hsp60, hs40 등으로 세분되며, 다른 cofactor나 샤프롱과 함께 다단백질 복합체를 구성하고 발현정도는 상호 의존적이다. Hsp90는 항암타겟으로 많은 주목을 받았으며, 최근에는 Hsp70의 선택적 조절물질에 대한 관심도가 높아지고 있다. hsp70은 세포 생존에 필요하며 hsp70의 기능을 저해하면 기생충이나 바이러스의 증식이 억제된다. Hsp70의 기능은 낭포성 섬유증, 파킨슨, 헌팅턴, 알츠하이머 등을 포함한 신경질환과 관련되어 있다. Hsp70의 다양한 기능이 늦게 알려졌기 때문에 Hsp70의 효능제나 길항제 연구도 지연되었으며 현재까지 알려진 물질들도 비 선택적이거나 화학적으로 불안정하고 또는 의약화학적으로 개선이 어려운 구조가 대다수이다.
2004년 pyrimidinone core를 갖는 새로운 구조의 Hsp70 조절물질이 합성되었으며, multicomponent 반응 및 연쇄반응 등으로 통하여 다양한 구조의 합성이 가능하였다. β-ketoester 13, aldehyde 14와 urea 15의 반응을 통해 헤테로고리 화합물 16을, 연속적인 Ugi 축합반응에 의해 17과 같이 펩타이드 side chain이 있는 물질을 합성하였다.

출처 : J. Biol. Chem. 2004, p51131
[그림 4-2-4] Hsp70 조절물질의 합성

출처 : Proc. Natl. Aczd. Sci. U.S.A. 2011, p6757
[그림 4-2-5] Hsp70 Probes
다. 국내 현황
치료제 개발 뿐 아니라 타겟 및 질병과의 상호관계를 규명하기 위한 화학생물학 연구가 학교 및 출연연 등의 아카데믹 기관에서 활발히 진행되고 있으며, probe 화합물의 연구가 궁극적으로 질병의 진단 및 치료제 개발로 연결되므로 산업계의 관심도 높다.
라. 발전 전망
인간게놈프로젝트가 완성되었음에도 불구하고, 복잡한 네트워크로 연결된 생체물질의 기능과 질병과의 상관성은 아직 미지의 영역이며, 생물학, 화학, 구조학, 정보학 등 다양한 학문의 융합연구를 통하여 생명현상의 암호를 해독함으로써 질병의 진단과 치료를 위한 새로운 방향이 제시될 것이다. 합성신약 연구는 이미 알려진 타겟의 유효하고 안전한 조절물질을 찾는 기존의 전략과 함께, 질병현상의 암호를 풀 수 있는 chemical probe의 활용으로 인류의 건강한 미래에 일조할 수 있을 것이다.
2. 바이오신약
가. 개요
의약품은 화학합성 의약품을 중심으로 하는 저분자(small molecule이 치료제와 단백질 및 백신을 중심으로 하는 생물학적 의약품(biologics)으로 구분된다. 바이오의 약품은 바이오기술의 의약적 활용을 의미하며 기존의 생체 내에 존재하는 물질을 의약품으로 사용하는 것은 물론 유전자재조합 세포융합 세포배양 등 생명체 관련 바이오기술을 직접 활용하여 생산하는 치료 및 예방 목적의 의약품을 말한다.
바이오의약품은 크게 치료용 단백질, 백신, 단클론 항체로 구분할 수 있으며 이 중에서 단클론 항체의 성장률이 가장 클 것으로 예측되고 있다(표 4-2-2). 이외에도 유전자 치료제와 세포치료제 등이 새로운 분야로 개발되고 있으나 현재까지 바이오 의약품에서 이 둘의 비중은 크지 않다.
[표 4-2-2] 각 분야별 의약품의 시장 예측(2009∼2015년)
|
부 처 |
’09년 |
’10년 |
’11년 |
’12년 |
’13년 |
’14년 |
’15년 |
’09년~ ’15년 CAGR (%) |
’09년~ ’15년 diff (Sm) |
|
저분자 |
396,663 |
396,442 |
400,035 |
388,985 |
386,222 |
387,360 |
390,296 |
(0.3) |
-6,396 |
|
치료단백질 |
63,107 |
64,893 |
67,752 |
70,036 |
72,327 |
74,232 |
75,429 |
3.0 |
+12,322 |
|
단클론항체 |
36,398 |
40,346 |
44,914 |
49,979 |
54,130 |
58,647 |
62,658 |
9.5 |
+26,259 |
|
백신 |
20,937 |
23,807 |
24,438 |
25,917 |
27,302 |
28,769 |
30,159 |
6.3 |
+9,221 |
|
합계 |
517,105 |
525,488 |
537,140 |
534,916 |
539,981 |
549,008 |
558,541 |
1.3 |
+41,436 |
Source : Dataminitor Pharmavitae, September 2012; company-reported information
출처 : Datamonitor
화학의약품과 비교할 때 바이오의약품은 제품의 효능과 안전성 예측이 용이하여 제품 개발과 임상 소요 비용이 적을 뿐만 아니라 그에 따른 산업화 성공 가능성이 높아 전 세계적으로 적극적인 기술개발이 진행되는 상황이다. 2015년을 전후하여 바이오의약품이 합성의약품을 넘어 세계적인 주력의약품으로 등장할 것으로 예상되며 그 중에서도 각종 항체 치료제가 주류를 구성할 것으로 예상된다.
또한 바이오의약품은 특허 유무와 신규성에 따라 바이오신약 개량바이오의약품 (바이오베터)과 바이오시밀러(동등생물의약품)로 구분할 수 있다. 신규 물질로서 특허를 확보하여 높은 사업성이 보장되는 바이오신약 및 개량바이오의약품과는 달리 바이오시밀러는 특허가 만료된 오리지널 바이오의약품과 동일한 성분으로서 그 유효성과 안전성이 동등한 의약품을 말한다.
(1) 단백질 의약품
단백질 의약품은 유전자 재조합기술 세포배양기술 바이오공정기술을 바탕으로 미생물이나 동물 세포시스템을 이용한 대량 생산을 통해 생산된 의약용 단백질을 말한다(표 4-2-3). 이 1세대 바이오 의약품들은 특허가 만료되어 다수의 바이오시밀러, 바이오베터 등이 개발되었다.
[표 4-2-3] 1세대 단백질 의약품
|
성분 |
적응증 |
브랜드명 |
개발자 |
특허만료 |
|
Insulin |
당뇨병 |
Humulin |
Eli Lilly |
2002년 |
|
Insulin |
당뇨명 |
Novolin |
Novo Nordisk |
2002년 |
|
Growth hormone |
성장호르몬 결핍 |
Nutropin |
Genentech |
2002년 |
|
Growth hormone |
성장호르몬 결핍 |
Humatrope |
Eli Lilly |
2002년 |
|
Interferon alpha |
백혈병 |
Intron-A |
Schering-Plough |
2002년 |
|
EPO |
빈혈 |
Epogen |
Amgen |
2004년 |
|
EPO |
빈혈 |
Procrit |
Johnson & Johnson |
2004년 |
|
TPA |
심장발작, 심부전 |
Activase |
Genentech |
2005년 |
|
Growth hormone |
성장호르몬 결핍 |
Protropin |
Genentech |
2005년 |
|
G-CSF |
항암치료보조 |
Neupogen |
Amgen |
2006년 |
|
Imiglucerase |
Gaucherqud |
Cerezyme |
Cerezyme |
2010년 |
|
Interferon beta |
다발성 경화증 |
Avonex |
Biogen |
2011년 |
2002년 이후 1세대 단백질 의약품의 특허만료와 함께 단백질 공학 및 분석 제형연구의 발전으로 초기 제품의 단점을 극복한 제형이 2세대 제품으로 출시되어 성공적으로 시장에 안착함으로써 기존 단백질의약품 시장을 확대시키는 효과를 보이고 있다. 현재까지 개발된 2세대 단백질의약품은 Aranesp(hyperflucosylated -EPO; Amgen), Neulasta(PEG G-CSF; Amgen) PEG-intron A(PEG interferon alpha-2b; Schering-Plough) Pegasys(PEG interferon alpha-2a; Roche) 등이 있다.
PEGylation을 이용하여 지속성을 증가시켰던 2세대 제품에 이어 최근에는 polysialic acid, albumin 접합 기술, non-natural D-amino acid가 포함된 peptide 접합 기술 등을 이용하여 체내 반감기를 증가 시키려는 기술이 개발되고 있으며 또한 생리활성물질이나 독소단백질과 융합된 단백질을 제작하여 신규 기능을 부여하는 기술 등이 개발되고 있다. 특히 단백질의약품 대부분이 주사제임으로 통증 유발을 줄이기 위해 경구나 경피 비강이나 폐 흡입 같은 경로로 투여하는 기술개발이 이루어지고 있다.
국내에서도 1세대 단백질 의약품보다 개량된 2세대 제품을 개발하는 전략을 추진중이다. LG 생명과학의 경우 서방형 인성장 호르몬 제품을 개발하여 산업화 하였으며, 한올제약의 경우 아미노산 치환 기술을 이용하여 기존 단백질 의약품의 효능과 안정성이 개량된 바이오베터 개발에 집중하고 있다. 녹십자와 동아제약은 PEG G-CSF, 한미약품과 제넥신 등은 항체의 Fc를 기반으로 한 바이오베터 단백질 치료제를 개발하고 있다.
(2) 항체의약품
1975년 단클론 항체(monoclonal antibody(mAb)) 생산기법이 확립되어 특이성이 높은 항체를 제한 없이 생산할 수 있게 된 이후 마우스 유래 항체의 항원성을 줄여 치료목적으로 사용하려는 연구가 지속되어 1970년대의 마우스 항체에서 1980년대의 카이메릭 항체(chimeric mAb), 1990년대 인간화항체(humanized mAb)를 거쳐 2000년대 인간항체 개발로 발전하였다.
항체의약품은 난치성 질환 치료(암, 면역질환, 감염질환, 호흡기질환, 심혈관질환, 당뇨 및 대사 질환 등)를 위해서 대부분 표적 지향적인 치료제로 개발이 되고 있는데, 현재까지 30여종의 항체가 다양한 질환에 사용되고 있다. 세계 단클론항체 시장은 2010년 480억 달러에서 2015년 800억 달러로 급성장이 예견되고 있는 가운데 현재 전 세계적으로 314개의 단클론 항체 제품이 임상시험 중에 있는 것으로 알려져 있다(터프츠 약물개발 연구센터(CSDD)).
치료용 항체는 현재 인간화 항체 및 카이메릭 항체가 시장을 주도하고 있으나 향후에는 인간항체가 시장의 주류를 이룰 것으로 예측되며 항체와 합성 약물을 결합시킨 ADC(Antibody Drug Conjugate) 형태의 치료제가 시장에서 급부상 할 것으로 예측 된다. 다양한 질환에 대해 치료항체가 개발되고 있는 가운데 항암(oncology), 면역 및 염증성 질환(immunology & inflammation) 분야의 항체가 가장 큰 부분을 차지하고 있고 항체개발 회사로는Genentech, Amgen, Roche, Abbott, Johnson & Johnson, Merck, Novartis 등의 회사가 항체시장을 주도해 왔으며 향후에도 이 추세가 계속될 것으로 예측 된다.
국내 제약회사들은 항체의약품 개발에 지속적인 관심을 가지고 있으며 이에 따라 특허가 만료되는 항체 치료제의 바이오시밀러 개발, 기존 항체 제품의 단점 (면역원 성, 짧은 PK, 낮은 효능 등)을 향상시킨 바이오베터, 신규 타겟 확보를 통한 신규 항체 치료제 개발 등 항체 치료제 개발에 적극적인 노력과 투자가 진행되고 있다. 삼성전자, 한화, LG생명과학 등 대기업이 항체 사업에 참여하였고, 녹십자, 동아제약, 유한양행, 대웅제약, 종근당, 유영제약 등 많은 제약 기업과 셀트리온, 이수앱지스, 파맵신, 아이바이오, 앱클론, 다이노나 등 많은 벤처기업에서 항체의약품 개발을 진행 중에 있다.
특히 2009년도 삼성전자의 항체의약품 개발에 대한 참여는 제약업체에 큰 관심을 불러 일으켜 항체의약품 개발의 중요성을 확인해 주었으며, 2011년 한화의 엔브렐 바이오 시밀러가 머크사에 기술이전하는 성과도 있었다. 아울러 동아제약이 항체 바이오시밀러 사업에 참여하여 송도에 생산공장을 신설하는 것을 발표하였다. 국내 최대의 바이오의약품 생산 시설을 보유한 셀트리온은 다수의 항체 바이오시밀러를 개발하고 있는데 최근 레미케이드 바이오시밀러의 임상을 완료하고 유럽에서 허가를 획득하였다. 녹십자는 B형 간염 치료용 인간 항체의 임상 1상을 완료하고 임상 2/3상을 준비 중이고 EGFR를 중화하는 인간항체는 비임상 시험 중에 있다. 이수앱지스는 2007년 항혈전 항체 Clotinab을 상업화에 성공한 이후 희귀질환 치료제 개발에 집중하면서 신규 항체 개발을 진행하고 있다. 한화는 앞에서 언급한 Enbrel biosimilar를 Merck사에 기술 이전한 것과 더불어 anti-VCAM1항체 등 다수의 항체를 개발하고 있으며, 아이바이오는 HGF(hepatocyte growth factor)를 차단하는 암치료항체, 파맵신은 VEGFR2를 차단하는 암치료항체, 앱클론은 epitope을 달리한 항체를 개발하고 있다. 이외에도 서울대 KAIST 강원대 아주대 이화여대 생명공학연구소 SKAI(스크립스 코리아 항체 연구소) 등의 대학 및 국공립 연구소 등에서도 항체연구개발을 활발하게 진행하고 있다.
(3) 유전자치료제
유전자 치료제는 난치병 원인인 비정상 유전자를 정상 유전자로 대체해 질병을 완치하는 치료제를 말한다. 유전자 치료제는 지난 1999년 첫 임상 시험이 진행되면서 전 세계의 관심을 모았으나 당시에는 실패로 끝났다. 이후에도 유전자 치료제가 손상된 유전자를 정확히 대체하지 못해 암이 생기거나 약효가 감소하는 현상이 빈번하게 발생했다. 중국, 러시아, 필리핀 등 일부 국가에서 유전자 치료제가 상용화되어 쓰이고 있지만 글로벌 치료제로 인정받지 못한 것도 이 때문이다. 그러나 지난해 유럽에서 유전자 치료제가 선진국 시장 최초로 승인을 받으면서 부작용 문제가 어느 정도 해결될 것으로 보인다. 2012년 10월 네덜란드 제약사 유니큐어가 개발한 ʻ글리베라ʼ가 유럽의약품감독국(EMA)의 허가를 받아 지방을 분해하지 못해 지방을 섭취하면 심한 복통과 췌장염 증상을 보이는 희귀 유전성 질환을 치료하는 데 쓰인다. 전문가들은 유럽 EMA 승인을 받은 이상 미국 식품의약국(FDA) 승인도 무리 없이 받아낼 것으로 전망한다.
현재 진행 중에 있는 유전자치료제 임상연구 가운데 미국에서 이루어지는 연구가 975건(63.4%) 으로 가장 높은 비율을 차지하고 있다. 종양관련치료제가 대부분을 차지하였으며(993건), 심혈관계 질환 치료제가 137건으로 그 뒤이고 그 외에 감염성 질환 치료제와 단일 유전자 질환(Monogenic disease) 등이다.
전형적인 유전자치료제 이외에 antisense 약물인 Vitravene(ISIS Pharmaceuticals)과 aptamer 약물 Macugen(Eytech 사)는 이미 시판 허가를 받고 발매되고 있어 DNA/RNA 기반 의약품의 상업화 가능성을 보여주고 있으며 또한 다양한 방법의 유전자치료제가 개발되고 있다.
2011년 기준 유전자 치료제 시장 규모는 20억달러(2조1500억원)에 불과하지만 2016년에는 100억달러(10조7500억원)로 5배가량 성장하는 것으로 예측 된다(Jain Pharma Biotech Report).
국내 유전자치료제 개발이 활기를 띠며 임상 2상 이상만 해도 7건인 것으로 나타났다. 식품의약품안전처에 따르면 현재 유전자치료제 개발 업체가 8개사 (15품목)에 달했으며, 임상이 활발히 진행되고 있다. 업체별로는 바이로메드가 4개, 동아제약 3개, 제넥신과 뉴젠팜이 2개씩 개발 중이다. 이들 회사는 이같이 암 뿐 아니라 당뇨, 간염, 뇌종양, 에이즈 등 다양한 유전자치료제를 개발하고 있다. 그 중 임상 2상 이상 단계에 있는 업체는 코오롱생명과학(퇴행성관절염), 녹십자(간암), 동아제약(허혈성 족부궤양), 제넥신(B형간염), 뉴젠팜(전립선암) 등이다. 코오롱생명과학은 최근 티슈진C가 3상 승인을 받았고, 바이로메드는 중증 하지허혈증과 당뇨병성 신경병증 치료제 개발이 2상 단계다. 이밖에 대웅제약은 고형암이 1상, 이연제약은 유방암이 1상 단계로 나타났다.
(4) 백신
백신은 다양한 감염성 질병과 암을 예방 또는 치료할 목적으로 독성을 줄인 병원체 자체나 구성분의 일부를 이용하여 면역체계의 자극을 통해 항원에 대한 특이적 반응을 유발하여 생체 내에서 항체를 유도할 수 있는 생물학적 제제를 의미하며 예방용 백신과 치료용 백신으로 구분된다. 기존 백신의 문제점을 극복하기 위해 세포배양백신, 유전자재조합 백신, 수지상세포 기반 백신, 플라스미드 DNA 및 바이러스 기반 백신 등이 개발되고 있으며. 기존의 예방적 방어용 백신 외에도 AIDS 말라리아 탄저균 같은 치명적인 질환뿐만 아니라 알츠하이머, 다발성 경화증, 당뇨, 비만, 고혈압, 천식, 동맥경화, 암 등을 대상으로 하는 치료용 백신 개발이 이루어지고 있다.
현재 미국에서 예방 및 치료 백신이 271개 임상시험 및 승인심사 중인 것으로 미국 제약협회(PHRMA)에 의해 파악됐다. 종류별로는 감염질환에 대한 백신이 137개로 가장 많고 암에 대해 99개, 알레르기 백신이 15개, 신경장애에 대한 백신이 10개 개발되고 있다. 그 중에서도 주목되는 백신후보로 새나리아(Sanaria)의 말라리아 백신으로 최근 초기 임상시험 결과 감염을 100% 예방했다. 아울러 어드백시스(Advaxis)의 생 약독화 리스테리아균 기반 자궁경부암 백신인 ʻADXS-HPVʼ도 이미 자궁경부암에 걸린 여성에 대해 면역치료 효과를 보여 2상 임상 중이다. 이와 함께 HIV에 바이러스의 p24 단백질에 변이가 잘 안되는 부위를 이용한 치료 백신도 개발되고 있고, 크루셀의 단클론항체 독감 백신 ʻCR6261ʼ이 1상, 췌장암에 리스테리아 기반 백신이 아두로 바이오테크에 의해 2상 개발 중이며, 셀렉타가 금연을 위한 합성 나노입자 백신 ʻSEL-068ʼ을 1상 개발 중이다. 2012년 계란을 사용하지 않고 세포배양을 통한 백신이 첫 승인을 받았으며 DNA 백신도 나오고 있다.
PHRMA에 따르면 세계백신 시장은 제약시장의 3%정도로 2012년에 273억달러 규모에 달했으며 향후 5년간 연평균 12%의 성장률이 기대된다. 소아용 예방백신에서는 결합백신과 폐구균 백신이 성인용 백신의 경우 인플루엔자 백신이 향후 4∼5년에 걸쳐 가장 빠른 성장률을 보일 것으로 전망하고 있다.
특히 치료용 백신 시장의 가장 큰 부분인 암 치료 백신 시장은 115.3%의 연평균 성장률을 기록하며 2014년 29억 달러의 시장을 형성할 전망이다. 대표적인 암치료 백신으로 작년 미국 FDA의 승인을 획득한 전립선암 치료백신인 프로벤지(Provenge. Sipuleucel-T)를 들 수 있는데 암 치료 백신의 경우 기존 치료법과 달리 환자의 면역세포를 이용하기 때문에 일정부분 개인별 맞춤치료가 가능하여 여러 회사들이 다양한 방법의 암 치료 백신 개발을 시도하고 있다.
국내의 자체 생산이 가능한 백신 종류는 5가지(B형 간염백신, 결핵백신 (BCG), 수두백신, 일본뇌염백신, 신증후군출혈열)에 불과한 상황이며 주로 기초 예방 접종 대상 연구에 국한되고 있는 상태이나 2009년도에 녹십자가 신종플루에 대한 백신을 자체 생산할 수 있는 기술을 확보하고 2011년에는 SK케미칼과 일양약품이 세포 배양기반의 독감백신 생산설비를 구축하는 등 국내 예방 백신 개발 능력은 차츰 선진국 수준에 도달하고 있다. 보령제약과 녹십자는 2013년 세포배양 일본뇌염 백신을 허가받았다.
치료용 백신 개발은 선진국 대비 다소 뒤떨어져 있으나, CJ는 바이오리더스사와 치료용 백신 개발을 공동연구 중이며, 크레아젠은 자가유래 수지상 세포와 신장암세포를 활용하여 CreaVax-RCC라는 치료용 백신을 개발하였다. 카엘젬백스사는 최초의 췌장암 치료용 백신인 GV1001을 개발하여 현재 영국에서 임상 3상을 진행 중이고, 제넥신은 자궁경부 상피내 종양(GX-188E 전임상)에 대한 유전자 백신을 개발하고 있으며, 바이로메드에서는 이연제약과 더불어 유방암 치료 백신(VM206RY)를 개발하여 국내 임상 1상을 진행 중이다.
보건복지부에 따르면, 국내 백신시장은 현재 8,500억원 정도로 세계 시장의 2.1% 수준밖에 되지 않지만 폐렴이나 자궁경부암 백신 등 프리미엄 백신을 중심으로 연평균 16.7%씩 고성장하고 있다.
나. 발전 전망
국내 제약시장은 5년간 6% 고성장해 왔으며 향후 8%로 성장할 예정이며, 전 세계적으로 바이오의약품 시장이 급속히 성장하여 향후 시장을 주도할 것으로 예상되는 가운데 식품의약품안전처는 2017년까지 세계 7대 바이오의약품 강국으로 도약하기 위한 지원방안을 발표했다. 식약처는 2017년까지 ▲바이오시밀러 4개 품목 ▲줄기세포치료제 6품목 ▲백신 자급 품목 20종 ▲다국가임상 수행 국내 수탁전문업체 3개소 ▲글로벌 바이오의약품 위탁제조업체 2개소 등을 육성한다는 계획이다.
2013년 7월 기준으로 바이오시밀러는 9개사 12품목이 식약처 임상승인을 받은 상태이다. 식약처는 2017년까지 4개 품목을 확보할 예정으로 세계 항체의약품 시장 20% 점유를 목표로 지원방안을 추진할 예정이다. 현재 셀트리온, 한화케미칼, 대웅제약, 삼성바이오에피스, 삼성전자, LG생명과학, 슈넬생명과학, 종근당 등 9개 업체가 12개 품목의 임상시험을 진행 중이다.
식약처는 국내에서 접종되는 백신 28종 중에서 자급 가능한 백신은 8종으로 2017년에는 20종으로 자급률을 71%까지 확보할 예정이다. 백신 자급 품목 확대 전략은 ▲백신 생산용 세포주 확립·분양 ▲백신 제품화 지원 민·관협의체 운영 등 이다.
우선 현재 8종에 불과한 백신 자급 품목을 2017년 20종까지 확대하기로 했다. 지난해 기준 28종 백신 가운데 B형 간염·일본뇌염(사백신)·수두·인플루엔자· 장티푸스·두창 등 8종만이 국내에서 생산된다. 식약처는 2017년까지 필수예방백신 5종, 프리미엄백신 4종, 대유행·대테러대비 백신 3종을 국산화할 계획이다. 구체적으로는 피내용 BCG, 디프테리아·파상풍·백일해(DTaP), 사백신 소아마비(IPV), 성인용 디프테리아·파상풍·백일해(Tdap), 폐렴구균(PCV), 자궁경부암(HPV), 대상포진, 콜레라, 탄저, 조류 인플루엔자 등으로, 현재 임상시험을 진행 중이거나 기술이전 단계에 있다. 이렇게 되면 현재 30%에 불과한 백신자급률이 2017년 71%까지 올라간다.
식약처는 또한 지원을 통해 2017년까지 다국가 임상을 수행할 수 있도록 전문성을 갖춘 국내 CRO 3곳도 육성한다. 다국가임상 수행 가능 CRO 육성 전략은 ▲전문인력 양성 지원 ▲자료관리 등 시스템 구축지원 ▲인증제 도입 등이다.
식약처는 2017년까지 바이오의약품 전문 글로벌 CMO 2곳을 육성할 예정이다. 글로벌 바이오의약품 생산기지로서 CMO를 육성하겠다는 것인데 ▲제조시설 없이도 품목허가 가능한(위탁제조판매업) 범위 확대 ▲CMO 활성화를 위한 규제 발굴·정비 등을 통해 글로벌 CMO를 육성할 예정이다.
정부의 지속적인 지원과 더불어 바이오신약에 대한 고부가가치 제품 창출을 위하여 국내 제약회사와 바이오벤처기업들은 자체 R&D 투자를 확대하고 정부 R&D 지원금과 세제혜택 및 관련 기반시설을 활용한 바이오신약 후보물질 확보, 개량신약개발, 생산시설 확충, 글로벌화 된 비즈니스모델 도입, 기술이전 확대 등에 적극적인 노력이 진행되고 있다.
국내 바이오신약을 성공적으로 개발하기 위해서는 국내시장의 다변화에 적응함은 물론 더 나아가 국부창출이 가능한 세계적인 블록버스터급 신약, 바이오시밀러, 슈퍼제네릭 등의 독자적 기술개발 능력을 확보하고 각 분야별 글로벌화 개발 전략을 수립하여 보다 융합적인 시너지 효과를 창출할 수 있는 적극적인 노력이 필요하다. 따라서 국내의 바이오신약 개발은 제약회사뿐만 아니라 바이오벤처를 중심으로 대학과 연구소가 연계하여 연구개발에서 임상연구까지 기초-응용-개발 단계에서의 상호 경쟁과 보완 협조를 통하여 이루어져야 한다.
이렇게 글로벌 바이오신약은 정부의 과감한 연구개발 투자와, 물적 인적 제도적 인프라 구축 등의 노력뿐만 아니라 학·연·산 간의 기초·원천 연구와 병원 중심의 중개연구 및 전임상·임상연구를 보다 적극적으로 활성화하고, 후보물질과 산업화기술을 확보하여 선진국과 상용화를 위한 상호 적극적인 공동연구 등을 통하여 가능할 것이다.
3. 바이오장기
가. 개요
(1) 바이오장기의 정의
바이오장기란 기능을 잃은 인간의 조직과 장기를 복원, 재생, 대체하기 위해 생명공학적 기법을 이용하여 인간생체의 장기와 같은 기능을 갖는 기기를 인공적으로 만든 것을 말한다. 줄기세포, 조직공학, 바이오인공장기, 바이오이종장기연구 분야 등을 포함하며, 이를 위해서는 세포활용기술, 이종장기생산기술, 면역조절기술, 장기이식기술, 생체조직공학기술 등의 생명공학 핵심기술이 요구된다.
(2) 바이오장기의 필요성
고령화로 인한 장기부전환자의 수가 급증하고 있으며, 장기이식수술은 이들 환자에게 유일한 치료법이지만, 타인으로부터 공급되는 장기의 절대수가 부족한 상황이다.
(가) 장기이식 수요 및 공급 현황
국내외적으로 장기이식 대기자 수는 매년 증가하고 있는데 반해 장기공급은 제한적이다. 국내에서 장기이식을 대기 중인 환자는 2000년 이후 계속적으로 증가하여 2011년에는 약 22,000 명에 이르고 있다. 증가하는 수요량에 비해 장기 기증을 희망하는 사람의 수는 저조하여 대기 중인 환자 수가 늘어가고 이식 대기 중에 사망하는 환자 또한 증가하고 있는 실정이다. 이 같은 현상은 미국을 비롯하여 전 세계적으로 나타나고 있다. 특히 국내에서는 성인병의 증가, 고령화, 유교문화, 핵가족화의 영향으로 외국보다 이식 장기의 수요와 공급의 불균형 현상이 심각하다. 이러한 결과로 불법 장기 매매가 성행하고 있으며, 최근에는 국내보다 의료기술 수준이 낮은 외국에서 장기이식을 받는 사례가 증가하여 심각한 사회문제를 일으키고 있다.
(단위 : 명)

출처 : 국립장기이식관리센터(KONOS) 2012
[그림 4-2-6] 연도별 국내 장기이식대기자 추이

출처 : http://www.organdonor.gov/about/data.html
[그림 4-2-7] 연도별 미국 내 이식대기자 (Waiting List), 이식환자 (Transplats), 장기공여자 (Donors) 수
(나) 대체장기로서의 바이오 이종장기
장기부전환자를 위한 대체장기의 확보방법으로 줄기세포 분화, 생체조직공학을 이용한 조직재생, 바이오 이종장기 등이 있다. 하지만 줄기세포는 아직 복잡한 세포분화과정을 조작하는 것에 대한 이론적 토대가 마련되어 있지 않고, 대량생산이 어렵기 때문에 상용화까지 많은 시간이 걸릴 것으로 예상된다. 그리고 사람의 조직을 생체조직 공학적 방법을 이용해 연골, 뼈, 피부로 제작하는 방법이 응용되고 있으나, 복잡한 기능을 하는 장기를 제작하는 데에는 많은 어려움이 있다. 이에 반해 바이오 이종장기는 이식을 목적으로 사람이 아닌 다른 종의 동물로부터 생산된 장기를 사람에게 이식하여 부전된 기능을 즉시 회복시킬 수 있기 때문에 대체장기로 적합하다.
[표 4-2-4] 부족한 장기를 대체할 수 있는 방법
|
장기 대체방법 |
심장 |
신장 |
간장 |
폐 |
|
동종이식 |
현재 적용 중 |
현재 적용 중 |
현재 적용 중 |
현재 적용 중 |
|
인공장기 (기계적장기) |
현재 적용 중 |
개발 중 |
현재 적용 중 |
개발 중 |
|
세포치료 |
개발 중 |
- |
개발 중 |
- |
|
조직공학 |
개발 중 |
개발 중 |
개발 중 |
- |
|
인공장기 (바이오장기) |
- |
개발 중 |
- |
- |
|
이종장기 |
개발 중 |
개발 중 |
개발 중 |
개발 중 |
출처 : J Korean Soc Transplant 2009;23: 203~213
[표 4-2-5] 장기부족에 대처하기 위한 해결책
|
해결책 |
적용 가능한 장기 |
현재 상태 |
|
돼지 이종장기 이식 |
대부분의 장기 ; 간은 더 많은 연구가 필요함 |
전임상 ; 돼지 췌도 이식의 임상시험 |
|
기계적 장치 |
심장에서 가장 성공적 |
이식대상환자의 bridge therapy |
|
바이오 인공 신장 |
급성신부전증 환자의 세뇨관 보조기구 |
체외 투석 |
|
줄기세포에서 분화된 조직 |
모든 장기 |
세포치료에 대한 연구, 임상단계 ; 고형장기 부분에서는 아직 초기연구단계 |
출처 : J Korean Soc Transplant 2009;23: 203~213
(다) 바이오장기 공급원
사람에게 제공될 장기를 공급하기 위해서는 사람과 생리적인 면에서 유사점이 많아야 하고, 또한 대량 공급을 위해 번식이 잘 되어야한다. 사람과 가장 유사한 영장류는 그러나 번식에 오랜 시간이 걸리고, 사람에게 치명적인 바이러스를 보유할 위험이 있으며, 전 세계적으로 희귀동물로 지정되었기 때문에 이종장기 제공 대상에서 제외되었다.
현재는 미니돼지를 가장 많이 사용하고 있는데, 인간과 비슷한 크기의 장기를 갖고 있으며, 생리적으로 유사점이 많다. 또한 어미 1두가 연간 20마리 이상의 새끼돼지를 생산할 수 있어, 이식용 장기의 대량공급이 가능하여 이식 대기시간이 단축된다. 간염이나 AIDS 바이러스와 같은 치명적인 감염원의 회피가 가능하기 때문에 미리 철저한 분석과 계획 하에 이식수술을 받을 수 있다.
미니돼지를 이용할 때의 문제점으로 돼지 세포 표면에 존재하는 당(sugar)에 의한 초급성 면역거부 반응이 대두되었으나 유전공학기법을 이용한 형질전환돼지 생산이 가능하게 됨으로 인해 이를 극복할 수 있게 되었다.
(3) 바이오 이종장기 산업 발전을 위해 극복되어야 할 난관
(가) 장기이식 거부반응 및 복제 기술의 불안정성
이종장기 이식 후에 일어날 수 있는 주요 문제점은 조직의 거부반응이며 동종이식보다 빠르고 강하게 일어남이 임상시험을 통하여 밝혀졌다. 사람에게 이식한 이종장기는 장기 수혜자의 체내에서 초급성 거부반응, 급성혈관성 거부반응, 세포매개성 거부반응, 만성 거부반응을 유도하여 이식된 장기가 제 기능을 하지 못하고 괴사하는 문제가 발생한다. 이러한 거부반응은 활발한 연구를 통하여 기전이 비교적 잘 알려져 있으며, 단계별로 거부반응을 제어하기 위한 유전자 적중 및 형질전환돼지의 생산이 연구되어 왔다(그림 4-2-8).

출처 : BIOSAFETY 한국바이오안전성정보센터 2010 11
[그림 4-2-8] 체세포복제에 의한 형질전환돼지 제조방법
돼지 세포 표면에 존재하는 당(sugar) 성분인 알파-갈(1,3-α-Galactose)에 의해 혈청보체계와 혈액응고계가 활성화되어 이식 후 수 분 이내에 초급성 거부반응이 나타난다. 이것을 극복하는 방법이 활발히 연구 중인데, 알파-갈 전이효소가 제거된 형질전환돼지가 2002년 미국에서 개발되었고(Science 2002;295:1089), 국내에서도 2009년 4월 알파-갈 합성효소 유전자 중 하나가 제거된 미니돼지 지노, 지노 2의 개발 성공과 더불어 활발한 연구가 이루어져 향후 이종이식 연구에 널리 사용될 것으로 예상된다.
자연항체, 자연살해세포, 단핵구에 의해 혈관내피세포가 활성화되어 나타나는 급성혈관성 거부반응은 혈청보체 조절인자를 형질전환한 돼지를 제작하고 혈관내피세포의 안정화, 내피세포유래 면역 매개물질 조절, 혈소판 기능조절로 극복 가능할 것으로 예상된다.
다양한 이종항원에 의해 면역세포가 활성화되어 나타나는 세포매개성 거부반응은 동종이식에 사용되고 있는 면역억제방법을 응용하거나 면역관용유도로 극복하려는 노력이 시도되고 있다.
이와 같이 초급성 거부반응을 억제하기 위하여 관련 유전자가 적중됨과 동시에 급성혈관성 거부반응 및 세포매개성 거부반응 등을 유도하지 않도록 여러 가지 관련 유전자의 형질전환이 복합적으로 이루어진 유전자적중 및 형질전환돼지의 생산이 가까운 미래에 가능할 것으로 예상되고 있다.
복제된 동물들이 유산, 사산, 태어난 지 며칠 되지 않아 죽는 등 복제효율이 떨어지는 불안정성을 극복하기 위해 형질전환 복제동물의 생산효율을 증진하기 위한 기술을 개발 중이다.
위와 같이 장기이식 관련 유전자를 탐색하고 체세포 유전자 적중기술 등을 통하여 이종장기 이식에 최적인 형질전환 복제돼지 생산은 기반기술이 확립된 상태이며, 현재의 문제점을 극복하고 산업화를 위한 연구가 활발히 진행되고 있다.
(나) 안전성 문제
인수공통감염병원체는 돼지의 무균화를 통해 차단할 수 있다. 그러나 돼지의 내인성레트로바이러스의 경우 바이러스 유전자가 돼지세포의 염색체내에 삽입되어 유전되므로 무균화 작업을 통해서 제거되지 않는다. 이종이식을 임상 적용함에 있어서 해결해야할 문제 중 한가지로써 이종장기 이식 수혜자에게로 잠재적인 병원체가 전염되는 것이다. 그러나 현재까지 다수의 영장류 이식실험과 이종이식을 받은 환자에서 돼지 내인성레트로바이러스 감염이 확인되지 않았다.
(다) 사회적, 생명윤리적 문제
생명연장, 환자 인권의 신장 등 긍정적인 면과 함께 장기이식과 관련하여 빈부 격차 등의 사회적 문제와 동물학대, 인간 복제 가능성과 같은 생명윤리적 문제를 풀어나가야 한다.
나. 국내 동향
국내에서는 교육과학기술부, 지식경제부, 보건복지부가 협력하여 바이오신약 장기사업단(2004년.12월.7월 종료)을 통해 이종장기 생산용 복제 돼지를 생산하기 위한 노력을 진행하였다.
이를 위해 바이오이종장기개발사업단에서는 2004년부터 2013년 까지 3단계에 걸쳐 이종장기용 돼지생산과 면역거부반응조절을 통해 이종장기의 전임상 및 임상적용 연구를 하고 있다.

출처 : 바이오이종장기개발사업단 www.xenokorea.org
[그림 4-2-9] 바이오신약장기 사업개요
(1) 형질전환 미니돼지 개발
농촌진흥청 바이오장기연구단에서 이종 간 장기이식 시 면역거부반응을 연구 중인 충남대 진동일 교수와 ㈜엠젠은 인간의 면역기능 유전자 중 ʻFasL(Fas Ligand)ʼ 유전자를 발현시킨 형질전환 복제 미니돼지를 개발하여 2009년 5월 11일 태어났다. 2009년 5월 탄생한 형질전환 돼지 ʻ지노ʼ의 경우 돼지 알파-갈 유전자를 제거한 것이라면, FasL 형질전환 복제돼지는 인체의 면역세포 관련 유전자 중 하나를 돼지에게 발현시킨 것으로 장기를 이식할 때 돼지가 아닌 인체의 장기로 인식, 세포 독성 효과를 크게 감소시킬 수 있을 것으로 기대된다.
농촌진흥청에서는 2010년 8월 초 급성 및 급성 면역거부반응 유전자 2개를 동시에 제어한 다중 유전자 제어 형질전환 복제 미니돼지 ʻ믿음이ʼ를 생산했다. ʻ믿음이ʼ는 면역거부반응을 일으키는 알파-갈 유전자를 제거하고 초급성과 급성 거부반응에 관여하는 유전자인 MCP와 CD46를 삽입해 생산한 것으로, 유전자를 조작한 미니돼지 체세포를 일반돼지 난자에 주입시켜 탄생시켰다. 이후 2011년 7월에는 급성 혈관성 면역거부반응을 제어할 수 있는 인간 유전자인 CD73가 도입된 복제 미니돼지 ʻ소망이 1, 2ʼ를 생산하는데 성공했다. 혈액응고현상을 감소시키는 중요한 역할을 하는 인간유전자 CD73이 돼지에서 나타나도록 개발된 것이다.
바이오신약장기사업에서 형질전환 미니돼지를 생산 중인 이왕재 교수 연구팀은 2011년 현재 알파-갈 유전자가 제거된 무균 미니돼지를 유지해오고 있으며, 복합형질전환 세포주 개발과 개발된 세포 및 조직의 당질 분석과 혈액 응고 분석 기술을 확보해 나가는 중이다.
서울대 의대 안규리 교수와 수의대 이병천 교수 연구팀은 종양괴사인자 (TNF-α)를 차단하는 sTNFRI-Fc 단백질을 가진 형질전환 복제돼지를 세계에서 처음으로 확보하고 2011년 7월 해외 유명 저널인 Transplantation 에 게재했다(Transplantation 2011 27;92(2):139-47). 종양괴사인자는 이종장기 이식거부반응에서 중요한 역할을 하기 때문에 형질전환 돼지를 이용함으로써 거부반응을 극복할 수 있을 것으로 기대된다.
(2) 돼지 췌도 이식 전임상 시험
서울대 의대 병리학과 박성회 교수 연구팀은 돼지 췌도세포를 원숭이에 이식하는 전임상 시험 결과를 2011년 10월 해외 유명 저널인 The Journal of Experimental Medicine에 게재하였다(JEM 2011 208;12:2477-2488). 무균돼지에서 분리한 췌도세포를 당뇨병 원숭이에 이식하고 자체 개발한 항원 선택적 면역억제제와 2종의 기존 보조억제제를 투여했다. 4개월 후 면역억제제 등 모든 약제의 투입을 중단했음에도 현재 7개월째 거부반응 없이 혈당을 조절하고 있다. 이 같은 성과가 나온 데에는 박성회 교수팀이 개발한 새로운 면역조절항체가 결정적인 역할을 했다. 이 항체로 인해 면역세포인 T세포가 돼지 췌도를 이물질로 인지하지 못하게 한다.

출처 : MK 뉴스 2011년 10월 31일
[그림 4-2-10] 돼지 췌도 이식 흐름도
다. 발전 전망
(1) 바이오장기의 발전과제
이종장기이식은 인공장기 및 줄기세포 분화 기술을 이용한 장기이식에 비해 빠르게 임상에 적용할 수 있는 기술이다. 형질전환돼지 개발, 이식거부반응의 기전규명, 새로운 면역억제요법의 개발로 이식된 장기가 장기간 생존하고 기능을 유지할 수 있음이 영장류 실험을 통해 입증되고 있다. 향후 보체 활성, 응고증, 세포 매개성 거부반응과 같은 남아있는 장벽을 하나씩 극복해 간다면 머지않은 장래에 이종장기이식은 생명을 구하는 중요한 치료수단으로 자리 잡을 것이다.
이러한 과학기술의 발달과 더불어 안정성 확보와 윤리적 문제도 함께 해결되어야 한다. 모든 연구자가 이종장기이식이 가져올 수 있는 위험성을 염두에 두고 세계이종이식학회나 World Health Organization(WHO)에서 제시하는 국제적인 가이드라인에 따라 이종장기의 임상시험이 이루어져야 한다. 우리나라도 최근의 연구 성과에 따라 이종장기이식 임상연구가 수행될 가능성에 대비하기 위해 임상가이드라인 등 제도화를 추진하고 있다.
(2) 바이오장기의 전망
이식장기 수요의 폭발적 증가로 인한 수급 불균형은 앞으로 더욱 심화될 것으로 예상된다. 따라서 바이오장기의 시장규모도 급속도로 커질 것으로 전망된다. 생명공학정책연구센터의 ʻ2007 바이오 신약 장기 제품군별/주요 질환별 세계 및 국내 시장현황과 전망분석에 관한 연구ʼ에 따르면 이종장기의 상용화 시점으로 예상되는 2015년에는 국내 장기이식 대기환자의 수가 29,572명에 이를 것으로 예측된다. 현재까지 이루어온 연구 성과와 기반 시설을 꾸준히 발전시키고, 제도적인 뒷받침이 이루어진다면 학문, 산업, 경제적으로 큰 기여를 할 것이다.

1. 농작물 생명공학
가. 개요
일반적으로 생명과학 분야에 새로운 주제나 이슈가 생기면 역사적으로 미생물에서 제일 먼저 시작됨을 볼 수 있다. 이후 그 분야가 발달하면서 다른 대상으로 전이되는데 동물, 사람 그리고 마지막으로 식물 또는 작물의 순이어서 생명공학의 발달 분야도 농작물 생명공학이 제일 마지막이다. 그러나 그 산업측면에서는 단순한 먹거리 산업을 넘어서 여러 분야의 연계산업으로 발전하고 있어서 엄청난 파급효과가 있으며 미래 원료산업의 근간이 되고 있다(그림 4-3-1). 특히 작물은 그 근본이 종자이다. 종자로부터 시작하여 식량, 사료, 일반 채소, 과일 등의 먹거리 외에 가공식품, 의약품, 에너지 등 여러 연관 산업으로 발전하고 있는 것이다.
선진국이나 OECD 주요 국가를 볼 경우 농작물관련 산업이 발달하지 않는 국가는 없다. 즉 선진국 대열에 들어가기 위해서는 농업의 선진화가 필수이며 이는 농작물에 첨단 농업생명공학기술의 활용여부에 달려 있다. 즉 예전의 관행적인 농작물개발기술에서 생명공학기술이 접목되어야 하며 이는 유전체 정보를 비롯한 proteomics, metabolomics, transcriptomics 등 여러 omics 정보와 phenotyping, GM(genetically modified)기술, 첨단 site-direct mutagenesis 등과 같은 여러 육종 tool을 엮어 만든 융복합 농업기술이 요구된다. 이 첨단 융복합 농업기술에 대한 국내의 연구현황은 선진국의 약 50% 수준에 머물러 있어서 국가적인 차원에서 적극적 지원이 필요하다.

[그림 4-3-1] 종자는 고부가가치 미래원료산업의 근간임
나. 산업 현황
농작물 관련된 생명공학산업은 크게 종자산업, 분자육종, 분자농업 등으로 나눌 수 있다. 이중에서 가장 규모가 큰 산업은 종자산업이며 나머지 산업은 이제 막 창궐된 수준이다. (1) 종자산업은 매년 약 5% 씩 꾸준히 증가하고 있으며 지금까지 단 한번도 마이너스 성장한 적이 없는 전진산업이다. 전 세계 종자시장은 2012년 약 450억불이며 2020년에는 615억불로 추정되고 있다(표 4-3-1). 종자시장 자체는 IT, 자동차처럼 타 산업에 비해 큰 규모는 아니더라도 종자에 의해 만들어지는 생산물시장은 종자시장의 약 50배로서 2012년 기준으로 약 2조불정도로 추산되는 엄청난 시장이다.
[표 4-3-1] 세계 종자시장 규모의 변천
|
1985년 |
1996년 |
2006년 |
2009년 |
2010년 |
2011년 |
2012년 |
2015년 |
2020년 |
|
120억$ |
180억$ |
300억$ |
380억$ |
420억$ |
430억$ |
450억$ |
482억$ |
615억$ |
출처 : ISF(International Seed Federation) 2013, 농우바이오 생명공학연구소 추정
현재 전체 종자시장의 약 60%를 불과 4개의 다국적기업이 차지하고 있어서 종자시장의 독점화로 말미암아 농산물의 생산 및 유통시장이 항상 불안한 상태이다. 전 세계 종자의 약 80%는 곡류이며 10% 정도가 채소 그리고 나머지가 과수, 기타원예, 특용작물 등이다. 상대적으로 한국의 전체 종자 매출규모는 약 6천억원 정도이며 곡류는 국가에서 관장하고 채소, 과수만 기업에서 육종사업을 하고 있다.
(단위 : 백만달러)

출처 : 농우바이오 생명공학연구소 정리, 2013
[그림 4-3-2] 주요 다국적기업의 종자 매출규모
(2) 분자육종산업은 유전체정보, DNA 마커, genotyping 등을 활용하여 육종사업에 도움을 줄 수 있는 분야이다. 이 분야는 시설비와 개발비가 높아서 주로 service 기업들이 대행하고 있는데 전문적으로 크게 운영하는 기업은 DNA LandMark와 Keygene 정도이며 나머지는 거의 영세기업들이다. 또한 LemnaTec은 작물의 이미징분석을 토대로 phenotyping을 전문적으로 하는 기업으로서 분자육종의 새로운 분야를 개척하고 있다. 이런 분자육종기업들은 대부분 다국적기업, 국립연구소, 학교에 기술을 이전하거나 service, 공동연구를 통하여 매출을 만들고 있다. 국내에는 마크로젠에서 최근 식물유전체정보에 대한 분석을 해 주고 있으며 분자육종관련 마커개발을 하는 회사는 (주)고추와육종과 (주)에프엔피라는 벤처기업이다.
(3) 분자농업은 식물체를 재배하거나 식물세포를 배양해서 특정 고가의 단백질, 호르몬, 생체활성물질을 추출하는 산업이다. 지난 20년부터 미래 식물생명공학의 중요한 분야라고 예측은 했지만 기술적으로 쉽지 않았고 또한 임상실험을 해야 하는 관계로 영세기업들이 감당하기에 매우 어려운 점이 많았다. 2011년에 Protalix 는 Gaucher병 치료제인 glucoceribrosidase를 당근 배양세포에서 추출하여 최초로 FDA승인을 받고 판매 중에 있다. 또한 Sembiosys(insulin), Biolex(antibodies), Prodigene, Medicago 등 여러 벤처회사들이 식물세포를 이용하여 특정단백질을 생산하여 임상에 임하고 있어서 이 분야가 다시 크게 성장될 것으로 기대하고 있다. 이분야에 유일한 국내기업은 (주)엔비엠으로 벼의 현탁배양세포로부터 bovine trypsin, enterokinase, hGM-CSF를 분리정제, 생산하여 국내에서 판매하였다.
다. 해외 동향
(1) 다국적 종자기업의 연구동향
농작물 종자는 크게 3가지로 나누어진다. (가) OP(open pollination): 재래종이며 즉 오래전서부터 각 지역별 특색이 있는 종자로서 우리 조상들이 자가수분을 통하여 지금까지 대대로 물려준 종자이다. 현재는 종자기업에서 선발하여 대량생산하여 판매한다. (나) F1: 종자기업에서 모계, 부계를 육성한 다음 교배를 통해서 선발한 제1대 잡종으로서 잡종강세를 나타내는 개체이다. (다) GM종자: 특정 유전자를 삽입하여 고부가가치를 갖는 유전자변형종자로서 결국 이것도 F1 종자이다.
전 세계적으로 OP 종자가 아직도 지배적이지만 점차 F1 종자시장으로 전환되고 있는 실정이다. OP는 R&D 투자가 필요 없으나 F1 종자를 개발하려면 유전자원 확보, 전통육종기술의 전개 등을 위하여 R&D 연구소가 필요하다. 기본 전통 관행육종에는 교배육종, 여교배기술, MS(mail sterile), SI (self-incompatibility) 육종체계들을 활용하고 있으며 DH(double haploid), 돌연변이 등을 엮어 새로운 유전자원을 만들고 있다. 그러나 이런 관행 육종방법만으로는 새로운 고부가가치 품종개발에 한계가 있기 때문에 생명공학 기술이 접목되었다. 1980년대에 분자생물학이 발달하여 DNA marker를 이용한 선발(MAS)이 일반 육종에 적용됨으로서 육종기간이 단축되고 비용이 대폭 절감되어 복합내병성, 다기능성 종자개발이 용이하게 되었다. 1990년 중반 이후 GM 작물이 상업화됨에 따라 GM 작물에 대한 육종 방법이 화두가 되었으며 관행육종 방법과의 접목으로 기존 육종방법만의 결과에 비해 탁월한 효과를 주었다. 2010년대에 다국적 종자회사의 육종은 관행적 일반육종에 MAS 육종, GMO개발 육종, 유전체를 이용한 육종, 약리성이 있는 대사체를 이용한 기능성 육종이 성행하고 있으며 앞으로 2020년에는 모든 오믹스정도와 작물에 대한 모든 정보를 컴퓨터를 넣고 컴퓨터를 이용한 육종방법(In silico breeding)이 등장할 것으로 예측된다(그림 4-3-3).

[그림 4-3-3] 다국적기업의 육종기술 변화(농우바이오 생명공학연구소 정리, 2013)
(2) GMO(genetically modified organism, 유전체변형작물) 분야
GM작물의 재배면적은 1996년 170만ha에서 2012년 1억7000만ha로 100배가 증가하였고 2011년 1억 6000만ha에서 2012년에는 1억7300만ha로 늘어나 1년만에 6%의 성장률을 나타냈다(그림 4-3-4). ʻ농업생명공학 응용을 위한 국제서비스(ISAAA)ʼ의 보고서에 따르면 2012년말 기준, 전 세계적으로 28개국에서 1730만명에 이르는 농민이 GM작물을 경작한다고 분석하였다. 이처럼 GM작물의 재배면적이 증가하게 되는 이유는 여러 가지 이점이 있기 때문이다. 연료 사용 감소, CO2 감소, 온실가스방출 낮춤, 농약 감소에 의한 친환경, 수확량증가 등으로 GM작물을 재배하는 농가는 GM종자 자체를 매우 선호하고 있다. 2012년 GM작물 총 경작면적은 세계 총 작물경작지의 약 10%에 달하며 2012년 옥수수, 콩, 면화, 유채, 사탕수수, 알팔파, 파파야, 호박, 토마토, 피만, 포플라 총 11작물이 재배되었으며 옥수수, 콩, 면화, 유채의 재배가 전체 GM작물 중의 약 96%를 차지하고 있다. 전 세계 목화의 81%, 콩의 81%, 옥수수의 35%, 캐놀라의 30%가 GM기술을 이용한 GMO이며 국가마다 다르지만 미국에서 생산하는 콩과 옥수수 약 95%가 GMO이다.

[그림 4-3-4] 세계 GM작물 재배면적(1996~2012년)
GM작물의 특성은 제초제저항성과 곤충저항성이 주 특성이며 제초제저항성과 곤충저항성 형질이 같이 들어가 있는 경우가 늘고 있다(gene stacking). 이외에도 바이러스저항성, 아밀로스프리 감자 등도 있으며 2014년에는 필리핀에서 Golden rice, 다국적기업이나 중국에서는 GM벼 재배를 기대하고 있다.
[표 4-3-2] 주요 GM형질의 재배면적(ISAAA, 2013)
|
Crop |
2011년 |
2012년 |
|
Herbicide tolerant Soybean |
75.4 |
80.7 |
|
Stacked traits Maize |
37.3 |
39.9 |
|
Bt Cotton |
17.9 |
18.8 |
|
Herbicide tolerant Canole |
8.2 |
9.2 |
|
Herbicide tolerant Maize |
7.7 |
7.8 |
|
Bt Maize |
6.0 |
7.5 |
|
Stacked traits Cotton |
4.9 |
3.7 |
|
Herbicide tolerant Cotton |
1.8 |
1.8 |
|
Herbicide tolerant Sugat beet |
0.5 |
0.5 |
|
Herbicide tolerant Alfalfa |
0.2 |
0.4 |
|
Others |
0.1 |
<0.1 |
|
Total |
160.0 |
170.3 |
출처 : Million Hectares
지난 1996년서부터 상업화가 시작된 GM작물의 종자시장은 2012년 150억불로, 전체 종자시장의 약 33%를 차지하였으며 아주 빠른 속도로 시장을 잠식하고 있다(표 4-3-3). 2015년에는 약 200억불 정도의 GM 종자시장이 형성될 것으로 예상하며 전체 종자시장의 41%가 GM 종자시장으로 바뀔 것이라는 전망이다.
[표 4-3-3] 세계 GM 종자시장 규모의 변천
|
1996년 |
1998년 |
2000년 |
2004년 |
2006년 |
2008년 |
2009년 |
2010년 |
2011년 |
2012년 |
2015년 |
|
0.93억$ |
15.16억$ |
24.29억$ |
50.90억$ |
66.70억$ |
90.45억$ |
104.85억$ |
117.0억$ |
132.0억$ |
150.0억$ |
200.00억$ |
출처 : Global marker value of biotech crops=biotech Seed+technology fee(ISAAA, 2013)
GM작물은 향후 식량-식품 산업, 친환경-바이오에너지 산업, 건강기능-의약품 바이오산업 등에 많은 영향력을 줄 것이어서 다국적기업들이 GM종자를 미래산업의 근간으로 연계 범위를 넓히고 있다. 이외에도 다국적기업에서는 미래에 출시하려는 유용 GM작물 개발에 열을 올리고 있다(표 4-3-4). Monsanto의 정책 중에 하나는 2030년에 생산량 2배에 비료, 물은 1/3만 사용하는 작물을 개발하는 것이다.
[표 4-3-4] 연구 중인 미래 GM작물 종류
|
▪병저항성 작물(복합내병성: gene stacking) |
|
▪제초제저항성, 내충성 작물 |
|
▪고온, 저온, 가뭄, 염 등 환경 stress 저항성 |
|
▪바다 물로 쉽게 경작할 수 작물 |
|
▪불포화지방산 고함유작물 |
|
▪백신을 비롯한 바이오 의약품을 생산하는 작물 |
|
▪고농도의 비타민 등 항산화물질 또는 고부가가치 신체활성물질 함유 (기능성작물) |
|
▪광합성과 질소 고정율이 매우 높은 작물 |
|
▪산업쓰레기, 방사선물질, 중금속, 농약 등을 흡수하는 작물 |
|
▪작물의 구조 변형 작물(다수확, 소재배지, 농법변경) |
출처 : 농우바이오 생명공학연구소 정리, 2012
(3) 유전체정보를 포함 여러 신육종기술을 이용한 연구분야
다국적기업에서 실시하는 육종프로그램에는 다음과 같은 생명공학기술인 platform technology(표 4-3-5)가 있으며 다국적기업 중에서도 몇 회사만 대부분의 기술을 적용하고 있다. Keygene이나 DNA LandMark 같은 회사들은 특정 기술들만 운영하고 있으며 이들은 육종프로그램을 도와주는 service, outsourcing 역할만 한다.
[표 4-3-5] 농작물 육성관련 첨단 생명공학기술의 종류
|
Platform Technology |
몬산토, 신젠타 등 |
Keygene |
DNA LandMark |
|
DNA sequencing |
√ |
√ |
√ |
|
DNA marker development |
√ |
√ |
√ |
|
Genotyping (marker-assisted selection) of cultivar |
√ |
√ |
√ |
|
Marker-assisted backcrossing |
√ |
|
√ |
|
Genomics-assisted breeding |
√ |
|
√ |
|
Mapping (GWAM, linkage, QTL) |
√ |
|
√ |
|
Finggerprinting(characterization of stock seed using DNA marker) |
√ |
|
√ |
|
Site-directed mutagenesis |
√ |
√ |
|
|
Double haploid line development |
√ |
|
|
|
Bioinformatics |
√ |
√ |
√ |
|
Omics cross-talk |
√ |
|
|
|
GMO development |
√ |
|
|
|
Risk assessment technology |
√ |
|
|
|
Purity and quality control of F1 and variety protection |
√ |
|
√ |
|
Trait platforms: targeting genes for trait improvement |
√ |
√ |
|
|
Phenotyping/Phenomics |
√ |
√ |
|
|
Breeding program |
√ |
|
|
출처 : 농우바이오 생명공학연구소 정리, 2013
(4) Molecular farming에 관련된 연구분야
전 세계적으로 단백질의약품은 이미 약10억불 시장이 형성되어 있는데 대부분 미생물에서 제조된 것들이다. 그러나 유전자재조합기술과 bioreactor를 이용한 식물 세포배양기술을 통해 단백질이나 호르몬을 대량으로 생산할 수 있게 되었다. 최근에 고가의 제품들이 성공리에 시장에 진입하고 있어서 향후 이 분야의 연구가 활발해질 것으로 본다. 특히 의료용(표 4-3-6) 고부가가치 단백질, 동물백신, 경구백신, 산업용 단백질 등의 생산이 구축되었으며 식물세포를 이용하면 동물세포배양의 1/30, 미생물의 1/3의 비용으로 대체할 수 있다.
[표 4-3-6] 식물유래 의료용 단백질 산업화 현황
|
작물 |
product |
회사명 |
|
|
벼 |
항염증 식품첨가제 |
Ventria Bioscience |
판매 |
|
당근 |
고셔씨 병 치료제 |
Protalix |
판매승인 |
|
담배 |
뉴케슬백신(닭) |
Dow Agroscience |
승인 |
|
홍화 |
인슐린 |
SemBiosys |
승인 |
|
애기장대 |
VB12 강화 |
Cobento AS |
사전승인 |
|
옥수수 |
남포성 섬유종 치료제(lipase) |
Meristem Therapeutics |
임상 |
|
옥수수 |
인슐린 |
Meristem Therapeutics |
임상 |
|
옥수수 |
결장, 직장암 대응 IgG |
Monsanto |
임상 |
|
답배 |
충치예방 IgG |
Plant Biotechnology |
임상 |
출처 : 농우바이오 생명공학연구소 정리, 2013
분자농업의 연구분야는 이미 유럽이나 미국 등에서 여러 프로젝트로 진행하고 있는데 그 내용은 다음과 같으며(표 4-3-7) 결론은 Green Pharmaceuticals을 식물에서 생산하겠다는 목표이다. 2015년까지 시장수요가 있는 Green Pharmaceutical은 약 40여개로 약 10억불 시장을 기대하고 있다.
[표 4-3-7] 지난 20여 년간 연구 project 현황
|
Project |
|
▪Molecular farming of therapeutic antibodies in plants |
|
▪Production of diagnostic and therapeutic antibodies in plant by molecular farming |
|
▪production of recombinant immune complexes in trangenic plants for systemic and mucosal vaccines |
|
▪Processing technology for recovery of recombinant antibody in crop plants |
|
▪The pant as a factory for the production of Oral vaccines and diagnostics |
|
▪The plastid factory |
|
▪Immunotherapy of enteric infections by rotaviruses and coronalviruses using plantantibodies |
|
▪Metabolic engineering of plant cells for the production of pharmaceuticals |
|
▪Pharma-planta |
출처 : 농우바이오 생명공학연구소 정리, 2013
라. 국내 현황
농림축산식품부는 크게 3 기관에서 R&D 투자를 하고 있다. 자체평가기관인 농기평(농림수산식품기술기획평가원), 국가연구기관인 농진청(농촌진흥청) 그리고 산림청이다. 연구개발사업 총 예산은 2012년 9,089억원, 2013년에는 9,655억원 이며 2014년에는 1조 162억원으로 확충하고 있다(농림축산식품부 2013년 10월 보도자료). 그러나 다국적기업인 몬산토의 일년 연구비는 2012년 기준으로 15억불이어서 한국의 농축식품부 R&D의 약 1.5배 정도가 된다. 따라서 국내 전체 연구수준이 일개 외국기업체의 연구수준에 비해 질적, 양적으로 현격하게 차이가 있을 수 밖에 없다는 것이다.
2013년도 9,655억원 중에서 실제로 순수 농작물관련 R&D 출연금으로 사용되는 비용은 약 874억원으로 1/10로 되지 않는다(표 4-3-8). 그나마 이것이라도 최근 농진청과 농기평에서 여러 사업들을 운영하고 있는 덕택이며 국내 농업생명공학 분야 발전에 도움을 주고 있는 것은 사실이다.
[표 4-3-8] 신품종 육성산업과 관련(생명공학, 일반 농업) 국가연구사업 종류
|
사업 |
금액 |
연구분야 |
|
차세대바이오그린21 사업(농진청) |
약 300억원 |
▪유전체연구사업단(유전체 분석) ▪식물분자육종사업단(마커개발) ▪GM작물실용화사업단(GMO개발 및 평가) |
|
골든시드프로젝트(GSP) (농기평) |
약 349억원 |
▪주로 신품종개발을 위한 육종사업에 집중 ▪마커개발관련 연구도 전체의 10%정도로 포함 (채소, 식량, 원예사업단만 총 260억원) |
|
Seed valley(농기평) |
약 25억원 |
▪약 700억원(2015년) 투입 예정 ▪20개 기업이 민간육종단지 cluster 형성 |
|
생명산업개발사업 중 종자, 신품종관련 기반 또는 개발 연구(농기평) |
약 200억원 |
▪산학연 모두 참여하는 자유공모, 기획공모 과제 ▪연구과제 당 평균 5천만원 - 1억원 지원 |
|
총 국가연구비 |
약 874억원 |
▪일본의 최대 종자기업(매출규모가 약 4800억원)의 R&D 비용에 약 2배에 해당 ▪몬산토 전체 R&D의 약 5%정도 |
출처 : 농우바이오 생명공학연구소 정리, 2013
(1) 농진청의 연구개발
실상 한국의 농작물 생명공학은 농진청에서 주관하고 있다고 해도 과언이 아니다. 특히 차세대바이오그린 사업단 지원으로 유전체분석, 분자마커개발, GMO과제 등 수백개의 연구과제가 수행되고 있으며 산학연 공동과제임으로 대학, 국립연구소, 기업체의 농작물 생명공학연구는 농진청을 통해서 이루어지고 있다고 볼 수 있다.
(가) GMO 연구
GMO는 지금까지 국내에서 약 20작물에서 200여 개의 event를 개발하고 있으나 아직 위해성평가 승인/재배허가를 받은 작물은 없으며 첫 번째 승인은 아직도 1~2년은 더 걸릴 것으로 본다. 농진청에서 event 개발을 위하여 지원하고 있는 GM작물은 벼 14점, 콩 5점, 배추 5점, 고추 4점 그리고 화훼를 포함 기타 작물 11점으로 총39점이 개발되고 있다. 그리고 현재 인체, 환경위해성 연구를 진행하고 있는 작물은 아래표와 같다.
[표 4-3-9] 위해성평가 연구 중인 GM작물 및 형질
|
작물 |
형질 |
|
벼 |
▪제초제저항성 ▪건조저항성 ▪돼지설사병 예방 ▪기능성 |
|
고추 |
▪바이러스 저항성 |
|
감자 |
▪바이러스 저항성 |
|
백합 |
▪제초제저항성 |
|
국화 |
▪조기개화 |
|
잔디 |
▪제초제저항성 |
|
대목 |
▪바이러스 저항성 대목 ▪건조/염해 내성 박과류 |
|
7작물 |
11 events |
출처 : 농진청, 2013
(나) 분자육종 및 유전체 연구
2014년까지 식물분자육종사업단과 유전체연구사업단의 연구목표는 아래표와 같다. 농진청 사업단에서 확보된 자료는 산학연 연구자들이 활용할 수 있도록 되어 있다.
[표 4-3-10] 식물분자육종사업단 및 유전체연구사업단 연구목표
|
식물분자육종사업단 |
|
유전체연구사업단 |
|
|
신종자 |
90점 |
신규유전체해독 |
작물 9종 미생물 30종 |
|
분자표지 |
510점 |
유전체재분석(resequencing) |
390점 |
|
유용유전자확보 |
190점 |
유용 allele 발굴 |
300건 |
|
- |
|
신규유용유전자발굴 |
250점 |
|
- |
|
생명정보 생산 및 등록 |
480건, 3000Gb |
|
- |
|
오믹스정보 DB구축 |
70건 |
|
미션: 세계 5대 분자육종강국 진입 |
- |
미션: 농생물 유전체 분야 세계 5위 달성 |
- |
출처 : 농진청, 2013
(2) 기업체의 연구개발
(가) 종자산업 분야
한국에는 약 100여개의 종자기업이 있으며 이중 약 50개만 종자협회에 회원으로서 등록하고 있다. 대부분이 채소종자회사이며 옥수수, 벼, 콩에 대한 신품종 개발은 거의 하지 않는다. 종자기업 중에 매출규모 1위는 (주)농우바이오이며 몬산토코리아, 신젠타코리아, 다끼코리아, 사카다코리아, 동부한동-흥농, 코레곤, 농협 등이 매출규모로 상위 업체이다. 국내 전체 종자시장은 약 6000억원이며 채소종자는 약 2400억원 규모이다. 채소종자시장 규모는 작으나 생산물시장은 약 15조원 정도의 시장을 확보하고 있다.
(나) GMO 분야
국내에서 GM개발 연구를 하고 있는 기업은 (주)농우바이오가 유일하다. 지금까지 위해성 평가를 수행하고 있는 작물은 고추 2점, 양배추 1점, 대목 1점이며 이들은 상기 농진청 data와 중복이 되는 숫자이다. 이외에도 고추의 곤충내성, 배추의 곤충내성, 대목의 바이러스 저항성 GM고추가 event로서 개발되어 있으며 최근 들어서 GM옥수수개발을 착수하였다.
(다) 분자육종 분야
(주)농우바이오는 지난 10여년간 R&D에 집중투자를 하여 국내에서 분자육종기술의 인프라를 가장 많이 확보하고 있다. 내병성, 기능성 DNA 마커 약 100여점을 개발하여 현재 분자육종에 활용하고 있으며 Genotyping, Fingerprinting, MAS, MAB, Mapping 등 다양한 분석을 하고 있으며 F1 순도검정까지 포함하면 일년에 약 80만점 정도의 genotyping을 하고 있다(참고로 몬산토는 일년에 globally 7천만점). 이외에도 마커 분석과 개발을 대행해 주는 벤처로서 (주)고추와 육종, (주)에프앤피가 있는데 검정 수는 그리 많지 않다.
(라) 분자농업 분야
(주)엔비엠은 국내에서 유일하게 식물체로부터 유용단백질을 생산하는 벤처회사이다. 벼의 현탁배양세포로부터 bovine trypsin, enterokinase, hGM-CSF를 분리정제, 생산하여 국내에서 판매하고 있지만 매출규모는 적다. 최근에 유용단백질을 산업화규모로 대량재배, 분리정제, QC, 판매 등의 산업기반 모델을 구축하기 위한 연구를 하고 있다.
마. 발전 전망
세계 각국은 식량안보 및 산업경쟁력 제고를 위해 유전자원에 대한 주권을 강화하고 있는 추세이고 미국 등 선진국은 생명공학기법을 활용하여 수확량이 많고 기능성이며 육종연한을 단축하는 새로운 분자육종을 전개하고 있다. 그리고 지난 17년 동안 GMO 작물의 상업화를 통해서 세계 종자시장을 새롭게 바꿔 놓고 있으며 다국적기업들의 시장 독점화가 되고 있다. 또한 농작물을 위한 생명공학분야는 종자로부터 시작하여 많은 연계산업을 만들고 있는데 의약산업, 바이오산업, 환경산업으로 전개하여서 새로운 fusion시장이 구축되고 있으며 고용창출 및 새로운 패러다임이 형성되는 중이다.
농작물 생명공학분야는 무궁무진하게 성장할 수 있는 분야이어서 대한민국의 신성장동력이 될 수 있음에도 불구하고 그동안 실제로 국가에서 투자한 순수 R&D 연구비용은 매우 적다. 특히 GMO 개발 기술에 대한 투자가 너무 열악한데 이 중요성을 제대로 아는 부처 담당자나 정치인이 없고 시민연대의 반대 목소리만 높아져 있는 상황이다.
또한 산업화가 되려면 국내 기업들이 활성화가 되어야 하는데 대부분 농업관련 기업들은 중소기업이며 영세하여 생명공학에 투자할 여력이 되지 않는다. 따라서 질적, 양적으로 상당히 후진성을 벗어나지 못하고 있는 실정이며 다국적기업과의 기술적 격차는 계속 벌어지고 있다.
2012년 한국의 식량·곡물자급률은 23.6%이며 이중에서 쌀 자급을 제외하면 10%이내이다. 즉 근본적인 먹거리 산업이 외국의 농작물수급에 따라 좌우되고 있다는 것이다. 이런 위기 속에서 국가연구비 부족, 산업체 열악, 기술과 인력 인프라 부족 등 총체적 문제점이 있으며 이를 극복하기 위한 당면적, 장기적 정책이 요망된다.
농작물 생명공학 분야에 국가 경쟁력을 최대로 올릴 필요가 있다. 이 분야의 선진화가 바로 농업의 창조경제라는 국가브랜드의 비전이 실현될 것이다. 이 분야에 거국적 신사업이 육성될 수 있도록 미래 R&D의 재구성이 필요하며 국립연구소의 선진화 방안이 극대화 됨과 동시에 민간기업에 대한 국가적 투자가 절실하다.
2. 식품 생명공학
가. 개요
식품의 가공, 생산 및 산업적 활용을 위해 생명공학기술을 개발 및 응용하는 분야로서 대표적으로 건강기능성 식품 및 소재, 식품의 안전성 평가 및 관리, 발효식품 분야 등을 포함한다. 전통적인 식품 관련 기술뿐만 아니라 유전자재조합, 세포배양, 면역조절기술, 유전체, 단백체, 대사체 분석 등 생명공학의 핵심기술이 요구되며, 제품은 원료, 중간체 및 최종 제품을 모두 포함한다.
건강기능성 식품 및 소재는 생명공학기술을 적용하여 미생물, 식물 및 동물세포를 직·간접적으로 이용하여 생산되는 유용한 물질을 가공 또는 제조한 것으로 원료, 중간체 및 최종 제품을 포함한다. 특히 식품뿐만 아니라 화장품·의약품분야와 상호간의 기술 및 소재를 공통적으로 포함하는 융합산업(fusion industry)의 성격이 높은데, nutraceuticals․cosmeceuticals․beauty foods, 바이오신약 등 과거의 별도 산업영역이 융합되어 신 산업군을 형성하는 추세이다.
식품의 안전성 평가 및 관리 분야는 생명공학기술을 이용한 식품위해평가, 위해인자의 제어 및 산업적 적용을 위한 바이오칩을 포함한 원료, 중간체 및 최종 제품과 관련된 일련의 기술 및 관련 제품을 포함한다. 식품안전관련 기술 및 제품은 인류에게 안전한 식품공급을 위한 가장 직접적인 기술 분야로 최근 들어 나노기술(NT) 및 정보기술(IT) 등과 융합을 하고 있는 추세이다.
발효식품은 발효과정을 거쳐 부가가치를 높인 식품 및 소재로 한국의 전통식품은 발효식품이 대부분을 차지하고 있다. 발효식품 분야는 발효미생물의 유전·단백질체 분석 및 대사체학(metabolomics)을 활용한 전통발효식품의 표준화, 기능성 증진, 실용화에 관련된 일련의 기술을 포함한다. 특히 전통식품은 국제시장에서 전통지식(traditional knowledge & culture)과 자원에 대한 종주권을 주장할 수 있는 중요한 분야이기 때문에 세계 각국에서 자국의 전통발효식품의 고부가 가치화 전략기술 개발에 박차를 가하고 있다.
나. 해외 동향
(1) 기능성 식품소재
세계적인 웰빙 트렌드의 확산과 고령화의 영향으로 건강 기능식품이 포함된 nutrition industry의 시장규모는 최근 5년간 연평균 6% 수준의 고성장세를 지속하고 있다. DataMonitor 자료에서 글로벌 식품산업의 최근 5년간 연평균 성장률이 3.7%임을 감안할 때 건강기능식품 시장의 성장세는 상당히 높은 수준이며, 최근 중국, 인도, 라틴아메리카 등 신흥 개발국의 경제성장과 함께 수요가 크게 증가하는 추세이기 때문에 높은 잠재력을 지닌 시장으로 평가된다. 이러한 건강기능식품 시장의 높은 성장세는 ʻ건강지향적 소비자ʼ의 증가에 따라 지속·확대될 것으로 예상된다. 특히 Datamonitor의 조사에 의하면, 소비자의 약 60%는 평소에 건강에 대한 관심이 매우 높았으며, 미국의 Food Marketing Institute의 조사에서는 소비자의 65%가 음식섭취를 통해 건강상태를 조절하는 특성이 있는 것으로 나타났다.
2011년 세계 건강기능식품 시장규모는 890억달러이며, 향후 2016년에는 1,200억 달러를 상회할 것으로 예상된다. 특히 개발도상국에서의 성장률이 향후 2016년까지 약 12%의 수준을 유지할 것으로 예상된 반면 선진국들은 약 3%의 낮은 성장률을 유지할 것으로 예상되어, 향후 세계 건강기능식품 시장은 이들 개발도상국이 주도할 것으로 판단된다.
품목별로는 건강기능식품의 대표상품으로 이미 소비자들에게 깊게 인식된 비타민 및 무기질(Vitamins & Minerals)의 2011년 시장규모가 360억 달러로 전년대비 5.3%의 성장률을 기록하며 1위를 차지했다. 또한 최근건강에 대한 소비자들의 관심이 체중조절과 체력향상을 돕는 performance enhancers, muscle builders, weight gainers 등 건강증진용 제품의 판매확대로 연결되면서 sports nutrition 시장의 최근 5년간 연평균 성장률이 가장 높은 6.2%를 기록했다.
최근 들어 생명공학의 첨단기술을 식품분야와 연관시켜 영양과 인간 유전체간 관련성 추적, 영양관련 질병 제어 및 맞춤형 처방 분야로 응용하려는 연구가 세계적으로 핵심 연구 분야로 부상하고 있다. 이는 nutrigenomics, proteomics, metabolomics 등 오믹스(omics) 기반 과학기술과 bioinformatics의 급속한 발전에 따라 개인의 질병감수성을 미리 예측하고 개인별 질병발생예방을 위한 개인별 맞춤형 건강관리가 가능해져 이에 대한 산업적 응용 필요성이 증가되고 있기 때문이다
(단위 : 백만달러, %)

출처 : Nutrition Business Journal, 2012
[그림 4-3-5] 건강기능식품 세계시장 규모 및 성장률
(단위 : 백만달러, %)

주 : 한국은행 경제통계시스템(ECOS), 2011년도 원/달러 평균환율 적용
출처 : 1) 식약청, 2011년 건강기능식품 생산실적 분석결과 발표, 보도자료, 2012. 5. 9
2) ʻNBJ's Global Supplent & Nutrition Industry Reportʼ, Nutrition Business Journal, 2012
[그림 4-3-6] 국가/지역별 건강기능식품 시장규모 및 성장률(2011)
(2) 식품의 안전성 평가 및 관리
식품안전기술은 인류에게 건강 기능성의 안전한 식품공급을 위한 가장 직접적인 기술 분야이다. 선진국에서는 정부차원에서 식품안전연구를 주도하고 있고 민관합동으로 국가 식품안전 프로그램 및 안전한 식품공급을 위한 기반기술을 연구하고 있다. 유전자재조합이나 나노기술은 식품 및 관련 산업의 성장 동력을 제공하는 기술로 부상되고 있으나 안전성 평가가 주도권을 선점하는데 핵심이 되고 있다. 최근 독일엔지니어협회 산하 기술센터(VDI Technologiezentrum) 미래기술컨설팅(ZTC) 연구팀은 세계 8개국 기술예측 조사에서 바이오칩이 중요한 역할을 할 것이라고 예상했으며 덴마크와 남아프리카 보고서는 식품 안전을 높이고 식품이력추적관리를 강화하기 위한 센서 및 정보통신기술 투입을 강조하고 있다. 또한 바이오센서의 감도를 증진시키기 위해 나노기술(NT)을 이용한 항체 고정화 및 최적화 배열에 많은 연구가 이루어지고 있으며, 마이크로 어레이 및 미세채널 칩 등의 상용화가 가속화되고 있다.
Kalorama Information의 2013년 보고서에 따르면 식품안전관련 진단시장 (Food Safety Diagnostics Market)은 2012년을 기준으로 14억 달러를 넘었고, 과거 5년 동안 연간 9.9%(CAGR)의 성장을 해왔으며 2015년에는 20억 달러 이상의 규모를 넘어설 것으로 예측되었다. 또한, PCR/항원-항체기반 검출 및 진단과 같은 테스트 시장은 연간 12.6% 이상으로 식품안전 진단시장 중에서 가장 두드러진 성장세를 지속하고 있다. 미국의 글로벌 화학회사 듀폰의 B2B 전망보고서에 따르면, 식품 안전 검사 특히 식중독 검출을 위한 분자진단 제품이 도약할 것으로 세계시장을 전망하였다.
(단위 : 백만달러)

출처 : Kalorama Information, Food Safety Diagnostics, 2013
[그림 4-3-7] Food Safety Diagnostics Market(millions 달러, 2008~2017년)
(단위 : 억원)

출처 : Wikibon, 2013. 3. 7
[그림 4-3-8] 전 세계 식품 안전 및 식중독 검사 시장 규모 현황 및 전망(2010~2015년)
(3) 발효식품
세계 각국에서 자국의 전통발효식품의 세계시장을 겨냥한 고부가 가치화 전략기술 개발이 활발하게 진행되고 있다. 발효식품은 각 나라마다 고유한 방식으로 제조되는 오래된 역사를 가진 식품이 대부분으로 건강과 문화를 동시에 제공하고 있다. 각 나라마다 고유의 발효식품에 대한 균주개발과 기능성 물질 탐색 및 증진, 표준화 등에 대해 연구를 지속적으로 진행해 오고 있다. 그러나 최근에는 오믹스 기술을 활용하여 게놈, 트란스크립톰, 프로테옴, 메타볼롬 등의 해독으로 보다 근원적인 해석을 시도하고 새로운 균주개발 등을 통하여 자국 전통발효식품의 부가가치 제고에 연구역량을 집중하고 있다.
세계바이오식품 시장은 약 2,585억 달러로 연간 약 17%의 성장률을 보이고 있으며 이 중 약 73억 달러가 발효제품이다.
다. 국내 현황
(1) 기능성 식품 및 소재
국내 건강기능식품 시장의 2011년 생산액은 1조 3,682억원이었다. 전체생산액 중 국내 판매금액이 1조 3,126억원(95.9%), 수출액은 556억원(4.1%)으로 내수시장을 중심으로 빠르게 성장하는 것으로 나타났다. 홍삼이 건강기능식품 중 가장 큰 시장을 형성하며, 2011년 전체 건강기능식품 생산액의 52.6%(7,000억원)를 차지하고 있다. 최근 홍삼제품의 면역효과 이외에도 피부미용 및 주름개선 등의 미용기능이 각광받기 시작하면서, 전년 대비 성장률이 23.6%를 기록하면서 국내 건강기능식품 시장의 성장을 주도하고 있다. 이러한 홍삼제품에 대한 주요 소비계층이 기존의 40·50대 중장년위주에서 미용에 관심이 많은 20·30대 젊은 층으로 확장되면서 연령에 구분 없이 홍삼의 수요는 지속적으로 증가할 것으로 전망된다.
(단위 : 억원)

출처 : 2011년 건강기능식품 생산실적 분석결과 발표, 식품의약품안전청, 2012
[그림 4-3-9] 주요 품목별 생산액 및 성장률 현황
(단위 : %)

출처 : 2011년 건강기능식품 생산실적 분석결과 발표, 식품의약품안전청, 2012
[그림 4-3-10] 개별인정형 세부품목별 생산현황
국내에서는 정부차원의 다양한 지원에 의해 기능성 식품 및 소재에 관한 연구개발이 진행되고 있다. 2차 생명공학육성계획 2단계에서도 생명공학 기법을 이용한 개인 맞춤형 기능성 식품 원천 기술 연구 등이 포함되어 있다. 농식품부는 고부가가치식품기술개발사업을 통한 기능성식품 및 소재개발 연구, 차세대 바이오그린21사업을 통한 농식품 원료를 이용한 기능성 식품 및 소재 개발 기술 강화 및 실용화 연구를 지원하고 있다. 교육부와 미래창조과학부는 이공분야 기초연구사업, 유전자-동의보감 사업 등을 통해 기능성 식품 및 소재 개발을 위한 원천기술 개발을 지원하고 있다. 한국식품연구원에서도 식품 소재의 기능성 탐색 및 발굴, 질병 예방과 건강 증진용 식품 개발, 이들의 기능성을 평가하는 기술 개발을 지원하여 비만억제, 정신건강(수면조절, 기억력향상, 스트레스해소 등), 개인맞춤형 식품 등에 관한 연구가 진행 중에 있다.
국내 건강기능식품의 시장규모는 건강관심 고조, 인구고령화 등에 힘입어 지속적으로 성장할 것으로 전망된다. 그러나 동 산업을 보다 더 육성·발전시키기 위해서는 글로벌 시장진출 방안을 모색해야 하고, 국내 대표 기능성 소재 및 브랜드 발굴을 위한 국가적인 육성 및 지원책이 필요하다. 특히 국내 건강기능식품 인·허가 획득까지 투입되는 고비용에 비해, 정부부처의 건강기능식품 연구개발비의 지원규모는 적은 편이다. 뿐만 아니라 건강기능식품산업 환경의 불확실성이 예상되는 FTA와 나고야의정서 등 국제협약 대응에 대한 대응방안 마련이 필요하다.
(2) 식품의 안전성 평가 및 관리
최근 들어 국민 개개인의 행복실현을 위해서는 생활 속 불안을 초래하는 위험요인의 하나로 불량식품의 근절이 반드시 해결해야 할 선결과제로 인식되어 정부의 식품안전관리 체계도 통합되었다. 이에 따라 기술 개발의 추세도 소비자가 신뢰할 수 있는 안전한 식품의 공급을 위해 식품 생산에서 소비까지 전 유통과정의 안전성 확보 및 효율성 제고를 위한 제반기술의 확보에 역점을 두고 있다. 식품의 안전성을 확보하기 위해서는 위해요소가 생성된 후에 물리적·화학적인 방법으로 제어하는 기술이 아닌 분자수준에서 발생의 근원을 연구하고 신속하게 검출한 다음 제어할 수 있는 기술이 요구되고 있다. 이를 위해 위해발현 메커니즘을 기반으로 위해요소를 제어할 수 있는 기술과, 현장에서 식품위해요소를 판별할 수 있는 신속고감도 검출 기술과 관련 제품의 개발이 요구되고 있다.
제2차 생명공학 육성기본계획 2단계(ʼ12~ʼ16)에 식품 위해인자 신속 검출 등 식품 안전성 연구가 포함되어 있어 국가 수준에서 연구의 중요성을 인지하고 있다. 그러나 위해인자 검출에 있어 소요되는 시간과 인력의 90% 이상을 차지하는 시료전처리 과정을 위한 연구는 기술 중요도 인식부족으로 활발하지 못한 실정이다. 식품 위해인자 검출을 위한 바이오센서 기술은 빈번한 식중독 사고 해결을 위하여 대학과 출연연을 포함 관련 부처(식약처, 농진청 등)에서도 활발히 연구되고 있다. 최근에는 미래창조과학부 공공복지안전연구 사업에서도 관련 연구가 이루어지고 있다. 특히 식중독균 검출과 관련한 바이오센서는 몇몇 개발 제품이 보고되고 있으나, 시료전처리/검출시간/감도 등과 같은 근본적 문제해결은 미진한 상태이어서 상용화가 잘 이루어지지 않고 있다. 식품 위해미생물·독소 관련 바이오센서 제품은 의료진단 분야의 제품보다 상대적으로 공인 허가가 용이하여 초기 시장진출이 유리하며 확보한 know-how, 원천기술을 이용하여 의료지단, 환경 및 국방관련 바이오센서 시장으로도 효과적으로 진입할 수 있다.
최근 국내 발전된 IT 기술을 토대로 스마트폰을 이용한 식품의 실시간 품질 및 유통이력 정보를 모니터링하는 기술이 개발되고 있으나 안전 정보는 아직 포함되지 못하고 있다. 전반적으로 위해인자의 검출을 제외한 제어 분야나 유통과정 중 추적 분야는 원천기술의 개발보다 외국기술을 국내 식품 공정이나 유형에 적용하는데 중점을 두고 있는 실정이다.
(3) 발효식품
발효식품은 전통식품 산업과 농림수산업의 동반성장, 시장규모 및 수출확대를 견인할 분야로 인식되고 있다. 2012년 국내 발효식품 산업의 규모는 4조원 규모로 식품산업 전체의 4%에 불과하나, 향후 성장가능성이 높은 것으로 전망되고 있다. 한국산업마케팅연구소에 따르면, 2011년 대비 바이오식품이 1조 2,157억원으로 가장 크게 증가할 것으로 전망되며, 세부 분야로는 사료첨가제와 항암제, 발효식품, 진단키트 등 4개 분야가 시장을 선도할 것으로 전망하였다. 또한, 현재 생명공학 관련 제품의 상당수는 미생물 자원을 활용한 발효기술로 만들고 있다. 발효식품뿐만 아니라 정밀화학 분야 등 미생물을 이용한 산업은 세계적으로 보편화되고 있어 미생물 확보 자체가 국가경쟁력이 될 것이라는 전망도 나오고 있다.
CJ는 미생물 발효공법을 통해 고부가 식품조미료 핵산을 생산하여 세계 80여개국에 수출(세계시장 점유율 1위)하고 있다. 그 외 미생물 발효공정을 통해 아미노산류, 자일리톨 등 유용소재의 생산이 꾸준하게 이루어지고 있다. 최근에는 전통 발효 주류인 막걸리의 기능성이 알려지면서 국내외 소비층이 증가하고 있으며, 전통 발효 식초도 조미용보다는 음료 형태의 식초시장이 확대되고 있는 추세이다. 또한 기능성 제품 시장 중에서도 대부분 유산균 제품의 형태로 발효식품이 약 1%를 차지하고 있다.
전통발효식품을 글로벌 경쟁력이 있는 제품으로 개발하기 위해서는 발효과정에서 일어나는 전체 미생물 군집변화, 상호작용, 발효특성을 규명해야 하며, 발효식품 전반에 걸쳐 우수한 특성을 가진 발효 종균이 관련 업체에 안정적으로 공급될 수 있는 기술이 개발되어야 한다. 최근에 고부가가치식품기술개발 사업의 지원을 받아 대용량 유전체분석법의 하나인 파이로시퀀싱(pyrosequencing) 분석기술을 이용하여 김치 및 젓갈 내 전체 미생물군집 및 메타지놈(metagenome)을 분석하므로써 미생물군집변화 및 서로간의 상호작용, 발효특성이 연구된 바 있다. 한국식품연구원에서도 전통발효식품 유래 미생물 특성을 규명하고 장내미생물 균총 조절기술 기반 항상성 유지 발효식품 개발에 관한 연구가 진행 중에 있다.

1. 제조 및 생물공정
가. 개 요
생물공정기술은 생명공학기술을 이용하여 목적 산물을 대량생산하기 위한 기술로써 ʻʻ생명과학의 연구발견을 실제제품 및 공정 또는 사회적 수요에 부합하는 시스템으로 변환시키는 기술ʼʼ을 총칭하는 것으로 정의할 수 있다. 이러한 생물공정기술이 추구하는 최종목표는 생명공학기술을 활용하여 산업적으로 필요한 원료 또는 최종 물질을 대량으로 제조하는 것이다. 생물공정기술을 이용하여 대량 생산되어질 수 있는 소재는 미생물 이용 발효공정을 통한 식품 및 사료 원료, 효소, 바이오연료와 같은 바이오에너지, 바이오플라스틱과 같은 바이오 화학 소재 등이다. 그러나 바이오공정기술은 최근에는 미생물뿐만 아니라 동물세포, 식물세포의 배양을 통하여 대량생산이 필요한 항체의약품 생산에도 필수적으로 사용되고 있어 최근 관심이 커지고 있다.
나. 해외 동향
2010년도 발효를 기반으로 한 화학제품의 세계시장 규모는 389억 달러로 추정되며 2007~2015년 동안 연평균 성장률은 4.7% 예상되며 이를 기준으로 2015년에는 485억의 시장이 형성될 것으로 예측 된다17). 가장 큰 시장을 형성하고 있는 미국의 2010년 시장 규모는 세계시장의 36.8%에 해당하는 143억 달러로 추정되며, 2007~2015년 동안 평균 성장률이 4.1%에 이룰 것으로 보아 2015년에는 171억 달러에 이를 것으로 예상된다.
대표적인 수송용 연료의 하나인 바이오 에탄올의 경우 2007~2015년 연 평균 성장률 5.1%를 기준으로 2015년 세계시장 규모가 257억 달러로 전망된다. 다음으로는 2010년 현재 년 51억 달러의 시장을 갖고 있는 발효 유기산(예; 젖산, 유기산 등)으로 연평균 5.4%씩 성장하여 2015년에는 63억 달러의 시장을 형성할 것으로 전망된다(표 4-4-2). 전통적으로 유기산은 식품첨가물의 용도로 사용되었으나, 최근 이러한 유기산을 바이오플라스틱 단량체로 이용하려는 시도가 활발히 진행되고 있다. 대표적인 것은 젖산을 단량체로 한 PLA (polylactic acid)이다. 최근 증가하고 있는 젖산 생산량은 주로 PLA 생산을 위한 것이라 할 만큼 바이오플라스틱 생산량의 증가는 기대할만하다. 이외에 숙신산, 아디픽산 등 고분자 단량체로 이용될 수 있는 유기산 생산에 대한 관심이 증가하고 있으며, 이러한 유기산은 폴리에스테르 고분자, 폴리아마이드 고분자와 같은 바이오플라스틱에서 핵심역할을 할 것으로 전망된다.
생물공정을 이용한 발효 화학 물질의 생산은 중국에서 폭발적으로 증가 하고 있다. 중국은 약 700 여개의 전문회사와 수백의 작은 회사들을 중심으로 아미노산, 메티오닌, 비타민 C, 구연산 및 기타 발효화학 물질들을 생산하는 바이오텍 산업의 제조 허브가 되고 있다. 이 회사들 중에서 1/3정도는 제약 제품을 생산하고 있고, 1/3은 아미노산과 관련제품들을 생산하고 있고, 나머지 1/3 정도의 기업은 식품 및 음료와 기타 화학 물질들을 생산하고 있다. 지난 3년간 중국의 생명공학 제품 생산량은 두 배로 증가하였으며 각 기업체들은 공격적으로 생산 능력을 확대하고 있다. 중국은 최대 항생제 생산국으로 전 세계 생산량의 50%를 담당하고 있고, 효소와 아미노산도 주요 생산국이 되고 있다.
중국의 급속한 생산능력 확대는 우리나라에서는 큰 위기이자 기회가 될 것으로 전망된다. 그 이유는 기술 및 경제성을 가지지 못한 발효생산공정의 경우 중국에 대하여 비교우위를 가지지 못하여 국내 생산기반이 와해될 가능성이 있는 반면 비교우위를 가질 경우 중국의 넓은 시장 기반을 십분 활용할 수 있기 때문이다. 최근 국내 기업인 CJ의 경우 지속적인 연구개발 및 생산시설 확장을 통하여 2015년 라이신 생산 70만톤 생산규모를 계획하고 있는 것으로 알려져 있다. 이러한 라이신 생산 규모는 세계 1위 규모가 될 것으로 전망되고 있어 지속적인 연구개발을 통하여 미생물 발효공정을 통한 세계 1등 상품 생산이 가능하다는 대표적인 사례가 될 것으로 예상된다.
[표 4-4-1] 국가별 발효 화학 물질 시장 현황 및 전망1)
(단위 : 백만불)
|
지역/ 국가 |
2010년 |
2011년 |
2012년 |
2013년 |
2014년 |
2015년 |
평균 성장율 (%) |
|
미국 |
14,295 |
14,892 |
15,476 |
16,044 |
16,578 |
17,071 |
4.12 |
|
카나다 |
1,027 |
1,061 |
1,095 |
1,128 |
1,162 |
1,194 |
3.47 |
|
일본 |
916 |
954 |
992 |
1,030 |
1,068 |
1,105 |
4.2 |
|
유럽 |
8,764 |
9,089 |
9,407 |
9,720 |
10,027 |
10,329 |
3.73 |
|
아태 |
7,328 |
7,754 |
8,222 |
8,723 |
9,288 |
9,891 |
6.02 |
|
중동 |
1,052 |
1,106 |
1,165 |
1,231 |
1,303 |
1,382 |
5.31 |
|
중남미 |
5,524 |
5,847 |
6,206 |
6,604 |
7,043 |
7,527 |
6.1 |
|
총계 |
38,905 |
40,702 |
42,564 |
44,489 |
46,467 |
48,499 |
4.71 |
[표 4-4-2] 제품별 세계 발효 화학물질 시장 현황 및 전망1)
(단위 : 백만불)
|
발효제품 |
2010년 |
2011년 |
2012년 |
2013년 |
2014년 |
2015년 |
평균 성장율 (%) |
|
항생제 |
5,876 |
6,105 |
6,343 |
6,590 |
6,845 |
7,107 |
3.95 |
|
알코올 |
20,594 |
21,613 |
22,673 |
23,770 |
24,898 |
26,056 |
5.06 |
|
효소 |
2,843 |
2,947 |
3,050 |
3,151 |
3,250 |
3,346 |
3.60 |
|
유기산 |
5,120 |
5,345 |
5,576 |
5,813 |
6,056 |
6,308 |
4.45 |
|
비타민 |
1,599 |
1,696 |
1,799 |
1,911 |
2,030 |
2,159 |
6.29 |
|
폴리머/검 |
1,098 |
1,143 |
1,189 |
1,237 |
1,287 |
1,338 |
4.20 |
|
기타 |
1,775 |
1,854 |
1,935 |
2,017 |
2,100 |
2,185 |
4.51 |
|
총계 |
38,905 |
40,702 |
42,564 |
44,489 |
46,467 |
48,499 |
4.71 |
2008~2009년에 발효 에탄올 소비는 가장 큰 소비국인 미국의 수요 감소에 기인하여 감소하였으나 2010년 이후부터는 꾸준히 증가하고 있다. 특히 바이오 에탄올은 가솔린 첨가제로 사용하는 MTBE 대체하는 가장 빠르게 성장하는 발효 화학 물질로 각광을 독차지하고 있다. 최근 전 세계적으로 생산되고 있는 에탄올의 86%는 바이오 연료로 소비되고 있다. 사탕수수와 당밀(브라질), 옥수수(미국), 사탕무우(프랑스), 밀(케나다), 고구마와 카사바(중국) 같은 식품원료들이 주요 에탄올 생산원료로 사용되고 있다. 에탄올은 그 자체로는 가솔린을 대체할 수 있으며, 이를 화학적으로 전환하여 PET, PE와 같은 범용 플라스틱을 만드는 핵심 원료가 될 수 있다. 최근 코카콜라는 에탄올에서 유래된 PET를 자사의 PET 용기에 채용하여 이미 PlantBottle이라는 상표로 자사 용기의 8%인 150억개 이상 사용하였으며, 2020년까지 자사의 PET 용기를 바이오유래 PET로 대체하겠다는 계획을 발표한 바 있다.
세계 효소 시장은 전체적으로는 최근 안정적인 성장을 하고 있으나 분야에 따라서는 부침이 있다. 즉, 식품 및 사료용 효소 시장은 침체되어 있는 반면 세제용 및 산업용 효소 시장은 미미한 성장을 나타내고 있다(표4-4-3). 산업용 효소 시장의 구조는 굳혀진 형태를 갖고 있다. 즉, Novozyme과 Genenco/Danisco로 양분되어 거의 세계시장의 2/3를 이들이 차지하고 있고, 기타 DMS, BASF, ABF, AB Enzymes, Amano Enzyme 이 주요 효소 기업으로 활동하고 있다. 특히 최근 미국의 대표적인 화학회사인 듀폰(DuPont)이 Genenco/Danisco를 63억달러에 인수하여 화학회사에서 생명공학 회사로의 변신을 시도하고 있다. 듀폰이 Genenco/Danisco를 인수한 것은 발효를 통한 식품 소재 생산 외에 셀룰로오즈 에탄올 생산을 위하여 필수적으로 필요한 효소를 확보하기 위한 전략으로 해석되고 있다. 따라서 앞으로 효소생산 및 발효를 통한 바이오화학소재를 일관적으로 생산하는 종합 생명화학회사의 출현이 기대된다.
[표 4-4-3] 국가별 발효 효소 시장 현황 및 전망1)
(단위 : 백만불)
|
지역/ 국가 |
2010년 |
2011년 |
2012년 |
2013년 |
2014년 |
2015년 |
평균 성장율 (%) |
|
미국 |
1,432 |
1,506 |
1,579 |
1,651 |
1,720 |
1,785 |
5.06 |
|
카나다 |
45 |
45 |
46 |
47 |
47 |
48 |
1.65 |
|
일본 |
60 |
61 |
61 |
62 |
63 |
64 |
1.37 |
|
유럽 |
756 |
772 |
787 |
803 |
818 |
833 |
2.17 |
|
아태 |
325 |
333 |
341 |
350 |
359 |
368 |
2.45 |
|
중동 |
76 |
78 |
80 |
82 |
84 |
86 |
2.42 |
|
중남미 |
150 |
152 |
154 |
157 |
159 |
162 |
1.55 |
|
총계 |
2,843 |
2,946 |
3,049 |
3,151 |
3,250 |
3,346 |
3.60 |
대표적인 유기산인 구연산 시장은 최종 소비처인 식품, 음료 및 세제의 수요 감소에 따라 구미에서는 미미한 성장을 하고 있지만 아태 및 중동과 같은 개도국에서는 크게 성장 하고 있다(표 4-4-4). 젖산은 최근 생분해성 고분자인 polylactic acid(PLA) 합성 원료로 각광을 받으며 시장이 빠르게 성장하고 있다. 특히 미국과 유럽에서 PLA는 커트레이(cutlery), 보존용기, 플라스틱 포장 마켓에서 사용이 크게 증가하고 있다(표 4-4-5). 현재 PLA는 초기에 일회용 포장과 같은 생분해성이 강조된 시장에서 진화하여 자동차용 내장재, 전자제품 외장재와 같이 내구성, 내열성이 필요한 부분에 까지 빠르게 적용되고 있다. 이러한 PLA 바이오플라스틱의 성공은 PHA, PBS와 같은 다른 바이오플라스틱의 적용 및 생산 확대를 이끌고 있다(그림 4-4-1).

[그림 4-4-1] 바이오플라스틱 개발 동향
[표 4-4-4] 국가별 발효 구연산 시장 현황 및 전망1)
(단위 : 백만불)
|
지역/ 국가 |
2010년 |
2011년 |
2012년 |
2013년 |
2014년 |
2015년 |
평균 성장율 (%) |
|
미국 |
548 |
565 |
581 |
595 |
608 |
619 |
2.97 |
|
카나다 |
49 |
50 |
52 |
54 |
55 |
57 |
3.42 |
|
일본 |
59 |
61 |
63 |
64 |
6 |
68 |
3.04 |
|
유럽 |
635 |
655 |
674 |
692 |
709 |
726 |
3.12 |
|
아태 |
443 |
464 |
488 |
515 |
543 |
573 |
5.13 |
|
중동 |
101 |
106 |
112 |
119 |
126 |
134 |
5.64 |
|
중남미 |
142 |
146 |
152 |
157 |
163 |
170 |
3.58 |
|
총계 |
1,975 |
2,048 |
2,121 |
2,195 |
2,270 |
2,346 |
3.71 |
[표 4-4-5] 국가별 발효 젖산 시장 현황 및 전망1)
(단위 : 백만불)
|
지역/ 국가 |
2010년 |
2011년 |
2012년 |
2013년 |
2014년 |
2015년 |
평균 성장율 (%) |
|
미국 |
118 |
127 |
135 |
144 |
152 |
160 |
7.03 |
|
카나다 |
29 |
30 |
30 |
31 |
32 |
32 |
2.73 |
|
일본 |
26 |
27 |
28 |
28 |
29 |
30 |
3.51 |
|
유럽 |
321 |
334 |
347 |
359 |
371 |
382 |
4.18 |
|
아시아/ 태평양 |
340 |
357 |
374 |
394 |
415 |
438 |
4.92 |
|
중동 |
61 |
66 |
71 |
77 |
83 |
89 |
7.76 |
|
중남미 |
116 |
123 |
132 |
140 |
150 |
161 |
6.43 |
|
총계 |
1,010 |
1,063 |
1,117 |
1,174 |
1,232 |
1,292 |
5.10 |
아미노산 시장의 대표적인 품목인 라이신은 주로 양돈 사료로 사용된다. 따라서 지난 10년간 구제역으로 인하여 시장이 침체된 경험도 있으나 유럽에서의 동물성 사료 사용금지에 힘입어 시장이 회복되었다. 더욱이 중국, 동유럽, 중남미 등 개도국에서의 높은 수요증가로 시장이 크게 개선되고 있다.
[표 4-4-6] 국가별 발효 아미노산 시장 현황 및 전망1)
(단위 : 백만불)
|
지역/ 국가 |
2010년 |
2011년 |
2012년 |
2013년 |
2014년 |
2015년 |
평균 성장율(%) |
|
미국 |
342 |
353 |
362 |
371 |
379 |
385 |
2.94 |
|
카나다 |
43 |
45 |
47 |
49 |
51 |
52 |
5.22 |
|
일본 |
43 |
44 |
46 |
48 |
49 |
51 |
4.05 |
|
유럽 |
528 |
547 |
566 |
584 |
602 |
619 |
3.70 |
|
아태 |
475 |
505 |
537 |
572 |
611 |
653 |
6.37 |
|
중동 |
83 |
89 |
97 |
105 |
114 |
125 |
8.07 |
|
중남미 |
140 |
147 |
156 |
165 |
175 |
186 |
5.64 |
|
총계 |
1,653 |
1,730 |
1,811 |
1,894 |
1,981 |
2,073 |
4.78 |
다. 국내 현황
국내에서는 기존의 석유화학회사(SK, GS칼텍스, LG화학 등)와 발효전문회사 (CJ제일제당, 대상 등)를 중심으로 발효를 통한 바이오화학 제품 연구개발을 진행중이다. 국내의 바이오화학 산업 규모는 2010년 6,304억 원으로 바이오의약(24,196억원)이나 바이오식품(23,692억원) 산업에 비하여 상대적으로 낮은 편이나, 전년도 대비 50.9%로 증가율이 크게 늘어나는 등 이에 대한 시장이 비약적으로 성장하고 있다. 비록 많은 전문가들은 원유 가격이 배럴당 80불이상이 되면 바이오화학 제품들이 석유화학 제품들에 비해 가격 경쟁력이 우위를 보일 것으로 전망하고 있지만, 궁극적으로 바이오화학 제품의 가격 경쟁력은 원유가격 등 외부 환경요인이 아닌 생산 기술 경쟁력에 의하여 결정될 것으로 전망된다.
라. 발전 전망
생물공정 기술에 의한 원료 및 제품 생산은 고부가 의약품을 제외하고는 핵심기술이 개발된 이후부터는 원료가격에 경제성이 크게 좌우 된다. 즉, 무엇보다도 저렴하고 풍부한 탄소원의 확보가 관건이다. 특히 최근 바이오 에탄올의 생산 증가에 기인한 곡류 및 설탕 가격의 급등으로 발효산업의 경쟁력이 저하되고 있는 추세이다. 따라서 이를 극복하기 위한 대안으로 섬유질계 바이오매스 원료를 사용한 발효성 당 생산 기술개발이 당면과제가 되고 있다. 따라서 앞으로의 과제는 저가의 발효가능당 생산기술과 동시에 발효산물의 바이오화학소재로의 전환기술 개발이 핵심이 될 것이다. 이를 위해서는 바이오화학소재를 발효를 통하여 생산할 수 있는 미생물개발 기술과 더불어 생산된 소재를 효율적으로 분리할 수 있는 분리기술의 개발이 시급하다.
2. 환경생명공학
가. 개요
(1) 환경생명공학기술의 개요
환경생명공학(Environmental Biotechnology)이란 생명공학기술(Biotechnology, BT)을 환경공학(Environmental Technology, ET)분야에 이용하여 환경오염을 방지하고 환경을 효율적으로 보전하고 관리하는데 활용되는 모든 기술 또는 학문을 의미한다. 이 분야는 21세기 첨단기술로 주목되는 것 중 하나로써 분자생물학, 환경과학, 생태학 등의 분야와 융화하여 빠르게 발전되고 있다.
환경생명공학기술은 기술표준원의 기술 분류에 따라 청정기술, 환경오염제어 및 관리기술, 바이오에너지 기술 및 기타 환경생명공학 기술로 나누어져 있다. 이러한 기술들은 전 세계적으로 환경 분야의 핵심기술로 연구개발을 통해 실용화를 추진하고 있다.
본 장에서는 환경생명공학기술 중 환경오염제어 및 관리기술에 해당하는 생물정화(Bioremediation)를 중심으로 관련 내용을 조사하여 정리하였다.
(2) 환경생명공학 기술개발의 필요성
환경문제는 21세기 인류생존을 위협하는 최대 현안문제 중 하나로써 기존의 환경문제를 해결하기 위해 물리적, 물리·화학적, 생물학적 방법을 이용하였으나 여기에 첨단기술로 주목받고 있는 생명공학기술까지 도입되어 환경문제를 해결하기 위해서 전 세계적인 노력을 기울이고 있다. 생물정화기술은 미생물이나 식물에 의한 난분해성 물질 및 환경오염물질의 분해 촉진 및 생물전환 (Biotransformation) 등을 통해 오염물질의 농도가 근본적으로 감소되고, 2차 오염을 방지할 수 있으며, 장기적면에서 고려할 때 물리적, 화학적 또는 물리·화학적 방법보다 환경관리 비용이 적게 든다는 경제적인 장점을 가지고 있다.
정화 분야 기술개발 동향 미생물을 이용한 생물정화 ▪중금속 저항성, 금속 분해능을 도입한 생물정화용 형질전환 미생물 개발 ▪PCB 분해용 신규미생물 분리 ▪생체물질 진단도구 및 방법 개발 ▪독성물질 검출도구 및 수질 모니터링 시스템 개발 ▪생분해성․환경친화적 필름 및 용도 ▪미생물 분해성 폴리머 조성에 대한 연구 ▪유기물질 고속 분해 방법 식물을 이용한 생물정화 ▪수경식물 재배방법 및 재배구조 ▪식물생장 촉진 인자 탐색 연구 ▪Phytoremediation을 적용한 사례로는 1986년 우크라이나 체르노빌에서 일어난 방사능 유출지역을 해바라기를 정화에 이용 ▪포플러 나무와 인디언 겨자의 특성을 이용하여 미국의 무기 시험장 및 군사지역의 오염물질 정화에 적용 ▪400종 이상의 중금속 과축적 식물이 발견되었으며, 많은 연구기관과 회사에서 보다 향상된 과축적 식물을 찾기 위해 연구 진행 ▪과축적 식물들의 기능향상을 위한 형질전환 식물체를 이용한 환경정화 기술개발이 활발히 진행
지속적으로 모색하여야 할 것이다. 첫째, 환경정화의 공익성을 고려하여 효과적인 생물정화를 위한 기초연구부터 산업적 활용까지 총괄적인 전략과 국가차원의 지원이 필요할 것이다. 둘째, 생물정화의 기초연구분야의 국내 기술수준은 높은 수준인 것으로 평가되고 있기 때문에 지속적인 투자와 교육을 통한 관련 기술의 축적과 인재양성 프로그램의 개발이 병행되어져야 한다. 셋째, 생물정화를 통한 환경복원 기술은 오염지역의 자연환경 특성에 따라 그 세부방업이 달라지기 때문에 국내에서 개발된 기술이 국내 자연환경에 도입하여 성공할 확률이 높을 것이며, 국내 오염지역뿐만 아니라 환경이 유사한 해외의 오염지역에도 적용이 가능할 것이다. 넷째, 탄소배출권 규제와 같은 국제적인 환경보전에 대한 책임이 국가와 기업들에게 부가되어질 것이므로 이와 관련한 대비와 투자가 필요할 것이다. 다섯째, 환경정화를 위한 최종 산물인 LMO의 위해성 평가 기술 확보 및 안전관리 방안 마련을 위한 노력과 투자도 늘려야 할 것이다.
3. 해양생명공학
가. 개요
해양생명공학은 생명공학의 원료나 대상으로 해양생물 및 유전자원을 이용하는 분야이며 전통적인 수산 양식분야에서도 첨단 해양생명공학 기법이 활용된 분자 육종, 분자 진단, 백신 등으로 적용범위가 확대되고 있다. 최근까지 탐사 장비와 연구 방법론 등의 미비로 해양생물자원에 대한 접근 및 이해가 부족하여 다른 생명공학 분야에 비해 발전 속도가 늦었다. 그러나 해양생물자원이 식량, 에너지, 환경, 인류 보건의 문제를 해결할 수 있는 중요한 자원으로 부각되고 해양탐사기술과 차세대 염기서열 분석기술(Next Generation Sequencing, NGS)의 발전, 그리고 해양생물 센서스(Census of Marine Life, COML)18)같은 국제 대형 프로젝트의 결과로 해양생물의 다양성에 대한 이해의 폭이 넓혀지고 이를 근거로 아직 91% 생물종에 대해서는 알려지지 않은 것으로 예측되면서19) 해양생명공학분야의 높은 발전 가능성을 기대하게 한다.
나. 기술 동향
(1) 양식 분야 해양생명공학
21세기 중반에 인류의 동물단백질 예상 소비량은 현재의 2배정도로 예상되며 주요 공급원으로 양식과 양계가 가장 큰 성장을 할 것으로 추정 된다20). 현재는 양식이 전체 어획량(
(2) 의료 분야 해양생명공학
1960년대 이후 2008년까지 20,000개 이상의 새로운 해양천연물을 발견하였고23) 이 중 일부는 소염제, 진통제, 항암제, 기타 신약, 상처치료, 조직 재생용으로 이용 가능하다. 2012년 기준으로 세계적으로 해양 천연 화학물이 8,940 종, 전임상 공급단계 1,458종, 임상 단계 11종, 미국 FDA 승인 의약품이 7종이다24). 현재 승인받았거나 임상단계에 있는 물질이 대부분 항암제이다(표 4-4-8). 이러한 해양생물 유래 신약개발에 가장 큰 문제는 기초 해양 약학과 유전자 기능 연구를 위한 재정 지원 부족이다.
[표 4-4-8] 해양 천연물 신약 개발 현황25)
|
개발 단계 |
화합물 이름 |
추출대상 |
대상 질병 |
|
FDA 승인 |
Cytarabine(Ara-C) |
Sponge |
Cancer |
|
FDA 승인 |
Vidarabine(Ara-A) |
Sponge |
Antiviral |
|
FDA 승인 |
Ziconotide |
Cone snail |
Pain |
|
FDA 승인 |
Erbulin Mesylate |
Sponge |
Cancer |
|
FDA 승인 |
Omega-3-acid ethyl esters |
Fish |
Hypertriglyceridemia |
|
FDA 승인 |
Trabectedin(ET-743) |
Tunicate |
Cancer |
|
FDA 승인 |
Brentuximab vedotin |
Mollusk |
Cancer |
|
임상 3상 |
Plinabulin(Aplidine) |
Tunicate |
Cancer |
|
임상 2상 |
DMXBA(GTS-21) |
Worm |
Cognition, Schizophrenia |
|
임상 2상 |
Plinabulin(NPI 2358) |
Fungus |
Cancer |
|
임상 2상 |
Elisidepsin |
Mollusk |
Cancer |
|
임상 2상 |
Zalypsis(PM00104) |
Nudibranch |
Cancer |
|
임상 2상 |
Glembatumumab vedotin |
Mollusk |
Cancer |
|
임상 1상 |
Marizomib |
Bacterium |
Cancer |
|
임상 1상 |
Trabectedin analog |
Tunicate |
Cancer |
|
임상 1상 |
SGN-75 |
Mollusk |
Cancer |
|
임상 1상 |
ASG-5ME |
Mollusk |
Cancer |
|
임상 1상 |
Hemiasterlin derivative |
Sponge |
Cancer |
|
임상 1상 |
Bryostatin 1 |
Bryozoan |
Cancer, Alzheimer’s |
|
임상 1상 |
Pseuclopterosins |
Soft coral |
Wound healing |
(3) 해양바이오에너지 분야 해양생명공학
2008년 OECD는 2세대 바이오연료가 온실가스(Greenhouse gas) 감소, 에너지의 안정적 공급, 세계 곡물가 안정에 영향을 주지 못한다고 평가하고 친환경적이며 경제성 있는 새로운 형태의 바이오에너지를 제안하였다26). 3세대 바이오연료로 분류되는 해조류 바이오연료는 이 같은 요구에 보다 부합하며 해양생명공학의 적용으로 바이오연료에 적합한 조류의 제조, 생산이 가능해 지면서 상용화 가능성을 높이고 있다. 바이오아키텍처 레브러토리(Bio Architecture Laboratories)사는 합성생물학 기법을 이용하여 갈조류를 바이오연료의 원료로 사용이 용이하도록 변형하는데 성공하였다27). 현재 미세조류 기반 디젤의 가격은 1리터당 2.8∼5.3달러 수준이며28) 2020년경에 석유 디젤 대비 가격 경쟁력을 가질 것으로 예상한다.
다. 해외 동향
신약관련 해양생명공학 기업은 아직 규모와 기술력에 있어서 미흡한 면이 있지만 본격적으로 항암제를 비롯한 신약개발 단계에 이르는 등 다른 생명공학 수준에 근접하고 있다. 해양생물자원 특히 미세 조류를 이용한 해양바이오에너지생산 회사는 다우(Dow) / 알게놀(Algenol), 셰브론(Chevron) / 솔라자임(Solazyme) 등 글로벌 기업이 기술 기업과 협력해서 사업을 추진하는 경우가 많다. 아직은 매출을 실현하는 단계는 아니지만 항공유 등에 시험 사용되고 있다. 해외 해양생명공학 기업 현황은 아래 표와 같다.
[표 4-4-9] 해외 해양생명공학 기업
|
국 가 |
회 사 명 |
사 업 내 용 |
|
카나다 |
Ocean Nutrition Canada: |
omega-3 EPA/DHA 생산업체 |
|
Acadian Seaplants Limited |
건강기능식품업체 |
|
|
노르웨이 |
Aker BioMarine ASA |
해양 생물 성분 생산. Omega3가 대표상품 |
|
Genomar ASA |
종어(種魚) 생산 및 수산물의 유전적 검증 |
|
|
Napro Pharma AS |
고순도의 어류 지방(Omega3) 생산 및 판매 |
|
|
Probio Nutraceuticals ASA |
Omega3 지방산 및 항산화제 생산 및 판매 |
|
|
미국 |
Nereus Pharma |
해양미생물 추축물에서 신약개발 |
|
Albany Molecular Research |
해양생물 추축물에서 신약개발 |
|
|
Estee Lauder |
해양생물 화장품 소재 생산 |
|
|
Bio Architecture Lab: |
macrocystis에서 알코올 생산 |
|
|
Solazyme |
해양 조류에서 바이오연료 생산 |
|
|
Earthrise Nutritionals |
스피루리나 생산업체 |
|
|
CP Kelco ApS |
hydrocolloid 생산업체 |
|
|
Cyanotech Corporation |
미세 조류 생산 업체 |
|
|
FMC Corporation |
해양 바이오폴리머 생산업체 |
|
|
International Specialty Products Inc |
다양한 특수 화학물 생산 |
|
|
MariCal |
양식관련 혁신적 생명과학회사 |
|
|
Martek Biosciences Corporation |
미세조류, 균류에서 다양한 영양물질 생산 |
|
|
Mera Pharmaceuticals Inc |
광생물반응기를 이용한 미세조류의 배양 및 천연축출물의 산업화 |
|
|
New England Biolabs Inc |
생명과학의 시약 제조업체. 해양 기원 효소 제조 생산 |
|
|
Prolume Ltd |
연구 및 신약 개발에 목적으로 심해의 bioluminiscent 생명체의 유전자를 발굴하는 업체 |
|
|
Sea Run Holdings Inc |
어류 혈장을 진단 및 실험 시료 생산 |
|
|
Tequesta Marine Biosciences |
해양 미세조류에서 추출한 천연물 생산 업체 |
|
|
Algenol Biofuels |
미세조류에서 에탄올 생산. 상용화 근접 |
|
|
Sapphire Energy |
조류에서 항공유, 디젤 등을 생산. 상용화 근접 |
|
|
영국 |
GlycoMar Ltd |
해양생물 기원 소염제재 생산 |
|
Integrin Advanced Biosystems Ltd |
해양 수산물 안정성 관련 회사 |
|
|
PML Application Ltd |
바이오센서를 이용하여 해양 생물에서 신물질을 동정, 분리하는 업체. |
|
|
아이슬란드 |
NorthIce Ltd |
식품가공업체를 위한 수산물 재료 생산 업체 |
|
Primex Ltd |
키토산 및 키토산 유도물질을 생산하는 업체 |
|
|
호주 |
Marinova Pty Ltd |
거대조류의 생리활성물질 생산 |
|
스페인 |
PharmaMar, S.A. Sociedad Unipersonal |
해양 기원 항암제 개발 |
|
스위스 |
Lonza Group Ltd |
의료, 생명과학, 제약 회사 |
|
아일랜드 |
Elan Corporation PLC |
신경질환 계통 제약회사 |
라. 국내 현황
국내 해양생명공학 기업은 대부분 건강기능식품 사업을 중심으로 이미 외국에서 효능이 검증된 키토산, 글루코사민과 같은 해양생물 추출물을 생산 판매하거나 외국에서 원료를 수입·판매하는 기업이 대부분을 차지하고 있다. 그러나 의약, 화학, 신소재 등 고부가가치 산업 분야의 연구개발이 점차 활발히 이루어지고 있다. 최근에는 토종 해양생물 기반으로 하는 기능성 소재 및 신약을 개발하는 회사가 등장하고 있다. 2004년부터 2013년까지 해양수산부에서 지원하는 해양생명공학사업은 우리나라에 전무하던 해양생명공학의 기틀을 마련하는데 일조하였다. 이를 바탕으로 하는 해양바이오에너지생산기술개발 연구사업, 해양초고온 고세균을 이용한 바이오수소 생산기술개발 사업과 미래창조과학부의 차세대바이오매스사업단 등이 해양바이오에너지 기반기술 개발에 지원되고 있다. 그러나 관련 기업의 발전은 미미한 수준이며 국내 관련 업체 목록은 표 4-4-10과 같다.
[표 4-4-10] 국내 해양생명공학 기업
|
회 사 명 |
사 업 내 용 |
비 고 |
|
바이올시스템즈 |
해조류에서 바이오에탄올 제조 |
홍조류에서 바이오에탄올을 생산하는 파일럿플랜트 준공 |
|
에이엠바이오(주) |
해양미세조류 유래 건강기능식품 |
|
|
ANYGEN |
해양생물 유래 신약 개발 |
청자고동 유래 신규 omega –conotoxin으로 진통제 개발 |
|
㈜해림후코이단 |
해조류 추출 건강기능식품 |
|
|
㈜해원바이오테크 |
해양생물소재 전문기업 |
|
|
㈜아데나 |
해양유용물질 유래 소재 개발 |
해양생물 유래 기능성화장품 소재 생산 |
|
(주)미래자원ML |
해양생물 유래 소재 개발 |
해양생물유래 가축사료 개발 |
|
(주)웰바이코리아 |
기능성 화장품 생산 전문기업 |
해양생물 유래 기능성화장품 소재 개발 |
|
(주)엔존비앤에프 |
천연 자원 유래 기능성 식품개발 |
해양 생물 유래 기능성 식품 생산 |
|
(주)마린바이오프로세스 |
해양생물소재 발효전문기업 |
해조류를 발효하여 GABA 생산 |
|
(주)키토라이프 |
키토산을 기본으로 건강기능식품 중심 기업 |
|
|
라이브켐 |
갈조류 추출물을 이용한 건강기능식품 및 화장품 생산 판매 |
자생 해조류인 감태에서 추출한 원료의 효능을 기반으로 산업화 |
|
건풍바이오 |
키토산 및 키토산 유도물질을 생산 판매 |
식품, 사료, 농업용 생산 판매 |
|
(주)서울프로폴리스 |
양어장 전용 사료 첨가제 생산 판매 |
|
|
(주)보령제약 |
건강기능식품인 정어리 펩타이드 판매 |
건강기능식품으로 개별인정 1호 선정된 품목 |
|
(주)아라바이오 |
해양생물 추출물을 원료를 생산 판매 하는 건강기능식품회사 |
키토산, 키토산 유도물질 중심 |
|
(주)아미코젠 |
해양생물 추출물을 원료로 생산 판매 하는 건강기능식품회사 |
키토산, 글루코사민 |
마. 발전 전망
오믹스 과학(Omics Science)의 발전과 해양생물공학으로의 도입이 해양 생물자원을 다양하게 이용할 수 있는 방법을 제공하고 있다. 따라서 어패류, 미세조류, 거대조류 등의 해양바이오매스를 적절한 기술과 공정을 통해 식량 생산, 에너지 개발, 기능성식품을 비롯한 신소재로 동시에 생산하는 방식(One Source Multi Use)으로 경제성을 높이고 환경문제를 최소화할 수 있을 것이다29). 또한 2012년 OECD는 해양 생명공학에 대한 워크숍에서 해양생명자원의 유용성과 다양성을 감소시키는 온실가스 배출(Greenhouse gas emissions, GHG), 해수 산성화 및 오염 등과 같은 지구환경 변화는 궁극적으로 해양 생명공학의 발전을 저해할 요인으로 해양생명공학의 지속 가능성(sustainability)을 유지하기 위해서는 이 같은 문제도 함께 고려하여 발전 전략을 수립하여야 한다고 밝혔다.

BT+ICT
1. BT+ICT 연구의 개요
가. 개요
(1) 배경
차세대 기술혁명은 NT, BT, IT 등 신기술간 또는 이들과 타 분야와의 상승적 결합을 통한 ʻʻ융합기술ʼʼ이 주도할 것으로 예측하고 있다. 이에 2009년 마련된 ʻʻ국가융합기술 발전 기본계획ʼʼ은 국가차원에서 융합기술을 종합적·체계적으로 육성하기 위해 중장기 추진전략 및 실천과제 등을 반영한 5개년 간의 범부처 계획을 담고 있다. 주요 선진국 역시 융합에 대한 큰 방향을 제시하고 있는데 미국 국가정보위원회(National Intelligence Council, NIC)가 2012년 12월에 발간한 글로벌 트렌드 2030(ʻʻNIC Global Trends 2030ʼʼ)에 의하면 4가지 메가드렌드 및 6가지 주요 변화요인을 근거로 4가지 시나리오를 제시했는데 그중에 최상의 시나리오로 경제, 사회, 기술 그리고 정치가 포괄적으로 발전하며 새로운 균형을 이루는 융합(Fusion)을 제시하고 있다. BT분야 융합의 기폭제 역할은 여러 가지 요인이 있지만 크게 2가지로 나누어 볼 수 있다. 첫째는 정보생산기술, 단적으로 염기서열을 읽어내는 기술이다(출처: The Next-Generation Sequencing Revolution and Its Impact on Genomics, Cell, 2013). 인간게놈프로젝트가 13년간 약 30억 달러를 투자해서 얻은 결과를 현재는 5천 달러 비용으로 일주일이면 결과를 볼 수 있다.

[그림 4-5-1] 생명정보 분야 대량데이터 생산을 이끌어가는 주요 국제 연구프로젝트
유전체 분석 비용은 2016년 1천 달러 수준으로 떨어질 것으로 예측하고 있어 연구 접근방식이나 데이터 저장, 분석 그리고 서비스 등 전 분야에 커다란 변화가 예상된다(출처: Strategic Analysis of the U.S. Next-Generation Sequencing Services Market, Frost & Sullivan, 2011). 두 번째는 신기술을 활용한 데이터 양의 급격한 증가다. 이는 비용의 감소와 요구의 증가가 맞물린 결과라고 할 수 있는데 생명과학분야의 빅데이터라고 표현할 수 있다. 실제 BT-ICT 융합분야에서 데이터의 구축, 관리 그리고 활용적인 측면에서 다루는 내용이나 연구분야, 특히 IT-infrastructure 그리고 방법론은 매우 유사하다고 할 수 있다.
(2) 정의
2008년 국가과학기술위원회를 중심으로 융합기술개발 기본계획에 따르면 BT기반 융합기술을 ʻʻ생명공학(BT)과 타 첨단 기술의 융합을 통해 새로운 제품 및 서비스를 창출하거나 기존 제품의 성능을 향상ʼʼ 시키는 것으로 정의하고 있으며, 예시로 바이오인포메틱스, 약물전달시스템, 생체정보인터페이스, 바이오정보보호 등을 제시하고 있다. 그리고 IT-BT 융합기술의 범위 및 분류체계에 따르면 바이오인포매틱스, 바이오감지소자, 생체인터페이스, 생체정보보호 그리고 바이오컴퓨터로 구분하고 있다(IT-BT-NT 기술 융합에 따른 산업육성전략, 전자통신 동향분석 제21권 제2호 2006년 4월). 세부적으로 바이오인포매틱스는 바이오데이터분석, 대용량 바이오데이터의 검색 및 관리, 질병과 약물반응의 유전적 요인 추출 및 검색, 세포내 유전자, 단백질 및 각종 화합물의 시공간적 움직임을 컴퓨터로 모델링하고 시뮬레이션 하는 S/W기술로 정의하고 있다(출처: BINT 융합기술 개발 현황과 과제, 2009, 충북개발연구원). 본 내용에는 협의적으로 바이오인포매틱스로 한정하고 분야를 데이터 분석과 소프트웨어(Data Analysis and Software), 툴과 데이터베이스 서비스(Tools and Database Services) 그리고 정보통신 인프라(IT-infrastructure)로 구분하여 작성하고자 한다.
나. 해외 동향
(1) 연구분야별
각 분야별로 동향을 기술하기에는 공간적인 한계가 있어 연구활동이나 연구방향성을 추정할 수 있는 시장변화와 규모를 통해 간략하게 설명하고자 한다. 전문보고서에 따르면 2012년을 기준으로 데이터분석 및 소프트웨어(Data Analysis and Software) 시장은 전체 35.1%, 툴 및 데이터베이스 서비스(Tools and Database Services) 시장은 47.9% 그리고 정보과학 인프라(IT-infrastructure) 시장은 17%로 나타났는데 이러한 추세는 당분간 계속될 것으로 예측하고 있다(출처: Global Bioinformatics Market Forecast to 2017).
[표 4-5-1] 전 세계 생명정보 시장
(단위 : Million US$)
|
구분 |
2011년 |
2012년 |
2013년 |
2014년 |
2015년 |
2016년 |
2017년 |
|
Data Analysis and Software |
990 |
1,120 |
1,280 |
1,490 |
1,780 |
2,160 |
2,610 |
|
Tools and Database Services |
1,310 |
1,520 |
1,770 |
2,080 |
2,450 |
2,900 |
3,460 |
|
IT-infrastructure |
478 |
544 |
628 |
735 |
869 |
1,024 |
1,209 |
|
전체 |
2,820 |
3,190 |
3,690 |
4,330 |
5,100 |
6,080 |
7,280 |
출처 : Global Bioinformatics Market Forecast to 2017
(가) Data Analysis and Software
데이터 분석이나 소프트웨어 분야는 현재 생명정보 시장을 이끌어가고 있는데 상업적인 영역이외에 오픈소스 시장도 활발하게 개발되고 있다(출처: Computational solutions for omics data, Nature Reviews Genetics 14, 333–346 (2013)). 크게 3가지 분야로 나누어 볼 수 있는데, CHAMM, TINKER, Amber, Moscito와 같은 분자 다이나믹스 소프트웨어(Molecular Dynamics Software), RasMol, Avogadro, SimBioSys 등과 같은 분자모델링 소프트웨어 (Molecular Modelling software) 그리고 Tarverna workbench, EMBOSS, BioJava, Bioconductor 등과 같은 오픈소스 소프트웨어(Open Source Bioinformatics Software) 등이다. 새로운 대부분의 오픈 소스는 Nucleic Acids Research 저널에서 제공하는 Database Issue나 Web Server Issue 그리고 Bioinformatics 저널의 application note를 통해 확인할 수 있으며, 주요 저널에 소개되는 전체 웹 리소스는 Informatics Tools in PubMed(http://into.kobic.re.kr/)에서 확인할 수 있다.
(나) Tools and Database Services
유전체, 단백체, 대사체, 구조체 그리고 진화체등 다양한 연구 분야의 실험, 문헌, 기술, 그리고 분석 등을 통해 확보한 정보를 담고 있는 데이터베이스의 양이나 수가 최근 단기간 가장 급속한 증가세를 보여주고 있다. 또한 빅데이터로 표현되는 대용량 데이터나 비정형 데이터를 저장처리하기 위한 NoSQL, 분산 처리 기술인 맵리듀스(MapReduce)와 하둡(Hadoop) 등이 각광받고 있다. NoSQL 기술은 아파치 Cassandra와 CouchDB, 구글의 BigTable, 아마존 다이나모(Dynamo) DB, IBM Lotus Domino 등이 있다. 뿐만 아니라 데이터 마이닝 기법이나 자연어 처리 그리고 데이터 시각화 기술 등 다양한 기술들이 새롭게 선보이고 있다. 향후 전문분야별로 특화된 DB 구축과 워크폴로우 기반의 통합서비스가 더욱 더 시장에서 중심적인 역할을 할 것으로 예측된다.
(다) IT-infrastructure
IT-infrastructure 시장의 특징은 시장을 리더하기 보다는 다른 분야와 같이 조화를 이루며 성장하는 특징을 가지고 있는데 주로 IBM, SGI 그리고 SUN Microsystems와 같은 기업들이 첨단 연구에 필수적인 인프라 개발에 열을 올리고 있다. 또한 생명정보 어플리케이션에 적합한 하드웨어 개발 시장이 주목받고 있는데, 생명정보 산업에 접근 가능한 네트워크, 서버 그리고 데이터 저장 장비 분야에 Compaq 그리고 IBM이 주도적으로 투자를 하고 있다. 그리고 가장 주목해야할 것이 IT-infrastructure가 Computer cluster model에서 Cloud computing platform으로 이동하고 있다는 것이다. 이것은 주요 몇몇 크라우드 서비스 제공기업에 의해 독점될 수 있다는 것과 크라우드를 통해 하드웨어, 소프트웨어 그리고 서비스의 통합이 가속화를 될 가능성이 커져 간다는 것이다. 생명정보 분야에서 크라우드 기반의 정보서비스는 Public dataset이나 Biological databases를 다루는 데이터베이스(Data as a Service, DaaS), 생명정보 툴이나 파이프라인을 다루는 소프트웨어(Software as a Service, SaaS), 분석이나 프로그래밍 환경을 제공하는 플랫폼(Platform as a Service, PaaS), 그리고 가상화 장비나 리소스를 다루는 인프라(Infrastructure as a Service, IaaS)로 구분할 수 있다(출처: Dai et al. Biology Direct 2012 7:43). 2012년 기준으로 하드웨어 시장이 전체 60%, 소프트웨어 시장이 22% 그리고 서비스 분야 시장이 18%를 차지한 것으로 나타났는데 장기적으로 소프트웨어와 서비스시장의 성장이 하드웨어 시장보다 빠른 성장이 있을 것으로 예측하고 있다.
(2) 활용 분야별

출처 : Source: Annual Reports, SEC Filings, Press Releases, Investor Presentations, Oxford Journals, Expert Interviews, MnM Analysis
[그림 4-5-2] 활용 분야별 생명정보학 시장 규모 2012~2017년
(가) 지노믹스, Genomics
앞장에서 상세한 내용을 다루고 있어 간략하게 논하면 다음과 같다. 유전체분야는 크게 단편서열의 변화(Short variations SNVs 그리고 Indel), 구조변화(Structural variations 혹은 rearrangements, CNVs, large indels), 표현형과 관련된 돌연변이(Variations associated with phenotypes), GWAS 및 관계연구, 암유전자 및 변이체, 그리고 크라우드소싱 유전자 및 변이체 등이 있다. 현재 유전체 연구분야는 생명과학연구와 신약개발, 그리고 상업적인 활용(Commercial applications)이 시장을 견인하고 있지만 향후 임상진단이나 개인유전체 분야가 2010년 전체 시장의 1.2%에서 2015년 16.4%로 성장할 것으로 예측하고 있다. 전체적으로는 연구프로젝트 그리고 임상적용분야가 시장을 이끌어 나갈 것이다. 전문 분석보고서에 따르면 차세대 염기서열 시퀀싱(NGS) 세계 시장규모 전망에서 2013년 13억 4천만 달러에서 연간 성장률 20% 성장세를 유지해 2017년 29억 7천만 달러에 달할 것으로 전망하고 있다(출처: Introduction to the European Next Generation Sequencing Market, Frost & Sullivan, 2011).
(나) 프로테오믹스, Proteomics
유전체학의 발전이 선행되어야 한다는 한계가 있고, 비싼 장비와 분석 도구로 인해 타 분야에 비해 상대적으로 연구 투자나 성과가 부족한 측면이 있지만 궁극적으로 기능해석이라는 목표를 달성하기 위해서는 가장 중요한 연구 분야다. 핵심기술은 mass-spectrometry(MS)와 단백질 칩(biochip) 분야로 질병관련 새로운 마커 발굴에 주로 활용되고 있었으나 최근 칩의 소형화나 장비 통합기술의 발전뿐만 아니라 MS 분석 워크플로우나 장비의 개선을 통해 신약발굴이나 개발 그리고 진단 분야에도 폭넓게 활용되고 있다(출처: Proteomics and the analysis of proteomic data: 2013 overview of current protein-profiling technologies., Curr Protoc Bioinformatics. 2013). 전 세계 프로테오믹스 시장은 2013년 48.2억 달러, 2015년 64.6억 달러 그리고 2017년 89.8억 달러로 예측하고 있다(출처: Global Bioinformatics Market Forecast to 2017).
(다) Pharmacogenomics
Pharmacogenomics는 개인의 유전적 차이가 어떻게 약물에 대한 반응의 차이를 나타내는 지를 연구하는 분야로 약리학(pharmacology)과 유전체학 (genomics)합성어다. 주요 연구분야는 SNP를 찾는 기술과 유전자형을 분석하는 제노타이핑기술 그리고 이들에 대한 진단기술로 구분할 수 있다. 진단시장은 2009년에만 37억 달러 정도의 시장을 형성하였고, 향후 약제 안정성과 효율성을 중심으로 전체 시장을 이끌어 갈 것으로 예측하고 있다. 현재 알려진 주요 데이터베이스는 DrugBank, CYP-allele database, NAT-allele database, PMT, TP-search database, PharmaADME 그리고 PharmGKB등이 알려져 있다. 특히 PharmGKB는 스탠포드 대학에서 수작업을 통한 큐레이션과 자동화 텍스트마이닝 기법을 사용해 사람의 주요 300여 질환과 375개 약제를 대상으로 1,500여개 유전자변이와의 관계를 정의한 데이터베이스를 구축한 바 있다.
(3) 지역별
미국은 아시아 시장보다 성장률은 낮지만 지속적으로 전 세계에서 가장 큰 시장을 형성할 것으로 예산되며, 이를 뒷받침하는 전문인력 수 역시 지속적으로 압도적 우위를 점할 것으로 예상된다. 전체적으로 보면 2012년을 기준으로 북아메리카 시장이 전체 53%(2017년 58% 예측), 유럽이 28%(2017년 22% 예측) 그리고 아사아-태평양이 19%(2017년 20% 예측)로 나타났다(출처: Global Bioinformatics Market Forecast to 2017).
다. 국내 현황
국내 동향은 주요 이슈별로 나누어 기술하면 다음과 같다. 우리나라는 지정학적으로 전체 시장의 31%를 차지하는 주요국가에 인접해 있어 직접 혹은 진출 교두보로 장점을 가지고 있고 2013년부터 2017년까지 연평균 성장률이 16% 수준으로 성장할 것으로 전망하고 있다. 특히 정부의 강력한 의지와 지원으로 유전체 그리고 포스트 유전체 연구 활동이 활발해져 시장이 급격하게 성장할 것으로 예측하고 있다. 전체 시장(Bioassay Market 포함) 규모는 2013년 2억7천만 달러, 2015년 3억6천만 달러 그리고 2017년에 4억9천만 달러로 성장할 것으로 예측하고 있다(출처: Global Bioinformatics Market Forecast to 2017, RNCOS Industry Research Solutions).
(1) 다부처유전체사업
유전체 관련 기술의 비약적 발전, 유전체 정보를 활용한 맞춤의료에 대한 수요, 유전체 정보의 산업화 지원, 유전정보 분석 관련 인프라 수요, 유전체 분석 시장의 확대 등의 필요성이 배경이 되어 보건복지부에서 추진한 유전체 사업이 국가과학기술위원회의 권고에 따라 미래부, 농식품부, 해수부 그리고 산업부가 참여하는 다부처 사업으로 2014년부터 본격 추진된다. 부처별로 구성된 13개 세부사업과 부처 공동으로 진행되는 5개 공동연구사업(질병 기전규명 유전체 연구, Host-microbe interaction, 인간게놈 표준지도 작성, 국제협력 공동연구 사업, 유전체 전문인력 양성사업)으로 구성되어 있으며 총사업비는 2020년까지 정부에서 9,492억 원이 지원된다(출처: 포스터게놈 신산업육성을 위한 다부처 유전체사업 예비타당성조사 보고서., 2012년 12월, 한국과학기술기획평가원).
한편 암유전체 연구는 현재까지 많은 암관련 유전체 변이가 밝혀져 있는데 대표적인 유전체 변이는 참고 문헌(Lessons from the cancer genome. Cell, 2013 Mar 28;153.17-37.)을 참조하면 된다. 우리나라도 참여(혈액암과 유방암)하고 있는 국제컨소시움, International Cancer Genome Consortium (ICGC)을 통해 주요 50여 타입의 암 유전체 연구가 진행 중에 있다. 최근에는 대량데이터 생산 덕분에 암유전체 및 후성유전체 연구는 특정 유전자 내의 유전체 변이의 유무를 분석하는 것 보다 전체 유전체 변이의 특징적인 패턴(signature)을 분석하고 발굴하는 것에 집중하고 있고(Signatures of mutational processes in human cancer. Nature. doi:10.1038/nature 12477) 또한 암 환자로부터 직접 분리한 암세포를 쥐에 이식한 환자 유래의 실험동물 (Patient-derived Xenograft, PDX)을 활용함으로써 개인 편차에 따른 에러를 줄여 정확한 진단과 치료가 가능할 것으로 기대된다(출처 : 개인맞춤형 암유전체 연구동향 및 전망., KEIT PD Issue Report 2013).
(2) 유전자분석서비스
국내 주요 유전체 혹은 유전자 분석 서비스를 제공하는 곳은 다음과 같다. SK케미칼은 약 4만 건의 한국인 데이터베이스를 확보하고 있는 DNA링크와 협약을 맺고 지난해 말부터 유전체분석 서비스(DNAGPS)를 800여개 의료기관에 제공하고 있다. 다음으로 테라젠이텍스-유한양행의 ʻ헬로진ʼ은 한국인 게놈을 분석한 기술을 바탕으로 소량의 혈액을 통해 개인의 유전형을 분석하는 개인 유전체 분석 서비스를 제공하고 있다. 마크로젠은 유전자 정보가 담긴 DNA칩을 이용해 우리 몸 전체 염색체의 1,440여 곳을 스캔해 분석하는 ʻG-스캐닝(게놈 스캐닝)ʼ 서비스를 제공하고 있으며, CLIA 인증 연구실을 갖춘 자회사 MCL(Macrogen Clinical Laboratory, Inc.)를 통해 미국 진출계획을 본격화 하고 있다. 기타 삼성제약은 메디젠휴먼캐어를 통해 유전체분석서비스 상용화를 위한 전국네트워크를 구축하였고, KT는 유전자 분석 서비스인 게놈클라우드 제공 그리고 삼성SDS는 삼성지놈닷컴을 통해 유전자 분석 서비스를 제공 하고 있다. 한편 최근 IT 전문기업 소니가 2020년 게놈해석 사업에서 2,000억엔의 매출을 올린다는 목표로 세계 최대 유전자 분석장비회사인 미국 일루미나(Illumina)와 합작회사를 설립하기로 합의했다고 발표(2013년.8월)했는데 이는 이 분야의 성장 가능성을 간접적으로 확인해 볼 수 있는 뉴스다.
(3) 연구인력
모든 국가들이 융합연구 분야에 공통적으로 어려움을 겪고 있는 것이 분야별 전문인력의 확보라고 할 수 있다. 분야별 전문 인력은 생명정보학분야(검색어 , Bioinformatics)는 514명으로 세계 11위(1위 미국, 16,586명), 유전체학(검색어, Genomics)는 4,991명으로 전체 12위(1위 미국125,011명), 단백체학(검색어, Proteomics)는 1,074명으로 전체 9위(1위 미국 18,160명) 그리고 Pharmacogenomics(검색어, Pharmacogenomics)는 76명으로 전체 11위(1위 미국, 2,034명)로 나타났다. 이는 절대적인 수치가 아니지만 비교적 객관적인 기준에 따라 나온 결과라고 할 수 있다(출처: Maven Semantics TM 2013년 9월 검색결과).
(4) 기술수준
유전체 응용기술 분야 수준은 기술선진국을 빠르게 추격하고 있으며, 유전체 기술 전반에 기술수준은 지속적으로 향상될 것으로 예측하고 있다(2010년 최고 선진국대비 52.5% 기술격차 5.7년). ʻ신규 유전체 자원 탐색 및 확보기술ʼ과 ʻ유전체 기능분석 및 구조해석 기술ʼ은 기술수준의 향상과, ʻ유전체 서열 고속해독 및 분석기술ʼ은 기술격차가 크게 축소되었고, 전반적으로 유전체 응용기술 분야와 유관 기술 분야 모두 기술수준의 향상과 기술격차의 축소 양상을 보이고 있다. 유전체 기술의 연장선상에 있다고 할 수 있는 ʻ단백체·대사체 응용 기술ʼ의 경우도 미흡하지만 기술선진국과의 격차(2010년 기준 최고선진국대비 56.1% 기술격차 6.8년)는 좁혀지고 있다(출처: 포스터게놈 신산업육성을 위한 다부처 유전체사업 예비타당성조사 보고서, 2012년 12월, 한국과학기술기획평가원).
(5) 연구개발 투자 및 성과
융합기술연구개발 전체 예산을 기준으로 2013년 투자계획은 2조 374억원으로 전년대비 4.2% 증가하였고, 정부 전체 연구개발 투자에 대비 비중은 12% 내외로 매년 비슷한 수준으로 나타났다. 전체 2013년 투자 계획은 신산업창출 8,348억원(41%), 원천융합기술 6,183억원(30.3%), 산업고도화, 3,509억원(17.2%), 전문인력양성, 2,081억원(10.2%) 그리고 개방형공동연구, 254억원(1.2%)이다. 정부의 2013년도 융합기술 연구개발 투자 계획은 전년대비 4.2%가 증가하여 전체 국가연구개발 투자대비 12.1% 차지했다. 2012년 주요 성과는 논문이 15,824편, 특허출원 7,360건, 특허등록이 2,684건, 기술 이전을 통해 약 400억원 그리고 석·박사 전문 인력 10,230명을 배출한 것으로 나타났다(출처: 2013년도 국가융합기술 발전 시행계획).
라. 발전 전망
융합분야, 특히 생명과학과 정보통신의 융합분야는 데이터 생산 및 관리, 데이터마이닝 그리고 정보서비스 등 모든 분야가 정부나 기업의 투자 대상으로 관심을 모으고 있다. 즉 거의 모든 분야가 시장평가나 미래 예측에서 당분간 연평균 성장률이 10% 이상의 고속 성장을 유지할 것으로 평가하고 있다. 또한 분야의 속성상 시계열적인 인과 관계를 가지고 있어 거시적으로 약간의 차이가 있겠지만 거의 모든 분야가 동반성장할 것으로 판단하는 것이 합당해 보인다.
2. BT+NT(바이오나노기술)
가. 개요
바이오나노기술은 인간의 질병과 생명현상을 연구하고 그와 관련된 제품을 생산하는 바이오기술과 원자나 분자 단위에서 물성을 규명하고 조작하여 새로운 재료 및 소자를 개발하는 나노기술이 결합된 융합기술이다. 살아있는 모든 생명체 내부에서 발생하는 모든 대사 현상들은 나노 스케일(Nanoscale)의 생물학적 요소들에 의해 일어나는 현상들이기 때문에 나노기술을 이용하여 효율적으로 생물학적 요소들을 다룰 수가 있다. 이런 기술을 바탕으로 최근에는 질병에 직접적인 영향을 주는 DNA와 단백질 등의 생체분자에 대한 연구가 활발하다.
바이오나노기술의 대표적인 기술로는 나노바이오칩/센서기술와 나노생체소재기술이 있다. 나노바이오칩/센서는 매우 작은 소자를 제조하여 그 위에 수많은 생체분자들의 상호작용을 관찰할 수 있다. 또한 고감도를 가지고 있어서 소량의 분자들도 측정할 수 있는 장점이 있다. 그리고, 바이오센서/칩 기술은 반도체, 전자공학, 화하공학, 분자생물학, 유전공학, 재료공학 등 과학 전반에 걸친 기술의 집약체인 미래형 융합기술이며, 각종 질병의 진단과 예측 등의 의료, 신약개발, 식품가공 및 군사 분야까지 적용 및 응용이 광범위하고 무궁무진한 잠재력을 가지고 있다. 나노생체소재는 나노미터 크기를 갖는 구조체로 주로 생체적합성을 가지고 있어 세포나 생물체 안에 주입하여 분자 이미징이나 약물전달 등에 사용된다. 암세포가 있는 부분에 특이적으로 반응하여 빛을 낸다거나 암세포에만 치료약물을 전달하는 개념이 하나의 예라고 할 수 있다. 이처럼 바이오나노기술은 기존에 가능하지 않았던 기술적 한계를 극복할 수 있는 길을 제시해주었다. 이를 이용하여 생체분자의 상호작용 연구나 메디컬분야 등 다양한 분야에 효과적으로 이용될 수 있다.
나. 해외 동향
(1) 나노바이오칩/센서 기술
바이오칩은 대표적인 융합기술로 IT, BT, NT 등 다양한 분야의 학제간 연구를 필요로 한다. 이런 바이오칩은 일반적으로 좁은 영역 위에서 DNA, 단백질 등의 생물 분자들을 결합시켜 유전자 발현 양상, 유전자 결함, 단백질 분포, 반응 양상 등을 분석해낼 수 있는 생물학적 마이크로칩을 말한다. 바이오칩은 분석하고자 하는 생물학적 요소의 종류에 따라 DNA칩, 단백질칩, 세포칩 등으로 다양하게 나뉜다. 바이오칩은 DNA 칩을 시작으로 다양하게 연구되어 왔으나 현재에는 단백질칩을 중심으로 연구되고 있다. 단백질칩은 질병의 진단 및 치료 개발의 직접적인 관련이 있는 단백질 연구를 통해 효소의 활성도 분석, 단백질의 발현 및 기능연구, 신약물질의 초고속 스크리닝, 질병 진단 등에 사용될 수 있는 매우 중요한 기술로 보고되고 있다.
바이오칩 기술을 구현하는데 반드시 필요한 기술이 원하는 샘플을 배열하는 기술인 어레이 기술이다. 최근에 칩기반 기술이 발달하여 기존의 마이크로 어레이(microarray)를 대체하는 기술이 많이 개발되어 왔다. 나노 어레이 기술을 통해 기존의 마이크로어레이의 한계를 넘어 훨씬 많은 생체분자들을 같은 크기의 칩 위에서 동시에 분석할 수 있다. 또한 더 작은 면적에서 반응이 일어나므로 필요한 시료의 양도 획기적으로 줄일 수 있다. 또한 나노 기술을 통해 다양한 모양을 갖는 패턴들을 나노 크기의 면적과 간격을 갖는 나노 어레이를 통해 다양한 광학적 특성을 분석함으로써 바이오칩의 감도를 조절하기도 한다.
바이오칩은 생명공학, 유기화학, 표면화학, 재료공학, 전자공학, 나노기술 등 다양한 분야의 융합이 필요한 분야인데, 바이오칩 표면에 생체분자의 고정화 방법은 생체분자들의 상호작용 효율을 높이는데 매우 중요하기 때문에 지속적으로 연구개발이 진행되고 있다. 바이오칩의 응용기술 개발에도 광범위한 연구가 진행되고 있는데, 바이오칩은 유전체 및 프로테오믹스 등의 기초연구 뿐만 아니라 신약개발, 진단 및 의료기기 개발에도 활용되고 있으며, 특히 의료기기의 소형화를 가능하게 하여 홈케어기기 개발을 선도할 것으로 예상되고 있다. 또한, 세계바이오칩 시장 규모는 2009년 22억 달러에서 연평균 10%로 성장하여 2017년 46억 달러를 형성할 것으로 예측하고 있으며, 국가별로는 2013년 미국이 14억 달러로 전 세계 시장의 절반가량을 차지하고 있고, 유럽은 12억 달러로 미국과 유럽이 전 세계시장의 대부분을 차지하고 있다.
(단위 : 백만달러)
|
국가/지역 |
2009년 |
2010년 |
2011년 |
2012년 |
2013년 |
2014년 |
2015년 |
2016년 |
2017년 |
CAGR |
|
미국 |
1,053 |
1,116 |
1,195 |
1,293 |
1,412 |
1,559 |
1,740 |
1,944 |
2,176 |
9.50% |
|
캐나다 |
70 |
74 |
80 |
86 |
95 |
105 |
117 |
130 |
145 |
9.42% |
|
일본 |
150 |
160 |
172 |
187 |
205 |
227 |
255 |
284 |
315 |
9.70% |
|
유럽 |
854 |
913 |
983 |
1,067 |
1,171 |
1,297 |
1,450 |
1,619 |
1,806 |
9.81% |
|
기타 |
59 |
64 |
70 |
78 |
87 |
98 |
112 |
127 |
143 |
11.68% |
|
합계 |
2,187 |
2,327 |
2,500 |
2,711 |
2,970 |
3,286 |
3,673 |
4,104 |
4,584 |
9.69% |

출처 : Global Industry Analysts, Biochips - A Global Strategic Business Report(2012)
[그림 4-5-3] 국가별/지역별 바이오칩 시장전망
바이오칩과 더불어 발전하고 있는 분야가 나노바이오센서 분야이다. 바이오센서란 특정한 물질에 대한 인식기능을 갖는 생물학적 수용체가 전기 또는 광학적 변환기와 결합되어 생물학적 상호작용 및 인식반응을 전기적 또는 광학적 신호로 변환함으로써 분석하고자 하는 극미량의 생화학 물질을 선택적으로 감지할 수 있는 소자를 말한다. 나노기술을 통해 다양한 나노구조체 제작이 가능해지면서 고감도의 성능을 갖는 나노바이오센서의 개발이 가능해졌다. 그 대표적인 예가 나노와이어, 탄소나노튜브, 캔틸레버, 나노갭 등의 나노구조체를 사용하는 센서이다. 이들을 이용한 생체분자 검출 방법으로는 전기화학적 특성 변화를 측정하거나, 기계적 구조, 광학적 특성(형광, 발색, SPR), 전하(Field Effect Transistor (FET)), 질량(Quartz Crystal Microbalance) 등의 변화를 측정하는 다양한 물리화학적 방법들이 있다.
나노구조체를 이용한 나노바이오센서의 대표적인 예가 반도체 특성을 갖는 실리콘 나노와이어(silicon nanowire)이다. 수 나노미터의 직경을 갖는 나노와이어를 bottom-up 방식으로 합성하여 표면에 붙은 단백질의 표면전하의 변화를 측정하는 방법으로, 전립선암 표지 물질인 PSA(prostate specific antigen)를 90 fg/ml의 농도까지 측정한 바 있다. Bottom-up 방식으로 제작한 나노와이어, 나노튜브 등은 균일한 크기를 갖고 고감도의 특성 등의 장점을 갖고 있다. 하지만 그 크기가 매우 작기 때문에 다루기가 어렵고 이것들을 이용하여 소자화 시키는데 어려움이 있다. 이런 단점을 보완하기 위해 미국의 예일대학교에서 silicon-on-insulator에의 구조를 이용하여 CMOS(complementary metal oxide semiconductor) compatible 실리콘 나노와이어를 개발하였다. 이것은 기존의 반도체 공정과 접목하여 제조할 수 있기 때문에 대량으로 생산할 수 있고, 소자화도 가능하다는 장점이 있다. 또한 기존의 나노와이어와 비슷한 고감도 특성을 나타낸다.

출처 : Nature Nanotechnology, 8, 329 (2013)
[그림 4-5-4] Large-scale 실리콘 나노와이어
최근에는 그래핀의 높은 전도성, 열 안정성, 넓은 표면적 특성을 이용한 그래핀 FET 바이오센서도 연구되고 있다. 그래핀은 전기화학적으로 noise가 상당히 낮은 소재로서, 흡착된 분자들에 의해 변하는 저항을 고감도로 측정할 수가 있다. 화학센서로서 뿐만 아니라 화학적 방법으로 수식화된 그래핀은 대면적, 고감도 전기적 특성, 표면 기능화를 통해 세포 및 생체분자 측정 등 바이오 물질 분석을 위한 FET 기반 바이오센서에도 응용가능하다. Lain-Jong Li그룹에서는 그래핀 필름을 solution-gated transistor로 사용하여 단일염기 다형성 측정을 수행하였다. 이런 트랜지스터를 통해 다양한 농도 수준의 상보적인 혹은 단일 염기 돌연변이 DNA를 측정할 수 있었다. 또한, Junhong Chen 그룹에서는 열 환원 방법으로 제작된 그래핀 시트에 항체가 결합되어 있는 금 나노입자로 혼성화를 이루어 항원을 고감도 측정할 수 있는 FET 바이오센서를 개발하였다.

출처 : Adv Mater 22, 3521 (2010)
[그림 4-5-5] 열 환원 방법으로 제작된 그래핀을 이용한 FET 바이오센서
(2) 나노생체소재 분야
나노생체소재기술은 생물학적 기능을 가진 나노레벨의 소재를 개발하는 기술로써 이러한 나노생체소재를 이용하여 생명현상의 규명, 질병진단과 치료, 그리고 기능성 의료용 소재의 개발이 가능하게 되었다. 나노생체소재는 크게 단백질, DNA/RNA, 지질, 다당류로 구성되어 있는 생체유래의 소재와 고분자, 금속나노입자, 카본나노튜브와 풀러렌 등의 탄소 계열의 나노물질 등 비생체 유래의 소재로 나눌 수 있다. 생체유래 소재 중에는 생물학적 기능 외에도 독특한 구조를 이용해 전기, 전자 분야에도 응용하는 시도가 활발히 진행 중이다. 예를 들어 MIT의 Angela Belcher 박사 연구팀은 바이러스가 증식속도가 빠르고 유전공학적으로 설계가 가능하다는 점에 착안하여 한쪽에는 전도성이 좋은 탄소나노튜브와 결합하고 다른 한쪽은 인산철(
출처 : J. Mater. Chem. 21, 3448 (2011)
[그림 4-5-6] 산화 그래핀 다중 작용기 기반의 anticancer 약물 운반체
최근에는 활발한 나노기술의 발전과 개인맞춤형 의료를 위한 테라그노시스 나노입자 연구가 진행되고 있다. 테라그노시스 나노소재는 하나의 시스템 안에 진단과 치료를 위한 기능이 동시에 포함하기 때문에, 진단, 치료, 치료효과 모니터링을 동시에 가능하게 할 뿐만 아니라, 개별 환자의 암에서 다양한 세포 표현형을 분석한 후, 치료를 함으로써 환자 맞춤형 치료를 가능하게 할 수 있다. 테라그노시스 나노입자는 생체 내에 투입된 약물의 실시간 정보를 제공할 수 있고, 약물의 최적 투여량, 치료효과의 모니터링에 사용될 수 있는 가능성을 가지고 있다. Huh연구팀은 충분한 siRNA를 가지고 생체 내 순환하는 동안 혈청단백질과의 결합을 저해하기 위해 소수성으로 개질된 글라이콜 키토산과 폴리에틸렌이민으로 자가조합 나노입자를 만들었으며 광학영상 관찰을 위해 형광시약을 siRNA에 결합시켜 세포와 동물모델에서 광학영상을 통해 추적하였다. 이들 나노입자는 동물모델에서 암세포 증식이 억제되는 것을 확인하였다. 다기능성의 테라그노시스 나노입자는 환자맞춤형 치료 시대에 중요한 역할을 감당할 수 있고, 이는 암치료방법의 새로운 패러다임으로 자리매김할 수 있을 것이다.

출처 : J Control Release, 144, 134 (2010)
[그림 4-5-7] 테라그노시스 나노입자를 이용한 질병치료
다. 국내 현황
나노바이오칩/센서의 경우, 국내에서도 다양한 나노구조체를 이용하여 고감도 바이오센서를 개발하고 있다. 최근에는 단일칩 상에서 만들어 샘플을 분리하고 측정하는 단계를 한꺼번에 수행할 수 있는 랩온어칩(Lab-On-a-Chip)의 개발이 활발하게 이루어지고 있다.
최근 한국생명공학연구원은 단백질칩을 분석하기 위한 측정시스템으로서 세계에서 가장 작은 mini-SPR 바이오칩 분석시스템을 개발하였다. 이 초소형 바이오칩 분석시스템은 손바닥 만한 크기로 SPR 이미징을 통해 보다 용이하게 질병 진단, 생체간 상호작용을 이용한 신약 개발 연구, 그리고 농수산물의 잔류 농약 검출을 통한 식품안정성 평가 등 폭넓은 분야에서 활용될 것으로 전망된다. 또한, 한국전자통신연구원에서는 8인치 CMOS 공정 기술을 통해 33개의 채널을 갖는 나노선 FET 바이오센서를 개발하였다. 또한, KAIST에서는 일반적인 반도체 트랜지스터 구조에 나노미터 크기의 나노갭을 형성하고 그 사이에 측정 대상물의 생체분자를 고정시킨 후 내부의 유전율 변화에 의해 소스에서부터 드레인으로 전류의 흐름 변화를 측정하여 생체 분자를 검출하는 방식의 CMOS기반 바이오센서를 개발하였다.
나노생체소재 분야에서도 국내 연구진의 활동은 활발한데, 예로 한국과학기술원에서 개발한 전도성이 높은 펩타이드 나노막대와 한국생명공학연구원에서 개발한 탄소계열의 풀러렌과 실리카를 융합한 새로운 형광 나노입자를 들 수 있다. 서울대 재료학과 연구팀은 다공성 자성나노입자를 제조하여 약물전달과 MRI 이미징이 동시에 가능한 다기능성 나노생체소재를 개발하기도 하였다.
라. 나노물질 안정성 연구 동향
최근 나노 기술의 급격한 발전은 산업 및 바이오 의약 등 다양한 분야에 새로운 활용가능성을 제시하고 있다. 나노 물질을 이용한 나노 소비재의 증가와 함께 환경으로의 나노 물질 노출 가능성이 제기되고 있으며, 최근 나노물질의 인체 및 환경 영향이 주요 현안으로 떠오르고 있다. 나노입자의 체내 침착현상은 입자 크기가 작을수록 증가하고, 흡입된 불용성 나노입자의 독성은 크기, 물리화학적 특성과 구조, 노출 및 독성학적 특성 등에 대한 폭넓은 연구와 관련 정보의 확보가 필요하다. 호흡기와 경구 및 피부를 통해 흡수되며, 실험동물을 이용한 나노물질의 독성연구 및 유해성 평가는 전신흡입과 호흡기흡입 등의 방법을 이용한다. 나노입자는 신체조직에 쉽게 흡수되고 표적장기에 축적되며, 세포와 세포내 기관 및 단백질에도 생물학적 영향을 끼치게 되며 나노물질의 크기와 주요 독성기전은 반응성산소종의 생성과 산화적 스트레스로 추정한다. 한 예로, 자성나노물질의 경우 마우스에서 100 mg/kg 이하의 용량으로 4주간 복강투여 한 결과 뇌를 포함한 주요 장기에 장기간 분포하지만 명백한 독성증상은 관찰되지 않았다. 또한, Long연구팀은 실험동물을 이용하여 산화티타늄 나노입자의 실험에서 뇌세포에서 활성산소 생성여부를 조사하였고 이러한 연구 결과를 토대로 나노 입자는 노출 부위인 호흡기나 피부를 통해 혈액으로 유입해 폐장과 간장, 뇌에 축적되어 독성을 유발함을 알 수 있다. 나노물질은 폐장을 중심으로 한 호흡기 장애와 혈관기능장애, 중추신경계 영향, 그리고 노화나 암의 주요원인이 되는 활성산소의 생성으로 해당 표적 장기의 산화적 스트레스와 염증성 반응을 초래하며, 특히 나노입자는 세포 및 혈관 침투 등 체내흡수가 쉬워 독성의 영향을 더욱 가중시킬 수 있다.

[그림 4-5-8] 나노입자 노출에 의한 체내 흡수경로와 영향
마. 발전 전망
나노바이오기술의 눈부신 발전은 기존 기술로 불가능하게 여겨졌던 부분이 가능하고 현재 상용화 되고 있는 기술의 한계를 극복하는데 큰 기여를 하고 있지만 해결해야 할 문제가 여전히 남아있다. 예를 들어 바이오칩/센서 분야에서는 고감도 진단에 사용하는 나노소재나 나노디바이스의 재현성이 중요한 요소를 차지하고 있으며 또한 의료/보건 분야에 폭넓게 활용하기 위한 칩/센서 제작비용의 절감을 위한 새로운 나노소재 혹은 기술 개발도 시급한 실정이다. 다기능성 나노생체소재의 개발과 더불어 최근 대두되고 있는 신소재의 독성과 생물학적, 환경적 영향에 대한 연구도 함께 진행되고 있으며 이는 안전한 나노생체소재의 활용에 중요한 역할을 할 것으로 기대한다.

1. 개요
국제경제협력개발기구(OECD)는 생명공학기술이 정보통신(IT) 등 타 분야 기술들과 융합하여 2030년경에 글로벌 경제에 대규모 변화를 가져오는 ʻ바이오경제시대ʼ로 진입할 것으로 전망(The Bioeconomy to 2030: Designing a Policy Agenda, 2009)하며, 21세기 인류가 직면한 보건, 식량, 에너지, 환경 등 4대 문제를 해결하는데 바이오기술이 핵심적인 역할을 할 것으로 예측하고 있다. 보고서는 바이오 경제에 대해 ʻ바이오 기술이 경제적 산출량의 상당부분에 기여하는 경제ʼ로 정의하고, 차세대 산업 분야로 주목 받고 있는 생명공학의 중요성을 강조한 바 있다.
이에 앞서 생명공학 발전을 위한 핵심재료인 생물자원의 중요성을 인식한 OECD는, 2001년 세계 각국에 고품질의 생물자원 및 정보를 관리 보급하는 생물자원센터(Biological Resource Center, BRC)의 설치를 권고하였다. 자원센터는 생명공학 및 관련 산업의 성장을 견인하는 핵심 인프라 기관으로서 국가차원에서 지원해야할 중요 연구기반으로 제시한 바 있다.
따라서 도래하는 바이오경제 시대를 창출하는 핵심자원으로서 무궁한 가치를 지닌 생물자원의 중요성을 인식한 각국은 자원의 확보를 위한 치열한 경쟁을 벌이고 있다. 최근 ʻ유전자원의 접근 및 이익공유(Access to Genetic Resources and Benefit Sharing)에 관한 나고야 의정서ʼ가 채택(ʼ10.10)됨으로써 자원 주권이 더욱 강조되고 있다. 의정서에 따라 외국 자원을 이용할 경우 자원 접근에 대한 국가 승인을 거쳐야 하며, 자원 이용에 따른 유무형의 결과물에 대하여 공정하고 공평하게 이익을 공유해야하는 새로운 장이 열리게 된 상황이다. 새로운 국제규범의 출현에 따라 생명공학 연구 및 바이오산업에 막대한 영향이 예상되고 있다.
우리나라 역시 생명공학산업의 핵심소재인 생명자원의 중요성을 인식하고 법률 및 제도 정비를 통하여 생명자원의 효율적인 관리 및 활용을 위한 기반을 조성하기 위해 노력하고 있다. 2007년 건강하고 풍요로운 바이오경제 기반조성을 위하여 당시 과학기술부를 중심으로 농림부, 복지부, 환경부, 해수부 등 5개 부처 공동으로 ʻ국가 생명자원 확보·관리 및 활용 마스터플랜(ʼ07.12)ʼ을 수립하였다. 이는 생명자원의 국가적인 종합 관리체계를 구축하고, 생명자원 관련 육성정책의 커다란 근간을 마련하는 획기적인 전환점이 되었다. 이러한 토대위에 기본법적인 성격의 ʻ생명연구자원의 확보·관리 및 활용에 관한 법률’ (ʼ09)이 제정되었고, 농림축산식품부의 ʻ농수산생명자원의 보존·관리 및 이용에 관한법률ʼ(ʼ07)과 해수부의 ʻ해양생명자원 확보·관리 및 활용 등에 관한 법률ʼ (ʼ12) 등이 제정되었다. 마스터플랜과 생명연구자원법을 근거로 범부처 차원의 생명연구자원관리 기본계획(ʼ11~ʼ20)이 국가과학기술위원회에서 확정(ʼ11.05)되어, 매년 시행계획을 통해 범부처 차원의 생명자원의 정책을 종합적으로 추진하고 있다. 또한 생명연구자원의 확보·관리 및 활용에 관한 법률 시행령에 따라 미래부 주관으로 6개 부처가 참여하는 책임기관협의회가 운영되고 있으며, 산하에 정보시스템실무위원회와 자원별 실무 위원회(구성 중)를 두어 생명자원 관련 현안에 대한 효율적인 논의를 진행하고 있다.
2. 연구 동향
가. 생명연구자원의 정의
OECD는 생물자원센터에서 관리되는 자원의 정의를 ʻ배양 가능한 생물체(미생물, 식물, 동물, 인간세포)와 생물다양성 부분 중 복제 가능한 부분, 배양 불가능한 생물체 및 이와 관련된 분자, 생리, 구조적 정보를 포함ʼ하며, 또한 이들로부터 유래되는 유전체, 전사체, 단백체, 대사체, 생물학적 화합물, 추출물, cDNA clone or library, Amplicon, Metagenome 등으로 규정하고 하고 있다. 우리는 현재 생명자원의 근간이 되는 ʻ국가 생명자원 확보․관리 및 활용 마스터플랜ʼ에 따르면 생명자원(Bioresource)이란 생물자원, 생물다양성, 생명정보를 총칭하며, 생명공학 연구기반이 되는 생물체 및 이를 구성하고 있는 구성체를 의미한다고 정의하고 있다. 이를 근거로 생명연구자원법에서도 생명연구자원을 ʻ생명공학연구의 기반이 되는 자원으로서 산업적으로 유용한 동물, 식물, 미생물, 인체유래 연구자원 등 생물체의 실물(實物)과 정보ʼ로 정의하고 있어, 향후 용어 사용은 이에 준하여 서술한다.
나. 생물자원
국가생명연구자원통합정보시스템인 국가생명연구자원정보센터의 KOBIS 통계에 따르면, 국내 미생물자원은 세균 3,368종, 진균 2,161종, 조류 360종, 원생동물 92종, 바이러스 32종, 고세균 12종 등 총 6669종, 약8만여 주를 보유하고 있는 것으로 나타났다. 그러나 아직 부처 기관별로 분류체계와 정량적 기준에 차이가 있어 지표 표준화를 위한 실물 및 정보표준화 위원회 구성을 추진 중이다. 미생물자원의 대표관리기관은 한국의 유전자은행으로 알려진 한국생명공학 연구원의 미생물자원센터(KCTC)이다. KCTC는 1985년 한국과학기술연구원(KIST)내 설립되어 다양한 국제 공인균주를 확보 관리하여 산학연 연구자에 보급하는 자원은행 역할을 수행하며. 국내 생명공학연구의 역사와 궤를 같이하는 최대 자원센터로 발전해 왔다. 현재 약 25,000여주의 세균, 효모, 곰팡이 등 공인균주를 보유하여 세계 8위권 자원센터로서의 위상을 보이고 있다. 매년 PubMed 등재 논문에서 KCTC자원이 활용된 인용지수를 살펴보면, 세계 자원센터 중 독일 DSMZ, 미국 ATCC, 네덜란드 CBS, 일본 JCM에 이어 세계 5위권을 유지하고 있다. 또 전 세계에서 새롭게 발굴 보고되는 신종미생물의 확보 수준에서, 독일, 일본에 이어 세계 3위의 신종미생물 보유기관으로 국제적인 위상을 보이고 있다. KCTC는 부다페스트조약에 의한 국제특허미생물 보존기관(IDA)로서 국내 특허미생물기탁의 절반 이상을 담당하고 있다. 더불어 ʻ국가연구개발사업의 관리 등에 관한 규정(ʼ08.5)ʼ에 의해 국가연구개발 사업을 통해 확보된 생명자원 연구성과물의 기탁 전담기관으로 활용기반을 마련하고 있다. 이외에도 미래창조과학부가 지원하는 국가지정연구소재 은행사업을 통해 대학중심으로 특화된 여러 종류의 연구용 미생물이 관리되고 있다. 2012년 종결된 21세기 프론티어연구개발사업 미생물유전체사업단은 유용 미생물 발굴 활용사업을 통해 신종미생물 발굴 분야에서 한국이 세계 1위의 성과를 나타내는데 크게 기여했다.
국가생명연구자원정보센터(KOBIC)의 KOBIS 통계에 따르면, 국내 식물자원은 16,988종 약 178만여 건을 보유하고 있는 것으로 나타나며, 농식품부의 BRIS는 농진청 및 삼림청의 식량작물 및 삼림자원을 중심으로 종자 3,617, 영양체 5,717 등 8,866종을 보존하는 것으로 나타났다. 그 외 미래부의 한국생명공학연구원, 환경부의 국립생물자원관 등에서도 식물자원 관리를 수행하고 있다. 그러나 우리나라가 확보한 식물종자는 약 15만 점으로 미국(50만 점)의 1/3, 중국(38만 점)의 1/2.5, 일본(28만 점)의 1/1.8수준에 불과하다. 전체 보유 종자 중에서 식량작물의 비중이 가장 높으며 채소, 특용작물, 사료작물 등 타 작물과 야생 식물의 종자 보유는 상대적으로 저조한 실정이다.
국내 동물자원 인프라는 선진국에 비해 아직 미흡한 수준이나, 신약개발 관련 연구들이 진행되면서 투자가 확대되고 있는 상황이다. 한국생명공학연구원은 국제 공인 모니터링센터(ICLAS Monitoring Subcenter Korea)를 운영하여 국내 실험동물시설에 대한 병원성미생물 감염모니터링을 지원하고 있다. 2010년 시작된 유전자변형마우스기반구축사업을 통해 국내 바이오연구개발의 필수재료인 유전자변형마우스(GEM)의 생산, 활용 기반구축이 추진되고 있다. 더불어 최근 신약연구에 필요한 인프라인 영장류 기반시설이 구축되고 있다. 한국과학기술원 의과학연구센터가 관리하는 25,000line의 형질전환 초파리 라이브러리은행과 한국인유래 암세포주 분양 업무를 수행하는 한국세포주은행 등은 유용자원으로 국내외 많은 연구실에서 활용되어 여러 우수 논문으로 발표되었다.
다. 생물다양성
우리나라의 생물다양성 종은 2012년 기준으로 척추동물 1,889종, 곤충 14,145종, 무척추동물 6,468종, 식물 5,281종, 균류와 지의류 4,113종, 원생생물 1,573종, 조류(algae) 4,672종, 원핵생물 1,009종으로 총 39,150종으로 알려졌다. 그러나 생물다양성 연구가 부처 기관별로 분산되어 국가전체에 대한 정확한 통계에 어려움이 있다. 한반도의 전체 생물종 수는 환경이 유사한 영국, 일본 등과 비교할 때 약 10만 종으로 추정되는데, 현재 기록된 생물종 수는 추정치의 25~30% 정도에 불과하다. 미래부는 국립중앙과학관을 중심으로 국내 생물다양성에 대한 표본 확보 및 정보의 수집 관리를 주도하고 있다. 생물다양성통합 DB 및 네트워크 구축운영사업을 통하여 생물다양성 정보를 구축하고 있으며, 국내 자연사관련 박물관 및 생물다양성 관련 기관을 중심으로 45개 기관 네트워크인 ʻ국가생물다양성기관연합ʼ의 주관기관으로서 활동하고 있다. 또한 자연사참조표본 확보 및 활용지원 기반기술 개발사업을 통해 국내 자원의 인벤토리 구축, 참조표본 확보, DNA 연구 등을 수행하고 있다. 현재 국립중앙과학관은 세계생물다양성정보기구(GBIF)의 한국사무국(KBIF) 역할과 국가자연사연구종합정보 시스템(NARIS) 운영을 통하여 165만여건의 생물다양성 정보를 수집하고, 이를 KOBIS에 연계하고 있다. 한국과학기술정보연구원은 GBIF 정보 포탈에 대한 아시아권역 미러사이트를 운영하고 있다.
환경부는 국립생물자원관을 중심으로 자생생물 서식지를 대상으로 생물다양성자원을 수집하고 신종·미기록종을 조사하는 사업을 수행하고 있으며, 주요 생물자원의 유전자 분석연구를 통해 생물자원의 보전, 관리의 기초자료를 확보하고 있다. 한반도 자생생물의 생태 등 다양한 정보를 종합적으로 수록한 종합 생물지 발간, 법적보호대상종, 수집자원을 중심으로 한반도 주요생물 계통수 및 동정서비스 시스템을 운영을 하고 있다. 또한 확보 자원의 DB화 및 한반도 생물자원 포털 서비스 시스템을 구축하여 생물표본 15.4만점과 자생생물 정보 3천종을 구축하고 있다.
농림축산식품부 수행기관인 농진청 국립농업과학원에서 식물, 곤충, 누에 등에 대한 국내 야생종, 재래종 등 농업자원의 다양성을 확보하고 있다. 또한 곤충에 대한 유전적 다양성 보존을 위한 자원을 수집하고 있으며, 보존자원에 대한 내병충성 및 주요성분 분석을 통하여 식물자원의 특성 평가 사업을 수행 중에 있다. 가장 많은 자원을 보유한 산림청 국립수목원은 국가생물종지식정보 시스템(Nature)을 통해 식물, 곤충, 버섯, 그리고 야생조수류에 대한 생물다양성 데이터베이스를 구축하고 있으며, 식물표본 정보 약 75만 건, 곤충표본 정보 약 55만 건을 보유하고 있다.
해양수산부는 추진중인 국립해양생물자원관을 중심으로 국내 다양한 해양자원의 체계적 연구를 위해 해양생물종 표본 및 기타 생물재료를 확보하고 있다. 최근 구축한 해양생명자원통합정보시스템(MBRIS)를 중심으로 해양생물자원의 DB구축, 분양, 기탁 등을 수행하며, 한국해양생물다양성정보 시스템(KoMBIS)을 구축하여 18개 해양생물군에 속하는 총 9,829여 종의 생물명과 3,000여개의 동종이명에 대한 정보를 보유하고 있다. 또한 유전자 분석을 위한 해양유용생물종을 보존하고 있으며 갯벌 등 습지에 대한 해양환경의 생태조사를 수행하고 있다.
라. 생명정보
우리나라 유전체연구사업이 시작된 2001년 10월 국무조정실 주관으로 생명정보는 과기부(現, 미래부)에서 총괄관리 하는 것으로 결정된 이후, 마스터플랜과 생명연구자원법을 근거로 국가생명연구자원정보센터(KOBIC)가 출범하고 국가생명연구자원통합정보시스템(KOBIS, http://www.kobis.re.kr)이 운영되고 있다. KOBIC은 2010년 9월부터 시작된 1단계 국가생명연구자원 통합체계구축사업을 통해 다양한 역할과 성과를 도출하였다. 범부처 정보연계표준안을 근간으로 생명연구자원 통합관리시스템(KOBIS)을 구축하여 미래부 내 기탁등록 보존기관의 정보연계를 추진하였으며, 범부처 정보연계 시범사업으로 농식품부 생명자원정보서비스(BRIS)와 정보연계를 추진하였다. 범부처 차원에서 협력을 위해 생명연구자원법에 따라 범부처 정보연계 및 통합을 추진하고, 효과적인 정보공유를 위해 관련부처 책임기관으로 협의회를 운영하고 있다. KOBIS 통계에 따르면, 국내 생명정보는 미생물 453,797건, 식물 221,765건, 동물 247,394건, 인체유래물 14,167건 등 약 160만건 이상을 보유하고 있는 것으로 나타났다.
환경부는 고유 업무인 생태조사와 기후 변화에 따른 환경조사 및 모니터링을 위해 국내 및 아시아 관련국과 공동 조사를 추진하고 있다. 생물다양성 관련법을 마련하여 국가생물다양성센터를 설치하였고,「야생생물 보호 및 관리에 관한 법률」개정을 추진 중에 있다.
농림축산식품부는 농작물개발 관련 분야 연구개발 투자를 확대하고 있으며, 부처 내 기관들에 의해 기구축된 다양한 자원 관련 정보를 통합하여 통합시스템인 생명자원서비스(BRIS)를 구축 운영하고 있다.
보건복지부는 제2단계 한국인체자원 은행사업(2013~15년)계획 수립과 유전체 연구에 기반한 맞춤의료 기술개발을 위해 유전체 맞춤의료 기술개발촉진법 제정을 추진하고 있다. 또한 인체유래생물자원 종합관리방안(ʼ08~ʼ12)을 통한 인체유래물 확보, 활용 방안 및 인체유래자원의 표준화를 추진하고, 질병관리본부를 통한 보건의료분야 생명연구자원의 관리 체계를 강화하고 있다.
해양수산부는 해양생물자원관 건립을 통해 해양생명자원 분야 거버넌스 확보와 첨단 생명공학기술 및 융합기술을 통해 새로운 도약을 추진하고 있다. 자원관 건립을 통해 해양 자원 확보와 관리시스템을 구축하고 있으며, 2013년 해양과학기술 육성 전략 발표를 통해 첨단기술의 활용뿐만 아니라 융합기술의 접목을 통해 해양수산업 지원뿐만 아니라 새로운 가치 창출을 통해 산업화에 주력하고 있다.
3. 발전 전망
생명자원은 이러한 바이오 분야의 발전과 혁신을 위한 필수적인 연구소재이며 바이오경제 창출을 위한 핵심 원천재료로 인식되고 있다. 유용 생명자원은 과거에는 인류공동의 자산으로 인식되어 누구나 자유롭게 사용할 수 있었으나 최근에는 자원이 속한 국가의 자원주권이 인정되면서 생명자원의 중요성이 더욱 부각되었으며, 특히 나고야의정서 채택으로 그 중요성이 다시 조명되고 있다. 의정서가 발효될 경우 국내 생명공학 연구경쟁력 제고와 바이오산업의 지속적 발전에 막대한 파급효과를 미칠 것으로 전망되고 있다. 의정서에 따라, 향후 바이오 연구개발 및 산업화 과정에서 다른 나라의 유전자원을 이용할 경우, 반드시 자원제공국의 사전승인을 받아야 하며 상호합의조건에 따라 이익을 서로 공유해야 하는 법적 통제체제하에 놓이게 됨을 의미한다. 현재 국제적으로 각국은 의정서 이행을 위한 비준절차 및 국내 이행체계 마련을 진행 중이며, 이에 대한 관련 단체의 대응노력과 더불어 국민 및 관련자에 대한 인식제고 활동을 벌이고 있다. 이러한 국내외적인 상황변화에 따라 국내 생명자원의 활용도를 높이기 위한 인식전환이 필요하며, 국내 생명자원의 확보 및 도출된 연구성과물의 활용성 제고를 위한 연구성과물 기탁제도의 기반강화가 요구된다. 더불어 ABS에 대한 생명자원 관련 연구자들의 인식제고를 통해 국제현안에 대한 대내외적 대응능력을 강화하고, 각계 관계자들의 의견 수렴을 통한 효과적인 대응전략을 마련해야 하는 상황이다.

1. 개요
일반적으로 실용화기술개발 단계의 세부과정은 ① 순수연구 및 독창적·창의적 ʻ기초연구(Basic research)ʼ 과정, ② 개발가능성 확보 및 효능확인의 ʻ응용연구(Applied research)ʼ 과정, ③ Prototype 및 시제품 제작의 ʻ개발(Development)ʼ 과정, ④ 대량생산의 가능성 확보 및 제품성능평가의 ʻ시생산(Pilot-plant)ʼ 과정, ⑤ 대량생산 및 품질관리의 ʻ산업화(Manufacturing)ʼ 과정으로 세분화할 수 있으나, 생물산업은 일반산업 분야와 달리 차별성 및 특이성이 존재하며, 이는 개발과정 → 시생산과정 → 산업화과정 등을 거치면서 개발될 제품(의약품 및 식품 등)을 최종적으로 인체에 적용하기 위하여 체내 안전성·유효성 등에 대한 신뢰성평가(비임상 GLP, 임상 GCP, 우수제조기준 GMP 등)를 필수적으로 검증해야 한다는 것이다. 또한 이러한 생물산업의 실용화기술개발 단계에서 ʻR&D 기능ʼ 뿐만 아니라 기술하부구조로 되어 있는 ʻ인프라구조(Infra-structure)ʼ의 효율적인 지원체계 구축은 성공적인 생물산업 육성 및 지속적 성장을 가능케 하는 필수 요인이다.
생물산업 인프라 분야와 관련하여, ① 실용화기술개발의 ʻ응용연구ʼ 과정까지는 주로 한국생명공학연구원, 한국화학연구원, 한국식품연구원, 한국한의약연구원, 한국기초과학지원연구원, 한국표준과학연구원, 한국과학기술연구원, 한국전자통신연구원 등의 정부출연기관과 정부에서 지원하는 연구소재은행 및 한국세포주은행 (미래창조과학부), 줄기세포·재생연구센터(보건복지부) 등을 중심으로 R&D 인프라가 구축·운영되고 있고, ② ʻ응용연구ʼ 과정 이후부터는 산업화에 특화된 지원을 위해 산업통상자원부를 중심으로 R&D 및 시제품 제작·생산에 필요한 고가의 시설·장비, 관련 기업의 창업~성장 단계별 지원을 위한 인프라인 산학연공동연구 기반구축센터 3개, 바이오벤처기업지원센터(BVC; Bio Venture Center) 9개, 지역특화센터 23개(2단계사업 13개 별도), 한국바이오협회 코리아바이오허브센터 (Korea Bio-Hub Center) 등과 우수의약품 제조기준(cGMP)에 맞는 (주)바이넥스(舊 한국생산기술연구원) 생물산업기술실용화센터 등이 구축·운영되고 있으며, ③ 특히 생물산업(의약품 등) 제품의 신뢰성평가에 특화된 인프라는 미래창조과학부 지원 한국화학연구원 부설 안전성평가연구소(KIT)를 포함하여 보건복지부 식품의약품안전처에서 지정된 비임상(GLP) 기관 19개와 임상(GLP) 기관 163개 인프라가 구축․운영되고 있다. 또한, 의약품 개발 R&D 비용 중 2/3 정도의 비용이 임상시험 비용 등에 소요되고 있고, 그 중 30% 이상이 임상시험전문연구용역기관(CRO)에서 사용되는 것으로 추정되고 있으며, CRO의 주요 성장기반이 되는 제약분야가 지속적인 확대30)에 따라, 바이오산업 글로벌 진출을 위한 CRO 육성의 중요성이 어느 때 보다도 강조되고 있다.
[표 4-7-1] 실용화기술개발 단계별 생물산업 관련 주요 인프라 현황
|
인프라단계 |
세부구분 |
인프라기관 |
주요역할 |
|
Research
(기초연구 및 응용연구) |
의약바이오
|
한국한의약연구원 한국표준과학연구원 한국과학기술연구원 |
한의학표준화기반 연구 바이오분야 측정표준 연구 표적지향형 신규항암제 후보물질 연구 |
|
산업/그린/ 융합바이오
|
한국생명공학연구원 한국생명공학연구원 한국생명공학연구원 한국생명공학연구원 한국식품연구원 한국화학연구원 한국전자통신연구원 한국과학기술연구원 |
바이오제품 안전성평가 및 정보관리 국가영장류센터 운영 바이오융합 연구 국가생물자원정보 관리 식품기능성 및 신소재․신공정 연구 화학기술분야 연구 및 성과 보급 유비쿼터스건강관리모듈/시스템개발 실시간분자영상 스마트센서기술 개발 |
|
|
종합분야
|
한국기초과학지원연구원 한국세포주은행 한국생명공학연구원 한국생명공학연구원 |
고가의 연구기자재 활용 미생물 및 세포주은행(관리 및 공급) 해외생물소재(식물) 허브센터 국가생명공학정책연구 및 확산 |
|
|
Development Pilot-plant Manufacturing
(개발, 시생산 및 산업화) |
공동장비지원 |
경기바이오센터 등 3개 한국식품연구원 한국화학연구원 한국화학연구원 |
산학연공동연구기반구축 건강기능식품플랫폼 신약개발플랫폼, 바이오화학실용화 Drug Repositioning 연구지원 |
|
벤처기업지원 |
한국생명공학연구원 등 9개 |
바이오벤처기업지원센터 (TIC를 포함 BVC) 구축 |
|
|
지역클러스터
|
대전테크노파크 등 23개 (지원기반정비 13개 별도)
|
지역특화산업 분야 혁신역량 제고 (시설․장비지원, 기술지원, 교육훈련, 시생산(Pilot plant, GMP 등) 및 공인검사 수행 등) |
|
|
종합분야
|
(주)바이넥스(舊 생기원) 한국생명공학연구원 한국바이오협회 순창군 장류연구소 |
생물산업기술실용화센터건립(cGMP) 바이오안전성정보센터(LMO관련) 코리아바이오허브구축(Networking) 발효미생물종합활용센터건립(전통식품) |
|
|
GLP(비임상) GCP(임상) (신뢰성평가) |
GLP(비임상)
|
식약처 지정 GLP 19개 (안전성평가연구소 등) |
비임상 시험항목별 허가기관(’13.1)
|
|
GCP(임상) |
식약처 지정 GCP 163개 |
임상1상, 임상2상, 임상3상(’13.7) |
* 의약바이오 : 바이오신약, 바이오장기 등 바이오기술을 보건의료 분야에 응용한 것
* 산업/그린바이오 : 건강기능식품, 바이오매스, 바이오플라스틱 등 바이오기술을 농축산, 식품, 바이오플라스틱, 바이오연료 등에 응용한 것
* 융합바이오 : 바이오공정, 바이오환경, 바이오에너지 등 바이오기술을 산업공정/생산 및 환경 분야에 응용한 것
* BVC : 바이오벤처기업지원센터(Bio Venture Center), 전국 바이오벤처기업지원센터간 협력네트워크 및 전략적 연계운영시스템 구축을 통한 효율적 기업지원시스템 구축, 바이오산업의 지역별 균형발전을 도모하기 위해 설립․운영
* TIC : 지역기술혁신센터(Technology Innovation Center), 지역대학을 중심으로 지역내 산업기술혁신을 지원하도록 설립․운영
* 지역클러스터(지역특화센터 ): 지역특화산업 분야의 혁신역량을 제고하기 위하여 지역내 설치 운영되는 센터이며, 지역의 기획역량, 기술개발역량의 중재자 기능을 수행하는 인프라 역할 수행
2. 현황
가. 기초·응용연구 단계 인프라
기초·응용연구 단계 인프라는 기초이론 및 실험, 실용 목적의 아이디어 특허 등 개념 정립, 연구실 규모의 기본성능 검증, 연구실 규모의 부품 및 시스템 핵심성능 평가 등을 지원하는 인프라에 해당되며, 주로 국책연구원을 중심으로 인프라가 형성되어 기술개발을 지원하고 있다.
특히 기초·응용연구 단계에서 가장 큰 비중을 차지하는 한국생명공학연구원은 바이오제품 안전성평가 및 정보관리, 국가영장류센터 운영, 바이오융합 연구, 해외생물소재 허브센터 운영, 국가 생명공학 정책연구 및 확산 등의 기능을 담당하고 있고, 한국식품연구원은 식품기능성 및 신소재·신공정 연구를 담당하고 있고, 한국화학연구원은 바이오분야를 포함한 화학기술분여 연구를 담당하고 있고, 한국과학기술연구원은 표적지향형 신규항암제 후보물질 연구, 실시간 분자영상 스마트센터기술 연구 등의 기능을 담당하고 있으며, 기타 한국한의약연구원의 한의학표준화연구, 한국전자통신연구원의 유비쿼터스 건강관리시스템 연구 등도 중요한 인프라 기능을 담당하고 있다.
그러나, 기초·응용연구 환경에 종합적으로 필요한 2개의 핵심인프라로 한국기초과학지원연구원과 서울대학교 의과대학 암연구소 내에 설치된 한국세포주은행을 꼽을 수 있다. 한국기초과학연구원은 1988년 기초과학 진흥을 위한 연구지원 및 공동연구 수행을 목적으로 설립되어 국가적 대형공동연구장비 개발·설치·운영, 첨단연구장비 이용자 교육, 범 국가적 연구장비 정보수집·분석 등의 기능을 담당하고 있으며, 2011년 현재 대전 본원 및 10개(서울, 부산, 대구, 광주, 전주, 춘천, 순천, 강릉, 오창, 제주) 분원에 총 181명의 인력 및 368종의 지원장비(약 1,139억원 규모)를 보유하고 있으며, 한국세포주은행은 1982년 전국의 연구기관에 필요한 세포주 개발․공급을 목적으로 설립되어 세포주 자원에 관련 정보 수집·보존·공급, 세포주 관련 각종 교육·연수·학술회의 실시, 특허출원 세포주의 기탁 및 보존 등의 기능을 담당하고 있으며, 1993년 UN 산하 세계지적재산권기구로부터 특허미생물의 국제기탁기관의 지위를 취득하였고, 현재 자체개발 세포주 330여종(109종 분양가능), 외국도입 세포주 428종을 보유하고 있다.
나. 개발·시생산 및 산업화 단계 인프라
개발·시생산 및 산업화 단계 인프라는 기초단계 이후의 효능검증 연구·확인, 확정된 부품·시스템의 시작품 제작·평가, Pilot 규모의 시작품 제작 및 성능 평가 등을 지원하는 인프라에 해당되며, 대부분 산업통상자원부 지원기관을 중심으로 인프라가 형성되어 산업화를 지원하고 있다.
산업화 지원 인프라는 기본적으로 기업성장 단계별 지원(창업보육 등), 시설·장비구축·활용, 교육훈련, 정보교류, 기술지도 등을 담당하고 있고, 인프라구축 형태로 크게 구분하면, ① 생물산업실용화기반(cGMP, 발효미생물활용센터), ② 바이오안전성기반(LMO), ③ 연계협력기반(Korea Bio-Hub), ④ 산업기술기반조성 (BVC, 산학연공동연구기반, 플랫폼센터, DR센터), ⑤ 지역클러스터(지역특화센터) 등으로 구분될 수 있으며, 국내 생물산업의 여건 및 경쟁력을 고려하여 산업통상자원부를 중심으로 전략적으로 구축되었다.
생물산업실용화기반 부분을 살펴보면, 1998년 국내 생물의약 분야의 성장에도 불구하고 미국 FDA의 인증을 받은 우수의약품 제조 및 품질관리기준인 cGMP31)기준의 생산공장이 전무한 취약한 실정을 감안하여 선진국 수출지원 등을 위하여 미국 FDA와 유럽 EMA가 요구하는 기술적 사항을 종합적으로 반영한 시설로 국제적으로 인정된 기준에 맞는 생물의약품 전문생산시설(생물산업기술 실용화센터(1998년~2007년)32)이 구축되었으며 현재 바이넥스에서 운영을 하고 있으며, 2007년 국내 발효식품산업 육성을 위해 전통발효식품(고추장, 된장 등)의 안전성 확보 및 발효미생물자원의 허브 구축을 위하여 발효미생물종합 활용센터(1998년~2007년)33)가 구축되었다.
바이오안전성기반 부분을 살펴보면, 2002년 LMO(유전자변형생물체)를 중심으로 대두된 국제무역질서에 대응하기 위한 의무사항·교육·홍보 등을 위하여 바이오안전성정보센터(2002년~계속)가 구축되었으며, 연계협력기반 부분을 살펴보면, 국내외 바이오네트워크 구축·활성화 및 웹포털 구축·운영을 통한 각종 협업기관 지원을 위하여 코리아바이오허브센터(2004년~계속)가 구축되었다.
또한, 산업기술기반조성 및 지역클러스터 부분을 살펴보면 수도권을 포함한 각 지역에 소재한 중소 바이오벤처기업 등의 특성화 지원 및 현장 밀착형 지원을 위해 산업정책 차원에서의 바이오벤처기업지원센터(BVC, 1998년~2007년)34)와 산학연공동연구기반구축(2004년~2011년)35), 지역균형발전 차원에서의 지역 바이오클러스터(지역특화센터, 2002년~2012년)36), 건강식픔개발 및 신약개발을 위한 플랫폼구축(2009년~2014년), Drug Repositioning 기술을 이용한 신약개발 활용 시스템 구축(2010년~2015년) 등이 구축되었다.
(1) 산업화 인프라 지원 현황
산업화 지원 인프라에 2013년까지 실제 지급한 국비지원금은 27개 기관, 44개 과제(2단계 13개 미포함)에 총 5,802.48억원이 지원되었으며, 44개 과제는 cGMP 1개, LMO 3개, 산기반 3개, 네트워킹 1개, 발효산업 1개, BVC 9개, 지역특화센터 22개(2단계 13개 미포함), 산업융합원천 인프라 4개로 구성되어 있다.
(5+2)광역경제권역별로 2013년까지의 정부 지원금액(지원과제수 포함) 비중을 살펴본 결과, 호남권이 24.8%(1,438.73억원, 13개) 지원되었으며, 수도권이 21.1%(1,225.8억원, 4개), 충청권이 20.9%(1,213.22억원, 16개), 대경권이 9.0%(522.13억원, 9개), 강원권이 8.8%(511.27억원, 5개), 제주권이 8.4%(487.09억원, 3개), 동남권이 7.0%(404.24억원, 7개) 순으로 지원되었으며, 지원분야별 지원금액(지원과제수 포함) 비중을 살펴본 결과, 각각 산업/그린바이오 분야가 52.1%(3,022.48억원, 35개), 의약바이오 분야가 35.9%(2,082.30억원, 15개), 복합지원(의약/산업/그린) 분야가 9.5%(552.1억원, 5개), 융합바이오 분야가 2.5%(146억원, 2개) 등의 비중을 차지하고 있다.
지원과제별 지원서비스 분야별 현황(2개 이상 지원 역할 포함)을 살펴보면, Pilot Plant 지원이 64.9%(37개), GMP 지원이 43.9%(25개), GLP 지원이 1.8%(1개), 공인인증검사(식품위생검사 등)이 29.8%(17개), 기타(연구지원, 정보제공 등)가 29.8%(17개) 등으로 구성되어 있다.
(단위 : 억원)

[그림 4-7-1] 광역경제권역별 산업화 인프라 지원 현황(~2013년)
(단위 : 억원)

[그림 4-7-2] 지원분야별 산업화 인프라 지원 현황(~2013년)
(2) 산업화 인프라 지원 성과
산업화 지원 인프라 구축을 통해 2013년 8월말 현재 총 303,439평의 부지가 사용되었으며, 행정동, 연구동, 장비지원동, Pilot Plant, 기업입주 공간 등의 건물 규모는 총 100,882평이며, 인프라 지원 상주인력은 총 1,024명에 다다르고 있다.
구체적으로 (5+2)광역경제권역별로 구분하면, 수도권이 부지 15,973평, 건물 13,099평, 상주인력 178명, 충청권이 부지 16,030평, 건물 12,750평, 상주인력 180명, 호남권이 부지 170,804평, 건물 41,848평, 상주인력 348명, 동남권이 부지 38,621평, 건물 10,085평, 상주인력 89명, 대경권이 부지33,157평, 건물 8,759평, 상주인력 116명, 강원권이 부지 23,329평, 건물 10,329평, 상주인력 63명, 제주권이 부지 5,525평, 건물 4,013평, 상주인력 50명 등으로 구성되어 있으며, 지원분야별로 비중을 살펴보면, 산업/그린바이오 분야 부지가 55.4%(168,153평), 건물이 50.4%(50,817평), 상주인력이 48.6%(498명), 의약바이오 분야 부지가 39.3%(119,148평), 건물이 38.6%(38,920평), 상주인력이 37.5%(384명), 융합바이오 분야 부지가 3.4%(7,230평), 건물이 4.3%(3,654평), 상주인력이 1.6%(16명), 복합지원 분야 부지가 4.2%(8,908평), 건물이 8.9%(7,492평), 상주인력이 12.3%(126명) 등의 비중을 차지하고 있다.
또한, 2013년 8월까지의 산학연 등 지원 성과(연도별 누계)를 보면, 입주기업 수가 2011년말 762개, 2012년말 781개, 2013년 8월말 현재까지 792개, 장비구축건수가 2011년말 7,910건, 2012년말 7,705건, 2013년 8월말 현재까지 7,743건, 기술지도 및 기술상담 건수가 2011년말 7,009건, 2012년말 8,056건, 2013년 8월말 현재 8,139건, 세미나 및 교육훈련 건수가 2011년말 2,338건, 2012년말 2,312건, 2013년 8월말 현재 2,370, 각종 산업화 지원 등을 통한 수익금 현황이 2011년말 278.6억원, 2012년말 334.9억원, 2013년 8월말 현재 483.6억원 등에 달하는 우수한 성과를 도출하였으며, 2013년 8월말 현재 지원분야별로 성과 비중을 살펴보면, 산업/그린바이오 분야 입주기업이 69.7%(552개), 장비구축 건수가 74.2%(5,742건), 기술지도 및 기술상담 건수가 60.3%(4,906건), 세미나 및 교육훈련 건수가 54.3%(1,287건), 수익금 규모가 40.3%(195.0억원), 의약바이오 분야 입주기업이 21.3%(169개), 장비구축 건수가 19.3%(1,498건), 기술지도 및 기술상담 건수가 29.2%(2,379건), 세미나 및 교육훈련 건수가 33.2%(787건), 수익금 규모가 52.4%(253.3억원), 융합바이오 분야 입주기업이 3.2%(25개), 장비구축건수가 0.7%(52건), 기술지도 및 기술상담 건수가 3.7%(302건), 세미나 및 교육훈련 건수가 2.8%(66건), 수익금 규모가 2.2%(10.4억원), 복합지원 분야 입주기업이 5.8%(46개), 장비구축 건수가 5.8%(451건), 기술지도 및 기술상담 건수가 6.8%(552건), 세미나 및 교육훈련 건수가 9.7%(230건), 수익금 규모가 5.1%(24.9억원) 등의 비중을 차지하고 있다.
(단위 : 개)

[그림 4-7-3] 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과(입주기업)
(단위 : 건)

[그림 4-7-4] 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과(장비구축)
(단위 : 건)

[그림 4-7-5] 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과(기술지도)
(단위 : 건)

[그림 4-7-6] 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과(교육훈련)
(단위 : 억원)

[그림 4-7-7] 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과(수익금발생)
(단위 : 원, 건)

[그림 4-7-8]지원분야별 산업화 인프라 지원 성과(2013년 8월말 누계치)
(3) 신뢰성평가 단계 인프라
신뢰성평가 단계 인프라는 최종 개발제품의 산업화 전후 단계에서의 인체 적용을 통하여 체내 안전성·유효성 등에 대한 신뢰성(비임상, 임상 등) 확보를 지원하는 인프라에 해당되며, 대부분 보건복지부(식품의약품안전처)의 인허가를 득한 지원기관을 중심으로 인프라가 형성되어 지원하고 있다. 구체적으로 식품의약품안전처로부터 GLP(비임상시험관리기준, Good Laboratory Practice) 시험기관으로 지정된 기관은 2013년 8월말 현재 19개 기관이 운영 중에 있으며, GCP(임상시험관리기준, Good Clinical Practice) 기준에 맞는 자격기준을 갖추고 있고 식품의약품안전처에서 임상시험실시기관으로 지정된 국내기관은 2013년 8월말 현재 163개 기관이 운영 중에 있다. 특히, 산업통상자원부에서는 2010년부터 대규모 투자가 이루어지고 있는 의약품에 관한 임상 수요를 국내 임상 CRO(전문연구용역기관, Contracted Research Organization)를 통해 충족시킴으로써 국내 개발사에 대한 신속하고 저비용의 전문 서비스 제공과 아울러 국내 임상 CRO산업의 육성을 위해 (주)드림씨아이에스, (주)엘에스케이글로벌파마서비스, (주)씨엔알리서치, (주)지디에프아이 등 4개의 국내 대표적인 임상 CRO 회사를 중심으로 핵심 인프라 구축을 지원하고 있다. 이를 통해 국내 CRO관련 산업의 성장과 발전을 도모하고 국내 임상 CRO의 활성도를 제고하여 바이오의약품의 해외진출 지원하고자 하는 것이다. 주요 인프라 구축 내용으로는 ① 글로벌 기준에 맞는 임상시험자료 관리시스템(CDM) 구축, ② 다국적 임상시험 진행시 원활한 진행을 위한 임상시험 관리시스템(PM) 구축, ③ 글로벌수준의 임상시험 신뢰성보증시스템(QA)구축과 임상시험 모니터요원(CRA) 교육, ④ 구축된 기반을 활용한 바이오시밀러 제품에 대한 임상시험 시범수행 등이 있다.
[표 4-7-2] 국내 GLP 현황(2013년 9월 현재)
|
GLP기관 지정순서 |
1호 |
2호 |
3호 |
4호 |
5호 |
6호 |
7호 |
8호 |
9호 |
10호 |
11호 |
12호 |
13호 |
14호 |
15호 |
16호 |
17호 |
18호 |
19호 |
20호 |
21호 |
22호 |
23호 |
24호 |
|
|
시험기관
시험항목 (세부시험항목) |
안전성평가연구소(KIT) |
유한양행 |
동아제약 |
LG 생명과학 |
CJ |
바이오톡스텍 |
산업안전보건연구원 |
켐온 |
태평양기술연구원 |
서울대 병원 |
한국화학융합시험연구원 |
메드빌 |
바이오코아 |
아이바이오팜 |
대구카톨릭대학교 |
동아대병원 |
크리스탈지노믹스 (서울의약연구소) |
한국건설생활환경시험연구원 |
바이오인프라 |
한국원자력의학원 |
한국의약연구소 |
호서대학교안전성평가센터 |
스카스비티티바이오애널리시스 |
동아제약 |
|
|
단회투여독성 |
설치류 |
○ |
○ |
○ |
○ |
○ |
○ |
○ |
○ |
- |
○ |
○ |
○ |
- |
- |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
- |
|
비설치류 |
○ |
- |
○ |
○ |
- |
○ |
- |
○ |
- |
○ |
○ |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
|
|
반복투여독성 |
설치류 |
○ |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
○ |
○ |
- |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
|
비설치류 |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
○ |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
|
|
영장류 |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
생식발생독성 |
수태능 및 초기배 발생시험 |
○ |
- |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
출생전후발생/모체기능시험 |
○ |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
배태자발생시험 |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
유전독성시험 |
복귀돌연변이시험 |
○ |
○ |
- |
○ |
- |
○ |
○ |
○ |
- |
○ |
○ |
○ |
- |
- |
- |
○ |
- |
○ |
- |
- |
- |
○ |
- |
- |
|
체외염색체이상or쥐림포마 tk |
○ |
- |
- |
○ |
○ |
○ |
○ |
○ |
- |
○ |
○ |
○ |
- |
- |
○ |
- |
- |
○ |
- |
- |
- |
○ |
- |
- |
|
|
체내 소핵시험 |
○ |
○ |
- |
○ |
- |
○ |
○ |
○ |
- |
○ |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
면역독성시험 |
아나필락시스 쇼크반응 |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
수동피부아나필락시스반응 |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
피부감작성시험 |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
|
|
기타면역독성시험 |
○ |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
발암성시험 |
○ |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
의존성시험 (비GLP) |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
국소독성시험 |
피부자극시험 |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
○ |
○ |
○ |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
|
안점막 자극시험 |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
○ |
○ |
○ |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
|
|
기타 |
광감작성시험 |
○ |
- |
- |
- |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
광독성 시험 |
○ |
- |
- |
- |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
독성동태시험中 분석시험 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
○ |
|
|
일반약리시험 (비GLP) |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
소재지 |
대전 |
경기 |
경기 |
대전 |
경기 |
충북 |
대전 |
경기 |
경기 |
서울 |
경기 |
서울 |
서울 |
대전 |
경북 |
부산 |
서울 |
인천 |
경기 |
서울 |
경기 |
충남 |
충북 |
경기 |
|
|
지정 |
최초지정일 |
’88. 7.22 |
’88. 8.11 |
’89. 11.15 |
’95. 5.24 |
’02. 2.22 |
’02. 12.13 |
’02. 6.4 |
’02. 8.12 |
’02. 8.21 |
’03. 1.9 |
’03. 5.30 |
’03. 9.20 |
’05. 5.24 |
’05. 5.27 |
’05. 7.26 |
’05. 11.10 |
’06. 7.21 |
’06. 11.6 |
’09. 1.15 |
’09. 3.2 |
’11. 5.23 |
’11. 7.12 |
’11. 7.12 |
‘11. 9.20 |
|
지정취하일 |
|
’10. 12.14 |
’06. 7.15 |
|
’06. 7.5 |
|
|
|
’09. 12.31 |
|
|
|
|
|
|
’10. 6.1 |
|
|
|
|
|
|
|
|
|
출처 : 식약처 임상제도과(ʼ13.1.10) 자료를 토대로 필자 작성
[표 4-7-3] 국내 GCP 현황(2013년 9월 현재)
|
지정번호 |
기관명 |
지정일자 |
지정번호 |
기관명 |
지정일자 |
||||
|
임상1상 |
임상2상 |
임상3상 |
임상1상 |
임상2상 |
임상3상 |
||||
|
1 |
가톨릭대학교 강남성모병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
46 |
한국원자력연구소 원자력병원 |
|
’97.3.11 |
’97.3.11 |
|
2 |
가톨릭대학교 대전성모병원 |
|
’04.4.8 |
’97.3.11 |
47 |
한국전력공사 부속한일병원 |
|
|
’97.3.11 |
|
3 |
가톨릭대학교 성가병원 |
|
’05.3.28 |
’97.3.11 |
48 |
한림대학교 강남성심병원 |
|
’97.3.11 |
’97.3.11 |
|
4 |
가톨릭대학교 성모병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
49 |
한림대학교 부속춘천성심병원 |
|
’97.3.11 |
’97.3.11 |
|
5 |
가톨릭대학교 성모자애병원 |
|
’97.3.11 |
’97.3.11 |
50 |
한림대학교 한강성심병원 |
|
’97.3.11 |
’97.3.11 |
|
6 |
가톨릭대학교 성바오로병원 |
|
’04.2.9 |
’97.3.11 |
51 |
한양대학교 구리병원 |
|
|
’97.3.11 |
|
7 |
가톨릭대학교 의정부성모병원 |
’05.10.27 |
’05.1.13 |
’97.3.11 |
52 |
한양대학교 병원 |
’05.12.13 |
’97.4.29 |
’97.3.11 |
|
8 |
한림대학교 강동성심병원 |
|
’97.3.11 |
’97.3.11 |
53 |
원광대학교 치과병원 |
|
|
’97.6.11 |
|
9 |
경북대학교 병원 |
’05.12.19 |
’97.3.11 |
’97.3.11 |
55 |
가톨릭대학교 성빈센트병원 |
|
’00.1.25 |
’97.6.11 |
|
10 |
경희대학교 의과대 부속병원 |
|
’97.3.11 |
’97.3.11 |
56 |
연세대학교 광주세브란스병원 |
|
|
’97.6.11 |
|
11 |
포천중문의과대학 분당차병원 |
|
’97.3.11 |
’97.3.11 |
57 |
서울특별시립보라매병원 |
|
|
’97.6.23 |
|
12 |
계명대학교 동산병원 |
|
’99.6.15 |
’97.3.11 |
58 |
인하대학교 의대부속병원 |
’97.8.12 |
’97.8.12 |
’97.8.12 |
|
13 |
고려대학교 의대부속구로병원 |
|
’99.11.26 |
’97.3.11 |
59 |
경희대학교 치과병원 |
|
|
’97.11.7 |
|
14 |
고려대학교 의대부속병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
60 |
경희대학교 한의대부속한방병원 |
|
|
’97.11.7 |
|
15 |
국립중앙의료원 |
|
|
’97.3.11 |
61 |
대구가톨릭대학교 병원 |
|
’03.7.29 |
’98.5.28 |
|
16 |
단국대학교 의대부속병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
62 |
제일의료재단 제일병원 |
|
’98.5.28 |
’98.5.28 |
|
17 |
동아대학교 병원 |
’03.11.10 |
’97.3.11 |
’97.3.11 |
63 |
연세대학교 원주기독병원 |
|
’05.6.15 |
’98.8.18 |
|
18 |
부산대학교 병원 |
’03.11.10 |
’97.3.11 |
’97.3.11 |
64 |
고신대학교 복음병원 |
|
’06.5.22 |
’99.2.6 |
|
19 |
삼성생명공익재단 삼성서울병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
67 |
한림대학교 평촌성심병원 |
|
’00.7.22 |
’99.7.19 |
|
20 |
서울대학교 병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
68 |
경상대학교 병원 |
|
’02.9.24 |
’99.9.13 |
|
22 |
순천향대학교 의대부속병원 |
’00.10.23 |
’00.10.23 |
’97.3.11 |
69 |
충남대학교 병원 |
|
’99.9.20 |
’99.9.20 |
|
23 |
아산복지사업재단 서울아산병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
70 |
고려대학교 안산병원 |
’06.2.21 |
’00.1.25 |
’00.1.25 |
|
24 |
아주대학교 병원 |
’05.2.19 |
’97.3.11 |
’97.3.11 |
71 |
국립마산결핵병원 |
|
’00.10.23 |
’00.10.23 |
|
25 |
연세대학교 세브란스병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
72 |
순천향대학교 의대부속부천병원 |
’01.5.22 |
’01.5.22 |
’01.5.22 |
|
27 |
연세대학교 강남세브란스병원 |
|
’97.3.11 |
’97.3.11 |
73 |
단국대학교 치과병원 |
|
|
’01.7.11 |
|
28 |
연세대학교 치과병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
74 |
국립암센터 |
’02.3.26 |
’01.7.11 |
’01.7.11 |
|
29 |
영남대학교 의대부속병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
76 |
인제대학교 일산백병원 |
|
|
’01.10.30 |
|
30 |
왈레스기념침례병원 |
|
|
’97.3.11 |
77 |
국민건강보험공단 일산병원 |
|
’01.11.9 |
’01.11.9 |
|
31 |
원광대학교 의과대학병원 |
|
’97.3.11 |
’97.3.11 |
78 |
영훈의료법인 대전선병원 |
|
’02.5.31 |
’02.5.31 |
|
32 |
길의료재단 중앙길병원 |
’99.12.29 |
’99.12.29 |
’97.3.11 |
79 |
울산대학교 병원 |
’06.2.14 |
’02.9.24 |
’02.9.24 |
|
33 |
삼성의료재단 강북삼성병원 |
|
’97.3.11 |
’97.3.11 |
80 |
의료법인 을지병원 |
|
’02.9.24 |
’02.9.24 |
|
34 |
이화여자대학교 의대목동병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
81 |
대구파티마병원 |
|
’02.9.24 |
’02.9.24 |
|
36 |
인제대학교 부속부산백병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
82 |
동국대학교 경주병원 |
|
’03.3.31 |
’03.3.31 |
|
37 |
인제대학교 상계백병원 |
|
’97.3.11 |
’97.3.11 |
83 |
조선대학교 부속병원 |
|
’03.7.29 |
’03.7.29 |
|
38 |
인제대학교 서울백병원 |
|
’06.10.22 |
’97.3.11 |
84 |
원광대학교 광주한방병원 |
|
’03.9.25 |
’03.9.25 |
|
39 |
전남대학교 병원 |
’04.10.4 |
’97.3.11 |
’97.3.11 |
85 |
분당서울대병원 |
|
’03.9.25 |
’03.9.25 |
|
40 |
전북대학교 병원 |
’06.4.10 |
’97.3.11 |
’97.3.11 |
86 |
순천향대학교 천안병원 |
’04.2.9 |
’04.2.9 |
’04.2.9 |
|
41 |
중앙대학교 병원 |
|
’05.4.15 |
’97.3.11 |
87 |
국립서울병원 |
|
|
’04.2.9 |
|
43 |
서울의료원 |
|
|
’97.3.11 |
88 |
을지의과대학 부속병원 |
|
’04.4.8 |
’04.4.8 |
|
44 |
충북대학교 병원 |
|
’97.3.11 |
’97.3.11 |
89 |
보훈복지의료공단 서울보훈병원 |
|
’05.6.15 |
’04.4.8 |
(계속)
|
지정번호 |
기관명 |
지정일자 |
지정번호 |
기관명 |
지정일자 |
||||
|
임상1상 |
임상2상 |
임상3상 |
임상1상 |
임상2상 |
임상3상 |
||||
|
90 |
강릉원주대학교 치과병원 |
|
|
’04.5.13 |
134 |
동국대학교 한의대 분당한방병원 |
|
’09.6.3 |
’09.6.3 |
|
91 |
제주대학교 병원 |
|
’04.5.13 |
’04.5.13 |
135 |
국립공주정신병원 |
|
’09.7.9 |
’09.7.9 |
|
92 |
동의대학교 부속한방병원 |
|
’04.6.3 |
’04.6.3 |
136 |
대전대학교 둔산한방병원 |
|
’09.7.22 |
’09.7.22 |
|
93 |
건국대학교 충주병원 |
|
|
’04.6.12 |
137 |
한국보훈복지의료공단 대구보훈병원 |
|
’09.7.24 |
’09.7.24 |
|
94 |
전남대학교 화순병원 |
|
’04.11.11 |
’04.6.12 |
138 |
대항병원 |
|
’09.7.30 |
’09.7.30 |
|
95 |
메리놀병원 |
|
|
’04.6.18 |
139 |
의료법인 동강의료재단 동강병원 |
|
’09.8.19 |
’09.8.19 |
|
96 |
청주성모병원 |
|
’06.5.19 |
’04.9.6 |
140 |
서울특별시 은평병원 |
|
’09.11.9 |
’09.11.9 |
|
97 |
대동병원 |
|
|
’04.10.12 |
141 |
부산보훈병원 |
|
’09.12.15 |
’09.12.15 |
|
98 |
의료법인 한라병원 |
|
’04.11.5 |
’04.11.5 |
142 |
의료법인 영서의료재단 천안충무병원 |
|
’09.12.24 |
’09.12.24 |
|
99 |
건국대학교 병원 |
|
’06.3.17 |
’04.11.26 |
143 |
글로리병원 |
|
’10.3.9 |
’10.3.9 |
|
100 |
건양대학교 병원 |
|
’04.12.1 |
’04.12.1 |
144 |
대전대학교부속천안한방병원 |
|
’10.3.23 |
’10.3.23 |
|
101 |
성광의료재단 차병원 |
|
’05.1.13 |
’05.1.13 |
145 |
차의과대학교부속구미차병원 |
|
’10.3.31 |
’10.3.31 |
|
102 |
명지의료재단 명지병원 |
|
’05.1.19 |
’05.1.19 |
146 |
베데스다병원 |
|
’10.4.20 |
’10.4.20 |
|
103 |
강원대학교 병원 |
|
’05.1.20 |
’05.1.20 |
147 |
서울송도병원 |
|
’10.5.28 |
’10.5.28 |
|
104 |
창원파티마병원 |
|
|
’05.5.7 |
148 |
의료법인혜원의료재단 세종병원 |
|
’10.5.31 |
’10.5.31 |
|
105 |
강릉아산병원 |
|
|
’05.8.11 |
149 |
인제대학교 해운대백병원 |
|
‘10.6.14 |
’10.6.14 |
|
106 |
경원대학교부속 길한방병원 |
|
|
’05.8.29 |
150 |
동남권원자력의학원 |
|
’11.3.8 |
’11.3.8 |
|
107 |
동국대학교 병원 |
’05.9.14 |
’05.9.14. |
’05.9.14. |
151 |
동신대학교 부속 순천한방병원 |
|
’11.3.28 |
’11.3.28 |
|
108 |
효산의료재단 샘안양병원 |
|
|
’05.10.24 |
152 |
칠곡경북대학교병원 |
|
’11.4.4 |
’11.4.4 |
|
109 |
대진의료재단 분당제생병원 |
’05.11.04 |
’05.11.4. |
’05.11.4. |
153 |
예수병원유지재단 예수병원 |
|
’11.4.29 |
’11.4.29 |
|
110 |
대전대학교 부속한방병원 |
|
’05.12.28 |
’05.12.28 |
154 |
부산대학교한방병원 |
|
’11.5.24 |
’11.5.24 |
|
111 |
성균관대학교 삼성창원병원 |
|
|
’06.5.23. |
155 |
순천성가롤로병원 |
|
’11.7.6 |
’11.7.6 |
|
112 |
상지대학교 부속한방병원 |
|
|
’06.6.2. |
156 |
삼육서울병원 |
|
’11.7.28 |
|
|
113 |
광주기독병원 |
|
’06.6.5 |
’06.6.5 |
157 |
순천향대학병원부속 구미병원 |
|
’11.8.18 |
|
|
114 |
경희대학교 동서신의학병원 |
’06.8.17 |
’06.8.17 |
’06.8.17 |
159 |
베데스다삼성병원 |
|
’12.1.10 |
|
|
115 |
부산성모병원 |
|
’06.12.26 |
’06.12.26 |
160 |
원광대학교 익산한방병원 |
|
’12.1.11 |
|
|
116 |
원광대학교 산본한방병원 |
|
’07.1.8 |
’07.1.8 |
161 |
국립경찰병원 |
|
’12.1.26 |
|
|
117 |
경희대학교 강동한방병원 |
|
’07.2.9 |
’07.2.9 |
162 |
미즈메디병원 |
|
’12.3.19 |
|
|
118 |
동국대학교 일산 한방병원 |
|
’07.2.9 |
’07.2.9 |
163 |
익산의료재단 메트로병원 |
|
’12.5.30 |
|
|
119 |
국립부곡병원 |
|
’07.8.23 |
’07.8.23 |
164 |
연세대학교 용인세브란스병원 |
|
’12.5.30 |
|
|
120 |
김원묵기념봉생병원 |
|
’07.10.29 |
’07.10.29 |
165 |
연세사랑병원 |
|
’12.8.6 |
|
|
121 |
국립나주병원 |
|
’07.12.4 |
’07.12.4 |
166 |
성애병원 |
|
’12.9.10 |
|
|
122 |
자생한방병원 |
|
’08.2.27 |
’08.2.27 |
167 |
의료법인대우의료재단 대우병원 |
|
’12.11.1 |
|
|
123 |
대구한의대학교 대구한방병원 |
|
’08.3.28 |
’08.3.28 |
168 |
모코리한방병원 |
|
’12.12.3 |
|
|
124 |
세명대학교 부속 제천한방병원 |
|
’08.3.28 |
’08.3.28 |
165 |
연세사랑병원 |
|
’12.8.6 |
|
|
125 |
세명대학교 부속 충주한방병원 |
|
’08.5.20 |
’08.5.20 |
166 |
성애병원 |
|
’12.9.10 |
|
|
126 |
동신대학교 부속 한방병원 |
|
’08.7.3 |
’08.7.3 |
167 |
의료법인대우의료재단 대우병원 |
|
’12.11.1 |
|
|
127 |
건양의료재단 김안과병원 |
|
’08.7.30 |
’08.7.30 |
168 |
모코리한방병원 |
|
’12.12.3 |
|
|
128 |
베스티안병원 |
|
’08.8.7 |
’08.8.7 |
169 |
양지병원 |
|
’13.2.4 |
|
|
129 |
누네안과병원 |
|
’08.8.20 |
’08.8.20 |
170 |
한림대학교 동탐성심병원 |
|
’13.2.4 |
|
|
130 |
우석대학교 전주한방병원 |
|
’08.12.23 |
’08.12.23 |
171 |
비에이치에스한서병원 |
|
’13.4.2 |
|
|
131 |
양산부산대학교병원 |
|
’08.12.24 |
’08.12.24 |
172 |
씨엠충부병원 |
|
’13.5.8 |
|
|
132 |
광주보훈병원 |
|
’09.1.9 |
’09.1.9 |
173 |
제일안과병원 |
|
’13.7.10 |
|
|
133 |
용인정신병원 |
|
’09.3.6 |
’09.3.6 |
총 163개 임상시험실시기관 지정 |
||||
|
출처 : 식약처 임상제도과(ʼ13.7.12) 자료를 토대로 필자 작성 |
|||||||||
[표 4-7-4] 국내 대표적인 2개 비임상 CRO 회사 현황(2013년 9월 현재)
 * 기업 자료를 토대로 작성
* 기업 자료를 토대로 작성
[표 4-7-5] 국내 대표적인 4개 임상 CRO 회사 현황(2013년 9월 현재)

* 기업 자료를 토대로 작성
다. 발전 전망
생명공학 인프라 분야는 생물산업의 발전을 위한 하부구조를 구성하며, 기초연구에서 사업화까지의 전 과정에 걸쳐 다양한 역할을 통해 필요한 분야이다. 일반적으로 R&D 지원 인프라를 세부적으로 구분하면, 고가의 장비지원(연구용· 분석용·시제품용 등), 교육훈련지원, 정보화지원, 표준화지원, 국제협력 지원, 신뢰성평가지원, (비)임상지원, 생산지원, 입주공간 등 공간지원, 마케팅지원, 위탁생산 등으로 구분이 가능하나, 실질적인 R&D 생산성 및 전문성 제고를 위해서는 이러한 다양한 인프라 서비스가 효과적으로 결집된 형태로 운영되는 것이 중요하다. 특히, 전문인력의 안정적인 확보를 통한 특성화, 종합화된 인프라의 내실화 지원은 R&D 활동의 전주기적인 지원체계 확립 차원에서 매우 중요하다.
기 구축된 공공연구소, 산업화 및 신뢰성 단계의 인프라 시설은 그 역할이 매우 중요하며, 앞으로도 생명공학 인프라의 발전을 위해서 인프라간 연계성 강화, 관련 주무부처간 협조체계 강화 및 예산 확대, 글로벌 경쟁력 제고를 위한 인프라 내 전문인력의 지속적인 확보 및 지원서비스 개발이 강화될 필요가 있으며, 선진국형 생물제품평가 인프라(GLP, GCP, GMP 내실화)의 지속적 지원은 생물산업의 성장을 가속화할 것이다.
특히, GLP, GCP 등과 관련하여 글로벌 수준의 (비)임상 CRO 인프라 확충을 위해서는 국내 민간 CRO 시스템의 선진화를 통한 역량강화, CRO 기관간 원활한 정보 교류를 통한 네트워킹 활성화와 상호협력 강화, 정부차원의 공공 CRO 인프라 조성, 전문인력 개발, 국내외 특허 및 가이드라인 등에 대한 정보제공 등 강화를 위해 산·학·연·관이 함께 노력해야 할 것이다.
아울러, 건강한 생명 중심사회와 풍요로운 바이오경제 구현을 위해, 세계 최고 수준의 생물공학 기술 및 제품에 대한 질적 수준 제고, 품질확보, 연구역량 강화 등을 위한 지속적인 인프라 확충과 관련 R&D 부문에 투자 확대가 절대적으로 필요하다. 이를 토대로 국내 산학연 공동연구 강화, 국내 기업의 우수한 기술과 제품 수출 등을 통한 해외 시장 선점이 필요하다.
[표 4-7-6] 바이오분야 산업화 인프라 지원 현황 및 주요 성과(2013년 8월말 현재)
|
광역 경제권 |
특화분야 |
사업구분 |
과제명(사업기간) / 지원기능 |
주관기관(URL) |
정부 지원금 (~‘13) (억원) |
2013년도 8월말 현재 주요 실적 |
||||||
|
건물 면적 (평) |
인력 (명) |
입주 기업 (개) |
장비 구축 (대) |
기술 지도/ 상담(건) |
교육 훈련 (건) |
수익금 현황 (백만원) |
||||||
|
수도권 |
복합지원(의약/산업/그린) |
네트워킹 |
코리아바이오허브구축(’04~)/[기타-연구장비] |
한국바이오협회 www.koreabio.org |
237.80 |
752 |
89 |
5 |
175 |
14 |
101 |
13 |
|
의약바이오 |
cGMP |
생물산업기술실용화센터건립(’98~’07)/[GMP] |
(주)바이넥스 www.bi-nex.com/songdo |
898.00 |
2,660 |
58 |
|
213 |
28 |
8 |
15,000 |
|
|
의약바이오 |
산기반 |
바이오개량신약제제화공동연구기반구축(’06~’11)/[PP, GMP] |
경기과학기술진흥원 경기바이오센터 www.ggbc.or.kr |
50.00 |
9,687 |
31 |
27 |
110 |
243 |
22 |
1,784 |
|
|
산업/그린바이오 |
산업융합원천 |
건강기능식품플랫폼(’09~’14/[기타-연구장비] |
한국식품연구원 www.kfri.re.kr |
40.00 |
|
|
|
|
39 |
|
|
|
|
충청권 |
의약바이오 산업/그린바이오 산업/그린바이오 산업/그린바이오 산업/그린바이오 |
BVC LMO LMO LMO 산기반 |
(BVC)생물의약TIC(’99~’04)/[PP, GMP] 바이오안전성정보기반구축(’02~계속)/[기타-안전성정보] 바이오안전성의정서운영(’08~계속)/[기타-안전성정보] LMO위해성평가센터구축(’04~’07)/[기타-안전성정보] 단백질소재의산업적활용 극대화를위한기반구축(’05~’10)/[기타-연구장비] |
한국생명공학연구원 bvc.kribb.re.kr www.biosafety.or.kr
biocat.or.kr |
50.30 86.37 13.40 124.52 45.25 |
700 40
85 |
10 15
2 |
58
|
47 1 1
37 |
244
8 |
178 34
19 |
690
189 |
|
의약바이오 의약바이오 산업/그린바이오 |
산업융합원천 산업융합원천 산업융합원천 |
신약개발플랫폼(’09~’14)/[기타-연구장비] Drug Repositioning 기술을 이용한 신약개발 활용 시스템 구축(’10~’15)/[기타-연구장비] 바이오화학실용화센터(’10~’14)/[PP] |
한국화학연구원www.ddpt.krict.re.kr www.krict.re.kr www.krict.re.kr |
89.00 66.00 71.00 |
1,500 2,865 |
21 28 22 |
|
9 3
|
100
|
15
|
|
|
|
의약바이오 의약바이오 |
지역클러스터 지역클러스터 |
바이오벤처타운조성(’02~’07)/[GMP] (2단계)바이오의약산업화허브구축사업(’08~’10)/[GMP] |
(재)대전테크노파크 www.daejeontp.or.kr |
260.66 49.00 |
3,427
|
35
|
35
|
351
|
65
|
358
|
3,761
|
|
|
복합지원(의약/산업/그린) |
BVC |
(BVC)생물의약및식품TIC(’01~’06)/[PP, 공인검사] |
영동대학교 www.biotic.re.kr |
46.80 |
813 |
7 |
|
63 |
36 |
73 |
468 |
|
|
의약바이오 의약바이오 의약바이오 |
지역클러스터 지역클러스터 지역클러스터 |
보건의료산업종합지원센터건립(’04~’07)/[PP, GMP, 공인검사] 전통의약품개발지원센터건립(’03~’07)/[PP, 공인검사] (2단계)한방산업클러스터고도화사업(’08~’10)/[PP, 공인검사] |
(재)충북테크노파크 www.cbtp.or.kr/cbhic www.cbtp.or.kr/cbomc |
124.70 97.97 15.87 |
1,230 444 299 |
14 8
|
17 4 11 |
124 179 12 |
196 613
|
41 34
|
140 1,377
|
|
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
동물자원사업화지원센터건립(’03~’07)/[PP, GMP, 공인검사] (2단계)충남농축산바이오산업생산지원인프라구축사업(’08~’10)/[PP, GMP, 공인검사] |
(재)충남동물자원센터 www.cnasc.or.kr |
47.87 25.00 |
1,347 |
18 |
19 |
249 |
11 |
29 |
102 |
|
|
호남권 |
산업/그린바이오 산업/그린바이오 산업/그린바이오 |
BVC 지역클러스터 지역클러스터 |
(BVC) 생물벤처기업지원센터설립(’00~’04)/[PP, GMP, 공인검사] 바이오파크인프라구축(’05~’08)/[PP, GMP, 공인검사] (2단계)발효식품소재완제품화일괄지원시스템구축사업(’08~’10)/[PP, GMP, 공인검사] |
(재)전라북도생물산업진흥원 www.jib.re.kr |
50.62 143.45 22.50 |
4,365 |
48 |
81 |
382 |
242 |
112 |
1,282 |
|
산업/그린바이오 |
산기반 |
기능성식품 임상시험지원센터설립(’04~’09)/[공인검사] |
전북대학교 www.ctcf2.com |
49.73 |
379 |
24 |
|
145 |
1,053 |
110 |
750 |
|
|
산업/그린바이오 |
발효산업 |
발효미생물종합활용센터건립(’07~’10)/[PP] |
순창군 장류연구소 www.kochujang.go.kr |
234.00 |
3,956 |
30 |
4 |
330 |
15 |
31 |
188 |
|
|
산업/그린바이오 |
BVC |
(BVC)생물산업산학연협동연구및실용화기반구축(’00~’04)/[PP] |
동신대학교 www.bic.re.kr |
50.00 |
1,600 |
6 |
131 |
359 |
384 |
|
358 |
|
|
산업/그린바이오 산업/그린바이오 의약바이오 의약바이오 의약바이오 산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 지역클러스터 지역클러스터 지역클러스터 지역클러스터 지역클러스터 |
전남생물식품사업화지원센터건립운영(’02~’07)/[PP, GMP] (2단계)건강기능식품소재산업지원기반구축사업(’08~’10)/[PP, GMP] 전남생물농업산학공동연구센터건립운영(’02~’07)/[PP, GMP] (2단계)생물의약품완제라인구축사업(’08~’10)/[PP, GMP] 독감백신원료생산기반구축(’05~’08)/[PP, GMP] 친환경생물산업클러스터구축(’07~’09)/[PP, 공인검사] 전남특산자원산업화기반구축(’07~’10)/[PP] |
(재)전라남도생물산업진흥재단 www.jbio.org www.biohub.re.kr www.jbf.kr, www.jbc.re.kr www.jinr.re.kr www.jbf.kr www.jinr.re.kr |
304.00 25.00 173.80 25.60 128.33 128.31 89.29 |
4,114
5,389 2,420 9,900 8,513 1,212 |
26
34
130 32 18 |
18
8
44 10 |
602
300
29 285 514 |
451
2
125 80 |
27
35
65 45 |
1,638
2,100
700
|
|
|
동남권 |
산업/그린바이오 |
BVC |
(BVC)마린바이오기능성물질연구기반구축(’02~’07)/[PP] |
신라대학교 mcbi.silla.ac.kr |
45.46 |
1,538 |
12 |
44 |
164 |
105 |
88 |
619 |
|
융합바이오 융합바이오 |
지역클러스터 지역클러스터 |
차세대 의생명융합산업지원센터 구축사업(’05~’08)/[] 첨단 의생명테크노타운 건립 사업(’09~’11)/[] |
(재)김해시차세대의생명융합산업지원센터 www.gbmc.or.kr |
58.00 88.00 |
955 2,699 |
16
|
13 12 |
38 14 |
302
|
66
|
475 566 |
|
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
해양생물산업육성센터(’04~’08)/[PP, GLP, 공인검사] (2단계)해양산업안전성확보기반구축사업(’09~’11)/[PP, GLP, 공인검사] |
(재)부산테크노파크 www.mbdc.or.kr |
113.89 20.00 |
2,628 442 |
11 11 |
10
|
361 284 |
67
|
17
|
836 116 |
|
|
산업/그린바이오 산업/그린바이오 |
BVC 지역클러스터 |
(BVC) 생물화학소재산업지원센터설립(’00~’04)/[PP] 바이오벤처프라자건립(’04~’08)/[PP] |
(재)바이오21센터 www.bio21.or.kr |
50.00 28,89 |
1,071 752 |
28 11 |
19 11 |
286
|
226 9 |
42 6 |
108 |
|
|
대경권 |
산업/그린바이오 산업/그린바이오 의약바이오 의약바이오 |
지역클러스터 지역클러스터 지역클러스터 지역클러스터 |
전통생물소재산업화센터(’04~’08)/[GMP] (2단계)건강기능소재산업육성기반정비사업(’09~’12)/GMP] 한방산업지원센터기반구축(’04~’08)/[PP] (2단계)한방산업육성기반정비사업(’09~’11)/[PP] |
(재)대구테크노파크 www.dbic.or.kr www.omisc.or.kr |
106.40 20.08 34.46 5.00 |
1,303 381 1,264
|
38
15
|
5
9
|
15
121
|
30
888
|
49
96
|
100
474
|
|
산업/그린바이오 |
BVC |
(BVC)생물농업및식품용생물소재TIC(’01~’06)/[PP, GMP] |
경북대학교 sc.knu.ac.kr |
42.07 |
550 |
4 |
7 |
100 |
115 |
61 |
338 |
|
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
생물건강산업사업화지원센터건립(’02~’07)/[PP, GMP, 공인검사] (2단계)경북기능성바이오소재산업기반정비사업(’08~’12)/[PP, GMP, 공인검사] |
(재)경북바이오산업연구원 www.gib.re.kr |
137.48 27.00 |
2,543
|
21
|
36 7 |
256 59 |
444
|
198
|
3,962 1,175 |
|
|
산업/그린바이오 |
지역클러스터 |
해양생명환경산업지원센터건립(’04~’07)/[PP] |
(재)경북해양바이오산업연구원 www.gimb.or.kr |
80.00 |
1,812 |
33 |
17 |
94 |
59 |
20 |
|
|
|
산업/그린바이오 |
지역클러스터 |
포항테크노(바이오)정보지원센터건립(’07~’10)/[공인검사] |
(재)포항테크노파크 www.pohangtp.org |
69.61 |
906 |
5 |
1 |
58 |
67 |
72 |
4,897 |
|
|
강원권 |
복합지원(의약/산업/그린) 복합지원(의약/산업/그린) 복합지원(의약/산업/그린) |
BVC 지역클러스터 지역클러스터 |
(BVC) 생물산업벤처기업지원기반조성(’98~’02)/[PP, GMP] 춘천바이오타운조성(’02~’07)/[PP, GMP, 공인검사] (2단계)생물의약소재시험생산지원기반정비(’08~’11)/[PP, GMP, 공인검사] |
(재)춘천바이오산업진흥원 www.cbf.or.kr www.cbf.or.kr |
58.00 172.30 37.20 |
5,927 |
30 |
41 |
213 |
502 |
56 |
2,008 |
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
강릉해양생물산업지원센터(’02~’07)/[PP] (2단계)해양의용식품사업화지원기반구축사업(’08~’11)/[PP] |
(재)강릉과학산업진흥원 www.gsif.or.kr |
225.87 17.90 |
2,127 |
16 |
32 |
355 |
300 |
1 |
1,178 |
|
|
제주권 |
산업/그린바이오 |
BVC |
(BVC)기능성바이오첨가제및생물자원TIC(’01~’06)/[PP, GMP, 공인검사] |
제주대학교 chejutic.cheju.ac.kr |
47.70 |
550 |
16 |
14 |
85 |
169 |
189 |
652 |
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
바이오사이언스파크(’02~’07)/[PP, GMP] (2단계)제주건강·뷰티생물산업기반정비사업(’08~’12)/[PP, GMP] |
(재)제주테크노파크 www.jejutp.or.kr |
210.69 228.70 |
3,463 |
34 |
42 |
1,102 |
907 |
72 |
315 |
|
|
합계 |
5,802.48 |
100,882 |
1,024 |
792 |
7,743 |
8,139 |
2,370 |
48,359 |
||||
출처 : 필자 자체조사 후 정리

1. 법과학
가. 개요
ʻʻ법과학ʼʼ 이란 과학기술을 활용하여 각종 범죄사건에 대한 수사 및 사법적 판단에 도움을 주는 학문들을 일컬으며, 기존의 과학기술을 응용함과 동시에 보편성과 객관성, 신뢰성을 담보하는 과학 분야들을 망라한다. 법집행기관에서 의뢰되는 증거물(physical evidences)1)의 분석과 시신의 법의학적 부검을 뜻하는 고전적인 의미에 더하여, 현장 증거물의 수집과 과학적인 수사기법을 포괄하는 광의의 의미로도 쓰여지고 있다. 최근 유럽연합 회원국가의 법과학 관련 기관 네트워크인 ENFSI(European network of forensic science institute)에서 구성된 분야별 Working group기준에 따르면 그림 4-8-1과 같이 총 17개 분야의 기술․업무 분류를 통해 전문가 집단 간의 의견교환과 연구개발, 품질관리 업무를 시행하고 있다. 또 다른 측면인 법과학 시험분야의 품질관리를 위한 국제신뢰성 인정체계인 ISO/IEC 17025의 법과학 분류에 따르면 법독성학, 규제물질류, 면역혈청학, DNA감식, 미세증거물분석, 총기 및 탄도학, 문서감정, 흔·흔적(물리적 분석), 지문감식, CSI 등의 범죄현장조사, 화재 및 교통사고 등의 사고조사, 법의병리학, 법치의학, 법곤충학, 오디오/비디오 /컴퓨터 과학 등으로 나뉘고 있다.

[그림 4-8-1] ENFSI(유럽법과학네트워크)의 분야별 법과학 분류 및 Working Group 구성
이같이 법과학 분야는 업무의 다양성과 각 국가별 법과학기관의 조직체계에 따라 조금씩 그 분류가 달라지고는 있으나, 가능한 모든 범죄 및 사고 유형이 그 대상인 관계로 DNA감식을 비롯한 법생물학 분야, 독성물질 및 규제약물류를 포괄하는 법독성학 분야, 법의학, 심리학, 음성학, 영상 분석 및 컴퓨터 과학, 화재조사, 총기 및 폭발물 분석과 안전사고를 분석하는 법공학, 교통과학, 미세물질 분석 등을 위한 법화학 등 수많은 분야의 과학기술이 모두 해당되어 영문으로는 forensic sciences로 표기하고 있다. 이같이 다양한 법과학 기술분류 체계임에도 불구하고, 이들은 모두 사법기관 및 수사기관의 법집행 결정을 지원하는 공통적인 업무를 수행하고, 있으며 다른 과학기술에 비하여 보다 엄격하고 보수적인 품질 요건이 요구되고 있다.
법과학기술은 의뢰기관의 목적을 반영하여 ① 범죄 행위자 증명, ② 범죄행위 증명, ③ 사인규명, ④ 사고원인 조사를 그 목표로 하고 있다. 또한, 범죄 증명을 위해 각 증거물에 대한 다양한 기술들의 융합적이고 상호 보완적인 기술을 활용하는 특징을 가지고 있다. 국가 과학기술표준분류에 따르면, 법과학은 크게 범 BT분야(생물학 및 융합기술을 기반으로 한 생체시료 및 미지물질 분석, 음성 및 얼굴 영상 인식 기술, 심리·생리학적 검사, 사인 및 인체 손상 해석 등)와 공학적 분야(디지털 데이터 복원, 화재, 교통 등 안전사고 원인 조사)로 분류가 가능할 것으로 판단된다.
최근 국내·외 법과학 관련 연구개발 동향을 살펴보면, 기존 살인 강도 및 성폭력 등 강력사건에 대한 해결과 함께 재난안전사고, 기업형 범죄, 보건·환경 관련 범죄, 보안관련 문제 해결 및 사이버 범죄 등 다양한 분야에 대한 해결을 위한 법과학적 기술 개발 및 적용이 그 초점이 되고 있으며, 수사기관의 주요 목적인 범인 검거를 위한 개인식별(범죄행위자 증명) 업무와 관련된 DNA감식과 디지털 영상 복원 기술 등에 중점 투자되는 경향을 보인다.
나. 해외 동향
(1) 세계 각국의 법과학·과학수사 관련 기관 현황
각국의 법과학·과학수사관련 기관들은 각 나라별 사법체계에 따라, 법무부, 내무성, 경찰청 등의 치안관련 주무부처 또는 식약청 등과 같은 보건부에 설립되어 있다(그림 4-8-2). 최근에는 업무의 중립성을 위해 독립기관인 국가법과학원(National Institute of Forensic Science) 설립 운동이 호주 및 유럽을 중심으로 나타나고 있다. 이들 기관은 지속적으로 그 업무와 조직 구조가 확장되는 경향을 보이는데, 이는 지속적인 DNA 데이터베이스 구축과 공판중심주의 사법제도 등의 영향으로 역할이 증대되는 것에 따른 것으로 보인다.

[그림 4-8-2] 해외 법과학․과학수사 관련 기관 동향
(2) 세계 법과학 분야의 성장
세계 법과학 분야의 시장규모 및 성장을 살펴보면, 지문인식, 홍채인식, 음성인식, DNA분석 등과 관련한 제품 시장과 서비스 시장을 포함한 세계 법과학 시장은 2010년 약 22조원 규모에서 2016년 약 38조원 규모로 1.7배 성장할 것으로 전망되고 있으며, 이 중 DNA 분석관련 법과학 시장은 2010년 약 2.8조원에서 2016년 5.5조원으로 1.9배 성장할 것으로 전망되고 있다(표 4-8-1).
[표 4-8-1] 세계 법과학 관련 시장규모
(단위: 억원)
|
구분 |
2010년 |
2011년 |
2012년 |
2013년 |
2014년 |
2015년 |
2016년 |
|
법과학 전체 |
222,200 |
243,087 |
265,937 |
290,935 |
318,283 |
348,202 |
380,932 |
|
DNA 분석 |
28,600 |
31,918 |
35,620 |
39,752 |
44,363 |
49,509 |
55,252 |
출처 : Forensic Technologies: New and Growing Markets, BCC research(2011.5)
(3) 국제적 법과학 R&D 확대 추세
지속적으로 성장하는 세계 법과학 시장 및 국제적인 경쟁의 가속화에 따라 해외 주요국은 법과학적 DNA관련 연구와 디지털 포렌식관련 연구 등에 집중 투자하고 있으며, 법과학 분야의 과학수사 연구개발 필요성 증대에 따라 유관기관간 공동협력을 모색하고, 주요 분야에서 법적증거물로서의 신뢰성 및 유효성 확보를 위한 연구개발을 진행하고 있다.
(가) 미국 동향
미국 국토안보부(Department of Homeland Security)의 경우, 법과학분야의 중요성을 인식하여 법과학 R&D 예산을 2011년 20백만달러(약 213억원)에서 2012년 25백만달러(약 266억원)으로 25% 증액하였다.
미국의 경우, 산·학·연 협업체계의 모법사례로 꼽히고 있는데, 현재 전 세계 DNA감식시장의 90% 이상을 점유하는 Life technology사와, 미 표준연구소(NIST) 중심의 표준화 연구개발 예산과, 미연방수사국 연구소(FBI Lab.) 중심의 법과학 관련 유효성 검증 및 신기술개발의 가이드라인 작성 등의 역할 분담체계를 지니고 있다. 또한 정부차원의 DNA감식 인프라 구축과 DB확장을 위해 법과학 기반 예산2)에 대한 대폭적인 지원 역시 이루어지고 있는 실정이다.
(나) 유럽의 동향
유럽연합은 회원국들간의 법과학 네트워크(ENFSI, European Network of Forensic Science Institute)를 구성(그림 4-8-3), 공동 기금을 활용하여 법과학 연구개발사업의 활성화를 도모하고 있다.

[그림 4-8-3] 유럽 법과학 연구소 네트워크(ENFSI) 구조
유럽연합 집행위원회(EU Commission)로부터 조달하는 것으로 2007~2013년까지 진행되는 6억 유로의 금액이 Prevention of and Fight against crime(ISEC) 명목으로 구성된 프로젝트로부터 연구자금을 지원받아 연구를 진행하고 있다.
(다) 중국의 동향
최근 1,500만명의 관계자 대조시료 데이터베이스를 구축하여 전 세계 최대 DNA DB를 확보한 중국의 경우, 자체 개발한 DNA감식키트와 자동유전자 추출 장비 등을 직접 감정에 활용하여 국내 산업 발전과 선순환 구조를 정착시키고 있으며, 이를 바탕으로 동남아시아 등의 해외 시작 개척에 나서고 있는 실정이며, 성장률이 높은 DNA 및 디지털 관련 시장에 집중 투자함과 동시에, 법과학의 다양한 연구수요를 반영하여 기초분야에 대한 투자 역시 병행되고 있다.
중국의 경우 공안부 소속 IFS(Institute of Forensic Science)를 통해 사건의 법과학 감정과 관련 연구개발을 추진하고 있으며, 공공기관으로부터 의뢰받은 감정물에 대한 감정뿐만 아니라, 사회단체 및 개인으로부터 교통사고, 시민 분쟁과 같은 중요 사건을 위탁받아 감정업무를 수행하고 있고, 관련 연구개발사업은 과학기술부(Ministry of Science and Technology)와 국가자연과학재단(National Natural Science Foundation), 법무부, 상해지방과학기술위원회(Shanghai Municipal Scientific and Technological Commission) 등으로부터 지원받아 법과학 전 분야에 투자하고 있으며, 각 대학 및 산업체와의 연계를 통해 개발 제품의 유효성 평가 및 검증을 시행하고 있다.
(라) 국외 법과학 R&D관련 주요 이슈
법과학 분야 연구개발 필요성 증대에 따라 해외 각국들은 유관 기관 간 공동협력을 모색하고, 범죄 유형 및 사법 환경변화에 따라 주요 분야에 법적증거물로서의 신뢰성 및 유효성 확보를 위한 연구개발을 진행하고 있다. DNA관련 감식은 모든 나라에서 가장 큰 이슈로 생각하여 연구를 진행하고 있고, 그 외에도 대학 및 연구 기관들을 중심으로 하여 컴퓨터 및 인터넷 관련 범죄에 대응하기 위해 디지털 및 모바일 관련 연구도 증가하는 추세에 있다. 뿐만 아니라 ISO 17025와 같은 확립된 표준을 검토하고 자문위원회의 자문을 거쳐 보고서나 증언 과정에서 법과학 수사의 결과에 사용될 표준 용어들을 확립하는 쪽으로 연구방향을 잡아가는 등 연구의 유효성 평가나 공인시험법 등 또한 주요 이슈로 대두되고 있는 실정이다.
시장개척을 위한 신제품 및 신기술 연구개발과 동시에, 국제적인 법과학 표준프로토콜 및 법과학 분야별 규격(Minimum requirement Document) 제정 움직임이 국제법과학연맹(IFSA, International Forensic Strategy alliance) 및 권역별 협의체인 ASCLD(미주 법과학 품질보증 및 국제협력 협의체), AFSN(아시아 법과학 협의체) 등을 중심으로 2014년까지 시범적으로 3개 분야(DNA, 불법약물, 현장감식)에 대해 수립될 예정이며, 향후 국제 법과학 네트워크 및 시장은 권역별 협의체3)를 중심으로 블록화 될 전망이다. 이는 글로벌화 된 국제 생활 환경과 국가 간 DNA 데이터베이스 조회, 사이버 범죄 등에 대한 국제 공조 등으로 권역별 법과학 표준 통일의 필요성이 증대되고 향후 법과학 관련 연구개발 성과(시약, 장비 등의 제품과 프로그램 등)가 보다 치열한 국제적 경쟁 체제로 전환될 것을 예상할 수 있는 시사점이다.
다. 국내 현황
(1) 국내 법과학 및 과학수사 관련 기관 현황
국내 과학수사 및 법과학 관련 시험검사·연구기관(그림 4-8-4)으로는 안전행정부 국립과학수사연구원, 경찰청 과학수사센터 및 사이버대응센터, 검찰청 과학수사기획관실, 국방부 조사본부 과학수사연구소, 해양수산부 해양경찰연구 개발센터 등이 주된 업무를 하고 있다.
이외에도 마약류 및 부정식품관련 업무를 담당하는 식품의약품안전처, 부정원산지 추적 업무와 관련된 농림축산식품부 및 해양수산부, 화재 및 재난 사고 등의 업무를 수행하는 소방방재청과 재난안전연구원 등 여러 국가 기관과 대학 및 시험연구기관 등이 광의의 법과학 업무와 관련 되어 있다.

[그림 4-8-4] 우리나라의 법과학 관련 연구시험기관
(2) 국내 법과학 관련 연구개발사업 현황
현재 국내 법과학 관련하여 국가연구개발사업의 중과제 이상으로 진행되는 사업은 아래 표와 같다.
[표 4-8-2] 법과학 관련 국가연구개발 예산
|
국가연구개발사업명 |
연구사업 소관부처 |
발주 기관명 (수요/참여) |
사업기간 |
총사업비 |
지원조건 |
2013년 예산 |
|
과학수사 감정기법 연구개발사업 |
안전행정부 |
국립과학수사 연구원 |
’08년~계속 |
해당없음 |
직접수행 (시험연구비 및 연구개발비) |
40억 |
|
구매조건 담보 연구개발 사업 (인간 STR키트국산화) |
산업자원 통산부 |
중소기업청 (국과수) |
’11년.9월~ ’13년.8월 |
5억 |
출연금 |
2.5억 |
|
유전자감식 국산화 및 선진화 |
법무부 대검찰청 |
대검찰청 |
’12년~ ’14년(3년) |
60억 |
직접수행 (연구개발비) |
20억 |
|
첨단치안 안전망 개발 |
산업자원 통산부 |
산업기술평가원 (경찰청) |
’11.년6월~ ’13년.6월 |
60억 |
출연금 |
30억 |
|
과학수사를 위한 첨단 분자인지기술 개발사업 |
미래창조 과학부 |
연구재단 (국과수/대검) |
’12년.9월~ ’15년.8월 |
26.2억 |
출연금 |
7억 |
|
디지털 기반의 첨단 과학수사 기술개발 |
미래창조 과학부 |
연구재단 (국과수/대검) |
’12년.10월~ (3+2년) |
25억 |
출연금 |
5억 |
각 기관들은 독립적으로 연구개발 업무를 수행하고 있으나, 현재 법과학 주제와 관련된 계속사업으로 국가연구개발사업 예산을 확보하여 수행하는 기관은 국립과학수사연구원 한곳에 불과하다. 대부분 한시적 사업으로 진행되는 경향을 보이며, 미래창조과학부, 식품의약품안전처 및 보건복지부, 산업통상자원부 등의 정부출연금 관련 R&D 사업에 일부 중과제별 연구개발이 수행되고 있는 실정이다. 국과수의 경우 10 여 가지 법과학 분야들에 대해 연간 약 40억원 투자 규모로 인해 분야별 충분한 투자가 이뤄지지 못하는 실정이며, 타 과제들의 경우 한시적 운영으로 인해 중장기적인 대형과제들의 지속적인 투자에 지장을 초래하고 있다.
최근 부정불량식품이 범죄척결대상인 4대악으로 지정되고, 이에 대한 수사 수요는 급격히 증가되는데 비하여 관련 부처간의 연구개발 성과 공유 및 공동 기획의 부재로 인해 효율적인 업무수행에 지장을 받고 있는 실정은 법과학 관련 연구개발 사업의 재편 필요성을 나타내는 대표적인 사례라고 할 수 있겠다.
(3) 국내 법과학 연구개발사업 성과 및 문제점
(가) 국내 법과학 연구개발 사업 성과
법과학 관련 R&D 사업의 예산 부족과 컨트롤 타워 부재 및 공동 기획 부족에도 불구하고, 그 간의 연구개발사업은 나름대로의 성과를 이뤄왔으며, 실무적용을 통한 사건해결에도 많은 기여를 하여 왔다. 더군다나, 세계에서 56번째 시행 국가로 다소 늦은 감이 있으나, 2010년 10월 DNA신원확인정보의 이용 및 보호에 관한 법률 시행에 따라 국내 DNA감식 관련 업무 확대가 이뤄지고 있는 현실은 관련 R&D 사업에 대한 수요와 관심을 증대시키는 계기가 되었다. 특히 DNA감식 시약을 전량 수입에 의존하는 현실에서 비슷한 시기에 진행된 중기청 구매조건부 R&D사업의 인간STR키트 국산화 과제와 대검찰청 DNA관련 R&D사업은 나름대로의 성과를 바탕으로 향후 국내 시약 수요 충당뿐만 아니라 가격경쟁력을 바탕으로 동남아 국가 등으로의 수출 가능성에 대한 전망이 밝은 편이다. 또한 부족한 예산 상황을 극복하고 집중 투자 분야에 대한 선정을 통해 영상분석 및 디지털포렌식 분야에 대한 투자가 증가된 것은 미래 과학수사 방향에 발맞춘 적절한 선택이라고 판단된다. 2008년 이후, 본격적으로는 2011년부터 각 부처의 R&D사업에 법과학 관련 연구개발과제가 선정되어 투자되고 있으며, 현재 국제 규격에 부합한 국산 DNA감식키트 시제품, 세계 최초의 메스암페타민 모발 표준물질 생산, 영상분석프로그램 국산화를 통한 70억원 상당의 수입대체 효과 달성 등 다양한 분야에서 법과학 실무에 적용 가능한 연구 성과들이 산출되고 있다. 이는 과거 단순한 논문 게재 등의 한계를 극복하고 수요기관의 필요에 부응하는 성과로 판단되며, 2011년도 이후 본격화된 R&D투자에 비례하는 결과이다.
(나) 국내 법과학 연구개발 사업 문제점
외국의 법과학 R&D 투자규모뿐만 아니라, 국내 보건·재난안전 연구개발사업과 비교시 부족한 연구개발예산으로 인해 시의 적절한 R&D 사업 추진이 장애를 받고 있는 사실은 부정할 수 없는 현실이다. 또한 예산부족과 이로 인한 학계 및 산업계의 참여 부족 및 법과학 전문 연구 인력 양성 기반이 취약한 것은, 성과 부족으로 이어져 지속적인 악순환의 원인이 되고 있다.
대표적인 사례로, 출연금 기반 연구개발사업을 수행할 수 있는 관련 법률 부재로 국과수와 대검찰청은 연구용역사업을 수행하고 있는데, 이는 산출물의 소유권이 발주처로 귀속되는 관련 규정들로 인해, 산업계 및 학계의 적극적인 연구참여 의지를 제한하는 결과를 초래하고 있다. 특히, 정부출연 R&D예산을 확보할 수 있는 미래창조과학부, 산업자원통상부의 사업들에 중과제 또는 개별 연구과제 별로 참여·수행되는 법과학 관련 연구 테마들의 경우, 그 사업 목표 및 성과평가 방식 등이 본연의 법과학 연구개발사업에 적합하지 않은 문제점을 극복할 필요성이 존재한다.
또한, 법과학 분야 연구개발 수요는 최근 과학수사 관련 법집행 기관 뿐아니라 식품, 보건 환경 관련 주무부처의 공동 관심분야로 폭발적인 증가를 가져오고 있으나, 제한된 예산의 효율적인 활용을 위한 공동기획 및 컨트롤 타워 부재로 인한 과제중복성과 연구성과 공유의 부진, 특히 법과학 관련 감정기관 및 수사기관의 수요와 동떨어진 산발적 과제 진행이 일부 나타나고 있다. 최근, 미래창조과학부 정식 출범 후 국가과학기술심의위원회에 다부처 공동기획 R&D사업 특위가 발족하고 범부처 R&D사업에 대한 공동기획 논의가 시작된 것은, 현재의 한국 법과학 R&D상황을 극복할 수 있는 다행스러운 계기로 판단되며, 법집행기관과 법과학 및 과학수사 관련 기관들의 적극적인 대응을 통한 한 단계 업그레이드 되는 법과학 R&D사업으로의 재편을 기대해 본다.
라. 발전 전망
ʻʻ범죄로부터 안전한 사회ʼʼ라는 국정목표에 따라 최근 법과학 관련 연구개발사업에 대한 관심이 높아지는 것은 다행스러운 일이다. 그러나 전술한 외국 사례와 국내 현실을 살펴볼 때 법과학 연구개발 분야 기반 조성과 발전을 통한 국가적인 인프라 구축을 위해서는 당면한 과제들이 상당수 존재한다.
무엇보다도 절대적으로 부족한 법과학분야 연구개발예산 증대와 효율적인 연구수행 인프라 구축이 가장 선행되어야 한다. 생명과학부터 물리·화학, 의학, 정보통신, 공학 분야 등 다양한 분야의 학문들이 종합적으로 요구되는 법과학의 특성으로 인해, 현재의 국가과학기술분류와 심의위원회 구조에서 소외되어 왔다. 실례로 국과수의 ʻʻ과학수사 감정기법 연구개발ʼʼ 사업의 경우 지난 5년간 국가과학기술심사위원회의 생명복지 위원회와 거대공공위원회에 교대로 소속되어 심의를 받아 왔으며, 해당 심의위원회와 상이한 과학기술분류에 속하는 연구과제들로 인해 예산확보 결과가 타 분야 특히 재난안전 연구분야와 비교할 때 상당히 저조한 실정이다.
따라서, 법과학을 크게 생명과학분야와 IT·공학분야로 분류하고 이에 따른 연구 수행 인프라를 구축하는 것이 가장 시급한 과제로 판단되며, 이를 해결하기 위한 방법으로 아래의 내용을 제안하고자 한다.
(1) 지원 정책/제도 등 법적근거 마련
먼저, 부족한 예산 문제와 다부처 공동 협력을 위한 체계 구축을 위해서는 정부출연 R&D 예산 확보를 위한 법률적 근거 마련이 장기적으로 필요하다. 재난 및 안전관리 기본법, 나노기술개발 촉진법 등의 경우와 같이 여러 부처가 유기적으로 협조할 수 있는 법률적 근거에 따라 정부출연금을 확보할 수 있도록 가칭 ʻʻ법과학·과학수사 연구개발 촉진법ʼʼ 등의 제정이 필요하다.
특히 국내 법과학 관련 연구비의 50% 이상을 담당하고 있는 안전행정부 국립과학수사연구원과 대검찰청 디지털포렌식센터의 경우 관련 법률 부재로 인해 연구개발예산 중 출연금을 확보하지 못해 개별적 연구용역을 통해 외부 전문가 및 연구기관을 활용하고 있어, 다년간의 중장기적인 대형 연구과제를 수행하기 곤란한 현실이다.
현재 제도적 장치가 미흡하고 업무 분장의 연계성이 부족하여 법과학 관련 부처 및 기관별 역할 분담 및 시너지가 부족한 점을 극복하기 위해 법과학 R&D사업 진흥에 관한 법률과 유관기관 간 업무 협정 법규를 마련하고, 부처 및 관련기관의 책무를 명시하도록 하는 발전방안을 설계할 필요가 있다.
(2) 사회문제 해결 위한 다부처 공동 기획 R&D 사업 추진 필요
차후 관련 법률·제도 제정과 더불어, 과학수사 일선과 사법기관의 수요 및 요구에 대응하여야 하는 법과학의 특성에 따라, 관련 기관들이 공동기획 및 협업을 할 수 있는 ʻʻ다부처 공동 R&D 기획 체계ʼʼ가 필요하다. 현재 안전행정부(국과수 및 경찰청), 법무부(대검찰청), 해양수산부(해양경찰청) 및 국방부(조사본부)와 같은 전통적인 과학수사 관련기관과, 식품·보건 분야와 환경 부분 범죄에 대한 식품의약처, 환경부 등 다양한 부처의 법과학관련 R&D 수요에 대응하고 성과공유를 통한 국내 법과학 관련 인프라 발전을 위해서는 총괄적인 컨트롤 타워 구축과 다부처 공동 기획 시스템을 구축할 필요가 있다. 이러한 다부처 공동기획 시스템에는 사법기관의 재판결과 등을 반영할 수 있는 피드백 시스템과, 산·학·연 연계시스템을 구축할 수 있는 연구개발 부처의 관심 있는 참여가 요구된다.
특히 대규모 중장기적 투자가 필요한 부처 공동과제의 경우, 법집행기관의 수요와 법과학 감정기관의 수요 발굴, 전문연구 기관의 체계적이고 중장기적인 기초원천 기술 연구개발 사업 관리, 그리고 연구성과에 대한 법과학 감정기관의 유효성 검증을 통한 선순환 구조를 구축함으로써, 연구과제 중복 등에 따른 예산의 비효율성을 극복하고 보다 객관적이고 신뢰성 있는 법과학 관련 연구개발사업이 수행될 수 있을 것으로 판단된다.
(3) 법과학 및 과학수사관련 R&D 성과관리체계의 재정립 필요
사법기관의 피드백 등 연구개발 성과의 검증과 신뢰성에 대한 요구가 지속적으로 증가하는 법과학의 특성상, 기존의 특허와 논문실적, 기술료 징수 건수 등 만으로는 법과학관련 연구개발사업의 성과지표로서 부적합하며, 업무의 특성을 고려한 성과평가 체계의 구축이 필요하다.
실제 미국 등 선진국의 경우 법과학 관련 R&D 성과물에 대한 유효성 검증을 최우선으로 평가하는 점 등을 고려할 때, 범죄로부터 안전한 사회 구축을 위한 R&D 사업 목표에 부합하는 실질적인 성과관리체계의 재정립이 법과학 R&D 사업 체질 개선에 중요한 요소로 판단된다. 이러한 시스템 정립을 위해서는 앞서 이야기한 다부처 공동기획 사업을 통한 법과학 R&D 수행과 관련 부처 및 기관간의 역할 분담이 전제되어야 한다. 기존의 각 부처별 개별 추진 사업들의 서로 상이한 성과지표와 R&D성과에 대한 공동 활용체계 부재 시, 그 효과는 국가치안 및 안전 시스템구축에 도움이 되지 못한다. 따라서, 수사기관의 현장 수요와 사법기관의 피드백을 반영하는 성과관리 전략 방향성을 설정이 필요하며, 법과학 관련 감정·연구기관의 활용도 및 유효성 평가에 대한 성과지표도입을 위해, 현재 국립과학수사연구원 등에서 시행하고 있는 국제인정관련 실적지표 등과 같은 감정활용 실적, SOP(Standard Operation Protocol) 제·개정 실적 등과 유효화 보고서 산출 건수 등에 대한 별도의 신규 성과지표가 필요하다.
법과학 관련 연구개발사업은 범죄로부터 안전한 사회 구축을 통해 국민의 생명, 건강과 인권 및 재산을 보호하는 국가 본연의 임무를 위한 인프라구축의 시발점으로, 경제적인 효과로 환산 시 단순한 기술료 징수나 사업화 실적을 뛰어넘는 막대한 사회·경제적인 효과를 지니고 있다. 생명과학과 IT분야 등 다양한 과학기술분야에서 이룬 그간의 국가 R&D성과를 법과학연구개발 사업으로 융합·접목시키고 사회안전망 구축을 위한 도구로 활용함으로써, 국민의 생활에 직접적인 영향을 끼치는 생활공감형 R&D사업으로 체계적인 추진체계(그림 4-8-5)를 갖추기를 희망한다. 이를 통해 국가 법과학 및 과학수사 인프라를 강화하고, 아시아 권역 국가 법과학 업무를 선도하는 기반을 마련할 수 있을 것으로 기대된다.

[그림 4-8-5] 법과학연구개발사업 발전을 위한 제언
2. 노화과학연구
가. 개요
생물학적 노화(biological aging)란 시간이 흐름에 따라, 점진적으로 생명체의 기능은 떨어지며, 생명력, 생식력 또한 감소하면서 종국에는 죽음이 이르게 되는 일련의 생물학적 현상을 의미한다. 좁은 의미의 ʻ노화과학ʼ 이란 ʻ생물학적 노화에 관한 연구ʼ라 할 수 있다. 그러나, 급속한 인구의 고령화에 따른 노인성 만성 질환의 증가, 기능장애 노인의 증가, 노인 의료비 증가, 장기요양보호 대상자의 증가 등을 고려한다면, ʻʻ노화과학ʼʼ 이란 ʻʻ건강수명의 연장ʼʼ과 ʻʻ건강한 노화(Well Aging)ʼʼ를 위한 연구를 포괄하는 의미로 확대 해석하여야 할 것이다. 실제로 2008년에 제안된 ʻ노화과학기술연구 촉진법안ʼ에서는 아래와 같이 노화과학연구를 정의하였다.
노화의 기전 규명을 위한 생물의학적 연구
건강 노화를 유지할 수 있는 생의학적 연구
노화 과정에 따른 질병의 예방과 치료를 위한 기전 연구
일상생활의 원활한 수행을 가능하게 하는 신체의 정신의 기능을 극대화하는 장수 연구
그 밖에 노화 연구와 관련된 정보 획득 및 교육에 필요한 학문 기술 분야의 연구
(1) 노화과학연구의 시급성
(가)급속한 고령화에 따른 노인 의료 비용 증가
① 우리나라는 2011년 현재 65세 이상 인구가 전체의 11.3%(약 549만명)로 세계 역사상 가장 빠른 속도로 고령화가 진행되고 있으며, 이에 따라 만성질환 및 기능저하 노인 수 또한 급격히 증가하고 있다. 2000년에 이미 65세 이상 인구가 7.2%를 넘어서며 UN이 정한 고령화 사회에 진입하였고, 2018년에 고령사회(14%), 2026년에 초고령사회(20%)로 진입할 것으로 예상이 된다(그림 4-8-6).

출처 : 2011년 고령자 통계, 통계청 (http://kostat.go.kr)
[그림 4-8-6] 전체 인구 중 65세 이상 노인 인구의 비율의 변화
② 급속한 고령화에 따른 노인 인구의 증가는 의료비용 및 건강보험의 재정 부담을 증가시키는 주요 원인으로 작용하고 있다(표 4-8-3).
[표 4-8-3] 노인 의료비의 연도별 증가 현황
|
구분 |
2005년 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
연평균 증가율(%) |
|
적용인구*(천명) |
47,103 |
47,392 |
47,820 |
48,160 |
48,614 |
48,907 |
0.5 |
|
노인인구*(천명) |
3,541 |
3,912 |
4,387 |
4,600 |
4,826 |
4,979 |
5.0 |
|
비율(%) (노인/적용인구) |
7.5 |
8.3 |
9.2 |
9.6 |
9.9 |
10.2 |
- |
|
총의료비(억원) |
207,420 |
248,615 |
323,892 |
348,690 |
393,390 |
436,281 |
11.2 |
|
노인 의료비(억원) |
44,008 |
60,731 |
91,189 |
107,371 |
124,236 |
140,583 |
18.1 |
|
비율(%) (노인/총의료비) |
21.2 |
24.4 |
28.2 |
30.8 |
31.7 |
32.2 |
- |
(나) 항노화 산업의 발전과 국내 산업 기반의 취약성
① 전 세계적인 노인인구의 증가로 인하여 건강한 삶에 대한 욕구로 기능성식품, 의료기기 등 항노화산업의 발전이 요구되고 있다. 미국, 일본 등 항노화산업이 활성화된 선도국과 비교할 때, 국내 항노화산업의 규모 및 세계시장 점유율은 매우 미비한 상황이다. 2001년 이후 전 세계적으로 공개된 특허에서 미국이 699건으로 전체 특허의 46%를 보유하여 노화분야 연구 및 기술 개발을 주도하고 있으며, 그 뒤를 잇는 대표적 장수국인 일본의 경우 노화 관련 세계 시장의 9.7%를 차지하고 있다. 더욱이 생명과학 기술의 발전으로 노화의 분자 기전 규명 및 노화 제어 기술 개발이 가시화되어 노화 기초 연구에 기반한 노화 제어 원천기술의 확보는 향후 항노화산업의 발전에 필수적이라 할 수 있으나, 현재 국내에서는 항노화산업의 기반이 되는 기초 노화과학 연구가 매우 시급하다고 할 수 있다(그림 4-8-7).

[그림 4-8-7] 국내 노화과학 연구의 시급성
나. 해외 동향
UN은 21세기 중점연구 분야 및 연구 우선순위로 ʻʻ노화에 대한 연구주제 (Research Agenda on Ageing for the 21st Century)ʼʼ를 제시하였다.
(1) 미 국
미국은 공중보건법(Public Health Service Act) 제9조(Title IX)를 수정하여 「Healthcare Research and Quality Act of 1999」법안 내용에 연구대상 우위 인구집단으로 노인인구를 정하고 있다. 노화과학연구는 NIH(National Institutes of Health)를 구성하는 27개 연구소 중 하나인 NIA(National Institute on Aging)와 AOA(Administration on Aging) 등 공공기관을 중심으로 각 대학 연구소에서 참여하고 있으며 미국 NIA(National Institute on Aging)는 노인건강 및 복지를 증진하기 위하여 노화의 근본을 이해하기 위한 국가 차원의 과학적 연구를 선도하고 있다. 이를 위해 노화과학연구의 4대 목표를 제시하는 등 기초연구 성과의 임상연구 연계를 위한 미래 연구, 프로그램 관리 및 정보 확산 등 노화연구를 위한 인프라 구축에 힘쓰고 있다(표 4-8-4). NIA의 예산은 2013년 한해 11억 달러 이상에 달하며, 이중 10% 수준이 내부연구(intramural research) 예산이며 대부분의 예산은 외부연구(extramural research)에 지원되고 있다. 이는 자체적으로 해결되지 않는 연구들은 외부 대학 또는 연구기관들과 컨소시움 형태의 연구를 추진하거나 독립적인 연구를 수행함으로써, 연구 효율을 높이기 위한 전략이다.
[표 4-8-4] NIA의 노화과학 연구 주요내용
|
4대 주요목표 |
세부목표 |
실행방안 |
|
노인의 건강과 삶의 질 향상 |
노화 관련 질환, 장애 예방 및 감소 |
1. 질환의 원인규명 및 초기진단 향상 2. 신규 치료 및 예방법 개발 3. 건강한 생활습관 및 의약품 사용 4. 질환부담 경감 및 건강증진을 위한 임상연구 실시 5. 임상시험 및 임상연구에 필요한 인프라와 자원 확대 |
|
육체적 건강과 기능 유지 |
1. 노인의 신체장애 속도 감소에 대한 이해 2. 건강한 생활습관 증진을 위한 방법 개발 3. 호르몬 대체법 및 건강보조식품 평가 4. 의료시스템에서 노인과의 상호작용 향상 5. 만성질환 개인대처 향상 및 간병인과 가족부담 경감 |
|
|
노인들의 사회적 역할과 대인관계 형성 기회증가 및 사회적 고립 감소 |
1. 노인의 가치 있는 역할과 독립성 유지에 대한 방법 연구 2. 가족기능 증대 3. 노인 무시 및 학대 감소 4. 건강관리 및 장기요양 향상 5. 임종에 대한 관리 증진 6. 노인과 그 가족들이 질환에 의한 건강, 수입, 기능변화에 대한 대처방안 연구 |
|
|
건강한 노화과정의 이해 |
노화, 건강, 장수의 비밀 규명 |
1. 노화과정 조절인자 연구 2. 인지, 감각 및 물리적 기능을 최대화하는 생물학적․환경적 요소 규명 3. 노화, 장수, 노화질환 및 행동 관련 유전자 발견 4. 건강, 웰빙 및 장수를 증진하는 사회적, 정신적 요소 및 생활습관 연구 5. 정상적 노화와 질환의 연관을 없애는 연구 |
|
뇌의 기능, 인지 및 기타 다른 행동의 유지 및 향상 |
1. 정상 두뇌의 노화와 신경퇴화질환 사이의 차이점 규명 2. 장수노인의 정상인지와 뇌기능 규명 3. 최적의 인지기능을 위한 유전적, 분자적, 세포적, 환경적 요인의 상호작용 이해 4. 학습, 주의, 기억, 언어, 유추, 판단 등 인지에 대한 증진 |
|
|
노인인구 사이의 건강 불균형 감소 |
소수민족그룹 노인의 활동적인 수명 증가와 건강상태 향상 |
1. 소수민족그룹에서의 질병 발생율 및 발생과정 분석 2. 연구에서 소수민족그룹 포함 증가 3. 다양한 인구에 적합한 건강한 노화를 위한 예방법 개발 4. 문화적으로 적합한 건강관리 방법 향상 5. 정보확산을 위한 방법 개발 6. 건강한 생할습관과 건강증진 방법 향상 |
|
인종, 민족, 성별, 환경, 사회경제, 지역, 문화에 따른 건강 차이 이해 |
1. 특정 집단에서의 정상 노화과정 연구 2. 성인건강에 대한 초기수명 인자의 효과 연구 3. 건강차이와 원인 관련 필요 데이터 개발 4. 인종, 문화, 민족의 기능적 정의 증진 5. 인종, 민족, 경제상태, 교육 및 경력이 건강에 미치는 영향 연구 |
|
|
노인의 건강, 경제상태 및 삶의 질 모니터링 및 정책 반영 |
1. 노인건강 및 기능변화 및 요인 연구 2. 정책에 유용한 정보 제공 3. 질환비용, 건강수명, 장수에 대한 비용 및 경제적 부담 데이터 생산 4. 노인인구 및 질환에 대한 전세계 부담 모니터 |
|
|
노화 연구를 지원하는 자원 확대 |
노화연구에 필요한 다양한 연구인력 확보 및 훈련 |
|
|
연구능력을 최대한 발휘할 수 있는 NIA 연구력과 전문적 연구환경 조성 |
||
|
대중, 과학단체 및 보건의료 전문가들에게 정확한 정보 제공 |
||
|
연구자원의 개발 및 공급 |
||
(2) 일 본
일본은 노인연구에 대한 지원 법령을「고령사회대책기본법 제13조(조사연구 등의 추진)」에 명시하고, 고령자의 특유질병 및 건강증진을 위한 치매, 암, 만성질환 연구에 중점을 두고 있다. 체계적인 노화과학연구의 추진을 위하여 1995년 국립장수의료센터 산하에 NILS(National Institute for Longevity Science) 설립하였다. NILS는 노화과학기초연구에서 중개연구를 망라하는 중심적 기관으로, 노화 메커니즘의 규명과 조절, 알츠하이머, 골다공증 위주의 노인성질환의 발병기전 규명과 예방·치료법 개발과 함께, 고령자의 구강질환 연구, 고령자의 재활의학 연구, 고령자 관련정책 연구 등을 수행하고 있다.
다. 국내 현황
국내에서도 국가적인 현안(National Agenda)으로 대두되고 있는 고령화에 대응하기 위해서 꾸준한 제도적 노력들이 있어왔다. 2010년 ʻ과학기술 미래비전 2040ʼ은 ʻ건강한 세상 구현에 필요한 핵심기술ʼ로 ʻ수명연장 및 고령화 대비 노화과학 연구ʼ를 제시하였고, 2012년 ʻ제2차 생명공학육성기본계획(Bio-Vision 2016) 2단계 기획ʼ을 통해 국민의 건강 및 복지를 위한 고령화 대응 필요성을 강조하였다. 새 정부 추진 중점국정과제에서도 고령친화사업 및 항노화산업의 중요성을 강조하였다. 그러나 국내 노화과학연구는 해외 주요 선진국의 연구 동향과 비교해 볼 때, 다양한 측면에서 한계를 지니고 있다. 노화 R&D를 통합적으로 추진할 수 있는 컨트롤 타워의 부재로 노화과학연구 장기로드맵이 미비하다고 할 수 있다. 뇌신경, 혈관, 관절, 인식 및 지각, 암, 당뇨 및 비만 등에 이르는 다양한 노화과학연구 분야에도 불구하고, 노화라는 관점에서 체계적이고 통합적인 연구가 부재한 실정이다. 그 결과 개별 연구자 중심의 산발적 연구로 인하여, 국가적 수준에서의 수요 맞춤형. 목적 지향적 연구 수행이 미흡한 편이다. 노화R&D 예산의 경우도 2011년 기준 NIA 예산의 1% 수준으로 절대적으로 부족한 실정이다.
라. 발전 전망
(1) 체계적인 지원 필요
현재 우리나라는 고령화 대응 국가 정책으로서 노인층을 복지 수혜의 대상으로 인식하는 복지 위주의 정책이 추진되고 있다. 노화과학연구의 발전으로 인하여 노화란 피할 수 없는 자연적 현상이 아닌, 가역적으로 제어 혹은 회복 가능한 질병으로의 인식의 변환이 일어나고 있다. 따라서 해외 노화 R&D 선진국을 벤치마킹하여 체계적인 R&D 프로그램을 지원함으로써 노화 제어 원천기술을 개발하고 이를 통해서 건강한 노화와 의료비 절감을 추구할 수 있는 근본적인 대책이 추진되어야 한다. 이러한 노화과학연구를 통한 항노화산업의 활성화는 새정부의 국정과제 기조인 국민행복 및 신성장 동력산업 육성을 통한 일자리창출이라는 두 가지 목적 실현에 기여할 수 있을 것이다.
(2) 지원 방안
(가) 체계적이고 종합적인 연구 지원
해외 선진국들은 노화과학 연구 및 제어 기술 개발의 효율성 추구를 위해서 국가적 컨트롤 타워에 의해 주도되는 체계적이고 종합적인 연구개발 프로그램을 갖추고 있는 반면에, 우리나라의 경우에는 현재 개인적, 산발적 연구자 주도의 연구에 치우쳐 있다. 따라서 고령화라는 국가적 아젠다에 대응하기 위한 대형성과 창출 및 효율적 연구개발이 어려운 상황이다. 이를 효과적으로 극복하기 위해서는 국가 주도의 체계적인 사업단 방식의 사업추진이 요구된다. 이를 통하여 국내 산재해 있는 노화과학 연구 집단을 통합하여, 기존 인력과 시설을 최대한 활용함으로서 투자의 효율성을 극대화할 수 있으며, 노화라는 생리적인 현상에 대한 연구와 노화로 인해서 야기되는 질환들에 대한 연구가 체계적이고 통합적으로 이루어 질수 있을 것이다. 또한 연구에 그치지 않고, 실제로 국민 건강수명 연장에 이바지하기 위한 중개연구로의 활발한 연계를 위해서도 국가 주도의 노화과학연구를 위한 체계적이고 종합적인 연구 지원이 필수적일 것이다.
3. 감염병
가. 개요
최근 전 세계적으로 증가하고 있는 주요 질병의 66% 이상이 감염병으로 조사된 바와 같이 국내에서도 조류인플루엔자, 신종플루에 대유행, 구제역등의 신변종 감염병의 출현 및 신속한 전파(WHO, 2007) 등으로 인한 국민들의 인명과 재산의 막대한 피해를 보는 사례들이 나옴에 따라 감염병에 대한 과학적 대응 연구가 주요현안으로 대두되고 있다. 또한 세계 도처에서 치사율이 높은 바이러스성 감염병인 중국에서의 H7N9 인플루엔자바이러스 및 사우디 아라비아에서의 MERS 코로나바이러스의 출현 등으로 인하여 그 공포감은 증폭되고 있다. 감염병 대응을 위한 연구는 미국, 영국 등의 나라에서 가장 활발하게 이루어지고 있으며 최근 들어 네델란드, 인도, 중국 등에서 실질적인 응용이 가능한 연구 기술 개발의 약진이 두드러지고 있다. 감염병의 과학적 대응을 위하여 감염병 병원체 특성을 신속히 규명하고 진단·치료 및 대응 가이드라인 등을 선제적으로 제공하기 위한 핵심 기술의 확보가 필요하나 국내에서의 인적 및 기술적 인프라는 현재 선진국에 비하여 미흡한 상황이며 특히 감염병 대응에 가장 효율적인 의약품인 백신은 국내 예방백신 접종 실시 감염병 22종 중 7종 백신만 국내생산(5종은 수입백신과 혼용) 가능하나, 15종 감염병 백신은 전량 해외 수입 의존하고 있어서 선진국에 비하여 국산백신 자급율이 낮고 백신의 수입 의존도가 큰 상황이다. 따라서 백신 및 치료제 생산을 위한 기초기술 및 원천기술의 개발이 시급한 상황이다. 또한 세계적으로 감염병에 의해 유도되는 암등의 질병을 예방, 치료하는 암백신 등의 미래백신 연구 및 개발이 요구와 더불어 감염병 세계 백신 시장은 연평균 12.6%성장으로 ʼ13년 전체 매출규모를 약 405억 달러(한화 약 44조원)로 급속히 성장하고 있다.
나. 해외 동향
(1) 감염병 연구논문 발표 현황
감염병 확산을 우려하면서 대규모 질병 발생 예방 및 관리를 위해 국제기구와 선진국을 중심으로 국제기구 간 협력 체계를 구축하고 있으며 동시에, 세계 각국에서는 감염병의 과학적 대응을 위하여 감염병 연구에 박차를 가하고 있다. 2001년부터 2010년까지 전체 감염병 연구논문은 약 1.4배의 증가가 있었으며 특히 중국은 3배의 증가를 보여 가장 큰 폭의 증가를 보였다. 가장 논문을 많이 낸 10개국 중 1위는 27.7%를 차지하는 미국이었고 2위는 7.3%를 차지하는 영국이었고 아시아권에서는 일본(5.1%), 중국(3.1%), 인도(2.3%)등이 10위권에 포함되었다.
[표 4-8-5] 감염병연구논문발표 선도그룹 10개국
|
나라 (Countries) |
Original articles |
Reviews |
Original articles & reviews |
Rate |
|
World |
132,282 |
16,153 |
148,435 |
|
|
US |
35,425 |
5,630 |
41,055 |
27.7 |
|
UK |
9,106 |
1,787 |
10,893 |
7.3 |
|
France |
6,884 |
827 |
7,711 |
5.2 |
|
Germany |
5,457 |
756 |
6,213 |
4.2 |
|
Italy |
4,129 |
484 |
4,613 |
3.1 |
|
Spain |
4,587 |
464 |
5,051 |
3.4 |
|
The Netherland |
3,172 |
353 |
3,525 |
2.4 |
|
Japan |
7,081 |
501 |
7,582 |
5.1 |
|
China |
4,618 |
118 |
4,736 |
3.2 |
|
India |
3,337 |
187 |
3,524 |
2.4 |
출처 : Insight and /Control of Infectious Disease in Global Scenario, 2013, 7:130
(2) 미국 현황
감염병 연구 및 대응에 있어서 가장 선진국인 미국은 질병통제예방센터 (CDC)는 전 세계의 감염병에 대한 정보를 파악하고 있으며 감염성질병에 대한 효과적인 연구 활동을 위해 신흥 인수공통감염병센터(NCEZID)를 설립(ʼ10년)하여 세계 질병에 관한 연구는 CDC로 집중되며 전 세계의 모든 감염증에 대한 정보를 파악하고 있다. 2009년도 예산은 87억 9,000만 달러이며 전체 예산의 85%에 해당하는 70억 달러를 연구기관이나 기업에 투자하고 있다. 최대사업은 백신접종으로 약 27억 6,000만 달러, 감염병 대책에 18억 6,000만 달러를 투자하였다. 또한 국립보건원(NIH) 내에 ʻ국립 알러지 및 전염성질환 연구원(NIAID)ʼ에서 인류의 건강을 위협하거나, 생물테러에 활용가능성이 큰 바이러스들에 대한 무료 약효평가 프로그램을 운영을 하고 있으며 NIAID내에 백신연구센터(Vaccine Research Center)를 운영하여 다수의 국민에게 피해를 주는 고위험 병원체(HIV, Influenza, Ebola/Marburg 등) 및 생물테러에 대한 백신연구를 수행하고 있으며 ʼ10년 NIAID는 48억 달러(약 5조 6천억원)의 예산을 사용하였다. 감염병 치료제 연구로는 후천성 면역결핍증후군(HIV)과 C형 간염바이러스(HCV), 인플루엔자, B형 간염바이러스(HBV, hepatitis B virus), 헤르페스 바이러스(Herpes) 등과 생물테러에 활용가능성이 큰 천연두(poxvirus) 등의 바이러스 치료제 연구가 활발히 진행되고 있다. 미국은 감염병 연구를 수행할 수 있는 연구시설 인프라가 잘 구축되어 있다. 미국전역에 RCE(Regional Center of Excellence) 및 RBL (Regional Biocontainment Laboratory)개념의 BSL-3급 우수지역센터가 운영되고 있고 NBL(National Biocontainment Laboratory) 개념의 국가운영 차단시설이 대학 내에 설치되어 있다.
(3) 유럽 현황
유럽은 질병예방통제센터(ECDC, European Centre for Disease Prevention and Control)를 구축하여서 인플루엔자 백신, 치료제저항성 연구 및 결핵, 수인성 인수공통 전염병, 곤충매개 감염병, HPV, B형 간염등 백신연구, HIV, STI등 혈액 질병, 다제내성 박테리아 분야에 대한 감염성 감시체계 및 대응전략 마련하였다. 또한 가축의 신흥 동물원성 질병 연구를 위한 EMIDA(Emerging and Major Infectious Diseases of Livestock) ERA-NET을 설립하여서 인수공통감염병 등 가축의 신흥 동물원성 질병에 관한 유럽의 연구 프로그램 협력 및 조정 강화를 위해 수인성감염병, 인수공통감염병, 어류양식관련 감염병 등에 대한 정보 공유, 상호협력, 공동 연구 아젠다 수립 및 공동 연구자금 확보 활동 4가지 주요 연구 주제(12개 프로젝트)에 총 2,000만 유로 투자(2011)하였다. 영국은 IAH에서 광우병 등 영국 내 주요 인수공통감염병에 대한 연구개발을 수행하고 있고, VLA에서는 인수공통감염병의 발생 모니터링, 진단 및 예방을 위한 연구개발을 수행하고 있고 스웨덴은 SVA(National Veterinary Institute)와 덴마크 National Food Institute에서 인수공통감염병 센터를 설립하여 질병 방제 및 감시 연구를 수행하고 있다. 유럽은 특히 백신 생산시설이 집중되어 있어서 전 세계 백신 생산량의 2/3이상을 생산하고 있다.
(4) 일본 현황
일본은 문부과학성, 농림수산성, 후생노동성 3개부처 공동주관으로 주요 감염병 대응 정책을 마련(ʼ05년)하여 신흥·재흥 감염증 극복 기술개발을 위해 감염 연구 국제 네트워크 추진 프로그램(J-GRID4)) 2단계 착수(ʼ10~ʼ14년)하고 아시아 6개국, 아프리카 2개국과 공동 연구 거점 설립하였다.
[표 4-8-6] 국립동물위생연구소 주요연구내용
|
연구팀 |
주요 연구 내용 |
|
역학 연구팀 |
질병 및 병원체의 역학적 특성 해명에 의한 방제대책의 고도화 |
|
인수감염증 연구팀 |
신흥·재흥 인수공통감염증 병원체의 검출 및 감염 방제기술의 개발 |
|
바이러스병 연구팀 |
바이러스 감염증의 진단·방제기술의 고도화 |
|
국제 중요 전염병 연구팀 |
국제 중요 감염병의 침입 방지와 청정화기술의 개발 |
|
세균·기생충 연구팀 |
세균·기생충 감염증의 진단·방제기술의 고도화 |
|
요네병 연구팀 |
요네병의 발증 메커니즘의 해석과 진단기술의 고도화 |
|
차세대 제제(濟濟) 개발팀 |
생체 방어능을 활용한 차세대형 제제의 개발 |
|
생산병 연구팀 |
생산병의 병태 해석에 의한 질병 방제기술의 개발 |
|
안전성 연구팀 |
사료·축산물의 생산단계에서 안전성 확보기술의 개발 |
|
환경·상주 질병 연구팀 |
환경성·상재성 질병의 진단과 총합적 방제기술의 개발 |
|
프리온병 연구팀 |
프리온병의 방제기술 개발 |
출처 : 과학기술정책연구원(2011)
후생노동성에서는 신형 인플루엔자 등 신흥·재흥 감염증 연구사업을 통해 58개의 과제에 약 19억엔을 투자(ʼ11년)하여 신종 인플루엔자를 비롯한 신흥·재흥 감염증에 대한 예방법, 진단법, 치료법 등 기타 감염 대책을 목적으로 연구 수행하고 있다. 농업식품산업기술종합연구기구(NARO) 산하 국립동물위생연구소(NIAH) 에서 동물감염병 연구를 주도적으로 수행하고 있다.
(4) 중국 현황
중국은 상기한 바와 같이 최근10년 내에 감염병 연구논문 발표가 3배 이상 증가되어 가장 급격하게 증가한 나라이다. 중국은 사스, 조류인플루엔자, HIV, HPV, 결핵 등의 감염병 발병이 매우 빈번한 나라이기 때문에 감염병 대응 기술개발 및 백신생산에 매우 큰 예산과 노력을 기울이고 있다. 약 130만 명의 활동성 결핵 환자가 있어(WHO, 2007), 허난성 보건국은 미 국립보건원(NIH) 산하 국립 알러지 및 전염성질환연구원(NIAID)과 결핵연구 강화를 위한 실행 협정 체결을 맺었으며, 백신개발을 위한 국가적 지원 확대 및 다국적 제약사와의 기술제휴를 확대하였다. 중국은 2009년 신종플루 대유행이 시작되자 인플루엔자 백신을 세계 최초로 개발하였으며 30여 중국 백신 생산업체들이 연간 10억 명이 투약 가능한 백신 생산 능력을 보유하고 있다. WHO는 중국 의약품의 안전성이 국제 표준 백신 규정에 부합한다고 발표(2010)하였다. 다롄에 연면적 1만㎡ 규모로 연간 300만명 분의 독감 백신 생산이 가능한 백신공장 설립(2009)하였고 머크사가 중국 베이징에 아시아 지역 연구·개발 전초기지를 설립하는 등 중국 제약기업들과의 제휴관계를 구축하고 있다.
다. 국내 동향
국내의 연구개발 활동은 대부분의 연구가 신종인플루엔자에 집중되어 있으며, 미래 발병 가능한 신·변종 감염병 및 국내 감염자가 많은 감염병에 의해 유도되는 암등에 대한 질병에 대한 연구는 미흡한 상황이다. 인접국인 중국 및 동남아시아에 빈번히 발병하는 감염병 대응을 위한 연구 및 기술개발이 필요하며 국제 공동연구 네트워크를 구축하여 국내 미발생 중인 인접국 감염병에 대한 선제적 대응을 위한 진단, 백신, 치료제 기초연구 및 기술개발이 필요하다.
[표 4-8-7] 국내 면역·감염 관련 기술의 기술수준
|
핵심기술명 |
국내현황 |
기술의 발전단계 |
기술 수준(%) |
|
|
세계 |
국내 |
|||
|
고감도탐지·진단기술 |
바이오 센서 등 기반기술력은 높으나 전염성 병원체 탐지진단분야에 활용이 미흡 |
성숙기 |
개발기 |
60 |
|
변이주/신종병원체 탐색 및 역학조사 |
임상과의 연계가 미흡하고 IT와의 접목이 필요 |
성장기 |
성장기 |
80 |
|
병원체 활성부위 규명기술 |
대학에서 일부 병원체의 특성분석연구가 수행되고 있으나 초보적 단계임 |
성장기 |
도입기 |
50 |
|
예방백신개발기술 |
최근 인플루엔자백신 생산시설 확보, 기초연구를 위한 BSL-3시설 필요 |
성장기 |
개발기 |
80 |
|
병원체 연구자원 활용체계 구축기술 |
국내유행 병원체에 대한 유전체, 단백체 연구가 미흡하며, 확보된 자원규모 및 활용 정도가 미비 |
성장기 |
개발기 |
60 |
출처 : 2010년 기술수준평가 결과(교육과학기술부)
또한 국가의 감염병 극복을 목표로 각 부처마다 투자되는 연구예산의 중복 투자를 막고 효율적인 연구를 진행하기 위하여 통합적으로 연구를 수행할 감염병 연구기관/조직이 필요하다고 사료된다.
4. 중독
가. 개요
중독 관련 질환은 예방 가능한 원인을 가지고 있다는 특징을 지닌 주요 정신 건강 문제이다. 지난 수십년간의 연구 기술의 발전과 더불어 중독 질환은 ʻ뇌질환ʼ이라는 것이 받아들여지고 있다. 최근 연구의 주요 흐름으로는 뇌영상 기술의 발전을 이용한 뇌 기전, 진단, 그리고 치료에의 적용 연구이며, 동시에 유전체 단위에서 중독의 취약성(addiction vulnerability)과 관련한 연구들이 이루어지고 있다. 또한 최근에는 인터넷, 도박, 게임 등을 포함한 행위 중독(behavioral addiction)이 가지는 사회적 영향이 커지고 기존의 물질 중독 (Internet gaming disorder, DSM-5)과의 비교를 중심으로 연구가 이루어지면서 앞으로 중요한 연구 분야를 이룰 것으로 예측된다.
(2) 행위 중독의 기본 framework
최근 중독에 대한 개념은 약물중독 혹은 물질중독의 개념을 넘어 도박, 인터넷, 게임, 스마트폰에 이르기까지 소위 행위 중독의 개념으로 확산되고 있다. 2013년 새롭게 발표된 미국정신의학회의 새로운 진단 체계인 정신의학 진단 및 통계 편람 DSM-5(diagnostic and statistical manual of mental disorders, 5th edition)에서는 기존의 연구 결과를 검토한 후 인터넷 게임 장애(Internet gaming disorder)를 ʻ향후 연구를 위한 상태(Conditions for further study)ʼ 항목에 포함하였다. 우리나라 등 아시아 지역의 유병률이 높게 보고될 뿐만 아니라 개인의 사회적, 학문적 기능저하 뿐만 아니라 사회적 문제를 야기하는 경향 때문에 앞으로 큰 관심을 가져야 할 주제이다. 우리나라의 전체 인터넷 이용인구 중 약 8%, 2백만 명 정도가 인터넷 중독으로 조사되었으며, 최근 스마트폰과 관련한 실태조사에서도 10% 이상에서 과다 사용을 하고 있음이 보고되었다. 도박중독의 유병률도 캐나다, 호주 및 영국 등에 비해 2~3배 정도 높은 수준이다.

[그림 4-8-8] 국내 행위 중독의 현황
나. 해외 동향
(1) 물질 중독에서의 해외 연구 개발 동향
10~15년 전부터 유전학과 뇌영상학을 결합한 연구가 진행되고 있다. 초기의 연구들은 특정 유전자(도파민 관련 등)의 변화와 뇌영상의 변화를 관찰하였으나, 최근에는 유전체 범위 유전연구(GWAS)를 이용한 연구가 이루어지고 있다. 이 중 가장 일관된 연구 결과를 보이는 연구로는 알코올 중독에서 알코올탈수소효소(ADH), 아세트알데히드 탈수소효소(ALDH2)의 유전자들이며, 최근 흡연과 관련하여 니코틴 수용체(nicotinic acetylcholine receptors) subunit 유전자의 영향이 보고되고 있다.
뇌영상 연구 분야에서는 물질 중독 환자들에게서 보상회로와 행동억제에 관여하는 뇌 영역의 이상이 주로 알려져 있다. 이와 연관하여 각종 물질/약물이 dopamine pathway에 어떤 영향을 주는지에 대한 연구는 꾸준히 진행되고 있는 추세이다. 최근에는 뇌 영상을 이용하여 물질 남용으로 진행할 가능성이 있는 사람들을 조기에 예측할 수 있는 지의 여부와, 발병 가능성이 큰 환자들의 뇌영상을 이용하여 물질 중독의 생물학적 표지자(biomarker)를 찾아 치료의 질을 높이려는 연구가 진행 되고 있다.
[표 4-8-8] 물질 중독에서의 해외 뇌영상 최신 주요 연구들
|
저자 |
발표 연도 |
저널명 |
연구내용 |
|
Duncan 등 |
2011년 |
Addiction |
물질사용장애 청소년에서 전두-두정엽의 백질 이상 |
|
Karen 등 |
2012년 |
Science |
마약중독 환자와 형제들에서 뇌의 구조적 변화 관찰 |
[표 4-8-9] 치료 약물의 종류
|
약물 종류 |
작용 기전 |
주요 적응증 |
|
Acamprosate |
glutamatergic NMDA receptor에 길항작용(antagonist), GABA-A receptor에 효현작용(agonist) |
알코올 사용 장애 |
|
Naltrexone |
opioid 길항제로서 물질에 의한 도파민 방출을 차단하여 물질의 유희효과 및 강화효과를 감소시키고 물질에 대한 갈망도 감소 |
알코올 및 opioid 사용 장애, 병적 도박 |
|
Nalmefene |
naltrexone과 유사한 기능으로 opioid에 길항하여 알콜 의존에 효과를 보이지만 반감기가 더 길고, 간독성이 더 적다는 이점 |
알코올 사용 장애 |
|
Varenicline |
니코틴 수용체 부분 효현제로서, 2006년부터 미국과 유럽에서 금연 치료에 승인 |
니코틴 의존 |
알코올 및 opioid 중독 치료 등의 물질 중독 치료제 시장은 전 세계적으로 2011년 88억 달러 규모를 기록했고, 2018년에는 127억 달러에 이를 전망이다.
(2) 행위 중독에서의 해외 연구 개발 동향

[그림 4-8-9] 행위 중독의 해외 연구 현황
유전자 연구 분야에서는 적은 수의 유전적 소인에 관한 연구들이 있어 왔지만 최근 그 수가 증가하고 있다. 도파민, 세로토닌 및 모노아민 산화효소와 관련된 단일 염기서열 변이에 중심되고 있다.
뇌영상 연구에서는 2003년부터 도박 중독에서의 뇌기능 변화가 보고된 이후부터 주로 도박 중독을 대상으로 이루어져 왔으나 2010년이 지나면서부터는 인터넷 중독에서의 뇌영상 연구 보고가 시작되어 왔다. 물질 중독에서와 유사한 중뇌변연계 및 전전두엽의 활성화 변화에 대한 보고가 있었고 최근에는 대뇌의 회백질이나 신경섬유다발 등 구조적 이상에 대한 연구 및 기능적 뇌영상학 연구가 활발하게 진행되고 있다.
[표 4-8-10] 행위 중독에서의 해외 뇌영상 최신 주요 연구들
|
저자 |
발표 연도 |
저널명 |
연구내용 |
|
Dong 등 |
2012년 |
J Psychiatric Res |
보상과 관련된 기대조건에 따른 뇌 활성 관찰로 약물 중독과 다른 인터넷 중독의 강화기전 시사 |
|
Lin 등 |
2012년 |
PLoS ONE |
인터넷중독에서 안와전두엽, 띠이랑, 뇌량, 내섬유막 부위 백질 연결성이 저하 |
|
van Holst 등 |
2012년 |
PLoS ONE |
중립 자극에 대한 반응억제과제에서 도박 중독의 비정상적인 뇌 활성 관찰 하여 반응억제시 과도한 노력이 필요함을 시사 |
다. 국내 현황
(1) 물질 중독에서의 국내 연구 개발 동향
유전자 연구 분야는 주로 알코올 중독과 관련된 연구가 이루어져 왔으며, 최근에는 유전체 범위 유전연구(GWAS)를 이용하여 ADH 관련 유전자 변이에 대한 연구가 이루어지고 있다.
또한 뇌영상 연구를 통해서는 알코올 및 암페타민 중독 환자에게서 외측 뇌실 등 뇌 구조적 변화 및 뇌의 구조적 위축이 없는 상태에서도 신경화학물질의 변화를 확인하여 보고하였다.
국내 물질 중독 치료제 시장에서 가장 큰 부분을 차지하는 것은 알코올 중독에 대한 치료제이다. 2012년 알코올 중독 치료제 시장은 국내에서 61억원으로 평가되었으며, 2010년 이후 연평균 7% 정도의 성장세를 보이고 있다.
(2) 행위 중독에서의 국내 연구 개발 동향
행위 중독에서 국내의 뇌 연구가 본격화된 것은 2000년대 후반부터이다. 인터넷 과다이용자들은 대조군에 비하여 DRD2 Taq1A1, COMT L alleles와 보상에 대한 의존성 사이에 유의한 상관관계가 있음을 보고하였다(한덕현 등, J Addict Med, 2007). 그러나 아직은 국내의 유전자 연구는 활발하지는 못하여 향후 연구 개발이 필요한 분야이다.
뇌영상 연구 분야 역시 최근 들어 본격화되기 시작하였고 2012년에 국내 연구 결과로는 처음으로 도박 중독에서의 보상신경회로 이상이 보고되었다. 인터넷 중독 연구는 국내에서 2010년에 비디오게임과 연관된 뇌기능의 변화 결과가 보고된 이후 물질중독에서 제안된 보상회로의 도파민 수용체와 관련된 연구 및 중독 매체와 관련된 자극 제시를 통한 기능적 뇌영상 연구 등의 보고가 시작되고 있다.
[표 4-8-11] 행위 중독에서의 국내 뇌영상 최신 주요 연구들
|
저자 |
발표 연도 |
저널명 |
연구내용 |
|
최정석 등 |
2013년 |
Int J Psychophysiol |
인터넷 중독에서 안정상태 베타 및 감마파워의 이상 및 충동성과의 연관성 |
|
홍순범 등 |
2013년 |
PLoS ONE |
인터넷 중독 청소년에서 안정 상태 뇌 연결성의 이상 |
|
최정석 등 |
2012년 |
PLoS ONE |
도박 중독에서 금전보상 지연과제에서의 도박결과에 대한 민감도 저하 |
|
한덕현 등 |
2011년 |
Compr Psychiatry |
정상인에서 게임 과몰입 이후 대상회와 안와전두엽의 활성 증가 |
라. 발전 전망
중독 분야에서는 물질 중독 및 행위 중독 모두에서 중독에 의해 변화하는 뇌에 대한 신경생물학적 지표를 발굴하여 이를 이용한 중독 취약성의 예측 및 중독 발병을 예방하기 위한 연구가 지속될 것이다. 특히 우리나라는 인터넷 중독을 포함한 행위 중독의 문제가 심각해지고 있는 상황에서 2012년부터 국가 지원의 뇌과학 연구 과제도 본격화되고 있으며 향후 우리나라의 인터넷 중독 뇌과학 연구는 세계적으로 선도 역할을 할 것으로 기대되고 있다. 또한 발병 기전 규명과 더불어 이를 활용한 치료제 개발 및 뇌심부자극술 등 신경조절 (neuromodulation)을 활용한 신 치료기술 개발이 이루어져야 한다. 이와 더불어, 뇌과학적 근거에 기반한 예방 교육 및 치료 프로그램 개발이 필요할 것이다.

[그림 4-8-10] 최근 시행된 국가 지원 행위 중독의 뇌과학 연구 개발 과제
1) BCC Research, Proteomics: Technologies and Global Markets, 2013
2) 2013년도 연구개발사업종합안내서(2013. 3)
3) 자체 검색
4) Pluripotent stem cells induced from mouse somatic cells by small-molecule compounds. 341, 651-654 (2013)
5) Deterministic direct reprogramming of somatic cells to pluripotency. 502, 65-70 (2013)
6) Ring, K. L. et al. Direct reprogramming of mouse and human fibroblasts into multipotent neural stem cells with a single factor. Cell Stem Cell 11, 100-109 (2012).
7) Wang, L. et al. Generation of integration-free neural progenitor cells from cells in human urine Nature methods 10, 84-89 (2013).
8) Lu, J. et al. Generation of integration-free and region-specific neural progenitors from primate fibroblasts. Cell Rep 3, 1580-1591 (2013).
9) Nakano, T. et al. Self-formation of optic cups and storable stratified neural retina from human ESCs. Cell Stem Cell 10, 771-785 (2012).
10) Lancaster, M. A. et al. Cerebral organoids model human brain development and microcephaly. Nature 501, 373-379 (2013).
11) Takebe, T. et al. Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature 499, 481-484 (2013).
12) Tachibana, M. et al. Human embryonic stem cells derived by somatic cell nuclear transfer. Cell 153, 1228-1238 (2013).
13) Lee, J. et al. A novel small molecule facilitates the reprogramming of human somatic cells into a pluripotent state and supports the maintenance of an undifferentiated state of human pluripotent stem cells. Angew. Chem. Int. Ed. Engl. 51, 12509-12513 (2012).
14) Han, D. W. et al. Direct reprogramming of fibroblasts into neural stem cells by defined factors. Cell Stem Cell 10, 465-472 (2012).
15) Inhibition of pluripotent stem cell-derived teratoma formation by small molecules. 110, E3281-90 (2013).
16) LIN28A is a suppressor of ER-associated translation in embryonic stem cells. 151, 765-777 (2012).
17) Fermentation chemicals-A global strategic business report(2011), Global Industry Analysts, Inc
18) COML: 10년간 80여개국 과학자들이 참여하여 해양생물의 다양성, 분포 등을 조사하여 2010년에 발표
19) Mora et al., (2011) Plos Biology vol 9 e1001127
20) Nutreco (2010) “Can we feed 9 billion people in 2050 in a sustainable way?” Nutreco, Amersfoort, Netherlands
21) Browdy, C. L. et al (2012) “Novel and emerging technologies: can they contributeto improving aquaculture sustainability?”
22) Ledford (2013) Nature vol 497, 17-18
23) Hu et al., (2010) Marine Drugs vol 9, 514-525
24) www.oecd.org/sti/biotechnologypolicies/Session%204%20Mayer.pdf
25) Gerwick & Moore (2012) Chemistry & Biology vol 19. 85-98
26) http://dx.doi.org/10.1787/9789264050112-en
27) Wargacki et al., (2012) Science vol. 335, 308-313
28) Haq, Z. 2012, Biofuels Design Cases. US Department of Energy, Office of Biomass Program
29) OECD(2013) Marine Biotechnology. Enabling solutions for ocean productivity and sustainability.
30)ㆍ의약품 세계시장 추이(십억$, IMS 2011) : ('05)605 → ('10)856 → ('15)1,065~1,095
ㆍCRO 세계시장 추정(억$, Biopharm Knowlege 2011) : ('06)140 → ('10)280 → ('15)327
ㆍ국제적 CRO규모(억$, 백명, '07) : (Quintiles Transnational) 매출 29, 직원 230, (Charles River) 매출 15, 직원 85, (Covance) 매출 14, 직원 89 등
31) cGMP(current Good Manufacturing Practices) : 의약품 제조에 필요한 공장건립에서부터 원료구입 및 제조공정에 이르는 전 과정에 걸쳐 미국 FDA(미국의 식약청)에서 요구하는 기준
32) 건평 5,913.9㎡, 연면적 16,912.6㎡, 동물세포라인 1기, 미생물발효라인 1기, 완제라인 1기 등 구축
ㆍ동물세포/미생물라인 : 항암제, 빈혈치료제, 당뇨병치료제, 성장호르몬, 재조합 백신 등의 원료의약품 생산
ㆍ완제라인 : 동물세포라인과 미생물라인에서 생산된 원료의약품을 Vial(유리병)이나 Syringe(주사기) 형태의 완성된 의약품으로 생산
33) HACCP(위해요소중점관리기준) 플랜트 : HACCP 순창메주 공급(년간 1,000톤)
미생물관리센터 : 발효미생물 은행(20,000균주 이상) 및 발효관련 기업체 지원
34) 1998년~2002년 : 산업기술기반조성사업 BVC 9개 신규 지원 (’98년 1개, ’99년 1개(TIC), ’00년 3개, ’01년 3개(TIC), ’02년 1개)
35) 2004년~2006년 : 산업기술기반조성사업 3건 신규 지원(연도별 1건씩)
36) 2002년 : 9개지역(대전충북충남, 전북전남제주, 강원경북울산) 11개 지역전략산업진흥사업 지원 2004년 : 4개지역(대구, 부산, 광주, 경남) 4개 지역전략산업진흥사업 지원 2005년 : 지역전략산업진흥사업 중 지역혁신산업기반구축 5개 지원 2008년 : 지원기반정비 및 효율성 제고를 위해 13개 센터에 2단계 사업 지원
1) 실제 범죄현장과 관련하여 남겨질 수 있는 물질로서 꽃가루 분자만큼 작을 수도 있고 기차처럼 아주 클 수 있으며 기체, 고체, 액체 등의 형태를 가질 수도 있다. 그리고 규칙성을 지니는 형태로 발생될 수 있고 만질 수 있는 물건의 형태일 수 있다.
2) 미국의 “The President's DNA Initiative”(http://www.dna.gov/)
3) 유럽 ENFSI, 미주 ASCLD, 아시아 AFSN 등
4) Japan Initiative for Global Research Network on Infectious Diseases



1. 바이오안전성 동향
가. 개요
유전자변형기술, 세포융합 등 현대 생명공학기술의 발달로 다양한 유전자변형생물체 (Living Modified Organisms, LMO)가 연구·개발되고 산업화됨에 따라 유전자변형생물체의 국가간 이동의 규제에 초점을 두어 유전자변형생물체의 안전한 이동, 취급 및 이용에 관한 규정과 절차를 확립함으로써 바이오안전성을 확보하고자 바이오안전성의정서(Cartagena Protocol on Biosafety, CPB)가 국제적인 움직임을 통해 만들어 졌다. 바이오안전성의정서는 2000년 1월 캐나다 몬트리올에서 열린 ʻ생물다양성협약(CBD, Convention on Biodiversity, 이하 ʻCBDʼ)ʼ 특별당사국총회에서 채택되었으며 ʻ사전예방적 접근방식(Precautionary Approach)ʼ에 따라 잠재적 위해성에 관한 과학적 확실성이 없더라도 환경피해를 방지하기 위한 비용효과적인 조치를 취할 수 있도록 하였으며, ʻ사전통보합의절차(Advance Informed Agreement)ʼ를 규정하여 수출국(자)가 환경방출 LMO에 대한 의도적 국가간 이동전에 수입국에 사전 통보하여 수입국의 동의를 획득하도록 하고 있다. 의정서는 2003년 6월 팔라우가 50번째로 비준함에 따라 그로부터 90일 이후인 2003년 9월 국제적으로 발효되었고, 2013년 5월 기준, 166개국1) (유럽연합포함)이 가입하고 있다.
[표 5-1-1] 바이오안전성의정서 가입현황(2013년 5월 기준 166개국)
|
구분1) 지역 |
의정서 발효 기준 50개국2) |
발효 기준일 이후 가입국 |
국가 수 |
|
아프리카 |
보츠와나, 카메룬, 지부티, 가나, 케냐, 레소토, 라이베리아, 말리, 모리셔스, 모잠비크, 탄자니아, 튀니지, 우간다(13) |
나이지리아, 부르키나파소, 남아공, 세네갈, 에티오피아, 마다가스카르, 이집트, 잠비아, 세이셸, 감비아, 토고, 르완다, 알제리, 니제르, 나미비아, 짐바브웨, 베냉, 에리트레아, 콩고민주공화국, 수단, 리비아, 모리타니, 카보베르데, 스와질란드, 콩고, 차드, 가봉, 기니, 부룬디, 중앙아프리카공화국, 말라위, 코모로, 앙골라, 기니비사우, 소말리아, 모로코(36) |
49 |
|
아시아 ․ 태평양 |
부탄, 피지, 인도, 몰디브, 마샬군도, 나우루, 니우에, 오만, 팔라우, 사모아(10) |
몽고, 북한, 말레이시아, 캄보디아, 통가, 요르단, 이란, 일본, 키프로스, 베트남, 방글라데시, 타지키스탄, 시리아, 키리바시, 스리랑카, 솔로몬, 라오스, 인도네시아, 중국, 파푸아뉴기니, 태국, 예맨, 필리핀, 카타르, 키르키즈스탄, 사우디아라비아, 대한민국, 미얀마, 투르크메니스탄, 카자흐스탄, 파키스탄, 바레인, 레바논, 아프가니스탄(34) |
44 |
|
중남미 ․ 카리브해 |
바베이도스, 볼리비아, 콜롬비아, 쿠바, 에콰도르, 멕시코, 니카라과, 파나마, 세인트키트네비스, 트리니다드토바고, 베네수엘라(11) |
세인트 빈센트, 앤티카바부다, 엘살바도르, 브라질, 바하마, 그레나다, 벨리즈, 파라과이, 페루, 도미니카, 과테말라, 세인트루시아, 도미니카공화국, 코스타리카, 가이아나, 수리남, 온두라스, 우루과이, 자메이카(19) |
30 |
|
중앙․ 동유럽 |
벨로루시, 불가리아, 크로아티아, 체코, 몰도바, 슬로베니아, 우크라이나(7) |
루마니아, 리투아니아, 슬로바키아, 폴란드, 헝가리, 라트비아, 에스토니아, 아르메니아, 알바니아, 아제르바이잔, 유고, 세르비아, 몬테네그로, 그루지야, 보스니아(15) |
22 |
|
서유럽 ․ 기타 |
오스트리아, 덴마크, 유럽연합, 프랑스, 룩셈부르크, 노르웨이, 스페인, 스웨덴, 스위스, 네덜란드(10) |
터키, 아일랜드, 영국, 독일, 이탈리아, 벨기에, 그리스, 핀란드, 포르투갈, 뉴질랜드, 몰타공화국(11) |
21 |
출처 : 바이오안전성의정서 홈페이지(www.biodiv.org/biosafety/)내용 재구성
2001년 3월 산업자원부(現산업통상자원부)가 주관이 되어 「유전자변형생물체의 국가 간 이동 등에 관한 법률」(이하 ʻLMO법ʼ)을 제정·공포하였다. 이후 각 관계 기관별로 동법 시행에 필요한 하위 법령 제정을 위해 노력해 왔고, 2007년 8월 이러한 노력의 마지막 단계로서 LMO법 통합고시안이 입법예고 되었다. 이후 2007년 10월 3일 의정서에 비준함으로써 143번째 가입국이 되었으며 그로부터 90일 이후인 2008년 1월 1일에 의정서 및 LMO국내법이 시행되었다.
이에 본 절에서는 2011년부터 2013년 상반기까지의 LMO를 둘러싼 국제법적 논의 동향과 더불어 우리나라가 동 의정서의 이행과 국내 바이오안전성 확보를 위해 어떠한 노력을 전개해왔는지 등에 대해 기술한다.
2. LMO를 둘러싼 국제법적 논의 동향
가. 바이오안전성의정서 당사국총회 논의 동향
바이오안전성의정서 당사국들의 의정서 이행사항을 점검하고 필요시 결정문을 통해 추가 규정을 제정하는 역할을 하는 바이오안전성의정서 당사국총회(이하 ʻ당사국 총회ʼ)가 2004년부터 개최되고 있다. 제6차 당사국총회는 2012년 10월 1일부터 5일까지 당사국 대표(164개 당사국 중 116개국 참석)를 비롯하여 비당사국, 국제기구, 기업계, NGO 등에서 총 1,300여명이 참가한 가운데 인도 하이데라바드에서 개최되었다. 우리나라에서는 장호민 바이오안전성정보센터장을 수석대표로 하여 바이오안전성정보센터(KBCH), 농촌진흥청, 국립농산물품질관리원, 국립수산과학원, 질병관리본부, 국립환경과학원에서 총 13명이 대표단으로 참석하였다.
당사국총회에서는 실무그룹회의와 총회를 거쳐 의무준수, 책임 및 구제 등 총 22개 의제에 대한 보고서와 총 15개 의제에 대한 결정문을 채택하였으며, 특히 위해성평가 및 관리, 사회·경제적 고려 및 의정서 운영 예산 대해서는 콘택트그룹, 프렌드그룹이 결성되는 등 치열한 논의가 이루어졌다.
우리나라 대표단은 바이오안전성정보센터 운영, 비의도적 국가간 이동 및 비상조치, 사회·경제적 고려 등에 대한 발언을 통하여 관련 내용이 최종 보고서 및 결정문에 반영되었고, 의무준수위원회에는 2015년부터 공식 위원으로 참여하는 것으로 결정되었으며, 제7차 당사국총회의 한국 유치라는 성과도 거두었다.
주요 의제로 논의된 <의제 4> 의무준수위원회는 의정서 이행에 곤란을 겪고 있는 일부 개발도상국들에 대한 정보 수집과 이를 바탕으로 한 능력형성 지원 등을 강조하였으며, 공공인식 및 교육 프로그램을 이용할 것을 촉구하였다. 우리 대표단은 아시아·태평양지역 의무준수위원으로 최승환 교수(현재 예비위원, 경희대 법학전문대학원)를 추천하였으나, 차기 총회 개최국으로서의 입장 등을 고려하여 후보 경쟁을 철회하면서, 2년 뒤인 2015년부터 한국의 공식 위원 자격을 확보하는 것으로 마무리하였다. <의제 5> 바이오안전성정보센터의 운영 및 활동과 관련해서 우리 대표단은 UNEP과 KBCH가 공동으로 개최해 온 BCH능력형성워크숍을 지속적으로 지원할 계획이라고 밝히면서 2013년에 제3차 워크숍을 한국에서 개최할 의사를 표명하였다. 이에 중국 대표단은 한국이 주도한 제2차 KBCH-UNEP 워크숍(2011년 10월, 대전)이 성공적이었다고 평가하면서 지역워크숍을 활성화하여야 한다고 발언하였고, 우리 대표단 제안은 총회 결정문에 한 단락으로 반영되었다. <의제 16> 사회·경제적 고려에 대해 콘택트그룹을 구성하여 사회·경제적 고려의 필요성, 개념적 명확화, 논의 주체와 방법 등에 대해 심도 깊은 논의가 진행되었는데 우리 대표단은 10월 5일 오전, 실무그룹Ⅰ 회의에서 사회·경제적 고려에 대한 특별전문가그룹 회의를 한국에서 주최할 용의가 있음을 밝혀 차기 당사국총회 개최국으로서 역할을 도모하였고, 이어 노르웨이는 재정적 지원을 할 용의가 있음을 발언하였다. 또한 10월 5일 마지막 총회에서 볼리비아가 특별전문가그룹회의 유치를 신청함에 따라 특별전문가회의는 한국과 볼리비아에서 개최될 예정이다.
10월 5일 오후 개최된 폐회식에서 총회 의장(인도 대표)이 차기 당사국총회 개최와 관련한 한국 대표의 발언을 요청함에 따라 우리 대표단(장호민 수석대표)은 이미 한국 유치가 확정된 제7차 당사국총회 초청 발언을 하여 당사국들의 환영과 박수를 받았다.
나. 책임·구제 추가의정서
바이오안전성의정서 제27조(책임 및 구제)를 근거로 제1차 바이오안전성의정서 당사국총회(2004년 2월, 쿠알라룸푸르)부터 논의를 시작하여 제5차 당사국총회 (2010년 10월, 나고야)에서 채택된 ʻ책임 및 구제에 대한 나고야·쿠알라룸푸르 추가의정서ʼ(이하 ʻ추가의정서ʼ)는 유전자변형생물체와 관련된 책임과 구제 분야에 있어 국제 규칙 및 절차를 제공함으로써 인체 건강에 대한 위해를 고려함과 동시에 생물다양성의 보전과 지속가능한 이용에 기여하는 것을 목적으로 하고 있다. 이 추가의정서에 적용되는 범위는 의정서와 마찬가지로 식품·사료·가공 목적 LMO, 밀폐이용 LMO, 환경방출 LMO 모두를 포괄하고 있다.
이외에도 추가의정서에는 LMO와 피해간 인과 관계, 피해가 발생할 경우의 대응 조치, 책임의 면제와 시효, 구상권, 재정 보증, 국제불법행위에 대한 국가책임, 이행 및 민사책임 관계 등을 규정하고 있으며, 인과 관계 등 많은 부분을 국내법에 위임하고 있다. 추가의정서 제18조에 따라 바이오안전성의정서 당사국만이 추가의정서에 가입할 수 있으며, 40번째 비준서가 기탁된 날로부터 90일 이후에 발효한다.
추가의정서에는 총 54개국이 서명하였고, 2013년 5월 현재 알바니아, 불가리아, 체코, 유럽연합, 아일랜드, 라트비아, 리투아니아, 멕시코, 노르웨이, 스페인, 스웨덴, 시리아, 룩셈부르크, 몽골 등 총 14개국이 가입하고 있다. 그런데 이미 비준서를 기탁한 유럽연합 소속 회원국들을 중심으로 2014년 초에는 본격적인 가입이 이루어질 것으로 예상됨에 따라 제7차 바이오안전성의정서 당사국총회가 개최되는 2014년 10월 즈음에는 가입국이 40개국을 상회하여 국제적으로 추가의정서가 발효될 것으로 전망된다.
다. 경제개발협력기구(OECD) 논의 동향
경제협력개발기구(Organization for Economic Cooperation and Development, OECD)는 생물다양성협약(The Convention on Biological Diversity, CBD)의 부속서인 바이오안전성의정서(Biosafety Protocol) 이행에 있어서, OECD 회원국 간의 생명공학기술 규제법 및 제도와 관련한 국가 간 규제에 대해 조화를 유지하고 무역마찰을 최소화하기 위하여 1995년 4월 전문가 그룹회의를 처음 구성하여 약 9개월 간격으로 실무회의를 개최하고 있다. 회의의 주요 목표는 워크숍 등을 통해 LMO의 위해성 평가 국제표준기술서들의 초기 체계를 구축하고 다음 단계인 바이오트렉 온라인(Bio-Track Online, OECD LMO관련 데이터베이스)을 확립하여 회원국과 비회원국 모두에게 활용토록 하는데 있다. 이에 따라 2013년 4월 제27차 ʻ생명공학 규제조화 작업반 회의(Working group on Harmonization of Regulatory Oversight in Biotechnology)ʼ와 제20차 ʻ신규식품사료의 안전성 작업반 회의(The Task Force for the Safety of Novel Foods and Feeds)ʼ가 개최되었다.
구 분 추진 내용 2000년 1월 ▪「바이오안전성에 관한 카르타헤나의정서(바이오안전성의정서)」채택 2000년 8월 ▪「유전자변형생물체의 국가간 이동 등에 관한 법률(LMO법)」제정안 입법예고 2000년 9월 ▪우리나라의 바이오안전성의정서 서명 2000년 10월 ▪LMO법 제정안에 대한 공청회 개최 2000년 11월 ▪LMO법 제정안에 대한 토론회 개최 2001년 2월 ▪LMO법(안) 국회 본회의 의결 2001년 3월 ▪LMO법 제정․공포 2002년 2월 ▪LMO법 시행령 및 시행규칙 제정안 마련 2002년 6월 ▪LMO법 시행령(안) 및 시행규칙(안) 입법예고 2003년 9월 ▪바이오안전성의정서 국제적 발효 2005년 9월 ▪LMO법 시행령 확정(관보 게재) 2005년 10월 ▪LMO법 시행규칙 제정안 관계부처 협의 2005년 11월 ▪LMO법 시행규칙 제정안 법제처 심의 2005년 12월 ▪LMO법․제도 설명회 개최 2006년 3월 ▪LMO법 시행규칙 확정(관보 게재) 2007년 4월 ▪LMO법 통합고시 제정안 관계부처 협의 2007년 6월 ▪LMO법․제도 설명회 개최 2007년 8월 ▪LMO법 통합고시 제정안 입법예고 2007년 10월 ▪바이오안전성의정서 비준서 유엔사무국 기탁 2007년 11월 ▪LMO법․제도 찾아가는 설명회 개최(서울, 대전, 대구, 광주, 부산) 2007년 12월 ▪LMO법 일부 개정안 확정(관보 게재), 통합고시 확정(관보 게재) 2008년 1월 ▪바이오안전성의정서 및 LMO법 발효 2009년 12월 ▪LMO법 일부 개정․공포(바이오안전성정보센터 출연 근거 마련) 2012년 12월 ▪LMO법 일부 개정․공포(2013년 12월 12일 시행 예정) 2013년 6월 ▪LMO법 하위규정(시행령, 시행규칙, 통합고시) 개정 추진 중
나. LMO법 시행 및 안전관리계획 수립 동향
LMO법 및 동법 시행령과 시행규칙에 의하면 그 용도에 따라 해당 LMO의 안전관리를 책임지고 있는 관계 중앙행정기관이 지정되어 있다. 이에 따라 시험·연구용 LMO는 미래창조과학부, 농업용 LMO는 농림축산식품부, 산업용 LMO는 산업통상자원부, 보건의료용 LMO는 보건복지부, 환경정화용 LMO는 환경부, 해양용·수산용 LMO는 해양수산부, 식품용·의약품용·의료기기용 LMO는 식품의약품안전처에서 그 안전관리를 책임지고 있다. 또한 의정서 이행에 대한 국가책임기관 역할은 산업통상자원부가, 의정서 이행을 위한 국가연락기관 역할은 외교부에서 담당하고 있다. 또한 국제바이오안전성정보센터(BCH, Biosafety Clearing House)와의 정보 교류 및 LMO관련 국내외 정보의 수집, 관리, 제공 등의 업무는 LMO법 제32조에 따라 국가책임기관에서 지정한 한국바이오안전성정보센터 (KBCH, Korea Biosafety Clearing House)에서 담당하고 있다(그림 5-1-1).
|
|
|
|
|
|
|
바이오안전성위원회 (심의기구) |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
국가책임기관(산업통상자원부) (의정서 이행 행정 담당) |
|
|
|
|
|
|
국가연락기관(외교부) (의정서 이행 연락 담당) |
||||||||||||||||
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
바이오안전성정보센터 (정보 수집, 관리 등) |
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
미래창조 과학부 |
|
농림축산식품부 |
|
산업통상 자원부 |
|
보건복지부 |
|
환경부 |
|
해양수산부 |
|
식품의약품 안전처 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
시험․연구용 LMO의 수출입등에 관한 업무 |
|
농업용․ 임업용․ 축산업용 LMO의 수출입등에 관한 업무 |
|
산업용 LMO의 수출입등에 관한 업무 |
|
보건의료용 LMO의 수출입등에 관한 업무 |
|
환경정화용 LMO의 수출입등에 관한 업무 |
|
해양수산용 LMO의 수출입등에 관한 업무 |
|
식품․ 의약품․ 의료기기용 LMO의 수출입등에 관한 업무 |
|||||||||||
[그림 5-1-1] 바이오안전성 국가관리 체계
이러한 관계기관별 역할에 따라 연구개발, 수입, 수출, 생산, 유통 등 전반에 걸쳐 LMO법은 현재까지 효과적으로 시행되어 왔다. 그리고 이와 같이 효과적으로 시행되고 있는 LMO법 및 시행령·시행규칙, 통합고시 등 LMO 안전관리 체계를 범부처 차원에서 통합·시스템화하여 안전관리의 효율성을 제고하기 위한 ʻ제1차 유전자변형생물체 안전관리계획ʼ이 수립된 바 있다. 이 안전관리계획은 LMO법 제7조제1항 및 동법 시행령 제4조에 근거하여 관계 중앙행정기관의 장이 소관별로 5년마다 수립·시행하도록 규정되어 있다. 이에 따라 6개의 관계 중앙행정기관에서는 2008년 상반기 중에 소관 LMO에 대한 안전관리계획 초안을 수립하였고, 이후 부처간 협의와 전문가 용역 등의 과정을 거쳐 관계기관 통합 안전관리계획(안)을 마련하였다. 동 안전관리계획(안)은 2008년 9월 26일 서울 전경련회관에서 공청회를 개최하여 다양한 국민의견도 수렴하였다. 이러한 절차를 바탕으로 ʻ제1차 유전자변형생물체 안전관리계획안ʼ이 마련되었으며, 국무총리를 위원장으로 하는 바이오안전성위원회의 심의를 거쳐 2008년 12월에 최종 확정되어 시행되고 있다. 이후 제1차 안전관리계획을 근거로 각 부처에서는 세부시행계획을 매년 수립하여 시행하고 있다.
2008년 1월 1일부터 LMO법이 시행됨에 따라 해당 관계기관을 통해 시험연구용· 식품용·사료용 LMO에 대한 수입 승인 또는 수입 신고가 이루어지고 있다. 전체적으로 살펴보면, 시험연구용 LMO의 수입신고는 계속 증가하는 반면, 식품용· 사료용 LMO의 수입승인은 국제 곡물가격과 재배여건 변화에 따라 변화하는 추세를 보이고 있다.
2011년 한 해 동안 국내에 수입승인 또는 수입 신고된 LMO는 총 3,112건 이었다. 이 중 시험연구용 LMO는 239건으로 주로 마우스(쥐)와 대두 등이 수입 신고 되었으며, 1건이 수입 승인되었다. 식품용 LMO는 88건으로 옥수수와 콩이 188만 톤 수입 승인되었으며, 사료용 LMO는 옥수수와 면화 등이 2,781건, 598만 톤 수입 승인되었고 비료용 콩이 2건, 버섯재배용 옥수수가 1건이 소량 수입승인 되었다. 국내 수입 승인된 전체 식품용․사료용 LMO는 약 785만 톤으로 2010년 대비 약 7% 감소하였으며 주된 수입국은 미국이었다.
한편, 2012년에 국내에 수입승인 또는 수입 신고된 LMO는 총 3,112건이었다. 시험·연구용 LMO는 마우스와 대두 등이 총 234건 수입신고 되었다. 식품용 LMO는 총 88건으로 옥수수와 콩이 191만 톤 수입 승인되었으며, 캐놀라가 1톤 소량 수입 승인되었다. 사료용 LMO는 옥수수, 면화, 콩 등이 총 2,788건, 592만톤, 버섯 재배용 옥수수는 총 2건이 소량 수입승인 되었다. 국내 수입 승인된 전체 식품용·사료용 LMO는 약 784만 톤으로 2011년과 거의 비슷하였으나 주된 수입국은 기존의 미국 중심에서 브라질, 아르헨티나 등으로 확대되었다.
(단위 : 만톤)

[그림 5-1-2] 연도별 식용/사료용 LMO 수입량
(단위 : 만톤)
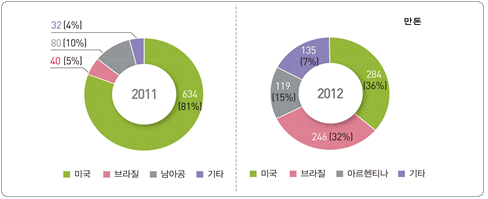
[그림 5-1-3] 국가별 수입량
LMO법 시행령 제12조 제1항에 의하여 시험·연구용으로 사용하거나 박람회 또는 전시회에 출품하기 위하여 수입하는 LMO를 수입하는 경우는 보건복지부 장관의 승인을 얻어야 하며, 시행령 제12조 제1항에 해당하지 않는 LMO를 시험·연구용으로 사용하거나 박람회 또는 전시회에 출품하기 위해 수입하는 경우는 시행령 제12조 제3항에 따라 관계중앙행정기관의 장에게 관련 내용을 신고해야 한다.
2008년 이후 시험·연구용이나 박람회 또는 전시회 출품을 위한 LMO 수입승인 건수는 총 3건이 있었으며, 시험·연구용으로 미래창조과학부장관에게 LMO 수입신고를 한 건수는 2011년 총 239건, 2012년 234건으로 LMO법이 시행된 이후 지속적으로 증가하는 추세이다. 수입 품목은 쥐(Mouse, Rat)가 대부분을 차지하였으며 이 외에도 대두, 벼, 세포주 등이 수입되었다. 주요 수입기관은 대학과 민간 기업이었으며, 대학은 주로 쥐를 수입 한 반면, 기업에서는 쥐와 대두를 주로 수입하였다.
[표 5-1-3] LMO수입승인 등 현황(2008년 1월~2013년 6월)
|
구 분 |
건수, 천톤 |
관계기관 |
|
|
위해성심사 |
농업용 |
89건 |
농촌진흥청 |
|
식품용 |
94건 |
식품의약품안전처 |
|
|
수입승인 |
옥수수(식품용) |
4,732천톤 |
식품의약품안전처 |
|
콩(식품용) |
4,680천톤 |
식품의약품안전처 |
|
|
옥수수(사료용) |
34,531천톤 |
농산물품질관리원 |
|
|
콩, 면실 등(사료용) |
746천톤 |
농산물품질관리원 |
|
|
수입신고 |
시험연구용(쥐, 세균등) |
1,588건 |
미래창조과학부 |
|
수출통보 |
시험연구용 쥐등 |
18건 |
산업통상자원부 |
|
연구시설 연구개발 |
시설신고 |
2,255건 |
미래창조과학부 및 관계기관 |
|
시설허가 |
23건 |
미래창조과학부 및 질병관리본부 |
|
|
연구개발 승인 |
950건 |
미래창조과학부 및 관계기관 |
|
4. 바이오안전성 정보관리
LMO의 안전한 이용을 위한 경험 및 정보 공유를 위해 바이오안전성의정서 제20조에서는 국제바이오안전성정보센터(이하 ʻBCHʼ)를 설치하도록 규정하고 있으며, 각 회원국들이 자국의 BCH(National BCH)를 설치하여 BCH로 정보를 제공하도록 권고하고 있다. 이에 우리나라의 BCH인 한국바이오안전성정보 센터(KBCH)는 국내외 LMO 관련정보를 수집·관리·제공·홍보하기 위한 업무를 정식적으로 수행하고 있으며, 이를 위하여 LMO 국가통합정보망, 바이오안전성포탈, 영문포탈 등의 LMO 정보관리 체계를 구축하여 운영하고 있다.
LMO법에 따른 관계중앙행정기관인 미래창조과학부, 농림축산식품부, 산업통상자원부, 보건복지부, 환경부, 해양수산부, 식품의약품안전처에서도 행정기관의 업무에 따라 LMO관련 정보를 제공하고 있다. 미래창조과학부는 ʻ시험·연구용 LMO정보시스템ʼ (http://biosafety.mest.go.kr)을 통해 LMO 연구시설, 시험·연구용 LMO 수입 및 개발·실험과 관련된 신고·허가·승인 신청을 편리하게 할 수 있도록 하고 있고, 농림수산식품부는 ʻ농식품 안전·품질 통합정보시스템ʼ(http://www.agrin.go.kr)을 통해 사료용 LMO 수입업자들이 직접 인터넷상에서 수입승인 신청을 할 수 있도록 하였다. 식품의약품안전처에서는 ʻ유전자재조합식품(GMO) 정보 홈페이지ʼ(http://www. kfda. go.kr/gmo)를 통해 식품용 LMO에 대한 정보를 제공하고 있으며, 환경부는 ʻLMO환경안전성센터ʼ(Environmental safety center, http://ecosystem.nier.go. kr/lesc)를 운영하여 유전자변형생물체의 생태계 안전관리를 위한 정책수립, 연구현황 등 관련 정보와 국내 LMO 자연환경위해성 심사협의 내용을 투명하게 국민에게 공개하고 있다.
LMO 국가통합정보망은 의정서 및 LMO 법의 정보의무사항 준수 및 이행을 위해 LMO 관련 개발·실험, 위해성평가 및 심사, 생산, 수출입과 기타 안전관리 등에 필요한 정보를 국가 전체 차원에서 통합·관리하기 위한 폐쇄 형태의 관계 기관간 정보 네트워크이다. LMO 국가통합정보망의 운영을 위해 유전자변형생물체 관련 정보를 실무적으로 관리하는 관계기관 담당자들의 지속적인 정보교류와 회의 등을 통해 관계기관 간의 유기적인 협조 체계를 유지하고 있다.
KBCH의 국문 바이오안전성포털은 LMO 및 바이오안전성에 관한 정보를 국민(산·학·연·관·민)에게 제공하는 오픈형 정보시스템으로서 LMO에 대한 국민의 인식 제고를 목적으로 운영되고 있다. 2012년에는 날로 변화하는 사용자의 다양한 요구에 부응하고, 계층별 이용자들이 만족할만한 콘텐츠를 제공하기 위하여 개편을 실시하였다. 이번 개편은 2010년에 실시한 홈페이지 개편의 장점을 그대로 유지하면서 그동안 개선점으로 지적되었던 정보검색의 용이성과 편의성을 확보하고, 방문자들의 관심이 높은 분야들을 메인페이지에 노출시켜 접근이 용이하도록 노력하였다.
5. 바이오안전성 커뮤니케이션
바이오안전성의정서 제23조에서는 유전자변형생물체(LMO) 및 바이오안전성에 대해 일반대중과 적극적으로 협의하도록 하기 위한 ʻ공공인식 및 참여(Public Awareness & Participation)ʼ를 규정하고 있다. 이에 한국바이오안전성정보센터 (KBCH) 및 LMO 관계기관은 포털사이트를 통해 LMO 관련 정보를 제공해 오고 있으며, 정기간행물과 연구사업 보고서, 교육 및 홍보자료 등을 발간하고 있다. 또한 LMO 관련 정보의 공유와 이를 바탕으로 사회적 합의를 위한 소통의 필요성이 대두됨에 따라 ʻLMO 포럼ʼ을 기획하여 2010년부터 총 10여 차례의 ʻLMO 포럼 세미나ʼ를 개최하였다.
LMO에 대한 청소년들의 폭넓은 이해와 관심을 제고하고자 ʻ전국 학생 바이오안전성 논술대회ʼ를 2007년부터 2011년까지 개최 하였으며 ʻ전국 고등학생 바이오안전성-바이오산업 토론대회ʼ를 2009년부터 매년 개최하고 있다. 이러한 청소년 대상 참여형 대회들은 바이오안전성의정서 제23조의 공공인식 및 참여 증진과도 부합되는 대회로써 국내외적으로 논쟁의 중심에 있는 유전자변형생물체 (LMO)에 대하여 청소년기 학생들의 관심유발과 대중매체를 통한 일방향적 정보습득이 아닌 올바른 정보에 근거한 학습을 바탕으로 균형적인 인식을 정립할 수 있는 기회를 제공하였다.
또한 LMO법 시행과 함께 LMO법(제32조)에 근거하여 관계기관 등으로부터 수집·정리된 자료를 바탕으로 LMO 연구개발, 위해성심사, 수입승인, 작물재배, 공공인식 등 LMO의 개발에서부터 소비에 이르는 주요 통계를 언론에 발표하여 정보 접근성을 제고하였다. 이 밖에도 LMO포럼(www.lmoforum.org)과 논술대회(http://essay. biosafety.or.kr), 토론대회(http://debate.biosafety.or.kr), 다음(DAUM)과 네이버(NAVER)에 ʻLMO맨 블로그ʼ와 같은 패밀리 사이트를 개설 운영함으로 일반인과 이해당사자를 대상으로 각 계층별 수준에 맞는 콘텐츠를 제작·제공하였다.
2000년부터 바이오안전성에 관한 분기별 주요 동향과 이슈를 균형 잡힌 시각에서 정리하여 주요 여론 주도층의 인식 및 이해를 증진시키고자 계간지「BIOSAFETY」를 발간하고 있으며 LMO관련 정보 전달을 목적으로 다양한 홍보책자를 발간· 배포하고 있다.
6. 발전 전망
바이오안전성의정서와 LMO법이 시행된 지 6년이 지나가고 있다. 그 동안 산업통상자원부를 비롯한 관계 중앙행정기관과 바이오안전성정보센터 등 관계기관은 바이오안전성의정서와 LMO법을 근거로 LMO 안전관리를 위해 맡은 소임을 잘 수행해 왔으며, 앞으로도 바이오안전성의정서 책임기관인 산업통상자원와 관계부처는 협력하여 변화된 국내외 사정에 적합한 LMO법 체제 구축을 위하여 최선을 다할 예정이다. 그 일환으로 산업통상자원부와 관계부처는 개정된 LMO법(ʼ13년 12월 12일부터 시행) 시행에 차질이 없도록 시행령, 시행규칙, 통합고시의 개정을 완료할 계획이다.
또한 ʻʻLMO로 인한 피해 책임 및 구제에 관한 나고야·쿠알라룸푸르 추가의정서ʼʼ 국내 입법 및 시행을 준비하기 위한 절차를 지속적으로 진행할 계획이다. 2014년 말까지는 LMO 책임·구제 추가의정서의 국제적 발효가 예상됨에 따라 지난 2년여 동안 바이오안전성정보센터와 함께 진행해 온 추가의정서 관련 연구용역 결과 등을 토대로 추가의정서 주요 내용과 이슈, 국내외 동향을 분석한 종합보고서를 발간하고, 이를 근거로 추가의정서 가입 타당성과 국내 입법안에 관한 관계부처 협의와 국민의견수렴 절차 등을 진행할 계획이다.
그리고 2014년 9월 29일부터 10월 3일까지 강원도 평창에서 개최될 제7차 바이오안전성의정서 당사국총회와 2014년 상반기 중에 예정되어 있는 바이오안전성의정서 제26조에 따른 사회·경제적 고려 특별전문가회의 준비에도 환경부 등 관계부처와 협력하여 최선을 다할 계획이다. 더불어 산업통상자원부와 관계부처에서는 제7차 당사국총회 의장국으로서 논의를 선도하고 당사국간의 이견을 조정하는 역할을 성공적으로 수행하기 위하여 의정서 주요 안건에 대해 보다 체계적이고 면밀하게 검토·분석하고, 그 대응방안을 빈틈없이 준비할 것이다.
LMO로 인한 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 대한 위해를 방지하기 위하여 LMO의 위해성 심사, 수입승인, 운송·보관·유통, 연구개발 등과 관련한 안전관리에 최선을 다하고 있다. LMO 관계기관뿐만 아니라 LMO의 개발·생산·수입·수출·판매·운반 및 보관 등의 관련활동에 종사하고 있는 이해당사자, 그리고 시민단체를 포함한 우리나라 국민 모두가 LMO법의 시행에 적극 협조하여 바이오안전성의 확보 및 바이오산업의 건전한 발전의 토대가 형성될 수 있기를 기대한다.

1. 의생명과학연구 관련 생명윤리의 전반적 동향
의생명과학연구와 관련된 최근 한국 생명윤리 동향으로서 주목할 만한 것은 「생명윤리 및 안전에 관한 법률」(이하 ʻ생명윤리안전법ʼ)이 전면개정되어 2013년 2월 2일부터 시행되었다는 것이다. 전면개정의 핵심내용은 생명윤리안전법이 인간을 대상으로 하는 연구와 인체유래물을 이용하는 연구를 규율 범위에 포함시켰다는 점이다.
이러한 변화는 생명윤리안전법이 종래와 같이 단순히 배아연구 및 유전자연구만을 규율하는 법률이라기보다 의생명과학연구를 포함하여 인간을 대상으로 하는 연구일반에 대해 규제하는 법률로서의 성격을 지녔다는 것을 의미한다. 특히 사회행동과학 연구를 수행하는 연구자들에게는 큰 변화가 아닐 수 없으며, 의학연구분야의 사회행동과학연구는 그동안 자율적으로 IRB(Institutional review board)의 심사를 받아 수행되었으나 이제는 법률적 준수사항이 되었다.
또한 그동안 유전자연구만을 규율해 왔던 생명윤리안전법이 유전자연구와 비유전자연구의 구분을 없애고 인체유래물을 이용하는 모든 연구를 규율 범위에 포함시키는 큰 변화가 있었다. 이러한 변화는 의생명과학의 발달과 정보사회의 도래, 아울러 개인정보에 대한 보호의식의 확산과 맥을 같이 하는 것으로 위험의 인식이 단지 물리적 위험에 그치지 않고 개인정보 유출로 인한 프라이버시 침해의 위험까지 확장되는 방향으로 변화되고 있다는 것을 보여주는 것이기도 하다.
2. 인간대상연구
생명윤리안전법은 인간을 대상으로 하는 연구(이하 ʻ인간대상연구ʼ)를 ʻʻ사람을 대상으로 물리적으로 개입하는 연구(연구대상자를 직접 조작하거나 연구대상자의 환경을 조작하여 자료를 얻는 연구)ʼʼ, ʻʻ의사소통, 대인 접촉 등의 상호작용을 통하여 수행하는 연구(연구대상자의 행동관찰, 대면(對面) 설문조사 등으로 자료를 얻는 연구)ʼʼ, ʻʻ개인을 식별할 수 있는 정보를 이용하는 연구(연구대상자를 직접·간접적으로 식별할 수 있는 정보를 이용하는 연구)ʼʼ로 설명하고 있다.2) 여기서 주목해야 할 것은 인간대상연구에 설문조사, 면접조사 연구 및 관찰연구가 포함되고 있다는 점이다.
인간대상연구를 수행하는 연구자가 속한 연구기관은 기관생명윤리위원회(이하 ʻ기관위원회ʼ)를 설치하여야 한다.3) 연구기관에 설치된 기관위원회는 흔히 ʻIRBʼ라 불려왔던 위원회를 의미한다.4) 이 위원회는 기관으로부터 독립성을 지니고 있어야 하며, 특별히 이번에 전면개정된 법률에서는 위원회 구성과 관련하여 ʻʻ5명 이상의 위원으로 구성하되, 하나의 성(性)으로만 구성할 수 없으며ʼʼ라고 함으로써 위원들의 성별에 대해서도 최소한의 고려를 하고 있다.5)
인간을 대상으로 하거나 인체유래물을 이용하거나 배아를 연구하는 경우, 연구자는 연구자가 소속된 기관의 기관위원회에서 연구계획서에 대한 사전 심의를 받아야 한다. 따라서 소속 기관의 기관위원회가 설치되지 않은 연구자는 어려움을 겪을 수 있다. 이런 문제점을 해결하기 위해 생명윤리안전법은 공용위원회의 심의를 받아 연구를 진행할 수 있도록 규정하고 있다.6)
3. 기관위원회의 심의와 심의면제
모든 인간대상연구와 인체유래물 연구는 기관위원회의 연구계획서 심의를 받고 연구대상자로부터 동의를 획득하여 수행하는 것이 기본적인 원칙이다. 그러나 ʻʻ국가나 지방자치단체가 공공복리나 서비스 프로그램을 검토·평가하기 위해 직접 또는 위탁하여 수행하는 연구ʼʼ나 ʻʻ교육기관에서 통상적인 교육실무와 관련하여 하는 연구ʼʼ는 정의상 인간대상연구에 포함시키지 않고 있지 않아,7) 심의가 면제된다. 아울러 ʻʻ일반 대중에게 공개된 정보를 이용하는 연구 또는 개인식별정보를 수집·기록하지 않는 연구ʼʼ로서 다음의 조건에 해당하는 연구는 인간대상연구에 포함되더라도 심의가 면제된다. 첫째, ʻʻ연구대상자를 직접 조작하거나 그 환경을 조작하는 연구 중ʼʼ에서 ʻʻ약물투여, 혈액채취 등 침습적 행위를 하지 않는 연구 또는 신체적 변화가 따르지 않는 단순 접촉 측정장비 또는 관찰장비만을 사용하는 연구ʼʼ, 또는 법에 따라 ʻʻ판매 등이 허용되는 식품 또는 식품첨가물을 이용하여 맛이나 질을 평가하는 연구ʼʼ 또는 법이 정한 ʻʻ안전기준에 맞는 화장품을 이용하여 사용감 또는 만족도 등을 조사하는 연구” 등이며 둘째, ʻʻ연구대상자등을 직접 대면하더라도 연구대상자등이 특정되지 않고 「개인정보 보호법」 제23조에 따른 민감정보를 수집하거나 기록하지 않는 연구ʼʼ와 셋째, ʻʻ연구대상자등에 대한 기존의 자료나 문서를 이용하는 연구ʼʼ에 대한 심의가 면제될 수 있다.8) 그런데 주의해야 할 것은 이러한 연구들에 대한 심의 면제여부를 연구자가 판단하지 못하고 기관위원회가 확인하도록 하고 있다는 점이다.9)
4. 동의 획득과 동의면제
인간대상연구와 인체유래물연구는 연구대상자로부터의 동의를 획득한 후 수행되는 것이 기본적인 원칙이다. 생명윤리안전법은 동의 획득에 대해 규정하면서 기본적으로 어떤 내용이 동의획득시 연구대상자에게 설명되어야 하는지 규정하고 있다.10) 그런데 기관위원회의 심의와 연구대상자로부터의 동의 획득은 별개로 고려되어야 한다. 따라서 심의면제와 동의면제 역시 구분하여 고려되어야만 한다.
생명윤리안전법은 ʻʻ연구대상자의 동의를 받는 것이 연구 진행과정에서 현실적으로 불가능하거나 연구의 타당성에 심각한 영향을 미친다고 판단되는 경우ʼʼ 그리고 동시에 ʻʻ연구대상자의 동의 거부를 추정할 만한 사유가 없고, 동의를 면제하여도 연구대상자에게 미치는 위험이 극히 낮은 경우ʼʼ에 동의면제가 가능하도록 규정하고 있다. 그러나 이러한 동의면제는 국제적 지침과 마찬가지로 반드시 기관위원회의 심의를 거쳐야만 가능하도록 규정되어 있다.
법문의 내용에 다소 모호함이 있지만 동의 면제에 대해서는 하위법령에 특별히 위임한 것이 없다. 따라서 위 내용만으로 기관위원회는 동의 면제 여부를 판단하여야 한다. 상기한 규정은 동의면제에 대한 일반적인 국제적 지침과 부합하지만 ʻʻ연구대상자의 동의 거부를 추정할 만한 사유가 없고ʼʼ라는 부분은 국제지침에는 없는 표현이어서 주의할 필요가 있다.
생명윤리안전법에서 시급히 개정되어야 할 문제점 중 하나는 동의 면제에 대한 예외 조항에서 발생한다. 현재 법률은 대리동의의 경우에는 일체의 동의 면제를 허용하지 않고 있다.11) 이 부분에 대해서는 추후 개정을 통해 연구 현실에 부합하는 규정으로 수정될 필요가 있을 것이다.
5. 인체유래물연구 및 유전자연구
생명윤리안전법은 인간대상연구에 인체유래물연구를 포함시키지 않고, 별도로 인체유래물연구를 정의하고 있다. 인체유래물연구는 ʻʻ인체유래물을 직접 조사·분석하는 연구ʼʼ를 말하며, 여기서 인체유래물이란 ʻʻ인체로부터 수집하거나 채취한 조직·세포·혈액·체액 등 인체 구성물 또는 이들로부터 분리된 혈청, 혈장, 염색체, DNA(Deoxyribonucleic acid), RNA(Ribonucleic acid), 단백질 등을ʼʼ 말한다.12) 인체유래물연구의 정의에서 확인할 수 있듯이, 전면개정된 생명윤리안전법은 유전자연구를 특별히 별도로 다루고 있지 않다. 유전자연구는 기본적으로는 인체유래물을 이용하는 연구이므로 인체유래물연구에 대한 규율내용을 그대로 적용받도록 했기 때문이다. 이와 같은 변화는 이전의 생명윤리안전법이 유전자특수주의에 입각했던 것을 고려할 때 대단히 큰 변화라고 볼 수 있다.
인체유래물연구를 수행하려는 연구자는 기관위원회의 연구계획서 심사를 받은 후 연구를 시작해야 한다. 동법 하위법령은 ʻʻ교육기관에서 통상적인 교육과정의 범위에서 실무와 관련하여 수행하는 연구ʼʼ와 ʻʻ공중보건상 긴급한 조치가 필요한 상황에서 국가 또는 지방자치단체가 직접 수행하거나 위탁한 연구ʼʼ는 심의가 면제되며, ʻʻ연구자가 개인정보를 수집·기록하지 않은 연구 중ʼʼ13) 다음과 같은 연구는 심의가 면제될 수 있다. ʻʻ인체유래물은행이 수집·보관하고 있는 인체유래물과 그로부터 얻은 유전정보(이하 ʻʻ인체유래물등ʼʼ이라 한다)를 제공받아 사용하는 연구로서 인체유래물등을 제공한 인체유래물은행을 통하지 않으면 개인정보를 확인할 수 없는 연구ʼʼ, ʻʻ의료기관에서 치료 및 진단을 목적으로 사용하고 남은 인체유래물등을 이용하여 정확도 검사 등 검사실 정도관리 및 검사법 평가 등을 수행하는 연구ʼʼ, ʻʻ인체유래물을 직접 채취하지 않는 경우로서 일반 대중이 이용할 수 있도록 인체유래물로부터 분리·가공된 연구재료(병원체, 세포주 등을 포함한다)를 사용하는 연구ʼʼ, ʻʻ연구자가 인체유래물 기증자의 개인식별정보를 알 수 없으며, 연구를 통해 얻어진 결과가 기증자 개인의 유전적 특징과 관계가 없는 연구(단, 배아줄기세포주를 이용한 연구는 제외)ʼʼ 등이다.14)
인체유래물연구의 경우에도 동의획득은 원칙적으로 필수적인 사항이다. 그러나 생명윤리안전법은 동의면제 규정을 갖고 있으므로 원칙적으로는 동의면제가 가능한 인체유래물연구도 있을 것이다. 하지만 앞서 언급되었던 ʻʻ연구대상자의 동의 거부를 추정할 만한 사유가 없고ʼʼ라는 부분의 해석이 엄격하게 이루어질 때에는 실질적으로 동의면제가 허용되는 연구는 많지 않을 가능성이 높다. 특히 인체유래물연구는 유전정보를 획득할 수 있는 물질을 기증하는 것이기에 동의거부 추정 사유에 대한 기관위원회의 판단이 쉽지 않을 것이다. 이 문제는 애초의 검사나 연구를 위해 동의를 획득할 때 이차적 사용에 대한 동의를 획득하지 못한 경우에도 적용될 것이다. 따라서 가장 바람직한 경우는 검사나 일차적 연구를 위해 인체유래물을 획득하는 경우 이차적 사용에 대해서도 동의를 획득하는 것이 바람직하다. 동의 시 설명해야 하는 내용에서 ʻʻ인체유래물과 그로부터 얻은 유전정보(이하 ʻʻ인체유래물등ʼʼ이라 한다)의 제공에 관한 사항ʼʼ이란 부분은 바로 이러한 이차적 사용에 대한 동의·획득을 구하는 내용이다.15)
많은 연구자들은 전면개정으로 인해 생명윤리안전법 시행이전 동의 없이 연구에 사용했던 인체유래물을 계속 사용할 수 있는지에 대해 우려하고 있다. 생명윤리안전법 부칙은 ʻʻ이 법 시행 전에 유전자연구 외의 인체유래물연구에서 이미 사용되고 있는 인체유래물에 대하여는 제37조제1항에 따른 서면동의 없이 계속 연구에 사용할 수 있다. 다만, 이를 타인에게 제공할 경우에는 그러하지 아니하다ʼʼ라고 하고 있다.16) 따라서 법시행일 이전 이미 획득한 인체유래물은 동의가 없었더라도 유전자연구가 아닌 연구에 그리고 타인에게 제공하지 않는 경우 계속 사용할 수 있도록 하고 있다.
6. 줄기세포연구
전면개정된 생명윤리안전법에서 줄기세포연구에 대한 부분은 커다란 변화가 없다. 다만 단성생식배아연구 등도 체세포복제배아연구와 유사한 생명윤리적 우려와 조치가 필요하다고 판단되기 때문에 체세포복제배아연구와 동일하게 규제되도록 하고 있다. 한 동안 논란이 많았던 난자 사용에 대한 제한 부분도 동법 시행령에 그대로 유지되었다. 또한 배아줄기세포주의 등록제 역시 유지되고 있다. 배아줄기세포주의 이용과 관련하여 배아줄기세포를 ʻʻ체외에서 질병의 진단·예방 또는 치료를 위한 연구, 줄기세포의 특성 및 분화에 관한 기초연구, 또는 국가위원회의 심의를 거쳐 대통령령으로 정하는 연구ʼʼ 목적으로만 ʻʻ체외에서ʼʼ 이용하도록 한 규정17)도 다소 논란이 있었지만 전면개정과정에서도 수정은 없었다.
성체줄기세포연구 및 유도전분화능줄기세포연구와 관련된 중요한 변화는 이러한 연구도 성체세포의 획득을 전제로 하고 있기 때문에 인체유래물연구의 규제에 포함되게 되었다는 점이다. 그런데 배아줄기세포와 달리, 특별히 어떤 경우에 성체줄기세포나 유도전분화능줄기세포를 이용할 수 있는지에 대한 규정은 생명윤리안전법에는 없다. 따라서 실험실연구를 넘어서서 직접 환자에게 성체줄기세포를 투입하는 연구에 대해서는 ʻʻ의약품 등의 안전에 관한 규칙 별표 4 의약품 임상시험 관리기준ʼʼ에 따라 수행되어야 할 것이다.
줄기세포연구와 관련된 커다란 쟁점 중 하나는 과연 줄기세포치료제 개발 역시 기존의 의약품 허가절차를 따라 개발되어야 하느냐는 문제이다. 이 문제를 해결하기 위해서는 우선 해외법제에 대한 연구가 수행될 필요가 있고, 우리나라에 적합한 법제를 마련하기 위한 의견수렴이 필요할 것이다. 물론 이런 과정에서 줄기세포치료제 개발이 지닌 특수성이 반드시 고려되어야 할 것이며, 생명윤리적 핵심 쟁점은 안전성이므로 세포치료제의 안전성 검증에 대한 과학적 연구가 수행되어야 할 뿐만 아니라 안전성 검증의 합리적인 기준이 마련되어야 할 것이다.
7. 결론
생명윤리안전법의 개정내용을 중심으로 의생명과학연구의 생명윤리 관련 규율 내용의 변화를 살펴보았다. 연구자들에게 생명윤리는 전문직 윤리이기 때문에 연구자들 사이의 자율적인 가이드라인 개발이 바람직하다. 또한 현행 법률에 문제점이 있다고 생각한다면 이를 개선하려는 연구자의 노력도 필요하다. 연구자들에게 필요한 것은 법률은 주어지는 것이 아니라 연구자들 스스로 만들어 나가는 것이란 의식이다. 아울러 최소한의 내용만이 법률에 담기고 많은 부분이 자율적인 전문직 생명윤리의 범위에서 작동하려면 연구자들의 생명윤리 의식도 성장해야 할 뿐만 아니라, 연구의 윤리성에 대한 사회적 신뢰 구축 역시 과학연구만큼이나 중요할 것이다.

1. 개요
생명공학 분야는 살아 있는 생물체를 발명의 대상으로 하고 있다는 특성 때문에 다른 기술 분야와는 별도의 독특한 지식재산권 제도를 운영하고 있다. 현재까지도 이 분야는 연구 방법이 지속적으로 개발되어 새로운 유형의 발명이 증대되고 있고, 특허 출원의 내용과 수준도 날로 복잡·다양해지고 있다. 이에 따라 생명공학 분야는 특허성 판단을 위한 심사 실무나 청구범위의 해석, 침해 여부의 판단에 이르기까지 모든 단계에서 다른 기술 분야와 차별화된 특수성을 보이고 있으며 이에 부합하는 심사의 질 제고와 제도의 변화가 요구되고 있다.
그동안 미생물에 특허를 허여할 수 있는가 하는 문제에서부터 출발해서 인간의 유전자나 생물체 자체, 그로부터 분리된 물질과 진단·수술·치료 등 의료 관련 방법을 특허 대상으로 허여할 것인지에 이르기까지 생명공학 분야의 특허 대상을 놓고 국가별로 상당한 논란이 계속되어 왔고, 현재 이 분야의 특허 대상 및 발명의 성립성에 대해서는 국가별로 상이한 기준을 가지고 있는 실정이다. 또한 생명공학의 급속한 발전이 가져온 배아복제나 배아줄기세포 관련 발명 등은 인류의 의료기술에 획기적인 기여를 할 것으로 예상되는 반면 일각에서는 인간 복제의 가능성 등에 따른 사회윤리적인 문제도 제기하고 있다.
생명공학 분야는 기술의 특성상 장기간의 연구 개발을 통해 특허가 창출되므로 지식재산권을 통한 연구결과의 보호가 필수적인 분야라는 점에서 국제적인 공감대가 형성되어 있으며, 인간 유전체 연구(Human Genome Project)의 완성 이후 국가 간에 유전체 관련 핵심기술을 선점하기 위한 경쟁이 치열하게 전개되는 양상을 보이고 있다. 질병의 조기진단과 개인별 맞춤형 의료 및 바이오 의약품 개발을 위한 기반 기술인 유전정보 분석기술, 약물 유전체학, 줄기세포 연구 등이 포스트 게놈 시대의 신산업 성장 동력으로 부상하고 있음에 따라 원천·핵심기술의 확보와 이를 위한 국가 차원의 장기적 투자가 이 분야 산업 경쟁력의 핵심으로 자리 잡을 전망이다.
생명공학 기술이 사회 전반에 영향을 미치게 될 바이오 경제의 시대가 도래함에 따라 국제 경쟁력 확보를 위해서는 기술의 파급력과 영향력이 높은 지식재산권의 창출이 필수적이다. 우리나라는 아직 생명공학 분야에서 기초 기술 개발 단계에 있으므로 정부의 장기적 로드맵에 따라 유전체·단백질체·생명자원·바이오의약·의료기기 등의 기술분야에 집중적인 R&D 투자가 요구된다. 또한 개발된 연구 성과물들에 대해서는 지식재산권으로 보호·활용하는 등의 산업 육성 전략을 통해 국내 생명공학 산업을 지속적으로 성장·발전시킬 필요성이 대두되고 있다.
2. 생명공학 분야 특허출원 및 등록 현황
가. 특허출원 현황
생명공학 분야는 그 응용기술에 따라 크게 4개 분야로 구분되고, 이 4개 분야는 유전체, 단백질, 생물자원 관련 기술인「기초 분야」, 측정·진단 등의「생물공정 분야」,「의약 분야」및 바이오 농약, 신규 동·식물 개발 기술인「농업 분야」로 분류된다. 생명공학 분야 전체의 특허출원은 2010년에 5,987건, 2012년에 6,506건이 출원되어 매년 꾸준한 증가 추세를 보이고 있고, 이 분야의 내국인 출원 비중도 생명공학 분야의 국내 산업이 발전함에 따른 결과로 2008년 67.1%, 2010년 72.4%에서 2012년에는 74.5%로 꾸준히 증가하고 있다.
[표 5-3-1] 연도별 생명공학 분야 특허출원 현황
(단위 : 건)
|
구 분 |
2003년 |
2004년 |
2005년 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
2011년 |
2012년 |
|
내국인 |
2,045 |
2,026 |
2,295 |
2,606 |
3,137 |
3,398 |
3,789 |
4,339 |
4,556 |
4,852 |
|
외국인 |
1,047 |
1,215 |
1,272 |
1,058 |
1,437 |
1,669 |
1,380 |
1,648 |
1,750 |
1,654 |
|
계 |
3,092 |
3,241 |
3,567 |
3,664 |
4,574 |
5,067 |
5,169 |
5,987 |
6,306 |
6,506 |
* 2012년 12월 31일 기준
나. 특허등록 현황
특허청은 2007년까지 심사 대상 물량의 증가에 따라 심사관을 꾸준히 증원하고 심사처리기간을 큰 폭으로 단축시킨 결과, 생명공학 분야의 특허등록 건수도 2005년 2,022건에서 매년 꾸준히 증가하여 2007년에는 2,830건에 이르렀다. 그러나 이후 특허심사정책이 심사품질 중심으로 패러다임이 전환됨에 따라 심사처리물량 및 특허등록 결정률이 감소하여 이 분야 특허등록 건수도 2009년에 1443건, 2010년에는 1755건으로 감소하였다. 2010년 이후에는 안정적인 심사품질 및 꾸준한 심사관 증원으로 2011년에 2,669건, 2012년에 3,708건의 특허등록으로 가파른 등록률 증가 추세를 보이고 있다.
생명공학 분야의 2012년 특허등록 현황은 기술 분류별로 국제특허분류기호(IPC)18) A61K와 C12N에 해당하는 바이오 의약품 관련 발명, 미생물·효소·유전공학에 대한 발명이 각각 1,112건(전체 비중 29.9%)과 930건(전체 비중 25.0%)으로 전체 특허등록 건의 약 55%로 높은 비중을 차지하고 있다. 그 다음으로 단백질 관련 발명이 전년 대비 약 1.7배의 증가율을 보이며 361건(전체 비중 9.7%)이 등록되었고, 시험, 측정, 분리·정제 관련 발명과 진단시약 관련 발명이 꾸준한 특허등록 증가세를 보이고 있다. 반면 미생물 이용 폐수처리 관련 발명은 상대적으로 비중이 작아지고 있다.
생명공학 분야 전체 등록특허 중 내국인 등록특허 비중은 2003년 68.8%, 2005년 74.4%에서 매년 꾸준히 증가하여 2011년에는 82.6%에 이르렀으나, 2012년에 74.3%로 다소 낮아졌다. 이는 내국인 등록특허의 대부분이 원천기술에 관한 것이라기보다는 개량·응용기술에 대한 것이어서 지속적인 증가세를 보이지 못하는 것으로 판단되고, 이러한 문제를 개선하기 위해서는 앞으로 국내에서도 원천·핵심기술을 개발하여 강한 특허를 등록받을 수 있도록 생명공학 산업 전체의 기술개발 투자가 확대되어야 할 것이다.
[표 5-3-2] 연도별 생명공학 분야 특허등록 현황
(단위 : 건)
|
연도 분류 |
2003년 |
2004년 |
2005년 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
2011년 |
2012년 |
|
|
A01H (식물 신품종) |
내국인 |
17 |
27 |
70 |
11 |
40 |
27 |
13 |
10 |
18 |
50 |
|
외국인 |
1 |
7 |
4 |
1 |
12 |
1 |
2 |
0 |
1 |
24 |
|
|
계 |
18 |
34 |
74 |
12 |
52 |
28 |
15 |
10 |
19 |
74 |
|
|
A01K 67/00∼67/04 (신규 동물) |
내국인 |
8 |
10 |
14 |
25 |
14 |
18 |
5 |
15 |
22 |
23 |
|
외국인 |
0 |
0 |
3 |
12 |
7 |
2 |
1 |
2 |
1 |
7 |
|
|
계 |
8 |
10 |
17 |
37 |
21 |
20 |
6 |
17 |
23 |
30 |
|
|
A01N 63/00∼65/00 (바이오 농약) |
내국인 |
14 |
19 |
50 |
28 |
37 |
47 |
1 |
21 |
20 |
30 |
|
외국인 |
2 |
3 |
6 |
5 |
2 |
3 |
2 |
2 |
1 |
6 |
|
|
계 |
16 |
22 |
56 |
33 |
39 |
50 |
3 |
23 |
21 |
36 |
|
|
A61K3) (바이오 의약품 관련) |
내국인 |
153 |
128 |
336 |
597 |
565 |
594 |
309 |
370 |
745 |
907 |
|
외국인 |
85 |
67 |
90 |
189 |
165 |
179 |
95 |
86 |
123 |
205 |
|
|
계 |
238 |
195 |
426 |
786 |
730 |
773 |
404 |
456 |
868 |
1,112 |
|
|
C02F 3/00∼3/34, 11/02∼11/04 (미생물 이용 폐수처리) |
내국인 |
121 |
259 |
191 |
235 |
241 |
184 |
140 |
189 |
247 |
217 |
|
외국인 |
7 |
12 |
10 |
18 |
23 |
4 |
3 |
5 |
6 |
18 |
|
|
계 |
128 |
271 |
201 |
253 |
264 |
188 |
143 |
194 |
253 |
235 |
|
|
C07H 19/00∼21/04 (당류) |
내국인 |
5 |
5 |
9 |
7 |
6 |
2 |
4 |
1 |
3 |
3 |
|
외국인 |
16 |
15 |
22 |
24 |
20 |
18 |
7 |
8 |
5 |
12 |
|
|
계 |
21 |
20 |
31 |
31 |
26 |
20 |
11 |
9 |
8 |
15 |
|
|
C07K (단백질) |
내국인 |
38 |
78 |
133 |
108 |
144 |
142 |
68 |
83 |
118 |
155 |
|
외국인 |
71 |
76 |
108 |
167 |
111 |
124 |
97 |
93 |
96 |
206 |
|
|
계 |
109 |
154 |
241 |
275 |
255 |
266 |
165 |
176 |
214 |
361 |
|
|
C12C∼M (발효 및 그 장치) |
내국인 |
50 |
87 |
87 |
91 |
144 |
122 |
86 |
100 |
138 |
231 |
|
외국인 |
6 |
6 |
5 |
11 |
17 |
20 |
8 |
14 |
18 |
48 |
|
|
계 |
56 |
93 |
92 |
102 |
161 |
142 |
94 |
114 |
156 |
279 |
|
|
C12N (미생물, 효소, 유전공학) |
내국인 |
235 |
401 |
413 |
458 |
538 |
448 |
228 |
379 |
530 |
654 |
|
외국인 |
94 |
104 |
190 |
206 |
241 |
185 |
114 |
89 |
111 |
276 |
|
|
계 |
329 |
505 |
603 |
664 |
779 |
633 |
342 |
468 |
641 |
930 |
|
|
C12P (발효 생성물) |
내국인 |
40 |
71 |
50 |
58 |
39 |
44 |
42 |
41 |
89 |
82 |
|
외국인 |
22 |
34 |
37 |
49 |
38 |
28 |
35 |
16 |
25 |
36 |
|
|
계 |
62 |
105 |
87 |
107 |
77 |
72 |
77 |
57 |
114 |
118 |
|
|
C12Q,S (시험, 측정, 분리정제) |
내국인 |
33 |
136 |
101 |
201 |
224 |
161 |
87 |
102 |
136 |
228 |
|
외국인 |
15 |
38 |
37 |
42 |
61 |
30 |
37 |
28 |
41 |
62 |
|
|
계 |
48 |
174 |
138 |
243 |
285 |
191 |
124 |
130 |
177 |
290 |
|
|
G01N 33/50∼33/98 (진단 시약) |
내국인 |
16 |
22 |
36 |
92 |
97 |
67 |
46 |
80 |
141 |
177 |
|
외국인 |
12 |
11 |
20 |
54 |
44 |
24 |
13 |
21 |
34 |
51 |
|
|
계 |
28 |
33 |
56 |
146 |
141 |
91 |
59 |
101 |
175 |
228 |
|
|
계 |
내국인 |
730 |
1,243 |
1,490 |
1,911 |
2,089 |
1,856 |
1,029 |
1,391 |
2,207 |
2,757 |
|
외국인 |
331 |
373 |
532 |
778 |
741 |
618 |
414 |
364 |
462 |
951 |
|
|
계 |
1,061 |
1,616 |
2,022 |
2,689 |
2,830 |
2,474 |
1,443 |
1,755 |
2,669 |
3,708 |
|
* 2012년 12월 31일 기준
3. 생명공학 분야 심사 인프라 확충
특허청은 급속히 발전하고 있는 생명공학 분야의 새로운 기술을 보호하는 한편 국제화 추세에 발맞추어 생명윤리 문제 등의 판단기준을 제시하고자 생명공학 특허 심사기준을 제정하여 운용하고 있으며, 기술개발 추이에 발맞추어 우수특허의 권리를 효율적으로 보호할 수 있도록 심사기준 개정, 심사 전문인력 확보, 유전자서열 DB 구축 등 지식재산권 제도와 인프라를 확충하고 심사의 전문화를 꾀하고 있다.
가. 생명공학 특허 심사기준의 제정 및 개정
(1) 생명공학 특허 심사기준의 제정(1998년.3월)
생명공학 분야 특허란 직접 또는 간접적으로 자기복제를 할 수 있는 생물학적인 물질(biological material) 즉, 자기 복제력을 갖는 생물, 유전정보 및 그 복제에 관련된 발명을 포함하는 특허를 의미한다. 이러한 생명공학 분야 출원기술의 심사에 대한 표준운영절차를 확립하고자 산재된 생명공학 관련 심사기준을 통합하여 1998년에 생명공학 분야 산업부문별 심사기준을 제정하였다. 유전공학 관련발명, 미생물관련 발명, 식물관련 발명, 동물관련 발명으로 크게 네 개의 분야로 나눠서 심사기준을 신설하고 윤리성 기준과 불특허 요건을 명시하였다.
(2) 생명공학 특허 심사기준 1차 개정(2000년.12월)
인간 유전체 연구(HGP)의 1차 결과가 발표됨에 따라 그의 산물인 DNA 단편, SNP(개체 간 단일염기변이) 등 새로운 형태의 발명이 출원되고 있어 이를 보호할 기준 마련을 위해 개정하였다. HGP의 산물인 EST 등 DNA 단편, SNP 등에 대한 심사기준을 마련하였고, 유전자, 단백질, 모노클로날 항체 등에 대한 포괄적인 청구범위 기재를 인정하며, 안티센스에 대한 기재요건을 추가하는 등 기존의 심사 실무를 반영하였고 대용량 유전정보 출원에 대비한 단일성 판단기준에 대해서 정비하였다.
(3) 생명공학 특허 심사기준 2차 개정(2003년.12월)
생명공학 분야의 새로운 기술을 보호하는 한편, 생명윤리문제의 판단기준을 제시하고 유전공학관련 발명의 실질적인 보호에 중점을 두었다. 이에 따라 유전자 및 단백질 변이체에 대한 청구범위 기재요건을 강화하고 서열로 특정할 수 없는 경우의 단백질의 특정 요건을 구체화하였으며, 모노클로날 항체의 실시가능성요건 및 청구범위 기재요건을 보호하는 등의 보완이 이루어졌다.
(4) 생명공학 특허 심사기준 3차 개정(2005년.5월)
당초 2차 개정안에서는 생명과학기술의 생명윤리 및 안전을 확보하기 위해 제정될 예정이었던 「생명윤리 및 안전에 관한 법률」에 근거하여 생명공학 분야 발명의 생명윤리 문제를 판단하는 내용이 포함되어 있었으나, 법률의 제정 및 시행이 늦어짐에 따라 이 내용이 삭제된 채로 개정되었었다. 3차 개정에서는 「생명윤리 및 안전에 관한 법률」의 시행에 연계하여 정부의 공식 승인을 받은 연구 성과물에 대한 발명은 특허등록 대상으로 하는 한편, 동법에서 금지하는 행위 또는 연구 성과물에 대한 발명은 특허법 제32조의 규정에 의거 특허를 받을 수 없는 발명으로 하여 생명공학분야 발명의 생명윤리 및 안전에 대한 판단 기준을 보완하였다.
(5) 생명공학 특허 심사기준 4차 개정(2006년.9월)
당초 우리 특허법에서는 식물관련 발명의 경우는 특허법 제31조에 의해서 무성적으로 반복 생식할 수 있는 식물에 한하여 특허를 허여하여 왔으나, 국내·외 특허제도 및 품종보호제도가 발전함에 따라 유성번식 식물도 특허 대상에 포함시키기 위해 특허법 제31조를 삭제(2006년 10월 1일 시행)하게 되었다. 이에 따라 4차 개정에서는 식물관련 특허의 대상을 무성번식방법을 갖춘 식물에서 신규식물 자체 또는 일부분 및 그 육종방법으로 확대하였고, 유성번식 식물의 재현성 요건을 충족시키기 위해 종자 기탁제도를 도입하였다.
(6) 생명공학 특허 심사기준 5차 개정(2010년.1월)
인간 유전자 지도의 완성으로 관련 발명의 출원이 증가되고 다양화되고 있는 상황에서 이를 심사기준에 반영하기 위한 5차 개정에서는, 기능으로 한정한 공지의 유전자 또는 단백질에 대한 신규성 판단기준, 폴리뉴클레오티드 단편이나 안티센스의 진보성 판단기준, 다수의 유전자나 단백질을 마커로 청구하는 경우의 단일성 판단기준을 보완하고 이에 대한 구체적 예시를 부가하였으며, 공지의 미생물과 동일종이면서 기탁번호를 달리하는 미생물의 진보성 판단기준에 대한 예시와 설명을 부가하였다.
(7) 생명공학 분야 심사실무가이드 통합 개정(2012년.1월)
심사의 공정성 및 일관성 유지를 통한 심사품질 향상을 위해 생명공학분야 심사실무가이드가 개정(2012년 2월 시행)되었다. 개정된 생명공학 분야 심사실무 가이드는 품질 제고 노력의 일환으로 중복된 내용이 심사기준에 포함되고 일부 심사기준의 활용도가 낮은 문제점을 보완하고자 하였으며, 유형별 사례를 통해 기재요건과 특허요건에 대한 판단기준을 구체적으로 제시하여 쉽게 이해하고 적용할 수 있는 생명공학분야 심사 실무 기준을 정립하였다. 또한 발명의 상세한 설명 기재요건과 관련된 특허법 개정사항과 특허출원의 서열 목록 작성 및 제출 요령에 관련된 고시 개정사항을 반영하였다. 생명공학 분야 심사실무가이드는 특허청 홈페이지(www.kipo.go.kr)의 정보마당(간행물 카테고리) 에서 다운받을 수 있다.
[표 5-3-3] 생명공학 분야 심사실무가이드에 따른 특허 보호대상
|
구분 |
대상 |
특허여부 |
비고 |
|
물질 |
유전자 (DNA서열) |
특허가능 |
유용성이 밝혀진 경우만 특허가능 (단순 유전체(genome) 서열만으로는 특허불가) |
|
단백질 (아미노산서열) |
특허가능 |
||
|
단세포 생명체 (virus, bacteria) |
특허가능 |
관련 미생물 기탁 의무 (특허법 시행령 제2조) |
|
|
동물 |
특허가능 (단, 공서양속에 반하지 않는 것) |
동물발명의 동물이란 사람을 제외한 다세포 동물을 의미함 |
|
|
식물 |
특허가능 |
유성번식 식물의 경우 종자기탁을 통해 재현성 요건 충족 |
|
|
인간의 신체 부분 |
특허불가 |
인체의 존엄성을 해치는 발명은 특허대상에서 배제 (인체에서 旣 분리․배출된 것은 가능) |
|
|
방법 |
수술, 치료방법 |
사람 특허불가, 동물 특허가능 |
사람의 치료․진단 방법은 의료행위에 해당하므로 산업상 이용가능성이 없는 것으로 봄 (특허법 제29조제1항본문) |
|
유전자 치료법 |
사람 특허불가, 동물 특허가능 |
||
|
진단방법 |
사람 특허불가, 동물 특허가능 |
나. 심사 전문인력 확보 및 역량 강화
특허청은 생명공학 분야의 특허출원 증가에 효율적으로 대처하고 심사 전문성을 제고하기 위하여 해당분야 전문 심사인력을 지속적으로 채용하고 있다. 또한 기술 간의 융합화 현상이 진전되고 있는 생명공학 분야의 최근 논의를 점검하고, 관련 기술 및 특허 동향을 분석하기 위하여 이 분야의 청 내·외 인사들로 구성된『바이오특허 연구회』를 운영하고 있다. 바이오특허 연구회를 통해 바이오 또는 지재권분야 전문가 세미나 및 토론회를 개최함으로써 최신 기술과 정보를 습득·교류하는 기회를 마련하고, 연간 활동 보고서를 발간· 배포하는 등 심사의 질적 향상과 생명공학 기술의 전파에 적극 노력하고 있다.
다. 유전자 서열목록 제출제도 시행 및 관련 DB 구축
특허청은 핵산 또는 아미노산 관련 발명의 신속·정확한 검색 및 서열 DB 구축을 위하여, 1999년 이후에 특허출원된 발명에 대해서는 핵산염기 및 아미노산 서열 데이터인 서열목록을 특허청에서 제공하는 소프트웨어 또는 특허청 홈페이지를 이용하여 작성한 전자파일(서열목록전자파일)로 제출하도록 의무화하였다19). 이 서열목록은 출원서에 첨부된 명세서의 마지막(도면이 있는 경우 도면의 다음)에 기재하며 독립된 쪽 번호를 부여하고, 온라인 출원의 경우에는 서열목록전자파일을 명세서에 입력하여 서열목록을 기재하는 것을 가능하도록 하는「핵산염기 서열목록 또는 아미노산 서열목록 작성기준(특허청 고시 제2013-1호)」을 개정하여 서열목록의 명세서 기재 방법을 명확히 하였다.
또한 특허청은 2004년에 한국생명공학연구원과 업무협정을 체결하고, 특허 출원된 유전자 서열 데이터를 한국생명공학연구원 내 국가생명연구자원정보센터에 제공하고 있으며, 유전자서열 검색 시스템을 통합 운영함으로써 검색 기능과 속도가 비약적으로 향상된 검색 시스템을 확보하여 운영 중이다. 2007년 10월부터는 한·일 특허청간 유전자 서열 DB교환을 통해 검색 DB를 확대 운영하고 있다. 한편, 국가생명연구자원정보센터에서는 매월 특허 공개분에 대한 특허서열을 특허청에서 제공받아 국내외 연구자들이 자유롭게 특허서열을 검색하고 이용할 수 있도록 웹기반의 검색 서비스(http://patome.kr)를 제공하고 있다.
[표 5-3-4] 서열목록을 포함한 특허출원 건수
(단위 : 건)
|
구 분 |
2003년 |
2004년 |
2005년 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
2011년 |
2012년 |
|
내국인 |
584 |
619 |
688 |
903 |
1,126 |
1,089 |
1,277 |
1,437 |
1,556 |
1,920 |
|
외국인 |
469 |
577 |
653 |
770 |
967 |
989 |
924 |
1,149 |
1,164 |
1,291 |
|
계 |
1,053 |
1,196 |
1,341 |
1,673 |
2,093 |
2,078 |
2,201 |
2,586 |
2,720 |
3,211 |
* 2012년 12월 31일 기준
4. 미생물 기탁제도 운영
가. 미생물 기탁제도의 취지
미생물20)에 대한 발명은 살아 있는 생명체를 대상으로 하는 것이어서 특허 명세서에 아무리 상세하게 미생물의 균학적 성질이나 그 외의 다른 특성을 기재한다 하더라도 제3자는 그 미생물을 재현하거나 입수하여 그 발명을 실시하는 것이 실질적으로 불가능할 수 있다. 이처럼 미생물 발명에서 그 발명이 속하는 기술분야에서 통상의 지식을 가진 자가 특허 명세서 내에 반복 재현할 수 있도록 기재하는 것이 불가능한 경우가 발생하기 때문에 이를 보완하기 위해 서면주의의 예외적 규칙으로「미생물 기탁제도」가 마련되었다. 이 제도는 출원인으로 하여금 해당 미생물을 공인기관에 기탁하도록 하여 제3자가 일정조건(기탁자 또는 특허청 허락)하에 분양을 받아 당해 발명을 쉽게 실시할 수 있도록 하는 제도로써, 미생물 발명의 일정한 확실성과 반복생산 가능성의 문제를 해결하고 있다.
미생물에 관계되는 발명에 대하여 특허출원을 하고자 하는 자는 특허법시행령 제2조에 따라 그 미생물을 특허청장이 정하는 기탁기관인 국내기탁기관 또는 특허절차상 미생물 기탁의 국제적인 승인에 관한 부다페스트 조약21)에 따른 국제기탁기관에 기탁하고 그 수탁증을 출원서에 첨부하여야 한다22). 다만, 그 발명이 속하는 기술 분야에서 통상의 기술자가 그 미생물을 용이하게 입수할 수 있는 경우는 이를 기탁하지 않아도 되는 것으로 규정하고 있다.

[그림 5-3-1] 미생물 기탁 및 출원 절차 개요
나. 미생물 기탁기관 및 관리 현황
국내의 기탁기관은 아래와 같이 4개의 기관이 운영 중이며, 이들 기관은 발명자가 미생물을 기탁하면 고유번호를 부여하고 수탁증을 발급해 주고 있다. 이와 관련하여, 특허청은 제3자가 연구 또는 시험을 위해 특허관련 미생물의 분양을 신청할 경우 미생물분양자격증명서를 발급하여 기탁미생물의 분양을 허락하고 있으며, 기탁된 미생물의 관리 실태를 분기별로 점검하고 있다.
[표 5-3-5] 국내 미생물 기탁기관 현황
|
구 분 |
한국생명공학연구원 생명자원센터4) (KCTC) |
한국미생물 보존센터 (KCCM) |
한국세포주 연구재단 (KCLRF) |
국립농업과학원 농업유전자원센터 (KACC) |
|
국제기탁기관 (지정일) |
자격있음 (1990.06.30.) |
자격있음 (1990.06.30.) |
자격있음 (1993.08.31.) |
자격없음 |
|
국내기탁기관 (지정일) |
자격있음 (1981.08.25.) |
자격있음 (1981.08.25.) |
자격없음 |
자격있음 (2002.01.01.) |
* 2012년 12월 31일 기준
한국생명공학연구원 생명자원센터(KCTC)와 한국미생물 보존센터(KCCM)은 국제기탁기관 및 국내기탁기관으로 지정되어 있고, 한국세포주 연구재단(KCLRF)은 국제기탁기관으로 지정되어 있어, 국제특허출원뿐만 아니라 국내특허출원 시에도 기탁기관으로 인정된다. 반면 국립농업과학원 농업유전자원센터(KACC)는 국내기탁기관이나 국제기탁기관에는 해당하지 않아, 국내특허출원 시에는 기탁기관으로 인정되지만, 국제특허출원의 경우에는 기탁기관으로 인정되지 아니한다.
23)
(단위 : 건)
|
구 분 |
한국생명공학연구원 생명자원센터 (KCTC) |
한국미생물 보존센터 (KCCM) |
한국세포주 연구재단 (KCLRF) |
국립농업과학원 농업유전자원센터 (KACC) |
합계 |
|
|
기탁 미생물 |
국내 |
1,194 |
1,544 |
- |
1,092 |
3,830 |
|
국제 |
3,385 |
1,344 |
284 |
- |
5,013 |
|
|
전체 |
4,579 |
2,888 |
284 |
1,092 |
8,843 |
|
|
분양 미생물 |
456 |
287 |
216 |
240 |
1,199 |
|
* 2012년 12월 31일 기준
기탁 가능한 미생물의 종류는 기탁기관에 따라 다르며, 한국생명공학연구원 생명자원센터(KCTC)가 가장 폭넓은 생물자원에 대하여 기탁 서비스를 제공하고 있으나, 위험하다고 판단되는 성질을 가진 미생물, 특별한 수준의 실험실 요건이 필요한 미생물은 기탁 가능한 미생물에서 제외된다.
[표 5-3-7] 기탁기관별 기탁 가능 미생물
(단위 : 건)
|
구분 |
기탁 가능 미생물 종류 |
생명자원센터 (KCTC) |
한국미생물 보존센터 (KCCM) |
한국세포주 연구재단 (KCLRF) |
농업유전 자원센터 (KACC) |
|
미생물 소재 |
비병원성 세균 (Non-Pathogenic Bacteria) |
○ |
○ |
|
○ |
|
방선균 (Actinomycetes) |
○ |
○ |
|
○ |
|
|
비병원성 진균류 (Non-Pathogenic Fungi) |
○ |
○ |
|
○ |
|
|
비병원성 효모 (Non-Pathogenic Yeasts) |
○ |
○ |
|
○ |
|
|
점균류 (Molds) |
○ |
|
|
|
|
|
동물 바이러스 (Animal Virus) |
○ |
○ |
|
|
|
|
식물 바이러스 (Plant Virus) |
○ |
○ |
|
○ |
|
|
조류 (Algae) |
○ |
|
|
|
|
|
박테리오파지 (Bacteriophages) |
○ |
○ |
|
○ |
|
|
동물 소재 |
사람세포 (Human Cell Cultures) |
○ |
|
○ |
|
|
융합세포 (Hybridomas) |
○ |
|
○ |
|
|
|
동물세포 (Animal Cell Cultures) |
○ |
|
○ |
|
|
|
수정란 (Embryos) |
○ |
|
|
|
|
|
비기생성 원생동물 (Non-Pathogenic Protozoa) |
○ |
|
|
|
|
|
식물 소재 |
식물세포 (Plant Cell Cultures) |
○ |
|
|
|
|
종자 (Seeds) |
○ |
|
|
○ |
|
|
유전체 소재 |
진핵생물 DNA (Eukaryotic DNA) |
○ |
|
|
○ |
|
숙주 내 플라스미드 (Plasmids in Hosts) |
○ |
○ |
○ |
○ |
|
|
숙주 외 플라스미드 (Plasmids not in Hosts) |
○ |
○ |
|
|
* 2012년 12월 31일 기준
특허청은 미생물 기탁업무에 대한 개선 대책을 추진하여 부다페스트조약에 어긋났던 일부 미생물 기탁기관의 내부 규정을 개정하고, 기탁기관별로 상이하던 서식을 통일화하였으며, 신청자 편의 위주로 미생물 분양 절차를 간소화하고 온라인 신청체계를 마련하여 특허청 홈페이지에서 온라인상으로도 신청 가능하도록 하였다. 또한 미생물 관련 특허자원의 안정적 보전 및 관리를 위해 2006년에 기존 기탁 미생물 보관 장소와는 별도의 장소에 특허 미생물에 대한 백업을 시행하였으며, 「미생물 기탁기관 지정 등에 관한 고시」를 개정하여 기탁기관의 특허미생물 복제본 보관 의무화 및 보관시설 요건을 규정하였다. 2010년에는 전쟁, 지진 등 비상시에도 미생물 관련 특허자원의 안정적 보존을 담보하기 위해서 각 기탁기관에 비상시 특허 미생물 관리계획을 마련하였다.
현재 특허청은 기탁기관별로 상이한 비상시 특허미생물 관리계획에 대해 기탁기관과 함께 종합화·통일화를 진행하기 위해 특허생물자원 기탁기관 운영회를 설치(2012년 9월)하고 운영 중이며, 국가 특허미생물 통합 보존소를 농촌진흥청 국립농업과학원으로 지정(2013년 4월)하고, 2013년 6월에 특허청과 농총진흥청 간에 업무협정(MOU)을 체결하여 효율적인 운영을 위해 노력하고 있다.
5. 지식재산 및 생명공학 분야 관련 법·제도
가. 지식재산기본법(법률 제10629호, 2011.07.20. 시행)
우리나라의 지식재산기본법은 지식재산의 창출·보호 및 활용을 촉진하고 그 기반을 조성하기 위한 정부의 기본 정책과 추진 체계를 마련하여 우리 사회에서 지식재산의 가치가 최대한 발휘될 수 있도록 함으로써 국가의 경제·사회 및 문화 등의 발전과 국민의 삶의 질 향상에 이바지하는 것을 목적으로 하고 있다. 대통령 소속으로「국가지식재산위원회」를 둠으로써 지식재산에 관한 정부의 주요 정책과 계획을 심의·조정하고 그 추진상황을 점검·평가하여 정부 각 부처의 지식재산 관련 정책을 종합·체계화하여 중복과 비효율을 개선하고 있다.
나. 생명공학 관련 법
(1) 생명공학육성법(법률 제11683호, 2013.03.23. 시행)
생명공학24) 연구의 기반을 조성하여 생명공학을 보다 효율적으로 육성 발전시키고, 그 개발기술의 산업화를 촉진하여 국민경제의 건전한 발전에 기여함을 목적으로 1983년에 제정되었고, 11차에 걸쳐 개정되었다. 이 법은 ʻʻ생명공학에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 의한다.(제3조)ʼʼ고 규정하여 생명공학에 관한 중심적인 법률로서의 지위를 가짐을 선언하고 있다.
(2) 생명연구자원의 확보·관리 및 활용에 관한 법률(법률 제11713호, 2013.03.23. 시행)
생명공학연구의 기반이 되는 자원으로서 산업적으로 유용한 동물, 식물, 미생물, 인체유래 연구자원 등 생물체의 실물과 정보를 의미하는 생명연구자원의 효율적인 확보와 체계적인 관리를 통하여 지속 가능한 활용을 도모하고 생명공학의 발전 기반을 조성함으로써 국민의 삶의 질 향상과 국가 경제 발전에 기여 하는 것을 목적으로 하고 있다. 또한 이 법은 생명공학 관련 기관의 육성·지원, 투자재원의 마련, 전문인력의 양성, 공동연구의 지원, 생명연구자원의 활용·정보유통, 통계간행물의 발간 등 생명연구자원 관련 분야의 육성을 도모하고 있다.
(3) 생명윤리 및 안전에 관한 법률(법률 제11690호, 2013.03.23. 시행)
생명과학기술에서의 생명윤리 및 안전을 확보하여 인간의 존엄과 가치를 침해하거나 인체에 위해를 주는 것을 방지하고, 생명과학기술이 인간의 질병 예방 및 치료 등을 위하여 개발 이용될 수 있는 여건을 조성함으로써 국민의 건강과 삶의 질 향상에 이바지하기 위한 법률로써「국가생명윤리심의위원회」 및 「기관생명윤리심의위원회」를 설치하여 생명과학기술에서의 생명윤리 및 안전에 관한 심의25)를 하고 있다.

1. 개요
생명공학산업은 DNA, 단백질, 세포 등을 이용한 생명체 관련기술(Bio Technology)을 직접 활용하여 제품과 서비스를 생산하는 신산업으로 의약, 화학, 환경, 식품, 에너지, 농업, 해양 등 다양한 분야에서 21세기 산업성장을 주도할 핵심기술산업으로 평가받고 있다. 특히 의약(Red BT)부분에서의 연구개발이 가장 활발하게 이루어지고 있으며, 점차 농업(Green BT), 산업(White BT)으로 확산되는 추세에 있다.
전 세계적으로 기존 합성신약의 한계를 극복하기 위한 생명공학의약품(생물의약품, 바이오의약품) 개발에 정부가 주도적으로 막대한 예산을 투자하고 있으며 미국, 유럽 등 주요 선진국의 의약품 허가․규제기관 및 WHO 등 국제기구에서는 개인 맞춤형, 고부가가치 바이오신약의 개발을 위한 기술 지원 및 안전성․유효성 평가 가이드라인 개발 등에 박차를 가하고 있다.
우리나라의 경우 1983년 생명공학육성법이 제정된 이후 「제1차 생명공학육성기본계획 (1994~2006)」에 따라 생명공학에 대한 국가차원의 체계적인 연구개발 육성에 착수하여 기술적인 인프라를 구축하여 왔다. 그러나 이러한 기술적 인프라와 정부의 R&D 지원은 기초연구에 집중되어 있어 세계적인 연구 성과들이 신속하게 상업화(실용화)로 이어지고 있지 않아 이에 대한 범부처 대책방안이 속속 마련되고 있다.
2007년부터 향후 10년 간은 생명공학분야 세계7위의 기술 강국 진입을 목표로 「제2차 생명공학육성기본계획(2007~2016)」을 확정하여 생명공학의약품 실용화를 위한 과제를 추진할 계획에 있으며, 신약으로 개발될 가능성이 있는 후보물질에 대하여는 선택과 집중에 의한 비임상·임상시험 R&D 지원을 강화할 예정이다.
한편, 유전자재조합기술을 이용한 제1세대 생명공학의약품 ʻ유전자재조합 치료용 단백질 의약품(insulin, human growth hormon 등)ʼ이 1980년대에 처음으로 세계시장에 소개된 이후, 최근 동 의약품의 특허 만료시점이 도래하면서 다수의 업체들이 바이오시밀러(Bio-Similar) 개발에 참여하고 있으며, 한미 FTA 협상 타결로 국내 제약환경은 큰 변화를 맞고 있다.
이상과 같은 국내외 제약환경의 변화에 발맞추어 생명공학의약품 인허가 과정, 국내외 생명공학의약품 개발동향, 생명공학의약품 실용화와 관련한 식약청의 역할 및 안전관리방안 등에 대하여 살펴보기로 한다.
2. 생명공학의약품 인허가 과정
생명공학의약품은 인체 내에서 유래한 물질을 대상으로 하여 유전자 조작, 유전자 이식, 줄기세포 배양 등의 생명공학기술을 적용하여 개발된 의약품으로써 기존의 합성 화학의약품과 마찬가지로 인체의 질병을 치료, 경감, 진단을 목적으로 한다. 따라서 제품의 실용화를 위해서는 반드시 그 제품에 대한 안전성과 유효성 평가를 거쳐야 한다.
의약품이 개발되어 환자에게 사용되기 까지는 약 10년 이상의 기간이 소요되는데, 이는 대부분 안전성과 유효성을 입증하기 위하여 실시하는 비임상·임상시험에 해당하며 의약품 개발 기간과 투자비용의 대부분을 차지하고 있다(그림 5-4-1).

[그림 5-4-1] 의약품의 개발과정
범정부 차원에서 차세대 성장 동력으로서 육성·지원하고 있는 생명공학의약품의 실용화는 안전성과 유효성 평가를 위한 자료가 얼마나 과학적이고 합리적인지에 달려있으며, 신약개발기간의 대부분을 차지하고 있는 비임상·임상에 대한 지원과 최종 허가단계에서의 안전성·유효성 심사과정이 국제 경쟁력을 결정하는 큰 요인으로 작용한다고 해도 과언이 아니다.
생명공학의약품의 안전성·유효성을 입증하는 임상시험이 완료된 후, 실용화를 위한 마지막 단계인 의약품 허가를 위해서는 의약품을 생산할 수 있는 GMP 시설이 요구된다. 그러나 생명공학의약품을 연구·개발하는 주체인 벤처기업이 막대한 투자비용이 소요되는 GMP 시설은 갖춘다는 것은 Bio 신약개발에 있어 또 하나의 장애 요인으로 작용하였으나, 의약품 제조업 허가와 제조품목허가 분리를 위한 약사법 개정이 이루어짐으로써 제조업 허가와 제조품목허가를 별도로 받을 수 있게 되었다.

[그림 5-4-2] 품목허가 절차
의약품 허가를 받기 위해서는 1상, 2상 및 3상 임상시험을 모두 수행하여야 하나, 신속한 도입이 필요한 희귀의약품 또는 항암제 등의 경우에는 시판 후 3상 임상시험자료 제출을 조건으로 2상 임상시험 완료 후 품목허가를 받을 수 있으며, 생명을 위협하는 질환자 등 응급환자의 경우에는 식약처장의 승인을 받아 임상시험용의약품을 사용할 수 있는 제도를 운영하고 있다.
한편, 2011년 약사법의 개정으로 의약품을 개발하는 업체나 연구자들은 임상단계나 품목허가 단계에서 준비된 허가심사 자료를 미리 검토 받거나, 개발과정에서 발생하는 기술적·규정적·제도적 질의사항들을 상담할 수 있는 사전검토제도가 법제화되었다.
3. 국내외 생명공학의약품 개발 동향
가. 해외 동향
1982년 Eli Lilly사가 미국 FDA로부터 유전자재조합 인슐린의 허가를 받은 것을 시발로 하여 성장호르몬, 항암보조제 G-CSF, 빈혈치료제인 EPO 등 많은 재조합 단백질이 개발, 실용화 되었다.
현재까지 생명공학의약품은 EPO(erythropoietine, 빈혈치료제), TPA(tissue plasminogen activator, 혈전용해제) 등의 심혈관계 질환약과 CSF(colony stimulating factor, 골수계 성장인자), 인터페론, 인터루킨 등 암 치료제 제품이 괄목할 만한 성장을 보여주었으며 최근에는 혈액질환, 면역계질환, 호흡기 질환 등 많은 질병의 치료에 목적을 두고 개발되고 있다. 또한 난치병과 불치병에 대한 치료 가능성 등의 장점에 의하여 활발한 연구가 진행 중이다.
2세대 생명공학 의약품으로 불리는 항체의약품은 암세포에 특이적으로 부착하여 인체의 면역시스템이 암세포를 제거할 수 있도록 설계된 의약품으로 97년 비호지킨성 림프종 치료제인 리툭산(Rituxan)이 허가된 이후 엔브렐(Enbrel), 레미케이드(Remicade), 허셉틴(Herceptin), 아바스틴(Avastin) 등 현재까지 미국 FDA와 유럽 EMA로부터 30품목 이상이 허가되었다.
[표 5-4-1] 주요 바이오신약 특허만료 현황
|
상품명 |
성분명 |
의약용도 |
개발사 |
특허만료 (미국) |
|
엔브렐(Enbrel) |
에타너셉트(etanercept) |
류마티스관절염 |
Amgen |
2012년 |
|
에포젠(Epogen) |
에포에틴알파(epoetin-α) |
빈혈 |
Amgen |
2013년 |
|
레미케이드 (Remicade) |
인플릭시맙(infliximab) |
류마티스관절염 |
Johnson & Johnson |
2013년 |
|
리툭산(Rituxan) |
리툭시맙(rituximab) |
비호지킨성 림프종 |
Genentech |
2015년 |
|
란투스(Lantus) |
인슐린글라진 (insulin glargine) |
당뇨병 |
Sanofi-Aventis |
2015년 |
|
휴미라(Humira) |
아달리무맙(adalimumab) |
류마티스관절염 |
Abbott |
2016년 |
|
허셉틴(Herceptin) |
트라스트주맙(trastzumab) |
유방암 |
Genentech |
2019년 |
|
아바스틴(Avastin) |
베바시주맙(bebacizumab) |
대장암 등 |
Genentech |
2019년 |
|
루센티스(Lucentis) |
라니비주맙(ranibizumab) |
황반변성 |
Novartis |
2019년 |
출처 : EvaluatePharma, Company Reports(2007)
세계적 시장조사 전문기관 중 하나인 Datamonitor는 단클론 항체의약품(mAb 제제, monoclonal antibodies)이 2009~2015년 사이 6년 동안 연평균 9.5% 성장률로 생명공학의약품 산업을 주도할 것이라고 예측하였다.
아울러, 위의 표와 같이 항체의약품을 중심으로 블록버스터 바이오신약의 특허가 이미 만료되었거나 만료가 임박함에 따라 세계적으로 바이오시밀러 신시장이 본격 형성될 것으로 전망되고 있다.
세포치료제는 1990년대 초반에 시작되어 현재까지 골수 및 조혈모세포 이식, 수지상세포, 자기 활성화 림프구, 줄기세포 등을 이용한 치료법 연구가 활발하게 진행 중이다. 그 중 줄기세포치료제는 희귀난치성 질환 치료의 대안으로 주목받으면서 미국, 일본, 유럽 등 세계 각국의 지원이 확대되고 있으며, 성체줄기세포치료제는 우리나라와 미국 등을 중심으로 제품화가 이루어지고 있고, 배아줄기세포의 경우에도 여전히 윤리성 논란이 있긴 하지만 우수한 분화능으로 인한 잠재력 때문에 미국과 우리나라, 일본을 중심으로 활발한 연구와 임상시험이 진행 중에 있다.
유전자치료제는 DNA나 RNA와 같은 유전물질을 인체에 투입하여 유전적인 질병을 치료하는 제제로 향후 제품시장이 본격적으로 형성되기 시작하면 기존의 의약품시장을 대체할 수 있는 막강한 잠재력이 있는 것으로 평가되고 있다. 2007년 기준으로 전 세계적으로 약 700여 건의 임상시험이 진행 중이며 세계 각국에서 빠른 속도로 개발이 진행되고 있다. 현재까지는 대부분 임상시험 단계에 있으나, 2003년 중국에서 두경부암치료제인 젠다이신(Genedicine)이 최초로 허가되었으며, 2013년에는 유럽에서 혈중 지질분해 치료제인 글리베라(Glybera)가 허가되었다.
나. 국내 현황
유전자재조합의약품은 인체에서 생리활성을 나타내는 다양한 효소나 호르몬의 정보를 담고 있는 유전자를 대장균이나 효모와 같은 미생물 등에 이입하여, 목적으로 하는 단백질을 합성해 대량생산으로 제조한 의약품을 말한다. 생명공학의약품 중 가장 많이 허가되어 사용되고 있는 의약품으로서 2002년부터 2013년 9월까지 총 265 품목이 허가되었다.
항체의약품의 경우 엘지생명과학, 녹십자, 이수앱지스 등 50개 이상의 바이오기업에서 연구가 활발히 진행 중이며, 현재까지 우리나라에서 항체의약품 2개 품목이 허가되었고, 그 중 국내 제조는 이수앱지스의 ʻʻ클로티냅주(압식시맙)ʼʼ 1품목이 있다. ʻ셀트리온ʼ은 세계 최초로 항체 바이오시밀러인 ʻ램시마주ʼ를 개발하여 2012년 국내 허가를 받은데 이어 2013년 8월에는 유럽의약청(EMA)의 허가를 획득하는 성과를 올리기도 했다.
세포치료제는 2001년 1월 연골이식 및 조혈 적응증으로 허가된 자가(自家)유래 세포치료제 ʻʻ콘드론ʼʼ을 필두로, 2013년 9월까지 국내에서 18품이 허가되었으며, 이 중 환자 자신의 세포를 이용한 자가유래 세포치료제가 14품목, 다른 사람의 세포를 이용한 동종(同種)유래 세포치료제가 2품목이다. 줄기세포치료제의 경우 성체줄기세포를 중심으로 제품화 연구가 활발히 이루어지면서 국내 바이오업체인 ʻFCB파미셀ʼ이 2011년 식품의약품안전처로부터 세계 최초로 줄기세포치료제 ʻ하티셀그램-AMIʼ(심근경색치료제) 판매허가를 받았으며 이후 2013년 9월까지 ʻ메디포스트ʼ의 ʻ카티스템ʼ(관절염치료제), ʻ안트로젠ʼ의 큐피스템(크론병으로 인한 누공 치료) 등 3개 품목이 허가되었다.
국내 임상시험 현황을 보면, 26개 업체에서 심근경색, 뇌경색 또는 척수손상 등의 난치병 치료제를 포함하여 총 80건의 세포치료제 임상시험이 완료되었거나 진행 중이며, 이 중 줄기세포치료제 임상시험은 총 31건으로 이는 미국, 유럽 등과 함께 세계적으로 많은 수치이다.
[표 5-4-2] 세포치료제 허가 현황
|
|
업체명 |
제품명 |
분류 |
분류 |
대상질환 |
허가 일자 |
|
1 |
세원셀론텍 |
콘드론 |
자가 |
연골세포 |
무릎연골결손 |
2001.01.30. |
|
2 |
테고사이언스 |
홀로덤 |
자가 |
피부각질세포 |
피부화상치료 |
2002.12.10. |
|
3 |
테고사이언스 |
칼로덤 |
동종 |
피부각질세포 |
피부화상치료 당뇨병성족부궤양 |
2005.03.21. 2010.06.24. |
|
4 |
엠씨티티 |
케라힐 |
자가 |
피부각질세포 |
피부화상 치료 |
2006.05.03. |
|
5 |
크레아젠 |
크레아박스- 알씨씨주 |
자가 |
수지상세포 |
전이성 신세포암 |
2007.05.15. |
|
6 |
이노셀 |
이뮨셀엘씨주 |
자가 |
활성화T 림프구 |
간암 |
2007.08.06. |
|
7 |
엔케이바이오 |
엔케이엠주 |
자가 |
활성화림프구 |
악성림프종 |
2007.08.07. |
|
8 |
차바이오앤 디오스텍 |
하이알그라프트 쓰리디 |
자가 |
피부섬유아세포 |
당뇨병성 족부궤양 |
2007.09.14. |
|
9 |
세원셀론텍 |
알엠에스 오스론 |
자가 |
뼈세포 |
국소 골형성 촉진 |
2009.08.26. |
|
10 |
차바이오앤 디오스텍 |
오토스템 |
자가 |
최소조작 지방세포 |
피하지방 결손 |
2010.02.01. |
|
11 |
안트로젠 |
퀸셀 |
자가 |
최소조작 지방세포 |
피하지방 결손 |
2010.03.26. |
|
12 |
에스바이오 메딕스 |
큐어스킨 |
자가 |
섬유아세포 |
여드름 치유과정에 수반된 함몰된 흉터부위 개선 |
2010.05.11. |
|
13 |
차바이오앤 디오스텍 |
엘에스케이 오토그라프트 |
자가 |
피부각질세포 |
피부화상치료 |
2010.09.17. |
|
14 |
에프씨비파미셀 |
하티셀그램- 에이엠아이 |
자가 |
골수유래 중간엽줄기세포 |
급성심근경색환자에서 좌심실구혈율 개선 |
2011.07.01 |
|
15 |
메디포스트 |
카티스템 |
동종 |
제대혈유래 중간엽줄기세포 |
골관절염 환자(ICRS grade IV)의 무릎 연골결손 치료 |
2012.1.18 |
|
16 |
안트로젠 |
큐피스템 |
자가 |
지방유래 중간엽줄기세포 |
크론병으로 인한 누공 치료 |
2012.1.18 |
출처 : 식품의약품안전처(2013.9월 현재)
[표 5-4-3] 세포치료제 임상승인 현황(2013.9월 현재)
|
승인수 |
업체수 |
세포종류 |
진행여부 |
|||||
|
줄기세포 |
면역세포 |
조직세포 |
조직공학 |
이종이식 |
종료 |
진행중 |
||
|
80 |
26 |
31 |
24 |
18 |
6 |
1 |
39 |
41 |
출처 : 식품의약품안전처
[표 5-4-4] 줄기세포치료제 임상승인 현황(2013.9월 현재)
|
전체 |
업체수 |
세포기원 |
세포유래 |
진행여부 |
||||
|
자가 |
동종 |
골수유래 |
제대혈유래 |
지방유래 |
종료 |
진행 중 |
||
|
31 |
8 |
17 |
14 |
9 |
11 |
11 |
17 |
14 |
출처 : 식품의약품안전처
유전자치료제는 현재까지 우리나라에서 허가받은 유전자치료제는 없으나, 2003년 동아제약에서 허혈성 족부궤양 치료용 유전자치료제 국내 임상시험을 처음으로 승인받은 이후 2013년 9월 현재까지 총 29건의 임상시험이 진행 중에 있다.
[표 5-4-5] 유전자치료제의 임상시험 현황(2013.9월 현재)
|
전체 |
업체수 |
유전자운반체 |
진행여부 |
||||
|
플라스미드 |
바이러스 |
플라스미드 + 바이러스 |
유전자변형 세포 |
종료 |
진행중 |
||
|
29 |
12 |
13 |
9 |
1 |
6 |
14 |
13 |
출처 : 식품의약품안전처
4. 발전 전망
현재 의약품 시장의 성장률은 점차 둔화되는 반면, 바이오의약품 시장은 점점 증가하고 있어 점차 세계 의약품 시장은 바이오의약품으로 대체되어 나갈 것으로 전망된다. 특히, 세계 100대 의약품 중에서 바이오의약품이 차지하는 비중이 2014년에는 50%까지 확대될 것으로 예상되고 있다.
향후, 줄기세포치료제, 바이오시밀러 등의 첨단 바이오의약품의 개발로 인한 새로운 시장의 형성, 이머징 마켓26)의 등장, 융합기술 등 신기술의 발전에 따라, 세계시장 선점을 위한 바이오의약품 업체들의 경쟁이 더욱 치열하게 전개될 것이다.
식약처는 사전검토제도의 내실있는 운영, 첨단제품의 특성에 맞는 허가심사 기준 마련, 안전성․유효성 평가를 위한 각종 가이드라인의 발간 등을 통해 지속적으로 첨단 생명공학의약품의 제품개발을 지원해 나갈 계획이다.

1. 국내외 바이오기업 현황
가. OECD 바이오기업 현황
OECD에서는 각 국가별로 제공받은 데이터를 토대로 바이오기업을 바이오기업(Biotechnology firm)과 바이오집중기업(Dedicated Biotechnology firm)으로 구분하여 통계를 발표하고 있으며, 2010년 기준 미국이 6,213개사로 가장 많고, 우리나라는 5위인 913개사로 발표되었으며, 전체 바이오기업 중 바이오집중기업의 비율은 55%에 달하고 있다.

[그림 5-5-1] 국가별 바이오기업 및 바이오집중기업 현황
바이오기업의 규모는 대부분이 50명 미만으로, 50명 미만의 기업 비율을 국가별로 보면 뉴질랜드가 90%로 가장 높고, 일본은 43%로 가장 낮았으며, 전체 국가의 평균은 71%로 나타났다.

[그림 5-5-2] 국가별 바이오 기업규모(인력규모)
나. 상장 바이오기업 현황
해외 시장조사컨설팅기업인 Enst & Young사 자료에 따르면 미국 상장 바이오기업은 2012년 기준 총 316개사에서 10만명이 종사하고 있으며, 상장기업의 매출액은 637억 달러로 이중 약 30%인 193억 달러를 연구개발비에 투자하고 있다.
[표 5-5-1] 미국 상장 바이오기업 현황
|
구 분 |
2012년 |
2011년 |
증감율(%) |
|
상장기업 수(개) |
316 |
315 |
0% |
|
제품 판매액($ bln) |
63.7 |
58.8 |
8% |
|
연구개발비($ bln) |
19.3 |
18.0 |
7% |
|
순이익($ bln) |
4.5 |
3.3 |
34% |
|
시장가치($ bln) |
360.3 |
278.12 |
30% |
|
종사자 수(명) |
100,100 |
98,570 |
2% |
출처 : Biotechnology Industry Report 2013, Ernst & Young, May 2013
유럽의 상장 바이오기업의 경우, 2012년 기준 총 165개사에 5만 1천여명이 종사하고, 이들 상장기업의 매출은 203억 달러로 이중 약 24%인 49억 달러를 연구개발비에 투자한 것으로 나타났다.
[표 5-5-2] 유럽 상장 바이오기업 현황
|
구 분 |
2012년 |
2011년 |
증감율(%) |
|
상장기업 수(개) |
165 |
169 |
-2% |
|
제품 판매액($ mln) |
20,385 |
18,951 |
8% |
|
연구개발비($ mln) |
4,902 |
4,940 |
-1% |
|
순이익(손실) ($ mln) |
236 |
(19) |
-1,342% |
|
시장가치($ mln) |
79,829 |
71,497 |
12% |
|
종사자 수(명) |
51,740 |
47,700 |
8% |
출처 : Biotechnology Industry Report 2013, Ernst & Young, May 2013
2. 바이오기업 지원 제도
가. 정책 분야
보건복지부는 2012년에 혁신형제약기업을 선정하여 약가, 세제, 연구개발 등의 혜택을 지원하고 있으며, 2013년 7월 2020년 세계 7대 제약강국 도약을 위해 「제1차 제약산업 육성지원 5개년 종합계획」을 발표하여 정부 R&D 지원 2배 확대, 5년간 누적 5조원 재원 투입, 일자리 58천개 및 전문인력 1만명 양성, 해외 수출 11조원 달성, 임상시험 국가순위 5위권 진입 등 5대 목표를 설정하고 13대 세부 추진전략을 제시하고 있다.
산업통상자원부는 2020년 세계 5위 바이오화학 강국을 목표로 한 「바이오화학 육성정략」을 발표하였으며 이를 위해, 대중소 바이오화학기업간 협력을 유도하기 위한 전주기적 R&D를 추진하고, 업계 수요 맞춤형 전문인력을 양성하며, 산학연관 소통의 장 마련과 해외협력을 추진하며, 인증표준화 등을 추진하여 시장창출을 중장기적으로 지원할 방침이다.
또한, 산업통상자원부는 서울 글로벌 바이오메디컬 신성장 투자펀드 조성을 통해 유망 바이오기술을 가진 바이오기업의 투자유치를 지원하고 있으며, 보건복지부도 글로벌 제약산업육성펀드를 조성하여 해외기업과의 M&A, 기술제휴 및 해외 생산설비/판매망 확보 등을 지원하고 있다.
중소기업청 옴주즈만실에서는 바이오산업에 대한 불합리한 제도, 규제 및 애로사항 등을 파악하여 해당부처에 건의하는 등 바이오분야 중소기업에 대한 지원을 하고 있다.
한편, 정부에서는 KOREA바이오경제포럼 및 HT포럼 등을 통해 산학연관 관계자 네트워킹을 지원하고 있으며, 생명공학정책연구센터 및 보건산업진흥원 등 국가출연기관에서도 정기적으로 분야별, 기술별 산업동향 및 시장분석보고서를 관련업계에 제공하고 있다
나. R&D 분야
우리 정부는 2012년 「제2차 2단계 생명공학육성기본계획(2012~2016년)」을 수립하였으며, 미래창조과학부 등 관계부처가 매년 생명공학육성시행계획을 수립하여 생명공학 육성을 추진 중이다.
2012년의 경우에는 정부에서 총 1조 7,029억원이 투자되었으며, 국가 재난·재해 대응 R&D 투자전략 수립과 국가 감염병 위기대응 연구개발을 위한 추진로드맵, 그리고 줄기세포 기술개발 투자 전략 등이 범정부차원에서 마련되었고, 급변하는 유전체산업에 대응하고 관련 연구기반 확보 및 조기 산업화를 위해 포스트게놈시대 신산업육성을 위한 다부처 유전체 사업 등이 추진되는 등 국가적 관점의 시급․중요한 분야의 연구개발을 위한 정책 및 범부처 공동연구가 추진되고 있다.
2013년의 경우,「2013년도 생명공학육성시행계획」에 따라, 이들 7개 부처 및 정부출연연구기관에서는 연구개발에 1조 5,036억원, 인프라에 3,891억원, 인력양성에 274억원 등 총 1조 9,201억원을 투자할 계획이다.
2013년도 정부의 연구개발부문 투자비는 전년 실적대비 3.0% 증가하였으며, 전년대비 미래창조과학부는 바이오·의료기술개발사업에 196억원이 증액되었고, 보건복지부는 보건의료 R&D에 132억원이 증액되었다.
[표 5-5-3] 부처별 주요 연구개발사업 2012년 투자실적 및 2013년 투자계획
(단위 : 백만원)
|
부 처 |
주요 연구개발사업 |
2012년 실적 |
2013년 계획 |
|
미래창조과학부 |
바이오․의료기술개발사업 |
130,346 |
149,964 |
|
농림축산식품부 |
농식품기술개발정책연구 |
113,951 |
122,944 |
|
산업통상자원부 |
산업진흥고도화(산업핵심기술) |
93,027 |
87,823 |
|
보건복지부 |
보건의료 R&D |
277,172 |
290,370 |
|
환경부 |
자연환경․생물자원보전 |
17,065 |
19,039 |
|
해양수산부 |
국토해양연구개발 |
27,248 |
25,180 |
출처 : 2013년도 생명공학육성시행계획
다. 마케팅 분야
정부에서는 바이오분야 중소·중견기업들이 활용할 수 있는 해외 마케팅 지원책을 마련하고, 개별기업들의 해외마케팅 역량 강화에 기여할 수 있도록 각 지원기관별 특성에 따라 차별화된 프로그램을 개발하여 지원하고 있다.
개별기업 차원에서 해외 전략파트너를 발굴하고, 해외 협력네트워크를 구축하려면 각 지원기관에서 제공하고 있는 국내외 전시회 및 파트너링, 수출로드쇼 및 해외시장개척단, 무역사절단 파견, 해외시장조사 및 컨설팅 서비스 등의 해외마케팅 촉진수단을 적극적으로 활용하는 것이 많은 시간과 비용을 투자하지 않으면서도 효율적으로 마케팅을 추진할 수 있는 방법일 것이다.
국내외 전시회 및 기업간 파트너링의 경우, 한국보건산업진흥원 및 충청북도가 주최하는 Bio Korea나 코트라 주최 Global Bio & Medical Forum이 매년 서울에서 개최되고 있다.
해외 마케팅의 경우, 산업통상자원부 및 코트라는 해외 전시부스 참가 지원 및 Medi Star Initiative를 통해 국내 제약 및 의료기기 산업의 해외진출 확대를 지원하고 있으며, 한국바이오협회 주최로 매년 미국에서 개최되는 세계 최대 바이오행사인 BIO Annual Convention에 참가단을 파견하고 있다.
중소기업청은 World Class 300 프로젝트를 통해 히든 챔피언 중소·중견기업을 매년 발굴하여 해외진출, 기술개발, 금융, 컨설팅 등 맞춤형 패키지 지원을 제공하여 이들 기업이 World Class 수준의 기업으로 성장할 수 있도록 지원하고 있으며, 보건복지부 및 한국보건산업진흥원은 국내 제약업계의 북미시장 진출 지원 위해 수립한 콜럼버스 프로젝트를 통해 컨설팅 지원 및 해외 관련기관과의 파트너십 구축을 위한 콜럼버스 시장개척단 파견을 지원하고 있다.
라. 특허 분야
특허청은 제약업계 지식재산권 인식제고 및 특허 중심의 제약산업 발전방향을 모색하기 위하여 특허청과 제약기업, 한국제약협회가 참여하는 정책협의체인 「특허정책협의회」를 2013년 3월에 발족하였다.
ʻ특허정책협의회ʼ는 특허관점에서의 제약분야 현안 논의를 통한 국내 제약기업의 특허 경쟁력 강화 및 특허분쟁대응에 실질적인 도움을 줄 수 있는 특허청의 지원정책 방향을 제시하는 역할을 수행하고, ʻ실무협의회ʼ는 제시된 정책방향에 대한 실무자급 논의를 통하여 구체적인 방안을 도출하는 역할을 수행하며, 특허청과 제약기업간 협력강화를 위한 정보공유방안도 논의할 예정이다.
또한, 2015년도까지 심사처리기간을 10개월로 단축하고, 제약 기업군별 맞춤형 지식재산권 전략수립을 지원하며, 의약품 허가-특허 연계제도 조기정착 지원을 위해 해외 허가-특허 연계제도에 따른 특허장벽 해결을 위한 특허분쟁 맞춤형 컨설팅, 국제 소송보험 지원 및 국제특허분쟁사례 DB를 제공할 예정이다.
산업통상자원부의 경우 미국, 유럽, 중국 등을 중심으로 바이오·의료기기 제품의 특허 만료예정일, 독점권 정보, 인허가 제도, 경쟁자 정보 등을 제공하고자 2012년에 바이오헬스정보지원시스템(KOBICS)을 개설하여 기업에서 활용할 수 있도록 지원하고 있다.
동 시스템을 통해, 핵심 바이오의약품 및 의료기기에 대한 특허 및 임상 인허가 시장 정보를 무료로 제공하고 매년 대상제품을 추가하여 업데이트하고 있으며, 바이오의약품의 경우 업계 수요조사 결과를 바탕으로 바이오시밀러, 항체의약품, 백신·주사용제, 세포치료제, 유전자치료제 등의 순서로 데이터베이스를 구축할 방침이다.
마. 세제 및 관세 분야
바이오산업은 신약개발 등 연구개발에 투자하는 비용이 높아 연구개발 및 시설투자비 관련 조세감면 등이 필요하다. 미국, 영국, 일본 등 선진국에서는 연구개발비 세액공제제도를 운영하고 있으며, 국가별로 희귀병 임상실험 지원세제(미국), 백신 또는 의약품 개발관련 연구개발 추가감면(영국), 특별시험연구 세액공제(일본)를 별도 규정하고 있으며, 우리나라는 「조세특례 제한법」 및 「관세법」에 따라 세제 및 관세 분야 혜택을 지원하고 있다(한국보건산업 진흥원, 제약기업 세제 지원방안).
우리나라「조세특례제한법」에서는 파급효과가 크나 개발 불확실성이 높은 기술을 신성장동력기술로 선정하여 연구·인력개발비에 대해서 일반적인 연구인력 개발비 세액공제보다 공제율을 상향시켜 세액 공제를 지원하고 있다(법 제10조).
또한, 2015년 12월 31일까지 중소기업이 시설 투자한 투자금의 100분의 3 상당액을 공제(제5조), 내국인의 연구개발 설비투자 금액의 100분의 10에 상당하는 금액에 대한 세액공제(제11조), 내국인의 생산성향상시설 투자금의 100분의 3 및 중소기업의 경우 100분의 7에 상당하는 금액에 대한 세액공제(제24조)를 지원하고 있다.
특별히, 의약품 품질관리 개선시설에는 2013년 12월 31일까지 투자한 금액의 100분의 7 상당액에 대한 세액공제(제25조의4), 중소기업에 대해서는 기술취득금액의 7%에 대한 세액공제(제12조)도 제공하고 있다.
한편,「관세법」에서는 법 제91조제4호에 근거하여 만성신부전증환자가 사용할 물품, 희귀병치료제, 임상시험용 의약품 중 시험약(위약 포함, 2015년 12월 31일까지 수입신고된 것) 등 시행규칙 별표2에서 정한 물품에 대한 관세면제, 같은 법 제95조 제1항 제3호에 따라 국내에서 제작하기 곤란한 물품을 시행규칙 별표2의4에서 공장자동화 물품으로 지정해 관세를 감면하고 있다.
1) 유럽연합공동체인 EC를 포함했을 경우 가입국 수는 161개국이며, EC를 제외한 경우에는 160개국임
2) 생명윤리안전법 제2조제1호과 생명윤리안전법 시행규칙 제2조제1항.
3) 생명윤리안전법 제10조.
4) 배아생성의료기관과 유전자은행에 설치된 기관위원회는 단순히 IRB와 동일시될 수 없는 관리, 감독의 기능을 가지고 있음에 유의해야 한다.
5) 생명윤리안전법 제11조제1항.
6) 생명윤리안전법 제12조제1항.
7) 생명윤리안전법 시행규칙 제2조제2항.
8) 생명윤리안전법 시행규칙 제13조제1항.
9) 보건복지부 및 질병관리본부, 생명윤리법 관련 기관 관리안내(2013. 2), 40면 참조.
10) 생명윤리안전법 제16조제1항 참조.
11) 생명윤리안전법 제16조제3항.
12) 생명윤리안전법 제2조 제11호 및 제12호.
13) 여기서 “개인정보”는 “개인식별정보”의 오타로 이해해야 한다.
14) 생명윤리안전법 시행규칙 제33조제1항
15) 생명윤리안전법 제37조제1항.
16) 생명윤리안전법 부칙 제2조.
17) 생명윤리안전법 제35조제1항.
18) 국제특허분류기호(IPC) : 심사관이나 특허정보를 이용하고자 하는 자가 특허정보를 용이하게 검색할 수 있도록 기술내용을 세부적으로 구분해 놓은 분류체계. 1971.03.24. 스트라스부르그 협정에 근거하여 1975.10.07. 발효되었으며, 현재는 IPC 2013.01이 우리나라뿐만 아니라 100여 개 국에서 사용 중.
19) 서열목록을 포함한 특허출원은 핵산 및 아미노산 서열과 기타 유용한 정보를「핵산염기 서열목록 또는 아미노산 서열목록 작성기준 (특허청 고시 제2013-1호)」별표 2의 세부기준에 따라 명세서에 상세하게 기재하여야 하고,「핵산염기 서열 또는 아미노산 서열에 관한 서열목록 작성 및 제출요령 (특허청고시 제2012-26호, 2012.08.22. 일부 개정.)」에 따라 서열목록전자파일을 제출하여야 함.
20) 미생물 기탁제도에서 미생물이란 유전자, 벡터, 재조합 벡터, 형질전환체, 융합세포, 재조합 단백질, 모노클로날 항체, 바이러스, 세균, 효모, 곰팡이 버섯, 방선균, 단세포 조류, 원생동물, 동식물의 세포, 조직 배양물, 종자 등 특허절차상 기탁 가능한 생물학적 물질(biological material)을 의미함.
21) 부다페스트조약(1980.08.19. 발효) : 특허절차상 여러 나라에 미생물 관련 발명을 출원할 경우, 하나의 국제기탁기관에 기탁한 후 조약동맹국에 출원 시 그 효과를 상호 인정하는 것을 주 내용으로 함. 우리나라는 1987년에 가입하였고 2012년 12월 현재 78개국이 가입, 41개 국제기탁기관이 공인 중.
22) 미생물 관련 발명의 특허출원시 기탁기관에 미생물의 특허기탁을 의무화함. 이는 특허법 시행령 제2조, 「미생물기탁기관지정 등에 관한 고시」(특허청고시 제2012-25호 2012.08.22.현행)에 의거함.
23) 특허미생물 기탁이 시작된 1981년부터 현재 2012년 12월 31일까지의 누계임.
24) 생명공학육성법에서 정의된 생명공학은 산업적으로 유용한 생산물을 만들거나 생산공정을 개선할 목적으로 생물학적 시스템, 생체, 유전체 또는 그들로부터 유래되는 물질을 연구활용하는 학문과 기술, 생명현상의 기전, 질병의 원인 또는 발명과정에 대한 연구를 통하여 생명공학의 원천지식을 제공하는 생리학·병리학·약리학 등의 기초의과학을 포함.
25) 국가의 생명윤리 및 안전에 관한 정책의 수립에 관한 사항은 잔여 배아를 이용할 수 있는 연구의 종류·대상 및 범위에 관한 사항(제17조제3항), 체세포핵이식행위를 할 수 있는 연구의 종류·대상 및 범위에 관한 사항(제22조 제2항), 금지되는 유전자검사의 종류에 관한 사항(제25조 제1항), 유전자치료를 할 수 있는 질병의 종류(제36조 제1항), 그 밖에 윤리적·사회적으로 심각한 영향을 미칠 수 있는 생명과학기술의 연구·개발 또는 이용에 관하여 심의위원회의 위원장이 부의하는 사항이 있음.
26) 자본시장 및 산업 부문에서 급성장하고 있는 국가들의 신흥시장



▮ 기원전 8000년
○ 인간이 농작물과 가축을 경작하고 사육하기 시작
○ 최초로 감자를 식용으로 경작
▮ 기원전 4000~2000년
○ 이집트에서 효모를 사용해 빵과 맥주의 발효 시작
○ 수메리아, 중국, 이집트에서 치즈를 생산하고 포도주를 발효시킴
○ 바빌로니아인들은 몇 그루 수술 나무의 꽃가루를 가지고 선별적으로 암술나무에 수정하여 대추야자를 생산
▮ 기원전 500년
○ 중국에서 항생물질을 가진 곰팡이가 핀 두부로 종기를 치료
▮ 서기 100년
○ 중국에서 최초로 살충제를 국화에 살포함
▮ 1322년
○ 아랍에서 우성 말을 생산하기 위해 최초로 인공수정을 사용
▮ 1590년
○ Janssen, 현미경 발명
▮ 1663년
○ Hooke, 세포의 존재 발견
▮ 1675년
○ Leeuwenhoek, 박테리아를 발견
▮ 1761년
○ Koelreuter, 다른 종의 농작물을 성공적으로 이종교배 하였음을 보고
▮ 1797년
○ Jenner, 아이들에게 천연두를 막기 위한 바이러스성 백신을 접종
▮ 1830~1833년
○ 1830년 단백질 발견
○ 1833년 최초로 효소가 발견되고 분리됨
▮ 1835~1855년
○ Schleiden와 Schwann, 모든 유기체는 세포들로 구성되어 있다고 제안
○ Virchow, ʻʻ모든 세포는 세포에서 생겼다ʼʼ고 선언
▮ 1857년
○ Pasteur, 미생물들이 발효를 유발한다고 제안
▮ 1859년
○ Charles Darwin, 자연 도태의 진화론을 발표(1800년대 후반 유전학의 무지에도 불구하고 선택된 부모와 도태된 다양한 자손에 대한 개념은 동식물 사육사들에게 매우 큰 영향을 줌)
▮ 1865년
○ 유전학 연구 시작
○ Gregor Mendel, 오스트리아인 수도사인 그는 완두를 연구하여 유전법칙에 의해 유전적 특징이 부모로부터 자손에게 물려진다는 점을 발견함
▮ 1870~1890년
○ Darwin의 이론을 이용하여 면화를 이종교배하고 수백 가지의 우성품종을 개발
○ 최초로 농부들이 수확량을 늘리기 위해 농지에 질소고정 박테리아 미생물을 섞음
○ William James Beal, 최초로 실험실에서 실험용 옥수수 잡종 생산
▮ 1877년
○ Koch, 박테리아를 염색하고 동정하기 위한 기술 개발
▮ 1878년
○ Laval, 최초로 원심분리기 개발
▮ 1879년
○ Fleming, 후에 염색체라 불려지는 세포핵 안쪽의 봉모양의 염색질을 발견
▮ 1900년
○ 초파리가 유전연구에 사용
▮ 1902년
○ 면역학이라는 용어가 처음으로 나타남
▮ 1906년
○ 유전학이라는 용어가 소개됨
▮ 1911년
○ Rous, 최초로 암을 유발하는 바이러스 발견
▮ 1914년
○ 최초로 박테리아를 영국 맨체스터의 하수처리에 사용
▮ 1915년
○ Phage(박테리아성 바이러스)발견
▮ 1919년
○ 최초로 생명공학(Biotechnology)이라는 단어가 출판물에 사용
▮ 1920년
○ Evans와 Long, 인간성장 호르몬 발견
▮ 1928년
○ Alexander Fleming, 항생물질인 페니실린 발견
○ 유럽에서 조명충 나방제어를 위한 소규모의 Bacillus thuringiensis(Bt) 테스트 시작
○ 1938년 프랑스에서 미생물 살충제의 상업적 생산 시작
○ Karpechenko, 무와 양배추를 교배하여 서로 다른 속(屬)의 식물 사이에서 번식력이 강한 자손을 만듦
○ Laibach, 최초로 오늘날 이종교배라 알려진 광범위한 교배로부터 잡종을 얻기 위해 배구제(embryo rescue)를 사용
▮ 1930년
○ 美의회에서 식물육종생산의 특허를 가능하게 하는 식물특허법(Plant Patent Act) 통과
▮ 1933년
○ 1920년대 Henry Wallace에 의해 개발된 잡종옥수수가 상업화 됨(1945년에는 엄청난 매출액은 증가된 연 종자구입비를 능가했고 잡종 옥수수는 미국 전체 옥수수 생산량의 78%를 차지)
▮ 1938년
○ 분자 생물학이란 용어가 생김
▮ 1941년
○ 유전공학이란 용어가 폴란드 Lwow의 기술연구소에서 효모복제에 관한 강의를 맡고 있는 덴마크의 미생물학자 A. Jost에 의해 최초로 사용
▮ 1942년
○ 박테리아를 감염시키는 박테리오파지를 규명하고 확인하기 위해 전자 현미경을 사용
○ 페니실린을 미생물에서 생산함
▮ 1944년
○ Avery와 그 외 다른 사람들에 의해 DNA가 유전정보를 운반한다는 점이 입증됨
○ Waksman, 결핵에 효과적인 항생제인 streptomycin을 분리(추출)
▮ 1946년
○ 새로운 타입의 바이러스를 형성하기 위해 서로 다른 바이러스로부터의 유전물질이 결합할 수 있다는 일종의 유전자 재조합이 발견
○ 유전적 다양성의 상실로 인한 위협을 인식한 미의회는 식물수집과 보존 그리고 이러한 인식의 홍보에 막대한 자금을 제공함
▮ 1947년
○ McClintock, 옥수수에서 소위 움직이는 유전자(jumping genes)라 불리는 전이요소를 발견
▮ 1949년
○ Pauling, 겸상(鎌狀) 적혈구 빈혈증(흑인의 유전병)이 헤모글로빈 내 단백질분자의 돌연변이로 야기된 ʻ분자병ʼ임을 밝혀냄
▮ 1951년
○ 냉동정액을 사용한 가축의 인공수정이 성공적으로 수행됨.
▮ 1953년
○ 과학저널 Nature는 현대 유전학의 출발을 상징하는 DNA의 이중나선구조를 묘사한 James Watson과 Francis Crick의 원고를 출판
▮ 1955년
○ 핵산 합성에 관한 효소가 처음으로 추출됨
▮ 1956년
○ Kornberg, DNA 복제에 필요한 효소 DNA 중합효소Ⅰ(DNA polymeraseⅠ) 발견
▮ 1958년
○ 겸상 적혈구 빈혈증이 단일 아미노산의 변화 때문에 발생한다고 밝혀짐
○ DNA가 처음으로 시험관에서 만들어짐
▮ 1959년
○ 조직 살균제가 개발됨
○ 단백질 생합성의 첫 단계가 그려짐
▮ 1950년대
○ 바이러스 증식억제 물질(interferon) 발견
○ 최초 합성 항생 물질 개발
▮ 1960년
○ 시냅시스(세포의 감수분열 초기에 있는 상동염색체의 병렬접착)를 이용해 DNA-RNA 잡종 분자가 만들어짐
○ 메신저 리보 핵산(Messenger RNA) 발견
▮ 1961년
○ 美 농림부가 최초 미생물 살충제인 Bacillus thuringiensis를 등록함
▮ 1963년
○ Norman Borlaug에 의해 신품종 밀이 개발됨으로 인해 생산량이 70% 상승함
▮ 1964년
○ 필리핀의 국제 벼 연구소(The International Rice Research Institute)는 새로운 품종을 개발하여 충분한 비료를 주면 이전의 생산량보다 2배 많은 수확량을 얻을 수 있는 녹색 혁명을 일으킴
▮ 1965년
○ Harris와 Watkins가 성공적으로 생쥐와 사람 세포를 융합시킴
▮ 1966년
○ 유전암호가 해독되고 일련의 3개의 뉴클리오티드가 하나의 아미노산을 결정한다는 사실이 밝혀짐
▮ 1967년
○ 최초로 자동 단백질 서열 분석기 완성
▮ 1969년
○ 처음으로 효소가 생체 외에서 합성됨
▮ 1970년
○ 노르만인 Borlaug, 노벨 평화상 수상(1963년 참조)
○ 유전물질을 자르는 제한 효소(두 줄 사슬 DNA를 특정 부위에서 절단하는 효소)의 발견으로 유전자 복제의 장이 열림
▮ 1971년
○ 처음으로 유전자가 완벽하게 합성됨
▮ 1972년
○ 인간의 DNA 구성이 침팬지와 고릴라의 DNA와 99% 유사함이 발견됨
○ 최초로 배이식(胚移植)이 시도됨
▮ 1973년
○ Stanley Cohen와 Herbert Boyer, 제한효소와 리가제(ligases)를 사용해서 DNA를 자르고 붙이는 기술과 박테리아에서 새로운 DNA를 복제하는 기술을 완성함
▮ 1974년
○ 미국 NIH는 유전자 재조합 연구를 총괄하기 위해 재조합 DNA 자문위원회 (Recombinant DNA Advisory Committee) 구성
▮ 1975년
○ 최초로 미국 정부가 캘리포니아 Asilomar 회의에서 유전자재조합실험을 규제하기 위한 가이드라인 개발을 주장함
○ 단일클론항체가 생산됨
▮ 1976년
○ 유전자 재조합 기술이 유전 장애인에 최초로 적용
○ 분자교배가 태아의 alpha thalassemia 진단에 사용됨
○ 효모의 유전자가 대장균(E.coli)에서 발현됨
○ 최초로 특정유전자의 염기쌍 순서가 결정됨(A, C, T, G)
○ 美國재조합 DNA 자문위원회(NIH Recombinant DNA Advisory Committee)에 의해유전자 재조합 실험에 대한 가이드라인이 처음으로 발표
▮ 1977년
○ 인간유전자를 박테리아에서 처음으로 발현시킴
○ 전기영동을 이용해 DNA의 긴 마디를 빠르게 나열하기 위한 연구수행
▮ 1978년
○ 바이러스의 고방사선 구조가 최초로 확인됨
○ 재조합 인간 인슐린이 최초로 생산됨
○ 미국 노스캐롤라이나 과학자들이 DNA 분자상의 특정 위치에 특정 돌연변이를 일으키는 것이 가능하다는 것을 보여줌
▮ 1979년
○ 최초로 인간성장 호르몬이 합성됨
▮ 1970년대
○ 유전공학 제품을 개발하기 위해 최초의 상업적 회사가 설립
○ 중합효소(polymerases)의 발견
○ 뉴클리오티드(nucleotides)의 빠른 나열기술 완성
○ 유전자 표적화
○ RNA splicing
▮ 1980년
○ Diamond v. Chakrabarty 재판에서 미 연방법원은 유전자재조합생물형태에 대한 특허를 인정했으며, Exxon 석유회사가 기름 먹는 미생물에 대한 특허 취득
○ 美國정부 유전자복제에 대한 권한을 Cohen과 Boyer에게 부여
○ 최초의 유전자합성 기계 개발
○ 인간인터페론유전자를 박테리아로 형질전환(Transformation) 시킴
○ 노벨 화학상이 유전자 재조합분자를 개발한 Berg, Gilbert, Sanger에게 수여됨
▮ 1981년
○ 오하이오 대학의 과학자들이 다른 동물의 유전자를 쥐에 이식함으로써 최초로 유전자 이식동물을 생산함
○ 중국의 과학자가 최초로 복제 물고기 금잉어를 만듦
▮ 1982년
○ 미국의 Applied Biosystems社는 단백질 서열분석에 필요한 샘플의 양을 획기적으로 줄일 수 있는 상업적 가스 상 단백질 서열분석기를 발표
○ 가축을 위한 최초의 유전자 재조합 DNA 백신 개발
○ 유전적 변이를 거친 박테리아에서 생산된 인간인슐린이 미국 FDA로부터 최초의 생명공학 기술에 의한 의약품으로 승인 받음
○ 최초의 유전자 변형식물인 피튜니아 생산
▮ 1983년
○ 중합효소연쇄반응(PCR) 기술이 소개(유전자와 유전자 조각의 복제를 위해 열과 효소를 사용하는 PCR 기술은 이후 유전공학에서의 연구와 개발에 광범위하게 쓰이는 중요한 도구가 됨)
○ TI 플라스미드(plasmid: 염색체와는 따로 증식할 수 있는 유전인자)에 의한 식물 세포들의 유전학적인 변형이 수행됨
○ 최초로 인공염색체 합성
○ 특정유전병 유발인자 발견
○ 생명공학기술을 이용해 피튜니아를 완전 성장시킴
○ 피튜니아 식물을 통해 유전자변형식물의 새로운 특징이 자손에게 전달됨을 확인함
▮ 1984년
○ DNA 지문검색 기술이 개발
○ HIV 바이러스의 전체 게놈이 복제되고 서열 결정됨
▮ 1985년
○ 신장병과 낭포성 섬유증을 유발하는 유전인자 발견
○ 법적 증거로서 유전자 지문법이 도입
○ 최초로 곤충과 박테리아, 바이러스에 저항력이 있는 유전자 변형식물이 시험됨.
○ 미국 NIH는 인간을 대상으로 하는 유전자 치료법 실험수행에 대한 가이드라인을 정함
▮ 1986년
○ 유전자 재조합 B형 간염 백신 최초 개발
○ 최초의 유전공학 항암치료제 인터페론 생산
○ 미국 정부는 유전자 재조합 유기체에 대해 전통적인 유전자재조합기술로 만들어진 제품에 적용된 규정보다 더 엄격한 ʻʻThe Coordinated Framework for Regulation of Biotechnologyʼʼ 규정 확립
○ California Berkeley 대학의 화학자가 신약을 개발하기 위해 항체와 효소를 결합하는 방법(abzymes) 제시
○ 유전자 변형식물(담배)의 실제 실험이 수행됨
○ 최초로 환경 보호국이 유전자변형 담배의 판매를 승인
▮ 1987년
○ 바이러스에 내성이 있는 토마토의 field test를 최초로 승인함
○ 캘리포니아에서 농작물의 서리 형성을 억제하는 유전자 변형 박테리아인 Frostban을 딸기와 감자를 통해 시험하였는데 이것이 처음으로 공식 승인된 유전자 재조합 박테리아 외부 실험임
▮ 1988년
○ 미국 정부는 하버드대학 분자유전학자에게 유전자 변형동물 즉, 유전자변형 쥐에 대한 특허권을 부여함
○ 세제에 사용할 수 있는 표백제 내성을 지닌 단백질 분해효소를 만드는 공정에 대한 특허권이 부여됨
○ 미국 의회가 다른 종의 게놈 뿐만 아니라 인간유전자 암호를 해독하고 지도를 만드는 인간 게놈 프로젝트 연구비를 승인함
▮ 1989년
○ 최초로 유전자변형 해충방지 면화의 field test 승인
○ 식물 게놈 프로젝트 시작
▮ 1980년대
○ 진화의 역사를 밝히기 위한 DNA 연구 시작
○ 유럽에서 유전자 재조합 동물백신의 사용 승인
○ 기름 청소에 미생물을 이용한 생물학적 정화기술 사용
▮ 1990년
○ 미국 최초로 유전자재조합 기술을 이용하여 치즈제조에 쓰이는 인공적으로 제조된 chymosin 효소인 Chy-MaxTM이 소개됨
○ 인체의 모든 유전자 지도를 제작하려는 국제적인 노력인 인간 게놈 프로젝트가 시작됨
○ 면역장애를 앓고 있는 4살 여자 어린이를 대상으로 실시한 유전자 치료가 성공적으로 수행됨
○ 유아 조유용 우유 단백질을 만드는 유전자 변형 젖소 탄생
○ 해충에 강한 옥수수인 Bt 옥수수 생산
○ 영국 최초로 유전자변형 효모식품이 승인됨
○ 유전자 변형 척추동물 송어의 실지실험이 수행됨
▮ 1992년
○ 미국과 영국의 과학자들이 시험관 내에서 배아에 낭포성 섬유증과 혈우병과 같은 유전적 기형을 테스트하는 기법을 밝힘
○ 미국 FDA는 유전자 이식 음식이 유전적으로 위험하지도 않고 특별한 규정도 필요 없다고 선언함
▮ 1993년
○ 미국 FDA, 낙농가의 우유생산 촉진을 위해 BST(Borine Somatotropin)를 승인
▮ 1994년
○ 미국 FDA, 생명공학으로 만들어진 FLAVRSAVRTM tomato 승인
○ 최초로 유방암 유전자 발견
○ CF 환자의 폐에 단백질이 쌓이지 않게 하는 재조합 인간 DNase 승인
○ 소 성장호르몬(POSILAC)이 상용화됨
▮ 1995년
○ 에이즈 환자에게 최초로 비비의 골수가 이식됨
○ 최초로 바이러스 이외의 살아있는 유기체(Hemophilus Influenzae)의 완벽한 유전자 배열이 완성됨
○ 암정복을 위해 면역시스템 모듈, 유전자 재조합 항체형성과 같은 유전자 치료가 도입됨
▮ 1996년
○ 파킨슨병과 관련된 유전자의 발견으로 퇴행성 신경질환의 잠재 가능한 치료와 그 원인 연구의 중요한 이정표를 제시함
▮ 1997년
○ 스코틀랜드에서 어른세포로 복제된 최초의 복제양 Dolly 탄생
○ 해충방지 농작물인 Roundup ReadyTM 콩과 BollgardTM 해충방지 면화와 같은 작물이 상업화 됨
○ 아르헨티나, 호주, 캐나다, 중국, 멕시코와 미국 등 전 세계적으로 500만 에이커 면적에서 유전자조작 작물이 재배됨
○ Oregon주 연구자들은 두 마리의 붉은 털 원숭이를 복제했다고 주장함
○ 유전병 연구의 새로운 기술을 창조하기 위해 PCR, DNA 칩과 컴퓨터를 결합한 새로운 DNA기술 탄생
▮ 1998년
○ 하와이대학 연구진이 어른의 난소 적(cumulus)세포 핵으로부터 쥐를 복제함
○ 인간 배아줄기세포주가 확립됨
○ 일본 Kinki 대학 연구진은 한 마리 어른암소로부터 얻은 세포를 이용하여 8마리의 동일 송아지 복제함
○ 최초로 C. elegans 벌레에 대한 동물 게놈 염기서열 해독 완료
○ 30,000개 이상의 유전자 위치를 보여주는 인간 게놈지도의 초안 완성
○ 동남아시아 다섯 나라가 병에 강한 파파야 나무를 개발하기 위해 컨소시엄을 구성
▮ 1990년대
○ 최초로 영국에서 유전자 지문법을 이용해 유죄를 판결함
○ 규정 질량의 일반적 융기에 착상된 유전자 분리성공
○ 유전성 대장암이 DNA 치료 유전자의 결핍으로 야기된다는 사실 발견
○ 유전자 재조합 광견병 백신을 너구리에 실험
○ 미국에서 농약을 기본으로 한 생명공학 제품판매 승인
○ 특수이식 유전자를 가진 쥐에 관한 특허 허용
○ 최초로 유럽에서 발암물질에 민감한 유전자변형 쥐에 관한 특허 제기
○ 유방암 유전자 복제
▮ 2000년
○ 최초로 애기장대(학명 Arabidopsis thaliana)의 게놈지도 개발
○ 13개 나라에서 총 1억 89만 에이커 면적에서 생물공학 농작물이 재배됨
○ 최초로 바이러스에 강한 고구마가 케냐에서 실질 시험됨
○ 인간게놈 배열의 초안 발표
▮ 2001년
○ 최초로 벼 게놈지도 완성
○ 오스트리아 연구진들은 Barley Yellow Dwarf Virus와 같은 바이러스 예방백신에 사용되는 hairpin RNA를 이용한 기술개발을 보고함
○ Chinese National Hybrid 연구진들은 일반 쌀 생산량보다 두 배 많은 super rice종 개발을 보고함
○ 유럽위원회(The European Commission)가 모든 유전자 변형 식품에 라벨을 붙일 것을 제기함
○ 농업적으로 중요한 시노라이조비움 멜리로티(Sinorhizobium meliloti) 박테리아의 DNA배열 완성
○ 염분이 있는 물과 땅에서 성장 가능한 최초의 농작물을 만들기 위해 애기장대로부터 추출된 유전자를 토마토에 이식함
○ 농업에 중요한 식물병원균 Agrobacterium tumefaciens의 게놈서열이 공표됨
○ 스트레스에 더 강한 농작물 개발의 실마리로서, 손상을 입거나 스트레스를 받았을 때 빛을 발하는 세일 크레스(thale cress)라 불리는 실험용 식물 재배
○ 최초로 땅콩의 종합적 분자지도가 완성됨
▮ 2002년
○ 완성된 인간 게놈 배열을 과학전문지에 게재함
○ 효모의 프로테옴(Proteome: 단백질 간 상호작용과 네트워크의 총합)의 기능지도(functional map)의 초안 완성, 효모의 게놈지도는 1996년에 발표되었음
○ 줄기세포의 분화에 관여하는 조절인자 연구에 큰 발전이 있었으며, 이에 관여하는 200여개의 유전자가 밝혀짐
○ 생명공학 농작물이 16개국, 1억 4천 5백만 에이커에서 재배되고 있으며 이는 2001년보다 12% 증가한 것임
○ 자궁경부암에 대한 백신 개발에 성공하였으며 이는 특정 암에 대한 예방백신이 가능함을 처음으로 보여준 성과임
▮ 2003년
○ 인간게놈 완전 해독(4월)
○ 정신분열증과 우울증 등 정신병의 발병 위험을 증가시키는 특정유전자 변형을 확인한 연구결과 발표
○ 美최초의 GM 애완동물로 광고된 붉은 빛 형광물고기 GloFish 상업화
○ 세계적으로 생명공학작물 이용의 활성화 증대
○ 영국은 최초로 상업적인 생명공학작물인 제초제 저항옥수수를 인정
○ 미국 환경 보호국은 최초로 형질전환 해충저항성 옥수수를 승인함
○ 2003년 banteng 들소가 최초로 복제되었으며, 노새, 말, 사슴도 복제되었음
○ 1997년 포유동물의 최초 복제양 돌리는 폐병연구 후에 안락사 됨
○ 일본 연구팀은 자연적으로 카페인을 제거하는 생명공학 커피를 개발함
○ RNA 형태는 유전자 형식을 지시, 변형시키며 줄기세포와 배(胚)의 성장에 영향을 미침을 밝힘
○ 쥐의 배 세포줄기가 정자나 난자 세포로 성장할 수 있음을 확인
○ 남성을 결정짓는 Y염색체가 동일한 유전자를 함유하고 있음을 발견
○ 종양으로 하여금 암의 전이에 필요한 혈관을 생성하지 못하도록 하는 약물의 개발
▮ 2004년
○ 미국 식품의약국(FDA)은 아바스틴이라는 최초의 신세대 항암제를 승인함.
○ FDA는 다양한 종류의 약물치료와 질병을 위해 첫 DNA칩 및 유전자칩 개발
○ RNA 방해 제품으로, 임상 시험에 들어가는 첫 번째 RNAi 제품 생산
○ 국제연합 식량농업기구(FAO)의 생명공학 작물 승인
○ 국립과학연구원 산하 의학연구소에서는 ʻ생명공학작물이 건강에 해를 끼치지 않는다ʼ라고 밝힘.
○ FDA는 식품안전성 검토 후 생명공학 밀의 안전성 밝힘.
○ 몬산토사는 지방산을 감소 삭제한 low-linolenic 콩을 소개함
○ 닭 게놈 DNA 완전 해독
○ 최초로 애완 새끼고양이 복제
○ ʻ쓸모없는 DNA(junk DNA)ʼ 규명
○ 인간의 유전자 DNA 중 단백질을 합성하는 DNA는 전체 게놈의 10%에 불과하며 아무런 기능이 없는 DNA에 대한 규명 이루어짐
○ 지난 3월 영국의 과학자들, 지난 20년간 나비 58종의 개체 수가 71% 줄었으며, 조류는 54% 감소했다고 보고
○ 新의약품 개발 활발
○ 유엔(UN), 대학, 민간자선단체, 제약업체 등 공공단체와 민간기업이 손을 잡고 미개발국의 환자를 위해 의약품을 개발하는 새로운 움직임이 일어남.
○ 미생물게놈 추출성공, 인간게놈프로젝트 주역인 미국 크레이크 벤터 박사는 3월 사이언스에 바닷물에서 미생물 게놈을 추출해 10억 5,000만 염기쌍을 한꺼번에 분석하는 데 성공했다고 밝힘
▮ 2005년
○ 게놈지도와 야외 관찰로 진화가 일어나는 복잡한 과정을 밝힘
○ 유럽 호이겐스 탐사선이 토성의 달 타이탄에 착륙하고, NASA의 Deep Impact가 혜성에 충돌한 실험 등
○ 분자 생물학자들이 봄에 꽃이 다양한 색깔을 내게 하는 원리를 발견
○ 위성과 지상망원경으로 도시 크기의 죽은 별들인 중성자별 관찰
○ 정신분열증, 난독증, 안면경련증과 같은 뇌 신경질환 연구
○ 외계에서 온 암석과 지구의 암석을 비교 분석한 결과 지구 생성에 대해 새로운 이론 설립
○ volage-gated potassium channel의 분자 구조 밝힘
○ 인간 활동에 의한 지구 온난화의 증거 추가 발견
○ 분자 생물학자들이 복잡한 시스템의 행태를 이해하기 위해 엔지니어 기술 이용
○ 120억 달러 규모의 국제 핵융합 실험로(International Thermonuclear Ex-perimenta Reactor) 위치가 18개월의 논란 끝에 프랑스 Cadarache로 결정
○ Z 나선형 DNA와 B 나선형 DNA의 결합구조 규명, 네이처지 게재
▮ 2006년
○ 네안데르탈인 DNA 염기서열 분석
○ 급진전되는 지구 온난화 전망 제기
○ 땅위를 걸어다닌 물고기 화석 발견
○ 시력감퇴 치료제 개발
○ 생물 다양성의 재발견
○ 최첨단 현미경 기술 개발
○ 기억메커니즘 규명 단초 발견
○ 마이크로 RNA와 siRNA보다 약간 긴 새로운 RNA를 발견
○ 미연방정부 연구비 천만 달러를 받아 일리노이 대학 연구팀이 진행하고 있는 돼지 게놈 해독은 2년 안에 완성될 것으로 기대
○ 미 부시 대통령이 상하원 합동연설에서 농업 페기물로부터 바이오에탄올 생산 지원
○ 미 NIH가 유방암 재발을 예측하기 위해 10년간, 만 명의 환자에 대해 유전자 검사를 실시하는 연구를 개시
○ 미국 당뇨병 협회(ADA)가 농업 및 식량분야 생명공학에 대한 지원을 재확인
○ 다우사가 최초의 식물 생산 백신에 대한 허가를 취득
○ Renessen사가 생명공학 기술을 이용하여 유용성이 추가된 작물에 대해 최초로 동물 사료로 판매할 수 있는 허가를 취득
○ USDA가 밀의 게놈연구를 위해 18개 대학 밀번식 컨소시엄에 연구비 오백만 달러 지원
○ 오메가-3 지방산을 생산하는 형질전환 돼지 개발
○ 세계무역기구는 EU가 21가지의 농업 생명공학제품에 대해 통상약정을 위반 했다고 발표
○ 프랑스 농무부가 생명공학 옥수수 및 담배 작물에 대해 17가지의 새로운 실지 시험을 허가
○ 마이크로RNA의 초기프로세싱 기전 규명
○ 암 발생 억제기능 SUSP4 유전자의 분리 및 작용 메커니즘 규명
○ 저분자화합물을 이용한 세포노화의 가역적 재프로그래밍
▮ 2007년
○ AMPK 효소 항암기능 최초 규명. AMPK 활성화를 통해 대장암 세포가 정상으로 변화
○ 체내 면역반응 조절 ʻ브레이크 장치ʼ 물질 발견
○ ʻ스페인감기ʼ 바이러스를 이용해 조류독감을 치료할 수 있는 길이 열림
○ 화성에 물 존재 증거 발견
○ 자연계에 존재하지 않는 D-아미노산을 손쉽게 합성할 수 있는 신기술 개발
○ 수명이 다하거나 손상을 입은 세포에 죽음의 신호를 보내는 메커니즘 규명
○ 암 발병을 억제하는 유전자의 기능 규명
▮ 2008년
○ 조류독감 인체 간 감염 유발 경로 찾았다(출처:Nature Biotechnology)
○ 모유수유가 천식 등을 유발하는 항원에 대해 아이들을 어떻게 보호하는지에 대한 기전 규명(출처: Nature Medicine)
○ 장내 세균과의 공생 기제 밝혀냈다(출처: Science)
○ 인간배아줄기세포로 당뇨병 쥐 치료 성공(출처: Nature Biotechnology)
○ 탈모유발 유전자 발견, 새 탈모약 개발기대(출처: Nature Genetics)
○ 암 세포를 무제한 자라게 하는 ʻ효소단백질ʼ 확인(출처: Nature)
○ 비만 원인 ʻ유전자 네트워크 이상ʼ(출처: Nature)
○ 루게릭병 유발 ʻ유전자ʼ 찾았다(출처: Nature Genetics)
○ 운동신경세포 분화과정 규명(Developmental Cell)
○ 알즈하이머치매 ʻ기억력ʼ 떨어뜨리는 핵심 단백질 규명(출처: Nature Genetics)
○ 배꼽시계 등 생체회로 조절원리 규명(출처: Science)
○ 예방법 없는 ʻ말라리아ʼ 백신 개발된다(출처: Nature Medicine)
○ 물체 인식과정 규명, 실명치료 도움(출처: Nature)
○ 항생제 ʻ페니실린ʼ 만드는 균 ʻ유전자서열ʼ 규명(출처: Nature Biotechnology)
○ 유전자 제어 마이크로RNA 조절·사멸 메커니즘 규명(출처: Molecular Cell)
○ ʻ소리ʼ 잘 듣게 하는 귀 속 ʻ단백질ʼ 규명(출처: Nature)
○ 인체 세포 죽이는 단백질 규명, 새로운 항암제 개발(출처: Nature)
○ 日 연구팀 ʻ암세포ʼ 추적자 영상촬영물질 개발(출처: Nature Medicine)
▮ 2009년
○ 파킨슨병 등 신경퇴행성질환 유발 기전 규명(출처: Nature Medicine)
○ 염색체 응축 ʻ단백질 복합체ʼ 분자구조 규명(출처: Cell)
○ 마이크로 RNA 메커니즘 규명(출처: Cell)
○ ʻ고혈압ʼ 유발 유전자 변이 규명(출처: Nature Genetics)
○ 단백질과 패혈증의 원인 물질인 세균의 내독소가 결합된 복합체의 분자구조를 세계 최초로 규명(출처: Nature)
○ 당뇨 원인 인슐린 저항성 유발인자 발견(출처: Cell Metabolism)
○ 장(腸) 세포의 세균 제거 기전 규명(출처: Developmental Cell)
○ 소 유전자 지도 완성 ʻ축산혁명ʼ(출처: Science)
○ 미칠 듯한 가려움증 ʻ긁어주면 좋아지는 이유ʼ 규명(출처: Nature Neurons)
○ 다운증후군 ʻ암ʼ 잘 안 걸리는 이유 규명(출처: Nature)
○ 자도 자도 졸린 ʻ기면증ʼ 면역계 기능 부전이 원인(출처: Nature Genetics)
○ 체내 자연 발생 ʻ표백성분ʼ 상처회복 돕는다(출처: Nature)
○ 사람 줄기세포로 뇌졸중 쥐 치료성공(출처: Gene Therapy)
○ 한국 남성 ʻ유전자 서열ʼ 밝혔다(출처: Nature)
○ NMR로 생체막 단백질 구조 규명(출처: Science)
○ 줄기세포 분화조절 단백질 발견(출처: Cell)
○ ʻ새벽잠 없는 이유 있다ʼ, 적게 자게 하는 유전자 발견(출처: Science)
▮ 2010년
○ 배아줄기세포 치매치료제 국내서 첫 임상 실시
○ 혈관치료용 마이크로 로봇 개발 (세계 최초로 살아있는 미니돼지의 혈관에 주입돼 이동하는 실험 성공)
○ 0.3mm 핏줄까지 보이는 세계에서 가장 선명한 사람 뇌지도『7.0 Tesla MRI Brain Atlas』 발간
○ 나노 소재로 인공 광합성 성공
○ 세계 최초 암 관련 신규 유전자 발굴
○ 암 진행과 전이 매커니즘 규명
▮ 2011년
○ 인체면역결핍바이러스 예방 치료 네트워크(HPTN) 052
○ 밝혀진 인간의 기원 : 현생 인류의 DNA 일부가 네안데르탈인 게놈과 연관되었다는 사실 발견
○ 식물광합성 촉매 구조 규명 : 물 분해 촉매가 되는 막단백질 복합체의 구조 규명
○ 말라리아 백신 : ʻRTS,Sʼ 말라리아 백신이 아프리카 영유아의 말라리아 감염률을 50% 이상 감소시킴
○ 인간 장 속 미생물 : 인간의 장속 미생물이 혈액형과 같이 크게 3가지로 나뉨. 군집 종류에 따라 질병, 체질, 식습관이 달라짐
○ 노화세포제거 : 실험쥐의 노화세포를 제거하자 백내장, 근육 손실 등의 현상이 사라지고 나이 들어도 운동능력 저하되지 않는다는 사실 발견
▮ 2012년
○ 한국 식약청서 동종(타가) 줄기세포 치료제 판매를 세계최초로 승인.
○ 유럽의약청(EMA)이 서구 최초로 유전자치료제를 승인하고 희귀유전질환 지단백지질분해효소결핍증(LPLD) 치료제 글리베라(Glybera)를 판매를 허가.
○ 먹는 C형간염치료제, 미국 FDA 승인.
○ 한국기업 셀트리온, 세계 최초의 항체 바이오시밀러인 ʻ램시마ʼ 출시
○ 뇌신경세포 신호전달 원리 규명
○ 체세포를 성체줄기세포로 직접교차분화를 유도하는데 성공
○ 아시아인 당뇨-비만에 관계하는 새로운 유전변이 현상 및 요인 발견
○ 자폐증에 관여하는 새로운 유전자 및 발병원인 발견
▮ 2013년
○ 인간 배아줄기세포 복제 성공. 태아의 피부세포를 핵을 제거한 난자에 융합시켜 인간 배아줄기세포를 만들고, 이후 심장세포로 자라게 하는 데 성공.
○ ʻDNA 백과사전ʼ 완성. 기능이 거의 없어 98%의 쓰레기 DNA(Junk DNA)의 기능이 거의 없고 정체가 불투명한 쓸모없는 유전자들로 ʻ쓰레기ʼ 가 인간 질병과 돌연변이에 관여한다는 사실 규명.
○ 유도만능줄기세포(iPS) 임상 연구를 세계 최초로 승인. 삼출형가령황반변성 (滲出型加齢黄斑変性)이라는 눈의 난치병의 환자로부터 만들어낸 iPS를 망막색소 상피세포로 변화시켜 손상된 부분에 이식하는 방식.
○ iPS 이용해 인간의 ʻ간ʼ 조직 배양 성공
○ 대사공학 기술을 이용해 대장균으로 휘발유 및 벤젠의 인공합성에 성공
○ 태아 중뇌에서 추출한 줄기세포로 만든 ʻ도파민 신경전구세포ʼ를 파킨슨병 환자의 뇌 피각부에 이식하는데 성공.
○ mRNA의 비정상적인 기능 인식과 제거에 관한 메커니즘 규명.
○ 포유류 신경 재생 메커니즘 규명. 포유류의 말초신경 재생 메커니즘 규명. 중추신경에 적용 할 경우 하반신 및 전신 마비환자 치료가능성 열려.

1. 예산투자

출처 : 연도별 생명공학육성시행계획 자료가공
[그림 부록 2-1] 정부부문 생명공학 BT 투자실적(1994∼2012년)
[표 부록 2-1] 국내 부처별 BT 투자실적 및 계획(ʼ12∼ʼ13년)
(단위 : 백만 원)
|
구 분 |
‘13년 투자계획 |
‘12년 계획 (B) |
‘12년 실적 (C) |
달성율 (%) (C/B) |
||||
|
연구 개발 |
인프라 |
인력 양성 |
합계 (A) |
증가율 (%) ((A-B)/B) |
||||
|
미래창조과학부 |
575,148 |
29,470 |
3,012 |
607,630 |
1.3% |
600,016 |
595,131 |
99.2% |
|
교 육 부 |
- |
- |
17,835 |
17,835 |
Δ60.0% |
44,548 |
44,651 |
100.2% |
|
농림축산식품부 |
232,888 |
800 |
4,290 |
237,978 |
20.2% |
198,041 |
232,708 |
117.5% |
|
산업통상자원부 |
117,672 |
17,145 |
2,298 |
137,115 |
Δ14.3% |
159,952 |
158,246 |
98.9% |
|
보 건 복 지 부 |
357,641 |
239,902 |
- |
597,543 |
62.0% |
368,959 |
380,727 |
103.2% |
|
환 경 부 |
46,103 |
150 |
- |
46,253 |
13.9% |
40,593 |
42,015 |
103.5% |
|
해 양 수 산 부 |
39,858 |
74,510 |
- |
114,368 |
3.4% |
104,178 |
81,828 |
78.5% |
|
출 연 기 관 |
134,311 |
27,091 |
- |
161,402 |
Δ2.2% |
165,104 |
167,618 |
101.5% |
|
총 계 |
1,503,621 |
389,068 |
27,435 |
1,920,124 |
14.2% |
1,681,391 |
1,702,924 |
101.3% |
출처 : 2012년도 생명공학육성시행계획, 교육과학기술부, 2012. 6

출처: 2013년도 생명공학육성시행계획, 교육과학기술부, 2013. 6. 자료가공
[그림 부록 2-2] 부처별 생명공학분야 연구개발비 점유율(ʼ13)
- 미래창조과학부가 전체 R&D 예산의 31.6%, 교육부 0.9%, 농림축산식품부 12.4%, 산업통상자원부 7.1%, 보건복지부 31.1%, 환경부 2.5%, 해양수산부 6.0%, 출연연에서 8.4%를 투자

[그림 부록 2-3] 분야별 투자계획(ʼ13)
- 5대 기술분야별 투자는 생명과학(32.7%), 보건의료(33.9%), 농수축산․식품(13.1%), 산업공정/환경·해양(11.1%), 바이오융합(9.2%) 순으로 나타남
(단위 : 백만원)
|
구 분 |
생명과학 |
보건의료 |
농수축산 식품 |
산업공정/ 환경·해양 |
바이오 융합 |
합계 |
|
2012실적 |
482,217 |
473,174 |
196,163 |
159,039 |
149,470 |
1,460,063 |
|
2013계획 |
491,948 |
509,801 |
197,126 |
166,289 |
138,457 |
1,503,621 |
|
증감률(%) |
2.0% |
7.7% |
0.5% |
4.6% |
Δ7.4% |
3.0% |
출처 : 2013년도 생명공학육성시행계획, 교육과학기술부, 2013. 6. 자료가공
[표 부록 2-2] 기관별 생명공학분야 투자비교(ʼ10년 실적 & ʼ11년 계획)
(단위: 백만 원)
|
구분 |
미래창조 과학부 |
농림축산 식품부 |
산업통상 자원부 |
보건 복지부 |
환경부 |
해양 수산부 |
출연연 |
합계 |
|
2012실적 |
562,921 |
227,688 |
123,567 |
335,223 |
42,015 |
29,948 |
138,701 |
1,460,063 |
|
2013계획 |
575,148 |
232,888 |
117,672 |
357,641 |
46,103 |
39,858 |
134,311 |
1,503,621 |
|
증감률(%) |
2.2% |
2.3% |
Δ4.8% |
6.7% |
9.7% |
33.1% |
Δ3.2% |
3.0% |
출처 : 2013년도 생명공학육성시행계획, 교육과학기술부, 2013. 6. 자료가공
주1) 증감율 = (ʼ13년 투자계획 - ʼ12년 투자실적)/ʼ10년 투자실적
[표 부록 2-3] 5대 분야별 연구개발 투자비교(ʼ12년 실적 & ʼ13년 계획)
(단위: 백만 원)
|
구 분 |
생명과학 |
보건의료 |
농수축산 식품 |
산업공정/ 환경·해양 |
바이오 융합 |
합계 |
|
2012실적 |
482,217 |
473,174 |
196,163 |
159,039 |
149,470 |
1,460,063 |
|
2013계획 |
491,948 |
509,801 |
197,126 |
166,289 |
138,457 |
1,503,621 |
|
증감률(%) |
2.0% |
7.7% |
0.5% |
4.6% |
Δ7.4% |
3.0% |
출처 : 2013년도 생명공학육성시행계획, 교육과학기술부, 2013. 6. 자료가공
주1) 증감율 = (ʼ13년 투자계획 - ʼ12년 투자실적)/ʼ10년 투자실적
[표 부록 2-4] 기관별 세부사업 투자계획(ʼ13)
|
기관명 |
사업명 |
2012 계획 |
2012 실적 |
2013 계획 |
|
미래 창조 과학부 |
<연구개발> |
|
|
|
|
◦ 글로벌프론티어연구개발사업 |
30,000 |
30,000 |
30,000 |
|
|
◦ 21세기프론티어연구개발사업 |
9,000 |
9,000 |
- |
|
|
◦ 바이오·의료기술개발사업 |
121,678 |
130,346 |
149,964 |
|
|
◦ 미래유망원천기술개발사업(공공복지안전연구사업) |
13,574 |
13,574 |
14,774 |
|
|
◦ 뇌과학원천기술개발사업 |
12,860 |
12,860 |
9,110 |
|
|
◦ 첨단융합기술개발사업 |
6,850 |
8,400 |
8,000 |
|
|
◦ 개인연구사업 |
317,872 |
281,078 |
283,212 |
|
|
◦ 집단연구사업 |
45,100 |
52,207 |
52,574 |
|
|
◦ 국제공동연구사업 |
6,900 |
19,956 |
21,514 |
|
|
◦ 해양극지기초원천기술개발사업 |
5,500 |
5,500 |
6,000 |
|
|
<시설 및 기반구축> |
|
|
|
|
|
◦ 바이오·의료기술개발사업 |
14,182 |
15,282 |
14,870 |
|
|
◦ 전문연구정보활용사업 |
2,800 |
216 |
300 |
|
|
◦ 동북아R&D기반구축사업 |
13,700 |
13,700 |
14,300 |
|
|
<인력양성> |
|
|
|
|
|
◦ 바이오·의료기술개발사업 |
- |
3,012 |
3,012 |
|
|
소계 |
600,016 |
595,131 |
607,630 |
|
|
교육부 |
<인력양성> |
|
|
|
|
◦ 세계수준의연구중심대학(WCU)육성사업 |
17,221 |
17,362 |
17,835 |
|
|
◦ 2단계연구중심대학(BK21)육성사업 |
27,327 |
27,289 |
- |
|
|
소계 |
44,548 |
44,651 |
17,835 |
|
|
농림축산 식품부 |
<연구개발> |
|
|
|
|
◦ 농식품기술개발정책연구 |
79,604 |
113,951 |
122,944 |
|
|
◦ 생명과학연구개발사업 |
70,000 |
70,000 |
69,900 |
|
|
◦ 농업기술연구‧개발 및 정보화 |
14,475 |
14,475 |
14,404 |
|
|
◦ 검역검사 R&D 및 정보화 |
24,547 |
24,547 |
24,380 |
|
|
◦ 수산업생명공학연구* |
3,465 |
3,465 |
- |
|
|
◦ 산림과학기술개발 |
1,350 |
1,250 |
1,260 |
|
|
<시설 및 기반구축> |
|
|
|
|
|
◦ 지방임업연구 기반조성 |
800 |
800 |
800 |
|
|
<인력양성> |
|
|
|
|
|
◦ 농식품기술개발정책연구 |
3,000 |
3,000 |
3,000 |
|
|
◦ 인력양성 |
800 |
1,220 |
1,290 |
|
|
소계 |
198,041 |
232,708 |
237,978 |
|
|
산업통상 자원부 |
<연구개발> |
|
|
|
|
◦ 산업진흥고도화(산업원천기술개발) |
89,769 |
93,027 |
87,823 |
|
|
◦ 신시장 창출(사업화 연계기술개발) |
10,000 |
10,000 |
12,000 |
|
|
◦ 국내외자원개발(신재생에너지개발) |
20,300 |
20,540 |
17,849 |
|
|
<시설 및 기반구축> |
|
|
|
|
|
◦ 산업진흥고도화(산업원천기술개발) |
2,800 |
2,100 |
5,100 |
|
|
◦ 산업진흥고도화(바이오분야국제협력이행) |
2,320 |
2,020 |
2,225 |
|
|
◦ 산업진흥고도화(생물화학산업기간구축지원) |
3,800 |
38,00 |
4,000 |
|
|
◦ 광역경제활성화 |
8,187 |
3,900 |
5,820 |
|
|
◦ 지역전략산업진흥 |
19,176 |
20,107 |
- |
|
|
<인력양성> |
|
|
|
|
|
◦ 산업진흥고도화(산업기술진흥) |
3,600 |
2,752 |
2,298 |
|
|
소계 |
159,952 |
158,246 |
137,115 |
출처 : 2013년도 생명공학육성시행계획, 교육과학기술부, 2013. 6. 자료가공
2. 시설 및 인프라
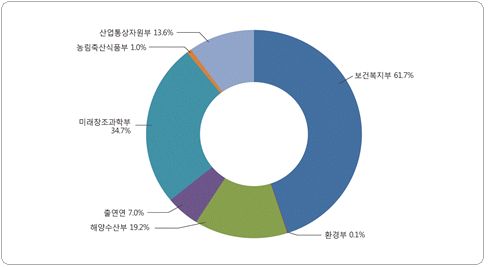
[그림 부록 2-4] 기관별 시설 및 기반구축 투자계획
- ʼ13년도 인프라 부문은 미래창조과학부 7.6%, 농림축산식품부 0.2%, 산업통상자원부 4.4%, 보건복지부 61.7%, 해양수산부 19.2%, 출연(연)이 7.0% 담당
(단위 : 백만 원)
|
구분 |
미래창조 과학부 |
농림축산 식품부 |
산업통상 자원부 |
보건 복지부 |
환경부 |
해양 수산부 |
출연연 |
합계 |
|
2012실적 |
29,198 |
800 |
31,927 |
45,504 |
- |
51,880 |
28,917 |
188,226 |
|
2013계획 |
29,470 |
800 |
17,145 |
239,902 |
150 |
74,510 |
27,091 |
389,068 |
|
증감률(%) |
0.9% |
- |
Δ46.3% |
427.2% |
- |
43.6% |
Δ6.3% |
106.7% |
출처 : 2013년도 생명공학육성시행계획, 교육과학기술부, 2013. 6. 자료가공
3. 인력양성

[그림 부록 2-5] 부처별 인력향성 투자계획
- ʼ13년도 생명공학 인력양성은 교육부(65.0%), 농림축산식품부(15.6%) 순으로 인력양성을 지원하고 있으며, 농림축산식품부의 예산이 증가(1.6%)
|
|
|
(단위 : 백만원) |
|||||
|
구분 |
미래창조 과학부 |
교육부 |
농림축산 식품부 |
산업통상 자원부 |
합계 |
||
|
2012실적 |
3,012 |
44,651 |
4,220 |
2,752 |
54,635 |
||
|
2013계획 |
3,012 |
17,835 |
4,290 |
2,298 |
27,435 |
||
|
증감률(%) |
- |
Δ60.1% |
1.6% |
Δ16.5 |
Δ49.8% |
||
4. 산업

출처 : Datamonitor, Global Biotechnology, 2011. 9
[그림 부록 2-6] 세계 바이오산업 현황 및 전망(ʼ10~ʼ15)

출처 : Biotechnology - A Global Outlook, Global Industry Analysis, 2012. 1
[그림 부록 2-7] 지역별 세계 바이오산업 현황 및 전망(ʼ10~ʼ15)
[표 부록 2-5] 세계 바이오산업 현황 및 전망(ʼ10~ʼ15)
(단위 : 백만 달러, %)
|
구분 |
2010 |
2011 |
2012 |
2013 |
2014 |
2015 |
CAGR |
|
US |
71,544.73 |
73,090.10 |
74,880.81 |
76,543.16 |
77,882.67 |
79,113.22 |
2.03 |
|
Europe |
57,851.29 |
61,176.17 |
65,315.41 |
70,232.83 |
75,786.83 |
81,746.48 |
7.16 |
|
Asia- Pacific |
91,498.23 |
100,788.13 |
112,105.64 |
125,562.15 |
139,284.08 |
153,373.41 |
10.88 |
|
Rest of World |
3,444.29 |
3,862.43 |
4,419.01 |
5,099.54 |
5,826.22 |
6,629.67 |
13.99 |
출처 : Biotechnology - A Global Outlook, Global Industry Analysis, 2012. 1
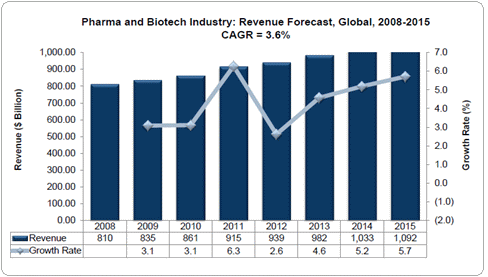
출처 : Changing Dynamics in the Pharma and Biotech Industry, Frost & Sullivan, 2012. 6
[그림 부록 2-8] 세계 제약 및 바이오산업 시장규모(ʼ08~ʼ15)
(단위 : 억 원 )

출처 : 한국산업마케팅연구소, 2012
[그림 부록 2-9] 국내 바이오산업 시장 규모 전망
[표 부록 2-6] 국내 바이오산업 시장규모(ʼ92~ʼ10)
(단위 : 억 원)
|
연도 |
’92 |
’93 |
’94 |
’95 |
’96 |
’97 |
’98 |
’99 |
’00 |
’01 |
|
국내판매 |
581 |
952 |
1,166 |
1,652 |
2,233 |
2,861 |
3,383 |
4,587 |
5,694 |
7,587 |
|
수출제품 |
246 |
569 |
569 |
735 |
2,448 |
3,018 |
4,815 |
4,543 |
6,101 |
6,363 |
|
합계 |
827 |
1,521 |
1,735 |
2,387 |
4,681 |
5,879 |
8,198 |
9,130 |
11,795 |
13,950 |
|
연도 |
’02 |
’03 |
’04 |
’05 |
’06 |
’07 |
’08 |
’09 |
’10 |
- |
|
국내판매 |
9,254 |
10,853 |
12,854 |
15,403 |
18,093 |
22,423 |
26,082 |
29,075 |
34,158 |
- |
|
수출제품 |
7,622 |
9,938 |
11,345 |
12,311 |
13,502 |
14,715 |
19,038 |
19,038 |
27,445 |
- |
|
합계 |
16,876 |
20,791 |
24,199 |
27,714 |
31,595 |
37,138 |
45,120 |
45,120 |
61,603 |
- |
출처 : 한국바이오협회 30년의 발자취, 한국바이오협회, 2012.11
(단위 : 억 원)

출처 : 한국바이오협회 30년의 발자취, 한국바이오협회, 2012.11
[그림 부록 2-10] 국내 바이오산업 시설투자 및 연구개발비(ʼ91~ʼ10)

출처 : 국내 바이오산업 실태조사, 지식경제부; 한국바이오협회, 2012. 6
[그림 부록 2-11] 국내 바이오산업 분야별 수출규모(ʼ10)

출처 : 국내 바이오산업 실태조사, 지식경제부; 한국바이오협회, 2012. 6
[그림 부록 2-12] 국내 바이오산업 분야별 수입규모(ʼ10)

생명공학육성법
[시행 2013.3.23] [법률 제11683호, 2013.3.23, 일부개정]
제1조(목적) 이 법은 생명공학연구의 기반을 조성하여 생명공학을 보다 효율적으로 육성·발전시키고 그 개발기술의 산업화를 촉진하여 국민경제의 건전한 발전에 기여하게 함을 목적으로 한다.
[전문개정 2013.3.23]
제2조(정의) 이 법에서 "생명공학"이라 함은 다음 각호의 학문과 기술을 말한다.
1. 산업적으로 유용한 생산물을 만들거나 생산공정을 개선할 목적으로 생물학적 시스템, 생체, 유전체 또는 그들로부터 유래되는 물질을 연구·활용하는 학문과 기술
2. 생명현상의 기전(起傳), 질병의 원인 또는 발병과정에 대한 연구를 통하여 생명공학의 원천지식을 제공하는 생리학·병리학·약리학 등의 학문[이하 "기초의과학(基礎醫科學)" 이라 한다]
[전문개정 2003.12.30]
제3조(적용범위) 생명공학에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 의한다. <개정 1995.1.5, 2013.3.23>
[제목개정 2013.3.23]
제4조(생명공학육성기본계획의 수립) ① 제13조의 규정에 의한 관계부처의 장은 소관별로 생명공학육성에 관한 계획을 미래창조과학부장관에게 제출하여야 한다. <개정 2013.3.23>
② 미래창조과학부장관은 제1항의 규정에 의하여 관계부처의 장이 제출한 소관사항에 관한 생명공학육성계획을 종합·조정하여 생명공학육성기본계획(이하 "기본계획"이라 한다)을 수립한다. <개정 2013.3.23>
③ 제2항의 규정에 의한 기본계획에는 다음의 사항이 포함되어야 한다. <개정 1995.1.5, 1997.8.28, 2013.3.23>
1. 생명공학의 기초연구 및 산업적 응용연구의 육성에 관한 종합계획과 지침
2. 생명공학의 연구에 필요한 인력자원의 개발종합계획과 인력자원의 효율적인 활용에 관한 지침
3. 생명공학의 연구 및 이와 관련된 산업기술인력의 국제교류와 해외과학기술자의 활용에 관한 계획과 그 지침
④ 미래창조과학부장관은 기본계획을 수립하고자 할 때에는 제6조의 생명공학종합정책심의회의 심의를 거쳐야 한다. <개정 2013.3.23>
[제목개정 2013.3.23]
제5조(생명공학육성 연차별 시행계획의 수립등) ① 관계부처의 장은 기본계획에 따라 생명공학육성 연차별 시행계획(이하 "시행계획"이라 한다)을 수립하고 이를 시행하여야 한다. <개정 2013.3.23>
② 관계부처의 장은 시행계획을 수립하고자 할 때에는 미리 미래창조과학부장관과 협의하여야 한다. <개정 2013.3.23>
③ 미래창조과학부장관은 시행계획의 수립을 위하여 필요한 때에는 그 계획의 수립에 필요한 기본지침을 작성하여 관계부처의 장에게 통보할 수 있다. <개정 2013.3.23>
④ 시행계획의 수립 및 그 시행에 관하여 필요한 사항은 대통령령으로 정한다. <개정 2013.3.23>
[제목개정 2013.3.23]
제6조(생명공학종합정책심의회) ① 기본계획의 수립과 그 집행 및 조정에 관한 업무를 관장하기 위하여 미래창조과학부장관소속하에 생명공학종합정책심의회(이하 "심의회"라 한다)를 둔다. <개정 2013.3.23>
② 심의회는 다음 사항을 심의 결정한다. <개정 1995.1.5, 1997.8.28, 2003.12.30, 2008.2.29, 2011.7.21, 2013.3.23>
1. 생명공학의 기초연구 및 산업적 응용연구의 육성에 관한 계획의 수립 및 그 집행의 조정
2. 생명공학의 연구 및 기술개발에 관한 기본계획의 수립과 이에 따른 중요정책의 수립 및 그 집행의 조정
3. 생명공학분야 인력개발에 관한 종합계획과 이에 따른 중요정책, 인력활용지침의 수립 및 그 집행의 조정
4. 생명공학의 연구 및 이와 관련된 산업기술인력의 개발교류와 해외과학기술자의 활용에 관한 계획의 수립 및 그 집행의 조정
5. 유전자원의 이용과 보전을 위한 연구개발계획의 수립 및 그 집행의 조정
6. 「뇌연구 촉진법」 제5조제2항의 뇌연구촉진기본계획의 수립·변경과 이에 따른 중요 정책의 수립 및 그 집행의 조정
7. 「뇌연구 촉진법」 제9조에 따른 뇌연구 투자 확대계획 등 뇌연구 관련 예산의 확대방안에 관한 사항
8. 뇌연구 분야 인력 개발 및 교류에 관한 종합계획과 이에 따른 중요 정책, 인력활용지침의 수립 및 그 집행의 조정
9. 뇌연구 결과의 이용과 보전을 위한 계획의 수립 및 그 집행의 조정
10. 그 밖에 생명공학육성과 뇌연구 촉진에 관하여 미래창조과학부장관이 필요하다고 인정하는 사항
③ 심의회는 위원장 1인을 포함한 17인 이내의 위원으로 구성한다. <신설 2003.12.30>
④ 위원장은 미래창조과학부장관이 되고 위원은 다음 각호의 자가 된다. <신설 2003.12.30, 2008.2.29, 2013.3.23>
1. 대통령령이 정하는 관계 중앙행정기관의 차관급 공무원
2. 학계·연구기관 또는 산업계에 종사하는 생명공학 관계자 및 생명윤리 전문가
⑤ 이 법에서 규정한 사항외에 심의회의 조직 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다. <신설 2003.12.30>
[제목개정 2013.3.23]
제7조 삭제 <2003.12.30>
제8조 삭제 <2003.12.30>
제9조(연구 및 기술협력) 미래창조과학부장관은 생명공학의 연구 및 기술에 관한 국제협력의 증진에 노력하고 선진기술의 도입을 위한 효율적인 방안을 강구한다.
[전문개정 2013.3.23]
제10조(공동연구의 촉진) 정부는 생명공학연구 및 기술개발의 효율적 육성을 위하여 학계·연구기관 및 산업계간의 공동연구를 촉진하여야 한다.
[전문개정 2013.3.23]
제11조(생명공학의 산업적 응용촉진에 대한 지원) 정부는 생명공학 연구개발을 활성화하고 그 결과의 산업적 응용을 촉진하기 위하여 다음 각호의 사항에 대한 지원시책을 강구하여야 한다.
1. 생명공학관련 신기술제품의 생산지원에 관한 사항
2. 생명공학 연구결과의 산업적 응용을 촉진하기 위한 연구개발 및 지역거점 구축에 관한 사항
3. 생명공학관련 중소·벤처기업의 창업지원에 관한 사항
[전문개정 2003.12.30]
제12조(기술정보의 수집과 보급) 정부는 생명공학연구에 관한 정보를 수집, 관계기관에 보급함으로써 연구개발촉진에 노력하여야 한다.
[전문개정 2013.3.23]
제13조(생명공학 육성시책 강구 등) ①정부는 생명공학의 효율적인 육성을 위하여 생명공학의 기초연구 및 산업적 응용연구에 관하여 다음 각호의 시책을 강구한다. 다만, 기초의과학(基礎醫科學)분야의 연구개발 촉진 및 육성업무는 미래창조과학부장관 및 보건복지부장관의 소관으로 한다. <개정 1997.8.28, 2001.1.29, 2003.12.30, 2004.12.31, 2008.2.29, 2010.1.18, 2013.3.23>
1. 미래창조과학부장관: 제4조제2항의 규정에 의한 기본계획의 수립과 부처별 정책 수립의 지원 및 종합조정, 생명공학 관련 기초기술 및 첨단기술의 개발지원, 과학기술 분야의 유용한 유전자의 확보·분석·이용·보전을 위한 연구의 지원, 생명공학 지원기관의 육성·발전, 생명공학의 육성·발전을 위한 정보통신기술의 개발 지원을 위한 시책
2. 교육부장관: 생명공학분야의 연구를 촉진시키기 위한 전문인력의 양성과 생명과학기초분야의 연구지원을 위한 시책으로서, 미래창조과학부장관과 협의한 시책
3. 농림축산식품부장관: 동·식물 및 미생물의 육종·품종개량 및 식품소재의 개발 등 응용연구의 지원 및 농림분야의 유용한 유전자의 확보·분석·이용·보존 등 기초연구의 지원 및 연구기관의 육성·발전을 위한 시책
4. 산업통상자원부장관: 생명공학 관련 산업공정의 개발과 개선, 신·재생에너지개발, 에너지 및 광물자원의 효율적 활용, 생명공학 관련 생산기술개발 등의 지원과 그 개발기술의 산업화 촉진을 위한 시책
4의2. 삭제 <2008.2.29>
5. 보건복지부장관: 보건·의료·식품위생 등 생명공학과 관련되는 기술에 대한 연구개발의 촉진과 관련전문인력 양성, 임상시험 관련사업 육성 및 연구의 지원을 위한 시책
6. 환경부장관: 생물다양성의 보전, 그 구성요소의 지속가능한 이용 및 생명공학기술을 이용한 폐수·폐기물의 처리 및 환경오염의 방지등을 위한 기술개발과 기초연구 및 응용연구 지원을 위한 시책
7. 해양수산부장관: 해양수산생물을 이용한 유용물질의 생산과 해양수산생물의 육종·개량 및 식품소재의 개발 등 응용연구의 지원, 해양수산분야의 유용한 유전자의 확보·분석·이용·보존 등 기초연구의 지원, 해양오염방지 등을 위한 기술개발 및 연구기관의 육성·발전을 위한 시책
② 미래창조과학부장관과 보건복지부장관은 기초의과학(基礎醫科學)을 육성하기 위한 시책을 수립하고자 하는 때에는 협의하여야 한다. <신설 2003.12.30, 2008.2.29, 2010.1.18, 2013.3.23>
[전문개정 1995.1.5]
[제목개정 2013.3.23]
제14조(검정 및 임상) ① 정부는 생명공학 관련제품에 대한 임상 및 검정체제를 확립한다. <개정 2013.3.23>
② 제1항의 임상 및 검정체제확립에 관하여 필요한 사항은 대통령령으로 정한다. <개정 2013.3.23>
[제목개정 2013.3.23]
제15조(실험지침의 작성·시행등) ① 정부는 생명공학연구 및 산업화의 촉진을 위한 실험지침을 작성·시행하여야 한다. <개정 2013.3.23>
② 제1항의 실험지침에서는 생명공학의 연구와 이의 산업화 과정에서 예견될 수 있는 생물학적 위험성, 환경에 미치는 악영향 및 윤리적 문제발생의 사전방지에 필요한 조치가 강구되어야 하며, 유전적으로 변형된 생물체의 이전·취급·사용에 대한 안전기준이 마련되어야 한다. <개정 2013.3.23>
[제목개정 2013.3.23]
제16조(한국생명공학연구원) ①생명공학연구[다만, 기초의과학(基礎醫科學)연구를 제외한다. 이하 이 조에서 같다] 및 유전자원의 이용과 보전에 관한 연구의 중추적 기능을 담당하고 생명공학분야에서의 학계·연구기관 및 산업계간의 상호유기적 협조체제를 유지·발전시키며, 이들을 지원하기 위하여 재단법인인 한국생명공학연구원(이하 "연구원"이라 한다)을 설립할 수 있다. <개정 1995.1.5, 2003.12.30, 2013.3.23>
② 제1항의 규정에 의한 연구원은 특정연구기관육성법의 적용을 받는 특정연구기관으로 한다. <개정 2013.3.23>
③ 삭제 <1995.12.6>
[제목개정 2013.3.23]
제17조(기초의과학육성지원기구) ①정부는 기초의과학(基礎醫科學)을 육성하기 위하여 기초의과학육성지원기구(이하 "육성지원기구"라 한다)를 지정하여 운영할 수 있다.
② 정부는 예산의 범위안에서 육성지원기구의 운영에 필요한 경비를 지원할 수 있다.
③ 육성지원기구의 지정 및 운영에 관하여 필요한 사항은 대통령령으로 정한다.
[본조신설 2003.12.30]
제18조 삭제 <1995.12.6>
제19조(수입신고 수리 전 반출) ① 삭제 <2003.12.30>
② 생명공학연구활동에 필요한 관련 자재·기기나 시약 중 국내에서 생산하지 아니하는 품목으로서, 변질 등의 이유로 통관이 시급히 필요한 물품은 「관세법」의 규정에도 불구하고 대통령령으로 정하는 바에 따라 수입신고 수리 전에 반출할 수 있다. <개정 2013.3.23>
[제목개정 2013.3.23]
제20조 삭제 <2003.12.30>
<제11683호, 2013.3.23>
이 법은 공포한 날부터 시행한다.
생명윤리 및 안전에 관한 법률
[시행 2013.3.23] [법률 제11690호, 2013.3.23, 타법개정]
제1장 총칙
제1조(목적) 이 법은 인간과 인체유래물 등을 연구하거나, 배아나 유전자 등을 취급할 때 인간의 존엄과 가치를 침해하거나 인체에 위해(危害)를 끼치는 것을 방지함으로써 생명윤리 및 안전을 확보하고 국민의 건강과 삶의 질 향상에 이바지함을 목적으로 한다.
제2조(정의) 이 법에서 사용하는 용어의 뜻은 다음과 같다.
1. "인간대상연구"란 사람을 대상으로 물리적으로 개입하거나 의사소통, 대인 접촉 등의 상호작용을 통하여 수행하는 연구 또는 개인을 식별할 수 있는 정보를 이용하는 연구로서 보건복지부령으로 정하는 연구를 말한다.
2. "연구대상자"란 인간대상연구의 대상이 되는 사람을 말한다.
3. "배아"(胚芽)란 인간의 수정란 및 수정된 때부터 발생학적(發生學的)으로 모든 기관(器官)이 형성되기 전까지의 분열된 세포군(細胞群)을 말한다.
4. "잔여배아"란 체외수정(體外受精)으로 생성된 배아 중 임신의 목적으로 이용하고 남은 배아를 말한다.
5. "잔여난자"란 체외수정에 이용하고 남은 인간의 난자를 말한다.
6. "체세포핵이식행위"란 핵이 제거된 인간의 난자에 인간의 체세포 핵을 이식하는 것을 말한다.
7. "단성생식행위"란 인간의 난자가 수정 과정 없이 세포분열하여 발생하도록 하는 것을 말한다.
8. "체세포복제배아"(體細胞複製胚芽)란 체세포핵이식행위에 의하여 생성된 세포군을 말한다.
9. "단성생식배아"(單性生殖胚芽)란 단성생식행위에 의하여 생성된 세포군을 말한다.
10. "배아줄기세포주"(Embryonic stem cell lines)란 배아, 체세포복제배아, 단성생식배아 등으로부터 유래한 것으로서, 배양 가능한 조건에서 지속적으로 증식(增殖)할 수 있고 다양한 세포로 분화(分化)할 수 있는 세포주(細胞株)를 말한다.
11. "인체유래물"(人體由來物)이란 인체로부터 수집하거나 채취한 조직ㆍ세포ㆍ혈액ㆍ체액 등 인체 구성물 또는 이들로부터 분리된 혈청, 혈장, 염색체, DNA(Deoxyribonucleic acid), RNA(Ribonucleic acid), 단백질 등을 말한다.
12. "인체유래물연구"란 인체유래물을 직접 조사ㆍ분석하는 연구를 말한다.
13. "인체유래물은행"이란 인체유래물 또는 유전정보와 그에 관련된 역학정보(疫學情報), 임상정보 등을 수집ㆍ보존하여 이를 직접 이용하거나 타인에게 제공하는 기관을 말한다.
14. "유전정보"란 인체유래물을 분석하여 얻은 개인의 유전적 특징에 관한 정보를 말한다.
15. "유전자검사"란 인체유래물로부터 유전정보를 얻는 행위로서 개인의 식별 또는 질병의 예방ㆍ진단ㆍ치료 등을 위하여 하는 검사를 말한다.
16. "유전자치료"란 질병의 예방 또는 치료를 목적으로 유전적 변이를 일으키는 일련의 행위를 말한다.
17. "개인식별정보"란 연구대상자와 배아ㆍ난자ㆍ정자 또는 인체유래물의 기증자(이하 "연구대상자등"이라 한다)의 성명ㆍ주민등록번호 등 개인을 식별할 수 있는 정보를 말한다.
18. "개인정보"란 개인식별정보, 유전정보 또는 건강에 관한 정보 등 개인에 관한 정보를 말한다.
19. "익명화"(匿名化)란 개인식별정보를 영구적으로 삭제하거나, 개인식별정보의 전부 또는 일부를 해당 기관의 고유식별기호로 대체하는 것을 말한다.
제3조(기본 원칙) ① 이 법에서 규율하는 행위들은 인간의 존엄과 가치를 침해하는 방식으로 하여서는 아니 되며, 연구대상자등의 인권과 복지는 우선적으로 고려되어야 한다.
② 연구대상자등의 자율성은 존중되어야 하며, 연구대상자등의 자발적인 동의는 충분한 정보에 근거하여야 한다.
③ 연구대상자등의 사생활은 보호되어야 하며, 사생활을 침해할 수 있는 개인정보는 당사자가 동의하거나 법률에 특별한 규정이 있는 경우를 제외하고는 비밀로서 보호되어야 한다.
④ 연구대상자등의 안전은 충분히 고려되어야 하며, 위험은 최소화되어야 한다.
⑤ 취약한 환경에 있는 개인이나 집단은 특별히 보호되어야 한다.
⑥ 생명윤리와 안전을 확보하기 위하여 필요한 국제 협력을 모색하여야 하고, 보편적인 국제기준을 수용하기 위하여 노력하여야 한다.
제4조(적용 범위) ① 생명윤리 및 안전에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 따른다.
② 생명윤리 및 안전에 관한 내용을 담은 다른 법률을 제정하거나 개정할 경우에는 이 법에 부합하도록 하여야 한다.
제5조(국가와 지방자치단체의 책무) ① 국가와 지방자치단체는 생명윤리 및 안전에 관한 문제에 효율적으로 대처할 수 있도록 필요한 시책을 마련하여야 한다.
② 국가와 지방자치단체는 생명윤리 및 안전 관련 연구와 활동에 대한 행정적ㆍ재정적 지원방안을 마련하여야 한다.
③ 국가와 지방자치단체는 각급 교육기관 등에서 생명윤리 및 안전에 대한 교육을 할 수 있도록 하여야 하고, 교육 프로그램을 개발하는 등 교육 여건이 조성되도록 지원하여야 한다.
제6조(생명윤리정책연구센터의 지정) ① 보건복지부장관은 생명윤리정책에 관한 전문적인 조사, 연구 및 교육 등을 실시하기 위하여 해당 업무를 수행할 능력이 있다고 인정하는 기관ㆍ단체 또는 시설을 생명윤리정책연구센터로 지정할 수 있다.
② 제1항에 따른 생명윤리정책연구센터의 지정 및 운영 등에 필요한 사항은 보건복지부령으로 정한다.
제7조(국가생명윤리심의위원회의 설치 및 기능) ① 생명윤리 및 안전에 관한 다음 각 호의 사항을 심의하기 위하여 대통령 소속으로 국가생명윤리심의위원회(이하 "국가위원회"라 한다)를 둔다.
1. 국가의 생명윤리 및 안전에 관한 기본 정책의 수립에 관한 사항
2. 제12조제1항제3호에 따른 공용기관생명윤리위원회의 업무에 관한 사항
3. 제15조제2항에 따른 인간대상연구의 심의 면제에 관한 사항
4. 제19조제3항에 따른 기록ㆍ보관 및 정보 공개에 관한 사항
5. 제29조제1항제3호에 따른 잔여배아를 이용할 수 있는 연구에 관한 사항
6. 제31조제2항에 따른 연구의 종류ㆍ대상 및 범위에 관한 사항
7. 제35조제1항제3호에 따른 배아줄기세포주를 이용할 수 있는 연구에 관한 사항
8. 제36조제2항에 따른 인체유래물연구의 심의 면제에 관한 사항
9. 제50조제1항에 따른 유전자검사의 제한에 관한 사항
10. 그 밖에 생명윤리 및 안전에 관하여 사회적으로 심각한 영향을 미칠 수 있다고 판단하여 국가위원회의 위원장이 회의에 부치는 사항
② 국가위원회의 위원장은 제1항제1호부터 제9호까지의 규정에 해당하는 사항으로서 재적위원 3분의 1 이상의 위원이 발의한 사항에 관하여는 국가위원회의 회의에 부쳐야 한다.
제8조(국가위원회의 구성) ① 국가위원회는 위원장 1명, 부위원장 1명을 포함한 16명 이상 20명 이하의 위원으로 구성한다. <개정 2013.3.23>
② 위원장은 위원 중에서 대통령이 임명하거나 위촉하고, 부위원장은 위원 중에서 호선(互選)한다.
③ 국가위원회의 위원은 다음 각 호의 사람이 된다. <개정 2013.3.23>
1. 미래창조과학부장관, 교육부장관, 법무부장관, 산업통상자원부장관, 보건복지부장관, 여성가족부장관
2. 생명과학ㆍ의과학(醫科學)ㆍ사회과학 등의 연구 분야에 대한 전문지식과 경험이 풍부한 사람 중에서 대통령이 위촉하는 7명 이내의 사람
3. 종교계ㆍ윤리학계ㆍ법조계ㆍ시민단체(「비영리민간단체 지원법」 제2조에 따른 비영리민간단체를 말한다) 또는 여성계를 대표하는 사람 중에서 대통령이 위촉하는 7명 이내의 사람
④ 제3항제2호 및 제3호에 따른 위원의 임기는 3년으로 하되, 연임할 수 있다. 다만, 위원의 자리가 비게 된 경우에 새로 위촉된 위원의 임기는 전임자 임기의 남은 기간으로 한다.
⑤ 국가위원회에 간사위원 2명을 두되, 간사위원은 미래창조과학부장관과 보건복지부장관으로 하며, 수석 간사위원은 보건복지부장관으로 한다. <개정 2013.3.23>
제9조(국가위원회의 운영) ① 국가위원회의 효율적인 운영을 위하여 국가위원회에 분야별 전문위원회를 둘 수 있다.
② 국가위원회의 사무는 수석 간사위원이 처리한다.
③ 국가위원회의 회의 등 활동은 독립적이어야 하고, 공개를 원칙으로 한다.
④ 국가위원회는 필요한 경우에 관련 당사자의 출석, 의견 진술 및 자료 제출 등을 요구할 수 있다. 이 경우 해당 요구를 받은 자는 타당한 사유가 없으면 요구에 따라야 한다.
⑤ 이 법에서 정한 사항 외에 국가위원회 및 전문위원회의 구성ㆍ운영, 그 밖에 필요한 사항은 대통령령으로 정한다.
제10조(기관생명윤리위원회의 설치 및 기능) ① 생명윤리 및 안전을 확보하기 위하여 다음 각 호의 기관은 기관생명윤리위원회(이하 "기관위원회"라 한다)를 설치하여야 한다.
1. 인간대상연구를 수행하는 자(이하 "인간대상연구자"라 한다)가 소속된 교육ㆍ연구 기관 또는 병원 등
2. 인체유래물연구를 수행하는 자(이하 "인체유래물연구자"라 한다)가 소속된 교육ㆍ연구 기관 또는 병원 등
3. 제22조제1항에 따라 지정된 배아생성의료기관
4. 제29조제2항에 따라 등록한 배아연구기관
5. 제31조제3항에 따라 등록한 체세포복제배아등의 연구기관
6. 제41조제1항에 따라 보건복지부장관의 허가를 받은 인체유래물은행
7. 그 밖에 생명윤리 및 안전에 관하여 사회적으로 심각한 영향을 미칠 수 있는 기관으로서 보건복지부령으로 정하는 기관
② 제1항에도 불구하고 보건복지부령으로 정하는 바에 따라 다른 기관의 기관위원회 또는 제12조제1항에 따른 공용기관생명윤리위원회와 제3항 및 제11조제4항에서 정한 기관위원회 업무의 수행을 위탁하기로 협약을 맺은 기관은 기관위원회를 설치한 것으로 본다.
③ 기관위원회는 다음 각 호의 업무를 수행한다.
1. 다음 각 목에 해당하는 사항의 심의
가. 연구계획서의 윤리적ㆍ과학적 타당성
나. 연구대상자등으로부터 적법한 절차에 따라 동의를 받았는지 여부
다. 연구대상자등의 안전에 관한 사항
라. 연구대상자등의 개인정보 보호 대책
마. 그 밖에 기관에서의 생명윤리 및 안전에 관한 사항
2. 해당 기관에서 수행 중인 연구의 진행과정 및 결과에 대한 조사ㆍ감독
3. 그 밖에 생명윤리 및 안전을 위한 다음 각 목의 활동
가. 해당 기관의 연구자 및 종사자 교육
나. 취약한 연구대상자등의 보호 대책 수립
다. 연구자를 위한 윤리지침 마련
④ 제1항에 따라 기관위원회를 설치한 기관은 보건복지부장관에게 그 기관위원회를 등록하여야 한다.
⑤ 제3항 및 제4항에 따른 기관위원회의 기능 및 등록 등에 필요한 사항은 보건복지부령으로 정한다.
제11조(기관위원회의 구성 및 운영 등) ① 기관위원회는 위원장 1명을 포함하여 5명 이상의 위원으로 구성하되, 하나의 성(性)으로만 구성할 수 없으며, 사회적ㆍ윤리적 타당성을 평가할 수 있는 경험과 지식을 갖춘 사람 1명 이상과 그 기관에 종사하지 아니하는 사람 1명 이상이 포함되어야 한다.
② 기관위원회의 위원은 제10조제1항 각 호의 기관의 장이 위촉하며, 위원장은 위원 중에서 호선한다.
③ 기관위원회의 심의대상인 연구ㆍ개발 또는 이용에 관여하는 위원은 해당 연구ㆍ개발 또는 이용과 관련된 심의에 참여하여서는 아니 된다.
④ 제10조제1항 각 호의 기관의 장은 해당 기관에서 수행하는 연구 등에서 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있는 경우에는 지체 없이 기관위원회를 소집하여 이를 심의하도록 하고, 그 결과를 보건복지부장관에게 보고하여야 한다.
⑤ 제10조제1항 각 호의 기관의 장은 기관위원회가 독립성을 유지할 수 있도록 하여야 하며, 행정적ㆍ재정적 지원을 하여야 한다.
⑥ 제10조제1항에 따라 둘 이상의 기관위원회를 설치한 기관은 보건복지부령으로 정하는 바에 따라 해당 기관위원회를 통합하여 운영할 수 있다.
⑦ 제1항부터 제6항까지에서 규정한 사항 외에 기관위원회의 구성 및 운영에 필요한 사항은 보건복지부령으로 정한다.
제12조(공용기관생명윤리위원회의 지정 및 기관위원회의 공동 운영) ① 보건복지부장관은 다음 각 호의 업무를 하게 하기 위하여 제10조제1항에 따라 설치된 기관위원회 중에서 기관 또는 연구자가 공동으로 이용할 수 있는 공용기관생명윤리위원회(이하 "공용위원회"라 한다)를 지정할 수 있다.
1. 제10조제2항에 따라 공용위원회와 협약을 맺은 기관이 위탁한 업무
2. 교육ㆍ연구 기관 또는 병원 등에 소속되지 아니한 인간대상연구자 또는 인체유래물연구자가 신청한 업무
3. 그 밖에 국가위원회의 심의를 거쳐 보건복지부령으로 정하는 업무
② 둘 이상의 기관이 공동으로 수행하는 연구로서 각각의 기관위원회에서 해당 연구를 심의하는 것이 적절하지 아니하는 경우에 수행 기관은 각각의 소관 기관위원회 중 하나의 기관위원회를 선정하여 해당 연구를 심의하게 할 수 있다.
③ 제1항 및 제2항에 따른 공용위원회의 지정, 기능, 운영 및 기관위원회의 공동 운영 등에 필요한 사항은 보건복지부령으로 정한다.
제13조(기관위원회의 지원 등) ① 보건복지부장관은 기관위원회의 운영을 적절하게 감독ㆍ지원하기 위하여 다음 각 호의 업무를 수행한다.
1. 기관위원회의 조사
2. 기관위원회 위원의 교육
3. 그 밖에 기관위원회의 감독 및 지원에 필요한 업무로서 보건복지부령으로 정하는 업무
② 기관위원회의 조사 및 교육 지원 등에 필요한 사항은 보건복지부령으로 정한다.
제14조(기관위원회의 평가 및 인증) ① 보건복지부장관은 기관위원회의 구성 및 운영실적 등을 정기적으로 평가하여 인증할 수 있다.
② 보건복지부장관은 제1항에 따라 인증을 받은 기관위원회의 인증 결과를 인터넷 홈페이지 등에 공표할 수 있다.
③ 중앙행정기관의 장은 제1항에 따른 인증 결과에 따라 그 기관에 예산 지원 및 국가 연구비 지원 제한 등의 조치를 할 수 있다.
④ 보건복지부장관은 제1항에 따라 인증을 받은 기관위원회가 다음 각 호의 어느 하나에 해당하면 그 인증을 취소할 수 있다. 다만, 제1호에 해당하는 경우에는 그 인증을 취소하여야 한다.
1. 거짓이나 부정한 방법으로 인증을 받은 경우
2. 기관위원회의 구성 및 운영에 중요한 변동사항이 발생하여 제5항에 따른 인증기준에 맞지 아니하는 경우
⑤ 제1항에 따른 인증의 기준 및 유효기간 등에 관하여 필요한 사항은 대통령령으로 정한다.
제15조(인간대상연구의 심의) ① 인간대상연구를 하려는 자는 인간대상연구를 하기 전에 연구계획서를 작성하여 기관위원회의 심의를 받아야 한다.
② 제1항에도 불구하고 연구대상자 및 공공에 미치는 위험이 미미한 경우로서 국가위원회의 심의를 거쳐 보건복지부령으로 정한 기준에 맞는 연구는 기관위원회의 심의를 면제할 수 있다.
제16조(인간대상연구의 동의) ① 인간대상연구자는 인간대상연구를 하기 전에 연구대상자로부터 다음 각 호의 사항이 포함된 서면동의(전자문서를 포함한다. 이하 같다)를 받아야 한다.
1. 인간대상연구의 목적
2. 연구대상자의 참여 기간, 절차 및 방법
3. 연구대상자에게 예상되는 위험 및 이득
4. 개인정보 보호에 관한 사항
5. 연구 참여에 따른 손실에 대한 보상
6. 개인정보 제공에 관한 사항
7. 동의의 철회에 관한 사항
8. 그 밖에 기관위원회가 필요하다고 인정하는 사항
② 제1항에도 불구하고 동의 능력이 없거나 불완전한 사람으로서 보건복지부령으로 정하는 연구대상자가 참여하는 연구의 경우에는 다음 각 호에서 정한 대리인의 서면동의를 받아야 한다. 이 경우 대리인의 동의는 연구대상자의 의사에 어긋나서는 아니 된다.
1. 법정대리인
2. 법정대리인이 없는 경우 배우자, 직계존속, 직계비속의 순으로 하되, 직계존속 또는 직계비속이 여러 사람일 경우 협의하여 정하고, 협의가 되지 아니하면 연장자가 대리인이 된다.
③ 제1항에도 불구하고 다음 각 호의 요건을 모두 갖춘 경우에는 기관위원회의 승인을 받아 연구대상자의 서면동의를 면제할 수 있다. 이 경우 제2항에 따른 대리인의 서면동의는 면제하지 아니한다.
1. 연구대상자의 동의를 받는 것이 연구 진행과정에서 현실적으로 불가능하거나 연구의 타당성에 심각한 영향을 미친다고 판단되는 경우
2. 연구대상자의 동의 거부를 추정할 만한 사유가 없고, 동의를 면제하여도 연구대상자에게 미치는 위험이 극히 낮은 경우
④ 인간대상연구자는 제1항 및 제2항에 따른 서면동의를 받기 전에 동의권자에게 제1항 각 호의 사항에 대하여 충분히 설명하여야 한다.
제17조(연구대상자에 대한 안전대책) ① 인간대상연구자는 사전에 연구 및 연구환경이 연구대상자에게 미칠 신체적ㆍ정신적 영향을 평가하고 안전대책을 마련하여야 하며, 수행 중인 연구가 개인 및 사회에 중대한 해악(害惡)을 초래할 가능성이 있을 때에는 이를 즉시 소속 기관의 장에게 보고하고 적절한 조치를 하여야 한다.
② 인간대상연구자는 질병의 진단이나 치료, 예방과 관련된 연구에서 연구대상자에게 의학적으로 필요한 치료를 지연하거나 진단 및 예방의 기회를 박탈하여서는 아니 된다.
제18조(개인정보의 제공) ① 인간대상연구자는 제16조제1항에 따라 연구대상자로부터 개인정보를 제공하는 것에 대하여 서면동의를 받은 경우에는 기관위원회의 심의를 거쳐 개인정보를 제3자에게 제공할 수 있다.
② 인간대상연구자가 제1항에 따라 개인정보를 제3자에게 제공하는 경우에는 익명화하여야 한다. 다만, 연구대상자가 개인식별정보를 포함하는 것에 동의한 경우에는 그러하지 아니하다.
제19조(기록의 유지와 정보의 공개) ① 인간대상연구자는 인간대상연구와 관련한 사항을 기록ㆍ보관하여야 한다.
② 연구대상자는 자신에 관한 정보의 공개를 청구할 수 있으며, 그 청구를 받은 인간대상연구자는 특별한 사유가 없으면 정보를 공개하여야 한다.
③ 제1항 및 제2항에 따른 기록ㆍ보관 및 정보 공개에 관한 구체적인 사항은 국가위원회의 심의를 거쳐 보건복지부령으로 정한다.
제20조(인간복제의 금지) ① 누구든지 체세포복제배아 및 단성생식배아(이하 "체세포복제배아등"이라 한다)를 인간 또는 동물의 자궁에 착상시켜서는 아니 되며, 착상된 상태를 유지하거나 출산하여서는 아니 된다.
② 누구든지 제1항에 따른 행위를 유인하거나 알선하여서는 아니 된다.
제21조(이종 간의 착상 등의 금지) ① 누구든지 인간의 배아를 동물의 자궁에 착상시키거나 동물의 배아를 인간의 자궁에 착상시키는 행위를 하여서는 아니 된다.
② 누구든지 다음 각 호의 행위를 하여서는 아니 된다.
1. 인간의 난자를 동물의 정자로 수정시키거나 동물의 난자를 인간의 정자로 수정시키는 행위. 다만, 의학적으로 인간의 정자의 활동성을 시험하기 위한 경우는 제외한다.
2. 핵이 제거된 인간의 난자에 동물의 체세포 핵을 이식하거나 핵이 제거된 동물의 난자에 인간의 체세포 핵을 이식하는 행위
3. 인간의 배아와 동물의 배아를 융합하는 행위
4. 다른 유전정보를 가진 인간의 배아를 융합하는 행위
③ 누구든지 제2항 각 호의 어느 하나에 해당하는 행위로부터 생성된 것을 인간 또는 동물의 자궁에 착상시키는 행위를 하여서는 아니 된다.
제22조(배아생성의료기관의 지정 등) ① 체외수정을 위하여 난자 또는 정자를 채취ㆍ보존하거나 이를 수정시켜 배아를 생성하려는 의료기관은 보건복지부장관으로부터 배아생성의료기관으로 지정받아야 한다.
② 배아생성의료기관으로 지정받으려는 의료기관은 보건복지부령으로 정하는 시설 및 인력 등을 갖추어야 한다.
③ 배아생성의료기관의 지정 기준 및 절차 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
④ 제1항에 따라 지정을 받은 배아생성의료기관(이하 "배아생성의료기관"이라 한다)이 보건복지부령으로 정하는 중요한 사항을 변경할 경우에는 보건복지부장관에게 그 변경사항을 신고하여야 한다.
⑤ 배아생성의료기관의 장은 휴업하거나 폐업하는 경우에는 보건복지부령으로 정하는 바에 따라 보건복지부장관에게 신고하여야 한다.
⑥ 배아생성의료기관의 장은 휴업하거나 폐업할 때에 보건복지부령으로 정하는 바에 따라 보관 중인 배아, 생식세포 및 관련 서류를 질병관리본부 또는 다른 배아생성의료기관으로 이관하여야 한다.
제23조(배아의 생성에 관한 준수사항) ① 누구든지 임신 외의 목적으로 배아를 생성하여서는 아니 된다.
② 누구든지 배아를 생성할 때 다음 각 호의 어느 하나에 해당하는 행위를 하여서는 아니 된다.
1. 특정의 성을 선택할 목적으로 난자와 정자를 선별하여 수정시키는 행위
2. 사망한 사람의 난자 또는 정자로 수정하는 행위
3. 미성년자의 난자 또는 정자로 수정하는 행위. 다만, 혼인한 미성년자가 그 자녀를 얻기 위하여 수정하는 경우는 제외한다.
③ 누구든지 금전, 재산상의 이익 또는 그 밖의 반대급부(反對給付)를 조건으로 배아나 난자 또는 정자를 제공 또는 이용하거나 이를 유인하거나 알선하여서는 아니 된다.
제24조(배아의 생성 등에 관한 동의) ① 배아생성의료기관은 배아를 생성하기 위하여 난자 또는 정자를 채취할 때에는 다음 각 호의 사항에 대하여 난자 기증자, 정자 기증자, 체외수정 시술대상자 및 해당 기증자ㆍ시술대상자의 배우자가 있는 경우 그 배우자(이하 "동의권자"라 한다)의 서면동의를 받아야 한다. 다만, 장애인의 경우는 그 특성에 맞게 동의를 구하여야 한다.
1. 배아생성의 목적에 관한 사항
2. 배아ㆍ난자ㆍ정자의 보존기간 및 그 밖에 보존에 관한 사항
3. 배아ㆍ난자ㆍ정자의 폐기에 관한 사항
4. 잔여배아 및 잔여난자를 연구 목적으로 이용하는 것에 관한 사항
5. 동의의 변경 및 철회에 관한 사항
6. 동의권자의 권리 및 정보 보호, 그 밖에 보건복지부령으로 정하는 사항
② 배아생성의료기관은 제1항에 따른 서면동의를 받기 전에 동의권자에게 제1항 각 호의 사항에 대하여 충분히 설명하여야 한다.
③ 제1항에 따른 서면동의를 위한 동의서의 서식 및 보관 등에 필요한 사항은 보건복지부령으로 정한다.
제25조(배아의 보존 및 폐기) ① 배아의 보존기간은 5년으로 한다. 다만, 동의권자가 보존기간을 5년 미만으로 정한 경우에는 이를 보존기간으로 한다.
② 제1항에도 불구하고 항암치료 등 보건복지부령으로 정하는 경우에는 동의권자가 보존기간을 5년 이상으로 정할 수 있다.
③ 배아생성의료기관은 제1항 또는 제2항에 따른 보존기간이 끝난 배아 중 제29조에 따른 연구의 목적으로 이용하지 아니할 배아는 폐기하여야 한다.
④ 배아생성의료기관은 배아의 폐기에 관한 사항을 기록ㆍ보관하여야 한다.
⑤ 제3항 및 제4항에 따른 배아의 폐기 절차 및 방법, 배아의 폐기에 관한 사항의 기록ㆍ보관에 필요한 사항은 보건복지부령으로 정한다.
제26조(잔여배아 및 잔여난자의 제공) ① 배아생성의료기관은 연구에 필요한 잔여배아를 제30조제1항에 따라 배아연구계획서의 승인을 받은 배아연구기관에 제공하거나 잔여난자를 제31조제4항에 따라 체세포복제배아등 연구계획서의 승인을 받은 체세포복제배아등의 연구기관에 제공하는 경우에는 무상으로 하여야 한다. 다만, 배아생성의료기관은 잔여배아 및 잔여난자의 보존 및 제공에 든 경비의 경우에는 보건복지부령으로 정하는 바에 따라 제공받는 연구기관에 대하여 경비지급을 요구할 수 있다.
② 제1항에 따른 잔여배아 및 잔여난자의 제공 절차, 경비의 산출, 그 밖에 필요한 사항은 보건복지부령으로 정한다.
③ 배아생성의료기관은 잔여배아 및 잔여난자의 보존 및 제공 등에 관한 사항을 보건복지부령으로 정하는 바에 따라 보건복지부장관에게 보고하여야 한다.
제27조(난자 기증자의 보호 등) ① 배아생성의료기관은 보건복지부령으로 정하는 바에 따라 난자를 채취하기 전에 난자 기증자에 대하여 건강검진을 하여야 한다.
② 배아생성의료기관은 보건복지부령으로 정하는 건강 기준에 미치지 못하는 사람으로부터 난자를 채취하여서는 아니 된다.
③ 배아생성의료기관은 동일한 난자 기증자로부터 대통령령으로 정하는 빈도 이상으로 난자를 채취하여서는 아니 된다.
④ 배아생성의료기관은 난자 기증에 필요한 시술 및 회복에 걸리는 시간에 따른 보상금 및 교통비 등 보건복지부령으로 정하는 항목에 관하여 보건복지부령으로 정하는 금액을 난자 기증자에게 지급할 수 있다.
제28조(배아생성의료기관의 준수사항) 배아생성의료기관은 다음 각 호의 사항을 준수하여야 한다.
1. 제24조에 따른 동의서에 적힌 내용대로 배아ㆍ난자 및 정자를 취급할 것
2. 보건복지부령으로 정하는 바에 따라 잔여배아 및 잔여난자의 보존ㆍ취급 및 폐기 등의 관리를 철저히 할 것
3. 그 밖에 생명윤리 및 안전의 확보를 위하여 필요하다고 인정하여 보건복지부령으로 정하는 사항
제29조(잔여배아 연구) ① 제25조에 따른 배아의 보존기간이 지난 잔여배아는 발생학적으로 원시선(原始線)이 나타나기 전까지만 체외에서 다음 각 호의 연구 목적으로 이용할 수 있다.
1. 난임치료법 및 피임기술의 개발을 위한 연구
2. 근이영양증(筋異營養症), 그 밖에 대통령령으로 정하는 희귀ㆍ난치병의 치료를 위한 연구
3. 그 밖에 국가위원회의 심의를 거쳐 대통령령으로 정하는 연구
② 제1항에 따라 잔여배아를 연구하려는 자는 보건복지부령으로 정하는 시설ㆍ인력 등을 갖추고 보건복지부장관에게 배아연구기관으로 등록하여야 한다.
③ 제2항에 따라 등록한 배아연구기관(이하 "배아연구기관"이라 한다)이 보건복지부령으로 정하는 중요한 사항을 변경하거나 폐업할 경우에는 보건복지부장관에게 신고하여야 한다.
제30조(배아연구계획서의 승인) ① 배아연구기관은 잔여배아의 연구를 하려면 미리 보건복지부장관에게 배아연구계획서를 제출하여 승인을 받아야 한다. 배아연구계획서의 내용 중 대통령령으로 정하는 중요한 사항을 변경하는 경우에도 또한 같다.
② 제1항에 따른 배아연구계획서에는 기관위원회의 심의 결과에 관한 서류가 첨부되어야 한다.
③ 보건복지부장관은 다른 중앙행정기관의 장이 연구비를 지원하는 배아연구기관으로부터 배아연구계획서를 제출받았을 때에는 승인 여부를 결정하기 전에 그 중앙행정기관의 장과 협의하여야 한다.
④ 배아연구계획서의 승인 기준 및 절차, 제출서류, 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제31조(체세포복제배아등의 연구) ① 누구든지 제29조제1항제2호에 따른 희귀ㆍ난치병의 치료를 위한 연구 목적 외에는 체세포핵이식행위 또는 단성생식행위를 하여서는 아니 된다.
② 제1항에 따른 연구의 종류ㆍ대상 및 범위는 국가위원회의 심의를 거쳐 대통령령으로 정한다.
③ 체세포복제배아등을 생성하거나 연구하려는 자는 보건복지부령으로 정하는 시설 및 인력 등을 갖추고 보건복지부장관에게 등록하여야 한다.
④ 제3항에 따라 등록한 기관(이하 "체세포복제배아등의 연구기관"이라 한다)은 체세포복제배아등을 생성하거나 연구하려면 보건복지부령으로 정하는 바에 따라 미리 보건복지부장관에게 연구계획서(이하 "체세포복제배아등 연구계획서"라 한다)를 제출하여 승인을 받아야 한다.
⑤ 체세포복제배아등 연구계획서의 승인에 관하여는 제30조를 준용한다. 이 경우 "잔여배아"는 "체세포복제배아등"으로, "배아연구계획서"는 "체세포복제배아등 연구계획서"로 각각 본다.
제32조(배아연구기관 등의 준수사항) ① 배아연구기관 및 체세포복제배아등의 연구기관은 해당 기관에서 수행하는 연구로 인하여 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있는 경우에는 연구 중단 등 적절한 조치를 하여야 한다.
② 배아연구기관 및 체세포복제배아등의 연구기관이 잔여배아 및 잔여난자를 제공받은 후 이를 연구의 목적으로 이용하지 아니하려는 경우에는 제25조제3항부터 제5항까지의 규정을 준용한다. 이 경우 "배아"는 "잔여배아 및 잔여난자"로 본다.
③ 배아연구기관이 잔여배아를 관리하는 경우 및 체세포복제배아등의 연구기관이 잔여난자, 체세포복제배아등을 관리하는 경우에는 제28조를 준용한다.
제33조(배아줄기세포주의 등록) ① 배아줄기세포주를 수립하거나 수입한 자는 그 배아줄기세포주를 제34조에 따라 제공하거나 제35조에 따라 이용하기 전에 보건복지부령으로 정하는 바에 따라 그 배아줄기세포주를 보건복지부장관에게 등록하여야 한다.
② 보건복지부장관은 배아줄기세포주의 등록을 신청한 자가 다른 중앙행정기관의 장으로부터 과학적 검증을 받은 경우에는 제1항에 따른 등록을 하는 데에 그 검증자료를 활용하여야 한다.
③ 보건복지부장관은 제1항에 따라 배아줄기세포주를 등록한 자에게 배아줄기세포주의 검증 등에 든 비용의 전부 또는 일부를 지원할 수 있다.
제34조(배아줄기세포주의 제공) ① 배아줄기세포주를 수립한 자가 그 배아줄기세포주를 타인에게 제공하려면 보건복지부령으로 정하는 바에 따라 기관위원회의 심의를 거쳐야 한다.
② 제1항에 따라 배아줄기세포주를 제공한 자는 보건복지부령으로 정하는 바에 따라 보건복지부장관에게 배아줄기세포주의 제공현황을 보고하여야 한다.
③ 제1항에 따라 배아줄기세포주를 제공하는 경우에는 무상으로 하여야 한다. 다만, 배아줄기세포주를 제공하는 자는 배아줄기세포주의 보존 및 제공에 든 경비의 경우에는 보건복지부령으로 정하는 바에 따라 이를 제공받는 자에 대하여 경비지급을 요구할 수 있다.
④ 제1항부터 제3항까지의 규정에 따른 배아줄기세포주의 제공 및 보고, 경비의 산출 방법 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제35조(배아줄기세포주의 이용) ① 제33조제1항에 따라 등록된 배아줄기세포주는 체외에서 다음 각 호의 연구 목적으로만 이용할 수 있다.
1. 질병의 진단ㆍ예방 또는 치료를 위한 연구
2. 줄기세포의 특성 및 분화에 관한 기초연구
3. 그 밖에 국가위원회의 심의를 거쳐 대통령령으로 정하는 연구
② 제1항에 따라 배아줄기세포주를 이용하려는 자는 해당 연구계획서에 대하여 보건복지부령으로 정하는 바에 따라 기관위원회의 심의를 거쳐 해당 기관의 장의 승인을 받아야 한다. 승인을 받은 연구계획서의 내용 중 대통령령으로 정하는 중요한 사항을 변경하는 경우에도 또한 같다.
③ 제2항에 따라 승인 또는 변경승인을 받은 자는 보건복지부령으로 정하는 바에 따라 그 사실을 보건복지부장관에게 보고하여야 한다.
④ 제2항에 따라 승인을 받은 자는 배아줄기세포주를 제공한 자에게 제공받은 배아줄기세포주의 이용계획서를 작성하여 제출하여야 한다.
⑤ 제2항에 따라 연구를 승인한 기관의 장은 연구를 하는 자가 연구계획에 적합하게 연구를 하도록 감독하여야 한다.
제36조(인체유래물연구의 심의) ① 인체유래물연구를 하려는 자는 인체유래물연구를 하기 전에 연구계획서에 대하여 기관위원회의 심의를 받아야 한다.
② 제1항에도 불구하고 인체유래물 기증자 및 공공에 미치는 위험이 미미한 경우로서 국가위원회의 심의를 거쳐 보건복지부령으로 정한 기준에 맞는 연구는 기관위원회의 심의를 면제할 수 있다.
제37조(인체유래물연구의 동의) ① 인체유래물연구자는 인체유래물연구를 하기 전에 인체유래물 기증자로부터 다음 각 호의 사항이 포함된 서면동의를 받아야 한다.
1. 인체유래물연구의 목적
2. 개인정보의 보호 및 처리에 관한 사항
3. 인체유래물의 보존 및 폐기 등에 관한 사항
4. 인체유래물과 그로부터 얻은 유전정보(이하 "인체유래물등"이라 한다)의 제공에 관한 사항
5. 동의의 철회, 동의 철회 시 인체유래물등의 처리, 인체유래물 기증자의 권리, 연구 목적의 변경, 그 밖에 보건복지부령으로 정하는 사항
② 제1항에도 불구하고 인체유래물연구자가 아닌 인체유래물 채취자로부터 인체유래물을 제공받아 연구를 하는 인체유래물연구자의 경우에 그 인체유래물 채취자가 인체유래물 기증자로부터 제1항 각 호의 사항이 포함된 서면동의를 받았을 때에는 제1항에 따른 서면동의를 받은 것으로 본다.
③ 인체유래물연구의 서면동의 면제에 관하여는 제16조제3항을 준용한다. 이 경우 "연구대상자"는 "인체유래물 기증자"로 본다.
④ 인체유래물연구자는 제1항에 따른 서면동의를 받기 전에 인체유래물 기증자에게 제1항 각 호의 사항에 대하여 충분히 설명하여야 한다.
⑤ 제1항에 따른 서면동의를 위한 동의서의 서식 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제38조(인체유래물등의 제공) ① 인체유래물연구자는 제37조제1항에 따라 인체유래물 기증자로부터 인체유래물등을 제공하는 것에 대하여 서면동의를 받은 경우에는 기관위원회의 심의를 거쳐 인체유래물등을 인체유래물은행이나 다른 연구자에게 제공할 수 있다.
② 인체유래물연구자가 제1항에 따라 인체유래물등을 다른 연구자에게 제공하는 경우에는 익명화하여야 한다. 다만, 인체유래물 기증자가 개인식별정보를 포함하는 것에 동의한 경우에는 그러하지 아니하다.
③ 제1항에 따라 인체유래물등을 제공할 경우 무상으로 하여야 한다. 다만, 인체유래물연구자가 소속된 기관은 인체유래물등의 보존 및 제공에 든 경비의 경우에는 보건복지부령으로 정하는 바에 따라 인체유래물등을 제공받아 연구하는 자에게 경비지급을 요구할 수 있다.
④ 인체유래물연구자는 제1항에 따라 인체유래물등을 제공하거나 제공받았을 때에는 보건복지부령으로 정하는 바에 따라 인체유래물등의 제공에 관한 기록을 작성ㆍ보관하여야 한다.
⑤ 인체유래물등의 제공 방법 및 절차, 경비의 산출, 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제39조(인체유래물등의 보존 및 폐기) ① 인체유래물연구자는 동의서에 정한 기간이 지난 인체유래물등을 폐기하여야 한다. 다만, 인체유래물등을 보존하는 중에 인체유래물 기증자가 보존기간의 변경이나 폐기를 요청하는 경우에는 요청에 따라야 한다.
② 인체유래물연구자는 제1항에 따른 인체유래물등의 폐기에 관한 사항을 보건복지부령으로 정하는 바에 따라 기록ㆍ보관하여야 한다.
③ 인체유래물연구자가 부득이한 사정으로 인하여 인체유래물등을 보존할 수 없는 경우에는 기관위원회의 심의를 거쳐 인체유래물등을 처리하거나 이관하여야 한다.
④ 인체유래물등의 보존, 폐기, 처리 또는 이관 등에 필요한 사항은 보건복지부령으로 정한다.
제40조(인체유래물연구자의 준수사항) 인체유래물연구자의 인체유래물 기증자에 대한 안전대책 및 기록의 유지와 정보 공개에 관하여는 제17조 및 제19조를 각각 준용한다. 이 경우 "인간대상연구"는 "인체유래물연구"로, "연구대상자"는 "인체유래물 기증자"로 각각 본다.
제41조(인체유래물은행의 허가 및 신고) ① 인체유래물은행을 개설하려는 자는 대통령령으로 정하는 바에 따라 보건복지부장관의 허가를 받아야 한다. 다만, 국가기관이 직접 인체유래물은행을 개설하고자 하는 경우는 제외한다.
② 제1항에도 불구하고 다른 법령에 따라 중앙행정기관의 장으로부터 연구비 지원의 승인을 받아 인체유래물은행을 개설하려는 경우에는 그 중앙행정기관의 장으로부터 연구비 지원의 승인을 받은 후 보건복지부장관에게 신고하면 제1항에 따른 허가를 받은 것으로 본다. 이 경우 그 중앙행정기관의 장은 미리 보건복지부장관과 협의하여야 한다.
③ 제1항 및 제2항에 따라 개설된 인체유래물은행이 대통령령으로 정하는 중요한 사항을 변경하거나 휴업 또는 폐업하려는 경우에는 보건복지부장관에게 신고하여야 한다.
④ 인체유래물은행의 시설ㆍ장비 기준 및 허가ㆍ신고 절차, 그 밖에 필요한 사항은 대통령령으로 정한다.
제42조(인체유래물 채취 시의 동의) ① 인체유래물은행은 인체유래물연구에 쓰일 인체유래물을 직접 채취하거나 채취를 의뢰할 때에는 인체유래물을 채취하기 전에 인체유래물 기증자로부터 다음 각 호의 사항이 포함된 서면동의를 받아야 한다.
1. 인체유래물연구의 목적(인체유래물은행이 인체유래물연구를 직접 수행하는 경우만 해당한다)
2. 개인정보의 보호 및 처리에 관한 사항
3. 인체유래물등이 제공되는 연구자 및 기관의 범위에 관한 사항
4. 인체유래물등의 보존, 관리 및 폐기에 관한 사항
5. 동의의 철회, 동의의 철회 시 인체유래물등의 처리, 인체유래물 기증자의 권리나 그 밖에 보건복지부령으로 정하는 사항
② 인체유래물은행은 제1항에 따른 서면동의를 받기 전에 인체유래물 기증자에게 제1항 각 호의 사항에 대하여 충분히 설명하여야 한다.
③ 제1항에 따른 서면동의를 위한 동의서의 서식 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제43조(인체유래물등의 제공) ① 인체유래물은행의 장은 인체유래물등을 제공받으려는 자로부터 이용계획서를 제출받아 그 내용을 검토하여 제공 여부를 결정하여야 한다.
② 인체유래물은행의 장은 인체유래물등을 타인에게 제공하는 경우에는 익명화하여야 한다. 다만, 인체유래물 기증자가 개인식별정보를 포함하는 것에 동의한 경우에는 그러하지 아니하다.
③ 인체유래물은행의 장은 인체유래물등을 타인에게 제공하는 경우에는 무상으로 하여야 한다. 다만, 인체유래물등의 보존 및 제공에 든 경비를 보건복지부령으로 정하는 바에 따라 인체유래물등을 제공받는 자에게 요구할 수 있다.
④ 기관위원회는 인체유래물등의 제공에 필요한 지침을 마련하고, 지침에 따라 적정하게 제공되고 있는지 정기적으로 심의하여야 한다.
⑤ 인체유래물등 이용계획서의 기재내용ㆍ제출절차, 제공에 필요한 지침, 기관위원회의 심의, 그 밖에 인체유래물등의 제공 및 관리에 필요한 사항은 보건복지부령으로 정한다.
제44조(인체유래물은행의 준수사항) ① 인체유래물은행의 장 또는 그 종사자는 보존 중인 인체유래물등을 타당한 사유 없이 사용, 폐기, 손상하여서는 아니 된다.
② 인체유래물은행이 제38조제1항 및 제53조제1항에 따라 인체유래물등을 제공받은 경우에는 익명화하여야 한다.
③ 인체유래물은행의 인체유래물등의 보존 및 폐기에 관하여는 제39조를 준용한다.
④ 인체유래물은행의 장은 보건복지부령으로 정하는 바에 따라 인체유래물등의 익명화 방안이 포함된 개인정보 보호 지침을 마련하고, 개인정보 관리 및 보안을 담당하는 책임자를 지정하여야 한다.
제45조(인체유래물은행에 대한 지원) 국가나 지방자치단체는 예산의 범위에서 인체유래물은행의 운영에 필요한 비용을 지원할 수 있다.
제46조(유전정보에 의한 차별 금지 등) ① 누구든지 유전정보를 이유로 교육ㆍ고용ㆍ승진ㆍ보험 등 사회활동에서 다른 사람을 차별하여서는 아니 된다.
② 다른 법률에 특별한 규정이 있는 경우를 제외하고는 누구든지 타인에게 유전자검사를 받도록 강요하거나 유전자검사의 결과를 제출하도록 강요하여서는 아니 된다.
③ 의료기관은 「의료법」 제21조제2항에 따라 환자 외의 자에게 제공하는 의무기록 및 진료기록 등에 유전정보를 포함시켜서는 아니 된다. 다만, 해당 환자와 동일한 질병의 진단 및 치료를 목적으로 다른 의료기관의 요청이 있고 개인정보 보호에 관한 조치를 한 경우에는 그러하지 아니하다.
제47조(유전자치료) ① 유전자치료에 관한 연구는 다음 각 호의 모두에 해당하는 경우에만 할 수 있다. 다만, 보건복지부장관이 정하는 질병의 예방이나 치료를 위하여 필요하다고 인정하는 경우에는 그러하지 아니하다.
1. 유전질환, 암, 후천성면역결핍증, 그 밖에 생명을 위협하거나 심각한 장애를 불러일으키는 질병의 치료를 위한 연구
2. 현재 이용 가능한 치료법이 없거나 유전자치료의 효과가 다른 치료법과 비교하여 현저히 우수할 것으로 예측되는 치료를 위한 연구
② 유전자치료는 배아, 난자, 정자 및 태아에 대하여 시행하여서는 아니 된다.
제48조(유전자치료기관) ① 유전자치료를 하고자 하는 의료기관은 보건복지부장관에게 신고하여야 한다. 대통령령으로 정하는 중요한 사항을 변경하는 경우에도 또한 같다.
② 제1항에 따라 보건복지부장관에게 신고한 의료기관(이하 "유전자치료기관"이라 한다)은 유전자치료를 하고자 하는 환자에 대하여 다음 각 호의 사항에 관하여 미리 설명한 후 서면동의를 받아야 한다.
1. 치료의 목적
2. 예측되는 치료 결과 및 그 부작용
3. 그 밖에 보건복지부령으로 정하는 사항
③ 유전자치료기관의 신고 요건 및 절차, 동의서의 서식, 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제49조(유전자검사기관) ① 유전자검사를 하려는 자는 유전자검사항목에 따라 보건복지부령으로 정하는 시설 및 인력 등을 갖추고 보건복지부장관에게 신고하여야 한다. 다만, 국가기관이 유전자검사를 하는 경우에는 그러하지 아니하다.
② 제1항에 따라 신고한 사항 중 대통령령으로 정하는 중요한 사항을 변경하는 경우에도 신고하여야 한다.
③ 보건복지부장관은 제1항에 따라 신고한 유전자검사기관(이하 "유전자검사기관"이라 한다)으로 하여금 보건복지부령으로 정하는 바에 따라 유전자검사의 정확도 평가를 받게 할 수 있고, 그 결과를 공개할 수 있다.
④ 유전자검사기관은 유전자검사의 업무를 휴업하거나 폐업하려는 경우에는 보건복지부령으로 정하는 바에 따라 보건복지부장관에게 신고하여야 한다.
⑤ 보건복지부장관은 유전자검사기관이 「부가가치세법」 제5조에 따라 관할 세무서장에게 폐업신고를 하거나 관할 세무서장이 사업자등록을 말소한 경우에는 신고 사항을 직권으로 말소할 수 있다.
제50조(유전자검사의 제한 등) ① 유전자검사기관은 과학적 증명이 불확실하여 검사대상자를 오도(誤導)할 우려가 있는 신체 외관이나 성격에 관한 유전자검사 또는 그 밖에 국가위원회의 심의를 거쳐 대통령령으로 정하는 유전자검사를 하여서는 아니 된다.
② 유전자검사기관은 근이영양증이나 그 밖에 대통령령으로 정하는 유전질환을 진단하기 위한 목적으로만 배아 또는 태아를 대상으로 유전자검사를 할 수 있다.
③ 의료기관이 아닌 유전자검사기관에서는 질병의 예방, 진단 및 치료와 관련한 유전자검사를 할 수 없다. 다만, 의료기관의 의뢰를 받아 유전자검사를 하는 경우에는 그러하지 아니하다.
④ 유전자검사기관은 유전자검사에 관하여 거짓표시 또는 과대광고를 하여서는 아니 된다. 이 경우 거짓표시 또는 과대광고의 판정 기준 및 절차, 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제51조(유전자검사의 동의) ① 유전자검사기관이 유전자검사에 쓰일 검사대상물을 직접 채취하거나 채취를 의뢰할 때에는 검사대상물을 채취하기 전에 검사대상자로부터 다음 각 호의 사항에 대하여 서면동의를 받아야 한다. 다만, 장애인의 경우는 그 특성에 맞게 동의를 구하여야 한다.
1. 유전자검사의 목적
2. 검사대상물의 관리에 관한 사항
3. 동의의 철회, 검사대상자의 권리 및 정보보호, 그 밖에 보건복지부령으로 정하는 사항
② 유전자검사기관이 검사대상물을 인체유래물연구자나 인체유래물은행에 제공하기 위하여는 검사대상자로부터 다음 각 호의 사항이 포함된 서면동의를 제1항에 따른 동의와 별도로 받아야 한다.
1. 개인정보의 보호 및 처리에 대한 사항
2. 검사대상물의 보존, 관리 및 폐기에 관한 사항
3. 검사대상물의 제공에 관한 사항
4. 동의의 철회, 동의 철회 시 검사대상물의 처리, 검사대상자의 권리, 그 밖에 보건복지부령으로 정하는 사항
③ 유전자검사기관 외의 자가 검사대상물을 채취하여 유전자검사기관에 유전자검사를 의뢰하는 경우에는 제1항에 따라 검사대상자로부터 서면동의를 받아 첨부하여야 하며, 보건복지부령으로 정하는 바에 따라 개인정보를 보호하기 위한 조치를 하여야 한다.
④ 검사대상자가 동의 능력이 없거나 불완전한 경우의 대리인 동의에 관하여는 제16조제2항을 준용한다. 이 경우 "연구대상자"는 "검사대상자"로, "연구"는 "검사"로 각각 본다.
⑤ 다음 각 호의 어느 하나에 해당하는 경우에는 동의 없이 유전자검사를 할 수 있다.
1. 시체 또는 의식불명인 사람이 누구인지 식별하여야 할 긴급한 필요가 있거나 특별한 사유가 있는 경우
2. 다른 법률에 규정이 있는 경우
⑥ 제1항부터 제4항까지의 규정에 따라 서면동의를 받고자 하는 자는 미리 검사대상자 또는 법정대리인에게 유전자검사의 목적과 방법, 예측되는 유전자검사의 결과와 의미 등에 대하여 충분히 설명하여야 한다.
⑦ 유전자검사의 동의 방식, 동의 면제 사항, 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제52조(기록 보관 및 정보의 공개) ① 유전자검사기관은 다음 각 호의 서류를 보건복지부령으로 정하는 바에 따라 기록ㆍ보관하여야 한다.
1. 제51조에 따른 동의서
2. 유전자검사 결과
3. 제53조제2항에 따른 검사대상물의 제공에 관한 기록
② 유전자검사기관은 검사대상자나 그의 법정대리인이 제1항에 따른 기록의 열람 또는 사본의 발급을 요청하는 경우에는 그 요청에 따라야 한다.
③ 제2항에 따른 기록의 열람 또는 사본의 발급에 관한 신청 절차 및 서식 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제53조(검사대상물의 제공과 폐기 등) ① 유전자검사기관은 제51조제2항에 따라 검사대상자로부터 검사대상물의 제공에 대한 서면동의를 받은 경우에는 인체유래물연구자나 인체유래물은행에 검사대상물을 제공할 수 있다.
② 제1항에 따른 검사대상물의 제공에 관하여는 제38조제2항부터 제5항까지의 규정을 준용한다. 이 경우 "인체유래물등"은 "검사대상물"로, "인체유래물 기증자"는 "검사대상자"로 각각 본다.
③ 유전자검사기관은 제1항에 따라 검사대상물을 제공하는 경우 외에는 검사대상물을 유전자검사 결과 획득 후 즉시 폐기하여야 한다.
④ 유전자검사기관은 검사대상물의 폐기에 관한 사항을 기록ㆍ보관하여야 한다.
⑤ 유전자검사기관은 휴업 또는 폐업이나 그 밖에 부득이한 사정으로 인하여 검사대상물을 보존할 수 없는 경우에는 보건복지부령으로 정하는 바에 따라 검사대상물을 처리하거나 이관하여야 한다.
⑥ 검사대상물의 폐기, 폐기에 관한 기록ㆍ보관 및 검사대상물의 처리 또는 이관에 필요한 사항은 보건복지부령으로 정한다.
제54조(보고와 조사) ① 보건복지부장관은 생명윤리 및 안전의 확보와 관련하여 필요하다고 인정할 때에는 제10조제1항 각 호의 기관과 유전자검사기관(이하 "감독대상기관"이라 한다) 및 그 종사자에 대하여 보건복지부령으로 정하는 바에 따라 이 법의 시행에 필요한 보고 또는 자료의 제출을 명할 수 있고, 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있을 때에는 그 연구 및 연구 성과 이용의 중단을 명하거나 그 밖에 필요한 조치를 할 수 있다.
② 보건복지부장관은 이 법에서 정하고 있는 사항의 이행 또는 위반 여부의 확인을 위하여 필요하다고 인정할 때에는 관계 공무원으로 하여금 감독대상기관 또는 그 사무소 등에 출입하여 그 시설 또는 장비, 관계 장부나 서류, 그 밖의 물건을 검사하게 하거나 관계인에게 질문하게 할 수 있으며, 시험에 필요한 시료(試料)를 최소분량으로 수거하게 할 수 있다. 이 경우 관계 공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 보여주어야 한다.
③ 감독대상기관 또는 그 종사자는 제1항 및 제2항에 따른 명령ㆍ검사ㆍ질문 등에 대하여 타당한 사유가 없으면 응하여야 한다.
제55조(폐기 및 개선 명령) ① 보건복지부장관은 감독대상기관 또는 그 종사자와 제33조부터 제35조까지의 규정에 따라 배아줄기세포주를 등록ㆍ제공 또는 이용한 자에게 다음 각 호의 대상물을 폐기할 것을 명할 수 있다. 이 경우 폐기의 절차 및 방법에 관하여는 제25조제5항, 제39조제4항, 제53조제6항을 각각 준용한다.
1. 제22조제1항부터 제3항까지, 제23조, 제24조제1항, 제25조제3항(제32조제2항에서 준용하는 경우를 포함한다), 제26조제1항, 제27조제1항부터 제3항까지, 제29조제1항ㆍ제2항, 제30조제1항부터 제3항까지, 제31조제1항ㆍ제3항ㆍ제4항, 제33조제1항, 제34조제1항ㆍ제3항, 제35조제2항을 위반하여 채취ㆍ생성ㆍ보존ㆍ연구 또는 제공된 배아ㆍ체세포복제배아등ㆍ배아줄기세포주 또는 난자
2. 제39조제1항, 제41조제1항, 제43조제2항, 제49조제1항, 제50조제1항부터 제3항까지, 제51조제1항ㆍ제2항ㆍ제4항, 제53조제1항부터 제3항까지의 규정을 위반하여 채취ㆍ보존 또는 제공된 검사대상물 및 인체유래물
② 보건복지부장관은 감독대상기관의 시설ㆍ인력 등이 제22조제2항, 제29조제2항, 제31조제3항 또는 제41조제4항에서 정하는 기준 등에 맞지 아니하여 연구ㆍ채취ㆍ보존 또는 배아의 생성 등을 하는 경우에 생명윤리나 안전에 중대한 위해가 발생하거나 발생할 우려가 있다고 인정할 때에는 감독대상기관에 대하여 그 시설의 개선을 명하거나 그 시설의 전부 또는 일부의 사용을 금지할 것을 명할 수 있다.
제56조(등록 등의 취소와 업무의 정지) ① 보건복지부장관은 감독대상기관이 다음 각 호의 어느 하나에 해당할 때에는 그 지정ㆍ등록 또는 허가를 취소하거나 1년 이내의 기간을 정하여 그 업무의 전부 또는 일부의 정지를 명할 수 있다.
1. 제10조제1항(같은 항 제1호 및 제2호에 해당하는 기관의 경우는 제외한다), 제20조, 제21조, 제22조제1항부터 제3항까지, 제23조, 제24조제1항ㆍ제2항, 제25조제3항ㆍ제4항(제32조제2항에서 준용하는 경우를 포함한다), 제26조제1항ㆍ제3항, 제27조제1항부터 제3항까지, 제28조(제32조제3항에서 준용하는 경우를 포함한다), 제29조제2항, 제30조제1항, 제31조제1항, 제32조제1항, 제43조제2항, 제44조제1항, 제48조제1항 후단, 제48조제2항, 제50조, 제51조제1항부터 제4항까지, 제52조제1항ㆍ제2항 및 제53조제2항부터 제5항까지의 규정을 위반하였을 때
2. 제54조제1항 및 제55조에 따른 명령을 이행하지 아니하였을 때
3. 제54조제2항에 따른 검사ㆍ질문ㆍ수거에 응하지 아니하였을 때
② 제1항에 따른 행정처분의 세부 기준은 그 위반행위의 유형과 위반 정도 등을 고려하여 보건복지부령으로 정한다.
제57조(청문) 보건복지부장관은 제56조에 따라 기관의 지정ㆍ등록 또는 허가를 취소하려는 경우에는 청문을 하여야 한다.
제58조(과징금) ① 보건복지부장관은 감독대상기관이 다음 각 호의 어느 하나에 해당하여 업무정지처분을 하여야 할 경우로서 그 업무정지가 해당 사업의 이용자에게 심한 불편을 주거나 그 밖에 공익을 해칠 우려가 있을 때에는 대통령령으로 정하는 바에 따라 그 업무정지처분을 갈음하여 2억원 이하의 과징금을 부과할 수 있다.
1. 제22조제1항부터 제3항까지, 제24조제1항ㆍ제2항, 제25조제3항ㆍ제4항(제32조제2항에서 준용하는 경우를 포함한다) 및 제27조제1항부터 제3항까지의 규정을 위반하였을 때
2. 제28조(제32조제3항에서 준용하는 경우를 포함한다) 및 제32조제1항에 따른 준수사항을 위반하였을 때
3. 제54조제1항 및 제55조에 따른 명령을 이행하지 아니하였을 때
4. 제54조제2항에 따른 검사ㆍ질문ㆍ수거에 응하지 아니하였을 때
② 제1항에 따라 과징금을 부과하는 위반행위의 종류와 위반 정도 등에 따른 과징금의 금액이나 그 밖에 필요한 사항은 보건복지부령으로 정한다.
③ 보건복지부장관은 제1항에 따른 과징금을 내야 할 자가 납부기한까지 내지 아니하였을 때에는 국세 체납처분의 예에 따라 징수한다.
제59조(수수료) 보건복지부장관은 이 법의 규정에 따라 지정ㆍ허가ㆍ등록ㆍ승인을 받으려 하거나 신고를 하는 자 또는 그 내용을 변경하려는 자로 하여금 보건복지부령으로 정하는 바에 따라 수수료를 내게 할 수 있다.
제60조(국고 보조) 보건복지부장관은 이 법에 따른 생명윤리 및 안전의 확보에 이바지할 수 있는 연구사업 및 교육을 육성ㆍ지원하기 위하여 대통령령으로 정하는 바에 따라 해당 단체ㆍ기관 또는 종사자에게 필요한 비용의 전부 또는 일부를 지원할 수 있다.
제61조(위임 및 위탁 등) ① 보건복지부장관은 이 법에 따른 권한의 일부를 대통령령으로 정하는 바에 따라 소속 기관의 장에게 위임할 수 있다.
② 보건복지부장관은 대통령령으로 정하는 바에 따라 다음 각 호의 어느 하나에 해당하는 업무의 일부를 관계 전문기관 또는 단체에 위탁할 수 있다.
1. 제13조제1항제2호에 따른 기관위원회 위원의 교육에 관한 업무
2. 제14조에 따른 기관위원회의 평가ㆍ인증에 관한 업무
3. 제49조제3항에 따른 유전자검사의 정확도 평가에 관한 업무
③ 보건복지부장관은 제2항에 따라 관계 전문기관 또는 단체에 업무를 위탁한 경우에는 필요한 예산을 보조할 수 있다.
④ 제2항에 따른 관계 전문기관 또는 단체에 대한 예산 보조, 보조금 환수(還收), 지원 금지 등에 필요한 사항은 대통령령으로 정한다.
제62조(벌칙 적용 시의 공무원 의제) 보건복지부장관이 제61조에 따라 위탁한 업무에 종사하는 기관, 단체의 임직원은 「형법」 제129조부터 제132조까지의 규정을 적용할 때에는 공무원으로 본다.
제63조(비밀 누설 등의 금지) 감독대상기관 또는 그 종사자나 업무에 종사하였던 사람은 직무상 알게 된 개인정보 등의 비밀을 누설하거나 도용하여서는 아니 된다.
제64조(벌칙) ① 제20조제1항을 위반하여 체세포복제배아등을 자궁에 착상시키거나 착상된 상태를 유지하거나 출산한 사람은 10년 이하의 징역에 처한다.
② 제1항의 경우 미수범도 처벌한다.
제65조(벌칙) ① 제21조제1항을 위반하여 인간의 배아를 동물의 자궁에 착상시키거나 동물의 배아를 인간의 자궁에 착상시킨 사람 또는 같은 조 제3항을 위반하여 같은 조 제2항 각 호의 어느 하나에 해당하는 행위로부터 생성된 것을 인간 또는 동물의 자궁에 착상시킨 사람은 5년 이하의 징역에 처한다.
② 제1항의 경우 미수범도 처벌한다.
제66조(벌칙) ① 다음 각 호의 어느 하나에 해당하는 사람은 3년 이하의 징역에 처한다.
1. 제20조제2항을 위반하여 체세포복제배아등을 자궁에 착상시키거나 착상된 상태를 유지 또는 출산하도록 유인하거나 알선한 사람
2. 제21조제2항 각 호의 어느 하나에 해당하는 행위를 한 사람
3. 제23조제1항을 위반하여 임신 외의 목적으로 배아를 생성한 사람
4. 제23조제3항을 위반하여 금전, 재산상의 이익 또는 그 밖의 반대급부를 조건으로 배아나 난자 또는 정자를 제공 또는 이용하거나 이를 유인하거나 알선한 사람
5. 제31조제1항을 위반하여 희귀ㆍ난치병의 치료를 위한 연구 목적 외의 용도로 체세포핵이식행위 또는 단성생식행위를 한 사람
6. 제63조를 위반하여 비밀을 누설하거나 도용한 사람
② 제29조제1항을 위반하여 잔여배아를 이용한 자는 3년 이하의 징역 또는 5천만원 이하의 벌금에 처한다.
③ 제1항제1호 및 제2호의 경우 미수범도 처벌한다.
제67조(벌칙) ① 다음 각 호의 어느 하나에 해당하는 자는 2년 이하의 징역 또는 3천만원 이하의 벌금에 처한다.
1. 배아를 생성할 때 제23조제2항 각 호의 어느 하나에 해당하는 행위를 한 자
2. 제24조제1항을 위반하여 서면동의 없이 난자 또는 정자를 채취한 자
3. 제27조제1항을 위반하여 난자 기증자에 대하여 건강검진을 하지 아니한 자 또는 같은 조 제2항이나 제3항을 위반하여 난자를 채취한 자
4. 제46조제1항부터 제3항까지의 규정을 위반하여 유전정보를 이유로 다른 사람을 차별한 자, 유전자검사를 받도록 강요하거나 유전자검사 결과를 제출하도록 강요한 자 또는 환자 외의 자에게 제공하는 기록 등에 유전정보를 포함시킨 자
5. 제47조제1항 또는 제2항을 위반하여 유전자치료에 관한 연구를 하거나 유전자치료를 시행한 자
6. 제50조제1항부터 제3항까지의 규정을 위반하여 유전자검사를 한 자
7. 제55조에 따른 폐기명령 또는 개선명령을 이행하지 아니한 자
② 제22조제6항을 위반하여 배아, 생식세포를 이관하지 아니한 자는 2년 이하의 징역 또는 1천만원 이하의 벌금에 처한다.
제68조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 1년 이하의 징역 또는 2천만원 이하의 벌금에 처한다.
1. 제22조제1항부터 제3항까지의 규정을 위반하여 배아생성의료기관으로 지정받지 아니하고 인간의 난자 또는 정자를 채취ㆍ보존하거나 이를 수정시켜 배아를 생성한 자
2. 제25조제3항(제32조제2항에서 준용하는 경우를 포함한다)을 위반하여 배아를 폐기하지 아니한 자
3. 제26조제1항을 위반하여 유상(有償)으로 잔여배아 및 잔여난자를 제공한 자
4. 제26조제3항을 위반하여 보건복지부장관에게 보고하지 아니한 자
5. 제29조제2항을 위반하여 배아연구기관으로 등록하지 아니하고 잔여배아를 연구한 자
6. 제30조제1항을 위반하여(제31조제5항에서 준용하는 경우를 포함한다) 배아연구계획서의 승인을 받지 아니하고 배아연구를 한 자
7. 제31조제3항을 위반하여 보건복지부장관에게 등록하지 아니하고 체세포복제배아등을 생성하거나 연구한 자
8. 제41조제1항을 위반하여 허가를 받지 아니하고 인체유래물은행을 개설한 자
9. 제42조제1항을 위반하여 서면동의 없이 인체유래물을 직접 채취하거나 채취를 의뢰한 자
10. 제50조제4항을 위반하여 유전자검사에 관하여 거짓표시 또는 과대광고를 한 자
11. 제51조제1항ㆍ제2항ㆍ제4항을 위반하여 유전자검사에 관한 서면동의를 받지 아니하고 검사대상물을 채취한 자 또는 같은 조 제3항을 위반하여 서면동의서를 첨부하지 아니하거나 개인정보를 보호하기 위한 조치를 하지 아니하고 유전자검사를 의뢰한 자
제69조(양벌규정) ① 법인의 대표자나 법인 또는 개인의 대리인, 사용인, 그 밖의 종업원이 그 법인 또는 개인의 업무에 관하여 제64조부터 제66조까지의 어느 하나에 해당하는 위반행위를 하면 그 행위자를 벌하는 외에 그 법인 또는 개인을 5천만원 이하의 벌금에 처한다. 다만, 법인 또는 개인이 그 위반행위를 방지하기 위하여 해당 업무에 관하여 상당한 주의와 감독을 게을리하지 아니한 경우에는 그러하지 아니하다.
② 법인의 대표자나 법인 또는 개인의 대리인, 사용인, 그 밖의 종업원이 그 법인 또는 개인의 업무에 관하여 제67조 또는 제68조의 위반행위를 하면 그 행위자를 벌하는 외에 그 법인 또는 개인에게도 해당 조문의 벌금형을 과(科)한다. 다만, 법인 또는 개인이 그 위반행위를 방지하기 위하여 해당 업무에 관하여 상당한 주의와 감독을 게을리하지 아니한 경우에는 그러하지 아니하다.
제70조(과태료) ① 다음 각 호의 어느 하나에 해당하는 자에게는 500만원 이하의 과태료를 부과한다.
1. 제10조제1항을 위반하여 기관위원회를 설치하지 아니한 자
2. 제33조제1항을 위반하여 등록하지 아니하고 해당 배아줄기세포주를 제공하거나 이용한 자
3. 제35조제1항을 위반하여 배아줄기세포주를 이용한 자
4. 제38조제2항을 위반하여 인체유래물등을 익명화하지 아니하고 다른 연구자에게 제공한 자
5. 제39조제1항 본문 또는 제3항(제44조제3항에서 준용하는 경우를 포함한다)에 따라 인체유래물을 폐기, 처리하거나 이관하지 아니한 자
6. 제41조제2항에 따른 신고를 하지 아니한 자
7. 제44조제4항을 위반하여 인체유래물등의 익명화 방안이 포함된 개인정보 보호 지침을 마련하지 아니하거나 개인정보 관리 및 보안을 담당하는 책임자를 두지 아니한 자
8. 제48조제1항을 위반하여 신고하지 아니하고 유전자치료를 한 자
9. 제49조제1항 본문에 따른 신고를 하지 아니한 자
10. 제54조제3항을 위반하여 보건복지부장관의 명령ㆍ검사ㆍ질문 등에 대하여 타당한 사유 없이 응하지 아니한 감독대상기관 또는 그 종사자
② 다음 각 호의 어느 하나에 해당하는 자에게는 300만원 이하의 과태료를 부과한다.
1. 제22조제4항 또는 제5항, 제29조제3항을 위반하여 보건복지부장관에게 신고하지 아니한 자
2. 제22조제6항을 위반하여 관련 서류를 이관하지 아니한 자
③ 다음 각 호의 어느 하나에 해당하는 자에게는 200만원 이하의 과태료를 부과한다.
1. 제10조제4항을 위반하여 보건복지부장관에게 등록하지 아니한 자
2. 제11조제4항을 위반하여 보건복지부장관에게 보고하지 아니한 자
3. 제34조제3항을 위반하여 유상으로 배아줄기세포주를 제공한 자
4. 제38조제3항을 위반하여 유상으로 인체유래물등을 제공한 자
5. 제41조제3항에 따른 신고를 하지 아니한 자
6. 제49조제2항 또는 제4항에 따른 신고를 하지 아니한 자
④ 제1항부터 제3항까지에 따른 과태료는 대통령령으로 정하는 바에 따라 보건복지부장관이 부과ㆍ징수한다.
<제11690호, 2013.3.23> (정부조직법)
제1조(시행일) ① 이 법은 공포한 날부터 시행한다.
② 생략
제2조부터 제5조까지 생략
제6조(다른 법률의 개정) ①부터 <468>까지 생략
<469> 생명윤리 및 안전에 관한 법률 일부를 다음과 같이 개정한다.
제8조제1항 중 "15명 이상 19명"을 "16명 이상 20명"으로 한다.
제8조제3항제1호 중 "교육과학기술부장관, 법무부장관, 지식경제부장관"을 "미래창조과학부장관, 교육부장관, 법무부장관, 산업통상자원부장관"으로 한다.
제8조제5항 중 "교육과학기술부장관"을 "미래창조과학부장관"으로 한다.
<470>부터 <710>까지 생략
제7조 생략
생명연구자원의 확보·관리 및 활용에 관한 법률
[시행 2013.3.23] [법률 제11713호, 2013.3.23, 타법개정]
제1조(목적) 이 법은 생명연구자원의 효율적인 확보와 체계적인 관리를 통하여 지속가능한 활용을 도모하고 생명공학의 발전 기반을 조성함으로써 국민의 삶의 질 향상과 국가경제 발전에 기여하는 것을 목적으로 한다.
제2조(정의) 이 법에서 사용하는 용어의 뜻은 다음과 같다. <개정 2011.3.9>
1. "생명연구자원"이란 생명공학연구의 기반이 되는 자원으로서 산업적으로 유용한 동물, 식물, 미생물, 인체유래 연구자원 등 생물체의 실물(實物)과 정보를 말한다.
2. "국가연구개발사업"이란 「과학기술기본법」 제11조에 따른 국가연구개발사업을 말한다.
3. "연구기관"이란 다음 각 목의 연구기관을 말한다.
가. 국공립 연구기관
나. 「특정연구기관 육성법」의 적용을 받는 연구기관
다. 「과학기술분야 정부출연연구기관 등의 설립·운영 및 육성에 관한 법률」에 따라 설립된 연구기관
라. 「기초연구진흥 및 기술개발지원에 관한 법률」 제14조제1항제2호에 따른 기업부설연구소
마. 「산업기술연구조합 육성법」에 따른 산업기술연구조합
제3조(국가 등의 책무) ① 국가와 지방자치단체는 생명연구자원의 효율적인 확보·관리 및 활용을 위하여 노력하여야 한다.
② 다음 각 호의 기관 등은 생명연구자원의 확보·관리 및 활용에 관하여 국가와 지방자치단체가 수행하는 업무에 적극 협력하여야 한다.
1. 국가연구개발사업을 수행하는 「고등교육법」 제2조에 따른 학교
2. 국가연구개발사업을 수행하는 연구기관
3. 그 밖에 생명연구자원을 관리·이용하는 자
제4조(다른 법률과의 관계) 생명연구자원의 확보·관리 및 활용에 관하여 다른 법률에 특별한 규정이 있는 경우 외에는 이 법에서 정하는 바에 따른다.
제5조(생명연구자원 관리의 기본원칙) ① 관계 중앙행정기관의 장은 소관 분야의 생명연구자원과 국가연구개발사업의 연구 결과 생산된 생명연구자원을 관리한다.
② 미래창조과학부장관은 제1항에 따라 관계 중앙행정기관이 관리하는 생명연구자원에 관한 정보를 종합적으로 관리한다. <개정 2013.3.23>
제6조(기본시책의 마련) 정부는 이 법의 목적을 효율적으로 달성하기 위하여 생명연구자원의 확보·관리 및 활용을 도모하기 위한 다음 각 호의 시책을 마련하여야 한다. <개정 2010.1.18, 2013.3.23>
1. 미래창조과학부장관: 생명연구자원의 통합정보시스템을 구축하고 통계를 유지하며, 소관 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 생명연구자원의 관리 및 활용을 위한 정보통신기술의 확보를 지원하기 위한 시책
2. 교육부장관: 생명연구자원 분야의 전문인력 양성 및 기초 연구를 지원하기 위한 시책으로서, 미래창조과학부장관과 협의한 시책
3. 농림축산식품부장관: 농업 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 이를 지원하기 위한 시책
4. 산업통상자원부장관: 산업 분야 생명연구자원의 확보·관리 및 활용체계를 조성하고 생명연구자원의 산업적 활용을 지원하기 위한 시책
5. 보건복지부장관: 보건·의료 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 이를 지원하기 위한 시책
6. 환경부장관: 야생생물 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 이를 지원하기 위한 시책
7. 해양수산부장관: 해양·수산 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 이를 지원하기 위한 시책
제7조(생명연구자원 관리 기본계획의 수립·시행 등) ① 정부는 생명연구자원의 활용촉진과 정보관리를 위하여 5년마다 생명연구자원 관리 기본계획(이하 "기본계획"이라 한다)을 수립·시행하여야 한다.
② 기본계획에는 다음 각 호의 사항이 포함되어야 한다.
1. 생명연구자원의 확보·관리 및 활용의 기본방향
2. 생명연구자원의 조사, 연구, 개발 및 확보
3. 생명연구자원의 보존·관리 및 활용
4. 생명연구자원 관련 인프라의 구축
5. 생명연구자원 정보유통체계 구축
6. 생명연구자원의 확보·관리 및 활용을 위한 투자의 확대
7. 생명연구자원 전문인력 양성
8. 그 밖에 생명연구자원 분야의 육성 및 관리 등에 필요한 사항
③ 관계 중앙행정기관의 장은 제2항 각 호의 사항에 대하여 소관 분야별로 계획을 세우고 이를 미래창조과학부장관에게 통보하여야 한다. <개정 2013.3.23>
④ 미래창조과학부장관은 제3항에 따라 통보받은 관계 중앙행정기관의 계획을 종합하여 기본계획안을 작성하고 「과학기술기본법」 제9조제1항에 따른 국가과학기술심의회의 심의를 거쳐 이를 확정한다. <개정 2013.3.23>
⑤ 관계 중앙행정기관의 장은 기본계획에 따라 연도별 시행계획을 수립·시행하여야 한다.
⑥ 기본계획과 시행계획의 수립·시행에 필요한 사항은 대통령령으로 정한다.
제8조(생명연구자원 기탁등록보존기관의 지정 등) ① 관계 중앙행정기관의 장은 생명연구자원 기탁등록보존기관을 지정할 수 있다.
② 제1항에 따라 지정된 생명연구자원 기탁등록보존기관(이하 "기탁등록보존기관"이라 한다)은 다음 각 호의 업무를 수행한다.
1. 생명연구자원의 수탁, 등록 및 평가
2. 생명연구자원의 보존과 관리
3. 생명연구자원 정보시스템의 구축과 운영
4. 소관 정보시스템, 제10조제2항제2호에 따른 정보시스템 및 제11조제2항제1호에 따른 통합정보시스템 간의 상호 연계
5. 국내외 생명연구자원 관련 기관과의 협력
6. 그 밖에 생명연구자원의 관리와 활용 등에 필요한 사항
③ 기탁등록보존기관은 생명연구자원의 안정적 보존을 위하여 복수의 시설에서 생명연구자원을 보존 및 관리할 수 있다.
④ 정부는 기탁등록보존기관의 운영에 필요한 경비의 전부 또는 일부를 지원할 수 있다.
⑤ 기탁등록보존기관의 지정기준과 운영 등에 필요한 사항은 대통령령으로 정한다.
제9조(기탁 및 등록 등) ① 생명연구자원을 관리·이용하고 있는 자는 기탁등록보존기관에 생명연구자원을 기탁·등록할 수 있다.
② 국가연구개발사업을 수행한 자는 사업수행 결과에 따라 생산된 생명연구자원을 기탁등록보존기관에 기탁·등록하여야 한다. 다만, 대통령령으로 정하는 사유로서 관계 중앙행정기관의 장이 인정하는 경우에는 그러하지 아니하다.
③ 정부는 제2항에 따른 생명연구자원의 기탁 및 등록실적을 해당 사업의 평가 등에 반영할 수 있다.
④ 생명연구자원의 기탁 및 등록의 방법 등에 필요한 사항은 대통령령으로 정한다.
제10조(책임기관 및 생명연구자원정보센터의 지정 등) ① 관계 중앙행정기관의 장은 기탁등록보존기관 중에서 다음 각 호의 업무를 수행하는 기관을 책임기관으로 지정할 수 있다.
1. 기탁등록보존기관의 관리
2. 기탁등록보존기관 간의 정보 교류
② 관계 중앙행정기관의 장은 필요한 경우 소관 분야의 생명연구자원의 관리와 유통을 촉진하기 위하여 다음 각 호의 업무를 수행하는 생명연구자원정보센터를 지정할 수 있다.
1. 소관 분야의 생명연구자원과 관련된 정보의 수집
2. 소관 분야의 생명연구자원 정보시스템의 구축과 운영
3. 그 밖에 소관 분야의 생명연구자원의 관리와 유통에 필요한 사항
③ 관계 중앙행정기관의 장은 제2항에 따라 지정된 생명연구자원정보센터(이하 "생명연구자원정보센터"라 한다)와 제11조제1항에 따른 국가생명연구자원정보센터 간의 정보유통을 촉진하여야 한다.
④ 정부는 제1항에 따라 지정된 책임기관(이하 "책임기관"이라 한다)과 생명연구자원정보센터의 운영에 필요한 경비의 전부 또는 일부를 지원할 수 있다.
⑤ 책임기관과 생명연구자원정보센터의 지정기준과 운영 등에 필요한 사항은 대통령령으로 정한다.
제11조(국가생명연구자원정보센터의 지정 등) ① 미래창조과학부장관은 관계 중앙행정기관이 관리하는 생명연구자원의 통합적 관리와 유통을 위하여 국가생명연구자원정보센터를 지정할 수 있다. <개정 2013.3.23>
② 제1항에 따라 지정된 국가생명연구자원정보센터(이하 "국가생명연구자원정보센터"라 한다)는 다음 각 호의 업무를 수행한다.
1. 생명연구자원 통합정보시스템의 구축과 운영
2. 생명연구자원과 관련된 정보의 분석 및 제공
3. 생명연구자원과 관련된 자동화시스템의 설계, 개발, 구축과 관리
4. 생명연구자원과 관련된 연구기관 및 기탁등록보존기관의 정보관리 지원 및 교육
5. 국내외 생명연구자원 정보관리기관과의 협력
6. 그 밖에 생명연구자원의 통합적 관리와 유통에 필요한 사항
③ 미래창조과학부장관은 관계 중앙행정기관의 장 및 지방자치단체의 장에게 생명연구자원과 관련된 정보 및 현황 등 생명연구자원의 관리에 필요한 자료 등에 관하여 협조를 요청할 수 있다. <개정 2013.3.23>
④ 정부는 국가생명연구자원정보센터의 운영에 필요한 경비의 전부 또는 일부를 지원할 수 있다.
⑤ 국가생명연구자원정보센터의 지정기준과 운영 등에 필요한 사항은 대통령령으로 정한다.
제12조(지정의 취소 등) ① 관계 중앙행정기관의 장은 기탁등록보존기관, 책임기관 또는 생명연구자원정보센터의 지정을 받은 자가 다음 각 호의 어느 하나에 해당하는 경우에는 지정을 취소하거나 6개월 이내의 기간을 정하여 사업의 정지를 명할 수 있다. 다만, 제1호에 해당하는 경우에는 그 지정을 취소하여야 한다.
1. 거짓이나 그 밖의 부정한 방법으로 지정을 받은 경우
2. 제8조제5항 또는 제10조제5항에 따른 지정기준을 충족하지 못하게 된 경우
② 미래창조과학부장관은 국가생명연구자원정보센터의 지정을 받은 자가 다음 각 호의 어느 하나에 해당하는 경우에는 지정을 취소하거나 6개월 이내의 기간을 정하여 사업의 정지를 명할 수 있다. 다만, 제1호에 해당하는 경우에는 그 지정을 취소하여야 한다. <개정 2013.3.23>
1. 거짓이나 그 밖의 부정한 방법으로 지정을 받은 경우
2. 제11조제5항에 따른 지정기준을 충족하지 못하게 된 경우
③ 제1항 및 제2항에 따른 처분의 기준과 절차 등에 필요한 사항은 대통령령으로 정한다.
제13조(관련 기관의 육성·지원) 정부는 생명연구자원의 확보·관리 및 활용을 촉진하기 위하여 생명연구자원의 연구, 기탁, 등록 또는 보존 등의 업무를 수행하는 기관 또는 단체 등을 육성·지원하여야 한다.
제14조(투자재원의 마련) 정부는 생명연구자원의 확보·관리 및 활용을 위한 시책을 추진하는 데에 필요한 투자재원을 지속적이고 안정적으로 마련하기 위하여 노력하여야 한다.
제15조(전문인력의 양성) 정부는 생명연구자원의 효과적인 확보·관리 및 활용에 필요한 전문인력을 체계적으로 양성하기 위하여 다음 각 호의 시책을 마련하여야 한다.
1. 생명연구자원 분야의 중·장기 전문인력 양성
2. 전문인력 교육프로그램의 확보 및 보급 지원
제16조(공동연구의 지원 등) ① 정부는 생명연구자원의 효율적인 확보·관리 및 활용을 위하여 산업계, 학계, 연구기관 간의 공동연구 및 관련 학술활동을 지원하여야 한다.
② 정부는 외국 및 국제기구 등과 생명연구자원의 확보·관리 및 활용에 관한 기술협력, 정보교환, 공동조사, 연구 등 효율적인 국제협력의 증진을 촉진하기 위하여 적극 노력하여야 한다.
제17조(생명연구자원의 활용) ① 정부는 국민이 생명연구자원에 대한 연구개발 및 산업화를 위하여 생명연구자원을 적극적으로 활용할 수 있도록 필요한 시책을 마련하여야 한다.
② 정부는 산업계, 학계, 연구기관이 필요한 생명연구자원을 효과적으로 활용할 수 있도록 홍보 및 교육 등의 시책을 추진하여야 한다.
제18조(생명연구자원의 정보유통) ① 관계 중앙행정기관의 장은 소관 분야의 생명연구자원과 관련된 정보를 디지털화된 형태로 수집·확보할 수 있도록 필요한 시책을 마련하여야 한다.
② 정부는 생명연구자원의 효율적인 관리와 유통을 촉진하기 위하여 생명연구자원과 관련된 정보의 수집·보존 및 전송에 관한 표준화를 추진하여야 한다.
제19조(통계간행물의 발간 등) ① 미래창조과학부장관은 생명연구자원의 종류와 보유기관 등 생명연구자원의 현황이 파악될 수 있도록 관계 중앙행정기관의 장 및 통계청장과의 협의를 거쳐 매년 통계간행물을 발간·보급하여야 한다. <개정 2013.3.23>
② 미래창조과학부장관은 제1항에 따른 통계간행물의 발간을 위하여 관계 중앙행정기관의 장에게 필요한 자료를 제출하도록 요청할 수 있다. <개정 2013.3.23>
제20조(청문) 관계 중앙행정기관의 장과 미래창조과학부장관은 제12조제1항 또는 제2항에 따라 기탁등록보존기관, 책임기관, 생명연구자원정보센터 또는 국가생명연구자원정보센터의 지정을 취소하려면 청문을 하여야 한다. <개정 2013.3.23>
제21조(위임 및 위탁) ① 이 법에 따른 관계 중앙행정기관의 장과 미래창조과학부장관의 권한은 그 일부를 대통령령으로 정하는 바에 따라 특별시장·광역시장·도지사·특별자치도지사, 시장·군수·구청장(자치구의 구청장을 말한다) 또는 소속 기관의 장에게 위임할 수 있다. <개정 2013.3.23>
② 이 법에 따른 관계 중앙행정기관의 장과 미래창조과학부장관의 업무는 그 일부를 대통령령으로 정하는 바에 따라 관련 법인·단체에 위탁할 수 있다. <개정 2013.3.23>
<제11713호, 2013.3.23> (과학기술기본법)
제1조(시행일) 이 법은 공포한 날부터 시행한다.
제2조부터 제5조까지 생략
제6조(다른 법률의 개정) ①부터 <18>까지 생략
<19> 생명연구자원의 확보ㆍ관리 및 활용에 관한 법률 일부를 다음과 같이 개정한다.
제7조제4항 중 "국가과학기술위원회"를 "국가과학기술심의회"로 한다.
<20>부터 <28>까지 생략
실험동물에 관한 법률
[시행 2013.7.30] [법률 제11987호, 2013.7.30, 일부개정]
제1조(목적) 이 법은 실험동물 및 동물실험의 적절한 관리를 통하여 동물실험에 대한 윤리성 및 신뢰성을 높여 생명과학 발전과 국민보건 향상에 이바지함을 목적으로 한다.
제2조(정의) 이 법에서 사용하는 용어의 정의는 다음과 같다.
1. "동물실험"이란 교육ㆍ시험ㆍ연구 및 생물학적 제제(製劑)의 생산 등 과학적 목적을 위하여 실험동물을 대상으로 실시하는 실험 또는 그 과학적 절차를 말한다.
2. "실험동물"이란 동물실험을 목적으로 사용 또는 사육되는 척추동물을 말한다.
3. "재해"란 동물실험으로 인한 사람과 동물의 감염, 전염병 발생, 유해물질 노출 및 환경오염 등을 말한다.
4. "동물실험시설"이란 동물실험 또는 이를 위하여 실험동물을 사육하는 시설로서 대통령령으로 정하는 것을 말한다.
5. "실험동물생산시설"이란 실험동물을 생산 및 사육하는 시설을 말한다.
6. "운영자"란 동물실험시설 혹은 실험동물생산시설을 운영하는 자를 말한다.
제3조(적용 대상) 이 법은 다음 각 호의 어느 하나에 필요한 실험에 사용되는 동물과 그 동물실험시설의 관리 등에 적용한다.
1. 식품ㆍ건강기능식품ㆍ의약품ㆍ의약외품ㆍ생물의약품ㆍ의료기기ㆍ화장품의 개발ㆍ안전관리ㆍ품질관리
2. 마약의 안전관리ㆍ품질관리
제4조(다른 법률과의 관계) 실험동물의 사용 또는 관리에 관하여 이 법에서 규정한 것을 제외하고는 「동물보호법」으로 정하는 바에 따른다.
제5조(식품의약품안전처의 책무) ① 식품의약품안전처장은 제1조의 목적을 달성하기 위하여 다음 각 호의 사항을 수행하여야 한다. <개정 2013.3.23>
1. 실험동물의 사용 및 관리에 관한 정책의 수립 및 추진
2. 동물실험시설의 설치ㆍ운영에 관한 지원
3. 동물실험시설 내에서 실험동물의 유지ㆍ보존 및 개발에 관한 지원
4. 실험동물의 품질향상 등을 위한 연구 지원
5. 실험동물 관련 정보의 수집ㆍ관리 및 교육에 대한 지원
6. 동물실험을 대체할 수 있는 방법의 개발ㆍ인정에 관한 정책의 수립 및 추진
7. 그 밖에 실험동물의 사용과 관리에 필요한 사항
② 제1항을 수행하기 위하여 필요한 사항은 총리령으로 정한다. <개정 2010.1.18, 2013.3.23>
[제목개정 2013.3.23]
제6조(동물실험시설 운영자의 책무) 동물실험시설의 운영자는 동물실험의 안전성 및 신뢰성 등을 확보하기 위하여 다음 각 호의 사항을 수행하여야 한다.
1. 실험동물의 과학적 사용 및 관리에 관한 지침 수립
2. 동물실험을 수행하는 자 및 종사자에 대한 교육
3. 동물실험을 대체할 수 있는 방법의 우선적 고려
4. 동물실험의 폐기물 등의 적절한 처리 및 작업자의 안전에 관한 계획 수립
제7조(실험동물운영위원회 설치 등) ① 동물실험시설에는 동물실험의 윤리성, 안전성 및 신뢰성 등을 확보하기 위하여 실험동물운영위원회를 설치ㆍ운영하여야 한다.
② 제1항의 실험동물운영위원회의 기능 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
제8조(동물실험시설의 등록) ① 동물실험시설을 설치하고자 하는 자는 식품의약품안전처장에게 등록하여야 한다. 등록사항을 변경하는 경우에도 또한 같다. <개정 2013.3.23>
② 동물실험시설에는 해당 시설 및 실험동물의 관리를 위하여 대통령령으로 정하는 자격요건을 갖춘 관리자(이하 "관리자"라 한다)를 두어야 한다.
③ 제1항에 따른 등록기준 및 절차 등에 관하여 필요한 사항은 총리령으로 정한다. <개정 2010.1.18, 2013.3.23>
제9조(실험동물의 사용 등) ① 동물실험시설에서 대통령령으로 정하는 실험동물을 사용하는 경우에는 동물실험시설 또는 제15조제1항에 따른 우수실험동물생산시설에서 생산된 실험동물을 우선적으로 사용하도록 노력하여야 한다.
② 외국으로부터 수입된 실험동물을 사용하고자 하는 경우에는 총리령으로 정하는 기준에 적합한 실험동물을 사용하여야 한다. <개정 2010.1.18, 2013.3.23>
제10조(우수동물실험시설의 지정) ① 식품의약품안전처장은 실험동물의 적절한 사용 및 관리를 위하여 적절한 인력 및 시설을 갖추고 운영상태가 우수한 동물실험시설을 우수동물실험시설로 지정할 수 있다. 이 경우 지정기준, 지정사항 변경 등에 관한 사항은 총리령으로 정한다. <개정 2010.1.18, 2013.3.23>
② 제1항에 따른 우수동물실험시설로 지정받고자 하는 자는 총리령으로 정하는 바에 따라 지정신청을 하여야 한다. <개정 2010.1.18, 2013.3.23>
③ 식품의약품안전처장은 실험동물을 사용하는 관련 사업자 또는 연구 용역을 수행하는 자에게 제1항에 따라 지정된 우수동물실험시설에서 그 업무를 수행하도록 권고할 수 있다. <개정 2013.3.23>
제11조(동물실험시설 등에 대한 지도ㆍ감독) ① 제8조 또는 제10조에 따라 동물실험시설로 등록 또는 우수동물실험시설로 지정 받은 자는 식품의약품안전처장의 지도ㆍ감독을 받아야 한다. <개정 2013.3.23>
② 제1항에 따른 지도ㆍ감독의 내용ㆍ대상ㆍ시기ㆍ기준 등에 관하여 필요한 사항은 식품의약품안전처장이 정한다. <개정 2013.3.23>
제12조(실험동물공급자의 등록) ① 대통령령으로 정하는 실험동물의 생산ㆍ수입 또는 판매를 업으로 하고자 하는 자(이하 "실험동물공급자"라 한다)는 총리령으로 정하는 바에 따라 식품의약품안전처장에게 등록하여야 한다. 다만, 제8조의 동물실험시설에서 유지 또는 연구 과정 중 생산된 실험동물을 공급하는 경우에는 그러하지 아니하다. <개정 2010.1.18, 2013.3.23>
② 제1항에 따른 등록사항을 변경하고자 할 때에는 총리령으로 정하는 바에 따라 변경등록을 하여야 한다. <개정 2010.1.18, 2013.3.23>
제13조(실험동물공급자의 준수사항) 실험동물공급자는 실험동물의 안전성 및 건강을 확보하기 위하여 다음 각 호의 사항을 준수하여야 한다. <개정 2010.1.18, 2013.3.23>
1. 실험동물생산시설과 실험동물을 보건위생상 위해(危害)가 없고 안전성이 확보되도록 관리할 것
2. 실험동물을 운반하는 경우 그 실험동물의 생태에 적합한 방법으로 운송할 것
3. 그 밖에 제1호 및 제2호에 준하는 사항으로서 실험동물의 안전성 확보 및 건강관리를 위하여 필요하다고 인정하여 총리령으로 정하는 사항
제14조(실험동물 수입에 관한 사항) 실험동물의 수입과 검역에 관하여는 「가축전염병예방법」 제32조, 제34조, 제35조 및 제36조의 규정에 따른다.
제15조(우수실험동물생산시설의 지정 등) ① 식품의약품안전처장은 실험동물의 품질을 향상시키기 위하여 충분한 인력 및 시설을 갖추고 관리상태가 우수한 실험동물생산시설을 우수실험동물생산시설로 지정할 수 있다. 이 경우 지정기준, 지정사항 변경 등에 관한 사항은 총리령으로 정한다. <개정 2010.1.18, 2013.3.23>
② 제1항에 따른 우수실험동물생산시설로 지정받고자 하는 자는 총리령으로 정하는 바에 따라 지정신청을 하여야 한다. <개정 2010.1.18, 2013.3.23>
③ 제1항에 따라 우수실험동물생산시설로 지정된 경우가 아니면 실험동물의 운송용기나 문서 등에 우수실험동물생산시설 또는 이와 유사한 표지를 부착하거나 이를 홍보하여서는 아니 된다.
제16조(실험동물공급자 등에 대한 지도ㆍ감독) ① 제12조에 따라 실험동물공급자로 등록하거나 제15조에 따라 우수실험동물생산시설로 지정받은 자는 식품의약품안전처장의 지도ㆍ감독을 받아야 한다. <개정 2013.3.23>
② 제1항에 따른 지도ㆍ감독의 대상ㆍ시기ㆍ기준 등에 관하여 필요한 사항은 식품의약품안전처장이 정한다. <개정 2013.3.23>
제17조(교육) ① 다음 각 호의 자는 실험동물의 사용ㆍ관리 등에 관하여 교육을 받아야 한다.
1. 제8조제1항에 따른 동물실험시설 설치자
2. 제8조제2항에 따른 관리자
3. 제12조에 따른 실험동물공급자
4. 그 밖에 동물실험을 수행하는 자
② 식품의약품안전처장은 제1항에 따른 교육을 수행하여야 하며, 교육 위탁기관, 교육내용, 소요경비의 징수 등에 관하여 필요한 사항은 총리령으로 정한다. <개정 2010.1.18, 2013.3.23>
제18조(재해 방지) ① 동물실험시설의 운영자 또는 관리자는 재해를 유발할 수 있는 물질 또는 병원체 등을 사용하는 동물실험을 실시하는 경우 사람과 동물에 위해를 주지 아니하도록 필요한 조치를 취하여야 한다.
② 동물실험시설 및 실험동물생산시설로 인한 재해가 국민 건강과 공익에 유해하다고 판단되는 경우 운영자 또는 관리자는 즉시 폐쇄, 소독 등 필요한 조치를 취한 후 그 결과를 식품의약품안전처장에게 보고하여야 한다. 이 경우 「가축전염병예방법」 제19조를 준용한다. <개정 2013.3.23>
③ 동물실험 및 실험동물로 인한 재해가 국민 건강과 공익에 유해하다고 판단되는 경우 운영자 또는 관리자는 살처분 등 필요한 조치를 취한 후 그 결과를 식품의약품안전처장에게 보고하여야 한다. 이 경우 「가축전염병예방법」 제20조를 준용한다. <개정 2013.3.23>
제19조(생물학적 위해물질의 사용보고) ① 동물실험시설의 운영자는 총리령으로 정하는 생물학적 위해물질을 동물실험에 사용하고자 하는 경우 미리 식품의약품안전처장에게 보고하여야 한다. <개정 2010.1.18, 2013.3.23>
② 제1항의 보고에 관한 사항은 총리령으로 정한다. <개정 2010.1.18, 2013.3.23>
제20조(사체 등 폐기물) ① 동물실험시설의 운영자 및 관리자 또는 실험동물공급자는 해당 시설에서 나온 실험동물의 사체가 외부에 유출되어 재이용되거나 재해가 발생되지 아니하도록 처리하여야 한다.
② 동물실험시설과 실험동물생산시설에서 배출된 실험동물의 사체 등의 폐기물은 「폐기물관리법」에 따라 처리한다.
제21조(기록) 동물실험을 수행하는 자는 총리령으로 정하는 바에 따라 실험동물의 종류, 사용량, 수행된 연구의 절차, 연구에 참여한 자에 대하여 기록하여야 한다. <개정 2010.1.18, 2013.3.23>
제22조(동물실험 실태보고) ① 식품의약품안전처장은 동물실험에 관한 실태보고서를 매년 작성하여 발표하여야 한다. <개정 2013.3.23>
② 제1항에 따른 실태보고서에는 다음 각 호의 사항이 포함되어야 한다. <개정 2010.1.18, 2013.3.23>
1. 동물실험에 사용된 실험동물의 종류 및 수
2. 동물실험 후의 실험동물의 처리
3. 동물실험시설 및 실험동물공급시설의 종류 및 수
4. 제11조에 따른 동물실험시설 등에 대한 지도ㆍ감독에 관한 사항
5. 제18조에 따른 재해유발 물질 또는 병원체 등의 사용에 관한 사항
6. 제19조에 따른 위해물질의 사용에 관한 사항
7. 제24조에 따른 지정취소 등에 관한 사항
8. 그 밖에 총리령으로 정하는 사항
제23조(실험동물협회) ① 동물실험의 신뢰성 증진 및 실험동물산업의 건전한 발전을 위하여 실험동물협회(이하 "협회"라 한다)를 둘 수 있다.
② 협회는 법인으로 한다.
③ 다음 각 호에 해당하는 자는 협회의 회원이 될 수 있다.
1. 제8조제1항에 따른 등록을 한 자
2. 제8조제2항에 의한 관리자
3. 실험동물분야에 관한 지식과 기술이 있는 자 중 협회의 정관으로 정하는 자
④ 협회를 설립하고자 하는 경우에는 대통령령으로 정하는 바에 따라 정관을 작성하여 식품의약품안전처장의 설립인가를 받아야 한다. <개정 2013.3.23>
⑤ 협회의 정관 기재 사항과 업무에 관하여 필요한 사항은 대통령령으로 정한다.
⑥ 협회에 관하여 이 법에 규정되지 아니한 사항은 「민법」 중 사단법인에 관한 규정을 준용한다.
⑦ 국가는 협회가 제1항에 따라 사업을 하는 때에 필요하다고 인정하는 경우 재정 등의 지원을 할 수 있다.
제24조(지정 등의 취소 등) ① 식품의약품안전처장은 제8조 또는 제12조에 따라 동물실험시설 또는 실험동물공급자로 등록한 자가 다음 각 호의 어느 하나에 해당하는 때에는 해당 시설 또는 공급자의 등록을 취소하거나 6개월 이내의 범위에서 시설의 운영 또는 영업을 정지할 수 있다. <개정 2013.3.23>
1. 속임수나 그 밖의 부정한 방법으로 등록한 것이 확인된 경우
2. 동물실험시설로부터 또는 실험동물공급과 관련하여 국민의 건강 또는 공익을 해하는 질병 등 재해가 발생한 경우
3. 제11조 또는 제16조에 따른 지도ㆍ감독을 따르지 아니하거나 기준에 미달한 경우
② 식품의약품안전처장은 제10조 또는 제15조에 따라 우수동물실험시설 또는 우수실험동물생산시설로 지정을 받은 자가 다음 각 호의 어느 하나에 해당하는 때에는 그 지정을 취소하거나 또는 6개월 이내의 범위에서 시설의 운영을 정지할 수 있다. <개정 2013.3.23>
1. 속임수나 그 밖의 부정한 방법으로 지정을 받은 것이 확인된 경우
2. 우수동물실험시설 또는 우수실험동물생산시설로부터 국민의 건강 또는 공익을 해하는 질병 등 재해가 발생한 경우
3. 제11조 또는 제16조에 따른 지도ㆍ감독을 따르지 아니하거나 기준에 미달한 경우
③ 제1항 및 제2항에 따른 처분의 기준은 총리령으로 정한다. <개정 2010.1.18, 2013.3.23>
제25조(결격사유) 다음 각 호의 어느 하나에 해당하는 자는 동물실험시설의 운영자 또는 관리자 및 실험동물공급자가 될 수 없다.
1. 「정신보건법」제3조제1호에 따른 정신질환자. 다만, 전문의가 운영자 또는 관리자로서 적합하다고 인정하는 사람은 그러하지 아니하다.
2. 금치산자ㆍ한정치산자로서 복권되지 아니한 자
3. 마약이나 그 밖의 유독물질의 중독자
4. 이 법을 위반하여 금고 이상의 실형을 선고받고, 집행이 종료(집행이 종료된 것으로 보는 경우를 포함한다)되거나 집행이 면제된 날부터 2년이 지나지 아니한 자
5. 이 법을 위반하여 금고 이상의 형의 집행유예 선고를 받고 그 유예기간 중에 있는 자
6. 제24조제1항에 따라 시설의 운영정지를 받거나 등록이 취소된 후 2년이 지나지 아니한 자
제26조(청문) 식품의약품안전처장은 제24조에 따라 해당 시설의 등록 취소, 운영정지, 지정 취소 등을 하고자 하는 때에는 미리 청문을 실시하여야 한다. <개정 2013.3.23>
제27조(지도ㆍ감독 등) ① 식품의약품안전처장은 제11조 및 제16조에 따른 지도 및 감독을 위하여 관계 공무원으로 하여금 현장조사를 하게 하거나 필요한 자료의 제출을 요구할 수 있다. <개정 2013.3.23>
② 제1항에 따라 조사를 하는 공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 제시하여야 한다.
제28조(과징금) ① 식품의약품안전처장은 시설의 운영자가 제24조에 해당하는 경우에는 해당 시설의 운영정지에 갈음하여 5천만원 이하의 과징금을 부과할 수 있다. <개정 2013.3.23>
② 제1항에 따라 과징금을 부과하는 위반행위의 정도 등에 따른 과징금의 금액 등에 관하여 필요한 사항은 대통령령으로 정한다.
③ 식품의약품안전처장은 제1항에 따른 과징금을 기한 이내에 납부하지 아니한 때에는 국세 체납처분의 예에 따라 징수한다. <개정 2013.3.23>
제29조(수수료) 다음 각 호의 어느 하나에 해당하는 자는 총리령으로 정하는 바에 따라 수수료를 납부하여야 한다. <개정 2010.1.18, 2013.3.23>
1. 제8조에 따른 등록 또는 제10조에 따른 지정을 받고자 하는 자
2. 제12조에 따른 등록 또는 제15조에 따른 지정을 받고자 하는 자
제30조(벌칙) 제12조제1항 또는 제2항을 위반하여 등록 또는 변경등록을 하지 아니한 자는 500만원 이하의 벌금에 처한다.
제31조(벌칙) 제27조제1항에 따른 현장조사를 정당한 사유 없이 거부ㆍ기피ㆍ방해한 자 또는 자료제출 요구에 응하지 아니하거나 거짓의 자료를 제출한 자는 200만원 이하의 벌금에 처한다.
제32조(양벌규정) 법인의 대표자나 법인 또는 개인의 대리인ㆍ사용인 및 그 밖의 종업원이 그 법인 또는 개인의 업무에 대하여 제31조에 해당하는 행위를 한 때에는 행위자를 벌하는 외에 그 법인 또는 개인에 대하여도 각 해당 조의 벌금형을 과한다. 다만, 법인 또는 개인이 그 위반행위를 방지하기 위하여 해당 업무에 관하여 상당한 주의와 감독을 게을리하지 아니한 경우에는 그러하지 아니하다. <개정 2013.7.30>
제33조(과태료) ① 다음 각 호의 어느 하나에 해당하는 자에게는 100만원 이하의 과태료를 부과한다.
1. 제8조에 따른 등록을 하지 아니한 자
2. 제15조제3항을 위반하여 우수실험동물생산시설 또는 이와 유사한 표지를 부착하거나 이를 홍보한 자
3. 제17조제1항을 위반하여 교육을 받지 아니한 동물실험시설 설치자, 관리자 또는 실험동물공급자
4. 제18조제2항 및 제3항 또는 제19조제1항에 따른 보고를 하지 아니하거나 거짓으로 보고한 자
② 제1항에 따른 과태료는 대통령령으로 정하는 바에 따라 식품의약품안전처장이 부과ㆍ징수한다. <개정 2013.3.23>
③ 삭제 <2013.3.23>
④ 삭제 <2013.3.23>
⑤ 삭제 <2013.3.23>
<제11987호, 2013.7.30>
이 법은 공포한 날부터 시행한다.
뇌연구촉진법
[시행 2013.3.23] [법률 제11680호, 2013.3.23, 일부개정]
제1조(목적) 이 법은 뇌연구 촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성ㆍ발전시키고 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 이바지함을 목적으로 한다.
[전문개정 2010.3.17]
제2조(정의) 이 법에서 사용하는 용어의 뜻은 다음과 같다. <개정 2013.3.23>
1. "뇌연구"란 뇌과학(腦科學), 뇌의약학(腦醫藥學), 뇌공학(腦工學) 및 이와 관련된 모든 분야에 대한 연구를 말한다.
2. "뇌과학"이란 뇌의 신경생물학적 구조, 인지(認知), 사고, 언어심리 및 행동 등의 고등신경(高等神經) 정신활동에 대한 포괄적인 이해를 위한 기초학문을 말한다.
3. "뇌의약학"이란 뇌의 구조 및 기능상의 결함과 뇌의 노화 등으로 인한 신체적ㆍ정신적 질환 및 장애의 원인 규명과 이의 치료, 예방 등에 관한 학문을 말한다.
4. "뇌공학"이란 뇌의 고도의 지적 정보처리 구조와 기능을 이해하고 이의 공학적 응용을 위한 이론 및 기술에 관한 학문을 말한다.
5. "관계 중앙행정기관"이란 미래창조과학부, 교육부, 산업통상자원부, 보건복지부를 말한다.
[전문개정 2010.3.17]
제3조(적용 범위) 뇌연구에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 따른다.
[전문개정 2010.3.17]
제4조(정부 등의 책무) ① 정부는 뇌연구 촉진을 지원하기 위한 시책을 마련하고, 이를 적극적으로 추진하여야 한다.
② 대학, 연구기관, 기업 및 개인 등 뇌연구를 하는 자는 제1항에 따른 시책에 적극 협력하여야 한다.
[전문개정 2010.3.17]
제5조(뇌연구촉진기본계획의 수립) ① 관계 중앙행정기관의 장은 소관별로 뇌연구 촉진을 위한 계획과 전년도 추진 실적을 미래창조과학부장관에게 제출하여야 한다. <개정 2013.3.23>
② 미래창조과학부장관은 제1항에 따라 관계 중앙행정기관의 장이 소관별로 제출한 뇌연구 촉진을 위한 계획을 종합ㆍ조정한 후 「생명공학육성법」 제6조에 따른 생명공학종합정책심의회(이하 "심의회"라 한다)의 심의를 거쳐 뇌연구촉진기본계획(이하 "기본계획"이라 한다)을 수립하고, 이를 관계 중앙행정기관의 장에게 통보하여야 한다. 기본계획을 변경하는 경우에도 또한 같다. <개정 2011.7.21, 2013.3.23>
③ 기본계획에는 다음 각 호의 사항이 포함되어야 한다.
1. 뇌연구의 중장기적 목표 및 내용
2. 뇌연구에 필요한 투자재원(投資財源)의 확대 방안 및 추진계획
3. 교육, 산업, 보건복지, 정보통신, 과학기술 등 각 분야의 뇌연구에 관한 계획
4. 뇌연구에 필요한 인력자원의 개발 및 효율적인 활용에 관한 종합계획
5. 뇌연구 결과의 이용과 보전(保全)에 관한 계획
6. 그 밖에 뇌연구 촉진을 위하여 필요한 중요 사항
[전문개정 2010.3.17]
제6조(뇌연구촉진시행계획의 수립) ① 관계 중앙행정기관의 장은 기본계획에 따라 매년 뇌연구촉진시행계획(이하 "시행계획"이라 한다)을 수립하고 시행하여야 한다.
② 관계 중앙행정기관의 장은 시행계획을 수립하려면 미리 미래창조과학부장관과 협의하여야 한다. <개정 2013.3.23>
③ 미래창조과학부장관은 필요하면 시행계획의 수립에 필요한 기본지침을 작성하여 관계 중앙행정기관의 장에게 통보할 수 있다. <개정 2013.3.23>
④ 시행계획의 수립 및 그 시행에 필요한 사항은 대통령령으로 정한다.
[전문개정 2010.3.17]
제6조의2(뇌연구실무추진위원회) ① 심의회에 상정할 안건을 사전에 심의하기 위하여 미래창조과학부장관 소속으로 뇌연구실무추진위원회를 둘 수 있다. <개정 2013.3.23>
② 제1항의 뇌연구실무추진위원회의 구성, 운영 및 그 밖에 필요한 사항은 대통령령으로 정한다.
[본조신설 2011.7.21]
제7조 삭제 <2011.7.21>
제8조 삭제 <2011.7.21>
제9조(뇌연구 투자의 확대) ① 정부는 제5조제3항제2호의 투자재원의 확대 방안 및 추진계획에 따라 예산의 범위에서 뇌연구 투자를 확대하기 위하여 최대한 노력하여야 한다.
② 미래창조과학부장관은 매년 뇌연구 투자 확대계획을 작성하여 심의회의 심의를 거친 후 「국가과학기술자문회의법」에 따른 국가과학기술자문회의에 보고하여야 한다. <개정 2013.3.23>
[전문개정 2010.3.17]
제10조(연구 및 기술 협력) 정부는 뇌연구와 그 기술 개발에 관한 국제 협력 증진을 위하여 노력하고 선진기술을 도입하기 위한 전문인력 파견, 해외 전문인력 유치 등의 방안을 마련하여야 한다.
[전문개정 2010.3.17]
제11조(공동연구 및 학술활동 촉진) 정부는 뇌연구와 그 기술개발을 효율적으로 육성하기 위하여 학계, 연구기관 및 산업계 간의 공동 연구를 촉진하고 관련 학회 및 학회의 학술활동을 적극 지원하여야 한다.
[전문개정 2010.3.17]
제12조(관계 산업체 지원) 정부는 뇌연구 결과의 산업화를 촉진하기 위하여 신기술제품의 생산을 지원할 수 있다.
[전문개정 2010.3.17]
제13조(기술정보의 수집과 보급) 정부는 뇌연구에 관한 정보를 수집하여 관련 기관에 보급하도록 노력하여야 한다.
[전문개정 2010.3.17]
제14조(뇌연구 추진시책의 마련) 관계 중앙행정기관의 장은 뇌연구를 효율적으로 촉진하기 위하여 다음 각 호의 구분에 따른 시책을 마련한다. <개정 2013.3.23>
1. 미래창조과학부장관: 기본계획의 수립과 시행계획 수립의 지원 및 조정, 뇌 관련 기초기술 및 첨단기술의 개발, 유용한 연구 결과의 이용 및 보전을 위한 연구의 지원, 공공적 성격의 뇌연구 지원체제의 육성, 뇌연구 결과를 정보ㆍ통신 등의 분야에 응용하기 위한 기술의 개발 및 개발기술의 산업화 촉진을 위한 시책
1의2. 교육부장관: 뇌연구를 촉진하기 위한 전문인력의 양성과 뇌과학 기초분야의 연구지원을 위한 시책으로서, 미래창조과학부장관과 협의한 시책
2. 산업통상자원부장관: 뇌연구 결과를 생산 및 산업 공정에 효율적으로 응용하기 위한 응용기술의 개발과 개발기술의 산업화 촉진을 위한 시책
3. 보건복지부장관: 보건ㆍ의료 등에 관련되는 뇌의약(腦醫藥) 연구와 그 결과의 응용기술 개발 및 개발기술의 산업화 촉진을 위한 시책
[전문개정 2010.3.17]
제15조(임상 및 검정) ① 정부는 뇌연구 관련 제품에 대한 임상 및 검정체제를 확립한다.
② 제1항의 임상 및 검정체제 확립에 필요한 사항은 대통령령으로 정한다.
[전문개정 2010.3.17]
제16조(실험지침의 작성ㆍ시행 등) ① 정부는 뇌연구와 그 산업화의 촉진을 위한 실험지침을 작성ㆍ시행하여야 한다.
② 제1항의 실험지침에는 뇌연구와 그 산업화 과정에서 예견될 수 있는 생물학적 위험성, 인간에게 미치는 악영향 및 윤리적 문제의 발생을 사전에 방지하기 위하여 필요한 조치 및 안전기준이 마련되어야 한다.
[전문개정 2010.3.17]
제17조(연구소의 설립) ① 뇌 분야에 관한 연구 및 그 이용과 지원에 관한 기능을 수행하고 뇌 분야에서 학계, 연구기관 및 산업계 간의 유기적 협조체제를 유지ㆍ발전시키기 위하여 정부가 출연(出捐)하는 연구소를 설립할 수 있다.
② 제1항에 따른 연구소는 「특정연구기관 육성법」을 적용받는 특정연구기관으로 한다.
[전문개정 2010.3.17]
<제11680호, 2013.3.23>
이 법은 공포한 날부터 시행한다.
유전자변형생물체의 국가 간 이동 등에 관한 법률
[시행 2013.3.23] [법률 제11690호, 2013.3.23, 타법개정]
제1조(목적) 이 법은 「바이오안전성에 관한 카르타헤나 의정서」의 시행에 필요한 사항과 유전자변형생물체의 개발ㆍ생산ㆍ수입ㆍ수출ㆍ유통 등에 관한 안전성의 확보를 위하여 필요한 사항을 정함으로써 유전자변형생물체로 인한 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 미치는 위해(危害)를 사전에 방지하고 국민생활의 향상 및 국제협력을 증진함을 목적으로 한다.
[전문개정 2007.12.21]
제2조(정의) 이 법에서 사용하는 용어의 뜻은 다음과 같다.
1. "유전자변형생물체"란 다음 각 목의 현대생명공학기술을 이용하여 얻어진 생물체로서 새롭게 조합된 유전물질을 포함하고 있는 생물체를 말한다.
가. 인위적으로 유전자를 재조합하거나 유전자를 구성하는 핵산을 세포 또는 세포 내 소기관으로 직접 주입하는 기술
나. 분류학에 의한 과(科)의 범위를 넘는 세포융합으로서 자연상태의 생리적 증식이나 재조합이 아니고 전통적인 교배나 선발(選發)에서 사용되지 아니하는 기술
2. "환경 방출"이란 유전자변형생물체를 시설, 장치, 그 밖의 구조물을 이용하여 밀폐하지 아니하고 의도적으로 자연환경에 노출되게 하는 것을 말한다.
3. "관계중앙행정기관"이란 유전자변형생물체의 개발ㆍ생산ㆍ수입ㆍ수출ㆍ판매ㆍ운반ㆍ보관 등(이하 "수출입등"이라 한다)의 업무에 따라 대통령령으로 정하는 기준에 해당하는 중앙행정기관을 말한다.
[전문개정 2007.12.21]
제2조(정의) 이 법에서 사용하는 용어의 뜻은 다음과 같다. <개정 2012.12.11>
1. "생물체"란 유전물질을 전달 또는 복제할 수 있는 생물학적 존재(생식능력이 없는 생물체, 바이러스 및 바이로이드를 포함한다)를 말한다.
2. "유전자변형생물체"란 다음 각 목의 현대생명공학기술을 이용하여 새롭게 조합된 유전물질을 포함하고 있는 생물체를 말한다.
가. 인위적으로 유전자를 재조합하거나 유전자를 구성하는 핵산을 세포 또는 세포 내 소기관으로 직접 주입하는 기술
나. 분류학에 의한 과(科)의 범위를 넘는 세포융합기술
3. "후대교배종"이란 제7조의2에 따라 위해성심사를 거친 유전자변형식물끼리 교배하여 얻은 유전자변형식물을 말한다.
4. "환경 방출"이란 유전자변형생물체를 시설, 장치, 그 밖의 구조물을 이용하여 밀폐하지 아니하고 의도적으로 자연환경에 노출되게 하는 것을 말한다.
5. "관계 중앙행정기관"이란 다음 각 목의 어느 하나에 해당하는 업무를 관장하는 중앙행정기관으로서 대통령령으로 정하는 중앙행정기관을 말한다.
가. 유전자변형생물체의 개발·생산·수입(휴대품 또는 우편물로 수입하는 경우를 포함한다. 이하 같다)·수출·판매·운반·보관·이용 등(이하 "수출입등"이라 한다)에 관한 업무
나. 바이오안전성에 기반한 유전자변형생물체의 연구개발과 관련 산업의 건전한 발전을 촉진하는 업무
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제2조
제3조(적용 범위) 인체용 의약품으로 사용되는 유전자변형생물체에 대하여는 이 법을 적용하지 아니한다.
[전문개정 2007.12.21]
제4조(다른 법률과의 관계) 유전자변형생물체를 수출입등을 할 때에 그 취급 및 안전관리에 관하여 다른 법률에 특별한 규정이 있는 경우 외에는 이 법으로 정하는 바에 따른다.
[전문개정 2007.12.21]
제5조(국가 등의 책무) 국가와 지방자치단체는 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 대하여 유전자변형생물체가 끼칠 위해를 방지하기 위하여 필요한 시책을 마련하여야 한다.
[전문개정 2007.12.21]
제5조(국가 등의 책무) ①국가와 지방자치단체는 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 대하여 유전자변형생물체가 끼칠 위해를 방지하기 위하여 필요한 시책을 마련하여야 한다. <개정 2012.12.11>
② 유전자변형생물체의 수출입등을 하는 자는 국민 건강과 환경에 위해가 발생하지 아니하도록 유전자변형생물체를 안전하게 관리하여야 한다. <신설 2012.12.11>
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제5조
제6조(국가책임기관 등) ① 「바이오안전성에 관한 카르타헤나 의정서」(이하 "의정서"라 한다) 제19조에 따른 국가연락기관은 외교부로 하고, 국가책임기관은 산업통상자원부로 한다. <개정 2008.2.29, 2013.3.23>
② 국가책임기관의 장은 대통령령으로 정하는 바에 따라 국가책임기관으로서 의정서를 이행하는 데에 필요한 업무를 수행한다.
[전문개정 2007.12.21]
제6조(국가책임기관 등) ① 「바이오안전성에 관한 카르타헤나 의정서」(이하 "의정서"라 한다) 제19조에 따른 국가연락기관은 외교부로 하고, 국가책임기관은 산업통상자원부로 한다. <개정 2008.2.29, 2013.3.23>
② 제1항에 따른 국가책임기관(이하 "국가책임기관"이라 한다)의 장은 대통령령으로 정하는 바에 따라 국가책임기관으로서 의정서를 이행하는 데에 필요한 업무를 수행한다. <개정 2012.12.11>
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제6조
제7조(유전자변형생물체 안전관리계획의 수립ㆍ시행) ① 관계중앙행정기관의 장은 소관별로 유전자변형생물체 안전관리계획(이하 "안전관리계획"이라 한다)을 수립ㆍ시행하여야 한다.
② 안전관리계획에는 다음 각 호의 사항이 포함되어야 한다.
1. 유전자변형생물체의 수출입등에 따른 안전관리의 기본방침에 관한 사항
2. 유전자변형생물체를 취급하는 시설 및 작업 종사자의 안전에 관한 사항
3. 유전자변형생물체에 관한 기술 개발 및 지원에 관한 사항
4. 그 밖에 유전자변형생물체의 안전관리와 관련한 중요 사항
③ 관계중앙행정기관의 장은 안전관리계획을 수립ㆍ시행하려면 미리 제31조에 따른 바이오안전성위원회의 심의를 거쳐야 한다.
④ 관계중앙행정기관의 장은 안전관리계획의 시행을 위한 세부시행계획을 수립ㆍ시행하여야 하며, 이를 위하여 필요하면 안전관리지침을 정하여 고시할 수 있다.
[전문개정 2007.12.21]
제7조(유전자변형생물체 안전관리계획의 수립·시행) ① 관계 중앙행정기관의 장은 소관별로 유전자변형생물체 안전관리계획(이하 "안전관리계획"이라 한다)을 수립·시행하여야 한다. <개정 2012.12.11>
② 안전관리계획에는 다음 각 호의 사항이 포함되어야 한다.
1. 유전자변형생물체의 수출입등에 따른 안전관리의 기본방침에 관한 사항
2. 유전자변형생물체를 취급하는 시설 및 작업 종사자의 안전에 관한 사항
3. 유전자변형생물체에 관한 기술 개발 및 지원에 관한 사항
4. 그 밖에 유전자변형생물체의 안전관리와 관련한 중요 사항
③ 관계 중앙행정기관의 장은 안전관리계획을 수립·시행하려면 미리 제31조에 따른 바이오안전성위원회의 심의를 거쳐야 한다. <개정 2012.12.11>
④ 관계 중앙행정기관의 장은 안전관리계획의 시행을 위한 세부시행계획을 수립·시행하여야 하며, 이를 위하여 필요하면 안전관리지침을 정하여 고시할 수 있다. <개정 2012.12.11>
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제7조
제7조의2(신규 유전자변형생물체에 대한 위해성심사) ① 다음 각 호의 어느 하나에 해당하는 자는 각각 제8조, 제12조 및 제22조의4에 따른 승인을 받기 전까지 대통령령으로 정하는 위해성심사에 필요한 자료를 갖추어 대통령령으로 정하는 바에 따라 관계 중앙행정기관의 장으로부터 위해성심사를 받아야 한다. 다만, 제2호 및 제3호에 해당하는 자가 제1호에 따라 수입 시에 위해성심사를 받은 신규 유전자변형생물체를 생산하거나 이용하는 경우에는 그러하지 아니하다.
1. 제8조에 따라 신규 유전자변형생물체를 수입하려는 자
2. 제12조에 따라 신규 유전자변형생물체를 생산하려는 자
3. 제22조의4에 따라 신규 유전자변형생물체를 이용하려는 자
② 신규 유전자변형생물체를 개발한 자는 개발된 신규 유전자변형생물체에 대하여 제1항에 따른 위해성심사 이전에 관계 중앙행정기관의 장으로부터 위해성심사를 받을 수 있다. 이 경우 관계 중앙행정기관의 장은 신규 유전자변형생물체를 수입, 생산 또는 이용하려는 자가 제1항에 따라 받는 위해성심사를 대통령령으로 정하는 바에 따라 약식으로 하거나 면제할 수 있다.
③ 관계 중앙행정기관의 장은 제1항 및 제2항에 따른 위해성심사를 하는 경우 유전자변형생물체가 인체에 미치는 영향에 대하여는 보건복지부장관과 협의하여야 하며, 환경 방출되거나 환경 방출될 우려가 있는 유전자변형생물체의 경우에는 다음 각 호의 구분에 따른 기관의 장과 협의하여야 한다. <개정 2013.3.23>
1. 작물재배 환경에 미치는 영향: 농림축산식품부
2. 자연생태계에 미치는 영향: 환경부
3. 수산 환경 및 해양생태계에 미치는 영향: 해양수산부
④ 유전자변형생물체의 위해성심사의 기준·방법, 그 밖에 필요한 사항은 유전자변형생물체의 환경 방출 가능성, 이용 목적 및 후대교배종 여부 등을 고려하여 관계 중앙행정기관의 장이 정하여 고시한다.
⑤ 관계 중앙행정기관의 장은 유전자변형생물체의 위해성심사 업무를 대통령령으로 정하는 바에 따라 지정하는 자(이하 "위해성심사대행기관"이라 한다)로 하여금 대행하게 할 수 있다.
⑥ 제5항에도 불구하고 해양수산부장관은 제3항제3호의 수산 환경 및 해양생태계에 미치는 영향에 대한 위해성심사 업무를 대통령령으로 정하는 바에 따라 위임 또는 위탁할 수 있다. <개정 2013.3.23>
⑦ 관계 중앙행정기관의 장 및 제6항에 따라 위임 또는 위탁을 받은 자가 유전자변형생물체의 위해성심사를 하였을 때에는 그 유전자변형생물체에 관한 정보를 대통령령으로 정하는 바에 따라 국민에게 알려야 한다.
[본조신설 2012.12.11]
[시행일 : 2013.12.12] 제7조의2
제8조(수입승인 등) ① 유전자변형생물체를 수입(휴대하여 수입하는 경우를 포함한다. 이하 같다)하려는 자는 대통령령으로 정하는 바에 따라 관계중앙행정기관의 장의 승인을 받아야 한다. 승인을 받은 사항을 변경하려는 경우에도 또한 같다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려는 경우에는 이를 신고하여야 한다.
② 환경 방출로 사용되는 유전자변형생물체를 수입하려는 자는 제1항에도 불구하고 국가책임기관의 장을 거쳐 관계중앙행정기관의 장에게 수입승인을 신청하여야 한다. 이 경우 국가책임기관의 장과 관계중앙행정기관의 장은 대통령령으로 정하는 바에 따라 의정서 제8조부터 제10조까지에 따른 그 유전자변형생물체의 국가간 이동에 필요한 절차를 따라야 한다.
③ 제1항 및 제2항에 따라 승인을 신청하는 자는 해당 유전자변형생물체를 생산하거나 수출하는 자가 작성한 위해성평가서와 유전자변형생물체를 수출하려는 자가 속한 국가의 정부기관이 발행하는 위해성심사서를 제출하여야 한다.
④ 제3항에도 불구하고 유전자변형생물체에 대한 위해성심사서를 발행할 수 있는 정부기관이 없거나 그 밖에 대통령령으로 정하는 사유가 있는 경우에는 관계중앙행정기관의 장이 대통령령으로 정하는 바에 따라 지정하는 위해성평가기관(이하 "위해성평가기관"이라 한다)이 작성한 위해성평가서를 제출하여야 한다.
⑤ 관계중앙행정기관의 장은 제1항 및 제2항에 따른 승인신청을 받으면 해당 유전자변형생물체의 위해성을 심사하고 그 유전자변형생물체가 국내 생물다양성의 가치에 미칠 사회ㆍ경제적 영향을 고려하여 승인 여부를 결정하여야 한다.
⑥ 관계중앙행정기관의 장은 제5항에 따른 승인 여부를 국가책임기관의 장에게 통보하여야 한다.
⑦ 제3항에 따른 위해성평가서의 평가항목과 평가기준 등에 관하여 필요한 사항은 관계중앙행정기관의 장이 정하여 고시한다.
[전문개정 2007.12.21]
제8조(수입승인 등) ① 유전자변형생물체를 수입하려는 자는 대통령령으로 정하는 바에 따라 관계 중앙행정기관의 장의 승인을 받아야 한다.
② 환경 방출로 사용되는 유전자변형생물체를 수입하려는 자는 제1항에도 불구하고 국가책임기관의 장을 거쳐 관계 중앙행정기관의 장에게 수입승인을 신청하여야 한다. 이 경우 국가책임기관의 장과 관계 중앙행정기관의 장은 대통령령으로 정하는 바에 따라 의정서 제8조부터 제10조까지에 따른 그 유전자변형생물체의 국가간 이동에 필요한 절차를 따라야 한다.
③ 제1항에 따라 승인을 받은 자는 승인받은 사항을 변경하려면 변경승인을 받아야 한다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려면 변경신고를 하여야 한다.
④ 관계 중앙행정기관의 장은 수입승인 여부를 결정할 때에는 유전자변형생물체가 국내 생물다양성의 가치에 미칠 사회적·경제적 영향을 고려하여야 한다.
⑤ 관계 중앙행정기관의 장은 제1항 및 제3항에 따른 승인 여부 및 신고 내용을 국가책임기관의 장에게 통보하여야 한다.
⑥ 제1항 및 제3항에 따른 승인, 신고의 절차 및 방법에 관하여 필요한 사항은 대통령령으로 정한다.
[전문개정 2012.12.11]
[시행일 : 2013.12.12] 제8조
제9조(시험ㆍ연구용 등의 유전자변형생물체의 수입) ① 제8조에도 불구하고 시험ㆍ연구용으로 사용하거나 박람회ㆍ전시회에 출품하기 위하여 유전자변형생물체를 수입하려는 자는 대통령령으로 정하는 바에 따라 관계중앙행정기관의 장의 승인을 받거나 관계중앙행정기관의 장에게 신고하여야 한다.
② 관계중앙행정기관의 장은 제1항에 따른 승인 여부 및 신고내용을 국가책임기관의 장에게 통보하여야 한다.
[전문개정 2007.12.21]
제9조(시험·연구용 등의 유전자변형생물체의 수입) ① 제8조제1항에도 불구하고 시험·연구용으로 사용하거나 박람회·전시회에 출품하기 위하여 유전자변형생물체를 수입하려는 자는 관계 중앙행정기관의 장에게 신고하여야 한다. 다만, 다음 각 호의 어느 하나에 해당하는 유전자변형생물체의 경우에는 승인을 받아야 한다. <개정 2012.12.11>
1. 분류학에 의한 종(種)의 이름까지 명시되어 있지 아니하고 인체병원성 여부가 밝혀지지 아니한 미생물을 이용하여 얻어진 유전자변형생물체
2. 척추동물에 대하여 보건복지부장관이 고시하는 단백성 독소를 생산할 능력을 가진 유전자변형생물체
3. 의도적으로 도입된 약제내성 유전자를 가진 유전자변형생물체. 다만, 보건복지부장관이 고시하는 약제내성 유전자를 가진 유전자변형생물체는 제외한다.
4. 국민보건상 국가관리가 필요하다고 보건복지부장관이 고시하는 병원성미생물을 이용하여 얻어진 유전자변형생물체
② 제1항에 따라 신고한 자는 신고한 사항을 변경하려면 변경신고를 하여야 한다. <신설 2012.12.11>
③ 제1항 및 제2항에 따른 수입승인 및 신고에 관하여는 제8조제3항 및 제5항을 준용한다. <개정 2012.12.11>
④ 제1항부터 제3항까지에 따른 승인, 신고의 절차 및 방법에 관하여 필요한 사항은 대통령령으로 정한다. <신설 2012.12.11>
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제9조
제10조(우편물로 수입되는 유전자변형생물체의 수입검사) ① 세관장은 국제우편물에 제8조 또는 제9조에 따른 승인을 받지 아니하거나 신고를 하지 아니한 유전자변형생물체가 담겨 있거나 담겨 있다고 의심되면 지체 없이 그 사실을 관계중앙행정기관의 장에게 통보하여야 한다.
② 제1항에 따라 세관장이 통지하면 관계중앙행정기관의 장은 해당 국제우편물을 검사한 후 폐기, 반송 등 적절한 조치를 하여야 한다.
③ 유전자변형생물체가 담겨 있는 국제우편물을 받은 자는 그 유전자변형생물체가 제8조 또는 제9조에 따른 승인을 받지 아니하거나 신고를 하지 아니한 것임을 알았을 때에는 지체 없이 관계중앙행정기관의 장에게 이를 신고하고, 관계중앙행정기관의 장이 명하는 바에 따라 처리하여야 한다.
[전문개정 2007.12.21]
제10조(수입검사) ① 관계 중앙행정기관의 장은 수입되는 유전자변형생물체(제9조제1항 본문에 따라 신고한 유전자변형생물체는 제외한다)가 제8조 또는 제9조에 따른 승인 또는 신고 내용에 맞는지 등을 확인하기 위하여 통관절차 완료 전에 유전자변형생물체를 검사할 수 있다. <신설 2012.12.11>
② 제1항에도 불구하고 세관장은 국제우편물에 제8조 또는 제9조에 따른 승인을 받지 아니하거나 신고를 하지 아니한 유전자변형생물체가 담겨 있거나 담겨 있다고 의심되면 지체 없이 그 사실을 관계 중앙행정기관의 장에게 통보하여야 한다. <개정 2012.12.11>
③ 제2항에 따라 세관장이 통지하면 관계 중앙행정기관의 장은 해당 국제우편물을 검사한 후 폐기, 반송 등 적절한 조치를 하여야 한다. <개정 2012.12.11>
④ 유전자변형생물체가 담겨 있는 국제우편물을 받은 자는 그 유전자변형생물체가 제8조 또는 제9조에 따른 승인을 받지 아니하거나 신고를 하지 아니한 것임을 알았을 때에는 지체 없이 관계 중앙행정기관의 장에게 이를 신고하고, 관계 중앙행정기관의 장이 명하는 바에 따라 처리하여야 한다. <개정 2012.12.11>
⑤ 제1항부터 제4항까지에 따른 검사의 대상, 방법에 관하여 필요한 사항은 대통령령으로 정한다. <신설 2012.12.11>
[전문개정 2007.12.21]
[제목개정 2012.12.11]
[시행일 : 2013.12.12] 제10조
제11조(수입항구 등의 지정) ① 국가책임기관의 장은 유전자변형생물체의 안전관리를 위하여 필요하다고 인정하면 관계중앙행정기관의 장과 협의하여 유전자변형생물체를 수입하는 항구ㆍ공항 등을 지정할 수 있다.
② 국가책임기관의 장은 제1항에 따라 항구ㆍ공항 등을 지정하는 경우에는 지체 없이 이를 공고하여야 한다.
[전문개정 2007.12.21]
제11조(수입항구 등의 지정) ① 국가책임기관의 장은 유전자변형생물체의 안전관리를 위하여 필요하다고 인정하면 관계 중앙행정기관의 장과 협의하여 유전자변형생물체를 수입하는 항구·공항 등을 지정할 수 있다. <개정 2012.12.11>
② 국가책임기관의 장은 제1항에 따라 항구·공항 등을 지정하는 경우에는 지체 없이 이를 공고하여야 한다.
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제11조
제12조(생산승인 등) ① 유전자변형생물체를 생산하려는 자는 대통령령으로 정하는 바에 따라 관계중앙행정기관의 장의 승인을 받아야 한다. 승인을 받은 사항을 변경하려는 경우에도 또한 같다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려는 경우에는 이를 신고하여야 한다.
② 제1항에 따른 승인을 신청하는 자는 제8조제3항에 따른 위해성평가서를 제출하여야 한다.
③ 유전자변형생물체를 생산하려는 경우에는 제8조제5항부터 제7항까지의 규정을 준용한다.
[전문개정 2007.12.21]
제12조(생산승인 등) ① 유전자변형생물체를 생산하려는 자는 대통령령으로 정하는 바에 따라 관계 중앙행정기관의 장의 승인을 받아야 한다.
② 제1항에 따라 승인을 받은 자는 승인받은 사항을 변경하려면 변경승인을 받아야 한다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려면 변경신고를 하여야 한다.
③ 제1항 및 제2항에 따른 생산승인 및 신고에 관하여는 제8조제4항 및 제5항을 준용한다. 이 경우 "수입"은 "생산"으로 본다.
④ 제1항 및 제2항에 따른 승인, 신고의 절차 및 방법에 관하여 필요한 사항은 대통령령으로 정한다.
[전문개정 2012.12.11]
[시행일 : 2013.12.12] 제12조
제13조(위해성 심사 절차 및 대행 등) ① 관계중앙행정기관의 장은 제8조제5항 또는 제12조제3항에 따라 유전자변형생물체의 위해성 심사를 하는 경우에 그 유전자변형생물체가 인체에 미치는 영향에 대하여는 보건복지부장관과, 환경 방출되거나 환경 방출될 우려가 있는 유전자변형생물체의 경우에는 다음 각 호에서 정하는 기관의 장과 미리 협의하여야 한다. <개정 2008.2.29, 2013.3.23>
1. 해당 유전자변형생물체가 자연생태계에 미치는 영향 : 환경부장관
2. 작물재배 환경에 미치는 영향 : 농림축산식품부장관
3. 해양생태계에 미치는 영향 : 해양수산부장관
② 제8조제5항 또는 제12조제3항에 따른 위해성 심사의 기준ㆍ방법, 그 밖에 필요한 사항은 관계중앙행정기관의 장이 정하여 고시한다.
③ 관계중앙행정기관의 장은 제8조제5항 또는 제12조제3항에 따른 유전자변형생물체의 위해성 심사 업무를 대통령령으로 정하는 바에 따라 지정하는 자(이하 "위해성심사대행기관"이라 한다)로 하여금 대행하게 할 수 있다.
④ 관계중앙행정기관의 장은 제8조 또는 제12조에 따라 유전자변형생물체의 수입 또는 생산 승인을 할 때에는 미리 그 유전자변형생물체에 관한 정보를 국민에게 알리고 의견을 수렴하여야 한다.
[전문개정 2007.12.21]
제13조 삭제 <2012.12.11>
[시행일 : 2013.12.12] 제13조
제14조(수입 또는 생산의 금지 등) ① 관계중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 유전자변형생물체(제2호의 생물체를 포함한다)의 수입이나 생산을 금지하거나 제한할 수 있다.
1. 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다고 인정하는 유전자변형생물체
2. 제1호에 해당하는 유전자변형생물체와 교배하여 생산된 생물체
3. 국내 생물다양성의 가치와 관련하여 사회ㆍ경제적으로 부정적인 영향을 미치거나 미칠 우려가 있다고 인정하는 유전자변형생물체
② 관계중앙행정기관의 장은 제1항에 따라 유전자변형생물체의 수입이나 생산을 금지하거나 제한하는 경우에는 국가책임기관의 장에게 통보하여야 한다.
③ 국가책임기관의 장은 제1항 각 호에 따라 수입이나 생산을 금지하거나 제한하는 생물체의 품목 등에 관하여 필요한 사항을 공고하여야 한다.
[전문개정 2007.12.21]
제14조(수입 또는 생산의 금지 등) ① 관계 중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 생물체의 수입이나 생산을 금지하거나 제한할 수 있다. <개정 2012.12.11>
1. 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다고 인정하는 유전자변형생물체
2. 제1호에 해당하는 유전자변형생물체와 교배하여 생산된 생물체
3. 국내 생물다양성의 가치와 관련하여 사회·경제적으로 부정적인 영향을 미치거나 미칠 우려가 있다고 인정하는 유전자변형생물체
② 관계 중앙행정기관의 장은 제1항에 따라 유전자변형생물체의 수입이나 생산을 금지하거나 제한하는 경우에는 국가책임기관의 장에게 통보하여야 한다. <개정 2012.12.11>
③ 국가책임기관의 장은 제1항 각 호에 따라 수입이나 생산을 금지하거나 제한하는 생물체의 품목 등에 관하여 필요한 사항을 공고하여야 한다.
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제14조
제15조(위해성이 없는 유전자변형생물체) ① 국가책임기관의 장은 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해가 발생할 우려가 없는 유전자변형생물체에 대하여 그 품목 등을 고시하여야 한다.
② 국가책임기관의 장은 제1항에 따라 유전자변형생물체의 품목 등을 고시할 때에는 미리 제31조에 따른 바이오안전성위원회의 심의를 거쳐야 한다.
③ 제1항에 따라 고시된 품목의 유전자변형생물체를 수입하거나 생산하려는 자는 제8조 또는 제12조에도 불구하고 국가책임기관의 장에게 신고하여야 한다.
[전문개정 2007.12.21]
제15조 삭제 <2012.12.11>
[시행일 : 2013.12.12] 제15조
제16조(「대외무역법」에 따른 수입승인 의제 등) ① 제8조 및 제9조에 따라 관계중앙행정기관의 장이 수입승인을 하거나 신고를 수리한 유전자변형생물체에 대하여는 「대외무역법」 제11조제2항에 따른 산업통상자원부장관의 수입승인을 받은 것으로 본다. <개정 2008.2.29, 2013.3.23>
② 제15조제3항 및 제20조에 따른 유전자변형생물체를 수입하거나 수출하려는 자가 국가책임기관의 장에게 그 내용을 신고하거나 통보한 유전자변형생물체에 대하여는 「대외무역법」 제11조제2항에 따른 산업통상자원부장관의 수입승인이나 수출승인을 받은 것으로 본다. <개정 2008.2.29, 2013.3.23>
[전문개정 2007.12.21]
제16조(「대외무역법」에 따른 수입승인 의제 등) ① 제8조 및 제9조에 따라 관계 중앙행정기관의 장이 수입승인을 하거나 신고를 수리한 유전자변형생물체에 대하여는 「대외무역법」 제11조제2항에 따른 산업통상자원부장관의 수입승인을 받은 것으로 본다. <개정 2008.2.29, 2012.12.11, 2013.3.23>
② 제20조에 따라 유전자변형생물체를 수출하려는 자가 관계 중앙행정기관의 장에게 그 내용을 통보한 유전자변형생물체에 대하여는 「대외무역법」 제11조제2항에 따른 산업통상자원부장관의 수출승인을 받은 것으로 본다. <개정 2008.2.29, 2012.12.11, 2013.3.23>
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제16조
제17조(승인취소) ① 관계중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 경우에는 제8조, 제9조 또는 제12조에 따른 유전자변형생물체의 수입승인이나 생산승인을 취소할 수 있다. 다만, 제1호 또는 제2호에 해당하는 경우에는 수입승인이나 생산승인을 취소하여야 한다.
1. 수입승인이나 생산승인을 받은 유전자변형생물체가 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다는 사실이 밝혀진 경우
2. 속임수나 그 밖의 부정한 방법으로 수입승인이나 생산승인을 받은 경우
3. 수입승인이나 생산승인을 받은 유전자변형생물체를 승인을 받은 용도와 다르게 사용하는 경우
4. 제8조제1항 또는 제12조제1항을 위반하여 변경승인을 받지 아니하거나 변경신고를 하지 아니하고 유전자변형생물체를 수입하거나 생산한 경우
5. 제24조제1항 또는 제2항을 위반하여 유전자변형생물체의 종류 등의 표시를 하지 아니한 경우 또는 거짓으로 표시하거나 표시를 임의로 변경 또는 삭제한 경우
6. 제25조제1항을 위반하여 취급관리기준을 지키지 아니한 경우
7. 제26조를 위반하여 유전자변형생물체의 수출입등에 관한 기록을 작성ㆍ보관하지 아니한 경우
8. 제27조제2항을 위반하여 유전자변형생물체의 부정적인 영향을 알면서도 관계중앙행정기관의 장이나 국가책임기관의 장에게 그 내용을 통보하지 아니한 경우
9. 정당한 사유 없이 제36조제1항에 따른 보고나 자료 또는 시료(試料)의 제출을 거부하거나 출입ㆍ검사를 거부ㆍ방해 또는 기피한 경우
10. 그 밖에 대통령령으로 정하는 사유에 해당하는 경우
② 관계중앙행정기관의 장은 제1항에 따라 수입승인이나 생산승인을 취소한 경우에는 지체 없이 국가책임기관의 장에게 통보하여야 한다.
[전문개정 2007.12.21]
제17조(승인취소) ① 관계 중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 경우에는 제8조, 제9조 또는 제12조에 따른 유전자변형생물체의 수입승인이나 생산승인을 취소할 수 있다. 다만, 제1호 또는 제2호에 해당하는 경우에는 수입승인이나 생산승인을 취소하여야 한다. <개정 2012.12.11>
1. 수입승인이나 생산승인을 받은 유전자변형생물체가 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다는 사실이 밝혀진 경우
2. 속임수나 그 밖의 부정한 방법으로 수입승인이나 생산승인을 받은 경우
3. 수입승인이나 생산승인을 받은 유전자변형생물체를 승인을 받은 용도와 다르게 사용하는 경우
4. 제8조제3항, 제9조제3항 또는 제12조제2항을 위반하여 변경승인을 받지 아니하거나 변경신고를 하지 아니하고 유전자변형생물체를 수입하거나 생산한 경우
5. 제24조제1항 또는 제2항을 위반하여 유전자변형생물체의 종류 등의 표시를 하지 아니한 경우 또는 거짓으로 표시하거나 표시를 임의로 변경 또는 삭제한 경우
6. 제25조제1항을 위반하여 취급관리기준을 지키지 아니한 경우
7. 제26조를 위반하여 유전자변형생물체의 수출입등에 관한 기록을 작성·보관하지 아니한 경우
8. 제27조제2항을 위반하여 유전자변형생물체의 부정적인 영향을 알면서도 관계 중앙행정기관의 장이나 국가책임기관의 장에게 그 내용을 통보하지 아니한 경우
9. 정당한 사유 없이 제36조제1항에 따른 보고나 자료 또는 시료(試料)의 제출을 거부하거나 출입·검사를 거부·방해 또는 기피한 경우
10. 그 밖에 대통령령으로 정하는 사유에 해당하는 경우
② 관계 중앙행정기관의 장은 제1항에 따라 수입승인이나 생산승인을 취소한 경우에는 지체 없이 국가책임기관의 장에게 통보하여야 한다. <개정 2012.12.11>
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제17조
제18조(재심사) ① 제8조ㆍ제12조 및 제17조제1항에 따른 처분에 불복하는 자는 대통령령으로 정하는 바에 따라 관계중앙행정기관의 장에게 재심사를 요청할 수 있다.
② 관계중앙행정기관의 장은 제1항에 따른 재심사를 요청받은 경우에는 국가책임기관의 장과 협의하고 제31조에 따른 바이오안전성위원회의 심의를 거쳐 재심사에 대한 결정을 하여야 한다.
[전문개정 2007.12.21]
제18조(재심사) ① 제8조·제12조 및 제17조제1항에 따른 처분에 불복하는 자는 대통령령으로 정하는 바에 따라 관계 중앙행정기관의 장에게 재심사를 요청할 수 있다. <개정 2012.12.11>
② 관계 중앙행정기관의 장은 제1항에 따른 재심사를 요청받은 경우에는 제31조에 따른 바이오안전성위원회의 심의를 거쳐 재심사에 대한 결정을 하여야 한다. <개정 2012.12.11>
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제18조
제19조(폐기ㆍ반송 등의 명령) ① 관계중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 유전자변형생물체의 소유자에게 대통령령으로 정하는 바에 따라 일정한 기간을 정하여 그 유전자변형생물체의 폐기ㆍ반송 등을 명할 수 있다.
1. 제8조, 제9조 또는 제12조에 따른 관계중앙행정기관의 장의 승인 또는 변경승인을 받지 아니하거나 관계중앙행정기관의 장에게 신고를 하지 아니한 유전자변형생물체
2. 제14조에 따라 수입이나 생산이 금지되거나 제한된 유전자변형생물체
3. 제17조에 따라 수입승인이나 생산승인이 취소된 유전자변형생물체
② 관계중앙행정기관의 장은 유전자변형생물체의 소유자가 제1항에 따른 폐기ㆍ반송 등의 명령을 따르지 아니한 경우에는 대통령령으로 정하는 바에 따라 그 유전자변형생물체 소유자의 부담으로 소속 공무원에게 직접 폐기ㆍ반송 등을 하게 할 수 있다.
③ 관계중앙행정기관의 장은 수입된 유전자변형생물체에 대하여 제1항에 따른 유전자변형생물체의 폐기ㆍ반송 등을 명하였을 때에는 관세청장에게 그 내용을 통보하여야 한다.
[전문개정 2007.12.21]
제19조
[제19조는 제23조의2로 이동 <2012.12.11>]
[시행일 : 2013.12.12] 제19조
제20조(수출 통보) 유전자변형생물체를 수출하려는 자는 산업통상자원부장관에게 품목, 수량, 수출국가 등 대통령령으로 정하는 사항을 미리 통보하여야 한다. <개정 2008.2.29, 2013.3.23>
[전문개정 2007.12.21]
제20조(수출 통보) 유전자변형생물체를 수출하려는 자는 관계 중앙행정기관의 장에게 품목, 수량, 수출국가 등 대통령령으로 정하는 사항을 미리 통보하여야 한다. <개정 2008.2.29, 2012.12.11>
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제20조
제21조(경유 신고) 유전자변형생물체를 국내를 경유하여 다른 국가로 수출하려는 자는 국가책임기관의 장에게 품목, 수량, 수출국가, 수입국가 등 대통령령으로 정하는 사항을 신고하여야 한다.
[전문개정 2007.12.21]
제21조(경유 신고) 유전자변형생물체를 국내의 항구, 공항 또는 대통령령으로 정하는 장소에서 하역한 후 다른 국가로 수출하려는 자는 관계 중앙행정기관의 장에게 품목, 수량, 수출국가, 수입국가 등 대통령령으로 정하는 사항을 신고하여야 한다. <개정 2012.12.11>
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제21조
제22조(연구시설의 설치ㆍ운영허가 등) ① 유전자변형생물체를 개발하거나 이를 이용하여 실험을 하는 시설(이하 "연구시설"이라 한다)을 설치ㆍ운영하려는 자는 대통령령으로 정하는 바에 따라 연구시설의 안전관리 등급별로 관계중앙행정기관의 장의 허가를 받거나 관계중앙행정기관의 장에게 신고를 하여야 한다. 허가받은 사항을 변경하려는 경우에도 허가를 받아야 한다. 다만, 허가받은 사항 중 대통령령으로 정하는 경미한 사항을 변경하려는 경우에는 대통령령으로 정하는 바에 따라 신고하여야 한다.
② 관계중앙행정기관의 장은 제1항에 따른 연구시설의 설치ㆍ운영의 허가 여부 및 신고내용을 국가책임기관의 장에게 통보하여야 한다.
③ 제1항에 따라 연구시설의 설치ㆍ운영에 대한 허가를 받거나 신고를 한 자는 연구시설의 안전관리 등급별로 대통령령으로 정하는 바에 따라 유전자변형생물체를 개발하거나 실험을 할 수 있다. 다만, 위해 가능성이 큰 유전자변형생물체를 개발하거나 실험하는 경우로서 대통령령으로 정하는 경우에는 관계중앙행정기관의 장의 승인을 받아야 한다.
④ 제1항에 따른 연구시설의 안전관리의 등급 및 설치ㆍ운영에 대한 허가기준 등에 관한 사항은 대통령령으로 정한다.
[전문개정 2007.12.21]
제22조(연구시설의 설치·운영) ① 유전자변형생물체를 개발하거나 이를 이용하여 실험을 하는 시설(이하 "연구시설"이라 한다)을 설치·운영하려는 자는 연구시설의 안전관리 등급별로 관계 중앙행정기관의 장의 허가를 받거나 관계 중앙행정기관의 장에게 신고하여야 한다.
② 제1항에 따라 허가를 받은 자는 허가받은 사항을 변경하려면 변경허가를 받아야 한다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려면 변경신고를 하여야 한다.
③ 제1항에 따라 신고한 자는 신고한 사항을 변경하려면 변경신고를 하여야 한다.
④ 제1항에 따라 허가를 받거나 신고를 한 자는 연구시설을 폐쇄하는 경우 그 내용을 관계 중앙행정기관의 장에게 신고하여야 한다.
⑤ 관계 중앙행정기관의 장은 제1항부터 제3항까지에 따른 연구시설의 설치·운영 허가 여부 및 신고 내용과 제4항에 따른 연구시설의 폐쇄 신고 내용을 국가책임기관의 장에게 통보하여야 한다.
⑥ 제1항부터 제3항까지에 따라 연구시설의 설치·운영 허가를 받거나 신고를 한 자는 연구시설의 안전관리 등급에 따라 대통령령으로 정하는 준수사항을 지켜야 한다.
⑦ 제1항부터 제4항까지에 따른 연구시설의 범위, 안전관리 등급, 설치·운영 허가 및 신고의 기준과 절차, 폐쇄 신고의 기준과 절차에 관하여 필요한 사항은 대통령령으로 정한다.
[전문개정 2012.12.11]
[시행일 : 2013.12.12] 제22조
제22조의2(유전자변형생물체의 개발·실험) ① 제22조에 따라 연구시설의 설치·운영 허가를 받거나 신고를 한 자는 대통령령으로 정하는 위해 가능성이 큰 유전자변형생물체를 개발·실험하려는 경우에는 관계 중앙행정기관의 장의 승인을 받아야 한다.
② 제1항에 따라 승인을 받은 자는 승인받은 사항을 변경하려면 변경승인을 받아야 한다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려면 변경신고를 하여야 한다.
③ 관계 중앙행정기관의 장은 제1항 및 제2항에 따른 유전자변형생물체의 개발·실험 승인 여부 및 신고 내용을 국가책임기관의 장에게 통보하여야 한다.
[본조신설 2012.12.11]
[시행일 : 2013.12.12] 제22조의2
제22조의3(생산공정이용시설의 설치·운영) ① 생산공정 중에 유전자변형미생물을 이용하는 시설(이하 "생산공정이용시설"이라 한다)을 설치·운영하려는 자는 생산공정이용시설의 안전관리 등급별로 관계 중앙행정기관의 장의 허가를 받거나 관계 중앙행정기관의 장에게 신고하여야 한다.
② 제1항에 따라 허가를 받은 자는 허가받은 사항을 변경하려면 변경허가를 받아야 한다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려면 변경신고를 하여야 한다.
③ 제1항에 따라 신고한 자는 신고한 사항을 변경하려면 변경신고를 하여야 한다.
④ 제1항에 따라 허가를 받거나 신고를 한 자는 생산공정이용시설을 폐쇄하는 경우 그 내용을 관계 중앙행정기관의 장에게 신고하여야 한다.
⑤ 관계 중앙행정기관의 장은 제1항부터 제3항까지에 따른 생산공정이용시설의 설치·운영 허가 여부 및 신고 내용과 제4항에 따른 생산공정이용시설의 폐쇄 신고 내용을 국가책임기관의 장에게 통보하여야 한다.
⑥ 제1항부터 제4항까지에 따른 생산공정이용시설의 범위, 안전관리 등급, 설치·운영 허가 및 신고의 기준과 절차, 폐쇄 신고의 기준과 절차에 관하여 필요한 사항은 대통령령으로 정한다.
[본조신설 2012.12.11]
[시행일 : 2013.12.12] 제22조의3
제22조의4(유전자변형미생물의 이용) ① 제22조의3에 따라 생산공정이용시설의 설치·운영 허가를 받거나 신고를 한 자는 유전자변형미생물을 생산공정이용시설에 이용하려면 대통령령으로 정하는 바에 따라 관계 중앙행정기관의 장의 승인을 받아야 한다.
② 제1항에 따라 승인을 받은 자는 승인받은 사항을 변경하려면 변경승인을 받아야 한다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려면 변경신고를 하여야 한다.
③ 제1항에 따른 이용승인에 관하여는 제8조제4항·제5항 및 제18조를 준용한다. 이 경우 "수입"은 "이용"으로 본다.
④ 제1항 및 제2항에 따른 승인 및 신고의 기준, 절차 및 방법에 관하여 필요한 사항은 대통령령으로 정한다.
[본조신설 2012.12.11]
[시행일 : 2013.12.12] 제22조의4
제23조(허가취소 등) ① 관계중앙행정기관의 장은 제22조제1항에 따라 연구시설의 설치ㆍ운영의 허가를 받거나 신고를 한 자가 다음 각 호의 어느 하나에 해당하는 경우에는 그 허가를 취소하거나 1년 이내의 기간을 정하여 그 시설의 운영을 정지하도록 명할 수 있다. 다만, 제1호에 해당하는 경우에는 허가를 취소하여야 한다.
1. 속임수나 그 밖의 부정한 방법으로 허가를 받은 경우
2. 제22조제1항 후단에 따른 변경허가를 받지 아니하고 그 허가내용을 변경한 경우
3. 제22조제3항 단서에 따른 승인을 받지 아니하고 개발 또는 실험을 한 경우
4. 제22조제4항에 따른 허가기준에 미달한 경우
② 관계중앙행정기관의 장은 제22조제3항 단서에 따라 승인을 받은 유전자변형생물체의 개발 또는 실험이 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다는 사실이 밝혀진 경우에는 승인을 취소할 수 있다.
[전문개정 2007.12.21]
제23조(허가취소 등) ① 관계 중앙행정기관의 장은 제22조제1항에 따라 연구시설의 설치·운영의 허가를 받거나 신고를 한 자가 다음 각 호의 어느 하나에 해당하는 경우에는 그 허가를 취소하거나 연구시설의 폐쇄를 명하거나 1년 이내의 기간을 정하여 그 시설의 운영을 정지하도록 명할 수 있다. 다만, 제1호에 해당하는 경우에는 허가를 취소하거나 연구시설의 폐쇄를 명하여야 한다. <개정 2012.12.11>
1. 속임수나 그 밖의 부정한 방법으로 허가를 받거나 신고한 경우
2. 제22조제2항 또는 제3항에 따른 변경허가를 받지 아니하거나 변경신고를 하지 아니하고 허가 내용 또는 신고 내용을 변경한 경우
3. 제22조제6항에 따른 준수사항을 지키지 아니한 경우
4. 제22조제7항에 따른 허가 또는 신고의 기준에 미달한 경우
5. 제22조의2제1항에 따른 승인을 받지 아니하고 개발·실험을 한 경우
6. 제22조의2제2항에 따른 변경승인을 받지 아니하거나 변경신고를 하지 아니하고 허가 내용 또는 신고 내용을 변경한 경우
② 관계 중앙행정기관의 장은 제22조의3에 따라 생산공정이용시설 의 설치·운영 허가를 받거나 신고를 한 자가 다음 각 호의 어느 하나에 해당하는 경우에는 그 허가를 취소하거나 생산공정이용시설의 폐쇄를 명하거나 1년 이내의 기간을 정하여 그 시설의 운영을 정지하도록 명할 수 있다. 다만, 제1호 또는 제2호에 해당하는 경우에는 허가를 취소하거나 생산공정이용시설의 폐쇄를 명하여야 한다. <신설 2012.12.11>
1. 속임수나 그 밖의 부정한 방법으로 허가를 받거나 신고한 경우
2. 제22조의3제2항 또는 제3항에 따른 변경허가를 받지 아니하거나 변경신고를 하지 아니하고 허가 내용 또는 신고 내용을 변경한 경우
3. 제22조의3제6항에 따른 허가기준 또는 신고기준에 미달한 경우
4. 제22조의4제1항에 따른 승인을 받지 아니하고 유전자변형미생물을 이용한 경우
5. 제22조의4제2항에 따른 변경승인을 받거나 변경신고를 하지 아니하고 승인 내용을 변경한 경우
6. 제22조의4제4항에 따른 승인기준 또는 신고기준에 미달한 경우
③ 관계 중앙행정기관의 장은 제22조의2제1항 및 제22조의4제1항에 따라 승인을 받은 유전자변형생물체의 개발·실험 또는 이용이 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다는 사실이 밝혀진 경우에는 승인을 취소할 수 있다. <개정 2012.12.11>
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제23조
제23조의2(폐기·반송 명령) ① 관계 중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 유전자변형생물체의 소유자에게 대통령령으로 정하는 바에 따라 일정한 기간을 정하여 그 유전자변형생물체의 폐기·반송을 명할 수 있다. <개정 2012.12.11>
1. 제8조, 제9조, 제12조, 제22조의2 또는 제22조의4에 따른 관계 중앙행정기관의 장의 승인 또는 변경승인을 받지 아니하거나 관계 중앙행정기관의 장에게 신고를 하지 아니한 유전자변형생물체
1의2. 속임수 또는 그 밖의 부정한 방법으로 제8조, 제9조, 제12조, 제22조의2 또는 제22조의4에 따른 관계 중앙행정기관의 장의 승인 또는 변경승인을 받았거나 신고한 경우
2. 제14조에 따라 수입이나 생산이 금지되거나 제한된 유전자변형생물체
3. 제17조 또는 제23조제3항에 따라 수입승인, 생산승인, 개발·실험 승인 또는 이용승인이 취소된 유전자변형생물체
② 관계 중앙행정기관의 장은 유전자변형생물체의 소유자가 제1항에 따른 폐기·반송의 명령을 따르지 아니한 경우에는 대통령령으로 정하는 바에 따라 그 유전자변형생물체 소유자의 부담으로 소속 공무원에게 직접 폐기·반송을 하게 할 수 있다. <개정 2012.12.11>
③ 관계 중앙행정기관의 장은 수입된 유전자변형생물체에 대하여 제1항에 따른 유전자변형생물체의 폐기·반송을 명하였을 때에는 관세청장에게 그 내용을 통보하여야 한다. <개정 2012.12.11>
[전문개정 2007.12.21]
[제목개정 2012.12.11]
[제19조에서 이동 <2012.12.11>]
[시행일 : 2013.12.12] 제23조의2
제24조(표시) ① 유전자변형생물체를 개발ㆍ생산 또는 수입하는 자는 그 유전자변형생물체 또는 그 유전자변형생물체의 용기나 포장에 유전자변형생물체의 종류 등 대통령령으로 정하는 사항을 표시하여야 한다.
② 누구든지 제1항에 따른 표시를 거짓으로 하거나 이를 임의로 변경하거나 삭제하여서는 아니 된다.
③ 관계중앙행정기관의 장은 제1항에 따른 표시의 방법, 그 밖에 필요한 사항을 정하여 고시한다.
[전문개정 2007.12.21]
제24조(표시) ① 유전자변형생물체를 개발·생산 또는 수입하는 자는 그 유전자변형생물체 또는 그 유전자변형생물체의 용기나 포장 또는 수입송장에 유전자변형생물체의 종류 등 대통령령으로 정하는 사항을 표시하여야 한다. <개정 2012.12.11>
② 누구든지 제1항에 따른 표시를 거짓으로 하거나 이를 임의로 변경하거나 삭제하여서는 아니 된다.
③ 관계 중앙행정기관의 장은 제1항에 따른 표시의 방법, 그 밖에 필요한 사항을 정하여 고시한다. <개정 2012.12.11>
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제24조
제25조(취급관리) ① 유전자변형생물체의 수출입등을 하는 자는 유전자변형생물체를 취급하거나 관리할 때에 밀폐운송 등 대통령령으로 정하는 취급관리기준을 지켜야 한다.
② 제1항에 따른 취급관리의 방법과 그 밖에 필요한 사항은 관계중앙행정기관의 장이 정하여 고시한다.
[전문개정 2007.12.21]
제25조(취급관리) ① 유전자변형생물체의 수출입등을 하는 자는 유전자변형생물체를 취급하거나 관리할 때에 밀폐운송 등 대통령령으로 정하는 취급관리기준을 지켜야 한다.
② 제1항에 따른 취급관리의 방법과 그 밖에 필요한 사항은 관계 중앙행정기관의 장이 정하여 고시한다. <개정 2012.12.11>
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제25조
제26조(관리ㆍ운영기록의 보존) 유전자변형생물체의 수출입등을 하는 자와 연구시설을 설치ㆍ운영하는 자는 산업통상자원부령으로 정하는 바에 따라 유전자변형생물체의 수출입등 및 연구시설의 관리ㆍ운영에 관한 기록을 작성하여 보관하여야 한다. <개정 2008.2.29, 2013.3.23>
[전문개정 2007.12.21]
제26조의2(유전자변형생물체로 인한 환경영향 등의 조사) ① 관계 중앙행정기관의 장은 국내에 유통되는 유전자변형생물체가 국민 건강과 환경에 미치는 영향을 파악하기 위하여 필요하다고 인정하면 연구시설·생산공정이용시설·사업장·보관장소 및 그 주변지역 등을 조사할 수 있다.
② 관계 중앙행정기관의 장은 제1항에 따른 조사를 위하여 필요할 때에는 다른 관계 중앙행정기관의 장에게 협조를 요청할 수 있다. 이 경우 요청을 받은 관계 중앙행정기관의 장은 특별한 사유가 없으면 협조하여야 한다.
③ 관계 중앙행정기관의 장은 제1항에 따른 조사결과를 대통령령으로 정하는 절차와 방법에 따라 공개한다.
④ 제1항에 따른 조사의 방법, 절차에 관하여 필요한 사항은 대통령령으로 정한다.
[본조신설 2012.12.11]
[시행일 : 2013.12.12] 제26조의2
제27조(위해 방지를 위한 비상조치) ① 국가책임기관의 장은 유전자변형생물체로 인하여 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 중대한 부정적인 영향이 발생하거나 발생할 우려가 있다고 인정되면 대통령령으로 정하는 바에 따라 지체 없이 필요한 조치를 하여야 한다.
② 유전자변형생물체의 수출입등을 하는 자가 유전자변형생물체의 부정적인 영향을 알게 되었을 때에는 관계중앙행정기관의 장 또는 국가책임기관의 장에게 지체 없이 그 내용을 통보하여야 한다.
[전문개정 2007.12.21]
제27조(위해방지 조치) ① 관계 중앙행정기관의 장은 소관 유전자변형생물체로 인하여 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 중대한 부정적인 영향이 발생하거나 발생할 우려가 있다고 인정되면 대통령령으로 정하는 바에 따라 지체 없이 필요한 조치를 하여야 한다. <개정 2012.12.11>
② 유전자변형생물체의 수출입등을 하는 자가 유전자변형생물체의 부정적인 영향을 알게 되었을 때에는 관계 중앙행정기관의 장 또는 국가책임기관의 장에게 지체 없이 그 내용을 통보하여야 한다. <개정 2012.12.11>
[전문개정 2007.12.21]
[제목개정 2012.12.11]
[시행일 : 2013.12.12] 제27조
<개정 2007.12.21>
제28조(정보 보호) 유전자변형생물체에 대한 정보를 취급하는 관계중앙행정기관, 국가책임기관, 위해성평가기관, 위해성심사대행기관 및 제32조에 따른 바이오안전성정보센터(이하 "정보취급기관"이라 한다)의 장은 유전자변형생물체의 정보가 도난ㆍ누출 또는 훼손되지 아니하도록 정보 보호에 필요한 조치를 마련하여야 한다.
[전문개정 2007.12.21]
제28조(정보 보호) 유전자변형생물체에 대한 정보를 취급하는 관계 중앙행정기관, 국가책임기관, 제7조의2제1항에 따른 위해성심사를 위하여 관계 중앙행정기관의 장이 대통령령으로 정하는 바에 따라 지정하는 위해성평가기관(이하 "위해성평가기관"이라 한다), 위해성심사대행기관 및 제32조에 따른 바이오안전성정보센터(이하 "정보취급기관"이라 한다)의 장은 유전자변형생물체의 정보가 도난·누출 또는 훼손되지 아니하도록 정보 보호에 필요한 조치를 마련하여야 한다. <개정 2012.12.11>
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제28조
제29조(정보 이용 및 정보 제공의 제한) ① 정보취급기관의 장은 대통령령으로 정하는 경우 외에는 유전자변형생물체의 정보를 상업적으로 이용하거나 다른 자에게 제공하여서는 아니 된다.
② 정보취급기관의 장은 유전자변형생물체의 정보를 다른 자에게 제공할 때에는 사용목적ㆍ사용방법 등에 관하여 제한을 하거나 정보 보호를 위하여 필요한 조치를 마련하도록 요청할 수 있다.
[전문개정 2007.12.21]
제30조(정보취급기관 임직원의 의무) 정보취급기관의 임직원이거나 임직원이었던 자는 직무상 알게 된 정보를 누설하거나 타인이 이용하도록 제공하는 등 부당한 목적을 위하여 사용하여서는 아니 된다.
[전문개정 2007.12.21]
제31조(바이오안전성위원회) ① 유전자변형생물체의 수출입등에 관한 다음 각 호의 사항을 심의하기 위하여 국무총리 소속으로 바이오안전성위원회(이하 "위원회"라 한다)를 둔다.
1. 의정서의 이행에 관한 사항
2. 안전관리계획의 수립ㆍ시행
3. 제15조에 따른 위해성이 없는 유전자변형생물체의 품목 등의 고시
4. 제18조에 따른 재심사
5. 유전자변형생물체의 수출입등과 안전관리에 관련된 법령ㆍ고시 등에 관한 사항
6. 유전자변형생물체로 인한 피해 예방 및 대책에 관한 사항
7. 그 밖에 위원장 또는 국가책임기관의 장이 심의를 요청하는 사항
② 위원회는 위원장 1명을 포함한 15명 이상 20명 이하의 위원으로 구성한다.
③ 위원회의 위원장은 국무총리가 되고, 위원은 다음 각 호의 자로 한다. <개정 2008.2.29, 2010.1.18, 2013.3.23>
1. 기획재정부장관, 미래창조과학부장관, 교육부장관, 외교부장관, 농림축산식품부장관, 산업통상자원부장관, 보건복지부장관, 환경부장관 및 해양수산부장관
2. 대통령령으로 정하는 자 중에서 국가책임기관의 장의 제청으로 위원장이 위촉하는 자
④ 국가책임기관의 장은 제3항제2호에 따라 위원을 제청하려면 미리 관계중앙행정기관의 장과 협의하여야 한다.
⑤ 위원회를 효율적으로 운영하기 위하여 위원회에 분과위원회 및 실무위원회를 둘 수 있다.
⑥ 위원회에 간사 1명을 두되, 간사는 산업통상자원부 소속 공무원 중에서 위원장이 지명하는 자가 된다. <개정 2008.2.29, 2013.3.23>
⑦ 위원회ㆍ분과위원회 및 실무위원회의 구성ㆍ기능ㆍ운영 등에 관한 사항은 대통령령으로 정한다.
[전문개정 2007.12.21]
제31조(바이오안전성위원회) ① 유전자변형생물체의 수출입등에 관한 다음 각 호의 사항을 심의하기 위하여 산업통상자원부장관 소속으로 바이오안전성위원회를 둔다. <개정 2012.12.11, 2013.3.23>
1. 의정서의 이행에 관한 사항
2. 안전관리계획의 수립·시행
3. 삭제 <2012.12.11>
4. 제18조 및 제22조의4제3항에 따른 재심사
5. 유전자변형생물체의 수출입등과 안전관리에 관련된 법령·고시 등에 관한 사항
6. 유전자변형생물체로 인한 피해 예방 및 대책에 관한 사항
7. 그 밖에 위원장 또는 국가책임기관의 장이 심의를 요청하는 사항
② 바이오안전성위원회는 위원장 1명을 포함한 15명 이상 20명 이하의 위원으로 구성한다. <개정 2012.12.11>
③ 바이오안전성위원회의 위원장은 산업통상자원부장관이 되고, 위원은 다음 각 호의 자로 한다. <개정 2008.2.29, 2010.1.18, 2012.12.11, 2013.3.23>
1. 기획재정부차관, 미래창조과학부차관, 교육부차관, 외교부차관, 농림축산식품부차관, 보건복지부차관, 환경부차관 및 해양수산부차관
2. 대통령령으로 정하는 자 중에서 위원장이 위촉하는 자
④ 바이오안전성위원회의 위원장은 제3항제2호에 따라 위원을 위촉하려면 미리 관계 중앙행정기관의 장과 협의하여야 한다. <개정 2012.12.11>
⑤ 바이오안전성위원회를 효율적으로 운영하기 위하여 바이오안전성위원회에 분과위원회 및 실무위원회를 둘 수 있다. <개정 2012.12.11>
⑥ 바이오안전성위원회에 간사 1명을 두되, 간사는 산업통상자원부 소속 공무원 중에서 위원장이 지명하는 자가 된다. <개정 2008.2.29, 2012.12.11, 2013.3.23>
⑦ 바이오안전성위원회·분과위원회 및 실무위원회의 구성·기능·운영 등에 관한 사항은 대통령령으로 정한다. <개정 2012.12.11>
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제31조
제32조(바이오안전성정보센터) ① 국가책임기관의 장은 유전자변형생물체의 정보관리 및 정보교환에 관한 사항 등을 전문적으로 수행하는 바이오안전성정보센터(이하 "바이오안전성정보센터"라 한다)를 지정할 수 있다.
② 바이오안전성정보센터는 유전자변형생물체의 안전성에 관한 정보를 국민에게 공개하여야 한다.
③ 국가책임기관의 장은 바이오안전성정보센터의 설립 및 운영에 필요한 경비를 예산의 범위에서 출연할 수 있다. <신설 2009.12.30>
[전문개정 2007.12.21]
제32조(바이오안전성정보센터) ① 국가책임기관의 장은 유전자변형생물체의 정보관리 및 정보교환에 관한 사항 등을 전문적으로 수행하는 바이오안전성정보센터(이하 "바이오안전성정보센터"라 한다)를 지정할 수 있다.
② 바이오안전성정보센터는 다음 각 호의 업무를 수행한다. <개정 2012.12.11>
1. 유전자변형생물체의 안전성에 관한 정보 공개
2. 유전자변형생물체 및 관련 산업에 관한 정보의 수집·관리·제공·홍보 및 교류
3. 그 밖에 대통령령으로 정하는 업무
③ 국가책임기관의 장은 바이오안전성정보센터의 설립 및 운영에 필요한 경비를 예산의 범위에서 출연할 수 있다. <신설 2009.12.30>
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제32조
제33조(자금 등의 지원) ① 정부는 유전자변형생물체의 안전성에 대한 국민의 이해를 증진하고 소비자의 인식을 제고하기 위하여 관련 기관 및 단체가 실시하는 홍보 및 교육사업 등에 필요한 자금 등을 지원할 수 있다.
② 정부는 연구시설의 안전성을 확보하기 위하여 필요한 시설의 설치ㆍ운영 등에 드는 자금 등을 지원할 수 있다.
[전문개정 2007.12.21]
제33조(자금 등의 지원) ① 정부는 유전자변형생물체에 대한 국민의 이해를 증진하고 소비자의 인식을 제고하거나 바이오안전성에 기반한 유전자변형생물체의 연구·개발 및 관련 산업의 건전한 발전을 위하여 다음 각 호의 사업을 할 수 있다.
1. 연구시설 및 생산공정이용시설의 안전에 관한 교육 및 사업
2. 유전자변형생물체 관련 기술 및 위해성평가기술의 개발
3. 유전자변형생물체의 검출 및 모니터링 지원
4. 유전자변형생물체 및 위해성심사 관련 교육 및 홍보
② 정부는 제1항 각 호와 관련된 사업을 실시하는 기관 및 단체에 필요한 자금 등을 출연하거나 지원할 수 있다.
[전문개정 2012.12.11]
[시행일 : 2013.12.12] 제33조
제34조(재원 확보) 국가책임기관의 장은 유전자변형생물체의 수출입등과 관련하여 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 피해가 발생하는 경우에 대비하여 안전성 확보를 위한 재원 확보 방안을 마련하여야 한다.
[전문개정 2007.12.21]
제35조(수수료) ① 다음 각 호의 어느 하나에 해당하는 자는 수수료를 내야 한다.
1. 제8조제1항 및 제2항에 따라 수입승인을 받으려는 자
2. 제9조제1항에 따라 수입승인을 받으려는 자
3. 제12조제1항에 따라 생산승인을 받으려는 자
4. 제22조제1항에 따라 연구시설 설치ㆍ운영의 허가를 받으려는 자
② 제1항에 따른 수수료의 금액, 납부방법 및 납부기간 등에 관한 사항은 대통령령으로 정한다.
[전문개정 2007.12.21]
제35조(수수료) ① 다음 각 호의 어느 하나에 해당하는 자는 수수료를 내야 한다. <개정 2012.12.11>
1. 제7조의2에 따라 위해성심사를 받으려는 자
2. 제8조제1항 및 제2항에 따라 수입승인을 받으려는 자
3. 제9조제1항 단서에 따라 수입승인을 받으려는 자
4. 제12조제1항에 따라 생산승인을 받으려는 자
5. 제22조제1항에 따라 연구시설 설치·운영의 허가를 받으려는 자
6. 제22조의3제1항에 따라 생산공정이용시설의 설치·운영 허가를 받으려는 자
7. 제22조의4제1항에 따라 이용승인을 받으려는 자
② 제1항에 따른 수수료의 금액, 납부방법 및 납부기간 등에 관한 사항은 대통령령으로 정한다.
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제35조
제36조(보고 및 검사) ① 관계중앙행정기관의 장 또는 국가책임기관의 장은 유전자변형생물체의 안전관리를 위하여 다음 각 호의 어느 하나에 해당하는 자에게 보고를 하게 하거나 자료 또는 시료의 제출을 요구할 수 있으며, 소속 공무원으로 하여금 해당 사무소ㆍ연구시설ㆍ사업장ㆍ보관장소 등에 출입하여 관계 서류나 시설ㆍ장비 및 보관상태 등을 검사하게 할 수 있다.
1. 제8조제1항ㆍ제2항, 제9조제1항 또는 제12조제1항에 따라 수입승인 또는 생산승인을 받거나 수입신고 또는 생산신고를 한 자
2. 제15조제3항에 따라 신고를 한 자
3. 위해성평가기관
4. 위해성심사대행기관
5. 제22조에 따라 연구시설의 설치ㆍ운영허가를 받거나 신고를 한 자
6. 제25조에 따라 취급하거나 관리하는 자
② 관계중앙행정기관의 장 또는 국가책임기관의 장은 승인을 받지 아니하거나 신고를 하지 아니한 유전자변형생물체로 판단되는 물품의 수출입등을 하거나, 허가를 받지 아니하거나 신고를 하지 아니하고 연구시설을 운영하고 있다고 의심되는 자에 대하여는 소속 공무원으로 하여금 그 사무소ㆍ연구시설ㆍ사업장ㆍ보관장소 등에 출입하여 관계 서류나 시설ㆍ장비 및 보관상태 등을 검사하게 할 수 있다.
③ 제1항 또는 제2항에 따라 출입ㆍ검사를 하는 공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 내보여야 한다.
[전문개정 2007.12.21]
제36조(보고 및 검사) ① 관계 중앙행정기관의 장 또는 국가책임기관의 장은 다음 각 호의 어느 하나에 해당하는 자에 대하여 소속 공무원으로 하여금 해당 사무소·연구시설·생산공정이용시설·사업장·보관장소 등에 출입하여 관계 서류나 시설·장비 및 보관상태 등을 검사하게 할 수 있다. 다만, 관계 중앙행정기관의 장 또는 국가책임기관의 장은 유전자변형생물체의 안전관리를 위하여 제1호 및 제3호부터 제7호까지의 어느 하나에 해당하는 자에게 보고를 하게 하거나 자료 또는 시료의 제출을 요구할 수 있다. <개정 2012.12.11>
1. 제8조제1항부터 제3항까지, 제9조제1항부터 제3항까지 또는 제12조제1항·제2항에 따라 승인을 받거나 신고를 한 자
2. 삭제 <2012.12.11>
3. 위해성평가기관
4. 위해성심사대행기관
5. 제22조에 따라 연구시설의 설치·운영허가를 받거나 신고를 한 자
6. 제22조의3에 따라 생산공정이용시설의 설치·운영 허가를 받거나 신고를 한 자
7. 제25조에 따라 취급하거나 관리하는 자
8. 승인을 받지 아니하거나 신고를 하지 아니한 유전자변형생물체로 판단되는 물품의 수출입등을 하거나, 허가를 받지 아니하거나 신고를 하지 아니하고 연구시설, 생산공정이용시설을 운영하고 있다고 의심되는 자
② 제1항에 따라 출입·검사를 하는 공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 내보여야 한다. <개정 2012.12.11>
③ 제1항에 따른 검사의 대상, 기준 및 절차에 관하여 필요한 사항은 대통령령으로 정한다. <신설 2012.12.11>
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제36조
제37조(청문) 관계중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 처분을 하려면 청문을 하여야 한다.
1. 제17조에 따라 수입승인이나 생산승인을 취소하는 경우
2. 제23조에 따라 연구시설 설치ㆍ운영의 허가를 취소하는 경우
[전문개정 2007.12.21]
제37조(청문) 관계 중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 처분을 하려면 청문을 하여야 한다. <개정 2012.12.11>
1. 제17조에 따라 수입승인이나 생산승인을 취소하는 경우
2. 제23조에 따라 연구시설 또는 생산공정이용시설의 설치·운영 허가를 취소하거나 연구시설 또는 생산공정이용시설의 폐쇄 또는 운영 정지를 명하는 경우
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제37조
제37조의2(권한의 위임·위탁) ① 이 법에 따른 관계 중앙행정기관의 장의 권한은 그 일부를 대통령령으로 정하는 바에 따라 소속 기관 또는 다른 행정기관의 장에게 위임하거나 위탁할 수 있다.
② 이 법에 따른 관계 중앙행정기관의 장의 업무는 그 일부를 대통령령으로 정하는 바에 따라 관계 전문 기관 또는 단체에 위탁할 수 있다.
[본조신설 2012.12.11]
[시행일 : 2013.12.12] 제37조의2
제38조(벌칙 적용 시의 공무원 의제) 위해성평가기관, 위해성심사대행기관 및 바이오안전성정보센터의 임직원은 「형법」 제129조부터 제132조까지의 규정을 적용할 때에는 공무원으로 본다.
[전문개정 2007.12.21]
제38조(벌칙 적용 시의 공무원 의제) 다음 각 호의 기관의 임직원 및 바이오안전성위원회의 위원 중 공무원이 아닌 위원은 「형법」 제129조부터 제132조까지의 규정을 적용할 때에는 공무원으로 본다. <개정 2012.12.11>
1. 위해성평가기관
2. 위해성심사대행기관
3. 바이오안전성정보센터
4. 제37조의2에 따라 관계 중앙행정기관의 장이 위탁한 업무를 수행하는 기관 또는 단체
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제38조
제39조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 5년 이하의 징역 또는 7천만원 이하의 벌금에 처한다.
1. 제14조를 위반하여 수입이나 생산이 금지되거나 제한된 유전자변형생물체(같은 조 제1항제2호의 생물체를 포함한다)를 수입하거나 생산한 자
2. 제17조제1항제1호에 따라 승인이 취소된 유전자변형생물체를 수입하거나 생산한 자
3. 제19조제1항에 따른 폐기ㆍ반송 등의 명령을 위반하여 유전자변형생물체를 국내에 유통하게 한 자
[전문개정 2007.12.21]
제39조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 5년 이하의 징역 또는 7천만원 이하의 벌금에 처한다. <개정 2012.12.11>
1. 제14조를 위반하여 수입이나 생산이 금지되거나 제한된 유전자변형생물체(같은 조 제1항제2호의 생물체를 포함한다)를 수입하거나 생산한 자
2. 제17조제1항제1호에 따라 승인이 취소된 유전자변형생물체를 수입하거나 생산한 자
3. 제23조의2제1항에 따른 폐기·반송의 명령을 위반하여 유전자변형생물체를 국내에 유통하게 한 자
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제39조
제40조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 3년 이하의 징역 또는 5천만원 이하의 벌금에 처한다.
1. 제8조제1항ㆍ제2항, 제9조제1항 또는 제12조제1항에 따른 승인 또는 변경승인을 받지 아니하고 유전자변형생물체를 수입하거나 생산한 자
2. 제17조제1항제2호부터 제10호까지의 규정에 따라 승인이 취소된 유전자변형생물체를 수입하거나 생산한 자
3. 제22조제1항 전단에 따른 허가를 받지 아니하거나 같은 항 후단 본문에 따른 변경허가를 받지 아니하고 연구시설을 설치ㆍ운영한 자
4. 제22조제3항 단서에 따른 승인을 받지 아니하고 개발하거나 실험한 자
[전문개정 2007.12.21]
제40조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 3년 이하의 징역 또는 5천만원 이하의 벌금에 처한다. <개정 2012.12.11>
1. 제8조제1항·제2항 및 제3항 본문, 제9조제1항 단서 및 제3항, 제12조제1항 또는 제2항 본문에 따른 승인 또는 변경승인을 받지 아니하고 유전자변형생물체를 수입하거나 생산한 자
2. 제17조제1항제2호부터 제10호까지의 규정에 따라 승인이 취소된 유전자변형생물체를 수입하거나 생산한 자
3. 제22조제1항에 따른 허가를 받지 아니하거나 같은 조 제2항 본문에 따른 변경허가를 받지 아니하고 연구시설을 설치·운영한 자
4. 제22조의2제1항 또는 제2항 본문에 따른 승인 또는 변경승인을 받지 아니하고 개발하거나 실험한 자
5. 제22조의3제1항 또는 제2항 본문에 따른 허가 또는 변경허가를 받지 아니하고 생산공정이용시설을 설치·운영한 자
6. 제22조의4제1항 또는 제2항 본문에 따른 승인 또는 변경승인을 받지 아니하고 유전자변형생물체를 이용한 자
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제40조
제41조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 2년 이하의 징역 또는 3천만원 이하의 벌금에 처한다.
1. 제9조제1항에 따른 신고를 하지 아니하고 유전자변형생물체를 수입한 자
2. 제19조제1항에 따른 폐기ㆍ반송 등의 명령을 이행하지 아니한 자
3. 제20조에 따른 통보를 하지 아니하고 유전자변형생물체를 수출한 자
4. 제21조에 따른 신고를 하지 아니하고 유전자변형생물체를 국내 경유한 자
5. 제22조제1항 전단에 따른 신고를 하지 아니하고 연구시설을 설치ㆍ운영한 자
6. 제23조에 따른 연구시설의 운영정지명령을 위반한 자
7. 제30조를 위반하여 직무상 알게 된 정보를 누설하거나 타인이 이용하도록 제공한 자
[전문개정 2007.12.21]
제41조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 2년 이하의 징역 또는 3천만원 이하의 벌금에 처한다. <개정 2012.12.11>
1. 제9조제1항 본문에 따른 신고를 하지 아니하고 유전자변형생물체를 수입한 자
2. 제20조에 따른 통보를 하지 아니하고 유전자변형생물체를 수출한 자
3. 제21조에 따른 신고를 하지 아니하고 유전자변형생물체를 국내를 경유하여 다른 국가로 수출하려는 자
4. 제22조제1항에 따른 신고를 하지 아니하고 연구시설을 설치·운영한 자
5. 제23조에 따른 연구시설 또는 생산공정이용시설의 폐쇄명령 또는 운영정지명령을 위반한 자
6. 제23조의2제1항에 따른 폐기·반송의 명령을 이행하지 아니한 자
7. 제30조를 위반하여 직무상 알게 된 정보를 누설하거나 타인이 이용하도록 제공한 자
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제41조
제42조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 1년 이하의 징역 또는 2천만원 이하의 벌금에 처한다.
1. 제24조제1항 또는 제2항을 위반하여 유전자변형생물체의 종류 등을 표시하지 아니하거나 거짓으로 표시한 자 또는 표시를 임의로 변경하거나 삭제한 자
2. 제25조에 따른 취급관리기준을 지키지 아니한 자
[전문개정 2007.12.21]
제43조(양벌규정) 법인의 대표자나 법인 또는 개인의 대리인, 사용인, 그 밖의 종업원이 그 법인 또는 개인의 업무에 관하여 제39조부터 제42조까지의 어느 하나에 해당하는 위반행위를 하면 그 행위자를 벌하는 외에 그 법인 또는 개인에게도 해당 조문의 벌금형을 과(科)한다. 다만, 법인 또는 개인이 그 위반행위를 방지하기 위하여 해당 업무에 관하여 상당한 주의와 감독을 게을리하지 아니한 경우에는 그러하지 아니하다.
[전문개정 2008.12.26]
제44조(과태료) ① 다음 각 호의 어느 하나에 해당하는 자에게는 1천만원 이하의 과태료를 부과한다.
1. 제8조제1항 후단 단서에 따른 변경신고를 하지 아니한 자
2. 제10조제3항에 따른 신고를 하지 아니하거나 관계중앙행정기관의 장의 명령을 이행하지 아니한 자
3. 제11조제1항에 따라 지정되지 아니한 수입항구ㆍ공항 등의 장소로 유전자변형생물체를 수입한 자
4. 제12조제1항 후단 단서에 따른 변경신고를 하지 아니한 자
5. 제15조제3항에 따른 신고를 하지 아니한 자
6. 제22조제1항 후단 단서에 따른 변경신고를 하지 아니한 자
7. 제26조에 따른 관리ㆍ운영기록을 작성ㆍ보관하지 아니한 자
8. 제36조제1항 또는 제2항에 따른 보고나 자료 또는 시료의 제출을 거부하거나 출입ㆍ검사를 거부ㆍ방해 또는 기피한 자
② 제1항에 따른 과태료는 대통령령으로 정하는 바에 따라 관계중앙행정기관 또는 국가책임기관의 장이 부과ㆍ징수한다.
③ 삭제 <2009.2.6>
④ 삭제 <2009.2.6>
⑤ 삭제 <2009.2.6>
[전문개정 2007.12.21]
제44조(과태료) ① 다음 각 호의 어느 하나에 해당하는 자에게는 1천만원 이하의 과태료를 부과한다. <개정 2012.12.11>
1. 제8조제3항 단서 또는 제9조제2항·제3항에 따른 변경신고를 하지 아니한 자
2. 제10조제4항에 따른 신고를 하지 아니하거나 관계 중앙행정기관의 장의 명령을 이행하지 아니한 자
3. 제11조제1항에 따라 지정되지 아니한 수입항구·공항 등의 장소로 유전자변형생물체를 수입한 자
4. 제12조제2항 단서에 따른 변경신고를 하지 아니한 자
5. 삭제 <2012.12.11>
6. 제22조제2항 단서 또는 제3항에 따른 변경신고를 하지 아니한 자
7. 제22조제4항에 따른 신고를 하지 아니한 자
8. 제22조의2제2항 단서에 따른 변경신고를 하지 아니한 자
9. 제22조의3제2항 단서 또는 제3항에 따른 변경신고를 하지 아니한 자
10. 제22조의3제4항에 따른 신고를 하지 아니한 자
11. 제22조의4제2항 단서에 따른 변경신고를 하지 아니한 자
12. 제26조에 따른 관리·운영기록을 작성·보관하지 아니한 자
13. 제36조제1항 또는 제2항에 따른 보고나 자료 또는 시료의 제출을 거부하거나 출입·검사를 거부·방해 또는 기피한 자
② 제1항에 따른 과태료는 대통령령으로 정하는 바에 따라 관계 중앙행정기관 또는 국가책임기관의 장이 부과·징수한다. <개정 2012.12.11>
③ 삭제 <2009.2.6>
④ 삭제 <2009.2.6>
⑤ 삭제 <2009.2.6>
[전문개정 2007.12.21]
[시행일 : 2013.12.12] 제44조
<제11690호, 2013.3.23> (정부조직법)
제1조(시행일) ① 이 법은 공포한 날부터 시행한다.
② 생략
제2조부터 제5조까지 생략
제6조(다른 법률의 개정) ①부터 <410>까지 생략
<411> 유전자변형생물체의 국가간 이동 등에 관한 법률 일부를 다음과 같이 개정한다.
제6조제1항 중 "외교통상부"를 "외교부"로, "지식경제부"를 "산업통상자원부"로 한다.
법률 제11536호 유전자변형생물체의 국가간 이동 등에 관한 법률 일부개정법률 제7조의2제3항제1호 중 "농림수산식품부"를 "농림축산식품부"로 하고, 같은 항 제3호 중 "농림수산식품부ㆍ국토해양부"를 "해양수산부"로 하며, 같은 조 제6항 중 "농림수산식품부장관과 국토해양부장관은 서로 협의하여"를 "해양수산부장관은"으로 한다.
제13조제1항제2호 중 "농림수산식품부장관"을 "농림축산식품부장관"으로 하고, 같은 항 제3호 중 "국토해양부장관"을 "해양수산부장관"으로 한다.
제16조제1항 및 제2항 중 "지식경제부장관"을 각각 "산업통상자원부장관"으로 한다.
법률 제11536호 유전자변형생물체의 국가간 이동 등에 관한 법률 일부개정법률 제16조제2항 중 "지식경제부장관"을 "산업통상자원부장관"으로 한다.
제20조 중 "지식경제부장관"을 "산업통상자원부장관"으로 한다.
제26조 중 "지식경제부령"을 "산업통상자원부령"으로 한다.
제31조제3항제1호를 다음과 같이 하고, 같은 조 제6항 중 "지식경제부"를 "산업통상자원부"로 한다.
1. 기획재정부장관, 미래창조과학부장관, 교육부장관, 외교부장관, 농림축산식품부장관, 산업통상자원부장관, 보건복지부장관, 환경부장관 및 해양수산부장관
법률 제11536호 유전자변형생물체의 국가간 이동 등에 관한 법률 일부개정법률 제31조제1항 각 호 외의 부분 및 같은 조 제3항 각 호 외의 부분 중 "지식경제부장관"을 각각 "산업통상자원부장관"으로 하고, 같은 항 제1호의 개정규정을 다음과 같이 한다.
1. 기획재정부차관, 미래창조과학부차관, 교육부차관, 외교부차관, 농림축산식품부차관, 보건복지부차관, 환경부차관 및 해양수산부차관
<412>부터 <710>까지 생략
제7조생략
제약산업 육성 및 지원에 관한 특별법
[시행 2013.3.23] [법률 제11690호, 2013.3.23, 타법개정]
제1조(목적) 이 법은 제약산업의 체계적인 육성ㆍ지원과 혁신성 증진 및 국제협력 강화를 통하여 제약산업의 발전기반을 마련하고 외국 제약기업의 국내투자유치환경을 조성하여 제약산업이 국제적인 경쟁력을 갖추도록 함으로써 국민의 건강증진과 국가경제의 발전에 이바지하는 것을 목적으로 한다.
제2조(정의) 이 법에서 사용하는 용어의 정의는 다음과 같다.
1. "제약산업"이란 「약사법」 제2조제4호에 따른 의약품을 연구개발ㆍ제조ㆍ가공ㆍ보관ㆍ유통하는 것과 관련된 산업을 말한다.
2. "제약기업"이란 국내에서 제약산업과 관련된 경제활동을 하는 다음 각 목의 어느 하나에 해당하는 기업을 말한다.
가. 「약사법」 제31조에 따라 의약품 제조업 허가 또는 제조판매품목허가를 받거나 제조판매품목신고를 한 기업
나. 외국계 제약기업으로서 「약사법」 제42조에 따라 의약품 수입품목허가를 받거나 수입품목신고를 한 기업
다. 「벤처기업육성에 관한 특별조치법」 제2조의2에 따른 벤처기업 중 신약 연구개발을 전문으로 하는 기업
3. "혁신형 제약기업"이란 다음 각 목의 어느 하나에 해당하는 기업으로서 제7조에 따라 보건복지부장관으로부터 인증을 받은 제약기업을 말한다.
가. 신약 연구개발 등에 대통령령으로 정하는 규모 이상의 투자를 하는 제약기업
나. 국내에서 대통령령으로 정하는 규모 이상의 신약 연구개발 투자실적이 있거나 신약 연구개발을 수행하고 있는 외국계 제약기업
제3조(제약기업의 책무) ① 제약기업은 제약산업의 체계적인 발전과 혁신성 강화 등을 통하여 제약산업 발전기반 조성, 국제경쟁력 강화, 국민건강 증진에 기여하여야 한다.
② 제약기업은 의약품 제조 및 품질관리기준을 준수하는 등 의약품 품질향상을 위한 제도개선에 적극 부응하여야 한다.
③ 제약기업은 의약품과 관련한 부정ㆍ부패 근절책 마련 등 제약산업의 투명성 강화를 위한 공동의 실천을 하여야 한다.
제4조(제약산업육성ㆍ지원종합계획) ① 보건복지부장관은 제약산업 발전기반 조성 및 국제경쟁력 강화를 촉진하기 위하여 5년마다 제약산업육성ㆍ지원종합계획(이하 "종합계획"이라 한다)을 수립하여야 한다.
② 종합계획에는 다음 각 호의 사항이 포함되어야 한다.
1. 제약산업의 육성을 위한 중장기적 목표
2. 제약산업 육성에 필요한 투자재원의 조달 및 활용계획
3. 제약산업 육성에 필요한 인력자원의 개발 및 효율적 활용계획
4. 제약산업의 국제협력 및 해외시장진출 지원계획
5. 신약 등 연구개발 및 기술거래 지원계획
6. 혁신형 제약기업 지원계획
7. 외국계 제약기업의 신약 연구개발과 관련된 국내 투자유치를 위한 지원계획
8. 그 밖에 제약산업 육성에 관하여 필요한 사항
③ 보건복지부장관은 종합계획을 수립하는 경우 관계 중앙행정기관의 장과 협의하여야 한다.
④ 종합계획은 제6조에 따른 제약산업육성ㆍ지원위원회의 심의를 거쳐 확정한다. 종합계획을 변경하려는 경우에도 또한 같다.
⑤ 보건복지부장관은 확정ㆍ변경된 종합계획을 관계 중앙행정기관의 장에게 통보하여야 한다.
⑥ 보건복지부장관은 종합계획의 수립을 위하여 필요하다고 인정하는 경우에는 관계 기관의 장에게 종합계획의 수립에 필요한 자료의 제출을 요구할 수 있다.
제5조(제약산업육성ㆍ지원시행계획) ① 보건복지부장관은 종합계획을 시행하기 위하여 관계 중앙행정기관의 장과 협의를 거쳐 매년 제약산업육성ㆍ지원시행계획(이하 "시행계획"이라 한다)을 수립ㆍ시행하여야 한다. 이 경우 보건복지부장관은 수립된 시행계획을 관계 중앙행정기관의 장에게 통보하여야 한다.
② 보건복지부장관과 관계 중앙행정기관의 장은 시행계획 중 소관 사항을 시행하고 이에 필요한 재원을 확보하기 위하여 노력하여야 한다.
③ 그 밖에 시행계획의 수립 및 시행 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제6조(제약산업육성ㆍ지원위원회) ① 다음 각 호의 사항을 심의하기 위하여 보건복지부장관 소속으로 제약산업육성ㆍ지원위원회(이하 "위원회"라 한다)를 둔다.
1. 종합계획 및 시행계획의 수립ㆍ시행에 관한 사항
2. 혁신형 제약기업 인증 및 인증 취소에 관한 사항
3. 그 밖에 제약산업 육성 및 지원 등에 관하여 대통령령으로 정하는 사항
② 위원회는 위원장 1명을 포함한 15명 이내의 위원으로 구성하되, 위원장은 보건복지부장관으로 하고 위원은 기획재정부, 미래창조과학부, 산업통상자원부 등 관계 중앙행정기관의 장이 위촉하는 차관급 공무원과 제약산업 육성에 관하여 전문성과 경험이 풍부한 산업계ㆍ학계ㆍ연구기관 등에 종사하는 자 중에서 보건복지부장관이 위촉하는 자로 한다. <개정 2013.3.23>
③ 위원회의 업무를 효율적으로 수행하기 위하여 위원회에 제약산업육성ㆍ지원실무위원회(이하 "실무위원회"라 한다)를 둘 수 있다. 이 경우 실무위원회의 위원장은 보건복지부에서 보건산업정책을 담당하는 자로 한다.
④ 제1항부터 제3항까지에서 규정한 사항 외에 위원회 및 실무위원회의 구성 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
제7조(혁신형 제약기업의 인증) ① 혁신형 제약기업으로 인증받고자 하는 제약기업은 보건복지부령으로 정하는 바에 따라 혁신형 제약기업 인증을 보건복지부장관에게 신청하여야 한다.
② 보건복지부장관은 제1항에 따른 신청이 있는 경우 위원회의 심의를 거쳐 혁신형 제약기업으로 인증할 수 있다. 이 경우 인증에 관하여 필요한 기준은 대통령령으로 정한다.
③ 인증의 방법, 절차 및 고시 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
① 제7조제2항에 따른 인증의 유효기간은 인증을 받은 날부터 3년으로 한다.
② 최초 인증 이후 3년마다 재평가를 통하여 인증을 연장할 수 있다.
③ 제2항에 따른 인증의 연장신청 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
① 보건복지부장관은 제7조제2항에 따라 혁신형 제약기업으로 인증을 받은 기업이 다음 각 호의 어느 하나에 해당하는 경우에는 보건복지부령으로 정하는 바에 따라 그 인증을 취소할 수 있다. 다만, 제1호의 경우에는 그 인증을 취소하여야 한다.
1. 거짓이나 그 밖의 부정한 방법으로 인증을 받은 때
2. 인증기준에 적합하지 아니하게 된 때
② 보건복지부장관은 제1항제1호에 따라 인증이 취소된 제약기업에 대하여 취소된 날부터 3년이 지나지 아니한 경우에는 인증을 하여서는 아니 된다.
③ 정부는 제1항에 따라 인증이 취소된 제약기업에 대하여 제13조부터 제17조까지의 규정에 따라 제공한 각종 우대조치를 취소할 수 있다.
제10조(자료의 제공) ① 제7조에 따라 혁신형 제약기업 인증을 신청한 기업이나 혁신형 제약기업은 보건복지부장관이 인증 또는 인증취소 등 그 업무에 필요한 자료를 요구하는 경우 이에 응하여야 한다.
② 제1항에 따른 자료 요구의 범위, 절차 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제11조(청문) 보건복지부장관은 제9조제1항에 따라 인증을 취소하고자 하는 경우에는 청문을 실시하여야 한다.
제12조(혁신형 제약기업의 유형별 구분) ① 혁신형 제약기업의 유형별 구분은 제2조제3호에서 정의된 범위에서 대통령령으로 정한다.
② 정부는 제1항에 따른 혁신형 제약기업의 유형별로 보건복지부령으로 정하는 바에 따라 그 지원 방법ㆍ규모 등을 달리 할 수 있다.
제13조(혁신형 제약기업 지원) 정부는 제약산업 육성을 위하여 혁신형 제약기업의 신약 연구개발, 연구ㆍ생산 시설 개선 등에 필요한 지원을 할 수 있다.
제14조(국가연구개발사업 등 우대) ① 국가 또는 지방자치단체는 혁신형 제약기업의 신약 연구개발에 대하여 국가연구개발사업 등에 우선 참여하게 할 수 있다.
② 제1항에 따른 우선 참여의 방법 및 절차 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제15조(조세에 관한 특례) ① 국가 및 지방자치단체는 제약산업을 지원ㆍ육성하기 위하여 필요한 경우 혁신형 제약기업에 대하여 「조세특례제한법」, 「지방세특례제한법」 등의 조세 관계 법률에서 정하는 바에 따라 법인세ㆍ소득세ㆍ취득세ㆍ등록면허세 및 재산세 등의 조세를 감면할 수 있다.
② 국가 및 지방자치단체는 혁신형 제약기업이 자체 개발한 기술을 이전하고 대금을 지급받는 경우에는 「법인세법」 및 「지방세특례제한법」에서 정하는 바에 따라 법인세 및 주민세를 감면할 수 있다.
③ 국가 및 지방자치단체는 혁신형 제약기업이 당사자로 참여하는 합병, 분할 또는 분할합병이 이루어지는 경우에는 「조세특례제한법」 등 조세 관계 법률에서 정하는 바에 따라 부동산 등의 등기에 따른 등록세, 합병으로 소멸되는 제약기업의 청산소득에 대한 법인세, 합병으로 소멸되는 제약기업주주의 의제배당에 대한 소득세 또는 법인세 등의 조세를 감면할 수 있다.
제16조(연구시설 건축에 관한 특례) ① 혁신형 제약기업은 연구시설(시제품 생산시설 등 대통령령으로 정하는 부속용도로 인정되는 시설을 포함한다)을 「국토의 계획 및 이용에 관한 법률」 제36조에 따른 지역(보전녹지 및 생산녹지 등 대통령령으로 정하는 지역은 제외한다) 중 보건복지부장관이 고시하는 지역에 건축할 수 있다.
② 제1항에 따른 고시의 절차 등에 필요한 사항은 대통령령으로 정한다.
[법률 제10519호(2011.3.30) 부칙 제2조의 규정에 의하여 이 조는 2022년 3월 30까지 유효함]
제17조(각종 부담금의 면제) 혁신형 제약기업의 연구시설에 대하여는 다음 각 호의 부담금을 면제할 수 있다.
1. 「개발이익환수에 관한 법률」 제5조에 따른 개발부담금
2. 「도시교통정비 촉진법」 제36조에 따른 교통유발부담금
3. 「산지관리법」 제19조에 따른 대체산림자원조성비
4. 「초지법」 제23조에 따른 대체초지조성비
[법률 제10519호(2011.3.30) 부칙 제2조의 규정에 의하여 이 조는 2022년 3월 30까지 유효함]
제18조(연구개발투자의 확대) 국가 및 지방자치단체는 제약기업의 연구개발에 관한 투자 확대와 외국계 제약기업의 신약 연구개발과 관련된 국내 투자유치를 위하여 적극 노력하여야 한다.
제19조(연구개발정보의 수집과 보급) ① 보건복지부장관은 제약산업 연구개발을 효율적으로 촉진하기 위하여 국내외 연구개발 동향, 시장 동향 등 국내외 신약 연구개발에 관한 정보를 수집ㆍ조사하여 이를 체계적ㆍ종합적으로 관리ㆍ보급하여야 한다.
② 보건복지부장관은 제1항의 업무를 추진하기 위하여 신약연구개발 관련 정보를 전문적으로 관리하는 기관을 지정할 수 있다.
③ 제2항에 따른 신약 연구개발 관련 정보를 전문적으로 관리하는 기관의 지정 요건ㆍ절차 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제20조(연구개발 생산성 향상에 대한 포상) ① 보건복지부장관은 우수한 의약품 개발 보급으로 국민보건 향상과 제약산업 발전에 기여한 제약기업을 선정하여 포상하고 필요한 지원을 할 수 있다.
② 제1항에 따른 포상 및 지원 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제21조(제약기업의 국제협력활동 지원) 보건복지부장관은 제약기업 또는 관련 단체가 외국의 기관ㆍ단체 등과 산업협력활동을 추진하는 때에는 관련 정보의 수집ㆍ제공 등 필요한 지원을 할 수 있다.
제22조(권한의 위탁) 보건복지부장관은 이 법에 따른 업무의 일부를 대통령령으로 정하는 바에 따라 관계 전문기관에 위탁할 수 있다.
<제11690호, 2013.3.23> (정부조직법)
제1조(시행일) ① 이 법은 공포한 날부터 시행한다.
② 생략
제2조부터 제5조까지 생략
제6조(다른 법률의 개정) ①부터 <484>까지 생략
<485> 제약산업 육성 및 지원에 관한 특별법 일부를 다음과 같이 개정한다.
제6조제2항 중 "교육과학기술부, 지식경제부"를 "미래창조과학부, 산업통상자원부"로 한다.
<486>부터 <710>까지 생략
제7조생략
첨단의료복합단지 지정 및 지원에 관한 특별법
[시행 2013.3.23] [법률 제11690호, 2013.3.23, 타법개정]
제1조(목적) 이 법은 첨단의료복합단지의 지정 및 지원을 통하여 기업, 대학, 연구기관, 의료기관 등의 상호 협력에 의한 의료연구개발의 활성화 및 연구 성과의 상품화를 촉진함으로써 첨단의료복합단지를 세계적인 의료연구개발의 중심지로 육성하고 국내 의료산업의 발전에 이바지함을 목적으로 한다.
제2조(정의) 이 법에서 사용하는 용어의 뜻은 다음과 같다. <개정 2010.1.18>
1. "첨단의료복합단지"란 의료연구개발의 활성화와 연구 성과의 상품화를 촉진하기 위하여 제6조에 따라 보건복지부장관이 지정ㆍ고시하는 단지를 말한다.
2. "의약품"이란 「약사법」에 따른 의약품을 말한다.
3. "의료기기"란 「의료기기법」에 따른 의료기기를 말한다.
4. "보건의료기술"이란 「보건의료기술 진흥법」 제2조제1항제1호 및 제3호에 따른 보건의료기술을 말한다.
5. "의료연구개발"이란 의약품, 의료기기 또는 보건의료기술을 연구ㆍ개발하거나 연구ㆍ개발을 위하여 임상시험을 하는 것 또는 임상시험용으로 사용하는 의약품이나 의료기기를 생산하는 것을 말한다.
6. "의료연구개발기관"이란 다음 각 목의 어느 하나에 해당하는 기관으로서 의료연구개발의 연구인력 및 시설 등이 대통령령으로 정하는 기준에 맞는 기관을 말한다.
가. 의료연구개발을 목적으로 설립된 기관
나. 의료연구개발업무를 담당하는 부서를 설치ㆍ운영하는 다음의 어느 하나에 해당하는 기관
(1) 의료기관
(2) 「고등교육법」 제2조에 따른 대학
(3) 연구기관
(4) 정부출연기관 등
7. "의료연구개발지원기관"이란 제11조에 따라 의료연구개발지원업무를 할 목적으로 설립된 기관을 말한다.
8. "입주의료연구개발기관"이란 제31조에 따른 입주승인을 받아 첨단의료복합단지에 입주한 의료연구개발기관을 말한다.
제3조(다른 법령과의 관계) ① 이 법 중 규제를 완화하기 위하여 특례를 정한 제4장(제20조부터 제26조까지)은 다른 법령에 우선하여 적용한다. 다만, 다른 법령에서 이 법의 규제 특례보다 완화되는 규정이 있는 경우에는 그 법령으로 정하는 바에 따른다.
② 제21조제2항, 제23조제2항 및 제24조제2항에 따라 규제 특례를 적용받는 자가 이 법에서 정한 사항을 따르지 아니한 경우에는 각 개별 법령을 적용한다.
제4조(첨단의료복합단지 조성계획의 수립) ① 보건복지부장관은 관계 중앙행정기관의 장과 첨단의료복합단지가 설치될 지역을 관할하는 광역지방자치단체의 장의 의견을 들어 첨단의료복합단지 조성계획(이하 "조성계획"이라 한다)을 수립하고 제27조에 따른 첨단의료복합단지위원회(이하 "첨단의료복합단지위원회"라 한다)의 심의ㆍ의결을 거쳐 확정한다. 조성계획을 변경하려는 경우에도 또한 같다. <개정 2008.12.31, 2010.1.18>
② 보건복지부장관은 국토균형발전을 고려하여 조성계획을 수립하여야 한다. <개정 2008.12.31, 2010.1.18>
③ 조성계획에는 다음 각 호의 사항이 포함되어야 한다.
1. 첨단의료복합단지의 위치 및 면적 등 입지 선정에 관한 사항
2. 첨단의료복합단지의 조성 목적
3. 첨단의료복합단지의 시설 등의 배치계획
4. 의료연구개발지원기관의 설립 및 의료연구개발기관의 유치계획
5. 재원조달계획
6. 사업추진 기간 및 연도별 사업추진계획
7. 그 밖에 첨단의료복합단지의 개발 및 지원에 필요한 사항으로서 대통령령으로 정하는 사항
제5조(첨단의료복합단지의 입지 선정 등) ① 보건복지부장관은 첨단의료복합단지의 입지를 선정하려면 다음 각 호의 어느 하나에 해당하는 구역(이하 "단지등"이라 한다)의 전부 또는 일부 지역 중에서 입지 선정 요건이 우수한 지역을 선정하여야 한다. <개정 2008.12.31, 2009.1.30, 2010.1.18, 2011.8.4, 2012.1.26>
1. 「산업입지 및 개발에 관한 법률」 제2조제8호에 따른 산업단지
2. 「경제자유구역의 지정 및 운영에 관한 특별법」 제2조제1호에 따른 경제자유구역
3. 「연구개발특구의 육성에 관한 특별법」 제2조제1호에 따른 연구개발특구
4. 「도시개발법」 제2조제1항제1호에 따른 도시개발구역
5. 「산업기술단지 지원에 관한 특례법」 제2조에 따른 산업기술단지
6. 「공공기관 지방이전에 따른 혁신도시 건설 및 지원에 관한 특별법」 제2조제4호에 따른 혁신도시개발예정지구
7. 「기업도시개발 특별법」 제2조제2호에 따른 기업도시개발구역
8. 그 밖에 개별 법률에서 지정되어 개발되는 지역으로서 첨단의료복합단지로의 발전가능성 등을 고려하여 대통령령으로 정하는 지역
② 보건복지부장관이 제1항에 따라 첨단의료복합단지의 입지를 선정하려는 경우의 입지 선정 요건은 다음 각 호와 같다. <개정 2008.12.31, 2010.1.18>
1. 국내외 우수 연구인력과 의료연구개발기관의 유치 및 정주(定住) 가능성
2. 우수 의료연구개발기관의 집적ㆍ연계 정도
3. 우수 의료기관의 집적 정도
4. 첨단의료복합단지의 부지 확보의 용이성
5. 재정ㆍ세제 등 지방자치단체의 지원 내용
6. 그 밖에 국토균형발전 등 첨단의료복합단지를 조성ㆍ육성하기 위하여 필요한 사항으로서 대통령령으로 정하는 사항
③ 제2항에 따른 우수 연구인력, 우수 의료연구개발기관 및 우수 의료기관의 기준, 유치 및 정주 가능성, 우수 의료연구개발기관의 집적ㆍ연계 정도 등에 관한 세부적인 기준은 대통령령으로 정한다.
④ 보건복지부장관은 제1항에도 불구하고 단지등 외의 지역이 단지등보다 제2항 각 호에 따른 입지 선정 요건이 우수하다고 인정되면 첨단의료복합단지위원회의 심의를 거쳐 해당 지역을 첨단의료복합단지의 입지로 선정할 수 있다. <개정 2008.12.31, 2010.1.18>
제6조(첨단의료복합단지의 지정) ① 보건복지부장관은 제5조에 따라 첨단의료복합단지의 입지가 선정되면 해당 지역을 대통령령으로 정하는 바에 따라 첨단의료복합단지로 지정ㆍ고시하고, 지체 없이 이를 관계 중앙행정기관 및 관할 광역지방자치단체의 장에게 통지하여야 한다. <개정 2010.1.18>
② 제1항에 따른 통지를 받은 광역지방자치단체의 장은 그 내용을 14일 이상 일반인이 열람할 수 있도록 하여야 한다.
제7조(첨단의료복합단지의 개발) ① 제5조제1항에 따른 단지등이 첨단의료복합단지로 지정ㆍ고시된 경우 첨단의료복합단지의 개발은 단지등의 근거가 되는 법률에서 정한 절차에 따른다.
② 제5조제4항에 따라 선정된 입지에 제6조제1항에 따라 첨단의료복합단지가 지정ㆍ고시된 경우에 국토교통부장관은 「산업입지 및 개발에 관한 법률」에 따라 국가산업단지로 지정하여 개발하여야 한다. 이 경우 국가산업단지의 지정, 지정 해제 및 개발에 관하여는 같은 법에 정하여진 절차에 따르되, 그 절차 중 산업입지정책심의회의 심의는 이를 거친 것으로 본다. <개정 2013.3.23>
③ 국토교통부장관은 제2항에 따라 첨단의료복합단지를 국가산업단지로 지정하는 경우 「산업입지 및 개발에 관한 법률」제8조의2에도 불구하고 산업단지의 지정 면적 및 미분양 비율의 기준을 충족하지 아니한 경우에도 국가산업단지로 지정할 수 있다. <개정 2013.3.23>
제8조(첨단의료복합단지의 지정 해제) ① 보건복지부장관은 첨단의료복합단지의 지정 목적을 달성하였거나 지정 목적을 달성하는 것이 불가능하다고 인정되면 첨단의료복합단지의 지정을 해제할 수 있다. <개정 2010.1.18>
② 제1항에 따라 첨단의료복합단지의 지정을 해제하는 경우의 절차에 관하여는 제6조를 준용한다.
제9조(기반시설에 대한 우선 지원) 국가와 지방자치단체는 첨단의료복합단지의 원활한 조성을 위하여 도로와 용수 등 기반시설의 설치를 우선적으로 지원하여야 한다.
제10조(첨단의료복합단지 종합계획의 수립) ① 미래창조과학부장관, 산업통상자원부장관, 식품의약품안전처장, 관할 광역지방자치단체의 장(이하 이 조에서 "운영기관의 장"이라 한다)은 첨단의료복합단지 육성을 위한 소관 사항의 추진방안을 대통령령으로 정하는 바에 따라 3년마다 보건복지부장관에게 제출하여야 한다. <개정 2008.12.31, 2010.1.18, 2013.3.23>
② 보건복지부장관은 제1항에 따라 제출받은 추진방안을 종합하여 첨단의료복합단지 육성에 관한 종합계획(이하 "종합계획"이라 한다)을 수립하되, 첨단의료복합단지 관련 업무의 원활한 수행을 위하여 필요한 경우에는 해당 운영기관의 장과 협의하여 제1항에 따라 제출된 추진방안 중 추진일정 및 중복ㆍ상충되는 사항 등을 조정할 수 있다. <개정 2008.12.31, 2010.1.18>
③ 보건복지부장관은 제2항에 따라 수립된 종합계획을 제27조에 따른 첨단의료복합단지위원회의 심의ㆍ의결을 거쳐 확정한 후 운영기관의 장에게 통보하여야 한다. 종합계획을 변경하려는 경우에도 또한 같다. <신설 2008.12.31, 2010.1.18>
④ 종합계획에는 다음 각 호의 사항이 포함되어야 한다. <개정 2008.12.31>
1. 첨단의료복합단지 육성의 기본 방향과 목표 설정에 관한 사항
2. 제11조에 따른 의료연구개발지원기관의 운영 및 지원에 관한 사항
3. 입주의료연구개발기관에 대한 지원에 관한 사항
4. 입주의료연구개발기관 간의 상호 교류와 협력 활성화에 관한 사항
5. 의료연구개발지원기관 및 입주의료연구개발기관과 국내외 의료연구개발기관과의 협력 활성화에 관한 사항
6. 국내외 우수 연구인력ㆍ의료연구개발기관의 유치 및 정주를 위한 여건 조성에 관한 사항
7. 첨단의료복합단지 운영 성과의 활용 및 전파에 관한 사항
8. 그 밖에 첨단의료복합단지를 육성하기 위하여 필요한 사항으로서 대통령령으로 정하는 사항
⑤ 운영기관의 장은 제3항에 따라 통보받은 종합계획을 기초로 매년 세부시행계획을 수립하여 추진하여야 한다. <개정 2008.12.31>
제11조(의료연구개발지원기관 등의 설립 및 지원) ① 첨단의료복합단지의 소재지를 관할하는 지방자치단체와 의료연구개발기관 및 출연기관은 공동으로 출연하여 다음 각 호의 어느 하나에 해당하는 의료연구개발지원기관을 설립할 수 있다.
1. 의약품 의료연구개발지원기관: 의약품을 연구개발하는 의료연구개발기관의 연구개발 업무를 지원하고 의료연구개발기관과 공동으로 의약품을 연구개발하는 기관
2. 의료기기 의료연구개발지원기관: 의료기기를 연구개발하는 의료연구개발기관의 연구개발 업무를 지원하거나 의료연구개발기관과 공동으로 의료기기를 연구개발하는 기관
3. 그 밖의 의료연구개발지원기관: 그 밖에 의료연구개발을 지원하는 다음 각 목의 어느 하나에 해당하는 기관
가. 연구용 세포 등을 보관ㆍ관리하는 기관
나. 실험용 동물의 사육 및 관리기관
다. 임상시험용 의약품을 생산하거나 생산시설을 제공하는 기관
라. 그 밖에 의료연구개발 관련 자원 관리기관 등 대통령령으로 정하는 기관
4. 복합의료연구개발지원기관: 제1호부터 제3호까지 중 2 이상의 성격을 가지는 의료연구개발지원기관
② 제1항에 따른 의료연구개발지원기관은 「민법」 제32조에 따라 주무관청의 허가를 받아 설립한다.
③ 국가와 지방자치단체는 의료연구개발지원기관의 설립ㆍ운영에 필요한 경비를 예산의 범위 안에서 보조할 수 있으며, 대통령령으로 정하는 바에 따라 의료연구서비스의 제공 수준, 연구성과의 향상 정도, 조직운영의 효율성 등을 고려하여 차등하여 지원할 수 있다.
④ 국가와 지방자치단체는 입주의료연구개발기관에 대한 투자를 주된 목적으로 하는 다음 각 호의 투자조합의 결성이나 회사의 설립을 지원할 수 있다.
1. 「중소기업창업 지원법」제20조에 따른 중소기업창업투자조합
2. 「여신전문금융업법」제41조에 따른 신기술사업투자조합
3. 「자본시장과 금융투자업에 관한 법률」제9조제18항제7호에 따른 사모투자전문회사
제12조(공동연구개발사업 지원) ① 의료연구개발지원기관과 의료연구개발기관은 공동으로 의료연구개발지원기관의 시설ㆍ인력 등을 활용하여 일정 기간 의료연구개발을 공동으로 수행하는 사업(이하 "공동연구개발사업"이라 한다)을 할 수 있다.
② 국가와 지방자치단체는 공동연구개발사업을 지원하기 위한 연구개발 자금을 조성하여 지원할 수 있다.
③ 의료연구개발지원기관은 제1항에 따른 공동연구개발사업의 결과에 따른 지식재산권 등을 배분하거나 「기술의 이전 및 사업화 촉진에 관한 법률」제2조제2호에 따른 기술이전을 할 때에 기업을 우대할 수 있다.
제13조(융자지원) ① 산업통상자원부장관은 의료연구개발지원기관 및 의료연구개발기관이 첨단의료복합단지에서 수행하는 의료연구개발에 대하여 「중소기업진흥에 관한 법률」 제63조에 따른 중소기업진흥 및 산업기반기금 중 산업기반자금을 융자할 수 있다. <개정 2009.5.21, 2013.3.23>
② 산업통상자원부장관은 제1항에 따른 융자를 할 때에 융자를 받은 자가 해당 사업에 실패하여 지원받은 융자금의 상환이 불가능한 경우에는 그 원리금의 전부 또는 일부를 감면할 수 있으며, 해당 사업에 성공한 경우에는 수익금의 일부를 상환하게 할 수 있다. 이 경우 상환하는 금액 중 원리금 상당금액을 제외한 부분은 「이자제한법」 제4조에 따른 간주이자로 보지 아니한다. <개정 2013.3.23>
③ 제2항에 따른 사업의 성공 및 실패의 기준, 융자의 대상 및 조건, 융자의 절차 및 상환 방법 등에 필요한 사항은 대통령령으로 정한다.
제14조(세제지원) 국가와 지방자치단체는 의료연구개발지원기관 및 입주의료연구개발기관에 대하여 세법으로 정하는 바에 따라 국세 및 지방세를 감면할 수 있다.
제15조(입주지원) 지방자치단체는 의료연구개발을 목적으로 첨단의료복합단지에 입주하려는 자에 대하여 토지나 건물 등의 임대료 등을 감면할 수 있다.
제16조(부대시설 설치 등 지원) 국가와 지방자치단체는 의료연구개발지원기관 및 입주의료연구개발기관에 숙소, 편의시설, 탁아시설, 복지시설 등 각종 부대시설의 설치 및 운영에 필요한 자금을 지원할 수 있다.
제17조(고용보조금 등의 지급) 국가와 지방자치단체는 의료연구개발지원기관 및 입주의료연구개발기관에 고용보조금 및 교육훈련보조금 등을 지원할 수 있다.
제18조(국ㆍ공유재산의 사용ㆍ수익ㆍ대부 및 매각 등의 특례) ① 국가와 지방자치단체는 「국유재산법」ㆍ「공유재산 및 물품 관리법」 그 밖의 다른 법령의 규정에도 불구하고 국가나 지방자치단체가 소유하는 국ㆍ공유재산을 수의계약에 따라 의료연구개발지원기관 및 입주의료연구개발기관에 사용ㆍ수익하게 하거나 대부 또는 매각할 수 있다.
② 제1항에 따라 국ㆍ공유재산을 사용ㆍ수익하게 하거나 대부하는 경우 그 기간은 「국유재산법」 제27조제1항 및 제36조제1항과 「공유재산 및 물품 관리법」 제21조제1항 및 제31조제1항에도 불구하고 20년의 범위 이내로 할 수 있다. 이 경우 그 기간은 갱신할 수 있으며, 갱신기간은 갱신할 때마다 20년을 초과할 수 없다.
③ 제1항에 따라 국가나 지방자치단체가 소유하는 토지를 사용ㆍ수익하게 하거나 대부하는 경우에는 「국유재산법」 제24조제3항 및 「공유재산 및 물품 관리법」 제13조에도 불구하고 그 토지 위에 영구시설물을 축조하게 할 수 있다. 이 경우 그 시설물의 종류 등을 고려하여 그 기간이 끝나는 때에 이를 국가 또는 지방자치단체에 기부하거나 원상으로 회복하여 반환하는 조건을 붙일 수 있다.
④ 제1항에 따라 사용ㆍ수익하게 하거나 대부하는 국ㆍ공유재산의 사용ㆍ수익료 및 대부료의 산정기준은 「국유재산법」 제25조제1항 및 제38조와 「공유재산 및 물품 관리법」 제22조 및 제32조에도 불구하고 대통령령으로 정하는 바에 따른다.
⑤ 제1항에 따라 국ㆍ공유재산을 의료연구개발지원기관 및 입주의료연구개발기관에게 매각할 때에 매입하는 자가 매입대금을 일시불로 납부하기 곤란하다고 인정되면 「국유재산법」 제40조제1항, 「공유재산 및 물품 관리법」 제37조제1항에도 불구하고 대통령령으로 정하는 바에 따라 납부 기일을 연기하거나 분할납부하게 할 수 있다.
제19조(국ㆍ공립연구기관 연구원의 휴ㆍ겸직 허용) ① 공무원이 아닌 국ㆍ공립연구기관의 연구원(「한국과학기술원법」 제15조와 「광주과학기술원법」 제14조에 따른 교원 및 연구원을 포함한다. 이하 같다)은 의료연구개발지원기관 및 입주의료연구개발기관의 임직원으로 근무하기 위하여 휴직하거나 임직원으로 겸직할 수 있다.
② 제1항에 따른 휴직기간은 3년 이내로 한다.
③ 제1항에 따라 국ㆍ공립연구기관의 연구원이 6개월 이상 휴직하는 경우에는 휴직일부터 해당 국ㆍ공립연구기관에 그 휴직자의 수에 해당하는 연구원의 정원이 따로 있는 것으로 본다.
제20조(「출입국관리법」에 관한 특례) 「출입국관리법」 제8조 및 제10조에도 불구하고 의료연구개발지원기관 및 입주의료연구개발기관에서 근무하는 외국인에 대한 사증 발급의 절차와 1회에 부여할 수 있는 체류자격별 체류기간의 상한은 대통령령으로 달리 정할 수 있다.
제21조(「의료법」에 관한 특례) ① 「의료법」제5조 및 제27조에도 불구하고 보건복지부장관이 정하는 기준에 맞는 외국의 의사ㆍ치과의사는 첨단의료복합단지 안에 있는 보건복지부장관이 지정하는 의료기관에서 의료연구개발을 목적으로 하는 의료행위를 할 수 있다. <개정 2010.1.18>
② 제1항에 따라 의료행위를 하려는 자는 보건복지부장관의 승인을 받아야 한다. <개정 2010.1.18>
③ 제1항과 제2항에 따른 의료행위를 하는 자는 「의료법」에 따른 의사ㆍ치과의사로 보며, 「의료법」 제65조 및 제66조에 규정된 위반행위를 하면 보건복지부장관은 승인을 취소할 수 있다. <개정 2010.1.18>
제22조(「국민건강보험법」에 관한 특례) ① 「국민건강보험법」 제41조에도 불구하고 첨단의료복합단지 안에 있는 보건복지부장관이 지정하는 의료기관에서 의료연구개발을 위한 의약품, 의료기기 및 의료기술을 임상연구 대상자에게 사용하는 경우는 이를 요양급여로 본다. <개정 2010.1.18, 2011.12.31>
② 제1항에 따른 요양급여의 대상ㆍ방법ㆍ절차ㆍ범위ㆍ상한 등 요양급여의 기준은 보건복지부령으로 정한다. <개정 2010.1.18>
제23조(「약사법」에 관한 특례) ① 입주의료연구개발기관은 연구개발한 의약품을 제조하려면 보건복지부령으로 정하는 바에 따라 식품의약품안전처장의 품목허가를 받아야 한다. 이 경우 식품의약품안전처장은 입주의료연구개발기관이 「약사법」 제31조에 따른 제조업 허가를 받지 아니하였거나 같은 법에 따른 시설 등의 기준을 갖추지 아니하였더라도 품목허가를 할 수 있으며 식품의약품안전처장이 품목허가를 한 경우 해당 입주의료연구개발기관은 「약사법」에 따른 제조업 허가를 받은 자로 본다. <개정 2010.1.18, 2013.3.23>
② 의료연구개발지원기관 및 입주의료연구개발기관이 의료연구개발 목적에 사용하기 위하여 식품의약품안전처장이 지정하는 국가로부터 수입하는 의약품의 품목 및 수량 등에 대하여 식품의약품안전처장의 수입 승인을 받으면 「약사법」 제42조에 따른 수입 허가를 받거나 수입 신고를 한 것으로 본다. <개정 2013.3.23>
③ 입주의료연구개발기관이 제1항 또는 「약사법」 제31조제11항 및 제42조제5항에 따라 식품의약품안전처장에게 의약품 제조품목의 허가 또는 수입 품목의 허가를 신청하는 경우에는 첨단의료복합단지 안에서의 의료연구개발에 한하여 신청서를 식품의약품안전처장이 정하는 바에 따라 외국어로 적을 수 있다. <개정 2011.3.30, 2013.3.23>
④ 식품의약품안전처장은 제1항 또는 「약사법」 제31조제11항 및 제42조제5항에 따라 입주의료연구개발기관 및 의료연구개발지원기관에 대하여 행하는 의약품의 제조품목의 허가 및 수입 품목의 허가 기준 등에 관하여 보건복지부장관이 정하는 국제기구 등에서 정하는 기준을 적용할 수 있다. <개정 2010.1.18, 2011.3.30, 2013.3.23>
⑤ 제1항, 제2항 및 제4항에 따른 품목허가, 수입 승인의 기준과 절차 등에 필요한 사항은 보건복지부령으로 정한다. <개정 2010.1.18>
제24조(「의료기기법」에 관한 특례) ① 입주의료연구개발기관은 연구개발한 의료기기(「의료기기법」 제6조제7항에 따라 보건복지부령으로 정하는 제조신고의 대상은 제외한다)를 제조하려면 보건복지부령으로 정하는 바에 따라 식품의약품안전처장의 제조허가를 받아야 한다. 이 경우 식품의약품안전처장은 입주의료연구개발기관이 「의료기기법」 제6조에 따른 제조업허가를 받지 아니하였거나 같은 법에 따른 시설 등의 기준을 갖추지 아니하였더라도 제조허가를 할 수 있으며 식품의약품안전처장이 제조허가를 한 경우 해당 입주의료연구개발기관은 「의료기기법」에 따른 제조업허가를 받은 자로 본다. <개정 2010.1.18, 2011.4.7, 2013.3.23>
② 의료연구개발지원기관 및 입주의료연구개발기관이 의료연구개발을 목적으로 사용하기 위하여 식품의약품안전처장이 지정하는 국가로부터 수입하는 의료기기의 품목 및 수량 등에 대하여 식품의약품안전처장의 수입 승인을 받으면 「의료기기법」 제15조에 따른 수입업허가 또는 품목류별ㆍ품목별 수입허가를 받거나 수입신고를 한 것으로 본다. <개정 2011.4.7, 2013.3.23>
③ 입주의료연구개발기관이 제1항 또는 「의료기기법」 제6조제7항 및 제15조제6항에 따라 식품의약품안전처장에게 의료기기 제조허가 또는 수입허가를 신청하는 경우에는 첨단의료복합단지 안에서의 의료연구개발에 한하여 신청서를 식품의약품안전처장이 정하는 바에 따라 외국어로 적을 수 있다. <개정 2011.4.7, 2013.3.23>
④ 식품의약품안전처장은 제1항 또는 「의료기기법」 제6조제7항 및 제15조에 따라 의료연구개발지원기관 및 입주의료연구개발기관에 대하여 행하는 의료기기의 제조허가 또는 수입허가의 기준 등에 관하여 보건복지부장관이 정하는 국제기구 등에서 정하는 기준을 적용할 수 있다. <개정 2010.1.18, 2011.4.7, 2013.3.23>
⑤ 제1항, 제2항 및 제4항에 따른 제조허가 및 수입 승인의 기준과 절차 등에 필요한 사항은 보건복지부령으로 정한다. <개정 2010.1.18, 2011.4.7>
제25조(「생명윤리 및 안전에 관한 법률」에 관한 특례) ① 「생명윤리 및 안전에 관한 법률」에 따른 국가생명윤리심의위원회는 첨단의료복합단지 분과위원회를 설치하여 첨단의료복합단지에서의 같은 법에 따른 생명윤리 및 안전에 관한 사항 중 보건복지부령으로 정하는 사항을 심의하게 할 수 있다. <개정 2010.1.18>
② 제1항에 따른 첨단의료복합단지 분과위원회에서 심의를 한 사항은 「생명윤리 및 안전에 관한 법률」에 따른 국가생명윤리심의위원회에서 심의한 것으로 본다.
③ 「생명윤리 및 안전에 관한 법률」 제10조에도 불구하고 입주의료연구개발기관은 공동으로 기관생명윤리위원회를 둘 수 있다. <개정 2012.2.1>
④ 제1항과 제3항에 따른 첨단의료복합단지 분과위원회 및 기관생명윤리위원회의 구성ㆍ운영과 그 밖에 필요한 사항은 대통령령으로 정한다. <개정 2012.2.1>
제26조(「특허법」에 관한 특례) 특허청장은 입주의료연구개발기관이 제출한 첨단의료복합단지 안 의료연구개발과 관련된 특허출원에 대하여는 「특허법」 제61조에도 불구하고 심사관에게 다른 특허출원에 우선하여 심사하게 할 수 있다.
제27조(첨단의료복합단지위원회의 설치) 첨단의료복합단지의 육성에 관한 다음 각 호의 사항을 심의하기 위하여 국무총리 소속으로 첨단의료복합단지위원회를 둔다.
1. 첨단의료복합단지 육성을 위한 기본정책에 관한 사항
2. 조성계획의 수립 및 변경, 첨단의료복합단지의 지정 및 지정 해제 등에 관한 사항
3. 종합계획 수립 및 성과 평가에 관한 사항
4. 공동연구사업 실적 평가 및 의료연구개발지원기관 운영성과 평가에 관한 사항
5. 국내외 우수 연구인력 및 의료연구개발기관 등의 유치에 관한 사항
6. 첨단의료복합단지 육성을 위한 재정 지원, 규제 특례 등에 관한 사항
7. 첨단의료복합단지의 운영 및 지원에 대한 관계 행정기관의 장과 관할 광역지방자치단체의 장과의 의견 조정에 관한 사항
8. 자금 지원 및 규제 특례 적용 등의 성과평가에 관한 사항
9. 그 밖에 첨단의료복합단지위원회의 심의사항으로 규정된 사항 및 첨단의료복합단지 지정 및 지원을 위하여 필요한 사항으로서 위원장이 회의에 부치는 사항
제28조(구성 및 운영) ① 첨단의료복합단지위원회는 위원장을 포함한 당연직 위원과 10명 이내의 위촉위원으로 구성한다.
② 위원장은 국무총리가 되고, 그 밖의 당연직 위원은 대통령령으로 정하는 관계 중앙행정기관의 장, 첨단의료복합단지의 관할 광역지방자치단체의 장이 된다.
③ 위촉위원은 첨단의료복합단지의 발전 및 운영에 이바지할 수 있는 지식과 경험이 풍부한 자 중에서 위원장이 위촉한다.
④ 첨단의료복합단지위원회의 회의는 재적위원 과반수 출석으로 열고, 출석위원 과반수 찬성으로 의결한다.
⑤ 첨단의료복합단지위원회의 운영을 지원하기 위하여 간사 1명을 두되, 간사는 보건복지부차관으로 한다. <개정 2008.12.31, 2010.1.18>
⑥ 그 밖에 첨단의료복합단지위원회의 구성 및 운영에 필요한 사항은 대통령령으로 정한다.
제29조(자료 제출 등의 요청) ① 첨단의료복합단지위원회는 관계 중앙행정기관의 장과 관계 광역지방자치단체의 장에게 심의에 필요한 자료를 제출하도록 요청할 수 있다. 이 경우 요청받은 중앙행정기관의 장과 관계 광역지방자치단체의 장은 정당한 사유가 없는 한 이에 따라야 한다.
② 첨단의료복합단지위원회위원장은 심의에 필요하면 관계 행정기관의 장이나 민간전문가에게 위원회에 출석할 것을 요청할 수 있다.
제30조(지원기구) ① 첨단의료복합단지위원회의 사무를 처리하기 위하여 보건복지부장관 소속으로 필요한 지원기구를 둘 수 있다. <개정 2008.12.31, 2010.1.18>
② 제1항에 따라 보건복지부장관 소속으로 두는 지원기구는 첨단의료복합단지의 지정 및 지원을 위하여 필요한 업무로서 대통령령으로 정하는 업무를 할 수 있다. <개정 2008.12.31, 2010.1.18>
③ 보건복지부장관은 제1항에 따른 지원기구를 효율적으로 운영하기 위하여 필요하면 관계 행정기관 및 법인ㆍ단체(단지등 개발 및 의료연구개발과 관련한 업무를 수행하는 법인ㆍ단체로 한정한다)의 장에게 공무원 또는 법인ㆍ단체의 임직원의 파견을 요청할 수 있다. <개정 2008.12.31, 2010.1.18>
④ 제1항부터 제3항까지에 규정된 것 외에 지원기구의 구성 및 운영에 필요한 사항은 대통령령으로 정한다.
⑤ 첨단의료복합단지를 효율적으로 관리하기 위하여 첨단의료복합단지 관할 지방자치단체, 의료연구개발지원기관, 입주의료연구개발기관 등은 공동으로 지원사무소를 설립할 수 있다.
⑥ 지원사무소는 법인으로 하되, 보건복지부장관은 그 주무관청이 된다. <개정 2010.1.18>
⑦ 지원사무소에 관하여 이 법에 규정된 사항을 제외하고는 「민법」의 재단법인에 관한 규정을 준용한다.
제31조(입주의 승인 등) ① 의료연구개발을 목적으로 첨단의료복합단지에 입주하려는 자는 보건복지부장관의 승인을 받아야 한다. <개정 2010.1.18>
② 제1항에 따라 입주 승인을 받은 자가 승인받은 사항 중 대통령령으로 정하는 중요한 사항을 변경하려면 미리 보건복지부장관의 승인을 받아야 한다. <개정 2010.1.18>
③ 보건복지부장관은 입주의료연구개발기관이 다음 각 호의 어느 하나에 해당하면 6개월 이내의 이행기간을 정하여 시정명령을 하고 이를 이행하지 아니하는 경우에는 입주 승인을 취소할 수 있다. 이 경우 입주 승인을 취소하려면 청문을 하여야 한다. <개정 2010.1.18>
1. 입주 승인을 받은 후 정당한 사유 없이 1년 이내에 시설의 설치 또는 건축물의 공사를 시작하지 아니한 경우
2. 시설의 설치 또는 건축물의 건축이 불가능하게 된 경우
3. 시설 또는 건축물의 준공 후 정당한 사유 없이 6개월 이내에 해당 사업을 시작하지 아니하거나 계속하여 6개월 이상 해당 사업을 수행하지 아니한 경우
4. 입주 승인을 받은 자가 제2항을 위반하여 변경승인을 받지 아니한 경우
5. 제23조제2항 및 제24조제2항에 따라 수입 승인을 받은 자가 승인 조건을 위반하거나 의료연구개발 목적으로 사용하지 아니한 경우
④ 보건복지부장관은 제1항 및 제3항에 따라 입주 승인을 하거나 입주 승인을 취소하는 경우에는 첨단의료복합단지위원회의 심의ㆍ의결을 거쳐야 한다. <개정 2010.1.18>
⑤ 제1항 및 제3항에 따른 입주 승인 또는 입주 승인 취소와 관련한 절차 등에 관하여 필요한 사항은 대통령령으로 정한다.
제32조(행정권한의 위임 또는 위탁) ① 중앙행정기관의 장은 이 법에 따른 권한의 일부를 대통령령으로 정하는 바에 따라 소속 기관의 장이나 관할 광역지방자치단체의 장에게 위임할 수 있다.
② 중앙행정기관의 장은 이 법에 따른 첨단의료복합단지에 관한 업무의 일부를 대통령령으로 정하는 바에 따라 민간에 위탁할 수 있다.
<제11690호, 2013.3.23> (정부조직법)
제1조(시행일) ① 이 법은 공포한 날부터 시행한다.
② 생략
제2조부터 제5조까지 생략
제6조(다른 법률의 개정) ①부터 <487>까지 생략
<488> 첨단의료복합단지 지정 및 지원에 관한 특별법 일부를 다음과 같이 개정한다.
제7조제2항 전단 및 같은 조 제3항 중 "국토해양부장관"을 각각 "국토교통부장관"으로 한다.
제10조제1항 중 "교육과학기술부장관, 지식경제부장관, 식품의약품안전청장"을 "미래창조과학부장관, 산업통상자원부장관, 식품의약품안전처장"으로 한다.
제13조제1항 및 같은 조 제2항 전단 중 "지식경제부장관"을 각각 "산업통상자원부장관"으로 한다.
제23조제1항 전단 및 후단, 같은 조 제2항부터 제4항까지 및 제24조제1항 전단 및 후단, 같은 조 제2항부터 제4항까지 중 "식품의약품안전청장"을 각각 "식품의약품안전처장"으로 한다.
<489>부터 <710>까지 생략
제7조생략

▮ 생명공학과 관련한 총제적(-omics) 학문
◎ 글라이코믹스(Glycomics)
당쇄를 인위적으로 목적한 기능을 갖게 변화시킴으로써 의약품 개발에 응용하려는 연구 분야이다.
※ 당쇄 : 단당류가 연쇄상으로 다수 결합된 분자로 일반적으로 생체의 세포 표면에 존재하는 당쇄를 지칭한다. 이러한 당은 당화(Glycosylation)되는 과정에서 단백질의 기능을 결정하거나 안정화시키는 데 중요한 역할을 한다.
◎ 기능유전체학(Functional genomics)
유전자와 유전자 산물의 기능, 유전자 산물 간의 상호작용을 밝히는 학문 분야이다. 이러한 연구를 통해 인간 유전자를 기능상으로 분류할 수 있으며, 이를 통해 질병 진단과 예후 예측, 치료제 개발에 유익한 정보를 제공할 수 있다.
◎ 단백질체학(Proteomics)
단백질의 3차원 구조분석, 기능 확인, 다른 생체물질과의 상호작용 등에 대한 연구를 통해 질병의 작용기구를 파악하고 신약개발에 활용하는 분야이다.
◎ 대사체학(Metabolomics)
세포 내에 존재하는 대사물의 총체인 대사체를 연구하는 학문이다.
◎ 독성유전체학(Toxicogenomics)
독성물질에 의해 발현양성이 변하는 유전자를 유전체학(genomics) 기법을 동원하여 대량으로 동정한 후 이 결과를 활용하여 개체의 독성물질 피폭 여부 등을 조사하는 학문 또는 기술이다. 이 기술을 이용하면 동물 또는 기타 시험관 내 방법에 비해 신속하고 정확하게 독성물질을 스크리닝할 수 있으며 한 번의 실험으로 다수 유전자의 변화를 분석할 수 있다.
◎ 약리유전체학(Pharmacogenomics)
개체 간에 나타나는 약물 효과, 독성 등의 차이를 개체의 유전적 요인과 관련지어 연구하는 학문 분야로, 개개인의 유전적인 요인을 파악해 약에 대한 반응성을 예측할 수 있도록 하는 것이 목표이다.
◎ 유전체학(Genomics)
게놈(genome)은 유전자(gene)와 염색체(chromosome)의 합성어로, 염색체에 담긴 유전자를 총칭하는 말이며, Genomics는 유전정보 전체(유전체)를 연구하는 학문분야를 말한다.
◎ 합성생물학(Synthetic Biology)
새로운 생물학적 부분(Part), 장치(Device), 시스템(System)을 디자인하고 구축하기 위해 또는 기존에 존재하는 자연 상태의 생물학적 시스템을 새로운 생물학적 시스템이나 인공생명체를 만드는 등 특정 목적으로 재설계(Redesign)하기 위해 사용하는 기술이다.
◎ 화학유전체학(Chemical Genomics)
Genomics와 조합화학이 결합된 분야로 유전자 분석을 통하여 특정 질환에 관련된 단백질 등 생체 내 타깃을 찾고 이와 반응할 수 있는 구조의 화합물들을 대량으로 합성하여 Lead(신약 후보의 구조적 출발물질)를 찾아내는 분야이다.
▮ 생명공학과 관련한 기타 학문
◎ 구조생물학(Structural biology)
단백질의 3차원 구조로부터 기능의 정보를 얻으려고 하는 학문적 영역이다.
◎ 나노기술(Nanotechnology)
10억 분의 1 수준의 정밀도를 요구하는 극미세가공 과학기술분야이다.
◎ 나노바이오
생명공학과 나노기술 상호간의 접목을 통하여 생명현상에 대해 분자수준의 이해를 증진시키며, 생명체 유래의 각종 물질들을 나노소재로 응용하는 연구이다.
◎ 뇌과학(Brain science)
뇌의 신비를 밝혀냄으로써 궁극적으로는 인간이 갖는 물리적·정신적 기능성의 전반을 심층적으로 탐구하는 응용 학문분야이다.
◎ 단백질공학(Protein engineering)
기존 단백질 구조와 기능 간의 관계를 규명하고 새로운 단백질을 설계하고 창출하는 기술이다. 아미노산 서열 결정, 유전자조작, 단백질 입체 구조 규명, 단백질의 분리와 정제, 컴퓨터 그래픽스 등의 기술이 요구된다. 신기능 효소, 고활성 효소, 의약용 단백질 개발에 이용된다.
◎ 당쇄공학(Glyco engineering)
천연에 존재하는 당쇄 구조 화합물의 기능․활성 규명, 구조 수식, 유도체 합성 등에 관련된 기술 분야이다. 당쇄 구조 화합물은 세포 간 인식, 정보 전달에 중요한 역할을 하는 것으로 알려져 있다.
◎ 대사공학(Metabolic engineering, Metabolomics)
생명체 대사과정의 네트워크를 각종 정보와 유전자조작 기술을 이용하여 유익한 방향으로 조절하려는 기술분야이다.
◎ 면역유전학(Immunogenetics)
개체간의 면역학적 차이를 연구하는 유전학 분야. 혈액형, 조직적합성, 면역 응답 등에 관련된 정보를 이용한다.
◎ 생명공학
생명공학은 생명과학으로부터의 과학적 발견에 기반하여 응용기술을 창출하여 산업에 적용하는 분야를 말한다. 생명공학은 농업에서의 품종개량 유전자공학등에 뿌리를 두고 있다.
◎ 생명과학
생명현상의 규명으로부터 생물기능의 응용연구에 이르기까지 생명체에 관련된 모든 연구분야를 총괄하는 과학군이다.
◎ 생물정보학(Bioinfomatics)
컴퓨터 기술을 활용하여 유전자와 관련된 정보를 해석하고, 기능과 구조를 밝혀내는 학문분야이다.
◎ 생체공학(Bionics)
생체 기작과 기능에 대한 공학적 지식을 응용하는 학문이다. 생체의 기능을 모방해 생체와 같이 동작하는 기계를 제작하는 기술 등이 포함된다.
◎ 세포공학(Cell engineering)
염색체나 유전자의 인위적인 조작 또는 이전 기술을 통해 유용한 유전자 형질을 발현할 수 있는 새로운 세포를 만들어 내는 기술이다. 세포융합에 의한 잡종 세포 형성을 이용하는 연구나 하이브리도마세포 제작을 비롯해 돌연변이주의 분리법이나 조직배양, 세포배양 기술 등이 포함된다.
◎ 시스템생물학(Systems biology)
생물 시스템을 구성하는 각각 요소의 행동을 해석할 뿐만 아니라, 전 구성 요소의 동적인 상호 관계를 시스템 전체 수준으로 분석해 고차적인 특성을 총체적으로 연구하는 학문이다.
◎ 의약 바이오(Red Biotechnology)
질병 치료 등에 활용되는 의약품을 개발하는 분야로 재조합 바이오 의약품(단백질 의약품, 치료용 항체, 백신, 유전자의약품 등), 재생 의약품(세포치료제, 조직 치료제, 바이오 인공장기 등), 저분자 및 천연물의약품, 바이오 의약 기반 구축 기술 등을 포함한다.
◎ 조직공학(Tissue engineering)
생명과학, 의학, 공학의 기본 개념과 기술을 바탕으로 하여 인공생체조직 또는 기관을 만들어 이용함으로써 생체 기능의 유지, 향상, 복원을 목표로 하는 학문 분야이다.
◎ 진화생물학(Tissue engineering)
지구 상의 생물의 진화를 연구하는 학문으로서, 찰스 다윈의 진화론의 영향으로 현대 생물학에서 빼놓을 수 없는 분과이다. 다윈의 진화론에 따르면 생물의 진화란 생물의 발전 과정을 뜻하며, 이 발전 과정을 더듬어 보는 일은 우선 생물이 무엇에서 발생하였는가를 밝히는 데에서부터 시작하여야 할 것이다.
◎ 해양생명공학(Marine biotechnology)
식량으로서의 어패류, 해조류의 이용, 조류 등의 에너지원으로서의 이용, 해양 생물로부터의 화학제품, 의약품 등의 추출, 정제 등이 포함되며, 이러한 목적을 위해 조직배양, 세포융합, 재조합DNA 기술 등을 활용하는 것을 해양생명공학이라 한다.
◎ 환경생명공학(Environmental biotechnology)
생명공학 기술을 이용한 오염물의 제거, 오염지역의 복원, 오염 탐지 및 측정, 생태 시스템 영향 평가 등 환경 관련 기술분야이다.
◎ 혈액학(Hematology)
혈액과 조혈기관에 관련된 사항을 다루는 학문분야이다.
▮ 생명공학 용어
◎ 게놈(Genome)
게놈은 유전자(gene)와 염색체(chromosome)의 합성어로서 한 생물체가 지닌 모든 유전정보(DNA)의 집합체를 뜻한다.
◎ 계대배양(Subculture)
미생물이나 동식물 세포를 증식 또는 유지할 때 그 일부를 새로운 배지에 계속 옮겨 배양하는 것을 말한다.
◎ 공통서열(Consensus sequence)
DNA, RNA 및 단백질의 일차 구조상에서, 특정 기능에 관계된 영역에 공통적으로 존재하는 염기나 아미노산 서열이다. DNA와 RNA의 경우, 특정 단백질의 결합 부위인 것이 일반적이다. 예를 들면, RNA중합효소의 결합 부위인 프로모터나 각종 전사 조절 단백질의 결합 부위에서, 각각의 단백질이 결합하는 특정 공통서열을 볼 수 있다.
◎ 과변이(Hypervariability)
셋 이상의 대립형이 나타나는 DNA 염기서열의 변화를 뜻한다.
◎ 광학분할(Optical resolution)
광학 이성질체 혼합물에서 원하는 광학 활성체를 분리하는 것이다. 광학 활성을 지닌 산 또는 염기를 이용하여 한 가지 광학 활성체에 대해서만 광학 활성염을 만든 다음 분리하는 방법이다. 광학 활성 분리용 담체에 의한 크로마토그래피법, 또는 미생물이나 효소에 의해 한 가지 광학 활성체에만 반응을 선택적으로 진행시킨 후 분리하는 방법 등이 있다.
◎ 균사체(Mycelium)
곰팡이나 버섯 등 균류의 몸체를 구성하는 실 모양의 구조체이다.
◎ 글루코사민(Glucosamine)
포도당에 아미노기가 결합된 대표적인 아미노당이다. 자연계에는 키틴을 비롯해 세균의 세포벽, 동물의 연골, 피부를 구성하는 뮤코다당류 등 다당류의 성분으로 널리 분포한다. 혈액이나 점액 속에도 이것과 결합한 당단백질, 당지질이 존재한다. 관절염 치료를 위한 건강식품으로 널리 사용된다.
◎ 기능성식품(Functional food)
생체 방어, 생체 리듬 조절, 질병 예방 등 생체 조절 기능을 충분히 발휘할 수 있도록 설계되고 가공된 식품을 말한다.
◎ 나노바이오센서(Nano-Biosensor)
IT, NT 기술과 BT기술을 융합한 U-헬스케어의 핵심 기반으로 나노바이오센서 기술은 대부분의 건강정보가 담겨 있는 혈액을 채취해 실시간으로 심근경색 등의 질환을 검사하고 조기에 예방할 수 있는 3세대 U-헬스케어 기술을 의미한다.
◎ 나노바이오테크놀로지(Nanobiotechnology)
나노기술과 생명공학기술이 접합된 형태의 기술 분야. DNA칩, 단백질칩, 초소형 바이오센서, 고속대량스크리닝(HTS) 시스템의 개발과 적용에 핵심적인 분야이다.
◎ 나선포자(helicospore)
1개의 주축으로 이루어지는데 180。이상 만곡되어 많은 경우 2~3회 소용돌이모양 또는 나선형으로 감겨 있는 포자. 모기향처럼 평면적으로 감는 것과 스프링처럼 입체적으로 감는 것이 있다. 무격벽 또는 유격벽으로 단실포자와 사상포자가 소용돌이모양으로 된 것이다.
◎ 내포체(Inclusion body)
외래 단백질이 숙주세포 내에서 과량 발현될 때 흔히 형성되는 불용성 단백질 덩어리이다. 내포체를 형성하면 단백질이 활성을 잃게 되므로 재접힘(refolding)을 통해 활성화시켜야 한다.
◎ 다기능효소(multifunctional enzyme)
하나의 효소가 2개 또는 3개 이상의 반응을 촉매하는 효소의 총칭. E.coli의 트립토판에서 유도 형성한 균체로부터 정제한 결정효소는 인돌+L-세린→L- 트립토판+H2O, L-트립토판+H2O→인돌+피루브산+NH3, L-세린→피루브산+NH3, L-시스테인+H2O→피루브산+NH3+H2S, 인돌+L-시스테인→L-트립토판+H2S의 여러 가지 반응을 촉매하는 것이다.
◎ 다운증후군(Down syndrome)
상염색체 중에서 가장 소형인G군에 속하는 제21염색체가 정상보다 1개가 많아 합계 3개 존재하는 것(21=염색체성)에서 나타나는 선천성 이상증후군. 정신지체, 낮은 코, 몸통에 비해 사지가 짧아 땅달막한 체형, 수지가 짧은 심기형 합병이 빈도 높게 나타나는 것이 특징이다.
◎ 다당류(Polysaccharide)
다수의 단당이 글리코시드결합에 의해 탈수축합한 고분자화합물. 여러 가지 방법으로 분류한다. 예를 들면 1종류의 구성당으로 된 단순다당(호모다당), 2종류 이상의 구성당으로 구성한 복합다당(헤테로다당), 중성당만으로 구성된 중성다당, 우론산이나 황산기를 포함하는 산성다당 등이다.
◎ 단백질(Protein)
아미노산을 단량체로 하는 고분자 유기화합물의 총칭으로 세포의 주요 구성 성분이다. 생명현상에 관여하는 효소, 항체, 호르몬 등이 포함된다.
◎ 단백질삼차구조(Tertiary structure of protein)
단백질 사슬 내에서 비교적 멀리 떨어진 기능기 간의 수소 결합, 이황화결합, 소수성 상호작용(hydrophobic interaction)등에 의하여 형성되는 입체 구조. 효소의 활성, 특이성 등 단백질의 기능과 밀접한 관계가 있다.
◎ 단백질칩(Protein chip)
실리콘, 유리 등의 표면에 여러 종류의 단백질을 고밀도로 고정화시킨 바이오칩의 일종이다. 단백질-단백질(항원-항체), 단백질-리간드, 단백질-DNA, 효소-기질 등 단백질이 관여하는 모든 상호작용의 분석에 이용된다. 이를 통해 생명 현상의 이해, 질병의 진단과 원인 규명, 신호 전달 체계의 이해가 가능하며, 궁극적으로 질병의 예방 및 치료법을 개발할 수 있다.
◎ 단세포단백질(Single-cell protein(SCP))
세균, 효모, 사상균, 방선균, 곰팡이, 조류 등의 미생물을 대량 배양하여 균체로부터 추출한 단백질, 사료첨가물이나 식품첨가물, 증량제로 사용된다.
◎ 단일클론항체(Monoclonal antibody)
단 하나의 항원성결정기에만 작용하는 항체로 하이브리도마 또는 재조합 미생물 배양을 통해 생산된다. 미량 물질의 분리, 감염증이나 암 진단과 치료 등과 같은 의료 분야에 있어서 중요한 역할을 한다.
◎ 당뇨망막병증
만성적으로 고혈당이 지속되면 혈관 내피세포의 기능 이상을 초래, 망막 혈관의 폐쇄로 의한 망막허혈이 발생하고, 그 결과 비정상적인 혈관증식 및 출혈을 초래하여 실명으로 이어질 수 있는 질환
◎ 돌연변이(Mutation)
한 개체의 유전체를 구성하는 염색체나 DNA의 일부에 생긴 영구적인 변화, 염기서열 상의 염기 1개가 다른 염기로 치환된 경우를 점 돌연변이라고 한다. 여러 개의 염기를 포함하는 DNA 영역에 걸쳐 변화가 일어나는 경우도 있다. 생식세포에 생긴 돌연변이는 후대에 전달된다. 체세포돌연변이는 후대에 전달되지 않는다.
◎ 동물자원기술(Animal resources technology)
동물이 생산하는 산물 및 축산 동물의 효율적 생산을 위한 자원 동물의 육종, 사육, 관리 등과 관련된 기술이다.
◎ 동형접합체(Homokaryon)
하나의 세포 내에 유전자형이 다른 두 개 이상의 핵이 존재하는 상태이다. 핵융합이 일어나지 않으므로 세포질 유전 연구에 이용된다.
◎ 루틴(Rutin)
루티노오즈(글루코오즈와 만노오즈가 결합한 이당류)가 결합된 배당체 형태의 플라보노이드. 콩, 팥, 메밀, 토마토, 감귤류 등에 함유되어 있다. 모세혈관의 기능을 정상으로 유지하고 혈관을 튼튼히 하는 비타민P의 작용이 있어 고혈압이나 뇌일혈을 예방하는 데 쓰인다.
◎ 마이코톡신(Mycotoxins)
곰팡이류가 생산하는 독성 물질의 총칭이다. 사람이나 동물에게 급성 또는 만성 장해를 유발한다. 대표적인 것으로 Aspergillus flavus가 생산하는 aflatoxin류가 있다.
◎ 마이크로어레이(Microarray)
기판 위에 DNA나 단백질과 같은 포획 탐침(capture probe)이 미세한 점으로 고정화된 어레이 장치이다. 특정 DNA나 단백질의 분석을 통해 유전질환의 진단, 유전자 발현 모니터링 등에 사용된다.
◎ 맞춤의료(order-made medicine, tailored medicine)
개인의 체질·약물에 대한 반응에 따라 각각 다른 투약이나 치료하는 의료 행위.
◎ 면역억제제(Immunosuppressive agents/immunosuppressants)
생체의 면역 반응을 억제하는 활성을 지닌 물질이다. 대표적으로 사이클로스포린 A(cyclosporin A) 등이 있으며 장기 이식 시 거부반응을 억제하기 위해 사용된다.
◎ 면역세포(Immunocyte)
면역담당세포의 총칭. 림프구계 면역세포의 유약형(幼若型)은 대형 호피로닌세포이며 면역아구라고 한다.
◎ 면역치료제(Immunotherapeutic)
체내의 면역반응에 관여하는 세포로 단백질로서 치료제로 사용되는 물질이다. 인터페론, 인터루킨 등이 대표적인 예이다.
◎ 미생물(Microorganism)
육안으로는 관찰이 불가능한 미세한 생물체. 일반적으로 크기 0.1mm 이하인 생물체를 의미한다. 주로 단일 세포 또는 균사체로 존재하며, 최소 생활 단위를 유지한다. 세균류, 사상균류, 효모류, 조류, 원생동물류, 바이러스 등이 이에 속한다.
◎ 바이러스(Virus)
숙주세포 내에서만 증식할 수 있는 비세포성 생물체이다. DNA나 RNA 중 하나를 게놈으로 갖는 감염세포 내에서만 증식하는 감염성 미소구조체이다.
◎ 바이오디젤(Biodiesel)
지방산 메틸에스터. 식물성 또는 동물성 지방과 메탄올의 산 또는 염기촉매반응에 의해 생산된다. 그 자체 또는 석유 디젤과 혼합해 연료로 사용되며, 바이오디젤은 재생가능자원인 바이오매스로부터 생산되므로 에너지 자원의 고갈 문제가 없으며, 연소 시 이산화탄소 및 미세분진의 배출량이 경유에 비해 현저히 낮고, SOx는 전혀 배출되지 않는다.
◎ 바이오리파이너리(Biorefinery)
석유 대신 바이오매스로부터 연료와 화학 원료를 제조하는데 필요한 기술의 집합이다.
◎ 바이오매스(Biomass)
식물이나 미생물 등을 에너지원으로 이용하는 생물체를 말한다.
◎ 바이오멤스(BioMEMS)
생물학적 시스템에 극미세 전자 기계 시스템(micro-electro-mechanical systems, MEMS) 기술을 결합한 새로운 기술 분야. 고성능의 극소형 생물 측정 장치나 생화학 반응 장치 등의 제작이 이에 속한다.
◎ 바이오센서(Biosensor)
생체 물질이 갖는 반응 특성과 그 반응에 의해 발생되는 전기 화학적 또는 광학적 신호 등을 이용해 특정 물질을 검출하거나 정량 분석하는 장치이다.
◎ 바이오에너지(Bioenergy)
바이오매스(biomass)와 이를 원료로 하여 생물학적 또는 열화학적으로 생산되는 연료로부터 얻어지는 에너지를 말한다. 경우에 따라서 바이오매스로부터 생산되는 연료를 지칭하기도 한다.
◎ 바이오연료(Biofuel)
생물체(바이오매스 자원)에서 만들어지는 연료이다. 액체 연료로는 에탄올, 메탄올, 바이오디젤, 피셔-트롭쉬(Fischer-Tropsch) 디젤이 있고 기체 연료로는 수소와 메탄이 있다.
◎ 바이오플라스틱(Bioplastic)
생물체(바이오매스 자원)에서 만들어지는 연료이다. 액체 연료로는 에탄올, 메탄올, 바이오디젤, 피셔-트롭쉬(Fischer-Tropsch) 디젤이 있고 기체 연료로는 수소와 메탄이 있다.
◎ 바이오칩(Biochip)
1) 유리, 실리콘 등의 재질로 된 작은 고체 기판 위에 DNA, 단백질 등의 생체 물질을 고밀도로 고정화시킨 마이크로어레이칩이다. 유전자 발현 양상, 유전자 결함, 단백질 분포, 반응 양상 등을 분석하는데 이용된다.
2) 단백질이나 지질, 신경세포 등의 생체 물질로 구성되며, 기본적인 연산이나 정보 처리 기능을 갖는 소자이다. 현재는 싸이토크롬이나 박테리오로돕신 등이 갖는 전자/광 스위치 특성을 이용한 소자들이 개발되고 있다.
◎ 바이오필터(Biofilter)
담체에 고정화된 미생물을 이용해 여러 가지 독성 물질이나 악취 물질을 제거하는 환경 처리장치이다.
◎ 박테리오신(Bacteriocin)
세균에 의해서 생합성되는 단백질로서 항균 효과가 있는 물질의 총칭이다.
◎ 발현벡터(Expression vector)
목적 유전자의 효율적인 발현을 위해 제작된 벡터이다. 전사가 효율적으로 이루어지도록 강력한 프로모터와 적절한 조절 유전자를 갖는다.
◎ 배아
난자와 정자의 수정이 이루어진 후 8주까지(인간의 경우)를 말하며 후에 태아가 된다.
◎ 배아줄기세포(Embryonic stem cell(ESC))
발생 초기의 배반포에서 얻어지는 미분화 상태의 세포로 자가 재생산 능력이 뛰어나 대부분의 조직과 세포로 분화할 수 있다.
◎ 복제 DNA(Cloned DNA)
공여체로부터 분리, 동정된 후 벡터에 삽입된 DNA를 말한다.
◎ 복제동물(Cloned animal)
무성적으로 복제되어 유전적으로 모체와 동일한 동물 개체를 말한다. 난세포에서 핵을 제거하고 모체 체세포의 핵을 이식하는 과정을 거쳐서 복제된다.
◎ 복제장기(Cloned organ)
인간 또는 동물의 장기의 일부분 또는 세포를 이용하여 장기로서의 기능이 가능하도록 배양된 생물학적 인공장기이다. 복제동물의 사육을 통하여 얻을 수도 있다.
◎ 생명윤리(Bioethics)
생명을 의미하는 바이오(bio)와 윤리를 뜻하는 에식스(ethics)의 합성어로 생명윤리 또는 생물윤리로 번역된다. 생명에 관한 윤리와 생물학의 기본원칙에 입각한 윤리의 2가지로 생각할 수 있다. 생명에 관한 윤리는 이제까지 ʻ의사의 윤리ʼ, 또는 ʻ의료의 윤리ʼ라고 일컬어왔는데, 의료의 발전과 인권의식이 서로 연관되어 넓은 입장에서 생명, 특히 인간의 생명에 대한 간섭의 시비를 검토하게 되었다.
◎ 생명자원
생명자원은 지구상에 존재하는 생물(동·식물, 미생물, 인간세포 등), 생물의 구성물(DNA, 유전체 등) 및 이들의 정보를 포함하는 것으로 배양 가능한 생물체, 복제 가능한 부분, 유전자원, 배양 불가능한 생물체 및 이와 관련된 분자, 생리, 구조적 정보를 포함한다.
◎ 생명정보
생물자원(유전체, 전사체, 단백질체 포함)과 생물다양성으로부터 유래된 정보와 그것의 가공처리 결과물을 말한다.
◎ 생물공정(Bioprocess)
생물체, 또는 생물체로부터 유래된 물질을 이용하거나 대상으로 하는 공정의 총칭이다.
◎ 생물다양성
육상, 해양 등의 수중 생태계와 이들 유기체가 서식하는 생태계를 말하며, 이는 종과 종사이, 또는 종과 생태계 사이의 다양성도 포함한다.
◎ 생물다양성보존(Biodiversity conservation)
생태계에 있어서 종 구성의 다양성과 다양한 종들 사이의 상호작용, 그리고 그 기능과의 상관관계를 활용해 자연 환경을 안정하게 유지하는 것이다.
◎ 생물산업(Bioindustry)
생명공학 기술을 이용하거나 이에 관련된 산업의 총칭이다.
◎ 생물안전성(Biosafety)
생명공학기술과 그 생산물로부터 유래하는 잠재적 위해성을 감소시키기 위한 노력을 지칭하는 용어이다.
◎ 생물융합기술(Biohybrid technology)
생명공학, 마이크로시스템, 센서시스템 등 여러 가지 분야의 기술이 융합된 것이다. 생명공학 연구에 필요한 여러 가지 방법을 자동화, 병렬화, 동기화하기 위해서 개발된 기술이다.
◎ 생물의약(Biopharmaceutical)
생물체 또는 이로부터 유래된 물질을 이용해 생산되는 의약품의 총칭이다. 단백질 치료제, 백신, 항생제, 세포 치료제, 유전자치료제 등이 포함된다.
◎ 생물학적지표(Biological indicator)
생리활성 물질의 효능을 말한다. 환경오염 또는 독성의 정도를 특정 생물을 대상으로 하여 수량적으로 표시하는 지표이다.
◎ 생체고분자(Biomolecule)
생체 내에서 합성되는 거대분자의 총칭이다. 단백질, 핵산, 지질, 다당류가 있다.
◎ 생체모방기술(Biomimetics)
생체의 기능을 다른 재료로 대체하거나 생체 기능을 모방, 이용하는 기술이다. 생체모방화학, 바이오일렉트로닉스, 바이오미캐닉스 등이 포함된다.
◎ 성체줄기세포(Adult stem cell)
조혈기관 상피조직 등의 세포재생계에서 세포생산의 기초가 되는 세포의 줄기세포를 추출하여 치료목적의 조직 세포로 분화한 것.
◎ 생체지표(Biomarker)
발암, 유전질환, 노화 등이 진행되는 단계 중 특징적으로 나타나는 형태학적· 생화학적·분자생물학적 변화. 생체지표를 검색함으로써 물질의 위해성을 판단할 수 있다.
◎ 세포공장(Biofactory)
세포의 유전자를 조작하여 원하는 화합물을 대량으로 생산하도록 만든 것이다. 세포 공장은 화합물 생산을 조절하는 효소 및 다양한 유전자의 발현을 억제, 활성화 시키고 이로써 생산 수율을 향상시킴으로써 제작된다. 세포 공장이 향후 현재의 화학공장과 같은 수준으로 생산 수율이 향상될 경우 기존 화학산업을 바이오산업으로 변화시킬 수 있을 것으로 기대되는 기술이다.
◎ 세포융합(Cell fusion)
두 개의 서로 다른 세포의 원형질체(protoplast)를 융합하는 것을 말한다. 동시다발적 유전 형질 변환이 가능하다. 식물세포에서는 육종 기술로서 동물세포에서는 단일클론항체 생산을 위한 하이브리도마 세포주를 만드는 데 사용된다. 미생물 분야에 있어서는 곰팡이와 방선균 등의 균주 개발에 이용된다.
◎ 세포치료기술
손상된 조직 또는 기관 부위를 치료할 목적으로 체외에서 세포를 배양하여 체내에 투여하는 치료법이다.
◎ 시냅스
하나의 신경세포의 축삭돌기 말단과 다른 신경세포의 수상돌기가 만나는 세포간 연접부위로서 신경세포 사이에 전기적, 화학적 신호를 전달하는 대화창구 역할을 수행한다.
◎ 알츠하이머병(Alzheimer's disease)
퇴행성 뇌질환의 하나로 치매의 원인 중 가장 흔한 형태이다. 병리 조직학적으로는 뇌의 전반적인 위축, 뇌실의 확장, 신경 섬유의 다발성 병변(neurofibrillary tangle)과 초로성 반점(neuriticplaque) 등이 특징이다.
◎ 약물전달시스템(Drug delivery system(DDS))
약물 방출 속도를 조절하거나 약물을 목표 부위에 효율적으로 전달시키는 방법 등을 통해 의약품의 부작용을 최소화하고 효능 및 효과를 극대화시키는 기술 및 시스템이다.
◎ 염기서열
아데닌(A), 구아닌(G), 시토신(C), 티닌(T) 4개의 상이한 코드(염기)로 이루어진 특정 서열로 DNA에 유전정보를 저장한다.
◎ 유도만능줄기세포(iPS, induced Pluripotent Stem cell)
사람 성체세포에 역분화 유도 인자를 도입하여 제작한 배아줄기세포와 비슷한 특성(우수한 분화능 및 증식력)의 줄기세포로 ʻ역분화 줄기세포ʼ라고도 하며, 수정란이나 난자를 사용하지 않아 윤리 문제에서 비교적 자유로움
◎ 유전공학(Genetic Engineering)
생물체에 주어진 유전형질을 인위적으로 변형․개조시켜 새로운 형질을 가진 생물체를 만들어내는 기술(세포융합핵치환 단백질공학 유전자 재조합)이다.
◎ 유전자 재조합(Genetic recombination)
DNA나 RNA와 같이 유전자를 이루는 요소가 해체와 재조립 과정에서 원래의 서열과는 다르게 뒤바뀌는 과정을 가리키는 유전학 용어이다. 진핵생물의 경우 DNA 수리의 과정에서 유사 분열이 발생하는 경우, 그리고 감수 분열의 과정에서 일어나는 염색체 접합에 의해 이루어진다.
◎ 인간화항체(Humanized antibody)
항원을 다른 동물에 주입했을 때 생성되는 항체 구조 중 항원이 결합하는 부위인 상보성결정부위(CDR)에 해당되는 유전자 배열만을 인간 항체 유전자에 대체하는 과정을 통하여, 인간 항체와 특징이 유사하도록 제조된 재조합 항체동물로부터 유래된 부분이 적기 때문에 체내 투여용 항체치료제로 사용하기에 적합하다.
◎ 인공장기(Artificial organ)
장기의 인공적인 대체물을 말한다. 심장, 신장, 간장 등의 대체 장기 외에도 인공혈관, 인공혈관 밸브 등도 포함된다. 인공 재료와 배양 세포를 결합시킨 혼성(hybrid)형도 있다.
◎ 인터페론(Interferon(IFN))
인체세포 내에서 바이러스 RNA와 단백질의 생성을 억제하는 항바이러스 단백질의 발현을 유도하는 기능을 갖는 당단백질의 총칭이다. 생성장소와 기능이 각기 다른 3가지가 있는데 IFNα는 주로 백혈구, IFNβ는 섬유모세포 그리고 IFNy는 주로 림프구에서 생성된다. 항바이러스 작용 외에 면역조절작용도 갖는다. IFNα와 IFNβ는 주로 항바이러스활성을 나타내는 반면 IFNy는 주로 면역조절작용을 한다. IFNα는 자연살해세포의 활성을 증강시키는 작용도 지니고 있다. 산업적으로는 유전공학적인 방법으로 생산이 가능해졌으며, 바이러스 간염의 치료에 사용되며 IFNα는 모발상세포 백혈병의 치료에도 유효하게 사용된다.
◎ 자가면역질환(Autoimmune disease)
자가면역에 의해 생체방어기능을 담당하는 면역계가 자기 세포를 공격해 발생하는 질병. 만성 류마티스성 질환이 대표적인 예이다.
◎ 자가생식(Selfing)
동일 개체 또는 동일 계통에 유래하는 배우자간의 교배. 교배형에 의한 자웅이체성이 확인되고있는 미생물의 일부 계통으로, 동일 교배형의 클론 내에서 한정적으로 교배가 일어나는 것이다.
◎ 자살유전자(Suicide gene)
발생과정의 어느 시기에 특정한 세포 내에서 발현하여 그 세포를 세포예상사 시키는 치사유전자의 일종. 이 유전자의 작용으로 살생단백질을 합성하고, 이것이 어떤 기작으로 세포를 죽게 하는 기능을 하는 것으로 보고 있는데 아직도 불분명한 점이 많다. 자살유전자는 초기에는 그 발현이 억제되지만 특정한 사이에 발현하는데 그 방아쇠가 되는 요인은 다양한 것으로 알려져 있다.
◎ 자세포(Cnidoblast)
자포동물에서 자포를 만들고 대부분의 경우 이를 마지막까지 내장하는 세포. 간세포(I세포)에서 유래하는 것으로 알려져 있다. 자세포는 1개의 독립효과기로 기능하는 것으로, 특정한 지질성분에 대한 접촉화학적 반응이 종종 그 원래의 흥분형태가 된다.
◎ 재구성핵(Restitution nucleus)
유사분열의 중기 또는 후기에 핵분열의 착오에 의해 딸 염색체가 분배되지 않고 하나로 된 핵. 그 결과, 염색체수가 배가된 핵이 형성된다. 감수분열에서는 1가염색체, 염색분체다리 등에 의한 염색체 지체가 원인이 된다.
◎ 재조합 DNA 기술(Recombinant DNA technology)
목적 유전자를 제한효소를 이용해 잘라내고 이를 벡터에 삽입해 재조합 DNA를 제작한 후, 숙주에 도입해 발현시키는 과정에 관련되는 기술의 총칭이다.
◎ 전임상(Preclinical)
실험실 차원 및 동물을 대상으로 약물의 생리적 특성과 대상 질병에 대한 효능을 검증하는 것이다.
◎ 제대혈(Cord blood)
태반과 탯줄에 있는 혈액으로 백혈구, 적혈구, 혈소판 등을 만드는 조혈모세포를 다량 함유하고, 연골, 뼈, 근육, 신경 등을 만드는 간엽줄기세포를 가지고 있다.
◎ 줄기세포(Stem Cell)
조직분화 과정에서 볼 수 있는 미분화된 세포. 줄기세포는 신체 내 모든 조직으로 분화될 수 있는 가능성을 가지고 있다.
◎ 줄기세포치료(Stem cell therapy)
미분화된 줄기세포를 적당한 조건 하에서 특정 세포나 조직으로 분화하도록 유도해 손상된 조직이나 장기를 치료하는 기술이다.
◎ 제네릭(Generic) 약품
특허 보호중인 의약품에 반대되는 개념으로 특허가 만료됐거나 특허보호를 받지 않는 의약품을 통칭한다.
◎ 진세노사이드(Ginsenoside)
인삼 사포닌을 구성하는 물질의 총칭으로 현재 약 30여 종이 알려져 있으며 건조 인삼 중 약 3.2% 정도 함유되어 있다. 화학구조의 특성에 따라 프로토파낙사디올 (protopanaxadiol, PD)계, 프로토파낙사트리올(protopanaxatriol, PT)계, 올레안(oleanane)계 사포닌으로 구분되며 항암, 혈액 순환 개선, 당뇨의 예방 및 치료, 신장 보호, 치매 예방, 간장 보호, 동맥 경화, 고지혈증, 체질 개선, 피로 회복, 면역 기능 증진과 노화 방지 등에 효과가 있다고 알려져 있다.
◎ 진핵생물(Eukaryote)
핵막으로 둘러싸인 핵과 다양한 세포 소기관을 가지는 세포로 구성되어 있는 생물을 말한다. 원생생물, 조류, 사상곰팡이, 효모, 식물, 동물이 포함된다. 원핵생물과 대응된다.
◎ 체세포돌연변이(Somatic mutation)
발생이 진행 중인 개체 또는 완전한 개체 내에서 방사선이나 다른 원인들에 의해 일부의 체세포에 변화가 일어나 새로운 형질이 만들어지는 현상이다.
◎ 체세포변이(Somaclonal variation)
한 개체에서 단일세포를 떼어내어 재배양했을 때 얻어진 새로운 개체가 원래의 개체와 유전적으로 동일하지 않은 현상이다.
◎ 체세포융합(Somatic cell hybridization)
유전자가 다른 체세포를 접합하여 새로운 유전자형의 세포를 만드는 기술이다.
◎ 치료용효소(Therapeutic enzyme)
치료제로 이용되는 효소 또는 그 제제이다. 혈전용해제로 사용되는 조직플라스미노젠 활성인자 (TPA: tissue plasminogen activator), 스트렙토카이네이즈(streptokinase), 유로카이네이즈(urokinase)와 항혈액응고제인 안티트롬빈 III(antithrombin III) 등이 대표적인 예이다.
◎ 카로티노이드(Carotenoid)
녹색식물과 어떤 종의 곰팡이, 효모, 버섯, 세균 등이 만드는 황색, 적색, 자색(흡수극대 400~550nm) 등의 불용성 폴리엔색소. 대부분 탄소수가 40(때로는C30, C45, C50 등)이고 좌우대칭에 가까운 구조인 테트라테르페노이드 이다. 토마토과실에 많은 리코펜(φ,φ-카로틴)을 원형(原型)으로 하여 그 분자의 양끝폐환(閉環), 산소화 등으로 생기는 500종 이상의 색소가 알려져 있다.
◎ 캡사이신(Capsaicin)
고추의 매운맛을 내는 무색의 휘발성 알칼로이드 화합물로 약용과 향료로 이용된다. 진통작용과 체지방 감소 효과가 있는 것으로 알려져 있다.
◎ 클로렐라(Chlorella)
클로렐라과의 비운동성 담수 조류로 건강 보조 식품, 유제품의 원료로 주로 사용된다.
◎ 키토산(Chitosan)
키틴을 탈아세틸화한 물질로 의약 분야에서는 인공 피부, 약물전달시스템 등에 응용되며 환경 분야에서는 응집제로도 사용된다. 세포를 활성화해 노화를 억제하고 면역력을 강화해 주며 질병을 예방해 주는 것으로 알려져 있어 건강 기능 식품의 소재로 사용된다.
◎ 타닌(Tannin)
다가페놀을 포함하며 유피성(鞣皮性)의 복잡한조성을 가진 식물 성분. 식물계에는 농도의 차이는 있으나 널리 분포하며 물관부, 수피, 잎, 과실, 뿌리 등에 들어 있다. 유혁작용의 주체는 다가페놀로서 단백질, 특히 콜라겐과 결합하여 동물의 생피를 안정된 가죽으로 변성하게 한다. 알칼로이드와 침전반응을 하고 3가의 철이온과 결합하여 녹색 또는 흑자색의 착화합물을 형성한다.
◎ 페니실린(Penicillin)
푸른곰팡이(penicillium)가 생산하는 β-락탐계의 4원자 고리화합물의 항생 물질로 세균의 세포벽 구성 성분인 펩티도글리칸의 합성을 저해하는 대표적인 세균 감염증 치료제이다. 모핵은 6-아미노페니실란산(6-amino penicillanic acid, 6-APA)으로, 치환기를 화학적으로 수식한 많은 종류의 유도체(반합성 페니실린)가 개발되었다. Flemming(1928)에 의해서 최초로 발견된 후, 생물공학기술에 의해 대량 생산이 가능하게 된 대표적인 생물산업 제품이다.
◎ 펙틴(Pectin)
식물의 세포벽이나 세포벽 사이에 존재하는 다당류의 하나로 주성분은 D-갈락투론산이 α-1,4 결합한 고분자이다. 팽윤성이 뛰어난 수용성 식이섬유로서 섭취 시 포만감을 주나 칼로리는 매우 낮다. 배변활동을 원활하게 하고, 지방흡수 저하, 지방합성 저해, 체지방 분해 등의 작용을 하므로 다이어트 식품의 원료로 사용된다.
◎ 폴리펩타이드(Polypeptide)
대략 10개 이상의 아미노산잔기로 이루어진 펩타이드이다. 단백질과 같은 뜻으로 쓰기도 하나 보통 분자량이 작은 단백질을 가리킬 때 쓰인다.
◎ 표지단백질(Marker protein)
특정 질병 진단의 척도로 사용되는 단백질로 특정 질병 상태에서 발현된다. 일례로 간암의 경우 혈액 내의 알파태아단백(AFP: α-fetoprotein)을 표지단백질로 사용한다.
◎ 표지유전자(Marker gene)
특정 형질에 대한 유전적 해석의 척도로 이용되는 유전자, 유전질환, 약제내성(항생물질 내성 등), 염도 감수성, 영양 요구성 등을 유전적으로 판단하는데 이용된다.
◎ 프로바이오틱(Probiotic)
인간의 건강에 이로운 생균제 식이보조물 또는 생균 성분이다. 유산균 식품과 표모 체제가 대표적이다. Pro(촉진하는) biotic(생명체)의 합성어이다.
◎ 플랫폼 기술(Platform Technology )
신제품 개발과 생산 시스템에 범용적으로 활용되는 표준화된 하드웨어 및 소프트웨어 기술. 핵심 기술을 표준화, 모듈화, 공용화 함으로써 개방형 혁신 활동을 촉진하는 기술.
◎ 항상성효소(Constitutive enzyme)
세포의 생존, 성장과 함께 항상 발현되는 효소. 일상적인 배양조건 하에서 세포의 일상적인 기능을 수행하기 위한 효소들이 이에 해당된다. 이들의 유전자는 특정 대사물질에 의해 조절되는 작동 유전자(operator)를 가지고 있지 않다.
◎ 항체(Antibody)
생체 내에 들어온 항원에 반응해 만들어지는 당단백질이다. 해당 항원에 특이적으로 결합하며 면역글로블린(Ig)이라고도 한다.
◎ 항체바이오시밀러
항체의약품이란 체내에서 병을 유발하는 원인 단백질에 항체처럼 작용해 그 단백질만을 무력화시키는 의약품을 말한다. 특정 단백질에만 반응하기 때문에 효과가 뛰어나고 타깃 질병 이외에는 반응하지 않아 화학의약품에 비해 부작용이 적다. 특허가 끝난 항체바이오의약품을 오리지널과 동일한 효능을 갖도록 만든 복제 의약품이 항체바이오시밀러다. 램시마의 오리지널은 존슨앤존슨사의 레미케이드다. 류머티즘 관절염, 강직성 척추염, 건성, 소아 크론병을 포함, 7개 병에 대한 적응증을 유럽당국에서 승인받았다.
◎ 핵산(Nucleic acid)
푸린 또는 피리미딘 염기, 오탄당(디옥시리보오스 또는 리보오스), 인산기로 이루어진 뉴클레오타이드 중합체이다. 당부분이 디옥시리보오스인 DNA와 당부분이 리보오스인 RNA 두 종류로 대별된다.
◎ 핵이식
어떤 세포로부터 핵을 떼어낸 뒤 다른 세포(핵을 제거한 것)에 이식하는 조작이다.
◎ 형질전환(Transformation)
어느 주의 유전형질 일부를 다른 주에 옮겨 넣는 유전교배의 한 형태로, 공여체로부터 추출한 고분자 DNA를 직접 수용체에 거두어 넣어 그 세포 중에서 재조합하는 경우이다.
◎ 형질전환생물(Transgenic organism)
인위적인 방법에 의하여 외래 유전자가 도입된 동식물과 미생물의 총칭이다. 보통 교잡육종으로는 얻어질 수 없는 형질을 가진 생물체를 말한다.
◎ 호르몬(Hormone)
미량으로도 효능을 나타내는 생리활성 조절 물질이다. 척추동물의 호르몬은 펩타이드계(인슐린, 글루카곤, 뇌하수체 호르몬, 부갑상선 호르몬), 아미노산 유도체계(아드레날린, 갑상선 호르몬), 스테로이드계(성 호르몬, 부신피질 호르몬)로 나누어진다.
◎ 효모(Yeast)
구형의 단세포로 존재하며 주로 출아법에 의해 증식하는 진균류(fungi)의 한 종류로 양조, 제빵 등에 이용되는 Saccharomyces cerevisiae가 대표적이다. Saccharomyces, Hansenula, Pichia 속에 속하는 효모는 재조합 단백질 생산에 이용한다.
◎ 효소(Enzyme)
생체 내에서 만들어지는 단백질 생촉매. 생체 내의 화학반응은 거의 모두가 효소 반응에 의해 촉진된다. 산화환원효소, 전이효소, 가수분해효소, 라이에이즈, 이성질화효소, 라이게이즈의 여섯 가지 종류로 분류한다.
◎ 효소공학(Enzyme engineering)
효소 촉매의 특성, 관련 기술, 물질, 장비를 수단으로 하는 방법과 기술의 총체이다.
◎ 휴면세포(Resting cell)
살아 있기는 하나 증식은 하지 않는 상태의 세포를 말한다. 배양액으로부터 세포를 수확하여 적당한 완충액에 현탁시킬 경우 세포들이 분열 증식을 하지 않는 상태로 상당기간 유지될 수 있다. 포자 등의 휴면형의 세포나 핵분열 사이클의 간기에 있는 세포를 지칭하는 경우도 있다.
◎ B-세포(B-cell)
골수 모세포로부터 유래한 림프구의 일종이다. 일반적으로 골수에서 면역세포로 성숙한다. 항원과 반응해 체액성 면역에 관여하는 항체를 분비하는 형질 세포(plasma cell)가 된다. B-림프구라고도 한다.
◎ DNA중합효소(DNA polymerase)
DNA 중합을 촉진하는 효소이다. 주형(template)DNA의 염기 배열 순서에 맞추어서 이에 서로 상보적인 염기를 지닌 디옥시리보뉴클레오타이드(deoxyribonucleotide, dNTP)를 인산이중 에스터(phosphodiester) 결합으로 연결함으로써 새로운 DNA 사슬을 5ʼ에서 3ʼ 방향으로 합성한다. DNA의 복제와 회복에 관여하는 중요한 효소이다.
◎ RNA(Ribonucleic acid (RNA))
리보오스, 염기(구아닌, 아데닌, 시토신, 우라실), 인산기로 이루어진 뉴클레오타이드의 중합체로 DNA와 함께 핵산의 일종이다. 전령RNA, 운반RNA, 리보좀RNA(rRNA: ribosomal RNA)의 세 종류가 대표적이다.
◎ T-세포(T-cell (T-lymphocyte))
흉선에서 유래하는 면역 관련 림프구이다. B-세포의 항체생산을 촉진하는 헬퍼 T-세포, 억제하는 억제 T-세포, 특이적으로 표적세포를 상해하는 킬러 T-세포 등으로 나누어진다.

1. 생명공학의 정의
가. OECD에서의 생명공학의 정의
지식, 재화 및 서비스의 생산을 목적으로 생물 또는 무생물을 변형시키는 과정에서 생물체, 생체유래 물질 및 생물학적 모델에 과학과 기술을 적용하는 활동을 말한다.
나. Biotechnology Industry Organization(BIO)에서의 생명공학의 정의
생명공학산업기구(Biotechnology Industry Organization, BIO)에서는 생명공학을 ʻʻ문제해결 혹은 유용제품 생산을 위한 세포 및 생물분자적 과정의 이용ʼʼ으로 정의하고 있다.
다. 「생명공학육성법」에서의 생명공학의 정의(2008.2.29)
산업적으로 유용한 생산물을 만들거나 생산 공정을 개선할 목적으로 생물학적 시스템, 생체, 유전체 또는 그들로부터 유래되는 물질을 연구·활용하는 학문과 기술을 말한다. 생명현상의 기전, 질병의 원인 또는 발병과정에 대한 연구를 통하여 생명공학의 원천지식을 제공하는 생리학, 병리학, 약리학 등의 학문(기초의과학)을 통칭하고 있다.
라.「제7회 과학기술관계장관회의(2005. 5. 26)」에서의 생명공학의 정의
제7회 과학기술관계장관회의(2005. 5. 26)의「바이오 연구개발의 효율적 추진방향(안)」에 따르면, 생명공학이란 생물체의 기능과 유전정보를 규명하고 이를 이용·활용하여 산업 및 인류복지에 응용하는 과학기술을 총칭한다.
이는 생명과학, 생명공학 및 생명공학 활용 신약개발 관련 화학을 포괄하는 광의의 개념이다. 생물체의 기능과 정보는 생명현상을 일으키는 생체나 생체 유래물질 또는 생물학적 시스템의 탐구로부터 획득이 가능하다.
[표 부록-5-1-1] 생명과학, 생명공학, 화학의 개념
|
분야 |
개념 |
비고 |
|
생명과학 |
생명현상이나 생물의 여러 가지 기능을 밝히고 그 성과를 의료 등 인류복지에 응용하는 종합과학 |
|
|
생명공학 |
생물체, 생물전자․정보를 이용하여 산업적으로 유용한 생산물을 만들거나, 개선하는 학문과 기술 |
|
|
화학 |
물질의 성질, 조성, 구조 등을 다루는 학문과 기술 |
- 최근 신소재개발과 생명현상을 탐구하는 부분에 관심 증대 - 기존의 신약개발과 새로운 신약개발 방법의 융합화 현상 |
|
화합물 신약 |
전통적인 Chemical drug을 주로 말하며 저분자(기존방법) 화합물 위주 |
|
|
바이오 신약 |
생명현상의 원리 규명에서부터 시작하며 단백체(새로운 방법), 유전체, 줄기세포 등 새로운 개념을 도입한 치료제 |
바이오신약과 화합물 신약 모두 생명공학 영역으로 포함하는 추세 |
[표 부록-5-1-2] 바이오기술의 개념
|
바이오기술 〓 생명과학 + 생명공학 + 화학(신약) |
2. 생명공학의 범위
생명공학이 다른 첨단 기술 즉 IT, NT등과 융합되고 관련 기반학문들이 통합되면서 생명공학의 범위가 계속 확대되고 동시에 전통적인 경계들이 모호해지는 경향을 가진다.
가. 제2차 생명공학육성기본계획(Bio-Vision 2016)에서의 생명공학의 범위
제2차 생명공학육성기본계획(Bio-Vision 2016)에는 생명공학기술을 총 5개 분야 즉 1) 생명공학 2) 보건의료 3) 농축산·식품 4) 산업공정/환경·해양수산 5) 바이오 융합의 총 5개 분야로 대분류하고 ʻʻ국가과학기술표준분류ʼʼ의 세부기술 목록에 따라 재분류함으로써 객관적 기준을 적용하였다.
[표 부록-5-2-1] 제2차 생명공학육성기본계획(Bio-Vision 2016)에서 분류한 생명공학기술
|
분야 |
기본계획 분류 |
과학기술 표준 분류상의 범위 |
|
생명과학 |
◦ 유전체, 단백체 ◦ 세포체, 대사체 ◦ 뇌과학, 생체기능 ◦ 생체네트워크 |
C06 생화학, E01분자세포생물학, E02유전학/유전공학, E03발생/신경생물학, E04면역학/생리학, E05분류/생태/환경생물학, E06생화학/구조생물학 등 기타(B0901, C0107, C0201, C0207 등) |
|
보건의료 |
◦ 기초의과학 ◦ 임상의과학 ◦ 제품화기술 ◦ 인허가 |
G01의생명과학, G02 임상의학, G03 의약품/의약품개발기술, G04 치료/진단기기, G06 의료정보/시스템, G07 한의과학, G08 보건학, G09 간호과학, G10 치의과학, G15 독성/안정성관리 기반기술 등 기타(G1206 등) |
|
농림수 축산 ․식품 |
◦ 농림수축산 생명연구자원 확보 및 오믹스 활용 기술 ◦ 농림수축산 자원 활용 바이오에너지 개발 ◦ 기능성 식품 및 소재 개발 ◦ 신품종 육종기술 및 유전자변형 농림수축산 생물개발 ◦ 안정성 평가 기반 |
F01식량작물과학, F02원예작물과학, F03농생물학, F06동물자원과학, F07 수의과학, F13수산양식, F17식품과학, F18식품영양과학 기타(F0401, F0506 등) |
|
산업공정/ 환경․ 해양 |
◦ 생물산업공정 ◦ 환경생명공학 ◦ 해양생명공학 |
E05분류/생태/환경생물학, E08 생물공학, E09 산업바이오, E10 바이오공정/기기, J04생물화학공정기술, D10 해양생명, O04생태계 복원/관리, O06해양환경, E11 생물위해성 등 기타(C1002, D0803, D1109, M0603 등) |
|
바이오 융합 |
◦ BT-IT 융합기술 ◦ BT-NT 융합기술 ◦ BT-IT-NT 융합기술 ◦ BT-타기술(BT-RT, GT, CS) |
E07 융합바이오 기타(C1006, E1002 등) |
출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 교육과학기술부, 2008

출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006
[그림 부록-5-2-1] 제2차 생명공학육성기본계획(Bio-Vision 2016)에서 분류한 생명공학기술
나. 제7회 과학기술관계장관회의에서의 생명공학의 범위
제7회 과학기술관계장관회의「바이오 연구개발의 효율적 추진방향」의 자료에 따르면 생명공학의 범위를 1) 생명의약/의약 2) 농림축산/식품 3) 생물전자/정보 4) 생물공정/화학으로 분류하고 있다.

출처 : 바이오 연구개발의 효율적 추진방향(제7회 과학기술관계장관회의), 과학기술혁신본부, 2005
[그림 부록-5-2-2] 제7회 과학기술관계장관회의에서의 생명공학의 범위
다. 「생명공학육성법」에서의 생명공학의 범위
생명공학에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법 (생명공학육성법 : 국회법률지식정보시스템 공개)에 의한다.

 2013 생명공학백서 바로가기
2013 생명공학백서 바로가기
 2013 생명공학백서 바로가기
2013 생명공학백서 바로가기
