2015 생명공학백서

- 발행일 2016-01-20
- 출처 생명공학백서 2015
- 담당자 이지현 ( 042-879-8366 / ljih@kribb.re.kr )
- 조회수 19802
-
키워드
#생명공학백서
-
첨부파일
-
 2015 생명공학백서_전체.pdf
(다운로드 4310회)
바로보기
2015 생명공학백서_전체.pdf
(다운로드 4310회)
바로보기
-
-
차트+
개요
□ 2015 생명공학백서에서는, 그간의 기초연구에 대한 투자와 노력이 산업적인 성과로 이어지면서 국내 바이오 분야가 글로벌로 진출 할 수 있는 충분한 잠재력을 가지고 있음을 보여준다.
○ 정부는 바이오 경제로의 진입 등 패러다임의 변화에 다른 바이오분야의 글로벌 산업 육성을 위한 바이오 헬스 신산업 육성전략을 발표하여 태동기 분야의 바이오 의약품, 의료기기를 선택과 집중을 통해 투자할 수 있는 전략을 발표 하여 그 실행을 위해 주력하고 있으며,
○ 또한 나고야 의정서의 비준 등 바이오분야의 국제적인 관심과 협력이 절실한 상황에서 국내 R&D 국제협력 및 국가간 협력 현황을 통해 국내 역량을 제고하며 국제적인 이슈로 등장한 생물소재의 표준화에 대한 국내의 노력을 담고 있다.
○ 주요 현안분야로는 2015 상반기 메르스 사태를 겪으며 대두 되었던 감염병 대응에 대한 국내외 현황과 발전과제를 수록하였으며, 세월호 참사 이후 국민적 관심도가 높아진 외상 후 스트레스 장애에 대한 연구개발 동향 등을 살펴봄으로써 국민의 안전과 행복을 위한 바이오 기술 등을 살펴볼 수 있다.
○ 아울러 지난 2년간 있었던 바이오 분야의 발자취를 더듬어 볼 수 있도록 주요 이슈와 성과들을 사진으로 정리하였다.




- 글로벌 산업 육성을 위한「바이오미래전략」-
1. 새로운 경제성장의 동력
바이오기술은 타 기술과의 융‧복합에 힘입어 향후에는 정보 디지털경제를 거쳐 새로운 경제성장인 바이오경제시대로 진입할 것으로 OECD는 일찍이 전망하고 있다. 이러한 경제성장의 변화는 성장기반인 게놈 해독의 유전공학기술의 급속한 발전으로 가능하게 된 것이다.

출처: Davis et al., Harvard Univ, 생명공학정책연구센터 재가공
[특집 그림 1] 세계 경제성장 동력의 변화
ICT 혁명은 개인 컴퓨터가 1,000달러가 되면서 대중화되어 경제성장을 유도한 것처럼, 바이오는 분자생물학 기술의 급속한 발전과 분석기기의 고도화로 인해 개인 유전체분석 비용이 1,000달러로 감소하여 개인 유전체 정보 확보 및 분석에 힘입어 바이오혁명을 초래할 것이다. 이와 관련된 분야에 세계적으로 새로운 시장을 형성할 것으로 예상하고 있다. 또한 바이오혁명 이후에는 ICT 뿐만 아니라 화학, 생물학, 물리학, 의학 등의 융합으로 제2차 바이오혁명으로 바이오중심의 경제성장이 지속가능하게 유지될 것이다.

[특집 그림 2] 세계 경제성장 동력의 변화
미국은 의료혁신 정책을 시장에 반영하여 관련 산업의 새로운 성장기회를 형성하고 있다. 개인 유전자, 환경 및 생활양식 등의 개인차 질병 예방 및 치료가 중요해짐에 따라 개인 맞춤형 치료를 확대하기 위한 정밀의학계획(Precision medicine initiative)를 추진(2015년 1월)하여 의료 패러다임 변화를 주도하고 있다. 또한 바이오시밀러인 엔브렐(류마티스성관절염치료제)이 처음으로 FDA 승인(2015년 10월) 되어 후속 제품의 승인도 이어질 전망이어서 바이오시밀러에 대한 성장이 예상된다. 영국은 암․희귀질환의 치료 및 구제를 목표로 자국 보건의료서비스 등록 환자 10만 명의 전체 유전체 염기서열 분석을 위한 10만 게놈 프로젝트를 추진하고 있다. 일본은 일본판 NIH인 일본의료연구개발기구(AMED, Japan Agency for Medical research and Development)를 설립하고, 문부과학성․후생노동성․경제산업성 등에 나눠져 있던 의료분야 연구개발예산을 일원적으로 관리 추진(2015년 4월)하고 있다, 또한 유전자 정보 분석을 위한 범국가적 네트워크 형성과 민관 공동 의약품 개발을 위한 컨소시엄 형성을 중심으로 하는 의약품산업 강화 종합 전략(2015년)을 수립하여 추진 중이다. 중국은 부족한 의료진과 병상 수 해결 목적으로 무선 통신업체, 지역 진료소와 함께 ‘무선 시장 건강ʼ 프로그램 추진을 위해 디지털헬스육성계획(2015년)을 추진하고 있다.
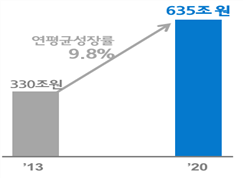
의료패러다임이 맞춤치료, 예방․건강관리로 전환되고 있어 바이오의약품, ICT 융합 의료기기, 유전체의학 분야의 급성장으로 인한 바이오헬스산업의 시장이 태동기시장으로 창출되고 있다. 바이오산업 시장은 연평균 9.8% 성장률로 고성장이 예측되며, 부작용이 적고 치료율이 높은 바이오의약품의 시장이 급성장할 것으로 예상되고 있다.1)
|
|
|
|
[특집 그림 3] 바이오산업 시장규모 전망 |
[특집 그림 4] 바이오의약품 비중 전망 |
세계 바이오약품시장은 2013년 1,626억 달러에서 향후 6년간 연평균 8.3%씩 증가하여 2019년 2,625억 달러에 달할 것으로 전망되며, 2013년 시장규모가 1,626억 달러로 2008년의 932억 달러에 비해 그 규모가 74.5% 증가하였다.2)

[특집 그림 5] 바이오의약품 시장규모 전망
2. 바이오미래전략 Ⅰ-바이오의약품 중심3)
바이오미래전략 Ⅰ은 향후 급속한 성장이 예상되며, 시장지배자가 없는 태동기 바이오산업을 선택과 집중을 통해 육성하고자 마련되었으며, 우리나라가 강점을 보유한 기술 및 임상능력을 토대로 바이오의약품(줄기세포․유전자치료제 등) 세계 최초제품 출시를 통해 글로벌 시장을 선점하는 전략이다.
정부는 생명공학육성기본계획수립(1차 1994년, 2차 2007년)을 통해 국가 주도의 집중 투자로 글로벌 성장의 발판을 마련하였다. 이러한 정부의 노력은 세계 속으로 대한민국을 알리는 주요한 바이오헬스 성과를 창출하였다. 산업화 성과로는 세계최초 항체 바이오시밀러인 램시마가 유럽 허가를 획득(2012년)하였고, 글로벌 상용화된 줄기세포 치료제 제품 6개 중 4개를 보유하고 있으며, 상용화 목적의 임상건수가 미국에 이어 세계 2위를 차지하고 있다. 태동기 바이오분야의 기술역량은 최고기술 보유국 대비 기술격차에서 융합의료기기는 1.8년, 줄기세포치료는 2.8년, 유전자치료는 3.8년으로 타 분야의 바이오기술 평균 기술격차인 5년에 비해 기술선도 그룹에 위치하고 있는 것으로 분석된다. 또한 산업측면에서도 기술력을 바탕으로 한 바이오벤처 기업이 지속적으로 성장하고 있으며(코스닥 기술특례 상장기업수(누적) : 2005년 2개에서 2014년 14개), 코스닥 내에서 바이오벤처 시가총액의 비중이 2004년 3.6%에서 2014년 13.7%로 3.8배가 증가하였다. 이러한 트렌드에 가장 민감한 벤처케피탈에서도 2014년 기준으로 IT제조 1,705억 원, IT 서비스 1,483억 원인 반면에 바이오의료분야에 2,530억 원으로 가장 많은 투자를 하고 있다. 이러한 사업화 성과와 기술 및 산업 역량에 기반 하여 우리가 잘할 수 있는 분야를 더욱 강화하여 태동기시장을 선점하기 위해 바이오의약품 중심의 바이오미래전략Ⅰ을 추진하게 되었다.
바이오미래전략 Ⅰ의 추진 방향 첫째는 글로벌 진출을 위하여 선진국과 경쟁이 가능한 태동기 바이오의약품을 선택하였으며, 이는 세계적으로 성장가능성이 높으면서 국내 상업화 역량 및 잠재력이 높은 품목에 집중 투자를 하는 것이다. 둘째는 민간중심의 투자 혁신 환경 조성으로 정부와 민간이 협력적인 연구개발, 산업과 시장 수요에 맞는 인력양성, 민간투자 촉진을 위한 제도와 인프라 마련 등 민간중심의 전방위 지원을 하는 것이다.
바이오미래전략 Ⅰ은 “태동기 바이오산업을 미래성장동력으로 육성” 이라는 비전을 제시하여 시장중심의 R&D 추진, 글로벌 임상 지원 강화, 수요 맞춤형 취업확대, 기업 진출 종합지원이라는 4개 대표과제를 추진하는 것이다.

[특집 그림 6] 비전과 대표 과제
대표과제 첫 번째는 시장중심의 R&D 추진으로 줄기세포치료제와 유전자치료제를 중심으로 하고 있다. 기업이 원하는 정부과제가 없고, R&D 지원이 부처마다 흩어져 있다는 현장의견을 해소하기 위해 기업이 희망하는 아이템 발굴 및 투자, 부처간 연계사업 도입을 세부과제로 포함하고 있다.

[특집 그림 7] 대표과제 1 : 시장중심의 R&D 추진
대표과제 두 번째는 글로벌 임상 지원 강화이다. 임상지원 비용이 소규모이며, 해외 허가획득이 어렵다는 현장의견을 반영하여 이를 해결하기 위해 펀드조성을 통한 바이오의약품의 글로벌 임상지원 확대와 해외 인허가 장벽을 완화하여 신속한 승인을 지원한 과제를 포함하고 있다.

[특집 그림 8] 대표과제 2 : 글로벌 임상 지원 강화
대표과제 세 번째는 수요맞춤형 취업 확대이다. 기초연구성과를 제품 또는 사업화로 이어줄 전문가가 부족하고, 융합기술의 발전으로 새로운 분야의 전문가가 필요하다는 요구가 있다. 기술의 조기 사업화와 핵심 요구 인력을 양성하기 위해 연구역량을 갖춘 의사를 확보하고 새로운 분야에 대한 일자리를 확대하여 현장요구에 필요한 인력을 양성하는 내용으로 세부과제를 포함하고 있다.

[특집 그림 9] 대표과제 3 : 수요맞춤형 취업 확대
대표과제 네 번째는 기업 해외진출 종합지원이다. 수출 대상국의 정보부족으로 해외진출에 어려움이 있고, 대-중소기업의 협력을 활성화하는 주체가 필요하다는 기업의 요구가 있다. 이러한 요구를 해결하기 위해 해외진출의 전방위로 지원할 수 있는 종합정보 제공 시스템 구축과 기업 간의 협력 활성화를 유도하는 창조경제혁신센터의 역할을 포함하는 세부과제로 구성하고 있다.

[특집 그림 10] 대표과제 4 : 기업 해외 진출 종합 지원
3. 바이오미래전략 Ⅱ-의료기기 중심4)
의료기기분야는 기술간의 융‧복합이 가속화되고, u-헬스케어의 태동으로 새로운 트렌드가 확산되고 있다. IT와 NT 등의 기술 접목을 통해 10억 개의 정상 세포 사이에 숨겨진 단 한 개의 암세포로 식별할 수 있는 초정밀기기 개발로 진단 및 치료를 동시에 수행할 수 있는 신개념의 의료기기가 개발되고 있다. 또한 그간에 병원에 국한된 의료서비스가 언제, 어디서나 가능한 개념으로 확장되고 있으며 이와 관련된 모바일 기기 개발도 확대되고 있다. 이러한 기술의 발전과 혁신적인 기기 개발로 세계의료기기 시장규모는 2015년 4,158억 달러에서 2020년 5,679억 달러로 연평균 7.3%의 고성장이 전망되고 있다. 특히 미국, 일본, 독일, 중국, 프랑스 등 상위 5개국이 전체시장의 66%를 차지할 정도로 선진국에 집중되고 있으며, 향후에는 아시아-태평양 시장이 연평균 8.4% 성장률로 크게 성장할 전망이다. 품목에서는 현재까지 심장, 심혈관, 안과 등 전통품목인 의료기기의 시장규모가 크나, 향후에는 ICT 융합 영상진단기기, 헬스케어 IT 등 융복합 신개념 의료기기의 높은 성장으로 시장 지배력이 전환될 것이다. 글로벌 기업도 이러한 트렌드에 대응하기 위해 M&A를 통해 기업규모를 확대하거나 다양한 사업운영으로 사업다각화 추진하고 있다. GE, 필립스 등은 기술전문기업과 M&A를 통해 핵심기술을 확보하여 새로운 비즈니스를 개발하고 있으며, 필립스, 히타치 등은 의료기기의 소형화, 모바일화 등을 포함하는 라이프로그 신산업에 진출하고 있다.
이러한 트랜드에 대응하기 위해 정부는 의료기기분야에서 우리의 강점과 역량을 활용하여 글로벌 태동기시장 진출을 위한 전략으로 의료기기 중심의 바이오미래전략 Ⅱ를 수립하였다. 정부는 생명공학육성기본계획 수립 이후 보건의료기술육성기본계획(2013년), 의료기기산업중장기 발전계획(2014) 등을 마련하였다. 이러한 노력의 결과로 국내 시장규모가 2014년 생산액 기준 4조 5,533억 원을 형성으로 연평균 11.3% 성장률을 기록하고 있다. 또한 세계 산부인과 시장점유율 1위를 차지한 초음파영상기기, 국내시장 90%를 점유한 의료영상저장전송장치인 초음파진단기, 디지털 엑스레이 등 일부 분야에서는 핵심 기술을 보유하고 있다. 또한 삽입관 교환이 가능하고 HD급 화질을 보유한 3D 전자내시경, 레이저를 활용한 안과수술을 할 수 있는 정밀시술 OCT, 국소적인 약물배출이 가능한 국소약물배출스텐트, 고령화를 대비한 근력 보조 시스템 등 융복합기술의 특허 증가로 글로벌 기술경쟁력을 가진 제품도 점차 증가하고 있는 추세이다.
이러한 산업구조와 핵심역량에 기반한 의료기기 중심의 바이오미래전략 Ⅱ의 추진방향으로 첫째, 급격한 기술의 변화와 신제품 출시 등에 대응한 특화된 전략을 추진하는 것이다. 조기시장 진입과 미래시장 선도 등이 가능한 태동기 미래유망 분야를 선택하고 국내 성장 잠재력이 높은 품목에 대해서 집중 투자하는 것이다. ICT 융합 의료기기, 웨어러블 헬스케어 기기, 생체대체 소재 등은 태동기 분야로 선진국에서도 시장 형성 초기 단계이기 때문에 선택과 집중이 필요한 품목이다.

[특집 그림 11] 유망 의료기기 품목군
두 번째 추진방향은 혁신적 아이디어의 시장진입을 지원하기 위해 제품개발, 규제개선을 통한 시장진입, 국내외 보급 확산 등 全주기적 지원 대책을 추진하는 것이다.
바이오미래전략 Ⅱ는 “2020년 세계 7대 의료기기 강국 진입”을 비전으로 제시하고, 미래 유망 기술 R&D투자 확대, 혁신제품의 조기시장 진출 지원, 판로 개척을 통한 성장기반 마련, 산업육성을 위한 인프라 확충이라는 4개 중점과제를 추진하는 것이다.

[특집 그림 12] 비전과 중점 추진과제
중점추진과제 첫 번째는 미래 유망기술 중심의 R&D 추진 및 시장중심의 R&D 추진으로 태동기 3대 유망 의료기기 품목군을 중심으로 하고 있다. 병원이 필요로 하는 의료기기 개발이 적고 우리의 강점을 활용한 신개념 의료기기의 수요를 해결하기 위해 수요자 중심의 의료기기 개발과 혁신적인 아이디어가 제품으로 이어지게 하는 산업계-대학-연구기관-병원간의 협력을 세부과제로 포함하고 있다.

[특집 그림 13] 중점 추진과제 1 : 미래 유망기술 중심의 R&D 추진
중점추진과제 두 번째는 혁신제품의 조기 시장진출 지원이다. 의료기기 개발 이후 시장 진입까지 시간이 오래 걸리고, 임상지원 체계가 부족하다는 산업계 의견을 반영하여 이를 해결하기 위해 신기술과 신제품의 조기 시장 진출을 위한 규제개선과 기업의 임상연구지원을 위한 수요자 맞춤 공동연구 체계를 마련하는 것을 세부과제로 포함하고 있다.

[특집 그림 14] 중점 추진과제 2 : 혁신 제품의 조기 시장진출 지원
중점 추진과제 세 번째는 맞춤형 국내외 판로개척 지원이다. 국산 의료기기의 신뢰성이 부족하고, 해외 진출 대상국별 진출 전략이 상이해서 의료기기 업체가 판로개척의 어려움을 호소하고 있다. 이러한 의견을 반영하여 병원이 참여하는 검증 테스트를 수행하여 신뢰도를 높여 신개발 유망 의료기기의 국내 보급을 활성화하고, 기업의 해외 인증 역량강화를 위한 대상국별 인증기관과 연계 등의 내용을 세부과제로 포함하고 있다.
fPIC6F1D.gif

[특집 그림 15] 중점 추진과제 3 : 맞춤형 국내외 판로개척 지원
중점 추진과제 네 번째는 인프라간 연계 및 민간 투자 활성화를 유도하는 것이다. 기업이 활용할 수 있는 투자와 시설이 부족하고, 기업 혼자 제품 개발까지 가기에는 어려움이 있어 조력자가 필요하다는 기업의 요구가 있다. 이러한 요구를 해결하기 위해 민간투자를 유도하는 펀드 조성을 확대하고, 지역별로 기업을 맞춤 지원할 수 있는 인프라 육성과 이를 연계하는 네트워크를 구축한다는 내용이 세부과제로 포함하고 있다.

[특집 그림 16] 중점 추진과제 4 : 인프라간 연계 및 민간투자 활성화 유도
1) 바이오미래전략(2014), 국가과학기술자문회의
2) Regulatory frameworks and product pipelines in the global biosimilars market, GlobalData (2014)
3) 바이오헬스 미래 新산업 육성전략-바이오미래전략1(바이오의약품), 국가과학기술심의회(2015)
4) 바이오헬스 미래 新산업 육성전략-바이오미래전략Ⅱ(의료기기), 국가과학기술심의회(2015)



1. 바이오산업 – 창조경제 실현의 주역
세계 경제를 이끌어가는 주요 산업이 빠르게 변하고 있다. 과거 수 만년동안 이어진 농경사회가 18세기 공업기반의 산업화시대를 거쳐 정보화 사회에 진입하였다. 한국도 이와 같은 세계 경제 흐름에 맞추어 반도체, 디스플레이, 스마트폰 등 ICT 관련기술이 국가경제 성장에 많은 역할을 하였다. 하지만 글로벌 경제 위기 등의 불안정한 요소로 국가경제 성장은 한계에 도달해 있으며, 이를 극복하고 국가 경제 성장의 재도약하기 위한 비전이 필요한 상황이다.
바이오산업은 국민 건강과 직결되기 때문에 관심이 높을 뿐만 아니라 향후 관련 산업의 세계 시장이 빠르게 성장할 것으로 기대하고 있다. 2012년에 3,040억 달러에 이르는 세계 바이오 시장규모는 매년 10%에 가까운 성장률을 보이면서 2017년에는 4,681억 달러에 이를 것으로 예상하고 있다1). 게다가 한국을 포함한 세계 인구의 평균연령이 점점 높아짐에 따라 바이오산업은 보다 많은 수요가 예측된다.
이와 같은 국면에서 바이오산업은 새로운 먹거리를 창출할 수 있는 주역으로 떠오르고 있다. 1983년에 제정된 생명공학육성법이 수립된 이후 30여 년간 투자로 다져진 연구기반 위에 ICT 기술 등 타 기술과 융합하면서 새로운 도약이 가능해졌다. 또한 바이오산업은 경제 전반에 혁신적인 제품 생산 및 개인 맞춤형 서비스를 제공하는 등 고부가가치를 창출하는 핵심 유망산업으로 발전할 가능성이 높을 뿐 아니라 다른 산업에 미치는 파급효과도 매우 클 것으로 예상된다.

출처 : MarketLine, MarketLine Industry Guide Biotechnology, 2013. 8
[그림 1-1-1] 글로벌 바이오 시장현황 및 전망(MarketLine 기준)
바이오산업은 한국경제가 보다 치열해지는 글로벌 시장 속에서 자리매김하여 창조경제를 실현할 수 있는 핵심 분야 중 하나이며 국민 개개인의 삶의 질을 향상시키는 행복한 성장의 토대가 될 수 있도록 견인하기 위한 전략 및 준비가 필요하다.
2. 바이오산업 투자전략 – 바이오의약품 등
한국산업기술평가관리원은 바이오산업 분야를 총체적으로 파악했을 경우 한국은 후발 주자에 속하며 국가 간 기술 경쟁력이 타 국가에 비해 낮으나 기술 발전 속도는 빠르다고 하였다. 이스라엘의 경우 바이오 분야의 시장 선도 국가 중 특이하게 높은 시장 점유율과 기술력을 가진 것으로 나타났는데, 이는 이스라엘의 바이오산업 육성 정책에서 기인한 것2)으로 분석했다.
이와 같이 한국에서도 현 상황에 알맞은 바이오산업 육성 전략이 필요하며, 이에 따른 선택과 집중을 해야 할 시점이다. 따라서 다른 국가 및 업계에서 아직 유효 특허가 상대적으로 적은 바이오의약품과 같은 틈새시장을 선택적으로 집중 투자하는 전략이 필요하다. 바이오의약품은 기존 합성의약품으로 치료되기 어려운 질병을 해결 할 수 있는 대안으로 떠오르고 있어 세계 시장규모가 빠르게 증가하고 있는 추세이다.

출처 : 식품의약품안전처(2012)
[그림 1-1-2] 세계 바이오의약품 시장규모 추이
또한 바이오의약품은 타 분야에 비해 기술개발 수준이 태동기인 상태로, 한국은 바이오의약품분야에서 기술 선도그룹에 위치하고 있으며, 최고기술 보유국과의 기술격차 수준이 3년 이내로 빠른 시일 안에 추월이 가능한 상태이다. 글로벌 시장을 선점할 바이오의약품을 집중 투자하여 개발할 경우 2~3년 이내에 높은 부가가치를 창출함과 동시에 특허권(20년) 확보로 장기간 동안 독점 수익을 창출할 것으로 전망한다.
이 외에도 바이오시밀러‧베터는 글로벌 틈새시장을 선점할 수 있는 분야이다. 한국은 2013년 기준으로 세계 3위에 달하는 생산 역량(약 17만 리터)을 갖추고 있으며, 대형 신약의 특허 만료시한이 임박하였다. 따라서 중소‧벤처기업들의 해외 진출에 필요한 종합 지원 및 생산 전문인력 양성 등으로 바이오시밀러 분야에서 빠른 추격자(Fast Follower) 전략을 통해 글로벌 시장 선도가 가능할 것으로 생각된다.

출처 : 바이오미래전략, 2015. 3
[그림 1-1-3] 태동기 시장 특성 및 산업 전망
이와 같은 바이오산업 투자전략에서 원활한 성과를 얻기 위해서는 기초에서 응용까지 각 단계별로 기술개발 및 지원 전략이 필요할 뿐 아니라, 산‧학‧연간의 광범위한 협력 연구가 필요하다. 정부 컨트롤타워를 중심으로 해외 진출 종합지원 및 글로벌 임상 지원을 강화하고, 이러한 일을 담당하고 수행하는 우수 전문 인력 양성도 반드시 필요한 요소이다. 또한 바이오산업 관련 부처 간의 규제개혁을 통하여 빠른 기술성과가 창출될 수 있도록 지원해야 할 것이다.
3. 바이오산업의 미래
미국의 문명평론가 앨빈 토플러(Alvin Toffler)는 그의 저서 ʻ제3의 물결ʼ에서 인류는 농경 혁명인 제1의 물결과 산업 혁명인 제2의 물결을 거치면서 정보화 사회인 제3의 물결로 변화한다고 하였다. 이에 많은 사람들이 제4의 물결을 예견하려는 시도가 계속되어 왔으며 수많은 과학자들이 제4의 물결로 바이오기술(BT)을 주목하고 있다.
바이오기술은 시대를 앞당길 수 있는 핵심기술로 IT, NT 등의 기술과 융합하여 빠르게 개발성과를 확산시킬 수 있는 단계에 진입하고 있다. 지속적인 IT기술의 발달로 저비용의 게놈분석이 가능하게 될 향후 20년은 개인별 맞춤형 치료기술이 바로 바이오혁명이라는 것을 예측할 수 있다. 또한 다양한 맞춤형 바이오의약품의 출현으로 희귀난치성 유전질환이 개선되어, 인류의 건강 행복이 증진될 것이다.
한국의 바이오산업은 미국, 유럽과 같은 바이오산업 선진국에 비해 짧은 기간에도 불구하고 국민 건강에 지대한 공헌을 하였다. 2015년을 기준하여 한국인 평균수명은 81세에 도달했으며, 계속 증가하고 있는 것이 바로 그 반증일 것이다. 바이오산업은 새로운 경제사회를 창출할 수 있는 원동력으로 앞으로 막대한 상업적‧경제적 성장을 실현할 가능성을 가지고 있다. 새로운 시대로의 진화라는 긍정적 기대와 희망으로 그동안 해결하지 못한 수많은 난치질환 극복 및 바이오기술의 확산이 한국경제를 한 단계 업그레이드 할 것으로 기대한다.

1. 서론
바이오기술이 발전하고 IT, NT 등 신기술과의 융합이 급속히 진전되면서 바야흐로 바이오경제시대의 실현을 앞두고 있다. OECD(2006)는 바이오경제를 ʻ바이오기술에 의한 새로운 발견이 관련 제품의 보급이나 서비스의 향상을 통해 인류에 편익을 가져다주는 다양한 경제 활동ʼ이라고 정의하고, 바이오경제가 IT기반 경제에 버금가는 효과를 가져 올 것으로 예상한 바 있다. 실제로 의약품과 의료기기를 포함한 세계 바이오헬스 시장 규모는 2024년 2조 6,000억 달러(약 2,934조원)에 이를 것으로 전망되며 이는 반도체․화학제품․자동차 등 우리나라 주력 수출산업의 세계 시장을 모두 합친 규모보다 크다. 또한 바이오헬스 산업은 아직 태동기에 있는 산업으로 기술선점에 따른 시장지배효과가 커 정보기술(IT)에 이어 우리나라 경제를 책임질 차세대 먹거리로 부각되고 있다. 반도체, 전자, 자동차, 조선, 철강 등 우리나라 주력산업의 국제 경쟁력이 앞으로 10년도 채 유지되지 못할 것이라는 주요 전문가들의 예상에 따라 글로벌 산업 경쟁력 확보를 기술 선점이 어느 때 보다 시급한 시점이라고 할 수 있다. 또한 모든 사람들이 가장 바라는 소망이 건강과 장수이므로 산업의 중요성은 한층 배가 된다. 이에 본 장에서는 바이오경제 시대에 다가올 변화와 우리나라가 글로벌 시장 선점을 위해 주목해야 할 분야에 대해 살펴보도록 하겠다.
2. 미래 바이오헬스 시장 지형의 변화
가. 바이오헬스 기술의 패러다임 변화와 기회
바이오경제시대를 촉진하는 주요 환경요소로는 ʻ과학기술의 발전ʼ, ʻ산업 구조의 질적 변화ʼ, ʻ세계 경제 질서 개편ʼ, ʻ인구 고령화ʼ, ʻ자원과 환경 문제 확대ʼ 등 다섯 가지 환경변화를 들 수 있다. 이러한 주요 환경 변화 중에서 바이오경제 시대에 바이오헬스 산업의 측면에서 대응해야 하는 가장 중요한 환경 변화는 범세계적인 고령화와 과학기술의 발전으로 압축할 수 있다. 인구의 고령화로 인한 만성질환의 증가와 신의료기술의 확산으로 의료비용이 급격히 증가하고 있으며, 바이오기술 뿐 아니라 ICT 기술 등 주변기술의 획기적인 발전으로 기존 바이오헬스 산업의 영역이 확장되어 ʻ건강ʼ이라는 요소가 새로운 경제성장의 원동력이 되는 시대가 도래하고 있다.
이러한 바이오헬스 기술의 패러다임 변화와 관련하여 Christensen(2008)은 ʻ직관의학ʼ에서 ʻ경험의학ʼ으로 변화했던 의학이 앞으로는 ʻ정밀의학ʼ으로 변화할 것이라고 예견했으며 Galas와 Hood(2009), Auffray외(2010)는 미래의료는 ʻ맞춤(Personalized)ʼ, ʻ예측(Predictive)ʼ, ʻ예방(Preventive)ʼ, ʻ참여(Participatory)ʼ의 ʻ4P의학ʼ으로 발전할 것으로 내다봤다. 우리나라에서는 이러한 변화를 ʻ예방과 관리를 통한 건강수명 연장ʼ을 주요 골자로 하는 ʻ헬스케어 3.0ʼ으로 명명(고유상 외, 2012) 하고, ʻ예방 및 건강관리ʼ, ʻ맞춤 치료ʼ, ʻ진단과 치료의 미세화ʼ, ʻ환자 중심화ʼ 등의 변화를 예측한 바 있다.
[표 1-2-1] 바이오 헬스 기술 패러다임의 변화
|
문헌 |
바이오 헬스 기술 패러다임의 변화 내용 |
|
Cristensen 외(2008) |
직관의학 → 경험의학 → 정밀의학 |
|
Galas & Hood(2009), Auffray 외(2010) |
4P의료 : 맞춤(Personalized), 예측(Predictive), 예방(Preventive), 참여(Participatory) |
|
고유상 외(2012) |
전염병 예방(헬스케어 1.0) → 질병치료로 인한 기대수명 연장 (헬스케어 2.0) → 예방과 관리를 통한 건강수명의 연장(헬스케어 3.0) |
나. 국․내외 바이오헬스 미래기술 대응 현황
우리나라를 포함한 주요국들은 패러다임 변화에 맞춰 글로벌 시장을 선점하기 위한 노력을 아끼지 않고 있다. 미국은 ʻ국가 바이오 경제 청사진(National Bioeconomy Blueprint, 2012)ʼ을 통해 합성생물학(Synthetic biology), 프로테오믹스, 생물정보기술 등 미래유망기술육성을 위한 계획을 마련하여 추진 중에 있다. 또한 빅데이터(Big data) 이니셔티브(2012), 뇌연구(Brain) 이니셔티브(2013), 정밀의학(Precision medicine) 이니셔티브(2015) 등의 대형 중장기 투자전략 마련을 통해 글로벌 시장 선점을 위한 미래기술개발에 적극적으로 나서고 있다.
유럽은 차세대 백신, 의약품 및 치료제 개발을 목표로 하는 민관합작 신약개발 프로그램인 ʻ개인 맞춤형 헬스케어 패키지 개발(IMI2, Second Innovation Medicines Initiative)ʼ을 위해 32.7억 유로, ʻHorizon 2020(2014~020)ʼ의 빅데이터 분야 연구에 향후 5년간(2016~020) 약 25억 유로를 투자할 예정이다. 특히 영국은 암 또는 희귀질환 분야의 유전체 기반 진단 치료 향상을 목표로 2012년부터 2017년까지 3억 파운드가 투자되는 ʻ10만 게놈 프로젝트ʼ를 진행하고 있다.
일본은 바이오헬스 분야 기술개발을 강화하고자 의료분야 연구개발의 사령탑인 ʻ일본의료연구개발기구ʼ를 설립(2015.4)하였으며, ʻ재생의료 실현화 하이웨이 구상 프로젝트ʼ에 164억 엔을 투자하고 뇌과학 분야 투자를 강화하는 등 바이오헬스 분야 시장 선점을 위한 노력을 계속하고 있다.
우리나라 또한 미래창조과학부, 산업통상자원부, 보건복지부, 식품의약품안전처를 중심으로 ʻ바이오헬스 미래 신산업 육성 전략ʼ(2015.3)을 발표하고, ʻ바이오의약품ʼ, ʻ의료기기ʼ 등 글로벌 시장 선점이 가능한 분야에 2015년 한 해 동안 총 3,400억 원을 투자하는 등 아직 태동기인 바이오헬스 분야 글로벌 시장 선점을 위해 박차를 가하고 있다.
3. 글로벌 시장 선점을 위한 미래기술
보건복지부는 건강에 대한 다양한 국민요구 충족과 글로벌 보건의료 기술 및 산업발전 선도를 위한 미래기술발굴을 목적으로 한 기획연구를 진행한 바 있다. 기획연구를 통해 약 100여명의 바이오헬스 관련 전문가들의 집단 지성을 활용하여 2030년 경 실현 가능한 미래유망기술을 도출하였다. 글로벌 시장 선점을 위한 미래기술 도출을 위해 기획연구에서 도출된 미래유망기술 중 경제적 파급효과가 크고 국내 기술 확보 가능성이 높은 기술을 선별하고, 국․내외 바이오헬스 미래유망기술 예측 보고서에서 제시한 미래유망기술을 참고하여 글로벌 시장 선점을 위한 8대 미래기술을 도출하였다. 이에 관한 설명은 아래와 같다.
가. 개인맞춤형 예방의학의 실현 : 정밀의료(Precision Medicine)기술
유전체 분석 기술, 생물정보학(Bioinformatics) 기반의 초고속 생체 정보 처리 알고리즘 등 차세대 생명공학기술의 발전에 따라 가까운 미래에 개인의 유전적(Genetic) 특징 및 임상 정보, 생활환경 및 습관(Lifelog) 정보 등에 기반 하여 환자에게 최적의 맞춤형 질병 예방 및 치료가 이루어지는 정밀의료가 현실화 될 것이다. 정밀의료가 현실화 되면 분자 수준에서 질병의 원인을 정확히 진단하여 꼭 필요한 약제만을 사용함으로 인해 약제비용을 크게 절감할 수 있으며 환자는 불필요한 약제에서 오는 부작용을 최소화 할 수 있을 것이다. 또한 개인 건강정보의 지속적 수집과 장기 추적을 통해 발병위험, 예후, 재발 가능성 등을 예측하여 치료 중심에서 예방 중심의 헬스케어 체계를 실현할 수 있을 것이다. 정밀의료와 관련하여 유전체/단백체 기반 분자 진단기술, 유전체 스크리닝 기술, 신약개발에서의 유전체 분자 단위 정보 응용 기술, 의료정보 플랫폼 구축 기술 등의 시장성이 밝을 것으로 예상되며 시장조사기관 KellySciPub research에 따르면 글로벌 맞춤의료 시장은 2019년 600억 달러(약70조원)에 달할 것으로 예측된 바 있다.
나. 재생의료(regenerative medicine) 기술
오늘날 의료기술의 놀랄 만한 발전에도 불구하고 아직도 수많은 환자들이 난치성 질환으로 고통을 받고 있다. 미래에는 질병, 사고, 노령화 등으로 손상된 세포, 조직 및 장기의 형태 및 기능을 근원적으로 복원하는 기술인 재생의료기술을 통해 난치 질환을 근본적으로 치료하는 새로운 패러다임의 시대가 도래 할 것이다. Frost & Sullivan(2015)에 따르면 재생의료 시장은 매년 23%씩 성장하여 오는 2020년에는 675억 달러(약 80조 4천억 원)의 시장 규모를 형성할 것으로 예상되었다. 재생의료의 핵심기술로는 줄기세포, 생체소재(biomaterials), 조직공학(tissue engineering)기술이 있으며, 특히 유도만능 줄기세포(induced Pluripotent Stem Cells, iPS)기술과 이종 이식(xenotransplantation)기술의 파급력과 시장성이 클 것으로 예상된다. 분화가 끝난 체세포를 분화 이전의 세포 단계로 되돌려 만능성을 유도시킨 유도만능 줄기세포(induced Pluripotent Stem Cells, iPS)기술을 활용하면 자신의 세포를 이용하여 면역 거부반응이 없는 맞춤형 세포치료제 개발이 가능하다. 또한 직접 사람의 질병 모델의 제작이 가능하여 기존의 동물 모델을 이용하는 것보다 안전성과 효율성을 크게 향상시킨 drug screening platform의 개발이 가능해 지며 이는 신약개발 분야에 큰 파급효과를 가져올 것으로 기대된다. 이종 이식의 경우 유전자 편집기술의 발전에 힘입어 최근 미국 하버드 대학 의과대학 연구팀이 돼지 장기의 인간 이식을 가로막는 요인 중 하나인 돼지 내인성 레트로바이러스(PERV:porcine endogenous retrovirus)를 지닌 DNA염기서열을 유전자 가위(CHRISPER-Cas9)로 잘라내는데 성공하는 등 현실화가 한 단계 더 가까이 다가왔다. 이를 통해 가까운 미래에 돼지 등 동물의 장기를 사람에 이식하는 이종이식의 길이 열릴 것으로 예상되며 당뇨병, 각막 질환 등 난치질환 환자의 고통을 해결해 줄 수 있을 것으로 기대된다.
다. 시공초월 의료서비스(Ubiquitous healthcare technology)
u-health는 물리적으로 떨어져 있는 환자를 ICT 기술을 활용하여 원격으로 진단/치료하는 일련의 활동 뿐 아니라 일상적인 생활 속에서 건강에 관련된 신호 등을 수집 분석하여 상시적으로 건강을 관리하는 새로운 의료 패러다임을 포함한다. 즉 현재 병원과 의사를 중심으로 단절적으로 이루어지던 의료가 생활 속으로 스며들어 ʻ지속적이며 상시적 관리ʼ라는 의료시스템 전반에 혁명적인 변화를 유도할 수 있는 기술이다. 15년 이상 많은 논란에도 불구하고 아직 크게 발전하지 못하고 있는 것은 이렇게 사회 전반적인 시스템 변화가 수반되어야 하기 때문이다. 그러나 이러한 변화는 인구 고령화와 폭발적으로 증가하고 있는 의료비 문제 등으로 이미 거스를 수 없는 대세이며 이에 대한 깊은 고민과 사회적인 합의가 필요한 부분이다. 따라서 u-health는 치료의 질을 향상시키는 한편 비용 절감이라는 두 마리 토끼를 잡을 수 있는 유일한 대안으로 제시되고 있으며 글로벌 시장조사업체 IHS 테크놀로지에 따르면 비용 절감과 의료 서비스 향상을 위해 의료기관이 원격통신 기술 및 모니터링 기술사용을 늘리면서 세계 원격의료 기기 및 서비스 시장의 매출이 2013년 4억 4,060만 달러(4,847억 원)에서 2018년에는 45억 달러(4조 9,500억 원)로, 원격의료 서비스를 사용하는 환자 수도 2013년 35만 명 이하에서 2018년 700만 명으로 증가할 것으로 예상 된 바 있다.
라. 실시간 건강모니터링 : 체외진단(In Vitro Diagnostics) 기기
미래에는 ICT 기술 및 상시 진단기기의 발달과 급속히 늘어나는 의료비문제로 인한 질병 예방 중요성의 증대에 따라 현재 개인 주도적으로 이루어지는 건강관리가 사회 주도적 건강관리 시스템으로 변화할 것이다. 이에 개인의 건강모니터링과 적시 관리가 일상화 되며 개인의 건강관리에 대한 사회적 책임 또한 확산될 것이다. 이에 따라 생활상의 복합적 생체정보를 실시간으로 측정할 수 있는 체외진단기기의 수요 또한 크게 증가할 것으로 예상된다. Frost & Sullivan 한국지사는 2013년 473억 달러(52조 300억 원)이던 체외진단기기 시장이 오는 2017년에는 626억 달러(68조 8,600억 원)에 달할 것으로 예측했다. 미래의 체외진단기기는 단순히 건강정보를 확인하는 수준에서 벗어나 사물인터넷(IoT) 및 빅데이터 기술과 연동되어 분석된 개인의 건강정보를 의료기관 등에 전송하고 실시간으로 피드백 받을 수 있는 종합 건강관리 시스템으로 발전할 것으로 예상된다. 이에 빅데이터를 활용한 통합의료정보 시스템 등 연관 기술의 발전도 함께 염두에 두어야 할 것이다.
마. 맞춤형 장기 생산 : 바이오프린팅(Bio printing)
3D 프린터를 이용한 바이오프린팅 기술은 현재 가상 시뮬레이션을 통한 수술 시간 단축 및 성공률 향상, 보청기, 틀니, 의족 등 개인 맞춤형 의료보형물 제작 등에 제한적으로 사용되고 있지만, 앞으로 그 범위는 무궁무진하게 확대될 것이다. 미래에는 내부가 복잡한 심장이나 간, 혈관 등을 프린팅 할 수 있는 기술이 개발될 것이며 이런 변화로 인해 뼈나 장기를 병원의 필요에 따라 생산하는 시대가 올 것이다. 이렇게 바이오프린팅은 기존 보형물 등을 통한 수술의 단점인 이식 거부반응 등을 피할 수 있고 간이나 신장 등 장기 부족 문제를 해결할 수 있는 혁신적인 대안으로 부상하고 있다. 최근 급성장 중인 바이오 프린팅 산업은 2018년에는 글로벌 시장규모가 40조원에 이를 것으로 추산되고 있다.
바. 의료기술과 로봇기술의 융합 : 의료로봇(Medical Robot)
정확한 진단과 최소 침습치료, 그리고 체계적 재활을 통한 회복은 질병극복이라는 과제 앞에서 모두가 지향하는 바이며, 이러한 지향점이 로봇공학의 발전과 함께 현실로 다가오고 있다. 캡슐형 내시경 로봇과 혈관 내에 주사 가능한 마이크로 로봇을 통해 정확한 진단과 병변 제거가 가능할 것이며 수술 로봇의 도움을 받아 최소 침습의 정밀한 수술을 수행할 수 있을 것이다. 또한 뇌자극 시스템, 외골격 시스템, 착용 로봇 등 재활로봇은 질병, 사고, 노화 등으로 심각한 부상을 입은 사람들의 회복에 큰 도움이 될 것이며 이를 통해 일반인 보다 신체적 기능이 월등한 장애인의 탄생도 가능 할 것이다. 최근 시장조사기관 마켓앤마켓은 2013년 17억 8,100만 달러(약2조원)이던 세계 의료로봇시장이 5년간 연평균 16.1% 성장해 오는 2018년에는 37억 6400만 달러(약 4조 1,400억 원)에 이를 것으로 예측했다.
사. ʻ소우주ʼ 비밀에 대한 탐구 : 뇌과학 기술
뇌연구는 과학계의 미개척 분야 중 하나로 소우주인 뇌의 신비를 밝히는 일은 20세기 달 탐사에 비견되는 21세기 과학계의 최대 관심 주제이다. 특히 고령화 사회에 진입하면서 증가하고 있는 난치성 질환인 뇌졸중, 파킨슨병, 알츠하이머 등 퇴행성 뇌신경질환의 병인이 정확히 밝혀져 있지 않고 조현병을 포함한 중증 정신질환의 유병율도 높아지고 있어 미래 건강사회 구현에 커다란 장애물이 될 것으로 예상되고 있다. 실제로 뇌질환의 세계의료시장 규모는 2007년 150조 원에 이르렀고, 매년 8.7%로 가파른 성장을 보이고 있다. 뇌질환 의약품 시장은 120조 원으로 전체 의약품 시장의 15.3%에 달하며, 뇌질환으로 발생하는 직․간접적 경제적 비용은 전 세계적으로 2,000조원으로 추정되고 있다.
미래에는 뇌의학 및 뇌공학 기술의 발전으로 이러한 뇌신경질환의 근본적인 치료가 가능할 것으로 예상된다. 뇌지도 작성을 통해 뇌 기능의 원리가 밝혀지게 되면 뇌 기능 향상이나 뇌질환 진단. 치료제 개발로 이어지는 것은 물론이고 다양한 융합기술을 통해 미래 산업의 새로운 패러다임을 제시할 수 있을 것이다. 뇌과학은 기초과학, 의학, 공학, 심리학 등 다양한 분야와 연관돼 있어 뇌신경생물학, 뇌질환, 뇌인지, 뇌공학 등 다양한 융합연구를 가속화 할 것이다. 대표적인 예로 뇌-IT 융합 기술인 BMI(뇌․기계인터페이스)나 BCI(뇌․컴퓨터 인터페이스) 기술이 있으며, 이러한 기술은 두뇌에서 나오는 전기적 신호인 뇌파를 컴퓨터나 다양한 기기와 직접 연결해 신체를 사용하지 않고 제어하는 것으로 생각만으로 의료보조기기를 조종하거나 터치 없이 스마트폰 등 휴대기기나 웨어러블 기를 작동시키는데 활용될 수 있다. 이러한 기술이 상용화 될 경우 신체마비 등을 겪는 난치성 질환 환자 등에게 큰 도움이 될 것이며 통신, 엔터테인먼트, 컴퓨터 산업 등 관련 산업에도 큰 파급효과를 불러올 것으로 예상된다.
아. 암 완치 시대의 도래 : 항암 면역치료제(Cancer Immunotherapy)
면역세포 치료는 현재 암 치료에 이용되는 외과적 수술과 방사선 조사, 항암제 등과 더불어 ʻ제4의 치료법ʼ으로 자리 잡을 가능성이 높은 분야다. 미국 과학학술지 사이언스는 2013년 환자 스스로 암을 물리치게 만드는 면역항암제의 획기적 방법 때문에 ʻ가장 주목할 연구ʼ 분야로 꼽은 바 있다. 항암 면역치료는 환자 자신의 면역체계를 이용해 몸 안에 존재하는 암 세포를 제거하기 때문에 부작용이 적고, 면역 시스템의 기억 기능은 암의 재발이나 전이를 방지하여 기존의 약물 치료와 비교할 때 상당한 장점으로 인식되고 있다. 이에 항체를 포함하는 면역 치료제들은 기존의 약물치료 위주의 항암제 시장의 판도를 바꾸고 앞으로 15년에서 20년 내에 항암제 분야를 주도할 것으로 전망된다. 헬스케어 시장조사기관인 Decision Resources에 따르면 항암 면역치료제 세계 시장은 2012년 11억 달러(1조 2,100억 원)에서 2022년 90억 달러(9조 9,000억 원) 규모로 성장할 것으로 예측되고 있다.
4. 글로벌 시장 선점을 위한 미래기술 육성을 위한 제언
바이오경제 시대의 도래와 더불어 태동기인 바이오헬스 시장 선점을 위한 각국의 치열한 경쟁이 시작되었다. 바이오헬스 기술은 기술수명주기가 길고 ICT 등 다른 기술과의 융․복합을 통한 기술 활용 범위의 확대가 용이하여 시장 선점에 따른 수익체증효과를 얻는 것이 무엇보다 중요하다. 이를 위해 시장 수요 중심의 유망기술 아이템을 발굴하고, 발굴된 아이템은 ʻ기술개발-임상-인허가 사업화ʼ의 R&D 전주기를 포함하는 패키지형 프로젝트로 지원될 필요가 있다. 우리나라의 경우 국가 R&D 투자액의 절대 규모가 선진국에 비해 상대적으로 작아 유망기술 아이템을 중심으로 선택과 집중 전략을 추진하고 민간 투자를 확대 할 수 있도록 노력해야 한다. 또한 국․내외 인허가를 신속히 밟을 수 있는 자금 지원의 확대, 불합리한 규제의 완화, 기술개발 인력 양성 계획 수립 등 기술 개발 촉진을 위한 환경적인 측면도 적극적으로 검토되어야 하겠다.

1. 정책의 변화
전 세계적으로 인구 고령화와 만성질환의 증가로 의료비용에 대한 정부의 지출 문제가 대두되고 있다. 미국은 2012년 총 GDP의 17%였던 의료비용 지출이 2023에는 23%로 증가할 전망이며, 유럽의 경우 프랑스 성인 13%, 영국 성인 6%는 의료비용 충당에 어려움을 겪고 있으며, 인도는 의료비용의 지출이 빈곤의 주요 원인으로 작용하는 것으로 분석되고 있다. 또한 향후에는 만성질환이 헬스케어 지출의 75%를 차지할 것으로 예상되며, 이에 Ernst & Young은 2030년까지 전 세계 GDP 중 47조 달러의 경제적 손실이 발생할 것으로 전망하고 있다. 선진국들은 국자재정 확보를 위해, 앞 다투어 의료비용의 효율화와 절감에 대한 정책을 추진하고 의료패러다임의 전환에 집중하고 있다.
특히, BT-IT-NT 융복합 기술의 급속한 발전은 질병 치료 방법에 대한 새로운 개념 도입을 촉진하였으며, 사후대처 방식인 현재의 치료방법에서 탈피하여 예방의학과 개인맞춤형 의료를 통한 바이오 의료기술 및 의료서비스의 패러다임 전환을 가져오고 있다. 미국에서는 이러한 새로운 패러다임을 접목한 헬스케어 산업 육성을 통해 국민의 삶의 질을 높이는 동시에 의료비 재정을 절감할 수 있는 ʻ오바마케어(Obama Care)ʼ, ʻ정밀의학계획(Precision medicine initiative, 2015.1.)ʼ 등의 정책을 추진하고 있다.
2010년 3월 승인된 오바마케어(Obama Care)는 2014년 1월부터 본격 시행에 들어갔다. 이에 따라 상대적으로 의료재정의 부담을 줄일 수 있는 바이오시밀러에 대한 관심이 증가하였다. 이러한 이유로 최근 글로벌 제약업체 노바티스의 자회사인 산도즈(Sandoz)의 바이오시밀러 제품 ʻ작시오(Zarxio)ʼ가 최초로 美 FDA 승인을 취득(2015.3)하였으며, 향후 후속 제품 승인도 이어질 전망이어서, 바이오시밀러 시장 확대에 대한 기대감이 커지고 있다.
또한, 개인 유전자, 환경 및 생활양식 등의 개인차가 질병 예방 및 치료에 중요하게 작용하기 때문에 개인 맞춤형 의학의 확대를 지원하는 ʻ정밀의학계획 Precision medicine initiative, 2015.1.)ʼ을 추진하는 등 의료 패러다임 변화를 주도하기 위한 정책이 강화되고 있으며, 이러한 미국 정부의 의료혁신 정책은 시장에 즉각 반영되어 관련 산업의 新성장 기회를 형성하고 있다.
2. 융합에 의한 신사업 기회
미국정부의 정책기조는 융합 헬스케어 제품에 대한 규제 완화로 이어지고 있으며, 관련된 제품이 본격적으로 시장에 출시될 수 있도록 환경을 조성하고 있다. 대표적인 예로 美 FDA에서 그동안 모바일 의료 앱을 의료기기로 분류하고 규제하였으나 최근 시책을 완화하여 실제 건강에 위협을 주지 않는 수준이라면 규제를 하지 않기로 하는 새로운 가이드라인을 발표하였다(2015.2.). 이에 따라 최초로 의료용 모바일 어플리케이션(Dexcom SHARE system)이 FDA 승인을 취득하였고, 이는 향후 디지털 의료기기/서비스 시장이 급속도로 성장 할 수 있는 환경을 제공하였다고 볼 수 있다.
2013년 미국 벤처캐피털협회가 600명의 벤처투자자 및 기업 CEO를 대상으로 한 향후 투자 전망에 따르면, 창업 투자에 유망한 분야로 최첨단 ICT 기술을 활용한 원격의료 및 건강관리 등 디지털 헬스(Digital Health)분야를 유망 분야로 전망하고 있으며, 건강관리 관련 소비 지원(Health consumer engagement), 생체정보 측정 및 개인 건강관리기기‧서비스(Personal health tools and tracking), 병원 의무기록‧저장 및 활용 EMR/HER, 병원업무관리 등 4분야를 주요 분야로 선정하였다. 이로 인해 2013년 대비 2014년 미국 내 디지털헬스 분야 스타트업의 투자 규모가 125% 증가하였다.
시장의 높은 성장률에 따라 기존 헬스케어 기업과 신규 진입기업 간의 경쟁은 가속화 될 것으로 보이며, 특히 IT업체는 데이터 분석 처리에 대한 문제를 제기하며 헬스케어 시장에 지속적으로 진출할 전망이며, 유통업체와 식품업체는 건강기능식품시장 진입을 위한 연구에 주력할 것으로 보인다.
결국, 향후 헬스케어 시장은 산업 간의 융합을 통해 시장의 경계가 사라지고 하나의 시장으로 통합될 것으로 보인다. 미국 정부는 원격의료 관련 지원정책을 지속적으로 발표하고 디지털 의료 서비스에 대한 의료수가 체계를 적극적으로 마련하고 있으며 이에 따라 IT 기업의 디지털병원 플랫폼 사업 혹은 모바일 웰니스 기기에 대한 진출이 최근 몇 년 사이에 하나의 메가트렌드로 자리 잡고 있다.
또한, 의약품, 기기, 헬스서비스 기업 등이 경계 없이 하나의 시장에서 경쟁하는 구도가 만들어짐에 따라, 새로운 창업 기회가 더 빠르게 증가하고 있으며, 향후 미국의 헬스케어 시장은 기존 IT 및 제약기업 뿐만 아니라 스포츠·의류업체, 유통·물류업체, 통신업체 등 미국 내 대부분의 산업과 연관된 하나의 경제 체제가 될 것으로 예상된다.

출처 : 생명공학정책연구센터, 2015
[그림 1-3-1] 미국의 헬스케어 사업 시장의 신시장 창출 기회(2013~2014)
그 예로 기존 제약기업 외에 Google 등 IT기업이 진단/의료서비스 시장 진입을 가속화하고 있고, 기존에 의료서비스(유전체 진단) 영역 기업들은 비즈니스 과정에서 축적된 유전체 정보를 바탕으로 맞춤의약품을 개발하는 등 새로운 형태의 비즈니스 진출 현상이 나타나고 있다. 특히 Google은 자회사로 설립한 ʻGoolge Venturesʼ를 통해 유전체 분야의 투자뿐만 아니라 바이오헬스분야에 대한 투자 비중이 급격히 증가(2013년 6% → 2014년 36%)하고 있다. 이외에도 Apple, Microsoft 등의 대표적인 IT기업들이 모바일 헬스케어기기 및 헬스서비스를 통해 본격적으로 시장에 진출하고 있다.
[표 1-3-1] 구글 벤처스의 투자 포트폴리오(2013~2014)
|
2013년 |
소비자 인터넷 |
모바일 |
전자상거래 |
기업 및 데이터 |
생명과학 |
에너지 |
|
33% |
28% |
18% |
11% |
6% |
4% |
|
|
2014년 |
생명과학 |
모바일 |
기업 및 데이터 |
소비자 |
전자상거래 |
|
|
36% |
27% |
24% |
8% |
5% |
||
출처 : 생명공학정책연구센터 분석자료, 2015
반대로 기존 제약업체들은 정부정책의 변화 및 시장 패러다임의 변화를 인지하고, 의약품 판매 일변도의 판매 전략을 수정하여 의약품과 함께 환자들에게 다양한 의료제품과 의료서비스를 제공하는 패키지 형태의 비즈니스로 변화를 꾀하고 있다. 이를 통해 제약사는 치료와 결과의 통합적 관리를 통해 효율성을 향상하고 자체 의약품의 효과를 입증할 수 있는 데이터 축적이 가능할 것으로 보이며, 빅데이터 기반의 디지털 분석법, 자동화 등의 도입은 신약의 개발 속도와 효율성을 향상시켜 시장에서 유리한 위치를 선점할 수 있는 필수적인 요소로 자리 잡고 있다.
3. 바이오분야 신사업 전망
헬스케어 산업은 모바일‧소셜 헬스 솔루션 개발로 점차 일생생활과 연계될 전망이다. 특히 가트너(Gartner), 맥킨지(McKinsey) 등에서는 모두 사물인터넷(IoT) 시장에서 헬스케어가 차지하는 비중이 가장 주요할 것으로 전망하고 있다. 특히 가트너(Gartner)는 2020년 헬스케어 영역이 전체 사물인터넷 시장의 15%를 차지, 제조업과 함께 가장 높은 부가가치를 창출할 것으로 분석하였다.
그리고 스마트폰 사용자 수가 증가하고 사물인터넷이 급속히 발달하는 환경에서 고령화시대의 건강관리 수요가 함께 급증하면서 모바일 헬스케어 디바이스 시장은 크게 성장할 것으로 예측되고 있다. Markets&Markets의 2013년 산업분석 보고서를 보면 글로벌 모바일 헬스케어 시장은 2013년 63.4억 달러에서 연평균 26.7%로 성장하여 2018년 207억 달러 규모로 높은 성장을 기록할 것으로 전망하고 있다.

출처 : Markets and markets, Mobile Health Apps & Solutions Market worth $20.7 Billion by 2018, 2013
[그림 1-3-2] 지역별 모바일 헬스케어 시장 성장률(2013~2018년)
Ernst&Young의 ʻMegatrend 2015 보고서ʼ에서도 현재 2만개 이상의 헬스케어 관련 스마트폰 앱이 출시되어 있고, 향후에는 더 많은 앱이 출시될 것으로 예측하고 있으며, 글로벌 모바일 헬스케어 및 센서 시장은 2013년부터 2018년까지 연평균 40%에 달하는 성장률을 기록하고, 소셜미디어를 통해 생산되는 헬스케어 데이터가 현재 50페타바이트(Petabyte)에서 2020년에는 25,000페타바이트로 급증할 것으로 예상하고 있다. 또한 헬스케어 시장은 빅데이터와 융합하면서 전 세계 헬스케어 분석시장은 2012년부터 2017년까지 연평균 23.7%로 성장할 것으로 보고 있으며, 곧 도래할 것으로 예상되는 개인맞춤의약 시대에는 개인 유전체 분석 비용이 1천 달러 이하로 감소하고 개인맞춤의약 진단시장이 2013년부터 2018년까지 두 자리 수 이상의 성장률을 기록할 것으로 예상하고 있다.
4. 국내 바이오 산업 현황과 미래전망
2015년 한미약품은 총 6조 5천억 원 규모의 기술이전을 진행했으며 삼성바이오로직스와 셀트리온은 각각 바이오시밀러인 엔브렐과 램시마주 등의 판매 허가를 획득했다. 2018년 삼성바이오로직스가 바이오시밀러 생산을 위한 제3공장을 완공 하게 되면 세계 2위의 생산시설을 갖추게 된다. 이 같은 국내 바이오시밀러 기업들의 성과는 국내 바이오시밀러 시장 확대로 이어져 2012년 7천만 달러에서 2019년 1.2억 달러(CAGR 7.8%) 규모 이상의 성장이 전망된다. 2015년 바이로메드는 미국 유전자치료제 바이오기업인 블루버드바이오에 570억 원 규모의 기술 수출 성과를 냈다. 이 성과들은 국내 바이오기업의 기술력이 세계적인 수준임을 다시 한 번 입증하였으며 국내 기업들의 지속적인 성과 창출은 바이오산업 생태계의 경쟁력을 더욱 강화 시키고 있다.
이와 같은 국내 바이오 산업의 성장으로 몇 년 사이에 바이오분야에 대한 투자가 급격하게 증가하고 있는 추세이다. 한국벤처케피탈협회에서 발행한 2015 Yearbook에 의하면 2013년 대비 2014년 벤처캐피탈 신규투자는 두 배 이상이 증가하였다. 바이오벤처 기업은 지속적으로 성장하여 코스닥 기술특례 상장기업수(누적)가 2005년 2개에서 2014년 14개로 증가하였고 코스닥 내에서 바이오벤처 시가총액의 비중이 2004년 3.6%에서 2014년 13.7%로 3.8배 증가하였다. 이러한 트랜드에 가장 민감한 벤처케피탈은 IT제조(1,705억원), IT서비스(1,483억원)보다 더 많은 금액인 2,530억 원을 바이오‧의료분야에 투자하였다. 특히, 최근에는 예전의 바이오벤처 일변도에서 벗어나 디지털과 융합된 새로운 바이오 비즈니스 분야에도 투자가 집중되고 있다.
[표 1-3-2] 2014년 벤처캐피탈 신규 투자의 업종별 현황
|
구분 |
2010 |
2011 |
2012 |
2013 |
2014 |
|
|
ICT 제조 |
업체수(개사) |
89 |
88 |
102 |
99 |
86 |
|
투자금액(억원) |
1,860 |
1,754 |
2,099 |
2,955 |
1,951 |
|
|
ICT서비스 |
업체수(개사) |
53 |
58 |
83 |
106 |
153 |
|
투자금액(억원) |
804 |
892 |
918 |
1,553 |
1,913 |
|
|
전기/기계/장비 |
업체수(개사) |
95 |
103 |
98 |
105 |
86 |
|
투자금액(억원) |
2,141 |
2,966 |
2,433 |
2,297 |
1,560 |
|
|
화학/소재 |
업체수(개사) |
51 |
51 |
53 |
45 |
47 |
|
투자금액(억원) |
1,064 |
1,266 |
1,395 |
989 |
827 |
|
|
바이오/의료 |
업체수(개사) |
40 |
43 |
59 |
63 |
87 |
|
투자금액(억원) |
840 |
933 |
1,052 |
1,463 |
2,928 |
|
|
영상/공연/음반 |
업체수(개사) |
140 |
150 |
158 |
159 |
208 |
|
투자금액(억원) |
1,733 |
2,083 |
2,360 |
1,963 |
2,790 |
|
|
게임 |
업체수(개사) |
47 |
61 |
91 |
106 |
137 |
|
투자금액(억원) |
945 |
1,017 |
1,126 |
940 |
1,762 |
|
|
유통/서비스 |
업체수(개사) |
44 |
57 |
56 |
79 |
119 |
|
투자금액(억원) |
954 |
1,270 |
608 |
1,092 |
2,046 |
|
|
기타 |
업체수(개사) |
33 |
27 |
20 |
36 |
38 |
|
투자금액(억원) |
569 |
427 |
342 |
593 |
616 |
|
|
합계 |
업체수(개사) |
560 |
613 |
688 |
755 |
901 |
|
투자금액(억원) |
10,910 |
12,608 |
12,333 |
13,845 |
16,393 |
|
출처 : 2015 KVCA Yearbook, 한국벤처캐피탈협회, 2015
국내 건강관련 애플리케이션 및 헬스케어 산업은 주로 삼성전자, LG전자, SK텔레콤 등 스마트폰 제조사와 통신사들을 중심으로 선점되고 있다. 이들 회사들은 모바일헬스케어 산업을 미래의 신수종사업으로 선정하고, 대대적인 투자를 감행하고 있다. LG전자는 애플리케이션과 연동되는 개인의 식생활 및 건강상태를 관리할 수 있는 헬스워치를 시장에 선보였으며 삼성전자는 갤럭시S4 시리즈에 S헬스 기능을 탑재하고 갤럭시 기어 시리즈와 함께 사용자의 건강 상태와 주변 환경을 인지할 수 있도록 하였다. SK텔레콤은 ICT기반의 스마트 의료 구축사업을 위한 다양한 모바일 솔루션 개발로 B2C 유형의 사업인 헬스온 서비스를 모델화하고 2011년 서울대병원과 합작사인 헬스커넥트를 설립하여 예방, 진단, 치료, 관리를 연계한 차세대 의료서비스모델 개발을 추진 중이다.
정부도 최근에는 헬스케어 산업의 중요성을 인식하고 관련 정책들을 펼치고 있다. 특히 미래부는 2014년 2월 과학기술과 ICT 신산업 육성을 목표로 바이오 헬스 산업을 집중 육성하겠다는 계획을 밝혔다. 미래부는 이 사업을 통해 유아 행동장애(ADHD, 자폐증 등), 청소년 인터넷‧게임 중독 및 비만, 청장년층 질병 자가진단 및 4대 중증질환(암, 심장, 뇌혈관, 난치성질환), 노인성질환(치매 등) 및 노령화(신체노화 등) 대응기술 등으로, 생애 전 단계에 걸쳐 ICT가 국민 건강문제 해결에 기여할 것으로 기대하고 있다.
또한 사물인터넷 헬스케어 서비스와 관련한 실증 사업도 추진 중에 있다. 개방형 사물인터넷 헬스케어 플랫폼을 기반으로 의료기기 업체 등 공급기관과 첨단 의료복합단지‧의료기관 등의 수요기관과 연계한 헬스케어 실증서비스를 추진할 계획이다
하지만, 국내에선 아직 시장 초기 형성 단계로, 직면하고 있는 다양한 문제점이 있다. 디지털-헬스케어 융합산업의 기본적인 문제인 기술 표준화 문제, 개방형 플랫폼의 부재, 보안 및 프라이버시 보호 등과 같은 문제가 있으며, 이를 비롯한 생체정보를 활용해야 하는 헬스케어 분야의 특성상 이와 관련된 보안 및 프라이버시 문제는 더욱 예민한 문제임에 틀림이 없다. 따라서 이러한 환경‧제도적 문제를 해결하고 글로벌 시장에 성공적으로 안착할 수 있는 정부의 정책적 지원이 계속적으로 필요하다. 글로벌 시장 흐름에 맞는 법‧제도의 신속한 제‧개정과 시장수요에 부합한 정부의 R&D 및 시장진출 지원은 국내 헬스케어 생태계를 강화 할 수 있는 좋은 계기가 될 것이다.

1. 국가과학기술심의회
2013년 박근혜 정부가 출범하면서 과학기술 정책과 연구개발 사업 등을 총괄‧조정하는 컨트롤 타워의 역할을 수행하는 ʻʻ국가과학기술심의회ʼʼ (이하 국과심)가 새롭게 출범하였다. 국과심은 과학기술기본법 제9조에 근거하여 1999년 1월 대통령을 위원장으로 설치된 국가과학기술위원회를 거쳐 2011년 3월 상설행정위원회로 개편되었다. 이후 종전의 상설 국과회(사무처+심의회의체)에서 수행하던 과학기술정책 및 R&D 사업 종합‧조정 기능(사무처)이 미래부로 이관되고 최고 심의의결기구로서의 심의회의체 역할 수행을 위한 국과심을 2013년 4월 신설하게 되었다.
[표 1-4-1] 국가과학기술위원회 연혁(1999.1.∼2015.12.)
|
구분 |
제1기 (1999년~2003년) |
제2기 (2004년~2007년) |
제3기 (2008년~2010년) |
제4기 (2011년~2013년.3) |
제5기 ((2013년.3~현재) |
|
특징 |
과학기술정책의 종합·조정체계 구축 |
과기부총리에게 예산 배분‧조정기능 부여 |
BH 중심의 종합·조정체계 구축 |
상설 행정위원회로 독립 |
국가연구개발 투자 효율성 제고 |
|
구성 |
▪위원장: 대통령 ▪부위원장: - ▪위원: 정부(14명), 민간(3→ 10명) |
▪위원장: 대통령 ▪부위원장:과기부총리 ▪위원: 정부(13명), 민간(8명) |
▪위원장: 대통령 ▪부위원장: 교과부 장관 ▪위원: 정부(10명), 민간(13명) |
▪위원장: 장관급 ▪부위원장: - ▪위원: 정부(2명), 민간(7명) |
▪위원장: 국무총리, 공동위원장 ▪부위원장: - ▪위원: 정부(14명), 민간(9명) |
|
산하 기구 |
운영위원회, 특별위원회(2), 전문위원회(3) 협의회(1) |
운영위원회, 특별위원회(2), 전문위원회(2) 협의회(2) |
운영위원회, 분야별 민간 전문위원회(7) 협의회(2) |
운영위원회, 특별위원회(2), 전문위원회(7), 협의회(2) |
운영위원회 특별위원회(4) 전문위원회(9) 협의회(2) |
|
간사 |
과학기술부장관 |
과학기술혁신본부장 |
BH 교육과학문화수석 |
국과위 사무처장 |
미래창조과학부장관 |
국과심의 구성은 위원장(2명)과 위원(23명) 총 25명으로 구성되며 위원장은 국무총리(의장)와 민간 공동위원장(대통령 위촉)으로 구성, 관계부처 장관을 포함한 당연직 13명과 위촉직 민간 위원 10명으로 총 23명으로 구성되어 있다. 이로써 국과심의 위상을 제고하고 민간위원을 통한 전문성을 보강하여 현장의 목소리를 정책에 적극적으로 수용할 수 있는 체계를 갖추게 되었다. 또한 총 9개의 전문위원회 중 생명․의료전문위원회가 구성되어 위원장을 포함하여 16명의 전문위원회 간사위원으로 구성‧운영되고 있다. 생명․의료전문위원회는 생명․보건․의료, 농림․수산․식품 분야 안건의 사전 검토 및 정부 R&D 투자방향 및 기술 분야별 투자전략을 마련하는 기능을 하고 있다.

[그림 1-4-1] 국가과학기술심의회
2. 2016년 R&D분야 예산조정·배분
OECD 경제전망보고서는 한국의 2016년 성장률 전망치를 2015년 6월의 3.6%에서 3.1%로 하향 조정한다고 밝혔고, 2015년 다보스포럼에서는 세계경제가 저성장 시대로 진입하였으며 글로벌 저성장 시대를 맞아 잠재성장률 제고를 위한 R&D 확대 등 해결방안을 모색해야 한다고 밝혔다.3)
이에 2016년도 R&D분야 재원배분은 어려운 재정여건 하에서도 경제 활력을 제고하고 미래를 대비하기 위해 전략적 R&D 투자를 강화하면서, 과감하고 지속적인 R&D 투자 효율화를 통해 생산성을 높이고 책임성을 강화하고자 하였으며 미래성장동력 창출, 기초연구, 중소․중견기업 지원, 재난재해․안전 등에 대한 투자를 확대하였다.
2016년도 정부연구개발사업 예산 배분·조정(안)에 따르면 2016년도 주요 R&D 예산 편성 규모는 전년대비 2,970억 원(2.3%) 감소한 12조 6,380억 원으로 미래성장동력 및 재난재해‧안전 분야의 예산 증가율이 높고, 부처별로는 10개 부처가 전년대비 증액 된 것으로 파악 된다.
2016년도 정부 R&D 예산은 정부 총지출인 386조 4천억 원 중 약 4.9%로 전년 대비 1.1% 증가한 19조 942억 원으로 확정되었다. 이 중 주요 R&D 예산은 12조 8,337억 원(67.2%)이며 기술분야별 R&D 예산은 [표 1-4-4]와 같다.
[표 1-4-2] 2016년 주요 정책 분야별 예산(안)
(단위 : 억 원 %)
|
주요정책 |
’15년 예산 |
’16년(안) |
증 감 |
% |
|
미래성장동력 |
10,530 |
11,423 |
893 |
8.5 |
|
개인 및 집단기초연구 |
10,729 |
11,071 |
342 |
3.2 |
|
중소․중견기업 전용사업 |
13,629 |
13,821 |
192 |
1.4 |
|
재난재해․안전 (감염병대응) |
6,371 (776) |
7,083 (941) |
713 (164) |
11.2 (21.2) |
출처 : 2016년도 정부연구개발사업 예산 배분․조정(안) 국가과학기술심의위원회(2015.7)
[표 1-4-3] 2016년 부처별 주요 R&D 예산(안)
(단위 : 억원 %)
|
구 분 |
’15년 예산 (A) |
’16년 예산안 (B) |
증 감 (B-A) |
|
|
% |
||||
|
주요R&D총액 |
129,350 |
126,380 |
∆2,970 |
∆2.3 |
|
[회계별] |
129,350 |
126,380 |
∆2,970 |
∆2.3 |
|
ㅇ 예산 |
111,116 |
110,089 |
∆1,027 |
∆0.9 |
|
- 일반회계 |
87,433 |
88,790 |
1,357 |
1.6 |
|
- 특별회계 |
23,683 |
21,299 |
∆2,484 |
∆10.1 |
|
ㅇ 기금 |
18,234 |
16,291 |
∆1,943 |
∆10.7 |
|
[부처별] |
129,350 |
126,380 |
∆2,970 |
∆2.3 |
|
미래창조과학부 |
54,848 |
53,983 |
∆865 |
∆1.6 |
|
산업통상자원부 |
32,477 |
30,928 |
∆1,549 |
∆4.8 |
|
중소기업청 |
9,619 |
9,626 |
6 |
0.1 |
|
농촌진흥청 |
4,729 |
4,786 |
56 |
1.2 |
|
해양수산부 |
4,890 |
4,622 |
∆268 |
∆5.5 |
|
보건복지부 |
4,551 |
4,403 |
∆149 |
∆3.3 |
|
국토교통부 |
4,432 |
4,355 |
∆77 |
∆1.7 |
|
교육부 |
3,649 |
3,657 |
8 |
0.2 |
|
환경부 |
2,841 |
2,662 |
∆179 |
∆6.3 |
|
농림축산식품부 |
2,067 |
1,967 |
∆100 |
∆4.8 |
|
기상청 |
1,394 |
1,538 |
144 |
10.3 |
|
산림청 |
879 |
855 |
∆24 |
∆2.8 |
|
식품의약품안전처 |
776 |
780 |
4 |
0.5 |
|
문화체육관광부 |
680 |
732 |
52 |
7.6 |
|
국민안전처 |
709 |
633 |
∆76 |
∆10.7 |
|
원자력안전위원회 |
552 |
568 |
15 |
2.8 |
|
문화재청 |
176 |
177 |
1 |
0.4 |
|
행정자치부 |
57 |
61 |
4 |
6.7 |
|
경찰청 |
22 |
48 |
26 |
118.5 |
출처 : 2016년도 정부연구개발사업 예산 배분․조정(안) 국가과학기술심의위원회(2015.7)
2016년 정부 R&D 예산안 중 R&D분야의 경우 미래성장동력 확충을 위한 창의․선도형 R&D 투자를 확대하여 창의성 기반의 성장동력 및 미래 신산업을 창출하고, R&D 기술사업화 촉진 및 국민 밀착형 R&D 지원을 강화하여 공공 R&D 성과물의 사업 촉진 및 기술력 신장을 통한 중소‧중견기업의 성장을 견인하고자 하였다. 또한 시장수요와 성과에 기반한 R&D 지원시스템 구축으로 시장수요․성과중심으로 개편하고자 하였다.
2016년도 정부의 R&D 투자는 경제혁신 선도, 국민행복 실현, 과학기술 기반 혁신이라는 3가지 중점추진 분야를 제시하고 있으며 특히 과학기술 기반혁신 에서는 창의적 기초연구 및 목적형 융합연구를 확대하고자 기초연구의 비중을 2017년 40%로 확대하고자 하며 문화․전통과학융합 R&D를 개발하고자 한다. 또한 국민행복실현을 위해 인체 감염병 예산을 크게 확대하였다.
바이오 분야의 경우 글로벌 신시장 진출 잠재력이 높은 유망 바이오분야의 전략적 R&D 투자로 선진국과 경쟁 가능한 태동기 바이오의약품(글로벌 신약) 및 의료기기분야의 지원을 확대한다. 또한 농수산업경쟁력 제고를 위해 ICT 융복합을 통한 농가 생산성 증대와 농수산업 경쟁력 제고를 위한 투자를 강화하고 국민의 먹거리 안전 확보를 위해 건강식품 원료 등에 대한 안전․평가기술 등에 지원을 확대한다. 시장개방에 대응하여 작물생산성 제고, 신품종 개발, 연안어업분야 등을 중심으로 식량안보 확보에 집중 지원할 예정이며 초고령화 사회에 대응하기 위해 치매․뇌혈관 장애 극복 기술 및 고령자 등을 위한 사회 인프라 고도화 R&D를 확대하고자 한다.
[표 1-4-4] 2016년 기술분야별 R&D 예산
(단위: 억원)
|
구분 |
’15 |
’16안 |
’16 |
비고 |
|
▪기초·나노 |
22,980 |
21,900 |
21,954 |
· 개인·집단연구 지원(7,364→7,680) |
|
▪에너지·환경 |
24,675 |
23,162 |
23,198 |
· 기후변화대응기술개발(465→528) · C1가스 리파이너리(40→140) |
|
▪우주항공· 해양·생명 |
46,700 |
47,887 |
48,452 |
· 한국형발사체 및 달탐사(2,555→2,692) · 바이오 의료기술개발(1,656→1,949) |
|
▪기계·제조·공정 |
22,783 |
22,532 |
15,164 |
· 기계산업핵심기술개발(784→855) |
|
▪전자·정보 |
26,495 |
24,715 |
24,981 |
· IT·SW융합산업원천기술개발(486→669) |
|
▪기타 |
45,267 |
49,167 |
57,193 |
· 국립대학 인건비 등 |
|
합 계 |
188,900 |
189,363 |
190,942 |
’15년 예산 대비 1.1% 증가 |
출처 : 2016년 예산(안) 기획재정부(2015.9), 2016년도 정부연구개발투자방향 미래부(2015.12)
3. 발전 전망
세계경제가 ʻ생산성 경제ʼ 패러다임에서 ʻ지식경제ʼ 패러다임으로 전환하면서 제조업 기반의 한국경제는 성장의 한계에 도달하였으며 이러한 저성장 시대에서 경기둔화로 인하여 세입 여건은 계속해서 어려울 전망이나 복지수요 및 지방재정 지원 등 지출소요는 지속적으로 증가할 것으로 보인다.
바이오의료분야의 경우 지금까지의 현황은 투자대비 성과가 미흡하고 관련 산업의 발전이 타 산업과 비교해 낮은 편이다. 최근 바이오의약품의 상업적 성과가 나오기는 하였으나 향후 기존의 기술을 갖고 어떻게 창조경제에 기여할 수 있을지 전략적 고민이 필요한 시점이다.
또한 글로벌 바이오 시장의 패러다임 변화와 공공성이 확대되고 있는 위기와 기회의 시점에서 국가과학기술심의회의 역할은 매우 중요하며, 국가연구개발사업에 대한 조정방안 및 제도들이 명확하게 자리 잡고 정교하게 작동되어야 할 것이다. 바이오 경제가 신성장동력으로 창조경제 실현을 뒷받침하고 바이오 R&D를 통한 국민행복이 실현될 수 있도록 효율적인 정책 조정에 국가과학기술심의회가 그 역할을 다할 것이다.
1) MarketLine, 2013
2) 한국산업기술평가관리원, 특허분석을 통한 산업기술분야 메가트렌드 보고서(2012)
3) 정부전망치 3.3%, 한국은행 3.2%, 한국개발연구원(KDI) 3.1%로 전망



1. 개요
OECD는 2009년 바이오기술이 인류가 직면한 4대 난제 해결과 성장동력 창출의 핵심 기술로서 주목받고 있으며, 바이오기술이 타 기술들과 융합을 지속하여 2030년경에 글로벌 경제에 대규모 변화를 가져오는 바이오경제 시대로 진입할 것으로 전망하였다.
같은 해 미국 과학한림원(NRC)은 ʻ국가 新생물학 프로그램ʼ 보고서에서 미국 정부의 생명공학 정책의 큰 방향을 바꾸는 권고를 하였다. 이 보고서에서는 생물학 연구개발이 생물학 내 세부학문간 통합, 학제간 융합, 생물학 데이터(양‧질)의 폭발적 증가 등으로 변곡점을 맞게 되었고, 식량, 환경, 에너지, 보건 등 사회문제들은 해결책들도 서로 연결되어 있기 때문에 생물학, 물리‧화학, 컴퓨터, 공학, 수학 등 다학제 융합을 통한 생명시스템의 통합적 이해가 필요하다고 주장하였다.
미국 정부는 이러한 패러다임 변화에 대응하기 위해 2010년 정부 과학기술예산 지침에서 ʻ21세기 바이오경제 기반 구축을 위한 연구 지원ʼ을 최우선 순위로 설정하였고, 이어 2012년 오바마 대통령은 대선공약의 하나로 미국 바이오경제의 무한한 잠재성을 실현시키기 위한 전략적 목표를 제시하였으며, 이후 다양한 정책을 통해 바이오경제 선점을 위한 다각적인 노력을 기울이고 있다.
2. 정부 정책
오바마 대통령은 2012년에 대선공약인 바이오경제 창출을 위한 기본방향으로 백악관에서 ʻ국가 바이오경제 청사진ʼ을 발표하였다. 국가 바이오경제 청사진은 미국 미래 바이오경제 기반 구축을 위한 연구개발 지원 확대, 기초연구 성과의 산업계 이전 촉진을 위한 중개과학 및 규제 개혁, 규제 절차의 속도 및 예측가능성 증대를 통한 진입장벽 낮추기, 교육과정 개선, 대학장려금-학생교육 연계를 통한 일자리수요 창출, 공공-민간의 협력을 통한 자원, 지식, 전문성 공유 등을 제시하고 있다.
같은 해 백악관 정부과학기술정책국(OSTP)은 ʻ빅 데이터 활용을 위한 연구개발 이니셔티브ʼ에서 빅 데이터 기술의 진전이 새로운 혁신을 가져올 것으로 전망하고 정부의 정책적 지원을 권고하고 있다.
분야별로 보면, 우선 의료분야의 경우 오바마 대통령은 2015년 1월 연두교서를 통해“정밀의학 이니셔티브(Precision medicine initiative)ʼʼ를 추진하겠다는 계획을 발표했다. 정밀의학은 개인의 유전자 정보를 분석해 맞춤형 치료 또는 치료제를 제공하는 것으로 이 계획은 백만 명 이상의 환자 정보를 공유하는 코호트를 구축해 ʻ정밀의학사전ʼ을 발간하는 것을 목표로 하고 있다. 이를 위해 미국 정부는 정밀의학 이니셔티브를 2016년 예산안에 우선정책으로 선정하고, 국가 코호트 연구, 암치료법 개발, 데이터베이스 개발, 개인정보보호 시스템 개발 등에 총 2억 1,500만 달러를 투입한다고 발표하였다.
[표 2-1-1] 인간유전체 해독 관련 인프라 변화
|
|
10년 전 |
현재(2014) |
|
1인 인간유전체 해독비용 |
22,000,000 달러 |
1,000~5,000 달러 |
|
1인 인간유전체 해독시간 |
2년 |
<1일 |
|
미국 스마트폰 수 |
1백만 (<2%) |
1억 6천만 (58%) |
|
전자의료기록(EMR) |
20~30% |
>90% |
|
컴퓨팅 파워 |
n |
n × 16 |
출처:The US Precision Medicine Initiative(2015)
에너지‧환경 분야에서는 오바마 대통령은 녹색 뉴딜 보고서를 발표하였다. 녹색 뉴딜은 지구 온난화, 세계 금융 위기, 석유자원 고갈 등 3대 위기를 동시에 해결하기 위해 관련 연구개발과 공공사업에 투자를 확대하여 산업을 활성화하고, 새로운 일자리를 창출하는 것을 목표로 하고 있다. 오바마 대통령은 이를 위한 미국 재투자‧재생법안에 서명하고, 에너지부(DOE)에 119억 달러(2013년)가 지원되었다. 식량 분야에서는 농무부(USDA)을 중심으로 유용 생물자원의 수집‧보전‧이용에 관한 프로그램을 진행하고 있다.
3. 생명공학 연구개발 및 산업 현황
가. 생명공학 연구개발 현황
미국에서 생명공학 분야는 전통적으로 최우선 투자분야이다. 미국 정부의 연구개발 예산을 목적별로 2000년부터 2012년까지 추이를 보면 국방이 53~60%로 가장 높은 비중을 차지하고 있으며 보건 분야가 21~26%로 2위를 유지하고 있고, 우주분야는 4~7% 수준에 불과하다. 2016년 예산안에 따르면 오바마 정부는 중산층 지원에 중점을 두고 미래 신규 사업과 일자리 창출을 위한 연구개발을 집중지원 할 계획이다.
(단위 : 백만 달러)

출처:Federal R&D Funding by Budget Function(각 년도), 일본 과학기술진흥기구 연구개발전략센터(2015)
[그림 2-1-1] 미국 연구개발 예산의 목적별 비중 추이(2000~2012)
미국은 세계 최대의 연구비와 인력 pool을 바탕으로 의료, 환경, 에너지, 식량 등 거의 모든 생명공학 응용분야에서의 기초/응용 연구와 산업화를 선도하고 있다. 특허(2010~2013)의 경우 미국은 전 세계 생명공학 특허의 37%를 보유하고 있다.

출처:OECD, STI Micro-data Lab: Intellectual Property Database, http://oe.cd/ipstats, July 2015
[그림 2-1-2] 주요국 생명공학 특허 비중(2010~2013)
최근에는 빅 데이터에 기초한 새로운 연구개발 접근이 주목받고 있으며, 다부처 협력을 통해 건강, 에너지, 식량 안보 분야의 우수 기초연구 성과 창출 지원, 군인과 퇴역군인의 정신건강 향상을 위한 효과적 진단‧치료 기술의 개발, 항생제 내성균의 증가에 따른 공공보건, 국가안전 상의 문제에 대응하고 있다. 이를 위해 2016년에는 항생제 내성균, 신경과학, 정밀의료(Precision Medicine)등 의료분야의 혁신을 강화하고 기초 생명공학 분야의 발전을 가속화하는 연구를 중점적으로 지원할 계획이다.
의료분야는 NIH와 산하 27개 연구소 및 센터를 중심으로 이루어지며, 2016년도 예산안에서 전년 대비 10억 달러 늘어난 313억 달러를 배정하였다. NIH의 중점 연구분야는 다음과 같다.
[표 2-1-2] 미국 NIH 중점 연구분야
|
주제 |
주요 연구분야 |
|
1. 기초 연구를 통한 생명의 미스터리 규명 |
단일세포 생물학, 첨단 세포 이미징, 4차원 뉴클레옴, BRAIN 이니셔티브 |
|
2. 기초성과의 임상 중개 |
정밀의료, 에볼라 바이러스 연구/백신 개발, 줄기세포, 독감 백신, HIV백신/치료, 항생제 내성균, 의료파트너십가속화(AMP), 알츠하이머 질병 |
|
3. 데이터 및 기술을 활용한 건강 증진 |
암 퇴지 기술 이용, 마이크로바이옴 응용, Big Data to Knowledge, 바이오전자의료, 환자중심 임상연구 네트워크 |
|
4. 다양하고 유능한 연구인력 육성 |
혁신적 연구자와 변혁적 연구의 지원, 생물의학 연구인력 양성, 연구인력 다양성 확대 |
특히, NIH는 오바마 대통령의 정밀의학 이니셔티브를 실행하는 핵심 주체이다. 정밀의학 이니셔티브는 100만 명 이상의 자원봉사자를 대상으로 미국 전역에서 코호트 연구를 진행하게 된다. 참가자로부터 진료기록 정보, 유전자 정보, 대사물질 정보, 체내 미생물 정보, 생활환경 데이터, 생활습관 데이터, 행동 데이터 등 다양한 정보를 모으게 된다. 이에 각종 개인정보의 제공에 따른 프라이버시 문제를 대응하기 위한 방안을 마련하는 한편 관련 규제를 재검토하고 있다. 정밀의학 연구를 위해 NIH에 총 2억 달러(NIH 코호트 연구 1.3억 달러, NCI 암 유전자 발굴, 효과적 암치료법 개발 7,000만 달러)가 지원된다. FDA에는 현재 규제를 개선하고 관련 데이터베이스를 구축하기 위해 1,000만 달러를, 국가의료정보기술조정실(ONC)에는 프라이버시, 시스템 간 정보교환 표준 확립 등을 위해 500만 달러가 지원된다. 이와 함께 항생제 내성균 대책에 4.61억 달러, 알츠하이머병 대책에 6.38억 달러를 투자하고, 브레인 이니셔티브1)(BRAIN: Brain Research through Advancing Innovative Neurotechnologies)에도 1.35억 달러를 계속 투자하는 방침을 포함하고 있다.
최근 NIH는 기초의학의 임상연계를 활성화하기 위한 중개연구를 중점 지원하고 있다. 이를 위해 2012년 첨단중개연구센터(NCATS)를 설립하고, 치료가속화네트워크(CAN)를 통해 병의 진단과 치료방법의 발견‧개발 간 연계를 강화하고, 연구성과의 실용화를 촉진하고 있다.
국립과학재단(NSF)은 생명공학 전 분야를 지원하고 있으며, 특히 5대 그랜드 챌린지 사업으로 생명체 유사 시스템 합성, 뇌 이해, DNA 시퀀스를 통한 장기 특성 예측, 지구-환경-생태계 상호작용 규명, 생물학적 다양성 이해를 중점적으로 추진하고 있다. 2016년 생명공학 분야 예산은 7억 4,792만 달러로 2015년(7억 3,103만 달러) 대비 2.3%가 증가하였다. NSF는 미국 생명공학 분야에서 의료분야를 제외한 기초연구 예산의 66%를 지원하고 있다. 특히, 주목할 만한 것은 2016년 약 6천만 달러가 지원되는 합성생물학 분야이다. 기존의 자연 생물시스템을 맞춤형(청정에너지를 위한 광합성 효율성 제고, 경제적으로 중요한 작물을 이용한 질소고정 등)으로 재 디자인 할 뿐만 아니라 새로운 생물학적 컴포넌트를 디자인하고 만드는 것을 목표로 하고 있다. 이러한 목표를 달성하기 위한 일환으로 생물학, 공학, 수학, 물리학 등 학제간 융합을 위한 생물학‧수학‧물리학 인터페이스 연구 프로그램(BioMaP)을 지원하고 있다. 이 프로그램은 다학제적 융합을 통해 생물학적 시스템을 이해하고, 이를 이용하여 청정에너지 등 신기술에 적용하여 바이오 기반 소재, 센서, 장치를 개발하는 것을 목표로 하고 있다. 또한 다부처 협력사업인 BRAIN 이니셔티브에 1억 4,393만 달러(전년도 대비 35.2%, 3,749만 달러 증가)가 배정되었다.
에너지부(DOE)는 자국에서 생산된 비식용 바이오매스 자원을 활용하고 외국산 석유의존도를 낮추는 한편 온실가스 배출량을 줄이기 위한 기술개발을 지원하고 있다. 에너지부의 2016년도 생명공학 관련 예산은 6억 1,240만 달러로 2015년(5억 9,200만 달러) 대비 3.4%가 증가하였다. Bioenergy Science Center(BESC), Great Lakes Bioenergy Research Center(GLBRC), Joint Bioenergy Institute(JBEI) 등 3개 센터가 중추적인 역할을 하고 있고, 특히 비식용 바이오매스의 오믹스 분석(유전체, 단백체, 대사체), 구조생물학, 고해상 이미징, 특성분석, 컴퓨터 모델링 등을 통한 제3세대 바이오 연료의 연구개발에 집중하고 있다.
농림부(USDA)는 인간의 영양, 비만 인구의 감소, 식품의 안전성, 지속 가능한 바이오연료, 세계의 식량안보, 기후 변화 등에 관한 다양한 연구 활동을 지원하고 있다. 이 밖에도 국방부(DOD), 재향군인청(VA), 내무부(DOI) 미국지질조사국(USGS) 등도 생명공학 관련 연구개발 활동을 지원하고 있다.
민간분야에서도 생명공학 분야에 대한 R&D 투자가 활발하게 이루어지고 있다. 최근 OECD 통계에 따르면 미국의 기업들은 2012년 268.93억 달러를 투자하였는데, 이는 기업 전체 R&D 투자액에서 8.5%에 해당하는 금액이다.

출처 : OECD, Key Biotechnology Indicators, http://oe.cd/kbi; and OECD, Main Science and Technology Indicators Database, www.oecd.org/sti/msti.htm, July 2015.
[그림 2-1-3] 세계 바이오 R&D 투자 현황
나. 생명공학 산업 육성 정책 및 현황
미국 정부는 기술혁신을 통한 경제성장을 위해 공공 R&D 성과물의 기술이전․사업화를 촉진하는 다양한 정책을 펼치고 있다. 연방연구소들은 보유기술을 상용화하고 기술이전을 촉진하기 위한 ʻLab-to-Marketʼ 정책을 시행하고 있다. 생명공학 분야에서는 NIH와 NSF가 협력하여 연구자의 기업가정신 고취에 노력을 기울이고 있다.
이를 위해 NIH는 중소기업혁신연구(SBIR), 중소기업기술이전(SBTT) 프로그램의 지원을 받는 연구자와 기업에게 NSF의 I-Corps를 바이오의료기술에 맞게 개량한 NIH I-Corps 프로그램에 참여토록 하고 있고, NSF는 2011년부터 NSF 자금을 지원받는 연구자에게 기술사업화 교육 및 자문을 제공하는 NSF Innovation Corps(I-Corps) 프로그램을 운영하고 있다.
미국 바이오산업의 주요 지표를 살펴보면, 2014년은 상장기업의 각종 지표(수익, 시가총액, 종업원 수, R&D 투자)와 자본조달의 모든 측면에서 2013년에 비해 크게 증가하였는데 특히, 상장기업의 순이익은 293%, 시가총액은 34%, 조달 자본은 89%가 증가하여 시장의 활력이 크게 높아졌다고 볼 수 있다.
[표 2-1-3] 미국 바이오산업 개황(2013~2014)
(단위 : 10억 달러)
|
|
2014 |
2013 |
증감(%) |
|
상장기업 |
|
|
|
|
수익 |
93.1 |
72.1 |
29% |
|
R&D 지출 |
28.8 |
23.6 |
22% |
|
순이익 |
10.6 |
2.7 |
293% |
|
시가총액 |
853.9 |
636.5 |
34% |
|
종업원 수 |
110,090 |
99,850 |
10% |
|
금융 |
|
|
|
|
자본조달(상장기업) |
37.8 |
20.0 |
89% |
|
기업공개 수 |
63 |
41 |
54% |
|
자본조달(비상장기업) |
7.3 |
5.7 |
28% |
|
기업 수 |
|
|
|
|
상장기업 수 |
403 |
345 |
17% |
|
비상장기업 수 |
2,116 |
2,010 |
5% |
자료 : Ernst&Young(2015)
Ernst&Young는 미국에서 상장기업과 비상장기업을 합하여 생명공학 분야 기업 수가 약 2,600개인 것으로 집계하였으나, OECD에 따르면 생명공학 분야 기업 수는 11,367개이고, 이 중 생명공학을 전문으로 하는 기업 수는 1,165개(10.2%)이다.
[표 2-1-4] 세계 바이오기업 현황
|
|
생명공학 기업 수 |
전문생명공학 기업 수 |
전문생명공학 기업비중(%) |
년도 |
|
미국 |
11,367 |
1,165 |
10.2 |
2012 |
|
스페인 |
2,831 |
554 |
19.6 |
2013 |
|
프랑스 |
1,950 |
1,284 |
65.8 |
2012 |
|
한국 |
939 |
353 |
37.6 |
2013 |
|
독일 |
709 |
578 |
81.5 |
2014 |
|
영국 |
614 |
#N/A |
#N/A |
2013 |
|
일본 |
552 |
#N/A |
#N/A |
2013 |
자료 : OECD, Key Biotechnology Indicators, http://oe.cd/kbi, 2015.7
한편, 세계 의약품 시장 규모는 2007년부터 2012년 동안 32%가 성장(7,310억 달러 → 9,650억 달러)하였는데 비해, 바이오의약품 시장은 59%가 성장(1,060억 달러 → 1,690억 달러)하여 의약품 시장 확대속도를 크게 넘어섰다. 이 중에서 바이오시밀러의 증가속도가 매우 빠르고, 초기 바이오의약품은 사이토카인 등 생체 내 존재하는 물질을 이용한 것이 많았지만 최근에는 미국 바이오벤처가 주도하는 특정 표적 분자를 저해하는 항체 의약품이 증가하고 있다.
|
미국 한국 인도 중국 러시아 독일 이란 |
미국 스위스 독일 영국 일본 한국 벨기에 호주 인도 |
|
자료 : 일본제약산업정책연구소(2014) |
자료 : 일본제약산업정책연구소(2014) |
|
[그림 2-1-4] 기업국적별 바이오시밀러 개발 품목수 |
[그림 2-1-5] 기업국적별 항체개발 품목수 |

1. 개요
일본은 초고령사회 진입으로 인한 의료비 증가, 평균수명과 건강수명 사이의 괴리 등을 해소하기 위해 건강장수사회의 형성을 중요한 정책적 과제로 인식하고 있다. 더불어 노벨상 수상 등 기초연구 성과는 세계를 선도하는 수준에 이르고 있으나 실질적인 상용화로의 연계는 미흡한 것으로 파악하고, 조속한 실용화 성과 창출을 위한 ʻ혁신ʼ을 중요한 키워드로 파악하고 있다.
이에 종합과학기술회의2)를 2014년 5월 종합과학기술이노베이션회의로 바꾸고 제5기 과학기술기본계획(2016~2020)작성 작업을 진행하고 있다. 제4기 과학기술기본계획에서 Life Innovation의 추진성과로는 ① 혁신적 예방법 개발, ② 새로운 조기진단법 개발, ③ 안전하고 유효성 높은 치료의 실현, ④ 고령자·장애자·환자의 질(QOL) 향상, ⑤ 바이오혁신 추진을 위한 시스템 개혁을 들 수 있다.3)
제5기 기본계획에서는 경제·사회적인 과제를 해결하기 위한 선제적 조치 중 하나로 세계 최첨단 의료기술의 실현을 통한 건강장수사회 형성과 같은 ʻʻ초고령화·인구감소 사회 등에 대응하는 지속가능한 사회실현ʼʼ을 5개 중요과제 중 하나로 설정4)하고 있다.
2. 일본의 바이오정책
가. 바이오 컨트롤 타워 설치
일본 정부는 부처별 분산된 연구개발 지원체계, 임상시험진행 제도 미비, 일본 내 의약품·의료기기 무역적자액 증가 문제 등 위기의식을 바탕으로 ʻʻ일본부흥전략-Japan is BACKʼʼ에서 건강장수사회형성을 위해 의료분야의 연구개발 사령탑 기능 창설을 결정(2013.6.14.)하고 2014년 5월 건강·의료전략 추진법과 독립행정법인 일본의료연구개발기구법을 입안하였다.
(단위: 억엔)
|
의약품 수출·수입액 추이 |
의료기기 수출·수입액 추이 |
|
|
|
출처 : 厚生労働省「薬事工業生産動態統計」, 平成25年薬事工業生産動態統計年報
[그림 2-2-1] 의약품․의료기기의 수출․수입액 추이
이에 따라 의료분야의 연구개발 사령탑 본부인 건강·의료전략추진본부(본부장 : 내각총리대신, 법안근거)를 2014년 6월 내각에 설치하고, 기초부터 실용화까지 일원화된 지원을 수행하는 국립연구개발기구 일본의료연구개발기구(Japan Agency of Medical Research and Development, 이하 AMED)를 2015년 4월에 발족하였다.
건강·의료전략추진본부는 건강·의료전략 수립 및 의료분야 연구개발추진계획 작성, 예산배분 방침 마련의 역할을 하고, AMED는 본부의 방침에 따라 ① 의료에 관한 연구개발의 매니지먼트, ② 연구부정방지, ③ 임상연구 및 치료데이터 매니지먼트, ④ 실용화지원, ⑤ 연구개발기반정비, ⑥ 국제전략추진을 목표로 하고 있다.
[표 2-2-1] 건강·의료 전략 개요
|
구분 |
내용 |
|
기본이념 |
세계 최고수준의 기술을 이용한 의료제공, 경제성장기여, 세계 공헌 |
|
과제 |
초 고령사회 진입 대응건강장수사회형성을 위한 세계 최첨단 의료기술 및 서비스 실시를 통한 건강수명연장 |
|
추진방향 |
- 기초부터 실용화까지 일관된 연구개발 추진 등에 따른 세계 최고 수준의 기술을 사용한 의료 제공 - 건강장수사회 형성에 기여하는 산업활동의 창출, 해외진출의 촉진에 따른 일본 경제성장, 글로벌 의료의 질적 향상 기여 - 과제 해결 선진국으로서 초 고령화 사회 극복 모델의 국제적 전개 추진 |
|
2020년경까지의 추진 목표 |
- 의료분야의 연구개발 : 10종이상의 암치료약 치험개시, 창약 타깃 동정 10건 등 - 신산업 창출 : 건강증진·예방, 생활지원관련 산업의 시장규모 확대 (4조엔→10조엔) - 의료의 국제전개 : 해외에 일본 의료거점 창솔(3개소→10개소) - 의료의 ICT화 : 의료·간호·건강분야의 디지털 기반 구축 등 |
출처 : 健康・医療戦略推進本部, 「健康・医療戦略」, 平成 25年 6月14日
이로 일본은 그간 각 부처별로 따로 집행되던 예산집행의 창구를 AMED로 일원화함으로써 각 부처가 연대한 혁신적인의료기술의 실용화를 추진하고 연구개발에 관한 시설·장비 중복투자 방지 및 국가 전체의 통합적이고 효율적인 예산배치를 도모하고 있다.

[그림 2-2-2] 예산집행 구조의 변화
나. 재생의료 상용화 추진 강화
일본의 2012년 재생의료 시장규모는 91억 엔으로 추산되며 향후 2030년에는 1조 엔이 될 것으로 예측된다. 또한 세포의 배양, 가공을 위한 시설 및 기구, 시약, 제조 및 운반, 관리 등의 위탁서비스 등 주변산업의 시장규모가 2012년 170억 엔에서 2030년 5,500억 엔에 이를 것으로 전망하면서 향후 시장 확대에 대한 기대를 드러내고 있다.
[표 2-2-2] 재생의료 시장규모 전망
|
구분 |
2012년 |
2020년 |
2030년 |
2050년 |
|
|
일본 재생 의료시장규모 |
제품·가공품 |
90억엔 |
950억엔 |
1.0조엔 |
2.5조엔 |
|
주변산업 |
170억엔 |
950억엔 |
5,500억엔 |
1.3조엔 |
|
|
합계 |
260억엔 |
1,900억엔 |
1.6조엔 |
3.8조엔 |
|
|
세계 재생 의료시장규모 |
제품·가공품 |
1,000억엔 |
1.0조엔 |
12.0조엔 |
38.0조엔 |
|
주변산업 |
2,400억엔 |
1.0조엔 |
5.2조엔 |
15.0조엔 |
|
|
합계 |
3,400억엔 |
2.0조엔 |
15.0조엔 |
53.0조엔 |
|
출처 : 経済産業省「再生医療の実用化・産業化に関する報告書(平成25年2月)
이처럼 iPS세포 등에 의한 재생의료와 같은 혁신적인 의료의 실용화에 대한 국민적 기대가 높으나, 재생의료 특성상 안전성, 실용화 소요기간, 규제 등의 문제가 대두된 상황을 타개하기 위해 관련 법안을 정비하였다. 「의약품, 의료기기 등의 품질, 유효성 및 안전성 확보 등에 관한 법률」(약칭: 의약품의료기기등 법, 舊 약사법) 개정(2014.11.25.(공포 2013.11.27.)), 「재생의료 등의 안전성 확보 등에 관한 법률」 제정(2014.11.25.(공포 2013.11.27.))5)을 통해 재생의료의 새로운 전기를 맞이하고 있다.
의약품의료기기 등 법에서는 재생의료 및 유전자치료 등을 대상으로 하는 조기승인제도가 도입되었다. 5년간의 조건부 승인기간 안에 유효성이 입증된 임상시험데이터를 제출하면 최종승인이 되는 형태로, 이를 통해 재생의료제품화 기간 단축 및 비용절감을 노리고 있다. 이에 따라 2015년 9월 중증 심부전 환자의 허벅지 근육 세포를 시트로 배양해 심장에 붙이는 ʻ하트시트ʼ와 골수 이식 후 보이는 합병증인 급성 이식편대숙주병(GVHD)에 대한 세포성 의약품 ʻ템셀HS주ʼ에 대한 조건부 승인이 이루어졌다.
또한 재생의료 등의 안전성 확보 법에서는 재생의료를 리스크 순에 따라 구분하여 제출서류의 수준을 달리하고, 재생의료를 위한 세포가공을 위탁할 수 있는 특정세포가공물 제조사 창설이 가능하게 되어 세포가공 비용이 절감될 것으로 전망된다.

[그림 2-2-3] 재생의료 활성화를 위한 법 제‧개정 개요
3. 일본의 바이오 연구개발 및 산업 현황
가. 바이오 연구개발 현황
일본은 AMED에 연구개발 예산을 집중하여 신약창출, 의료기기개발, 의료기술창출 거점프로젝트, 재생으로 실현, 게놈의료 실현, 암 프로젝트, 뇌질환 극복, 감염병 제어, 난치질환 극복의 9개의 중점프로젝트를 추진하고 있다. 2015년 AMED의 예산은 2014년도 1,215억 엔(문부성 570억 엔, 후생성 476억 엔, 경산성 169억 엔)에서 일부 증액된 1,248억 엔(문부성 598억 엔, 후생성 474억 엔, 경산성 177억 엔)이 요구되었다.
[표 2-2-3] 일본의료연구개발기구(AMED) 9개의 주요 프로젝트
(단위: 억엔)
|
프로젝트 |
개요 |
예산 |
|
|
의약품· 의료기기 개발을 위한 시책 |
1. All Japan으로 의약품 창출 |
신약창출을 위한 지원기능의 강화 도모 및 혁신적 의약품 등의 개발을 추진 |
256 |
|
2. All Japan으로 의료기기 개발 |
의료 니즈에 대응하는 의료기기개발 및 그 지원체제를 정비 |
145 |
|
|
임상연구· 치험에의 시책 |
3. 혁신적 의료기술 창출 거점 프로젝트 |
Seeds에의 지원을 기초연구단계부터 실용화까지 끊김 없이 실시할 수 있는 거점을 의료법의 성립에 기반 하여 강화· 충실히 하고, 혁신적의료기술의 실용화를 촉진 |
106 |
|
세계최첨단 의료 실현을 위한 시책 |
4. 재생의료 실현화 하이웨이 구상 |
2015년말까지 연구과제의 임상연구단계로의 이행을 더욱 지향하면서 재생의료제품 개발을 촉진 |
143 |
|
5. 질병극복을 위한 게놈 의료실현화 프로젝트 |
임상응용을 지향한 바이오뱅크·재팬과 국립고도전문의료연구센터 등과의 공동연구를 추진 |
74 |
|
|
질병영역별 시책 |
6. Japan Cancer Research Project |
암의료의 실용화를 “암연구 10개년 전략”에 기초하여 가속화 |
162 |
|
7. 뇌와 정신이 건강한 대국 실현 프로젝트 |
치매·정신질환 등의 극복을 위한 전략을 가속화 |
68 |
|
|
8. 신종·재발 감염병제어 프로젝트 |
병원체 전체 게놈 정보 등의 집적·해석 등을 더욱 추진하고 약제 타깃 부위의 특정 등에 연계 |
58 |
|
|
9. 난치질환 극복 프로젝트 |
2014년 5월에 난치병 환자에 대한 의료 등에 관한 법률이 성립된 것을 기반으로, 연구개발을 더욱 추진 |
96 |
|
출처 : 健康・医療戦略推進本部, 平成27年度医療分野の研究開発関連予算のポイント, 2015.04
부처별로는 2015년도 바이오관련 예산은 후생노동성 1,245억 5,000만 엔(2014년 대비 392억 엔(24%) 감소), 경제산업성 187억 500만 엔(2014년 대비 23억 4,400만 엔(14.3%) 증가), 문부과학성 956억 1,000만 엔(2014년 대비 114억 5,100만 엔(13.5%) 증가), 농림수산성 549억 3,000만 엔(2014년 대비 104억 4,400만 엔(23.5% 증가), 환경성 161억 7,100만 엔(2014년도 예산대비 37억 7,900만 엔(30.6%) 증가)인 것으로 나타났다.
후생노동성은「의약품창출」및 「암」,「신종·재발 감염병」,「행정정책연구분야」및 「질환·장해 대책 연구분야」를 대폭 증액 요구하였으며, 농림수산성은 환태평양경제동반자협정(TPP)의 교섭으로 육류 및 유제품에 대한 관세의 대폭 삭감 요구에 대응하기 위해 축산·낙농의 경쟁력 강화를 위한 신규 시책을 추진하고 있다. 환경성은 「동일본대지진에서의 복구와 지진의 교훈을 바탕으로 한 방재·감재」와「새로운 순환공생형 도시 만들기·거리 만들기 추진」을 중점 추진 중이다.
[표 2-2-4] 부처별 주요 추진사업
|
부처 |
주요추진사업 |
예산 |
|
후생노동성 |
미승인의약품 등 임상연구안전성 확보지원 사업* |
7억 6000만엔 |
|
임상연구의 신뢰성 확보를 위한 정비사업* |
2억 6000만엔 |
|
|
게놈의료 실용화 추진 연구사업 |
3억엔 |
|
|
혁신적 암의료 실용화 연구사업 |
101억엔 |
|
|
경제산업성 |
차세대 치료·진단 실현을 위한 신약창출기반 연구개발 사업 |
52억 700만엔 |
|
재생의료의 산업화를 위한 평가기반기술개발사업 |
25억엔 |
|
|
혁신적 Biomaterial 실현을 위한 고기능화 게놈디자인 기술개발 |
4억 3000만엔 |
|
|
밀폐형식물공장을 활용한 유전자재조합 식물 생산 실증연구개발 |
1억 500만엔 |
|
|
문부과학성 |
감염병연구 국제전개전략 프로그램* |
20억 2800만엔 |
|
혁신적 바이오의약품창출 기반기술개발사업 |
20억엔 |
|
|
뇌과학연구 전략추진 프로그램·뇌기능네트워크 전모 해명 프로젝트 |
63억 6700만엔 |
|
|
혁신적 의료기술창출거점프로젝트 |
65억 1200만엔 |
|
|
재생의료 실현화 하이웨이 구상 |
89억 9300만엔 |
|
|
토호쿠(東北) 메디칼·메가뱅크계획 |
32억 4300만엔 |
|
|
농림수산성 |
생산현장강화를 위한 연구개발* |
2억 5800만엔 |
|
일본판 푸드밸리(Food valley)조사추진사업* |
1억 4500만엔 |
|
|
농림수산성·식품산업 과학기술 연구추진사업 |
4억 8000만엔 |
|
|
증·양식 대책(수산청사업) |
15억 3600만엔 |
|
|
차세대 농림수산사업창조기술(Agri Innovation창출) |
35억엔 |
|
|
환경성 |
방사선 건강영향, 피폭선량평가 등에 관한 조사연구사업 |
12억 2800만엔 |
|
주민 개인 피폭선량파악사업 |
6억 6400만엔 |
|
|
방사선피폭건강불안대책사업 |
7억 8100만엔 |
|
|
삼림(森)·마을(里)·하천·바다의 연계확보로 안전하고 풍요로운 지역 만들기 사업 |
6억엔 |
|
|
저탄소·순환·자연공생지역 창생실현 플랜책정사업* |
4억 5000만엔 |
|
|
미나마타병의 치료 향상에 관한 조사연구* |
2300만엔 |
|
|
화학물질 내분비교란 작용에 관한 평가 등 추진 사업 |
3억 600만엔 |
주 : * 신규사업
출처 : Nikkei Biotechnology & Business社, 日経バイオ年鑑, 2015
나. 산업 현황과 전망
2014년 일본 내 바이오제품·서비스 시장의 시장규모는 3조 685억 엔으로 2013년 대비 5.2% 증가한 것으로 나타났다. 바이오관련 시장에서 중심이 되는 유전자조작기술을 이용하여 제조된 제품의 2014년도 시장규모는 2013년도 대비 4.5% 증가한 2조 179억 엔이었다. 바이오제품·서비스 중 조작기술응용제품을 제외한 바이오제품서비스시장의 증가율은 6.6% 증가한 1조 506억 엔이었다.
[표 2-2-5] 2014년 일본 바이오제품·서비스 시장규모
|
구분 |
2013년 |
2014년 |
증가율 |
|
유전자조작기술 관련 제품 |
1조 9313억엔 |
2조 179억엔 |
4.5% |
|
그 외 바이오제품서비스 |
9849억엔 |
1조 506억엔 |
6.6% |
|
합계 |
2조 9162억엔 |
3조 685억엔 |
5.2% |
출처 : Nikkei Biotechnology & Business社, 日経バイオ年鑑, 2015
국제적으로 일본 생명공학산업 시장 규모는 일본 내 조사와 차이를 나타내는데, Marketline에 따르면 2014년도 일본 바이오산업 총 수익은 376억 달러로, 아시아태평양지역의 바이오산업에서 가장 높은 비중인 48.5%를 차지하고 있으며, 2010년에서 2014년 사이의 연평균성장률(CAGR)은 3.6%인 것으로 나타난다. 같은 기간 중국과 인도의 연평균 성장률은 각각 12.9%, 12.3%, 2014년도 총 수익은 157억 달러, 68억 달러로 일본에 비해 총수익 금액은 적지만 빠른 속도로 성장하고 있는 것으로 나타났다.
[표 2-2-6] 해외에서 보는 일본 생명공학산업 시장규모
|
연도 |
시장규모(억달러) |
증가율(%) |
연평균증가율(%) |
|
2010 |
33.6 |
|
3.6% |
|
2011 |
33.8 |
3.5 |
|
|
2012 |
35.4 |
4.9 |
|
|
2013 |
36.5 |
2.9 |
|
|
2014 |
37.6 |
3.0 |
출처 : Marketline, Biotechnology in Japan, 2015.02
[표 2-2-7] 아시아-태평양 생명공학산업 지역별 규모
|
국가명 |
2014년 시장규모(억달러) |
비중 |
|
일본 |
37.6 |
48.5% |
|
중국 |
15.7 |
20.3% |
|
인도 |
6.8 |
8.8% |
|
한국 |
3.6 |
4.7% |
|
기타 |
13.7 |
17.7% |
|
합계 |
77.4 |
100% |
출처 : Marketline, Biotechnology in Asia-Pacific, 2015.02
산업분야별로는 환경 및 공정분야가 수익 127억 달러로, 전체의 33.8% 수준을 차지하고 있으며 보건의료 분야는 110억 달러로 29.3%로 그 뒤를 잇고 있다.
[표 2-2-8] 일본 생명공학산업 시장 구분
|
구분 |
2014년 시장규모(억달러) |
비중 |
|
환경 및 공정(Environment & Industrial processing) |
12.7 |
33.8% |
|
보건의료(Medical/Healthcare) |
11.0 |
29.3% |
|
식품 및 농업(Food & Agriculture) |
7.9 |
20.9% |
|
기술 및 서비스(Technology service) |
4.8 |
12.8% |
|
서비스 제공(Service Provider) |
1.2 |
3.2% |
|
합계 |
37.6 |
100% |
출처 : Marketline, Biotechnology in Japan, 2015.02
일본 바이오산업의 대표 기업으로는 아스텔라스 제약(Astellas Pharma Inc.), 다이이치산쿄(Daiichi Sankyo Co., Ltd.), 미츠비시 타나베 제약(Mitsubishi Tanabe Pharma Corporation), 타케다 제약(Takada Pharmaceutical Company Limited)이 있다.
아스텔라스는 심혈관질환과 당뇨병, 중추신경계(CNS), 감염병, 염증과 운동기관, 비뇨기과 관련 처방약을 판매하고 있으며, 주요 제품은 콜레스테롤 치료제 Lipitor, 전립선 치료제 Harmal, 면역억제제 Prograf가 있다. 다이이치산쿄는 처방약과 일반의약품(OTC) 관련 비즈니스를 하며, 심혈관, 감염병, 뼈/관절 질환, 조영제, 종양학과 심혈관 대사질환 영역에 대한 약품을 판매하고 있다. 미츠비시 타나베 제약은 치료용 의약품 및 일반의약품 관련 비즈니스를 하며, 대표적 치료용 의약품으로는 항-TNF 항체인 Remicade (infliximab), 고혈압, 협심증, 부정맥, 만성심부전 치료제 Maintate(bisoprolol), 알러지 질환 치료용 Talion(bepotastine), 만성 신장질환 치료제인 Kremezin이 있다. 타케다 제약은 치료용의약품, 헬스케어 등의 사업을 수행하고 있다. 타케다의 치료용의약품은 알레르기, 심혈관계, 중추신경계, 당뇨, 위장병, 통풍, 감염, 종양, 골다공증, 비뇨기과, 산부인과 관련 질환을 대상으로 하고 있으며, 디프테리아와 파상풍과 같은 질병의 백신도 개발하고 있다. 헬스케어와 관련해서는 비타민 기반 조제약을 포함한 일반의약품의 제조 및 판매, 건강보조제와 감기약 등 의약부외품을 판매한다.
[표 2-2-9] 일본 대표 제약회사 매출, 순이익, 자산총액
(단위 : 100만달러)
|
구분 |
2010 |
2011 |
2012 |
2013 |
2014 |
|
|
아스텔라스 |
매출 |
9,991.6 |
9,777.1 |
9,935.3 |
10,306.6 |
미집계 |
|
순이익 |
1,253.0 |
693.4 |
801.8 |
849.1 |
미집계 |
|
|
자산총액 |
13,981.5 |
13,683.4 |
14,355.1 |
14,815.6 |
미집계 |
|
|
산쿄 |
매출 |
9,758.2 |
9,914.6 |
9,620.5 |
10,227.0 |
11,460.9 |
|
순이익 |
428.9 |
718.7 |
106.4 |
682.8 |
624.6 |
|
|
자산총액 |
15,266.1 |
15,171.1 |
15,563.0 |
16,850.2 |
19,002.1 |
|
|
타나베 |
매출 |
4,148.3 |
4,197.4 |
4,173.0 |
4,296.2 |
4,229.5 |
|
순이익 |
310.1 |
384.1 |
399.9 |
429.4 |
465.2 |
|
|
자산총액 |
8,167.0 |
8,391.0 |
8,403.5 |
8,883.6 |
9,085.5 |
|
|
타케다 |
매출 |
15,024.8 |
14,547.4 |
15,465.1 |
15,960.5 |
17,338.2 |
|
순이익 |
3,051.6 |
2,540.4 |
1,272.5 |
1,345.1 |
1,093.1 |
|
|
자산총액 |
28,935.9 |
28,558.0 |
36,661.2 |
40,54.1.1 |
46,829.4 |
|
출처 : Marketline, Biotechnology in Japan, 2015.02

1. 유럽연합(EU)의 바이오정책
2010년 유럽연합(EU) 집행위원회는 유럽 경제위기 극복 및 재건을 목적으로 ʻ유럽 2020 전략(Europe 2020 Strategy)ʼ을 2020년까지의 미래를 대비하여 수립하였으며, 이를 달성하기 위한 추진방안 격으로 ʻ7개 중점계획(Flagship Initiative)ʼ도 함께 수립하였다. ʻ유럽 2020 전략ʼ에서는 똑똑하고(Smart Growth), 지속가능하며(Sustainable Growth), 포괄적인 성장(Inclusive Growth)을 추구하고 있다.
2011년에는 ʻEU Frameworkʼ로 명명되던 사업명칭을 차기 7년(2014∼2020)의 연구프로그램인 ʻHorizon 2020ʼ으로 변경하여 발표하였다. 유럽연합(EU)은 ʻHorizon 2020ʼ을 통해 혁신의 관점을 강조하여 연구개발을 포괄하고 예산 운영의 탄력성을 높이고자 하며, 기존 제7차 프레임워크 프로그램(Framework Programme 7, FP7)과 경쟁력향상사업을 통합하여 사업차원에서 혁신과의 연계를 강화하였다.
ʻEurope 2020 Strategyʼ와 ʻHorizon 2020ʼ을 기반으로 바이오 관련 주요 정책 및 과제는 중점추진영역으로 많은 예산이 투입되고 있다.
[표 2-3-1] EU 주요 혁신 정책
|
정책 |
발표 년도 |
발표 기관 |
중점 내용 |
|
유럽 2020 전략 |
2010년 |
EU 집행위원회 |
주요정책 · Smart Growth · Sustainable Growth · Inclusive Growth |
|
유럽 2020 혁신공동체 중점계획 |
2010년 |
EU 집행위원회 |
· 혁신 공동체 관련 실행계획으로서 지식기반 강화 및 분산화 방지, 창의적 아이디어 상업화, 사회적·지역적 결합성 최대화 등 |
|
Horizon 2020 |
2011년 |
EU 집행위원회 |
대표사업 · 유럽 과학의 우수성 강화 · ICT, NT, BT, AM, ST 중심으로 산업기술 분야 주도적 역할 강화 |
출처 : 유럽연합(EU)(http://europa.eu)
2007년부터 시작되어 2013년 종료되는 FP7의 전체 예산은 약 505억 유로이며, 4개의 특정 프로그램들과 1개의 핵심연구프로그램으로 구성되어 있다. 이 중 바이오와 관련 있는 프로그램은 협력 프로그램으로 총 10개의 세부프로그램으로 구성되어 있는데, 건강과 식품, 농업, 생명공학 관련 세부 프로그램들이다. 협력 프로그램의 주요 주제이며 대표적인 세부 프로그램은 건강 관련 세부 프로그램이며, FP7 기간 동안 약 60억 유로의 예산이 배정되었는데, 이는 전체 협력 프로그램 예산(약 324억 유로)의 18.5%에 해당되며, 이와 관련된 대표적인 연구 분야는 미생물 저항, HIV/AIDS, 말라리아, 결핵, 전염병 등이다.
ʻ유럽 2020 전략ʼ은 2010년 지속가능한 포괄적 성장을 위해 수립되었으며, 기술과 제품의 영역을 넘어 서비스 혁신이 갖는 의미와 정책적 권고사항 및 응용서비스 개발 추진 필요성 등을 세부전략으로 제시하였다. 2020년까지 유럽연합(EU)의 GDP 대비 약 3%(공공펀딩 1%+민간투자 2%)를 R&D에 투자하는 것을 목표로 삼고 있으며, 바이오 관련 기술을 유럽의 지속적 경제성장을 위한 필수적인 기술로 정의하고 있다. 이를 통해 약 370만개의 일자리 창출과 약 8,000억 유로 정도의 연간 GDP 증가를 기대하고 있다.
ʻHorizon 2020ʼ 프로그램의 7년 전체 예산은 약 800억 유로이며 유럽의 과학 우수성 강화를 위해 약 244억 유로(유럽연구위원회 130억 유로 포함), 산업혁신 강화를 위해 약 170억 유로, 주요 사회적 관심사 연구를 위해 약 244억 유로를 배정하였다. 산업혁신 강화에는 핵심기술 개발과 중소기업 지원에 대한 투자가 주요 과제이며, 주요 사회적 관심사 연구에는 기후변화, 지속가능한 교통, 재생에너지, 식량 안전 및 안보, 인구 고령화 등이 포함된다. ʻHorizon 2020ʼ은 FP7에 이어 유럽이 직면하고 있는 도전과제와의 연관성, 연구 경영 및 관리 개선, 상호 보완적 접근, 로드맵에 기반을 둔 연구수행 등에 중점을 두고 2014년부터 2020년까지 진행될 예정이다.
한편 유럽연합(EU)은 에너지 사용을 최소화하고 동시에 재생에너지 활용을 확대하며, 더 나아가서는 폐기물을 에너지로 활용하여 폐기물 발생을 저감하는 에코시스템에 기반을 둔 ʻ바이오기반 경제(Bio-based Ecosystem)ʼ 구축에 대한 전략을 구체화하고 있다. 따라서 ʻHorizon 2020ʼ은 유럽연합(EU)이 산업부문과 정부의 파트너십을 강화하여, 기술적 혁신을 실질적인 상업적 잠재력을 가지는 활용 가능한 제품으로의 발전을 공고히 하고자 한다. 또한 유럽의 중점 연구 분야들에 대한 진보적인 발전을 이끌고자 한다. 이와 더불어 유럽 이외의 국가와 기관들과의 국제협력을 견고히 하여 연구와 혁신을 강화하고자 한다. 이에 향후 세부 프로그램의 진행 등 지속적인 모니터링을 통해 우리나라도 적극 참여 및 협력하는 것을 고려해야 할 것이다.
2. 주요 국가의 현황
가. 영국
영국정부가 2010년 발표한 ʻThe Age of Bioscience-Strategic Planʼ에서 집중 연구주제인 식량안보, 바이오에너지 및 산업생명공학, 건강유지를 위한 기초 생명공학은 전체 계획 중 중간 지점에 도달하였다. 이에 따라 최근 로드쇼 등 다양한 이해관계자 모임을 통해 향후 방향성에 대한 논의가 진행 중이다. 특히 최근에는 ʻ화이트 바이오테크놀로지ʼ를 지향하는 산업적 바이오기술, 바이오에너지 및 합성생물학 분야에 관심이 집중되고 있다. 이는 유럽의 바이오경제 건설과 무관하지 않은 것으로 판단된다. 영국정부는 또한 2011년 이후 치열한 R&D 경쟁에서 선도적 위치를 차지하기 위한 성장계획 및 전략들을 적극적으로 제시해오고 있다.
영국의 생명과학 산업은 세계적으로 성공한 사례로 현재 유럽에서 선두에 있으며 또한 미국의 뒤를 이어 세계에서 두 번째라는 위치를 차지하고 있다. 유럽 내 바이오테크놀로지 기업 중 3/4 정도가 영국회사로 추산되며 The Bio Industry Association에 따르면 유럽의 바이오테크놀로지 시장은 약 600억 파운드 규모이다. 따라서 영국정부 정책에서 기초과학과 바이오 분야는 매우 중요한 위치를 차지하고 있으며 실제로 예산 비중이 매우 높은 상황이다. 영국의 경제사회 목적별 정부 R&D 예산 비중 추이를 살펴보면 기초과학 등 지식증진 부문이 25%(2011)로 가장 높게 나타나고, 보건 분야가 20%(2011)로 지속적으로 증가하고 있는 경향을 나타낸다. 뿐만 아니라 연구회별 정부연구개발예산을 살펴보아도 의학연구회가 21.2%(2011) 679백만 파운드로 높은 비중을 나타내고 있으며 특히 전년대비 증가율은 7.1%로 가장 높은 상황이다.
영국 비즈니스 혁신 기술부(Department for Business, Innovation and Skills, BIS)에 따르면 영국 정부는 2012년 유전자 변형 작물(GM Crops) 실험에 대해 2억 5천만 파운드를 지원하여 해당 분야의 연구기반을 확고하게 하고, 산학 간의 보다 강도 높은 협력관계를 형성함으로써 정부가 제도적으로 신기술을 보다 용이하게 인식할 수 있는 기반을 형성하였다. 영국 정부는 국내 생명 산업의 육성과 해외 직접 투자가들을 위한 대영 투자 환경 개선을 위해 중소기업의 R&D 사업에 대한 세금 감면 혜택을 2012년 4월 22.5%까지 확대하였고, 2013년부터 특허 박스 시스템을 도입, 특허사업을 통한 이윤에 대한 기업 과세를 10% 감소하는 등 산업 육성을 위한 다양한 지원 정책을 도입하였다.
영국의 제약 산업은 영국의 가장 대표적인 산업 중 하나로 약 83,000명의 인력을 직접 고용하고 있다. 세계에서 가장 많이 사용되는 의약품 100개 품목 중 50개 품목이 영국의 연구기관을 통해 개발되었고 영국은 제약 산업의 R&D 분야에 강점을 가지고 있으며, 지속적으로 많은 투자가 유입되는 분야이다. 상대적으로 높은 구매력을 보유한 국가의료시스템(NHS)는 2013년부터 도입된 바이오 신약 특허 박스 제도를 통해 영국 내 개발 및 출원된 기술에 대해 우선 구매권을 행사함으로써 영국 바이오산업 육성을 지원하고 있다.
나. 독일
독일은 연구개발 투자를 확대하여 혁신적인 기술개발의 토대를 구축하고자 많은 노력을 기울이는 나라이며 2006년 정부, 연구원 산업계 전문가들의 참여 아래 범부처 차원에서 수립하고 2009년 수정‧보완한 국가과학기술육성 전략인 ʻ첨단기술전략 프로그램(High-tech Strategy 2020 for Germany, HTS 2020)ʼ을 독일연방정부 연방교육연구부(BMBF) 주도하에 2010년 7월에 발표하고 5대 중점기술 분야를 지정하여 육성하고 있다. 이 중 건강/영양 분야가 바이오 분야와 직접적으로 관련된다고 할 수 있다. 5대 중점기술 분야에서 총 11개의 과학기술 개발 우선추진 과제(Forward-looking Projects)를 설정하였다. 이에는 이산화탄소 저감 및 에너지 효율화, 지능형 에너지 공급시스템, 신재생에너지, 신약 개발, 보건 연구, 노령화 연구, 전기자동차, 정보네트워크 보호, 에너지 저감형 인터넷, 디지털 지식확산시스템, 미래 노동시스템이 포함되었다.
[표 2-3-2] HTS 2020의 5대 중점기술 분야
|
중점기술 분야 |
HTC 2020 대응 내용 |
|
기후/에너지 |
· 저탄소, 에너지의 높은 효율 또한 기후에 적응할 수 있는 도시 · 지능화 개조로 에너지 공급/석유의 대체, 재생 가능한 원료, 낮은 에너지 소모의 네트워크를 더욱 많이 사용 |
|
건강/영양 |
· 창의적인 의료구조로 질병을 더욱 효과적으로 치료 · 목적 지향적 식품연구로 건강 강화/고령인도 혜택 |
|
교통 |
· 2020년까지 독일에 100만 대의 전기 자동차 |
|
안전 |
· 더욱 효과적으로 통신네트워크 확보 |
|
통신 |
· 지능화 개조/에너지절약형 네트워크/디지털화/지식산업화 |
출처 : 위키백과(https://ko.wikipedia.org/wiki)
건강/영양 분야에서의 가장 큰 목표는 건강‧의료기술, 영양, 농업, 소비자보호를 위한 연구개발이다. 세부적으로 맞춤형 의료진료, 식단을 통한 질병예방과 건강 증진, 그리고 노인인구의 생활 지원 등이 있다. 먼저 개인 맞춤형 진료를 통하여 효과적인 질병치료를 하고자 한다. 기초연구, 임상연구, 실제적용이 지속적으로 연계될 수 있는 연구 프로젝트, 시스템 생물학, 재생의학 및 계산 뇌과학 분야, 질병 예방을 위한 영양학 연구 분야, 그리고 임상 실험분야를 추가적으로 지원하며 개개인의 특성에 맞는 치료방법을 알아내고자 한다. 이러한 맞춤형 진료를 통하여 현재의 의료기술의 한계로 인하여 환자개개인에게 일어날 수 있는 부작용의 정도를 줄일 수 있으며 환자를 더욱 보호할 수 있다. 또한 의료산업 분야의 새로운 기업경영 모델이 만들어진다. 독일 정부는 이 분야에 3.7억 유로를 지원할 계획이다.
질병예방 및 합리적 식단을 통한 건강 증진과 최적화된 식단에 기반을 둔 다이어트를 통한 건강개선도 건강/영양 분야의 목표 중 하나이다. 이 분야에서는 음식연구와 식품 재료와 인체 기관의 상호작용을 연구하므로 식품의 올바른 선택과 섭취를 통해 질병을 예방하고 더 효과적으로 환자를 치료할 수 있도록 하고 있다. 이러한 음식연구와 식품재료연구를 통하여 인체에 도움이 되는 새로운 식량 품종개발에 도움이 될 수 있으며 이후 국제적으로 독일의 식품공업이 경쟁력을 지닐 수 있도록 할 수 있다. 독일 정부는 이러한 첨단기술 2020전략을 가능하게하기 위해 이 분야에 9천만 유로를 투자할 계획이다.
또한 고령자의 자립적 생활 지원도 건강/영양 분야의 목표이다. 지속적인 연구를 통해 고령화의 생물학적 메커니즘을 규명하고 이를 통해 건강한 노령화를 지원한다. 노령자의 안전하고 자립적인 생활을 위해 연령에 맞는 지원 시스템과 이동 및 통신 기술을 개발 하고자 하며 고령인구들의 삶의 질을 높이려 한다. 이러한 부분의 연구에 독일정부는 3억 5백만 유로를 투자하고자 한다.
독일정부의 바이오 보건의료 연구는 독일 사회에 빈번하게 발생하는 6대 질병(퇴행성 신경질환, 당뇨, 심혈관 질환, 감염질환, 암, 폐질환)에 연구 역량을 결집시키고 있으며 실용화 촉진을 위한 중개연구 및 전략적 연구 파트너쉽을 구축하는데 집중하고 있다. 이를 지원하기 위한 대표적인 프로그램으로는 ʻ독일 6대 다발질환 연구센터ʼ, ʻ독일 유전자 연구네트워크ʼ, ʻ의약학 연구 네트워크ʼ, ʻ희귀질환 연구연합ʼ, ʻ보건의료 지역클러스터ʼ, ʻ제약기술 컨소시움ʼ, ʻ고령화 대응 기술개발ʼ 등이 있으며 다른 나라들과 더불어 유럽의 바이오기반 경제 건설에 주력하고 있는 것으로 분석된다. 또한 독일은 해외 바이오기업들에게 협력을 위한 문호를 개방하고 있다. 진단에서 제약, 녹색 생명공학에서 나노 생명공학까지 외국기업들은 수월하게 파트너십 기회를 찾을 수 있으며 특히 건강/의약 분야 생명공학기업들의 80%가 외국 기업과 협력하고 있다. 독일 바이오기업에서는 의료관련 분야의 활동이 가장 활발히 이루어지고 있으며, 약품 또는 진단법 개발에 중점을 두고 있다.
독일정부는 바이오산업 육성정책의 일환으로 연방교육연구부(BMBF)가 발의한 ʻBio Industry 2021ʼ을 추진하고 있는데 이는 대학 연구소 및 기업의 공동 투자를 통해 산업용 바이오테크놀로지 분야에 현존하는 지식을 상품 및 서비스로 전환할 수 있는 기회를 제공하려는 목표를 가지고 있다. 이에 따라 독일정부는 2021년까지 6,000만 유로를 바이오 분야에 지원할 것이며, 경제계로부터 추가 지원이 이루어지면 총 1억 5,000만 유로 규모의 연구개발 프로젝트가 성사될 예정이다. 이를 통해 관련 지식과 정보를 확대시키게 되면, 신기술 및 생산된 제품을 차세대가 사용할 수 있고, 계속해서 연구개발이 이루어지게 될 것으로 기대하고 있다.
다. 프랑스
프랑스의 바이오 정책방향은 유럽의 바이오기반 경제건설과 맥락을 같이 하고 있는 것으로 판단된다. 프랑스 정부는 자국의 바이오 분야 기술수준이 세계적 수준보다 뒤쳐진 것으로 판단하고 전략적으로 바이오기술 관련 기업들을 지원 및 발전시키려고 노력하고 있다. 바이오기술 기업의 중점 분야는 ʻ진단과 분석 서비스ʼ(16.8%), ʻ연구와 생산ʼ(16.4%), ʻ치료법ʼ(10.6%)으로 대변될 수 있으며, ʻ바이오기술 관련 서비스와 공급ʼ(24.7%)이 이들의 기반이 되어주고 있다. 한편 의료기술 기업의 중점 분야는 아래 [표 2-3-4]에서 보여주는 것과 같다.
[표 2-3-3] 프랑스 바이오기술 기업 분야(2015년)
(총 바이오기술 기업 수: 720개)
|
분야 |
비중 |
|
AgroBio |
3.3 % |
|
Bioinformatics and Bioelectronics |
2.8 % |
|
Contract Research and Manufacturing |
16.4 % |
|
Cosmetics |
4.2 % |
|
Diagnostics and Analytical Services |
16.8 % |
|
Drug Delivery |
2.1 % |
|
Environment |
2.8 % |
|
Food and Nutraceuticals |
5.9 % |
|
Genomics and Proteomics |
5.4 % |
|
Industrial Biotechnology |
1.9 % |
|
Other Services and Suppliers |
24.7 % |
|
Therapeutics |
10.6 % |
|
Veterinary |
3.4 % |
|
총합 |
100 % |
출처 : www.frenchbiotech.com(French Life Sciences Database)
[표 2-3-4] 프랑스 의료기술 기업 분야(2015년)
(총 의료기술 기업 수: 162개)
|
분야 |
비중 |
|
Active implantable devices |
2.9 % |
|
Anaesthetic and respiratory devices |
1.7 % |
|
Biomaterials |
5.2 % |
|
Coatings |
1.2 % |
|
Delivery devices |
2.0 % |
|
Dental devices |
3.2 % |
|
Diagnostic and therapeutic radiation devices |
2.3 % |
|
Diagnostic devices |
2.3 % |
|
Electro mechanical medical devices |
8.1 % |
|
Hospital hardware |
2.6 % |
|
Imaging |
6.4 % |
|
Non-active implantable devices |
12.8 % |
|
Ophthalmic and optical devices |
4.4 % |
|
Regenerative Medicine |
1.2 % |
|
Reusable instruments |
12.2 % |
|
Single use devices |
8.4 % |
|
Technical aids for disabled persons |
2.3 % |
|
Wound care |
2.3 % |
|
Other |
18.3 % |
|
총합 |
100 % |
출처 : www.frenchbiotech.com(French Life Sciences Database)

2015년 중국 생명공학 분야에서 사회적으로 가장 큰 2개의 이슈는 지난 10월 5일 중국 연구자로서는 처음으로 중의과학원(중국전통의학연구원) 투유유(屠呦呦) 명예교수가 노벨 생리의학상 공동 수상자로 선정된 것과, 10월 29일 북경에서 폐막한 중국공산당 제18기 중앙위원회 전체회의(18기 5중 전회)에서 지난 35년간 고수해온 ʻ한 자녀 정책ʼ을 완전 폐기하고 모든 부부에게 자녀 2명을 낳는 것을 허용하기로 한 것이다.
투 교수는 중국고대 전통의학서 ʻ주후비급방(肘後備急方)ʼ에 학질 특효약으로 기록되어 있는 개똥쑥(菁蒿, Artemisia annua)에서 모기가 전파하는 원충에 의해 발생하는 말라리아의 치료성분 아르테미시닌(Artemisinin)을 발견하여 아프리카 등 세계에서 지금도 매년 약 80만 명 이상이 죽음에 이르는 질병의 사망자 수를 현저하게 감소시키는데 크게 기여한 공로를 인정받았다. ʻ주후비급방ʼ은 1,700여 년 전 진(晉)나라 때 갈홍(葛洪)이 지은 의학서이며, 우리나라의 동의보감, 향약집성방에 같은 효능으로 기록되어 있기도 하다. 저장성 닝보 태생으로 북경대학 출신의 투 교수는 중국국적 과학자로서 최초의 노벨상 과학 분야 수상자이다. 리커창 총리는 ʻ투 교수가 이번에 노벨상을 수상하면서 중국과학 기술의 진보와 전통의학이 국제사회에 기여한 것을 전 세계에 알렸다.ʼ고 말했다.
중국 지도부는 또한 ʻ전면적 두 자녀 정책ʼ을 18기 5중 전회에서 2016년부터 2020년까지 추진할 국가 발전 로드맵인 ʻ국민경제 및 사회발전에 관한 13차 5개년 계획(13·5)ʼ에 포함시켰다. 13억 7,000만 명의 인구 대국인 중국이 중국 고속성장을 뒷받침해온 풍부하고 값싼 노동력이 최근 경제활동 인구 감소 및 급격한 고령화 문제를 해결하기 위하여 인구정책에 대전환을 가져온 것이다. 중국 노동인구(16∼59세)는 2011년 9억 4,000만 명에서 2014년 9억 1,500만 명으로 급격히 감소하는 추세이다. 그동안 중국공산당은 1980년 9월 공개서한을 통해 공식적으로 한 자녀 정책을 채택하여 4억 명 이상의 인구증가를 억제해왔고, 2013년 11월 개최된 3중 전회에서 기존의 한 자녀 정책을 완화한 단독 2자녀 정책을 도입한 바 있으나, 새로운 정책이 채택되면서 향후 4년간 중국의 신생아는 1억 2,000만 쌍 부부에서 최저 2,500만 명에서 최고 5,200만 명까지 더 태어날 것으로 기대하고 있다.
현재 중국 생명공학 규모는 커지고 성과는 날로 높은 수준으로 발전하고 있으며, 국제협력도 활발하여 여러 분야에서 세계 경쟁에서도 뒤지지 않는 실력을 갖추게 되었다. 또한 국내시장은 치열한 국제적 경쟁에 직면하고 있고, 지속적인 발전을 거듭해온 제약 산업의 기술혁신과 구조개혁은 도약 발전하는 계기를 필요로 하고 있다. 생명공학은 중국의 국가 전략 분야 중 하나이며, 국무원이 발표한 <ʻ12·5ʼ 국가전략신생산업의 발전규획>에서 2020년까지 생명공학 산업양성을 국민경제 기간산업의 목표로 하였다. 2012년 12월, 중국 국무원은 ʻ12·5ʼ의 <생물산업발전규획>에서 중국 생물 산업의 미래 발전은 고품질 발전, 기업 주체의 발전, 연관 산업의 상호 발전, 국제화 발전의 요구와 이념 수용, 생물의약 발전을 제시하고, 생물의학공정, 생물농업, 생물제조, 바이오에너지, 생물환경보호, 생물서비스 등의 중대 방향을 설정하고 11개 행동계획의 구체적 임무와 미래 중국 생명공학 발전의 새로운 경로를 표현했다. 수 년 내로 혁신 추진, 수요공급 상호작용, 정책 선도로 생명공학 분야의 투자와 발전이 매우 활발하여 산업규모도 한 단계 더 심도 있게 성장할 것이다. 2013년 10월, 중국 국무원은 민간과 해외자본에 의료시장을 대폭 개방해 건강서비스 산업을 2020년까지 8조 위엔(약 1,400조원) 규모로 육성하는 계획을 발표하였고, 2013년 11월 중국공산당 제18기 중앙위원회 제3차 전체회의(3중 전회)에서 ʻ중국의 꿈(中國夢)ʼ을 실현하기 위해 향후 10년의 청사진을 제시하는 개혁방안으로 녹색성장, 민생개선, 대외개방 등을 제시하여 친환경 산업인 헬스케어, 스포츠서비스, 식료품 분야 등에서 빠른 성장이 기대된다. 이는 2015년 10월 18기 5중 전회에서 통과한 13차 5개년 규획(13·5규획, 2016∼2020)에서 심화 승계를 확인하였다.
[표 2-4-1] 중국 제18기 5중 전회(2015.10.26∼29) 주요의제
|
분 야 |
내 용 |
|
경 제 |
- 향후 5년간 연평군 경제성장률 목표 6%대로 하향 설정 - 빈부격차 해소 등 샤오캉(小康)사회 건설 - 바이오, IT 등 미래 성장동력 육성 방안 마련 |
|
사 회 |
- 향후 5년간 청년일자리 창출 목표 설정 - 탄소배출 규제 등 환경오염 방지책 마련 - 농촌소득 증대와 도시화 계획 구상 |
|
지 역 |
- 동북3성 경제 부흥계획 설계 - 지역별 일대일로(一帶一路, 육해상 실크로드) 프로젝트 구축 - 베이징, 텐진, 허베이 수도권 통합발전계획 마련 |
[표 2-4-2] 중국 제18기 5중 전회(2015.10.26.∼29) 과학기술분야 내용
|
|
주요 내용 : ‘국민경제와 사회발전 13·5계획(2016∼2020)’에 반영 |
|
1 |
혁신창업 활력 활성화로 대중창업, 민중혁신을 추진, 새로운 수요 확대, 새로운 공급 창조, 새로운 기술, 산업, 업종의 활발한 발전 추진 |
|
2 |
네트워크 강국 전략, ‘인터넷+’행동계획, 국가빅데이터 전략 실시, 공유경제 발전 |
|
3 |
혁신주도형 발전유도 전략 실시, 과학기술혁신으로 전면적 혁신 선도, 국가중대과학기술프로젝트 실시, 중대혁신 영역 국가실험실 건설, 국제 대과학계획 및 공정 추진 |
|
4 |
산업 신세계 구축, ‘중국제조 2015’ 및 공업 강력기반 공정 실시, 관련 전략산업 육성 및 서비스산업 발전 |
|
5 |
농촌도시 지역적 협조발전 및 경제사회 협조발전 촉진, 신형공업화, 정보화, 농촌도시화, 농업현대화 동시발전으로 중국 강성(hardware)실력 강화 및 연성(software)실력 향상 |
|
6 |
저탄소순환발전 추진, 청정 안전 고효율 현대화 에너지체계 구축 및 탄소제로배출시범공정 실시, 자원절약 및 고효율 이용 실시 및 절약집약순환이용 체계 구축, 에너지사용권, 물사용권, 오염물배출권, 탄소배출권 분배제도 구축 및 건전화 |
|
7 |
대외개방 전략 확산 및 양방향 개방 추진, 연해지역의 글로벌 경제협력 및 경쟁력 |
|
8 |
‘일대일로’건설 추진 및 관련국가와 지역의 다중영역에서 win-win협력 추진, 육지해상의 연동적 협력 강화로 동서양의 개방 형성 |
|
9 |
인재강국 건설 가속화 및 인재우선발전 전략 실시, 안력양성 체제개혁 및 정책혁신 추진으로 국제경쟁력 지닌 인력양성제도 경쟁력 확보 |
1. 중국의 생명공학정책
2014년 시진핑(習近平)주석은 생명공학기술이 경제성장을 위한 신성장동력을 창출할 것이며, 유전자기술, 단백질공정, 우주활용, 해양개발, 대체에너지 및 신소재의 발전을 통해 중대한 혁신성과를 창출하여 국민의 생활수준과 삶의 질을 향상시킬 것이라고 강조했다. 1981년 덩샤오핑이 “농업문제 해결은 최종적으로 생명공학이 해결할 수 있으니, 관련 첨단기술에 의지해야 한다.ʼʼ고 언급한 이래, 1986년 중국 정부는 ʻ863계획ʼ을 발표하고 생명공학을 우선분야로 하여 집중 지원하였다. 또한 1988년 중국 국무원의 비준을 받아 중국 과학기술부에 의해 실시되고 있는 ʻ횃불계획(첨단기술산업발전계획)ʼ은 첨단기술성과 상품화, 첨단기술상품 산업화, 첨단기술산업 국제화를 목표로 ▸첨단기술산업 발전을 위한 환경조성 ▸첨단기술산업개발구 건설 ▸첨단기술창업서비스센터 건설 ▸세부프로젝트 실행 ▸과학기술형 중소기업기술창업기금 조성 ▸첨단기술산업의 국제화 ▸인재양성이라는 7대 활동을 통해 중국 첨단기술 산업화의 중추적 역할을 수행하고 있다. 아울러 1997년부터 실시된 ʻ973계획ʼ은 미래 기술을 중점 연구하는 정부의 선행 연구 프로젝트로 중국의 미래 산업 발전에 필요한 최첨단 기술 기초연구와 응용 기초연구로써 질병유전자학 등을 수행하고 있다.
ʻ9·5ʼ기간(1996∼2000년) 15억 위안, ʻ10·5ʼ기간(2001∼2005년) 120억 위안으로 중국 정부는 생명공학 연구개발 투자 규모를 빠르게 늘려왔으며, 2005년 9월 ʻ중국의 생명공학 및 생물산업 전략계획ʼ(마스터플랜)을 공식 발표하고 농업, 의약, 공업, 환경, 에너지, 해양, 중의약 등 중점 발전분야를 확정하고 기술 축적을 위해 전력을 다하고 있다. 이 ʻ전략계획ʼ에서“향후 2020년도 중국의 생명공학 및 산업화 발전 전략 목표는 중국을 생명공학기술 강국과 생물산업 대국으로 건설하는 것이며, 15년간의 노력을 통해 중국의 생명공학과 산업화 수준을 세계 선진국 수준에 도달시키는 것이 기본 목표이다ʼʼ라고 정리하고 있다. 중국 국가 과학기술부 산하 ʻ중국 국가생명공학 발전센터ʼ에서 작성한 이 계획에서 중국은 3단계를 거쳐 2020년 생명공학기술 강국 및 생물산업 대국으로 부상하는 전략 목표 실현 의지를 표명했다.
또한“국가생명공학연구개발과 산업화 촉진 지도자 그룹ʼʼ을 결성하고 동시에 <중국생명공학기술 및 산업화 발전 계획> 및 <생물안전법>을 제정하였고, 중국 생명공학산업체협회 등을 설립하여 생명공학 연구개발비에 대한 대대적인 지원을 강화하고 있다.
[표 2-4-3] 중국의 ʻ생명공학 및 생물산업 마스터플랜ʼ에 제시된 전략목표
|
단계 |
기간(년) |
세부목표 |
|
1단계 (기술축적단계) |
2005~2010 |
◦ 생명공학 연구개발 전체 수준을 개발도상국 중 제일 높은 수준으로 도달시킴 ◦ 논문, 특허 수량 세계 6위 달성 ◦ 생물산업 총생산액 8,000억 위안 달성 |
|
2단계 (산업발전단계) |
2010~2015 |
◦ 생명공학 연구개발 전체 수준을 세계 선진수준으로 도달시킴 ◦ 논문, 특허 수량 세계 3~4위 달성 ◦ 생물산업 총생산액 15,000억 위안 달성 |
|
3단계 (지속발전단계) |
2015~2030 |
◦ 생명공학 연구개발과 산업화 전체 수준을 세계 선진 국가 수준에 도달시킴 ◦ 세계 생명공학과 기술분야 최우수 인재를 유치하며, 세계 생명공학 연구 혁신의 중심지로 성장 ◦ 생물산업 총생산액 25,000~30,000억위엔 달성 및 GDP에서 차지하는 비율 7~8% 으로 향상 ◦ 생명공학 산업을 중국의 기간산업으로 육성 |
출처: 중국 국무원
이 ʻ전략계획ʼ에서는 향후 20년간의 중국 생물산업 발전의 9개 중점 분야를 다음과 같이 제시하였다. 농업 생명공학으로 제2차 녹색혁명 추진, 의약 생명공학으로 제4차 의학혁명 추진 및 민족 평균 수명 연장, 공업 생명공학으로 ʻ녹색 제조업ʼ 발전 추진 및 녹색 GDP 대폭 증가, 에너지 생명공학으로 중국의 에너지 부족 상황 개선, 환경 생명공학으로 순환(循環) 경제 발전 추진, 생물자원 적극 개발로 새로운 생물산업 육성, 해양 생물산업 및 해양경제 발전, 생물안전과 생물테러 방지기술 연구개발 추진으로 생물안전관리시스템 구축, 중의(中醫)와 서의(西醫)를 효과적으로 결합시킨 새로운 의료 보건 체계 구축 및 중의약(中醫藥) 산업 발전 추진 등이다.
가. 생물산업의 발전을 촉진하는 여러 정책
2009년 중국 국무원이 발표한 <생물산업발전촉진기본정책>은 정책목표, 현대 생물산업 발전의 중요 영역, 생물 기업의 발전, 자주적 혁신의 촉진, 우수 인재의 양성, 관련예산 및 세금 지원의 확대, 투융자 방법의 적극적 확대, 양호한 시장 환경의 조성, 생물 유전자원에 대한 보호와 생물안전성의 감독, 그리고 조직과 리더십의 강화 등 총 10부분, 33항으로 구성되어 있다. <생물산업발전촉진기본정책>에서, 생물 산업을 빠르게 육성하는 것은 중국의 신세기 과학기술 혁명의 전략적인 기회이고, 새로운 국가를 전면적으로 건설하는 중요한 과제가 되었다. 위 정책은 <국가중장기과학기술발전계획요강(2006~2020)>과 <생물산업발전ʻ11·5ʼ계획>을 실행하여, 생물산업을 하이테크 기술 영역의 기간산업과 국가의 전략적 신흥 산업으로 빠르게 육성하는데 그 목적이 있다. 위 정책은 기술‧인재‧금 등 자원을 생명공학 산업으로 유도하여 생명 공학 기술의 혁신과 산업화를 촉진해, 생명공학 산업 규모화‧집적화‧국제화 발전을 가속시킨다. 기업을 주체로, 시장수요 중심 방향으로 산‧학‧연이 서로 결합하는 산업 기술 혁신 체계를 건설하며, 우수 인재를 양성하여 자주적 혁신 능력을 강화시켜 자주적 지적 재산권을 갖고 있는 중요한 생명공학 기술‧제품과 표준을 파악한다고 요구하고 있다.
<생물산업발전촉진기본정책>에서, 여러 개의 다국적 대형 생명공학 기업과 자주적 지적재산권을 보유하는 혁신적 생명공학 중소기업의 육성; 여러 개의 산업 밀집도가 높고 핵심 경쟁력이 강하고 전문화 특색이 현저한 생명공업 산업의 본거지의 형성, 생명공학 기술 특허의 보호와 물질특허 생물유전자원의 보호를 강화하여, 생물유전자원의 개발‧이용 수준을 향상시켜 생물안전성의 보장을 요구하고 있다.
생물 의약 분야에서, 중국 국민의 생명 건강을 위협하고 있는 중대 전염병을 예방하고 진단하는 신형 백신과 진단 시약의 개발에 중점을 두고 있다. 흔한 질환과 주요 질환의 치료에 현저한 효과가 있는 생물기술 약물‧저분자 약물과 현대 중약을 적극적으로 연구하고 개발한다.
생물 농업 분야에서 중국은, 양질‧다수확‧고효율‧다환경적응성 농업‧임업 신품종과 야생 동식물 번식 종자개발을 중점적으로 발전시키고 있다. 생물농약‧생물 사료 및 사료첨가제‧생물비료‧식물성장조절제‧동물백신‧진단시약‧현대 동물용 중약‧동물용 생물치료제‧어류용 생물치료제‧미생물 완전분해 농업용 박막 등과 같은 친환경 녹색농업용 생물제품을 크게 발전시켜, 동식물 바이오리액터의 산업화 개발을 추진하여 고효율 녹색 농업의 발전을 촉진시키고 있다.
2010년 국무원은 생물산업을 중국의 전략산업으로 제시하여 국민경제중심산업으로 선도산업의 발전목표와 정책지표로 하였고, 2012년 ʻ12.5계획ʼ(2011~2015)기간 국가과기계획으로 추진하는 11개 주요 시범 수행과 함께 시작된 국가주요과기전문 프로젝트와 연계강화 분야는 전염병 신약개발 등 20개, 전략적 차세대사업의 이론적 지원확대 분야로 신에너지, 바이오기술 등 30개 이다. 농업과 민생분야 지원확대를 위해 작물의 핵심암수개체, 벼 분자설계 육종, 동맥경화와 II형 당뇨병의 발병 메커니즘 등 40개 및 국가주요과학연구계획과제로 단백질 연구, 나노과학 연구, 발육과 생식연구, 줄기세포 연구 등 64개 프로젝트가 수행되고 있다.
2011년 <국무원 판공실의 ʻ과학기술부, 재정부의 과기형 중소기업 기술혁신기금 관련 잠정규정ʼ 전달 통지>, <과기형 중소기업 기술혁신기금 재무관리 잠정방법>의 관련 규정에 근거해 과기부 과기형 중소기업 기술혁신기금을 지원하고 있다. 또한 중국과기부는 <국가 중장기 과학기술 발전계획(2006~2020년)요강>의 시행을 구체화하고 70개 관련 프로젝트를 2012년부터 지원하고 있다.
2. 중국의 생명공학기술 및 산업
중국은 풍부한 생물자원을 보유하고 있다는 장점을 바탕으로 생물산업 발전을 가속화하고 있다. 중국에는 동식물, 미생물이 26만종이 있으며 세계에서 천연자원과 생물다양성이 가장 풍부한 국가 중의 하나이다. 이미 3,000여 가지의 질병 근원 미생물 수집에 성공하였고, 농작물 재배에 유용한 천연 생물자원도 32만종이나 확보하여 그 수치는 단연 세계 1위를 차지한다. 그밖에 형질전환기술, 단백질공학, 복제기술 등을 포함한 현대 생명공학기술은 개발도상국가 중 우위를 차지하고 있으며 일부는 세계 수준으로 평가받고 있다. 최근 중국의 생명공학 관련 특허 및 논문의 빠른 증가는 관련 연구계로부터 크게 주목 받고 있다.
중국에는 중앙정부, 유관 정부부처 및 지방정부가 지원하는 생명공학중점실험실이 약 200여개 정도 있고, 많은 대학이 생명공학 및 생물산업 분야의 전공을 개설하고 있다. 중국의 생명공학 응용연구 및 산업화는 농업 생명공학기술(형질전환 농작물, 현대육종과 슈퍼교잡벼, 식물조직배양, 생물농약, 사료생물기술, 가축용 백신)과 의약 생명공학기술(생명공학신약, 백신, 혈액제품, 생화약품, 진단시약, 조직장기공학)이 중심이며, 중약(천연물)은 중국 정부가 중화민족의 자부심을 가지고 추진하는 생명공학산업 분야이다.
(단위 : 억 위안)

출처 : 서남증권, 2014
[그림 2-4-1] 중국 대규모 건강산업 직접투자
중국발전개혁위원회가 생명공학 산업화 프로젝트와 중대과학프로젝트 등을 추진한 기술성과가 지속적으로 산업화됨에 따라 생물산업은 연간 약 3배씩 빠르게 성장하고 있다. 중국의 13억 인구가 식량을 섭취하고 5억 정도가 건강기능식품을 소비하고, 1.3억의 인구가 환자이며 새로운 품종의 농작물을 재배할 농경지가 20억무(1畝=200평)나 되는 등 중국은 세계에서 가장 큰 생물제품 소비시장을 보유하고 있어 향후 지속적 발전 가능성이 크게 기대된다.
중국내 생명공학 관련 기업과 종사인력은 계속 증가하고 있고, 베이징과 상하이, 선전 등지에 이미 20여개 생명공학 클러스터가 설립되어 있다. 중국정부는 중국 생명공학이 향후 더욱 커다란 발전 잠재력을 보유하고 있고 중국의 생명공학 연구개발이 식량안보, 인구건강, 환경증진, 에너지 안보에 주력하고 경제사회 개발의 병목현상을 해결할 수 있을 것이라고 확신하고 있다.
가. 중국생명공학 산업 규모
“2020년까지, 중국 의약 위생 관련 산업의 생산액은 4만억 위안에 달할 것이고, 생명공학 관련 산업의 생산액과 합쳐서 6만억 위안을 넘을 것이다(全國人大常委會 위원장 桑国卫).” 생물 의약 산업은 전략 산업 뿐만 아니라 미래의 기간산업이 될 것이고, 앞으로 중국 GDP의 10% 또는 그 이상 차지할 것이다. 2010년 국무원은 생물산업을 중국의 전략산업으로 제시하고, 경제발전방식 전환과 산업구조 격상 및 경제사회 추진으로 지속적인 발전을 이루게 하고, 또한 세계적으로 경쟁력을 가진 전략을 수립할 수 있는 중국생물산업발전의 방향을 제시하였다.
ʻ12·5ʼ(2011∼2015) 시기에도 중국 생물산업은 계속 빠르게 성장하여 하이테크산업발전의 중요 분야로 자리 잡고 독자적 창의개발능력이 뚜렷이 강화되었다. 유전자 분석, 줄기세포, 항체공정, 단백질 약물, 의료기구, 생물합성, 이식 유전자 육종, 동물반응기, 효소 공정, 신약개발과 백신개발 등 생명공학 기술의 최전방 영역에서, 국가공정연구센터, 국가공정연구소, 국가중점실험실, 기업기술센터를 설치하고 이를 중심으로 관련분야에서 커다란 성과를 얻었으며, 중소기업 연구개발 활동을 활발하게 수행하여 산업 핵심경쟁력의 성장을 확실하게 달성하였다. 그리고 창의적 혁신연구개발 성과는 상업화를 도출하였다. 백신과 시약진단, 새로운 약물 개발, 현대 중약, 생물의약공정, 생물육종, 녹색농용생물제품, 생물자원, 생물소재, 미생물이용 분야의 새로운 성과를 통해 산업화 실현 및 현대농업의 발전을 달성하였다. 또한 관련 산업은 발전적 형세를 갖추었다. 북경, 상해, 장춘, 창사, 선전, 덕주, 태주 등 국가생물산업기지는 발전단계로 빠르게 진입하여 경제사회발전의 새로운 성장엔진으로 거듭났다.
2011년 후진타오 주석이 중국중앙정치국의 제29회 집단학습에서 전략적 신흥산업을 본격적으로 육성하는 것을 강조한 것과 관련하여 중국 ʻ소강사회ʼ(小康社會)의 전면 건설이 관건인 ʻ12·5ʼ(2011~2015)기간에는 개혁개방을 가속화하고 경제발전방식의 난관을 극복하여 변화를 도모하고, 미래 <전략신흥산업 ʻ12·5ʼ계획>, <생물산업발전ʻ12·5ʼ계획>의 출현, 의료위생체제개혁과 새로운 농합, 주민사회보장제도의 지속적인 개선, 녹색기술의 발전과 ʻ양형사회ʼ(兩型社會) 건설에 따라 생물산업은 발전 범위를 넓히고 있다. ʻ12·5ʼ기간, 중국은 생물산업발전기술의 기반강화에 주력하고 중대성과의 산업화를 추진하며, 한 단계 업그레이드된 재정과 세무, 금융정책의 지원, 기술혁신과 인재정책의 개선, 양질의 시장 환경 조성, 중요 분야와 중점 개혁의 추진 등으로 중국 생물 산업을 빠르게 발전시켰다.
나. 중국 생명공학 산업 현황
중국 생명공학 산업은 계속 왕성한 성장력을 보이며 바이오제약, 생물농업, 생물공정 등 모든 분야에서 발전하였다. 산업이 빠르게 성장하고, 기업이윤이 높아졌으며, 국내외 자금 유치능력도 높아졌고, 생산기지 건설이나 연구기지 건설 모두 호황을 보였다. 특히 주된 두 가지 이유는 국내의료위생개혁과 중국의 신흥기업이 창업하는데 유리한 자본조달 시장 때문이다.
중국은 2009년 <생물산업발전정책추진>에서 생물산업을 하이테크분야의 중심산업으로 규정하고 빠른 발전을 수행하고 있다. 업계 분석가들은 생물 의약 산업은 산업구조를 격상시키고, 기술혁신을 추진하고, 국가과학기술경쟁력을 높이는 중대한 임무를 지니며, 국가는 재정, 세금, 은행신용 등과 같은 방면에서 지원를 해주어야 하고, 예산투자를 확대하면 미래의 생물의약은 발전의 황금시대를 맞이할 수 있다고 판단하고 있다. 2009년부터 추진하고 있는 중국 공공위생의료체계개혁에 따라 면역백신과 진단시약의 수요가 증가했고, 이를 통해 의료시장에서 거대한 수요를 창출하여 생명공학 제약산업의 발전을 기대하고 있다.
중국 생물산업은 여전히 자본이 풍부하고, 특히 창업 허가 설립과 초기 융자가 확대되었으며, 사회자본의 투자가 활발하다. 또한 최근 합성생물학, 해양생명공학, 유전자변형식물의 안전성평가, 효소이용 기술 분야에서도 매우 큰 발전과 산업적 성장이 기대되고 있다. 2011년부터 시작된 ʻ12·5ʼ계획에서는 생물산업이 전략적 신흥산업과 국가미래의 기간산업으로서 더욱 좋은 발전 환경을 지니고 있다. 산업정책 지원으로 중국생명공학은 전면적으로 발전추세이고, 특히 창업기업의 출현이후 중국 생물산업은 이미 기술과 자본촉진으로 접어들어 시장이 빠르게 발전하는 추세이기에 최근 20년간 가장 좋은 황금발전단계로 진입하였다.
다. 생물의약
2015년도 통계에 의하면 2013년도 기준 중국의약공업기업 수는 7,150개로 전년대비 7.9% 성장하였다. 총 매출액은 21,681억 위안으로 전년대비 17.9%, 총실현이익은 2,197억 위안으로 전년대비 17.6% 증가하였다. 2014년도 상반기에는 총매출액은 13.85%, 총이익은 14.78% 증가하였다. 중국 의약공업 500대 기업 중 화학약품기업은 50%, 중성약기업은 30.2%를 차지하고 있다. 면역백신은 국민건강을 위해 매우 중요한 분야로 정부의 적극적인 정책과 지원으로 지속적 발전을 하고 있고, 줄기세포 연구개발도 미국, 캐나다, 한국과 경쟁할 수준으로 많은 노력을 하고 있다. 중의약(中医葯)은 중국의 전략적 분야로 높은 성장을 보였는데 2006∼2013년 기간 중에 중성약(中成葯)은 연평균 22.4% 성장했고, 중약음편(中葯飮片)은 연평균 34.9% 성장했다. 2013년도 기준으로 중성약 매출은 5,065억 위안으로 전년대비 21.1% 증가하였고 중성약 생산량은 310만 톤으로 5.7% 줄었다. 대략적으로 2014년 중약 총생산액은 7,600억 위안 정도로 추산된다. 2012년 1월 공업정보부가 발표한 <의약공업ʻ12·5ʼ계획>, 2012년 5월 상무부의 <중약재중점품종유통보고>, 2012년 6월 <중의약사업 ʻ125ʼ계획>의 목표에 따라 2015년에도 중의약의료자원 및 이용 관련 사업을 수행하고 있다. 2014년 11월 25일, 국가발전 및 개혁위원회는 중의약 발전을 위해 약품가격개혁 등의 방침을 결정하고 2015년 1월부터 시행하는 결정을 통해 중의약 발전에 계속 박차를 가하고 있다. 2014년 상반기 동안 중약 무역은 양호하여 미화 21.94억 달러로 전년대비 10.76% 증가하였고, 수출은 미화 16.91 달러로 전년대비 13.41% 증가하였다.
최근 중국 정부차원에서 재산권보호, 약품시장의 정비와 기술혁신체계 구축을 중시하면서 글로벌 제약기업의 연구개발 및 임상시험 기능의 이전뿐만 아니라 시장으로서 중국을 대상으로 하는 것이 전 세계 생물의약분야의 주요 추세이며, 북경, 상해 등에 각각 설립한 세계 수준의 생명공학 및 약물연구센터에서는 심혈관, 대사질환 및 신경변성 등의 질병의 치료법 개발이 주요 분야이다. 또한 중국과학원 상해생명과학원을 중심으로 글로벌 협력네트워크도 확보하는 등 세계 3대 생명공학연구기지가 되었다. 세계적으로 크게 성장한 중국생물의약서비스기업은 중국 생명공학 연구개발 기관에 지속적으로 도움을 주고, 적극적으로 스스로의 생존 무대를 개척하기 시작하면서 기술과 인력자원을 확보하기 시작하였다. 연구개발센터 설립이외에 생산라인 건설과 투자도 계속 진행되고 있다. Sanofi-Aventis의 세계 최대의 간염백신기지 건설, 중국생물기술공사의 길림성 생산 및 연구개발기지, 사천성 성도국제의학단지의 보아오(博奧)생물생산연구개발 기지, 화치에기업(化纖行業)의 세계 총생산 80% 점유 biopolymer 생산시설, 천진생물재료유한공사의 세계 최대 PHA생산라인, 산동차오린(山東澣霖)생물기술유한 공사의 중국 자체 개발 세계 최대 규모 생물발효시설 등도 가동을 시작하면서 계속 확대 건설하고 있다.
라. 생물농업
최근에도 중국 생물종자, 생물사료, 생물농약, 생물비료, 생물백신 등 농업녹색산업은 여러 분야에서 고르게 빠른 발전을 계속하고 있다. 특히 벼, 밀, 누에 등의 주요 농업생물유전자에 대한 연구개발이 활발하다.
생물종자 산업은 중국 국가 전략 핵심 산업으로 과학기술적으로 쾌속 발전하며 국가 식량안보 및 농업발전에 크게 기여하고 있다. 2013년 상품종자 총매출액은 731.88억 위안, 총이익은 67.16억 위안으로 전년대비 4.95억 위안, 3.65억 위안 증가하였다. 미국에 이어 세계 2위의 규모로 종자생산기업이 8,700개인데, 그 중 기술력 높은 상위 50개 기업이 33%의 시장을 점유하고 있다. 또한 95%이상이 전통육종기술을 이용하고 염색체교잡벼, 유전자조작 항충면화 등은 세계 수준이다. 2012년 농업부, 과기부 등 16개 부처가 <전국현대농작물종자산업발전계획(2011∼2020)>을 마련하여 생산기지 건설, 정책 등을 실현하고 있다. 2014년 11월 현대종자산업발전기금도 출범하여 10개 투자항목을 결정하고, 2014년 농업부, 과기부, 재정부의 협력체제로 중국농업과학원 작물과학연구소 등 4개 거점단위를 중심으로 생물종자산업과학기술체계 개혁을 주도하고 있다. 2013년 국가급 개발 신청한 주요농작물 품종은 133종이고, 그중 벼 43종, 밀 25종, 옥수수 18종, 면화 5종, 대두 16종, 유채 23종, 감자 3종이고, 성(省)급에선 벼 380종, 밀 98종 등 총 1,372종에 달한다.
생물사료 분야는 국민경제수준이 향상되면서 동물성 식품 수요가 증대하며 연평균 20%정도로 빠르게 성장하고 있으며, 규모로는 세계 1위이다. 2013년 전국사료 총생산량은 1.9억톤으로 개혁개방이후 처음으로 전년대비 2% 감소하였고, 2014년 총생산액은 약 100억 위안으로 전년대비 증가하지 않았는데, 2014년 상반기 사료원료가격이 폭등하였기 때문이다. 2011년 10월 중국농업부가 발표한 <사료공업ʻ12·5ʼ발전계획>대로 2015년 중국 사료 총생산량은 2억 톤에 달할 것으로 예상되며, 2014년 2월부터 농업부가 공포한 <사료첨가제품종목록(2013)>이 정식 시행되어 사료용 효소, 미생물, 식물추출물 등 사료효율을 향상시키는 안전하고 우수한 사료첨가제 개발을 중점 지원하고 있다. 주요 제품으로 사료용 효소가 가장 주목 받고 있으며 이는 안전 고품질 축산물을 경제적으로 생산 가능하기 때문이다. 중국의 사료용 효소제 총생산량은 2010년 8.5만 톤에서 2013년 13.5만 톤으로 빠르게 성장했다. 현재 가장 중점관심분야는 사료용 효소, 사료용 미생물, 항생제 대체제 등이다.
생물농약은 생활수준이 향상되면서 생태안전 및 시장소비자의 식품안전, 위생, 영양, 고품질의 요구에 따라 빠르게 발전하고 있다. 2014년 9월 기준 Bt살충제를 비롯하여 활성성분등록 기준 104여개, 제품 수 3,335개, 연생산량 13만 톤, 매출액 30억 위안, 연간 사용면적 4억 무(1무=200평)이다. 그 중 미생물농약 27개(제품 수 376개), 식물원농약 31개(제품 수 373개), 단백과당류 7개, 생물화학농약 21개(제품 수 437개), 농용항생제 15개(제품 수 2,055개), 식물백신 9개(제품 수 92개), 천적생물 2개로, 전체 농약의 약 10%를 차지하고 있다. 중국에는 90여개의 연구소, 대학에서 미생물농약을 개발하고 있으며 260개의 생물농약 생산기업이 있다. 현재 생물농약의 연구개발 방향은 약제저항성을 극복하는 새로운 품종 개발, 토양을 건강하게 회복, 천적곤충과 고효율 미생물 균주 이용, 곤충 정보전달 물질 이용 성유인제 개발, 대사산물의 생합성 기술 등이다. ʻ녹색식보(綠色植保)ʼ를 위해 2014년 3월 22일 중국농업과학원 식물보호연구소를 중심으로 149개 기관이 이사회회원으로 산학연관 연맹을 결성하였는데, 이는 중국내 생물농약 생산연구개발기관의 50%이상이고 총생산의 40%를 차지한다. ʻ식량안전ʼ, ʻ식품안전ʼ, ʻ생태환경안전ʼ 실현을 주도할 주요기관은 우한우대녹주생물유한공사, 호북생물농약공정기술연구센터, 강소성농업과학원 식물보호연구소 등이다.
중국은 세계 최대 축산대국으로 돼지의 50%를 생산하며, 가금류도 세계 1위이다. 2013년 돼지 7.15억 마리로 전년대비 2.5% 증가하였고, 2014년 1∼6월 기간은 3.52억 마리였다. 가금류 140억 마리, 가금란 2876만 톤, 우유 3,531만 톤으로, 축산은 농업총생산액의 29%를 차지하여 2013년 28,435억 위안으로 전년대비 4.5% 성장했다. 2008∼2013년 기간에 동물백신시장은 43.99억 위안에서 94.33억 위안으로 114.4% 증가했고 2015년에는 100억 위안 규모로 예상한다. 2014년 축산업은 2013년의 H7N9형 조류독감으로 많은 손실을 입었다. 동물용 백신은 가축생산성에 중요한 역할을 하며, 최근 중국은 가축 질병예방용 면역접종이 급격히 증가하고 있으며, 산양(山羊)약독화백신, 돼지 O형 구제역백신, 고병원성 조류독감백신을 비롯한 많은 종류의 백신을 생산하고 있으며 품질도 향상되었다. 2012년 <중화인민공화국 동물방역법> 제정으로 관련 연구개발 및 시장 규모가 급성장하고 있다. 2014년도 통계에 의하면 2013년 기준 가금백신 147종, 돼지백신 68종, 소양백신 31종이 시판되고 있다. 2013년 동물백신 총생산은 1,360억 도스로 94.33억 위안이고 그 중 돼지가 48.22억 위안으로 절반을 차지한다. 2008∼2014년 기간에 1류(類) 8개, 2류, 32개, 3류 107개로 총 147개의 동물백신이 비준되었다.
세계에서 가장 많은 화학비료를 사용하고 있는 중국의 생물비료시장은 다양한 작물, 지역, 토양에 적합한 유형별 고효율 생물비료제품이 필요하다. 최근 10년간 중국 생물비료 산업은 빠르게 발전하였고 2014년 생물비료 총생산은 1,000만 톤이며, 균종은 세균, 진균, 방선균, 효모 등 110종에 달한다. 그 중 미생물균제 250만 톤으로 250억 위안, 생물유기비료 750만 톤으로 75억 위안 등 총 300억 위안 규모이다. 생물비료산업은 국가식량안전을 확보하고, 농업생태계 환경을 보호하며, 농업생산성을 향상시키면서도 지속가능한 발전을 할 수 있는 전략자원산업이다. 생물비료산업은 중국의 부족한 녹색농산품 생산을 촉진시키고 현재 농업발전을 가속화하여 관련 산업에 큰 영향을 준다.
중국의 형질전환작물육종은 콩, 옥수수, 밀, 벼, 면화를 대상으로 병충해저항성 및 생산성 향상 목적으로 수행해 왔다. 2014년 육종한 형질전환 항충면화 신품종은 30개로 지금까지 모두 221개이며, 전체 재배품종의 34.8%, 재배면적의 75%를 차지하고 있다. 참고로 1990∼1991년 48만 톤 면화 생산에서 2013∼2014년 600만 톤으로 12배 증가했다. 현재 형질전환 벼 육종은 세계 수준이며 150여개의 유전자 발현시스템을 보유하고 있고, 2012년 형질전환 옥수수 품종 199개 중 76개는 안전성평가 시험을 거쳤다. 형질전환 밀은 내병성과 내한성을 강화하고 있다. 소, 돼지, 양 등을 대상으로 한 형질전환 동물도 내병성, 품질 및 생산성 향상을 목적으로 개발되고 있다. 특히 세계 최대 양모가공 및 소비 국가로 연간 40만 톤을 가공한다. 우유, 계란, 산양에서 인체에 유용한 대사물질 생산 연구개발에 중점을 두고 있다.
마. 바이오에너지, 생물제조(발효산업), 바이오환경
중국은 세계 최대의 에너지 생산 및 소비국이다. 2014년 통계에 의하면 2013년 중국에너지 총 소비량은 37.5억 톤으로 전년대비 3.7% 증가하여, 세계 1차 에너지 소비의 22.4%를 차지하고 있기에 바이오에너지의 생산에 관심이 크다. 중국에서는 지금까지도 주로 연료용 에탄올을 생산하기 위해 전분으로 고구마와 옥수수를 사용하고 있으나 식량원료자원의 제한적 특성으로 최근에는 기타 비(非)곡물을 이용하여 바이오에너지를 생산하려는 움직임도 함께 활발하다. ʻ12·5ʼ규획요강 중 바이오에너지를 6대 중점산업으로 육성한다고 명시하고 <재생가능에너지법>과 <재생가능에너지중장기발전계획>, 그리고 2014년 11월 중국국무원의 <에너지발전전략행동계획(2014∼2020)>에 따라 2020년까지 바이오에탄올 연간 1,000만 톤, 바이오디젤 연간 200만 톤 생산을 목표하고 있다. 2014년 중국 바이오에탄올 생산량은 233.2만 톤이며 원료의 80%를 옥수수로 사용하고 있다. 2013년 중국 바이오디젤 생산량은 약 100만 톤이며 시장에서의 규격은 기존 BD100, BD5에서 BD20, BD10이 추가되었다. 중국내 일반 디젤 총 소비량은 연간 1.7억 톤이다.
2012년 7월 중국 국무원이 발표한 <ʻ12·5ʼ국가전략성 신흥산업발전계획>에서 육성할 생물산업 분야를 생물의약, 생물의약공정, 생물농업, 생물제조 산업(발효산업) 4개의 구체적 방향을 제시하였다. 중국 발효산업의 주요품목으로 전통발효제품은 2011∼2013년 중국 생물발효산업은 전반적으로 양호하고 주요 제품 생산이 크게 증가하여 연평균 4.4% 성장하였다. 2013년 발효산업 주요제품 총생산량은 2,429만 톤으로 전년대비 2.7% 증가했고 총생산액은 2,780억 위안으로 전년대비 3.0% 증가했다. 그 중 효모, 아미노산, 유기산, 효소제의 성장이 돋보였다. 아미노산 400만 톤, 유기산 158만 톤, 전분당 1,225만 톤, 효소제 110만 톤 등이다. 2013년 주요제품 수출은 328만 톤으로 전년대비 13.2% 증가했다. 백주, 장유, 식초 등 생산 포함 중국 전체 발효식품기업 45,000개의 직접종사인원은 150여만 명, 관련 산업은 10,000억 위안 규모이다. 아미노산 생산은 세계 제1위 수준이며 세계 평균 성장률보다 2배의 빠른 성장을 보였다. 유기산 생산도 세계 수준이며, 전분당 생산은 주로 80%를 옥수수, 나머지를 고구마 등으로 사용하고 있다. 2013년 12월 국가발전개혁위, 재정부, 과기부와 중국과학원 연합으로 ʻ생물소재주요혁신발전공정실시방안ʼ, 2014년 6월 발전개혁위와 재정부 연합의 ʻ2014년 생물소재개발항목ʼ 등을 통하여 부가가치 높은 산업용 바이오소재를 개발 생산하는데 적극 노력하고 있다. 바이오폴리머는 PHA, PLA가 주요 생산품이다. 또한 해조류에서 생산한 섬유를 이용한 위생용품 등의 제품도 개발되었다.
2015년 10월 5중 전회에서도 강조하듯 중국은 환경보호와 오염방지 관련 대책이 현재 가장 시급한 과제 중 하나이다. 2014년 생물환경보호산업발명특허 가운데 생물환경보호 1,116항, 생물균제 6,317항, 바이오모니터링 1,874항, 설비가 174항 이었다. 가장 주목 받는 것은 생물효소제인데 식품, 사료, 세제, 의약에 이용되며 환경미생물제제인 EM도 그 중 하나이다. 2012년 <환경보호 ʻ12·5ʼ발전계획> 등 관련정책의 시행과 함께 중국 정부는 미국의 <청정에너지 및 안전법안(ACESA)>은 물론, 특히 한국의 <녹색성장기본법>, <녹색발전국가전략 및 5개년계획>, ʻ한강의 기적ʼ 등 관련 상황과 함께 한국이 2020년 세계 제7대 ʻ녹색강국ʼ을 목표로 하고 있다는 내용을 심도 있는 정책 및 홍보자료로 활용하고 있다.
3. 중국의 생명공학 투자현황
2014년 중국에서 규모 이상 생물의약기업 수는 전년대비 4.2% 증가한 6,797개로 의료기기 기업을 합하면 7,872개로 전년대비 4.68% 증가했다. 생물생화제약기업도 3.4% 증가했고, 2,000만 위안 이상 수입이 증가한 기업도 29개이다. 생물생화기업 총자산액은 2,848.2억 위안으로 16.9% 증가했다. 생물의약 주식시장에서는 IPO를 통한 자본조달이 회복되고 있어, 지난 3년간 감소추세였지만 총규모는 870.88억 위안으로 동기대비 59.1% 증가했다. 2014년의 중심 분야는 재투자로 32개 생물의약기업이 한 해 동안 365.97억 위안으로 전년대비 104.7% 증가했고, 벤처캐피탈도 84건, 97.76억 위안을 투자했다.

출처 : 서남증권, 2014
[그림 2-4-2] 중국 일정규모이상 생물의약 기업 수
(단위 : 만 위안)

출처 : 서남증권, 2014
[그림 2-4-3] 중국 생물제약기업 PE/VC 투자 금액 분석
현재 중국에서 진행 중인 국가과기공관계획, ʻ863계획ʼ, ʻ973계획ʼ, 자연과학기금, 횃불계획 등 여러 과학기술 및 산업발전계획은 모두 첨단과학기술 가운데 생명공학을 우선적 발전분야로 하고 있다. 중국과기부와 국가발전개혁위원회가 공동 설립한 북경생명과학연구소는 세계 수준의 중국 생명과학 기초분야연구를 수행 중이며, 중국과학원 광주생물의학건강연구원은 중국과학원과 산동성 정부, 광주시 정부가 공동으로 설립하여 생물의학연구 및 산업화를 촉진하고 있다. 상해시 정부 등 다른 지역에서도 지역별 대규모 생명공학 투자사업을 진행하고 있다. 북경의 중관촌 생명과학단지, 해남성 해구(海口)제약밸리, 광주(廣州)시 생물첨단기술산업화시범기지, 그리고 중국 최대 규모의 3대 생물산업기지(심천, 석가장, 장춘) 및 난링시 영장류실험동물기지와 함께, 중국 최대 규모인 빈해과학단지에서도 생물산업을 중점 육성하는 계획을 실현시키고자 노력하고 있다. 또한 북경 생명공학학술센터에는 500여 연구팀과 100여개 바이오기업을 동시에 수용할 수 있는 아시아 최대 규모의 바이오산업 인큐베이터가 있다. 현재 북경(北京), 곤명(昆明), 석가장(石家庄), 통화(通化), 장춘(長春), 무한(武漢), 장사(長沙), 항주(抗州), 서안(西安), 제남(濟南), 덕주(德州) 등 23개 국가생물산업기지에서 연구개발, 기술이전 및 사업화가 활발히 진행되고 있다.
2013년 10월 중국 국무원이 민간자본과 해외자본에 의료시장을 대폭 개방하여 바이오헬스산업을 획기적으로 육성하기 위한 ʻ건강서비스산업 발전 촉진에 관한 의견ʼ을 발표했다. 여기에 언급된 건강서비스산업은 의료와 건강관리, 건강보험 등을 포괄하는 것으로 의약품과 의료기기, 보건용품, 건강식품 등 제조업 기반과도 연관된다. 따라서 향후 한국, 미국, 유럽 등의 선진의료기관들의 중국진출이 크게 늘어날 수 있을 것으로 예상된다. 세부 실행 방안은 의료시장 민간자본에 개방(명시되지 않은 모든 분야 진출 가능, 해외자본도 국내자본과 동일하게 적용, 각종 심사권한 하부기관으로 이양), 공공의료 민간에 허용(비영리 의료기관 가격통제 철폐, 첨단신기술 도입 시 세제혜택 부여, 전기 가스 수도 난방 등 가격 우대), 금융서비스 강화(건강서비스산업에 맞는 금융상품 개발, 상장과 융자, 채권발행 적극지원, 금융과 산업자본을 통한 건강산업기금 조성) 등으로 구성되어 있다. 중국은 2013년 11월 중국공산당 18기 3중 전회에서 ʻ중국의 꿈(中國夢)ʼ을 실현하는 향후 10년의 청사진 제시에 이어, 2015년 10월 26∼29일 개최된 18기 5중 전회에서 ʻ신창타이(新常態, 뉴노멀 new normal)ʼ에 부합하는 미래 성장 동력 분야로 IT등과 함께 생명공학 육성 발전을 통하여 ʻ샤오캉(小康)사회ʼ를 당초 계획대로 차질 없이 실현하기로 결정하였다. 샤오캉 사회란 전 국민이 기본적 복지를 누리는 중산층 사회를 말하는데, 중국 공산당은 2020년까지 국민소득 1만 2,000달러를 달성하고, 공산당 창건 100주년이 되는 2021년 샤오캉 사회를 실현한다는 목표를 세워 놓고 있다.
2014년 한 해 동안 중국에서는 365만 개(하루에 만 개꼴)의 기업이 새롭게 설립되었고, 2015년 중앙정부 차원의 ʻ대중창업(大衆創業)ʼ 슬로건 하에 많은 바이오기업도 창업하였다. 2015년 8월 기준 최근 5년간 중국 귀국 유학생 수는 131만 명을 넘어 누적 귀국 유학생 수의 72.5%를 차지했는데, 귀국 유학생의 가장 큰 목적은 창업이다. 현재 유학생 창업단지 305개, 창업단지 입주기업 3만개에서 5만 명이 넘는 창업 사업자가 있다. 중국은 R&D 예산 규모가 세계 2위로 올라섰고 증가율도 경제성장률보다 높다. 민간부문의 R&D 투자가 더욱 증가되고 보다 많은 과학자가 강한 유동성을 갖추고 있다. 지금까지 ʻ백인계획ʼ을 통해 2,212명의 국내우수인력을 지원하고, ʻ천인계획ʼ을 통해 해외 고급인력 566명을 유치했고, ʻ만인계획ʼ을 통해 6명의 뛰어난 인물을 선출했다.
중국은 2020년에 50세 이상의 노령인구가 3억 명, 2030년에는 10억 명에 달할 것으로 예상되며, 지난 10년간 의료수혜율이 13%에서 95%로, 병원병상수도 매년 18% 증가하여 생물의약산업의 발전이 크게 기대된다. 최근 세계의 유수 다국적 기업들은 중국을 ʻ글로벌 공장ʼ에서 ʻ글로벌 연구중심ʼ, 그리고 ʻ글로벌 시장ʼ으로 인식을 전환하면서 중국은 세계 신약개발의 전진기지로 변모를 기대하고 있다. 따라서 농업 및 의약 생명공학 기술과 관련 산업분야에 있어 세계 최고의 생명공학 강국으로 성장하고자 하는 중국의 원대한 목표는 앞으로 생명공학 분야에 대한 중국 정부의 관심과 투자가 계속 획기적으로 증대될 것을 명확하게 보여준다.
[표 2-4-4] 2009∼2013년 중국 7대 전략산업별 발명특허 등록건수 (단위: 건)
|
|
2009년 |
2010년 |
2011년 |
2012년 |
2013년 |
|
에너지 절감 환경보호 |
12,532 |
12,020 |
16,069 |
21,881 |
23,170 |
|
차세대 IT |
26,773 |
23,833 |
25,550 |
31,948 |
27,402 |
|
바이오 |
12,633 |
14,206 |
20,113 |
26,927 |
30,167 |
|
첨단장치 제조 |
3,533 |
3,744 |
4,774 |
5,999 |
5,974 |
|
신에너지 |
1,947 |
2,223 |
3,585 |
5,529 |
6,018 |
|
자동차 |
7,589 |
7,575 |
10,692 |
14,773 |
14,935 |
|
신에너지자동차 |
695 |
735 |
977 |
1,464 |
1,722 |
출처 : 특허통계보고 2015년제11기, 중국 국가지식재산권규획발전사
[표 2-4-5] 2013년 7대 전략적 신흥산업별 내국인-외국인 발명특허 등록 현황
|
전략적 신흥산업 |
2013년 발명특허 등록건수 (건) |
|
|
내국인 |
외국인 |
|
|
에너지 절감 환경보호 |
15,833 |
7,337 |
|
차세대 IT |
13,648 |
13,754 |
|
바이오 |
21,410 |
8,757 |
|
첨단장치 제조 |
3,601 |
2,373 |
|
신에너지 |
4,233 |
1,785 |
|
자동차 |
9,230 |
5,705 |
|
신에너지자동차 |
774 |
948 |
출처 : 특허통계보고 2015년제11기, 중국 국가지식재산권규획발전사
[표 2-4-6] 2013년 7대 전략적 신흥산업별 외국인 발명특허 등록건수 Top5 국가
|
순위 |
에너지절감 환경보호 |
차세대 IT |
바이오 |
첨단장비 제조 |
신에너지 |
신소재 |
신에너지 자동차 |
|
1 |
일본 |
일본 |
미국 |
미국 |
미국 |
일본 |
일본 |
|
2 |
미국 |
미국 |
일본 |
일본 |
일본 |
미국 |
미국 |
|
3 |
독일 |
한국 |
독일 |
독일 |
독일 |
독일 |
한국 |
|
4 |
한국 |
독일 |
스위스 |
프랑스 |
한국 |
한국 |
독일 |
|
5 |
프랑스 |
네덜란드 |
네덜란드 |
한국 |
프랑스 |
프랑스 |
프랑스 |
출처 : 특허통계보고 2015년제11기, 중국 국가지식재산권규획발전사

[그림 2-4-4] 2013년 7대 전략신흥산업 내국인·외국인 발명특허 비율

[그림 2-4-5] 2013년 전략적 신흥산업 외국인 발명특허 등록건수 (단위: 건)
[표 2-4-7] 2013년 중국의약공업 주요 통계
|
구분 |
매출액 (억 위안) |
전년비 (%) |
총이익 (억 위안) |
전년비 (%) |
이익률 (%) |
전년비 (%) |
|
화학약품원료약 |
3,819.9 |
13.7 |
284.7 |
1.4 |
7.5 |
-0.6 |
|
화학약품제제 |
5,730.9 |
15.8 |
639.4 |
16.4 |
11.2 |
-0.3 |
|
중약음편(中葯飮片) |
1,259.3 |
26.9 |
94.2 |
30.9 |
7.5 |
-0.7 |
|
중성약(中成葯) |
5,065.0 |
21.1 |
538.4 |
21.4 |
10.6 |
-1.1 |
|
생물약품 |
2,381.4 |
17.5 |
282.4 |
13.2 |
11.9 |
-1.1 |
|
의료기기설비 |
1,888.6 |
17.2 |
199.2 |
13.2 |
10.5 |
-1.3 |
|
위생재료/의약용품 |
1,398.2 |
21.8 |
16.5 |
23.5 |
10.2 |
-0.4 |
|
제약전용설비 |
138.2 |
22.3 |
16.5 |
19.7 |
11.9 |
-0.1 |
|
합계 |
21,681.6 |
17.9 |
2,197.0 |
17.6 |
10.1 |
-0.7 |
출처 : 중국 국가통계국 2013년 통계속보
[표 2-4-8] 2013년 동물백신 판매량 및 매출액
|
동물종류 |
판매량 (억 도스) |
매출액 (억 위안) |
매출액 비중 (%) |
|
돼지용 |
91.68 |
48.22 |
51.12 |
|
가금용 |
1,242.2 |
35.74 |
37.89 |
|
소/양용 |
21.09 |
8.11 |
8.6 |
|
토끼용 |
1.74 |
0.2 |
0.21 |
|
애완 및 기타 |
4.1 |
2.06 |
2.18 |
|
합계 |
1,360.81 |
94.33 |
100 |
출처: 2013년 수의약산업발전보고, 중국수의약협회, 2014
[표 2-4-9] 한·중 주요 과학기술통계지표 비교
|
구분 |
단위 |
한국 |
중국 |
비고 |
||
|
인재 양성 / 확보 |
대학원졸업자 |
명 |
44,652(’14년) |
535,863(’14년) |
|
|
|
이공계졸업자 |
명 |
26,368(’14년) |
294,841(’14년) |
의약계열 포함, 농학계열 미포함 |
||
|
비중(%) |
59.1 |
55.0 |
||||
|
세계 100위권 대학 |
개 |
3 |
4 |
QS평가(’15년) |
||
|
활용 |
연구원 수 |
연구개발인력수 |
천명 |
410.3(’13년) |
3,532.8(’13년) |
|
|
연구원 수(A) |
천명 |
321.84(’13년) |
1,484.04(’13년) |
|
||
|
경제활동인구 천명당 연구원 수 |
명 |
12.4(’13년) |
1.8(’12년) |
|
||
|
박사비율 |
% |
21.7(’13년) |
5.7(’13년) |
|
||
|
연구 개발비 |
연구개발비(B) |
백만 US달러 |
54,164 (’13년) |
191,205 (’13년, 세계2위) |
|
|
|
GDP대비 비중 |
% |
4.15(’13년) |
2.01(’13년) |
|
||
|
정부 : 민간 |
- |
24.0:75.7 |
21.1:74.6 |
외국재원 미포함 |
||
|
기초 : 응용 : 개발 |
- |
18:19:63 (’13년) |
4.7:10.7:84.6 (’13년) |
|
||
|
연구원 1인당 연구개발비 |
천 US달러 |
168 (’13년) |
129 (’13년) |
B/A |
||
|
성과 |
논문 |
SCI논문 발표수 (’13년) |
편 |
51,051 (세계 12위) |
219,281 (세계 2위) |
미국 1위 일본 5위 |
|
연구원 백명당 SCI논문 발표수(’13년) |
편 |
16.18 (37위) |
15.62 (39위) |
스위스 1위 (108.68편) |
||
|
SCI논문 1편당 평균 피인용 횟수(’13년) |
회 |
0.44 (’13년) |
0.48 (’13년) |
스위스 1위(1.01) 세계평균 0.53회 |
||
|
특허 |
삼극특허(’13년) |
건 |
3,154 (세계 4위) |
1,785 |
일본 1위 |
|
|
PCT 출원(’13년) |
건 |
11,438 |
19,757 |
|
||
|
BT분야 PCT출원 |
건 |
512 |
485 |
미국1위(4,729건) |
||
|
기술무역 수지 |
백만 US달러 |
△5,193 (’13년) |
△1,494 (’12년) |
|
||
출처: 중국과학기술통계연감2014, 한중과학기술협력센터, 2015
2) 일본의 과학기술 진흥을 위한 기본적인 정책의 조사심의, 예산 배분 방침 등 과학기술 진흥에 관한 중요사항의 조사·심의 수행기관
3) 일본의료개발전략센터(CRDS), 주요국의 연구개발전략, 2015
4)
5) 후생노동성, 재생의료 등의 안전성 확보 등에 관한 법률에 대해서
(http://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/iryou/saisei_iryou/)



1. 생명공학 연구개발 지원 정책
가. 개요
세계 미래학회 ʻ20대 미래예측분야ʼ 및 유엔 ʻ미래보고서ʼ 등과 같은 ʻ미래 예측보고서ʼ에 따르면 건강‧의료‧품 등 BT 관련 이슈가 중요하게 부각되고 있다. 또한 OECD는 2030년경에 BT와 타 기술이 융합하여 글로벌 경제에 대규모 변화를 가져오는 바이오경제시대로 진입할 것으로 전망하고 있으며, 바이오 및 의약‧치료기술은 글로벌 경제의 중심으로 발전하고 있다. 세계 의약품 시장은 500대 제약회사 및 바이오 회사 기준 7,430억 불 규모로 추정되고 있으며, 연평균 4.8%로 성장하여 향후 2020년 9,870억 원 규모에 이를 것으로 전망된다.
우리나라도 박근혜 정부의 국정과제인 창조경제 실현계획(2013.6.), 제3차 과학기술기본계획(2013.7.), 경제혁신 3개년 계획(2014.1.), 성장과 복지를 위한 바이오 미래전략(2014.7.) 등을 통해 BT관련 육성 및 지원 정책을 다수 포함하여 추진하고 있으며, ICT와 같이 다른 분야와의 융복합 등을 통한 신산업 및 일자리 창출에 기여할 것으로 전망하고 있다.

출처 : Burrill-KB Investment PPT, Oxford Bioscience Partners(2012) 수정
[그림 3-1-1] 주력산업군 변화와 GDP 성장률 추이
정부 차원의 생명공학육성의 시작은 1982년 과학기술부에서 생명공학을 핵심전략기술로 선정하여 특정연구개발사업으로 지원하면서부터이다. 그 이후 1983년 「유전공학육성법」(現 「생명공학육성법」)을 제정하여 정부의 생명공학육성‧지원을 위한 법적 기반을 마련하였고, 1985년 동법을 기반으로 한국과학기술연구원(KIST) 부설로 ʻʻ유전공학센터ʼʼ(現 ʻʻ한국생명공학연구원ʼʼ)를 설립하여 생명공학을 본격 육성‧지원하였다.
1994년 제1차 생명공학육성기본계획을 통하여 창의적 연구개발의 저변을 확대하고 제도적 뒷받침을 마련하는 등 연구기반을 조성하였고, 지난 2007년에는 제2차 생명공학육성기본계획(2007~2016)을 수립하여 2012년까지 원천기술 확보 및 산업화로 가기 위한 인프라 구축을 추진하였다. 또한 뇌연구촉진기본계획 (2008~2017), 줄기세포연구활성화방안(2010~2015), 생명연구자원관리기본계획 (2011~2020) 등 세부 연구 분야별 기본계획 등을 수립하여 육성‧지원하고 있다.
2013년 새정부 출범과 함께 미래창조과학부는 그 소관영역이 확대됨에 따라 기초연구부터 사업화까지 연계된 전주기 차원의 지원 전략을 수립하고 연구개발 프로그램을 추진하고 있다.
기초연구사업은 「기초연구진흥 및 기술개발 지원에 관한 법률」 제6조, 「국가연구개발사업의 관리 등에 관한 규정」 및 「미래창조과학부 소관 과학기술분야 연구개발사업 처리규정」에 근거하여 추진하고 있으며, 대상사업으로 크게 개인연구지원, 집단연구육성, 기초연구기반구축으로 나눌 수 있다.
개인연구지원은 연구자의 역량단계별 지원을 통해 창의적 기초연구능력을 배양하고, 연구를 심화․발전시켜 나가도록 지원하는 사업으로 신진연구자지원사업 (신진연구, 여성과학자지원, 신진멘토링(舊 커리어과학자)), 중견연구자지원사업 (핵심연구, 도약연구), 리더연구자지원사업(창의연구, 국가과학자)을 추진하고 있다.
집단연구육성은 국내 대학 등에 산재되어 있는 우수 연구인력을 특정분야별로 조직화하여 집중 지원함으로써 고급인력 양성 및 기초연구 활성화를 도모하고자 하며, 선도연구센터지원사업(이학분야(SRC), 공학분야(ERC), 기초의과학분야(MRC), 학제간융합분야(CRC)), 기초연구실지원사업(BRL), 글로벌연구실지원사업(GRL)이 있다.
기초연구기반구축은 전문연구정보 및 실험데이터 제공, 연구 인프라 지원, 연구장비 전문인력 양성 등 기초연구 활성화를 위한 기반구축을 그 내용으로 하며 전문연구정보활용사업, 기초연구실험데이터글로벌허브구축사업, 연구장비엔지니어 양성사업을 수행하고 있다.
대형국책사업으로 2010년부터 추진된 글로벌프론티어 사업이 있으며 미래부의 대표적인 대형․중장기 국가연구개발사업이다. 이 사업은 신산업과 일자리를 창출하는 창조경제 구현을 위한 국가 대표적 창조․선도형 R&D 사업 육성의 필요로, 미래를 선도하는 기술분야에서 세계 수준의 원천기술개발로 새로운 시장을 개척하고 창조경제의 견인을 목적으로 한다. G7프로젝트(1992~2002년), 21세기 프론티어(1999~2013년), 글로벌프론티어 사업(2010~2022년)순으로 진행되고 있다.
2010년 사업에 착수하여 2015년 현재 총 10개 연구단을 선정‧지원하고 있다. 2010년 의약바이오 컨버전스 연구단, 인체감응 솔루션, 차세대 바이오매스 연구단, 2011년 멀티스케일 에너지시스템, 나노기반 소프트 일렉트로닉스, 3차원 스마트 IT융합 시스템, 바이오 설계 및 합성 연구단, 2013년 하이브리드 인터페이스미래소재, 바이오나노 헬스가드 연구단, 2014년 파동에너지 극한제어 연구단을 선정‧지원하고 있다.
나. 연구개발 지원 체제
(1) 법적, 제도적 기반
법적 성과로는 2009년 생명연구자원에 대한 국가차원의 관리 및 지원체계를 구축하고자 「생명연구자원의 확보‧관리 및 활용에 관한 법률」을 제정하였고 2006년 시행한 「연구실 안전환경 조성에 관한 법률」에 있어서 미비점을 보완하여 개정을 추진하였다. 그리고 2009년 국가과학기술위원회 안건 상정을 통한 원천연구 개념 및 비중 산정(안)을 마련하고 줄기세포연구 활성화 방안을 마련하였다.
또한 나노기술발전시행계획, 국가융합기술발전시행계획, 생명공학육성시행계획, 줄기세포연구시행계획, 생명연구자원관리시행계획 수립 등 범부처 시행계획을 통한 제도적 지원 체계를 갖추고 있다. 2011년에는 범부처 공동으로 지난 2006년 수립된 제2차 생명공학육성기본계획(Bio-Vision 2016, 2007~2016) 2단계 계획을 수립하였다.
(가) 생명공학육성법
생명공학육성법은 생명공학연구의 기반을 조성하여 생명공학을 보다 효율적으로 육성‧발전시키고 그 개발기술의 산업화를 촉진하여 국민경제의 건전한 발전에 기여하게 함을 목적한다. 이 법은 1983년 「유전공학육성법」으로 제정되었으며 1995년 유전공학에서 생명공학으로 확대하는 내용의 제3차 개정을 통하여 「생명공학육성법」으로 개명하였다.
주요내용은 생명공학육성기본계획 및 연차별 시행계획의 수립, 생명공학종합정책 심의회 설치‧운영, 생명공학의 산업적 응용촉진에 대한 지원, 생명공학 육성시책의 강구 등이다.
(나) 뇌연구촉진법
뇌연구촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성‧발전시키고 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 기여하기 위하여 1998년 6월 『뇌연구촉진법』을 제정‧운영하고 있다.
주요 내용은 뇌연구촉진기본계획 및 연차별 시행계획의 수립, 뇌연구실무추진위원회의 구성‧운영, 뇌연구 투자의 확대, 4개 부처(미래창조과학부, 교육부, 산업통산자원부, 보건복지부)의 뇌연구촉진시책 강구 등이다. 또한, 제2차 뇌연구촉진2단계 기본계획(2013~2017)을 수립하여 뇌연구 실용화 촉진 연구개발을 강화하고 있다.
(다) 생명공학종합정책심의회
생명공학육성기본계획의 수립과 그 집행 및 조정에 관한 업무를 관장하기 위하여 미래창조과학부장관 소속하에 생명공학종합정책심의회가 있으며, ① 생명공학의 기초연구 및 산업적 응용연구의 육성에 관한 계획의 수립 및 그 집행의 조정, ② 생명공학의 연구 및 기술개발에 관한 기본계획의 수립과 이에 따른 중요 정책의 수립 및 그 집행의 조정, ③ 생명공학분야 인력개발에 관한 종합계획과 이에 따른 중요 정책, 인력활용지침의 수립 및 그 집행의 조정, ④ 생명공학의 연구 및 이와 관련된 산업기술인력의 개발교류와 해외과학기술자의 활용에 관한 계획의 수립 및 그 집행의 조정, ⑤ 유전자원의 이용과 보전을 위한 연구개발계획의 수립 및 그 집행의 조정 등의 사항을 심의‧결정하는 기능을 가지고 있다.
(2) 한국생명공학연구원
미래창조과학부는 「과학기술분야 정부출연연구기관 등의 설립‧운영 및 육성에 관한 법률」 제8조에 근거하여 1985년 2월 30명의 연구원으로 KIST 부설 유전공학센터를 설립하여 유전공학연구를 본격적으로 지원 육성하였다. 이후 1990년 12월 KIST 부설 유전공학연구소로 명칭을 변경하였고, 유전공학육성법이 생명공학육성법으로 개정되어 1995년 3월 KIST 부설 생명공학연구소로 명칭을 변경하고, 1999년 5월 기초기술연구회 산하 생명공학연구소로 독립하였다. 2001년 1월 기초기술연구회 산하 한국생명공학연구원으로 승격하여 현재는 정부출연연구기관으로 미래창조과학부에 소속되어 있다. 한국생명공학연구원은 생명과학기술 분야의 연구개발 및 공공인프라 구축․운영을 통해 국가 생명과학기술, 산업발전 및 국가 사회현안 해결에 기여하며 첨단 생명과학기술분야 원천기술 개발․보급 및 바이오 경제를 견인하며 국내외 생명과학 연구를 위한 공공 인프라 지원을 그 기능으로 한다.
현재(2015.11.) 대덕본원 외에 충북 오창분원, 전북분원(2분원, 5연구소, 4본부, 1총괄단, 1센터, 2지원본부)을 두고 있으며, 인력은 2015년 기준 정규직원 총 385명이고 총 예산은 160,624백만 원이다.
(3) 생명공학육성기본계획 및 시행계획 수립
(가) 생명공학육성기본계획
미래창조과학부는 「생명공학육성법」 제4조에 근거하여 생명공학 분야의 효율적인 연구개발을 촉진하기 위하여 1994년부터 범국가적인 ʻʻ생명공학육성기본계획(Biotech 2000, 1994~2006년)ʼʼ을 수립하여 시행하고 있다. 지난 2006년에 제2차 생명공학육성기본계획(Bio-Vision2016, 2007~2016년)을 수립하여 시행하고 있으며 2011년에는 제2차 생명공학육성기본계획 2단계 계획(2012~2016)을 수립하였다.
동 계획은 미래창조과학부 주관으로 교육부, 농림축산식품부, 산업통상자원부, 보건복지부, 환경부, 해양수산부 등 7개 부처가 공동 추진하고 있다.
(나) 생명공학육성 연도별 시행계획
미래창조과학부는 『생명공학육성법』 제5조에 근거하여 관계부처와 합동으로 생명공학육성기본계획에 따른 연도별 ʻʻ생명공학육성 연도별 시행계획ʼʼ을 매년 수립하여 시행하고 있다. 2014년도 생명공학분야 정부 투자액은 총 2조 3,031억 원으로 전년계획(2조 5,284억원) 대비 약 8.9% 감소하였다. 생명과학, 보건의료, 농수축산식품, 산업공정/환경․해양, 바이오융합의 연구개발과 공공 R&D 인프라 구축을 위한 예산 확대 등 시설 및 기반구축, 인력양성에 대한 지원을 추진하고 있다. 부처별 연구개발 투자실적 및 계획은 아래와 같다.
[표 3-1-1] 부처별 연구개발 투자실적 및 계획
(단위 : 백만원, %)
|
구 분 |
ʼ15년 투자계획 |
ʼ14년 계획 (B) |
ʼ14년 실적 (C) |
달성율 (%) (C/B) |
||||
|
연구 개발 |
인프라 |
인력 양성 |
합계 (A) |
증가율 (%) ((A-B)/B) |
||||
|
미래창조과학부 |
875,260 |
92,413 |
|
967,673 |
11.5% |
867,704 |
931,181 |
107.3% |
|
교 육 부 |
128,839 |
|
134,113 |
262,952 |
89.3% |
138,923 |
254,799 |
183.4% |
|
농림축산식품부 |
329,286 |
|
|
329,286 |
11.7% |
294,774 |
331,175 |
112.3% |
|
산업통상자원부 |
192,008 |
31,183 |
2,049 |
225,240 |
△40.1% |
376,044 |
233,272 |
62% |
|
보 건 복 지 부 |
413,553 |
13,733 |
|
427,286 |
39.3% |
306,732 |
406,166 |
132.4% |
|
환 경 부 |
30,868 |
387 |
|
31,255 |
△13.7% |
36,226 |
41,221 |
113.8% |
|
해 양 수 산 부 |
70,550 |
56,068 |
|
126,618 |
85.1% |
68,404 |
97,025 |
141.8% |
|
식품의약품안전처 |
9,335 |
736 |
|
10,071 |
23.4% |
8,164 |
8,249 |
101% |
|
총 계 |
2,049,699 |
194,520 |
136,162 |
2,380,381 |
100% |
2,096,971 |
2,303,088 |
109.8% |
※ 2013.3., 이전 보건복지부의 외청이었던 식품의약품안전처 포함
출처 : 2015년 생명공학육성시행계획, 2015
다. BT 주요 분야별 투자전략
미래창조과학부는 창조경제 실현이라는 미래부의 특성에 맞도록 BT분야에 대한 R&D 지원체계를 마련하고 그에 맞는 산업화 및 투자전략을 수립하여 추진하고 있으며, 특히 뇌과학, 유전체, 줄기세포 등 기초 의․생명과학 및 보건의료 관련 원천기술 확보 및 실용화 연계 분야를 발굴․지원하고 있다.
미래부는 국가 생명공학육성 추진체계 혁신, 연구개발 일류화 기반확충, 바이오산업 발전가속화 및 글로벌화, 법/제도 정비 및 국민 수용성제고 등 4개의 전략을 중점적으로 추진하고 있으며. 2016년도에는 유망분야 실용화 연계기술 투자로 경제․산업적 성과창출, 국가 위기대응, 국민 복지증진 등 정부 R&D의 공공성․책임성 강화, 인프라 활용도 제고, 정부-민간 협력 활성화로 상생적 연구 생태계를 조성하고자 한다.
(1) 신약개발
2013년 신약개발분야의 정부 R&D 투자는 총 3,120억원 규모로, 미래부, 산업부, 복지부 등을 중심으로 인프라‧임상시험 등에 집중 지원되고 있다.
미래부는 기초연구부터 임상단계까지 단절 없는 R&D 연계로 사업화 성공을 제고하고 신약개발의 우수 역량과 유전체, 줄기세포, 뇌연구 분야의 성과를 결합하여 새로운 영역을 개척하는데 지원하고 있다. 또한 신약개발 관련기관의 산학협력체계를 강화하는 한편 복제약, 개량신약 등의 산업화 경쟁력을 높이기 위해 시장 수요를 분석하고, 이를 통해 특허 만료제품에 대한 선택과 집중으로 기술개발 지원을 강화할 계획이다.
또한 신약개발의 경우 기존 신약개발 기술에 더해 유전체, 줄기세포 등 기술 발전을 토대로 혁신적인 의약품 및 맞춤형 치료제 개발이 활성화 되고 있으며 2016년도에는 시장수요를 반영한 기초․임상 가교성 R&D 및 국민체감형 실용화 기술, 미래 유망기술 지원을 강화할 예정이다.
(2) 줄기세포
2011년 미래부(舊. 교과부)와 복지부가 공동 추진한 ʻ줄기세포 R&D 활성화 및 산업경쟁력 확보방안ʼ을 계기로 2012년 예산이 대폭 증액되었으며(총 1,000억여 원, 2011년 대비 67.1%상승) 2014년 총 투자액은 약 1,151억 원(2013년 대비 6.6% 증가)으로 영국, 일본 등 주요 선진국과 유사한 규모의 국내 투자가 이뤄지고 있다.
미래부는 단기적으로 기 개발된 ʻ성체줄기세포 치료제ʼ의 효능강화와 개발비용 절감을 지원하고, ʻ희귀난치질환ʼ에 대한 세포치료제의 선도적 개발을 추진할 예정이다. 또 줄기세포기술과 질환치료기술이 연계된 ʻ세포유전자치료제ʼ 개발 및 줄기세포를 활용한 신약개발의 효율성 증대를 제고하고, 기초‧원천 R&D 우수성과에 대한 부처간 연계도 추진할 예정이다. 중장기적으로 희귀 및 난치병 치료를 위하여 줄기세포기반 차세대 유전자 치료제 개발을 위하여 유도만능줄기세포(iPS)기술 및 ʻ직접교차분화(Direct Conversion)ʼ 등 신기술분야의 원천기술을 확보할 수 있도록 투자를 확대할 계획이다.
줄기세포의 경우 신기술 개발의 가속으로 줄기세포의 활용범위가 유전자 치료, 조직재생, 신약개발 스크리닝 등 다양한 분야로 확대되고 있는 추세이며, 2016년에는 실용화 촉진을 위하여 중개․임상연구의 목적성 강화 및 산업화 기술 확보와 미래유망기술 선점을 위한 원천연구를 지원할 예정이다.
(3) 뇌연구
뇌연구분야의 R&D 정부 투자는 미래부를 중심으로 뇌신경질환과 뇌신경생물 분야에 집중되어 투자되고 있으며 2014년도 투자액은 약 1,045억 원이다. 미래부는 제2차 뇌연구촉진 2단계 기본계획(2013~2017)에 따른 뇌과학 4대 분야 융합기술을 개발 추진하며, 특히 ʻ생애단계별 8대 건강문제 해결ʼ 과제 및 ʻ국가재난 대책ʼ 과제를 우선 추진 할 계획이다. 또한 뇌연구 네트워크 강화를 통한 국가 전략 기획 및 개별 연구능력을 극대화하고 국가 뇌연구 인프라 구축 및 뇌연구 효율화 시스템을 구축하며 뇌연구 컨트롤 타워 출연(연) 특성화 운영(안)을 작성하여 한국뇌연구원(KBRI), 기초과학연구원(IBS), 한국과학기술연구원(KIST) 등 출연(연)의 기관 특성화 및 협력체계 추진 역할에 맞는 뇌연구를 추진할 계획이다.
(4) 유전체 연구
2013년 유전체분야 정부 R&D투자는 총 803억원 규모로 미래부는 ʻ포스트게놈 다부처 유전체사업ʼ(5개 부처 공동 사업)을 착수(2014)하였으며, 2014년도 462억 원, 2015년도 480억 원을 투입하였다. 이를 계기로 맞춤의료(예방‧진단‧치료) 서비스를 제공하기 위하여 질병 조기진단 및 치료 등을 위한 유전체 원천기술 개발, 유전체 정보 분석 기술개발, 인력양성 및 국제협력 등 인프라 구축에 주력하고, 또한 정부 R&D사업으로 생산된 유전체 정보를 국가생명연구자원정보센터(KOBIC)에 기탁할 수 있는 체계를 구축하여 유전체 DB 구축․관리의 중심기관으로 운영할 계획이다.
2016년 투자방향은 기초연구성과를 토대로 가시적인 성과창출을 위해 임상응용 및 IT 융합 R&BD분야 지원을 강화하여 유전자치료제의 글로벌 시장 진출을 가속화하고 임상적용이 가능한 진단법 및 치료법을 발굴, 환자별 맞춤의료 구현을 통한 치료효과 증대로 국민건강 증진에 기여하고자 한다.
(5) 차세대 의료기반기술
차세대 의료기반기술(의료기기+의료서비스)은 미래부, 복지부, 산업부 등 5개 부처‧청을 중심으로 2013년 4,115억원이 투자된 분야이다. 미래부는 차세대 의료기반기술에 단기적으로는 BT-ICT 융합을 기반으로 한 스마트 의료기술 개발 및 중장기적으로는 개발에 장시간이 소요되나 고부가가치 창출이 가능한 분자영상진단장비‧의료용 로봇 등에 필요한 원천기술 개발, 노령화와 만성질환 확산 추세에 부합한 고혈압 치료 관련기기, MRI핵심 부품 및 영상화 기술 국산화를 통한 초고자장 진단기기 개발에 집중 지원하고, 또한 기술이전 및 사업화 활성화를 위하여 R&D 수행 주체 간 ʻOpen Innovation 플랫폼ʼ 구축을 통한 신산업 창출 지원을 위한 산업화 연계체계를 마련할 계획이다.
차세대 의료기기의 경우 진단․처방 등 의료서비스의 분산화로 현장적용 고감도 다중 분자진단기술, 맞춤형 치료기술(동반진단치료기기)의 수요가 증가하고 있으며, 2016년 의료기기의 투자방향은 의료현장의 수요를 반영한 시장창출 및 실용화기반기술 및 국민체감도 향상을 위한 생활-복지기술 지원 강화이다
(6) 생명연구자원
생명연구자원 분야는 2014년 1,086.1억 원(전년대비 31.5% 감소)의 정부 예산이 투자되었으며 생명연구자원의 확보‧관리 및 활용에 관한 법률(제6조)에 따라 각 부처별 역할이 구분되어 범부처적으로 추진되고 있는 분야이다.
미래부는 생명연구자원의 확보․관리 및 활용체계 조성, 생명연구자원의 통합정보시스템 구축 및 통계 유지, 생명연구자원의 관리 및 활용을 위한 정보통신기술의 확보를 지원하는 것을 기본시책으로 한다. 국가 유용 생명연구자원 활용 체계 및 나고야 의정서 지원체계 강화를 비전으로 지속 가능한 유용 생명연구자원의 활용 체계 강화, 고부가가치 핵심 생명연구자원의 전략적 확보, 나고야의정서 대응방안 마련을 통한 생명연구자원 주권 강화, 생명연구자원관리법/시행령 제정을 통한 법/제도 정비, 범부처적 생명정보데이터 종합관리시스템 고도화를 목표로 한다.
라. 추진방향 및 발전과제
최근 고령화‧전염병 등 인류 공통의 난제를 극복하기 위한 해결책 및 경제성장의 핵심 열쇠로서 BT 분야의 중요성이 대두되고 있다. 이러한 가운데 바이오는 기아 및 질병, 에너지 문제 등 인류 생존과 더불어 글로벌 경제위기의 출구로서 핵심적인 역할 수행이 기대되는 분야이며 타 기술과의 융합이 활발해 지면서 IT, 에너지‧환경, 화학 등과의 융합이 가능한 응용분야로 확대되는 추세이다. 또한 앞서 말한바와 같이 2013년 새롭게 출범한 박근혜 정부에서도 국정과제, 창조경제 실현계획, 제3차 과학기술기본계획 등에 BT 관련 정책이 다수 포함되면서 그 중요성이 더욱 강조되고 있다.
이러한 흐름에 맞추어 국가 생명공학 분야의 주무부처인 미래창조과학부에서는 생명공학분야의 미래 메가트랜드를 반영한 핵심 원천기술 확보 및 선진화 기반 확충에 적극적 투자와 지원을 추진하여 곧 다가올 바이오 경제시대를 준비하고 있다. 범부처 종합계획인 제2차 생명공학육성기본계획 2단계 계획(2012~2016)에 맞추어 산업화로 가기 위한 기반 확보를 탄탄히 하는 것에 초점을 두고 있다. 또한 앞서 소개한 신약개발을 포함한 유전체, 뇌과학, 줄기세포, 차세대 의료기반 기술에 대한 중점 지원에 역점을 두고 있다.
BT분야 산업화 성과 창출을 위한 기술사업화 전략 마련에도 힘쓰고 있다. 국내 바이오 시장은 글로벌 시장보다 높은 성장률을 보이나 그 규모는 세계 시장 대비 매우 협소한 실정이다. 이러한 상황에서 의료기기 분야, 신약분야 등과 같은 정부 R&D 투자로, 가장 활발한 분야의 사업화를 활성화하는 전략과 지원 정책을 강구하는 것이 중요할 것이다.
이러한 생명공학 육성 지원 정책들이 국가 생명공학의 기틀을 확고히 하여 글로벌 경쟁력을 갖추어 풍요로운 바이오 경제 구현을 이루기를 희망한다.
2. 생명공학 산업육성 정책
가. 개요
생명공학기술(Biotechnology, BT : 바이오기술)은 생명체의 유전적인 구조를 변형하여 우리가 원하는 특별한 성질을 나타내게 하는 등 생물체의 기능과 정보를 이용한 제품 및 서비스를 창출하기 위해 필요한 기술이다. 생명공학기술은 대표적인 신생기술(Emerging Technology)로서 기술의 난이도, 복합성, 확장성 등에 있어서 기존의 여타 기술과는 많은 차이를 보이고 있다. 또한, 산업화 및 부가가치의 창출에 있어서 원천 핵심기술이나 지적 재산권의 확보가 결정적인 영향력을 갖는다는 특징이 있다.
산업적인 응용에 있어서는 생명공학기술 자체에 기초한 생명공학 신산업의 육성은 물론, DNA․단백질․세포 등 생명체 관련기술을 직접 활용하여 의약, 농업뿐만 아니라 화학․연료 및 IT․NT 등의 기술융합으로 응용범위가 확대되는 특징을 갖는다. 생명공학기술에 기초한 생명공학산업은 IT에 이어 세계 경제의 견인차가 될 것으로 기대되는 기술집약적인 고부가가치 지식기반 산업이며, 건강․식량․환경 등과 같은 인류 난제를 해결할 수 있는 지식기반 산업으로 의약, 화학, 환경, 식품, 에너지, 농업, 해양 등 산업 전반에 걸쳐 21세기 산업 성장을 주도하고 삶의 질을 향상시킬 수 있는 기술로 주목받고 있다. 그러나 신약개발 등 생명공학산업의 육성을 위한 핵심기술의 개발 및 임상적 검증을 위해서는 타 산업에 비해 장기적이고 대규모 투자(Long Term Investment) 및 고위험(High Risk)이 따른다. 이러한 투자규모와 위험성을 민간이 단독으로 감당하기에는 어려움이 많으므로 세계 각국에서는 정부가 앞장서서 생명공학관련 기술개발을 주도하고 있으며, 생명공학산업을 국가 전략산업으로 선정하여 집중 육성하고 있다.
나. 산업통상자원부의 주요 정책
산업통상자원부는 중소‧중견기업 등 관련 기업체가 글로벌 시장에 진출 가능한 기술경쟁력을 갖출 때까지 산업화 부분에 집중 지원한다는 기본 정책방향을 가지고 있다. 고령화 사회에 따른 급격한 기술변화와 글로벌 시장의 성장 추세를 감안하여 전략적 투자방향을 설정하며, 관련 부처와 협조체제를 강화하여 산업생태계 구축을 위한 환경 조성에 주력할 계획이다. 국가 R&D 투자 효율성을 제고하며 사업화 중심의 R&BD 전략 등을 통하여 생명공학기술의 산업화 육성정책을 추진하고 있다.
(1) 국가 R&D 투자 효율성 제고
산업통상자원부는 과거 중기거점기술개발사업, 성장동력기술개발사업, 차세대신기술개발사업, 전략기술개발사업 등으로 분산되어 있던 R&D 사업구조를 2008년부터 산업핵심기술개발사업으로 통합하여 일원화하였다. 이에 생명공학산업 R&D도 바이오의료기기 산업핵심기술개발사업으로 일원화하여 운영하고 있다. 기존의 R&D사업이 정부가 선정한 바이오분야 기술군에 대한 Top-down 방식으로 이루어진 반면, 개편된 산업핵심기술개발사업에서는 정부의 산업기술혁신계획(5개년), 핵심투자대상 및 테마, R&BD전략보고서 등에 기반한 Top-down 방식과 함께 정기 및 상시 기술수요조사에 기반한 Bottom-up방식을 동시에 고려하여 과제를 기획하는 것이 가장 큰 특징이다. 이와 같이 산업통상자원부는 현장 수요를 고려한 기술 개발을 전략적으로 추진하여 산업화 성공사례를 창출해 나갈 계획이다. 중점 지원 분야는 바이오의약(개량신약, 천연물신약, 줄기세포, 바이오인프라 등), 바이오화학(바이오플라스틱, 기능성 소재, 작물보호제 등), 융합바이오(유전체사업, 스마트헬스, 분자진단, 바이오장비 등) 3개 분야이다. 동 사업을 위해 산업부의 역할에 부합한 R&D 지원범위 및 기준을 마련하여 국내 바이오산업의 중장기적 발전 및 신성장동력화를 위한 R&D를 발굴하여 지원중이며 2015년에는 글로벌 시장에 진입하여 성과를 창출할 수 있는 산업핵심기술을 적극 발굴‧지원하였다.
특히 의약분야 중 신약개발 분야는 범부처전주기신약개발사업단을 통해 글로벌시장 진출이 가능한 제품개발을 위한 R&D를 지원하고 있다. 동 사업을 위해 보건복지부, 미래창조과학부, 산업통상자원부 3개 부처가 공동으로 예산을 지원하여 설립하였으며 산업부는 후보물질 도출 단계부터 상업화 목표와 연계되는 전주기상에서 산업화를 위한 지원을 추구하고 있다.
또한 선진국과 기술격차 지속, 중국 추격 등으로 우리 제조업의 미래 전망이 불확실한 상황으로, 새로운 성장엔진 창출이 필요하여 주력 산업의 고도화 및 신산업생태계 창출을 위해 민간 중심의 추진체계를 구성하고자 「제6차 산업기술혁신 5개년 계획」의 일환으로 13대 산업엔진 프로젝트를 발표하였다. 바이오분야는 ʻʻ스마트 바이오생산시스템ʼʼ, ʻʻ개인맞춤형 건강관리시스템ʼʼ 분야에 대한 산업엔진 추진단을 구성하였고 동 분야의 기술개발과 산업생태계 구축을 위한 종합 발전계획을 수립하였다.
(2) 수요자중심 정책지원
바이오산업을 향후 국가의 주력산업으로 자리매김할 수 있는 정책적 지원을 강화하고자, 산업통상자원부는 기업들의 의견을 바탕으로 바이오산업 분야 프로젝트 발굴, 바이오산업 통계, 바이오비즈니스 및 바이오경제 활성화 등 수요자 중심의 지원을 꾀하고 있다. 우선 중소/벤처기업, 대학 및 출연연 등이 보유한 잠재 유망 IP를 기업에 이전하여 우수한 제품이 개발되는 오픈이노베이션 생태계 구축을 위해 ʻ유망바이오IP사업화촉진사업ʼ을 신규 추진하였고 이를 통해 우수한 IP의 사업화를 통한 바이오기업의 기술혁신역량 제고에 대한 노력을 기울였다. 또한 기업군별 경쟁력을 강화하기 위해 벤처‧중소기업과 중견‧대기업간 정례적인 기술이전, 공동협력 프로그램 등 지원을 통해 실질적 동반성장 비즈니스 생태계 기반을 마련하고 있다. 그리고 바이오산업 구조 고도화를 위한 바이오산업 통계시스템을 구축하여 글로벌 시장에 진출하려는 국내 바이오기업 및 정책관련 부서에 대한 다양한 정보서비스를 제공하고 있다. 이 외에 국내 바이오기술‧제품의 글로벌 시장 진출을 지속적으로 촉진하기 위해 바이오산업의 가치사슬 및 부문별 다양한 해외 마케팅 비즈니스를 지원하고 있다.
* Inbound : GBMF(Global Bio-Medical Forum)
* Outbound : BIO(미국), BIO-Europe(EU), 한중일바이오행사 등
(3) 생명공학전문인력 양성
지식기반산업인 생명공학산업에 있어 우수인력의 확보는 산업경쟁력 확보의 관건이다. 특히 생명공학기술의 산업화에 따른 생물공정관련 기술인력 수요와 IT‧NT 등과의 융합 추세에 따라 이에 부응할 전문인력의 질적 부족현상이 심화되고 있는 실정이다. 이에 바이오기업 현장에서 요구하는 실무지식과 기술을 가진 생명공학전문인력 양성을 추진 중이며 GMP‧바이오화학‧스마트헬스케어 전문인력 양성 및 생명공학기업 재직자 재교육을 통하여 2014년 1,421명을 양성하였다.
(4) 유전자변형생물체(LMOs)의 대응시스템 구축
산업통상자원부는 바이오안전성의정서의 이행을 위한 국가책임기관으로서 LMO의 개발‧생산‧수입‧수출‧유통 등에 관한 안전성을 확보하고 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 미치는 위해를 사전에 방지하고자 2001년 국내이행법인 「유전자변형생물체의국가간이동등에관한법률(LMO법)」을 제정하여 2008년 1월부터 시행하고 있다.
또한 관계부처 통합으로 LMOs의 개발‧생산‧수출입‧유통 등 종합적인 안전관리 계획을 수립하고 LMO의 안전성평가를 위한 LMO위해성평가센터를 설립하여 수입‧생산‧연구개발 중인 모든 LMO에 대해 보다 엄격한 안전관리를 진행하고 있다.
향후 바이오안전성의정서의 원활한 이행 및 LMO의 수요증가에 대비하여 국내외 동향 및 향후전망을 파악하여, 국내환경에 적합한 안전관리 시스템을 마련하고 LMO의 안전성 확보를 위한 안전관리 전문능력 향상 및 위해성 평가‧관리 등 관련 기술개발을 지원해 나갈 계획이다. 또한 내년 중 우리나라에서 개최될 예정인 바이오안전성의정서 당사국 총회를 대비하여 개최국으로서 의제를 주도하기 위해 관계부처와 협동하여 다양한 준비를 하고 있다.
(5) 바이오화학산업화 촉진
글로벌 경기회복, 중동사태, 개도국의 경제성장으로 유가상승이 지속될 것으로 예상되는 가운데, 바이오매스(식물자원)를 기반으로 한 바이오화학산업이 기존 석유화학산업을 대체할 신산업으로 주목받고 있다. 또한, 온실가스 감축부담과 함께 환경 친화적 제품 요건이 무역규제로 작용하면서 친환경 바이오화학제품의 중요성이 더욱 부각되고 있다. 바이오화학산업은 석유의존 탈피, 온실가스 규제 등 새로운 무역환경에 대응하는 新성장산업으로 기존 석유화학 산업을 보완할 수 있으며, 글로벌 환경규제 추세에 따라 EU 등 주요국 수출시 바이오소재, 공정개발 등 지속가능한 산업기반의 구축이 필요하나, 높은 기술적 수요에도 불구하고 초기 투자 부담 등의 요인으로 현재 기업 투자는 매우 미흡한 상황이다.
이에 바이오화학산업의 조기정착과 기술적 우위선점을 위하여 정부는 다양한 시책을 강구할 예정이며, 주력산업별(전기전자, 자동차, 섬유 등)로 바이오화학제품을 조기 산업화하기 위해 바이오화학 원료 생산기술, 소재 개발, 산업융합기술을 지원하는 ʻ바이오화학산업화촉진기술개발사업ʼ을 추진하였다. 중점 지원 전략과제로 바이오화학 원료(바이오슈가) 생산기술개발, 바이오화학 소재 개발(바이오아크릴 수지, 바이오 섬유소재), 바이오화학 산업융합기술 개발을 통한 산업화 기반마련 (바이오플라스틱 원스톱공정, 바이오콤비나트) 등이 있다. 이미 선진국을 중심으로 상용화단계에 들어선 범용 바이오 플라스틱 소재를 중심으로 다양한 원료로부터 다양한 생산물을 만들어 낼 수 있는 데모급 콤비나트 플랜트 등이 포함된다.
(6) 지역바이오 활성화 기반 구축
산업통상자원부는 생명공학산업의 저변 확대 등을 목적으로 1998년~2010년까지 지역특성을 바탕으로 총20개의 지역바이오산업 인프라(특화센터)를 구축하였으며, 바이오센터별 차별화, 특성화하여 지역경제 활성화를 유도하였다. 2008년부터는 이미 구축된 바이오 인프라 시설을 보완하면서 기술지원‧인력양성‧마케팅에 집중 지원하고 있다.
최근 바이오산업이 급속히 성장함에 따라 지역에서도 신규 사업에 대한 사업검토 및 예산 지원요청 등이 증가하고 있으며, 이러한 지역의 바이오산업 진흥을 위한 수요에 맞추어 특화센터가 행정적‧제도적 지원을 제공하여 지역바이오 활성화에 기여하고 있다
[표 3-1-2] 지역별 바이오 인프라 시설
|
분 류 |
연번 |
센터명(소재지) |
중점분야 |
특화분야 |
|
충청권 |
1 |
ㅇ대전TP 바이오산업지원센터 (대전) * (구)바이오센터 |
의약 |
생물의약, 기능성식품 |
|
2 |
ㅇ충북TP 바이오센터(충북오창) * (구)보건의료산업센터 |
의약, 식품 |
의약소재, 기능성식품 |
|
|
3 |
ㅇ충북TP 한방천연물센터(충북제천) * (구)전통의약산업센터 |
한방, 식품 |
한방제품, 한약제제 |
|
|
4 |
ㅇ충남TP 바이오센터(충남논산) * (구)동물자원센터 |
그린, 사료 |
동물약품, 사료 첨가제 |
|
|
호남권 |
5 |
ㅇ천연자원연구센터(전남장흥) * 전남생물산업진흥원 |
전통, 소재 |
천연물소재, 기능성 규명 |
|
6 |
ㅇ식품산업연구센터(전남나주) * 전남생물산업진흥원 |
전통, 식품 |
일반식품 |
|
|
7 |
ㅇ생물의약연구센터(전남화순) * 전남생물산업진흥원 |
의약 |
백신, 세포․유전자 |
|
|
8 |
ㅇ나노바이오연구센터(전남장성) * 전남생물산업진흥원 |
융합, 소재 |
천연물 소재 나노 소재 |
|
|
9 |
ㅇ전라북도생물산업진흥원(전북전주) |
전통, 식품 |
건강기능성식품 |
|
|
10 |
ㅇ발효미생물산업진흥원(전북순창) |
전통, 식품 |
발효, 미생물 |
|
|
동남권 |
11 |
ㅇ진주바이오산업진흥원(경남진주) |
전통, 식품 |
바이오식품, 생물화학 |
|
12 |
ㅇ부산TP 해양생물산업육성센터(부산) |
해양, 식품 |
해양생태독성, 해양기능성식품 |
|
|
13 |
ㅇ김해의생명센터(경남김해) |
의료기기 |
비전자의료기기, 융합부품소재 |
|
|
대경권 |
14 |
ㅇ대구TP 바이오헬스융합센터(대구) |
전통, 식품 |
전통생물소재, 액상식품 |
|
15 |
ㅇ대구TP 한방산업지원센터(대구) |
전통, 한방 |
한약재효능검증, 한방임상평가 |
|
|
16 |
ㅇ경북바이오산업연구원(경북안동) |
전통, 식품 |
일반식품, 건강기능식품 |
|
|
17 |
ㅇ경북해양바이오산업연구원(경북울진) |
해양, 식품 |
해양식품, 식품소재 |
|
|
18 |
ㅇ포항TP 바이오정보지원센터(경북포항) |
바이오소재 효능검증 |
화장품 효능검증 |
|
|
강원권 |
19 |
ㅇ춘천바이오산업진흥원(강원춘천) |
의약, 소재 |
건강기능식품 생물의약소재 |
|
20 |
ㅇ강릉과학산업진흥원 해양바이오사업단 (강원강릉) |
해양, 식품 |
기능성식품, 바이오화장품 |
|
|
제주권 |
21 |
ㅇ제주TP 바이오융합센터(제주) |
산업, 화장품 |
천연소재향장 |
|
경기권 |
22 |
ㅇ경기과학기술진흥원 바이오센터 (경기수원) |
의약 |
신약개발 지원 |
다. 생명공학육성과 산업통상자원부
최근 우리사회는 인구고령화와 삶의 질 향상에 대한 요구가 증대되고 있고, 화석연료의 고갈, 지구 온난화 등의 글로벌 이슈에 대응해야 하며, IT와의 결합을 통한 다양한 분야의 수요가 증가되고 있다. 이 모든 조건을 해결하는 방안에는 생명공학 분야를 분리해서 생각할 수 없다.
이러한 글로벌 메가트렌드와 산업이슈에 부응하고 ICT의 진보로 기술간, 산업간, 온-오프라인간 융복합화가 가속화 및 보편화되는 시대에 대응하기 위해서 정부에서도 미래 신산업인 생명공학산업의 발전이 필요하다는 것은 인식하고 있으며, 생명공학의 한 분야인 바이오제약‧의료기기 분야를 17대 신성장동력으로 선정한 바 있다. 산업통상자원부는 제6차 산업기술혁신계획(2014~2018) 및 2015년 R&BD전략보고서에 따라 2020년 세계 제7위 바이오 강국 입성 등을 목표로 바이오 기술의 글로벌 산업화 및 바이오 생태계 조성을 위해 새로운 기술과 시장 창출, 기존산업의 고부가가치와, 산업 생태계 활성화에 초점을 맞추고 관련 산업 육성을 위해 정책적 지원을 다할 계획이다.
3. 생명공학 기초과학진흥 정책
가. 개요
최근 유전체학/단백체학 및 세포체학/대사체학 연구 등에서 급속한 진전을 보이고 있는 생명공학은 우리의 미래 생활에 큰 변화를 주도하고 있으며, 우리 삶의 질 향상에 크게 기여하고 있다. 정부의 창조경제 정책에 부응하여 기초과학 연구결과를 응용하여 실생활에 도움이 되도록 적용한 생명공학 정책의 성공사례로 최근 한미약품의 당뇨병 치료제의 성공적인 개발에서 보듯이 의약품 개발 및 진단․세포/유전자 치료법 개발 기술, 유전체 대량 분석과 정보를 활용한 난치병 예방, 진단 및 치료법 개발 기술, 세포 치료제 개발 기술로 인해 많은 질병이 퇴치되고 수명이 연장되고 있다. 이러한 생명공학의 성과는 생물학, 생화학, 생리학, 생물물리학 등 관련 기초생명과학의 다양한 실험 기술의 성과에서 기인한 것으로 관련분야의 기초과학 발전이 있었기에 가능한 것이었다. 이를 통해 볼 때, 미래유망 분야에 대한 핵심원천기술개발 확보 및 선진화 기반 확충을 위해 추진되고 있는 바이오․의료기술개발사업 및 첨단의료기반기술개발 등과 같은 연구개발사업도 기초연구의 선행이 전제되어야 한다고 할 수 있다.
생명공학분야의 창조경제정책은 기초생명과학의 응용생명과학과의 창조적 융합을 통한 바이오․생명 공학 분야의 고부가가치를 창출하는 것이며 세계적 흐름 속에서 생명공학 분야에서의 기초과학의 진흥 역시 그 역할이 더욱 증대되고 있는데, 이와 같은 맥락에서 볼 때 희귀․난치질환 치료를 위한 줄기세포 치료제 개발, 유전체 정보분석기술 및 질병기전 규명기술 개발 등의 파생분야도 기초과학이 제 역할을 해낼 때 비로소 가능한 것이기 때문이다.
나. 정부의 기초과학진흥 추진 과정
OECD Frascati Manual(2002년)에 기초연구의 개념이 기술된바 기초연구란 관찰 가능한 현상과 사실들의 기저에 놓여 있는 근본 원리에 대한 새로운 지식 획득을 목적으로 수행되는 실험적 혹은 이론적 작업으로 순수기초연구는 자연현상의 원리(mechanism) 규명을 통해 새로운 창조적 지식을 획득하는 연구로, 목적지향적인 목적기초연구는 미래의 광범위한 응용을 위하여 원천지식의 토대를 산출하는 연구라 정의하고 있다. 반면에, 응용연구란, 알려진 지식을 심화·발전시켜 특정 문제를 해결하거나 특정 상황에 적용하여 활용하는 연구로서, 그 연구가 성공적으로 이루어져 기대하는 결과(물)를 얻을 경우, 그 결과(물)가 적용될 분야가 확실한 연구라 하였으며, 개발연구란 실용적이고 유통 가능한 (시)제품, 물질, 장치 또는 제품의 공정 과정을 개발하기 위한 연구라 정의하였다.
2004년 과학기술부에 ʻʻ과학기술혁신본부ʼʼ를 설치하고 부총리급으로 격상하고, 정부 간 합의를 거쳐 기존 과학기술부가 추진하던 기초연구 사업을 3개 유형으로 나누어, 순수기초연구와 기초과학기반구축사업은 당시 교육인적자원부(現 교육부)에서 주관하고 목적기초연구는 과학기술부(現 미래창조과학부)에서, 응용연구 부분에 대하여는 산업자원부(現 산업통상자원부)와 정보통신부(現 미래창조과학부)에서 주관하도록 조정하였다. 이와 더불어 교육인적자원부는 대학연구의 제도 및 기반을 구축하고 대학의 우수 연구 인력양성 지원 사업을 하도록 하였다.
정부는 기초연구의 진흥을 위한 여건 조성을 위하여 기초연구에 관하여 1) 대학교수, 연구원 등 관계 전문가의 연수 및 연구비 지원, 2) 석사 및 박사 과정 학생의 연구장학금 지원, 3) 연구교수(연구조교를 포함한다)제도, 교수의 연구휴가제도, 객원교수제도 및 객원연구원제도의 활용, 4) 대학의 연구시설 및 기자재 지원, 5) 대학부설연구소 및 우수연구집단 형성 지원, 6) 대학, 국공립 연구기관기업부설 연구소와의 공동연구, 인력교류, 연구 시설․장비 공동활용 등 산업계․학계 및 연구소 간의 교류 촉진, 7) 기업 등의 대학 기초연구 지원 촉진, 8)그 밖에 기초연구환경 조성 및 기초연구기반 구축에 필요한 사항 등을 정책추진에 있어서 의무적으로 마련하도록 기초연구진흥 및 기술개발지원에 관한 법률 제7조에 명시하고 있다. 또한 동 법에 따라, 기초연구진흥종합계획 및 시행계획을 수립하여 국가의 기초연구진흥을 위한 정책적 노력을 계속해 나가고 있다.
2008년 2월 교육인적자원부와 과학기술부의 통합으로 교육과학기술부가 출범하였다. 두 기관의 통합은 기초과학에 관한 여러 정책이 일관성 있게 정리될 수 있는 기회를 제공하였으며, 2013년 미래창조과학부의 출범으로 창조적 기초연구 추진전략이 마련되고, 상상력․창의력을 기반으로 한 과학기술과 ICT의 융합을 바탕으로 그 어느 때 보다도 기초연구에 대한 기대가 높아지고 있다고 할 수 있다. 2014년에는 ʻ기초연구를 통한 미래 창조사회 구현ʼ을 비전으로 삼아 정부 기초연구비 산정대상 예산 중 37.1%를 기초연구에 지원하여 창의적 아이디어 중심의 도전적․혁신적 기초연구를 강화하였다.
다. 미래창조과학부의 기초과학연구지원 현황
미래창조과학부와 한국연구재단에서는 우리나라 연구력의 근본이라 할 수 있는 기초연구를 중점 지원하고 있다. 이에 따라 개인 또는 소규모 공동연구 중심의 기초연구를 지원하여 국가연구역량 토대를 구축하고 국제적 수준의 연구 결과를 도출하여 국가 사회 발전과 학문의 발전을 도모할 수 있도록 지원하고 있다. 특히 한국연구재단은 기초연구본부의 생명과학단, 의약학단, 그리고 ICT․융합연구단에서 대학과 국책연구기관의 생명과학분야를 지원하고 있으며, 국책연구본부의 생명공학팀에서는 대단위 국책사업을 지원하고 있다. 기초연구본부의 생명과학단에서는 기존의 기초생명, 응용생명, 농림수산식품 분야를 기초생명, 분자생명, 기반생명의 순수기초연구 중심으로 전면 개편하여 생명과학의 메커니즘(mechanism) 연구를 집중 수행하는 생명 과학자를 다수 양성하고, 향후 노벨상 수상연구에 근접하는 연구역량 제고 및 연구기반을 구축하며, 미래의 첨단 기초생명과학 연구를 선점하기 위해, 선도형 순수기초연구에 대한 지원을 강화하고 있다.
(1) 기초연구지원 사업 현황
미래창조과학부는 개인연구지원사업인 신진․중견․리더연구자지원사업을 통해 꾸준히 신규과제를 지원하고 있으며, 선도연구센터 및 기초연구실 사업과 같은 집단연구지원사업에서도 신규 예산을 편성하여 지원해 나갈 예정이다. 그 외에도 전문연구 정보 활용 및 기초연구실험데이터 글로벌허브구축 사업을 통해 기초연구기반 구축에도 박차를 가하고 있다.
[표 3-1-3] 2014년~2015년도 기초연구지원 사업내용
(단위 : 백만 원)
|
세 부 사 업 |
’14년 예산(A) |
’15년 예산(B) |
증감액(B-A) |
증감률 |
|
합 계 |
696,663 |
744,292 |
47,629 |
6.8% |
|
【개인연구】 |
542,100 |
587,531 |
45,431 |
8.4% |
|
ㅇ 신진연구자 지원 |
141,937 |
142,500 |
563 |
0.4% |
|
- 신진연구 |
103,860 |
105,860 |
2,000 |
1.9% |
|
- 여성과학자지원 |
28,077 |
30,990 |
2,913 |
10.4% |
|
- 신진멘토링 (舊 커리어과학자) |
10,000 |
5,650 |
△4,350 |
△43.5% |
|
ㅇ 중견연구자 지원 |
348,795 |
388,295 |
39,500 |
11.3% |
|
- 핵심연구 |
192,573 |
229,992 |
37,419 |
19.4% |
|
- 도약연구 |
156,222 |
158,303 |
2,081 |
1.33% |
|
ㅇ 리더연구자 지원 |
51,368 |
56,736 |
5,368 |
10.5% |
|
- 창의연구 |
46,368 |
51,736 |
5,368 |
11.6% |
|
- 국가과학자 |
5,000 |
5,000 |
|
|
|
【집단연구】 |
146,485 |
148,864 |
2,379 |
1.6% |
|
ㅇ 선도연구센터 지원 |
103,471 |
105,850 |
2,379 |
2.3% |
|
- 이학분야(SRC) |
26,633 |
25,247 |
△1,386 |
△5.2% |
|
- 공학분야(ERC) |
33,488 |
33,303 |
△185 |
△0.6% |
|
- 기초의과학분야(MRC) |
29,950 |
33,100 |
3,150 |
10.5% |
|
- 융합분야(CRC) |
13,400 |
14,200 |
800 |
6.0% |
|
ㅇ 기초연구실 지원 |
20,500 |
20,500 |
|
|
|
ㅇ 글로벌연구실 지원 |
22,514 |
22,514 |
|
|
|
【기초연구기반구축】 |
8,078 |
7,897 |
△181 |
△2.2% |
|
- 전문연구정보활용 |
2,280 |
2,167 |
△113 |
△5.0% |
|
- 기초연구실험데이터 글로벌허브구축 |
3,028 |
2,829 |
△199 |
△6.6% |
|
- 연구장비엔지니어 양성 |
2,770 |
2,901 |
131 |
4.7% |
출처 : 미래창조과학부, 2015년도 기초연구사업 시행계획
(2) 생명과학분야 사업 지원 현황
정부에서 이공분야에 지원하는 총 R&D 투자액 중 생명과학분야의 범주에 속하는 생명과학, 농림수산, 보건의료 부문에 지원되는 총 투자액수는 3조 1,661억 원으로서 전체 R&D 투자액의 19.3%를 차지하고 있다.
[표 3-1-4] 과학기술표준분류별 투자 추이(2014년)
(단위 : 억원)
|
구 분 |
금 액 |
비 중(%) |
|
수학 |
767 |
0.5 |
|
물리학 |
4,755 |
2.9 |
|
화학 |
3,508 |
2.2 |
|
지구과학 |
5,986 |
3.7 |
|
생명과학 |
7,412 |
4.5 |
|
농림수산식품 |
11,140 |
6.8 |
|
보건의료 |
13,109 |
8.0 |
|
기계 |
23,837 |
14.6 |
|
재료 |
6,474 |
4.0 |
|
화공 |
4,057 |
2.5 |
|
전기/전자 |
17,044 |
10.4 |
|
정보/통신 |
17,789 |
10.9 |
|
에너지/자원 |
9,048 |
5.5 |
|
원자력 |
6,607 |
4.0 |
|
환경 |
4,574 |
2.8 |
|
건설/교통 |
8,395 |
5.1 |
|
과학기술과 인문사회 |
4,409 |
2.7 |
|
기타 |
14,236 |
8.7 |
|
합계 |
163,147 |
100 |
출처 : 2014년도 국가연구개발사업 조사·분석 보고서
[표 3-1-5] 2015년도 신진연구자지원사업 중 생명과학분야 중분야별 선정현황
|
중분야명 |
신청과제 수 |
선정과제 수 |
|
세포생물학 |
55 |
13 |
|
유전학 |
35 |
6 |
|
생화학 |
11 |
3 |
|
생리학 |
14 |
6 |
|
식물학 |
12 |
3 |
|
미생물학 |
28 |
9 |
|
분류/생태/환경생물학 |
26 |
3 |
|
분자생물학 |
7 |
3 |
|
신경생물학 |
27 |
4 |
|
발생생물학 |
25 |
5 |
|
구조생물 및 생물물리학 |
20 |
7 |
|
유전자발현 |
33 |
7 |
|
면역학 |
16 |
5 |
|
감염생물학 |
15 |
4 |
|
노화/암생물학 |
48 |
7 |
|
식량작물 및 원예작물 |
32 |
8 |
|
응용생물화학 |
31 |
6 |
|
농림생태환경 |
41 |
9 |
|
동물자원학 |
33 |
5 |
|
수의학 |
47 |
12 |
|
수산학 |
25 |
6 |
|
식품학 |
83 |
18 |
|
영양학 |
46 |
9 |
|
생물공학 |
49 |
8 |
|
총계 |
759 |
166 |
중견연구자지원사업은 핵심연구, 도약연구로 구성되어 있으며, 2015년에 핵심 및 도약연구로 지원된 생명과학분야 연구비의 중분야별 지원 비율은 [표 3-1-6], [표 3-1-7]과 같다.
[표 3-1-6] 2015년도 핵심연구자지원사업 중 생명과학분야 중분야별 선정현황
|
중분야명 |
신청과제 수 |
선정과제 수 |
|
세포생물학 |
24 |
7 |
|
유전학 |
14 |
3 |
|
생화학 |
12 |
4 |
|
생리학 |
8 |
2 |
|
식물학 |
16 |
4 |
|
미생물학 |
21 |
5 |
|
분류/생태/환경생물학 |
26 |
6 |
|
분자생물학 |
2 |
1 |
|
신경생물학 |
11 |
5 |
|
발생생물학 |
16 |
6 |
|
구조생물 및 생물물리학 |
7 |
3 |
|
유전자발현 |
10 |
3 |
|
면역학 |
7 |
6 |
|
감염생물학 |
9 |
2 |
|
노화/암생물학 |
23 |
9 |
|
식량작물 및 원예작물 |
14 |
3 |
|
응용생물화학 |
16 |
4 |
|
농림생태환경 |
17 |
3 |
|
동물자원학 |
12 |
2 |
|
수의학 |
31 |
6 |
|
수산학 |
14 |
3 |
|
식품학 |
37 |
7 |
|
영양학 |
12 |
2 |
|
생물공학 |
27 |
4 |
|
총계 |
386 |
100 |
[표 3-1-7] 2015년도 도약연구자지원사업 중 생명과학분야 중분야별 선정현황
|
중분야명 |
신청과제 수 |
선정과제 수 |
|
세포생물학 |
23 |
8 |
|
유전학 |
11 |
- |
|
생화학 |
10 |
- |
|
생리학 |
6 |
2 |
|
식물학 |
6 |
3 |
|
미생물학 |
13 |
6 |
|
분류/생태/환경생물학 |
3 |
- |
|
분자생물학 |
5 |
1 |
|
신경생물학 |
14 |
1 |
|
발생생물학 |
9 |
2 |
|
구조생물 및 생물물리학 |
18 |
3 |
|
유전자발현 |
13 |
3 |
|
면역학 |
14 |
3 |
|
감염생물학 |
11 |
2 |
|
노화/암생물학 |
23 |
5 |
|
식량작물 및 원예작물 |
4 |
1 |
|
응용생물화학 |
11 |
2 |
|
농림생태환경 |
1 |
- |
|
동물자원학 |
5 |
- |
|
수의학 |
10 |
1 |
|
수산학 |
5 |
1 |
|
식품학 |
19 |
4 |
|
영양학 |
8 |
1 |
|
생물공학 |
29 |
4 |
|
총계 |
271 |
53 |
4. 생명공학 인력양성 정책
가. 생명공학분야 고급인력 양성정책의 현주소 및 비전
정부는 「기초연구진흥 및 기술개발지원에 관한 법률」에 따라, 5년 주기로 기초연구 진흥에 관한 중장기 정책목표와 방향 설정을 위한 ʻ기초연구진흥 종합계획ʼ을 수립하여 시행하고 있으며, 2017년까지 정부 R&D 중 기초연구 투자 비중을 40%까지 확대를 목표로 매년 투자를 확대하고 있다.
[표 3-1-8] 정부 R&D 중 기초연구 투자 비중
(단위 : 조원, %)
|
구 분 |
2011 |
2012 |
2013 |
2014 |
2015 |
|
정부 R&D예산 |
14.9 |
16.0 |
16.9 |
17.7 |
18.9 |
|
기초연구비 산정대상 예산*(A) |
10.3 |
11.0 |
11.5 |
12.6 |
13.1 |
|
기초연구비(B) (비중 : B/A×100) |
3.4 (33.1%) |
3.9 (35.2%) |
4.1 (35.4%) |
4.68 (37.1%) |
4.99 (38.1%) |
* 정부 R&D 중 시설장비구축사업 등 연구단계(기초, 응용, 개발) 구분이 곤란한 사업 제외
출처 :「2015년도 정부 기초연구비 비중」(2015.3., 기초연구진흥협의회)
정부의 기초연구 확대 기조 속에 교육부는 생명공학 분야의 경쟁력 확보를 위해서는 장기적 관점에서 연구의 지속가능성이 중요하다고 판단하고, 기초연구 분야에 대한 저변 확대와 우수 연구인력의 양성에 보다 정책 역량을 집중하고자 하였다. 교육부는 다양한 생명공학 분야에 대한 개인 및 대학 연구소 단위의 균형 잡힌 기초연구를 지원하여 연구 저변을 지속적으로 넓혀 나감과 동시에 석‧박사 연구인력에 대한 연수기회 부여, 연구경험 제공 및 장학금 지원을 통해 미래 한국을 책임질 학문후속세대를 육성해 나가고 있다.
특히 선진국과 같이 생명공학분야의 경우 대학의 이러한 장기적 관점의 연구역량 제고는 연구와 인력양성이라는 중요한 역할을 담당할 필요가 있기 때문에 대학의 연구역량을 강화하기 위해 노력하고 있다.
나. 기초연구지원사업
교육부는 2015년 일반연구자지원사업을 이공학개인기초연구 지원사업으로 개편하여 2,943억 원을 투자하였으며, 학문후속세대 및 대학중점연구소 지원사업에 423억을 포함하여 총 3,365억 원을 투자하여 이공학분야의 기초연구가 보다 활성화될 수 있도록 노력하였다.
[표 3-1-9] 교육부 기초연구지원사업
(단위 : 백만원, %)
|
사업명 |
2014년 예산 (A) |
2015년 예산 (B) |
증감 |
||
|
차액 (B-A) |
증감률 (%) |
||||
|
이공학개인기초연구 |
290,500 |
294,250 |
3,750 |
1.3 |
|
|
|
기본연구 |
230,750 |
237,050 |
6,300 |
2.7 |
|
리서치펠로우 |
33,250 |
31,200 |
△2,050 |
△6.2 |
|
|
보호연구 |
1,500 |
1,250 |
△250 |
△16.7 |
|
|
지역대학우수과학자 |
25,000 |
24,750 |
△250 |
△1.0 |
|
|
이공학학술연구기반구축 |
40,870 |
42,250 |
1,380 |
3.4 |
|
|
|
대학중점연구소 |
23,680 |
25,400 |
1,720 |
7.3 |
|
학문후속세대 |
17,190 |
16,850 |
△340 |
△2.0 |
|
|
합계 |
331,370 |
336,500 |
5,130 |
1.5 |
|
(1) 이공학개인기초연구지원(舊일반연구자지원)
교육부는 이공학개인기초연구지원을 통해 이공학분야 개인연구자에게 5천만원 내외의 연구비를 폭넓게 지원하여 생명공학 분야 연구자가 창의적이고 혁신적인 연구에 전념할 수 있는 환경을 제공하고 있다.
특히 2012년부터는 대학의 리서치펠로우(장기계약직 박사후연구원)에 대한 지원을 신설함으로써 잠재력 있는 연구 인력이 안정적 환경에서 연구에 몰입할 수 있는 환경을 조성하고 책임급 연구과제를 수행할 수 있는 기회를 제공하여 장래에 우수 연구 인력으로 성장할 수 있도록 지원하고 있다. 또한 지역대학우수 과학자 사업을 통해 지역의 연구자를 정책적으로 배려하여 지역대학의 우수과학자가 연구에 몰입할 수 있도록 지원하고 있다.
[표 3-1-10] 이공학개인기초연구사업 생명공학분야 지원 현황
(단위 : 개, 백만원)
|
분야 |
2014년 |
2015년 |
||
|
지원과제 수 |
사업비 |
지원과제 수 |
사업비 |
|
|
분자세포생물학 |
251 |
11,762 |
246 |
12,211 |
|
유전학‧유전공학 |
83 |
3,735 |
86 |
4,174 |
|
발생‧신경생물학 |
130 |
5,995 |
117 |
5,827 |
|
면역학‧생리학 |
73 |
3,383 |
70 |
3,456 |
|
분류‧생태‧환경생물학 |
67 |
3,122 |
57 |
2,835 |
|
생화학‧구조생물학 |
66 |
3,089 |
66 |
3,263 |
|
융합바이오 |
67 |
3,164 |
57 |
2,926 |
|
생물공학 |
34 |
1,695 |
33 |
1,644 |
|
산업바이오 |
35 |
1,389 |
36 |
1,736 |
|
바이오공정‧기기 |
5 |
197 |
3 |
136 |
|
생물유해성 |
3 |
132 |
5 |
234 |
|
기타생명과학 |
17 |
667 |
17 |
818 |
|
계 |
831 |
38,330 |
793 |
39,260 |
※ 2015년 11월말 기준 자료임.
(2) 이공학학술연구기반구축
교육부는 이공학학술연구기반구축사업을 통해 생명공학분야를 포함한 이공학분야의 연구 기반 확충을 지원하고 있다. 세부사업인 대학중점연구소 지원사업을 통해서는 대학부설연구소의 인프라 지원을 통해 대학의 연구거점을 구축하고, 대학연구소의 특성화‧전문화를 유도하며 중점연구소를 통해 우수 신진연구인력이 육성될 수 있도록 지원하고 있다. 학문후속세대는 이공학분야 박사 후 연구자에게 국내‧외 대학 및 연구소에서의 연수 기회를 제공하여 학술연구의 지속성 유지 및 연구 능력의 질적 향상을 유도하고 있으며, 2015년에는 박사 후 국내연수 103명, 박사 후 국외연수 50명, 대통령 Post-Doc. 펠로우십 12명을 선정하여 지원하였다.
[표 3-1-11] 이공학학술연구기반구축사업 생명공학분야 지원 현황
(단위 : 개, 백만원)
|
분야 |
2014년 |
2015년 |
||
|
지원과제 수 |
사업비 |
지원과제 수 |
사업비 |
|
|
분자세포생물학 |
23 |
2,562 |
18 |
1,706 |
|
유전학‧유전공학 |
9 |
992 |
3 |
760 |
|
발생‧신경생물학 |
8 |
1,104 |
9 |
1,115 |
|
면역학‧생리학 |
6 |
315 |
8 |
1,015 |
|
분류‧생태‧환경생물학 |
8 |
498 |
6 |
454 |
|
생화학‧구조생물학 |
4 |
249 |
5 |
983 |
|
융합바이오 |
8 |
710 |
7 |
607 |
|
생물공학 |
2 |
590 |
2 |
583 |
|
산업바이오 |
1 |
33 |
|
|
|
바이오공정‧기기 |
1 |
150 |
1 |
150 |
|
기타생명과학 |
|
|
1 |
33 |
|
계 |
70 |
7,203 |
60 |
7,406 |
※ 2015년 11월말 기준 자료임.
(3) 주요성과
2015년도 교육부 주요 연구개발사업 성과분석보고서에 따르면, 2014년 생명공학 분야에서 발표한 SCI 논문은 996건, 상위 10%논문은 105건이고, 특허 출원은 151건, 등록은 84건이었다.
[표 3-1-12] 생명공학 분야 SCI 논문 발표 현황
(단위 : 개, 백만원)
|
분야 |
2013년 |
2014년 |
||
|
전체 |
상위10% |
전체 |
상위10% |
|
|
이공학개인기초연구 |
656 |
91 |
828 |
85 |
|
이공학학술기반구축사업 |
136 |
20 |
168 |
20 |
출처 : 각 연도별 주요 연구개발사업 성과분석보고서
[표 3-1-13] 생명공학 분야 특허 출원·등록 현황
(단위 : 개, 백만원)
|
분야 |
2013년 |
2014년 |
||
|
출원 |
등록 |
출원 |
등록 |
|
|
이공학개인기초연구 |
68 |
84 |
117 |
70 |
|
이공학학술기반구축사업 |
15 |
14 |
34 |
14 |
출처 : 각 연도별 주요 연구개발사업 성과분석보고서
다. 고급인력 양성사업
교육부는 인력양성 총괄 부처로서 다양한 초‧중등, 대학에 걸쳐 전주기적 인재 양성을 지원하고 있다. 특히 최근에는 생명공학 등 과학기술 분야에 대한 중요성이 높아짐에 따라 초‧중등교육에서 융합인재교육(STEAM; Science, Technology, Engineering, Arts and Mathematics)을 통해 실생활 문제를 창의적으로 해결하는 방법으로 과학에 대한 흥미도를 제고하고 있고, 이는 과학기술 선도 인재 양성의 초석이 되고 있다.
이와 함께 고등교육 단계에서도 고급인력을 양성하기 위한 노력을 기울이고 있다. 특히 2013년 9월부터 추진하고 있는 BK21 플러스 사업에서는 농생명 및 생명공학 분야 사업단(팀)에 약 502억 원을 투자하여, 약 4,000여명의 대학원생에게 연구장학금, 국제화경비 등을 지원하였다. 또한 2015년 중간평가 추진 시 의약학, 농‧생명 등 분야 평가지표를 별도로 적용하여 각 분야의 특성을 반영한 질적 성과를 제고하였다. 이를 통해 생명공학분야 연구성과의 사회적 기여를 증진하고, 산학협력을 활성화할 수 있을 것으로 기대하고 있다.
[표 3-1-14] BK21 및 BK21플러스 사업 지원 현황
(단위 : 개, 백만원)
|
분야 |
BK21 |
BK21 플러스 |
||
|
지원과제 수 |
사업비 |
지원과제 수 |
사업비 |
|
|
농생명 분야 |
30 |
3,232 |
15 |
10,283 |
|
생물학 분야 |
15 |
12,317 |
23 |
12,980 |
|
약학 등 분야 |
22 |
2,862 |
15 |
8,727 |
|
응용생명 분야 |
17 |
14,972 |
17 |
3,877 |
|
의학/치의/한의학 분야 |
18 |
2,645 |
22 |
14,362 |
|
계 |
102 |
36,028 |
92 |
50,229 |
※ BK21사업은 2012년, BK21플러스는 2015년 지원액 기준임
[표 3-1-15] BK21 플러스 중간평가 지표(의약학, 농‧생명‧수산‧해양 분야) 특징
|
분야 |
평가지표 특징 |
|
의약학 |
기초 의약학 연구 활성화를 위한 연구지표 강화, 사회적 기여 지표 신설 |
|
농‧생명‧수산‧해양 |
연구진(참여교수 등) 구성의 우수성 강조, 산학협력 지표 강화 |
의약학 및 생명과학 분야에 특화한 의과학자 육성지원 사업도 추진 중이다. 의과학자 과정(의사면허증(M.D/DDS)과 박사학위(Ph.D)를 동시에 또는 연계하여 취득하는 과정)을 이수하는 153명의 우수 전문대학원생에 등록금 전액과 연간 5백만 원의 교육연구비를 최대 7년간 장기 지원하여 전문 임상경험과 기초의학 연구력을 겸비한 신진 의과학자로 양성하고 있다.
라. 추진방향 및 발전과제
교육부는 기초연구 진흥과 인력양성을 담당하는 부처로서 생명공학 분야의 연구와 인력양성을 위한 지원을 확충하는 것이 무엇보다 필요하다. 아울러 기초연구와 인력양성 간 긴밀한 연계를 통해 시너지를 창출하기 위한 노력을 강구해야 하고 있다. 예를 들어 BK21플러스 등 인력양성 사업과 이공학개인 기초연구지원 등 기초연구지원사업을 효과적으로 연계할 수 있는 방안에 대해 모색하는 것이 생명공학 분야의 장기적 연구역량 제고를 위해서는 필수적인 조건이라 할 수 있다. 특히 이러한 시너지가 가장 효과적으로 나타날 수 있는 현장이 대학이므로 대학에 대한 지원을 확대할 필요가 있다.
아울러 교육부는 생명공학 분야 중에서 장래에 성장가능성이 있으나 현재 투자가 미흡한 분야나 다른 분야의 성장을 위해서는 반드시 필요한 기반 분야 등 민간에서 투자가 소홀할 수 있는 부분을 적극적으로 발굴하고 정책적인 배려를 해 나갈 예정이다.
5. 농식품분야 생명공학 육성 정책
가. 개요
바이오경제시대가 도래함에 따라 석유․화학소재 대체 등 산업의 기본 소재로서 생명자원의 가치가 재해석되고, 이를 활용하기 위한 관련 산업의 중요성 또한 증대되고 있다. 즉 생명자원을 단순 식품 공급원이 아닌 고부가가치 제품으로 활용할 수 있는 농생명 산업이 주목 받고 있으며, BT기술의 발달 및 IT‧NT 등 첨단기술 분야와의 접목으로 농식품 분야의 새로운 가능성과 중요성이 재평가되고 있다.
특히, 농업은 창조경제를 견인할 신성장 동력 산업으로 주목받고 있으며, 식료품 생산 중심의 단순생산․가공 산업에서 고 부가치 기능성‧맞춤형 산업으로, 에너지 문제해결의 보완산업으로 그 가능성을 확인하고 있다.
농림축산식품부는 농식품 산업을 인간의 생명과 직결되는 첨단 산업인 동시에 새로운 가치를 창조하여 경제적 부를 창출해 낼 수 있는 고부가 미래 전략산업으로 육성해 나갈 계획이다.
나. 주요 연구개발 사업
농림축산식품부는 생명자원을 활용한 기술 개발 및 실용화를 위하여, 골든시드프로젝트 사업, 고부가가치식품기술개발사업, 기술사업화지원사업 등 2014년 생명공학 관련 예산으로 345,925백만 원을 투자하고 있다.
지속적인 투자결과 농업생명공학 우수 기술이 꾸준히 개발되어 분자육종 기술을 이용한 탄저병 저항성 고추, 탈모예방 단백질 벼 등 기능성 GM작물 개발, 곤충 항생 펩타이드 이용 염증치료물질 개발, 세계 최초 브루셀라균 10종 모두를 동시 감별 가능한 진단키트 개발 등 가시적인 성과가 도출되고 있다.
농림축산식품부는 농식품 산업을 최첨단 과학기술과 접목한 고부가가치 융복합 산업으로 발전시키기 위하여 다음과 같은 주요 생명공학 육성사업들을 추진하고 있다.
[표 3-1-16] 농림축산식품분야 생명공학사업 투자계획
(단위 : 백만원)
|
기관명 |
사 업 명 |
사업기간 |
2014년 실적 |
2015년 예산 |
|
농림축산 식품부 |
▪고부가가치식품기술개발 |
2010년~계속 |
37,633 |
38,250 |
|
▪기술사업화지원 |
2008년~계속 |
5,760 |
6,960 |
|
|
▪생명산업기술개발사업 |
1994년~계속 |
46,732 |
47,450 |
|
|
▪수출전략기술개발사업 |
2011년~계속 |
16,026 |
17,151 |
|
|
▪골든시드프로젝트 |
2012년~계속 |
31,444 |
32,339 |
|
|
▪첨단생산기술개발사업 |
2011년~계속 |
20,978 |
22,529 |
|
|
▪가축질병대응기술 |
2012년~계속 |
3,748 |
5,798 |
|
|
▪농림축산식품연구센터 지원 |
2010년~계속 |
5,000 |
5,900 |
|
|
▪포스트게놈 다부처 유전체사업 |
2014년~2021년 |
2,500 |
2,500 |
|
|
▪농림축산검역검사기술개발 |
1998년~계속 |
21,336 |
19,867 |
|
|
농진청 |
▪차세대바이오그린 21사업 |
2011년~-2020년 |
66,366 |
46,000 |
|
▪포스트게놈 다부처 유전체사업 |
2014년~2021년 |
8,000 |
8,000 |
|
|
▪우장춘 프로젝트 |
2010-2019년 |
5,000 |
5,000 |
|
|
▪유용유전자 대량 발굴 및 형질전환 작물 개발 |
1994년~계속 |
3,100 |
2,800 |
|
|
▪GMO 국가관리 및 안전성 평가 |
2004년~계속 |
2,390 |
2,410 |
|
|
▪농업유전자원 국가관리체계 확립 및 활용 |
1994년~계속 |
4,600 |
4,800 |
|
|
산림청 |
▪산림과학연구 |
1949년~계속 |
33,738 |
46,742 |
|
▪임업기술연구개발 |
2007년~계속 |
18,814 |
17,668 |
|
|
▪산림생물종 연구 |
2006년~계속 |
12,760 |
12,562 |
|
|
|
계 |
345,925 |
344,726 |
|
출처 : 농림축산식품부
(1) 고부가가치 식품기술개발사업
농림축산식품부가 식품산업 진흥업무를 담당하게 되어 본격적인 식품산업 R&D 추진을 위해 수립한 「식품산업 R&D 중장기계획」(2009.6.)에 따라 기존 농림기술개발사업에서 식품부문을 분리‧확대하여 고부가가치 식품기술개발사업을 2010년부터 추진하였고 2014년 주요 성과로는 가공 부산물을 이용한 기능성 식품 소재 개발에 관한 기술이전이 있었다.
기능성강화식품, 전통웰빙식품, 식품 안전‧품질관리, 식품 핵심소재, 식품 기자재, 저탄소‧신가공 기술개발을 지원하고 있으며, 농업과 식품산업의 동반 성장을 도모하고 식품산업의 국제 경쟁력을 향상시켜 나갈 계획이다.
(2) 기술사업화지원사업
연구개발로 얻어진 우수한 원천 기술의 사장을 방지하고 산업화 단계로 진입할 수 있도록 기술사업화지원사업을 추진하고 있다. 기술사업화지원 사업은 2008년에 농림바이오기술산업화지원사업이라는 명칭으로 시작되었으며, 2011년 기술사업화지원사업으로 변경되었다.
기 개발․확보한 기술을 단기간에 산업화하는 현장연계 제품사업화 사업과 민간연구지원 조직 육성 사업을 중점 사업으로 추진 중이며, 2014년에는 산학 공동연구를 통한 발효음료 개발 및 대중화에 성공한 바 있다.
(3) 생명산업기술개발사업
동식물, 미생물 등 생명자원의 생산‧응용‧유지관리에 대한 연구개발을 통해 차세대 핵심산업인 ʻ생명산업ʼ을 육성할 목적으로 추진 중인 사업으로, 기존의 ʻ농림기술개발사업ʼ에서 농생명자원의 집중 육성을 목적으로 2011년부터 별도의 ʻ생명산업기술 개발 사업ʼ으로 분리하여 추진 중이다.
생명자원 생산․관리, 생명자원 부가가치 제고 등을 주요 사업으로 추진하고 있으며, 2014년에는 폐기되는 생물자원을 활용한 인공뼈 개발, 피부 항노화 기능성 소재 등을 개발하여 제품화에 성공한 바 있다.
(4) 골든시드1)프로젝트
종자산업의 기반을 구축하고 이를 토대로 종자산업을 수출전략산업으로 육성하기 위해 농식품부 등 4개 부‧청 R&BD사업인 골든시드 프로젝트 사업을 추진 중이다.
2012년도에는 본격적인 사업추진에 앞서 사전기획과 품목별 상세기획을 추진하였으며, 2013년부터는 GSP 채소종자사업단, GSP 원예종자사업단, GSP 식량종자사업단, GSP 종축사업단, GSP 수산종자사업단 5개의 사업단을 이끌고 갈 사업단장 및 프로젝트 연구기관을 선정하고 본격적인 연구를 추진 중에 있다.
(5) 농림축산검역검사기술개발 사업(검역검사 R&D)
1998년부터 추진되고 있는 본 사업은 구제역(FMD), 고병원성 조류인플루엔자 (HPAI)와 같은 국가 재난형 동물질병이나 국내발생 가축 전염성 질병 및 웨스트나일열, 중증열성혈소판감소증후군(SFTS) 등 해외 악성 가축전염병 및 식물 병해충의 유입방지를 위한 방역 및 검역기술개발로 관련 산업을 보호하고 인수공통 전염병 방제기술개발 및 축산물 안전성 관리기술을 개발하여 국민 보건 향상을 통한 국민의 안전한 삶 보장을 목표로 한다.
동물질병 예방 및 치료제 개발, 기후변화대응 신종질병 방제기술 개발, 해외전염병 검역검사기술 개발, 동물보호 및 동물용의약품 관리기술 개발, 식물검역기술 개발 연구 등을 수행 중에 있다.
(6) 차세대바이오그린21사업
본 사업은 우리농업의 신성장동력 창출과 우리나라의 세계 5위권 농업생명공학강국 진입을 목표로 최신생명공학 분야의 융복합을 통한 국가원천기술의 개발과 실용화, 기후변화와 식량안보 등 국가현안 대응을 위한 국가전략대응기술의 개발을 위해 산학연 대형공동 국책기술개발사업으로 추진되고 있다.
2011년부터 시작된 차세대바이오그린21사업은 1단계(2011~2014) 사업을 마무리하고, 2015년부터 2단계 사업을 진행 중에 있다. 1단계 지난 4년간 총 2,714억 원을 투자하였으며, 천연레티놀 합성 기술 개발, 탄저병저항성고추 개발, 고추유전체해독 완성, 천연물 조영제개발 등의 괄목할 만한 성과를 거두었다. 2014년도사업계획적 정성평가를 거쳐 현재 2단계 사업이 진행 중이며, 농생물게놈활용사업단, GM작물개발사업단, 동물분자유전육종사업단, 식물분자육종사업단, 농생명바이오식의약소재개발사업단, 시스템합성농생명공학사업단, 동물바이오신약장기 개발 사업단 등 7개 사업단을 지원하고 있다.
(7) 우장춘프로젝트
본 사업은 우장춘 박사와 같은 저명 과학자를 육성하여 세계적인 연구성과를 도출 및 미래 농업을 이끌어갈 신성장 동력을 창출하기 위해 기존연구사업과는 차별화된 사업운영으로 창의적‧도전적 연구 수행을 보장함으로써 세계 최상급 학술성과와 실용화기술 개발을 목표로 한다. 2010년부터 2019년까지 10년간 연간 50억 원의 규모를 지원하고 있으며 과제당 예산지원은 연 10억 원 내외로 최대화하고 연구팀의 자율성을 최대한 보장하고 있다. 최대 5년까지 연구를 진행하며, 2년간 기반연구를 수행한 후 단계별 평가를 통해 3년차(심화연구, 세계적 학술성과) 진입을 결정하는 방식으로 운영되고 있다.
(8) 포스트게놈다부처유전체사업
우리 고유자원에 대한 대규모 유전체 해독을 위한 밀레니엄 농생명자원 유전체 해독사업, 농림축산식품분야 생물정보 통합 및 활용을 위한 농림수산식품 바이오정보 고도화사업, 부처 공동사업인 국제협력사업을 지원하고 있다. 이를 위해 2014년부터 향후 8년간 668.7억 원의 예산을 확보하여 추진할 계획이다.
(9) 유용유전자 대량발굴 및 형질전환 작물 개발
농업생명공학기술 기초, 응용연구 확산 및 농산업화를 촉진하기 위해 작물과 미생물 유전체 연구, 오믹스 기반의 고부가 생물소재 기능성 유전자와 활용기술 개발 연구를 수행하고 있다. 대규모 유전자 기능 연구와 활용을 위해서 과발현 형질전환 집단을 육성하고 있고 기후변화 대응 등 생명공학기술을 이용하여 친환경 작물 육종소재를 개발하기 위한 연구를 하고 있다. 또한, 국립농업생명공학정보센터 (NABIC)를 중심으로 바이오 빅데이터 통합 및 생물정보 서비스를 실시하고 있다.
(10) GMO 국가관리 및 안전성 평가
유전자변형생물체의 국가간 이동 등에 관한 법률에 의거하여 농림축산업용 유전자변형생물체(GMO)에 대한 안전관리, 위해성심사 및 안전성평가에 관한 임무를 수행하는 농촌진흥청 연구개발 사업이다.
GMO 안전관리를 위해 GMO 실험 및 연구시설에 대한 안전성 검토, 현장 점검 등을 통한 안전성 확보와 수입 및 국내개발 농림축산업용 유전자변형생물체에 대한 농업용 환경위해성심사를 위해 전문가심사위원회 및 환경위해성평가기관 13개소를 지정 운영하고 있으며 GMO 안전성 평가기준 마련을 위한 가이드라인을 개발하고 있다.
국립농업과학원에서는 농업생명공학 기술로 개발된 농림축산업용 유전자변형생물체의 실용화를 위해 식품․환경 위해성평가 기술개발, GMO 격리시설 운영․관리, GMO 판별 모니터링 기술개발 및 환경영향조사 등을 수행하고 있다.
(11) 농업유전자원 국가관리체계 확립 및 활용
본 사업은 식물, 미생물, 버섯, 가축, 곤충 등의 농업유전자원의 다양성 확보, 활용을 위한 특성평가 DB 구축 등 유전자원의 정보를 종합하여 국가적 농업유전자원정보센터를 구축하고 인터넷 포털 등을 통해 이용자들에게 정보를 제공하고 있다. 농촌진흥청에서는 국가 농업유전자원의 효과적인 관리, 활용을 도모하고자 농촌진흥기관, 대학, 민간기업 등 98개의 농업생명자원 관리기관을 지정하여 유전자원의 수집, 증식 및 특성평가 DB화 등 국가적으로 유전자원을 관리, 지원하고 있다.
(12) 산림과학기술개발사업
산림과학기술개발사업은 산림청의 국가연구개발사업으로, 본 사업의 목표는 창조적 생명공학 기술개발을 통하여 산림자원의 활용도를 제고하고 임업을 첨단산업화 하는 것이다. 사업의 주요 내용은 임목 분자육종 기술개발, 신기능 유용물질 탐색 및 자원화, 세포공학을 이용한 고부가가치 창출, 유용유전자 분리‧규명, 산림생명자원 현황 조사이다.
산림청의 연구기관인 국립산림과학원(산림과학연구), 국립수목원(산림생물 종연구)에서 생명공학연구를 추진하고 있다. 산림청에서는 대학연구역량 강화를 위한 산림과학연구인력양성사업과 지역 특화 소득사업 기반 구축을 위한 지방임업연구를 통하여 생명공학기술을 이용한 산림소득 자원개발과 전문인력 양성을 추진하고 있으며, 임업현장실용화연구를 통하여 생명자원의 활용가치 증대를 위한 연구개발을 추진하고 있다. 또한 다부처 유전체 사업으로 산림자원 유전체 해독사업을 통하여 사시나무의 유전체 분석을 추진하고 있다.
다. 추진방향 및 발전과제
세계 주요 선진국들은 생명자원이 미래 강국의 중요 조건임을 인식하고 농업의 패러다임을 발 빠르게 바꾸고 있으며, 생명자원에 대한 주권을 강화하고 있다. 우리나라도 기존의 먹을거리를 생산하는 농업에서 미래성장가능한 산업으로의 전환이 필요한 바, 생명자원의 보고(寶庫)인 농식품 분야를 과학기술과의 융복합을 통해 차세대 핵심 산업으로 육성하고자 한다. 우리나라는 세계 6위의 생명자원 보유국으로 이를 적극 활용한다면 국가경쟁력을 갖출 수 있을 것이다.
이를 위해서 농식품 분야 생명공학 기술개발은 품종개량 등 전통적인 연구 외에도 기능성소재, 바이오에너지, 동물의약품 등 다양한 분야로 연구개발을 확대할 필요가 있다. 특히, 생명공학기술은 기술개발에 장기간이 소요되고, 복잡한 산업화 과정과 대규모 자본투입이 필요하다. 독자적인 원천기술을 지속적으로 개발해 나가는 한편, 산업화 실현이 전제로 이루어져야 하며, 농업소득과의 연계도 필요하다.
앞으로 농림축산식품부는 그 동안 먹을거리 생산으로 여겨졌던 농업을 동‧식물, 미생물 등의 다양한 생명자원을 활용하는 고부가가치 산업으로 육성하고자 하며, 이를 위하여 차세대 성장동력 분야에 투자를 확대해 나갈 계획이다.
6. 보건의료분야 연구개발 육성 정책
가. 개요
노인인구 증가, 생활습관 및 기후환경 변화에 따라 만성질환, 신‧변종 감염병 발생 가능성이 높아지는 한편, 지속적으로 증가하는 의료비용 부담 해소를 통해 지속가능한 보건의료체계를 구축하고, 질병 조기진단 및 난치병 극복을 통해 건강과 행복을 증진하고자 하는 국민적 요구가 증가2)함에 따라 보건의료기술 수요가 높아지고 있다.
한편 최근 과학기술의 패러다임은 과학기술을 활용해 삶의 질 향상을 추구하는 방향으로 변화하고 있으며, 기술개발의 성과물을 노인․장애인․중독 의료격차 등 사회문제를 해결하는데 활용하려는 움직임도 나타나고 있다. 특히, 개인 맞춤의료 시대에 대응하기 위해 빅데이터 연구, 유전체 등 첨단의료기술과 IT-NT 등의 융합기술개발, 기술개발의 성과물을 실제 임상에 적용하기 위한 중개임상연구 등에 대해 정부 뿐 아니라 사회 전체(Whole-of-Society)의 투자 강화가 요구되고 있다.
이러한 환경적, 기술적 요구사항은 보건의료적 측면에서 의료비는 절감하면서 의료서비스의 질은 높일 수 있는 ʻBetter care, Lower costʼ 이슈, 정책 제도적 측면에서는 빅데이터 활용 근거 마련, 줄기세포 연구임상규제 완화, 신의료기술 규제 완화, 디지털헬스케어 인허가 합리화 등의 요구로 표출되고 있다.
이에 우리 정부는 국정과제로서 ʻ보건산업을 미래성장산업으로 육성ʼ을 포함하여 보건의료산업을 창조경제 견인을 위한 핵심 산업으로 육성하고 글로벌 헬스케어 시장을 선점하고자 노력하고 있으며, 구체적으로는 제약산업 글로벌 10대 강국 도약, 첨단의료기기와 화장품 산업육성 지원, 신의료․융합서비스 발전을 위한 기반 조성, 한의약 세계화, 보건의료 R&D 기본계획 등의 추진계획을 수립‧시행하고 있다.
보건의료기술(Health Technology, HT)이란 궁극적으로 질병극복 및 국민건강증진을 목표로 BT, IT, NT와 같은 요소기술을 융합하여 인체적용을 목적으로 활용하는 기술을 총칭하며 하는 기술이다.
BT는 요소 기술 자체에 중점을 둔 반면에, 보건의료기술(HT)은 목적(기술의 활용)에 중점을 두고 있어, 보건의료기술(HT)와 BT는 개념상 큰 차이점을 보인다. 보건의료기술(HT)과 BT는 일부 중첩관계로, BT의 응용 범위 중 인체와 건강 관련된 제반 영역을 보건의료기술(HT) 관련 분야로 정의내릴 수 있으며, 대표적인 분야로는 제약, 의료기기, 의료서비스가 해당되며 최근에는 의료 전달체계와 같은 보건의료 시스템 및 서비스와 관련된 분야를 포괄하는 개념으로 발전하고 있다.

[그림 3-1-2] HT의 개념 및 범주
4).
미국은 2015년도 보건의료 연구개발 예산을 약 334.5억 달러(정부 R&D 투자 총액의 22% 규모) 투자하였고 ʻ브레인 이니셔티브(Brain Initiative)ʼ, ʻ정밀의료 이니셔티브(Precision Medicine Initiative)ʼ 등의 주요 시행계획을 발표했다. 영국은 ʻResearch Change Lives 2014-2019ʼ의 전략기획을 근거로 정밀의료 카터펄트 센터(Precision Medicine Catapult Center) 등 정밀의료 투자, 영국 주도 ʻ국제 iPS 세포은행ʼ 설립 추진, ʻ치매연구기금ʼ(Dementia Discovery Fund) 조성 등 전략적 보건의료 연구개발 투자를 추진하고 있다. 일본은 의료 분야의 기초연구 성과를 실용화로 연결하기 위한 중개연구 활성화 대책으로서 ʻ일본의료연구개발기구ʼ(AMED)를 설립하여 보건의료 분야의 기술별, 질환별로 구체적 연구개발을 추진하기 시작하였다. 우리 정부에서도 2009년 이후 보건의료기술(HT)의 개념 정립과 연구개발 투자를 지속적으로 확대하는 등 다양한 노력을 기울이고 있으나 선진국에 비해 여전히 투자비중과 규모가 낮은 수준이다
보건복지부는 보건의료기술(HT)을 활용한 건강사회 구축을 위해 ʻʻ국민건강 G7 선진국 도약, 2020 건강수명 75세 시대 달성ʼʼ을 비전으로 설정하고 5개 기본 방향(건강 수명 연장, 신성장 동력 창출, 국민 행복 실현, 연구자 친화적 생태계 조성)과 5대 추진전략(보건의료 R&D의 투자확대, 기술사업화 촉진, 성과관리 혁신, 관리프로세스 투명성과 전문성 제고, 보건의료 빅데이터 연계를 통한 개방형 플랫폼 구축)을 주요 골자로 하여 연구개발 투자, 인프라 구축 등을 지원하고 있다.
ʻ국민건강 G7 선진국 도약ʼ 비전과 목표 달성을 위한 HEALTH 5개 기본방향 중 ʻHealing 주요 질환 극복을 위한 R&Dʼ는 중개․임상연구 지원을 통해 기초연구 성과의 임상적용 연계 및 주요 질환 극복을 위한 효율적 연구 지원의 체계를 마련하기 위해 중개연구, 임상연구, 만성병, 한의약, 암분야의 사업으로 약 1,300억 원(2015년 기준)을 지원하였다.
비전
「 국민건강 G7 선진국 도약 」
- “2020 건강수명 75세 시대” 달성 -
|
목표 |
① 정부 R&D 중 건강 R&D 투자 비중 확대 ② R&D 기술 수준 : ('11) 72.6% → ('17) 75% ③ 산업별 세계시장 점유율 - 제약 산업 : (ʼ11) 0.4% → (ʼ20) 3.8% - 의료기기 산업 : (ʼ13) 1.2% → (ʼ20) 3.8% |
|
|
기본 방향 |
|
|||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||
|
|
추진전략 |
|
|||||||||
|
|
|
||||||||||
|
|
|||||||||||
[그림 3-1-3] 보건의료 R&D 정책방향
ʻEconomy, 첨단의료 조기실현 및 신산업창출을 위한 연구개발 확대ʼ를 위하여 신규 보건의료 T2B 기반구축, 미래제약바이오 특화지원, 시스템 통합적 항암신약, 범부처 전주기 신약개발사업 등의 신약개발사업을 지원하고, 첨단바이오의약품, 의료기기, 포스트게놈 다부처 유전체사업, 줄기세포와 재생의료분야 등에 약 1,935억 원(2015년 기준)을 지원하였다.
ʻAlert 보건복지 위기대응 R&D투자 강화ʼ의 경우 공공보건 차원에서 사회적 문제인 희귀질환, 저출산, 기후환경질환과 감염병 발생에 대응하고 이를 극복하기 위한 보건의료기술 개발에 대한 지원을 확대하고자 약 438억 원(2015년 기준)을 지원하였다.
ʻbetter Life 건강증진 및 돌봄 기술 투자 확대ʼ에서는 일상생활자와 건강한 삶을 지속시킬 수 있는 기술과 보건의료 서비스 체계를 구축하기 위한 사업을 지원한다. 구체적으로 정신건강, 고령친화, 보건의료서비스, 사회서비스, 여성건강 관련 사업에 약 177억 원을 지원하고 있다.
ʻTogetHer 연구자 친화적 생태계 조성ʼ은 산․학․연․병원 협력 연구와 보건의료 R&D 생태계 고도화를 위한 연구중심병원, 그리고 글로벌 연구전문인력 양성을 위한 사업, 의약품과 의료기기 연구 성과의 상용화 촉진을 위한 첨단의료복합단지 기반기술구축 등의 사업을 추진하기 위하여 약686억 원(2015년 기준)을 투자하였다.
지원 프로그램으로는 근거 법률에 따라 보건의료기술연구개발사업을 비롯하여 한의약선도기술 개발사업, 암정복추진사업, 질병관리연구사업 등으로 구분할 수 있으며 2015년 기준으로 4,535억 원을 지원하였다.
[표 3-1-17] 보건복지부 R&D 예산5)
(단위 : 억 원)
|
기관명 |
프로그램 |
2014년 |
2015년 |
|
한국보건산업진흥원 |
보건의료기술연구개발사업 |
3,274 |
3,444 |
|
한의약연구개발사업 |
122 |
182 |
|
|
국립암센터 |
기관고유사업 |
154 |
149 |
|
암정복추진사업 |
151 |
161 |
|
|
질병관리본부 |
질병관리연구사업 |
309 |
526 1) |
|
첨단의료복합단지 |
첨단의료복합단지기반기술구축 |
40 |
74 |
|
합계 |
4,050 |
4,535 |
|
나. 주요 연구개발 프로그램
(1) 보건의료기술연구개발
(가) 개요
보건복지부는 21세기 지식기반경제의 핵심 산업으로 등장하는 보건의료 분야를 국민건강 증진과 국가경제 발전에 이바지하는 고부가가치 국가 전략산업으로 육성․발전시키기 위하여 「보건의료기술진흥법」(1995)을 제정하여 ʻ보건의료기술연구개발사업ʼ을 추진해 오고 있으며, 지난 20년간(1995〜2015년) 약 3조 2천억 원의 정부연구개발자금을 지원했다.
보건복지부는 연도별 연구개발사업 시행계획을 수립하고, 전문기관인 한국보건산업진흥원에서 보건의료기술연구개발사업을 시행하며 단위사업은 [표 3-1-18]과 같다
(나) 지원내용
2015년도 ʻ보건의료기술연구개발사업ʼ은 국민의 삶의 질을 향상시키고 보건산업을 미래성장동력으로 육성하는 것을 목표로 다양한 세부사업으로 구성되어 있다.
주요 세부사업으로는 주요 질병 극복을 목표로 예방․진단․치료기술의 완성 단계를 높이기 위해 중개연구에 약 854억 원을 지원하였다. 또한 미래 패러다임 변화에 대응하고 산업경쟁력 강화를 목표로 유망 기술을 조기에 개발하기 위한 연구를 확대하여 줄기세포․재생의료, 보건의료정보, 장기이식․나노의학 등 융복합 분야, 신약개발에 약 790억 원을 지원하였다. 국내외 임상 실용화단계에 진입한 첨단 바이오의약품 개발을 집중 지원하는 ʻ첨단바이오의약품 글로벌 진출사업ʼ에 신규 75억 원을 투입하였고, 유전체 데이터를 기반으로 한 한국형 질병 진단을 위한 ʻ질환유전자분석 플랫폼기술개발사업ʼ을 신규로 시행하였다.
[표 3-1-18] 보건의료기술연구개발사업 단위사업
|
단위사업명 |
지원 분야 |
|
질환극복기술개발사업 |
○ 창의적 중개연구, 문제해결형 중개연구 ○ 임상의과학자연구역량 강화 ○ 공공보건기술개발 |
|
첨단의료기술개발사업 |
○ 줄기세포‧재생의료 실용화, 맞춤의료 실용화, 융복합 보건의료기술, 신약개발 지원, 제약산업 특화지원 |
|
임상연구인프라조성사업 |
○ 국가임상시험사업단(Ko-NECT), 근거창출임상연구국가사업단, 의료기기인프라, 질환유효성평가기반구축 |
|
감염병위기대응기술개발사업 |
○ 면역백신개발, 국가감염병위기대응 |
|
의료기기기술개발사업 |
○ 미래융합의료기기개발, 의료기기임상시험지원 |
|
선도형특성화연구사업 |
○ 선도형특성화연구사업단(수도권/비수도권) |
|
글로벌화장품신소재‧신기술 연구개발지원사업 |
○ 기능성 화장품 신소재 개발센터, 그린코스메틱 연구개발센터, 글로벌코스메틱연구개발사업단 |
|
포스트게놈다부처유전체사업 |
○ 맞춤의료를 위한 인간 유전체 이행연구, 유전체 이행연구 지원사업, 한국인 유전체 연구자원 정보생산 및 활용 |
|
범부처전주기신약개발사업 |
○ 범부처전주기신약개발사업단(신약개발을 위한 후보물질도출단계, 비임상‧임상단계) |
|
연구중심병원육성 |
○ 연구중심병원육성사업 |
|
시스템통합적항암신약개발사업 |
○ 항암제 개발을 위한 물질효능검증 및 보완 단계, 비임상‧임상단계 |
|
보건의료서비스 R&D사업 |
○ 의료서비스, 간호‧약료서비스 등 보건의료서비스 R&D 과제 발굴 및 지원 |
|
사회서비스 R&D사업 |
○ 사회환경 변화에 대응하기 위한 보편적 서비스개발, 취약계층을 위한 맞춤형 사회서비스 개발 등 |
|
정신건강기술개발사업 |
○ 인터넷 게임중독 해결 정신건강기술개발, 성범죄 문제 해결 정신건강기술개발, 정신건강 R&D 기반역량 강화연구 |
|
100세 사회대응 고령친화제품 연구개발사업 |
○ 100세 사회대응 고령친화제품 중점기술 |
|
첨단바이오의약품 글로벌진출사업 |
○ 국내외 임상 실용화 단계에 진입한 첨단바이오의약품 개발을 집중 지원 |
|
질환유전자분석플랫폼기술개발사업 |
○ 유전체 데이터 기반 한국형 질병 진단 소프트웨어 플랫폼 개발 |
|
첨단의료산업기반기술구축사업 (첨단의료복합단지) |
○ 대구‧오송 실험동물센터 및 임상시험신약생산센터 |
(2) 한의약선도기술개발
(가) 개요
인구의 고령화에 따라 만성․난치성 질환이 증가하고 세계적으로는 웰빙에 대한 관심과 친환경주의의 선호로 전통의학과 보완대체의학에 대한 수요가 급증하고 있다. 현대의학의 한계점을 인식하고 의료비의 증가를 억제하기 위하여 전통의학과 보완대체의학에 대한 관심이 커짐에 따라 세계 전통의학 시장은 계속 성장하고 있다(2008년 2,100억 달러 규모).
이러한 세계적인 관심 속에서 우리의 전통의학인 한의학적 접근방법을 통한 치료기술개발은 높은 경쟁력을 가질 수 있으므로 정부는 오랜 전통을 지닌 한의약의 경험과 지식정보를 이용하여 핵심 원천기술과 응용기술을 개발하고, 한의약의 안전성․유효성을 입증하여 국민보건향상과 한방산업에 기여하고자 1998년부터 「한방치료기술연구개발사업(2010 프로젝트)」을 추진하였다.
2008년 제1차 한의약육성발전 종합계획(2008〜2017)을 수립한 이후 한의약선도기술 개발사업으로 명칭을 변경하고 2011년 제2차 한의약육성 발전계획(2011〜2015년)을 수립하여 한의약 산업 발전을 위한 R&D 사업과 인프라 구축을 지원하고 있으며, 1998년부터 2015년까지 총 17년간 약 1,062억 원을 지원하였다.
(나) 지원내용
보건복지부는 한의약 산업 육성 및 경쟁력 강화를 비전으로 설정하고 한의약 분야의 과학화․표준화․제품화 연구개발을 통한 산업화 촉진을 목표로 한의약 R&D 선진화, 한방산업 발전 가속화, 한의약 R&D 혁신 기반 구축 등에 중점 지원하고 있다.
2015년에는 한의약선도기술개발사업을 통해 한약제제, 한방의료기기, 한의약 임상인프라, 한의씨앗연구 등에 107억 원을 지원하였으며, 한의학과 현대의학을 융합하여 새로운 치료기술 개발을 위한 양‧한방 융합기반 기술개발사업에 75억 원을 지원하였다.
(3) 암연구사업
(가) 개요
보건복지부는 국민보건 향상을 목적으로 암에 관한 전문적인 연구와 암환자의 진료 등을 위해 2000년에 「국립암센터법」을 제정하여 국립암센터를 설립‧운영하고 있으며, 암의 발생‧예방‧진단‧치료 및 관리 등에 관한 연구로 기관고유연구사업을 추진하고 있다.
아울러 1996년도에 제1차 암정복 10개년 계획(1996∼2006)을 수립하고 암정복추진단을 발족하여 암정복추진연구개발사업을 추진했으며, 현재는 제2기 암정복 10개년 계획(2006∼2015)6) 기간으로 지난 1기 기간에 축적된 기반을 바탕으로 국민의 암발생률 및 암사망률을 감소시키고 치료하는 데 주력하고 있다.
2003년부터 2015년까지 국립암센터 기관고유연구사업과 암정복추진연구개발사업으로 총 2,798억 원의 정부연구개발자금이 지원되었다.
(나) 지원내용
국립암센터는 기관고유연구개발사업(intramural program)과 암정복추진연구개발사업 (extramural program)을 상호보완적으로 추진하여 연구개발 성과를 극대화하고자 노력하고 있다. 특히 한국인의 주요 암(위‧간‧폐‧대장‧자궁‧유방)의 발생률 및 사망률을 낮추고 치료율을 제고할 수 있도록 단순 기초연구를 지양하고 기초연구와 임상연구 결과를 상호 유기적으로 연계할 수 있는 이행성 연구(중개연구)에 중점을 두고 있다. 또한 암 관련 기술개발을 통해 우리나라 생명과학 분야의 국가 경쟁력 향상에 기여하는 실용화 과제 수행을 지원하고 있다.
2015년 기관고유연구개발사업은 글로벌항암신약개발, 암 발생기전 연구, 첨단 암 진료기술 및 의료기기 개발, 신기술 실용화 지원 등에 149억 원을 지원하였으며, 암정복추진연구개발사업을 통해 암 중개융합연구, 공익적 암 임상연구, 암 예방․관리․서비스 연구 등에 161억 원을 지원하였다.
(4) 질병관리연구
(가) 개요
질병관리본부는 질병극복 및 미래 맞춤의료 대비를 위한 R&D를 추진하겠다는 모토 아래 산하 국립보건연구원을 주축으로 질병관리연구를 지원하고 있다. 국내 질병관리의 실무를 담당하는 질병관리본부의 연구사업 수행은 국내 발생 질병에 대한 현안 대응의 측면을 강조하고 있다. 주요 연구 분야는 국내 발생 감염병 및 만성질환에 대한 예방, 진단 및 치료 기술 개발연구와 질환 관련 유전체를 분석해 질병을 예측하려는 유전체연구이다.
(나) 지원내용
질병관리본부는 질병의 조사․감시․예방․진단․치료 등에 필요한 기술개발에 중점 투자하고 있으며, 보건복지부 소관 사업 중 인프라 구축 사업 또한 활발히 지원하고 있다. 특히 한국인 코호트, 질병코호트 및 유전형질 연구, 연구 자원을 수집․관리하는 국립중앙인체자원은행을 비롯하여 국립의과학지식센터, 국립줄기세포재생센터, 생물안전 특수복합시설 등 국내 연구자들에게 필요한 보건의료 연구 인프라를 구축․발전시키고자 노력하고 있다.

[그림 3-1-5] 질병관리본부 인프라 구축 현황
2015년 주요 연구개발 사업으로는 ʻ감염병 예방 및 관리에 관한 법률ʼ에 따라 국가관리 대상 감염병 관리를 위한 공익적 기반기술 개발과 국내외 공동대응, 관련 실험 인프라 조성을 위한 ʻ감염병 관리기술개발ʼ에 약 89억 원, ʻ감염병 위기대응 기술개발ʼ 중 감염병 예측과 조기감지 시스템 구축을 위하여 20억을 투자하였다.
또한 초 고령사회 진입에 따른 대응으로 주요 만성질환인 당뇨, 심뇌혈관질환, 치매, 비만 등에 대한 조사연구 및 예방, 관리지표를 개발하고자 ʻ만성병 관리기술개발ʼ에 약 73억 원, 한국인의 유전체 지도 작성과 분석, 마커발굴을 위한 ʻ한국인 유전체 분석기반 연구ʼ에 약 45억 원, 여성건강 및 질병 예방과 관리기술 개발을 위해 ʻ여성건강 융복합 기반기술개발ʼ에 약 27억 원, 국내 줄기세포와 재생의료 연구 활성화를 위한 인프라로서 ʻ줄기세포‧재생연구센터 건립ʼ에 약 73억 원과 ʻ줄기세포은행 운영 및 표준화 기반구축ʼ에 64억 원, 기후변화에 따른 질환과 매개체 감시, 발생예측, 피해저감을 위한 ʻ기후변화 급․만성질병연구ʼ에 25억 원 등 질병관리연구에 총 526억 원 규모를 지원하였다.
다. 추진방향 및 발전과제
보건복지부에서는 보건의료기술(HT) 발전을 통한 국민의 건강 증진과 보건의료산업의 경쟁력 강화를 위해 부처차원 뿐 아니라 관련 부처 간 협력 등 범부처 차원의 노력을 확대하고 있다. 이를 위하여 2013년 관계 부처7)와 함께 「국민건강을 위한 범부처 R&D 중장기 추진계획」을 수립하였고, 2014년에는 국가과학기술심의회에서 동 계획을 제1차 건의료기술육성기본계획(2013~2017)으로 채택하였다. 동 계획은 ʻ국민의 건강한 삶ʼ에 기여할 수 있는 R&D 투자를 활성화하고 건강 R&D 성과 창출 및 산업화의 촉진을 목적으로 하고 있다. 이를 실현하기 위하여 건강 전반에 대한 지속적 투자 확대와 글로벌 수준의 기술개발을 위한 선택과 집중, 성과 창출 형 R&D 지원시스템 고도화, 연구생태계 조성, 건강산업 발전 촉진을 위한 제도 개선 등 5대 추진전략을 추진하고 있다.
5대 추진전략을 주요 골자로 하여 2017년까지 보건의료 R&D투자비를 전체 국가 R&D 투자비중의 10%까지 확대하고자 사업 재구조화, 재원 다양화 등을 통해 연구비 규모를 확대하기 위해 노력하고 있다. 더불어, 연구성과의 기술사업화 연계를 강화하기 위한 사업선정절차와 방식을 개선하고 보건의료 R&D 연구(기술)성과의 산업화를 촉진하기 위한 노력도 병행하고 있다.
보건의료 R&D 관리프로세스의 투명성과 전문성을 제고하고자 복지부 3개 관리기관(한국보건산업진흥원, 국립보건원, 국립암센터)의 연구사업 관리 시스템의 일원화 등을 골자로 하는 ʻ보건의료 R&D 프로세스 개편방안ʼ을 마련하였으며 ʻ보건의료 R&D 기획자문단ʼ 구성, 개방형 기획 및 RFP 사전공시를 통해 기획을 강화하는 등 성과지향적인 전주기 R&D 관리방안을 시행하였다.
궁극적으로는 국민행복을 위한 보건복지부 미션에 부합할 수 있도록 보건의료 R&D를 국민(환자) 중심의 R&D로 전환하여 책임성을 강화하고, 국민 건강 증진과 보건산업 발전이라는 보건의료 R&D에 대한 국민적 요구에 선제적으로 대응할 수 있도록 지속적인 혁신을 추진할 계획이다.
7. 환경분야 생명공학 육성 정책
가. 기술개발 필요성
(1) 환경생명공학기술
환경생명공학기술(Environmental Bio Technology, EBT)이란 환경공학기술 (Environmental Technology, ET)과 생명공학기술(Bio Technology, BT)이 융합된 기술 분야로 생물, 분자생물학적기법과 생물학적 처리공정을 이용하여 환경오염을 예방(prevention) 및 감시(monitoring)하고 오염된 환경을 복원(restoration) 및 정화(remediation)하는 기술을 의미한다. 환경생명공학기술은 환경과학, 생태학, 분자생물학간의 유기적인 협조가 필요한 기술 분야로 생명공학기술의 기본적인 핵심기술8) 중에서 생물공정기술(발효공정제어, 분리정제, 배양기 설계‧제작)과 미생물이용기술(미생물분리‧배양, 항암물질 탐색기술)을 주로 활용하고 있다.
환경생명공학기술은 청정기술, 환경오염제어 및 관리기술, 바이오에너지기술 분야를 포함하며 이외에 생물학적 방법에 의한 오염의 검출(detection), 친환경 소재‧제품 개발, 생태계‧생물 다양성 유지, 토양‧지하수 복원, 기후변화 저감 및 적응에 필요한 기술 등으로 범위가 확대되고 있다. 환경생명공학기술은 근래 각 분야에서 개발되고 있는 첨단기술과 융합하며 기존의 환경기술로는 극복하기 어려운 한계를 해결할 수 있다는 점에서 그 중요성이 부각되고 있으며 전 세계적으로 추구하고 있는 지속가능한 성장(sustainable growth)의 핵심기술이라 할 수 있다.
(2) 환경산업 및 환경기술의 변화
환경기술9)의 개발목적은 현안환경문제의 해결이라는 수요와 이러한 환경정책의 요구에 부응하기 위한 환경산업10)의 발전과 상호 연관되어 있다. 1960년대부터 형성되기 시작한 환경산업은 주로 발생한 환경오염물질을 처리하는 사후처리 중심의 산업이었다. 그러나 1990년대 이후부터 환경오염물질을 사전에 예방하는 사전저감 중심의 산업으로 범위가 확대되었고, 최근에는 환경복원 및 재생에너지 관련 분야로 산업의 성장축이 이동하고 있다. 이에 따라 환경기술의 개발 방향도 사후처리기술 중심에서 청정공정기술, 신‧재생 에너지 개발기술로 변화하게 되었다.
21세기에 접어들어 지구환경 문제가 국제사회에서 중요한 의제로 대두되면서 환경과학 분야에 대한 수요가 증대되고 있다. 특히, UN을 중심으로 지구 온난화로부터 파생되고 있는 기후변화, 생물종 다양성 감소, 사막화 확산으로 발생하는 황사 등 복합적인 환경문제를 해결하고 자연환경 보전을 위해 세계 3대 환경협약11)을 체결하는 등 국제사회의 공동 대응 요구가 지속되고 있다. 이와 함께 전 세계적으로 신․재생 에너지 산업지원이 확대되고 환경 규제가 강화되고 있어, 기존 환경기술 및 환경산업으로는 새로운 환경변화에 적절히 대응하기 어려운 실정이다. 이를 극복하기 위해 환경융합 신기술(환경기술(ET), 생명기술(BT), 정보기술(IT) 및 나노기술(NT) 융합) 개발 촉진 및 환경바이오산업 분야 활성화에 대한 중요성이 증가하고 있다.
나. 기술개발 연구동향
(1) 세계동향
1990년대 이후, 기후변화 및 환경오염으로 인한 생태계 훼손으로 인해 자연보전 및 복원의 중요성이 부각되었고, 토양과 지하수의 환경적 순기능에 대한 중요성이 강조되었다. 또한 생태계 및 토양․지하수는 한번 오염되면 개선이 어려울 뿐만 아니라, 복원하는데 많은 시간과 비용을 필요로 한다. 이런 문제들이 중요하게 부각되면서 이에 대응하기 위해 생태계 복원기술 개발, 토양․지하수 보전․복원을 위한 자연친화적 정화기술도 집중 개발되고 있다. 생명과학 발전에 따른 유전자변형생물체(LMO), 내분비계 장애물질의 환경(인체, 생태계) 위해성이 부각됨에 따라 새로운 화학물질에 대한 위해성 평가 연구도 중요성이 커지고 있다.
유럽의 청정에너지 기술정책 이슈와 아울러 미국, 일본, 독일 등은 폐자원 및 바이오매스 에너지화 정책을 강화하고 있다. 유럽연합은 2020년의 최종에너지 소비에서 차지하는 재생에너지 도입목표 의무달성(전력․열․수송의 3부분)을 위해 바이오매스 자원을 적극 활용하는 것을 지원 및 추진하고 있다. 미국 에너지부(DOE)는 2022년까지 선도 바이오연료를 연간 210억 갤런(약 137만 BPD)제조 및 공급을 목표로 한 바이오리파이너리 프로젝트(Bio-refinery project)를 진행하고 있고, 중국은 2020년까지 신재생에너지를 전체 에너지 소비량의 15%까지 확대하겠다는 목표 하에 2008년에 생물연료(Biomass)에 대한 연구개발과 실증을 위해 2.9억 달러를 투자하였다. 이처럼 선진국들은 이미 국가 주도로 미래 국가 경쟁력 확보를 위해 융합기술에 대한 투자를 가속화하고 있으며 자국 산업의 경쟁력 확보차원에서 국제규모의 환경문제 대응기술 개발을 적극적으로 추진하고 있다.
또한 생물자원을 활용하여 환경을 복원하고 정화하기 위한 기술개발도 활발하게 진행되고 있다. 환경오염물질을 분해할 수 있는 세균 등 미생물에 대한 기능 연구를 통해 친환경 환경산업이 성장하고 있으며, 천적 생물종 연구를 통해 환경생태계 보전 기반도 강화되고 있다. 생물-생물간, 생물-무생물환경 간 상호작용 연구를 통해 훼손 환경‧생태계 복원 사업의 시장 규모도 점차 증대하고 있다.
(2) 국내동향
우리나라의 환경기술 관련 연구개발은 1992년 6월에 수립된 ʻʻ선도기술개발사업 (G-7프로젝트)ʼʼ의 환경공학기술개발사업으로 시작되었고, 이를 통해 1994년부터 유해 화합물 생물정화 기술개발, 침출수의 생물학적 처리기술개발, 환경오염물질의 생물학적 검출기법개발 등 환경생명공학분야의 연구개발을 추진하였다. 이어 환경부는 2001년부터 2011년까지 ʻʻ차세대핵심환경기술개발사업(이하 차세대사업)ʼʼ을 통해 환경생명공학 관련 연구개발을 지원하였다. 차세대사업 예산은 총 12,367억 원(정부 출연금 8,791억 원, 민간부담금 3,576억 원)이였고 그중 환경생명공학기술 분야에 지원된 투자규모는 총 예산의 약 22%인 1,940억 원을 차지했다.
2001년에서 2011년 사이 환경생명공학 관련 연구개발 과제는 생물정화 기술개발, 생태독성시험법 개발, 식물 추출물을 이용한 살충제 및 향균제 개발, 나노-효소 복합체 기반의 휴대용 잔류농약 검출용 바이오센서 개발 등이었다. 지금까지의(2015년 8월말 기준) 차세대사업의 생명공학 관련 추진실적을 보면, 지식재산권 출원․등록 6,450건, 국내․국외 학술지 게재 5,778건 등의 과학적 성과를 달성하였다. 또한, 기술실시계약을 통해 3,409억 원, 국내․외 공사수주 및 제품판매 5조 2,562억 원 등의 산업 경제적 성과를 보였다. 이후, 환경부는 2011년부터 ʻʻ차세대 에코이노베이션기술개발사업(이하 차세대 EI사업)ʼʼ을 시작하여 2020년까지 총 1조 4,930억 원을 투자할 계획이며, 그 중 총 예산의 20%이상을 환경생명공학기술 분야의 사업에 지원할 예정이다. 그간(2011년부터 2015년 8월말 기준) 차세대 EI사업을 통해 지식재산권 출원․등록 309건, 국내․국외 학술지 게재 206건의 성과를 내었다. 또한 환경융합신기술개발사업, 생활공감 환경보건기술개발사업, 폐자원 에너지화기술개발사업 및 토양․지하수오염방지기술개발 사업을 통해 다양한 환경생명공학기술 분야를 육성 하고 있다.
이처럼 여러 지원 사업을 통해 환경생명공학기술은 단순히 연구개발에 그치는 것이 아니라 고부가가치 창출을 이루고 있고 종래 환경기술의 경제성, 지속가능성 및 경쟁력 향상을 이루고 있다.
|
사업명 |
사업년도 |
전체 사업과제 |
전체 중 BT관련 과제 |
|||
|
과제수 |
국고지원금* (단위: 억원) |
과제수 |
국고지원금 (단위: 억원) |
% |
||
|
차세대사업 |
ʼ01~ʼ10 |
1,238 |
8,791 |
378 |
1,940 |
22 |
|
차세대EI사업 |
ʼ11~ʼ20 |
32 |
580 |
11 |
217 |
37 |
|
환경융합신기술개발사업 |
ʼ09~ |
32 |
324 |
9 |
78 |
24 |
|
생활공감 환경보건기술개발사업 |
ʼ12~ʼ21 |
5 |
314 |
2 |
206 |
66 |
|
폐자원 에너지화기술개발사업 |
ʼ13~ʼ20 |
192 |
1,149 |
16 |
172 |
15 |
|
토양․지하수오염방지기술개발사업 |
ʼ08~ʼ17 |
120 |
759 |
9 |
132 |
17 |
* 집계기준으로 완료 또는 진행 중인 사업과제의 총 지원금
다. 주요 연구분야
활발히 진행되고 있는 환경생명공학 연구 분야는 청정바이오소재 개발 분야와 식․생물을 이용한 폐기물 저감 및 오염물질 정화기술 분야 그리고 폐자원 및 바이오매스의 에너지화 기술로 요약된다.
(1) 융합기반 청정기술
환경오염 문제가 심각한 사회문제로 대두되면서 기존 고분자 화합물의 대체물질로 생분해성 고분자의 중요성이 크게 부각되고 있다. 재생 가능한 원료로부터 생산되어 사용 후에는 생분해되어 이산화탄소, 물 등으로 변환되기 때문에 자원 순환형 시스템을 구축하는데 가장 이상적이라 할 수 있다. 청정기술에는 공정관련 청정기술, 생물농약, 생분해성소재, 청정 유기용재 개발 및 생산기술 등이 포함된다. 현재 수행하고 있는 연구과제의 예는 아래와 같다.
|
○ 폐식물성오일 기반 바이오 탄성체의 제조기술 개발 |
|
- 연구기간 : 2009년 6월 ∼ 2014년 5월 - 연구목표 : 고분자물질과 폐식물성 오일을 결합시켜 기존 석유 고분자재료를 대체할 수 있는 바이오 탄성체(elastomer) 제조 기술 개발 |
|
○ 균주개량을 통한 폐글리세롤로부터 프로판디올의 제조와 scale-up 공정기술 개발 |
|
- 연구기간 : 2009년 6월 ∼ 2014년 5월 - 연구목표 : 바이오디젤 생산시 부산물로 발생하는 글리세롤을 생물학적 공정을 통해 섬유합성 원료인 1,3-프로판디올을 생산 |
|
○ 폐 작물부산물을 이용한 젖산 및 생분해성 수지 대량 생산기술 개발 |
|
- 연구기간 : 2011년 5월 ∼ 2014년 3월 - 연구목표 : 비식용인 작물 폐기물을 활용하여 고분자량 PLA 최적 중합기술을 개발하여 자동차 내장재용 sc-PKA 얼로이(alloy) 및 컴포지트(composite) 기술 개발 |
|
○ 기능성 고분자폴리머를 이용한 식생복원용 토양개량제의 개발 |
|
- 연구기간 : 2013년 5월 ∼ 2016년 3월 - 연구목표 : 고분자폴리머, 이온치환 폴리머, 미생물을 혼합한 식생복원용 토양개량제를 개발하고 나이지리아 현지 사막화에 적용하여 기후변화에 따른 건조지역을 안정적으로 녹화시키는 기술 |
|
○ 토양미생물의 biomineralization과 산업폐기물을 이용한 국내 외 중금속 오염부지의 hybrid형 불용화 기술 개발 |
|
- 연구기간 : 2015년 7월 ∼ 2018년 3월 - 연구목표 : 토양미생물, 불용화제를 활용하여 오염토양(광물찌꺼기)을 고결하는 오염정화 기술 개발 |
|
○ 바이오 고분자 기반 광학 센서 개발을 통한 중금속 및 유기오염물질 검출 현장측정용 kit 및 중금속 정화공정 개발 |
|
- 연구기간 : 2015년 4월 ∼ 2018년 3월 - 연구목표 : 오염물질과 선택적 결합‧분리 특성이 높은 바이오 고분자를 활용하여 현장내의 중금속 및 잔류성 유기오염물질의 측정센서 개발 |
(2) 환경오염제어 및 관리
신환경오염물질(미량 유해 물질 포함)에 대한 새로운 환경모니터링 기술12)이 요구됨에 따라 세포 칩 개발 등 세포내 유해성 관리 모니터링까지 그 범위가 확대되고 있다. NT, IT가 융합한 환경 바이오모니터링에 의해 나노수준의 환경문제 기작 규명이 가능해 지고 있다. 환경오염제어 및 관리기술에는 식․생물 정화기술, 환경오염측정 기술, 생태계복원 기술 등이 포함된다. 현재 수행하고 있는 연구과제의 예는 아래와 같다.
|
○ 실제 환경에서 인간에 대한 VOCs 노출 사전예측 생체 지표 개발 및 활용 연구 |
|
- 연구기간 : 2010년 6월 ∼ 2016년 3월 - 연구목표 : 유전체 분석기법과 단백질 지표를 활용하여 환경위해물질에 대한 인체 위해성 예측 시스템 개발 |
|
○ 하폐수 처리용 분리막-생물 반응 시스템의 에너지 저감을 위한 정족수 감지 억제제 개발 |
|
- 연구기간 : 2012년 10월 ∼ 2017년 3월 - 연구목표 : 환경분야 생물막오염 문제에 정족수 감지 억제 기술을 적용하여 기존기술 대비 40%이상의 에너지 절감 효과의 원천기술 개발 |
|
○ 조류생물자원 이용 바이오센서 기술 개발 |
|
- 연구기간 : 2011년 5월 ∼ 2016년 3월 - 연구목표 : 미세조류를 이용한 항산화 물질 개발 및 항산화 기작 유전자를 이용한 Biosensor 개발 - 홍조류 섬유 개발에 이용 가능한 50종류의 생물 자원 탐색 및 Haplotype 분석 - Agar와 홍조류 섬유를 이용하여 친환경적이고, 기능성과 인체 친화성을 높인 생분해성 Agar 마스크 팩을 개발하여 국내 및 국제시장에 진입 |
|
○ 실내 라돈 진단 및 모니터링을 위한 보급형 실시간 검출기 개발 |
|
- 연구기간 : 2015년 5월 ∼ 2017년 3월 - 연구목표 : 무선 등 통신기능 및 Data 저장이 가능한 실내 라돈 측정 기술 및 검출기기 개발, 기존 국외제품 대비 가격경쟁력을 확보하고, 휴대가 간편하도록 보급형 기기를 개발하는 등의 국산화 기술 개발 |
|
○ 매몰지 사후관리 평가기술 및 안전성 확보기술 개발 |
|
- 연구기간 : 2012년 4월 – 2017년 3월 - 연구목표 : 토양․지하수 오염 특성을 고려하여 가축 매몰지내 병원성 미생물 등의 오염물질 제어 및 정화 기술 개발 |
(3) 폐자원 에너지화
폐자원 에너지화 기술은 가연성 폐기물, 유기성 폐기물, 매립가스, 산업 폐가스 등을 열화학적 또는 생물학적 방법으로 열, 전력, 수송연료 등으로 에너지화 하거나 폐화학제품의 화학전환에 의해 화학원료로 전환하는 기술이다. 혐기성 폐수 처리과정에서 발생하는 바이오가스는 대체에너지로 사용하는 연구와 친환경적인 바이오소재를 이용하여 금속을 제거 회수하는 연구가 증가 하고 있는데 이는 촉매 사용량을 최소화하고 오염물질은 효과적으로 제어할 수 있는 기술이다. 뿐만 아니라 회수된 자원을 다시 ET, IT, NT 분야에 활용하여 고부가가치 소재를 만들어 낼 수 있다. 현재 수행하고 있는 연구과제의 예는 아래와 같다.
|
○ 한국형 유기성 폐자원 바이오가스 에너지화 기술 및 복합악취 제어기술 개발 |
|
- 연구기간 : 2013년 12월 ∼ 2019년 5월 - 연구목표 : 유기성폐자원(음식물 폐자원, 가축분뇨 등)을 혐기소화, 가스정제, 악취제어 등을 통하여 바이오가스를 생산할 수 있는 한국형 기술개발 |
|
○ 유기성폐자원을 이용한 바이오부탄올 연료화 기술 개발 |
|
- 연구기간 : 2013년 12월 ∼ 2019년 5월 - 연구목표 : 혼합당 발효균주를 통해 폐목재 등 유기성폐자원으로부터 자동차 연료 등으로 활용 가능한 비아오부탄올을 생산할 수 있는 기술 개발 |
|
○ 미세조류를 이용한 가축분뇨 고도처리 및 Bio-fuel 생성 기술 개발 |
|
- 연구기간 : 2011년 11월 ∼ 2015년 9월 - 연구목표 : 가축분뇨공공처리장에서 발생하는 이산화탄소를 고정하는 미세조류를 배양하여 질소, 인의 고도처리, 바이오디젤 생산용 lipid 생산, 잔류조류바이오매스를 활용한 혐기성 바이오가스 생산을 동시에 구현하는 폐수처리 공정 기술 개발(선진화) |
|
○ 돈분뇨의 바이오에너지 회수 및 퇴비화 기술 실증 |
|
- 연구기간 : 2011년 11월 ∼ 2014년 9월 - 연구목표 : 낮은 메탄 회수율, 발효폐액 처리의 어려움 등의 이유로 귀중한 유기질 자원 이지만 바이오에너지 생산에 잘 이용되지 못하고 있는 돈분뇨슬러리를 비롯한 가축분뇨 문제를 해결함으로서 바이오에너지 생산에 적극적으로 이용 |
|
○ 위해성을 고려한 음폐수 처리 및 에너지 회수 최적화 기술 |
|
- 연구기간 : 2012년 12월 ∼ 2015년 9월 - 연구목표 : 해양투기를 대체하는 육상처리 대책으로서 생활폐기물 소각로에서 음폐수를 혼합 소각하는 음폐수 병합 처리기술을 개발하고 이로부터 폐열회수를 극대화하는 최적기술을 구현 |
(4) 생물자원을 활용한 환경복원‧정화
기후변화에 따른 과학적이고 장기적인 한반도 생태계 변화 관리체계와 생물다양성 보전대책 수립을 위해 2004년부터 최근까지 ʻʻ국가 장기 생태 연구사업ʼʼ 및 ʻʻ생물자원 보존 종합대책 사업ʼʼ을 통해 생태변화 모니터링, 생태계 변화 예측모델 개발 및 영향평가를 수행하였고, 생태계 위해 외래생물종의 피해 저감 관리 강화 및 국내 고유생태계를 보호하기 위해 ʻʻ생물자원 발굴‧분류 연구사업ʼʼ을 통해 자생생물과 고유종, 그리고 해외 생물자원의 발굴‧확보 관리 인프라를 구축하였다. 근래에는 한반도 생물종/생물자원 다양성 관리 및 생물자원 산업화 육성기반 마련을 위해 유용생물자원 기능별 실용화기술개발에 투자하고 있다. 현재 수행하고 있는 연구과제의 예는 아래와 같다.
|
○ 센서네트워크 기반 기후변화에 따른 한국 아고산 생태계 모니터링 플랫폼 기술 개발 |
|
- 연구기간 : 2013년 5월 ∼ 2016년 3월 - 연구목표 : 생태계 분석 및 예측을 위한 생태 정보의 기술의 표준화 및 공동활용 기반구축을 통해 한국 아고산 생태변화 및 환경오염을 실시간 모니터링할 수 있는 센서네트워크 시스템 개발 |
|
○ 매토종자, 현장 발생토 및 임목폐기물을 이용한 생태복원기술 개발 |
|
- 연구기간 : 2011년 5월 ∼ 2014년 3월 - 연구목표 : 건설공사, 하천공사 현장에서 발생하는 매토종자, 표토, 임목폐기물을 활용하여 개발 현장의 생태계 재생 최적기술과 이를 국내 현실에 적용한 정책 개발 |
|
○ DMZ일원 훼손지역의 자생종 활용 생태복원기술 개발 |
|
- 연구기간 : 2014년 5월 ∼ 2017년 3월 - 연구목표 : DMZ 일원을 포함한 생태적 중요도가 높은 지역의 현지 식물자원 확보 및 종자를 이용하여 생태복원용 소재 및 특수묘목 생산시스템 구축 |
|
○ 멸종위기종 등 자생식물종 보존을 위한 습지조성관리기술개발 |
|
- 연구기간 : 2014년 5월 ∼ 2017년 3월 - 연구목표 : 멸종위기종 등 자생식물종 보존을 위한 습지조성관리기술 개발을 최종 목표로 습지식물 inventory 구축, 습지생태계 유형별 분류, 생육유도 방안 모색, 자생식물 식재방안 도출 및 퇴적물 생태 위해성 평가 방안을 수립하여 기수습지와 담수습지에 이르는 습지생태계 유지관리기술 매뉴얼 구축 |
|
○ 생태계 복원‧환경 평가 지표 생물자원 개발 |
|
- 연구기간 : 2011년 5월 ∼ 2016년 3월 - 연구목표 : 훼손된 생태계를 복원하고 환경을 평가하기 위한 지표종을 개발하기 위하여 국내의 생태계를 대표할 수 있는 자생생물종을 탐색하여 지표종을 선정하고, 실내에서 지속적으로 사육 가능하도록 인공사육 및 대량사육 기술 개발 |
|
○ 바이오연료 생산과 바이오매스 회수를 결합한 식물재배정화법 설계 표준 개발 |
|
- 연구기간 : 2012년 4월 ∼ 2015년 3월 - 연구목표 : 식물을 이용해 중금속 오염토양을 정화하고 이용된 식물에서 바이오연료를 생산하고 매스를 회수하여 자원으로 재활용하는 기술 개발 |
라. 향후 추진방향
환경기술 개발은 현안인 환경오염문제를 해결하는 것 뿐만 아니라 점증하는 국제 무역환경규제에 효과적으로 대응하기 위해서도 그 중요성이 더욱 증대되고 있다. 개발과 보전이 조화를 이루는 지속가능한 사회구현을 위하여 환경기술 개발이 국가 경쟁력 제고에 필수요소가 되고 있는 것이다. 특히 다변화되고 복잡한 환경시장에서의 경쟁력을 확보하기 위해서 국내 환경공학기술 수준을 선진국 대비 80%까지 제고하는 한편, 신 환경융합기술 개발에 적극적으로 투자해야 한다. 이에 환경부는 차세대 에코이노베이션 기술개발 사업 내 ET-BT 융합기술 지원 및 생명공학 분야 강화를 위한 신규과제(RFP)도출 및 투자규모를 확대할 것이고, 생명공학 원천기술 후속으로 사업화를 위한 실용연구를 지원할 계획이다. 또한 기존 토양‧지하수 실용화 연구 지속 추진 및 기존 ET-BT 융합 원천기술 분야 신규과제 지원을 확대할 예정이다.
8. 해양수산분야 생명공학 육성 정책
가. 개요
해양수산생명공학(Marine Biotechnology, MBT)이란 ʻ해양 생물체 내에서 일어나는 현상, 구조 및 기능을 이해하고, 그로부터 얻어진 지식을 활용하여 제품을 생산하거나 서비스를 제공함으로써 산업 및 인류복지 증진에 응용하는 과학기술ʼ을 총칭한다.
(1) 해양수산생명자원의 가치
해양수산생명공학의 원천이라 할 수 있는 해양수산생명자원은 이용 잠재력이 큰 차세대 신물질 개발의 보루이다. 해양은 지구 표면적의 70%정도를 차지하고 있으며, 지구 생물종의 80% 정도가 서식하고 있다. 한편 매년 지구상에서 생산되는 2,000억 톤의 광합성량 중 90%가 해양에서 이루어지고 있다. 갯벌 및 연안에서부터 심해, 열대, 한대에 이르기까지 다양한 해양공간에 광범위하게 분포하는 해양생물들의 가치는 기후조절, 오염물질 자정능력만 계산되어도 육상의 2배인 연간 26조 달러에 이르는 경제적 가치를 지니는 것으로 추정된다.
해양수산생명자원은 해양생물자원, 해양생물다양성 및 해양생명정보를 포함하며, 생명공학연구 또는 산업을 위하여 실제적이거나 잠재적인 가치가 있는 자원을 포함한다. 해양에 서식하는 생물은 육지에서와는 달리 높은 수압과 염도, 저온에 적응하고 진화하며 살아 왔기 때문에 육상생물에서 발견할 수 없는 특이한 대사물질 및 생리활성물질 등을 생산한다. 이러한 해양생물에서 유래한 유용물질은 식품, 의약 및 화학 등의 분야에서 관심을 받으며, 해양생명공학의 주요 자원으로 급부상하고 있다. 특히 육상생명자원의 경우 이미 메커니즘이 밝혀져 있는 경우가 대부분이고, 대다수 선진국들이 특허를 보유하고 있는 경우가 많다. 그러나 해양수산생명자원의 경우 아직 국제적으로 연구가 미진한 분야이므로 우리의 노력 여하에 따라 원천기술 확보의 가능성이 높은 분야이다. 산업화 측면에서도 해양수산생명자원은 가능성이 매우 높은 분야이다. 일반적으로 육상생명자원의 산업소재화 성공률은 1/13,000 정도이나, 해양수산생명자원의 산업소재화 성공률은 1/6,000 정도로 성공률이 두 배 정도 높게 나타나고 있다.
해양수산생명자원의 가치가 높아짐에 따라 해양수산생명자원을 확보하려는 국가간 경쟁이 치열해지고 있다. 더욱이 나고야의정서 발효(2014.10.)로 세계적인 생명자원 주권화 추세 등 유용 해양수산생명자원을 확보하려는 경쟁이 국제적으로 심화되고 있는 추세이다.
(2) 해양생명공학산업의 개요
해양생명공학산업은 해양생물체의 시스템, 구성성분, 과정 및 기능을 활용한 제품과 서비스를 생산하는 산업을 의미하며, 정보통신산업 이후 국가 경제성장의 핵심산업이 될 분야이다. 또한 고도성장의 잠재력을 가지고 향후 경제발전을 이끌 부가가치산업으로 기술‧정보‧지식 집약형 첨단산업이다.
해양생명공학분야는 특징적으로 해양천연물 또는 해양생물에서 기원한 의약재와 고분자물질, 화학소재 등을 생산하며, 원천기술 확보가 용이하여 독점적 물질특허권 확보가 가능하다. 또 유용신물질 발견율과 제품화 비율이 높으며 신제품 개발기간의 단축이 가능하고, 극한환경 미생물의 생체기능을 이용하기 위한 특수기술이 필요하다. 그리고 대량배양 등의 고유한 영역을 지닌다는 특징을 가지고 있다. 이러한 특징들은 해양생물자원을 활용하여 창출할 수 있는 분야의 다양성이 매우 높다는 것을 의미한다.
해양생명공학의 세부 분류군을 살펴보면 해양생명공학산업의 범위와 중요성을 알 수 있으며, 다음과 같은 다섯 가지 응용산업 분야를 포함하고 있다.
[표 3-1-20] 해양생명공학 응용산업 분야
|
대분류 분야 |
세부 응용산업 분야 |
|
건강/의약 (Health/Medicine) |
항생제, 항산화제, 항암제, 항혈전제, 치매질환예방, 효소저해제 |
|
에너지 (Energy) |
바이오에탄올, 바이오부탄올, 바이오디젤, 바이오가솔린, 바이오수소, 바이오매스 |
|
기능성 생활소재 (Functional Life form) |
해양식품, 미세조류, 저서동물, 어류, 해조류 |
|
산업용 소재 (Industrial Material) |
고분자 바이오센서, 천연색소, 화장품, 바이오세라믹 |
|
환경 (Environment) |
적조방제, 유류오염, 중금속 |
출처 : 한국해양과학기술진흥원. (2012).「해양생명공학사업」성과분석 및 미래예측을 통한 중장기 추진계획 수립 연구., p3.
해양생명공학의 중요성이 증가함에 따라 2006년 OECD는 ʻ생명과학에 의한 새로운 발견들이 관련 제품의 보급이나 서비스의 향상을 통하여 인류에 편익을 제공하는 다양한 경제활동을 포괄하는 새로운 개념ʼ으로 IT발전에 버금가는 효과를 갖게 될 것으로 전망했다. 또한 다가오는 미래를 ʻ바이오경제(Bio-Economy) 시대ʼ로 선언했으며, OECD 생명공학분과에서는 2011년부터 주요 논의 주제로 ʻʻ해양생명공학ʼʼ을 다루고 있다.

[그림 3-1-6] 해양생물의 적용분야
(3) 수산생명공학산업의 개요
수산생명공학기술은 수산생물의 현상 및 기능을 이해하고 이를 활용함으로써 수산업의 가치 창출에 이용되는 과학기술이다. 수산생명공학기술이 추구하는 목적은 체계적으로 수집‧관리된 수산생명자원을 활용하여 수산업을 고부가가치 생명산업으로 육성하는 것이다. 기술의 범위는 원천기반기술, 식량‧식품자원 개발기술, 첨단 수산소재 개발기술이며, 원천기반기술에는 수산생명자원 분석 및 활용 연구, 수산생물 유전체 연구, 식량‧식품자원 개발기술에는 수산생물 육종연구, 수산생물 형질전환 및 안전관리 연구, 첨단 수산소재개발기술에는 친환경 수산 바이오소재 개발, 수산생물 유래 고부가가치 기능성 물질 개발이 포함된다. 최근 수산생명자원의 중요성이 증대되면서 자국에서 중요한 수산생물 유전체 해독, 특수 환경에 서식하는 수산생물에서 바이오 소재 개발 등 수산생물자원 기반의 새로운 연구 영역이 확대될 것으로 예상된다.
나. 주요국의 해양수산생명공학 육성 동향
(1) 미국
미국은 세계 해양바이오산업의 약 45%를 점유하고 있는 세계 최고의 해양바이오 강국이다. 미국은 해양 정책(Our Nation and Sea, 1969) 수립을 통하여 해양과학기술 개발에 주력하였으며, An Ocean Blueprint for the 21st Century(2004)를 새로운 국가 해양 정책으로 채택하여 7개 중점과제를 선정하여 기술개발을 추진하고 있다.
미국정부의 해양바이오 관련 연구 및 기술개발을 위한 프로그램은 해양 대기청(NOAA), (미)국립과학재단(NSF)에서 중점적으로 추진하고 있다. NOAA는 해양 및 수산과학, NSF는 기초 해양과학 기술 등을 중점적으로 지원하고 있다. NOAA의 경우 대표적 해양생명공학 정책인 씨그랜트 프로그램(Sea grant program)을 통해 200개 이상의 대학과 기관에 해양생명공학 프로젝트 자금을 지원하고 있다. 전 세계 해양 미생물의 환경 유전체분석 프로젝트를 진행하고 있으며, 해양생명공학 분야의 벤처기업을 적극 육성하고 있다. 1천 여 건 이상의 해양신약물질 특허를 보유하고 있으며 활발한 산업화를 촉진하고 있다. 현재는 2013년 발표한 ʻ국가해양정책실행계획ʼ의 주요 전략의 하나로서 해양생명공학에 대한 정책을 추진하고 있다.
(2) 일본
일본은 해양생명공학 기술개발을 꾸준히 추진함으로써 해양생명공학 분야의 전통적인 강국으로 자리매김하고 있다. 해양관련 정책을 총괄하는 종합해양정책 본부의“제2차 해양기본계획(2013〜2017)ʼʼ의 경우 해양바이오를 활용한 산업 창출을 강조하고 있다. 해양 미 이용 바이오매스자원의 활용을 도모하기 위한 미이용 바이오매스자원 수집을 추진하고, 이를 활용한 산업적 연구개발사업을 실시한다. 특히 해저 미생물권에 대해 미지의 생명기능을 탐색하고 유효이용으로 이어가는 것을 목표로 한 연구개발을 실시한다.
대표적 연구기관인 해양과학기술연구센터(JAMSTEC)와 해양생명공학연구소(MBI) 등을 중심으로 산‧학‧연의 합동연구가 활발히 진행되고 있다. 특히 JAMSTEC은 심해미생물 분야를 중점분야로 선정하고 최근 10년간 5천 여 억원을 지원하여 심해미생물 분야에서 세계 최고의 위치를 선점하고 있다.
(3) 유럽연합
유럽연합 내에서는 기본적으로 회원국 간의 경쟁과 화합이 공존하고 있으며, 해양생명공학에 있어서 선두국인 미국과 일본을 추격하는 것을 목표로 정책을 추진하고 있다. 미국경제를 추격하기 위해 마련한 신 리스본전략(2005)을 실현하기 위한 ʻ제7차 프레임워크 프로그램(FP7)ʼ에서 중점 육성분야에 해양바이오 관련기술을 포함시키고 있다. 유럽연합집행위원회(European Commission, EC)는 성장과 고용창출을 위한 해양부문의제로서 제출한 ʻ청색성장보고서(2012)ʼ에서는 유럽의 해양산업 5대 중점육성분야로 해양생명공학을 선정하여 관련연구의 중점지원을 추진하고 있다.
국가별 해양생명공학 정책을 살펴보면 영국은 ʻBioscience 2015ʼ 장기발전계획에 맞추어 연도별로 정부의 강력한 지원을 통해 해양바이오 분야를 육성하고 있으며, 독일은 ʻBioIndurtry 2021ʼ을 추진함으로써 산‧학‧연 협력을 통해 해양생명공학 분야의 산업기반을 확대하고자 노력하고 있다. 프랑스는 해양연구소(IFREMER)의 주도로 심해 생태계 조사 및 심해열수 조사를 진행하였으며, 미생물의 분리와 효소류, 다당류 등을 미생물에서 분리하여 유용 물질을 발효 생산하기 위한 연구를 중점적으로 추진하고 있다.
(4) 노르웨이
풍부한 해양생물 다양성을 가진 국가로서 세계적인 수산업 강국으로 해양생명공학 분야에서도 높은 잠재력을 가지고 있다. 정부주도로 개발한 대서양 연어 선발육종을 통해 최고 품질의 대서양 연어 종자를 확보하고 질병제어, 사육기술 및 시설 개발을 통해 세계 연어 시장의 주도하고 있다. 현재 해양양식은 노르웨이 제2의 산업으로 발전해서 GNP 4.3%를 창출하고 있다. 연어, 고등어와 같은 해양생물 소재를 활용한 DHA 및 EPA 기능성제품으로 연간 2천 억 원 이상의 매출을 올리고 있다. 노르웨이는 정부차원에서 해양수산생명공학산업을 미래 선도 산업으로 선정하여 해양자원, 신약, 식품 등 7개 분야 센터에 R&D 예산을 지원하고 있다.
(5) 중국
중국은 식량생산을 위해 1996년부터 2005년까지 해양생명공학육성 정책으로 ʻ해양생명공학 863 프로그램ʼ을 운영하였다. 양식 생물 육종, 양식 생물의 질병 제어, 사육시설 개발, 의약품 개발, 유전체 등 다양한 생명공학 연구를 추진해 왔다. 2007년 이후 부터는 식품생산 외에 해수양식, 수산물 가공뿐만 아니라 해양생물의약산업에서도 성과가 나오기 시작했다. 2010년에는 해양과학기술 모든 분야에 걸친 ʻ해양과학기술개발 2050로드맵ʼ을 수립하여 해양수산생명공학 육성전략을 추진하고 있다. 관련 연구로는 해양수산생물자원의 지속적인 이용 및 보전, 해양수산생물 유전체, 해양수산생물자원 개발 및 산업화 등이 있다.
(6) 주요국의 수산생명공학 육성 동향
미국, 일본, 중국, 노르웨이 등 국가들은 수산생명공학기술의 중요성을 인식하여 수산생명산업을 선점하기 위해 적극적인 투자 확대 정책으로 차세대 성장동력 창출을 추진하고 있으며, 가시적인 산업화 결과 도출을 위해 신품종 개발, 신소재, 신기능성 물질 개발 등의 분야에서 핵심기술 개발에 주력하고 있다. 최근에는 기초 기술 개발을 위한 주요 수산생물의 유전체 연구가 확대되고 있으며 첨단 생명공학기술을 활용한 양식 생산성 향상 연구 등도 수행하고 있다. 각 국가별 수산생명공학기술의 연구동향은 [표 3-1-21]과 같다.
[표 3-1-21] 국외 수산생명공학기술 연구동향
|
국가 |
주요 연구내용 |
|
미국 |
○ 국가과학재단(NSF) - 수산생물 오믹스 분석을 통한 IT․BT 융합기술 및 신소재 개발 ○ NOAA의 Sea Grant 사업 - 무척추생물과 해면생물에서 수해양천연물 추출 - 담수어류(차넬메기등), 굴, 전복, 새우 선발육종 |
|
일본 |
○ 농림수산성 산하 수산청과 수산연구종합센터(FRA) - 주요 수산생물(참다랑어 등) 유전체 해독 연구 ○ 도립연구소, 대학 등 연구연합그룹 - 수산생물(참돔, 비단잉어, 전복, 굴 등) 육종연구 |
|
중국 |
○ 중국수산과학연구원(CAFS) - 집단유전, 육종기술개발, 바이오 소재 개발 ○ 중국과학원(CAS) - 고속성장 형질전환 잉어 개발 ○ 중국게놈연구소(CGI) - 수산생물 유전체 해독 연구 |
|
유럽 |
○ EU 공동체 프로그램(ECMB) - 연어 및 틸라피아 육종 기술 개발 및 산업화(노르웨이) - 틸라피아 전수컷 집단 개발 (영국) - Halibut, turbot, 대서양 대구 등의 육종 연구(유럽연합) ○ 포르투칼 해양수산연구소(IPIMAR) - 양식업 관련 생명공학연구 |
|
호주 |
○ 호주연방과학산업연구기구(CSIRO) - 집단유전, 새우와 전복 선발 육종 - 바이오 소재 개발, 유전체 연구 |
|
캐나다 |
○ 국가연구위원회(NRC) 산하연구소 Institute for Marine Bioscience - 유전체 연구, 바이오 소재 개발 |
|
이스라엘 |
○ Ben Gurion Univ. - 유전자 제어를 통한 민물새우 전수컷 집단 생산 |
다. 해양수산생명공학사업 현황
(1) 세계 해양생명공학 현황
해양생명 시장은 아직 산업발전상 초창기로 전체 생명공학 시장에서 차지하는 비중은 2009년을 기준으로 약2.3%로 매우 미약한 수준이다. 그럼에도 불구하고 해양생명공학 시장은 꾸준한 성장을 통해 시장규모가 확대되어 가고 있다. 2010년 유럽과학재단(European Science Foundation)은 2010년 해양생명공학산업은 4~5%의 연평균 성장률을 보이고 세계 시장 규모는 2010년 기준 28억 유로로 추정하고 있다.
해양생명공학의 세계 시장규모에 대한 추정치는 조사기관에 따라 다양한 견해를 보이고 있는데 이는 해양생명공학 산업에 대한 정의의 차이에서 기인하는 것으로 추정된다. 과거 해양생명공학 세계 시장규모를 추정한 연구결과를 살펴보면 민간 시장조사 기관인 biz Acumen에서 2009년 발간한 Marine Biotechnology(worldwide trend, 2009)에서는 해양생명공학 세계시장은 연평균 4.28%의 성장세를 보여 2012년 기준으로 약 36억 달러의 글로벌 시장 규모를 보일 것으로 예측하였다. 이 기관의 보고서에 따르면 해양생명공학 산업 시장의 50%는 생체활성물질(bioactive substance) 시장으로 추정되고 있다(호르몬, 효소, 억제제, 해양천연물신약 등). 한편 최근의 국내 한국해양과학기술원의 연구결과에 따르면 2010년 기준의 세계 해양생명공학 산업시장 규모는 약 219.7억 달러 수준이며, 2024년에는 769억 달러 수준으로 증가할 것으로 예상된다.13) 2010년 기준 각 분야별 시장현황을 보면 의약분야가 53억 달러, 에너지 2.7억 달러, 기능성 식품 134억 달러, 의료보건 30억 달러로서 기능성 식품이 가장 높은 비중을 차지하고 있다. 그러나 2024년에는 기능성 식품 332억 달러에 이어 의약분야 220억 달러, 에너지 166억 달러로 크게 성장할 것으로 예측되고 있다.
[표 3-1-22] 지역별 해양생명공학 세계시장(GIA 추정)
(단위 : 백만불, %)
|
지 역 |
’06 |
’07 |
’08 |
’09 |
’10 |
’11 |
’12 |
성장율 |
|
미국 외 |
1,979.4 (67.6) |
2,054.0 (67.5) |
2,154.4 (67.7) |
2,256.5 (67.9) |
2,361.7 (68.2) |
2,466.9 (68.4) |
2,575.0 (68.7) |
39.2 |
|
미국 |
947.9 (32.4) |
987.0 (32.5) |
1,025.9 (32.3) |
1,064.4 (32.1) |
1,102.3 (31.8) |
1,139.0 (31.6) |
1,175.4 (31.3) |
29.5 |
|
전체시장 |
2,927.3 |
3,041.0 |
3,180.3 |
3,320.9 |
3,463.9 |
3,605.9 |
3,750.4 |
36.0 |
|
한국 |
44.3 (1.5) |
49.1 (1.6) |
52.9 (1.7) |
56.9 (1.7) |
62.9 (1.8) |
69.1 (1.9) |
73.7 (2.0) |
89.0 |
출처 : Global Industry Analysts, a global strategic budiness report : marine biotechnology, 2008
주) ( )안의 값은 연도별 총 세계시장규모에서 지역이 차지하는 비중
biz Acumen과 유사한 형태로 해양생명공학 산업분야의 세계 시장규모를 측정하고 있는 기관으로는 GIA(Global Industry Analysts)가 있다. 이 기관에서는 2008년 해양생명공학분야의 글로벌 전략 비즈니스 레포트(A Global Strategic Business Report : Marine Biotechnology, 2008)를 통해 세계 해양생명공학 시장에서 우리나라의 점유율을 추정하고 있다. GIA의 추정에서도 biz Acumen과 유사하게 2012년 세계 해양생명공학 산업영역의 시장규모를 37억 달러 규모로 추정하였다. 미국의 산업규모 비중은 점차 감소하고 있는 추세로 추정되었으며, 2012년 기준으로 전체 시장의 약 31.3%를 점유할 것으로 추정하고 있다.
GIA의 추정에 따르면, 한국은 2012년 기준으로 세계 산업시장의 약 2.0% 정도를 점유할 것으로 추정하였으며, 2005년〜2012년의 7년 사이 약 1.9배의 시장 규모가 증가할 것으로 전망하고 있다. 우리나라의 해양생명공학 시장 성장률은 전 세계에 비해 비약적으로 높아지고 있다.
(2) 국내 해양생명공학 정책현황
해양수산부에서는 2004년 ʻ마린바이오21 사업(2004〜2013)ʼ을 시작으로 해양생명공학분야를 꾸준히 육성하고 있다. 또한 2008년 ʻ해양생명공학육성 기본계획(2008〜2016)ʼ을 수립하였으며, 2009년에는 ʻ해양바이오 연구개발 활성화 대책(2010∼2014)ʼ을 수립하여 해양생명공학을 중점적으로 육성하였다. 한편 「해양생명자원의 보존‧관리 및 이용 등에 관한 법률」을 제정(2012.7.)하여 해양생명자원의 확보와 체계적이고 효율적인 관리 및 이용을 위한 제도를 마련하였다. 특히,「국립해양생물자원관의 설립 및 운영에 관한 법률」을 제정(2015.4.)하고, 해양생물자원의 수집‧보존‧전시 및 연구 등을 체계적으로 수행하기 위한 국립해양생물자원관을 설립(2015.4.)하였다. 향후 세계적으로 해양생물자원의 주권화 및 국가자산화 추세에 발맞추어 적극 대응할 예정이다.
|
|
|
해양수산부 |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
한국해양과학기술진흥원 |
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
해양수산생명공학기술개발 |
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
해양생명자원 확보 및 기초인프라 구축 |
|
해양생명공학산업화 기술개발 |
|
포스트 게놈 |
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
기탁등록 보전기관 (14개) (ʼ08∼계속) |
|
해외 생물자원 (KIOST) (ʼ09∼계속) |
|
통합DB 운영 (자원관) (ʼ08∼ʼ16) |
|
지역해양바이오 (5개) (ʼ14∼ʼ18) |
|
바이오 에너지 (인하대/ KIOST) (ʼ09∼ʼ18) |
|
섬유 및 플라스틱 (포항공대) (ʼ10∼ʼ19) |
|
융복합 바이오 닉스 (ʼ15∼ʼ19) |
|
미세조류 색소 기반 고부가 소재 (ʼ15∼ʼ19) |
|
해양수산생물 유전체 분석 (ʼ14∼ʼ21) |
|
|||||||||||||||||||||||||||
[그림 3-1-7] 해양생명공학사업 추진체계
2004년부터 현재까지 총 2,161억 원을 해양생명공학 R&D사업에 투자하였다. 이 중 384억 원은 ʻ생명자원 확보 및 기초인프라 구축사업ʼ에 투자하였고, 1,777억 원은 ʻ해양생명공학 기초 및 산업화 기술 개발ʼ에 투자하였다. 이러한 투자를 통해 해양생명공학 분야에서 많은 성과를 이룰 수 있었다. 우선, 국내외의 해양생명자원 10,000여종 130,000여점을 발굴하여 해양생명공학기술의 소재를 확보하였고, 다양한 분야에서 SCI 논문 1,356편, 특허 등록 366건(국내 291건, 국외 75건), 기술이전 27건을 달성하였다. 주요 성과로는 홍합 유래 의학용 접착소재 개발, 신약 후보물질 및 기능성 소재 개발, 미세조류를 이용한 바이오디젤 생산기술개발, 해양 고세균을 이용한 바이오수소 생산기술개발, 세계최초 밍크고래 유전체 해독 등이 있다. 또한, 해양생물 차세대 유전체 연구 기반을 구축하고 해양유전체 유래 기초원천기술 개발을 위한 ʻʻ포스트게놈다부처 유전체사업ʼʼ(2014∼2021)을 추진 중이다.
(3) 국내 수산생명공학 정책현황
수산생명공학연구는 해양수산부 국립수산과학원에서 해양수산발전기본법, 생명공학육성법, 생명연구자원의 확보‧관리 및 활용에 관한 법률, 농수산생명자원의 보존‧관리 및 이용에 관한 법률, 유전자변형생물체의 국가간 이동 등에 관한 법률, 농수산물의 원산지 표지에 관한 법률, 수산자원관리법 등에 따라 2004년부터 국가 R&D 사업을 수행하고 있으며, 예산은 2012년 36억, 2013년 38억 원, 2014년 41억, 2015년 40억 원으로, 해양생명공학기술개발사업(273억) 예산 규모에 비해 약 15% 수준이다. 주요 연구내용은 수산 생명자원의 분석‧보존 및 활용, 수산생물 유전체 및 기능 연구, 수산 바이오 소재 개발, 육종기술 개발, 형질전환생물의 안전관리 기술 개발 및 심사이다. 최근 5년간 국내외 총 157건의 논문을 게재하였고, 38건의 특허를 출원 하고 이 중 21건을 등록하여 매년 논문과 특허 건수가 증가하고 있다. 대학 및 연구소 등에서는 해양수산부의 수산실용화기술개발사업을 통하여 수산생명공학 연구를 수행하고 있다.
[표 3-1-23] 수산생명공학기술사업 투자실적
(단위 : 백만원)
|
사업명 |
2012년 |
2013년 |
2014년 |
2015년 |
|
수산생명공학연구 |
3,685 |
3,887 |
4,171 |
3,978 |
라. 향후 추진계획
해양수산생명공학산업은 전 세계적으로 신생산업 분야이다. 그리고 해양수산생명공학 산업영역은 대표적인 ʻʻ하이 리스크, 하이 리턴(High Risk, High Return)ʼʼ 분야이다. 따라서 이윤추구를 근본 목적으로 하는 기업에 R&D 투자를 맡겨둘 경우 필연적으로 과소공급에 따른 시장실패가 예상된다는 한계점이 존재한다. 그러나 해양수산생명공학산업은 미래 성장동력 산업으로 미래 우리나라의 경쟁력 제고를 위해 반드시 필요한 산업이다. 그리고 현재 해양수산생명공학은 초기 단계에 있기 때문에 기초원천기술 분야에 대한 투자가 무엇보다 필요한 시점이다. 따라서 국가 차원의 집중적인 육성 및 지원이 절실하다. 또한 UN해양법, 나고야의정서 등 국제적으로 생명자원 이용제한 추세에 따라 국내외 해양생물자원 확보와 보존을 위한 국가 주도의 체계적인 사업 추진이 필요할 것으로 전망된다.
해양수산부에서는 해양수산생명공학산업을 고부가가치 창출 융복합 산업으로 육성하기 위해 해양수산생명자원확보 및 자원을 활용한 신소재, 바이오 에너지 등 원천기술 및 산업화기술 개발을 위해 해양수산생명공학기술개발사업을 중점 추진 중이다. 특히, 해양생물에 관한 수집‧연구 및 활용기반 구축 등의 업무를 전담할 국립해양생물자원관이 개관(2015.4)됨에 따라 해양수산생명공학에 대한 체계적인 정책운영을 추진해나갈 계획이다.
이러한 정책들을 바탕으로 연간 4조원대의 해양수산생명공학산업 시장을 육성하고, 1만 명의 취업효과를 창출할 계획이다. 현재 선진국의 70% 수준인 해양수산생명공학 기술수준을 90% 수준까지 끌어올릴 것이며, 세계 해양생명공학산업 시장 점유율을 현행 2%에서 5%까지 확대할 것이다. 이러한 성과들을 바탕으로 해양수산생명공학산업 세계 7대강국으로 도약해 나갈 것이다.
해양수산부는 해양수산생명공학사업 지원을 통해 해양수산생명공학기업을 고부가가치 해양수산생명공학산업체로 육성하며, 산‧학‧연의 연구체계를 강화하는 등 민간이 할 수 없는 다양한 공공분야의 투자와 인프라 구축을 적극적으로 주도하여 해양수산생명자원을 보존 및 활용하고, 해양수산생명공학산업이 활성화 될 수 있도록 지속적으로 지원하고 육성해 나갈 것이다.
9. 생명자원 분야의 육성 및 관리 정책
가. 개요
생명자원은 지구상에 존재하는 생물(동․식물, 미생물, 인간세포 등), 생물의 구성물(DNA, 유전체 등) 및 이들의 정보를 포함하는 것으로 생명자원의 구체적인 대상으로는 생물자원, 생물다양성, 생명정보(국가 생명자원 확보‧관리 및 활용 마스터플랜, 2007.12., 국과위)가 있다.
생명자원은 기후변화, 환경오염, 에너지 위기, 식량부족 등 인류가 직면하고 있는 난제를 해결하는 생명공학연구의 필수 자원이며 식품, 의약품, 농업 환경 등 고부가가치 창출이 가능한 핵심 재료로서 활용범위가 넓으며, 잠재적인 경제적 가치도 높아 전 세계적으로 자국 및 국외의 생명자원의 확보를 강화하고 있다.
또한, 나고야의정서가 2014년 발효되면서 국가별로 자원의 주권을 강화하려는 움직임이 나타나고 있으며, 선진국과 자원부국간의 이익배분에 대한 첨예한 분쟁이 예상되고 있어 이에 대한 국가차원의 대응이 필요한 시점이다.
미국은 국가바이오경제 청사진 실현을 위하여 국가생명정보센터(NCBI), 국가생명자원정보인프라(NBII), 미국유전자은행(ATCC), 국립암센터(NCI), 국립유전자원보존센터(NCGRP) 등 다양한 거점기관을 운영하며 분야별 연구개발을 강화하고 있다. 유럽은 ʻHorizon 2020ʼ의 재조정을 통해 생명자원 인프라 구축 및 나고야의정서 대응 방안 마련을 마련하고 있으며 식량안보, 지속가능한 농업, 어업 및 해양연구를 위하여 유럽 전체 생명자원의 정보화 및 관리 기능을 강화하고 있으며 유럽생명정보네트워크(EBI), 유럽생물자원센터 네트워크(EBRCN)등을 통한 생명연구자원 및 정보 네트워크를 구축하였다. 일본의 경우는 이화학연구소 바이오자원센터(Riken BRC, 2001) 설립 및 내셔널 바이오리소스 프로젝트(NBRP, 2002)를 통해 국가 중점자원 선정, 거점 육성 및 통합 DB 사업 수행을 통하여 세계 최고 수준의 생명자원 정비에 국가적인 노력을 기울이고 있다.
우리나라의 경우 연차별 ʻ생명연구자원관리 시행계획ʼ을 통하여 관계부처별 자원의 발굴‧확보, 보존‧관리, 활용을 위한 연구개발 및 지원이 활발하게 진행하고 있다. 2014년 총 투자액은 1,086.1억 원이며 미래부가 380.5억 원(35.0%), 환경부 179.7억 원(16.5%), 농식품부 171.2억 원(15.8%), 산업부 149.3억 원, 복지부 93.7억 원, 해수부 87.2억 원, 식약처 24.4억 원 순으로 투자되었다.
[표 3-1-24] 부처별/분야별 투자실적(2014년 성과 기준)
(단위 : 백만원)
|
부처명 |
생물자원 |
생물다양성 |
생명정보 |
소계 |
|
미래창조과학부 |
32,406 |
633 |
5,013 |
38,052 |
|
농림축산식품부 |
16,795 |
330 |
- |
17,125 |
|
산업통상자원부 |
8,934 |
- |
6,000 |
14,934 |
|
보건복지부 |
9,370 |
- |
- |
9,370 |
|
환경부 |
14,569 |
3,404 |
- |
17,973 |
|
해양수산부 |
5,715 |
2,500 |
500 |
8,715 |
|
식품의약품안전처 |
2,440 |
- |
- |
2,440 |
|
합계 |
90,229 |
6,867 |
11,513 |
108,609 |
※ 농식품부는 농진청, 산림청 포함
출처 : 2015년도 생명공학육성시행계획(2015.7.)
관계 부처의 역할은 ʻ생명연구자원의 확보‧관리 및 활용에 관한 법률 제6조ʼ에 따라 미래부가 생명연구자원 및 통합정보시스템을 총괄하면서 기초‧원천 연구분야를 담당하며 교육부가 전문인력양성분야, 농식품부가 농업분야, 산업부가 산업분야, 복지부/식약처가 보건‧의료분야, 환경부가 야생생물분야, 해수부가 해양‧수산분야 생명연구자원을 담당하고 있다.

[그림 3-1-8] 관계 부처별 역할
나. 생명연구자원 및 통합정보시스템 관리(미래부)
(1) 범부처 생명연구자원14) 총괄 관리 역할 강화
생명연구자원 기본법의 위상 확립, 나고야 의정서 대응 체계 수립 등을 위한 ʻ생명연구자원의 확보‧관리 및 활용에 관한 법률ʼ 개정을 추진하여 생명연구자원의 총괄부서로 역할의 강화를 추진하는 한편, 목표 지향적인 생명연구자원 인프라 확보 및 산학연 지원체제 강화를 위한 유용 생명연구자원의 활용체계를 구축하고 범부처적인 생명연구자원 인프라 지원 체계(생명정보데이터 종합관리시스템 고도화)를 확립할 방침이다. 또한 나고야의정서 대응을 위해 ABS 연구지원센터(생명연)를 신설하여 ABS 가이드책자 발간 등 국내 연구자의 인식제고를 위한 노력도 추진하고 있으며, 관계부처 전문가로 구성된 책임기관협의회를 운영하면서 현안 공동 대응 및 부처 간 협력도 강화하고 있다.
(2) 생명연구자원의 발굴‧확보 및 활용 확대
유용 생명연구자원의 고품질화를 통한 활용성을 극대화하여 그 가치를 제고하고 가치 제고된 생명연구자원의 산업적 활용지원을 통한 바이오산업 경쟁력 강화를 추진 할 예정이다
또한 국내외 환경변화 및 미래유망 생명연구자원에 대한 수요분석을 통해 국가 전략형 중점자원을 선택‧발굴하는 등 전략적 생명연구자원의 발굴‧확보에 중점을 둘 예정이다. 마지막으로 생명연구자원 관리‧인프라 구축에 있어서 국제 수준의 표준화 체계를 구축하고 융복합 바이오 연구소재 개발을 위한 생명연구자원 응용기술 및 전문인력양성 지원 프로그램을 구축하고, 빅데이터 기반 데이터 분석기술, 유전체정보 활용 질환 진단기술 지원 인프라 구축 등 목적형 수요에 기반을 둔 정보 지원 인프라를 창출하는데 지원할 방침이다.
(3) 국제협력 강화
국제협력에 있어서는 기 구축된 4대 해외거점(베트남, 중국, 인도네시아, 코스타리카)을 활용하여 전략적 해외 생명연구자원 확보를 강화하고 해외거점의 범부처적 공동 활용을 통한 이익 공유 모델을 개발하는 한편 주요 선진국과의 협력 네트워크 강화를 통한 국제 컨소시엄 및 관련 프로젝트에 참여하는 등 해외 생명자원 확보 및 국제적 이슈 대응을 위한 국제협력을 강화할 방침이다.
(4) 향후 추진 계획
대내외적인 환경을 반영하고 ʻ생명연구자원관리기본계획(2011∼2020)15)ʼ을 수정‧보완하기 위해, 1차 기본계획 2단계 (2016~2020) 추진 방안을 수립 중이다. 특히, 자원의 공유 및 정보 네트워크를 통하여 수요자 기반의 자원 가치제고 및 유용 생명연구자원의 활용을 강화하고, 고부가가치 생명연구자원의 전략적 확보 및 국가차원의 연구자원 관리를 체계화하고 산업적 활용을 높이기 위한 범부처적 협력을 강화 할 예정이다.
다. 농업분야의 육성 및 관리정책(농림부)
농업 생명자원은 신품종 개발, 신물질 탐색 등에 활용되는 등 생명산업의 기본소재로 그 중요성이 증대되고 있다. 이에 국가 차원의 농업 유전자원 이용활성화 등을 위해『농업유전자원 보존‧관리 및 이용 활성화를 위한 기본계획』을 수립하였고(2009.8., 2014.10.), 국내외 유전자원을 효율적으로 수집‧보존‧활용할 수 있는 종합관리체계를 구축하여 2018년까지 ʻʻ세계 5대 유전자원 강국 실현ʼʼ을 위해 노력할 것이다.
또한 농수산생명자원을 체계적으로 관리하기 위한 조사‧등재‧분양에 관한 내용, 무분별한 해외반출 방지를 위한 취득‧해외반출 허가, 농수산생명산업의 발전을 위한 지원 내용 등을 보완하여 『농업유전자원의 보존‧관리 및 이용에 관한 법률』을 『농수산생명자원의 보존‧관리 및 이용에 관한 법률』(2011.7.25. 공포)로 개정하여 국내외 농수산생명자원을 종합적‧체계적으로 확보‧관리 및 이용할 수 있는 제도적 근거를 마련하였다.
그 동안 농림축산식품분야 생명자원은 각 기관별로 DB를 관리하고 있어 수요자 입장에서 농림축산 생명자원 정보에 대한 종합적인 접근‧이용이 어려웠다. 또한 생물다양성협약(Convention on Biological Diversity, CBD)에서 논의되고 있는 유전자원에 대한 접근 및 이익공유(Access and Benefit-Sharing, ABS)에 관련한 국제규범 제정 논의에 대응이 필요하다. 이에 2011년부터 농촌진흥청, 산림청, 농림축산검역본부, 국립종자원이 보유한 생명자원을 연계‧통합관리하기 위해 생명자원 통합 DB구축사업을 추진하고 있다.
2015년에는 자원보유기관별 통합 DB 데이터 내실화를 기하기 위해 국제환경 변화를 반영한 나고야의정서(ABS) 대비 최신 정보 제공 및 대응체계 수립을 위한 정책연구용역을 완료할 계획이다.
이를 통해 생명산업 정보화를 기반으로 하는 생명공학 연구 및 산업화를 촉진하고 생명자원의 다양성을 확보하여 우리 고유자원의 주권보호를 위한 생명자원의 국가 관리체계를 확립해 나가고자 한다.

[그림 3-1-9] 생명자원 통합 DB 구축체계
라. 보건·의료분야의 육성 및 관리정책(복지부)
미래보건의료연구의 인프라인 인체자원의 확보 및 분양을 위한 한국인체 자원은행사업(Korea Biobank Project) 2기(ʼ13~ʼ15년)를 추진하고 있다.
(1) 추진배경
(가) 개인별 유전체 연구의 급속한 발전에 따라 보건의료연구 및 산업계의 대량 인체자원 수요 증가
(나) 한국인체자원은행사업(KBP) 1기의 성공적 운영(ʼ08~ʼ12년)에 따라 확보한 50만 명분 인체자원의 가치 극대화 필요
(2) 추진전략
(가) 기 확보한 50만 명분의 인체자원을 적극 활용할 수 있는 수요자 중심의 분양시스템 구축
(나) 맞춤의료, 예방치료 등 보건의료 신 성장 분야를 지원하기 위해 고부가가치 자원을 적극 확보하고 분양
(다) 대규모 R&D과제의 기획 단계부터 인체자원은행의 역할을 명시하여 인체자원의 수급 협력체계 구축
(라) 인체자원은행에서 분양된 자원으로 수행된 연구 성과 및 결과의 기탁을 활성화하는 등 R&D 선순환 체계 마련

[그림 3-1-10] 한국인체자원은행사업(KBP) 중장기 발전전략
(3) 추진현황 및 성과
(가) 제1기 한국인체자원은행사업(ʼ08~ʼ12년)의 성공적 운영 및 아시아 최대 규모의 국립중앙인체자원은행(이하 ʻʻ중앙은행ʼʼ) 공식 출범(ʼ12.4.)
(나) 중앙은행과 17개 인체자원단위은행(지역거점은행12개, 협력은행 5개)이 네트워크를 구성하여 다양한 코호트 및 질환군 인체자원 수집
(다) 2014년 12월 기준 질병관리본부 중앙은행과 17개 인체자원단위은행을 통해 인체자원 67만 여명 확보(중앙은행 386,447명, 단위은행 284,398명) 및 1,417건(474,624 vials)의 연구과제에 인체자원을 분양
(라) ʻ분양활성화ʼ를 목표로, 원스탑 분양시스템 구축‧운영(ʼ14.7.), BIMS 3.0 업그레이드‧지원 등 보건의료 연구 대상 대규모 인체자원‧정보 지원(ʼ14.12.)

[그림 3-1-11] 국가 바이오뱅크 구축 현황
[그림 3-1-12] 중앙은행 및 인체자원단위은행 분양현황
(4) 향후 추진계획
(가) 다양한 실물 자원과 관련 정보가 포함된 질환별 고부가가치 인체자원 확보
(나) 분양 활성화를 위한 맞춤형 분양시스템(온라인 분양포털) 운영 및 분양제도 개선
(다) 한국인 표준 유전체 확보를 위해 5만 명분의 전장 유전체를 지속적으로 분석하고, 암, 호흡기질환, 노인성질환 등 특화자원을 은행별로 특성화하여 집중 수집하는 체계 구축
(라) R&D 선순환 체계 마련 및 운영
(마) ISBER, BRIF 등 초기단계 국제 바이오뱅크 네트워크에 적극 참여
마. 산업분야의 육성 및 관리정책(산업부)
(1) 생명연구자원 발굴·확보 및 활용
산업통상자원부는 바이오산업의 발전을 견인하는 원천 재료인 생물자원의 중요성을 인식하고 ʻ생명연구자원의 확보‧관리 및 활용에 관한 법률ʼ의 시행계획에 따라 바이오 연구개발 사업과의 연계를 통해 산업 분야 생명연구자원 확보를 위한 기술개발 지원, 차세대 생명정보 분석을 위한 플랫폼 및 활용 SW 개발 지원, 생물자원 특허DB 구축(특허청)개선, 바이오화학실용화센터 건립 진행, 정보 인프라 간 체계적 연계를 통해 유전체 정보서비스 산업 기반 구축과 유전체 연구 성과의 실용화 및 산업화 지원 등 생물자원의 산업적 활용을 지원하고 있다.
(2) 생물자원의 산업적 활용 지원
산업통상자원부는 글로벌 수준의 천연물 원료의 생산 시설과 품질관리 시스템 구축 및 프로그램 운영, 천연물 원료 기업의 해외 수출 지원 및 해외 자원 확보를 위한 네트워크 구축을 위하여 충북테크노파크를 통해 ʻ천연물 원료제조 거점시설 구축사업ʼ을 지원하고 있다. 이를 통해 국제 규격에 적합한 생물자원 원료생산, 품질관리, 인허가, 국내외 시장 확보 등 천연물 원료 산업 분야에 특화된 지원 시스템을 구축할 것으로 기대된다. 또한 우리 고유의 토착미생물의 산업주권 확보를 위한 미생물 발굴 및 지역 미생물 지도 작성, 미생물 분석 및 기업체가 이를 활용할 수 있도록 ʻ한국형 유용균주 산업화 기반 구축ʼ 사업을 지원하고 있다. 이를 통해 우리나라 고유의 미생물 산업주권을 확보(균주특허)하고 발효 미생물 활용 중소기업의 국제 경쟁력 강화가 기대된다. 이 외에도 산업통상자원부는 23개의 지역 바이오특화센터를 통해 생물자원의 산업적 활용을 추진하고 있으며 향후 지원을 강화할 계획이다.
(3) 향후 추진계획
산업통상자원부는 기 구축된 해외 네트워크를 활용하여 생물자원 확보를 위한 국제협력을 추진하고 지역바이오특화센터 등 기존 인프라를 활용하여 국내외 생물자원의 체계적 발굴‧확보에서 바이오소재의 제품화, 산업화에 이르는 전주기적 산업 생태계 지원 체계를 구축할 예정이다.
바. 야생생물자원 분야의 육성 및 관리정책(환경부)
(1) 「생물다양성 보전 및 이용에 관한 법률」제정 및 시행
환경부는 생물다양성의 종합적‧체계적인 보전과 생물자원의 지속가능한 이용을 도모하고「생물다양성협약16)」의 이행에 관한 사항을 정함으로써 국민생활을 향상시키고 국제협력을 증진하기 위한 목적으로 「생물다양성 보전 및 이용에 관한 법률」을 제정하였고(2012.2.1.) 동 법은 2013년 2월 2일 시행되었다.
관계부처 별로 소관사항에 따라 생물다양성 관리 및 확보 관련 업무들을 각기 추진해 오고 있는 상황에서, 동 법의 시행으로 국가 생물다양성의 총괄 관리체계를 구축할 수 있게 되었고, 생물다양성 보전 정책을 실효적 추진이 가능해졌다.
(2) 「생물자원 보전ㆍ관리 및 이용 마스터플랜」수립 및 시행
한편, 정부는 생물자원의 보전․관리 및 이용을 종합적으로 연계하여, 생물자원의 활용을 극대화하기 위한 전략 및 실천계획으로 「생물자원 보전‧관리 및 이용 마스터플랜」을 수립하여 국무회의에 보고하고 확정(2010.10.)하였다.
「생물자원 보전‧관리 및 이용 마스터플랜」시행은 한반도 고유 생물자원 확보, 생물자원의 관리능력 배양 및 국가 생물주권 기반확립 등을 목표로 하며, 이를 달성하기 위해 선정한 5대 전략 및 47개 추진과제에 향후 10년간(2011~2020) 총 1조 5천여억 원을 투자할 계획이다.

[그림 3-1-13] 생물자원 보전ㆍ관리 및 이용 마스터플랜의 추진체계
주요 추진과제를 살펴보면, 첫째 국가 생물자원을 체계적으로 조사‧발굴하여 한반도 생물지 및 생물도감을 발간하고, 생물자원 확보‧수장시스템 등 관련 정보를 표준화하는 한편, 생물자원 인벤토리 및 생물종 확증표본 시스템 등을 구축함으로써 생물주권을 확보해 나가고자 한다.
둘째, 멸종 위기종 증식‧복원, 야생동물 질병관리 및 외래종‧LMO 안전관리 강화, 생물자원 국외반출 승인제도 개선 등을 통하여 생물자원을 효율적으로 보전․관리하는 한편, 기후변화 생태계 적응기술 및 기후변화 대응형 도시생태계 조성‧관리기술을 개발하고자 한다.
셋째, 야생생물 유전자원센터, 대국민 생물종 동정서비스 및 DNA 바코드시스템 운영을 통하여, 생물자원의 활용 인프라를 구축하고 자생생물에 대한 검색시스템 및 분류‧검색체계를 표준화할 계획이다.
넷째, 자생생물 탐색기술, 생물자원 증식‧배양 및 보전기술, 고유 생물자원을 이용한 생태계 복원기술 등을 개발하여, 각종 생물소재를 국산화하고 야생생물 추출물질의 산업적 활용기반을 마련하여 생물자원산업을 체계적으로 육성할 계획이다.
다섯째, 국가생물다양성법 시행 및, 국립생태원․국립생물자원관․국립습지센터 등 생물다양성 및 생물자원 관리‧연구 기관 간 유기적인 네트워크를 구성하여 생물자원 관리기반을 강화할 계획이다.
(3) 「국가생물자원 종합관리시스템」구축 및 운영
환경부는 나고야 의정서 발효를 대비하고, 「생물다양성협약」의 국내 이행과 국가생물다양성 정보의 종합적인 관리를 위하여「국가생물자원 종합관리 시스템」17)을 구축하였다(2012.12.). 이 시스템을 통하여 부처별로 분산 관리중인 생물자원 정보를 연계하고 관련 정보를 표준화하여 체계적 관리 기반을 마련하였다.
2011년 7월 ʻ생물자원 DB 구축 추진단ʼ을 구성하여 운영하였으며, 그 성과로 ʻ국가 생물자원 DB 현황 분석 및 통합화 방안ʼ을 마련하였다(2011.12.). 그리고 환경부 등 관계부처 합동으로 ʻ나고야 의정서 범정부 대책ʼ을 마련하여 국무회의를 거쳐 본 대책을 확정하였으며, 동 대책에는 ʻ국가 생물자원 종합관리시스템 구축ʼ 등 7개 추진과제가 포함되었다. 그 결과 2012년 12월 ʻ국가생물자원 종합관리시스템ʼ이 구축되어 운영 중이다. 국가생물자원 종합관리시스템의 본연의 역할의 원활한 수행을 위해 농림축산식품부, 미래창조과학부, 특허청 등 부처 간 생물자원 정보 연계를 추진하였다. 또한 문화관광부, 제주특별자치도 등과도 정보 연계를 추진하고 있다. 부처간 정보 연계와 함께 환경부 내 관련기관18) 간 생물다양성‧생물자원 정보 연계시스템을 구축하였다.
「국가생물자원 종합관리시스템」은 2014년 말까지 발굴한 42,756종의 국가생물종목록을 기준으로 한 생물다양성 정보 약 390만 건19)을 포함하고 있다. 이러한 정보에는 학명, 분류체계, 표본사진, 분류군 정보, DNA 등 유전자원 정보 등 생물종 정보, 분포, 서식지, 생활사, 주요 특징, 유용성 등 생물다양성 정보, 특허, 학술정보 및 전통지식 정보가 포함되어 있다.
ʻ국가생물종목록 사업ʼ을 통해 2014년 말까지 구축된 자생생물 42,756종 전체에 대한 종 목록 서비스를 2015년 말까지 구축하여 제공할 계획이며, 한국한의학연구원의 전통의학지식정보, 국립국어원의 생물이름 정보, 제주특별자치도의 환경생태정보를 연계할 예정이다.
또한, 국가생물다양성 및 생물자원 관련 통계에 대한 온라인 서비스를 2015년 12월부터 실시할 계획이며, 멸종위기야생생물. 국외반출승인대상 생물자원, 국제적멸종위기종(CITES) 등 국가 지정관리 종 현황 및 종 목록을 현행 화하여, 생물자원의 종합적인 관리 체계를 구축할 예정이다.
(4) 생물자원 관리 기관 설치 및 운영
환경부는 생물자원을 체계적으로 관리하기 위하여 관련법 제․개정을 통하여 유형별 생물자원 관리 기관을 설치하여 운영‧관리하고 있다. 2007년 국립생물자원관이 개원하여, 생물종 발굴 및 생물다양성 기초 연구 활동을 수행하고 있으며, 국립환경과학원에서도 수인성 질병, 생태계위해우려 종 및 수생태계 관련 연구를 활발하게 수행하고 있다. 2013년 11월 충청남도 서천시에 국립생태원이 개원하여 우리나라 생태계 연구 역량을 크게 확장할 것으로 기대되며, 또한 2015년 7월 경상북도 상주시에 ʻ낙동강생물자원관ʼ을 개관하였으며, 호남권 생물자원관 건립 등 권역별 생물자원관 설립을 지속적으로 추진하고 있다. 지자체 또는 학계 등 민간 분야의 생물자원 보전 및 분양 체계를 구축하기 위하여 「야생생물 보호 및 관리에 관한 법률」에 근거하여 서식지외 보전기관 (멸종위기 종 증식, 복원 연구), 생물자원 보전시설(지역별 특화 자생생물 연구 및 전시, 교육), 야생동물 구조관리센터를 지정하여 관리하고 있다.
(5) 생물종 발굴 및 주요 기능 분석 사업
국립생물자원관은 국내 최대의 생물 표본 수장 기관이자 최고 수준의 분류 전문인력을 확보하고 있다. 국립생물자원관의 생물분류 전문 인력은 58명으로 전체 연구직 직원 61명의 95%를 차지하며 단일 기관으로 국내 최다 분류 인력이 다양한 연구 활동을 수행하고 있다. 국립생물자원관은 아시아 최고 수장시설(6,686㎡, 20개실) 및 생물자원 관리 표준화 시스템에 의한 표본의 영구적‧학술적 관리 기반을 갖추고 있으며, 개원 이래 신종 및 미 기록 종(후보 종) 9,144종을 발굴하여(2014.12말 현재) 국가 생물자원 인벤토리를 구축하고 있다. 또한 국내 최다인 생물자원(표본, 애생생물소재 등) 258만 여점을 확보하여 (2014.12말 현재) 자생생물 실체규명, 생물종 인증을 위한 생물자원 보고 역할을 수행하고 있다.
또한 국립생물자원관은 ʻ의미 있는 발굴ʼ로의 전환을 통해 유용한 생물종 분석 연구를 통하여 산업계 활용의 기반을 넓혀 가고 있다. 환경오염물질을 분해할 수 있는 세균과 난분해성(자연 상태에서 잘 분해되지 않는) 물질을 분해할 수 있는 균류(버섯 등)를 탐색하고 그 기능을 연구하고 있으며, 천적자원으로서 자생 곤충을 연구하여 가시적인 성과를 거두고 있다.
국립환경과학원과 국립생태원도 생태계 기초 연구를 통하여 건강한 환경을 조성하고, 환경오염을 저감할 수 있는 유용 생물자원에 대한 연구를 확대하고 있다.
(6) 멸종위기 종 증식‧복원 사업
환경부는 자생생물 보전‧복원을 위해 법정관리 종(멸종위기 종, 국외반출 승인대상 종 등)에 대한 증식, 복원 연구를 확대하고 있다. 주요 멸종위기 종(반달가슴곰, 여우, 산양, 장수하늘소 등)의 생활사, 증식 방법 등에 대한 기초 연구 및 서식지 확보를 전제로 한 자연 방사를 계속하고 있다.
(7) 생물자원 전문 인력 양성사업 운영
환경부는 2012년부터 생물다양성 및 생물자원 관련 석박사급 전문 인력을 양성하고 있다. 그간 발굴이 더디었던 미개척 분류군에 대한 발굴, 분류 전문 인력을 양성하기 위하여 해외 유수 대학과의 교류를 통해 국내 11개 대학(10개 사업단)에 지원을 하고 있다. 2013년에는 우수 인력의 산업계 진입 확산을 위하여 생물자원 전문 인력의 산업계 취업을 지원하는 프로그램을 운영하고 있다. 또한 2014년부터 생태계 보전 및 생태계 서비스 평가를 위한 전문 인력의 양성 프로그램을 운영하여 많은 호응을 받고 있다.
(8) 야생생물자원 이용기반구축 사업
또한 환경부는 2014년부터 야생생물자원의 산업계 및 학계의 활용기반을 확대하기 위하여 ʻ야생생물자원 이용기반구축ʼ 사업을 시행하고 있다.
본 사업은 정부와 민간에서 확보하고 있는 생물자원의 통합관리, 표준 보존 방법의 개발과 통합 분양 체계 구축을 통해 중소기업의 생물자원 활용을 원활하게 하여 산업계 R&D를 활성화하는 것이다.
또한 그 목적은 생물자원의 원활한 분양체계 구축 및 품질보증을 통해 효율적인 생물자원 접근시스템을 구축하고 국내 벤처‧중소기업의 소재확보 능력 제고를 통해 생물산업의 중장기 성장동력 육성에 있다.
|
|
|
|
|
|
|
|
|
|
보존·관리 체계 구축 |
|
|
|
|
|
|
|
(산업계 수요 기반 유용야생생물 보존가이드라인) |
|
|
|
|
|
|
|
↓ |
|
|
|
|
|
|
|
분양 시스템 구축 |
|
|
|
|
|
|
|
(정부, 민간 통합 분양체계) |
→ |
산업계 야생생물자원 지원․관리 지도 |
|
|
|
|
|
|
|
(품질검증, 특허․수출입지원, 기술수요조사) |
→ |
산업계 R&D 활성화 |
|
|
|
|
|
|
|
(의약․향장․식품 등 분야별 R&D 활성화) |
|
[그림 3-1-14] 야생생물자원 이용기반구축 사업 개요
본 사업을 통해 정부와 민간기관별로 분산‧관리되고 있는 생물자원에 대해 표준화된 보존‧분양방법을 개발하여 산업계에 제공할 수 있게 될 것이다.
국내 생물자원에 대한 정보를 한눈에 볼 수 있는 통합관리시스템을 구축하고 분양 매뉴얼을 개발하여 보급하게 된다. 또한 야생생물자원 정보 및 가이드라인 등을 산업계에 제공하고 생물자원 산업화를 위한 정보 등 기술지원체계를 구축할 계획이다.

[그림 3-1-15] 야생생물자원 이용기반구축 추진 체계도
사. 해양생명자원 분야의 육성 및 관리정책(해수부)
(1) 해양생명자원의 확보 현황
생명자원의 주권화 및 이익공유를 인정하는 나고야의정서(ABS)의 발효(2014.10.)로 해양생명자원의 이용에 관한 국제레짐 마련의 움직임 등 세계적으로 해양생명자원의 중요성이 날로 증가하는 추세이다. 세계 각국은 더 많은 해양생명자원을 확보하기 위해 치열한 경쟁을 벌이고 있다. 해양수산부는 국제적인 환경변화와 미래의 수요를 반영할 수 있는 국가차원의 해양생명자원의 확보‧관리 및 이용하기 위한 다양한 정책을 추진하고 있다.
해양수산부는 2008년부터 현재까지 해양생명자원 확보 및 활용기반 구축에 384억원을 투자하였다. 2008년에는 해양생명자원 기탁등록보존기관 사업으로 해양생명자원에 대한 관리 사업을 시작하였다. 국내 대학 및 연구기관 등에 해양생명자원 기탁등록보존기관을 지정하여 주요 해양생명자원 분류군별 자원의 채집‧기탁 및 활용기반 구축이 이루어지도록 하였다. 이를 통해 현재까지 국내 해양생명자원 5,676종 121,742점을 확보하였으며, 14개 해양생명자원 기탁등록보존기관으로 지정하여 운영하고 있다.
한편 해외 해양생명자원은 발굴과 확보의 우선순위를 설정하고, 기존에 확보된 해양수산생명자원을 활용한 연구의 거점사업을 육성해 나가고 있다. 2009년부터 2013년까지 해외 해양생물자원 개발 및 활용기반 구축 1단계 사업으로 마이크로네시아, 필리핀, 인도양, 통가해역, 동중국해 등지에서 해양생명자원을 채집하고 있으며, 인도네시아(LIPI). 러시아(PIBOC), 베트남(IMBC), 필리핀(UPV) 등의 해외연구기관과 MOU를 체결하였다. 1단계 해외 해양생물자원 사업결과 현재까지 해양생물자원 4,147종과 해양미생물균종 6,547점을 확보하고 있다. 또한 생물자원활용연구를 통해 5,842종의 추출물과 725종의 화합물을 확보하여 추출물 라이브러리를 구축하고 있다.
해양수산부는 해양생명자원의 확보에 그치지 않고, 확보한 해양생명자원의 표준화 및 통합DB 구축을 통해 분산된 실물정보 연계 및 통합검색에 의한 국가 해양생명자원 관리기반 구축을 2011년부터 추진해오고 있다. 이 사업을 통해 해양생명자원 통합정보시스템(MBRIS)을 구축하였으며, 현재까지 5,676종 121,742점의 자원을 정보화하였다.
(2) 해양생명자원 육성 및 관리정책
해양수산부는 해양생명자원의 중요성을 인식하고 이에 대한 체계적인 육성 및 관리를 더욱 강화해나갈 계획이다. 2015년에는 해양수산생명자원의 체계적인 관리를 위해 2012년 제정된 「해양생명자원의 확보‧관리 및 이용 등에 관한 법률」과 「농수산생명자원의 보존‧관리 및 이용 등에 관한 법률」을 통합하는 「해양수산생명자원의 확보‧관리 및 이용 등에 관한 법률」로 개정을 추진해나가고 있다.
해양생명자원에 대한 육성 및 관리정책에 대한 총괄 기관인 국립해양생물자원관이 2015년 4월에 개관하였으며, 해양수산생명자원조사, 해외해양생물자원 개발 및 활용기반연구(2단계) 사업 등 국가해양생명자원의 실물 및 관련정보의 지속가능한 보존관리를 위한 인프라 체계를 구축할 것이다. 또한 국립해양생물자원관은 책임기관으로서 해양수산생명자원의 확보‧관리 및 연구, 통합정보시스템 운영, 기탁 등록기관 간의 정보교류 등의 업무를 수행하게 된다.
한편 해양생명자원 기탁등록보존기관을 10개 기관에서 15년 14개 기관으로 확대하였으며, 장기적으로 지속적인 확대를 추진해 나갈 계획이다. 해외 해양생명자원의 확보에 관한 부분에 있어서도 현재의 남태평양 중심의 자원 확보에서 벗어나 극지 등 그 영역을 확대시켜 나갈 것이다.
위와 같은 일련의 정책들을 통하여 우리나라가 세계적으로 경쟁이 가속화되고 있는 해양생명자원 확보에서 우위를 선점할 수 있도록 할 계획이다. 이를 통해 2025년까지 해양생명자원 분야 7대 강국으로 도약해 나갈 것이다.

1. 국내 R&D 국제협력 및 국가간 협력 현황
가. 과학기술 국제협력 개요
전 세계적으로 개방형 기술혁신이 가속화됨에 따라 과학기술 국제협력의 중요성이 한층 부각되고 있으나, 아직까지 국내 과학기술 분야, 특히 생명공학 분야의 국제협력 수준은 많이 미흡한 실정이다. 국제 연구개발 환경의 변화에 대응하여 새로운 창조적 지식가치를 창출하고 사회경제발전에 이바지하기 위해서는 정부 연구개발사업의 목표와 성과가치를 재설계하는 노력이 필요한 시점이다. 과학기술 국제협력사업에 대해서는 국제과학기술협력규정(대통령령 제24423호) 및 산업기술혁신촉진법(법률 제11713호)에 각각 일부 정의되어 있으나, 아직까지 국내에서 과학기술 국제협력이라는 개념은 명확하게 정의하기 어려운 실정이다. 미래창조과학부가 매년 추진하는 정부 연구개발사업에 대한 조사․분석의 정의를 따른다면 국제협력은 과학기술 외국연구기관(외국인)이 참여한 위탁연구와 외국 연구자 유치, 연구자 해외 파견, 정보 교환, 기술 연수, 국제협약의 참여 형태로 추진되는 공동연구개발 활동으로 정의할 수 있다.
2014년도 정부연구개발사업으로 지원한 총 45,865건의 과제 중 232건(0.5%)의 과제가 495건의 국제 공동․위탁연구를 수행하였으며, 이는 2013년도 대비 205건이 감소한 수치이다. 부처별로 살펴보면 아래 [그림 3-2-1]과 같이 국제 공동․위탁연구는 대부분 미래부(214건, 43.2%)와 산업부(200건, 404%)에서 지원하고 있다.

출처 : 2014 국가연구개발 조사․분석보고서, KISTEP
[그림 3-2-1] 부처별 국제 공동․위탁연구 추이, 2012~2014
국가별로 살펴보면 국제 공동․위탁연구는 아래 [그림 3-2-2]와 같이 미국이 180건(36.4%)으로 가장 많고, 독일 28건(5.7%), 일본 27건(5.5%) 등으로 수행되었다. 2013년도 대비 미국은 130건(△41.9%), 일본은 22건(△44.9%)이 감소하였다.

출처 : 2014 국가연구개발 조사․분석보고서, KISTEP
[그림 3-2-2] 국가별 국제 공동․위탁연구 상위 10개국 추이, 2012~2014
미래유망신기술(6T)별로 살펴보면, ET가 164건(33.1%)으로 가장 많고, IT가 89건(18.0%), BT는 84건(17.0%)에 이른다.
[표 3-2-1] 2014년도 국가별 국제 공동․위탁연구 미래유망신기술(6T)별 현황
|
구분 |
공동연구 |
위탁 |
합계 |
||||
|
국제 협약 |
기술 연수 |
연구자 해외파견 |
외국연구자 유치 |
정보 교환 |
|||
|
IT |
38 |
1 |
1 |
18 |
19 |
12 |
89 |
|
BT |
28 |
0 |
0 |
17 |
6 |
33 |
84 |
|
NT |
12 |
0 |
0 |
15 |
5 |
14 |
46 |
|
ST |
0 |
0 |
0 |
1 |
1 |
1 |
3 |
|
ET |
25 |
0 |
1 |
50 |
14 |
74 |
164 |
|
CT |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
기타 |
27 |
1 |
0 |
21 |
24 |
36 |
109 |
|
합계 |
130 |
2 |
2 |
122 |
69 |
170 |
495 |
출처 : 2014 국가연구개발 조사․분석보고서, KISTEP
나. 해외 동향
미국, 독일, 일본 등 선진국들은 자국의 과학기술 경쟁력을 유지․강화하기 위해 ʻ국제화ʼ를 과학기술발전의 중요한 전략으로 추진하고 있다. 2014년 노벨 물리학상 수상자인 일본 나고야대학교 아마노 히로시(Amano Hiroshi) 교수가 언급한 바와 같이 정부차원의 장기적인 국제교류 지원과 국제공동연구의 참여는 세계 최고수준의 연구성과 도출의 필수조건이라고 할 수 있다. 또한, 주지하듯이 과학기술 분야에서 추격형 모델의 한계를 극복하고 선도적인 위상을 확립하기 위해서는 창조적 지식가치를 창출하는 것이 필수적이며, 이를 위해서는 선진국의 국가별 과학기술 경쟁력에 대한 치밀한 분석을 통해 전략적인 국제협력 연구개발을 추진할 필요가 있다. 이를 위해 우리나라 정부는 과학기술기본법 및 동법 시행령에 근거하여 매 2년마다 “기술수준평가ʼʼ를 실시하고 있으며, 국가적 주요 핵심기술에 대한 기술수준을 평가하여 R&D 투자전략, 기술향상 대책 등 R&D 정책 수립의 기초자료로 활용하고 있다.
2015년 4월에 국가과학기술심의위원회에서 발표한 「2014년도 기술수준평가 결과(안)」 보고서에 따르면, 우리나라의 전체 기술수준 및 기술격차는 최고국가 대비 78.4%, 4.4년으로 2012년도(77.8%, 4.7년)에 비해 기술수준은 0.6% 향상되었고, 기술격차는 0.3년 단축되었다. 국가별로는 미국이 최고의 기술수준 국가로 평가되었으며, EU(95.5%), 일본(93.1%) 등 순으로 평가되었다. 10대 분야별 주요국가의 기술수준 및 기술격차는 아래 [표 3-2-2]와 같다.
[표 3-2-2] 10대 분야별 주요국 기술수준 및 기술격차
|
10대 분야 |
한국 |
미국 |
EU |
일본 |
중국 |
|||||
|
기술 수준 (%) |
기술 격차(%) |
기술 수준(%) |
기술 격차(%) |
기술 수준 (%) |
기술 격차(%) |
기술 수준 (%) |
기술 격차(%) |
기술 수준 (%) |
기술 격차 (%) |
|
|
□ 국가전략기술 전체 |
78.4 |
4.4 |
100.0 |
0.0 |
95.5 |
1.1 |
93.1 |
1.6 |
69.7 |
5.8 |
|
◦ 전자·정보·통신 |
83.2 |
2.7 |
100.0 |
0.0 |
91.3 |
1.5 |
91.3 |
1.5 |
70.3 |
4.5 |
|
◦ 의료 |
77.9 |
4.0 |
100.0 |
0.0 |
92.8 |
1.5 |
89.7 |
2.1 |
68.3 |
5.5 |
|
◦ 바이오 |
77.9 |
4.5 |
100.0 |
0.0 |
95.8 |
1.2 |
93.4 |
1.7 |
70.4 |
6.2 |
|
◦기계·제조·공정 |
83.4 |
3.3 |
100.0 |
0.0 |
98.9 |
0.5 |
97.1 |
0.8 |
72.3 |
5.0 |
|
◦ 에너지·자원·극한기술 |
77.9 |
4.6 |
100.0 |
0.0 |
97.8 |
0.5 |
92.8 |
1.7 |
71.3 |
5.5 |
|
◦ 항공·우주 |
68.8 |
9.3 |
100.0 |
0.0 |
93.8 |
2.5 |
84.2 |
4.8 |
81.9 |
5.0 |
|
◦ 환경·지구·해양 |
77.9 |
5.0 |
100.0 |
0.0 |
99.3 |
0.4 |
96.2 |
1.3 |
63.3 |
8.3 |
|
◦ 나노·소재 |
75.8 |
4.1 |
100.0 |
0.0 |
93.6 |
1.4 |
94.3 |
1.3 |
69.2 |
5.2 |
|
◦ 건설·교통 |
79.6 |
4.3 |
100.0 |
0.0 |
98.5 |
0.6 |
97.0 |
0.7 |
69.7 |
6.1 |
|
◦ 재난·재해·안전 |
73.0 |
6.0 |
100.0 |
0.0 |
92.4 |
2.2 |
94.3 |
1.8 |
65.8 |
7.6 |
출처 : 2014년도 기술수준평가 결과(안), 국가과학기술심의위원회(2015.4)
(1) 미국
주요 선진국의 과학기술 정책을 살펴보면, 먼저 미국은 국가 차원에서 장기적이며 경제성장에 중요한 역할을 할 수 있는 목표지향적인 전략과제를 중점적으로 지원하고 있다. 2009년 발표된 과학기술 외교 전략에 따르면 더욱 지속적인 천연자원 활용, 생물다양성의 보존과 기후변화영향의 탄력성을 촉진하기 위한 기술적 진보의 촉진을 포함한 연구 적용에 초점을 맞추고 있다. 특히, 생명공학 분야에 대해서는 각별한 관심을 가지고 있는데, 외교 전략에 농업생산성 향상을 위해 신기술이 필요한 생명공학 분야를 포함하여 과학적․기술적 적용의 지원과 더욱 안정적이고, 영양이 풍부하며 구매 가능한 식품공급을 제공하겠다는 계획이 포함되어 있다. 기초연구는 새로운 제품과 서비스에 대한 개발을 염두에 두고 투자하고 있으며, 기초연구에 대한 지원을 전담하고 있는 미국립과학재단(National Science Foundation)은 2012년부터 과학과 교육을 연계하여 다학제적으로 국제적 이슈를 해결하기 위한 국제협력사업 SAVI(Science Across Virtual Institutes)를 추진하고 있다.
미국은 우리나라의 10대 국가전략기술 분야를 기준으로 모든 분야에서 세계 최고의 기술수준을 확보하고 있기 때문에, 과학기술 발전을 위해서는 필수적인 협력대상국이라고 할 수 있다. 한국도 미국과 장기적이고 견고한 협력 관계를 확대해야 하며, 신진인력교류 활성화, 대규모 공동연구 확대, 우수 연구기관 유치 등 장기적인 관점에서 성과를 도출할 수 있도록 지속적인 지원이 필요하다. 특히, 미국이 주도하고 있는 대형 연구에 적극적으로 참여하는 것은 세계적인 과학기술 의제를 선점할 수 있고 이에 따른 경제적․산업적 파급효과가 클 것으로 기대된다.
(2) 유럽연합(EU)
유럽연합(EU)의 경우는 환경, 에너지 등 회원국의 공동 문제 해결을 위해 1984년부터 Framework Programme을 추진하고 있으며, 2014년부터 시작된 제8차 Framework Programme은 Horizon 2020으로 이름을 바꾸어 전 지구적 문제 해결을 위한 국제협력을 확대하고 있다. 2007년부터 시작된 제7차 Framework Programme의 경우, 유럽연합의 특성상 전체 예산에서 ʻ협력ʼ 부분의 비중이 69.4%로 국제협력이 가장 활발하게 진행되고 있다. 2007년부터 2010년까지 주요 연구분야별 예산지원 비율은 정보통신(33%), 보건의료(18%), 나노과학/재료/신생산기술(12%), 운송(10%), 환경(6%), 식품/농업/바이오(6%), 에너지(6%), 사회/경제/인문(2%), 안전(3%), 우주(3%) 등으로 구성되어 있다.
유럽연합의 2014년도 기술수준은 95.5%로 평가되었으며, 환경/지구/해양 분야와 기계/제조/공정 분야가 가장 높았고, 바이오의 경우는 95.8% 수준이었다. Horizon 2020은 비회원국과의 활발한 협력을 통한 시너지 창출을 목표로 삼고 있으므로 우리나라 정부 차원으로 적극적이고 전략적인 참여가 필요한 상황이다. 에너지, 환경, 기계 등의 분야에서 국제협력을 적극적으로 추진한다면 경제적․산업적 파급효과가 클 것으로 기대된다.
(3) 일본
일본의 경우는 과학기술을 경제사회적 활력의 핵심 요소이며 사회의 요구와 미래에 대한 선행 투자로 인식하고 인재육성과 연구성과의 산업화를 위한 시스템 개혁을 적극적으로 추진하고 있다.
일본의 2014년도 전체 기술수준은 93.1%로 평가되었으며 비교우위 강점 기술 분야는 기계/제조/공정, 건설/교통, 재난 대비 기술, 차세대 소재, 스마트 자동차, 에너지 등을 들 수 있다. 또한, 초정밀 디스플레이 공정 및 장비 기술, 환경 친화 자동차 기술, 맞춤형 신재배기술 등은 세계 최고의 기술력을 확보하고 있다. 특히, 일본은 과학 분야에서 노벨상을 19회 수상했을 정도로 기초과학이 발달해 있으므로 지리적 장점을 살려 인력교류를 확대하고, 심화 공동연구를 강화하고, 첨단산업 분야의 국제 협력이 필요한 상황이다.
(4) 독일
유럽연합 회원국 중 독일은 경제가 가장 안정적으로 성장하고 있으며, 과학기술 분야에 대해 매우 적극적으로 투자하고 있다. 독일 정부는 우수한 연구결과를 신속히 제품화하는데 적극적으로 지원한다는 목표로 17개 핵심기술을 도출, 분야별로 구체적인 전략을 제시하고 있으며, 산학연계, 혁신적 중소기업을 위한 여건을 개선하고 있다. 특히 독일의 ʻ첨단기술전략 2020(High-tech Strategy 2020 for Germany)ʼ은 정부, 연구원, 산업계 전문가의 참여 아래 범정부 차원에서 수립한 국가 과학기술육성 전략이다. 당 전략의 골자는 전지구적으로 대응할 필요가 있는 기후보호 및 에너지, 보건 및 영양, 이동성, 커뮤니케이션, 보안 등 5개 영역에서 총 11개의 과학기술 개발 우선추진 과제(Forward-looking Projects)를 목표로 한 국제과학기술 협력이다.
이러한 시점에 한국 정부도 첨단과학기술연구와 관련된 장기적인 협력전략을 수립할 필요가 있으며, 독일과 함께 견고한 협력관계를 맺고 협력을 통해 전 지구적 대응에 동참할 필요가 있다고 할 수 있다. 특히 독일은 유럽통합의 가장 큰 공로국가로서 유럽 내에서의 첨단 과학기술이전에 있어서도 그 어느 나라보다 적극적인 자세를 견지하고 있다는 점에서 협력의 기회는 증가하고 있다.
(5) 중국
마지막으로 중국의 경우는 1980년대 이후 정부 주도의 과학기술 연구발전 계획이 본격적으로 시행되어 상대적으로 기초과학 분야가 취약한 것으로 평가되고 있지만, 최근 들어 기초연구의 국제적 선진화 달성을 위해 중점적으로 투자를 확대하고 있다. 중국의 2014년도 전체 기술 수준은 69.4%이며, 우리나라와의 기술격차가 2012년 1.9년에서 2014년 1.4년으로 축소될 정도로 추격 속도가 빠르다. 특히, 건설/교통, 바이오 분야의 성장 속도가 빠르며, 항공우주 분야는 우리나라가 4.3년이나 뒤쳐진 것으로 평가되었다.
양국 간 과학기술 경쟁력의 차이가 빠르게 축소되고 있으므로 기술수준 차이를 고려한 분야별 세부 협력 프로그램을 마련하여야 하며, 중국이 미래 자원 및 에너지 확보 등을 공격적으로 추진하고 있으므로 해당 분야의 한-중 협력을 증진할 특화 프로그램이 필요하다.
다. 국내 현황
박근혜 정부는 신산업 및 고용창출을 목적으로 ICT와 과학기술을 적극적으로 활용하는 ʻ창조경제ʼ를 국정기조로 제시하였으며, 창의자산의 효율적 획득과 경제적 성과 창출을 위해 활동영역을 국제무대로 확장할 필요성이 커지고 있다. 미래창조과학부가 2014년 4월 국가과학기술심의위원회를 통해 발표한 “과학기술․ICT 기반 국제협력 종합계획”에는 국내외 자원을 효과적으로 활용하여 해외진출을 활성화하고 경제적 성과로 연계하기 위한 국제협력 중장기전략이 담겨 있다.
종합계획의 목표로는 미래창조과학부를 중심으로 관계부처가 힘을 합하여 과학기술․ICT 글로벌 진출을 통한 경제성과 창출과 혁신역량을 향상하는 것이며, 이를 통해 글로벌 위상을 제고하고 창조경제를 실현하는 것을 비전으로 삼고 있다. 종합계획을 통해 추진할 5대 전략은 1) 국제협력 및 해외진출 지원 협업체계 구축, 2) 중소․벤처기업 해외진출 지원 강화, 3) 글로벌 우수 자원 활용을 위한 혁신역량 강화, 4) 과학기술․ICT 외교를 통한 협력기반 조성 강화, 5) 국제협력 성과관리 효율화이다.
2015년 4월 국가과학기술심의위원회에서 발표한 기술수준 평가 결과에 따르면, 2014년도 한국의 바이오 분야 기술수준은 선진국에 비해 77.9%로 2012년도에 비해서는 0.6% 향상되었으나, 중국의 추격이 빨라짐에 따라 대중국 기술격차는 1.7년에 불과하여 위기감이 고조되고 있는 상황이다. 세부기술을 살펴보면, 아래 [그림 3-2-3]과 같이 ʻ줄기세포 분화․배양기술ʼ(84.8%)의 기술수준이 상대적으로 높은 수준이며, ʻ유전체 정보를 이용한 질환원인 규명기술ʼ(71.6%)은 상대적으로 낮은 수준에 그치고 있다.

출처 : 2014년도 기술수준평가 결과(안), 2015.4.
[그림 3-2-3] 바이오 분야 기술수준 격차 현황
한국의 의료 분야 기술수준은 선진국에 비해 77.9%로 2012년도에 비해서는 0.3% 향상되었으나, 중국의 추격이 매우 빨라짐에 따라 대중국 기술격차는 –1.5년에 불과한 상황이다. 세부기술을 살펴보면, 아래 [그림 3-2-4]와 같이 ʻ불임․난임 극복기술ʼ(89.7%)의 기술수준이 상대적으로 높은 수준이며, ʻ생활 및 이동 지원기기기술ʼ(70.6%)은 상대적으로 낮은 수준이다.

출처 : 2014년도 기술수준평가 결과(안), 2015.4.
[그림 3-2-4] 의료 분야 기술수준 격차 현황
정부가 국제협력 활성화를 위해 추진하고 있는 사업은 부처별로 아래 표와 같이 매우 다양하지만, 본 백서에서는 부처별로 다양한 국제협력 사업 중에서 미래창조과학부와 교육부의 주요 사업들에 대한 지원 현황과 우수성과를 분석할 계획이다.
연구개발을 중심으로 하는 사업은 미래창조과학부와 산업통상자원부가 주도하고 있으며, 교육부에서는 연구의 네트워크를 확대하는 사업을 시행하고 있다. 특히, 교육부는 국제백신연구소를 지속적으로 지원하고 있다. 국제백신연구소는 UN개발계획의 설립 제안으로 국제개발도상국을 위한 안전하고 효과적이며 저렴한 백신의 발굴, 개발 및 보급을 위해 1996년도에 국내에 설립된 국제기구이다.
미래창조과학부는 2015년도에 해외과학기술자원활용사업에 2014년도 대비 약 12억 원이 증가한 977억 원을 배정했으며, 산업통상자원부는 산업기술국제협력사업에 2014년도 대비 약 37억 원이 증가한 626억 원을 배정하였다. 교육부는 2015년 글로벌연구네트워크지원사업의 예산을 2014년과 동일하게 66억 원을 배정했으며, 국제백신연구소에 대한 2015년 지원 예산은 2014년도에 비해 약 19억 원 감소한 40억 원을 배정하였다. 부처별 주요 국제협력사업에 대한 현황은 아래 [표 3-2-3]과 같다.
[표 3-2-3] 국제협력 분야 정부연구개발예산 편성현황(2014~2015)
(단위 : 억 원, %)
|
부처 |
회계명 |
세부사업명 |
2014년 |
2015년 |
|
교육부 |
일반 |
대학연구인력국제교류지원 |
18 |
18 |
|
일반 |
글로벌연구네트워크지원 |
66 |
66 |
|
|
일반 |
국제백신연구소지원 |
59 |
40 |
|
|
국무총리실 |
일반 |
대개도국과학기술정책협력사업(ODA) |
3 |
3 |
|
일반 |
아태지역양성평등정책인프라 강화연수사업(ODA) |
5 |
5 |
|
|
기상청 |
일반 |
아태기후정보서비스및연구개발 |
70 |
75 |
|
농촌진흥청 |
일반 |
해외농업기술개발지원(ODA) |
156 |
157 |
|
일반 |
글로벌농업기술협력 |
193 |
195 |
|
|
미래창조과학부 |
일반 |
기후변화대응기술개발 |
435 |
465 |
|
일반 |
국제교류협력연구기획평가사업 |
26 |
26 |
|
|
일반 |
과학기술국제부담금 |
31 |
31 |
|
|
일반 |
과학기술국제협력네트워크사업 |
2 |
16 |
|
|
일반 |
해외과학기술자원활용 |
965 |
977 |
|
|
일반 |
막스플랑크한국연구소설치 |
40 |
45 |
|
|
일반 |
프라운호퍼IME한국연구소설치 |
- |
- |
|
|
일반 |
개도국과학기술지원 |
22 |
29 |
|
|
일반 |
개도국과학부담금 |
8 |
8 |
|
|
일반 |
글로벌연구실 |
225 |
225 |
|
|
일반 |
국가간협력기반조성 |
174 |
180 |
|
|
일반 |
국제연구인력교류 |
57 |
- |
|
|
일반 |
원자력국제협력기반조성 |
68 |
65 |
|
|
일반 |
국제핵융합실험로공동개발 |
566 |
748 |
|
|
기금 |
국제핵융합실험로공동개발 |
300 |
- |
|
|
일반 |
한국파스퇴르연구소운영 |
85 |
75 |
|
|
일반 |
아태이론물리센터지원 |
32 |
32 |
|
|
일반 |
해외우수연구기관유치 |
139 |
125 |
|
|
산업통상자원부 |
일반 |
산업기술국제협력 |
589 |
626 |
|
특별 |
에너지국제공동연구 |
76 |
84 |
|
|
기금 |
에너지국제공동연구 |
123 |
8 |
|
|
해양수산부 |
일반 |
해양과학국제연구사업(R&D) |
16 |
18 |
|
합계 |
4,549 |
4,342 |
||
미래부창조과학부의 국제협력사업 중 한국연구재단을 전문기관으로 지정하여 추진하고 있는 국제협력 연구개발사업은 크게 글로벌연구실지원, 국제화기반조성, 글로벌협력기반조성(ODA), 해외우수연구기관 유치, 과학기술네트워크지원사업 등의 내역사업으로 구분할 수 있다. 이외에도 한국연구재단은 교육부가 시행하고 있는 글로벌연구네트워크지원사업, 한-EU 교육협력사업, 국제협력선도대학사업 등을 추진하고 있다. 또한 한국연구재단은 약 104억 원의 출연금으로 한중일교류협력사업, 한독공동기금지원, 한스웨덴 공동기금지원, 연구교류지원사업, 개도국지원사업, 국제응용시스템분석연구원(IIASA)협력사업 등도 추진하고 있다.
2010년 이후로 한국연구재단에서 지원한 국제협력 연구개발사업 과제들에 대한 미래유망신기술(6T) 분류 현황은 아래 [표 3-2-4]와 같다. 2014년에는 가장 많이 지원한 분야는 생명공학(BT) 분야로 약 295억 원(전체 사업비의 38.0%)을 지원하였다.
[표 3-2-4] 2014년 과학기술국제화사업 미래유망신기술(6T)별 지원 현황
|
(단위 : 백만 원) |
|||||
|
구분 |
2010 |
2011 |
2012 |
2013 |
2014 |
|
IT |
3,742 |
4,256 |
3,917 |
5,209 |
4,120 |
|
BT |
27,911 |
31,948 |
37,804 |
34,128 |
29,546 |
|
NT |
10,568 |
9,179 |
10,764 |
12,813 |
11,873 |
|
ST |
896 |
903 |
1,823 |
318 |
155 |
|
ET |
7,185 |
7,812 |
8,972 |
7,204 |
7,881 |
|
CT |
|
17 |
190 |
87 |
15 |
|
기타 |
20,547 |
18,465 |
17,651 |
25,875 |
23,590 |
|
합계 |
70,850 |
72,581 |
81,119 |
85,633 |
77,181 |
미래창조과학부의 국제협력 연구개발사업 중 대표적인 사업으로는 글로벌연구실 지원사업, 해외우수기관유치지원사업을 들 수 있다. 글로벌연구실지원사업(Global Research Laboratory)은 핵심 기초․원천 기술분야에서 해외 우수 연구주체와의 심화된 국제 공동연구를 통해 글로벌 협력 네트워크를 강화하고 국내 연구역량을 세계적 수준으로 제고하는 것을 목적으로 하고 있다. 지원 규모는 연간 5억 원 이내이며, 총 6년(3년 + 3년)까지 지원한다. 2014년에는 약 225억 원의 예산으로 총 51과제(신규 7, 계속 44)를 지원하였고, 2015년도에는 같은 예산으로 총 52과제(신규 8, 계속 44)를 지원하였다. 2014년과 2015년에 글로벌연구실 지원사업으로 선정된 생명공학 분야의 신규과제목록과 대표적인 우수성과는 다음 [표 3-2-5]와 [표 3-2-6]과 같다.
[표 3-2-5] 2014-15 글로벌연구실지원사업 생명공학 분야 신규 선정과제 목록
|
연도 |
책임자 |
기관명 |
과제명 |
|
2014 |
최광욱 |
KAIST |
Crumbs 및 Xpd와 관련된 희귀질병의 유전적 억제 |
|
2014 |
박윤경 |
조선대 |
전염성 Superbugs 확산 제어를 위한 항생펩타이드 설계 및 원천기술 개발 |
|
2014 |
안교한 |
포항공대 |
질병진단 및 영상화를 위한 이광자 형광 프로브의 개발 |
|
2015 |
김동억 |
동국대 |
단핵구생물학기반 동맥혈전증 예방-진단-치료 동시수행 나노 플랫폼 기술개발 |
|
2015 |
권호정 |
연세대 |
비수식 화합물의 표적결정시스템과 이미징 질량분석기술을 활용한 한의약 유래 화합물의 혈관 신생 저해 효능 및 기전 규명 |
|
2015 |
김학성 |
KAIST |
종양 유발 인산화 효소를 표적하는 환자 맞춤형 단백질 치료제 개발 |
|
2015 |
문인규 |
조선대 |
치료진단용 다중모드 홀로그래픽 세포영상 인포매틱스 |
[표 3-2-6] 글로벌연구실지원사업 생명공학 분야 우수성과(2014)
|
○ 연구책임자 : 포항공대/ 이영숙 교수 (2006년 선정) ○ 식물 성장 호르몬 사이토카이닌의 수송에 관여하는 수송단백질 규명 - 비소에 대한 내성과 쌀에 비소 축적을 조절하는 key 수송단백질 OsABCC1 발견했다. - 비소 수송단백질 OsABCC1이 줄기의 마디 조직의 체관세포 액포에 위치해서 비소를 수송 격리시켜서 비소가 쌀로 이동되는 것을 억제한다는 점을 발견함으로써 쌀에서 비소 축적을 줄일 수 있는 유전자를 확정하였다. ※ 「PNAS」 誌 게재 ('14. 5.) |
|
○ 연구책임자 : 이화여대/ 남원우 교수 (2013년 선정) ○ 광합성 시 칼슘 역할 규명, 친환경 기술 개발 실마리 - 식물의 광합성 과정에서 칼슘의 역할을 처음으로 밝혀내 인공광합성과 친환경 에너지 개발의 새 가능성을 제시하였다. ※ 「Nature Chemistry」 誌 게재 ('14. 09.) |
|
○ 연구책임자 : 광주과학기술원/ 김민곤 교수 (2013년 선정) ○ 암세포 치료를 위한 헤테로 나노물질에 대한 시뮬레이션 성공 - 헤테로 플라즈모닉(hetero plasmonic) 현상에 대한 규명을 위한 광학적 시뮬레이션을 수행하고, 이를 바탕으로 보다 효율적인 암치료제로 사용이 가능한 HPNs을 제조하기 위한 기반 정보를 제공하였다. |
해외우수기관유치지원사업은 해외로부터 연구인력, 기술, 연구비 등이 유입되는 공동연구센터의 국내 설립 및 운영을 지원하여 원천기술을 확보하고 글로벌 연구개발 허브기반을 구축하는 것을 목적으로 하고 있다. 지원 규모는 연간 6억 원 이내이며 총 6년(2년+4년)을 지원한다. 2014년도에는 약 140억 원의 예산으로 24개의 계속과제를 지원했으며, 2015도에는 125억 원의 예산으로 총 21과제(신규 4, 계속 17)를 지원하였다.
동 사업은 2005년 시범사업을 시작한 이후, 미국 Betelle, NIH, CASE, 일본 RIKEN 및 독일 프라운호퍼-IFAM 등 세계의 최고 수준의 연구기관과 함께 설치한 공동연구센터를 지원함으로써 국내 연구개발역량을 크게 향상시키는 성과를 거두었다. 2015년 현재 생명공학(BT) 분야에서 아래 [표 3-2-7]와 같이 12개의 공동연구센터를 지원하고 있으며, 대표적인 우수성과는 아래 [표 3-2-8]와 같다.
[표 3-2-7] BT분야 해외우수연구기관유치사업 공동연구센터 현황
|
선정 |
센터명 |
주관기관 (연구책임자) |
해외 연구기관 |
기술분야 |
|
’09년 |
차세대의학물리연구센터 |
가톨릭대 (서태석) |
미 스탠포드대 MIPS |
의학물리 |
|
’10년 |
생명연-리켄 화학생물공동연구센터 |
생명연 (안종석) |
일 RIKEN |
천연물 및 생약학 |
|
연세대학교 프라운호퍼 의료기기 공동연구센터 |
연세대 (김한성) |
독 프라운호퍼 IKTS |
의료기기 |
|
|
’11년 |
화순전남대학교병원‧ 프라운호퍼 공동연구소 |
화순전남대병원 (김형준) |
독 프라운호퍼-IZI |
면역백신 |
|
아산-다나파버 암 유전체 연구 센터 |
울산대 (장세진) |
미 DFCI |
종양학 진단 |
|
|
가톨릭-하버드 Wellman 광의학 핵심기술 개발센터 |
가톨릭대 (최명규) |
미 하버드 웰만 광의학 센터 |
의료기기 |
|
|
’12년 |
연세 – Cedars-Sinai 심장융합영상연구센터 |
연세대 (정남식) |
미 씨다-사이나 메디컬 센터 |
심혈관질환 영상 및 진단 |
|
한국베크만 광의료기기 연구센터 |
단국대 (정필상) |
미 베크만레이저연구소 |
의료기기 |
|
|
’13년 |
서강-하버드 질병 바이오 물리 연구센터 |
서강대 (최정우) |
미 하버드 Wyss 질병 바이오물리 연구소 |
바이오칩 |
|
’15년 |
아산-미네소타 이식 이노베이션 센터 |
서울아산병원 (김종재) |
미 미네소타대학교 |
장기이식 |
|
SNU-SciLifeLab차세대유전체기술 센터 |
서울대 (권성훈) |
스웨덴 싸이라이프연구소 |
바이오소자 |
|
|
이화-잭슨랩 암면역치료법 연구센터 |
이화여대 (김재상) |
미 잭슨랩 |
암치료 |
[표 3-2-8] 해외우수기관유치지원사업 생명공학 분야 우수 연구성과(2014)
|
○ 연세대/ 정남식 교수 ○ 연세-Cedars-Sinai 심장융합영상연구센터 - 심혈관 CT영상의 획득부터 응용 기술까지 전반적인 의료영상 기반 기술을 개발하고 이에 대한 특허권 확보 완료 - 심혈관 시술의 정확도를 높이기 위한 방사선 불투과성 반구형 입체 표지를 이용한 X-선 조영 영상과 CT 혈관 조영 영상 간의 정합 방법 및 시스템을 개발하고, 이를 국내 특허 및 해외특허(PCT)로 출원 완료 - 시술 방법의 결정 및 결과 예측 평가를 위한 기반 기술로 좌심방의 폐쇄를 위한 기구삽입 시뮬레이션 방법 개발 |
|
○ 전남대/ 김형준 교수 ○ 화순전남대학교병원-프라운호퍼 공동연구소 - 다발골수종 환자를 위한 수지상세포치료제(Vax-DC/MM)에 대한 임상시험신청을 통해 식약청 승인(2013.10.)을 받았고, 현재 환자를 대상으로 임상 1/2a 연구 진행 중 - 마우스 종양모델을 이용한 Vax-DC의 유효성 평가 수행 - Vax-DC의 제조에 대한 자가기준 및 시험방법 확립 |
교육부가 시행하는 글로벌연구네트워크지원사업은 해외우수 연구자들과의 공동연구 및 네트워크 확대를 통해 국내 연구역량 제고와 세계 수준의 연구성과 창출을 목표로 삼고 있다. 지원규모는 연간 1억 원 이내이며, 최대 3년까지 지원한다. 2014년에는 66억 원의 예산으로 총 57과제(신규 41, 계속 16)를 지원했으며, 2015년에는 66억 원의 예산으로 총 57과제(신규 1, 계속 56)를 지원하였다. 글로벌연구네트워크지원사업의 대표적인 우수성과는 아래 [표 3-2-9]와 같다.
[표 3-2-9] 글로벌연구네트워크지원사업 생명공학 분야 우수 연구성과
|
○ 연구책임자 : 중앙대/김성기 교수 ○ 협력기관 및 연구자 : Carnegie Institution in Stanford University(Wang, Zhiyong, Park, Chan Ho) ○ 과제명: - BRs가 식물면역반응 신호와의 상호작용에 있어서도 중요한 역할을 하고 있음을 강력히 제시 · BR과 PTI signaling 간에는 길항적 상호작용이 있음을 밝혀냄 - 브라시노스테로이드의 기능을 밝히게 된다면 추후 스테로이드 호르몬연구 활용 가능함 ※「Plant Cell (IF=9.575)」誌 게재('14.02) |
|
○ 연구책임자 : 서강대/정광환 교수 ○ 협력기관 및 연구자 : Univeristy of Guelph(Leonid Brown) ○ 과제명: 부유 미생물 군집에서 새로운 광감지 전달 기능 발굴 및 생체에너지 전환 기전 연구 - 막단백질의 구조를 규명하기 위한 새로운 NMR 구조 분석 방법 개발 · 850 MHz NMR 기자재를 이용하여 새로운 구조 분석법 시도 및 개발성공 - 막단백질 수용체를 이용한 치료 약물개발 · 새로운 구조 분석법의 개발로 원천기술 확보 ※「Nature Methods (IF=23.565)」誌 게재('13.10) |
라. 국가 간 협력 현황
한국연구재단은 2015년 10월 현재 49개국 76개 기관과 협력관계를 유지하고 있으며, 한-미, 한-독, 한-중 등과 같은 양자 간 과학기술 협력사업 뿐만 아니라 한국-EU, 한-ASEAN과 같은 다자 간 과학기술 협력사업을 추진하고 있다. 본 백서에서는 한국연구재단이 지원하고 있는 양자 및 다자 간 과학기술 협력사업의 현황과 주요 성과, 특히 생명공학 분야의 우수성과를 소개하고자 한다.
(1) 한국-미국
한국과 미국 사이의 과학기술 협력을 활성화하기 위한 사업은 크게 5가지를 들 수 있다. 과학기술 교육․교류 사업으로는 미국 대학원생 하계연수사업, 미국 우수 대학원생 방문연구사업, 연구관리․국제협력 전문가 교육과정을 운영하고 있다. 또한 미국과의 국제협력 네트워크를 강화하고 효율적으로 미래핵심기술을 확보하기 위해 미공군협력사업을 추진하고 있으며, 2015년 지원예산은 5억 6천만 원이다. 한국연구재단은 한국과 미주국가 간 공동연구 수행을 통해 과학기술 R&D 협력 기반을 강화하기 위해 미주국가와의 과학기술협력확충 사업을 추진하고 있으며, 2015년 예산은 2억 원이다.
(2) 한국-독일
한국과 독일 사이의 과학기술 협력을 활성화하기 위해 한-독 협력기반조성사업을 운영하고 있다. 과제당 연간 지원예산은 1천 5백만 원이며 2년 동안 지원한다. 2015년에는 한-독 협력기반조성사업의 신규과제를 8과제 선정․지원할 예정이다.
한-독 협력기반조성사업을 수행한 연구자 중에서 동국대학교 남기창 교수는 인공심장 기능 모니터링 시스템 관련 국제 워크숍을 3차례 개최하여 독일의 인공심장 시뮬레이터와 한국의 혈관 시뮬레이터를 접목하는 공동연구 방향을 수립하였으며, 독일 아헨병원에서 국내 맥박 측정 기기의 임상 실험을 추진할 예정이다. 한국화학연구원 부설 안정성평가연구소의 윤석주 박사는 독일 연구자와의 교류․협력을 통해 ʻ비알콜성 지방간암 치료 및 진단용 암줄기세포 바이오마커ʼ에 대한 특허를 출원하는 성과를 거두었다.
(3) 한국-프랑스
한국과 프랑스 사이의 과학기술 협력을 활성화하기 위해 한-프랑스 협력기반조성사업을 운영하고 있다. 과제당 연간 지원 예산은 1천 5백만 원이며 2년 동안 지원한다. 2015년에는 한-프랑스 협력기반조성사업의 신규과제를, 2016년에는 제6차 한-프랑스 과학기술공동위원회가 프랑스에서 개최될 예정이다.
한-프랑스 협력기반조성사업을 수행한 연구자 중에서 영남대학교 백승만 교수는 바이오디지털 첨단농업단지에 대한 연구를 통해 2015년 5월 파리 국립 과학관에 바이오디지털 관련 연구소를 설립하는 성과를 거두었다.
(4) 한국-스위스
한국과 스위스 사이의 과학기술 협력을 활성화하기 위해 한-스위스 협력기반조성사업을 운영하고 있다. 과제당 연간 지원예산은 9천만 원이며 3년 동안 지원한다. 2014년도에는 신규 4과제를 지원하였으며, 2015년에는 신규 12과제를 지원할 뿐만 아니라, 대형 공동연구‧사업화 지원과제로 신규 2과제를 선정하여 연간 과제당 4억 5천만 원을 지원할 계획이다.
(5) 한국-영국
한국과 영국 사이의 과학기술 협력을 활성화하기 위해 한-영 협력창구(Focal Point)사업을 운영하고 있다. 과제당 연간 지원예산은 6천만 원이며 2년 동안 지원한다. 2015년 3월에는 한-영 과학기술공동위원회(국장급)를 서울에서 개최하였다.
한-영 협력창구사업을 수행한 연구자 중에서 경북대 윤병욱 교수는 한-영 국제 심포지움을 3차례 개최하여 식물의 방어 유도물질을 활용한 암 예방 기능성 식품신소재 개발 연구의 수준을 높여 가고 있다.
(6) 한국-러시아
미래창조과학부와 한국연구재단은 한국과 러시아 사이의 과학기술협력을 위해 2007년 3월에 한-러시아 과학기술협력센터를 설립하여 현재까지 운영하고 있다. 한-러 센터는 현지 과학기술정보의 수집․제공, 과학기술자 국내유치, 상호 방문 알선 등의 업무를 추진하고 있으며, 2016년도부터 Korea Innovation Center로 개편하여 본격적으로 기술사업화를 추진하고자 한다.
(7) 한국-중국
한국과 중국 사이의 과학기술 협력을 활성화하기 위해 한-중 핵심공동연구지원사업을 운영하고 있다. 본 사업은 한-중 간 대형 공동연구 추진을 통해 양국의 공통 문제 해결에 기여할 수 있는 실질적인 연구 성과를 도출하기 위해 양국에서 전략분야를 지정․지원함으로써 연구 성과를 제고하고 있다. 한국연구재단과 중국 국가자연과학기금위원회(NSFC) 간에 체결한 양해각서에 의거, 양 기관이 공동으로 승인한 과제를 지원하고 있으며, 2015년도에는 New and Renewable Energy Materials 분야에 대한 과제를 2과제 선정하여 과제당 연간 1억 원 이내로 총 3년 동안 지원할 예정이다.
이외에도 한-중 협력사업으로 2014년도에는 신규 30과제, 2015년도에는 신규 33과제를 선정․지원하였다. 한-중 신진과학자 교류 사업으로는 8명의 중국인 과학자를 초청하고, 6명의 국내 연구자를 파견함으로써 연구교류를 확대해 나가고 있다.
한국연구재단은 한국, 중국, 일본 3국이 참여하는 공동연구지원사업으로 A3 Foresight 프로그램을 운영하고 있다. 2015년도에는 Method and Modeling for High Performance Scientific Computing 분야에 대한 과제를 2과제 선정하여 연간 7천5백만 원 내외로 총 5년 동안 지원할 예정이다.
A3 Foresight 프로그램을 수행한 연구자 중에서 이화여자대학교 이승진 교수는 2015년 7월과 9월에 한중일 국제공동연구 심포지움을 개최하였다. 심포지움에서는 재생의학 기술의 현재와 Nano-Bio-chemistry 융합기술을 이용한 차세대 재생치료제 개발에 필요한 기술 전반의 응용사례 및 최신기술 정보를 다룸으로써, 국내외 관련 연구자간 차세대 줄기세포기반 난치성 질환 재생치료제 개발의 미래를 전망하고 연구개발 전략 및 방향을 모색하는 기회를 제공하였다.
미래창조과학부와 한국연구재단은 한국과 러시아 사이의 과학기술협력을 위해 2003년 9월에 한-중 과학기술협력센터를 설립하여 현재까지 운영하고 있다. 한-중 센터는 현지 과학기술정보의 수집․제공, 과학기술자 국내유치, 상호 방문 알선 등의 업무를 추진하고 있으며, 2015년 12월에는 Korea Innovation Center로 확대‧개편하여 본격적으로 기술사업화 업무도 함께 추진할 계획이다.
(8) 한국-일본
한국과 일본 사이의 과학기술 협력사업으로는 한-일 협력사업을 운영하고 있으며, 협력연구와 공동 세미나를 지원한다. 2014년도에는 신규 30과제를 선정하였고, 2015년 12월에 신규 30과제를 선정‧지원할 예정이다.
한-일 협력사업을 수행한 연구자 중에서 연세대 정한성 교수는 배아의 희생 없이 bio tooth를 만들어내는 기술의 기반을 만들었다. 연구결과는 ʻʻOsteogenic Potency of Nacre on Human Mesenchymal Stem Cellsʼʼ라는 제목의 논문으로 MOLECULES AND CELLS 38(3)호(2015년 3월)에 게재되었다. 현재 학계에서 활발히 진행되고 있는 인공장기 개발 중 치아 재생 분야에서 가장 진보된 방향을 확보하였다는 평가를 받고 있다. 이로 인해 해당 분야의 획기적인 치료법이 발전될 수 있는 기반을 마련하였을 뿐 아니라, 다른 뼈 재생 연구에도 많은 도움을 줄 것으로 예상된다.
이외에도 한국과 일본 사이의 협력 증진을 위해 일본연수특별프로그램, 일본학술진흥회(JSPS) Fellowship Program, HOPE Meeting 참가 지원사업, 일본논문박사학위지원사업 등을 추진하고 있다. 특히, HOPE Meeting은 한국연구재단(National Research Foundation of Korea)에서는 일본학술진흥회(JSPS) 간 협력사업의 일환으로 추진되는 사업으로, 국내 신진과학도들에게 일본의 노벨상 수상자 및 저명 과학자와의 만남의 장을 제공하고, 아시아-태평양 지역의 우수한 신진과학도들 간의 협력 네트워크를 구축하는데 기여하고 있다.
(9) 한국-유럽연합(EU)
한국과 유럽연합(EU) 사이의 협력을 위해 2015년 6월 15일에 개최된 제5차 한-EU 과기공동위원회에서는 2013년 박근혜 대통령 순방 시 선정된 전략 분야인 나노, 바이오, 에너지 ICT와 신규 분야인 위성항법 분야에 대한 연구협력 추진에 합의하였다. 특히, 바이오 분야에서는 감염병 연구기관 간 컨소시엄(GloPID-R, Global Research Collaboration for Infectious Disease Preparedness)에 참여하는 공동연구 사업을 개시하였다. 또한 2015년 12월에는 신약 및 의료기기 신규 협력 논의를 위한 생명공학포럼을 개최할 계획이다.
한국연구재단은 유럽연합과의 협력을 강화하고 핵심 원천기술 확보하고 다자간 국제협력 네트워크를 구축하기 위해 Framework Program에 참여를 희망하는 연구자들의 공동연구를 지원하고 있다. ʻʻEU Framework Programme 공동연구지원사업ʼʼ은 ʻʻPeopleʼʼ 분야에는 연간 5천만 원 내외, ʻʻCooperationʼʼ 분야에는 연간 1억 5천만 원 내외의 연구비를 지원하여 유럽연합 내 선도적인 연구집단 사이의 지속적인 연구교류와 협력을 촉진하고 있다.
한국연구재단의 지원을 받은 연구자 중에서 2010년도부터 5년 동안 지원을 받은 한국화학연구원의 정영식 박사는 ʻʻ바이러스 질환 치료제 후보물질개발ʼʼ 과제를 통해 프랑스 UNIVERSITE DE LA MEDITERRANEE 등 11개국의 우수 연구자들과 연구협력 네트워크를 구축하는 성과를 거두었다. 11개국의 우수 연구자들의 대한 자세한 내용은 아래 [표 3-2-10]과 같다.
[표 3-2-10] EU Framework Programme 공동연구 상대 국가/연구기관 현황
|
성명(Name) |
전공분야 (Field of Study) |
소속/부서(Affiliation/Depatment) |
국가 |
|
Lamballerie |
바이러스 |
UNIVERSITE DE LA MEDITERRANEE D'AIX-MARSEILLE II |
프랑스 |
|
Gould |
바이러스 |
UNIVERSITE DE LA MEDITERRANEE D'AIX-MARSEILLE II |
프랑스 |
|
Canard |
계산학 |
UNIVERSITE DE LA MEDITERRANEE D'AIX-MARSEILLE II |
프랑스 |
|
Hilgenfeld |
바이러스 |
UNIVERSITAET ZU LUEBECK |
독일 |
|
Neyts |
동물학 |
KATHOLIEKE UNIVERSITEIT LEUVEN |
벨기에 |
|
Snijder |
바이러스 |
ACADEMISCH ZIEKENHUIS LEIDEN - LEIDS UNIVERSITAIR MEDISCH CENTRUM |
네덜란드 |
|
Fouchier |
바이러스 |
ERASMUS UNIVERSITAIR MEDISCH CENTRUM ROTTERDAM |
네덜란드 |
|
Bourhy |
바이러스 |
INSTITUT PASTEUR |
프랑스 |
|
Bartenschlagar |
바이러스 |
UNIVERSITAETSKLINIKUM HEIDELBERG |
독일 |
|
Kuppeveld |
바이러스 |
STICHTING KATHOLIEKE UNIVERSITEIT |
네덜란드 |
|
Rohayem |
화학 |
RIBOXX GMBH |
독일 |
|
Grimes |
바이러스 |
THE CHANCELLOR, MASTERS AND SCHOLARS OF THE UNIVERSITY OF OXFORD |
영국 |
|
Vasseur |
바이러스 |
CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE |
프랑스 |
|
Coll |
바이러스 |
AGENCIA ESTATAL CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS |
스페인 |
|
Bricogne |
바이러스 |
Global Phasing Limited |
영국 |
|
Kessler |
바이러스 |
PIKE PHARMA GMBH |
스위스 |
|
Purstinger |
화학 |
UNIVERSITAET INNSBRUCK |
오스트리아 |
|
Meier |
바이러스 |
UNIVERSITAET HAMBURG |
독일 |
|
Liu |
바이러스 |
SHANGHAI INSTITUTE OF MATERIA MEDICA, CHINESE ACADEMY OF SCIENCES |
중국 |
|
Hwu |
화학 |
National Central University |
중국 |
|
Bolognesi |
바이러스 |
UNIVERSITA DEGLI STUDI DI MILANO |
이탈리아 |
|
Rademann |
바이러스 |
UNIVERSITAET LEIPZIG |
독일 |
|
Chaltin |
화학 |
CENTRUM VOOR INNOVATIE EN STIMULATIEVAN MEDICIJNONTWIKKELING LEUVEN VZW |
벨기에 |
|
정영식 |
|
한국화학연구원 |
한국 |
한국연구재단은 2014년도부터 추진되고 있는 Horizon 2020 프로그램에 참여 기회를 늘리기 위한 노력을 경주하고 있다. 2008년 금융위기 이후 촉발된 유럽의 경기침체 해소와 경제 시스템의 안정화, 미래를 위한 경제적 기회 창출의 필요성이 대두됨에 따라 유럽연합은 유럽의 글로벌 경쟁력 확보와 현재 직면하고 있는 사회문제 해결을 위해 연구 및 혁신 분야에 대한 지속적인 투자의 필요성을 인식하게 되었다. Horizon 2020 프로그램은 유럽연합에 부가가치를 창출하는 사항에 자원을 집중하는 원칙에 따라 과학적 탁월성, 산업 리더십, 사회적 과제 해결을 3대 중점 추진 과제로 삼고 있다. 총 예산은 약 786억 유로(한화 약 98조 6천억 원)인데, 이는 7차 Framework Program에서 투입된 약 253억 유로보다 약 47.6% 증가한 규모이다. 특히, 녹색에너지, 보건, 건강 등을 사회적 과제 부분에 전체 투입 금액의 39%(약 296억 유로)라는 최대 예산을 배정하였다.
한국연구재단은 2015년도에 EU 공동연구지원사업을 통해 생명공학 분야에서 2개 과제를 선정했다. 이화여자대학교의 오억수 교수의 ʻʻ염증성 대장암 발암인자로서의 syndecan-2 기능 연구ʼʼ(연구기간 3년 10개월, 총 2억 원) 과제를 통해 독일 Westfaelische Wilhelms-Universitaet Muenster 등 총 10개국 13개 기관 참여하는 국제협력네트워크 구축을 추진하고 있다. 또한, 연세대학교 신성재 교수는 ʻʻ마우스를 이용한 다양한 결핵백신 평가용 모델 개발과 새로운 백신의 효능평가ʼʼ(연구기간 3년 10개월, 총 5억 5천만 원)과제를 통해 네덜란드 Tuberculosis Vaccine Initiative 등 총 15개국 40개 기관 참여하는 연구협력 네트워크를 구축할 계획이다.
한국연구재단은 높은 수준의 교육 및 경력 개발 기회를 제공하기 위해 EU MSCA(Marie Skłodowska Curie Action) 인력교류 프로그램에 참여하는 국내 연구자들을 지원하고 있다. 지원기간은 EU측 연구기간에 따라 2~4년까지 가능하며, 과제당 연간 5천만 원까지 지원할 계획이다. 2015년도 지원예산은 9억 원이며, 10월 초 공모를 통해 12월에 약 10개 과제를 선정․지원할 계획이다.
또한, 한국연구재단은 2013년부터 한-EU 과기협력을 심화․확대하기 위한 협력 인프라를 구축하고 미래 협력분야를 발굴함으로써 국내 연구자의 참여 기회를 늘리기 위한 ʻ한-EU 과학기술혁신 협력사업(KONNECT)ʼ을 추진하고 있다. 본 사업은 총 26억 원의 예산으로 2016년까지 3년간 진행될 계획이다. 한국(NRF, KIAT, KISTEP), 독일(DLR, KIST_Europe), 네덜란드(RVO), 스페인(CDTi), 터키(TUBITAK) 5개국의 8개 기관 사이의 컨소시엄 형태의 과제를 지원하고 있다.
(10) 한국 정부의 개발협력
미래창조과학부는 한국의 국제적 위상에 부합하는 개발협력(ODA)을 위해서 개도국의 과학기술을 발전시키는 일에도 앞장서고 있다. 미래창조과학부와 한국연구재단이 시행하는 ʻʻ개도국과학기술지원사업ʼʼ은 개도국의 대학‧연구기관의 과학기술 역량증진을 통해 과학기술 발전과 이공계 전문인력의 양성을 지원하는 것을 목적으로 삼고 있다. 특히 본 사업은 물, 에너지 등 생존‧생계 문제의 근본적 해결과 삶의 질 제고를 위하여 지역실정에 적합한 적정과학기술을 지원하고, 개도국들이 스스로 빈곤극복과 경제성장을 해결할 수 있는 역량을 강화할 수 있도록 돕고 있다.
미래창조과학부는 2015년도에는 개도국과학기술지원사업의 예산을 2014년도에 비해 7억 1천만 원 증가한 28억 6천만 원을 배정하고 지원과제도 3과제 늘려 총 15과제를 지원했다. 이 중에서 서울대 김성민 교수의 경우는 2014년부터 개도국과학기술지원사업의 지원과제를 통해 가나 주민의 질병 퇴치를 위한 보건의료 교육과 의료기술을 지원하고 있다. 김성민 교수는 지난 2014년 2월에 가나 주민의 자궁경부암, 구강암 및 얼굴기형 예방과 AIDS 등의 질병퇴치를 위한 아프리카 가나 보건의료육과 의료기술 지원 사업 기부 전달식을 개최하고, 쌍용자동차 등의 기업 후원 유치를 통해 환자 이송용 차량 및 교육자료, 기재재․의료장비 등을 기증함으로써 가나 순야니병원의 인프라 구축에 기여하는 성과를 거두었다.
교육부는 개도국을 위한 개발협력 증진을 위해 정부와 국내대학 공동으로 대학의 자원 및 학문적․교육적 역량을 활용하여 개도국 개발을 지원하는 ʻʻ국제협력 선도대학 육성․지원 사업ʼʼ을 2012년부터 시행하고 있다. 2014년도에는 약 26억 원의 예산으로 총 6과제(계속 4, 신규 2)를 지원했으며, 2016년도에는 신규로 3과제를 선정·지원할 계획이다. 선정된 사업단은 연간 약 4~5억 원의 예산으로 최대 4년까지 지원받을 수 있다. 국제협력 선도대학사업단 중 인제대학교는 2013년부터 ʻʻ스리랑카 보건의료 수준 향상을 위한 간호학과 학위과정 구축 및 지역 보건의료 역량강화 프로그램ʼʼ 과제를 수행하고 있다. 인제대학교 사업단이 개발한 간호학과 학사학위 교육과정은 스리랑카 고등교육부의 인가를 받았으며, 보건부의 주관으로 스리랑카 전체 19개 국립대학교의 학사학위과정에 적용하는 성과를 거두었다. 또한, 지금까지 스리랑카 전체 19개 국립간호대학 교수들의 역량강화를 위한 워크숍을 6회 실시하였다. 교수진들을 초청하여 인제대학교 간호대학 석사학위과정을 이수할 수 있도록 지원하여 현재까지 2명이 졸업했으며, 현재 7명이 재학 중에 있다. 인제대학교 사업단은 스리랑카 현지에서 기본간호학 실습 매뉴얼을 편찬하고 교육용 DVD를 제작하는 등 간호학과의 수준을 높이기 위한 개발협력사업에 총력을 다하고 있다.
마. 발전 과제
미래창조과학부가 2015년 3월 발표한 「2015년도 과학기술․ICT 국제화사업 시행계획」에 따르면, 정부는 과학기술․ICT 국제협력 및 해외진출 지원을 통해 창조경제 글로벌 역량을 강화하는 것을 목표로 삼고 있다. 이를 위해 권역별․국가별 전략적 국제협력을 강화하고, 글로벌화 플랫폼을 통한 성과창출을 극대화하며, 동반자적 상생협력을 통해 글로벌 리더십을 확보해 나갈 계획이다. 특히 생명공학 분야에서는 전략적 해외 생명자원 및 연구소재 확보를 위한 정보분석 및 기획기능을 강화하고 지역별 거점 구축 및 범부처적 활용 강화 등 이익공유 모델을 개발하는 한편 국제 컨소시엄 활동을 활성화 하는 등 해외 생명자원 확보를 위한 국제협력을 강화할 방침이다. 또한 주요 선진국과의 협력을 통한 핵심 고부가가치 자원을 확보하는데 주력할 방침이다.
국가별 특성을 반영한 R&D 국제협력을 다변화하기 위한 대표적인 사업으로는 스위스와 생물의공학 등 양국의 강점 분야 또는 기술사업화 등 시너지 효과가 기대되는 분야를 중심으로 공동연구를 확대할 예정이다. 더불어 다자협력활동과 관련하여 2015년 10월 19일에 미래창조과학부는 세계과학정상회의를 개최함으로써 세계경제의 저성장 국면 전환과 글로벌 도전과제 해결을 위한 과학기술계의 역할을 모색하였으며, 향후 10년간 국제 과학기술 정책방향에 대한 ʻʻ대전 선언문ʼʼ을 채택하였다.
과학기술 국제협력 분야에 속한 연구개발사업의 경우 과학기술정책연구원(STEPI)의 보고서(김기국, 최효민, 2013)도 지적하고 있는 바와 같이, 평가체계를 글로벌 표준에 맞추어 분야별 전문성과 유연한 제도 운영, 그리고 각 단계별로 부합하는 성과를 달성할 수 있도록 평가구조의 효율성을 높여야하는 당면과제를 해결해야 한다. 국제협력사업의 고유한 특성을 반영한 평가체계와 평가지표를 통해 사업을 관리해야 하며, 사업 수행을 통한 명백한 실적(outputs)과 잠재된 실적(outcomes)에 대하여 차별화된 성과 측정 방식이 도입되어야 할 것이다.
2. 국제 표준화 노력
가. 국제 표준화 노력
(1) 개요
생명공학 시장은 신기술의 개발과 더불어 지속적으로 진화하여 의학, 농업, 산업생명공학 등 다양한 분야에 적용되고 있다. OECD 통계에 의하면 세계적으로 20,000여개의 회사에서 생명공학 관련 연구개발비로 연간 410억 달러를 사용하고 있다. 2013년도 국가과학기술자문회의 보고서에 의하면 생물산업의 세계시장은 2013년도 현재 330조원으로 연평균 9.8%의 성장률로 2020년도에는 635조원이 될 것으로 전망하였다. 국내 생물산업 시장은 2013년도 현재 6,061억 원에서 2020년도에는 4조 9천 3백억 원으로 연평균 성장률이 14%에 달할 것으로 전망하고 있다.
생명공학 시장의 급부상과 나고야의정서의 비준으로 생물소재에 대한 표준화가 국제적인 이슈로 등장하게 되면서 2013년 12월 국제표준화기구(ISO, International Organization for Standardization)에 생물공학 기술위원회(TC 276, Technical Committee 276)가 설립되었다. 현재 ISO/TC 276 총회는 용어(WG 1, Working group 1), 생물자원은행 및 생물자원(WG 2), 분석방법(WG 3), 생물공정(WG 4)과 데이터처리 및 통합(WG 5) 등 5개의 작업반에서 관련 표준화 활동을 추진하고 있다. TC 276 표준화 작업에 활동하는 국가는 간사국인 독일을 비롯하여 한국, 일본, 미국 등 총 22개국이 정회원으로, 이스라엘, 인도 등 13개국의 준회원과 그 밖의 Internal liaison이 16개, Category A liaison은 5개 등이 있다.
(2) 작업반별(WGs) 목표 및 전략
(가) WG 1 : 용어
생명공학기술 분야에서 사용하고 있는 용어 중 표준문서, 가이드라인 등 현재 국내외적으로 사용하고 있는 용어와 조화를 이루면서 ISO/TC 276의 각 작업반에서 사용하는 용어들을 grouping할 수 있는 말뭉치 틀을 개발하고 있다. 이를 위하여 한국에서는 (재)연구소재중앙센터가 각 생물자원은행들이 사용하는 용어를 조사‧연구하여 단체표준화한 용어 49개를 제안하여 우리 용어의 국제화에 기여하고 있다.
(나) WG 2 : 생물자원은행 및 생물자원
생물자원은 생명공학의 진보, 식품산업, 사람과 동물의 건강, 생명과학에 대한 연구 등을 위하여 필수적인 원자재로, 생물자원에서 유래한 생물학적 시료나 생체분자학적인 연구는 인간의 질병과 그 영향을 생리병리학적으로 풀 수 있는 핵심요소라고 할 수 있다. 예를 들어 인체시료로 바이오마커와 맞춤형 의약품의 개발이 가능해지고 미생물을 이용하여 개발된 바이오제품의 보급과 서비스가 인류의 편익을 가져다주는 등 바이오기술을 기반으로 하는 바이오경제시대로 입문하였다. 현재까지 알려진 인간의 단백질 암호화 유전자는 3만개 이상이나 시장에 출시된 유전자 제품은 고작 500여개에 불과한 것에서 볼 수 있듯이 생물자원의 성장가능성은 무궁무진하며, 생물자원의 품질이 맞춤의약, 바이오제품 등의 생산 가능성 여부를 결정한다.
WG 2에서는 생물자원의 품질을 보장하고, 인류공동의 관심사인 바이오마커의 품질보증(QA)을 위해 국제공동연구를 촉진하고 질병관리 등 생명자원을 관리할 수 있는 국가 혹은 국제적인 생물자원은행에 관한 가이드라인을 개발하고 있다. 이 가이드라인의 범위는 인체를 포함한 동물, 식물, 미생물 등의 생물자원은행이며 임상진단이나 치료, 규제가 심한 식량생산과 농업생산 등은 적용대상에서 제외된다.
(재)연구소재중앙센터는 연구소재은행 34개소를 중심으로 제정한 ʻ연구소재은행을 위한 운영관리지침 SPS-KNRRC 0001-2008 : 2015(개정)ʼ 중 연구소재은행 운영시스템 과정, 이해관계자의 만족도 증진을 위한 불만 처리 관리 등을 ISO/TC 276에서 제정 중인 가이드라인 총 15개 항목 중 10개 항목에 대한 의견을 개진하고, 그 외 보안사고 대응, 국가별 법률에 따른 관리 등을 독자적으로 제안하는 등 ISO 가이드라인 제정을 주도하고 있다.
(다) WG 3 : 분석방법
정확하고 재현이 가능한 생명공학기술임을 입증하기 위한 분석방법의 제정은 TC 276의 다른 WGs과 협업하여 진행하고 있다. WG 3에서는 세포주의 특성화, 핵산의 정량 및 서열분석, 세포계수 및 활성도 등의 표준문서 제정에 주력하고 있다. 현재 세포계수 분야에서 2건의 제안서가 2018년 제정을 목표로 표준화작업이 진행 중이며 4건의 예비 작업항목(PWI)이 제안되었다. 한국의 전문가들은 위의 분석방법을 검토하는 등 국익을 위해 최선을 다 하고 있다.
(라) WG 4 : 생물공정
생물공정은 최종용도가 아닌 ʻ과정ʼ을 기록하여 전 과정동안 연속성 있는 관리가 지속적으로 이루어질 수 있도록 기록하는 표준 문서를 개발하고 있다. 즉 수행하는 공급자와 제품을 구매하는 소비자에게 신뢰를 줄 수 있도록 생명공학 제품의 생산과 제조공정에 대한 가이드라인을 제정하는 것이 WG 4의 표준개발 목표라고 볼 수 있다. 구성물질의 제어, 생물반응기 가공, 수집‧분리‧정제‧배합, 취급‧운송‧보관 등 최종 용도가 아닌 처리공정에 초점을 맞추며, 생명공학기술 표준화 수요가 있는 세포배양, 세포분리 등에 대한 표준화 작업도 수행 중이다. 이를 위해 한국생물공학회를 중심으로 타 국가의 기술을 검토하는 등 한국의 생물공정 기술의 국제표준화와 국익을 위하여 노력하고 있다.
(마) WG 5 : 데이터처리 및 통합
2015년 7월 독일을 중심으로 결성된 WG 5에서는 생명공학 및 생명과학 분야에서 통합된 데이터처리를 이용하여, 소급적이고 상호운용적인 자료 및 자료의 가공을 위한 통합된 표준문서 제정을 목표로 회권국의 전문가들이 활동하고 있다. 특히, 데이터와 모델 형태 간의 인터페이스 정의, 메타데이터와 데이터 모델간의 관계 정의, 가공된 데이터 및 모델의 품질관리 등에 초점을 맞추어 표준제정을 하고 있다. 우리나라에서는 국가생명자원정보센터의 전문가가 WG 5에 참여하여 활동하고 있다.
나. 해외 동향
(재)연구소재중앙센터에서는 2015년 4월부터 7월까지 인터넷망을 이용하여 아프리카지역을 제외한 유럽지역, 아시아주, 남북아메리카대륙, 오세아니아주에 현존하는 생물자원은행에 관한 조사를 실시하였다. [그림 3-2-5]와 [표 3-2-11]은 대륙별 운영 중인 자원은행 수를 나타낸 것으로 2015년 7월 현재 세계의 생물자원은행의 수는 5,066개이며 그 중 식물 자원은행은 3,822개로 전체은행의 75%의 비율을 차지하고 있으며, 미생물자원은행 11%, 인체유래물자원은행 10%, 동물관련 자원은행 3%, 그 외의 생물자원은행 1%의 비율로 운영되고 있다.
(2) 대륙별 생물자원은행 현황
(가) 남북아메리카대륙
남북아메리카대륙에는 1,370개의 생물자원은행이 운영 중이다. 분야별 자원은행의 비율을 살펴보면 식물분야의 자원은행이 980개로 71%, 그 외 인체유래물, 미생물 및 동물분야의 순서로 각각 17%, 9%, 3%의 비율로 생물자원은행이 활성화 되어 있다.
(나) 유럽22)
대륙별 생물자원은행의 분포를 조사한 결과 유럽은 120여 년 동안 자원은행을 운영하고 있으며 그 역사에 걸맞게 이에 대한 다수의 논문을 발표하고 가장 많은 수의 자원은행(1,679개)을 운영하고 있다. 그 중 식물분야는 전체자원은행의 79%(자원은행 1,369개)로 타 분야보다 월등히 많은 수로 운영 중이다. 미생물, 인체유래물 및 동물분야의 생물자원은행이 각각 12%, 7%, 2%의 비율로 운영되고 있다.
현재는 유럽보다 적은 수의 생물자원은행을 운영하고 있으나 나고야의정서 시행과 더불어 향후 중국25), 베트남, 태국 등 아시아의 자원부국들이 폭발적으로 자원은행들을 설립하여 운영할 것으로 예상된다. 2015년 7월 현재 운영 중인 생물자원의 총 개수는 1,738개이다. 식물, 미생물, 인체유래물 및 동물분야에서 각각 1,353개, 195개, 84개, 74개의 자원은행을 운영 중이며 그 외의 생물자원으로 운영되고 있는 자원은행도 32개가 있다. 대부분 아시아의 자원은행은 타 대륙의 은행과 달리 국가 차원에서 장기적인 계획을 세워 지원, 운영하고 있다.
(라) 오세아니아
오세아니아는 운영 중인 생물자원은행의 수가 175개로 타 대륙에 비해 월등히 적었다. 이 중 84개의 식물자원은행, 47개의 미생물자원은행, 26개의 동물자원은행, 18개의 인체유래물자원은행이 운영 중이다.
[그림 3-2-5] 대륙별 각 소재분야 운영 중인 바이오뱅크 수
[표 3-2-11] 대륙별 각 소재분야 운영 중인 바이오뱅크 수
|
|
미생물 |
동물 |
식물 |
인체유래물 |
기타 |
합계 |
|
아메리카 |
118 |
40 |
980 |
229 |
3 |
1370 |
|
유럽 |
220 |
35 |
1405 |
123 |
0 |
1783 |
|
아시아 |
195 |
74 |
1353 |
84 |
32 |
1738 |
|
오세아니아 |
47 |
26 |
84 |
18 |
0 |
175 |
|
합계 |
580 |
175 |
3822 |
454 |
35 |
5066 |
(3) 국외 자원은행 표준 현황
(가) 국제기구의 생물자원 표준화 동향
경제협력개발기구(OECD)는 2007년 나고야의정서 실행에 앞서 ʻ생물자원은행을 위한 모범운영지침ʼ을 발행하고 각 나라의 생물자원은행들이 이 지침을 사용할 것을 권고하였다. ISO에서는 TC 276 생명공학위원회를 설립하여 OECD 모범 운영지침을 근간으로 ʻ생물자원은행 및 생물자원ʼ에 대한 가이드라인을 제정하고 있다.26) 세계미생물자원센터연맹(WFCC)은 2010년 경제협력개발기구의 모범 운영지침을 기초로 ʻ미생물자원센터의 설립과 운영을 위한 지침ʼ이라는 단체표준형태의 지침서를 제정하여 미생물 분양 자원센터의 운영관리에 대한 인증을 시범적으로 추진하고 있다.27) 또한 국제생물환경소재은행학회(ISBER)는 2012년 ʻ인체유래검체은행을 위한 ISBER의 모범운영지침(제3판)ʼ을 발행하여 인체유래물은행의 운영관리에 대한 내용을 자세히 소개하였다.28)
(나) 각국의 생물자원 표준화 동향
① 미국 및 유럽
미국과 유럽국가들은 국제표준화 활동이 가장 활발한 분야인 생물자원은행, 바이오공정, 분석방법, 데이터 관리 등 바이오의약품 생산과 직접 연계되는 ISO/TC 276/WGs에 적극적으로 참여하여 자국의 기술을 국제표준화하고자 노력하고 있다. 이는 앞으로 도래할 바이오 경제시대에서 세계 생물산업시장을 겨냥한 미국과 유럽이 세계시장을 선점하기 위한 준비라고 볼 수 있다.
② 프랑스
프랑스는 2007년에 보급된 생물자원은행을 위한 OECD 가이드라인을 기초로 자원은행운영 국가표준(NF S 96-900)을 제정하였으며, 이를 2013년 ISO/TC 276/WG 2의 세계생물자원은행의 국제표준 가이드라인으로 제안하여 세계시장을 선도하고자 노력하였으나 제정 작업 초반 한국, 일본 등의 강력한 대응으로 프랑스 규격의 국제표준화는 무산되고 앞서 설명한 것처럼 WG 2의 표준제정의 주도권을 한국이 가지고 오게 되었다.
③ 중국
중국은 2006년 시작된 ʻ국가중장기과학기술발전기획강요ʼ에 근거하여 ʻ제11차 5개년 규획ʼ에 따라 생물산업을 집중 육성하고 있다. 이 사업으로 미생물분야 생물자원은행들을 설립, 은행 간 네트워크를 형성하여 해당 홈페이지를 운영하고 있다.29) 또한 중국 정부는 최근 생물자원으로써의 인체유래물을 전략적으로 수집․보관․연구․통합관리하기 위하여 centralized human biobank를 구축하였다. 이곳에서는 인체자원을 표준화하고 최신 기술을 받아 전파하는 허브 역할과 함께 각기 다른 특성을 갖고 있는 바이오뱅크들을 지원하고 있다. 1999년 북경에 설립된 유전체연구소(BGI; Beijing Genomics Institute)는 2007년부터 본격적으로 인체유래자원의 상업화에 돌입하였다. 이를 위하여 TC 276 총회를 지난 4월 심천에 유치하고 TC 276/WGs에서 새로운 표준제안서들을 발표하는 등 활발히 활동하고 있다.
④ 일본
일본은 1980년대 초반부터 생물자원을 확보하기 위해 국가에서 직접 자원센터를 운영하고 체계적인 생물자원의 개발․확보․보존․관리 등을 위해 교육과 재정지원을 아끼지 않고 있다. 경제산업성의 NITE(National Institute of Technology and Evaluation)가 중심이 되어 자원보유국과 양자적 신뢰관계 구축, 환경성 주도의 생물다양성 보존, 중‧장기 프로젝트로 생물자원을 안정적으로 확보하고 MEXT(Ministry of Education, Culture, Sports, Science and Technology)와 MHWL(Ministry of Health, Welfare, and Labours)이 협력하여 Genomic medicine project를 수행하여 생명연구자원 관리와 활용을 극대화 하고 있다. 일본이화학연구소(RIKEN)는 2002년에 시작된 국가생물자원프로젝트(NBRP, National Biological Resource Project)에서 생물자원특화 캠퍼스를 중심으로 전국대학과 국립연구소의 생물자원은행을 운영 중이다.30) ISO/TC 276에서도 WG 3 분석방법, WG 4 생물공정 등에 대한 신규작업항목제안(NWIP, New Work Item Proposal)으로 자국 기술을 국제표준으로 선도하고 있다.
다. 국내 현황31)
(1) 국내 생물자원은행 설립 배경 및 현황
(가) 생물자원은행의 태동
우리나라는 1980년대 중반부터 대학을 중심으로 작은 규모의 바이오뱅크가 운영되기 시작하였다. 우리나라 생물자원은행은 1985년 생명공학연구원의 미생물 자원은행인 KCTC가 설립된 이후 본격적으로 1995년에 과학기술처(현 미래창조과학부)에서 특성화장려사업으로 5개의 연구소재은행을 운영하기 시작하였고 이는 현재 타 부처의 생물자원은행의 벤치마킹 대상이 되고 있다. 연구소재은행들이 20년이 지난 지금까지도 은행의 목적에 맞는 사업을 수행 할 수 있었던 것은 다른 일몰형 연구사업과 달리 국가 인프라 구축을 위한 정부의 지속적인 지원이 있었기에 가능했다. 현재는 서울대학교, 고려대학교 등 21개 대학 실험실을 중심으로 34개의 연구소재은행이 운영되고 있다.
(나) 생물자원은행의 운영
2000년대에 들어서면서 나고야의정서로 생물다양성과 생물자원에 대한 중요성이 부각되자 한국정부는 생물표본 확보 및 소장, 생물자원의 발굴, 분류연구, 한반도 생물다양성 기원규명 등의 조사연구를 목적으로 국립생물자원관을 설립하여 2007년부터 운영하고 있다. 또한 2009년 5월 생물자원에 관련된 「생명연구자원 확보 관리 및 활용에 관한 법률」을 제정하였으며 이 법률에 따라 ʻ생물다양성은 미래의 자산이다.ʼ 라는 모토 하에 6개 부처가 협업하여 매년 생명연구자원관리 기본계획(2011~2020)을 수립하고 있다. 주된 협업의 내용은 연구자원을 확보, 관리, 정보시스템의 통합 및 정보통신기술의 활용으로 연구자원의 산업 및 학술적 활용 체계를 구축하는 것이며 명확한 목표와 이해관계에 따라 부처별 소속 기탁관리기관들은 그들이 속해 있는 부처의 특성에 따라 운영되고 있다.
(2) 국내 부처별 자원은행 및 표준화 현황
(가) 미래창조과학부
① 연구소재은행32)
연구소재은행들은 1995년부터 과학기술처와 한국과학재단이 지원하는 특성화장려사업 내 특수연구소재은행사업을 시작으로 서울대학교 한국세포주은행 등 5개의 은행을 설립하였으며 매년 3~12개의 신규 소재은행을 선정‧평가하고 있다. 1998년에는 비생물분야인 단결정은행들을 선정하여 대학의 비생물분야 연구기능 활성화에도 기여하였다. 2005년에는 분야별 소재은행을 총괄하는 미생물거점은행, 2006년에 인체유래검체거점은행, 2007년에 식물거점은행을 설립 하였고 2008년도에는 모든 연구소재은행을 통합 관리하는 (재)연구소재중앙센터를 설립하였다. 현재 (재)연구소재중앙센터는 인체유래물, 동물, 식물, 미생물 분야에서 대학 중심의 다양한 바이오뱅크 27개소와 융합물질 분야의 연구소재은행 7개소를 관리하고 있다.
연구소재은행의 체계적이고 효율적인 품질경영을 위하여 (재)연구소재중앙센터에서는 2013년 3월 국내 최초로 단체표준인 ʻ연구소재은행을 위한 운영관리지침(SPS-KNRRC 0001-2008)ʼ을 제정하였고 2015년 9월 개정하였다. 이 표준은 연구소재은행 운영을 위한 필요한 사항들을 규정하고 있으며, 우리나라에서는 이 표준을 ISO/TC 276/WG 2의 ʻ생물자원은행 및 생물자원ʼ의 국제표준으로 제안하여 국제표준화하고자 총력을 기울이고 있다. 또한 2015년 2월에는 (재)연구소재중앙센터의 관리 하에 있는 생물자원은행들이 공통적으로 사용하고 있는 용어 149개 중 51개를 단체표준 ʻ연구소재은행-용어(운영관리) SPS-KNRRC 0002-6198 : 2015ʼ로 제정하여 ISO/TC 276 WG 1에 우리의 생물자원 용어를 제안하였다.
② 한국생명공학연구원33)
한국생명공학연구원은 바이오인프라총괄본부에 1개의 인체유래물과 동물, 식물, 미생물 등 분야별 5개의 자원센터를 운영하고 있다.
③ 국립중앙과학관34)
다양한 생물자원에 관한 자료를 수집하여 보존하고 관련 연구와 전시, 교육 및 과학문화행사를 수행하고 있는 국립중앙과학관에서는 306종의 조류(birds) 3,865점을 포함하여 식물(1,810종, 40,418점), 곤충(2,008종, 321,269점), 해양생물(399종, 34,603점), 어류(345종, 766,603점)등 총 5,248종의 생물자원(약 117만여 점)과 약 3,000개의 유전자원(DNA)을 보유하고 있다.
(나) 산업통상자원부
산업통상자원부의 국가기술표준원은 국가표준을 관장하는 기관으로 생물자원 표준문서를 제정하여 보급하고 있다. 생물자원 관련 표준문서를 살펴보면, 생물일반(56종), 생물공정(4종), 생물화학‧생물연료(0종), 산업미생물(4종), 생물검정‧정보(12종), 기타(3종) 등 총 79종의 생물자원 관련 표준문서를 제정하였으나, 생물자원은행 및 생물자원의 분석에 관한 표준문서는 전무한 실정이다. 특허청에서는 연구자가 미생물에 관한 발명을 특허출원하고자 하는 경우 출원된 미생물을 공인된 기관에 기탁하고 특허 공개 후 제3자가 분양받을 수 있도록 제도적으로 미생물 기탁제도를 실시하고 있다.35) 이를 위해 한국미생물보존센터(KCCM)36)를 특허 기탁기관으로 지정하여 운영하고 있다. 이 외의 특허기탁기관으로 미래창조과학부 소속의 생명공학연구원의 KCTC(미생물자원센터)37)와 연구소재지원사업의 한국세포주 은행(KCLB)38), 농업축산식품부 국립농업유전자원센터39)의 미생물센터(KACC)가 특허기탁기관으로 지정되어 있다.
(다) 보건복지부
보건복지부는 2008년부터 한국인체자원은행사업(KBP; Korea Biobank Project)을 총괄기획 및 관리 하고 있다.40) 이 사업의 목표는 일반인 인체자원과 질환자 인체자원을 수집하는 것으로 보건복지부 산하 질병관리본부 내에 있는 국립중앙인체자원은행과 전국 17개소 대학병원소재 민간운영 인체자원단위은행과 협력하여 자원을 수집‧보관한다. 일반인 자원은 코호트 사업으로 2001년부터 수집되어 국립중앙인체자원은행에 보관하고 있다.41) 이 외에도 보건복지부는 질병기반에 대해서 HCV 코호트 등 10개 질병의 인체자원을 인체자원단위은행의 연구사업을 통해 수집하고 있으며42) 수집‧보관된 자원은 한국인체자원은행 네트워크(KBN; Korea Biobank Network)를 통해 필요한 곳에 분양하기도 한다. 이 밖에 국립중앙인체자원은행에서는 인체자원에 대한 연구와 정도관리기법을 개발하고 있다.43),44)
(라) 농림축산식품부
농촌진흥청 산하 국립농업과학원45) 및 국립축산과학원46)에서는 국내 총 21개 대학 내 41개의 실험실과 지자체, 정부출연, 민간연구소를 포함한 약 100개의 보존센터를 통해 작물자원, 가축유전자원 등의 생물자원을 보존하고 분양하고 있다. 또한 산림청 산하에 국립산림과학원47), 국립산림품종관리센터48), 국립수목원49)을 운영하여 식물, 미생물자원, 곤충자원을 취급·관리하여 분양하고 있다.
(마) 해양수산부
국립해양생물자원관을 중심으로 기탁등록 보존기관50)으로 지정된 10개 대학의 실험실 및 한국해양과학기술원 내 2개소를 통해 해양생물 및 해양 미생물관련 자원을 관리하고 있다. 2013년 12월 준공된 국립해양생물자원관에서는 해양척추동물에서 해양미생물에 이르기까지 약 410,000여점의 다양한 해양생물을 보존하고 있다.51)
(바) 환경부
국립생물자원관을 중심으로 주로 한국의 고유자생생물, 멸종위기종, 야생동‧식물 등의 생물자원을 확보하여 보호하고, 생물다양성보존을 위한 생물주권확립을 목표로 국가생물자원을 보존하고 있다.52)
라. 전망
(1) 생물자원 표준 개발
ISO/TC 276에서는 각 WG에서 제정하고 있는 표준문서 외에도 중국, 룩셈부르크가 제안한 동물의 생식질(Germplasm) 및 인체 유전자원의 확보, 처리 등과 인체유래 검체 바이오뱅크 운영과 이행을 위한 기술적인 요구사항에 대한 3건의 표준문서가 현재 개발 중이다. 또한 TC 276이 활동을 개시하기 전에 축적된 다양한 샘플 및 인체의 줄기세포시장을 겨냥한 NWIP(New Work Item Proposal)도 WG 2에서 진행 중이다. 향후 바이오 정보, 생물소재 인증 등 생물자원 신뢰의 주축이 되는 많은 표준문서들이 개발될 것으로 예상되어, (재)연구소재중앙센터에서는 표준의 꽃으로 불리우는 인증업무를 한국화학융합시험 연구원과 함께 전략적으로 기획하고 있다.
(2) 생물소재 표준화
(가) 생물자원은행 운영의 효율화
생물자원은행 가이드라인의 표준 제정으로 생물자원 기술선진국과 자원보유국 모두 고품질의 생물자원을 보증하고 새로 개발되거나 수집된 생물자원, 기존에 보유하고 있던 자원들을 표준화된 절차에 따라 효율적으로 관리할 수 있을 것이다. 또한 양질의 연구소재 확보, 분양, 보관, 폐기 등에 관한 정보를 보다 정확하고 체계적으로 관리할 수 있을 것으로 예상된다.
(나) 신뢰성 제고
생물자원은행 간 동일한 품질보증 과정을 공유함으로써 공공기관, 산업계, 연구자, 소비자 등 모든 이해관계자들의 고품질 생물자원에 대한 신뢰도와 만족도가 상승할 것이다.
(3) 생물산업 및 바이오 경제시대의 번영
생물학, 생명의학, 생물공학 분야에서 독창적인 신기술을 연구하여 산업화 시킬 수 있는 지름길은 고품질 생물소재의 발굴 및 개발, 보관, 분양 등 적절한 관리라고 할 수 있다. 세계적으로 생물산업 발전분야의 가장 기본이 되는 양질의 생물소재를 관리하는 기관은 각 국가에서 운영하는 생물자원은행 혹은 생물자원센터이다. 이 기관들의 대표들이 ISO/TC 276/WG 2에 모여 자국의 생물자원은행에서 보존하고 있거나 혹은 개발된 생물소재의 취급방법, 안전성, 유지‧보안관리 등에 관하여 치열하게 논의하면서 국제표준을 제정하고 있다. 이는 지속적이며 폭발적으로 늘어나고 있는 생물산업의 수요와 바이오 경제시대를 준비하는 자국기술의 국제 선점을 노리는 것이라고 해도 과언이 아닐 것이다. 우리나라도 미래창조과학부와 산업통상자원부 국가기술표준원의 지원을 받아 (재)연구소재중앙센터는 WG 2에서 제정하고 있는 생물자원은행 및 생물자원에 관한 가이드라인 제정의 선구자 역할을 하고 있으며, 한국생물공학회도 WG 4에서 생물공정 표준을 선도하고 있다.
이러한 우리의 적극적인 표준화 활동은 바이오선진국들의 인식을 전환시켜 한국 주도의 ʻ생물자원 보존 및 기술개발을 위한 국가 간 공동연구ʼ 수행을 가능하게 하는 계기가 되고 있다. 양질의 생물소재 개발, 보존, 관리 등에 대한 표준화를 진행하고 있는 (재)연구소재중앙센터는 제정된 단체표준을 국가기술 표준원의 바이오기술전문위원회(TC 276 mirror committee)를 중심으로 정책적으로 국제표준화하고자 최선을 다하고 있다. 이는 우리의 기술이 바이오경제시대의 핵심요소인 표준의 중심에 서게 되는 국가적으로 아주 중요한 도화선이 되는 것이다. 이 표준의 중심기술인 인체의 노화, 발암, 유전질환 등에 필요한 바이오마커, 맞춤제약 및 신약개발, 생명공학기술과 타 기술과의 융합을 이용한 생물산업의 발전은 우리나라가 바이오선진국으로 급부상 할 것을 예견한다. 이제 막 시작한 생명공학의 국제표준 선점으로 우리는 대한민국이라는 국가의 브랜드 가치를 높이고 미국, 독일, 프랑스, 일본 등 바이오선진국들과 바이오경제시대의 한 축을 만들어 갈 것이다.

1. 투자 현황
가. 정부 연구개발예산 중 미래유망신기술(6T) 분야별 투자
2014년도 정부 연구개발 총투자는 일반회계, 특별회계 및 기금을 포함해서 17조 6,395억 원으로 2010년의 13조 6,827억 원에서 3조 9,568억 원이 증가하여 1.29배 확대된 것으로 나타났다. 이는 당초 편성된 2014년 예산 17조 7,793억 원 대비 99.2%의 집행실적을 나타냈고 전체 사업 수는 605개, 과제 수는 53,493개가 지원된 것으로 조사되었다.
최근 5년간(2010~2014) 정부 연구개발예산의 연평균 증가율은 6.6%로 정부예산의 통합재정규모 증가율 5.3%를 상회한 것으로 나타났다. 최근 5년간 국가연구개발사업 규모 변화 추이는 [그림 3-3-1]과 같다.

출처 : 2014년도 국가연구개발사업 조사‧분석 보고서 재가공(미래창조과학부/KISTEP)
[그림 3-3-1] 국가연구개발사업 규모 변화 추이(2010년~2014년)
2014년도 미래유망신기술(6T) 분야 투자액은 전년 대비 5.4%(2,725억 원) 증가하여 총 10조 996억 원으로 정부연구개발 투자 중 61.9%를 차지하였다53). 최근 5년간 6T 분야별 투자에서 BT는 IT와 유사하게 6.3%의 연평균증가율로 꾸준히 증가하고 있는 추세이다. 2014년도 BT분야의 투자액은 2조 9,730억 원으로 전년 대비 3.3% 증가하였고, 정부 연구개발 투자에서 차지하는 비중은 18.2%로 나타났는데, 이는 IT 분야의 3조 41억 원(18.4%) 다음으로 많은 투자가 이루어진 것이다.

출처 : 2014년도 국가연구개발사업 조사‧분석 보고서 재가공(미래창조과학부/KISTEP)
[그림 3-3-2] 6T별 투자 추이(2010년~2014년)
BT 분야 전체 사업 수는 2013년 241개에서 2014년 253개 사업으로 증가했고 과제 수는 2013년 17,826개에서 2014년 17,966개로 증가하였다.
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
출처 : 2014년도 국가연구개발사업 조사‧분석 보고서 재가공(미래창조과학부/KISTEP)
[그림 3-3-3] 6T별 투자현황
나. BT 분야 상세 투자 현황 및 주요 특징
(1) 부처별 투자 현황
2014년도 BT분야에 대한 부처별 투자현황을 살펴보면, 미래창조과학부가 1조 71억 원으로 전체 BT분야의 33.9%를 투자하였고 농촌진흥청 4,703억 원(15.8%), 보건복지부 4,051억 원(13.6%), 산업통상자원부 3,261(11.0%), 교육부 1,956억 원(6.6%)순으로 투자가 이루어졌다.

출처 : 2014년도 국가연구개발사업 조사‧분석 보고서 재가공(미래창조과학부/KISTEP)
[그림 3-3-4] 부처별 투자현황
(2) 연구개발단계/연구수행 주체별 투자 현황
연구개발단계별로 살펴보면 기초연구, 응용연구, 개발연구에 각각 39.8%(1조 1,821억 원), 16.9%(5,038억 원), 26.0%(7,728억 원)가 투자된 것으로 나타났다. IT 분야를 비롯한 대부분의 분야가 개발연구에 많은 투자가 이루어진 것에 비해, BT 분야는 기초연구에 집중적인 투자가 이루어졌다.
연구수행주체별로는 대학 1조 2,196억 원(41.0%), 출연연구소 6,326억 원(21.6%), 국공립연구소 5,121억 원(17.2%), 중소기업 3,520억 원(11.8%), 중견기업 767억 원(2.6%)의 순으로 많은 투자가 이루어졌다.
비슷한 규모의 투자규모를 나타내는 IT분야의 경우 출연연구소 연구수행 비중이 가장 높게 나타나는데 반해, BT분야의 경우 대학의 비중이 가장 높게 나타남을 알 수 있다.

출처 : 2014년도 국가연구개발사업 조사‧분석 보고서 재가공(미래창조과학부/KISTEP)
[그림 3-3-5] 연구개발단계별(좌) 및 수행주체별(우) 투자현황
(3) 적용분야별 투자 현황
BT분야의 적용분야별 투자액은 공공분야가 1조 6,227억 원(54.6%), 산업분야가 1조 3,503억 원(45.4%) 순으로 나타났다.
세부분야별 투자 현황을 살펴보면 공공분야에서는 건강 1조 1,230억 원(37.8%), 지식의 진보(비목적 연구) 2,211억 원(7.4%), 기타 공공목적 1,467억 원(4.9%), 환경 595억 원(2.0%) 순으로 투자액이 크다. 산업분야에서는 농업, 임업 및 어업 6,899억 원(23.2%), 제조업(의료용물질 및 의약품) 1,978억 원(6.7%), 제조업(의료, 정밀, 광학기기 및 시계) 1,611억 원(5.4%), 제조업(화학물질 및 화학제품) 714억 원(2.4%) 순으로 투자액이 크다.
투자 규모가 유사한 IT 분야와 비교했을 때, 산업분야의 투자비중이 높은 IT에 비해 BT는 공공분야의 투자비중이 높은 것으로 나타났다.

출처 : 2014년도 국가연구개발사업 조사‧분석 보고서 재가공(미래창조과학부/KISTEP)
[그림 3-3-6] 적용분야별 투자현황
(4) 기술분류별(과학기술표준분류) 투자 현황
2014년 BT분야에 대한 투자를 과학기술표준분류 대분류 기준으로 살펴보면 보건의료 11,265억 원(37.9%), 농림수산식품 8,082억 원(27.2%), 생명과학 6,493억 원(21.3%), 화학 608억 원(2.0%), 뇌과학 574억 원(1.9%) 순으로 투자가 이루어졌다.

출처 : 2014년도 국가연구개발사업 조사‧분석 보고서 재가공(미래창조과학부/KISTEP)
[그림 3-3-7] 국가과학기술표준분류별 투자 현황
(5) 국가전략기술별 투자 현황
BT분야에 대한 국가전략기술별 투자는 건강장수시대 구현(1조 447억 원, 35.1%), 미래성장동력 확충(7,600억 원, 25.6%), 걱정 없는 안전사회 구축(2,647억 원, 8.9%), 깨끗하고 편리한 환경 조성(788조원, 5.7%) 등의 순으로 나타났다. 이 중 30개 중점 국가전략기술은 42.4%인 9,473억 원을 차지하였다.

출처 : 2014년도 국가연구개발사업 조사‧분석 보고서 재가공(미래창조과학부/KISTEP)
[그림 3-3-8] 국가전략기술별 투자 현황
(6) 기타 BT 분야 투자의 주요 특징
○ 산학 공동연구 비중이 높음
2014년 BT분야의 10.6%(2,979억 원)가 공동연구에 해당된다. 각 협력유형별 투자를 살펴보면, 산학 공동연구(1,378억 원, 46.2%), 산학연 공동연구(417억 원, 14.0%), 산연 공동연구(280억 원, 9.4%) 순으로 많아 대학과 기업의 협력이 가장 많았음을 알 수 있다.

출처 : 2014년도 국가연구개발사업 조사‧분석 보고서 재가공(미래창조과학부/KISTEP)
[그림 3-3-9] 협력유형별 협동연구 현황
○ 여성연구책임자의 비중이 높음
2014년 BT 분야 과제에 참여한 연구책임자는 12,208명으로 2013년 11,937명에 비해 2.3% 많은 연구자가 참여했다. 연구책임자의 성별 분포를 살펴보면, 전체 기술 분야의 여성 연구책임자의 비중이 12.6%(4,492명)인데 반해 BT 분야의 경우 21.6%(2,639명)로 여성연구책임자의 비중이 전체 기술분야 대비 높은 편임을 알 수 있다.

출처 : 2014년도 국가연구개발사업 조사‧분석 보고서 재가공(미래창조과학부/KISTEP)
[그림 3-3-10] 연구책임자 현황
○ 수도권의 투자비중이 높음
BT분야의 지역별 투자는 수도권 1조 5,534억 원(52.3%), 대전광역시 3,842억 원(12.9%), 지방 1조 354억 원(34.8%) 순으로 많이 이루어졌으며, 전년대비 증가율은 수도권 0.8%(130억 원), 지방 8.9%(846억 원) 순으로 높았으며 대전광역시는 0.4%(17억 원) 감소하였다. 16개 시‧도 중 투자액 기준 상위 3개 지역은 서울특별시(8,064억 원) 경기도(7,076억 원), 대전광역시(3,842억 원) 순으로 나타났으며, 지방의 경우 충청북도(1,752억 원), 대구광역시(1,083억 원), 전라북도(1,035억 원), 강원도(1,005억 원) 순으로 나타났다.
6T분야 내에서 지역별 투자는 BT분야를 비롯한 대부분이 수도권에 집중되어 있음을 알 수 있다.

출처 : 2014년도 국가연구개발사업 조사‧분석 보고서 재가공(미래창조과학부/KISTEP)
[그림 3-3-11] 지역별 투자 현황
다. 참고
[표 3-3-1] BT분야 부처·사업 현황(2014년)
|
(단위 : 억원, %) |
||||
|
부처 |
사업명 |
BT 투자액 (A) |
전체 투자액 (B) |
A/B |
|
교육부 |
일반연구자지원 |
1,299 |
2,900 |
44.8 |
|
BK21플러스사업(0.5) |
329 |
1,475 |
22.3 |
|
|
농림축산식품부 |
농생명산업기술개발 |
428 |
467 |
91.5 |
|
고부가가치식품기술개발 |
315 |
376 |
83.8 |
|
|
농림축산검역검사기술개발 |
210 |
213 |
98.3 |
|
|
농촌진흥청 |
차세대바이오그린21 |
659 |
664 |
99.4 |
|
농업기초기반연구 |
481 |
550 |
87.5 |
|
|
농업과학원(인건비+기본경비) |
372 |
372 |
100.0 |
|
|
국책기술개발 |
328 |
400 |
82.1 |
|
|
식량과학원(인건비+기본경비) |
266 |
266 |
100.0 |
|
|
원예특작과학원(인건비+기본경비) |
256 |
256 |
100.0 |
|
|
축산과학원(인건비+기본경비) |
235 |
235 |
100.0 |
|
|
원예특작시험연구 |
210 |
491 |
42.9 |
|
|
축산시험연구(R&D,책임운영) |
206 |
390 |
52.8 |
|
|
신품종지역적응연구 |
191 |
201 |
95.1 |
|
|
작물시험연구 |
188 |
403 |
46.8 |
|
|
미래창조과학부 |
중견연구자지원 |
1,423 |
3,488 |
40.8 |
|
바이오·의료기술개발 |
1,345 |
1,446 |
93.1 |
|
|
한국생명공학연구원연구운영비지원 |
750 |
757 |
99.2 |
|
|
신진연구자지원 |
704 |
1,419 |
49.6 |
|
|
선도연구센터지원 |
522 |
1,035 |
50.4 |
|
|
기초과학연구원연구운영비지원 |
489 |
2,020 |
24.2 |
|
|
한국과학기술연구원연구운영비지원 |
471 |
1,590 |
29.6 |
|
|
한국한의학연구원연구운영비지원 |
362 |
480 |
75.4 |
|
|
미래창조과학부 |
글로벌프론티어사업 |
305 |
950 |
32.1 |
|
한국식품연구원연구운영비지원 |
256 |
364 |
70.3 |
|
|
한국원자력의학원연구운영비지원 |
225 |
519 |
43.4 |
|
|
안전성평가연구소연구운영비지원 |
199 |
199 |
100.0 |
|
|
한국화학연구원연구운영비지원 |
198 |
788 |
25.1 |
|
|
리더연구자지원 |
195 |
512 |
38.0 |
|
|
방사선기술개발사업 |
183 |
365 |
50.1 |
|
|
범부처 사업 |
GoldenSeed프로젝트(농식품부,산림청,해수부,농진청) |
383 |
384 |
99.8 |
|
범부처전주기신약개발 |
290 |
297 |
97.6 |
|
|
보건복지부 |
질환극복기술개발 |
801 |
883 |
90.7 |
|
첨단의료기술개발 |
664 |
790 |
84.0 |
|
|
암연구소및국가암관리사업본부운영 |
528 |
533 |
99.1 |
|
|
임상연구인프라조성 |
283 |
334 |
84.7 |
|
|
감염병위기대응기술개발(구.면역백신개발) |
191 |
200 |
95.5 |
|
|
선도형특성화연구개발사업(구.연구중심병원구축) |
186 |
195 |
95.4 |
|
|
산림청 |
산림과학연구 |
198 |
337 |
58.7 |
|
산업통상자원부 |
바이오의료기기산업핵심기술개발사업 |
637 |
744 |
85.7 |
|
지역특화산업육성 |
514 |
1,673 |
30.7 |
|
|
광역경제권선도산업육성 |
492 |
2,425 |
20.3 |
|
|
산업기술개발기반구축 |
212 |
1,580 |
13.4 |
|
|
소재부품기술개발 |
191 |
2,742 |
7.0 |
|
|
식품의약품 안전처 |
식품등안전관리 |
234 |
244 |
96.0 |
|
의약품등안전관리 |
187 |
189 |
98.9 |
|
|
중소기업청 |
중소기업기술혁신개발 |
343 |
2,470 |
13.9 |
|
산학연협력기술개발 |
245 |
1,458 |
16.8 |
|
|
해양수산부 |
수산시험연구 |
215 |
285 |
75.3 |
|
출처 : 2014년도 국가연구개발사업 조사‧분석 보고서 재가공 |
||||
[표 3-3-2] BT분야 수행 상위기관(Top 50)
|
(단위 : 억원, %) |
|||
|
순위 |
연구수행기관 |
금액 |
비중 |
|
1 |
서울대학 |
1,695 |
5.7 |
|
2 |
한국생명공학연구원 |
1,249 |
4.2 |
|
3 |
국립농업과학원 |
1,079 |
3.6 |
|
4 |
연세대학 |
886 |
3.0 |
|
5 |
한국과학기술연구원 |
735 |
2.5 |
|
6 |
국립축산과학원 |
733 |
2.5 |
|
7 |
국립원예특작과학원 |
614 |
2.1 |
|
8 |
고려대학 |
584 |
2.0 |
|
9 |
국립식량과학원 |
561 |
1.9 |
|
10 |
국립암센터 |
527 |
1.8 |
|
11 |
한국원자력의학원 |
500 |
1.7 |
|
12 |
기초과학연구원 |
489 |
1.6 |
|
13 |
한국과학기술원 |
454 |
1.5 |
|
14 |
경북대학 |
431 |
1.5 |
|
15 |
한국한의학연구원 |
410 |
1.4 |
|
16 |
경희대학 |
406 |
1.4 |
|
17 |
울산대학 |
378 |
1.3 |
|
18 |
한국화학연구원 |
356 |
1.2 |
|
19 |
질병관리본부 |
338 |
1.1 |
|
20 |
한국식품연구원 |
322 |
1.1 |
|
21 |
이화여자대학 |
321 |
1.1 |
|
22 |
가톨릭대학 |
319 |
1.1 |
|
23 |
전남대학 |
315 |
1.1 |
|
24 |
농림축산검역본부 |
311 |
1.0 |
|
25 |
건국대학 |
308 |
1.0 |
|
26 |
국립수산과학원 |
307 |
1.0 |
|
27 |
성균관대학 |
293 |
1.0 |
|
28 |
부산대학 |
283 |
1.0 |
|
29 |
충남대학 |
267 |
0.9 |
|
30 |
국립산림과학원 |
259 |
0.9 |
|
31 |
전북대학 |
257 |
0.9 |
|
32 |
한양대학 |
254 |
0.9 |
|
33 |
서울대학병원 |
250 |
0.8 |
|
34 |
충북대학 |
238 |
0.8 |
|
35 |
경상대학 |
210 |
0.7 |
|
36 |
중앙대학 |
206 |
0.7 |
|
37 |
포항공과대학 |
203 |
0.7 |
|
38 |
동국대학 |
198 |
0.7 |
|
39 |
강원대학 |
194 |
0.7 |
|
40 |
한국기초과학지원연구원 |
192 |
0.6 |
|
41 |
아주대학 |
188 |
0.6 |
|
42 |
식품의약품안전평가원 |
179 |
0.6 |
|
43 |
한국화학연구원부설안전성평가연구소 |
171 |
0.6 |
|
44 |
한국원자력연구원 |
166 |
0.6 |
|
45 |
한국표준과학연구원 |
165 |
0.6 |
|
46 |
삼성서울병원 |
160 |
0.5 |
|
47 |
한국뇌연구원 |
152 |
0.5 |
|
48 |
원광대학 |
142 |
0.5 |
|
49 |
단국대학 |
142 |
0.5 |
|
50 |
한국보건산업진흥원 |
140 |
0.5 |
|
합계 |
19,537 |
|
|
|
출처 : 2014년도 국가연구개발사업 조사‧분석 보고서 재가공 |
|||
2. 인력 현황
가. 바이오산업 인력 현황
산업통상자원부와 한국바이오협회가 조사하여 발표한 「2013년도 기준 국내 바이오산업 실태조사」에 따르면, 국내 971개 기업에 종사하는 인력 수는 38,197명으로 2012년 대비 627명이 증가했으며, 1개 업체 당 평균 39.3명이 근무하고 있는 것으로 조사되었다.
(1) 분야별 인력 현황
국내 바이오기업 인력을 직종별로 보면 연구인력이 11,605명(30.4%), 생산인력 12,205명(32.0%), 영업/관리인력 14,387명(37.7%)으로 구성된다. 분야별로 보면 연구직은 바이오화학, 바이오에너지 및 자원, 바이오검정, 정보서비스 및 연구개발산업 등 3개 분야에서 높았고, 생산직은 바이오식품, 바이오전자 등 2개 분야에서 높았으며, 영업/관리직은 바이오의약, 바이오환경, 바이오공정 및 기기산업 등 3개 분야에서 상대적으로 다른 직에 비해 높았다.
[표 3-3-3] 2013년 바이오산업 종사자 인력 분포(명, %)
|
구분 |
업체수 |
연구 인력 |
생산 인력 |
영업/ 관리 |
계 |
산업별. 구성비 |
|
|
전체 |
인력 |
971 |
11,605 |
12,205 |
14,387 |
38,197 |
100.0 |
|
비율 |
100.0 |
30.4 |
32.0 |
37.7 |
100.0 |
||
|
바이오의약산업 |
317 |
4,906 |
5,545 |
8,018 |
18,469 |
48.4 |
|
|
바이오화학산업 |
203 |
2,137 |
1,520 |
1,279 |
4,936 |
12.9 |
|
|
바이오식품산업 |
199 |
1,849 |
3,361 |
2,860 |
8,070 |
21.1 |
|
|
바이오환경산업 |
76 |
400 |
388 |
542 |
1,330 |
3.5 |
|
|
바이오전자산업 |
26 |
343 |
574 |
252 |
1,169 |
3.1 |
|
|
바아오공정 및 기기산업 |
70 |
397 |
404 |
458 |
1,259 |
3.3 |
|
|
바이오에너지 및 자원산업 |
27 |
424 |
275 |
346 |
1,045 |
2.7 |
|
|
바이오검정, 정보서비스 및 연구개발산업 |
53 |
1,149 |
138 |
632 |
1,919 |
5.0 |
|
(2) 학위별 인력 현황
2013년 기준 바이오기업체 종사자 중 학사 졸업자가 15,420명(40.4%)으로 가장 많았으며, 다음으로는 석사 7,411명(19.4%), 박사 2,096명(5.5%) 순으로 나타났다.
[표 3-3-4] 2013년 바이오산업 종사자 분야별 학위별 분포(단위 : 명, %)
|
구분 |
박사 |
석사 |
학사 |
기타 |
계 |
산업별 구성비 |
|
|
전체 |
인력 |
2,096 |
7,411 |
15,420 |
13,270 |
38,197 |
100.0 |
|
비율 |
5.5 |
19.4 |
40.4 |
34.7 |
100.0 |
||
|
바이오의약산업 |
인력 |
1,030 |
3,519 |
6,877 |
7,043 |
18,469 |
48.4 |
|
바이오화학산업 |
인력 |
362 |
1,355 |
1,937 |
1,282 |
4,936 |
12.9 |
|
바이오식품산업 |
인력 |
345 |
1,298 |
3,527 |
2,900 |
8,070 |
21.1 |
|
바이오환경산업 |
인력 |
57 |
180 |
702 |
391 |
1,330 |
3.5 |
|
바이오전자산업 |
인력 |
58 |
221 |
432 |
458 |
1,169 |
3.1 |
|
바아오공정 및 기기산업 |
인력 |
53 |
230 |
565 |
411 |
1,259 |
3.3 |
|
바이오에너지 및 자원산업 |
인력 |
55 |
167 |
358 |
465 |
1,045 |
2.7 |
|
바이오검정, 정보서비스 및 연구개발산업 |
인력 |
136 |
441 |
1,022 |
320 |
1,919 |
5.0 |
바이오산업 분야별 구성비에서 석사, 박사 등 고급인력의 구성비는 바이오화학산업(34.8%)과 바이오검정, 정보서비스 및 연구개발업(30.1%)이 다른 분야에 비해 높게 나타났다.

[그림 3-3-12] 2013년 바이오산업 종사자 분야별 학위별 구성비(단위 : %)
(3) 최근 연구‧생산인력 변화 추이
2013년 기준 바이오산업부문 연구인력 및 생산인력은 23,810명으로 2012년 대비 652명(2.8%) 늘어난 것으로 나타났다. 2009년부터 2013년까지 최근 5년간의 연구․생산인력 변화 추이를 보면, 2009년에 전년대비 증가폭이 컸으며, 2010년에 감소했다가 2011년에 다시 증가세로 돌아선 것으로 조사되었다.
[표 3-3-5] 2009년~2013년 바이오산업 연구‧생산인력 증감률(단위 : 명, %)
|
구분 |
2009년 |
2010년 |
2011년 |
2012년 |
2013년 |
연평균 증감률 |
|
종사자수 |
22,817 |
21,172 |
22,105 |
23,158 |
23,810 |
1.1 |
|
증감률 |
11.0 |
-7.2 |
4.4 |
4.8 |
2.8 |
2009년부터 2013년까지 연구․생산인력 학위변화를 살펴보면 박사와 석사 인력은 2010년을 기점으로 소폭 증가추세에 있으며, 학사 인력은 2009년까지 꾸준히 증가하다가 2010년부터 감소를 보이고 2012년에 증가세로 돌아선 것으로 조사되었다.
(단위 : 명, %)

[그림 3-3-13] 2009년~2013년 바이오산업 연구‧생산인력 학위별 변화 추이
나. 바이오분야 산업기술인력 현황
바이오산업 인적자원개발협의체 운영기관인 한국바이오협회는 산업통상자원부의 지원으로 바이오업계의 기술인력 수급 현황과 활용 실태를 확인하기 위해 「바이오산업 인력수급 실태조사」를 실시하고 있다. 동 조사는 「국내 바이오산업 실태조사」모집단에서 표본설계를 실시한 것으로 각 업종별 응답결과에 가중 값을 부여해 전체 바이오기업의 결과로 추정하여 분석한 것이다. 2014년 말에 실시하여 2015년 상반기에 발표한 조사에는 200개 바이오기업의 인사관리 및 교육 담당자가 응답하였으며, 이 조사결과를 전체 바이오기업 결과로 추정한 결과는 다음과 같다.
(1) 바이오분야 산업기술인력 현황
산업기술인력이란 기업에서 바이오산업분야의 연구, 개발, 생산, 품질관리, 시설, 영업 및 마케팅 직무를 수행하는 인력으로 정의하였다. 응답 기업에서 보유하고 있는 산업기술인력의 수는 ʻ10인~50인 미만ʼ이 45.4%로 가장 많았으며, 응답기업 전체의 산업기술인력 수는 평균 70명으로 조사되었다.

[그림 3-3-14] 바이오분야 산업기술인력 수(단위 : 명, %)
(2) 분야별 산업기술인력 인력 현황
분야별로 산업기술인력의 수는 전체 평균이 70명인 가운데 바이오화학분야에서 평균 111.4명으로 가장 많았으며, 다음으로 ʻ바이오의약(89.1명), 바이오전자(78.8명), 바이오공정 및 기기(48.9명) 순으로 나타났다.

[그림 3-3-15] 바이오산업 분야별 평균 산업기술인력 수(단위 : 명)
(3) 직종별 산업기술인력 인력 현황
직종별로는 생산직이 25.2명으로 가장 많았고, 다음으로 영업․마케팅직(20.8명), 연구직(11.5명), 품질관리직(6.3명) 등의 순으로 많은 인력을 보유하고 있었다. 여성인력은 생산직이 가장 많아 평균 4.7명으로 확인되었으며, 연구직에는 4.3명, 영업 및 마케팅직은 3.3명으로 조사되었다.

[그림 3-3-16] 바이오분야 직종별 평균 산업기술인력 수(단위 : 명)
(4) 종사자 특성별 산업기술인력 수
연령별 분포를 보면, 30대가 44.4%로 절반 가까운 비율을 보이고 있으며, 다음으로 40대(24.5%), 20대(23.8%) 순으로 높게 나타났다. 30대의 평균 인력 수는 19명 정도이며, 40대 및 20대는 10명 수준이었다. 고용형태별로는 정규직이 92.4%로 높은 비율을 보였으며, 정규직의 평균 인력 수는 39명이었다.
|
연령별 |
고용형태별 |
|
|
|
3. 특허 현황
가. 생명공학 특허개요
생명공학분야에 있어 특허는 원천기술 확보 이상의 의미를 갖는다. 타 분야에 비해 연구개발기간과 개발비용이 막대하고, 상용화 준비단계에 승인 및 허가 제도가 도입되어 있어 투자회수 뿐만 아니라 단계별 자금 확보를 위한 법적 장치로서 특허권 획득은 매우 중요하다고 할 수 있다.
특허정보에는 기술적 내용과 더불어 기술의 흐름 및 실용적 사례 등이 내포되어 있으며, 특허의 수치적 분석은 관련 분야의 경제 및 산업 동향 파악에 접목될 수 있다. 따라서 특허통계정보는 연구개발 성과를 측정하고 국가의 과학기술정책을 수립하는 기초자료인 동시에 기획 단계부터 지식재산권을 고려한 전략적 R&D 수행을 위한 중요한 자료로 활용되고 있다.
나. 분석기준
생명공학 분야의 기술분류는 OECD에서 분류한 기준을 토대로 한국특허청의 전문가 집단에서 세분류한 6개 산업, 13개 기술분류, 27개 세분류로 구분하였다.54)
분석대상 국가로는 한국과 세계적 동향을 파악하기 위해 특허를 가장 강하게 보호하고 시장규모도 큰 미국특허를 대상으로 하였으며, 시간적 기준으로 한국은 출원 시점으로 2001~2013년까지를, 미국특허는 등록기준으로 2002~2014년까지의 특허를 가지고 동향을 파악하였다.
또한, 기술분류는 IPC 8판 기준으로 그간의 누락 데이터를 보완하고 수정하여 최종적으로 데이터 셀을 완성하였다.
[표 3-3-6] 생명공학의 기술분류
|
산업 |
기술분류 |
세분류 |
|
공정 |
생물공정 |
동식물 세포배양장치, 분리정제, 생물학적합성, 효소 미생물관련 장치 |
|
측정진단 |
조사․분석, 측정․시험 |
|
|
생물자원탐색 |
미생물, 바이러스 |
|
|
기초 |
동식물세포배양 |
동식물세포 |
|
효소공학 |
효소 |
|
|
농업 |
유전체 |
당유기함유핵산, 유전공학 |
|
단백질체 |
고정화펩티드, 펩티드, 하이브리드펩티드 |
|
|
식품 |
항체이용 |
면역글로블린 |
|
생물농약 |
생물농약 |
|
|
의약 |
형질전환동식물 |
신규한동물, 신규한 식물 |
|
발효식품 |
알콜발효 및 장치 |
|
|
환경 |
생물의약 |
단백질치료제, 방사선의약, 신약후보물질, 유전자치료, 치료용 항체 |
|
환경생물공학 |
생물학적 수처리, 슬러지처리 |
다. 한국에 출원된 생명공학 특허건수 동향
한국에 출원한 생명공학분야의 특허출원건수를 살펴보면, 2001년 이후 꾸준히 증가하고 있는 것으로 나타났다. 13년간의 연평균 증가율은 4.63%를 나타내고 있다
세부기술별로는, 유전체의 유전공학관련 특허출원건수가 가장 많은 것으로 나타났고, 측정진단의 조사․분석과, 측정․시험관련 특허출원건수도 많은 것으로 나타났다. 연평균 증가율은 측정진단의 조사․분석이 10.58%를 나타냈고, 측정․시험은 7.05%, 유전체의 유전공학은 4.64%로 조사되었다.
단백질체에서는 펩티드분야가 연평균증가율 2.41%로 특허출원건수가 지속적으로 증가하고 있는 것으로 나타났고, 생물자원탐색의 미생물분야가 7.40%의 연평균 증가율을 보여주고 있다. 단백질치료제와 신약후보물질은 최근 들어 특허출원건수가 조금씩 감소되고 있는 것으로 나타났다.
[표 3-3-7] 한국에 출원한 생명공학분야의 기술분류별-연도별 특허출원건수
(단위 : 건)
|
기술분류 |
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
2009 |
2010 |
2011 |
2012 |
2013 |
||
|
공정 |
생물공정 |
분리정제 |
0 |
0 |
2 |
0 |
1 |
0 |
0 |
1 |
4 |
0 |
0 |
0 |
0 |
|
생물학적합성 |
130 |
134 |
152 |
106 |
101 |
95 |
189 |
212 |
210 |
215 |
169 |
174 |
205 |
||
|
동식물세포배양장치 |
6 |
10 |
8 |
16 |
16 |
39 |
30 |
40 |
37 |
63 |
61 |
104 |
66 |
||
|
효소, 미생물관련장치 |
34 |
37 |
23 |
38 |
47 |
78 |
84 |
110 |
90 |
131 |
104 |
148 |
156 |
||
|
측정진단 |
조사, 분석 |
96 |
118 |
155 |
154 |
153 |
237 |
301 |
391 |
369 |
498 |
399 |
454 |
321 |
|
|
측정, 시험 |
227 |
240 |
281 |
289 |
399 |
327 |
472 |
381 |
412 |
541 |
353 |
467 |
514 |
||
|
기초 |
유전체 |
유전공학 |
384 |
322 |
332 |
394 |
428 |
459 |
618 |
820 |
567 |
697 |
627 |
662 |
662 |
|
당류기함유핵산 |
39 |
50 |
37 |
29 |
47 |
35 |
39 |
46 |
31 |
47 |
20 |
14 |
24 |
||
|
단백질체 |
펩티드 |
251 |
231 |
213 |
274 |
258 |
348 |
403 |
468 |
322 |
435 |
273 |
301 |
334 |
|
|
고정화펩티드 |
1 |
0 |
0 |
0 |
3 |
3 |
9 |
7 |
8 |
10 |
2 |
6 |
2 |
||
|
하이브리드펩티드 |
18 |
24 |
39 |
19 |
24 |
29 |
46 |
62 |
68 |
71 |
54 |
86 |
83 |
||
|
항체이용 |
면역글로불린 |
50 |
58 |
72 |
91 |
93 |
141 |
188 |
386 |
220 |
374 |
203 |
263 |
244 |
|
|
효소공학 |
효소 |
82 |
90 |
77 |
75 |
75 |
107 |
109 |
138 |
144 |
176 |
131 |
135 |
163 |
|
|
생물자원탐색 |
미생물 |
189 |
219 |
213 |
192 |
211 |
288 |
247 |
291 |
311 |
412 |
338 |
398 |
445 |
|
|
바이러스 |
23 |
23 |
15 |
16 |
21 |
15 |
25 |
36 |
24 |
45 |
46 |
44 |
49 |
||
|
동식물 세포배양 |
동식물세포 |
48 |
70 |
68 |
127 |
129 |
184 |
199 |
267 |
196 |
281 |
193 |
165 |
201 |
|
|
농업 |
생물농약개발 |
생물농약 |
47 |
40 |
38 |
52 |
78 |
84 |
93 |
70 |
105 |
90 |
76 |
61 |
52 |
|
형질전환동식물 개발 |
신규한동물 |
14 |
25 |
28 |
30 |
36 |
33 |
41 |
33 |
43 |
60 |
45 |
53 |
65 |
|
|
신규한식물 |
46 |
58 |
69 |
35 |
51 |
44 |
51 |
74 |
57 |
176 |
139 |
160 |
119 |
||
|
식품 |
발효식품개발 |
알코올발효 및 장치 |
118 |
108 |
87 |
83 |
102 |
149 |
166 |
169 |
186 |
261 |
181 |
169 |
152 |
|
의약 |
생물의약개발 |
방사선의약 |
13 |
6 |
11 |
8 |
14 |
11 |
17 |
14 |
6 |
19 |
8 |
16 |
14 |
|
유전자치료 |
24 |
18 |
15 |
24 |
28 |
20 |
35 |
38 |
36 |
29 |
17 |
62 |
79 |
||
|
치료용항체 |
106 |
107 |
108 |
88 |
116 |
134 |
244 |
332 |
198 |
346 |
214 |
173 |
186 |
||
|
단백질치료제 |
143 |
116 |
134 |
163 |
178 |
204 |
282 |
448 |
230 |
510 |
232 |
262 |
209 |
||
|
신약후보물질 |
365 |
394 |
465 |
486 |
57 |
104 |
101 |
163 |
127 |
193 |
146 |
145 |
127 |
||
|
환경 |
환경생물공학 |
슬러지처리 |
12 |
9 |
18 |
5 |
10 |
17 |
25 |
62 |
58 |
74 |
61 |
68 |
36 |
|
생물학적수처리 |
251 |
222 |
210 |
188 |
217 |
230 |
259 |
273 |
245 |
269 |
189 |
169 |
170 |
||
|
계 |
2,717 |
2,729 |
2,870 |
2,982 |
2,893 |
3,415 |
4,273 |
5,332 |
4,304 |
6,023 |
4,281 |
4,759 |
4,678 |
||
라. 한국에 출원된 생명공학 특허의 상위 10대 다출원 국가현황
생명공학특허 상위 10대 출원 국가의 2001년 이후 누적출원 건수를 살펴보면, 한국이 30,392건으로 가장 많고, 그 다음으로 미국이 8,452건, 일본이 3,824건 순으로 나타났다.
다 출원 상위 10대 국가들을 보면 4~10위까지는 모두 유럽국가가 차지하고 있는 것으로 나타나, 유럽국가에서 생명공학관련 특허가 국내에 많이 들어오고 있음을 알 수 있다.
2001년~2013년까지의 연평균 증가율을 살펴보면, 한국은 5.56%의 연평균 증가율을 보이고 있다. 미국은 2.69%를 보이고 있는 반면, 일본은–2.66%로 연평균증가율이 감소하고 있는 것으로 나타났다.
중국과 스위스는 연평균증가율이 크게 늘어나고 있는 것으로 조사되었다. 중국의 연평균증가율은 13.97%로 상위 10개 출원국 중 가장 높은 수치를 보였고, 스위스도 13.11%로 연평균증가율이 매우 높게 증가한 것으로 나타났다.
연평균증가율이 감소하고 있는 국가는 일본 외에 독일, 영국, 덴마크로 조사되었다.
[표 3-3-8] 국내 상위 10대 다출원 국가현황
(단위 : 건, %)
|
|
2001 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
2009 |
2010 |
2011 |
2012 |
2013 |
연평균증가율 |
|
대한민국 |
1,682 |
1,802 |
1,797 |
1,761 |
1,665 |
2,073 |
2,339 |
2,367 |
2,702 |
3,025 |
2,821 |
3,140 |
3,218 |
5.56 |
|
미국 |
458 |
417 |
388 |
577 |
629 |
694 |
909 |
1144 |
728 |
651 |
606 |
621 |
630 |
2.69 |
|
일본 |
253 |
253 |
241 |
276 |
300 |
348 |
372 |
510 |
322 |
235 |
274 |
257 |
183 |
-2.66 |
|
스위스 |
26 |
30 |
60 |
69 |
69 |
104 |
144 |
212 |
120 |
118 |
144 |
124 |
114 |
13.11 |
|
독일 |
115 |
95 |
134 |
108 |
105 |
123 |
151 |
182 |
109 |
112 |
91 |
94 |
103 |
-0.91 |
|
프랑스 |
33 |
36 |
33 |
39 |
30 |
56 |
65 |
134 |
98 |
72 |
79 |
65 |
70 |
6.47 |
|
영국 |
53 |
45 |
59 |
50 |
60 |
73 |
75 |
108 |
48 |
45 |
46 |
59 |
43 |
-1.73 |
|
네덜란드 |
19 |
25 |
30 |
38 |
36 |
48 |
66 |
70 |
29 |
49 |
33 |
39 |
37 |
5.71 |
|
덴마크 |
45 |
19 |
28 |
31 |
28 |
27 |
48 |
53 |
36 |
20 |
39 |
39 |
29 |
-3.60 |
|
중국 |
5 |
3 |
11 |
14 |
11 |
12 |
25 |
22 |
25 |
20 |
33 |
51 |
24 |
13.97 |
마. 한국특허로 본 생명공학분야의 상위 다출원기관 현황
국내 상위 20대 다출원기관를 살펴보면, 한국생명공학연구원이 각 연도구간에서 가장 많은 특허출원건수를 보여주고 있으며 2010~2013년의 특허출원건수는 428건으로 나타났다.
농촌진흥청은 2001~2005년까지는 6위에서 2006~2009년에는 3위 2010~2013년에는 337건을 출원하여 다출원기관 2위를 차지하였다.
대학에서는 서울대가 가장 꾸준한 특허출원을 보이고 있고, 건국대학교, 연세대학교, 한국과학기술원 등의 약진이 두드러지게 나타났다.
국내 출원기관들의 특허출원이 늘어남에 따라 외국기업인 제넨테크와 에프호프만라로슈 등의 순위가 뒤로 밀리고 있는 현상을 보여주고 있다.
[표 3-3-9] 국내 상위20대 다출원기업 현황
(단위 : 건)
|
2001∼2005년 |
2006∼2009년 |
2010∼2013년 |
|||
|
출원기관명 |
특허건수 |
출원기관명 |
특허건수 |
출원기관명 |
특허건수 |
|
한국생명공학연구원 |
286 |
한국생명공학연구원 |
473 |
한국생명공학연구원 |
428 |
|
삼성전자 |
200 |
서울대학교 |
354 |
농촌진흥청 |
337 |
|
제넨테크(코) |
169 |
농촌진흥청 |
294 |
서울대학교 |
258 |
|
CJ |
155 |
제넨테크(코) |
250 |
삼성전자 |
234 |
|
서울대학교 |
145 |
고려대학교 |
224 |
건국대학교 |
229 |
|
농촌진흥청 |
114 |
삼성전자 |
197 |
연세대학교 |
229 |
|
고려대학교 |
104 |
노파르티스(AG) |
149 |
한국과학기술원 |
210 |
|
한국과학기술연구원 |
98 |
에프호프만라로슈(AG) |
149 |
경북대학교 |
179 |
|
한국과학기술원 |
78 |
전남대학교 |
147 |
에프호프만라로슈(AG) |
177 |
|
바스프(AG) |
75 |
한국과학기술원 |
146 |
서울대학교산학협력단 |
169 |
|
포항공과대학교 |
73 |
한국과학기술연구원 |
135 |
제넨테크(코) |
148 |
|
메르크파텐트(GMBH) |
70 |
건국대학교 |
128 |
가톨릭대학교 |
146 |
|
(주)메디제네스 |
68 |
연세대학교 |
111 |
한국과학기술연구원 |
146 |
|
아지노모토(가) |
67 |
경북대학교 |
109 |
전남대학교 |
136 |
|
건국대학교 |
61 |
몬도바이오테크 |
98 |
강원대학교 |
117 |
|
에프호프만라로슈(AG) |
51 |
글락소스미스클라인 |
90 |
한국식품연구원 |
117 |
|
인하대학교 |
48 |
경상대학교 |
86 |
고려대학교 |
107 |
|
화이자(코) |
43 |
경희대학교 |
79 |
충남대학교 |
107 |
|
와이어쓰 |
43 |
성균관대학교 |
76 |
노파르티스(AG) |
107 |
|
인제대학교 |
43 |
CJ제일제당 |
76 |
경상대학교 |
94 |
바. 미국에 등록된 생명공학특허건수 동향
미국의 생명공학특허도 특허등록건수가 매년 지속적으로 증가하고 있는 것으로 나타났다. 2013년 이후에는 매년 10,000건 이상의 특허가 등록되고 있고, 2002년~2014년까지의 특허등록 연평균 증가율은 3.35%를 나타내고 있다.
세부기술 분야를 살펴보면, 생물의약개발의 치료용 항체분야와 단백질 치료제의 특허등록 증가율이 높게 나타났다. 치료용 항체의 연평균 증가율은 8.02%이고 단백질 치료제의 연평균 증가율은 7.18%이다. 형질전환동식물개발의 신규한 식물은 특허등록건수가 가장 많으며, 연평균 증가율은 4.32%를 보이고 있다. 측정진단의 측정․시험분야 역시 연평균 1,000건 이상의 특허등록을 보여주고 있는 것으로 조사되었다.
대부분의 세부기술 분야에서 특허등록건수가 지속적으로 증가하고 있는 것으로 나타났으나, 생물의약개발분야의 신약후보물질은 특허등록건수가 감소하는 현상을 보여주고 있고, 연평균 증가율 역시 –4.23%로 조사되었다.
[표 3-3-10] 미국에 등록된 생명공학분야의 기술분류별-연도별 특허등록건수 현황
(단위 : 건)
|
기술분류 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
2009 |
2010 |
2011 |
2012 |
2013 |
2014 |
||
|
공정 |
생물공정 |
분리정제 |
10 |
14 |
8 |
4 |
7 |
4 |
2 |
0 |
4 |
1 |
1 |
3 |
1 |
|
생물학적합성 |
551 |
470 |
403 |
377 |
518 |
481 |
417 |
483 |
568 |
666 |
702 |
711 |
772 |
||
|
동식물세포배양장치 |
18 |
17 |
5 |
11 |
18 |
16 |
21 |
15 |
32 |
33 |
24 |
14 |
30 |
||
|
효소, 미생물관련장치 |
134 |
131 |
107 |
85 |
81 |
94 |
136 |
143 |
261 |
270 |
229 |
222 |
264 |
||
|
측정진단 |
조사, 분석 |
512 |
490 |
457 |
372 |
539 |
535 |
529 |
546 |
876 |
798 |
764 |
755 |
738 |
|
|
측정, 시험 |
1,125 |
981 |
876 |
732 |
878 |
894 |
827 |
834 |
1,099 |
1,104 |
1,077 |
1,135 |
1,126 |
||
|
기초 |
유전체 |
유전공학 |
495 |
478 |
456 |
361 |
585 |
581 |
392 |
458 |
601 |
587 |
589 |
605 |
702 |
|
당류기함유핵산 |
489 |
399 |
346 |
316 |
427 |
407 |
434 |
483 |
590 |
618 |
541 |
512 |
445 |
||
|
단백질체 |
펩티드 |
423 |
373 |
312 |
306 |
446 |
544 |
555 |
453 |
452 |
422 |
376 |
405 |
472 |
|
|
고정화펩티드 |
19 |
15 |
23 |
14 |
18 |
10 |
12 |
16 |
8 |
12 |
11 |
10 |
15 |
||
|
하이브리드펩티드 |
5 |
4 |
2 |
3 |
3 |
3 |
2 |
5 |
5 |
7 |
4 |
10 |
9 |
||
|
항체이용 |
면역글로불린 |
104 |
110 |
106 |
101 |
184 |
211 |
213 |
183 |
240 |
236 |
221 |
289 |
265 |
|
|
효소공학 |
효소 |
428 |
366 |
310 |
284 |
375 |
325 |
259 |
235 |
274 |
285 |
280 |
340 |
397 |
|
|
생물자원탐색 |
미생물 |
123 |
135 |
103 |
107 |
135 |
125 |
120 |
104 |
151 |
142 |
183 |
230 |
269 |
|
|
바이러스 |
53 |
30 |
31 |
23 |
35 |
33 |
39 |
47 |
27 |
31 |
41 |
48 |
42 |
||
|
동식물 세포배양 |
동식물세포 |
257 |
238 |
200 |
180 |
216 |
202 |
186 |
206 |
268 |
290 |
327 |
365 |
447 |
|
|
농업 |
생물농약개발 |
생물농약 |
153 |
133 |
115 |
79 |
105 |
130 |
115 |
106 |
134 |
179 |
257 |
271 |
276 |
|
형질전환동식물 개발 |
신규한동물 |
51 |
51 |
35 |
26 |
59 |
50 |
55 |
43 |
50 |
31 |
43 |
48 |
45 |
|
|
신규한식물 |
1,411 |
1,226 |
1,333 |
1,020 |
1,547 |
1,534 |
1,720 |
1,591 |
1,643 |
760 |
1,047 |
2,040 |
2,343 |
||
|
식품 |
발효식품개발 |
알코올발효 및 장치 |
10 |
19 |
21 |
15 |
26 |
18 |
11 |
8 |
10 |
13 |
16 |
17 |
17 |
|
의약 |
생물의약개발 |
방사선의약 |
53 |
65 |
48 |
36 |
43 |
44 |
47 |
44 |
61 |
54 |
99 |
127 |
128 |
|
유전자치료 |
86 |
73 |
71 |
56 |
70 |
72 |
38 |
55 |
99 |
118 |
131 |
132 |
177 |
||
|
치료용항체 |
482 |
470 |
396 |
323 |
511 |
496 |
561 |
679 |
857 |
846 |
993 |
1,137 |
1,217 |
||
|
단백질치료제 |
547 |
538 |
528 |
524 |
707 |
653 |
660 |
724 |
995 |
907 |
1,002 |
1,221 |
1,257 |
||
|
신약후보물질 |
257 |
245 |
197 |
199 |
179 |
56 |
44 |
52 |
84 |
78 |
109 |
141 |
153 |
||
|
환경 |
환경생물공학 |
슬러지처리 |
0 |
2 |
1 |
2 |
0 |
1 |
2 |
5 |
4 |
2 |
1 |
3 |
1 |
|
생물학적수처리 |
97 |
96 |
121 |
115 |
117 |
152 |
150 |
140 |
142 |
108 |
122 |
93 |
108 |
||
|
계 |
7,893 |
7,169 |
6,611 |
5,671 |
7,829 |
7,671 |
7,547 |
7,658 |
9,535 |
8,598 |
9,190 |
10,884 |
11,716 |
||
사. 미국에 등록된 생명공학특허의 상위 15대 다등록 국가현황
미국에 등록된 특허의 상위 15대 다 등록 국가55)의 특허건수를 살펴보면 미국이 72,501건으로 가장 많고, 일본이 8,808건, 독일이 5,829건 순으로 나타났다.
스위스는 2002~2005년까지 394건이 특허가 등록되었으나, 2010~2014년에는 1,448건의 특허가 등록되어 다 등록 국가 중 건수의 증가폭이 가장 큰 것으로 나타났다.
한국의 미국특허 등록건수도 지속적으로 증가하여 총 1,683건의 특허가 등록되었고, 처음으로 다 등록 10대 국가에 포함되었다.
[표 3-3-11] 미국에 등록된 생명공학분야의 15대 다등록국가현황
(단위 : 건)
|
국가 |
2002∼2005년 |
2006∼2009년 |
2010∼2014년 |
합계 |
|
미국 |
17,442 |
24,548 |
30,511 |
72,501 |
|
일본 |
1,725 |
3,125 |
3,958 |
8,808 |
|
독일 |
1,517 |
2,029 |
2,283 |
5,829 |
|
네덜란드 |
1,028 |
1,530 |
1,623 |
4,181 |
|
영국 |
764 |
1,068 |
1,243 |
3,075 |
|
캐나다 |
769 |
1,061 |
1,046 |
2,876 |
|
프랑스 |
720 |
957 |
1,261 |
2,938 |
|
스위스 |
394 |
809 |
1,448 |
2,651 |
|
덴마크 |
519 |
615 |
934 |
2,068 |
|
대한민국 |
208 |
523 |
952 |
1,683 |
|
호주 |
335 |
577 |
703 |
1,615 |
|
이스라엘 |
233 |
474 |
695 |
1,402 |
|
벨기에 |
274 |
420 |
525 |
1,219 |
|
스웨덴 |
239 |
286 |
343 |
868 |
|
이탈리아 |
139 |
227 |
369 |
735 |
아. 미국에 등록된 생명공학특허의 기술력수준 분석 현황
최근 5년(2010년~2014년)의 상위15대 국가별 기술력 수준을 양적․질적 지표를 이용하여 분석한 결과는 다음과 같다.
질적지표 분석을 위해 인용지수를 사용하였고 상대적 수준을 평가하기 위한 지표인 PII(patent impact index)를 사용하였다.
분석결과, 미국이 기술력(TS)이 압도적으로 우세한 것으로 나타났고, 그 다음으로 일본이 2,220.44로 나타났으며 덴마크가 988.17로 3위를 차지하고 있는 것으로 조사되었다.
한국은 동기간 특허등록국가 순위에서는 9위를 차지하고 있으나, 기술력 수준에서는 313.21점으로 12위를 차지하고 있는 것으로 나타났다.
[표 3-3-12] 2010∼2014년 미국에 등록된 생명공학분야의 국가별 기술력 수준 현황
(단위 : 건, 점)
|
국가 |
등록건수 |
Patent Impact factor |
Technology Strength |
순위 |
|
미국 |
30,511 |
1.34 |
40,945.76 |
1 |
|
일본 |
3,958 |
0.56 |
2,220.44 |
2 |
|
독일 |
2,283 |
0.43 |
972.56 |
4 |
|
네덜란드 |
1,623 |
0.43 |
701.14 |
7 |
|
스위스 |
1,448 |
0.44 |
635.67 |
9 |
|
영국 |
1,243 |
0.72 |
898.69 |
6 |
|
캐나다 |
1,046 |
0.91 |
951.86 |
5 |
|
프랑스 |
1,261 |
0.34 |
422.44 |
11 |
|
대한민국 |
952 |
0.33 |
313.21 |
12 |
|
덴마크 |
934 |
1.06 |
988.17 |
3 |
|
호주 |
703 |
0.90 |
630.59 |
10 |
|
이스라엘 |
695 |
0.99 |
685.97 |
8 |
|
벨기에 |
525 |
0.37 |
193.20 |
14 |
|
스웨덴 |
343 |
0.68 |
232.21 |
13 |
|
이탈리아 |
369 |
0.21 |
78.60 |
17 |
자. 미국특허의 생명공학분야 다등록 20개 기관 현황
최근 5년(2010년~2014년)의 다등록 20개 기관을 미국전체와 미국에 등록된 특허 중 한국인 등록기관을 따로 정리하였다.
미국전체에서는 Monsanto Technology가 1,656건으로 가장 많고, Pioneer Hi-Bred Intʼl이 1,265건, University of California가 434건 순으로 나타났다.
한국 다등록기관으로는 삼성전자가 95건을 등록하여 가장 많은 것으로 나타났고, CJ 제일제당이 54건, 한국생명공학연구원이 54건, KAIST가 29건 등의 순으로 나타났다
[표 3-3-13] 2010∼2014년 미국에 등록된 생명공학분야의 다등록기관 현황
(단위 : 건)
|
다등록기관명(미국전체) |
건수 |
다등록기관명(한국) |
건수 |
|
Monsanto Technology LLC |
1,656 |
SAMSUNG ELECTRONICS CO., LTD. |
95 |
|
Pioneer Hi-Bred Int'l, Inc. |
1,265 |
CJ Cheiljedang Corp. |
54 |
|
University of California |
434 |
Korea Research Institute of Bioscience and Biotechnology |
54 |
|
US Dept Health & Human Services |
356 |
Korea Advanced Institute of Science and Technology |
29 |
|
Genentech Inc |
333 |
Korea Institute of Science and Technology |
29 |
|
Syngenta Participations AG |
304 |
Sungkyunkwan University |
18 |
|
E I DuPont de Nemours & Co |
301 |
Pohang University of Science and Technology Foundation |
17 |
|
Syngenta Crop Protection AG |
248 |
Samsung Electronics Co., Ltd. |
17 |
|
Novozymes A/S |
244 |
Seoul National University |
17 |
|
Amgen Inc. |
232 |
Mogam Biotechnology Research Institute |
10 |
|
Danisco US Inc. |
219 |
Chonnam National University |
9 |
|
Stanford University |
215 |
Korea University Research and Business Foundation |
9 |
|
Wisconsin Alumni Research Foundation |
211 |
Postech Academy-Industry Foundation |
9 |
|
Allergan, Inc. |
205 |
CJ Cheiljedang Corporation |
8 |
|
Pioneer Hi Bred International Inc |
203 |
Aprogen, Inc. |
7 |
|
Seminis Vegetable Seeds, Inc. |
202 |
Hanall Biopharma Co., Ltd. |
7 |
|
Terra Nova Nurseries, Inc. |
186 |
Infopia Co., Ltd. |
7 |
|
NOVARTIS AG |
172 |
iNtRON Biotechnology, Inc. |
7 |
|
Stine Seed Farm, Inc. |
170 |
Seegene, Inc. |
7 |
|
Ajinomoto Co Inc |
164 |
Bioleaders Corporation |
6 |
4. 논문 현황
가. 개요
연구개발 결과는 논문을 통해 전파되고 이를 통해 학문이 발전하며 응용연구로 연결된다. 연구자는 논문발표를 통해 연구결과에 대한 객관적인 비판과 평가를 받으며, 자신의 축적된 연구역량을 확인해 주는 주요 수단이 되기도 한다. 이러한 논문의 현황분석은 우리나라 생명공학의 수준과 역량을 보다 객관적으로 진단하는데 유용하다. 특히, 질적 성과 중심의 선도형 R&D체계로 전환56)을 위해서는 논문의 양적수준 뿐 아니라 질적 수준에 대한 객관적인 분석이 필요하다.
논문분석을 수행하기 위해서는 논문 데이터베이스(DB)가 필요하다. Thomson Reuters에서 발간하는 SCI(Science Citation Index) DB는 학계에 널리 알려진 DB로써 SCI등재 학술지 논문 수는 한 나라의 국제적인 연구개발 활동의 지표로서 널리 인식되고 있다. SCI DB는 30년 이상 엄정한 심사를 통과한 학술지에 대한 DB를 구축하여 제공함으로써 세계적인 권위를 인정받고 있다. 논문현황 분석은 SCI DB의 일종인 NSI(National Science Indicators, 1981∼2014년)와 ESI(Essential Science Indicators, 2004∼2014년)를 기반으로 하였다. 전체 과학기술분야 중 생명공학분야를 분석하기 위해 SCI 과학기술 18개 분야 중 관련 6개 분야를 대상으로 하였다.
나. 한국의 SCI논문 현황
2014년 우리나라 SCI논문 수는 54,831편으로 세계 12위 수준이다. 세계 점유율도 2005년 대비 0.74% 증가하는 등 매년 양적으로 점진적인 증가 추세를 나타내고 있다.
[표 3-3-14] 최근 10년간 한국의 SCI논문 발표 현황
|
구분 |
2005 |
2006 |
2007 |
2008 |
2009 |
|
논문발표수(편) |
26,009 |
28,272 |
29,123 |
34,158 |
37,481 |
|
세계 총 논문수(편) |
926,401 |
980,867 |
1,030,524 |
1,106,974 |
1,157,902 |
|
세계 점유율(%) |
2.81% |
2.88% |
2.83% |
3.09% |
3.24% |
|
세계 순위 |
11위 |
11위 |
12위 |
12위 |
12위 |
|
구분 |
2010 |
2011 |
2012 |
2013 |
2014 |
|
논문발표수(편) |
41,177 |
45,367 |
49,682 |
52,021 |
54,831 |
|
세계 총 논문수(편) |
1,200,007 |
1,277,407 |
1,350,345 |
1,423,369 |
1,461,571 |
|
세계 점유율(%) |
3.43% |
3.55% |
3.68% |
3.65% |
3.75% |
|
세계 순위 |
11위 |
11위 |
10위 |
12위 |
12위 |
우리나라 SCI논문의 최근 5년간(2010∼2014년) 평균 피인용 횟수는 4.74회로, 세계 평균(5.25회)과 비교했을 때 질적 수준에서 다소 차이를 보이고 있다. 하지만 우리나라의 평균 피인용 횟수가 세계대비 74.6% 수준에서 90.3% 수준으로 증가하는 등 향후 질적 수준이 점진적으로 개선될 것으로 기대된다.
[표 3-3-15] 5년 주기별 한국의 SCI논문 1편당 평균 피인용 현황
|
구분 |
’05∼’09년 |
’06∼’10년 |
’07∼’11년 |
’08∼’12년 |
’09∼’13년 |
’10∼’14년 |
|
한국 |
3.50 |
3.65 |
3.90 |
4.14 |
4.43 |
4.74 |
|
세계평균 |
4.69 |
4.78 |
4.91 |
5.04 |
5.15 |
5.25 |
|
세계대비 |
74.6% |
76.4% |
79.4% |
82.1% |
86.0% |
90.3% |
다. 바이오분야 SCI논문 현황
우리나라 바이오 6개 분야의 최근 5년간(2010∼2014년) SCI논문 수는 [표 3-3-16]과 같다. 미생물학과 약리학 분야가 논문수로 세계 8위 수준이며, 점유율도 우리나라 평균(3.30%) 보다 높은 것으로 나타났다. 국가별로는 미국이 6개 분야 모두 월등히 앞서 있으며, 중국, 영국, 독일, 일본, 프랑스 순으로 나타났다.
[표 3-3-16] 최근 5년간(2010∼2014) 한국의 바이오분야 SCI 논문 현황
|
분야명 |
분야 논문수 |
세계순위 |
한국 대비 |
세계 대비 |
||
|
총논문수 |
점유율 |
세계분야 총 논문수 |
점유율 |
|||
|
면역학 |
2,850 |
16위 |
243,078 |
1.17% |
120,027 |
2.37% |
|
미생물학 |
4,003 |
8위 |
243,078 |
1.65% |
97,085 |
4.12% |
|
분자생물학 & 유전학 |
6,401 |
12위 |
243,078 |
2.63% |
209,980 |
3.05% |
|
생물학 & 생화학 |
12,559 |
10위 |
243,078 |
5.17% |
341,231 |
3.68% |
|
신경과학 & 행동과학 |
5,840 |
13위 |
243,078 |
2.40% |
240,574 |
2.43% |
|
약리학 |
7,617 |
8위 |
243,078 |
3.13% |
180,441 |
4.22% |
|
생명공학 합계 |
39,270 |
12위 |
243,078 |
16.16% |
1,189,338 |
3.30% |

[그림 3-3-18] 최근 5년간(2010∼2014) 국가별 바이오분야 SCI 논문수
한국의 바이오분야 SCI논문을 연도별 살펴보면 분자생물학 및 유전학 분야의 SCI논문수가 최근 10년간 19.8%의 연평균 증가율을 보이며 대략 3배 정도 증가하였고, 면역학(18.2%), 신경과학 및 행동학(11.7%), 생물학 및 생화학(9.4%), 약리학(6.9%), 미생물학(5.8%) 순으로 SCI논문이 증가하고 있는 것으로 나타났다.
[표 3-3-17] 최근 10년간 한국의 생명공학분야 SCI논문 현황
|
분야명 |
구분 |
2005 |
2006 |
2007 |
2008 |
2009 |
|
면역학 |
논문수 |
228 |
266 |
286 |
327 |
369 |
|
피인용수 |
5,896 |
5,920 |
7,480 |
8,459 |
6,541 |
|
|
평균피인용 |
25.86 |
22.26 |
26.15 |
25.87 |
17.73 |
|
|
미생물학 |
논문수 |
535 |
618 |
714 |
751 |
669 |
|
피인용수 |
8,746 |
8,139 |
10,431 |
8,787 |
6,846 |
|
|
평균피인용 |
16.35 |
13.17 |
14.61 |
11.70 |
10.23 |
|
|
분자생물학 & 유전학 |
논문수 |
516 |
522 |
690 |
895 |
1,008 |
|
피인용수 |
18,245 |
17,470 |
21,117 |
18,688 |
19,066 |
|
|
평균피인용 |
35.36 |
33.47 |
30.60 |
20.88 |
18.91 |
|
|
생물학 & 생화학 |
논문수 |
1,472 |
1,643 |
1,656 |
1,870 |
1,891 |
|
피인용수 |
37,312 |
34,815 |
33,235 |
32,875 |
26,559 |
|
|
평균피인용 |
25.35 |
21.19 |
20.07 |
17.58 |
14.04 |
|
|
신경과학 & 행동과학 |
논문수 |
595 |
587 |
718 |
816 |
850 |
|
피인용수 |
16,353 |
13,815 |
14,472 |
14,722 |
13,067 |
|
|
평균피인용 |
27.48 |
23.53 |
20.16 |
18.04 |
15.37 |
|
|
약리학 |
논문수 |
923 |
855 |
979 |
1,219 |
1,282 |
|
피인용수 |
17,018 |
16,324 |
17,251 |
19,221 |
17,282 |
|
|
평균피인용 |
18.44 |
19.09 |
17.62 |
15.77 |
13.48 |
|
분야명 |
구분 |
2010 |
2011 |
2012 |
2013 |
2014 |
|
면역학 |
논문수 |
473 |
521 |
620 |
592 |
644 |
|
피인용수 |
6,512 |
5,201 |
4,056 |
1,844 |
374 |
|
|
평균피인용 |
13.77 |
9.98 |
6.54 |
3.11 |
0.58 |
|
|
미생물학 |
논문수 |
668 |
757 |
920 |
811 |
847 |
|
피인용수 |
6,596 |
4,928 |
4,561 |
1,645 |
335 |
|
|
평균피인용 |
9.87 |
6.51 |
4.96 |
2.03 |
0.40 |
|
|
분자생물학 & 유전학 |
논문수 |
992 |
1,200 |
1,331 |
1,344 |
1,534 |
|
피인용수 |
18,522 |
13,218 |
13,353 |
5,563 |
1,342 |
|
|
평균피인용 |
18.67 |
11.02 |
10.03 |
4.14 |
0.87 |
|
|
생물학 & 생화학 |
논문수 |
2,170 |
2,297 |
2,474 |
2,758 |
2,860 |
|
피인용수 |
26,081 |
21,835 |
16,011 |
8,451 |
1,601 |
|
|
평균피인용 |
12.02 |
9.51 |
6.47 |
3.06 |
0.56 |
|
|
신경과학 & 행동과학 |
논문수 |
1,003 |
1,037 |
1,224 |
1,286 |
1,290 |
|
피인용수 |
11,898 |
9,243 |
7,189 |
3,707 |
704 |
|
|
평균피인용 |
11.86 |
8.91 |
5.87 |
2.88 |
0.55 |
|
|
약리학 |
논문수 |
1,408 |
1,542 |
1,573 |
1,535 |
1,559 |
|
피인용수 |
14,689 |
11,159 |
8,056 |
4,028 |
683 |
|
|
평균피인용 |
10.43 |
7.24 |
5.12 |
2.62 |
0.44 |

[그림 3-3-19] 한국의 연도별 바이오분야 SCI 논문수 추이
최근 5년간 우리나라에서 발표한 바이오 6개 분야 SCI논문 39,270편 중 1회 이상 피인용된 논문은 29,054편으로 논문의 피인용율은 74% 수준으로 나타났다. 분야별로는 약리학 분야가 세계평균보다 피인용율이 높게 나타났고, 생물학 및 생화학 분야의 피인용율이 세계 평균 대비 99% 수준으로 세계 평균 수준에 근접하였다.
[표 3-3-18] 최근 5년(2010∼2014) 한국의 바이오분야 SCI논문 피인용율
|
구분 |
한국 바이오분야 논문 |
세계대비 |
|||
|
논문수 |
피인용된 논문수 |
피인용율 (a) |
세계 피인용율(b) |
세계대비 (a/b) |
|
|
면역학 |
2,850 |
2,165 |
76.0% |
78.3% |
0.97 |
|
미생물학 |
4,003 |
2,864 |
71.5% |
75.6% |
0.95 |
|
분자생물학 & 유전학 |
6,401 |
4,503 |
70.3% |
78.2% |
0.90 |
|
생물학 & 생화학 |
12,559 |
9,526 |
75.8% |
76.3% |
0.99 |
|
신경과학 & 행동과학 |
5,840 |
4,340 |
74.3% |
77.0% |
0.97 |
|
약리학 |
7,617 |
5,656 |
74.3% |
73.3% |
1.01 |
|
생명공학 합계 |
39,270 |
29,054 |
74.0% |
76.4% |
0.97 |
최근 5년간 우리나라 SCI논문의 바이오 6개 분야 평균 피인용수는 5.94회로 세계 평균(8.04)대비 74% 수준으로 나타났다. 10년 전(2000∼2004년) 50% 수준과 비교했을 때 질적으로 빠르게 성장하고 있는 것으로 나타났다. 최근 5년간 6개 분야 중 약리학 분야의 평균 피인용수가 세계 평균 대비 88% 수준으로 가장 높았다.
[표 3-3-19] 최근 5년(2010∼2014) 한국의 바이오분야 SCI논문 피인용율
|
분야명 |
2000∼2004년 |
2005∼2009년 |
2010∼2014년 |
||||||
|
한국평균(a) |
세계 평균(b) |
비율(a/b) |
한국평균(a) |
세계 평균(b) |
비율(a/b) |
한국평균(a) |
세계 평균(b) |
비율(a/b) |
|
|
면역학 |
4.40 |
9.11 |
0.48 |
6.30 |
9.36 |
0.67 |
6.31 |
8.77 |
0.72 |
|
미생물학 |
2.72 |
6.76 |
0.40 |
3.76 |
7.12 |
0.53 |
4.51 |
6.95 |
0.65 |
|
분자생물학 & 유전학 |
6.35 |
13.11 |
0.48 |
7.20 |
12.02 |
0.60 |
8.12 |
11.18 |
0.73 |
|
생물학 & 생화학 |
4.17 |
7.35 |
0.57 |
5.42 |
7.50 |
0.72 |
5.89 |
7.42 |
0.79 |
|
신경과학 & 행동과학 |
4.24 |
6.95 |
0.61 |
5.29 |
7.62 |
0.69 |
5.61 |
7.93 |
0.71 |
|
약리학 |
2.78 |
4.67 |
0.60 |
3.91 |
5.54 |
0.71 |
5.07 |
5.79 |
0.88 |
|
생명공학 합계 |
3.99 |
8.02 |
0.50 |
5.18 |
8.17 |
0.63 |
5.94 |
8.04 |
0.74 |
라. 바이오분야 SCI 고피인용(상위 1%) 논문 현황
최근 11년간 우리나라의 바이오 6개 분야 피인용 상위 1% SCI논문수는 359편으로 세계 18위 수준이며, 피인용 상위 1% SCI논문 비율은 0.52%로 세계평균(1%)에 미치지 못하는 것으로 나타났다. 하지만, 연도별 현황을 분석하면 피인용 상위 1% 논문비율은 2004∼2008년 0.49%에서 2010∼2014년 0.54%로 점진적으로 증가하고 있는 것으로 나타났다. 최근 5년간 분야별로는 분자생물학 및 유전학분야가 피인용 상위 1% SCI논문 비율이 0.84%로 세계 평균(1%)에 가장 근접한 것으로 나타났다. 반면, 약리학 분야는 피인용 상위 1% SCI논문 비율이 점차 감소하는 것으로 나타났다.
[표 3-3-20] 최근 11년간(2004∼2014) 바이오 분야 피인용 상위 1% 논문
|
구분 |
한국 바이오분야 논문 |
1% 세계 논문수 |
|||
|
1% 논문수 |
전체 논문수 |
1%논문 비중 |
1%논문 세계순위 |
||
|
면역학 |
22 |
4,551 |
0.48% |
22위 |
2,287 |
|
미생물학 |
16 |
7,762 |
0.21% |
21위 |
1,767 |
|
분자생물학 & 유전학 |
88 |
10,453 |
0.84% |
17위 |
3,905 |
|
생물학 & 생화학 |
114 |
22,558 |
0.51% |
17위 |
6,703 |
|
신경과학 & 행동과학 |
37 |
9,934 |
0.37% |
20위 |
4,597 |
|
약리학 |
82 |
13,656 |
0.60% |
16위 |
3,418 |
|
생명공학 합계 |
359 |
68,914 |
0.52% |
18위 |
22,677 |
[표 3-3-21] 세계 전체 대비 5년 주기별 한국의 피인용 상위 1%논문 비중
|
구분 |
ʼ04∼ʼ08 |
ʼ05∼ʼ09 |
ʼ06∼ʼ10 |
ʼ07∼ʼ11 |
ʼ08∼ʼ12 |
ʼ09∼`13 |
ʼ10∼ʼ14 |
|
면역학 |
0.38% |
0.47% |
0.52% |
0.61% |
0.61% |
0.58% |
0.53% |
|
미생물학 |
0.16% |
0.18% |
0.15% |
0.17% |
0.16% |
0.18% |
0.25% |
|
분자생물학 & 유전학 |
0.85% |
0.80% |
0.78% |
0.65% |
0.72% |
0.83% |
0.84% |
|
생물학 & 생화학 |
0.53% |
0.52% |
0.48% |
0.59% |
0.51% |
0.50% |
0.52% |
|
신경과학 & 행동과학 |
0.28% |
0.31% |
0.23% |
0.27% |
0.30% |
0.39% |
0.43% |
|
약리학 |
0.59% |
0.65% |
0.73% |
0.70% |
0.75% |
0.67% |
0.56% |
|
생명공학 합계 |
0.49% |
0.51% |
0.50% |
0.53% |
0.53% |
0.54% |
0.54% |

[그림 3-3-20] 연도별 한국의 피인용 상위 1%논문 비율 추이
5. 산업 현황57)
가. 바이오기업 규모 및 매출발생 현황
2014년 기준 국내 바이오기업은 총 975개사로 기업 전체 종사자 규모를 기준으로 보면, ʻ1∼50명 미만ʼ 기업이 585개(60%)로 가장 많고, 1,000명 이상의 기업은 43개(4.4%)인 것으로 나타났다.
매출발생 현황을 살펴보면, 전체 975개 기업에서 미 응답기업 44개를 제외한 931개 기업 중 295개 기업(31.7%)이 2014년 현재 ʻ매출 발생 이전ʼ 단계인 것으로 조사되었으며, 매출 발생이 있는 636개 기업 중 332개 기업은 ʻ손익분기점 미만ʼ 수준으로 조사되었다. 2014년 매출 발생이 있는 636개 기업 중 2014년 처음 매출이 발생한 기업은 18개(2.8%), 매출 발생이 10년 이상인 기업은 262개(41.2%)로 조사되었다.
(단위 : 개, %)
|
기업 규모 |
매출발생 현황 |
|
|
|
[그림 3-3-21] 국내 바이오기업 규모 및 매출발생 현황
나. 외부 협력 현황
전체 975개 기업 중 2014년 기준 타 기관과의 협력관계가 있었던 기업은 275개로 28.2%의 비율을 보였다. 275개 협력실적이 있는 업체는 주로 국내 기관과의 협력을 하고 있으나 10건 중 1건 정도는 해외와 협력을 하고 있었다.
바이오의약, 바이오식품, 바이오화학 등 3개 분야의 기업이 협력기업 수의 79.3%, 협력 건수의 76.6%를 차지하고 있었다. 바이오의약은 기업체와의 협력이 많은 반면 바이오화학은 연구기관과, 바이오식품은 대학과 협력이 많이 일어나는 등 분야별로 협력의 특징을 보이고 있었다.
협력관계 형태는 공동연구 개발계약이 77%로 가장 많았으며, 다음으로 기술제휴-라이센싱(13.1%), 국내외 기술인력 교류(6.4%), 합작 투자(3.5%) 순으로 나타났다. 단계별로는 기초연구단계가 총 1,060건 중 355건으로 33.5%의 가장 큰 비중을 보이며, 다음으로 실험단계가 312건으로 29.4%로 높았으며, 전체 단계 중 마지막 단계인 사업화단계는 66건으로 6.2%의 낮은 비율을 보였다.
분야별 및 단계별 협력 건수는 바이오의약산업, 바이오식품산업, 바이오검정, 정보서비스 및 연구개발산업이 실험단계에서 비중이 높은 반면, 나머지 산업 분야는 기초연구단계에서의 비중이 더 높았다.
[표 3-3-22] 2014년 기준 바이오산업 분야별 협력 단계별 협력 건수
(단위 : 건, %)
|
구 분 |
전체 업체 수 |
협력 관계 보유 업체 |
협력관계 단계 |
||||||
|
기초 연구 |
실험 |
시작품 |
제품화 |
사업화 |
합계 |
||||
|
전 체 |
975 |
275 |
355 |
312 |
183 |
144 |
66 |
1,060 |
(100.0%) |
|
바이오의약산업 |
322 |
91 |
109 |
129 |
98 |
54 |
11 |
401 |
(37.8%) |
|
바이오화학산업 |
204 |
64 |
60 |
37 |
17 |
26 |
33 |
173 |
(16.3%) |
|
바이오식품산업 |
197 |
63 |
64 |
83 |
35 |
46 |
10 |
238 |
(22.5%) |
|
바이오환경산업 |
76 |
14 |
8 |
8 |
5 |
1 |
6 |
28 |
(2.6%) |
|
바이오전자산업 |
24 |
7 |
59 |
3 |
6 |
4 |
2 |
74 |
(7.0%) |
|
바이오공정 및 기기산업 |
73 |
15 |
11 |
11 |
9 |
10 |
4 |
45 |
(4.2%) |
|
바이오에너지 및 자원산업 |
28 |
8 |
14 |
7 |
11 |
1 |
- |
33 |
(3.1%) |
|
바이오검정, 정보서비스 및 연구개발산업 |
51 |
13 |
30 |
34 |
2 |
2 |
- |
68 |
(6.4%) |
다. 바이오산업 수급 현황
2014년 국내 바이오산업의 생산 규모는 7조 5,935억 원으로 국내판매 4조 1,948억 원(55.2%), 수출 3조 3,987억 원(44.8%)으로 나타났다. 국내판매와 수입에 따른 내수시장 규모는 5조 5,955억 원이며, 국내판매 4조 1,948억 원(75%), 수입 1조 4,006억 원(25%)으로 조사되었다.
바이오산업의 생산규모에서 바이오식품산업이 3조 494억 원으로 전체 산업의 40.2%를 차지하였고, 바이오의약산업이 2조 8,689억 원으로 37.8%의 비중을 보였다. 내수시장에서 가장 큰 비중을 차지하고 있는 산업은 바이오의약산업이며, 전체 시장의 49.1%인 2조 7,485억 원 규모로 조사되었다.
2012년∼2014년 바이오산업의 수급변화 추이를 보면 생산은 지속적인 성장을 보이지만 내수는 감소하였으며, 2012년 이후 연평균 증감률은 수급 2,4%, 생산 3.1%, 내수 0.6%로 나타났다.
2014년의 생산 부문은 전년 대비하여 1.1%가 증가하였으며, 바이오환경산업의 성장률이 23.9%로 가장 높게 나타났다. 2013년의 내수 부문은 전년 대비하여 2.4% 감소하였으며, 바이오환경산업이 23.1%의 높은 성장률을 보였다.
[표 3-3-23] 2012년∼2014년 바이오산업 생산 및 내수 변화 추이
(단위 : 억원, %)
|
구분 |
생산 |
내수 |
||||||||
|
2012 |
2013 |
2014 |
전년 대비 증감률 |
연평균 증감률 |
2012 |
2013 |
2014 |
전년 대비 증감률 |
연평균 증감률 |
|
|
전체 |
71,445 |
75,108 |
75,935 |
1.1 |
3.1 |
55,281 |
57,337 |
55,955 |
-2.4 |
0.6 |
|
바이오의약산업 |
27,087 |
27,635 |
28,689 |
3.8 |
2.9 |
28,194 |
28,490 |
27,485 |
-3.5 |
-1.3 |
|
바이오화학산업 |
5,030 |
5,622 |
5,245 |
-6.7 |
2.1 |
4,749 |
5,147 |
4,733 |
-8.0 |
-0.2 |
|
바이오식품산업 |
28,579 |
30,211 |
30,494 |
0.9 |
3.3 |
13,019 |
13,666 |
14,102 |
3.2 |
4.1 |
|
바이오환경산업 |
275 |
301 |
373 |
23.9 |
16.5 |
277 |
303 |
373 |
23.1 |
16.0 |
|
바이오전자산업 |
1,238 |
1,517 |
1,534 |
1.1 |
11.3 |
242 |
373 |
355 |
-4.8 |
21.1 |
|
바이오공정 및 기기산업 |
1,219 |
1,216 |
1,072 |
-11.8 |
-6.2 |
1308 |
1,294 |
1,063 |
-17.9 |
-9.9 |
|
바이오에너지 및 자원산업 |
6,122 |
6,659 |
6,432 |
-3.4 |
2.5 |
5,959 |
6,504 |
6,145 |
-5.5 |
1.5 |
|
바이오 검정 정보서비스 및 연구개발산업 |
1,895 |
1,946 |
2,096 |
7.7 |
5.2 |
1,533 |
1,560 |
1,698 |
8.8 |
5.2 |
라. 바이오산업 국내판매 현황
2014년 바이오제품의 국내판매 규모는 4조 1,948억 원으로 바이오의약산업이 1조 5,259억 원(36.4%)으로 국내판매 부분에서 가장 큰 비중을 차지하고 있었다. 다음으로는 바이오식품산업이 1조 3,791억 원(32.9%), 바이오에너지 및 자원산업 6,059억 원(14.4%)으로 이들 세 개 분야는 전체 국내 판매액의 83.7%(2013년 82.9%)를 차지하는 것으로 조사되었다.
국내판매 추이를 보면, 2014년은 전년 대비 1,517억 원(3.5%)이 감소하였다. 분야별로는 바이오식품산업이 전년 대비 3.0% 증가하였고, 바이오검정, 정보서비스 및 연구개발산업도 9.5%, 바이오환경산업의 경우 23.2% 성장하였다. 반면에, 바이오의약산업은 전년 대비 6.2% 감소하였고 산업내 비중도 1.0%p 감소하였으며, 바이오화학산업과 바이오공정 및 기기산업도 각각 13.1%, 28.7% 감소하였다.
2014년 기준 주요 바이오제품의 국내판매 현황을 보면, 사료첨가제의 국내판매 규모가 6,942억 원으로 전체 바이오제품 판매액 중 16.5%의 비중을 차지하였다. 다음으로는 기타바이오의약품(12.3%), 바이오연료(9.8%), 건강기능식품(8.8%) 순으로 조사되었다.
[표 3-3-24] 2012년∼2014년 바이오산업 분야별 국내판매 추이
(단위 : 백만원, %)
|
구분 |
2012년 |
2013년 |
2014년 |
전년 대비 증감 |
연평균 증감률 |
||||
|
국내 판매 |
비중 |
국내 판매 |
비중 |
국내 판매 |
비중 |
국내 판매 |
비중 |
||
|
전체 |
4,097,024 |
100.0 |
4,346,527 |
100.0 |
4,194,817 |
100.0 |
-151,710 |
-3.5 |
1.2 |
|
바이오의약산업 |
1,577,524 |
38.5 |
1,627,163 |
37.4 |
1,525,873 |
36.4 |
-101,290 |
-6.2 |
-1.7 |
|
바이오화학산업 |
406,185 |
9.9 |
451,091 |
10.4 |
392,179 |
9.3 |
-58,912 |
-13.1 |
-1.7 |
|
바이오식품산업 |
1,250,255 |
30.5 |
1,338,933 |
30.8 |
1,379,073 |
32.9 |
40,140 |
3.0 |
5.0 |
|
바이오환경산업 |
27,446 |
0.7 |
30,093 |
0.7 |
37,076 |
0.9 |
6,983 |
23.2 |
16.2 |
|
바이오전자산업 |
23,987 |
0.6 |
35,814 |
0.8 |
34,700 |
0.8 |
-1,114 |
-3.1 |
20.3 |
|
바이오공정 및 기기산업 |
76,691 |
1.9 |
72,391 |
1.7 |
51,619 |
1.2 |
-20,772 |
-28.7 |
-18.0 |
|
바이오에너지 및 자원산업 |
582,984 |
14.2 |
637,245 |
14.7 |
605,945 |
14.4 |
-31,300 |
-4.9 |
2.0 |
|
바이오 검정 정보서비스 및 연구개발산업 |
151,952 |
3.7 |
153,797 |
3.5 |
168,351 |
4.0 |
14,554 |
9.5 |
5.3 |
마. 바이오산업 수출입 현황
2014년 기준 바이오산업의 수출규모는 3조 3,987억 원으로 조사되었다. 분야별 보면, 바이오식품산업이 1조 6,703억 원(49.1%)으로 가장 컸으며, 다음으로 바이오의약산업이 1조 3,430억 원(39.5%)을 수출하였다.
수출 제품별로 보면 사료첨가제가 1조 2,023억 원 수출되어 전체 수출액의 35.4%를 차지하였으며, 다음으로 면역제제(12.4%), 식품첨가물(11.0%), 백신(5.8%), 기타바이오의약제품(4.8%) 순이었다. 수출상위 10개 제품 중 7개는 바이오의약제품, 2개는 바이오식품, 1개는 바이오전자제품 이었으며, 이들 10개 제품이 전체 수출액의 85.8%를 차지하고 있었다.
2014년 기준 바이오산업의 수입규모는 1조 4,006억 원으로 조사되었다. 분야별로 보면 바이오의약산업이 1조 2,227억 원으로 전체 수입액의 대부분(87.3%)을 차지하였다.
수입 제품별로 보면 백신은 3,615억 원이 수입되어 전체 수입의 25.8%를 차지하였으며, 다음으로 항암제 2,252억 원(16.1%), 혈액제제 2,110억 원(15.1%), 호르몬제 1,448억 원(10.3%) 순이었다. 수입상위 10개 제품 중 8개가 바이오의약제품, 1개는 바이오공정 및 기기, 1개는 바이오화학제품이었으며, 이들 10개 제품이 전체 수입액의 91.2%를 차지하고 있다.
[표 3-3-25] 2014년 기준 주요 바이오제품 수출입 현황
(단위 : 백만 원, %)
|
주요 수출제품 |
주요 수입제품 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
바. 바이오헬스케어기업 기술특례상장현황(2015년 기준)
코스닥시장에서는 2005년부터 기술성과 성장성을 보유한 벤처기업의 상장예비심사시 일반기업과 차별화된 예비심사요건을 적용하는 기술성장기업 상장예비심사 특례를 시행하고 있다. 지난 10년간 관련 제도를 수행한 결과 바이오분야에서는 총 24개 기업이 기술특례를 통하여 상장하였다.
기술특례상장기업은 2005년 2개(바이로메드, 바이오니아), 2006년 1개(크리스탈지노믹스), 2009년 3개(이수앱지스, 제넥신, 진매트릭스), 2011년 3개(인트론바이오, 나이벡, 디엔에이링크), 2013년 4개(코인텍, 레고켐바이오, 아미코젠, 인트로메딕), 2014년 1개(알테오젠), 2015년 10개(제노포커스, 코아스템, 펩트론, 에이티진, 유엔아이, 아이진, 엠지메드, 멕아이씨에스, 강스템바이오텍, 씨트리)등으로 2015년에 무려 10개 기업이 코스닥시장에 진출하였다.

[그림 3-3-22] 연도별 기술특례상장기업 수 및 시가총액
[표 3-3-26] 연도별 기술특례상장기업 현황 및 시가총액
|
기술특례상장기업 |
||||||||
|
번호 |
회사명 |
업종 |
년도(백만단위) |
|||||
|
2005 |
2006 |
2007 |
2008 |
2009 |
2010 |
|||
|
1 |
바이로매드 |
생물공학 |
362,046 |
178,893 |
109,324 |
76,385 |
134,880 |
103,219 |
|
2 |
바이오니아 |
생물공학 |
213,216 |
74,242 |
45,711 |
23,776 |
89,428 |
75,546 |
|
3 |
크리스탈지노믹스 |
생명과학 |
|
349,367 |
254,976 |
245,170 |
248,847 |
180,200 |
|
4 |
이수앱지스 |
제약 |
|
|
|
|
326,025 |
287,841 |
|
5 |
제넥신 |
생물공학 |
|
|
|
|
142,660 |
114,045 |
|
6 |
진매트릭스 |
생물공학 |
|
|
|
|
53,201 |
66,841 |
|
7 |
인트론바이오 |
생명과학 |
|
|
|
|
|
|
|
8 |
나이벡 |
제약 |
|
|
|
|
|
|
|
9 |
디엔에이링크 |
생명과학 |
|
|
|
|
|
|
|
10 |
코렌텍 |
의료,정밀기기 |
|
|
|
|
|
|
|
11 |
레고켐바이오 |
생명과학 |
|
|
|
|
|
|
|
12 |
아미코젠 |
생물공학 |
|
|
|
|
|
|
|
13 |
인트로메딕 |
의료,정밀기기 |
|
|
|
|
|
|
|
14 |
알테오젠 |
제약 |
|
|
|
|
|
|
|
15 |
제노포커스 |
생물공학 |
|
|
|
|
|
|
|
16 |
코아스템 |
생물공학 |
|
|
|
|
|
|
|
17 |
펩트론 |
생물공학 |
|
|
|
|
|
|
|
18 |
에이티젠 |
생명과학 |
|
|
|
|
|
|
|
19 |
유앤아이 |
의료,정밀기기 |
|
|
|
|
|
|
|
20 |
아이진 |
생물공학 |
|
|
|
|
|
|
|
21 |
엠지메드 |
생명과학 |
|
|
|
|
|
|
|
22 |
멕아이씨에스 |
의료기기 |
|
|
|
|
|
|
|
23 |
강스템바이오텍 |
생물공학 |
|
|
|
|
|
|
|
24 |
씨트리 |
제약 |
|
|
|
|
|
|
|
총 합 |
575,262 |
602,502 |
410,011 |
345,331 |
995,041 |
827,692 |
||
|
연도별 회사개수 |
2 |
3 |
3 |
3 |
6 |
6 |
||
|
기술특례상장기업 |
|||||||
|
번호 |
회사명 |
업종 |
년도(백만단위) |
||||
|
2011 |
2012 |
2013 |
2014 |
2015 |
|||
|
1 |
바이로매드 |
생물공학 |
154,047 |
377,664 |
560,816 |
748,228 |
2,613,829 |
|
2 |
바이오니아 |
생물공학 |
67,186 |
146,950 |
168,732 |
112,283 |
151,399 |
|
3 |
크리스탈지노믹스 |
생명과학 |
178,483 |
177,258 |
237,324 |
273,364 |
348,141 |
|
4 |
이수앱지스 |
제약 |
154,103 |
131,976 |
133,934 |
126,885 |
156,844 |
|
5 |
제넥신 |
생물공학 |
130,634 |
149,296 |
225,602 |
394,804 |
778,826 |
|
6 |
진매트릭스 |
생물공학 |
46,085 |
60,063 |
29,735 |
21,009 |
27,363 |
|
7 |
인트론바이오 |
생명과학 |
136,850 |
178,958 |
190,237 |
207,531 |
816,588 |
|
8 |
나이벡 |
제약 |
34,857 |
20,595 |
17,300 |
37,329 |
54,577 |
|
9 |
디엔에이링크 |
생명과학 |
102,967 |
68,436 |
51,107 |
86,643 |
80,365 |
|
10 |
코렌텍 |
의료,정밀기기 |
|
|
161,031 |
173,491 |
142,819 |
|
11 |
레고켐바이오 |
생명과학 |
|
|
172,753 |
156,472 |
225,664 |
|
12 |
아미코젠 |
생물공학 |
|
|
549,680 |
379,215 |
604,375 |
|
13 |
인트로메딕 |
의료,정밀기기 |
|
|
36,788 |
101,114 |
84,261 |
|
14 |
알테오젠 |
제약 |
|
|
|
148,509 |
234,426 |
|
15 |
제노포커스 |
생물공학 |
|
|
|
|
164,951 |
|
16 |
코아스템 |
생물공학 |
|
|
|
|
310,419 |
|
17 |
펩트론 |
생물공학 |
|
|
|
|
396,032 |
|
18 |
에이티젠 |
생명과학 |
|
|
|
|
344,297 |
|
19 |
유앤아이 |
의료,정밀기기 |
|
|
|
|
177,989 |
|
20 |
아이진 |
생물공학 |
|
|
|
|
147,000 |
|
21 |
엠지메드 |
생명과학 |
|
|
|
|
63,904 |
|
22 |
멕아이씨에스 |
의료기기 |
|
|
|
|
31,633 |
|
23 |
강스템바이오텍 |
생물공학 |
|
|
|
|
150,607 |
|
24 |
씨트리 |
제약 |
|
|
|
|
74,096 |
|
총 합 |
1,005,212 |
1,311,196 |
2,535,039 |
2,966,877 |
8,180,405 |
||
|
연도별 회사개수 |
9 |
9 |
13 |
14 |
24 |
||
1) 골든시드는 금값 이상의 가치를 가진 고부가가치 종자를 의미한다.
2) 국민 대상 기술 영역별 사회문제 해결 기대치 ①건강・의료(54.0%), ②환경보호(14.2%), ③주거(14.0%), ④경제성장(9.7%) (KISTEP, ʼ12)
3) 보건의료연구개발 분야 10억원 투자시 19.5명의 고용유발효과가 있어, 타 산업(평균 16.9명) 대비 우위(ʼ08)
4) 2014년 국가연구개발사업 총 투자규모는 17조 6천억 원 수준이며, 이중 보건의료의 비중은 약 1조 3억 원으로 전체의 7.4% 수준이다.
5) 2015년도 보건의료기술정책심의 위원회 자료 기준
6) 2015년에 제2기 암정복 10개년 계획(2006∼2015)이 완료됨에 따라 제3기 계획 수립 예정
7) 미래창조과학부, 산업통상자원부, 농림축산식품부, 환경부, 식품의약품안전처, 농촌진흥청
8) 유전자 조작기술(유전공학), 세포 융합기술(세포공학), 세포 대량 배양기술(세포배양공학), 생물공정기술(효소공학), 미생물 이용기술(미생물공학)
9) 환경의 자정능력(自淨能力)을 향상시키고 사람과 자연에 대한 환경피해 유발 요인을 억제·제거하는 기술로서 환경오염을 사전에 예방 또는 감소시키거나 오염 및 훼손된 환경을 복원하는 등 환경의 보전과 관리에 필요한 기술 (「환경기술 및 환경산업 지원법」)
10) 대기, 수질, 상․하수도, 폐기물, 소음․진동 등과 같은 환경적 유해요인을 측정․예방․제어․복구하거나 환경피해를 최소화하기 위한 제품 생산 또는 서비스를 제공하는 산업 활동
11) 생물다양성협약, 기후변화협약, 사막화방지협약
12) 물리적, 화학적, 생물학적, 광학적 정보를 센서에서 인식하여 전기적 신호나 소리, 광 등을 이용하여 대상 오염물질을 감지하는 기술
13) Ocean and Polar Research, Vol.35, No.2, 2013.6
14) ʻʻ생명공학연구의 기반이 되는 자원으로서 산업적으로 유용한 동물, 식물, 미생물, 인체유래 연구자원등 생물체의 실물(實物)과 정보ʼʼ를 의미한다(생명연구자원의 확보·관리 및 활용에 관한 법률 제2조 제1항, 2009. 11 시행).
15) 「생명연구자원의 확보·관리 및 활용에 관한 법률」에 근거, 5년마다 범부처 기본계획 수립
16) 생물다양성협약(1994.10. 가입) : 각국의 생물자원에 대한 주권적 권리 인정, 생물 서식처의 파괴행위에 대한 규제, 생물다양성의 보전과 지속가능한 이용을 위한 국가전략의 수립, 유전자원 제공국과 이용국과의 공정한 이익 공유 등 규정
17) 국가생물자원 종합관리시스템(http://www.kbr.go.kr)
18) 국립환경과학원, 국립공원관리공단(2013.4)
19) 2015년 10월 기준
28) http://c.ymcdn.com/sites/www.isber.org/resource/resmgr/Files/ISBER_Best_Practices_3rd_Edi.pdf
53) 기술분야별 투자현황 분석은 인문사회 분야를 제외한 과학기술 분야와 국방(비밀 세부과제 포함) 분야가 분석대상(2014년의 경우에는 45,865개 세부과제, 16조 3,147억원)임
55) 한국을 포함하기 위해 다등록 국가수를 15대로 산정
56) 국가과학기술심의회(2013), 제3차 과학기술기본계획(’13∼’17)
산업통상자원부와 한국바이오협회가 국가표준 KS J 1009(바이오산업 분류체계)에 따라 국내 바이오기업 975개사를 대상으로 조사한 「2014년 기준 국내 바이오산업 실태조사」잠정결과(2015년 12월)를 통해 작성하였으며, 국내 바이오산업 생산 및 수출입이 지속적인 증가세를 보이고 있는 것으로 나타났다.



1. 유전체
가. 유전체연구의 개요
(1) 유전체학(Genomics) 이란?
유전체학(Genomics) 이란, 한 개체 내에 존재하는 유전자(gene)들의 총합체인 유전체(Genome) 및 관련 정보를 종합적․체계적으로 분석하는 분야이다.
유전체연구는 연구 성격에 따라 유전체정보 생산 및 분석에 초점을 맞추는 염기서열 해독연구(기초 유전체연구 또는 구조유전체연구)와 분석된 정보를 토대로 신약개발과 맞춤의료 등의 응용이 가능한 유전체기능 규명연구(응용유전체연구 또는 기능유전체연구)로 구분 지을 수 있다.
최근 인간 유전체 해독비용이 한 명당 1,000달러 이하의 비용으로 낮아지면서 학문적으로 풀지 못한 의학적/생물학적 문제 해결과 산업적으로는 새로운 의약학/바이오제품 개발 및 기존의 산업을 혁신시키는 매개체 역할을 해낼 것으로 기대되고 있다.
(2) 유전체학의 핵심기술
유전체학 핵심기술은 기반형 기술인 초고속 유전체정보 해독기술, 유전체정보 분석 기술, 빅데이터 분석 및 관리 기술과 실용화 기술인 유전체 정보 활용 진단/치료 기술로 나뉜다.
초고속 유전체정보 해독기술은 NGS(Next Generation Sequencing)로 조직 및 세포의 DNA, RNA를 이용하여 Whole Genome-Seq, RNA-Seq, Whole Exome-Seq, Chip-Seq, MeDip-Seq, Small RNA-Seq 등 유전체 데이터를 생산 할 수 있는 기술이다.
유전체정보 분석 기술은 대용량 유전체정보(유전체, 전사체, 후성유전체)의 통합 분석 및 유전자/대사/조절 경로의 시스템적 네트워크를 분석할 수 있는 기술이다.
빅데이터 분석 및 관리 핵심기술은 대용량 유전체 정보, 임상정보, 일상 건강정보 등의 빅데이터의 통합 분석에 의한 유용 정보의 도출 및 빅데이터의 저장 장치 및 데이터 분석기기에 관한 기술이다.
유전체기반 맞춤의료(진단/치료) 기술은 개인유전체(personal genomics)에 기반한 질병의 진단, 치료, 예측 및 예방에 필요한 기반 기술이다.

출처 : Convergence Research Review, 2015, July voL1 no 4 재가공
[그림 4-1-1] 유전체학의 핵심기술
나. 해외동향
(1) 최근 기술개발 동향
(가) 유전체 해독기술
Illumina사는 전 세계적으로 광범위하게 사용되고 있는 NGS 기계인 Hiseq2500(600Gb/run, $40/Gb) 제품을 개선한 HiSeqX10(1.8Tb/run,$7/Gb) 시스템을 출시하였으며 이로써 인간 유전체 해독 비용을 획기적으로 낮춰 ʻ1,000달러 유전체시대ʼ를 현실화했다.
중국의 거대 유전체 해독 전문기업 BGI는 Illumina의 HiSeqX10에 대항하여 한 해에 1만 명의 유전체을 해독할 수 있는 NGS 시스템을 출시해 유전체 해독기 기술 경쟁에 박차를 가하고 있다.
1개 세포 수준에서 유전체를 분석할 수 있는 Single-Cell Sequencing 기법이 개발되어 종양세포 이질성(tumor cell heterogeneity) 등의 다양한 유전체 연구 분야에 활용되고 있다.
(나) 유전체정보 분석기술
Moore의 법칙보다 빠른 속도로 유전체 해독 비용이 하락함에 따라, 대용량 유전체 분석 기술의 중요성이 강조되고 있다.
최근 NGS 시스템 기반 개인 및 질환 유전체 연구에서는 대용량 유전체데이터 분석을 통해 다양한 질병 관련 유전자들을 동시에 분석할 수 있는 정보 분석 소프트웨어를 개발하여 질환 분자진단에 활용하고 있다.
또한, 한 명의 개인유전체 정보 분석 및 CVCD(Common Variant Common Disease) 정보 분석 기반에서 RVAS(Rare Variant Association Study)와 같이 다수의 집단유전체학 기반의 유전체정보 분석 기법의 개발 도 매우 활발하게 진행되고 있다.
초고속 유전체정보 분석시스템 구축을 위해 GPGPU(General-Purpose Computing on Graphics Processing Units)를 활용하여 유전체정보 분석 각 단계 중에 계산 시간이 오래 걸리는 곳을 가속화하여 100GB에 달하는 WGS 정보 분석을 하루 안에 끝낼 수 있는 기술을 개발 중이다.
(다) 빅데이터 분석 및 관리기술
유전체 빅데이터의 연구방향은 고도화된 표준 유전체와 전사체, 단백체, 후성유전체 정보와 임상정보를 결합하여 질환 치료 및 개인 맞춤형 의료에의 적용이다. 특히 유전체 빅데이터는 개개인의 상세한 생물학적, 유전적 정보를 분석한 자료 및 임상자료에 기반을 두어 약물 반응과 질환 발생위험을 예측한다는 점에서 맞춤의학에서 핵심적인 역할을 하고 있다.
최근 IBM은 10여 곳의 세계적인 암연구소들과 협력하여 유전체 및 임상데이터를 활용한 최첨단 인지컴퓨팅 솔루션인 왓슨을 암 환자의 맞춤형 치료에 활용하는 프로젝트를 시작했다.
2015년 미국 보스톤의 베스 이스라엘 디커네스 의료센터(Beth Israel Deaconess Medical Center)는 지난 30년간 25만명의 다양한 임상정보의 빅데이터를 활용 할 수 있는 인공지능 슈퍼컴퓨터가 앞으로 개발되어 데이터 중심의 의사결정 시대가 열리게 될 것이라고 이야기하고 있다.
(라) 유전체기반 맞춤의료기술
파운데이션 메디슨(Foundation Medicine)은 ʻ파운데이션 원'(FoundationOne)ʼ 이라는 고형종양과 혈액 암에 대한 진단 서비스를 제공하고 있다. 이 서비스는 개인유전체 해독을 기반으로 암 환자의 유전적 특징을 분석해 최적의 치료제를 찾도록 도와주는 유전자 변이 검사이다.
2015년 1월에 오바마 대통령이 ʻʻ정밀의학 이니셔티브(Precision medicine initiative)ʼʼ를 발표하면서 미국인 100만 명의 유전체를 해독해 의료혁명을 이끌겠다고 선언하였으며, 영국은 앞으로 2017년까지 10만 명의 암 및 유전 질환 환자들의 유전체 정보를 기반으로 질환과 유전자와의 상관관계를 찾아 질병 예방의 지표를 수립하고, 궁극적으로는 디지털화된 개인 유전자 정보를 전자 건강 기록에 활용하려는 계획을 진행 중에 있다.
(2) 주요국 연구개발 투자 현황
현재 선진국들은 2000년 이전부터 유전체 연구를 위한 연구거점 연구소를 설립/운영하여 왔으며, 최소 200명이상의 연구진과 1,000억 원 이상의 연구비를 투자하여 공격적인 연구개발을 하고 있다.
[표 4-1-1] 주요국 연구개발 투자동향
|
국가 |
기관명 |
투자예산 |
주요연구분야 |
|
미국 |
NHGRI1) |
5,669억원 |
- 게놈 구조, 생물학, 질병생물학의 이해 - 의과학 발전 - 헬스케어 효과향상 |
|
Precision Medicine Initiative (NIH) |
2억1500만달러 (2015년) |
- 백만 명의 Volunteer의 건강정보를 일생에 걸처 기록하고, 게놈분석을 통해 암의 유전적 기전 등을 밝히는 연구를 수행 |
|
|
Goolge |
142억원 |
- 게놈연구를 통한 바이오 의약품 연구를 지원 |
|
|
영국 |
Sanger Institute |
1,156억원 |
- 인간과 병원균 자연 유전변이 및 모델 생물, 마우스 및 제브라 피쉬 관련 게놈연구 - 병원균 게놈 시퀀스 실험 |
|
Genomics England |
1.6억달러 |
- 10만명의 환자 유전체 분석계획 - 항암제 맞춤치료 적용을 위한 시퀀싱, 정보저장 분석등을 실시 |
|
|
UK Biobank |
1.6억달러 |
- 50만명의 Genotyping연구 - Affymetrix Genotyping chip이용 분석 |
|
|
일본 |
OSC2) |
- |
- 게놈 네트워크연구 (대규모 유전체정보 수집 및 분석기반) - 기능 RNA연구 프로그램개발 - 완전장 cDNA 수집/분석 |
|
중국 |
BGI3) |
1,180억원 (2013년) |
- 유전체서열분석, 질병진단/예측/치료 - 제약연구 및 미생물/동식물 육종 - 클라우드 컴퓨팅 |
|
캐나다 |
GAPP4) |
3,000만달러 (2013년) |
- 유전체 연구 활성화를 위해 설립된 비영리기구 |
출처 : 한국생명공학연구원 분원(가칭, 유전체연구소) 설립 추진 적정성 조사 연구 최종보고서 재가공
(3) 시장 및 산업동향
글로벌 유전체 시장은 차세대 염기서열분석기(NGS)의 급격한 발전으로 유전자 진단, 소비재, 서비스 시장을 중심으로 꾸준히 발전하고 있다. 글로벌 전체 유전체 시장규모는 2013년 111억 달러에서 2018년 198억 달러까지 성장을 전망하고 있다.
글로벌 유전체 시장의 60% 이상을 Tier 11)수준의 기업들이 차지하고 있으며, 그 중 Roche Diagnostics가 2013년 글로벌 유전체 시장에서 18.3%로 가장 큰 점유율을 차지하였고, 그 뒤로 Life Technologies가 17.9%를 차지하였다.
글로벌 유전체 제품군 시장에서는 소비재 시장이 2013년 69.9억 달러로 가장 수익률이 높으며, 유전체 응용분야 시장에서 진단분야가 39억 달러로 가장 높은 수익률을 달성하였다.

[그림 4-1-2] 글로벌 유전체 시장 전망(2010년~2018년)2)
|
부처명 |
사업명 |
공동연구 사업 |
|
미래부 (1,513억) |
유전체 미래 원천 기술 개발 사업 |
- 국제협력연구사업 |
|
유전체 정보분석 공동연구 기반사업 |
[표 4-1-3] 부처별 역할 분담
|
구분 |
주요 역할 |
비고 |
|
미래부 |
- 생명현상 기능 및 기전 연구, 유전체 관련 기초·원천 기술 개발, 유전체 전문인력 양성 |
실용화기반 |
|
복지부 |
- 건강 및 질병유전체 분석 및 기능연구, 유전체 기능의 임상적 검증 및 적용, 약물 유전체 및 개인별 맞춤의학 |
실용화 |
|
농림부 |
- 동식물, 곤충, 미생물 등 농수산식품 관련 유전체 분석, 중요 경제형질 (품질·내병충) 관련 유전체 기능 연구, 바이오에너지, 생물농약 등 신 산업화 소재 발굴 |
실용화 |
|
해수부 |
- 해양 생물에 관한 유전체 연구 |
실용화 |
|
산업부 |
- IT 기반 기술 및 인프라 구축, 유전체인프라 운영 및 유전체 분석 관련 기술개발, 산업적 적용 및 관련 바이오산업 육성 |
산업화 |
(2) 관련 산업 현황
국내의 경우 유전체 관련시장은 유전체 분석시장을 중심으로 형성되어 있다. 현재는 초기단계를 형성하고 있으나, 최근 들어 유한양행, SK케미칼, 동아제약 등과 같은 주요 제약회사에서 유전체 분석업체와 전략적 협약을 맺고 분석시장의 진입을 적극적으로 추진하고 있는 상황이다.
[표 4-1-4] 국내 유전체 분석관련 기업
기업명 주요내용 테라젠이텍스 - 게놈, 바이오신약, 제약, LCD장비의 4개 분야를 사업영역으로 함 - 유한양행과 개인 유전자 정보서비스 헬로진의 국내 독점판매권 및 신상품 우선 확보 등의 전략적 제시 마크로젠 - 개인별 맞춤의학 실현을 위한 다양한 DNA 분석서비스 제공 - 바이오칩, G-스캐닝의 중국 시장 런칭 디엔에이링크 - 유전체 분석 및 연구관련 토탈 솔루션 제공업체 - SK케미칼과 공동 마케팅으로 개인 유전체 정보분석 서비스 DNA-GPS 판매 개시 바이오니아 - 유전자 기술 국산화를 목표로 원재료부터 장비까지 자체개발 - 유전자 합성, 분자진단시스템, RNAi 원천기술 등 관련 400개 특허 보유
출처 : 한국생명공학연구원 분원(가칭, 유전체연구소) 설립 추진 적정성 조사 연구 최종보고서
라. 발전방향
최근 NGS 개발을 통한 염기 해독기술의 눈부신 발전, 정보 분석 및 빅데이터 해독 기술의 발전은 인류가 현재 직면한 다양한 문제를 해결하기 위한 중요한 열쇠가 될 것으로 기대된다.
그 예로, 급속히 발전하는 각 개인의 유전체 연구를 통해 약물의 특이성, 반응성에 대한 예측이 가능하게 될 것이며, 다양한 난치성 질병에 대한 유전체 분석은 보다 효과적인 치료제 개발을 위한 필수적인 단계가 될 것이다. 또한 유전체 분석을 이용한 진단 마커 개발은 질병의 보다 정확한 ʻ조기진단ʼ이라는 획기적인 결과로 인류를 안내할 것이다. 즉, 국민 건강과 복지의 기본 정보가 될 것이다. 더 나아가, NGS 기술을 적용한 식물, 동물, 미생물의 다양한 유전체 연구는 인류가 직면한 식량문제 및 환경 문제 해결을 가능하게 만들 것이다.
따라서 향후 유전체 연구는 국가 경쟁력을 기르기 위한 필수적인 아이템으로 성장할 것이며, 이를 기반으로 유전체 비즈니스가 활성화될 것이다. 이에 능동적으로 대처하기 위해 유전체 연구에 공격적인 투자가 이루어져야 할 것이다.
2. 단백질체
가. 단백질체학(Proteomics: 프로테오믹스) 개요
(1) 단백질체학(Proteomics)이란?
단백질체학은 세포, 조직, 혈액 등에서 발현되는 모든 단백질의 총합인 단백질체에 대한 총체적인 연구로, 생체 활동, 질병, 노화 등에 따른 단백질 발현 정량뿐 아니라 단백질의 위치와 변화, 상호작용, 기능과 구조 분석을 포함하며, 유전체 서열과 생명현상의 연결 정보를 제공하여 새로운 질병 치료제 및 진단 시약개발에 있어서 가장 잠재력 있는 연구 분야이다.
(2) 단백질체학의 핵심기술
단백질체학 기술은 크게 프로테옴분석기술, 단백질기능규명기술, 단백질체정보기술로 나뉘며, 핵심기술인 프로테옴분석기술은 프로테옴분리 분획기술과 질량분석을 이용한 단백질 동정 및 정량 기술이 주를 이룬다. 단백질기능 분석은 단백질 상호작용 및 경로 분석, 단백질구조 규명 및 디자인, 세포 및 개체 기반 단백질기능검증기술 등으로 구분되며, 단백질체정보기술은 단백질체학 전 과정에서의 자료 분석 및 결과 해석을 위한 기반기술이다.

[그림 4-1-4] 단백질체학의 핵심기술
나. 해외 동향
(1) 기술개발동향
(가) 분리분획기술
폭넓은 프로테옴 분석범위를 확보하기 위해 단백질과 펩티드 수준에서 다양한 크로마토그래피적 분획법이 개발되어 사용되고 있으며, 검출의 다이내믹레인지를 크게 증가시키기 위해 이러한 분획법들과 역상크로마토그래피 (Reverse Phase Liquid Chromatography)가 결합된 다차원 분리기술을 적용하고 있다. LC-MS/MS기반 프로테오믹스을 위한 단백질 분획법으로는 여전히 1D SDS-PAGE에 이은 in-gel digestion 방법이 많이 사용되고 있다. in-gel 방법의 시료손실 문제를 보완하고 in-solution digestion이 가능한 gel 기반의 단백질 분획법으로 off-gel electrophoresis기술이 개발되어 혈장시료 분석에 적용된 바 있다. 또한 단백질 등전점(chromatofocusing)과 혐수성에 기반 한 이차원 분획기술인 PF2D가 선보였고, free-flow electrophoresis 기반이나 size-exclusion chromatography기반의 offline 단백질 분획법이 사용되고 있다. 그리고 분자량 기반의 Gel-Free 분획법이 시료의 복잡성을 획기적으로 줄여줌에 따라 top-down 프로테오믹스의 coverage를 높이는데 성공적으로 적용되고 있다. 한편 CIEF기술과 RPLC기술은 전기분무이온원을 통해 질량분석장비에 직접 연계하여 단백질 수준의 LC-MS/MS 실험을 할 수 있는 온라인 분리기술로 가장 유력한 방법이다. 이들 기술은 앞서 소개한 다양한 단백질 분획기술과 분리직교성이 뛰어나 다양한 형태의 offline 2D 단백질 분리기술로 개발되고 있다.
펩티드 수준의 분리분획기술은 가장 활발히 개발되는 프로테오믹스기술 중의 하나인데, LC-MS/MS 기반의 bottom-up 프로테오믹스의 발전을 이끈 분리기술은 초고압 액체크로마토그래피 기술(UPLC)이다. 고정상 충진물 소형화, 컬럼 길이 증가, 그리고 컬럼 내경 소형화를 통해 극대화된 펩티드 분리분해능은 나노전기분무이온원과 효과적으로 결합되어 한 번의 실험으로 수(십)만종의 펩티드와 수천종의 단백질을 동정할 수 있는 수준까지 개발되었다. 최근에는 UPLC와 분리직교성을 가지는 SCX, HILIC, high-pH RPLC, Offgel 등의 offline 펩티드 분획법의 연계로 프로테옴의 분석범위가 크게 개선되고 있다. 특히 주목할 만한 UPLC 기술은 서로 다른 분리원리의 결합을 통한 분리기술 혼성화와 하나의 시료에서 온라인으로 동시에 PTM과 단백질 프로파일링을 함으로써 시료손실 문제를 개선하고, 다차원 프로테옴 데이터 획득을 가능하게 하는 다기능 UPLC 기술이다. 또한 시료 수의 증가와 시료분획으로 인해 절대적으로 요구되는 높은 LC-MS/MS 실험 효율성을 실현할 수 있는 이중온라인 액체크로마토그래피 기술 등 재현성 높은 high-throughput 분리기술의 개발도 활발히 진행되고 있다.
(나) 질량분석기술
2015년 현재 질량분석기술의 지배적인 동향은 ʻ다양한 mass analyzer, ion optics, 그리고 fragmentation 기술들의 혼성화를 통한 다차원 질량분석데이터 생산ʼ으로 요약될 수 있다. 기존 삼중-사중극자(Triple Quad), 사중극자-TOF 결합(Q-TOF)을 필두로 하여 이온트랩과 사중극자(Q-TRAP), 이온트랩과 FT-ICR MS의 결합(LTQ-FT)에 이어, 이온트랩-오비트랩(LTQ-Orbitrap), 사중극자-오비트랩(Q-Exactive), 사중극자-오비트랩-이온트랩(Fusion Orbitrap) 등 다양한 혼성화 기술들이 선보이고 있다. 나노전기분무법은 여전히 프로테오믹스의 지배적인 이온원으로 사용되고 있으며, 액체크로마토그래피 기술과의 접합기술들이 다양하게 개발되고 있는데, 이온깔대기 기술이 기존의 skimmer-다중극자 장치기반의 이온전달계를 지속적으로 대체하여 미래 질량분석장비의 지배적인 이온전달기술이 될 것으로 전망한다. 또한 검출기술의 개발도 다양하게 진행되고 있는데, Q-TOF 등 TOF기술 기반의 질량분석기술은 검출기술의 속도 및 신호 감도 기술 개선 등에서 큰 발전을 이루고 있으며, Orbitrap기술은 high-field Orbitrap기술과 개선된 후리에 변환 기술의 개발 등으로 측정 속도 및 검출 감도, 질량분해능의 획기적 개선을 이루고 있다.
FT-ICR기술은 dynamic harmonization기술을 채용한 ParaCell과 초고속 ICR신호검출기술의 개발을 통해 질량분해능과 질량측정정확도가 크게 개선되었다. FT-ICR은 높은 감도, 높은 질량분해능, 0.01 ppm 이하의 높은 질량측정정확도 등으로 단백질 혼합물의 동정을 개선하고, ECD, ETD 등 단백질 분해기술의 개선으로 전단백질에 대한 더 정확한 화학적 정보를 제공한다. 펩티드 수준의 bottom-up분석의 한계를 극복하기 위해 middle-down 혹은 top-down 방식이 향후 프로테오믹스기술에 있어 가장 주목할 만한 기술이다. 고분해능/고정확성 FT 질량분석계 및 Gel-Free 분획분리기술의 발달과 high-field Orbitrap기술의 발전은 다양한 질량분석기술의 혼성화를 통해 이전의 불과 몇 종의 원형 단백질분석에서 최근에는 1,000개 이상의 원형 단백질들을 동정하고 그에 대한 다양한 단백질 아형들을 검출하는 연구 결과 보고가 점차 늘고 있다.
진보된 질량분석기술 기반의 프로테옴 프로파일링 연구를 통해 도출된 바이오마커 후보 및 주요 질병관련 신호전달체계에 대한 타겟지향적 질량분석기술이 다양하게 진행되고 있다. 여전히 MRM기술을 이용한 타겟지향적 질량분석 에세이 개발이 주요기술이며, 최근에는 개선된 질량분해능의 딸이온 스펙트럼 데이터를 활용하여 펩티드 특이성과 정량성을 높이는 질량분석 에세이 기술이 주목을 받고 있다. 특히 사중극자-오비트랩 질량분석기술의 도입으로 가능하게 된 PRM기술의 발전이 두드러진다. 또한 실험에 최적화된 실험방법 제어기술의 발전과 함께 단일 실험을 통해 검증되는 단백질 및 펩티드 수가 크게 증가하고 있어, 암질환 subtyping 등 기존 질환진단의 패러다임 변화를 이끌 수 있는 기술들이 활발히 개발되고 있다. 기존 프로테오믹스 기법과 별도로 ICP MS기술과 cytometry기법을 결합한 mass cytometry(cyTOF)도 단일 세포의 sub-proteome 측정을 가능하게 하는 기술로 주목받고 있다.
(다) Informatics기술
질량분석에서 얻어진 방대한 데이터로부터 펩티드의 서열, 정량, PTM 정보를 정확히 해석하고, 생물학적 의미를 추출하는 informatics기술은 미국의 Scripps, ISB와 PNNL 그리고 독일 MPI 등의 유수 연구기관에서 기술개발이 활발하게 진행되고 있다. 이들 기관에서는 분석의 자동화와 생산된 질량스펙트럼의 해석을 위한 소프트웨어(Census, MS-GF+, PeptideProphet/ProteinProphet, MaxQuant 등) 환경을 구축하고, 이를 공개하여 문제점 개선을 위해 노력하고 있다. 또한 펩타이드 서열로부터 단백질을 동정하고 정량적으로 해석하는 다양한 프로그램의 개발과 단백질의 PTM 분석을 위한 알고리즘(MODi, Ascore, debunker 등)의 개발도 활발히 진행되고 있다.
단편적인 펩티드 정보를 조합하여 정확한 proteoform을 동정하고 더 나아가 정량적으로 분석하는 문제는 여전히 어려운 문제로 남아있다. 특히, modification의 정확한 해석과 정량은 질량분석이 해결해야 하는 난제 중 하나이다. 이에 대응하기 위한 top-down방식의 질량분석과 데이터 해석기술이 발전하고 있으며 현재는 절충적인 middle-down분석이 종종 행해지나, top-down 및 middle-down 프로테오믹스에서 PTM 해석을 위한 기술 개발은 답보 상태에 있다. 그 외에도 단백질의 구조와 관련된 정보를 유추할 수 있게 하는 HDX-MS나 crosslinking에 의한 분석 등의 다양한 질량분석 기반의 분석기술이 개발되면서 이의 해석을 돕는 소프트웨어의 개발도 주목받고 있고, 항체를 이용한 단백질 상호작용을 분석하는 AP-MS(Affinity Purification Mass Spectrometry) 등에서는 기질 단백질의 정량을 위한 데이터 분석 기술 개발이 함께 진행되면서 단백질체 연구의 정확성을 높이고 다양한 응용에의 활용을 가능하게 하였다.
최근에는 단백질체와 유전체연구를 병행하여 종합적으로 해석하기 위한 프로테오지노믹스 연구가 활성화되면서, 질량분석을 통해 확인하고자 하는 proteoform을 DB search를 통해 동정 가능하도록 유전체 데이터베이스를 표현하고 구축하는 방법에 대한 연구가 진행되고 있다. 단순하게는 whole genome sequence에 기반한 6-frame translation에서 시작하여, NGS나 알려진 mutation DB로부터 구한 non-synonymous SNP, 더 나아가 alternative splice variant를 쉽게 포함할 수 있도록 하는 exon graph, splice graph 등이 제안되었으며, 이들 유전체 기반의 아미노산 서열 DB에 포함된 서열 간의 중복을 최소화하는 알고리즘도 제안된 바가 있다. 프로테오지노믹스 연구에서는 이들 DB에 다양한 가능성을 포함하게 되어 필연적으로 커지는 DB의 크기로 인해 search 시간이 늘어나고 random hit에 의한 false positive의 가능성이 높아지는 문제가 있어 이를 해결하기 위한 다양한 방안이 제시되고 있다. 고도로 분획화된 시료에서 얻어진 단백질체 프로파일링 데이터분석에 많은 시간이 소요되는데 프로테오지노믹스 DB크기의 증가는 계산적 부담을 배가하고 있어 분산 또는 병렬 컴퓨팅 환경을 활용한 신속한 분석을 가능케 하는 소프트웨어 분석 환경이 중요하다.
(라) 단백질체 정량기술
단백질체 정량은 gel을 사용하지 않고 LC와 질량분석기로만 정량하는 추세이다. 정량 프로테오믹스에는 약간의 변형은 있으나, 일반적으로 두 가지 접근법이 있다. 안정 동위원소 치환펩티드를 내부 표준물질로 사용하여 상대정량하거나 절대정량을 하는 접근법은 주로 무거운 동위원소 치환펩티드가 동일한 이온화 효율을 갖는 가정 하에 실시된다. 상대정량기술에는 ICAT, iTRAQTM, SILAC, IDBESTTM, TMT 등이 있는데 불완전 표지, 반응 부산물 발생, 시료의 복잡성 증가와 같은 문제점을 보이기도 하였으나 최근에는 사용법의 표준화가 상당히 진행되어 정량성이 개선되고 있으며, 특히 프로테오믹스 연구의 효율성을 크게 개선함으로써 그 적용 사례가 증가하고 있다. SILAC방법에 BONCAT방법을 도입하여 여러 조건으로 인하여 새롭게 합성되는 단백질을 정량할 수 있는 방법이 개발되었다. 또한 TMT의 새로운 안정 동위원소를 사용하여 동시에 최대 10개의 서로 다른 시료를 분석 가능한 10-plex TMT와 cysteine에 표지되어 산화 환원 반응에 주요한 단백질을 정량할 수 있는 iodo6plex TMT가 개발되어 적용되고 있다. 또다른 정량법인 비표지 정량법은 펩티드들의 상이한 이온화 효율, 존재량과 peak 세기 간의 비선형 관계, 데이터 처리 부분에서 여러 가지 난제를 안고 있으나 spectral counting, extracted ion chromatogram 비교와 같은 방법을 이용한 MaxLFQ, iBAQ, NASF 등의 알고리즘이 개발되어 비표지 정량법의 난제를 개선하여 바이오마커 발굴에 적용되고 있다. 절대정량기술에는 SISCAPA, QCAT proteotypic peptide, mTRAQTM(Applied Biosystems사)기술 등이 사용되고 있으며, 또한 SIS를 사용한 Triple quadrupole 질량분석기반 MRM기술 이용이 크게 증가하고 있다. 최근 MRM에 비해 Transition 선정시 소요되는 시간이 짧은 PRM과 SWATH방법이 개발되어 적용되고 있다.
(마) PTM(Post-translational modification) 분석기술
PTM 분석의 난제는 낮은 stoichiometry이므로, 각 PTM이 지닌 특이적인 물리화학적 성질을 이용하여 특정 PTM 단백질 혹은 펩티드를 농축하는 기술이 활발하게 개발되어 정착되고 있다. 인산화 펩티드 농축기술로는 가장 널리 쓰이는 IMAC이나 TiO2를 이용한 affinity 분리기술과 SCX 또는 SAX, high-pH RPLC활용기술 그리고 인산화자리의 화학적 변환을 이용한 분리기술이 있으며, 최근에는 항체를 이용하여 인산화된 tyrosine을 농축하는 기술이 개발되었다. 당쇄화의 경우는 주로 N-linked glycoprotein분석이 진행되고 있으며, hydrazide resin을 이용한 화학적 농축법과 lectin을 이용한 affinity기반 농축법이 활용되고 있다. 최근에는 membrane filter와 lectin affinity 분리를 결합한 FACE기법이 개발되어 다양한 당쇄화 프로테옴 분석에 적용되고 있으며, 당쇄화의 데이터분석 프로그램의 개발과 데이터베이스 구축으로 glycan의 구조가 발견되어 여러 분야에 적용되고 있다. 아세틸화에서는 N-terminome과 Acetylome의 발굴을 위한 COFRADIC, C-TAIL 등의 방법으로 유전자의 새로운 번역시작점을 발굴하거나 후성유전적 유전자 발현 조절에 관한 연구로 활용되고 있다. 최근에는 top-down 프로테오믹스 분석기술이 하나의 단백질에 나타나는 복잡한 PTM의 조합을 규명하는데 활용되고 있다.
(바) 바이오마커 연구
질병의 조기진단, 예후, 약물치료에 대한 반응, 신약 후보물질에 대한 평가 등에 유용한 오믹스기반 바이오마커 중 단백질 마커는 표현형 바이오마커로서 생리상태를 직접 반영하며, 병원에서 쉽게 분석할 수 있는 혈액이나 소변을 사용한다는 이점이 있다. 미국 AACR-FDA-NCI Cancer Biomarker Collaborative를 중심으로 바이오마커의 효율적인 개발을 통해 암 치료의 임상중개를 촉진하고 있으며, 미국 국립암센터의 EDRN에서는 각종 암에 대한 단백질 바이오마커군의 평가를 지속적으로 수행하고 있다. 최근에는 유전체와 단백체 데이터를 통합하는 프로테오지노믹스 기술 기반의 바이오마커 개발방법론이 대두되어 확산되고 있다. 그 대표적인 예로 유전체기업인 Illumina와 단백질체 기업인 AB Sciex는 OneOmics라는 협력관계를 맺었으며, 미국 국립암센터의 Clinical Proteomic Tumor Analysis Consortium은 TCGA 유전체 정보와 단백질체 정보를 통합하는 initiative 프로그램을 진행 중이다. 한편, 세계인간프로테옴기구는 Chromosome Centric Human Proteome Project를 출범하여 사람의 chromosome별 단백질 발현을 정리하고 단백질 발현여부가 알려져 있지 않은 단백질을 찾는 일을 수행하고 있어 바이오마커 개발이 가속화될 것으로 예상된다.
단백질체 분석에는 일반적으로 충분한 양의 시료가 필요하기 때문에 FFPE 조직 시료, biopsy 시료, Cyst 혹은 마우스 뇌와 같은 동물모델의 미량 시료와 같이 미세 시료 대상의 프로테옴 프로파일링이나 타겟티드 정량 연구가 제한적이었다. 최근 2-3년간 FFPE 1장의 슬라이드에서 deparaffinization 등의 일련의 과정을 통해 조직 시료를 처리하여 50ug이상 펩티드 시료를 얻는 시료 준비 기술이 발전하게 되어, FFPE 슬라이드 혹은 환자 biopsy 등으로 얻을 수 있는 미세 시료로 단백질 동정 및 타겟티드 정량을 수행하는 micro-scale 프로테오믹스가 태동하여, 향후 바이오마커 활용 연구에 이용될 것으로 기대되고 있다.
(2) 주요국 연구개발 투자 동향
[표 4-1-5] 대규모 단백질체 이니셔티브
|
Initiative |
Objective |
|
Biomakers Consortium |
Discovery and development of novel biomarkers for drug development, diagnostics and therapy. |
|
Biomakers Research Initiatives in Mass Spectrometry |
Helps to bridge the gap between early-stage discovery and application of protein biomarkers in clinical settings. |
|
Cancer Proteome Atlas |
Database with proteomic profiles of more than 4,495 tumor samples |
|
Chromosome Centric Human Proteome Project |
Map and characterize 20,000 proteins in the human proteome. The goal is to understand what proteins are coded by genes present on particular chromosomes. |
|
Clinical Proteomic Tumor Analysis Consortium |
Parallels the Cancer Genome Atlas program by analyzing cancer genomes for protein changes and linking these profiles to phenotypes. |
|
Early Detection Research Network |
Assists the translation of biomarkers from research to clinical application in cancer detection applications. |
|
Human Protein Atlas |
To compile a database of antibodies specific for human proteins; to link database with MS data from Human Proteome Project. |
|
Human Proteome Organization Projects |
To apply 13 initiatives that are based in one country, with subprojects that involve international research laboratories; to cover a wide range of human organs and proteomic topics. |
|
Human Liver Proteome Project |
To generate a comprehensive protein atlas of the human liver; to understand the proteomic basis of liver function and pathology; to develop liver-specific diagnostics and therapeutics. |
|
Human Proteome Project |
To map the entire human protein set using MS, antibody capture and bioinformatics tools. |
|
International Human Epigenomics Consortium |
To produce reference maps for human epigenomes and correlate to human diseases, including high-resolution histone modification and DNA methylation maps, as well as landmark maps for transcription start sites for protein-coding genes. |
|
National Biomaker Development Alliance |
Develope standards and guidelines for encouraging biomaker development and use. |
|
Peptide Atlas |
To provide an informatics framework for analyzing high-throughput MS-based proteomic data. |
|
Protein Data Bank |
To deposit, process and distribute proteomic data. |
|
Single-Cell Analysis Program |
To apply new technologies that can detect differences between individual cells within the same tissue |
|
SMRAtlas |
To compile database of peptides useful to drug discovery and research efforts. |
출처 : BCC Research, Proteomics: Technologies and Global Markets, 2015
[표 4-1-6] 주요국 연구개발 투자동향
|
국가 |
구분 |
연구개발 투자내용 |
|
미 국 |
NCI (National Cancer Institute) |
▪ Clinical Proteomic Tumor Analysis Consortium(CPTAC): $75-120M (’11~’16) |
|
NHLBI (National Heart, Lung and Blood Institute) |
▪ 3단계 Clinical Proteomics 프로그램: $80M(’10~ʼ15) |
|
|
NIGMS (National Institute of General Medical Science) |
▪ PSI 3단계사업: $290M(ʼ11~ʼ16) ▪ Top-down proteomics: $7.5M(ʼ15~ʼ20, Northwestern) |
|
|
NIH (National Health Institute) |
▪ NIH grants in proteomics: 연 ~$50M |
|
|
EU |
Horizon 2020 프로그램 |
▪ Biotechnology 분야: €509M(ʼ14~ʼ20) |
|
덴마크 Novo Nordisk 재단 |
▪ 질환 단백질 연구를 위한 센터(Novo Nordisk Foundation Center) ▪ 코펜하겐대학에 ʼ07 설립 및 지원(ʼ15 까지 €8M): 질환 단백질 연구를 위해 €140M 지원 (ʼ15~ʼ19) |
|
|
영국 |
▪ U of Manchester for omics-directed projects: £24M (ʼ14 시작) |
|
|
캐나다 |
CFI (Canada Foundation for Innovation) |
▪ Genomics Innovation Network(Genome Canada): C$30.5M (ʼ15 시작: 10 center including the Proteomics Center and the Sequencing Platform in BC, the Center for Advanced Proteomics Analyses in Quebec, and etc) ▪ Research including Omics-based studies: C$30.4M (ʼ14 시작: 다수의 프로테오믹스 funding 포함) |
(3) 단백질체학의 시장 동향 및 규모
2014년 5월, 미국과 인도의 독립적인 두 연구그룹과 독일에서 질량분석 데이터 기반의 인간 단백질체에 대한 초안을 발표하였다. 이러한 지도 초안은 단백질체학이 단순 연구개발에서 응용분야로 변천하고 있음을 보여준다. 현재 단백질체 기술은 대규모 유전체 및 단백질체 이니셔티브로부터 제공되는 단백질체 콘텐츠의 증가에 따라 급속도로 발전하고 있고, 질병에 중요한 새로운 바이오마커 발굴 가속화에 기여하고 있으며, 신약개발과 진단 등 다양한 응용의 동력으로 작용하고 있다.
2014년 세계 단백질체학 시장은 약 50억불로 연평균 약 18%씩 성장하여 2019년 약 116억불로 예측된다.4) 질량분석기반 프로테오믹스 시장은 기기, 신약개발 및 진단 응용분야가 성장을 주도하고 있는데, 2014년 약 40억불로 연평균 15%씩 성장하여 2019년 약 82억불의 시장을 형성할 것으로 보인다. 단백질체학 시장을 최종 소비자에 따라 분류하면 연구/신약개발 분야는 2014년에 78%의 시장 규모를 차지하며 연평균 약 11%씩 성장하여 2019년에는 약 68억불의 시장을 형성할 것으로 예측된다. 진단/응용분야의 경우는 2014년에는 전체시장의 22% 정도였지만, 연평균 34%씩 증가하여 2019년에는 약 48억불의 시장 규모로 크게 성장할 것으로 보인다.

[그림 4-1-5] 최종 소비자 분류에 따른 단백질체 시장 전망
다. 국내현황
(1) 연구개발 투자 현황
포스트게놈다부처유전체사업으로 단백질체관련 연구 사업이 계획되었으나, 2015년 현재 진행 중인 단백질체관련 국책 연구사업은 다중오믹스신기술 개발사업5)이 있으며 2015년 연구비는 약 30억 원으로 세계적으로 대규모 단백질체 이니셔티브가 진행되고 있는 상황에 비해 국내 투자는 상당히 미미한 편이다. 그 외에 대형사업단인 글로벌프론티어연구개발사업 중 의약바이오컨버젼스 연구단과 기초과학연구원 연구단(RNA 연구단, 식물 노화‧수명 연구단)에서 프로테옴분석인프라를 갖추고 연구에 활용하고 있으며, 기 구축된 질량분석기기 등을 활용한 연구가 산발적으로 진행 중이다.
(2) 관련 산업 현황6)
[표 4-1-7] 국내 대표적 단백질체 벤처기업 현황
|
기업명 |
주요 업종 |
설립 |
|
(주)영인프런티어 |
항체, 진단키트 생산 및 판매, HUPO Antibody Initiative에 참여 (에이비프론티어 합병) www.abfrontier,com |
1994. 3 |
|
(주)팹트론 |
주문형 펩타이드 제조 서비스, 기능성 및 의약용 펩타이드 개발 및 생산 www.peptron.co.kr |
1997. 11 |
|
(주)프로테오젠 |
단백질 칩, 단백질 기능분석 장치개발 및 판매 www.proteogen.co.kr |
2000. 2 |
|
(주)프로테옴텍 |
프로테옴 분리 및 질량분석, 단백질 동정 및 확인법 개발, 진단 키트 개발 www.proteometech.com |
2000. 3 |
|
(주)노바셀테크놀로지 |
프로테오믹스 기술과 펩타이드 라이브러리 기술 등의 플랫폼 기술 기반으로 바이오의약품과 세포치료제 개발 www.novacelltech.com |
2000. 6 |
|
(주)바이오인프라 |
암 조기진단을 위한 서비스 개발, 프로테옴분석을 위한 바이오 인포메틱스 기술 개발, 조기암진단 알로리즘 개발 및 단백질칩 시제품, 치료백신 및 암 유전자치료 개발(누백스와 합병) www.bio-infra.com |
2001. 2 |
|
다이아텍코리아(주) |
질량분석 기반 단백질의약품 특성 분석, 정량 프로테오믹스 분석 서비스 및 질량분석 기반 진단 키트/단백질 다중마커 동시검출 기술 개발 www.biomedms.co.kr |
2000. 1 |
|
(주)아스타 |
MALDI-TOF 진단 기기(로봇기술 활용 최초 국산화), MALDI plate 생산 판매, 시료전처리 기기 개발 생산 www.maldiplate.com |
2006. 1 |
|
바이오앤시스템즈(주) |
단백질의약품 특성 분석 서비스 www.bionsystems.co.kr |
2009. 7 |
|
프로테인웍스 |
프로테옴분석, 단백질의약품 분석 서비스 proteinworks.co.kr |
2008. 7 |
|
(주)한국질량분석기술 |
단백질분석서비스, LC/MS/MS 분석 서비스 N-말단서열분석 서비스 www.proteinlab.co.kr |
2009. 12 |
|
(주)진메트릭스 |
MALDI-TOF를 이용한 바이러스 및 미생물 유전자 진단 기술 개발 및 서비스 www.genematrix.net |
2000. 12 |
라. 발전과제
미래 도전분야는 인간의 질병문제를 해결할 수 있는 주요 수단으로 인간 프로테옴의 이해와 생명시스템에서의 유효하고 적절한 assay 개발이다. 그 방법으로 MRM방법이 제안되어 그 장점이 검증되었으나, 민감도 개선을 위한 대안으로 immuno-MRM의 개발, 정착 및 생물학이나 임상에서의 응용이 시급하여 국제적인 공동 노력이 제안되어 왔다. 하지만 필요한 리소스의 고비용과 표준방법을 확립하는 더디고 단조로운 과정 때문에 기초연구나 중개연구에 접목시킬 수 있는 동력은 국제 네트워크를 기반으로 확보되어야 할 필요가 있다. 또한 NGS 혹은 microarray수준의 분석이 가능한 micro-scale 프로테옴 분석기술의 발전은 환자 개개인의 치료 진단 등에 이용되어 궁극적으로 미량 시료에서의 유전체 및 단백질체 정보를 동시 획득하여 환자의 치료 진단 및 약물반응 등의 정밀의학을 구현하는 기반 기술로 활용 가능할 것이다.
3. 세포체
가. 세포체 및 줄기세포 기술 개요
세포는 생명체를 구성하는 가장 기본적인 단위로써 인체는 약 50조개의 세포로 이루어져 있는 것으로 보고 있으며, 세포의 종류는 약 230여 종류가 있는 것으로 알려져 있다. 인체를 구성하는 다양한 종류의 세포는 수정란이라는 하나의 세포로부터 시작되어 발생 및 분화단계를 거쳐 인체를 구성하게 된다. 이들 세포는 여러 가지 조직과 기관을 구성하고 있으며, 수명을 다한 세포는 사멸하게 된다. 각 조직과 기관에서 손실되는 세포들은 성체줄기세포 혹은 조직 특이적 줄기세포에 의해서 재생되어 각 조직과 기관이 원래의 기능을 지속적으로 수행하도록 한다.
세포체학은 생체에서 일어나는 위와 같은 세포의 생성과 사멸을 연구하는 학문이며, 손상된 세포를 정상적인 세포로 치환하여 기능을 회복시키는 것을 목적으로 하는 재생의학과 밀접한 관계가 있다. 재생의학 분야에서 주요하게 다뤄지는 세포가 바로 줄기세포이다.
줄기세포는 인체의 조직에 있는 성체줄기세포와 발생단계의 배반포에서 분리하여 in vitro 환경에 적응시킨 배아줄기세포로 나누어 질 수 있다. 배아줄기세포는 인체를 구성하는 230여 종류의 모든 세포로 분화할 수 있는 전분화능(pluripotency)을 가지고 있기 때문에 만능줄기세포로도 불린다. 2006년 일본의 Shinya Yamanaka는 섬유아세포에 4개의 유전자를 도입함으로써 세포의 운명을 전환시켜 유도만능줄기세포(induced pluripotent stem cells, iPSCs)를 만들 수 있는 발견7)을 하여, 2012년 노벨 생리의학상을 수상하였다. iPSC 기술은 세포체학 및 재생의학분야에서 패러다임을 전환하는 기술로 여겨지고 있으며 2006년에 발간된 최초의 논문은 google scholar기준으로 현재 13,000여 건의 인용도를 보이고 있다.
iPSC와 같이 세포의 운명을 전환시켜 새로운 운명을 갖도록 하는 기술을 ‘리프로그래밍ʼ이라고 한다. 여기에는 핵치환 배아줄기세포 제작기술, iPSC줄기세포 제작기술, 직접교차분화기술이 포함된다. 특히, 직접교차분화기술 (direct conversion, direct reprogramming, transdifferentiation)은 iPSC의 생성 없이 목표하는 세포를 직접 만들 수 있는 기술로 새롭게 주목받고 있다.
리프로그래밍 기술은 환자특이적인 세포를 제작할 수 있는 기술로, 이를 통해 만들어진 세포는 환자에게 이식시 면역거부반응을 일으키지 않을 것으로 예상되어 재생의학적으로 매우 중요한 기술로 여겨진다. 또한, 리프로그래밍을 통해 환자특이적인 세포를 획득할 수 있게 되어 실험실 환경에서 환자의 질환을 모델링하여 분석할 수 있게 되었다. 리프로그래밍을 통한 질환 모델링은 신약개발과정에 활용되어 신약후보물질의 안전성과 유효성을 획기적으로 높이는데 기여할 것으로 기대된다.
나. 해외 동향
(1) 기술개발 동향
(가) 유도만능줄기세포 유래 세포의 임상시험
2014년 일본의 RIKEN에서는 환자 특이적 iPSC를 망막색소상피세포(RPE)로 분화시켜 환자에게 이식하는 최초의 임상시험을 진행하였으며 일부 환자는 치료효과가 나타나는 긍정적인 결과를 보였다. 하지만 2015년 두 번째 환자의 임상시험을 돌연 중단한다고 발표하였는데, 원인은 환자세포에서 돌연변이가 발견되었기 때문이다8). 이로 인해 iPSC 유래 치료세포의 안전성에 대한 우려가 제기되었다.
iPSC가 아닌 배아줄기세포를 이용하여 RPE 세포를 만들어 이식하려는 시도가 미국의 오카타 테라퓨틱스(전. ACT)와 한국의 차병원에서 있었으며, 임상시험결과 안전성과 효과를 입증하였고 임상1상을 마친 상태이다.
향후 유도만능줄기세포를 이용한 재생의학적 치료는 지속적으로 추진될 것으로 전망된다. 하지만 iPSC의 경우 자가이식을 통한 접근보다는 HLA homotype iPSC를 이용한 동동이식을 통한 방법이 고려되고 있고, 일본은 이를 위한 뱅크를 확립하는 프로젝트를 진행 중에 있다.
(나) 직접교차분화 기술의 발전
유전자 과발현을 통한 직접교차분화 기술은 오래전에 그 현상이 보고되었지만, 2010년 Marious Wernig 그룹에서 중배엽 유래의 섬유아세포로부터 외배엽세포인 신경을 만들어 냄으로써 직접교차분화 연구가 활발해지는 계기가 되었다. 이후 다양한 종류의 신경세포와 심근세포, 간세포, 혈관세포 등을 직접교차분화를 통해서 제작할 수 있게 되었다. 2013년에는 염색체상에 외부유전자의 삽입 없이 유도신경줄기세포를 제작하는 방법이 보고되었고9)10), 최근에는 유전자의 사용 없이 화합물만을 이용한 결과도 보고되고 있다11)12).
(다) 오가노이드 분화기술의 진전
만능성줄기세포를 이용하여 목적하는 세포로 분화 시키는 연구는 오가노이드(organoid)라고 불리는 소형 장기유사체를 제작하는 방향으로 진전이 이루어지고 있다. Optic-cup, 뇌, 간의 오가노이드를 만든 결과가 보고되었고, 최근에는 소뇌13), 신장14), 장관15)을 만드는 결과들이 보고되고 있다.
이와 같은 오가노이드로의 분화는 인간의 조직발생을 연구할 수 있는 재료를 확보하는 기초적인 의미뿐만 아니라, 재생의학적 치료 및 질병모델링에도 활용될 수 있다는 점에서 향후 발전이 매우 기대되는 분야이다.
(라) 리프로그래밍을 이용한 질병 모델링 기술 개발
환자의 체세포로부터 줄기세포를 획득할 수 있는 리프로그래밍 기술을 이용하여 환자의 질병상태를 모델링할 수 있는 세포를 확보할 수 있게 되었다. 이는 리프로그래밍 기술이 개발되기 전에는 존재할 수 없었던 것으로 질병의 기전연구와 신약개발의 패러다임을 바꿀 수 있는 기술로 여겨지고 있다. 현재까지 무수히 많은 종류의 질환 모델링에 관한 결과가 보고되었고, 특히 신경계질환은 일반적인 방법으로는 환자의 표현형이 나타나는 세포를 확보하기 어렵기 때문에 리프로그래밍을 이용한 질환모델링에 대한 관심이 높다16).
(2) 연구개발 투자 현황
미국은 2012년에 National Bioeconomy Blueprint를 통해 iPSC분야를 중점과제로 지정하였고, 캘리포니아 재생의료기구(CIRM)는 2017년까지 30억 달러의 예산을 줄기세포에 투자하기로 하였다. 일본은 ʻ일본의료연구개발기구ʼ를 2015년에 발족하여 재생의료를 포함한 분야에서 정부 R&D 예산을 관리하기로 하였으며, ʻ재생의료 실현화 하이웨이ʼ를 통해 2015년에 178억 엔을 투자한다. 중국정부는 2011년 ʻ줄기세포연구 국가지도조율위원회ʼ를 설립하여 이를 연구개발의 컨트롤타워로 삼고, 5개년 계획(2011~2015)을 통해 30억 위안을 지원한다. 유럽은 줄기세포‧재생의료 연구를 2014년부터 ʻHorizon 2020ʼ으로 통합하여 지원한다.
(3) 관련 산업현황
글로벌 줄기세포 시장은 2011년 기준 105.5억 달러에서 2018년 236.6억 달러의 규모로 연평균 12.3%의 성장률을 보일 것으로 전망하고 있다. 2011년 기준으로 세포의 확보(32.2%)와, 세포의 생산(28.4%), 동결 보존(25.3%), 증식배양(14.2%)의 기술 순으로 시장을 배분하고 있으며, 비율은 2018년까지 유사하게 유지될 것으로 전망하고 있다.

출처 : 생명공학정책연구센터(원본출처: Transparency Market Research, Stem Cells Market(2012))
[그림 4-1-6] 글로벌 줄기세포 기술 분야별 시장 현황 및 전망(단위: 억 달러)
(가) 리프로그래밍 및 질환 모델링, 유전자 치료기술 개발
2014년 고려대 유승권 교수팀은 유전물질 없이 저분자 물질만을 이용하여 iPSC를 확립할 수 있음17)을 보여주었고, 동국대 김종필 교수팀은 리프로그래밍에 전자기파를 이용하여 효율을 증진시키는 새로운 방법18)을 고안하였다. 기초과학지원연구원의 김영혜 박사는 신경줄기세포를 3차원적으로 배양하여 알츠하이머병을 최초로 모델링하는 결과19)를 보고하였다. 연세대학교 김동욱 교수팀과 IBS 김진수 교수팀은 혈우병환자의 iPSC를 제작하고 Crispr/Cas9으로 교정하여 치료하는 결과20)를 발표하였다.
(나) 줄기세포 치료제 개발 및 인프라 확충
2014년 차바이오엔디오스텍의 동종배아줄기세포유래 망막색소상피세포치료제는 식품의약품안전처로부터 개발단계 희귀의약품으로 지정받았고 루게릭병의 치료제로 개발된 코아스템의 ʻ뉴로나타-알주ʼ가 시판허가를 획득하였다.
국립보건연구원은 오송첨단의료복합단지에 ʻ국립줄기세포‧재생센터ʼ를 설립하여 2015년 완공 예정이며, 줄기세포주 등록제 시행, 국가줄기세포은행(2012년 10월 개소) 운영, 핵심연구지원시설 확보, GMP 컨소시엄 구축, 줄기세포 임상연구 관리를 추진하고 있다.
(2) 연구개발 투자 현황
정부는 2012년부터 줄기세포 연구비를 대폭 증액하여 2015년까지 투자를 지속하고 있다. 분야별로는 원천기술 확보(51.8%), 체계적 임상연구(26.9%), 인프라 구축(18.9%), 생명윤리(2.4%)로 투자하여 집중적인 원천기술개발과 실용화연구를 동시에 진행하고 있다.
[표 4-1-8] 줄기세포 정부 R&D 투자 동향
(단위 : 백만원)
|
부처 |
2012 |
2013 |
2014 |
2015 (계획) |
연평균 증가율(%) |
|
미래창조과학부 |
42,687 |
45,779 |
48,228 |
48,950 |
3.5 |
|
교육부 |
5,786 |
7,699 |
8,203 |
7,926 |
8.2 |
|
농림축산식품부 |
5,465 |
5,772 |
7,201 |
5,126 |
-1.6 |
|
산업통상자원부 |
1,425 |
1,680 |
2,400 |
2,400 |
13.9 |
|
보건복지부 |
40,827 |
44,830 |
46,918 |
49,468 |
4.9 |
|
식품의약품안전처 |
1,860 |
2,224 |
2,320 |
2,350 |
6.0 |
|
합계 |
98,050 |
107,984 |
115,090 |
116,220 |
4.3 |
출처 : 2013, 2014, 2105년도 줄기세포시행계획 종합

출처 : 2013, 2014, 2105년도 줄기세포시행계획
[그림 4-1-8] 2015년 분야별 정부 R&D 투자계획
특히 2015년 바이오헬스 미래 신산업 육성 전략을 통하여, 바이오산업을 2020년 이후 우리나라의 성장 동력으로 육성하기 위한 전략을 수립하였는데, 이중 바이오의약품 부분에서 줄기세포와 유전자치료제 분야가 선정되어 향후 집중적으로 육성될 전망이다.
위와 같은 투자에 대한 전략적 운영을 위하여 미래부에서는 ʻ줄기세포 원천기술 확보 촉진지원사업(KoNSCRT, http://konscrt.bioin.or.kr)ʼ을, 복지부에서는 ʻ글로벌 줄기세포‧재생의료 연구개발촉진센터(GSRAC, http://www.gsrac.org)사업ʼ을 추진하여 R&D 정책‧기획을 강화하기 위한 사업을 운영하고 있다.
(3) 국내 산업현황
국내 줄기세포치료제의 경우 파미셀의 ʻ하티셀그램-AMIʼ이 세계최초로 품목허가를 획득한 이후 메디포스트의 ʻ카티스템ʼ, 안트로젠의 ʻ큐피스템ʼ, 코아스템의 ʻ뉴로나타- 알주ʼ가 허가를 받아 시판되고 있다.
현재 46건의 줄기세포 치료제가 임상시험이 승인되었고, 이 중 25건이 진행 중에 있다(2014.11.기준). 세포기원별로는 동종세포가 26건으로 가장 많으며, 세포유래별로는 지방유래줄기세포가 16건으로 가장 많이 승인 받았다.
라. 발전 전망
비록 일본의 iPSC유래 RPE 세포의 임상시험이 중단되기는 했지만, 만능성 줄기세포를 이용한 세포치료제의 개발은 지속적으로 이루어질 것으로 전망된다. 특히 향후에는 단일세포가 아닌 오가노이드형태의 세포/조직치료제가 활성화될 가능성이 높다. Liver-bud를 개발한 일본의 연구팀은 주입식 세포치료제를 개발하기 위한 시스템을 개발하고 있는데, 이식한 세포의 생착과 기능회복이라는 측면에서 장점이 있는 것으로 여겨진다.
우리나라는 줄기세포 치료제 개발에 있어 성체줄기세포를 이용하여 제일 먼저 상업화에 성공한 경험을 가지고 있지만 리프로그래밍 및 만능성 줄기세포를 이용한 세포치료제의 개발은 안전성의 확보요구로 상업화까지는 시간이 더 필요할 것으로 생각된다. 때문에 우리나라의 경우 성체줄기세포 중심의 재생의학적 치료제 상업화가 성공할 가능성이 높을 것으로 보인다. 하지만 국제적인 기준을 충족 할 수 있는 연구 개발이 요구되고 있는 상황이며, 장기적으로는 유도만능줄기세포 유래의 세포를 치료제로 활용하기 위하여 현시점에서 분화세포 및 조직을 안전하고 안정적으로 확보하기 위한 연구개발이 집중적으로 이루어져야 할 필요가 있다.
리프로그래밍을 이용한 환자의 in vitro 질환 모델링은 의생명과학연구의 패러다임을 전환시킬 것으로 기대되는 만큼 질환의 기전을 분석하는 기초연구뿐만 아니라 신약개발 분야에서 그 활용이 크게 기대되고 있다. 또한 국외의 흐름에 뒤처지지 않기 위해 줄기세포 분야뿐만 아니라 관련 생물학 분야 전반에서 이 기술을 적극 활용할 수 있는 정책적 지원이 필요하다.
현재까지의 세포생물학은 2차원적인 in vitro 배양환경을 기반으로 하였지만 향후에는 오가노이드와 같은 3차원적 조직을 중심으로 전환될 것으로 전망된다. 인체의 모든 세포와 조직이 3차원적인 환경에 놓여 있다는 점을 고려하면 향후 미래 연구의 방향으로써 세포체학은 당연할 것이다. 3차원적인 조직이나 기관의 생산은 재생의학적 치료의 새로운 차원을 제시할 것으로 전망하며, 화합물 혹은 생물학적 치료제를 개발하는데 소요되는 동물실험의 최소화와 개인 맞춤형 치료제를 개발하는데 효과적으로 활용할 수 있을 것이다. 또한 새로운 차원의 세포체학 연구와 개발을 위하여 줄기세포학이나 세포생물학 뿐만 아니라 수학, 전산학, 조직공학 등의 다양한 학문들과 융합적인 연구가 필요하다.
세포체학은 미래의 성장동력으로 기대되는 바이오산업의 핵심 분야로써 최근의 연구개발 흐름을 살펴보았을 때 재생의학적 치료제뿐만 아니라 화합물 및 생물제제 기반의 치료제 개발의 전환기를 촉발할 것으로 기대되고 있다.
창의적이고 선도적인 과학적 연구와 이를 바탕으로 한 산업적 응용을 위해서 정부뿐만 아니라 기업체의 적극적인 투자와 참여가 촉진될 수 있기를 기대한다.
4. 대사체
가. 대사체학(Metabolomics) 연구의 개론
오믹스(omics)는 생물학적 복잡성을 조절하고 해석하려는 전체론적 접근법이며, 이 방법들은 유전체학, 전사체학, 단백체학 및 대사체학 등을 포함하고 있다. 대사체학은 시스템 생물학 즉, 세포, 조직, 장기 및 생명체 내의 여러 옴들(omes), 즉 유전체, 전사체, 단백제들의 변화들이 반영된 표현형인 저분자 대사체(분자량<1,500 Da)들의 변화를 모니터링함으로써 복잡한 생명체의 구조를 구명하려는 연구 분야이다.
대사(metabolism)의 의미는 그리스어로 ʻ변화하다ʼ이며, 최초의 대사체학 연구는 고대시대 당뇨진단을 뇨(尿)의 색깔, 맛, 냄새의 변화로 대사체의 변화를 측정한 것이다. 1960년 후반 크로마토그래피를 이용한 분리 및 정제 기술의 발전으로 대사체들의 검출이 가능하게 되면서 본격화되기 시작했으며, 1970년대 Horning 등이 대사체의 변화가 특정 상태에 있는 생물체의 전체 프로파일을 결정한다는 개념을 확립하였다. Robison 및 Pauling 등은 비타민 B6를 투여한 후, 뇨(尿) 시료에서 복잡한 크로마토그래피 패턴들을 분석하고, 이러한 패턴이 뇨(尿) 시료 내에 유용한 정보를 가진 수많은 화합물들을 함유하고 있다고 발표하면서 발전되었다. 1971년 PNAS에“Quantitative Analysis of Urine Vapor and Breath by Gas-Liquid Partition Chromatographyʼʼ를 발표한 이후, 생체시료 내 대사체들의 정량적 패턴들을 분석함으로써 질병 진단, 질환상태 및 연령에 따른 생체 변화 등에 대한 논문들이 다수 발표되었으며 이러한 생체 시료 내에서의 분석은 적은 비용으로 많은 정보를 얻을 수 있으며, 또한 생리 상태에 따른 대사물의 측정을 가능하게 하였다. 1990년대 Oliver SG, Winson MK, Kell DB 및 Baganz F 등이 효모의 기능을 체계적으로 분석함으로써 처음으로 대사체학이란 용어를 사용하였다.21)
대사체들의 변화를 측정하기 위한 방법으로는 Metabolic profiling, fingerprinting, footprinting 등이 있다. Metabolic profiling은 amino acids, carbohydrates 등 특정 대사과정에서의 변화를 정성 및 정량적으로 측정하는 표적대사체분석(targeted analysis)이다. Metabolic fingerprinting은 특정 조건하에서 대사체들의 패턴 거동을 측정하는 비표적대사체 분석(untargeted analysis)이다. Metabolic footprinting은 미생물, 분자생물학의 연구 분야에 적용되는 것으로서 cell, 미생물 등에서의 대사과정을 확인하는 방법이다.

[그림 4-1-9] 대사체학의 개념 및 연구 절차
대사체학의 연구는 2000년에 Imperial College의 Nicholson 교수팀이 NMR을 활용한 생체시료내의 대사체 변화를 연구한 논문에서 ʻʻmetabonomicsʼʼ라는 용어를 사용하면서 생명공학 연구 분야에 적용되기 시작했다. 2004년에는 전세계 학자들이 “Metabolomics Societyʼʼ를 결성하여 대사체학의 연구에 다양한 생화학적 방법 및 생명정보학 등을 적용한 연구가 활성화되는 계기가 되었다. 2007년 캐나다의 알버타대 Wishart 교수는 2,500개의 대사체, 1,200개의 약물 및 3,500개의 식품 성분들을 확인한 “Human Metabolome Projectʼʼ라는 최초의 인간대사체군을 발표하였다.
최근 대사체학은 다양한 연구 분야에 활용 되고 있다. 건강 및 질병 진단에 있어서 생체지표 선정, 시스템 생물학, 동위원소 이성질체를 활용한 pathway discovery, 신약개발, 그리고 식물, 미생물, 영양학 및 환경 대사체학 등의 다양한 분야에 그 적용 범위를 넓혀가고 있다.
이러한 대사체학 연구는 주로 미국, 유럽, 일본 등 선진국 위주로 진행되어왔고, 지난 10년간 대사체학 연구의 논문 발표 횟수가 꾸준히 증가하고 있는 추세이다.

출처 : Web of Science
[그림 4-1-10] 연도별 대사체학 관련 SCI급 논문 발표 수
국가별 대사체학 연구는 미국이 주도적으로 연구를 진행하고 있으며, 최근 중국에서는 한약연구에 대사체학을 활용하는 추세로 진행되고 있으며 우리나라 역시 대사체학 연구가 크게 증가하고 있는 상황이다.

출처 : Web of Science
[그림 4-1-11] 국가별 대사체학 관련 SCI급 논문 발표 수
나. 대사체학 (Metabolomics) 연구의 필요성
대사체학 연구 분야는 다양한 유전적, 생리적 또는 환경적 조건에서 변화하는 생체 내 저분자량 대사물질군의 구성과 농도를 분석하고 해석함으로써 생명현상의 변화 원인을 규명해 나가는 총체적 연구 분야이다.
(1) 질병 등과 같은 다양한 조건에서 변화하는 생물체의 표현형(phenotype)을 가장 잘 반영하는 것은 생체 내에 존재하는 대사체(metabolite) 및 대사체군(metabolome)이며,
(2) 생체 내에 존재하는 대사체를 분석하는 대사체학 및 이들과 생체내의 거대분자 (유전자 및 단백질 등)들과의 상호 관련성 연구는 특정질환내의 대사경로와 인체질환 기전 규명에 매우 중요하고,
(3) 질병의 조기진단용 biomarker 연구에 있어서의 대사체학은 대단히 유용하다고 알려져 있다.
다. 해외 연구 동향
(1) Disease Biomarker 분야
스페인 José Luis Gómez-Ariza 교수팀은 알츠하이머 환자들의 serum에서 phospholipid 대사과정을 연구하였다. 전체적인 대사체들을 UPLC-MS를 이용하여 스크리닝 후에 질병 특이적인 대사체들을 분석하였다. Phospholipases가 활성화됨에 따라 리소 인지질의 동화작용이 증가 하며, phospholipids와 oxidative stress 구조에서 포화/불포화 지방산 비율이 달라짐을 확인하였다.

출처 : J. Proteomics, 2014
[그림 4-1-12] UPLC-ESI-QTOF-MS를 이용해 확인한 Serum sample의 Phospholipid profiles (A), UPLC-ICP-MS (B)과 PLS-DA model 적용 후 알츠하이머 환자군과 정상군에서의 대사패턴 차이 도출
영국 Kingʼs College London의 Christin Stegemann팀은 MS를 이용하여 심혈관 질환 환자들의 plasma 시료에서 8 그룹으로 분류화 된 135종의 lipid species profiling한 결과 여러 변수들에 따라 특징지어지는 lipid metabolites network를 확인하였다. 이 연구는 심혈관질환 cohort를 실시한 결과로서 lipid metabolomics를 활용한 조기 진단의 가능성을 확인하였다.

출처 : American Heart Association, Inc, 2014
[그림 4-1-13] 심혈관 질환 환자들의 8 lipid group Manhattan plot 과 lipid 네트워크 분석
(2) Pharmacometabolomics
독일 Stephan Weidinger 교수팀은 IgE에 특이적인 천식치료제인 Omalizumab를 아토피 피부염 환자에게 투여하였을 때의 효능을 관찰하였다. 투여 결과 filaggrin 변형이 줄어들었고 lipid metabolite에서 다양한 인지질의 양이 높아짐을 확인하였다. 이로써 Omalizumab을 통해 아토피 피부염을 치료할 수 있음을 시사하였다.

출처 : J. Allergy, 2013
[그림 4-1-14] 실험 과정을 도식화한 schematic diagram
미국 Colorado State 대학의 John T Belisle팀은 LC-MS를 이용하여 폐결핵 환자의 urine 샘플을 측정하여 임상치료 동안에 약의 효과 및 metabolites이 어떠한 변화 양상을 보이는지 관찰하였다. 이러한 연구를 활용하여 기존 치료제에 내성을 나타내는 환자들을 위한 새로운 의약품 개발 가능성을 얻었다.

출처 : BMC Infectious Diseases. 2014
[그림 4-1-15] 결핵치료제를 투여하기 시작하였을 때 환자군에서 PCA 예측 결과
(3) Environmental Metabolomics 분야
일본의 Nagoya 대학의 Jun Kikuchi 교수팀은 계절 변화에 따른 Sargassum fusiforme(톳)의 극성물질 및 금속, 주요 물질 및 isotopic 비율을 포함한 organic과 inorganic chemical의 차이를 관찰하였다. 뿐만 아니라 multivariate curve를 이용하여 metabolites 사이의 관계를 확인하였다. 이런 총체적인 분석 접근은 환경 및 유전자 분야에서 다양한 chemical data에 적용할 수 있는 방법을 보여주었다.

출처 : Anal. Chem.. 2014
[그림 4-1-16] 환경 분야에서의 새로운 분석 발전 개념
미국 Emory University의 Dean P. Jones 교수팀은 카드뮴에 노출되었을 때 쥐의 간 미토콘드리아의 metabolome과 산화환원 proteome을 관찰하여 toxicological mechanisms과의 관계를 확인하였다. 이 연구를 통해 대사체와 단백질체를 접목하여 독성평가를 가능하게 하였다.

출처 : TOXICOLOGICAL SCIENCES, 2014
[그림 4-1-17] 미토콘드리아에서 카드뮴에 노출되었을 때 영향 받는 경로
(4) Food Metabolomics 분야
네덜란드의 Daniel Granato 교수팀은 전 세계에서 많이 소비되고 있는 오렌지주스에서 얻어진 sensory, chemical, antioxidant activity data에서 bioinformatics를 활용한 data mining을 하였다. 뿐만 아니라 식품 분야에서 사용되어지고 있는 여러 기술들을 이용하여 효과적인 chemometric 분석을 위한 guideline을 제시하였다.

출처 : Institute of Food Technologist, 2014
[그림 4-1-18] 오렌지 쥬스에서의 지정학적 기원, 생물학적 기능과 감각특성을 평가하기 위한 전제적인 분석 관점
이스라엘 Aaron Fait 교수팀은 Cabernet Sauvignon과 Shiraz 와인을 제조하는 데 사용되는 포도껍질에서 GC-MS와 LC-MS를 이용하여 대사체를 분석하였고, RNA sequence와 비교하여 대사체들을 profiling 하였다. 그 결과 phenylpropanoid pathway에 관련된 유전자의 전사가 증가되어졌음을 확인하였다.

출처 : BMC Plant Biology, 2014
[그림 4-1-19] 와인 품종에 따른 포도 껍질의 전체적인 대사체 차이 비교
(5) Nutrition Metabolomics 분야
독일 Thomas Clavel 연구팀은 FT-IR spectroscopy와 MS를 이용하여 쥐에게 탄수화물 또는 고지방 식이를 진행시 맹장세균에 어떤 변화양상이 보이는지 관찰하였다. 그 결과 호르몬, anti-microbial networks, bile acid와 bilirubin metabolism이 변화되었으며 amino acid 및 simple sugar metabolism의 차이도 관찰하였다. 고지방 식단이 박테리아의 생존에 영향을 주는 것으로 확인하였다.

출처 : The ISME Journal, 2014
[그림 4-1-20] 식단에 따른 박테리아의 다양성 및 구성의 변화
캐나다 Calgary 대학의 Jane Shearer 연구팀은 쥐의 serum에서, NMR을 이용하여 고지방 식단과 함께 커피를 먹게 했을 때 어떠한 metabolites 차이가 나타나는지 분석하였다. 연구 결과는 고지방 식이 습관이 야기할 수 있는 여러 가지 생체 내 metabolites 변화가 커피의 소비와 어떠한 영향이 있는지 확인하였다.

출처 : J. Nutritional Biochemistry, 2014
[그림 4-1-21] 식단에 따른 박테리아의 구성 변화
(6) Statistics analysis Metabolomics 분야
네덜란드 M. M. W. B. Hendriks 연구팀은 대사체 data를 분석할 때 일도량 분석과 다변량 분석 결과의 차이를 설명하였고, PCA와 PLS-DA 분석 방법을 어떻게 적용할 수 있는지 제시하였다. 대사체 변화를 분석함에 있어 data의 분포 특성을 고려하여 적절한 분석 방법이 적용되어야 함을 확인하였다.

출처 : Metabolomics, 2014
[그림 4-1-22] 일도량 분석과 다변량 분석에서 신뢰구간에 따른 차이 비교
독일 Georg-August-University 대학의 Peter Meinicke 교수팀은 MS 기반의 metabolomics와 proteomics, RNA sequence 기반의 transcriptomics를 융합하는 분석 방법을 개발하였다. 이러한 meta-analysis는 서로 다른 data sets 간의 상관관계를 보여줄 수 있을 뿐만 아니라, key pathway를 구별할 수 있는 multiple analyses의 결과를 요약하는 강력한 도구를 제시하였다.

출처 : PLOS ONE, 2014
[그림 4-1-23] metabolomics와 transcriptomics에서 정규화 히스토그램
(7) Isotope flux analysis 분야
캐나다 Liang Li 연구팀은 isotope labled LC-MS data를 처리하는 과정에서 IsoMS(MS spectral 특징을 통해 chemical labeling 하는 software)를 실행하는 방법을 개발하였다. Dansyl labeled metabolites를 비롯하여 커피를 마시기 전 후의 인체 소변 시료에 적용하여 통계 분석적 차이를 확인 하였다.

출처 : Analytical Chemistry, 2014
[그림 4-1-24] IsoMS data 처리 과정
일본 Makoto Suematsu 연구팀은 CE-MS를 활용, 쥐 뇌에서 포도당 대사를 관찰하였다. 13C6-glucose가 뇌에서 lactate와 glutamate pathway로 대사되는 정도를 확인하였다. 이러한 연구는 뇌에서 13C labeled glucose로 부터의 탄소 흐름을 보여줄 뿐만 아니라 세포 특이적인 metabolic mechanisms을 묘사 할 수 있게 되었다.

출처 : Analytical Chemistry, 2014
[그림 4-1-25] 뇌에서 13C가 대사되는 pathway
(8) Sample preparation 및 extraction 분야
독일 Ann Van Loey 연구팀은 색깔이 다른 당근을 전 처리 할 때 높은 압력과 온도 및 휘발성 물질들이 대사체에 영향을 주는 것을 확인하였다. 전처리 조건이 다른 당근을 GC-MS 분석을 통해 얻은 data를 MVDA에 적용하였다. 이 연구는 식품 분석에 있어서, 전처리 조건이 잠재적인 biomarker를 찾는데 영향을 미치는지를 확인하였다.

출처 : Food Chemistry, 2014
[그림 4-1-26] 서로 다른 전처리 조건에서 분석한 PLS-DA plots
스페인 Santiago de Compostela 대학의 Marta Lores 교수팀은 SPME-GC/MS를 이용하여 화장품에 있는 미생물의 휘발성 유기화합물을 분석하는 방법을 개발하였다. 이러한 연구는 미생물의 kinetic study에 응용되어 오염 진행 과정을 모니터링 할 수 있음을 확인하였다.

출처 : Anal. Methods, 2013
[그림 4-1-27] 핸드크림에 P. fluorescens을 배양하였을 때 분석되는 휘발성 물질의 TIC와 extracted ion chromatograms
라. 국내 현황
(1) Disease Biomarker 분야
(가) 서울대학교
방광암 환자의 urine에서 high-performance liquid chromatography-quadrupole time-of-flight mass spectrometry (HPLC-QTOF/MS)를 활용 암환자군과 정상군의 대사체간 차이를 분석하였다. 특히 carnitine transferase, pyruvate dehydrogenase complex expression 과정들이 정상군과 다르게 나타남을 확인하였다. 또한 OPLS-DA 분석을 통해 두 군간의 대사체 차이를 확인하였으며, 이를 통해 진단 혹은 환자의 생존율 분석에 사용할 수 있음을 보였다.

출처 : Oncotarget, 2014
[그림 4-1-28] OPLS-DA score plots and 3D scatter plots, Box plots of the levels of potential metabolomic markers
(나) 고려대학교
류마티즘 관절염 환자들의 관절액(synovial fluid)을 gas chromatography/ time-of-flight mass spectrometry(GC-TOF/MS)를 통해 분석하였다. OPLS-DA등의 통계분석법을 통해 분석한 결과 citrulline, succinate, glutamine, octadecanol, isopalmitic acid, glycerol 등이 biomarker가 될 수 있음을 확인하였다.

출처 : PLoS One, 2014
[그림 4-1-29] Schematic comparison of the primary metabolisms of RA vs. non-RA groups
(2) Pharmacometabolomics
(가) 성균관 대학교
GC-MS를 활용하여 fluoxetine과 imipramine을 우울증을 유도한 쥐에 투여한 후, 해마의 대사체 변이를 확인하였다. 약물의 투여에 따라 amino acid metabolism, energy metabolism, adenosine receptors, neurotransmitters 등에 영향을 끼침을 확인하였고, fluoxetine과 imipramine에 대한 biomarker로서 myo-inositol과 lysine, oleic acid을 예상하였다.

출처 : Sci Rep., 2015
[그림 4-1-30] Metabolic pathways affected by CMS and/or sub-chronic treatment with fluoxetine and imipramine
(3) Environmental Metabolomics 분야
(가) 부산대학교
NMR을 이용한, 쥐의 urine에서 카드늄 복용에 따른 변화를 관찰하였다. 고농도의 카드늄에 노출된 쥐의 경우 정상군에 비해 주로 cysteine, serine, methionine, glutamate을 포함하는 glutathione 생합성 경로에 관련된 대사체들의 감소를 확인하였다.

출처 : Toxicol Environ Health A., 2014
[그림 4-1-31] Perturbed metabolic pathways in response to CdCl2-induced nephrotoxicity
(나) 한국기초과학지원연구원
NMR, GC−MS, UPLC/QTRAP−MS를 이용하여 우엉뿌리에서의 copper stress에 대한 대사체 변이를 관찰하였다.
출처 : Sci Rep., 2015
[그림 4-1-32] Quantification of identified metabolites
(4) Food Metabolomics 분야
(가) 한국식품연구원
지리, 날씨, 재배법 등과 같은 환경적 요인에 의해 변화하는 녹차(Camellia sinensis) 대사체를 분석하였고, 국가 및 도시별로 대사체의 양이 차이를 보임을 확인하였으며, 이러한 대사체학적 접근이 제품 품질평가에 도움을 줄 것으로 예상하였다.

출처 : Food Chem, 2015
[그림 4-1-33] PCA and OPLS-DA plot in different region
(나) 고려대학교
GC-QTOF-MS와 UPLC-QTOF-MS를 이용하여 블루베리(Vaccinium spp.)의 종간 특이적 대사체 차이를 분석할 결과 종간의 대사체 함량 차이 및 항산화 물질의 함유 차이를 비교하였다.

출처 : J Agric Food Chem, 2014
[그림 4-1-34] PLS-DA score plots of metabolite profiles in three blueberry species
(5) Sample preparation 및 extraction 분야
(가) 고려대학교
일반적으로 Gram-positive strict anaerobe인 Clostridium acetobutylicum의 전처리는 혐기성 환경에서 분석되어 왔는데, 호기성 조건에서 전처리 후와 비교하여 두 조건이 차이가 없음을 확인하였다.

출처 : Biotechnol Bioeng, 2014
[그림 4-1-35] Comparison of the atmospheric and anaerobic processing of metabolitesamples of intracellular metabolites of C. acetobutylicum in the score plot of the PCA
(나) 국민대학교
Human blood plasma의 전처리 과정 방법들을 GC-TOF-MS, LTQ-MS를 이용하여 비교, 분석하였다.

출처 : Anal Bioanal Chem, 2014
[그림 4-1-36] Comparative evaluation of five different extraction methods
라. 발전 과제(전망)
대사체학 연구의 기본은 크게 세 가지 분야로 발전할 가능성이 있다.
(1) 시료 채취 시 각 연구 주제에 알맞은 시료 채취 절차의 표준화, 보관, 운송 등에 대한 표준화 절차가 필요하며,
(2) 시료분석 단계에서 시료 전처리 방법 및 초정밀 기기분석법의 표준화
(3) 대용량의 데이터를 단순화하고 상관성을 찾을 수 있는 data mining 기술의 발전과 통계기법의 발전 등의 가능성이 있다.
대사체학 연구를 통해 얻어진 결과들을 기존의 생화학적인 이론에 적용하여 질병의 원인 및 기전을 구명함으로써 맞춤의학 발전이 활발해질 전망이며, Metabolic fingerprinting을 통한 원산지 판별 및 GMO 식품의 위해도 평가 연구 및 미량의 환경유해물질 노출에 의한 질환 연구 등에 적용 가능성이 있다. 또한 stable isotope를 이용한 metabolic flux연구는 질병의 원인 규명을 더욱 명확히 설명할 수 있을 것이며, 또한 환경에 노출되었을 경우 유해인자 추적 연구에 활용이 될 것이다.
5. 시스템생물
가. 시스템생물학의 개요
시스템생물학(Systems biology)은 시스템이론을 생명과학에 적용하여 생체 구성인자간의 상호관계와 상호작용의 원리를 이해하고 나아가 동역학적 특성을 구명함으로써 그 속에 잠재된 지배원리를 시스템 차원에서 이해하는 학제 간 신기술 융합분야로, 시스템생물학의 본질은 개별요소가 독립적으로 존재할 때는 나타나지 않지만 집단, 즉 시스템을 형성하여 주변의 다른 요소와 상호작용을 할 때 비로소 표출되는“창발적 속성(Emergent property)ʼʼ을 이해하는 것이다. 다시 말해, 기존의 생물학이 생물체의 구성요소 하나하나를 분해하여 유전자 혹은 단백질의 개별적 기능을 알아내는 환원주의적(Reductionism) 접근방식이었다면, 시스템생물학은 생명현상을 총괄적이고 체계적으로 분석하기 위한 전체론적(Holism)인 관점의 접근방식이라 할 수 있다.
시스템생물학이란 개념은 이미 오래 전부터 존재해왔으나, 시스템의 구성인자에 관한 정보획득과정의 어려움 때문에 이런 시스템생물학적 접근법이 본격적으로 사용된 것은 21세기에 들어와서라고 볼 수 있다. 이는 복잡한 생물체를 단순화된 실험적 재현의 틀 안에서 이해하려는 기존 환원주의적 접근법의 한계성에 대한 인식과 더불어, 그 동안 축적되어온 소위 오믹스(omics)로 표현되는 다층적인 대량의 데이터 발굴(high-throughput, HT)과 컴퓨팅 능력의 조합이 시스템적 접근을 가능하게 한 것이다.

[그림 4-1-37] 융합연구를 통한 시스템생물학 연구
시스템생물학에서 기본적으로 주장하는 것은“전체기능체계(whole functional system)는 그것을 이루는 구성인자들 사이의 상호관계를 통해 이해할 수 있고, 역으로 각각의 구성인자들의 기능은 전체기능체계 안에서 다른 구성인자들과의 관계성에 의해 이해할 수 있다.ʼʼ는 것이다. 따라서 일반적으로 시스템생물학에서 던지는 질문들은 다음과 같다.
(1) 생체 네트워크의 기본적인 구조와 특성들은 무엇인가?
(2) 생체 시스템은 다양한 환경 안에서 시간에 따라 어떻게 작동하는가?
(3) 생체 시스템은 어떻게 안정성과 견고성을 유지하는가?
(4) 어떻게 하면 생체 시스템을 우리가 원하는 바람직한 특성을 갖도록 변형하거나 구현할 수 있는가?
2000년대 초부터 일본과 미국을 중심으로 새롭게 시작된 시스템생물학은 불과 10여년 사이에 세계적 학술대회와 주요 연구기관 및 연구그룹을 중심으로 그 중요도에 대한 인식이 급격히 확산되었으며, Pubmed에 등록된 시스템생물학관련 연구결과를 보면, 과거 3년간 발표된 논문 수(11,319건)가 전체 누적 논문 수(24,044편)의 절반(47.1%)에 육박하고, 특히 2014년에는 한 해 동안 출판된 시스템생물학관련 논문 수는 5,000편에 달할 만큼 관련연구가 전 세계적으로 급격히 증가하고 있음을 알 수 있다.

[그림 4-1-38] 시스템생물학 관련 논문의 연도별 발표 현황
시스템생물학 연구분야는 최근 급격히 성장하여 미생물을 대상으로 새로운 유전자 회로 설계 및 변경과 같은 엔지니어링 기술을 이용한 실용적인 목적을 추구하는 합성생물학(synthetic biology)의 발전을 아울러 가져왔고, 최근에는 다세포 동식물체를 대상으로 유전자의 신기능 예측 및 효과적인 치료제 개발을 목표로 활발한 연구가 진행되고 있다.
나. 해외 동향
시스템생물학은 선진국에서도 2000년대에 들어와서야 새롭게 연구가 시작되었지만, 현재는 선진국을 중심으로 매우 활발한 연구가 진행되고 있으며, 그 중요도에 대한 인식이 급격히 확산되고 있다. 포스트 게놈시대에 축적된 방대한 데이터와 기술의 진보로 향후 인간의 질병 메카니즘에 대한 새로운 이해와 체계적인 신약후보물질 발굴에 중요한 역할을 하게 될 것으로 판단된다.
시스템생물학은 최근 개인수준의 인식을 넘어서 연구기관과 대학, 그리고 국가주도의 연구프로그램으로 확대되고 있다.
일본에서는 Systems Biology Institute(SBI)22)가 설립되었고, ERATO-SORST Kitano Symbiotic Systems Project23)를 통해 시스템생물학이 정립된 이후 여러 생명체의 모델개발이 이루어질 때를 대비하여 세계적 표준안을 만듦으로써 기술적 우위를 선점하기 위한 투자와 노력을 경주하였다. 특히, 2010년부터 GARUDA를 통해 시스템생물학 소프트웨어개발을 위한 플랫폼을 제공하여 GUI, API를 통합하고 소프트웨어 간 데이터 공유를 위한 노력을 기울이고 있다.
미국은 댈러스의 AfCS(Allliance for Cellular Signalling), 시애틀의 시스템생물학 연구소(Institute for Systems Biology, ISB), 버클리의 분자과학연구소(Molecular Sciences Institute) 등을 설립하고, 시스템생물학 연구를 주도해 나가기 위한 투자를 해오고 있다. AfCS는 미국과 영국의 7개 연구소가 공동으로 2000년 설립하였고, 노벨상 수상자인 Alfred Gilman을 회장으로 한 운영이사회가 이끌고 있다. ISB도 2000년 초 유전자 염기서열 자동분석법의 개발자 가운데 한 사람인 Leroy Hood가 Reudi Aebersold, Alan Aderem과 함께 설립하여 현재는 전산, 소프트웨어, 데이터베이스, 생물학, 물리학, 화학, 수학, 의학, 유전학 등 다양한 분야를 전공한 300여명의 전문가들이 모여서 연구하고 있으며, 시스템생물학 관련 우수 연구성과를 산출하고 있다. 버클리 분자과학연구소는 1996년 노벨상 수상자인 Sidney Brenner에 의해 설립되어 생물정보학과 컴퓨터 모델링을 바탕으로 한 예측 생물학(Predictive biology)을 선도하고 있다.
유럽에서는 독일이 가장 먼저 정부 차원의 시스템생물학 연구과제를 주도하고 있으며 2003년부터 매년 막대한 연구비를 투자하고 있고24), 스위스는 스위스 정부 역대 가장 큰 연구단(SystemsX)을 구성하여 시스템생물학 연구를 지원하고 있다. 영국 또한 다양한 시스템생물학 연구주제를 바탕으로 여러 정부기관(BBSRC, EPSRC 등)과 사설재단의 연구비를 수주하여 연구해 오고 있다.
[표 4-1-9] 국외 시스템생물학 관련 주요 연구 기관 및 프로그램
|
국가 |
관련기관명 |
내용 및 URL |
|
미국 |
Institute for Systems Biology |
2000년 미국 시애틀에 설립됨. 다수의 생물학자, 공학자, 전산학자, 물리학자들이 유전체학, 단백체학 기법을 통해 당뇨병, 헌팅턴병, 프리온병 등을 타겟으로 시스템생물학의 선도적인 연구를 수행하고 있음. 또한 cytoscape, Systems Biology Markup Language 등의 시스템생물학 연구를 위한 소프트웨어 개발에 앞장서고 있음. (http://www.systemsbiology.org) |
|
Institute for Genomics and Systems Biology |
2006년 시카고에서 발족되었고 유전체학 연구를 토대로, 실제적인 이익의 증대를 위한 연구. 유방암, 대사성 질환 및 당뇨병, 염증성 장 질환 등에 대한 연구를 진행 (http://www.igsb.anl.gov) |
|
|
Center for Systems Biology at IGSP |
2004년에 발족. 효모와 사람의 세포주기, 식물 뿌리와 성게의 발생에 대한 연구가 진행되고 효모와 성게에서의 진화를 networking하는 연구도 진행 중임. (http://www.genome.duke.edu/centers/csb) |
|
|
Department of Systems Biology at Harvard Medical School |
2003년 설립되어 세계 최초의 본격적인 시스템생물학과를 표방하고 있으며 M. Kirschner를 중심으로 다수의 faculty를 확보하고 있음. (http://sysbio.med.harvard.edu) |
|
|
캐나다 |
Ottawa Institute of Systems Biology |
2004년 오타와에서 발족. 인간 질병에 관한 시스템 이해 및 고속 대용량 실험 테크닉 개발에 집중 (http://www.med.uottawa.ca/oisb/) |
|
독일 |
Berlin Institute for Medical Systems Biology at MDC |
2008년 본격적 연구 시작. 전사 조절 메커니즘, 신호전달계, 단백질-단백질 결합 네트워크에 관한 연구가 주로 이루어지고 있음. (http://www.mdc-berlin.de/en/bimsb) |
|
HapatoSys |
2004년 독일 정부의 대규모 지원으로 연구 시작. 해독작용, endocytosis, 철분 조절, 재생 등의 간세포 특이적 세포 활성에 대한 정량적, 총체적 이해를 목표 (http://www.hepatosys.de/en) |
|
|
룩셈부르크 |
Luxembourg Centre for Systems Biomedicine |
Institute for Systems Biology, Systems Biology Institute 등과 협력하여 난치성 질병에 관한 연구(주로 파킨슨병과 같은 신경질환과 대사질환 연구를 수행) (http://wwwen.uni.lu/lcsb) |
|
스위스 |
SystemsX.ch |
스위스 최대의 연구 과제로 기초 연구분야로 부터 학제 간 연구까지 다양한 시스템생물학 연구를 지원 (http://www.systemsx.ch) |
|
Institute of Molecular Systems Biology |
2005년 취리히에 설립됨. 생물학, 화학, 생물정보학의 연구들을 결합하는데 목적을 두고 있음. SystemsX.ch의 한 파트. (http://www.imsb.ethz.ch) |
|
|
영국 |
Manchester Centre for Integrative Systems Biology |
2005년 맨체스터 대학에서 시작. 전체 유전체를 커버하는 정량 데이터 산출을 목표로 새로운 기술 개발과 오믹스 데이터 생산에 집중. 정량적 데이터 생산과 더불어 대사과정 모델링과 데이터 통합 기술 개발 (http://www.mcisb.org) |
|
Cambridge Systems Biology Centre |
2006년 캠브리지 대학에서 시작. 세균주화성 (bacterial chemotaxis)의 생화학 회로의 시뮬레이션. 마이크로어레이 기반의 유전체학 기술, 질량분석 등 단백질체학 고속 대용량 데이타 산출 기술, 데이터 분석 기법 연구를 주도 (http://www.sysbiol.cam.ac.uk) |
|
|
일본 |
Systems Biology Institute |
2000년 일본 동경에 설립됨. Luxembourg Centre for Systems Biomedicine과 함께 파킨슨병 공동연구를 수행하고 있으며, SBI Australia를 설립하여 불임에 관한 시스템생물학 연구를 수행 (http://www.sbi.jp) |
|
말레이시아 |
INBIOSIS institute of systems biology |
다양한 오믹스 데이터를 통합하여 식물 생산량 및 체내에서 유용하게 사용되는 대사 산물의 합성과 생산 증가를 위한 유전자 변형기술 개발 (http://www.inbiosis.ukm.my) |
출처 : 2013 생명공학백서 내용 수정‧보완
최근 다양한 시스템생물학 관련 국제 학술대회가 개최되고 있는데, 국외 시스템생물학 관련 주요 학술대회를 보면, 2003년부터 정부 차원의 대규모 연구비를 투자하고 있는 독일에서 관련 학술대회가 활발하게 진행되고 있음을 볼 수 있다.
[표 4-1-10] 국외 시스템생물학 관련 주요 학술대회
|
연도 |
장소 |
내용 |
|
2013년 8월 |
Denmark |
The International Conference on Systems Biology |
|
2013년 9월 |
Nevşehir, Turkey |
Computational Biology: From Genomes to Cells and Systems |
|
2014년 4월 |
China |
Genome Assisted Biology of Crops and Model Plant Systems |
|
2014년 9월 |
Germany |
Frontiers in Fungal Systems Biology |
|
2014년 10월 |
Germany |
High-throughput Microscopy for Systems Biology |
|
2014년 11월 |
Germany |
From Functional Genomics to Systems Biology |
|
2014년 11월 |
Austraila |
The International Conference on Systems Biology |
|
2014년 11월 |
USA |
RECOMB/ISCB Conference on Regulatory and Systems Genomics |
|
2015년 2월 |
USA |
Systems Biology of Lipid Metabiolism |
|
2015년 2월 |
USA |
Computational and Systems Biology of Cancer |
|
2015년 4월 |
Japan |
Computational Biology: From Genomes to Systems |
|
2015년 6월 |
Germany |
The International Conference on Systems Biology of Human Disease(SBHD) |
|
2015년 9월 |
Switzerland |
Systems Biology of Infection Symposium |
|
2015년 11월 |
Singapore |
The International Conference on Systems Biology |
|
2015년 12월 |
UK |
Target Validation using Genomics and Informatics |
출처 : 자체자료
다. 국내 현황
국내에서는 2002년도에 시스템생물학 연구회 구성으로 그룹화, 상호연계연구, 연구대상 생체시스템의 체계적인 선정 등이 이루어지기 시작했으며, 2003년 4월 서울대 문화관에서 국내에서 처음으로 시스템생물학 국제학술대회(Seoul Symposium on Systems Biology 2003)가 개최되었다. 2003년 6월부터는 시스템생물학을 국책연구사업과제로 선정하여“시스템생물학사업단ʼʼ을 출범시켰으며 11개 세부과제를 중심으로 시스템생물학연구가 시작되었다. 2005년에 2단계 사업으로 진핵세포를 대상으로 “칼슘대사 시스템생물학연구(KOSBI)ʼʼ와 원핵세포를 대상으로 한 “대사회로분석 및 가상세포시스템연구ʼʼ가 선정되었으며, 2008년부터 3단계, 2010년부터 4단계 사업으로 이어져 연구가 마무리 되었다.
이들 연구 과제를 통해 신규 인자의 체계적 발굴, 구성인자들 간의 상호작용 계측, 네트워크 규명, 수학적 모델링, 미생물 대사회로의 정성적, 정량적 분석, 시스템재설계 기술 및 가상세포 시스템 개발 등이 이루어졌다.
또한 2009년에는 GIST에 시스템생물학연구소가 설립되어, 이화여대시스템생물학 연구소, 국가생명연구자원정보센터(KOBIC)와 함께 시스템생물학 인프라구축사업을 추진하고 있다. 이를 통해 국내 시스템생물학 연구를 위한 기반기술을 개발하고 인프라를 구축함으로써 우리나라 시스템생물학의 국제적 경쟁력 향상을 위해 노력하고 있다.
국내 시스템생물학 관련 주요 학술대회 및 학술 활동을 살펴보면, 2011년부터 한국생물정보시스템생물학회에서는 매년 Translational Bioinformatics Conference를 개최하여 유전체학, 생물정보학, 의료정보학 분야의 핵심현안에 대한 활발한 학술적 교류가 이루어지고 있다.
[표 4-1-11] 국내 시스템생물학 관련 주요 학술 대회 및 학술 활동
|
연 도 |
내 용 |
|
2002년 |
시스템생물학 연구회 구성 |
|
2003년 |
시스템생물학 사업단 시작 |
|
2003년 4월 |
서울국제심포지움 개최 |
|
2003년 5월 |
BEC(Integrated Biology of Escherichia coli) 구성 |
|
2004년 |
YSBN(Yeast Systems Biology Network) 구성 |
|
2005년 1월 |
RTKC(Receptor Tyrosin Kinase Consortium) 구성 |
|
2005년 11월 |
Electronic International Molecular Biology Network-Systems Biology(eIMBL) 설립 |
|
2006년 10월 |
시스템생물학의 대장균 관련 국제 학술대회 ʻ제3회 IECA2006ʼ 개최 |
|
2007년 11월 |
제304회 학연산 연구성과교류회(주제: 시스템생물학) |
|
2008년 11월 |
시스템 생명정보학 국제 심포지엄 (International Symposium on Systems Bioinformatics) |
|
2009년 1월 |
GIST 시스템생물학연구소 개소식 및 기념 심포지움 개최 |
|
2009년 1월 |
제2회 한독심포지움(ʻ시스템생물학: 게놈에서 생명까지ʼ) 개최 |
|
2009년 12월 |
한국분자세포생물학회 시스템생물학분과 심포지움 개최 |
|
2010년 12월 |
한국분자세포생물학회 시스템생물학분과 심포지움 개최 |
|
2011년 1월 |
The 9th Asia Pacific Bioinformatics Conference 개최 |
|
2011년 8월 |
5thAsian Young Researchers Conference on Computational and Omics Biology개최 |
|
2011년 9월 |
20thKorea Genome Organization(KOGO) Annual Conference 개최 |
|
2011년 11월 |
1stAnnual Translational Bioinformatics Conference 개최 |
|
2012년 10월 |
2ndAnnual Translational Bioinformatics Conference 개최 |
|
2013년 10월 |
3rdAnnual Translational Bioinformatics Conference 개최 |
|
2013년 11월 |
대한의료정보학회 및 한국생물정보시스템생물학회 추계학술대회 |
|
2014년 10월 |
4thAnnual Translational Bioinformatics Conference 개최 |
|
2014년 11월 |
한국생물정보시스템생물학회 추계학술대회 |
|
2015년 10월 |
한국생물정보시스템생물학회 추계학술대회 |
|
2015년 11월 |
5thAnnual Translational Bioinformatics Conference 개최 |
라. 발전 과제
2003년 IEEE Control Systems Magazine에 첫 리뷰논문이 등장한 이래 전 세계적으로 시스템생물학 관련논문 수가 급증하였고, 시스템생물학을 적용한 질병 진단 및 치료와 관련된 시장의 규모도 급격한 성장이 예상되고 있다. 우리나라의 경우도 연구 성과는 가시적으로 늘어나고 있으나 이미 10여 년 전부터 막대한 연구비투자를 해온 선진국에 비하면 그 중요도의 인식이나 투자규모 면에서 아직 미미한 수준에 있으며 시스템생물학관련 인프라를 구축하는 단계에 있다.
시스템생물학은 생명과학, 정보과학, 컴퓨터 기술 등의 새로운 기술의 집약과 다양한 학문 분야의 협력이 요구되는 자본·기술 집약적인 분야인 만큼, 연구자 중심의 Bottom-up 방식의 아이디어 발굴보다는 정부차원에서의 Top-down 방식의 기획이 필요할 것으로 판단되며 특히, 미국, 독일, 영국, 일본 등 이 분야 선진국과 같이 일관성 있고 체계적인 연구가 수행될 수 있도록 국가차원의 시스템생물학 연구소의 설립이 시급하다고 볼 수 있다. 뿐만 아니라, 시스템생물학이 실효를 거두어 나가기 위해서는 무엇보다 실험생물학자가 전통적인 접근방법에서 벗어나 실험계획의 단계에서부터 시스템과학 전공자와 논의할 수 있는 학문적 분위기가 조성되어야 하고, 열린 생각(Open-mind)과 진정한 공동연구수행을 위한 상호노력이 이루어져야 할 것이다.
키워드“Systems Biologyʼʼ로 검색한 논문의 국가별 통계 자료를 보면, 2014년 기준 시스템생물학 관련 국가별 누적 SCI 논문발표 수가 미국이 7,820편으로 여전히 전체 상위 16개국 누적 논문 수(20,874편)의 37.4%를 차지 할 만큼 압도적임을 알 수 있다. 한편, 최근 1년간 논문 증가율은 호주가 69.9%로 가장 높은 증가율을 보였고, 네덜란드(63.8%)와 프랑스(57.0%)가 그 뒤를 이었다. 우리나라는 누적 SCI 논문 수는 16위지만, 최근 1년간 논문 증가율은 56.0%로 전체 4위를 차지하여 시스템생물학 연구 분야에서 매우 고무적인 성과를 내고 있는 것을 볼 수 있다.
[표 4-1-12] 키워드 ʻʻSystems Biologyʼʼ로 검색한 국가별 누적논문 통계
|
순위 |
국가 |
∼2013년 |
∼2014년 |
1년간 논문증가율 |
|
1 |
미국 |
6,213 |
7,820 |
25.9% |
|
2 |
영국 |
1,926 |
2,510 |
30.3% |
|
3 |
독일 |
1,259 |
1,859 |
47.7% |
|
4 |
중국 |
1,085 |
1,567 |
44.4% |
|
5 |
캐나다 |
843 |
1,152 |
36.7% |
|
6 |
벨기에 |
628 |
826 |
31.5% |
|
7 |
일본 |
489 |
692 |
41.5% |
|
8 |
덴마크 |
445 |
659 |
48.1% |
|
9 |
스위스 |
387 |
589 |
52.2% |
|
10 |
스페인 |
395 |
578 |
46.3% |
|
11 |
이탈리아 |
363 |
564 |
55.4% |
|
12 |
프랑스 |
358 |
562 |
57.0% |
|
13 |
네덜란드 |
318 |
521 |
63.8% |
|
14 |
타이완 |
240 |
346 |
44.2% |
|
15 |
호주 |
193 |
328 |
69.9% |
|
16 |
대한민국 |
193 |
301 |
56.0% |
출처 : 자체자료
시스템생물학적 연구를 통한 효과적 질병원인 규명, 약물의 효과 예측, 신약후보물질 및 바이오마커 발굴은 신약개발의 새로운 패러다임으로써 기대되는 바가 크다. 따라서 비용과 시간이 많이 소모되고 위험부담이 많은 신약개발에 큰 영향을 미치고 있는데, 이미 세계 10대 제약업체 중 많은 수가 신약개발에 있어 시스템생물학적 접근법을 직접 도입하거나 시스템생물학 기술을 가진 업체와 협력 또는 인수‧합병하여 신약개발에 시스템생물학 연구 활용을 본격화하고 있다. 현재 국제적인 시스템생물학관련 기업에서 추구하는 주요 연구 현황은 다음 표와 같다.
[표 4-1-13] 신약 관련 기업의 시스템생물학연구 현황
|
연구센터 |
주소 |
연구내용 |
|
AstraZeneca |
www.astrazeneca.com |
MIT(Doug Lauffenburger's systems biology lab)와 함께 암 및 염증 질환에 대한 컴퓨터 모델 연구 |
|
Bioseek |
www.bioseekinc.com |
시스템생물학 기법을 이용하여 인간의 주요 세포 질환 모델들을 연구하고 안전한 신약 후보물질 개발 |
|
CytoPathFinder |
www.cytopathfinder.com |
세포기반 스크리닝을 위한 transfection microarray를 개발 |
|
Eli Lilly Center for Systems biology |
www.lilly.com |
회사의 신약개발 노력을 지원하기 위한 단백질 및 유전체 기술의 통합에 주력 |
|
Entelos |
www.entelos.com |
PhysioLab 기술을 이용한 질병의 컴퓨터 모델 개발. Pfizer와 협력관계 |
|
GSK |
www.gsk.com |
신약 표적 발굴, 검증 기술을 가진 Chemical proteomics 전문 연구업체인 Cellzome을 인수하여 신약 개발 능력을 확충 |
|
Ingenuity |
www.ingenuity.com |
시스템생물학 통합 소프트웨어 및 지식 DB 개발(omics data와 model biological system을 분석하는 툴 제공) |
|
Johnson & Johnson |
www.jnj.com |
Georgia Institute of Technology와 연구협력을 체결하고 의과학 연구에 중점을 둔 다학제간 협력연구를 수행 |
|
Roche |
www.roche.com |
스위스의 SystemsX 프로그램과 3년간 연구협력을 체결하여 베타세포(beta cell) 손상을 진단하는 바이오마커 발굴과 신약개발을 수행 |
출처 : 2013 생명공학백서 내용 수정‧보완
마. 시스템생물학의 산업 활용 현황
짧은 10여년의 역사를 가진 시스템생물학은 주로 복잡한 생체시스템을 이해하는데 역점을 두고 발전하여 왔고, 의약 및 바이오산업을 위한 활용에는 아직 초기 단계에 있다. 그러나 2005년 454 life sciences(2007년 로슈가 인수)가 최초의 차세대염기서열분석기(Next Generation Sequencing, NGS)인 GS20 system을 출시한 이후, NGS 기술의 급속한 발달로 수년 내 곧 1,000달러 게놈시대가 도래할 것으로 예상되며, 그로 인한 시스템생물학의 활용 가치는 더욱 높아지게 될 것으로 예상된다.
최근에는 질병의 치료보다는 질병이 발생하기 전에 발병 가능성을 가늠케 하는 예측진단(Predictive testing)과 약물에 대한 환자의 민감도를 시뮬레이션 하는 의약 맞춤처방이 확대될 것으로 전망되어, 시스템생물학을 주요 기술로 하는 맞춤의료(Personalized medicine) 사업이 향후 제약시장에서 큰 비중을 차지할 것으로 사료된다. 또한, 산업 미생물 개발 분야에서도 시스템생물학의 활용 가치가 크게 대두되고 있다. 시스템생물학 기술은 이미 이론상 가능한 최대 수율에 근접한 산업 미생물 개발에 가상세포 시뮬레이션을 도입하여 효율을 획기적으로 끌어올리는가 하면, 미생물 균주를 이용한 바이오 대체에너지 생산기술에도 전통적 대사공학 기법과 더불어 시스템생물학 기법이 활용되어 향후 화석 에너지 자원 고갈문제를 해결하는데도 큰 역할을 할 것으로 기대되고 있다.
6. 구조생물
가. 구조생물학연구의 개요
구조생물학은 중요단백질의 구조를 구명하여 생물학적 기능을 설명하는 것에서 발전하여 최근에는 단백질의 기능을 산업적으로 이용하는 바이오신약, 바이오센서, 신소재, 단백질설계 분야에서 중요하게 응용되고 있다. 단백질의 기능을 이용하여 유용하게 설계 또는 변형하기 위해서는 원자수준의 정보 확보가 필수적이며 이는 구조생물학의 기법을 통해 가능하다. 단백질의 구조분석을 위해서는 결정성장 등 연구대상 단백질의 물리-화학적 특성, 기능적 특성을 분석하는 것이 선행되어야 할 경우가 많은데 이러한 과정은 항체치료제 등 단백질 치료제/신약을 개발하는 데 전문성이필수적이기 때문에 제약 및 생명공학 기업에서 적극적으로 활용하고 있다.
나. 해외 동향
(1) 기술적 진보
최근 2~3년간 구조생물학 분야의 새로운 트렌드로서 자리를 잡아가고 있는 것은 하나이상의 구조연구기법을 융합하는 통합적 구조생물학 접근방법이다. 예를 들어 최근에 규명된 바 있는 26S 프로테아좀의 전체복합체 구조는 우선 저온전자현미경으로 전체의 윤곽을 규명한 후에 결정학적 방법으로 규명된 각 부분의 원자구조를 전체윤곽에 끼워 맞추고 분자역학적 계산으로 안정한 구조를 찾는 방식으로 전체복합체의 구조를 원자수준으로 구축하는데 성공하였다. 이러한 통합적 구조생물학의 수단으로서 엑스선결정학 및 저온전자현미경 뿐 아니라 핵자기공명분광학, 저각엑스선산란, 수소-중수소교환 질량분석, 단분자형광, 원자힘현미경을 비롯한 다양한 생화학적, 분석생물학적인 방법이 사용되고 있다.

출처 : Nature 525, 172-174, 2015
[그림 4-1-39] 저온전자현미경의 모식도
(2) 구조기반신약개발의 예
(가) Vemurafenib
신약개발연구에서 단백질 삼차구조 정보의 중요성은 날이 갈수록 증대되고 있으며, 보다 효율적이고 효과적으로 맞춤형 신약을 개발할 수 있는 가장 좋은 수단으로 각광받고 있다.
화합물 스크리닝 또는 구조기반 가상검색 분석 어느 방향이던 간에 최초 탐색만으로 선택성과 저해성을 가지는 물질을 발굴하는 것은 불가능하며, 초기물질 선정 후 화합물 재 디자인을 통한 물성 개선은 신약개발과정에 있어서 필수적이다. 이러한 과정에서 단백질-저해제 복합체 삼차구조 규명은 타겟 단백질을 선택적으로 강하게 저해하는 물질을 계획적으로 디자인하는데 가장 좋은 방법이다.
대표적인 단백질-저해제 복합체 삼차구조 규명을 통한 신약개발 예시는 흑색종 피부암(melanoma) 맞춤형 항암제 Vemurafenib(약제명 Zelboraf)가 있다. Vemurafenib 개발은 V600E 돌연변이형 B-Raf 단백질-저해후보물질 복합체 삼차구조를 규명하고 이를 기반으로 선택성과 저해성을 향상시키는 과정을 반복하여 이루어졌으며, 그 결과 일반적인 항암제 개발 연구에 비해 시간과 노력을 크게 단축시킬 수 있었다. 2014년 해당 약품의 세계시장 매출은 3억 100만 스위스 프랑(한화 3,400억 원)에 달하며, 흑색종 피부암 환자들의 삶의 질을 매우 향상시킨 것으로 평가받고 있다.

출처 : US DOE website, Plexxikon Inc.
[그림 4-1-40] Vemurafenib 과 표적단백질 복합체 삼차구조
(나) 복합체 삼차구조 연구를 통한 항암제 AT13387 개발
영국 Astex Therapeutics, Ltd. 연구팀은 우선 Hsp90 단백질과 1차 저해물질 (KD=790 μM) 간의 복합체 구조를 규명하였다.25) 이를 기반으로 화합물 재 디자인, 2차 저해물질(KD=0.54 nM) 도출 및 복합체 구조를 규명하였다.26) 이 복합체 구조를 기반으로 추가적인 화합물 재 디자인을 통해 최종적으로 AT13387 도출(KD=0.70 nM) 및 복합체 구조 규명하였다.27)
AT13387은 전립선암, 비소세포성 폐암(non-small cell lung cancer) 치료제로 현재 미국에서 임상(1/2상) 테스트 중이며, 2014년 8월 국내에서도 임상 승인받아 삼성서울병원, 국립암센터 등 6개 기관에서 임상(1상) 테스트 중이다.
(다) 복합체 삼차구조 연구를 통한 알츠하이머 치료제 MK-8931개발
미국 Schering-Plough Research Institute 연구팀은 우선 BACE 단백질과 1차 저해물질(IC50=210 μM)간의 복합체 구조를 규명하였다.28)이를 기반으로 화합물 재 디자인, 2차 저해물질(IC50=0.47 μM) 도출 및 복합체 구조를 규명하였다29) MK-8931은 알츠하이머 치료제로 2012년 12월부터 21개국에서 임상(2/3상) 테스트 중이다.
(라) 인슐린 신호전달 과정 조절의 핵심 단백질인 PTP1B 타겟 약물개발
미국의 Cold Spring Harbor 연구팀은 aminosterol 계열의 천연물 Trodusquemine가 PTP1B의 C-terminus 부분을 타겟하여 PTP1B 작용을 선택적으로 저해하는 것을 확인하였다. Ottawa Hospital Research Institute의 2015년 3월 보고에 따르면 65명의 환자를 대상으로 수행된 임상 1상에서 투여량 증가(Dose Escalation)에 따라 Trodusquemine가 특별한 부작용 없이 식욕과 체중 조절, 혈당 조절에 효과가 있는 것으로 확인되었다.
영국의 MRC 연구팀은 2015년 4월자로 단백질 항상성(proteostasis) 질병 타겟 protein phosphatase 1 선택적 저해제 Sephin1을 보고하였다. Sephin1은 protein phosphatase 1의 조절 서브유닛과 결합하며, 스트레스에 의해 발현이 유도되는 PPP1R15A와는 결합하지만 세포 내에서 항상 발현되는 PPP1R15B에는 결합하지 않아 선택성을 지닌다. 생쥐 모델 실험결과 Sephin1은 단백질 이상으로 생기는 샤코-마리-투스 1B 질환과 근위축성 측색 경화증에 대해 치료효과를 보이는 것으로 확인하였다.
|
|
|
[그림 4-1-41] Trodusquemine (좌측) 및 Sephin1 (우측) 화학구조
다. 국내 현황
(1) 연구 및 기술현황
국내 구조생물학 연구수준은 매우 우수한 수준이며, 가속기를 이용한 단백질 패밀리의 고효율 구조 규명 기술은 세계적 수준이다. Nature, Science, Nature 자매지 등에 연간 여러 편의 논문이 게재되고 있어 단백질의 구조기능에 대한 구조생물학적인 연구의 세계적인 기초연구결과가 도출되었다.
포항가속기에 단백질 구조규명 전용 빔라인을 2기 운영하고 있어서 단백질 구조규명에 있어서 필요한 위상결정을 신속하게 할 수 있는 설비를 제공하고 있으며 구조기반 신약개발에 필수적인 단백질-저해제 복합체의 고해상도 구조를 규명할 수 있는 인프라가 구축되어 있다.
미국, 일본에 이어서 포항가속기연구소 내에 국제수준의 사양을 갖는 4세대 가속기가 건설되고 있다. 미국의 스탠포드에 있는 LCLS의 설비는 2010년부터 가동되기 시작하였고 일본의 오사카에 있는 SACLA 설비는 2011년에 완공되어 2012년부터 가동되고 있다. 유럽에서도 독일의 DESY 연구소에 설비를 구축하고 있는데 이 설비는 포항의 설비보다 늦게 완공될 예정이다. 포항의 설비는 2016년 가동을 목표로 건설이 진행되고 있다. 구조생물학 분야의 이용을 위해 결맞음엑스선이미징 빔라인을 구축하고 있으며 광학장비, 시료처리장비, 회절검출장비 등을 준비하고 있다. 이 설비가 완공되면 마이크로-나노 크기의 결정을 이용한 단백질 구조규명이 가능할 것이며 효소반응이나 단백질기계기작을 연구하기 위해 시분해 회절 실험도 가능할 것이다.
(2) 신규 인프라구축 현황
X-선을 이용한 구조규명의 인프라인 가속기 분야는 3세대 가속기 및 XFEL(4세대 가속기)의 구축으로 세계최고 수준의 인프라를 확보하고 있지만 저온전자현미경의 설치 및 응용은 비교적 늦은 편이다. KAIST 등 몇 개 기관에 저온전자현미경의 설치 및 이용되고 있지만 원자수준의 구조를 규명할 수 있는 고해상도 설비는 최근 기초과학연구원에 설치가 진행되고 있고 추가로 초고해상도 설비구축이 논의되고 있다.
라. 발전 과제
구조생물학은 중요단백질의 구조를 규명해서 생물학적 기능을 설명하는 것에서 발전하여 최근에는 단백질의 기능을 산업적으로 이용하는 바이오신약, 바이오센서, 신소재, 단백질설계 분야에 중요하게 응용되고 있다. 단백질의 구조분석을 위해서는 결정성장 등을 위해 연구대상 단백질의 물리-화학적 특성, 기능적 특성을 분석하는 것이 선행되어야 할 경우가 많다. 이러한 과정은 항체치료제 등 단백질 치료제/신약을 개발하는 데 필수적인 전문성이어서 제약 및 생명공학 기업에서 적극적으로 활용하고 있다. 최근 국내의 대기업 및 벤처기업에서 바이오시밀러를 필두로 해서 단백질을 기반으로 한 질병치료제를 대량생산 및 산업화 하는데 많은 투자를 진행하고 있다.
국내의 구조생물학은 세계수준의 인프라를 갖추고 있으며 그에 걸맞는 기초연구결과를 생산해 왔다. 이제 기초연구결과에 기반한 응용분야가 활성화 되는 단계에 있으며 제약기업과 바이오텍 기업에서 점차로 구조기반 신약설계의 응용을 확대해 나가고 있으며 학계 및 연구계에서도 기초연구결과를 바탕으로 한 응용연구를 시작하고 있다. 앞으로 저온전자현미경과 XFEL의 인프라구축으로 기초연구결과의 산출과 응용연구의 활성화가 진행될 것으로 전망된다.
7. 뇌과학
가. 개요
뇌는 몸 밖 환경과 몸 속 환경을 감지하고, 이에 반응하여 생명체의 다양하고 복잡한 생명현상을 조절, 제어, 유지하는 중심축으로 기능하며, 사고, 기억, 감정, 언어에 이르는 고등 인지기능을 관장할 뿐만 아니라, 자체적인 신경신호를 발생시켜 상상력, 창조력 등을 유발하기도 하는 매우 복잡하고 정교한 장기이다.
이러한 뇌를 심층적으로 연구하는 뇌과학(neuroscience, brain science)은 다층적이고 다면적일 수밖에 없으며, 이에 따라 융합적 성격이 매우 높은 연구 분야인 동시에 어떤 분야보다도 다양한 연구 기술의 융합을 필요로 하는 특징을 가진다. 분자 수준에서의 세포생물학적 미시적 접근(뇌신경생물학)과 인지과학적인 이해를 바탕으로 하는 거시적 접근(뇌인지)을 근간으로 하여, 뇌신경계의 구조와 기능 형성 및 조절 과정의 장애에 따른 각종 뇌질환에 대한 병인 규명과 치료제 개발을 위한 의학적인 접근(뇌질환)을 포함할 뿐만 아니라, 뇌에 대한 공학적인 해석 및 그 활용적 측면에서의 접근(뇌공학)을 포괄하는 매우 넓은 스펙트럼을 가지고 있다.
인간이 스스로에 대하여 궁금증을 가지고 그 본질에 접근하고자 하는 시도는 고대 철학을 포함한 인문과학에서 출발하여 이루어 왔으며 현대의 자연과학적 접근은 큰 성과를 가져오고 있다. 다양하게 축적된 정보가 통합되어 이루어진 뇌과학의 발전은 아마도 미래의 인문학으로서 인간의 본질에 대한 가장 정확한 해석을 가능하게 할 것이다. 인간에 대한 정확한 이해가 사회경제적으로 효용가치가 높음은 두말할 여지가 없다.
뇌의 천문학적인 복잡성을 고려할 때 최근에 대두되고 있는 정보과학적 접근은 특히 뇌과학의 연구 방법을 획기적으로 변화시킬 것으로 전망된다. 정보과학적 접근이란 뇌에 대한 방대한 양의 정보를 취득하고 컴퓨터 알고리즘을 통하여 분석하는 방법으로 뇌의 작동원리를 규명하고자 하는 것이다. 최근 미국과 유럽 등지에서 활발하게 수행하고 있는 뇌지도 연구 분야 또는 뇌유전체를 기반으로 하는 정밀의학 연구 분야 등은 뇌에 대한 방대한 데이터베이스를 구축하기 위한 노력으로, 방대한 정보가 뇌의 신비를 규명하는 열쇠이자 핵심적인 자원이라는 인식에 근거하여 진행되고 있는 것이다.
또한 줄기세포 기술은 체외에서 인공 뇌(오가노이드)를 제작할 수 있는 수준으로 향상되었다. 이는 신경회로를 구성하여 자체적인 신경신호를 일으키는 인간 뇌 조직을 살아있는 상태로 체외에서 배양할 수 있음을 의미하는 것으로, 인간 뇌의 발달 및 작동 원리를 이해할 뿐만 아니라 각종 뇌질환의 모델링이나 약물 스크리닝 등에 활용 가능할 것으로 기대된다. 특히 노령화 사회 진입과 함께 뇌질환 발병율 증대에 따른 사회적 문제가 심각해지고 있는 점을 감안할 때, 뇌에 대한 이해 증진과 신개념 질환 모델의 대두, 뇌영상적 기법을 활용한 진단 기술의 약진 등은 조만간 조기진단 및 뇌질환 치료제의 개발에 대한 기대감을 높이고 있어 국가 및 기업의 투자 증대 및 세계적 기술선점 경쟁이 치열해질 것으로 전망된다.
나. 해외 동향
1990년 미국의 ʻ뇌의 10년(Decade of the Brain)ʼ 선언 이후, 뇌의 이해를 위한 전 세계적인 국가 차원의 정책적 노력이 지속되어 왔다. 앞서 언급한 것처럼 초대형 연구 과제를 통하여 뇌 전체를 대상으로 하는 신경망, 구조발달, 유전자 발현, 뇌활성 변화 등 다양한 정보를 집적하여 지금까지 개별 연구진 수준에서는 알 수 없었던 새로운 지식을 창출하고자 하는 노력이 최근에 뚜렷이 관찰되고 있다. 2013년 현재 미국과 유럽이 각각 착수한 BRAIN INITIATIVE와 Human Brain Project(향후 10년간 각각 3.2조원과 1.7조원의 연구비 투입할 예정)가 가장 대표적인 사례이다. 이러한 대형 프로젝트의 경우 수많은 연구진이 참여하며 장기적으로 진행되어야 하는 특징을 가지기 때문에, 안정적인 예산 투자뿐만 아니라 이 과제를 수행할 전문적인 뇌연구기관을 상설 또는 한시적으로 구성하여 진행된다는 점 역시 특징으로 볼 수 있다. 이 과정에서 국가주도 뇌연구기관인 NIH(미국), RIKEN(일본), MPI(독일) 등이 주도적으로 참여하고 있으며, 기업 또는 민간자본으로 구성된 Allen연구소, Janelia Farm등의 관련 연구소 역시 특화된 연구 내용에 집중함으로써 그 역할을 수행하고 있다.
대형 국가주도 연구개발 사업에 이어, 세계적인 노령화 위기와 함께 뇌질환에 관련된 사회적인 경각심 역시 높아지고 있으며 이에 따른 조기진단 또는 치료제 개발을 위한 다양한 중대규모 연구개발이 지속적으로 이루어지고 있다. 특히 제약산업이 발달한 선진국들의 경우 국가주도 연구는 물론이거니와 민간주도의 연구개발 또한 활발하다는 점 역시 주목할 만하다.
|
국가 |
주요기관 |
특 징 |
비 고 |
|
|
미국 |
- 국립 보건원 (NIH)
- 국립 과학재단 (NSF) |
■ NIH 뇌연구기관 연합체인 ʻBlueprint for Neuroscience Researchʼ를 중심으로 뇌연구 추진 (Blueprint Grand Challenge를 통해 인간 커넥톰 프로젝트(’09년), 통증연구(ʼ09년), 신경계질환 신약 전임상개발(ʼ10년) 등 중점지원) ■ 초대형 프로젝트 ʻBRAIN INITIATIVEʼ 추진(ʼ13년), 인간의 뇌기능 연구 및 뇌활동 지도 작성을 위한 첨단기술 개발에 향후 10년간 30억 달러(한화 3조2천억원) 투입 ■ ʻ국가 알츠하이머 프로젝트 법ʼ 제정(’11년)으로 알츠하이머 조기진단, 치료, 예방, 환자 돌봄까지의 연구 및 서비스 지원 ■ 2015년 NIH 총 예산은 303억 달러이며 이 중 신경과학 연구비는 56억 달러로 전체예산의 19% 정도를 차지함 |
1990년 ʻ뇌의 10년ʼ 선언 이후 세계적으로 뇌연구의 주도권 보유 |
|
|
일본 |
- 이화학 연구소의 뇌과학 종합연구소 (RIKEN BSI) |
■ ʻ뇌과학프로젝트(1997~2016년)ʼ를 통한 집중적인 뇌연구 추진하며 1998년도부터 ʻ뇌과학 종합연구소ʼ를 설립, 국가 연구기관 운영 ■ 2004년부터는 융합적 뇌연구 수행을 위한 통합뇌 및 계산뇌 프로그램을 출범하고 NT, IT 등의 학제간 협력연구를 강화 ■ 2009년 문부과학성이 내놓은 ʻ뇌과학 연구 기본 구상ʼ에 따라 뇌 연구에 매년 약 300억엔 규모로 지원 ■ 2014년 마모셋 원숭이의 뇌지도 작성 사업 위한 Brain/MINDS 프로젝트 추진, 1차년도 30억엔, 2차년도 40억엔 예산 수립 |
미국에 대응하여 21세기를 ʻ뇌의 세기ʼ라고 명명 |
|
|
유 럽 |
영 국 |
- MRC (Medical Research Council)
- Welcome Trust (민간기금) |
■ 뇌신경 전 분야에 걸친 투자 및 연구를 통해 미국에 이은 세계 2위의 위치를 고수 ■ 2008년 Welcome Trust-MRC 공동 퇴행성 뇌질환 연구 진흥을 위해 3천만 파운드(한화 6백억원) 지원계획 발표 ■ 임상의학과 산업화에 적용하기 위한 프로그램의 활성화 ■ 실제 영국에서 발표되는 뇌연구 논문 중 절반이상이 뇌질환 연구에 집중되는 경향 ■ 국제 만능유도줄기세포(ips)은행 추진을 통한 질환타겟형 연구시작 |
유럽연합 차원에서 인간 뇌 프로젝트 (Human Brain Project, HBP) 추진 |
|
프 랑 스 |
- 국립과학 연구소 (CNRS)
- 국립생명 과학연구소 (INSERM) |
■ 유럽연합 7차 프레임워크 프로그램(FP7)의 일환으로 NAD(Nanoparticles for the therapy and diagnosis of Alzheimer's disease)프로젝트 운영 ■ 신경과학 특화 테마별 연구 네트워크 The Ecole des Neuroscience de Paris-lle-de-France(ENP) 결성 ■ 뇌과학 연구 집중 분야로서 알츠하이머병에 대한 연구 및 치료에 많은 예산을 투자 |
||
|
독 일 |
- 막스플랑크 연구소 (MPI) |
■ 신경정신의학 분야의 기초과학연구와 임상연구 간의 상호 보완적 연구 장려 ■ 지역별 산학연 뇌과학 연구 클러스터의 형성으로 공동연구 활성화 ■ Computational Neuroscience 분야 집중육성을 위해 “Bernstain Award”를 제정하여 연구지원(ʻ06년) ■ 정부정책에서 자연과학 각 분야 간의 융합이 점차 강조되어 융합학문에 대한 지원이 늘고 있는 추세 |
||
|
스 위 스 |
- 스위스 로잔 공과대학 (EPFL) |
■ 헨리 마크럼 교수팀을 중심으로 Blue Brain Project (BBP)를 수행하고 있으며, HBP의 주도적 역할 수행 |
||
|
중국 |
- SIBS (상해생명 과학연구소) |
■ 국가자연과학기금은 핵심원천연구영역 9개 중 2개 분야 (뇌과학 연구, 인지과학) 연구 선정 ■ 중국신경과학회 산하 연구분야별 13개 분회와 지역별 10개 분회 중심으로 뇌과학 연구 주도 ■ 상해신경과학연구소(ION), 북경MRI센터(BMCB) 등 세계적인 신경과학 연구소 육성 ■ 기능성 질환군(신경통, 통증)에 대한 연구에 집중투자 |
|
|
출처 : NIH 미국국립보건원(www.nih.gov); 2015년도 뇌연구촉진시행계획(안), 미래창조과학부, 2015
다. 국내 현황
우리나라의 뇌과학은 1998년 ʻ뇌연구촉진법ʼ의 제정을 출발점으로 정부 차원의 계획적인 진흥 정책에 힘입어 발전하기 시작하였다. 뇌연구촉진법에 근거하여 10년마다 뇌연구촉진기본계획을 수립하고 시행하고 있으며 현재는 제2차 뇌연구촉진기본계획(2008~2017)에 따른 뇌연구 진흥 정책이 시행 중이다. 2013년에는 제2차 뇌연구촉진기본계획 진행 5년을 맞아 ʻ제2차 뇌연구촉진 2단계(2013~2017) 기본계획ʼ을 수립하여 제2차 1단계 5년간의 성과를 분석하고 수정보완 계획을 세웠다. 현재까지 2단계 기본계획에 의거, 1) R&D 핵심역량 강화의 가속화, 2) 연구개발시스템 제도화, 3) 실용화 촉진 및 연구개발 성과 확산의 3대 추진전략 하에 연구개발 지원이 이뤄지고 있다.
연도 추진내용 1998년 ■ ʻ뇌연구촉진법ʼ 제정 1999년 ■ 범부처 차원의 ʻ제1차 뇌연구촉진기본계획(BRAINTECH21)ʼ 수립, 시행 ■ ʻ뇌신경생물학사업단ʼ, ʻ뇌의약학사업단ʼ, ʻ뇌신경정보학사업단ʼ 3개 국책사업단 발족 2003년 ■ 21세기 프론티어연구개발사업의 일환으로 뇌기능활용 및 뇌질환치료기술
개발연구 ■ 사업단ʼ 출범 2008년 ■ ʻ제2차 뇌연구촉진기본계획(2008~2017년)ʼ 수립, 시행 ■ 연구기반 조성에서 탈피하여 원천기술 확보를 목표로 함 ■ 뇌과학 분야의 세계적인 추세를 반영하여 연구분야에 있어서 기존의 뇌신경생물,
뇌의약학, 뇌신경정보학 외에 뇌인지과학 및 뇌융합연구 분야 신설 ■ 학제간 융합을 위한 ʻ한국 뇌연구원 설립추진기획단ʼ 발족 2011년 ■ ʻ한국뇌연구원ʼ 설립 유치기관 선정(대구‧경북-DGIST 컨소시움) ■ ʻ한국뇌연구원ʼ을 대구경북과학기술원(DGIST) 부설(연)으로 설립 추진하여
2014년 개원 ■ ʻ한국뇌연구원ʼ의 운영은 내‧외부간 연계연구를 활성화하기 위하여 Hub-Spoke
개념을 적용한 유연한 개방형 연구시스템 도입 2013년 ■ ʻ제2차 뇌연구촉진 2단계 기본계획(ʼ13∼’17)ʼ 수립 ■ ʻ뇌기능활용및뇌질환치료기술개발연구사업단ʼ 종료(ʼ13.9) ■ 기초과학지원연구원(IBS) 뇌연구 분야 지원 개시(시냅스 뇌질환 연구단, 인지 및
사회성 연구단에 총 200억원 지원, 성균관대 뇌영상 연구단 신규 선정) ■ ʻ창조경제 실현을 위한 미래부 BT분야 투자전략ʻ(ʼ13.11)에 의하여
BT 5대 중점 투자분야 중 하나로 뇌연구 선정 ■ ʻ치매 예측을 위한 뇌지도 구축 및 치매 조기진단 방법 확립 사업ʼ 신규과제 선정,
향후 5년간 약 250∼300억원 지원 예정 및 2017년부터 실시될
ʻ치매조기진단 대국민 서비스ʼ 계획 수립 2014년 ■ ʻ생애 단계별 8대 건강문제 해결(VIP 연두업무보고)ʼ에 의거, 생애 전 주기별
뇌질환 극복 연구 추진 ■ 한국뇌연구원과 브라질 상파울루대학 부설 뇌은행(BBBABSG)간 협력 MOU체결 2015년 ■ ʻ바이오헬스 미래 신산업 육성 전략–바이오미래전략ʼ의 일환으로 신규과제
선정, 뇌과학에 약 415억원 규모 예산 투자
출처 : 2015년도 뇌연구촉진시행계획(안), 미래창조과학부, 2015; 자체 조사
2015년 국내 뇌연구 투자규모는 전년 대비 20.2%증가한 1,266억원으로 미래창조과학부가 전체의 30.8%(390억원)를 차지하고 있으며, 출연(연)이 47%(596억원), 보건복지부 11.1%(141억원), 산업통상자원부 5.6%(71억원), 교육부 5.2%(66억원) 순으로 투자될 예정이다.
[표 4-1-16] 2014/2015 뇌연구 투자 실적 및 계획
|
|
|
|
|
(단위 : 백만원) |
|
기관 |
사업명 |
사업기간 |
’14년 실적 |
’15년 계획 |
|
미래 창조 과학부 |
○ 집단 연구자 지원사업 |
|
2,000 |
1,000 |
|
- 선도연구센터지원사업 |
’02.9∼계속 |
2,000 |
1,000 |
|
|
○ 뇌과학원천기술개발사업 |
|
14,060 |
24,072 |
|
|
- 뇌과학원천기술개발 |
’06.11∼계속 |
14,060 |
24,072 |
|
|
○ 개인 연구지원 사업 |
|
13,195 |
13,968 |
|
|
- 신진연구자 지원 |
’00∼계속 |
3,771 |
3,360 |
|
|
- 중견연구자 지원 |
’86∼계속 |
7,188 |
8,372 |
|
|
- 리더연구자 지원 |
’97∼계속 |
2,236 |
2,236 |
|
|
○ 한국과학기술연구원 |
’13∼ʼ17 |
1,098 |
1,081 |
|
|
- 뇌과학기술개발사업 |
1,098 |
1,081 |
||
|
○ 한국뇌연구원 |
’09.6∼계속 |
14,559 |
20,271 |
|
|
- 기관고유사업 등 |
14,559 |
20,271 |
||
|
○ 한국생명공학연구원 |
|
3,245 |
2,500 |
|
|
- 뇌신경기반 대사질환연구 |
’12.1∼ʼ14.12 |
755 |
300 |
|
|
- 뇌신경 발달 및 분화조절 인자 단백체 분석 등 |
’12.1∼ʼ14.12 |
290 |
- |
|
|
- 노인성 뇌질환 형질전환 동물모델 개발 |
’14.1∼ʼ17.12 |
2,200 |
2,200 |
|
|
○ 한국표준과학연구원 |
’13.1∼ʼ15.12 |
1,098 |
1,081 |
|
|
- 차세대 생체자기공명 측정기술개발 |
1,098 |
1,081 |
||
|
○ 한국한의학연구원 |
’15.1∼ʼ19.12 |
- |
1,500 |
|
|
- 노인성 인지장애 예방 및 치료 한약소재 개발연구 |
- |
1,500 |
||
|
○ 한국기초과학연구원 (IBS) |
|
25,934 |
25,702 |
|
|
- 인지 및 사회성 연구 |
|
7,934 |
7,902 |
|
|
- 시냅스 뇌질환 연구 |
|
6,000 |
5,800 |
|
|
- 기초뇌과학 및 생물물리학 융합연구 |
|
12,000 |
12,000 |
|
|
소 계 |
|
79,237 |
98,672 |
|
|
[출연연] |
|
[49,982] |
[59,632] |
|
|
교육부 |
○ 이공학개인기초연구지원 |
’89∼계속 |
3,979 |
4,346 |
|
- 이공학개인기초연구지원 |
3,979 |
4,346 |
||
|
○ BK21 플러스 사업 |
’13.9∼’20.8 |
2,322 |
2,322 |
|
|
- BK21 플러스 사업 |
2,322 |
2,322 |
||
|
소 계 |
|
6,301 |
6,668 |
|
|
산업 통상 자원부 |
○ 미래산업선도기술개발사업 |
|
|
|
|
- 웰니스휴먼케어플랫폼구축사업 |
’13.6∼ʼ16.7 |
3,674 |
5,326 |
|
|
|
(1,499) |
(1,873) |
||
|
소 계 |
|
5,173 |
7,199 |
|
|
보건 복지부 |
○ 보건의료(R&D) |
|
|
|
|
- 질환극복기술개발(뇌신경계질환) |
’13∼계속 |
14,032 |
13,500 |
|
|
|
(611) |
(611) |
||
|
소 계 |
|
14,643 |
14,111 |
|
|
총 계 |
|
105,354 |
126,650 |
|
|
(민간) |
|
(2,110) |
(2,484) |
|
|
출처 : 2015년도 뇌연구촉진시행계획(안), 미래창조과학부, 2015.7 |
|
|||
이러한 뇌연구 투자규모는 2008년 이후 매년 증가되고 있는 추세이며, 최근 3년간은 투자 증가율이 평균 20%로 나타나 괄목할 만한 변화를 이루었음을 알 수 있다. 그럼에도 여전히 국내 생명공학 전체연구비 대비 3% 수준으로, 주요 선진국들의 전체 생명공학 분야 대비 투자비율이 대부분 10%를 상회하는 점을 감안할 때 상대적으로 열악한 환경에서도 놀라운 연구 역량의 증가를 보였다고 판단된다.
기업명 주요제품 및 개발내용 지엔티파마 개발중인 뇌졸중 신약 ʻNeu2000ʼ에 대해 한국, 미국, 중국, 일본, 유럽
특허 취득 신풍제약 뇌졸중치료제 후보물질 'SP-8203'의 임상 2상 시험 허가 승인 대웅제약 알츠하이머형 치매 신약 후보물질 ʻDWP 09031ʼ의 임상 1상 진행 중 아이큐어 아리셉트 패치형 치매치료제 임상 3상 시험 돌입 일동제약 천련자 추출 치매치료제 'ID1201' 임상 2상 진행 중 메디포스트 제대혈 줄기세포 이용한 알츠하이머형 치매 치료기술에 대해 유럽 6개국 동시 특허 취득
출처 : 자체 자료 검색
마. 발전 전망
인류복지 향상을 위한 핵심기반기술로 뇌연구가 부상하면서, 세계적으로 뇌연구에 대한 정부 및 민간의 투자가 증대되고 있다. 그동안 종양 연구, 유전체 연구 등 세계적인 주목을 받으며 과학기술을 주도하는 핵심 연구주제로 각광받은 연구 분야들의 경우, 연구 장비 등 산업기반시설이 확충되고 이를 통하여 수행된 새로운 연구 성과들이 기업과 협력하여 다시 시장을 움직이는, 연구개발과 비즈니스가 결합된 선순환적 발전이 진행되어 왔다. 앞으로는 뇌연구가 과학비즈니스 선순환의 중심핵으로 작동할 것으로 전망된다. 뇌연구 분야는 기초연구, 연구기술개발, 연구성과를 기반으로 하는 실용화, 뇌 신약개발 등 다양한 수준에서 실용화 및 기술 확산이 가속화될 것이다. 이러한 시대의 흐름에서 한국의 뇌연구는 위기이자 기회를 맞이하고 있다. 한국 역시 뇌전문 연구기관으로서 ʻ한국뇌연구원ʼ이 설립되어 기함형 대형 국가 뇌연구를 관장하는 국내 산학연 네트워크의 중요한 축으로 자리매김하고 있으며, 뇌연구 관련 기초과학지원연구원(IBS)을 통하여 기초뇌과학에 대한 집중적인 투자 역시 이루어지고 있다. 기회의 창이 닫히기 전에 정부 주도의 뇌연구 진흥정책을 통하여 민간 투자 증대를 이끌어내고, 뇌 특화 기업의 약진 등 모범을 창출하여 뇌연구 과학비즈니스 생태계를 튼튼하게 만드는 것이 한국 뇌연구가 세계로 도약할 수 있는 지름길이 될 것으로 전망된다. 이를 위해서는 장기적 전망을 가지고 뇌연구 개발을 위한 투자가 사회 및 시장에 미치는 영향을 꼼꼼히 분석하면서 진행될 수 있도록 전략적 정책을 수립하고 추진하는 것이 필요하다고 보인다.
8. 노화
가. 노화과학연구의 개요
오늘날의 노화과학은 단순한 수명연장이 아닌 건강한 노년을 추구한다. 사회활동은 물론 경제활동을 정상적으로 수행하는 ʻ건강한 노년ʼ은 급속한 고령화에 따른 경제활동인구의 감소, 복지재정의 증가 등 여러 사회․경제적 문제를 해결할 대안으로 떠오르고 있다.
노인성질환에는 잘 알려져 있듯이 치매 등의 뇌신경계와 동맥경화 등의 순환계, 골다공증과 같은 근골격계, 당뇨 등과 같은 대사성 질환 등이 대표적이라 할 수 있다. 고혈압과 같은 질환의 경우 더 이상 좋은 약의 개발이 필요 없을 정도로 성공적인 개발 사례도 있지만, 다른 노인성 질환에 있어서는 아직도 이렇다 할 치료법이 없는 실정이다. 단지 증세를 완화시키거나 진행을 지연시키는 치료수준에 머물러 있다. 이렇게 암과 같은 난치성 질환에 대한 치료기술이 빠르게 발전하고 있는 반면, 노인성 질환의 치료기술의 발전이 더딘 이유로는 노인성 질환을 질환 자체로만 해석하는데 그 문제가 있다. 이제는 이를 해결하기 위해 보다 근본적으로 왜 노화가 이런 질병을 동반하게 하는가 하는 원인기전을 이해하는 것이 필요하다.
실제로 2008년 대한민국 국회에서 발의된 ʻ노화과학기술연구 촉진법안ʼ에서는 아래와 같이 노화과학연구를 정의하였다.
1. 노화의 기전 규명을 위한 생물의학적 연구
2. 건강 노화를 유지할 수 있는 생의학적 연구
3. 노화 과정에 따른 질병의 예방과 치료를 위한 기전 연구
4. 일상생활의 원활한 수행을 가능하게 하는 신체의 정신의 기능을 극대화하는 장수 연구
5. 그 밖에 노화 연구와 관련된 정보 획득 및 교육에 필요한 학문 기술 분야의 연구
(1) 노화과학연구의 시급성
(가) 급속한 고령화에 따른 노인 의료비용 증가
2014년을 기준으로 우리나라 국내 고령자 인구는 전체 인구의 12.7%로 1990년 5.1% 수준에서 현재까지 지속적으로 증가하고 있으며, 향후 30년에는 24.3% 수준까지 도달할 것으로 전망되는 등 고령사회 진입속도는 선진국에 비해 매우 빠른 속도로 진행 중이다. 우리나라는 2000년에 이미 65세 이상 인구가 7.2%를 넘어서며 UN이 정한 고령화 사회에 진입하였고, 2026년경에는 초고령 사회로 진입할 것으로 전망된다. 이러한 급속한 인구 고령화는 국민의 건강문제를 발생시키고, 경제 활력을 저하시키는 등 국가발전과 사회 안정을 위협하는 잠재적 불안요인으로 여겨지고 있다.

출처 : 월간의약정보 (2010.3)
[그림 4-1-44] 고령자(65세 이상) 비율 추이 및 전망
급속한 고령화에 따른 노인 인구의 증가는 의료비용 및 건강보험의 재정 부담을 증가시키는 주요 원인으로 작용하고 있다. 2013년 65세 이상 노인인구는 5,740천명으로 전체의 11.5%이며, 2013년 노인진료비는 18조 852억 원으로 2006년 대비 2.5배 증가했음을 알 수 있다.
[표 4-1-18] 노인 의료비의 연도별 증가 현황
|
구분 |
2006년 |
2007년 |
2008년 |
2009년 |
2010년 |
2011년 |
2012년 |
2013년 |
|
전체 인구(천명) |
47,410 |
47,820 |
48,160 |
48,614 |
48,907 |
49,299 |
49,662 |
49,999 |
|
65세 이상 인구(천명) |
4,073 (8.6%) |
4,387 (9.2%) |
4,600 (9.6%) |
4,826 (9.9%) |
4,979 (10.2%) |
5,184 (10.5%) |
5,468 (11.0%) |
5,740 (11.5%) |
|
65세 이상 진료비 (억원) |
73,504 |
91,190 |
107,371 |
124,236 |
141,350 |
153,893 |
164,494 |
180,852 |
|
노인 1인당 연평균 진료비(천원) |
1,805 |
2,079 |
2,334 |
2,574 |
2,839 |
2,968 |
3,076 |
3,219 |
|
전체 1인당 연평균 진료비(천원) |
599 |
679 |
726 |
813 |
895 |
941 |
967 |
1,022 |
출처 : 건강보험심사평가원 보도자료(2014.9)
더불어 노인인구의 증가로 노년 부양비32) 및 장기요양급여비도 지속적으로 상승하고 있으며, 이로 인한 노인부양문제가 사회적 문제로 대두되고 있다. 가족 규모가 감소하고, 가족구성 및 동거형태의 변화로 노인단독세대가 크게 증가하고 있으며, 특히 노인 장기요양 신청 및 요양급여비 증가는 가계 및 국가의 재정 부담으로 이어지고 있다.
(나) 항노화 산업의 발전과 국내 산업 기반의 취약성
전 세계적으로 노인인구의 증가로 인하여 건강한 삶에 대한 욕구로 기능성식품, 의료기기 등 항노화 산업의 발전이 요구되고 있다. 미국, 일본 등 항노화 산업이 활성화된 선도국과 비교할 때, 국내 항노화 산업의 규모 및 세계시장 점유율은 매우 미비한 상황이다. 노화과학 기술과 관련하여 주요 우선권 주장국가는 미국으로, 총 3,159건 전체 특허의 60%를 보유하고 있으며, 노화분야의 연구 및 기술 개발을 주도하고 있다. EP(402건)를 제외하고는 프랑스, 일본, 영국 순으로 대부분의 유럽 국가들이 순위를 차지하고 있다. 우리나라의 경우 96건으로 전체의 2% 수준에 그치며, 세계 7위에 위치하고 있다.

출처 : 2015 건강노화과학기술개발사업 KISTEP
[그림 4-1-45] 노화 우선권 주장국가별 해외특허
특허뿐만 아니라 노화과학 기술 관련 주요 논문 발표 국가 또한 미국으로, 29,781건을 발표하여 전체 논문의 29%를 점유하고 있다. 우리나라는 264건으로 12위의 논문 발표국가이며, 전체 논문의 3%를 차지하고 있다.

출처 : 2015 건강노화과학기술개발사업 KISTEP
[그림 4-1-46] 국가별 논문 게재 현황
더욱이 생명과학 기술의 발전으로 노화의 분자 기전 규명 및 노화 제어 기술 개발이 가시화되어 노화 기초 연구를 기반으로 한 노화 제어 원천기술의 확보는 향후 항노화 산업의 발전에 필수적이라 할 수 있으나, 현재 국내에서는 항노화 산업의 기반이 되는 기초 노화과학 연구가 매우 시급하다고 할 수 있다.

[그림 4-1-47] 국내 노화과학 연구의 시급성
나. 해외 동향
(1) 국제기구
UN은 21세기 중점연구 분야 및 연구 우선순위로“노화에 대한 연구주제(Research Agenda on Ageing for the 21st Century)ʼʼ를 제시하였다. 자립, 참가, 돌봄, 자아실현 그리고 존엄으로 분류한“노인을 위한 유엔원칙ʼʼ을 채택하고, 고령층의 삶의 질 향상을 위해 고령사회의 현황문제 진단을 통한 종합적인 정책방향 및 실천과제를 제안하고 있다.
또한, WHO는 2012년 세계 보건의 날 주제로“Aging&Healthʼʼ를 선정하여, 노인 인구의 건강한 삶을 유지할 수 있는 건강행태 및 방안에 초점을 두고, 노년기의 삶의 질을 높이기 위하여 건강과 사회활동 및 안전에 대한 사회적 안전망을 구축해나가는 실천목표를 제시하고 있다.
[표 4-1-19] 21세기 노화과학 증진 프로그램과 중점 노화 과학 우선순위 내용
|
|
우선연구과제 |
주요 연구영역 |
|
고령자의 개발 |
1. 인구고령화와 사회경제 개발 2. 노인의 물적 자산 확보 3. 가족구조 및 사회 역학의 패턴 변화 등 |
1. 사회 참여와 통합 2. 경제적 안정 3. 거시적 사회 변화와 발전 |
|
고령자의 건강과 안녕 |
1. 건강노화의 결정 요인 2. 노화와 노인 질환의 기본 메커니즘 3. 문화, 사회경제, 생태 환경에서의 삶의 질과 노화 현상 |
1. 건강한 노화 2. 생의학적 기전 3. 신체적 및 정신적 기능 4. 삶의 질 |
|
노인 친화 환경의 확보 |
1. 가족구조 및 사회 역학의 패턴 변화 등 2. 문화, 사회경제, 생태 환경에서의 삶의 질과 노화 현상 |
1. 노인 개호 시스템 2. 가족, 이웃, 지역사회의 구조와 기능의 변화 |
출처 : 2015 건강노화과학기술개발사업 KISTEP
(2) 미국
미국은 공중보건법(Public Health Service Act) 제9조(Title IX)를 수정하여 「Healthcare Research and Quality Act of 1999」법안을 마련하고, 노인건강 증진 및 건강한 삶의 영위를 위해 노화의 근본 이해에 대한 국가 차원의 과학적 연구를 제안하고 있다. 그래서 고령화 관련 질병의 연구와 이해를 위한 선도적 전문기관으로 NIH(National Institutes of Health)를 구성하는 27개 연구소 중 하나인 NIA(National Institute on Aging)와 AOA(Administration on Aging) 등 공공기관을 중심으로 노화에 대한 과학적 근거 생산에 주력하고 있다. 미국 NIA(National Institute on Aging)는 노인건강 및 복지를 증진하기 위하여 국가 차원의 과학적 연구를 선도하고 있으며, 이를 위해 노화과학연구의 4대 목표를 제시하는 등 기초연구 성과의 임상연구 연계를 위한 미래 연구, 프로그램 관리 및 정보 확산 등 노화연구를 위한 인프라 구축에 힘쓰고 있다. NIA의 예산은 2013년 한해 11억 달러(약 1.1조) 이상에 달하며, 이중 10%의 예산을 내부연구(intramural research)에 사용하며, 그 외 예산은 외부연구(extramural research)에 지원되고 있다. 이는 자체적으로 해결되지 않는 연구들의 경우 외부 대학 또는 연구기관들과 컨소시엄 형태의 연구를 추진하거나 독립적인 연구를 수행함으로써, 연구 효율을 높이기 위한 전략이다.

출처 : NIA 공식 홈페이지
[그림 4-1-48] NIA 연도별 예산
(3) 일본
일본은 노인연구에 대한 지원 법령을「고령사회대책기본법 제13조(조사연구 등의 추진)」에 명시하고, 고령자의 특유질병 및 건강증진을 위한 치매, 암, 만성질환 연구에 중점을 두고 있다. 2003년 건강 증진 법 시행을 통해 ʻ건강일본 21ʼ을 적극적으로 추진할 법적인 기반을 마련하였으며, 고령화의 진행, 생활습관 병의 증가, 치매/병상 노인의 증가 등을 국민 건강과제로 꼽기도 하였다. 고령화 대응 연구개발이 실제 응용될 수 있는 과학기술의 현장화를 강조하고자 1995년 노화 연구의 양적 질적 향상을 위한 노화 관련 전문 연구기관으로 국립장수의료센터 산하에 NILS(National Institute for Longevity Science)를 설립하였다. NILS는 노화과학기초연구에서 중개연구를 망라하는 중심적 기관으로, 노화 메커니즘의 규명과 조절, 알츠하이머, 골다공증 위주의 노인성질환의 발병기전 규명과 예방․치료법 개발과 함께 고령자의 구강질환 연구, 고령자의 재활의학 연구, 고령자 관련정책 연구 등 폭넓은 연구를 수행하고 있다. 동경도립노인종합연구소의 경우에는 노인종합병원과 요양시설 그리고 연구기관이 통합되어 있어 연구 대상의 설정이나 병원 연계가 즉각적으로 대처 가능하도록 하였다. 이밖에도 일본 정부는“인생 90년 시대ʼʼ를 전제로 종합적인 중장기 고령화 대책 마련을 통해 고령자의 계속고용과 신규고용 촉진을 위한 정책지원을 강화함으로써 이러한 법과 제도의 정비를 통한 초 고령화 사회 일본 정책의 대전환을 촉구하고 있다.
(4) 독일
독일은 1970년대 중반부터 독자적인 노인장기요양의 필요성을 인식하고, 장기간의 국가적 논의 과정을 통하여 세계 최초로 사회보험 방식의 장기요양보험제도인 수발보험(Pflegeversicherung)을 제정하였다. 또한 독일 연방정부는 독일 첨단기술 전략 중기실천계획의 10대 미래 중점 프로젝트 중 하나로 고령화 대응 프로젝트를 포함시켰으며, 사회보장제도 개혁의 일환으로 “아젠다 2010”정책 추진을 통해 민간 의료보험 역할을 늘리는 등 장기적인 지원 관점에서 노화에 대한 사회제도 및 서비스 확충을 강화하는데 노력하였다. 2005년 라이프니츠연구협회에 의해 생의학 연구중심의 노인 연구기관인 라이프니츠 노화연구소를 설립하여, 노인성 질환과 노화에 관한 생물학 및 생의학에서의 분자 메커니즘 연구를 중심으로 한 독일 노인연구의 중요한 역할을 담당하는 등 국가 주요 연구기관을 중심으로 종합적인 노화 R&D 연구를 수행하고 있다.
(5) 영국
영국은 1948년 국민부조법에 의거하여 노인에 대한 재가서비스가 의무적으로 실시된 이후로 노인건강보장과 관련된 법들이 다수 제정되었다. 고령화 대응을 위한 10개년 중장기 계획인 ʻ노인을 위한 국가서비스 협약ʼ을 수립하고, 노화에 대한 장기적 연구, 치료서비스 제공에 대한 평가, 지속적인 치료서비스에 대한 연구 등을 연구과제로 제시하고 있다. 아직 노화종합 관련 전문 연구기관은 설립되지 않고 있으나, 정부 관련기관인 노화 연구 위원회를 주축으로 교육기관 및 자선 기관에서 프로젝트 형식의 컨소시엄 연구를 수행 중에 있다.
다. 국내 현황
국내에서도 빠른 속도로 고령화가 진행됨에 따라 만성질환, 노인의 신체적 기능저하와 장애 등에 의해 새로운 국민 보건의료 수요에 선제적으로 대응하고자, 국가적인 현안(National Agenda)으로 대두되고 있는 고령화와 관련하여 꾸준히 법과 제도의 정비를 추진해왔다. 인구고령화에 효율적으로 대응하기 위하여 ʻ노인복지법ʼ, 2005년 ʻ저 출산, 고령사회기본법ʼ, 2006년 ʻ고령친화산업진흥법ʼ 등을 제정하여 국가 및 지방자치단체의 고령친화산업 기반을 조성하고, 경쟁력 강화에 필요한 시책 수립을 통하여 향후 중장기적 발전 로드맵을 체계적으로 추진해 나가고 있다. 뿐만 아니라, 2010년 ʻ과학기술 미래비전 2040ʼ은 건강한 세상 구현에 필요한 핵심기술로 ʻ수명연장 및 고령화 대비 노화과학 연구ʼ를 제시하였고, 2012년 ʻ제2차 생명공학육성기본계획(Bio- Vision 2016) 2단계ʼ 기획을 통해 국민의 건강 및 복지를 위한 고령화 대응 필요성을 강조하였다. 새 정부 추진 중점국정과제에서도 고령친화사업 및 항노화 산업의 중요성을 강조하였다. 그러나 국내 노화과학연구는 해외 주요 선진국의 연구 동향과 비교해 볼 때, 다양한 측면에서 한계를 지니고 있다. 사회정책관점에서의 노인사회복지 연구는 활발하게 이뤄지고 있으나, 국가 차원의 인구 고령화 대응 노화과학 R&D 에 대한 지원은 아직 부족하며, 근본적인 지원 정책 수립이 필요한 실정이다.
또한, 노화 R&D를 통합적으로 추진할 수 있는 control tower의 부재로 노화과학연구 장기로드맵이 미비하다고 할 수 있다. 뇌신경, 혈관, 관절, 인식 및 지각, 암, 당뇨 및 비만 등에 이르는 다양한 노화과학연구 분야에도 불구하고, 노화라는 관점에서 체계적이고 통합적인 연구가 부재한 실정이다. 그 결과 개별 연구자 중심의 산발적 연구로 인하여, 국가적 수준에서의 수요 맞춤형, 목적 지향적 연구 수행이 미흡한 편이다. 노화 R&D 예산의 경우도 2011년 기준 NIA 예산의 1% 수준으로 절대적으로 부족한 실정이다. 2012년에는 노화 관련 R&D 정부 투자규모가 큰 폭으로 확대되기는 했지만, BT R&D 전체 정부 투자 규모 대비 노화 R&D가 차지하고 있는 비중은 약 1.9%로 약소한 수준이었다. 그러므로 노화 현상에 대한 이해를 통해 국민들의 건강한 노년기를 유지하기 위한 다각적인 정책 지원이 필요하다. 특히 고령사회 진입에 대한 대응을 위해서는 복지제도를 확충하는 등의 사회과학적인 연구뿐만 아니라, 노화를 근원적으로 해결할 수 있는 생명과학 및 의과학 기반의 노화과학 R&D 투자 지원이 반드시 필요하다.
[표 4-1-20] 국내 노화 관련 R&D의 SWOT 분석 매트릭스
|
강점(Strength) |
약점(Weakness) |
|
○ 삶의 질 제고를 위한 정부의 강력한 과학기술 투자 의지 ○ 노화 연구의 기반이 되는 BT에 대한 연구 역량 확보 및 정부의 지속적인 투자 ○ 법·제도 정비를 통해 고령친화산업에 대한 육성 정책 강화 ○ 세계적으로 경쟁력 있는 IT,NT 등 기술과의 융합연구로 시너지 확보 용이 ○ 노화의 최근 연구 트렌드에 부합하는 국내 연구 성과의 증가 |
○ 정부의 노화 대책이 대부분 노화 복지 정책에 편중되어 있음 ○ 노화 R&D 분야의 절대적 투자 규모가 선진국에 비해 부족하고, 부처간 칸막이 현상으로 인해 통합적인 연구가 불가능 ○ 노화 R&D에 대한 중장기 전략의 부재로 정부투자 분야와 실제 수요 간의 괴리 발생 ○ 노화를 전문적으로 연구할 수 있는 연구 그룹 및 인력 양성 미흡 ○ 국내 노화관련 산업체는 대부분 영세한 중소기업으로 구성되어 산업기반이 약함 |
|
기회(Opportunity) |
위협(Threat) |
|
○ 저출산, 고령화 사회의 도래로 노인문제 해결을 위한 각국 정부의 노화 R&D 수요 확대 ○ 세계 최고의 고령화 속도로 말미암아 노화연구 및 산업에 대한 국민적 관심 증가 ○ 노화 연구에 대한 패러다임의 변화에 따라 다양한 분야로 연구 범위 확장 가능 ○ 노화 관련 산업이 대부분 성장기에 있고 향후에 높은 성장이 예상되어, 시장 진입 기회 증대 |
○ 노화에 대한 사회적 이해도 및 고령화 문제에 대한 능동적 대처 미흡 ○ 최근 주요 선진국들이 노화 R&D에 대한 정책 강화 및 투자 비중 증가 ○ 선행 기술 보유국들의 연합 체계 및 배타적 권리 주장 발효 ○ 세계 고령화 산업의 급속 성장으로 거대 다국적 기업의 관련 산업 진출 증가 |
출처 : 2015 건강노화과학기술개발사업 KISTEP
라. 발전 과제
(1) 체계적인 지원 필요
노화과학연구의 발전으로 노화란 피할 수 없는 자연적 현상이 아닌, 가역적으로 제어 혹은 회복 가능한 질병으로의 인식 변환이 일어나고 있다. 따라서 상대적으로 선진국에 비해 뒤쳐진 국내 노화과학 기술 수준을 높이기 위해서는 국가 차원의 중장기 계획을 통해 정부 주도의 대형 연구개발사업을 추진하여 기술 선도국과의 기술 격차를 좁혀야 한다. 주요 선진국은 노화와 관련된 전문 연구기관을 설립하여 다양한 연구를 수행하고 있으며, 높은 기술 장벽과 국내의 열악한 연구기반을 극복하기 위하여 정부 투자를 통해 원천기술을 확보하고, 연구기반을 다지고 있다. 더욱이 노인의 정신, 신체, 사회적 건강에 대한 종합적인 차원의 정책을 수립하고 연계를 통해 체계적인 대책을 마련하고 있다. 그러나 국내의 경우 노화과학 분야의 연구개발과 관련한 정책 수립 및 추진에 대한 부처 간의 수평적 네트워크와 소통이 부족한 형편이며, 다양한 사회적 제도가 마련되고 있음에도 불구하고, 대부분의 법과 제도가 노인을 수혜대상으로 인식하고 있어 능동적인 사회참여를 유도할 수 있는 정책 마련 또한 시급한 현실이다. 노화 R&D 선진국을 벤치마킹하여 체계적인 R&D 프로그램을 지원함으로써 노화 제어 원천기술을 개발하고 이를 통해서 건강한 노화와 의료비 절감을 추구할 수 있는 근본적인 대책이 추진되어야 한다. 이러한 노화과학연구를 통한 항노화 산업의 활성화는 새 정부의 국정과제 기조인 국민행복 및 신성장 동력산업 육성을 통한 일자리 창출이라는 두 가지 목적 실현에 기여할 수 있을 것이다.
(2) 지원 방안
해외 선진국들은 노화과학 연구 및 제어 기술 개발의 효율성 추구를 위해서 국가적 control tower에 의해 주도되는 체계적이고 종합적인 연구개발 프로그램을 갖추고 있는 반면에, 우리나라의 경우에는 현재 개인적, 산발적 연구자 주도의 연구에 치우쳐 있다. 생명정보의 수집, 정리 및 관련 데이터베이스 구축을 위한 지원은 이루어지고는 있으나, 정보가 산재되어 있고, 노화 관련 유전체 연구에 대한 통합 인프라 구축은 전무한 실정이다. 국내 노화 연구자들이 산발적으로 노화 관련 데이터베이스를 구축한 예는 있으나, 제한된 데이터를 수집하고 제공하는 기능에 머물고 있다. 따라서 고령화라는 국가적 아젠다에 대응하기 위한 대형성과 창출 및 효율적 연구개발이 어려운 상황이다. 이를 효과적으로 극복하기 위해서는 국가 주도의 체계적인 사업단 방식의 사업추진이 요구된다. 이를 통하여 국내 산재해 있는 노화과학 연구 집단을 통합하여, 기존 인력과 시설을 최대한 활용함으로써 투자의 효율성을 극대화할 수 있으며, 노화라는 생리적인 현상에 대한 연구와 노화로 인해서 야기되는 질환들에 대한 연구가 체계적이고 통합적으로 이루어질 수 있을 것이다. 또한 노화 연구 지원 활성화를 위하여 노화 동물모델 자원, 고품질 생물자원 및 항노화 라이브러리 네트워크 확립을 통한 통합적인 연구자원 통합 인프라 구축을 통해 다양한 오믹스기반 고령화 대비 노화 연구 활성화에 기여할 수 있다.

출처 : 2015 건강노화과학기술개발사업 KISTEP
[그림 4-1-49] 기 구축 인프라 활용 및 협조체계 강화
또한 연구에 그치지 않고, 실제로 국민 건강수명 연장에 이바지하기 위한 중개연구로의 활발한 연계를 위해서도 국가주도의 노화과학연구를 위한 체계적이고 종합적인 연구 지원 및 대응 전략이 필수적일 것이다.
[표 4-1-21] 국내 노화 관련 R&D의 대응 전략
|
구분 |
대응전략 |
|
SO전략 (강점활용 기회포착) |
○ BT경쟁력을 활용한 노화 첨단기술 선점으로 차세대 의료 및 고령친화산업 육성 기반 기술 확보 ○ IT, NT 등 타 분야와의 기술 융합 강화로 노화분야 신시장 창출 |
|
ST전략 (강점활용 위협회피) |
○ 선진국 대비 선점 가능 분야 선택/집중화 ○ 세계 연구 패러다임의 변화에 따른 새로운 차원의 노화과학기술 개발 |
|
WO전략 (약점극복 통한 기회활용) |
○ 기존에 산발적으로 수행되던 노화 R&D를 통합하고 국가 차원의 중장기 종합 전략 수립 ○ 노화관련 연구 인프라 및 정보체계 구축으로 연구 효율성 증대 |
|
WT전략 (약점최소화 및 위협회피) |
○ 사회문제 해결형 R&D 추진으로 인구 고령화에 따른 사회·경제적 부작용 해결 ○ 국민 Needs에 부합하는 중점 연구분야 및 사업 프로그램 도출로 국민적 공감대 형성 |

1. 합성신약
가. 서론
2014년 글로벌 제약시장은 1조 272억 달러로 처음으로 1조 달러를 상회하였으며 최근 5년 연평균 5.4%의 성장률을 보였고, 향후에도 아시아, 아프리카, 호주 및 중남미 파머징 국가의 경제성장 및 의약품 수요증가에 따라 성장이 지속될 것으로 예측된다. 2014년에는 총 30개의 합성신약이 미국 FDA의 승인(생물학적 제제는 11개)을 받아 2012년(33종)과 2004년(31종)에 이어 3번째로 30개 이상 승인받은 해였다. 2013년 12월 승인받은 Gilead사의 C형 간염 치료제 Sovaldi는 2014년 93.75억$의 매출로 전체 합성의약품 판매 1위를 기록하였고, 2014년 복합제의 추가 승인으로 향후 시장이 지속 확대될 전망이다.
국내 제약시장은 2014년 19조 3,472억 원으로 세계 시장의 1.79%를 차지하여 2010년 2.09%보다 감소하였고 연평균 성장률도 세계평균 성장률을 하회하고 있다. 국내 제약시장의 저성장 기조에도 불구하고, 2014년 동아에스티에서 개발한 oxazolidinone계 항생제 Tedizolid가 LG생명과학의 팩티브에 이어 2번째로 미국 FDA의 승인을 받았으며, 2015년 한미약품(주)이 2종의 kinase 저해제의 대형 기술이전을 실시하여 합성신약 기술력을 입증하였다.
산․학․연 개방형 공동연구의 활성화가 지속되어 거대 제약사들의 자체개발 대비 도입품목에 대한 연구개발 비용 및 매출 의존도가 증대되는 추세이며, 생물학적 제제와 합성의약품의 협동연구가 증가되고 있다. 시장에 기 출시된 항체와 톡신의 결합물질인 ADC(Antibody-drug conjugate) 이외에도, 면역요법 항암제와 저분자 표적 항암제의 병용 임상 연구, PCSK9 항체와 스타틴의 병용임상 등이 활발하게 진행되고 있다.
나. 해외동향
(1) 미국 FDA 신약 승인

출처 : NME; new molecular entity; BLA biologics license applications; 자료: Nature Reviews/ Drug Discovery 2013
[그림 4-2-1] 최근 10년 미국 FDA 신약 승인 수
미국 FDA 승인된 2014년 합성신약(NME, New Molecular Entity)은 30개로 2013의 25개에 비해 생산성이 증가하였으며, 2000년 이후로 30개 이상의 허가를 받은 해는 2004년, 2012년, 2014년 3개 연도이다.
2002년 LG생명과학(주)의 팩티브정이 미국 FDA의 첫 번째 승인을 받은 이래 12년만인 2014년에, 동아에스티에서 Cubist(2015년 Merck & Co.에 인수됨)로 기술이전 된 oxazolidinone계 항생제 Tedizolid가 두번째로 미국 FDA의 승인을 받았다.
SGLT2(sodium glucose cotransporter) 저해제인 dapagliflazin과 empagliflozin이 동 계열 2번째, 3번째로 승인받는 등 2014년은 혁신성 측면에서는 크게 두각을 보이지 못했으며, Gilead의 ledpasvir과 sofosbuvir의 복합제인 havorni는 유전형 1형 C형 간염의 첫 번째 경구 치료제로 시장 성장성이 클 것으로 전망된다.
항암제는 4건으로 감소 추세이지만 신약 승인이 지속되고 있으며, 감염증이 9건으로 가장 많은 신약 승인을 받은 분야로 급성 세균성 피부 및 피부조직 감염증의 심의 기준이 변경된 것이 가장 큰 원인으로 분석되고 있다. 우선 심사를 받은 것이 17건으로 전체의 56.7%로 지속적인 증가추세에 있다.
[표 4-2-1] 2014년도 미국 FDA 승인 합성신약 리스트
|
일반명 (상품명) |
회사 |
기전 |
적응증 |
심사형태* |
|
Dapaglifozin (Farxiga) |
Astra-Zeneca |
SGLT2 2 저해제 |
2형 당뇨 |
S |
|
Tasimeltion (Hetlioz) |
Vanda |
mekatonin 수용체 효능약 |
수면장애 |
P, O |
|
Droxydopa (Noethera) |
Lundbeck |
noradrealine의 합성 아미노산 전구체 |
기립성저혈압 환자의 경미한 두통 |
P, O, A |
|
Florbetaben-F18(Neuraceq) |
Piramal Imaging |
방사능 진단물질 |
amylpoid-β 플랙 측정용 뇌조영제 |
S |
|
Miltefosin (Impavido) |
Knight |
기전 모름 |
리슈마니아증 |
P, O |
|
Apremilast (Otezla) |
Celgene |
PDE4 저해제 |
건선성 관절염, 판상 건선 |
S |
|
Ceritinib (Zykadia) |
Novartis |
ALK, IGFR1, ROS1 kinase 저해제 |
ALK-양성 전이성 비소세포성폐암 |
P, O, B, A |
|
Vorapaxar (Zontivity) |
Merck & Co. |
PAR1 길항제 |
혈전성 심장질환 |
S |
|
Dalbavancin (Dalvance) |
Durate |
반합성 lipoglycopeptide |
급성세균성피부, 피부조직 감염증 |
P |
|
Efinaconazole (Jublia) |
Dow |
azole계 항진균제 |
발톱 조갑진균증 |
S |
|
Tedizolid (Sivextro) |
Cubist |
oxazolidinone계 항생제 |
급성세균성피부, 피부조직 감염증 |
P |
|
Belinostat (Beleodaq) |
Spectrum |
HDAC 저해제 |
말초 T세포 림프종 |
P, O, A |
|
Tevaborole (Kerydin) |
Anacore |
항진균제 |
발톱 조갑진균증 |
S |
|
Idelalisib (Zydelig) |
Gilead |
PI3Kδ 저해제 |
만성임파구성 백혈병, 림프종 |
P, O, B, A |
|
Olodaterol (Striverdi Respimat) |
Boehringer Ingelheim |
지속성 β2-adrenoceptor 효능제 |
만성 폐쇄성폐질환 |
S |
|
Empagliflozin (Jardiance) |
Boehringer Ingelheim |
SGLT2 저해제 |
2형 당뇨 |
S |
|
Oritavancin (Orbactiv) |
The medicines |
반합성 lipoglycopeptide |
급성세균성피부, 피부조직 감염증 |
P |
|
Suvorexant (Belsomra) |
Merck & Co. |
orexin 수용체 길항제 |
불면증 |
S |
|
Eliglustat (Cerdelga) |
Genzyme |
glucosylceramide synthase 저해제 |
고셔병 |
P, O |
|
Naloxegol (Movantik) |
Astra-Zeneca |
opioid 수용체 길항제 |
opioid 유도 변비 |
S |
|
Sulfur hexafluoride (Lumason) |
Bracco |
초음파 조영제 |
심혈관 이미징 |
S |
|
Netupitant + palonosetron (Akynzeo) |
Helsinn |
NK1 수용체 길항제 + 5-HT3 수용체 길항제 |
화학요법제 관련 구토 |
S |
|
Ledipasvir + sofosbuvir (Harvoni) |
Gilead |
NS5A 저해제 + NS5B polymerase저해 |
유전자형 1형 C형 간염 |
P, B |
|
Pirfenidone (Esbriet) |
InterMune |
기전 모름 |
특발성 폐섬유화증 |
P, O, B |
|
Nintedanib (Ofev) |
Boehringer Ingelheim |
kinase 저해제 (PDGFR, FGFR, VEGFR, FLT3) |
특발성 폐섬유화증 |
P, O, B |
|
Finafloxacin (Xtoro) |
Alcon |
fluoroquinolone 항생제 |
급성 외이도염 |
P |
|
Olaparib (Lynparza) |
Astra-Zeneca |
PARP 저해제 |
BRCA 변이 진전 유방암 |
P, O, A |
|
Ombitasvir+ paritaprevir + dasabuvir + ritonavir (ViekiraPak) |
AbbVie |
NS5A저해제 + NS3A 및 NS4A-protease 저해제 + NS5B polymerase 저해제 + CYP3A 저해제 |
유전형 1형 만성 C형 간염 |
P, B |
|
Ceftolozane + tazobactam (Zerbaxa) |
Cubist |
세파계 항생제 + β-lactamase 저헤제 |
복강 및 요도 감염 |
P |
|
Peramivir (Rapivab) |
BioCryst |
Neuraminidase 저해제 |
인플루엔자 감염 |
S |
출처 : Nature Reviews/ Drug Discovery 2015
* A : accelerated approval, B : breakthrough designation, O : Orphan designation, P : Priority review, S : standard review
2015년도 상반기 6개월 동안 11종의 합성신약이 미국 FDA의 허가를 받았으며, 생물학적 제제는 동 기간에 3종의 허가를 받았다.
[표 4-2-2] 2015년도 상반기 미국 FDA 승인 합성신약 리스트
|
일반명 (상품명) |
회사 |
적응증 |
|
Edoxaban tosylate (Savaysa) |
Daiichi Sankyo |
비판막성 심방세동 황자의 뇌졸중 및 전신 색전증 |
|
Palbociclib (Ibrance) |
Pfizer |
ER-양성, HER2-음성 유방암 |
|
Levatinib (Lenvima) |
Eisai |
갑상선암 |
|
Panobinostat (Farydak) |
Novartis |
다발성 골수증 |
|
Abibavtam + ceftazidime (Avycaz) |
Allergan |
복합성 복강내감염 및 요로감염증 |
|
Isavuconazonium (Cresemba) |
Astellas Pharma |
항진균제 |
|
Cholic acid (Cholbam) |
Retrophin |
담즙생성 장애 및 과산화소체 질환 |
|
Ivabradine (Corlanor) |
Amgen |
만성 심부전증 |
|
Deoxycholic acid (Kybella) |
Kythera |
턱 밑 지방 |
|
Eluxadoline (Viberzi) |
Actavis |
과민성 대장질환 |
|
Cangrelor (Kengreal) |
The Medicines |
심근경색, 반복 혈관재생술 및 스텐트 혈전 |
자료 : Nature Reviews/ Drug Discovery 2015
(2) 개방형 연구의 지속적 확대
미국 제약사는 2013년부터 자체 개발 과제보다 기술도입 과제에 대한 연구개발비용이 상회하기 시작하여 2014년에는 연구개발비의 60% 이상이 기술도입 과제에 투입, 점차 그 비율이 증가하여 2019년에는 80% 이상이 될 것으로 예측되며, 10대 제약회사의 매출도 기술도입 품목의 의존도가 50%를 상회하고 있다.
글로벌 제약회사들은 2011년 이후 블록버스터 의약품들이 대거 특허 만료됨으로써 특허절벽을 해소하기 위하여 대규모 구조조정을 실시하였고, 파생된 연구개발 역량의 감소를 개방형 연구의 확대로 충족시키고 있다.

출처 : EvaluatePharma, PhRMAwebsite, DefinedHealth
[그림 4-2-2] 미국 제약사의 자체 개발 대비 기술도입 과제에 대한 연구개발 비용

출처 : EvaluatePharma, DefinedHealth
[그림 4-2-3] 10대 제약사의 도입품목 매출의존도
(3) 생물학적 제제와 합성의약품의 복합치료 활성화
기존의 합성의약품의 병용치료요법이나 복합제 연구에서 생물학적 제제와 합성의약품의 복합 치료 연구가 활성화되고 있는 추세이다.
항체와 톡신의 결합체인 ADC(antibody drug conjugate)는 3종의 물질이 항암제로 미국 FDA 승인허가를 받았으며, 2001년 승인받은 Pfizer의 Mylotarg가 2010년 시장에서 취하되어 현재 2종이 판매되고 있다. 2011년 승인되어 Seattle Genetics와 Millenium/Takeda가 판매 중인 Brentuximab vendotin과 2013년 승인된 Genentech과 Roche의 Trastuzumab emtansine이며, 임상 파이프라인에 30종 이상의 ADC가 있다.
Novartis는 Bristol-Myers squibb의 면역요법 항암제인 PD1 저해제 Opdivo와 Novartis의 ALK 저해제 ceritinib의 병용투여 임상을 crizotinib에 내성인 ALK 양성 전이성 비소세포성폐암 환자를 대상으로 진행할 계획이며 Opdivo와 선택적 cMET receptor tyrosine kinase 저해제인 INC280과 별도로 3세대 EGFR kinase 저해제인 EGF816과의 병용 임상도 계획 중에 있다. INC280과 EGF816은 각각 단독으로 임상 I/II 상 연구가 진행 중이다. 이와 같이 아직 허가 승인받지 않은 물질에 대한 병용요법 연구를 단독요법 연구와 동시에 진행하는 것이 증가추세이다.
고지혈증 치료제로 연구 중인 PCSK9(Proprotein Convertase Subtilisin/ Kexin Type 9) 저해제는 모두 statin과 병용요법으로 임상 중에 있다.
(4) 시장현황
2014년 세계 제약시장은 최초로 1조 달러(1조 272억 달러)를 상회하였으며, 최근 5년 동안 5.4%의 연평균 성장률을 나타내고 있다.
향후 유럽 및 일본은 세계 성장률을 하회하는 저성장 추세가 지속될 것이며, 북미, 아시아, 아프리카, 호주 및 중남미 지역이 세계시장 성장률의 견이차가 될 것으로 예측된다.
2013년 12월 미국 FDA의 승인을 받은 Gilead의 C형간염 치료제 Sovaldi가 93.75억$의 매출로 합성의약품 중 전체 1위였으며, AstraZeneca의 항궤양제 Nexium은 특허만료에 따라 판매가 감소되었다. Sovaldi는 다처방 의약품이 아니라 12주 치료에 약 84,000$인 높은 약가에 의해 매출액이 높고, 2015년 Ledipasvir과의 복합제가 추가로 승인됨에 따라 향후에도 시장 확대가 지속될 것으로 예측된다. 2014년 글로벌 매출 상위 10개 합성의약품은 [표 4-2-3]과 같다.
[표 4-2-3] 글로벌 상위 10개 합성의약품
|
순위 |
의약품 |
기업 |
적응증 |
매출액(백만$, %) |
||
|
2013 |
2014 |
증감률 |
||||
|
1 |
Sovaldi |
Gilead |
C형간염 치료 |
70 |
9,375 |
13,262 |
|
2 |
Abilify |
BMS |
조현증, 조증, 우울증 |
7,824 |
9,285 |
19.2 |
|
3 |
Seretide |
GSK |
천식치료 |
9,198 |
8,652 |
-5.3 |
|
4 |
Crestor |
AstraZeneca |
콜레스테롤혈증, 고지혈증 |
8,140 |
8,473 |
5.6 |
|
5 |
Nexium |
AstraZeneca |
역류성식도염 |
7,867 |
7,681 |
-1.4 |
|
6 |
Lyrica |
Pfizer |
신경병증성 통증 |
5,107 |
6,002 |
19.0 |
|
7 |
Spiriva |
Boehringer Ingelheim |
만성페쇄성 폐질환 유지 |
5,283 |
5,483 |
4.8 |
|
8 |
Januvia |
MSD |
당뇨 |
4,457 |
4,991 |
14.0 |
|
9 |
Copaxone |
Teva |
다발성 경화증 |
4,691 |
4,788 |
2.8 |
|
10 |
Symbicort |
AstraZeneca |
진해거담제 |
3,885 |
4,535 |
18.9 |
출처 : IMS health
다. 국내현황
(1) 신약 승인현황
1999년 SK케미칼(주)의 선플라가 국내신약 1호로 승인된 이래 현재까지 26종의 신약을 도출하였으며 대웅제약의 이지에프외용액과 CJ제일제당의 슈도박신주를 제외한 24종이 합성신약이며, 2010년 이후로는 매년 신약이 승인되었고 2015년에는 현재까지 5종의 신약허가가 이루어졌다.
2014년 LG생명과학(주)의 팩티브정 이래 두 번째로 미국 FDA의 승인을 받은 동아에스티(주)의 tedizolid는 2015년에 주사제와 tablet 2종의 신약이 국내에서 승인되었다.
[표 4-2-4] 국내신약 리스트
|
연번 |
제품명 |
회사명 |
주성분 |
효능ㆍ효과 |
허가일 |
|
26 |
슈가논 |
동아에스티㈜ |
에보글립틴 |
당뇨병치료제 |
2015.10. |
|
25 |
시벡스트로주 |
동아에스티㈜ |
테디졸리드포스페이트 |
항균제(항생제) |
2015.04. |
|
24 |
시벡스트로정 |
동아에스티㈜ |
테디졸리드포스페이트 |
항균제(항생제) |
2015.04. |
|
23 |
자보란테정 |
동화약품㈜ |
자보플록사신 D-아스파르트산염 |
ABE-COPD항균제 |
2015.03. |
|
22 |
아셀렉스캡슐 |
크리스탈지노믹스㈜ |
폴마콕시브 |
골관절염 치료제 |
2015.02. |
|
21 |
리아백스주 |
(주)카엘젬백스 |
테르토모타이드염산염 |
항암제(췌장암) |
2014.09. |
|
20 |
듀비에정 |
(주)종근당 |
로베글리타존 황산염 |
당뇨병치료제 |
2013.07. |
|
19 |
제미글로정 |
(주)LG생명과학 |
제미글립틴타르타르산염 1.5수화물 |
당뇨병치료제 |
2012.06. |
|
18 |
슈펙트캡슐 |
일양약품(주) |
라도티닙염산염 |
항암제(백혈병) |
2012.01. |
|
17 |
제피드정 |
JW중외제약(주) |
아바나필 |
발기부전치료 |
2011.08. |
|
16 |
피라맥스정 |
신풍제약(주) |
피로나리딘인산염, 알테수네이트 |
말라리아치료 |
2011.08. |
|
15 |
카나브정 |
보령제약(주) |
피마살탄칼륨삼수화물 |
고혈압치료제 |
2010.09. |
|
14 |
놀텍정 |
일양약품(주) |
일라프라졸 |
항궤양제 |
2008.10. |
|
13 |
엠빅스정 |
SK케미칼(주) |
미로데나필염산염 |
발기부전치료 |
2007.07. |
|
12 |
펠루비정 |
대원제약(주) |
펠루비프로펜 |
골관절염치료 |
2007.04. |
|
11 |
레보비르캡슐 |
부광약품(주) |
클레부딘 |
B형간염치료 |
2006.11. |
|
10 |
자이데나정 |
동아제약(주) |
유데나필 |
발기부전치료 |
2005.11. |
|
9 |
레바넥스정 |
(주)유한양행 |
레바프라잔 |
항궤양제 |
2005.09. |
|
8 |
캄토벨정 |
(주)종근당 |
벨로테칸 |
항암제 |
2003.10. |
|
7 |
슈도박신주 |
CJ제일제당(주) |
건조정제슈도모나스백신 |
농구균예방백신 |
2003.05. |
|
6 |
아피톡신주 |
구주제약(주) |
건조밀봉독 |
관절염치료제 |
2003.05. |
|
5 |
팩티브정 |
(주)LG생명과학 |
메탄설폰산제미플록사신 |
항균제(항생제) |
2003.04. |
|
4 |
큐록신정 |
JW중외제약(주) |
발로플록사신 |
항균제(항생제) |
2001.12. |
|
3 |
밀리칸주 |
동화약품공업(주) |
질산홀뮴-166 |
항암제(간암) |
2001.07. |
|
2 |
이지에프외용액 |
(주)대웅제약 |
인간상피세포성장인자 |
당뇨성 족부 궤양치료제 |
2001.05. |
|
1 |
선플라주 |
SK케미칼(주) |
헵타플라틴 |
항암제(위암) |
1999.07. |
출처 : 신약개발조합
(2) 기술이전 현황
2000년부터 약 15년 이상 kinase 저해제 연구를 집중적으로 수행해왔던 한미약품(주)는 2015년에 BTK 저해제 및 내성표적 EGFR kinase 저해제 2건의 대형 기술이전을 성사시켰다.
BTK 저해제(HM71244)는 BTK(Bruton tyrosine kinase)를 선택적으로 저해하는 경구용 자가면역 치료제로서 류마티스관절염을 적응증으로 2014년 유럽에서 임상 1상 시험을 완료하였으며, 전신성 홍반성 낭창, 쇼그렌증후군 등으로 적응증을 확대할 계획이다. Eli Lilly사에 정액기술료 6억 4천만$, 계약금 5천만$의 조건으로 2015년 3월 기술이전 계약을 체결하였다. BTK 저해제로는 백혈병과 림프종의 2차 치료제로 미국 FDA와 유럽 EMA의 허가를 받은 ibrutinib이 있으며 원개발사인 Pharmacyclics는 AbbVie에 인수되었다. Eli Lilly는 JAK1/JAK2, CDK 4/6, PI3 kinase/mTOR, MET/EGFR, Chk1, FGFR, c-MET 등 다양한 kinase 저해제의 파이프라인을 보유하고 있으나 BTK 저해제는 확보하고 있지 않았다.
내성표적 EGFR kinase 저해제는 BTK 저해제에 이어 한미약품은 내성표적 EGFR kinase 저해제(HM61813)를 Boehringer Ingelheim사에 정액기술료 6억 8,000만$, 계약금 5,000만$에 기술이전 계약을 체결하였으며 EGFR kinase에 내성이 생긴 변이 EGFR kinase를 선택적으로 저해하여 기존 치료제에 내성이 생긴 폐암환자를 표적으로 하고 있다.
(3) 시장 현황
2014년 국내 제약시장 규모는 약 19조 3,400억 원이며, 최근 5년간 연평균 성장률은 2.4%로 2010년 세계시장에서 점유율 2.01%에서 2014년 1.79%로 그 비중이 감소하였으며, 세계 제약시장 성장률(5.4%)보다 낮은 저성장을 나타내고 있다.
국내 제조업 GDP에서 의약품 생산이 차지하는 비중은 2010년 4.47%에서 2014년 4.0%로 감소하여 전체 제조업 생산의 성장보다 낮았으며 국내 제약시장의 저성장기조가 지속될 것으로 예측되므로 수출시장을 확대하기 위한 전략이 요구된다.
라. 발전과제
(1) 중개연구의 강화와 개방형 혁신을 통한 연구개발이 지속 성장의 모델로 인식되고 있다.
(2) 일반 심사보다는 orphan 적응증을 포함하여 우선 심사를 받는 신약 수가 지속적으로 증가하고 있는 추세이며, 이러한 심사기준의 변화로 감염증 치료제의 신약허가 건수가 증가하고 있다.
(3) ADC(항체-톡신 복합체), 면역요법 항암제와 kinase 저해제 병용, PSCK9 항체와 스타틴의 병용 등 항체를 포함한 생물학적 제제와 합성의약품의 병용 임상연구가 활성화되고 있으며, 이종 기술 간의 협동연구가 합성신약의 새로운 혁신을 주도할 것으로 전망된다.
2. 바이오의약품
가. 개요
바이오의약품은 의약품의 생산 수단으로 인간 세포, 동물 세포, 혹은 미생물과 같이 생체를 이용하는 의약품으로 정의하며, 질병 및 의료 상태의 치료뿐만 아니라, 질병의 예방 및 진단에도 이용할 수 있다. 제약회사 및 바이오텍 회사가 고전적인 방법으로 수행해 온 합성 의약품의 개발과 비교한다면, 바이오의약품은 종래의 신약개발 방식의 난점과 약점을 뛰어넘을 다양한 장점을 보유하고 있다. 예를 들면, 항체 의약품의 경우 합성 의약품에서 찾아보기 힘든 타겟 선택성과 결합능력을 보이며, 이로 인해 상대적으로 높은 수준의 치료지수(therapeutic index)를 보일 가능성이 높다. 최근 10년 간 이러한 바이오의약품의 개발은 큰 진전을 보이고 있으며, 국내외 수많은 회사들이 이러한 새로운 분야에 대한 도전과 투자를 아끼지 않고 있다.
바이오의약품의 분류 및 종류는 다음과 같으나, 다음의 종류로만 국한되는 것은 아니다.
∙ 항체 의약품
∙ 백신, 치료용 백신
∙ 혈액 및 혈액 유래 의약품
∙ 유전자 치료제
∙ 세포 치료제
∙ RNA 혹은 DNA 기반 치료제
위의 종류로 분류하여 현재 임상개발 진행 중인 의약품들의 현황은 [그림 4-2-4]과 같다. PhRMA의 보고서에 따르면 현재 총 907종의 바이오의약품이 임상 단계 이상의 단계에서 개발 진행 중이며, 이 중 가장 많은 임상 프로젝트가 진행 중인 종류는 항체 의약품과 백신에 해당된다. 그러나 가장 최근에는 세포 치료제와 유전자 치료제에 대한 관심도 급증하고 있다.
적응증으로 분류한 데이터에 따르면, 바이오의약품의 적응증으로 암과 감염질환이 가장 많고, 다양한 방법의 획기적인 시도가 이루어지고 있다. 특히 항암제로의 바이오의약품 개발의 진척은 최근 10년 간 괄목할 만한 성과를 이루어냈고, 최근 시판 승인을 받은 항암 바이오의약품들이 속속 등장하는 것이 그 증거라 할 수 있겠다.

출처 : PhRMA report
[그림 4-2-4] 바이오의약품의 종류별 개발 단계

출처 : PhRMA report
[그림 4-2-5] 미 FDA 승인 하에 임상 개발 중인 바이오의약품의 적응증 분류
EvaluatePharma(2014)에 따르면 세계 시장 매출 랭킹 10위 이내의 의약품 10종 중 총 7종이 바이오의약품에 해당된다. 2008년에는 10위 내의 10종 중 총 5종이 바이오의약품이었고, 이들이 차지하는 매출 비중이 전체 10종 의약품 매출의 61%를 차지하는 반면, 2014년에는 약 총75%가 바이오의약품의 매출 비율이다. 이를 이 분야의 상대적인 기여도로 환산해본다면, 약 2배가 넘는 성장률에 해당한다.
[표 4-2-5] 의약품 매출 글로벌 Top 10
|
Rank |
Product |
Company |
Technology |
WW Sales($m) |
|
1 |
Avastin |
Roche |
Monoclonal antibody |
9,232 |
|
2 |
Humira |
Abbott&Eisai |
Monoclonal antibody |
9,134 |
|
3 |
Rituxan |
Roche |
Monoclonal antibody |
7,815 |
|
4 |
Enbrel |
Wyeth, Amgen & Takeda |
Recombinant product |
6,583 |
|
5 |
Lantus |
Sanofi-Aventis |
Recombinant product |
6,386 |
|
6 |
Herceptin |
Roche |
Monoclonal antibody |
5,796 |
|
7 |
Crestor |
AstraZeneca |
Small molecule chemistry |
5,739 |
|
8 |
Spiriva |
Boehringer Ingelheim |
Small molecule chemistry |
5,552 |
|
9 |
Remicade |
SGP, J&J &Mitsubishi Tanabe |
Monoclonal antibody |
5,220 |
|
10 |
Gleevec/Glivec |
Novartis |
Small molecule chemistry |
5,136 |
출처 : EvaluatePharma(2014)
최근 바이오의약품의 상대적 매출 성장세의 가장 큰 요인 중 하나는 공교롭게도 patent cliff라고 불리는, 합성신약계의 블록버스터 약품들의 특허 만료로 인한 매출 감소에 기인한 것이다. 즉, 최근 수년 간 매년 10억불 이상의 매출을 안겨 주었던 합성신약의 특허 만료에 따른 제네릭 약품들의 출현과 시장 견제로 인하여, 소위 글로벌 제약사들은 전체 매출의 큰 손실을 맞게 되었고, 이러한 손실의 틈을 타서 상대적으로 특허 만료 기간에 여유가 있는 바이오의약품들의 매출 비중이 높아지게 된 것이다. 그러나 간과할 수 없는 또 다른 요인으로는 최근 항암제로서의 항체 의약품들의 선전을 들 수 있으며, 신생혈관저해제, 항체-약물 중합체, 그리고 신규 표적 항체 항암치료제들의 괄목할 만한 개발 성공, 승인 및 성공적인 시장 안착에 힘입은 바가 크다.
나. 해외 동향
2015년 1월에 미국 FDA의 CDER(Center for Drug Evaluation and Research)에서 공식 발표한 자료에 따르면 2014년도에 총 41종의 신약이 시판 허가를 획득하였고, 이는 2005년부터 2013년까지의 평균 신약 승인 횟수인 25회에 비하여 크게 향상된 수치이다. 이는 그동안 통상적으로 이해되어 왔던 신약개발절차의 난점에도 불구하고 수년간의 혁신과 시도가 성과로 이어진 사례로 해석되며, 특히 규제기관의 심사절차의 유동적 운영과 규제기관과 개발사 간의 유기적 협의에 의한 성과로도 해석된다.
신약승인절차로서 합성 저분자 화합물인 new molecular entities(NME)의 승인을 위한 New Drug Applications(NDA)와 new therapeutics biologics의 승인을 위한 Biologics License Applications(BLA) 두 가지로 나뉘는데, 본 제에서 다루고 있는 바이오의약품의 승인 절차는 BLA에 해당된다. [그림 4-2-6]은 1994년부터 2014년까지의 미국 FDA의 신약승인 횟수를 보여주며, 특히 바이오의약품 신약의 승인에 대한 비율도 나타내고 있다. 녹색으로 보여 주는 부분에 해당하는 BLA 승인 횟수로 볼 때, 고전적인 신약에 해당하는 NME 개발에 비하여, 해를 거듭할수록 상당한 숫자 바이오의약품이 신약으로 승인되는 것을 알 수 있다. 현재 많은 글로벌 제약사 및 바이오회사에서 미래 전략으로 바이오의약품 개발에 큰 관심을 가지고 투자를 아끼지 않고 있으며, 이에 대한 결과는 향후 10년간의 신약 승인에 있어서 바이오의약품의 비중이 꾸준히 상승할 것으로 보아 질적인 상승 뿐 아니라 양적인 상승에서도 그 트렌드를 예측할 수 있을 것으로 본다.

출처 : FDA
[그림 4-2-6] 1994년∼2014년 미 FDA의 신약승인 횟수
다. 바이오의약품 개발의 난점
대부분의 바이오의약품은 매우 복잡다단한 물질로 이루어져 있으며, 현존하는 과학이 제공하는 도구로 완벽하게 재현 가능한 분석이 불가능한 면이 있다. 이러한 난점은 바이오의약품 개발 및 시판을 위한 생산 단계 전반에 걸친 걸림돌에 해당되며, 시험법의 개발, 문서화 작업, 규제기관의 노력 등 이를 해결하기 위한 여러 가지 시도들이 행해지고 있다. 바이오의약품은 예를 들면, 온도의 변화, pH의 변화 등 공정상의 혹은 보관상의 작은 조건의 변화에도 민감하며, 이러한 작은 변화로 인하여 최종 물질 및 최종 약제의 특성, 안정성, 효능 등에 큰 변화를 초래할 수 있다. 바꿔 말하면, 이러한 생산 시의 민감성이 결국은 환자를 치료하는 효능 및 독성에 있어서 큰 영향을 미칠 수 있으므로 규제 기관에서는 이러한 바이오의약품의 태생적 특성 및 한계를 인지하여 그에 해당하는 규제 및 문서화 작업을 요구하게 된다. 예로 생산 시설 및 생산 설비의 변동, 공정상의 변화 등이 있을 시에는 안전성, 순도, 및 효능에 대한 재검증, 동등성에 대한 검증을 필요로 하게 된다. [그림 4-2-7]에서 보는 바와 같이, 기존의 고전적인 약품 중 하나인 아스피린에 비하여 항체 의약품은 분자의 크기 및 복잡성에 대하여 비교 불가능한 태생적 난점을 보유하고 있으며, 전임상․비임상 및 임상 개발 시 이에 대한 적절한 통제와 보다 철저한 문서화 작업이 요구된다.

[그림 4-2-7] 바이오의약품인 항체의약품과 합성 의약품인 아스피린의 분자 크기와 복잡성 비교
라. 바이오의약품 개발 성공의 실례 : 암 면역 치료제로서 PD-1 (Programmed cell death-1)항체
최근 항암제 개발의 트렌드는 크게 변화하고 있으며, 이의 가장 중심에 있는 것이 암 면역체계를 조절하는 기전을 보유한 치료제 개발에 해당된다. 이는 종래의 비특이적 항암화학요법이나 암 유래 특이적인 타겟을 초점으로 하는 표적치료제와는 달리, 생체 내의 면역 체계를 활용하여 암의 면역 회피 체계를 공격하여 항암치료를 시도하는 새로운 분야에 해당된다. 최근에는 이러한 분야에서 수많은 항체치료제 및 세포치료제가 신약개발 파이프라인을 채우고 있고, 향후 항암치료의 패러다임을 크게 변화시킬 것으로 예측하고 있다.
그 중 가장 주목받고 있는 항체 의약품은 PD-1에 결합하는 항체 의약품에 해당된다. 생체 내의 T세포는 암세포를 인지하여 면역 체계를 통하여 암세포를 제거할 수 있는 능력을 보유하고 있으나, 이미 진행된 암의 경우 이러한 항암 면역 체계에 대한 회피 능력을 갖게 되고, 이의 기전 중에 하나가 암세포 표면에 PD-L1 (PD-1의 리간드)을 발현하여 T세포 상의 PD-1과 결합하는 것이다. 이러한 결합은 암조직의 면역 회피능력에 필수적이고, 이 결합을 저해하는 PD-1 결합 항체를 통하여 암 면역 회피를 저해하여(cancer immune checkpoint inhibitor) 항암 효능을 갖게 되는 것이다.
PD-1항체에 앞서 CTLA-4 결합 항체인 Ipilimumab이 전이성 흑색종 환자를 대상으로 한 치료제로서 2011년도에 FDA의 승인을 획득하였다. CTLA-4는 최초의 암 면역 회피 저해제로서의 의의를 갖으며, 암세포 표면의 항원의 인지 후 T세포의 유도와 활성화에 관여하는 것으로 알려져 있다. 그에 반해, PD-1은 좀 더 다양한 면역 체계의 하위 신호전달에 관여해 있으며, 면역 감시 기능을 보유한, 각종 주변 조직의 effector T세포의 활성에 관여하므로, CTLA-4를 타겟하는 것보다 훨씬 더 강력한 효능을 보일 것으로 예상된다.
Yervoy라는 제품명의 ipilimumab은 1,861명의 흑색종 환자를 대상으로 한 임상시험에서 3년 및 7년 생존률이 각각 22% 및 17%로 나타났다. 반응율은 다소 낮은 11%였으며, 독성 면에서도 46%의 환자가 3, 4도의 독성을 보인 관계로, 면역 관련 부작용에 대한 경고문구가 라벨에 삽입되었다.
2014년도 9월에 미 FDA의 신속심사 대상으로 Pembrolizumab이라고 하는 PD-1 항체가 신약 승인을 받았으며, BRAF 돌연변이 보유, BRAF 저해제 불응성 및 ipilimumab 불응성 전이성 흑색종 환자가 대상 적응증이다. Merck사가 Keytruda라는 제품명으로 시장에 내놓은 이 의약품은 흑색종으로 승인 받은 최초의 PD-1 항체라는 의의가 있다.
Pembrolizumab의 임상 1상은 총 173명의 흑색종 환자를 대상으로 하였으며 2mg/kg 혹은 10mg/kg을 3주에 한 번 투여하여 경과를 관찰하였다. 결과는 환자의 BRAF 돌연변이 보유와 무관하게, 2mg/kg인 경우 반응율이 24%였다. 2015년에 발표한 임상 3상 결과에 따르면, pembrolizumab 투여군인 경우 ipilimumab 투여 군에 비하여 progression-free survival과 overall survival의 유의한 증가를 보이며 낮은 독성을 나타내었다.
현재의 시점에서 Ipilimumab(Yervoy; Bristol-Myers Squibb), nivolumab (Opdivo; Bristol-Myers Squibb/Ono Pharmaceuticals)과 pembrolizumab (Keytruda; Merck & Co.)의 총 3종의 암 면역 치료제가 승인을 받아 시장에 안착하였고, 모두 악성 흑색 종을 적응증으로 하였다. 이 3종의 면역치료제는 현재 다른 적응증으로 확대하기 위하여 여러 암 적응증에서 활발하게 임상시험을 진행 중이며, 비소성세포폐암, 두경부암, 신장암, 신경교종, 방광암 등이 이에 해당된다. 각 암종에 있어서 효능을 극대화할 수 있는 방안으로 효능예측인자의 발굴, 반응환자의 항암 기전 연구 등의 다양한 접근법을 통하여 약품의 가치를 극대화하고 시장 점유율을 확대하려는 시도를 꾀하고 있다.
현재 PD-1 항체 외에 다른 다양한 항체가 암 면역체계를 타겟으로 하여 개발 진행 중에 있으며, 그 중에서 PD-1의 리간드에 결합하는 PD-L1 항체인 MEDI-4736(AstraZeneca)와 MPDL3280A(Roche)가 임상 3상 진행 중이다. 그 외에도 암면역에 관련된 다양한 타겟에 대한 항체 의약품들이 수많은 제약사와 바이오회사의 R&D 파이프라인을 채우고 있다.
특히, 이들 암면역 타겟의 항체들의 가치 상승에 주요한 요인은 이들 항체와 기존의 여러 약제 간의 병용 요법 및 효능의 상승작용에 대한 것이다. 이는 효능에 대한 검증뿐만 아니라 시장 확대 차원에서도 큰 가치를 부여하게 된다. 현재 개발사들을 주축으로 다양한 임상시험이 진행 중에 있으며, 항암면역치료제 2종을 병용(예, CTLA-4 항체와 PD-1 항체의 병용), 신생혈관생성 저해제와 병용, 합성 신약으로서 표적치료제와 병용(예, BRAF 혹은 MEK 저해제) 하는 임상시험이 활발하게 진행 중이다. Ipilimumab과 nivolumab의 병용은 전이성 흑색종 및 신장암 환자를 대상으로 이루어졌으며, 임상 1상 결과에서 약 53%의 반응율을 보였다. 그러나 3, 4도의 독성을 보인 환자가 63%나 해당되어 이에 대한 문제점과 동시에 높은 약가에 대한 난점을 해결해야 하는 상황에 직면하게 되었다. 이는 개발사 간의 공동개발 혹은 글로벌 빅파마와 병원, 학계 혹은 작은 바이오벤처 간의 공동연구 및 공동개발이 가장 활발하게 이루어지고 있는 분야이기도 하다. 즉, 개발사가 분산되어 있는 여러 다양한 병용치료에 대한 개발의 수요에 응하기 위해 이전에는 찾아보기 힘든 형태의 공동연구, 공동개발, 혹은 회사 합병 및 투자가 이루어지고 있고, 이로 인해 제약 R&D의 생태(ecosystem)에 큰 변화를 초래하는 결과를 낳기도 하였다.
암면역치료제의 시장은 2014년도에서 2020년도까지 매우 급격한 성장세를 보일 것으로 예상하며, 미국, 프랑스, 독일, 이태리, 스페인, 영국, 일본 등 세계 7대 시장에서 매년 33%의 성장률로 2013년도의 10억불에서 2020년도의 70억불로 성장할 것으로 예측하고 있다. 이러한 성장세는 현재 시도 중인 다양한 적응증에서 nivolumab, pembrolizumab, MPDL3280A, MEDI4736이 시장 안착에 성공했을 시를 가정한 것이다. 2022년도에는 PD-1 항체 시장이 전체 암면역치료제 시장을 주도하여 총 72%의 시장점유율을 보일 것으로 예상한다. Nivolumab의 경우 다양한 적응증에서 단독 혹은 ipilimumab과의 병용요법을 통하여 2020년에 총 30억불 매출을 예상하고 있다. 이러한 수많은 암면역 타겟의 항체의약품의 경쟁 구도에서 병용요법의 다양성과 타당성을 근거로 한 특장점 및 차별성을 보유한 항체의약품만이 시장점유율의 변화를 유도할 수 있을 것으로 예측된다.

[그림 4-2-8] 암면역치료항체 시장의 전망, Source : Nature Review, Drug Discovery
마. 향후 전망
새로운 바이오의약품의 개발은 오랜 시간과 많은 비용이 소요되는 복잡한 프로세스다. 최근 1종의 신약을 개발하기까지 총 소요비용에 대한 평균치를 계산해 본 데이터에 따르면 대체적으로 신약 1종 당 10~15년의 기간과 12억불 가량의 비용이 소요된다고 한다. 그럼에도 불구하고 새로운 시도는 이 시간에도 이루어지고 있으며, 현재 전 세계의 신약 파이프라인에는 대략 5,000종 이상의 신약이 개발 중이고, 이 중 수백 종의 신약이 최근 10년 간 꾸준히 승인되어 환자들의 의학적 수요를 만족시켜 왔다.
이러한 바이오의약품의 효율적인 개발과 안전한 치료법 확립을 위해서는 규제기관과 개발사 간의 유기적인 협력이 필수적이다. 특히 바이오의약품의 많은 사례가 보여주듯이 기존의 방법과는 차별화된 혁신적인 신약일 경우 규제기관이 안전성에 대한 기준은 유지하되 혁신적인 접근법 및 유동적인 검토 일정이 요구된다.
시장의 측면에서 보면, 2002년 전체 바이오의약품의 매출은 약 460억불 이었으나, 2012년에는 1,690억불에 이르게 될 정도로 크게 성장하였다. 2006년에는 약 20종의 블록 버스터급 바이오의약품이 시장에 존재하였지만, 2012년에는 그 수가 33종으로 증가하였다. 이대로라면 바이오의약품의 성장세는 기존의 제약 전반의 성장세를 크게 웃돌며, 향후 2017년에는 전체 제약 시장의 19~20%를 차지하고, 전체 매출은 약 2,210억불에 해당할 것으로 전망하고 있다. 항체의약품뿐만 아니라 백신과 세포치료제 등의 성장세도 평균 약 9.5% 이상이 될 것으로 예측된다.

출처 : IMS Health
[그림 4-2-9] 바이오의약품 시장 규모 및 성장세
시장의 성장세와 맞물려 제약 업계가 이러한 혁신적인 바이오의약품에 거는 기대치는 전무후무할 정도로 매우 크며, 실제로 글로벌 제약사 및 바이오텍사의 R&D 활동의 상당 부분을 바이오의약품의 개발에 투자하고 있는 실정이다. 바이오의약품은 대부분 최신의 혁신적 과학 검증 결과를 토대로 중개 연구를 통해 고안된 새로운 방법의 치료제에 해당하므로, 오랜 연구에 대한 결실로써 최근 인체와 질병에 대한 과학적 이해도가 급증함에 따라 향후 큰 성과로 결실을 맺을 것으로 예상되다. 또한 바이오의약품의 시장 성장세에 따른 기대치 증가 및 개발에 대한 투자 규모의 상승세를 고려해 본다면 미래에는 다양한 종류의 획기적이고도 혁신적인 바이오의약품이 지속적으로 등장하여 의약품 시장의 변화를 주도할 것으로 전망한다.
3. 바이오장기
가. 바이오장기의 개요
(1) 바이오장기의 정의
ʻ바이오장기ʼ란 기능을 잃은 인간의 조직과 장기를 복원, 재생, 대체하기 위해 생명 공학적 기법을 이용하여 인간생체의 장기와 같은 기능을 갖는 기기를 인공적으로 만든 것을 말한다. 줄기세포, 조직공학, 바이오 인공장기, 바이오 이종장기연구 분야 등을 포함하며, 이를 위해서는 세포활용기술, 이종장기생산기술, 면역조절기술, 장기이식기술, 생체조직공학기술 등의 생명공학 핵심기술이 요구된다.
(2) 바이오장기의 필요성
고령화에 따라 장기부전환자의 수가 기하급수적으로 증가하고 있으며, 이들 환자에게는 장기이식수술이 유일한 치료법이지만 타인으로부터 공급되는 장기의 절대수가 부족한 상황이다.
(가) 장기이식 수요 및 공급 현황
국내외적으로 장기이식 대기자 수는 매년 증가하고 있는데 반해 장기공급은 제한적이며, 국내에서 장기이식을 기다리고 있는 환자는 2000년 이후 계속적으로 증가하여 2014년에는 약 24,600명에 이르고 있다. 장기기증을 희망하는 사람의 수는 저조한 반면, 대기 중인 환자 수가 늘어남에 따라 이식 대기 중에 사망하는 환자 또한 증가하고 있는 실정이다. 이 같은 현상은 미국을 비롯하여 전 세계적으로 나타나고 있으며, 특히 국내에서는 성인병의 증가, 고령화, 유교문화, 핵가족화의 영향으로 외국보다 이식 장기의 수요와 공급의 불균형 현상이 심각하다. 이러한 결과로 불법 장기 매매가 성행하고 있으며, 최근에는 국내보다 의료기술 수준이 낮은 외국에서 장기이식을 받는 사례가 증가하여 심각한 사회문제를 일으키고 있다.

출처 : 국립장기이식관리센터(KONOS) 2014
[그림 4-2-10] 연도별 국내 장기이식대기자 추이

출처 : http://www.organdonor.gov/about/data.html
[그림 4-2-11] 연도별 미국 내 이식대기자(Waiting List), 이식환자(Transplats), 장기공여자(Donors) 수
(나) 대체장기로써의 바이오 이종장기
부족한 수의 대체장기를 확보하는 방법으로 줄기세포 분화, 생체조직공학을 이용한 조직재생, 바이오 이종장기 등이 있다. 하지만 줄기세포는 아직 복잡한 세포분화과정을 조작하는 것에 대한 이론적 토대가 마련되어 있지 않으며, 대량생산이 어렵기 때문에 상용화까지 많은 시간이 걸릴 것으로 예상된다. 또한 생체조직 공학적 방법을 이용해 사람의 연골, 뼈, 피부를 생산하는 방법이 있으나, 복잡한 기능을 수행하는 장기를 제작하는 데에 많은 어려움이 있다. 이에 반해 바이오 이종 장기는 사람이 아닌 다른 종의 동물로부터 이식을 목적으로 생산된 장기를 사람에게 이식함으로써 부전된 기능을 빠르게 회복시킬 수 있기 때문에 대체장기로 가장 적합하다.
[표 4-2-6] 부족한 장기를 대체할 수 있는 방법
|
장기 대체방법 |
심장 |
신장 |
간장 |
폐 |
|
동종이식 |
현재 적용 중 |
현재 적용 중 |
현재 적용 중 |
현재 적용 중 |
|
인공장기 (기계적장기) |
현재 적용 중 |
개발 중 |
현재 적용 중 |
개발 중 |
|
세포치료 |
개발 중 |
- |
개발 중 |
- |
|
조직공학 |
개발 중 |
개발 중 |
개발 중 |
- |
|
인공장기 (바이오장기) |
- |
개발 중 |
- |
- |
|
이종장기 |
개발 중 |
개발 중 |
개발 중 |
개발 중 |
출처 : J Korean Soc Transplant 2009;23: 203-213
[표 4-2-7] 장기 부족에 대처하기 위한 해결책
|
해결책 |
적용 가능한 장기 |
현재 상태 |
|
돼지 이종장기 이식 |
대부분의 장기 (간은 더 많은 연구가 필요) |
전임상시험 중 (돼지 췌도는 일부 임상적용) |
|
기계적 장치 |
대부분 심장환자 |
동종이식시까지 임시 방편으로 사용 |
|
바이오 인공 신장 |
급성신부전증 환자의 세뇨관 보조기구 |
체외 투석 |
|
줄기세포에서 분화된 조직 |
모든 장기 |
세포치료는 실험단계 (일부 임상시험) 고형장기는 초기단계 |
출처 : J Korean Soc Transplant 2009;23: 203-213
(다) 바이오장기 공급원
사람에게 제공될 장기를 제작하기 위해서는 사람과 생리적인 면에서 유사점이 많아야 하고, 또한 대량 공급을 위해 번식이 잘 되어야 한다. 때문에 영장류는 사람과 가장 유사하지만 번식에 오랜 시간이 걸리고, 사람에게 치명적인 바이러스를 보유할 위험이 있으며, 전 세계적으로 희귀동물로 지정되었기 때문에 이종장기 제공 대상에서 제외되었다.
미니돼지의 경우 인간과 비슷한 크기의 장기를 갖고 있으며, 생리적으로 유사점이 많기 때문에 현재 가장 많이 사용되고 있다. 또한 어미 1두가 연간 20마리 이상의 새끼돼지를 생산할 수 있어, 이식용 장기의 대량공급이 가능하여 이식 대기시간이 단축된다. 또한 간염이나 AIDS 바이러스와 같은 치명적인 감염원의 회피가 가능하다는 장점이 있다.
하지만 미니돼지를 이용할 때 대두되는 문제점인 돼지 세포 표면에 존재하는 당(sugar)에 의한 초급성 면역거부반응이 있으나 유전공학기법을 통한 형질전환돼지 생산이 가능하게 됨으로써 이를 극복할 수 있게 되었다.
(3) 바이오 이종장기 산업 발전을 위해 극복되어야 할 난관
(가) 장기이식 거부반응 및 복제 기술의 불안정성
이종장기 이식 후에 일어날 수 있는 주된 문제점으로는 조직의 이식거부반응이 있으며 이러한 거부반응은 임상시험을 통해 동종이식보다 훨씬 빠르고 강하게 일어나는 것을 알 수 있었다. 이식거부반응이란, 이식된 장기가 수혜자의 체내에서 초급성 거부반응, 급성혈관성 거부반응, 세포매개성 거부반응, 만성 거부반응을 일으켜 장기로써 제 기능을 하지 못하고 괴사해버리는 것을 말한다. 활발한 연구를 통하여 이러한 이식거부반응의 기전은 비교적 많이 밝혀졌으며 이를 토대로 이식거부반응을 제어하기 위한 유전자 적중기술 및 형질전환돼지의 생산이 연구되어 왔다.

출처 : http://news.donga.com/3/all/20090423/8723567/1
[그림 4-2-12] 체세포복제에 의한 형질전환돼지 제조방법
돼지 세포 표면에 존재하는 당(sugar) 성분인 1,3-α-galactose에 의해 혈청보체계와 혈액응고계가 활성화되어 이식 후 수 분 이내에 초급성 거부반응이 나타난다. 이것을 극복하는 방법이 활발히 연구 중인데, 2002년 미국에서 1,3-α-galactose 전이효소가 제거된 형질전환돼지가 개발되었으며33), 국내에서도 2009년 4월 1,3-α-galactose 합성효소 유전자 중 하나가 제거된 미니돼지 지노, 지노 2의 개발에 성공하였다. 지금까지도 형질전환돼지에 관한 연구가 활발히 이루어지고 있으며 향후 이종이식 연구에 초석이 될 것이라고 예상된다.
급성혈관성 거부반응은 자연항체, 자연 살해세포, 단핵구에 의해 혈관내피세포가 활성화됨에 따라 나타나는 반응이다. 이는 혈청보체 조절인자가 형질전환된 돼지를 제작함으로써 혈관내피세포의 안정화, 내피세포유래 면역 매개물질 조절 및 혈소판 기능조절이 가능할 것이라 예상된다.
세포매개성 거부반응은 이종항원에 의해 면역세포가 활성화되어 나타나는 반응으로 동종이식에 사용되고 있는 면역억제방법과 면역관용유도 기술을 통하여 극복하려는 노력이 시도되고 있다.
이와 같이 초급성 거부반응, 급성혈관성 거부반응 및 세포매개성 거부반응을 제어하기 위해 관련 유전자들의 적중이 시도되고 있으며 이를 통하여 바이오 이종장기의 제작이 가능한 형질전환돼지의 생산이 가까운 미래에 가능할 것으로 예상되고 있다.
또한 복제된 동물들이 유산, 사산, 태어난 지 며칠 되지 않아 죽는 등의 문제를 극복하기 위해 형질전환 복제동물의 생산성 안정화 및 생산효율 증진을 위한 기술도 개발 중에 있다.
위와 같이 이종장기 이식에 적합한 형질전환 복제돼지를 생산하는 기술은 관련 유전자의 발굴과 체세포 유전자 적중기술 등을 통하여 어느 정도 기반이 확립된 상태이다. 앞으로는 현존하는 몇 가지 문제점을 개선하는 것과 산업화를 위한 연구가 필요할 것으로 전망된다.
(나) 안전성 문제
인수공통감염병원체는 돼지의 무균화를 통해 차단할 수 있다. 그러나 돼지의 내인성 레트로바이러스의 경우 바이러스 유전자가 돼지세포의 염색체내에 삽입되어 다음 세대로 유전되므로 무균화 작업을 통해서 제거되지 않는다. 이는 이종이식의 임상 적용에 있어서 해결해야할 문제 중 하나로 대두되고 있다. 그러나 현재까지 다수의 영장류 이식실험과 이종이식을 받은 환자에서 돼지 내인성 레트로바이러스 감염이 확인되진 않았다.
(다) 사회적, 생명윤리적 문제
아직까지는 이종이식이 초기 단계인 만큼 이종이식을 받은 수여자들에 대한 추적관리가 요구될 것으로 전망된다. 이는 수여자들의 혈액이나 조직 기증에 제한되지 않고 성생활이나 출산에도 영향을 미칠 수 있다. 따라서 피험자의 인권 보호를 위하여 사회적, 생명윤리적 공감대를 논의하는 장이 필요할 것으로 생각된다.
나. 바이오장기의 국내 기술 동향
국내에서는 보건복지부와 농촌진흥청에서 주관하는 ʻ바이오이종장기개발사업단ʼ과 ʻ동물바이오신약장기개발사업단ʼ에서 이종장기 이식용 복제 돼지를 생산하기 위한 노력을 하고 있다. ʻ바이오이종장기개발사업단ʼ 은 2004년 출범하여 2012년도까지 1단계에서 WHO(세계보건기구)의 장기이식원 권고기준을 만족시키는 미니돼지를 생산하였다. 2013년도부터 시작되는 2단계에는 이종장기용 돼지 생산과 면역거부반응 조절을 위한 이종장기의 전임상 및 임상적용에 대한 연구를 진행할 계획이다.

출처 : 바이오이종장기개발사업단 www.xenokorea.org
[그림 4-2-13] 바이오이종장기개발사업단 사업개요
또한 ʻ동물바이오신약장기개발사업단ʼ은 차세대바이오그린21사업의 일환으로 이종장기 이식용 형질전환 돼지의 제작 및 생산에 노력을 하고 있으며 최종적으로 바이오장기의 실용화를 사업의 목적으로 하고 있다.
(1) 형질전환 돼지의 개발
2014년도에는 차세대바이오그린21사업의 일환으로 진행된 공동 연구를 통하여 현상환 교수팀은 유전자 발현이 조절된 형질전환 복제돼지 생산 기술을 개발하였다. 연구를 통하여 현상환 교수팀은 테트라사이클린 계열의 항생제인 ʻ독시사이클린ʼ에 노출됐을 때만 특이적으로 반응해 유전자 발현되는 Tet on/off 시스템을 성공적으로 구축하였다. 연구팀은 돼지 태아 유래 섬유아세포에 녹색 형광(GFP) 유전자를 삽입하고 체세포 복제를 통하여 형질전환 수정란을 생산하였으며, 복제 수정란을 대리모 돼지에게 이식함으로서 형질전환 복제돼지를 생산하였다. 이후, 생산된 형질전환 돼지에 테트라사이클린이 첨가된 사료를 급여했을 때 돼지의 신체 곳곳에서 녹색형광단백질이 발현되는 것을 확인하였다. 이와 같은 기술은 향후 인체 치료용 단백질을 생산하는 형질전환동물과 장기공여용 형질전환 돼지를 생산하는데 큰 파장을 일으킬 것이라 전망된다.
또한 같은 해인 2014년도에 건국대와 미국 미주리대학의 공동 연구를 통하여 면역기능이 완전히 결핍된 새로운 질환동물모델이 세계 최초로 생산되었다. 건국대학교 김진회 교수팀은 외부 항원이 침입했을 때 생체면역시스템을 활성화 시켜주는 ʻRAGʼ 유전자를 제거시킨 형질전환 복제 돼지를 생산하는데 성공했다. 개발한 면역결핍 돼지는 생체의 초기 면역기전의 중요 역할을 하는 흉선의 발달이 완전히 억제 되어있다. 또한 비장 발달도 저해되어 생체 내 면역 기능을 담당하는 성숙 T세포와 B세포가 제거된 면역결핍모델 동물이다. 이 형질전환 돼지는 생체 기전이 인간과 유사해 인간의 질병치료 연구의 최적 모델로서 인정받고 있다.
2015년도에는 2단계 바이오이종장기개발사업단과 ㈜엠젠플러스가 연구협력 MOU를 체결하였으며 이종장기 이식용 형질전환돼지에 관한 공동연구에 나섰다. 이번 공동연구는 이종장기 이식을 했을 때, 수 시간 내에 이식된 장기의 사망을 초래하는 초급성 거부반응을 제어함과 동시에 급성거부반응 제어유전자, 혈관성 거부반응 제어유전자가 동시에 삽입된 형질전환 돼지의 생산을 목표로 한다. 연구를 통해 생산된 형질전환돼지는 이종장기이식의 임상화를 위해 향후 영장류 전임상 시험에 활용할 계획이다. 2단계 바이오이종장기개발사업단에서는 전임상시험에 심장을 비롯한 고형장기 뿐만 아니라 췌도 및 각막 등으로 이종장기 연구 분야를 점차 확대해 나갈 계획이다.
또한 면역거부반응을 일으키는 α-GalT 유전자가 제거된 형질전환 돼지 ʻ지노ʼ를 탄생시킨 단국대 심호섭 교수팀은 돼지세포 표면에 존재하는 당(sugar) 분자에 관한 연구를 이어가고 있다. 연구팀은 2015년 ʻMolecules and cellsʼ에 형질전환 돼지 세포에 존재하는 N-글리칸(N-glycan)의 형태와 양에 대한 분석결과를 게재하였다. 연구팀은 향후 돼지-사람간의 장기이식에 있어 α-GalT 유전자와 더불어 N-글리칸에 대한 연구가 요구 될 것이라 전망하였다.
(2) 형질전환 돼지의 전임상 시험
2014년에 삼성서울병원 장기이식센터에서 돼지와 영장류 간의 췌도이식에 성공했다. 연구진은 초급성 면역거부반응 유전자인 α-GalT 유전자가 제거 된 형질전환 돼지의 췌도를 당뇨병이 걸린 원숭이에게 이식하였다. 이 원숭이는 췌도 이식 후 인슐린을 거의 쓰지 않고 6개월 이상 정상혈당을 유지한 것으로 알려졌다. 앞으로 이종의 췌장을 활용한 이식에 있어 기술적인 안정성만 확보가 된다면 향후 난치성 당뇨 환자들에게 큰 도움이 될 것으로 예상된다.
또한 2014년도에 초급성 면역거부반응을 일으키는 α-GalT 유전자가 제거되고 초급성과 급성거부반응에 관여하는 유전자인 MCP 2가 도입된 형질전환돼지 ʻ믿음이ʼ의 심장을 원숭이에게로의 이식이 성공하였다. 형질전환돼지의 개발과 공급은 국립축산과학원에서, 장기 이식수술은 건국대학교 윤익진 교수팀이, 이식 전후 면역 모니터링과 이식 후 원숭이의 건강관리는 서울대학교 안규리 교수팀에서 진행하였다. 이 원숭이는 43일 이상 생존하였으며 형질전환돼지와 원숭이 간의 고형장기이식의 성공적인 사례가 되었다.
2015년도 서울대학교 박정규 교수팀은 형질전환 돼지의 각막 전체를 원숭이에게 이식한 뒤, 면역 억제요법으로서 항 CD154 항체를 투여하였다. 연구팀은 항 CD154 항체를 투여 받은 원숭이들이 투여하지 않은 대조군에 비해 생존기간이 길어졌음을 해외유명 저널인 ʻThe Journal of Immunologyʼ에 보고하였다. 향후 항 CD154 항체는 형질전환 돼지와 원숭이간의 이종각막이식 모델에서 면역거부반응을 효과적으로 제어할 수 있을 것이라 기대하고 있다.
출처 : 생화학분자생물학회 http://www.ksmbmb.or.kr/ksbmb
[그림 4-2-14] 췌도이식 과정
다. 바이오장기의 발전과제와 전망
(1) 바이오장기의 발전과제
이종장기이식은 인공장기 및 줄기세포 분화 기술을 이용한 장기이식에 비해 빠르게 임상에 적용할 수 있는 기술이다. 최근 영장류 실험에서 이식된 이종장기가 거부반응 없이 장시간 제 기능이 유지되는 것이 관찰되었으며 수혜 동물의 생존기간 또한 연장되었다. 이것은 이종장기이식의 가능성을 입증한 연구였다. 향후 보체 활성, 응고증, 세포 매개성 거부반응과 같은 남아있는 장벽을 하나씩 극복해 간다면 가까운 미래에 이종장기이식은 생명을 구하는 치료수단으로 자리 잡을 것이다.
과학기술의 개발과 이종장기이식의 안정성 확보와 더불어 윤리적 문제 역시도 반드시 고려해야할 사항이다. 연구자들은 이종장기이식이 가져올 수 있는 위험성을 염두에 두고 세계이종이식학회나 WHO에서 제시하는 국제적인 가이드라인에 따라 이종장기의 임상시험을 수행해야만 한다. 뿐만 아니라 이종이식의 안전성을 확보하는 동시에 연구대상자와 사회를 보호하기 위하여 연구대상자 선정, 임상시험 관리·감독, 공여동물 사육시설 관리 등에 대한 규제를 임상시험 실시 전에 반드시 마련해야 할 것이다.
(2) 바이오장기의 전망
장기이식 수요의 폭발적 증가에 따른 수급 불균형으로 인하여 바이오 이종장기 시장규모는 급속도로 커질 것으로 전망된다. 바이오 이종장기는 장기 이식만을 기다리는 환자에게 고통을 덜어주고 희망을 줄 수 있을 뿐만 아니라 우리나라를 미래 바이오의약품 선진국가로 도약하게 할 미래 산업이 될 것이다. 현재까지 이루어온 바이오 이종장기 연구 성과와 기반 시설을 지속적으로 유지 및 발전시키고, 바이오장기 생산 규제와 가이드라인을 갖춘다면 향후 학문, 산업, 경제적으로 큰 기여를 할 것으로 예상한다.
4. 진단 및 의료기기
가. 개요
최근 20여 년간 암에 대한 기술적 진보에도 불구하고, 여전히 치료불응을 보이는 진행성 암의 경우 기존의 치료로는 해결되지 않고 거의 100%에 가까운 사망률을 보이고 있다. 또한 진단, 치료 및 후처리 비용의 증가에도 불구하고, 환자체감 의료서비스 품질은 저하되고 있어 이에 대응할 수 있는 맞춤형 치료/의료서비스에 대한 사회적 요구가 점차 증가하고 있는 추세이다.
맞춤형 의료시장은 2012년부터 2017년까지 연평균 9.5%의 성장률을 기록할 것으로 예상되며, 특히 암과 같은 질병의 빠른 진단, 효율적 치료방법에 대한 수요가 시장을 견인할 것으로 전망된다.34)
2015년 들어서 의료서비스 분야에서 가치 중심의 헬스케어 모델이 발전되어 감에 따라 전 세계 다국적 생명과학 회사들은 대규모의 데이터 분석, 기술통합 및 산업 간의 협력을 필요로 하는 개인맞춤 정밀의학 분야에 역량을 집중하고 있다. 의료기기산업계에서도 진단기기 업체와 대형 제약 업체, 의료기기 업체와 생명공학기기 업체, 그리고 중소기업과 중견기업체 간 협력관계가 눈에 띄게 활성화 되고 있어 향후 관련 헬스케어 시장의 판도변화가 예상된다.
모바일 의료용 앱(Mobile Medical Applications(App)) 및 환자감시용 웨어러블기기의 사용이 증가함에 따라, 이 분야 선도 업체들은 제품개발의 혁신과 함께 수집된 데이터의 적정관리 방법 및 개인정보 보안유지를 위한 연구를 진행 중이며, 아울러 관련 의료기기 허가 및 서비스 시행에 대한 모호한 정부규제의 해결을 요구하고 있다.
나. 국내·외 동향
(1) 의료기기산업의 전략적 파트너쉽 구축
2011년 이후 의료기기 산업계는 기업체 간 활발한 인수합병을 통해 새롭고 혁신적인 제품개발에 주력하여 의료기기의 글로벌 포트폴리오를 구축하고 있다.35)
헬스케어서비스 구조가 점차 복잡해짐에 따라 중소 의료기기 제조업체들도 제품의 가격경쟁력 확보를 위해 업체 간 인수합병이 활성화 되고 있다. 의료 소비자들에게도 개인맞춤 정밀의학과 모바일 헬스케어 등 디지털 헬스케어 서비스의 등장이 현실로 다가오고 있어, 향후 지속적 발전이 예상된다.36)
(2) 진단의학과 생물공학
진단의학과 생물공학은 개인맞춤 정밀의학 분야로 점차 발전하고 있다. 과거의 진단의학은 환자의 질병을 확인하는데 그친 반면, 현재의 진단의학은 해당 질병의 진행상황을 예측할 수 있도록 하며 특정 환자에게 가장 적합한 치료법을 제시하도록 발전하고 있다. 특히, 특정 환자의 DNA 염기서열을 분석함으로써 환자특이적인 진단 및 치료가 가능해 지고 있다. 많은 다국적 제약 회사들은 진단의학 기술을 연구개발 전략에 포함시켜 개인맞춤 치료제 개발에 주력하고 있다.
종양학 분야의 경우 Thermo Fisher Scientific사와 Illumina사는 현재 다국적 제약기업들과 함께 차세대 염기서열 분석(Next Generation Sequencing, NGS)을 기반으로 한 동반진단(Companion Diagnostics) 제품 및 서비스를 개발 중에 있다.
(3) 환자정보 관리 및 분석
의료진의 입장에서 대량의 환자정보를 효율적으로 관리할 수 있는 환자 감시장치의 등장은 환자 관리의 질을 향상시킬 수 있는 계기가 되었으며, 실제로 전자의무기록(Electnonic Medical Record, EMR) 등을 활용하여 많은 의료기록을 통합관리 함으로써 진료의 객관성 확보와 의료진 간의 효율적인 협진을 가능케 하고 있다37). 또한, 의료현장에서 웨어러블 기기의 사용이 증가함에 따라 관리대상 의료데이터의 양이 증가 할 것으로 예상되므로38) 해당 제조업체는 적절한 데이터 관리방법 및 보안기법을 마련해야 할 것이다.
(4) 웨어러블 기기와 모바일 의료용 앱
모바일 헬스케어(또는 mHealth)는 지난 몇 년간 전 세계적으로 빠르게 상용화되고 있고, 향후에도 지속적인 발전이 예상되는 분야이며, 모바일 헬스케어와 웨어러블 기기의 시대가 도래 하면서 새로운 유형의 웰니스 기기와 앱(어플리케이션) 등이 등장하게 되었고, 본 서비스 등이 규제대상인지 또는 규제해야 한다면 어떠한 기준을 통해 규제할 것인지 명확한 가이드라인이 없어 관련 산업분야의 발전을 저해하는 주요 원인으로 작용하고 있다.
업계의 추정에 따르면, 2015년 기준 5억 명 이상의 스마트폰 사용자들이 모바일 헬스 앱을 사용하고 있는 것으로 예상하고 있으며, 2018년까지 17억 명 이상으로 증가할 것으로 예상하고 있다. PwC Health Research Institute에 따르면 미국 의사의 약 90퍼센트가 향후 5년 내에 모바일 앱이 환자 건강관리에 필수적이 될 것이라고 판단하고 있다.
모바일 앱은 보통 시장출시에 걸리는 시간이 짧고, 기존 의료기기에 비해 비교적 완화된 규제가 적용될 수 있기 때문에 특히 스타트업 기업들에게 매력적일 수 있다. 특히 의료기기가 아닌 웰니스 앱의 경우 규제당국의 규제를 받지 않기 때문에 제조자 입장에서는 제품 공급 확대로 새로운 수익모델을 창출할 수 있게 되었다.
그러나 이면에는 모바일 헬스 앱은 단순한 편의성 향상이 아닌 진단이나 치료 효과와 같은 실제 가치 입증이 요구되기도 한다. 때문에 소비자와 사용자인 의사 모두 모바일 헬스 앱 구매 또는 처방의 기준으로 규제당국의 승인 여부를 고려한다고 한다.
2014년 들어서 건강관리용 웨어러블 기기를 포함하는 디지털헬스 분야에 대한 투자는 125% 정도 증가하는 양상을 보였다. 이러한 디지털헬스 분야의 기기는 개인의 건강관리와 활동량 측정뿐만 아니라 만성질환 환자와 아이들과 노인들의 안전을 원격으로 모니터링 할 수 있다는 점에서 대단히 중요한 의미가 있다. 하지만, 대부분의 해당 혁신기술은 헬스케어 산업에 익숙하지 않은 업체를 중심으로 개발되어 제품의 의료기기 해당여부 판단과 해당 서비스 시행과정에서 발생하는 정부규제에 부합해야 하는 어려움이 있다.
의료기기는 제품의 안전성, 성능 등에 대하여 해당국가 규제당국자(예, 미국 FDA)의 철저한 검증 및 승인을 통해 비로소 시장에서 판매 또는 환자에게 사용 될 수 있고, 승인과정에는 엄격한 규제 및 검증 절차가 존재하여 제품을 생산·판매하는 기업들은 해당 규제를 철저히 준수해야 한다. 아울러 의료용이 아닌 운동․레저용 등 비의료용 목적인 제품의 상품화 수요가 발생함에 따라 의료용, 비 의료용으로의 구분관리 필요성이 대두되고 있다.
최근 이러한 패러다임 변화와 신규 헬스케어 분야 서비스에 발맞추어 전 세계 주요국은 의료기기 관리와 제도를 빠르게 변화시키고 있으며, 관련 산업 성장에 저해가 되거나, 신규 비즈니스 모델 개발 및 제공에 장애가 되는 불필요한 규제는 완화하고 있는 추세이다. 미국 FDA에서는 지난 2013년 9월 “Mobile Medical Applicationsʼʼ에 관한 드래프트 가이드라인 발표에 이어 2015년 2월 최종 가이드라인을 공표하였다39). 여기에는 모든 앱과 관련 기기들이 FDA 규제를 적용 받아야하는 것은 아니나, 실제 그 기능이 제대로 작동하지 않을 때, 환자의 건강을 위협할 수 있는 기능을 가진 앱와 관련 기기들은 기존 의료기기가 받은 규제와 동일하게 적용됨을 표기하였다. 아울러 미국 FDA는 2015년 1월 General Wellness 가이던스(안)을 발표하여 의료기기와 개인용 건강관리(웰니스)제품의 판단기준을 명확히 하였다.
2015년 7월 대한민국 식품의약품안전처에서도 의료기기와 개인용 건강관리제품인 비의료기기에 대한 구분기준을 명확하게 하기 위하여“의료기기와 개인용 건강관리(웰니스)제품 판단기준”가이드라인을 제정하였다.
(5) 3D 프린팅
3D 프린팅 기술을 사용하여 의사가 특정 환자에 맞추어 임플란트의 모양과 크기를 조정해서 제작하거나 인간의 장기를 종이문서 출력 하듯이 쉽게 제작할 수 있는 기술은 이제 더 이상 먼 미래의 이야기가 아닌 현실로 다가오고 있다.
의료기기 제조업체들은 환자 맞춤형 임플란트, 보철, 용품, 수술도구 등을 제작하기 위해 적층가공(Additive Manufacturing)기술을 활용하고 있다. 특히 3D 프린팅 기술은 재생의학(regenerative medicine) 분야에서 중요한 역할을 하게 되어 혈관이 있는 생체조직, 뼈, 심장판막, 연골, 피부 등 주요 장기를 공급하게 될 것이다. 이러한 맞춤형 의료기기는 수술에 소요되는 시간뿐만 아니라, 수술 후 회복시간과 후속관리 시간을 대폭 줄일 수 있으며 결과적으로 의료비용의 감소로 이어질 수 있다. 3D 프린팅은 의료행위 방식을 대중기반 모델에서 개인 맞춤형으로 변화시키고 있다.
3D 프린팅 기술을 이용하여 대부분의 맞춤형 또는 복제 의료용품을 제작할 수 있게 됨과 동시에 지적 재산권(Intellectual Property, IP)의 침해 가능성이 커지게 되었다. 또한, 기존 의료기기의 표준 제조방식과는 다른 기술적인 고려가 필요함에도 불구하고, 적층 제조방식으로 만들어진 3D 프린터를 이용해서 제작된 기기는 기존 의료기기와 동일한 규제 기준을 적용하고 있다. FDA 등 규제당국에서는 3D 프린팅의 3차원 설계기술을 고려한 새로운 품질관리기준 설정을 고려하고 있다.
(6) 게임형태의 건강관리 앱
게임은 컴퓨터나 스마트폰을 통하여 많은 사람들에게 보편화되어 있다. 약 50%의 만성질환자는 의사의 처방과 지시를 제대로 지키지 않고 있는 것으로 파악되고 있으며 이런 게임으로 구현된 건강관리 앱을 단순히 재미의 차원이 아닌 환자의 건강관리를 위한 기본정보를 수집할 수 있도록 설계한다면 만성질환자들의 건강관리에 크게 기여할 수 있을 것이다.
(7) 휴머노이드(humanoid) 수술로봇
의료현장에서 로봇수술은 점차 정교해지고 활성화되어 최소 침습 수술이 보편화되고 있다. 기능이 향상된 로봇수술기가 개발됨에 따라 이제는 하나의 수술실 차원을 벗어나 원격으로 수술을 지원하는 단계로 까지 발전하고 있다.
(8) 생체 센서(Body sensors)
생체공학기술의 발달로 인체 주요 건강지표의 연속측정을 위한 초소형, 웨어러블 센서가 개발되어 활용되고 있다.
(9) 동력형 엑소스켈레톤(외골격) 로봇
동력형 엑소스켈레톤(외골격) 로봇의 개발로 상·하반신 마비환자의 운동 및 보행이 가능해 지고 있다. 생체신호 감지센서의 개발과 구동모터의 정밀조작기능으로 뇌신경과의 실시간 정보교환이 가능할 수 있게 된다.
(10) 환자맞춤 의료서비스의 가치
의료진과 환자는 치료법을 결정하고 어떠한 기기를 사용할지를 결정할 때, 입증된 환자데이터를 기반으로 하는 치료법을 선택하고 있다. 다국적 의료기기업체의 경우, 치료 전후에 지속적인 환자맞춤 정보를 의료진과 공유하도록 하는 헬스케어 플랫폼을 출시하여 치료의 효율성과 환자만족도를 높이고 있다.
(11) 환자참여 의료의 정착
건강관리의 주체가 병원중심에서 점차 환자중심으로 이동하고 있다. 인터넷 등을 활용하여 환자는 자신의 병증과 이에 대한 진단 및 치료방법에 대한 정보를 습득하게 되고, 웨어러블 기기 및 건강관리 앱 등을 통한 평상시의 건강정보를 분석하여 이를 의료진에게 적극 개진하고 의료진과 협의 후 최선의 진료법을 선택하는 방향으로 의료서비스 형태가 진화하고 있다.
다. 발전 전망
2015년 들어 의료기기 산업은 더 많은 기술이 융복합되고, 소비자 중심으로 변화하면서 큰 변혁의 해를 맞이하고 있다. 3D 프린팅, 모바일 헬스케어 앱 등 혁신적인 기술의 발달로 의료서비스 방식이 변화하고 있고, 이에 대한 적절한 규제의 재정립 등 규제당국의 역할이 중요해지고 있다. 더구나, 기존 전통의학의 개념이 예측, 예방, 맞춤 및 환자참여형 의학(Predictive, Preventive, Personalized and Participatory Medicine)을 포함하는“4P 의학(P4 Medicine)ʼʼ으로 변화하고 있는 추세이다.
ʻʻ4P 의학ʼʼ의 등장으로 건강한 웰니스 상태에서 질병의 예방 또는 예측이 가능해지고, 질병이 발생하더라도 쉽게 진료할 수 있게 된다. 질병을 예방 또는 예측한다는 것은 환자맞춤 진료가 가능해 진다는 의미이며, 수년이내에 개인의 유전체(individualʼs genome)분석을 미화 일천달러 이하로 수행 가능할 것으로 예측된다. 개인의 유전자 특성 차이는 고유의 외형적 특성뿐만 아니라 질병에 대한 감수성의 차이를 유발한다. 따라서 이러한 유전자 특성을 이용한 의학의 발전은 개인의 환경적 요인과 함께 환자맞춤으로 질병의 예방, 진단 및 치료가 가능하게 될 것이다.
ʻʻ4P 의학ʼʼ의 본격 시행을 위해서는 개인의 생물학적 및 건강정보의 처리에 대한 새로운 기준과 정책수립이 필요할 것이다. 특히, 개인의 유전체 정보는 개인의 현재 및 미래의 건강상태에 관한 모든 정보를 내포하고 있으므로 이권관계자 또는 보험회사 입장에서는 적극적으로 수집하고자 할 것이므로 보안유지 등 철저한 관리체계의 정립도 요구되고 있다.
ʻʻ4P 의학ʼʼ으로 인하여 향후 10년 이내에 전통 헬스케어산업 전반의 근본적인 변화가 초래될 것으로 예측된다. 이것은 기존 기업에게는 변화의 기회가 될 것이며, 새로운 기업에게는 ʻʻ4P 의학ʼʼ에 대한 도전의 기회가 될 것이다.
1) 높은 시장점유율을 차지하고 있으며 다양한 제품군을 제공하는 글로벌 기업을 뜻함
(Life Technologies, Illumina, Roche Diagnostics, Qiagen 등)
2) 바이오 인더스트리-유전체시장, 87호 (2014년)
3) 다부처유전체사업(ʼ14∼ʼ21/미래부·복지부·산업부·농림부·해수부/총 5,788억원)
4) BCC Research, Proteomics: Technologies and Global Markets, 2015
5) 주관부처: 미래창조과학부, 수행기간: 2012년~2017년, 2015년 연구비: 30억 원, 주관기관: 한국과학기술연구원)
6) 자체 검색
126
9) Wang, L. et al. (2013) Generation of integration-free neural progenitor cells from cells in human urine Nature methods 10, 84-89
10) Lu, J. et al. (2013) Generation of integration-free and region-specific neural progenitors from primate fibroblasts. Cell Rep 3, 1580-1591 .
11) Cheng, L., Gao, L., Guan, W., Mao, J., Hu, W., Qiu, B., Zhao, J., Yu, Y., and Pei, G. (2015). Direct conversion of astrocytes into neuronal cells by drug cocktail. Cell Research.
12) Cheng, L., et al (2014). Generation of neural progenitor cells by chemical cocktails and hypoxia. Cell Research.
13) Muguruma, K., Nishiyama, A., Kawakami, H., Hashimoto, K., and Sasai, Y. (2015). Self-Organization of Polarized Cerebellar Tissue in 3D Culture of Human Pluripotent Stem Cells. Cell Rep 10, 537-550.
14) Xia, Y., Sancho-Martinez, I., Nivet, E., Rodriguez Esteban, C., Campistol, J.M., and Izpisua Belmonte, J.C. (2014). The generation of kidney organoids by differentiation of human pluripotent cells to ureteric bud progenitor-like cells. Nature Protocols 9, 2693-2704.
15) McCracken, K.W., Catá, E.M., Crawford, C.M., Sinagoga, K.L., Schumacher, M., Rockich, B.E., Tsai, Y.-H., Mayhew, C.N., Spence, J.R., Zavros, Y., et al. (2014). Modelling human development and disease in pluripotent stem-cell-derived gastric organoids. Nature 1-19.
16) Okano, H., and Yamanaka, S. (2014). iPS cell technologies: significance and applications to CNS regeneration and disease. Mol Brain 7, 22.
17) Kang, et al. (2014). Reprogramming of mouse somatic cells into pluripotent stem-like cells using a combination of small molecules. 35, 7336-7345.
18) Baek, et al. (2014). Electromagnetic fields mediate efficient cell reprogramming into a pluripotent state. 8, 10125-10138.
19) Choi, et al (2014). A three-dimensional human neural cell culture model of Alzheimer" s disease. nature 515, 274-278. <>P>
20) Park, et al. (2015). Functional Correction of Large Factor VIII Gene Chromosomal Inversions in Hemophilia A Patient-Derived iPSCs Using CRISPR-Cas9. 17, 213-220.
21) Trends Biotechnol. 16, 373-378
22) http://sbi.jp
23) http://www.symbio.jst.go.jp
24) http://www.systembiologie.de
25) (PDB 등록코드 2XDL)
26) (PDB 등록코드 2XAB)
27) (PDB 등록코드 2XJX)
28) (PDB 등록코드 3KMX)
29) (PDB 등록코드 3L5F)
30)
32)
34)RNCOS E-Services Private Limited, Personalized Medicine Market Analysis, 2013.05
35) Silicon Valley Bank Financial Group. “Trends in Investments and Exits 2014.” Revised July 2014.
36) Hartford, Jamie. “5 Medical Technologies to Watch in 2015: Mobile Medical Apps.” Medical Device and Diagnostic Industry. December 15, 2014
37) The Economist Intelligence Unit. “Value-based healthcare: The implications for pharma strategy.” March 2014
38) Davies, Michael. “Wearable Tech Can Extend Clinical Analytics.” InformationWeek. August 12, 2014
39) U.S. Department of Health and Human Services Food and Drug Administration. “Mobile Medical Applications: Guidance for Industry and Food and Drug Administration Staff.” February 9, 2015

1. 농림
가. 개요
인류가 약 1만여년 전 유목생활에서 벗어나 정착하기 시작한 것은 식량작물을 재배하면서 부터이다. 야생초목의 종자를 털어서 땅에 심고 추수하여 먹거리화하기 시작한 농산업은 20세기에 들어와서 육종이란 학문을 통해 생산성과 맛, 품질이 우수한 품종들을 만들어냈다. 특히 제1대 교잡 품종 육성체계는 당시 농업의 녹색혁명이었으며 대량생산을 가능하게 하여 곡류생산이 급증하였으며, 일반 먹을거리뿐만 아니라 가공 산업의 발달을 가져와 수요가 증가하였다.
급속하게 증가한 세계 인구는 2010년에 70억 명을 넘었으며 생산보다는 소비가 많아지기 시작하였고, 2050년엔 90억 인구를 예상하고 있다. 이에 현재 생산되고 있는 식량의 약 70%를 더 증산해야 인류가 이 지구상에서 생존할 수 있을 것으로 예측된다. 소비가 수확량보다 더 빠르기 증가하기 때문에 식량의 부족은 국가의 안보까지도 위협할 수 있는 가능성을 가지고 있으며 현 상황을 총칼 없는 종자전쟁, 식량전쟁이라고 말하고 있다.
이런 일반 관행 육종방법은 한계가 있어 1990년대부터 새로운 생명공학기술이 작물개발에 활용되었으며 생산량 증대, 친환경, 내병성, 내충성, 환경내성 등 기능 강화 작물들을 개발하기 시작하였다. 최근 농작물 개발 산업은 종자, 제약, 유통, 비료, 농약, 바이오산업과 연계되고 있으며 향후 미래에는 빅테이터를 활용한 농업기반으로 모든 technology를 활용한 고효율, 고수확 제조농작물이 만들어지면서 해수농업, 우주농업 등으로 전개될 것으로 생각 된다.
최근 국내 농업도 기술적으로 많이 발전하였지만 선진국, 다국적기업들이 미래를 위해 투자하는 첨단농업기술개발 수준과 비교하면 격차가 매우 크다. 농업의 선진화는 필수이고 미래지향적 고부가가치 농작물을 개발해야 하며 이는 첨단 농업생명공학기술의 활용여부에 달려 있다. 즉 예전의 관행적인 전통육종 기술에 생명공학기술이 접목되어야 하며 이는 genomics, proteomics, metabolomics, transcriptomics 등 여러 omics 정보와 phenotyping, GM(genetically modified)기술, genome edition 등과 같은 새로운 첨단육종기술을 엮어 만든 융복합 농업기술이 요구된다. 이 첨단 융복합 농업기술에 대한 국내의 연구현황은 선진국의 약 50% 이하 수준에 머물러 있어서 국가적인 차원에서 좀 더 적극적 지원이 필요하다.

출처 : 농우바이오 정리, 2015
[그림 4-3-1] 농산업의 발달 과정
나. 산업현황
농작물산업은 산업적 측면에서 단순한 먹거리 산업을 넘어 여러 분야와의 연계산업으로 발전하고 있으며, 모든 연계산업에 접목되는 생명공학기술은 산업발전에 중추적인 R&D 기술로 자리매김하여 미래산업의 근간이 되고 있다. 농작물 생명공학 산업은 크게 (1) 종자산업, (2) 분자육종산업, (3) 분자농업 등으로 나눌 수 있다. 이 중에서 가장 규모가 큰 산업은 종자산업이며 분자육종산업과 분자농업은 최근에 나타난 산업으로 종자산업과 연계 된다.
(1) 종자산업
종자산업은 전 세계 인류와 동물의 먹거리를 책임지고 있으며 지금까지 단 한 번도 마이너스 성장한 적이 없는 산업이다. 평균적으로 약 3~5% 성장을 하고 있는데 2008~2013년까지 종자시장은 약 9%가 증가하였고 같은 기간 동안에 GM(genetically modified, 유전자변형)작물은 17% 증가하였으며 일반 non-GM종자시장은 약 3%, GM종자는 약 17% 증가하였다. 전 세계 종자시장은 2015년 약 482억불이며 2020년에는 615억불로 추정되고 있다1). 그리고 종자에 의해 만들어지는 생산물 시장은 종자시장의 약 50배로 2015년 기준으로 약 2.4조불 정도로 추산되는 매우 큰 시장이다.

출처 : Philips Mcdougall, 2014
[그림 4-3-2] 종자시장의 변화
(2) 분자육종산업
분자육종산업은 유전체정보, DNA 마커, genotyping, phenotyping, genome editing 등을 활용하여 작물 육종사업에 도움을 줄 수 있는 분야이다. 시장은 크지 않지만 농작물생명공학분야에선 필수적이며 점차 확대되고 있다. 분자육종은 시설비와 개발비가 높아서 주로 service 기업들이 대행하고 있는데 전문적으로 크게 운영하는 기업은 DNA LandMark와 Keygene 정도이며 나머지는 거의 영세기업들이다. 국내는 마크로젠에서 작물유전체정보에 대한 분석을 하고 있으며 분자육종관련 마커개발을 하는 회사는 (주)고추와육종과 (주)에프엔피라는 벤처기업이다. 또한 작물의 이미징 분석을 토대로 phenotyping을 전문적으로 하는 대표적인 기업으로서 독일의 LemnaTec과 체코의 Photon System Instruments(PSI)를 들 수 있는데 다국적기업에선 phenotyping DB를 구축하여 genotyping과 연계하는 분자육종의 새로운 분야를 개척하고 있다. 해외의 분자육종기업들은 대부분 다국적기업, 국립연구소, 학교에 기술을 이전하거나 service를 통하여 매출을 만들고 있다.
(3) 분자농업
분자농업은 특정 고가의 단백질, 호르몬, 생체활성물질 관련 유전자를 식물세포에 형질 전환하여 식물체를 재배하거나 식물세포를 배양해서 그 목적물질을 추출하는 산업이다. 특히 고등세포에 존재하는 바이오물질들은 대장균이나 미생물에서 대량 추출하는 것보다는 고등세포에서 추출하는 것이 활성이 훨씬 높다.
분자농업을 지난 20년 동안 미래 식물생명공학의 중요한 분야로 예측 했지만 기술적으로 쉽지 않았고 또한 임상실험을 해야 하는 관계로 영세기업들이 감당하기에 매우 어려운 점이 많았다. 2011년에 이스라엘의 Protalix라는 생명공학기업이 Gaucher병 치료제인 glucoceribrosidase를 당근 배양세포에서 추출하여 최초로 FDA승인을 받고 판매 중이다. 또한 Sembiosys(insulin), Biolex(antibodies), Prodigene, Medicago 등 여러 벤처회사들이 식물세포를 이용하여 특정단백질을 생산하여 임상에 임하고 있어 이 분야가 다시 크게 성장될 것으로 기대하고 있다. 이 분야에 유일한 국내기업은 (주)엔비엠으로 벼의 현탁배양세포로부터 bovine trypsin, enterokinase, hGM-CSF 등을 분리정제, 생산하여 국내에서 판매하고 있다.
나. 연구개발의 해외동향
(1) 종자산업
상업적으로 판매되는 농작물 종자는 크게 3가지로 나누어진다. 첫 번째는 자연교배(open pollination, OP) 재래종이며, 오래전부터 각 지역별 특색이 있는 종자로 자가수분을 통하여 지금까지 대대로 물려받은 종자이다. 현재는 종자기업에서 선발하여 대량생산하여 판매한다. 둘째는 종자기업에서 모계, 부계를 육성한 다음 교배를 통해서 선발한 제1대 교잡종으로서 잡종강세를 나타내는 품종이다. 마지막으로 특정 유전자를 삽입하여 고부가가치를 갖는 GM종자(유전자변형종자)로 육성방법은 F1 종자와 동일하다. 개발도상국이나 후진국은 OP 종자가 아직도 지배적이지만 점차 고가, 고품질인 F1 종자시장으로 전환되고 있는 실정이다. OP 종자는 R&D 투자가 거의 필요 없고 생산지만 있으면 되지만, F1 종자를 개발하려면 육성재료 확보 및 개발, 전통육종기술의 활용 등을 위하여 R&D 투자가 필요하다.
(가) 다국적기업의 품종개발을 위한 R&D 기반
종자산업은 소수의 다국적 기업들인 몬산토, 듀퐁, 신젠타, 리마그린이 전 세계 종자시장 60%를 점유하고 있다. 다국적기업들은 관행육종기술과 첨단생명공학 기술을 작물별, 목적형질에 따라 골고루 활용하는 여러 단계의 육성 파이프라인을 갖추고 있어서 최고의 품질을 갖는 품종개발에 성공하였고 빠른 속도로 종자시장을 평정하였다. 일반관행육종에는 교배육종, 여교배기술, MS(mail sterile), SI(self-incompatibility) 육종체계들을 활용하고 있으며 DH(double haploid), 돌연변이 등을 엮어 새로운 유전자원을 만들고 있다. 그러나 이런 관행 육종방법만으로는 새로운 고부가가치 품종개발에 한계가 있기 때문에 생명공학 기술이 접목되었다. 1980년대에 분자생물학이 발달하여 DNA marker를 이용한 선발(MAS)이 일반 육종에 적용되어 육종기간을 단축하고 비용을 대폭 절감하여 복합내병성, 기능성 종자개발이 용이하게 되었다. 1990년 중반 이후 GM 작물이 상업화됨에 따라 GM 작물에 대한 육종 방법이 화두가 되었으며 관행육종 방법과의 접목으로 기존 육종방법만의 결과에 비해 탁월한 효과를 주었다. 2000년대 중반부터 다국적 종자회사의 육종은 GM기술을 이용하여 non-GMO를 개발하는 새로운 육종기술들을 도입하기 시작하였다(NBT). 또한 최근에 유전체편집기술의 이용이 폭발적으로 증가하면서 유전체 정보에서 쉽게 돌연변이화하여 GMO를 대체할 수 있는 최고의 기술로 자리매김하였으며 이로써 막대한 연구비용과 위해성 논란을 갖는 GMO에서 탈피할 수 있게 되었다. 다국적기업들은 일반관행육종부터 모든 첨단육종방법을 활용하여 품종을 개발하면서 그 과정에서 나온 모든 정보를 DB화하고 분석하여 최종 품종을 선발한다.

출처 : 농우바이오 정리, 2015
[그림 4-3-3] 다국적기업의 품종육성 파이프라인. MAS(marker-assisted selection); MAB (marker-assisted backcross).
(나) GMO (genetically modified organism, 유전체변형작물)분야
① 재배면적과 시장
농업생명공학 응용을 위한 국제서비스(ISAAA, 2015)의 발표에 의하면 생명공학작물의 재배면적은 1996년 170만ha에서 2014년 181.5백만ha로 약 100배 증가하였다. 또한 전 세계적으로 28개국에서 1,800만 명에 이르는 농민이 GM작물을 경작하고 있으며 2014년 GM작물 총 경작면적은 세계 총 작물경작지의 약 10%에 달하고 있다. 총 12작물(옥수수, 콩, 면화, 유채, 사탕무, 알팔파, 파파야, 호박, 토마토, 피만, 포플라, 가지)이 재배되고 있으며 특히 콩의 82%, 면화의 68%, 옥수수의 30%, 캐놀라의 25%가 GMO이다. 국가마다 다르지만 미국에서 생산하는 콩과 옥수수의 약 95%는 GM작물이다. 전체 GM 종자시장은 1996년 0.93억불에서 2014년 157억불로 성장하였으며 전체 종자시장(약 482억불, 2015)의 약 33%에 해당되어 인류역사상 농업에 이렇게 빠르게 특정 기술이 적용된 것은 처음이다. 또한 여러 data에 의하면 수확량 증가와 농약절감에 지대한 역할을 하고 있으며 약 20년이 지난 지금까지 환경이나 인체의 위험성에 대한 논란은 지속되고 있지만 과학적으로 위험성은 감지되고 있지 않다.

출처 : ISAAA, 2015
[그림 4-3-4] 세계 GM작물 재배면적(1996∼2014)
[표 4-3-1] 세계 GM종자시장의 변천. GM종자시장과 기술료를 합친 금액
|
1996 |
1998 |
2000 |
2004 |
2006 |
2008 |
2009 |
2010 |
2011 |
2012 |
2013 |
2014 |
year |
|
0.09 |
1.51 |
2.42 |
5.10 |
6.70 |
9.04 |
10.48 |
11.70 |
13.20 |
14.60 |
15.60 |
15.70 |
B$ |
출처 : 농우바이오 정리, 2015
② 현 GMO 연구방향 및 향후 연구방향
GM작물의 특성은 제초제저항성, 곤충저항성, 바이러스저항성, 아밀로스프리 등이며 특히 제초제저항성과 해충저항성 형질이 같이 들어가 있는 경우가 늘고 있다(stacking). 형질로 보면 가뭄내성이 급성장하고 있는데, 가뭄내성 옥수수는 이미 시판중이며 가뭄내성 밀, 면화, 콩이 개발 중이다. 또한 위해성평가가 이미 승인이 된 작물로는 항암 효과가 있는 파인애플, 심장 건강에 도움을 주는 보라색 토마토 그리고 저지방 식물성 오일을 만드는 대두, 감귤녹화병 저항성 오렌지, 갈변현상을 없앤 사과, 질병 저항성과 품질을 향상시킨 복숭아와 체리, 사과 등이다. 그리고 나무 분야에서는 짧은 기간에 산림조성과 벌목이 가능한 미루나무(포플러)와 유칼리나무가 주목받고 있는데 추운지방에서 잘 자랄 수 있는 유칼리스와 바이오매스생산량이 20~30% 이상 높은 유칼리스와 포플러의 상용화가 추진 중이다. 또한 화훼작물로는 여러 색깔의 카네이션(moon series)과 blue 장미가 상업화 중이다.
[표 4-3-2] GM형질 및 해당작물
|
|
GM 형질 |
작물 |
|
지금까지 상업화된 GM 형질 |
제초제저항성 해충저항성 바이러스저항성 아밀로스프리 가뭄내성 숙성지연 색깔 |
대두, 옥수수, 캐놀라, 사탕무, 알팔파, 면화 대두, 옥수수, 캐놀라, 면화, 가지, 포플라 파파야, 호박, 피만 감자 옥수수 토마토 장미, 카네이션 |
|
현재 상업화를 위해 개발 된 기능성 GM 형질 |
항암 보라색 저지방오일 감귤녹화병 저항성 갈변방지 질병 저항성과 고품질 아크릴아마이드 감소 저온내성 바이오매스향상 리그닌감소 가뭄저항성 비타민 A |
파인애플 토마토 대두 오렌지 나무 사과 복숭아, 체리, 사과 감자 유칼리스 유칼리스, 포플라 알팔파 사탕수수 벼 |
|
미래 GM 형질 |
고효율 질소고정 고온내성 염분저항성 고효율 광합성 저산소 내성 |
곡류 |
출처 : 농우바이오 정리, 2015
(2) 분자육종산업
우수품종을 개발하기 위하여 실시하는 첨단 육종프로그램에는 다양한 기반기술(platform technology)이 있으며 다국적기업들을 포함하여 유럽의 종자회사들은 대부분 이 기술들을 활용하고 있다. Keygene이나 DNA LandMark 같은 회사들은 특정 기술들만 운영하고 있으며 육종프로그램을 도와주는 service와 outsourcing 역할을 한다.
[표 4-3-3] 농작물 육성관련 첨단 생명공학기술의 종류
|
Platform Technology |
몬산토, 신젠타 등 |
Keygene |
DNA LandMark |
|
DNA sequencing |
○ |
○ |
○ |
|
DNA marker development |
○ |
○ |
○ |
|
Marker-assisted selection |
○ |
○ |
○ |
|
Marker-assisted backcrossing |
○ |
|
○ |
|
Genomics-assisted breeding |
○ |
|
○ |
|
Mapping (GWAM, linkage, QTL) |
○ |
|
○ |
|
Finger-printing(원종 identification) |
○ |
|
○ |
|
Site-directed mutagenesis |
○ |
○ |
|
|
Double haploid line development |
○ |
|
|
|
Bioinformatics |
○ |
○ |
○ |
|
Omics정보를 이용한 cross-talk |
○ |
|
|
|
GMO development |
○ |
|
|
|
Risk assessment technology |
○ |
|
|
|
Purity and quality control of F1 and variety protection |
○ |
|
○ |
|
Trait platforms: targeting genes for trait improvement |
○ |
○ |
|
|
Phenotyping/Phenomics |
○ |
○ |
|
|
F1, 원종 순도를 위한 SNP 대량 분석 시스템 |
○ |
|
○ |
|
New plant breeding technology |
○ |
|
|
|
Genome editing |
○ |
|
|
출처 : 농우바이오 정리, 2015
최근 들어 다국적기업들의 매출에 지대한 영향을 미치기 때문에 필수적으로 활용하고 있는 분야는 F1 종자의 동정으로, 생산지에서 재배되어 수확하는 종자들의 identification이다. 즉 생산지가 다양하고 각 생산지에서 많은 농가들이 재배하기 때문에 수확하려는 종자가 타 종자와 오염이 되지 않고 정상적으로 확보하였는가가 관건이다. 이를 위하여 많은 양의 종자에 대해 무작위로 검정하는 시스템이 요구되었다.

[그림 4-3-5] SNP 대량분석(High-throughput SNP marker analysis)
이런 시스템이 바로 대량 SNP 분석을 이용하여 F1 품종의 identification을 확정할 수 있는 시스템으로 몬산토 같은 다국적기업은 1년에 1억 점 이상의 datapoint를 가동하고 있으며, Enza Zaden 같은 유럽종자회사는 1천 7백만 점, 한국의 농우바이오는 약 1백만 점을 분석하고 있다.
(3) 분자농업
고부가가치 유용물질의 대량생산을 위하여 대부분 미생물을 활용하였고 전 세계적으로 유용물질 의약품 시장은 10억불로 형성되어 있다. 지난 10여 년 간 유전자재조합기술과 bioreactor를 이용한 식물 세포배양기술을 통해 단백질이나 백신을 대량으로 생산할 수 있게 되었는데 최근에 고가의 제품들이 임상을 통해서 성공리에 시장에 진입하고 있어서 향후 이 분야의 연구가 활발해 질 것으로 보인다. 특히 의료용 고부가가치 단백질, 동물백신, 경구백신, 산업용 단백질 등의 생산이 구축되었으며 식물세포를 이용하면 동물세포배양의 1/30, 미생물의 1/3의 비용으로 대체할 수 있는 장점이 있다.
[표 4-3-4] 식물유래 의료용 단백질 산업화 현황
|
작물 |
product |
회사명 |
|
|
벼 |
항염증 식품첨가제 |
Ventria Bioscience |
판매 |
|
당근 |
고셔씨 병 치료제 |
Protalix |
판매승인 |
|
담배 |
뉴케슬백신(닭) |
Dow Agroscience |
승인 |
|
홍화 |
인슐린 |
SemBiosys |
승인 |
|
애기장대 |
VB12 강화 |
Cobento AS |
사전승인 |
|
옥수수 |
남포성 섬유종 치료제(lipase) |
Meristem Therapeutics |
임상 |
|
옥수수 |
인슐린 |
Meristem Therapeutics |
임상 |
|
옥수수 |
결장, 직장암 대응 IgG |
Monsanto |
임상 |
|
담배 |
충치예방 IgG |
Plant Biotechnology |
임상 |
|
딸기 |
치주염 인터페론 |
AIST(일본) |
판매 |
출처 : 농우바이오 정리, 2015
분자농업의 연구 분야는 이미 유럽이나 미국, 일본 등에서 여러 프로젝트로 진행하고 있는데 진단 및 치료 항생제, 면역단백질, 경구백신, 바이러스저항성 식물백신, 생체물질 등 Green Pharmaceuticals을 식물에서 생산하여 동물용 또는 사람용으로 임상중에 있다.
다. 연구개발의 국내현황
국내에서 농작물연구와 관련하여 연구개발을 지원하는 곳은 유일하게 농림축산식품부이며 미래부, 산자부의 연구비지원은 대부분 감소하여 연구비 부족 하에 있다. 2016년 농림축산식품부의 1년 예산은 14조 3천억 원이며 이중에서 R&D 배정 예산은 약 1조원에 가깝다. R&D 예산은 자체평가기관인 농림수산식품기술기획평가원(이하 농기평), 국가연구기관인 농촌진흥청 그리고 산림청에 투자를 하고 있으며 상당 부분이 기관 지원금이다. 그나마 장기간 연구지원 사업인 농진청의 차세대바이오그린 3개 사업단, GSP 사업의 3개 사업단이 있어 국내 농업생명공학 분야 발전에 도움을 주고 있다. 실제로 순수 종자, 분자육종, 분자농업 관련 R&D 출연금은 연 600억 원 밖에 되지 않는다. 과거에 있었던 농기평의 자유, 기획과제로 지원했던 생명산업개발사업 중 종자, 신품종관련 개발 연구가 중복이란 명목으로 없어져서 새로운 아이디어의 신규과제 신청에 어려움이 있다.
[표 4-3-5] 신품종 육성산업과 관련(생명공학, 육종) 국가연구사업 종류
|
사업 |
기간 및 금액 |
사업단 및 연구분야 |
|
차세대바이오그린21사업 (농진청) |
2단계 (2015∼2017) 연 약 220억원 |
- 농생명게놈활용연구사업단(유전체 분석) - 식물분자육종사업단(마커개발) - GM작물개발사업단(GMO개발 및 평가) |
|
골든시드프로젝트(GSP) (농기평) |
1단계, 4년 (2013∼2016) 연 240억원 |
- 채소, 원예, 식량사업단 - 주로 신품종개발을 위한 육종사업에 집중 - 수출 및 수입대체 종자개발 - 유전자원 수집 및 발굴 - 우량계통 교배조합 작성 및 교배 - 육종지원 마커 개발 |
|
다부처유전체 (농진청) |
(2014∼2021) 연 80억원 |
- 농생명자원유전체해독사업 - 농작물은 약 50억원 |
|
생명산업개발사업 (농기평) |
연 약 50억원 |
- 과거 수행중인 연구과제 - 분자농업 포함 |
|
총 국가연구비 |
약 600억원 |
- 산학연이 국가지원금으로 신청할 수 있는 유일한 연구비 |
출처 : 농우바이오 정리, 2015
(1) 종자산업
(가) 국내 종자산업 시장
국내 종자산업은 지난 10여 년 간 매년 약 5% 정도 성장하고 있다. 2012년 종자시장은 약 6천억 원 정도이며 그 중에 식량작물이 약 2,200억 원, 채소가 약 2,500억 원 시장이며 나머지가 과수, 화훼, 약용작물, 버섯 등이다. 2021년에 약 8,800억 원, 2030년에는 1조 3천억 원을 기대하고 있다. 종자시장 자체는 현재 세계종자시장의 약 1%정도 밖에 되지 않으나 곡류와 채소의 생산물시장은 약 19조 원 정도의 큰 시장을 이루고 있다.

[그림 4-3-6] 국내 종자시장의 변화
2015년 기준으로 한국에는 약 200개의 종자 기업이 있으며 이 중 약 55개 기업이 종자협회의 회원이다. 대부분이 채소종자회사이며 옥수수, 벼, 밀, 보리, 콩에 대한 신품종 개발은 민간 종자 기업에서 하지 않고 국가기관에서 개발한다. 따라서 한국의 종자 산업은 채소 종자 기업들이 이끌고 있다고 해도 과언이 아니다. 중소-중견기업 모두 전통 육종기술(교배육종, 여교배기술, MS(mail sterile)와 SI(self-incompatibility)육종체계, DH(double haploid))을 다 가지고 있으며 한국의 채소육종기술은 세계적으로 최고수준이다. 또한 대부분의 주요 기업들이 GSP 연구과제를 수행하고 있어서 어느 정도 국가에서 지원하고 있다. 채소 종자기업 중에 매출규모 1위는 (주)농우바이오이며 동부한농-흥농, 코레곤, 아시아종묘, 농협 등이 매출 상위 업체이다. 이외 국내 주둔 외국기업들이 여럿 있으나 이들의 매출 규모는 전체 국내시장의 약 20% 밖에 되지 않는다.
(나) GMO 연구
한국의 농작물 GMO관련 생명공학은 농진청에서 주관하고 있다고 해도 과언이 아니다. 특히 농진청 차세대바이오그린 GM작물개발사업단 지원으로 수십 개의 GMO 연구과제가 수행되고 있으며 대부분 산학연 공동과제이다. 특히 GMO는 지금까지 국내에서 약 20작물에서 200여 개의 event를 개발하고 있으며 이 중에서 농진청에서 event 개발을 위하여 지원하고 있는 GM작물은 벼 24점, 콩 5점, 배추 6점, 고추 2점 그리고 화훼와 기타 작물 포함하여 총 58점이다. 이들은 현재 개발 중이거나 또는 이미 개발되어서 인체, 환경위해성 연구를 진행하고 있다. 특히 이중에서 위해성평가 연구가 다 끝나서 심사를 신청할 수 있는 작물은 가뭄저항성벼, 제초제저항성 잔디, 바이러스저항성 고추이다. 아직 위해성평가 승인/재배허가를 받은 작물은 없지만 첫 번째 승인이 1년 안에 이루어질 것으로 생각된다.
[표 4-3-6] 개발 중인 GM작물 및 형질
|
작물 |
형질 |
합계 |
|||||
|
벼 |
콩 |
배추 |
고추 |
화훼류* |
기타** |
||
|
환경내성 |
9 |
1 |
2 |
|
3 |
3 |
18 |
|
병해충저항성 |
5 |
3 |
2 |
2 |
6 |
1 |
19 |
|
생산성 |
6 |
1 |
|
|
|
1 |
8 |
|
품질/기능성 |
4 |
1 |
2 |
|
4 |
2 |
13 |
|
계 |
24 |
5 |
6 |
|
13 |
7 |
58 |
* 5작물; ** 4작물
출처 : 농진청, 2014
국내에서 GMO 개발 연구를 하고 있는 기업은 (주)농우바이오가 유일하다. 지금까지 위해성 평가를 수행하고 있는 작물은 고추 2점(바이러스 저항성), 양배추 1점(Bt, 배추좀나방저항성), 대목 1점(바이러스저항성)이며 고추 2점은 상기 농진청에서 지원 받았다. 이외에도 고추의 해충내성, 배추의 해충내성이 event로 개발되어 있으나 기업의 연구비 부족으로 현재 후속연구를 진행 하지 못하고 있다. 그리고 국내의 위해성평가연구를 지원하는 기관은 한국생명공학연구원이 있으며 외부 연구자가 환경위해성, 인체위해성 평가를 위탁할 때 국내에서 유일하게 같이 연구를 수행해 주고 있다.
(2) 분자육종산업
국내 분자육종산업은 농진청의 차세대바이오그린 농생명게놈활용연구사업단과 식물분자육종사업단이 주축이 되어 운영하고 있다. 2015~2017년까지 연구목표는 다음과 같다. 농진청 사업단에서 확보한 자료는 산학연 연구자들이 활용할 수 있도록 되어 있다.
[표 4-3-7] 차세대바이오그린 21 분자육종관련 연구
|
|
사업목표 |
추진 프로젝트 |
|
식물분자육종 사업단 |
- 글로벌 주요작물 분자육종 기반 확립 및 실용화 - 식량안보를 위한 생산성 등 관여 유전자 발굴, 활용 - 육종목표 형질의 분자표지 기술 개발 및 확립 - 변이창출 기술 등 미래육종기술 개발 등 |
- 식량안보를 위한 초다수성 생리형질 개량 분자육종 기술 - 국제경쟁력 강화 복합기능성 및 고품질 작물의 분자육종 기술 - 비생물적 스트레스 및 해충 저항성 증진 분자육종 기술 - 이종 게놈 및 돌연변이 자원 활용 분자육종 기술 - 농업 주요 형질 유전자지도 작성 및 분자표지 개발 - 수요자 맞춤식 고효율 분자표지 기술 확립 및 실용화 - 소면적 작물 분자표지 개발 및 기반기술 확립 - 작물 생장과 발육 관여 유용 유전자 발굴 - 작물 생산성 및 기능성 성분 함량 증진 유전자 동정 - 생물적 비생물적 스트레스 저항성 메카니즘 구명 및 육종 소재 개발 - 육종목표 유전자 표적 돌연변이 및 재조합 확대 기술 - 초형 조절과 신형질 도입에 의한 초다수 벼 분자육종 및 실용화 |
|
농생명 게놈활용연구 사업단 |
- 해독 표준유전체(농작물) 정보 정밀도 향상연구 - 비교·집단 유전체 연구를 통한 유전체 육종 인프라 구축 - 유전체 정보기반 유전자 대량 발굴 및 기능분석 - 농작물 후성유전 연구 및 응용기술 - 농용 미생물 유전 정보 활용 연구 |
- 작물 유전체 정보 완성도 향상과 활용 및 생명정보 기술개발 - 중요 작물의 자원/집단 기반 게놈전체연관분석(GWAS) 및 활용연구 - 무 핵심집단 유전체재분석을 통한 유전체육종 기반 구축 및 활용 - 생명정보 기반 작물의 유전자 대량 기능분석 연구 및 활용 - 후성유전체 조절인자와 기작 연구 및 농업적 활용 연구 - 작물과 병원성 미생물의 상호작용 관련 오믹스 연구 및 농업적 활용 - 작물환경의 메타게놈 연구를 통한 농용 미생물 소재 발굴 및 응용 연구 - 중요 작물체내 메타게놈 연구를 통한 농용 미생물 소재 발굴 및 응용 연구 |
출처 : 농우바이오 정리, 2015
농진청은 2014년서부터 40품목의 농생명자원의 유전체 정보를 해독하기 위한 포스트게놈 다부처 유전체사업인 밀레니엄 농생명자원 유전체 해독사업을 시작하였고 8년 동안 총 668억 7,000만 원을 투입하고 매년 80억 원을 투자한다. 유전체정보를 통하여 식량, 의료, 에너지, 신소재 사업에 활용하여 지식기반형 농축산업이 활성화 될 것으로 기대하고 있다. 총 17품목으로 △들깨, 메밀, 고구마, 국화, 양파, 배, 결명자, 도라지, 버섯(2품목) 등 작물 10품목 △오골계, 토종오리, 진돗개, 제주마 등 가축 4품목 △왕지네, 애멸구, 천잠 등 곤충‧선충 3품목이 있다.
국내 종자 기업들은 지난 10여 년 간 분자육종기술의 인프라를 많이 확보하였다. 기업들은 농진청이나 국내 대학에서 유전체정보를 확보하여 병저항성, 환경내성, 기능성 DNA 마커를 개발하였고 genotyping, finger-printing, MAS, MAB, Mapping 등에서 확보한 데이터를 육성하여 활용하고 있다. 마커를 자체 개발하기 어려운 영세기업들은 마커 분석을 아웃소싱하는데, 대행 벤처기업으로는 (주)고추와 육종, (주)에프앤피가 있다. 또한 유전체정보를 쉽게 활용할 수 있도록 중간역할(interface)을 해주는 (주)Seeders가 있으며 (주)인실리코젠은 생물정보분야를 국내에서 가장 큰 규모로 운영하고 있다.
(3) 분자농업
애석하게도 국내에서는 분자농업이 활성화 되지 않고 있다. (주)엔비엠이 국내에서 유일하게 식물체로부터 유용단백질을 생산하는 벤처회사이며 유용단백질을 산업화규모로 대량재배, 분리정제, QC하고 판매하는 등의 산업기반을 갖추고 있다. 벼의 현탁배양세포로부터 생체활성물질인 Bovine Trypsin, hGM-CSF, IL-12, hG-CSF, Human Enterokinase (Light Chain), hVEGF-165를 분리정제, 생산하여 국내에서 판매하고 있으며 또한 세포의 성장, 분화, 증식에 관여하는 성장인자인 EGF, hFGFa, hFGFb, hVEGF-165, hKGF를 화장품 성분으로 활용할 수 있도록 화장품회사에 납품하고 있다.
라. 발전과제
농작물산업은 먹거리 산업 외에도 의약산업, 바이오산업, 환경산업으로 발전하여 새로운 융합시장이 구축되고 있으며, 고용창출 및 새로운 패러다임이 형성되고 있어서 양적, 질적으로 충족해야 할 기술적 뒷받침이 필요하다. 따라서 농작물을 개발하고 생산하는데 과거 관행육종만으로는 해결하기 어려워 생명공학기술을 활용하여 수확량이 많고, 고품질이자 기능성이며, 재배하기 쉽고 육성하기 편리하며 육종연한을 단축한 농작물 생명공학이 탄생하였다. 그러나 이 분야는 지난 20여 년간 다국적기업들이 기술을 축적하고 첨단화 시켜서 산업화를 이끌어 왔으며 종자산업, 분자육종산업, 그리고 분자농업으로 나뉘어졌다. 또한 다국적기업들은 GMO 작물을 포함하여 세계 종자시장의 판도를 새롭게 변화시키며 시장을 독점화하고 있다.
바이오산업은 앞으로 자동차나 반도체보다 더 성장할 수 있는 산업으로 알려져 있고 농작물 생명공학분야는 바이오산업의 하나로 무궁무진하게 발전할 수 있는 분야이다. 국내 육성기술은 세계 첨단으로 생명공학만 접목이 되면 농산업이 신성장동력이 될 수 있지만 국가에서 투자하는 순수 R&D 연구비용은 매우 적은 상황이다. 그나마 GSP 사업, 차세대바이오그린 21사업 등이 연구 활성화에 도움을 주고 있지만 기술적 격차가 계속 벌어지고 있어 정부의 새로운 대책이 요구된다.
그동안 우리는 fast follower를 자처했지만 이 분야의 R&D 투자가 계속해서 부족하면 fast follower 신분도 없어질 것이다. 가장 중요한 것은 현재 우리가 부족한 부분을 어떻게 집중 지원을 받으면서 농작물 산업을 일으킬 수 있느냐이다.
우선 기술적 제고를 위한 모든 방안을 마련해야한다. 훌륭한 아이디어를 가지고 연구를 하고자 하더라도 GSP 사업, 차세대바이오그린 21사업 외에는 접근할 수 있는 연구기금이 없다는 것이 가장 큰 정책적 장벽이므로 농림축산식품부에서는 이런 문제를 해결하여 포괄적으로 농작물생명공학분야를 지원을 해야 한다. 특히 GMO를 대체할 수 있는 새로운 첨단육성 기술 개발에 집중 투자해야 한다. 우리나라는 국내 농작물 생산량(25조원)의 약 12%인 3조원에 해당하는 GMO를 매년 수입하고 있으며 향후 10년 안에는 수입 GMO에 대한 대처방안이 없다는 것이 현실이다. 따라서 이 분야는 국가적인 차원에서 하루 속히 적극적인 행동을 취해야 한다.
또한 농작물이 산업화가 되려면 국내 기업들이 활성화가 되어야 하는데 대부분 농업관련 기업들은 중소기업이며 영세하여 생명공학에 투자할 여력이 없다. 따라서 질적, 양적으로 상당히 후진성을 벗어나지 못하고 있는 실정이며 기술과 인력, 인프라 부족 등 총체적 문제점이 있어서 이를 극복하기 위한 당면적, 중장기적 정책이 필요하다.
농작물 생명공학은 국민의 소중한 먹거리를 책임지는 생명산업이며 국민행복을 지켜주는 안보산업이기 때문에 반드시 지켜야 한다. 따라서 국가가 나서서 농작물 생명공학의 경쟁력을 강화할 필요가 있으며 이 분야의 선진화가 바로 농업의 창조경제라는 국가의 비전이 실현되는 것이므로 이 분야에 거국적 신사업이 육성될 수 있도록 R&D 지원 기획의 재구성을 제안하는 바이다.
2. 축산
가. 개요
축산 분야의 생명공학은 과학과 기술을 활용하여 동물의 형질을 변형, 개선시켜 농림축산, 수산 및 의료산업에 이용하는 학문영역으로 정의 할 수 있다. 최근 생명공학 기술과 발생공학 기술의 발전으로 동 분야는 응용 분야와 이용 범위가 커 미래사회에서 고부가가치 창출이 가능한 분야로 산업화를 위한 연구가 활발히 진행되고 있다. 축산에서 생명공학 기술은 동물 복제에 의한 우수한 개체의 대량 증식과 외래 유전자 도입에 의한 형질전환 동물 생산 및 산업화에 활용될 수 있다.
본 장에서는 형질전환 동물 생산과 관련된 기술개발 현황에 대해 기술하려 한다. 형질전환동물의 응용분야 및 이용 범위를 살펴보면, 크게 가축의 개량, 바이오신약, 질환모델동물생산 및 이종장기 생산용 동물 개발로 나눌 수 있다.
나. 산업현황
(1) 가축의 개량
고전적인 육종방법에 의한 가축의 개량은 우량형질의 유전적 요인을 선택적으로 선발하기 위하여 20년 이상의 기간이 소요되지만, 유전자변형기술과 복제동물 생산기술이 가축의 개량에 응용된다면 우수한 형질의 가축을 단기간에 생산할 수 있다. 성장 속도가 빠른 가축, 질 좋은 우유나 고기를 생산하는 가축, 내병성이 증가된 가축, 사료 효율을 증가시킨 가축의 개발, 사육 시 발생하는 환경오염을 줄일 수 있는 가축 및 고품질의 모(毛)를 생산할 수 있는 양이나 기타 동물들의 개발 등이 시도되고 있다. 최근 많은 연구자들에 의해 근육성장호르몬 유전자의 발현이나 근육성장인자의 변형을 통하여 면양, 소, 돼지 근육의 양과 질을 향상시키려는 노력과 오메가-3 지방산이 함유된 돼지와 소를 개발하여 고급육을 생산하려는 시도들도 이루어지고 있다.
또한 광우병 유발 원인인 프리온(Prion)을 완전히 제거한 형질전환 젖소, 라이소자임을 분비하는 염소, 바이러스 백신을 분비하는 토끼 등 내병원성이 강화된 가축이 개발되었고, 우유 알러지의 원인 단백질인 락토글로불린을 분비하지 않는 젖소 생산에 성공하여 고급우유 생산 가능성을 시사하고 있다.
(2) 유용 생리활성물질(바이오의약품) 생산
초유 성분인 인간의 락토페린(lactoferin)을 생산하는 형질전환 소를 비롯하여 조혈촉진인자(erythropoietin, EPO), 백혈구증식인자(hGM-CSF), 성장호르몬(Growth factor, GF) 등 유용한 생리활성 물질을 유즙이나 오줌으로 분비하는 형질전환 가축이 개발되고 있다. 류머티스관절염 치료물질 유전자를 발현하는 돼지와 항암 치료 보조제인 G-CSF를 대량 생산할 수 있는 형질전환 돼지가 개발되었고, 일본에서는 인간의 알부민 단백질을 혈액으로 분비하는 돼지가 생산되었다. 또한 항산화제를 과발현, 생산할 수 있는 형질전환 닭과 인위적으로 유전자 발현 시스템을 이용하여 EPO 단백질의 필요에 따라 발현을 조절 할 수 있는 형질전환 닭도 개발되어 형질전환 동물을 이용한 바이오의약품 생산 기술이 급격히 발전하고 있다. 또한 바이오의약품으로써 줄기세포는 환자 맞춤 의약품 개발 가능성을 가져 향후 활용범위 및 시장 비중이 확대될 것으로 전망된다.
(3) 질환모델 동물 생산
질환모델동물은 질환의 원인이 되는 유전자의 기능 규명은 물론 발병 기작을 이해하여 치료법 개발을 용이하게 한다. 또한 질환모델동물은 새로이 개발된 치료제의 효과와 독성 및 부작용 검증 과정에도 유용하게 활용된다. 과거에는 대부분의 질환모델 동물로 쥐를 사용하였으나 설치류는 인간과 해부학적, 생리학적 차이가 커, 인간의 장기와 유사한 구조를 갖는 돼지를 질환모델 동물로 개발하려는 노력이 활발히 진행되고 있다. 병과 연관된 특정 유전자의 과발현(overexpression), 저발현(knock-down), 완전 발현제거(knock-out) 기술들과 유전자 발현시기를 조절하는 시스템을 이용해서 필요에 따라 발현 조절이 가능한(conditional knock-down 또는 conditional regulation) 방법이 함께 개발되어 다양한 질환모델동물 개발에 이용되고 있다.
(4) 이종 장기 개발
이종장기이식(xenotransplantation)은 동물의 살아있는 장기나 조직 또는 세포를 이종 간에 이식하는 것을 의미하며 2005년 미국 하버드 대학교의 야마다(Yamada) 교수팀이 유전자변형동물의 생산 기술로 만들어진 돼지의 신장을 원숭이에게 이식하여 6개월 동안 생존시킨 연구 결과를 통하여 사람의 대체장기로 이용할 수 있는 가능성을 제시하였다. 인간의 장기와 크기가 비슷하고 생리학적으로 유사한 미니돼지는 사육 기간이 짧으며, 한 번에 많은 수의 새끼를 낳을 수 있고, 무균상태로 사육이 가능하여 이종장기 공여체로 주목 받고 있다. 현재 국내외 많은 연구 기관에서 돼지와 원숭이를 이용한 이종장기 전임상실험이 진행 중으로 이종장기이식에서 발생되는 면역거부반응을 최소화하여 이식된 이종장기가 안정적으로 기능을 수행할 수 있는 기술이 개발되면 본격적인 이종장기의 시대가 열릴 것으로 기대되고 있다.
다. 해외 동향
1990년대부터 형질전환 동물의 상업화가 가능하다고 예상한 생명공학 관련회사들을 중심으로 다양한 형질전환 동물들이 개발되고 있다. 과거 20여 년간 대부분의 연구자들은 가축의 개량, 유용 생리활성 물질의 대량 생산 및 질환모델동물을 생산하는 목적으로 유전자 조작 동물을 개발하였고, 2000년대부터 시작된 이종장기 이식가능성으로 현재는 면역거부반응을 극복하려는 연구가 활발히 진행되고 있다.
(1) 미국
미국은 1981년 세계 최초로 형질전환동물을 개발하여 전 세계에 있는 수천 종의 형질전환동물 중 약 50%를 보유하고 있다. 이제까지는 다양한 질환모델동물을 개발하였으며, 이종장기 생산용 형질전환 돼지의 생산과 이종장기 이식분야 연구를 주도하고 있다.
조지아대학의 연구팀은 2010년에 세계 최초로 돼지의 유도만능줄기세포를 이용하여 형질전환 키메라(chimera) 돼지를 생산하였고, 캘리포니아 대학에서는 인간의 lysozyme 유전자를 과발현시키는 염소를 생산하여 상업화를 추진하고 있다. 2012년 텍사스 A&M 대학에서는 근육성장 조절인자와 Myostatin 유전자를 소형RNA(siRNA) 방법으로 발현 감소(knock-down)시킨 소를 개발한 결과 GM소의 육질과 육량이 높아졌다고 보고하였다.
2014년 미국 국립보건원 산하의 심장, 폐, 혈관연구소(NHLBI)에서는 α-1,3-gal 유전자가 제거된 GM돼지에 면역거부 반응에 의한 혈액응고를 막기 위하여 보체조절 유전자 또는 Thrombomodulin유전자를 과발현 시킨 후 심장을 원숭이에게 이식하고 면역억제제를 투여하였을 때 보체조절 유전자 과발현 그룹은 평균 생존기간이 21일에서 80일이었고, 혈액응고를 감소시키는 Thrombomodulin을 과발현 시킨 그룹은 원숭이에 따라 이식 후 150일에서 500일 이상 생존을 하였다는 연구 결과도 보고하였다.
또한 메사추세츠 종합병원 연구진들은 ʻ알파갈ʼ을 제거한 GM 돼지 유래 피부를 화상으로 손상된 원숭이 피부에 이식하여 이종 이식 시 발생하는 면역거부반응이 동종 이식을 하였을 때와 유사하다는 결과를 보고함으로써 화상 환자들의 피부 이식에 이종 피부 이식 사용 가능성이 기대하고 있다.
(2) 영국
영국의 케임브리지 대학과 로슬린연구소는 조류독감 저항성 유전자변형 닭을 생산하여 특허를 출원하고 상업화를 시도하고 있다. 일본의 나고야 대학에서는 낮은 유전자변형 조류 생산의 성공률과 효율성을 향상시키기 위하여 정자와 원시생식세포 매개의 유전자변형 닭을 생산하였고, 향상된 프로모터를 사용하여 사람의 조혈인자인 EPO(Erythropoetin)를 대량 생산 분비하는 닭을 생산하였다. 최근 가고시마대학에서는 광우병을 유발하는 프리온 발현을 억제시킨 젖소를 개발하였고, 도쿄대 연구팀은 유전자조작으로 췌장이 없는 돼지를 생산한 후 그 태아로부터 체세포를 채취하고 복제 기술을 이용하여 배아를 만든 다음, 정상적인 돼지 배아의 할구를 삽입시켜 키메라 배아를 만든 후, 대리모에 이식하여 생산한 돼지에서 정상적인 췌장이 만들어지게 하는 기술 개발에 성공하여 재생의료용 인간 장기를 동물의 체내에서 생산할 수 있는 연구의 기초를 마련하였다고 평가된다.
(3) 중국
중국에서도 국가적 지원과 사회적 지원 아래 유전자변형 동물생산 연구가 활발히 진행되고 있다. 2010년에 세포와 기관에 지방이 축적되는 유전병인 가우처(Gaucher)의 치료물질 acid beta-glucosidase를 분비하는 염소를 개발하였고, 인간의 락토페린을 과발현하는 젖소, 오메가3 지방산 또는 인간 라이소자임을 과발현하는 GM돼지 생산에 성공하였다. 2012년 지린대학에서는 인간 지방대사에 중요한 유전자 Apolipoprotein을 과발현하는 돼지를 생산하였고, 2014년에는 Methyl-CpG binding protein2(MeCP2) 유전자를 돌연변이 시켜 제거한 원숭이에게서 발달성 신경이상을 보고하였다.
(4) 기타
독일을 비롯한 호주, 캐나다, 뉴질랜드 등의 여러 국가에서도 장기이식용 유전자변형 돼지를 안정적인 기술로 생산하고 있으며, 유용 생리활성 물질의 대량 생산이나 유전자변형 동물생산의 효율성을 높이기 위한 연구가 활발히 진행 중이다. 특히 뉴질랜드의 농업연구소는 siRNA 방법을 이용하여 우유의 알레르기 성분인 락토글로불린은 분비하지 않고, 카제인은 두 세배 많이 분비하는 형질 전환 젖소를 생산하였다.
라. 국내 현황
국내 형질 전환 동물의 개발은 1987년 사람의 성장호르몬 유전자를 발현하는 유전자발현 생쥐가 개발된 이후 여러 연구 기관과 대학교에서 형질전환 동물이 생산되고 있다. 생쥐는 실험동물로써 많은 장점을 가지고 있어 유전자 조작을 통해 질환모델 동물로 자주 이용되고 있다. 그러나 질환동물모델로서 생쥐는 인간과 해부학적, 생리학적 차이가 많아 돼지, 개, 원숭이 등의 대동물을 이용한 질환모델이 만들어지고 있다.
[표 4-3-8] 국내 형질전환 가축의 최근 개발 현황
|
연도 |
개발기관명 |
가축 |
주요내용 |
|
2013 |
국립축산과학원 |
닭 |
3D8 scFv 유전자 변형 바이러스 질병저항성 닭 |
|
2013 |
건국대학교 |
돼지 |
Rag 유전자 변형 면역억제 형질전환 돼지 |
|
2013 |
충북대학교 |
소 |
형광표지 유전자 GFP 발현 형질전환 소 생산 |
|
2013 |
충남대학교 |
돼지 |
TNFr-Fc 융합 항체단백질 생산용 형질전환 돼지 |
|
2013 |
충북대학교 |
돼지 |
만성대사질환 모델 형질전환 돼지 |
|
2013 |
강원대학교 |
돼지 |
간암 모델 돼지 |
|
2013 |
건국대학교 |
원숭이 |
당뇨질환모델 영장류 |
|
2013 |
대구가톨릭대학교 |
닭 |
인간의 조혈 단백질 EPO을 생산하는 형질전환 닭 |
|
2013 |
(재)수암생명공학연구원 |
개 |
알츠하이머 질환 모델 |
|
2013 |
건국대학교 |
돼지 |
α1,3-gal 과 Neu5Gc 두 개의 유전자가 제거된 이종장기이식용 형질전환 돼지 |
|
2013 |
경상대학교 |
돼지 |
동결보존된 피부조직 유래 줄기세포를 사용한 복제 돼지 |
|
2014 |
충북대학교 |
돼지 |
테트라사이클린 (Tetracycline, Tet)에 의한 조건적 외부 유전자 발현 조절 [Tet-On/Off] 형질전환 돼지 |
|
2014 |
국립축산연구원 |
돼지 |
이종장기이식용 복합형질전환 돼지 (GalT-(hDAF+hCD39+hTFPI+hC1inhibiotr+hTNFAIP3)/+) |
|
2014 |
충북대학교 |
돼지 |
형광표지 유전자 GFP 발현 형질전환 돼지 생산 |
|
2014 |
서울대학교 |
닭 |
TALENs 방법으로 난백단백질인 오브알부민(ovalbumin) 유전자가 제거된 형질전환 닭 |
|
2014 |
건국대학교 |
돼지 |
‘사람 줄기 세포 분화’ 면역결핍 형질전환 복제 돼지 |
농촌진흥청 주관 차세대바이오그린21 사업의 일환인 동물바이오신약장기개발 사업단에서는 질환동물모델로 허혈/재관류 질환 관련 돼지, 간암모델 돼지를 개발하였고, 2013년에는 당뇨질환 모델 원숭이 및 알츠하이머 질환 개 모델을 개발하였으며 다른 연구 기관에서도 최신 유전자 변형기술을 활용하여 다양한 질환 모델 동물을 생산하기 노력하고 있다.
해외에서는 최신의 유전자 조작 기술인 TALENs와 CRISPR/Cas9을 활용하여 가족성 고콜레스테롤 혈증과 발달성 신경장애 질환 모델 등을 개발하였다.
또한 유전자 조작 동물을 이용하여 바이오의약품을 생산하려는 노력의 일환으로 2012년 충남대학교에서 류머티스관절염 치료물질인 TNF-α receptor inhibitor 유전자를 발현하는 형질전환 돼지를 생산하였고, 형질전환 유전자의 발현 여부 및 바이오의약품 물질 분리정제의 표지가 되는 해파리의 형광유전자(Green Fluorescence Protein, GFP)를 발현하는 닭, 돼지, 한우 등이 개발되고 있으며, 여러 가지 유용한 생체 내 활성 물질을 생산하려는 바이오리엑터(bioreactor) 개발 연구도 활발히 진행되고 있다.
인간의 장기와 유사한 크기 및 생리적 특성을 지닌 돼지로부터 이종장기를 얻기 위해서는 인간과 돼지 사이에 발생하는 면역거부반응을 해결하여야 한다. 이종장기이식에서 발생하는 면역거부 반응에서 반응발생 시간별로 초급성 면역거부반응(hyperacute rejection, HAR), 급성면역반응(acute rejection, AR)으로 분류되는데, 장기를 이식할 때 24시간 내에 일어나는 면역거부 반응을 ʻ초급성 면역거부ʼ라고 한다. 이 문제를 극복하는 방법은 장기공여 미니돼지에서 ʻ알파갈ʼ 유전자를 제거(knock-out)하는 것으로 2009년에 태어난 지노(Xeno)는 미국에 이어 세계 두 번째, 국내 최초로 알파갈이 제거된 장기이식용 유전자조작 복제미니돼지이다. 초급성 면역거부 반응을 극복하는 다른 방법은 알파갈 항원과 수여자의 자연항체가 결합된 항원-항체 결합으로 활성화되는 보체(complement) 활성을 억제하는 것이다. 알려진 보체활성억제인자(complement inhibitory proteins, CIP)로는 CD46(membrane cofactor protein, MCP), CD55(decay accelerating factor, DAF)와 CD59(protectin) 등의 세포막 단백질(membrane- bound regulator)이 있는데 이식 장기의 혈관내피세포에서 보체활성억제인자의 유전자를 과 발현시켜 초급성면역거부 반응을 효율적으로 억제하려는 시도들이 수행되고 있다.
2010년 국립축산과학원이 개발하여 ʻ믿음이ʼ이라고 명명한 형질 전환 돼지는 항원인 알파갈 유전자는 제거하고 보체활성인자 일종인 MCP 유전자를 과발현시켜 초급성면역거부반응을 극복한 1세대 이종장기용 형질전환돼지이다. 2011년 국립축산과학원에도 ʻ소망이ʼ라는 이름으로 α-1,3-gal 유전자를 제거하고, CD73 유전자를 과발현시켜 초급성면역거부반응과 급성면역거부반응이 일어나지 않도록 한 형질전환된 돼지를 연구하였다. 또한 2013년 건국대학교 김진회 교수 연구팀은 α-1,3-gal 유전자와 급성 이식 거부반응을 야기하는 물질인 Non-Gal antigen(비알파갈)의 주원인 유전자인 Neu5Gc(글리콜뉴라민산)을 제거한 미니 복제돼지를 생산하였다.
마. 발전방향
형질전환 동물의 개발은 기존 동물의 이용 효율을 획기적으로 극대화 시켜 인류의 복지 증진은 물론 산업적으로 활용도가 높을 것으로 예상되어 국내외의 많은 연구자들에 의해 연구 및 기술이 개발되고 있다. 질환모델동물의 시장 규모는 2013년에 11억 달러였고, 암, 후천성면역결핍증 및 난치성질환 등에 대한 새로운 질환모델동물이 개발됨에 따라 2018년에는 18억 달러 규모가 될 것으로 전망된다. 또한 GM질환모델 동물 연구는 앞으로 의약산업 발전 및 의학적 발전에 크게 기여 할 것으로 예상된다.
미국의 국가조사위원회와 식품의약국에서 정상적인 동물과 형질전환 동물로부터 유래된 제품들에 어떠한 차이점도 존재하지 않는다고 보고하고 여러 가지 형질전환동물의 상업화를 허용하였으나 GMO 반대 사회단체와 시민단체에서는 GMO 사용을 반대하고 있다. 그러므로 형질전환동물의 효용 가치 창출도 중요하지만 정부와 산업체 및 연구자들의 유전자 조작 제품의 안전성 연구에 많은 노력이 필요하다.
질환치료연구용 동물모델 개발과 이종장기 생산용 미니무균돼지의 개발은 미래 고부가가치 산업으로 예상된다. 이에 국내 형질전환 가축생산 기술이 세계시장을 선점하기 위하여 정부의 장기적인 목표 설정과 정책 지원이 절실히 요구되며, 학계와 산업계에서 기술 개발을 수행하는 연구자들도 학문 영역간의 상호협조를 통한 공동연구를 수행하여 효율적인 기술 개발이 이루어져야 한다고 사료된다.
3. 식품
가. 개요
식품의 제1목적은 인체에 필요한 영양성분을 공급하고 기호성을 부여하며 먹는 즐거움을 제공하는 것이다. 이런 목적을 달성하기 위한 기본 재료는 농축수산물이다. 따라서 식품산업은 원료 생산 영역인 농축수산업과 밀접한 관계가 있으며 이들 1차 산물의 생산 여건과 생산물량이 식품산업의 근간을 이룬다.
우리나라 농업 생산물을 시대별로 분류해 보면 1970년대까지 기아를 해결해야 했던 세대로 양(量)이 가장 큰 소비 판단의 기준이 되어 생산자가 소비자를 선택할 수 있었으나 그 이후 양이 충족되면서 소비자가 생산자의 제품을 평가하고 구매여부를 결정하는 시대로 변하게 되었다. 양이 충족되면서 모든 농산물의 평가기준은 질(質)이 되었고, 질적으로 우수하지 않은 제품은 시장 진입이 어렵게 되었다. 특히 2000년대에 들어와서는 식품의 질적 기준을 넘어 안전과 건강 지향적 소비 추세가 두드러지고 있다.
현대의 농산물 생산은 전통적인 농업생산, 즉 기존 품종의 범위와 재배 방법을 과감히 벗어나 21세기형 앞선 농업으로 진입해야 할 시점에 와있다. 이를 위하여 생명공학 기법을 활용한 품종 육종을 통한 우수종자의 확보, 생리활성을 촉진하는 특수 성분이 들어있는 원료의 생산, 그리고 부가가치를 높일 수 있는 가공 용도에 맞는 원료의 특성 부여 등은 이제 우리 농업이 지향해야 할 방향이다.
우리 농업생산물은 국내생산 판매의 한계를 벗어나 여러 외국의 제품과 경쟁하여 경쟁력을 갖추지 않으면 생존하기 어렵게 되었다. 이를 위하여 차별화 전략 수립이 필요하고 여기에 생명공학기법이 다양하게 적용되고 활용되어야 할 것이다.
시대가 변하여 농산물을 생산하여 생체로 유통, 판매하는 것은 생산자, 농민의 소득을 올리는데 한계에 다다랐다. 농산물 원료의 경우 계절성, 저장성 결여, 생산 시기의 홍수출하에 의한 가격 하락 등의 특성 때문이다. 따라서 생산자가 1차 산물인 농산물로부터 소득을 올리기 위해서는 저장성이 있고 소비자의 기호에 부응하면서 부가가치를 높일 수 있는 2차 산업으로 다양한 가공식품의 개발, 보급이 필요하다.
일반적으로 식품가공이라고 하면 대기업이나 사업을 하는 사람들만의 전유물로 생각 할 수 있으나 김치류 제조, 장류, 절임류 제조, 한과 생산 등 소자본으로 가공식품을 생산 판매할 수 있는 기회가 있다. 근래 정부에서도 생산자의 2차 산업 참여를 돕기 위하여 제도적 뒷받침과 함께 자금 지원도 활발히 이루어지고 있다.
선진 외국의 경우 식탁에 오르는 식품을 구분해 보면 가공식품의 비중이 90%이상을 점하고 있으나 우리나라의 경우 50~60%내외로 사회 환경의 변화 및 여성사회참여 활성화 경향을 감안할 때 우리식탁도 멀지 않아 가공식품의 비중이 선진국 수준에 접근할 것은 확실하다.
앞으로 가공 식품은 간편하고 경제적으로 소비할 수 있도록 처리, 가공한 식품의 종류와 그 양상이 크게 확대될 것이며 이 분야의 생산자들도 여러 방향에서 접근이 가능할 것이다.
나. 해외 동향
(1) 식품산업 현황
세계 식품산업은 다른 제조업과 비교하여 가장 큰 영역이다. 전체규모는 2011년 4.8조 달러에서 2015년 5.6조 달러, 2018년은 6.3조 달러로 추정(연평균 3.9% 증가)되며 지역별로 보면 현재는 유럽의 비중이 높으나 점차 감소 추세를 보이고 있다. 이에 반하여 아시아, 태평양 지역의 비중이 높아지고 있으며 연평균 성장률은 5.9%로 예상하고 있다.
특히 아시아, 태평양 식품시장 규모와 비중이 2014년 처음으로 유럽 시장규모를 넘어서고 있으며 경제규모와 인구 분포로 봐서 이 경향은 지속 될 것으로 보인다. 아울러 신흥시장인 중남미의 추세도 눈여겨 봐야할 필요가 있다.
[표 4-3-9] 전 세계 식품시장 규모(대륙 별)
(단위 : 10억달러,%)
|
구분 |
’11 |
’12 |
’13 |
’14 |
’15 |
’16 |
’17 |
’18 |
|
○ 세계식품시장 |
4,817.6 |
4,983.7 |
5,158.5 |
5,347.7 |
5,563.9 |
5,788.2 |
6,030.8 |
6,291.0 |
|
(100.0) |
(100.0) |
(100.0) |
(100.0) |
(100.0) |
(100.0) |
(100.0) |
(100.0) |
|
|
- 유럽 |
1,691.6 |
1,728.9 |
1,764.1 |
1,802.5 |
1,847.1 |
1,891.6 |
1,939.6 |
1,988.3 |
|
(35.1) |
(34.7) |
(34.2) |
(33.7) |
(33.2) |
(32.7) |
(32.2) |
(31.6) |
|
|
- 아시아-태평양 |
1,570.2 |
1,649.7 |
1,737.3 |
1,834.2 |
1,948.2 |
2,067.4 |
2,196.6 |
2,338.0 |
|
(32.6) |
(33.1) |
(33.7) |
(34.3) |
(35.0) |
(35.7) |
(36.4) |
(37.2) |
|
|
- 북미 |
1,034.9 |
1,056.2 |
1,081.4 |
1,102.9 |
1,123.5 |
1,143.4 |
1,162.4 |
1,179.5 |
|
(21.5) |
(21.2) |
(21.0) |
(20.6) |
(20.2) |
(19.8) |
(19.3) |
(18.7) |
|
|
- 중남미 |
441.0 |
464.9 |
487.5 |
516.1 |
549.1 |
586.0 |
628.2 |
676.5 |
|
(9.2) |
(9.3) |
(9.5) |
(9.7) |
(9.9) |
(10.1) |
(10.4) |
(10.8) |
|
|
- 중동·아프리카 |
80.0 |
84.1 |
88.1 |
92.0 |
95.9 |
99.8 |
104.0 |
108.7 |
|
(1.7) |
(1.7) |
(1.7) |
(1.7) |
(1.7) |
(1.7) |
(1.7) |
(1.7) |
자료 : Datamonitor(www.datamonitor.com)
주) Food, Alcoholic beverages, Non-alcoholic beverages, Tobacco 합계, 2015~2018은 추정치
식품시장을 세계 타 주요 산업과 비교해보면 2014년 기준 자동차시장(1.조 달러), IT시장(2.9조 달러), 철강시장(1조 달러)의 규모보다 각각 3.2배, 1.8배, 5.1배로 세계에서 가장 큰 제조업으로 자리매김하고 있다. 이런 이유는 생명유지에 가장 필수적인 식품을 제조하는 분야이고 선‧후진국을 막론하고 규모의 차이는 있으나 모두가 국민생존에 필수 불가결하기 때문이다.
[표 4-3-10] 타 주요 산업과 비교한 세계 식품시장 규모
(단위 : 10억달러)
|
구분 |
’11 |
’12 |
’13 |
’14 |
’15 |
’16 |
’17 |
’18 |
|
세계 식품시장 |
4,817.6 |
4,983.7 |
5,158.5 |
5,347.7 |
5,563.9 |
5,788.2 |
6,030.8 |
6,291.0 |
|
세계 자동차시장 |
1,345.8 |
1,433.1 |
1,521.1 |
1,657.6 |
1,782.6 |
1,904.7 |
2,012.5 |
2,151.8 |
|
세계 IT 시장 |
2,482.8 |
2,596.0 |
2,854.3 |
2,946.3 |
3,093.8 |
3,271.8 |
3,423.8 |
3,581.0 |
|
세계 철강시장 |
1,229.8 |
1,120.9 |
1,027.7 |
1,045.3 |
1,132.2 |
1,250.7 |
1,267.8 |
1,357.3 |
자료 : ʼ15.7월 Datamonitor(www.datamonitor.com), ʼ14.12월 Marketline(www.marketline.com), Datamonitor․Marketline: 영국 리서치&컨설팅 기관
주 1) 식품시장의 경우 2015~2018년은 추정치, 주 2) 자동차․IT․철강시장의 경우 2014~2018년은 추정치
식품산업의 시장규모는 인구 및 경제규모와 관계가 있으며 이런 기준에 따라 중국(16,220억) 미국(9,990억), 일본(3,320억)이 그 규모면에서 선두그룹을 이루고 있으며 한국은 590억불로 앞으로 더 발전 할 가능성은 있다.
(단위 : 10억 달러)

출처 : 2015년도 식품산업 주요지표(aT, 2015. 7.)
[그림 4-3-7] 주요국의 식품시장 규모(2014)
(2) 기능성 식품 현황
경제적 여유와 삶의 질 향상을 원하는 소비자 요구에 따라 기능성 식품의 수요는 매년 증가하고 있으며 선진국을 선두로 빠르게 성장하는 제조업 분야이다. 이 범주에는 영양원을 공급하는 경우를 포함한 기능성을 갖는 모든 식품이 포함된다. 이 분야에서도 발효기법을 활용하거나 특정한 기능성 성분을 생산하기 위한 생명공학 기법이 폭넓게 적용되고 있으며 앞선 발효산업이 기반을 갖춘 우리나라의 경우 가능성이 높은 분야의 하나이다.
Datamonitor사의 자료에 의하면 기능성 식품시장은 최근 5년간 연평균 6%의 성장을 보이고 있다.
(단위 : 백만달러, %)

출처 : Nutrition Business Journal, 2012
[그림 4-3-8] 건강기능식품 세계시장 규모 및 성장률
분야별 기능성 식품의 규모는 기능성 식품시장이 가장 크고(35%) 영양 보충제(29%), 천연유기식품(26%)순으로 나타나고 있다.
국가별로 건강 기능식품의 시장규모를 보면 미국(29,242백만 불), 서유럽(15,657백만 불), 일본(10,599백만 불), 중국(10,639백만 불) 순이며 한국은 1,235백만 불로 성장 가능성은 높으나 규모는 아직 선진국에 비하여 낮다.2)

출처 : Nutrition Business Journal Global Supplement & Nutrition Industry Report 2010($mil., consumer sales)
[그림 4-3-9] 세계 기능성 제품 분야별 판매현황
(3) 발효식품현황
발효식품산업은 미생물이나 이들이 생장한 효소를 이용하여 농축수산물을 기질로 새로운 형태의 식품이나 발효산물을 생산하는 업종이다. 세계인의 발효식품 섭취량은 향후 50~400g/일로 총 식품섭취량의 5~40%에 이르고 종류만도 5,000여 종에 이를 것으로 추정한다.3)
발효의 역사는 기원전 1만 년 전으로 거슬러 올라가며 기원전 7,000년 전 치즈, 빵을 발효하여 먹었다. 서양은 소시지, 햄 등 육류, 요거트 그리고 포도주 등 알콜성 음료가 주된 제품이나 동양은 곡류, 채소류, 수산물을 이용한 발효식품이 발달하였다. 발효식품 외에 미생물을 이용한 2차 대사산물을 다양하게 생산하여 식재료나 의료용으로 사용하고 있다. 이 분야에서는 폭넓게 생명 공학기법을 활용하여 미생물 균주의 개량, 신균주의 발굴 등이 부각 되고 있다. 발효 산물로써 생산하는 대표적인 아미노산과 바이오시장 규모는 각각 다음 그림과 같다.

출처 : 고부가가치 식품산업/발효산업의 기술 동향과 육성 전략/지식산업정보원(2013. 7.)
[그림 4-3-10] 사료용 아미노산 시장규모

출처 : 산업연구원/한국은행
[그림 4-3-11] 미생물관련 제품산업 현황
다. 국내 현황
(1) 식품산업현황
식품산업은 넓게는 식품‧외식산업 그리고 유통업이 포함될 수 있다. 실제 식음료 제조업은 77조 3천억 원, 외식업은 79조 5천억 원으로 총 156조 9천억 원4)에 이르나 여기서는 식품산업에 국한하여 분석하고자 한다.
식품산업의 매출액 추이를 보면 2002년 36조4천억 원이었으나 2014년 53조 7천억 원(축산물가공품제외)로 크게 성장하였으며, 동 기간 중 국내산업 대비 식품산업 비중은 제조업 GDP대비 각각 19.7%에서 12.07%로 변하였고 총 GDP로 비교할 때는 4.64%에서 3.34%로 비중이 낮아졌다.
[표 4-3-11] 식품산업 생산실적 추이
|
연도 |
생산량(T) |
생산액(천원) |
매출액(천원) |
증가율(%) |
|
2002 |
19,269,737 |
35,388,130,152 |
36,388,079,110 |
18.2 |
|
2004 |
23,431,972 |
30,045,258,292 |
33,181,087,253 |
38.8 |
|
2006 |
25,147,665 |
32,694,772,305 |
35,699,307,123 |
7.1 |
|
2008 |
24,382,413 |
36,649,627,163 |
39,298,783,847 |
5.2 |
|
2010 |
26,996,594 |
34,548,229,978 |
38,790,939,006 |
-12.7 |
|
2012 |
33,836,234 |
43,478,331,108 |
47,327,653,596 |
6.5 |
|
2014 |
35,812,205 |
49,530,575,375 |
53,736,286,078 |
-0.5 |
출처 : 2014년도 식품 및 식품첨가물 생산실적(식약처)
[표 4-3-12] 국내산업 대비 식품산업 비중
|
연도 |
제조업 GDP |
국내총생산 (GDP) |
식품산업 총 생산액 |
||
|
|
제조업 GDP대비 |
GDP 대비 |
|||
|
2002 |
184,578 |
761,939 |
35,388 |
19.17 |
4.64 |
|
2004 |
225,328 |
876,033 |
30,045 |
13.33 |
3.43 |
|
2006 |
242,292 |
966,055 |
32,695 |
13.49 |
3.38 |
|
2008 |
284,940 |
1,104,492 |
36,650 |
12.86 |
3.32 |
|
2010 |
351,771 |
1,265,308 |
34,548 |
9.82 |
2.73 |
|
2012 |
388,010 |
1,377,457 |
43,478 |
11.21 |
3.16 |
|
2014 |
410,214 |
1,485,078 |
49,531 |
12.07 |
3.34 |
출처 : 2014년도 식품 및 식품첨가물 생산실적(식약처)
한편 우리나라 식품산업의 10년간 추이를 보면 연평균 출하액 성장률은 6.7%, 2004년 대비 77.6%가 증가하였다.
[표 4-3-13] 우리나라 식품산업의 10년간 추이
|
구분 |
2005년 |
2007년 |
2009년 |
2011년 |
2013년 |
연평균 성장률 |
’04년 대비 성장률 |
|
|
식품제조· 외식 |
사업체수(개) |
- |
427,885 |
426,025 |
444,154 |
463,868 |
1.3% |
9.2% |
|
전년대비(%) |
- |
0.7% |
0.3% |
3.3% |
1.8% |
|||
|
종사자수(명) |
1,603 |
1,730 |
1,768 |
1,861 |
2,008 |
1.8% |
17.0% |
|
|
전년대비(%) |
-6.6% |
2.6% |
1.7% |
4.6% |
3.9% |
|||
|
출하액(10억원) |
89,920.7 |
107,514.5 |
130,636.5 |
143,715.1 |
156,870.1 |
6.2% |
70.7% |
|
|
전년대비(%) |
-2.1% |
9.6% |
8.9% |
9.5% |
2.9% |
|||
|
음식료품 제조업 |
사업체수(개) |
3,932 |
4,257 |
4,169 |
4,360 |
4,616 |
2.1% |
20.2% |
|
전년대비(%) |
2.4% |
4.9% |
2.7% |
2.3% |
4.4% |
|||
|
종사자수(명) |
158 |
163 |
167 |
177 |
184 |
1.6% |
15.0% |
|
|
전년대비(%) |
-1.3% |
3.8% |
3.7% |
3.5% |
2.8% |
|||
|
출하액(10억원) |
43,668.2 |
48,149.1 |
60,771.3 |
70,208.1 |
77,320.5 |
6.7% |
77.6% |
|
|
전년대비(%) |
0.3% |
8.5% |
10.1% |
10.2% |
2.9% |
|||
|
음식점업 |
사업체수(개) |
- |
423,628 |
421,856 |
439,794 |
459,252 |
1.3% |
9.1% |
|
전년대비(%) |
- |
0.7% |
0.3% |
3.3% |
1.8% |
|||
|
종사자수(명) |
1,445 |
1,567 |
1,601 |
1,684 |
1,824 |
1.8% |
17.2% |
|
|
전년대비(%) |
-7.1% |
2.5% |
1.5% |
4.7% |
4.1% |
|||
|
출하액(10억원) |
46,252.5 |
59,365.4 |
69,865.2 |
73,507.0 |
79,549.6 |
5.9% |
64.5% |
|
|
전년대비(%) |
-4.4% |
10.5% |
8.0% |
8.8% |
2.9% |
|||
출처 : 식품산업 주요지표(aT, 2015)
(2) 분야별 현황
(가) 기능성 식품
우리나라 기능성 식품은 크게 고시형과 개별인정형으로 나누고 있으며 고시형은 2015년 현재 인삼 등 60건, 개별인정형은 정어리 펩티드 등 162건이 허가되었다. 2013년 현재 기능성 원료로는 463건이 인정되었다. 각국마다 법적으로 기능성식품을 관리하는 방법이 다르나 우리나라는 완전 국가 허가제를 도입하고 있다.
건강기능식품의 생산실적은 2013년 총생산액은 14,820억 원으로 전년대비 5% 증가하였고 새로운 기능성 원료를 사용한 개별인정형 제품(전년대비29%증가)과 프로바이오틱스 제품(전년대비 55%증가)이 상승을 주도하였다. 2013년도 건강기능성 식품시장 규모는 1조 9,920억 원으로 2009년 이후 계속 성장하는 경향을 보였다. 동기간 중 수출은 29% 증가하였고 2013년 754억 원이었다.
[표 4-3-14] 건강기능 식품 생산실적(2009~2013)
*1$=1,095원(2013년)
|
구분 |
총 생산액 (억원) |
총 생산량 (톤) |
내수용 |
수출용 |
||
|
생산액(억원) |
생산량(톤) |
생산액(억원) |
생산량(톤) |
|||
|
2009년 |
9,598 |
19,885 |
9,184 |
19,293 |
415 |
592 |
|
2010년 |
10,671 |
25,361 |
10,211 |
24,994 |
460 |
367 |
|
2011년 |
13,682 |
40,258 |
13,126 |
39,611 |
556 |
647 |
|
2012년 |
14,091 |
34,599 |
13,507 |
33,735 |
584 |
864 |
|
2013년 |
14,820 |
31,446 |
14,066 |
30,490 |
754 |
956 |
|
증감률 (2013/ 2012, %) |
5.2 |
△ 9.1 |
4.1 |
△ 9.6 |
29.1 |
10.6 |
출처 : 보도자료(식약처, 2013.12.)
한편 건강기능식품 기능별 품목의 생산 점유율을 보면 아래 그림과 같다.

출처 : 식약처(2013.12.31. 기준)
[그림 4-3-12] 기능성별 건강기능식품 생산실적(점유율)
기능별로는 면역기능 개선(24.8%), 혈행 개선(21.9%) 항산화(20.6%), 영양소 보충(6.5%)순이었다.
한편 건강기능식품으로 유망한 분야를 조사한 결과 피로회복, 혈행 개선에 가장 관심이 높은 것으로 나타났다.

자료 : 건강기능식품산업동향보고서, 농업기술실용화재단(2013. 12.)
[그림 4-3-13] 사업화 유망 분야 매트릭스 분석
(나) 발효분야
① 발효식품분야
한국의 발효식품은 크게 나눠 김치, 장류, 젓갈, 식초로 구분되며 전통주 등은 알코올의 독성 때문에 발효식품으로 구분되기 어렵고 알코올성 음료로 구분해야 할 것이다.
우리나라에서 생산되는 대표적인 발효식품의 연도별 생산량 및 출하액은 아래 표와 같다.
[표 4-3-15] 한국대표 발효식품 산업현황
(단위: 백만 원/톤)
|
|
2007 |
2009 |
2012 |
2013 |
2014 |
|||||
|
품목 |
생산량 |
출하액 |
생산량 |
출하액 |
생산량 |
출하액 |
생산량 |
출하액 |
생산량 |
출하액 |
|
장류 |
663,166 |
835,429 |
631,063 |
919,234 |
613,933 |
1,035,662 |
621,764 |
783,681 |
632,925 |
779,821 |
|
김치류 |
364,506 |
596,050 |
426,834 |
726,755 |
412,989 |
942,239 |
447,628 |
984,838 |
421,505 |
886,943 |
|
젓갈류 |
112,171 |
199,431 |
101,241 |
221,773 |
118,086 |
250,719 |
100,935 |
244,412 |
108,312 |
240,838 |
|
발효 음료 |
52,476 |
32,229 |
84,970 |
54,601 |
96,247 |
92,707 |
100,270 |
70,531 |
109,124 |
69,275 |
|
식초 |
63,982 |
61,137 |
61,126 |
52,857 |
75,596 |
86,281 |
84,526 |
73,749 |
92,443 |
78,430 |
출처 : 식품 및 식품첨가물 생산실적(식품의약품안전청, 각 년도)
이들 발효식품의 연도별 생산액 추이는 아래 그림과 같다. 전체적으로 발효식품의 출하액은 약간씩 증가하나 생산량은 큰 변화가 없어 산업이 침체하고 있다는 것을 볼 수 있다.

[그림 4-3-14] 전통 발효식품의 생산액 추이
② 발효 산물 분야
발효기법을 활용하여 특정 물질을 생산하는 발효 산물은 발효 조미료와 다목적용 아미노산류로 나눌 수 있다. 발효 조미료는 MSG, IMP, GMP가 국내에서 모두 생산이 되고 있으며 내수 시장규모는 2013년 기준 32,524톤 정도이나 식생활의 변화로 다소 감소하는 경향을 보인다.
국내 생산뿐만 아니라 수입되는 양도 2013년 15천 톤에서 2014년 17천 톤으로 증가하였고 이는 산업용으로 사용량이 증가한 이유이다.
[표 4-3-16] 최근 3개년 발효조미료 생산 판매 추이
(단위 : 수량(톤), 신장율(%))
|
연도 |
생산량 |
출하량 |
재고량 |
내수량 |
수입량 |
수출량 |
||||||
|
|
신장률 |
|
신장률 |
|
신장률 |
|
신장률 |
|
신장률 |
|
신장률 |
|
|
2012년 |
33,572 |
-8.7 |
16,618 |
-20.4 |
8,266 |
162.7 |
28,611 |
-27.7 |
11,993 |
-35.7 |
8,688 |
-31.8 |
|
2013년 |
27,640 |
-17.7 |
17,933 |
7.9 |
3,353 |
-59.4 |
32,642 |
-14.1 |
14,709 |
22.6 |
6,354 |
-26.9 |
|
2014년 |
25,800 |
-6.7 |
15,580 |
-13.1 |
5,115 |
52.5 |
32,524 |
-0.4 |
16,944 |
15.2 |
5,105 |
-19.7 |
출처 : 식품의약품안전처 식품 및 식품첨가물 생산실적 통계자료, 무역협회수출입 통계
아미노산류는 CJ제일제당이 주로 생산하고 있으며 생산 품목은 lysine(80만톤), threonine(4만 톤), tryptophan(1만 톤), methionine(8만 톤) 등으로 주로 국내 기술로 중국, 말레이시아 등에서 생산한다. 대상도 일부 lysine을 생산한다.
라. 종합
식품은 인류의 역사와 함께하였고 인간이 생존하는 한 존재해야할 필수품이다. 그 원료는 자연에만 의존해야하는 특성과 한계가 있다. 그간 눈부신 생명공학 기술에 힘입어 농축수산물의 생산량이 획기적으로 증가하였고 그 품질도 크게 개량되었다. 농축산 원료의 품종 개량과 재배, 사육 기술의 발달로 양질의 식재료가 생산되어 이들 식재료를 이용하는 식품산업도 다양한 제품과 특성을 달리한 우수한 신제품들이 개발되어 국내만 하더라도 약 6만종의 가공식품이 생산 유통되고 있다.
식품산업에서 생명공학기술의 활용은 주로 미생물을 활용하는 발효식품과 아미노산 등 발효산물을 생산하는 분야에 주로 적용되었고 신제품개발, 수율의 향상, 품질 개선 등의 목적으로 연구가 진행되고 있다.
발효식품은 우리전통식품의 근간을 이루면서 한식의 독창성을 부여하는 기반식품으로 앞으로 계속 발전시켜 나가야 할 분야이며 아미노산, 핵산조미료 등은 국내 시장보다는 국제시장에서 경쟁력을 갖추기 위하여 계속하여 신 균주의 발굴, 발효기법의 개량 등을 통하여 우리 몫을 넓혀가야 할 것이다.
또한 건강하고 장수하려는 욕구에 힘입어 크게 수요가 늘고 있는 기능성 식품도 새로운 소재의 발굴, 기능의 과학적 입증 등 관련 연구가 필요하며 새로운 영역을 개척해야하는 등 할 일이 많다.

1. 환경 생명공학
가. 서론
(1) 환경생명공학기술의 개요
환경생명공학(Environmental Biotechnology)이란 생명공학기술(Biotechnology, BT)을 환경공학(Environmental Technology, ET)분야에 이용하여 환경오염을 방지하고 환경을 효율적으로 보전하고 관리하는데 활용되는 모든 기술 또는 학문을 의미한다. 이 분야는 21세기 첨단기술로 주목되는 것 중 하나로써 분자생물학, 환경과학, 생태학 등의 분야와 융화하여 빠르게 발전하고 있다.
환경생명공학기술은 국가과학기술 표준분류체계에서 미래유망 신기술 6가지 중 2개 분야에 걸쳐 있는 중요한 분야이며 이러한 기술들은 전 세계적으로 환경분야의 핵심기술로 연구개발을 통해 실용화를 추진하고 있다.
본 장에서는 환경생명공학기술 중 환경오염제어 및 관리기술에 해당하는 생물정화(Bioremediation)를 중심으로 관련 내용을 조사하여 정리하였다.5)
(2) 환경생명공학 기술개발의 필요성
환경문제는 21세기 인류생존을 위협하는 최대 현안문제 중 하나로 기존의 환경문제를 해결하기 위해 물리적, 물리․화학적, 생물학적 방법을 이용하였으나 여기에 첨단기술로 주목받고 있는 생명공학기술까지 도입하여 환경문제를 해결하기 위해서 전 세계적인 노력을 기울이고 있다. 생물정화기술은 미생물이나 식물에 의한 난분해성 물질 및 환경오염물질의 분해 촉진 및 생물전환(Biotransformation) 등을 통해 오염물질의 농도가 근본적으로 감소되고, 2차 오염을 방지할 수 있으며, 장기적인 측면에서 물리적, 화학적 또는 물리․화학적 방법보다 환경관리 비용이 적게 든다는 경제적인 장점을 가지고 있다.
[표 4-4-1] BT 분야 세부기술 분류표, 미래유망 신기술 중 환경생명공학 포함 분야 (국가과학기술분류체계, 2013)
|
구 분 (중분류) |
코드값 |
기술명(소분류) |
분 류 기 준 |
|
농업‧해양‧환경 관련 응용 |
020311 |
유전자 변형 생물체 개발기술 |
농업‧해양형질전환 동식물, 발생생물공학, 육종기술, 생물체 복제기술, 곤충이용 기반기술, 형질전환 실험동물 모델개발, 형질전환 동식물을 이용한 단백질 생산기술 등 |
|
020312 |
농업‧해양 생물자원의 보존 및 이용기술 |
생물 다양성 활용기술, 국가 생물다양성 조사‧보전, 농업‧해양 생물자원 확보 및 유전체 분석‧활용기술, 분자표지를 이용한 작물 및 가축의 분자육종 체계 확립, 해양자원을 이용한 신의약‧신소재 탐색 개발 및 활용기술 등 |
|
|
020313 |
동식물 병해충 제어기술 |
병충해 관련 유전자 및 단백질 분석기술, 병충해 감염 조기 진단 chip 개발 등 |
|
|
020314 |
환경 생명공학기술 |
환경 친화형 생물소재 개발, Bioremediation 등 |
|
|
020315 |
기타 농업‧해양‧환경 응용기술 |
실험동물 이용 기술, 고유 식품 개발, 달리 분류되지 않는 농업해양 관련 생명공학기술 |
출처 : 국가과학기술분류체계, 2013
[표 4-4-2] ET 분야 세부기술 분류표, 미래유망 신기술 중 환경생명공학 포함 분야
|
구분 (중분류) |
코드값 |
기술명(소분류) |
분 류 기 준 |
|
환경 기반 |
050112 |
자연환경 ‧오염토양 ‧지하수의 정화 ‧복원기술 |
오염토양․지하수 정화 및 복원기술(불량매립지 복원기술, 폐광지역 환경복원기술, 유해화합물, 오염지역 정화기술, 자연정화 촉진기술, 오염지하수 확산방지기술), 하천정화 및 호수 부영양화 저감기술, 토양․지하수 복원 요소기술(난분해성 유독물질 정화를 위한 혁신기술․기기․장비 개발), 토양․지하수 통합관리기술(GIS를 이용한 토양지하수 오염 통합관리기술) 등 |
|
050113 |
수질오염처리 및 재이용기술 |
질소․인 제거기술, 고도처리기술, 하수처리장 자동화를 위한 Fuzzy 이론의 적용 등 전문가 시스템, 산업폐수 고도처리기술, 정수장․하수처리장 효율향상기술, 오수․분뇨․축산폐수 복합처리기술 등 |
|
|
050114 |
폐기물 처리 및 활용기술 |
폐타이어의 재생기술, 폐기물의 자원화 기술, 폐기물 발생 저감 및 매립지 안정화기술, 소각 및 열분해․용융기술, 음식물 찌꺼기의 퇴비화․사료화를 위한 염분제거기술 등 |
출처 : 국가과학기술분류체계, 2013
나. 연구개발 동향
국제적으로 활발히 연구가 진행되고 있는 환경생명공학분야에는 바이오플라스틱, 바이오디젤(바이오에너지), 기능성섬유(거미줄 단백질생산을 이용한 방탄복 생산 등) 등과 같은 석유화학성분을 대체하기 위한 분야와 식물 또는 미생물을 이용해 폐기물 및 오염물질의 저감하거나 제어 하는 생물정화분야의 연구가 활발히 진행 되고 있으며, 이들 중 생물정화의 주요 연구개발 동향을 요약정리 하였다.
최근까지도 환경생명공학 연구분야의 다양성은 크게 증가하지 않았으나 바이오가스 생산 분야, 폐기물 처리 분야 등 각 분야별 효율성이 증가되는 연구결과들이 계속적으로 보고되고 있다.6)
생물정화는 주로 미생물 또는 식물을 이용하는 두 가지로 크게 구분된다. 미생물을 이용하는 최근 연구는 생물정화 효율을 높이는 미생물의 복잡한 대사과정을 파악하고 이해하는 연구가 활발히 진행되고 있으며, 저비용, 환경 친화적으로 생각되는 오염대상을 바로 그 오염장소(in-situ)에서 처리 또는 in-situ와 ex-situ(오염된 대상을 다른 장소로 이동하여 처리)에서의 미생물과 영향분석의 효율적인 공급방법 개발이 진행되고 있다. 한 예로 산성광산배수는 중금속과 황산염의 높은 농도와 낮은 pH로 인해, 수질과 주변생태계에 장기간 악영향뿐만 아니라 황색 혹은 적갈색 금속침전물로 인해 시각적 혐오감도 강하게 유발하는 오염원이다. 초기 산성광산배수 처리방법은 물리화학적 처리에 의존을 했지만, 황산염환원균이나 철산화균의 작용이 보고되면서 생물학적 처리로 진행된 것이다. 식물을 이용한 생물정화(Phytoremediation)는 환경 친화적이며, 비용 절감 적이고 다양한 오염물질 정화 그리고 지하수로의 오염물질 누출을 방지하는 등의 2차 오염이 없는 장점을 지니며, Phytoremediation에 관한 최근연구는 식물의 독성 금속물질 수송기작과 특정식물의 독성금속 흡수와 저항성 연구 분야 및 기능이 규명된 유전자를 식물에 삽입․발현시켜 금속오염에 저항성을 보이는 형질전환 식물체를 개발하는 분야가 활발히 진행 중이다.
[표 4-4-3] 생물학적 정화의 주요 연구개발 동향
|
정화 분야 |
기술개발 동향 |
|
미생물을 이용한 생물정화 |
․중금속 저항성, 금속 분해능을 도입한 생물정화용 형질전환 미생물 개발 ․PCB 분해용 신규미생물 분리 ․생체물질 진단도구 및 방법 개발 ․독성물질 검출도구 및 수질 모니터링 시스템 개발 ․생분해성․환경친화적 필름 및 용도 ․미생물 분해성 폴리머 조성에 대한 연구 ․유기물질 고속 분해 방법 |
|
식물을 이용한 생물정화 |
․수경식물 재배방법 및 재배구조 ․식물생장 촉진 인자 탐색 연구 ․포플러 나무와 인디언 겨자의 특성을 이용하여 미국의 무기 시험장 및 군사지역의 오염물질 정화에 적용 ․400종 이상의 중금속 과축적 식물이 발견되었으며, 많은 연구기관과 회사에서 보다 향상된 과축적 식물을 찾기 위해 연구 진행 ․과축적 식물들의 기능향상을 위한 형질전환 식물체를 이용한 환경정화 기술 개발이 활발히 진행 |
생물정화에서는 형질전환 미생물 이용기술, 생물학적 투과장벽(Biowell) 및 Biocapping 기술, Biobeads 기술, 복합기술/Phasic 정화방법, 신규 영양 첨가물을 통한 정화능력향상 기술 등이 향후 유망기술로 발전할 것으로 여겨진다.
다. 환경정화를 위한 유전자변형생물체 기술현황 및 전망
생물정화분야의 최근 동향 중 한 흐름은 유전자변형생물체를 생물정화에 이용하는 것이다. 따라서 환경정화를 위해 연구개발 되고 있는 대표적인 몇 가지 사례를 기술하였다.
(1) 오염물질의 정화를 위한 유전자변형미생물 개발연구
미생물은 다양한 화합물을 분해할 수 있는 능력을 가지고 있기 때문에 오염물질의 정화에 이상적인 활용방안이다. 또한 활발한 신진대사 능력을 가지고 있어 천연 및 합성화합물의 에너지원으로 이용 가능하다. 이러한 분해 능력에 관여하는 수백여 개의 유전자정보들을 이용하여 형질전환 미생물을 개발하고 이를 생물정화에 적용한다.
생명공학을 이용한 형질전환 기술은 일반미생물을 생물정화에 이용 할 경우 각종 오염물질의 분해 시에 발생되는 한계점들을 개선시킬 수 있는 해결방안을 제시하고 있다. 일반미생물들은 대부분 난분해성 오염화합물을 분해하는데 필요한 대상경로를 갖추고 있지 않다. 그러나 형질전환 기술은 일반미생물의 이화학적 대사경로를 개선하거나 해당경로를 확장하여 일반미생물이 분해 할 수 없는 오염물질을 분해 가능하게 할 수도 있으며 특정오염물질이나 대사산물의 독성이나 미생물 생육억제 작용을 극복하는데 이용 할 수도 있다.
이러한 유전자변형미생물의 개발 전략에는 첫째, 전사과정(transcription)의 개선이 필요하다. 일반적으로 분해에 관련된 유전자들은 오페론의 전사를 증폭하거나 조절하는 기술의 발전이 필요하다. 둘째 번역(translation)의 향상이 필요하다. 이를 위해 번역촉진자(translation enhancers), mRNA 안전성, 지정부위 돌연변이(site directed mutagenesis)에 관련한 연구개발이 활발히 진행 중에 있다. 셋째, 단백질안정성과 활동성 향상이 필요하다. 앞에서 언급한 전사와 번역과정을 향상시키면 오염물질의 분해에 필요한 효소와 단백질이 많이 생성되지만 안전성과 활성이 부족하거나 오염물질에 대한 특이성이 낮다면 결국 오염물질 분해 효율이 낮아질 수밖에 없다. 따라서 아미노산 서열을 변경하여 단백질 안전성을 높이는 연구개발이 활발히 진행 중에 있다. 넷째, 분해대사 경로의 범위확장이 필요하다. 대사경로를 확장하여 더 많은 오염물질을 분해시키는 연구가 지속적으로 보고되고 있다. 다섯째, 앞서 언급한 기술을 모두 접목시키는 유전자변형미생물의 개발 연구가 필요하다. 오염지역에 살포된 유전자변형미생물이 오염물질에서 유발되는 스트레스에 적응되었을 지라도 산소, 물, pH 등이 함께 제한요인으로 작용한다면 오염물질 분해 효율에 한계가 있을 것이다. 이러한 조건에서도 오염물질을 분해 할 수 있게 하는 연구개발이 지속적으로 필요하다. 이러한 연구들에는 유전자변형 곰팡이를 이용하는 연구도 진행 중에 있다.
(2) 오염물질 모니터링을 위한 유전자변형미생물의 연구개발
미생물은 환경 내에서 오염물질의 분해, 존재, 독성을 관찰하는데 이용될 수 있다. 미생물은 독성물질에 빠르게 반응하며, 오염물질이 존재하는 나쁜 환경에서도 생존하기 때문에 오염물질의 모니터링에 사용가능한 이상적인 대상이다. 또한 미생물은 광범위한 환경오염물질의 분해와 더불어 특정오염물질을 관찰하고 오염된 환경에 존재하는 실제 독성수준을 분석하는 용도로 사용하기 위한 연구개발이 활발히 진행 중에 있다.
형질전환 기술을 이용하여 luc, lux, gfp 등의 리포트 유전자를 해당미생물로 삽입하여 오염물질 모니터링을 위한 유전자변형미생물의 연구개발이 지속되고 있다. 이러한 바이오센스의 중요한 장점은 특정 오염물에만 반응하는 센서라는 특이성이다. 오염지역의 예비 평가에서 lux를 포함하고 있는 유전자변형미생물을 이용하여 그 지역에 존재하는 독성오염물질의 위치와 농도를 파악할 수 있는 현장 적용이 수행되었다. 이를 통하여 정화효율을 증가시키고 정화비용을 절감하는 접근방법에 한층 접근하는 효과를 가져왔다. 최근에는 광섬유 케이블에 오염물질을 모니터링 할 수 있는 유전자변형미생물을 고정시키기 위한 연구개발이 진행되고 있다.
(3) 오염물질의 정화를 위한 유전자변형식물의 연구개발
생명공학기술과 육종학기술의 발달은 환경을 파괴하지 않고 지속가능한 성장을 위한 요구에 따라 비용절감과 환경 친화적인 기술로 여겨지는 유전자변형식물의 개발이 활발히 진행되고 있다. 이는 전통적인 식물육종 방법을 대신할 빠르고 개량된 방법으로, 다양한 종류의 유전자형질과 적용할 식물의 다양성에 관한 연구개발이 진행 중에 있다. 이런 유전자변형식물의 장점은 미생물과 비교할 때 특정한 영양분이나 배양조건이 필요하지 않으며, 살균처리과정을 생략할 수 있고, 환경적응력이 미생물에 비해 높다는 것이다.
유전자변형식물의 개발에 고려되는 전략들은 첫째, 식물추출법(phytoextraction)은 토양 내에 있는 오염물질을 식물체내에 흡수 축적하여 오염물질을 제거하는 기작을 의미한다. 가장 널리 사용하고 있는 방법이며 식물을 수확하여 소각하면 중금속의 회수도 가능하다.
둘째, 뿌리여과법(rhizofiltration)은 토양이 아닌 수용액 또는 액상폐수에 있는 오염물질을 식물뿌리 또는 뿌리근처에 살고 있는 근권 미생물에 의해 금소류, 유기오염물질과 방사성오염물질 등을 제거하는 기작이다.
셋째, 식물안정화법(phytostabilization)은 오염물질을 분해하지는 않으나 오염물질을 침전시키거나 뿌리에 흡착시켜 오염물질의 이동성을 줄여주고 더 깊은 토양 속 또는 지하수로 이동하지 못하도록 해주는 기작이다.
넷째, 식물휘발법(phytovolatilization)은 수은(Hg), 셀레늄(Se)의 제거에 큰 효과가 있는 것으로 오염물질이 휘발성과 독성이 강할 때 독성을 낮추는데 이용하는 기작이다. 금속이온을 더 휘발성이 강한 상태로 전환시켜 독성을 경감시키고 이를 기공을 통해 대기 중으로 배출시킨다.
다섯째, 식물분해법(phytodegradation)은 식물이 생산하는 여러 종류의 효소가 여러 독성물질을 부분 또는 완전 분해시켜 저독성 또는 무독성으로 전환하는 기작이다. 유용한 효소들로는 nitroredutase, laccase, peroxidase, nitrilase 등이 있으며 유전자변형식물들을 이용해서는 trichloroethylene(TCE), 2,4,6-trinitrotoluene(TNT)를 분해하는 유전자를 발현하는 식물들도 개발 중에 있다. 폐수처리, 중금속처리, 탄화수소 처리, 염소화합물 처리, 방사성물질 처리 등에 활용하기 위한 유전자변형 식물의 연구개발이 활발히 진행 중 이다. 환경정화용 유전자변형식물의 연구는 상당히 진전 중에 있으며 토양오염, 지하수를 포함한 수질오염, 방사성물질 오염 등의 환경오염 문제를 해결해 줄 수 있는 친환경 대안기술로 여겨지고 있다.
라. 향후전망 및 발전방향
환경생명공학기술은 에너지 절약형이면서 환경 친화형 기술로써 지속가능한 성장과 환경보전을 동시에 추구하는 미래 산업으로 쾌적한 환경을 확보하여 삶의 질 향상에 큰 영향을 미칠 것으로 기대된다.
생물정화 관련 국내 특허 상황을 살펴보면 해외 출원기관의 특허는 국내에 거의 진입하지 못한 상황으로 국내 기술 시장을 보호하기에 상대적으로 유리 할 수 있다. 또한, 21세기 국가 핵심 산업으로 인식되고 있는 BT와 ET가 융합된 환경생명공학기술은 산업화 및 발전 가능성이 높은 분야라 사료된다.
따라서, 다음과 같은 점들을 고려하여 국내 환경생명공학의 발전방향을 지속적으로 모색하여야 할 것이다. 첫째, 환경정화의 공익성을 고려하여 효과적인 생물정화를 위한 기초연구부터 산업적 활용까지 총괄적인 전략과 국가차원의 지원이 필요할 것이다. 둘째, 생물정화의 기초연구분야의 국내 기술수준은 높은 수준 인 것으로 평가되고 있기 때문에 지속적인 투자와 교육을 통한 관련 기술의 축적과 인재 양성 프로그램의 개발이 병행되어져야 한다. 셋째, 생물정화를 통한 환경복원 기술은 오염지역의 자연환경 특성에 따라 그 세부방법이 달라지기 때문에 국내에서 개발된 기술이 국내 자연환경에 도입하여 성공할 확률이 높을 것이며, 국내 오염지역뿐만 아니라 환경이 유사한 해외의 오염지역에도 적용이 가능할 것이다. 넷째, 탄소배출권 규제와 같은 국제적인 환경보전에 대한 책임이 국가와 기업들에게 부가되어 질 것이므로 이와 관련한 대비와 투자가 필요 할 것이다. 다섯째, 환경정화를 위한 최종 산물인 LMO의 위해성 평가 기술 확보 및 안전관리 방안 마련을 위한 노력과 투자도 늘려야 할 것이다.
2. 해양 생명공학
가. 개요
해양생명공학은 해양생물자원을 대상으로 발달된 생명공학기술을 적용하는 분야로 생명공학기술 응용의 원료, 수단, 혹은 대상으로 해양생명기능을 활용하는 것으로 정의된다. [그림 4-4-1]과 같이 OECD 보고서(2013)에서는 해양생물자원에 발달된 생명공학기술을 적용하여 생태계 관리, 기초연구 및 생물정화에 서비스를 제공하거나 의약품, 바이오연료, 전기, 식품, 효소, 활성물질 등의 산물을 생산하여 부가가치를 증대시키는 것으로 폭 넓게 해석하고 있다.7) 최근의 해양생명공학에 대한 관심 증대는 유전자 분석 기술의 발달로 해양생태계의 생물다양성 특히, 유전적 다양성에 기인한다. 해양에 얼마나 많은 생물종이 존재하는가에 대한 답을 얻기 위해 진행된 국제협력 프로그램인 ʻ해양생물센서스 프로젝트(Census of Marine Life, 2000~2010)ʼ에서 수십만 종의 새로운 해양생물종이 발견되었으며 여전히 미지의 생물종이 미발견 상태로 남아 있음을 확인하였다8). 해양생물자원은 천연물, 양식, 유전자특허 등의 원천자원으로 활용되고 있으며, 2010년까지 해양으로부터 18,000여 종의 천연물이 발견되었고, 4,900여 개의 해양생물 유래 유전자 특허가 출원되었으며 특히 최근에 들어 해양유전자 특허 출원 증가 속도가 연간 12%에 달할 정도로 관심도가 집중되고 있다. 생물종 수에 대한 유전자 특허율을 비교하면 육상생물종(0.19%)에 비해 해양생물종(0.38%)이 더 높음을 알 수 있다9). 이는 새로운 해양생물종의 발견은 그만큼 새로운 기능의 유전자를 찾을 수 있음을 의미한다. 게다가 대양 및 심해저와 같은 해양생태계 탐사 및 생물 시료 채집 기술 발전에 따른 특이한 생명체의 발견에 힘입은 바도 크다. 생명공학 연구의 패러다임을 변화시키는 차세대 시퀀싱 기술과 유전체정보 분석기술의 발달은 해양유전자원의 미래 가치를 더욱 상승시키고 있다.

[그림 4-4-1] Marine biotechnology: Resource-infrastructure-innovations
나. 기술 동향
(1) 해양생물 유래 의약품
인간 질병을 치료하기 위한 의약용 천연물 연구는 오랜 역사를 지니고 있으며 현대 의학에서도 중요한 부분을 차지하고 있다. 해양생물자원도 천연물 연구의 주요 대상으로 이용되었으며, 1969년 Ara-C(CytosarⓇ(ziconotide)가 미국 식품의약청(FDA)으로부터, 2007년도에는 YondelisⓇ가 연조직육종 치료제로 유럽연합의 승인을 받으면서 해양 천연물 의약 개발이 활발하게 진행되고 있다. 해양 유래 의약개발의 현황을 살펴보면 FDA승인을 받은 의약품이 7종, 임상시험 중인 물질이 11개, 전임상단계 물질이 약 1,458종, 해양천연물의 화학적 구조가 밝혀진 것이 약 8,940 종으로 알려져 있다11). 해양생물을 활용한 의약품의 개발은 향후 지속적으로 신약개발 파이프라인에 적용될 것으로 예측된다.
[표 4-4-4] 해양의약품의 개발 현황
|
|
Compound Name |
Trademark |
Marine Organism |
Disease Area |
|
FDA- Approved |
Brentuximab vedotin (SGN-35) |
AdcetrisⓇ |
Mollusk/ cyanobacterium |
Cancer |
|
Cytarabine (Ara-C) |
Cytosar-UⓇ |
Sponge |
Cancer |
|
|
Eribulin Mesylate (E7389) |
HalavenⓇ |
Sponge |
Cancer |
|
|
Omega-3-acid ethyl esters |
LovazaⓇ |
Fish |
Hypertriglyceridemia |
|
|
Ziconotide |
PrialtⓇ |
Cone snail |
Severe Chronic Pain |
|
|
Vidarabine (Ara-A) |
Vira-AⓇ |
Sponge |
Antiviral (Herpes Simplex Virus) |
|
|
EU- Approved |
Trabectedin (ET-743) (EU Registered only) |
YondelisⓇ |
Tunicate |
Cancer |
|
Phase III |
Plitidepsin |
AplidinⓇ |
Tunicate |
Cancer |
|
Tetrodotoxin |
TectinⓇ |
Pufferfish |
Chronic Pain |
출처 : http://marinepharmacology.midwestern.edu/index.htm
(2) 수산양식
수산양식산업은 전통 산업으로 인류에게 동물성 단백질원을 제공하는 역할을 한다. 세계적으로 약 10억 명 이상의 인구가 수산물에 의한 단백질 공급에 의존하고 있으며, 그 수요는 계속 증가할 것으로 예측하고 있다. 수산물 남획으로 인해 향후 세계 수산물의 50% 이상이 양식으로 공급될 것으로 예측되어 양식기술 및 산업의 중요성이 더해감에 따라 그 생산성이 매우 중요하여 양식산업의 발전을 ʻ청색혁명(blue revolution)ʼ이라 부르기도 한다.12) 양식산업은 수산자원 고갈을 막고, 새로운 일자리를 창출하고, 수산업을 대체할 수 있지만, 양식생물의 질병 같은 안전성 등의 지속가능성에 대한 문제 해결이 남아있다. 그런 측면에서 해양생명공학은 양식기술에 새로운 기회를 제공해줄 것으로 기대되고 있다. 즉, 양식용 백신개발, 수산생물 질병의 분자진단기술 개발 필요성이 더욱 높아진다. 개발도상국에서는 양식에서 많은 양의 항생제가 사용되고 있는데, 노르웨이는 연어 양식에 전혀 항생제를 사용하지 않는 기술을 개발하였다. 현재 빠르게 발전하고 있는 유전체 연구 및 기술은 분자 양식(molecular aquaculture) 형태로 발전하고 있으며, 유전체 기술을 활용하여 신속성장 및 질병에 저항성 있는 종자 개발을 위한 분자육종기술 개발로 활용될 수 있다. 이미 대구와 대서양 연어에 대한 전장 유전체 해독이 완료되었고, 유전체 정보는 새로운 종 개발로 활용될 수 있다. 또한 DNA 재조합 기술을 이용하여 제브라피쉬, 돔(Tilapoa)을 대상으로 연구하여 유전자재조합생물(GMO, Genetically modified organism) 생산이 가능하게 되었다. 미국의 수산생명공학 회사인 AquaBounty Technologies는 유전자 변형 연어를 개발하고 미국 식품의약청(FDA)에 승인을 요청한 상태이나, 인체 및 환경위해성 문제로 논쟁이 치열하다.13)
(3) 해양바이오에너지
바이오에너지는 기후온난화 문제로 인한 온실가스인 이산화탄소를 저감하기 위한 수단으로 인식되고 있다. 특히, 식용작물(통, 옥수수, 사탕수수)을 이용한 1세대, 비식용작물인 목질계 섬유소자원을 이용하는 2세대, 그리고 해조류 기반의 3세대 해양바이오연료가 대안으로 떠오르고 있다. 미세조류를 활용하는 바이오디젤, 거대조류를 원료로 하는 바이오에탄올, 바이오가스, 바이오수소 등이 있다. 해조류 기반의 바이오연료는 난분해성 리그닌 성분이 거의 없고, 경작지, 용수, 비료 등의 투입이 필요 없는 환경적인 장점을 지녔으나 아직까지 경제성과 규모의 문제로 상업적인 생산에는 이르지 못 하고 있다. 미국에서는 에너지성(DOE, Department of Energy)이 수송용 바이오연료 생산기술 개발을 적극적으로 투자하고 있으며 최근에는 CC(Carbon Capture) 프로그램으로 해조류 활용 바이오연료 개발을 지원하고 있다. 개발 목표는 광반응기 개선, 응집(Flocculation)에 의해 경제적인 수확 및 탈수기술을 개발하고 있다. 한편으로 석탄화력발전소에서 배출되는 이산화탄소를 활용하여 조류를 생산하고자 한다. 미국의 엑손모빌(ExxonMobil) 해양바이오연료 연구를 위해 2009년부터 많은 투자를 하였고 Synthetic Genomics Inc와 기초연구부터 응용연구까지 지원하고 있으며 핵심적 내용은 바이오오일을 생산하는 다양한 미세조류 종을 확보하여 경제성을 갖추는 것이다. 현재 미세조류 기반 바이오디젤은 석유 기반의 디젤에 비해 가격이 3∼5배 비싼 것으로 추정되나, 기후변화 협약 등에 대비하여 지속적 연구개발과 정책적 지원이 필요한 실정이다.14)
(4) 기능성식품
해양생물 원료로부터 추출된 식품보조제, 효소, 활성대사물질 등이 이미 기능성식품 및 영양제 등으로 오래전부터 활용되고 있다. 대상 해양생물은 거대조류, 어류, 미생물 등으로 ARA(arachidonic acid), DHA(Docosahexaenoic acid)와 같은 지방산의 원료로 이용되고 있다. 특히 어패류는 칼슘, 카이틴(글루코사민의 원료) 등의 영양보조물질로 이용되고 있다. 이외에도 해양생물은 다양하게 생리적 활성기능을 활용하여 면역증강, 대사기능 개선, 항암, 항산화제, 필수지방산 및 비타민 등의 건강보조제 혹은 기능성 식품 등으로 활용하려는 노력이 전개되고 있다.15)
[표 4-4-5] 해양생물자원의 성분과 활성 기능 연구
|
생물 자원 |
유용성분 |
연구 분야 |
|
어류 |
LC n-3 PUFA (omega-3 fatty acid) |
대사증, 항암, 항염증, 뇌기능개선, 임신부 건강보조제 |
|
Pospholipids |
뇌기능개선, 항암 |
|
|
VitaminD |
뼈건강, 항염증 |
|
|
Selenum(Se) |
면역증진, 항바이이러스 |
|
|
Fish peptides and hydrolysts |
혈압조절, 면역증진, 암성빈혈 |
|
|
Selcted Amino acids in fish |
동맥경화, 혈액, 항염증, 항산화, 2형당뇨I |
|
|
Fish protein |
고혈압, 지질대사, 비만 및 대사증, 당대사, 인슐린 민감성 |
|
|
패류 |
Chitosan and glucosmamind |
고콜레스테롤, 항감염, 항암, 면역증강, 알츠하이머 |
|
Chondrotin sulphates |
관절개선, 비만, 항암, 항산화, 신경성 질병 |
|
|
Long Chain n-3PUFA fortification |
영유아, 미숙아의 인지 발달 |
|
|
해조류 |
Proeins, peptides and amino acids |
항고혈압, 면역활성, 비만/대사증후군, 포도당 및 지질 대사 |
|
Fatty acid |
심장질환, 항염증 |
|
|
Polysaccharides sulphated fucan sulphated galactan |
항산화, 항바이러스, 심장 보호(cardioprotective) |
|
|
Metabolites Polyphenols Steroids |
콜레스테롤, 항산화, 항당뇨, 항염증 |
|
|
Vitamins Vitamin C Vitamin E |
항산화 |
|
|
Pigments Carotenoids Chlorophylls |
심장병, 대사증, 비만, 당뇨 |
다. 해양생명공학산업 시장
개념적으로 해양생명공학은 포괄적으로 생명공학에 포함되는 특성으로 인해 해양생명공학산업의 정확한 시장 규모 산출이 어렵다. 해양생명공학 산업의 세계 시장 규모 추정은 최근에 이루어졌으며 기관별로 차이가 있으나 2012년 기준으로 36억 달러에서 56억 달러 정도로 추정되며 대략적인 연간 성장률은 5% 내외로 예측되고 우리나라 해양생명공학산업 시장의 점유율은 약 2% 정도로 추산된다. 최근 해양생명공학산업의 실질적인 시장규모를 산정하였으며, 2010년 219.7억 달러 수준에서 2024년 약 3.5배 증가하여 769억 달러로 증가되며 국내시장규모는 13.9억 달러로 추정하고 있다.16) 현재 해양생명공학산업이 성장 초기 단계로 현재 시장규모는 크지 않으나 성장 잠재력이 매우 높은 산업이다. 세부적으로 해양생명공학산업을 분야별로 살펴보면 의약 및 제약, 에너지, 기능성 식품, 기능성 화장품 등의 산업이 중요한 비중을 차지할 것으로 보인다.
[표 4-4-6] 해양생명공학분야 미래 세계시장 및 국내시장 예측
($ 100million)
|
Industrial area |
2010 |
2024 |
||
|
Global |
Domestic |
Global |
Domestic |
|
|
Medicine |
53 |
0 |
220 |
4.6 |
|
Energy |
2.7 |
0 |
166 |
2.6 |
|
Functional foods |
134 |
1.8 |
332 |
4.7 |
|
Personal care |
30 |
0.6 |
51 |
2 |
|
Total |
219.7 |
2.4 |
769 |
13.9 |
라. 국내연구 및 기술개발 동향
우리나라 해양생명공학연구는 2004년 해양수산부의‘마린바이오21사업ʼ을 시작으로 본격적으로 활성화되었다. 2009년 해양수산부 주도로 해양생명공학연구의 미래성장 잠재력을 인식하고 ʻ해양바이오활성화대책ʼ을 수립하여 해당 분야 예산을 국가전체 R&D BT 분야의 6% 수준으로 상향할 것을 제안하기도 하였다. 또한 후속조치의 일환으로 2013년 해양수산부는 2014년부터 향후 10년간 해양생명공학연구전략 수립을 위한 ʻ차세대 해양생명공학사업 추진 방안ʼ 기획연구를 실시하였다.17) 그러나 해양생명공학 분야에 국가의 R&D 투자수준은 2013년 기준으로 BT 사업에 투입된 국가연구개발비가 약 1조 8,000억 원인데 비해 해양수산부가 230억 원, 미래창조부가 40억 원으로 여전히 부족한 수준이다. 다음 [표 4-4-7]에서는 해양생명공학 분야에 투자되는 국가연구개발사업의 주요한 연구 사업, 과제와 연구 내용을 정리하였다.18) 주요한 성과를 살펴보면 해양과기원의 해양포유류인 밍크고래의 유전체 해독19), 바이오수소생산 원천기술개발20), 포항공대의 조개 유래의 생체접착제 개발21), 인하대의 해양 미세조류 기반의 바이오디젤을 이용한 차량 주행시험 성공22) 등의 성과를 보여주었다. 지난 해양생명공학연구는 국내의 유수한 연구개발사업과 비교해 질적, 양적에서 우수한 성과를 달성하고 있는 것으로 평가되고 있고, 해양생명공학연구 분야에서 저변확대에 기여한 것으로 평가되고 있다.
[표 4-4-7] 해양생명공학 분야 주요한 국가연구개발사업의 연구내용
|
부처 |
사업명/과제명 |
연구내용 |
|
해양 수산부 |
해양수산생명공학기술개발사업 |
|
|
⋅해양극한생물분자유전체연구 (’04∼’13, 종료) |
⋅해양생물 유전체 해독 및 오믹스 분석연구
|
|
|
⋅해양천연물신약연구단 (’04∼’13, 종료) |
⋅해양천연물 이용 질환모델, 선도물질유도체 기술로 신약 후보물질 개발 |
|
|
⋅해양바이오프로세스연구단 (’04∼’13, 종료) |
⋅해양생물유래 기능성 화장품 및 식품 소재 개발, 시험공정센터 구축 |
|
|
⋅해양생명자원 정보표준화 및 DB 구축사업(종료) |
⋅해양생명자원의 통합데이터베이스구축 |
|
|
⋅해외해양생물자원개발 및 활용 기반 구축
|
⋅해외해양생물자원 확보와 분류, 생태, 보존, DB 구축 및 자원분양과 국제네트워크 구축, 해양생물관련 국제협약 대응 |
|
|
⋅해양바이오산업신소재기술개발
|
⋅해양바이오매스 기반 바이오플라스틱, 카르복실산 생산, 바이오나노섬유소재, 창상치료제, 의약횽 복합소재 생산기술 개발 |
|
|
⋅해양초고온 고세균이용 바이오수소 생산기술개발 |
⋅해양초고온고세균 이용 바이오수소생산기술개발
|
|
|
⋅해양융복합 바이오닉스 소재 상용화 기술개발 연구단
|
⋅해양생물로부터 광반응성, 생리활성, 생체적합성을 보유한 기능성 물질들을 활용하여 조영제 및 광감작제를 개발하고, 이를 기반으로 생체진단·치료용 바이오닉스 디바이스를 개발 |
|
|
포스트게놈다부처유전체사업 |
|
|
|
⋅해양수산생물 유전체 정보준석 및 활요기반연구 |
⋅해양 동물, 식물, 미생물 메타게놈 등의 차세대 유전체 연구 및 유전체 정보센터 구축 |
|
|
Golden Seed 프로젝트 |
|
|
|
⋅수산종자사업단
|
⋅넙치, 전복, 바리과 및 김 등의 전략형 수산종자 개발 |
|
|
미래창조 과학부 |
해양극지기초원천기술개발사업 |
|
|
⋅해양바이오기초원천기술개발사업
|
⋅해양생물 유전체 분석을 통한 해양생명현상 원리 규명, 해양생물의 생체기능 활용 및 신의약 소재 및 기초활성연구, 해양원생생물 생명현상 연구 |

1. 생물공정(산업바이오)
가. 개 요
19세기 영국에서 시작되어 오늘날 전 세계 에너지 소비의 약 80%를 차지하는 화석연료 기반의 산업체계23)는 70년대에 들어서 에너지 위기를 맞았고 90년대에는 지구 온난화에 따른 다양한 환경 변화 이슈를 발생시켰다. 이러한 문제 제기에 따라 1992년 브라질 리우데자네이루에서 환경과 개발에 관한 유엔회의(UNCED)가 개최되었으며, 이 회의에서 선언적 의미의 ‘리우 선언ʼ과 ʻ의제 21(Agenda 21)ʼ을 채택하고, ʻ지구 온난화 방지 협약ʼ, ʻ생물다양성 보존 협약ʼ 등이 체결되어 ʻʻ산업성장과 지구환경보호 그리고 인류 복지의 조화(long-term balance between the environment, the economy, and the social well-being of humanity)ʼʼ라는 개념이 등장하였다. 이러한 지속가능 경제체계(Sustainable economy)의 필요성에 따라 산업바이오(White BT or Industrial Biotechnology IB)는 2001년 OECD의“지속가능한 산업으로서의 생물공학”테스크포스팀(Task Force on Biotechnology for Sustainable Industrial Development of the OECDʼs Working Party on Biotechnology(WPB))에서 제안되고24) 2004년 OECD 과학기술장관회의에서 정립되었다.
이런 일련의 흐름 속에서 산업바이오은“바이오기술(생촉매)을 이용하여 바이오매스를 원료로 바이오기반 화학제품(유기산, 아미노산, 폴리올, 바이오폴리머 등) 또는 바이오연료(바이오 에탄올, 바이오디젤, 바이오부탄올)를 생산하는 분야ʼʼ로 정의되었다.25) 산업바이오는 또한 재생 가능한 바이오기반 원료 물질을 사용하여 기존의 석유화학산업 원료물질을 공급함으로써 지구의 온실가스 방출을 저감시키고 자원의 순환 사이클을 구성하는 혁신적인 기술로, 이러한 환경적인 이점에 더하여 기존의 석유화학 제품의 성능 및 가치를 향상시킬 수 있는 기술‧지식 집약적 산업으로 21세기 산업 성장을 주도할 분야로 주목을 받고 있다. 산업바이오의 기술‧지식 집약적 특성을 기반으로 화학, 플라스틱, 식품, 계면활성제, 펄프 제지산업, 전자, 자동차, 섬유 및 수송용 원료 등 다양한 산업분야로 확대되고 있다.
산업바이오의 개념정립 이후 OECD에서는 경제적 관점에서 생물학적 제품의 개발과 생산 등 환경 친화적인 경제 활동을 바이오경제라 정의하고 이와 관련된 정책을 제안하고 있다26). 이러한 추세에 따라 2012년 미국 바이오협회(BIO) 보고에 따르면 미국의 바이오경제 규모는 1조 2,500억불 규모로 보고되었으며, 유럽공동체의 2014년 보고에 따르면 바이오경제의 규모는 2009년에 이미 약 2.7조 달러, 약 2,000만 규모의 고용효과(전체 고용의 약 9%)가 추정 되었다27). 또한 최근 보고된 문헌에 따르면 유럽은 바이오경제의 발전을 통하여 약 400만개의 새로운 일자리가 창출되고 약 50%의 온실가스 저감 효과가 있을 것으로 예측 보고 되었다28). 산업바이오의 발전에 따라 연간 약 1.5억 갤런의 수송용 에너지 부분의 원유가 바이오 리파이너리에 의해 대체 저감되고, 또한 바이오기반 석유화학제품의 개발 및 사용에 따라 연간 1.5억 갤런의 원유 사용이 저감될 것으로 예측되고 있다. 따라서 향후 연간 약 3억 갤런의 원유가 산업바이오의 발전에 따라 저감될 수 있을 것으로 추정하고 있다29).

[그림 4-5-1] 산업바이오의 개념 및 활용분야
나. 해외 동향
산업바이오분야 연구개발 동향의 가장 큰 특징은 정부나 학계 주도의 연구개발 보다는 산업 주도의 개발이 이루어지고 있다는 것이다. 미국의 경우 농무성(USDA)와 에너지성(DOE)에서 다양한 정책을 수립하고 있으나 실질적으로는 산업바이오 관련 회사를 주축으로 전 세계 30개국 산업계가 가입되어 운영되는 미국생물공정협회(Biotechnology Industry Organization: BIO)30)의 활동이 주도적이다. 미국 농무성에서는 바이오기반 제품의 생산과 사용을 증가시키고 농촌지역의 일자리 창출을 위하여 2002년에 제정된 ʻ2002년 농장법ʼ과 ʻ2008년 에너지법ʼ 그리고 ʻ2014년 농업법ʼ을 기반으로 BioPreferred
[그림 4-5-2] 미국 농무성에서 시행중인 바이오기반제품 인증라벨
유럽의 경우는 2013년 9월 FP7 프로젝트32)의 하나로 약 280만 유로 규모의 프로젝트로 BIO-TIC을 출발시켰다. BIO-TIC는 유럽의 산업바이오 분야 기술 혁신을 위한 목적으로 온라인 산업바이오 커뮤니티 구축, 산업 바이오분야의 지속 가능성 평가 및 유럽의 산업바이오 분야의 실행 계획 수립을 목적으로 한다33). 한편 2012년에 산업바이오 민간 컨소시엄(Bio-based Industries Consortium, BIC)이 발족되었고, 2014년 유럽 집행위원회는 이를 기반으로 BBI Joint Undertaking(BBI)을 발족시켰다. BBI는 EU 집행위원회와 산업체 주축의 민간 컨소시엄(BIC) 간에 구축되어 2020년까지 약 37억 유로 규모(EC: 10억 유로, 민간 27억 유로)의 산업바이오 협력 프로젝트를 발족시켰다34).
일본정부는 2002년 12월 중장기 계획 인 ʻ바이오테크놀로지 전략 대강(大綱)ʼ과 ʻ바이오매스 닛폰(日本) 종합 전략ʼ을 수립하고 2009년에는 ʻ바이오매스활용추진 기본법ʼ을 그리고 2010년에 ʻ바이오매스활용추진 기본계획ʼ을 발표하였다35). 이 계획에 따라 바이오매스 플라스틱의 개발‧보급을 추진하고 촉진하기 위한 민간단체인 ʻ일본바이오매스제품협의회ʼ를 발족하였다. 일본의 인증 프로그램도 정부차원이 아닌 민간에서 운영 중이다.
2013년도 기준 전 세계 발효 기반 산업규모는 1,270억 달러 이상으로 보고되고 있으며 연간 생산량 규모로 볼 때는 약 1억 100만 톤 규모로 알려져 있다. 전체 산업바이오 제품 중 약 94%(약 9천 980만 톤)가 바이오에탄올이 차지하고 있으며 시장규모로 볼 때는 약 87%(1,100억 달러)를 차지하고 있다. 바이오에탄올을 제외한 다른 주요 소재로는 라이신이나 MSG와 같은 아미노산류가 약 710만 톤(약 110억 달러)이고 이후 락틱산과 같은 유기산은 290만 톤(35억 달러)을 차지하고 있다. 2020년까지 산업바이오분야의 시장 성장률은 약 4.6%로 예측되고 있고, 바이오에탄올을 제외한다면 약 6.5%로 예측 된다. 특히 2013년 약 6억 달러(200만 톤/년) 시장 규모인 바이오기반 폴리머 분야는 약 13.5%의 시장 성장율이 예측되고 있다36). 또 다른 보고에 의하면 2015년 현재 약 40,000여종의 바이오기반 제품이 판매 중에 있으며 2013년 기준 약 1,260억 달러 정도의 시장규모가 보고되고 있다37).
유럽 바이오플라스틱 협회의 연구에 따르면 바이오기반 폴리머의 연간 생산량은 2013년 520만 톤에서 2018년 약 1,700만 톤으로 약 3배 성장할 것으로 추정 된다. 바이오기반 플라스틱은 현재 전 세계 합성 플라스틱 시장의 2% 수준인 256만 톤을 차지하고 있으며 매년 20∼30%씩 성장하고 있다. 바이오기반 플라스틱*은 현재 전 세계적으로 PLA(폴리락틱산)과 폴리트리메틸렌테레 프탈레이트(PTT), 폴리아미드(나일론)등 약 20여 종 이상이 생산되고 있다38).
한편 2013년도 기준 산업바이오 제품의 생산지역별 분포39)를 보면, 유럽이 28.8%를 차지하고 미국(15.4%), 중국(12.2%)순으로 나타나고 있다. 이중 유럽 내에서는 독일(7.3%), 네덜란드(6.8%) 그리고 프랑스(4.7%)순으로 나타나고 있다.
바이오기반 플라스틱 시장을 주도하고 있는 제품은 polyethylene terephthalate(PET)와 polyethylene(PE) 제품으로 알려져 있다. 2013년과 2018년 바이오폴리머 시장 변화의 특징은 향후 생분해성 플라스틱 시장의 규모가 줄어들고 바이오기반 플라스틱, 즉 석유화학제품(화학적으로 동일한 석유화학 제품과 도일한 바이오기반 폴리머) 시장이 확대 된다는 점이다. 이러한 변화는 코카콜라가 주도하고 있는 Plant PET Technology Collaborative에 의해 이루어지고 있다40).
[표 4-5-1] 2013년 기준 산업바이오제품 시장 규모 및 2020까지의 시장 성장률 예측41)
|
Category |
Market Size in product output (quantity produced) |
Average theoretical yield |
Market size in cabohy- drate input required |
Market size in value |
Average added value generated from car- bohydrate |
Maket growth until 2020 |
Arable land use* |
|
Min ton |
Ton product/ ton glucose |
Mln ton CHEQ |
Bn USD |
USD/CHEQ |
% CAGR |
Min ha |
|
|
Alcohols |
99.8 |
0.51 |
195.1 |
110.0 |
164 |
4.4% |
25.08 |
|
Amino Acids |
7.1 |
0.92 |
7.8 |
11.0 |
1,010 |
5.6% |
1.00 |
|
Organic Acids |
2.9 |
1.05 |
2.8 |
3.5 |
850 |
8.8% |
0.36 |
|
Biogas |
0.1 |
0.27 |
0.5 |
0.2 |
0 |
5.0% |
0.06 |
|
Polymers |
0.2 |
0.93 |
0.2 |
0.6 |
2,600 |
13.5% |
0.03 |
|
Vitamins |
0.2 |
0.96 |
0.2 |
0.7 |
3,100 |
2.6% |
0.03 |
|
Antibiotics |
0.2 |
1.00 |
0.2 |
0.8 |
3,600 |
4.0% |
0.03 |
|
Industrial Enzymes |
0.1 |
1.00 |
0.1 |
0.3 |
2,600 |
8.0% |
0.01 |
|
Total |
110.5 |
|
206.8 |
127.0 |
|
4.6% |
26.6 |
(1) 바이오기반 플라스틱 시장동향
2013년 산업연구원의 바이오플라스틱 시장분석 자료에 따르면 PLA를 포함한 생분해성 플라스틱은 NatureWorks, PURAC, Metabolix등이 생산을 주도하고 있으며 바이오기반 플라스틱과 전구체는 BASF, DSM등 대부분 다국적 석유화학 회사들이 생산할 예정에 있거나 시험 생산 중에 있는 것으로 보고되었다42). 각 바이오 기반 플라스틱의 시장 현황을 살펴보면, 폴리에틸렌테레프탈레이트(PET)는 바이오 기반 모노에틸렌글리콜 (MEG)과 석유기반 테레프탈산(TPA)의 중합을 통하여 생산되는 폴리머로서 20%가 바이오 기반 폴리머이다. 세계 시장은 2013년도에 60만 톤이 생산되었으며, 2020년도 기준으로 약 700만 톤 정도로 예측되고 있다43).
[표 4-5-2] 세계 주요 기업의 분야별 진출 현황
|
|
Plastics |
Developers |
|
Novelty |
PHA |
Metaboilx, Jiangsu, Nantian, Tianan Biologic, ADM Biomer DSM, Micromidas |
|
PLA |
NatureWords, PURAC, Toray, Sulzer, Synbra, Toyobo, Zhejiang Hisun |
|
|
Starch based |
PSM, Plantic, Biograde, Livan, Wuhan Huali |
|
|
Cellulose based |
FKuR, Formosa, Innovia, Lenzing, SK Chemical, Teijin |
|
|
Drop-in |
PE |
Braskem, Dow, PSM, Solvay, Limagrain |
|
PP |
Braskem/Novozymes |
|
|
PA |
Arkema, Hipro Polymers(Suzhou) |
|
|
Isobutanol |
Gevo |
|
|
n-Butanol |
Butamax, Cathay Industrial Bio, Cobalt, Green Biologics, Old Town Fuel&Fiber |
|
|
PBS |
Mitsubishi, Anquing Hexing, BioAmber, PTT |
|
|
Adipic acid |
DSM, Rennovia, Verdeayne |
|
|
PDO |
Dupont, Inventure, MetEx |
|
|
Others (icludes platform chemical) |
Succinate |
BASF, BioAmber, Bluestar, DSM, LANXESS, Mitsubishi, Mitsui, Roquette |
|
Lactic acid |
PURAC, Galactic |
|
|
BDO |
BioAmber, Chemtex, Genomatica, Mitsubishi, Myrant, Novamont |
|
|
PUR |
Cargill, IFS Chemical, Mitsui Chemicals |
|
|
Polyester |
Avantium, BASF, Kaneka |
|
|
Epichloro-hydrin |
Dow, Solvay |
자료 : Luxresearch(2011), Global Bio-based Chemical Capacity Springs to Scale을 토대로 산업연구원에서 재구성.
석유기반으로 생산되는 TPA는 현재 지속적인 연구가 이루어져 파일럿 스케일에서 바이오 기반 TPA가 생산되고 있다. 대부분의 바이오기반 PET와 MEG는 아시아 국가에서 생산되고 있으며 바이오 기반 폴리머 시장의 주력으로 현재까지 가장 큰 생산 규모와 시장을 가지고 있다. 이러한 시장형성에는 코카콜라 회사에 의해 시작된 PTC 이니셔티브44)가 크게 기여하고 있다.
에폭시는 바이오 기반 모노머인 에피클로로히드린(epichlorohydrin)으로 부터 합성되며 에폭시의 약 30%가 바이오 기반의 폴리머로 합성되며 현재 기술과 시장이 성숙된 제품이다.
폴리우레탄(PUR)은 식물성오일을 원료로 하여 합성되는 폴리머로 10~100%가 바이오 기반 폴리머이다. 석유기반 아디프산을 바이오 기반 숙신산으로 대체하여 생산할 수 있으며, 바이오기반 PUR시장은 석유기반 PUR시장보다 빠르게 성장할 것으로 예상된다.
폴리에틸렌피란노익산(PEF)는 2,5-furandicarboxylic산(2,5-FDCA) 및 MEG의 중합을 통해 생산되는 100% 바이오 기반 바이오폴리머로 PEF는 PET와 유사한 물리적 특성을 가진 새로운 폴리머로서 Avantium에 의하여 2017년도에 시장 진입이 예상된다.

[그림 4-5-3] 2018년 기준 전세계 세계 바이오기반 플라스틱 생산규모
에틸렌 프로필렌 디엔 단량체(EPDM)은 바이오기반 에틸렌을 이용해 50~70%는 바이오 기반으로 생산되며 프랑스의 바이오화학기업 랑세스에 의해 브라질에서 생산되고 있다.
폴리에틸렌(PE)는 100% 바이오 기반 중합체로서 사탕수수로부터 만든 에틸렌을 이용해 브라질의 석유 화학 회사 Braskem에 의해 생산된다.
폴리부틸렌숙시네이트(PBS)는 생분해 플라스틱으로 현재 석유화학 기반으로 생산되고 있으나 이론적으로 100% 바이오 기반으로 생산이 가능한 제품이다. PBS는 1,4-부탄디올 (1,4-BDO) 및 숙신산을 중합하여 현재 1,4-BDO는 석유기반으로 생산되며 바이오기반으로 2015년 상업생산이 예상된다. 현재 PBS는 전량 아시아 지역에서 생산되고 있다.
폴리트리메틸렌테레프탈레이트(PTT)는 바이오기술로 합성된 1,3-프로판 디올(1,3-PDO)을 기반으로 합성되는 폴리머로서 PTT의 27%가 바이오기반 폴리머이다. PTT는 PET와 마찬가지로 석유기반의 TPA를 활용하여 합성되며 바이오 기반 PTT 및 1,3-PDO은 Dupont에서 생산하고 있다.
폴리유산(PLA)은 현재 전 세계 25개 회사에서 개발 완료되어 연간 18 만 톤 규모의 생산 능력을 가지고 있다. PLA의 가장 큰 생산자인 NatureWorks사는 2011년 기준 약 14만 톤 정도의 생산용량을 보유하고 있고 나머지 생산자는 연간 1,500~10,000톤의 생산 능력을 보유하고 있다.
생분해성 플라스틱으로서 100% 발효공정을 통하여 생산되는 폴리 하이드록시 알카노에이트(PHA)는 이미 상용화된 폴리머로서 2013년 현재 약 3만여 톤의 시장을 가지고 있으나 연간 10~30%(IEA 바이오 에너지)의 성장률을 보이고 있다.
(2) 바이오기반 플라스틱 전구체 생산 현황
바이오기반 석유화학소재를 생산하기 위해서는 바이오매스로부터 폴리머를 합성하기 위한 전구체를 생산하여야 한다. 현재 상용적으로 생산되고 있거나 생산 예정인 전구체는 주로 알콜과 다이엑시드(Diacids)류로 이들 모노머의 선두는 Succinic acid이다. 2013년 현재 전 세계적으로 5개 업체가 Succinic acid의 상업 생산에 들어가 2018년도에는 연간 25만 톤 이상이 생산될 것으로 기대 된다. 현재기준으로 가장 많은 생산량을 보이고 있는 모노머는 코카콜라가 주도하고 있는 Plant PET Technology Collaborative에 의해 탄력을 받고 있는 폴리에틸렌테레프탈레이트(PET)의 모노머인 모노 에틸렌 글라이콜로서 2013년 현재 4개 기업에서 연간 40만 톤이 생산되고 있으며 2020년도에 160만 톤 이상 생산될 것으로 기대된다. 아래 표에는 2020년까지 전 세계 바이오기반 플라스틱 중합체의 전구체 생산 능력을 분석 하였다.
[표 4-5-3] 2011∼2020년 전 세계 바이오기반 폴리머 전구체 생산 현황45)
|
Bio-based building blocks |
Producing companies worldwide until 2013* |
Production capacities worldwide 2011* (t/a) |
Production capacities worldwide 2013* (t/a) |
Production capacities worldwide 2020* (t/a) |
|
1,3 Propanediol |
2 |
confidential |
78,000 |
120,000 |
|
1,4-Butanediol |
0 |
0 |
0 |
216,010 |
|
2,3-Butanediol |
1 |
80,000 |
80,000 |
80,000 |
|
Adipic acid |
3 |
0 |
n.a. |
n.a. |
|
Azelaic acid |
1 |
0 |
0 |
n.a. |
|
Paraxylene |
3 |
33 |
1,473 |
201,473 |
|
Butanol |
1 |
64,500 |
64,500 |
100,000 |
|
Epichlorohydrin |
6 |
44,000 |
395,000 |
495,000 |
|
Ethylene |
4 |
300,000 |
478,000 |
840,000 |
|
Furanic building blocks |
1 |
30,000 |
30,000 |
30,000 |
|
Isobutanol |
1 |
0 |
169,500 |
169,500 |
|
Isosorbide |
1 |
3,000 |
3,000 |
3,000 |
|
Latic acid(L-D-L+D) |
6 |
209,000 |
284,000 |
375,000 |
|
Monoethylene glycol |
4 |
300,000 |
400,000 |
1,605,000 |
|
Natural oil polyols |
4 |
46,200 |
46,200 |
47,200 |
|
Polyether polyol |
4 |
55,000 |
85,000 |
85,000 |
|
Propylene |
0 |
0 |
0 |
50,000 |
|
Propylene glycol |
2 |
200,000 |
395,000 |
395,000 |
|
Sebacic acid |
1 |
22,000 |
22,000 |
22,000 |
|
Succinic acid |
5 |
3,200 |
25,000 |
250,000 |
|
Terephtalic acid |
1 |
0 |
110 |
110 |
|
Other building blocks |
4 |
85,000 |
85,000 |
85,000 |
|
Total |
55 |
ca.1,222.000 |
2,641,783 |
5,169,293 |
(3) 기타 산업바이오 소재 현황
Biolubricants 유채 오일 또는 미네랄 오일 기반의 제품으로 식물성 오일을 에스터 반응화 시켜서 생산한다. Biolubricants는 항공, 자동차, 해양 응용 프로그램뿐만 아니라 전동 공구 윤활제 및 해양 시추장비에 사용될 수 있다.
Biosolvents는 대두유 메틸 에스테르, 락트산 에스테르(발효 유래 락트산을 메탄올 또는 에탄올과 에스테르 반응을 통하여 생산) 및 감귤류의 표피로부터 추출된 limonene등이 있다. Biosolvents의 주요 장점 중 하나는 휘발성 유기 화합물(VOC)을 방출하지 않으며 주로 금속 및 직물용 탈지제로 사용되며, 또한 접착제와 페인트의 제거 용제 및 희석제로 사용될 수 있으며 또한 향수와 의약품의 추출 용매로 사용된다.
Biosurfactants는 팜유, 코코넛 등 식물성 오일과 소르비톨, 포도당, 설탕 등 식물성 탄수화물을 이용해 생산된다. 현재 Biosurfactants는 가정용 세제, 퍼스널 케어 제품, 식품 가공 제품, 섬유, 코팅, 펄프 및 종이 제품, 농약, 산업용 청소기를 만들기 위해 사용된다.
Bioisoprene과 Biobutylene등은 향후 석유화학을 대체할 수 있는 인조고무 전구체 소재로 자동차 타이어, 승용차, 모터 오일, 해양 윤활제, 풍력 터빈, 식품 등급 윤활제, 유전 유체, 냉동 냉매, 스킨 케어 및 헤어 케어 제품 등에 활용될 수 있다.
잉크와 염료로 사용되는 바이오기반 연료소재는 현재 신문 인쇄에 필요한 잉크의 90% 이상, 그리고 프린터와 복사기, 볼펜용 잉크 및 리소그래피 잉크 등 상업용 프린터에 소모되는 잉크 및 토너의 25% 이상이 콩기름 잉크 토너가 사용되고 있다. 식물성 오일 기반 잉크의 시장 점유율은 1989년 5%에서 2002년 약 25%로 증가했다.
산업용 효소류는 식품, 섬유, 가죽 제품, 펄프 및 종이, 곡물, 세제 등의 생산에 산업적으로 사용된다. 현재 산업용 효소 시장의 구조는 Novozyme과 Genenco/Danisco로 양분되어 거의 세계시장의 2/3를 이들이 차지하고 있고, 기타 DMS, BASF, ABF, AB Enzymes, Amano Enzyme이 주요 나머지 시장을 차지하고 있다.
다. 국내 현황
국내 산업바이오분야는 산업통상자원부 주도로 산업육성 정책이 추진되고 있다. 산업부는 2010년 12월 ʻ바이오분야 산업화 촉진을 위한 중장기 전략 및 세부 추진방안 연구ʼ를 수행하여 2020년까지 세계 5위권 바이오화학 산업 강국으로 도약하기 위한 바이오화학 발전과제를 도출하였다. 또한 2012년에는 『바이오화학 육성전략』발표하고 이를 위하여 산업핵심기술개발사업 산업바이오 분야에 매년 100억 원의 R&D 지원을 하고 있으며, 2014년 신규 사업으로 ʻ바이오화학 산업화 촉진기술개발ʼ 사업을 5년(2014∼2018년)동안 총사업비 2,155억원(국비 842억 원)규모로 바이오화학 원료개발, 주력산업 소재개발, 데모플랜트 구축에 지원하고 있다. 또한 바이오기술 융합 인력 양성을 위해 바이오화학 전문대학원 교육과정을 개설하여 산학연 석․박사 통합 특성화 대학원을 운영하고 있다. 또한 바이오화학 실증연구를 위한 울산 실증화 시설을 총사업비 367억 원 규모로 진행하고 있다. 현재 산업통상자원부 주관으로 추진되고 있는 산업바이오분야 중 바이오화학제품 주요 사업은 아래 표와 같다.
[표 4-5-4] 2015년 현재 산업통상자원부 산업바이오 분야 주요 추진 사업
|
사업명 |
사업내용 |
|
바이오화학제품 생산을 위한 통합공정용 바이오콤비나트 기술개발 |
바이오콤비나트 구축을 위한 각 제품별 단위공정 및 통합공정 상세 설계 완료, 바이오화학 제품별 시장 동향 조사 및 경제성 평가 수행 |
|
고유가 시대 대비 생물공정을 통한 섬유/엔지니어링 플라스틱용 바이오 PTT 생산 기술 개발 |
뮤코닉산 생합성 균주 확보 및 발효공정 최적화, 부가고리화 반응/방향족화 반응 성능향상, 바이오PTT 중합 연구 수행 |
|
C-Zero 바이오플랫폼용 2, 3- 부탄다이올 및 유도체 생산 기술 개발 |
고농도 미생물 생산성 향상 및 산업화 공적 최적화 균주 선정, pilot-scale 발효 공정 최적 조건 확립, 1ton/year 실증 공정용 반응기 시운전 수행 |
|
Long-chain diacid(DC9∼DC13)의 생물전환 공정과 응용제품 (코팅제, 윤활제 등)의 개발 |
C9-C11 디카르복실산 생물전환효소 활성 개선, 생물전환 공정/분리정제 공정 최적화, C11 diacid 유도체 합성 및 물성 평가 수행 |
|
ICT용 바이오 폴리아마이드 510의 생물학적 생산기술 개발 |
고순도 카데발린 분리정제 공법 확립, LDC 효소 생산균주 개발 및 고정화, 세바식산 생산공정/정제 기술 개발 수행 |
산업측면에서는 기존의 석유화학회사(SK, GS칼텍스, LG화학 등)와 발효 전문회사(CJ제일제당, 대상 등)를 중심으로 발효를 통한 산업바이오 관련 제품 연구 개발이 진행 중이다. 바이오플라스틱을 중심으로 살펴 볼 때 국내 바이오플라스틱의 수요는 2013년까지 연 6.6%의 성장을 통해 2018년에는 4만 톤의 수요량을 예측하고 있다. 이는 아시아 시장 전체에서 약 6%의 비중을 차지할 것으로 전망하며 2018년 국내 바이오플라스틱 시장규모는 1억 달러에 도달할 것으로 전망하고 있다46).
전체 플라스틱 시장동향도 생분해성 바이오플라스틱보다는 석유화학제품 바이오기반 플라스틱으로 점차 전환되어 가고 있다. 이는 소비재 중심의 생분해성 플라스틱 보다는 산업분야에서 필요로 하는 바이오기반 플라스틱 소재가 부가가치가 높으며 개발 범위도 넓고 다양하기 때문이다.
대표적인 생분해성 바이오플라스틱 제품인 PLA를 기준으로 보았을 때, 국내 바이오플라스틱 소재 공급은 대부분 수입에 의존하고 있으며 국내에서는 이를 활용한 제품 생산에 주력해 오고 있다. 주요 기업과 제품으로는 웅진케미칼(에코웨이-B), 에콜바이오텍(에콜그린), 도레이새하(Ecodear), 삼성정밀화학(Enpol)이 있다.
석유화학 대체 바이오기반 플라스틱분야의 선두는 세계적인 추세와 동일하게 바이오 PET 분야이다. 국내에서는 롯데케미칼이 도요타 통상(원료제공)과 협력을 통해 바이오 PET를 생산하고 있으며 현대자동차의 경우 자동차 내장재를 바이오 기반의 플라스틱으로 대체하기 위한 연구개발을 진행 중이다. GS 칼텍스는 바이오 원료 기반의 2,3-BDO와 폴리트리메틸렌테레프탈레이트의 합성에 사용되는 1,3-PDO, butanol을 연구개발 중이다. 또한 백광은 현재 lysine으로부터 cadaverine을 생산하여 polyamide의 전구체로 쓰기 위한 연구를 수행 중이다.
국내 산업바이오를 기술의 성숙도 측면에서 분야별로 살펴보면 아미노산과 같은 전통 발효산업분야는 해외 다국적 기업들과 대등한 경쟁력을 가지고 있으나 생분해성 바이오플라스틱 산업은 원료수입을 통한 가공생산에 머물러 있고 바이오기반 플라스틱 분야는 현재 플라스틱 전구체 생산을 위한 연구개발 중인 것으로 알려져 있다.
[표 4-5-5] 국내업체들의 바이오플라스틱 진출 현황47)
|
업체명 |
사업영역 및 주요 내용 |
|
롯데케미칼
|
도요타 통상(원료제공)과 협력을 통해 바이오 PET를 생산하여, 바이오 PET병용으로 납품하고 있음. |
|
휴비스
|
기존 폴리에스터 섬유에 옥수수에서 추출한 PTT를 첨가 하여 신축성을 높인 신섬유(PET/PTT 복합방사 단섬유) 개발 |
|
SK 케미칼
|
기존 TPA에 바이오매스 기반 물질을 첨가하여 바이오 폴리에스터 수지를 개발(상품명 : ECOZEN) |
|
에콜바이오텍
|
옥수수 전분 기반의 PLA를 활용한 다양한 친환경 생분해성 플라스틱 소재 개발(상품명 : 에콜그린) |
|
SKC
|
PLA를 원료로 사용한 이축연신필름 생산 |
|
LG 하우시스
|
옥수수 전분을 활용하여 광고용 접착필름 생산 |
|
도레이첨단소재
|
옥수수 전분을 원료로 이용한 PLA 생분해 플라스틱 생산(상품명 : Ecodear) |
|
삼성정밀화학
|
생분해가 가능한 폴리에스테르 수지 생산(상품명 : Enpol) |
|
CJ제일제당
|
Lysine, methionine등의 사료 첨가용 아미노산과 바이오매스 기반의 xylose (다이어트 슈가 개념) 등을 생산하여 제품화함 |
|
대상
|
건강식품 소재로서의 미세조류(클로렐라) 등을 제품화하였고 PLA, pyrrolidone 등을 연구개발 중임 |
|
삼양사
|
sorbitol을 isosorbide로 전환하여 바이오플라스틱 단량체로 생산 공정 개발 중. 울산에 연 10만톤 규모의 isosorbide 파일럿 플랜트 건설 중 |
|
백광
|
Lysine를 생산하여 제품화하였고 현재 lysine으로부터 cadaverine을 생산하여 polyamide의 전구체로 쓰기 위한 산업부 연구과제를 수행중임 |
|
현대자동차
|
자동차 내장재를 바이오 기반의 플라스틱으로 대체하기 위한 연구개발을 진행 중임 |
|
GS 칼텍스
|
바이오 원료 기반의 2,3-BDO, 1,3-PDO, butanol을 연구개발 중임 |
라. 발전 과제
산업바이오분야는 아미노산과 항생제로 대표되는 전통 발효산업의 바이오소재부터 미래 석유화학산업 성장의 기반기술로서 발전해 나갈 바이오에너지, 바이오기반 플라스틱 그리고 정밀 화학소재 분야까지 점차 그 규모와 시장이 확대되어 가고 있다. 우리나라 항생제와 아미노산 분야의 발효기술은 80년대에 이미 선진국 대비 90% 이상의 경쟁력을 갖춘 분야이기도 하다. 석유화학 산업 또한 산업규모면에서 전 세계 4~5위 순위권에 위치하고 있는 경쟁력 있는 산업으로 알려져 있다. 그러나 이들 두 분야는 최근 중국의 급속한 생산능력 확대와 세계적인 경기 침체로 인하여 급격하게 경쟁력을 잃어가고 있다. 또한 국제 사회의 온실가스 감축 압박과 친환경 규제 강화에 따른 친환경 화학제품 생산의 필요성 증대는 우리나라 발효산업과 석유화학산업에 혁신적인 변화를 요구하고 있으며 정부의 관련 산업 정책을 위한 과감한 R&D 투자와 전략이 필요하다.
이러한 측면에서 가장 중요한 점은 산업바이오의 체계적 육성을 위한 법‧제도적 체계 마련이 시급하다는 것이다. 미국의 경우 2000년부터 추진해온 다양한 법체계를 기반으로 한 BioPreferred® 프로그램 등이 산업바이오 분야를 육성하기 위한 좋은 예이다. 또 다른 측면에서 우리에게 가장 필요한 역량은 산업바이오 관련 산학연 주체간의 협력이다. 산업바이오 분야는 바이오 기업이나 석유화학 기업이 서로의 협력이 없이 단독으로 추진하기에는 기술과 산업적 특성으로 인하여 성공하기 매우 어려운 분야로 알려져 있다. 따라서 선진국의 다국적 기업들은 대부분 산학연 공동연구, 화학회사와 바이오회사의 제휴 등 다양한 형태의 협력프로그램과 공동 투자 전략을 수립하고 있다. 따라서 정부의 과감한 투자와 시장경쟁력 강화를 위한 적극적인 인센티브 및 소비 장려 정책 그리고 바이오․화학산업 간의 협력이 석유화학산업과 생물공정의 융합산업인 산업바이오 강국 진입을 위한 초석이 될 것이다.
2. BT+ICT
가. 개요
스마트폰의 보급과 스마트TV, 다른 스마트 제품들의 활약으로 거의 모든 디지털 기술이 하나의 기기에 포함되는 방식으로 변화하였으며 피부로 느낄 수 있을 정도로 기술의 혁명은 융합기술에 의해 주도되고 있다.
2008년 11월, 국가과학기술위원회에 의해 수립된 ʻ국가융합기술 발전 기본계획ʼ에 따르면 융합기술이란 나노기술, 바이오기술, 정보기술 등의 신기술간 또는 이들과 기존 산업‧학문 간의 상승적인 결합을 통해 새로운 창조적 가치를 창출함으로써 미래 경제와 사회․문화의 변화를 주도하는 기술이라 정의하고 있다. 특정 기술에 기초를 두고 다른 기술의 융합을 통해 새로운 제품과 서비스를 창출하거나 기존 제품의 성능을 향상시키는 것을 기준으로, 이 특정 기술에 기반한 융합기술이라는 표현을 사용하게 된다. 그리고 당시의 분류 체계에 따르면 BT ICT 융합 기술로 바이오센서칩, 바이오인포매틱스, 바이오컴퓨터, 생체인식․보호, 휴먼인터페이스를 해당 기술로 분류하였다.
이러한 BT ICT 융합 기술 중에서 유전체, 즉 게놈(genome) 정보를 사용하는 기술들에는 해당 게놈 정보를 생산(genome sequencing; 게놈 시퀀싱; 유전체 염기서열분석)하고 분석하는 기술이 포함된다. 현재 게놈 정보를 생산하는 데에 사용되는 기술은 차세대 염기서열 분석법(next generation sequencing; NGS)이 대표적이고 전체적으로 데이터를 생산, 관리, 분석하는 데에 연관된 기술은 바이오인포매틱스(bioinformatics)로 명명된다.
이러한 차세대 염기서열 분석법을 통해 생성된 많은 양의 게놈 정보를 관리하고, 분석하기 위해서 바이오인포매틱스 기술을 사용하며, 한국과학기술정보 연구원의 ʻ바이오인포매틱스ʼ 보고서에 따르면 바이오인포매틱스는 정보학(informatics)의 한 응용분야로 그 응용 대상이 생물학(bio-) 분야로 생물학 데이터를 얻고(acquisition), 이를 바탕으로 데이터를 관리(management)하고, 분석(analysis) 하는 정보학(학문측면), 또는 정보기술(응용측면) 이다. 따라서 바이오인포매틱스는 생물학에서의 의문, 문제의 답을 구하기 위해 정보기술 자원을 활용하여 데이터를 수집하고, 평가하고, 저장하고, 관리하고, 분석하는 일을 지칭한다. 이를 위해 기초생물학, 응용생물학, 의학, 약학, 수학, 통계학, 물리학, 화학, 공학 등 다양한 학문과 그 학문 분야에서 사용하는 다양한 기술들이 융합되어 바이오인포매틱스를 구성한다.
다양한 염기서열 분석법 기술들로 생산된 데이터를 이용하여 특정 생물체의 진화적 역사를 밝히고, 환경에 반응하는 유전자들과 형질의 관계를 알고, 형질을 예측하고, 질병의 원인이 되는 변이를 찾는 등 여러 생물학적 문제를 풀기 위해 바이오인포매틱스에서는 생물학, 의학, 약학, 수학, 통계학, 물리학, 화학, 공학적 방법이 적용된 다양한 분석 방법을 개발하고 사용하고 있다. 이렇듯 게놈 정보 기술은 다양한 학문과 기술의 융합이 있는 대표적 BT ICT 융합기술이다.
따라서 본 내용에서는 BT ICT 융합기술 중 게놈 정보를 사용하는 기술에 한정하여, 이를 사용하여 진행되었거나 진행되고 있는 혹은 진행될 연구 프로젝트들을 통하여 연구개발 동향을 살펴보고 간략하게 산업 동향을 살펴보고자 한다.
나. 해외 동향
(1) 해외 주요 프로젝트
(가) ENCODE 프로젝트
미국 국립 인간 유전체 연구소(The National Human Genome Research Institute; NHGRI)가 인간 게놈 시퀀스의 모든 기능적 성분을 규명하는 프로젝트를 진행하기 위해 2003년 9월 DNA 성분 백과사전, 즉 ENCODE(the Encyclopedia Of DNA Elements)라는 연구 컨소시엄을 시작했다.
시험 단계에서는 인간 게놈 시퀀스의 특정 부분을 엄밀하게 분석하기 위해 기존의 방법들을 검사하고 비교 대조하였다. 이 시험 프로젝트의 결과는 2007년 6월에 네이처(Nature)지와 게놈 리서치(Genome Research)지에 발표되었다. 연구 결과는 인간 게놈에서 기능적 성분들을 확인하고 특성을 살피기 위한 프로젝트의 성공을 보여주었다. 기술 개발 단계 역시 기능 성분들에 대한 대용량 데이터를 생산하기 위한 몇 가지 새로운 기술을 선보이며 성공적으로 이루어졌다.
ENCODE 프로젝트 초기 단계의 성공으로, NHGRI 는 2007년 9월 새로이 자금을 조성하고 ENCODE 프로젝트를 시험 단계 규모 연구의 바탕 위에 추가적으로 전체 게놈을 아우르는 규모의 생산 단계로 이행하였다.
ENCODE 시험 단계는 5,500 만 달러가 들어갔고, 규모 확장 단계에는 약 1억 3 천만 달러가 들어간 것으로 추정된다. 그리고 다음 단계를 위해 NHGRI가 1억 2천 3백만 달러의 자금을 조성할 것으로 추정된다.

출처 : Maher, B. ENCODE: The human encyclopaedia. Nature 489, 46, 2012
[그림 4-5-4] ENCODE 프로젝트에서 수행된 실험들의 개요
(나) modENCODE 프로젝트
modENCODE 프로젝트는 모델 생물체 DNA 성분 백과사전(Model Organism Encyclopedia of DNA Elements)으로, NHGRI 의 청구신청(Requests for Applications) 자금으로 시작되었다.
초파리(D. melanogaster)와 예쁜꼬마선충(C. elegans)의 게놈들을 연구하기 위해 modENCODE 연구자들은 컴퓨터를 이용한 접근법과 실험적 접근법 모두 적용하고 있다. 모델 생물체에서 기능 성분을 분석하는 것의 장점은 발견된 요소들을 인간에서는 적용될 수 없는 방법을 사용하여 생물학적으로 검증할 수 있다는 것이다. modENCODE 프로젝트로의 결과에 따라 예상되는 종합적인 데이터 세트는 초파리와 예쁜꼬마선충뿐만 아니라 다른 생물체, 예를 들면 사람과 같은 생물체의 생물학에 대한 중요한 이해를 제공할 것이다.

출처 : http://www.modencode.org/
[그림 4-5-5] 초파리의 크로마틴 상태를 보여주기 위한 동반자 웹 페이지
(다) GRANDIOSE 프로젝트
리프로그래밍은 분화된 체세포가 줄기 세포로 변환될 수 있는 과정이다. Grandiose 프로젝트는 줄기세포의 리프로그래밍에 대한 이해를 넓히기 위한 연구이다. 이 연구는 50명에 가까운 연구자들, 세계적으로 많은 연구실들의 협력 속에 진행되었고 연구 결과는 2014년 12월에 네이처에 두 편, 네이처 커뮤니케이션에 3편으로 발표되었다.
(라) IHEC 프로젝트
암과 같은 몇몇 질병들은 후성유전체에 생긴 해로운 변화에 의해 발생할 수도 있고, 혹은 후성유전체에서의 변화가 생겼다는 사실이 질병의 원인이 되는 것일 수도 있다. 한 사람이 일생 동안 혹은 24시간에 해당하는 생물학적 주기 동안 갖게 될 후성유전체에서의 많은 정상적 변이에 대해서는 알려진 것이 없고, 이러한 후성유전체적 표지의 유형들을 탐색하고자 하는 기술들은 여전히 개발 중이다.
국제 인간 후성유전체 컨소시엄(International Human Epigenomics Consortium; IHEC)은 2010년에 후성유전체의 분야에서 조직된 국제적인 활동으로, IHEC 활동의 목표는 질병과 관련된 다양한 인간 세포 유형으로부터 최소한 1,000개의 참조 인간 후성유전체(epigenome)를 생산하는 것이다. 세대를 거듭하면서 인간 집단을 형성하게 하고 환경 변화에 반응하게 하는 후성유전체에 대한 이해를 확장시키고자 하는 장기적인 목적을 가지고, 미국, 캐나다를 포함하는 북미 국가, 영국, 이탈리아, 프랑스, 독일을 포함한 유럽 국가, 한국, 일본, 싱가폴을 포함한 아시아 국가, 그리고 호주의 연구자들이 각국의 재정 지원 하에 참여하였다.

출처 : http://ihec-epigenomes.org/about/ihec-countries/
[그림 4-5-6] IHEC 에 참여하는 연구자들이 속한 국가들
컨소시엄의 일차적인 목표는 다음과 같다. 첫째, 핵심 세포 상태에 대해서 보건과 질병에 관련된 인간 후성유전체의 참조 지도들을 생산하는 활동을 편성하는 것이다. 인간 후성유전체에 대한 상당한 범위의 정보를 갖기 위해 IHEC는 7~10년 안에 최소한 1,000개의 후성유전체를 해석하는 목표를 설정했다. 둘째, IHEC는 줄기세포상태(stemness), 불멸(immortality), 분화(differentiation), 노화(senescence), 스트레스 같은 핵심 세포 상태에 주력한다. 셋째, 보건과 질병에 대한 새로운 지식의 번역이 더 빠르게 될 수 있도록 최소한의 제한사항을 가진 데이터를 연구 커뮤니티에 신속하게 배포하는 활동을 편성한다. IHEC는 이 국제 활동으로부터 생산된 전체 후성유전체 데이터를 정리하고 통합하고 보여주기 위해 공통적으로 적용되는 바이오인포매틱스 기준, 데이터 모델, 분석 도구들을 개발하는 활동을 조직한다. 넷째, IHEC는 개인 참가자, 자율적으로 형성된 컨소시엄들, 투자자와 국가들에게 프로젝트의 이익과 우선권이 돌아갈 수 있도록 이 국제적 활동을 조정하는 효율적인 구조를 만든다. IHEC는 전 세계적으로 존재하는 후성유전학적 활동들이 최소한으로 중복되길 권장한다. 또한 국제 암 게놈 컨소시엄(International Cancer Genomic Consortium; ICGC)과 ENCODE와 같은 다른 국제 프로젝트와 교류하고 협력한다.
이차적인 목표로는, 첫째, 보건과 질병의 후성유전체를 이해할 수 있게 하고 기능 분석할 수 있는 새롭고도 강건한 기술을 개발하는 것을 촉진하여 후성유전체 매핑에 들어가는 비용을 상당량 줄일 수 있게 한다. 둘째, 새로운 기술, 소프트웨어와 더불어 전 세계의 후성유전학 연구자들 간에 데이터를 통합하고 공유하는 방법에 대한 지식과 표준 사항의 보급을 지원한다.
이러한 목표를 위해 IHEC 는 국제적 연구 커뮤니티를 묶어 과학자들 간의 효율을 극대화하고 있다. BLUEPRINT 프로젝트, 미국국립보건원 로드맵 후성유전체(NIH Roadmap Epigenomics) 프로젝트, DEEP 프로젝트, CREST/IHEC, Team Japan 프로젝트, 후성유전체 플랫폼 프로그램(Eigenomic platform program)이 그것이다.

출처 : http://ihec-epigenomes.org/research/projects/
[그림 4-5-7] IHEC 와 연관된 프로젝트들
(마) 100K 게놈 프로젝트
100,000 게놈 프로젝트는 영국 보건부(department of health) 산하의 Genomics England Ltd에서 시행할 7만 명 내외의 100,000 게놈을 염기서열 분석하는 프로젝트이다. 염기서열 분석 대상자는 영국의 공공건강보험 NHS(National Health Service)를 적용 받는 희귀병을 가진 환자와 그 가족, 그리고 암환자가 된다.
현재의 치료 방식을 완전히 바꾸는, 즉 NHS 환자에 대해 새로운 게놈 의약을 만드는 것이 목표이며 환자들은 전에 없었던 진단 방법을 제공받을 수 있게 되고 새롭고 더 효율적인 치료 가능성도 있다.
이 프로젝트는 새로운 의학 연구를 가능하게 할 것이며 게놈 시퀀스 데이터와 의료 기록의 융합은 획기적인 자원이 된다. 연구자들은 의료 서비스에서 유전체학을 이용하는 최선의 방법을 연구할 것이고 환자들을 돕기 위해 데이터를 해석하는 최선의 방법을 탐구할 것이다. 병의 원인, 진단법, 치료법 또한 조사될 것이다. 이는 세계적으로도 가장 큰 규모의 국가 염기서열 분석 프로젝트이다. 영국 수상은 NHS 환자에게 유전체학으로 예상되는 혜택을 가져다주기 위해 영국 수상이 2012년 말에 프로젝트를 가동하였다. 프로젝트를 위해 Genomics England가 만들어졌고 2017년까지 NHS 환자의 100,000 게놈을 염기서열 분석할 예정이다.
(바) FAANG 프로젝트
FAANG(the Functional Annotation of Animal Genomes project) 프로젝트는 초기 단계의 국제적인 컨소시엄 활동으로 이 프로젝트의 목표는 가축 종의 게놈 상에서 기능적 요소들의 종합적 지도를 만드는 것이다.
가축화된 동물 연구는 과학적으로 사회경제적으로 중요한데, 여기에는 의학 연구에 기여하는 것, 반려 동물의 건강과 복지를 개선시키는 것, 농업에서의 동물 부분의 기반을 향상시키는 것이 포함된다. 이를 위한 핵심은 가축화된 동물들 간의 유전적‧표현형적 다양성의 풍부함을 확보하는 것과, 이 다양성을 양적 형질의 기저에 위치하는 유전적 구조를 밝히는 연구와 결합하는 것이다.
(2) 해외 산업 현황 및 전망
전 세계 게놈 시장 규모는 2013년 기준 111억 달러(11조 8천억 원)에서 연평균 12.2%로 성장할 것으로 전망된다. 2018년에는 198억 달러(21조원)의 시장 규모를 가질 것으로 예측된다. 앞서 언급한 바와 같이 게놈 관련 기술을 향상시키고 해당 과학 분야와 산업 기반을 발전시키기 위해 여러 국가에서 대규모의 투자지원이 이루어지고 있기 때문에 전 세계 게놈 시장 성장은 그 영향을 받아 성장하고 있다. 차세대 염기서열 분석 기계의 관련 기술이 꾸준히 발전하고 있고 암과 각종 질병과 관련하여 유전자 테스트가 증가하고 있어 진단에 필요한 시약류와 기타 소비재, 서비스 시장이 활성화되고 있고, 게놈 기술을 이용한 개인 맞춤 의학의 적용과 그 대상의 확대에 대한 관심이 높아지고 있어 게놈 시장의 성장은 지속될 것으로 전망된다.

출처 : 생명공학정책연구센터, 2014 글로벌 유전체 시장 및 산업동향
[그림 4-5-8] 2010년∼2018년의 전 세계 게놈 시장 수익 및 전망
세계 지역별 게놈 시장에서 2013년~2018년까지의 기간을 기준으로 하여 북미는 12.7%, 유럽은 12.9%, 아시아‧태평양 지역은 13.4%, 기타 국가는 7.6%의 연평균 성장률을 가질 것으로 예측이 되어 아시아‧태평양 지역에서 가장 빠른 성장을 기대해 볼 수 있겠으나 한국, 중국, 인도, 일본을 제외한 아시아‧태평양 지역은 게놈 연구 단계에서 초기에 해당하며 지역의 기술 발달 수준이 고르지 않고 편중 된 부분이 있다. 그러나 게놈 기술에 대한 인식의 변화로 성장은 지속적으로 이루어질 것으로 전망된다(하단 표 참조).
[표 4-5-6] 2010년∼2018년의 세계 지역별 게놈 시장 수익 및 전망
(단위 : 백만 달러)
|
연도 |
북미 |
유럽 |
아시아·태평양 |
기타 국가 |
합계 |
|
2010 |
2,821.2 |
2,198.9 |
1,867.0 |
1,410.6 |
8,297.7 |
|
2011 |
3,103.3 |
2,422.8 |
2,068.9 |
1,479.1 |
9,074.1 |
|
2012 |
3,436.2 |
2,694.8 |
2,314.2 |
1,572.8 |
10,018.0 |
|
2013 |
3,835.5 |
2,990.6 |
2,579.3 |
1,712.1 |
11,117.5 |
|
2014 |
4,280.4 |
3,352.6 |
2,907.2 |
1,830.9 |
12,371.1 |
|
2015 |
4,793.6 |
3,771.3 |
3,274.0 |
1,975.5 |
13,814.4 |
|
2016 |
5,398.7 |
4,250.7 |
3,707.7 |
2,156.4 |
15,513.5 |
|
2017 |
6,118.5 |
4,824.9 |
4,230.5 |
2,307.5 |
17,481.4 |
|
2018 |
6,977.8 |
5,475.9 |
4,842.9 |
2,470.9 |
19,767.5 |
출처 : 생명공학정책연구센터, 2014 글로벌 유전체 시장 및 산업동향
유럽의 게놈 프로젝트들은 임상 결과를 개선시키기 위해 기술적 기반을 끌어올리는 것에 주력하고 있다. 특히 기술 부문에서의 발달을 기대할 수 있고, 미국과 캐나다의 게놈 연구에 대한 활발한 정부 지원은 새로운 기술을 만들어 내는 데 매우 유리한 환경이 될 것으로 예상된다. 기타 국가에서는 유전자 테스트의 증가로 해당 분야의 소비재 및 서비스 분야가 증가할 전망이고 게놈 염기서열 분석과 분석 장비 시장이 주요 수익 시장이 될 것으로 전망된다.
전 세계 게놈 시장에서 게놈 기술의 응용 분야에 대한 수익률을 살펴보면, 2013년 기준 진단 분야가 38억 달러의 수익으로 34.7%의 수익률을 나타내면서 가장 많은 수익을 창출하였다. 신약 개발과 학술 연구가 진단과 더불어 시장에서의 주요 분야로 나타났다. 또한 염기서열 분석 기술과 데이터 분석 기술의 발달로 맞춤 의학에 대한 인식이 증가하고 있고, 실제 적용 사례와 적용 확대의 시도가 꾸준하므로 향후 개인 맞춤 의학 분야의 성장이 클 것으로 전망된다. 현재 높은 시장 점유율을 차지하고 있으며 다양한 제품군을 제공하는 글로벌 기업들이 이러한 게놈 응용에 기반 한 기술에 주력하는 추세인데, 일루미나(Illumina)는 소비자 게놈과 생식건강 분야에, 애피매트릭스 (Affymetrix)는 세포유전학적 연구 분야에, 로슈(Roche Diagnostics)는 여성건강 분야에, 애질런트 테크놀로지(Agilent Technologies)는 세포유전학적 연구와 출산전 검사 분야에 집중하고 있다.
[표 4-5-7] 응용분야별 수익률
|
응용 분야 |
수익률 (%) |
수익 (백만 달러) |
|
진단 |
34.7 |
3,857.8 |
|
신약 개발 |
20.1 |
2,234.6 |
|
학술 연구 |
17.4 |
1,934.4 |
|
농업 및 동물 연구 |
10.7 |
1,189.6 |
|
맞춤 의학 |
10.6 |
1,178.5 |
|
기타 |
6.5 |
722.6 |
|
합계 |
100 |
11,117.5 |
출처 : 생명공학정책연구센터, 2014 글로벌 유전체 시장 및 산업동향
다. 국내 현황
(1) 국내 주요 프로젝트
국내는 해외의 프로젝트 사례와 같이 주도적으로 공개 컨소시엄을 만들어 진행하지는 않고 있다. 국내 연구자들은 국제 컨소시엄에 참여하여 작업을 하는 방식을 택하고 있고 연구 프로젝트는 연구비를 지원하는 국가에 의해 주도되는 형태를 가진다. 현재 국내의 주요 프로젝트로 ʻ포스트게놈 다부처 유전체 사업ʼ이 있다. 유전체 기술은 미래유망 분야 중의 하나로서, 정부는 기술 수준을 글로벌 수준으로 끌어올리기 위해 유전체 분야를 창조경제 핵심분야로 분류하여 ʻ포스트게놈 다부처 유전체 사업ʼ으로 대표되는 대형 사업을 추진하기로 결정했다. 국가 차원의 전략적 투자를 통해 국내 유전체 연구의 역량을 키우고 또한 산업화하여 투자에 대한 조기적 성과를 창출하는 목표를 가지고 있다.
유전체 분야는 새로이 창출된 시장으로 필요성이 인식되어 예전부터 국가 차원의 지원이 필요하다는 요구가 있었고, 이에 따라 90년대 후반부터 유전체 분야에 대한 투자가 활성화되었다. 1999년의 21C 프론티어연구개발 사업과 2000년의 질환군별유전체연구센터 등이 그것이다. 그러나 유전체 분야는 앞서 말한 바와 같이 여러 학문과 기술의 융합적인 분야라서 여러 필요에 의해 각 부처별로 개별적, 산발적으로 유전체 사업이 추진되어 왔다. 유사한 성격의 연구가 관리하는 집행 기관이 달라 연구 기반 시설의 불필요한 중복 투자가 발생하고 정보 연계가 되지 않아 효율성이 떨어졌다.
2014년 미국의 NHGRI에서 임상의료 측면의 유전체학(clinical genomics)을 위해 전 세계적 계획을 수립하고 지원 프로그램을 업데이트한 것처럼 전 세계의 유전체학 분야는 그 초점이 게놈 정보 분석과 데이터 생산에서 의료 유전체학의 임상 적용으로 옮겨가고 있다. 국내의 유전체학 분야가 국제적으로 기술 경쟁력이 있고 투자를 받으려면 연구 결과를 토대로 산업화가 이루어지는 것이 바람직하다. 따라서 유전체 연구 분야에서 각 부처간 연계·협력을 강화하여 투자 효율성을 높이기 위해, 그리고 대형 사업 추진으로 본격적인 투자 분위기 조성과 연구의 산업화를 위해, 나아가서는 국민건강 증진을 위해 ʻ다부처 유전체 사업ʼ이 추진되었다.
범부처 ʻ포스트게놈 다부처 유전체사업ʼ을 주관하는 정부 부처는 총 7개로, 보건복지부, 농림축산식품부(농촌진흥청, 산림청), 해양수산부, 미래창조과학부, 산업통상자원부이다. 중점적인 사업 내용은 다음과 같다. 복지부에서는 개인별 맞춤의료를 실현하기 위한 질병 진단 치료법을 개발하고, 농진청과 산림청을 포함한 농식품부와 해수부는 동 식물, 해양생물 등 유전정보를 활용한 고부가가치 생명자원을 개발한다. 미래부와 산업부는 유전체 분석 기술 등 연구 기반을 확보한다. 또한 각 부처는 협력하여 질병기전 규명 유전체 연구, 숙주-병원체 상호작용, 인간게놈 표준지도 작성, 국제협력 공동연구, 유전체 전문인력 양성의 공동연구 사업을 진행하여 연구 목표를 달성한다. 최소한 진단치료법 8건을 만들고, 유용유전자원 30건을 확보하여 세계 5위권의 연구역량을 갖추는 것이 그 목표이다.
다부처 유전체사업의 목적이 성공적으로 달성된다면 다양한 기대효과를 가져올 것으로 예상된다. 먼저 국민의 관점에서 보면, 환자별 맞춤의료가 구현되어 치료의 효과가 예측 가능하고 환자에 적합한 치료를 선택할 수 있는 등 의료적 향상을 가져올 것이다. 따라서 국민건강의 증진을 기대할 수 있다. 또한 불필요한 치료와 약물의 부작용을 최소화하는 등 사회 경제적으로 의료비의 절감을 기대할 수 있다. 2008년 미국 국립 보건원의 예측에 따르면 맞춤 의료는 약물 부작용을 25% 감소시켜 연간 450~1,350억불의 의료비용을 절감할 수 있을 것으로 전망한다. 산업화에 따라 바이오 기술, 정보 기술, 나노 기술 등이 결합된 이공계 분야의 일자리가 창출될 것이다. 또한 식품 등에서 확보된 유용생물자원 및 유전체정보를 활용한 양질의 맞춤형 서비스가 확대될 것이다.
둘째, 연구자 관점에서 보면, 기초‧원천 연구역량이 향상되고 대한민국은 세계적 유전체 연구거점으로 성장하여 새로운 지식과 산업을 만들어 낼 수 있는 기반을 갖게 될 것이다. 유전체 빅데이터를 활용하기 위해 전산시스템의 기반이 충분히 갖추어질 것이고 세계 어느 곳과도 공동으로 연구할 수 있는 기반 서비스를 사용할 수 있을 것이다.
셋째, 산업적 관점에서 보면, 생물자원의 유전체정보 확보를 통해 바이오산업 분야의 생물 정보 자원을 선점하여 국가 자산화 할 수 있어, 생물자원의 국가 소유를 인정하는 나고야 의정서의 발효라는 국제적 상황에서 선제적 대응을 통한 주도권을 확보할 수 있고 지식재산권을 선점할 수 있을 것이다. 또한 맞춤형 유전체정보 서비스 제공과 유전체 기반 맞춤형 의료 구현으로 기존 시장의 확장 및 새로운 시장의 성장을 기대할 수 있다.
(2) 국내 산업 현황 및 전망
국내 게놈 시장 규모는 세계 시장과 비교해 보았을 때 적은 부분을 차지하고 있다. 미래창조과학부의 포스트게놈 다부처 유전체사업 추진계획안에 따르면 10조원이 넘는 세계 시장에서 국내 시장은 2015년에 2천억 원의 수준으로 예상되고 이는 세계 시장의 2%가 넘지 않는 규모이다. 2002년부터 2008년까지 국내 바이오 기술 분야의 개발 지원 증가폭은 25.0%의 연평균 증가율을 가진 것으로 나왔으나 유전체 분야는 13.4%, 인간유전체 분야는 4.7%의 증가율을 가진 것으로 보고되었다. 상대적으로 개발의 지원이 침체된 기간이 있었다. 유전체 정보 생산과 분석에 대한 투자는 2008년에서 2010년까지 정보생산과 분석에 942억 원, 기능분석에 1,787억 원, 기반시설 구축 등에 420억 원이 들었으나, 해외와 비교하였을 때 전체 생명공학 예산 대비 유전체 정보 생산과 분석에 대한 투자 비중은 0.9%로 일본과 미국의 투자 비중인 5.8%, 1.6%과 차이가 있었다. 따라서 최고 수준의 기술을 보유하고 있는 미국에 비해 기술 수준은 57.7%로 기술의 격차는 4.2년이 존재하는 것으로 보고되고 있다.
정부는 2012년 수립된 유전체 R&D 투자 효율화 방안에 입각하여 핵심 연구분야로 유전체, 전사체, 후성유전체를, 연관 연구분야로 단백체, 대사체, 시스템 생물학을, 기반 분야로 정보 생산‧분석‧활용을 지정하여 최근까지 기초‧기반 단계의 유전체 연구 분야에 투자하여 게놈 기반 연구 분야는 정립되었으나 실용화를 위한 연구 분야는 초기 단계에 있어서 학문에서 산업으로의 이동은 아직 미흡한 점이 있다. 즉 국내의 유전체 시장에서 실용화 시장은 초기 단계에 있다. 그럼에도 불구하고, 유전체 분석 시장은 지속적으로 성장세를 보이고 있다.
유전체 분석 분야에서는 민간 서비스 업체가 정보 분석 수요에 대응하면서 성장을 이루었다. 개인 유전체 분석 서비스의 시장 개척 수요가 있다. 민간 기업으로 마크로젠, 디엔에이링크, 테라젠이텍스 등에서 국내 정보 분석의 수요를 대부분 소화하고 있는데, 마크로젠은 안국약품, 동아제약과 제휴하여 유전체 분석을 통한 맞춤치료제를 개발하기 시작했고 기존 400만원대의 게놈정보분석서비스를 100만원 대로 낮출 계획이다. 디엔에이링크는 반도체 기술을 이용한 유전정보 분석 서비스를 제공하고 있고 SK케미칼과 유전체 정보 분석 서비스를 판매하고 공동으로 연구개발하는 것을 제휴했다. 테라젠이텍스는 유한양행과 제휴하여 개인유전체 분석서비스를 제공하고 있다.
진단칩과 신호검출기 생산 분야에서는 실리콘화일, LG생명과학, 바이오니아 등의 기업에서 기술을 개발하고 있고 일부분 국산화에 성공하였는데, 바이오코아에서는 인간 유두종 바이러스 진단 키트를 개발했고, 나노스토리지에서는 칩 신호검출기의 소형화와 고속화에 성공하여 국내 대학병원에 70여대를 공급하였다.
유전체 데이터의 저장과 처리 분야에서는 일부 대기업이 ICT 기반 기술에 관심을 표명하고 있지만 시장 형성은 활성화 되어 있지 않다. 현재 제공되는 서비스로는 국내 통신사에서 갖추고 있는 데이터 센터 설비를 활용하여 유휴 저장공간과 중앙처리장치를 이용한 클라우드 기반의 서비스를 제공하고 있다. KT에서는 KT GenomeCloud 서비스를 제공하여 사용자가 별도의 ICT 기반 시설을 갖추지 않고도 유전체 분석에 특화된 클라우드 시스템을 임대하여 데이터를 저장하는 것에서부터 대용량 처리가 가능한 클러스터 시스템을 사용하여 계산하고 분석하는 것까지 유전체 데이터를 분석할 수 있다. SKT에서는 유사하게 빅데이터를 처리할 수 있는 클라우드 서버를 제공한다.
현재 시장의 규모는 크지 않지만 꾸준한 증가세를 보이고 있고, 포스트게놈 다부처 유전체사업처럼 지속적인 지원과, 제약회사나 암 치료센터에서의 개인 맞춤 유전체 서비스의 수요 등 유전체 산업에 대한 새로운 수요가 있으므로 향후 국내 유전체 산업은 최소한 지금의 성장률을 유지하거나 더 높은 성장률을 보일 것으로 전망된다.
라. 발전 전망
게놈 염기서열 분석 시장에서 일루미나의 플랫폼이 저렴한 비용을 내세워 시장을 선도하고 있지만 다른 기업 역시 자사의 염기서열 분석 기술의 단점을 지속적인 연구개발을 통해서 보완해나가고 있기 때문에 앞으로의 상황은 예측하기 힘들다. 그리고 여러 플랫폼에서 생산되는 데이터는 해당 플랫폼의 고유 특징을 갖고 있어 데이터의 플랫폼 특징에 맞게 수정된 분석방법을 사용하기 때문에 향후 염기서열 분석 기술이 발전함에 따라 그에 적용하는 분석기술 및 데이터의 품질 검증 또한 많은 변화를 겪게 될 것으로 예측된다. 그럼에도 불구하고 염기서열 분석 기술에서 꾸준히 개선되어야 할 사항은 보다 긴 리드길이가 필요하고, 정확도가 높아져야 하며, 비용은 더 저렴해져야 하고, 소량의 DNA 분자에 대한 염기서열 분석이 가능해야 한다는 것이다. 염기서열 분석에 소모되는 비용과 장비들의 가격은 지속적으로 하락하고 있기 때문에, 현재 실험실의 범용 장비로 자리를 매김하고 있는 PCR 기술 장비처럼 향후 대부분의 연구실에서 염기서열 분석 기계를 도입하여 염기서열 분석을 간편하게 수행할 수 있을 것으로 예상된다.
지금까지는 NGS 기술을 통한 데이터의 생산이 중요한 요소였지만, 앞으로는 생산된 데이터를 효과적으로 사용하여 과학적 연구뿐만 아니라 보건과 질병 등 실생활에 활용할 수 있는 연구결과를 만들어 내는 데에 필요한 데이터 분석 능력에 대한 수요가 급격히 증가할 것이며, 또한 대용량의 염기서열 분석 데이터를 처리하기 위한 데이터 저장장치와 서버 등이 필수적으로 요구되기 때문에 이를 처리하기 위한 알고리즘과 장비 확보 및 사용에 대한 수요가 지속적으로 늘어날 것으로 예상된다. 분석을 수행하는 업체나 기관들이 보유, 운용하고 있는 서버 시스템 등의 시설 기반과 아마존 웹 서비스와 같은 서버 호스팅 전문업체가 보유한 대용량 데이터 처리를 용이하게 할 수 있는 클라우딩 컴퓨터 시스템에 대한 활용은 이러한 수요에 맞추어 지속적으로 보완하고 성장할 전망이다.
유전체학에서 개별 유전자에 국한하여 기능을 살펴보던 시기는 지났다. 특정한 생물학적 조건에서 발현 및 조절되는 모든 유전자 외 지역의 역할에 대해 알기 위해 다양한 기술들이 개발되어 사용되었고, 생명 현상을 이해하기 위한 과정은 진보했다. 특정 생물학적 조건의 생물 반응을 이해하기 위해 다양한 데이터의 복합적 분석이 가능해졌고 이해의 정도는 더욱 깊어졌다. 해석에 필요한 데이터는 더욱 많아졌고 수많은 기술의 도입으로 데이터의 생산 방법은 더욱 복잡해졌다. 전문적인 영역이 더욱 세분화되었고 따라서 각 분야의 연구자금을 가진 연구자들이 모여 진행하는 인간 질병, 동물의 게놈-표현형 연관성 연구 등 국제 협력을 통한 대규모의 연구는 이미 세계적인 추세이다. 데이터의 복잡성은 계속 상승할 것으로 전망되고 그에 따라 협력을 통한 연구 역시 증가할 것으로 예상된다.
3. BT+NT
가. 개요
바이오나노기술은 인간의 질병과 생명현상을 연구하고 그와 관련된 제품을 생산하는 바이오기술과 원자나 분자 단위에서 물성을 규명하고 조작하여 새로운 재료 및 소자를 개발하는 나노기술이 결합된 융합기술이다. 살아있는 모든 생명체 내부에서 발생하는 모든 대사 현상들은 나노 스케일(Nanoscale)의 생물학적 요소들에 의해 일어나는 현상들이기 때문에 나노기술을 이용하여 효율적으로 생물학적 요소들을 다룰 수가 있다. 이런 기술을 바탕으로 최근에는 질병에 직접적인 영향을 주는 DNA와 단백질 등의 생체분자에 대한 연구가 활발하다.
바이오나노기술의 대표적인 기술로는 나노바이오칩/센서기술과 나노생체소재 기술이 있다. 나노바이오칩/센서는 매우 작은 소자를 제조하여 그 위에 수많은 생체분자들의 상호작용을 관찰할 수 있다. 또한 고감도를 가지고 있어서 소량의 분자들도 측정할 수 있는 장점이 있다. 나노바이오칩/센서기술은 반도체, 전자공학, 물리학, 화학(공학), 분자생물학, 유전공학, 재료공학 등 과학 전반에 걸친 기술의 집약체인 미래형 융합기술이며, 각종 질병의 진단과 예측 등의 의료, 신약개발, 식품가공 및 군사 분야까지 적용 및 응용이 광범위하고 무궁무진한 잠재력을 가지고 있다. 나노생체소재는 나노미터 크기를 갖는 구조체로 생체적합성을 가지고 있어 세포나 생물체 안에 주입하여 분자 이미징이나 약물전달 등에 사용된다. 암세포가 있는 부분에 특이적으로 반응하여 빛을 낸다거나 암세포에만 치료약물을 전달하는 개념이 하나의 예라고 할 수 있다. 이처럼 바이오나노기술은 기존에 가능하지 않았던 기술적 한계를 극복할 수 있는 길을 제시해주었다. 이를 이용하여 생체분자의 상호작용 연구나 메디컬분야 등 다양한 분야에 효과적으로 이용될 수 있다.
나. 해외 동향
(1) 나노바이오칩/센서 기술
가까운 미래에는 주민등록증 혹은 여권 대신 무엇을 들고 다닐까? 흔히 SF영화에서는 개인의 DNA를 담은 칩을 인체 속에 삽입하고 다니면서 신분증으로 사용하는 장면이나 눈물 한 방울로 환자의 질병을 진단하는 모습이 연출되어 왔다. 이러한 영화 속 장면이 NBIT 기술이 바탕이 되어 현실로 실현화되고 있다. NBIT 대표 융합기술 중 하나인 나노바이오 칩(Nanobio chip)기술은 기존 한 가지 특정 성분분석 검출기의 한계(긴 검출시간 및 많은 양의 환자 혈액 필요 등)를 극복하기 위해 개발되어 온 상업화된 상품으로써, 다중의 분석물을 자발적으로 측정할 수 있는 감지소자를 일컫는다. 크게 면역진단과 분자진단으로 나뉘며, 구체적으로 분석 대상에 따라서 DNA chip, 단백질 칩, 세포 칩, 뉴런 칩, 그리고 생체삽입용 칩 등이 있다. 현재 다양한 표면 화학적 활성화 기술을 바탕으로 고효율의 바이오 탐침(bio-probe) 고정화기술 및 바이오어레이 기술을 자동화하는데 성공함으로써 다양한 고효율성 나노바이오 칩 시제품들이 출시되고 있다.
인체 또는 동물을 대상으로 하는 다양한 형태의 실험들은 생명윤리적 문제점을 포함하고 있으며, 막대한 시간과 비용이 소요된다는 문제점이 있으며 이를 해결하기 위한 핵심기술로 나노바이오 칩 기술개발이 각광받고 있다. 이러한 전 세계적 연구 트랜드에 맞춰, 최근 나노바이오 칩 응용기술 개발이 질병 진단을 넘어, 인체 장기를 모사한 3D 나노바이오 칩 기술개발로 진화하고 있다. 미국의 UC 버클리 대학에서는 심장근육세포처럼 정상 작동이 가능한 심장세포를 삽입한 바이오칩(Sci. Rep. 2015, 3, 9), 합성수지 생체막에 폐세포와 모세혈관조직을 배양한 실제 허파꽈리를 재현한 인공 허파(서울대 의대 허동은 교수), 인간 폐를 모사한 렁 온 칩(Lung on a chip; 미국 하버드대 위스 연구소) 인공 간 등 주요 장기의 구조와 기능을 모사한 3D 나노바이오 칩 등이 대표적인 예이다. 이들 3D 기반“장기 모사 나노바이오 칩”기술 개발은 동물 모델에서 진행하기 힘든 연구를 가능하게 할 것이며, 새로운 연구결과를 도출하는데 중요한 역할을 할 것이다.
국내외 세계바이오칩 시장은 꾸준히 성장하고 있으며 연평균 10%로 성장하여 2015년 69억 달러를 형성하였다. 특히, 바이오칩 시장은 DNA칩이 가장 큰 비중을 차지하고 있으며, 그 뒤로 단백질 칩, 랩온어 칩, 기타 칩 순으로 시장이 구성되어 있으며, 응용분야로는 보건의료, 환경, 정밀화학, 식품 및 생물공정 등이 있다. 향후, 바이오칩은 인체 내 질병예측 및 진단, 뇌 연구 분야 등에서 차세대 융복합 전자소자로 새로운 부가가치를 지닌 국가 기반산업의 초석이 될 것으로 사료된다.
[표 4-5-8] 바이오칩 시장 규모
|
구분 |
직전년도 2012년 |
당해연도 2013년 |
차기년도 2014년 |
|
해외시장 |
42억달러 |
49억달러 |
59억달러 |
|
국내시장 |
1,922억원 |
2,652억원 |
3,714억원 |
출처 : 보건산업기술이전센터 시장정보 Report 46, ʻʻTech Market Report - 바이오칩 시장 동향ʼʼ(2014.7)
나노바이오 칩 기술과 더불어 NBIT 대표 기술로 나노바이오센서를 들 수 있으며, 이는 미래 의료진단/예측, 신약개발, 식품가공분야, 그리고 생체모사 등 다양한 분야에 패러다임을 가져올 것으로 예측하고 있어 세계 각국은 막대한 자원을 투자하고 있다.
나노바이오센서란 특정 물질에 인식기능을 갖는 생물학적 탐침(bioprobe: 압타머, 리셉터, 단백질, 항원/항체, DNA, 베지클 등)이 전기 또는 광학적 변환기(Transducer: 전도성 나노입자/나노튜브, 탄소나노튜브, 실리콘 나노와이어 등)와 결합되어 타켓 생물분자와의 상호작용을 인식함으로써, 극미량의 생화학 물질을 선택적으로 감지할 수 있는 소자를 말한다.
나노바이오센서는 측정방법에 따라서 광 에너지 전이/변환 및 전기변환 방식으로 나뉜다. 특히, 반도체 소자간의 집적형태인 전계유발 효과 트랜지스터 (Field-Effect Transistor)기반 나노바이오센서 시스템은 입력전압에 의해서 트랜지스터의 두 단자 사이에 흐르는 전류의 변화를 실시간 관측하는 시스템이다. 이는 광학적인 측정방법에 비해 측정시간이 비교적 빠르며, 고가의 측정 장비가 필요 없다는 장점 덕분에 선호되고 있으며, 호르몬 센서, HIV 면역센서, DNA 분자진단 센서 등 다양한 나노바이오 센서가 개발 중이다.
최근 2D 나노구조체기반 FET 나노바이오센서는 1D에 비해 고감응성 및 고선택성이 가능하여 세계적으로 활발히 연구되고 있다. 대표적 2D 나노 구조체로는 그래핀(graphene), 이황화 몰리브덴(MoS2), WO3, MoO3, WS2, GaSe 등이 있으며, 이들 나노구조체 중 일부는 전기적 성질이 매우 우수해 트랜지스터로 각광받고 있다. 또한, 단층으로 이루어져 플렉시블 평면에 쉽게 전이가 가능하여 플렉시블 나노바이오 센서로도 활용이 가능하다는 장점을 가지고 있다. 대표적인 예로, 플렉시블 FET 기반 암 진단센서, 혈당 센서, 전자코 등이 있다.

[그림 4-5-9] a) 그래핀 구조도(좌) 및 그래핀 기판 FET 바이오센서(우), b) MoS2 기반 FET 바이오센서 구성도
(2) 나노생체소재 분야
나노생체소재기술은 생물학적 기능을 가진 나노레벨의 소재를 개발하는 기술로써 이러한 나노생체소재를 이용하여 생명현상의 규명, 질병진단과 치료, 그리고 기능성 의료용 소재의 개발이 가능하게 되었다. 나노생체소재는 크게 단백질, DNA/RNA, 지질, 다당류로 구성되어 있는 생체유래의 소재와 고분자, 금속, 세라믹, 복합 재료 등 비생체 유래의 소재로 나눌 수 있다. 생체유래소재는“살아있는 생체조직에 직접 접촉하는 재료의 총칭ʼʼ으로서, 신체 각 부위가 불가역적으로 질병이나 손상을 입을 경우 대체 시술에 이용되는 것이다. 즉, 생체유래소재는 의료용 재료로 사용되는 생체재료(Bio- material)중 인공재료가 아닌 천연재료를 활용하는 생체적합성 소재로, 미생물, 동물 등 생체로부터 유래되는 당, 단백질 및 이들의 조성물이다.
나노생체소재 분야에서 가장 주목받는 분야로 지능형 약물 전달 전달체 개발을 들 수 있다. 약물 전달 시스템은 표적부위에 약물을 선택적으로 전달하여 장시간 동안 유효 혈중 농도를 질병에 따라 최적화함으로써 치료 효능 및 치료 효과를 극대화시키고, 약물 부작용의 극소화를 목적으로 한다.

출처 : Cancer Cell, 4, 337 (2003)
[그림 4-5-10] 바이오 재료를 이용한 다양한 약물전달장치
약물 전달 및 생체 조직공학에 주로 이용되는 바이오 재료는 크게 천연 재료와 인공재료로 나눈다. 대표적인 천연재료인 리포좀(Liposome)은 생체세포막의 구성성분인 인지질을 모방하여 개발되었다. 세포막과 유사한 구조와 성분 때문에 독성 없이 세포막을 통과하여 세포 내로 약물을 전달하는데 유용하게 활용된다. 현재 실제 임상 및 연구에 가장 많이 사용되는 천연재료로는 콜라겐(Collagen)과 실크 피브로인(Silk Fibroin)이 있으며 인공재료로는 폴리라틱에시드(poly(lactic acid, PLA), 폴리글라이콜릭 에시드(polyglycolic acid, PGA)와 이 둘을 혼합한 폴리라틱에시드-글라이콜릭 에시드 공중합체(poly(lactic acid-co-glycolic acid, PLGA)와 같은 폴리에스테르계 고분자와 폴리에틸렌 옥사이드(poly(ethylene oxide), PEO)가 사용되고 있다.
생분해성 고분자로 만든 나노 입자를 이용한 약물 전달 시스템의 개발이 활발히 진행되고 있다. 나노 입자를 이용하면 친수성 약물뿐만 아니라 난용성 약물도 전달이 가능하며, 약물을 특정 세포나 기관에만 전달되게 하거나 일정 농도를 유지시키는 등 다양한 형태의 전달이 가능하다. 난용성 약물의 가용화를 통한 약물 흡수 촉진 기술의 개발은 장기적으로 고분자량 단백성 약물의 효율적 체내수송에 적용함으로써 치료 효율을 극적으로 향상시킨 고부가가치 제품을 성공적으로 개발 할 수 있다.
영국의 Molly 연구팀은 신체의 일부를 자극해 성공적으로 혈관생성을 유도한 경피용 나노니들을 개발하였다. 국내의 비주사형 약물전달 분야의 나노기술은 경구용, 경피용에 중점 되어 있으며 새로운 전달방법을 통한 약물전달 기술이 개발되고 있다.

출처 : Nature Materials 14, 532–539 (2015)
[그림 4-5-11] 다공성 생분해성 나노 니들 구조
최근에는 환자의 개별 특성과 질병의 상태에 따라 약물의 종류와 용량을 조절하는 맞춤형 의료가 도래하고 있다. 이를 위한 핵심의료기술로 활발한 나노기술의 발전과 개인맞춤형 의료를 위한 테라그노시스 나노입자 연구가 진행되고 있다. 테라그노시스 나노소재는 하나의 시스템 안에 진단과 치료를 위한 기능이 동시에 포함하기 때문에, 진단, 치료, 치료효과 모니터링을 동시에 가능하게 할 뿐만 아니라, 개별 환자의 암에서 다양한 세포 표현형을 분석한 후, 치료를 함으로써 환자 맞춤형 치료를 가능하게 할 수 있다. 테라그노시스 나노입자는 생체 내에 투입된 약물의 실시간 정보를 제공할 수 있고, 약물의 최적 투여량, 치료효과의 모니터링에 사용할 수 있는 가능성을 가지고 있다. 또한 암세포에 선택적으로 약물을 전달함으로써 치료 효과를 높이고 부작용을 줄이는 항체 기반 표적지향형 치료제에 조영제를 첨가하여 암조직의 크기변화를 실시간으로 추적함으로써 치료 효과를 모니터링하고 치료의 종료시점을 판단하게 하는 기술도 개발되었다.
다. 국내 현황
최근 각광받고 있는 FET기반 나노바이오 센서 기술 중의 하나는 인간의 오감을 모사한 인공감각센서이다. 특히, 인간의 감각 가운데 그 복잡성으로 인하여 가장 알려지지 않은 영역이 후각 분야로써 신비의 감각으로 불리 우고 있다. 이러한 인공 후각 재현 기술(바이오전자 코)은 사람의 코를 대체할 기술로 비침습 암 진단, 식품/향수 감별, 마약/생화학무기 검출, 인간의 후각 코드화, 향기 나는 TV 등 미래 인간생활과 연관된 첨단 과학기술에 응용할 수 있기 때문에 활발히 연구되고 있다.
고성능 바이오전자 코는 국내 연구진들에 의해서 처음 소개 되었으며, 후각 수용체(서울대 박태현 교수)가 결합된 전도성 고분자 나노튜브 FET(서울대 장정식 교수) 혹은 카본나노튜브 FET(서울대 홍승훈 교수)를 활용한 시스템이다. 제조 과정은 실리콘 전극 기판 위에 카본나노튜브를 물리적 흡착 후, 카본나노튜브 표면에 후각 수용체를 도입하는 것이다. 이 전자 코는 극미세 냄새분자(펨토 몰, 10-15)를 감지 할 수 있었으며, 원자 한 개 차이까지 구별하는 초고감도 성능을 보여 주었다.
하지만, 기존의 1D 전도성 나노구조체 기반 바이오전자 코는 한 번에 냄새 분자 하나만을 감지하기에 실제 사람 코를 재현하기에는 기술적 한계를 지니고 있었다. 최근 한국생명공학연구원에서는 사람 코보다 더 정확한 FET 기반 인공 후각 재현 기술개발에 성공하였다(Nano Letters, 2015). 이는 반도체 칩 공정 기술을 활용하여 단층 그래핀 마이크로 패턴을 제조한 후, 그래핀 표면에 각각 다른 종류의 인간 후각 수용체를 부착함으로써 동시에 여러 가지 냄새를 인지하는 바이오나노전자코이다. 특히, 다양한 냄새분자 인지결과를 주성분 분석(principle component analysis: PCA)시스템에 도입함으로써 인간의 후각 인지능력보다 더 정확하게 모방이 가능한 인간 후각 신호의 코드화를 재현하였다.

[그림 4-5-12] 여러 가지 냄새 인지가 가능한 인간 후각 수용체-그래핀 기반 FET 나노바이오전자 코
나노생체소재 분야에서도 국내 연구진의 활동은 활발한데, 예로 한국생명공학연구원에서 개발한 암 세포 환경에서 고감도 조영효과를 보이는 pH 감응형 MR조영제 및 유방암 표적형 다당류 기반의 광학영상 나노 입자를 들 수 있다. 연세대와 고려대 공동연구팀은 공동구조의 자성 나노 입자를 제조하여 MR 영상과 약물전달체의 역할이 동시에 가능한 나노 생체 소재를 개발하였다. 특히 이 소재는 암 조직 환경에서 급격한 약물 방출 거동을 보여 효율적인 맞춤형 암치료를 가능하게 한다. 또한, 최근 나노 소재 기반 암 진단/치료 기술의 최근 연구 동향 및 미래 연구 방향에 대한 총설이 발표되었다.

출처 : Chem. Rev., 115, 327–394 (2015)
[그림 4-5-13] 테라그노시스를 위한 다기능성 나노 입자
라. 바이러스 측정 및 검출을 위한 나노바이오기술
2015년 5월 국내 첫 메르스코로나바이러스 감염자가 발생하고 현재까지 36명의 사망자가 발생하였으며, 국가적으로 엄청난 사회, 경제적 손실이 발생하였다. 이처럼, 새로운 감염질환의 출현과 과거 감염질환의 재출현, 난치성 감염질환(intractable infectious diseases)의 세계적인 증가와 지속은 21세기에 인류보건을 위협하고 있다. 따라서 세계적으로 바이러스 측정 및 검출을 위한 나노바이오기술이 최근 들어 활발하게 연구되고 있다.
현재 바이러스 검출 및 진단을 위하여 가장 많이 이용되는 시스템은 항원-항체반응을 이용한 시스템으로 AIPCON Biotech CO., Ltd, Secure Detect Co., Ltd, Shenzhen Lvshiyuan Biotechnology Co., Ltd 등 많은 회사들이 이러한 시스템을 이용한 제품을 생산 판매 중이다. 유럽의 반도체 회사인 ST Microelectronics와 Veredus Lab.에서는 VereFlu™라는 랩온어칩기술을 응용한 광학적 방법 기반의 조류 인플루엔자 검출 시스템을 시장에 출시하였다. 이 제품은 세균 감지 및 진단분야에서 필요한 시료의 첨가, 희석, 혼합, 반응, 분리, 검출의 모든 단계를 하나의 칩 상에서 구현한 사례로 기록되어 있다. 또한, PCR을 이용한 시스템은 이미 SARS를 진단하는데 사용되면서 그 효용성을 입증하였으며, Alere사에서 최근 PCR을 이용한 인플루엔자 바이러스 검출기기를 개발하였다. 중국의 Yao와 그의 동료들은 바이러스 DNA와 상호 반응하는 peptide nucleic acid(PNA)가 고정화 되어 있는 금 박막을 이용하여 PCR를 통한 DNA의 증폭 없이도 높은 선택도로 8.6pg/L의 농도까지 측정 가능함을 나타내었고, Wang과 그의 동료들은 조류독감 바이러스의 표면 단백질과 특이적인 반응을 하는 압타머와 교차 결합된 히드로겔이 코팅된 금 박막을 이용하여 바이러스와의 반응 시 나타나는 히드로겔의 풀어짐 현상으로 H1N1 바이러스를 검출 가능함을 보여주었다. 미국의 Wang과 동료들은 적혈구를 이용한 임피던스 신호 증폭을 통해 H1N1 바이러스를 높은 선택도로 검출하였으며, 그 검출 한계는 103EID50/ml까지 가능하였다. 또한, Chen 그룹은 금 나노입자를 이용해 에볼라 바이러스의 육안 검출이 가능한 기술을 개발하였다.

출처 : Angew Chem Itn Ed, 52, 14065 (2013)
[그림 4-5-14] 금 나노입자를 이용한 바이러스 육안 검출
국내에서는 씨젠, 인트론 바이오테크놀로지, 바이오니아, 파나진 등 국내 체외 진단 관련 대표적 기업들에서 항원-항체반응을 이용한 바이러스 진단방법을 활발하게 연구하고 있다. 고려대학교 연구팀은 메르스 검출 키트를 개발하였고, KAIST 연구팀이 용해된 바이러스에서 추출된 유전자 분석을 위해 전도성 탄소나노튜브 및 나노자성입자를 이용한 초고감도 나노바이오센서를 개발하였다. 최근, 연세대 연구팀은 나노물질과 결합된 캔틸레버 센서를 이용해 바이러스와 같은 생체물질을 쉽고 빠르게 검출할 수 있는 기술을 개발하였다. 또한, 서울대 연구팀은 인공 세포막 상에서 자유롭게 움직이는 나노입자의 상호작용을 실시간으로 관찰하는 기술을 개발하였으며, 이를 이용해 PCR없이 초고감도로 바이러스 유전자의 검출이 가능할 것으로 기대하고 있다. 한국생명공학연구원 바이오나노헬스가드 연구단은 국가 재난형 바이러스의 조기 검출 및 진단을 위한 포집-농축-검출-신호전송이 가능한 통합형 시스템을 개발하고 있다.

출처 : J Am Chem Soc, 136, 4081 (2014)
[그림 4-5-15] 나노입자 상호작용 실시간 관찰기술
마. 나노물질 안정성 연구 동향
최근 나노 기술의 급격한 발전은 산업 및 바이오 의약 등 다양한 분야에 새로운 활용가능성을 제시하고 있다. 나노 물질을 이용한 나노 소비재의 증가와 함께 환경으로의 나노 물질 노출 가능성이 제기되고 있으며, 최근 나노물질의 인체 및 환경 영향이 주요 현안으로 떠오르고 있다. 나노입자의 체내 침착현상은 입자 크기가 작을수록 증가하고, 흡입된 불용성 나노입자의 독성은 크기, 물리화학적 특성과 구조, 노출 및 독성학적 특성 등에 대한 폭넓은 연구와 관련 정보의 확보가 필요하다. 나노입자는 신체조직에 쉽게 흡수되고 표적장기에 축적되며, 세포와 세포내 기관 및 단백질에도 생물학적 영향을 끼치게 되며 나노물질의 크기와 주요 독성기전은 반응성산소종의 생성과 산화적 스트레스로 추정한다. 실험동물을 이용한 나노물질의 독성연구 및 유해성 평가는 전신흡입과 호흡기흡입 등의 방법을 이용한다. 한 예로, 자성나노물질의 경우 마우스에서 100mg/kg 이하의 용량으로 4주간 복강투여 한 결과 뇌를 포함한 주요 장기에 장기간 분포하지만 명백한 독성증상은 관찰되지 않았다.
Long 연구팀은 실험동물을 이용하여 산화티타늄 나노입자의 실험에서 뇌세포에서 활성산소 생성여부를 조사하였고 이러한 연구 결과를 토대로 나노 입자가 노출 부위인 호흡기나 피부를 통해 혈액으로 유입해 폐장과 간장, 뇌에 축적되어 독성을 유발함을 알 수 있었다. 또한, 나노물질은 폐장을 중심으로 호흡기 장애와 혈관기능장애, 중추신경계 영향, 그리고 노화나 암의 주요원인이 되는 활성산소의 생성으로 해당 표적 장기의 산화적 스트레스와 염증성 반응을 초래하며, 특히 나노입자는 세포 및 혈관 침투 등 체내흡수가 쉬워 독성의 영향을 더욱 가중시킬 수도 있다.

[그림 4-5-16] 나노입자 노출에 의한 체내 흡수경로와 영향
마. 발전 전망
나노바이오기술의 눈부신 발전은 기존 기술로 불가능하게 여겨졌던 부분이 가능해졌고 현재 상용화 되고 있는 기술의 한계를 극복하는데 큰 기여를 하고 있지만 해결해야 할 문제가 여전히 남아있다. 예를 들어 바이오칩/센서 분야에서는 고감도 진단에 사용하는 나노소재나 나노디바이스의 재현성이 중요한 요소를 차지하고 있으며, 의료/보건 분야에 폭넓게 활용하기 위한 칩/센서 제작비용의 절감을 위한 새로운 나노소재 혹은 기술 개발도 시급한 실정이다. 다기능성 나노생체소재의 개발과 더불어 최근 대두되고 있는 신소재의 독성과 생물학적, 환경적 영향에 대한 연구도 함께 진행되고 있으며 이는 안전한 나노생체소재의 활용에 중요한 역할을 할 것으로 기대한다.

1. 생명연구자원의 개요
지난해 유전자원에 대한 자원소유국의 주권을 인정한 나고야의정서(유전자원의 접근 및 이익공유(Access to Genetic Resources and Benefit Sharing)에 관한 나고야 의정서)가 발효(2014.10)되어 바이오분야의 새로운 국제 규범이 출현하게 되었다. 지난 2010년 10월 채택된 나고야의정서에 따라 국제적으로 각국의 유전자원에 대한 보호와 통제가 더욱 강화되고 있다. 의정서에 따라 외국 자원을 이용할 경우 자원 취득에 대한 소유국가의 승인을 받아야 하며, 자원 이용에 따른 경제적 이익(유무형의 결과물)에 대하여 공정하고 공평하게 이익을 공유해야하는 새로운 장이 열리게 된 상황이다. 이러한 새로운 국제적 환경이 도래함에 따라 유전자원, 생물자원 등 생명연구자원을 기초소재로 이용하는 생명공학 연구 및 바이오산업에 막대한 영향이 예상되고 있다.
일찍이 국제경제협력개발기구(OECD)는 생명공학기술(BT)이 정보통신(IT) 등 타 분야 기술들과 융합하여 2030년경에 글로벌 경제에 대규모 변화를 가져오는 ʻ바이오경제시대ʼ로 진입할 것으로 전망하며48), 21세기 인류가 직면한 보건, 식량, 에너지, 환경 등 4대 문제를 해결하는데 바이오기술이 핵심적인 역할을 할 것으로 예측한 바 있다. 보고서는 바이오 경제에 대해 ʻ바이오 기술이 경제적 산출량의 상당부분에 기여하는 경제ʼ로 정의하고, 차세대 산업 분야로 주목 받고 있는 생명공학의 중요성을 강조한 바 있다.
이에 앞서 생명공학 발전을 위한 핵심재료인 생명연구자원의 중요성을 인식한 OECD는, 2001년 세계 각국에 고품질의 생물자원 및 정보를 관리 보급하는 생명자원센터(Biological Resource Center, BRC)의 설치를 권고하였다. 자원센터는 생명공학 및 관련 산업의 성장을 견인하는 핵심 인프라 기관으로서 국가차원에서 지원해야할 중요 연구기반으로 제시한 바 있다.
따라서 도래하는 바이오경제 시대를 창출하는 핵심자원으로서 무궁한 가치를 지닌 생명연구자원의 중요성을 인식한 각국은 자원의 확보를 위한 치열한 경쟁을 벌이고 있다. 최근 발효된 나고야 의정서에 따라 타국의 자원을 이용할 경우 막대한 로얄티를 지불해야하는 새로운 환경에 대한 대응방안이 필요한 상황이다. 우리나라 역시 생명공학산업의 핵심소재인 생명자원의 중요성을 인식하고 법률 및 제도 정비를 통하여 생명자원의 효율적인 관리 및 활용을 위한 기반을 조성하기 위해 노력하고 있다. 2007년 건강하고 풍요로운 바이오경제 기반조성을 위하여 과학기술부를 중심으로 농림부, 복지부, 환경부, 해수부 등 5개 부처 공동으로 ʻ국가 생명자원 확보․관리 및 활용 마스터플랜(2007.12.)ʼ을 수립하였다. 이는 생명자원의 국가적인 종합 관리체계를 구축하고, 생명자원 관련 육성정책의 커다란 근간을 마련하는 획기적인 전환점이 되었다.
이러한 토대위에 기본법적인 성격의 ʻ생명연구자원의 확보․관리 및 활용에 관한 법률ʼ(2009)이 제정되었고, 농림축산식품부의 ʻ농수산생명자원의 보존‧관리 및 이용에 관한법률ʼ(2007)과 해수부의 ʻ해양생명자원 확보‧관리 및 활용 등에 관한 법률ʼ(2012) 등이 제정되었다. 마스터플랜과 생명연구자원법을 근거로 범부처 차원의 생명연구자원관리 기본계획(2011~2020)이 국가과학기술위원회에서 확정(2011.05.)되어, 매년 시행계획을 통해 범부처 차원의 생명자원의 정책을 종합적으로 추진하고 있다. 또한 생명연구자원법 시행령에 따라 미래부 주관으로 6개 부처가 참여하는 책임기관협의회가 운영되고 있으며, 산하에 정보시스템 실무위원회와 자원별실무위원회(동물, 식물, 미생물, 인체유래자원)를 두어 생명자원 관련 현안에 대한 효율적인 논의를 진행하고 있다.
2. 연구동향
가. 생명연구자원의 정의
OECD는 생명자원센터에서 관리되는 자원의 정의를 ʻ배양 가능한 생물체 (미생물, 식물, 동물, 인간세포)와 생물다양성 부분 중 복제 가능한 부분, 배양 불가능한 생물체 및 이와 관련된 분자, 생리, 구조적 정보를 포함ʼ하며, 또한 ʻ이들로부터 유래되는 유전체, 전사체, 단백체, 대사체, 생물학적 화합물, 추출물, cDNA clone or library, Amplicon, Metagenome 등ʼ으로 규정하고 하고 있다.
우리는 현재 생명자원의 근간이 되는 ʻ국가 생명자원 마스터플랜ʼ에 따르면 생명자원 (Bioresource)이란 생물자원, 생물다양성자원, 생명정보자원을 총칭하며, 생명공학 연구기반이 되는 생물체 및 이를 구성하고 있는 구성체를 의미한다고 정의하고 있다. 이를 근거로 생명연구자원법에서도 생명연구자원을 ʻ생명공학연구의 기반이 되는 자원으로서 산업적으로 유용한 동물, 식물, 미생물, 인체유래 연구자원 등 생물체의 실물(實物)과 정보ʼ로 정의하고 있다. 이에 준하여 이후 용어 사용은 생명연구자원으로 서술하기로 한다.
국가생명연구자원정보센터(KOBIC)의 국가생명연구자원통합정보시스템(KOBIS) 통계에 따르면, 국내 생명연구자원은 동물, 식물, 미생물, 인체유래자원 등 실물자원과 생명정보자원을 합쳐 총 6만 3천여 종 7백 4십만 건을 보유하고 있는 것으로 나타났다. 이 중 실물자원은 약 6만 3천여 종 340만 건을 보존하고 있고, 종류별 통계를 보면 미생물은 약 12,000종 18만 건, 식물 23,000종 150만 건, 동물 11,000종 150만 건, 인체유래물 15만 건을 보유하고 있다. 또 생명정보의 자원 종류별 통계에 따르면 미생물은 약 12,000종 194만 건, 식물 4,000종 116만 건, 동물 5,000종 62만 건, 인체유래물 25,500여 건 등의 생명정보가 등록되어 있는 것으로 나타났다.
나. 생물자원
국가생명연구자원통합정보시스템(KOBIS) 통계에 따른 국내 실물자원 중 생물자원의 종류별 부처별 자원보유량을 보면, 미생물자원은 미래창조과학부 약 8,300종 11만 건, 농림축산식품부 약 2,230종 36,000건, 환경부 약 2,700종 38,000건, 해양수산부 약500종 33,000점 등을 보존하고 있다. 식물자원은 미래창조과학부 약 16,500종 28만 건, 농림축산식품부 약 8,500종 99만 건, 환경부 약 4,740종 18만 건, 해양수산부 약 1천종 5만점 등을 보유하고 있다. 동물자원은 미래창조과학부 약 5,530종 110만 건, 농림축산식품부 약 4,220종 20만 건, 환경부 약 4,840종 18만 건, 해양수산부 약 3천종 33만점 등이 등록되어 있다. 인체유래물자원은 미래창조과학부만이 약 14만 건을 보유하고 있다.
그러나 아직 부처별로 정보 연계가 진행 중이고, 기관별로 분류체계와 정량적 기준에 차이가 있어 통계지표 표준화를 위한 실물자원 및 정보자원 등 자원 분야별로 분류정보 표준화 위원회를 구성하여 운영 중이다. 미생물자원의 대표관리기관은 한국의 유전자은행으로 알려진 한국생명공학연구원 바이오인프라 총괄본부의 미생물자원센터(KCTC)이다. KCTC는 1985년 한국과학기술연구원(KIST)내 설립되어 다양한 국제 공인균주를 확보 관리하여 산학연 연구자에 보급하는 자원은행 역할을 수행하며, 국내 생명공학연구의 역사와 궤를 같이하는 최대 자원센터로 발전해 왔다. 현재 약 25,000여주의 세균, 효모, 곰팡이 등 공인균주를 보유하여 세계 8위권 자원센터로서의 위상을 보이고 있다.
매년 PubMed 등재 논문에서 KCTC자원이 활용된 인용지수를 살펴보면, 세계 자원센터 중 독일 DSMZ, 미국 ATCC, 네덜란드 CBS, 일본 JCM에 이어 세계 5위권을 유지하고 있다. 또 전 세계에서 새롭게 발굴 보고되는 신종미생물의 확보 수준에서, 독일, 일본에 이어 세계 3위의 신종미생물 보유기관으로 국제적인 위상을 보이고 있다. KCTC는 부다페스트조약에 의한 국제특허미생물 보존기관(IDA)로서 국내 특허미생물기탁의 절반 이상을 담당하고 있다.
더불어 ʻ국가연구개발사업의 관리 등에 관한 규정(2008.5.)ʼ에 의해 국가연구개발 사업을 통해 확보된 생명자원 연구성과물의 기탁 전담기관으로 지정된 바이오인프라총괄본부 산하의 보존기관으로 활용기반을 마련하고 있다. 이 외에도 미래창조과학부가 지원하는 국가지정연구소재은행사업을 통해 대학중심으로 특화된 여러 종류의 연구용 미생물이 관리되고 있다. 2012년 종결된 21세기 프론티어연구개발사업 미생물유전체사업단은 유용 미생물 발굴 활용사업을 통해 신종미생물 발굴 분야에서 한국이 세계 1위의 성과를 나타내는데 크게 기여했다.
국가생명연구자원정보센터의 KOBIS 통계에 따르면, 국내 식물자원은 약 23,000종 150만 건을 보유하고 있는 것으로 나타나며, 농림부의 생명자원정보서비스(BRIS)에서는 농진청, 산림청 등의 농업식량작물 및 삼림자원을 중심으로 종자 4,049, 영양체 6,331 등 약 1만여 종을 보존하는 것으로 나타났다. 그리고 미래부의 한국생명공학연구원 식물추출물은행, 해외생물소재센터, 연구소재은행 등에서 주로 연구자에게 필요한 식물추출물 형태의 연구자원 약 16,500종을 관리하고 있으며, 환경부의 국립생물자원관 등에서도 식물표본을, 해양수산부의 해산식물 약 1천종 5만여 점 등을 관리하고 있다. 그러나 우리나라가 확보한 식물종자는 약 15만 점으로 미국(50만 점)의 1/3, 중국(38만 점)의 1/2.5, 일본(28만 점)의 1/1.8수준에 불과하다. 전체 보유 종자 중에서 식량작물의 비중이 가장 높으며 채소, 특용작물, 사료작물 등 타 작물과 야생 식물의 종자 보유는 상대적으로 저조한 실정이다.
국내 동물자원 인프라는 선진국에 비해 아직 미흡한 수준이나, 신약개발 관련 연구들이 진행되면서 투자가 확대되고 있는 상황이다. 한국생명공학연구원은 국제공인 모니터링센터(ICLAS Monitoring Subcenter Korea)를 운영하여 국내 실험동물시설에 대한 병원성미생물 감염모니터링을 지원하고 있다. 2010년 시작된 유전자변형마우스기반구축사업을 통해 국내 바이오연구개발의 필수재료인 유전자변형마우스(GEM)의 생산, 활용 기반구축이 추진되고 있다. 더불어 최근 신약연구에 필요한 인프라로 국가영장류센터가 구축되어 원숭이, 침팬지 등 영장류 관리시설이 가동 중이며, 이들의 생산 기반시설이 한국생명공학연구원 전북분원에 새로이 구축되고 있다.
한국과학기술원 의과학연구센터가 관리하는 25,000 line의 형질전환 초파리 라이브러리은행과 한국인유래 암세포주 분양 업무를 수행하는 한국세포주은행 등은 유용자원으로 국내외 많은 연구실에서 활용되어 여러 우수 논문으로 발표되었다. 농림축산식품부의 농진청, 산림청, 수산과학원 등의 기관에서 가축 11종 15여 점을 비롯하여 곤충, 해양생물 등 다양한 동물자원들이 관리되고 있다. 최근 개관한 해양수산부의 해양생물자원관에서 약 3천여 종 33만여 점의 해양척추 및 무척추동물을 관리 보존하고 있다.
다. 생물다양성자원
우리나라의 자생생물은 약 10만 종으로 추정되고 있다. 2013년 말 기준으로 ʻ국가 생물종 목록ʼ에 등재된 생물은 척추동물 1,899종, 곤충 15,651종, 무척추동물 8,534종, 식물 5,308종, 균류와 지의류 4,153종, 원생생물 1,573종, 조류(algae) 4,879종, 원핵생물 1,059종으로 총 41,483종에 이른다. 약 10만 종의 한반도 전체 생물종 추정치의 25~30% 정도에 불과하다. 더욱이 생물다양성 연구가 관련 부처의 각 기관별로 분산되어 있어 국가 전체에 대한 정확한 통계를 확보하는 데 어려움이 있다.
미래부는 국립중앙과학관을 중심으로 국내 생물다양성에 대한 표본 확보 및 정보의 수집 관리를 주도하고 있다. 생물다양성 통합DB 및 네트워크 구축운영사업을 통하여 생물다양성 정보를 구축하고 있으며, 국내 자연사 표본을 소장하고 있는 과학관, 자연사박물관, 자원관 등 48개 관련 부처 기관과의 네트워크인 ʻ국가생물다양성기관연합ʼ의 주관기관으로 활동하고 있다. 또한 자연사참조표본 확보 및 활용지원 기반기술개발사업을 통해 국내 자연사자원의 인벤토리 구축, 참조표본의 확보 및 분양, DNA 연구 등을 수행하고 있다. 현재 국립중앙과학관은 국가자연사연구종합정보시스템(NARIS) 운영과 세계생물다양성 정보기구(GBIF)의 한국사무국(KBIF) 역할 수행하여 200만여 건의 생물다양성 정보를 구축하고, 이를 국가생명연구자원통합시스템(KOBIS)에 연계하고 있다. 한국과학기술정보연구원은 GBIF 정보 포탈에 대한 아시아권역 미러사이트를 운영하고 있다.
환경부는 국립생물자원관을 중심으로 자생생물 서식지를 대상으로 생물다양성자원을 수집하고 신종․미기록종을 조사하는 사업을 수행하고 있으며, 주요 생물자원의 유전자 분석연구를 통해 생물다양성의 보전, 관리의 기초자료를 확보하고 있다. 한반도 자생생물의 생태 등 다양한 정보를 종합적으로 수록한 종합 생물지 발간, 법적보호대상종, 수집자원을 중심으로 한반도 주요생물 계통수 및 동정서비스시스템을 운영을 하고 있다. 또한 확보 자원의 DB화 및 한반도생물자원포털(Species Korea)을 구축하여 생물표본 15.4만 점과 자생생물 정보 3천 종을 구축하고 있다.
농림부는 농진청 국립농업과학원에서 식물, 곤충, 누에 등에 대한 국내 야생종, 재래종 등 농업자원의 다양성을 확보하고 있다. 또한 곤충에 대한 유전적 다양성 보존을 위한 자원을 수집하고 있으며, 보존자원에 대한 내병충성 및 주요성분 분석을 통하여 식물자원의 특성 평가 사업을 수행 중에 있다. 가장 많은 자원을 보유한 산림청 국립수목원은 국가생물종지식정보시스템(Nature)을 통해 식물, 곤충, 버섯, 그리고 야생조수류에 대한 생물다양성 데이터베이스를 구축하고 있으며, 식물표본 정보 약 75만 건, 곤충표본 정보 약 55만 건(2012년)을 보유하고 있다.
해수부는 국립해양생물자원관을 중심으로 국내 다양한 해양자원의 체계적 연구를 위해 해양생물종 표본 및 기타 생물재료를 확보하고 있다. 해양생명자원통합정보시스템(MBRIS)을 중심으로 해양생물자원의 DB구축, 분양, 기탁 등을 수행하고 있으며, 한국해양생물다양성정보시스템(KoMBIS)을 통해 18개 해양생물군에 속하는 총 9,829여 종의 생물명과 3,000여 개의 동종이명에 대한 정보를 구축하고 있다. 또한 유전자 분석을 위한 해양유용생물종을 보존하고 있으며 갯벌 등 습지에 대한 해양환경의 생태조사를 수행하고 있다.
라. 생명정보자원
우리나라 유전체연구사업이 시작된 2001년 10월 국무조정실 주관으로 생명정보는 과기부(현, 미래부)에서 총괄관리 하는 것으로 결정된 이후, 마스터플랜과 생명연구자원법을 근거로 국가생명연구자원정보센터(KOBIC)가 출범하고 국가생명연구자원통합정보시스템(KOBIS)이 운영되고 있다. KOBIC은 2010년 9월부터 시작된 1단계 국가생명연구자원 통합체계구축사업을 통해 다양한 역할과 성과를 도출하였다. 범부처 정보연계표준안을 근간으로 KOBIS를 구축하여 미래부 내 기탁등록 보존기관의 정보연계를 추진하였으며, 범부처 정보연계 시범사업으로 농림부 생명자원정보서비스(BRIS)와 정보연계를 시작으로 환경부, 해수부, 복지부 등과의 정보연계를 추진하고 있다.
범부처 차원에서 협력을 위해 생명연구자원법에 따라 범부처 정보연계 및 통합을 추진하고, 효과적인 정보공유를 위해 관련부처 책임기관으로 협의회를 운영하고 있다. 최근의 KOBIS 통계에 따르면, 국내 생명정보는 미생물 약 193만 건, 식물 116만 건, 동물 62만 건, 인체유래물 25,500건, 기타 18만 건 등 총 393만 건 이상의 자원정보를 보유하고 있는 것으로 나타났다.
농림부는 농작물개발 관련 분야 연구개발 투자를 확대하고 있으며, 부처 내 기관들에 의해 기 구축된 다양한 자원 관련 정보를 통합하여 통합시스템인 생명자원서비스(BRIS)를 구축 운영하고 있다. 환경부는 고유 업무인 생태조사와 기후 변화에 따른 환경조사 및 모니터링을 위해 국내 및 아시아 관련국과 공동 조사를 추진하고 있다. 생물다양성 관련법을 마련하여 국가생물다양성센터를 설치하였고, 「야생생물 보호 및 관리에 관한 법률」개정을 추진 중이다.
보건복지부는 제2단계 한국인체자원은행사업(2013~2015년)계획 수립과 유전체 연구에 기반 한 맞춤의료 기술개발을 위해 유전체 맞춤의료 기술개발촉진법 제정을 추진하고 있다. 또한 인체유래생물자원 종합관리방안을 통한 인체유래물 확보, 활용 방안 및 인체유래자원의 표준화를 추진하고, 질병관리본부를 통한 보건의료분야 생명연구자원의 관리 체계를 강화하고 있다.
해수부는 해양생물자원관 건립을 통해 해양생명자원 분야 거버넌스 확보와 첨단 생명공학기술 및 융합기술을 통해 새로운 도약을 추진하고 있다. 자원관 건립을 통해 해양 자원 확보와 관리시스템을 구축하고 있으며, 2013년 해양과학기술 육성 전략 발표를 통해 첨단기술의 활용뿐만 아니라 융합기술의 접목으로 해양수산업 지원뿐만 아니라 새로운 가치 창출을 위한 산업화에 주력하고 있다.
3. 발전과제
생명연구자원 또는 생명자원은 이러한 바이오 분야의 발전과 혁신을 위한 필수적인 연구소재이며 바이오경제 창출을 위한 핵심 원천재료로 인식되고 있다. 유용 생명연구자원은 과거에는 인류공동의 자산으로 인식되어 누구나 자유롭게 사용할 수 있었으나 최근에는 자원을 소유한 국가의 자원주권이 인정되면서 자원의 중요성이 더욱 조명되고, 특히 나고야의정서 발효로 국가 자산 및 국익적 관점이 부각되고 있다. 의정서가 본격적으로 적용될 경우 국내 생명공학 연구경쟁력 제고와 바이오산업의 지속적 발전에 막대한 파급효과를 미칠 것으로 전망되고 있다. 의정서에 따라, 향후 바이오 연구개발 및 산업화 과정에서 다른 나라의 유전자원을 취득할 경우, 반드시 자원제공국의 사전승인을 받아야 하며 상호합의조건에 따라 이익을 서로 공유해야 하는 법적 통제체제하에 놓이게 됨을 의미한다.
현재 국제적으로 각국은 의정서 이행을 위한 비준절차 및 국내 이행체계 마련을 진행 중이며, 이에 대한 관련 단체의 대응노력과 더불어 국민 및 관련자에 대한 인식제고 활동을 벌이고 있다. 이러한 국내외적인 상황변화에 따라 국내 생명연구자원의 활용도를 높이기 위한 인식전환이 필요하며, 국내 생명자원의 확보를 통한 국내 자산화 연구가 필요할 것이다. 더불어 나고야의정서에 대한 자원 관련 연구자들의 인식제고를 통해 국제현안에 대한 대내외적 대응능력을 강화하고, 각계 관계자들의 의견 수렴을 통한 효과적인 대응전략을 마련해야 하는 상황이다.
생명자원의 성격상 연구과정을 통하여 산출된 결과물로써의 최종 산출이기보다는 제품생산을 위한 중간제적 존재물인 특성을 반영하여, 도출된 유무형의 이익을 연구자 개인과 국가가 어떻게 적정하게 분배할지에 관한 논의가 필요할 것으로 생각된다. 또한 외국자원을 이용할 경우 자원 소유국과 어떻게 어느 수준으로 이익을 공유해야 하는지 국가 또는 기관 수준의 적정한 가이드라인을 제시할 필요가 있으며, 이에 대한 심층적 논의가 요구되는 상황으로 보인다.

1. 개요
일반적으로 생명공학 분야의 경쟁력을 강화하기 위해서는 핵심기술 개발도 중요하지만 산업에 대한 경쟁력 확보의 징검다리 역할을 할 수 있는 생명공학 인프라의 확충 및 내실화도 매우 중요하다. 생명공학 인프라의 역할은 실용화 기술개발 및 산업화에 필요한 강건한 뼈대 역할을 하는 것이다.
실용화기술개발 단계의 세부과정은 ① 순수연구 및 독창적․창의적 ʻ기초연구 (Basic research)ʼ 과정, ② 개발가능성 확보 및 효능확인의 ʻ응용연구(Applied research)ʼ 과정, ③ Prototype 및 시제품 제작의 ʻ개발(Development)ʼ 과정, ④ 대량생산의 가능성 확보 및 제품성능평가의 ʻ시생산(Pilot-plant)ʼ 과정, ⑤ 대량생산 및 품질관리의 ʻ산업화(Manufacturing)ʼ 과정 등으로 세분화 할 수 있으나, 생물산업의 경우에는 타 산업 분야와 달리 차별성 및 특이성이 존재하게 되는데, 이는 개발과정 → 시생산과정 → 산업화과정 등을 거치면서 개발될 제품(의약품 및 식품 등)을 최종적으로 인체에 적용하기 위하여 체내 안전성․유효성 등에 대한 신뢰성평가(비임상 GLP, 임상 GCP, 우수제조기준 GMP 등)를 필수적으로 거치면서 객관적인 성능에 대한 검증을 받아야 한다는 것이다. 이러한 생물산업의 실용화기술개발 단계에서 ʻR&D 기능ʼ을 전-후, 좌-우, 상-하 등 적시에 지원해주는 기술하부구조인 ʻ인프라구조(Infra- structure)ʼ의 효율적인 체계 구축은 생물산업의 지속가능한 성장을 촉진시키는 필수 요인이 된다.
생명공학 인프라 분야와 관련하여, ① 실용화기술개발의 ʻ응용연구ʼ 과정까지는 주로 한국생명공학연구원, 한국화학연구원, 한국식품연구원, 한국한의약연구원, 한국기초과학지원연구원, 한국표준과학연구원, 한국과학기술연구원, 한국전자통신연구원 등의 정부출연기관과 정부에서 지원하는 연구소재은행 및 한국세포주은행 (미래창조과학부), 줄기세포․재생연구센터(보건복지부) 등을 중심으로 R&D 인프라가 구축․운영되고 있고, ②‘응용연구ʼ 과정 이후부터는 산업화에 특화된 지원을 위해 산업통상자원부를 중심으로 R&D 및 시제품 제작․생산에 필요한 고가의 시설․장비, 관련 기업의 창업부터 성장까지 단계별로 지원하는 인프라인 산학연공동연구기반구축센터, 바이오벤처기업지원센터(BVC; Bio Venture Center), 지역특화센터, 한국바이오협회 코리아바이오허브센터(Korea Bio-Hub Center) 등과 우수의약품 제조기준(cGMP)에 맞는 (주)바이넥스(舊 한국생산기술연구원) 생물산업기술실용화센터 등이 구축․운영되고 있으며, ③ 특히 생물산업(의약품 등) 제품의 신뢰성평가에 특화된 인프라는 안전성평가연구소(KIT)를 포함하여 보건복지부 식품의약품안전처에서 지정한 비임상(GLP) 기관과 임상(GLP) 기관이 구축․운영되고 있다. 또한 의약품 개발 R&D 비용 중 2/3 정도의 비용이 (비)임상시험 비용 등에 소요되고 있고, 그 중 30% 이상이 전문연구용역기관(CRO)에서 사용되는 것으로 추정되고 있으며, CRO의 주요 성장기반이 되는 제약분야가 지속적으로 확대됨49)에 따라, 바이오산업 글로벌 진출을 위한 CRO 육성의 중요성이 어느 때 보다도 강조되고 있다. CRO는 기업에게 비용 절감의 효과를, CRO 회사는 수익을 창출할 수 있어 서로에게 이익이 된다.
[표 4-7-1] 실용화기술개발 단계별 생물산업 관련 주요 인프라 현황
|
인프라단계 |
세부구분 |
인프라기관 |
주요역할 |
|
Research
(기초연구 및 응용연구) |
의약바이오
|
한국한의약연구원 한국표준과학연구원 한국과학기술연구원 |
한의학표준화기반 연구 바이오분야 측정표준 연구 표적지향형 신규항암제 후보물질 연구 |
|
산업/그린/융합바이오
|
한국생명공학연구원 한국생명공학연구원 한국생명공학연구원 한국생명공학연구원 한국식품연구원 한국화학연구원 한국전자통신연구원 한국과학기술연구원 한국뇌연구원 |
바이오제품 안전성평가 및 정보관리 국가영장류센터 운영 바이오융합 연구 국가생물자원정보 관리 식품기능성 및 신소재‧신공정 연구 화학기술분야 연구 및 성과 보급 유비쿼터스건강관리모듈/시스템개발 실시간분자영상 스마트센서기술 개발 뇌손상기전 등 다학제융합기술 기반 뇌연구 |
|
|
종합분야
|
한국기초과학지원연구원 한국세포주은행 한국생명공학연구원 한국생명공학연구원 |
고가의 바이오 연구기자재 활용 미생물 및 세포주은행(관리 및 공급) 해외생물소재(식물) 허브센터 국가생명공학정책연구 및 확산 |
|
|
Development Pilot-plant Manufacturing
(개발, 시생산 및 산업화) |
산기반 공동장비/연구지원 |
경기바이오센터 등 5개 한국식품연구원 한국화학연구원 한국화학연구원 부산대학교 항노화센터 |
산학연공동연구기반구축 건강기능식품플랫폼 신약개발플랫폼, 바이오화학실용화 Drug Repositioning 연구지원 항노화산업 제품화 연구지원 |
|
벤처기업지원 |
한국생명공학연구원 등 9개 |
바이오벤처기업지원센터 (TIC를 포함 BVC) 구축 |
|
|
지역 클러스터
|
대전테크노파크 등 22개 (지원기반정비 13개 별도)
|
지역특화산업 분야 혁신역량 제고 (시설‧장비지원, 기술지원, 교육훈련, 시생산 (Pilot plant, GMP 등) 및 공인검사지원 등 수행) |
|
|
종합분야
|
(주)바이넥스(舊 생기원) 한국생명공학연구원 한국바이오협회 순창군 장류사업소 |
생물산업기술실용화센터건립(cGMP) 바이오안전성정보센터(LMO관련) 코리아바이오허브구축(Networking) 발효미생물종합활용센터건립(전통식품) |
|
|
GLP(비임상) GCP(임상) (신뢰성평가) |
GLP(비임상)
|
식약처 지정 GLP 23개 (안전성평가연구소 등) |
비임상 시험항목별 허가기관 (’15.5)
|
|
GCP(임상) |
식약처 지정 GCP 173개 |
임상1상, 임상2상, 임상3상(’15.8) |
* 의약바이오 : 바이오신약, 바이오장기 등 바이오기술을 보건의료 분야에 응용한 것
* 산업/그린바이오 : 건강기능식품, 바이오매스, 바이오플라스틱 등 바이오기술을 농축산, 식품, 바이오플라스틱, 바이오연료 등에 응용한 것
* 융합바이오 : 바이오공정, 바이오환경, 바이오에너지 등 바이오기술을 산업공정/생산 및 환경 분야에 응용한 것
* BVC : 바이오벤처기업지원센터(Bio Venture Center), 전국 바이오벤처기업지원센터간 협력네트워크 및 전략적 연계운영시스템 구축을 통한 효율적 기업지원시스템 구축, 바이오산업의 지역별 균형발전을 도모하기 위해 설립․운영(지역대학 중심으로 지원한 TIC(Technology Innovation Center) 포함)
* 지역클러스터(지역특화센터) : 지역특화산업 분야의 혁신역량을 제고하기 위하여 지역 내 설치 운영되는 센터이며, 지역의 기획 및 기술개발역량의 중재자 기능을 수행
* 산기반 공동장비/연구지원 : 산업부 산업기술기반조성/산업핵심기술개발 등으로 지원된 인프라
2. 현황
가. 기초․응용연구 단계 인프라
기초․응용연구 단계 인프라는 기초이론 및 실험, 실용 목적의 아이디어 특허 등의 개념 정립, 연구실 규모의 기본성능 검증, 연구실 규모의 부품 및 시스템 핵심성능 평가 등을 지원하는 인프라에 해당되며, 주로 국책연구원을 중심으로 인프라가 형성되어 기술개발을 지원하고 있다.
기초․응용연구 단계에서 가장 큰 비중을 차지하는 한국생명공학연구원은 바이오제품 안전성평가 및 정보관리, 국가영장류센터 운영, 바이오융합 연구, 해외생물소재 허브센터 운영, 국가생명공학정책연구 및 확산 등의 기능을 담당하고 있다. 한국식품연구원은 식품기능성 및 신소재․신공정 연구를 담당하고 있고, 한국화학연구원은 바이오분야를 포함한 화학기술분야 연구 및 성과보급을 담당하고 있고, 한국과학기술연구원은 표적지향형 신규항암제 후보물질 연구, 실시간 분자영상 스마트센터기술 연구 등의 기능을 담당하고 있으며, 한국뇌연구원은 뇌손상기전 등 다학제적인 융합기술기반의 뇌연구를 담당하고 있다. 기타로 한국한의약연구원의 한의학표준화연구, 한국전자통신연구원의 유비쿼터스 건강관리시스템 연구 등도 중요한 인프라 기능을 담당하고 있다.
그러나 기초․응용연구 환경에 종합적으로 필요한 2개의 핵심인프라는 분석기능을 지원하고 있는 한국기초과학지원연구원과 연구개발 검증에 필요한 세포주를 지원하고 있는 한국세포주은행이라 할 수 있다. 한국기초과학연구원은 1988년 기초과학 진흥을 위한 연구지원 및 공동연구 수행을 목적으로 설립되어 국가적 대형공동연구장비 개발․설치․운영, 첨단연구장비 이용자 교육, 범국가적 연구장비 정보수집․분석 등의 기능을 담당하고 있으며, 2015년 현재 대덕 및 오창 본원, 지역특화산업을 기반으로 한 10개 분원(서울, 서울서부, 부산, 대구, 광주, 전주, 춘천, 순천, 강릉, 제주)에 총 254명의 인력 및 170종의 지원장비(BT, NT, ET 분야로 구분하여 분석포털시스템(USE-KBSI)을 통해 인프라 지원 중)를 보유하고 있다.
한국세포주은행은 1982년 전국의 연구기관에 필요한 세포주 개발․공급을 목적으로 설립되어 세포주 자원에 관련 정보 수집․보존․공급, 세포주 관련 각종 교육․연수․학술회의 실시, 특허출원 세포주의 기탁 및 보존 등의 기능을 담당하고 있고, 세포주 품질관리에 필요한 각종 실험기자재 및 실험 보조 장치를 확보하고 있으며, 1993년 UN 산하 세계지적재산권기구로부터 특허미생물의 국제기탁기관의 지위를 취득하였고, 현재 자체개발 세포주 330여 종, 외국도입 세포주 430여 종을 보유하고 있는 세계 5대 은행 수준의 규모이다.
나. 개발․시생산 및 산업화 단계 인프라
개발․시생산 및 산업화 단계 인프라는 기초단계 이후의 효능검증 연구․확인, 확정된 부품․시스템의 시작품 제작․평가, Pilot 규모의 시작품 제작 및 성능 평가 등을 지원하는 인프라에 해당되며, 대부분 산업통상자원부 지원 기관을 중심으로 인프라가 형성되어 의약바이오, 산업바이오, 융합바이오 분야의 산업화를 지원하고 있다.
산업화 지원 인프라는 기본적으로 기업성장 단계별 지원(창업보육 등), 시설․장비구축․활용, 교육훈련, 정보교류, 기술지도 등을 담당하고 있고, 인프라구축 형태로 크게 구분하면, ① 생물산업실용화기반(cGMP, 발효미생물활용센터), ② 바이오안전성기반(LMO), ③ 연계협력기반(Korea Bio-Hub), ④ 산업기술기반조성(BVC, 산학연공동연구기반, 플랫폼센터, DR센터), ⑤ 지역클러스터(지역특화센터) 등으로 구분할 수 있으며, 국내 생물산업의 여건 및 경쟁력을 고려하여 산업통상자원부를 중심으로 전략적으로 구축되었다.
생물산업실용화기반 부분을 살펴보면, 1998년 국내 생물의약 분야의 성장에도 불구하고 미국 FDA의 인증을 받은 우수의약품제조 및 품질관리기준인 cGMP50)기준의 생산공장이 전무한 실정을 감안하여 선진국으로의 수출지원 등을 위하여 미국 FDA와 유럽 EMA가 요구하는 기술적 사항을 종합적으로 반영하여 국제적으로 인정된 기준에 맞는 생물의약품 전문생산시설(생물산업기술실용화센터(1998년~2007년)51))이 구축되어 현재 바이넥스에서 운영하고 있다. 2007년 국내 발효식품산업 육성을 위해 전통발효식품(고추장, 된장 등)의 안전성 확보 및 발효미생물자원의 허브 구축을 위하여 발효미생물종합활용센터(2007년~2010년)52)가 구축되었다.
바이오안전성기반 부분을 살펴보면, 2002년 LMO(유전자변형생물체)를 중심으로 대두된 국제무역질서에 대응하기 위한 의무사항․교육․홍보 등을 위하여 바이오안전성정보센터(2002년~)가 구축되었으며, 연계협력기반 부분을 살펴보면, 국내외 바이오네트워크 구축․활성화 및 웹포털 구축․운영을 통한 각종 협업기관 지원을 위하여 코리아바이오허브센터(2004년~)가 구축되었다.
또한, 산업기술기반조성 및 지역클러스터 부분을 살펴보면 수도권을 포함한 각 지역에 소재한 중소 바이오벤처기업 등의 특성화 지원 및 현장 밀착형 지원을 위해 산업정책 차원에서의 바이오벤처기업지원센터(BVC, 1998년~2007년)53)와 산학연공동연구기반구축(2004년~2011년)54), 지역균형발전 차원에서의 지역 바이오클러스터(지역특화센터, 2002년~2012년)55), 건강식품개발 및 신약개발을 위한 플랫폼구축(2009~2014), Drug Repositioning 기술을 이용한 신약개발 활용 시스템 구축(2010~2015), 바이오화학실용화 센터 구축(2010~2014)56), 지역산업 육성을 위한 융복합 연구지원(2012~2015) 및 항노화제품개발 인프라(2011~2015)57)등이 구축되었다.
(1) 산업화 인프라 지원 현황
산업화 지원 인프라는 국비지원이 대부분 종료되었으나, 전국적으로 생물산업 제품의 산업화를 지원하고 있으며, 2015년까지 지급한 국비지원금은 29개 기관, 60개 과제(2단계 13개 포함)에 총 5,994억 원이 지원되었다. 60개 과제는 cGMP 1개, LMO 3개, 산기반 3개, 네트워킹 1개, 발효산업 1개, BVC 9개, 지역특화센터 35개(2단계 13개 미포함), 산업핵심 및 산기반 인프라 7개로 구성되어 있다.
광역경제권역별로 2015년까지의 정부 지원 금액(지원과제수 포함) 비중을 살펴본 결과, 호남권이 24%(1,441억원, 14개) 지원되었으며, 충청권이 20.9%(1,251억원, 16개), 수도권이 20.5%(1,226억원, 4개), 동남권이 9.3%(555억원, 9개), 대경권이 8.7%(522억원, 9개), 강원권이 8.5%(511억원, 5개), 제주권이 8.1%(487억원, 3개) 순으로 지원되었으며, 지원분야별 지원금액(지원과제수 포함) 비중을 살펴본 결과, 각각 산업/그린바이오 분야가 50.5%(3,025억원, 36개), 의약바이오 분야가 35.4%(2,121억원, 15개), 복합지원(의약/산업/그린) 분야가 9.2%(552억원, 5개), 융합바이오 분야가 4.9%(296억원, 4개) 등의 비중을 차지하고 있다.
60개 지원과제별 지원서비스 분야별 현황(2개 이상 지원 역할 포함)을 살펴보면, Pilot Plant 지원이 73.3%(44개), GMP 지원이 58.3%(35개), 공인인증검사 (식품위생검사 등 포함)이 48.3%(29개), 기타(연구지원, 정보제공 등)가 18.3%(11개) 등으로 주요 역할이 생물산업 제품화 지원을 위한 시제품생산 및 공인시험 인증지원에 큰 비중을 두고 있다.

[그림 4-7-1] 광역경제권역별 산업화 인프라 지원 현황(∼2015년)

[그림 4-7-2] 지원분야별 산업화 인프라 지원 현황(∼2015년)
(2) 산업화 인프라 지원 성과
생물산업 제품화 지원 인프라 구축을 통해 2015년 9월말 현재 총 320,175평의 부지가 사용되었으며, 행정동, 연구동, 장비지원동, Pilot Plant, 기업입주 공간 등의 건물 규모는 총 106,379평이며, 인프라 지원 상주인력은 총 1,100명(기관 평균 38명의 전담인력을 보유)에 다다르고 있다.
구체적으로 광역경제권역별로 구분하면, 수도권이 부지 15,973평, 건물 13,099평, 전담인력 178명, 충청권이 부지 20,098평, 건물 12,750평, 전담인력 185명, 호남권이 부지 176,342평, 건물 43,231평, 전담인력 367명, 동남권이 부지 38,621평, 건물 10,306평, 전담인력 101명, 대경권이 부지40,287평, 건물 12,652평, 전담인력 153명, 강원권이 부지 23,329평, 건물 10,329평, 전담인력 76명, 제주권이 부지 5,525평, 건물 4,013평, 전담인력 50명 등으로 구성되어 있으며, 지원분야별로 비중을 살펴보면, 산업/그린바이오 분야 부지가 56.5%(180,821평), 건물이 52.7%(56,093평), 전담인력이 49.9%(554명), 의약바이오 분야 부지가 38.5%(123,216평), 건물이 36.6%(38,920평), 전담인력이 35%(389명), 융합바이오 분야 부지가 2.3%(7,230평), 건물이 3.6%(3,875평), 전담인력이 2.5%(28명), 복합지원 분야 부지가 2.8%(8,908평), 건물이 7%(7,492평), 전담인력이 12.5%(126명) 등의 비중을 차지하고 있다.
또한, 2015년 9월까지의 산학연 등 지원성과(연도별 누계)를 보면, 입주기업수가 2013년 말 827개, 2014년 말 842개, 2015년 9월말 현재까지 852개, 장비구축건수가 2013년 말 7,759건, 2014년 말 7,795건, 2015년 9월말 현재까지 7,812건, 기술지도 및 기술상담 건수가 2013년 말 9,190건, 2014년 말 9,462건, 2015년 9월말 현재 9,932건, 세미나 및 교육훈련 건수가 2013년 말 2,604건, 2014년 말 2,739건, 2015년 9월말 현재 2,887, 각종 산업화 지원 등을 통한 수익금 현황이 2013년 말 492.1억 원, 2014년 말 559.7억 원, 2015년 9월말 현재 571억 원 등으로 연도별 지속적으로 생물산업 관련 지원역할을 충실히 하고 있다. 지원분야별로 2015년 9월 기준 성과 비중을 살펴보면, 산업/그린바이오 분야 입주기업이 68.1%(580개), 장비구축 건수가 73.3%(5,723건), 기술지도 및 기술상담 건수가 50.3%(4,998건), 세미나 및 교육훈련 건수가 50.7%(1,464건), 수익금 규모가 37.6%(214.5억원), 의약바이오 분야 입주기업이 21.5%(183개), 장비구축 건수가 19.5%(1,520건), 기술지도 및 기술상담 건수가 27.8%(2,764건), 세미나 및 교육훈련 건수가 28.2%(813건), 수익금 규모가 49.4% (282.1억 원), 융합바이오 분야 입주기업이 2.9%(25개), 장비구축건수가 1.5%(116건), 기술지도 및 기술상담 건수가 3.2%(313건), 세미나 및 교육훈련 건수가 2.5%(72건), 수익금 규모가 1.9%(10.6억 원), 복합지원 분야 입주기업이 7.5%(64개), 장비구축 건수가 5.8%(453건), 기술지도 및 기술상담 건수가 18.7%(1,862건), 세미나 및 교육훈련 건수가 18.6%(538건), 수익금 규모가 11.2%(63.8억 원) 등의 비중을 차지하고 있다.

[그림 4-7-3] 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과(입주기업)

[그림 4-7-4] 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과(장비구축)

[그림 4-7-5] 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과(기술지도)

[그림 4-7-6] 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과(교육훈련)

[그림 4-7-7] 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과(수익금발생)

[그림 4-7-8] 지원분야별 산업화 인프라 지원 성과(2015년 9월말 누계치)
다. 신뢰성평가 단계 인프라
신뢰성평가 단계 인프라는 최종 개발제품의 산업화 전후 단계에서의 인체 적용을 통하여 체내 안전성․유효성 등에 대한 신뢰성(비임상, 임상 등) 확보를 지원하는 인프라에 해당하며, 대부분 보건복지부(식품의약품안전처)의 인허가를 득한 지원기관을 중심으로 인프라가 형성되어 지원하고 있다. 구체적으로 식품의약품안전처로부터 GLP(비임상시험관리기준, Good Laboratory Practice) 시험기관으로 지정된 기관은 1988년부터 2014년말까지 28개 기관이었으나, 5개 기관의 지정 취하로 인해 2015년 9월말 현재 23개 기관이 운영 중에 있다. GCP(임상시험관리기준, Good Clinical Practice) 기준에 맞는 자격기준을 갖추고 있고 식품의약품안전처에서 임상시험실시기관으로 지정된 국내기관은 188개가 지정되었으나, 2015년 9월말 현재 173개 기관이 운영 중이다. 특히 GLP 기관은 전체의 48%에 해당하는 11개가 수도권에 위치하여 비임상 지원을 하고 있으며, 충청권에 30%에 해당하는 7개, 호남권에 2개, 동남권에 1개, 대경권에 1개, 강원권에 1개씩 위치하고 있다.
특히, 산업통상자원부에서는 2010년부터 대규모 투자가 이루어지고 있는 의약품에 관한 임상 수요를 국내 임상 CRO(전문연구용역기관, Contracted Research Organization)를 통해 충족시킴으로써 국내 개발사에 대한 신속하고 저렴한 비용으로 전문서비스를 제공하고 있으며, 국내 임상 CRO산업의 육성을 위해 ㈜드림씨아이에스, ㈜씨엔알리서치, ㈜지디에프아이, ㈜엘에스케이글로벌파마 서비스 등 4개의 국내 대표적인 임상 CRO 회사를 중심으로 핵심 인프라 구축을 지원하고 있다. 이들은 국내 CRO관련 산업의 성장과 발전을 도모하고 국내 임상 CRO의 활성도를 제고하여 바이오의약품의 해외진출을 지원하는 역할을 담당하고 있다. 주요 서비스 내용으로는 ① 글로벌 기준에 맞는 임상시험자료 관리시스템(CDM) 구축, ② 다국적 임상시험 진행시 원활한 진행을 위한 임상시험 관리시스템(PM) 구축, ③ 글로벌 수준의 임상시험 신뢰성보증시스템(QA)구축과 임상시험 모니터요원(CRA) 교육, ④ 구축된 기반을 활용한 바이오시밀러 제품에 대한 임상시험 시범수행 등이 있다.
3. 발전 과제
생명공학 분야의 인프라 기관은 생물산업 발전을 위한 기술 및 제품화 지원의 하부구조를 구성하며 기초연구에서 사업화까지 전 과정에서 제 역할을 담당하고 있으나, 생명공학 제품의 효율적인 산업화 촉진 지원을 위해서는 각 유형별 강점을 잘 활용하여 결집된 형태로 서비스를 지원하는 것이 중요하다. 또한, 전문인력의 기술지원 강화, 고도화가 필요한 부분에 대한 장비 등 인프라 내실화 등은 R&D 활동의 전주기적인 지원체계의 확립 차원에서 매우 중요하다.
기 구축된 공공연구소, 산업화 및 신뢰성 단계의 인프라 시설은 그 역할이 매우 중요하며, 앞으로도 생명공학 인프라의 발전을 위해서 인프라간 연계성 강화, 관련 부처간 협조체계 강화 및 예산 확대, 글로벌 경쟁력 제고를 위한 인프라 내 전문인력의 지속적인 확보 및 서비스 개발이 강화될 필요가 있으며, 선진국형 생명공학 제품평가 인프라(GLP, GCP, GMP 내실화)의 지속적인 지원은 생물산업의 성장을 가속화할 것이다.
특히, GLP, GCP, GMP와 관련하여 글로벌 수준58)의 (비)임상 CRO 내실화 및 제조 CMO 확충을 위해 민간 CRO 시스템의 선진화를 통한 역량강화, CRO 기관간 원활한 정보교류를 통한 네트워킹 활성화와 협력 강화, 정부차원의 공공 CRO 인프라 조성, 전문인력 개발, 국내외 특허 및 가이드라인 등에 대한 정보제공 등 강화, CMO의 다양한 서비스 포트폴리오 구축 지원 등을 위해 산․학․연․관이 함께 노력해야 할 것이다.
아울러, 건강한 생명 중심사회와 풍요로운 바이오경제 구현을 위해 그리고 세계 최고 수준의 생물공학 기술 및 제품에 대한 질적 수준 제고, 품질확보, 연구역량 강화 등을 위한 지속적인 인프라 확충과 관련 R&D 부문에 투자 확대가 절대적으로 필요하다. 이를 토대로 국내 산학연 공동연구 강화, 국내 기업의 우수한 기술과 제품 수출 등을 통한 해외시장 선점이 가능할 것이다.
[표 4-7-2] 국내 GLP 현황 (2015년 9월말 현재)
|
GLP기관 지정순서 |
1호 |
2호 |
3호 |
4호 |
5호 |
6호 |
7호 |
8호 |
9호 |
10호 |
11호 |
|
|
시험기관
시험항목 (세부시험항목) |
안전성평가 연구소 (KIT) |
유한 양행 |
동아 제약 |
LG 생명 과학 |
CJ |
바이오톡스텍 |
산업 안전 보건 연구원 |
켐온 |
태평양기술 연구원 |
서울대 병원 |
한국화학융합 시험 연구원 |
|
|
단회 투여 독성 |
설치류 |
○ |
○ |
○ |
- |
○ |
○ |
○ |
○ |
- |
○ |
○ |
|
비설치류 |
○ |
- |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
○ |
|
|
반복 투여 독성 |
설치류 |
○ |
○ |
- |
- |
- |
○ |
- |
○ |
- |
○ |
○ |
|
비설치류 |
○ |
- |
- |
- |
- |
○ |
- |
○ |
- |
○ |
○ |
|
|
영장류 |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
생식 발생 독성 |
수태능 및 초기배 발생시험 |
○ |
- |
○ |
- |
- |
○ |
- |
○ |
- |
- |
○ |
|
출생전후발생/모체기능시험 |
○ |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
○ |
|
|
배태자 발생시험 |
○ |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
○ |
|
|
유전 독성 |
체외염색체이상or쥐림포마tk |
○ |
- |
- |
- |
○ |
○ |
○ |
○ |
- |
○ |
○ |
|
체내 소핵시험 |
○ |
○ |
- |
- |
- |
○ |
- |
○ |
- |
○ |
○ |
|
|
항원성독성 |
아나필락시스쇼크반응 |
○ |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
○ |
|
수동피부아나필락시스반응 |
○ |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
○ |
|
|
피부감작 성시험 |
○ |
- |
- |
- |
- |
○ |
- |
○ |
○ |
- |
○ |
|
|
면역 독성 |
세포매개 및 체액성 |
○ |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
|
발암성 |
○ |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
- |
|
|
국소 독성 |
피부자극시험 |
○ |
- |
- |
- |
- |
○ |
- |
○ |
○ |
○ |
○ |
|
안점막 자극시험 |
○ |
- |
- |
- |
- |
○ |
- |
○ |
○ |
○ |
○ |
|
|
기타 독성 |
광감작성시험 |
○ |
- |
- |
- |
- |
○ |
- |
○ |
○ |
- |
○ |
|
광독성 시험 |
○ |
- |
- |
- |
- |
○ |
- |
○ |
○ |
- |
○ |
|
|
국소내성 |
- |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
○ |
|
|
설치류흡입독성 (단회, 반복) |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
변이 원성 |
복귀돌연변이 |
○ |
○ |
- |
- |
- |
○ |
○ |
○ |
- |
○ |
○ |
|
독성동태시험中 분석시험 |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
|
|
혈액조직병리 및 의존성(비GLP) |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
안전성약리 |
○ |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
- |
|
|
소재지 |
대전 |
경기 |
경기 |
대전 |
경기 |
충북 |
대전 |
경기 |
경기 |
서울 |
전남 |
|
|
지정 |
최초 지정일 |
’88. 7.22 |
’88. 8.11 |
’89. 11.15 |
’95. 5.24 |
’02. 2.22 |
’02. 12.13 |
’02. 6.4 |
’02. 8.12 |
’02. 8.21 |
’03. 1.9 |
’03. 5.30 |
|
지정 취하일 |
|
’10. 12.14 |
’06. 7.15 |
|
’06. 7.5 |
|
|
|
’09. 12.31 |
|
|
|
|
GLP기관 지정순서 |
12호 |
13호 |
14호 |
15호 |
16호 |
17호 |
18호 |
19호 |
20호 |
21호 |
22호 |
|
|
시험기관
시험항목 (세부시험항목) |
메드빌 |
바이오코아 |
아이 바이오팜 |
대구 카톨릭대학교 |
동아대 병원 |
크리 스탈 지노 믹스 |
한국건설생활 환경 시험 연구원 |
바이오인프라 |
한국 원자력의학원 |
한국 의약 연구소 |
호서 대학교 |
|
|
단회 투여 독성 |
설치류 |
○ |
- |
- |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
|
비설치류 |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
|
반복 투여 독성 |
설치류 |
○ |
- |
- |
○ |
- |
- |
○ |
- |
- |
- |
- |
|
비설치류 |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
|
영장류 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
생식 발생 독성 |
수태능 및 초기배 발생시험 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
출생전후발생/모체기능시험 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
배태자 발생시험 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
유전 독성 |
체외염색체이상or쥐림포마tk |
○ |
- |
- |
○ |
- |
- |
○ |
- |
- |
- |
○ |
|
체내 소핵시험 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
항원성독성 |
아나필락시스쇼크반응 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
수동피부아나필락시스반응 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
피부감작 성시험 |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
|
면역 독성 |
세포매개 및 체액성 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
발암성 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
국소 독성 |
피부자극시험 |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
안점막 자극시험 |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
|
기타 독성 |
광감작성시험 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
광독성 시험 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
국소내성 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
설치류흡입독성 (단회, 반복) |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
|
변이 원성 |
복귀돌연변이 |
○ |
- |
- |
- |
○ |
- |
○ |
- |
- |
- |
○ |
|
독성동태시험中 분석시험 |
- |
○ |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
- |
|
|
혈액조직병리 및 의존성(비GLP) |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
안전성약리 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
소재지 |
서울 |
서울 |
대전 |
경북 |
부산 |
서울 |
인천 |
경기 |
서울 |
경기 |
충남 |
|
|
지정 |
최초 지정일 |
’03. 9.20 |
’05. 5.24 |
’05. 5.27 |
’05. 7.26 |
’05. 11.10 |
’06. 7.21 |
’06. 11.6 |
’09. 1.15 |
’09. 3.2 |
’11. 5.23 |
’11. 7.12 |
|
지정 취하일 |
|
|
|
|
’10. 6.1 |
|
|
|
|
|
|
|
|
GLP기관 지정순서 |
23호 |
24호 |
25호 |
26호 |
27호 |
28호 |
|
|
시험기관
시험항목 (세부시험항목) |
스카스 비티티 바이오애널리시스 |
동아 에스티 |
안전성평가연구소 (전북본부) |
호서 의과학분석 연구소 |
인터네셔널사이언스티픽스탠다드 |
크로앤 리서치 |
|
|
단회 투여 독성 |
설치류 |
- |
- |
○ |
- |
- |
○ |
|
비설치류 |
- |
- |
- |
- |
- |
- |
|
|
반복 투여 독성 |
설치류 |
- |
- |
○ |
- |
- |
- |
|
비설치류 |
- |
- |
- |
- |
- |
- |
|
|
영장류 |
- |
- |
○ |
- |
- |
- |
|
|
생식 발생 독성 |
수태능 및 초기배 발생시험 |
- |
- |
- |
- |
- |
- |
|
출생전후발생/모체기능시험 |
- |
- |
- |
- |
- |
- |
|
|
배태자 발생시험 |
- |
- |
- |
- |
- |
- |
|
|
유전 독성 |
체외염색체이상or쥐림포마tk |
- |
- |
- |
- |
- |
○ |
|
체내 소핵시험 |
- |
- |
○ |
- |
- |
- |
|
|
항원성독성 |
아나필락시스쇼크반응 |
- |
- |
- |
- |
- |
- |
|
수동피부아나필락시스반응 |
- |
- |
- |
- |
- |
- |
|
|
피부감작 성시험 |
- |
- |
- |
- |
- |
- |
|
|
면역 독성 |
세포매개 및 체액성 |
- |
- |
- |
- |
- |
- |
|
발암성 |
- |
- |
- |
- |
- |
- |
|
|
국소 독성 |
피부자극시험 |
- |
- |
- |
- |
- |
- |
|
안점막 자극시험 |
- |
- |
- |
- |
- |
- |
|
|
기타 독성 |
광감작성시험 |
- |
- |
- |
- |
- |
- |
|
광독성 시험 |
- |
- |
- |
- |
- |
- |
|
|
국소내성 |
- |
- |
- |
- |
- |
- |
|
|
설치류흡입독성 (단회, 반복) |
- |
- |
○ |
- |
- |
- |
|
|
변이 원성 |
복귀돌연변이 |
- |
- |
- |
- |
- |
○ |
|
독성동태시험中 분석시험 |
○ |
○ |
- |
○ |
○ |
- |
|
|
혈액조직병리 및 의존성(비GLP) |
- |
- |
- |
- |
- |
- |
|
|
안전성약리 |
- |
- |
- |
- |
- |
- |
|
|
소재지 |
충북 |
경기 |
전북 |
충남 |
강원 |
경기 |
|
|
지정 |
최초 지정일 |
’11. 7.12 |
’11. 9.20 |
’12. 12.12 |
’14. 7.28 |
’14. 10.1 |
’14. 10.10 |
|
지정 취하일 |
|
|
|
|
|
|
|
* 식약처 임상제도과(~’15.5.6) 자료를 토대로 필자 작성
[표 4-7-3] 국내 GCP 현황 (2015년 9월말 현재)
|
지정번호 |
기관명 |
지정일자 |
||
|
임상1상 |
임상2상 |
임상3상 |
||
|
1 |
가톨릭대학교 서울성모병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
|
2 |
가톨릭대학교 대전성모병원 |
|
’04.4.8 |
’97.3.11 |
|
3 |
가톨릭대학교 부천성모병원 |
|
’05.3.28 |
’97.3.11 |
|
4 |
가톨릭대학교 여의도성모병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
|
5 |
가톨릭대학교 인천성모병원 |
|
’97.3.11 |
’97.3.11 |
|
6 |
가톨릭대학교 성바오로병원 |
|
’04.2.9 |
’97.3.11 |
|
7 |
가톨릭대학교 의정부성모병원 |
’05.10.27 |
’05.1.13 |
’97.3.11 |
|
8 |
한림대학교 강동성심병원 |
|
’97.3.11 |
’97.3.11 |
|
9 |
경북대학교 병원 |
’05.12.19 |
’97.3.11 |
’97.3.11 |
|
10 |
경희대학교 병원 |
|
’97.3.11 |
’97.3.11 |
|
11 |
차의과대학교 분당차병원 |
|
’97.3.11 |
’97.3.11 |
|
12 |
계명대학교 동산병원 |
|
’99.6.15 |
’97.3.11 |
|
13 |
고려대학교 의대 부속 구로병원 |
|
’99.11.26 |
’97.3.11 |
|
14 |
학교법인 고려중앙학원 고려대학교 의대 부속 병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
|
15 |
국립중앙의료원 |
|
|
’97.3.11 |
|
16 |
단국대학교 의대 부속병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
|
17 |
동아대학교 병원 |
’03.11.10 |
’97.3.11 |
’97.3.11 |
|
18 |
부산대학교 병원 |
’03.11.10 |
’97.3.11 |
’97.3.11 |
|
19 |
삼성서울병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
|
20 |
서울대학교 병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
|
22 |
순천향대학교 서울병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
|
23 |
아산복지사업재단 서울아산병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
|
24 |
아주대학교 병원 |
’05.2.19 |
’97.3.11 |
’97.3.11 |
|
25 |
연세대학교 세브란스병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
|
27 |
연세대학교 강남세브란스병원 |
|
’97.3.11 |
’97.3.11 |
|
28 |
연세대학교 치과병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
|
29 |
영남대학교 병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
|
30 |
한국침례회의의료재단 왈레스기념침례병원 |
|
|
’97.3.11 |
|
31 |
원광대학교 의과대학병원 |
|
’97.3.11 |
’97.3.11 |
|
32 |
길병원 |
’99.12.29 |
’99.12.29 |
’97.3.11 |
|
33 |
삼성의료재단 강북삼성병원 |
|
’97.3.11 |
’97.3.11 |
|
34 |
이화여자대학교 부속 목동병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
|
36 |
인제대학교 부속 부산백병원 |
’97.3.11 |
’97.3.11 |
’97.3.11 |
|
37 |
인제대학교 상계백병원 |
|
’97.3.11 |
’97.3.11 |
|
38 |
인제대학교 서울백병원 |
|
’06.10.22 |
’97.3.11 |
|
39 |
전남대학교 병원 |
’04.10.4 |
’97.3.11 |
’97.3.11 |
|
40 |
전북대학교 병원 |
’06.4.10 |
’97.3.11 |
’97.3.11 |
|
41 |
중앙대학교 병원 |
|
’05.4.15 |
’97.3.11 |
|
43 |
서울특별시 서울의료원 |
|
|
’97.3.11 |
|
지정번호 |
기관명 |
지정일자 |
||
|
임상1상 |
임상2상 |
임상3상 |
||
|
44 |
충북대학교 병원 |
|
’97.3.11 |
’97.3.11 |
|
46 |
한국원자력연구소 원자력병원 |
|
’97.3.11 |
’97.3.11 |
|
47 |
한전의료재단 한전병원 |
|
|
’97.3.11 |
|
48 |
한림대학교 부속 강남성심병원 |
|
’97.3.11 |
’97.3.11 |
|
49 |
한림대학교 부속 춘천성심병원 |
|
’97.3.11 |
’97.3.11 |
|
50 |
한림대학교 한강성심병원 |
|
’97.3.11 |
’97.3.11 |
|
51 |
한양대학교 구리병원 |
|
|
’97.3.11 |
|
52 |
한양대학교 병원 |
’05.12.13 |
’97.4.29 |
’97.3.11 |
|
53 |
원광대학교 부속 치과병원 |
|
|
’97.6.11 |
|
55 |
가톨릭대학교 성빈센트병원 |
|
’00.1.25 |
’97.6.11 |
|
57 |
서울특별시 보라매병원 |
|
|
’97.6.23 |
|
58 |
인하대학교 의대 부속병원 |
’97.8.12 |
’97.8.12 |
’97.8.12 |
|
59 |
경희대학교 치과병원 |
|
|
’97.11.7 |
|
60 |
경희대학교 한방병원 |
|
|
’97.11.7 |
|
61 |
대구가톨릭대학교 병원 |
|
’03.7.29 |
’98.5.28 |
|
62 |
제일의료재단 제일병원 |
|
’98.5.28 |
’98.5.28 |
|
63 |
연세대학교 원주세브란스 기독병원 |
|
’05.6.15 |
’98.8.18 |
|
64 |
고신대학교 복음병원 |
|
’06.5.22 |
’99.2.6 |
|
67 |
한림대학교 성심병원 |
|
’00.7.22 |
’99.7.19 |
|
68 |
경상대학교 병원 |
|
’02.9.24 |
’99.9.13 |
|
69 |
충남대학교 병원 |
|
’99.9.20 |
’99.9.20 |
|
70 |
고려대학교 부속 안산병원 |
’06.2.21 |
’00.1.25 |
’00.1.25 |
|
71 |
국립마산병원 |
|
’00.10.23 |
’00.10.23 |
|
72 |
순천향대학교 부속 부천병원 |
’01.5.22 |
’01.5.22 |
’01.5.22 |
|
73 |
단국대학교 치과대학 부속 치과병원 |
|
|
’01.7.11 |
|
74 |
국립암센터 |
’02.3.26 |
’01.7.11 |
’01.7.11 |
|
76 |
인제대학교 일산백병원 |
|
|
’01.10.30 |
|
77 |
국민건강보험공단 일산병원 |
|
’01.11.9 |
’01.11.9 |
|
78 |
의료법인영훈의료재단 대전선병원 |
|
’02.5.31 |
’02.5.31 |
|
79 |
학교법인 울산공업학원 울산대학교 병원 |
’06.2.14 |
’02.9.24 |
’02.9.24 |
|
80 |
을지병원 |
|
’02.9.24 |
’02.9.24 |
|
81 |
파티마병원 |
|
’02.9.24 |
’02.9.24 |
|
82 |
동국대학교 경주병원 |
|
’03.3.31 |
’03.3.31 |
|
83 |
조선대학교병원 |
|
’03.7.29 |
’03.7.29 |
|
84 |
원광대학교 광주한방병원 |
|
’03.9.25 |
’03.9.25 |
|
85 |
분당서울대학교 병원 |
|
’03.9.25 |
’03.9.25 |
|
86 |
순천향대학교 부속 천안병원 |
’04.2.9 |
’04.2.9 |
’04.2.9 |
|
87 |
국립서울병원 |
|
|
’04.2.9 |
|
88 |
을지의과대학교 병원 |
|
’04.4.8 |
’04.4.8 |
|
지정번호 |
기관명 |
지정일자 |
||
|
임상1상 |
임상2상 |
임상3상 |
||
|
89 |
보훈복지의료공단 중앙보훈병원 |
|
’05.6.15 |
’04.4.8 |
|
91 |
제주대학교 병원 |
|
’04.5.13 |
’04.5.13 |
|
92 |
동의대학교 부속한방병원 |
|
’04.6.3 |
’04.6.3 |
|
93 |
건국대학교 충주병원 |
|
|
’04.6.12 |
|
94 |
화순 전남대학교 병원 |
|
’04.11.11 |
’04.6.12 |
|
95 |
천주교부산교구유지재단 메리놀병원 |
|
|
’04.6.18 |
|
96 |
청주성모병원 |
|
’06.5.19 |
’04.9.6 |
|
97 |
대동병원 |
|
|
’04.10.12 |
|
98 |
제주 한라병원 |
|
’04.11.5 |
’04.11.5 |
|
99 |
건국대학교 병원 |
|
’06.3.17 |
’04.11.26 |
|
100 |
건양대학교 병원 |
|
’04.12.1 |
’04.12.1 |
|
101 |
차의과대학교 강남 차병원 |
|
’05.1.13 |
’05.1.13 |
|
102 |
명지의료재단 명지병원 |
|
’05.1.19 |
’05.1.19 |
|
103 |
강원대학교 병원 |
|
’05.1.20 |
’05.1.20 |
|
104 |
창원파티마병원 |
|
|
’05.5.7 |
|
105 |
강릉아산병원 |
|
|
’05.8.11 |
|
106 |
경원대학교부속 길한방병원 |
|
|
’05.8.29 |
|
107 |
동국대학교 일산불교병원 |
’05.9.14 |
’05.9.14. |
’05.9.14. |
|
108 |
효산의료재단 안양샘병원 |
|
|
’05.10.24 |
|
109 |
대진의료재단 분당제생병원 |
’05.11.04 |
’05.11.4. |
’05.11.4. |
|
110 |
대전대학교 대전한방병원 |
|
‘05.12.28 |
’05.12.28 |
|
111 |
성균관대학교 삼성창원병원 |
|
|
’06.5.23. |
|
112 |
상지대학교 부속 한방병원 |
|
|
’06.6.2. |
|
113 |
광주기독병원 |
|
’06.6.5 |
’06.6.5 |
|
114 |
강동경희대학교의대 병원 |
’06.8.17 |
’06.8.17 |
’06.8.17 |
|
115 |
부산성모병원 |
|
’06.12.26 |
’06.12.26 |
|
117 |
경희대학교 강동한방병원 |
|
’07.2.9 |
’07.2.9 |
|
118 |
동국대학교 일산불교 한방병원 |
|
’07.2.9 |
’07.2.9 |
|
119 |
국립부곡병원 |
|
’07.8.23 |
’07.8.23 |
|
120 |
김원묵기념 봉생병원 |
|
’07.10.29 |
’07.10.29 |
|
121 |
국립나주병원 |
|
’07.12.4 |
’07.12.4 |
|
122 |
자생한방병원 |
|
’08.2.27 |
’08.2.27 |
|
123 |
대구한의대학교 대구한방병원 |
|
’08.3.28 |
’08.3.28 |
|
124 |
세명대학교 부속 한방병원 |
|
’08.3.28 |
’08.3.28 |
|
125 |
세명대학교 부속 충주한방병원 |
|
’08.5.20 |
’08.5.20 |
|
126 |
동신대학교 광주한방병원 |
|
’08.7.3 |
’08.7.3 |
|
127 |
김안과병원 |
|
’08.7.30 |
’08.7.30 |
|
128 |
베스티안병원 |
|
’08.8.7 |
’08.8.7 |
|
129 |
누네안과병원 |
|
’08.8.20 |
’08.8.20 |
|
지정번호 |
기관명 |
지정일자 |
||
|
임상1상 |
임상2상 |
임상3상 |
||
|
130 |
우석대학교 전주부속 한방병원 |
|
’08.12.23 |
’08.12.23 |
|
131 |
양산부산대학교병원 |
|
’08.12.24 |
’08.12.24 |
|
132 |
광주보훈병원 |
|
’09.1.9 |
’09.1.9 |
|
133 |
용인정신병원 |
|
’09.3.6 |
’09.3.6 |
|
134 |
동국대학교 한의대 분당한방병원 |
|
’09.6.3 |
’09.6.3 |
|
135 |
국립공주병원 |
|
’09.7.9 |
’09.7.9 |
|
136 |
대전대학교 둔산한방병원 |
|
’09.7.22 |
’09.7.22 |
|
137 |
한국보훈복지의료공단 대구보훈병원 |
|
’09.7.24 |
’09.7.24 |
|
138 |
대항병원 |
|
’09.7.30 |
’09.7.30 |
|
139 |
의료법인 동강의료재단 동강병원 |
|
’09.8.19 |
’09.8.19 |
|
140 |
서울특별시 은평병원 |
|
’09.11.9 |
’09.11.9 |
|
141 |
한국보훈복지의료공단 부산보훈병원 |
|
’09.12.15 |
’09.12.15 |
|
143 |
글로리병원 |
|
’10.3.9 |
’10.3.9 |
|
144 |
대전대학교 부속 천안한방병원 |
|
’10.3.23 |
’10.3.23 |
|
145 |
차의과대학교 부속 구미차병원 |
|
’10.3.31 |
’10.3.31 |
|
147 |
서울송도병원 |
|
’10.5.28 |
’10.5.28 |
|
148 |
의료법인혜원의료재단 세종병원 |
|
’10.5.31 |
’10.5.31 |
|
149 |
인제대학교 해운대백병원 |
|
’10.6.14 |
’10.6.14 |
|
150 |
동남권원자력의학원 |
|
’11.3.8 |
’11.3.8 |
|
151 |
동신대학교 부속 순천한방병원 |
|
’11.3.28 |
’11.3.28 |
|
152 |
칠곡경북대학교병원 |
|
’11.4.4 |
’11.4.4 |
|
153 |
예수병원유지재단 예수병원 |
|
’11.4.29 |
’11.4.29 |
|
154 |
부산대학교 한방병원 |
|
’11.5.24 |
’11.5.24 |
|
155 |
순천성가롤로병원 |
|
’11.7.6 |
’11.7.6 |
|
156 |
삼육서울병원 |
’11.7.28 |
||
|
157 |
순천향대학병원 부속 구미병원 |
’11.8.18 |
||
|
159 |
베데스다 삼성병원 |
’12.1.10 |
||
|
160 |
원광대학교 익산한방병원 |
’12.1.11 |
||
|
161 |
국립경찰병원 |
’12.1.26 |
||
|
162 |
미즈메디병원 |
’12.3.19 |
||
|
163 |
익산의료재단 메트로병원 |
’12.5.30 |
||
|
164 |
연세대학교 용인세브란스병원 |
’12.5.30 |
||
|
165 |
연세사랑병원 |
’12.8.6 |
||
|
166 |
성애병원 |
’12.9.10 |
||
|
167 |
의료법인대우의료재단 대우병원 |
’12.11.1 |
||
|
168 |
모커리한방병원 |
’12.12.3 |
||
|
169 |
양지병원 |
’13.2.4 |
||
|
170 |
한림대학교 동탐성심병원 |
’13.2.4 |
||
|
171 |
비에이치에스한서병원 |
’13.4.2 |
||
|
지정번호 |
기관명 |
지정일자 |
||
|
임상1상 |
임상2상 |
임상3상 |
||
|
172 |
씨엠충무병원 |
’13.5.8 |
||
|
173 |
제일안과병원 |
’13.7.10 |
||
|
174 |
나누리병원 |
’13.11.1 |
||
|
175 |
효산의료재단 지샘병원 |
’13.12.31 |
||
|
176 |
국립재활원 |
’14.1.7 |
||
|
177 |
부산대학교 치과병원 |
’14.3.3 |
||
|
178 |
원광대학교 전주한방병원 |
’14.3.20 |
||
|
179 |
의료법인녹산의료재단 동수원병원 |
’14.3.21 |
||
|
180 |
한길의료재단 한길안과병원 |
’14.4.9 |
||
|
181 |
학교법인 동의병원 |
’14.5.27 |
||
|
182 |
가톨릭관동대학교 국제성모병원 |
’14.6.9 |
||
|
183 |
동신대학교부속 목포한방병원 |
’14.6.19 |
||
|
184 |
의료법인 실로암안과병원 |
’14.6.24 |
||
|
185 |
의료법인 광명성애병원 |
’14.7.24 |
||
|
186 |
의료법인인당의료재단 부민병원 |
’14.12.12 |
||
|
187 |
의료법인세광의료재단 성모안과병원 |
’15.3.27 |
||
|
188 |
부민병원(서울) |
’15.5.21 |
||
|
임상시험실시기관 총 188개(지정) 중 173개(운영) |
||||
* 식약처 임상제도과(∼ʼ15년 8.7) 자료를 토대로 필자 작성
[표 4-7-4] 국내 대표적인 2개 비임상 CRO 회사 현황 (2015년 9월말 현재)
|
업 체 명 |
(주)바이오톡스텍 |
최근5년간 기업현황(단위: 천원,명) |
|||||||||||
|
구분 |
2010년 |
2011년 |
2012년 |
2013년 |
2014년 |
||||||||
|
총자산 |
44,836,976 |
42,867,218 |
43,832,484 |
45,844,255 |
48,328,060 |
||||||||
|
설 립 년 월 일 |
2000년 08월 23일 |
총자본 |
15,055,459 |
20,171,218 |
24,786,204 |
24,904,095 |
27,487,910 |
||||||
|
사업자등록번호 |
301-81-45781 |
총부채 |
29,781,517 |
22,696,000 |
19,046,280 |
20,940,160 |
20,840,150 |
||||||
|
법 인 등록번호 |
150111-0048707 |
매출액 |
18,733,549 |
23,432,080 |
17,965,818 |
17,072,862 |
14,213,991 |
||||||
|
대 표 자 성 명 |
강종구 |
총인원 |
168명 |
175명 |
184명 |
167명 |
172명 |
||||||
|
주소 |
본 사 |
충북 청원군 오창읍 양청리 686-2 |
연락처 |
전화/팩스 |
043-210-7777 / 043-210-7778 |
||||||||
|
홈페이지 |
www.biotoxtech.com |
||||||||||||
|
주요생산품 (2014년말 기준) |
산업분류 코드 |
시장규모(억원) |
시장점유율(%) |
매출액(억원) |
|||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
||||||||
|
비임상시험대행업 |
M70113 (의학 및 약학연구개발업) |
1,000(추정) |
미확인 |
|
|
115 |
27 |
||||||
|
비임상시험 과제수(∼’15년 상반기) |
주요 조직 |
네트워크 기관 |
|||||||||||
|
12,000건 이상(최근 5년간) |
연구부문(조제부, 일반독성부, 특수독성부, 약리부, 병리부), 연구지원부문(QA팀, 시험관리팀, 시험지원팀, 운영지원팀), 영업부문(영업팀), 관리부문(경영관리팀-재무회계/구매/총무/인사/기획) |
동아제약, 녹십자, 유한양행, 셀트리온, 한미약품 외 다수의 국내 및 일본 제약/식품/화장품/화학물질기업 |
|||||||||||
|
업 체 명 |
(주)켐온 |
최근5년간 기업현황(단위: 천원,명) |
|||||||||||
|
구분 |
2010년 |
2011년 |
2012년 |
2013년 |
2014년 |
||||||||
|
총자산 |
8,412,630 |
8,594,196 |
9,470,140 |
13,869,081 |
15,300,681 |
||||||||
|
설 립 년 월 일 |
2000년 01월 11일 |
총자본 |
4,370,692 |
4,806,180 |
6,617,399 |
8,693,751 |
10,410,238 |
||||||
|
사업자등록번호 |
108-81-19928 |
총부채 |
4,041,938 |
3,788,016 |
2,852,741 |
5,175,331 |
4,890,443 |
||||||
|
법 인 등록번호 |
110111-1848542 |
매출액 |
7,955,015 |
8,710,489 |
10,361,863 |
10,279,429 |
13,252,878 |
||||||
|
대 표 자 성 명 |
송시환 |
총인원 |
78명 |
81명 |
85명 |
95명 |
103명 |
||||||
|
주소 |
본 사 |
경기 수원 영통 이의동 864-1 경기바이오센터 11층 |
연락처 |
전화/팩스 |
031-888-6634/031-888-6640 |
||||||||
|
홈페이지 |
www.chemon.co.kr |
||||||||||||
|
주요생산품 (2014년말 기준) |
산업분류 코드 |
시장규모(억원) |
시장점유율(%) |
매출액(억원) |
|||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
||||||||
|
비임상시험 |
M70113 (의학 및 약학연구 개발업 |
1,000(추정) |
미확인 |
10 |
|
103 |
|
||||||
|
비임상시험 과제수(∼’15년 상반기) |
주요 조직 |
네트워크 기관 |
|||||||||||
|
5,000건 이상 |
연구소장, 연구책임자, IACUC, 안전성평가부(일반독성, 안전성약리, 특수독성실), 조제분석부(분석과, 조제과), 효능평가부, 병리부(병리과, 검경과), 시험관리과, 공무과, 동물실험실, QAU, 경영지원부, 사업개발부 |
동아ST, 대웅제약, 녹십자, 중외제약, 제일약품, 영진약품, 한화케미칼, LGLS, 삼양사, 영진약품, 환인제약, 안국약품, 일동제약, 삼일제약, 삼천당제약등 |
|||||||||||
* 기업 자료를 토대로 필자 작성
[표 4-7-5] 국내 대표적인 4개 임상 CRO 회사 현황 (2015년 9월말 현재)
|
업 체 명 |
(주)드림씨아이에스 |
최근5년간 기업현황(단위: 천원,명) |
||||||||||||
|
구분 |
2010년 |
2011년 |
2012년 |
2013년 |
2014년 |
|||||||||
|
총자산 |
9,936,471 |
12,142,660 |
16,641,998 |
19,129,445 |
15,503,285 |
|||||||||
|
설 립 년 월 일 |
2000년 04월 27일 |
총자본 |
5,073,057 |
6,191,590 |
7,559,857 |
9,680,308 |
10,172,591 |
|||||||
|
사업자등록번호 |
101-81-57329 |
총부채 |
4,863,414 |
5,951,070 |
9,082,141 |
9,449,137 |
5,330,694 |
|||||||
|
법 인 등록번호 |
110111-1953953 |
매출액 |
13,010,260 |
16,672,045 |
21,051,227 |
20,890,473 |
18,335,127 |
|||||||
|
대 표 자 성 명 |
최 원 정 |
총인원 |
165명 |
216명 |
238명 |
241명 |
247명 |
|||||||
|
주소 |
본 사 |
서울 종로 적선 80 적선현대빌딩 1010호 |
연락처 |
전화/팩스 |
02-2010-4504 / 02-720-5385 |
|||||||||
|
홈페이지 |
http://www.dreamcis.com |
|||||||||||||
|
주요생산품 (2014년말 기준) |
산업분류 코드 |
시장규모(억원) |
시장점유율(%) |
매출액(억원) |
||||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
|||||||||
|
임상시험대행업 |
M74221 |
|
|
|
|
183 |
|
|||||||
|
임상시험 과제수(∼’15년 상반기) |
주요 조직 |
네트워크 기관 |
||||||||||||
|
1,373건 |
임상사업본부(부산지점 포함), PVPMS사업본부, Biometrics Center(BS팀, DM팀), 메디칼부문, BD부문, 경영지원본부(기획인사팀, 재무팀, 교육팀), IT팀, QS팀 |
지역임상시험센터 및 다수 해외CRO |
||||||||||||
|
업 체 명 |
(주)씨엔알리서치 |
최근5년간 기업현황(단위: 천원,명) |
||||||||||||
|
구분 |
2010년 |
2011년 |
2012년 |
2013년 |
2014년 |
|||||||||
|
총자산 |
2,378,383 |
2,532,856 |
3,696,354 |
5,376,234 |
5,822,485 |
|||||||||
|
설 립 년 월 일 |
1997년 07월 |
총자본 |
1,041,816 |
1,262,994 |
507,766 |
1,056,398 |
1,735,918 |
|||||||
|
사업자등록번호 |
214-86-50573 |
총부채 |
1,336,567 |
1,269,862 |
3,188,588 |
4,319,836 |
4,086,567 |
|||||||
|
법 인 등록번호 |
110111-1895999 |
매출액 |
10,459,808 |
15,247,455 |
13,269,793 |
17,758,830 |
18,980,353 |
|||||||
|
대 표 자 성 명 |
윤 문 태 |
총인원 |
126명 |
147명 |
168명 |
180명 |
202명 |
|||||||
|
주소 |
본 사 |
서울시 종로구 경운동 63-7 이양원빌딩 |
연락처 |
전화/팩스 |
02-6251-1500 / 02-6251-1504 |
|||||||||
|
홈페이지 |
http://www.cnrres.co.kr, http://www.cnracademy.org |
|||||||||||||
|
주요생산품 (2014년말 기준) |
산업분류 코드 |
시장규모(억원) |
시장점유율(%) |
매출액(억원) |
||||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
|||||||||
|
임상시험대행업 |
M74221 |
|
|
|
|
190 |
5 |
|||||||
|
임상시험 과제수(∼’15년 상반기) |
주요 조직 |
네트워크 기관 |
||||||||||||
|
850건 |
Clinical Operation(PM, CR1, CR2, CR3, CR4, CR5 Oncology, LPS), Business development, Data management, Medical & STAT, C&R Academy, Quality Assurance, 경영지원팀 |
국내 네트워크: 녹십자 의료재단, 고려대학교 구로병원, 인제대학교부산백병원, 메디크로스타 해외 네트워크: PACRA, VCRO, Ecron -Acunova, INC Research, Rundo International Pharmaceutical R&D, Asia Global Research |
||||||||||||
|
업 체 명 |
(주)지디에프아이 |
최근5년간 기업현황(단위: 천원,명) |
|||||||||||||
|
구분 |
2010년 |
2011년 |
2012년 |
2013년 |
2014년 |
||||||||||
|
총자산 |
279,248 |
623,619 |
877,269 |
1,043,428 |
1,128,000 |
||||||||||
|
설 립 년 월 일 |
2005년 10월 1일 |
총자본 |
|
133,625 |
503,552 |
532,427 |
1,000,000 |
||||||||
|
사업자등록번호 |
211-87-69478 |
총부채 |
|
489,994 |
373,717 |
511,001 |
558,000 |
||||||||
|
법 인 등록번호 |
110111-3287227 |
매출액 |
|
750,381 |
738,156 |
1,307,288 |
1,671,000 |
||||||||
|
대 표 자 성 명 |
김 정 자 |
총인원 |
30명 |
30명 |
34명 |
38명 |
43명 |
||||||||
|
주소 |
본 사 |
서울 강남 논현동 242-29 요현빌딩 5층 |
연락처 |
전화/팩스 |
02-3445-0666 / 02-3445-0222 |
||||||||||
|
홈페이지 |
www.gdfi.co.kr |
||||||||||||||
|
주요생산품 (2014년말 기준) |
산업분류 코드 |
시장규모(억원) |
시장점유율(%) |
매출액(억원) |
|||||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
||||||||||
|
1 |
임상시험대행업 |
M74221 |
|
|
|
|
16 |
0 |
|||||||
|
2 |
IND,RA |
M74221 |
|
|
|||||||||||
|
임상시험 과제수(∼’15년 상반기) |
주요 조직 |
네트워크 기관 |
|||||||||||||
|
55건 |
임상시험연구본부(CR 1팀, CR 2팀, CR 3팀, CR4팀), RA(등록)사업본부(RA 1팀, RA 2팀, RA 3팀), CDM Center(STAT 팀, CDM팀, DBA팀 IT 팀), 기획전략본부(Admin. Associate, HR/Training, Contract/Accounting), Business Development(Planning & Marketing, local BDA, Global BDA), QA/Audit system, Scientific Advisory Committee |
미국: CDG, Registrar, CRTO 유럽: Accovion, HCR, ERA, MTPC, WMDE, Gregmed 중국: JTG, KWA, PHDS Health careResearch, Venture pharm 아시아태평양: Iberica, Brand wood, ERA, Genelife Clinical Research, Sanjeevani |
|||||||||||||
|
업 체 명 |
(주)엘에스케이글로벌파마서비스 |
최근5년간 기업현황(단위: 천원,명) |
||||||||||||
|
구분 |
2010년 |
2011년 |
2012년 |
2013년 |
2014년 |
|||||||||
|
총자산 |
2,006,696 |
2,259,062 |
4,869,523 |
4,347,437 |
7,750,620 |
|||||||||
|
설 립 년 월 일 |
2001년 10월 01일 |
총자본 |
730,566 |
879,021 |
-1,168,626 |
-2,577,284 |
-2,232,991 |
|||||||
|
사업자등록번호 |
211-87-01667 |
총부채 |
1,254,377 |
1,380,041 |
6,038,149 |
6,924,720 |
9,983,611 |
|||||||
|
법 인 등록번호 |
110111-2340646 |
매출액 |
5,622,457 |
7,093,010 |
6,552,518 |
9,682,853 |
12,347,754 |
|||||||
|
대 표 자 성 명 |
이영작 |
총인원 |
83 명 |
93 명 |
119 명 |
150명 |
160명 |
|||||||
|
주소 |
본 사 |
서울시 중구 퇴계로 97 고려대연각타워 16층 |
연락처 |
전화/팩스 |
Tel. 02-546-1008 / Fax. 02-584-9008 |
|||||||||
|
홈페이지 |
www.lskglobal.co.kr |
|||||||||||||
|
주요생산품 (2014년말 기준) |
산업분류 코드 |
시장규모(억원) |
시장점유율(%) |
매출액(억원) |
||||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
|||||||||
|
임상시험대행업 |
M70113 |
|
|
|
|
98억 |
25억 |
|||||||
|
임상시험 과제수(∼’15년 상반기) |
주요 조직 |
네트워크 기관 |
||||||||||||
|
736건 |
임상팀(임상 1팀∼임상6팀), QC팀, PM팀, DM팀, STAT /ER팀, Medical Writing & Research팀, Quality Assurance팀, Business Development팀, RA팀, SSU팀, PD팀, Contract Management팀, 경영지원팀, 재무회계팀 |
PRA International, MDS, Pharma Service, Covance, INC Research, Julius Clinica, Research, Cato Research, StatPlus, SLG, MPI, Target, Health, Medidata, LSK, Biopartners, George Clinical, Veras Research Japan, Semler, Research Center Pvt Ltd, Veras Research Sdn Bhd |
||||||||||||
* 기업 자료를 토대로 필자 작성
[표 4-7-6] 생명공학분야 산업화 인프라 지원 현황 및 주요 성과 (2015년 9월말 현재)
|
광역 경제권 |
특화분야 |
사업구분 |
과제명(사업기간) / 지원기능 |
주관기관(URL) |
정부지원금 (~'15)(억원) |
2015년 9월말 현재 주요 실적(누계) |
||||||
|
건물평수 |
인력수 |
입주기업수 |
장비구축건수 |
기술지도건수 |
교육훈련건수 |
수익금 현황(백만원) |
||||||
|
수도권 |
복합지원(의약/산업/그린) |
네트워킹 |
코리아바이오허브구축(ʼ04-)/[기타-연구장비] |
한국바이오협회 www.koreabio.org |
237.8 |
752 |
89 |
5 |
175 |
14 |
101 |
13 |
|
의약바이오 |
cGMP |
생물산업기술실용화센터건립(ʼ98-ʼ07)/[GMP] |
㈜바이넥스 www.bi-nex.com |
898 |
2,660 |
58 |
|
213 |
28 |
8 |
15,000 |
|
|
의약바이오 |
산기반 |
바이오개량신약제제화공동연구기반구축(’06-’11)/[PP, GMP] |
경기과학기술진흥원 www.ggbc.or.kr |
50 |
9,687 |
31 |
27 |
110 |
243 |
22 |
1,784 |
|
|
산업/그린바이오 |
산업융합원천 |
건강기능식품플랫폼(’09-’14/[기타-연구장비] |
한국식품연구원 www.kfri.re.kr |
40 |
|
|
|
|
39 |
|
|
|
|
충청권 |
의약바이오 산업/그린바이오 산업/그린바이오 산업/그린바이오 산업/그린바이오 |
BVC LMO LMO LMO 산기반 |
(BVC)생물의약TIC(’99-’04)/[PP, GMP] 바이오안전성정보기반구축(’02-계속)/[기타-안전성정보] 바이오안전성의정서운영(’08-계속)/[기타-안전성정보] LMO위해성평가센터구축(’04-’07)/[기타-안전성정보] 단백질소재의산업적활용 극대화를위한기반구축(’05-’10)/[기타-연구장비] |
한국생명공학연구원 bvc.kribb.re.kr www.biosafety.or.kr biocat.or.kr |
50.3 86.37 13.4 124.52 45.25 |
700 40
85 |
10 15
2 |
58
|
47 1 1
37 |
244
8 |
178 34
19 |
690
189 |
|
의약바이오 의약바이오 산업/그린바이오 |
산업핵심 산업핵심 산업핵심 |
신약개발플랫폼(’09-’14)/[기타-연구장비] Drug Repositioning 기술을 이용한 신약개발 활용 시스템 구축(’10-’15)/[기타-연구장비] 바이오화학실용화센터(’10-’14)/[PP] |
한국화학연구원 ddpt.krict.re.kr www.krict.re.kr ulsan.krict.re.kr |
89 66 71 |
1,500 2,865 |
21 28 22 |
|
20 5
|
310 4
|
43
|
|
|
|
의약바이오 의약바이오 |
지역클러스터 지역클러스터 |
바이오벤처타운조성(’02-07)/[GMP] (2단계)바이오의약산업화허브구축사업(’08-’10)/[GMP] |
(재)대전테크노파크 www.daejeontp.or.kr |
260.66 49 |
3,427
|
23
|
37
|
351
|
109
|
401
|
5,034 591 |
|
|
복합지원(의약/산업/그린) |
BVC |
(BVC)생물의약및식품TIC(’01-(’06)/[PP, 공인검사] |
영동대학교 www.biotic.re.kr |
46.8 |
813 |
7 |
11 |
63 |
36 |
73 |
468 |
|
|
의약바이오 의약바이오 의약바이오 |
지역클러스터 지역클러스터 지역클러스터 |
보건의료산업종합지원센터건립(’04-’07)/[PP, GMP, 공인검사] 전통의약품개발지원센터건립(’03-’07)/[PP, 공인검사] (2단계)한방산업클러스터고도화사업(’08-’10)/[PP, 공인검사] |
(재)충북테크노파크 www.cbtp.or.kr/cbhic www.cbtp.or.kr/cbomc |
124.7 97.97 15.87 |
1,230 444 299 |
14 8
|
17 4 11 |
124 179 12 |
196 613
|
41 34
|
140 1,377
|
|
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
동물자원사업화지원센터건립(’03-’07)/[PP, GMP, 공인검사] (2단계)충남농축산바이오산업생산지원인프라구축사업(’08-’10)/[PP, GMP, 공인검사] |
(재)충남동물자원센터 www.cnasc.or.kr |
47.87 25 |
1,347 |
18 |
19 |
249 |
11 |
29 |
102 |
|
|
호남권 |
산업/그린바이오 산업/그린바이오 산업/그린바이오 |
BVC 지역클러스터 지역클러스터 |
(BVC) 생물벤처기업지원센터설립(’00-’04)/[PP, GMP, 공인검사] 바이오파크인프라구축(’05-’08)/[PP, GMP, 공인검사] (2단계)발효식품소재완제품화일괄지원시스템구축사업(’08-’10)/[PP, GMP, 공인검사] |
(재)전라북도생물산업진흥원 www.jjf.re.kr |
50.62 143.45 22.5 |
4,365 |
48 |
81 |
382 |
242 |
112 |
1,282 |
|
산업/그린바이오 |
산기반 |
기능성식품 임상시험지원센터설립(’04-’09)/[공인검사] |
전북대학교 www.ctcf2.com |
49.73 |
379 |
24 |
|
145 |
1,053 |
110 |
750 |
|
|
산업/그린바이오 |
발효산업 |
발효미생물종합활용센터건립(’07-’10)/[PP] |
순창군장류사업소 www.gochujang.go.kr |
234 |
3,956 |
30 |
4 |
330 |
15 |
31 |
188 |
|
|
산업/그린바이오 |
산기반 |
지역특화기술융복합연구지원(’12-’15)/[연구지원] |
(재)발효미생물산업진흥원 mifi.kr |
2.43 |
1,383 |
17 |
|
4 |
|
|
|
|
|
산업/그린바이오 |
BVC |
(BVC)생물산업산학연협동연구및실용화기반구축(’00-’04)/[PP] |
동신대학교 www.bic.re.kr |
50 |
1,600 |
6 |
131 |
359 |
384 |
191 |
358 |
|
|
산업/그린바이오 산업/그린바이오 의약바이오 의약바이오 의약바이오 산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 지역클러스터 지역클러스터 지역클러스터 지역클러스터 지역클러스터 |
전남생물식품사업화지원센터건립운영(’02-’07)/[PP, GMP] (2단계)건강기능식품소재산업지원기반구축사업(’08-’10)/[PP, GMP] 전남생물농업산학공동연구센터건립운영(’02-’07)/[PP, GMP] (2단계)생물의약품완제라인구축사업(’08-’10)/[PP, GMP] 독감백신원료생산기반구축(’05-’08)/[PP, GMP] 친환경생물산업클러스터구축(’07-’09)/[PP, 공인검사] 전남특산자원산업화기반구축(’07-’10)/[PP] |
(재)전라남도생물산업진흥재단 www.jbio.org www.jbrc.re.kr www.jbrc.re.kr www.jbrc.re.kr www.jbc.re.kr www.jinr.re.kr |
304 25 173.8 25.6 128.33 128.31 89.29 |
4,114 5,389 2,420 9,900 8,513 1,212 |
26 34
130 32 20 |
18 8
44 31 |
602 300 29 285 3 |
451 17
125 120 |
27 35
65 18 |
1,638
2,100
700 1,382 |
|
|
동남권 |
산업/그린바이오 |
BVC |
(BVC)마린바이오기능성물질연구기반구축(’02-’07)/[PP] |
신라대학교 mcbi.silla.ac.kr |
45.46 |
1,538 |
12 |
44 |
164 |
105 |
88 |
619 |
|
융합바이오 융합바이오 |
산업핵심 산기반 |
항노화 산업 제품화 기술개발(’11-’15)/[연구개발지원] 항노화 산업기반 구축(’12-’15)/[연구개발지원] |
부산대학교 anti-aging.re.kr |
37.56 112.87 |
221 |
12 |
|
64 |
11 |
6 |
16 |
|
|
융합바이오 융합바이오 |
지역클러스터 지역클러스터 |
차세대 의생명융합산업지원센터 구축사업(’05-’08)/[PP, 공인검사] 첨단 의생명테크노타운 건립 사업(’09-’11)/[PP, GMP, 공인검사] |
(재)김해시차세대의생명융합산업지원센터 www.gbmc.or.kr |
58 88 |
955 2,699 |
16
|
13 12 |
38 14 |
302
|
66
|
475 566 |
|
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
해양생물산업육성센터(’04-’08)/[PP, GLP, 공인검사] (2단계)해양산업안전성확보기반구축사업(’09-’11)/[PP, GLP, 공인검사] |
(재)부산테크노파크 www.mbdc.or.kr |
113.89 20 |
2,628 442 |
11 11 |
10
|
361 284 |
67
|
17
|
836 116 |
|
|
산업/그린바이오 산업/그린바이오 |
BVC 지역클러스터 |
(BVC) 생물화학소재산업지원센터설립(’00-’04)/[PP] 바이오벤처프라자건립(’04-’08)/[PP] |
(재)바이오21센터 www.bio21.or.kr |
50 28,89 |
1,071 752 |
39 |
36 |
286 |
344 |
66 |
337 |
|
|
대경권 |
산업/그린바이오 산업/그린바이오 의약바이오 의약바이오 |
지역클러스터 지역클러스터 지역클러스터 지역클러스터 |
전통생물소재산업화센터(’04-’08)/[PP, GMP, 공인검사] (2단계)건강기능소재산업육성기반정비사업(’09-’12)/[PP, GMP, 공인검사] 한방산업지원센터기반구축(’04-’08)/[PP, GMP, 공인검사] (2단계)한방산업육성기반정비사업(’09-’11)/[PP, GMP, 공인검사] |
(재)대구테크노파크 www.dbic.or.kr www.omisc.or.kr
|
106.4 20.08 34.46 5 |
4,300 1,277 1,264
|
37 38 15
|
4 9
|
31 89 93
|
10 1,000
|
51
|
265 1,496
|
|
산업/그린바이오 |
BVC |
(BVC)생물농업및식품용생물소재TIC(’01-’06)/[PP, GMP] |
경북대학교 www.knu.ac.kr |
42.07 |
550 |
4 |
7 |
100 |
115 |
61 |
338 |
|
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
생물건강산업사업화지원센터건립(’02-’07)/[PP, GMP, 공인검사] (2단계)경북기능성바이오소재산업기반정비사업(’08-’12)/[PP, GMP, 공인검사] |
(재)경북바이오산업연구원 www.gib.re.kr |
137.48 27 |
2,543
|
21
|
36 7 |
256 59 |
444
|
198
|
3,962 1,175 |
|
|
산업/그린바이오 |
지역클러스터 |
해양생명환경산업지원센터건립(’04-’07)/[PP, GMP] |
(재)경북해양바이오산업연구원 www.gimb.or.kr |
80 |
1,812 |
33 |
17 |
94 |
59 |
20 |
|
|
|
산업/그린바이오 |
지역클러스터 |
포항테크노(바이오)정보지원센터건립(’07-’10)/[공인검사] |
(재)포항테크노파크 www.pohangtp.org |
69.61 |
906 |
5 |
3 |
59 |
92 |
104 |
5,069 |
|
|
강원권 |
복합지원(의약/산업/그린) 복합지원(의약/산업/그린) 복합지원(의약/산업/그린) |
BVC 지역클러스터 지역클러스터 |
(BVC) 생물산업벤처기업지원기반조성(’98-’02)/[PP, GMP, 공인검사] 춘천바이오타운조성(’02-’07)/[PP, GMP, 공인검사] (2단계)생물의약소재시험생산지원기반정비(’08-’11)/[PP, GMP, 공인검사] |
(재)춘천바이오산업진흥원 www.cbf.or.kr |
58 172.3 37.2 |
5,927 |
43 |
48 |
215 |
1812 |
364 |
5,900 |
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
강릉해양생물산업지원센터(’02-’07)/[PP, GMP, 공인검사] (2단계)해양의용식품사업화지원기반구축사업(’08-’11)/[PP, GMP, 공인검사] |
(재)강릉과학산업진흥원 www.gsif.or.kr |
225.87 17.9 |
2,127 2,275 |
16 17 |
32 |
355 |
300 |
13 |
1,178 |
|
|
제주권 |
산업/그린바이오 |
BVC |
(BVC)기능성바이오첨가제및생물자원TIC(’01-’06)/[PP, GMP, 공인검사] |
제주대학교 chejutic.cheju.ac.kr |
47.7 |
550 |
16 |
14 |
85 |
169 |
189 |
652 |
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
바이오사이언스파크(’02-’07)/[PP, GMP, 공인검사] (2단계)제주건강·뷰티생물산업기반정비사업(’08-’12)/[PP, GMP, 공인검사] |
(재)제주테크노파크 bio.jejutp.or.kr |
210.69 228.7 |
3,463 |
34 |
42 |
1,102 |
907 |
72 |
315 |
|
|
합계 |
5,993.57 |
106,379 |
1,110 |
852 |
7,812 |
9,932 |
2,887 |
57,101 |
||||
* 필자 자체조사 후 정리

1. 감염병 대응
가. 감염병의 개요
(1) 감염병의 정의
감염병이란 세균 스피로헤타, 리케차, 바이러스, 진균, 기생충과 같은 여러 병원체에 의해 감염되어 발병하는 질환으로 음식의 섭취, 호흡에 의한 병원체의 흡입, 다른 사람과의 접촉 등 다양한 경로를 통해 발생하며 이 중에서도 여러 사람에게 전파되는 감염병을 전염병이라고 한다.
법정감염병은「감염병의 예방 및 관리에 관한 법률」 제2조 제2호 내지 제7호에 명시된 감염병을 의미하며, 질병으로 인한 사회적인 손실을 최소화기 위하여 법률로써 이의 예방 및 확산을 방지하는 감염병을 말하며 환자와 그 가족, 의료인 및 국가의 권리와 의무를 명시한 감염병으로 제1군감염병, 제2군감염병, 제3군감염병, 제4군감염병, 제5군감염병 및 지정감염병으로 구분된다. 이 밖에 세계보건기구 감시대상 감염병, 생물테러감염병, 성매개감염병, 인수공통감염병, 의료관련 감염병 등이 있으며, 이는 보건복지부장관이 각 필요와 목적에 따라 고시한다.
또한 감염병은 해외 교류의 급증과 기후변화로 인한 감염병 매개체의 서식 변화를 고려하여 국내 질병뿐만 아니라, 과거 전 세계적으로 유행한 질병, 신종 감염병 및 재출현 감염병 등 자연 및 인위적으로 전파될 수 있는 모든 감염병을 포함하고 있다.
[표 4-8-1] 감염병 위기 경보 수준
|
단계 |
판단기준 |
주요 대응 조치 |
|
관심 (BLUE) |
해외 신종 전염병 발생 국내외 원인불명 감염환자 발생 국내 가금류에 조류인플루엔자 발생 |
징후감시활동 중앙방역대책본부(질병관리본부)운영 해외동향 신속 파악 및 대응 환자 조기발견 감시체계 가동 환자 진단 및 발생대비 체계 수립 |
|
주의 (YELLOW) |
해외 신종 전염병의 국내 유입 국내에서 신종 전염병 발생 (사람간 전파는 없었음) 국내 인플루엔자 인체감염발생 해외 사람간 전파가 소규모 또는 대규모 |
협조체계가동 중앙방역대책본부 운영(질병관리본부) 상황모니터링 및 위기경보발령 전염병 감시체계 강화(일일보고) 신속 진단 실험실 진단체계 구축 국가방역 인프라 준비테세 점검 |
|
경계 (ORANGE) |
해외 신종 전염병의 국내 유입후 타 지역으로 전파 국내 신종 전염병의 타 지역 전파 해외에서 일반인구 사이에 유행 |
대비계획점검 중앙인플루엔자 대책본부 운영(보건복지부) 국가방역검역체계강화(24시간 비상방역체계) 필요물자 비축확대, 국가방역·검역 인력 보강 대국민 홍보 강화 |
|
심각 (RED) |
해외 신종 전염병의 전국적 확산 징후 국내 신종 전염병의 전국적 확산 징후 국내 일반인구 사이 유행 |
즉각대응태세돌입 중앙재난안전대책본부 운영(행정안전부) 범정부적 대응체계 구축, 윤영 강화 국가 가용자원 동원방안 마련 : 의료인 지도명령권발동, 군 의료인력 지원 등 국내외 입출국자 관리강화 |
(2) 감염병의 발생현황
2015년 5월 한국에서 발생한 Middle East Respiratory Syndrome (중동호흡기증후군, MERS)는 2012년 중동 지역을 중심으로 변종 코로나바이러스 (coronavirus)에 의해 감염되는 호흡기 질환으로, 중증폐렴과 함께 신부전, 호흡곤란을 유발하여, 사우디아라비아에서만 282명의 사망자가 보고되었고, 세계적으로 20개국에서 700여건 이상의 감염 사례, 250명 이상의 사망자가 발생을 초래하였다. MERS 바이러스 경우처럼 최근 재난형 감염병은 대부분 동물에서 기인하며 사람에게 전파되어 인수(人獸)공통의 감염 특징을 가지고 있다. 2000년대 초반 중국 남부에서 최초 발생한 신종 코로나 바이러스인 SARS(Severe Acute Respiratoy Syndrome: 중증급성호흡기증후군)바이러스의 경우, 박쥐에서 시작하여 사향고양이에 전파된 변종 코로나바이러스가 사람에게 감염된 사례이다. SARS 환자를 치료하다 감염된 한 중국인 의사에 의해 같은 호텔 같은 층에 묵었던 12명의 투숙객이 사스에 감염된 상태로 미국, 캐나다, 싱가포르, 베트남, 아일랜드로 가면서 3월 26일까지 249명을 감염시킨 것이 초기 전염병 확산의 원인이었다. WHO의 통계에 따르면 중국 광둥성에서 첫 환자가 발생한 이래 2003년 4월 22일까지 전 세계 27개 국가에서 3천9백47명의 사스 환자가 발생했으며 사망자는 2백29명에 달하였다. WHO는 2003년 4월 16일 코로나바이러스가 사스의 발병 원인으로 확인됐다고 밝히고 바이러스가 동물의 몸속에서 돌연변이를 일으켜 치명적인 바이러스로 변한 것이라고 결론지었다.
에볼라 역시 동물원성 감염병의 대표적인 사례로, 박쥐로부터 전파된 filovirus이며 2014년 2월 서아프리카 기니를 최초로 지속적으로 감염자가 늘어나고 있는 치사율 약 65%의 매우 치명적이고 위험한 병원체이다. 1967년 최초 보고 이후, 아프리카에서 산발적인 발생이 이루어졌고, 대부분 국지적 형태로 단기간에 통제 되어왔으나, 최근 발생한 에볼라 바이러스는 WHO에서 비상사태를 선포할 만큼 인접국으로 걷잡을 수 없이 확산되고 있다.
이러한 사례들은 최근 재난형 바이러스성 병원체들이 동물과 사람을 동시에 감염시키는 인수공통바이러스라는 사실을 재확인하였고, 더 이상 동물과 사람의 감염병의 경계를 둘 수 없는, 하나의 잠재적 감염숙주로써 One Health 개념을 제시하게 되었다.
One Health 개념이 더욱 강조되었던 사례는 2009년 지구 남반구 지역의 새로운 인플루엔자 팬더믹(Pandemic)을 유발한 신종 H1N1 인플루엔자 바이러스 감염사례를 들 수 있다. 조류에서 돼지, 돼지에서 사람으로 종간경계를 무너뜨리고 사람에게 감염되어 2009년에만 206개 국가에서 50만 건 이상의 감염 사례와 6,000건 이상의 사망자 발생 사례가 보고되는 등 지구촌에 큰 충격을 불러 일으켰다. 우리나라에서는 2009년 4월 26일부터 2010년 8월 31일까지 질병관리본부의 전염병웹보고시스템의 신고건과 역학조사 과정에서 확인된 인플루엔자 A(H1N1) 2009 확진자는 총 759,685명이었고, 사망자는 총 270명이었다. WHO는 2010년 8월 10일 대유행 인플루엔자 H1N1 단계를 6단계에서 대유행후단계(Post Pandemic)로 조정하며 대유행 종료를 선언하였으며 국내 대유행 인플루엔자 H1N1 유행은 2010년 23주 이후 종료되었다. 최근에는 2013년도 4월에 중국에서 이례적인 조류유래 H7N9바이러스가 갑자기 출현하여 사람이 감염되고, 30명이 넘는 사망자가 유발되어 상시 감시시스템의 강화와 신종인플루엔자 출현에 대한 대비가 요구 되고 있다.

[그림 4-8-1 ] 하나의 건강(one health) 관계도
신/변종 바이러스의 발생 사례에서 보는 바와 같이, 최초 발생국에서 작게는 20개국 크게는 200여 개국으로 다른 국가로의 전파가 매우 빠르게 진행되는 양상을 볼 수 있다. 바이러스 감염 이후 잠복기와 같이 임상증상이 나타나지 않는 시기의 여행객 등은 국가 간 신/변종 바이러스 전파의 위험 요인이 될 수 있고, 실제로 인플루엔자의 경우 증상이 약할 경우, 가벼운 감기 등과 감별이 쉽지 않아 현실적으로 바이러스 전파를 막을 수 없는 실정이다.
항바이러스제, 항생제 등 기존 항병원성 제제에 대한 내성기전을 이해하기 위하여 선진국을 필두로 바이러스 변이에 관한 연구가 활발히 진행 중이며, 염기서열 분석을 통한 유전자 변이에 대한 계통학적 분석으로 치료제 내성 유전자 변이 발생, 교통수단 발달로 인한 변이, 바이러스 확산의 영향을 규명하고 있다. 1999년 여름에 미국 뉴욕에 처음 출현했던 웨스트나일 바이러스의 변이를 확인하고 뇌염, 뇌막염 등 웨스트나일 바이러스 감염증상을 분석하였고 이를 통해 바이러스와 숙주, 인간감염의 계통적 이해와 상관관계를 규명하기 위한 시스템생물학적 접근이 강화되었다. 이전에는 바이러스 증식, 숙주와의 상호작용, 특이면역반응 등에 대한 연구도 활성화되었으나, 최근에는 단순 기전규명과 더불어 질병의 감염경로, 병원체의 세포 내 증식 기전 및 인체 내에서의 면역작용 등 전반적인 병인기전 연구를 통해 백신, 치료제, 진단제 개발을 위한 후보물질을 개발하기 위한 목적형 연구가 추진되고 있다.
(3) 감염병의 진단, 치료 및 예방
(가) 진단
감염병에 대한 항원 제작을 통해 다양한 진단시스템을 개발하고 신속, 정확한 바이러스 검출 기술을 활용함으로써 병원 내 혹은 공공장소에 적용하여 잠재적 전파자 선별 및 확산을 방지해야 한다. 현재 감염자 확진 방법으로 사용되고 있는 실시간 중합효소 연쇄반응(Real-Time PCR)기법 등을 활용하여 바이러스 감염 진단이 이루어지고 있으나, 신/변종 바이러스를 빠르게 검출할 수 있는 신속하고 특이도와 민감도가 향상된 최신 기법 연구를 지속적으로 진행할 필요가 있다. 감염환자의 검체를 확보하여 진단기관에 의뢰 후 유전자 추출, Real-Time PCR 등 일련의 과정동안 소요되는 시간을 단축하기 위해서는 신속진단시스템이 필요하기 때문이다. 이는 감염자 격리 조치나 치료 시점을 획기적으로 앞당길 수 있으며 감염병의 전파를 효과적으로 막을 수 있다.
(나) 예방
전 세계적으로, 바이러스 백신 생산량 증가와 보급이 이루어지고 있지만 주요 국가에서 소비되는 반면, 저개발국가에는 공급이 원활히 이루어지고 있지 않은 실정이다. 인플루엔자 백신의 경우, 백신 생산이 가능한 나라는 현재 약 10개국 정도로, 미국, 영국, 캐나다, 독일, 프랑스, 이탈리아, 네덜란드, 스위스, 호주, 일본 등의 선진국이며 생산시설을 갖추지 못한 국가는 백신 수급이 어려울 수 있어 국가적인 위기를 초래할 수 있다.
우리나라의 경우 현재까지 외국의 바이러스백신 원액 수입이 주를 이루며 이를 분주하여 판매하는 수준에 머물고 있다. 또한 인플루엔자 백신 대량생산을 위한 대책과 대체 생산 방안 등에 대한 대비가 부족하고, 대유행 가능성 바이러스에 대한 시험단계 백신의 개발도 미흡한 실정이다.
|
<세계 백신 시장> |
<국내 백신 시장> |
|
|
|
|
출처 : The Global Vaccines Market 2008∼2023, visiongain(왼쪽), 국내백신산업 국산화의 시작, 하이투자증권 리서처(2012, 오른쪽)
|
|
|
[그림 4-8-2] 백신시장현황 |
|
선제적인 백신 대응기반을 수립하기 위해서는 감염병 출현 예측모델 연구를 통해 급변하는 바이러스의 변이패턴 및 출현속도를 대처하여 사전에 백신을 개발하여야 한다. 신/변종 바이러스가 일으키는 위기상황 발생 시, 주변국에서 대응하기 위한 가장 좋은 방법은 위험 구간에 속하는 사람을 대상으로 백신을 접종하는 것이라 할 수 있다. 이를 위해서는 국가적으로 발 빠르게 백신의 개발 및 상용화를 할 수 있는 체계를 갖추어야 한다.
또한 다양한 신/변종 바이러스 아형에 대응 가능한 범용백신의 개발이 필요하다. 고 위험성 신/변종 바이러스를 분리 배양하여 백신주를 확보할 수 있는 BSL-3 이상의 실험환경 구축뿐만 아니라, 사람에서 안전하고 효과적으로 방어능력을 부여할 수 있는 첨단 백신 개발 및 제품 생산 시설 구축이 병행될 필요가 있다. 이러한 바이러스 질병 연구 및 백신 개발은 중동호흡기증후군, 에볼라, 신종인플루엔자 같은 고 위험성 바이러스 발생 위기상황에 대응하기 위한 가장 좋은 방법이며 백신의 안정성과 효능이 균형 있게 개발되어야한다.
(다) 치료
세균 감염에 빠르게 대처할 수 있는 항생제와 달리 시판 중인 항바이러스 제제는 매우 제한적인 만큼 신/변종 바이러스에 감염된 환자 치료를 위해 1차적으로 즉시 적용할 수 있는 다양하고 효과적인 항바이러스 제제의 개발이 필요하다. 항바이러스 제제의 경우, 항바이러스 약물이 신/변종 바이러스의 전파를 차단할 수는 없지만 감염의 합병증과 증상의 중증도는 경감시킬 수 있으며 대유행 백신 개발을 위한 시간을 벌 수 있는 수단이 될 수 있기 때문에 항바이러스 제제에 대한 국가적 차원의 연구지원은 매우 중요하다. 뿐만 아니라 항바이러스제제에 내성을 가진 바이러스 출현을 보완할 수 있는 새로운 치료제 개발도 필요하다.
나. 해외 동향
(1) 국외 연구개발 동향
미국은 1990년대부터 감염병 대응 정책기조를 수립하기 위하여 정책보고서를 발간하고 있다. NIH 및 CDC를 중심으로 감염병 대응 연구 및 지원을 강화하고 있으며 국립알레르기전염병연구소(NIAID)는 미국립보건연구원의 기관 중 3위로 예산을 받고 있으며(2010년 기준 48억 불), 이 중 약 83%는 주로 AIDS, 결핵, 말라리아, 인플루엔자, 슈퍼박테리아(항생제내성), 생화학테러 등의 연구에 대하여 대학, 병원 등 외부연구에 지원하고 있다. 질병통제예방센터(CDC)는 AIDS 및 신종 감염병의 증가를 반영하여 2010년 예산 중 약 18.6억 달러를 감염병 분야에 사용하고 있으며, 전 세계의 감염병 정보를 파악하고 감염성 질병의 효과적인 연구 활동을 위해 인수공통감염병센터(NCEZID)를 설립하였다.

출처 : I&Company Analysis, PubMed
[그림 4-8-3] 진단, 치료, 백신 분야의 핵심 연구 영역 변화
유럽의 경우, EU차원에서 질병예방통제센터(ECDC)를 중심으로 감염병에 대한 질병감시체계를 구축하고 대응전략을 마련함으로써, EU와 주변국의 데이터수집 표준화, 검증, 저장, 보급, 원스톱 시스템, 국가 간 링크 역할 수행 등 업무 효율성 증대 및 국가 차원에서의 감시체계 강화를 위해 노력하고 있다.
일본은 신종 및 재출현 감염증의 연구를 위해 내각부, 후생노동성, 문부과학성의 주도로 정부부처별 전략을 마련하고 투자를 확대하였다. 일본 후생노동성은 국립감염증연구소(NIID)에 감염병에 대한 기초 및 응용 연구, 표준화, 감시, 정보 수집 및 분석, 정부차원의 검정 및 검사, 백신관련 품질관리, 국제협력 등을 추진하기 위해 2010년 약 75억 엔을 투자하였고, 산하 결핵연구소를 설립하여 최근 BCG백신을 대신할 DNA 및 재조합 백신의 개발에 성공하였으며, 진단기술 프로젝트도 추진 중에 있다. 또한, 문부과학성은 신흥‧재출현 감염증 극복 기술개발을 위해 감염연구를 위한 국제 네트워크 추진 프로그램(J-GRID) 2단계에 착수(2010~2014년)하였으며, 2010년 약 20억 엔을 투자하였다. 농림수산성은 2003년 광우병 연구를 시작으로 조류인플루엔자 등 주요 인수공통감염병 발생 및 만연 방지를 위해 노력하고 있으며 질병메커니즘 규명, 검사체계의 신속화 및 정확도 향상, 방제기술개발, 감시시스템 구축 등을 목표로 연구를 추진하고 있다.
중국은 백신개발을 위한 국가적 지원을 확대하고 연구를 강화하고 있으며 2010년 백신개발에 약 1,800만 달러를 투자하고 있다. 현재 30여개 업체에서 연간 10억 명에게 투약할 수 있는 백신 생산능력을 보유하고 있다.
(2) 국외 산업 동향
글로벌 제약 시장의 매출 및 R&D 투자비용은 지속적으로 증가하고 있으며, 감염병 대응에 필요한 백신 및 항바이러스제 등의 비중도 점차 늘어나고 있는 추세이다. 특히 2008년 이후 인플루엔자 대유행을 통해 주요 제약사들의 관련 의약품 개발 및 생산도가 높아졌다. 글로벌 제약 시장 내 감염병 예방 및 치료에 쓰이는 백신과 항바이러스제의 비중이 높아짐에 따라 해당 업체들도 많은 성장세를 보이고 있다. 전체 제약시장이 3%대의 성장을 이룰 것으로 예상되는 반면, 백신과 항바이러스제는 각각 7%와 6%의 성장률을 보이며 제약제품 중 성장률이 가장 클 것으로 기대된다.
전 세계 백신 시장의 규모는 2011년도 317억 달러(약 35조원)에 이르며, 연평균 11.5% 성장하여 2017년도에는 567억 달러(약65조원)에 도달할 것으로 전망된다. 전체 제약 시장 성장률인 6~7%를 크게 웃도는 성장속도를 보이고 있으며, 특히 인플루엔자 백신, 폐렴구균 백신, 자궁경부암 백신, 로타 바이러스 백신 등과 같은 고부가가치 프리미엄 백신이 그 성장을 이끌고 있다. 2013년 글로벌 백신시장은 281억 달러로 추산되었으며 오는 2015년에는 642억 달러의 시장으로 크게 확대될 것으로 전망되고 있다. 백신시장을 사람용 백신과 동물용 백신 두 섹션으로 나눠 전망했을 경우, 사람용 백신시장은 작년 239억 달러에서 2015년 586억 달러의 시장으로 매우 큰 폭의 성장세가 전망된 것으로 나타났다. 예상 연평균성장률인 19.6%는 전체 백신시장 평균인 17.9%를 상회하며 글로벌 시장의 성장세를 주도할 것이란 전망이 나타났다.
(단위 : 백만원)

출처 : BCC Research
[그림 4-8-4] 글로벌 백신 시장 전망
또한 개발도상국의 경제성장에 따른 백신 접종률 증가, 선진국의 고령화에 따른 성인 백신 및 치료백신 수요증가를 비롯하여 충분한 개발 여지가 존재한다. 특히 전 세계적으로 백신 관련 감염병이 8백여 종 존재하나, 현재까지 개발된 백신은 아직 30여 종에 불과하므로 개발 가능성이 많은 산업 분야이다. 현재 제약 시장의 잠재력을 보유한 주요 품목은 질병의 감염을 사전에 방지하는 예방백신이라고 판단된다. 최근 백신 개발은 기존 백신의 부작용 및 단점을 해결하기 위한 새로운 패러다임에 주목하고 있으며 백신 개발에 대한 트렌드도 기존의 예방 백신에서 최근에는 치료백신의 발달이 두드러졌으며, 앞으로는 중독치료백신 등 다양한 분야에 목적을 둔 새로운 종류의 백신 개발로 이어질 것으로 예상된다.
다. 국내 현황
(1) 국내 연구개발 동향
2009년 기준 정부의 총 연구개발 투자(약 12조 3천억 원) 중 감염병 분야는 0.5%에 해당하는 574억 원을 투자받고 있으며, 연평균 13.1%씩 지속적으로 확대되고 있다(전체 보건 분야 중 약 5.3%). 연구분야별 분포를 보면 치료기술(25.6%), 기초/기전(22.7%), 백신(19.2%) 중심으로 연구가 수행되고 있고(전체의 76.7%), 진단기술(9.7%), 감시/역학(7.2%), 임상/정책(2.7%) 분야는 상대적으로 투자가 적은 것으로 나타나고 있다.
인체 감염병 연구의 질환별 분포를 보면 법정 감염병에 대한 연구와 그 외 연구가 절반 정도씩 차지하며, 특히 법정 감염병 중에서는 2군과 3군에 연구가 집중되어 있다. 그 외의 연구에서는 질환이 특정되지 않은 치료법(항생제 등) 및 백신 연구, 항생제 내성 연구, 바이러스 등 병원체에 대한 기초연구가 많은 상태이다. ʻ기타 인체 감염병 연구ʼ로 분류된 연구에는 주로 ʻ호흡기 질환ʼ과 같이 특정 질환군에 대한 연구가 많았으며, 단일 질환에 대한 연구비 지원 순위는 신종인플루엔자, 인플루엔자, 노로바이러스 등의 장관감염증군, 결핵, AIDS, 패혈증, 자궁경부암, B형간염, C형간염, 인간광우병, 폐렴알균 등의 급성호흡기 감염증군, 파상풍, 말라리아, SARS 순으로 나타나 있다.
(2) 국내 산업개발 동향
현 수준의 국내 제약 산업은 국내 제약시장의 특성에 따라 국내 자체 연구개발을 통한 의약품 생산보다 해외 의존도가 높은 실정이다. 국내 상위 5개 제약회사의 전체 매출 규모는 약 3조 원으로 글로벌 상위 5위의 단일 제약회사 매출규모인 약 50조 원의 6%에 불과한 실정이다. 국내 상위 5개 제약사의 R&D 투자규모의 합이 글로벌 상위 5위 단일 제약회사의 단 4.8%에 불과하여 국내 R&D 기반은 매우 미흡한 반면, 해외 제약시장은 지속적인 매출 증대와 R&D 투자비 확대를 통해 감염병 대응에 필요한 백신 및 항바이러스 연구에 적극적인 모습을 보여주고 있다. 국내 유통되는 66개의 백신 중 완제품 수입 및 원료 수입 백신이 50개로 75.8%의 백신이 수입되어 오는 바와 같이, 국내 자체 연구개발을 통한 의약품 생산보다 해외 의존도가 크게 높은 것으로 나타나고 있다.
라. 발전 과제
향후 발생가능한 감염병 대응을 위해서는 앞서 언급한 진단, 예방, 치료 3원칙의 대응전략이 잘 갖추어져야한다. 바이러스 감염병 원인체들은 빠르게 변이하고 있어 선제적인 예측모델 연구를 통해 급변하는 바이러스의 변이패턴 및 출현속도를 따라 잡아야하며 이를 통해 사전에 진단 시스템을 구축해놓아야 한다. 안정적으로 백신을 생산할 수 있는 기술과 국내에 충분한 생산 시설을 갖추는 것이 시급하며 차세대 백신 연구를 위해 신변종 바이러스 병원체에 대한 감시와 예측 인프라 구축은 반드시 갖추어야할 대응기반이다. 동시에, 항원 선발기술 개발을 통해 기존의 긴 시간이 소요되는 바이러스 배양방식을 극복하게 함으로써 대유행 상황에 빠르게 대처할 수 있는 여건을 마련하여야한다. 이러한 신·변종 바이러스 발생에 대비한 사전 개발 백신 연구뿐만 아니라, 특히 비강백신 또는 경구백신 연구를 통해 바늘을 이용하지 않은 새로운 백신접종 기법을 개발하여야 하고 의료기반시설이 미흡한 국가에서 효율적인 백신접종도 가능케 하여 국내 뿐 아니라 주요 해외발생국에 공급할 수 있어야 한다. 바이러스 질병 및 대응기반 연구는 단순한 질병치료가 아닌 국가의 경제 사회적 안정 유지와 위기 극복에 대비한 매우 중요하고 필수적인 연구분야로, 국가차원의 사업 추진과 구체적인 장기 계획 수립 및 이의 시행이 시급하다. 또한 체계적이고 종합적인 연구개발 추진이 필요하며 산발적이고 중복 되지 않도록 효율적으로 진행되어야 한다. 안전하고 효과적인 바이러스질병 대응에 대한 국가적 차원의 연구 지원이 감염자와 사망자를 최소화하고 국민 건강에 기반한 국가 경제 사회적 안정 유지에 필수적이기 때문이다.
2. 외상 후 스트레스장애
가. 개요
(1) 외상 후 스트레스 장애(PTSD)의 발생 및 동향
외상 후 스트레스 장애(post-traumatic stress disorder, PTSD)는 실제 죽음, 죽음의 위기, 심각한 상해, 성폭력과 같은 외상 사건을 직접 경험 혹은 목격하거나, 이와 같은 외상 사건이 가까운 친지에게 일어난 것을 알게 된 경우, 또는 구조, 구급 등 직업적으로 외상사건에 반복적으로 노출되거나 극단적인 사건에 노출된 경우에 발생하는 질환이다1). PTSD에서 주로 나타나는 증상은 침투 및 회피, 인지와 기분의 부정적인 변화, 그리고 각성과 반응의 문제이다.
PTSD를 일으킬 수 있는 외상 사건의 종류에는 전쟁, 자연재해 이외에도 국민 누구나 노출될 수 있는 범죄피해, 교통사고, 치명적인 질병 등이 포함된다. 미국의 대규모 역학연구들에 따르면, 일평생 살면서 일반인이 외상사건에 1번이라도 노출되는 유병률은 50~70%이다. 국내에서는 이러한 각종 외상 사건에 대한 피해자의 규모는 체계적으로 집계되어 있지 않다. 범죄피해(연간 약 70만 명: 직접 노출)2)와 교통사고 피해(연간 약 35만 명: 직접 노출)3)의 국내 통계자료를 토대로 추정해보았을 때, 직간접 노출을 포함한 국내 외상 사건 피해자는 연간 약 500만 명에 이를 것으로 생각된다. 또한 WHO의 2000년 자료에 따르면, 국내에서 폭력과 같은 외상으로 인한 직접적인 사회경제적 손실은 약 3조로 추정된다. 이는 삶의 질 저하로 인한 간접적인 손실은 포함되지 않은 금액이다. 더군다나, 이러한 외상 사건으로 인한 직간접적인 피해의 막대한 규모에 비해서 외상 사건에 대한 현재의 대응체계는 아직 미흡하여, 외상 사건 자체의 수습과 신체 손상 치료 등에만 주로 초점을 맞추고 있어, 외상에 대한 보다 통합적인 접근이 필요한 상태이다.
이와 같은 외상 사건에 노출된 이후, 외상의 유형에 따라 10~35%의 외상 노출군에서 PTSD가 발병하는 것으로 보고되어 있다4). PTSD의 경우, 보통 외상 후 첫 한 달 이내에 증상이 발현되지만, 저절로 회복되는 경우는 적어, 치료를 하지 않는 경우 환자의 33~47%가 만성화되는 것으로 알려져 있다5). PTSD의 이러한 만성화 경과는 사회적‧직업적 기능 저하를 초래한다. Haagsma 등6)은 비의도적인 손상으로 인해 PTSD로 진료를 받은 문헌 자료를 이용하여 신체손상을 제외하고 PTSD로 인해서만 인구 10만 명당 380 DALY(disability adjusted life years)의 질병부담이 발생하는 것으로 추정하였다7). 이는 2002년에 국내에서의 단극성 우울증으로 인한 손실(331 DALY)에 맞먹는 수치로, PTSD에 흔히 동반되는 알코올 사용 장애, 우울 장애, 불안 장애까지 고려한다면, 외상으로 인한 정신적, 심리적 피해 및 이로 인한 삶의 질 저하는 상당하다고 할 수 있겠다.
나. 해외 동향
(1) 예방‧치료 전략 개발로의 패러다임 변화
최근 전 세계적으로 자연재해, 전쟁 및 테러, 교통사고, 각종 사회범죄(가정폭력/ 성폭력/학교폭력 등)와 같은 ʻ재난/사고/외상ʼ 사건이 빠르게 증가하는 추세로, 이에 대한 사회 및 국가의 관심과 적극적인 대처는 매우 중요한 이슈일 뿐 아니라, 정부의 위기관리 능력을 보여 주는 지표가 되고 있다.
특히, 미국의 경우 9·11 테러 이후 자국민의 외상 이후 정신 건강에 대한 관심이 증가하였을 뿐만 아니라 이라크전, 아프가니스탄전 참전 용사들 및 총기 난사 사고로 인한 피해자들의 PTSD가 미국 내에서 중요한 사회적 문제로 대두됨에 따라, 정부의 주도 하에 여러 세부 부처에서 PTSD에 대한 R&D 분야를 적극적으로 지원하고 있다. 대표적으로 미국 정부는, 2013년도에 범부처간 공동 연구프로젝트인 National Research Action Plan(NRAP)을 발표하였는데, 이는 PTSD 및 외상성 뇌손상의 진단 및 치료 기술 개발을 위한 것이다. 이 프로젝트는 정부의 대규모 지원을 통해 PTSD의 바이오마커, 진단, 기전 기반의 치료 기술 개발 등, PTSD에 대한 연구 및 기술 개발을 촉진시키는 것을 목적으로 한다. 이는 ʻ재난/사고/외상ʼ에 대한 ʻ국가적 관리 체계의 확립ʼ 뿐 아니라 실질적인 관리를 위한 ʻ구체적인 기술 개발ʼ의 중요성을 강조하였다는 면에서 그 의의가 있다.
(2) 조기 예측 기술 개발 동향
PTSD의 바이오마커의 종류는 크게 PTSD 발생 위험 및 회복 예측(susceptibility/ resilience), 진단(diagnosis), 치료의 반응 추적(therapy) 목적으로 나누어 생각해 볼 수 있다11). 현재까지는 개별 연구자들을 중심으로 PTSD에 대한 유전학, 면역학, 대사, 뇌영상학 등을 이용한 바이오마커 연구가 이루어져 왔다12). 하지만 이를 통합하고 또 실용화하는 부분에 대해서는 세계적으로도 아직 연구의 수가 아주 적은 편에 속한다[표 4-8-2].
PTSD의 조기 예측을 위한, 바이오마커 기반의 바이오칩(biochip) 혹은 바이오센서(biosensor) 개발 역시 아직까지는 매우 초보적인 단계이며, 관련 분야의 특허도 소수만 출원되어 있는 상태이다. 특허의 내용 또한 단편적인 연구 결과에 대한 출원이 대다수를 차지하고 있어, 현재까지는 기술의 한계 및 낮은 시장 확보력으로 인해 실용화 단계에 이르지는 못하고 있는 것으로 분석된다.
[표 4-8-2] 외상후증후군의 바이오마커
|
위험 및 회복 예측 마커 (Susceptibility/Resilience marker) |
|
- Gender - Cognitive function - Nightmares - Previous mental illness - Multiple trauma - Socioeconomic factors - Heart rate - Fear provocation (CO2) - Gene (FKBP5, COMT etc) - Hypothalamus-pituitary adrenal (HPA)-axis characteristics - Hippocampal volume - Hippocampal N-acetylaspartate |
|
진단 목적 마커 (Diagnostic marker) |
|
- HPA-axis dysregulation - FKBP5 expression - Sympathetic adrenomedullary system(SAM) - Startle response - Hippocampal volume - Amygdala activity |
|
치료의 반응 추적 마커 (Therapy marker) |
|
- Anterior cingulate cortex volume/activity - Amygdala activity - Cerebral blood flow changes - LL 5HTTLPR genotype - BDNF serum level |
(3) 조기 치료 기술 개발 동향
현재까지 PTSD에 대한 주된 조기 개입 전략은 인지 행동적 치료 접근이었다. 그러나 이러한 인지 행동 치료의 경우 치료 프로토콜에 대한 표준화가 어려우며, 관련된 시간과 비용, 전문 인력 등의 리소스가 많이 필요한 제한점이 있다. 이러한 제한점을 극복하기 위해 컴퓨터 프로그램과 보조적 도구를 활용한 전산화된 인지 조절(computerized cognitive modulation)에 대한 관심이 증가하였고, 이에 따라 특히 미국 등 선진국에서는 PTSD 치료를 위한 전산화 인지 조절에 대한 프로그램 개발 및 관련된 특허의 출원이 증가하고 있는 상태이다[표 4-8-3].
[표 4-8-3] 외상후증후군 분야에 적용될 수 있는 인지조절기술과 관련된 특허의 예시
|
출원번호 |
출원인 |
발명의 명칭 및 내용 |
|
US 20140024883 |
University Of South Florida |
Device and method for stimulating eye movement |
|
안구운동 민감소실 및 재처리요법(eye movement desensitization and reprocessing, EMDR) 관련되어 안구 움직임 추적에 적용되는 컴퓨터 소프웨어 개발 |
||
|
US 20110213197 |
Robertson Bruce D, Bernard Robert Franza |
Computer augmented therapy |
|
바이오피드백, 가상현실 트레이닝 등을 이용한 교감 신경계 조절을 위한 트레이닝 |
||
|
EP 2542147 |
Neumitra LLC |
Devices and methods for treating psychological disorders |
|
웨어러블 바이오센서 디바이스를 통한 개인의 측정 정보를 바탕으로 한 실시간 심리치료 |
||
|
US 8498708 |
Neuronix Ltd. |
Integrated system and method for treating disease using cognitive-training and brain stimulation and computerized magnetic photo-electric stimulator (CMPES) |
|
뇌자극 기술과 인지조절 기술을 같이 사용 |
||
|
US 20110118555 |
Abhijit Dhumne, Hans Kristofer Breville |
System and methods for screening, treating, and monitoring psychological conditions |
|
PTSD 모니터링과 치료를 위한 컴퓨터 기반의 리모트 기술 |
||
|
US 8323191 |
Koninklijke Philips Electronics N.V. |
Stressor sensor and stress management system |
|
심장 박동수, 체온, 전류 피부 반응(galvanic skin reflex), 목소리 톤 등의 다양한 감각센서를 이용하여 스트레스를 정량화 |
PTSD에 대한 약물 치료도 임상에서 흔히 시도되었던 개입방법 중 하나이다. 하지만 아직까지 PTSD에 특이적인 치료제로 개발된 약물은 없으며 PTSD의 예방을 가능하게 하는 약물도 없는 실정이다. 현재 PTSD에 대해 FDA 공인된 치료제로는 선택적 세로토닌 재흡수 억제제(selective serotonin-reuptake inhibitor, SSRI)계열 약물 중 세르트랄린(sertraline)과 파록세틴(paroxetine) 단 2가지뿐이고, 이마저도 치료 효과가 만족스럽지 않아, PTSD에 동반된 우울, 불안, 불면에 대한 증상 호전을 위해서 항우울제 및 벤조다이아제핀 (benzodiazepine)과 같은 약물들이 허가외 사용(off-label)으로 사용 된다.
이와 같이 PTSD에 대한 현재의 인지 행동 치료 및 약물적 치료 접근은 그 효과가 아직은 불충분하여, PTSD 발생 기전에 기반한 치료 전략 및 조기 개입 기술 개발의 필요성이 점차 강조되고 있다. 최근 PTSD에 대한 기전 기반의 예방 및 조기 개입 전략의 하나로, PTSD의 발생 기전과 직접적인 연관을 가지는 뇌의 특정 회로를 자극하는 신경 자극(neurostimulation) 혹은 신경 조절 (neuromodulation)과 같은 기술이 주목을 받고 있다. PTSD 분야의 뇌자극 기술 분야는, 현재 기술시장 성장 단계상 출원수와 출원인수가 늘어나고 있는 발전기에 해당하는 상태로, 조금씩 특허 출원이 시작되는 단계로 분석 된다. 미국이 뇌자극 기술 분야에서 주로 특허 출원을 주도하는 주요 기술 시장국이며, 미국 다음으로는 유럽 국가에서 관련된 특허 출원이 많이 있는 것으로 분석 된다13).
다. 국내 현황
국내에서는 PTSD에 대한 사회적 인식의 부족으로 발생에 대한 정확한 역학 정보도 아직 부족한 상태이다. 또한, 현재까지 ʻPTSDʼ에 특이적인 R&D 영역은, 관심 있는 일부 몇몇 개인/소규모 연구팀을 중심으로 연구가 진행되고 있다[표 4-8-4].
[표 4-8-4] PTSD 관련 R&D 현황
|
지원기관 |
연구개발 내용 |
|
검색방법 : NTIS 내 '국가 R&D 사업관리서비스' 검색키워드 : 외상후 스트레스 OR 외상후 스트레스 장애 |
|
|
미래창조과학부 |
공포 기억 학습 및 소거의 메커니즘 규명 : 사람 모델에서 분자, 유전자, 뇌, 행동을 관통하는 통합적 접근 |
|
보건복지부 |
외상 후 스트레스 장애의 뇌 기능적/구조적 연결성에 대한 기능 자기공명영상과 확산텐서영상 연구 |
|
교육과학기술부 |
심리적 외상의 유형에 따른 뇌 구조 및 기능의 차이 : 북한이탈주민 연구 |
|
교육과학기술부 |
동물모델을 이용한 공포기억의 억제 및 제거 |
|
미래창조과학부 |
공포 처리 과정과 연관 기억에 관여하는 두뇌 기작 규명 및 조절법 모색 |
|
미래창조과학부 |
내측 전전두엽피질에서 소멸(extinction) 기억 신경회로 분리 및 광유전학을 이용한 조절 |
|
보건복지부 |
외상 후 스트레스 장애의 시냅스 기초 및 치료 기전 연구 |
|
교육과학기술부 |
공포기억 코딩 및 디코딩의 기전 연구 : 이온채널에서 행동까지 |
|
교육과학기술부 |
스트레스성 인지장애에 관여하는 뇌기전 연구 및 뉴로펩타이드의 역할 |
|
보건복지부 |
공포기억 재경화에 중추적인 off-line 신경 활성 : 공포기억삭제를 위한 핵심 분자 타겟 발굴 |
|
교육과학기술부 |
CREB 과잉발현 뉴런의 선택적 자극을 통한 공포 기억의 발현과 변화에 대한 연구 |
최근 세월호 참사 이후 PTSD에 대한 국민적 관심도가 크게 증가하여 외상 노출 후 PTSD 발생, 예측, 조기 대응에 대한 체계적 연구 및 기술 개발에 대한 요구도가 높아졌다. 즉, 현재까지의 외상‧재난과 관련된 재산적/심리적 1차 피해에 대한「사후 복구」중심의 외상‧재난 대응에서,「예방과 대비」중심의 선제적 관리를 위한 R&D 사업의 필요성이 증가하고 있다. 특히, 사고 및 재난 발생의 방지(pre-disaster track) 및 PTSD 발생 예방(post-disaster track)의 외상‧재난 전주기에 대한 통합적 접근을 위한 원천기술 개발 뿐 아니라 기술-산업-정책이 결합된 융합형 대응 전략이 요구된다.
라. 발전 전망
우리나라는 빠른 경제성장으로 인해 재난에 취약한 나라가 되어, 재난 발생으로 인한 사회경제학적 피해 비용이 점차 증가하고 있는 실정이다. 이로 인하여 외상 노출 후 PTSD 발생 예측 및 조기 대응 전략 개발의 요구도가 증가하고 있다.
우리나라의 경우 뇌인지과학 및 재난 대응 관련 전체 R&D 규모는 주요 선진국에 비해 적지만, 선진국과의 세부 기술 분야별 기술 격차를 빠르게 좁혀나가고 있는 편에 속한다. 그러므로 아직까지 태동기 단계에 머무르고 있는 재난 대응 및 PTSD의 조기진단/조기개입을 위한 뇌인지과학기술 개발 전략은, 빠른 시간 안에 세계적인 선두 그룹으로의 진입을 가능하게 할 것으로 기대된다.
또한, 재난 대응을 위한 뇌인지과학적 기술 개발을 목표로 하는 R&D 사업을 적극적으로 지원함으로써, 재난 대응이라는 국가적 당면과제를 해결하고 국민의 삶의 질을 향상시킬 뿐 아니라, 첨단 뇌인지과학 신기술 개발을 통해 지속적인 경제 성장을 견인할 수 있는 미래지향적 신산업 창출을 유도할 수 있을 것으로 기대된다.
1) International Seed Federation, 2013
2) 식약청:2012, Nutrition Business. J. 2012
3) Tamang., 2010
4) 통계청, 2015
5) 참고문헌: 2015 바이오안전성백서, 한국바이오안전성정보센터 ; 2014 환경백서. 환경부 ; BT기술동향 보고서 환경생명공학(Bioremidiation을 중심으로) 생명공학정책연구센터 (총서 68권, 2008) ; 이영숙, 송원용, 박점옥, 정은화, 심동환, 이주현, 김유영, 김도영, 이미영, 노은운. 2003. 31p. 환경정화용 식물개발 기술. 과학기술부 ; “환경정화용 식물개발의현황과 전망” 바이오안전성정보센터(Biosafety Vol 8 No 3),(2007) ; 식물정화기술의 개요와 환경오염 제어에의 응용 현황. 한국생물공학회지 27, 281-288, 2012 ; 산성광산배수 자연정화에서의 생물공학. 한국지형공학회지 vol 49(6) 844-854, 2012 ; A review on the state of the art of physical/chemical and biological technologies for biogas upgrading. Rev Environ Sci Biotechnol(2015) ; 이재홍(2012) 한국생명공학회지 (27)281-288 식물정화기술의 개요와 환경오염 제어에의 용용현황
6) Raul Munoze 등 2015
7) OECD(2013), Marine Biotechnology: Enabling Solutions for Ocean Productivity and Sustainability. OECD Pblishing. (
http://dz.doi.org/10.1787/9789264194243-en)8) PLoS ONE: Marine Biodiversity and Biogeography – Regional Comparisons of Global Issues (2010) PLoS Collections:
http://dx.doi.org/10.1371/issue.pcol.v02.i099) Arrieta J.M. et al., (2010). What lies underneath: Conserving the oceans' genetic resources. 107(43):18318-18324.
10) Mayer, A.M.S. et al., (2010). The odyssey of marine pharmaceuticals: a current pipeling perspective. TRends in Pharmacological Sciences 31(6): 255-265.
11)
http://marinepharmacology.midwestern.edu/12) OECD(2013), Marine Biotechnology: Enabling Solutions for Ocean Productivity and Sustainability. OECD Pblishing. (
http://dz.doi.org/10.1787/9789264194243-en)13) http://aquabounty.com/
14) 오유관, 나정걸. (2015). 미세조류 바이오디젤 생산 공정기술. KIC News 18(3): 1-14.
15) OECD(2013), Marine Biotechnology: Enabling Solutions for Ocean Productivity and Sustainability. OECD Pblishing. (
http://dz.doi.org/10.1787/9789264194243-en)16) Jang et al., (2013). 국내외 해양생명공학 산업시장의 장기예측 및 함의. Ocean and Polar Res. 35(2): 93-105.
17) 해양생명공학기술개발사업 2012년도 최종보고서.(2013). 차세대 해양생명공학사업 추진 방안 연구. 해양수산부(한국해양과학기술진흥원).
18) https://www.kimst.re.kr/2012html/sub01_02_2015.jsp(한국해양과학기술진흥원)
19) Yim et al., (2014). Minke whale genome and aquatic adaptation in cetaceans. Nature Genetics 46:88-92.
20) Rittmann et al., (2015). One-carbon substrate-based biohydrogen production: Microbes, mechanism, and productivity. 33(1): 165–177.
21) Choi et al., (2015). Engineered mussel bioglue as a functional osteoinductive binder for grafting of bone substitute particles to accelerate in vivo bone regeneration. J. Mater. Chem. B, 3: 546-555
22) http://www.ecomedia.co.kr/news/newsview.php?ncode=1065589576192574
Key World Energy Statistics 2014.
25) Future Prospects for Industrial Biotechnology; OECD, 2011.
26) The Bioeconomy to 2030 (2009), OECD Report
27) Why Biobased?; opportunities in the Emerging Bioeconomy, Jay S. Golden and Robert B. Handfield, (July 25, 2014), USDA report
28) An Economic Impact Analysis of the U.S. Biobased Products Industry A Report to the Congress of the United States of America (2015), USDA Report
29) Growth and Jobs through the European bioeconomy, Patrick van Leeuwen(March 2015), the European Files
30) www.bio.org
31) An Economic Impact Analysis of the U.S. Biobased Products Industry A Report to the Congress of the United States of Americ (2015), USDA Report
32) 7th Framework Programme for Research and Technological Development
33) http://www.industrialbiotech-europe.eu/
34) http://www.bbi-europe.eu/about/about-bbi#sthash.eq10wJlX.dpuf
35) 신성장동력으로서의 바이오화학산업의 정책과제(2014) 산업연구원 연구보고서
36) Opportunities for the fermentation-based chemical industry(2014), Deloitte report
37) Industry Report: An Economic Impact Analysis of the US Biobased Products Industry:, Jay S. Golden et al.,(AUGUST 2015), INDUSTRIAL BIOTECHNOLOGY
38) Why Biobased?; Opportunities in the Emerging Bioeconomy, Jay S. Golden and Robert B. Handfield(July 25, 2014), USDA report
* 바이오기반 플라스틱은 바이오매스로부터 생산된 바이오기반 석유화학대체 폴리머를 지칭하며 바이오기반 폴리머는 전분폴리머와 생분해성 프라스틱을 포함한 모든 생물학적 폴리머를 나타냄
39) The Market for Bio-Based Chemicals (2013), Market Beyong Data
40)
42) 탈석유화학산업 바이오플라스틱의 창조적 역할과 발전방안, 심우석·남장근(2013), 산업연구원
43) Industry Report: An Economic Impact Analysis of the US Biobased Products Industry:, Jay S. Golden et al.(AUGUST 2015), INDUSTRIAL BIOTECHNOLOGY
44)
45)
48) The Bioeconomy to 2030: Designing a Policy Agenda, 2009
49)ㆍ바이오산업 세계시장규모(십억$, MarketLine, 2013) : (" 13)329→ ('15)392.4→ ('17)468.1 <>P>
ㆍ의약품 국내시장규모(조원, KHIDI, 2013) : ('09)17.9→ ('12)18.9(CAGR 2.9%)
ㆍCRO 글로벌시장규모(억$, Fost&Sullivan, 2015) : ('14)287.5→ ('19)504.1(CAGR 11.9%)
(북미시장 145.8(CAGR 10%), 유럽시장 95.5(CAGR 11.1%), 아태시장 34.7(CAGR 19.5%)
50) cGMP(current Good Manufacturing Practices) : 의약품 제조에 필요한 공장건립에서부터 원료구입 및 제조공정에 이르는 전 과정에 걸쳐 미국 FDA(미국의 식약청)에서 요구하는 기준
51) 건평 5,913.9㎡, 연면적 16,912.6㎡, 동물세포라인 1기, 미생물발효라인 1기, 완제라인 1기 등 구축
ㆍ동물세포/미생물라인 : 항암제, 빈혈치료제, 당뇨병치료제, 성장호르몬, 재조합 백신 등의 원료의약품 생산
ㆍ완제라인 : 동물세포라인과 미생물라인에서 생산된 원료의약품을 Vial(유리병)이나 Syringe(주사기)형태의 완성된 의약품으로 생산
52) HACCP(위해요소중점관리기준) 플랜트 : HACCP 순창메주 공급(년간 1,000톤) 미생물관리센터 : 발효미생물 은행(20,000균주 이상) 및 발효관련 기업체 지원
53) 1998년~2002년 : 산업기술기반조성사업 BVC 9개 신규 지원
(ʼ98년 1개, ʼ99년 1개(TIC), ʼ00년 3개, ʼ01년 3개(TIC), ʼ02년 1개)
54) 2004년~2006년 : 산업기술기반조성사업 3건 신규 지원(연도별 1건씩)
55) 2002년 : 9개지역(대전충북충남, 전북전남제주, 강원경북울산) 11개 지역전략산업진흥사업 지원
2004년 : 4개지역(대구, 부산, 광주, 경남) 4개 지역전략산업진흥사업 지원
2005년 : 지역전략산업진흥사업 중 지역혁신산업기반구축 5개 지원
2008년 : 지원기반정비 및 효율성 제고를 위해 13개 센터에 2단계 사업 지원
56) 2009년~2010년 : 산업원천기술개발사업으로 4개 연구개발지원 인프라 지원(건강기능성식품플랫폼, 신약개발플랫폼, Drug Repositioning, 바이오화학실용화센터)
57) 2011년~2012년 : 융합바이오 지원 등을 위한 산업핵심/산업기반 연구지원 인프라 3개 지원(지역특화융복합연구, 항노화산업화제품개발, 항노화연구지원인프라)
58) ㆍ글로벌 Top 10 CRO(Frost&Sullivan, 2015) : Quintiles, Covance, Parexel International, PRA Health Science, PPD, ICON Plc, InVentiv Health, Charles River Lab., WuXi AppTec, INC Res.
ㆍ세계적인 CMO(Datamonito, 2013) : Boehringer Ingelheim, Lonza, Sandoz, Fujifilm, DSM
(중국 : Autekbi, SL Pharm, WuXi Apptec, 인도 : Biocon, Dr.Reddy's, Aurigene, 브라질 : Recepta, EuroPharma)
1) 정신질환 진단 및 통계 편람 제 5판, 2013.
2) 2013 범죄분석, 2013, 대검찰청.
3) 교통사고통계, 2015, 도로교통공단.
4) Galea et al., Epidemiology Reviews, 2005; Kessler et al., Archives of General Psychiatry, 1995
5) Davidson et al., Psychological Medicine, 1991; Helzher et al,, New England Journal of Medicine, 1987
6) Haagsma el al., Injury Prevention, 2011
7) 질병부담은 조기사망으로 인한 생존년수의 상실(years of life loss; YLL)과 장애로 인해 정상적인 삶을 살지 못하는 건강년수의 상실(years lost due to disability, YLD)의 합인 장애보정생존년수(disability adjusted life year, DALY)로 추정할 수 있다.
8) 외상에 노출된 모든 사람에게 일괄적으로 개입하여 특정 치료 전략을 제공하는 것
9) 외상에 대한 정상 반응을 교육하고, 사고에 대한 감정 반응이나 본인의 경험을 서로 나누는 접근 방식
10) PTSD에 대한 여러 연구들에서 외상 경험 당시와 외상 경험 직후 3개월(peri-traumatic period)의 기간 동안에 일어나는 뇌의 기능적, 구조적, 화학적 변화가 궁극적인 외상후 스트레스/정서 장애 발생에 중요한 역할을 한다고 보고하고 있다(출처: Zhang et al.,Meddical Hypotheses, 2009).
11) Schmidt et al., Disease Markers, 2013
12) Schmidt et al., Disease Markers, 2013; Zhang et al., Medical Hypotheses, 2009
13) 외상 후 스트레스에 따른 뇌인지장애 극복 사업 기획연구, 2014.



1. 서론
현대 생명공학기술을 활용하여 개발된 유전자변형생물체(Living Modified Organisms, LMO)는 1996년 상업적 재배가 시작된 이후로 GM작물의 재배면적은 꾸준히 증가하여 100배 이상 증가되었으며 GM동물, GM미생물 등 그 활용 범위도 넓어지고 있다. 또한 다양한 분야에서 유전자변형생물체에 대한 연구개발이 활발히 진행되고 있어 앞으로 그 이용이 더 늘어날 전망이다. 그러나 한편으로는 유전자변형생물체의 위해성에 대한 우려가 지속적으로 제기되고 있으며, 규제강화 등의 요구로 이어지고 있다.
한국바이오안전성정보센터(KBCH)에서는 전문조사기관인 한국리서치를 통해 대국민 LMO 인식조사를 진행하였으며 그 결과 응답자 10명 중 8.5명 꼴(84.7%)로 유전자변형생물체 및 그 외 관련 용어를 인지하고 있는 것으로 나타났다. 유전자변형생물체에 대하여 들어본 적이 있는 응답자들을 대상으로 유전자변형생물체에 대한 이해정도를 묻는 문항에서 유전자변형생물체 인지자의 4.4%가 유전자변형생물체의 생산과정과 활용분야에 대하여“꽤/아주 많이 알고 있다.ʼʼ라고 응답하였으며, 43.8%가“잘 알지 못한다.ʼʼ고 응답하여 LMO에 대한 이해정도는 여전히 낮은 수준으로 나타났으며 유전자변형생물체에 대한 우려도 높게 나타나고 있다.
유전자변형생물체, 유전자변형기술에 우려가 존재함에 따라 국제사회에서는 유전자변형생물체의 국가간 이동의 규제에 초점을 두어 유전자변형생물체의 안전한 이동, 취급 및 이용에 관한 규정과 절차를 확립함으로써 바이오안전성을 확보하고자 바이오안전성의정서(Cartagena Protocol on Biosafety, CPB)를 채택하였다. 국내에서는 바이오안전성의정서의 국내 이행을 위해 2001년 3월 산업자원부(現산업통상자원부)가 주관이 되어 「유전자변형생물체의 국가 간 이동 등에 관한 법률」(이하 LMO법)을 제정․공포․시행하고 있다.
바이오안전성의정서는 2000년 1월 캐나다 몬트리올에서 열린 ʻ생물다양성협약ʼ(CBD, Convention on Biodiversity, 이하 CBD) 특별당사국총회에서 채택되었으며 ʻ사전예방적 접근방식(Precautionary Approach)ʼ에 따라 잠재적 위해성에 관한 과학적 확실성이 없더라도 환경피해를 방지하기 위한 비용효과적인 조치를 취할 수 있도록 하였으며, ʻ사전통보합의절차(Advance Informed Agreement)ʼ를 규정하여 수출국(자)가 환경방출 LMO에 대한 의도적 국가간 이동전에 수입국에 사전 통보하여 수입국의 동의를 획득하도록 하고 있다. 의정서는 2003년 6월 팔라우가 50번째로 비준함에 따라 2003년 9월 국제적으로 발효되었고, 2015년 8월 기준, 170개국1)(유럽연합포함)이 가입하고 있다.
LMO법 제정․공포 이후 각 관계기관별로 동법 시행에 필요한 하위 법령 제정을 위해 노력해 왔고, 2007년 8월 이러한 노력의 마지막 단계로서 LMO법 통합고시안이 입법예고 되었다. 이후 2007년 10월 3일 의정서에 비준함으로써 143번째 가입국이 되었으며 2008년 1월 1일에 의정서 및 LMO국내법이 시행되었다. 2012년 LMO법의 시행 5년을 맞아 그동안의 생명공학 기술의 발전과 환경변화에 대응하기 위해 LMO법을 개정‧공포하였다.
이에 본 절에서는 2014년부터 2015년 상반기까지의 LMO를 둘러싼 국제법적 논의 동향과 더불어 우리나라가 동 의정서의 이행과 국내 바이오안전성 확보를 위해 어떠한 노력을 전개해왔는지 등에 대해 기술한다.
[표 5-1-1] 바이오안전성의정서 가입현황(2015년 8월 기준 170개국)
|
구분1) 지역 |
의정서 발효 기준 50개국2) |
발효 기준일 이후 가입국 |
국가 수 |
|
아프리카 |
보츠와나, 카메룬, 지부티, 가나, 케냐, 레소토, 라이베리아, 말리, 모리셔스, 모잠비크, 탄자니아, 튀니지, 우간다(13) |
나이지리아, 부르키나파소, 남아공, 세네갈, 에티오피아, 마다가스카르, 이집트, 잠비아, 세이셸, 감비아, 토고, 르완다, 알제리, 니제르, 나미비아, 짐바브웨, 베냉, 에리트레아, 콩고민주공화국, 수단, 리비아, 모리타니, 카보베르데, 스와질란드, 콩고, 차드, 가봉, 기니, 부룬디, 중앙아프리카공화국, 말라위, 코모로, 앙골라, 기니비사우, 소말리아, 모로코, 코트디브아르(37) |
50 |
|
아시아 ․ 태평양 |
부탄, 피지, 인도, 몰디브, 마샬군도, 나우루, 니우에, 오만, 팔라우, 사모아(10) |
몽고, 북한, 말레이시아, 캄보디아, 통가, 요르단, 이란, 일본, 키프로스, 베트남, 방글라데시, 타지키스탄, 시리아, 키리바시, 스리랑카, 솔로몬, 라오스, 인도네시아, 중국, 파푸아뉴기니, 태국, 예맨, 필리핀, 카타르, 키르키즈스탄, 사우디아라비아, 대한민국, 미얀마, 투르크메니스탄, 카자흐스탄, 파키스탄, 바레인, 레바논, 아프가니스탄, 이라크, 아랍에미레이트, 팔레스타인(37) |
47 |
|
중남미 ․ 카리브해 |
바베이도스, 볼리비아, 콜롬비아, 쿠바, 에콰도르, 멕시코, 니카라과, 파나마, 세인트키트네비스, 트리니다드토바고, 베네수엘라(11) |
세인트 빈센트, 앤티카바부다, 엘살바도르, 브라질, 바하마, 그레나다, 벨리즈, 파라과이, 페루, 도미니카, 과테말라, 세인트루시아, 도미니카공화국, 코스타리카, 가이아나, 수리남, 온두라스, 우루과이, 자메이카(19) |
30 |
|
중앙․동유럽 |
벨로루시, 불가리아, 크로아티아, 체코, 몰도바, 슬로베니아, 우크라이나(7) |
루마니아, 리투아니아, 슬로바키아, 폴란드, 헝가리, 라트비아, 에스토니아, 아르메니아, 알바니아, 아제르바이잔, 유고, 세르비아, 몬테네그로, 그루지야, 보스니아(15) |
22 |
|
서유럽 ․ 기타 |
오스트리아, 덴마크, 유럽연합, 프랑스, 룩셈부르크, 노르웨이, 스페인, 스웨덴, 스위스, 네덜란드(10) |
터키, 아일랜드, 영국, 독일, 이탈리아, 벨기에, 그리스, 핀란드, 포르투갈, 뉴질랜드, 몰타공화국(11) |
21 |
출처 : 바이오안전성의정서 홈페이지(www.biodiv.org/biosafety/)내용 재구성
2. 국제 LMO 법․제도 및 바이오안전성 동향
가. 제7차 바이오안전성의정서 당사국총회 개최 및 논의동향
바이오안전성의정서 당사국들의 의정서 이행사항을 점검하고 필요시 결정문을 통해 추가 규정을 제정하는 역할을 수행하고 있는 의정서 당사국회의는 2004년부터 개최되고 있으며, 2014년 9월 우리나라 평창에서 제7차 바이오안전성의정서 당사국회의(이하 COP-MOP7)가 개최되었다.
COP-MOP7에는 당사국 대표(168개 당사국 중 113개국 참석)를 비롯하여 비당사국, 국제기구, 산업계, NGO 등에서 총 1,000여명이 참가하였는데, 우리나라에서는 정석진 산업통상자원부 바이오나노과장을 수석대표로 하여 KBCH, 농촌진흥청, 국립농산물품질관리원, 국립수산과학원, 질병관리본부, 국립환경과학원에서 총 36명이 대표단으로 참석하였다. 당사국회의에서는 실무그룹회의와 총회를 거쳐 의무준수, 책임 및 구제 등 총 14개 의제에 대한 보고서와 결정문을 채택하였다. 특히 우리나라는“코리아 바이오안전성 능력형성 이니셔티브ʼʼ를 제안하였으며, 이니셔티브를 통해 효과적인 의정서 이행이 달성될 수 있기를 희망한다고 발언하였다.
우리나라 대표단은 바이오안전성정보센터 운영, 위해성평가, 사회․경제적 고려 등에 대한 발언을 통하여 관련 내용이 최종 보고서 및 결정문에 반영되었으며, 의무준수위원회 위원으로 최승환 교수(경희대 법학전문대학원)가 선출되어 2015년부터 공식 위원으로 참여하는 성과를 거두었다.
주요 의제로 논의된 <의제 4> 의무준수위원회는 효과적인 의정서 이행을 위해서는 재정지원뿐만 아니라 BCH를 운영 관리하기 위한 기술지원도 중요하며, 국제협력, 지역협력, 국가간 협력, 의정서 사무국과의 협조, 국가내 부처간 협력이 모두 중요하다고 강조하였다. 2014년 9월 29일 총회 세션에서는 2014년에 임기가 종료되는 5명의 의무준수위원을 대신할 새로운 5명의 멤버를 선출해야 함을 공지하고, 2015년부터 임기를 시작할 5명의 의무준수위원을 각 지역그룹에서 선출하였다. 아시아-태평양 지역에서는 한국의 최승환 경희대학교 교수가 의무준수위원으로 선출되어 우리나라에서 새로운 의무준수위원을 배출하는 성과를 얻게 되었다.
<의제 5> 바이오안전성정보센터의 운영 및 활동과 관련해 우리나라는 국제바이오안전성정보센터(BCH)의 능력형성을 위한 재정적 지원을 지속할 것을 약속하였으며, 2015년부터 2020년까지 매년 BCH 능력형성을 위한 워크숍을 우리나라가 지원하는 ʻ코리아 바이오안전성 능력형성 이니셔티브(Korea Biosafety Capacity-Building Initiative, 이하 코리아 이니셔티브)ʼ를 제안하여 큰 호응을 보였다.
<특별세션> 바이오안전성의정서 이행 10년이 지나가는 시점에서 바이오안전성 이행과 관련한 당사국들의 경험을 공유함으로써 효과적인 의정서 이행을 촉진하기 위해 처음으로 바이오안전성의정서 이행 특별 세션이 진행되었다. 이 세션은 장호민 한국바이오안전성정보센터장이 의장 역할을 수행하였으며 우리나라 대표단의 단장인 정석진 산업통상자원부 바이오나노과장은 코리아 이니셔티브를 구체적으로 제안하였다.
<의제 13> 사회‧경제적 고려 의제는 사회‧경제적 고려의 개념을 명확하게 하는 단계를 벗어나지 못하여 당사국 사이에서 많은 논의가 있었으며, 우리나라의 대표도 콘택트그룹에 적극적으로 참여하여 사회․경제적 고려에 대한 구체적인 가이드라인 개발을 위한 AHTEG 운영기간을 연장하고, 온라인 토론 그룹 운영과 정보 수집 등을 사무국에 요청하고 있는 결정문 초안을 전반적으로 지지하며, 관련 정보 제출 및 온라인, 오프라인 논의 과정에 향후 적극적으로 참여할 계획을 밝혔다.
우리나라는 COP-MOP7 개회식(산업부 장관 주관)을 비롯하여 본회의 합동 기자회견 2회 등을 원활하게 진행하여 COP-MOP7의 성공적 개최에 기여하였다. 특히, 회의 기간 중 매일 저녁 열린 COP-MOP7 의장단 회의를 이인호 의장대행이 주관하면서 주요 의제 등에 대한 논의가 원활하게 이루어질 수 있도록 직간접적으로 지원하였다.
또한 ʻ바이오안전성의정서 이행 특별세션ʼ에서 우리나라 대표단은 ʻ바이오안전성 전략계획 2011~2020ʼ과 연계하여 바이오안전성의정서 실효성 확보와 개도국 능력형성 지원을 목적으로 ʻ코리아 바이오안전성 능력형성 이니셔티브(이하 코리아 이니셔티브)ʼ를 제안하였다. 코리아 이니셔티브는 대한민국 정부가 주도하는 ʻLMO 안전관리 교육ʼ 및 ʻBCH 능력형성 프로그램ʼ, 협약 사무국이 주관하는 ʻLMO 위해성평가 훈련ʼ 및 ʻLMO 검출 및 식별 능력형성ʼ으로 구성되어 있다. 산업부는 2015년부터 2020년까지 6년간 프로그램을 진행할 계획이며, 2014년 말 산업부와 협약 사무국간 MOU 체결을 통해 이니셔티브가 구체화되었다. 2016년 12월 멕시코에서 개최 예정인 제8차 바이오안전성의정서 당사국회의를 통해 코리아 이니셔티브의 진행 경과와 성과에 대한 중간 점검이 있을 것으로 전망된다.
나. 책임․구제 추가의정서
바이오안전성의정서 제27조(책임 및 구제)를 근거로 제1차 바이오안전성의정서 당사국회의(2004년 2월, 쿠알라룸푸르)부터 논의를 시작하여 제5차 당사국회의(2010년 10월, 나고야)에서 채택된 ʻ책임 및 구제에 대한 나고야․쿠알라룸푸르 추가의정서ʼ(이하 추가의정서)가 채택되었다. 추가의정서는 유전자변형생물체와 관련된 책임과 구제 분야에 있어 국제 규칙 및 절차를 제공함으로써 인체 건강에 대한 위해를 고려함과 동시에 생물다양성의 보전과 지속가능한 이용에 기여하는 것을 목적으로 하고 있다. 이 추가의정서에 적용되는 범위는 의정서와 마찬가지로 식품․사료․가공 목적 LMO, 밀폐이용 LMO, 환경방출 LMO 모두를 포괄하고 있다.
이외에도 추가의정서에는 LMO와 피해간의 인과 관계, 피해가 발생할 경우의 대응 조치, 책임의 면제와 시효, 구상권, 재정 보증, 국제 불법행위에 대한 국가책임, 이행 및 민사책임 관계 등을 규정하고 있으며, 인과 관계 등 많은 부분을 국내법에 위임하고 있다. 추가의정서 제18조에 따라 바이오안전성의정서 당사국만이 추가의정서에 가입할 수 있으며, 40번째 비준서가 기탁된 날로부터 90일 이후에 발효한다.
추가의정서에는 총 51개국이 서명하였고, 2015년 5월 현재 알바니아, 불가리아, 체코, EU, 아일랜드, 라트비아, 리투아니아, 멕시코, 노르웨이, 스페인, 스웨덴, 시리아, 룩셈부르크, 몽골, 독일, 캄보디아, 기니비사우, 루마니아, 부르키나파소, 헝가리, 네덜란드, 베트남, 핀란드, 슬로베니아, 우간다, 아랍에미레이트, 스위스, 인도, 에스토니아, 덴마크, 영국, 슬로바키아 등 총 32개국이 가입하고 있다. 발효 조건인 40개국 가입을 현재 9개국(EU 제외)을 남겨 놓고 있는 상황이어서 조만간 국제적으로 추가의정서가 발효될 것으로 전망된다.
다. 경제개발협력기구(OECD) 논의 동향
경제협력개발기구(Organization for Economic Cooperation and Development, 이하 OECD)는 생물다양성협약(the Convention on Biological Diversity, 이하 CBD)의 부속서인 바이오안전성의정서(Biosafety Protocol) 이행에 있어서, OECD 회원국 간의 생명공학기술 규제법 및 제도와 관련한 국가 간 규제에 대해 조화를 유지하고 무역마찰을 최소화하기 위하여 1995년 4월 전문가 그룹회의를 처음 구성하여 약 9개월 간격으로 실무회의를 개최하고 있다. 회의의 주요 목표는 워크샵 등을 통해 LMO의 위해성 평가 국제표준기술서들의 초기 체계를 구축하고 다음 단계인 바이오트랙 온라인(Bio-Track Online, OECD LMO산물 데이터베이스)을 확립하여 회원국 및 비회원국에서 활용토록 하는 데 있다. 이에 따라 2014년 2월 제28차 ʻ생명공학 규제조화 작업반 회의(Working group on Harmonization of Regulatory Oversight in Biotechnology)ʼ와 같은 해 4월 제21차 ʻ신규식품사료의 안전성 작업반회의(The Task Force for the Safety of Novel Foods and Feeds)ʼ가 개최되었다.
(1) 생명공학 규제감시조화 작업반 회의
OECD ʻ생명공학기술의 규제감시조화 작업반회의ʼ는 우리나라를 포함한 프랑스, 미국, 일본, 독일, 네덜란드, 캐나다 등 20개국 회원국, 유엔환경계획(UNEP) 사무국, 경제산업자문위원회(BIAC, Business and Industry Advisory Committee), ILSI-CERA, ICGEB 및 비회원국 참관인(러시아, 아르헨티나, 브라질, 필리핀, 남아프리카공학국, 방글라데시, 인도네시아) 등 총 35개국 국가‧기관 90명과 OECD사무국 직원들이 참가한 가운데 개최되었다.
OECD에서는 표준기술서 개발을 위해 수년간 식물분야(수목포함)에 대해 기술합의서 작성을 준비하고 있으며, 작물 5품목, 수목 1품목에 대한 논의를 진행하고 있다. 기술합의서가 완료된 품목은 수수(Sorghum)가 있으며, 현재 작업 중인 카사바(Cassava), 동부(Cowpea-중국콩) 2품목은 2013년도에 제안되어 현재 초안 작업을 진행 중에 있다. 수목인 유칼립투스는 3차의 수정안에 대해 미국, 일본의 검토의견을 반영하여 주도국인 호주가 개정안을 제출할 예정에 있다. 동물분야에서는 대서양 연어의 생물학 기술합의서 개발 지연에 대한 보고, 모기의 기술합의서가 지속적으로 작성되어 보고되고 있다.
그밖에도 GM종자와 GM농산물의 저수준 혼입(Low Level Presence, 이하 LLP) 환경 위해성 평가 관련해 LLP 위해성평가와 상업적 방출 위해성평가의 비교표, GMO 검정을 위한 정보공유, 위해성평가 결과 의미가 없을 경우의 ʻ무조치(no action)ʼ 이외의 4가지 조치사항 등의 내용이 포함된 최종 LLP합의문이 2013년 9월 공개되었다. GM식물의 환경방출시 위해성/안전성평가와 관련한 합의문이 캐나다 주도로 진행 중에 있으며 그 경과가 보고되었다.
(2) 신규식품사료안전성작업반회의
신규식품사료안전성작업반은 유전자변형작물에서부터 유래된 식품 및 사료의 안전성 평가를 논의하기 위하여 1999년에 설립되었다. 작업반에서는 세계 여러 국가들 중에서 정보수집이 가능한 국가들을 대상으로 안전성 또는 위해성 평가, 평가방법 수집 등에 관한 일들을 주로 수행하고 있다.
3. 국내 LMO 법․제도 및 바이오안전성 동향
가. 「유전자변형생물체의 국가간 이동 등에 관한 법률」(LMO법)의 개정
「생물다양성협약(CBD, Convention on Biological Diversity)」의 부속의정서인 「바이오안전성에 관한 카르타헤나의정서(CPB, Cartagena Protocol on Biosafety, 이하 바이오안전성의정서)」의 국내 이행법으로 2001년 3월 28일 법률 제6448호로 제정·공포된 LMO법이 시행된 것은 그로부터 7년이 지난 2008년 1월 1일이었다. 다시 그로부터 5년여가 지난 2013년 12월 12일에는 개정 LMO법이 시행되었다.
우리나라 LMO법의 제정‧공포 시기와 발효시기 사이에 약 7년의 차이가 있다 보니, 그 사이에 생명공학기술의 발전에 따른 현실과 법의 내용에 이질적 요소가 존재하였으며, 또한 법 시행 이후, 유전자변형미생물의 개발 및 산업화가 본격적으로 이루어지며 법률 개정 수요가 발생하게 되었다. 법 시행 이후 각 부처의 유전자변형생물체(LMO, Living Modified Organisms, 이하 LMO) 안전관리 실무현황을 반영한 통합고시를 개정하여 2014년 7월 30일 개정·공포하면서 이른바 LMO 안전관리의 정착기에 들어서게 되었다. 최근 LMO법의 개정 경과는 [표 5-1-2]와 같다.
[표 5-1-2] LMO법 정비 경위(2012~2015)
|
구 분 |
추 진 내 용 |
|
2012년 12월 |
LMO법 일부 개정 공포 |
|
2013년 6월 |
LMO법 하위규정(시행령, 시행규칙, 통합고시) 개정 추진 |
|
2013년 12월 |
개정 LMO법 시행 |
|
2013년 12월 |
개정 LMO법 시행령, 시행규칙 시행 |
|
2014년 7월 |
LMO 통합고시 개정 공포 |
|
2015년 2월 |
LMO 통합고시 중 경미한 자구수정을 위한 개정 추진 |
2012년 12월 11일 개정‧공포되고, 2013년 12월 12일 시행된 LMO법(법률 제11536호)에서는 생물체와 후대교배종 정의를 명확히 하였으며 유전자변형 미생물을 생산공정 중에 이용하려는 경우 관계 중앙행정기관의 장에게 시설허가를 받거나 신고하도록 하는 등 생산공정이용시설의 설치허가 등 (제22조의3 및 제22조의4 신설)의 조항을 신설하였다. 또한 유전자변형생물체가 국민 건강과 환경에 미치는 영향을 파악하기 위하여 연구시설, 생산공정이용시설, 사업장, 보관 장소 및 그 주변지역을 조사할 수 있도록 하고(제26조의2 신설), 바이오안전성위원회를 국무총리 소속에서 산업통상자원부 소속으로 변경하고 위원장을 국무총리에서 산업통상자원부장관으로 하며, 바이오안전성위원회의 구성을 장관급에서 차관급으로 하여 실효성을 확보하였다(제31조 개정).
나. LMO법 시행 및 LMO 안전관리
우리나라 LMO 안전관리는 용도에 따라 [그림 5-1-1]과 같이 해당 LMO의 안전관리를 책임지고 있는 관계 중앙행정기관이 지정되어 있다. 바이오안전성의정서 이행에 대한 국가책임기관 역할은 산업통상자원부가 담당하며, 의정서 이행을 위한 국가연락기관 역할은 외교부에서 담당하고 있다. 그리고 국제바이오안전성정보센터(BCH, Biosafety Clearing House)와의 정보 교류 및 LMO관련 국내외 정보의 수집, 관리, 제공 등의 업무는 LMO법 제32조에 따라 국가책임기관에서 지정한 한국바이오안전성정보센터(KBCH, Korea Biosafety Clearing House)에서 담당하고 있다.
용도별 LMO 안전관리는 시험․연구용 LMO는 미래창조과학부, 농림축산업용 LMO는 농림축산식품부, 산업용 LMO는 산업통상자원부, 보건의료용 LMO는 보건복지부, 환경정화용 LMO는 환경부, 해양․수산용 LMO는 해양수산부, 식품․의료기기용 LMO는 식품의약품안전처에서 안전관리를 책임지고 있으며 각 관계 중앙행정기관은 LMO안전관리계획을 수립하고 시행하고 있다. 제1차 안전관리계획 시행에 이어 개정 LMO법에 따른 제2차 유전자변형생물체 안전관리계획을 2013년 12월 12월 개정 LMO법의 발효에 맞추어 수립하고, 국민의견 수렴을 위한 공청회 진행과 바이오안전성위원회의 심의를 거쳐서 최종 확정하여 시행하고 있다.
|
|
|
|
|
|
|
바이오안전성위원회 (심의기구) |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
국가책임기관(산업통상자원부) (의정서 이행 행정 담당) |
|
|
|
|
|
|
국가연락기관(외교부) (의정서 이행 연락 담당) |
||||||||||||||||
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
바이오안전성정보센터 (정보 수집, 관리 등) |
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
미래창조 과학부 |
|
농림축산식품부 |
|
산업통상 자원부 |
|
보건복지부 |
|
환경부 |
|
해양수산부 |
|
식품의약품 안전처 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
시험․연구용 LMO의 수출입등에 관한 업무 |
|
농림축산업용 LMO의 수출입등에 관한 업무 |
|
산업용 LMO의 수출입등에 관한 업무 |
|
보건의료용 등 LMO의 수출입등에 관한 업무 |
|
환경정화용 LMO의 수출입등에 관한 업무 |
|
해양수산용 LMO의 수출입등에 관한 업무 |
|
식품 의료기기용 LMO의 수출입등에 관한 업무 |
|||||||||||
[그림 5-1-1] 바이오안전성 국가관리 체계
우리나라는 유전자변형생물체의 안전관리를 위하여 LMO법에 근거한 통합고시를 제정하여 운영하고 있다. 통합고시는 생명공학기술의 발달과 바이오산업의 발전에 부응하기 위하여 2007년 통합고시 제정 이후 첫 개정을 통하여 유전자변형생물체의 위해성심사 항목을 보다 구체화하고 체계화하여 현재 작물위주의 위해성심사를 동물까지 포함하여 모든 유전자변형생물체의 위해성심사를 진행할 수 있도록 하였으며, 생산공정이용시설의 설치‧운영 기준 및 유전자변형미생물의 안전한 이용절차를 확보하기 위한 기준 등을 마련하였다. 개정 LMO 통합고시는 2014년 7월 30일 최종 공포되어 발효되었다.
다. 산업용 LMO 안전관리 제도
시험‧연구용, 농림축산업용, 보건의료용, 환경정화용, 해양‧수산용, 식품‧의료기기용 LMO를 제외한 섬유‧기계‧화학‧전자‧에너지‧자원 등의 산업분야에 이용되는 LMO를 말하며, 앞에서 언급한 시험‧연구용, 농림축산업용, 보건의료용, 환경정화용, 해양‧수산용, 식품‧의료기기용 LMO를 제외한 모든 LMO는 산업용 LMO이다.
그러나 LMO의 종류가 많아지고 그 용도 또한 매우 다양해지고 있어, 위해성심사 및 승인신청을 준비하는 민원인의 입장에서는 해당 LMO의 용도가 무엇인지 확정하기 어려운 경우가 발생할 수 있는데, 이 경우 산업통상자원부는 7개의 LMO소관 관계부처와 협의를 통하여 해당 LMO의 소관부처를 확정할 수 있도록 하고 있다.
우리나라의 산업용 LMO에 대한 안전관리는 [그림 5-1-2]와 같이 다섯 단계로 구분할 수 있다. 개발 및 연구 단계는 연구기관의 자체적 안전관리와 미래창조과학부 또는 보건복지부의 안전관리가 필요한 단계이다. 산업용 LMO의 개발 이후는 산업통상자원부의 안전관리 업무가 시작되는 단계이다. 산업통상자원부 소관 안전관리 업무는 산업용 LMO를 생산 또는 이용하려는 시설의 국가등록, 개발된 산업용 LMO의 위해성심사, 위해성심사를 통해 적합 판정을 받은 산업용 LMO의 생산‧수입‧이용 승인, 마지막으로 취급관리 및 모니터링 업무이다.

[그림 5-1-2] 산업용 LMO 국가 안전관리
라. 국내 LMO 수출입 현황
2008년 1월 1일부터 LMO법이 시행됨에 따라 해당 관계 중앙행정기관을 통해 시험‧연구용 유전자변형생물체, 식용 유전자변형생물체, 농업용 유전자변형생물체의 수입 승인 또는 수입 신고가 이루어지고 있다. 전체적으로 살펴보면, 시험‧연구용 유전자변형생물체의 수입신고는 지속적으로 증가하는 반면, 식용․농업용 유전자변형생물체의 수입승인은 국제 곡물가격과 재배여건 변화, 국내 보유재고량에 따라 변화하는 추세를 보이고 있다.
2014년 시험‧연구용으로 수입 신고 된 유전자변형생물체는 총 1,439건으로 지속적인 증가 추세를 보여주었고, 식용‧농업용으로 수입승인 된 유전자변형생물체는 총 1,082만 톤, 31.2억 달러 규모로 LMO법이 시행되기 시작한 2008년 이후 처음으로 1천만 톤 이상이 수입승인 되었다. 이는 2013년 미국의 가뭄으로 인해 옥수수 확보가 어려웠던 경험을 바탕으로 식품‧사료업체들이 지속적인 유전자변형생물체 수입을 통해 옥수수 재고량을 크게 늘렸고, 사료제조에 이용되는 소맥(밀)의 상대적으로 높은 가격으로 인해 옥수수로 대체하는 수입량이 증가했기 때문인 것으로 사료된다.
 [그림 5-1-3] 연도별 국내 식용/사료용 LMO 수입량
[그림 5-1-3] 연도별 국내 식용/사료용 LMO 수입량
마. 국내 LMO 연구개발 동향
2000년대 초반부터 시작된 농업생명공학연구 활성화로 국내에는 약 40여 작물 200여종의 GM작물이 개발되고 있는 것으로 추정되고 있다. 다양한 GM작물이 연구개발 되고 있지만 현재 우리나라에서 상업화된 GM작물은 없다. 즉, 시험연구용을 제외하고 GM작물 재배가 이루어지지 않고 있다. 최근 농촌진흥청은 ʻGM작물개발사업단ʼ을 중심으로 상업적으로 이용 가능한 GM작물 개발을 지원하고 있고, 일부 작물은 안전성평가 및 심사 단계에 있다. 또한 GMO를 산업공정에 이용하거나 GMO에서 생산된 유용부산물들을 이용하려는 노력이 확대됨에 따라 국내 GMO 연구개발 및 상업화에도 변화가 예상되고 있다.
ʻGM작물개발사업단(2011년~2020년, 차세대바이오그린21사업)ʼ에서는 현재까지 개발된 유용 GM작물 중에서 안전성 심사기준을 충족시키는 최종 후보인 4종을 선발하여 안전성평가를 실시하고 현재 안전성심사서 작성을 준비하고 있으며 그 중에서도 제주대학교 이효연 박사팀이 개발한 제초제저항성 GM잔디가 2014년 안전성심사를 신청하여 현재 심사가 진행 중이다. 또한 ㈜농우바이오의 한지학 박사팀이 개발한 오이 모자이크 바이러스(Cucumber Mosaic Virus, CMV) 저항성 GM고추도 안전성심사를 준비하고 있다. 이 밖에도 가뭄저항성 GM벼, 대사성 질환 예방에 도움이 되는 레스베라트롤을 생산하는 GM벼 등이 안전성심사를 준비하고 있어 국내에서 개발된 상업적 GM작물을 볼 수 있을 것으로 전망된다.
4. 바이오안전성 정보관리
바이오안전성정보센터(Biosafety Clearing House, 이하 BCH)는 바이오안전성 정보관리를 위한 정보협력 메커니즘의 효율적 수행을 지원하는 핵심이라 할 수 있다. 이를 위해 의정서 제20조에서는 관련 정보와 경험의 교환 촉진, 개발도상국 등의 의정서 이행 지원 등을 위해 BCH를 설치하며, BCH로의 정보제공 등을 규정하고 있다. 아울러 의정서 정부간위원회에서는 유전자변형생물체 정보의 효율적 관리 및 유통을 위해 국가별 BCH 구축 및 운영을 권고하고 있다. 국가별 BCH는 각국의 의정서 국가이행사항 및 국내 안전성정보의 통합관리, 대국민 교육 및 홍보를 담당하고 있다. BCH와 국가별 BCH는 지속적인 상호 정보교류를 통한 전세계 바이오안전성 확보를 위해 노력하고 있다.
우리나라는 국제법적 정보의무사항 이행과 바이오산업의 건전한 발전을 위한 유전자변형생물체 정보의 체계적․통합적 관리 및 정보공개의 필요성을 「유전자변형생물체의 국가간 이동 등에 관한 법률(LMO법)」의 규정에 반영하였다. 의정서 제19조에 따라 국가연락기관은 외교부로 하고 국가책임기관은 산업통상자원부로 정하였으며, 국가책임기관인 산업통상자원부는 2002년부터 한국생명공학연구원 내에 바이오안전성정보센터(이하 KBCH)를 설치하여 의정서 및 LMO법의 이행과 그 지원을 위한 관련능력 형성을 지원해 왔다. 2008년부터 LMO법이 시행됨에 따라, KBCH는 국내외 유전자변형생물체 관련정보를 수집․관리․제공․홍보하기 위한 업무를 정식적으로 수행하고 있으며, 이를 위하여 LMO 국가통합정보망2), 바이오안전성패밀리 사이트(바이오안전성 포탈3), 영문포탈4), 토론대회5), LMO포럼6)) 등의 LMO 정보관리체계(이하 ʻ바이오안전성 정보시스템ʼ)를 구축․운영하고 있다. LMO법에서 정한 7개 관계중앙행정기관들은 LMO의 용도별로 LMO의 개발․생산․수입․수출․판매․운반․보관 등(이하 수출입 등)의 업무를 수행하고 있으며, LMO 통합정보망에 필요한 유전자변형생물체 관련 정보를 KBCH에 제공하고 있다.
가. 국가통합정보망
LMO 국가통합정보망은 의정서 및 LMO법의 정보의무사항 준수 및 이행을 위해 LMO관련 개발․실험, 위해성평가 및 심사, 생산, 수출입과 기타 안전관리 등에 필요한 정보를 국가 전체 차원에서 통합․관리하기 위한 폐쇄 형태의 관계기관간 정보 네트워크이다. 유전자변형생물체관련 정보를 실무적으로 관리하는 관계기관에는 미래창조과학부, 산업통상자원부, 식품의약품안전처, 농촌진흥청, 국립농산물품질관리원, 농림축산검역본부, 국립종자원, 질병관리본부, 국립수산과학원, 국립환경과학원 등이 있으며, 지속적인 유전자변형생물체 관련 정보교류와 회의 등을 통해 관계기관 간의 유기적인 협조 체계를 유지하고 있다.
나. 바이오안전성포털
바이오안전성포털은 KBCH가 유전자변형생물체 및 바이오안전성에 관한 국내외 정보 및 통계를 국민(산‧학‧연‧관‧민)에게 제공하기 위해 2004년부터 구축‧운영하고 있는 대표적인 커뮤니케이션 채널로서 일반인은 물론 일반기업, 생명공학관련 연구자들까지 이용 가능하도록 다양한 수준의 콘텐츠를 지속적으로 제공하고 있다. 날로 변화하는 사용자의 다양한 요구에 부응하고, 계층별 이용자들이 만족할만한 콘텐츠를 제공하기 위하여 KBCH는 최신 뉴스를 요약‧제공하는 1차적인 활동뿐만 아니라 이를 바탕으로 각종 동향보고서(주간/월간/국가별/작물별 등)와 GMO리플릿, 뉴스&이슈 등의 가공된 자료를 새롭게 제공하고 있다.
5. 바이오안전성 커뮤니케이션
바이오안전성의정서는 LMO의 안전한 이동, 취급, 이용에 대한 공공인식을 촉진할 수 있도록 협력해야 함을 규정하고 있다. 의정서 제23조(공공인식 및 참여)에서 당사국은 LMO와 관련된 의사결정 과정에서 자국의 법령에 따라 공중과 협의하고, 공중이 그러한 결정의 결과를 이용할 수 있도록 규정하고 있다. 또한 공공인식 및 교육을 통하여 수입가능성이 있고 확인된 LMO의 정보에 접근할 수 있도록 보장하는 것을 당사국이 노력해야 한다고 정하고 있다. 이 규정에 따라 우리나라를 비롯한 각국 정부는 국가적 차원에서 일반대중에게 바이오안전성 및 LMO에 대한 정보를 투명하고 올바르게 제공하고자 다양한 방식의 커뮤니케이션 활동을 펼치고 있다.
가. LMO포럼 세미나
2008년 LMO법의 시행과 LMO 수입‧이용에 대한 정보가 공개됨에 따라 LMO 이해당사자는 물론, 전문가, NGO 및 일반시민들이 LMO 정보를 공유하고 소통하는 커뮤니케이션의 필요성이 대두되었고, 이에 LMO관계자 및 일반시민 누구나 자유롭게 LMO 정보를 공유하고 LMO 궁금증을 해결하거나 자신의 의견을 낼 수 있는 토론의 장을 제공하고자 LMO 포럼세미나를 2010년부터 정기적으로 개최하고 있다. 2013년에는 미국 오레곤주에서 발견된 미승인 GM밀 이슈와 관련해 ʻ미승인 LMO를 중심으로 본 유전자변형생물체 안전관리 정책방향ʼ을 주제로 세미나를 개최해 최신 이슈를 바탕으로 국내 안전관리 방향을 진단해 볼 수 있는 자리를 마련하기도 하였다. 또한 ʻ제2차 LMO 안전관리계획 공청회ʼ, ʻ2014 LMO 법제도 설명회ʼ 등을 그 주제로 LMO 이해당사자들이 LMO법을 이행하는데 도움이 되고자 노력했다.

[그림 5-1-4] LMO국가통합정보망
나. 각 계층별 커뮤니케이션 활동
KBCH에서는 2009년 시범적으로 개최한 토론대회를 시작으로 2010년부터 ʻ전국 고등학생 바이오안전성-바이오산업 토론대회(이하 토론대회)ʼ를 개최하고 있다. 2013년 토론대회는 “바이오산업의 발전을 위한 합성생물학의 적용은 바람직한가?(예선)ʼʼ, ʻʻGMO는 기후변화에 대한 대응책이 될 수 있는가?ʼʼ를 논제로 진행하였으며 2014년에는“식량안보 확보를 위해 GMO를 적극 도입하는 것이 바람직한가?ʼʼ를 논제로 토론대회를 진행하여 토론문화 확산과 학생들이 다각적이고 심도 깊은 토론을 통해 생명과학에 대한 폭넓은 이해와 과학적 소양 함양에 기여할 수 있도록 하였다.
이 밖에도 GMO 제품의 주 소비층이자 가족과 자녀를 위한 먹거리에 관심이 많은 주부들을 대상으로 ʻGMO 바로알기 설명회(이하 설명회)ʼ를 2012년부터 정기적으로 개최하고 있다. 또한 사회적 영향력 및 활동이 증가할 대학생을 대상으로 ʻGMO 바로 알기ʼ 프로그램의 필요성을 인식하고 생명공학 및 GMO에 관심 있는 대학생을 대상으로 ʻKBCH 대학생 기자단ʼ을 선발하여 운영하고 있다.
다. 관계 중앙행정기관의 LMO 커뮤니케이션
시험‧연구용 LMO에 대한 안전관리를 담당하고 있는 미래창조과학부에서는 생물안전관리(책임)자, 연구종사자들을 위한 맞춤형 프로그램을 신설‧확대 운영하고 있고 안전문화 확산을 위하여 학회대상 안전문화 홍보활동 및 대국민 공모전, 워크숍 등 다양한 홍보활동을 실시하고 있다. 농림수산용 LMO안전관리를 담당하고 있는 농림축산식품부에서는 LMO 이해당사자들을 대상으로 간담회, 세미나 및 법령설명회 등을 개최하고 있으며 LMO 안전관리 갈등대응 매뉴얼 제작․배포, KBS 과학카페 ʻ생명과학의 미래코드 유전자ʼ를 제작․지원하는 등 LMO에 대국민 이해증진을 도모하였다. 식품의약품안전처는 ʻ유전자변형식품정보 사이트ʼ를 통해 GMO의 이해, GMO 안전성, GMO 표시, GMO 자료실, GMO 소식 등의 메뉴를 바탕으로 GMO에 대한 정보를 제공하고 있다.
6. 향후전망
2015년, 올해로 바이오안전성의정서가 발효된 지 12년째가 되었으며, 제정 LMO법 시행 8년이 되었다. 그 동안 산업통상자원부를 비롯한 관계부처와 바이오안전성정보센터 등 관계기관에서는 국제협약과 국내법을 근거로 LMO 안전관리를 위해 노력을 다해왔다고 자부할 수 있다. 또한 바이오안전성의정서 이행 책임기관인 산업통상자원부는 관계부처와 협력하여 변화된 국내외 사정에 적합한 LMO법 체제 구축을 위하여 최선을 다할 예정이다. 우선 LMO법을 개정하여 2013년 12월 12일부터 시행 중이며, 2015년 중에는 하위법령인 시행령, 시행규칙, 통합고시 중 개정 수요를 파악하여 LMO 및 바이오안전성과 관련한 최근 상황이 합리적으로 반영된 LMO법 및 하위 규정 체제를 갖추어 시행할 수 있도록 법·제도의 정착을 추구할 것이다.
특히 산업용 LMO의 위해성심사 신청, 생산승인 신청, 생산공정이용시설 국가등록 및 산업용 유전자변형미생물 이용승인 신청이 다수 있을 것으로 예상되는 바, 관련 안전관리 업무를 체계적이고 합리적인 방향에서 진행하도록 노력할 것이다. 한편, 현재 산업용 유전자변형미생물을 이용하여 산업용 소재를 생산하고 있는 것으로 파악되는 업체의 사례를 적극 발굴하여 법적 의무사항을 이행할 수 있도록 권고하고, 해당 기관 자체적인 안전관리방안을 마련할 수 있도록 교육 및 훈련을 지원할 것이다. 또한 「LMO로 인한 피해 책임 및 구제에 관한 나고야․쿠알라룸푸르 추가의정서」국내 입법 및 시행을 준비하기 위한 절차를 지속적으로 진행할 계획이며 수년 간 진행하여 마련된 ʻ나고야․쿠알라룸푸르 추가의정서 전문가 포럼ʼ을 통한 추가의정서 주요 내용과 이슈, 국내외 동향을 분석, 국내 입법체제를 마련하기 위한 기초 작업의 결과를 바탕으로 관계부처와 협의하여 국내 입법안을 마련하고, 국민 의견 수렴 및 국제적 진행상황에 맞추어 입법 절차를 진행할 계획이다.
우리 정부는 LMO로 인한 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 대한 위해를 방지하기 위하여 LMO의 위해성 심사, 수입승인, 운송․보관․유통, 연구개발 등과 관련한 안전관리에 최선을 다하고 있다. LMO 관계기관뿐만 아니라 LMO의 개발․생산․수입․수출․판매․운반 및 보관 등의 관련활동에 종사하고 있는 이해당사자, 그리고 시민단체를 포함한 우리나라 국민 모두가 LMO법의 시행에 적극 협조하여 바이오안전성의 확보 및 바이오산업의 건전한 발전의 토대가 형성될 수 있기를 기대한다.

1. 정책의 방향
생명공학 발전 정책 중 생명윤리와 가장 관련 있는 정부의 정책은 「생명윤리 및 안전에 관한 법률(이하 생명윤리법)」이다. 2005년 제정된 생명윤리법은 인간의 배아와 세포, 유전자 등을 대상으로 생명현상을 규명하고 활용하는 과학과 기술에서 생명윤리 및 안전을 확보하기 위해 제정되었으며 지난 2013년 2월 전면개정 및 시행되었다. 개정된 생명윤리법은 배아 및 유전자의 취급은 물론, 인간 및 인체유래물 등을 대상으로 연구하는 의생명과학연구, 사회과학행동관찰연구까지 생명윤리 및 안전의 확보를 중요하게 취급하고 있다.
개정된 생명윤리법의 중요한 특징은 생명윤리법 제10조제1항 각호의 기관들7)과 그 밖에 생명윤리 및 안전에 관하여 사회적 영향을 미칠 수 있는 기관의 다양한 활동에 대하여 스스로 생명윤리 및 안전을 확보하도록 하기 위해 기관생명윤리위원회(Institutional Bioethics Committee)를 설치하여 운영하도록 하는 것이다.
이러한 변화는 황우석 사태를 겪으면서 아무리 훌륭한 연구 성과라 하더라도 기본적인 연구윤리나 생명 존중 및 안전 등 포괄적인 생명윤리의 확보 없이는 그 성과가 사회적으로 의미 있게 정착하고 성장하기 어렵다는 연구 환경의 변화를 의미한다고 할 수 있으며, 연구 진흥 및 촉진 등의 연구지원 일색의 구조를 탈피하고자 한 정책적 반영이었다.
2. 기관생명윤리위원회의 역할 및 특징
생명윤리법에 따른 기관생명윤리위원회(이하 기관위원회)는 개정 전에 각 기관에 설치되었던 기관생명윤리심의위원회(Institutional Bioethics Review Board)나 약사법에 따라 임상시험실시기관에 설치된 소위 ʻIRB(Institutional Review board)’로 알려진 임상시험심사위원회와 유사하나 그 성격이 조금 다르다.
다시 말하면, 기존 IRB는 주로 피험자 보호를 위한 연구계획서 심의기구였던 반면, 생명윤리법의 기관위원회는 연구계획서 등 어떤 연구나 활동 계획에 대한 과학적, 윤리적 타당성을 심의하는 심의 기능뿐 아니라, 심의를 받고 수행 중인 연구나 활동에 대한 조사, 감독은 물론, 이러한 심의, 조사 및 감독 등을 시행할 수 있는 인프라의 종사자 교육이나 지침 마련 등의 다양한 활동까지 포함한다. 즉, 단순한 심의나 심사의 기능만을 수행하는 수동적 기구가 아닌 해당 기관에서 생명윤리 및 안전을 확보하기 위한 적극적인 업무를 수행할 수 있는 기구로 규정되어 있다. 때문에 다른 위원회와는 달리 운영지원인력 등 해당 업무만을 전담하는 행정 조직 및 인력이 필요하다는 특징이 있다.
주요 역할은 생명윤리법 제3조에서 기본원칙8)을 제시하고는 있으나 법률에서 그 밖에 기관위원회 업무의 기준이나 절차를 구체적으로 강제하고 있지는 않기 때문에, 사실상 각 기관에서 심의‧조사‧감독의 기준 및 절차, 조치 등에서부터 해당 기관의 연구자 및 종사자에 대한 교육 및 지침의 마련까지 자체적으로 마련할 수 있는 재량권을 갖는 상당히 자율적 규제 기구에 해당한다. 다만, 위원회는 수행되는 연구나 관련 활동에서 연구대상자 또는 기증자 등을 보호하기 위한 적절한 권한이 필요하므로 기관장이 위촉하여 기관장 직속에 설치하도록 하고 있다. 기관으로부터의 독립성 확보를 위해 기관과 이해관계가 없는 외부위원을 위촉하고 반드시 위원회 의사정족수에 포함하게 하는 등 위원회의 몇 가지 구성 및 운영 요건을 강제하고 있다.
물론, 어떤 측면에서 보편적이고 절대적이어야 하는 ʻ생명윤리ʼ와 ʻ안전ʼ이 자율적 규제의 대상이 되어야 하는 부분에 대해서는 반론이 가능할 것이다. 하지만 일방적이고 획일적일 수 있는 법률적 규제에 비효율성이 적용된다는 것은 빠르게 발전하고 창의성이 요구되는 과학기술 및 연구 개발 등에 종사하는 연구자 및 연구기관의 자율적 환경을 상당히 고려한 규제라 할 수 있다.
3. 연구용 인체유래물 등의 윤리적 관리
생명윤리법의 전면개정이 생명공학의 연구 분야에 미치는 중요한 변화는 인체유래물의 연구목적 활용에 대한 기증자의 자율성, 즉 동의의 강조 등 연구용 인체유래물 등의 윤리적 관리에 관한 규제이다.
과거 인체로부터 유래한 인체구성물 즉, 검체를 연구용으로 활용하는 것은 매우 제한된 범위의 연구 인력이 수행하는 연구 분야였으나, 유전체학 및 생물정보학 등 맞춤의료를 목적하는 연구의 증가는 새로운 융합기술의 혁신적 발전으로 NGS와 같이 검체뿐 아니라, 유전정보 그리고 해당 검체의 주체인 대상자의 임상정보 등 개인정보까지 연계된 인체자원으로 인식되고 있다.
이에 따라 의료기관에서 진료 및 검사 등을 목적으로 채취된 인체유래물은 해당 환자의 임상정보 등과 결합하여 연구목적으로 이용할 수 있는 자원으로 인식되고 있으며, 비교적 최근까지도 의료기관에서 진료 등의 목적으로 채취 및 이용된 후 보관되고 있는 인체유래물은 해당 의사들이 소유권을 주장할 수 있는 연구재료로 인식하고 있었고 그것이 어색하지 않았다. 그러나 1990년 미국 캘리포니아 대학의 Moore 사건을 계기로 인체유래물의 주체인 당사자의 권리와 생명공학기술의 개발 및 발전 사이에 어떤 균형이 필요하다는 것을 인식하게 되었고 그 이후 인체유래물은 그 채취 이유 및 목적과 관계없이 즉, 원래 채취된 1차 목적 이외의 사용을 위해서는 그 목적 및 방법 등에 대한 다양한 정보를 해당 주체에게 제공하고 자율적으로 획득하는 ʻ충분한 정보에 의한 동의(Informed Consent)ʼ가 강조되고 있다.
생명윤리법에서도 연구 전 인체유래물연구자에게 해당 인체유래물연구 참여자 즉, 해당 검체의 주체로부터 인체유래물연구의 목적과 개인정보의 보호 및 처리에 관한 사항, 인체유래물의 보존 및 폐기 등에 관한 사항, 인체유래물과 그로부터 얻은 유전정보의 제공에 관한 사항 및 동의의 철회와 동의 철회 시 인체유래물등의 처리, 인체유래물 기증자의 권리, 연구 목적의 변경 등에 관한 사항에 대해 설명하고 자발적으로 동의를 받을 것을 요구하고 있다.9) 또한, 인체유래물의 2차적 사용이나 제3자에게로의 제공 등에 대해서는 별도의 동의를 받도록 하고 있으며, 인체유래물을 통한 거래 등을 방지하기 위한 무상 제공의 원칙을 마련해 두고 있다.10) 물론, 인체유래물을 통한 연구적 성과로 이익의 창출이 가능할 수 있다. 따라서 이 법에서는 이러한 영역에서 연구 참여자의 권리를 구체적으로 규정하고 있지는 않지만, 연구자가 연구 참여자로부터 받아야 하는 동의서 서식 하단 설명에 ʻʻ6. 귀하의 인체유래물등을 이용한 연구결과에 따른 새로운 약품이나 진단도구 등 상품개발 및 특허출원 등에 대해서는 귀하의 권리를 주장할 수 없으며ʼʼ로 명시된 것으로 볼 때, 어느 정도 연구자의 이익 창출에 관한 사항을 인정한 것이라 할 수 있다.
다만, 연구자는 연구 참여자로부터 충분한 정보에 의한 동의를 받고(제37조), 연구 참여자로부터 동의 받은 범위 내에서 기관위원회의 승인을 받은 인체유래물 연구에 사용하며(제38조), 동의권자의 요구에 따라 해당 인체유래물을 취급하고 기관위원회 승인 범위 외에서 인체유래물 등을 이용하거나, 제공 또는 이관 및 폐기 시에 기관위원회 승인을 받고, 이러한 사항을 인체유래물등의 관리 대장을 통해 기록 및 보관하게 하는 등을 요구하고 있다(제38조 내지 제39조).
다만, 인체유래물 기증자의 보호 법익이 없다고 판단되는 상황의 연구에 대해서 일부 인체유래물연구에 대한 심의를 면제할 수 있도록 하는 규정11)을 제공하고 있으며, 인간 대상연구에 준하여 연구대상자의 동의를 받는 것이 연구 진행과정에서 현실적으로 불가능하거나 연구의 타당성에 심각한 영향을 미친다고 판단되는 경우로 연구대상자의 동의 거부를 추정할 만한 사유가 없고, 동의를 면제하여도 연구대상자에게 미치는 위험이 극히 낮은 경우에 기관위원회 승인을 거쳐 동의를 면제할 수 있도록 규정하고 있다(제16조).
4. 결론
생명과학기술의 발전은 계속될 것이다. 그러나 그러한 과학기술의 발전은 과거와 달리, 기술의 발전으로 인한 영향력이 상당히 크고 비가역적인 경우가 종종 있다. 특히, 혁신적인 기술과 그 적용인 경우에 그렇다. 그 동안 과학의 역사가 실수와 오류의 반복을 통해 성장해 왔다는 점은 최근 혁신적인 바이오분야의 기술 및 그 적용에 대한 윤리적 기준과 절차를 강조하게 된 반증일 수 있다.
연구자는 연구를 하는 것이 인류의 발전과 국민건강증진 및 국익의 창출이라고 생각한다. 사실, 그러한 마음은 진심이고 어느 정도 사실이기도 하다. 그러나 그 과학기술의 발전이 우리 사회, 그리고 미래 사회에 어떤 영향을 미칠 것인가를 생각해보는 연구자는 많지 않다. 그러나 생명을 대상으로 또는 생명을 위해 또는 생명에 대하여 연구하는 생명공학 또는 생명과학기술이라면, 그 기술의 발전이 종국에 누구를 위한 것인지에 대한 깊은 성찰이 필요해 보인다. 그리고 그 성찰은 연구자만의 몫일 수 없으며 반드시 보편적 가치에 따른 윤리적 숙고의 결과로 사회적 합의를 통해 나아가야 할 것이다.

1. 개요
생명공학 분야는 살아 있는 생물체를 발명의 대상으로 하고 있다는 특성 때문에 다른 기술 분야와는 별도의 독특한 지식재산권 제도를 운영하고 있다. 현재까지도 이 분야는 연구 방법이 지속적으로 개발되어 새로운 유형의 발명이 증대되고 있고, 특허 출원의 내용과 수준도 날로 복잡‧다양해지고 있다. 이에 따라 생명공학 분야는 특허성 판단을 위한 심사 실무나 청구범위의 해석, 침해 여부의 판단에 이르기까지 모든 단계에서 다른 기술 분야와 차별화된 특수성을 보이고 있으며 이에 부합하는 심사의 질 제고와 제도의 변화가 요구되고 있다.
그동안 미생물에 특허를 허여할 수 있는가 하는 문제에서부터 출발해서 인간의 유전자나 생물체 자체, 그로부터 분리된 물질과 진단‧수술‧치료 등 의료 관련 방법을 특허 대상으로 허여할 것인지에 이르기까지 생명공학 분야의 특허 대상을 놓고 국가별로 상당한 논란이 계속되어 왔고, 현재 이 분야의 특허 대상 및 발명의 성립성에 대해서는 국가별로 상이한 기준을 가지고 있는 실정이다. 또한 생명공학의 급속한 발전이 가져온 배아복제나 배아줄기세포 관련 발명 등은 인류의 의료기술에 획기적인 기여를 할 것으로 예상되는 반면 일각에서는 인간 복제의 가능성 등에 따른 사회윤리적인 문제도 제기하고 있다.
생명공학 분야는 기술의 특성상 장기간의 연구 개발을 통해 특허가 창출 되므로 지식재산권을 통한 연구결과의 보호가 필수적인 분야라는 점에서 국제적인 공감대가 형성되어 있으며, 인간 유전체 연구(Human Genome Project)의 완성 이후 국가 간에 유전체 관련 핵심기술을 선점하기 위한 경쟁이 치열하게 전개되는 양상을 보이고 있다. 질병의 조기진단과 개인별 맞춤형 의료 및 바이오 의약품 개발을 위한 기반 기술인 유전정보 분석기술, 약물 유전체학, 줄기세포 연구 등이 포스트 게놈 시대의 신산업 성장 동력으로 부상하고 있음에 따라 원천‧핵심기술의 확보와 이를 위한 국가 차원의 장기적 투자가 이 분야 산업 경쟁력의 핵심으로 자리 잡을 전망이다.
생명공학 기술이 사회 전반에 영향을 미치게 될 바이오 경제의 시대가 도래함에 따라 국제 경쟁력 확보를 위해서는 기술의 파급력과 영향력이 높은 지식재산권의 창출이 필수적이다. 우리나라는 특히 생명공학 분야를 21세기를 이끌어갈 전략사업의 하나로 인식하고 있으므로 정부의 장기적 로드맵에 따라 유전체‧단백질체‧생명자원‧바이오의약‧의료기기 등의 기술 분야에 체계적이고 효율적인 R&D 투자가 요구된다. 또한 개발된 연구 성과물들에 대해서는 지식재산권으로 보호‧활용하는 등의 산업 육성 전략을 통해 국내 생명공학 산업을 지속적으로 성장‧발전시킬 필요성이 대두되고 있다.
2. 생명공학 분야 특허출원 및 등록 현황
가. 특허출원 현황
생명공학 분야는 그 응용기술에 따라 크게 4개 분야로 구분되고, 이 4개 분야는 유전체, 단백질, 생물자원 관련 기술인「기초 분야」, 측정‧진단 등의「생물공정 분야」,「의약 분야」및 바이오 농약, 신규 동‧식물 개발 기술인「농업 분야」로 분류된다. 생명공학 분야 전체의 특허출원은 2011년에 6,306건, 2014년에 7,429건이 출원되어 매년 꾸준한 성장세를 보이고 있다.
[표 5-3-1] 연도별 생명공학 분야 특허출원 현황
(단위 : 건)
|
구 분 |
’10년 |
’11년 |
’12년 |
’13년 |
’14년 |
’15년7월* |
연평균 증가율 |
|
|
특허출원 건수 |
특허 전체 |
170,101 |
178,924 |
188,915 |
204,589 |
210,292 |
118,166 |
5.4% |
|
생명공학 분야 |
5,987 |
6,306 |
6,506 |
7,081 |
7,429 |
3,330 |
5.5% |
|
|
비중(%) |
3.5% |
3.5% |
3.4% |
3.5% |
3.5% |
2.8% |
3.5%(평균) |
|
* ʼ15년은 연평균 증가율 및 평균에서 제외하였음
나. 특허등록 현황
특허청은 2007년까지 심사 대상 물량의 증가에 따라 심사관을 꾸준히 증원하고 심사처리기간을 큰 폭으로 단축시킨 결과, 생명공학 분야의 특허등록 건수도 2005년 2,022건에서 매년 꾸준히 증가하여 2007년에는 2,830건에 이르렀다. 그러나 이후 특허심사정책이 심사품질 중심으로 패러다임이 전환됨에 따라 심사처리물량 및 특허등록 결정률이 감소하여 이 분야 특허등록 건수도 2009년에 1,443건, 2010년에는 1,755건으로 감소하였다. 2010년 이후에는 안정적인 심사품질 및 꾸준한 심사관 증원으로 2011년에 2,669건, 2014년에 4,530건의 특허등록으로 가파른 특허등록 결정률 증가 추세를 보이고 있다.
생명공학 분야의 2014년 특허등록 현황은 기술 분류별로 국제특허분류기호 (IPC)12) A61K와 C12N에 해당하는 바이오 의약품 관련 발명, 미생물‧효소‧ 유전공학에 대한 발명이 각각 1,342건(전체 비중 29.6%)과 1,202건(전체 비중 26.5%)으로 전체 특허등록 건의 약 56%로 높은 비중을 차지하고 있다. 또한, 생명공학 분야의 핵심기술의 하나인 단백질 관련 발명은 연평균 등록 증가율이 25.6%를 보이며 높은 증가율을 보이고 있고, 식물 신품종, 시험, 측정, 분리‧정제 관련 발명과 진단시약 관련 발명이 꾸준한 특허등록 증가세를 보이고 있다. 반면 미생물 이용 폐수처리 관련 발명은 상대적으로 비중이 작아지고 있다.
생명공학 분야 전체 등록특허 연평균 증가율은 5.5%로 특허 전체 연평균 증가율 5.4%와 큰 차이를 보이지 않고 있다. 이는 등록특허의 70% 이상을 차지하는 내국인 출원 발명이 원천기술에 관한 것이라기보다는 개량‧응용기술에 대한 것이어서 상대적으로 높은 증가세를 보이지 못하는 것으로 판단되고, 이러한 문제를 개선하기 위해서는 앞으로 국내에서도 원천‧핵심기술을 개발하여 강한 특허를 등록받을 수 있도록 생명공학 산업 전체의 기술개발 투자가 확대되어야 할 것이다.
[표 5-3-2] 연도별 생명공학 분야 특허등록 현황
(단위 : 건)
|
분류* |
’10년 |
’11년 |
’12년 |
’13년 |
’14년 |
’15년7월 |
연평균 증가율 |
|
A01H (식물 신품종) |
10 |
19 |
74 |
155 |
149 |
32 |
96.5% |
|
A01K (신규 동물) |
17 |
23 |
30 |
32 |
46 |
18 |
28.3% |
|
A01N (바이오 농약) |
23 |
21 |
36 |
34 |
34 |
14 |
10.3% |
|
A61K (바이오 의약품) |
456 |
868 |
1,112 |
1203 |
1,342 |
755 |
31.0% |
|
C02F (미생물 폐수처리) |
194 |
253 |
235 |
272 |
146 |
50 |
-6.9% |
|
C07H (당류) |
9 |
8 |
15 |
22 |
17 |
6 |
17.2% |
|
C07K (단백질) |
176 |
214 |
361 |
413 |
438 |
270 |
25.6% |
|
C12C∼M (발효 및 장치) |
114 |
156 |
279 |
301 |
389 |
112 |
35.9% |
|
C12N (미생물, 효소 및 유전공학) |
468 |
641 |
930 |
1131 |
1,202 |
697 |
26.6% |
|
C12P (발효 생성물) |
57 |
114 |
118 |
128 |
143 |
79 |
25.9% |
|
C12Q, S (시험 및 분리정제) |
130 |
177 |
290 |
286 |
379 |
251 |
30.7% |
|
G01N (진단 시약) |
101 |
175 |
228 |
306 |
245 |
82 |
24.8% |
|
계 |
1,755 |
2,669 |
3,708 |
4,283 |
4,530 |
2,366 |
26.8% |
* 각 IPC 중 BT에 해당되는 기술분야(서브그룹)의 특허만 계수함.
(연평균 증가율 및 평균에서 ʼ15년 자료는 제외함)
3. 생명공학 분야 심사 인프라 확충
특허청은 급속히 발전하고 있는 생명공학 분야의 새로운 기술을 보호하는 한편 국제화 추세에 발맞추어 생명윤리 문제 등의 판단기준을 명확히 하고자 생명공학 특허 심사기준을 제정하여 운용하고 있으며, 기술개발 추이에 따른 우수특허의 권리를 효율적으로 보호할 수 있도록 심사기준 개정, 전문화된 심사인력 확보, 특허미생물 기탁제도 정비, 유전자서열 DB 구축 등 지식재산권 제도와 인프라를 확충함으로서 첨단 분야인 생명공학관련 특허품질 향상에 노력하고 있다.
가. 생명공학 특허 심사기준의 제정 및 개정
(1) 생명공학 특허 심사기준의 제정(1998년 3월)
생명공학 분야 특허란 직접 또는 간접적으로 자기복제를 할 수 있는 생물학적인 물질(biological material) 즉, 자기 복제력을 갖는 생물, 유전정보 및 그 복제에 관련된 발명을 포함하는 특허를 의미한다. 이러한 생명공학 분야 출원기술의 심사에 대한 표준운영절차를 확립하고자 산재된 생명공학 관련 심사기준을 통합하여 1998년에 생명공학 분야 산업부문별 심사기준을 제정하였다. 유전공학 관련발명, 미생물관련 발명, 식물관련 발명, 동물관련 발명으로 크게 네 개의 분야로 나눠서 심사기준을 신설하고 윤리성 기준과 불특허 요건을 명시하였다.
(2) 생명공학 특허 심사기준 1차 개정(2000년 12월)
인간 유전체 연구(HGP)의 1차 결과가 발표됨에 따라 그의 산물인 DNA 단편, SNP(개체 간 단일염기변이) 등 새로운 형태의 발명이 출원되고 있어 이를 보호할 기준 마련을 위해 개정하였다. HGP의 산물인 EST 등 DNA 단편, SNP 등에 대한 심사기준을 마련하였고, 유전자, 단백질, 모노클로날 항체 등에 대한 포괄적인 청구범위 기재를 인정하며, 안티센스에 대한 기재요건을 추가하는 등 기존의 심사 실무를 반영하였고 대용량 유전정보 출원에 대비한 단일성 판단기준에 대해서 정비하였다.
(3) 생명공학 특허 심사기준 2차 개정(2003년 12월)
생명공학 분야의 새로운 기술을 보호하는 한편, 생명윤리문제의 판단기준을 제시하고 유전공학관련 발명의 실질적인 보호에 중점을 두었다. 이에 따라 유전자 및 단백질 변이체에 대한 청구범위 기재요건을 강화하고 서열로 특정할 수 없는 경우의 단백질의 특정 요건을 구체화하였으며, 모노클로날 항체의 실시가능성요건 및 청구범위 기재요건을 보호하는 등의 보완이 이루어졌다.
(4) 생명공학 특허 심사기준 3차 개정(2005년 5월)
당초 2차 개정안에서는 생명과학기술의 생명윤리 및 안전을 확보하기 위해 제정될 예정이었던 「생명윤리 및 안전에 관한 법률」에 근거하여 생명공학 분야 발명의 생명윤리 문제를 판단하는 내용이 포함되어 있었으나, 법률의 제정 및 시행이 늦어짐에 따라 이 내용이 삭제된 채로 개정되었었다. 3차 개정에서는 「생명윤리 및 안전에 관한 법률」의 시행에 연계하여 정부의 공식 승인을 받은 연구 성과물에 대한 발명은 특허등록 대상으로 하는 한편, 동법에서 금지하는 행위 또는 연구 성과물에 대한 발명은 특허법 제32조의 규정에 의거 특허를 받을 수 없는 발명으로 하여 생명공학분야 발명의 생명윤리 및 안전에 대한 판단 기준을 보완하였다.
(5) 생명공학 특허 심사기준 4차 개정(2006년 9월)
당초 우리 특허법에서는 식물관련 발명의 경우는 특허법 제31조에 의해서 무성적으로 반복 생식할 수 있는 식물에 한하여 특허를 허여하여 왔으나, 국내‧외 특허제도 및 품종보호제도가 발전함에 따라 유성번식 식물도 특허 대상에 포함시키기 위해 특허법 제31조를 삭제(2006년 10월 1일 시행)하게 되었다. 이에 따라 4차 개정에서는 식물관련 특허의 대상을 무성번식방법을 갖춘 식물에서 신규식물 자체 또는 일부분 및 그 육종방법으로 확대하였고, 유성번식 식물의 재현성 요건을 충족시키기 위해 종자 기탁제도를 도입하였다.
(6) 생명공학 특허 심사기준 5차 개정(2010년 1월)
인간 유전자 지도의 완성으로 관련 발명의 출원이 증가되고 다양화되고 있는 상황에서 이를 심사기준에 반영하기 위한 5차 개정에서는, 기능으로 한정한 공지의 유전자 또는 단백질에 대한 신규성 판단기준, 폴리뉴클레오티드 단편이나 안티센스의 진보성 판단기준, 다수의 유전자나 단백질을 마커로 청구하는 경우의 단일성 판단기준을 보완하고 이에 대한 구체적 예시를 부가하였으며, 공지의 미생물과 동일종이면서 기탁번호를 달리하는 미생물의 진보성 판단기준에 대한 예시와 설명을 부가하였다.
(7) 생명공학분야 심사실무가이드 통합 개정(2012년 1월)
심사의 공정성 및 일관성 유지를 통한 심사품질 향상을 위해 생명공학분야 심사실무가이드가 개정(2012년 2월 시행)되었다. 개정된 생명공학 분야 심사실무 가이드는 품질 제고 노력의 일환으로 중복된 내용이 심사기준에 포함되고 일부 심사기준의 활용도가 낮은 문제점을 보완하고자 하였으며, 유형별 사례를 통해 기재요건과 특허요건에 대한 판단기준을 구체적으로 제시하여 쉽게 이해하고 적용할 수 있는 생명공학분야 심사 실무 기준을 정립하였다. 또한 발명의 상세한 설명 기재요건과 관련된 특허법 개정사항과 특허출원의 서열 목록 작성 및 제출 요령에 관련된 고시 개정사항을 반영하였다. 생명공학 분야 심사실무가이드는 특허청 홈페이지(www.kipo.go.kr)의 정보마당(간행물 카테고리)에서 다운받을 수 있다.
(8) 생명공학분야 심사실무가이드 특허‧실용신안 심사기준에 통합 개정(2014년 7월)
특허청 조직개편에 따른 각 부서에 분산 배치된 기술 분야별 심사기준을 특허‧실용신안 심사기준에 통합할 필요성에 따라, 생명공학분야 심사기준의 공서양속 규정에서「생명윤리법」관련 내용을 삭제하고, 심사지침서의 공통기준과 중복되는 내용을 정리하여 특허‧실용신안 심사기준 제9부의 기술 분야별 심사기준에 통합하였다.
[표 5-3-3] 생명공학 분야 심사실무가이드에 따른 특허 보호대상
|
구분 |
대상 |
특허여부 |
비고 |
|
물질 |
유전자 (DNA서열) |
특허가능 |
유용성이 밝혀진 경우만 특허가능 (단순 유전체(genome) 서열만으로는 특허불가) |
|
단백질 (아미노산서열) |
특허가능 |
||
|
단세포 생명체 (virus, bacteria) |
특허가능 |
관련 미생물 기탁 의무 (특허법 시행령 제2조) |
|
|
동물 |
특허가능 (단, 공서양속에 반하지 않는 것) |
동물발명의 동물이란 사람을 제외한 다세포 동물을 의미함 |
|
|
식물 |
특허가능 |
유성번식 식물의 경우 종자기탁을 통해 재현성 요건 충족 |
|
|
인간의 신체 부분 |
특허불가 |
인체의 존엄성을 해치는 발명은 특허대상에서 배제 (인체에서 旣 분리․배출된 것은 가능) |
|
|
방법 |
수술, 치료방법 |
사람 특허불가, 동물 특허가능 |
사람의 치료․진단 방법은 의료행위에 해당하므로 산업상 이용가능성이 없는 것으로 봄 (특허법 제29조제1항본문) |
|
유전자 치료법 |
사람 특허불가, 동물 특허가능 |
||
|
진단방법 |
사람 특허불가, 동물 특허가능 |
나. 심사 전문 인력 확보 및 역량 강화
특허청은 생명공학 분야의 특허출원 증가에 효율적으로 대처하고 심사 전문성을 제고하기 위하여 해당분야 전문 심사인력을 지속적으로 채용하고 있다. 또한 기술 간의 융합화 현상이 진전되고 있는 생명공학 분야의 신기술을 점검하고, 관련 기술 및 특허 동향을 분석하기 위하여 이 분야의 청 내‧외 인사들로 구성된『바이오특허 연구회』를 운영하고 있다. 바이오특허 연구회를 통해 바이오 또는 지재권분야 전문가 세미나 및 토론회를 개최함으로써 최신 기술과 정보를 습득‧교류하는 기회를 마련하고, 연간 활동 보고서를 발간‧배포하는 등 심사의 질적 향상과 생명공학 기술의 전파에도 적극 노력하고 있다.
다. 유전자 서열목록 제출제도 시행 및 관련 DB 구축
특허청은 핵산 또는 아미노산 관련 발명의 신속‧정확한 검색 및 서열 DB 구축을 위하여, 1999년 이후 특허 출원된 발명에 대해서는 핵산염기 및 아미노산 서열목록을 특허청에서 제공하는 소프트웨어 또는 특허청 홈페이지에서 작성한 전자파일(서열목록전자파일) 형태로 출원 명세서와 함께 제출하도록 의무화하였다13). 이 서열목록은 출원서에 첨부된 명세서의 마지막(도면이 있는 경우 도면의 다음)에 기재하며 독립된 쪽 번호를 부여하고, 온라인 출원의 경우에는 서열목록전자파일을 명세서에 입력하여 서열목록을 기재하는 것을 가능하도록 하는「핵산염기 서열목록 또는 아미노산 서열목록 작성기준(특허청 고시 제2013-1호)」을 개정하여 서열목록의 명세서 기재 방법을 쉽고 명확하게 하였다.
또한 특허청은 2004년에 한국생명공학연구원과 업무협정을 체결하고, 특허 출원된 유전자 서열 데이터를 한국생명공학연구원 내 국가생명연구자원정보 센터에 제공하고 있으며, 유전자서열 검색 시스템을 통합 운영함으로써 검색 기능과 속도가 비약적으로 향상된 검색 시스템을 확보하여 운영 중이다. 2007년 10월부터는 한‧일 특허청간 유전자 서열 DB교환을 통해 검색 DB를 확대 운영하고 있고, 서열목록정보의 국제적 관리 및 공유는 세계 3대 서열목록 관리기관인 DDBJ14)(일본), GenBank15)(미국), EMBL16)(유럽)에 의해 이루어지고 있으며, 특허청은 일본 DDBJ를 통해 특허청 서열목록정보를 국제적으로 공유할 수 있는 협조체계를 마련하고 있다. 한편, 국가생명연구자원정보센터에서는 매월 특허 공개분에 대한 특허서열을 특허청에서 제공받아 국내외 연구자들이 자유롭게 특허서열을 검색하고 이용할 수 있도록 웹기반의 검색 서비스17)를 제공하고 있다.

[그림 5-3-1] 세계 3대 서열목록 관리기관과 각국 특허청 협조체계도
4. 미생물 기탁제도 운영
가. 미생물 기탁제도의 취지
미생물18)에 대한 발명은 살아 있는 생명체를 대상으로 하는 것이어서 특허 명세서에 아무리 상세하게 미생물의 균학적 성질이나 그 외의 다른 특성을 기재한다 하더라도 제3자는 그 미생물을 재현하거나 입수하여 그 발명을 실시하는 것이 실질적으로 불가능할 수 있다. 이처럼 미생물 발명에서 그 발명이 속하는 기술 분야에서 통상의 지식을 가진 자가 특허 명세서 내에 반복 재현할 수 있도록 기재하는 것이 불가능한 경우가 발생하기 때문에 이를 보완하기 위해 서면주의의 예외적 규칙으로「미생물 기탁제도」가 마련되었다. 이 제도는 출원인으로 하여금 해당 미생물을 공인기관에 기탁하도록 하여 제3자가 일정조건(기탁자 또는 특허청 허락)하에 분양을 받아 당해 발명을 쉽게 실시할 수 있도록 하는 제도로써, 미생물 발명의 일정한 확실성과 반복생산 가능성의 문제를 해결하고 있다.
미생물에 관계되는 발명에 대하여 특허출원을 하고자 하는 자는 특허법시행령 제2조에 따라 그 미생물을 특허청장이 정하는 기탁기관인 국내기탁기관 또는 특허절차상 미생물 기탁의 국제적인 승인에 관한 부다페스트 조약19)에 따른 국제기탁기관에 기탁하고 그 수탁증을 출원서에 첨부하여야 하며, 2015년 개정법령에 따른 미생물 기탁제도에서는 특허출원서의 서지사항에 산업자원부령으로 정하는 방법에 따라 그 취지를 기재토록하고 있다20). 다만, 그 발명이 속하는 기술 분야에서 통상의 기술자가 그 미생물을 용이하게 입수할 수 있는 경우는 이를 기탁하지 않아도 되는 것으로 규정하고 있다.

[그림 5-3-2] 미생물 기탁 및 출원 절차 개요
나. 미생물 기탁기관 및 관리 현황
국내의 기탁기관은 아래와 같이 4개의 기관이 운영 중이며, 이들 기관은 발명자가 미생물을 기탁하면 고유번호를 부여하고 수탁증을 발급해 주고 있다. 이와 관련하여, 특허청은 제3자가 연구 또는 시험을 위해 특허관련 미생물의 분양을 신청할 경우 미생물분양자격증명서를 발급하여 기탁미생물의 분양을 허락하고 있으며, 기탁된 미생물의 관리 실태를 분기별로 점검하고 있다.
[표 5-3-4] 국내 미생물 기탁기관 현황
|
구 분 |
한국생명공학연구원 생명자원센터 (KCTC) |
한국미생물 보존센터 (KCCM) |
한국세포주 연구재단 (KCLRF) |
농촌진흥청 국립농업과학원3) (KACC) |
|
국제기탁기관 (지정일) |
자격있음 (1990.06.30.) |
자격있음 (1990.06.30.) |
자격있음 (1993.08.31.) |
자격있음 (2015.05.01.) |
|
국내기탁기관 (지정일) |
자격있음 (1981.08.25.) |
자격있음 (1981.08.25.) |
자격없음 |
자격있음 (2002.01.01.) |
* 2015년 09월 30일 기준
한국생명공학연구원 생명자원센터(KCTC), 한국미생물 보존센터(KCCM) 및 농촌진흥청 국립농업과학원(KACC)은 국제기탁기관 및 국내기탁기관으로 지정되어 있고, 한국세포주 연구재단(KCLRF)은 국제기탁기관으로 지정되어 있어, 국제특허출원뿐만 아니라 국내특허출원 시에도 기탁기관으로 인정된다.
[표 5-3-5] 기탁기관별 미생물 기탁 및 분양 현황21)
(단위 : 건)
|
구 분 |
한국생명공학연구원 생명자원센터 (KCTC) |
한국미생물 보존센터 (KCCM) |
한국세포주 연구재단 (KCLRF) |
농촌진흥청 국립농업과학원 (KACC) |
합계 |
|
|
기탁 미생물 |
국내 |
1,357 |
1,717 |
- |
1,516 |
4,488 |
|
국제 |
3,901 |
1,615 |
343 |
3 |
5,964 |
|
|
전체 |
5,258 |
3,332 |
343 |
1,519 |
10,452 |
|
|
분양 미생물 |
591 |
354 |
262 |
309 |
1,516 |
|
기탁 가능한 미생물의 종류는 기탁기관에 따라 다르며, 한국생명공학연구원 생명자원센터(KCTC)가 가장 폭넓은 생물자원에 대하여 기탁 서비스를 제공하고 있으나, 위험하다고 판단되는 성질을 가진 미생물, 특별한 수준의 실험실 요건이 필요한 미생물은 기탁 가능한 미생물에서 제외된다.
[표 5-3-6] 기탁기관별 기탁 가능 미생물
|
구분 |
기탁 가능 미생물 종류 |
생명자원센터 (KCTC) |
한국미생물 보존센터 (KCCM) |
한국세포주 연구재단 (KCLRF) |
국립농업 과학원 (KACC) |
|
미생물 소재 |
비병원성 세균 (Non-Pathogenic Bacteria) |
○ |
○ |
|
○ |
|
방선균 (Actinomycetes) |
○ |
○ |
|
○ |
|
|
비병원성 진균류 (Non-Pathogenic Fungi) |
○ |
○ |
|
○ |
|
|
비병원성 효모 (Non-Pathogenic Yeasts) |
○ |
○ |
|
○ |
|
|
점균류 (Molds) |
○ |
|
|
|
|
|
동물 바이러스 (Animal Virus) |
○ |
○ |
|
|
|
|
식물 바이러스 (Plant Virus) |
○ |
○ |
|
○ |
|
|
조류 (Algae) |
○ |
|
|
|
|
|
박테리오파지 (Bacteriophages) |
○ |
○ |
|
○ |
|
|
동물 소재 |
사람세포 (Human Cell Cultures) |
○ |
|
○ |
|
|
융합세포 (Hybridomas) |
○ |
|
○ |
|
|
|
동물세포 (Animal Cell Cultures) |
○ |
|
○ |
|
|
|
수정란 (Embryos) |
○ |
|
|
|
|
|
비기생성 원생동물 (Non-Pathogenic Protozoa) |
○ |
|
|
|
|
|
식물 소재 |
식물세포 (Plant Cell Cultures) |
○ |
|
|
|
|
종자 (Seeds) |
○ |
|
|
○ |
|
|
유전체 소재 |
진핵생물 DNA (Eukaryotic DNA) |
○ |
|
|
○ |
|
숙주 내 플라스미드 (Plasmids in Hosts) |
○ |
○ |
○ |
○ |
|
|
숙주 외 플라스미드 (Plasmids not in Hosts) |
○ |
○ |
|
|
* 2015년 09월 30일 기준
특허청은 미생물 기탁업무에 대한 개선 대책을 추진하여 부다페스트조약에 어긋났던 일부 미생물 기탁기관의 내부 규정을 개정하고, 기탁기관별로 상이하던 서식을 통일화하였으며, 신청자 편의 위주로 미생물 분양 절차를 간소화하고 온라인 신청체계를 마련하여 특허청 홈페이지에서 온라인상으로도 신청 가능하도록 하였다. 또한 미생물 관련 특허자원의 안정적 보전 및 관리를 위해 2006년에 기존 기탁 미생물 보관 장소와는 별도의 장소에 특허 미생물에 대한 백업을 시행하였으며, 「미생물 기탁기관 지정 등에 관한 고시」를 개정하여 기탁기관의 특허미생물 복제본 보관 의무화 및 보관시설 요건을 규정하였다. 2010년에는 전쟁, 지진 등 비상시에도 미생물 관련 특허자원의 안정적 보존을 담보하기 위해서 각 기탁기관에 비상시 특허 미생물 관리계획을 마련하였다.
현재 특허청은 기탁기관별로 상이한 비상시 특허미생물 관리계획에 대해 기탁기관과 함께 종합화‧통일화를 진행하기 위해 연2회 특허생물자원 기탁기관 운영위원회를 개최 중이고, 국가 특허미생물 통합보존소를 농촌진흥청 국립농업과학원으로 지정(2013년 4월) 운영 중이며, 을지훈련 기간을 통해 특허청과 기탁기관간의 재난대비훈련을 매해 실시하고 있다.
5. 지식재산 및 생명공학 분야 관련 법‧제도
가. 지식재산기본법(법률 제10629호, 2011.07.20. 시행)
우리나라의 지식재산기본법은 지식재산의 창출‧보호 및 활용을 촉진하고 그 기반을 조성하기 위한 정부의 기본 정책과 추진 체계를 마련하여 우리 사회에서 지식재산의 가치가 최대한 발휘될 수 있도록 함으로써 국가의 경제‧사회 및 문화 등의 발전과 국민의 삶의 질 향상에 이바지하는 것을 목적으로 하고 있다. 대통령 소속으로「국가지식재산위원회」를 둠으로써 지식재산에 관한 정부의 주요 정책과 계획을 심의‧조정하고 그 추진상황을 점검‧평가하여 정부 각 부처의 지식재산 관련 정책을 종합‧체계화하여 중복과 비효율을 개선하고 있다.
나. 생명공학 관련 법
(1) 생명공학육성법(법률 제11683호, 2013.03.23. 시행)
생명공학22) 연구의 기반을 조성하여 생명공학을 보다 효율적으로 육성 발전시키고, 그 개발기술의 산업화를 촉진하여 국민경제의 건전한 발전에 기여함을 목적으로 1983년에 제정되었고, 11차에 걸쳐 개정되었다. 이 법은 ʻʻ생명공학에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 의한다.(제3조)ʼʼ고 규정하여 생명공학에 관한 중심적인 법률로서의 지위를 가짐을 선언하고 있다.
6. 국내 바이오 특허 분쟁 사례 (ʻʻ지방 유래 줄기 세포ʼʼ 사건, 특허 제870508호)
가. 사건 경위
특허 제870508호 청구항 제1항은 지방 흡입 유출물인 지방조직을, 3개 이상의 발달 경로로 분화되는 능력을 갖는 미분화된 간세포를 유리하기 위해 사용하는 방법으로서, 상기 방법을 수행하는데 있어서 상기 간세포의 분화를 필요로 하지 않는 방법에 관한 것이다.
특허심판원(2009당3057)은 2012.6.28. 심결에서 피고의 정정청구는 적법하고, 이 사건 정정발명은 비교대상발명 1, 2에 의하여 신규성‧진보성이 부정되지 않는다는 이유로 원고의 무효심판청구를 기각하는 심결을 한다.
특허심판원에서의 쟁점은 정정된 특허발명이 비교대상발명들에 의하여 신규성‧진보성이 부정되는지 여부, 즉 줄기세포 다분화능 및 자가 재생능을 알 수 있는지 여부에 있는데, 비교대상발명 어디에도 지방유래 세포집단이 자가 재생능과 골, 연골, 힘줄, 인대, 골수성 간질, 지방세포 등과 같은 다양한 계통으로 분화될 수 있는 것임을 뒷받침하는 구체적인 자료가 기재되어 있지 아니한바, 비록 발생학적으로 중배엽에 속하는 지방조직이 중간엽 세포를 포함하는 것이기는 해도 이를 비교대상발명에 정의되어 있는 의미의 중간엽 간세포와 동일한 것이라고 할 수는 없다고 결론지었다.
나. 특허법원 판단
지방조직 내에 지방의 전구세포가 존재한다는 것은 당연히 예측할 수 있으나, 전혀 다른 조직인 골 또는 연골의 전구세포가 존재할 것이라고는 쉽게 예측하기 어렵다고 주장할 수 있다. 그러나 비교대상발명 1, 2에서 지방유래 세포 집단의 다분화능을 확인하였다고 기재되어 있으므로, 통상의 기술자라면 이로부터 지방조직 내에 줄기세포가 존재할 수도 있음을 용이하게 예측할 수 있을 뿐만 아니라, 이를 확인할 필요성이 있다고 판단할 경우 비교대상발명의 기재를 참작하여 그 세포 집단을 계대 배양하고 클론을 정립한 후 다분화능과 재생능을 확인해 볼 수 있다고 할 것이어서, 진보성이 부정된다.
다. 대법원의 판단
이 사건 특허발명의 우선권주장일 당시에, 단순한 가능성이나 추측만으로는 지방조직에서 줄기세포의 존재를 인정하기 어려운 것으로 보이는 점, 지방조직에서 분리한 간질세포에는 균질하지 않은 상태로 다양한 종류의 세포가 존재한다고 알려져 있었던 점 등을 고려할 때, 통상의 기술자가 비교대상발명들에 개시된 분화능이 지방조직에 존재하는 단일한 줄기세포의 다분화능에 의한 것임을 인식 또는 예측한다는 것은 용이하다고 볼 수 없고, 오히려 그와 같은 각각의 특정한 분화 경로가 이미 결정되어 있는 전구세포의 혼합에 의한 것이라고 인식할 수 있는 여지가 있을 뿐이다. 또한, 이 사건 특허발명의 명세서에 개시된 발명의 내용을 이미 알고 있음을 전제로 하여 사후적으로 판단하지 아니하는 한, 통상의 기술자가 비교대상발명들로부터 정정된 특허발명의 구성을 용이하게 도출할 수 없다.
결론으로 발명의 진보성 유무를 판단함에 있어서는, 적어도 선행기술의 범위와 내용, 진보성 판단의 대상이 된 발명과 선행기술의 차이 및 그 발명이 속하는 기술 분야에서 통상의 지식을 가진 사람의 기술 수준에 대하여 증거 등 기록에 나타난 자료에 의하여 파악한 다음, 이를 기초로 하여 통상의 기술자가 특허출원 당시의 기술수준에 비추어 진보성 판단의 대상이 된 발명이 선행기술과 차이가 있음에도 그러한 차이를 극복하고 선행기술로부터 그 발명을 용이하게 발명할 수 있는지를 살펴보아야 하는 것이다. 이 경우 진보성 판단의 대상이 된 발명의 명세서에 개시되어 있는 기술을 알고 있음을 전제로 하여 사후적으로 통상의 기술자가 그 발명을 용이하게 발명할 수 있는지를 판단하여서는 아니 된다.

1. 서론
생명공학산업은 DNA, 단백질, 세포 등을 이용한 생명체 관련기술(Bio Technology)을 직접 활용하여 제품과 서비스를 생산하는 신산업으로 의약, 화학, 환경, 식품, 에너지, 농업, 해양 등 다양한 분야에서 활발한 연구가 이루어지고 있으며 21세기 산업성장을 주도할 핵심기술 산업으로 평가받고 있다. 생명공학산업은 의약(Red BT)분야를 필두로 농업(Green BT), 화학(White BT) 산업 등이 주축을 이루고 있다.
특히, 의약 분야의 경우 미국, 유럽, 일본 등 선진국을 비롯한 각국 정부가 미래성장 동력으로 육성하기 위해 경쟁적으로 막대한 예산을 투자하고 있으며, 규제개혁 및 허가심사의 국제조화 등을 통해 제품개발에 유리한 환경을 조성하기 위해 노력하고 있다.
우리나라의 경우 1983년 생명공학육성법이 제정된 이후 「제1차 생명공학육성 기본계획 (1994~2006)」에 따라 생명공학에 대한 국가차원의 체계적인 연구개발 육성에 착수하여 기술적인 인프라를 구축하여 왔다.
2007년부터 생명공학분야 세계 7위의 기술 강국 진입을 목표로「제2차 생명공학육성기본계획(2007~2016)」을 수립하여 그 간의 연구성과를 실용화하기 위한 과제들을 추진해 왔으며, 최근에는 줄기세포치료제 등 첨단 생명공학의약품 (바이오의약품) 개발을 지원함으로써 난치병 환자들의 치료기회를 확대하고 세계시장을 선점하기 위한 노력도 지속해 나가고 있다.
한편, 유전자재조합기술을 이용한 제1세대 생명공학의약품인 ʻ유전자재조합 치료용 단백질 의약품(인슐린, 성장호르몬 등)ʼ이 1980년대에 처음으로 세계시장에 소개된 이후, 유전자재조합 기술을 이용한 제품개발이 활발히 이루어져 왔으며, 특히 2세대 유전자재조합의약품인 고부가가치 항체 의약품이 개발되어 널리 사용되면서 합성의약품 중심의 세계 의약품 시장에서 바이오의약품 비중이 급속히 확대되고 있다. 아울러, 다수 항체 의약품의 특허가 만료되거나 만료 시점이 임박하면서 바이오시밀러 시장을 선점하기 위한 치열한 경쟁이 시작되었으며, 특히 국내에서 세계 최초로 줄기세포치료제 및 항체 바이오시밀러(Bio-Similar)가 개발되고, 한-미, 한-EU FTA가 체결되는 등 국내 제약환경은 큰 변화와 성장의 기회를 맞고 있다.
이상과 같은 국내외 제약환경의 변화에 발맞추어 생명공학의약품 인허가 과정, 국내외 생명공학의약품 개발동향 및 실용화와 관련한 식약처의 역할 등에 대하여 살펴보기로 한다.
2. 생명공학의약품 인허가 과정
생명공학의약품은 인체 유래 물질을 대상으로 하여 유전자 조작, 유전자 이식, 줄기세포 배양 등의 생명공학기술을 적용하여 개발된 의약품으로써 기존의 합성 화학의약품과 마찬가지로 인체의 질병을 치료, 경감, 진단을 목적으로 한다. 따라서 제품의 실용화를 위해서는 반드시 그 제품에 대한 안전성과 유효성 평가를 거쳐야 한다.
의약품이 개발되어 환자에게 사용되기까지는 약 10년 이상의 기간이 소요되는데, 이는 대부분 안전성과 유효성을 입증하기 위하여 실시하는 비임상․임상시험에 해당하며 의약품 개발 기간과 투자비용의 대부분을 차지하고 있다.

[그림 5-4-1] 의약품의 개발과정
범정부 차원에서 차세대 성장 동력으로서 육성․지원하고 있는 생명공학의약품의 실용화는 안전성과 유효성 평가를 위한 자료가 얼마나 과학적이고 합리적인지에 달려있으며, 신약개발기간의 대부분을 차지하고 있는 비임상․임상에 대한 지원과 최종 허가단계에서의 안전성․유효성 심사과정이 국제 경쟁력을 결정하는 큰 요인으로 작용한다고 해도 과언이 아니다.
생명공학의약품의 안전성․유효성을 입증하는 임상시험이 완료된 후, 실용화를 위한 마지막 단계인 의약품 허가를 위해서는 의약품을 생산할 수 있는 GMP(Good Manufacturing Practice, 제조 및 품질관리 기준) 시설 및 시스템이 요구된다. 그간 생명공학의약품을 연구․개발하는 주체인 벤처기업이 막대한 투자비용이 소요되는 GMP 시설을 갖춘다는 것은 바이오 신약개발에 있어 또 하나의 장애 요인으로 작용하였으나, 의약품 제조업 허가와 제조품목허가 분리를 위한 약사법 개정이 이루어짐으로써 제조업 허가와 제조품목허가를 별도로 받을 수 있게 되었다.

[그림 5-4-2] 품목허가 절차
의약품 허가를 받기 위해서는 1상, 2상 및 3상 시험을 모두 수행하여야 하나, 희귀난치성 환자에 신속히 사용할 필요가 있는 희귀의약품 또는 항암제 등의 경우에는 시판 후 3상 임상시험자료 제출을 조건으로 2상 임상시험 완료 후 품목허가 할 수 있으며, 유전자치료제, 세포치료제, 동등생물의약품(바이오시밀러)에 대해서는 준비된 허가심사자료부터 먼저 제출하여 심사받을 수 있는 단위별 심사 제도를 운영하고 있다.
한편, 2011년 약사법의 개정으로 의약품을 개발하는 업체나 연구자들은 임상단계나 품목허가 단계에서 사전상담을 통해 제품개발에 필요한 기술적 지원을 받을 수 있는 사전검토제도가 법제화되었다.
3. 국내외 생명공학의약품 개발동향
가. 세계동향
1982년 Eli Lilly사가 미국 FDA로부터 유전자재조합 인슐린의 허가를 받은 것을 시발로 하여 성장호르몬, 항암보조제 G-CSF, 빈혈치료제인 EPO 등 많은 재조합 단백질이 개발, 실용화 되었다.
현재까지 생명공학의약품은 EPO(erythropoietine, 빈혈치료제), TPA(tissue plasminogen activator, 혈전용해제) 등의 심혈관계 질환약과 CSF(colony stimulating factor, 골수계 성장인자), 인터페론, 인터루킨 등 암 치료제 제품이 괄목할 만한 성장을 보여주었으며 최근에는 혈액질환, 면역계질환, 호흡기 질환 등 많은 질병의 치료에 목적을 두고 개발되고 있다. 또한 난치병과 불치병에 대한 치료 가능성 등의 장점에 의하여 활발한 연구가 진행 중이다.
2세대 생명공학 의약품으로 불리는 항체의약품은 암세포에 특이적으로 부착하여 인체의 면역시스템이 암세포를 제거할 수 있도록 설계된 의약품으로 97년 비호지킨성 림프종 치료제인 리툭산(Rituxan)이 허가된 이후 엔브렐(Enbrel), 레미케이드(Remicade), 허셉틴(Herceptin), 아바스틴(Avastin) 등 현재까지 미국 FDA와 유럽 EMA로부터 30품목 이상이 허가되었다.
[표 5-4-1] 주요 바이오신약 특허만료 현황
|
상품명 |
성분명 |
의약용도 |
개발사 |
특허만료 (미국) |
|
엔브렐(Enbrel) |
에타너셉트(etanercept) |
류마티스관절염 |
Amgen |
2012 |
|
에포젠(Epogen) |
에포에틴알파(epoetin-α) |
빈혈 |
Amgen |
2013 |
|
레미케이드 (Remicade) |
인플릭시맙(infliximab) |
류마티스관절염 |
Johnson & Johnson |
2013 |
|
리툭산(Rituxan) |
리툭시맙(rituximab) |
비호지킨성 림프종 |
Genentech |
2015 |
|
란투스(Lantus) |
인슐린글라진 (insulin glargine) |
당뇨병 |
Sanofi-Aventis |
2015 |
|
휴미라(Humira) |
아달리무맙(adalimumab) |
류마티스관절염 |
Abbott |
2016 |
|
허셉틴(Herceptin) |
트라스트주맙(trastzumab) |
유방암 |
Genentech |
2019 |
|
아바스틴(Avastin) |
베바시주맙(bebacizumab) |
대장암 등 |
Genentech |
2019 |
|
루센티스(Lucentis) |
라니비주맙(ranibizumab) |
황반변성 |
Novartis |
2019 |
출처 : EvaluatePharma, Company Reports(2007)
세계적 시장조사 전문기관인 ʻEvaluatePharmaʼ에 따르면 2014년 현재 세계 생명공학의약품 시장은 총 1,790억달러로 2010년부터 2014년까지 매년 9.1% 성장하였고, 현재 세계 10대 의약품 중 6개 제품이 생명공학의약품이 차지하고 있으며 그 중심에 항체의약품이 있다. 아울러, 위의 표와 같이 블록버스터 바이오신약의 특허만료가 도래함에 따라, 국내․외 업체들이 바이오시밀러 시장에 뛰어들면서 향후 바이오시밀러 신시장이 본격 형성될 것으로 전망되고 있다.
유전자치료제는 유전물질을 인체에 투입하여 유전적인 질병을 치료하고자 하는 목적으로 연구가 진행 중이며 아직까지는 대부분 임상시험 단계에 있으며, 세계적으로 허가된 유전자치료제는 중국의 Genedicine(2003년10월, 두경부암)과 EU에서 허가된 Giybera(2012년 10월, 과지단백증 Ⅰ형)가 있다. 수년 내 제품시장이 본격적으로 형성되기 시작하면 기존의 의약품시장을 대체할 수 있는 막강한 잠재력을 가진 의약품으로 평가받고 있다. 2014년 6월을 기준으로 전 세계에서 2,076건의 임상시험이 진행 중이며 세계 각국에서 빠른 속도로 개발되고 있다.
세포치료제는 1990년대 초반에 시작되어 현재까지 골수 및 조혈모세포 이식, 수지상세포, 자기 활성화 림프구, 줄기세포 등을 이용한 치료법 연구가 활발하게 진행 중이다. 배아줄기세포와 관련한 연구도 여전히 윤리성 논란이 있긴 하지만 희귀난치성 치료 및 글로벌 산업화에 대한 잠재력 때문에 미국을 비롯한 각국 정부의 지원이 확대되고 있다.
나. 국내동향
유전자재조합의약품은 인체에서 생리활성을 나타내는 다양한 효소나 호르몬의 정보를 담고 있는 유전자를 대장균이나 효모와 같은 미생물 등에 이입하여, 목적으로 하는 단백질을 합성해 대량생산으로 제조한 의약품을 말한다. 생명공학의약품 중 가장 많이 허가되어 사용되고 있는 의약품으로서 2014년까지 총 316 품목이 허가되었다.
바이오시밀러의 경우 2012년 처음으로 렘시마주(레미케이드 바이오시밀러, 류마티스관절염 치료)가 허가된 이래 총 6개 품목이 국내‧외에서 허가를 받았으며, 셀트리온, 싸이젠코리아, 삼성바이오에피스 등이 세계시장 선점을 목표로 활발하게 연구개발을 진행하고 있다.
세포치료제는 2001년 1월 연골이식 및 조혈 적응증으로 허가된 자가(自家)유래 세포치료제 ʻʻ콘드론ʼʼ을 필두로, 현재까지 국내에서 13품목이 허가되었으며, 이 중 환자 자신의 세포를 이용한 자가유래 세포치료제가 11품목, 다른 사람의 세포를 이용한 동종(同種)유래 세포치료제가 2품목이다.
그 중에서 줄기세포치료제는 2011년 7월 심근경색치료용 자가유래 줄기세포치료제 ʻʻ하티셀그램-에이엠아이ʼʼ가 세계 최초로 우리나라에서 허가된 이래 총 4품목이 허가되었으며, 모두 성체줄기세포에서 유래한 제품이다.
[표 5-4-2] 국내 바이오시밀러 허가현황(2015.6월 현재)
|
연번 |
제품명(업체명) |
대조약 |
대상질환 |
품목허가 일자 |
|
1 |
렘시마주100mg(셀트리온) |
레미케이드 |
류마티스관절염 등 |
2012년 7월 |
|
2 |
허쥬마주150mg(셀트리온) |
허셉틴주 |
유방암, 위암 |
2014년 1월 |
|
3 |
허쥬마주440mg(셀트리온) |
허셉틴주 |
유방암, 위암 |
2014년 1월 |
|
4 |
싸이트로핀에이카트리지주5mg (싸이젠코리아) |
지노트로핀 |
소아의 성장부전 등 |
2014년 1월 |
|
5 |
싸이트로핀에이카트리지주10mg (싸이젠코리아) |
지노트로핀 |
소아의 성장부전 등 |
2014년 1월 |
|
6 |
다빅트렐주사25mg(한화케미칼) |
엔브렐 |
류마티스관절염 등 |
2014년 11월 |
[표 5-4-3] 세포치료제 허가현황(2015.6월 현재, 줄기세포치료제 4건 포함)
|
연번 |
제품명(업체명) |
특징 |
대상질환 |
품목허가 일자 |
|
1 |
콘드론(세원셀론텍) |
자가유래 연골세포 |
연골이식 및 재생 |
2001년 1월 |
|
2 |
홀로덤(테고사이언스) |
자가유래 피부각질세포 |
피부화상치료 |
2002년 12월 |
|
3 |
칼로덤(테고사이언스) |
동종유래 피부각질세포 |
피부화상치료 |
2005년 3월 |
|
4 |
케라힐(엠씨티티) |
자가유래 피부각질세포 |
피부화상치료 |
2006년 5월 |
|
5 |
크레아박스-알씨씨 (크레아젠) |
자가유래 수지상세포 |
전이성신세포암 |
2007년 5월 |
|
6 |
이뮨셀엘씨주(이노셀) |
자가유래 활성화T림프구 |
간세포암 |
2007년 8월 |
|
7 |
알엠에스오스론 (세원셀론텍) |
자가유래 뼈세포 |
국소 골형성 촉진 |
2009년 8월 |
|
8 |
퀸셀(안트로젠) |
자가유래 최소조작지방세포 |
피하지방 결손 |
2010년 3월 |
|
9 |
큐어스킨 (에스바이오메딕스) |
자가유래 섬유아세포 |
여드름 치유과정에 수반된 함몰 흉터개선 |
2010년 5월 |
|
10 |
하티셀그램-에이엠아이 (에프씨비파미셀) |
자가유래 골수 중간엽줄기세포 |
급성심근경색환자에서 좌심실구혈율 개선 |
2011년 7월 |
|
11 |
카티스템 (메디포스트) |
동종유래 제대혈 중간엽줄기세포 |
퇴행성관절염 |
2012년 1월 |
|
12 |
큐피스템 (안트로젠) |
자가유래 지방 중간엽줄기세포 |
크론병으로 인한 누공치료 |
2012년 1월 |
|
13 |
뉴로나타-알주 (코아스템) |
자가유래 골수 중간엽줄기세포 |
루게릭병 환자의 질환진행 속도 완화 |
2014년 7월 |
국내 세포치료제 임상시험 현황을 보면, 28개 업체에서 심근경색, 뇌경색 또는 척수손상 등의 난치병 치료제를 포함하여 총 103건의 세포치료제 임상시험이 완료되었거나 진행 중이며, 이 중 줄기세포치료제 임상시험은 총 53건으로 이는 미국, 유럽 등과 함께 세계적으로 많은 수치이다.
유전자치료제는 현재까지 우리나라에서 허가받은 유전자치료제는 없으나, 2003년 동아제약에서 허혈성 족부궤양 치료용 유전자치료제가 국내 임상시험을 처음으로 승인받은 이후 2015년 6월 현재까지 총 39건의 임상시험이 종료 또는 진행 중이다.
[표 5-4-4] 국내 유전자치료제의 임상시험 현황(2015년 6월 현재)
|
전체 |
업체 수 |
유전자운반체 |
진행여부 |
||||
|
플라스미드 |
바이러스 |
플라스미드+바이러스 |
유전자변형세포 |
종료 |
진행 중 |
||
|
39 |
18 |
18 |
14 |
1 |
6 |
26 |
13 |
4. 향후계획 및 전망
현재 의약품 시장의 성장률은 둔화되고 있는 반면, 바이오의약품 시장은 확대되고 있어 세계 의약품 시장은 점차 바이오의약품 중심으로 재편되어 나갈 것으로 전망된다. 머지않아, 판매금액 기준으로 세계 100대 의약품 중 50개 정도가 바이오의약품으로 채워질 것으로 예상되고 있다.
향후 줄기세포치료제, 유전자치료제, 바이오시밀러 등의 첨단 바이오의약품의 개발로 인한 새로운 시장의 형성, 이머징 마켓의 성장, IT-BT 등 융합기술 및 3D 프린팅 기술 등 신기술을 활용한 신제품의 등장이 본격화되면 세계시장 선점을 위한 업체들의 경쟁이 더욱 더 치열하게 전개될 것이다.
식품의약품안전처는 업체의 제품개발 및 GMP 시설 관련 기술지원, 첨단제품의 특성에 맞는 허가심사 체계 마련 및 안전성․유효성 심사기준의 국제조화 등을 통해 지속적으로 첨단 바이오의약품의 제품개발을 지원해 나갈 계획이다.

1. 국내외 바이오기업 현황
가. OECD 바이오기업 현황
OECD에서는 바이오 관련 제품생산이나 서비스 또는 R&D를 수행하는 기업을 바이오기업(Biotechnology firm)이라하며, 이 기업 중에서 생산이나 서비스 또는 R&D의 75% 이상이 바이오에 집중된 기업을 바이오집중기업(Dedicated Biotechnology firm)으로 정의하고 각 국가에서 제공받은 데이터를 토대로 「OECD Key Biotech Indicators」를 발표하고 있다.
2015년 7월 발표된 2013년 기준 OECD 바이오기업 현황을 보면, 미국이 11,367개사로 가장 많고 우리나라는 미국, 스페인, 프랑스에 이어 4위인 939개사로 발표되었다. 바이오집중기업의 수는 프랑스가 1,284개사로 가장 많았고, 우리나라는 353개 사로 프랑스, 미국, 독일, 스페인 다음으로 많았으며, 바이오집중기업들의 분야는 ʻ보건의료ʼ 관련 기업이 많았다.

[그림 5-5-1] OECD 바이오 기업 현황(OECD, 2015.7)
OECD 국가의 바이오기업 규모는 대부분이 50명 미만의 소기업으로, 국가별로 보면 미국은 전체 바이오기업의 72%인 8,184개 사, 우리나라는 60.5%인 568개 사가 50명 미만의 소기업이었다.
나. 상장 바이오기업 현황
해외 시장조사컨설팅기업인 Ernst&Young사 자료에 따르면, 미국 상장 바이오기업은 2014년 기준 총 714개 사로 2013년 619개 사와 비교해 15%가 증가하였으며, 이들 상장기업의 매출액은 1,231억 달러로 매출액의 28.8%인 354억 달러를 연구개발비에 투자한 것으로 나타났다.
[표 5-5-1] 미국의 상장 바이오기업
(단위 : 개, $ bln, 명)
|
구 분 |
2014년 |
2013년 |
증감율(%) |
|
상장기업 수(개) |
714 |
619 |
15% |
|
매출액($ bln) |
123.1 |
99.0 |
24% |
|
연구개발비($ bln) |
35.4 |
29.4 |
20% |
|
순이익($ bln) |
14.9 |
4.5 |
231% |
|
시장가치($ bln) |
1,063.4 |
794.8 |
34% |
|
종사자 수(명) |
183,610 |
168,010 |
9% |
자료 : Biotechnology Industry Report 2015, Ernst & Young, 2015
2014년 기준 유럽의 상장 바이오기업은 2013년 164개 사에서 20% 증가한 196개사로 조사되었으며, 이들 상장사의 매출액은 239억 달러로 매출액의 약 23%인 55억 달러를 연구개발비에 투자한 것으로 나타났다.
[표 5-5-2] 유럽의 상장 바이오기업
(단위 : 개, $ bln, 명)
|
구 분 |
2014년 |
2013년 |
증감율(%) |
|
상장기업 수(개) |
196 |
164 |
20% |
|
매출액($ mln) |
23,992 |
20,915 |
15% |
|
연구개발비($ mln) |
5,576 |
4,910 |
14% |
|
순이익(손실) ($ mln) |
3,255 |
1,087 |
199% |
|
시장가치($ mln) |
162,149 |
114,699 |
41% |
|
종사자 수(명) |
58,770 |
54,440 |
8% |
자료 : Biotechnology Industry Report 2015, Ernst & Young, 2015
최근 5년간 시장가치가 가장 많이 상승한 기업을 보면, 미국의 경우 2009년 말 389억 달러에서 2014년 말 1,422억 달러로 1,033억 달러가 상승한 Gilead Sciences가 1위를 차지하였으며, 2위는 646억 달러가 상승한 Biogen, 그리고 Amgen, Celgene, Regeneron 등이 뒤를 이었다. 유럽의 경우는 Shire가 310억 달러가 상승하여 1위를 차지하였으며, Jazz Pharma, Alkermes, Novozymes, Actelion순으로 많이 상승한 것으로 조사되었다.
우리나라의 경우, 국내 유일한 바이오산업 통계인 ʻ국내 바이오산업 실태조사ʼ로 보면 2013년 기준 총 971개 기업 중 상장기업은 총 172개사로 코스닥에 85개사, 유가증권시장에 87개사가 상장되어 있는 것으로 조사되었다. 이들 상장기업의 2013년 기준 바이오부문 매출액은 5조 8,715억 원으로 전년대비 3.8%가 증가하였으며, 투자비는 전년대비 8.1% 감소한 9,347억 원으로 매출액의 15.9%를 투자한 것으로 나타났다.
[표 5-5-3] 우리나라의 상장 바이오기업 현황
|
구 분 |
2013년 |
2012년 |
증감율(%) |
|
|
상장기업 수(개) |
172 |
164 |
4.9% |
|
|
매출액(억원) |
국내판매 |
33,148 |
31,571 |
5.0% |
|
해외수출 |
25,567 |
24,970 |
2.4% |
|
|
(소계) |
58,715 |
56,541 |
3.8% |
|
|
투자비(억원) |
연구개발비 |
7,796 |
7,170 |
8.7% |
|
시설투자비 |
1,551 |
3,001 |
-48.3% |
|
|
(소계) |
9,347 |
10,171 |
-8.1% |
|
|
종사자 수(명) |
19,131 |
18,889 |
1.3% |
|
자료 : 2013년 기준 국내 바이오산업 실태조사, 산업통상자원부/한국바이오협회, 2014 자료 가공
한편, 해외 시장조사 컨설팅 기업에서 발간한 자료에는 우리나라의 상장 바이오기업에 대한 분석 자료가 없고, 각 나라별로 바이오 기술 및 기업에 대한 정의와 범위가 달라 우리나라와 해외 상장 바이오기업 현황을 직접 비교하는 것은 한계가 있다.
2. 바이오기업 지원 제도
가. 기업 지원정책 개발 동향
2014년 7월 대통령 주재로 제11차 국가과학기술자문회의가 개최되었으며, 성장과 복지를 위한 바이오 미래전략, 바이오산업 활성화를 위한 규제개혁방안 등 5개 안건을 보고하였다.
바이오 미래전략에서는 글로벌 시장 진출을 위한 전략으로 바이오시밀러‧베터 등 틈새시장 선점, 줄기세포‧유전자 치료제 등 혁신시장 선도 분야 육성, 융합의료기기 및 진단제품 등 ICT융합 신시장 개척 방안을 제시하였으며, 사업화 연계 기반 확충을 위한 전략으로 치매‧당뇨 치료제 등 민간주도 R&D 촉진, 중개연구 활성화, 바이오 Big Data 플랫폼 구축 등 2대 전략 6개 방안을 제시하였다.
바이오산업 활성화를 위한 규제개혁방안에서는 부처별로 규제개혁 개선과제를 추진 중이나 아직까지 현장에서는 체감도가 낮고 바이오 산업발전을 위해서는 개선해야 할 규제가 많음을 지적하며 신 의료기술평가제도 개선, 유전자치료제 개발 대상 질환 확대, 의료기기 복합‧중복규제 개선, 연구자주도 임상 제도 개선 등 4개의 선도 개선과제를 제안하였다.
한편, 지역특화 전략산업 분야의 중소․중견기업 성장 및 글로벌 진출과 창의적 아이디어 사업화를 통한 창업을 지원하기 위해 창조경제혁신센터가 설립되었다. 바이오분야 관련 센터를 보면, 충북창조경제혁신센터는 바이오 및 화장품 분야 중소벤처를 발굴해 기술개발부터 글로벌 진출까지 맞춤형으로 지원하기 위해 바이오 멘토단을 운영하고 바이오펀드를 조성하였으며, 바이오테크페어를 개최하고 있다. 전남창조경제혁신센터는 농수산식품 발굴과 판로 개척을 통하여 케이푸드를 육성하는 한편, 친환경 바이오화학산업 생태계 조성을 추진하고 있으며, 경남창조경제혁신센터는 천연물소재 개발부터 사업화까지 연계지원을 통해 항노화 벤처창업지원체계를 구축하고, 항노화바이오포럼을 구성하며, 충북창조경제혁신센터 등과의 협력확대를 통해 제품개발과 판로개척을 지원하고 있다.
나. 분야별 주요 지원사업
(1) 바이오의약
바이오 미래전략의 후속조치로 2015년 3월 미래창조과학부․산업통상자원부․ 보건복지부․식품의약품안전처가 공동으로 ʻʻ바이오헬스 미래 신(新)산업 육성전략ʼʼ을 수립하였다. 종전 바이오분야 정부계획이 관련분야 기술을 중심으로 수립되어 R&D에서 산업으로의 연계성이 분명하지 않았다면, 동 전략은 줄기세포‧유전자치료제 등 아이템에 집중하여 기업 희망 아이템 발굴․투자 및 암․난치질환 치료제 등 제품지향형 부처연계사업 도입(R&D), 정부-민간 공동 펀드 활용 글로벌 임상지원 확대 및 해외 인허가 신속 지원(임상), 2017년까지 연구역량을 갖춘 의사 2,000명 확보 및 바이오인포메틱스 등 새로운 분야에 대한 취업 연계형 인력 양성(인력), 해외진출 컨트롤타워를 중심으로 해외진출 전방위 지원(인력) 등 ʻR&D-임상-인력-수출ʼ 등 패키지 지원 내용을 담고 있다.
또한, 식품의약품안전처는 2014년부터 첨단 의약품을 신속하게 제품화하고 글로벌 수출로 연계하기 위한 ʻ팜 나비(Pharm Navi)ʼ사업을 추진하고 있다. 이는 식품의약품안전처가 ʻ제품화 내비게이터ʼ와 ʻ나비ʼ가 되어 신약개발의 리스크를 줄이고 결실을 맺는데 지원자로서의 역할을 하기 위한 사업으로, 의약품 허가심사자가 내비게이터가 되어 실시간으로 개발부터 허가까지 안내자 역할을 하고, 허가심사 정보공개 및 기업 교육프로그램을 운영하며, 신속한 허가심사가 이루어질 수 있도록 대응하며, 주요 수출국가 규제정보 및 WHO 사전적격성평가(PQ) 인증 기술지원 등을 통해 기업의 수출 확대를 지원하고 있다.
(2) 바이오화학
산업통상자원부는 석유의존 탈피, 온실가스 배출규제 등 친환경 무역규제 환경에 대응하고 신성장동력으로 바이오화학산업을 육성하기 위해 2014년부터 5년간 842억원(총사업비 2,155억원)을 투자하는 ʻ바이오화학 산업화촉진기술개발ʼ을 지원하고 있다. 동 사업은 2013년 예비타당성조사를 거쳐 2014년부터 신규로 지원되는 사업으로 바이오화학의 원료가 되는 바이오슈가(sugar) 대량생산기술부터 제품국산화를 위한 소재개발, 바이오화학제품 양산체제 마련을 위한 데모플랜트 구축까지 바이오화학 전주기 기술개발을 위한 6대 전략과제를 지원하게 되고, 각 전략 과제별 특성에 따라 중소 바이오기업과 글로벌 경쟁력을 가진 석유화학기반의 화학기업 및 지자체 등이 컨소시엄을 이루어 기술개발을 진행하게 된다.
(3) 바이오융합
미래창조과학부와 산업통상자원부는 2015년 3월「미래성장동력-산업엔진 종합실천계획」을 발표하였으며 여기에 ʻ스마트 바이오생산시스템ʼ이 포함되었다. 동 사업은 바이오산업의 생산성 향상 및 경쟁력 확보를 목표로 단기적으로 국내 반도체 공정기술을 활용하여 진입장벽이 높지 않고 우리나라가 앞선 세포치료제 자동생산시스템(배양, 정제, 분석)을 개발하고, 중기적으로는 급성장이 전망되는 바이오시밀러 시장을 타겟으로 고도기술이 필요한 항체치료제용 생산시스템 개발을 추진하고 있다.
또한, 산업통상자원부는 2015년부터 어디서나 편리하게 개인의 건강관리를 위한 서비스를 제공하는 스마트 헬스케어 산업의 활성화를 추진하고 있다. 이를 위해 병원-기업 상시연계 연구개발시스템 구축(2015년, 60억 원)과 개인맞춤형 건강관리시스템 구축(2015년~2017년, 90억 원)을 추진하고 있으며, 스마트 헬스케어기업에 대한 벤처투자연계, 정책자금 활용 등을 시행하고, 유헬스 종합지원센터를 구축하여 성능, 안전성 시험평가 등의 지원을 추진하고 있다.
(4) 바이오 연구자원
정부는「생명연구자원의 확보․관리 및 활용에 관한 법률」에 근거한 ʻ생명연구자원관리기본계획ʼ에 따라 다양한 바이오연구 분야에서 활용이 가능한 연구용 생명연구자원을 확보하고, 국가차원의 체계적인 자원관리 및 통계 신뢰도 향상을 위한 국가생명연구자원정보센터 중심의 범부처 정보연계를 강화하고 있다. 또한 기업들의 생명연구자원의 활용 극대화를 위해 확보된 생명연구자원의 가치제고 및 유용생물종을 확보하고, 2014년 10월 발효된 나고야의정서 대응체계 구축 및 인식제고를 추진하여 기업들의 피해 최소화 및 역량강화를 지원하고 있다.
다. 해외 진출 지원
정부에서는 바이오분야 중소․중견기업들이 활용할 수 있는 해외 마케팅 지원책을 마련하고, 개별기업들의 해외마케팅 역량 강화에 기여할 수 있도록 각 지원기관별 특성에 따라 차별화된 프로그램을 개발하여 지원하고 있다.
한국보건산업진흥원 및 충청북도는 컨퍼런스, 전시회, 비즈니스 포럼과 기타 잡페어 등 부대행사로 구성된 Bio Korea 국제행사를 매년 개최하여 국내외 기업간 협력기회를 제공하고 있다. 산업통상자원부와 코트라는 Global Bio & Medical Forum에 해외 유수기업의 사업개발담당 임원 등을 초청하여 국내기업과의 상담을 주선하고, 해외 전시부스 참가 및 해외 수출 로드쇼 개최 등을 통해 국내 바이오 및 헬스케어 산업의 해외진출을 지원하고 있다.
보건복지부는 제약산업 경쟁력 강화 및 글로벌 진출 등에 투자하는 ʻ제1호 및 제2호 글로벌 제약산업 육성 펀드ʼ를 각각 2013년 1,000억 원 규모, 2014년에 1,350억 원 규모로 조성하였으며, 추가로 2015년에 1,500억 원 이상 규모의 펀드를 조성하여 기업의 해외시장 진출 및 생산시설 고도화 등을 지원할 계획이다.
라. 세제 및 관세 분야
바이오산업은 신약개발 등 연구개발에 투자하는 비용이 높아 연구개발 및 시설투자비 등에 관련된 기업 지원이 필요하며, 우리나라는 「조세특례제한법」 및 「관세법」에 따라 세제 및 관세 분야 혜택을 지원하고 있다.
「조세특례제한법」에서는 파급효과가 크나 개발 불확실성이 높은 기술을 신성장동력기술로 선정하여 연구․인력개발비에 대해서 일반적인 연구인력개발비 세액공제보다 공제율을 상향시켜 세액 공제를 지원하고 있다(법 제10조). 신성장동력기술에는 바이오의약품(유전자치료제, 항체치료제, 줄기세포치료제, 바이오시밀러, 백신)과 첨단의료기기(삶의 질 향상 고령친화 의료기기, 첨단영상 진단기기) 등이 포함되어 있다.
또한, 기업 규모별로 세액공제비율에 차이는 있으나 중소기업의 경우 2018년 12월 31일까지 시설 투자한 투자금의 100분의 3 상당액(제5조) 및 연구개발 설비투자금의 100분의 10 상당액에 대한 세액공제(제11조)를 받을 수 있으며, 생산성향상시설 투자의 경우는 2017년 12월 31일까지 투자금의 100분의 7 상당액에 대한 세액공제(제24조)를 받을 수 있다. 특별히, 의약품 품질관리 개선시설에는 2016년 12월 31일까지 투자한 금액의 100분의 10 상당액에 대한 세액공제(제25조의4)를 받을 수 있다.
한편,「관세법」에서는 만성신부전증환자가 사용할 물품, 희귀병치료제, 임상 시험용 의약품 중 시험약(위약 포함, 2015년 12월 31일까지 수입신고된 것) 등 시행규칙 별표2에서 정한 물품에 대해 관세를 면제해 주고 있으며(제91조제4호), 국내제작이 곤란한 공장자동화 물품을 시행규칙 별표2의4에서 지정해 관세를 감면하고 있다(제95조제1항제3호).
1) 유럽연합(EU)를 포함했을 경우 가입국 수는 170개국이며, EU를 제외한 경우에는 169개국임
2) http://www.bchnetwork.or.kr
3) http://www.biosafety.or.kr
4) http://www.biosafety.or.kr/english
5) http://debate.biosafety.or.kr
6) http://www.lmoforum.org
7) 인간대상연구 또는 인체유래물연구를 수행하는 자가 소속된 교육·연구기관 또는 병원이나, 임신목적으로 체외수정시술을 시행하여 배아를 생성하도록 지정된 배아생성의료기관, 잔여배아 및 체세포복제배아등을 이용하여 배아연구를 수행할 수 있는 배아연구기관, 체세포복제배아연구기관 등이나, 연구목적으로 인체유래물등을 수집, 보관, 이용 및 제공하기 위해 허가를 받은 인체유래물은행 등이 해당한다(생명윤리법 제10조제1항 참조).
8) 생명윤리법 제3조(기본 원칙) ① 이 법에서 규율하는 행위들은 인간의 존엄과 가치를 침해하는 방식으로 하여서는 아니 되며, 연구대상자등의 인권과 복지는 우선적으로 고려되어야 한다.
② 연구대상자등의 자율성은 존중되어야 하며, 연구대상자등의 자발적인 동의는 충분한 정보에 근거하여야 한다.
③ 연구대상자등의 사생활은 보호되어야 하며, 사생활을 침해할 수 있는 개인정보는 당사자가 동의하거나 법률에 특별한 규정이 있는 경우를 제외하고는 비밀로서 보호되어야 한다.
④ 연구대상자등의 안전은 충분히 고려되어야 하며, 위험은 최소화되어야 한다.
⑤ 취약한 환경에 있는 개인이나 집단은 특별히 보호되어야 한다.
⑥ 생명윤리와 안전을 확보하기 위하여 필요한 국제 협력을 모색하여야 하고, 보편적인 국제기준을 수용하기 위하여 노력하여야 한다.
9) 생명윤리법 제37조(인체유래물연구의 동의) ① 인체유래물연구자는 인체유래물연구를 하기 전에 인체유래물 기증자로부터 다음 각 호의 사항이 포함된 서면동의를 받아야 한다.
1. 인체유래물연구의 목적
2. 개인정보의 보호 및 처리에 관한 사항
3. 인체유래물의 보존 및 폐기 등에 관한 사항
4. 인체유래물과 그로부터 얻은 유전정보(이하 "인체유래물등"이라 한다)의 제공에 관한 사항
5. 동의의 철회, 동의 철회 시 인체유래물등의 처리, 인체유래물 기증자의 권리, 연구 목적의 변경, 그 밖에 보건복지부령으로 정하는 사항
② 제1항에도 불구하고 인체유래물연구자가 아닌 인체유래물 채취자로부터 인체유래물을 제공받아 연구를 하는 인체유래물연구자의 경우에 그 인체유래물 채취자가 인체유래물 기증자로부터 제1항 각 호의 사항이 포함된 서면동의를 받았을 때에는 제1항에 따른 서면동의를 받은 것으로 본다.
③ 인체유래물연구의 서면동의 면제에 관하여는 제16조제3항을 준용한다. 이 경우 "연구대상자"는 "인체유래물 기증자"로 본다.
④ 인체유래물연구자는 제1항에 따른 서면동의를 받기 전에 인체유래물 기증자에게 제1항 각 호의 사항에 대하여 충분히 설명하여야 한다.
⑤ 제1항에 따른 서면동의를 위한 동의서의 서식 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
10) 생명윤리법 제38조(인체유래물등의 제공) ① 인체유래물연구자는 제37조제1항에 따라 인체유래물 기증자로부터 인체유래물등을 제공하는 것에 대하여 서면동의를 받은 경우에는 기관위원회의 심의를 거쳐 인체유래물등을 인체유래물은행이나 다른 연구자에게 제공할 수 있다.
② 인체유래물연구자가 제1항에 따라 인체유래물등을 다른 연구자에게 제공하는 경우에는 익명화하여야 한다. 다만, 인체유래물 기증자가 개인식별정보를 포함하는 것에 동의한 경우에는 그러하지 아니하다.
③ 제1항에 따라 인체유래물등을 제공할 경우 무상으로 하여야 한다. 다만, 인체유래물연구자가 소속된 기관은 인체유래물등의 보존 및 제공에 든 경비의 경우에는 보건복지부령으로 정하는 바에 따라 인체유래물등을 제공받아 연구하는 자에게 경비지급을 요구할 수 있다.
④ 인체유래물연구자는 제1항에 따라 인체유래물등을 제공하거나 제공받았을 때에는 보건복지부령으로 정하는 바에 따라 인체유래물등의 제공에 관한 기록을 작성·보관하여야 한다.
⑤ 인체유래물등의 제공 방법 및 절차, 경비의 산출, 그 밖에 필요한 사항은 보건복지부령으로 정한다.
11) 생명윤리법 시행규칙 제33조(기관위원회의 심의를 면제할 수 있는 인체유래물연구) ① 법 제36조제2항에 따라 기관위원회의 심의를 면제할 수 있는 인체유래물연구는 다음 각 호의 연구로 한다.
1. 연구자가 개인정보를 수집·기록하지 않은 연구 중 다음 각 목의 연구
가. 인체유래물은행이 수집·보관하고 있는 인체유래물과 그로부터 얻은 유전정보(이하 "인체유래물등"이라 한다)를 제공받아 사용하는 연구로서 인체유래물등을 제공한 인체유래물은행을 통하지 않으면 개인정보를 확인할 수 없는 연구
나. 의료기관에서 치료 및 진단을 목적으로 사용하고 남은 인체유래물등을 이용하여 정확도 검사 등 검사실 정도관리 및 검사법 평가 등을 수행하는 연구
다. 인체유래물을 직접 채취하지 않는 경우로서 일반 대중이 이용할 수 있도록 인체유래물로부터 분리·가공된 연구재료(병원체, 세포주 등을 포함한다)를 사용하는 연구
라. 연구자가 인체유래물 기증자의 개인식별정보를 알 수 없으며, 연구를 통해 얻어진 결과가 기증자 개인의 유전적 특징과 관계가 없는 연구. 다만, 배아줄기세포주를 이용한 연구는 제외한다.
2. 「초·중등교육법」 제2조 및 「고등교육법」 제2조에 따른 학교와 보건복지부장관이 정하는 교육기관에서 통상적인 교육과정의 범위에서 실무와 관련하여 수행하는 연구
3. 공중보건상 긴급한 조치가 필요한 상황에서 국가 또는 지방자치단체가 직접 수행하거나 위탁한 연구
② 제1항제3호에 따른 연구를 수행하는 기관의 장은 보건복지부장관이 지정하여 고시하는 공용위원회에 연구 종료 전 연구의 진행 상황을 통보하여야 한다.
12) 국제특허분류기호(IPC) : 심사관이나 특허정보를 이용하고자 하는 자가 특허정보를 용이하게 검색할 수 있도록 기술내용을 세부적으로 구분해 놓은 분류체계. 1971.03.24. 스트라스부르그 협정에 근거하여 1975.10.07. 발효되었으며, 현재는 IPC 2013.01이 우리나라뿐만 아니라 100여 개 국에서 사용 중.
13) 서열목록을 포함한 특허출원은 핵산 및 아미노산 서열과 기타 유용한 정보를「핵산염기 서열목록 또는 아미노산 서열목록 작성기준 (특허청 고시 제2013-1호)」별표 2의 세부기준에 따라 명세서에 상세하게 기재하여야 하고,「핵산염기 서열 또는 아미노산 서열에 관한 서열목록 작성 및 제출요령 (특허청고시 제2012-26호, 2012.08.22. 일부 개정.)」에 따라 서열목록전자파일을 제출하여야 함.
14) DDBJ: 일본국립유전학연구소 산하기관(DNA Data Bank of Japan)
15) GenBank: 미국 NCBI(National Center for Biotechnology Information)에서 운영하는 유전자 정보 데이터베이스
16) EMBL: 유럽분자생물학연구소(European Molecular Biology Laboratory)
17) http://patome.kr
18) 미생물 기탁제도에서 미생물이란 유전자, 벡터, 재조합 벡터, 형질전환체, 융합세포, 재조합 단백질, 모노클로날 항체, 바이러스, 세균, 효모, 곰팡이 버섯, 방선균, 단세포 조류, 원생동물, 동식물의 세포, 조직 배양물, 종자 등 특허절차상 기탁 가능한 생물학적 물질(biological material)을 의미함.
19) 부다페스트조약(1980.08.19. 발효) : 특허절차상 여러 나라에 미생물 관련 발명을 출원할 경우, 하나의 국제기탁기관에 기탁한 후 조약동맹국에 출원 시 그 효과를 상호 인정하는 것을 주 내용으로 함. 우리나라는 1987년에 가입하였고 2012년 12월 현재 78개국이 가입, 41개 국제기탁기관이 공인 중.
20) 미생물 관련 발명의 특허출원시 기탁기관에 미생물의 특허기탁을 의무화함. 이는 특허법 시행령 제2조, 「미생물기탁기관지정 등에 관한 고시」에 의거함.
21) 특허미생물 기탁이 시작된 1981년부터 현재 2015년 06월 30일까지의 누계임.
22) 생명공학육성법에서 정의된 생명공학은 산업적으로 유용한 생산물을 만들거나 생산공정을 개선할 목적으로 생물학적 시스템, 생체, 유전체 또는 그들로부터 유래되는 물질을 연구활용하는 학문과 기술, 생명현상의 기전, 질병의 원인 또는 발명과정에 대한 연구를 통하여 생명공학의 원천지식을 제공하는 생리학‧병리학‧약리학 등의 기초의과학을 포함.



⋙ 기원전 8000년
○ 인간이 농작물과 가축을 경작하고 사육하기 시작
○ 최초로 감자를 식용으로 경작
⋙ 기원전 4000~2000년
○ 이집트에서 효모를 사용해 빵과 맥주의 발효 시작
○ 수메리아, 중국, 이집트에서 치즈를 생산하고 포도주를 발효시킴
○ 바빌로니아인들은 몇 그루 수술 나무의 꽃가루를 가지고 선별적으로 암술나무에 수정하여 대추야자를 생산
⋙ 기원전 500년
○ 중국에서 항생물질을 가진 곰팡이가 핀 두부로 종기를 치료
⋙ 서기 100년
○ 중국에서 최초로 살충제를 국화에 살포함
⋙ 1322년
○ 아랍에서 우성 말을 생산하기 위해 최초로 인공수정을 사용
⋙ 1590년
○ Janssen, 현미경 발명
⋙ 1663년
○ Hooke, 세포의 존재 발견
⋙ 1675년
○ Leeuwenhoek, 박테리아를 발견
⋙ 1761년
○ Koelreuter, 다른 종의 농작물을 성공적으로 이종교배 하였음을 보고
⋙ 1797년
○ Jenner, 아이들에게 천연두를 막기 위한 바이러스성 백신을 접종
⋙ 1830~1833년
○ 1830년 단백질 발견
○ 1833년 최초로 효소가 발견되고 분리됨
⋙ 1835~1855년
○ Schleiden와 Schwann, 모든 유기체는 세포들로 구성되어 있다고 제안
○ Virchow, ʻʻ모든 세포는 세포에서 생겼다ʼʼ고 선언
⋙ 1857년
○ Pasteur, 미생물들이 발효를 유발한다고 제안
⋙ 1859년
○ Charles Darwin, 자연 도태의 진화론을 발표(1800년대 후반 유전학의 무지에도 불구하고 선택된 부모와 도태된 다양한 자손에 대한 개념은 동식물 사육사들에게 매우 큰 영향을 줌)
⋙ 1865년
○ 유전학 연구 시작
○ Gregor Mendel, 오스트리아인 수도사인 그는 완두를 연구하여 유전법칙에 의해 유전적 특징이 부모로부터 자손에게 물려진다는 점을 발견함
⋙ 1870~1890년
○ Darwin의 이론을 이용하여 면화를 이종교배하고 수백 가지의 우성품종을 개발
○ 최초로 농부들이 수확량을 늘리기 위해 농지에 질소고정 박테리아 미생물을 섞음
○ William James Beal, 최초로 실험실에서 실험용 옥수수 잡종 생산
⋙ 1877년
○ Koch, 박테리아를 염색하고 동정하기 위한 기술 개발
⋙ 1878년
○ Laval, 최초로 원심분리기 개발
⋙ 1879년
○ Fleming, 후에 염색체라 불려지는 세포핵 안쪽의 봉모양의 염색질을 발견
⋙ 1900년
○ 초파리가 유전연구에 사용
⋙ 1902년
○ 면역학이라는 용어가 처음으로 나타남
⋙ 1906년
○ 유전학이라는 용어가 소개됨
⋙ 1911년
○ Rous, 최초로 암을 유발하는 바이러스 발견
⋙ 1914년
○ 최초로 박테리아를 영국 맨체스터의 하수처리에 사용
⋙ 1915년
○ Phage(박테리아성 바이러스)발견
⋙ 1919년
○ 최초로 생명공학(Biotechnology)이라는 단어가 출판물에 사용
⋙ 1920년
○ Evans와 Long, 인간성장 호르몬 발견
⋙ 1928년
○ Alexander Fleming, 항생물질인 페니실린 발견
○ 유럽에서 조명충 나방제어를 위한 소규모의 Bacillus thuringiensis(Bt) 테스트 시작
○ 1938년 프랑스에서 미생물 살충제의 상업적 생산 시작
○ Karpechenko, 무와 양배추를 교배하여 서로 다른 속(屬)의 식물 사이에서 번식력이 강한 자손을 만듦
○ Laibach, 최초로 오늘날 이종교배라 알려진 광범위한 교배로부터 잡종을 얻기 위해 배구제(embryo rescue)를 사용
⋙ 1930년
○ 美의회에서 식물육종생산의 특허를 가능하게 하는 식물특허법(Plant Patent Act) 통과
⋙ 1933년
○ 1920년대 Henry Wallace에 의해 개발된 잡종옥수수가 상업화 됨 (1945년에는 엄청난 매출액은 증가된 연 종자구입비를 능가했고 잡종 옥수수는 미국 전체 옥수수 생산량의 78%를 차지)
⋙ 1938년
○ 분자 생물학이란 용어가 생김
⋙ 1941년
○ 유전공학이란 용어가 폴란드 Lwow의 기술연구소에서 효모복제에 관한 강의를 맡고 있는 덴마크의 미생물학자 A. Jost에 의해 최초로 사용
⋙ 1942년
○ 박테리아를 감염시키는 박테리오파지를 규명하고 확인하기 위해 전자 현미경을 사용
○ 페니실린을 미생물에서 생산함
⋙ 1944년
○ Avery와 그 외 다른 사람들에 의해 DNA가 유전정보를 운반한다는 점이 입증됨
○ Waksman, 결핵에 효과적인 항생제인 streptomycin을 분리(추출)
⋙ 1946년
○ 새로운 타입의 바이러스를 형성하기 위해 서로 다른 바이러스로부터의 유전물질이 결합할 수 있다는 일종의 유전자 재조합이 발견
○ 유전적 다양성의 상실로 인한 위협을 인식한 미의회는 식물수집과 보존 그리고 이러한 인식의 홍보에 막대한 자금을 제공함
⋙ 1947년
○ McClintock, 옥수수에서 소위 움직이는 유전자(jumping genes)라 불리는 전이요소를 발견
⋙ 1949년
○ Pauling, 겸상(鎌狀) 적혈구 빈혈증(흑인의 유전병)이 헤모글로빈 내 단백질분자의 돌연변이로 야기된 ʻ분자병ʼ임을 밝혀냄
⋙ 1951년
○ 냉동정액을 사용한 가축의 인공수정이 성공적으로 수행됨.
⋙ 1953년
○ 과학저널 Nature는 현대 유전학의 출발을 상징하는 DNA의 이중나선 구조를 묘사한 James Watson과 Francis Crick의 원고를 출판
⋙ 1955년
○ 핵산 합성에 관한 효소가 처음으로 추출됨
⋙ 1956년
○ Kornberg, DNA 복제에 필요한 효소 DNA 중합효소Ⅰ(DNA polymeraseⅠ) 발견
⋙ 1958년
○ 겸상 적혈구 빈혈증이 단일 아미노산의 변화 때문에 발생한다고 밝혀짐
○ DNA가 처음으로 시험관에서 만들어짐
⋙ 1959년
○ 조직 살균제가 개발됨
○ 단백질 생합성의 첫 단계가 그려짐
⋙ 1950년대
○ 바이러스 증식억제 물질(interferon) 발견
○ 최초 합성 항생 물질 개발
⋙ 1960년
○ 시냅시스(세포의 감수분열 초기에 있는 상동염색체의 병렬접착)를 이용해 DNA-RNA 잡종 분자가 만들어짐
○ 메신저 리보 핵산(Messenger RNA) 발견
⋙ 1961년
○ 美 농림부가 최초 미생물 살충제인 Bacillus thuringiensis를 등록함
⋙ 1963년
○ Norman Borlaug에 의해 신품종 밀이 개발됨으로 인해 생산량이 70% 상승함
⋙ 1964년
○ 필리핀의 국제 벼 연구소(The International Rice Research Institute)는 새로운 품종을 개발하여 충분한 비료를 주면 이전의 생산량보다 2배 많은 수확량을 얻을 수 있는 녹색 혁명을 일으킴
⋙ 1965년
○ Harris와 Watkins가 성공적으로 생쥐와 사람 세포를 융합시킴
⋙ 1966년
○ 유전암호가 해독되고 일련의 3개의 뉴클리오티드가 하나의 아미노산을 결정한다는 사실이 밝혀짐
⋙ 1967년
○ 최초로 자동 단백질 서열 분석기 완성
⋙ 1969년
○ 처음으로 효소가 생체 외에서 합성됨
⋙ 1970년
○ 노르만인 Borlaug, 노벨 평화상 수상(1963년 참조)
○ 유전물질을 자르는 제한 효소(두 줄 사슬 DNA를 특정 부위에서 절단하는 효소)의 발견으로 유전자 복제의 장이 열림
⋙ 1971년
○ 처음으로 유전자가 완벽하게 합성됨
⋙ 1972년
○ 인간의 DNA 구성이 침팬지와 고릴라의 DNA와 99% 유사함이 발견됨
○ 최초로 배이식(胚移植)이 시도됨
⋙ 1973년
○ Stanley Cohen와 Herbert Boyer, 제한효소와 리가제(ligases)를 사용해서 DNA를 자르고 붙이는 기술과 박테리아에서 새로운 DNA를 복제하는 기술을 완성함
⋙ 1974년
○ 미국 NIH는 유전자 재조합 연구를 총괄하기 위해 재조합 DNA 자문위원회 (Recombinant DNA Advisory Committee) 구성
⋙ 1975년
○ 최초로 미국 정부가 캘리포니아 Asilomar 회의에서 유전자재조합실험을 규제하기 위한 가이드라인 개발을 주장함
○ 단일클론항체가 생산됨
⋙ 1976년
○ 유전자 재조합 기술이 유전 장애인에 최초로 적용
○ 분자교배가 태아의 alpha thalassemia 진단에 사용됨
○ 효모의 유전자가 대장균(E.coli)에서 발현됨
○ 최초로 특정유전자의 염기쌍 순서가 결정됨(A, C, T, G)
○ 美國재조합 DNA 자문위원회(NIH Recombinant DNA Advisory Committee)에 의해 유전자 재조합 실험에 대한 가이드라인이 처음으로 발표
⋙ 1977년
○ 인간유전자를 박테리아에서 처음으로 발현시킴
○ 전기영동을 이용해 DNA의 긴 마디를 빠르게 나열하기 위한 연구수행
⋙ 1978년
○ 바이러스의 고방사선 구조가 최초로 확인됨
○ 재조합 인간 인슐린이 최초로 생산됨
○ 미국 노스캐롤라이나 과학자들이 DNA 분자상의 특정 위치에 특정 돌연변이를 일으키는 것이 가능하다는 것을 보여줌
⋙ 1979년
○ 최초로 인간성장 호르몬이 합성됨
⋙ 1970년대
○ 유전공학 제품을 개발하기 위해 최초의 상업적 회사가 설립
○ 중합효소(polymerases)의 발견
○ 뉴클리오티드(nucleotides)의 빠른 나열기술 완성
○ 유전자 표적화
○ RNA splicing
⋙ 1980년
○ Diamond v. Chakrabarty 재판에서 미 연방법원은 유전자재조합생물형태에 대한 특허를 인정했으며, Exxon 석유회사가 기름 먹는 미생물에 대한 특허 취득
○ 美國정부 유전자복제에 대한 권한을 Cohen과 Boyer에게 부여
○ 최초의 유전자합성 기계 개발
○ 인간인터페론유전자를 박테리아로 형질전환(Transformation) 시킴
○ 노벨 화학상이 유전자 재조합분자를 개발한 Berg, Gilbert, Sanger에게 수여됨
⋙ 1981년
○ 오하이오 대학의 과학자들이 다른 동물의 유전자를 쥐에 이식함으로써 최초로 유전자 이식동물을 생산함
○ 중국의 과학자가 최초로 복제 물고기 금잉어를 만듦
⋙ 1982년
○ 미국의 Applied Biosystems社는 단백질 서열분석에 필요한 샘플의 양을 획기적으로 줄일 수 있는 상업적 가스 상 단백질 서열분석기를 발표
○ 가축을 위한 최초의 유전자 재조합 DNA 백신 개발
○ 유전적 변이를 거친 박테리아에서 생산된 인간인슐린이 미국 FDA로부터 최초의 생명공학 기술에 의한 의약품으로 승인 받음
○ 최초의 유전자 변형식물인 피튜니아 생산
⋙ 1983년
○ 중합효소연쇄반응(PCR) 기술이 소개(유전자와 유전자 조각의 복제를 위해 열과 효소를 사용하는 PCR 기술은 이후 유전공학에서의 연구와 개발에 광범위하게 쓰이는 중요한 도구가 됨)
○ TI 플라스미드(plasmid: 염색체와는 따로 증식할 수 있는 유전인자)에 의한 식물 세포들의 유전학적인 변형이 수행됨
○ 최초로 인공염색체 합성
○ 특정유전병 유발인자 발견
○ 생명공학기술을 이용해 피튜니아를 완전 성장시킴
○ 피튜니아 식물을 통해 유전자변형식물의 새로운 특징이 자손에게 전달됨을 확인함
⋙ 1984년
○ DNA 지문검색 기술이 개발
○ HIV 바이러스의 전체 게놈이 복제되고 서열 결정됨
⋙ 1985년
○ 신장병과 낭포성 섬유증을 유발하는 유전인자 발견
○ 법적 증거로서 유전자 지문법이 도입
○ 최초로 곤충과 박테리아, 바이러스에 저항력이 있는 유전자 변형식물이 시험됨.
○ 미국 NIH는 인간을 대상으로 하는 유전자 치료법 실험수행에 대한 가이드라인을 정함
⋙ 1986년
○ 유전자 재조합 B형 간염 백신 최초 개발
○ 최초의 유전공학 항암치료제 인터페론 생산
○ 미국 정부는 유전자 재조합 유기체에 대해 전통적인 유전자재조합기술로 만들어진 제품에 적용된 규정보다 더 엄격한 ʻʻThe Coordinated Framework for Regulation of Biotechnologyʼʼ 규정 확립
○ California Berkeley 대학의 화학자가 신약을 개발하기 위해 항체와 효소를 결합하는 방법(abzymes) 제시
○ 유전자 변형식물(담배)의 실제 실험이 수행됨
○ 최초로 환경 보호국이 유전자변형 담배의 판매를 승인
⋙ 1987년
○ 바이러스에 내성이 있는 토마토의 field test를 최초로 승인함
○ 캘리포니아에서 농작물의 서리 형성을 억제하는 유전자 변형 박테리아인 Frostban을 딸기와 감자를 통해 시험하였는데 이것이 처음으로 공식 승인된 유전자 재조합 박테리아 외부 실험임
⋙ 1988년
○ 미국 정부는 하버드대학 분자유전학자에게 유전자 변형동물 즉, 유전자변형 쥐에 대한 특허권을 부여함
○ 세제에 사용할 수 있는 표백제 내성을 지닌 단백질 분해효소를 만드는 공정에 대한 특허권이 부여됨
○ 미국 의회가 다른 종의 게놈 뿐만 아니라 인간유전자 암호를 해독하고 지도를 만드는 인간 게놈 프로젝트 연구비를 승인함
⋙ 1989년
○ 최초로 유전자변형 해충방지 면화의 field test 승인
○ 식물 게놈 프로젝트 시작
⋙ 1980년대
○ 진화의 역사를 밝히기 위한 DNA 연구 시작
○ 유럽에서 유전자 재조합 동물백신의 사용 승인
○ 기름 청소에 미생물을 이용한 생물학적 정화기술 사용
⋙ 1990년
○ 미국 최초로 유전자재조합 기술을 이용하여 치즈제조에 쓰이는 인공적으로 제조된 chymosin 효소인 Chy-MaxTM이 소개됨
○ 인체의 모든 유전자 지도를 제작하려는 국제적인 노력인 인간 게놈 프로젝트가 시작됨
○ 면역장애를 앓고 있는 4살 여자 어린이를 대상으로 실시한 유전자 치료가 성공적으로 수행됨
○ 유아 조유용 우유 단백질을 만드는 유전자 변형 젖소 탄생
○ 해충에 강한 옥수수인 Bt 옥수수 생산
○ 영국 최초로 유전자변형 효모식품이 승인됨
○ 유전자 변형 척추동물 송어의 실지실험이 수행됨
⋙ 1992년
○ 미국과 영국의 과학자들이 시험관 내에서 배아에 낭포성 섬유증과 혈우병과 같은 유전적 기형을 테스트하는 기법을 밝힘
○ 미국 FDA는 유전자 이식 음식이 유전적으로 위험하지도 않고 특별한 규정도 필요 없다고 선언함
⋙ 1993년
○ 미국 FDA, 낙농가의 우유생산 촉진을 위해 BST(Borine Somatotropin)를 승인
⋙ 1994년
○ 미국 FDA, 생명공학으로 만들어진 FLAVRSAVRTM tomato 승인
○ 최초로 유방암 유전자 발견
○ CF 환자의 폐에 단백질이 쌓이지 않게 하는 재조합 인간 DNase 승인
○ 소 성장호르몬(POSILAC)이 상용화됨
⋙ 1995년
○ 에이즈 환자에게 최초로 비비의 골수가 이식됨
○ 최초로 바이러스 이외의 살아있는 유기체(Hemophilus Influenzae)의 완벽한 유전자 배열이 완성됨
○ 암정복을 위해 면역시스템 모듈, 유전자 재조합 항체형성과 같은 유전자 치료가 도입됨
⋙ 1996년
○ 파킨슨병과 관련된 유전자의 발견으로 퇴행성 신경질환의 잠재 가능한 치료와 그 원인 연구의 중요한 이정표를 제시함
⋙ 1997년
○ 스코틀랜드에서 어른세포로 복제된 최초의 복제양 Dolly 탄생
○ 해충방지 농작물인 Roundup ReadyTM 콩과 BollgardTM 해충방지 면화와 같은 작물이 상업화 됨
○ 아르헨티나, 호주, 캐나다, 중국, 멕시코와 미국 등 전 세계적으로 500만 에이커 면적에서 유전자조작 작물이 재배됨
○ Oregon주 연구자들은 두 마리의 붉은 털 원숭이를 복제했다고 주장함
○ 유전병 연구의 새로운 기술을 창조하기 위해 PCR, DNA 칩과 컴퓨터를 결합한 새로운 DNA기술 탄생
⋙ 1998년
○ 하와이대학 연구진이 어른의 난소 적(cumulus)세포 핵으로부터 쥐를 복제함
○ 인간 배아줄기세포주가 확립됨
○ 일본 Kinki 대학 연구진은 한 마리 어른암소로부터 얻은 세포를 이용하여 8마리의 동일 송아지 복제함
○ 최초로 C. elegans 벌레에 대한 동물 게놈 염기서열 해독 완료
○ 30,000개 이상의 유전자 위치를 보여주는 인간 게놈지도의 초안 완성
○ 동남아시아 다섯 나라가 병에 강한 파파야 나무를 개발하기 위해 컨소시엄을 구성
⋙ 1990년대
○ 최초로 영국에서 유전자 지문법을 이용해 유죄를 판결함
○ 규정 질량의 일반적 융기에 착상된 유전자 분리성공
○ 유전성 대장암이 DNA 치료 유전자의 결핍으로 야기된다는 사실 발견
○ 유전자 재조합 광견병 백신을 너구리에 실험
○ 미국에서 농약을 기본으로 한 생명공학 제품판매 승인
○ 특수이식 유전자를 가진 쥐에 관한 특허 허용
○ 최초로 유럽에서 발암물질에 민감한 유전자변형 쥐에 관한 특허 제기
○ 유방암 유전자 복제
⋙ 2000년
○ 최초로 애기장대(학명 Arabidopsis thaliana)의 게놈지도 개발
○ 13개 나라에서 총 1억 89만 에이커 면적에서 생물공학 농작물이 재배됨
○ 최초로 바이러스에 강한 고구마가 케냐에서 실질 시험됨
○ 인간게놈 배열의 초안 발표
⋙ 2001년
○ 최초로 벼 게놈지도 완성
○ 오스트리아 연구진들은 Barley Yellow Dwarf Virus와 같은 바이러스 예방백신에 사용되는 hairpin RNA를 이용한 기술개발을 보고함
○ Chinese National Hybrid 연구진들은 일반 쌀 생산량보다 두 배 많은 super rice종 개발을 보고함
○ 유럽위원회(The European Commission)가 모든 유전자 변형 식품에 라벨을 붙일 것을 제기함
○ 농업적으로 중요한 시노라이조비움 멜리로티(Sinorhizobium meliloti) 박테리아의 DNA배열 완성
○ 염분이 있는 물과 땅에서 성장 가능한 최초의 농작물을 만들기 위해 애기장대로부터 추출된 유전자를 토마토에 이식함
○ 농업에 중요한 식물병원균 Agrobacterium tumefaciens의 게놈서열이 공표됨
○ 스트레스에 더 강한 농작물 개발의 실마리로서, 손상을 입거나 스트레스를 받았을 때 빛을 발하는 세일 크레스(thale cress)라 불리는 실험용 식물 재배
○ 최초로 땅콩의 종합적 분자지도가 완성됨
⋙ 2002년
○ 완성된 인간 게놈 배열을 과학전문지에 게재함
○ 효모의 프로테옴(Proteome: 단백질 간 상호작용과 네트워크의 총합)의 기능지도(functional map)의 초안 완성, 효모의 게놈지도는 1996년에 발표되었음
○ 줄기세포의 분화에 관여하는 조절인자 연구에 큰 발전이 있었으며, 이에 관여하는 200여개의 유전자가 밝혀짐
○ 생명공학 농작물이 16개국, 1억 4천 5백만 에이커에서 재배되고 있으며 이는 2001년보다 12% 증가한 것임
○ 자궁경부암에 대한 백신 개발에 성공하였으며 이는 특정 암에 대한 예방백신이 가능함을 처음으로 보여준 성과임
⋙ 2003년
○ 인간게놈 완전 해독(4월)
○ 정신분열증과 우울증 등 정신병의 발병 위험을 증가시키는 특정유전자 변형을 확인한 연구결과 발표
○ 美최초의 GM 애완동물로 광고된 붉은 빛 형광물고기 GloFish 상업화
○ 세계적으로 생명공학작물 이용의 활성화 증대
○ 영국은 최초로 상업적인 생명공학작물인 제초제 저항옥수수를 인정
○ 미국 환경 보호국은 최초로 형질전환 해충저항성 옥수수를 승인함
○ 2003년 banteng 들소가 최초로 복제되었으며, 노새, 말, 사슴도 복제되었음
○ 1997년 포유동물의 최초 복제양 돌리는 폐병연구 후에 안락사 됨
○ 일본 연구팀은 자연적으로 카페인을 제거하는 생명공학 커피를 개발함
○ RNA 형태는 유전자 형식을 지시, 변형시키며 줄기세포와 배(胚)의 성장에 영향을 미침을 밝힘
○ 쥐의 배 세포줄기가 정자나 난자 세포로 성장할 수 있음을 확인
○ 남성을 결정짓는 Y염색체가 동일한 유전자를 함유하고 있음을 발견
○ 종양으로 하여금 암의 전이에 필요한 혈관을 생성하지 못하도록 하는 약물의 개발
⋙ 2004년
○ 미국 식품의약국(FDA)은 아바스틴이라는 최초의 신세대 항암제를 승인함.
○ FDA는 다양한 종류의 약물치료와 질병을 위해 첫 DNA칩 및 유전자칩 개발
○ RNA 방해 제품으로, 임상 시험에 들어가는 첫 번째 RNAi 제품 생산
○ 국제연합 식량농업기구(FAO)의 생명공학 작물 승인
○ 국립과학연구원 산하 의학연구소에서는 ʻ생명공학작물이 건강에 해를 끼치지 않는다ʼ라고 밝힘.
○ FDA는 식품안전성 검토 후 생명공학 밀의 안전성 밝힘.
○ 몬산토사는 지방산을 감소 삭제한 low-linolenic 콩을 소개함
○ 닭 게놈 DNA 완전 해독
○ 최초로 애완 새끼고양이 복제
○ ʻ쓸모없는 DNA(junk DNA)ʼ 규명
○ 인간의 유전자 DNA 중 단백질을 합성하는 DNA는 전체 게놈의 10%에 불과하며 아무런 기능이 없는 DNA에 대한 규명 이루어짐
○ 지난 3월 영국의 과학자들, 지난 20년간 나비 58종의 개체 수가 71% 줄었으며, 조류는 54% 감소했다고 보고
○ 新의약품 개발 활발
○ 유엔(UN), 대학, 민간자선단체, 제약업체 등 공공단체와 민간기업이 손을 잡고 미개발국의 환자를 위해 의약품을 개발하는 새로운 움직임이 일어남.
○ 미생물게놈 추출성공, 인간게놈프로젝트 주역인 미국 크레이크 벤터 박사는 3월 사이언스에 바닷물에서 미생물 게놈을 추출해 10억 5,000만 염기쌍을 한꺼번에 분석하는 데 성공했다고 밝힘
⋙ 2005년
○ 게놈지도와 야외 관찰로 진화가 일어나는 복잡한 과정을 밝힘
○ 유럽 호이겐스 탐사선이 토성의 달 타이탄에 착륙하고, NASA의 Deep Impact가 혜성에 충돌한 실험 등
○ 분자 생물학자들이 봄에 꽃이 다양한 색깔을 내게 하는 원리를 발견
○ 위성과 지상망원경으로 도시 크기의 죽은 별들인 중성자별 관찰
○ 정신분열증, 난독증, 안면경련증과 같은 뇌 신경질환 연구
○ 외계에서 온 암석과 지구의 암석을 비교 분석한 결과 지구 생성에 대해 새로운 이론 설립
○ volage-gated potassium channel의 분자 구조 밝힘
○ 인간 활동에 의한 지구 온난화의 증거 추가 발견
○ 분자 생물학자들이 복잡한 시스템의 행태를 이해하기 위해 엔지니어 기술 이용
○ 120억 달러 규모의 국제 핵융합 실험로(International Thermonuclear Ex-perimenta Reactor) 위치가 18개월의 논란 끝에 프랑스 Cadarache로 결정
○ Z 나선형 DNA와 B 나선형 DNA의 결합구조 규명, 네이처지 게재
⋙ 2006년
○ 네안데르탈인 DNA 염기서열 분석
○ 급진전되는 지구 온난화 전망 제기
○ 땅위를 걸어다닌 물고기 화석 발견
○ 시력감퇴 치료제 개발
○ 생물 다양성의 재발견
○ 최첨단 현미경 기술 개발
○ 기억메커니즘 규명 단초 발견
○ 마이크로 RNA와 siRNA보다 약간 긴 새로운 RNA를 발견
○ 미연방정부 연구비 천만 달러를 받아 일리노이 대학 연구팀이 진행하고 있는 돼지 게놈 해독은 2년 안에 완성될 것으로 기대
○ 미 부시 대통령이 상하원 합동연설에서 농업 페기물로부터 바이오에탄올 생산 지원
○ 미 NIH가 유방암 재발을 예측하기 위해 10년간, 만 명의 환자에 대해 유전자 검사를 실시하는 연구를 개시
○ 미국 당뇨병 협회(ADA)가 농업 및 식량분야 생명공학에 대한 지원을 재확인
○ 다우사가 최초의 식물 생산 백신에 대한 허가를 취득
○ Renessen사가 생명공학 기술을 이용하여 유용성이 추가된 작물에 대해 최초로 동물 사료로 판매할 수 있는 허가를 취득
○ USDA가 밀의 게놈연구를 위해 18개 대학 밀번식 컨소시엄에 연구비 오백만 달러 지원
○ 오메가-3 지방산을 생산하는 형질전환 돼지 개발
○ 세계무역기구는 EU가 21가지의 농업 생명공학제품에 대해 통상약정을 위반 했다고 발표
○ 프랑스 농무부가 생명공학 옥수수 및 담배 작물에 대해 17가지의 새로운 실지 시험을 허가
○ 마이크로RNA의 초기프로세싱 기전 규명
○ 암 발생 억제기능 SUSP4 유전자의 분리 및 작용 메커니즘 규명
○ 저분자화합물을 이용한 세포노화의 가역적 재프로그래밍
⋙ 2007년
○ AMPK 효소 항암기능 최초 규명. AMPK 활성화를 통해 대장암 세포가 정상으로 변화
○ 체내 면역반응 조절 ʻ브레이크 장치ʼ 물질 발견
○ ʻ스페인감기ʼ 바이러스를 이용해 조류독감을 치료할 수 있는 길이 열림
○ 화성에 물 존재 증거 발견
○ 자연계에 존재하지 않는 D-아미노산을 손쉽게 합성할 수 있는 신기술 개발
○ 수명이 다하거나 손상을 입은 세포에 죽음의 신호를 보내는 메커니즘 규명
○ 암 발병을 억제하는 유전자의 기능 규명
⋙ 2008년
○ 조류독감 인체 간 감염 유발 경로 찾았다(출처: Nature Biotechnology)
○ 모유수유가 천식 등을 유발하는 항원에 대해 아이들을 어떻게 보호하는지에 대한 기전 규명(출처: Nature Medicine)
○ 장내 세균과의 공생 기제 밝혀냈다(출처: Science)
○ 인간배아줄기세포로 당뇨병 쥐 치료 성공(출처: Nature Biotechnology)
○ 탈모유발 유전자 발견, 새 탈모약 개발기대(출처: Nature Genetics)
○ 암 세포를 무제한 자라게 하는 ʻ효소단백질ʼ 확인(출처: Nature)
○ 비만 원인 ʻ유전자 네트워크 이상ʼ(출처: Nature)
○ 루게릭병 유발 ʻ유전자ʼ 찾았다(출처: Nature Genetics)
○ 운동신경세포 분화과정 규명(출처: Developmental Cell)
○ 알즈하이머치매 ʻ기억력ʼ 떨어뜨리는 핵심 단백질 규명(출처: Nature Genetics)
○ 배꼽시계 등 생체회로 조절원리 규명(출처: Science)
○ 예방법 없는 ʻ말라리아ʼ 백신 개발된다(출처: Nature Medicine)
○ 물체 인식과정 규명, 실명치료 도움(출처: Nature)
○ 항생제 ʻ페니실린ʼ 만드는 균 ʻ유전자서열ʼ 규명(출처: Nature Biotechnology)
○ 유전자 제어 마이크로RNA 조절·사멸 메커니즘 규명(출처: Molecular Cell)
○ ʻ소리ʼ 잘 듣게 하는 귀 속 ʻ단백질ʼ 규명(출처: Nature)
○ 인체 세포 죽이는 단백질 규명, 새로운 항암제 개발(출처: Nature)
○ 日 연구팀 ʻ암세포ʼ 추적자 영상촬영물질 개발(출처: Nature Medicine)
⋙ 2009년
○ 파킨슨병 등 신경퇴행성질환 유발 기전 규명(출처: Nature Medicine)
○ 염색체 응축 ʻ단백질 복합체ʼ 분자구조 규명(출처: Cell)
○ 마이크로 RNA 메커니즘 규명(출처: Cell)
○ ʻ고혈압ʼ 유발 유전자 변이 규명(출처: Nature Genetics)
○ 단백질과 패혈증의 원인 물질인 세균의 내독소가 결합된 복합체의 분자구조를 세계 최초로 규명(출처: Nature)
○ 당뇨 원인 인슐린 저항성 유발인자 발견(출처: Cell Metabolism)
○ 장(腸) 세포의 세균 제거 기전 규명(출처: Developmental Cell)
○ 소 유전자 지도 완성 ʻ축산혁명ʼ(출처: Science)
○ 미칠 듯한 가려움증 ʻ긁어주면 좋아지는 이유ʼ 규명(출처: Nature Neurons)
○ 다운증후군 ʻ암ʼ 잘 안 걸리는 이유 규명(출처: Nature)
○ 자도 자도 졸린 ʻ기면증ʼ 면역계 기능 부전이 원인(출처: Nature Genetics)
○ 체내 자연 발생 ʻ표백성분ʼ 상처회복 돕는다(출처: Nature)
○ 사람 줄기세포로 뇌졸중 쥐 치료성공(출처: Gene Therapy)
○ 한국 남성 ʻ유전자 서열ʼ 밝혔다(출처: Nature)
○ NMR로 생체막 단백질 구조 규명(출처: Science)
○ 줄기세포 분화조절 단백질 발견(출처: Cell)
○ ʻ새벽잠 없는 이유 있다ʼ, 적게 자게 하는 유전자 발견(출처: Science)
⋙ 2010년
○ 배아줄기세포 치매치료제 국내서 첫 임상 실시
○ 혈관치료용 마이크로 로봇 개발(세계 최초로 살아있는 미니돼지의 혈관에 주입돼 이동하는 실험 성공)
○ 0.3mm 핏줄까지 보이는 세계에서 가장 선명한 사람 뇌지도『7.0 Tesla MRI Brain Atlas』 발간
○ 나노 소재로 인공 광합성 성공
○ 세계 최초 암 관련 신규 유전자 발굴
○ 암 진행과 전이 매커니즘 규명
⋙ 2011년
○ 인체면역결핍바이러스 예방 치료 네트워크(HPTN) 052
○ 밝혀진 인간의 기원 : 현생 인류의 DNA 일부가 네안데르탈인 게놈과 연관되었다는 사실 발견
○ 식물광합성 촉매 구조 규명 : 물 분해 촉매가 되는 막단백질 복합체의 구조 규명
○ 말라리아 백신 : ʻRTS,Sʼ 말라리아 백신이 아프리카 영유아의 말라리아 감염률을 50% 이상 감소시킴
○ 인간 장 속 미생물 : 인간의 장속 미생물이 혈액형과 같이 크게 3가지로 나뉨. 군집 종류에 따라 질병, 체질, 식습관이 달라짐
○ 노화세포제거 : 실험쥐의 노화세포를 제거하자 백내장, 근육 손실 등의 현상이 사라지고 나이 들어도 운동능력 저하되지 않는다는 사실 발견
⋙ 2012년
○ 한국 식약청서 동종(타가) 줄기세포 치료제 판매를 세계최초로 승인.
○ 유럽의약청(EMA)이 서구 최초로 유전자치료제를 승인하고 희귀유전질환 지단백지질분해효소결핍증(LPLD) 치료제 글리베라(Glybera)를 판매를 허가
○ 먹는 C형간염치료제, 미국 FDA 승인.
○ 한국기업 셀트리온, 세계 최초의 항체 바이오시밀러인 ʻ램시마ʼ 출시
○ 뇌신경세포 신호전달 원리 규명
○ 체세포를 성체줄기세포로 직접교차분화를 유도하는데 성공
○ 아시아인 당뇨-비만에 관계하는 새로운 유전변이 현상 및 요인 발견
○ 자폐증에 관여하는 새로운 유전자 및 발병원인 발견
⋙ 2013년
○ 인간 배아줄기세포 복제 성공. 태아의 피부세포를 핵을 제거한 난자에 융합시켜 인간 배아줄기세포를 만들고, 이후 심장세포로 자라게 하는 데 성공.
○ ʻDNA 백과사전ʼ 완성. 기능이 거의 없어 98%의 쓰레기 DNA(Junk DNA)의 기능이 거의 없고 정체가 불투명한 쓸모없는 유전자들로 ʻ쓰레기ʼ 가 인간 질병과 돌연변이에 관여한다는 사실 규명.
○ 유도만능줄기세포(iPS) 임상 연구를 세계 최초로 승인. 삼출형가령황반변성 (滲出型加齢黄斑変性)이라는 눈의 난치병의 환자로부터 만들어낸 iPS를 망막색소 상피세포로 변화시켜 손상된 부분에 이식하는 방식.
○ iPS 이용해 인간의 ʻ간ʼ 조직 배양 성공
○ 대사공학 기술을 이용해 대장균으로 휘발유 및 벤젠의 인공합성에 성공
○ 태아 중뇌에서 추출한 줄기세포로 만든 ʻ도파민 신경전구세포ʼ를 파킨슨병 환자의 뇌 피각부에 이식하는데 성공.
○ mRNA의 비정상적인 기능 인식과 제거에 관한 메커니즘 규명.
○ 포유류 신경 재생 메커니즘 규명. 포유류의 말초신경 재생 메커니즘 규명. 중추신경에 적용 할 경우 하반신 및 전신 마비환자 치료가능성 열려.
⋙ 2014년
○ N-말단 메티오닌, 세포내 단백질 분해 신호의 발견(Cell, 2014/01/16)
○ 고추 유전체서열 국내 독자 기술로 완성(Nature Genetics, 2014/01/19)
○ 혈액암의 한 유형인 악성림프종 돌연변이 유전자 규명(Nature Genetics, 2014/03/03)
○ 비만 조절하는 핵심 수용체 발견(Cell Metabolism, 2014/03/04)
○ 철 대사를 조절하여 병원성 세균의 증식을 억제하는 항균제제 후보물질 발견(Nature Medicine, 2014/03/23)
○ 성인체세포 이용한 줄기세포주 세계 최초 확립((Cell Stem Cell, 2014/04/18)
○ 빛으로 세포 내 단백질을 원격 조정한다(Nature Methods, 2014/05/04)
○ C형간염바이러스의 면역회피 메커니즘 규명(Gastroenterology, 2014/05/19)
○ 면역억제제 부작용 유발하는 유전자 발견(Nature Genetics, 2014/08/11)
○ 초기 배아 단계의 마이크로RNA 조절 현상 규명(Molecular Cell, 2014/11/13)
⋙ 2015년
○ 표적유전자만 제거, '크리스퍼 유전자 가위' 정확성 입증(Nature Methods, 2015/02/10)
○ 혈압 조절에 중요한 단백질 세포 속 분해과정(Science, 2015/03/13)
○ 한의학 처방 원리(군신좌사) 규명(Nature Biotechnology, 2015/03/06)
○ 피로물질 젖산, 세포신호물질로 새로운 기전 발견(Cell, 2015/04/16)
○ 유해 단백질의 분해 작용원리와 최종 변화과정 규명(Nature Cell Biology, 2015/06/15)
○ 암줄기세포 에너지 대사 규명(Gastroenterology, 2015/06/16)
○ 급성 골수성 백혈병의 새로운 신호 전달 경로 규명(Cell Stem Cell, 2015/07/23)
○ 항암 효과 뛰어난 GITR 항체의 작용기전 밝혀(Nature Medicine, 2015/08/17)
○ 뇌종양 재발위치에 따른 유전체 변이 패턴 세계최초 규명(Cancer Cell, 2015/09/14)
○ 빛으로 칼슘 농도 조절하고 기억력 높여(Nature Biotechnology, 2015/09/15)

1. 예산투자

출처 : 연도별 생명공학육성시행계획 자료가공
[그림 부록 2-1] 정부부문 생명공학 BT 투자실적(1994~2014년)
주1) ʼ07~ʼ12년의 투자실적에는 출연기관의 투자실적(932억원, 1,046억원, 913억원, 1,218억원, 1,542억원, 1,676억원)이 포함됨
주2) ʼ94~ʼ13년 기간 동안의 정부투자는 총 14조 8,125억원
주3) ʼ14년도 수치는 실적치가 아닌 ʼ14년도 생명공학육성시행계획상의 계획치임
주4) 보건복지부 ʻ첨단의료복합단지조성사업ʼ의 시설 및 기반구축 완료로 ʼ13년 대비 ʼ14년 정부부문 생명공학 투자액 감소(약 2천억원 감소)
[표 부록 2-1] 국내 부처별 BT 투자실적 및 계획(ʼ13~ʼ14년)
(단위 : 백만원, %)
|
구 분 |
’14년 투자계획 |
’13년 실적 (B) |
증감율 (%) ((A-B)/B) |
|||
|
연구 개발 |
인프라 |
인력 양성 |
합계 (A) |
|||
|
미래창조과학부 |
867,704 |
83,737 |
- |
951,441 |
920,785 |
3.3% |
|
교 육 부 |
138,923 |
- |
70,709 |
209,632 |
214,193 |
△2.1% |
|
농림축산식품부 |
294,774 |
- |
5,000 |
299,774 |
279,244 |
7.4% |
|
산업통상자원부 |
376,044 |
29,694 |
2,824 |
408,562 |
427,973 |
△4.5% |
|
보건복지부 |
306,732 |
15,262 |
- |
321,994 |
525,328 |
△38.7% |
|
환 경 부 |
36,226 |
4,391 |
- |
40,617 |
38,743 |
4.8% |
|
해양수산부 |
68,404 |
30,344 |
- |
98,748 |
115,406 |
△14.4% |
|
식품의약품 안전처 |
8,164 |
- |
- |
8,164 |
6,678 |
22.3% |
|
총 계 |
2,096,971 |
163,428 |
78,533 |
2,338,932 |
2,528,350 |
7.5% |
출처 : 2014년도 생명공학육성시행계획(2014.04)

출처 : 2014년도 생명공학육성시행계획(2014.04)
[그림 부록 2-2] 부처별 생명공학분야 연구개발비 점유율(ʼ14)
- 미래창조과학부가 전체 R&D 예산의 40.7%를 담당하고 있고, 교육부 9.0%, 농림축산식품부 12.8%, 산업통상자원부 17.5%, 보건복지부 13.8%, 환경부 1.7%, 해양수산부 4.2%, 식품의약품안전처에서 0.3%를 투자

출처 : 2014년도 생명공학육성시행계획(2014.04)
[그림 부록 2-3] 5대 분야별 연구개발 투자계획(ʼ14)
- 5대 기술분야별 투자는 생명과학(38.1%), 보건의료(33.2%), 농림수축산식품(14.5%), 산업공정/ 환경해양(5.2%), 바이오융합(4.8%) 순으로 나타남
|
구 분 |
생명 과학 |
보건 의료 |
농수 축산 식품 |
산업 공정/ 환경·해양 |
바이오 융합 |
기타 |
합계 |
|
2013실적 |
772,547 |
710,777 |
267,366 |
112,829 |
117,329 |
87,813 |
2,068,661 |
|
2014계획 |
799,018 |
696.410 |
303,147 |
109,234 |
100,931 |
88,239 |
2,096,979 |
|
증감율(%) |
3.4% |
▵2.0% |
13.4% |
▵3.2% |
▵14.0% |
0.5% |
1.4% |
출처 : 2014년도 생명공학육성시행계획(2014.04)
[표 부록 2-3] 기관별 BT분야 연구개발 투자비교(ʼ13년 실적 & ʼ14년 계획)
(단위 : 백만원)
|
구 분 |
2013실적 |
2014계획 |
증감율(%) |
|
미래창조과학부 |
854,411 |
867,704 |
1.6% |
|
교육부 |
142,082 |
138,923 |
▵2.2% |
|
농립축산식품부 |
271,444 |
294,774 |
8.6% |
|
산업통상자원부 |
392,149 |
376,044 |
▵4.1% |
|
보건복지부 |
305,508 |
306,732 |
0.4% |
|
환경부 |
38,614 |
36,226 |
▵6.2% |
|
해양수산부 |
57,766 |
68,404 |
18.4% |
|
식품의약품안전처 |
6,678 |
8,164 |
22.3% |
|
합계 |
2,068,652 |
2,096,971 |
1.4% |
출처 : 2014년도 생명공학육성시행계획(2014.04)
[표 부록 2-4] 5대 분야별 연구개발 투자비교(ʼ13년 실적 & ʼ14년 계획)
(단위 : 백만원)
|
구 분 |
2013실적 |
2014계획 |
증감율(%) |
|
생명과학 |
772,547 |
799,018 |
3.4% |
|
보건의료 |
710,777 |
696,410 |
▵2.0% |
|
농수축산식품 |
267,366 |
303,147 |
13.4% |
|
산업공정/환경·해양 |
112,829 |
109,234 |
▵3.2% |
|
바이오융합 |
117,329 |
100,931 |
▵14.0% |
|
기타 |
87,813 |
88,239 |
0.5% |
|
합계 |
2,068,661 |
2,096,979 |
1.4% |
출처 : 2014년도 생명공학육성시행계획(2014.04)
[표 부록 2-5] 정부 및 민간 BT 연구개발 투자(ʼ10~ʼ13)
(단위 : 억원)
|
구 분 |
2010 |
2011 |
2012 |
2013 |
|
정부 |
23,252 |
25,808 |
27,509 |
28,770 |
|
민간 |
11,339 |
14,240 |
14,950 |
16,273 |
|
합계 |
34,591 |
40,048 |
42,459 |
45,043 |
출처 : 한국과학기술기획평가원, 2013년도 연구개발활동조사보고서(2014.12), NTIS 과학기술통계서비스, 생명공학정책연구센터 재가공
주1) 정부 BT 연구개발비는 NTIS 과학기술통계서비스를 참고함
주2) 합계액은 ʻ2013년도 연구개발활동조사보고서ʼ를 참고함(민간 BT 연구개발비 = 합계액 – 정부 BT 연구개발비)

출처 : 한국과학기술기획평가원, 2013년도 연구개발활동조사보고서(2014.12), NTIS 과학기술통계서비스, 생명공학정책연구센터 재가공
[그림 부록 2-4] 정부 및 민간 BT 연구개발 투자(ʼ10~ʼ13)
2. 시설 및 인프라

출처 : 2014년도 생명공학육성시행계획(2014.04)
[그림 부록 2-5] 기관별 시설 및 기반구축 투자계획(ʼ14)
- 기관별 시설 및 기반구축 투자는 미래창조과학부(51.2%), 해양수산부(18.6%), 산업통상자원부(18.2%), 보건복지부(9.3%), 환경부(2.7%) 순으로 나타남
[표 부록 2-6] 기관별 시설 및 기반구축 투자계획
(단위 : 백만원)
|
구 분 |
미래 창조 과학부 |
농림 축산 식품부 |
산업 통상 자원부 |
보건 복지부 |
환경부 |
해양 수산부 |
합계 |
|
2013 실적 |
66,374 |
4,800 |
33,516 |
219,820 |
129 |
57,640 |
382,279 |
|
2014 계획 |
83,737 |
- |
29,694 |
15,262 |
4,391 |
30,334 |
163,418 |
|
증감율 (%) |
26.2% |
▵100% |
▵11.4% |
▵93.1% |
3,303.9% |
▵47.4% |
▵57.3% |
출처 : 2014년도 생명공학육성시행계획(2014.04)
3. 인력 양성
[표 부록 2-7] 생명공학분야 인력양성 실적(ʼ09~ʼ13)
(단위 : 명, 건)
|
구 분 |
2009년 |
2010년 |
2011년 |
2012년 |
2013년 |
|
|
우수 인력 배출 |
석사 |
4,390명 |
3,146명 |
3,718명 |
2,990명 |
2,351명 |
|
박사 |
2,232명 |
1,322명 |
1,729명 |
1,407명 |
1,153명 |
|
|
국제 교류 인력 |
해외 연구자 유치 |
516명 |
644명 |
790명 |
407명 |
772명 |
|
국내 연구자 파견 |
71명 |
132명 |
171명 |
170명 |
233명 |
|
|
참여연구 인력 |
35,213명 |
54,289명 |
47,351명 |
68,244명 |
36,273명 |
|
|
국제 학술대회 개최(건) |
330건 |
513건 |
621건 |
428건 |
1,019건 |
|
출처 : 연도별 생명공학육성시행계획 자료가공

출처 : 2014년도 생명공학육성시행계획(2014.04)
[그림 부록 2-6] 기관별 인력양성 투자계획(ʼ14)
- 기관별 인력양성 투자는 교육부(90%), 농림축산식품부(6.4%), 산업통상자원부(3.6%) 순으로 나타남
[표 부록 2-8] 기관별 인력양성 투자계획
(단위 : 백만원)
|
구분 |
교육부 |
농림축산 식품부 |
산업통상 자원부 |
합계 |
|
2013실적 |
72,111 |
3,000 |
2,308 |
77,419 |
|
2014계획 |
70,709 |
5,000 |
2,824 |
78,533 |
|
증감율(%) |
▵1.9% |
66.7% |
22.4% |
1.4% |
출처 : 2014년도 생명공학육성시행계획(2014.04)

출처 : 교육통계서비스(http://cesi.kedi.re.kr/index) 자료, 생명공학정책 연구센터 재가공(2015.05)
[그림 부록 2-7] 국내 생명공학분야 졸업자 현황(ʼ11~ʼ14)
주1) 생명공학분야 : 교육통계에 제시된 소계열 분류 중 12개 소계열이 해당(농업학, 동물‧수의학, 보건학, 산림‧원예학, 생명과학, 생물학, 약학, 의료공학, 의학, 재활학, 치의학, 한의학)
[표 부록 2-9] 국내 생명공학분야 졸업자의 학위별 성별 현황(ʼ11~ʼ14)
(단위 : 명)
|
구분 |
2011 |
2012 |
2013 |
2014 |
|
|
석사 |
남자 |
4,091 |
4,283 |
4,554 |
4,665 |
|
여자 |
4,398 |
4,717 |
5,083 |
5,168 |
|
|
소계 |
8,489 |
9,000 |
9,637 |
9,833 |
|
|
박사 |
남자 |
1,924 |
1,958 |
1,915 |
1,905 |
|
여자 |
1,062 |
1,131 |
1,218 |
1,282 |
|
|
소계 |
2,986 |
3,089 |
3,133 |
3,187 |
|
|
총계 |
11,475 |
12,089 |
12,770 |
13,020 |
|
출처 : 교육통계서비스(http://cesi.kedi.re.kr/index) 자료, 생명공학정책 연구센터 재가공(2015.05)
4. 산업

출처 : 국가과학기술자문회의, 성장과 복지를 위한 바이오 미래전략(2014.07)
[그림 부록 2-8] 글로벌 바이오 시장 전망(Datamonitor 기준)

출처 : MarketLine, MarketLine Industry Guide Biotechnology(2013.08), 생명공학정책연구센터 재가공
[그림 부록 2-9] 글로벌 바이오 시장 현황 및 전망(MarketLine 기준)

출처 : 산업통상자원부, 한국바이오협회, 2013년 기준 국내 바이오산업 실태조사 결과 보고서(2015.02)
[그림 부록 2-10] 국내 바이오산업 수급 변화 추이(ʼ09~ʼ13)
[표 부록 2-10] 국내 바이오산업 수급 변화 추이(ʼ09~ʼ13)
(단위 : 억 원, %)
|
구분 |
2009년 |
2010년 |
2011년 |
2012년 |
2013년 |
연평균 중감률 |
|
|
수급 (생산+수입) |
금액 |
66,841 |
71,935 |
79,574 |
85,756 |
90,333 |
7.8 |
|
증감률 |
18.1 |
7.6 |
10.6 |
7.8 |
5.3 |
||
|
생산 (국내판매+수출) |
금액 |
53,549 |
57,878 |
63,963 |
71,445 |
75,238 |
8.9 |
|
증감률 |
18.7 |
8.1 |
10.5 |
11.7 |
5.3 |
||
|
내수 (국내판매+수입) |
금액 |
42,367 |
47,519 |
52,081 |
55,281 |
58,669 |
8.5 |
|
증감률 |
12.8 |
12.2 |
9.6 |
6.1 |
6.1 |
||
출처 : 산업통상자원부, 한국바이오협회, 2013년 기준 국내 바이오산업 실태조사 결과 보고서(2015.02)
[표 부록 2-11] 국내 바이오산업 분야별 수급 변화 추이(ʼ09~ʼ13)
|
구분 |
생산 |
내수 |
||||||||||||
|
’09 |
’10 |
’11 |
’12 |
’13 |
전년 대비 증감률 |
연평균 증감률 |
’09 |
’10 |
’11 |
’12 |
’13 |
전년 대비 증감률 |
연평균 증감률 |
|
|
전체 |
53,549 |
57,878 |
63,963 |
71,445 |
75,238 |
5.3 |
8.9 |
42,367 |
47,519 |
52,081 |
55,281 |
58,669 |
6.1 |
8.5 |
|
바이오의약 |
24,922 |
23,732 |
24,607 |
27,087 |
27,754 |
2.5 |
2.7 |
25,363 |
26,210 |
27,367 |
28,194 |
29,616 |
5.0 |
4.0 |
|
바이오화학 |
3,303 |
2,904 |
4,305 |
5,030 |
5,622 |
11.8 |
14.2 |
3,721 |
3,245 |
4,354 |
4,749 |
5,152 |
8.5 |
8.5 |
|
바이오식품 |
15,593 |
23,461 |
25,978 |
28,579 |
30,211 |
5.7 |
18.0 |
5,148 |
9,992 |
10,989 |
13,019 |
13,856 |
6.4 |
28.1 |
|
바이오환경 |
2,281 |
1,060 |
1,092 |
275 |
301 |
9.6 |
-39.7 |
2,192 |
1,037 |
1,066 |
277 |
303 |
9.6 |
-39.0 |
|
바이오전자 |
699 |
1,212 |
1,164 |
1,238 |
1,517 |
22.5 |
21.4 |
369 |
489 |
239 |
242 |
373 |
53.8 |
0.3 |
|
바이오공정 및 기기 |
2,127 |
963 |
811 |
1,219 |
1,228 |
0.7 |
-12.8 |
2,952 |
2,405 |
2,496 |
1,308 |
1,305 |
-0.2 |
-18.5 |
|
바이오 에너지 및 자원 |
1,207 |
2,913 |
4,387 |
6,122 |
6,659 |
8.8 |
53.3 |
1,216 |
2,769 |
4,237 |
5,959 |
6,504 |
9.1 |
52.1 |
|
바이오검정, 정보서비스 및 연구개발 |
3,417 |
1,633 |
1,620 |
1,895 |
1,947 |
2.7 |
-13.1 |
1,406 |
1,373 |
1,333 |
1,533 |
1,560 |
1.8 |
2.6 |
출처 : 산업통상자원부, 한국바이오협회, 2013년 기준 국내 바이오산업 실태조사 결과 보고서(2015.02)
[표 부록 2-12] 국내 바이오산업 수출·수입 변화 추이(ʼ09~ʼ13)
|
구분 |
2009년 |
2010년 |
2011년 |
2012년 |
2013년 |
연평균 증감률 |
|
|
수출 |
금액 |
24,474 |
24,415 |
27,494 |
30,475 |
31,664 |
6.7 |
|
증감률 |
28.6 |
-0.2 |
12.6 |
10.8 |
3.9 |
||
|
구분 |
2009년 |
2010년 |
2011년 |
2012년 |
2013년 |
연평균 증감률 |
|
|
수입 |
금액 |
13,292 |
14,057 |
15,612 |
14,311 |
15,095 |
3.2 |
|
증감률 |
15.9 |
5.8 |
11.1 |
-8.3 |
5.5 |
||
출처 : 산업통상자원부, 한국바이오협회, 2013년 기준 국내 바이오산업 실태조사 결과 보고서(2015.02)

출처 : 산업통상자원부, 한국바이오협회, 2013년 기준 국내 바이오산업 실태조사 결과 보고서(2015.02)
[그림 부록 2-11] 국내 바이오산업체의 소재지별 분포
주1) 바이오사업장의 경우 공장 > 연구소 > 본사의 순서로 소재지 분석


생명공학육성법
[시행 2014.11.19.] [법률 제12844호, 2014.11.19., 타법개정]
제1조(목적) 이 법은 생명공학연구의 기반을 조성하여 생명공학을 보다 효율적으로 육성·발전시키고 그 개발기술의 산업화를 촉진하여 국민경제의 건전한 발전에 기여하게 함을 목적으로 한다.
[전문개정 2013.3.23]
제2조(정의) 이 법에서 "생명공학"이라 함은 다음 각호의 학문과 기술을 말한다.
1. 산업적으로 유용한 생산물을 만들거나 생산공정을 개선할 목적으로 생물학적 시스템, 생체, 유전체 또는 그들로부터 유래되는 물질을 연구·활용하는 학문과 기술
2. 생명현상의 기전(起傳), 질병의 원인 또는 발병과정에 대한 연구를 통하여 생명공학의 원천지식을 제공하는 생리학·병리학·약리학 등의 학문[이하 "기초의과학(基礎醫科學)" 이라 한다]
[전문개정 2003.12.30]
제3조(적용범위) 생명공학에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 의한다. <개정 1995.1.5, 2013.3.23>
[제목개정 2013.3.23]
제4조(생명공학육성기본계획의 수립) ① 제13조의 규정에 의한 관계부처의 장은 소관별로 생명공학육성에 관한 계획을 미래창조과학부장관에게 제출하여야 한다. <개정 2013.3.23>
② 미래창조과학부장관은 제1항의 규정에 의하여 관계부처의 장이 제출한 소관사항에 관한 생명공학육성계획을 종합·조정하여 생명공학육성기본계획(이하 "기본계획"이라 한다)을 수립한다. <개정 2013.3.23>
③ 제2항의 규정에 의한 기본계획에는 다음의 사항이 포함되어야 한다. <개정 1995.1.5, 1997.8.28, 2013.3.23>
1. 생명공학의 기초연구 및 산업적 응용연구의 육성에 관한 종합계획과 지침
2. 생명공학의 연구에 필요한 인력자원의 개발종합계획과 인력자원의 효율적인 활용에 관한 지침
3. 생명공학의 연구 및 이와 관련된 산업기술인력의 국제교류와 해외과학기술자의 활용에 관한 계획과 그 지침
④ 미래창조과학부장관은 기본계획을 수립하고자 할 때에는 제6조의 생명공학종합정책심의회의 심의를 거쳐야 한다. <개정 2013.3.23>
[제목개정 2013.3.23.]
제5조(생명공학육성 연차별 시행계획의 수립등) ① 관계부처의 장은 기본계획에 따라 생명공학육성 연차별 시행계획(이하 "시행계획"이라 한다)을 수립하고 이를 시행하여야 한다. <개정 2013.3.23>
② 관계부처의 장은 시행계획을 수립하고자 할 때에는 미리 미래창조과학부장관과 협의하여야 한다. <개정 2013.3.23>
③ 미래창조과학부장관은 시행계획의 수립을 위하여 필요한 때에는 그 계획의 수립에 필요한 기본지침을 작성하여 관계부처의 장에게 통보할 수 있다. <개정 2013.3.23>
④ 시행계획의 수립 및 그 시행에 관하여 필요한 사항은 대통령령으로 정한다. <개정 2013.3.23>
[제목개정 2013.3.23]
제6조(생명공학종합정책심의회) ① 기본계획의 수립과 그 집행 및 조정에 관한 업무를 관장하기 위하여 미래창조과학부장관소속하에 생명공학종합정책심의회(이하 "심의회"라 한다)를 둔다. <개정 2013.3.23>
② 심의회는 다음 사항을 심의 결정한다. <개정 1995.1.5, 1997.8.28, 2003.12.30, 2008.2.29, 2011.7.21, 2013.3.23>
1. 생명공학의 기초연구 및 산업적 응용연구의 육성에 관한 계획의 수립 및 그 집행의 조정
2. 생명공학의 연구 및 기술개발에 관한 기본계획의 수립과 이에 따른 중요정책의 수립 및 그 집행의 조정
3. 생명공학분야 인력개발에 관한 종합계획과 이에 따른 중요정책, 인력활용지침의 수립 및 그 집행의 조정
4. 생명공학의 연구 및 이와 관련된 산업기술인력의 개발교류와 해외과학기술자의 활용에 관한 계획의 수립 및 그 집행의 조정
5. 유전자원의 이용과 보전을 위한 연구개발계획의 수립 및 그 집행의 조정
6. 「뇌연구 촉진법」 제5조제2항의 뇌연구촉진기본계획의 수립·변경과 이에 따른 중요 정책의 수립 및 그 집행의 조정
7. 「뇌연구 촉진법」 제9조에 따른 뇌연구 투자 확대계획 등 뇌연구 관련 예산의 확대방안에 관한 사항
8. 뇌연구 분야 인력 개발 및 교류에 관한 종합계획과 이에 따른 중요 정책, 인력활용지침의 수립 및 그 집행의 조정
9. 뇌연구 결과의 이용과 보전을 위한 계획의 수립 및 그 집행의 조정
10. 그 밖에 생명공학육성과 뇌연구 촉진에 관하여 미래창조과학부장관이 필요하다고 인정하는 사항
③ 심의회는 위원장 1인을 포함한 17인 이내의 위원으로 구성한다. <신설 2003.12.30>
④ 위원장은 미래창조과학부장관이 되고 위원은 다음 각호의 자가 된다. <신설 2003.12.30, 2008.2.29, 2013.3.23>
1. 대통령령이 정하는 관계 중앙행정기관의 차관급 공무원
2. 학계·연구기관 또는 산업계에 종사하는 생명공학 관계자 및 생명윤리 전문가
⑤ 이 법에서 규정한 사항외에 심의회의 조직 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다. <신설 2003.12.30>
[제목개정 2013.3.23]
제7조 삭제 <2003.12.30>
제8조 삭제 <2003.12.30>
제9조(연구 및 기술협력) 미래창조과학부장관은 생명공학의 연구 및 기술에 관한 국제협력의 증진에 노력하고 선진기술의 도입을 위한 효율적인 방안을 강구한다.
[전문개정 2013.3.23]
제10조(공동연구의 촉진) 정부는 생명공학연구 및 기술개발의 효율적 육성을 위하여 학계·연구기관 및 산업계간의 공동연구를 촉진하여야 한다.
[전문개정 2013.3.23.]
제11조(생명공학의 산업적 응용촉진에 대한 지원) 정부는 생명공학 연구개발을 활성화하고 그 결과의 산업적 응용을 촉진하기 위하여 다음 각호의 사항에 대한 지원시책을 강구하여야 한다.
1. 생명공학관련 신기술제품의 생산지원에 관한 사항
2. 생명공학 연구결과의 산업적 응용을 촉진하기 위한 연구개발 및 지역거점 구축에 관한 사항
3. 생명공학관련 중소·벤처기업의 창업지원에 관한 사항
[전문개정 2003.12.30]
제12조(기술정보의 수집과 보급) 정부는 생명공학연구에 관한 정보를 수집, 관계기관에 보급함으로써 연구개발촉진에 노력하여야 한다.
[전문개정 2013.3.23]
제13조(생명공학 육성시책 강구 등) ①정부는 생명공학의 효율적인 육성을 위하여 생명공학의 기초연구 및 산업적 응용연구에 관하여 다음 각호의 시책을 강구한다. 다만, 기초의과학(基礎醫科學)분야의 연구개발 촉진 및 육성업무는 미래창조과학부장관 및 보건복지부장관의 소관으로 한다. <개정 1997.8.28, 2001.1.29, 2003.12.30, 2004.12.31, 2008.2.29, 2010.1.18, 2013.3.23>
1. 미래창조과학부장관: 제4조제2항의 규정에 의한 기본계획의 수립과 부처별 정책 수립의 지원 및 종합조정, 생명공학 관련 기초기술 및 첨단기술의 개발지원, 과학기술 분야의 유용한 유전자의 확보·분석·이용·보전을 위한 연구의 지원, 생명공학 지원기관의 육성·발전, 생명공학의 육성·발전을 위한 정보통신기술의 개발 지원을 위한 시책
2. 교육부장관: 생명공학분야의 연구를 촉진시키기 위한 전문인력의 양성과 생명과학기초분야의 연구지원을 위한 시책으로서, 미래창조과학부장관과 협의한 시책
3. 농림축산식품부장관: 동·식물 및 미생물의 육종·품종개량 및 식품소재의 개발 등 응용연구의 지원 및 농림분야의 유용한 유전자의 확보·분석·이용·보존 등 기초연구의 지원 및 연구기관의 육성·발전을 위한 시책
4. 산업통상자원부장관: 생명공학 관련 산업공정의 개발과 개선, 신·재생에너지개발, 에너지 및 광물자원의 효율적 활용, 생명공학 관련 생산기술개발 등의 지원과 그 개발기술의 산업화 촉진을 위한 시책
4의2. 삭제 <2008.2.29>
5. 보건복지부장관: 보건·의료·식품위생 등 생명공학과 관련되는 기술에 대한 연구개발의 촉진과 관련전문인력 양성, 임상시험 관련사업 육성 및 연구의 지원을 위한 시책
6. 환경부장관: 생물다양성의 보전, 그 구성요소의 지속가능한 이용 및 생명공학기술을 이용한 폐수·폐기물의 처리 및 환경오염의 방지등을 위한 기술개발과 기초연구 및 응용연구 지원을 위한 시책
7. 해양수산부장관: 해양수산생물을 이용한 유용물질의 생산과 해양수산생물의 육종·개량 및 식품소재의 개발 등 응용연구의 지원, 해양수산분야의 유용한 유전자의 확보·분석·이용·보존 등 기초연구의 지원, 해양오염방지 등을 위한 기술개발 및 연구기관의 육성·발전을 위한 시책
② 미래창조과학부장관과 보건복지부장관은 기초의과학(基礎醫科學)을 육성하기 위한 시책을 수립하고자 하는 때에는 협의하여야 한다. <신설 2003.12.30, 2008.2.29, 2010.1.18, 2013.3.23>
[전문개정 1995.1.5]
[제목개정 2013.3.23]
제14조(검정 및 임상) ① 정부는 생명공학 관련제품에 대한 임상 및 검정체제를 확립한다. <개정 2013.3.23>
② 제1항의 임상 및 검정체제확립에 관하여 필요한 사항은 대통령령으로 정한다. <개정 2013.3.23>
[제목개정 2013.3.23.]
제15조(실험지침의 작성·시행등) ① 정부는 생명공학연구 및 산업화의 촉진을 위한 실험지침을 작성·시행하여야 한다. <개정 2013.3.23>
② 제1항의 실험지침에서는 생명공학의 연구와 이의 산업화 과정에서 예견될 수 있는 생물학적 위험성, 환경에 미치는 악영향 및 윤리적 문제발생의 사전방지에 필요한 조치가 강구되어야 하며, 유전적으로 변형된 생물체의 이전·취급·사용에 대한 안전기준이 마련되어야 한다. <개정 2013.3.23>
[제목개정 2013.3.23]
제16조(한국생명공학연구원) ①생명공학연구[다만, 기초의과학(基礎醫科學)연구를 제외한다. 이하 이 조에서 같다] 및 유전자원의 이용과 보전에 관한 연구의 중추적 기능을 담당하고 생명공학분야에서의 학계·연구기관 및 산업계간의 상호유기적 협조체제를 유지·발전시키며, 이들을 지원하기 위하여 재단법인인 한국생명공학연구원(이하 "연구원"이라 한다)을 설립할 수 있다. <개정 1995.1.5, 2003.12.30, 2013.3.23>
② 제1항의 규정에 의한 연구원은 특정연구기관육성법의 적용을 받는 특정연구기관으로 한다. <개정 2013.3.23>
③ 삭제 <1995.12.6>
[제목개정 2013.3.23]
제17조(기초의과학육성지원기구) ①정부는 기초의과학(基礎醫科學)을 육성하기 위하여 기초의과학육성지원기구(이하 "육성지원기구"라 한다)를 지정하여 운영할 수 있다.
② 정부는 예산의 범위안에서 육성지원기구의 운영에 필요한 경비를 지원할 수 있다.
③ 육성지원기구의 지정 및 운영에 관하여 필요한 사항은 대통령령으로 정한다.
[본조신설 2003.12.30]
제18조 삭제 <1995.12.6>
제19조(수입신고 수리 전 반출) ① 삭제 <2003.12.30>
② 생명공학연구활동에 필요한 관련 자재·기기나 시약 중 국내에서 생산하지 아니하는 품목으로서, 변질 등의 이유로 통관이 시급히 필요한 물품은 「관세법」의 규정에도 불구하고 대통령령으로 정하는 바에 따라 수입신고 수리 전에 반출할 수 있다. <개정 2013.3.23>
[제목개정 2013.3.23]
제20조 삭제 <2003.12.30.>
<제11683호, 2013.3.23>
이 법은 공포한 날부터 시행한다.
시행일) 이 법은 공포한 날부터 시행한다. 다만, 부칙 제6조에 따라 개정되는 법률 중 이 법 시행 전에 공포되었으나 시행일이 도래하지 아니한 법률을 개정한 부분은 각각 해당 법률의 시행일부터 시행한다.
제2조부터 제5조까지 생략
(다른 법률의 개정) ①부터 <18>까지 생략
<19> 생명공학육성법 일부를 다음과 같이 개정한다.
제13조제1항제1호 및 제2호를 각각 다음과 같이 한다.
1. 교육부장관: 생명공학분야의 연구를 촉진시키기 위한 전문인력의 양성과 생명과학기초분야의 연구지원을 위한 시책으로서, 미래창조과학부장관과 협의한 시책
2. 미래창조과학부장관: 제4조제2항의 규정에 의한 기본계획의 수립과 부처별 정책 수립의 지원 및 종합조정, 생명공학 관련 기초기술 및 첨단기술의 개발지원, 과학기술 분야의 유용한 유전자의 확보ㆍ분석ㆍ이용ㆍ보전을 위한 연구의 지원, 생명공학 지원기관의 육성ㆍ발전, 생명공학의 육성ㆍ발전을 위한 정보통신기술의 개발 지원을 위한 시책
<20>부터 <258>까지 생략

생명윤리 및 안전에 관한 법률
[시행 2014.11.19.] [법률 제12844호, 2014.11.19., 타법개정]
제1장 총칙
제1조(목적) 이 법은 인간과 인체유래물 등을 연구하거나, 배아나 유전자 등을 취급할 때 인간의 존엄과 가치를 침해하거나 인체에 위해(危害)를 끼치는 것을 방지함으로써 생명윤리 및 안전을 확보하고 국민의 건강과 삶의 질 향상에 이바지함을 목적으로 한다.
제2조(정의) 이 법에서 사용하는 용어의 뜻은 다음과 같다.
1. "인간대상연구"란 사람을 대상으로 물리적으로 개입하거나 의사소통, 대인 접촉 등의 상호작용을 통하여 수행하는 연구 또는 개인을 식별할 수 있는 정보를 이용하는 연구로서 보건복지부령으로 정하는 연구를 말한다.
2. "연구대상자"란 인간대상연구의 대상이 되는 사람을 말한다.
3. "배아"(胚芽)란 인간의 수정란 및 수정된 때부터 발생학적(發生學的)으로 모든 기관(器官)이 형성되기 전까지의 분열된 세포군(細胞群)을 말한다.
4. "잔여배아"란 체외수정(體外受精)으로 생성된 배아 중 임신의 목적으로 이용하고 남은 배아를 말한다.
5. "잔여난자"란 체외수정에 이용하고 남은 인간의 난자를 말한다.
6. "체세포핵이식행위"란 핵이 제거된 인간의 난자에 인간의 체세포 핵을 이식하는 것을 말한다.
7. "단성생식행위"란 인간의 난자가 수정 과정 없이 세포분열하여 발생하도록 하는 것을 말한다.
8. "체세포복제배아"(體細胞複製胚芽)란 체세포핵이식행위에 의하여 생성된 세포군을 말한다.
9. "단성생식배아"(單性生殖胚芽)란 단성생식행위에 의하여 생성된 세포군을 말한다.
10. "배아줄기세포주"(Embryonic stem cell lines)란 배아, 체세포복제배아, 단성생식배아 등으로부터 유래한 것으로서, 배양 가능한 조건에서 지속적으로 증식(增殖)할 수 있고 다양한 세포로 분화(分化)할 수 있는 세포주(細胞株)를 말한다.
11. "인체유래물"(人體由來物)이란 인체로부터 수집하거나 채취한 조직ㆍ세포ㆍ혈액ㆍ체액 등 인체 구성물 또는 이들로부터 분리된 혈청, 혈장, 염색체, DNA(Deoxyribonucleic acid), RNA(Ribonucleic acid), 단백질 등을 말한다.
12. "인체유래물연구"란 인체유래물을 직접 조사ㆍ분석하는 연구를 말한다.
13. "인체유래물은행"이란 인체유래물 또는 유전정보와 그에 관련된 역학정보(疫學情報), 임상정보 등을 수집ㆍ보존하여 이를 직접 이용하거나 타인에게 제공하는 기관을 말한다.
14. "유전정보"란 인체유래물을 분석하여 얻은 개인의 유전적 특징에 관한 정보를 말한다.
15. "유전자검사"란 인체유래물로부터 유전정보를 얻는 행위로서 개인의 식별 또는 질병의 예방ㆍ진단ㆍ치료 등을 위하여 하는 검사를 말한다.
16. "유전자치료"란 질병의 예방 또는 치료를 목적으로 유전적 변이를 일으키는 일련의 행위를 말한다.
17. "개인식별정보"란 연구대상자와 배아ㆍ난자ㆍ정자 또는 인체유래물의 기증자(이하 "연구대상자등"이라 한다)의 성명ㆍ주민등록번호 등 개인을 식별할 수 있는 정보를 말한다.
18. "개인정보"란 개인식별정보, 유전정보 또는 건강에 관한 정보 등 개인에 관한 정보를 말한다.
19. "익명화"(匿名化)란 개인식별정보를 영구적으로 삭제하거나, 개인식별정보의 전부 또는 일부를 해당 기관의 고유식별기호로 대체하는 것을 말한다.
제3조(기본 원칙) ① 이 법에서 규율하는 행위들은 인간의 존엄과 가치를 침해하는 방식으로 하여서는 아니 되며, 연구대상자등의 인권과 복지는 우선적으로 고려되어야 한다.
② 연구대상자등의 자율성은 존중되어야 하며, 연구대상자등의 자발적인 동의는 충분한 정보에 근거하여야 한다.
③ 연구대상자등의 사생활은 보호되어야 하며, 사생활을 침해할 수 있는 개인정보는 당사자가 동의하거나 법률에 특별한 규정이 있는 경우를 제외하고는 비밀로서 보호되어야 한다.
④ 연구대상자등의 안전은 충분히 고려되어야 하며, 위험은 최소화되어야 한다.
⑤ 취약한 환경에 있는 개인이나 집단은 특별히 보호되어야 한다.
⑥ 생명윤리와 안전을 확보하기 위하여 필요한 국제 협력을 모색하여야 하고, 보편적인 국제기준을 수용하기 위하여 노력하여야 한다.
제4조(적용 범위) ① 생명윤리 및 안전에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 따른다.
② 생명윤리 및 안전에 관한 내용을 담은 다른 법률을 제정하거나 개정할 경우에는 이 법에 부합하도록 하여야 한다.
제5조(국가와 지방자치단체의 책무) ① 국가와 지방자치단체는 생명윤리 및 안전에 관한 문제에 효율적으로 대처할 수 있도록 필요한 시책을 마련하여야 한다.
② 국가와 지방자치단체는 생명윤리 및 안전 관련 연구와 활동에 대한 행정적ㆍ재정적 지원방안을 마련하여야 한다.
③ 국가와 지방자치단체는 각급 교육기관 등에서 생명윤리 및 안전에 대한 교육을 할 수 있도록 하여야 하고, 교육 프로그램을 개발하는 등 교육 여건이 조성되도록 지원하여야 한다.
제6조(생명윤리정책연구센터의 지정) ① 보건복지부장관은 생명윤리정책에 관한 전문적인 조사, 연구 및 교육 등을 실시하기 위하여 해당 업무를 수행할 능력이 있다고 인정하는 기관ㆍ단체 또는 시설을 생명윤리정책연구센터로 지정할 수 있다.
② 제1항에 따른 생명윤리정책연구센터의 지정 및 운영 등에 필요한 사항은 보건복지부령으로 정한다.
제7조(국가생명윤리심의위원회의 설치 및 기능) ① 생명윤리 및 안전에 관한 다음 각 호의 사항을 심의하기 위하여 대통령 소속으로 국가생명윤리심의위원회(이하 "국가위원회"라 한다)를 둔다.
1. 국가의 생명윤리 및 안전에 관한 기본 정책의 수립에 관한 사항
2. 제12조제1항제3호에 따른 공용기관생명윤리위원회의 업무에 관한 사항
3. 제15조제2항에 따른 인간대상연구의 심의 면제에 관한 사항
4. 제19조제3항에 따른 기록ㆍ보관 및 정보 공개에 관한 사항
5. 제29조제1항제3호에 따른 잔여배아를 이용할 수 있는 연구에 관한 사항
6. 제31조제2항에 따른 연구의 종류ㆍ대상 및 범위에 관한 사항
7. 제35조제1항제3호에 따른 배아줄기세포주를 이용할 수 있는 연구에 관한 사항
8. 제36조제2항에 따른 인체유래물연구의 심의 면제에 관한 사항
9. 제50조제1항에 따른 유전자검사의 제한에 관한 사항
10. 그 밖에 생명윤리 및 안전에 관하여 사회적으로 심각한 영향을 미칠 수 있다고 판단하여 국가위원회의 위원장이 회의에 부치는 사항
② 국가위원회의 위원장은 제1항제1호부터 제9호까지의 규정에 해당하는 사항으로서 재적위원 3분의 1 이상의 위원이 발의한 사항에 관하여는 국가위원회의 회의에 부쳐야 한다.
제8조(국가위원회의 구성) ① 국가위원회는 위원장 1명, 부위원장 1명을 포함한 16명 이상 20명 이하의 위원으로 구성한다. <개정 2013.3.23>
② 위원장은 위원 중에서 대통령이 임명하거나 위촉하고, 부위원장은 위원 중에서 호선(互選)한다.
③ 국가위원회의 위원은 다음 각 호의 사람이 된다. <개정 2013.3.23., 2014.11.19.>
1. 미래창조과학부장관, 교육부장관, 법무부장관, 산업통상자원부장관, 보건복지부장관, 여성가족부장관
2. 생명과학ㆍ의과학(醫科學)ㆍ사회과학 등의 연구 분야에 대한 전문지식과 경험이 풍부한 사람 중에서 대통령이 위촉하는 7명 이내의 사람
3. 종교계ㆍ윤리학계ㆍ법조계ㆍ시민단체(「비영리민간단체 지원법」 제2조에 따른 비영리민간단체를 말한다) 또는 여성계를 대표하는 사람 중에서 대통령이 위촉하는 7명 이내의 사람
④ 제3항제2호 및 제3호에 따른 위원의 임기는 3년으로 하되, 연임할 수 있다. 다만, 위원의 자리가 비게 된 경우에 새로 위촉된 위원의 임기는 전임자 임기의 남은 기간으로 한다.
⑤ 국가위원회에 간사위원 2명을 두되, 간사위원은 미래창조과학부장관과 보건복지부장관으로 하며, 수석 간사위원은 보건복지부장관으로 한다. <개정 2013.3.23.>
⑥ 보건복지부장관은 국가위원회의 사무 처리 등 업무를 지원하기 위하여 보건복지부령으로 정하는 바에 따라 생명윤리 및 안전에 관련한 전문기관 중 하나를 지정하여 그 전문기관으로 하여금 사무국의 기능을 수행하게 할 수 있다. <신설 2014.3.18.>
제9조(국가위원회의 운영) ① 국가위원회의 효율적인 운영을 위하여 국가위원회에 분야별 전문위원회를 둘 수 있다.
② 국가위원회의 사무는 수석 간사위원이 처리한다.
③ 국가위원회의 회의 등 활동은 독립적이어야 하고, 공개를 원칙으로 한다.
④ 국가위원회는 필요한 경우에 관련 당사자의 출석, 의견 진술 및 자료 제출 등을 요구할 수 있다. 이 경우 해당 요구를 받은 자는 타당한 사유가 없으면 요구에 따라야 한다.
⑤ 이 법에서 정한 사항 외에 국가위원회 및 전문위원회의 구성ㆍ운영, 그 밖에 필요한 사항은 대통령령으로 정한다.
제10조(기관생명윤리위원회의 설치 및 기능) ① 생명윤리 및 안전을 확보하기 위하여 다음 각 호의 기관은 기관생명윤리위원회(이하 "기관위원회"라 한다)를 설치하여야 한다.
1. 인간대상연구를 수행하는 자(이하 "인간대상연구자"라 한다)가 소속된 교육ㆍ연구 기관 또는 병원 등
2. 인체유래물연구를 수행하는 자(이하 "인체유래물연구자"라 한다)가 소속된 교육ㆍ연구 기관 또는 병원 등
3. 제22조제1항에 따라 지정된 배아생성의료기관
4. 제29조제2항에 따라 등록한 배아연구기관
5. 제31조제3항에 따라 등록한 체세포복제배아등의 연구기관
6. 제41조제1항에 따라 보건복지부장관의 허가를 받은 인체유래물은행
7. 그 밖에 생명윤리 및 안전에 관하여 사회적으로 심각한 영향을 미칠 수 있는 기관으로서 보건복지부령으로 정하는 기관
② 제1항에도 불구하고 보건복지부령으로 정하는 바에 따라 다른 기관의 기관위원회 또는 제12조제1항에 따른 공용기관생명윤리위원회와 제3항 및 제11조제4항에서 정한 기관위원회 업무의 수행을 위탁하기로 협약을 맺은 기관은 기관위원회를 설치한 것으로 본다.
③ 기관위원회는 다음 각 호의 업무를 수행한다.
1. 다음 각 목에 해당하는 사항의 심의
가. 연구계획서의 윤리적ㆍ과학적 타당성
나. 연구대상자등으로부터 적법한 절차에 따라 동의를 받았는지 여부
다. 연구대상자등의 안전에 관한 사항
라. 연구대상자등의 개인정보 보호 대책
마. 그 밖에 기관에서의 생명윤리 및 안전에 관한 사항
2. 해당 기관에서 수행 중인 연구의 진행과정 및 결과에 대한 조사ㆍ감독
3. 그 밖에 생명윤리 및 안전을 위한 다음 각 목의 활동
가. 해당 기관의 연구자 및 종사자 교육
나. 취약한 연구대상자등의 보호 대책 수립
다. 연구자를 위한 윤리지침 마련
④ 제1항에 따라 기관위원회를 설치한 기관은 보건복지부장관에게 그 기관위원회를 등록하여야 한다.
⑤ 제3항 및 제4항에 따른 기관위원회의 기능 및 등록 등에 필요한 사항은 보건복지부령으로 정한다.
제11조(기관위원회의 구성 및 운영 등) ① 기관위원회는 위원장 1명을 포함하여 5명 이상의 위원으로 구성하되, 하나의 성(性)으로만 구성할 수 없으며, 사회적ㆍ윤리적 타당성을 평가할 수 있는 경험과 지식을 갖춘 사람 1명 이상과 그 기관에 종사하지 아니하는 사람 1명 이상이 포함되어야 한다.
② 기관위원회의 위원은 제10조제1항 각 호의 기관의 장이 위촉하며, 위원장은 위원 중에서 호선한다.
③ 기관위원회의 심의대상인 연구ㆍ개발 또는 이용에 관여하는 위원은 해당 연구ㆍ개발 또는 이용과 관련된 심의에 참여하여서는 아니 된다.
④ 제10조제1항 각 호의 기관의 장은 해당 기관에서 수행하는 연구 등에서 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있는 경우에는 지체 없이 기관위원회를 소집하여 이를 심의하도록 하고, 그 결과를 보건복지부장관에게 보고하여야 한다.
⑤ 제10조제1항 각 호의 기관의 장은 기관위원회가 독립성을 유지할 수 있도록 하여야 하며, 행정적ㆍ재정적 지원을 하여야 한다.
⑥ 제10조제1항에 따라 둘 이상의 기관위원회를 설치한 기관은 보건복지부령으로 정하는 바에 따라 해당 기관위원회를 통합하여 운영할 수 있다.
⑦ 제1항부터 제6항까지에서 규정한 사항 외에 기관위원회의 구성 및 운영에 필요한 사항은 보건복지부령으로 정한다.
제12조(공용기관생명윤리위원회의 지정 및 기관위원회의 공동 운영) ① 보건복지부장관은 다음 각 호의 업무를 하게 하기 위하여 제10조제1항에 따라 설치된 기관위원회 중에서 기관 또는 연구자가 공동으로 이용할 수 있는 공용기관생명윤리위원회(이하 "공용위원회"라 한다)를 지정할 수 있다.
1. 제10조제2항에 따라 공용위원회와 협약을 맺은 기관이 위탁한 업무
2. 교육ㆍ연구 기관 또는 병원 등에 소속되지 아니한 인간대상연구자 또는 인체유래물연구자가 신청한 업무
3. 그 밖에 국가위원회의 심의를 거쳐 보건복지부령으로 정하는 업무
② 둘 이상의 기관이 공동으로 수행하는 연구로서 각각의 기관위원회에서 해당 연구를 심의하는 것이 적절하지 아니하는 경우에 수행 기관은 각각의 소관 기관위원회 중 하나의 기관위원회를 선정하여 해당 연구를 심의하게 할 수 있다.
③ 제1항 및 제2항에 따른 공용위원회의 지정, 기능, 운영 및 기관위원회의 공동 운영 등에 필요한 사항은 보건복지부령으로 정한다.
제13조(기관위원회의 지원 등) ① 보건복지부장관은 기관위원회의 운영을 적절하게 감독ㆍ지원하기 위하여 다음 각 호의 업무를 수행한다.
1. 기관위원회의 조사
2. 기관위원회 위원의 교육
3. 그 밖에 기관위원회의 감독 및 지원에 필요한 업무로서 보건복지부령으로 정하는 업무
② 기관위원회의 조사 및 교육 지원 등에 필요한 사항은 보건복지부령으로 정한다.
제14조(기관위원회의 평가 및 인증) ① 보건복지부장관은 기관위원회의 구성 및 운영실적 등을 정기적으로 평가하여 인증할 수 있다.
② 보건복지부장관은 제1항에 따라 인증을 받은 기관위원회의 인증 결과를 인터넷 홈페이지 등에 공표할 수 있다.
③ 중앙행정기관의 장은 제1항에 따른 인증 결과에 따라 그 기관에 예산 지원 및 국가 연구비 지원 제한 등의 조치를 할 수 있다.
④ 보건복지부장관은 제1항에 따라 인증을 받은 기관위원회가 다음 각 호의 어느 하나에 해당하면 그 인증을 취소할 수 있다. 다만, 제1호에 해당하는 경우에는 그 인증을 취소하여야 한다.
1. 거짓이나 부정한 방법으로 인증을 받은 경우
2. 기관위원회의 구성 및 운영에 중요한 변동사항이 발생하여 제5항에 따른 인증기준에 맞지 아니하는 경우
⑤ 제1항에 따른 인증의 기준 및 유효기간 등에 관하여 필요한 사항은 대통령령으로 정한다.
제15조(인간대상연구의 심의) ① 인간대상연구를 하려는 자는 인간대상연구를 하기 전에 연구계획서를 작성하여 기관위원회의 심의를 받아야 한다.
② 제1항에도 불구하고 연구대상자 및 공공에 미치는 위험이 미미한 경우로서 국가위원회의 심의를 거쳐 보건복지부령으로 정한 기준에 맞는 연구는 기관위원회의 심의를 면제할 수 있다.
제16조(인간대상연구의 동의) ① 인간대상연구자는 인간대상연구를 하기 전에 연구대상자로부터 다음 각 호의 사항이 포함된 서면동의(전자문서를 포함한다. 이하 같다)를 받아야 한다.
1. 인간대상연구의 목적
2. 연구대상자의 참여 기간, 절차 및 방법
3. 연구대상자에게 예상되는 위험 및 이득
4. 개인정보 보호에 관한 사항
5. 연구 참여에 따른 손실에 대한 보상
6. 개인정보 제공에 관한 사항
7. 동의의 철회에 관한 사항
8. 그 밖에 기관위원회가 필요하다고 인정하는 사항
② 제1항에도 불구하고 동의 능력이 없거나 불완전한 사람으로서 보건복지부령으로 정하는 연구대상자가 참여하는 연구의 경우에는 다음 각 호에서 정한 대리인의 서면동의를 받아야 한다. 이 경우 대리인의 동의는 연구대상자의 의사에 어긋나서는 아니 된다.
1. 법정대리인
2. 법정대리인이 없는 경우 배우자, 직계존속, 직계비속의 순으로 하되, 직계존속 또는 직계비속이 여러 사람일 경우 협의하여 정하고, 협의가 되지 아니하면 연장자가 대리인이 된다.
③ 제1항에도 불구하고 다음 각 호의 요건을 모두 갖춘 경우에는 기관위원회의 승인을 받아 연구대상자의 서면동의를 면제할 수 있다. 이 경우 제2항에 따른 대리인의 서면동의는 면제하지 아니한다.
1. 연구대상자의 동의를 받는 것이 연구 진행과정에서 현실적으로 불가능하거나 연구의 타당성에 심각한 영향을 미친다고 판단되는 경우
2. 연구대상자의 동의 거부를 추정할 만한 사유가 없고, 동의를 면제하여도 연구대상자에게 미치는 위험이 극히 낮은 경우
④ 인간대상연구자는 제1항 및 제2항에 따른 서면동의를 받기 전에 동의권자에게 제1항 각 호의 사항에 대하여 충분히 설명하여야 한다.
제17조(연구대상자에 대한 안전대책) ① 인간대상연구자는 사전에 연구 및 연구환경이 연구대상자에게 미칠 신체적ㆍ정신적 영향을 평가하고 안전대책을 마련하여야 하며, 수행 중인 연구가 개인 및 사회에 중대한 해악(害惡)을 초래할 가능성이 있을 때에는 이를 즉시 소속 기관의 장에게 보고하고 적절한 조치를 하여야 한다.
② 인간대상연구자는 질병의 진단이나 치료, 예방과 관련된 연구에서 연구대상자에게 의학적으로 필요한 치료를 지연하거나 진단 및 예방의 기회를 박탈하여서는 아니 된다.
제18조(개인정보의 제공) ① 인간대상연구자는 제16조제1항에 따라 연구대상자로부터 개인정보를 제공하는 것에 대하여 서면동의를 받은 경우에는 기관위원회의 심의를 거쳐 개인정보를 제3자에게 제공할 수 있다.
② 인간대상연구자가 제1항에 따라 개인정보를 제3자에게 제공하는 경우에는 익명화하여야 한다. 다만, 연구대상자가 개인식별정보를 포함하는 것에 동의한 경우에는 그러하지 아니하다.
제19조(기록의 유지와 정보의 공개) ① 인간대상연구자는 인간대상연구와 관련한 사항을 기록ㆍ보관하여야 한다.
② 연구대상자는 자신에 관한 정보의 공개를 청구할 수 있으며, 그 청구를 받은 인간대상연구자는 특별한 사유가 없으면 정보를 공개하여야 한다.
③ 제1항 및 제2항에 따른 기록ㆍ보관 및 정보 공개에 관한 구체적인 사항은 국가위원회의 심의를 거쳐 보건복지부령으로 정한다.
제20조(인간복제의 금지) ① 누구든지 체세포복제배아 및 단성생식배아(이하 "체세포복제배아등"이라 한다)를 인간 또는 동물의 자궁에 착상시켜서는 아니 되며, 착상된 상태를 유지하거나 출산하여서는 아니 된다.
② 누구든지 제1항에 따른 행위를 유인하거나 알선하여서는 아니 된다.
제21조(이종 간의 착상 등의 금지) ① 누구든지 인간의 배아를 동물의 자궁에 착상시키거나 동물의 배아를 인간의 자궁에 착상시키는 행위를 하여서는 아니 된다.
② 누구든지 다음 각 호의 행위를 하여서는 아니 된다.
1. 인간의 난자를 동물의 정자로 수정시키거나 동물의 난자를 인간의 정자로 수정시키는 행위. 다만, 의학적으로 인간의 정자의 활동성을 시험하기 위한 경우는 제외한다.
2. 핵이 제거된 인간의 난자에 동물의 체세포 핵을 이식하거나 핵이 제거된 동물의 난자에 인간의 체세포 핵을 이식하는 행위
3. 인간의 배아와 동물의 배아를 융합하는 행위
4. 다른 유전정보를 가진 인간의 배아를 융합하는 행위
③ 누구든지 제2항 각 호의 어느 하나에 해당하는 행위로부터 생성된 것을 인간 또는 동물의 자궁에 착상시키는 행위를 하여서는 아니 된다.
제22조(배아생성의료기관의 지정 등) ① 체외수정을 위하여 난자 또는 정자를 채취ㆍ보존하거나 이를 수정시켜 배아를 생성하려는 의료기관은 보건복지부장관으로부터 배아생성의료기관으로 지정받아야 한다.
② 배아생성의료기관으로 지정받으려는 의료기관은 보건복지부령으로 정하는 시설 및 인력 등을 갖추어야 한다.
③ 배아생성의료기관의 지정 기준 및 절차 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
④ 제1항에 따라 지정을 받은 배아생성의료기관(이하 "배아생성의료기관"이라 한다)이 보건복지부령으로 정하는 중요한 사항을 변경할 경우에는 보건복지부장관에게 그 변경사항을 신고하여야 한다.
⑤ 배아생성의료기관의 장은 휴업하거나 폐업하는 경우에는 보건복지부령으로 정하는 바에 따라 보건복지부장관에게 신고하여야 한다.
⑥ 배아생성의료기관의 장은 휴업하거나 폐업할 때에 보건복지부령으로 정하는 바에 따라 보관 중인 배아, 생식세포 및 관련 서류를 질병관리본부 또는 다른 배아생성의료기관으로 이관하여야 한다.
제23조(배아의 생성에 관한 준수사항) ① 누구든지 임신 외의 목적으로 배아를 생성하여서는 아니 된다.
② 누구든지 배아를 생성할 때 다음 각 호의 어느 하나에 해당하는 행위를 하여서는 아니 된다.
1. 특정의 성을 선택할 목적으로 난자와 정자를 선별하여 수정시키는 행위
2. 사망한 사람의 난자 또는 정자로 수정하는 행위
3. 미성년자의 난자 또는 정자로 수정하는 행위. 다만, 혼인한 미성년자가 그 자녀를 얻기 위하여 수정하는 경우는 제외한다.
③ 누구든지 금전, 재산상의 이익 또는 그 밖의 반대급부(反對給付)를 조건으로 배아나 난자 또는 정자를 제공 또는 이용하거나 이를 유인하거나 알선하여서는 아니 된다.
제24조(배아의 생성 등에 관한 동의) ① 배아생성의료기관은 배아를 생성하기 위하여 난자 또는 정자를 채취할 때에는 다음 각 호의 사항에 대하여 난자 기증자, 정자 기증자, 체외수정 시술대상자 및 해당 기증자ㆍ시술대상자의 배우자가 있는 경우 그 배우자(이하 "동의권자"라 한다)의 서면동의를 받아야 한다. 다만, 장애인의 경우는 그 특성에 맞게 동의를 구하여야 한다.
1. 배아생성의 목적에 관한 사항
2. 배아ㆍ난자ㆍ정자의 보존기간 및 그 밖에 보존에 관한 사항
3. 배아ㆍ난자ㆍ정자의 폐기에 관한 사항
4. 잔여배아 및 잔여난자를 연구 목적으로 이용하는 것에 관한 사항
5. 동의의 변경 및 철회에 관한 사항
6. 동의권자의 권리 및 정보 보호, 그 밖에 보건복지부령으로 정하는 사항
② 배아생성의료기관은 제1항에 따른 서면동의를 받기 전에 동의권자에게 제1항 각 호의 사항에 대하여 충분히 설명하여야 한다.
③ 제1항에 따른 서면동의를 위한 동의서의 서식 및 보관 등에 필요한 사항은 보건복지부령으로 정한다.
제25조(배아의 보존 및 폐기) ① 배아의 보존기간은 5년으로 한다. 다만, 동의권자가 보존기간을 5년 미만으로 정한 경우에는 이를 보존기간으로 한다.
② 제1항에도 불구하고 항암치료 등 보건복지부령으로 정하는 경우에는 동의권자가 보존기간을 5년 이상으로 정할 수 있다.
③ 배아생성의료기관은 제1항 또는 제2항에 따른 보존기간이 끝난 배아 중 제29조에 따른 연구의 목적으로 이용하지 아니할 배아는 폐기하여야 한다.
④ 배아생성의료기관은 배아의 폐기에 관한 사항을 기록ㆍ보관하여야 한다.
⑤ 제3항 및 제4항에 따른 배아의 폐기 절차 및 방법, 배아의 폐기에 관한 사항의 기록ㆍ보관에 필요한 사항은 보건복지부령으로 정한다.
제26조(잔여배아 및 잔여난자의 제공) ① 배아생성의료기관은 연구에 필요한 잔여배아를 제30조제1항에 따라 배아연구계획서의 승인을 받은 배아연구기관에 제공하거나 잔여난자를 제31조제4항에 따라 체세포복제배아등 연구계획서의 승인을 받은 체세포복제배아등의 연구기관에 제공하는 경우에는 무상으로 하여야 한다. 다만, 배아생성의료기관은 잔여배아 및 잔여난자의 보존 및 제공에 든 경비의 경우에는 보건복지부령으로 정하는 바에 따라 제공받는 연구기관에 대하여 경비지급을 요구할 수 있다.
② 제1항에 따른 잔여배아 및 잔여난자의 제공 절차, 경비의 산출, 그 밖에 필요한 사항은 보건복지부령으로 정한다.
③ 배아생성의료기관은 잔여배아 및 잔여난자의 보존 및 제공 등에 관한 사항을 보건복지부령으로 정하는 바에 따라 보건복지부장관에게 보고하여야 한다.
제27조(난자 기증자의 보호 등) ① 배아생성의료기관은 보건복지부령으로 정하는 바에 따라 난자를 채취하기 전에 난자 기증자에 대하여 건강검진을 하여야 한다.
② 배아생성의료기관은 보건복지부령으로 정하는 건강 기준에 미치지 못하는 사람으로부터 난자를 채취하여서는 아니 된다.
③ 배아생성의료기관은 동일한 난자 기증자로부터 대통령령으로 정하는 빈도 이상으로 난자를 채취하여서는 아니 된다.
④ 배아생성의료기관은 난자 기증에 필요한 시술 및 회복에 걸리는 시간에 따른 보상금 및 교통비 등 보건복지부령으로 정하는 항목에 관하여 보건복지부령으로 정하는 금액을 난자 기증자에게 지급할 수 있다.
제28조(배아생성의료기관의 준수사항) 배아생성의료기관은 다음 각 호의 사항을 준수하여야 한다.
1. 제24조에 따른 동의서에 적힌 내용대로 배아ㆍ난자 및 정자를 취급할 것
2. 보건복지부령으로 정하는 바에 따라 잔여배아 및 잔여난자의 보존ㆍ취급 및 폐기 등의 관리를 철저히 할 것
3. 그 밖에 생명윤리 및 안전의 확보를 위하여 필요하다고 인정하여 보건복지부령으로 정하는 사항
제29조(잔여배아 연구) ① 제25조에 따른 배아의 보존기간이 지난 잔여배아는 발생학적으로 원시선(原始線)이 나타나기 전까지만 체외에서 다음 각 호의 연구 목적으로 이용할 수 있다.
1. 난임치료법 및 피임기술의 개발을 위한 연구
2. 근이영양증(筋異營養症), 그 밖에 대통령령으로 정하는 희귀ㆍ난치병의 치료를 위한 연구
3. 그 밖에 국가위원회의 심의를 거쳐 대통령령으로 정하는 연구
② 제1항에 따라 잔여배아를 연구하려는 자는 보건복지부령으로 정하는 시설ㆍ인력 등을 갖추고 보건복지부장관에게 배아연구기관으로 등록하여야 한다.
③ 제2항에 따라 등록한 배아연구기관(이하 "배아연구기관"이라 한다)이 보건복지부령으로 정하는 중요한 사항을 변경하거나 폐업할 경우에는 보건복지부장관에게 신고하여야 한다.
제30조(배아연구계획서의 승인) ① 배아연구기관은 잔여배아의 연구를 하려면 미리 보건복지부장관에게 배아연구계획서를 제출하여 승인을 받아야 한다. 배아연구계획서의 내용 중 대통령령으로 정하는 중요한 사항을 변경하는 경우에도 또한 같다.
② 제1항에 따른 배아연구계획서에는 기관위원회의 심의 결과에 관한 서류가 첨부되어야 한다.
③ 보건복지부장관은 다른 중앙행정기관의 장이 연구비를 지원하는 배아연구기관으로부터 배아연구계획서를 제출받았을 때에는 승인 여부를 결정하기 전에 그 중앙행정기관의 장과 협의하여야 한다.
④ 배아연구계획서의 승인 기준 및 절차, 제출서류, 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제31조(체세포복제배아등의 연구) ① 누구든지 제29조제1항제2호에 따른 희귀ㆍ난치병의 치료를 위한 연구 목적 외에는 체세포핵이식행위 또는 단성생식행위를 하여서는 아니 된다.
② 제1항에 따른 연구의 종류ㆍ대상 및 범위는 국가위원회의 심의를 거쳐 대통령령으로 정한다.
③ 체세포복제배아등을 생성하거나 연구하려는 자는 보건복지부령으로 정하는 시설 및 인력 등을 갖추고 보건복지부장관에게 등록하여야 한다.
④ 제3항에 따라 등록한 기관(이하 "체세포복제배아등의 연구기관"이라 한다)은 체세포복제배아등을 생성하거나 연구하려면 보건복지부령으로 정하는 바에 따라 미리 보건복지부장관에게 연구계획서(이하 "체세포복제배아등 연구계획서"라 한다)를 제출하여 승인을 받아야 한다.
⑤ 체세포복제배아등 연구계획서의 승인에 관하여는 제30조를 준용한다. 이 경우 "잔여배아"는 "체세포복제배아등"으로, "배아연구계획서"는 "체세포복제배아등 연구계획서"로 각각 본다.
제32조(배아연구기관 등의 준수사항) ① 배아연구기관 및 체세포복제배아등의 연구기관은 해당 기관에서 수행하는 연구로 인하여 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있는 경우에는 연구 중단 등 적절한 조치를 하여야 한다.
② 배아연구기관 및 체세포복제배아등의 연구기관이 잔여배아 및 잔여난자를 제공받은 후 이를 연구의 목적으로 이용하지 아니하려는 경우에는 제25조제3항부터 제5항까지의 규정을 준용한다. 이 경우 "배아"는 "잔여배아 및 잔여난자"로 본다.
③ 배아연구기관이 잔여배아를 관리하는 경우 및 체세포복제배아등의 연구기관이 잔여난자, 체세포복제배아등을 관리하는 경우에는 제28조를 준용한다.
제33조(배아줄기세포주의 등록) ① 배아줄기세포주를 수립하거나 수입한 자는 그 배아줄기세포주를 제34조에 따라 제공하거나 제35조에 따라 이용하기 전에 보건복지부령으로 정하는 바에 따라 그 배아줄기세포주를 보건복지부장관에게 등록하여야 한다.
② 보건복지부장관은 배아줄기세포주의 등록을 신청한 자가 다른 중앙행정기관의 장으로부터 과학적 검증을 받은 경우에는 제1항에 따른 등록을 하는 데에 그 검증자료를 활용하여야 한다.
③ 보건복지부장관은 제1항에 따라 배아줄기세포주를 등록한 자에게 배아줄기세포주의 검증 등에 든 비용의 전부 또는 일부를 지원할 수 있다.
제34조(배아줄기세포주의 제공) ① 배아줄기세포주를 수립한 자가 그 배아줄기세포주를 타인에게 제공하려면 보건복지부령으로 정하는 바에 따라 기관위원회의 심의를 거쳐야 한다.
② 제1항에 따라 배아줄기세포주를 제공한 자는 보건복지부령으로 정하는 바에 따라 보건복지부장관에게 배아줄기세포주의 제공현황을 보고하여야 한다.
③ 제1항에 따라 배아줄기세포주를 제공하는 경우에는 무상으로 하여야 한다. 다만, 배아줄기세포주를 제공하는 자는 배아줄기세포주의 보존 및 제공에 든 경비의 경우에는 보건복지부령으로 정하는 바에 따라 이를 제공받는 자에 대하여 경비지급을 요구할 수 있다.
④ 제1항부터 제3항까지의 규정에 따른 배아줄기세포주의 제공 및 보고, 경비의 산출 방법 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제35조(배아줄기세포주의 이용) ① 제33조제1항에 따라 등록된 배아줄기세포주는 체외에서 다음 각 호의 연구 목적으로만 이용할 수 있다.
1. 질병의 진단ㆍ예방 또는 치료를 위한 연구
2. 줄기세포의 특성 및 분화에 관한 기초연구
3. 그 밖에 국가위원회의 심의를 거쳐 대통령령으로 정하는 연구
② 제1항에 따라 배아줄기세포주를 이용하려는 자는 해당 연구계획서에 대하여 보건복지부령으로 정하는 바에 따라 기관위원회의 심의를 거쳐 해당 기관의 장의 승인을 받아야 한다. 승인을 받은 연구계획서의 내용 중 대통령령으로 정하는 중요한 사항을 변경하는 경우에도 또한 같다.
③ 제2항에 따라 승인 또는 변경승인을 받은 자는 보건복지부령으로 정하는 바에 따라 그 사실을 보건복지부장관에게 보고하여야 한다.
④ 제2항에 따라 승인을 받은 자는 배아줄기세포주를 제공한 자에게 제공받은 배아줄기세포주의 이용계획서를 작성하여 제출하여야 한다.
⑤ 제2항에 따라 연구를 승인한 기관의 장은 연구를 하는 자가 연구계획에 적합하게 연구를 하도록 감독하여야 한다.
제36조(인체유래물연구의 심의) ① 인체유래물연구를 하려는 자는 인체유래물연구를 하기 전에 연구계획서에 대하여 기관위원회의 심의를 받아야 한다.
② 제1항에도 불구하고 인체유래물 기증자 및 공공에 미치는 위험이 미미한 경우로서 국가위원회의 심의를 거쳐 보건복지부령으로 정한 기준에 맞는 연구는 기관위원회의 심의를 면제할 수 있다.
제37조(인체유래물연구의 동의) ① 인체유래물연구자는 인체유래물연구를 하기 전에 인체유래물 기증자로부터 다음 각 호의 사항이 포함된 서면동의를 받아야 한다.
1. 인체유래물연구의 목적
2. 개인정보의 보호 및 처리에 관한 사항
3. 인체유래물의 보존 및 폐기 등에 관한 사항
4. 인체유래물과 그로부터 얻은 유전정보(이하 "인체유래물등"이라 한다)의 제공에 관한 사항
5. 동의의 철회, 동의 철회 시 인체유래물등의 처리, 인체유래물 기증자의 권리, 연구 목적의 변경, 그 밖에 보건복지부령으로 정하는 사항
② 제1항에도 불구하고 인체유래물연구자가 아닌 인체유래물 채취자로부터 인체유래물을 제공받아 연구를 하는 인체유래물연구자의 경우에 그 인체유래물 채취자가 인체유래물 기증자로부터 제1항 각 호의 사항이 포함된 서면동의를 받았을 때에는 제1항에 따른 서면동의를 받은 것으로 본다.
③ 인체유래물연구의 서면동의 면제에 관하여는 제16조제3항을 준용한다. 이 경우 "연구대상자"는 "인체유래물 기증자"로 본다.
④ 인체유래물연구자는 제1항에 따른 서면동의를 받기 전에 인체유래물 기증자에게 제1항 각 호의 사항에 대하여 충분히 설명하여야 한다.
⑤ 제1항에 따른 서면동의를 위한 동의서의 서식 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제38조(인체유래물등의 제공) ① 인체유래물연구자는 제37조제1항에 따라 인체유래물 기증자로부터 인체유래물등을 제공하는 것에 대하여 서면동의를 받은 경우에는 기관위원회의 심의를 거쳐 인체유래물등을 인체유래물은행이나 다른 연구자에게 제공할 수 있다.
② 인체유래물연구자가 제1항에 따라 인체유래물등을 다른 연구자에게 제공하는 경우에는 익명화하여야 한다. 다만, 인체유래물 기증자가 개인식별정보를 포함하는 것에 동의한 경우에는 그러하지 아니하다.
③ 제1항에 따라 인체유래물등을 제공할 경우 무상으로 하여야 한다. 다만, 인체유래물연구자가 소속된 기관은 인체유래물등의 보존 및 제공에 든 경비의 경우에는 보건복지부령으로 정하는 바에 따라 인체유래물등을 제공받아 연구하는 자에게 경비지급을 요구할 수 있다.
④ 인체유래물연구자는 제1항에 따라 인체유래물등을 제공하거나 제공받았을 때에는 보건복지부령으로 정하는 바에 따라 인체유래물등의 제공에 관한 기록을 작성ㆍ보관하여야 한다.
⑤ 인체유래물등의 제공 방법 및 절차, 경비의 산출, 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제39조(인체유래물등의 보존 및 폐기) ① 인체유래물연구자는 동의서에 정한 기간이 지난 인체유래물등을 폐기하여야 한다. 다만, 인체유래물등을 보존하는 중에 인체유래물 기증자가 보존기간의 변경이나 폐기를 요청하는 경우에는 요청에 따라야 한다.
② 인체유래물연구자는 제1항에 따른 인체유래물등의 폐기에 관한 사항을 보건복지부령으로 정하는 바에 따라 기록ㆍ보관하여야 한다.
③ 인체유래물연구자가 부득이한 사정으로 인하여 인체유래물등을 보존할 수 없는 경우에는 기관위원회의 심의를 거쳐 인체유래물등을 처리하거나 이관하여야 한다.
④ 인체유래물등의 보존, 폐기, 처리 또는 이관 등에 필요한 사항은 보건복지부령으로 정한다.
제40조(인체유래물연구자의 준수사항) 인체유래물연구자의 인체유래물 기증자에 대한 안전대책 및 기록의 유지와 정보 공개에 관하여는 제17조 및 제19조를 각각 준용한다. 이 경우 "인간대상연구"는 "인체유래물연구"로, "연구대상자"는 "인체유래물 기증자"로 각각 본다.
제41조(인체유래물은행의 허가 및 신고) ① 인체유래물은행을 개설하려는 자는 대통령령으로 정하는 바에 따라 보건복지부장관의 허가를 받아야 한다. 다만, 국가기관이 직접 인체유래물은행을 개설하고자 하는 경우는 제외한다.
② 제1항에도 불구하고 다른 법령에 따라 중앙행정기관의 장으로부터 연구비 지원의 승인을 받아 인체유래물은행을 개설하려는 경우에는 그 중앙행정기관의 장으로부터 연구비 지원의 승인을 받은 후 보건복지부장관에게 신고하면 제1항에 따른 허가를 받은 것으로 본다. 이 경우 그 중앙행정기관의 장은 미리 보건복지부장관과 협의하여야 한다.
③ 제1항 및 제2항에 따라 개설된 인체유래물은행이 대통령령으로 정하는 중요한 사항을 변경하거나 휴업 또는 폐업하려는 경우에는 보건복지부장관에게 신고하여야 한다.
④ 인체유래물은행의 시설ㆍ장비 기준 및 허가ㆍ신고 절차, 그 밖에 필요한 사항은 대통령령으로 정한다.
제42조(인체유래물 채취 시의 동의) ① 인체유래물은행은 인체유래물연구에 쓰일 인체유래물을 직접 채취하거나 채취를 의뢰할 때에는 인체유래물을 채취하기 전에 인체유래물 기증자로부터 다음 각 호의 사항이 포함된 서면동의를 받아야 한다.
1. 인체유래물연구의 목적(인체유래물은행이 인체유래물연구를 직접 수행하는 경우만 해당한다)
2. 개인정보의 보호 및 처리에 관한 사항
3. 인체유래물등이 제공되는 연구자 및 기관의 범위에 관한 사항
4. 인체유래물등의 보존, 관리 및 폐기에 관한 사항
5. 동의의 철회, 동의의 철회 시 인체유래물등의 처리, 인체유래물 기증자의 권리나 그 밖에 보건복지부령으로 정하는 사항
② 인체유래물은행은 제1항에 따른 서면동의를 받기 전에 인체유래물 기증자에게 제1항 각 호의 사항에 대하여 충분히 설명하여야 한다.
③ 제1항에 따른 서면동의를 위한 동의서의 서식 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제43조(인체유래물등의 제공) ① 인체유래물은행의 장은 인체유래물등을 제공받으려는 자로부터 이용계획서를 제출받아 그 내용을 검토하여 제공 여부를 결정하여야 한다.
② 인체유래물은행의 장은 인체유래물등을 타인에게 제공하는 경우에는 익명화하여야 한다. 다만, 인체유래물 기증자가 개인식별정보를 포함하는 것에 동의한 경우에는 그러하지 아니하다.
③ 인체유래물은행의 장은 인체유래물등을 타인에게 제공하는 경우에는 무상으로 하여야 한다. 다만, 인체유래물등의 보존 및 제공에 든 경비를 보건복지부령으로 정하는 바에 따라 인체유래물등을 제공받는 자에게 요구할 수 있다.
④ 기관위원회는 인체유래물등의 제공에 필요한 지침을 마련하고, 지침에 따라 적정하게 제공되고 있는지 정기적으로 심의하여야 한다.
⑤ 인체유래물등 이용계획서의 기재내용ㆍ제출절차, 제공에 필요한 지침, 기관위원회의 심의, 그 밖에 인체유래물등의 제공 및 관리에 필요한 사항은 보건복지부령으로 정한다.
제44조(인체유래물은행의 준수사항) ① 인체유래물은행의 장 또는 그 종사자는 보존 중인 인체유래물등을 타당한 사유 없이 사용, 폐기, 손상하여서는 아니 된다.
② 인체유래물은행이 제38조제1항 및 제53조제1항에 따라 인체유래물등을 제공받은 경우에는 익명화하여야 한다.
③ 인체유래물은행의 인체유래물등의 보존 및 폐기에 관하여는 제39조를 준용한다.
④ 인체유래물은행의 장은 보건복지부령으로 정하는 바에 따라 인체유래물등의 익명화 방안이 포함된 개인정보 보호 지침을 마련하고, 개인정보 관리 및 보안을 담당하는 책임자를 지정하여야 한다.
제45조(인체유래물은행에 대한 지원) 국가나 지방자치단체는 예산의 범위에서 인체유래물은행의 운영에 필요한 비용을 지원할 수 있다.
제46조(유전정보에 의한 차별 금지 등) ① 누구든지 유전정보를 이유로 교육ㆍ고용ㆍ승진ㆍ보험 등 사회활동에서 다른 사람을 차별하여서는 아니 된다.
② 다른 법률에 특별한 규정이 있는 경우를 제외하고는 누구든지 타인에게 유전자검사를 받도록 강요하거나 유전자검사의 결과를 제출하도록 강요하여서는 아니 된다.
③ 의료기관은 「의료법」 제21조제2항에 따라 환자 외의 자에게 제공하는 의무기록 및 진료기록 등에 유전정보를 포함시켜서는 아니 된다. 다만, 해당 환자와 동일한 질병의 진단 및 치료를 목적으로 다른 의료기관의 요청이 있고 개인정보 보호에 관한 조치를 한 경우에는 그러하지 아니하다.
제47조(유전자치료) ① 유전자치료에 관한 연구는 다음 각 호의 모두에 해당하는 경우에만 할 수 있다. 다만, 보건복지부장관이 정하는 질병의 예방이나 치료를 위하여 필요하다고 인정하는 경우에는 그러하지 아니하다.
1. 유전질환, 암, 후천성면역결핍증, 그 밖에 생명을 위협하거나 심각한 장애를 불러일으키는 질병의 치료를 위한 연구
2. 현재 이용 가능한 치료법이 없거나 유전자치료의 효과가 다른 치료법과 비교하여 현저히 우수할 것으로 예측되는 치료를 위한 연구
② 유전자치료는 배아, 난자, 정자 및 태아에 대하여 시행하여서는 아니 된다.
제48조(유전자치료기관) ① 유전자치료를 하고자 하는 의료기관은 보건복지부장관에게 신고하여야 한다. 대통령령으로 정하는 중요한 사항을 변경하는 경우에도 또한 같다.
② 제1항에 따라 보건복지부장관에게 신고한 의료기관(이하 "유전자치료기관"이라 한다)은 유전자치료를 하고자 하는 환자에 대하여 다음 각 호의 사항에 관하여 미리 설명한 후 서면동의를 받아야 한다.
1. 치료의 목적
2. 예측되는 치료 결과 및 그 부작용
3. 그 밖에 보건복지부령으로 정하는 사항
③ 유전자치료기관의 신고 요건 및 절차, 동의서의 서식, 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제49조(유전자검사기관) ① 유전자검사를 하려는 자는 유전자검사항목에 따라 보건복지부령으로 정하는 시설 및 인력 등을 갖추고 보건복지부장관에게 신고하여야 한다. 다만, 국가기관이 유전자검사를 하는 경우에는 그러하지 아니하다.
② 제1항에 따라 신고한 사항 중 대통령령으로 정하는 중요한 사항을 변경하는 경우에도 신고하여야 한다.
③ 보건복지부장관은 제1항에 따라 신고한 유전자검사기관(이하 "유전자검사기관"이라 한다)으로 하여금 보건복지부령으로 정하는 바에 따라 유전자검사의 정확도 평가를 받게 할 수 있고, 그 결과를 공개할 수 있다.
④ 유전자검사기관은 유전자검사의 업무를 휴업하거나 폐업하려는 경우에는 보건복지부령으로 정하는 바에 따라 보건복지부장관에게 신고하여야 한다.
⑤ 보건복지부장관은 유전자검사기관이 「부가가치세법」 제5조에 따라 관할 세무서장에게 폐업신고를 하거나 관할 세무서장이 사업자등록을 말소한 경우에는 신고 사항을 직권으로 말소할 수 있다.
제50조(유전자검사의 제한 등) ① 유전자검사기관은 과학적 증명이 불확실하여 검사대상자를 오도(誤導)할 우려가 있는 신체 외관이나 성격에 관한 유전자검사 또는 그 밖에 국가위원회의 심의를 거쳐 대통령령으로 정하는 유전자검사를 하여서는 아니 된다.
② 유전자검사기관은 근이영양증이나 그 밖에 대통령령으로 정하는 유전질환을 진단하기 위한 목적으로만 배아 또는 태아를 대상으로 유전자검사를 할 수 있다.
③ 의료기관이 아닌 유전자검사기관에서는 질병의 예방, 진단 및 치료와 관련한 유전자검사를 할 수 없다. 다만, 의료기관의 의뢰를 받아 유전자검사를 하는 경우에는 그러하지 아니하다.
④ 유전자검사기관은 유전자검사에 관하여 거짓표시 또는 과대광고를 하여서는 아니 된다. 이 경우 거짓표시 또는 과대광고의 판정 기준 및 절차, 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제51조(유전자검사의 동의) ① 유전자검사기관이 유전자검사에 쓰일 검사대상물을 직접 채취하거나 채취를 의뢰할 때에는 검사대상물을 채취하기 전에 검사대상자로부터 다음 각 호의 사항에 대하여 서면동의를 받아야 한다. 다만, 장애인의 경우는 그 특성에 맞게 동의를 구하여야 한다.
1. 유전자검사의 목적
2. 검사대상물의 관리에 관한 사항
3. 동의의 철회, 검사대상자의 권리 및 정보보호, 그 밖에 보건복지부령으로 정하는 사항
② 유전자검사기관이 검사대상물을 인체유래물연구자나 인체유래물은행에 제공하기 위하여는 검사대상자로부터 다음 각 호의 사항이 포함된 서면동의를 제1항에 따른 동의와 별도로 받아야 한다.
1. 개인정보의 보호 및 처리에 대한 사항
2. 검사대상물의 보존, 관리 및 폐기에 관한 사항
3. 검사대상물의 제공에 관한 사항
4. 동의의 철회, 동의 철회 시 검사대상물의 처리, 검사대상자의 권리, 그 밖에 보건복지부령으로 정하는 사항
③ 유전자검사기관 외의 자가 검사대상물을 채취하여 유전자검사기관에 유전자검사를 의뢰하는 경우에는 제1항에 따라 검사대상자로부터 서면동의를 받아 첨부하여야 하며, 보건복지부령으로 정하는 바에 따라 개인정보를 보호하기 위한 조치를 하여야 한다.
④ 검사대상자가 동의 능력이 없거나 불완전한 경우의 대리인 동의에 관하여는 제16조제2항을 준용한다. 이 경우 "연구대상자"는 "검사대상자"로, "연구"는 "검사"로 각각 본다.
⑤ 다음 각 호의 어느 하나에 해당하는 경우에는 동의 없이 유전자검사를 할 수 있다.
1. 시체 또는 의식불명인 사람이 누구인지 식별하여야 할 긴급한 필요가 있거나 특별한 사유가 있는 경우
2. 다른 법률에 규정이 있는 경우
⑥ 제1항부터 제4항까지의 규정에 따라 서면동의를 받고자 하는 자는 미리 검사대상자 또는 법정대리인에게 유전자검사의 목적과 방법, 예측되는 유전자검사의 결과와 의미 등에 대하여 충분히 설명하여야 한다.
⑦ 유전자검사의 동의 방식, 동의 면제 사항, 그 밖에 필요한 사항은 보건복지부령으로 정한다.
제52조(기록 보관 및 정보의 공개) ① 유전자검사기관은 다음 각 호의 서류를 보건복지부령으로 정하는 바에 따라 기록ㆍ보관하여야 한다.
1. 제51조에 따른 동의서
2. 유전자검사 결과
3. 제53조제2항에 따른 검사대상물의 제공에 관한 기록
② 유전자검사기관은 검사대상자나 그의 법정대리인이 제1항에 따른 기록의 열람 또는 사본의 발급을 요청하는 경우에는 그 요청에 따라야 한다.
③ 제2항에 따른 기록의 열람 또는 사본의 발급에 관한 신청 절차 및 서식 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제53조(검사대상물의 제공과 폐기 등) ① 유전자검사기관은 제51조제2항에 따라 검사대상자로부터 검사대상물의 제공에 대한 서면동의를 받은 경우에는 인체유래물연구자나 인체유래물은행에 검사대상물을 제공할 수 있다.
② 제1항에 따른 검사대상물의 제공에 관하여는 제38조제2항부터 제5항까지의 규정을 준용한다. 이 경우 "인체유래물등"은 "검사대상물"로, "인체유래물 기증자"는 "검사대상자"로 각각 본다.
③ 유전자검사기관은 제1항에 따라 검사대상물을 제공하는 경우 외에는 검사대상물을 유전자검사 결과 획득 후 즉시 폐기하여야 한다.
④ 유전자검사기관은 검사대상물의 폐기에 관한 사항을 기록ㆍ보관하여야 한다.
⑤ 유전자검사기관은 휴업 또는 폐업이나 그 밖에 부득이한 사정으로 인하여 검사대상물을 보존할 수 없는 경우에는 보건복지부령으로 정하는 바에 따라 검사대상물을 처리하거나 이관하여야 한다.
⑥ 검사대상물의 폐기, 폐기에 관한 기록ㆍ보관 및 검사대상물의 처리 또는 이관에 필요한 사항은 보건복지부령으로 정한다.
제54조(보고와 조사) ① 보건복지부장관은 생명윤리 및 안전의 확보와 관련하여 필요하다고 인정할 때에는 제10조제1항 각 호의 기관과 유전자검사기관(이하 "감독대상기관"이라 한다) 및 그 종사자에 대하여 보건복지부령으로 정하는 바에 따라 이 법의 시행에 필요한 보고 또는 자료의 제출을 명할 수 있고, 생명윤리 또는 안전에 중대한 위해가 발생하거나 발생할 우려가 있을 때에는 그 연구 및 연구 성과 이용의 중단을 명하거나 그 밖에 필요한 조치를 할 수 있다.
② 보건복지부장관은 이 법에서 정하고 있는 사항의 이행 또는 위반 여부의 확인을 위하여 필요하다고 인정할 때에는 관계 공무원으로 하여금 감독대상기관 또는 그 사무소 등에 출입하여 그 시설 또는 장비, 관계 장부나 서류, 그 밖의 물건을 검사하게 하거나 관계인에게 질문하게 할 수 있으며, 시험에 필요한 시료(試料)를 최소분량으로 수거하게 할 수 있다. 이 경우 관계 공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 보여주어야 한다.
③ 감독대상기관 또는 그 종사자는 제1항 및 제2항에 따른 명령ㆍ검사ㆍ질문 등에 대하여 타당한 사유가 없으면 응하여야 한다.
제55조(폐기 및 개선 명령) ① 보건복지부장관은 감독대상기관 또는 그 종사자와 제33조부터 제35조까지의 규정에 따라 배아줄기세포주를 등록ㆍ제공 또는 이용한 자에게 다음 각 호의 대상물을 폐기할 것을 명할 수 있다. 이 경우 폐기의 절차 및 방법에 관하여는 제25조제5항, 제39조제4항, 제53조제6항을 각각 준용한다.
1. 제22조제1항부터 제3항까지, 제23조, 제24조제1항, 제25조제3항(제32조제2항에서 준용하는 경우를 포함한다), 제26조제1항, 제27조제1항부터 제3항까지, 제29조제1항ㆍ제2항, 제30조제1항부터 제3항까지, 제31조제1항ㆍ제3항ㆍ제4항, 제33조제1항, 제34조제1항ㆍ제3항, 제35조제2항을 위반하여 채취ㆍ생성ㆍ보존ㆍ연구 또는 제공된 배아ㆍ체세포복제배아등ㆍ배아줄기세포주 또는 난자
2. 제39조제1항, 제41조제1항, 제43조제2항, 제49조제1항, 제50조제1항부터 제3항까지, 제51조제1항ㆍ제2항ㆍ제4항, 제53조제1항부터 제3항까지의 규정을 위반하여 채취ㆍ보존 또는 제공된 검사대상물 및 인체유래물
② 보건복지부장관은 감독대상기관의 시설ㆍ인력 등이 제22조제2항, 제29조제2항, 제31조제3항 또는 제41조제4항에서 정하는 기준 등에 맞지 아니하여 연구ㆍ채취ㆍ보존 또는 배아의 생성 등을 하는 경우에 생명윤리나 안전에 중대한 위해가 발생하거나 발생할 우려가 있다고 인정할 때에는 감독대상기관에 대하여 그 시설의 개선을 명하거나 그 시설의 전부 또는 일부의 사용을 금지할 것을 명할 수 있다.
제56조(등록 등의 취소와 업무의 정지) ① 보건복지부장관은 감독대상기관이 다음 각 호의 어느 하나에 해당할 때에는 그 지정ㆍ등록 또는 허가를 취소하거나 1년 이내의 기간을 정하여 그 업무의 전부 또는 일부의 정지를 명할 수 있다.
1. 제10조제1항(같은 항 제1호 및 제2호에 해당하는 기관의 경우는 제외한다), 제20조, 제21조, 제22조제1항부터 제3항까지, 제23조, 제24조제1항ㆍ제2항, 제25조제3항ㆍ제4항(제32조제2항에서 준용하는 경우를 포함한다), 제26조제1항ㆍ제3항, 제27조제1항부터 제3항까지, 제28조(제32조제3항에서 준용하는 경우를 포함한다), 제29조제2항, 제30조제1항, 제31조제1항, 제32조제1항, 제43조제2항, 제44조제1항, 제48조제1항 후단, 제48조제2항, 제50조, 제51조제1항부터 제4항까지, 제52조제1항ㆍ제2항 및 제53조제2항부터 제5항까지의 규정을 위반하였을 때
2. 제54조제1항 및 제55조에 따른 명령을 이행하지 아니하였을 때
3. 제54조제2항에 따른 검사ㆍ질문ㆍ수거에 응하지 아니하였을 때
② 제1항에 따른 행정처분의 세부 기준은 그 위반행위의 유형과 위반 정도 등을 고려하여 보건복지부령으로 정한다.
제57조(청문) 보건복지부장관은 제56조에 따라 기관의 지정ㆍ등록 또는 허가를 취소하려는 경우에는 청문을 하여야 한다.
제58조(과징금) ① 보건복지부장관은 감독대상기관이 다음 각 호의 어느 하나에 해당하여 업무정지처분을 하여야 할 경우로서 그 업무정지가 해당 사업의 이용자에게 심한 불편을 주거나 그 밖에 공익을 해칠 우려가 있을 때에는 대통령령으로 정하는 바에 따라 그 업무정지처분을 갈음하여 2억원 이하의 과징금을 부과할 수 있다.
1. 제22조제1항부터 제3항까지, 제24조제1항ㆍ제2항, 제25조제3항ㆍ제4항(제32조제2항에서 준용하는 경우를 포함한다) 및 제27조제1항부터 제3항까지의 규정을 위반하였을 때
2. 제28조(제32조제3항에서 준용하는 경우를 포함한다) 및 제32조제1항에 따른 준수사항을 위반하였을 때
3. 제54조제1항 및 제55조에 따른 명령을 이행하지 아니하였을 때
4. 제54조제2항에 따른 검사ㆍ질문ㆍ수거에 응하지 아니하였을 때
② 제1항에 따라 과징금을 부과하는 위반행위의 종류와 위반 정도 등에 따른 과징금의 금액이나 그 밖에 필요한 사항은 보건복지부령으로 정한다.
③ 보건복지부장관은 제1항에 따른 과징금을 내야 할 자가 납부기한까지 내지 아니하였을 때에는 국세 체납처분의 예에 따라 징수한다.
제59조(수수료) 보건복지부장관은 이 법의 규정에 따라 지정ㆍ허가ㆍ등록ㆍ승인을 받으려 하거나 신고를 하는 자 또는 그 내용을 변경하려는 자로 하여금 보건복지부령으로 정하는 바에 따라 수수료를 내게 할 수 있다.
제60조(국고 보조) 보건복지부장관은 이 법에 따른 생명윤리 및 안전의 확보에 이바지할 수 있는 연구사업 및 교육을 육성ㆍ지원하기 위하여 대통령령으로 정하는 바에 따라 해당 단체ㆍ기관 또는 종사자에게 필요한 비용의 전부 또는 일부를 지원할 수 있다.
제61조(위임 및 위탁 등) ① 보건복지부장관은 이 법에 따른 권한의 일부를 대통령령으로 정하는 바에 따라 소속 기관의 장에게 위임할 수 있다.
② 보건복지부장관은 대통령령으로 정하는 바에 따라 다음 각 호의 어느 하나에 해당하는 업무의 일부를 관계 전문기관 또는 단체에 위탁할 수 있다.
1. 제13조제1항제2호에 따른 기관위원회 위원의 교육에 관한 업무
2. 제14조에 따른 기관위원회의 평가ㆍ인증에 관한 업무
3. 제49조제3항에 따른 유전자검사의 정확도 평가에 관한 업무
③ 보건복지부장관은 제2항에 따라 관계 전문기관 또는 단체에 업무를 위탁한 경우에는 필요한 예산을 보조할 수 있다.
④ 제2항에 따른 관계 전문기관 또는 단체에 대한 예산 보조, 보조금 환수(還收), 지원 금지 등에 필요한 사항은 대통령령으로 정한다.
제62조(벌칙 적용 시의 공무원 의제) 보건복지부장관이 제61조에 따라 위탁한 업무에 종사하는 기관, 단체의 임직원은 「형법」 제129조부터 제132조까지의 규정을 적용할 때에는 공무원으로 본다.
제63조(비밀 누설 등의 금지) 감독대상기관 또는 그 종사자나 업무에 종사하였던 사람은 직무상 알게 된 개인정보 등의 비밀을 누설하거나 도용하여서는 아니 된다.
제64조(벌칙) ① 제20조제1항을 위반하여 체세포복제배아등을 자궁에 착상시키거나 착상된 상태를 유지하거나 출산한 사람은 10년 이하의 징역에 처한다.
② 제1항의 경우 미수범도 처벌한다.
제65조(벌칙) ① 제21조제1항을 위반하여 인간의 배아를 동물의 자궁에 착상시키거나 동물의 배아를 인간의 자궁에 착상시킨 사람 또는 같은 조 제3항을 위반하여 같은 조 제2항 각 호의 어느 하나에 해당하는 행위로부터 생성된 것을 인간 또는 동물의 자궁에 착상시킨 사람은 5년 이하의 징역에 처한다.
② 제1항의 경우 미수범도 처벌한다.
제66조(벌칙) ① 다음 각 호의 어느 하나에 해당하는 사람은 3년 이하의 징역에 처한다.
1. 제20조제2항을 위반하여 체세포복제배아등을 자궁에 착상시키거나 착상된 상태를 유지 또는 출산하도록 유인하거나 알선한 사람
2. 제21조제2항 각 호의 어느 하나에 해당하는 행위를 한 사람
3. 제23조제1항을 위반하여 임신 외의 목적으로 배아를 생성한 사람
4. 제23조제3항을 위반하여 금전, 재산상의 이익 또는 그 밖의 반대급부를 조건으로 배아나 난자 또는 정자를 제공 또는 이용하거나 이를 유인하거나 알선한 사람
5. 제31조제1항을 위반하여 희귀ㆍ난치병의 치료를 위한 연구 목적 외의 용도로 체세포핵이식행위 또는 단성생식행위를 한 사람
6. 제63조를 위반하여 비밀을 누설하거나 도용한 사람
② 제29조제1항을 위반하여 잔여배아를 이용한 자는 3년 이하의 징역 또는 5천만원 이하의 벌금에 처한다.
③ 제1항제1호 및 제2호의 경우 미수범도 처벌한다.
제67조(벌칙) ① 다음 각 호의 어느 하나에 해당하는 자는 2년 이하의 징역 또는 3천만원 이하의 벌금에 처한다.
1. 배아를 생성할 때 제23조제2항 각 호의 어느 하나에 해당하는 행위를 한 자
2. 제24조제1항을 위반하여 서면동의 없이 난자 또는 정자를 채취한 자
3. 제27조제1항을 위반하여 난자 기증자에 대하여 건강검진을 하지 아니한 자 또는 같은 조 제2항이나 제3항을 위반하여 난자를 채취한 자
4. 제46조제1항부터 제3항까지의 규정을 위반하여 유전정보를 이유로 다른 사람을 차별한 자, 유전자검사를 받도록 강요하거나 유전자검사 결과를 제출하도록 강요한 자 또는 환자 외의 자에게 제공하는 기록 등에 유전정보를 포함시킨 자
5. 제47조제1항 또는 제2항을 위반하여 유전자치료에 관한 연구를 하거나 유전자치료를 시행한 자
6. 제50조제1항부터 제3항까지의 규정을 위반하여 유전자검사를 한 자
7. 제55조에 따른 폐기명령 또는 개선명령을 이행하지 아니한 자
② 제22조제6항을 위반하여 배아, 생식세포를 이관하지 아니한 자는 2년 이하의 징역 또는 1천만원 이하의 벌금에 처한다.
제68조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 1년 이하의 징역 또는 2천만원 이하의 벌금에 처한다.
1. 제22조제1항부터 제3항까지의 규정을 위반하여 배아생성의료기관으로 지정받지 아니하고 인간의 난자 또는 정자를 채취ㆍ보존하거나 이를 수정시켜 배아를 생성한 자
2. 제25조제3항(제32조제2항에서 준용하는 경우를 포함한다)을 위반하여 배아를 폐기하지 아니한 자
3. 제26조제1항을 위반하여 유상(有償)으로 잔여배아 및 잔여난자를 제공한 자
4. 제26조제3항을 위반하여 보건복지부장관에게 보고하지 아니한 자
5. 제29조제2항을 위반하여 배아연구기관으로 등록하지 아니하고 잔여배아를 연구한 자
6. 제30조제1항을 위반하여(제31조제5항에서 준용하는 경우를 포함한다) 배아연구계획서의 승인을 받지 아니하고 배아연구를 한 자
7. 제31조제3항을 위반하여 보건복지부장관에게 등록하지 아니하고 체세포복제배아등을 생성하거나 연구한 자
8. 제41조제1항을 위반하여 허가를 받지 아니하고 인체유래물은행을 개설한 자
9. 제42조제1항을 위반하여 서면동의 없이 인체유래물을 직접 채취하거나 채취를 의뢰한 자
10. 제50조제4항을 위반하여 유전자검사에 관하여 거짓표시 또는 과대광고를 한 자
11. 제51조제1항ㆍ제2항ㆍ제4항을 위반하여 유전자검사에 관한 서면동의를 받지 아니하고 검사대상물을 채취한 자 또는 같은 조 제3항을 위반하여 서면동의서를 첨부하지 아니하거나 개인정보를 보호하기 위한 조치를 하지 아니하고 유전자검사를 의뢰한 자
제69조(양벌규정) ① 법인의 대표자나 법인 또는 개인의 대리인, 사용인, 그 밖의 종업원이 그 법인 또는 개인의 업무에 관하여 제64조부터 제66조까지의 어느 하나에 해당하는 위반행위를 하면 그 행위자를 벌하는 외에 그 법인 또는 개인을 5천만원 이하의 벌금에 처한다. 다만, 법인 또는 개인이 그 위반행위를 방지하기 위하여 해당 업무에 관하여 상당한 주의와 감독을 게을리하지 아니한 경우에는 그러하지 아니하다.
② 법인의 대표자나 법인 또는 개인의 대리인, 사용인, 그 밖의 종업원이 그 법인 또는 개인의 업무에 관하여 제67조 또는 제68조의 위반행위를 하면 그 행위자를 벌하는 외에 그 법인 또는 개인에게도 해당 조문의 벌금형을 과(科)한다. 다만, 법인 또는 개인이 그 위반행위를 방지하기 위하여 해당 업무에 관하여 상당한 주의와 감독을 게을리하지 아니한 경우에는 그러하지 아니하다.
제70조(과태료) ① 다음 각 호의 어느 하나에 해당하는 자에게는 500만원 이하의 과태료를 부과한다.
1. 제10조제1항을 위반하여 기관위원회를 설치하지 아니한 자
2. 제33조제1항을 위반하여 등록하지 아니하고 해당 배아줄기세포주를 제공하거나 이용한 자
3. 제35조제1항을 위반하여 배아줄기세포주를 이용한 자
4. 제38조제2항을 위반하여 인체유래물등을 익명화하지 아니하고 다른 연구자에게 제공한 자
5. 제39조제1항 본문 또는 제3항(제44조제3항에서 준용하는 경우를 포함한다)에 따라 인체유래물을 폐기, 처리하거나 이관하지 아니한 자
6. 제41조제2항에 따른 신고를 하지 아니한 자
7. 제44조제4항을 위반하여 인체유래물등의 익명화 방안이 포함된 개인정보 보호 지침을 마련하지 아니하거나 개인정보 관리 및 보안을 담당하는 책임자를 두지 아니한 자
8. 제48조제1항을 위반하여 신고하지 아니하고 유전자치료를 한 자
9. 제49조제1항 본문에 따른 신고를 하지 아니한 자
10. 제54조제3항을 위반하여 보건복지부장관의 명령ㆍ검사ㆍ질문 등에 대하여 타당한 사유 없이 응하지 아니한 감독대상기관 또는 그 종사자
② 다음 각 호의 어느 하나에 해당하는 자에게는 300만원 이하의 과태료를 부과한다.
1. 제22조제4항 또는 제5항, 제29조제3항을 위반하여 보건복지부장관에게 신고하지 아니한 자
2. 제22조제6항을 위반하여 관련 서류를 이관하지 아니한 자
③ 다음 각 호의 어느 하나에 해당하는 자에게는 200만원 이하의 과태료를 부과한다.
1. 제10조제4항을 위반하여 보건복지부장관에게 등록하지 아니한 자
2. 제11조제4항을 위반하여 보건복지부장관에게 보고하지 아니한 자
3. 제34조제3항을 위반하여 유상으로 배아줄기세포주를 제공한 자
4. 제38조제3항을 위반하여 유상으로 인체유래물등을 제공한 자
5. 제41조제3항에 따른 신고를 하지 아니한 자
6. 제49조제2항 또는 제4항에 따른 신고를 하지 아니한 자
④ 제1항부터 제3항까지에 따른 과태료는 대통령령으로 정하는 바에 따라 보건복지부장관이 부과ㆍ징수한다.
<제12844호, 2014.11.19.> (정부조직법)
제1조(시행일) 이 법은 공포한 날부터 시행한다. 다만, 부칙 제6조에 따라 개정되는 법률 중 이 법 시행 전에 공포되었으나 시행일이 도래하지 아니한 법률을 개정한 부분은 각각 해당 법률의 시행일부터 시행한다.
제2조부터 제5조까지 생략
제6조(다른 법률의 개정) ①부터 <193>까지 생략
<194> 생명윤리 및 안전에 관한 법률 일부를 다음과 같이 개정한다.
제8조제3항제1호 중 "미래창조과학부장관, 교육부장관"을 "교육부장관, 미래창조과학부장관"으로 한다.
<195>부터 <258>까지 생략
제7조 생략

생명연구자원의 확보·관리 및 활용에 관한 법률
[시행 2014.11.19.] [법률 제12844호, 2014.11.19., 타법개정]
제1조(목적) 이 법은 생명연구자원의 효율적인 확보와 체계적인 관리를 통하여 지속가능한 활용을 도모하고 생명공학의 발전 기반을 조성함으로써 국민의 삶의 질 향상과 국가경제 발전에 기여하는 것을 목적으로 한다.
제2조(정의) 이 법에서 사용하는 용어의 뜻은 다음과 같다. <개정 2011.3.9>
1. "생명연구자원"이란 생명공학연구의 기반이 되는 자원으로서 산업적으로 유용한 동물, 식물, 미생물, 인체유래 연구자원 등 생물체의 실물(實物)과 정보를 말한다.
2. "국가연구개발사업"이란 「과학기술기본법」 제11조에 따른 국가연구개발사업을 말한다.
3. "연구기관"이란 다음 각 목의 연구기관을 말한다.
가. 국공립 연구기관
나. 「특정연구기관 육성법」의 적용을 받는 연구기관
다. 「과학기술분야 정부출연연구기관 등의 설립·운영 및 육성에 관한 법률」에 따라 설립된 연구기관
라. 「기초연구진흥 및 기술개발지원에 관한 법률」 제14조제1항제2호에 따른 기업부설연구소
마. 「산업기술연구조합 육성법」에 따른 산업기술연구조합
제3조(국가 등의 책무) ① 국가와 지방자치단체는 생명연구자원의 효율적인 확보·관리 및 활용을 위하여 노력하여야 한다.
② 다음 각 호의 기관 등은 생명연구자원의 확보·관리 및 활용에 관하여 국가와 지방자치단체가 수행하는 업무에 적극 협력하여야 한다.
1. 국가연구개발사업을 수행하는 「고등교육법」 제2조에 따른 학교
2. 국가연구개발사업을 수행하는 연구기관
3. 그 밖에 생명연구자원을 관리·이용하는 자
제4조(다른 법률과의 관계) 생명연구자원의 확보·관리 및 활용에 관하여 다른 법률에 특별한 규정이 있는 경우 외에는 이 법에서 정하는 바에 따른다.
제5조(생명연구자원 관리의 기본원칙) ① 관계 중앙행정기관의 장은 소관 분야의 생명연구자원과 국가연구개발사업의 연구 결과 생산된 생명연구자원을 관리한다.
② 미래창조과학부장관은 제1항에 따라 관계 중앙행정기관이 관리하는 생명연구자원에 관한 정보를 종합적으로 관리한다. <개정 2013.3.23>
제6조(기본시책의 마련) 정부는 이 법의 목적을 효율적으로 달성하기 위하여 생명연구자원의 확보·관리 및 활용을 도모하기 위한 다음 각 호의 시책을 마련하여야 한다. <개정 2010.1.18., 2013.3.23.,2014.11.19>
1. 미래창조과학부장관: 생명연구자원의 통합정보시스템을 구축하고 통계를 유지하며, 소관 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 생명연구자원의 관리 및 활용을 위한 정보통신기술의 확보를 지원하기 위한 시책
2. 교육부장관: 생명연구자원 분야의 전문인력 양성 및 기초 연구를 지원하기 위한 시책으로서, 미래창조과학부장관과 협의한 시책
3. 농림축산식품부장관: 농업 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 이를 지원하기 위한 시책
4. 산업통상자원부장관: 산업 분야 생명연구자원의 확보·관리 및 활용체계를 조성하고 생명연구자원의 산업적 활용을 지원하기 위한 시책
5. 보건복지부장관: 보건·의료 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 이를 지원하기 위한 시책
6. 환경부장관: 야생생물 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 이를 지원하기 위한 시책
7. 해양수산부장관: 해양·수산 분야 생명연구자원의 확보·관리 및 활용체제를 조성하고 이를 지원하기 위한 시책
제7조(생명연구자원 관리 기본계획의 수립·시행 등) ① 정부는 생명연구자원의 활용촉진과 정보관리를 위하여 5년마다 생명연구자원 관리 기본계획(이하 "기본계획"이라 한다)을 수립·시행하여야 한다.
② 기본계획에는 다음 각 호의 사항이 포함되어야 한다.
1. 생명연구자원의 확보·관리 및 활용의 기본방향
2. 생명연구자원의 조사, 연구, 개발 및 확보
3. 생명연구자원의 보존·관리 및 활용
4. 생명연구자원 관련 인프라의 구축
5. 생명연구자원 정보유통체계 구축
6. 생명연구자원의 확보·관리 및 활용을 위한 투자의 확대
7. 생명연구자원 전문인력 양성
8. 그 밖에 생명연구자원 분야의 육성 및 관리 등에 필요한 사항
③ 관계 중앙행정기관의 장은 제2항 각 호의 사항에 대하여 소관 분야별로 계획을 세우고 이를 미래창조과학부장관에게 통보하여야 한다. <개정 2013.3.23>
④ 미래창조과학부장관은 제3항에 따라 통보받은 관계 중앙행정기관의 계획을 종합하여 기본계획안을 작성하고 「과학기술기본법」 제9조제1항에 따른 국가과학기술심의회의 심의를 거쳐 이를 확정한다. <개정 2013.3.23>
⑤ 관계 중앙행정기관의 장은 기본계획에 따라 연도별 시행계획을 수립·시행하여야 한다.
⑥ 기본계획과 시행계획의 수립·시행에 필요한 사항은 대통령령으로 정한다.
제8조(생명연구자원 기탁등록보존기관의 지정 등) ① 관계 중앙행정기관의 장은 생명연구자원 기탁등록보존기관을 지정할 수 있다.
② 제1항에 따라 지정된 생명연구자원 기탁등록보존기관(이하 "기탁등록보존기관"이라 한다)은 다음 각 호의 업무를 수행한다.
1. 생명연구자원의 수탁, 등록 및 평가
2. 생명연구자원의 보존과 관리
3. 생명연구자원 정보시스템의 구축과 운영
4. 소관 정보시스템, 제10조제2항제2호에 따른 정보시스템 및 제11조제2항제1호에 따른 통합정보시스템 간의 상호 연계
5. 국내외 생명연구자원 관련 기관과의 협력
6. 그 밖에 생명연구자원의 관리와 활용 등에 필요한 사항
③ 기탁등록보존기관은 생명연구자원의 안정적 보존을 위하여 복수의 시설에서 생명연구자원을 보존 및 관리할 수 있다.
④ 정부는 기탁등록보존기관의 운영에 필요한 경비의 전부 또는 일부를 지원할 수 있다.
⑤ 기탁등록보존기관의 지정기준과 운영 등에 필요한 사항은 대통령령으로 정한다.
제9조(기탁 및 등록 등) ① 생명연구자원을 관리·이용하고 있는 자는 기탁등록보존기관에 생명연구자원을 기탁·등록할 수 있다.
② 국가연구개발사업을 수행한 자는 사업수행 결과에 따라 생산된 생명연구자원을 기탁등록보존기관에 기탁·등록하여야 한다. 다만, 대통령령으로 정하는 사유로서 관계 중앙행정기관의 장이 인정하는 경우에는 그러하지 아니하다.
③ 정부는 제2항에 따른 생명연구자원의 기탁 및 등록실적을 해당 사업의 평가 등에 반영할 수 있다.
④ 생명연구자원의 기탁 및 등록의 방법 등에 필요한 사항은 대통령령으로 정한다.
제10조(책임기관 및 생명연구자원정보센터의 지정 등) ① 관계 중앙행정기관의 장은 기탁등록보존기관 중에서 다음 각 호의 업무를 수행하는 기관을 책임기관으로 지정할 수 있다.
1. 기탁등록보존기관의 관리
2. 기탁등록보존기관 간의 정보 교류
② 관계 중앙행정기관의 장은 필요한 경우 소관 분야의 생명연구자원의 관리와 유통을 촉진하기 위하여 다음 각 호의 업무를 수행하는 생명연구자원정보센터를 지정할 수 있다.
1. 소관 분야의 생명연구자원과 관련된 정보의 수집
2. 소관 분야의 생명연구자원 정보시스템의 구축과 운영
3. 그 밖에 소관 분야의 생명연구자원의 관리와 유통에 필요한 사항
③ 관계 중앙행정기관의 장은 제2항에 따라 지정된 생명연구자원정보센터(이하 "생명연구자원정보센터"라 한다)와 제11조제1항에 따른 국가생명연구자원정보센터 간의 정보유통을 촉진하여야 한다.
④ 정부는 제1항에 따라 지정된 책임기관(이하 "책임기관"이라 한다)과 생명연구자원정보센터의 운영에 필요한 경비의 전부 또는 일부를 지원할 수 있다.
⑤ 책임기관과 생명연구자원정보센터의 지정기준과 운영 등에 필요한 사항은 대통령령으로 정한다.
제11조(국가생명연구자원정보센터의 지정 등) ① 미래창조과학부장관은 관계 중앙행정기관이 관리하는 생명연구자원의 통합적 관리와 유통을 위하여 국가생명연구자원정보센터를 지정할 수 있다. <개정 2013.3.23>
② 제1항에 따라 지정된 국가생명연구자원정보센터(이하 "국가생명연구자원정보센터"라 한다)는 다음 각 호의 업무를 수행한다.
1. 생명연구자원 통합정보시스템의 구축과 운영
2. 생명연구자원과 관련된 정보의 분석 및 제공
3. 생명연구자원과 관련된 자동화시스템의 설계, 개발, 구축과 관리
4. 생명연구자원과 관련된 연구기관 및 기탁등록보존기관의 정보관리 지원 및 교육
5. 국내외 생명연구자원 정보관리기관과의 협력
6. 그 밖에 생명연구자원의 통합적 관리와 유통에 필요한 사항
③ 미래창조과학부장관은 관계 중앙행정기관의 장 및 지방자치단체의 장에게 생명연구자원과 관련된 정보 및 현황 등 생명연구자원의 관리에 필요한 자료 등에 관하여 협조를 요청할 수 있다. <개정 2013.3.23>
④ 정부는 국가생명연구자원정보센터의 운영에 필요한 경비의 전부 또는 일부를 지원할 수 있다.
⑤ 국가생명연구자원정보센터의 지정기준과 운영 등에 필요한 사항은 대통령령으로 정한다.
제12조(지정의 취소 등) ① 관계 중앙행정기관의 장은 기탁등록보존기관, 책임기관 또는 생명연구자원정보센터의 지정을 받은 자가 다음 각 호의 어느 하나에 해당하는 경우에는 지정을 취소하거나 6개월 이내의 기간을 정하여 사업의 정지를 명할 수 있다. 다만, 제1호에 해당하는 경우에는 그 지정을 취소하여야 한다.
1. 거짓이나 그 밖의 부정한 방법으로 지정을 받은 경우
2. 제8조제5항 또는 제10조제5항에 따른 지정기준을 충족하지 못하게 된 경우
② 미래창조과학부장관은 국가생명연구자원정보센터의 지정을 받은 자가 다음 각 호의 어느 하나에 해당하는 경우에는 지정을 취소하거나 6개월 이내의 기간을 정하여 사업의 정지를 명할 수 있다. 다만, 제1호에 해당하는 경우에는 그 지정을 취소하여야 한다. <개정 2013.3.23>
1. 거짓이나 그 밖의 부정한 방법으로 지정을 받은 경우
2. 제11조제5항에 따른 지정기준을 충족하지 못하게 된 경우
③ 제1항 및 제2항에 따른 처분의 기준과 절차 등에 필요한 사항은 대통령령으로 정한다.
제13조(관련 기관의 육성·지원) 정부는 생명연구자원의 확보·관리 및 활용을 촉진하기 위하여 생명연구자원의 연구, 기탁, 등록 또는 보존 등의 업무를 수행하는 기관 또는 단체 등을 육성·지원하여야 한다.
제14조(투자재원의 마련) 정부는 생명연구자원의 확보·관리 및 활용을 위한 시책을 추진하는 데에 필요한 투자재원을 지속적이고 안정적으로 마련하기 위하여 노력하여야 한다.
제15조(전문인력의 양성) 정부는 생명연구자원의 효과적인 확보·관리 및 활용에 필요한 전문인력을 체계적으로 양성하기 위하여 다음 각 호의 시책을 마련하여야 한다.
1. 생명연구자원 분야의 중·장기 전문인력 양성
2. 전문인력 교육프로그램의 확보 및 보급 지원
제16조(공동연구의 지원 등) ① 정부는 생명연구자원의 효율적인 확보·관리 및 활용을 위하여 산업계, 학계, 연구기관 간의 공동연구 및 관련 학술활동을 지원하여야 한다.
② 정부는 외국 및 국제기구 등과 생명연구자원의 확보·관리 및 활용에 관한 기술협력, 정보교환, 공동조사, 연구 등 효율적인 국제협력의 증진을 촉진하기 위하여 적극 노력하여야 한다.
제17조(생명연구자원의 활용) ① 정부는 국민이 생명연구자원에 대한 연구개발 및 산업화를 위하여 생명연구자원을 적극적으로 활용할 수 있도록 필요한 시책을 마련하여야 한다.
② 정부는 산업계, 학계, 연구기관이 필요한 생명연구자원을 효과적으로 활용할 수 있도록 홍보 및 교육 등의 시책을 추진하여야 한다.
제18조(생명연구자원의 정보유통) ① 관계 중앙행정기관의 장은 소관 분야의 생명연구자원과 관련된 정보를 디지털화된 형태로 수집·확보할 수 있도록 필요한 시책을 마련하여야 한다.
② 정부는 생명연구자원의 효율적인 관리와 유통을 촉진하기 위하여 생명연구자원과 관련된 정보의 수집·보존 및 전송에 관한 표준화를 추진하여야 한다.
제19조(통계간행물의 발간 등) ① 미래창조과학부장관은 생명연구자원의 종류와 보유기관 등 생명연구자원의 현황이 파악될 수 있도록 관계 중앙행정기관의 장 및 통계청장과의 협의를 거쳐 매년 통계간행물을 발간·보급하여야 한다. <개정 2013.3.23>
② 미래창조과학부장관은 제1항에 따른 통계간행물의 발간을 위하여 관계 중앙행정기관의 장에게 필요한 자료를 제출하도록 요청할 수 있다. <개정 2013.3.23.>
제20조(청문) 관계 중앙행정기관의 장과 미래창조과학부장관은 제12조제1항 또는 제2항에 따라 기탁등록보존기관, 책임기관, 생명연구자원정보센터 또는 국가생명연구자원정보센터의 지정을 취소하려면 청문을 하여야 한다. <개정 2013.3.23>
제21조(위임 및 위탁) ① 이 법에 따른 관계 중앙행정기관의 장과 미래창조과학부장관의 권한은 그 일부를 대통령령으로 정하는 바에 따라 특별시장·광역시장·도지사·특별자치도지사, 시장·군수·구청장(자치구의 구청장을 말한다) 또는 소속 기관의 장에게 위임할 수 있다. <개정 2013.3.23>
② 이 법에 따른 관계 중앙행정기관의 장과 미래창조과학부장관의 업무는 그 일부를 대통령령으로 정하는 바에 따라 관련 법인·단체에 위탁할 수 있다. <개정 2013.3.23>
<제12844호, 2014.11.19.> (정부조직법)
제1조(시행일) 이 법은 공포한 날부터 시행한다. 다만, 부칙 제6조에 따라 개정되는 법률 중 이 법 시행 전에 공포되었으나 시행일이 도래하지 아니한 법률을 개정한 부분은 각각 해당 법률의 시행일부터 시행한다.
제2조부터 제5조까지 생략
제6조(다른 법률의 개정) ①부터 <19>까지 생략
<20> 생명연구자원의 확보ㆍ관리 및 활용에 관한 법률 일부를 다음과 같이 개정한다.
제6조제1호 및 제2호를 각각 다음과 같이 한다.
1. 교육부장관: 생명연구자원 분야의 전문인력 양성 및 기초 연구를 지원하기 위한 시책으로서, 미래창조과학부장관과 협의한 시책
2. 미래창조과학부장관: 생명연구자원의 통합정보시스템을 구축하고 통계를 유지하며, 소관 분야 생명연구자원의 확보ㆍ관리 및 활용체제를 조성하고 생명연구자원의 관리 및 활용을 위한 정보통신기술의 확보를 지원하기 위한 시책
<21>부터 <258>까지 생략

실험동물에 관한 법률
[시행 2013.7.30] [법률 제11987호, 2013.7.30, 일부개정]
제1조(목적) 이 법은 실험동물 및 동물실험의 적절한 관리를 통하여 동물실험에 대한 윤리성 및 신뢰성을 높여 생명과학 발전과 국민보건 향상에 이바지함을 목적으로 한다.
제2조(정의) 이 법에서 사용하는 용어의 정의는 다음과 같다.
1. "동물실험"이란 교육ㆍ시험ㆍ연구 및 생물학적 제제(製劑)의 생산 등 과학적 목적을 위하여 실험동물을 대상으로 실시하는 실험 또는 그 과학적 절차를 말한다.
2. "실험동물"이란 동물실험을 목적으로 사용 또는 사육되는 척추동물을 말한다.
3. "재해"란 동물실험으로 인한 사람과 동물의 감염, 전염병 발생, 유해물질 노출 및 환경오염 등을 말한다.
4. "동물실험시설"이란 동물실험 또는 이를 위하여 실험동물을 사육하는 시설로서 대통령령으로 정하는 것을 말한다.
5. "실험동물생산시설"이란 실험동물을 생산 및 사육하는 시설을 말한다.
6. "운영자"란 동물실험시설 혹은 실험동물생산시설을 운영하는 자를 말한다.
제3조(적용 대상) 이 법은 다음 각 호의 어느 하나에 필요한 실험에 사용되는 동물과 그 동물실험시설의 관리 등에 적용한다.
1. 식품ㆍ건강기능식품ㆍ의약품ㆍ의약외품ㆍ생물의약품ㆍ의료기기ㆍ화장품의 개발ㆍ안전관리ㆍ품질관리
2. 마약의 안전관리ㆍ품질관리
제4조(다른 법률과의 관계) 실험동물의 사용 또는 관리에 관하여 이 법에서 규정한 것을 제외하고는 「동물보호법」으로 정하는 바에 따른다.
제5조(식품의약품안전처의 책무) ① 식품의약품안전처장은 제1조의 목적을 달성하기 위하여 다음 각 호의 사항을 수행하여야 한다. <개정 2013.3.23>
1. 실험동물의 사용 및 관리에 관한 정책의 수립 및 추진
2. 동물실험시설의 설치ㆍ운영에 관한 지원
3. 동물실험시설 내에서 실험동물의 유지ㆍ보존 및 개발에 관한 지원
4. 실험동물의 품질향상 등을 위한 연구 지원
5. 실험동물 관련 정보의 수집ㆍ관리 및 교육에 대한 지원
6. 동물실험을 대체할 수 있는 방법의 개발ㆍ인정에 관한 정책의 수립 및 추진
7. 그 밖에 실험동물의 사용과 관리에 필요한 사항
② 제1항을 수행하기 위하여 필요한 사항은 총리령으로 정한다. <개정 2010.1.18, 2013.3.23>
[제목개정 2013.3.23.]
제6조(동물실험시설 운영자의 책무) 동물실험시설의 운영자는 동물실험의 안전성 및 신뢰성 등을 확보하기 위하여 다음 각 호의 사항을 수행하여야 한다.
1. 실험동물의 과학적 사용 및 관리에 관한 지침 수립
2. 동물실험을 수행하는 자 및 종사자에 대한 교육
3. 동물실험을 대체할 수 있는 방법의 우선적 고려
4. 동물실험의 폐기물 등의 적절한 처리 및 작업자의 안전에 관한 계획 수립
제7조(실험동물운영위원회 설치 등) ① 동물실험시설에는 동물실험의 윤리성, 안전성 및 신뢰성 등을 확보하기 위하여 실험동물운영위원회를 설치ㆍ운영하여야 한다.
② 제1항의 실험동물운영위원회의 기능 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
제8조(동물실험시설의 등록) ① 동물실험시설을 설치하고자 하는 자는 식품의약품안전처장에게 등록하여야 한다. 등록사항을 변경하는 경우에도 또한 같다. <개정 2013.3.23>
② 동물실험시설에는 해당 시설 및 실험동물의 관리를 위하여 대통령령으로 정하는 자격요건을 갖춘 관리자(이하 "관리자"라 한다)를 두어야 한다.
③ 제1항에 따른 등록기준 및 절차 등에 관하여 필요한 사항은 총리령으로 정한다. <개정 2010.1.18, 2013.3.23>
제9조(실험동물의 사용 등) ① 동물실험시설에서 대통령령으로 정하는 실험동물을 사용하는 경우에는 동물실험시설 또는 제15조제1항에 따른 우수실험동물생산시설에서 생산된 실험동물을 우선적으로 사용하도록 노력하여야 한다.
② 외국으로부터 수입된 실험동물을 사용하고자 하는 경우에는 총리령으로 정하는 기준에 적합한 실험동물을 사용하여야 한다. <개정 2010.1.18, 2013.3.23>
제10조(우수동물실험시설의 지정) ① 식품의약품안전처장은 실험동물의 적절한 사용 및 관리를 위하여 적절한 인력 및 시설을 갖추고 운영상태가 우수한 동물실험시설을 우수동물실험시설로 지정할 수 있다. 이 경우 지정기준, 지정사항 변경 등에 관한 사항은 총리령으로 정한다. <개정 2010.1.18, 2013.3.23>
② 제1항에 따른 우수동물실험시설로 지정받고자 하는 자는 총리령으로 정하는 바에 따라 지정신청을 하여야 한다. <개정 2010.1.18, 2013.3.23>
③ 식품의약품안전처장은 실험동물을 사용하는 관련 사업자 또는 연구 용역을 수행하는 자에게 제1항에 따라 지정된 우수동물실험시설에서 그 업무를 수행하도록 권고할 수 있다. <개정 2013.3.23>
제11조(동물실험시설 등에 대한 지도ㆍ감독) ① 제8조 또는 제10조에 따라 동물실험시설로 등록 또는 우수동물실험시설로 지정 받은 자는 식품의약품안전처장의 지도ㆍ감독을 받아야 한다. <개정 2013.3.23>
② 제1항에 따른 지도ㆍ감독의 내용ㆍ대상ㆍ시기ㆍ기준 등에 관하여 필요한 사항은 식품의약품안전처장이 정한다. <개정 2013.3.23.>
제12조(실험동물공급자의 등록) ① 대통령령으로 정하는 실험동물의 생산ㆍ수입 또는 판매를 업으로 하고자 하는 자(이하 "실험동물공급자"라 한다)는 총리령으로 정하는 바에 따라 식품의약품안전처장에게 등록하여야 한다. 다만, 제8조의 동물실험시설에서 유지 또는 연구 과정 중 생산된 실험동물을 공급하는 경우에는 그러하지 아니하다. <개정 2010.1.18, 2013.3.23>
② 제1항에 따른 등록사항을 변경하고자 할 때에는 총리령으로 정하는 바에 따라 변경등록을 하여야 한다. <개정 2010.1.18, 2013.3.23>
제13조(실험동물공급자의 준수사항) 실험동물공급자는 실험동물의 안전성 및 건강을 확보하기 위하여 다음 각 호의 사항을 준수하여야 한다. <개정 2010.1.18, 2013.3.23>
1. 실험동물생산시설과 실험동물을 보건위생상 위해(危害)가 없고 안전성이 확보되도록 관리할 것
2. 실험동물을 운반하는 경우 그 실험동물의 생태에 적합한 방법으로 운송할 것
3. 그 밖에 제1호 및 제2호에 준하는 사항으로서 실험동물의 안전성 확보 및 건강관리를 위하여 필요하다고 인정하여 총리령으로 정하는 사항
제14조(실험동물 수입에 관한 사항) 실험동물의 수입과 검역에 관하여는 「가축전염병예방법」 제32조, 제34조, 제35조 및 제36조의 규정에 따른다.
제15조(우수실험동물생산시설의 지정 등) ① 식품의약품안전처장은 실험동물의 품질을 향상시키기 위하여 충분한 인력 및 시설을 갖추고 관리상태가 우수한 실험동물생산시설을 우수실험동물생산시설로 지정할 수 있다. 이 경우 지정기준, 지정사항 변경 등에 관한 사항은 총리령으로 정한다. <개정 2010.1.18, 2013.3.23>
② 제1항에 따른 우수실험동물생산시설로 지정받고자 하는 자는 총리령으로 정하는 바에 따라 지정신청을 하여야 한다. <개정 2010.1.18, 2013.3.23>
③ 제1항에 따라 우수실험동물생산시설로 지정된 경우가 아니면 실험동물의 운송용기나 문서 등에 우수실험동물생산시설 또는 이와 유사한 표지를 부착하거나 이를 홍보하여서는 아니 된다.
제16조(실험동물공급자 등에 대한 지도ㆍ감독) ① 제12조에 따라 실험동물공급자로 등록하거나 제15조에 따라 우수실험동물생산시설로 지정받은 자는 식품의약품안전처장의 지도ㆍ감독을 받아야 한다. <개정 2013.3.23>
② 제1항에 따른 지도ㆍ감독의 대상ㆍ시기ㆍ기준 등에 관하여 필요한 사항은 식품의약품안전처장이 정한다. <개정 2013.3.23.>
제17조(교육) ① 다음 각 호의 자는 실험동물의 사용ㆍ관리 등에 관하여 교육을 받아야 한다.
1. 제8조제1항에 따른 동물실험시설 설치자
2. 제8조제2항에 따른 관리자
3. 제12조에 따른 실험동물공급자
4. 그 밖에 동물실험을 수행하는 자
② 식품의약품안전처장은 제1항에 따른 교육을 수행하여야 하며, 교육 위탁기관, 교육내용, 소요경비의 징수 등에 관하여 필요한 사항은 총리령으로 정한다. <개정 2010.1.18, 2013.3.23>
제18조(재해 방지) ① 동물실험시설의 운영자 또는 관리자는 재해를 유발할 수 있는 물질 또는 병원체 등을 사용하는 동물실험을 실시하는 경우 사람과 동물에 위해를 주지 아니하도록 필요한 조치를 취하여야 한다.
② 동물실험시설 및 실험동물생산시설로 인한 재해가 국민 건강과 공익에 유해하다고 판단되는 경우 운영자 또는 관리자는 즉시 폐쇄, 소독 등 필요한 조치를 취한 후 그 결과를 식품의약품안전처장에게 보고하여야 한다. 이 경우 「가축전염병예방법」 제19조를 준용한다. <개정 2013.3.23>
③ 동물실험 및 실험동물로 인한 재해가 국민 건강과 공익에 유해하다고 판단되는 경우 운영자 또는 관리자는 살처분 등 필요한 조치를 취한 후 그 결과를 식품의약품안전처장에게 보고하여야 한다. 이 경우 「가축전염병예방법」 제20조를 준용한다. <개정 2013.3.23>
제19조(생물학적 위해물질의 사용보고) ① 동물실험시설의 운영자는 총리령으로 정하는 생물학적 위해물질을 동물실험에 사용하고자 하는 경우 미리 식품의약품안전처장에게 보고하여야 한다. <개정 2010.1.18, 2013.3.23>
② 제1항의 보고에 관한 사항은 총리령으로 정한다. <개정 2010.1.18, 2013.3.23>
제20조(사체 등 폐기물) ① 동물실험시설의 운영자 및 관리자 또는 실험동물공급자는 해당 시설에서 나온 실험동물의 사체가 외부에 유출되어 재이용되거나 재해가 발생되지 아니하도록 처리하여야 한다.
② 동물실험시설과 실험동물생산시설에서 배출된 실험동물의 사체 등의 폐기물은 「폐기물관리법」에 따라 처리한다.
제21조(기록) 동물실험을 수행하는 자는 총리령으로 정하는 바에 따라 실험동물의 종류, 사용량, 수행된 연구의 절차, 연구에 참여한 자에 대하여 기록하여야 한다. <개정 2010.1.18, 2013.3.23>
제22조(동물실험 실태보고) ① 식품의약품안전처장은 동물실험에 관한 실태보고서를 매년 작성하여 발표하여야 한다. <개정 2013.3.23>
② 제1항에 따른 실태보고서에는 다음 각 호의 사항이 포함되어야 한다. <개정 2010.1.18, 2013.3.23>
1. 동물실험에 사용된 실험동물의 종류 및 수
2. 동물실험 후의 실험동물의 처리
3. 동물실험시설 및 실험동물공급시설의 종류 및 수
4. 제11조에 따른 동물실험시설 등에 대한 지도ㆍ감독에 관한 사항
5. 제18조에 따른 재해유발 물질 또는 병원체 등의 사용에 관한 사항
6. 제19조에 따른 위해물질의 사용에 관한 사항
7. 제24조에 따른 지정취소 등에 관한 사항
8. 그 밖에 총리령으로 정하는 사항
제23조(실험동물협회) ① 동물실험의 신뢰성 증진 및 실험동물산업의 건전한 발전을 위하여 실험동물협회(이하 "협회"라 한다)를 둘 수 있다.
② 협회는 법인으로 한다.
③ 다음 각 호에 해당하는 자는 협회의 회원이 될 수 있다.
1. 제8조제1항에 따른 등록을 한 자
2. 제8조제2항에 의한 관리자
3. 실험동물분야에 관한 지식과 기술이 있는 자 중 협회의 정관으로 정하는 자
④ 협회를 설립하고자 하는 경우에는 대통령령으로 정하는 바에 따라 정관을 작성하여 식품의약품안전처장의 설립인가를 받아야 한다. <개정 2013.3.23>
⑤ 협회의 정관 기재 사항과 업무에 관하여 필요한 사항은 대통령령으로 정한다.
⑥ 협회에 관하여 이 법에 규정되지 아니한 사항은 「민법」 중 사단법인에 관한 규정을 준용한다.
⑦ 국가는 협회가 제1항에 따라 사업을 하는 때에 필요하다고 인정하는 경우 재정 등의 지원을 할 수 있다.
제24조(지정 등의 취소 등) ① 식품의약품안전처장은 제8조 또는 제12조에 따라 동물실험시설 또는 실험동물공급자로 등록한 자가 다음 각 호의 어느 하나에 해당하는 때에는 해당 시설 또는 공급자의 등록을 취소하거나 6개월 이내의 범위에서 시설의 운영 또는 영업을 정지할 수 있다. <개정 2013.3.23>
1. 속임수나 그 밖의 부정한 방법으로 등록한 것이 확인된 경우
2. 동물실험시설로부터 또는 실험동물공급과 관련하여 국민의 건강 또는 공익을 해하는 질병 등 재해가 발생한 경우
3. 제11조 또는 제16조에 따른 지도ㆍ감독을 따르지 아니하거나 기준에 미달한 경우
② 식품의약품안전처장은 제10조 또는 제15조에 따라 우수동물실험시설 또는 우수실험동물생산시설로 지정을 받은 자가 다음 각 호의 어느 하나에 해당하는 때에는 그 지정을 취소하거나 또는 6개월 이내의 범위에서 시설의 운영을 정지할 수 있다. <개정 2013.3.23>
1. 속임수나 그 밖의 부정한 방법으로 지정을 받은 것이 확인된 경우
2. 우수동물실험시설 또는 우수실험동물생산시설로부터 국민의 건강 또는 공익을 해하는 질병 등 재해가 발생한 경우
3. 제11조 또는 제16조에 따른 지도ㆍ감독을 따르지 아니하거나 기준에 미달한 경우
③ 제1항 및 제2항에 따른 처분의 기준은 총리령으로 정한다. <개정 2010.1.18, 2013.3.23>
제25조(결격사유) 다음 각 호의 어느 하나에 해당하는 자는 동물실험시설의 운영자 또는 관리자 및 실험동물공급자가 될 수 없다.
1. 「정신보건법」제3조제1호에 따른 정신질환자. 다만, 전문의가 운영자 또는 관리자로서 적합하다고 인정하는 사람은 그러하지 아니하다.
2. 금치산자ㆍ한정치산자로서 복권되지 아니한 자
3. 마약이나 그 밖의 유독물질의 중독자
4. 이 법을 위반하여 금고 이상의 실형을 선고받고, 집행이 종료(집행이 종료된 것으로 보는 경우를 포함한다)되거나 집행이 면제된 날부터 2년이 지나지 아니한 자
5. 이 법을 위반하여 금고 이상의 형의 집행유예 선고를 받고 그 유예기간 중에 있는 자
6. 제24조제1항에 따라 시설의 운영정지를 받거나 등록이 취소된 후 2년이 지나지 아니한 자
제26조(청문) 식품의약품안전처장은 제24조에 따라 해당 시설의 등록 취소, 운영정지, 지정 취소 등을 하고자 하는 때에는 미리 청문을 실시하여야 한다. <개정 2013.3.23>
제27조(지도ㆍ감독 등) ① 식품의약품안전처장은 제11조 및 제16조에 따른 지도 및 감독을 위하여 관계 공무원으로 하여금 현장조사를 하게 하거나 필요한 자료의 제출을 요구할 수 있다. <개정 2013.3.23>
② 제1항에 따라 조사를 하는 공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 제시하여야 한다.
제28조(과징금) ① 식품의약품안전처장은 시설의 운영자가 제24조에 해당하는 경우에는 해당 시설의 운영정지에 갈음하여 5천만원 이하의 과징금을 부과할 수 있다. <개정 2013.3.23>
② 제1항에 따라 과징금을 부과하는 위반행위의 정도 등에 따른 과징금의 금액 등에 관하여 필요한 사항은 대통령령으로 정한다.
③ 식품의약품안전처장은 제1항에 따른 과징금을 기한 이내에 납부하지 아니한 때에는 국세 체납처분의 예에 따라 징수한다. <개정 2013.3.23>
제29조(수수료) 다음 각 호의 어느 하나에 해당하는 자는 총리령으로 정하는 바에 따라 수수료를 납부하여야 한다. <개정 2010.1.18, 2013.3.23>
1. 제8조에 따른 등록 또는 제10조에 따른 지정을 받고자 하는 자
2. 제12조에 따른 등록 또는 제15조에 따른 지정을 받고자 하는 자
제30조(벌칙) 제12조제1항 또는 제2항을 위반하여 등록 또는 변경등록을 하지 아니한 자는 500만원 이하의 벌금에 처한다.
제31조(벌칙) 제27조제1항에 따른 현장조사를 정당한 사유 없이 거부ㆍ기피ㆍ방해한 자 또는 자료제출 요구에 응하지 아니하거나 거짓의 자료를 제출한 자는 200만원 이하의 벌금에 처한다.
제32조(양벌규정) 법인의 대표자나 법인 또는 개인의 대리인ㆍ사용인 및 그 밖의 종업원이 그 법인 또는 개인의 업무에 대하여 제31조에 해당하는 행위를 한 때에는 행위자를 벌하는 외에 그 법인 또는 개인에 대하여도 각 해당 조의 벌금형을 과한다. 다만, 법인 또는 개인이 그 위반행위를 방지하기 위하여 해당 업무에 관하여 상당한 주의와 감독을 게을리하지 아니한 경우에는 그러하지 아니하다. <개정 2013.7.30>
제33조(과태료) ① 다음 각 호의 어느 하나에 해당하는 자에게는 100만원 이하의 과태료를 부과한다.
1. 제8조에 따른 등록을 하지 아니한 자
2. 제15조제3항을 위반하여 우수실험동물생산시설 또는 이와 유사한 표지를 부착하거나 이를 홍보한 자
3. 제17조제1항을 위반하여 교육을 받지 아니한 동물실험시설 설치자, 관리자 또는 실험동물공급자
4. 제18조제2항 및 제3항 또는 제19조제1항에 따른 보고를 하지 아니하거나 거짓으로 보고한 자
② 제1항에 따른 과태료는 대통령령으로 정하는 바에 따라 식품의약품안전처장이 부과ㆍ징수한다. <개정 2013.3.23>
③ 삭제 <2013.3.23>
④ 삭제 <2013.3.23>
⑤ 삭제 <2013.3.23>
<제11987호, 2013.7.30>
이 법은 공포한 날부터 시행한다.

뇌연구촉진법
[시행 2014.11.19.] [법률 제12844호, 2014.11.19., 타법개정]
제1조(목적) 이 법은 뇌연구 촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성ㆍ발전시키고 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 이바지함을 목적으로 한다.
[전문개정 2010.3.17]
제2조(정의) 이 법에서 사용하는 용어의 뜻은 다음과 같다. <개정 2013.3.23., 2014.11.19>
1. "뇌연구"란 뇌과학(腦科學), 뇌의약학(腦醫藥學), 뇌공학(腦工學) 및 이와 관련된 모든 분야에 대한 연구를 말한다.
2. "뇌과학"이란 뇌의 신경생물학적 구조, 인지(認知), 사고, 언어심리 및 행동 등의 고등신경(高等神經) 정신활동에 대한 포괄적인 이해를 위한 기초학문을 말한다.
3. "뇌의약학"이란 뇌의 구조 및 기능상의 결함과 뇌의 노화 등으로 인한 신체적ㆍ정신적 질환 및 장애의 원인 규명과 이의 치료, 예방 등에 관한 학문을 말한다.
4. "뇌공학"이란 뇌의 고도의 지적 정보처리 구조와 기능을 이해하고 이의 공학적 응용을 위한 이론 및 기술에 관한 학문을 말한다.
5. "관계 중앙행정기관"이란 미래창조과학부, 교육부, 산업통상자원부, 보건복지부를 말한다.
[전문개정 2010.3.17]
제3조(적용 범위) 뇌연구에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법에 따른다.
[전문개정 2010.3.17]
제4조(정부 등의 책무) ① 정부는 뇌연구 촉진을 지원하기 위한 시책을 마련하고, 이를 적극적으로 추진하여야 한다.
② 대학, 연구기관, 기업 및 개인 등 뇌연구를 하는 자는 제1항에 따른 시책에 적극 협력하여야 한다.
[전문개정 2010.3.17]
제5조(뇌연구촉진기본계획의 수립) ① 관계 중앙행정기관의 장은 소관별로 뇌연구 촉진을 위한 계획과 전년도 추진 실적을 미래창조과학부장관에게 제출하여야 한다. <개정 2013.3.23>
② 미래창조과학부장관은 제1항에 따라 관계 중앙행정기관의 장이 소관별로 제출한 뇌연구 촉진을 위한 계획을 종합ㆍ조정한 후 「생명공학육성법」 제6조에 따른 생명공학종합정책심의회(이하 "심의회"라 한다)의 심의를 거쳐 뇌연구촉진기본계획(이하 "기본계획"이라 한다)을 수립하고, 이를 관계 중앙행정기관의 장에게 통보하여야 한다. 기본계획을 변경하는 경우에도 또한 같다. <개정 2011.7.21, 2013.3.23>
③ 기본계획에는 다음 각 호의 사항이 포함되어야 한다.
1. 뇌연구의 중장기적 목표 및 내용
2. 뇌연구에 필요한 투자재원(投資財源)의 확대 방안 및 추진계획
3. 교육, 산업, 보건복지, 정보통신, 과학기술 등 각 분야의 뇌연구에 관한 계획
4. 뇌연구에 필요한 인력자원의 개발 및 효율적인 활용에 관한 종합계획
5. 뇌연구 결과의 이용과 보전(保全)에 관한 계획
6. 그 밖에 뇌연구 촉진을 위하여 필요한 중요 사항
[전문개정 2010.3.17]
제6조(뇌연구촉진시행계획의 수립) ① 관계 중앙행정기관의 장은 기본계획에 따라 매년 뇌연구촉진시행계획(이하 "시행계획"이라 한다)을 수립하고 시행하여야 한다.
② 관계 중앙행정기관의 장은 시행계획을 수립하려면 미리 미래창조과학부장관과 협의하여야 한다. <개정 2013.3.23>
③ 미래창조과학부장관은 필요하면 시행계획의 수립에 필요한 기본지침을 작성하여 관계 중앙행정기관의 장에게 통보할 수 있다. <개정 2013.3.23>
④ 시행계획의 수립 및 그 시행에 필요한 사항은 대통령령으로 정한다.
[전문개정 2010.3.17]
제6조의2(뇌연구실무추진위원회) ① 심의회에 상정할 안건을 사전에 심의하기 위하여 미래창조과학부장관 소속으로 뇌연구실무추진위원회를 둘 수 있다. <개정 2013.3.23>
② 제1항의 뇌연구실무추진위원회의 구성, 운영 및 그 밖에 필요한 사항은 대통령령으로 정한다.
[본조신설 2011.7.21]
제7조 삭제 <2011.7.21>
제8조 삭제 <2011.7.21>
제9조(뇌연구 투자의 확대) ① 정부는 제5조제3항제2호의 투자재원의 확대 방안 및 추진계획에 따라 예산의 범위에서 뇌연구 투자를 확대하기 위하여 최대한 노력하여야 한다.
② 미래창조과학부장관은 매년 뇌연구 투자 확대계획을 작성하여 심의회의 심의를 거친 후 「국가과학기술자문회의법」에 따른 국가과학기술자문회의에 보고하여야 한다. <개정 2013.3.23>
[전문개정 2010.3.17]
제10조(연구 및 기술 협력) 정부는 뇌연구와 그 기술 개발에 관한 국제 협력 증진을 위하여 노력하고 선진기술을 도입하기 위한 전문인력 파견, 해외 전문인력 유치 등의 방안을 마련하여야 한다.
[전문개정 2010.3.17]
제11조(공동연구 및 학술활동 촉진) 정부는 뇌연구와 그 기술개발을 효율적으로 육성하기 위하여 학계, 연구기관 및 산업계 간의 공동 연구를 촉진하고 관련 학회 및 학회의 학술활동을 적극 지원하여야 한다.
[전문개정 2010.3.17]
제12조(관계 산업체 지원) 정부는 뇌연구 결과의 산업화를 촉진하기 위하여 신기술제품의 생산을 지원할 수 있다.
[전문개정 2010.3.17]
제13조(기술정보의 수집과 보급) 정부는 뇌연구에 관한 정보를 수집하여 관련 기관에 보급하도록 노력하여야 한다.
[전문개정 2010.3.17]
제14조(뇌연구 추진시책의 마련) 관계 중앙행정기관의 장은 뇌연구를 효율적으로 촉진하기 위하여 다음 각 호의 구분에 따른 시책을 마련한다. <개정 2013.3.23., 2014.11.19.>
1. 미래창조과학부장관: 기본계획의 수립과 시행계획 수립의 지원 및 조정, 뇌 관련 기초기술 및 첨단기술의 개발, 유용한 연구 결과의 이용 및 보전을 위한 연구의 지원, 공공적 성격의 뇌연구 지원체제의 육성, 뇌연구 결과를 정보ㆍ통신 등의 분야에 응용하기 위한 기술의 개발 및 개발기술의 산업화 촉진을 위한 시책
1의2. 교육부장관: 뇌연구를 촉진하기 위한 전문인력의 양성과 뇌과학 기초분야의 연구지원을 위한 시책으로서, 미래창조과학부장관과 협의한 시책
2. 산업통상자원부장관: 뇌연구 결과를 생산 및 산업 공정에 효율적으로 응용하기 위한 응용기술의 개발과 개발기술의 산업화 촉진을 위한 시책
3. 보건복지부장관: 보건ㆍ의료 등에 관련되는 뇌의약(腦醫藥) 연구와 그 결과의 응용기술 개발 및 개발기술의 산업화 촉진을 위한 시책
[전문개정 2010.3.17]
제15조(임상 및 검정) ① 정부는 뇌연구 관련 제품에 대한 임상 및 검정체제를 확립한다.
② 제1항의 임상 및 검정체제 확립에 필요한 사항은 대통령령으로 정한다.
[전문개정 2010.3.17]
제16조(실험지침의 작성ㆍ시행 등) ① 정부는 뇌연구와 그 산업화의 촉진을 위한 실험지침을 작성ㆍ시행하여야 한다.
② 제1항의 실험지침에는 뇌연구와 그 산업화 과정에서 예견될 수 있는 생물학적 위험성, 인간에게 미치는 악영향 및 윤리적 문제의 발생을 사전에 방지하기 위하여 필요한 조치 및 안전기준이 마련되어야 한다.
[전문개정 2010.3.17]
제17조(연구소의 설립) ① 뇌 분야에 관한 연구 및 그 이용과 지원에 관한 기능을 수행하고 뇌 분야에서 학계, 연구기관 및 산업계 간의 유기적 협조체제를 유지ㆍ발전시키기 위하여 정부가 출연(出捐)하는 연구소를 설립할 수 있다.
② 제1항에 따른 연구소는 「특정연구기관 육성법」을 적용받는 특정연구기관으로 한다.
[전문개정 2010.3.17]
부칙 <제12844호, 2014.11.19.> (정부조직법)
제1조(시행일) 이 법은 공포한 날부터 시행한다. 다만, 부칙 제6조에 따라 개정되는 법률 중 이 법 시행 전에 공포되었으나 시행일이 도래하지 아니한 법률을 개정한 부분은 각각 해당 법률의 시행일부터 시행한다.
제2조부터 제5조까지 생략
제6조(다른 법률의 개정) ①부터 <16>까지 생략
<17> 뇌연구 촉진법 일부를 다음과 같이 한다.
제2조제5호 중 "미래창조과학부, 교육부"를 "교육부, 미래창조과학부"로 한다.
제14조제1호 및 제1호의2를 각각 다음과 같이 한다.
1. 교육부장관: 뇌연구를 촉진하기 위한 전문인력의 양성과 뇌과학 기초분야의 연구지원을 위한 시책으로서, 미래창조과학부장관과 협의한 시책
1의2. 미래창조과학부장관: 기본계획의 수립과 시행계획 수립의 지원 및 조정, 뇌 관련 기초기술 및 첨단기술의 개발, 유용한 연구 결과의 이용 및 보전을 위한 연구의 지원, 공공적 성격의 뇌연구 지원체제의 육성, 뇌연구 결과를 정보ㆍ통신 등의 분야에 응용하기 위한 기술의 개발 및 개발기술의 산업화 촉진을 위한 시책
<18>부터 <258>까지 생략
제7조생략

유전자변형생물체의 국가간 이동 등에 관한 법률
[시행 2014.11.19.] [법률 제12844호, 2014.11.19., 타법개정]
제1조(목적)이 법은 「바이오안전성에 관한 카르타헤나 의정서」의 시행에 필요한 사항과 유전자변형생물체의 개발ㆍ생산ㆍ수입ㆍ수출ㆍ유통 등에 관한 안전성의 확보를 위하여 필요한 사항을 정함으로써 유전자변형생물체로 인한 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 미치는 위해(危害)를 사전에 방지하고 국민생활의 향상 및 국제협력을 증진함을 목적으로 한다.
[전문개정 2007.12.21.]
제2조(정의)이 법에서 사용하는 용어의 뜻은 다음과 같다. <개정 2012.12.11.>
1. "생물체"란 유전물질을 전달 또는 복제할 수 있는 생물학적 존재(생식능력이 없는 생물체, 바이러스 및 바이로이드를 포함한다)를 말한다.
2. "유전자변형생물체"란 다음 각 목의 현대생명공학기술을 이용하여 새롭게 조합된 유전물질을 포함하고 있는 생물체를 말한다.
가. 인위적으로 유전자를 재조합하거나 유전자를 구성하는 핵산을 세포 또는 세포 내 소기관으로 직접 주입하는 기술
나. 분류학에 의한 과(科)의 범위를 넘는 세포융합기술
3. "후대교배종"이란 제7조의2에 따라 위해성심사를 거친 유전자변형식물끼리 교배하여 얻은 유전자변형식물을 말한다.
4. "환경 방출"이란 유전자변형생물체를 시설, 장치, 그 밖의 구조물을 이용하여 밀폐하지 아니하고 의도적으로 자연환경에 노출되게 하는 것을 말한다.
5. "관계 중앙행정기관"이란 다음 각 목의 어느 하나에 해당하는 업무를 관장하는 중앙행정기관으로서 대통령령으로 정하는 중앙행정기관을 말한다.
가. 유전자변형생물체의 개발ㆍ생산ㆍ수입(휴대품 또는 우편물로 수입하는 경우를 포함한다. 이하 같다)ㆍ수출ㆍ판매ㆍ운반ㆍ보관ㆍ이용 등(이하 "수출입등"이라 한다)에 관한 업무
나. 바이오안전성에 기반한 유전자변형생물체의 연구개발과 관련 산업의 건전한 발전을 촉진하는 업무
[전문개정 2007.12.21.]
제3조(적용 범위)인체용 의약품으로 사용되는 유전자변형생물체에 대하여는 이 법을 적용하지 아니한다.
[전문개정 2007.12.21.]
제4조(다른 법률과의 관계)유전자변형생물체를 수출입등을 할 때에 그 취급 및 안전관리에 관하여 다른 법률에 특별한 규정이 있는 경우 외에는 이 법으로 정하는 바에 따른다.
[전문개정 2007.12.21.]
제5조(국가 등의 책무)①국가와 지방자치단체는 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 대하여 유전자변형생물체가 끼칠 위해를 방지하기 위하여 필요한 시책을 마련하여야 한다. <개정 2012.12.11.>
② 유전자변형생물체의 수출입등을 하는 자는 국민 건강과 환경에 위해가 발생하지 아니하도록 유전자변형생물체를 안전하게 관리하여야 한다. <신설 2012.12.11.>
[전문개정 2007.12.21.]
제6조(국가책임기관 등)「바이오안전성에 관한 카르타헤나 의정서」(이하 "의정서"라 한다) 제19조에 따른 국가연락기관은 외교부로 하고, 국가책임기관은 산업통상자원부로 한다. <개정 2008.2.29., 2013.3.23.>
② 제1항에 따른 국가책임기관(이하 "국가책임기관"이라 한다)의 장은 대통령령으로 정하는 바에 따라 국가책임기관으로서 의정서를 이행하는 데에 필요한 업무를 수행한다. <개정 2012.12.11.>
[전문개정 2007.12.21.]
제7조(유전자변형생물체 안전관리계획의 수립ㆍ시행)① 관계 중앙행정기관의 장은 소관별로 유전자변형생물체 안전관리계획(이하 "안전관리계획"이라 한다)을 수립ㆍ시행하여야 한다. <개정 2012.12.11.>
② 안전관리계획에는 다음 각 호의 사항이 포함되어야 한다.
1. 유전자변형생물체의 수출입등에 따른 안전관리의 기본방침에 관한 사항
2. 유전자변형생물체를 취급하는 시설 및 작업 종사자의 안전에 관한 사항
3. 유전자변형생물체에 관한 기술 개발 및 지원에 관한 사항
4. 그 밖에 유전자변형생물체의 안전관리와 관련한 중요 사항
③ 관계 중앙행정기관의 장은 안전관리계획을 수립ㆍ시행하려면 미리 제31조에 따른 바이오안전성위원회의 심의를 거쳐야 한다. <개정 2012.12.11.>
④ 관계 중앙행정기관의 장은 안전관리계획의 시행을 위한 세부시행계획을 수립ㆍ시행하여야 하며, 이를 위하여 필요하면 안전관리지침을 정하여 고시할 수 있다. <개정 2012.12.11.>
[전문개정 2007.12.21.]
제7조의2(신규 유전자변형생물체에 대한 위해성심사)① 다음 각 호의 어느 하나에 해당하는 자는 각각 제8조, 제12조 및 제22조의4에 따른 승인을 받기 전까지 대통령령으로 정하는 위해성심사에 필요한 자료를 갖추어 대통령령으로 정하는 바에 따라 관계 중앙행정기관의 장으로부터 위해성심사를 받아야 한다. 다만, 제2호 및 제3호에 해당하는 자가 제1호에 따라 수입 시에 위해성심사를 받은 신규 유전자변형생물체를 생산하거나 이용하는 경우에는 그러하지 아니하다.
1. 제8조에 따라 신규 유전자변형생물체를 수입하려는 자
2. 제12조에 따라 신규 유전자변형생물체를 생산하려는 자
3. 제22조의4에 따라 신규 유전자변형생물체를 이용하려는 자
② 신규 유전자변형생물체를 개발한 자는 개발된 신규 유전자변형생물체에 대하여 제1항에 따른 위해성심사 이전에 관계 중앙행정기관의 장으로부터 위해성심사를 받을 수 있다. 이 경우 관계 중앙행정기관의 장은 신규 유전자변형생물체를 수입, 생산 또는 이용하려는 자가 제1항에 따라 받는 위해성심사를 대통령령으로 정하는 바에 따라 약식으로 하거나 면제할 수 있다.
③ 관계 중앙행정기관의 장은 제1항 및 제2항에 따른 위해성심사를 하는 경우 유전자변형생물체가 인체에 미치는 영향에 대하여는 보건복지부장관과 협의하여야 하며, 환경 방출되거나 환경 방출될 우려가 있는 유전자변형생물체의 경우에는 다음 각 호의 구분에 따른 기관의 장과 협의하여야 한다. <개정 2013.3.23.>
1. 작물재배 환경에 미치는 영향: 농림축산식품부
2. 자연생태계에 미치는 영향: 환경부
3. 수산 환경 및 해양생태계에 미치는 영향: 해양수산부
④ 유전자변형생물체의 위해성심사의 기준ㆍ방법, 그 밖에 필요한 사항은 유전자변형생물체의 환경 방출 가능성, 이용 목적 및 후대교배종 여부 등을 고려하여 관계 중앙행정기관의 장이 정하여 고시한다.
⑤ 관계 중앙행정기관의 장은 유전자변형생물체의 위해성심사 업무를 대통령령으로 정하는 바에 따라 지정하는 자(이하 "위해성심사대행기관"이라 한다)로 하여금 대행하게 할 수 있다.
⑥ 제5항에도 불구하고 해양수산부장관은 제3항제3호의 수산 환경 및 해양생태계에 미치는 영향에 대한 위해성심사 업무를 대통령령으로 정하는 바에 따라 위임 또는 위탁할 수 있다. <개정 2013.3.23.>
⑦ 관계 중앙행정기관의 장 및 제6항에 따라 위임 또는 위탁을 받은 자가 유전자변형생물체의 위해성심사를 하였을 때에는 그 유전자변형생물체에 관한 정보를 대통령령으로 정하는 바에 따라 국민에게 알려야 한다.
[본조신설 2012.12.11.]
제8조(수입승인 등)① 유전자변형생물체를 수입하려는 자는 대통령령으로 정하는 바에 따라 관계 중앙행정기관의 장의 승인을 받아야 한다.
② 환경 방출로 사용되는 유전자변형생물체를 수입하려는 자는 제1항에도 불구하고 국가책임기관의 장을 거쳐 관계 중앙행정기관의 장에게 수입승인을 신청하여야 한다. 이 경우 국가책임기관의 장과 관계 중앙행정기관의 장은 대통령령으로 정하는 바에 따라 의정서 제8조부터 제10조까지에 따른 그 유전자변형생물체의 국가간 이동에 필요한 절차를 따라야 한다.
③ 제1항에 따라 승인을 받은 자는 승인받은 사항을 변경하려면 변경승인을 받아야 한다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려면 변경신고를 하여야 한다.
④ 관계 중앙행정기관의 장은 수입승인 여부를 결정할 때에는 유전자변형생물체가 국내 생물다양성의 가치에 미칠 사회적ㆍ경제적 영향을 고려하여야 한다.
⑤ 관계 중앙행정기관의 장은 제1항 및 제3항에 따른 승인 여부 및 신고 내용을 국가책임기관의 장에게 통보하여야 한다.
⑥ 제1항 및 제3항에 따른 승인, 신고의 절차 및 방법에 관하여 필요한 사항은 대통령령으로 정한다.
[전문개정 2012.12.11.]
제9조(시험ㆍ연구용 등의 유전자변형생물체의 수입)① 제8조제1항에도 불구하고 시험ㆍ연구용으로 사용하거나 박람회ㆍ전시회에 출품하기 위하여 유전자변형생물체를 수입하려는 자는 관계 중앙행정기관의 장에게 신고하여야 한다. 다만, 다음 각 호의 어느 하나에 해당하는 유전자변형생물체의 경우에는 승인을 받아야 한다. <개정 2012.12.11.>
1. 분류학에 의한 종(種)의 이름까지 명시되어 있지 아니하고 인체병원성 여부가 밝혀지지 아니한 미생물을 이용하여 얻어진 유전자변형생물체
2. 척추동물에 대하여 보건복지부장관이 고시하는 단백성 독소를 생산할 능력을 가진 유전자변형생물체
3. 의도적으로 도입된 약제내성 유전자를 가진 유전자변형생물체. 다만, 보건복지부장관이 고시하는 약제내성 유전자를 가진 유전자변형생물체는 제외한다.
4. 국민보건상 국가관리가 필요하다고 보건복지부장관이 고시하는 병원성미생물을 이용하여 얻어진 유전자변형생물체
② 제1항에 따라 신고한 자는 신고한 사항을 변경하려면 변경신고를 하여야 한다. <신설 2012.12.11.>
③ 제1항 및 제2항에 따른 수입승인 및 신고에 관하여는 제8조제3항 및 제5항을 준용한다. <개정 2012.12.11.>
④ 제1항부터 제3항까지에 따른 승인, 신고의 절차 및 방법에 관하여 필요한 사항은 대통령령으로 정한다. <신설 2012.12.11.>
[전문개정 2007.12.21.]
제10조(수입검사)① 관계 중앙행정기관의 장은 수입되는 유전자변형생물체(제9조제1항 본문에 따라 신고한 유전자변형생물체는 제외한다)가 제8조 또는 제9조에 따른 승인 또는 신고 내용에 맞는지 등을 확인하기 위하여 통관절차 완료 전에 유전자변형생물체를 검사할 수 있다. <신설 2012.12.11.>
② 제1항에도 불구하고 세관장은 국제우편물에 제8조 또는 제9조에 따른 승인을 받지 아니하거나 신고를 하지 아니한 유전자변형생물체가 담겨 있거나 담겨 있다고 의심되면 지체 없이 그 사실을 관계 중앙행정기관의 장에게 통보하여야 한다. <개정 2012.12.11.>
③ 제2항에 따라 세관장이 통지하면 관계 중앙행정기관의 장은 해당 국제우편물을 검사한 후 폐기, 반송 등 적절한 조치를 하여야 한다. <개정 2012.12.11.>
④ 유전자변형생물체가 담겨 있는 국제우편물을 받은 자는 그 유전자변형생물체가 제8조 또는 제9조에 따른 승인을 받지 아니하거나 신고를 하지 아니한 것임을 알았을 때에는 지체 없이 관계 중앙행정기관의 장에게 이를 신고하고, 관계 중앙행정기관의 장이 명하는 바에 따라 처리하여야 한다. <개정 2012.12.11.>
⑤ 제1항부터 제4항까지에 따른 검사의 대상, 방법에 관하여 필요한 사항은 대통령령으로 정한다. <신설 2012.12.11.>
[전문개정 2007.12.21.]
[제목개정 2012.12.11.]
제11조(수입항구 등의 지정)① 국가책임기관의 장은 유전자변형생물체의 안전관리를 위하여 필요하다고 인정하면 관계 중앙행정기관의 장과 협의하여 유전자변형생물체를 수입하는 항구ㆍ공항 등을 지정할 수 있다. <개정 2012.12.11.>
② 국가책임기관의 장은 제1항에 따라 항구ㆍ공항 등을 지정하는 경우에는 지체 없이 이를 공고하여야 한다.
[전문개정 2007.12.21.]
제12조(생산승인 등)① 유전자변형생물체를 생산하려는 자는 대통령령으로 정하는 바에 따라 관계 중앙행정기관의 장의 승인을 받아야 한다.
② 제1항에 따라 승인을 받은 자는 승인받은 사항을 변경하려면 변경승인을 받아야 한다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려면 변경신고를 하여야 한다.
③ 제1항 및 제2항에 따른 생산승인 및 신고에 관하여는 제8조제4항 및 제5항을 준용한다. 이 경우 "수입"은 "생산"으로 본다.
④ 제1항 및 제2항에 따른 승인, 신고의 절차 및 방법에 관하여 필요한 사항은 대통령령으로 정한다.
[전문개정 2012.12.11.]
제13조삭제 <2012.12.11.>
제14조(수입 또는 생산의 금지 등)① 관계 중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 생물체의 수입이나 생산을 금지하거나 제한할 수 있다. <개정 2012.12.11.>
1. 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다고 인정하는 유전자변형생물체
2. 제1호에 해당하는 유전자변형생물체와 교배하여 생산된 생물체
3. 국내 생물다양성의 가치와 관련하여 사회ㆍ경제적으로 부정적인 영향을 미치거나 미칠 우려가 있다고 인정하는 유전자변형생물체
② 관계 중앙행정기관의 장은 제1항에 따라 유전자변형생물체의 수입이나 생산을 금지하거나 제한하는 경우에는 국가책임기관의 장에게 통보하여야 한다. <개정 2012.12.11.>
③ 국가책임기관의 장은 제1항 각 호에 따라 수입이나 생산을 금지하거나 제한하는 생물체의 품목 등에 관하여 필요한 사항을 공고하여야 한다.
[전문개정 2007.12.21.]
제15조삭제 <2012.12.11.>
제16조(「대외무역법」에 따른 수입승인 의제 등)① 제8조 및 제9조에 따라 관계 중앙행정기관의 장이 수입승인을 하거나 신고를 수리한 유전자변형생물체에 대하여는 「대외무역법」 제11조제2항에 따른 산업통상자원부장관의 수입승인을 받은 것으로 본다. <개정 2008.2.29., 2012.12.11., 2013.3.23.>
② 제20조에 따라 유전자변형생물체를 수출하려는 자가 관계 중앙행정기관의 장에게 그 내용을 통보한 유전자변형생물체에 대하여는 「대외무역법」 제11조제2항에 따른 산업통상자원부장관의 수출승인을 받은 것으로 본다. <개정 2008.2.29., 2012.12.11., 2013.3.23.>
[전문개정 2007.12.21.]
제17조(승인취소)① 관계 중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 경우에는 제8조, 제9조 또는 제12조에 따른 유전자변형생물체의 수입승인이나 생산승인을 취소할 수 있다. 다만, 제1호 또는 제2호에 해당하는 경우에는 수입승인이나 생산승인을 취소하여야 한다. <개정 2012.12.11.>
1. 수입승인이나 생산승인을 받은 유전자변형생물체가 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다는 사실이 밝혀진 경우
2. 속임수나 그 밖의 부정한 방법으로 수입승인이나 생산승인을 받은 경우
3. 수입승인이나 생산승인을 받은 유전자변형생물체를 승인을 받은 용도와 다르게 사용하는 경우
4. 제8조제3항, 제9조제3항 또는 제12조제2항을 위반하여 변경승인을 받지 아니하거나 변경신고를 하지 아니하고 유전자변형생물체를 수입하거나 생산한 경우
5. 제24조제1항 또는 제2항을 위반하여 유전자변형생물체의 종류 등의 표시를 하지 아니한 경우 또는 거짓으로 표시하거나 표시를 임의로 변경 또는 삭제한 경우
6. 제25조제1항을 위반하여 취급관리기준을 지키지 아니한 경우
7. 제26조를 위반하여 유전자변형생물체의 수출입등에 관한 기록을 작성ㆍ보관하지 아니한 경우
8. 제27조제2항을 위반하여 유전자변형생물체의 부정적인 영향을 알면서도 관계 중앙행정기관의 장이나 국가책임기관의 장에게 그 내용을 통보하지 아니한 경우
9. 정당한 사유 없이 제36조제1항에 따른 보고나 자료 또는 시료(試料)의 제출을 거부하거나 출입ㆍ검사를 거부ㆍ방해 또는 기피한 경우
10. 그 밖에 대통령령으로 정하는 사유에 해당하는 경우
② 관계 중앙행정기관의 장은 제1항에 따라 수입승인이나 생산승인을 취소한 경우에는 지체 없이 국가책임기관의 장에게 통보하여야 한다. <개정 2012.12.11.>
[전문개정 2007.12.21.]
제18조(재심사) ① 제8조ㆍ제12조 및 제17조제1항에 따른 처분에 불복하는 자는 대통령령으로 정하는 바에 따라 관계 중앙행정기관의 장에게 재심사를 요청할 수 있다. <개정 2012.12.11.>
② 관계 중앙행정기관의 장은 제1항에 따른 재심사를 요청받은 경우에는 제31조에 따른 바이오안전성위원회의 심의를 거쳐 재심사에 대한 결정을 하여야 한다. <개정 2012.12.11.>
[전문개정 2007.12.21.]
제19조
[제19조는 제23조의2로 이동 <2012.12.11.>]
제20조(수출 통보)유전자변형생물체를 수출하려는 자는 관계 중앙행정기관의 장에게 품목, 수량, 수출국가 등 대통령령으로 정하는 사항을 미리 통보하여야 한다. <개정 2008.2.29., 2012.12.11.>
[전문개정 2007.12.21.]
제21조(경유 신고)유전자변형생물체를 국내의 항구, 공항 또는 대통령령으로 정하는 장소에서 하역한 후 다른 국가로 수출하려는 자는 관계 중앙행정기관의 장에게 품목, 수량, 수출국가, 수입국가 등 대통령령으로 정하는 사항을 신고하여야 한다. <개정 2012.12.11.>
[전문개정 2007.12.21.]
제22조(연구시설의 설치ㆍ운영)① 유전자변형생물체를 개발하거나 이를 이용하여 실험을 하는 시설(이하 "연구시설"이라 한다)을 설치ㆍ운영하려는 자는 연구시설의 안전관리 등급별로 관계 중앙행정기관의 장의 허가를 받거나 관계 중앙행정기관의 장에게 신고하여야 한다.
② 제1항에 따라 허가를 받은 자는 허가받은 사항을 변경하려면 변경허가를 받아야 한다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려면 변경신고를 하여야 한다.
③ 제1항에 따라 신고한 자는 신고한 사항을 변경하려면 변경신고를 하여야 한다.
④ 제1항에 따라 허가를 받거나 신고를 한 자는 연구시설을 폐쇄하는 경우 그 내용을 관계 중앙행정기관의 장에게 신고하여야 한다.
⑤ 관계 중앙행정기관의 장은 제1항부터 제3항까지에 따른 연구시설의 설치ㆍ운영 허가 여부 및 신고 내용과 제4항에 따른 연구시설의 폐쇄 신고 내용을 국가책임기관의 장에게 통보하여야 한다.
⑥ 제1항부터 제3항까지에 따라 연구시설의 설치ㆍ운영 허가를 받거나 신고를 한 자는 연구시설의 안전관리 등급에 따라 대통령령으로 정하는 준수사항을 지켜야 한다.
⑦ 제1항부터 제4항까지에 따른 연구시설의 범위, 안전관리 등급, 설치ㆍ운영 허가 및 신고의 기준과 절차, 폐쇄 신고의 기준과 절차에 관하여 필요한 사항은 대통령령으로 정한다.
[전문개정 2012.12.11.]
제22조의2(유전자변형생물체의 개발ㆍ실험)① 제22조에 따라 연구시설의 설치ㆍ운영 허가를 받거나 신고를 한 자는 대통령령으로 정하는 위해 가능성이 큰 유전자변형생물체를 개발ㆍ실험하려는 경우에는 관계 중앙행정기관의 장의 승인을 받아야 한다.
② 제1항에 따라 승인을 받은 자는 승인받은 사항을 변경하려면 변경승인을 받아야 한다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려면 변경신고를 하여야 한다.
③ 관계 중앙행정기관의 장은 제1항 및 제2항에 따른 유전자변형생물체의 개발ㆍ실험 승인 여부 및 신고 내용을 국가책임기관의 장에게 통보하여야 한다.
[본조신설 2012.12.11.]
제22조의3(생산공정이용시설의 설치ㆍ운영)① 생산공정 중에 유전자변형미생물을 이용하는 시설(이하 "생산공정이용시설"이라 한다)을 설치ㆍ운영하려는 자는 생산공정이용시설의 안전관리 등급별로 관계 중앙행정기관의 장의 허가를 받거나 관계 중앙행정기관의 장에게 신고하여야 한다.
② 제1항에 따라 허가를 받은 자는 허가받은 사항을 변경하려면 변경허가를 받아야 한다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려면 변경신고를 하여야 한다.
③ 제1항에 따라 신고한 자는 신고한 사항을 변경하려면 변경신고를 하여야 한다.
④ 제1항에 따라 허가를 받거나 신고를 한 자는 생산공정이용시설을 폐쇄하는 경우 그 내용을 관계 중앙행정기관의 장에게 신고하여야 한다.
⑤ 관계 중앙행정기관의 장은 제1항부터 제3항까지에 따른 생산공정이용시설의 설치ㆍ운영 허가 여부 및 신고 내용과 제4항에 따른 생산공정이용시설의 폐쇄 신고 내용을 국가책임기관의 장에게 통보하여야 한다.
⑥ 제1항부터 제4항까지에 따른 생산공정이용시설의 범위, 안전관리 등급, 설치ㆍ운영 허가 및 신고의 기준과 절차, 폐쇄 신고의 기준과 절차에 관하여 필요한 사항은 대통령령으로 정한다.
[본조신설 2012.12.11.]
제22조의4(유전자변형미생물의 이용) ① 제22조의3에 따라 생산공정이용시설의 설치ㆍ운영 허가를 받거나 신고를 한 자는 유전자변형미생물을 생산공정이용시설에 이용하려면 대통령령으로 정하는 바에 따라 관계 중앙행정기관의 장의 승인을 받아야 한다.
② 제1항에 따라 승인을 받은 자는 승인받은 사항을 변경하려면 변경승인을 받아야 한다. 다만, 대통령령으로 정하는 경미한 사항을 변경하려면 변경신고를 하여야 한다.
③ 제1항에 따른 이용승인에 관하여는 제8조제4항ㆍ제5항 및 제18조를 준용한다. 이 경우 "수입"은 "이용"으로 본다.
④ 제1항 및 제2항에 따른 승인 및 신고의 기준, 절차 및 방법에 관하여 필요한 사항은 대통령령으로 정한다.
[본조신설 2012.12.11.]
제23조(허가취소 등) ① 관계 중앙행정기관의 장은 제22조제1항에 따라 연구시설의 설치ㆍ운영의 허가를 받거나 신고를 한 자가 다음 각 호의 어느 하나에 해당하는 경우에는 그 허가를 취소하거나 연구시설의 폐쇄를 명하거나 1년 이내의 기간을 정하여 그 시설의 운영을 정지하도록 명할 수 있다. 다만, 제1호에 해당하는 경우에는 허가를 취소하거나 연구시설의 폐쇄를 명하여야 한다. <개정 2012.12.11.>
1. 속임수나 그 밖의 부정한 방법으로 허가를 받거나 신고한 경우
2. 제22조제2항 또는 제3항에 따른 변경허가를 받지 아니하거나 변경신고를 하지 아니하고 허가 내용 또는 신고 내용을 변경한 경우
3. 제22조제6항에 따른 준수사항을 지키지 아니한 경우
4. 제22조제7항에 따른 허가 또는 신고의 기준에 미달한 경우
5. 제22조의2제1항에 따른 승인을 받지 아니하고 개발ㆍ실험을 한 경우
6. 제22조의2제2항에 따른 변경승인을 받지 아니하거나 변경신고를 하지 아니하고 허가 내용 또는 신고 내용을 변경한 경우
② 관계 중앙행정기관의 장은 제22조의3에 따라 생산공정이용시설 의 설치ㆍ운영 허가를 받거나 신고를 한 자가 다음 각 호의 어느 하나에 해당하는 경우에는 그 허가를 취소하거나 생산공정이용시설의 폐쇄를 명하거나 1년 이내의 기간을 정하여 그 시설의 운영을 정지하도록 명할 수 있다. 다만, 제1호 또는 제2호에 해당하는 경우에는 허가를 취소하거나 생산공정이용시설의 폐쇄를 명하여야 한다. <신설 2012.12.11.>
1. 속임수나 그 밖의 부정한 방법으로 허가를 받거나 신고한 경우
2. 제22조의3제2항 또는 제3항에 따른 변경허가를 받지 아니하거나 변경신고를 하지 아니하고 허가 내용 또는 신고 내용을 변경한 경우
3. 제22조의3제6항에 따른 허가기준 또는 신고기준에 미달한 경우
4. 제22조의4제1항에 따른 승인을 받지 아니하고 유전자변형미생물을 이용한 경우
5. 제22조의4제2항에 따른 변경승인을 받거나 변경신고를 하지 아니하고 승인 내용을 변경한 경우
6. 제22조의4제4항에 따른 승인기준 또는 신고기준에 미달한 경우
③ 관계 중앙행정기관의 장은 제22조의2제1항 및 제22조의4제1항에 따라 승인을 받은 유전자변형생물체의 개발ㆍ실험 또는 이용이 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 위해를 미치거나 미칠 우려가 있다는 사실이 밝혀진 경우에는 승인을 취소할 수 있다. <개정 2012.12.11.>
[전문개정 2007.12.21.]
제23조의2(폐기ㆍ반송 명령)① 관계 중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 유전자변형생물체의 소유자에게 대통령령으로 정하는 바에 따라 일정한 기간을 정하여 그 유전자변형생물체의 폐기ㆍ반송을 명할 수 있다. <개정 2012.12.11.>
1. 제8조, 제9조, 제12조, 제22조의2 또는 제22조의4에 따른 관계 중앙행정기관의 장의 승인 또는 변경승인을 받지 아니하거나 관계 중앙행정기관의 장에게 신고를 하지 아니한 유전자변형생물체
1의2. 속임수 또는 그 밖의 부정한 방법으로 제8조, 제9조, 제12조, 제22조의2 또는 제22조의4에 따른 관계 중앙행정기관의 장의 승인 또는 변경승인을 받았거나 신고한 경우
2. 제14조에 따라 수입이나 생산이 금지되거나 제한된 유전자변형생물체
3. 제17조 또는 제23조제3항에 따라 수입승인, 생산승인, 개발ㆍ실험 승인 또는 이용승인이 취소된 유전자변형생물체
② 관계 중앙행정기관의 장은 유전자변형생물체의 소유자가 제1항에 따른 폐기ㆍ반송의 명령을 따르지 아니한 경우에는 대통령령으로 정하는 바에 따라 그 유전자변형생물체 소유자의 부담으로 소속 공무원에게 직접 폐기ㆍ반송을 하게 할 수 있다. <개정 2012.12.11.>
③ 관계 중앙행정기관의 장은 수입된 유전자변형생물체에 대하여 제1항에 따른 유전자변형생물체의 폐기ㆍ반송을 명하였을 때에는 관세청장에게 그 내용을 통보하여야 한다. <개정 2012.12.11.>
[전문개정 2007.12.21.]
[제목개정 2012.12.11.]
[제19조에서 이동 <2012.12.11.>]
제24조(표시)① 유전자변형생물체를 개발ㆍ생산 또는 수입하는 자는 그 유전자변형생물체 또는 그 유전자변형생물체의 용기나 포장 또는 수입송장에 유전자변형생물체의 종류 등 대통령령으로 정하는 사항을 표시하여야 한다. <개정 2012.12.11.>
② 누구든지 제1항에 따른 표시를 거짓으로 하거나 이를 임의로 변경하거나 삭제하여서는 아니 된다.
③ 관계 중앙행정기관의 장은 제1항에 따른 표시의 방법, 그 밖에 필요한 사항을 정하여 고시한다. <개정 2012.12.11.>
[전문개정 2007.12.21.]
제25조(취급관리)① 유전자변형생물체의 수출입등을 하는 자는 유전자변형생물체를 취급하거나 관리할 때에 밀폐운송 등 대통령령으로 정하는 취급관리기준을 지켜야 한다.
② 제1항에 따른 취급관리의 방법과 그 밖에 필요한 사항은 관계 중앙행정기관의 장이 정하여 고시한다. <개정 2012.12.11.>
[전문개정 2007.12.21.]
제26조(관리ㆍ운영기록의 보존)유전자변형생물체의 수출입등을 하는 자와 연구시설을 설치ㆍ운영하는 자는 산업통상자원부령으로 정하는 바에 따라 유전자변형생물체의 수출입등 및 연구시설의 관리ㆍ운영에 관한 기록을 작성하여 보관하여야 한다. <개정 2008.2.29., 2013.3.23.>
[전문개정 2007.12.21.]
제26조의2(유전자변형생물체로 인한 환경영향 등의 조사)① 관계 중앙행정기관의 장은 국내에 유통되는 유전자변형생물체가 국민 건강과 환경에 미치는 영향을 파악하기 위하여 필요하다고 인정하면 연구시설ㆍ생산공정이용시설ㆍ사업장ㆍ보관장소 및 그 주변지역 등을 조사할 수 있다.
② 관계 중앙행정기관의 장은 제1항에 따른 조사를 위하여 필요할 때에는 다른 관계 중앙행정기관의 장에게 협조를 요청할 수 있다. 이 경우 요청을 받은 관계 중앙행정기관의 장은 특별한 사유가 없으면 협조하여야 한다.
③ 관계 중앙행정기관의 장은 제1항에 따른 조사결과를 대통령령으로 정하는 절차와 방법에 따라 공개한다.
④ 제1항에 따른 조사의 방법, 절차에 관하여 필요한 사항은 대통령령으로 정한다.
[본조신설 2012.12.11.]
제27조(위해방지 조치)① 관계 중앙행정기관의 장은 소관 유전자변형생물체로 인하여 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 중대한 부정적인 영향이 발생하거나 발생할 우려가 있다고 인정되면 대통령령으로 정하는 바에 따라 지체 없이 필요한 조치를 하여야 한다. <개정 2012.12.11.>
② 유전자변형생물체의 수출입등을 하는 자가 유전자변형생물체의 부정적인 영향을 알게 되었을 때에는 관계 중앙행정기관의 장 또는 국가책임기관의 장에게 지체 없이 그 내용을 통보하여야 한다. <개정 2012.12.11.>
[전문개정 2007.12.21.]
[제목개정 2012.12.11.]
<개정 2007.12.21.>
제28조(정보 보호)유전자변형생물체에 대한 정보를 취급하는 관계 중앙행정기관, 국가책임기관, 제7조의2제1항에 따른 위해성심사를 위하여 관계 중앙행정기관의 장이 대통령령으로 정하는 바에 따라 지정하는 위해성평가기관(이하 "위해성평가기관"이라 한다), 위해성심사대행기관 및 제32조에 따른 바이오안전성정보센터(이하 "정보취급기관"이라 한다)의 장은 유전자변형생물체의 정보가 도난ㆍ누출 또는 훼손되지 아니하도록 정보 보호에 필요한 조치를 마련하여야 한다. <개정 2012.12.11.>
[전문개정 2007.12.21.]
제29조(정보 이용 및 정보 제공의 제한)① 정보취급기관의 장은 대통령령으로 정하는 경우 외에는 유전자변형생물체의 정보를 상업적으로 이용하거나 다른 자에게 제공하여서는 아니 된다.
② 정보취급기관의 장은 유전자변형생물체의 정보를 다른 자에게 제공할 때에는 사용목적ㆍ사용방법 등에 관하여 제한을 하거나 정보 보호를 위하여 필요한 조치를 마련하도록 요청할 수 있다.
[전문개정 2007.12.21.]
제30조(정보취급기관 임직원의 의무) 정보취급기관의 임직원이거나 임직원이었던 자는 직무상 알게 된 정보를 누설하거나 타인이 이용하도록 제공하는 등 부당한 목적을 위하여 사용하여서는 아니 된다.
[전문개정 2007.12.21.]
제31조(바이오안전성위원회) ① 유전자변형생물체의 수출입등에 관한 다음 각 호의 사항을 심의하기 위하여 산업통상자원부장관 소속으로 바이오안전성위원회를 둔다. <개정 2012.12.11., 2013.3.23.>
1. 의정서의 이행에 관한 사항
2. 안전관리계획의 수립ㆍ시행
3. 삭제 <2012.12.11.>
4. 제18조 및 제22조의4제3항에 따른 재심사
5. 유전자변형생물체의 수출입등과 안전관리에 관련된 법령ㆍ고시 등에 관한 사항
6. 유전자변형생물체로 인한 피해 예방 및 대책에 관한 사항
7. 그 밖에 위원장 또는 국가책임기관의 장이 심의를 요청하는 사항
② 바이오안전성위원회는 위원장 1명을 포함한 15명 이상 20명 이하의 위원으로 구성한다. <개정 2012.12.11.>
③ 바이오안전성위원회의 위원장은 산업통상자원부장관이 되고, 위원은 다음 각 호의 자로 한다. <개정 2008.2.29., 2010.1.18., 2012.12.11., 2013.3.23., 2014.11.19.>
1. 기획재정부차관, 교육부차관, 미래창조과학부차관, 외교부차관, 농림축산식품부차관, 보건복지부차관, 환경부차관 및 해양수산부차관
2. 대통령령으로 정하는 자 중에서 위원장이 위촉하는 자
④ 바이오안전성위원회의 위원장은 제3항제2호에 따라 위원을 위촉하려면 미리 관계 중앙행정기관의 장과 협의하여야 한다. <개정 2012.12.11.>
⑤ 바이오안전성위원회를 효율적으로 운영하기 위하여 바이오안전성위원회에 분과위원회 및 실무위원회를 둘 수 있다. <개정 2012.12.11.>
⑥ 바이오안전성위원회에 간사 1명을 두되, 간사는 산업통상자원부 소속 공무원 중에서 위원장이 지명하는 자가 된다. <개정 2008.2.29., 2012.12.11., 2013.3.23.>
⑦ 바이오안전성위원회ㆍ분과위원회 및 실무위원회의 구성ㆍ기능ㆍ운영 등에 관한 사항은 대통령령으로 정한다. <개정 2012.12.11.>
[전문개정 2007.12.21.]
제32조(바이오안전성정보센터)① 국가책임기관의 장은 유전자변형생물체의 정보관리 및 정보교환에 관한 사항 등을 전문적으로 수행하는 바이오안전성정보센터(이하 "바이오안전성정보센터"라 한다)를 지정할 수 있다.
② 바이오안전성정보센터는 다음 각 호의 업무를 수행한다. <개정 2012.12.11.>
1. 유전자변형생물체의 안전성에 관한 정보 공개
2. 유전자변형생물체 및 관련 산업에 관한 정보의 수집ㆍ관리ㆍ제공ㆍ홍보 및 교류
3. 그 밖에 대통령령으로 정하는 업무
③ 국가책임기관의 장은 바이오안전성정보센터의 설립 및 운영에 필요한 경비를 예산의 범위에서 출연할 수 있다. <신설 2009.12.30.>
[전문개정 2007.12.21.]
제33조(자금 등의 지원) ① 정부는 유전자변형생물체에 대한 국민의 이해를 증진하고 소비자의 인식을 제고하거나 바이오안전성에 기반한 유전자변형생물체의 연구ㆍ개발 및 관련 산업의 건전한 발전을 위하여 다음 각 호의 사업을 할 수 있다.
1. 연구시설 및 생산공정이용시설의 안전에 관한 교육 및 사업
2. 유전자변형생물체 관련 기술 및 위해성평가기술의 개발
3. 유전자변형생물체의 검출 및 모니터링 지원
4. 유전자변형생물체 및 위해성심사 관련 교육 및 홍보
② 정부는 제1항 각 호와 관련된 사업을 실시하는 기관 및 단체에 필요한 자금 등을 출연하거나 지원할 수 있다.
[전문개정 2012.12.11.]
제34조(재원 확보)국가책임기관의 장은 유전자변형생물체의 수출입등과 관련하여 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 피해가 발생하는 경우에 대비하여 안전성 확보를 위한 재원 확보 방안을 마련하여야 한다.
[전문개정 2007.12.21.]
제35조(수수료) ① 다음 각 호의 어느 하나에 해당하는 자는 수수료를 내야 한다. <개정 2012.12.11.>
1. 제7조의2에 따라 위해성심사를 받으려는 자
2. 제8조제1항 및 제2항에 따라 수입승인을 받으려는 자
3. 제9조제1항 단서에 따라 수입승인을 받으려는 자
4. 제12조제1항에 따라 생산승인을 받으려는 자
5. 제22조제1항에 따라 연구시설 설치ㆍ운영의 허가를 받으려는 자
6. 제22조의3제1항에 따라 생산공정이용시설의 설치ㆍ운영 허가를 받으려는 자
7. 제22조의4제1항에 따라 이용승인을 받으려는 자
② 제1항에 따른 수수료의 금액, 납부방법 및 납부기간 등에 관한 사항은 대통령령으로 정한다.
[전문개정 2007.12.21.]
제36조(보고 및 검사)① 관계 중앙행정기관의 장 또는 국가책임기관의 장은 다음 각 호의 어느 하나에 해당하는 자에 대하여 소속 공무원으로 하여금 해당 사무소ㆍ연구시설ㆍ생산공정이용시설ㆍ사업장ㆍ보관장소 등에 출입하여 관계 서류나 시설ㆍ장비 및 보관상태 등을 검사하게 할 수 있다. 다만, 관계 중앙행정기관의 장 또는 국가책임기관의 장은 유전자변형생물체의 안전관리를 위하여 제1호 및 제3호부터 제7호까지의 어느 하나에 해당하는 자에게 보고를 하게 하거나 자료 또는 시료의 제출을 요구할 수 있다. <개정 2012.12.11.>
1. 제8조제1항부터 제3항까지, 제9조제1항부터 제3항까지 또는 제12조제1항ㆍ제2항에 따라 승인을 받거나 신고를 한 자
2. 삭제 <2012.12.11.>
3. 위해성평가기관
4. 위해성심사대행기관
5. 제22조에 따라 연구시설의 설치ㆍ운영허가를 받거나 신고를 한 자
6. 제22조의3에 따라 생산공정이용시설의 설치ㆍ운영 허가를 받거나 신고를 한 자
7. 제25조에 따라 취급하거나 관리하는 자
8. 승인을 받지 아니하거나 신고를 하지 아니한 유전자변형생물체로 판단되는 물품의 수출입등을 하거나, 허가를 받지 아니하거나 신고를 하지 아니하고 연구시설, 생산공정이용시설을 운영하고 있다고 의심되는 자
② 제1항에 따라 출입ㆍ검사를 하는 공무원은 그 권한을 표시하는 증표를 지니고 이를 관계인에게 내보여야 한다. <개정 2012.12.11.>
③ 제1항에 따른 검사의 대상, 기준 및 절차에 관하여 필요한 사항은 대통령령으로 정한다. <신설 2012.12.11.>
[전문개정 2007.12.21.]
제37조(청문) 관계 중앙행정기관의 장은 다음 각 호의 어느 하나에 해당하는 처분을 하려면 청문을 하여야 한다. <개정 2012.12.11.>
1. 제17조에 따라 수입승인이나 생산승인을 취소하는 경우
2. 제23조에 따라 연구시설 또는 생산공정이용시설의 설치ㆍ운영 허가를 취소하거나 연구시설 또는 생산공정이용시설의 폐쇄 또는 운영 정지를 명하는 경우
[전문개정 2007.12.21.]
제37조의2(권한의 위임ㆍ위탁) ① 이 법에 따른 관계 중앙행정기관의 장의 권한은 그 일부를 대통령령으로 정하는 바에 따라 소속 기관 또는 다른 행정기관의 장에게 위임하거나 위탁할 수 있다.
② 이 법에 따른 관계 중앙행정기관의 장의 업무는 그 일부를 대통령령으로 정하는 바에 따라 관계 전문 기관 또는 단체에 위탁할 수 있다.
[본조신설 2012.12.11.]
제38조(벌칙 적용 시의 공무원 의제) 다음 각 호의 기관의 임직원 및 바이오안전성위원회의 위원 중 공무원이 아닌 위원은 「형법」 제129조부터 제132조까지의 규정을 적용할 때에는 공무원으로 본다. <개정 2012.12.11.>
1. 위해성평가기관
2. 위해성심사대행기관
3. 바이오안전성정보센터
4. 제37조의2에 따라 관계 중앙행정기관의 장이 위탁한 업무를 수행하는 기관 또는 단체
[전문개정 2007.12.21.]
제39조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 5년 이하의 징역 또는 7천만원 이하의 벌금에 처한다. <개정 2012.12.11.>
1. 제14조를 위반하여 수입이나 생산이 금지되거나 제한된 유전자변형생물체(같은 조 제1항제2호의 생물체를 포함한다)를 수입하거나 생산한 자
2. 제17조제1항제1호에 따라 승인이 취소된 유전자변형생물체를 수입하거나 생산한 자
3. 제23조의2제1항에 따른 폐기ㆍ반송의 명령을 위반하여 유전자변형생물체를 국내에 유통하게 한 자
[전문개정 2007.12.21.]
제40조(벌칙)다음 각 호의 어느 하나에 해당하는 자는 3년 이하의 징역 또는 5천만원 이하의 벌금에 처한다. <개정 2012.12.11.>
1. 제8조제1항ㆍ제2항 및 제3항 본문, 제9조제1항 단서 및 제3항, 제12조제1항 또는 제2항 본문에 따른 승인 또는 변경승인을 받지 아니하고 유전자변형생물체를 수입하거나 생산한 자
2. 제17조제1항제2호부터 제10호까지의 규정에 따라 승인이 취소된 유전자변형생물체를 수입하거나 생산한 자
3. 제22조제1항에 따른 허가를 받지 아니하거나 같은 조 제2항 본문에 따른 변경허가를 받지 아니하고 연구시설을 설치ㆍ운영한 자
4. 제22조의2제1항 또는 제2항 본문에 따른 승인 또는 변경승인을 받지 아니하고 개발하거나 실험한 자
5. 제22조의3제1항 또는 제2항 본문에 따른 허가 또는 변경허가를 받지 아니하고 생산공정이용시설을 설치ㆍ운영한 자
6. 제22조의4제1항 또는 제2항 본문에 따른 승인 또는 변경승인을 받지 아니하고 유전자변형생물체를 이용한 자
[전문개정 2007.12.21.]
제41조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 2년 이하의 징역 또는 3천만원 이하의 벌금에 처한다. <개정 2012.12.11.>
1. 제9조제1항 본문에 따른 신고를 하지 아니하고 유전자변형생물체를 수입한 자
2. 제20조에 따른 통보를 하지 아니하고 유전자변형생물체를 수출한 자
3. 제21조에 따른 신고를 하지 아니하고 유전자변형생물체를 국내를 경유하여 다른 국가로 수출하려는 자
4. 제22조제1항에 따른 신고를 하지 아니하고 연구시설을 설치ㆍ운영한 자
5. 제23조에 따른 연구시설 또는 생산공정이용시설의 폐쇄명령 또는 운영정지명령을 위반한 자
6. 제23조의2제1항에 따른 폐기ㆍ반송의 명령을 이행하지 아니한 자
7. 제30조를 위반하여 직무상 알게 된 정보를 누설하거나 타인이 이용하도록 제공한 자
[전문개정 2007.12.21.]
제42조(벌칙) 다음 각 호의 어느 하나에 해당하는 자는 1년 이하의 징역 또는 2천만원 이하의 벌금에 처한다.
1. 제24조제1항 또는 제2항을 위반하여 유전자변형생물체의 종류 등을 표시하지 아니하거나 거짓으로 표시한 자 또는 표시를 임의로 변경하거나 삭제한 자
2. 제25조에 따른 취급관리기준을 지키지 아니한 자
[전문개정 2007.12.21.]
제43조(양벌규정) 법인의 대표자나 법인 또는 개인의 대리인, 사용인, 그 밖의 종업원이 그 법인 또는 개인의 업무에 관하여 제39조부터 제42조까지의 어느 하나에 해당하는 위반행위를 하면 그 행위자를 벌하는 외에 그 법인 또는 개인에게도 해당 조문의 벌금형을 과(科)한다. 다만, 법인 또는 개인이 그 위반행위를 방지하기 위하여 해당 업무에 관하여 상당한 주의와 감독을 게을리하지 아니한 경우에는 그러하지 아니하다.
[전문개정 2008.12.26.]
제44조(과태료)① 다음 각 호의 어느 하나에 해당하는 자에게는 1천만원 이하의 과태료를 부과한다. <개정 2012.12.11.>
1. 제8조제3항 단서 또는 제9조제2항ㆍ제3항에 따른 변경신고를 하지 아니한 자
2. 제10조제4항에 따른 신고를 하지 아니하거나 관계 중앙행정기관의 장의 명령을 이행하지 아니한 자
3. 제11조제1항에 따라 지정되지 아니한 수입항구ㆍ공항 등의 장소로 유전자변형생물체를 수입한 자
4. 제12조제2항 단서에 따른 변경신고를 하지 아니한 자
5. 삭제 <2012.12.11.>
6. 제22조제2항 단서 또는 제3항에 따른 변경신고를 하지 아니한 자
7. 제22조제4항에 따른 신고를 하지 아니한 자
8. 제22조의2제2항 단서에 따른 변경신고를 하지 아니한 자
9. 제22조의3제2항 단서 또는 제3항에 따른 변경신고를 하지 아니한 자
10. 제22조의3제4항에 따른 신고를 하지 아니한 자
11. 제22조의4제2항 단서에 따른 변경신고를 하지 아니한 자
12. 제26조에 따른 관리ㆍ운영기록을 작성ㆍ보관하지 아니한 자
13. 제36조제1항 또는 제2항에 따른 보고나 자료 또는 시료의 제출을 거부하거나 출입ㆍ검사를 거부ㆍ방해 또는 기피한 자
② 제1항에 따른 과태료는 대통령령으로 정하는 바에 따라 관계 중앙행정기관 또는 국가책임기관의 장이 부과ㆍ징수한다. <개정 2012.12.11.>
③ 삭제 <2009.2.6.>
④ 삭제 <2009.2.6.>
⑤ 삭제 <2009.2.6.>
[전문개정 2007.12.21.]
부칙 <제12844호, 2014.11.19.> (정부조직법)
제1조(시행일) 이 법은 공포한 날부터 시행한다. 다만, 부칙 제6조에 따라 개정되는 법률 중 이 법 시행 전에 공포되었으나 시행일이 도래하지 아니한 법률을 개정한 부분은 각각 해당 법률의 시행일부터 시행한다.
제2조부터 제5조까지 생략
제6조(다른 법률의 개정) ①부터 <184>까지 생략
<185> 유전자변형생물체의 국가간 이동 등에 관한 법률 일부를 다음과 같이 개정한다.
제31조제3항제1호 중 "미래창조과학부차관, 교육부차관"을 "교육부차관, 미래창조과학부차관"으로 한다.
<186>부터 <258>까지 생략
제7조생략

제약산업 육성 및 지원에 관한 특별법
[시행 2013.3.23.] [법률 제11690호, 2013.3.23., 타법개정]
제1조(목적)이 법은 제약산업의 체계적인 육성ㆍ지원과 혁신성 증진 및 국제협력 강화를 통하여 제약산업의 발전기반을 마련하고 외국 제약기업의 국내투자유치환경을 조성하여 제약산업이 국제적인 경쟁력을 갖추도록 함으로써 국민의 건강증진과 국가경제의 발전에 이바지하는 것을 목적으로 한다.
제2조(정의)이 법에서 사용하는 용어의 정의는 다음과 같다.
1. "제약산업"이란 「약사법」 제2조제4호에 따른 의약품을 연구개발ㆍ제조ㆍ가공ㆍ보관ㆍ유통하는 것과 관련된 산업을 말한다.
2. "제약기업"이란 국내에서 제약산업과 관련된 경제활동을 하는 다음 각 목의 어느 하나에 해당하는 기업을 말한다.
가. 「약사법」 제31조에 따라 의약품 제조업 허가 또는 제조판매품목허가를 받거나 제조판매품목신고를 한 기업
나. 외국계 제약기업으로서 「약사법」 제42조에 따라 의약품 수입품목허가를 받거나 수입품목신고를 한 기업
다. 「벤처기업육성에 관한 특별조치법」 제2조의2에 따른 벤처기업 중 신약 연구개발을 전문으로 하는 기업
3. "혁신형 제약기업"이란 다음 각 목의 어느 하나에 해당하는 기업으로서 제7조에 따라 보건복지부장관으로부터 인증을 받은 제약기업을 말한다.
가. 신약 연구개발 등에 대통령령으로 정하는 규모 이상의 투자를 하는 제약기업
나. 국내에서 대통령령으로 정하는 규모 이상의 신약 연구개발 투자실적이 있거나 신약 연구개발을 수행하고 있는 외국계 제약기업
제3조(제약기업의 책무)① 제약기업은 제약산업의 체계적인 발전과 혁신성 강화 등을 통하여 제약산업 발전기반 조성, 국제경쟁력 강화, 국민건강 증진에 기여하여야 한다.
② 제약기업은 의약품 제조 및 품질관리기준을 준수하는 등 의약품 품질향상을 위한 제도개선에 적극 부응하여야 한다.
③ 제약기업은 의약품과 관련한 부정ㆍ부패 근절책 마련 등 제약산업의 투명성 강화를 위한 공동의 실천을 하여야 한다.
제4조(제약산업육성ㆍ지원종합계획)① 보건복지부장관은 제약산업 발전기반 조성 및 국제경쟁력 강화를 촉진하기 위하여 5년마다 제약산업육성ㆍ지원종합계획(이하 "종합계획"이라 한다)을 수립하여야 한다.
② 종합계획에는 다음 각 호의 사항이 포함되어야 한다.
1. 제약산업의 육성을 위한 중장기적 목표
2. 제약산업 육성에 필요한 투자재원의 조달 및 활용계획
3. 제약산업 육성에 필요한 인력자원의 개발 및 효율적 활용계획
4. 제약산업의 국제협력 및 해외시장진출 지원계획
5. 신약 등 연구개발 및 기술거래 지원계획
6. 혁신형 제약기업 지원계획
7. 외국계 제약기업의 신약 연구개발과 관련된 국내 투자유치를 위한 지원계획
8. 그 밖에 제약산업 육성에 관하여 필요한 사항
③ 보건복지부장관은 종합계획을 수립하는 경우 관계 중앙행정기관의 장과 협의하여야 한다.
④ 종합계획은 제6조에 따른 제약산업육성ㆍ지원위원회의 심의를 거쳐 확정한다. 종합계획을 변경하려는 경우에도 또한 같다.
⑤ 보건복지부장관은 확정ㆍ변경된 종합계획을 관계 중앙행정기관의 장에게 통보하여야 한다.
⑥ 보건복지부장관은 종합계획의 수립을 위하여 필요하다고 인정하는 경우에는 관계 기관의 장에게 종합계획의 수립에 필요한 자료의 제출을 요구할 수 있다.
제5조(제약산업육성ㆍ지원시행계획)① 보건복지부장관은 종합계획을 시행하기 위하여 관계 중앙행정기관의 장과 협의를 거쳐 매년 제약산업육성ㆍ지원시행계획(이하 "시행계획"이라 한다)을 수립ㆍ시행하여야 한다. 이 경우 보건복지부장관은 수립된 시행계획을 관계 중앙행정기관의 장에게 통보하여야 한다.
② 보건복지부장관과 관계 중앙행정기관의 장은 시행계획 중 소관 사항을 시행하고 이에 필요한 재원을 확보하기 위하여 노력하여야 한다.
③ 그 밖에 시행계획의 수립 및 시행 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제6조(제약산업육성ㆍ지원위원회)① 다음 각 호의 사항을 심의하기 위하여 보건복지부장관 소속으로 제약산업육성ㆍ지원위원회(이하 "위원회"라 한다)를 둔다.
1. 종합계획 및 시행계획의 수립ㆍ시행에 관한 사항
2. 혁신형 제약기업 인증 및 인증 취소에 관한 사항
3. 그 밖에 제약산업 육성 및 지원 등에 관하여 대통령령으로 정하는 사항
② 위원회는 위원장 1명을 포함한 15명 이내의 위원으로 구성하되, 위원장은 보건복지부장관으로 하고 위원은 기획재정부, 미래창조과학부, 산업통상자원부 등 관계 중앙행정기관의 장이 위촉하는 차관급 공무원과 제약산업 육성에 관하여 전문성과 경험이 풍부한 산업계ㆍ학계ㆍ연구기관 등에 종사하는 자 중에서 보건복지부장관이 위촉하는 자로 한다. <개정 2013.3.23.>
③ 위원회의 업무를 효율적으로 수행하기 위하여 위원회에 제약산업육성ㆍ지원실무위원회(이하 "실무위원회"라 한다)를 둘 수 있다. 이 경우 실무위원회의 위원장은 보건복지부에서 보건산업정책을 담당하는 자로 한다.
④ 제1항부터 제3항까지에서 규정한 사항 외에 위원회 및 실무위원회의 구성 및 운영 등에 관하여 필요한 사항은 대통령령으로 정한다.
제7조(혁신형 제약기업의 인증)① 혁신형 제약기업으로 인증받고자 하는 제약기업은 보건복지부령으로 정하는 바에 따라 혁신형 제약기업 인증을 보건복지부장관에게 신청하여야 한다.
② 보건복지부장관은 제1항에 따른 신청이 있는 경우 위원회의 심의를 거쳐 혁신형 제약기업으로 인증할 수 있다. 이 경우 인증에 관하여 필요한 기준은 대통령령으로 정한다.
③ 인증의 방법, 절차 및 고시 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제8조(인증의 유효기간)① 제7조제2항에 따른 인증의 유효기간은 인증을 받은 날부터 3년으로 한다.
② 최초 인증 이후 3년마다 재평가를 통하여 인증을 연장할 수 있다.
③ 제2항에 따른 인증의 연장신청 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제9조(인증의 취소)① 보건복지부장관은 제7조제2항에 따라 혁신형 제약기업으로 인증을 받은 기업이 다음 각 호의 어느 하나에 해당하는 경우에는 보건복지부령으로 정하는 바에 따라 그 인증을 취소할 수 있다. 다만, 제1호의 경우에는 그 인증을 취소하여야 한다.
1. 거짓이나 그 밖의 부정한 방법으로 인증을 받은 때
2. 인증기준에 적합하지 아니하게 된 때
② 보건복지부장관은 제1항제1호에 따라 인증이 취소된 제약기업에 대하여 취소된 날부터 3년이 지나지 아니한 경우에는 인증을 하여서는 아니 된다.
③ 정부는 제1항에 따라 인증이 취소된 제약기업에 대하여 제13조부터 제17조까지의 규정에 따라 제공한 각종 우대조치를 취소할 수 있다.
제10조(자료의 제공)① 제7조에 따라 혁신형 제약기업 인증을 신청한 기업이나 혁신형 제약기업은 보건복지부장관이 인증 또는 인증취소 등 그 업무에 필요한 자료를 요구하는 경우 이에 응하여야 한다.
② 제1항에 따른 자료 요구의 범위, 절차 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제11조(청문)보건복지부장관은 제9조제1항에 따라 인증을 취소하고자 하는 경우에는 청문을 실시하여야 한다.
제12조(혁신형 제약기업의 유형별 구분)① 혁신형 제약기업의 유형별 구분은 제2조제3호에서 정의된 범위에서 대통령령으로 정한다.
② 정부는 제1항에 따른 혁신형 제약기업의 유형별로 보건복지부령으로 정하는 바에 따라 그 지원 방법ㆍ규모 등을 달리 할 수 있다.
제13조(혁신형 제약기업 지원)정부는 제약산업 육성을 위하여 혁신형 제약기업의 신약 연구개발, 연구ㆍ생산 시설 개선 등에 필요한 지원을 할 수 있다.
제14조(국가연구개발사업 등 우대)① 국가 또는 지방자치단체는 혁신형 제약기업의 신약 연구개발에 대하여 국가연구개발사업 등에 우선 참여하게 할 수 있다.
② 제1항에 따른 우선 참여의 방법 및 절차 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제15조(조세에 관한 특례)① 국가 및 지방자치단체는 제약산업을 지원ㆍ육성하기 위하여 필요한 경우 혁신형 제약기업에 대하여 「조세특례제한법」, 「지방세특례제한법」 등의 조세 관계 법률에서 정하는 바에 따라 법인세ㆍ소득세ㆍ취득세ㆍ등록면허세 및 재산세 등의 조세를 감면할 수 있다.
② 국가 및 지방자치단체는 혁신형 제약기업이 자체 개발한 기술을 이전하고 대금을 지급받는 경우에는 「법인세법」 및 「지방세특례제한법」에서 정하는 바에 따라 법인세 및 주민세를 감면할 수 있다.
③ 국가 및 지방자치단체는 혁신형 제약기업이 당사자로 참여하는 합병, 분할 또는 분할합병이 이루어지는 경우에는 「조세특례제한법」 등 조세 관계 법률에서 정하는 바에 따라 부동산 등의 등기에 따른 등록세, 합병으로 소멸되는 제약기업의 청산소득에 대한 법인세, 합병으로 소멸되는 제약기업주주의 의제배당에 대한 소득세 또는 법인세 등의 조세를 감면할 수 있다.
제16조(연구시설 건축에 관한 특례)① 혁신형 제약기업은 연구시설(시제품 생산시설 등 대통령령으로 정하는 부속용도로 인정되는 시설을 포함한다)을 「국토의 계획 및 이용에 관한 법률」 제36조에 따른 지역(보전녹지 및 생산녹지 등 대통령령으로 정하는 지역은 제외한다) 중 보건복지부장관이 고시하는 지역에 건축할 수 있다.
② 제1항에 따른 고시의 절차 등에 필요한 사항은 대통령령으로 정한다.
[법률 제10519호(2011.3.30.) 부칙 제2조의 규정에 의하여 이 조는 2022년 3월 30까지 유효함]
제17조(각종 부담금의 면제)혁신형 제약기업의 연구시설에 대하여는 다음 각 호의 부담금을 면제할 수 있다.
1. 「개발이익환수에 관한 법률」 제5조에 따른 개발부담금
2. 「도시교통정비 촉진법」 제36조에 따른 교통유발부담금
3. 「산지관리법」 제19조에 따른 대체산림자원조성비
4. 「초지법」 제23조에 따른 대체초지조성비
[법률 제10519호(2011.3.30.) 부칙 제2조의 규정에 의하여 이 조는 2022년 3월 30까지 유효함]
제18조(연구개발투자의 확대)국가 및 지방자치단체는 제약기업의 연구개발에 관한 투자 확대와 외국계 제약기업의 신약 연구개발과 관련된 국내 투자유치를 위하여 적극 노력하여야 한다.
제19조(연구개발정보의 수집과 보급)① 보건복지부장관은 제약산업 연구개발을 효율적으로 촉진하기 위하여 국내외 연구개발 동향, 시장 동향 등 국내외 신약 연구개발에 관한 정보를 수집ㆍ조사하여 이를 체계적ㆍ종합적으로 관리ㆍ보급하여야 한다.
② 보건복지부장관은 제1항의 업무를 추진하기 위하여 신약연구개발 관련 정보를 전문적으로 관리하는 기관을 지정할 수 있다.
③ 제2항에 따른 신약 연구개발 관련 정보를 전문적으로 관리하는 기관의 지정 요건ㆍ절차 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제20조(연구개발 생산성 향상에 대한 포상) ① 보건복지부장관은 우수한 의약품 개발 보급으로 국민보건 향상과 제약산업 발전에 기여한 제약기업을 선정하여 포상하고 필요한 지원을 할 수 있다.
② 제1항에 따른 포상 및 지원 등에 관하여 필요한 사항은 보건복지부령으로 정한다.
제21조(제약기업의 국제협력활동 지원)보건복지부장관은 제약기업 또는 관련 단체가 외국의 기관ㆍ단체 등과 산업협력활동을 추진하는 때에는 관련 정보의 수집ㆍ제공 등 필요한 지원을 할 수 있다.
제22조(권한의 위탁)보건복지부장관은 이 법에 따른 업무의 일부를 대통령령으로 정하는 바에 따라 관계 전문기관에 위탁할 수 있다.
<제11690호, 2013.3.23.> (정부조직법)
제1조(시행일) ① 이 법은 공포한 날부터 시행한다.
② 생략
제2조부터 제5조까지 생략
제6조(다른 법률의 개정) ①부터 <484>까지 생략
<485> 제약산업 육성 및 지원에 관한 특별법 일부를 다음과 같이 개정한다.
제6조제2항 중 "교육과학기술부, 지식경제부"를 "미래창조과학부, 산업통상자원부"로 한다.
<486>부터 <710>까지 생략
제7조 생략

첨단의료복합단지 지정 및 지원에 관한 특별법
[시행 2015.10.25.] [법률 제13448호, 2015.7.24., 타법개정]
제1조(목적)이 법은 첨단의료복합단지의 지정 및 지원을 통하여 기업, 대학, 연구기관, 의료기관 등의 상호 협력에 의한 의료연구개발의 활성화 및 연구 성과의 상품화를 촉진함으로써 첨단의료복합단지를 세계적인 의료연구개발의 중심지로 육성하고 국내 의료산업의 발전에 이바지함을 목적으로 한다.
제2조(정의)이 법에서 사용하는 용어의 뜻은 다음과 같다. <개정 2010.1.18.>
1. "첨단의료복합단지"란 의료연구개발의 활성화와 연구 성과의 상품화를 촉진하기 위하여 제6조에 따라 보건복지부장관이 지정ㆍ고시하는 단지를 말한다.
2. "의약품"이란 「약사법」에 따른 의약품을 말한다.
3. "의료기기"란 「의료기기법」에 따른 의료기기를 말한다.
4. "보건의료기술"이란 「보건의료기술 진흥법」 제2조제1항제1호 및 제3호에 따른 보건의료기술을 말한다.
5. "의료연구개발"이란 의약품, 의료기기 또는 보건의료기술을 연구ㆍ개발하거나 연구ㆍ개발을 위하여 임상시험을 하는 것 또는 임상시험용으로 사용하는 의약품이나 의료기기를 생산하는 것을 말한다.
6. "의료연구개발기관"이란 다음 각 목의 어느 하나에 해당하는 기관으로서 의료연구개발의 연구인력 및 시설 등이 대통령령으로 정하는 기준에 맞는 기관을 말한다.
가. 의료연구개발을 목적으로 설립된 기관
나. 의료연구개발업무를 담당하는 부서를 설치ㆍ운영하는 다음의 어느 하나에 해당하는 기관
(1) 의료기관
(2) 「고등교육법」 제2조에 따른 대학
(3) 연구기관
(4) 정부출연기관 등
7. "의료연구개발지원기관"이란 제11조에 따라 의료연구개발지원업무를 할 목적으로 설립된 기관을 말한다.
8. "입주의료연구개발기관"이란 제31조에 따른 입주승인을 받아 첨단의료복합단지에 입주한 의료연구개발기관을 말한다.
제3조(다른 법령과의 관계)① 이 법 중 규제를 완화하기 위하여 특례를 정한 제4장(제20조부터 제26조까지)은 다른 법령에 우선하여 적용한다. 다만, 다른 법령에서 이 법의 규제 특례보다 완화되는 규정이 있는 경우에는 그 법령으로 정하는 바에 따른다.
② 제21조제2항, 제23조제2항 및 제24조제2항에 따라 규제 특례를 적용받는 자가 이 법에서 정한 사항을 따르지 아니한 경우에는 각 개별 법령을 적용한다.
제4조(첨단의료복합단지 조성계획의 수립)① 보건복지부장관은 관계 중앙행정기관의 장과 첨단의료복합단지가 설치될 지역을 관할하는 광역지방자치단체의 장의 의견을 들어 첨단의료복합단지 조성계획(이하 "조성계획"이라 한다)을 수립하고 제27조에 따른 첨단의료복합단지위원회(이하 "첨단의료복합단지위원회"라 한다)의 심의ㆍ의결을 거쳐 확정한다. 조성계획을 변경하려는 경우에도 또한 같다. <개정 2008.12.31., 2010.1.18.>
② 보건복지부장관은 국토균형발전을 고려하여 조성계획을 수립하여야 한다. <개정 2008.12.31., 2010.1.18.>
③ 조성계획에는 다음 각 호의 사항이 포함되어야 한다.
1. 첨단의료복합단지의 위치 및 면적 등 입지 선정에 관한 사항
2. 첨단의료복합단지의 조성 목적
3. 첨단의료복합단지의 시설 등의 배치계획
4. 의료연구개발지원기관의 설립 및 의료연구개발기관의 유치계획
5. 재원조달계획
6. 사업추진 기간 및 연도별 사업추진계획
7. 그 밖에 첨단의료복합단지의 개발 및 지원에 필요한 사항으로서 대통령령으로 정하는 사항
제5조(첨단의료복합단지의 입지 선정 등)① 보건복지부장관은 첨단의료복합단지의 입지를 선정하려면 다음 각 호의 어느 하나에 해당하는 구역(이하 "단지등"이라 한다)의 전부 또는 일부 지역 중에서 입지 선정 요건이 우수한 지역을 선정하여야 한다. <개정 2008.12.31., 2009.1.30., 2010.1.18., 2011.8.4., 2012.1.26.>
1. 「산업입지 및 개발에 관한 법률」 제2조제8호에 따른 산업단지
2. 「경제자유구역의 지정 및 운영에 관한 특별법」 제2조제1호에 따른 경제자유구역
3. 「연구개발특구의 육성에 관한 특별법」 제2조제1호에 따른 연구개발특구
4. 「도시개발법」 제2조제1항제1호에 따른 도시개발구역
5. 「산업기술단지 지원에 관한 특례법」 제2조에 따른 산업기술단지
6. 「공공기관 지방이전에 따른 혁신도시 건설 및 지원에 관한 특별법」 제2조제4호에 따른 혁신도시개발예정지구
7. 「기업도시개발 특별법」 제2조제2호에 따른 기업도시개발구역
8. 그 밖에 개별 법률에서 지정되어 개발되는 지역으로서 첨단의료복합단지로의 발전가능성 등을 고려하여 대통령령으로 정하는 지역
② 보건복지부장관이 제1항에 따라 첨단의료복합단지의 입지를 선정하려는 경우의 입지 선정 요건은 다음 각 호와 같다. <개정 2008.12.31., 2010.1.18.>
1. 국내외 우수 연구인력과 의료연구개발기관의 유치 및 정주(定住) 가능성
2. 우수 의료연구개발기관의 집적ㆍ연계 정도
3. 우수 의료기관의 집적 정도
4. 첨단의료복합단지의 부지 확보의 용이성
5. 재정ㆍ세제 등 지방자치단체의 지원 내용
6. 그 밖에 국토균형발전 등 첨단의료복합단지를 조성ㆍ육성하기 위하여 필요한 사항으로서 대통령령으로 정하는 사항
③ 제2항에 따른 우수 연구인력, 우수 의료연구개발기관 및 우수 의료기관의 기준, 유치 및 정주 가능성, 우수 의료연구개발기관의 집적ㆍ연계 정도 등에 관한 세부적인 기준은 대통령령으로 정한다.
④ 보건복지부장관은 제1항에도 불구하고 단지등 외의 지역이 단지등보다 제2항 각 호에 따른 입지 선정 요건이 우수하다고 인정되면 첨단의료복합단지위원회의 심의를 거쳐 해당 지역을 첨단의료복합단지의 입지로 선정할 수 있다. <개정 2008.12.31., 2010.1.18.>
제6조(첨단의료복합단지의 지정)① 보건복지부장관은 제5조에 따라 첨단의료복합단지의 입지가 선정되면 해당 지역을 대통령령으로 정하는 바에 따라 첨단의료복합단지로 지정ㆍ고시하고, 지체 없이 이를 관계 중앙행정기관 및 관할 광역지방자치단체의 장에게 통지하여야 한다. <개정 2010.1.18.>
② 제1항에 따른 통지를 받은 광역지방자치단체의 장은 그 내용을 14일 이상 일반인이 열람할 수 있도록 하여야 한다.
제7조(첨단의료복합단지의 개발)① 제5조제1항에 따른 단지등이 첨단의료복합단지로 지정ㆍ고시된 경우 첨단의료복합단지의 개발은 단지등의 근거가 되는 법률에서 정한 절차에 따른다.
② 제5조제4항에 따라 선정된 입지에 제6조제1항에 따라 첨단의료복합단지가 지정ㆍ고시된 경우에 국토교통부장관은 「산업입지 및 개발에 관한 법률」에 따라 국가산업단지로 지정하여 개발하여야 한다. 이 경우 국가산업단지의 지정, 지정 해제 및 개발에 관하여는 같은 법에 정하여진 절차에 따르되, 그 절차 중 산업입지정책심의회의 심의는 이를 거친 것으로 본다. <개정 2013.3.23.>
③ 국토교통부장관은 제2항에 따라 첨단의료복합단지를 국가산업단지로 지정하는 경우 「산업입지 및 개발에 관한 법률」제8조의2에도 불구하고 산업단지의 지정 면적 및 미분양 비율의 기준을 충족하지 아니한 경우에도 국가산업단지로 지정할 수 있다. <개정 2013.3.23.>
제8조(첨단의료복합단지의 지정 해제)① 보건복지부장관은 첨단의료복합단지의 지정 목적을 달성하였거나 지정 목적을 달성하는 것이 불가능하다고 인정되면 첨단의료복합단지의 지정을 해제할 수 있다. <개정 2010.1.18.>
② 제1항에 따라 첨단의료복합단지의 지정을 해제하는 경우의 절차에 관하여는 제6조를 준용한다.
제9조(기반시설에 대한 우선 지원)국가와 지방자치단체는 첨단의료복합단지의 원활한 조성을 위하여 도로와 용수 등 기반시설의 설치를 우선적으로 지원하여야 한다.
제10조(첨단의료복합단지 종합계획의 수립)① 미래창조과학부장관, 산업통상자원부장관, 식품의약품안전처장, 관할 광역지방자치단체의 장(이하 이 조에서 "운영기관의 장"이라 한다)은 첨단의료복합단지 육성을 위한 소관 사항의 추진방안을 대통령령으로 정하는 바에 따라 3년마다 보건복지부장관에게 제출하여야 한다. <개정 2008.12.31., 2010.1.18., 2013.3.23.>
② 보건복지부장관은 제1항에 따라 제출받은 추진방안을 종합하여 첨단의료복합단지 육성에 관한 종합계획(이하 "종합계획"이라 한다)을 수립하되, 첨단의료복합단지 관련 업무의 원활한 수행을 위하여 필요한 경우에는 해당 운영기관의 장과 협의하여 제1항에 따라 제출된 추진방안 중 추진일정 및 중복ㆍ상충되는 사항 등을 조정할 수 있다. <개정 2008.12.31., 2010.1.18.>
③ 보건복지부장관은 제2항에 따라 수립된 종합계획을 제27조에 따른 첨단의료복합단지위원회의 심의ㆍ의결을 거쳐 확정한 후 운영기관의 장에게 통보하여야 한다. 종합계획을 변경하려는 경우에도 또한 같다. <신설 2008.12.31., 2010.1.18.>
④ 종합계획에는 다음 각 호의 사항이 포함되어야 한다. <개정 2008.12.31.>
1. 첨단의료복합단지 육성의 기본 방향과 목표 설정에 관한 사항
2. 제11조에 따른 의료연구개발지원기관의 운영 및 지원에 관한 사항
3. 입주의료연구개발기관에 대한 지원에 관한 사항
4. 입주의료연구개발기관 간의 상호 교류와 협력 활성화에 관한 사항
5. 의료연구개발지원기관 및 입주의료연구개발기관과 국내외 의료연구개발기관과의 협력 활성화에 관한 사항
6. 국내외 우수 연구인력ㆍ의료연구개발기관의 유치 및 정주를 위한 여건 조성에 관한 사항
7. 첨단의료복합단지 운영 성과의 활용 및 전파에 관한 사항
8. 그 밖에 첨단의료복합단지를 육성하기 위하여 필요한 사항으로서 대통령령으로 정하는 사항
⑤ 운영기관의 장은 제3항에 따라 통보받은 종합계획을 기초로 매년 세부시행계획을 수립하여 추진하여야 한다. <개정 2008.12.31.>
제11조(의료연구개발지원기관 등의 설립 및 지원)① 첨단의료복합단지의 소재지를 관할하는 지방자치단체와 의료연구개발기관 및 출연기관은 공동으로 출연하여 다음 각 호의 어느 하나에 해당하는 의료연구개발지원기관을 설립할 수 있다.
1. 의약품 의료연구개발지원기관: 의약품을 연구개발하는 의료연구개발기관의 연구개발 업무를 지원하고 의료연구개발기관과 공동으로 의약품을 연구개발하는 기관
2. 의료기기 의료연구개발지원기관: 의료기기를 연구개발하는 의료연구개발기관의 연구개발 업무를 지원하거나 의료연구개발기관과 공동으로 의료기기를 연구개발하는 기관
3. 그 밖의 의료연구개발지원기관: 그 밖에 의료연구개발을 지원하는 다음 각 목의 어느 하나에 해당하는 기관
가. 연구용 세포 등을 보관ㆍ관리하는 기관
나. 실험용 동물의 사육 및 관리기관
다. 임상시험용 의약품을 생산하거나 생산시설을 제공하는 기관
라. 그 밖에 의료연구개발 관련 자원 관리기관 등 대통령령으로 정하는 기관
4. 복합의료연구개발지원기관: 제1호부터 제3호까지 중 2 이상의 성격을 가지는 의료연구개발지원기관
② 제1항에 따른 의료연구개발지원기관은 「민법」 제32조에 따라 주무관청의 허가를 받아 설립한다.
③ 국가와 지방자치단체는 의료연구개발지원기관의 설립ㆍ운영에 필요한 경비를 예산의 범위 안에서 보조할 수 있으며, 대통령령으로 정하는 바에 따라 의료연구서비스의 제공 수준, 연구성과의 향상 정도, 조직운영의 효율성 등을 고려하여 차등하여 지원할 수 있다.
④ 국가와 지방자치단체는 입주의료연구개발기관에 대한 투자를 주된 목적으로 하는 다음 각 호의 투자조합의 결성이나 회사의 설립을 지원할 수 있다. <개정 2015.7.24.>
1. 「중소기업창업 지원법」제20조에 따른 중소기업창업투자조합
2. 「여신전문금융업법」제41조에 따른 신기술사업투자조합
3. 「자본시장과 금융투자업에 관한 법률」 제9조제19항제1호에 따른 경영참여형 사모집합투자기구
제12조(공동연구개발사업 지원)① 의료연구개발지원기관과 의료연구개발기관은 공동으로 의료연구개발지원기관의 시설ㆍ인력 등을 활용하여 일정 기간 의료연구개발을 공동으로 수행하는 사업(이하 "공동연구개발사업"이라 한다)을 할 수 있다.
② 국가와 지방자치단체는 공동연구개발사업을 지원하기 위한 연구개발 자금을 조성하여 지원할 수 있다.
③ 의료연구개발지원기관은 제1항에 따른 공동연구개발사업의 결과에 따른 지식재산권 등을 배분하거나 「기술의 이전 및 사업화 촉진에 관한 법률」제2조제2호에 따른 기술이전을 할 때에 기업을 우대할 수 있다.
제13조(융자지원)① 산업통상자원부장관은 의료연구개발지원기관 및 의료연구개발기관이 첨단의료복합단지에서 수행하는 의료연구개발에 대하여 「중소기업진흥에 관한 법률」 제63조에 따른 중소기업진흥 및 산업기반기금 중 산업기반자금을 융자할 수 있다. <개정 2009.5.21., 2013.3.23.>
② 산업통상자원부장관은 제1항에 따른 융자를 할 때에 융자를 받은 자가 해당 사업에 실패하여 지원받은 융자금의 상환이 불가능한 경우에는 그 원리금의 전부 또는 일부를 감면할 수 있으며, 해당 사업에 성공한 경우에는 수익금의 일부를 상환하게 할 수 있다. 이 경우 상환하는 금액 중 원리금 상당금액을 제외한 부분은 「이자제한법」 제4조에 따른 간주이자로 보지 아니한다. <개정 2013.3.23.>
③ 제2항에 따른 사업의 성공 및 실패의 기준, 융자의 대상 및 조건, 융자의 절차 및 상환 방법 등에 필요한 사항은 대통령령으로 정한다.
제14조(세제지원)국가와 지방자치단체는 의료연구개발지원기관 및 입주의료연구개발기관에 대하여 세법으로 정하는 바에 따라 국세 및 지방세를 감면할 수 있다.
제15조(입주지원)지방자치단체는 의료연구개발을 목적으로 첨단의료복합단지에 입주하려는 자에 대하여 토지나 건물 등의 임대료 등을 감면할 수 있다.
제16조(부대시설 설치 등 지원) 국가와 지방자치단체는 의료연구개발지원기관 및 입주의료연구개발기관에 숙소, 편의시설, 탁아시설, 복지시설 등 각종 부대시설의 설치 및 운영에 필요한 자금을 지원할 수 있다.
제17조(고용보조금 등의 지급)국가와 지방자치단체는 의료연구개발지원기관 및 입주의료연구개발기관에 고용보조금 및 교육훈련보조금 등을 지원할 수 있다.
제18조(국ㆍ공유재산의 사용ㆍ수익ㆍ대부 및 매각 등의 특례)① 국가와 지방자치단체는 「국유재산법」ㆍ「공유재산 및 물품 관리법」 그 밖의 다른 법령의 규정에도 불구하고 국가나 지방자치단체가 소유하는 국ㆍ공유재산을 수의계약에 따라 의료연구개발지원기관 및 입주의료연구개발기관에 사용ㆍ수익하게 하거나 대부 또는 매각할 수 있다.
② 제1항에 따라 국ㆍ공유재산을 사용ㆍ수익하게 하거나 대부하는 경우 그 기간은 「국유재산법」 제27조제1항 및 제36조제1항과 「공유재산 및 물품 관리법」 제21조제1항 및 제31조제1항에도 불구하고 20년의 범위 이내로 할 수 있다. 이 경우 그 기간은 갱신할 수 있으며, 갱신기간은 갱신할 때마다 20년을 초과할 수 없다.
③ 제1항에 따라 국가나 지방자치단체가 소유하는 토지를 사용ㆍ수익하게 하거나 대부하는 경우에는 「국유재산법」 제24조제3항 및 「공유재산 및 물품 관리법」 제13조에도 불구하고 그 토지 위에 영구시설물을 축조하게 할 수 있다. 이 경우 그 시설물의 종류 등을 고려하여 그 기간이 끝나는 때에 이를 국가 또는 지방자치단체에 기부하거나 원상으로 회복하여 반환하는 조건을 붙일 수 있다.
④ 제1항에 따라 사용ㆍ수익하게 하거나 대부하는 국ㆍ공유재산의 사용ㆍ수익료 및 대부료의 산정기준은 「국유재산법」 제25조제1항 및 제38조와 「공유재산 및 물품 관리법」 제22조 및 제32조에도 불구하고 대통령령으로 정하는 바에 따른다.
⑤ 제1항에 따라 국ㆍ공유재산을 의료연구개발지원기관 및 입주의료연구개발기관에게 매각할 때에 매입하는 자가 매입대금을 일시불로 납부하기 곤란하다고 인정되면 「국유재산법」 제40조제1항, 「공유재산 및 물품 관리법」 제37조제1항에도 불구하고 대통령령으로 정하는 바에 따라 납부 기일을 연기하거나 분할납부하게 할 수 있다.
제19조(국ㆍ공립연구기관 연구원의 휴ㆍ겸직 허용) ① 공무원이 아닌 국ㆍ공립연구기관의 연구원(「한국과학기술원법」 제15조와 「광주과학기술원법」 제14조에 따른 교원 및 연구원을 포함한다. 이하 같다)은 의료연구개발지원기관 및 입주의료연구개발기관의 임직원으로 근무하기 위하여 휴직하거나 임직원으로 겸직할 수 있다.
② 제1항에 따른 휴직기간은 3년 이내로 한다.
③ 제1항에 따라 국ㆍ공립연구기관의 연구원이 6개월 이상 휴직하는 경우에는 휴직일부터 해당 국ㆍ공립연구기관에 그 휴직자의 수에 해당하는 연구원의 정원이 따로 있는 것으로 본다.
제20조(「출입국관리법」에 관한 특례)「출입국관리법」 제8조 및 제10조에도 불구하고 의료연구개발지원기관 및 입주의료연구개발기관에서 근무하는 외국인에 대한 사증 발급의 절차와 1회에 부여할 수 있는 체류자격별 체류기간의 상한은 대통령령으로 달리 정할 수 있다.
제21조(「의료법」에 관한 특례)① 「의료법」제5조 및 제27조에도 불구하고 보건복지부장관이 정하는 기준에 맞는 외국의 의사ㆍ치과의사는 첨단의료복합단지 안에 있는 보건복지부장관이 지정하는 의료기관에서 의료연구개발을 목적으로 하는 의료행위를 할 수 있다. <개정 2010.1.18.>
② 제1항에 따라 의료행위를 하려는 자는 보건복지부장관의 승인을 받아야 한다. <개정 2010.1.18.>
③ 제1항과 제2항에 따른 의료행위를 하는 자는 「의료법」에 따른 의사ㆍ치과의사로 보며, 「의료법」 제65조 및 제66조에 규정된 위반행위를 하면 보건복지부장관은 승인을 취소할 수 있다. <개정 2010.1.18.>
제22조(「국민건강보험법」에 관한 특례)① 「국민건강보험법」 제41조에도 불구하고 첨단의료복합단지 안에 있는 보건복지부장관이 지정하는 의료기관에서 의료연구개발을 위한 의약품, 의료기기 및 의료기술을 임상연구 대상자에게 사용하는 경우는 이를 요양급여로 본다. <개정 2010.1.18., 2011.12.31.>
② 제1항에 따른 요양급여의 대상ㆍ방법ㆍ절차ㆍ범위ㆍ상한 등 요양급여의 기준은 보건복지부령으로 정한다. <개정 2010.1.18.>
제23조(「약사법」에 관한 특례)① 입주의료연구개발기관은 연구개발한 의약품을 제조하려면 보건복지부령으로 정하는 바에 따라 식품의약품안전처장의 품목허가를 받아야 한다. 이 경우 식품의약품안전처장은 입주의료연구개발기관이 「약사법」 제31조에 따른 제조업 허가를 받지 아니하였거나 같은 법에 따른 시설 등의 기준을 갖추지 아니하였더라도 품목허가를 할 수 있으며 식품의약품안전처장이 품목허가를 한 경우 해당 입주의료연구개발기관은 「약사법」에 따른 제조업 허가를 받은 자로 본다. <개정 2010.1.18., 2013.3.23.>
② 의료연구개발지원기관 및 입주의료연구개발기관이 의료연구개발 목적에 사용하기 위하여 식품의약품안전처장이 지정하는 국가로부터 수입하는 의약품의 품목 및 수량 등에 대하여 식품의약품안전처장의 수입 승인을 받으면 「약사법」 제42조에 따른 수입 허가를 받거나 수입 신고를 한 것으로 본다. <개정 2013.3.23.>
③ 입주의료연구개발기관이 제1항 또는 「약사법」 제31조제11항 및 제42조제5항에 따라 식품의약품안전처장에게 의약품 제조품목의 허가 또는 수입 품목의 허가를 신청하는 경우에는 첨단의료복합단지 안에서의 의료연구개발에 한하여 신청서를 식품의약품안전처장이 정하는 바에 따라 외국어로 적을 수 있다. <개정 2011.3.30., 2013.3.23.>
④ 식품의약품안전처장은 제1항 또는 「약사법」 제31조제11항 및 제42조제5항에 따라 입주의료연구개발기관 및 의료연구개발지원기관에 대하여 행하는 의약품의 제조품목의 허가 및 수입 품목의 허가 기준 등에 관하여 보건복지부장관이 정하는 국제기구 등에서 정하는 기준을 적용할 수 있다. <개정 2010.1.18., 2011.3.30., 2013.3.23.>
⑤ 제1항, 제2항 및 제4항에 따른 품목허가, 수입 승인의 기준과 절차 등에 필요한 사항은 보건복지부령으로 정한다. <개정 2010.1.18.>
제24조(「의료기기법」에 관한 특례)① 입주의료연구개발기관은 연구개발한 의료기기(「의료기기법」 제6조제7항에 따라 보건복지부령으로 정하는 제조신고의 대상은 제외한다)를 제조하려면 보건복지부령으로 정하는 바에 따라 식품의약품안전처장의 제조허가를 받아야 한다. 이 경우 식품의약품안전처장은 입주의료연구개발기관이 「의료기기법」 제6조에 따른 제조업허가를 받지 아니하였거나 같은 법에 따른 시설 등의 기준을 갖추지 아니하였더라도 제조허가를 할 수 있으며 식품의약품안전처장이 제조허가를 한 경우 해당 입주의료연구개발기관은 「의료기기법」에 따른 제조업허가를 받은 자로 본다. <개정 2010.1.18., 2011.4.7., 2013.3.23.>
② 의료연구개발지원기관 및 입주의료연구개발기관이 의료연구개발을 목적으로 사용하기 위하여 식품의약품안전처장이 지정하는 국가로부터 수입하는 의료기기의 품목 및 수량 등에 대하여 식품의약품안전처장의 수입 승인을 받으면 「의료기기법」 제15조에 따른 수입업허가 또는 품목류별ㆍ품목별 수입허가를 받거나 수입신고를 한 것으로 본다. <개정 2011.4.7., 2013.3.23.>
③ 입주의료연구개발기관이 제1항 또는 「의료기기법」 제6조제7항 및 제15조제6항에 따라 식품의약품안전처장에게 의료기기 제조허가 또는 수입허가를 신청하는 경우에는 첨단의료복합단지 안에서의 의료연구개발에 한하여 신청서를 식품의약품안전처장이 정하는 바에 따라 외국어로 적을 수 있다. <개정 2011.4.7., 2013.3.23.>
④ 식품의약품안전처장은 제1항 또는 「의료기기법」 제6조제7항 및 제15조에 따라 의료연구개발지원기관 및 입주의료연구개발기관에 대하여 행하는 의료기기의 제조허가 또는 수입허가의 기준 등에 관하여 보건복지부장관이 정하는 국제기구 등에서 정하는 기준을 적용할 수 있다. <개정 2010.1.18., 2011.4.7., 2013.3.23.>
⑤ 제1항, 제2항 및 제4항에 따른 제조허가 및 수입 승인의 기준과 절차 등에 필요한 사항은 보건복지부령으로 정한다. <개정 2010.1.18., 2011.4.7.>
제25조(「생명윤리 및 안전에 관한 법률」에 관한 특례)① 「생명윤리 및 안전에 관한 법률」에 따른 국가생명윤리심의위원회는 첨단의료복합단지 분과위원회를 설치하여 첨단의료복합단지에서의 같은 법에 따른 생명윤리 및 안전에 관한 사항 중 보건복지부령으로 정하는 사항을 심의하게 할 수 있다. <개정 2010.1.18.>
② 제1항에 따른 첨단의료복합단지 분과위원회에서 심의를 한 사항은 「생명윤리 및 안전에 관한 법률」에 따른 국가생명윤리심의위원회에서 심의한 것으로 본다.
③ 「생명윤리 및 안전에 관한 법률」 제10조에도 불구하고 입주의료연구개발기관은 공동으로 기관생명윤리위원회를 둘 수 있다. <개정 2012.2.1.>
④ 제1항과 제3항에 따른 첨단의료복합단지 분과위원회 및 기관생명윤리위원회의 구성ㆍ운영과 그 밖에 필요한 사항은 대통령령으로 정한다. <개정 2012.2.1.>
제26조(「특허법」에 관한 특례)특허청장은 입주의료연구개발기관이 제출한 첨단의료복합단지 안 의료연구개발과 관련된 특허출원에 대하여는 「특허법」 제61조에도 불구하고 심사관에게 다른 특허출원에 우선하여 심사하게 할 수 있다.
제27조(첨단의료복합단지위원회의 설치)첨단의료복합단지의 육성에 관한 다음 각 호의 사항을 심의하기 위하여 국무총리 소속으로 첨단의료복합단지위원회를 둔다.
1. 첨단의료복합단지 육성을 위한 기본정책에 관한 사항
2. 조성계획의 수립 및 변경, 첨단의료복합단지의 지정 및 지정 해제 등에 관한 사항
3. 종합계획 수립 및 성과 평가에 관한 사항
4. 공동연구사업 실적 평가 및 의료연구개발지원기관 운영성과 평가에 관한 사항
5. 국내외 우수 연구인력 및 의료연구개발기관 등의 유치에 관한 사항
6. 첨단의료복합단지 육성을 위한 재정 지원, 규제 특례 등에 관한 사항
7. 첨단의료복합단지의 운영 및 지원에 대한 관계 행정기관의 장과 관할 광역지방자치단체의 장과의 의견 조정에 관한 사항
8. 자금 지원 및 규제 특례 적용 등의 성과평가에 관한 사항
9. 그 밖에 첨단의료복합단지위원회의 심의사항으로 규정된 사항 및 첨단의료복합단지 지정 및 지원을 위하여 필요한 사항으로서 위원장이 회의에 부치는 사항
제28조(구성 및 운영)① 첨단의료복합단지위원회는 위원장을 포함한 당연직 위원과 10명 이내의 위촉위원으로 구성한다.
② 위원장은 국무총리가 되고, 그 밖의 당연직 위원은 대통령령으로 정하는 관계 중앙행정기관의 장, 첨단의료복합단지의 관할 광역지방자치단체의 장이 된다.
③ 위촉위원은 첨단의료복합단지의 발전 및 운영에 이바지할 수 있는 지식과 경험이 풍부한 자 중에서 위원장이 위촉한다.
④ 첨단의료복합단지위원회의 회의는 재적위원 과반수 출석으로 열고, 출석위원 과반수 찬성으로 의결한다.
⑤ 첨단의료복합단지위원회의 운영을 지원하기 위하여 간사 1명을 두되, 간사는 보건복지부차관으로 한다. <개정 2008.12.31., 2010.1.18.>
⑥ 그 밖에 첨단의료복합단지위원회의 구성 및 운영에 필요한 사항은 대통령령으로 정한다.
제29조(자료 제출 등의 요청)① 첨단의료복합단지위원회는 관계 중앙행정기관의 장과 관계 광역지방자치단체의 장에게 심의에 필요한 자료를 제출하도록 요청할 수 있다. 이 경우 요청받은 중앙행정기관의 장과 관계 광역지방자치단체의 장은 정당한 사유가 없는 한 이에 따라야 한다.
② 첨단의료복합단지위원회위원장은 심의에 필요하면 관계 행정기관의 장이나 민간전문가에게 위원회에 출석할 것을 요청할 수 있다.
제30조(지원기구)① 첨단의료복합단지위원회의 사무를 처리하기 위하여 보건복지부장관 소속으로 필요한 지원기구를 둘 수 있다. <개정 2008.12.31., 2010.1.18.>
② 제1항에 따라 보건복지부장관 소속으로 두는 지원기구는 첨단의료복합단지의 지정 및 지원을 위하여 필요한 업무로서 대통령령으로 정하는 업무를 할 수 있다. <개정 2008.12.31., 2010.1.18.>
③ 보건복지부장관은 제1항에 따른 지원기구를 효율적으로 운영하기 위하여 필요하면 관계 행정기관 및 법인ㆍ단체(단지등 개발 및 의료연구개발과 관련한 업무를 수행하는 법인ㆍ단체로 한정한다)의 장에게 공무원 또는 법인ㆍ단체의 임직원의 파견을 요청할 수 있다. <개정 2008.12.31., 2010.1.18.>
④ 제1항부터 제3항까지에 규정된 것 외에 지원기구의 구성 및 운영에 필요한 사항은 대통령령으로 정한다.
⑤ 첨단의료복합단지를 효율적으로 관리하기 위하여 첨단의료복합단지 관할 지방자치단체, 의료연구개발지원기관, 입주의료연구개발기관 등은 공동으로 지원사무소를 설립할 수 있다.
⑥ 지원사무소는 법인으로 하되, 보건복지부장관은 그 주무관청이 된다. <개정 2010.1.18.>
⑦ 지원사무소에 관하여 이 법에 규정된 사항을 제외하고는 「민법」의 재단법인에 관한 규정을 준용한다.
제31조(입주의 승인 등)① 의료연구개발을 목적으로 첨단의료복합단지에 입주하려는 자는 보건복지부장관의 승인을 받아야 한다. <개정 2010.1.18.>
② 제1항에 따라 입주 승인을 받은 자가 승인받은 사항 중 대통령령으로 정하는 중요한 사항을 변경하려면 미리 보건복지부장관의 승인을 받아야 한다. <개정 2010.1.18.>
③ 보건복지부장관은 입주의료연구개발기관이 다음 각 호의 어느 하나에 해당하면 6개월 이내의 이행기간을 정하여 시정명령을 하고 이를 이행하지 아니하는 경우에는 입주 승인을 취소할 수 있다. 이 경우 입주 승인을 취소하려면 청문을 하여야 한다. <개정 2010.1.18.>
1. 입주 승인을 받은 후 정당한 사유 없이 1년 이내에 시설의 설치 또는 건축물의 공사를 시작하지 아니한 경우
2. 시설의 설치 또는 건축물의 건축이 불가능하게 된 경우
3. 시설 또는 건축물의 준공 후 정당한 사유 없이 6개월 이내에 해당 사업을 시작하지 아니하거나 계속하여 6개월 이상 해당 사업을 수행하지 아니한 경우
4. 입주 승인을 받은 자가 제2항을 위반하여 변경승인을 받지 아니한 경우
5. 제23조제2항 및 제24조제2항에 따라 수입 승인을 받은 자가 승인 조건을 위반하거나 의료연구개발 목적으로 사용하지 아니한 경우
④ 보건복지부장관은 제1항 및 제3항에 따라 입주 승인을 하거나 입주 승인을 취소하는 경우에는 첨단의료복합단지위원회의 심의ㆍ의결을 거쳐야 한다. <개정 2010.1.18.>
⑤ 제1항 및 제3항에 따른 입주 승인 또는 입주 승인 취소와 관련한 절차 등에 관하여 필요한 사항은 대통령령으로 정한다.
제32조(행정권한의 위임 또는 위탁)① 중앙행정기관의 장은 이 법에 따른 권한의 일부를 대통령령으로 정하는 바에 따라 소속 기관의 장이나 관할 광역지방자치단체의 장에게 위임할 수 있다.
② 중앙행정기관의 장은 이 법에 따른 첨단의료복합단지에 관한 업무의 일부를 대통령령으로 정하는 바에 따라 민간에 위탁할 수 있다.
<제13448호, 2015.7.24.> (자본시장과 금융투자업에 관한 법률)
제1조(시행일) 이 법은 공포 후 3개월이 경과한 날부터 시행한다. <단서 생략>
제2조부터 제18조까지 생략
제19조(다른 법률의 개정) ①부터 ⑫까지 생략
⑬ 첨단의료복합단지 지정 및 지원에 관한 특별법 일부를 다음과 같이 개정한다.
제11조제4항제3호를 다음과 같이 한다.
3. 「자본시장과 금융투자업에 관한 법률」 제9조제19항제1호에 따른 경영참여형 사모집합투자기구
⑭부터 <20>까지 생략
제20조생략

▮ 생명공학과 관련한 총제적(-omics) 학문
◎ 글라이코믹스(Glycomics)
당쇄를 인위적으로 목적한 기능을 갖게 변화시킴으로써 의약품 개발에 응용하려는 연구 분야이다.
※ 당쇄 : 단당류가 연쇄상으로 다수 결합된 분자로 일반적으로 생체의 세포 표면에 존재하는 당쇄를 지칭한다. 이러한 당은 당화(Glycosylation)되는 과정에서 단백질의 기능을 결정하거나 안정화시키는 데 중요한 역할을 한다.
◎ 기능유전체학(Functional genomics)
유전자와 유전자 산물의 기능, 유전자 산물 간의 상호작용을 밝히는 학문 분야이다. 이러한 연구를 통해 인간 유전자를 기능상으로 분류할 수 있으며, 이를 통해 질병 진단과 예후 예측, 치료제 개발에 유익한 정보를 제공할 수 있다.
◎ 단백질체학(Proteomics)
단백질의 3차원 구조분석, 기능 확인, 다른 생체물질과의 상호작용 등에 대한 연구를 통해 질병의 작용기구를 파악하고 신약개발에 활용하는 분야이다.
◎ 대사체학(Metabolomics)
세포 내에 존재하는 대사물의 총체인 대사체를 연구하는 학문이다.
◎ 독성유전체학(Toxicogenomics)
독성물질에 의해 발현양성이 변하는 유전자를 유전체학(genomics) 기법을 동원하여 대량으로 동정한 후 이 결과를 활용하여 개체의 독성물질 피폭 여부 등을 조사하는 학문 또는 기술이다. 이 기술을 이용하면 동물 또는 기타 시험관 내 방법에 비해 신속하고 정확하게 독성물질을 스크리닝할 수 있으며 한 번의 실험으로 다수 유전자의 변화를 분석할 수 있다.
◎ 약리유전체학(Pharmacogenomics)
개체 간에 나타나는 약물 효과, 독성 등의 차이를 개체의 유전적 요인과 관련지어 연구하는 학문 분야로, 개개인의 유전적인 요인을 파악해 약에 대한 반응성을 예측할 수 있도록 하는 것이 목표이다.
◎ 유전체학(Genomics)
게놈(genome)은 유전자(gene)와 염색체(chromosome)의 합성어로, 염색체에 담긴 유전자를 총칭하는 말이며, Genomics는 유전정보 전체(유전체)를 연구하는 학문분야를 말한다.
◎ 합성생물학(Synthetic Biology)
새로운 생물학적 부분(Part), 장치(Device), 시스템(System)을 디자인하고 구축하기 위해 또는 기존에 존재하는 자연 상태의 생물학적 시스템을 새로운 생물학적 시스템이나 인공생명체를 만드는 등 특정 목적으로 재설계(Redesign)하기 위해 사용하는 기술이다.
◎ 화학유전체학(Chemical Genomics)
Genomics와 조합화학이 결합된 분야로 유전자 분석을 통하여 특정 질환에 관련된 단백질 등 생체 내 타깃을 찾고 이와 반응할 수 있는 구조의 화합물들을 대량으로 합성하여 Lead(신약 후보의 구조적 출발물질)를 찾아내는 분야이다.
▮ 생명공학과 관련한 기타 학문
◎ 구조생물학(Structural biology)
단백질의 3차원 구조로부터 기능의 정보를 얻으려고 하는 학문적 영역이다.
◎ 나노기술(Nanotechnology)
10억 분의 1 수준의 정밀도를 요구하는 극미세가공 과학기술분야이다.
◎ 나노바이오
생명공학과 나노기술 상호간의 접목을 통하여 생명현상에 대해 분자수준의 이해를 증진시키며, 생명체 유래의 각종 물질들을 나노소재로 응용하는 연구이다.
◎ 뇌과학(Brain science)
뇌의 신비를 밝혀냄으로써 궁극적으로는 인간이 갖는 물리적·정신적 기능성의 전반을 심층적으로 탐구하는 응용 학문분야이다.
◎ 단백질공학(Protein engineering)
기존 단백질 구조와 기능 간의 관계를 규명하고 새로운 단백질을 설계하고 창출하는 기술이다. 아미노산 서열 결정, 유전자조작, 단백질 입체 구조 규명, 단백질의 분리와 정제, 컴퓨터 그래픽스 등의 기술이 요구된다. 신기능 효소, 고활성 효소, 의약용 단백질 개발에 이용된다.
◎ 당쇄공학(Glyco engineering)
천연에 존재하는 당쇄 구조 화합물의 기능․활성 규명, 구조 수식, 유도체 합성 등에 관련된 기술 분야이다. 당쇄 구조 화합물은 세포 간 인식, 정보 전달에 중요한 역할을 하는 것으로 알려져 있다.
◎ 대사공학(Metabolic engineering, Metabolomics)
생명체 대사과정의 네트워크를 각종 정보와 유전자조작 기술을 이용하여 유익한 방향으로 조절하려는 기술 분야이다.
◎ 면역유전학(Immunogenetics)
개체간의 면역학적 차이를 연구하는 유전학 분야. 혈액형, 조직적합성, 면역 응답 등에 관련된 정보를 이용한다.
◎ 생명공학
생명공학은 생명과학으로부터의 과학적 발견에 기반하여 응용기술을 창출하여 산업에 적용하는 분야를 말한다. 생명공학은 농업에서의 품종개량 유전자공학 등에 뿌리를 두고 있다.
◎ 생명과학
생명현상의 규명으로부터 생물기능의 응용연구에 이르기까지 생명체에 관련된 모든 연구분야를 총괄하는 과학군이다.
◎ 생물정보학(Bioinfomatics)
컴퓨터 기술을 활용하여 유전자와 관련된 정보를 해석하고, 기능과 구조를 밝혀내는 학문분야이다.
◎ 생체공학(Bionics)
생체 기작과 기능에 대한 공학적 지식을 응용하는 학문이다. 생체의 기능을 모방해 생체와 같이 동작하는 기계를 제작하는 기술 등이 포함된다.
◎ 세포공학(Cell engineering)
염색체나 유전자의 인위적인 조작 또는 이전 기술을 통해 유용한 유전자 형질을 발현할 수 있는 새로운 세포를 만들어 내는 기술이다. 세포융합에 의한 잡종 세포 형성을 이용하는 연구나 하이브리도마세포 제작을 비롯해 돌연변이주의 분리법이나 조직배양, 세포배양 기술 등이 포함된다.
◎ 시스템생물학(Systems biology)
생물 시스템을 구성하는 각각 요소의 행동을 해석할 뿐만 아니라, 전 구성 요소의 동적인 상호 관계를 시스템 전체 수준으로 분석해 고차적인 특성을 총체적으로 연구하는 학문이다.
◎ 의약 바이오(Red Biotechnology)
질병 치료 등에 활용되는 의약품을 개발하는 분야로 재조합 바이오 의약품(단백질 의약품, 치료용 항체, 백신, 유전자의약품 등), 재생 의약품(세포치료제, 조직 치료제, 바이오 인공장기 등), 저분자 및 천연물의약품, 바이오 의약 기반 구축 기술 등을 포함한다.
◎ 조직공학(Tissue engineering)
생명과학, 의학, 공학의 기본 개념과 기술을 바탕으로 하여 인공생체조직 또는 기관을 만들어 이용함으로써 생체 기능의 유지, 향상, 복원을 목표로 하는 학문 분야이다.
◎ 진화생물학(Tissue engineering)
지구 상의 생물의 진화를 연구하는 학문으로서, 찰스 다윈의 진화론의 영향으로 현대 생물학에서 빼놓을 수 없는 분과이다. 다윈의 진화론에 따르면 생물의 진화란 생물의 발전 과정을 뜻하며, 이 발전 과정을 더듬어 보는 일은 우선 생물이 무엇에서 발생하였는가를 밝히는 데에서부터 시작하여야 할 것이다.
◎ 해양생명공학(Marine biotechnology)
식량으로서의 어패류, 해조류의 이용, 조류 등의 에너지원으로서의 이용, 해양 생물로부터의 화학제품, 의약품 등의 추출, 정제 등이 포함되며, 이러한 목적을 위해 조직배양, 세포융합, 재조합DNA 기술 등을 활용하는 것을 해양생명공학이라 한다.
◎ 환경생명공학(Environmental biotechnology)
생명공학 기술을 이용한 오염물의 제거, 오염지역의 복원, 오염 탐지 및 측정, 생태 시스템 영향 평가 등 환경 관련 기술분야이다.
◎ 혈액학(Hematology)
혈액과 조혈기관에 관련된 사항을 다루는 학문분야이다.
▮ 생명공학 용어
◎ 게놈(Genome)
게놈은 유전자(gene)와 염색체(chromosome)의 합성어로서 한 생물체가 지닌 모든 유전정보(DNA)의 집합체를 뜻한다.
◎ 계대배양(Subculture)
미생물이나 동식물 세포를 증식 또는 유지할 때 그 일부를 새로운 배지에 계속 옮겨 배양하는 것을 말한다.
◎ 공통서열(Consensus sequence)
DNA, RNA 및 단백질의 일차 구조상에서, 특정 기능에 관계된 영역에 공통적으로 존재하는 염기나 아미노산 서열이다. DNA와 RNA의 경우, 특정 단백질의 결합 부위인 것이 일반적이다. 예를 들면, RNA중합 효소의 결합 부위인 프로모터나 각종 전사 조절 단백질의 결합 부위에서, 각각의 단백질이 결합하는 특정 공통서열을 볼 수 있다.
◎ 과변이(Hypervariability)
셋 이상의 대립형이 나타나는 DNA 염기서열의 변화를 뜻한다.
◎ 광학분할(Optical resolution)
광학 이성질체 혼합물에서 원하는 광학 활성체를 분리하는 것이다. 광학 활성을 지닌 산 또는 염기를 이용하여 한 가지 광학 활성체에 대해서만 광학 활성염을 만든 다음 분리하는 방법이다. 광학 활성 분리용 담체에 의한 크로마토그래피법, 또는 미생물이나 효소에 의해 한 가지 광학 활성체에만 반응을 선택적으로 진행시킨 후 분리하는 방법 등이 있다.
◎ 균사체(Mycelium)
곰팡이나 버섯 등 균류의 몸체를 구성하는 실 모양의 구조체이다.
◎ 글루코사민(Glucosamine)
포도당에 아미노기가 결합된 대표적인 아미노당이다. 자연계에는 키틴을 비롯해 세균의 세포벽, 동물의 연골, 피부를 구성하는 뮤코다당류 등 다당류의 성분으로 널리 분포한다. 혈액이나 점액 속에도 이것과 결합한 당단백질, 당지질이 존재한다. 관절염 치료를 위한 건강식품으로 널리 사용된다.
◎ 기능성식품(Functional food)
생체 방어, 생체 리듬 조절, 질병 예방 등 생체 조절 기능을 충분히 발휘할 수 있도록 설계되고 가공된 식품을 말한다.
◎ 나노바이오센서(Nano-Biosensor)
IT, NT 기술과 BT기술을 융합한 U-헬스케어의 핵심 기반으로 나노바이오센서 기술은 대부분의 건강정보가 담겨 있는 혈액을 채취해 실시간으로 심근경색 등의 질환을 검사하고 조기에 예방할 수 있는 3세대 U-헬스케어 기술을 의미한다.
◎ 나노바이오테크놀로지(Nanobiotechnology)
나노기술과 생명공학기술이 접합된 형태의 기술 분야. DNA칩, 단백질칩, 초소형 바이오센서, 고속대량스크리닝(HTS) 시스템의 개발과 적용에 핵심적인 분야이다.
◎ 나선포자(Helicospore)
1개의 주축으로 이루어지는데 180。이상 만곡되어 많은 경우 2~3회 소용돌이모양 또는 나선형으로 감겨 있는 포자. 모기향처럼 평면적으로 감는 것과 스프링처럼 입체적으로 감는 것이 있다. 무격벽 또는 유격벽으로 단실포자와 사상포자가 소용돌이모양으로 된 것이다.
◎ 내포체(Inclusion body)
외래 단백질이 숙주세포 내에서 과량 발현될 때 흔히 형성되는 불용성 단백질 덩어리이다. 내포체를 형성하면 단백질이 활성을 잃게 되므로 재접힘(refolding)을 통해 활성화시켜야 한다.
◎ 다기능효소(Multifunctional enzyme)
하나의 효소가 2개 또는 3개 이상의 반응을 촉매하는 효소의 총칭. E.coli의 트립토판에서 유도 형성한 균체로부터 정제한 결정효소는 인돌+L-세린→L- 트립토판+H2O, L-트립토판+H2O→인돌+피루브산+NH3, L-세린→피루브산+NH3, L-시스테인+H2O→피루브산+NH3+H2S, 인돌+L-시스테인→L-트립토판+H2S의 여러 가지 반응을 촉매하는 것이다.
◎ 다운증후군(Down syndrome)
상염색체 중에서 가장 소형인G군에 속하는 제21염색체가 정상보다 1개가 많아 합계 3개 존재하는 것(21=염색체성)에서 나타나는 선천성 이상증후군. 정신지체, 낮은 코, 몸통에 비해 사지가 짧아 땅달막한 체형, 수지가 짧은 심기형 합병이 빈도 높게 나타나는 것이 특징이다.
◎ 다당류(Polysaccharide)
다수의 단당이 글리코시드결합에 의해 탈수축합한 고분자화합물. 여러 가지 방법으로 분류한다. 예를 들면 1종류의 구성당으로 된 단순다당(호모다당), 2종류 이상의 구성당으로 구성한 복합다당(헤테로다당), 중성당만으로 구성된 중성다당, 우론산이나 황산기를 포함하는 산성다당 등이다.
◎ 단백질(Protein)
아미노산을 단량체로 하는 고분자 유기화합물의 총칭으로 세포의 주요 구성 성분이다. 생명현상에 관여하는 효소, 항체, 호르몬 등이 포함된다.
◎ 단백질삼차구조(Tertiary structure of protein)
단백질 사슬 내에서 비교적 멀리 떨어진 기능기 간의 수소 결합, 이황화결합, 소수성 상호작용(hydrophobic interaction)등에 의하여 형성되는 입체 구조. 효소의 활성, 특이성 등 단백질의 기능과 밀접한 관계가 있다.
◎ 단백질칩(Protein chip)
실리콘, 유리 등의 표면에 여러 종류의 단백질을 고밀도로 고정화시킨 바이오칩의 일종이다. 단백질-단백질(항원-항체), 단백질-리간드, 단백질-DNA, 효소-기질 등 단백질이 관여하는 모든 상호작용의 분석에 이용된다. 이를 통해 생명 현상의 이해, 질병의 진단과 원인 규명, 신호 전달 체계의 이해가 가능하며, 궁극적으로 질병의 예방 및 치료법을 개발할 수 있다.
◎ 단세포단백질(Single-cell protein(SCP))
세균, 효모, 사상균, 방선균, 곰팡이, 조류 등의 미생물을 대량 배양하여 균체로부터 추출한 단백질, 사료첨가물이나 식품첨가물, 증량제로 사용된다.
◎ 단일클론항체(Monoclonal antibody)
단 하나의 항원성결정기에만 작용하는 항체로 하이브리도마 또는 재조합 미생물 배양을 통해 생산된다. 미량 물질의 분리, 감염증이나 암 진단과 치료 등과 같은 의료 분야에 있어서 중요한 역할을 한다.
◎ 당뇨망막병증
만성적으로 고혈당이 지속되면 혈관 내피세포의 기능 이상을 초래, 망막 혈관의 폐쇄로 의한 망막허혈이 발생하고, 그 결과 비정상적인 혈관증식 및 출혈을 초래하여 실명으로 이어질 수 있는 질환
◎ 돌연변이(Mutation)
한 개체의 유전체를 구성하는 염색체나 DNA의 일부에 생긴 영구적인 변화, 염기서열 상의 염기 1개가 다른 염기로 치환된 경우를 점 돌연변이라고 한다. 여러 개의 염기를 포함하는 DNA 영역에 걸쳐 변화가 일어나는 경우도 있다. 생식세포에 생긴 돌연변이는 후대에 전달된다. 체세포돌연변이는 후대에 전달되지 않는다.
◎ 동물자원기술(Animal resources technology)
동물이 생산하는 산물 및 축산 동물의 효율적 생산을 위한 자원 동물의 육종, 사육, 관리 등과 관련된 기술이다.
◎ 동형접합체(Homokaryon)
하나의 세포 내에 유전자형이 다른 두 개 이상의 핵이 존재하는 상태이다. 핵융합이 일어나지 않으므로 세포질 유전 연구에 이용된다.
◎ 루틴(Rutin)
루티노오즈(글루코오즈와 만노오즈가 결합한 이당류)가 결합된 배당체 형태의 플라보노이드. 콩, 팥, 메밀, 토마토, 감귤류 등에 함유되어 있다. 모세혈관의 기능을 정상으로 유지하고 혈관을 튼튼히 하는 비타민P의 작용이 있어 고혈압이나 뇌일혈을 예방하는 데 쓰인다.
◎ 마이코톡신(Mycotoxins)
곰팡이류가 생산하는 독성 물질의 총칭이다. 사람이나 동물에게 급성 또는 만성 장해를 유발한다. 대표적인 것으로 Aspergillus flavus가 생산하는 aflatoxin류가 있다.
◎ 마이크로어레이(Microarray)
기판 위에 DNA나 단백질과 같은 포획 탐침(capture probe)이 미세한 점으로 고정화된 어레이 장치이다. 특정 DNA나 단백질의 분석을 통해 유전질환의 진단, 유전자 발현 모니터링 등에 사용된다.
◎ 맞춤의료(order-made medicine, tailored medicine)
개인의 체질·약물에 대한 반응에 따라 각각 다른 투약이나 치료하는 의료 행위.
◎ 면역억제제(Immunosuppressive agents/immunosuppressants)
생체의 면역 반응을 억제하는 활성을 지닌 물질이다. 대표적으로 사이클로스포린 A(cyclosporin A) 등이 있으며 장기 이식 시 거부반응을 억제하기 위해 사용된다.
◎ 면역세포(Immunocyte)
면역담당세포의 총칭. 림프구계 면역세포의 유약형(幼若型)은 대형 호피로닌 세포이며 면역아구라고 한다.
◎ 면역치료제(Immunotherapeutic)
체내의 면역반응에 관여하는 세포로 단백질로서 치료제로 사용되는 물질이다. 인터페론, 인터루킨 등이 대표적인 예이다.
◎ 미생물(Microorganism)
육안으로는 관찰이 불가능한 미세한 생물체. 일반적으로 크기 0.1mm 이하인 생물체를 의미한다. 주로 단일 세포 또는 균사체로 존재하며, 최소 생활 단위를 유지한다. 세균류, 사상균류, 효모류, 조류, 원생동물류, 바이러스 등이 이에 속한다.
◎ 바이러스(Virus)
숙주세포 내에서만 증식할 수 있는 비세포성 생물체이다. DNA나 RNA 중 하나를 게놈으로 갖는 감염세포 내에서만 증식하는 감염성 미소구조체이다.
◎ 바이오디젤(Biodiesel)
지방산 메틸에스터. 식물성 또는 동물성 지방과 메탄올의 산 또는 염기촉매반응에 의해 생산된다. 그 자체 또는 석유 디젤과 혼합해 연료로 사용되며, 바이오디젤은 재생가능자원인 바이오매스로부터 생산되므로 에너지 자원의 고갈 문제가 없으며, 연소 시 이산화탄소 및 미세분진의 배출량이 경유에 비해 현저히 낮고, SOx는 전혀 배출되지 않는다.
◎ 바이오리파이너리(Biorefinery)
석유 대신 바이오매스로부터 연료와 화학 원료를 제조하는데 필요한 기술의 집합이다.
◎ 바이오매스(Biomass)
식물이나 미생물 등을 에너지원으로 이용하는 생물체를 말한다.
◎ 바이오멤스(BioMEMS)
생물학적 시스템에 극미세 전자 기계 시스템(micro-electro-mechanical systems, MEMS) 기술을 결합한 새로운 기술 분야. 고성능의 극소형 생물 측정 장치나 생화학 반응 장치 등의 제작이 이에 속한다.
◎ 바이오센서(Biosensor)
생체 물질이 갖는 반응 특성과 그 반응에 의해 발생되는 전기 화학적 또는 광학적 신호 등을 이용해 특정 물질을 검출하거나 정량 분석하는 장치이다.
◎ 바이오에너지(Bioenergy)
바이오매스(biomass)와 이를 원료로 하여 생물학적 또는 열화학적으로 생산되는 연료로부터 얻어지는 에너지를 말한다. 경우에 따라서 바이오매스로부터 생산되는 연료를 지칭하기도 한다.
◎ 바이오연료(Biofuel)
생물체(바이오매스 자원)에서 만들어지는 연료이다. 액체 연료로는 에탄올, 메탄올, 바이오디젤, 피셔-트롭쉬(Fischer-Tropsch) 디젤이 있고 기체 연료로는 수소와 메탄이 있다.
◎ 바이오플라스틱(Bioplastic)
생물체(바이오매스 자원)에서 만들어지는 연료이다. 액체 연료로는 에탄올, 메탄올, 바이오디젤, 피셔-트롭쉬(Fischer-Tropsch) 디젤이 있고 기체 연료로는 수소와 메탄이 있다.
◎ 바이오칩(Biochip)
1) 유리, 실리콘 등의 재질로 된 작은 고체 기판 위에 DNA, 단백질 등의 생체 물질을 고밀도로 고정화시킨 마이크로어레이칩이다. 유전자 발현 양상, 유전자 결함, 단백질 분포, 반응 양상 등을 분석하는데 이용된다.
2) 단백질이나 지질, 신경세포 등의 생체 물질로 구성되며, 기본적인 연산이나 정보 처리 기능을 갖는 소자이다. 현재는 싸이토크롬이나 박테리오로돕신 등이 갖는 전자/광 스위치 특성을 이용한 소자들이 개발되고 있다.
◎ 바이오필터(Biofilter)
담체에 고정화된 미생물을 이용해 여러 가지 독성 물질이나 악취 물질을 제거하는 환경 처리장치이다.
◎ 박테리오신(Bacteriocin)
세균에 의해서 생합성되는 단백질로서 항균 효과가 있는 물질의 총칭이다.
◎ 발현벡터(Expression vector)
목적 유전자의 효율적인 발현을 위해 제작된 벡터이다. 전사가 효율적으로 이루어지도록 강력한 프로모터와 적절한 조절 유전자를 갖는다.
◎ 배아
난자와 정자의 수정이 이루어진 후 8주까지(인간의 경우)를 말하며 후에 태아가 된다.
◎ 배아줄기세포(Embryonic stem cell(ESC))
발생 초기의 배반포에서 얻어지는 미분화 상태의 세포로 자가 재생산 능력이 뛰어나 대부분의 조직과 세포로 분화할 수 있다.
◎ 복제 DNA(Cloned DNA)
공여체로부터 분리, 동정된 후 벡터에 삽입된 DNA를 말한다.
◎ 복제동물(Cloned animal)
무성적으로 복제되어 유전적으로 모체와 동일한 동물 개체를 말한다. 난세포에서 핵을 제거하고 모체 체세포의 핵을 이식하는 과정을 거쳐서 복제된다.
◎ 복제장기(Cloned organ)
인간 또는 동물의 장기의 일부분 또는 세포를 이용하여 장기로서의 기능이 가능하도록 배양된 생물학적 인공장기이다. 복제동물의 사육을 통하여 얻을 수도 있다.
◎ 생명윤리(Bioethics)
생명을 의미하는 바이오(bio)와 윤리를 뜻하는 에식스(ethics)의 합성어로 생명윤리 또는 생물윤리로 번역된다. 생명에 관한 윤리와 생물학의 기본원칙에 입각한 윤리의 2가지로 생각할 수 있다. 생명에 관한 윤리는 이제까지 ʻ의사의 윤리ʼ, 또는 ʻ의료의 윤리ʼ라고 일컬어왔는데, 의료의 발전과 인권의식이 서로 연관되어 넓은 입장에서 생명, 특히 인간의 생명에 대한 간섭의 시비를 검토하게 되었다.
◎ 생명자원
생명자원은 지구상에 존재하는 생물(동·식물, 미생물, 인간세포 등), 생물의 구성물(DNA, 유전체 등) 및 이들의 정보를 포함하는 것으로 배양 가능한 생물체, 복제 가능한 부분, 유전자원, 배양 불가능한 생물체 및 이와 관련된 분자, 생리, 구조적 정보를 포함한다.
◎ 생명정보
생물자원(유전체, 전사체, 단백질체 포함)과 생물다양성으로부터 유래된 정보와 그것의 가공처리 결과물을 말한다.
◎ 생물공정(Bioprocess)
생물체, 또는 생물체로부터 유래된 물질을 이용하거나 대상으로 하는 공정의 총칭이다.
◎ 생물다양성
육상, 해양 등의 수중 생태계와 이들 유기체가 서식하는 생태계를 말하며, 이는 종과 종사이, 또는 종과 생태계 사이의 다양성도 포함한다.
◎ 생물다양성보존(Biodiversity conservation)
생태계에 있어서 종 구성의 다양성과 다양한 종들 사이의 상호작용, 그리고 그 기능과의 상관관계를 활용해 자연 환경을 안정하게 유지하는 것이다.
◎ 생물산업(Bioindustry)
생명공학 기술을 이용하거나 이에 관련된 산업의 총칭이다.
◎ 생물안전성(Biosafety)
생명공학기술과 그 생산물로부터 유래하는 잠재적 위해성을 감소시키기 위한 노력을 지칭하는 용어이다.
◎ 생물융합기술(Biohybrid technology)
생명공학, 마이크로시스템, 센서시스템 등 여러 가지 분야의 기술이 융합된 것이다. 생명공학 연구에 필요한 여러 가지 방법을 자동화, 병렬화, 동기화하기 위해서 개발된 기술이다.
◎ 생물의약(Biopharmaceutical)
생물체 또는 이로부터 유래된 물질을 이용해 생산되는 의약품의 총칭이다. 단백질 치료제, 백신, 항생제, 세포 치료제, 유전자치료제 등이 포함된다.
◎ 생물학적지표(Biological indicator)
생리활성 물질의 효능을 말한다. 환경오염 또는 독성의 정도를 특정 생물을 대상으로 하여 수량적으로 표시하는 지표이다.
◎ 생체고분자(Biomolecule)
생체 내에서 합성되는 거대분자의 총칭이다. 단백질, 핵산, 지질, 다당류가 있다.
◎ 생체모방기술(Biomimetics)
생체의 기능을 다른 재료로 대체하거나 생체 기능을 모방, 이용하는 기술이다. 생체모방화학, 바이오일렉트로닉스, 바이오미캐닉스 등이 포함된다.
◎ 성체줄기세포(Adult stem cell)
조혈기관 상피조직 등의 세포재생계에서 세포생산의 기초가 되는 세포의 줄기세포를 추출하여 치료목적의 조직 세포로 분화한 것.
◎ 생체지표(Biomarker)
발암, 유전질환, 노화 등이 진행되는 단계 중 특징적으로 나타나는 형태학적· 생화학적·분자생물학적 변화. 생체지표를 검색함으로써 물질의 위해성을 판단할 수 있다.
◎ 세포공장(Biofactory)
세포의 유전자를 조작하여 원하는 화합물을 대량으로 생산하도록 만든 것이다. 세포 공장은 화합물 생산을 조절하는 효소 및 다양한 유전자의 발현을 억제, 활성화 시키고 이로써 생산 수율을 향상시킴으로써 제작된다. 세포 공장이 향후 현재의 화학공장과 같은 수준으로 생산 수율이 향상될 경우 기존 화학산업을 바이오산업으로 변화시킬 수 있을 것으로 기대되는 기술이다.
◎ 세포융합(Cell fusion)
두 개의 서로 다른 세포의 원형질체(protoplast)를 융합하는 것을 말한다. 동시다발적 유전 형질 변환이 가능하다. 식물세포에서는 육종 기술로서 동물세포에서는 단일클론항체 생산을 위한 하이브리도마 세포주를 만드는 데 사용된다. 미생물 분야에 있어서는 곰팡이와 방선균 등의 균주 개발에 이용된다.
◎ 세포치료기술
손상된 조직 또는 기관 부위를 치료할 목적으로 체외에서 세포를 배양하여 체내에 투여하는 치료법이다.
◎ 시냅스
하나의 신경세포의 축삭돌기 말단과 다른 신경세포의 수상돌기가 만나는 세포간 연접부위로서 신경세포 사이에 전기적, 화학적 신호를 전달하는 대화창구 역할을 수행한다.
◎ 알츠하이머병(Alzheimer's disease)
퇴행성 뇌질환의 하나로 치매의 원인 중 가장 흔한 형태이다. 병리 조직학적으로는 뇌의 전반적인 위축, 뇌실의 확장, 신경 섬유의 다발성 병변(neurofibrillary tangle)과 초로성 반점(neuriticplaque) 등이 특징이다.
◎ 약물전달시스템(Drug delivery system(DDS))
약물 방출 속도를 조절하거나 약물을 목표 부위에 효율적으로 전달시키는 방법 등을 통해 의약품의 부작용을 최소화하고 효능 및 효과를 극대화시키는 기술 및 시스템이다.
◎ 염기서열
아데닌(A), 구아닌(G), 시토신(C), 티닌(T) 4개의 상이한 코드(염기)로 이루어진 특정 서열로 DNA에 유전정보를 저장한다.
◎ 유도만능줄기세포(iPS, induced Pluripotent Stem cell)
사람 성체세포에 역분화 유도 인자를 도입하여 제작한 배아줄기세포와 비슷한 특성(우수한 분화능 및 증식력)의 줄기세포로 ʻ역분화 줄기세포ʼ라고도 하며, 수정란이나 난자를 사용하지 않아 윤리 문제에서 비교적 자유로움
◎ 유전공학(Genetic Engineering)
생물체에 주어진 유전형질을 인위적으로 변형․개조시켜 새로운 형질을 가진 생물체를 만들어내는 기술(세포융합핵치환 단백질공학 유전자 재조합)이다.
◎ 유전자 재조합(Genetic recombination)
DNA나 RNA와 같이 유전자를 이루는 요소가 해체와 재조립 과정에서 원래의 서열과는 다르게 뒤바뀌는 과정을 가리키는 유전학 용어이다. 진핵생물의 경우 DNA 수리의 과정에서 유사 분열이 발생하는 경우, 그리고 감수 분열의 과정에서 일어나는 염색체 접합에 의해 이루어진다.
◎ 인간화항체(Humanized antibody)
항원을 다른 동물에 주입했을 때 생성되는 항체 구조 중 항원이 결합하는 부위인 상보성결정부위(CDR)에 해당되는 유전자 배열만을 인간 항체 유전자에 대체하는 과정을 통하여, 인간 항체와 특징이 유사하도록 제조된 재조합 항체동물로부터 유래된 부분이 적기 때문에 체내 투여용 항체치료제로 사용하기에 적합하다.
◎ 인공장기(Artificial organ)
장기의 인공적인 대체물을 말한다. 심장, 신장, 간장 등의 대체 장기 외에도 인공혈관, 인공혈관 밸브 등도 포함된다. 인공 재료와 배양 세포를 결합시킨 혼성(hybrid)형도 있다.
◎ 인터페론(Interferon(IFN))
인체세포 내에서 바이러스 RNA와 단백질의 생성을 억제하는 항바이러스 단백질의 발현을 유도하는 기능을 갖는 당단백질의 총칭이다. 생성장소와 기능이 각기 다른 3가지가 있는데 IFNα는 주로 백혈구, IFNβ는 섬유모세포 그리고 IFNy는 주로 림프구에서 생성된다. 항바이러스 작용 외에 면역조절작용도 갖는다. IFNα와 IFNβ는 주로 항바이러스활성을 나타내는 반면 IFNy는 주로 면역조절작용을 한다. IFNα는 자연살해세포의 활성을 증강시키는 작용도 지니고 있다. 산업적으로는 유전공학적인 방법으로 생산이 가능해졌으며, 바이러스 간염의 치료에 사용되며 IFNα는 모발상세포 백혈병의 치료에도 유효하게 사용된다.
◎ 자가면역질환(Autoimmune disease)
자가면역에 의해 생체방어기능을 담당하는 면역계가 자기 세포를 공격해 발생하는 질병. 만성 류마티스성 질환이 대표적인 예이다.
◎ 자가생식(Selfing)
동일 개체 또는 동일 계통에 유래하는 배우자간의 교배. 교배형에 의한 자웅이체성이 확인되고있는 미생물의 일부 계통으로, 동일 교배형의 클론 내에서 한정적으로 교배가 일어나는 것이다.
◎ 자살유전자(Suicide gene)
발생과정의 어느 시기에 특정한 세포 내에서 발현하여 그 세포를 세포예상사 시키는 치사유전자의 일종. 이 유전자의 작용으로 살생단백질을 합성하고, 이것이 어떤 기작으로 세포를 죽게 하는 기능을 하는 것으로 보고 있는데 아직도 불분명한 점이 많다. 자살유전자는 초기에는 그 발현이 억제되지만 특정한 사이에 발현하는데 그 방아쇠가 되는 요인은 다양한 것으로 알려져 있다.
◎ 자세포(Cnidoblast)
자포동물에서 자포를 만들고 대부분의 경우 이를 마지막까지 내장하는 세포. 간세포(I세포)에서 유래하는 것으로 알려져 있다. 자세포는 1개의 독립효과기로 기능하는 것으로, 특정한 지질성분에 대한 접촉화학적 반응이 종종 그 원래의 흥분형태가 된다.
◎ 재구성핵(Restitution nucleus)
유사분열의 중기 또는 후기에 핵분열의 착오에 의해 딸 염색체가 분배되지 않고 하나로 된 핵. 그 결과, 염색체수가 배가된 핵이 형성된다. 감수분열에서는 1가염색체, 염색분체다리 등에 의한 염색체 지체가 원인이 된다.
◎ 재조합 DNA 기술(Recombinant DNA technology)
목적 유전자를 제한효소를 이용해 잘라내고 이를 벡터에 삽입해 재조합 DNA를 제작한 후, 숙주에 도입해 발현시키는 과정에 관련되는 기술의 총칭이다.
◎ 전임상(Preclinical)
실험실 차원 및 동물을 대상으로 약물의 생리적 특성과 대상 질병에 대한 효능을 검증하는 것이다.
◎ 제대혈(Cord blood)
태반과 탯줄에 있는 혈액으로 백혈구, 적혈구, 혈소판 등을 만드는 조혈모세포를 다량 함유하고, 연골, 뼈, 근육, 신경 등을 만드는 간엽줄기세포를 가지고 있다.
◎ 줄기세포(Stem Cell)
조직분화 과정에서 볼 수 있는 미분화된 세포. 줄기세포는 신체 내 모든 조직으로 분화될 수 있는 가능성을 가지고 있다.
◎ 줄기세포치료(Stem cell therapy)
미분화된 줄기세포를 적당한 조건 하에서 특정 세포나 조직으로 분화하도록 유도해 손상된 조직이나 장기를 치료하는 기술이다.
◎ 제네릭(Generic) 약품
특허 보호중인 의약품에 반대되는 개념으로 특허가 만료됐거나 특허보호를 받지 않는 의약품을 통칭한다.
◎ 진세노사이드(Ginsenoside)
인삼 사포닌을 구성하는 물질의 총칭으로 현재 약 30여 종이 알려져 있으며 건조 인삼 중 약 3.2% 정도 함유되어 있다. 화학구조의 특성에 따라 프로토파낙사디올 (protopanaxadiol, PD)계, 프로토파낙사트리올(protopanaxatriol, PT)계, 올레안(oleanane)계 사포닌으로 구분되며 항암, 혈액 순환 개선, 당뇨의 예방 및 치료, 신장 보호, 치매 예방, 간장 보호, 동맥 경화, 고지혈증, 체질 개선, 피로 회복, 면역 기능 증진과 노화 방지 등에 효과가 있다고 알려져 있다.
◎ 진핵생물(Eukaryote)
핵막으로 둘러싸인 핵과 다양한 세포 소기관을 가지는 세포로 구성되어 있는 생물을 말한다. 원생생물, 조류, 사상곰팡이, 효모, 식물, 동물이 포함된다. 원핵생물과 대응된다.
◎ 체세포돌연변이(Somatic mutation)
발생이 진행 중인 개체 또는 완전한 개체 내에서 방사선이나 다른 원인들에 의해 일부의 체세포에 변화가 일어나 새로운 형질이 만들어지는 현상이다.
◎ 체세포변이(Somaclonal variation)
한 개체에서 단일세포를 떼어내어 재배양했을 때 얻어진 새로운 개체가 원래의 개체와 유전적으로 동일하지 않은 현상이다.
◎ 체세포융합(Somatic cell hybridization)
유전자가 다른 체세포를 접합하여 새로운 유전자형의 세포를 만드는 기술이다.
◎ 치료용효소(Therapeutic enzyme)
치료제로 이용되는 효소 또는 그 제제이다. 혈전용해제로 사용되는 조직플라스미노젠 활성인자 (TPA: tissue plasminogen activator), 스트렙토카이네이즈(streptokinase), 유로카이네이즈(urokinase)와 항혈액응고제인 안티트롬빈 III(antithrombin III) 등이 대표적인 예이다.
◎ 카로티노이드(Carotenoid)
녹색식물과 어떤 종의 곰팡이, 효모, 버섯, 세균 등이 만드는 황색, 적색, 자색(흡수극대 400~550nm) 등의 불용성 폴리엔색소. 대부분 탄소수가 40(때로는C30, C45, C50 등)이고 좌우대칭에 가까운 구조인 테트라테르페노이드 이다. 토마토과실에 많은 리코펜(φ,φ-카로틴)을 원형(原型)으로 하여 그 분자의 양끝폐환(閉環), 산소화 등으로 생기는 500종 이상의 색소가 알려져 있다.
◎ 캡사이신(Capsaicin)
고추의 매운맛을 내는 무색의 휘발성 알칼로이드 화합물로 약용과 향료로 이용된다. 진통작용과 체지방 감소 효과가 있는 것으로 알려져 있다.
◎ 클로렐라(Chlorella)
클로렐라과의 비운동성 담수 조류로 건강 보조 식품, 유제품의 원료로 주로 사용된다.
◎ 키토산(Chitosan)
키틴을 탈아세틸화한 물질로 의약 분야에서는 인공 피부, 약물전달시스템 등에 응용되며 환경 분야에서는 응집제로도 사용된다. 세포를 활성화해 노화를 억제하고 면역력을 강화해 주며 질병을 예방해 주는 것으로 알려져 있어 건강 기능 식품의 소재로 사용된다.
◎ 타닌(Tannin)
다가페놀을 포함하며 유피성(鞣皮性)의 복잡한조성을 가진 식물 성분. 식물계에는 농도의 차이는 있으나 널리 분포하며 물관부, 수피, 잎, 과실, 뿌리 등에 들어 있다. 유혁작용의 주체는 다가페놀로서 단백질, 특히 콜라겐과 결합하여 동물의 생피를 안정된 가죽으로 변성하게 한다. 알칼로이드와 침전반응을 하고 3가의 철이온과 결합하여 녹색 또는 흑자색의 착화합물을 형성한다.
◎ 페니실린(Penicillin)
푸른곰팡이(penicillium)가 생산하는 β-락탐계의 4원자 고리화합물의 항생 물질로 세균의 세포벽 구성 성분인 펩티도글리칸의 합성을 저해하는 대표적인 세균 감염증 치료제이다. 모핵은 6-아미노페니실란산(6-amino penicillanic acid, 6-APA)으로, 치환기를 화학적으로 수식한 많은 종류의 유도체(반합성 페니실린)가 개발되었다. Flemming(1928)에 의해서 최초로 발견된 후, 생물공학기술에 의해 대량 생산이 가능하게 된 대표적인 생물산업 제품이다.
◎ 펙틴(Pectin)
식물의 세포벽이나 세포벽 사이에 존재하는 다당류의 하나로 주성분은 D-갈락투론산이 α-1,4 결합한 고분자이다. 팽윤성이 뛰어난 수용성 식이섬유로서 섭취 시 포만감을 주나 칼로리는 매우 낮다. 배변활동을 원활하게 하고, 지방흡수 저하, 지방합성 저해, 체지방 분해 등의 작용을 하므로 다이어트 식품의 원료로 사용된다.
◎ 폴리펩타이드(Polypeptide)
대략 10개 이상의 아미노산잔기로 이루어진 펩타이드이다. 단백질과 같은 뜻으로 쓰기도 하나 보통 분자량이 작은 단백질을 가리킬 때 쓰인다.
◎ 표지단백질(Marker protein)
특정 질병 진단의 척도로 사용되는 단백질로 특정 질병 상태에서 발현된다. 일례로 간암의 경우 혈액 내의 알파태아단백(AFP: α-fetoprotein)을 표지단백질로 사용한다.
◎ 표지유전자(Marker gene)
특정 형질에 대한 유전적 해석의 척도로 이용되는 유전자, 유전질환, 약제내성(항생물질 내성 등), 염도 감수성, 영양 요구성 등을 유전적으로 판단하는데 이용된다.
◎ 프로바이오틱(Probiotic)
인간의 건강에 이로운 생균제 식이보조물 또는 생균 성분이다. 유산균 식품과 효모 체제가 대표적이다. Pro(촉진하는) biotic(생명체)의 합성어이다.
◎ 플랫폼 기술(Platform Technology )
신제품 개발과 생산 시스템에 범용적으로 활용되는 표준화된 하드웨어 및 소프트웨어 기술. 핵심 기술을 표준화, 모듈화, 공용화 함으로써 개방형 혁신 활동을 촉진하는 기술.
◎ 항상성효소(Constitutive enzyme)
세포의 생존, 성장과 함께 항상 발현되는 효소. 일상적인 배양조건 하에서 세포의 일상적인 기능을 수행하기 위한 효소들이 이에 해당된다. 이들의 유전자는 특정 대사물질에 의해 조절되는 작동 유전자(operator)를 가지고 있지 않다.
◎ 항체(Antibody)
생체 내에 들어온 항원에 반응해 만들어지는 당단백질이다. 해당 항원에 특이적으로 결합하며 면역글로블린(Ig)이라고도 한다.
◎ 항체바이오시밀러
항체의약품이란 체내에서 병을 유발하는 원인 단백질에 항체처럼 작용해 그 단백질만을 무력화시키는 의약품을 말한다. 특정 단백질에만 반응하기 때문에 효과가 뛰어나고 타깃 질병 이외에는 반응하지 않아 화학의약품에 비해 부작용이 적다. 특허가 끝난 항체바이오의약품을 오리지널과 동일한 효능을 갖도록 만든 복제 의약품이 항체바이오시밀러다. 램시마의 오리지널은 존슨앤존슨사의 레미케이드다. 류머티즘 관절염, 강직성 척추염, 건성, 소아 크론병을 포함, 7개 병에 대한 적응증을 유럽당국에서 승인받았다.
◎ 핵산(Nucleic acid)
푸린 또는 피리미딘 염기, 오탄당(디옥시리보오스 또는 리보오스), 인산기로 이루어진 뉴클레오타이드 중합체이다. 당부분이 디옥시리보오스인 DNA와 당부분이 리보오스인 RNA 두 종류로 대별된다.
◎ 핵이식
어떤 세포로부터 핵을 떼어낸 뒤 다른 세포(핵을 제거한 것)에 이식하는 조작이다.
◎ 형질전환(Transformation)
어느 주의 유전형질 일부를 다른 주에 옮겨 넣는 유전교배의 한 형태로, 공여체로부터 추출한 고분자 DNA를 직접 수용체에 거두어 넣어 그 세포 중에서 재조합하는 경우이다.
◎ 형질전환생물(Transgenic organism)
인위적인 방법에 의하여 외래 유전자가 도입된 동식물과 미생물의 총칭이다. 보통 교잡육종으로는 얻어질 수 없는 형질을 가진 생물체를 말한다.
◎ 호르몬(Hormone)
미량으로도 효능을 나타내는 생리활성 조절 물질이다. 척추동물의 호르몬은 펩타이드계(인슐린, 글루카곤, 뇌하수체 호르몬, 부갑상선 호르몬), 아미노산 유도체계(아드레날린, 갑상선 호르몬), 스테로이드계(성 호르몬, 부신피질 호르몬)로 나누어진다.
◎ 효모(Yeast)
구형의 단세포로 존재하며 주로 출아법에 의해 증식하는 진균류(fungi)의 한 종류로 양조, 제빵 등에 이용되는 Saccharomyces cerevisiae가 대표적이다. Saccharomyces, Hansenula, Pichia 속에 속하는 효모는 재조합 단백질 생산에 이용한다.
◎ 효소(Enzyme)
생체 내에서 만들어지는 단백질 생촉매. 생체 내의 화학반응은 거의 모두가 효소 반응에 의해 촉진된다. 산화환원효소, 전이효소, 가수분해효소, 라이에이즈, 이성질화효소, 라이게이즈의 여섯 가지 종류로 분류한다.
◎ 효소공학(Enzyme engineering)
효소 촉매의 특성, 관련 기술, 물질, 장비를 수단으로 하는 방법과 기술의 총체이다.
◎ 휴면세포(Resting cell)
살아 있기는 하나 증식은 하지 않는 상태의 세포를 말한다. 배양액으로부터 세포를 수확하여 적당한 완충액에 현탁시킬 경우 세포들이 분열 증식을 하지 않는 상태로 상당기간 유지될 수 있다. 포자 등의 휴면형의 세포나 핵분열 사이클의 간기에 있는 세포를 지칭하는 경우도 있다.
◎ B-세포(B-cell)
골수 모세포로부터 유래한 림프구의 일종이다. 일반적으로 골수에서 면역세포로 성숙한다. 항원과 반응해 체액성 면역에 관여하는 항체를 분비하는 형질 세포(plasma cell)가 된다. B-림프구라고도 한다.
◎ DNA중합효소(DNA polymerase)
DNA 중합을 촉진하는 효소이다. 주형(template)DNA의 염기 배열 순서에 맞추어서 이에 서로 상보적인 염기를 지닌 디옥시리보뉴클레오타이드(deoxyribonucleotide, dNTP)를 인산이중 에스터(phosphodiester) 결합으로 연결함으로써 새로운 DNA 사슬을 5ʼ에서 3ʼ 방향으로 합성한다. DNA의 복제와 회복에 관여하는 중요한 효소이다.
◎ RNA(Ribonucleic acid (RNA))
리보오스, 염기(구아닌, 아데닌, 시토신, 우라실), 인산기로 이루어진 뉴클레오타이드의 중합체로 DNA와 함께 핵산의 일종이다. 전령RNA, 운반RNA, 리보좀RNA(rRNA: ribosomal RNA)의 세 종류가 대표적이다.
◎ T-세포(T-cell (T-lymphocyte))
흉선에서 유래하는 면역 관련 림프구이다. B-세포의 항체생산을 촉진하는 헬퍼 T-세포, 억제하는 억제 T-세포, 특이적으로 표적세포를 상해하는 킬러 T-세포 등으로 나누어진다.

1. 생명공학의 정의
가. OECD에서의 생명공학의 정의
지식, 재화 및 서비스의 생산을 목적으로 생물 또는 무생물을 변형시키는 과정에서 생물체, 생체유래 물질 및 생물학적 모델에 과학과 기술을 적용하는 활동을 말한다.
나. Biotechnology Industry Organization(BIO)에서의 생명공학의 정의
생명공학산업기구(Biotechnology Industry Organization, BIO)에서는 생명공학을 ʻʻ문제해결 혹은 유용제품 생산을 위한 세포 및 생물분자적 과정의 이용ʼʼ으로 정의하고 있다.
다. 「생명공학육성법」에서의 생명공학의 정의(2008.2.29)
산업적으로 유용한 생산물을 만들거나 생산 공정을 개선할 목적으로 생물학적 시스템, 생체, 유전체 또는 그들로부터 유래되는 물질을 연구‧활용하는 학문과 기술을 말한다. 생명현상의 기전, 질병의 원인 또는 발병과정에 대한 연구를 통하여 생명공학의 원천지식을 제공하는 생리학, 병리학, 약리학 등의 학문(기초의과학)을 통칭하고 있다.
라.「제7회 과학기술관계장관회의(2005.5.26)」에서의 생명공학의 정의
제7회 과학기술관계장관회의(2005.5.26)의「바이오 연구개발의 효율적 추진방향(안)」에 따르면, 생명공학이란 생물체의 기능과 유전정보를 규명하고 이를 이용‧활용하여 산업 및 인류복지에 응용하는 과학기술을 총칭한다.
이는 생명과학, 생명공학 및 생명공학 활용 신약개발 관련 화학을 포괄하는 광의의 개념이다. 생물체의 기능과 정보는 생명현상을 일으키는 생체나 생체 유래물질 또는 생물학적 시스템의 탐구로부터 획득이 가능하다.
[표 부록 5-1] 생명과학, 생명공학, 화학의 개념
|
분야 |
개념 |
비고 |
|
생명과학 |
생명현상이나 생물의 여러 가지 기능을 밝히고 그 성과를 의료 등 인류복지에 응용하는 종합과학 |
|
|
생명공학 |
생물체, 생물전자․정보를 이용하여 산업적으로 유용한 생산물을 만들거나, 개선하는 학문과 기술 |
|
|
화학 |
물질의 성질, 조성, 구조 등을 다루는 학문과 기술 |
- 최근 신소재개발과 생명현상을 탐구하는 부분에 관심 증대 - 기존의 신약개발과 새로운 신약개발 방법의 융합화 현상 |
|
화합물 신약 |
전통적인 Chemical drug을 주로 말하며 저분자(기존방법) 화합물 위주 |
|
|
바이오 신약 |
생명현상의 원리 규명에서부터 시작하며 단백체(새로운 방법), 유전체, 줄기세포 등 새로운 개념을 도입한 치료제 |
바이오신약과 화합물 신약 모두 생명공학 영역으로 포함하는 추세 |
[표 부록 5-2] 바이오기술의 개념
|
바이오기술 〓 생명과학 + 생명공학 + 화학(신약) |
2. 생명공학의 범위
생명공학이 다른 첨단 기술 즉 IT, NT등과 융합되고 관련 기반학문들이 통합되면서 생명공학의 범위가 계속 확대되고 동시에 전통적인 경계들이 모호해지는 경향을 가진다.
가. 제2차 생명공학육성기본계획(Bio-Vision 2016)에서의 생명공학의 범위
제2차 생명공학육성기본계획(Bio-Vision 2016)에는 생명공학기술을 총 5개 분야 즉 1) 생명공학 2) 보건의료 3) 농축산‧식품 4) 산업공정/환경‧해양수산 5) 바이오 융합의 총 5개 분야로 대분류하고 ʻʻ국가과학기술표준분류ʼʼ의 세부기술 목록에 따라 재분류함으로써 객관적 기준을 적용하였다.
[표 부록 5-3] 제2차 생명공학육성기본계획(Bio-Vision 2016)에서 분류한 생명공학기술
|
분야 |
기본계획 분류 |
과학기술 표준 분류상의 범위 |
|
생명과학 |
◦ 유전체, 단백체 ◦ 세포체, 대사체 ◦ 뇌과학, 생체기능 ◦ 생체네트워크 |
C06 생화학, E01분자세포생물학, E02유전학/유전공학, E03발생/신경생물학, E04면역학/생리학, E05분류/생태/환경생물학, E06생화학/구조생물학 등 기타(B0901, C0107, C0201, C0207 등) |
|
보건의료 |
◦ 기초의과학 ◦ 임상의과학 ◦ 제품화기술 ◦ 인허가 |
G01의생명과학, G02 임상의학, G03 의약품/의약품개발기술, G04 치료/진단기기, G06 의료정보/시스템, G07 한의과학, G08 보건학, G09 간호과학, G10 치의과학, G15 독성/안정성관리 기반기술 등 기타(G1206 등) |
|
농림수 축산 ․식품 |
◦ 농림수축산 생명연구자원 확보 및 오믹스 활용 기술 ◦ 농림수축산 자원 활용 바이오 에너지 개발 ◦ 기능성 식품 및 소재 개발 ◦ 신품종 육종기술 및 유전자변형 농림수축산 생물개발 ◦ 안정성 평가 기반 |
F01식량작물과학, F02원예작물과학, F03농생물학, F06동물자원과학, F07 수의과학, F13수산양식, F17식품과학, F18식품영양과학 기타(F0401, F0506 등) |
|
산업공정/ 환경․ 해양 |
◦ 생물산업공정 ◦ 환경생명공학 ◦ 해양생명공학 |
E05분류/생태/환경생물학, E08 생물공학, E09 산업바이오, E10 바이오공정/기기, J04생물화학공정기술, D10 해양생명, O04생태계 복원/관리, O06해양환경, E11 생물위해성 등 기타(C1002, D0803, D1109, M0603 등) |
|
바이오 융합 |
◦ BT-IT 융합기술 ◦ BT-NT 융합기술 ◦ BT-IT-NT 융합기술 ◦ BT-타기술(BT-RT, GT, CS) |
E07 융합바이오 기타(C1006, E1002 등) |
출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 교육과학기술부, 2008

출처 : 제2차 생명공학육성기본계획(Bio-Vision 2016), 과학기술부, 2006
[그림 부록 5-1] 제2차 생명공학육성기본계획(Bio-Vision 2016)에서 분류한 생명공학기술
나. 제7회 과학기술관계장관회의에서의 생명공학의 범위
제7회 과학기술관계장관회의「바이오 연구개발의 효율적 추진방향」의 자료에 따르면 생명공학의 범위를 1) 생명의약/의약 2) 농림축산/식품 3) 생물전자/정보 4) 생물공정/화학으로 분류하고 있다.

출처 : 바이오 연구개발의 효율적 추진방향(제7회과학기술관계장관회의), 과학기술혁신본부, 2005
[그림 부록 5-2] 제7회 과학기술관계장관회의에서의 생명공학의 범위
다. 「생명공학육성법」에서의 생명공학의 범위
생명공학에 관하여는 다른 법률에 특별한 규정이 있는 경우를 제외하고는 이 법 (생명공학육성법 : 국회법률지식정보시스템 공개)에 의한다.

특집 : 바이오헬스 신산업 육성전략 생명공학정책연구센터
제1장 생명공학의 비전과 전망
제1절 창조경제 실현을 위한 비전 허광래/한국연구재단
제2절 글로벌 시장선점을 위한 미래기술 윤건호/보건산업진흥원
제3절 바이오 산업의 도약과 미래 전망 생명공학정책연구센터
제4절 종합조정 측면의 생명공학 육성정책 문병석/국가과학기술심의회 생명의료전문위원회
제2장 세계 주요국의 생명공학 동향
제1절 미국 김정석/한국생명공학연구원
제2절 일본 김유선/한국생명공학연구원
제3절 유럽연합(EU) 이상현/한국과학기술기획평가원
제4절 중국 박호용/한국생명공학연구원
제3장 국가 생명공학 육성 정책 및 지표
제1절 생명공학 육성 정책
1. 생명공학 연구개발 지원 정책 미래창조과학부/생명기술과
2. 생명공학 산업육성 정책 산업통상자원부/바이오나노과
3. 생명공학 기초과학진흥 정책 미래창조과학부/기초연구진흥과
4. 생명공학 인력양성 정책 교육부/학술진흥과
5. 농식품분야 생명공학 육성 정책 농림축산식품부/과학기술정책과
6. 보건의료분야 연구개발 육성 정책 보건복지부/보건산업정책과
7. 환경분야 생명공학 육성 정책 환경부/환경기술경제과
8. 해양수산분야 생명공학 육성 정책 해양수산부/생명자원과
9. 생명자원 분야의 육성 및 관리 정책 미래부/생명기술과, 농림축산식품부/종자생명산업과, 보건복지부/보건산업정책과, 산업통산자원부/바이오나노과, 환경부/식물자원과, 해양수산부/해양생태과
제2절 생명공학 국제협력 현황
1. 국내 R&D 국제협력 및 국가간 협력 현황 김석호/한국연구재단
2. 국제 표준화 노력 이연희/서울여자대학교
제3절 생명공학 경쟁력 지표 현황
1. 투자 현황 김은정/한국과학기술기획평가원
2. 인력 현황 오기환/한국바이오협회
3. 특허 현황 김봉진/특허정보원
4. 논문 현황 조석민/한국연구재단
5. 산업 현황 오기환/한국바이오협회
제4장 분야별 연구개발 및 산업 현황
제1절 생명과학
1. 유전체 김남순/한국생명공학연구원
2. 단백질체 양은경/한국과학기술연구원
3. 세포체 김장환/한국생명공학연구원
4. 대사체 정봉철/한국과학기술연구원
5. 시스템생물 김도한/광주과학기술원
6. 구조생물 류성언/한양대학교
7. 뇌과학 선웅/고려대학교
8. 노화 권기선/한국생명공학연구원
제2절 보건의료
1. 합성신약 이선경/한국화학연구원
2. 바이오의약품 김재은/한독약품
3. 바이오장기 정준호/서울대학교
4. 진단 및 의료기기 유규하/성균관대학교
제3절 농림축산식품
1. 농림 한지학/농우바이오
2. 축산 김남형/충북대학교
3. 식품 신동화/전북대학교
제4절 환경·해양수산
1. 환경 생명공학 김태성/국립환경과학원
2. 해양 생명공학 이정현/한국해양과학기술원
제5절 바이오 공정 및 융합
1. 생물공정 이홍원/한국생명공학연구원
2. BT+ICT 김운봉/한국생명공학연구원
3. BT+NT 정봉현/한국생명공학연구원
제6절 생명자원(생명연구자원) 장영효/한국생명공학연구원
제7절 생명공학 인프라 이강우/한국산업기술평가관리원
제8절 주요현안
1. 감염병 대응 송대섭/고려대학교
2. 외상 후 스트레스 장애 류인균/이화여자대학교
제5장 생명공학 관련 법제도 현황
제1절 바이오안전성 동향 장호민/한국생명공학연구원
제2절 생명윤리 동향 백수진/생명윤리정책연구원
제3절 생명공학 지적재산권 제도 동향 박정웅/특허청
제4절 생명공학 제품 인허가 현황과 과제 신준수/식약처
제5절 생명공학 기업 현황과 지원제도 오기환/한국바이오협회
부 록
1. 생명공학 연표 생명공학정책연구센터
2. 생명공학 주요통계 생명공학정책연구센터
3. 생명공학 관계법령 생명공학정책연구센터
4. 생명공학 용어 정리 생명공학정책연구센터
5. 생명공학의 정의 및 범위 생명공학정책연구센터

공동위원장 이진규 미래창조과학부 기초원천연구정책관 문병석 국가과학기술심의회 생명의료전문위원장 위원 염영일 한국생명공학연구원 부원장 허광래 한국연구재단 단장 이승규 한국바이오협회 전무 최윤희 산업연구원 팀장 권영근 연세대학교 교수 한용만 한국과학기술원 교수 김은정 한국과학기술기획평가원 실장 권석민 미래창조과학부 생명기술과장 간사 김흥열 생명공학정책연구센터장 실무작업팀 오판동 미래창조과학부 생명기술과 사무관 문성훈 생명공학정책연구센터 총괄팀장 이지현 생명공학정책연구센터 연구원

 2015 생명공학백서 바로가기
2015 생명공학백서 바로가기
 2015 생명공학백서 바로가기
2015 생명공학백서 바로가기