2017 생명공학백서

개요
2017 생명공학백서
□ 2017 생명공학백서 발간취지
과학기술정보통신부는 생명공학 분야의 정책과 국내.외 연구동향 등을 한눈에 살펴 볼 수 있는 ‘2017 생명공학백서’를 발간하였습니다.
여덟 번째로 발간되는 올해 생명공학백서는 급변하는 환경변화와 함께 우리나라의 도전과 노력을 수록하였으며, 더불어 세계 주요국의 동향, 관련제도, R&D 성과 등 생명공학 분야의 현황과 향후 방향을 가늠할 수 있는 다양하고 유용한 정보를 담고 있습니다. 아무쪼록 이 백서를 통하여 생명공학계에는 과거를 돌아보고 앞을 내다볼 수 있는 계기가, 국민에게는 우리의 미래 먹거리인 생명공학에 대한 이해를 높이는 좋은 참고자료로 활용되기를 기대합니다.
□ 2017 생명공학백서 특징
○2015년도 생명공학백서 발간 이후, 2017년 하반기까지 진행된 국가 생명공학의 비전과 전망, 해외 생명공학 동향, 국가 생명공학 육성 정책 및 지표, 생명공학 연구개발 및 산업현황 등을 수록
- ‘생명공학육성기본계획(정책)’, ‘4차 산업혁명(기술)’, ‘미래의학(현장)’을 키워드로, 우리나라 생명공학 육성의 성과와 함께 최근 크게 이슈가 되고 있는 4차 산업혁명, 고령화 등 대내외적인 환경변화에 대해 조망하고 있다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
 제 4유형 : 출처표시 + 상업적 이용금지 + 변경금지
제 4유형 : 출처표시 + 상업적 이용금지 + 변경금지
이용자는 이 공공저작물을 이용할 경우 저작물의 출처표시, 비영리 목적으로만 이용가능하며 저작물의 변경 혹은 2차 저작물 작성을 금지합니다.



전세계는 지금 4차 산업혁명 시대로 접어들고 있습니다.
4차 산업혁명을 한마디로 표현하자면 ‘초연결 기반 지능화 혁명’이라고 할 수 있습니다. 즉 초연결 지능화 인프라인 DNA(Data, Network, AI)를 구축하고, 이를 모든 산업과 사회에 접목하여 생산성을 획기적으로 높여, 다양한 사회문제도 해결함과 동시에 새로운 성장동력을 만들어 나가는 것입니다. 이러한 4차 산업혁명의 핵심 분야 중 하나는 분명 융합을 통해 새로운 먹거리와 일자리를 창출하는 바이오가 될 것입니다.
바이오 분야에서의 융합과 혁신은 바이오 기술이 인류의 복지와 경제성장을 동시에 달성하는 바이오경제 시대의 도래를 앞당기고 있습니다. 바이오경제 시대에서 생명공학 기술은 신산업 창출 뿐 아니라 고령화, 감염병, 안전한 먹거리 등 사회문제 해결 등 경제 전반에 새로운 변화를 촉발하는 기반기술(Enabler)입니다. 따라서 우리는 앞으로 생명공학을 연구・산업의 영역에서만 다루지 않고, 경제 전반의 관점에서 논의해 나가야 할 것입니다.
정부는 작년 9월, 다가올 바이오경제 시대에 대비하기 위해 ‘바이오경제 혁신전략 2025(제3차 생명공학육성기본계획)’를 수립하여 글로벌 바이오 강국 실현을 위한 향후 10년간의 범부처 로드맵을 제시한 바 있습니다. 특히 글로벌 최초 기술을 만드는 혁신적 R&D를 촉진하고, R&D에서 사업화까지 일원화된 지원을 제공하며, 글로벌 수준으로 규제를 혁파하는 데 모든 부처가 합심하여 국가적인 바이오 생태계를 조성하고자 합니다.
여덟 번째로 발간되는 올해 생명공학백서는 급변하는 환경변화와 함께 우리나라의 도전과 노력을 수록하였으며, 더불어 세계 주요국의 동향, 관련제도, R&D 성과 등 생명공학 분야의 현황과 향후 방향을 가늠할 수 있는 다양하고 유용한 정보를 담고 있습니다. 아무쪼록 이 백서를 통하여 생명공학계에는 과거를 돌아보고 앞을 내다볼 수 있는 계기가, 국민에게는 우리의 미래 먹거리인 생명공학에 대한 이해를 높이는 좋은 참고자료로 활용되기를 기대합니다.
끝으로 백서 발간을 위해 수고해 주신 각 분야 전문가 여러분 및 관계자께 감사의 말씀을 드립니다.
유영민
![]()
2017년 과학기술정보통신부 장관


4차 산업혁명이라는 거대한 물결의 흐름 속에서 우리가 바이오에 주목하는 이유는 저성장・고실업의 뉴노멀시대를 타개할 새로운 성장 동력이자, 보건・의료, 에너지, 환경, 식량 등 인류의 4대 난제를 해결함으로써 인류의 건강과 경제성장이라는 두 가지 목표를 달성할 수 있는 해법이기 때문입니다.
OECD는 이미 2009년에 ‘바이오경제 2030’ 보고서를 통해 다양한 기술과 생명공학기술의 융합으로 2030년경 글로벌 경제에 대규모 변화를 가져오는 ‘바이오경제시대’가 도래할 것으로 예견한 바 있으며 한 글로벌 시장조사업체가 2015년 미국 주요 산업의 영업이익률을 분석한 결과, 바이오산업이 30.2%로 주요 업종 중 1위를 기록했다는 결과를 보면 글로벌 경제가 이미 바이오경제시대에 진입했다는 사실을 실감할 수 있습니다.
또한 최근 4차 산업혁명을 통해 산업 간의 융합이 활발해지면서 바이오경제시대 진입속도가 빨라짐에 따라 바이오경제시대의 주도권을 잡기 위한 세계 각국의 경쟁이 치열해지고 있는 상황입니다.
급속하게 변하는 환경 속에서 바이오산업은 혁신적인 R&D 성과가 시장의 성공으로 이어지는 과학기술 집약적 산업이자, 타 기술과의 융합을 통해 신기술・신산업 창출이 가능한 분야이기 때문에 국가 신성장동력으로 급부상하고 있습니다.
이에 정부는 2017년 바이오경제시대를 실현하기 위한 제3차 생명공학육성기본계획을 수립하였습니다. 이 생명공학육성기본계획의 추진이 바이오산업의 양분이 되어 신성장동력으로써 우리나라가 바이오강국으로 성장하는 데 기여할 수 있기를 바랍니다.
과학기술정통부에서 발간하는 ‘2017 생명공학백서’에서는 생명공학 분야의 주요 이슈, 정책추진 현황, 연구개발 및 산업 동향과 전망 등 방대한 생명공학 정보를 체계적으로 종합하여 수록하였습니다. 생명공학분야의 종합 안내서 기능을 하는 이 백서를 통해 관련 분야 전문가는 물론 일반인들에게도 매우 유용한 자료가 되리라 생각됩니다.
다시 한 번 생명공학백서 발간을 축하드리며, 그동안 수고를 해 주신 과학기술정보통신부 및 생명공학정책연구센터 관계자 분들과 집필에 참여하신 모든 전문가 분들께 심심한 감사의 말씀을 드립니다.
감사합니다.
오구택
![]()
2017년 생명공학백서 편찬위원장


21세기 바이오경제 시대를 주도할 생명공학기술은 경제발전과 삶의 질 향상을 동시에 성취할 수 있는 4차 산업혁명의 핵심 기술 분야입니다.
전 세계적으로 파괴적인 기술혁신과 기술간 융합으로 산업간 경계가 허물어지고 있으며 입니다. 줄기세포치료제와 유전자치료제 등 첨단 바이오의약품 시장은 연평균 10% 이상으로 성장할 전망이며, 유전체 기반 맞춤의료 연구성과들이 실용화 되면서 정밀의료 서비스 시장도 급속하게 확대되고 있습니다.
생명공학기술은 개발까지 오랜 기간이 걸리는 고위험 고수익 분야이며, 우수 R&D 성과가 시장에서 성공으로 연결되는 과학기술 집약적인 산업입니다. 또한 인류의 삶에 직접적인 영향을 미칠 수 있는 분야인 만큼 우수성과 창출을 위한 다각도의 노력이 필요합니다.
이를 위해, 한국생명공학연구원은 초일류 바이오 R&D 국가 중심기관으로서 개방형 융합연구를 통하여 국가 사회적 현안을 해결하고, 역동적이고 유연한 연구 환경・문화 조성으로 바이오 경제시대를 주도해 나가도록 할 것이며, 더 나아가 사람 중심의 따뜻한 과학기술로 “안전하고 풍요로운 무병장수의 꿈”을 실현하기 위하여 최선의 노력을 다하겠습니다.
과학기술정보통신부에서 발간하는 ‘2017 생명공학백서’는 국내외 생명공학 정책동향, 분야별 연구개발 및 산업동향, 관련 법과 제도 등이 담겨 있어 생명공학에 대한 종합적인 안내서 기능 뿐 아니라 일반 국민들의 생명공학에 대한 이해의 폭을 넓히고 인식을 제고하는데 큰 역할을 할 것으로 기대합니다.
다시 한 번 2017 생명공학백서의 발간을 축하드리며 집필에 참여하신 전문가분들께 감사의 말씀을 전합니다.
감사합니다!
장규태
![]()
2017년 한국생명공학연구원 원장


지난해 1월 스위스에서 열린 세계경제포럼에서 클라우스 슈밥 회장이 그의 저서 ‘4차 산업 혁명의 충격’을 처음 인용하면서, 우리나라는 지금 그 어느 나라보다도 빠른 4차 산업혁명의 급물살을 타고 있습니다. 슈밥 회장의 말처럼 4차 산업혁명의 핵심은 물리학과 디지털 그리고 생물학 사이에 놓인 경계를 허물고 기술적 융합을 이루는 것입니다. 결과적으로 생명공학 분야 에서는 생물학 기반의 바이오 융합이 산업계 전반으로 가속화 될 전망입니다.
이렇듯 바이오경제가 주축이 될 4차 산업혁명의 시대를 위한 바이오 융합이 가장 활성화된 분야는 바이오의약품입니다. 바이오의약품은 기존의 합성 의약품과 달리 생물학 기술을 접목해 그 구조가 복잡하고 생산과 공정이 어렵습니다. 때문에 전 세계 제약산업계는 바이오의약품의 효율적인 생산 유통을 위한 구조개선에 노력을 기울이고 있습니다. CMO(생산 대행기업), CRO(연구 대행기업), CSO(판매 대행기업) 등 가치사슬을 기준으로 분업화가 활성화되고 있으며, 바이오의약품 개발에 드는 막대한 비용과 리스크를 감당하기 위해 기업 간의 오픈 이노베이션이 화두입니다. 이렇듯 경쟁과 협업을 동시에 진행함으로써 획기적인 성장이 기대되는 분야입니다.
또 하나 주목해야 할 분야는 개인 유전정보를 활용한 개인별 맞춤형 정밀의학 분야입니다. 그 동안 과학분야 학문으로만 연구돼오던 유전체 분야도 산업화가 가시화 되었습니다.
글로벌에서는 23앤드미가 올 초 소비자가 직접 의뢰하는 유전자분석서비스(DTC)에 대한 FDA의 허가를 받으면서, 전 세계 유전체 산업 시장의 문을 두드리고 있습니다. 국내 산업계에서도 마크로젠을 필두로 이원다이애그노믹스, 테라젠이텍스, 천랩 등이 차별화된 유전자 분석 서비스로 시장을 공략 중입니다.
그러나 유전체 분석시장과 같이 기존에 없던 새 시장을 여는 데는 정부의 강력한 규제 개혁이 필요합니다. 현재, 국내의 강력한 개인정보보호법 등으로 인해 산업화의 한계와 맞서기 위해 유전체 분석기업들이 고군분투 중입니다. 산업계와 학계가 함께 관심을 가지고 헤쳐 나가야 할 몫입니다.
올해 새 정부가 들어서면서 바이오산업계는 바이오산업화 활성화를 위해 정부와 어떻게 협조해나갈 수 있을지 고민과 함께 큰 기대를 갖고 있습니다. 정부의 기조가 일자리 창출에 강력한 목표를 두고 있는 것은 산업계가 매우 환영해야 할 대목입니다. 바이오분야의 활발한 창업이 청년 일자리 창출에 가장 큰 기여를 할 것입니다.
바이오 산업계를 대표하는 한국바이오협회는 바이오분야 산업화의 지평을 열 수 있도록 기업들을 독려하고 지원하는 역할을 수행하고 있습니다. 단백질 의약품, 세포치료제, 유전자 치료제, 생물학 제제 등의 바이오의약품은 물론, 유전체 분석산업, 체외진단 산업, 줄기세포치료제 분야 등 바이오신산업계 전반을 아우르며, 기업과 정부의 가교 역할을 통한 산업화 창출에 노력을 기울이고 있습니다.
또한, 해당 분야들의 R&D 지원과 벤처창업 지원을 통한 바이오산업계 생태계 조성을 위한 노력을 통해 정부의 많은 관심을 유도해 내기도 했습니다. 이제는 산업화를 시작한 우리 기업들이 보다 큰 시장인 글로벌로 진출할 수 있도록 한중일 3국간의 바이오 협력 네트워크를 통한 아시아 시장 공략과 함께 미국 바이오 및 유럽 바이오 행사 등을 지원해 국내 기업을 해외에 소개하는 활동도 함께 진행하고 있습니다.
이번에 새로 국내 생명공학 및 바이오산업 발전과정의 기록물인 『생명공학백서』가 발간된 것을 축하드립니다. 그간의 정부지원을 통한 성과, 산업 및 연구개발 동향, 그리고 향후 비전과 전망 등이 잘 정리되어 있어 국내 바이오산업계에 아주 유용한 자료로 활용될 것입니다.
『2017 생명공학백서』의 발간을 축하 드리며, 소중한 백서 발간을 위해 애쓰신 관계자 분들과 집필에 참여해 주신 전문가 분들께 진심으로 감사드립니다.
서정선
![]()
2017년 한국바이오협회 회장
사진으로 보는 바이오
정부 정책 수립
![]()
![]() 바이오특별위원회
바이오특별위원회
|
제1회 바이오특별위원회 (2016.3.22.)
|
회차 |
일시 |
안건 |
|
제1회 |
2016.3.22 |
∙바이오특별위원회 운영방안 ∙제2차 국가 감염병 위기대응 기술개발 추진전략(’17∼’21) ∙바이오 현안 이슈 및 주요 아젠다 |
|
|
제2회 |
2016.5.25 |
∙바이오 중기 육성전략(안) ∙바이오 창조경제 10대 활성화 프로젝트 추진방안 ∙바이오 미래전략(Ⅰ・Ⅱ) 이행실적 점검 |
|
|
제3회 |
2016.10.10 |
∙바이오신약 국가전략프로젝트 추진현황 및 계획(안) (미래부) ∙정밀의료 국가전략프로젝트 추진현황 및 계획(안) (복지부) ∙‘바이오 중기(’16∼’18)육성전략' 1차 실적점검 결과(안) (관계부처합동) ∙우수기업연구소지정제도 추진계획(안) (미래부) ∙글로벌 바이오 전시회 범부처 공동참가 계획(안) (관계부처합동) |
|
|
제4회 |
2017.1.17 |
∙바이오의약품 규제관리 선진화 방안(안) (식약처) ∙포스트게놈 다부처 유전체사업 추진 개선 계획(안) (관계부처합동) ∙2017년 바이오특별위원회 운영 계획(안) (미래부) ∙농생명 소재산업 육성방향(안) (관계부처합동) |
|
|
제6회 |
2017.9.18 |
∙바이오경제 혁신전략 2025(안) (관계부처합동) ∙AI・구제역 대응 범부처 R&D 추진 전략(안) (관계부처합동) ∙바이오 중기 육성전략 2차 실적점검 결과(안) (관계부처합동) ∙생명윤리법 바이오 R&D 규제 현황 (과기정통부) |
제3회 바이오특별위원회(2017.10.10.)
|
|
|
|
홍남기 미래부 1차관이 인천 송도에 위치한 바이오기업을 찾아 생산시설을 직접 둘러보면서 기업인들로부터 바이오산업의 발전 방향과 애로사항을 청취하고 있다. |
출처: 과학기술정보통신부
![]() 제3차 생명공학육성기본계획 수립
과학기술기반 바이오경제 혁신전략2025
제3차 생명공학육성기본계획 수립
과학기술기반 바이오경제 혁신전략2025
바이오경제 혁신 정책 대토론회(2017.9.15.)
|
|
|
|
과학기술정보통신부(장관 유영민)는 바이오경제 혁신전략 2025(제3차 생명공학육성기본계획, ’17∼’26) 수립을 위한 대국민 의견수렴 정책 대토론회를 국회와 공동으로 개최하였다.
|
제29회 생명공학종합정책심의회(2017.9.27.)
|
|
|
|
과학기술정보통신부는 제29회 생명공학종합정책 심의회를 개최하고, 제3차 생명공학육성기본 계획(바이오경제 혁신전략 2025, ’17∼’26)를 심의・의결하였다. 이번 계획은 국정과제 「고부가가치 창출 미래형 신산업 발굴・육성」의 일환으로 추진되며, 대한 민국 혁신성장과 4차 산업혁명의 한 축을 담당할 바이오산업 육성을 위한 향후 10년간의 청사진을 제시하고 있다. |
출처: 과학기술정보통신부
![]() 농식품부, 핵심 개혁과제 의견수렴 및 현장방문
-ICT 융복합 스마트팜, 5차 산업화 등(2016.1.6.)
농식품부, 핵심 개혁과제 의견수렴 및 현장방문
-ICT 융복합 스마트팜, 5차 산업화 등(2016.1.6.)

출처: 원예산업신문, 2016.01.11. http://m.wonyesanup.co.kr/news/articleView.html?idxno=32355
![]() 농림축산식품부(이동필 장관)는 빅데이터에 기반한 국산 생육관리 소프트웨어 조기 개발 방안, 스마트 팜 신축과 규모 확대에 수반되는 농가의 자본
투자 부담 완화 방안 등을 논의하고 6차산업 경영체로부터 제품판로, 창업 및 사업자금 부족, 현장규제 등 정책수요자들의 의견을 수렴하고 있다.
농림축산식품부(이동필 장관)는 빅데이터에 기반한 국산 생육관리 소프트웨어 조기 개발 방안, 스마트 팜 신축과 규모 확대에 수반되는 농가의 자본
투자 부담 완화 방안 등을 논의하고 6차산업 경영체로부터 제품판로, 창업 및 사업자금 부족, 현장규제 등 정책수요자들의 의견을 수렴하고 있다.
![]() 바이오창조경제 10대 활성화를 위한 간담회 개최(2017.12.6.)
바이오창조경제 10대 활성화를 위한 간담회 개최(2017.12.6.)
|
출처: 과학기술정보통신부 |

바이오산업 활성화의 핵심 축인 병원을 대상으로 미래부의 바이오 정책을 소개하고 현장의 생생한 소리를 청취해 차기 사업에 반영하기 위해 마련
분야별 주요 활동
![]()
![]() 국회-과총 바이오경제포럼
국회-과총 바이오경제포럼
|
회차 |
일시 |
안건 |
|
국회 제32회-과총 제1회 |
2017.5.18 |
신정부 바이오 과학기술 발전방향-바이오 R&D 성과, 현황 및 미래전략 |
|
국회 제33회-과총 제2회 |
2017.6.30 |
재생의료의 규제 합리화 |
|
국회 제34회-과총 제4회 |
2017.8.22 |
바이오산업 활성화: 공공 및 민간 투자전략 |
|
국회 제35회-과총 제6회 |
2017.9.11 |
바이오안전성 대중커뮤니케이션, 무엇이 문제인가? |
|
국회 제36회-과총 제7회 |
2017.9.28 |
맞춤 의료의 꽃, 분자진단산업・핵심이슈 및 전략 |
|
국회 제37회-과총 제8회 |
2017.11.3 |
바이오 의약품의 스마트 규제 |
|
국회 제38회-과총 제9회 |
2017.12.7 |
바이오 R&D 혁신을 위한 생명윤리법 개정 방향 |
|
제1회 과총바이오 경제포럼 (2017.5.18.)
|
|
|
제4회 과총바이오 경제포럼 (2017.8.22.)
|
출처: 한국과학기술단체총연합회, https://www.kofst.or.kr/bbs.bit
|
![]() 생명윤리 관련
생명윤리 관련
4차 산업혁명 시대에 생명윤리 정책방향 공청회(2017.8.30.)
출처: 보건복지부
출처: 디지털타임스, 2017.8.30., ttp://www.dt.co.kr/contents.html?article_no=2017083002109976029002


![]() 보건복지부는(장관 박능후)는 4차 산업혁명 기술 발전에 따른 생명윤리 정책방향을 모색하고자 이 공청회를 개최하였으며, ‘첨단
보건복지부는(장관 박능후)는 4차 산업혁명 기술 발전에 따른 생명윤리 정책방향을 모색하고자 이 공청회를 개최하였으며, ‘첨단
생명과학기술 연구 추진방향 및 사회적 책임’, ‘인공지능과 빅데이터 의료적 활용과 생명윤리’라는 두 가지 주제를 논의하였다.
바이오 R&D 혁신을 위한 생명윤리법 개정 방향(2017.12.7.)



출처: 한국과학기술단체총연합회, https://www.kofst.or.kr/bbs.bit
![]()
과학기술정보통신부는 국회의원 신용현 의원과 공동으로 이 포럼을 개최, 과학기술계
전문가들과 함께 「생명윤리 및 안전에 관한 법률」의 개정방향에 대해 논의하였다.
![]() 나고야 의정서 관련
나고야 의정서 관련
해양생명자원 ABS 정보지원센터 설치 운영(2016.10.6.)

출처: 해양생명자원 ABS 정보지원센터, http://www.mabik.re.kr/html/abs/
나고야의정서 대응 생물자원 컨퍼런스(2016.11.24.)

출처: 인천일보, 2016.11.25., http://www.incheonilbo.com/?mod=news&act=articleView&idxno=737567

출처: 환경부
![]() 환경부(장관 조경규)는 나고야의정서 시대에 발맞추어 생물자원의 활용에 관한 바이오산업계의 인식을 높이기 위해 이 행사를 개최하였다.
환경부(장관 조경규)는 나고야의정서 시대에 발맞추어 생물자원의 활용에 관한 바이오산업계의 인식을 높이기 위해 이 행사를 개최하였다.
나고야의정서 국내 이행법률 제정과 의정서 비준을 앞두고 열린 이 행사는 국내 산업계의 나고야의정서 체제 적응을 위한 지원 방법을 모색하였다.
제1회 국제 종자박람회 개최(2017.10.26∼28.)
|
출처: (주)한국농자재신문, 2017.11.06, http://www.newsam.co.kr/news/article.html?no=11576 |
출처: 한국영농신문, 2017.10.27, http://www.youngnong.co.kr/news/articleView.html?idxno=3578

농림축산식품부(장관 김영록)는 우리 품종의 우수성을 전 세계에 알리고 종자산업을 미래 성장산업으로 육성 지원하기 위해 ‘미래를 품은 씨앗’이라는 주제로 제1회 종자박람회를 개최하였다.
주요 행사
![]()
![]() 바이오미래포럼
바이오미래포럼
2016 바이오미래포럼(2016.11.7∼8., Bio Lab to Market)
|
|
|
▲ 전시관을 둘러보는 최양희 미래부 장관 |


2017 바이오미래포럼(2017.10.25∼26., 바이오경제 시대의 서막을 열며)
|
▲ 전시관을 둘러보는 임대식 과기정통부 과학기술혁신본부장 |
|
|
|
|
|
출처: http://www.bioforum.kr
![]() 과학기술정보통신부는 국내외 바이오 정책동향, 바이오생태계 활성화 방안을 논의하고자 매년 바이오미래포럼을
과학기술정보통신부는 국내외 바이오 정책동향, 바이오생태계 활성화 방안을 논의하고자 매년 바이오미래포럼을
개최하고 있으며, 연구개발(R&D) 연계성과 창출을 위한 연구자, 투자자, 기업간 교류의 장도 함께 마련하고 있다.
![]() 바이오기술 국제표준화기술위원회-서울(2017.5.13.)
바이오기술 국제표준화기술위원회-서울(2017.5.13.)

출처: 연구소재은행 웹진, http://www.knrrc.or.kr/webzine/vol.19/sub1/news.jsp?index=3&idx=1-1

출처: 산업부 보도자료 2017.5.11.
ISO/TC 276 조직
|
ISO/TC276(바이오기술) 개요 ◦(작업범위) 바이오산업의 용어, 바이오뱅크 및 바이오자원, 분석방법, 바이오공정, 정보처리 및 통합 등에 관한 표준화 ◦(회원국) 41개국 (P회원 28개국, O회원국 13개국) -간사국 : 독일(DIN) / 의장 : Mr. Ricardo Gent ( ∼2019, 독일) -P 회원국 : 한국, 독일, 프랑스, 미국, 일본, 중국 등 -O 회원국 : 노르웨이, 스페인, 폴란드, 네덜란드 등 ◦(표준활동) 11종 개발 중 ◦(조직구성) 5개의 WG 운영 ① WG1 (용어, Terminology) ② WG2 (바이오뱅크 및 바이오자원, Biobanks and Bioresources) ③ WG3 (분석방법, Analytical methods) ④ WG4 (바이오공정, Bioprocessing) ⑤ WG5 (정보처리 및 통합, Data processing &Integration) * 그룹별 컨비너: WG1(독일), WG2(프랑스), WG3(미국), WG4(일본), WG5(독일과 중국) |
![]() 2017년 글로벌 바이오 콘퍼런스(2017.6.26∼30.)
2017년 글로벌 바이오 콘퍼런스(2017.6.26∼30.)
|
|
|
◀ 식품의약품안전처(손문기 처장)가 주최하고 한국바이오의약품협회가 주관하는 이 콘퍼런스는 ‘4차 산업혁명의 중심, 바이오 의약품’이라는 주제로 개최되었다. |
|
|
|
◀ 문재인 대통령 축사 영상 |
출처: 식품의약품안전처 출처: 글로벌바이오콘퍼런스, http://www.gbckorea.kr
![]() 글로벌 인재포럼
글로벌 인재포럼
글로벌 인재포럼 2016(2016.11.4~5.)


출처: 글로벌 인재포럼, http://www.ghrforum.org
![]() 교육부(이준식 장관)는 ‘꿈, 도전 그리고 창조(Let's Dream, Challenge and Create)’라는 주제로 글로벌 인재포럼 2016을 개최하였다.
교육부(이준식 장관)는 ‘꿈, 도전 그리고 창조(Let's Dream, Challenge and Create)’라는 주제로 글로벌 인재포럼 2016을 개최하였다.
글로벌 인재포럼 2017(2017.10.31~11.2.)



출처: 교육부
![]() 교육부(김상곤 장관)는 ‘우리가 만드는 미래(Future in Your Hands)’라는 주제로 글로벌 인재포럼 2017을 개최하였다. 이 행사는
교육부(김상곤 장관)는 ‘우리가 만드는 미래(Future in Your Hands)’라는 주제로 글로벌 인재포럼 2017을 개최하였다. 이 행사는
12회째를 맞는 국제적 행사로 지구촌이 공동으로 직면하고 있는 문제의 해결을 위한 인재 육성 방안을 논의하는 국제포럼이다.
![]() 바이오코리아
바이오코리아
2016 바이오코리아(2016.3.30∼4.1.)







![]() 바이오코리아 2016을 통해 대한민국 바이오헬스산업의 현황과 미래 발전
바이오코리아 2016을 통해 대한민국 바이오헬스산업의 현황과 미래 발전
방향을 논의하고 바이오헬스 산업이 미래 먹거리 산업임을 실감하였다.
2017 바이오코리아(2017.4.12∼14.)






출처: http://www.biokorea.org
![]() 한국보건산업진흥원(원장 이영찬)과 충청북도(도지사 이시종)의 공동주최로 열린 바이오코리아 2017은
한국보건산업진흥원(원장 이영찬)과 충청북도(도지사 이시종)의 공동주최로 열린 바이오코리아 2017은
12회째를 맞았으며 이번 행사에는 47개국, 630여 개 기업, 24,000여 명이 참가 및 방문했다.
![]() BIO International Convention
BIO International Convention
2016 BIO International Convention(2016.6.6∼9.)


출처: https://ct.wolterskluwer.com/resource-center/events/tradeshow-bio-international-convention-2016

출처: https://medcitynews.com/2016/06/bio-2016-synthetic-biology/?rf=1

출처: https://best-storageprocess.com/blog/2016-bio-international-convention/

출처: http://www.tsnn.com/news/2016-bio-international-convention-sets-new-record-partnering-meetings



출처: KOTRA 실리콘밸리 무역관, nstands.com 제공


출처: http://kddf.org/bbs/bbs.asp ?no=65&mode=view&IDX=1387&p=1&CateId=35

출처: http://www.ebn.co.kr/news/view/834583
2017 BIO International Convention(2017.6.19∼22.)

출처: KOTRA 해외시장뉴스
![]() BIO 2017의 기조연설을 맡은 마이크 카메론 전 영국 총리
BIO 2017의 기조연설을 맡은 마이크 카메론 전 영국 총리


출처: convention.bio.org
▲ 숫자로 보는 BIO 2017

출처: 아시아경제, 2017.6.21, http://www.asiae.co.kr/news/ view.htm?idxno=2017062105050695528
2016년 주요연구성과
국가연구개발 우수성과 100선의 ‘생명・해양’ 분야에 선정된 성과를 기준으로 소개
◉ 2016년 국가연구개발 우수성과 100선 中 생명・해양 분야
|
일련 번호 |
성과분과 |
부처 |
성과명 |
연구자 |
소속기관 |
비고 |
|
1 |
생명해양 |
복지부 |
지속형 당뇨병 치료제 HM11260C(Efpeglenatide)개발 |
권세창 |
한미약품㈜ |
장관표창 |
|
2 |
생명해양 |
미래부 |
복합적인 기억 억제 기작 규명, 무선 생체 광 자극기 개발, SHANK2 유전자가 결실된 자폐증 모델 형질전환마우스 개발 |
강봉균 |
서울대학교 |
장관표창 |
|
3 |
생명해양 |
미래부 |
기후변화 대응 바이오기반 화학물질 생산을 위한 산업미생물 개발 전략 개발 |
이상엽 |
한국과학 기술원 |
|
|
4 |
생명해양 |
미래부 |
해양생물체의 수중접착, 오징어 빨판 구조 동시 적용 친환경 방오소재 개발 |
황동수 |
포항공과 대학교 |
|
|
5 |
생명해양 |
산자부 |
비소세포성폐암 내성치료제 항암신약 HM61713 개발 |
서귀현 |
한미약품㈜ |
|
|
6 |
생명해양 |
미래부 |
종양 미세환경을 표적으로 하는 항암 전략 |
서영준 |
서울대학교 |
|
|
7 |
생명해양 |
산자부 |
혁신 신물질제초제 Tiafenacil 개발 및 기술이전 |
고영관 |
한국화학 연구원 |
|
|
8 |
생명해양 |
농진청 |
풀사료 이용 효율 극대화를 위한 내재해성 사료 작물 신품종 개발 및 산업화 |
지희정 |
국립축산 과학원 |
|
|
9 |
생명해양 |
산자부 |
유방암 치료용 바이오베터 의약품 개발을 위한 ADC 원천 기술 (NexMab) 개발 및 기술이전 |
박순재 |
㈜알테오젠 |
|
|
10 |
생명해양 |
해수부 |
천리안 위성영상을 활용한 해양현안분석정보 서비스 |
박영제 |
한국해양과학기술원 |
|
|
11 |
생명해양 |
미래부 |
해양 공생생물의 발현 유전체 연구를 통한 적조 원인 규명 |
김광훈 |
공주대학교 |
|
|
12 |
생명해양 |
미래부 |
암표적 유전자(CAR)를 이용한 항암치료제 개발 및 미국으로 기술이전 |
유승신 |
㈜바이로메드 |
|
|
13 |
생명해양 |
복지부 |
진통치료제 개량신약 개발 |
이홍우 |
대원제약 주식회사 |
|
|
14 |
생명해양 |
미래부 |
화학효소적 방법을 통한 신규 당화 마크로락탐 항생제 최초합성 |
윤여준 |
이화여자 대학교 |
|
|
15 |
생명해양 |
해수부 |
어패류 항균펩타이드 이용 항생제 대체소재 개발 |
남보혜 |
국립수산 과학원 |
|
|
16 |
생명해양 |
해수부 |
뱀장어 인공종묘생산기술 개발 |
김대중 |
국립수산 과학원 |
|
|
17 |
생명해양 |
농진청 |
토종 곰팡이 억제 젖산균 이용 사일리지 품질 저장성 향상 및 산업화 |
최기춘 |
국립축산 과학원 |
|
|
18 |
생명해양 |
해수부 |
수산물 원산지 판별용 유전자 감식 기술개발 |
강정하 |
국립수산 과학원 |
|
|
19 |
생명해양 |
미래부 |
젖산에 의한 세포신호전달체계 규명 |
염영일 |
한국생명 공학연구원 |
|
|
20 |
생명해양 |
미래부 |
해마 신경망 모방 웨어러블 신경신호 활용 기술 |
신현출 |
숭실대학교 |
|
|
21 |
생명해양 |
식약처 |
축산물 안전관리 강화를 위한 잔류동물의약품 시험법 개발 |
신호철 |
건국대학교 |
|
|
22 |
생명해양 |
농진청 |
동물의 인도적 안락사 및 친환경적 동물사체 액상화 처리기술 개발 |
강석진 |
국립축산 과학원 |
|
2017년 주요연구성과
국가연구개발 우수성과 100선의 ‘생명・해양’ 분야에 선정된 성과를 기준으로 소개
◉ 2017년 국가연구개발 우수성과 100선 中 생명・해양 분야
|
일련 번호 |
성과분과 |
부처 |
성과명 |
연구자 |
소속기관 |
비고 |
|
1 |
생명해양 |
과기 정통부 |
바이러스를 제어하는 콩단백질 |
권요셉 |
한국기초과학 지원연구원 |
|
|
2 |
생명해양 |
과기 정통부 |
마이크로RNA 생성 열쇠, 드로셔 단백질 3차원 구조 규명 |
김빛내리 |
기초과학 연구원 |
|
|
3 |
생명해양 |
과기 정통부 |
단백질-단백질 상호작용 조절을 위한 천연물 유래 독점적 구조기반의 분자다양성 확보 |
박승범 |
서울대학교 |
|
|
4 |
생명해양 |
과기 정통부 |
의료용 바이오 플라스틱 PLGA 생산 미생물 개발 |
이상엽 |
한국과학 기술원 |
|
|
5 |
생명해양 |
과기 정통부 |
유전자가위 Cpf1 기술적용 생쥐 유전자 편집 성공 |
이상욱 |
서울아산병원 |
|
|
6 |
생명해양 |
과기 정통부 |
노화된 조혈줄기세포를 회춘시키는 기술 개발 |
최인표 |
한국생명공학 연구원 |
|
|
7 |
생명해양 |
농식품부 |
기능성 천연 감미료 소재 글로벌 상용화 기술 개발 |
김성보 |
씨제이 제일제당(주) |
|
|
8 |
생명해양 |
농식품부 |
내병성이 뛰어난 양배추 품종개발로 해외 수출시장 개척 |
안경구 |
농업회사 법인 조은종묘㈜ |
|
|
9 |
생명해양 |
농식품부 |
한국을 넘어 세계로 향하는 국산 종자의 힘 ‘라온파프리카’ |
안철근 |
경남농업 기술원 |
|
|
10 |
생명해양 |
농식품부 |
고기능성 및 저장성이 우수한 토마토 품종 개발로 내수 및 수출 증대에 기여 |
원동찬 |
농업회사법인 ㈜농우바이오 |
|
|
11 |
생명해양 |
농식품부 |
난용성 소재의 가용화 기술개발을 통해 기능성 식품의 신시장 창출 |
장판식 |
서울대학교 |
|
|
12 |
생명해양 |
산업부 |
골질불량 부족골질 환자를 위한 치주조직 재건 시스템 구축 |
송주동 |
오스템 임플란트㈜ |
|
|
13 |
생명해양 |
복지부 |
비알콜성 지방간염 대상 복합제 글로벌 개발 기술수출 |
김미경 |
동아ST |
|
|
14 |
생명해양 |
복지부 |
시공간적 유전체 분석 및 약물 스크리닝 적용을 통해 맞춤치료의 임상 효과 입증 |
남도현 |
삼성서울병원 |
|
|
15 |
생명해양 |
복지부 |
류마티스질환 원인 유전변이의 세계 최초 규명 및 치료제 제시 |
배상철 |
한양대학교 |
|
|
16 |
생명해양 |
복지부 |
국내 플랫폼 기술을 기반으로 한 지속형 만성신부전 빈혈치료제의 개발 및 기술 수출 |
우정원 |
㈜제넥신 |
|
|
17 |
생명해양 |
해수부 |
양식생산성 향상을 위한 친환경 미생물제제 개발 및 산업화 |
김영옥 |
국립수산 과학원 |
|
|
18 |
생명해양 |
해수부 |
해양경제 영토 확보 |
문재운 |
한국해양과학기술원 |
|
|
19 |
생명해양 |
농진청 |
배 산업 활로 개척을 위한 차세대 유망 품종 개발 및 보급 –빠른 성숙 껍질째 먹고, 병에 강한 맛 좋은 우리배 삼총사 개발 보급 |
김윤경 |
국립원예 특작과학원 |
|
|
20 |
생명해양 |
농진청 |
식물성 에스트로겐 고함유 콩잎 생산기술 |
박기훈 |
경상대학교 |
|
|
21 |
생명해양 |
농진청 |
세계시장 석권, 접목선인장 품종 개발과 수출 |
박필만 |
국립원예 특작과학원 |
|
|
22 |
생명해양 |
농진청 |
세계최초, 삼채의 신기능성 구명 및 맞춤형 제품 개발 |
이성현 |
국립농업 과학원 |
|
|
23 |
생명해양 |
농진청 |
약제내성 및 잠복 결핵균치료를 위한 신약후보물질(Ecumicin)의 발견과 응용 탐색 기술 개발 |
이한기 |
명지대학교 |
|
특집
지난 10년간의 기록:
생명공학육성기본계획
4차 산업혁명과 더불어 미래에 인류의 난제를 해결하고 경제성장을 이끌 새로운 경제 패러다임으로서 바이오경제 시대가 다가오고 있다. 바이오경제는 바이오기술을 통해 고령화 대비, 질병 극복 등 건강한 삶을 유지하고, 풍요롭고 안전한 먹거리와 쾌적한 환경을 제공하여 인류의 복지와 경제성장을 동시에 달성하는 새로운 경제 패러다임이다.
글로벌 바이오 시장은 반도체, 자동차, 화학제품 등 3대 산업 합계 규모를 뛰어 넘어 급성장을 지속할 것으로 전망하고 있으며, 수출 주도형 경제 구조를 지닌 우리나라가 바이오산업을 차세대 주력산업으로 육성하는 것은 선택이 아닌 필수이자 생존의 문제이다. 또한 바이오산업은 건강・식품・에너지 등 지속적 수요가 보장되는 안정적 산업이며 취업 유발계수가 큰 고용집약적 산업으로 양질의 일자리 창출이 가능할 것으로 보인다. 이런 고령화 대비, 새로운 성장동력 확보 등을 위해 바이오경제시대에 적합한 국가 차원의 바이오 육성 전략 수립이 필요한 시점이다.
해외 주요국에서는 국가차원의 바이오경제 청사진을 마련하고, 유망혁신 기술의 선점과 시장 선도를 위한 경쟁이 이미 본격화 되고 있다.
미국은 국가 바이오경제 청사진(2012) 수립과 대형 이니셔티브 추진을 통해 글로벌 시장과 선도 기술의 선점을 추진하고 있으며 정부・민간의 R&D 투자 활성화를 토대로 글로벌 시장에서 높은 점유율(42%, 2016)을 보이며 글로벌 바이오 기술과 산업을 주도하고 있다.
EU는 사회문제 해결과 공공-민간협력 기반 R&D 혁신을 위해 지속가능한 바이오경제(2012) 혁신 전략과 EU Horizon 2020(2014∼2020)을 수립하였다. 바이오 기술을 통한 글로벌 문제 해결과 지속가능한 바이오 경제 시대 구축을 위해 대형 프로젝트를 추진하고 있으며, 정부 주도의 고위험 공유 투자 형태인 EIF(유럽투자펀드) 운영과 공공-민간 협력 프로그램(Joint Tech Initiative, 172억 유로) 추진을 통해 민관 협업과 랩 투 마켓(Lab to Market)을 활성화 하고 있다.
일본은 고령화 문제 해결과 경제발전을 위한 차세대 성장 동력으로 재생의료 등 바이오・의료 분야를 선정하여 혁신적인 정책과 제도를 지원하고 있으며 저출산・초고령화 시대를 대비한 의료분야의 실용화와 지원의 일원화를 위한 통합 거버넌스 AMED(일본의료연구개발기구)를 설립(2015) 하고 재생의료 연구개발을 위해 고베 바이오클러스터를 중심으로 정책과 제도를 지원하는 등 과학기술혁신을 통한 국가 경쟁력을 확보하기 위해 주력하고 있다.
중국은 바이오를 국가 신성장 산업으로 성장시키기 위해 정부 주도의 전략적 산업 육성 및 발전 전략1)과 함께 지속적인 대규모 투자를 하고 있으며 이를 통해 창업을 촉진하고 지역별 바이오산업기지 구축 등으로 생태계 형성을 유도하고 있다. 특히 중관촌2) 등 산・학・연 공동연구 네트워크 구축으로 바이오 산업성장에 주력하고 있다.
우리나라의 정부 차원의 생명공학육성의 시작은 1982년 과학기술부에서 생명공학을 핵심전략기술로 선정하여 특정연구개발사업으로 지원하면서부터이다. 그 이후 1983년 유전공학육성법(現 생명공학육성법)을 제정하여 정부의 생명공학육성과 지원을 위한 법적 기반을 마련하였고, 1985년 동법을 기반으로 한국과학기술연구원(KIST) 부설 유전공학센터(現 한국생명공학연구원)를 설립하여 생명공학을 본격 육성・지원하였다.
생명공학육성기본계획(이하 기본계획)은 생명공학육성법에 따라 과학기술정보통신부(이하 과기부) 등 8개 부처(교육부, 농림축산식품부, 산업통상자원부, 보건복지부, 환경부, 해양수산부, 식품의약품안전처)가 공동으로 수립하는 생명공학분야 R&D 최상위 법정계획으로 관계부처의 세부계획을 종합・체계화하여 생명공학분야를 육성하고 발전시키기 위한 국가 차원의 비전과 정책 지침을 제시한다.
기본계획은 과기부 주관 하에 관계부처 협력을 통해 수립하고 있으며 생명공학육성법에 근거하여 매년 시행계획을 수립하고 10년 단위로 기본계획을 수립, 5년 주기로 단계별 수정・보완 계획을 추진한다.
제1차 기본계획(1994∼2006)을 토대로 정부의 지원정책이 지속적으로 추진되면서 R&D 기반이 확충되었으며 인적・물적 투자증대로 과학기술경쟁력이 증가되고 기초과학 역량을 바탕으로 산업적 성과가 태동되었다.
정부의 강력한 투자의지로 제2차 기본계획(Bio Vision 2016, 2007∼2016)에서는 ‘기초연구역량 선진화’와 ‘연구개발 및 산업인프라 확충’에 대한 부처별 계획과 사업이 집중되었으며 국내 바이오산업의 산업화 기반조성과 삼성, LG, SK, 한화 등 대기업들이 헬스케어 사업에 본격적으로 참여하면서 생태계가 조성되고 산업성과가 가시화되었다.
지난 2차 기본계획을 통해 우리는 연구개발 투자 확대 및 인프라 구축 등 산업생태계 성장 기반을 확보하였다. 연구개발 투자가 약 2.2배 증가(2007년 1.5조 원→2016년 3.3조 원)하는 등 정부 차원의 적극적인 육성정책이 추진되었다.
지난 10년간(2006∼2015) 공공인프라 투자는 2조 1,851억 원 규모(시행계획 기준)로 첨복단지 조성 등 산업성장 기반을 구축하였다. 선진국과 기술격차 8.8% 축소, 석・박사인력 11만 명 배출 등의 성과를 확보하며 역량을 축적해왔다. 이 기간 동안 목표 대비 특허기술 경쟁력(응용기술역량)은 달성하였으나, 논문창출(기초・원천역량) 및 시장규모(산업 육성)는 좀 더 성장이 필요한 상황이다. 시장규모의 경우 2001년 이후 벤처 창업의 정체 등 성장률이 둔화되었으나 최근 들어 대기업의 참여, 펀드 확대, 글로벌 기술이전 성과가 나오면서 본격적인 성장을 기대하고 있다.
1차 및 2차 기본계획을 거치면서 우리는 바이오경제를 본격적으로 구현할 수 있는 기반을 다졌다고 할 수 있지만 대내외적인 환경변화를 반영하고 바이오산업의 특성에 맞는 글로벌 수준의 원천기술 개발 및 시장 창출의 필요성이 크게 대두되고 있다.

|
구분 |
1차 |
2차 |
3차 |
|
정부투자 |
•(’94)536억 →(’06)1조3,019억 (24.3배 증가) |
•(’07)1조 5,063억 →(’16)3.3조 (2.2배 증가) |
•(R&D 혁신) 글로벌을 선도하는 기술경쟁력 확보
•(바이오경제) 세계 시장 점유율 확대 및 일자리 창출
•(생태계조성) 글로벌 수준 클러스터 성장 및 국제 규제 선도 |
|
기술력지수 |
•세계 15위 |
•세계 9위 |
|
|
인력양성 |
•석박사급 56,970명 (’99∼’05누적) |
•석박사급 116,239명 (’07∼’16누적) |
|
|
산업성과 |
•바이오벤처 최초 설립 •바이오벤처 설립 붐 (500여 개) |
•대기업 본격 참여 •의약품 기술수출 8.6조(’13∼’16) •바이오제약 생산규모 세계 3위(32만 리터) |
[그림 특집-1] 생명공학육성기본계획(1・2・3차) 비교
바이오산업은 우수한 R&D성과가 바로 시장에서 성공으로 연결되는 과학・기술 집약적 산업으로, R&D가 성패를 좌우하는 가장 중요한 요소로 작용하는 산업이다. 때문에 최종 결과물인 제품의 판매에 의해서만이 아닌 R&D 과정 전체에 걸쳐 기술 창업, 기술이전, 연구개발서비스업 등의 경제 효과가 창출된다. 또한 ICT, NT 등 타 과학기술과의 융합을 통한 신기술・신산업 등 새로운 부가가치 창출이 가능하여 4차 산업혁명을 주도할 대표적 융합 분야이며 윤리・규제 문제가 함께 수반되는 산업이므로 바이오산업을 신산업으로 육성하기 위해서는 기존 규제의 틀에서 벗어나 혁신의 관점에서 新규제를 정비할 필요가 있다.
때문에 바이오에 특화된, 그리고 R&D와 혁신에 기반을 둔 산업육성책의 적극적인 추진이 필요하며, 제3차 기본계획(바이오경제 혁신전략 2025, 2017∼2025)은 바이오경제 시대의 도래에 따른 대응이 절실한 상황에서 바이오산업의 특성에 맞는 전략을 추진하고자 한다.
3차 기본계획은 고령화, 감염병, 안전한 먹거리, 기후변화 대응 등 바이오 기술에 대한 사회적 수요가 높아지고 새로운 경제 패러다임으로 바이오경제 시대의 도래가 예상되는 상황에서, 연구개발(R&D) 승자가 시장을 독식하는 과학・기술집약적 산업인 바이오를 국가 차원에서 전략적으로 육성해 바이오경제 시대를 주도하는 글로벌 강국으로 도약하기 위해 수립하였다.
이번 계획은 국정과제 ‘고부가가치 창출 미래형 신산업 발굴・육성’의 일환으로 추진되며, 대한민국 혁신성장과 4차 산업혁명의 한 축을 담당할 바이오산업 육성을 위한 향후 10년간의 청사진을 제시하고 있다.
제3차 기본계획은 각 부처 추천으로 구성된 총괄위원회 및 6개 분과위원회(생명과학, 레드바이오, 그린바이오, 화이트바이오, 산업화(융합신산업), 규제/제도)를 통해 약 1년간 100여 명의 전문가와 함께 현장의 의견을 적극 수렴하여 수립하였으며 주요 추진경과는 다음과 같다.
|
<추진경과>
□ 2016. 3.: 제3차 기본계획 수립을 위한 사전 기획연구 추진 -성과분석(정부투자, R&D 및 산업성과 등), 국내외 환경 분석 및 이슈 도출
□ 2016. 8.∼ : 관계부처 추천을 통한 기획위원회 구성・운영 -총괄위원회, 자문위원회, 실무위원회, 6개* 분과위원회 등 *생명과학, 레드바이오, 그린바이오, 화이트바이오, 융합(신산업)분과, 규제/인문 ※ 총괄위 5회, 관계부처협의회 3회, 실무위 6회, 6개 분과 위원회 6∼7회 개최
□ 2016. 10. : 국민 공감대 형성을 위한 대국민 의견 수렴 -기본계획의 브랜드 및 비전 공모를 통한 국민 참여 확대 ※ 바이오 관련 학회(14개), 관계부처 전문기관, 바이오인, 생물학연구정보센터 홈페이지 등 활용
□ 2016. 11. : 바이오 미래포럼(11.8) 통한 기본계획 홍보 및 의견 수렴 -기본계획의 전략 등 주요내용 소개 및 국내외 전문가 의견 수렴 *해외 연사: Steven M. Ferguson(NIH), Dr. James Philp(OECD), Prof. Qi Zhou (중국과학원) 외 3명
□ 2016. 12.∼ : 제3차 생명공학육성기본계획(안) 작성 -국내 성과분석, 바이오경제의 글로벌 트렌드 분석, 7개 부처의 신규 사업 내용 반영 등으로 ‘바이오경제 혁신전략 2025’ 안건 작성
□ 2017. 4.∼9. : 관계부처 및 산・학・연・병 이해 관계자 의견 수렴 -공청회 개최(1차 : 2017.4.11., 2차 : 2017.9.15)를 통해 연구 및 임상・산업현장의 공감대를 형성하고 수렴된 의견을 기본계획에 반영
□ 2017. 9. : 제3차 생명공학육성기본계획(최종안) 수립 -관계부처 합동으로 안건 상정 ※ 생명공학정책종합심의회 ⇨ 바이오특별위원회 |

[그림 특집-2] 제3차 기본계획 비전과 추진전략
이번 계획은 ‘바이오경제를 주도하는 글로벌 바이오 강국 실현’을 위해 우리나라의 글로벌 바이오 시장 점유율을 현재 1.7%(생산 기준 27조 원) 수준에서 2025년 5%(생산 기준 152조 원)까지 달성하겠다는 도전적 목표를 수립하고, ①글로벌 신약 후보물질 100개, ②국산 블록버스터(1조 원 대) 5개 창출, ③글로벌 기술수출액 522M달러(2015)에서 2,732M달러(2025) 증가, 바이오기술기반 일자리 2.6만 개(2015)에서 14.5만 개(2025) 증가, ④사회문제해결 바이오 R&D 기여 약 1만 건 등 국민 생활에 직결되는 4대 세부 목표를 제시하고 있다. 정부는 목표 달성을 위해 ①바이오 R&D 혁신 ②바이오경제(Discovery to Market) 창출 ③국가생태계 기반 조성 등 3대 전략 9대 중점과제를 추진한다.
[전략1 글로벌 최초를 지향하는 ‘바이오 R&D혁신’]
먼저 R&D 승자가 시장을 선점하는 바이오 특성에 적합한 혁신형 R&D로 합성생물학, 마이크로바이옴, 유전자교정 등 미래유망 분야에서 글로벌 최초로 기술개발을 추진한다. 또한 국산 블록버스터 신약 창출, 新부가가치 그린 바이오(농식품) 육성, 미세먼지 저감 및 안전한 화학대체소재 개발 등 경제적 성과와 함께 사회적 문제 해결에 기여할 수 있게 전략적 R&D 투자를 강화한다. 정밀의료, 뇌연구, 차세대 의료기기 등 바이오기술이 기존 기술에 접목되고 활용되는 바이오 기반의 융합 R&D도 활성화하여 태동기 시장 및 미개척 융합기술 선점을 추진한다.
[전략2 우리나라의 미래 성장을 책임지는 ‘바이오경제 창출’]
글로벌 최초 R&D 성과를 경제효과로 연결하기 위해 ‘기술투자+경영・자본투자’ 합작 창업 및 M&A 등 기술과 사람이 함께 이전되는 과학 창업・사업화를 촉진하고 양질의 일자리를 창출할 계획이다. BT+ICT, BT+의료, BT+금융 등 융합인력을 양성해 융합 신산업을 육성하고 일자리를 창출해 인력 양성과 산업 수요 간 미스매치를 해소한다. 또한 ICT 융합 新의료 서비스산업 육성, 토종 CRO(연구대행기업) 성장 지원, 장비・부품・재료산업 패키지 지원과 수입대체기술 개발 등을 통해 융합형 바이오 신산업을 미래 성장동력으로 키운다는 계획이다. 마지막으로 전국에 산재한 바이오 클러스터를 지역별로 특화하고 연계시켜 광역 클러스터망(인터시티 클러스터)을 형성하고, 병원의 혁신기지화로 글로벌과 경쟁 가능한 바이오 생태계를 확충한다.
[전략3 민간 주도 바이오경제 구현을 위한 ‘국가 생태계 기반 조성’]
바이오산업은 다양한 관계부처와 이해관계자가 존재하는 만큼 국가 차원의 혁신 구심점 확보를 위해 바이오특별위원회 컨트롤타워의 역할을 강화하고 바이오정보의 통합 및 통계 구축 등을 통해 국가 바이오경제 혁신시스템을 정비한다. 또한 바이오산업은 윤리・규제가 항상 수반되므로 신기술・신제품의 조기 시장 진입을 지원하고 사회적 수용성을 높이기 위해 연구개발(R&D)과 함께 하는 선제적 인허가・규제혁신을 통해 기술과 규제의 조화를 추진한다. 제품개발부터 식약처 등 규제기관이 함께 참여하여 인허가 가이드라인을 선제적으로 마련하고, 규제 맵 구성・관리를 통해 바이오 규제 장벽을 상시 개선하는 체계도 구축한다.
초고속통신망이 ICT 산업 및 문화 부흥의 기반이 된 것처럼 바이오 혁신기술 및 신산업 육성의 토양이 되는 기술・자원・정보 플랫폼도 구축한다. 합성생물학, 유전자교정 등 범용혁신기술의 개발 및 활용을 촉진하는 법적 근거를 마련하고, 나고야 의정서 발효에 대응해 해외 자원의존을 극복하기 위해 국가전략자원도 확보한다. 바이오 정보 통합서비스를 올해부터 구축해 연구지원 정보, R&D 성과, 통계 등을 손쉽게 확인하고 활용할 수 있는 연구자/기업 수요 맞춤형 서비스도 제공한다.
우리 바이오산업은 제1차 및 제2차 계획을 통해 축적된 연구 및 산업역량을 활용해 바이오경제 도래가 예상되는 제3차 기간 중 글로벌 선도국으로의 위상을 어느 정도는 확보하였으나 향후 10년은 바이오산업 육성에 있어 글로벌 선도국으로 도약하느냐 영원한 추격자로 남느냐를 결정하는 기회의 순간에 직면해 있다. 때문에 R&D 승자가 시장을 독식하는 선제적 선점자의 특성을 가진 바이오산업에 유효한 R&D 중심의 글로벌 선점 전략이 긴요한 상황이며, 양적 성장에 비례한 질적 성장을 위해 이 육성 전략이 바이오경제를 선도하는 선도국으로 발돋움하는 기회로 작용하길 기대한다.
4차 산업혁명: 융합의 가속화
애플의 창업자 스티브 잡스는 1996년 <와이어드> 인터뷰 중에서 “창조라는 것은 여러 가지 요소를 하나로 연결하는 겁니다.”라는 의견을 피력하였다. 그 후 십 여 년이 지난 2010년 1월, 처음으로 아이패드를 소개하는 컨퍼런스에서 기술과 인문학이 표시된 교차로 표지를 보여주면서 “기술과 인문학을 융합함으로써 애플은 아이패드 같은 창조적인 제품을 만들 수 있었다.”라고 강조하였다. 아마도 인문학 소양이 갖추어진 애플의 기술진이 같은 조직 내의 인문학 전공자들과 소통을 하면서 아이패드라는 혁신적 제품을 개발하지 않았을까 생각이 든다. 그리고 정확히 6년 후인 지난 2016년 1월, 다보스 포럼(WEF; World Economic Forum)에서 ‘The Future of Jobs’ 보고서를

출처: KISTEP 이슈페이퍼 2017-04
[그림 특집-3] 산업혁명 과정과 핵심기술
통해 세계 산업분야에 혁명에 가까운 새로운 변화가 도래하며, 이로 인해 일자리 지형 변화라는 사회 구조 재편성이 일어날 것이라고 전망하였다. 이를 제4차 산업혁명이라 명명하며 ‘제3차 산업혁명(디지털 또는 자동화 혁명)에 기반하여 물리적 공간, 디지털적 공간, 그리고 생물학적 공간의 경계가 희석되는 기술융합의 시대’라고 정의하였다. 이른바 제4차 산업혁명이라는 화두가 세상에 던져진 것이다.
그러나 한 가지 흥미로운 경향이 국내에서 발표되고 발간되는 4차 산업혁명과 관련된 보고서와 언론기사들에서 일관되게 관찰된다. 4차 산업혁명의 3대 핵심 분야(디지털, 물리학, 바이오) 중 하나인 바이오 기반 융합기술들에 대한 언급이 생략되어 있거나, 바이오기술이 언급된다 하더라도 디지털 헬스 케어 산업분야가 바이오 핵심 분야로 소개되는 점이다. 실제로 4차 산업혁명에서 지목한 3대 핵심기술은 인공지능기술, 로봇기술, 그리고 유전학 기반 생명공학기술이며, 더 세부적으로 들어가서 제시한 바이오 분야의 핵심 산물은 4D 바이오프린팅 기술로도 불리 울 수 있다고 서술된 합성생물학 기술이다. 생명현상이라는 것이 생체에서 일어나는 물리 화학 현상이라는 엄연한 사실에 근거할 때, 오래 전 물리 화학기술이 뒷받침 되지 못했던 시절에는 관찰과 해부학 기반의 현상 발견 연구에 머물러 있을 수밖에 없었지만, 물리 화학을 비롯한 전자공학기술과의 융합은 생명현상을 보다 미시적으로 분석하여 분자수준에서의 생명현상을 이해할 수 있도록 하였을 뿐 아니라(DNA 구조 규명, 생명체 전장 염기서열 규명 등) 생명현상을 보다 거시적인 관점에서 규명할 수 있게 되었고(시스템생물학 등), 이제는 지구상에 존재하지 않았던 새로운 생명체를 공학적 개념이 도입된 시스템을 이용하여 인위적으로
[그림 특집-4] 바이오기술과 타 기술분야와의 융합연구 현황 (생명공학정책센터 자료)
합성할 수 있는 (가장 상위 개념의) 합성생물학이라는 새로운 생명공학 기술이 가능한 시대가 도래하게 된 것이다. 다시 말해서 바이오 분야의 발전은 이미 오래 전부터 타 학문과의 융합을 통한 꾸준하고 지속적인 발전이 진행되고 있었으며 최근에 이르러는 그 융합의 속도와 분야의 폭이 빠르게 증가하고 있다는 것이 가장 정확한 판단일지 모른다. 이러한 이유로 일부 전문가들은 산업혁명이라는 말 보다는 제3차 산업혁명 연장선상에 이어지고 있는 기술의 진보 또는 진화라는 표현이 보다 적절한 표현이라고 주장하기도 한다.
그러면 4차 산업혁명이라는 담론에서 생명공학기술이 융합의 핵심기술 중 하나로 거론되는 배경을 살펴볼 필요가 있다. 어떠한 생명공학기술들이 어떻게 발전되어 왔고 지금 그 기술들의 활용성 및 기술융합에서의 역할은 무엇인지를 살펴보도록 하겠다.
가. 왜 유전학인가?
4차 산업혁명의 담론을 제시한 다보스 포럼 보고서에서 굳이 유전학을 생물학기술의 핵심으로 거론했는지 먼저 생각해 보자. 20세기 후반에 들어서면서부터 현재까지도 우리는 21세기에 바이오경제시대가 도래할 것이라는 수많은 보고서와 국가별 대응 전략들을 접해오고 있다. 1950년대 생명체 정보의 핵심 유전물질인 DNA의 구조 규명(1962년 노벨상 수상) 이후 생물학은 생화학 기반의 분자생물학 시대로 진입하였다. 1970년대에는 하워드 테민 박사와 데이비드 볼티모어 박사에 의해 RNA를 유전물질로 가지고 있으며 진핵세포에 감염하여 증식하는 레트로바이러스 life cycle에 필수적으로 관여하는 역전사효소가 규명되고(1975년 노벨상 수상) 활용이 가능하게 되어 인간 세포를 비롯한 수많은 진핵세포의 생명현상을 분자수준에서 규명할 수 있게 되었다. 그로부터 5년 후인 1980년 노벨상 수상은 현대 생물학 발전사에 이정표가 되는 발표로 평가되고 있다. 게놈프로젝트와 유전자치료, 그리고 2016년 4차 산업혁명에서 언급된 합성생물학 기술의 가능성을 잉태하게 하였던 DNA 염기서열 시퀀싱 방법(생거 박사와 길버트 박사)과 재조합 DNA 기술을 진핵세포를 대상으로 실현(폴 버그 박사)시킨 공로로 3명의 과학자가 공동수상 하였다. 이 기술들은 생명현상의 본질인 유전물질의 정보의 해독을 가능하게 하였고, 더 나아가 유전물질의 재조합을 통해 생명을 조작하는 일을 가능하게 한 기술로 평가된다. 1세대 유전자가위(DNA절단 제한효소)기술을 이용한 재조합 DNA 기술의 엄청난 파급효과를 우려하여 1975년 2월 미국 캘리포니아 아실로마(Asiloma)에서 미국의 주도로 생물재해에 대비하기 위한 아실로마 국제 컨퍼런스가 개최될 정도로 유전자 조작기술의 파장은 매우 컸으며, 40년이 지난 아직도 미국 국립보건원 산하에 RAC(recombinant DNA advisory committee)가 설치되어 운영되고 있다. 기념비적인 1980년 노벨상 수상식 10년 후인 1990년에는 인체를 대상으로 선천성면역결핍증을 치료하기 위한 유전자치료 임상시험이 처음으로 시도되었으며, 같은 해에 미국, 영국 등 6개국 과학자들이 인간의 23쌍 염색체의 DNA 암호를 해독하기 위한 역사적인 인간게놈프로젝트(HGP)가 시작되었다. 이러한 현대 유전학의 발전은 21세기를 게놈 시대(Genome Era) 또는 바이오경제 시대라고 불리게 하였으며, 최근에는 새로운 유전자가위인 CRISPR 시스템이 발표되며 유전자재조합 뿐 아니라 유전체편집(genome editing)까지도 가능한 유전학 기반 정밀의학 및 합성생물학 기술의 잠재성을 다시 한 번 부각시키게 되었다.
(1) 차세대 염기서열 분석방법과 생물정보학
차세대염기서열분석법(NGS; Next-generation sequencing; Massive parallel sequencing)의 기본 발상은 컴퓨터 공학에서 한 작업을 동시에 수행하는 것을 뜻하는 병렬 컴퓨팅 (Massively parallel processing)과 유사한데, 하나의 유전체를 무수히 많은 조각으로 분해하여 각 조각을 동시에 읽어낸 뒤, 이렇게 얻은 데이터를 생물 정보학적 기법을 이용하여 조합함으로써 방대한 유전체 정보를 빠르게 해독할 수 있는 방법이 개발되고 2004년에 최초로 상용화 되었다. 그러나 2000년대 중반 이후 광학, 전자, 화학 등 세부 분석 기술과 컴퓨팅 파워가 비약적으로 향상되면서 NGS 플랫폼도 급속도로 진화하였고 급기야는 2015년 도달했던 유전체 분석 1000불 시대를 넘어 2017년 일루미나의 NovaSeq 6000 시리즈를 출시하면서 100불 유전체 분석시대의 도래를 예고하였다.


[그림 특집-5] 유전체 분석비용의 감소추세 및 일루미나의 NovaSeq 6000 시퀀서
인간 게놈프로젝트를 기점으로 비약적으로 발전한 염기서열분석기술은 생명현상 및 질병과 관련된 유전체 빅데이터 정보를 빠르고 정확하게 제공할 수 있으며, 이렇게 확보된 빅데이터는 생명정보학 기술에 의해 가공되어 분자진단, 정밀의료, 유전자 편집, 합성생물학 등 다양한 기술의 기반을 제공하게 된다. 인간 유전체 뿐 아니라 장내 세균총을 비롯하여 다양한 생물군의 유전체를 분석함으로써 의료분야 뿐 아니라 환경, 식량, 에너지 분야의 산업에도 합성생물학 기술과 융합하여 큰 파급효과를 미칠 것이라는 의견이 지배적이다. 이 중 유전체 분석기반 정밀의료기술은 빅데이터 처리 및 디지털 기술과의 융합을 통해 환자 개개인에 최적화된 예방 및 치료법을 제공하는 4P (personalized, predictive, preventive, participatory) 의료 패러다임 변화의 일환으로 이미 임상 현장에서 활용되고 있으며 스마트폰, 웨어러블 디바이스 등과의 융합을 통해 다양한 헬스케어 시스템으로의 진화를 이끌어 나갈 것으로 기대하고 있다.
(2) DNA 합성기술
오랜 기간 동안 DNA 합성기술(핵산 뉴클레오타이드를 화학적 결합반응을 이용하여 중합시켜 긴 사슬의 DNA를 합성하는 기술)은 고가의 비용이 소요되며 긴 사슬의 DNA 합성이 쉽지 않은 한계를 가지고 있었으나, 최근 기술의 발달로 인해 염기당 20∼25센트의 가격으로 수 만개의 염기서열을 갖는 긴 DNA의 합성이 가능하게 되었다. 대표적인 DNA합성 서비스 기업인 미국의 블루헤론 바이오테크놀로지는 최근 한 번에 5만 쌍이 넘는 DNA를 합성할 수 있다는 사실을 발표하기도 하였다. 이러한 DNA 합성기술의 발전은 NGS 기술에 의한 염기서열 분석법과 융합하여 합성생물학의 기본 요건인 생명체의 전장 유전정보를 합성할 수 있는 길을 열어 놓았다.
(3) 합성생물학
인간 게놈지도의 결과가 발표된 2003년, 발표의 주역 중 한 명인 크레이그 벤터 박사는 처음으로 합성생물학이라는 개념을 언급하고 박테리오 파아지 ΦX174의 DNA 염기서열의 합성을 시도하였다. 그 후 2010년 5월에 마이코플라즈마라는 세균의 염색체를 구성하는 전장 DNA 염기(약100만 염기쌍, 530개 유전자)를 합성하고 원래 유전체가 제거된 다른 종의 박테리아에 도입시켜 증식을 성공시킨 결과(Syn1.0)를

[그림 특집-6] 합성생물학 기술로 증식에 성공한 마이코플라즈마(Science 2016: Vol. 351, Issue 6280)
발표하였다. 더 나아가 2016년 3월, 염기서열 분석을 통해 마이코플라즈마의 증식에 필요 없는 서열을 제거한 약 53만개의 염기서열을 합성하여 증식에 성공하였다는 결과(Syn3.0)를 발표하기에 이르렀다. 이 연구의 의미는 바이러스를 제외하고 현존하는 가장 적은 수의 유전자를 가지고 있는 지구상에 존재하지 않았던 새로운 생명체를 창조하였다는 것이다. 이로써 유전자정보 데이터베이스를 이용해 생명체를 디자인하고, 유전체를 합성하여 새로운 생명체를 만들어내는 새로운 시대가 열렸다는 사실이다.
생명체의 유전체를 디자인하기 위해서는 유전체 빅데이터와 이를 처리할 수 있는 ICT 기술, 그리고 DNA합성을 위해서 나노기술 수준의 화학적 미세조작이 필요하다. 다시 말해 합성생물학은 생명과학, 정보공학, 나노기술 등이 연결된 대표적인 바이오 기반 융합기술이라 부를 수 있다. 재조합 DNA 기술 또는 게놈 편집기술이 적용되어 만들어지는 유전자변형 생물체(GMO)나 유전자치료용 바이러스벡터 및 세포가 고전적 의미의 합성생물학 산물이라고 한다면, 세상에 존재하지 않았던 생명체를 새로운 유전물질을 기반으로 공학적 개념을 적용하여 합성하는, 가장 상위개념의 합성생물학으로 발전할 수도 있다. 크레이그 벤터 박사가 만들어 낸 연구결과는 고전적 의미의 합성 생물학과 가장 상위 개념의 합성생물학의 중간 단계라고 볼 수 있을 것이다.
다보스 포럼에서는 4차 산업혁명에 의한 기술의 융합 기반 발전상만을 논의한 것이 아니라, 기술 융합이 몰고 올 여러 가지 부정적 사회변화에 대해서도 경고하고 있다. 그 중에는 합성생물학의 부정적 파급효과도 포함되어 있다. 2011년 9월 12일 네덜란드 로테르담에서 열린 인플루엔자 컨퍼런스에서 조류인플루엔자 바이러스 H5N1타입의 염기서열 중 일부를 변형하여 포유류에서 포유류로 전염이 가능한 신종 인플루엔자 바이러스를 합성하였다고 발표하고, 인간에서 인간으로 전염될 수 있는 인플루엔자 바이러스를 합성할 수 있는 정보를 알아냈다고 발표하였다. 이에 많은 공중보건 안전 전문가들은 DNA 합성기술 및 유전체 정보에 대한 어렵지 않은 접근성으로 인해 일정 수준 이상의 분자생물학 기법을 수행할 수 있는 환경 하에서는 위험성이 증가된 새로운 병원체의 합성이 가능하다는 사실에 경고를 보내고 있다. 다보스 포럼에서도 DNA 구성요소를 만들고 공급하는 기업을 대상으로 새로운 DNA 합성 및 생명체를 추적할 수 있는 시스템의 구축을 요구하고 있다. 그러나 아직까지 이러한 합성생물학의 이중 용도의 위험성을 대비하고자 하는 우려와 대책의 논의는 계속되고 있지만 국가마다 이해관계가 상이하게 걸려있는 문제들이 있어 아직까지 국제적 합의는 이루어지지 않고 있다.

[그림 특집-7] 세계 합성생물학 시장규모 예측 (매일경제신문 2016년, 미래 50년 경제 10대 기술)
현재 고전적 개념의 합성생물학의 활용분야는 주로 레드바이오(건강⋅의료)에 집중되어 있지만, 2030년 경 본격적으로 도래한다고 예측되고 있는 바이오경제 시대에는 상위개념의 합성생물학 기술을 기반으로 한 화이트바이오(에너지・환경)와 그린바이오(농식품)의 비약적 성장이 기대되고 있다. 레드바이오에 비해서 훨씬 큰 규모의 시장을 형성할 뿐 아니라 이중 용도의 위험성을 가지고 있어 사회경제적으로 미치는 영향력과 파급효과의 규모와 중요성을 감안하면 다보스 포럼에서 유전학 기반 융합기술인 합성생물학 기술을 4차 산업혁명의 바이오분야의 핵심기술로 선정한 것이 이해가 된다.
나. 바이오 융합기술
4차 산업혁명 화두에 담겨 있는 현실 인식에는 이미 많은 기술들이 성숙단계에 접어들었다는 판단을 내렸으며, 새로운 기술의 발전에 의한 산업발전 보다는 이미 개발된 기술들의 융합을 통한 산업 발전의 도래를 예측하였다. 그러나 이미 바이오기술은 타 학문분야와의 융합을 통해 발전하고 있었으며 최근에 들어서서 융합 분야의 폭과 융합의 속도가 빠르게 증가하고 있다는 사실이 정확한 융합 바이오기술에 대한 설명이라고 생각 된다.

[그림 특집-8] 바이오융합의 적용 범위 (2013 생명공학백서)
IBM 인공지능 왓슨을 활용한 암 진단 및 치료전략 결정, 바이오 나노소재 개발, 뇌 인터페이스 기반 의료기기, U-헬스 케어, 바이오 메카트로닉스 등 다양한 바이오 융합분야 기술들이 그 성과들을 창출해 나가고 있다. 여기에 더욱 고도화된 인공지능기술과 로봇기술이 융합된 새로운 산업분야 역시 머지않은 미래에 시장을 창출할 것으로 기대되고 있다. 이러한 바이오헬스 분야의 융합기술 발전의 가속도는 제너럴 일렉트릭사(GE)의 헬스케어 산업 진출에 뒤이어 구글이 미래 성장사업의 일환으로 헬스케어 및 생명과학에 투자함으로 더욱 빨라질 것으로 예측된다.
다. 규제 및 제도 개선
클라우스 슈밥은 자신의 4차 산업혁명 저서에서 “큰 물고기가 작은 물고기를 잡아먹는 시대에서 빠른 물고기가 느린 물고기를 잡아먹는 시대로 바뀐다.”라고 표현하였다. 빠른 속도로 기술 융합이 이루어지는 환경에서 얼마나 민첩(Agility)하게 반응 하느냐가 개인과 기업과 정부에 부여된 리더십의 핵심이라는 의미이다. 4차 산업혁명이라는 화두를 굳이 언급하지 않더라도 특히 빠르게 변화하며 진화하는 융합 바이오기술의 유효성과 안전성 평가에 대한 빠른 대처와 규제 및 제도의 개선은 이 분야 산업발전의 가장 중요한 한 축을 담당한다고 볼 수 있다. 그러므로 무분별한 규제의 완화가 아닌 과학기술 증거에 기반을 둔 규제 및 제도로의 개선시스템의 구축이 요구된다. 특히 바이오 융복합 산업이나 기술의 경우 다수 부처가 연관되어 있어 소관부처 뿐만 아니라 범정부 차원의 규제 검토 및 조정이 필요하다. 이번 기회에 많은 국내 연구자와 개발자들이 요구하는 네거티브 규제(금지하는 조항을 규제나 법안에 명기하고 그 외에는 모두 허용하는 규제로 하위 가이드라인 및 전문 심의위원회를 통해 네거티브 규제의 문제점을 보완하며 운영함)의 점차적 도입을 신중히 검토할 필요가 있다.
아직 4차 산업혁명이라고 부르는 변화의 개념과 의미는 전문가마다 그리고 국가마다 조금씩 다른 깊이와 범위로 강조되고 있다. 독일을 필두로 3차 산업 기반 제조업 기술이 발달되어 있는 선진국에서는 바이오기술에 비해 상대적으로 제조업 분야가 강조되고 있으며, 일본의 경우 기존 제조업 강점에 로봇기술을 집중적으로 융합하는 분야, 그리고 중국의 경우에는 알리바바와 같은 기업을 중심으로 웹서버 기반 내수시장 연계 제조플랫폼 기술을 구축하는 전략을 강조하는 것으로 보인다.
결론적으로 이미 성숙되어 있는 다양한 분야의 기술의 융합이 가까운 미래에 가져올, 산업을 넘어 사회구조와 정치 지형에도 영향을 끼치는 변화의 물결이 오고 있다는 사실은 혁명이든 진보(혹은 진화)든 용어선택의 이견을 제외 한다면 대부분의 선진 국가들이 의견을 같이 하고 있다는 점을 간과해서는 안 될 것으로 판단된다.
이러한 변화 속에서 우리는 생명공학기술을 기반으로 한 미래 전략을 어떻게 세울 것 인지에 대한 냉정하고도 신속한 방안을 마련하여(제3차 생명공학육성기본계획) 유행을 무작정 따라가는 연구지원이 아닌 생물공학의 기본이 되는 연구 분야들을 기반으로 하는 효율적인 R&D 투자전략 구축 및 프로세스 혁신을 이루어내고, 바이오 선진국으로의 진입을 달성하기 위한 그 동안의 노력의 결실을 맺는 원년으로 거듭 나기를 기대해 본다.
의료 패러다임의 변화: 미래의학
과학의 발전은 기술의 진보를 가져오고 새로운 기술은 생활의 편의를 제공하여 삶을 풍요롭게 해준다. 특히 의료 기술의 발전은 개인의 건강에 직접적으로 도움을 줄 수 있으며 새로이 개발된 영상장비와 신약을 통해 질병을 조기에 진단하고 치료할 수 있도록 해 준다. 세계보건기구(WHO, World Health Organization)의 발표3)에 의하면 2015년 기준 인간의 평균수명은 71.4세로 지난 15년간 5년이 증가했고 국가별 평균 수명이 최대 33.6년의 차이가 나는 것을 볼 수 있다. 이를 통해 의료 분야에서 기술의 발전이 인간의 건강에 얼마나 도움이 되는지 알 수 있다.
기술의 발전은 의료 분야뿐만이 아니라 사회 전반에 많은 변화를 가져오고 있다. 최근 4차 산업혁명으로 불리는 기술혁신이 빠르게 사람들의 생활에 접목되면서 보건의료분야에서의 혁명적인 변화가 미래 사회에 많은 영향을 미칠 것으로 예상되고 있다. 의료와 관련된 생활의 변화 중 하나는 웨어러블 디바이스를 이용해서 실시간으로 식이(食餌)나 운동정보를 입력하고 이에 대한 피드백을 받는 서비스가 활성화되고 있는 것과 자신의 유전정보를 분석해서 질병 발생의 위험도나 약물 부작용을 사전에 스크리닝 할 수 있다는 것이다. 또한 인터넷 정보검색 사이트를 통해 질병에 대한 구체적인 정보와 여러 환자들의 치료 경험도 찾아 볼 수 있다. 이러한 생활 속 변화들이 앞으로 미래의료의 패러다임을 결정하는 요소가 될 것으로 생각한다.
미래의료의 방향을 두 가지 핵심단어로 요약하면 ‘정밀의료’와 ‘디지털헬스’라고 할 수 있다. ‘정밀의료’는 개인의 정보를 최대한 활용하여 최적의 예방, 진단, 치료를 제공하는 것으로 미래 정보사회에서 대용량 처리와 인공지능을 통해 구현될 것으로 예상되며 ‘디지털헬스’를 통해서는 정보통신기술(ICT, information and communication technology)의 총화로 각종 의료기기와 사물인터넷(IoT, internet of things)에 기반을 두어 실시간으로 개인의 건강을 관리하여 사전에 질병을 예방하고 조기에 발견하게 할 수 있을 것이다. 이러한 기술을 통해 예상되는 패러다임의 변화를 요약하면 소비자 주도, 데이터 중심, 적극적 건강관리로 정리할 수 있다.
가. 미래 의료 패러다임
(1) 소비자 주도의 보건의료 서비스
웨어러블 디바이스를 포함한 각종 디지털 장비와 사물인터넷을 통해 개인의 생활습관 정보를 모니터링 할 수 있게 되면서 개인은 자신의 생활습관을 적극적으로 관리하기 시작했다. 보건의료 분야에서 이러한 정보를 개인이 적극적으로 활용하는 것은 환자 또는 소비자의 역할이 더 중요해 질 것이라는 것을 말하고 있다. OECD 자료4)에 의하면 우리나라 환자의 병원 방문횟수가 연간 16회로 가장 빈번한 것으로 파악되고 있는데 이는 우리나라의 국가 의료 시스템의 특성이 반영된 결과일 수도 있으나 결국 정밀의료에 필요한 임상정보를 상대적으로 많이 확보할 수 있다는 것을 의미하며 이 정보를 제대로 활용할 수만 있다면 향후 정밀의료의 발전가능성을 시사한다고 볼 수 있다.
개인의 건강에 관련된 정보로는 개인의 생활습관에 관련된 식이, 운동, 환경에 대한 정보와 병원에서 측정하는 임상정보, 그리고 개인의 유전적 특성을 반영하는 유전체(genome) 정보가 있다. 특히 유전정보를 분석하는 기술이 최근 급속하게 발전하여 차세대 대용량 염기서열 분석기술(NGS, next generation sequencing)로 사람의 30억 개 전장유전체염기서열(whole genome sequence)을 분석하는데 백만 원대의 비용으로 가능하게 되었다. 이처럼 유전정보 분석비용이 폭발적으로 감소하게 되면서 개인적으로 유전체정보를 분석하는 것이 활발해지고 있다. 미국의 23andMe5)사는 소비자의 주문에 의해 개인별로 유전체분석서비스를 제공하고 있으며 이미 70여만 건에 대한 서비스를 시행하였다.
(2) 데이터 중심 보건의료 서비스
미래 정보화 시대에는 빅데이터와 인공지능에 기반을 둔 의료서비스가 확대될 것으로 예상된다. 과거 전기전자 및 컴퓨터공학 기술이 의료기기의 발전을 가져온 것과 마찬가지로 4차 산업혁명의 대표적 기술 도입을 통해 데이터에 기반을 둔 미래의료를 생각해 볼 수 있다. 이미 의료에서도 인공지능기술을 활용한 여러 연구와 기술개발이 있어 왔다. 보건의료 분야에서 인공지능의 가장 대표적인 적용 예는 IBM社에서 구축한 ‘Watson for Oncology’6)라고 할 수 있다. 이 시스템은 전통적인 인공지능기법인 전문가 시스템으로서 다양한 암환자에게 진단과 치료기법을 제시하여 의료진의 판단을 보조하는 시스템이다. 최근에는 이 시스템에 요소기술로서 최신 딥러닝 기법을 추가하여 광범위한 질환별 가이드라인, 논문검색에 더해서 미국 유수병원의 진료기록을 활용하여 만들어지고 있다. 하지만 국가, 지역, 병원별 특수성을 반영하지 못하고 계속해서 발전하는 의학지식을 반영해야 한다는 제한점에도 불구하고 비교적 성공적으로 보건의료에 적용되고 있으며 국내에서도 몇몇 병원에서 도입하여 활용하고 있다.
전통적인 임상연구는 특정 환자군을 모집하여 진행하는데 이 과정이 길고 번거로우며, 특정 질병에 대한 정보만 얻을 수 있다. 하지만 각 병원에 이미 대규모로 존재하는 임상정보를 활용하면 세워둔 가설을 실시간으로 검증할 수 있고, 추적관찰이 가능하다. 특히 우리나라에서는 최근에 NGS 임상검사의 보험급여 실시에 따라 유전체 정보 데이터를 가지고 있기 때문에 이를 활용하는 것이 가능해졌다. 미국 제약사인 Regeneron사와 보험사인 Geisinger, 그리고 생물정보분석회사인 DNAnexus가 5만 명을 대상으로 임상정보와 유전체정보를 통합・분석하여 심장질환에 대한 새로운 마커를 찾았다.7) 향후, 이 데이터를 기반으로 찾은 유전자와 변이정보가 신약개발에 접목될 것으로 예상된다. 보건의료 빅데이터에 대한 분석은 규모가 확대될 것이며 궁극적으로 인체 질환에 대한 이해를 통해 정밀의료에서 추구하는 개인별 특성에 맞는 정확한 진단과 치료가 가능하게 될 것으로 예상한다.
(3) 환자의 치료로부터 적극적인 사전 건강관리
이제까지 의료가 환자의 치료와 재활을 중심으로 진행되었다면, 앞으로의 보건의료 서비스는 예방과 적극적 진단으로 전환될 것이다. 미국 존스홉킨스 의대 Vogelstein교수는 혈액생검과 같은 신기술에 기반을 두어 암을 조기에 진단하는 것이 암 발생을 줄일 수 있는 적극적인 방법이라고 소개하고 있다.8) 또한 다중오믹스 데이터와 임상검사 결과에 기반을 두어 개인별로 최적의 의료서비스를 제공하면 질병발생을 줄일 수 있다는 결과가 보고되었다.9) 미래에는 소비자의 요구에 의해 건강한 사람의 유전체를 비롯한 다중오믹스 분석과 임상검사 결과를 가지고 개인별로 맞춤건강관리를 하게 될 것으로 예상된다. 현재 우리 사회는 인구 초고령화 사회진입을 목전에 두고 있으며 이에 따라 만성질환 관리비용의 증대가 예상되고 있다. 또한 현재 우리나라 건강수명은 73.2세로 기대수명인 82.3세와 약 9년의 차이가 난다. 노령인구의 건강한 삶과 국가적 비용 절감을 위해서 만성질환에 대한 적극적인 예방과 관리가 필요하다.
나. 미래 보건의료 산업을 위한 지렛대
4차 산업혁명을 통해 도래할 미래사회에서 보건의료 분야는 기술개발 플랫폼이자 동시에 주요 시장이 될 것이다. 따라서 의료패러다임의 변화를 이해하는 것은 바이오의료산업과 의료서비스 시장 창출에 매우 중요하다. 대표적인 미래기술 중 하나인 인공지능 기술은 앞으로 보건의료 분야에서 선택사항이 아닌 우리가 반드시 당면할 미래로 다가올 것이다. 질환의 예방, 진단과 치료 그리고 국민의 건강 증진을 위해 이러한 기술들이 미래보건의료에 어떻게 수용하고 개발할 것인지 최선의 방법을 고민해야 하며, 크고 작은 의사결정 과정에서 환자와 일반국민의 적극적인 참여가 매우 당연하고 중요해지는 사회적 환경이 형성될 것이므로 이 문제를 바람직하게 접목시키기 위한 방안도 전문가와 각계의 의견이 필요하다. 또한 미래 보건의료를 창출해 나가기 위해서는 관련 분야에 대한 교육의 틀도 거의 혁명적 수준으로 바꾸어야 한다. 혁명적으로 변화하게 될 미래 보건의료 패러다임에 적응하고, 나아가 선도할 수 있는 선제적인 전략이 필요하다.
NGS 기술개발이 가속화됨에 따라 유전체정보 생산이 용이해지고 있다. 초기 유전체 특성과 인체 질환을 이해하는 연구를 하기 위해서는 데이터의 양이 중요했기 때문에 대규모 유전체 연구사업인 TCGA 및 ICGC를 통해 수 만 건의 암유전체 정보가 생산되었다. 또한 치매 및 당뇨와 같은 대표적인 만성질환에 대한 유전체 정보도 수 만 명 규모로 확보되어 있기 때문에 이제는 데이터 생산보다는 기존의 데이터를 활용해서 유용한 바이오마커나 신약 타깃을 찾는 것이 중요해졌다. 물론 이를 위해서는 유전체분석 기술에 대한 개발이 선행되어야 하고 임상정보나 다른 생활습관 정보를 연계하여 해석하는 방법이 필요하다. 세계적으로 기계학습을 포함한 인공지능 기술이 적용되고 있으며 NGS 비용감소에 따라 지속적으로 증가하게 될 데이터를 활용하는 것이 중요하게 대두될 것으로 예상된다.
다. 맺는말
정밀의료는 신기술로부터 의료 서비스와 산업화에 이르기까지 다양한 분야에 연결될 수 있다. 더욱이 정밀의료는 9대 국가전략프로젝트 중 하나로 정부에서 주도적으로 투자할 계획을 가지고 있다. 기존의 정밀의료 연구사업은 세계적으로 연구를 주도하고 있는 미국의 연구사업을 벤치마킹하여 시작하였지만 실제 국내 의료전달체계를 비롯하여, 산업구조 등을 종합적으로 고려하여 최종 목표를 설정하는 것이 중요하다. 전 세계적으로 정밀의료 관련 정보와 기술이 미래 바이오의료 산업에 중요한 역할을 할 것으로 인식하고 있으며, 이에 대한 정책적 차원에서 고려가 필요하다.
바이오의료 산업 전반에 걸쳐 이제까지 추격자 입장에서 선도 국가의 시스템을 벤치마킹하는 것이 하나의 전략이었다면, 정밀의료 분야에서 활용되는 신기술은 기술 반감기도 짧고 상품의 주기도 매우 짧기 때문에 이를 반영하는 전략이 개발자와 산업체 모두에게 필요하다. 특히 바이오의료 산업은 규제산업으로 국가 수준의 법, 제도를 통해 정확하게 정의되지 않으면 실제 활성화가 불가능하다. 따라서 정밀의료 연구개발 및 산업화를 활성화하기 위해서는 이를 뒷받침 할 수 있는 선도적 규제와 인허가 시스템의 운영이 필수이다.
아직도 전 세계적으로 5세 이전에 사망하는 어린이가 연간 약 6백만 명이고, 심장병으로 70세 이전에 사망하는 사람이 세계적으로 천만 명 이상에 이른다. 또한 소아비만도 4천만 명에 달하는 것으로 알려져 있다. 미래 정밀의료와 디지털헬스를 통해 우리의 질병을 조기에 예방하고 치료함으로써 삶의 질을 높일 수 있는 기회가 눈앞에 다가와 있다.
제1장 생명공학의 변화와 도전
![]() 제1절
제1절
생명공학의 변곡점
1. 미국
가. 정부 정책 동향
(1) 정부 생명공학 정책
미국은 과학기술 정책도 다양한 주체들이 권력의 견제와 균형(check and balance)을 이루는 다원화된 분산 체제를 가지고 있다는 특징이 있다.
백악관의 과학기술정책실(OSTP)은 정책을 총괄하고 예산을 배분하고, 정부 내 조정은 백악관과 각 부처의 장관으로 구성된 국가과학기술회의(NSTC)가 담당한다. 각 부처는 분야별 정책을 입안하고 연구개발을 수행・지원한다. 생명공학과 관련된 부처는 보건복지부(HHS), 국립보건원(NIH), 국립과학재단(NSF), 국방부(DOD), 에너지부(DOE), 농무부(USDA) 등이다.
미국의 생명공학 정책은 오바마 정부에서 2012년 4월 수립한 ‘국가 바이오경제 청사진(National Bio-Economy Blueprint)’에 기반을 두고 있다고 할 수 있다. 이 보고서는 미국이 보유한 자원을 최대한 활용하여 바이오경제의 잠재력을 극대화하기 위한 방안을 제시하였으며, 이를 위해 연구개발 역량 강화, 연구성과의 상업화 촉진, 규제개혁, 인력양성, 그리고 공공-민간 파트너십 촉진 등 5대 전략 목표를 제시하였다.
[표 1-1] 국가 바이오경제 청사진 5대 전략목표
|
구분 |
주요 내용 |
||
|
연구개발 역량 강화 |
정부 투자를 통해 바이오분야의 시장실패를 극복하고, 미래 미국 바이오경제의 토대를 제공할 혁신적, 도전적 R&D투자를 지원 |
||
|
연구성과의 사업화 촉진 |
연구성과의 산업화 촉진 및 이를 위한 중개과학, 규제과학 지원 강화 |
||
|
규제 완화 |
인간 건강과 환경을 보호하면서도 산업발전의 장애요인을 줄이고, 규제 과정의 속도 및 예측가능성 증진, 비용 절감 등을 위한 규제개혁 추진 |
||
|
교육훈련 강화 |
기업수요를 반영한 교육훈련 프로그램 설계/운영 및 교육기관 인센티브 제공 |
||
|
공공-민간 파트너십 촉진 |
공공-민간 파트너십 및 경쟁전(pre-competitive) 협력을 위한 기회 제공 및 지원, 자원, 지식 및 전문기술 공유 |
출처: 미국 백악관, 국가 바이오경제 청사진(2012)
미국은 정권이 바뀌면 정치가 크게 바뀌는 특징을 가지고 있다. 과학기술혁신을 위해 정부가 보다 적극적으로 개입해야 한다는 입장을 가진 민주당의 오바마 대통령 8년 재임이 끝나고, 정부의 역할이 최소화되어야 한다는 입장을 가진 공화당 소속의 트럼프 대통령이 2017년 1월 20일 취임하면서 생명공학 정책방향에 대한 불확실성이 매우 커졌다.
특히, 트럼프 대통령은 후보시절에 국립보건원(NIH)에 대해 비판적인 발언을 하였고, 오바마케어와 캔서문샷 이니셔티브(Cancer Moonshot)에 반대하는 프라이스(Thomas E. Price) 의원이 NIH와 FDA을 관할하는 보건복지부(Department of Health and Human Services, HHS) 장관으로 취임하여 향후 정책변화의 방향과 크기에 관심이 모아지고 있다.
한편, 바이오의료 분야 R&D 예산의 약 90%가 투자되는 국립보건원(NIH)은 2015년 12월 발표한 전략계획(NIH-Wide Strategic Plan 2016∼2020, Turning Discovery Into Health)에서 향후 5년간 중점 추진할 핵심 목표로 기초과학, 치료법, 건강증진 및 질병예방을 위한 바이오메디컬 연구개발 등을 제시하였다.
(2) 정부 생명공학 투자
미국에서 생명공학, 특히 보건분야는 전통적으로 가장 중요한 분야 중 하나로 인식되고 있고, 이에 따라 연구개발 투자도 항상 국방분야를 제외하고 가장 많은 예산이 배정되어 왔다.
보건분야를 관장하는 보건복지부(HHS)의 2018년도 예산은 776억 달러로 2017년 예산 대비 5.4억 달러가 감소되었지만, 의회에서 트럼프 대통령이 요청한 예산보다 145억 달러가 증가한 금액을 배정하였다.
이 중 NIH 예산은 2017년 예산보다 11억 달러가 증가된 352억 달러가 반영되었다. 트럼프 대통령 요청액보다는 86억 달러가 증가된 수치이다. 주요 연구 이니셔티브 예산을 보면 알츠하이머(18억 달러, 4억 달러 증), BRAIN(3.36억 달러, 0.76억 달러 증), All of Us(정밀의료 이니셔티브에서 명칭 변경, 4억 달러, 0.8억 달러 증), Cancer Moonshot(3억 달러), 재생의료(1천만 달러, 8백만 증), 임상중개과학(5.26억 달러, 1천만 달러 증), 항생제 내성 박테리아 퇴치(4.93억 달러, 3천만 달러 증) 등이다.
미국은 생명공학 분야에 NIH 외에도 국립과학재단(NSF), 국방부, 에너지부, 농림부 등 여러 정부부처가 생명공학 관련 예산을 투입하고 있다.
NSF의 2018년도 예산은 전년과 같은 60.3억 달러가 반영되었다. 트럼프 대통령은 6.72억 달러의 예산삭감을 요청하였으나 의회에서 이를 거부하고 전년 수준으로 배정하였다. NSF 내 생명공학국(BIO)의 2016년 예산은 7.24억 달러이다.
국방부(DOD)는 산하의 방위사업청(Defence Advance Research Projects Agency, DARPA)을 통해 국방 연구개발 예산을 배분을 하고 있다. 2017년도 총 예산은 약 30억 달러이고, 생물기술실(Biological Technologies Office, BTO)을 운영하고 있다.

출처: www.aaas.org/sites/default/files/TotRes%3B.xlsx 참고 저자 작성
[그림 1-1] 연방부처별 예산 추이(1976∼2017)
에너지부(DOE)는 과학국(Office of Science)을 통해 기초연구를 지원하고 있다. 6개 과학 연구 프로그램을 운영하고 있고, 생명공학 관련 프로그램은 이 중 하나인 생명환경연구(Biological and Environmental Research, BER)이다. 2017년도 과학국 전체 예산 57억 달러 중 생명환경연구(BER) 예산은 6.6억 달러이다.
농무부(USDA)의 2017년도 연구개발 예산 요구액은 총 29억 달러이며, 이 중 농업・식품 연구 이니셔티브(Agriculture and Food Research Initiative, AFRI) 예산으로 경쟁연구비(7억 달러)와 연구기반 구축비(3.25억 달러)가 포함되어 있다.
한편 바이오에너지, 고부가가치 바이오기반 제품 개발을 위해 농무부(USDA)와 에너지부(DOE)가 2012년부터 협력 프로그램인 ‘바이오매스 연구개발 이니셔티브’ (BRDI Initiative)를 지원하고 있다. 두 부처는 2017년 7월에 바이오매스 개발에 900만 달러를 공동 투자하는 계획을 발표하였다.
나. 정부 연구개발 동향
(1) 범부처 이니셔티브
미국이 범국가적으로 추진하고 있는 생명공학 분야 이니셔티브는 정밀의료(Precision Medicine)(2015년∼ ), BRAIN(2013년∼ ), Cancer Moonshot(2016년∼ ), 마이크로바이옴(National Microbiome Initiative, 2016년∼ )이다. 이들 프로그램에는 여러 부처와 연구기관이 참여하고 있다.
정밀의료 이니셔티브는 유전정보, 환경, 생활습관 등에 대한 개인별 차이를 고려한 예방이나 치료법 개발을 목표로 하고 있으며, 오바마 대통령이 2015년 국정연설을 통해 착수되었다. 국립암연구소(NCI)를 중심으로 한 국립보건원(NIH), 재향군인회, 식품의약청(FDA)과 40여개의 민간기관들이 참여한다. 이 사업의 특징은 민간 전자건강정보 개발업체, Broad연구소, 하버드의대, 보스턴어린이병원 등 민간 병원, 게이츠 재단과 같은 민간재단도 참여하며, 아마존 웹 서비스, Cedars-Sinai 등을 통해 의료 관련 샘플이나 데이터를 공유한다는 것이다.
BRAIN 이니셔티브는 NIH, NSF, 국방부 고등연구계획국(DARPA)이 협력하여 빅데이터 기술 등의 첨단 IT 기술을 뇌과학 연구와 접목시켜 뇌과학 분야에서 선도적 위치를 점하고, 새로운 일자리와 시장을 창출하기 위한 사업으로 로드맵에 따라 2019년 5억 달러, 2025년까지 12년간 총 45억 달러를 투입할 계획을 가지고 있다. 세부적으로는 두뇌의 작동 기작을 규명하여 치매 등의 뇌질환 치료, 인지기능 향상 등의 연구개발이 포함되어 있다.
Cancer Moonshot은 바이든 前부통령이 제안한 암 정복 프로젝트로 환자의 면역 세포를 이용하여 암세포를 죽이는 ‘면역치료’의 원리를 이용하여 새로운 항암제를 개발하는 것이 목표이다. 국립암연구소(NCI), 프레데릭 국립암연구소(Frederick National Laboratory for Cancer Research), 에너지부(DOE), 아르곤연구소, 오크리지연구소, 리버모어연구소, 로스앨러모스연구소, 전국 9개 암센터 등이 참여하며 대규모 암 환자 유전체를 분석하고, 그 정보와 데이터를 전국적으로 공유한다. 미국 정부는 총 10억 달러(한화 약 1조 1500억 원)를 투입하겠다는 계획을 발표한 바 있다.
National Microbiome Initiative는 다양한 생태계의 통합적인 마이크로바이옴 연구를 추진한다. 마이크로바이옴은 사람, 식물, 토양, 해양 대기에 사는 미생물 집단이고 지구상의 다양한 생태계의 건장(健壯)한 기능을 유지하고 인간의 건강, 기후 변화, 식량 안전 보장 등에 영향을 미친다. 이 프로그램은 마이크로바이옴 동태의 이해를 높이고 건장한 마이크로 바이옴의 기능 회복과 기능 장애 예방을 위한 방법론 확립을 목표로 한다.
(2) 국립보건원(NIH)
범국가적으로 수행하는 이니셔티브 외에 NIH가 수행하고 있는 주요 연구개발 사업으로는 Accelerating Medicines Partnership(AMP), Common Fund(CF), Data Science at NIH 등이 있다.
Accelerating Medicines Partnership(AMP)는 2014년 2월 출범한 민관 협력 프로그램으로 질병의 진단과 치료, 발병과 중증화 지연에 도움이 되는 생물학적 표적의 동정・평가를 목표로 한다. NIH, FDA, 바이오기업(10개), 비영리기관(12개)이 참여한다. 현재 알츠하이머병, Ⅱ형 당뇨병, 자가면역질환 등을 대상으로 파일럿 프로그램을 운영하고 있다. 5년간 총 사업비는 1억 7천 8백만 달러이며, 이중 NIH가 1억 2천 백 만 달러, 산업계가 6천 4백만 달러, 비영리기관(NPO)이 160만 달러를 출자한다.
두 번째는 2006년 제정된 NIH 혁신법률에 원장실의 권한 강화 및 다양한 분야 간 협력연구를 지원하기 위해 조성된 커먼펀드(Common Fund)이다. 2016년 말 현재 4D Nucleome, Big Data to Knowledge, Epigenomics, Extracellular RNA Communication 등 28개 협력 프로그램이 진행 중이다.
세 번째, 2012년에 시작된 데이터 과학 이니셔티브(Data Science at NIH)는 데이터과학 부원장(Associate Director for Data Science, ADDS) 직위를 신설하고, 디지털 연구 자산의 축적・활용을 위한 도구 및 방법 개발을 위한 Big Data to Knowledge (BD2K) 이니셔티브를 진행하고 있다. 또한 The NIH Commons라는 가상 공유 공간 구축을 통해 연구 데이터, 소프트웨어, 메타 데이터, 워크플로우를 탐색・관리・공유・이용할 수 있도록 클라우드 환경, 고성능 컴퓨팅 환경을 구축하고 있다.
(3) 국립과학재단(NSF)
NSF는 생물과학국(BIO)과 산하 5개 부서에서 생명공학 연구를 지원하고 있다. 분자세포생명과학부(Division of Molecular and Cellular Biosciences)는 분자세포 수준의 생명현상 이해를 위한 연구를 지원하고 있으며 2017년도 예산은 14억 달러이다. 환경생물학부(Division of Environmental Biology)는 집단, 커뮤니티, 생태계 등의 기원과 상호관계, 진화의 역사 이해 등의 연구를 지원한다(15억 달러). 통합조직시스템부(Division of Integrative Organismal Systems)는 생물(식물, 동물, 미생물) 자체 또는 생체, 조직, 장기의 통합적 이해를 지원한다(22억 달러). 미래 프론티어부(Division of Emerging Frontiers)는 국가 신경과학 연구 인프라 구축, 매크로시스템스 바이올로지, 생명의 기원, 바이오 이미징・시각화 혁신, 광합성 효율 향상 등 다학제 연구를 지원한다(16억 달러). 연구인프라부(Division of Biological Infrastructure)는 인적자원, 연구자원 관련 사업을 지원한다(14억 달러).
(4) 방위사업청(DARPA)
국방부 산하 DARPA는 생물기술실(Biological Technologies Office, BTO)을 통해 신경과학, 휴먼-머신 인터페이스, 신체 증강, 감염증, 합성생물학 등의 프로그램을 지원한다.
(5) 에너지부(DOE)
에너지부는 생물환경연구 프로그램(Biological and Environmental Research, BER)을 운영한다. 구체적으로는 ①미생물과 식물의 게놈 정보로부터 새로운 기능 탐색 및 바이오연료 생산, CO2저장, 환경정화에 활용, ②수십 년 혹은 몇 세기에 걸친 기후변화를 예측하여 미래의 에너지・자원 수요를 예측하고 이에 대응하기 위한 시스템 연구를 지원하고 있다.
기존부터 지원해 오던 유전체 연구와 3개 바이오에너지 연구센터(DOE Bioenergy Research Centers, BRC)를 계속 지원하는 한편, 2017년에는 다양한 환경에서의 마이크로바이옴 상호작용을 규명하기 위한 연구와 기후변화, 미생물-식물 간의 동적인 상호작용 규명을 위한 연구도 확대할 예정이다.
(6) 농무부(USDA)
농림부는 인체의 영양, 비만 인구의 감소, 식품 안전성, 지속 가능한 바이오연료, 세계 식량안보, 기후변화 등과 관련된 연구를 지원하고 있으며 2014년 1월에 ‘농림부 전략계획 2014∼2018’(USDA Strategic Plan, Fiscal Years 2014~2018)에서 ①농촌 지역 커뮤니티 지원(자립, 인구 증가, 경제발전), ②국유림, 사유지의 보전, ③기후변화 적응과 수자원보호, ④식량안보 강화, 농업생산성 향상, ⑤모든 미국 아이들에게 안전하고 영양가 높은 균형 잡힌 식사 제공 등 5개 전략목표를 제시하였다.
이 밖에도 재향군인청(VA), 산업부(DOC), 내무부(DOI) 등에서도 생명공학 관련 연구개발 활동이 이루어지고 있다.
다. 바이오산업10) 동향
(1) 바이오기업 현황
2016년 상장기업 수는 2015년 대비 2%가 증가한 449개이며, 이들 상장기업의 수익과 종업원 수는 4%가 증가하였다. 그러나 순익과 시가총액은 각각 40%, 22%, 상장기업의 자본금 유치액과 IPO 기업공개 수는 각각 50%와 47%가 감소하였다.
[표 1-2] 미국 바이오기업 현황
단위: 십억 달러
|
|
2016 |
2015 |
변화율(%) |
|
상장기업 데이터 |
|||
|
수익 |
112.2 |
107.4 |
4% |
|
R&D 지출 |
38.8 |
34.0 |
14% |
|
순익 |
9.2 |
15.3 |
Δ40% |
|
시가총액 |
698.6 |
891.2 |
Δ22% |
|
종업원 수 |
135,750 |
130,100 |
4% |
|
금융 |
|||
|
상장기업 유치 자본 |
25.6 |
51.5 |
Δ50% |
|
기업공개 수 |
24 |
45 |
Δ47% |
|
비상장기업 유치 자본 |
8.6 |
9.6 |
Δ10% |
|
기업 수 |
|||
|
상장기업 수 |
449 |
442 |
2% |
출처: EY(2017), Capital IQ and company financial statement data
(2) 바이오 클러스터 현황
바이오기업 수로 보면, LA, 보스턴, 뉴저지, 메릴랜드, 샌프란시스코 베이 지역 순으로 많은 기업들이 집적해 있다. 그러나 고용집중도, 고용성장률, 관련 기관 집중도, 벤처캐피탈 펀딩, NIH 연구비 펀딩, 시장점유율, 임대비, 임대가능 공간 등을 종합적으로 고려하면 보스턴, 샌프란시스코 베이 에어리어, 롤리더럼(노스캐롤라이나), 샌디에이고, 시애틀 등이 미국 내 상위 바이오클러스터인 것으로 평가된다.
[표 1-3] 미국 바이오클러스터 순위
|
순위 |
클러스터 |
가중점수 |
순위 |
클러스터 |
가중점수 |
[가중치] 고용집중(20%) 고용성장(10%) 기관집중(10%) VC펀딩(15%) NIH펀딩(15%) 시장점유율(10%) 임대비(10%) 임대가능 랩 공급(10%) |
|
1 |
그레이터 보스톤 |
87.5 |
9 |
웨체스터(뉴욕) |
41.2 |
|
|
2 |
샌프란시스코 베이 |
75.2 |
10 |
뉴저지 |
40.8 |
|
|
3 |
롤리더럼 (노스캐롤라이나) |
60.7 |
11 |
뉴욕시 |
34.7 |
|
|
4 |
샌디에고 |
58.3 |
12 |
미니애폴리스 |
34.5 |
|
|
5 |
시애틀-벨뷰 |
56.3 |
13 |
덴버 |
34.5 |
|
|
6 |
메릴랜드 교외/DC 메트로 |
53.2 |
14 |
시카고 |
30.7 |
|
|
7 |
필라델피아 |
49.4 |
15 |
플로리다 중남부 |
30.6 |
|
|
8 |
LA/오렌지 카운티 |
44.7 |
16 |
롱아일랜드 (뉴욕) |
30.0 |
출처: JLL, USA Life Science Outlook (2016), http://www.us.jll.com/united-states/en-us/Research/US-Life-Sciences-Outlook-2016-JLL.pdf?a162afbf-c305-4ea4-815c-6ac532bac09f
(3) 생명공학 특허등록 건수(2012∼2015)
2012년부터 2015년까지 미국 발명가가 포함된 특허등록 수는 총 101,026개이며, 매년 증가하는 추세이다. 2015년은 전년보다 약간 감소하였지만 4년간 약 15% 증가하였다.
분야별로는 의료・수술 기기 관련 특허가 47%로 가장 많은 비중을 차지하였고, 2012년 대비 2015년에 가장 높은 증가율을 기록한 분야는 제약・의약품개발 분야로 44%가 증가하였다. 바이오메디컬 디자인 특허는 전체 비중은 낮지만 2번째로 높은 증가율(43%)을 기록하였다.
(단위 : 건)

출처: TEConomy Partners analysis of Thomson Reuters Thomson Innovation patent analysis database, https://www.bio.org/sites/default/files/BIO%202016_Report_FINAL_DIGITAL.pdf
[그림 1-2] 연도별 생명공학 특허등록 현황(2012∼2015)
(단위 : 건)

출처: TEConomy Partners analysis of Thomson Reuters Thomson Innovation patent analysis database, https://www.bio.org/sites/default/files/BIO%202016_Report_FINAL_DIGITAL.pdf
[그림 1-3] 분야별 생명공학 특허등록 현황(2012∼2015)
(4) 생명공학 분야 일자리 현황
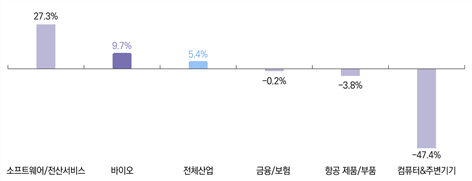
2014년 현재 미국 바이오산업 전체 고용자 수는 166만 명이다. 전체 산업 평균 고용이 크게 줄어든 2009∼2010년 동안 바이오산업의 일자리 감소율은 2%에 불과했고, 이후 빠르게 고용이 회복되면서 증가 추세를 보이고 있다.

출처: TEConomy Partners analysis of U.S. Bureau of Labor Statistics, QCEW data; enhanced file from IMPLAN Group., https://www.bio.org/sites/default/files/BIO%202016_Report_FINAL_DIGITAL.pdf
[그림 1-4] 전체 산업 평균과 바이오산업의 고용 지표 비교
출처: TEConomy Partners analysis of U.S. Bureau of Labor Statistics, QCEW data; enhanced file from IMPLAN Group., https://www.bio.org/sites/default/files/BIO%202016_Report_FINAL_DIGITAL.pdf
[그림 1-5] 고용증가율 (2001∼2014)
2001년부터 2014년까지 15년 동안 바이오산업의 고용 증가율은 약 10%로 14만 7,000명의 신규 일자리를 창출했다. 이는 미국의 전체 산업 평균보다 성장률이 높을 뿐만 아니라, 금융・보험, 항공우주, IT 등 다른 성장성이 높은 산업과 비교해도 매우 높은 수준이다.
-White House, National Biotechnology Blueprint(2012)
-www.aaas.org/sites/default/files/TotRes%3B.xlsx
-EY, Capital IQ and company financial statement data(2017)
-JLL, USA Life Science Outlook(2016)
-TEConomy Partners & BIO, The Value of Bioscience Innovation in Growing Jobs and Improving Quality of Life(2016)
-FY 2018 NSF Budget Request to Congress
-日本貿易振興機構, 2016年米国バイオテクノロジー産業の動向(2017)
-国立研究開発法人科学技術振興機構 研究開発戦略センター, 研究開発の俯瞰報告書-主要国の研究開発戦略(2017)
2. 유럽연합
가. 사회적 이슈
(1) 글로벌 감염성 질환 등장 및 항생제 내성 증가
에볼라바이러스, 지카바이러스 등 감염성 질환의 등장과 대규모 난민의 유럽 이동으로 인하여 신속한 치료 백신개발 및 예방은 더욱 중요한 사회적 이슈로 부상하게 되었다. 유럽연합은 돌발 상황에 대응하여 공공보건 분야 Horizon 연구를 신속 추진하였고, 감염성 질환의 국제적인 공동대응을 위해 설립된 ‘글로벌감염성질환네트워크(Global Research Collaboration for Infectious Disease Preparedness, GLOPID-R)’ 등 다양한 국제협력 네트워크를 통해 글로벌 공동연구를 강화하였다. 또한 2017년 7월 함부르크에서 개최된 G20 정상회담에서 독일은 감염성 질환에 대한 의약품, 백신 및 진단제 부족, 항생제 내성 증가에 대해 공동 대응 방안을 제안하고 주요 안건으로 협의되었다.
(2) 기후변화와 식량안보/안정성 및 바이오 기반 경제
전 세계적인 기후변화는 식량생산에 악영향을 주고 있으며 세계 인구증가 및 글로벌화로 인하여 식량증산과 식품안정성 문제가 더욱 강조되고 있다. 유럽에서는 식량의 증산도 중요하지만 연간 8천 8백만 톤에 달하는 EU내 식품 폐기물의 감소도 해결해야할 사회문제로 제기되었다. 최근 항생제 계란, 육가공품 안정성 문제 등 식품생산 및 유통의 글로벌화 전개에 따른 안정성 문제도 부각되었다. 이외에도 환경에 악영향을 주는 동물성 단백질 과소비 감소, 해산물 수입 의존도 감소를 위한 해양 개발, 바이오매스 등 식품이 아닌 바이오 재료를 기반으로 하는 바이오 에너지 전환으로 바이오 기반 경제를 추구하는 등 글로벌 이슈와 연계된 복합적 문제들이 사회적으로 민감한 이슈로서 논의되고 있다.
(3) GMO 작물 시장의 증대 및 유럽의 저항
GMO 시장은 계속해서 성장하고 있다. GMO 작물 재배 면적은 전 세계적으로 2015년 1억 7,970만 헥타르에서 2016년 1억 8,510만 헥타르로 3% 증가하였고, 유럽에서는 116,870헥타르(2015)에서 136,363헥타르(2016)로 17%가 증가하였다. 농업생명공학 응용을 위한 국제서비스(ISAAA: International Service for the Acquisition of Agri-biotech Applications)에 따르면, 생명공학 작물(biotech crops)을 재배함으로써 1년에 1,200만 대의 자동차를 제거한 것과 같은 이산화탄소 저감 효과를 가져왔고, 제초제 및 살충제의 사용을 19% 줄일 수 있었다. 물론 미국, 아시아에 비해 유럽은 아직 GMO 작물에 대한 저항성이 큰 편이다. 전체적인 재배 면적도 미국, 브라질 등에 비해 매우 작은 편이며, 단지 4개의 유럽 국가만이 GMO 작물을 재배하고 있다. 스페인(129,081헥타르), 포르투갈(7,069헥타르)이 대부분을 차지하고 있고, 그 밖에 슬로바키아, 체코에서 소량 재배하고 있다.11)
(4) 희귀의약품 시장의 증대
희귀의약품(orphan drug)과 관련해서 가장 보편적인 이미지는 투자 대비 성과가 높지 않아 글로벌 제약 기업들보다는 소규모 바이오벤처들로 산업이 구성되어 있다는 것이다. 하지만 실제로는 희귀의약품 역시 글로벌 제약기업들이 주된 매출을 올리고 있으며, 바이오테크 중소기업은 희귀의약품 상위 10개사 중 3개에 불과했다. 희귀의약품의 경우 환자당 평균 비용이 비희귀의약품에 비해 약 5.5배 높아 수요가 적은 만큼 개당 가격이 비싸 수익성이 높다. 2022년에는 전 세계 희귀의약품 매출액이 2천억 달러를 넘어설 것으로 예상되며, 이는 전체 처방의약품(제너릭 의약품 제외) 시장의 21.4%에 해당하는 것이다. 유럽 내에서는 2022년까지 전체 파이프라인 누적 가치의 55%를 차지할 것으로 예상하고 있다.12)
(5) 브렉시트(Brexit)의 영향
2019년까지 영국이 EU를 탈퇴하는 브렉시트(Brexit)는 이미 확정되었고 유럽연합은 영국의 회원국 혜택을 제한하는 방향으로 협상을 진행할 전망이다. Horizon 2020 프로그램의 최근 3년간 국가별 수주는 영국이 가장 앞서 있다.13) 캠브릿지, 옥스포드, 런던대학, 런던제국대학 등 4개 영국대학이 막스플랑크나 CNRS 등 독일 프랑스의 대형 공공연구기관에 이어 연구비 수주 상위권을 차지하고 있기 때문이다. 최근 유럽연합 고위그룹은 브렉시트(Brexit) 이후에도 상호투자 협정 등을 통해 영국과 호혜적인 협력모델이 구축되어야 한다고 권고하였다.14) 유럽연합은 모든 국가의 최고 연구기관과의 연구혁신 프로그램을 개방적으로 운영할 예정이기에 영국과의 호혜적인 공동연구 협력이 합의된 범위 내에서 지속될 전망이지만, 영국의 중소 바이오테크 관련 기업들의 유럽시장에서의 기업 활동에는 브렉시트가 악재로 작용하게 될 것으로 예상되고 있다.
나. 정책 동향
(1) Horizon 2020 내 생명공학 관련 연구사업
제7차 프레임워크 프로그램(FP7)에 이은 유럽연합 Horizon 2020에서는 사회적 도전과제(SC: Societal Challenge) 부문에 예산의 39%를 투입하고 있다. 건강, 식량, 에너지, 스마트 수송, 기후변화, 안보 등 제반 사회문제 해결형 R&D가 유럽 2020전략 정책을 반영하여 추진되고 있는데, 그 중에서 SC1 ‘건강, 인구변화, 웰빙(Health, Demographic change, Wellbeing)’과 SC2 ‘식량 안보, 지속가능 농업, 해양연구, 바이오경제(Food security, Sustainable agriculture, Marine research, Bio- economy)’가 생명공학 분야와 밀접한 관련이 있다.

자료 : EC, Factsheet: Horizon 2020 budgett (https://ec.europa.eu/programmes/horizon2020/sites/horizon2020/files/Factsheet_budget_H2020_0.pdf)
[그림 1-6] Horizon 2020 프로그램 구조 및 예산
SC1 프로그램은 개인 맞춤형 의료(PM: Personalized Medicine)에 특히 초점을 맞추고 있다. 특히 FP7의 건강(Health) 부문과 비교했을 때, Horizon 2020의 SC1 프로그램의 추가된 부분과 변경된 제도는 다음과 같다.
① 인구변화 측면을 새롭게 다룬다는 점과 e-health나 Environment&Health와 같이 건강 관련 분야들이지만 이전 FP에서는 다른 주제에 속하던 영역을 폭 넓게 수용하고 있다.
② 응모 방식(Challenge-based approach)의 과제 선정을 통해 보다 다양하고 창의적인 주제들이 채택되고 있다. 기존과는 달리 바텀업(bottom-up) 방식에 가까운 과제 도출 체계이며, 기존에는 간과하기 쉬웠던 연구 분야들에 대해서도 포착이 가능해졌다.
③ 대형 파트너와의 협력 연구를 강조하여, 대형 파트너가 펀딩하고 있는 프로젝트에 대해 지원을 강화하고 있다.
SC1 프로그램의 경우, 2014년부터 진행되면서 목표에 약간의 수정이 가해졌는데, 주로 공공보건 분야에 대한 강화가 이루어졌다. 이는 에볼라바이러스, 지카바이러스 등과 같은 치명적인 감염성 질환의 등장과 유럽으로의 대규모 난민 이동 등을 반영한 결과라고 볼 수 있다.
|
SC1 프로그램의 목표 |
|
1. 효과적인 건강 증진 |
|
2. 질병, 장애, 노령화, 기능상실 등을 예방하고, 조기에 진단하며 관리하고 치료하는 것 |
|
3. 빈곤 관련 질병, 소외 질병들에 대한 종합적인 접근 |
|
4. 개인 맞춤형 의료 |
자료: EC, (2017) Interim Evaluation of HORIZON 2020
SC1 프로그램의 활동별 예산 비중을 살펴보면, 여전히 질병의 치료와 관리 분야에 가장 많은 예산을 투입하고 있으며 질병의 예방과 이해 분야에도 상당한 비중의 예산을 투입하고 있다.
|
활동 |
예산 배분 비중 |
|
건강, 웰빙, 질병에 대한 이해 |
16.5% |
|
질병의 예방 |
16.5% |
|
질병의 치료와 관리 |
40.0% |
|
건강한 노화와 건강 자기관리 |
13.0% |
|
방법론과 데이터 |
7.0% |
|
헬스케어 제공과 통합 관리 |
7.0% |
자료: EC, (2017) Interim Evaluation of HORIZON 2020
SC1 프로그램이 인류의 건강과 관련된 생명공학 분야였다면, SC2 프로그램의 경우에는 식량과 에너지 그리고 생명공학과 관련된 경제적 영향 등을 다루고 있다.
|
분야 |
주요 과제 |
|
식량안보 |
・안전하고 건강한 식량을, 보다 환경에 적게 영향을 미치고 적은 자원으로 척박한 환경에서도 대량으로 생산하는 것 |
|
지속가능한 농업 |
・지속가능한 범위 내에서 자연으로부터 에너지, 자원을 얻는 것 |
|
해양 연구 |
・유럽의 과도한 해산물 수입 의존도를 낮추는 것 ・유럽의 해양, 해안가 등을 활용한 고용 창출 및 경제 성장 |
|
바이오경제 |
・기후변화에 대비하는 것은 물론 화석연료의 사용을 낮추고 녹색 성장을 이루는 것 |
자료: EC, (2017) Interim Evaluation of HORIZON 2020
SC2 프로그램의 경우, 2014-2015와 달리 2016-2017의 work program에 변동이 생겼다. ‘지속가능한 식량 안보(Sustainable Food Security)’와 ‘블루 성장(Blue Growth)’은 그대로 이어진 반면, ‘혁신적, 지속가능, 포용적 바이오경제(Innovative, Sustainable and Inclusive Bioeconomy)’는 ‘지속가능한 제품과 서비스를 위한 바이오기반 혁신(Bio-based innovation for sustainable goods and services)’으로 대체되었다. 한편, ‘농촌 르네상스(Rural Renaissance)’가 신설되었다.
(2) 독일의 新첨단기술전략과 생명공학 관련 연구사업
독일은 글로벌 현안과제에 대응하고 지속적인 경제성장을 통한 국가경쟁력 확보를 목표로 ‘첨단기술전략’을 범정부적으로 추진하고 있다. 메르켈 정부가 출범한 2006년에 ‘첨단기술전략’이 최초로 시작된 이후에 ‘첨단기술전략2020(2010년)’, ‘新첨단기술전략(2014년)’으로 미래 전략 프로그램이 지속적으로 보완 발전하며 진행 중이다. 첨단기술전략은 현안문제에 대응하고 각 중점영역의 신규 시장창출에 기여할 수 있도록 혁신을 통한 성장, 고용, 삶의 질 향상을 지향하고 있다.
|
|
첨단기술전략2020(2010년) |
新첨단기술전략(2014년) |
|
중점 연구분야 |
17개 핵심기술 (공통분야) 나노, 바이오, 마이크로시스템, 광, 소재, 생산 (이동성・통신) ICT, 교통, 항공, 우주, 해양, 서비스 (보건・안전) 보건의료, 보안, 식물, 에너지, 환경 |
6개 선행미래과제 ① 디지털경제 및 사회 ② 지속가능 경제 및 에너지 (바이오경제 등) ③ 혁신노동세계 ④ 건강한 생활(주요질병 대응, 맞춤형 의약품, 예방/영양, 간병, 신약, 의료기술) ⑤ 지능형이동성(Intelligent Mobility) ⑥ 시민안전 |
자료: BMBF The new High-Tech Strategy Innovation for Germany 및 홈페이지 참조
독일정부의 新첨단기술전략의 6대 선행 미래과제 중 ‘건강한 생활(Healthy Living)’ 분야가 생명공학과 가장 직접적으로 관련되어 있으며, ‘주요질병대응’, ‘맞춤형 의약품’, ‘예방 및 영양’, ‘간병 혁신’, ‘신약연구’, ‘의료기술혁신’ 분야의 과제가 포함되었다. 또한 ‘지속가능경제 및 에너지’ 분야에서 새로운 바이오 기술 및 생물자원의 효율적 사용에 대한 ‘바이오경제’가 포함되어 있다. 독일의 만성질병인 암, 심혈관 질환, 대사 장애, 폐, 신경질환 및 전염병 예방 연구를 위해서 6개 독일보건연구센터와 유전자 연구네트워크, 의약학 연구네트워크, 베를린 보건연구소가 관련 산업계와 밀접하게 협력하며 환자중심의 융합연구와 사업화를 추진하고 있다.
‘맞춤형 의약품 개발’도 중점분야이며 생명과학과 정보기술 분야의 결합을 통한 의료정보학(Medical Informatics) 전략을 활발하게 추진하고 있는 중이다. 예를 들어 5천 명의 환자를 대상으로 쾰른 대학이 주도적으로 수행한 게놈기반 정밀분자생물학적 진단 연구는 개인별 맞춤형 폐암진단 및 치료에 실제 응용되고 있다.
독일의 바이에른(Bayern) 주는 2025년까지 50억 유로의 투자의 일환으로, 2018년부터 2건의 야심찬 디지털 의료(digital medicine) 프로젝트를 시행한다고 밝혔다. 하나는 원격의료 프로젝트로서 인구 코호트(Cohort)에 대한 데이터와 심혈관질환 환자의 데이터를 병합하여 맞춤형 치료 및 관리를 목적으로 한다. 이 프로젝트에는 독일 심장 센터(German Heart Centre), 헬름홀츠 뮌헨(Helmholtz Centre Munich), Bio-M 등이 참여한다. 또 하나는 EMR(전자의무기록) 데이터 플랫폼화에 관한 프로젝트이다. 바이에른 주는 유럽 내에서 의료 데이터의 디지털화와 분석 등에 있어 선구자적인 역할을 하고 있다. 하지만 여전히 의료 데이터는 비구조화 되어있고 이곳저곳에 분산되어 있어, 이들을 하나의 플랫폼으로 모으는 것은 어려운 일이다. 이밖에도 독일은 연방정부 차원에서 의료분야의 디지털 인프라에 관심을 가지고 있다. 의료 데이터를 한 데 모으고 더 많은 개인 맞춤형 의료 서비스를 제공하기 위해 독일 전역의 4개의 병원 네트워크를 선정하여 2021년까지 1억 2천만 유로를 지원하기로 하였다.15)
‘질병예방 및 영양’ 분야에서 생애주기와 관련된 건강문제에 대한 연구를 장기적인 관점에서 추진하고 있으며, 연구 성과가 유럽 전체로 확대 적용이 가능하도록 노력하고 있다. 또한 ‘간병 혁신’을 위해 ‘간병혁신2020’ 정책을 수립하여 간병이 필요한 환자와 노인 및 가족들의 삶의 질을 개선하기 위한 새로운 기술 및 조직적인 해결책 개발을 모색하고 있다. ‘베른슈타인 컴퓨터 신경과학 네트워크(Nationale Netzwerk Computational Neuroscience)’는 인간의 뇌와 교감이 가능한 인지정보를 컴퓨터로 분석하여 지능형 의족을 개발하였다. 세계적인 의료보조기기 기업인 Otto Bock Health Care사가 파트너로 참여하여 센서, 컴퓨터 및 로봇기술을 결합한 지능형의족 기술 개발을 성공적으로 추진하였다.
다. 유럽 주요 국가별 기술 및 산업동향
전 세계적으로 2016년에는 2015년에 비해 바이오테크 산업의 상황이 악화되었다. 기업공개(IPO)된 바이오테크 기업의 수도 감소하였고(2015년 78개→2016년 47개), 기업공개를 통해 조달된 자본의 규모도 감소하였다(2015년 52억 달러(미국38억+유럽14억)에서 2016년 19억 달러(미국12억+유럽7억)). 2016년 유럽 바이오테크 산업에서 IPO를 통해 조달된 자본의 규모는 2015년 대비 절반 수준에 머물렀는데, 2016년에 있었던 미국 대선 및 영국의 EU 탈퇴(브렉시트)에 따른 유럽 바이오테크 산업의 불확실성 증가가 원인으로 지목되고 있다.16)
2016년 biotechgate에서 발표한 유럽 국가들의 생명공학 기업 수를 살펴보면, 독일이 총 1,876개로 가장 많고 그 다음을 영국(1,610개)과 프랑스(1,112개)가 뒤따르고 있다. 생명공학 산업에 근무하는 근로자 수도 기업 수와 비슷한 경향을 보이고 있다.
독일이 24만 7천명으로 가장 많고 영국(17만 4천명)과 프랑스(14만 6천명)가 그 뒤를 따르고 있다. 한편 인구 수 대비로는 스위스가 가장 높다.
|
국가 |
바이오테크 |
의료기기 |
제약 |
|||
|
기업 수 |
근로자 수 |
기업 수 |
근로자 수 |
기업 수 |
근로자 수 |
|
|
벨기에 |
315 |
15,000 |
135 |
5,000 |
74 |
40,000 |
|
프랑스 |
858 |
11,000 |
160 |
40,000 |
94 |
95,000 |
|
독일 |
1,201 |
37,000 |
572 |
100,000 |
103 |
110,000 |
|
아일랜드 |
83 |
6,000 |
39 |
9,000 |
11 |
12,000 |
|
네덜란드 |
495 |
8,000 |
117 |
9,500 |
40 |
9,000 |
|
스위스 |
450 |
20,000 |
230 |
45,000 |
7 |
40,000 |
|
영국 |
1,225 |
30,000 |
275 |
71,000 |
110 |
73,000 |
주 : 바이오테크는 biotechnology + biotech therapeutics(치료제) 합한 수치
출처: KPMG (2016) Site selection – for life science companies in Europe p.15
(1) 독일
독일 BMBF 통계에 따르면 보건 및 보건산업분야의 연구비는 2016년 20.6억에 달하며 독일 전체 연구비(총 94.6억 원)의 약 22%로 기술분야별 연구비로는 가장 높은 투자를 하고 있는 분야이다. 이는 보건기술이 고령화에 대응하고 복지를 증진하는 것뿐만 아니라 독일의 바이오테크 산업의 국제 경쟁력과 직결되어 있기 때문이다. 독일의 바이오테크 시장은 계속해서 성장하고 있다. 2016년에는 근로자 수, 매출액, R&D 비용 등에 있어 정점을 기록하였다. 2016년 독일 바이오테크 분야의 매출액은 35억 4천만 유로로 전년 대비 8% 증가하였고, 근로자 수는 2만 명을 넘어서서 역대 가장 큰 수치를 기록하였다. 독일 바이오테크 기업에 투자된 금액은 2015년 5억 5천만 유로, 2016년 5억 5백만 유로로 지난 기간 대비 월등히 높았으며 대부분은 상장 기업들이 유치하였다. 또한 최근에는 독일 중소 바이오테크 기업들과 글로벌 제약회사 간에 수억 유로에 달하는 라이선싱 계약들(BioNTech와 Genentech, 2억 7,800만 유로/ Medigene과 Bluebrid Bio, 9억 1,700만 유로 등)이 체결되면서 활력을 띠고 있다.17)
(2) 프랑스
프랑스의 대표적인 생명공학 관련 연구기관으로 INSERM(프랑스 국립보건의학연구소)이 있다. 의료, 헬스케어 연구를 주로 담당하며 2015년 유럽특허청(EPO)에 바이오테크 관련 특허를 가장 많이 등록하였다. 프랑스 바이오테크 기업의 56%는 학계 연구를 바탕으로 설립되었다. 뿐만 아니라 파트너십 또한 활발한데, 44%는 학계와 33%는 생산업체와, 17%는 다른 바이오테크 기업과 파트너십을 맺고 있다. 벤처캐피탈 자금으로 16억 유로 이상이 조달되었고, 여기에는 2015년 14개의 주식상장으로 인한 6억 유로가 포함된다. 이 같은 실적을 바탕으로 Euronext(파리)는 유럽의 바이오테크 산업의 선두 시장으로 자리매김하였다.
생명공학 기술은 프랑스 바이오테크 산업 내에서도 주도적인 위치를 차지하기 시작했다. 프랑스의 대표적인 다국적 제약기업인 Sanofi는 자사의 핵심 역량을 바이오테크로 변경하고 화학기반 제약기업에서 바이오제약 기업으로 변모하였다. 파리(Paris)와 리옹(Lyon), 두 바이오 클러스터를 중심으로 각종 벤처기업들의 성장도 눈에 띈다. 특히 그 중에서도 시가 총액이 각각 10억 유로가 넘는 두 기업이 주목받고 있다. DBV Technologies는 땅콩 알러지 치료제를 개발하고 있고, Advanced Accelerator Applications는 분자 핵의학 분야(molecular nuclear medicine)의 연구를 진행하고 있다. 한편, 프랑스에서는 전 세계 임상시험의 약 10% 가량이 실시되는데, 종양관련 질환(oncology), 감염 질환(infectious medicine), 희귀질환(rare diseases) 등이 주된 분야이다.18)19)
(3) 영국
유럽연합 집행위원회(EC: European Commission) 및 유럽의약청(EMA: European Medicine Agency)에서는 영국 소재 바이오제약 기업들을 대상으로 브렉시트(Brexit) 이후의 가이드라인을 제공하였다. 기본적으로 시장 허가 및 유럽 내 판매 허가(MAA: Marketing Authorization Application)는 유럽경제지역(EU 회원국 및 노르웨이, 아이슬란드 리히텐슈타인) 내에서만 유효하다. 영국 내에서 생산되는 최종 제품 및 원료의약품(API: Active Pharmaceutical Ingredients)은 2019년 3월 30일 이후로는 유럽경제지역(EEA: European Economic Area) 내에서 수입 제품으로 간주되고, 별도의 허가 절차를 밟아야 한다. 영국의 중소 제약기업들은 EEA 회원국에 자회사를 두고 있지 않은 한, 기존에 받았던 혜택들(EMA 허가등록 비용 감면 등)을 받지 못하게 된다.20) 이렇듯 영국의 중소 바이오테크 관련 기업들에게는 브렉시트가 악재로 작용하게 되었지만, 영국 정부는 영국의 생명과학 분야의 경쟁력이 매우 강하다고 판단하고 있다. 이 같은 신뢰의 바탕에는 영국이 기초과학 분야에서 강점을 가지고 있다는 사실이 자리 잡고 있다. 그럼에도 불구하고 장기적으로는 인재 유치 실패와 인력의 유출, Horizon 2020과 같은 범 유럽 프로그램에 대한 접근성 제한 등이 영국 생명과학 산업에 불리하게 작용할 것이라는 예측이 많은 것은 사실이다.21)
영국의 생명과학산업 근로자의 생산성은 2015년을 기준으로 104,000 파운드로 산업 전체 평균인 49,000 파운드에 비해 2배 이상 높다. 영국 내 주요 생명과학 클러스터가 위치한 East Anglia, Wales, South East of England 등에 약 22만 명이 근무하고 있으며, 여기서 매출액이 600억 파운드(2015) 이상 발생하였다. 이 같은 사실을 바탕으로 영국은 생명과학 분야를 향후 영국의 전략적 산업분야로 지정하였으며, 첨단 의약품 생산과 바이오제약 연구 등에 중점을 둘 것으로 보인다.22)
(4) 스위스
스위스에서 제약・바이오테크・화학 산업이 전체 수출에서 차지하는 비중은 2001년 31.8%에서 2016년 44.8%까지 꾸준히 증가하였다. 특히 2016년 해당 분야 수출액 943억 유로 중에서 약 85%에 해당하는 800억 유로는 제약(pharmaceutical)에서 발생했는데, 제약에서 생명공학 기술은 그 비중이 점점 커지고 있다. 2016년을 기준으로 스위스의 바이오테크 관련 특허 수는 전 세계 11위이다(중국 1위, 미국 2위, 일본 3위, 한국 4위 등). 하지만 특허의 질적 가치(인용 빈도 및 대상 국가)에 있어서는 덴마크와 함께 최상위권에 속하고 있다. 스위스 바이오테크 산업은 2016년 8억 2,300만 CHF(공개기업 3억 5,100만+비공개기업 4억 7,200만)의 자금을 조달하였다. 2015년 대비(9억 700만 CHF) 소폭 하락하기는 하였지만, 전반적으로 양호한 성적을 나타내고 있다.

출처: EY, (2017) Swiss Biotech Report 2017
[그림 1-7] 스위스 바이오테크 기업 수 추이
한편, 스위스 바이오테크 기업의 수는 해마다 증가하고 있는 추세이다. 공급기업(supplier)의 수가 소폭 감소하고 있기는 하지만 개발기업(developer)의 수가 그 이상으로 늘어나고 있다. 단순 생산업체가 줄어드는 대신 개발업체가 증가하고 있기 때문에 그만큼 스위스 바이오테크 산업은 고도화되고 있다고 해석할 수 있다.
2014년 대비 바이오테크 산업의 근로자 수는 조금씩 증가하고 있는데, 비공개기업(privately held company)보다는 공개기업(publicly traded company)의 근로자 수가 크게 증가했다는 사실을 살펴볼 수 있다. 최근 3년 동안 스위스 바이오테크 산업에서는 많은 기업들이 주식시장에 상장되었고, 그만큼 고용이 활발해졌다.

출처: EY (2017) Swiss Biotech Report 2017
[그림 1-8] 스위스 바이오테크 기업 근로자 수 추이
라. 법제도 동향
(1) EU의 규제 시스템
EU의 규제시스템의 영향은 협력연구와 시장 접근성의 측면으로 나누어 볼 수 있다. EU 단위에서의 연구 지원 프로그램들은 단순히 재정적인 지원 이상의 의미를 갖는다. 서로 다른 국가들 간의 협력연구를 가능하게 하고, 인력의 이동이 자유롭다는 점에서 더 큰 시너지 효과를 발휘하고 있는 것이다. 이를 위해 EU가 제시하고 있는 법률과 규제들은 이러한 협력연구를 불필요하게 가로막지 않도록 세밀하게 설계되어 있다. EU에서 협력연구(collaboration research)를 가능하게 하는 동인으로 공통된 체제(regime)를 들 수 있다. 이 제도들은 연구로부터 파생된 혁신을 승인하거나 규제하는 제도로서, EU 회원국 전체에 공통적으로 적용된다. 가령 몇몇 규제 프로세스 상에서는 개별 국가가 EU 전체에서 사용가능한 제품을 허가할 수도 있다. 이처럼 EU에서 규제 체제는 생명과학 제품, 프로세스, 치료법 등이 EU 전체 시장에서 사용될 수 있도록 하는 도구적 역할을 한다. EU 28개 회원국 사이에 일관적으로 적용되는 프로세스와 요구사항에 대한 규제로 인해 협력연구가 수월하게 진행될 수 있고 개발, 생산된 제품을 EU 시장에 빠르게 출시할 수 있는 것이다.23)
(2) 연구개발투자 확대 및 임무지향적인 글로벌 공조 강화
유럽연합 고위 자문단은 탁월한 연구제안서가 많이 탈락하는 문제점을 개선하기 위해서 차기 프로그램에서 연구비를 2배로 증액할 것을 권장하고 있다. 아울러 글로벌 사회문제 해결을 위해 회원국과의 공조를 강화하고 보다 임무지향적이고, 기대효과 중심으로 대형연구과제의 포트폴리오가 재정립되어야 한다고 권고하였다.24)
Horizon 2020 중간평가에 따르면 2014~2016년에 수행된 연구과제의 83%는 EU 지원이 없었으며 진행되지 못하였고 이는 글로벌, 다학제적 공동연구, 국가 연구과제 및 민간 연구개발 투자를 촉진하는데 기여하였음을 의미한다.25)
연구관리 단순화로 예측하지 못한 에볼라바이러스, 지카바이러스 등 치명적인 감염성 질환의 등장에 전례 없이 신속하게 대응연구를 추가 추진하는 것이 가능하게 되었다. 차기 프로그램은 유럽의 모든 연구혁신 프로그램이 참고할 수 있는 글로벌 아젠다로서의 역할이 더욱 강조될 것이다. 차기 프로그램의 글로벌 임무는 아직 확정되지 않았지만 생명공학분야 분야는 ‘인간 두뇌 이해’, ‘2034년 암환자 생존율 3/4 달성’ 등이 논의되고 있다.
(3) 유럽혁신위원회(European Innovation Council) 설립 및 시민참여 강화
‘유럽연구위원회(European Reserch Council)’가 기초연구진흥을 위해서 설립 운영되고 있는 바와 같이, ‘유럽혁신위원회(European Innovation Council)’를 상시적인 고위급 전략기구로 설립 운영하여, 다분야 다국적 융합연구 및 혁신활동을 촉진하는 방안이 유럽연합 내에서 논의되고 있다. 또한 유럽연합의 연구혁신 프로그램 기획, 설계 과정에 아이디어와 자금의 크라우드소싱(crowdsourcing)이 필수적인 부분으로 고려되어야 하며, 의사결정에 시민참여가 보다 강화되어야 한다는 권고안이 제기되었다.
3. 중국
가. 사회적 이슈
중국은 2013년 11월 중국공산당 18기 3중 전회에서 ‘중국의 꿈(中國夢)’을 실현하는 향후 10년의 청사진 제시에 이어, 2016년 3월 중국 발전개혁위원회는 ‘국민경제사회발전 제13차 5개년 규획(2016∼2020, 이하 13.5계획)’을 공식 발표하면서 경제, 사회, 과학기술, 교육 등 전 분야에 대해 2020년까지의 목표를 제시하였다. 중국은 1953년 처음으로 1차 5개년 계획을 수립할 당시부터 13.5계획에 이르기까지 일관되게 국가계획을 수립하고 추진하고 있다. 중국정부는 13.5계획이 마무리되는 2020년에는 모든 국민이 중산층 수준의 생활을 영위하는 샤오캉(小康)사회 실현을 대내외에 천명하였다.
중국은 과학기술에서도 굴기(屈起)하고 있다. 중국은 2015년 중국 내 고등연구기관 및 대학에서 과학기술 관련 논문을 총 29만 6,800편(전 세계의 17%) 발표하여 세계 2위를 기록하고 있으며 2005년 약 6%에 불과했던 비중과 비교해 볼 때 엄청난 증가세를 보이고 있다. 중국정부는 향후 중국과학원을 중심으로 과학기술 기초분야를 전문으로 연구, 투자하는 ‘국가기초연구프로젝트 13.5계획’을 과학기술부, 교육부, 자연과학기금위원회가 공동으로 연구에 특화된 인재양성과 막대한 사업비용을 동시에 충족시키는 계획을 실시할 방침이다.
(1) 13차 5개년 계획(2016∼2020)
13.5계획의 가장 큰 특징은 혁신(創新)을 강조하고 있다. 시진핑정부는 중속성장과 혁신을 계속 강조하고 있다.
(가) 13.5계획의 목표
13.5계획의 목표는 경제의 중고속 성장유지, 혁신드라이브 발전효과의 가시화, 발전협력 증가, 생활수준과 질 향상, 국민소양과 사회문명 향상, 생태환경 수준 개선, 각 제도의 성숙과 안착의 7가지로 정리 된다.
[표 1-9] 13차 5개년 계획(13.5계획)의 목표
|
목표 |
세부목표 및 수치 |
|
경제의 중고속 성장유지 |
-GDP 증가율 6.5% 이상 -2020년까지 GDP와 도농주민소득 두 배 이상 상승 (2015년 대비) |
|
혁신드라이브 발전효과의 가시화 |
-2020년까지 경제성장에서 과학기술이 차지하는 공헌도 60%까지 상승 -혁신형 국가와 인재강국 진입 |
|
발전협력 증가 |
-2020년까지 상주인구 도시화율 60% -80% 이상의 대도시에 고속철도 구축 |
|
생활수준과 질 향상 |
-모든 농촌빈곤층의 빈곤탈피 -도시 낙후지역 주택 개조 2,000만 채 -기대수명 1세 증가 |
|
국민소양과 사회문명 향상 |
-공공문화서비스 시스템 기본 형성 -문화산업을 지주산업으로 양성 |
|
생태환경 수준 개선 |
-단위GDP 에너지소모 15% 감소 -대도시 공기가 깨끗한 날이 80% 이상될 것 |
|
각 제도의 성숙과 안착 |
-각 기초제도 시스템 기본 형성 -법치정보 기본 형성 |
(나) 13.5계획의 주요내용
13.5계획은 신농촌 건설과 산업전환 및 업그레이드를 강조한 12.5계획에 비해 전 분야의 혁신을 강조하고 있다. 이와 관련한 13.5계획 주요 내용은 과학기술혁신을 핵심으로 인재발전을 지원하여 과학기술 혁신과 ‘대중창업(大衆創業), 만중혁신(萬衆創新)’의 유기적인 결합 등을 추진하는 혁신드라이브 발전전략을 명시하였다.
현대적 산업시스템을 최적화하기 위해 구조조정, 경제발전을 위해 공급자 측 구조개혁을 추진하며, 신흥산업 육성, 전통산업 업그레이드, 우수한 품질과 서비스, 친환경 현대산업의 새로운 시스템구축에 주안점을 두고 있다. 또한 중국은 4차 산업에 중요한 ICT분야를 집중육성하기 위해, 13.5계획에서도 정보기술 변화 추세에 맞춰 인터넷 강국 전략을 실시하고, 디지털 중국 건설을 추진, 정보기술과 경제사회 발전의 융합을 추진하고 정보통신 경제발전을 확대하는 것을 보여주고 있다.
[표 1-10] 혁신드라이브의 발전전략
|
목표 |
정책 |
|
과학기술혁신의 역할 강화 |
-전략적 혁신분야 혁신 추진 -혁신적 조직체계 최적화 -혁신 기초능력 업그레이드 -지역혁신 고지 조정 |
|
대중 창업과 민중혁신 심화 |
-창업혁신 공공서비스 플랫폼 건설 -창업 포용, 지원, 구축의 전면적 추진 |
|
혁신시스템 인센티브 메커니즘 구축 |
-과학기술관리 시스템 개혁 심화 -과학기술 사업화 및 수익분배 메커니즘 개선 -보급형 혁신 지원정책 시스템 구축 |
|
우수 인재 발전전략 실시 |
-대규모 인재풀 구성 -인재의 최적화 배치 촉진 -우수인재 발전환경 조성 |
|
발전 동력의 새로운 공간 확대 |
-소비 업그레이드 촉진 -효과적 투자확대 -수출의 새로운 우위분야 육성 |
(2) 국가혁신드라이브 발전전략(2016년)
중국정부는 2050년까지 세계 과학기술 강국으로 굴기하기 위한 전략으로 중국과학기술부는 13.5계획에서 제시한 ‘혁신드라이브정책’의 액션프로그램을 구체화하기 위하여 2016년 5월 19일 ‘국가혁신드라이브발전전략강요(國家創新驅動發展戰略綱要)’를 발표하였다. 이어 2016년 8월 13.5계획 국가과학기술혁신계획을 발표하였다.
중국 과학기술은 양적성장에서 질적 성장으로 도약하면서 과학기술, 공학, 산업의 자주적 혁신능력은 향상되고 있지만, 각종 산업의 글로벌 가치사슬은 업그레이드 할 필요가 있다. 과학기술인재도 양적으로 많으나 질적으로 떨어지고 고급 기술자가 부족하다는 인식이 발전전략 강요의 주요 추진배경이다. 2050년까지 단계별 국가혁신드라이브 발전전략은 다음과 같다.
(가) 국가혁신드라이브의 주요 내용
국가혁신드라이브는 2개 드라이브, 1개 시스템, 6개 변화추진에 따라 진행된다. 2개의 드라이브는 과학기술혁신 실현과 체제메커니즘 혁신 실현이며, 1개의 시스템은 국가혁신시스템 구축을, 6개의 변화란 성장방식, 요소, 산업가치사슬, 혁신능력, 자원배치, 주체 등에서 변화를 말한다.
(나) 국가혁신드라이브 단계별 발전전략
① 1단계(2020년까지)
2020년까지 혁신형 국가대열에 진입하여 중국 특색의 국가혁신시스템을 구축하고 전면적 소강사회 건설을 뒷받침하는 단계이다. 1단계 주요목표로 일부 중점사업은 글로벌 가치사슬의 중/고 단계에 진입하고 국가 경쟁력을 갖춘 혁신형 기업과 산업클러스터를 형성하는 것이다.
[표 1-11] 국가혁신드라이브 발전전략강요의 주요 내용
|
2개 드라이브 |
1. 과학기술 혁신 우선 실현 -발전방향과 중점을 명확히 하고 과학 탐색과 기술극복을 통한 지속적인 혁신시스템 능력 향상 |
|
2. 체제 메커니즘 혁신 실현 -과학기술과 경제, 정무 등 세 분야의 체제 메커니즘 개혁을 기획, 추진 |
|
|
1개 시스템 |
1. 국가혁신시스템 구축 -기업, 연구소, 대학, 사회조직 등 혁신주체의 기능방향 명확한 설정 -고등 교육기관의 혁신네트워크 구축 -군/민 융합의 국방과학기술협력 혁신 플랫폼 건설 -혁신 장려정책 시스템개선 -혁신 법률제도 보호 등으로 전사회의 혁신활력 활성화 |
|
6개 변화 |
1. 규모 확장 성장방식에서 질적 효과의 지속가능한 발전으로 변화 |
|
2. 전통적 요소 주도발전에서 혁신요소 주도발전으로 변화 |
|
|
3. 산업분야의 가치사슬 저/중 단계에서 중/고 단계로 변화 |
|
|
4. 혁신능력은 추격중심에서 병행과 선도위주로 변화 |
|
|
5. 자원배치는 연구개발 단계에서 산업/혁신/자금사슬 기획배치로 변화 |
|
|
6. 혁신주체는 과학기술자 등 소수에서 대중의 혁신과 창업의 상호연계 |
구체적으로 2020년까지 기존 국가과학기술 중대 프로젝트를 지속적으로 추진하여 IT산업(반도체, 첨단 디지털 수치제어기기, 집적회로 장비, 광대역 이동장치 등), BT산업(유전자변형 바이오제품, 신약제조, 전염병 방지 등), 원자력 에너지, 수자원 오염처리 분야에서 핵심기술을 개발하고 새로운 산업을 육성할 계획이다.
1단계에서 과학기술 공헌도는 60% 이상, 지식밀집형 서비스업 부가가치의 GDP점유율은 20% 이상, R&D 비용은 GDP의 2.5% 이상을 목표로 한다.
② 2단계(2030년까지)
2단계는 2030년까지 혁신형 국가 대열의 선두위치로 도약하는 단계로 경제사회 발전수준과 국제경쟁력 상승으로 경제 강국 구축을 위한 기반을 다지며, 2단계에서 주요사업은 글로벌 가치사슬의 중/고 단계에 진입하고 R&D 비용은 GDP의 2.8% 이상이 목표이다. 이 기간은 신제품, 신모델, 새로운 수요 및 시장창출, 취업과 삶의 질을 향상시킨다.
2030년까지는 항공엔진과 가스터빈의 중대 프로젝트를 추진하고, 양자통신, 정보통신 네트워크, 스마트제조와 로봇, 심해와 우주탐사, 신소재와 신에너지, 뇌과학, 건강의료 분야에서 중대 과학기술 프로젝트와 공정 재배치를 추진할 예정이다.
③ 3단계(2050년까지)
3단계에서는 2050년까지 과학기술 혁신 강국건설로 세계 과학기술 중심의 혁신국가로 성장하는 조화로운 사회주의 현대화 국가건설과 부흥을 뒷받침하는 것을 목표로 한다. 이 기간에는 경제발전의 질적 향상, 에너지소모 감소, 산업 핵심경쟁력 강화에 중점을 두고, 세계 일류 연구기관, 연구형 대학, 혁신형 기업을 보유하고, 원천성 과학기술 성과와 세계 일류수준의 과학자를 배출하고 글로벌 첨단인재와 혁신창업의 집결지로 성장할 계획이다.
(3) 13.5계획 국가과학기술혁신계획(2016년)
중국정부는 2050년까지 세계 과학기술 강국으로 굴기하기 위해 2016년 국가혁신드라이브 발전전략을 구체화하여 2016년 8월 ‘13.5계획 국가과학기술혁신계획’을 발표하였다. 신중국 설립 100주년을 목표로 부강하고 현대적인 사회주의 국가 건설 및 중화민족의 위대한 부흥이라는 중국의 꿈(中國夢) 실현을 위하여 혁신은 발전 제1의 동력이라는 전제하에 혁신주도형 발전전략을 본격적으로 추진하기 위한 것이다.
이를 위한 기본방향으로 2020년까지 종합혁신 경쟁력을 세계 15위로 끌어올려 혁신형 국가대열에 진입하고, 과학기술 경제성장 기여도를 60%로 높이는 등 발전목표를 세우고, 성과목표로 향후 5년 내 GDP대비 연구개발투자 비중 2.5% 달성, 인구 1만 명당 특허등록건수 12건, 과학기술진보 경제기여도 60% 달성 등을 제시하고 있다.
분야별 과제로서 2020년까지 목표달성을 위해 선두주자 우위확보, 원천기술 개발능력 향상, 혁신발전 공간마련, 대중창업・만중혁신 추진, 과학기술 체제개혁 심화, 과학문화 확산 등 6대 중점전략과 세부내용을 구체화하여 제시하였다.
[표 1-12] 13차 5개년 국가과학기술혁신계획 6대 전략
|
6대 전략 |
주요 내용 |
|
선두주자 우위확보 |
-국가과학기술중대전문프로젝트, 신규 중대과학기술프로젝트 (2030) -현대농업, 차세대 IT기술 등 현대 산업기술체계 구축 -생태환경보호, 인구건강 등 민생개선과 지속가능한 발전 기술체계 확립 -ʻ심우주(深空), 심해(深海), 심부지하(深地), IT(深蓝)ʼ 등 국가안보와 전략적 이익수호 기술체계를 구축 |
|
원천기술 개발능력 향상 |
-기초연구를 강화하고, 기초연구 투자 집중도를 향상시키며, 국제거대과학계획과 국제거대과학공정을 실시 -국가실험실 등 과학기술 혁신기지를 구축하고, 국가 과학기술혁신의 전략적 연구역량을 육성 -혁신형 인력풀 육성을 가속화하고, 세계적 수준의 과학기술 선도자 양성 |
|
혁신발전 공간마련 |
-지역혁신거점 구축, 베이징시와 상하이시는 국제적 영향력이 있는 과학기술혁신센터 건설 -ʻ일대일로ʼ 협동혁신공동체를 구축하여 글로벌 혁신망에 융합 -과학기술 국제화 수준 향상 |
|
대중창업・만중혁신 추진 |
-과학기술 서비스업의 발전수준을 전면 향상 -개방된 기술거래시장체계 구축 -실물경제 서비스 창업인큐베이팅체계 구축 -과학기술 혁신창업 지원 금융체계 정비 |
|
과학기술 체제개혁 심화 |
-과학기술 관리체제 개혁을 심도 있게 추진하고, 과학기술혁신 거버넌스 메커니즘 정비 -기업의 혁신주체 지위와 주도역할 강화, 국가 기술혁신공정 본격화 -고효율 R&D 조직체계 구축, 현대적 대학제도와 연구기관제도 정비 -과학기술 성과이전 메커니즘 개선, 성과이전의 시장화 서비스 강화 -민군 심층융합 혁신메커니즘 정비, 민군 기술의 양방향 전환과 자원공유 등을 촉진 |
|
과학문화 확산 |
-국민의 과학교육을 심도있게 실시하여 국민의 과학자질을 전면 향상 -국가 과학보급 능력육성 강화, 혁신창업과 과학보급 간 결합 촉진 -혁신을 권장하는 사회문화 분위기 조성, 과학정신과 과학연구 확산 기업가 정신과 혁신문화 육성 |
나. 정책동향
중국은 현재의 환경을 ‘신창타이(新常態, 뉴 노멀)’로 규정하고 이러한 환경변화로 발생하는 다양한 사회문제를 해결하면서 경제발전을 지속하기 위한 새로운 과학기술정책에 직면하고 있다.
(1) 중국 과학기술정책의 환경변화
중국정부의 과학기술 육성은 경제적 목표와 함께 정치적 정당성의 제고도 포함되어 있다. 중국정부의 주도하에 추진되는 과학기술육성은 상당한 성과를 거두고 있다. 미국 글로벌 과학기술전략위원회의 분석에 의하면 중국의 과학기술전략은 다음과 같은 특성을 가지고 있다. 1)과학기술발전을 통해 경제발전과 군사력 강화, 국제적 입지 재정립을 도모, 2)상부하달식의 집중적 과학기술투자는 성장의 주요 원동력, 3)다른 국가에 대한 영향력을 강화하기 위해 군사현대화 프로그램에 적극 투자, 4)적극적으로 선진기술 도입을 추구, 그리고 5)과학기술 인프라 구축을 우선순위에 두었다. 특히 IT, 에너지, BT 분야에 주력했다.
중국의 과학기술지표는 지난 20여 년간 크게 향상되었다. 중국정부는 2016년에 ‘13.5계획’과 ‘국가혁신드라이브발전전략강요’에서 제시한 것처럼 중국이 안고 있는 제반 한계를 분석하고 극복하기 위한 구체적인 과학기술정책과 행정체계의 변화를 추구하고 있다.
(2) 뉴 노말 시대의 과학기술 혁신정책
중국의 새로운 과학기술정책 방향은 크게 두 가지이다. 첫째, 경제성장을 위해 강력한 ‘혁신드라이브 전략’이 필요함을 인식하고 혁신능력 강화를 적극 추진하고 있다. 이는 3차 산업의 구조변화와 4차 산업에 대한 대비가 필요함을 인식한 결과이다. 2016년 5월 ‘국가혁신드라이브발전전략강요’를 발표하면서 2050년까지 3단계의 구체적인 목표를 설정하고 일사불란하게 추진하고 있다.
중국의 과학기술정책과 행정체제 변화에서 다음과 같은 의미와 시사점을 찾을 수 있다. 첫째, 새로운 환경인식이 중국의 과학기술 정책과 행정체제 변화의 출발점이다. 둘째, 뉴 노멀 시대를 맞아 중국정부는 양적 성장에서 질적 성장으로 변화를 추구하고 있다. 셋째, 중국은 과학기술 혁신을 경제성장과 발전의 동력으로 확실히 인식하고 있다. 넷째, 중국정부가 빈부격차와 도농격차 등 사회문제를 해결하고 소강사회를 건설하기 위해 과학기술을 활용하는 과학기술 발전전략을 추진하고 있다. 다섯째, 정책변화를 뒷받침하기 위해 국무원, 과학기술부, 공업・정보화부를 중심으로 중국식 국가혁신체제 구축을 추진하고 있다.
(3) 중국의 과학기술 행정체제
중국은 과학기술혁신과 혁신성과를 경제사회 여러 분야에 확산시키기 위해 과학기술 행정체제 변화도 추진하고 있다. 2015년 9월에 중국 국무원이 중앙정부의 과학기술 체제개혁을 구체화한 ‘과학기술 체제개혁 심화 실시방안’을 발표하고 과학기술행정과 정책체제 변화를 시도했다.
개혁의 목표는 2020년까지 과학기술 체제개혁으로 성과를 획기적으로 높이고 중국식 국가혁신체계를 구축하여 혁신국가 대열에 진입하는 것이다. 체제개혁은 중공중앙조직부, 국가발전개혁위원회, 재정부, 인사부, 과학기술부 등 40개 부처가 공동으로 추진하여 개혁조치별로 책임부처를 지정했다. 과학기술 혁신과 혁신주도형 발전을 위해 10개 분야 32개 개혁조치가 제시되었다.
중국의 과학기술 정책과 행정에서는 국무원, 과학기술부, 공업・정보화부가 핵심기관이다. 국무원은 중국 공산당의 최고기관인 정치국 상무위원회의 기본방침 아래 과학기술정책의 기본방향을 설정한다. 국무원 산하에는 중국과학원, 중국사회과학원, 중국공정원, 국무원발전연구중심, 국가자연과학기금 등 15개 직속기구와 14개 직속사업단위를 두고 과학기술정책 수립에 많은 영향을 미치고 있다. 과학기술부는 광범위한 과학기술 정책을 입안, 실행하는 집행기관으로 과학기술정보연구소, 과학기술발전전략연구원 등 14개 내부기관과 17개 직할 사업부문을 거느리고 있다. 공업・정보화부는 정보화 전략을 수립하고 관련 산업을 육성하는 부처로 2008년 신설되었다.
다. 기술 및 산업동향
(1) 보건바이오
중국은 소득이 증가하고 건강에 대한 관심이 높아지면서 보건바이오 분야에 큰 관심과 투자를 하고 있다. 특히 2015년 중의과학원 투유유 명예교수가 개똥쑥에서 말라리아 치료제 ‘아르테미시닌(artemisinin)’ 개발공적으로 노벨의약상을 수상한 계기로 신약개발에 대한 열기가 고조되고 있다. 그리고 ‘중국제조 2025’에서 바이오・의약을 중점분야로 지정하였고, 정부가 추진 중인 ‘의료 인프라 정비’와 고령화 진전에 따라 보건바이오분야의 전망은 매우 밝다.
(가) 의약품
중국 의약품시장은 지난 6년간 연평균 성장률 17%의 고속성장을 지속하면서 2015년 약 730억 달러 규모로 2016년 세계 2위 시장으로 성장하였다. 2020년 시장규모가 1,670억 달러에 이를 것으로 전망하고 있다. 아직 의약품 접근이 어렵고 1인당 의료비 지출이 낮은 점을 고려하면 향후 의약품 시장은 지속적으로 성장 할 것으로 전망된다. 또한 항생물질을 중심으로 하는 개도국형 의료시장에서 당뇨, 암 등 선진국형 의료시장으로 시장구조가 전환되고 있다.

[그림 1-9] 중국 의약품 시장 규모 추이 (자료: IMS Health Analytics Link)
중국 내 현재 약 7,000여 개의 제약회사 가운데 절반 이상이 제네릭(generic) 업체로, 2020년에 중국 제네릭 시장규모는 1조 4,000억 위안에 이를 전망이다. ‘중국제조 2025’는 바이오・의약을 중점분야로 지정하고, 지방정부를 통한 산업진흥펀드 개설, 연구성과 인센티브 제고 등으로 의약품 개발에 지원을 확대하고 있다.
중국은 항체의약품 등 바이오의약품과 신약 연구개발을 강화하고, 국내외 기업과의 인수합병을 활발히 추진하고 있다. 최근 미국, 유럽 등 선진기업이 주목하는 바이오 시밀러, 디지털 알약 등 신산업 진출을 위한 중국기업의 연구개발이 활발하다. 중국기업 약 6,000개사 간의 업계를 재편하면서 규모를 확대하고, 해외로부터 라이센스인(license-in)이나 기업인수를 통해 기술력이 향상되고 대외경쟁력을 제고시키고 있다. Novartis는 미국, 스위스에 이어 상하이에 글로벌 R&D센터를 건립하여 아시아 지역의 발병 빈도가 높은 질환연구에 투자하고, Pfizer도 3억 5천만 달러를 투자하여 바이오의약품 기술센터를 건립하고 있다.
최근 각광받고 있는 줄기세포(stem cell)의 경우도 중국의 발전은 괄목할 만하다. 특히 중국과학원(CAS)은 2014년 기준으로 줄기세포에 관해 411편의 논문을 발표하여 세계 4위를, 20개의 특허를 출원하여 세계 2위를 차지하였다. 중국은 인간배아 교정을 포함하여 줄기세포에 대한 규제가 없고, 줄기세포기술을 이용한 난치병 치료를 위한 줄기세포 임상병원(수천 bed 확보)도 있어 연구와 상용화 여건이 매우 좋다.

[그림 1-10] 중국과학원(CAS)의 줄기세포 연구논문과 특허 추이(자료: CAS 동물연구소)
(나) 의료기기
중국의 의료기기 시장은 정부가 추진 중인 ‘의료 인프라 정비’와 고령화 진전에 따른 의료수요 증가로 연간 20% 전후의 성장을 기록하고 있다. 2015년 시장규모는 약 3,080억 위안(약 460억 달러)을 기록하여 미국에 이어 세계 2위 시장으로 성장하였다. 영국 조사기관인 Espicom에 따르면, 중국시장은 향후 2020년까지 연평균 8∼9%의 성장을 예상했다.
중국정부의 첨단의료기기 개발보조금 투입, 의료기기 국산화 장려, 우수 국산의료기기 인증 등의 지원을 바탕으로 중국기업은 인수・제휴를 통해 기술력과 제품개발력을 제고시키고 있다. 중국 최대 의료기기 업체인 Mindray Medical International은 2008년 미국 Datascope의 생체 모니터링 사업을 인수하고, 2013년 미국 초음파회사인 Zonare Medical Systems를 인수했다. 영상진단기기 업체인 Neusoft Medical Systems도 2015년 국산 최초인 하이엔드 128슬라이스 헬리컬CT 장비를 개발해 유럽의 의료기기 인증인 CE마커를 획득하였다.

[그림 1-11] 중국의 의료기기 시장규모 추이 (자료: IMS Health Analytics Link)
중국 국가위생계획생육위원회가 국내 의료기기 산업육성을 위한 지원 대상으로 디지털X선, 영상진단장비, 컬러도플러초음파진단장비, 생화학자동분석장치 등을 선정하면서 본격적인 의료기기의 국산화에 박차를 가하고 있다. 2016년 3월에 지정분야 관련 우수 국산품 리스트를 공표하고, 2016년 4월 암치료장비, 인공혈관, 인공뼈, 심전계 등 10개 항목을 정하여 우수 국산품 선정을 진행하고 있다.
(다) 생물자원
현재 중국과 일본 유럽 등 100개 국가가 비준한 나고야의정서에선 생물자원에 관한 이익공유나 의무준수(이하 ABS)를 당사국과의 합의 및 규정에 따르도록 하고 있다. 생물자원 대국(大國) 중국은 생물유전자원 접근 및 이익공유 관리조례(안)을 연내 시행할 예정이다. 중국은 생물다양성 세계 8위, 북반구 생물당양성 1위인 국가로 고등식물 30,000여종(세계의 10%), 척추동물 6,347종(세계의 14%)을 보유하고 있다. 관리조례(안)에 따르면 외국기업 및 개인이 중국 생물유전자원을 이용시 반드시 중국기업과 합작으로 진행하고, 중국 내에서 중국 직원이 실질적인 연구개발 활동에 참여하도록 하는 내용이다. 또한 생물자원 보유인과 이익공유와는 별도로 연간 이익 발생금의 0.5∼10%를 추가로 납부하고, 위법시 5만∼20만 위안의 벌금을 부과할 수 있도록 규정하고 있다.
(2) 농업바이오
1995년 지구정책연구소 Lester Brown 소장은 한국과 일본의 산업화 과정에서 육류소비증가, 농지훼손 등으로 식량수요의 폭증을 지켜보면서 ‘누가 중국을 먹여 살릴 것인가?(Who will feed China?)’ 보고서를 발표한 바 있다. 중국의 사료소비량은 1980년의 2,500만 톤에서 1994년 8,000만 톤으로 증가하였다. 중국은 2001년 WTO에 가입한 이후 2004년부터 식량수출국에서 식량수입국으로 바뀌었다. 1995년 15만 톤에 불과하던 중국의 콩 수입량이 2015년에 8,300만 톤으로 증가하였다. 이는 세계 콩 거래량의 62%에 해당한다.
중국은 정부수립부터 13.5계획에 이르기까지 식량정책의 수립, 목표, 방법 등이 명확히 제시되고 일관성 있는 정책을 추진하고 있다. 중국정부는 13.5계획이 마무리되는 2020년에 모든 국민이 중산층 수준의 생활을 영위하는 소강사회(小康社會) 실현을 대내외에 제시하였다. 이러한 목표에 걸림돌이 되고 있는 농촌, 농민, 농업의 삼농(三農)문제를 해결하는 것이 중국 지도자들의 공통된 인식이다. 매년 초 중국공산당과 국무원이 공동으로 발표하는 중공중앙1호 문건이 2004년부터 2017년까지 줄곧 삼농문제를 다루고 있어 농업과 식량안보를 국가 최우선 과제로 하고 있다.
(가) 식량안보
모택동의 “먹거리 문제를 해결하지 못하면 결국 천하대란을 면할 수 없다.”는 주장에서부터 중국공산당은 인민의 먹거리 해결을 국가정책의 최우선 과제로 삼고 있다.
중국의 식량정책은 미곡뿐만 아니라 밀, 옥수수, 대두, 서류, 잡곡 등을 포함하고 있다. 중국은 2001년 WTO에 가입하면서 수입허가, 수량제한 등의 비관세장벽이 제거되고 농산물에 대한 관세도 낮추고, 식량, 면화, 식용류, 당류 등 10대 주요 농산물에 대해 관세할당(TRQ)제도를 계속 유지하는 등 농산물의 무역정책조정이 있었다.]
중국 13.5계획 시기는 2020년 소강사회가 완성단계에 들어설 것이고, 농업부문도 새로운 복잡한 형세에 직면하게 될 것이다. 경제 전반의 뉴 노멀 진입, 농산물 공급구조의 개혁, 재배업 구조조정, 식량안보 확보, 중요 농산물의 효과적 공급 등이 중요한 이슈로 전개될 전망이다. 중국 농업부는 2016년 중공중앙1호문건의 정신과 13.5계획에 의거하여 ‘전국 재배업 구조조정 계획(2016∼2020년)’에서 식량정책을 종합적이고 체계적으로 제시하였다.
2016년 10월 17일 국무원은 ‘전국 농업 현대화 계획(2016∼2020)’을 발표하면서 다음과 같은 9개 사항에 대하여 구체적으로 실행방안을 제시하였다.
[표 1-13] 전국 농업 현대화 계획의 9개 실행방안
|
1 |
상황을 정확히 인식하고, 발전의 새로운 특징을 파악 |
|
2 |
이념을 갱신하고, 발전의 새로운 방안을 과학적으로 모색 |
|
3 |
혁신강농: 농업 발전양식 전환 및 업그레이드를 추진 |
|
4 |
협조혜농: 농업의 균형적 발전을 모색 |
|
5 |
녹색흥농: 농업의 지속가능한 발전 수준을 제고 |
|
6 |
개방조농: 농업 대외협력 확대 |
|
7 |
공유부농: 민생복지 증진 |
|
8 |
자원확대: 간옹・혜농・부농정책 강화 |
|
9 |
책임완수: 계획의 순조로운 실시가 이루어질 수 있도록 할 것 |
이 가운데 3번째 혁신강농(革新强農)을 위한 주요 프로젝트로는 ①고표준 농경지 개발 프로젝트, ②현대 종자산업 개발 프로젝트, ③현대농업 과학기술 혁신 프로젝트, ④스마트농업 프로젝트, ⑤재배와 사육이 결합된 순환형 농업발전 프로젝트로 나누어 구체적인 실현방안을 포함하고 있다.
2) 종자산업
종자산업은 농업의 가장 중요한 원천이다. 2016년 2월 국영기업 중국화공집단공사(CHEMCHINA)는 스위스에 본부를 둔 세계 3대 종자회사 신젠타를 52조 원 규모로 인수・합병하여, 중국이 부족하다고 평가받던 종자산업의 원천기술을 다수 확보하였다. 중국이 보유하고 있던 종자의 다양성, 소비시장과 신젠타의 원천기술이 접목됨에 따라 중국은 종자산업 강국으로 성장할 수 있는 계기를 마련하였다. 중국의 종자산업은 향후 우리나라 종자시장에도 큰 영향을 미칠 것으로 전망된다. 중국 종자산업의 규모는 1999년 330억 위안에서 2006년 500억 위안, 2011년 990억 위안, 2015년 1,170억 위안으로 지속적으로 성장하고 있다.
중국은 ‘전국 농업 현대화 계획(2016∼2020)’에서 현대 종자산업 혁신발전을 추진하기 위하여 농업부와 과학기술부가 주도하고 국가발전개혁위원회, 재정부, 국토자원부, 국가임업국, 중국과학원 등이 참여하는 구체적인 실천방안을 제시하였다. 국가 종자산업 안전을 확보하고, 잡종강세 이용, 분자설계 육종, 효과적 종자증식 등 핵심기술 연구개발을 강화하여, 기계화 생산에 적합하고, 생산성이 뛰어나며, 저항성이 큰 신품종을 개발・보급하고, 우량종 증식기지의 시설조건과 원예작물 우량종 묘목증식 시스템을 개선함으로써 주요 농산물의 품종교체를 추진하고 있다. 아울러 가축 및 가금 우량종 증식시스템을 구축하고, 현대어업 종자산업 혁신역량을 제고하면서 유전자원을 조사, 평가하여 궁극적으로 종자산업 영역에서 과학연구 성과 및 권익관련 개혁을 추진하는 등 국가경쟁력을 갖춘 현대종자산업 기업을 양성하도록 하는 것이 중국 종자산업의 목표이다.
중국은 2016년 기준으로 GM작물 재배면적이 약 280만ha로 세계 8위에 해당한다. 작물별로는 Bt면화(280만ha), PRSV저항성 파파야(8,550ha), Bt포플러(543ha)순으로 재배하고 있다. 중국은 강력한 생명공학 국가로 도약하기 위해 정부차원에서 생명공학 신품종 육성개발에 적극 지원하고 있다.
(다) 중국의 농업혁신
앞서 서술했듯이 중국공산당과 국무원이 매년 초 공동으로 발표하는 중앙1호 문건이 2004년부터 연속하여 삼농(三農)문제를 다루면서 농업의 중요성을 강조하고 있다. 2017년 중앙1호 문건은 “농업 공급측면의 구조개혁(혁신)을 심층적으로 추진해 농업농촌발전의 새로운 동력육성에 박차를 가해야 한다.”는 ‘의견’을 담고 있다. 이를 위하여 구체적으로 국가식량안전을 확보하면서 농민들의 소득을 증대하고 농업의 공급품질을 제고하여 농업 산업체계와 생산체계, 경영체계를 최적화해야 한다고 제기했다.
전문은 약 1만 3천자이고 6개 부분 33조항으로 되어있다. 전체내용에는 1)농업생산성・효율성 향상, 2)지속가능 농업발전 강화, 3)농산업 가치사슬 확장, 4)농업현대화 촉진, 5)농촌지역 발전기초 강화, 6)농업・농촌의 내생적 발전 동력 강화 등 6개 분야에서 총 33개의 추진과제가 제시되었다. 농업공급측면의 구조개혁은 장기적인 과정이며 정부와 시장의 관계에서 각 방면의 이익을 조율하는데 많은 어려움에 직면해 있다고 강조했다. 어려움과 도전에 맞서 확고히 개혁을 추진해야 하고 개혁 위험요소에 적극 대응해 식량생산능력이 떨어지지 않고 농민들의 소득증대 추세가 계속 이어지며 농촌안정에 문제가 생기지 않도록 해야 한다고 지적하고 있다.
공급 측 구조개혁 구상은 중국이 뉴 노멀 시대의 경제성장 전략을 채택한 소비중심의 내수확대가 기대에 미치지 못한데서 출발했다. 농업분야 공급 측 구조개혁은 곡물자급 및 식량안보 확보를 전제로 시장수요에 부응하면서 자원부존 조건에 부합하는 농산물 생산구조와 생산지역 배치를 추진하는 것이 요지이다. 2016년 4월 ‘전국 재배업 구조조정 계획(2016∼2020)’을 제정하여 농작물(식량・특용・사료작물)간 생산조화, 식품 소비패턴 변화 등 시장수요 반영, 생산증대와 생태환경보호 조화, 지역별 특성을 고려한 경지이용체계 확립 등 4가지 방향으로 추진하고 있다. 품목별 재배업 구조조정을 보면 옥수수 공급과잉, 대두 공급부족 확대, 고품질 조사료 공급부족 현상을 해소하는데 초점을 맞추고 있다.
(3) 환경・에너지바이오
중국은 국내 정책상으로도 경제발전 13.5계획을 통해 녹색발전을 천명한 후, 후속계획을 통해 신재생 에너지 개발 등 적극적인 온실가스 감축을 추진하고 있다. ‘에너지발전 13.5계획’을 통해 2020년 에너지 소비총량을 50억 톤 표준석탄 이내로, 석탄 소비총량을 41억 톤 이내로 규제하는 방안을 명시하고 있다.
13.5계획에서 중국의 녹색정책은 더욱 비중이 커질 것으로 예상된다. 10.5계획에서 12.5계획까지 기존 오염된 환경 처리에 집중했던 정책에서 점차 오염방지를 위한 정책으로 변화하면서 13.5계획에서도 오염방지를 위한 정책이 늘어날 것으로 예상된다. 특히, 신재생에너지 안보가 강조될 전망(12.5계획에서 처음으로 원자력 자원 안보를 언급)이며, 자원문제 비중은 줄곧 중요한 비중을 차지하고 있다. 에너지 안보의 비중은 역대 가장 큰 비중을 차지한다.
점차 환경문제가 산업, 경제구조, 도시 등 여러 분야에 걸쳐 언급되고 있기 때문에 13.5계획에서도 이와 연계한 녹색산업, 도시정책 등이 강조되고 있다. 점차 내수(소비)진작으로 경제정책이 전환됨에 따라, 친환경, 녹색소비, 녹색 산업을 뒷받침할 정책이 나올 것으로 전망된다.
중국은 트럼프 정부의 온실가스 삭감을 위한 파리협정 탈퇴선언 이후에 EU 등과 연대하여 미국을 대체할 국제적 명분 확보에 주력하는 한편, 약점인 기술역량 등을 확보하기 위한 실리추구 전략을 병행하고 있다. 중국은 현재 저부가가치적인 노동집약적 산업중심 경제에서 하이테크 산업중심 경제구조로 전환을 추진하고 있어 첨단기술 확보차원에서 EU 등과 협력이 필요한 상황이다.
중국은 200억 위안 규모의 중국 기후변화 남남협력 기금조성 및 십백천(十百千) 프로젝트 추진을 선언하는 등 개도국에 대한 국제협력도 강화하고 있다. 개발도상국에서 저탄소 시범구 10곳, 기후변화 적응 및 감축 프로젝트 100개, 기후변화 대응 인력양성 1,000명의 협력프로젝트를 추진하고 있다. 중국이 대외적으로 추진하는 일대일로(一對一路) 전략도 개도국의 자원을 확보하면서 기후변화 대응을 펼치는 것으로 간주된다.
중국과학원도 13.5계획을 기반으로 제시한 저탄소 경제관련 에너지기술 분야의 기술발전의 중장기 전략은 고효율 비화석연료 지상교통기술, 석탄의 청정과 고부가가치 이용기술, 그리드의 안전/안정기술의 주요기술이 2020년에서 2035년 사이에 완성될 전망이다.

[그림 1-12] 저탄소 경제관련 에너지기술 분야(자료: 중국과학원)
라. 법제도동향
중국 사회의 인구노령화와 두 자녀 정책 시행 등 사회적, 정책적 요인에 힘입어 바이오의약, 바이오농업, 바이오환경/에너지 등 전반에 걸쳐 필요한 법제도는 13.5 계획의 분야별 후속조치에서 구체적으로 제시하고 있다.
‘중국제조2025’에서 바이오의약과 고성능 의료기기를 중점 발전분야로 지원하고, 신약개발 등 과학기술 방면에서도 특별사업을 추진 중으로 제약업계에 대한 정부 지원이 지속될 전망이다. 2016년 말 발표된 ‘13차 5개년 의약산업 발전계획지침(十三五醫藥工業發展規劃指南)’에 따르면, 향후 5년간 중국은 의약품 및 의료기기 심사비준제도 개혁이 기대된다. 특히 임상에 필요한 신약, 의료기기에 대한 심사비준을 간소화하고, 신약개발에 대한 투자를 적극 지원할 예정이다. 베이징시는 세금 감면, 행정절차 간소화 등의 조치를 통해 바이오의약 및 신약 개발에 대한 투자를 장려하고 있다.
2016년 10월 17일 국무원은 ‘전국 농업 현대화 계획(2016∼2020)’을 발표하면서 혁신강농, 책임완수 등 9개 사항에 대하여 구체적으로 실행방안을 제시하였다. 특히 계획의 순조로운 실시가 이루어질 수 있도록 제도개선 등 책임완수를 강조하고 있다. 현대 종자산업 혁신발전을 추진하기 위하여 농업부와 과학기술부가 주도하고 국가발전개혁위원회, 재정부, 국토자원부, 국가임업국, 중국과학원 등이 참여하는 구체적인 실천과 책임 있는 개혁방안을 제시하였다.
ABS 조례(안)은 중국의 최상위 행정기관인 국무원에 심의되고 있는 만큼 연내 시행될 것으로 전망된다. 이로 인해 중국 생물자원을 이용하는 대다수 국내 바이오・제약 업체들에게도 추가부담 발생이 불가피할 것으로 보인다. ABS 조례(안)이 시행되면 그간 국내기업이 무료로 활용이 가능했던 동식물 등의 생물유전자원 등으로 발생한 이익을 공유해야하기 때문에 로열티 상승, 자원수급 불안정, 연구개발 지연 등과 같은 어려움에 직면할 가능성이 높다.
4. 일본
가. 사회적 이슈
지난 10월 22일 일본 중의원 선거가 실시되어 여당인 자민당과 공명당이 전체의석(465석)의 2/3가 넘는 313석을 차지하여 제4차 아베내각이 발족되었다. 2016년과 2015년 2년 사이에 가장 큰 정치적 이슈였던 집단적 자위권의 행사를 위한 안전보장관련법의 성립, 선거권 연령이 18세로 개정된 이후의 최초선거였던 참의원 선거에서 개헌발의에 필요한 정족수인 2/3를 여당이 확보하였다.26)
2012년 12월 아베총리가 취임하면서 아베노믹스 경제정책을 선언하고 총리 직속으로 일본경제재생본부27)를 설치하고 2013년부터 매년 ‘일본재흥전략'28)을 수립하여 양적완화, 재정확대, 구조개혁 등의 정책수단을 통해 경제를 활성화시키기 위한 노력을 기울이고 있다.29) 현재 일본 경제의 최대 현안과제는 새로운 수요 창출과 생산성 향상을 통해 장기적인 경기침체를 타파하여 잠재성장률을 높이는 것이다. 이를 해결하기 위해 4차 산업혁명이 모든 산업이나 생활에 도입된 ‘Society 5.0’ 실현을 강력히 추진하고 있다.30)
요미우리신문의 주요 10대 뉴스31)를 살펴보면 2015년에는 오오무라(大村)교수와 카지타(梶田)교수가 생리학・의학상 분야와 물리학 분야의 노벨상을 받은 것이 1위로 올랐으며, ‘마이넘버’ 시작, 칸토우・토우호쿠(関東・東北) 호우, 안전보장관련법 성립 등이 주요 뉴스로 선정되었다. 2016년도에는 쿠마모토(熊本) 지진이 1위이고, 리오올림픽 메달 41개 획득, 오오스미(大隅)교수의 노벨 생리학・의학상 수상, 18세 선거권 시행, 포켓몬고의 일본 판매 개시 등이 주요 뉴스로 선정되었다.
2017년 6월 발표된 ‘미래투자전략 2017’32)에서 아베노믹스가 시작된 지 약 5년 동안 전력・가스시장의 전면자유화, 농지개혁, 재생의료제도 도입, 법인실효세율의 20%대 인하, 20년만의 최대 취업률 달성 등의 성과가 있었고, 향후 생산연령인구의 감소, 지역 고령화, 에너지・환경문제 등 직면하고 있는 사회적 과제를 해결하기 위해 4차 산업혁명(IoT, 빅데이터, 인공지능, 로봇, 공유경제 등)의 혁신을 국가적 주요과제로 설정하고 이의 실현을 위해 기존의 일본재흥전략 중・단기 로드맵을 수정하여 경제 활성화를 강력히 추진하고 있다.
나. 정책동향
(1) 과학기술기본계획
최근 2년 사이에 일본 과학기술 관련 정책 중에서 가장 중요한 이슈는 2016년 1월에 과학기술・이노베이션회의33)에서 주관한 제5기 과학기술기본계획(2016∼2020)34)이라고 볼 수 있다. 제5기 과학기술기본계획은 과학기술・이노베이션회의(CSTI, Council for Science, Technology and Innovation) 출범 이후 처음으로 수립된 과학기술기본계획으로 최근 ICT 등의 발전으로 인해 경제・사회적 구조가 크게 변하고 있어 과학기술 분야의 혁신을 추진할 필요성이 증대하고 있다는 인식을 바탕으로 작성되었다.
제5기 과학기술기본계획의 서두에 지난 20년간의 실적과 과제로 연구개발 환경의 정비, 노벨상 수상 등의 실적을 거두었지만 한편으로는 과학기술 기반이 약해지고 있고 정부의 연구개발투자가 정체되어 있는 것을 지적하고 있다. 이를 바탕으로 미래를 전망하고 전략을 수립하여 변화에 적확하게 대응하는 힘(선견성, 전략성, 다양성, 유연성)을 중요하게 생각하는 것을 기본방침으로 설정하고 지속적인 성장과 지역사회의 자율적 발전, 국가 및 국민의 안전・안신의 확보와 풍요롭고 질 높은 생활의 실현, 글로벌 과제의 대응과 세계 발전의 공헌, 지식 자산의 지속적 창출 등 4가지를 목표로 제시하고 있다. 주요 내용으로는 미래의 산업창조와 사회변혁, 경제・사회적 과제의 대응, 기반적인 힘의 강화, 인재・지식・자금의 선순환시스템의 구축 등이며 이를 달성하기 위한 주요 착안점 등으로 구성되어 있다. 특히, 이번 기본계획의 핵심개념으로 4차 산업혁명, ‘초스마트사회’, ‘Society 5.0’ 등이 제시되고 이것이 국가의제로 채택된 것은 눈여겨 볼 점이다.
[표 1-14] 일본 제5기 과학기술기본계획 개요
|
항목 |
주요내용 |
|
|
추진 과제 |
미래산업 창조와 사회변혁을 위한 새로운 가치창출의 추진 |
비연속적인 혁신을 만들어 내는 연구개발을 강화하고 새로운 가치나 서비스가 계속 창출되는 ‘초스마트사회’를 지속적으로 심화시켜 ‘Society 5.0’으로 강력하게 추진 |
|
경제・사회적 과제의 대응 |
국내 또는 해외의 현안과제에 앞서 대응하기 위해 국가가 중요한 정책과제를 설정하고 과제해결을 위한 대처방안을 추진 |
|
|
과학기술이노베이션의 기반적인 힘의 강화 |
향후의 변화에 유연하고 적확하게 대응하기 위해 젊은 인재의 육성・활약 촉진과 대학의 개혁・기능 강화 등의 대처방안을 추진 |
|
|
이노베이션 창출을 위한 인재, 지식, 자금의 선순환 시스템의 구축 |
새로운 가치의 창출과 사회적 실현의 촉진을 위해 기업, 대학, 공공연구기관의 본격적인 연대와 벤처기업의 창출을 강화하여 인재, 지식, 자금이 모든 벽을 넘어 순환되는 혁신시스템 구축을 추진 |
|
|
추진 과제
중요 사항 |
과학기술이노베이션과 사회와의 관계 심화 |
이노베이션의 창출에서 다양한 가치관을 가진 이용자의 시각과 과학기술혁신의 사회적 이해・신뢰・지지 획득이 중요한 전제조건이며 이를 위해 사회의 다양한 이해 관계자와의 대화・협력체계 구축 |
|
과학기술이노베이션의 추진기능 강화 |
과학기술이노베이션 활동의 다양한 실행주체로부터 공감을 통해 추진하고 각 주체의 기능강화를 위한 착수방안의 내실화와 산학관의 파트너십의 확대에 집중 |
|
출처: '과학기술기본계획', 각의결정, 2016.01.22.(http://www8.cao.go.jp/cstp/kihonkeikaku/5honbun.pdf)
(2) 미래투자전략 2017
일본 정부는 2016년 9월 일본경제재생본부 산하에 4차 산업혁명을 비롯한 미래성장에 이바지할 분야의 미래투자 확충을 위한 성장전략의 사령탑으로 기존의 산업경쟁력회의를 확대하여 미래전략회의를 신설하였다. 여기서 일본경제재생본부 출범 이후 4회에 걸쳐(2013∼2016) 발표되었던 ‘일본재흥전략’을 바탕으로 보다 구체적이고 총괄적인 투자전략안인 ‘미래투자전략 2017’을 수립하였다.
‘미래투자전략 2017’은 지금까지 추진되었던 ‘일본재흥전략’에서 말하는 이른바 암반규제 개혁35)은 어느 정도 성과를 거두었지만, 4차 산업혁명 등 미래에 대한 투자와 혁신을 보다 강화하고 민간부분을 활성화시키며 기술혁신의 사회적 구현을 위한 장애요인의 해결을 목표로 삼고 있다. 특히, 이노베이션과 구조개혁에 의한 사회혁신(Society 5.0)을 목표로 국민생활 편리성의 발본개혁, 지역의 글로벌화, 4차 산업혁명 등의 기술혁신을 사회적으로 구현하여 산업구조개혁을 촉진을 추진하고 있다.
[표 1-15] 미래투자전략 2017 개요
|
항목 |
지향점 |
|
|
전략 분야 |
건강수명의 연장 |
-의료 분야 데이터 활용기반의 구축(‘차세대의료기반법’(2017년 4월) 적용 등) -예방・건강 만들기(보험자, 경영자에 의한 ‘개인의 행동수정의 본격화’) -의료: 신수법 도입촉진에 의한 ‘질의 비약적 향상, 의사・환자의 부담경감’ -간병: 과학적 간병의 도입에 의한 ‘자립지원의 촉진’ |
|
이동혁명의 실현 |
-세계 수준의 이동수단의 실증(고속도로의 트럭, 드론 등) -데이터의 전략적 수집・활용, 협조영역의 확대(5G 서비스 2020년 개시 등) -국제적인 제도간 경쟁을 고려한 제도정비(고도자율주행 사업화 등) |
|
|
공급사슬의 차세대화 |
-세계 수준의 데이터 선진사례 창출/전개(국내외 복수기업간 제휴에 의한 국제적 실증, 데이터형식의 국제표준화 제안 등) |
|
|
쾌적한 인프라・ 마을만들기 |
-인프라의 특성에 맞춘 ‘공공분야가 견인하는 사회적 구현’(건설 분야의 시공・관리 전 과정의 ICT 활용 등, 로봇과 데이터의 활용에 의한 인프라 점검・재해대책, 선박의 개발・건조・운항의 전 ICT화) |
|
|
핀테크 (FinTech) |
-이노베이션을 위한 도전 가속(핀테크의 실증・실험, 국제적인 제휴・협력 등) -오픈이노베이션 추진(핀테크기업과 금융기관 등의 오픈API의 제휴・협력 확대 등) -기업의 성장력 강화를 위한 핀테크 활용촉진(송금, 기업회계 정보의 표준화 등) -캐시리스화의 추진(신용카드 이용 API 제휴, 전자영수증 활용촉진 등) |
|
|
횡단 과제 |
가치의 원천 창출 |
-데이터 활용기반의 구축・철저한 데이터 활용을 위한 제도정비 (공공데이터의 공개 등) -교육・인재양성 강화(IT인재 육성, 데이터사이언스 교육 강화 등) -이노베이션・벤처기업의 창출 선순환시스템(대학의 산학연대 기능 강화, 중점 연구거점의 집중 육성, 벤처기업의 자발적・연속적 창출 가속 등) |
|
가치의 극대화 지원제도 |
-규제샌드박스제도의 창설(블럭체인, 전력선통신의 활용 등) -규제개혁・행정절차 간소화・IT화 일제 추진(법인설립, 무역, 소송 등) -노동력의 강화(기업과 투자가의 대화 촉진, 경영시스템 강화 등) -공적 서비스・자산의 민간개방(성장대응분야, 성숙대응분야 등) |
|
|
지역경제 선순환시스템 구축 |
-지역의 부가가치・생산성을 향상시키는 IT화・데이터 활용 촉진(중소기업 등에 전문가 지원 IT・클라우드 서비스 도입 등) -성장자금의 공급, 인재・노하우의 활용(지역금융기관 담보・보증제도 개선 등) -지역의 공간 활성화, 권역 전체 파급('지역미래투자촉진법' 적용 등) |
|
출처: '미래투자전략 2017-포인트', 내각부 일본경제재생본부, 2017.06.09. (https://www.kantei.go.jp/jp/singi/keizaisaisei/pdf/miraitousi2017_point.pdf)
다. 기술 및 산업동향
(1) 노벨상 수상
일본은 2017년까지 23명(일본 국적자 기준)의 노벨상 수상자를 배출하였는데 이 중에서 과학기술분야가 20명을 차지하고 있다.36) 특히, 2016년 도쿄공업대학 오스미 요시노리(大隅 良典) 교수가 생리의학상을 수상함으로써 2015년 생리의학상의 오오무라 사토시(大村 智) 교수, 물리학상의 카지타 타카아키(梶田 隆章) 교수, 2014년 물리학상의 아카사키 이사무(赤崎 勇) 교수, 아마노 히로시(天野 浩) 교수에 이어 3년 연속 과학기술 분야의 노벨상 수상이라는 놀라운 성과를 이루었다.
앞에서 설명한 것처럼 제5기 과학기술기본계획에서는 노벨상 3년 연속 수상의 성과를 근거로 과학기술 분야의 연구개발 투자확대를 주요 근거로 삼고 있다. 대학의 연구개발을 총괄하고 있는 일본학술진흥회37)에서도 ‘일본인의 노벨상 연속수상은 자유로운 환경에서 만들어지는 독창적인 학술연구의 중요성이 나타난 것’으로 뛰어난 지식의 창조가 끊임없이 이루어지기 위해서는 학술연구 진흥의 확대가 필요하다고 주장하고 있다.
(2) 과학기술동향
일본 정부는 2013년 6월 과학기술이노베이션전략38)에 대한 정책을 각의결정으로 확정 짓고, 과학기술・이노베이션회의에서 이를 주관하여 2014년부터 매년 과학기술이노베이션전략을 수립하여 과학기술분야의 연구개발을 총괄하고 있다.
2017년 6월 각의에서 결정된 2017년 과학기술이노베이션전략에서는 ①‘Society 5.0’의 실현을 위해 일본에 축적되어 있는 고도의 모노즈쿠리, 재료과학, 기초과학 등의 강점을 살려 속도감 있게 적극적으로 추진하고, ‘Society 5.0’의 핵심 기반기술인 IoT시스템기술, 빅데이터 해석기술, AI기술 등을 강화 ②‘과학기술이노베이션 관민 투자확대 이니셔티브’39)의 실행을 위해 2025년까지 기업, 대학, 국립연구법인 등에 연구개발투자를 3배 이상 확대하고 이를 위해 예산편성프로세스개혁실행, 연구개발추자 확대를 위한 제도개혁 실행, 증거기반의 효과적인 관민연구개발투자 확대 실행 ③위의 2가지 목표를 실현하기 위해 과학기술・이노베이션회의는 정부연구개발투자 목표(GDP의 1%), 민간기업의 연구개발투자 목표(GDP의 3%)를 합쳐 일본의 전체 연구개발투자액이 GDP의 4% 이상이 되도록 정부와 기업이 노력하는 것 등이 주요골자로 제시되어 있다.
한편, 일본 문부과학성에서 매년 발간하고 있는 과학기술백서40)를 보면 2016년의 대표적인 과학기술성과로서 13개의 연구과제를 선정하였다. ①국지적인 호우의 관측・예측기술 ②보건가능성 성분의 연구개발 ③감성평가를 활용한 상품개발 ④재해대응기술 ⑤인공위성의 활용 ⑥단열재료, 태양광발전기술 ⑦삼나무화분증 대책기술 ⑧ 엄의 조기발견기술 ⑨항공기에 사용되는 재료 ⑩혹서 대책기술 ⑪디스플레이・스크린기술 ⑫희망이용 플랫폼의 활용성과 ⑬자동차기술 등이다.
(3) 바이오산업동향
일경바이오연감에서는 2016년 일본 바이오산업(바이오제품・서비스)의 시장규모는 2015년에 대비 6.1% 증가한 3조 2,929억 엔으로 추정하고 있다. 이 중에서 유전자재조합기술을 이용한 제품은 2조 1,978억 엔(전체 바이오시장의 약 67%)이고 기타 바이오제품・서비스는 1조 950억 엔(전체 바이오시장의 약 33%)로 나타났다. 그리고 2017년도 바이오(또는 라이프사이언스) 관련 정부 예산은 약 2,560억 엔, 2018년 요구예산은 2,474억 엔으로 집계하였다.41)
일본 바이오인더스트리협회42)는 바이오산업인회의43)와 협력하여 바이오 관련 산업계의 의견을 집약, 국가의 구체적인 정책에 반영하는 활동을 하고 있다. 바이오산업인회의는 2016년 3월에 일본의 2030년의 바이오이코노미 비전을 주요 내용으로 한 ‘진화를 계속하는 바이오산업의 사회공헌 비전’44)을 발표하였는데, 여기서 최근 미국과 유럽을 중심으로 게놈편집기술이나 합성생물학이 급속하게 발전하고 있고 천연자원에 의한 경제, 화석연료에 의한 경제에 이어 바이오 경제시대가 도래할 것으로 보고 있다. 바이오 경제시대가 도래하는 2030년에 예상되는 일본의 과제로는 건강・의료, 모노즈쿠리・환경・에너지, 농림수산업・식량 등의 3개 과제를 서술하고 있다. 또한, 2013년 일본의 건강・의료, 에너지, 농림수산・식량 전체시장을 120조 엔으로 집계하고 이를 기준으로 2030년에는 48조 엔이 증가한 168조 엔에 달할 것으로 추산하고 있으며 바이오산업이 광범위한 산업군에 영향을 미칠 것으로 보고 있다.
최근 산업경쟁력간담회45)46)는 기존의 과학기술이노베이션전략의 핵심과제인 ‘Society 5.0’의 실현을 위한 기존의 7개 주요 추진과제에 새롭게 추가되어야 할 중요분야로 바이오기술의 응용, 의료・간병・헬스케어의 융합, 디지털스마트시티 등을 과학기술・이노베이션회의에 제안하였다.
(4) 일본의료연구개발기구
일본의료연구개발기구(AMED)47)에서는 문부과학성・후생노동성・경제산업성 등의 3개 부처의 의료분야 연구개발 관련 예산을 일원화하여 2016년도부터 본격적인 연구개발과제를 추진하기 시작하였다. AMED의 주요 프로젝트는 의약품 창출, 의료기기 개발, 혁신적 의료기술 창출거점, 재생의료, 게놈의료, 암연구, 뇌・정신질환, 감염증제어, 난치병 극복 등 9개의 주요 연구분야와 건강・의료전략연구개발사업과 의료연구개발혁신기반조성사업(CiCLE, Cyclic Innovation for Clinical Empowerment)등 2개의 기반사업으로 구성되어 있다.
2016년도의 주요성과로 게놈의료의 사회적 구현, 다약제내성균연구 착수, iPS세포를 이용한 재생의료제품의 실용화, 미국 워싱턴과 영국 런던, 싱가폴에 사무소를 설치하여 외국정부나 연구기관과의 연대강화 및 정보수집 네트워크 구축 등을 들고 있다. 9개 주요연구 분야의 2017년도 예산은 2016년도와 동일한 1,265억 엔이 책정되었으며 2018년도에는 1,483억 엔을 요구예산으로 청구하였다.
라. 법제도동향
일본 정부는 환경과 기술변화에 대응한 규제개혁을 적시에 추진시키기 위해 2016년 9월 총리 직속 자문기구로 기존의 규제개혁 관련 회의를 통합하여 규제개혁추진회의48)를 설치하였다. ‘Society 5.0’의 성공적 달성을 위해 신기술에 대응하는 규제완화나 제도설계 등을 위해 과학적 합리성과 사회적 정당성에 근거한 증거의 수집이 필요하고 종래의 해석으로 대응이 충분한지, 법률의 개정이나 새로운 법률의 정비도 검토할 필요가 있다는 관점에서 규제개혁을 강력히 추진하고 있다.
주요 추진과제로는 각 부처・산학관 연대를 통해 관련제도의 토의 진행, 규제 샌드박스 제도의 창설, 과학적 분석이나 사회적 실증으로 얻어진 데이터에 근거하여 규제나 절차를 점검, 인공지능기술에 의해 발생하는 리스크에 대응하는 보험제도의 검토, 자율주행자동차의 사고 발생을 최소화하고 안전성을 향상시키기 위해 페일세이프(fail safe)기능 구비를 위한 제도 검토, 빅테이터를 이용한 새로운 기술 및 서비스의 사회적 실증을 통해 개인데이터를 제공하는 것의 이점에 대한 이용자의 인식 제고, 첨단 바이오기술의 사회적 수용성 제고 등을 들고 있다.
![]() 제2절
생명공학의 도전과 노력
제2절
생명공학의 도전과 노력
1. 한국 바이오산업 현황과 발전방향
가. 혁신 환경 변화와 바이오산업의 중요성 확대
차세대 유전체 분석 기술, 크리스퍼 가위 기술 등 바이오 분야에서의 기술 혁신이 활발하다. 여기에 더해서 바이오기술과 디지털기술의 융합, 빅데이터와 인공지능을 활용하는 4차 산업혁명 추세 등 최근의 파괴적 혁신 추세는 바이오산업을 둘러싼 환경을 크게 변화시키고 있다. 유전체 정보 등이 포함된 보건의료 빅데이터를 활용하여 개인 맞춤형 의약품과 정밀진단 의료기기가 개발되고 있으며, 이를 통해 진단과 치료에서의 부작용이 낮추고 난치성 질환에 대한 치료 효과가 강화되고 있다.
파괴적 기술 혁신과 기술간 융합으로 산업간 경계가 허물어지고 있으며, 바이오기술과 무관했던 기업들이 바이오 관련 사업을 적극적으로 추진하고 있다. IBM은 빅데이터 분석 인공지능을 활용하는 의료결정지원서비스 왓슨(Watson)을 개발하여 진단 분야에서 놀라운 능력을 시현하고 있다.49) 구글 벤처스(Google Ventures)는 바이오 분야 투자를 날로 확대하고 있으며, 퀄컴사(Qualcomm Life Inc.)는 디지털 병원 사업을 추진 중이다. 노바티스(Norvatis)와 같은 제약기업들은 유전정보에 기반을 둔
맞춤 치료서비스를 개발하고 있으며, 23andME 등 유전자 정보 분석기업은 질환 유전자 DB를 구축하고 이를 활용한 신약 개발 사업을 확대하고 있다.
삶의 질 향상에 대한 수요 증가, 범세계적인 고령화와 난치성 만성질환의 증가, 식량 및 환경 문제 해결 요구 등으로 바이오기술을 활용한 제품과 서비스에 대한 수요와 시장 규모는 날로 확대되는 추세이다. 보건의료 분야의 의약품과 의료기기 세계 시장이 연평균 6%대로 성장하고 있으며, 이중 바이오기술을 활용한 의약품과 의료기기의 비중이 크게 증가하고 있다.50) 줄기세포치료제와 유전자치료제 등 첨단 바이오의약품 시장은 연평균 10% 이상으로 성장할 전망이며, 유전체 기반 맞춤의료 연구 성과들이 실용화되면서 정밀의료서비스 시장도 급속하게 확대되고 있다. 다른 한편으로는 의료비 부담 증가에 대한 정책적 대응으로 약가 조정이 이루어지고, 비용 효율성이 높은 제너릭의약품과 바이오시밀러에 대한 시장 수요도 지속적으로 증가하고 있다.
바이오산업은 기술 혁신과 산업 발전을 통해 미래 성장 동력을 창출하고 경제 성장을 견인할 수 있는 산업이다. 동시에, 혁신적 기술로 난치성 질병을 극복하고 효율적인 건강관리시스템을 구축할 수 있을 뿐 아니라, 식량과 환경 문제 해결을 통해 국민 복지를 확대시킬 수 있다는 특성을 갖는다. 즉, 이상적인 바이오산업 생태계에서는 경제 성장과 복지 확대의 선순환 구조를 구축할 수 있으며, 궁극적으로 국가 전체의 사회경제적 편익을 증대시킬 수 있다.
한국은 세계 최고 속도로 고령화되고 있으며, 저성장 시대를 극복하기 위해 새로운 성장 동력을 찾고 있다. 가속화되는 고령화와 의료비 증가 등 다양한 사회적 수요에 대응하고 미래 성장 동력을 창출하기 위해서는 한국 바이오산업의 글로벌 경쟁력을 확보하는 것이 매우 중요한 시점이다.
나. 한국의 정책적 노력과 바이오산업의 성장
한국은 글로벌 기술 경쟁력을 확보하고 성장동력을 발굴하기 위해 연구개발 투자와 정책을 적극적으로 추진하여 왔다. 2015년 국내 총생산 대비 연구개발비 비중은 4.23%로 세계 주요국 중 1위이며, 절대 규모 66조 원은 세계 6위로 평가된다.
바이오산업에 대한 투자와 정책도 같은 맥락에서 이루어져 왔다. 한국 정부는 바이오산업을 새로운 성장 동력의 하나로 주목하였고, ‘제1차 생명공학육성기본계획(1994∼2006)’, ‘제2차 생명공학육성기본계획(2007∼2016)’에 이어 2017년 수립된 ‘제3차 생명공학육성기본계획(2017∼2026)’을 통해 바이오산업에 대한 정책적 지원을 강화하고 있다. 동 계획에 따라, 정부는 1994년부터 2015년까지 바이오 분야 연구개발 투자를 연평균 19.7%로 확대하여 왔다. 또 다른 통계에 의하면, 2015년 기준 정부의 바이오 분야 투자는 민간 투자의 1.23배에 달하는 것으로 보고되었다.51) 국가 전체의 연구개발비 중 정부의 투자 비중이 1/4 수준이고 민간의 투자 비중이 3/4인 것과 비교할 때, 바이오 분야의 혁신 생태계에서 한국 정부의 역할이 매우 크다는 사실을 확인할 수 있다.
한편, 바이오의약산업의 경쟁력 강화와 더불어 의약품 분야에서 민간의 투자가 최근 크게 증가하였고 2014년에는 민간 투자가 정부 투자의 4.3배로 나타났다.52) 이러한 민간 투자는 한미약품 등 주요기업의 기술 수출 등 연구개발 성과가 가시화되면서 크게 활성화된 것이다.
바이오 분야에 대한 적극적인 정책 지원에 힘입어 논문과 특허 등 지식기반자본 경쟁력은 일정 부분 강화되었다. SCIE 논문 건수와 SCI 논문 피인용률이 제1차 생명공학육성기본계획 초기에 비해 크게 증가하였고, 2015년 기준 논문 경쟁력은 세계 11위, 특허 경쟁력은 세계 9위로 평가받았다.
(단위: 억 원)

자료: 생명공학육성시행계획(관계부처 합동), 각 년도
[그림 1-13] 한국 정부의 바이오 연구개발 투자 현황
바이오기업의 혁신 경쟁력 역시 크게 강화되고 있다. 한미약품, 바이로메드, 코오롱라이프사이언스, 동아ST 등 연구개발에 적극적인 혁신형 제약사를 중심으로 신약 개발이 지속적으로 추진되어 왔으며, 국내 신약 기술이 해외에 수출되는 사례53)도 크게 증가하였다. 유전자치료제와 줄기세포치료제와 같은 첨단 바이오의약품의 선진국 임상시험도 증가하였다. 2017년 6월 기준 KFDA 허가를 받은 신약은 28개이며, 170여개 기업에서 908건의 임상시험이 진행되고 있다. 또한, 국내 대기업이 주도하는 바이오시밀러와 위탁생산(CMO) 분야의 글로벌 경쟁력은 세계 우위를 점하고 있다.
이러한 혁신 경쟁력 확보에 따라 한국 바이오산업의 생산과 수출의 증가도 가시화되고 있다. 한국 바이오산업은 2000년∼2015년간 연평균 14%로 성장하였으며, 특히 바이오의약산업의 수출이 최근 크게 증가하였다. 2015년 바이오산업 수급 규모는 9조 8,694억 원, 생산 규모는 8조 4,607억 원으로 2014년 대비 11.2% 성장하였다. 바이오의약품의 생산은 2014년∼2015년간 18.3%나 증가하였고, 2014년 생산액의 47%, 2015년 생산액의 55%를 수출한 것으로 나타났다. 2015년 바이오의약품 수출 금액은 1조 8,944억 원으로 2014년 대비 41.1% 증가하였고 이는 바이오산업 전체 수출 증가액의 65%에 달하는 금액이다.
[표 1-16] 한국 바이오산업의 성장 추세
(단위: 억원)
|
년도 |
2000 |
2005 |
2010 |
2015 |
CAGR(%) |
|||
|
(2000∼ 2005) |
(2005∼ 2010) |
(2010∼ 2015) |
(2000∼ 2015) |
|||||
|
생산 |
11,795 |
27,714 |
57,878 |
84,607 |
18.63 |
15.87 |
7.89 |
14.04 |
|
수입 |
3,306 |
7,912 |
14,057 |
14,087 |
19.07 |
12.18 |
0.04 |
10.15 |
|
내수 |
9,000 |
23,315 |
47,519 |
56,181 |
20.97 |
15.30 |
3.41 |
12.99 |
|
수출 |
6,101 |
12,311 |
24,415 |
42,513 |
15.07 |
14.68 |
11.73 |
13.82 |
자료: 산업통상자원부(각년도)
다. 생태계 총체적 활성화를 통해 국내 바이오산업 발전 촉진 필요
한국 바이오산업은 그 절대 규모가 아직까지 매우 작으며, 기업의 규모도 영세한 편이다. 향후 한국 바이오산업의 발전을 촉진하기 위해서는 생태계 총체적 관점에서의 활성화가 매우 중요하다.
무엇보다, 바이오산업 생태계 내에 파괴적 융합 환경을 조성하여야 한다. 한국 바이오산업이 양적 그리고 질적으로 성장하기 위해서는 바이오기술과 디지털기술, 인공지능기술 등 첨단기술이 원활하게 융합되고 파괴적 혁신이 활발하게 발생할 수 있어야 하기 때문이다. 생태계 내에 제조기업과 서비스기업간의 경계와 구분이 사라지고, IT벤처기업 등 다양한 분야와 다양한 규모의 혁신적 기업들이 바이오시장에 진입할 수 있어야 한다.
이처럼 생태계 내 주요주체와 환경이 변화하는 과정에서는, 시장에서 독점적 지위를 가지고 있던 기존 이해당사자와 신규 진입자간의 갈등이 불가피하다. 정부는 갈등의 주요 원인을 분석하고 이를 해결하기 위한 정책에 초점을 맞추어야 하며, 혁신 생태계에 대한 사회적 수용성을 높이는 중개자 역할을 강화하여야 한다. 특히, 중요한 갈등 요인의 하나인 비용 지불 구조에 대한 정책 혁신이 중요하다. 보건의료 등 바이오 분야의 공공적 특성으로 인해, 정부가 바이오산업의 가장 중요한 지불자이기 때문이다. 정부는 공공적 공급 시장에서 이해당사자 갈등이 해결될 수 있도록 지불 구조와 인센티브 배분 구조를 재정립하는데 주력할 필요가 있다.
바이오산업은 긴 호흡의 투자와 총체적 관점의 정책 지원이 중요한 산업이다. 정부는 국내외 환경변화와 미래비전을 고려한 중장기 비전과 혁신 전략을 바탕으로 범부처 관점에서 조정된 정책을 균형적으로 추진하여야 한다. 바이오산업의 경쟁력 확보와 성장을 위해서는 촉진 정책과 규제 정책간의 균형적인 추진을 통해 사회경제적 효과가 극대화될 수 있기 때문이다. 이를 위해 부처 간 역할 분담과 협력이 실질적으로 이루어질 수 있도록 거버넌스 체계를 개선하고, 정책 평가 체계도 조정되어야 한다. 또한, 4차 산업혁명 시대의 빠른 변화에 기민하게 대응하기 위해서는 민간 기업이 산업 생태계를 주도할 수 있어야 한다. 정부는 지불 구조 등 시장 환경 개선과 인허가 등 규제 수준의 선진화를 통해 산업 생태계 활성화를 중장기적 관점에서 간접적으로 지원하는 것이 바람직하다.
바이오산업 생태계가 총체적 관점에서 활성화되고, 연구개발의 혁신적인 성과들이 논문, 특허와 같은 지식기반자본 뿐 아니라 산업 성장과 복지 확대의 사회경제적 효과까지 크게 창출할 수 있도록 국가 전체적인 이해와 노력이 필요한 시점이다.
2. 바이오 경제 실현을 위한 도전: 거버넌스 변화
바이오경제 실현을 위해 민간부문의 산업 생태계가 진화하는 동안 이를 지원하기 위한 정부 차원의 노력도 지속되었다. 특히 2014년 이후 지난 3년 동안에는 과기정통부(구 미래부), 복지부, 산자부, 식약처 등 바이오 관련 부처 사이의 협력과 조정을 위한 노력이 보다 가시화되었다. 이러한 정부 내 거버넌스의 변화는 주로 국가과학기술자문회의와 국가과학기술심의회(바이오특별위원회)라는 두 개의 상위 기구를 통해 이루어졌다.
가. 국가과학기술자문회의와 ‘바이오 미래전략’
2014년 7월 17일 KIST에서 개최된 제11차 국가과학기술자문회의에서는 바이오분야에서 두 개의 안건이 대통령에게 보고되었다. ‘성장과 복지를 위한 바이오 미래전략’과 ‘바이오산업 활성화를 위한 규제개혁 방안’이 그것인데, 이 중 전자를 통해서는 2020년 바이오 7대 강국 도약을 목표로 글로벌 시장 진출(틈새시장 선점, 혁신시장 선도, ICT 융합 신시장 개척)과 사업화 연계 기반 확충(민간주도 R&D 촉진, 중개연구 활성화, 바이오 빅데이터 플랫폼) 측면에서 6가지 정책 과제가 제시되었다. 이후 2015년 1월 15일에는 미래부, 산자부, 방통위, 금융위, 중기청 등 5개 부처가 ‘역동적인 혁신경제’를 주제로 대통령에게 연두 업무보고를 하였다. 이 두 가지 보고의 후속 조치로 미래부, 산자부, 복지부, 식약처 등 바이오 관련 4개 부처는 ‘바이오 미래전략Ⅰ(바이오의약품)’(2015년 3월)과 ‘바이오 미래전략Ⅱ(의료기기)’(2015년 11월)를 공동으로 수립하여 발표하였다. 이 두 전략은 2014년 7월의 국가과학기술자문회의 보고 내용을 보다 구체화한 것이다.
2016년 4월 21일 개최된 제33차 국가과학기술자문회의 대통령 대면보고에서도 바이오 분야 보고가 있었는데, 이번에는 ‘바이오 산업생태계 확충 방안’이 주제였다. 이 보고에는 바이오 스타트업 육성 방안과 바이오 규제 개선 방안이 담겼고, 주요 정책 제언들이 각 부처의 후속 조치를 통해 추진되었다. 이 보고의 결과 시행된 대표적인 후속 조치로는 중기청과 산자부 주도로 바이오 초기 스타트업에 특화된 펀드가 조성된 것을 들 수 있다.
헌법기구인 국가과학기술자문회의는 의결기구가 아닌 자문기구이지만, 박근혜정부에서는 대통령이 직접 위원장을 맡음으로써 새로운 정책의 발표, 조정, 실행 점검 등의 실질적 행정 기능을 수행한 측면이 있었다. ‘바이오 미래전략’은 이런 조직적, 제도적 기반 위에서 시도된 바이오 분야의 범부처 협력 활동의 결과물이다. 그러나 단회적인 대통령 보고를 매개로 시도된 것이라서 상시적인 범부처 거버넌스 구조로 발전하지는 못한 한계가 있었다.
나. 국가과학기술심의회 바이오특별위원회
이러한 한계를 극복하는 상시적인 거버넌스 구조는 국가과학기술심의회를 통해 구현되었다. 국가과학기술심의회는 2016년 3월 3일 제11회 본회의를 통해 운영세칙을 개정하고 산하에 ‘바이오특별위원회(이하 바이오특위)’를 설치하기로 의결했다.
이러한 결정의 배경에는 그 전 해인 2015년에 있었던 한미약품의 대형 기술이전 성과가 있었다. 한미약품은 2015년 3월부터 11월까지 글로벌 제약사들과 5개의 기술이전 계약을 잇달아 체결하면서 세간의 주목을 받았다. 5개 계약의 총 규모(계약금+마일스톤)는 67.4억 달러(약 7조 5천억 원)에 달했고 그 중 사노피와 체결한 계약은 계약금만 4억 달러(약 4천 4백억 원)였다. 이러한 성과는 정부와 민간 모두에게 바이오산업이 지닌 가능성을 각인시키기에 충분했다. 그 결과 민간에서는 제2의 바이오 창업 붐이 일어나면서 바이오 분야의 신규 창업 수(443개사)와 벤처캐피탈 투자(4,686억 원, 전체 벤처캐피탈 투자의 21.8%로 1위)가 모두 사상 최고치를 기록했다. 정부 내에서도 바이오에 대한 관심이 높아지면서 각 부처들이 경쟁적으로 다양한 사업과 정책을 기획하고 추진했는데, 그로 인해 오래 전부터 잠재되어 있던 바이오 분야의 부처 간 종합조정 이슈가 더 첨예하게 드러났다. 국과심의 바이오특위 설치는 이러한 배경 속에서 바이오 분야의 종합조정 문제를 국과심이라는 과학기술 행정 최상위 기구 안에서 해결하고자 한 시도라고 볼 수 있다. 물론 바이오특위의 설치는 그 자체로 정부 내에서 바이오산업이 차지하는 위상이 높아졌음을 의미하는 것이기도 하다.

자료: 생명공학정책연구센터・STEPI, 매일경제(2017.6.19.)에서 재인용
[그림 1-14] 연도별 바이오 중소벤처기업 설립 현황
[표 1-17] 국내 벤처캐피탈의 분야별 투자 현황(2011∼2016)
|
분야 |
2011 |
2012 |
2013 |
2014 |
2015 |
2016 |
|
ICT 제조 |
1,754 |
2,099 |
2,955 |
1,951 |
1,463 |
959 |
|
ICT 서비스 |
892 |
918 |
1,553 |
1,913 |
4,019 |
4,062 |
|
전기/기계/장비 |
2,966 |
2,433 |
2,297 |
1,560 |
1,620 |
2,125 |
|
화학/소재 |
1,266 |
1,395 |
989 |
827 |
1,486 |
1,502 |
|
바이오/의료 |
933 |
1,052 |
1,463 |
2,928 |
3,170 |
4,686 |
|
영상/공연/음반 |
2,083 |
2,360 |
1,963 |
2,790 |
2,706 |
2,678 |
|
게임 |
1,017 |
1,126 |
940 |
1,762 |
1,683 |
1,427 |
|
유통/서비스 |
1,270 |
608 |
1,092 |
2,046 |
3,043 |
2,494 |
|
기타 |
427 |
342 |
593 |
616 |
1,668 |
1,570 |
|
합계 |
12,608 |
12,333 |
13,845 |
16,393 |
20,858 |
21,503 |
자료: 벤처캐피탈협회 VC통계정보(www.kvca.or.kr)
바이오특위는 당시 실장급이었던 과학기술혁신본부장이 위원장을 맡고 7개 부처의 바이오 담당 국장과 13명의 민간위원으로 구성되었는데, 문재인정부에서 과학기술혁신본부장이 차관급으로 격상되면서 정부위원도 실장급으로 조정되었다.
바이오특위는 2016년 3월 22일 첫 회의를 시작으로 2017년 9월까지 여섯 차례의 회의를 개최했고, 이 과정에서 ‘바이오 중기 육성전략’을 비롯한 다양한 안건들을 심의하고 논의했다. 바이오특위는 바이오 분야의 범부처 종합조정 거버넌스가 제도적, 조직적 기반을 확보했다는 점에서 의미가 크다고 할 수 있다.
[표 1-18] 바이오특별위원회 개최 경과
|
회차 |
일시 |
위원장 |
안건 |
|
제1회 |
2016. 3.22 |
홍남기 |
∙바이오특별위원회 운영방안 ∙제2차 국가 감염병 위기대응 기술개발 추진전략(‘17∼’21) ∙바이오 현안 이슈 및 주요 아젠다 |
|
제2회 |
2016. 5.25 |
홍남기 |
∙바이오 중기 육성전략(안) ∙바이오 창조경제 10대 활성화 프로젝트 추진방안 ∙바이오 미래전략(Ⅰ・Ⅱ) 이행실적 점검 |
|
제3회 |
2016. 10.10 |
홍남기 |
∙바이오신약 국가전략프로젝트 추진 현황 및 계획(안) (미래부) ∙정밀의료 국가전략프로젝트 추진현황 및 계획(안) (복지부) ∙‘바이오 중기(‘16∼’18)육성전략‘ 1차 실적점검 결과(안) (관계부처합동) ∙우수기업연구소지정제도 추진계획(안) (미래부) ∙글로벌 바이오 전시회 범부처 공동참가 계획(안) (관계부처합동) |
|
제4회 |
2017. 1.17 |
홍남기 |
∙바이오의약품 규제관리 선진화 방안(안) (식약처) ∙포스트게놈 다부처 유전체사업 추진 개선 계획(안) (관계부처합동) ∙2017년 바이오특별위원회 운영 계획(안) (미래부) ∙농생명 소재산업 육성방향(안) (관계부처합동) |
|
제5회 |
|
|
|
|
제6회 |
2017. 9.18 |
임대식 |
∙바이오경제 혁신전략 2025(안) (관계부처합동) ∙AI・구제역 대응 범부처 R&D 추진전략(안) (관계부처합동) ∙바이오 중기 육성전략 2차 실적점검 결과(안) (관계부처합동) ∙생명윤리법 바이오 R&D 규제 현황 (과기정통부) |
주: 제5회 특위 개최 정보는 확인이 안 됨 자료: 과기정통부(2017.9.18.); 미래부(2016.3.23.; 2016.5.25.; 2016.10.10.; 2017.1.17.)
다. 과학기술전략회의와 국가전략프로젝트
박근혜정부는 2016년 3월에 국가과학기술심의회와 별도로 대통령이 주재하는 과학기술전략회의를 설치하여 국가전략프로젝트를 추진하였다. 2016년 8월에 9개의 국가전략프로젝트를 선정했는데(①인공지능, ②가상증강현실, ③자율주행차, ④경량소재, ⑤스마트시티, ⑥정밀의료, ⑦바이오 신약, ⑧탄소자원화, ⑨(초)미세먼지), 이 중에 바이오 분야에서는 정밀의료(복지부)와 바이오 신약(미래부)이 포함되었다.
라. 발전 방향
바이오 분야의 부처 간 협력 및 조정의 거버넌스는 바이오특위를 통해 제도적, 조직적 기반을 확보했는데, 향후에는 정책 내용의 측면에서도 보다 긴밀한 협력이 이루어져야 한다. 예를 들어 과기부, 복지부, 산자부는 각각 의약품, 의료기기, 줄기세포/재생의료, 유전체 분야에서 연구개발사업을 기획해서 추진하고 있지만, 각 세부분야 예산 중 일부만 범부처/다부처 사업으로 공동 기획하고 있다. 향후에는 세부 분야별로(예: 의약품) 전 부처가 해당 분야의 전략적 목표를 공유하고 사업을 공동으로 기획하고 조정해서 마치 한 부처의 사업처럼 연계될 수 있도록 하는 것이 필요하다.
참고로, 우리와 비슷한 부처 구조를 가지고 있던 일본은 2015년에 일본의료연구개발기구(AMED)라는 통합 연구관리기관을 설립하고, 여기에 문부과학성, 후생노동성, 경제산업성의 관련 예산(약 1.4조 원)을 모은 뒤, 의약품, 의료기기, 재생의료 등의 분야에서 통합 연구개발사업을 기획해서 추진하고 있다. 향후 우리나라에 적합한 바이오 행정 거버넌스가 무엇인지는 좀 더 논의가 필요하지만, 우선 바이오특위를 통해서 보다 적극적인 협력과 조정이 이루어질 필요가 있다.
-과학기술정보통신부(2017.9.18.), “제6회 바이오특별위원회 개최”, 과학기술정보통신부 보도자료.
-국가과학기술심의회(2016.3.3.), “국가과학기술심의회 운영세칙 개정(안)”, 국가과학기술심의회 제11회 회의 1호 안건.
-국가과학기술자문회의(2014.7.17.a), “성장과 복지를 위한 바이오 미래전략”, 제11차 회의 보고자료.
-국가과학기술자문회의(2014.7.17.b), “바이오산업 활성화를 위한 규제개혁 방안”, 제11차 회의 보고자료.
-국가과학기술자문회의(2016.4.21.), “바이오 산업생태계 확충 방안”, 제33차 회의 보고자료.
-매일경제(2017.6.19.), “10년 후 바이오경제시대…‘퍼스트 R&D’로 스타기업 만들자”.
-미래창조과학부(2016.3.23.), “제1회 바이오특별위원회 개최”, 미래창조과학부 보도자료.
-미래창조과학부(2016.5.25.), “바이오 미래성장동력화를 위한 범부처 전략 마련: 제2차 바이오특별위원회 개최”, 미래창조과학부 보도자료.
-미래창조과학부(2016.8.10.), “대한민국 미래 책임질 9대 국가전략 프로젝트 선정”, 미래창조과학부 보도자료.
-미래창조과학부(2016.10.10.), “제3회 바이오특별위원회 개최”, 미래창조과학부 보도자료.
-미래창조과학부(2017.1.17.), “제4회 바이오특별위원회 개최”, 미래창조과학부 보도자료.
-미래창조과학부 외(2015.1.15.), “역동적 혁신경제로 경제 대도약 반드시 이루겠습니다.”, 미래창조과학부 외 4개 부처 공동 보도자료.
-한미약품 오픈이노베이션 홈페이지(oi.hanmi.co.kr) 보도자료.
제2장 국가 생명공학 육성 정책(부처별 투자 현황 및 계획 등)
![]() 제1절
생명공학 육성 정책
제1절
생명공학 육성 정책
1. 생명공학 연구개발 지원
가. 개요
바이오기술이 질병극복 등 인류의 복지와 일자리 창출, 새로운 성장동력 육성 등 경제성장을 동시에 달성하는 새로운 경제 패러다임인 바이오경제시대로 진입할 것으로 전망하고 있으며, 바이오는 건강(Red), 식량(Green), 환경・에너지(White) 문제를 해결 할 수 있는 대안으로 떠오르고 있다. 글로벌 바이오 시장은 2030년 4.4조 달러로 반도체, 자동차, 화학제품 등 3대 산업 합계 3.6조 달러 규모를 뛰어넘어 급성장할 것으로 예상하고 있다.

[그림 2-1] 글로벌 바이오 시장 전망
이 중 레드바이오는 대표적으로 의약품으로, 세계 의약품 시장은 500대 제약회사 및 바이오 회사 기준 7,430억 달러 규모로 추정되고 있으며, 연평균 4.8%로 성장하여 향후 2020년 9,870억 원 규모에 이를 것으로 전망된다.
우리나라도 제3차 과학기술기본계획(2013.7.), 경제혁신 3개년 계획(2014.1.), 성장과 복지를 위한 바이오 미래전략(2014.7.), 바이오 창업・사업화 10대 활성화 프로젝트(2016.5.) 등을 통해 BT 관련 육성 및 지원 정책을 다수 포함하여 추진하고 있으며, ICT와 같이 다른 분야와의 융복합 등을 통한 신산업 및 일자리 창출에 기여할 것으로 전망하고 있다.
나. 추진경과
정부 차원의 생명공학육성은 1982년 과학기술부에서 생명공학을 핵심전략기술로 선정하여 특정연구개발사업으로 지원하면서부터이다. 이후 1983년 ‘유전공학육성법(現 생명공학육성법)’을 제정하여 정부의 생명공학육성·지원을 위한 법적 기반을 마련하였고, 1985년 동법을 기반으로 한국과학기술연구원(KIST) 부설로 ‘유전공학센터(現 한국생명공학연구원)’를 설립하여 생명공학을 본격 육성·지원하였다.
1994년 제1차 생명공학육성기본계획을 통하여 창의적 연구개발의 저변을 확대하고 제도적 뒷받침을 마련하는 등 연구기반을 조성하였고, 지난 2007년에는 제2차 생명공학육성기본계획(2007~2016)을 수립하여 2012년까지 원천기술 확보 및 산업화로 가기 위한 인프라 구축을 추진하였다. 올해에는 제3차 생명공학육성기본계획(바이오경제 혁신전략 2025, 2017~2026)을 수립하고, 바이오경제시대 도래에 따라 대한민국을 바이오 글로벌 강국으로 도약시키기 위한 국가 차원의 바이오 육성 전략을 추진할 예정이다.
또한 뇌연구촉진기본계획(2008~2017), 줄기세포연구활성화방안(2010~2015), 생명연구자원관리기본계획(2011~2020) 등 세부 연구 분야별 기본계획 등을 수립하여 육성·지원하고 있다.
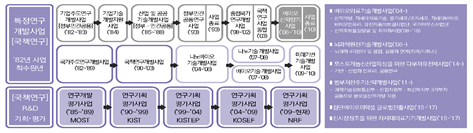
[그림 2-2] 특정연구개발사업 국책연구사업 변천과정
다. 주요정책
(1) 법적, 제도적 기반
법적 성과로는 2009년 생명연구자원에 대한 국가차원의 관리 및 지원체계를 구축하고자 ‘생명연구자원의 확보·관리 및 활용에 관한 법률’을 제정하였다. 그리고 2009년 국가과학기술위원회 안건 상정을 통한 원천연구 개념 및 비중 산정(안)을 마련하고 줄기세포연구 활성화 방안을 마련하였다.
또한 생명공학육성시행계획, 줄기세포연구시행계획, 생명연구자원관리시행계획, 나노기술발전시행계획, 국가융합기술발전시행계획 수립 등 범부처 시행계획을 통한 제도적 지원 체계를 갖추고 있다. 2017년에는 범부처 공동으로 제3차 생명공학육성기본계획(바이오경제 혁신전략 2025, 2017~2026)을 수립하였다.
(가) 생명공학육성법
생명공학육성법은 생명공학연구의 기반을 조성하여 생명공학을 보다 효율적으로 육성・발전시키고 그 개발기술의 산업화를 촉진하여 국민경제의 건전한 발전에 기여하게 함을 목적으로 한다. 이 법은 1983년 ‘유전공학육성법’으로 제정되었으며 1995년 유전공학에서 생명공학으로 확대하는 내용의 제3차 개정을 통하여 ‘생명공학육성법’으로 개명하였다.
(나) 뇌연구촉진법
뇌연구촉진의 기반을 조성하여 뇌연구를 보다 효율적으로 육성・발전시키고 그 개발기술의 산업화를 촉진하여 국민복지의 향상 및 국민경제의 건전한 발전에 기여하기 위하여 1998년 6월 ‘뇌연구촉진법’을 제정·운영하고 있다.
(다) 생명공학종합정책심의회
생명공학육성법 제6조에 근거하여 생명공학육성기본계획의 수립과 그 집행 및 조정에 관한 업무 등을 관장하기 위하여 과학기술정보통신부장관 소속하에 생명공학종합정책심의회를 두고 있다.
(2) 한국생명공학연구원
과학기술정보통신부는 ‘과학기술분야 정부출연연구기관 등의 설립·운영 및 육성에 관한 법률’ 제8조에 근거하여 1985년 2월 30명의 연구원으로 KIST 부설 유전공학센터를 설립하여 유전공학연구를 본격적으로 지원 육성하였다. 이후 1990년 12월 KIST 부설 유전공학연구소로 명칭을 변경하였고, 유전공학육성법이 생명공학육성법으로 개정되어 1995년 3월 KIST 부설 생명공학연구소로 명칭을 변경하였다. 1999년 5월 기초기술연구회 산하 생명공학연구소로 독립하여 2001년 1월 생명공학전문연구원으로 승격하였으며 현재는 정부출연연구기관으로 과기정통신부에 소속되어 있다.
(3) 생명공학육성기본계획 및 시행계획 수립
(가) 생명공학육성기본계획
과학기술정보통신부는 ‘생명공학육성법’ 제4조에 근거하여 생명공학 분야의 효율적인 연구개발을 촉진하기 위하여 1994년부터 범국가적인 ‘생명공학육성기본계획(Biotech 2000, 1994~2006)’을 수립하여 시행하고 있다. 특히 올해에는 바이오경제를 주도하는 글로벌 바이오강국 실현을 위해 국민 생활에 직결되는 4대 세부 목표를 제시한 제3차 생명공학육성기본계획(바이오경제 혁신전략 2025, 2017~2026)을 수립・추진 중이다.
동 계획은 과학기술정보통신부 주관으로 교육부, 산업부, 복지부, 농림부, 환경부, 해수부, 식약처 등 8개 부처가 공동 추진하고 있다.

[그림 2-3] 제3차 생명공학육성기본계획 비전과 목표
(나) 생명공학육성 연도별 시행계획
과학기술정보통신부는 ‘생명공학육성법’ 제5조에 근거하여 관계부처와 합동으로 생명공학육성기본계획에 따른 연도별 ‘생명공학육성 연도별 시행계획’을 매년 수립하여 시행하고 있다. 2017년도 생명공학분야 정부 투자계획은 총 3조 1,139억 원으로 전년 투자(3조 930억 원) 대비 약 0.7% 증가하였다. 생명과학, 보건의료, 농수축산식품, 산업공정/환경・해양, 바이오융합의 연구개발과 공공 R&D 인프라 구축을 위한 예산 확대 등 시설 및 기반구축, 인력양성에 대한 지원을 추진하고 있다.
[표 2-1] 2017년도 생명공학분야 정부투자계획
(단위: 억 원, %)
|
구분 |
과학기술 정보통신부 |
교육부 |
농림부 |
산업부 |
복지부 |
환경부 |
해수부 |
식약처 |
합계 |
|
R&D |
1조 1,933 |
1,117 |
6,405 |
2,262 |
4,379 |
299 |
1,380 |
392 |
1조 6,235 |
|
인프라 |
827 |
- |
48 |
490 |
217 |
10 |
224 |
9 |
1,825 |
|
인력양성 |
- |
1,123 |
- |
25 |
- |
- |
- |
- |
1,148 |
|
합 계 |
1조 2,760 (41%) |
2,240 (7%) |
6,453 (21%) |
2,777 (9%) |
4,596 (15%) |
309 (1%) |
1,604 (5%) |
401 (1%) |
3조 1,139 (100%) |
|
(증감율) |
8.9 |
Δ18.2 |
Δ3 |
Δ4.4 |
Δ2.1 |
Δ0.2 |
3.8 |
8.2 |
0.7 |
라. 주요사업
과학기술정보통신부는 미래유망 바이오 원천기술개발을 목표로 관련 바이오 분야 연구개발사업을 폭넓게 추진 중이다. 주요 사업으로는 바이오・의료기술개발사업, 뇌과학원천기술개발사업, 포스트게놈신산업육성을 위한 다부처유전체사업, 범부처전주기신약개발사업, 뇌연구원 주요사업지원 등이 있으며, 2017년 예산은 3,540억 원으로 2016년 대비(2,950억 원) 20% 증가하였다.
(1) 바이오의료기술개발사업
신약, 줄기세포, 첨단의료기반기술 등 미래유망 바이오 분야에 대한 연구개발을 통하여 고부가가치 창출이 가능한 핵심원천기술 확보 및 선진화 기반 확충을 목표로 2017년 2,643억 원을 투자하였다.
|
내역사업 |
사업개요 |
|
신약개발 |
산업계 연계・활용이 가능한 신약타겟검증 및 신약 기초물질 개발에서부터 신약 R&D 생산성을 향상시키는 기반기술개발에 이르기까지 국내 제약산업의 신성장동력 제공 및 글로벌 신약 개발을 지원 |
|
차세대의료 기술개발 |
국민건강 이슈에 선제적으로 대응하고 의료현장의 수요를 반영, 헬스케어・의료기기 등 차세대의료기술을 개발 |
|
줄기세포 /조직재생 |
난치성 질환치료제 개발에 응용 가능한 줄기세포 요소기술(세포재생, 장기조직재생 기술 등) 개발 |
|
차세대바이오 |
생명현상 발현 관련 질환 제어 및 시스템생물학적 생체정보 해석 등 국민 삶의 질 향상을 위한 미래유망 차세대 바이오기술 개발 |
|
바이오인프라 |
생명연구자원(동물, 식물, 미생물 등)을 효율적으로 확보・등록・활용하고 활용분야 확대 등 생명연구자원 가치를 제고 |
|
국가마우스표현형 분석기반구축사업 |
국내 바이오 연구 및 신약개발 분야 실험에 필수적인 유전자변형마우스(GEM) 자원의 생산 및 이를 활용한 질환 분석 |
|
전통천연물기반 유전자동의보감사업 |
전통천연물 기반으로 천연물 신약, 기능성 소재 등 개발을 위한 융복합원천기술개발 |
|
연구소재지원사업 |
구소재(36개 소재은행) 및 관련 정보의 확보・관리를 통하여 양질의 연구소재를 산학연 연구자에게 제공 |
|
신시장창조차세대 의료기기개발사업 |
국내의 앞선 ICT 기술을 활용한 융합제품분야 중심의 글로벌 성공모델 창출・확산 및 바이오산업 저변 확대 |
|
첨단바이오의약품 글로벌진출 |
국내외 임상연구단계에 진입한 바이오 첨단의약품 개발 기업의 투자 희망분야를 발굴, R&D에서 수출지원까지 토탈 패키지로 지원 |
(2) 뇌과학원천기술개발사업
태동기 유망분야인 뇌연구를 통해 뇌질환 예방・치료 기술, 신체장애 극복기술, 뇌기능 강화 기술 등의 뇌과학 핵심 4대 분야 원천기술 확보 및 BT, IT, CS(인지과학) 융합을 통한 신시장 선점을 사업 목표로 하며, 2017년 4,150억 원의 예산을 투입하였다. 뇌융합기술개발(뇌지도 구축)에 대한 연구개발을 지원하는 뇌연구 4대 분야 및 융합분야와 치매 예측 뇌지도 구축 등 치매 조기진단사업 등을 지원하는 실용화 연계 연구 분야로 나누어져 있다.
(3) 포스트게놈신산업육성을위한 다부처유전체사업
미래수요(맞춤의료 등)에 대비한 유전체 유망분야 기초‧원천기술 확보 및 인프라 구축(과기정통부, 복지부, 산업부, 농림부, 산림청, 해수부, 농진청 공동 추진)을 사업 목표로 하며, 2017년 1,130억 원을 지원하였다. 생명현상 발굴 등 기초·원천 연구와 유전체 분석 기술 등 연구기반 확보 및 유전체 정보센터 등 인프라 구축을 지원하는 기반·산업화 인프라와 질병기전 규명 유전체 연구, Host-Microbe Interaction, 인간 표준게놈지도 작성, 국제협력 공동연구, 유전체 전문인력 양성을 하는 공동연구 부분으로 나누어져 있다.
(4) 범부처전주기신약개발사업
부처 간 단절 없는 전주기적 신약개발 지원을 위해 3개 부처(과기정통부, 복지부, 산업부) 합동으로 출연한 ‘범부처신약개발사업단’을 통해 향후 시장성이 유망한 신약개발 프로젝트를 발굴하여 지원 및 관리하는 사업으로, 신약개발 특정영역에 국한된 지원이 아닌 신약개발 연구 전 단계(선도물질발굴-후보물질발굴-전임상-임상1,2상)에 걸쳐 우수한 연구 프로젝트를 발굴하여 지원하는 전주기 사업이다. 2017년 3개 부처(과기정통부, 산업부, 복지부) 공동 330억 원을 투자하여 글로벌 신약 개발을 위한 연구개발에 적극 지원하고 있다.
마. 향후 계획
최근 고령화・전염병 등 인류 공통의 난제를 극복하기 위한 해결책 및 경제성장의 핵심 열쇠로써 BT 분야의 중요성이 대두되고 있다. 이러한 가운데 바이오는 기아 및 질병, 에너지 문제 등 인류 생존과 더불어 글로벌 경제위기의 출구로 핵심적인 역할 수행이 기대되는 분야이다. 또한 4차 산업혁명 촉발에 따라 타 기술과의 융합이 활발해 지면서 IT, 에너지·환경, 화학 등과의 융합이 가능한 응용분야로 확대되는 추세이다. 제3차 과학기술기본계획 등에 BT 관련 정책이 다수 포함되면서 그 중요성이 더욱 강조되고 있다.
이러한 흐름에 맞추어 국가 생명공학 분야의 주무부처인 과학기술정보통신부에서는 생명공학분야의 미래 메가트랜드를 반영한 핵심 원천기술 확보 및 선진화 기반 확충에 적극적인 투자와 지원을 강화하여 곧 다가올 바이오 경제시대를 준비하고 있다. 범부처 종합계획인 제3차 생명공학육성기본계획(바이오경제 혁신전략 2025, 2017~2026)에 맞추어 신약・의료기기 등 바이오 신산업 육성을 위한 원천기술개발, 뇌과학・유전체・줄기세포 등 세계 선도형・혁신형 바이오 R&D 지원을 확대할 예정이다. 더불어 4차 산업혁명 대응 역량 제고를 위한 융복합기술 분야에 대한 투자도 강화할 예정이다.
나아가 BT분야 산업화 성과 창출을 위한 기술사업화 전략 마련에도 힘쓰고 있다. 국내 바이오 시장은 글로벌 시장보다 높은 성장률을 보이나 그 규모는 세계 시장 대비 매우 협소한 실정이다. 이러한 상황에서 의료기기 분야, 신약분야 등과 같은 정부 R&D 투자로, 가장 활발한 분야의 사업화를 활성화하는 전략과 지원 정책을 강구하는 것이 중요할 것이다.
이러한 생명공학 육성 지원 정책들이 국가 생명공학의 기틀을 확고히 하여 글로벌 경쟁력을 갖추어 풍요로운 바이오 경제 구현을 이루는 결실이 되기를 전망한다.
2. 생명공학산업 육성
가. 개요
(1) 생명공학산업
생명공학산업(바이오 산업)은 생명공학기술(Biotechnology)을 기반으로 생물체의 기능과 정보를 활용하여 제품 및 서비스 등 다양한 고부가가치를 생산하는 산업을 의미한다. 생물체의 기능을 이용하여 제품을 만들거나 유전적 구조를 변형시켜 새로운 특성을 나타내게 하는 생명공학기술은 제약 산업, 농업, 화학 산업 등에 직접 응용될 뿐만 아니라 IT‧NT 등의 기술과 융합하면서 그 적용 범위가 확대되고 있다. 특히, 최근 유전자분석기술, 생체신호 측정기술 등 다양한 생물체 분석 및 진단기술 발전과 함께 빅데이터 저장‧분석기술, 인공지능(AI) 등 이른바 4차 산업혁명 기술의 급격한 발전으로 개인 맞춤형 치료‧건강관리 등 새로운 제품과 서비스를 제공하는 신산업이 빠르게 등장하고 있다.
생명공학산업은 일반적으로 분야에 따라 의약바이오(의약품 등), 산업바이오(바이오화학제품 등), 그린바이오(유전자변형생물체 등), 융합바이오(디지털 헬스케어 등)로 분류하고 있다.
(2) 생명공학산업 육성 필요성
생명공학산업은 의약, 환경, 식품, 에너지, 농업, 해양 등 산업 전반에 걸쳐 성장을 주도함과 동시에, 건강‧식량‧환경 문제 등 인류 난제를 해결함으로써 삶의 질을 향상 시킬 수 있는 유망 산업으로 주목받고 있다. 그러나 다른 산업과 달리 생명공학산업은 연구개발 중심의 기술집약적 산업으로 생명공학기술에 대한 기초연구에서부터 신제품 출시라는 산업화에 성공하기까지는 소요 기간이 길고 개발비용도 큰 반면, 성공 확률은 낮아 정부의 전략적 지원이 필요하다. 이러한 이유로 미국, 유럽, 일본, 중국 등 주요국들은 생명공학산업을 핵심투자분야로 선정하여 산업화를 위한 중장기 계획을 수립하고 집중 지원하고 있다.
나. 추진경과
산업통상자원부는 과거 중기거점기술개발사업, 성장동력기술개발사업, 차세대신기술개발사업, 전략기술개발사업 등으로 분산되어 있던 R&D 사업구조를 2008년부터 통합하였고, 생명공학산업 분야의 R&D도 바이오의료기기 산업핵심기술개발사업으로 일원화하여 운영하였다. 바이오의료기기 산업핵심기술개발사업은 산업통상자원부의 산업기술혁신계획(5개년), 핵심투자대상 및 테마, R&BD전략보고서 등에 기반 한 하향식(Top-Down) 방식과 함께 정기・상시 기술수요조사에 기반 한 상향식(Bottom-Up) 방식을 동시에 고려하여 추진하는 것이 큰 특징이다. 2016년부터는 바이오 분야와 의료기기 분야의 특성과 전문성을 고려하여 바이오의료기기 산업핵심기술개발사업을 바이오산업핵심기술개발사업과 전자시스템산업핵심기술개발사업으로 분리하여 운영 중에 있다.
또한, 산업통상자원부는 생명공학산업에 대한 R&D 지원뿐만 아니라 생명공학기술의 산업화를 촉진하고 지속적인 산업 성장의 생태계를 구축하기 위해 2016년 바이오 사업화 촉진사업을 신설하여 바이오벤처 비즈니스 활성화에 필수요소인 창업 활성화, 투자 유치, 기술사업화, 글로벌 파트너십을 지원하기 시작하였다.
이 밖에도 기존 벤처캐피탈(VC)과 정책 펀드가 창업 초기 바이오벤처에 대한 투자가 상대적으로 미미했다는 한계를 극복하고, 우수 생명공학기술이 사업화로 이어지도록 지원하기 위한 초기 바이오기업 전문펀드를 2016년 말 조성하고 2017년부터 본격적인 투자에 착수했다.
다. 주요정책 및 사업
(1) 생명공학산업 분야별 사업화 촉진 R&D 지원
(가) 바이오 핵심기술 개발
산업통상자원부는 세계 최고 수준의 산업화 핵심기술을 개발하고 이를 기반으로 한 글로벌 사업화 제품 출시 등 국내 바이오산업 활성화를 위하여 산업바이오, 융합바이오, 의약바이오 등 분야별 사업화 촉진 기술 개발하는 것을 선택과 집중하여 지원하고 있다. 구체적으로 바이오의약품 개발에 필수적인 평가기반기술 개발, 플랫폼 기술 개발 등과 생물체 관련 검출‧분석 기술과 IT・NT 등이 융합되어 다양한 분야로 확대되는 응용 연구 및 사업화 연구를 지원하고 있다. 또한 식물 등 바이오매스를 원료로 하는 화학제품 또는 바이오 기능성 신소재 생산기술 및 공정개발을 지원한다. 2016년부터는 고기능 생체정보 측정기기, AI 활용 바이오 빅데이터 분석, 개인 맞춤형 진단・치료법 등 4차 산업혁명 시대에 대응하기 위한 산업 핵심기술 개발에 집중해 지원 중이다.
(나) 유망 바이오 IP 사업화 촉진
정부의 지원과 민간의 자발적 투자를 통해 대학, 출연연 및 중소/벤처기업이 개발한 기술 중 유망한 우수 기술임에도 사업화로 이어지지 못하고 잠재된 IP(Intellectual Property)가 다수 존재한다. 산업통상자원부는 이러한 잠재 유망 IP가 사업화 수요 기업에 이전되는 것을 촉진하여 우수한 제품이 개발되는 개방형 혁신(Open Innovation) 생태계를 구축하기 위해 유망바이오IP사업화촉진사업을 2015년부터 운영하고 있다. 2016년에는 유망한 IP를 보유했음에도 불구하고 재정 여건 등으로 인해 사업화에 어려움을 겪고 있는 창업 초기 벤처기업들의 R&D를 지원하기 위한 전담 프로그램을 신설하여 운영 중에 있다. 특히 동 사업은 개방형 과제 유형(품목지정형)의 지원을 통해 연구자의 도전성 및 창의성 제고, 가치사슬(Value Chain) 극대화를 유도하여 기초응용 연구기관과 바이오 기업의 자유로운 공동연구 문화 기반을 구축하는 것에 기여할 것으로 예상된다.
(다) 바이오화학 산업화 촉진
온실가스 감축과 환경 친화적 제품에 대한 기업의 책임이 커지고 인체에 무해한 친환경 소재에 대한 국민들의 관심이 급격히 커지면서 친환경 바이오화학제품에 대한 중요성이 더욱 커지고 있다. 바이오화학산업은 기존 석유화학 산업을 보완할 수 있어 높은 기술적 수요가 있으나, 바이오소재 개발, 공정 개발 등에 대한 투자 부담으로 인해 민간의 자발적인 투자는 아직 미흡한 상황이다.
이에 산업통상자원부는 바이오화학산업화촉진사업을 추진하여 바이오화학제품의 조기 산업화를 위한 생산기술 개발, 소재개발, 산업융합기술 개발을 지원하고 있다. 동 사업을 통해 수입에 전적으로 의존하고 있는 바이오화학 연료(바이오슈가)의 대량 생산기술 개발을 지원하고, 자동차 내외장재 등에 사용할 수 있는 친환경 바이오 폴리우레탄을 개발하고 있다. 또한 범용 바이오 플라스틱 소재를 중심으로 다양한 원료로부터 다양한 생산물을 만들어 낼 수 있는 데모급 콤비나트 플랜트 구축도 지원한다.
(2) 초기 바이오기업 전담 자금 지원
생명공학산업 분야 벤처캐피탈 신규 투자규모는 2011년 933억 원에서 2015년 3,137억 원으로 연평균 35.4%로 급성장하였으나, 창업 3년 미만 초기 바이오 벤처기업에 대한 투자는 385억 원으로 생명공학산업 분야 전체의 12.3%에 불과하였다. 이는 산업 전체 평균인 31.1%에 비해 저조한 수치로 민간 벤처캐피탈은 투자수익 실현이 용이한 상장 직전 단계 기업(후기기업) 또는 기술개발 성과가 알려진 기업(중기기업) 위주로 투자하고 있었던 것을 보여준다. 바이오 정책펀드도 그간 업력 구분 없이 바이오기업 전체에 대한 투자비율만을 규정하고 있어, 민간 펀드 실적과 유사하게 초기 기업에 대한 투자 실적이 미흡했다.
산업통상자원부는 이러한 초기 바이오기업들의 자금조달 애로를 해소하기 위해 초기 바이오기업 투자 전문 펀드 조성을 추진하였다. 그 결과 2016년 말 산업통상자원부가 100억 원을 출자하고 17개 민간 투자자들이 285억 원을 출자하여 총 385억 원 규모의 초기 바이오기업 육성펀드가 조성되었다. 당초 조성 목적을 달성하기 위해 조성 총액의 45% 이상을 창업 5년 미만 바이오 기업에 투자하도록 의무화하였고, 2017년부터 본격적인 투자에 착수하였다.
(3) 바이오산업의 지속성장 생태계 구축
최근 국내 바이오기업은 대규모 기술이전 등 가시적 성과를 나타내고 있으나 우수한 기술을 산업화하기 위한 비즈니스 기반 및 성공경험은 여전히 부족한 기업들이 많아 기술력을 보유한 기업의 사업화를 촉진하고 지속적인 성장의 기반이 되는 산업 생태계 조성이 필요하다. 이에 산업통상자원부는 2016년 바이오 사업화 촉진사업을 신설하고 바이오벤처 창업 활성화 지원, 국내외 파트너십 구축을 통한 바이오벤처의 기술이전 활성화 및 투자유치 등 비즈니스 여건 조성, 바이오산업 생태계 혁신을 위한 정책 콘텐츠 개발 등을 지원하고 있다.
또한, 생명공학기술의 산업화 가속에 따른 생물공정 관련 기술인력 수요와 BT-IT‧NT 융합 추세에 따른 전문 인력의 수요 증가에 대응한 인력양성도 지속 확대해 나가고 있다.
(4) 산업용 유전자변형생물체(LMO) 안전관리
산업용 LMO란 시험・연구용, 농림축산업용, 보건의료용, 환경정화용, 해양・수산용, 식품・의료기기용 LMO를 제외한 섬유・기계・화학・전자・에너지・자원 등의 산업분야에 이용되는 LMO를 말한다. LMO의 용도가 무엇인지 확정하기 어려운 경우, 산업통상자원부는 7개의 LMO 소관 관계부처와 협의를 통하여 해당 LMO의 소관부처를 확정할 수 있다.
산업통상자원부는 산업용 LMO의 안전관리업무를 유전자변형생물체의 국가간 이동 등에 관한 법률 제37조의2 및 통합고시 제1~4조에 따라 한국생명공학연구원 내 한국바이오안전성정보센터에 위탁하고 있다. 이에 따라 한국바이오안전성보센터는 산업용 LMO 위해성심사의 접수 및 심사위원회 운영 등의 업무를 담당하고 있으며, 산업용 LMO의 수입승인신청, 생산승인신청, 이용승인신청 접수 및 산업용 LMO 관련 시설의 신고, 허가 업무를 맡고 있다. 특히 2017년부터는 산업용 LMO 위해성심사 신청 전에 사전 상담신청을 민원인으로 받아 위해성심사에 필요한 서류 및 행정절차를 안내하고 있다.
(5) 지역바이오 활성화 기반 구축
산업통상자원부는 생명공학산업의 저변 확대 및 경쟁력 강화 등을 목적으로 1998년∼2010년까지 지역특성을 바탕으로 지역바이오산업 지원 클러스터(특화센터)를 구축하였으며, 지역 센터별 차별화, 특성화를 통한 지역경제 활성화를 선도해 오고 있다. 현재 전국에 위치한 총 22개의 바이오특화센터가 기 구축된 인프라 시설을 활용하여 기업의 성장을 위한 기술사업화・인력양성・네트워킹・마케팅 지원에 집중하고 있다.
최근 바이오산업이 국가 핵심 산업으로 급속히 성장하면서 지역에 특화된 바이오산업 경쟁력 강화를 위한 지역 신규 사업에 대한 수요가 급격히 증가하고 있으며, 이러한 지역의 바이오산업의 지속성장과 진흥을 위해 산업통상자원부와 지역의 바이오특화센터가 유기적이고도 선도적으로 행정적・재정적 지원을 통해 지역바이오 산업 활성화에 기여하고 있다.
지역바이오 기업의 규모를 고려해 볼 때 국내외 바이오산업 시장의 수요에 대응한 자생적인 활성화의 어려움이 내재하고 있으므로, 지역의 기술혁신역량 강화와 사업화 촉진을 지원 해 온 지역 바이오 기반구축사업을 지속적으로 지원해 나갈 예정이다.
라. 향후 계획
4차 산업혁명 시대를 맞아 생명공학산업도 빠르게 변화하고 있다. 개인의 의료정보, 유전체정보, 라이프로그(생체정보) 등 바이오 빅데이터와 인공지능이 결합해 경험 기반의 범용 제품과 서비스에서 데이터 기반의 개인 맞춤형 제품과 서비스로 진화하고 있다. 이러한 급격한 산업 환경 변화에 대응하여 국내 생명공학산업이 글로벌 경쟁력을 확보할 수 있도록 산업통상자원부는 선제적인 지원을 해 나갈 예정이다.
병원 등이 보유한 바이오 빅데이터를 기반으로 새로운 비즈니스가 조기에 창출될 수 있도록 데이터 활용 체계를 구축해 나가고, 빅데이터를 활용한 다양한 유망 서비스를 발굴해 시범사업 등을 지원해 나갈 예정이다. 또한 빅데이터 및 유전체 정보를 활용한 맞춤 신약개발을 적극 지원하고, 신약개발 역량 강화를 위한 전문 서비스기업도 육성할 계획이다.
[표 2-2] 지역별 바이오 인프라 시설
|
권역별 |
연번 |
센터명(소재지) |
중점분야 |
특화분야 |
|
충청권 |
1 |
대전TP 바이오센터(대전) |
바이오의약 |
생물의약, 바이오소재, 분자진단 |
|
2 |
충북TP 바이오센터(충북오창) |
의약, 화장품 |
의약소재, 기능성화장품 |
|
|
3 |
충북TP 한방천연물센터(충북제천) |
한방, 식품 |
한방제품, 한약제제 |
|
|
4 |
충남TP 바이오센터(충남논산) |
동물식의약 |
동물약품, 사료 첨가제 |
|
|
호남권 |
5 |
천연자원연구센터(전남장흥) * 전남생물산업진흥원 |
전통, 소재 |
천연물소재, 기능성 규명 |
|
6 |
식품산업연구센터(전남나주) * 전남생물산업진흥원 |
전통, 식품 |
건강기능성식품 |
|
|
7 |
생물의약연구센터(전남화순) * 전남생물산업진흥원 |
의약 |
백신, 세포・유전자 |
|
|
8 |
나노바이오연구센터(전남장성) * 전남생물산업진흥원 |
융합, 소재 |
천연물 소재, 나노 소재 생물영감기술, 생물모방기술 |
|
|
9 |
전라북도생물산업진흥원(전북전주) |
전통, 식품 |
건강기능성식품 |
|
|
10 |
발효미생물산업진흥원(전북순창) |
전통, 식품 |
발효, 미생물 |
|
|
동남권 |
11 |
진주바이오산업진흥원(경남진주) |
식품, 화장품 |
바이오식품, 생물화학, 항노화바이오 |
|
12 |
부산TP 해양생물산업센터(부산) |
해양, 식품 |
해양생태독성, 해양기능성식품 |
|
|
13 |
김해산업진흥의생명융합재단 (경남김해) |
의료기기 |
비전자의료기기, 융합부품소재 |
|
|
대경권 |
14 |
대구TP 바이오헬스융합센터(대구) |
식품, 의료기기 |
전통생물소재, 액상식품, 의료기기 |
|
15 |
대구TP 한방산업지원센터(대구) |
한방, 식품 |
한방임상평가, 한방식품제조 |
|
|
16 |
경북바이오산업연구원(경북안동) |
전통, 식품 |
일반식품, 건강기능식품 |
|
|
17 |
경북해양바이오산업연구원 (경북울진) |
해양, 식품 |
해양・소재뷰티, 식품, 바이오소재 |
|
|
18 |
포항TP 첨단바이오융합센터(경북포항) |
바이오소재 |
화장품 효능검증 |
|
|
강원권 |
19 |
춘천바이오산업진흥원(강원춘천) |
의약소재, 진단 |
체외진단, 생물의약소재, 건강기능식품 |
|
20 |
강릉과학산업진흥원 해양바이오융합사업단(강원강릉) |
해양, 식품 |
기능성식품, 바이오화장품 |
|
|
제주권 |
21 |
제주TP 바이오융합센터(제주) |
산업, 화장품 |
천연소재향장 |
|
경기권 |
22 |
경기도경제과학진흥원 바이오센터(경기수원) |
의약, 의료기기 |
신약개발 지원, 의료기기, 천연물의약품 |
3. 생명공학 기초과학진흥
가. 개요
최근 유전체학/단백체학 및 세포체학/대사체학 연구 등에서 급속한 진전을 보이고 있는 생명공학은 우리의 미래 생활에 큰 변화를 주도하고 있으며, 우리 삶의 질 향상에 크게 기여하고 있다. 의약품 개발, 진단・세포/유전자 치료법 기술 개발, 유전체 대량 분석과 정보를 활용한 난치병 예방・진단・치료법 기술 개발, 세포 치료제 개발 등으로 인해 많은 질병을 치료하고 수명을 연장하는 길이 열리고 있다. 생명공학의 성과는 생물학, 생화학, 생리학, 생물물리학 등 관련 기초생명과학의 다양한 실험에서 기인한 성과로 관련 분야의 기초과학 발전이 있었기에 가능한 것이었다. 최근의 한미약품의 당뇨병 치료제의 성공적인 개발 사례에서 보듯이 기초과학을 통해 개발한 항암제 후보물질, 항비만 신약 후보물질 등이 기업으로 기술이전 되어 상용화가 추진되고 있다. 이를 통해 볼 때, 미래유망 분야에 대한 핵심원천기술개발 확보 및 선진화 기반 확충을 위해 추진되고 있는 바이오・의료기술개발사업 및 첨단의료기반기술개발 등과 같은 연구개발사업도 기초과학의 선행이 전제되어야 한다고 할 수 있다.
나. 정부의 기초연구진흥 추진 과정
OECD에서 발간된 프라스카티 매뉴얼(Frascati Manual, 2015)에 따르면 기초연구는 ‘어떤 특정한 응용이나 사용 계획 없이 현상들이나 관찰 가능한 사실들의 근본 원리에 대한 새로운 지식을 얻기 위해 행해진 실험적 또는 이론적 작업’으로 정의된다. 기초연구는 세부적으로 순수 기초연구와 목적 기초연구로 나뉘는데, 순수 기초연구는 ‘경제사회적 편익을 추구하거나, 연구결과를 실제 문제에 적용하거나, 또는 연구 결과의 응용을 위한 관련 부문으로의 이전 없이 지식의 진보를 위해서만 수행되는 연구’로 정의되며, 목적 기초연구는 ‘이미 알려졌거나 예상되는 현재 또는 미래의 문제와 가능성에 있어, 그 해결책의 기초가 되는 광범위한 지식기반의 마련을 위해 수행되는 연구’로 정의된다.
기초연구는 특정 목표나 목적에 초점을 두는 응용연구나 새로운 제품ㆍ공정의 생산, 기존 제품과 공정의 개선 등을 목적으로 하는 개발연구와 대비된다. 기초연구-응용연구-개발연구 간에는 상호 많은 정보와 지식의 흐름으로 인해 개발연구가 기초연구에 지식을 제공하기도 하며, 기초연구가 새로운 상품이나 공정으로 이어지기도 한다.
2004년 과학기술부(現 과학기술정보통신부)에 ʻ과학기술혁신본부ʼ를 설치하고 부총리급으로 격상하여 과학기술 컨트롤 타워를 강화하였다. 과학기술부의 기초연구 사업은 정부 간 합의를 거쳐 3개 유형으로 나누고 부처 간 역할분담을 하였다. 교육인적자원부(現 교육부)는 순수 기초연구와 기초과학기반구축사업을 주관하였고, 과학기술부는 목적기초연구를 주관하였다. 응용연구 사업의 경우 산업자원부(現 산업통상자원부)와 정보통신부(現 과학기술정보통신부)에서 주관하도록 조정하였다. 이와 더불어 교육인적자원부는 대학연구의 제도 및 기반을 구축하고 대학의 우수 연구 인력양성을 지원하는 역할도 담당하였다.
정부는 기초연구의 진흥을 위한 여건 조성을 위하여 기초연구에 관하여 ①대학교수, 연구원 등 관계 전문가의 연수 및 연구비 지원, ②석사 및 박사 과정 학생의 연구・장학금 지원, ③연구교수(연구조교 포함)제도, 교수의 연구휴가제도, 객원교수제도 및 객원연구원제도의 활용, ④대학의 연구시설 및 기자재 지원, ⑤대학부설연구소 및 우수연구집단 형성 지원, ⑥대학, 국공립 연구기관, 정부출연연구기관, 기업부설 연구소와의 공동연구, 인력교류, 연구 시설・장비 공동 활용 등 산업계・학계 및 연구소 간의 교류 촉진, ⑦기업 등의 대학 기초연구 지원 촉진, ⑧그 밖에 기초연구환경 조성 및 기초연구기반 구축에 필요한 사항 등을 의무적으로 마련하도록 기초연구진흥 및 기술개발지원에 관한 법률 제7조에 명시하고 있다. 또한 동 법에 따라, 기초연구진흥종합계획 및 시행계획을 수립하여 국가의 기초연구진흥을 위한 정책적 노력을 계속해 나가고 있다.
2008년 2월 교육인적자원부와 과학기술부의 통합으로 교육과학기술부가 출범하였다. 두 기관의 통합은 2009년 관련 연구지원 통합기관인 한국연구재단의 출범과 더불어 기초연구에 관한 다양한 정책이 일관성 있게 추진될 수 있는 기회를 제공하였다. 2013년 미래창조과학부(現과학기술정보통신부)의 출범으로 창조적 기초연구 추진전략이 마련되었으며, 상상력・창의력을 기반으로 한 과학기술과 ICT의 융합을 바탕으로 그 어느 때 보다도 기초연구에 대한 기대가 높아지고 있다고 할 수 있다.
2017년 문재인정부 출범으로 연구자 주도 기초연구지원 예산 2배 확대, 연구 자율성 보장 등을 국정과제로 추진할 예정이며, 이를 통해 기초연구 과제 수혜율이 확대되고 창의적 아이디어 기반의 창의적ㆍ도전적 연구에 매진할 수 있는 연구자 친화적 연구환경이 조성될 것으로 기대된다.
다. 과학기술정보통신부의 기초연구지원 현황
과학기술정보통신부와 한국연구재단은 우리나라 연구력의 근본이라 할 수 있는 기초연구를 중점 지원하고 있다. 기초연구 지원은 개인 및 소규모 공동연구를 지원하는 ‘개인연구’, 우수 연구 인력을 조직화하여 지원하는 ‘집단연구’, 전문연구정보 및 연구 인프라를 지원하는 ‘기반구축’으로 구분하여 연구자 역량단계 및 참여연구원 규모에 따른 세부 프로그램을 통해 추진되고 있다.
생명공학분야 기초연구는 한국연구재단 기초연구본부의 생명과학단, 의약학단, ICT・융합연구단에서 지원하고 있으며, 대단위 국책연구사업의 경우 한국연구재단 국책연구본부 생명공학팀에서 지원하고 있다. 이 중에서도 생명공학 분야는 기초연구본부 생명과학단과 관련성이 높으며, 1) 분자생물학, 신경생물학, 발생생물학, 유전자발현, 면역학 등의 분자생명분야, 2) 세포생물학, 유전학, 생화학, 생리학, 식물학, 미생물학 등의 기초생명분야, 3) 생물공학, 식량작물 및 원예작물, 동물자원학, 수의학, 식품학 등의 기반생명 분야를 지원하고 있다. 이를 통해 생명과학의 메커니즘 연구를 집중 수행하는 생명 과학자를 양성하고, 노벨상 수상 수준으로 연구역량을 제고하며, 관련 연구기반을 확충하여 미래 첨단 기초생명과학 연구를 선점하고자 한다.
(1) 기초연구지원 사업 현황
과학기술정보통신부는 신진연구→중견연구→리더연구 등 역량단계별로 개인연구를 지원하고 있다. 2016년 연구자 맞춤형 지원제도를 도입하여 연구자가 필요한 연구비, 연구기간을 신청할 수 있도록 유연하게 개선하였다. 기초연구실/글로벌연구실→선도연구센터 등 규모별로 집단연구를 지원하고 있으며, 기초연구기반구축 사업을 통해 생물학연구정보센터(BRIC) 등 연구 인프라를 지원하고 있다.
[표 2-3] 과학기술정보통신부 기초연구지원 사업내용(2016~2017)
(단위 : 백만 원)
|
사 업 |
2016년 예산(A) |
2017년 예산(B) |
증감액 (B-A) |
증감률 |
|
|
합 계 |
772,709 |
886,576 |
113,867 |
14.7% |
|
|
【개인연구】 |
607,495 |
709,610 |
102,115 |
16.8% |
|
|
자유 공모 |
ㅇ 리더연구 |
57,936 |
52,299 |
Δ5,637 |
Δ9.7% |
|
ㅇ 중견연구 |
369,556 |
459,966 |
90,410 |
24.5% |
|
|
ㅇ 신진연구 |
118,073 |
148,166 |
30,093 |
25.5% |
|
|
전략공모 |
61,930 |
49,179 |
Δ12,751 |
Δ20.6% |
|
|
【집단연구】 |
155,174 |
168,282 |
13,108 |
8.4% |
|
|
ㅇ 선도연구센터 |
108,749 |
115,405 |
6,656 |
6.1% |
|
|
- 이학분야(SRC) |
27,414 |
31,215 |
3,801 |
13.9% |
|
|
- 공학분야(ERC) |
36,195 |
43,823 |
7,628 |
21.1% |
|
|
- 기초의과학분야(MRC) |
32,940 |
30,967 |
Δ1,973 |
Δ6.0% |
|
|
- 융합분야(CRC) |
12,200 |
9,400 |
Δ2,800 |
Δ23.0% |
|
|
ㅇ 기초연구실 |
23,675 |
32,501 |
8,826 |
37.3% |
|
|
ㅇ 글로벌연구실 |
22,750 |
20,376 |
Δ2,374 |
Δ10.4% |
|
|
【기초연구기반구축】 |
10,040 |
8,684 |
Δ1,356 |
Δ13.5% |
|
|
ㅇ 전문연구정보활용 |
2,800 |
1,917 |
Δ883 |
Δ31.5% |
|
|
ㅇ 기초연구실험데이터 글로벌허브구축 |
2,565 |
2,138 |
Δ427 |
Δ16.6% |
|
|
ㅇ 유럽핵입자물리연구소 (CERN) 협력 |
3,882 |
3,236 |
Δ646 |
Δ16.6% |
|
|
ㅇ 해외대형연구시설 활용연구지원 |
793 |
1,393 |
600 |
75.7% |
|
출처: 교육부 및 미래창조과학부, 2017년도 기초연구사업 시행계획 미래창조과학부, 2017년도 기초연구기반구축사업 시행계획
(2) 생명공학분야 사업 지원 현황
2015년 정부에서 이공분야에 지원하는 총 R&D 투자액 중 생명공학 분야 범주에 속하는 생명과학, 농림수산, 보건의료 부문에 지원되는 총투자 금액은 3조 5,247억 원으로 정부R&D 투자액의 20.1%를 차지하고 있다.
[표 2-4] 과학기술표준분류별 투자 추이(2015)
(단위: 억 원, %)
|
구분 |
금액 |
비중 |
|
수학 |
835 |
0.5 |
|
물리학 |
5,955 |
3.4 |
|
화학 |
3,343 |
1.9 |
|
지구과학 |
6,710 |
3.8 |
|
생명과학 |
7,895 |
4.5 |
|
농림수산식품 |
12,091 |
6.9 |
|
보건의료 |
15,261 |
8.7 |
|
기계 |
28,817 |
16.4 |
|
재료 |
6,865 |
3.9 |
|
화공 |
3,974 |
2.3 |
|
전기 / 전자 |
17,055 |
9.7 |
|
정보 / 통신 |
18,118 |
10.3 |
|
에너지 / 자원 |
8,564 |
4.9 |
|
원자력 |
6,853 |
3.9 |
|
환경 |
4,844 |
2.8 |
|
건설 / 교통 |
7,781 |
4.4 |
|
과학기술과 인문사회 |
4,799 |
2.7 |
|
기타 |
15,439 |
8.8 |
|
합계 |
175,199 |
100.0 |
2017년 신진연구를 통해 신청 및 선정된 생명과학 분야별 과제 현황은 다음 표와 같다. 신진연구는 이공학 분야 교원 및 연구원 중 박사학위 취득 7년 이내 또는 만 39세 이하의 신진연구자를 대상으로 최장 5년간 연평균 0.5∼1억 원을 지원하는 사업이다. 초기 연구실 구축 등이 필요한 신진연구자 특성을 감안하여 별도 심사를 통해 1년간 0.5∼1억 원을 연구환경 구축비로 추가 지원한다.
[표 2-5] 신진연구 중 생명과학분야 중분야별 선정 현황(2017)
(단위 : 건)
|
구분 |
신진연구 |
||
|
신청 과제 수 |
선정 과제 수 |
||
|
분자생명 |
분자생물학 |
13 |
3 |
|
신경생물학 |
24 |
5 |
|
|
발생생물학 |
15 |
3 |
|
|
구조생물 및 생물물리학 |
11 |
2 |
|
|
유전자발현 |
16 |
3 |
|
|
감염생물학 |
7 |
2 |
|
|
노화/암생물학 |
23 |
4 |
|
|
면역학 |
16 |
3 |
|
|
소계 |
125 |
25 |
|
|
기초생명 |
세포생물학 |
6 |
1 |
|
유전학 |
9 |
2 |
|
|
생화학 |
8 |
2 |
|
|
생리학 |
8 |
3 |
|
|
식물학 |
8 |
2 |
|
|
미생물학 |
13 |
4 |
|
|
분류/생태/환경생물학 |
15 |
3 |
|
|
소계 |
67 |
17 |
|
|
기반생명 |
생물공학 |
20 |
4 |
|
식량작물 및 원예작물 |
14 |
3 |
|
|
응용생물화학 |
19 |
4 |
|
|
농림생태환경 |
12 |
3 |
|
|
동물자원학 |
10 |
3 |
|
|
수의학 |
18 |
3 |
|
|
수산학 |
11 |
3 |
|
|
식품학 |
29 |
7 |
|
|
영양학 |
13 |
3 |
|
|
소계 |
146 |
33 |
|
|
총합계 |
338 |
75 |
|
중견연구는 이공학 분야 교원(전임ㆍ비전임) 및 공공ㆍ민간연구소 연구원을 대상으로 최장 5년간 0.5∼3억 원을 지원하는 사업으로 2017년 신청 및 선정된 생명과학 분야별 과제 현황은 다음 표와 같다.
[표 2-6] 중견연구 중 생명과학분야 중분야별 선정 현황(2017)
(단위 : 건)
|
구분 |
중견연구 |
||
|
신청 과제 수 |
선정 과제 수 |
||
|
분자생명 |
분자생물학 |
31 |
14 |
|
신경생물학 |
28 |
16 |
|
|
발생생물학 |
26 |
13 |
|
|
구조생물 및 생물물리학 |
22 |
13 |
|
|
분자생명 |
유전자발현 |
23 |
12 |
|
감염생물학 |
11 |
5 |
|
|
노화/암생물학 |
47 |
22 |
|
|
면역학 |
17 |
8 |
|
|
소계 |
205 |
103 |
|
|
기초생명 |
세포생물학 |
11 |
7 |
|
유전학 |
31 |
18 |
|
|
생화학 |
13 |
7 |
|
|
생리학 |
12 |
7 |
|
|
식물학 |
28 |
18 |
|
|
미생물학 |
23 |
14 |
|
|
분류/생태/환경생물학 |
25 |
12 |
|
|
소계 |
143 |
83 |
|
|
기반생명 |
생물공학 |
28 |
17 |
|
식량작물 및 원예작물 |
26 |
15 |
|
|
응용생물화학 |
27 |
15 |
|
|
농림생태환경 |
17 |
11 |
|
|
동물자원학 |
22 |
12 |
|
|
수의학 |
24 |
16 |
|
|
수산학 |
17 |
11 |
|
|
식품학 |
51 |
27 |
|
|
영양학 |
15 |
10 |
|
|
소계 |
227 |
134 |
|
|
총합계 |
575 |
320 |
|
4. 생명공학 인력양성
가. 개요
정부는 ‘기초연구진흥 및 기술개발지원에 관한 법률’에 따라, 5년 주기로 기초연구 진흥에 관한 중장기 정책목표와 방향 설정을 위한 ‘기초연구진흥종합계획’을 수립하여 시행하고 있으며, 2017년까지 정부 R&D 중 기초연구 투자 비중을 40%까지 확대를 목표로 매년 투자를 확대하고 있다.
[표 2-7] 정부 R&D 중 기초연구 투자 비중
(단위 : 조 원, %)
|
구 분 |
2012 |
2013 |
2014 |
2015 |
2016 |
|
정부 R&D예산 |
16.0 |
16.9 |
17.7 |
18.9 |
19.1 |
|
기초연구비 산정대상 예산*(A) |
11.0 |
11.5 |
12.6 |
13.1 |
13.3 |
|
기초연구비(B) (비중 : B/A×100) |
3.9 (35.2%) |
4.1 (35.4%) |
4.7 (37.1%) |
5.0 (38.1%) |
5.2 (39.0%) |
* 정부 R&D 중 시설장비구축사업 등 연구단계(기초, 응용, 개발) 구분이 곤란한 사업 제외 ※ 출처 : ’16년도 정부 기초연구비 비중(’16.2, 기초연구진흥협의회)
정부의 기초연구 확대 기조 속에 교육부는 생명공학 분야의 경쟁력 확보를 위해서는 장기적 관점에서 연구의 지속가능성이 중요하다고 판단하고, 기초연구 분야에 대한 저변 확대와 우수 연구인력의 양성에 보다 정책 역량을 집중하고자 하였다.
특히 이러한 장기적 관점의 연구역량 제고에서는 무엇보다 생명공학 분야의 선진국과 같이 대학이 연구와 인력 양성에 핵심적인 역할을 담당할 필요가 있기 때문에 대학의 연구역량을 강화하기 위해 노력하고 있다.
나. 추진경과
교육부는 대학의 연구역량 강화를 위해 1982년부터 박사후연구자의 연구경험을 축적하고자 학문후속세대를 지원하고 있으며, 국가 연구역량 제고를 위한 연구저변 확대를 위해 1989년부터 풀뿌리 기초연구를 지원해오고 있다.
1999년부터는 미래 인재 양성을 위한 대학원의 교육・연구역량 강화 기반 조성을 위한 BK21사업을 시작하여 현재 BK21플러스 사업까지 지속하고 있으며, 대학연구소의 특성화・전문화 유도 및 전임 연구인력 확충을 위해 대학중점연구소를 지원해오고 있다.
아울러 2008년부터는 의과학자 육성지원 사업을 시작하여 미래 성장 동력인 바이오산업 분야 경쟁력 확보를 위한 중개연구를 활성화하고, 이를 수행할 의과학자를 적극 양성해 오고 있다.
다. 주요정책
교육부는 인력양성 총괄 부처로서 다양한 초・중등에서 대학에 걸쳐 전주기적 인재 양성을 지원하고 있다. 특히 최근에는 생명공학 등 과학기술 분야에 대한 중요성이 높아짐에 따라 초・중등교육에서 융합인재교육(STEAM; Science, technology, engineering, arts and mathematics)을 통해 실생활 문제를 창의적으로 해결하는 방법으로 과학에 대한 흥미도를 제고하고 있으며, 이는 과학기술 선도 인재 양성의 초석이 되고 있으며, 이와 함께 고등교육 단계에서도 고급인력을 양성하기 위한 노력을 기울이고 있다.
교육부는 다양한 생명공학 분야에 대한 개인 및 대학 연구소 단위의 균형 잡힌 기초연구를 지원하여 연구 저변을 지속적으로 넓혀 나감과 동시에 석・박사 연구 인력에 대한 연수기회 부여, 연구경험 제공 및 장학금 지원을 통해 미래 한국을 책임질 학문후속세대를 육성해 나가고 있다.
라. 주요사업
(1) 기초연구지원사업
교육부는 2016년 이공학개인기초연구 지원사업에 2,680.5억 원, 학문후속세대 및 대학중점연구소 지원사업에 734.19억 원으로 총 3,414.69억 원을 투자하여 이공학분야의 기초연구가 보다 활성화 될 수 있도록 노력하였다.
[표 2-8] 교육부 기초연구지원사업
(단위 : 백만 원, %)
|
사업명 |
2015년 예산 (A) |
2016년 예산 (B) |
증감 |
||
|
차액 (B-A) |
증감률 (%) |
||||
|
이공학개인기초연구 |
294,250 |
268,050 |
Δ26,200 |
Δ8.9 |
|
|
|
기본연구 |
237,050 |
237,050 |
0 |
0.0 |
|
리서치펠로우* |
31,200 |
- |
Δ31,200 |
Δ100.0 |
|
|
보호연구 |
1,250 |
1,250 |
0 |
0.0 |
|
|
지역대학우수과학자 |
24,750 |
29,750 |
5,000 |
20.2 |
|
|
이공학학술연구기반구축 |
42,250 |
73,419 |
31,169 |
73.8 |
|
|
|
대학중점연구소 |
25,400 |
25,238 |
Δ162 |
Δ0.6 |
|
학문후속세대 |
16,850 |
48,181 |
31,331 |
185.9 |
|
|
합계 |
336,500 |
341,469 |
4,969 |
1.5 |
|
* 2016년부터 리서치펠로우는 학문후속세대 내역으로 편입되어 학문후속세대 예산에 포함
(가) 이공학개인기초연구지원
교육부는 이공학개인기초연구지원을 통해 이공학분야 개인연구자에게 5천만 원 내외의 연구비를 폭넓게 지원하여 생명공학 분야 연구자가 창의적이고 혁신적인 연구에 전념할 수 있는 환경을 제공하고 있다. 세부사업인 기본연구 지원을 통해 풀뿌리 개인기초연구를 폭넓게 지원하고 있으며, 보호연구 지원을 통해 국가차원의 보호육성이 필요한 분야를, 지역대학우수과학자 지원을 통해 지역의 연구역량제고 및 우수인력 양성을 지원하고 있다.
[표 2-9] 이공학개인기초연구사업 생명공학분야 지원 현황
(단위 : 개, 백만 원)
|
분야 |
2015년 |
2016년 |
||
|
지원과제 수 |
사업비 |
지원과제 수 |
사업비 |
|
|
분자세포생물학 |
248 |
12,311 |
203 |
10,287 |
|
유전학・유전공학 |
86 |
4,174 |
69 |
3,522 |
|
발생・신경생물학 |
119 |
5,927 |
89 |
4,565 |
|
면역학・생리학 |
70 |
3,456 |
66 |
3,348 |
|
분류・생태・환경생물학 |
57 |
2,835 |
54 |
2,716 |
|
생화학・구조생물학 |
69 |
3,413 |
43 |
2,186 |
|
융합바이오 |
58 |
2,977 |
59 |
3,055 |
|
생물공학 |
33 |
1,644 |
24 |
1,190 |
|
산업바이오 |
36 |
1,736 |
32 |
1,586 |
|
바이오공정・기기 |
3 |
136 |
3 |
151 |
|
생물유해성 |
5 |
234 |
4 |
200 |
|
기타생명과학 |
18 |
870 |
22 |
1,072 |
|
계 |
802 |
39,713 |
668 |
33,878 |
※ 2017년 8월말 기준
(나) 이공학학술연구기반구축
교육부는 이공학학술연구기반구축사업을 통해 생명공학분야를 포함한 이공학분야의 연구 기반 확충을 지원하고 있다. 세부사업인 대학중점연구소지원사업을 통해서는 대학부설연구소의 인프라 지원을 통해 대학의 연구거점을 구축하고, 대학연구소의 특성화・전문화를 유도하며 중점연구소를 통해 우수 신진연구인력이 육성될 수 있도록 지원하고 있다. 학문후속세대 지원을 통해 이공학분야 박사 후 연구자에게 국내외 대학 및 연구소에서의 연수 기회를 제공하여 학술연구의 지속성 유지 및 연구 능력의 질적 향상을 유도하고 있다.
[표 2-10] 이공학학술연구기반구축사업 생명공학분야 지원 현황
(단위 : 개, 백만 원)
|
분야 |
2015년 |
2016년 |
||
|
지원과제 수 |
사업비 |
지원과제 수 |
사업비 |
|
|
분자세포생물학 |
18 |
1,706 |
77 |
4,531 |
|
유전학・유전공학 |
3 |
760 |
17 |
870 |
|
발생・신경생물학 |
9 |
1,115 |
34 |
2,264 |
|
면역학・생리학 |
8 |
1,015 |
24 |
1,770 |
|
분류・생태・환경생물학 |
6 |
454 |
15 |
1,202 |
|
생화학・구조생물학 |
5 |
983 |
28 |
2,017 |
|
융합바이오 |
7 |
607 |
19 |
1,631 |
|
생물공학 |
2 |
583 |
10 |
969 |
|
산업바이오 |
- |
- |
7 |
847 |
|
바이오공정・기기 |
1 |
150 |
1 |
100 |
|
기타생명과학 |
1 |
33 |
7 |
722 |
|
계 |
60 |
7,406 |
239 |
16,923 |
※ 2017년 8월말 기준
3) 주요성과
2016년도 교육부 학술연구지원사업 성과분석보고서에 따르면, 2015년 생명공학 분야에서 발표한 SCI 논문은 1,021건, 상위 10% 논문은 122건이고, 특허 출원은 177건, 등록은 49건이었다.
[표 2-11] 생명공학 분야 SCI 논문 발표 현황
(단위 : 개, 백만 원)
|
분야 |
2014년 |
2015년 |
||
|
전체 |
상위10% |
전체 |
상위10% |
|
|
이공학개인기초연구 |
828 |
85 |
871 |
101 |
|
이공학학술기반구축사업 |
168 |
20 |
150 |
21 |
※ 출처: 각 연도별 주요 연구개발사업 성과분석보고서
[표 2-12] 생명공학 분야 특허 출원・등록 현황
(단위 : 개, 백만 원)
|
분야 |
2014년 |
2015년 |
||
|
출원 |
등록 |
출원 |
등록 |
|
|
이공학개인기초연구 |
117 |
70 |
148 |
40 |
|
이공학학술기반구축사업 |
34 |
14 |
29 |
9 |
※ 출처: 각 연도별 주요 연구개발사업 성과분석보고서
(2) 고급인력 양성사업
2013년 9월부터 추진하고 있는 BK21 플러스 사업에서는 농생명 및 생명공학 분야 사업단(팀)에 약 581억 원을 투자하여, 약 7,000여 명의 대학원생에게 연구장학금, 국제화경비 등을 지원하였다. 또한 2015년 중간평가 추진시 의약학, 농・생명 등 분야 평가지표를 별도로 적용하여 각 분야의 특성을 반영한 질적 성과를 제고하였다. 이를 통해 생명공학분야 연구성과의 사회적 기여를 증진하고, 산학협력을 활성화할 수 있을 것으로 기대하고 있다.
[표 2-13] BK21 및 BK21플러스 사업 지원 현황
(단위 : 개, 백만 원)
|
분야 |
BK21 |
BK21 플러스 |
||
|
지원 과제수 |
사업비 |
지원 과제수 |
사업비 |
|
|
농생명 분야 |
30 |
3,232 |
40 |
16,415 |
|
생물학 분야 |
15 |
12,317 |
23 |
13,238 |
|
약학 등 분야 |
22 |
2,862 |
15 |
9,298 |
|
응용생명 분야 |
17 |
14,972 |
17 |
3,847 |
|
의학/치의/한의학 분야 |
18 |
2,645 |
23 |
15,315 |
|
계 |
102 |
36,028 |
118 |
58,113 |
※ BK21사업은 2012년, BK21플러스는 2017년 지원액 기준임
[표 2-14] BK21 플러스 중간평가 지표(의약학, 농・생명・수산・해양 분야) 특징
|
분야 |
평가지표 특징 |
|
의약학 |
기초 의약학 연구 활성화를 위한 연구지표 강화, 사회적 기여 지표 신설 |
|
농・생명・수산・해양 |
연구진(참여교수 등) 구성의 우수성 강조, 산학협력 지표 강화 |
의약학 및 생명과학 분야에 특화한 의과학자 육성지원 사업도 추진 중이다. 의과학자 과정(의사면허증(M.D/DDS)과 박사학위(Ph.D)를 동시에 또는 연계하여 취득하는 과정)을 이수하는 153명의 우수 전문대학원생에 등록금 전액과 연간 5백만 원의 교육연구비를 최대 7년간 장기 지원하여 전문 임상경험과 기초의학 연구력을 겸비한 신진 의과학자로 양성하고 있다.
마. 향후 계획
교육부는 기초연구 진흥과 인력양성을 담당하는 부처로서 생명공학 분야의 연구와 인력양성을 위한 지원을 확충하는 것이 무엇보다 필요하다. 기초연구와 인력양성 간 긴밀한 연계를 통해 시너지를 창출하기 위한 노력을 강구해야 하며, 특히 이러한 시너지가 가장 효과적으로 나타날 수 있는 현장이 대학이므로 대학에 대한 지원을 확대할 필요가 있다.
아울러 교육부는 생명공학 분야 중에서 장래에 성장가능성이 있으나 현재 투자가 미흡한 분야나 다른 분야의 성장을 위해서는 반드시 필요한 기반 분야 등 민간에서 투자가 소홀할 수 있는 부분을 적극적으로 발굴하고 정책적인 배려를 해 나갈 예정이다.
5. 농림축산식품분야 생명공학 육성
가. 개요
농림축산식품 분야의 생명공학 육성 정책은 국민들에게 안전한 먹거리를 안정적으로 공급하고, 농생명 소재를 고부가가치화 하는 방향으로 산업을 육성한다는 측면에서 의의를 지닌다. 식량안보 외 국토・환경 보존과 수자원 함양, 전통문화의 계승과 휴양 등 농업의 다원적 기능과 농촌인구 고령화, 기후변화, 시장개방 등 환경변화를 고려할 때 지속가능한 농업・농촌을 위한 생명공학의 역할은 더 없이 중요하다.
농림축산식품부는 생명자원의 안정적 공급과 국민 건강・웰빙 실현, 고부가가치 신소재 발굴과 첨단 융복합 신산업 창출 및 관련 법・제도 정비 등 농생명 산업육성 프로세스를 전반적으로 혁신해 나갈 계획이다.
나. 추진경과
농림축산식품 분야의 과학기술 육성정책은 농촌진흥청의 1991년 ‘제1차 농업과학기술 중장기 연구개발 계획’을 시작으로 2009년 ‘농림식품 과학기술육성법’ 제정에 따라 부・청 공동계획인 ‘농림식품과학기술 육성 종합계획’수립과 함께 현 체계가 마련되었다. ‘농림식품과학기술 육성 종합계획’은 과기정통부의 ‘생명공학육성기본계획’을 기초로, 현재 제2차 종합계획(2015∼2019)에 따라 매년 시행계획을 수립하고 R&D 육성정책을 추진하고 있다. 농촌진흥청의 ‘농업과학기술 중장기 연구개발 계획’과 ‘농업생명공학육성 중장기 기본계획’은 각각 제6차 및 제3차 계획이 수립되어 시행되고 있다.

[그림 2-4] 농림축산식품분야 생명공학육성정책 체계
다. 주요정책
첫째, 지속가능하고 환경 친화적인 식량자원 및 농림축산 생명자원의 안정적 생산을 통해 국가 식량안보 기반을 구축한다. 수요・공급 맞춤형 최적 생산시스템을 구축하고, 사업화 가능한 생명자원의 수집・발굴 강화, 글로벌 기술 주도권 및 시장 경쟁력 확보를 위한 R&D를 지원한다.
둘째, 고부가가치 농생명 신소재 발굴 및 관련 식품산업 육성을 통해 첨단 융복합 신산업을 창출한다. 농생명자원에서 유래한 고부가가치 신소재의 발굴과 고기능성・고부가가치 식품산업 및 첨단기술과의 융복합을 통한 신산업을 육성한다.
셋째, 고령화・도시화에 대응한 건강하고 안전한 먹거리 공급으로 국민 건강・웰빙을 실현한다. 고령화에 대응한 개인 맞춤형 기능식품 개발과 생산에서 소비까지의 전 과정의 관리기술 고도화 및 웰빙농업・서비스를 확대한다.
넷째, 농생명산업 육성을 위한 법・제도와 인프라를 강화한다. 세계적 수준의 인허가 기준을 확립하여 식품안전에 대한 신뢰도를 확보하고, 농림식품과학분야 관련 정보・기술의 활용기반 고도화, 민간투자 유치 및 인력양성 프로그램 등을 확대한다.
라. 주요사업
농림축산식품부는 연구개발 정책목표 달성을 위해 골든씨드프로젝트, ICT 융합 한국형 스마트팜핵심기술개발, 농생명산업기술개발 등 2016년 기준 29개 사업에 총 339,239백만 원을 투자하였다. 이는 농림축산식품 R&D 전체 예산(953,145백만 원) 중 산하기관 인건비・기본경비 등을 제외한 예산(773,365백만 원)의 약 43.9%에 달하는 규모로, 농림축산식품분야 생명공학 육성을 위해 부・청은 적극적인 투자를 추진 중에 있다. 주요 연구개발 성과로는 약 300건에 달하는 품종개발과 201건의 특허출원, 종자수출 3,057만 달러를 달성(골든씨드프로젝트 1단계), 22종의 기자재와 4종의 스마트팜 모델 표준 및 수입의존도가 높은 기자재의 국산화 기술개발(한국형 스마트팜 사업) 등 과학기술・경제사회 전반에 걸쳐 우수한 성과가 창출되고 있다.
농림축산식품부의 주요 생명공학 육성사업은 다음과 같으며, 각 사업의 사업기간과 농식품부・농진청간의 연계협력 시너지 등을 고려하여 지속적인 사업구조 조정 및 협업을 추진하고 있다.
(1) 농생명산업기술개발
기존 농림기술개발사업에서 농생명자원의 부가가치 제고와 산업육성을 집중적으로 지원하기 위해 2011년 농생명산업기술개발로 분리하여 추진 중에 있다. 농생명자원의 부가가치를 제고하기 위한 핵심기술 개발과 농생명자원의 생산・관리 고도화에 필요한 기술개발을 중점적으로 지원하고 있다.
앞으로는 기술수요 대비 투자가 미흡했던 농생명 소재산업 부문과 동식물 질병대응기술 등에 대한 지원을 확대할 계획이다.
|
기관명 |
사업명 |
사업기간 |
2016년 실적 |
2017년 예산 |
|
농림축산 식품부 |
농생명산업기술개발 |
’94∼’20 |
45,799 |
37,239 |
|
고부가가치식품기술개발 |
’10∼’19 |
35,051 |
34,400 |
|
|
기술사업화지원 |
’08∼’18 |
9,795 |
10,284 |
|
|
첨단생산기술개발 |
’11∼’21 |
27,342 |
29,909 |
|
|
수출전략기술개발 |
’11∼’19 |
18,394 |
17,501 |
|
|
농림축산식품연구센터지원 |
’10∼’20 |
7,900 |
7,347 |
|
|
가축질병대응기술개발 |
’12∼’21 |
7,598 |
7,724 |
|
|
포스트게놈 다부처 유전체사업 |
’14∼’21 |
4,732 |
4,732 |
|
|
골든씨드 프로젝트 |
’12∼’21 |
30,927 |
29,264 |
|
|
소계 |
|
187,538 |
178,400 |
|
|
농진청 |
작물 및 미생물 유전체 연구 |
’90∼계속 |
1,163 |
1,203 |
|
기능성물질 생산 유전자 소재 발굴 및 개량 |
’90∼계속 |
1,995 |
887 |
|
|
BT 이용 농업형질 개선 기반기술 및 활용 |
’90∼계속 |
2,285 |
1,142 |
|
|
GM작물 안전성 평가기술 및 평가시스템 확립 |
’90∼계속 |
2,190 |
842 |
|
|
식물유전자원 관리 및 활용성 제고기술 개발 |
’90∼계속 |
8,570 |
5,994 |
|
|
BT 이용 고부가 가축 생산기술 개발 |
’90∼계속 |
2,203 |
2,309 |
|
|
동물유전정보 활용 실용화 기술 개발 |
’90∼계속 |
1,420 |
1,587 |
|
|
농생물게놈활용연구사업 |
’11∼’20 |
7,821 |
7,585 |
|
|
GM작물개발사업 |
’11∼’20 |
8,021 |
7,702 |
|
|
동물분자유전육종사업 |
’11∼’20 |
6,705 |
6,504 |
|
|
식물분자육종사업 |
’11∼’20 |
8,505 |
8,249 |
|
|
농생명바이오식의약소재개발사업 |
’11∼’20 |
8,189 |
7,942 |
|
|
시스템합성 농생명공학사업 |
’11∼’20 |
8,017 |
7,774 |
|
|
동물바이오신약・장기개발사업 |
’11∼’17 |
6,238 |
5,480 |
|
|
농진청 |
포스트게놈다부처유전체사업 |
’14∼’21 |
8,027 |
7,609 |
|
우장춘프로젝트 |
’10∼’19 |
5,000 |
3,010 |
|
|
소계 |
|
86,349 |
75,819 |
|
|
산림청 |
융복합 기반 임산업의 신산업화 기술개발 |
’16∼’20 |
3,000 |
5,629 |
|
산림과학연구 |
’49∼계속 |
42,803 |
42,786 |
|
|
산림생물종연구 |
’08∼계속 |
19,549 |
14,998 |
|
|
산림생명자원 소재발굴 연구 |
’17∼’21 |
- |
3,900 |
|
|
소계 |
|
65,352 |
67,503 |
|
|
|
합계 |
339,239 |
321,532 |
|
출처: 농림축산식품부
(2) 고부가가치식품기술개발
‘식품산업 R&D 중장기계획’ 수립(2009)에 따라 기존 농림기술개발사업에서 식품부문을 분리・확대하여 2010년부터 추진하였다. 농축산업과 식품산업의 동반성장과 우리 식품산업의 국제경쟁력 제고를 위한 핵심응용기술 분야(기능성 전통식품, 식품 품질관리기술, 식품 핵심소재 및 식품기자재 개발 등)을 집중 지원하고 있다.
(3) 기술사업화지원
2008년 농림바이오기술산업화지원사업에서 2011년 현행 기술사업화지원사업으로 변경된 이래 각 연구개발사업을 통해 확보한 기술이 사업화 단계로 진입할 수 있도록 후속 R&D를 지원하고 있다. 사업화 성과를 제고하기 위해 산업현장과 연계된 제품사업화를 집중 지원하고, 민간의 전문 위탁연구(CRO) 및 위탁생산(CMO)기관 육성도 포함하고 있다.
(4) 첨단생산기술개발
시장개방에 대응하여 우리 농산업의 첨단화, 자동화를 촉진시키기 위해 농기계・농자재・농업시스템 등의 기술개발을 지원하기 위해 2011년 시작되었다. 농업용 무인헬기 등 첨단 농기계, 발열필름 등 첨단 농자재 등은 물론, ICT 기술을 접목한 첨단 농업시스템과 관련된 기술개발을 지원하고 있다. 앞으로는 4차 산업혁명 시대의 혁신기술로 주목받는 인공지능, 사물인터넷, 빅데이터, 3D 프린팅, 로보틱스 등을 접목하여 농업 분야의 난제를 해결하기 위한 기술개발 영역을 발굴・지원할 예정이다.
(5) 골든씨드프로젝트
농생명 산업의 근간이 되는 종자(seed)에 대한 주권을 확보하고 나아가 종자산업을 수출전략산업으로 육성하기 위해 예비타당성조사를 거쳐 2012년 부・청 공동사업으로 착수하였다. 금(Gold)값 보다 비싼 종자를 개발한다는 목표 하에 식량・원예・채소・종축・수산종자 등 5개의 사업단 체제로 운영하여 2016년 사업 1단계(2012∼2016)가 종료되고 2017년 사업 2단계(2017∼2021)에 착수하였다.
(6) 작물 및 미생물 유전체 연구
주요작물 및 미생물 등을 대상으로 유전체 해독 및 정보분석과 이를 통한 유용유전자 및 분자마커 발굴 연구를 수행하고 있다. 국제공동연구를 통하여 벼, 배추, 무 유전체 완전해독에 참여하였으며, 현재는 들깨, 배, 국화 등 국내 주요작물에 대한 신규 및 비교유전체 연구를 추진하고 있다. 유전체분석으로 생산된 빅데이터는 생물정보 통합분석 시스템이 구축된 농업생명공학정보센터(NABIC)을 통해 대학, 연구소, 산업체 등에 대국민 서비스를 제공하고 있다.
(7) 기능성 물질 생산 유전자 소재 발굴 및 개량
농생명자원으로부터 대사체 분석통합기술을 구축하고, 유용물질 발굴, 유용 대사산물 생산 증대기술 및 실용화소재 개발로 고부가 신기능성 소재 창출을 위한 연구를 수행하고 있다. 토마토에 대한 대사체 데이터베이스를 구축하였으며, 플라보노이드 및 건강 기능성 지방산 증진기술 및 알레르기 저감 밀 소재 등을 개발하였다.
(8) BT 이용 농업형질 개선 기반기술 및 활용
기후변화 등 미래농업환경변화에 대응하기 위하여 내재해, 내병성, 생장발달유전자 등을 연구하고, 작물 농업형질을 비파괴 대량 검정하기 위한 ICT-BT융복합 표현체 연구를 수행하고 있다. 내한발 유전자 OsPYL/RCAR6, 내병성 유전자 OsWRKY, 수발아저항성 유전자 OsDOR 등을 개발하였으며, 국가표현체연구 인프라를 구축하기 위하여 3년간(2014∼2017) 약 80억 원을 투자하여 1,000화분 자동 생육 및 가시광, 근적외선, 형광 자동 촬영 표현체 온실을 건설 완료하였다.
(9) GM작물 안전성 평가기술 및 평가시스템 확립
GM작물의 식품 및 환경위해성 평가기술, GMO판별 모니터링기술, GMO 격리시설 안전관리 등을 수행하고 있다. 또한, 일반인과 전문가를 대상으로 GMO에 대한 올바른 정보제공을 위한 교육과 GMO 안전성관련 국내외 쟁점대응 및 정책지원 등의 업무를 수행하고 있다. 전 세계 GM작물 26작물 237품목에 대한 유전정보를 조사・분석하여 GM작물에 대한 효율적인 환경모니터링을 위한 기반을 구축하였다. GMO식품안전성평가를 위하여 국내 상업화작물에 대한 성분분석 및 함량 빅데이터 DB를 구축하였다. 2000년부터 40여종의 GMO관련서적을 발간하고, 2008년부터 직접 느끼면서 배우는 현장체험학습을 통해 쉽고 재미있게 GMO를 알 수 있는 교육을 진행하고 있다.
(10) 식물유전자원관리 및 활용성 제고기술 개발
식물유전자원의 활용체계 구축을 위해 국내외 유용자원의 전략적 확보를 통해 24만 6천 자원에 대한 국가등록번호를 부여하였고, 특히 우즈벡, 러시아, 조지아 등과의 국가협력사업을 통해 다양성을 확보하였다. 보존자원의 지속적 활용을 위해 저활력, 소량자원에 대한 증식과 영양체(감귤류, 국화, 마늘 등) 및 단명종자(인삼, 양파 종자 등)에 대한 초저온동결보존을 통해 장기보존 체계를 구축하였다. 또한 유전자원의 유용자원 발굴을 위해 농업적 형질, 성분 및 기능성, 내병성 및 재해저항성 등의 특성평가를 수행하였다. 수요자에게 유용정보 제공을 위해 누리집 및 농업유전자원 정보 시스템의 고도화를 추진하여 년 1만여 자원 이상의 분양을 실시하고 있다. 앞으로 나고야의정서 비준(2017년 8월)에 따른 종자산업 및 농생명바이오산업의 지원을 강화하기 위해 산학연 공동사업을 통해 농업생명자원의 유용형질 특성평가를 확대할 계획이다.
(11) BT 이용 고부가 가축 생산기술 개발
유전공학 및 체세포복제와 같은 첨단 생명공학기술과 기술융합을 통해 고부가가치 신성장동력산업으로 육성하기 위해 1990년부터 추진 중인 사업이다. 사람에게 이식 가능한 장기 및 각종 조직을 공급하기 위한 바이오이종장기용 형질전환돼지 개발, 고가의 치료용 단백질 생산을 위한 신약용 형질전환가축개발, 사람질병 기초연구 및 신약검증을 위한 사람질환 모델가축 개발 등의 성과를 달성하였다. 또한 정부 운영 우수 특수목적견을 복제 생산하여 정부기관에 보급하였다. 향후 초급성 및 급성면역반응 유전자가 제어된 형질전환돼지 개발을 통한 돼지-원숭이 이종장기 이식기술, 이종간 면역거부반응 억제기술, 바이오신약 및 사람질환모델 형질전환가축 생산 기술, 항바이러스 단백질 기능검증, 유용단백질 생산성 향상을 위한 벡터기술 등의 분야를 지원할 계획이다. 이와 함께 병원균 제어 바이오이종장기용 형질전환 돼지 생산시스템 구축해 나갈 것이다.
(12) 동물유전정보 활용 실용화 기술 개발
재래가축의 유전체 해독 및 표준유전체 지도 작성, 가축의 바이오마커 개발 및 실용화, 유용 유전자 발굴 및 생물신소재 개발을 위하여 농업과학기술연구개발사업으로 추진하고 있다. 그동안 한우고기 판별 기술을 개발하여 기술이전 하고, 한우, 재래돼지, 오골계, 제주마 등 재래가축에 대한 표준유전체 지도 작성, 한우 및 돼지의 경제형질 관련 바이오마커의 개발 및 산업재산권 확보, 미래 대비 축산분야 신규 수요 가치 창출을 위하여 반추위 미생물 유래 섬유소 분해효소 유전자 발굴하는 등의 성과를 거두었으며, 최근에는 4차 산업혁명에 대비하기 위한 동물유전체 빅데이터 구축 및 분석기술을 개발하고 있다. 향후 농업분야에서 이러한 가축의 동물유전체 빅데이터가 축산 현장에서 실질적으로 활용 될 수 있도록 실용화 하는 연구를 지속적으로 추진해 나갈 것이다.
(13) 산림과학연구
산림자원의 지속가능한 조성・이용 및 선순환적 가치 확산을 위해 1949년부터 시작된 산림 분야 대표 연구개발 사업이다. 건강하고 안전한 산림생태계의 유지・증진, 산림생명자원의 보존・육성 및 이용 활성화를 위한 기술개발과 산림산업을 육성하기 위한 기반기술, 산림복지 증진을 위한 연구개발을 지원하고 있다.
(14) 산림생물종연구
산림생물자원의 수집, 보전 및 관리체계 확립을 위해 2008년부터 시작된 산림생물종 다양성 증진 및 미래자원 활용기반 사업이다. 산림생물자원 조사・분류 연구 및 정보DB 구축, 희귀・특산식물의 안정적 보전 및 복원기술 개발, 기후변화 취약 산림식물종 모니터링 및 보전기술 개발, 산림식물자원의 증식 및 현지 외 보전시설 확충을 위한 연구개발을 지원하고 있다.
(15) 산림생명자원 소재발굴 연구
산림 내 미활용 되고 있거나, 잠재가치가 큰 산림생명자원 소재를 발굴・고부가가치화하기 위해 2017년부터 새롭게 착수한 사업이다. 자생 산림생명자원(산채류, 목본, 버섯류 등)으로부터 새로운 기능성 소재 탐색, 효능 구명 및 유효성분 함량 증대 기술개발 등을 지원한다.
(16) 융복합 기반 임산업의 신산업화 기술개발
임업과 산림의 안정적인 자원공급 기지화 및 미래 신산업・시장 창출을 위해 2016년부터 새롭게 착수한 사업이다. ICT 등 융복합 첨단기술개발과 임산업 기반의 6차 산업 모델 및 고부가가치화 기술 분야를 2020년까지 중점 지원한다.
마. 향후 계획
향후 농림축산식품부는 BT, ICT 기술과 농・수・축산업 접목을 통한 고부가가치 농생명산업으로 풍요로운 삶 구현을 목표로 전략적인 투자를 추진할 계획이다.
첫째, 수출・수입 대체품종 개발을 위해 차세대 육종 첨단기술(분자 육종 등) R&D 지원을 확대하여 종자 주권 확보를 위한 기반을 구축하고자 한다.
둘째, 바이오와 ICT 첨단기술 접목 및 활용을 통한 스마트팜 구축 등 차세대 농업생명공학(그린백신, 합성농생물, 신육종기술 등) 역량을 강화해 나갈 계획이다. 특히 4차 산업혁명시대가 도래함에 따라 인공지능(AI), 사물인터넷(IoT) 등 첨단기술을 접목한 스마트 농업시스템 구축 등 고기능・고효율 농업 기반 마련 및 생산・질병관리 기술 고도화 분야에 집중 투자해 나갈 계획이다.
셋째, 유용 농림축산자원의 발굴 및 유망 신소재 개발 확대를 통한 국산 농수산생명 소재 산업화를 촉진할 계획이다. 이를 위해 동식물, 미생물, 등 농림축산자원의 고부가가치화 및 유망 신소재개발 등 농생명자원 유래 소재개발 R&D 지원을 강화할 것이다.
넷째, 기후변화 등으로 발생되는 식물병해충 및 동물질병에 대응하기 위한 농축산물 생산・질병관리 기술 고도화 R&D지원을 중점 추진할 계획이다. 투자 분야로는 주요 동식물 질병에 대한 효과적 대응을 위한 예방, 검역, 진단, 방역, 확산 방지 및 사후관리 등 핵심기술의 산업화 연구 등이 될 것이다.
6. 보건의료분야 생명공학 육성
가. 개요
(1) 필요성
보건의료기술(Health Technology, HT)이란 궁극적으로 질병극복 및 국민건강증진을 목표로 BT, IT, NT와 같은 요소기술을 융합하여 인체적용을 목적으로 활용하는 기술을 총칭하는 기술이다. BT는 요소 기술 자체에 중점을 둔 반면, 보건의료기술(HT)은 목적(기술의 활용)에 중점을 두고 있어 HT와 BT는 개념상 큰 차이점을 보인다. HT와 BT는 일부 중첩관계로, BT의 응용 범위 중 인체와 건강 관련된 제반 영역을 HT 관련 분야로 정의내릴 수 있으며 대표적인 분야로는 제약, 의료기기, 의료서비스 등이 해당되고 최근에는 의료 전달체계와 같은 보건의료 시스템 및 서비스와 관련된 분야를 포괄하는 개념으로 발전하고 있다.
최근 고령화로 만성・노인성 질환 증가함에 따라 오래도록 건강하게 살고자 하는 건강수명에 대한 니즈가 증가하고 있다. 또한 보건의료체계의 지속가능성을 담보 할 수 있도록 의료비 절감54) 및 만성질환, 감염병, 항생제 내성 등과 같이 국민건강과 경제・사회적 손실을 유발하는 미해결 질병에 대한 국가적 대응체계에 대한 강화가 요구되고 있다.
4차 산업혁명에 따른 기술변화와 의료패러다임의 전환에 따라 의료현장에서의 인공지능 도입 및 활용 확대55), 공공기관-병원-기업간 빅데이터 공유・확산 및 3D 프린팅, 가상・증강현실 등에 대한 의료현장 수용도의 가속화가 전망되고 있다. 또한 유전체 분석, 생체・생활습관 정보 측정, 코호트 구축 등 글로벌 표준에 맞는 정밀의료 연구자원・수집・분석・활용 기술이 부각56)되고 있는 추세이다. 그리고 특정질환 근본 원인(유전자) 제거를 위한 유전자 가위기술과 세포・유전자 치료제 연계 외에, 신체조직・장기세포로의 분화능력을 인공적으로 유도하는 유도만능줄기세포 및 기전연구가 활발히 진행되고 있다57).
(2) 보건복지부 R&D 사업 추진체계
보건복지부에서는 매년 보건의료 R&D 통합시행계획을 수립하여 보건의료기술정책심의위원회 심의를 받아 시행하고 있으며, 이후 3개 전문기관(한국보건산업진흥원, 국립보건연구원, 국립암센터)이 R&D 사업을 관리・수행하고 있다.
나. 추진경과
부처별로 시행되고 있던 보건의료 R&D를 총망라하여 2013년 ‘보건의료 R&D’ 분야의 첫 중장기계획인 ‘국민건강을 위한 범부처 R&D 중장기 추진계획(제1차 보건의료기술육성기본계획(2013∼2017))’이 수립되었고, 이에 따라 2014년부터 매년 세부 시행계획을 수립・추진해 오고 있다. 2017년 현재 제1차 계획의 성과와 현시대 이슈를 반영한 제2차 보건의료기술육성기본계획(2018∼2022)을 수립 중이다.

[그림 2-5] 보건복지부 R&D 사업 추진체계
|
|
사업명 |
2017년 예산 |
|
한국보건산업진흥원 |
질환극복기술개발사업 등 20개 사업 |
355,155 |
|
질병관리본부 |
감염병 관리기술개발연구 등 8개 사업 |
55,577 |
|
국립암센터 |
암연구소 및 국가암관리사업본부 주요사업비 |
31,166 |
|
첨단의료복합단지 |
첨단의료복합단지 기반기술구축 |
7,394 |
|
국립재활원 |
국립재활원 재활연구개발용역사업 |
3,866 |
|
기타 |
- |
74,706 |
|
총 계 |
527,864 |
|
다. 주요정책
보건복지부는 보건의료기술(HT)을 활용한 건강사회 구축을 위해 ʻ국민건강 G7 선진국 도약, 2020 건강수명 75세 시대 달성ʼ을 비전으로 설정하고 5개 기본방향(건강 수명 연장, 신성장 동력 창출, 국민 행복 실현, 연구자 친화적 생태계 조성)과 5대 추진전략(보건의료 R&D의 투자확대, 기술사업화 촉진, 성과관리 혁신, 관리프로세스 투명성과 전문성 제고, 보건의료 빅데이터 연계를 통한 개방형 플랫폼 구축)을 주요 골자로 하여 연구개발 투자, 인프라 구축 등을 지원하고 있다.
ʻ국민건강 G7 선진국 도약ʼ 비전과 목표 달성을 위한 HEALTH 5개 기본방향 중 ʻHealing 주요 질환 극복을 위한 R&Dʼ로 난치형(암/심뇌혈관질환), 다빈도형(근골격/안질환/신장), 생활습관형(비만/정신/대사) 질환 및 희귀질환 등 주요 질병 극복을 위해 예방・진단・치료기술의 완성 단계를 높이기 위한 연구개발을 지원하고 있다. 중개・임상연구 지원을 통한 기초연구 성과의 임상적용 연계 및 주요 질환 극복을 위한 효율적 연구 지원의 체계를 마련하기 위해 중개연구, 임상연구, 만성병, 한의약, 암분야의 사업으로 약 1,282억 원(2017년 기준)을 지원하였다.
‘Economy, 첨단의료 조기실현 및 신산업창출을 위한 연구개발 확대ʼ를 위하여 보건의료 新산업을 견인하는 줄기세포・재생의료, 유전체 등 미래 유망기술 투자 확대 및 4차 산업혁명 대응 BT-ICT-NT 기술 융・복합을 통한 첨단의료 조기실현 촉진을 추진하고 있다. 신약개발, 의료기기, 포스트게놈 다부처유전체사업, 줄기세포와 재생의료분야, 국가전략프로젝트(정밀의료) 등에 약 1,636억 원(2017년 기준)을 지원하였다.
ʻAlert 보건복지 위기대응 R&D투자 강화ʼ의 경우 사회・환경변화에 따라 새롭게 부각되는 위험요인 등에 대하여 정부차원의 기술을 개발하기 위한 지원을 추진하였다. 감염병 대응/관리, 국가전략프로젝트(초미세먼지)에 약 526억 원(2017년 기준)을 지원하였다.
ʻbetter Life 건강증진 및 돌봄 기술 투자 확대ʼ에서는 일상생활자와 건강한 삶을 지속시키는 건강증진 기술과 복지서비스 대상자의 돌봄 기술과 같이 생애 전주기에 걸친 다양한 기술 개발을 지원하고 있다. 구체적으로 고령화대응, 희귀질환, 정신건강, 서비스R&D, 공공보건(질병예방, 저출산 대응 등) 재활연구 등 사업에 약 256억 원(2017년 기준)을 지원하였다.
ʻTogetHer 연구자 친화적 생태계 조성ʼ은 보건의료기술의 고도화 및 산업화를 촉진하기 위한 국가차원의 R&D 인프라 구축에 지원하였다. 연구중심병원 등 병원연구역량강화, 글로벌 연구전문인력 양성을 위한 사업, 의약품과 의료기기 연구 성과의 상용화 촉진을 위한 첨단의료복합단지 기반기술구축 등의 사업을 추진하기 위하여 약 794억 원(2017년 기준)을 투자하였다.

[그림 2-6] 보건의료 R&D 중장기 추진전략(2013~2017)
지원 프로그램으로는 근거 법률에 따라 보건의료기술연구개발사업을 비롯하여 한의약연구개발사업, 암정복추진사업, 질병관리연구사업 등으로 구분할 수 있으며 2017년 기준으로 5,278억 원을 지원하였다.
라. 주요사업
(1) 보건의료기술연구개발사업
(가) 개요
보건복지부는 21세기 지식기반경제의 핵심 산업으로 등장하는 보건의료분야를 국민건강 증진과 국가경제 발전에 이바지하는 고부가가치 국가전략산업으로 육성・발전시키기 위하여 ‘보건의료기술진흥법’(1995)을 제정하여 ʻ보건의료기술연구개발사업ʼ을 추진해 오고 있으며, 지난 22년간(1995〜2017) 약 3조 9천억 원의 정부연구개발자금을 지원했다. 보건복지부는 연도별 연구개발사업 시행계획을 수립하고, 전문기관인 한국보건산업진흥원에서 보건의료기술연구개발사업을 시행하며 단위사업은 아래 표와 같다.
(나) 지원내용
2017년도 ‘보건의료기술연구개발사업’은 국민의 삶을 향상시키고 보건산업을 미래 성장동력으로 육성함을 목표로 총 18개 세부사업으로 구성되어 있다.
[표 2-17] 보건의료기술연구개발사업 단위사업
|
단위사업명 |
지원분야 |
|
질환극복기술개발 |
창의적 중개연구, 문제해결형 중개연구, 임상의과학자연구역량 강화, 공공보건기술개발 |
|
첨단의료기술개발사업 |
줄기세포・재생의료 실용화, 맞춤의료 실용화, 융복합 보건의료기술, 신약개발 지원, 제약산업 특화지원 |
|
임상연구인프라조성사업 |
국가임상시험사업, 의료기기인프라, 국민건강임상연구사업, 질환유효성평가기반구축, 나노의학인프라연구, 환자안전연구, 보건의료 빅데이터 R&D, 희귀난치성질환 유전자치료기반기술개발, R&D조사분석 |
|
감염병위기대응기술개발사업 |
면역백신개발, 국가감염병위기대응 |
|
의료기기기술개발사업 |
미래융합의료기기개발, 의료기기임상시험지원, 신의료기술수반의료기기시장진출지원 |
|
선도형특성화연구사업 |
선도형특성화연구사업단(II단계) |
|
글로벌화장품신소재・신기술 연구개발지원사업 |
글로벌코스메틱연구개발사업단 |
|
포스트게놈다부처유전체사업 |
인간 유전체 이행연구, 유전체 이행연구 지원, 한국인 유전체 연구자원 정보생산 및 활용 |
|
범부처전주기신약개발사업 |
범부처전주기신약개발사업단 |
|
연구중심병원육성 |
연구중심병원육성사업 |
|
국가항암신약개발사업 |
국가항암신약개발사업 |
|
보건의료서비스 R&D사업 |
보건의료서비스 R&D |
|
사회서비스 R&D사업 |
사회서비스 R&D |
|
정신건강기술개발사업 |
정신건강기술개발사업단 |
|
100세 사회대응 고령친화제품 연구개발사업 |
100세 사회대응 고령친화제품 연구개발 |
|
첨단바이오의약품 글로벌진출사업 |
첨단바이오의약품글로벌진출사업 |
|
국가전략프로젝트(정밀의료기술개발) |
국가전략프로젝트(정밀의료) |
|
심혈관계첨단의료기술가상훈련시스템기술개발 |
심혈관계 첨단의료기술 가상훈련시스템 기술개발 |
(2) 한의약연구개발사업
(가) 개요
인구의 고령화에 따라 만성・난치성 질환이 증가하고 세계적으로는 웰빙에 대한 관심과 친환경주의의 선호로 전통의학과 보완대체의학에 대한 수요가 급증하고 있다. 현대의학의 한계점을 인식하고 의료비의 증가를 억제하기 위하여 전통의학과 보완대체의학에 대한 관심이 커짐에 따라 세계 전통의학 시장은 계속 성장하고 있다(2008년 2,100억 달러 규모). 이러한 세계적인 관심 속에서 우리의 전통의학인 한의학적 접근방법을 통한 치료기술개발은 높은 경쟁력을 가질 수 있으므로 정부는 오랜 전통을 지닌 한의약의 경험과 지식정보를 이용하여 핵심 원천기술과 응용기술을 개발하고, 한의약의 안전성・유효성을 입증하여 국민보건향상과 한방산업에 기여하고자 1998년부터 ‘한방치료기술연구개발사업(2010 프로젝트)’을 추진하였다.
2008년 제1차 한의약육성발전종합계획(2008〜2017)을 수립한 이후 한의약선도기술개발사업으로 명칭을 변경하고 2011년 제2차 한의약육성발전종합계획(2011〜2015)을 수립하여 한의약 산업 발전을 위한 R&D 사업과 인프라 구축을 지원하였다. 현재는 2016년 수립된 제3차 한의약육성발전종합계획(2016〜2020)의 세부계획을 반영하여 사업을 추진하고 있다.
(나) 지원내용
보건복지부는 한의약의 과학화・표준화・제품화 연구개발을 바탕으로 한의약산업의 신성장 동력 육성 및 국민건강증진을 목표로 비임상・임상 근거 구축을 통한 한의약 의료서비스(한약제제, 치료기술)의 질적 제고와 보장성 강화를 지향하고 있다.
2017년에는 한의약선도기술개발사업을 통해 한약제제, 한방의료기기, 한의약 임상인프라, 한의씨앗연구, 한의약근거창출임상연구, 질환중심맞춤한의학중개연구 등에 163억 원을 지원하였으며, 특히, 한의약에 대한 근거강화 및 신뢰도 제고를 목표로 한의약근거창출임상연구분야 중 ‘한의표준임상진료지침개발’을 중점 지원한다. 한의학과 현대의학을 융합하여 새로운 치료기술 개발을 위한 양・한방 융합기반 기술개발사업에 61억 원을 지원하였다
(3) 암정복추진사업
(가) 개요
보건복지부는 국민보건 향상을 목적으로 암에 관한 전문적인 연구와 암환자의 진료 등을 위해 2000년에 ‘국립암센터법’을 제정하여 국립암센터를 설립・운영하고 있으며, 암의 발생・예방・진단・치료 및 관리 등에 관한 연구로 기관고유연구사업을 추진하고 있다. 아울러 1996년도에 제1차 암정복 10개년 계획(1996〜2006)을 수립하고 암정복추진단을 발족하여 암정복추진연구개발사업을 추진했으며, 현재는 제3차(2016〜2020) 국가암관리종합계획을 바탕으로 국내 산・학・연・의료계 우수 암 연구자의 연구활동을 지원, 연구성과의 적극적인 활용ㆍ확산을 통해 암 연구혜택을 확대해 나가고 있다. 2001년부터 2017년까지 국립암센터 기관고유연구사업과 암정복추진연구개발사업으로 총 3,747억 원의 정부연구개발자금이 지원되었다.
(나) 지원내용
국립암센터는 기관고유연구개발사업(intramural)과 암정복추진연구개발사업(extramu- ral)을 상호・보완적으로 추진하여 연구개발 성과를 극대화하고자 노력하고 있다. 2017년 기관고유연구개발사업은 공익적 핵심 암 융합연구, 정밀의학 실현 암 기반연구, 근거기반 전주기적 암관리 연구, 공공개방형 암 연구 인프라 운용 등에 158억 원을 지원 하였으며, 암정복추진연구개발사업을 통해 암 중개융합연구, 공익적 다기관 암 임상연구, 암 예방・관리・서비스 연구, 지역암센터 연구사업 지원 등에 153억 원을 지원하였다.
(4) 질병관리연구사업
(가) 개요
질병관리본부는 질병극복 및 미래 맞춤의료 대비를 위한 R&D를 추진하겠다는 목표 아래 산하 국립보건연구원을 주축으로 질병관리연구를 지원하고 있다. 국내 질병관리의 실무를 담당하는 질병관리본부의 연구사업 수행은 국내 발생 질병에 대한 현안 대응의 측면을 강조하고 있다. 주요 연구 분야는 국내 발생 감염병 및 만성질환에 대한 예방, 진단 및 치료 기술 개발연구와 질환 관련 유전체를 분석해 질병을 예측하려는 유전체연구이다.
(나) 지원내용
질병관리본부는 질병의 조사・감시・예방・진단・치료 등에 필요한 기술개발에 중점 투자하고 있으며, 보건복지부 소관 사업 중 인프라 구축 사업 또한 활발히 지원하고 있다. 특히 한국인 코호트, 질병코호트 및 유전형질 연구, 연구 자원을 수집・관리하는 국립중앙인체자원은행을 비롯하여 국립의과학지식센터, 국립줄기세포재생센터, 생물안전특수복합시설, 공공백신개발지원센터 등 국내 연구자들에게 필요한 보건의료 연구 인프라를 구축・발전시키고자 노력하고 있다.
2017년 주요 연구개발 사업으로는 ʻ감염병 예방 및 관리에 관한 법률ʼ에 따라 국가관리 대상 감염병 관리를 위한 공익적 기반기술 개발과 국내외 공동대응, 주요 법정감염병을 대상으로 방역현장에서 직접 활용 가능한 진단법 개발 및 개선연구, 관련 실험 인프라 조성을 위한 ʻ감염병 관리기술개발ʼ에 약 89억 원을 투자하였다.
또한 초고령사회 진입에 따른 대응으로 주요 만성질환인 당뇨, 심뇌혈관질환, 치매, 비만 등에 대한 조사연구 및 예방, 관리지표를 개발하고자 ʻ만성병 관리기술개발ʼ에 약 81억 원, 한국인의 유전체 지도 작성과 분석, 유전변이 마커발굴을 위한 ʻ형질분석연구ʼ에 약 20억 원을 투자하였다.
특히, 2016년 예산사업구조개편에 따라 국가 보건의료 활성화를 위한 연구 인프라 구축을 통합하여, 여성건강 및 질병 예방과 관리기술 개발을 위해 ʻ여성건강기반기술개발ʼ에 약 17억 원, 국내 줄기세포와 재생의료 연구 활성화를 위한 인프라로서 ʻ줄기세포은행 운영 및 표준화 기반구축ʼ에 64억 원, 기후변화에 따른 질환과 매개체 감시, 발생예측, 피해저감을 위한 ʻ기후변화 급・만성질병연구ʼ에 25억 원, 희귀질환 임상 및 유전체 정보를 수집・분석함으로써 희귀질환의 특성 및 진단, 치료 관리기술 개발을 위한 ‘희귀질환연구인프라구축’에 약 6억 원, 임상연구 수행 및 연구데이터의 통합관리 지원을 통하여 국내 임상연구데이터의 질적 향상 및 연구자료의 신뢰성 제고를 위한 ‘질병극복임상연구 데이터자원화’에 4억 원 등 ‘국가보건의료연구인프라구축사업’에 총 116억 원을 투자하였다.
마지막으로 인체자원(인체유래물, 임상정보)의 수집・관리・분양, 인체자원연구지원센터 운영을 통한 분양지원 서비스 제공, 질환중심형 바이오뱅크 컨소시엄 운영을, 특정질환 고부가가치 인체자원 수집 및 관리 등 ‘보건의료생물자원종합관리’에 약 54억 원, 공공백신 연구・개발 및 지원을 위한 공공백신개발지원센터 건립을 통해 감염병위기 대응 및 백신자급 향상을 위한 ‘공공백신개발・지원센터 건립’에 17억 원 등 질병관리연구에 총 512억 원 규모를 지원하였다.
마. 향후 계획
(1) 보건의료 R&D 중장기 종합계획 수립
제1차 보건의료기술육성기본계획(2013∼2017)이 2017년 종료로 ‘보건의료기술 진흥법’에 근거한 제2차 보건의료기술육성기본계획(2018∼2022) 수립을 추진하고 있다. 1차 계획의 미비점을 보완하고 보건의료 R&D의 공익적 역할을 중시하며 새 정부 공약・국정과제를 이행58)하는 제2차 중장기 종합계획을 마련 중이다.
(2) R&D 투자확대를 위한 투자재원 다양화
주요 사업의 일몰 및 회계연도 일치 등 정부 R&D의 투자 효율화 기조에 따른 보건의료 R&D 정부투자 성장 정체로 국내 보건의료 R&D의 투자재원 다원화가 필요하게 되었다. 이에 백신 및 신약개발 투자와 글로벌 시장진출 가속화를 위한 ‘한국형 글로벌 민관협력펀드’를 조성하고 선행연구지원형 투자모델을 개발・검토하여 시범사업(2018년 분자진단기술개발 분야)을 추진하고 주요 R&D사업과 정책펀드59)간 연계60)를 통해 R&D 재원규모 확대 및 민간투자를 확대 유인할 계획이다.
(3) R&D 평가관리의 전문성 및 효율성 제고
R&D 평가의 전문성 강화로 평가결과에 대한 신뢰성과 수용성을 높이기 위해 평가위원의 기존 평가 관련정보를 DB화하고 전공분야, 연구업적 우수성 등을 고려하여 평가위원 풀을 확대할 계획이다(2016년 12월 7,000여 명 확보→2017년 12월까지 10,000명 달성 목표). 그리고 가산점 제도의 합리성 제고를 위해 ‘가산점 상한제’ 도입과 적용범위를 조정할 예정이다. 또한 연구몰입 환경 조성으로 성과창출 및 연구자 만족도를 높이기 위해 공고를 정례화하고 연차평가를 개선할 예정이다.
(4) 실용화 성과창출 생태계 조성
기술이전・사업화 등 실용화 성과를 창출하기 위해 부처별 우수성과를 연계하는 다부처 연계사업 기획 및 추진을 할 계획이며, 실용화지원사업간 노하우 및 정보 교류 활성화를 위한 성과정보 교류 협의체 운영 및 성과교류회를 추진할 예정이다.
7. 환경분야 생명공학 육성
가. 개요
(1) 기술개발 필요성
(가) 환경생명공학기술
환경생명공학기술(EBT: environmental biotechnology)이란 생명공학기술(BT: biotechnology)을 환경기술(ET: environmental technology)에 접목하거나 융합하는 기술이다. 즉, 생물학적・분자생물학적 기법이나 생물학적 처리공정을 이용하여 환경오염을 예방(prevention)하거나 감시(monitoring)하는 기술, 오염된 환경을 복원(restoration)하고 정화(remediation)하는 기술을 의미한다. 환경생명공학기술은 환경과학, 생태학, 분자생물학간의 유기적인 협조가 필요한 기술 분야다. 생명공학기술의 핵심기술61) 가운데 생물공정기술(발효공정제어, 분리정제, 배양기 설계・제작)과 미생물이용기술(미생물분리・배양, 항암물질 탐색기술)을 주로 활용하고 있다.
환경생명공학기술은 청정기술, 환경오염제어 및 관리기술, 바이오에너지기술을 포함한다. 그 밖에도 생물학적 방법을 이용한 환경오염물질의 검출(detection), 친환경 소재・제품 개발, 생태계건전성 및 생물다양성 유지, 토양・지하수 복원, 온실가스 감축, 기후변화 적응 등에 필요한 기술까지로 그 범위가 확대되고 있다. 환경생명공학기술은 근래 각 분야에서 개발되고 있는 첨단기술과 융합하며 기존의 환경기술로는 극복하기 어려운 한계를 해결할 수 있다는 점에서 그 중요성이 부각되고 있으며, 전 세계적으로 추구하고 있는 지속가능한 발전(sustainable development)의 핵심기술이라 할 수 있다.
(나) 환경산업 및 환경기술의 변화
환경기술62)을 개발하는 목적은 기본적으로는 현안 환경문제를 해결하기 위함이지만, 환경문제를 안정적으로 해결하기 위하여 추진하는 환경산업63) 육성정책과도 밀접하게 연관되어 있다.
1960년대부터 형성되기 시작한 환경산업은 초기에는 배출된 환경오염물질을 처리하는 ‘사후처리’ 중심의 산업이 대부분이었다. 그러나 1990년대부터는 환경오염물질의 발생을 사전에 예방하는 사전예방 중심의 산업으로 범위가 확대되었다. 최근에는 환경오염에 따른 인체・생태계 영향을 줄이기 위한 환경오염 적응산업, 훼손된 환경을 복원하는 생태계 복원・재생산업, 소모성자원・에너지 사용을 억제하는 자원순환 및 재생에너지 산업으로 환경산업의 성장축이 이동하고 있다.
이에 따라 환경기술 개발도 사후처리기술 중심에서 사전예방기술・청정기술을 거쳐, 수용체(인체 및 생태계) 중심의 환경영향저감기술, 친환경소재・제품기술, 환경복원기술, 자원순환기술, 재생에너지기술 쪽으로 방향을 틀어가고 있다.
세계 각국이 환경관련 국제협약64)을 체결해 공동으로 이행하며, 지구환경 문제가 국제사회에서 중요한 의제로 대두되는 것도 환경기술 변화의 한 요인이다. 기후변화 대응기술, 재생에너지 확보기술, 자연환경보전・복원기술, 자원순환기술, 황사・미세먼지 대응기술 등은 특히 지구환경문제 해결 요구가 해를 거듭하며 강화되고 있어 기존의 환경기술 개발 방식만으로는 적절히 대응하기 어려운 실정이다. 이를 극복하기 위해 환경기술(ET)과 생명공학기술(BT), 정보기술(IT: information technology) 및 나노기술(NT: nanotechnology) 등을 접목 또는 융합하는 환경융합기술 개발의 중요성이 더욱 증가하고 있다. 특히 수용체(인체 및 생태계)에 미치는 환경영향을 평가하기 위한 위해성평가(risk assessment)기술을 개발하거나 4차 산업혁명 시대에 대응하기 위하여 현재의 환경기술 및 환경생명공학기술도 ICT, IoT 등을 접목한 플랫폼, 스마트 환경관리기술 등 융・복합 첨단기술로 전환할 필요성이 요구되고 있다.
(2) 기술개발 연구동향
1990년대 이후, 기후변화 및 환경오염으로 인한 생태계 훼손으로 인해 자연보전 및 복원의 중요성이 부각되었고, 토양과 지하수의 환경적 순기능에 대한 중요성이 강조되었다. 또한 생태계 및 토양・지하수는 한번 오염되면 개선이 어려울 뿐만 아니라, 복원하는데 많은 시간과 비용을 필요로 한다. 이러한 문제들이 중요하게 부각되면서 이에 대응하기 위하여 생태계 복원기술 개발, 토양・지하수 보전・복원을 위한 자연친화적 정화기술도 집중 개발되고 있다. 생명과학 발전에 따른 유전자변형생물체(LMO: Living Modified Organism), 내분비계 장애물질의 환경(인체, 생태계) 위해성이 부각됨에 따라 새로운 화학물질에 대한 위해성 평가 연구도 중요성이 커지고 있다.
유럽의 청정에너지 기술정책 이슈와 아울러 미국, 일본, 독일 등은 폐자원 및 바이오매스 에너지화 정책을 강화하고 있다. 유럽연합은 2020년의 최종에너지 소비에서 차지하는 재생에너지 도입 목표(전력・열・수송의 3부분) 의무를 달성하기 위하여 바이오매스 자원을 적극 활용하도록 지원하고 있다. 미국 에너지부(DOE)는 2022년까지 선도바이오연료(advanced biofuel)를 연간 210억 갤런(약 137만 BPD)씩 제조・공급하겠다는 바이오리파이너리 프로젝트(Bio-refinery Project)를 진행하고 있다. 중국은 2020년까지 신재생에너지를 전체 에너지 소비량의 15%까지 확대하겠다는 목표를 세우고 2008년에 생물연료(biomass)에 대한 연구개발과 실증을 위하여 2억 9,000만 달러를 투자하였다. 이처럼 세계 주요 국가들은 미래 국가경쟁력 확보를 위하여 국가 주도의 융합기술에 대한 투자를 가속화하고 있으며, 자국의 산업경쟁력 확보 차원에서 국제규모의 환경문제 대응기술 개발을 적극적으로 추진하고 있다.
또한 생물자원을 활용하여 환경을 복원하고 정화하기 위한 기술개발도 활발하게 진행되고 있다. 환경오염물질을 분해할 수 있는 세균 등 미생물에 대한 기능 연구를 통해 친환경 환경산업이 성장하고 있으며, 천적 생물종 연구를 통해 환경생태계 보전 기반도 강화되고 있다. 생물-생물간, 생물-무생물 환경간 상호작용 연구를 통해 훼손 환경・생태계 복원 사업의 시장규모도 점차 커지고 있다.
나. 추진경과

다. 주요정책
(1) 주요정책 현황 및 성과
우리나라의 환경기술 관련 연구개발은 1992년 6월에 수립된 ‘선도기술개발사업(G7프로젝트)’의 환경공학기술개발사업으로 시작되었다. 이 사업을 통해 1994년부터 유해화합물 생물정화 기술, 침출수의 생물학적 처리기술, 환경오염물질의 생물학적 검출기법 등 환경생명공학분야의 기술개발을 추진하였다. 이어 환경부는 2001년부터 2011년까지 ‘차세대핵심환경기술개발사업(이하 차세대사업)’을 통해 환경생명공학 관련 기술개발을 지원하였다. 차세대사업 예산은 총 1조 2,367억 원(정부 출연금 8,791억 원, 민간부담금 3,576억 원)이었으며, 이 가운데 환경생명공학기술 분야에는 총예산의 약 22%인 1,940억 원이 투입되었다.
2001년부터 2011년까지 환경생명공학 관련 주요 기술개발 과제는 생물정화기술 개발, 생태독성시험법 개발, 식물추출물을 이용한 살충제 및 항균제 개발, 나노-효소 복합체 기반의 휴대용 잔류농약 검출용 바이오센서 개발 등을 들 수 있다. 차세대사업 중 환경생명공학 관련 과제 수행에 따른 2017년 7월 현재까지의 성과는 지식재산권 출원・등록 6,450건, 국내외 학술지 게재 5,778건 등의 과학적 성과를 나타냈다.
또한 기술실시계약을 통해 3,409억 원, 국내외 공사 수주 및 제품판매 5조 2,562억 원 등의 산업・경제적 성과도 내고 있다. 환경부는 차세대사업의 후속으로 2011년 부터 2020년까지 총 1조 3,444억 원을 투자하는 ‘차세대 에코이노베이션 기술개발사업(이하 ‘차세대EI사업’)’을 시행하고 있는데, 환경생명공학 기술개발 과제는 총 예산의 20% 이상을 지원할 예정이다. 2017년 7월 현재까지 차세대EI사업은 지식재산권 출원・등록 578건, 국내외 학술지 게재 581건의 성과를 나타냈다. 차세대EI 사업 외에 ‘환경융합신기술’, ‘생활공감 환경보건기술’, ‘폐자원 에너지화 기술’, ‘생물다양성 위협 외래생물관리기술’ 및 ‘토양・지하수오염방지’ 등의 기술개발사업에서도 다양한 환경생명공학 기술개발 과제를 지원하고 있다.
이처럼 여러 기술개발사업을 통해 환경생명공학기술은 단순히 연구개발에 그치는 것이 아니라 고부가가치를 창출하고 있어 환경기술 전반의 경제성, 지속가능성 및 경쟁력을 견인하고 있다.
|
사업명 |
사업 기간 |
전체 과제 |
전체 과제 중 EBT 관련 과제 |
||||
|
과제 수 |
국고지원 (억 원) |
과제 수 |
국고지원금 (억 원) |
% |
|||
|
차세대핵심환경기술개발 |
’01∼’10 |
1,238 |
8,791 |
378 |
1,940 |
22 |
|
|
차세대 EI 사업 |
환경산업선진화 기술개발 |
’11∼’20 |
218 |
2,112 |
51 |
597 |
28 |
|
환경정책기반 공공기술개발 |
’11∼’20 |
95 |
1,578 |
25 |
481 |
30 |
|
|
환경융합신기술개발 |
’09∼’16 |
39 |
606 |
13 |
126 |
20.8 |
|
|
생활공감환경보건기술개발 |
’12∼’21 |
50 |
602.74 |
8 |
89.5 |
14.8 |
|
|
폐자원 에너지화기술개발 |
’13∼’20 |
5 |
631 |
3 |
304 |
48 |
|
|
생물다양성 위협 외래생물관리 기술개발 |
’17∼’23 |
4 |
19 |
4 |
19 |
100 |
|
|
토양・지하수오염방지기술개발 |
’08∼’17 |
179 |
1,385 |
1 |
193 |
14 |
|
* 집계기준으로 완료 또는 진행 중인 사업과제의 총 지원금
라. 주요사업
(1) 융합기반 청정기술
환경오염물질을 처리하는 사후처리 방식만으로는 해결이 불가능할 정도로 환경오염 문제가 심각한 사회문제로 대두되면서 환경오염물질의 발생을 사전에 예방하는 사전오염 예방 기술이나 사업장 등 생산단계 또는 제품 소비단계에서 오염물질 배출을 억제하는 청정기술의 중요성이 부각되고 있다. 특히 청정기술은 순수한 환경기술(ET)만이 아닌 생명공학기술(BT) 등 여러 분야의 기술이 접목되거나 융합된 기술이 대부분이다.
청정기술에는 공정관련 청정기술, 생물농약 제조기술, 생분해성 소재 제조기술, 청정 유기용제 개발 및 생산기술, 미세먼지 등 유해물질 위해관리기술 등이 포함된다. 현재 수행하고 있는 기술개발 과제의 예는 아래 표와 같다.
[표 2-19] 융합기반 청정기술의 주요 연구과제
|
◈ 폐자동차 해체설비 및 공정기술 고효율화(’13.5∼’16.12) |
|
◦ 고분자폴리머, 이온치환 폴리머, 미생물을 혼합한 식생복원용 토양개량제를 개발하고 나이지리아 현지 사막화에 적용하여 기후변화에 따른 건조지역을 안정적으로 녹화시키는 기술 |
|
◈ Crude glycerol 기반 친환경 가소제 원료 물질의 에코공정기술개발(’13.5∼’16.3) |
|
◦ Crude 글리세롤 기반 고성능 글리시돌 (GD) 생산을 위한 촉매 및 생산 기술 확립 |
|
◈ 토양미생물의 biomineralization과 산업폐기물을 이용한 국내외 중금속 오염부지의 hybrid형 불용화 기술 개발(’15.7∼’18.3) |
|
◦ 토양미생물, 불용화제를 활용하여 오염토양(광물찌꺼기)을 고결하는 오염정화 기술 개발 |
|
◈ 미세먼지(PM10, PM2.5) 및 VOC 노출에 의한 환경성 눈질환 발생 메커니즘 규명 동물모델 기술개발(’16.5∼’18.12) |
|
◦ 환경성 눈질환 모델 구축 및 발 임상, 세포 및 동물실험결과 기반 다차원 예측모델 평가, 미세먼지 등에 의한 환경성 눈질환 발생 기전 및 바이오마커 개발 |
|
◈ 환경유해인자(미세먼지, 중금속 등)에 의한 상부호흡기 유발・악화 메커니즘 규명 및 환자 중심 관리기술 개발(’16.5∼’18.12) |
|
◦ 미세먼지 등에 의한 상부 호흡기 과민성 염증성 질환 유발 악화 기전 규명, 유발악화 메커니즘규명, 환자군별 상부 호흡기 질환 유발악화 예방관리 가이드라인개발 |
(2) 환경오염제어 및 관리기술
기존에 잘 알려진 환경오염물질 외에도 미량 함유 유해물질을 포함한 신(新)환경오염물질에 대한 새로운 환경모니터링 기술65)이 요구되고 있다. 이에 따라 세포 칩 개발 등 세포 내 유해성 관리 모니터링까지 필요한 환경오염 제어 및 관리 기술의 범위가 확대되고 있다. 나노기술(NT), 정보기술(IT)가 융합한 환경 바이오모니터링 기술을 개발함에 따라 나노수준의 환경문제 발현 메커니즘도 규명할 수 있게 되었다. 환경오염제어 및 관리기술에는 식・생물 정화기술, 환경오염측정 기술, 생태계복원 기술, 녹조제어 및 관리 기술 등이 포함된다. 현재 수행하고 있는 기술개발 과제의 예는 아래 표와 같다.
[표 2-20] 환경오염제어 및 관리기술의 주요 연구과제
|
◈ 환경 내 항생물질 내성 발생 파악 및 국가 감시체계 구축 기술 개발(’16.5∼’20.12) |
|
◦항생제 내성의 발생 및 전파의 주요 원인이 되는 점오염원 등을 파악함으로써 향후 환경에서 잠재적 위험요소가 되는 지역에 대한 중점적인 관리 방안 마련 및 항생제 내성 추적 시스템 (AR-tracking system) 기반 구축 |
|
◈ 야생동물 매개 인수공통감염병 대응을 위한 신속 현장적용 진단 기술 개발(’16.11∼’19.6) |
|
◦실시간 중합효소연쇄반응 기법 개발을 통한 야생동물 매개 24개 질병의 어레이카드 기반 패널화 및 진단 기법 개발, 등 온증폭기법을 활용한 간이 진단키트 시제품 개발 |
|
◈ EDCs 통합위해관리를 위한 한국형 환경 및 생태 유해성 평가 기술 개발(’16.10∼’19.12) |
|
◦ 환경 및 생태 내 내분비계장애물질(EDCs) 맞춤형 생태 및 인체 위해관리 시스템 구축으로 생태계 민감 수용체 파악과 위해관리 대책 및 EDCs의 노출저감 정책 기반 마련 |
|
◈ 호수의 자정기능 복원 및 지속가능한 관리를 위한 나노-마이크로 연계 시스템 개발(’16.11∼’19.6) |
|
◦지속가능한 호수 생태계 복원 및 유지관리 기술개발 |
|
◈ 생물학적 공정개선을 통한 하・폐수 미량 유해물질 처리효율 향상 기술(’16.11∼’19.6) |
|
◦기존 생물학적 처리공정에서 미량유해물질 생물분해 메커니즘을 파악하고 유용미생물을 활성화하여 처리대상 미량유해물질 처리효율을 향상할 수 있도록 기존 생물학적 처리공정 개선을 위한 최적 설계 및 운영 시스템 확립 |
|
◈ 바이오 고분자 기반 광학 센서 개발을 통한 중금속 및 유기오염물질 검출 현장측정용 kit 및 중금속 정화공정 개발(’15.4∼’18.3) |
|
◦오염물질과 선택적 결합・분리 특성이 높은 바이오 고분자를 활용하여 현장내의 중금속 및 잔류성 유기오염물질의 측정센서 개발 |
|
◈ SOURCE(Slow, Optimized and Uniformized Release Control for Environment) 기술을 이용한 고강도 질산성질소 오염원 통합 관리기술 개발(’15.4∼’18.3) |
|
◦정화용 복합소재 개발 및 생산 공정기술 최적화 |
|
◈ 항생제 내성 미생물의 불활성화와 전이 억제를 위한 소독 시스템 개발(’14.5∼’17.3) |
|
◦소독 실험 방법 셋업 및 항생제 내성 전이 표준미생물 선정, 항생제 내성 미생물의 전이 제어를 위한 정량적 소독기법 개발, 항생제 내성 미생물의 불활성화와 전이 억제를 위한 최적 소독기법 개발 및 사업화 가능성 검토 |
|
◈ 하폐수 처리용 분리막-생물 반응 시스템의 에너지 저감을 위한 정족수 감지 억제제 개발(’12.5∼’17.12) |
|
◦환경분야 생물막 오염 문제에 정족수 감지 억제 기술을 적용하여 기존기술 대비 40% 이상의 에너지 절약 효과의 원천기술 개발 |
|
◈ 실제 환경에서 인간에 대한 VOCs 노출 사전예측 생체 지표 개발 및 활용 연구(’10.6∼’16.3) |
|
◦유전체 분석기법과 단백질 지표를 활용하여 환경위해물질에 대한 인체 위해성 예측 시스템 개발 |
(3) 폐자원 에너지화 및 고부가가치 자원화 기술
폐자원 에너지화 기술은 가연성 폐기물, 유기성 폐기물, 매립가스, 산업 폐가스 등을 열화학적 또는 생물학적 방법으로 열, 전력, 수송연료 등으로 에너지화 하거나 폐화학제품의 화학전환에 의해 화학원료로 전환하는 기술이다. 혐기성 폐수 처리과정에서 발생하는 바이오가스를 대체에너지로 사용하고자 하는 연구와 친환경적인 바이오소재를 이용하여 금속을 제거 회수하는 연구가 증가하고 있는데, 이는 촉매 사용량을 최소화하고 오염물질은 효과적으로 제어할 수 있는 기술이다. 뿐만 아니라 회수된 자원을 다시 환경기술(ET), 정보기술(IT), 나노기술(NT) 분야에 활용하여 고부가가치 소재를 만들어 낼 수도 있다. 현재 수행하고 있는 기술개발 과제의 예는 아래 표와 같다.
[표 2-21] 폐자원 에너지화 및 고부가가치 자원화 기술의 주요 연구과제
|
◈ 한국형 유기성 폐자원 바이오가스 에너지화 기술 및 복합악취 제어기술 개발(’13.12∼’19.5) |
|
◦유기성폐자원(음식물 폐자원, 가축분뇨 등)을 혐기소화, 가스정제, 악취제어 등을 통하여 바이오가스를 생산할 수 있는 한국형 기술개발 |
|
◈ 유기성폐자원을 이용한 바이오부탄올 연료화 기술 개발(’13.12∼’19.5) |
|
◦혼합당 발효균주를 통해 폐목재 등 유기성폐자원으로부터 자동차 연료 등으로 활용 가능한 바이오부탄올을 생산할 수 있는 기술 개발 |
|
◈ 산화탈수와 일체형 건조 및 ORC 발전을 이용한 저에너지형 슬러지 건조 연료화 장치 기술 개발(’15.5∼’19.5) |
|
◦산업폐수처리장으로부터 발생되는 폐수슬러지를 일체형 건조시설을 통해 화력발전소 연료로 사용할 수 있는 건조슬러지 생산 기술 개발 |
|
◈ 미세조류를 이용한 가축분뇨 고도처리 및 Bio-fuel 생성 기술 개발(’11.11∼’15.9) |
|
◦가축분뇨 공공처리장에서 발생하는 이산화탄소를 고정하는 미세조류를 배양하여 질소, 인의 고도처리, 바이오디젤 생산용 lipid 생산, 잔류조류 바이오매스를 활용한 혐기성 바이오가스 생산을 동시에 구현하는 폐수처리 공정 기술 개발 |
(4) 생물자원을 활용한 환경복원・정화기술
환경부는 2004년부터 최근까지 ‘국가 장기생태 연구사업’ 및 ‘생물자원 보존 종합대책 사업’을 통해 생태계 변화를 모니터링하고, 생태계 변화 예측모델을 개발하며 생태계 변화에 따른 영향평가를 수행해 왔다. 기후변화에 따른 과학적이고 장기적인 한반도 생태계 변화 관리 체계와 생물다양성 보전대책을 수립하기 위함이었다.
최근 들어서는 생태계 위해 외래생물종의 피해를 줄이고 외래생물종 관리를 강화해 국내 고유생태계를 보호하기 위하여 ‘생물자원 발굴・분류 연구사업’, ‘생물다양성 위협 외래생물 관리 기술개발사업’을 실시하고 있다. 이들 사업을 통해 자생생물과 고유종, 그리고 해외 생물자원의 발굴・확보 관리 인프라를 구축하고, 외래생물 모니터링 및 변화예측・위해성 평가 기술, 생태계교란 생물 제거기술 개발 추진계획을 수립하였다. 또한 앞으로는 한반도 생물종/생물자원 다양성을 관리하고 생물자원 산업화 육성기반을 마련하기 위하여 유용생물자원 기능별 실용화 기술개발에 투자를 집중할 계획이다. 현재 수행하고 있는 대표적인 기술개발 과제는 아래와 같다.
[표 2-22] 생물자원을 활용한 환경복원・정화기술의 주요 연구과제
|
◈ 인공지능 및 기계학습 기반 동물 울음소리를 통한 동물 종 구별 원천 기술(’17.4∼’20.12) |
|
◦세부종 구별 기술 심화 및 animal log 기술을 활용하여 전문가 분석 보조를 위한 audio summarization 요약기술 연구, 종구별 기술 연구를 통해 양서류, 조류, 포유류, 곤충류 종구별 정화도 95% 달성 목표 |
|
◈ 생태계교란 식물 물리적 제거기술 개발(’17.11∼’20.12) |
|
◦제거된 생태계교란 식물의 추가번식 방지를 위한 현장 사멸장치 개발 |
|
◈ 생태계교란 어류 퇴치기술 개발(’17.11∼’20.12) |
|
◦큰입배스와 블루길을 선택적으로 제거할 수 있는 유인기술에 기반한 제거장치 개발 |
|
◈ 드론을 이용한 식생입체 정보 분석 및 정책활용 기술(’16.11∼’17.3) |
|
◦드론 및 기존 영상을 이용한 식생 분석 체계 구축 및 정책적 활용가능성 분석 기존 영상을 이용한 식생판별, 입체구조분석 기술 개발 및 정책 방안 시범 적용, 기존 영상을 이용한 식생입체구조 정보 기술 고도화, 플랫폼 개발 |
|
◈ DMZ 일원 훼손지역의 자생종 활용 생태복원기술 개발(’14.5∼’17.3) |
|
◦DMZ 일원을 포함한 생태적 중요도가 높은 지역의 현지 식물자원 확보 및 종자를 이용하여 생태복원용 소재 및 특수묘목 생산시스템 구축 |
|
◈ 센서네트워크 기반 기후변화에 따른 한국 아고산 생태계 모니터링 플랫폼 기술 개발(’13.5∼’16.3) |
|
◦생태계 분석 및 예측을 위한 생태 정보의 기술의 표준화 및 공동활용 기반구축을 통해 한국 아고산 생태변화 및 환경오염을 실시간 모니터링할 수 있는 센서네트워크 시스템 개발 |
마. 향후 계획
환경기술은 현안인 환경오염문제를 해결하기 위하여 기술을 개발할 필요가 있다. 뿐만 아니라 점차 강화되고 있는 국가간 무역과 연계한 환경규제, 즉 국제무역환경규제에 효과적으로 대응하기 위하여서도 그 중요성이 점차 커져가고 있다. 개발과 보전이 조화를 이루는 ‘지속가능한 사회’ 구현을 위하여 환경기술 개발은 국가경쟁력 확보의 필수요소가 되고 있는 것이다. 특히 다변화되고 복잡한 국제관계가 지속되는 현 시점에서 국제무역환경규제는 물론, 환경산업이 국제경쟁력을 확보하기 위해서는 국내 환경기술 수준을 선도권인 최고기술보유국 대비 80%까지 제고하는 한편, 제4차 산업혁명의 핵심기술을 접목한 새로운 융합형 환경기술 개발에 적극적으로 투자할 필요가 있다.
이에 환경부는 차세대EI사업 내에서 ET-BT 융합기술이 개발될 수 있도록 생명공학과 관련된 신규 RFP 도출 및 투자규모를 확대할 예정이다. 또한 생명공학 원천기술 후속으로 사업화를 위한 실용연구과제도 지원할 계획이다. 그 밖에도 기존 ET-BT 융합 원천기술 분야 신규과제 지원을 확대하고, 향후 지중 환경오염・위해 진단・예방 기술개발을 새로 추진할 예정이다.
8. 해양수산분야 생명공학 육성
가. 개요
해양수산생명공학기술(Marine Biotechnology, MBT)란 ‘해양 생물체 내에서 일어나는 현상, 구조 및 기능을 이해하고, 그로부터 얻어진 지식을 활용하여 제품을 생산하거나 서비스를 제공함으로써 산업 및 인류복지 증진에 응용하는 과학기술’을 총칭한다.
(1) 해양수산생명자원의 가치
해양수산생명공학기술의 원천이라 할 수 있는 해양수산생명자원은 이용 잠재력이 큰 차세대 신물질 개발의 보루이다. 해양은 지구 표면적의 70% 정도를 차지하고 있으며, 지구 생물종의 80% 정도가 서식하고 있다. 한편 매년 지구상에서 생산되는 2,000억 톤의 광합성량 중 90%가 해양에서 이루어지고 있다. 갯벌 및 연안에서부터 심해, 열대, 한대에 이르기까지 다양한 해양공간에 광범위하게 분포하는 해양생물들의 가치는 기후조절, 오염물질 자정능력만 계산되어도 육상의 2배인 연간 26조 달러에 이르는 경제적 가치를 지니는 것으로 추정된다.
해양수산생명자원은 해양생물자원, 해양생물다양성 및 해양생명정보를 포함하며, 생명공학연구 또는 산업을 위하여 실제적이거나 잠재적인 가치가 있는 자원을 포함한다. 해양에 서식하는 생물은 육지에서와는 달리 높은 수압과 염도, 저온에 적응하고 진화하며 살아 왔기 때문에 육상생물에서 발견할 수 없는 특이한 대사물질 및 생리활성물질 등을 생산한다. 이러한 해양생물에서 유래한 유용물질은 식품, 의약 및 화학 등의 분야에서 관심을 받으며, 해양생명공학의 주요 자원으로 급부상하고 있다. 특히 육상생명자원의 경우 이미 기작이 밝혀져 있는 경우가 대부분이고, 대다수 선진국들이 특허를 보유하고 있는 경우가 많다. 그러나 해양수산생명자원의 경우 아직 국제적으로 연구와 산업화가 미진한 분야이므로 우리의 노력 여하에 따라 원천기술 확보의 가능성이 높은 분야이다. 산업화 측면에서도 해양수산생명자원은 가능성이 매우 높은 분야이다. 일반적으로 육상생명자원의 산업소재화 성공률은 1/13,000 정도이나, 해양수산생명자원의 산업소재화 성공률은 1/6,000 정도로 육상생명자원에 비해 성공률이 두 배 정도 높게 나타나고 있다.
해양수산생명자원의 가치가 높아짐에 따라 해양수산생명자원을 확보하려는 국가간 경쟁이 치열해지고 있다. 더욱이 나고야의정서 발효(2014년 10월)로 세계적인 생명자원 주권화 추세 등 유용 해양수산생명자원을 확보하려는 경쟁이 국제적으로 심화되고 있는 추세이다.
(2) 해양수산생명공학 분야
해양수산생명공학 산업은 해양생물체의 시스템, 구성성분, 과정 및 기능을 활용한 제품생산 및 서비스를 제공하는 산업을 의미하며, 정보통신산업 이후 국가 경제성장의 핵심 산업이 될 분야이다. 또한 고도성장의 잠재력을 가지고 향후 경제발전을 이끌 부가가치산업으로 기술・정보・지식 집약형 첨단산업이다.
해양수산생명공학 분야는 해양천연물 또는 해양생물에서 기원한 의약재와 고분자물질, 화학소재 등을 생산하며, 원천기술 확보가 용이하여 독점적 물질특허권 확보가 가능하다는 특징이 있다. 또한 유용 신물질 발견과 제품화 가능성이 높으며, 고압, 저온, 수중이라는 극한환경에 서식하는 미생물의 생체기능을 이용하기 위해서 특수기술을 필요로 한다. 그리고 대량배양 등의 고유한 영역을 지닌다. 이러한 특징들은 해양생물자원을 활용하여 창출할 수 있는 분야의 다양성이 매우 높다는 것을 의미하며, 해양생명공학 기술은 자원, 식품, 의약, 화학, 에너지, 환경, 기기장비, 연구개발서비스에 이르기까지 매우 다양한 산업에 활용이 가능하다.
2006년 OECD는 다가오는 미래를 ‘바이오경제(Bio-Economy)시대’로 선언했으며, ‘생명과학에 의한 새로운 발견들이 관련 제품의 보급이나 서비스의 향상을 통하여 인류에 편익을 제공하는 다양한 경제활동을 포괄하는 새로운 개념’으로 IT발전에 버금가는 효과를 갖게 될 것으로 전망했다. 또한 OECD 생명공학분과에서는 해양수산생명공학의 중요성이 증가함에 따라 2011년부터 주요 논의 주제로 ‘해양생명공학’을 다루고 있다.

[그림 2-7] 해양수산생물자원의 적용분야
[표 2-23] 해양생명공학 응용산업 분야
|
대분류 분야 |
정의 |
|
해양바이오 자원 |
해양 생물체 또는 해양바이오 기술을 이용하여 새로운 기능을 위한 생물체를 발굴, 제작하여 재배 또는 사육하는 산업 활동 |
|
해양바이오 식품 |
해양 생물체로부터 분리 정제기술 혹은 해양바이오 기술을 연구・개발 또는 생산과정에 이용하여 각종 음식료품 및 동물사료, 동식물성 유지 등을 제조 및 수입, 연구・개발하는 산업 활동 |
|
해양바이오 의약 |
해양 생물체를 대상으로 해양바이오 기술을 연구ㆍ개발 또는 생산 과정에 이용하여 인간 또는 동물의 각종 질병을 진단, 예방, 치료하는데 사용되는 의약품 및 의료 용품을 제조 및 수입, 연구・개발하는 산업 활동 (의료기기 및 진단기기 제외) |
|
해양바이오 화학 |
해양바이오 기술 혹은 분리정제기술을 연구ㆍ개발 또는 생산과정에 이용하여 해양 생물체로부터 화합물을 제조 및 수입, 연구・개발하는 산업 활동 |
|
해양바이오 에너지 |
해양 생물체 혹은 해양바이오 기술을 연구・개발 또는 생산과정에 이용하여 에너지를 획득하는 산업 활동, 해양바이오에너지는 해양바이오매스로부터 화학적, 생물학적 전환공정을 거쳐 생산되는 대체 연료물질을 뜻함 (예 : 해양 미세조류를 활용한 바이오 연료와 해양 세균을 활용한 바이오 수소 등) |
|
해양바이오 환경 |
해양 생물체 또는 해양 생물체에서 유래된 물질, 혹은 해양바이오 기술을 연구・개발 또는 생산과정에 이용하여 환경정화, 환경복원, 환경오염 저감 및 방지 목적의 물질, 시스템을 제조 및 수입, 연구・개발하거나 이를 이용한 오염진단 및 측정서비스, 시설을 건설하는 활동 |
|
해양바이오 기기장비 |
해양 생물체에서 유래된 물질이나 해양바이오 기술이 포함된 연구・개발 및 산업적 응용을 목적으로 활용되는 장비 및 기기, 공정용 부품을 제조 및 수입, 연구・개발하는 산업 활동 |
|
해양바이오 연구ㆍ 개발 및 서비스 |
해양바이오 기술을 이용하여 연구ㆍ개발을 대행하거나 분석평가 관련 컨설팅 및 생물정보를 제공하는 산업 활동 (타 기업으로부터 수탁 받아 해양바이오 제품을 제조하는 활동 제외) |
출처: 한국해양수산개발원. 국내 해양바이오 산업화 동향과 정책방향. 2016. p6.
나. 추진경과
해양수산부는 2004년 ‘마린바이오21 사업(2004〜2013)’을 시작으로 해양생명공학분야를 꾸준히 육성하고 있다. 2008년 ‘해양생명공학육성기본계획(2008〜2016)’, 2009년에는 ‘해양바이오 연구개발 활성화 대책(2010∼2014)’을 수립하였을 뿐만 아니라 해양생명자원의 보존・관리 및 이용 등에 관한 법률을 제정(2012년 7월)하여 해양생명자원의 확보와 체계적이고 효율적인 관리 및 이용을 위한 제도를 마련하였다. 특히, ‘국립해양생물자원관의 설립 및 운영에 관한 법률’을 제정(2015년 4월)하고, 해양생물자원의 수집・보존・전시 및 연구 등을 체계적으로 수행하기 위한 국립해양생물자원관을 설립(2015년 4월)하여 해양생명자원을 통한 해양생명공학의 체계적 육성을 추진하였다.
다. 주요정책
(1) 해양수산생명자원의 보존・관리 및 이용을 위한 통합 법령체계 마련
해양수산부는 해양생명자원과 수산생명자원으로 이원화된 법령을 정비해 해양수산생명자원의 보존・관리 및 이용 등에 관한 법률(2017년 6월)을 마련하였다. 이에 따라, 유사한 내용의 두 개의 법률을 운용함에 따른 업무중복 및 혼선을 방지하게 되었다. 동 법에는 나고야의정서 발효(2014년 10월)에 따른 해양수산생명자원의 이용에 대한 이익공유의 근거규정과 국내 해양생명자원의 해외반출 등에 대한 보호 강화 규정이 추가되었다.
(2) 해양생명공학 유망분야 핵심기술 개발
해양수산부는 해양생명공학 유망분야 핵심기술 개발에 집중 투자하고 있다. 해양생명자원을 활용한 건강기능성 식품, 화장품 및 의료용 신소재 등 고부가가치 신소재 개발을 추진하고, 심해 열수구에 발견된 해양 고세균을 활용한 해양바이오 수소 생산기술 상용화를 위해 실증플랜트 규모를 확대하고, 기업을 주관연구기관으로 선정하는 등 기술 고도화 및 상용화를 목표로 추진하고 있다. 또한 성장기간이 짧고 번식률이 높은 어류의 유전자조작을 통해 고부가 바이오 원료의 대량생산이 가능한 바이오리액터 기술개발도 추진하고 있다.
(3) 해양바이오산업 육성
해양바이오 산업진흥을 위해 산업화 기반 정책을 추진하고 있다. 2016년 6월 해양바이오산업 분류체계를 마련하고, 2017년 1월부터는 국내 해양바이오기업의 기술수준, 매출액, 보유인력 등 정확한 현황 파악을 위해 해양바이오 산업 실태조사를 실시하였다. 아울러 해양수산부 산하 국립해양생물자원관의 전문인력과 확보된 유용 해양생물자원을 활용하여 산업화 헬프데스크를 구축하고, 산업화 지원 서비스를 시행하고 있다. 헬프데스크에서는 유용 추출물 분양, 전문장비를 활용한 분석서비스, 산업화 지원 컨설팅 등을 제공한다.
라. 주요사업
해양수산부는 해양수산생명공학의 기술경쟁력 확보 및 산업화 성과창출을 위해 2004년부터 2017년까지 총 2,619억 원을 해양생명공학 R&D사업에 투자하였다. 각 분야별로 해양수산생명자원 확보 및 활용기반구축 637억 원, 해양수산바이오 신소재 개발 971억 원, 해양바이오 에너지 개발 620억 원, 해양생명현상 활용연구에 390억 원을 투자하였다. 이러한 투자를 통해 해양생명공학 분야에서 많은 성과를 이룰 수 있었다.
우선, 국내외의 해양생명자원 9,700여종 290,000여점을 발굴하여 해양생명공학기술의 소재를 확보하였고, 다양한 분야에서 SCI 논문 1,586편, 특허 등록 401건(국내 332건, 국외 69건), 기술이전 36건을 달성하였다. 주요 성과로는 홍합 유래 의학용 접착소재 개발, 기능성 식・의약소재 개발, 미세조류를 이용한 바이오디젤 생산기술개발, 해양 고세균을 이용한 바이오수소 생산기술개발, 세계최초 밍크고래 유전체 해독 등이 있다. 또한, 해양생물 차세대 유전체 연구 기반을 구축하고 해양유전체 유래 기초원천기술 개발을 위한 포스트게놈다부처유전체사업(2014∼2021)을 추진 중에 있다.

[그림 2-8] 해양생명공학사업 추진체계
라. 향후 추진계획
해양수산부는 해양생물에 관한 수집・연구 및 활용기반 구축 등의 업무를 전담할 국립해양생물자원관이 개관(2015년 4월)됨에 따라 해양수산생명공학에 대한 체계적인 정책운영을 추진해나갈 계획이다. 아울러 해양수산생명공학기술개발 사업이 2018년에 일몰됨에 따라, 상용화에 중점을 둔 해양수산생물유래 유망소재 개발 사업, 국내외 해양수산생명자원의 국가자산화와 기반기술 개발 등 해양바이오산업 육성을 위한 R&D사업을 지속 지원 할 예정이다. 또한 산・학・연의 연구체계를 강화하는 등 민간이 할 수 없는 다양한 공공분야의 투자와 인프라 구축을 적극적으로 주도하여 해양생명자원을 보존 및 활용하고, 해양수산생명공학산업이 활성화 될 수 있도록 지속적으로 지원하고 육성해 나갈 것이다.
해양바이오 산업은 전 세계적으로 신생산업 분야이며 대표적인 하이 리스크 하이 리턴(High Risk, High Return) 분야이다. 따라서 이윤추구를 근본 목적으로 하는 기업에 R&D 투자를 맡겨둘 경우 필연적으로 과소공급에 따른 시장실패가 예상된다는 한계점이 존재한다. 그러나 해양바이오 산업은 미래 성장동력 산업으로 미래 우리나라의 경쟁력 제고를 위해 반드시 필요한 산업이다. 그리고 현재 해양바이오 산업은 초기 단계에 있기 때문에 기초원천기술 분야에 대한 투자가 무엇보다 필요한 시점이므로 국가 차원의 집중적인 육성 및 지원이 절실하다. 또한 UN해양법, 나고야의정서 등 국제적으로 생명자원 이용제한 추세에 따라 국내외 해양생물자원 확보와 보존을 위한 국가 주도의 체계적인 사업 추진이 필요할 것으로 전망된다.
9. 생명자원분야의 육성 및 관리
가. 개요
생명자원66)은 기후변화, 환경오염, 에너지 위기, 식량부족 등 인류가 직면하고 있는 난제를 해결하는 생명공학의 핵심 소재로 식품, 의약품, 농업, 환경 등 고부가가치 창출이 가능하다. 이러한 잠재적 가치로 인해 전 세계적으로 생명자원의 확보를 강화하고 있다.
미국은 국가바이오경제 청사진 실현을 위하여 국가생명공학정보센터(National Center for Biotechnology Information, NCBI), 국가생물정보인프라(National Biological Information Infrastructure, NBII), 미국세포수집은행(American Type Culture Collection, ATCC), 국가암센터(National Cancer Institute, NCI), 국가유전자원보존센터(National Center for Genetic Resources Preservation, NCGRP) 등 다양한 거점기관을 운영하며 분야별 연구개발을 강화하고 있다.
유럽은 ʻHorizon 2020ʼ의 재조정을 통해 생명자원 인프라 구축 및 나고야의정서 대응 방안을 마련하고 있으며, 식량안보, 지속가능한 농업, 어업 및 해양연구를 위하여 유럽 전체 생명자원의 정보화 및 관리 기능을 강화하고 있으며 유럽생물정보연구소(European Bioinformatics Institute, EBI), 미생물자원연구인프라(Microbial Resource Research Infrastructure, MIRRI) 등을 통한 생물자원 및 관련 정보에 대한 네트워크를 구축하였다.
일본은 이화학연구소(RIKEN) 생물자원센터를 2001년 설립하고, 국가생물자원프로젝트(National Biological Resource Project, NBRP)를 2002년부터 시작하여 국가 중점자원 선정, 거점 육성 및 통합 DB 사업 수행을 통하여 세계 최고 수준의 생물자원 인프라를 구축하기 위해 국가적인 노력을 기울이고 있다.
우리나라는 2011년 수립된 ‘생명연구자원관리 기본계획’을 바탕으로 2011년부터 매년 ʻ생명연구자원관리 시행계획ʼ을 수립하고, 관계부처별로 자원의 발굴・확보, 보존・관리, 활용을 위한 연구개발과 관련 인프라 구축을 활발하게 진행하고 있다. 2016년 총 투자액은 1,445.2억 원이며, 표에서 보는 바와 같이 과기정통부, 해수부, 농식품부, 환경부, 복지부, 식약처, 산업부 순으로 투자하고 있다.
[표 2-24] 부처별/분야별 투자실적(2016년 성과 기준)
(단위 : 백만 원)
|
부처명 |
생물자원 |
생물다양성 |
생명정보 |
소계 |
|
과학기술정보통신부 |
35,065 |
655 |
9,527 |
45,247 |
|
농림축산식품부 |
20,797 |
- |
661 |
21,458 |
|
산업통상자원부 |
- |
2,279 |
600 |
2,879 |
|
보건복지부 |
12,682 |
- |
- |
12,682 |
|
환경부 |
14,418 |
6,235 |
- |
20,653 |
|
해양수산부 |
6,550 |
- |
23,890 |
30,440 |
|
식품의약품안전처 |
11,169 |
- |
- |
11,169 |
|
합계 |
100,681 |
9,169 |
34,678 |
144,528 |
※ 농식품부는 농진청, 산림청 포함
출처: 2017년도 생명공학육성시행계획(2017.3.)
관계부처의 역할은 ʻ생명연구자원의 확보・관리 및 활용에 관한 법률’ 제6조에 따라 과기정통부가 통합정보시스템 구축 및 기초・원천 연구분야를 담당하고 있다. 교육부는 전문인력양성 분야, 농식품부는 농업 분야, 산업부는 산업 분야, 복지부・식약처는 보건・의료분야, 환경부는 야생생물 분야, 해수부는 해양・수산 분야 생명연구자원을 담당하고 있다.

출처: 제2생명연구자원관리 기본계획(2016)
[그림 2-9] 관계 부처별 역할
나. 생명연구자원 및 통합정보시스템 관리(과기정통부)
(1) 국가전략생명연구자원의 안정적 확보
기후변화, 감염병, 생물다양성 감소 등의 글로벌 이슈에 대응하고, 기술발전에 따른 미래수요, 산업적 잠재력, 한국적 희소성 등을 고려하여 국가전략생명연구자원을 선정할 예정이다. 부처별 소관분야 및 전문성에 따라 자원별 간사부처를 지정하고, 학문적・산업적 파급영향을 고려한 확보・운영방안을 수립할 예정이다.
(2) 생명연구자원의 발굴・확보 및 활용 확대
국가연구개발사업을 통해 확보・생산된 생명자원 기탁・등록 활성화로 고품질자원의 공동활용 촉진 및 R&D 생산성 제고를 추진할 예정이다. 또한, 자원별 특성분석을 통해 자원 가치를 제고하고 특성정보 기반 유용자원 개발・공급으로 자원의 활용성 증대, 관련 기술 개발을 추진할 예정이다. 마지막으로 자원관리기관의 기업 지원을 위한 개방형 연구지원 시스템 운영, 벤처・중소기업 연구개발 인큐베이팅 및 컨설팅 지원을 추진할 예정이다.
(3) 생명연구자원 관리체계 고도화
국가생명연구자원통합정보시스템 고도화를 통한 자원정보 통합검색, 다차원 통계분석 제공 등 사용자 중심 시스템 구축에 힘쓸 예정이다. 나고야의정서 국내 이행 관련 법령 정비 및 생명연구자원의 연구・산업적 활용 촉진을 위해 글로벌 수준에 부합하는 제도・규제 개선을 추진할 예정이다. 종다양성이 풍부한 중남미, 신종 감염병 문제가 대두되고 있는 중동・아프리카 등 미개척지역의 해외거점 확대 및 효혜적 이익공유모델 개발을 추진할 예정이다.
(4) 국제협력 강화
국제협력에 있어서는 기 구축된 4대 해외거점(베트남, 중국, 인도네시아, 코스타리카) 및 전략적 지역에 신규센터 1곳 (중앙아시아 또는 남미 지역)을 구축 운영하여 전략적 해외 생명연구자원 확보를 강화하고 해외거점의 범부처적 공동 활용을 통한 이익 공유 모델을 개발하는 한편 주요 선진국과의 협력 네트워크 강화를 통한 국제 컨소시엄 및 관련 프로젝트에 참여하는 등 해외 생명자원 확보 및 국제적 이슈 대응을 위한 국제협력을 강화할 방침이다.
(5) 향후 추진 계획
국내외 환경변화를 반영한 ʻ제2차 생명연구자원관리 기본계획(2016∼2020)67)ʼ을 바탕으로 선택과 집중을 통한 전략적 생명연구자원 확보, 고부가가치 생명연구자원의 확보・활용 및 산업기반 조성, 생명연구자원 통합관리체계 고도화 등을 추진하고자 하며 생명자원의 공유 및 정보 네트워크 통해 수요자 기반의 자원 가치제고 및 유용 생명연구자원의 활용을 강화하고, 고부가가치 생명연구자원의 전략적 확보 및 국가차원의 연구자원 관리의 체계화 등을 위한 범부처 협력을 강화할 예정이다.
다. 농업분야의 육성 및 관리(농림축산식품부)
농림축산식품 분야의 생명자원 육성 및 관리정책은 2007년 제정된 ‘농업유전자원의 보존・관리 및 이용에 관한 법률’을 2011년 ‘농수산생명자원의 보존・관리 및 이용에 관한 법률’로 개정하면서 농림축수산 분야 전반에 걸친 생명자원의 종합적인 보존・관리 및 이용의 근거를 마련하였다. 현재는 ‘농업생명자원의 보존・관리 및 이용에 관한 법률’과 ‘해양수산생명자원의 확보・관리 및 이용 등에 관한 법률’로 이원화(2017년 6월)되었다.
상기 법령에 근거하여 ‘농업생명자원 보존・관리 및 이용활성화를 위한 기본계획’ 제1차(2009∼2013) 및 제2차(2014∼2018) 기본계획을 수립하고, 매년 시행계획을 수립・시행하고 있다. 현행 2차 계획은 ‘자원 주권 강화’와 ‘세계 5대 농생명자원 강국 실현’이라는 목표달성을 위해 전략적 자원 확보, 맞춤형 관리체계 구축, 안전한 보존 및 산업화 생태계 조성이라는 4대 추진전략을 제시하고 있다.

[그림 2-10] 제2차 농생명자원 보존・관리 및 이용활성화를 위한 기본계획의 4대 추진전략

[그림 2-11] 농생명자원서비스 운영체계
농림축산식품부는 기관별 분산 관리・운영되고 있는 농업생명자원에 대한 서비스 일원화 및 통합 관리를 위해 생명자원통합정보서비스(BRIS)를 구축・운영하고 있다.
또한, 농업생명자원법에 따라 농촌진흥청(국립농업과학원, 국립축산과학원), 산림청(국립수목원, 국립산림품종관리센터, 국립산림과학원), 농림축산검역본부를 책임기관으로 하여 유전자원에 대한 수집・보존・특성평가 및 분양 등의 역할을 수행하고 있다. 농업생명자원에 대한 이용활성화를 위해 전국의 대학, 연구소 및 지자체 중 특정 기관을 관리기관으로 지정하여 기관의 특성에 맞게 자원의 수집, 단기보존 및 특성평가 수행과 다양성 확보와 이용에 관한 연구를 담당하도록 하고 있다. 농업생명자원 관리기관으로 지정된 곳은 지자체 61곳, 대학 46곳, 민간 19곳으로 총 126개소가 운영 중이며, 보존・관리중인 농업생명자원은 총 32,036종 1,595,971점으로, 각 기관 및 분야별 자원보존 현황을 아래 표와 같다.
|
구분 |
계 |
종자 |
영양체 |
미생물 |
가축 |
곤충 |
|
합계 |
126 |
39 |
62 |
11 |
12 |
2 |
|
지자체 |
61 |
9 |
43 |
- |
9 |
1 |
|
대학・민간 |
65 |
30 |
19 |
11 |
3 |
1 |
|
기관 |
분야 |
종수 |
보존점수 |
|
농진청 |
종자 |
1,553 |
217,909 |
|
영양체 |
996 |
28,027 |
|
|
미생물 |
6,890 |
23,692 |
|
|
가축 |
7 |
9937 |
|
|
곤충 |
19 |
374 |
|
|
계 |
9,465 |
279,939 |
|
|
산림청 |
종자 |
4,625 |
46,805 |
|
영양체 |
4,128 |
408,523 |
|
|
미생물 |
851 |
4,627 |
|
|
DNA |
84 |
139,270 |
|
|
산림청 |
현지내보존집단 |
64 |
2,938 ha |
|
표본 |
10,773 |
710,419 |
|
|
계 |
20,525 |
1,309,644(2,938 ha) |
|
|
검역본부 |
병원균 |
124 |
5,838 |
|
세포주 |
47 |
62 |
|
|
기타 |
128 |
964 |
|
|
계 |
299 |
6,864 |
|
|
합계 |
32,036 |
1,595,971(2,938 ha) |
|
라. 보건의료분야의 육성 및 관리(보건복지부)
미래 보건의료연구의 핵심 인프라인 인체자원의 국가적 종합관리를 위해 한국인체자원은행사업(KBP, Korea Biobank Project)을 추진하고 있으며, KBP 1, 2기(2008~2015)의 성과를 바탕으로, 미래 보건의료 연구 및 관련 기술개발에 있어 산·학・연 전반에 걸친 적극적인 지원을 목표로 KBP 3기(2016~2020)를 추진하고 있다.
(1) 추진배경
(가) 개인별 유전체 연구의 급속한 발전에 따라 보건의료연구 및 산업계의 대량 인체자원 수요 증가
(나) 그간 성과를 바탕으로 보다 강화된 고품질 특화자원의 수집체계 마련, 분양 확대 등을 통해 구체적 성과창출 필요
(2) 추진전략
(가) 바이오뱅크 포럼 운영, 인체자원은행-보건의료 R&D 연계 등 수요자 친화적 바이오뱅크 운영
(나) 질환중심형 바이오뱅크 구축·운영, 산업계 분양 확대 등 바이오뱅크의 보건의료 R&D 전주기 지원 성공모델 제시
(다) 바이오뱅크 국제협력 체계 구축, 인체자원 관리 기술 및 시스템 강화, 단위은행별 자원 수집·활용체계 강화 등 바이오뱅크 운영 고도화

[그림 2-12] 3기 한국인체자원은행사업(KBP) 추진전략 및 과제
(3) 추진 현황 및 성과
(가)중앙은행과 17개 인체자원단위은행 및 2개 협력병원이 네트워크를 구성하여 다양한 코호트 및 질환군 인체자원 수집
(나)2016년 12월 기준, 77만여 명분 인체자원 확보, 1,900여 개 과제에 분양, 논문(750여 편) 및 특허(46건) 성과 창출
(다)인체자원 분양데스크, 인체자원연구지원센터 운영 등 연구자 중심의 분양지원 체계 구축 및 실무자 교육, 인체자원은행 운영지원 등 인체자원 관리 표준화를 통해 인체자원 국가 종합관리체계 마련
(라)특정질환 극복을 목적으로 보건의료 R&D 연구를 위한 고부가가치 자원을 계획적으로 확보하기 위한 ‘질환중심형 바이오뱅크’ 구축

[그림 2-13] 한국인체자원은행네트워크 운영 현황

[그림 2-14] 중앙은행 및 인체자원단위은행 수집·활용성과
(4) 향후 추진계획
(가) 바이오뱅크 포럼 운영 등 수요자 중심의 소통채널 마련 및 바이오뱅크 인지도 향상을 위한 홍보사업 지속 전개
(나) 인체자원 품질관리기술 개발, 자원 및 정보 품질 관리 확대 등 지속적인 자원 신뢰도 제고
(다) 체액자원, 질환패널자원 등 분양다상자원 지속 확대
(라) 산업체 분양 확대 등 다양한 연구·개발 분야의 효율적 지원
(마) 질환중심형 바이오뱅크 지속 운영
마. 야생생물자원분야의 관리(환경부)
(1) 자생 생물자원 관리 정책
환경부는 생물다양성의 종합적・체계적 보전과 지속가능한 이용을 위한 ‘생물다양성협약68)’의 이행에 관한 사항을 정함으로써 국민생활을 향상시키고, 국제협력을 증진하기 위한 목적으로 ‘생물다양성 보전 및 이용에 관한 법률’을 제정(2012년 2월 1일)하였다.
또한 생물자원 조사・발굴, 보전・관리, 해외협력 강화 등을 골자로 하는 ‘생물자원 보전관리 및 이용 마스터플랜(2011∼2020)’과 , 자연생태계 서식지 보호, 야생생물 보호・복원 등에 ‘자연환경보전 기본계획(2016∼2025)’ 등을 통해 법적 기반을 근간으로 한 실행력을 확보하고 있다.
(2) 자생 생물자원의 확보・관리・활용 연구 현황
환경부는 국가생물자원의 조사・보전・관리 및 현명한 이용을 위한 정책을 추진하고 있다. 현재까지 지속적인 투자와 연구를 통해 47,003종의 국가생물종목록(2016년 12월)을 구축하고 283만점의 표본을 확보・관리하고 있으며, 생물종 정보, 유전자원 정보, 유용성 정보 등 각 부터에서 따로 관리되는 정보를 통합하여 표준화한 1,158만여 건(2016년 12월)의 정보를 국가생물자원 종합관리시스템을 통해 필요한 부처에 제공하고 있다.
유전자원의 접근・이용 및 이익 공유에 관한 법률 제정(2017년 1월 17일) 및 나고야의정서 비준(2017년 5월 19일) 이후 생물자원의 경제적 가치 급등이 현실화되고 각종 생물종 정보에 대한 과학적 요구가 증가함에 따라 이에 적절하게 대응하는 정책과 이를 지원하는 연구가 절실히 필요한 시점이다. 국립생물자원관에서는 내부적으로 생물자원의 보전과 지속가능한 이용을 위해 전통지식 대상종, 해외활용사례 생물종 근연종 대상 등의 효능・성분분석 및 유전체 분석을 수행하여 환경생물산업을 지원하고 있다. 2016년까지 국내・외 638종에 대한 항산화, 항염 등을 연구하여 유용성 정보를 확보하였으며, 최근에는 자생 말벌의 독에서 항균물질을 분리하여 친환경 동물용 백신으로 개발하는 연구가 진행 중에 있다. 또한 외부적으로 다양한 자생생물 소재를 국내 산업체에 제공하기 위해 야생생물 소재은행을 운영하고 있다. 4개 생물소재은행(유전자원, 종자, 천연물, 배양체)을 통해 144,411점의 고품질 생물소재를 확보・관리하여 국내 산학연 기관의 요구에 따라 분양하고 있는데 해마다 분양건수가 크게 늘어나고 있다(2014년 553건→2016년 1,533건). 잠재적 활용가치가 높은 해외 생물자원 소재 접근을 위해 캄보디아, 베트남, 미얀마 등 동남아 14개국 25개 기관과 MOU 및 MOU체결로 해외 네트워크를 확장하고 있다. 특히, 지금까지 이들 국가와 공동연구를 통해 자국 생물다양성 도감 10권을 발간하여 기증하고 9건의 특허도 공동 출원하여 국가간 신뢰도를 높이고 있다. 캄보디아와 공동연구로 현지식물의 미백효능을 확인하고 국내 기업에 기술이전하여 화장품을 개발한 것은 해외생물자원 활용의 좋은 방향성을 제시해 주고 있다.
(3) 향후 계획
앞으로 미발굴 자생종의 발굴 난이도는 점차 증가할 것으로 예상되고 이를 뒷받침해줄 국내 전문인력 또한 부족한 상황이다. 이를 위해 환경부는 생물자원 전문인력 양성사업을 운영하여 국내 연구자 인프라가 부족한 생물분류군 전문가를 양성해 나가고 있으며, 2016년 한해 9명이 학위를 취득하였다. 최근에는 곤충, 무척추동물, 균류, 지의류 등 대량발굴 가능성이 높은 분류군을 중심으로 자생종 발굴에 집중하고 있다. 이를 기반으로 한 지금까지 알려지지 않은 생물종에 대한 유용성 연구는 식품, 의약품, 향장품 등 다양한 분야에 새로운 가능성을 열어줄 수 있을 것으로 기대된다. 동시에 부족한 국내 생물자원을 대체할 해외생물자원 확보를 강화하기 위해 협력국을 동남아시아에서 남미, 아프리카까지 확대하여 국내 생물산업 지원을 위한 영역을 넓혀가고자 한다. 또한 지속적으로 늘어나는 생물산업 소재 요청을 지원하고 체계적인 생물소재의 관리를 위해 야생생물소재연구동을 건립하여 국가차원의 안정된 생물소재의 수급을 추진하고자 한다.
바. 해양수산생명자원 분야의 육성 및 관리정책(해양수산부)
(1) 해양수산생명자원의 확보 현황
생명자원의 주권화 및 이익공유를 인정하는 나고야의정서(ABS)의 발효(2014년 10월) 및 국내 발효로 해양수산생명자원의 이용에 관한 국제지침 마련의 움직임 등 세계적으로 해양수산생명자원의 중요성이 날로 증가하는 추세이다. 세계 각국은 더 많은 해양수산생명자원을 확보하기 위해 치열한 경쟁을 벌이고 있다. 해양수산부는 국제적인 환경변화와 미래의 수요를 반영할 수 있는 국가차원의 해양수산생명자원의 확보・관리 및 이용하기 위한 다양한 정책을 추진하고 있다.
해양수산부는 2008년부터 해양수산생명자원 기탁등록보존기관 사업으로 해양수산생명자원에 대한 관리 사업을 시작하였으며 2008년부터 2017년까지 해양생명자원 확보 및 활용기반 구축에 595억 원을 투자하였다. 국내 대학 및 연구기관 등에 주요 해양수산생명자원 분류군별 자원의 채집・기탁 및 활용기반 구축이 이루어지도록 하였으며, 현재 18개 해양생명자원 기탁등록보존기관을 지정・운영하고 있다.
한편 해외 해양수산생명자원의 발굴과 확보의 우선순위를 설정하고, 기존에 확보된 해양수산생명자원을 활용한 연구의 거점사업을 육성해 나가고 있다. 2009년부터 2016년까지 해외 해양생물자원 개발 및 활용기반 구축 1, 2단계 사업으로 마이크로네시아, 베트남, 필리핀, 인도양, 통가 해역, 동중국해 등지에서 해양수산생명자원을 채집하고 있으며, 인도네시아(LIPI). 러시아(PIBOC), 베트남(IMBC), 필리핀(UPV), 콜롬비아 등의 해외연구기관과 양해각서(MOU)를 체결하였다. 해양생명자원관은 1, 2단계 해외 해양생물자원 확보사업을 통해 해양생물자원 2,116종, 15,890점과 해양미생물 1,207종, 12,209점을 확보한 바 있다. 또한 해외 생물자원활용연구를 통해 8,680종의 추출물을 분석하여 추출물 라이브러리를 구축하고 있다. 해양수산부는 해양수산생명자원의 확보에 그치지 않고, 확보한 해양생명자원의 표준화 및 통합 DB 구축을 통해 분산된 실물정보 연계 및 통합검색에 의한 국가 해양생명자원 관리기반 구축을 2011년부터 추진해오고 있다. 이 사업을 통해 해양생명자원 통합정보시스템(MBRIS)을 구축하였으며, 6,446종 263,910점(2017년 12월 기준)의 자원을 정보화하였다.
(2) 해양수산생명자원 육성 및 관리정책
해양수산부는 해양수산생명자원의 중요성을 인식하고 이에 대한 체계적인 육성 및 관리를 더욱 강화해나갈 계획이다. 2015년에는 해양수산생명자원의 체계적인 관리를 위해 2012년 제정된 ‘해양생명자원의 확보・관리 및 이용 등에 관한 법률’과 ‘농수산생명자원의 보존・관리 및 이용 등에 관한 법률’ 통합에 착수하여 2016년 12월 28일 ‘해양수산생명자원의 확보・관리 및 이용 등에 관한 법률’을 전부 개정하였다.
해양수산생명자원에 대한 육성 및 관리정책에 대한 총괄 기관인 국립해양생물자원관이 2015년 4월에 개관하였으며, 해양수산생명자원조사, 해외해양생물자원 개발 및 활용기반연구(2단계) 사업 등 국가해양수산생명자원의 실물 및 관련정보의 지속가능한 보존관리를 위한 인프라 체계를 구축 중에 있다. 또한 국립해양생물자원관과 함께 국립수산과학원을 책임기관으로 지정하여 해양수산생명자원의 확보・관리 및 연구, 통합정보시스템 운영, 기탁등록기관 간의 정보교류 등의 업무를 수행하고 있다.
한편 해양수산생명자원 기탁등록보존기관을 18개 기관에서 2020년 20개 기관으로 확대해 나갈 계획이다. 해외 해양생명자원의 확보에 관한 부분에 있어서도 현재의 남태평양 중심의 자원 확보에서 벗어나 극지 등 그 영역을 확대시켜 나갈 것이다. 위와 같은 일련의 정책들을 통하여 우리나라가 세계적으로 경쟁이 가속화되고 있는 해양수산생명자원 확보에서 우위를 선점할 수 있도록 할 계획이다.
10. 국제협력 R&D 및 국가 간 협력
가. 과학기술 국제협력 개요
기후변화, 에너지, 식량, 감염병 등 전 세계적인 영향력을 갖는 문제들이 늘어가고 있으며, 개방형 기술혁신이 가속화됨에 따라 과학기술, 특히 생명공학분야의 국제협력의 중요성이 한층 부각되고 있다. 국제 연구개발 환경의 변화에 대응하여 새로운 창조적 지식가치를 창출하고 생명공학 연구개발을 통해 글로벌 공동 이슈 해결에 앞장서기 위해서는 정부 연구개발사업의 목표와 성과가치를 재설계하는 노력이 필요한 시점이다.
과학기술 국제협력사업에 대해서는 국제과학기술협력규정(대통령령 제24423호) 및 산업기술혁신촉진법(법률 제11713호)에 각각 일부 정의되어 있고, 과학기술정보통신부가 매년 추진하는 정부 연구개발사업에 대한 조사・분석의 정의를 따른다면 국제협력은 과학기술 외국연구기관(외국인)의 참여가 있는 위탁연구와 외국연구자 유치, 연구자 해외파견, 정보교환, 기술연수, 국제협약의 참여 형태로 추진되는 공동연구개발 활동으로 정의할 수 있다.
정부 주도의 과학기술 국제협력은 내용에 따라 협력협정체결, 국제기구・지역기구 등 다자간 협력체 참여 등과 같은 기술외교형과 인력교류, 해외연수 및 파견, 해외연구소 유치 등과 같은 자원교류형, 그리고 해외공동연구센터 설립, 대형 국제프로젝트 참여 등과 같은 거점구축형, 다음으로 국제공동연구, 해외위탁연구 등과 같은 공동연구형, 마지막으로 기술조사단, 인프라조사 사업 등과 같은 기반조사형으로 구분할 수 있다(홍성범 외 4, 2000).
|
협력 내용 |
기술외교형 |
협력협정체결, 정상 및 각료급 회담, 실무회담, 국제기구・지역기구 등 다자간 협력체 참여, 국제회의 주관 및 참여 |
|
자원교류형 |
인력교류, 해외연수 및 파견, 정보교류, 해외연구소 유치, 국제 세미나 개최, 단기기술자문 활용 |
|
|
거점확보형 |
해외공동연구센터 설립, 해외사무소 설립, 대형 국제프로젝트 참여, 국제기구 참여 |
|
|
공동연구형 |
국제공동연구, 해외위탁연구, 단기실용화 사업, 전략적 제휴 |
|
|
기반조사형 |
기술조사단, 인프라조사 사업, 해외전시회 참관 |
* 자료: 홍성범 외 4. (2000). 국별・기술별 과학기술 국제협력 현황점검 및 추진전략: 공공부문을 중심으로. 과학기술정책연구원.
공동연구, 특히 국제공동연구는 다른 국가에 속한 경제 주체 간에 공동연구개발이 일어나는 활동이라고 할 수 있으며(윤종민, 2008), 높은 연구개발비용과 위험을 분담하면서 동시에 한 국가가 개별적으로 R&D를 수행할 때보다 더 큰 성과를 창출할 수 있다(김정홍, 2000).
하지만 우리나라의 국제협력은 특히, 생명공학을 비롯한 기초연구에서 다른 국가들에 비해서 미흡한 실정이다. 다음 그림에 나타난 바와 같이, 주요국의 논문 성과에서 해외와 협력을 바탕으로 한 논문비중은 영국(59.2%), 프랑스(57.2%), 독일(54.8%) 등 유럽 국가들이 높으며, 미국은 37.8%에 이른다. 우리나라는 28.7%로 일본(29.1%)과 비슷한 수준으로 다른 국가들은 그동안 국제공동 논문을 늘려왔지만 한국은 지난 30년 동안 크게 개선되지 않는 상황이다.
연도별 피인용 상위 1% 논문의 국제협력연구 비율에서 확인할 수 있는 것처럼 국제협력의 성과이거나 저명 학술지에 게재된 논문일수록 피인용 논문이 될 가능성이 높다. 또한 최근 국제 논문활동에 대한 실증적 연구결과에 따르면, 국제공동연구 활동이 활발할수록 과학 활동이 활발하다는 것을 알 수 있다.
(단위: %)

* 출처: 톰슨 로이터 Web of Science XML(SCIE 2014년말 버전)
[그림 2-15] 주요국의 국제공동 논문 비중 추이

* 출처: 2014년도 주요국의 피인용 상위 1% 논문실적 비교분석 보고서, 2015.11., 한국연구재단
[그림 2-16] 연도별 피인용 상위 1% 논문 국제협력연구 비율

출처: Geuna, A.(2015), Global Mobility of Research Scientists, Elsevier
[그림 2-17] 국제과학협력의 정도가 과학 활동에 미친 영향
2017년 5월 출범한 문재인 정부의 국정운영 5개년 계획에 따르면 정부는 더불어 잘 사는 경제를 이룩하기 위해 과학기술의 발전과 미래 성장산업을 적극적으로 지원할 계획이다. 2017년도 정부연구개발 투자방향에서도 ‘국제협력 연구 강화를 통한 국제적 위상 제고’를 핵심 추진방향으로 설정하고 선진국과의 기술협력, 개발도상국과의 기술 지원, EU 및 아시아 신흥기술 강국과의 글로벌 R&D 협력 네트워크 구축 등이 제시되었다.
하지만 2016년도 국제협력 분야 정부 R&D 예산은 3,019억 원으로 2014년 3,649억 원 대비 630억 원이 감소했다. 정부 부처별 예산 현황은 2016년에 국제협력 R&D사업에 과학기술정보통신부(1,709억 원), 산업통상자원부(828억 원), 농촌진흥청(203억 원) 순으로 투자했다. 부처별 투자 현황을 기준으로 2014년 국제협력분야 R&D과제에 연구개발단계별 미래부(현 과기부)의 기초연구 투자가 1,398억 원으로 가장 많았으며, 산업부의 개발연구(640억 원), 과기정통부의 응용연구(218억 원) 순이다.
[표 2-28] 국제협력분야 정부 R&D 예산 현황(2012∼2016)
|
구분 |
2012 |
2013 |
2014 |
2015 |
2016 |
연평균 증가율 |
||
|
정부연구개발예산 |
160,244 |
169,090 |
177,793 |
188,931 |
190,942 |
4.5 |
||
|
|
국제협력분야 |
3,354 (2.1%) |
3,855 (2.3%) |
3,469 (2.0%) |
3,534 (1.9%) |
3,019 (1.6%) |
Δ2.6 |
|
|
|
|
ODA사업예산 |
190 |
216 |
237 |
244 |
257 |
7.8 |
|
|
|
비ODA사업예산 |
3,164 |
3,639 |
3,232 |
3,290 |
2,762 |
Δ3.3 |
(단위: 억 원)

[그림 2-18] 부처별/연구단계별 국제협력 R&D과제 투자 현황(2014)
과학기술표준분류별 투자현황을 기준으로 원자력(558억 원, 17%), 전기/전자(313억 원, 10%), 에너지/자원(298억 원, 9%), 보건의료(288억 원, 9%), 생명과학(215억 원, 7%) 순으로 투자되었다.
2016년도 국가연구개발사업으로 지원한 총 47,789건의 과제 중 540건(1.3%)의 과제가 총 808건의 국제 공동・위탁연구를 수행했으며, 2015년도 대비 국제 공동연구는 20.3%(105건) 증가한 622건, 국제 위탁연구는 전년대비 1.1%(2건) 감소한 186건에 이른다. 국제 공동・위탁연구의 국가별 수행건수를 살펴보면 미국(201건)이 가장 많으며 그 다음으로 독일(66건), 중국(54건) 등의 순이다.
(단위: 억 원)

[그림 2-19] 과학기술표준분류별 국제협력 R&D과제 투자 현황(2014)
(단위: 건)

* 출처: 2016년도 국가연구개발사업 조사・분석 결과(안)
[그림 2-20] 국가별 국제 공동・위탁연구 추이(2015~2016)
나. 해외 동향
미국, 독일, 일본 등 선진국들은 자국의 과학기술 경쟁력을 유지・강화하기 위해 국제화를 과학기술발전의 중요한 전략으로 추진하고 있다. 2014년 노벨 물리학상 수상자인 일본 나고야대학교 아마노 히로시(Amano Hiroshi) 교수가 언급한 바와 같이 정부차원의 장기적인 국제교류 지원과 국제공동연구에 대한 참여는 세계 최고수준의 연구 성과 도출의 필수조건이라고 할 수 있다. 또한, 주지하듯이 과학기술 분야에서 추격형 모델의 한계를 극복하고 선도적인 위상을 확립하기 위해서는 창조적 지식가치를 창출하는 것이 필수적이며, 이를 위해서는 선진국의 국가별 과학기술 경쟁력에 대한 치밀한 분석을 통해 전략적인 국제협력 연구개발을 추진할 필요가 있다. 이를 위해 우리나라 정부는 과학기술기본법 및 동법 시행령에 근거하여 매 2년마다 ‘기술수준평가’를 실시하고 있으며, 국가적 주요 핵심기술에 대한 기술수준을 평가하여 R&D 투자전략, 기술향상 대책 등 R&D 정책 수립의 기초자료로 활용하고 있다.
2017년 6월에 국가과학기술심의위원회에서 심의한 ‘2016년도 기술수준평가 결과(안)’ 보고서에 따르면, 우리나라의 전체 기술수준 및 기술격차는 최고국가 대비 78.6%, 4.2년으로 2014년도(78.4%, 4.4년)에 비해 기술수준은 0.2% 향상되었고, 기술격차는 0.2년 단축되었다. 국가별로는 미국이 최고의 기술수준 국가로 평가되었으며, EU(94.4%), 일본(92.7%), 중국(71.1%) 순으로 평가되었다. 주요국가의 기술수준 및 기술격차는 아래 표와 같이 기술수준이 선도그룹인 분야는 전자・정보・통신(84.2%)과 기계・제조・공정(81.8%)이며, 바이오, 의료를 비롯한 8개 분야는 추격그룹인 것으로 평가되었다.
[표 2-29] 국가별 전체 기술수준 및 변동 추이
(단위 : %, 년)
|
구분 |
한국 |
중국 |
일본 |
EU |
미국 |
|||||
|
’14 |
’16 |
’14 |
’16 |
’14 |
’16 |
’14 |
’16 |
’14 |
’16 |
|
|
기술수준 |
78.4 |
78.6 |
69.7 |
71.1 |
93.1 |
92.7 |
95.5 |
94.4 |
100 |
100 |
|
기술격차 |
4.4 |
4.2 |
5.8 |
5.2 |
1.6 |
1.5 |
1.1 |
1.1 |
0.0 |
0.0 |
[표 2-30] 10대 분야별 우리나라 기술 및 기술격차 변동
(단위 : %, 년)
|
10대 분야 |
기술수준 그룹 |
기술수준 |
기술격차 |
|||||
|
’14 |
’16 |
’14 |
’16 |
증감 |
’14 |
’16 |
증감 |
|
|
전자・정보・통신 |
선도 |
선도 |
83.2 |
84.2 |
1.0 |
2.7 |
2.2 |
Δ0.5 |
|
의료 |
추격 |
추격 |
77.9 |
77.5 |
Δ0.4 |
4.0 |
3.8 |
Δ0.2 |
|
바이오 |
추격 |
추격 |
77.9 |
77.4 |
Δ0.5 |
4.5 |
4.3 |
Δ0.2 |
|
기계・제조・공정 |
선도 |
선도 |
83.4 |
81.8 |
Δ1.6 |
3.3 |
3.4 |
0.1 |
|
에너지・자원・극한기술 |
추격 |
추격 |
77.9 |
78.3 |
0.4 |
4.6 |
4.5 |
Δ0.1 |
|
항공・우주 |
추격 |
추격 |
68.8 |
67.5 |
Δ1.3 |
9.3 |
9.7 |
0.4 |
|
환경・지구・해양 |
추격 |
추격 |
77.9 |
78.6 |
0.7 |
5.0 |
4.5 |
Δ0.5 |
|
나노・소재 |
추격 |
추격 |
75.8 |
78.6 |
2.8 |
4.1 |
3.8 |
Δ0.3 |
|
건설・교통 |
추격 |
추격 |
79.6 |
79.6 |
0.0 |
4.3 |
4.2 |
Δ0.1 |
|
재난・재해・안전 |
추격 |
추격 |
73.0 |
73.5 |
0.5 |
6.0 |
5.4 |
Δ0.6 |
주요 선진국의 과학기술 정책을 살펴보면, 먼저 미국은 국가 차원에서 장기적이며 경제성장에 중요한 역할을 할 수 있는 목표지향적인 전략과제를 중점적으로 지원하고 있다. 2009년 발표된 과학기술외교전략에 따르면, 더욱 지속적인 천연자원 활용, 생물다양성의 보존과 기후변화영향의 탄력성을 촉진하기 위한 기술적 진보의 촉진을 포함한 연구에 초점을 맞추고 있다. 특히, 미국 정부는 외교 전략에 신기술이 필요한 생명공학 분야를 포함하여 과학적・기술적 적용의 지원을 통해 농업생산성을 향상시켜 더욱 안정적이고, 영양이 풍부하며 구매 가능한 식품을 공급하겠다는 계획을 포함하고 있다.
또한 새로운 제품과 서비스 개발을 위해 기초연구에 투자하고 있으며, 기초연구 지원을 전담하고 있는 미국 국립과학재단(National Science Foundation, NSF)은 2018년 회계연도에 경쟁적 탁월성 평가를 통해 약 11,000건(신규과제 8천여 건 포함)을 지원할 예정이다. 2012년부터 과학과 교육을 연계하여 다학제적으로 국제적 이슈를 해결하기 위한 국제협력사업 SAVI(Science Across Virtual Institutes)를 추진하고 있다.
[표 2-31] 2018년도 미국 NSF 바이오 분야 투자 계획(안)
|
투자 분야 |
2016 회계연도 집행 |
2017 회계연도 (미정) |
2018 회계연도 요청안 |
FY 2016 회계연도 비교 변화 |
|
|
차액 |
(백분율) |
||||
|
분자세포생물학 (MCB) |
135.46 |
- |
123.21 |
Δ12.25 |
Δ9.0% |
|
통합유기체계 (Intergrative Organismal Systems (IOS)) |
214.21 |
- |
111.20 |
Δ103.01 |
Δ48.1% |
|
환경생물 (DEB) |
143.96 |
- |
130.78 |
Δ13.18 |
Δ9.2% |
|
생물 인프라구조 (DBI) |
144.61 |
- |
169.61 |
25.00 |
17.3% |
|
신흥 프론티어 (EF) |
85.53 |
- |
137.31 |
51.78 |
60.5% |
|
총합 |
723.78 |
- |
672.11 |
Δ51.67 |
Δ7.1% |
미국의 과학기술 부문 예산은 트럼프 행정부의 예산 삭감 제안에도 불구하고 여전히 우리나라의 10대 국가전략기술 분야를 기준으로 모든 분야에서 세계 최고의 기술수준을 확보하고 있기 때문에 과학기술 발전을 위해서는 필수적인 협력 대상국이라고 할 수 있다. 한국으로서는 미국과 장기적이고 견고한 협력관계를 확대해야 하며, 신진인력교류 활성화, 대규모 공동연구 확대, 우수 연구기관 유치 등 장기적인 관점에서 성과를 도출할 수 있도록 지속적인 지원이 필요하다. 특히, 미국이 주도하고 있는 대형 연구에 적극적으로 참여하는 것은 세계적인 과학기술 의제를 선점할 수 있고 이에 따른 경제적・산업적 파급효과가 클 것으로 기대된다.
유럽연합(EU)의 경우는 환경, 에너지 등 회원국의 공동 문제 해결을 위해 1984년부터 Framework Programme을 추진하고 있으며, 2014년부터 시작된 제8차 Framework Programme은 Horizon 2020으로 이름을 바꾸어 전 지구적 문제 해결을 위한 국제협력을 확대하고 있다. 특히, Horizon 2020에서는 EU 내에서의 협력뿐만 아니라 EU에 속하지 않은 국가들과의 협력을 통해 EU의 과학기술 경쟁력을 높이는 프로그램에 예산 투입을 늘렸다.
유럽연합의 2016년도 기술수준은 94.4%로 평가되었으며, 비교우위 강점 기술 분야는 환경/지구/해양 분야와 기계/제조/공정 분야 등을 들 수 있다. 지난 10년간(2006∼2015) 논문 점유율 평균은 EU가 26.2%로(우리나라 평균은 4.1%, 중국 21.3%, 미국 18.6%, 일본 4.7%) 1위를 차지했다. Horizon 2020은 비회원국과의 활발한 협력을 통한 시너지 창출을 목표로 삼고 있으므로 우리나라 정부 차원의 적극적이고 전략적인 참여가 필요한 상황이다. 그 중에서도 에너지, 환경, 기계 등 다양한 분야의 국제협력을 적극적으로 추진한다면 경제적・산업적 파급효과가 클 것으로 기대된다.
일본의 경우는 과학기술을 경제사회적 활력의 핵심 요소이며 사회의 요구와 미래에 대한 선행 투자로 인식하고 인재육성과 연구성과의 산업화를 위한 시스템 개혁을 적극적으로 추진하고 있다. 일본의 2016년도 전체 기술수준은 92.7%로 평가되었으며 비교우위 강점 기술 분야는 건설・교통과 나노・소재 등을 들 수 있다. 또한, 초정밀 디스플레이 공정 및 장비기술, 환경 친화 자동차기술, 맞춤형 신재배기술 등은 세계 최고의 기술력을 확보하고 있다. 특히 일본은 2016년도 노벨생리의학상(동경공업대 오스미 요시노리 명예교수)을 수상했고, 과학 분야에서 노벨상을 총 20회 수상했을 정도로 기초과학이 발달해 있으므로 일본과 인접해있다는 지리적 장점을 살려 인력교류를 확대하고, 심화 공동연구를 강화하고, 첨단산업 분야의 국제 협력이 필요한 상황이다.
유럽연합 회원국 중 독일은 가장 안정적으로 경제 성장세를 보이고 있으며, 과학기술 분야에 매우 적극적으로 투자하고 있다. 독일 정부는 우수한 연구결과를 신속히 제품화하는데 적극적으로 지원한다는 목표로 17개 핵심기술을 도출, 분야별로 구체적인 전략을 제시하고 있으며, 산학연계, 혁신적 중소기업을 위한 여건을 개선하고 있다. 특히 독일의 ‘첨단기술전략 2020(High-tech Strategy 2020 for Germany)’은 정부, 연구원, 산업계 전문가의 참여 아래 범정부 차원에서 수립한 국가 과학기술육성전략이다. 이 전략의 골자는 전 지구적으로 대응할 필요가 있는 기후보호 및 에너지, 보건 및 영양, 이동성, 커뮤니케이션, 보안 등 5개 영역에서 총 11개의 과학기술 개발 우선추진 과제(Forward-looking Projects)를 목표로 하는 국제과학기술 협력이다. 이러한 시점에 한국 정부도 첨단과학기술연구와 관련된 장기적인 협력전략을 수립할 필요가 있으며, 독일과 함께 견고한 협력관계를 통해 전 지구적 대응에 동참할 필요가 있다. 특히 독일은 유럽통합의 가장 큰 공로국가로서 유럽 내에서 첨단 과학기술 이외에도 그 어느 나라보다 적극적인 자세를 취하고 있다는 점에서 협력의 기회가 높아지고 있다고 할 수 있다.
마지막으로 중국의 경우 1980년대 이후 정부 주도의 과학기술 연구발전 계획이 본격적으로 시행되어 상대적으로 기초과학 분야가 취약한 것으로 평가되고 있지만, 최근 들어 기초연구의 국제적 선진화 달성을 위해 중점적으로 투자를 확대하고 있다. 중국의 2016년도 전체 기술 수준은 71.1%(2014년 69.7%)이며, 우리나라와의 기술격차가 2014년 1.4년에서 2016년 1.0년으로 축소될 정도로 추격 속도가 빠르다. 특히 건설/교통, 바이오 분야의 성장 속도가 빠르며, 2014년도 항공우주 분야는 우리나라가 4.3년이나 뒤쳐진 것으로 평가되었다. 양국 간 과학기술 경쟁력의 차이가 빠르게 축소되고 있으므로 기술수준 차이를 고려한 분야별 세부 협력 프로그램을 마련하여야 하며, 중국이 미래 자원 및 에너지 확보 등을 공세적으로 추진하고 있으므로 해당 분야의 한-중 협력을 증진할 특화 프로그램이 필요하다.
다. 국내 현황
과학기술정보통신부가 2017년 2월 발표한 ‘2015년도 과학기술・ICT 국제화사업 시행계획’에 따르면, 과학기술정보통신부는 과학기술・ICT 국제협력 및 해외진출 지원을 통해 글로벌 혁신 리더십을 강화하는 것을 목표로 삼고 있다. 이를 위해 창업・벤처기업의 해외진출 성과를 확대하고, 과학기술・ICT 협력 강화로 우리나라의 글로벌 위상을 제고하며, 성과창출에 기여하는 글로벌 협력체제와 인프라를 확충해 나갈 계획이다. 특히 생명공학 분야에서는 전략적 해외 생명자원 및 연구소재 확보를 위한 정보 분석 및 기획기능을 강화하고 지역별 거점구축 및 범부처적 활용강화 등 이익공유 모델을 개발하는 한편 국제 컨소시엄 활동을 활성화 하는 등 해외 생명자원 확보를 위한 국제협력을 강화할 방침이다. 또한 주요 선진국과의 협력을 통한 핵심 고부가가치 자원을 확보하는데 주력할 방침이다.

[그림 2-21] 바이오 분야 기술수준 및 격차 변화(2016년도 기술수준평가 결과)
2017년 6월 국가과학기술심의위원회에서 심의한 기술수준 평가 결과에 따르면, 2016년도 한국의 바이오 분야 기술수준은 선진국에 비해 77.4%로 2014년도에 비해
0.5%p 감소했고, 중국의 추격이 빨라짐에 따라 대중국 기술격차는 1.5년에 불과하여 위기감이 고조되고 있는 상황이다. 세부기술을 살펴보면, ‘줄기세포기술(분화・배양기술)’(84.0%)의 기술수준이 상대적으로 높은 편이며, ‘바이오 인공장기 개발기술’(70.4%)이 가장 낮은 수준으로 평가되었다. 기술격차는 ‘농축수산자원 질병 예방・대응・치료기술’(5.4년)이 가장 큰 것으로 평가되었다.
한국의 의료분야 기술수준은 선진국에 비해 77.9%로 2012년도에 비해서는 0.3% 향상되었으나, 중국의 추격이 매우 빨라짐에 따라 대중국 기술격차는 –1.5년에 불과한 상황이다. 세부기술을 살펴보면, ‘불임・난임 극복기술’(88.6%)의 기술수준이 상대적으로 높으며, ‘뇌・신경계 기능 분석기술’(68.1%)은 가장 낮은 것으로 평가되었다. 기술격차는 ‘맞춤형 신약개발기술’(5.8년)이 가장 큰 것으로 평가되었다.

[그림 2-22] 의료 분야 기술수준 및 격차 변화(2016년도 기술수준평가 결과)
정부가 국제협력 활성화를 위해 추진하고 있는 사업은 부처별로 매우 다양하지만, 본 백서에서는 부처별로 다양한 국제협력 사업 중에서 과학기술정보통신부와 교육부의 주요 사업들에 대한 지원 현황과 우수성과를 분석할 계획이다. 연구개발을 중심으로는
과학기술정보통신부와 산업통상자원부가 주도하고 있으며, 교육부에서는 연구의 네트워크를 확대하는 사업을 시행하고 있다.
과학기술정보통신부는 2017년도에 글로벌공동R&D 및 인력양성사업 660억 원, 글로벌협력기반조성사업 370억 원 등 약 1,654억 원(2016년 대비 약 15억 원 증가)을 배정했으며, 산업통상자원부는 산업기술국제협력사업에 2016년도 대비 약 62억 원이 감소한 557억 원을 배정하였다. 교육부는 2015년 글로벌연구네트워크지원사업(Global Research Network)에 2016년보다 약 22억 원 감소한 약 53억 원을 배정했다. 2016년도까지 교육부가 지원하던 국제백신연구소69)에 대한 지원 업무는 2017년부터 보건복지부가 맡고 있으며, 2017년도 지원예산으로는 2016년보다 약 4억 원이 증가한 61억 원을 배정했다.
과학기술정보통신부의 국제협력사업 중 한국연구재단을 전문기관으로 지정하여 추진하고 있는 국제협력연구개발사업은 크게 글로벌연구실지원사업(Global Research Laboratory), 국제화기반조성, 글로벌협력기반조성(ODA), 해외우수연구기관 유치(Global Research and Development Center), 과학기술네트워크지원사업 등의 내역사업으로 구분할 수 있다. 이외에도 한국연구재단은 교육부가 시행하고 있는 글로벌연구네트워크지원사업, 한-EU 교육협력사업, 국제협력선도대학사업 등을 추진하고 있다. 또한 한국연구재단은 약 89억 원의 출연금으로 한중일교류협력사업, 한독공동기금지원, 한스웨덴 공동기금지원, 연구교류지원사업, 개도국지원사업, 국제응용시스템분석연구원(IIASA)협력사업 등도 추진하고 있다.
[표 2-32] 국제협력 분야 정부연구개발예산 편성 현황(2012∼2016)
|
부처 |
사엄명 |
|
교육부(4) |
국제백신연구소지원, 글로벌연구네트워크지원, 대학연구인력국제교류지원, 세계수준의연구중심대학육성 |
|
국무조정실(7) |
개발도상국가와의교육과학기술협력에관한연구, 국제개발협력역량강화사업(ODA), 국제학생석사학위과정(ODA), 국제환경평가교류협력사업(ODA), 대개도국과학기술정책협력사업(ODA), 세계은행과의공동연구사업(ODA), 아태지역양성평등정책인프라강화연수사업(ODA) |
|
기상청(1) |
아태기후정보서비스및연구개발 |
|
농촌진흥청(2) |
국제농업기술협력, 해외농업기술개발지원(ODA) |
|
과학기술정보통신부 (19) |
IAEA기술협력부담금(ODA), 개도국과학기술부담금(ODA), 개도국과학기술지원(ODA), 과학기술국제부담금, 과학기술국제협력네트워크지원사업, 국가간협력기반조성, 국제교류협력연구기획평가, 국제연구인력교류, 국제핵융합실험로공동개발(일반, 기금), 글로벌연구실사업, 기후변화대응기술개발, 막스플랑크한국연구소설치, 아태이론물리센터지원, 원자력국제협력기반조성, 프라운호퍼IME한국연구소설립, 한국파스퇴르연구소운영, 해외과학기술자원활용, 해외우수연구기관유치 |
|
산림청(1) |
산림과학연구공적개발원조(ODA) |
|
산업통상자원부(3) |
산업기술국제협력, 에너지국제공동연구(에너지특별, 기금) |
|
해양수산부(1) |
해양과학국제연구사업 |
2010년 이후로 과학기술정보통신부가 주관한 국제협력연구개발사업 과제들에 대한 미래유망신기술(6T) 분류 현황을 살펴보면 2016년에 가장 많이 지원한 분야는 생명공학(BT) 분야로 약 297억 원(전체 사업비의 40.7%)을 지원하였다.
[표 2-33] 과학기술국제화사업 미래유망신기술(6T)별 지원 현황(2010~2016)
(단위: 백만 원)
|
구분 |
2010 |
2011 |
2012 |
2013 |
2014 |
2015 |
2016 |
|
IT |
3,742 |
4,256 |
3,917 |
5,209 |
4,120 |
5,170 |
5,267 |
|
BT |
27,911 |
31,948 |
37,804 |
34,128 |
29,546 |
33,968 |
29,689 |
|
NT |
10,568 |
9,179 |
10,764 |
12,813 |
11,873 |
9,932 |
9,844 |
|
ST |
896 |
903 |
1,823 |
318 |
155 |
509 |
- |
|
ET |
7,185 |
7,812 |
8,972 |
7,204 |
7,881 |
4,519 |
4,500 |
|
CT |
- |
17 |
190 |
87 |
15 |
15 |
- |
|
기타 |
20,547 |
18,465 |
17,651 |
25,875 |
23,590 |
25,757 |
23,526 |
|
합계 |
70,850 |
72,581 |
81,119 |
85,633 |
77,181 |
79,870 |
72,826 |
과학기술정보통신부의 국제협력연구개발사업 중 대표적인 사업으로는 글로벌연구실지원사업, 해외우수기관유치지원사업을 들 수 있다. 글로벌연구실지원사업은 핵심기초・원천기술분야에서 해외 우수 연구주체와의 심화된 국제 공동연구를 통해 글로벌 협력 네트워크를 강화하고 국내 연구역량을 세계적 수준으로 제고하는 것을 목적으로 하고 있다. 지원 규모는 연간 5억 원 이내이며, 총 6년(3년+3년)까지 지원한다. 2016년 약 227억 원의 예산으로 총 53과제(신규 10, 계속 43)를 지원하였고, 2017년도는 약 220억 원의 예산으로 같은 예산으로 총 53과제(신규 8, 계속 45)를 지원하였다.
2016년과 2017년에 글로벌연구실지원사업에서 선정한 생명공학분야의 신규과제 목록과 2016년도에 도출된 대표적인 우수성과는 다음과 같다.
[표 2-34] 글로벌연구실지원사업 생명공학 분야 신규 선정과제 목록(2016~2017)
|
연도 |
책임자 |
기관명 |
과제명 |
|
2016 |
윤주헌 |
연세대 |
난치성 알레르기 호흡기질환의 바이오마커 개발 |
|
2016 |
이상규 |
연세대 |
전사인자 기능제어를 통하여 염증성 자가면역 미세환경을 조절할 수 있는 맞춤형 신약개발 |
|
2016 |
류성호 |
포항공대 |
당뇨병 치료를 위한 인슐린 수용체 이성질체의 특이적 조절 연구 |
|
2016 |
송지준 |
KAIST |
퇴행성 뇌질환 발병기작 규명 및 진단/치료제 개발 |
|
2017 |
송민호 |
충남대 |
미토콘드리아 단백질 항상성 조절 |
|
2017 |
김상건 |
서울대 |
간세포 분비 ITIH1제어에 의한 근육장애 조절 및 대사질환 개선 |
[표 2-35] 글로벌연구실지원사업 생명공학 분야 우수성과(2016)
|
○ 연구책임자 : 연세대/ 권호정 교수 (2015년 선정) ○ 천연 화합물 표적 단백질 결정방법 제시 -신약개발의 효율성 강화 및 난치병원리 규명에 기여. 식 화합물의 표적 단백질 결정 방법 제시를 통해 천연물 유래생리활성 화합물 및 약물의 표적 단백질 결정 및 검증기술을 강화할 수 있다. ※ 「Natural Product Reports」 誌 게재 (2016. 5.) |
|
○ 연구책임자 : 서울대/ 김규원 교수 (2011년 선정) ○ 스트레스 상황 암세포의 자기 방어 시스템 해제 방법 규명 -암세포가 항암제나 방사선 치료 등의 스트레스 상황에서 살아남을 있도록 돕는 특정 단백질의 세포방어 역할 방법을 규명하였다. ※ 「Nature Commiunications」 誌 게재 (2016. 10.) |
|
○ 연구책임자 : 연세대/ 권호정 교수 (2015년 선정) ○ 새로운 오토파지 유도 약물 발견 -오토파지 현상을 유도하는 새로운 약물 발견을 통해 오토파지 관련 질환치료제와 혈관 재협착증 방지제 개발 가능성을 제시하였다. * 오토파지: 자가포식 작용으로서 세포 내 오래된 단백질 혹은 제 기능을 못하는 소기관들을 분해하여 다시 세포의 에너지원으로 사용하는 현상 ※ 「Scientific Reports」 誌 게재 (2016. 10.) |
해외우수기관유치지원사업은 해외로부터 연구인력, 기술, 연구비 등이 유입되는 공동연구센터의 국내 설립 및 운영을 지원하여 원천기술을 확보하고 글로벌 연구개발 허브기반을 구축하는 것을 목적으로 하고 있다. 지원 규모는 연간 6억 원 내외이며 총 6년(2년+2년+2년)을 지원한다. 2016년도에는 약 104억 원의 예산으로 19개의 계속과제를 지원했으며, 2017도에는 125억 원의 예산으로 총 19과제(신규 6, 계속 13)를 지원하였다.
위 사업은 2005년 시범사업을 시작한 이후, 미국 Betelle, NIH, CASE, 일본 RIKEN 및 독일 프라운호퍼-IFAM 등 세계의 최고 수준의 연구기관과 함께 설치한 공동연구센터를 지원함으로써 국내 연구개발 역량을 크게 향상시키는 성과를 거두었다. 2017년 현재 생명공학(BT) 분야에서 12개의 공동연구센터를 지원하고 있으며, 대표적인 우수성과는 다음 표와 같다.
[표 2-36] BT분야 해외우수연구기관유치사업 공동연구센터 현황
|
선정 |
센터명 |
주관기관 (연구책임자) |
해외 연구기관 |
기술분야 |
|
2011 |
화순전남대학교병원 프라운호퍼 공동연구소 |
화순전남대 |
독일, 프라운호퍼-IZI |
면역백신 |
|
아산-다나파버 암 유전체 연구 센터 |
울산대 (장세진) |
미국, DFCI |
종양학 진단 |
|
|
가톨릭-하버드 Wellman 광의학 핵심기술 개발센터 |
가톨릭대 (최명규) |
미국, 하버드 웰만 광의학 센터 |
의료기기 |
|
|
2012 |
연세 – Cedars-Sinai 심장융합영상연구센터 |
연세대 (정남식) |
미국, 씨다-사이나 메디컬 센터 |
심혈관질환 영상 및 진단 |
|
한국베크만 광의료기기 연구센터 |
단국대 (정필상) |
미국, 베크만레이저 |
의료기기 |
|
|
2013 |
서강-하버드 질병 바이오 물리 연구센터 |
서강대 (최정우) |
미국, 하버드 Wyss 질병 바이오물리 연구소 |
바이오칩 |
|
2015 |
아산-미네소타 이식 이노베이션 센터 |
서울아산병원 (김종재) |
미국, 미네소타대학교 |
장기이식 |
|
SNU-SciLifeLab차세대유전체기술 센터 |
서울대 (권성훈) |
스웨덴, 싸이라이프 |
바이오소자 |
|
|
이화-잭슨랩 암면역치료법 연구센터 |
이화여대 (이상혁) |
미국 잭슨랩 |
암치료 |
|
|
2016 |
와이즈만-순천향 조직재생 연구센터 |
순천향대 (윤정교) |
이스라엘, 와이즈만 연구소 |
줄기세포 |
|
독일 INP-광운대 PBRC 플라즈마 의과학 센터 |
광운대 (최은하) |
독일, 라이프니츠 INP |
플라즈마응용 피부질환치료 |
|
|
2017 |
반려동물 중개의학 암센터 |
충북대 (강지훈) |
미국, 존스홉킨스 |
난치성질환 치료기술 |
*2011년도 선정 과제는 2017년 상반기 지원종료
[표 2-37] 해외우수기관유치지원사업 생명공학 분야 우수 연구성과(2016)
|
○ 서강대/ 최정우 교수 ○ 서강-하버드 질병 바이오물리 연구 센터 -빛과 전기를 통하여 외부동력 없이 이동이 가능한 가오리 인공 바이오로봇을 개발 -합성고분자와 금속 지지대를 이용하여 구조체를 제작하고, 빛에 반응하는 재조합 심근세포의 접합 및 배양을 통한 조직 제작 기술은 인공생명체 개발에 있어서 혁신적인 결과 -위의 연구개발 성과를 Science誌에 게재 Phototactic guidance of a issue-engineered soft-robotic ray, Science, 353(6295), 158-162, 2016.7.) |
|
○ 울산대/ 장세진 교수 ○ 아산-다나파버 암 유전체 연구센터 - 110명의 대규모 소세포폐암환자 검체를 대상으로 WGS (whole genome sequencing)을 이용한 유전체 변이 분석을 수행한 결과, 유전체 재조합 현상에 의해 생성되는 특정 TP73 유전자의 체세포 유전변이가, 소세포폐암을 유발시키는 주요 유전변이임을 확인하였음 - 대량의 소세포페암 환자 검체를 이용한 포괄적 유전변이 분석을 통해, 소세포폐암을 유발하는 원인이 되는 유전변이를 확인할 수 있었으며, 이는 곧, 해당 유전 변이를 표적으로 하는 맞춤 치료로의 접근이 가능함을 의미 |
교육부가 시행하는 글로벌연구네트워크지원사업은 해외우수 연구자들과의 공동연구 및 네트워크 확대를 통해 국내 연구역량 제고와 세계 수준의 연구성과 창출을 목표로 삼고 있다. 지원규모는 연간 1억 원 이내이며, 최대 3년까지 지원한다. 2016년에는 65억 9천만 원의 예산으로 총 71과제(신규 31, 계속 40)를 지원했으며, 2017년에는 53억 2천만 원의 예산으로 총 69과제(신규 37, 계속 32)를 지원하였다. 2016년도에 도출된 글로벌연구네트워크지원사업의 대표적인 우수성과는 아래와 같다.
[표 2-38] 글로벌연구네트워크지원사업 생명공학 분야 우수 연구성과
|
○ 연구책임자 : 한양대 / 최재훈 교수 ○ 협력기관 및 연구자 : McGill University(Cheolho Cheong) ○ 과제명: 동맥경화증 발병과정에서 각 수지상세포군의 역할에 대한 분석 -동맥경화를 억제하는 면역세포 작동원리를 최초로 규명 -심혈관 질환 및 대사성질환(당뇨, 비만 등)에 새로운 치료법 기대 ※「Cell Metabolism(IF=17.565)」誌 게재(2016.5.) |
|
○ 연구책임자 : 숙명여대 / 김종민 교수 ○ 협력기관 및 연구자 : Univeristy of Guelph(Leonid Brown) ○ 과제명: 전단응력, G 단백질 연결 수용체 신호 및 microRNA의 통합적 이해를 통한 혈관 발생과정 기전 규명 -심장질환과 암 치료에 핵심적인 혈관신생 기전을 최초로 규명 -심장질환과 암 치료 후보물질로 활용 기대 ・혈관신생 억제로 암 치료, 혈관신생촉진으로 심장질환 치료 기대 ※「Nature Communications (IF=11.47)」誌 게재(2016.4.) |
라. 발전 과제
앞으로 생명공학분야 국제협력을 위해서는 미국, 유럽 등과 같은 전통적인 협력국가 외에 신흥강국과의 다양한 협력 기회를 모색하여 글로벌 리더십을 강화할 필요가 있다. 국가별 특성을 반영한 R&D 국제협력을 다변화하기 위한 대표적인 사업으로는 미국과 바이오, 뇌연구, 나노・소재 등 첨단기술 분야에 대해 공동연구가 추진될 수 있도록 미국 정부 및 연구기관과 협의가 필요하다. 중국과는 바이오(감염병, 뇌연구 포함), ICT(첨단제조 포함), 신재생에너지 등과 같은 분야에서 2건의 산・학・연 실용화 대형연구과제를 선정하는 등 공동연구를 심화시킬 필요성이 높다. 특히, 선진국 중에서는 캐나다와는 과학기술협력의 전망이 밝다. 2016년 12월 한국-캐나다 과학기술공동협정을 체결한 이후, 2017년 8월 캐나다 몬트리올에서 한국-캐나다 혁신포럼을 개최하여 과학기술공동협정에서 정했던 의료생명, 의료기기, 나노소재 등의 분야에 대한 협력 방안을 모색함으로써 앞으로 좋은 성과가 기대된다. 더불어 다자협력활동과 관련하여 과학기술정보통신부는 2005년부터 생명과학(뇌과학, 인체기능)분야의 기초연구 지원을 목적으로 다학제・다대륙 간 연구 및 펠로우십 프로그램을 운영하는 국제기구인 Human Frontier Science Program에 가입하여 부담금을 납부하면서 우리나라 생명과학 분야 과학자의 참여를 확대해왔다. 2017년부터는 한국연구재단이 주도적으로 HFSP에 참여하여 한국 과학자의 수혜를 늘리고 한국의 위상을 높여나갈 계획이다.
과학기술 국제협력분야에 속한 연구개발사업의 경우 과학기술정책연구원(STEPI)의 보고서(김기국, 최효민, 2013)도 지적하고 있는 바와 같이, 평가체계를 글로벌 표준에 맞추어 분야별 전문성과 유연한 제도 운영, 그리고 각 단계별로 부합하는 성과를 달성할 수 있도록 평가구조의 효율성을 높여야하는 당면과제를 해결해야 한다. 국제협력사업의 고유한 특성을 반영한 평가체계와 평가지표를 통해 사업을 관리해야 하며, 사업 수행을 통한 명백한 실적(outputs)과 잠재된 실적(outcomes)에 대하여 차별화된 성과측정 방식이 도입되어야 할 것이다.
마. 국가 간 협력 현황
한국연구재단은 2017년 10월 현재 51개국 80개 기관과 협력관계를 유지하고 있으며, 한-미, 한-독일, 한-중 등과 같은 양자 간 과학기술협력사업 뿐만 아니라 한-ASEAN, 한중일, 한국-EU, 한-V4(헝가리, 체코, 폴란드, 슬로바키아) 등과 같은 다자간 과학기술협력사업을 추진하고 있다. 본 백서에서는 한국연구재단이 지원하고 있는 양자 및 다자 간 과학기술 협력사업의 현황과 주요성과, 특히 생명공학분야의 우수성과를 소개하고자 한다.
(1) 한국-미국
한국과 미국 사이의 과학기술 협력을 활성화하기 위한 사업은 크게 5가지를 들 수 있다. 과학기술 교육・교류 사업으로는 미국 대학원생하계연수사업, 미국 우수대학원생방문연구사업, 연구관리・국제협력 전문가 교육과정을 운영하고 있다. 또한 미국과의 국제협력 네트워크를 강화하고 효율적으로 미래핵심기술을 확보하기 위해 미공군협력사업을 추진하고 있으며, 2017년 지원예산은 4억 9천만 원이다. 한국연구재단은 한국과 미주국가 간 공동연구 수행을 통해 과학기술 R&D협력기반을 강화하기 위해 미주국가와의 과학기술협력확충사업을 추진하고 있으며, 2015년 예산은 3억 6천만 원이다.
(2) 한국-독일
한국과 독일 사이의 과학기술협력을 활성화하기 위해 한-독 협력기반조성사업을 운영하고 있다. 과제당 연간 지원예산은 1천5백만 원이며 2년 동안 지원한다. 2016년에는 한-독 협력기반조성사업을 통해 대학중심의 산학연 공동연구 프로그램을 추진하여 다양한 분야에서 장기적으로 국제협력을 추진할 수 있는 기반을 마련하였으며, 과제당 연간 1억 5천만 원씩 총 3과제를 선정・지원하였다.
한-독 협력기반조성사업을 수행한 연구자 중에서 동국대학교 남기창 교수는 인공심장 기능 모니터링 시스템 관련 국제 워크숍을 3차례 개최함으로써 독일의 인공심장 시뮬레이터와 한국의 혈관시뮬레이터를 접목하는 공동연구 방향을 수립하였으며, 독일 아헨병원에서 국내 맥박측정기기의 임상실험을 추진하였다. 한국화학연구원 부설 안정성평가연구소의 윤석주 박사는 독일 연구자와의 교류・협력을 통해 ‘비알콜성 지방간암 치료 및 진단용 암줄기세포 바이오마커’에 대한 특허를 출원하는 성과를 거두었다.
(3) 한국-프랑스
한국과 프랑스 사이의 과학기술협력을 활성화하기 위해 한-프랑스 협력기반조성사업을 운영하고 있다. 과제당 연간 지원 예산은 1천 5백만 원이며 2년 동안 지원한다. 2002년 제1차 한-프랑스 과학기술공동위원회에서 사업개시에 합의하여 2003년 신규과제를 선정하였고 매년 15과제 내외를 선정하고 있다. 또한 2016년에 제6차 한-프랑스 과학기술공동위원회를 프랑스에서 개최하여 생명과학・공학, 보건・고령화경제학 등 6개 분야를 우선협력 과학기술분야로 새롭게 지정하였으며, 2018년 서울에서 제7차 한-프랑스 과학기술공동위원회를 개최하기로 합의하였다.
한편 2015∼2016년 한-프랑스 협력기반조성사업을 수행한 연구자 중 성균관대학교 엄숭호 교수 연구팀은 유전자(DNA) 이상으로 발생하는 유전 질환을 치료할 수 있는 ‘인공 세포핵’을 세계 최초로 개발하는 성과를 거두었다.
(4) 한국-영국
한국과 영국 사이의 과학기술협력을 활성화하기 위해 한-영 협력창구(Focal Point)사업을 운영하고 있다. 과제당 연간 지원예산은 6천만 원이며 2년 동안 지원한다. 2017년 3월에는 한-영 과학기술공동위원회(국장급)를 영국에서 개최하였으며, 3과제를 선정・지원하였다.
한-영 협력창구사업을 수행한 연구자 중에서 경북대 윤병욱 교수는 한-영 국제 심포지움을 4차례 개최하여 식물의 방어 유도물질을 활용한 암예방 기능성 식품신소재 개발 연구의 수준을 높여 가고 있다. 한국생명공학연구원의 이승구 박사는 총 4회에 걸친 한국・영국 합성생물학 포럼 개최를 통해 양국 전문가들의 기술정보 교류의 장을 마련하였으며, 합성생물학 연구 전략 수립의 기초를 다졌다.
(5) 한국-스위스
한국과 스위스 사이의 과학기술 협력을 활성화하기 위해 한-스위스 협력기반조성사업을 운영하고 있다. 과제당 연간 지원예산은 9천만 원이며 3년 동안 지원한다. 2014년도에는 신규 4과제를 지원하였으며, 2015년에는 신규 12과제를 지원하였다. 뿐만 아니라, 2016년에는 양국 간 신진과학도(박사, 박사후과정생)의 상호 방문연구를 지원하기 위해 한-스위스 박사과정생 연수사업을 추진하여 15인의 한국 연구자와 4인의 스위스 연구자를 선정하여 상호 간 방문을 지원하였다. 2017년에는 10인의 한국 연구자와 20인의 스위스 연구자를 모집・지원할 계획이다.
한-스위스 협력기반조성사업을 수행한 연구자 중에서 서울대학교 전누리 교수는 스위스 연구팀과의 공동연구를 통해 다양한 프로파일의 성장인자 자극이 가능한 미세유체소자 및 장기간 라이브 이미징 기술을 개발하였으며, 이를 통해 줄기세포의 분화 또는 분열을 유도하는 최적의 자극 프로파일 데이터베이스를 구축할 예정이다.
(6) 한국-스웨덴
한국과 스웨덴 사이의 과학기술 협력을 활성화하기 위해 한-스웨덴 과학기술 공동연구사업을 운영하고 있다. 과제당 5천만 원씩 2년 동안 지원한다. 2017년에는 5과제를 선정・지원하였다.
한-스웨덴 과학기술 공동연구사업에 참여하고 있는 연구자 중에서 연세대학교 김석준 교수는 스웨덴 연구그룹과의 공동연구를 통해 다양한 암종에서 높은 발현율을 보이는 특정 단백질(galectin-3)의 저해제 구축 및 적용을 통해 신규항암제 개발을 목표로 현재 연구를 수행중이다.
(7) 한국-러시아
과학기술정보통신부와 한국연구재단은 한국과 러시아 간의 과학기술협력을 위해 2007년 3월에 한-러시아 과학기술협력센터를 설립하여 현재까지 운영하고 있다. 한-러 센터는 현지 과학기술정보의 수집・제공, 과학기술자 국내유치, 상호 방문 알선, 기술사업화 등의 업무를 추진하고 있다.
한-러 센터는 제12차 한-러 과학기술공동위원회(2016. 8월, 서울) 후속조치의 일환으로 개최한 ‘제1차 한-러 과학기술의 날’(2017. 6월, 모스크바)에서 두뇌・인공지능, 항공우주, 원자력분야 관련 양국 간 협력 활성화방안을 논의했다. 특히 인공지능 분야에서는 인지기능(cognitive function) 모델링, Bio and Brain Signal Analysis, AI application for Big Data Analysis, 신경망, Deep Learning 등을 협력가능 세부분야로 도출하는 성과가 있었다.
(8) 한국-중국
한국과 중국 사이의 과학기술 협력을 활성화하기 위해 한-중 핵심공동연구지원사업을 운영하고 있다. 본 사업은 한-중 간 대형 공동연구 추진을 통해 양국의 공통 문제 해결에 기여할 수 있는 실질적인 연구 성과를 도출하기 위해 양국에서 전략분야를 지정・지원함으로써 연구성과를 제고하고 있다. 한국연구재단과 중국 국가자연과학기금위원회(NSFC) 간에 체결한 양해각서에 의거, 양 기관이 공동으로 승인한 과제를 지원하고 있으며, 2016년도에는 IoT(Internet of Things), Big Data 분야에 대한 모두 3과제를 선정하였으며, 2017년도에는 ‘Mechanistic Approach on Photocatalysis’ 분야에 대한 2과제를 선정할 예정이며, 해당 과제는 연간 6천만 원 이내로 3년간 지원할 예정이다.
이외에도 한-중 협력사업으로 2016년도에는 신규 34과제, 2017년도에는 신규 31과제를 각각 선정・지원하였다. 한-중 신진과학자교류사업으로는 2016년도에 7명의 중국인 과학자를 초청하고, 5명의 국내 연구자를 파견하였으며 2017년도에는 10명을 초청, 8명을 파견하여 연구교류를 확대해 나갈 예정이다.
한국연구재단은 한국, 중국, 일본 3국이 참여하는 공동연구지원사업으로 A3 Foresight 프로그램을 운영하고 있다. 2016년도에는 Chemical Biology 분야에 대한 2과제를 선정하였다. 2017년도에는 ‘Molecular Imaging-based Precision Medicine’ 분야에 대한 2과제를 선정하여, 연간 5천만 원 내외로 총 5년 동안 지원할 예정이다.
(9) 한국-일본
한국과 일본은 한-일 협력사업을 운영하고 있으며, 협력연구와 공동 세미나를 지원한다. 2016년도에는 신규 30과제를 선정하였고, 2017년 12월에 신규 30과제를 선정・지원할 예정이다.
한-일협력사업을 수행한 연구자 중에서 충북대 지운식 교수는 ‘비 가환 확률 해석학: 양자 백색잡음과 양자 워크의 새로운 전망’에 대해 연구하였다. 이 연구를 통해 비가환 랜덤현상의 특성적 성질에 따라 관심의 대상이 되는 문제들을 분류하고 공간화하고 그 공간의 대수적, 해석적 및 기하학적 구조와 성질들을 규명함으로써 관심의 대상인 문제들을 총체적으로 해결함은 물론 새로운 연구방법과 연구 분야를 개발하였다. 연구결과는 ‘Analytic Characterizations of Infinite Dimensional Distributions’라는 제목의 논문으로 학술지에 게재되었고, ‘Characterization of S-Transform for General Construction of Infinite Dimensional Distributions(교신저자)’라는 제목으로 SCI급 학술지에 제출될 예정이다. 이 연구의 결과는 양자장론, 시스템생물학, 네트워크과학, 정보과학, 금융공학 등 불확실성을 내포하고 있는 연구 분야에 큰 공헌을 할 것으로 기대되며, 젊은 연구자들에게 창의적인 연구 분위기를 조성하는데 크게 이바지 할 수 있을 것으로 생각된다.
이외에도 한국과 일본 사이의 협력 증진을 위해 일본학술진흥회(JSPS) HOPE Meeting 참가지원사업이 있다. HOPE Meeting은 한국연구재단과 일본학술진흥회(JSPS) 간 협력사업의 일환으로 추진되는 사업으로, 국내 신진과학도들에게 일본의 노벨상 수상자 및 저명 과학자와의 만남의 장을 제공하고, 아시아-태평양 지역의 우수한 신진과학도들 간의 협력 네트워크를 구축하는데 기여하고 있으며, 재단은 매년 6명의 우수한 신진과학도를 선발하여 이 프로그램에 참여시키고 있다.
(10) 한국-유럽연합(EU)
한국과 유럽연합(EU) 간의 협력 활성화를 위해 2017년 9월 개최 예정인 제6차 한-EU 과기공동위원회에서는 한-EU 간 전략 분야인 나노, 바이오, 에너지, ICT 및 위성항법 분야에 대한 연구협력 현황을 점검하고 향후 협력방향에 대해 논의할 계획이다. 특히 바이오 분야에서는 2014년부터 감염병 연구기관 간 컨소시엄(GloPID-R, Global Research Collaboration for Infectious Disease Preparedness)에 참여하여 공동연구 진행 중이며 2017년 3월에는 GloPID-R 총회를 서울에서 개최하여 전 세계 감염병 발생정보를 공유하고 신종/재발생 감염병 연구 협력방안을 논의하였다.
한국연구재단은 유럽연합과의 협력을 강화하고 핵심 원천기술을 확보하며 다자간 국제협력 네트워크를 구축하기 위해 Horizon2020에 선정・확정된 연구자들의 공동연구를 지원하고 있다. 한-EU 공동연구지원사업은 ‘인력교류’분야에 연간 5천만 원 이내, ‘공동연구’ 분야에 연간 1억 5천만 원 이내의 연구비를 2∼4년간 지원하여 유럽연합 내 선도적인 연구 집단 사이의 지속적인 연구교류와 협력을 촉진하고 있다. 2017년도 신규과제 지원예산은 약 8억 원이며, 10월 초 공모를 통해 12월에 7과제 내외를 선정・지원할 계획이다.
한-EU 공동연구지원사업 수혜 연구자 중 연세대학교의 신성재 교수는 2014년에 ‘마우스를 이용한 다양한 결핵백신 평가용 모델 개발과 새로운 백신의 효능평가’ 과제에 선정되어 2017년까지 지원받을 예정이다. 네덜란드의 Stichting TuBerculosis Vaccine Initiative 등 14개국 40개 기관의 우수 연구자들과 연구협력 네트워크를 구축하여 국제적으로 선두에 있는 새로운 백신후보들을 효능평가하고 국내 결핵백신 개발의 경쟁력을 확보하고자 한다. 협력 대상인 14개국 연구기관은 아래와 같다.
[표 2-39] EU Horizon2020 공동연구(연세대 신성재) 컨소시엄 참여국가 및 연구기관 현황
|
국가명 |
연구기관 |
|
Australia |
THE UNIVERSITY OF SYDNEY |
|
Belgium |
INSTITUT SCIENTIFIQUE DE SANTE PUBLIQUE |
|
Belgium |
UNIVERSITEIT GENT |
|
Belgium |
UNIVERSITE LIBRE DE BRUXELLES |
|
Denmark |
STATENS SERUM INSTITUT |
|
France |
INSTITUT PASTEUR |
|
France |
CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE |
|
France |
INSTITUT PASTEUR DE LILLE FONDATION |
|
Germany |
MAX PLANCK GESELLSCHAFT ZUR FOERDERUNG DER WISSENSCHAFTEN E.V. |
|
Germany |
UNIVERSITAET ULM |
|
Germany |
BUNDESINSTITUT FUR IMPFSTOFFE UND BIOMEDIZINISCHE ARZNEIMITTEL |
|
Ireland |
UNIVERSITY COLLEGE DUBLIN, NATIONAL UNIVERSITY OF IRELAND, DUBLIN |
|
Italy |
AZIENDA OSPEDALIERA UNIVERSITARIA POLICLINICO PAOLO GIACCONE DI PALERMO |
|
Italy |
ISTITUTO NAZIONALE MALATTIE INFETTIVE L.SPALLANZANI - IRCCS |
|
Italy |
ISTITUTO SUPERIORE DI SANITA |
|
Netherlands |
STICHTING TUBERCULOSIS VACCINE INITIATIVE |
|
Netherlands |
STICHTING BIOMEDICAL PRIMATE RESEARCH CENTER |
|
Netherlands |
ACADEMISCH ZIEKENHUIS LEIDEN - LEIDS UNIVERSITAIR MEDISCH CENTRUM |
|
Republic of Korea |
Yonsei University |
|
Republic of Korea |
INTERNATIONAL TUBERCULOSIS RESEARCH CENTER |
|
South Africa |
STELLENBOSCH UNIVERSITY |
|
South Africa |
UNIVERSITY OF CAPE TOWN |
|
South Africa |
KWAZULU NATAL RESEARCH INSTITUTE FOR TB-HIV (K-RITH) NPC |
|
Spain |
UNIVERSIDAD DE ZARAGOZA |
|
Spain |
INSTITUT DE INVESTIGACIO EN CIENCIES DE LA SALUT GERMANS TRIAS I PUJOL |
|
Switzerland |
UNIVERSITE DE GENEVE |
|
Switzerland |
EIDGENOESSISCHE TECHNISCHE HOCHSCHULE ZUERICH |
|
Switzerland |
UNIVERSITAET ZUERICH |
|
Switzerland |
HOSPICES CANTONAUX CHUV |
|
Switzerland |
UNIVERSITE DE LAUSANNE |
|
Switzerland |
UNIVERSITAT BASEL |
|
United Kingdom |
ASTON UNIVERSITY |
|
United Kingdom |
BANGOR UNIVERSITY |
|
United Kingdom |
DEPARTMENT OF HEALTH |
|
United Kingdom |
MEDICAL RESEARCH COUNCIL |
|
United Kingdom |
LONDON SCHOOL OF HYGIENE AND TROPICAL MEDICINE |
|
United Kingdom |
IMPERIAL COLLEGE OF SCIENCE, TECHNOLOGY AND MEDICINE |
|
United Kingdom |
THE CHANCELLOR, MASTERS AND SCHOLARS OF THE UNIVERSITY OF OXFORD |
|
United Kingdom |
THE SECRETARY OF STATE FOR ENVIRONMENT, FOOD AND RURAL AFFAIRS |
|
United States |
AERAS GLOBAL TB VACCINE FOUNDATION |
한편, 한국연구재단은 2014년도부터 추진되고 있는 Horizon 2020 프로그램에 참여 기회를 늘리기 위한 노력을 경주하고 있다. 2008년 금융위기 이후 촉발된 유럽의 경기침체 해소와 경제 시스템의 안정화, 미래를 위한 경제적 기회 창출의 필요성이 대두됨에 따라 유럽연합은 유럽의 글로벌 경쟁력 확보와 현재 직면하고 있는 사회문제 해결을 위해 연구 및 혁신 분야에 대한 지속적인 투자의 필요성을 인식하게 되었다. 이에 Horizon 2020 프로그램은 유럽연합에 부가가치를 창출하는 사항에 자원을 집중하는 원칙에 따라 과학적 탁월성, 산업 리더십, 사회적 과제 해결을 3대 중점 추진 과제로 삼고 있다. 총 예산은 약 786억 유로(한화 약 98조 6천억 원)인데, 이는 7차 Framework Program에서 투입된 약 253억 유로보다 약 47.6% 증가한 규모이다. 특히 녹색에너지, 보건, 건강 등을 사회적 과제 부분에 전체 투입 금액의 39%(약 296억 유로)라는 최대 예산을 배정하였다.
또한 한국연구재단은 한-EU 과기협력을 심화・확대하기 위한 협력 인프라를 구축하고 미래 협력분야를 발굴함으로써 국내 연구자의 참여 기회를 늘리기 위한 ‘한-EU 과학기술혁신 협력사업(KONNECT)’을 2013년부터 2017년 3월까지 성공적으로 수행했다. 한국(NRF, KIAT, KISTEP), 독일(DLR, KIST_Europe), 네덜란드(RVO), 스페인(CDTi), 터키(TUBITAK) 등 5개국 8개 기관 간 컨소시엄 형태로 진행된 이 프로젝트는 한국연구재단이 연구책임자로 활동하여 EU측으로부터 3년간 사업비 20억 원을 수주하고 한-EU 과기혁신 정책분석, 수요 맞춤형 네트워킹 구축, 신규 프로그램 런칭, 국제공동연구 평가모형 개발 등 많은 성과를 이루었다. 이 프로젝트의 결과를 기반으로 네트워크 확장 및 지속가능성을 확보하기 위하여 Post-KONNECT를 추진 중이다.
(11) 한국 정부의 개발협력
과학기술정보통신부는 한국의 국제적 위상에 부합하는 개발협력(ODA)을 위해서 개도국의 과학기술을 발전시키는 일에도 앞장서고 있다. 과학기술정보통신부와 한국연구재단이 시행하는 ‘개도국과학기술지원사업’은 개도국의 대학・연구기관의 과학기술 역량증진을 통해 과학기술 발전과 이공계 전문인력의 양성을 지원하는 것을 목적으로 삼고 있다. 특히 본 사업은 물, 에너지 등 생존・생계 문제의 근본적 해결과 삶의 질 제고를 위하여 지역실정에 적합한 적정과학기술을 지원하고, 개도국들이 스스로 빈곤극복과 경제성장을 해결할 수 있는 역량을 강화할 수 있도록 돕고 있다. 과학기술정보통신부는 2017년도에는 개도국과학기술지원사업의 예산을 2016년도에 비해 5억 원 증가한 33억 6천만 원을 배정하고 총 15과제를 지원했다.
지원과제 중 한밭대 오용준 교수의 경우는 2014년부터 라오스의 전통 음식인 카이펜(민물 김)의 위생 상태와 품질을 적정기술을 활용하여 획기적으로 개선하고, 생산시설 구축과 상품화를 통해 라오스 여성들에게 일자리를 제공하고 지속적인 소득 증대에 기여하고 있다. 기술적으로는 카이펜의 생산에 적합한 조류 세척장치 및 각종 살균처리장치, 자연 건조기술을 개발하였고, 2개의 농촌마을에 특화된 생산공장을 운영 중이다. 현지 지방정부에서 카이펜 시범 생산 공장을 위해 공장 부지를 제공하고 과학기술정보통신부가 설립한 적정기술센터가 보유・개발한 기술력을 통해 설비를 구축하고 현지 주민들이 마을조합을 설립하여 생산 관리를 책임지는 모범적인 ODA 협업 체계를 완성했다는 의의를 갖고 있다. 현재 카이펜 시범 생산 공장은 연간 6만 달러 이상의 지속적인 매출을 올리고 있으며, 53명의 고용을 창출하여 사업성을 확인하는 성과를 거두었다.
교육부와 한국연구재단은 정부와 국내대학 공동으로 대학의 자원 및 학문적・교육적 역량을 활용하여 개도국 개발을 지원하는 ‘국제협력선도대학육성지원사업’을 2012년부터 시행하고 있다. 개도국 대학에 학과나 단과대학을 설치하거나 리모델링하는 프로그램을 지원한다. 2017년 현재 약 40억 원의 예산으로 총 11과제(계속 5, 신규 4, 후속 2)를 지원하고 있다. 사업단별로 연간 약 4억 원의 예산으로 최대 4년까지 지원받는다. 사업이 종료된 이후에는 출구전략의 일환으로 1∼2년 간 후속지원을 받을 수 있다.
국제협력선도대학사업단 중 인제대학교는 2013년부터 ‘스리랑카 보건의료 수준 향상을 위한 간호학과 학위과정 구축 및 지역 보건의료 역량강화프로그램’ 과제를 수행하고 있다. 인제대학교 사업단이 개발한 간호학과 학사학위 교육과정은 18개 국립간호대학 최초로 스리랑카 고등교육부의 인가를 받았으며, 스리랑카 정부의 간호분야 교육개발 및 인력양성에 대한 관심과 지원을 이끌어내 200억 원의 스리랑카 정부 예산이 간호교육 분야에 추가 배정되었다. 이후 현지 협력대학인 국립간호대학을 4년제 학사학위 교육과정으로 전환하기 위하여 다각도로 노력하여 스리랑카에서 가장 명성 있는 콜롬보대학 내 간호대학을 설치하는 것으로 교육부 및 보건부와 협의하였으며 2017년 콜롬보대학 내 4년제 학사학위 간호교육과정으로 설치되었다(2017년 11월, 신입생 100명 선발). 이와 함께 현지 협력대학을 포함한 스리랑카 전체 18개 국립 간호대학에 우리나라의 선진 간호교육 학사과정을 점진적으로 적용・개편하는 성과를 거두었다. 또한 우수한 현지 교수진들을 선발하여 인제대학교 간호대학 석사학위과정을 이수할 수 있도록 지원하여 현재까지 6명의 석사를 배출하였으며, 3명이 석사학위과정 중에 있다. 이밖에도 전문간호사 양성의 일환으로 스리랑카 보건부와 함께 응급간호사 연수과정을 개설하였으며, 연 1회 총 3회 보건부 정식 자격 인정(Post Basic Certification) 연수과정을 시행하며 120명의 수료생 배출과 응급전문 강사진을 육성하는 등 스리랑카 내 간호인력 수준 향상을 위한 개발협력사업에 총력을 기울이고 있다.
![]() 제2절
제2절
생명공학 경쟁력 지표 현황
1. 투자
가. 정부 연구개발예산 중 미래유망신기술(6T) 분야별 투자
2016년도 정부 연구개발 총투자는 일반회계, 특별회계 및 기금을 포함해서 19조 44억 원으로 2012년 15조 9,064억 원에서 3조 980억 원이 증가하여 1.19배 확대된 것으로 확인되었다. 이는 당초 편성된 2016년도 예산 19조 942억 원 대비 99.5%의 집행실적을 나타내고 있으며, 전체 사업 수는 562개, 과제수는 5만 4,827개로 조사되었다.

출처: 2016년도 국가연구개발사업 조사분석 보고서 재가공(미래창조과학부(현 과학기술정보통신부)/KISTEP)
[그림 2-23] 국가연구개발사업 투자 추이(2012∼2016)
최근 5년간(2012년∼2014년) 정부 연구개발예산의 연평균증가율은 4.5%이며, 중소・중견기업지원, 기초연구, 지방 R&D, 과제당 평균 연구비 비중이 지속적으로 증가추세인 것으로 나타났다. 최근 5년간 국가연구개발사업 규모의 변화 추이는 그림과 같다.
2016년도 미래유망신기술(6T) 분야 투자액은 전년대비 1.3%(1,491억 원) 증가하여 총 11조 2,134억 원으로 정부연구개발 투자 중 59.0%를 차지하였다.70) 6T 분야별 투자 중에서 BT 분야는 최근 5년간 연평균 4.9% 증가율을 보이고 있는 것으로 나타났다. 2016년도 BT분야 투자액은 3조 3,341억 원으로 전년대비 1.0%(323억 원) 증가하였으며, 정부 연구개발 투자에서 IT 분야 19.0%(3조 3,617억 원) 다음으로 높은 18.8%의 비중을 차지하는 것으로 나타났다.
(단위: 억 원)

출처: 2016년도 국가연구개발사업 조사분석 보고서 재가공(미래창조과학부(현 과학기술정보통신부)/KISTEP)
[그림 2-24] 6T 분야별 투자 추이(2012∼2016)
BT 분야의 전체 사업 수는 2015년 138개에서 2016년 117개로 하락한 반면, 과제 수는 2015년 18,243개에서 2016년 18,820개로 증가하였다.
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
나. BT 분야 상세 투자 현황 및 주요특징
(1) 투자 현황
2016년도 BT분야에 대한 부처별 투자 현황을 살펴보면, 미래창조과학부(현 과학기술정보통신부)가 1조 2,092억 원으로 전체 BT분야 투자의 가장 큰 비중(36.3%)을 차지하고 있으며, 다음으로 농촌진흥청 5,005억 원(15.0%), 보건복지부 4,485억 원(13.5%), 산업통상자원부 3,779억 원(11.3%), 교육부 2,100억 원(6.3%)순으로 투자가 이루어졌다.

출처: 2016년도 국가연구개발사업 조사분석 보고서 재가공(미래창조과학부(현 과학기술정보통신부)/KISTEP)
[그림 2-26] BT분야 부처별 투자 현황
(2) 연구개발단계/연구수행 주체별 투자 현황
연구개발단계별로 살펴보면 BT분야는 기초연구(42.7%), 개발연구(27.3%), 응용연구(14.0%) 순으로 투자가 이루어진 것으로 확인되었다. IT 분야를 비롯한 6T 전체에서는 개발연구에 가장 많은 투자가 이루어진 반면에, BT 분야는 기초연구에 집중하고 있는 모습을 보이고 있다.
연구수행 주체별로는 대학 1조 3,879억 원(41.6%), 출연연구소 6,767억 원(20.3%), 국공립연구소 5,517억 원(16.5%), 중소기업 4,471억 원(13.4%), 중견기업 770억 원(2.3%)의 순으로 많은 투자가 이루어졌다.

출처: 2016년도 국가연구개발사업 조사분석 보고서 재가공(미래창조과학부(현 과학기술정보통신부)/KISTEP)
[그림 2-27] BT분야 연구개발단계별(좌)/연구수행주체별(우) 투자 현황
(3) 적용분야별 투자 현황
BT분야 투자액 3조 3,341억 원에서 공공분야가 54.2%(1조 8,071억 원) 비중을 차지하고 있으며, 산업분야는 45.8%(1조 5,271억 원)를 차지하고 있는 것으로 나타났다.
세부분야별 투자 현황을 살펴보면, 공공분야에서는 건강 1조 2,597억 원(37.8%), 지식의 진보(비목적 연구) 2,511억 원(7.5%), 기타 공공목적 1,556억 원(4.7%), 환경 629억 원(1.9%) 순으로 투자되고 있으며, 산업분야에서는 농업, 임업 및 어업 7,650억 원(22.9%), 제조업(의료용물질 및 의약품) 2,377억 원(7.1%), 제조업(의료, 정밀, 광학기기 및 시계) 1,981억 원(5.9%), 제조업(화학물질 및 화학제품) 794억 원(2.4%) 순으로 투자되고 있는 것으로 나타났다.
(단위: 억 원)

출처: 2016년도 국가연구개발사업 조사분석 보고서 재가공(미래창조과학부(현 과학기술정보통신부)/KISTEP)
[그림 2-28] BT분야 적용분야별 투자 현황
(4) 기술분류별(유망기술/과학기술표준분류) 투자 현황
2016년 BT분야 투자액(3조 3,341억 원)에서 유망기술 9개 분야71)의 예산은 1조 3,291억 원으로 39.9%의 비중을 차지하고 있으며, 2012년부터 2016년까지 연평균 6.7% 증가율을 보이고 있어, BT분야 투자액 증가율 4.5%를 상회하는 것으로 확인되었다.
투자규모는 의과학/의공학기술(2,691억 원), 농업/해양 생물자원의 보존 및 이용기술(2,482억 원), 바이오신약개발기술(2,202억 원) 순이며, 투자 추이에서는 난치성 질환치료기술(20.7%)과 유전자 치료기술(12.5%) 분야의 연평균 증가율이 높은 것으로 나타났다.
(단위: 억 원)

출처: 2016년도 국가연구개발사업 조사분석 보고서 재가공(미래창조과학부(현 과학기술정보통신부)/KISTEP)
[그림 2-29] BT분야 유망기술 투자 추이
국가과학기술표준분류 대분류 기준으로 보건의료 1조 3,032억 원(39.1%), 농림수산식품 8,536억 원(25.6%), 생명과학 7,347억 원(22.0%), 뇌과학 768억 원(2.3%) 순으로 투자가 이루어졌다.
(단위: 억 원)

출처: 2016년도 국가연구개발사업 조사분석 보고서 재가공(미래창조과학부(현 과학기술정보통신부)/KISTEP)
[그림 2-30] BT분야 국가과학기술표준분류별 투자 현황
BT분야에서 중점적으로 투자되고 있는 보건의료, 농림수산, 생명과학 분야를 국가표준과학기술분류 중분류를 기준으로 분석하였다. 보건의료 분야에서는 의약품/의약품개발(8.2%), 의생명과학(7.5%), 치료/진단기기(5.8%) 순으로 투자되고 있으며, 농림수산 분야는 식량작물과학(4.5%), 원예작물과학(3.4%), 기타 농림수산식품(3.3%) 순으로 집중 투자되고 있는 것으로 나타났다. 생명과학 분야에서는 분자세포생물학(3.3%), 산업바이오(3.1%), 융합바이오(3.1%) 순으로 많은 투자가 이루어졌다.
[표 2-40] BT분야 표준과학기술분류별(중분류) 중점투자 현황
(단위: 억 원, %)
|
보건의료 분야 |
농림수산 분야 |
생명과학 분야 |
||||||
|
|
정부 연구비 |
비중 |
|
정부 연구비 |
비중 |
|
정부 연구비 |
비중 |
|
의약품/의약품개발 |
2,738 |
8.2 |
식량작물과학 |
1,496 |
4.5 |
분자세포생물학 |
1,085 |
3.3 |
|
의생명과학 |
2,499 |
7.5 |
원예작물과학 |
1,121 |
3.4 |
산업바이오 |
1,040 |
3.1 |
|
치료/진단기기 |
1,931 |
5.8 |
기타농림수산식품 |
1,089 |
3.3 |
융합바이오 |
1,027 |
3.1 |
|
임상의학 |
1,636 |
4.9 |
동물자원과학 |
916 |
2.7 |
유전학/유전공학 |
846 |
2.5 |
|
보건의료전체 |
13,032 |
39.1 |
농림수산전체 |
8,536 |
25.6 |
생명과학전체 |
7,347 |
22.0 |
출처: 2016년도 국가연구개발사업 조사분석 보고서 재가공(미래창조과학부(현 과학기술정보통신부)/KISTEP)
주: 비중은 BT분야 정부연구비 33,341억 원 중 해당 기술분야가 차지하는 비중을 나타냄
(5) 국가전략기술별 투자 현황
(단위: 억 원)

출처: 2016년도 국가연구개발사업 조사분석 보고서 재가공(미래창조과학부(현 과학기술정보통신부)/KISTEP)
[그림 2-31] BT분야 국가전략기술별 투자 현황
BT분야에 대한 투자를 국가전략기술별로 살펴보면, 건강장수시대구현 1조 1,363억 원(34.1%), 미래성장동력확충 9,316억 원(27.9%), 걱정 없는 안전사회구축 2,211억 원(6.6%) 순으로 투자가 이루어지고 있다.
(6) 기타 BT 분야 투자의 주요 특징
(가) 학연 공동연구 비중이 높음
2016년 BT분야 투자액에서 협력유형이 있는 경우가 27.0%(9,002억 원), 협력유형이 없는 경우가 73.0%(2조 4,339억 원)로 나타났다. 협력유형별 투자를 세부적으로 살펴보면, 학연 공동연구(2,897억 원, 32.2%), 산학 공동연구(2,573억 원, 28.6%), 산학연 공동연구(893억 원, 9.9%) 순으로 투자되고 있는 것으로 나타나 대학과 연구소의 협력에 대한 지원이 가장 많은 것으로 확인되었다.
(단위: 억 원, %)

출처: 2016년도 국가연구개발사업 조사분석 보고서 재가공(미래창조과학부(현 과학기술정보통신부)/KISTEP)
[그림 2-32] BT분야 협력유형별 공동연구 투자 현황
(나) 수도권의 투자비중이 높음
BT분야의 지역별 투자는 서울 8,909억 원(26.7%), 경기 5,210억 원(15.6%), 대전 4,313억 원(12.9%), 전북 3,650억 원(10.9%) 순으로 많은 투자가 이루고 있다. 전년대비 증가율을 살펴보면 전북 55.9%(1,309억 원 증), 인천 30.9%(138억 원 증) 증가하여 가장 높은 증가율을 보이고 있는 반면, 경기도의 경우 22.9%(1,549억 원 감) 감소하여 큰 폭으로 감소된 것으로 나타났다.
6T 전체의 경우 수도권 35.3%, 대전 32.4%, 지방 32.3% 비중으로 지역별로 분산되어 투자가 이루어진데 비해, BT분야의 경우 수도권에 집중되어 있는 모습을 보이고 있다.
(단위: 억 원, %)

출처: 2016년도 국가연구개발사업 조사분석 보고서 재가공(미래창조과학부(현 과학기술정보통신부)/KISTEP)
[그림 2-33] BT분야 지역별 투자 현황
2. 인력
가. 학과별 배출인력
교육통계연구센터의 교육통계서비스에 따르면 2016년 기준 전문대학의 바이오분야 학사 재적 현황에서 보건 분야의 학사 재적생수(40,482명)가 가장 많은 것으로 조사되었다.
학과별 학사 재적생수의 성별 현황을 살펴보면 보건 및 재활학과를 제외한 나머지 분야에서 남성 비중이 높게 나타났으며 특히 환경학과에서 남성 비중이 가장 높았다. 보건학과는 약 4,000여 명이 여성학생 수가 더 많았고 재활학과는 약 1,000명 정도의 여학생이 더 많은 것으로 조사되었다.
(단위: 명)
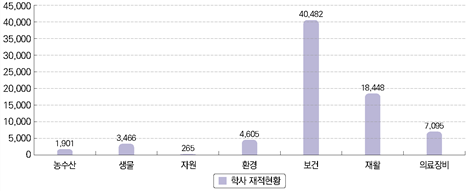
주) 전문대학의 바이오 분야 학사 재적 현황
출처: 교육통계서비스(http://kess.kedi.re.kr/index)
[그림 2-34] 2016년 기준 바이오분야 학과별 학사 재적 현황
[표 2-41] 2016년 기준 바이오분야 학과별 학사 재적생수의 성별 현황
(단위: 명)
|
학과 |
학사 재적생 |
||
|
남자 |
여자 |
소계 |
|
|
농수산 |
1,559 |
342 |
1,901 |
|
생물 |
2,095 |
1,371 |
3,466 |
|
자원 |
136 |
129 |
265 |
|
환경 |
3,757 |
848 |
4,605 |
|
보건 |
18,103 |
22,379 |
40,482 |
|
재활 |
8,623 |
9,825 |
18,448 |
|
의료장비 |
5,050 |
2,045 |
7,095 |
주) 전문대학의 바이오 분야 학사 재적 현황
출처: 교육통계서비스(http://kess.kedi.re.kr/index)
교육통계연구센터의 교육통계서비스에 따르면 2016년 기준 바이오분야 학과 중 의학분야의 석사(3,134명) 및 박사(1,059명) 졸업자가 가장 많은 것으로 조사되었다.
(단위: 명)

출처: 교육통계서비스(http://kess.kedi.re.kr/index)
[그림 2-35] 2016년 기준 바이오 분야 학과별 석・박사 졸업자 현황
학과별 석・박사 졸업자의 성별 현황을 살펴보면 석사 졸업자에서는 보건학과 재활학에서 여성 비중이 월등히 높았고 박사 졸업자에서는 보건학분야를 제외한 모든 학과에서 남성 비중이 높은 것으로 나타났다.
[표 2-42] 2016년 기준 바이오 분야 학과별 석・박사 졸업자의 성별 현황
(단위: 명)
|
학과 |
석사 졸업자 |
박사 졸업자 |
||||
|
남자 |
여자 |
소계 |
남자 |
여자 |
소계 |
|
|
농업학 |
111 |
58 |
169 |
36 |
10 |
46 |
|
동물・수의학 |
106 |
85 |
191 |
66 |
35 |
101 |
|
보건학 |
231 |
743 |
974 |
70 |
127 |
197 |
|
산림・원예학 |
111 |
114 |
225 |
37 |
25 |
62 |
|
생명과학 |
748 |
801 |
1,549 |
449 |
240 |
689 |
|
생물학 |
232 |
180 |
412 |
141 |
92 |
233 |
|
약학 |
178 |
314 |
492 |
111 |
97 |
208 |
|
의료공학 |
155 |
183 |
338 |
72 |
58 |
130 |
|
의학 |
1,784 |
1,350 |
3,134 |
635 |
424 |
1,059 |
|
재활학 |
269 |
953 |
1,222 |
55 |
54 |
109 |
|
치의학 |
554 |
369 |
923 |
118 |
102 |
220 |
|
한의학 |
150 |
121 |
271 |
110 |
52 |
162 |
출처: 교육통계서비스(http://kess.kedi.re.kr/index)
2015년과 2016년의 바이오 분야 학과별 학사 재적생수 변화를 살펴보면 생물, 자원, 보건, 의료장비 분야에서 재적생수 감소를 보였고 이 중 보건 분야의 재적생이 가장 많이 감소(1,024명)하였다. 농수산, 환경, 재활 분야에서는 재적생수가 증가하였으며 특히 재활 분야의 재적생수가 가장 많이 증가(182명)하였다.
(단위: 명)

출처: 교육통계서비스(http://kess.kedi.re.kr/index)
[그림 2-36] 바이오분야 학과별 학사 재적생수 비교(2015~2016)
2015년과 2016년의 바이오분야 학과별 석사 졸업자 변화를 살펴보면 생물학, 동물・수의학, 의학, 약학, 보건학, 의료공학에서 졸업생 수가 감소를 보였고 이 중 의학
(단위: 명)

출처: 교육통계서비스(http://kess.kedi.re.kr/index)
[그림 2-37] 바이오분야 학과별 석사 졸업자 비교(2015~2016)
분야의 졸업생이 가장 많이 감소(143명 감소)하였다. 나머지 학과에서는 졸업생이 증가하였으며 특히 재활학에서 가장 많은 증가(201명 증가)를 보였다.
2015년과 2016년의 바이오분야 학과별 박사 졸업자 변화를 살펴보면 산림・원예학, 생명과학, 재활학, 의료공학에서 졸업생 수가 감소하였고 대부분 6명 이하로 감소하였다. 이들 학과를 제외한 나머지 학과에서는 졸업생이 증가하였으며 특히 의학 분야가 131명으로 가장 많이 증가하였다.
(단위: 명)

출처: 교육통계서비스(http://kess.kedi.re.kr/index)
[그림 2-38] 바이오분야 학과별 박사 졸업자 비교(2015~2016)
나. 바이오산업 인력 현황
산업통상자원부와 한국바이오협회가 조사하여 발표한 ‘2015년 기준 국내 바이오산업 실태조사’에 따르면, 국내 978개 바이오기업에 종사하는 인력 수는 39,686명으로 2014년 대비 1,885명 증가하였고 1개 업체당 평균 40.6명이 근무하고 있는 것으로 조사되었으며, 2011년 이후 2013년 2.4%의 감소를 제외하고 연평균 2.7%씩 지속적으로 증가한 것으로 나타났다.
[표 2-43] 바이오산업 분야별 연도별 종사자 수
(단위 : 명, %)
|
구 분 |
2011년 |
2012년 |
2013년 |
2014년 |
2015년 |
연평균 증감률 |
|
종사자 수 |
35,718 |
37,570 |
36,684 |
37,801 |
39,686 |
2.7 |
|
증감률 |
11.1 |
5.2 |
Δ2.4 |
3.0 |
5.0 |
(1) 분야 및 직종별 인력 현황
국내 바이오산업 인력을 직종별로 보면 연구인력이 12,782명(32.2%), 생산인력 13,564명(34.2%), 영업/관리 13,340명(33.6%)으로 구성되어 있다.
[표 2-44] 바이오산업 분야별 종사자 인력 분포
(단위 : 명, %)
|
구 분 |
업체수 |
연구 인력 |
생산 인력 |
영업/ 관리 |
계 |
산업별 구성비 |
|
|
전 체 |
인력 |
978 |
12,782 |
13,564 |
13,340 |
39,686 |
100.0 |
|
비율 |
100.0 |
32.2 |
34.2 |
33.6 |
100.0 |
||
|
바이오의약산업 |
330 |
6,157 |
7,147 |
7,514 |
20,818 |
52.5 |
|
|
바이오화학산업 |
206 |
2,168 |
1,453 |
1,394 |
5,015 |
12.6 |
|
|
바이오식품산업 |
197 |
1,659 |
3,029 |
1,831 |
6,519 |
16.4 |
|
|
바이오환경산업 |
76 |
357 |
369 |
488 |
1,214 |
3.1 |
|
|
바이오전자산업 |
22 |
303 |
576 |
306 |
1,185 |
3.0 |
|
|
바이오공정 및 기기산업 |
71 |
428 |
510 |
576 |
1,514 |
3.8 |
|
|
바이오에너지 및 자원산업 |
26 |
371 |
409 |
369 |
1,149 |
2.9 |
|
|
바이오검정, 정보서비스 및 연구개발산업 |
50 |
1,339 |
71 |
862 |
2,272 |
5.7 |
|
출처: 2015년 기준 국내 바이오산업 실태조사(산업통상자원부, 한국바이오협회)
(2) 연구・생산직 학위별 인력 현황
2015년 기준 산업체 종사자 중 학사 졸업자는 16,718명(42.1%)으로 가장 많았으며, 석사 8,140명(20.5%), 박사 2,342명(5.9%) 순으로 나타났다.
[표 2-45] 2015년 바이오산업 종사자 분야별 학위별 분포
(단위 : 명, %)
|
구분 |
박사 |
석사 |
학사 |
기타 |
계 |
산업별 구성비 |
|
|
전 체 |
인력 |
2,342 |
8,140 |
16,718 |
12,486 |
39,686 |
100.0 |
|
비율 |
5.9 |
20.5 |
42.1 |
31.5 |
100.0 |
||
|
바이오의약산업 |
1,252 |
4,336 |
8,658 |
6,572 |
20,818 |
52.5 |
|
|
바이오화학산업 |
345 |
1,321 |
2,126 |
1,223 |
5,015 |
12.6 |
|
|
바이오식품산업 |
341 |
1,131 |
2,461 |
2,586 |
6,519 |
16.4 |
|
|
바이오환경산업 |
43 |
181 |
708 |
282 |
1,214 |
3.1 |
|
|
바이오전자산업 |
47 |
185 |
413 |
540 |
1,185 |
3.0 |
|
|
바이오공정 및 기기산업 |
78 |
238 |
656 |
542 |
1,514 |
3.8 |
|
|
바이오에너지 및 자원산업 |
61 |
157 |
438 |
493 |
1,149 |
2.9 |
|
|
바이오검정, 정보서비스 및 연구개발산업 |
175 |
591 |
1,258 |
248 |
2,272 |
5.7 |
|
출처: 2015년 기준 국내 바이오산업 실태조사(산업통상자원부, 한국바이오협회)
2011년부터 2015년까지 바이오산업분야 종사자의 학위 변화를 살펴보면 박사, 석사, 학사 인력은 점진적으로 증가하고 있으며, 기타 인력의 경우 2012년 감소하였으나 이후부터 다시 증가 추세를 보이고 있다.
(단위 : 명)

[그림 2-39] 2011∼2015년 바이오산업 종사자 학위별 인력 변화 추이
(3) 인력수급 현황
바이오산업 인적자원개발협의체 운영기관인 한국바이오협회에서 산업통상자원부의 지원으로 조사한 ‘바이오산업 인력수급 실태조사’에 따르면 2016년 기준 1개 업체당 직종별 평균 구인 인력은 신입 1.4명, 경력 1.1명 수준으로 나타났으며, 신입 구인인원은 생산 및 시설직이 2.3명으로 가장 많고 경력 구인인원 또한 생산 및 시설직이 1.4명으로 가장 많았다.

[그림 2-40] 2016년 기준 바이오기업 1개 업체당 직종별 평균 구인인원
2016년 기준 필요인원(채용계획 인원)에 대한 구인 충족률은 개발직, 품질관리직을 제외한 모든 직종에서 80% 대로 나타났으며, 전체 평균은 76.6%로 조사되었다.

[그림 2-41] 2016년 기준 바이오기업 1개 업체당 직종별 평균 구인인원
3. 특허
가. 생명공학 특허 개요
생명공학분야에 있어 특허는 원천기술 확보 이상의 의미를 갖는다. 타 분야에 비해 연구개발기간과 개발비용이 막대하고, 상용화 준비단계에 승인 및 허가 제도가 도입되어 있어 투자회수 뿐만 아니라 단계별 자금 확보를 위한 법적 장치로서 특허권 획득은 매우 중요하기 때문이다.
생명공학분야는 미래성장동력 및 사회문제 해결을 위한 수단으로 주목받으면서 정부의 R&D 투자는 연평균 18.3%의 높은 증가율을 보이고 있으며, 연구개발의 성과인 특허 역시 큰 폭으로 늘어나고 있다.
따라서 특허분석을 통해 연구개발의 성과를 측정해 보고 세부기술의 변화 추이를 살펴볼 필요가 있다. 이러한 정보는 국가의 과학기술 정책 수립 및 기업의 연구개발 방향결정에 중요한 기초자료가 된다.
나. 분석기준
생명공학 분야의 기술분류는 OECD에서 분류한 기준을 토대로 한국특허청의 전문가 집단에서 세분류한 6개 산업, 13개 기술분류, 27개 세분류로 구분하였다.72)
분석대상 국가로는 한국과 세계적 동향을 파악하기 위해 특허를 가장 강하게 보호하고 시장규모도 큰 미국특허를 대상으로 하였으며, 시간적 기준으로 한국은 출원시점으로 2001∼2015년까지를, 미국특허는 등록기준으로 2002∼2016년까지의 특허를 가지고 동향을 파악하였다.
또한, 기술분류는 IPC 8판 기준으로 그간의 누락데이터을 보완하고 수정하여 최종적으로 데이터셑을 완성하였다. 그러나 기술분류체계가 IPC에서 CPC(cooperative patent classification)를 전환되고 있는 과정에 있어 향후에는 CPC 중심의 분류체계로의 변화가 필요할 것으로 보인다.
[표 2-46] 생명공학의 기술분류
|
산업 |
기술분류 |
세분류 |
|
공정 |
생물공정 |
동식물 세포배양장치, 분리정제, 생물학적합성, 효소 미생물관련 장치 |
|
측정진단 |
조사・분석, 측정・시험 |
|
|
생물자원탐색 |
미생물, 바이러스 |
|
|
기초 |
동식물세포배양 |
동식물세포 |
|
효소공학 |
효소 |
|
|
농업 |
유전체 |
당유기함유핵산, 유전공학 |
|
단백질체 |
고정화펩티드, 펩티드, 하이브리드펩티드 |
|
|
식품 |
항체이용 |
면역글로블린 |
|
생물농약 |
생물농약 |
|
|
의약 |
형질전환동식물 |
신규한 동물, 신규한 식물 |
|
발효식품 |
알코올발효 및 장치 |
|
|
환경 |
생물의약 |
단백질치료제, 방사선의약, 신약후보물질, 유전자치료, 치료용 항체 |
|
환경생물공학 |
생물학적 수처리, 슬러지처리 |
다. 한국에 출원된 생명공학 특허건수 동향
한국에 출원한 생명공학분야의 특허출원건수를 살펴보면, 2001년 이후 꾸준히 증가하고 있는 것으로 나타났다. 15년간의 연평균 증가율은 3.60%로 한국전체특허의 연평균 증가율 5.52%보다는 조금 낮은 수준인 것으로 나타났다.
세부기술분야별로 살펴보면, 전체 특허출원건수에서는 유전체의 유전공학분야가 8,088건으로 가장 많은 건수를 보이고 있으며, 그 다음으로 측정진단 기술의 측정・시험분야가 6,236건, 단백질체 기술의 펩티드가 4,992건 순으로 나타났다.
최근 5년간의 특허출원건수의 변화의 흐름을 살펴보면, 특허출원건수가 가장 많은 유전공학분야는 여전히 건수는 많지만, 2013년 이후 서서히 줄어들고 있음을 알 수 있다. 측정진단의 측정・시험분야와 항체이용의 면역글로블린 기술분야는 반대로 특허출원건수가 지속적으로 늘어나고 있는 분야로 조사되었다. 생물의약개발의 치료용 항체와 단백질치료제 분야, 신약후보물질분야는 소폭 감소 또는 변화가 없는 것으로 나타났다.
[표 2-47] 한국에 출원한 생명공학분야의 기술분류별-연도별 특허출원건수
(단위 : 건)
|
기술분류 |
2001 ∼2005 |
2006 |
2007 |
2008 |
2009 |
2010 |
2011 |
2012 |
2013 |
2014 |
2015 |
||
|
공정 |
생물 공정 |
분리정제 |
3 |
0 |
0 |
1 |
4 |
0 |
0 |
0 |
0 |
0 |
0 |
|
생물학적합성 |
623 |
95 |
189 |
212 |
210 |
215 |
169 |
174 |
208 |
176 |
160 |
||
|
동식물세포배양장치 |
56 |
39 |
30 |
40 |
37 |
63 |
61 |
104 |
66 |
97 |
62 |
||
|
효소, 미생물관련장치 |
179 |
78 |
84 |
110 |
90 |
131 |
104 |
148 |
158 |
157 |
172 |
||
|
측정 진단 |
조사,분석 |
676 |
237 |
301 |
391 |
369 |
498 |
399 |
454 |
327 |
349 |
380 |
|
|
측정,시험 |
1436 |
327 |
472 |
381 |
412 |
541 |
353 |
467 |
518 |
651 |
670 |
||
|
기초 |
유전체 |
유전공학 |
1860 |
459 |
618 |
820 |
567 |
697 |
627 |
662 |
671 |
588 |
502 |
|
당류기함유핵산 |
202 |
35 |
39 |
46 |
31 |
47 |
20 |
14 |
25 |
23 |
22 |
||
|
|
단백 질체 |
펩티드 |
1227 |
348 |
403 |
468 |
322 |
435 |
273 |
301 |
348 |
446 |
393 |
|
고정화펩티드 |
4 |
3 |
9 |
7 |
8 |
10 |
2 |
6 |
2 |
3 |
1 |
||
|
하이브리드펩티드 |
124 |
29 |
46 |
62 |
68 |
71 |
54 |
86 |
84 |
52 |
31 |
||
|
항체 이용 |
면역글로불린 |
364 |
141 |
188 |
386 |
220 |
374 |
203 |
263 |
256 |
286 |
312 |
|
|
효소 공학 |
효소 |
399 |
107 |
109 |
138 |
144 |
176 |
131 |
135 |
167 |
183 |
143 |
|
|
생물자원탐색 |
미생물 |
1024 |
288 |
247 |
291 |
311 |
412 |
338 |
398 |
445 |
384 |
329 |
|
|
바이러스 |
98 |
15 |
25 |
36 |
24 |
45 |
46 |
44 |
52 |
61 |
45 |
||
|
동식물세포 배양 |
동식물세포 |
442 |
184 |
199 |
267 |
196 |
281 |
193 |
165 |
210 |
277 |
243 |
|
|
농업 |
생물 농약 개발 |
생물농약 |
255 |
84 |
93 |
70 |
105 |
90 |
76 |
61 |
52 |
42 |
42 |
|
형질 전환 동식물개발 |
신규한동물 |
133 |
33 |
41 |
33 |
43 |
60 |
45 |
53 |
66 |
76 |
100 |
|
|
신규한식물 |
259 |
44 |
51 |
74 |
57 |
176 |
139 |
160 |
120 |
71 |
56 |
||
|
식품 |
발효 식품 개발 |
알코올발효 및 장치 |
498 |
149 |
166 |
169 |
186 |
261 |
181 |
169 |
155 |
175 |
173 |
|
의약 |
생물 의약 개발 |
방사선의약 |
52 |
11 |
17 |
14 |
6 |
19 |
8 |
16 |
14 |
13 |
14 |
|
유전자치료 |
109 |
20 |
35 |
38 |
36 |
29 |
17 |
62 |
80 |
76 |
96 |
||
|
치료용항체 |
525 |
134 |
244 |
332 |
198 |
346 |
214 |
173 |
192 |
192 |
157 |
||
|
단백질치료제 |
734 |
204 |
282 |
448 |
230 |
510 |
232 |
262 |
217 |
245 |
219 |
||
|
신약후보물질 |
1767 |
104 |
101 |
163 |
127 |
193 |
146 |
145 |
133 |
170 |
143 |
||
|
환경 |
환경 생물 공학 |
슬러지처리 |
54 |
17 |
25 |
62 |
58 |
74 |
61 |
68 |
36 |
60 |
28 |
|
생물학적수처리 |
1088 |
230 |
259 |
273 |
245 |
269 |
189 |
169 |
174 |
161 |
161 |
||
|
계 |
14,191 |
3,415 |
4,273 |
5,332 |
4,304 |
6,023 |
4,281 |
4,759 |
4,776 |
5,014 |
4,654 |
||
라. 한국에 출원된 생명공학 특허의 국가별 특허출원건수 현황
한국에 출원된 특허출원건수를 국가별로 구분하여 5년 단위로 묶어 조사를 수행하였다. 대한민국이 36,895건으로 가장 많고, 미국이 9,825건, 일본이 4,199건 순으로 나타났다. 한국특허청에서 발표하는 전체 특허통계데이터를 기준으로 살펴보면 2001∼2014년까지 한국전체 특허에서 대한민국이 차지하는 비율은 76.2%(2,256,070건 중 1,718,668건) 반해 생명공학특허는 60.3%(61,221건 중 36,895건)로 대한민국은 생명공학분야의 연구개발 집중도가 타 기술분야에 비해 적은 것으로 나타났다. 최근 5년간의 특허를 대상으로 해당국가의 전체특허와 비교했을 때 생명공학분야의 점유율이 높은 국가는 일본(전체 8.07%, 생명공학 20.60%), 스위스(전체 0.61%, 생명공학 3.86%), 독일(전체 2.04%, 생명공학 3.03%)으로 나타났다. 프랑스, 영국, 네델란드 등도 한국에 출원하는 기술분야 중에서 생명공학 분야에 집중도가 높은 것으로 나타났다.
다출원 상위 10대 국가들을 보면 4∼9위까지는 모두 유럽이 차지하고 있는 것으로 나타나, 유럽국가에서 생명공학관련 특허가 국내에 많이 들어오고 있음을 알 수 있다.
[표 2-48] 국내 상위 10대 다출원 국가 현황
(단위 : 건)
|
국가 |
2001∼2005 |
2006∼2010 |
2011∼2015 |
합계 |
|
대한민국 |
8,707 |
12,506 |
15,682 |
36,895 |
|
미국 |
2,469 |
4,126 |
3,230 |
9,825 |
|
일본 |
1,323 |
1,787 |
1,089 |
4,199 |
|
스위스 |
254 |
698 |
606 |
1,558 |
|
독일 |
557 |
677 |
475 |
1,709 |
|
프랑스 |
171 |
425 |
370 |
966 |
|
영국 |
267 |
349 |
266 |
882 |
|
네덜란드 |
148 |
262 |
185 |
595 |
|
덴마크 |
151 |
184 |
158 |
493 |
|
중국 |
44 |
104 |
197 |
345 |
마. 한국특허로 본 생명공학분야의 상위 다출원인 현황
한국에 출원하는 생명공학 특허분야의 상위 15개 다출원인을 살펴보면, 대학의 약진이 두드러지게 나타났다. 2001∼2005년에는 상위 15위 안에 포함된 대학이 5곳에서 2006∼2010년에는 8곳, 2011∼2016년에는 10곳으로 늘어나 대한민국에서 생명공학분야의 연구개발과 특허를 창출하는 중심이 대학이 되고 있음을 보여주고 있다.
최근 5년간의 특허출원건수를 보면, 농촌진흥청이 746건으로 가장 많은 출원을 하였고, 전 구간에서 계속 1위를 하던 생명공학연구원이 531건으로 다출원 순위 3위를 차지하였다. 대학에서는 서울대학교가 552건으로 가장 많고, 고려대학교가 406건, 건국대학교가 354건 순으로 나타났다. 전자 기업으로 인식되는 삼성전자도 313건의 생명공학분야 특허를 출원하고 있는 것으로 나타났다. 국내 출원기관들의 특허출원이 늘어남에 따라 외국기업인 제넨테크와 에프호프만라로슈 등의 순위가 뒤로 밀리고 있는 현상이 나타났다.
[표 2-49] 국내 상위15대 다출원인 현황
(단위 : 건)
|
2001∼2005 |
2006∼2010 |
2011∼2015 |
|||
|
출원기관명 |
특허 건수 |
출원기관명 |
특허 건수 |
출원기관명 |
특허 건수 |
|
한국생명공학연구원 |
286 |
한국생명공학연구원 |
572 |
농촌진흥청 |
746 |
|
삼성전자 |
201 |
서울대 산학협력단 |
428 |
서울대 산학협력단 |
552 |
|
제넨텍,Co |
169 |
농촌진흥청 |
427 |
한국생명공학연구원 |
531 |
|
CJ |
155 |
제넨텍, Inc |
305 |
고려대 산학협력단 |
406 |
|
서울대학교 |
145 |
고려대 산학협력단 |
243 |
건국대 산학협력단 |
354 |
|
농촌진흥청 |
114 |
삼성전자주식회사 |
238 |
연세대 산학협력단 |
341 |
|
고려대학교 |
104 |
한국과학기술원 |
205 |
삼성전자주식회사 |
313 |
|
한국과학기술연구원 |
98 |
에프. 호프만 -라로슈 아게 |
187 |
경북대 산학협력단 |
269 |
|
한국과학기술원 |
78 |
전남대 산학협력단 |
184 |
한국과학기술원 |
260 |
|
바스프(AG) |
75 |
건국대 산학협력단 |
183 |
한국과학기술연구원 |
246 |
|
포항공과대학교 |
73 |
노파르티스 아게 |
175 |
가톨릭대 산학협력단 |
242 |
|
메르크파텐트(GMBH) |
70 |
연세대 산학협력단 |
175 |
에프. 호프만 -라로슈 아게 |
233 |
|
(주)메디제네스 |
68 |
한국과학기술연구원 |
162 |
전남대 산학협력단 |
205 |
|
아지노모토(가) |
67 |
경북대 산학협력단 |
147 |
경희대 산학협력단 |
195 |
|
건국대학교 |
61 |
고려대 산학협력단 |
146 |
이화여대 산학협력단 |
193 |
바. 미국에 등록된 생명공학특허건수 동향
미국의 생명공학특허도 특허등록건수가 매년 지속적으로 증가하고 있는 것으로 나타났다. 2012년 이후에는 매년 10,000건 이상의 특허가 등록되고 있고, 2002∼2016년까지의 특허등록 연평균 증가율은 2.98%를 나타내고 있다. 그러나 미국전체 등록특허의 연평균 증가율 4.55%보다는 낮은 것으로 조사되었다.
세부기술분야별로 살펴보면, 전체 특허등록건수에서는 형질전환동식물개발의 신규한 식물이 25,457건으로 가장 많고 그 다음으로 측정진단 기술의 측정・시험분야가 14,975건, 생물의약개발기술의 단백질치료제가 12,457건, 치료용항체가 11,149건 순으로 나타났다.
미국은 특허법상 식물특허(plant patent)제도가 체계화 되어 있어 신규한 식물에 대한 특허가 많은 것으로 보인다. 식물특허란 무성생식(Asexual reproduction)73)을 통한 개량식물에 대한 보호권이다.
신규한 식물특허를 제외하고 최근 5년간의 특허출원건수의 변화의 흐름을 살펴보면, 한국과는 조금은 다른 결과를 보여주고 있다. 측정 진단의 측정・시험분야는 조금씩 꾸준하게 늘어나고 있어 이 분야의 특허활동은 한국과 마찬가지로 매우 높다고 할 수 있다. 그러나 미국특허에서는 생물의약기술의 치료용 항체와 단백질 치료제 기술분야가 높은 특허등록건수를 보여 한국과는 차별화되어 있음을 알 수 있다. 2012년 이후 매년 특허등록건수가 1,000건 이상으로 나타나, 이 분야의 연구개발이 매우 활발히 진행되고 있음을 보여주고 있다.
그 밖에도 유전체기술의 유전공학분야, 측정진단의 조사・분석분야, 생물공정의 생물학적합성분야, 단백질체의 펩티드 분야는 특허등록건수가 500건 이상으로 나타났다.
발효식품 개발의 알코올 발효 및 장치 분야와 환경생물공학기술의 생물학적 수처리 분야는 한국과 달리 연구개발이 많지 않은 분야로 다른 기술분야에 비해 특허 등록건수가 현저히 적음을 알 수 있다.
[표 2-50] 미국에 등록된 생명공학분야의 기술분류별-연도별 특허등록건수 현황
(단위 : 건)
|
기술분류 |
2002 ∼ 2006 |
2007 |
2008 |
2009 |
2010 |
2011 |
2012 |
2013 |
2014 |
2015 |
2016 |
||
|
공정 |
생물 공정 |
분리정제 |
43 |
4 |
2 |
0 |
4 |
1 |
1 |
3 |
1 |
0 |
1 |
|
생물학적합성 |
2,319 |
481 |
417 |
483 |
568 |
668 |
704 |
711 |
772 |
741 |
693 |
||
|
동식물 세포배양장치 |
69 |
16 |
21 |
15 |
32 |
33 |
24 |
14 |
30 |
47 |
31 |
||
|
효소, 미생물관련장치 |
537 |
94 |
136 |
142 |
261 |
270 |
230 |
222 |
264 |
266 |
225 |
||
|
측정 진단 |
조사,분석 |
2,370 |
535 |
529 |
546 |
876 |
800 |
764 |
755 |
738 |
784 |
789 |
|
|
측정,시험 |
4,593 |
894 |
827 |
834 |
1,099 |
1,109 |
1,083 |
1,135 |
1,126 |
1,129 |
1,146 |
||
|
기초 |
유전체 |
유전공학 |
2,375 |
581 |
392 |
458 |
601 |
589 |
591 |
605 |
702 |
827 |
827 |
|
당류기함유핵산 |
1,976 |
407 |
433 |
483 |
589 |
619 |
541 |
512 |
445 |
413 |
391 |
||
|
단백 질체 |
펩티드 |
1,867 |
544 |
555 |
454 |
452 |
423 |
378 |
405 |
472 |
626 |
729 |
|
|
고정화펩티드 |
86 |
10 |
12 |
16 |
8 |
12 |
11 |
10 |
15 |
11 |
18 |
||
|
하이브리드펩티드 |
16 |
3 |
2 |
5 |
5 |
7 |
4 |
10 |
9 |
19 |
16 |
||
|
항체 이용 |
면역글로불린 |
603 |
211 |
213 |
183 |
240 |
236 |
224 |
289 |
265 |
422 |
529 |
|
|
효소 공학 |
효소 |
1,772 |
325 |
258 |
235 |
274 |
285 |
282 |
340 |
397 |
401 |
460 |
|
|
생물 자원 탐색 |
미생물 |
603 |
125 |
120 |
104 |
151 |
142 |
183 |
230 |
269 |
196 |
192 |
|
|
바이러스 |
171 |
33 |
39 |
47 |
27 |
31 |
41 |
48 |
42 |
41 |
70 |
||
|
동식물세포 배양 |
동식물세포 |
1,089 |
202 |
186 |
206 |
268 |
290 |
327 |
365 |
447 |
418 |
405 |
|
|
|
생물 농약 개발 |
생물농약 |
585 |
130 |
113 |
105 |
130 |
180 |
257 |
271 |
276 |
232 |
227 |
|
형질 전환 |
신규한동물 |
217 |
46 |
54 |
42 |
50 |
31 |
43 |
48 |
45 |
56 |
68 |
|
|
농업 |
동식물 개발 |
신규한식물 |
6,537 |
1,534 |
1,720 |
1,591 |
1,643 |
1,587 |
1,907 |
2,040 |
2,343 |
2,211 |
2,344 |
|
식품 |
발효 식품 개발 |
알코올발효 및 장치 |
91 |
18 |
11 |
8 |
10 |
13 |
16 |
17 |
17 |
18 |
39 |
|
의약 |
생물 의약 개발 |
방사선의약 |
245 |
44 |
47 |
44 |
61 |
55 |
99 |
127 |
128 |
114 |
104 |
|
유전자치료 |
356 |
72 |
38 |
55 |
99 |
117 |
131 |
132 |
177 |
192 |
171 |
||
|
치료용항체 |
2,178 |
495 |
560 |
679 |
856 |
847 |
995 |
1,137 |
1,217 |
1,114 |
1,071 |
||
|
단백질치료제 |
2,843 |
653 |
659 |
723 |
994 |
910 |
1,006 |
1,221 |
1,257 |
1,151 |
1,040 |
||
|
신약후보물질 |
1,077 |
56 |
44 |
52 |
85 |
79 |
110 |
141 |
153 |
224 |
241 |
||
|
환경 |
환경 생물 공학 |
슬러지처리 |
5 |
1 |
2 |
5 |
4 |
2 |
1 |
3 |
1 |
5 |
3 |
|
생물학적수처리 |
546 |
152 |
150 |
140 |
142 |
108 |
122 |
93 |
108 |
85 |
74 |
||
|
계 |
35,169 |
7,666 |
7,540 |
7,655 |
9,529 |
9,444 |
10,075 |
10,884 |
11,716 |
11,743 |
11,904 |
||
사. 미국에 등록된 생명공학 특허의 국가별 특허등록건수 현황
미국에 등록된 특허등록건수를 국가별로 구분하여 5년 단위로 묶어 조사를 수행하였다. 미국이 77,423건으로 가장 많고, 일본이 9,507건, 독일이 6,040건 순으로 나타났다. 한국은 1,991건으로 다등록 순위 10위를 차지하고 있는 것으로 나타났고, 최근 5년으로 한정하면 8위를 나타내고 있다. 미국 특허청에서 발표하는 전체 특허통계데이터를 기준으로 살펴보면 동기간 미국 전체 특허에서 미국이 차지하는 비율은 49.4%(2,874,818건 중 1,419,626건) 반해 생명공학 특허는 58.1%(133,325건 중 77,428건)로 미국은 생명공학 분야에 많은 연구개발과 특허보유를 하고 있는 것으로 나타났다. 해당 국가의 전체특허와 비교했을 때 생명공학 분야의 점유율이 높은 국가는 네덜란드(전체 0.79%, 생명공학 3.45%), 스위스(전체 0.76%, 생명공학 2.26%), 호주(전체 0.66%, 생명공학 1.20%)로 나타났다. 대한민국은 전체 특허는 4.56%인데 반해 생명공학특허는 1.49%로 여전히 타 산업에 비해 낮은 집중도를 가지고 있는 것으로 조사되었다.
[표 2-51] 미국에 등록된 생명공학특허의 국가별 특허등록건수 현황
(단위 : 건)
|
국가 |
2002∼2006 |
2007∼2011 |
2012∼2016 |
합계 |
|
미국 |
20,898 |
24,111 |
32,419 |
77,428 |
|
일본 |
2,271 |
3,259 |
3,977 |
9,507 |
|
독일 |
1,662 |
1,932 |
2,446 |
6,040 |
|
네덜란드 |
1,203 |
1,379 |
2,024 |
4,606 |
|
프랑스 |
897 |
907 |
1,535 |
3,339 |
|
영국 |
879 |
875 |
1,362 |
3,116 |
|
스위스 |
514 |
879 |
1,622 |
3,015 |
|
캐나다 |
903 |
942 |
1,006 |
2,851 |
|
덴마크 |
558 |
600 |
1,076 |
2,234 |
|
대한민국 |
274 |
558 |
1,159 |
1,991 |
|
호주 |
391 |
520 |
694 |
1,605 |
|
이스라엘 |
323 |
453 |
802 |
1,578 |
|
벨기에 |
335 |
447 |
593 |
1,375 |
|
대만 |
164 |
350 |
584 |
1,098 |
|
스웨덴 |
259 |
281 |
369 |
909 |
아. 미국에 등록된 생명공학특허의 국가별 기술력수준 분석 현황
최근 5년(2012년∼2016년)간 미국에 등록된 특허를 대상으로 국가별로 구분하여 기술력 수준을 양적・질적 지표를 사용하여 분석해보았다.
양적지표는 특허등록건수를, 질적지표는 인용횟수를 가지고 분석하였고, 상대적 기술수준을 평가하기 위해 인용지표는 CII74)(Current Impact Index)를 사용하였다. CII지수는 1을 기준으로 1보다 높으면 높을수록 특허의 질적 수준의 높음을 의미하고, 1보다 낮으면 낮을수록 질적 수준이 떨어짐을 의미한다.
미국이 양적・질적으로 모두 높은 수준으로 기술력 수준은 압도적으로 높게 나타났다. 일본은 양적으로는 미국 다음으로 2위를 계속 차지하고 있으나, 질적 수준이 상대적으로 낮은 것으로 나타나 4∼5위 수준을 유지하고 있는 것으로 조사되었다.
특허의 질적 수준에서는 호주가 가장 우수한 것으로 나타났다. CII지수가 미국보다도 높은 것으로 나타났고, 양적으로는 12위 정도이나 질적으로 1위를 차지함으로써 기술력 수준은 2∼3위를 차지하고 있는 것으로 나타났다. 또한 스위스 역시 생명공학분야 특허의 질적 수준이 우수한 것으로 나타났다. 스위스의 CII 역시 1에 근접하고 있어, 양적・질적 수준을 포함한 기술력 수준도 매우 높게 나타났다.
한국은 양적으로는 2012년 166건으로 10위에서 2015년에는 270건으로 8위 수준까지 올라갔다. 그러나 질적으로는 2012년 0.79에서 2015년에는 0.19로 떨어져 특허의 양적 성장에 비해 질적으로는 떨어지는 것으로 나타났다. 특히 특허의 질적 수준이 2012년에는 7위였으나 2015년에는 17위로 떨어져 질적 수준 향상을 위한 노력이 필요할 것으로 보인다.
[표 2-52] 2012∼2016년 미국에 등록된 생명공학분야의 국가별 기술력 수준 현황
(단위 : 건, 점)
|
|
2012년 |
기술력 지수 |
순위 |
2013년 |
기술력 지수 |
순위 |
2014년 |
기술력 지수 |
순위 |
|||
|
특허 건수 |
CII |
특허 건수 |
CII |
특허 건수 |
CII |
|||||||
|
미국 |
5,761 |
1.20 |
6,918.30 |
1 |
6,267 |
1.31 |
8,206.51 |
1 |
6,813 |
1.24 |
8,449.60 |
1 |
|
일본 |
731 |
0.36 |
261.63 |
6 |
781 |
0.49 |
384.22 |
2 |
852 |
0.35 |
294.85 |
5 |
|
독일 |
446 |
0.19 |
86.94 |
10 |
417 |
0.29 |
120.24 |
7 |
498 |
0.67 |
331.29 |
3 |
|
네덜란드 |
275 |
0.16 |
43.82 |
11 |
271 |
0.51 |
137.52 |
6 |
459 |
0.47 |
216.04 |
8 |
|
스위스 |
271 |
1.12 |
302.31 |
5 |
337 |
0.82 |
277.33 |
3 |
325 |
0.84 |
273.63 |
7 |
|
프랑스 |
244 |
0.18 |
43.49 |
14 |
305 |
0.11 |
33.38 |
14 |
280 |
0.63 |
177.42 |
9 |
|
영국 |
230 |
1.50 |
344.82 |
3 |
250 |
0.86 |
214.36 |
4 |
300 |
0.94 |
283.07 |
6 |
|
대한민국 |
166 |
0.79 |
131.00 |
8 |
218 |
0.17 |
36.81 |
12 |
245 |
0.19 |
45.85 |
14 |
|
캐나다 |
212 |
1.44 |
304.22 |
4 |
186 |
0.63 |
116.27 |
8 |
196 |
0.45 |
87.23 |
11 |
|
덴마크 |
176 |
0.77 |
134.83 |
7 |
203 |
0.93 |
187.81 |
5 |
256 |
1.17 |
300.37 |
4 |
|
이스라엘 |
131 |
1.00 |
131.00 |
8 |
145 |
0.71 |
103.23 |
9 |
161 |
0.62 |
99.32 |
10 |
|
호주 |
134 |
3.26 |
436.65 |
2 |
121 |
0.77 |
93.23 |
10 |
154 |
2.38 |
366.09 |
2 |
|
중국 |
67 |
0.00 |
- |
16 |
95 |
0.03 |
2.72 |
19 |
125 |
0.05 |
5.76 |
19 |
|
벨기에 |
94 |
0.46 |
43.67 |
12 |
99 |
0.12 |
11.88 |
17 |
106 |
0.58 |
61.53 |
12 |
|
대만 |
105 |
0.39 |
41.30 |
15 |
125 |
0.57 |
70.79 |
11 |
134 |
0.26 |
35.49 |
16 |
|
이탈리아 |
60 |
0.00 |
- |
16 |
74 |
0.17 |
12.69 |
15 |
81 |
0.73 |
58.98 |
13 |
|
스웨덴 |
68 |
0.00 |
- |
16 |
52 |
0.23 |
12.04 |
16 |
88 |
0.41 |
36.33 |
15 |
|
스페인 |
30 |
0.00 |
- |
16 |
34 |
- |
- |
20 |
61 |
0.17 |
10.28 |
18 |
|
인도 |
37 |
0.00 |
- |
16 |
54 |
0.10 |
5.50 |
18 |
54 |
0.09 |
4.75 |
20 |
|
뉴질랜드 |
19 |
2.30 |
43.67 |
12 |
23 |
1.48 |
34.06 |
13 |
44 |
0.24 |
10.54 |
17 |
|
|
2015년 |
기술력 지수 |
순위 |
2016년 |
기술력 지수 |
순위 |
||
|
특허 건수 |
CII |
특허 건수 |
CII |
|||||
|
미국 |
6753 |
1.28 |
8,634.91 |
1 |
6825 |
1.31 |
8,910.18 |
1 |
|
일본 |
807 |
0.31 |
248.50 |
5 |
806 |
0.35 |
282.44 |
4 |
|
독일 |
557 |
0.62 |
342.78 |
2 |
528 |
0.42 |
221.01 |
6 |
|
네덜란드 |
510 |
0.46 |
232.06 |
6 |
509 |
0.26 |
132.53 |
9 |
|
스위스 |
349 |
0.98 |
342.43 |
3 |
340 |
0.95 |
322.54 |
2 |
|
프랑스 |
343 |
0.29 |
97.78 |
12 |
362 |
0.29 |
105.51 |
11 |
|
영국 |
306 |
0.59 |
180.01 |
8 |
276 |
0.91 |
250.38 |
5 |
|
대한민국 |
260 |
0.23 |
60.69 |
13 |
270 |
0.19 |
50.99 |
14 |
|
캐나다 |
228 |
1.21 |
275.91 |
4 |
184 |
0.73 |
133.90 |
8 |
|
덴마크 |
209 |
0.72 |
151.46 |
9 |
232 |
0.56 |
129.93 |
10 |
|
이스라엘 |
188 |
0.73 |
137.52 |
10 |
177 |
0.48 |
84.71 |
12 |
|
호주 |
141 |
1.53 |
215.77 |
7 |
144 |
1.96 |
282.91 |
3 |
|
중국 |
140 |
0.24 |
33.79 |
16 |
175 |
0.18 |
32.26 |
15 |
|
벨기에 |
129 |
0.94 |
121.65 |
11 |
165 |
1.28 |
211.02 |
7 |
|
대만 |
119 |
0.27 |
32.23 |
17 |
101 |
0.18 |
18.62 |
17 |
|
이탈리아 |
85 |
0.40 |
33.80 |
15 |
92 |
0.34 |
31.03 |
16 |
|
스웨덴 |
79 |
0.57 |
44.71 |
14 |
82 |
0.78 |
64.11 |
13 |
|
스페인 |
57 |
0.16 |
9.26 |
19 |
54 |
0.16 |
8.40 |
20 |
|
인도 |
49 |
0.06 |
3.13 |
20 |
70 |
0.21 |
14.85 |
19 |
|
뉴질랜드 |
42 |
0.27 |
11.53 |
18 |
41 |
0.37 |
15.24 |
18 |
자. 미국특허의 생명공학분야 다등록 상위 10개 특허권자 현황
최근 5년(2012년∼2016년)의 多특허등록건수 보유 10개사를 미국전체 특허권자와 미국에 등록된 특허 중 한국인 특허권자로 구분하여 정리해 보았다.
미국전체 특허권자에서는 Monsanto Technology가 1,978, Pioneer Hi-Bred Int’l이 1,775건으로 다른 특허권자들에 비해 압도적으로 많은 특허를 보유하고 있는 것으로 나타났다. 대학으로는 유일하게 University of California가 583건 순으로 다등록 3위 특허권자로 조사되었다.
한국 특허권자 중에서는 삼성전자가 131건으로 가장 많은 특허권을 보유하고 있는 것으로 조사되어, 반도체, 이동통신분야 뿐만 아니라 생명공학분야에서도 우수한 지재권 활동을 하고 있는 것으로 나타났다. 그 다음으로는 한국생명공학연구원이 66건, CJ 제일제당이 65건 등의 순으로 나타났다.
미국전체에서는 대부분 기업들이 다특허권자로 나타난 반면, 한국특허권자 중에서는 출연(연)과 대학의 특허성과가 많음을 알 수 있다.
[표 2-53] 2012∼2016년 미국에 등록된 생명공학분야의 다등록기관 현황
(단위 : 건)
|
다등록기관명(미국전체) |
건수 |
다등록기관명(한국) |
건수 |
|
Monsanto Technology LLC |
1,978 |
SAMSUNG ELECTRONICS CO., LTD. |
131 |
|
Pioneer Hi-Bred Int'l, Inc. |
1,775 |
KRIBB |
66 |
|
The Regents of the University of California |
583 |
CJ Cheiljedang Corp. |
65 |
|
Syngenta Participations AG |
563 |
POSTECH ACADEMY-INDUSTRY FOUNDATION |
38 |
|
Genentech Inc |
293 |
SNU R&DB Foundation |
37 |
|
Seminis Vegetable Seeds, Inc. |
276 |
KAIST |
34 |
|
NOVARTIS AG |
273 |
KIST |
29 |
|
Novozymes A/S |
229 |
Korea University |
22 |
|
Terra Nova Nurseries, Inc. |
201 |
HANMI SCIENCE CO., LTD |
14 |
|
Danisco US Inc. |
196 |
National Cancer Center |
8 |
|
Sungkyunkwan University |
8 |
4. 논문(질적지표)
가. 개요
연구개발 결과는 논문을 통해 전파되고 이를 통해 학문이 발전하며 응용연구로 연결된다. 연구자는 논문발표를 통해 연구결과에 대한 객관적인 비판과 평가를 받으며, 자신의 축적된 연구역량을 확인해주는 주요 수단이 되기도 한다. 이러한 논문의 현황분석은 우리나라 생명공학의 수준과 역량을 보다 객관적으로 진단하는데 유용하다. 특히, 질적 성과 중심의 선도형 R&D체계로 전환75)하기 위해서는 논문의 양적 수준 뿐 아니라 질적 수준에 대한 객관적인 분석이 필요하다.
논문분석을 수행하기 위해서는 논문 데이터베이스(DB)가 필요하다. Clarivate Analytics에서 발간하는 SCI(Science Citation Index) DB는 학계에 널리 알려진 DB로써 SCI등재 학술지 논문수는 한 나라의 국제적인 연구개발 활동의 지표로서 널리 인식되고 있다. SCI DB는 30년 이상 엄정한 심사를 통과한 학술지에 대한 DB를 구축하여 제공함으로써 세계적인 권위를 인정받고 있다. 논문 현황 분석은 SCI DB의 일종인 InCites B&A(Benchmarking & Analysis, 1981∼2015)와 WoS(Web of Science), ESI(Essential Science Indicators, 2005∼2015)를 기반으로 하였다. 전체 과학기술분야 중 생명공학분야를 분석하기 위해 SCI 과학기술 18개 분야 중 관련 6개 분야를 대상으로 하였다.
나. 한국의 SCI논문 현황
2015년 우리나라 SCI논문수는 57,626편으로 세계 12위 수준이다. 세계 점유율도 2006년 대비 0.89% 증가하는 등 매년 양적으로 점진적인 증가 추세를 나타내고 있다.
[표 2-54] 최근 10년간 한국의 SCI논문 발표 현황
|
구분 |
2006 |
2007 |
2008 |
2009 |
2010 |
|
논문발표수(편) |
28,830 |
29,601 |
34,355 |
37,764 |
41,518 |
|
세계 총 논문수(편) |
999,080 |
1,049,965 |
1,129,244 |
1,183,591 |
1,226,822 |
|
세계 점유율(%) |
2.89 |
2.82 |
3.04 |
3.19 |
3.38 |
|
세계 순위 |
11위 |
12위 |
12위 |
12위 |
11위 |
|
구분 |
2011 |
2012 |
2013 |
2014 |
2015 |
|
논문발표수(편) |
45,726 |
49,884 |
52,322 |
55,126 |
57,626 |
|
세계 총 논문수(편) |
1,308,072 |
1,375,340 |
1,451,689 |
1,492,142 |
1,524,487 |
|
세계 점유율(%) |
3.50 |
3.63 |
3.60 |
3.69 |
3.78 |
|
세계 순위 |
11위 |
10위 |
12위 |
12위 |
12위 |
우리나라 SCI논문의 최근 5년간(2011∼2015) 평균 피인용 횟수는 5.13회로, 세계 평균(5.53회)과 비교했을 때 질적 수준에서 약간 낮은 수준을 보이고 있다. 하지만 우리나라의 평균 피인용 횟수가 세계대비 76.2% 수준에서 92.8% 수준으로 증가하는 등 향후 질적 수준이 점진적으로 개선될 것으로 기대된다.
[표 2-55] 5년 주기별 한국의 SCI논문 1편당 평균 피인용 현황
|
구분 |
’06∼’10 |
’07∼’11 |
’08∼’12 |
’09∼’13 |
’10∼’14 |
’11∼’15 |
|
한국 |
3.88 |
4.1 |
4.33 |
4.63 |
4.93 |
5.13 |
|
세계평균 |
5.09 |
5.18 |
5.3 |
5.4 |
5.49 |
5.53 |
|
세계대비 |
76.23% |
79.15% |
81.70% |
85.74% |
89.80% |
92.77% |
다. 바이오분야 SCI논문 현황
우리나라 바이오 6개 분야의 최근 5년간(2011∼2015) SCI논문수는 아래 표와 같다. 미생물학과 약리학 분야가 논문수로 세계 9위 수준이며, 점유율도 우리나라 평균(2.94%) 보다 높은 것으로 나타났다. 국가별로는 미국이 6개 분야 모두 월등히 앞서 있으며, 중국, 영국, 독일, 일본, 프랑스 순으로 나타났다.
[표 2-56] 최근 5년간(2011∼2015) 한국의 바이오분야 SCI논문 현황
|
분야명 |
분야 논문수 |
세계순위 |
한국 대비 |
세계 대비 |
||
|
총논문수 |
점유율 |
세계분야 총 논문수 |
점유율 |
|||
|
면역학 |
4,482 |
15위 |
260,684 |
1.72% |
206,210 |
2.17% |
|
미생물학 |
4,338 |
9위 |
260,684 |
1.66% |
109,951 |
3.95% |
|
분자생물학 & 유전학 |
8,219 |
12위 |
260,684 |
3.15% |
282,086 |
2.91% |
|
생물학&생화학 |
15,880 |
10위 |
260,684 |
6.09% |
481,734 |
3.30% |
|
신경과학&행동과학 |
8,751 |
13위 |
260,684 |
3.36% |
393,267 |
2.23% |
|
약리학 |
9,667 |
9위 |
260,684 |
3.71% |
275,412 |
3.51% |
|
생명공학 합계 |
51,337 |
12위 |
260,684 |
19.69% |
1,748,660 |
2.94% |

[그림 2-42] 최근 5년간(2011∼2015) 국가별 바이오분야 SCI논문수
한국의 바이오분야 SCI논문을 연도별 살펴보면 분자생물학 및 유전학 분야의 SCI논문수가 최근 10년간 11.3%의 연평균 증가율을 보이며 대략 2.6배정도 증가하였고, 면역학(8.8%), 신경과학 및 행동학(8.1%), 약리학(7.9%), 생물학 및 생화학(6.2%), 미생물학(4.6%) 순으로 SCI논문이 증가하고 있는 것으로 나타났다.
[표 2-57] 최근 10년간 한국의 생명공학분야 SCI논문 현황
|
분야명 |
구분 |
2006 |
2007 |
2008 |
2009 |
2010 |
|
면역학 |
논문수 |
419 |
486 |
514 |
599 |
705 |
|
피인용수 |
7,551 |
9,862 |
11,831 |
9,745 |
10,392 |
|
|
평균피인용 |
18.02 |
20.29 |
23.02 |
16.27 |
14.74 |
|
|
미생물학 |
논문수 |
629 |
718 |
754 |
692 |
679 |
|
피인용수 |
10,345 |
13,831 |
12,628 |
10,384 |
10,694 |
|
|
평균피인용 |
16.45 |
19.26 |
16.75 |
15.01 |
15.75 |
|
|
분자생물학 & 유전학 |
논문수 |
769 |
781 |
1,014 |
1,131 |
1,058 |
|
피인용수 |
23,742 |
28,172 |
25,494 |
27,598 |
29,062 |
|
|
평균피인용 |
30.87 |
36.07 |
25.14 |
24.40 |
27.47 |
|
|
생물학 & 생화학 |
논문수 |
1,974 |
2,157 |
2,831 |
2,487 |
2,994 |
|
피인용수 |
45,327 |
45,501 |
46,923 |
39,706 |
42,302 |
|
|
평균피인용 |
22.96 |
21.09 |
16.57 |
15.97 |
14.13 |
|
|
신경과학 & 행동과학 |
논문수 |
966 |
1,135 |
1,241 |
1,837 |
1,499 |
|
피인용수 |
18,183 |
19,535 |
20,911 |
19,680 |
19,321 |
|
|
평균피인용 |
18.82 |
17.21 |
16.85 |
10.71 |
12.89 |
|
|
약리학 |
논문수 |
1,140 |
1,326 |
1,488 |
1,680 |
1,750 |
|
피인용수 |
21,632 |
23,415 |
27,448 |
26,521 |
23,909 |
|
|
평균피인용 |
18.98 |
17.66 |
18.45 |
15.79 |
13.66 |
|
분야명 |
구분 |
2011 |
2012 |
2013 |
2014 |
2015 |
|
면역학 |
논문수 |
809 |
921 |
936 |
920 |
896 |
|
피인용수 |
9,344 |
8,855 |
6,870 |
5,410 |
2,845 |
|
|
평균피인용 |
11.55 |
9.61 |
7.34 |
5.88 |
3.18 |
|
|
미생물학 |
논문수 |
765 |
933 |
827 |
868 |
945 |
|
피인용수 |
8,728 |
10,595 |
5,539 |
4,680 |
2,727 |
|
|
평균피인용 |
11.41 |
11.36 |
6.70 |
5.39 |
2.89 |
|
|
분자생물학 & 유전학 |
논문수 |
1,392 |
1,571 |
1,456 |
1,787 |
2,013 |
|
피인용수 |
23,572 |
30,878 |
19,698 |
18,144 |
10,880 |
|
|
평균피인용 |
16.93 |
19.65 |
13.53 |
10.15 |
5.40 |
|
|
생물학 & 생화학 |
논문수 |
2,651 |
2,989 |
3,276 |
3,579 |
3,385 |
|
피인용수 |
39,988 |
37,236 |
31,359 |
22,618 |
13,275 |
|
|
평균피인용 |
15.08 |
12.46 |
9.57 |
6.32 |
3.92 |
|
|
신경과학 & 행동과학 |
논문수 |
1,405 |
1,703 |
1,828 |
1,865 |
1,950 |
|
피인용수 |
17,595 |
16,544 |
14,569 |
10,140 |
5,852 |
|
|
평균피인용 |
12.52 |
9.71 |
7.97 |
5.44 |
3.00 |
|
|
약리학 |
논문수 |
1,845 |
1,915 |
1,789 |
1,866 |
2,252 |
|
피인용수 |
20,766 |
18,539 |
15,437 |
10,530 |
6,797 |
|
|
평균피인용 |
11.26 |
9.68 |
8.63 |
5.64 |
3.02 |

[그림 2-43] 한국의 연도별 바이오분야 SCI논문수 추이
최근 5년간 우리나라에서 발표한 바이오 6개 분야 SCI논문 51,337편 중 1회 이상 피인용된 논문은 39,228편으로 논문의 피인용율은 76.4% 수준으로 나타났다. 대부분 분야에서 세계 평균과 비슷하게 나타났으나, 생물학 & 생화학 분야에서는 세계 평균 피인용율보다 1.1배정도 높은 것으로 나타났다.
[표 2-58] 최근 5년(2011∼2015) 한국의 바이오분야 SCI논문 피인용율
|
구분 |
한국 바이오분야 논문 |
세계대비 |
|||
|
논문수 |
피인용된 논문수 |
피인용율 (a) |
세계 피인용율(b) |
세계대비 (a/b) |
|
|
면역학 |
4,482 |
2,995 |
66.8% |
63.4% |
1.05 |
|
미생물학 |
4,338 |
3,858 |
88.9% |
87.4% |
1.02 |
|
분자생물학 & 유전학 |
8,219 |
6,530 |
79.5% |
78.5% |
1.01 |
|
생물학 & 생화학 |
15,880 |
12,415 |
78.2% |
70.7% |
1.11 |
|
신경과학 & 행동과학 |
8,751 |
5,924 |
67.7% |
64.2% |
1.06 |
|
약리학 |
9,667 |
7,505 |
77.6% |
65.9% |
1.18 |
|
생명공학 합계 |
51,337 |
39,228 |
76.4% |
69.9% |
1.09 |
최근 5년간 우리나라 SCI논문의 바이오 6개 분야 평균 피인용수는 8.77회로 세계 평균(9.95) 대비 88% 수준으로 나타났다. 10년 전(2001∼2005년) 73% 수준과 비교했을 때 질적으로 빠르게 성장하고 있는 것으로 나타났다. 최근 5년간 6개 분야 중 약리학 분야의 평균 피인용수가 세계 평균 대비 105% 수준으로 가장 높았다.
[표 2-59] 최근 10년간 한국의 바이오분야 SCI논문 피인용율
|
분야명 |
2001∼2005 |
2006∼2010 |
2011∼2015 |
||||||
|
한국 평균(a) |
세계 평균(b) |
비율 (a/b) |
한국 평균(a) |
세계 평균(b) |
비율 (a/b) |
한국 평균(a) |
세계 평균(b) |
비율 (a/b) |
|
|
면역학 |
26.18 |
37.29 |
0.70 |
18.13 |
22.44 |
0.81 |
7.44 |
9.10 |
0.82 |
|
미생물학 |
18.94 |
39.46 |
0.48 |
16.67 |
26.56 |
0.63 |
7.44 |
11.01 |
0.68 |
|
분자생물학 & 유전학 |
37.06 |
52.32 |
0.71 |
28.21 |
38.35 |
0.74 |
12.55 |
14.92 |
0.84 |
|
생물학 & 생화학 |
25.33 |
31.60 |
0.80 |
17.66 |
21.93 |
0.81 |
9.10 |
9.67 |
0.94 |
|
신경과학 & 행동과학 |
23.22 |
31.66 |
0.73 |
14.62 |
20.72 |
0.71 |
7.39 |
8.91 |
0.83 |
|
약리학 |
24.11 |
23.23 |
1.04 |
16.65 |
16.25 |
1.02 |
7.46 |
7.08 |
1.05 |
|
생명공학 합계 |
25.53 |
34.91 |
0.73 |
18.20 |
23.60 |
0.77 |
8.77 |
9.95 |
0.88 |
※ InCites DB 특성상 과거시점 5년주기 평균피인용율을 구할 수 없어 현재시점 피인용율을 나타냄
라. 바이오분야 SCI 고피인용(상위 1%) 논문 현황
최근 11년간 우리나라의 바이오 6개 분야 피인용 상위 1% SCI논문수는 394편으로 세계 17위 수준이며, 피인용 상위 1% SCI논문 비율은 0.53%로 세계평균(1%)에 미치지 못하는 것으로 나타났다. 하지만 연도별 현황을 분석하면 피인용 상위 1% 논문비율은 2005∼2009년 0.35%에서 2010∼2014년 0.58%로 점진적으로 증가하고 있는 것으로 나타났다. 최근 5년간 분야별로는 분자생물학 및 유전학분야가 피인용 상위 1% SCI논문 비율이 0.92%로 세계 평균(1%)에 가장 근접한 것으로 나타났다.
[표 2-60] 최근 11년간(2005∼2015) 바이오 분야 피인용 상위 1% 논문
|
구분 |
한국 바이오분야 논문 |
1% 세계 논문수 |
|||
|
1% 논문수 |
전체 논문수 |
1%논문 비중 |
1%논문 세계순위 |
||
|
면역학 |
22 |
4,949 |
0.44% |
27위 |
2,379 |
|
미생물학 |
17 |
8,212 |
0.21% |
25위 |
1,874 |
|
분자생물학 & 유전학 |
95 |
11,753 |
0.81% |
19위 |
4,214 |
|
생물학 & 생화학 |
125 |
24,024 |
0.52% |
16위 |
6,956 |
|
신경과학 & 행동과학 |
42 |
10,891 |
0.39% |
23위 |
4,879 |
|
약리학 |
93 |
14,662 |
0.63% |
16위 |
3,527 |
|
생명공학 합계 |
394 |
74,491 |
0.53% |
17위 |
23,829 |
[표 2-61] 세계 전체 대비 5년 주기별 한국의 피인용 상위 1% 논문 비중
|
구분 |
’05∼’09 |
’06∼’10 |
’07∼’11 |
’08∼’12 |
’09∼’13 |
’10∼’14 |
’11∼’15 |
|
면역학 |
0.47% |
0.52% |
0.51% |
0.56% |
0.50% |
0.42% |
0.37% |
|
미생물학 |
0.06% |
0.12% |
0.22% |
0.21% |
0.24% |
0.27% |
0.26% |
|
분자생물학 & 유전학 |
0.52% |
0.58% |
0.59% |
0.68% |
0.82% |
0.91% |
0.92% |
|
생물학 & 생화학 |
0.36% |
0.44% |
0.63% |
0.57% |
0.53% |
0.50% |
0.56% |
|
신경과학 & 행동과학 |
0.08% |
0.13% |
0.20% |
0.26% |
0.35% |
0.43% |
0.50% |
|
약리학 |
0.53% |
0.70% |
0.73% |
0.78% |
0.74% |
0.71% |
0.63% |
|
생명공학 합계 |
0.35% |
0.44% |
0.53% |
0.55% |
0.56% |
0.57% |
0.58% |

[그림 2-44] 연도별 한국의 피인용 상위 1%논문 비율 추이
5. 산업
산업통상자원부와 한국바이오협회가 국가표준 KS J 1009(바이오산업 분류체계)에 따라 국내 바이오기업 978개사를 대상으로 조사한 ‘2015년 기준 국내 바이오산업 실태조사’ 결과(2017년 1월), 국내 바이오산업 생산 및 수출입이 지속적인 증가세를 보이고 있는 것으로 나타났다.
가. 바이오기업 규모 및 매출발생 현황
2015년 기준 국내 바이오기업은 총 978개사로 기업 전체 종사자 규모를 기준으로 보면, ‘1∼50명 미만’ 기업이 574개(59.4%)로 가장 많고, 1,000명 이상의 기업은 46개(4.8%)인 것으로 나타났다.
기업 규모 매출발생 현황

[그림 2-45] 2015년 기준 국내 바이오기업 규모 및 매출발생 현황
매출발생 현황을 살펴보면, 전체 978개 기업에서 미응답기업 52개를 제외한 926개 기업 중 281개 기업(30.3%)이 2015년 현재 ‘매출 발생 이전’ 단계인 것으로 조사되었으며, 매출 발생이 있는 645개 기업 중 343개 기업(37.0%)은 ‘손익분기점 미만’인 것으로 조사되었다. 2015년 매출 발생이 있는 644개 기업 중 2015년 처음 매출이 발생한 기업은 11개(1.7%), 매출 발생이 10년 이상인 기업은 283개(43.9%)로 조사되었다.
나. 외부 협력 현황
전체 978개 기업 중 2015년 기준 타 기관과의 협력관계가 있었던 기업은 282개로 28.9%의 비율을 보였다. 282개 협력실적이 있는 업체는 주로 국내 기관과의 협력을 하고 있으며(89.6%), 10건 중 1건 정도는 해외와 협력을 하고 있었다.
바이오의약, 바이오식품, 바이오화학 등 3개 분야의 기업이 협력기업 수의 78.6%, 협력 건수의 80.9%를 차지하고 있었다. 바이오의약과 바이오식품은 기업체와의 협력이 많은 반면 바이오화학은 상대적으로 연구기관과의 협력건수가 많은 특징을 보이고 있다.
협력관계 형태는 공동연구 개발계약이 81.9%로 가장 많았으며, 다음으로 기술제휴-라이센싱(23.8%), 국내외 기술인력 교류(11.3%), 합작 투자(4.6%) 순으로 나타났다. 단계별로는 기초연구단계가 총 1,119건 중 376건으로 33.6%의 가장 큰 비중을 보이며, 다음으로 기초연구단계가 354건으로 31.6%로 높았으며, 전체 단계 중 마지막 단계인 사업화단계는 79건으로 7.1%의 낮은 비율을 보였다.
분야별 및 단계별 협력 건수는 바이오의약산업, 바이오식품산업, 바이오공정 및 기기산업은 실험단계의 비중이 높은 반면, 나머지 산업분야는 기초연구단계 비중이 더 높았다.
[표 2-62] 2015년 기준 바이오산업 분야별 협력 단계별 협력 건수
(단위 : 건)
|
구분 |
전체 업체수 |
협력 관계 보유 업체 |
협력관계 단계 |
||||||
|
기초연구단계 |
실험 단계 |
시작품 단계 |
제품화 단계 |
사업화 단계 |
합계 |
||||
|
전 체 |
978 |
282 |
354 |
376 |
172 |
138 |
79 |
1,119 |
(100.0%) |
|
바이오의약산업 |
330 |
100 |
122 |
155 |
96 |
51 |
19 |
443 |
(39.6%) |
|
바이오화학산업 |
206 |
65 |
46 |
44 |
21 |
33 |
38 |
182 |
(16.3%) |
|
바이오식품산업 |
197 |
63 |
68 |
117 |
23 |
38 |
8 |
254 |
(22.7%) |
|
바이오환경산업 |
76 |
14 |
10 |
5 |
4 |
1 |
5 |
25 |
(2.2%) |
|
바이오전자산업 |
22 |
6 |
43 |
3 |
7 |
3 |
2 |
58 |
(5.2%) |
|
바이오공정 및 기기산업 |
71 |
14 |
8 |
10 |
7 |
9 |
4 |
38 |
(3.4%) |
|
바이오에너지 및 자원산업 |
26 |
8 |
10 |
9 |
10 |
1 |
3 |
33 |
(2.9%) |
|
바이오검정, 정보서비스 및 연구개발산업 |
50 |
12 |
47 |
33 |
4 |
2 |
- |
86 |
(7.7%) |
다. 바이오산업 수급 현황
2015년 국내 바이오산업의 생산 규모는 8조 4,607억 원으로 국내판매 4조 2,094억 원(49.8%), 수출 4조 2,513억 원(50.2%)으로 나타났다. 국내판매와 수입에 따른 내수시장 규모는 5조 6,181억 원으로 조사되었다.
바이오산업의 생산규모에서 바이오의약산업이 3조 4,251억 원으로 전체 산업의 40.5%를 차지하였고, 바이오식품산업이 3조 2,174억 원으로 38.0%의 비중을 보였다. 내수시장에서 가장 큰 비중을 차지하고 있는 산업은 바이오의약산업이며, 전체 시장의 49.0%인 2조 7,514억 원 규모로 조사되었다.
2013년∼2015년 바이오산업의 수급변화 추이를 보면 생산은 지속적인 성장을 보이지만 내수는 감소하였으며, 2013년 이후 연평균 증감률은 수급 5,3%, 생산 6.1%, 내수 -1.0%로 나타났다.
2015년의 생산 부문은 전년 대비하여 11.2%가 증가하였으며, 바이오공정 및 기기산업의 성장률이 29.5%로 가장 높게 나타났다. 2015년의 내수 부문은 전년 대비하여 0.3% 증가하는데 그쳤으며, 바이오공정 및 기기산업과 바이오검정, 정보서비스 및 연구개발산업이 각각 18.7%와 14.6% 증가하여 증가폭이 컸다.
라. 바이오산업 국내판매 현황
2015년 바이오제품의 국내판매 규모는 4조 2,094억 원으로 바이오의약산업이 1조 5,307억 원(36.4%)으로 국내판매 부분에서 가장 큰 비중을 차지하고 있었다. 다음으로는 바이오식품산업이 1조 2,914억 원(30.7%), 바이오에너지 및 자원산업 6,001억 원(14.3%)으로 이들 세 개 분야는 전체 국내 판매액의 77.4%(2014년 78.9%)를 차지하는 것으로 조사되었다.
[표 2-63] 2013∼2015년 바이오산업 생산 및 내수 변화 추이
(단위 : 억 원, %)
|
구분 |
생산 |
||||
|
2013년 |
2014년 |
2015년 |
전년대비 증감률 |
연평균 증감률 |
|
|
전 체 |
75,108 |
76,070 |
84,607 |
11.2 |
6.1 |
|
바이오의약산업 |
27,635 |
28,709 |
34,251 |
19.3 |
11.3 |
|
바이오화학산업 |
5,622 |
5,484 |
5,714 |
4.2 |
0.8 |
|
바이오식품산업 |
30,211 |
30,392 |
32,174 |
5.9 |
3.2 |
|
바이오환경산업 |
301 |
306 |
306 |
0.0 |
0.9 |
|
바이오전자산업 |
1,517 |
1,543 |
1,602 |
3.8 |
2.8 |
|
바이오공정 및 기기산업 |
1,216 |
1,255 |
1,626 |
29.5 |
15.6 |
|
바이오에너지 및 자원산업 |
6,659 |
6,217 |
6,468 |
4.0 |
Δ1.4 |
|
바이오검정, 정보서비스 및 연구개발산업 |
1,947 |
2,161 |
2,466 |
14.1 |
12.5 |
|
구분 |
내수 |
||||
|
2013년 |
2014년 |
2015년 |
전년대비 증감률 |
연평균 증감률 |
|
|
전 체 |
57,337 |
56,024 |
56,181 |
0.3 |
Δ1.0 |
|
바이오의약산업 |
28,490 |
27,514 |
27,514 |
0.0 |
Δ1.7 |
|
바이오화학산업 |
5,147 |
4,972 |
5,239 |
5.4 |
0.9 |
|
바이오식품산업 |
13,666 |
14,032 |
13,275 |
Δ5.4 |
Δ1.4 |
|
바이오환경산업 |
303 |
306 |
304 |
Δ0.7 |
0.2 |
|
바이오전자산업 |
373 |
363 |
315 |
Δ13.1 |
Δ0.8 |
|
바이오공정 및 기기산업 |
1,294 |
1,203 |
1,428 |
18.7 |
5.1 |
|
바이오에너지 및 자원산업 |
6,504 |
5,870 |
6,083 |
3.6 |
Δ3.3 |
|
바이오검정, 정보서비스 및 연구개발산업 |
1,560 |
1,764 |
2,022 |
14.6 |
13.8 |
국내판매 추이를 보면, 2015년은 전년 대비 76억 원(0.2%)이 증가하였다. 분야별로는 바이오공정 및 기기산업이 전년 대비 35.8%, 바이오검정, 정보서비스 및 연구개발산업도 14.8% 성장한 것으로 조사되었다. 반면에, 바이오식품산업은 전년 대비 5.9%, 바이오전자산업은 13.4% 감소하였다. 바이오의약산업은 전년대비 0.1% 증가하는데 그쳤으나 전체 바이오산업에서 36.4%로 가장 큰 비중을 차지하고 있다.
2015 기준 주요 바이오제품의 국내판매 현황을 보면, 사료첨가제의 국내판매 규모가 6,942억 원으로 전체 바이오제품 판매액 중 16.5%의 비중을 차지하였다. 다음으로는 기타바이오의약품(12.3%), 바이오연료(9.8%), 건강기능식품(8.8%) 순으로 조사되었다.
[표 2-64] 2013∼2015년 바이오산업 분야별 국내판매 추이
(단위 : 백만 원, %)
|
구 분 |
2013년 |
2014년 |
2015년 |
전년 대비 증감 |
연평균 증감률 |
||||
|
국내 판매 |
비중 |
국내 판매 |
비중 |
국내 판매 |
비중 |
국내 판매 |
증감률 |
||
|
전 체 |
4,346,527 |
100 |
4,201,792 |
100 |
4,209,360 |
100 |
7,568 |
0.2 |
3.7 |
|
바이오의약산업 |
1,627,163 |
37.4 |
1,528,742 |
36.4 |
1,530,701 |
36.4 |
1,959 |
0.1 |
0.4 |
|
바이오화학산업 |
451,091 |
10.4 |
416,107 |
9.9 |
436,206 |
10.4 |
20,099 |
4.8 |
5.2 |
|
바이오식품산업 |
1,338,933 |
30.8 |
1,372,073 |
32.7 |
1,291,411 |
30.7 |
Δ80,662 |
Δ5.9 |
4.9 |
|
바이오환경산업 |
30,093 |
0.7 |
30,412 |
0.7 |
30,311 |
0.7 |
Δ101 |
Δ0.3 |
Δ26.9 |
|
바이오전자산업 |
35,814 |
0.8 |
35,550 |
0.8 |
30,774 |
0.7 |
Δ4,776 |
Δ13.4 |
6.7 |
|
바이오공정 및 기기산업 |
72,391 |
1.7 |
65,549 |
1.6 |
89,044 |
2.1 |
23,495 |
35.8 |
19.3 |
|
바이오에너지 및 자원산업 |
637,245 |
14.7 |
578,470 |
13.8 |
600,073 |
14.3 |
21,603 |
3.7 |
9.8 |
|
바이오검정, 정보서비스 및 연구개발산업 |
153,797 |
3.5 |
174,888 |
4.2 |
200,840 |
4.8 |
25,952 |
14.8 |
11.1 |
마. 바이오산업 수출입 현황
2015년 기준 바이오산업의 수출규모는 4조 2,513억 원으로 조사되었다. 분야별로 보면, 바이오식품산업이 1조 9,260억 원(45.3%)으로 가장 컸으며, 다음으로 바이오의약산업이 1조 8,944억 원(44.6%)을 수출하였다.
수출 제품별로 보면 사료첨가제가 1조 4,537억 원 수출되어 전체 수출액의 34.2%를 차지하였으며, 다음으로 기타바이오의약제품(13.4%), 면역제제(12.1%), 식품첨가물(8.9%), 백신(5.5%) 순이었다. 수출상위 10개 제품 중 7개는 바이오의약제품, 2개는 바이오식품, 1개는 바이오전자제품 이었으며, 이들 10개 제품이 전체 수출액의 87.9%를 차지하였다.
2015년 기준 바이오산업의 수입규모는 1조 4,087억 원으로 조사되었다. 분야별로 보면 바이오의약산업이 1조 2,207억 원으로 전체 수입액의 대부분(86.7%)을 차지하였다.
수입을 보면 백신은 2,707억 원이 수입되어 전체 수입의 19.2%를 차지하였으며, 다음으로 호르몬제 2,318억 원(16.1%), 기타바이오의약제품 2157억 원(15.3%), 혈액제제 1,996억 원(14.2%) 순이었다. 수입상위 10개 제품 중 7개가 바이오의약제품, 2개는 바이오화학제품, 1개는 바이오공정 및 기기였으며, 이들 10개 제품이 전체 수입액의 92.1%를 차지하고 있다.
[표 2-65] 2015년 기준 주요 바이오제품 수출입 현황
주요 수출제품 (단위 : 백만 원, %)
|
순위 |
제품명 |
수출액 |
구성비 |
|
1 |
사료첨가제 |
1,453,657 |
34.2 |
|
2 |
기타바이오의약제품 |
568,214 |
13.4 |
|
3 |
면역제제 |
514,228 |
12.1 |
|
4 |
식품첨가물 |
377,648 |
8.9 |
|
5 |
백신 |
235,257 |
5.5 |
|
6 |
진단키트 |
203,730 |
4.8 |
|
7 |
바이오센서 |
128,121 |
3.0 |
|
8 |
혈액제제 |
95,309 |
2.2 |
|
9 |
항생제 |
81,907 |
1.9 |
|
10 |
호르몬제 |
80,065 |
1.9 |
주요 수입제품
|
순위 |
제품명 |
수입액 |
구성비 |
|
1 |
백신 |
270,708 |
19.2 |
|
2 |
호르몬제 |
231,750 |
16.5 |
|
3 |
기타바이오의약제품 |
215,701 |
15.3 |
|
4 |
혈액제제 |
199,641 |
14.2 |
|
5 |
항암제 |
170,144 |
12.1 |
|
6 |
면역제제 |
62,733 |
4.5 |
|
7 |
바이오공정 및 분석기기 |
50,519 |
3.6 |
|
8 |
효소시약류 |
44,189 |
3.1 |
|
9 |
진단키트 |
30,714 |
2.2 |
|
10 |
기타바이오화학 |
21,927 |
1.6 |
바. 바이오헬스케어기업 기술특례상장 현황
코스닥시장에서는 2005년부터 기술성과 성장성을 보유한 벤처기업의 상장예비심사 시 일반기업과 차별화된 예비심사요건을 적용하는 기술성장기업 상장예비심사 특례를 시행하고 있다. 2017년 10월 현재까지 바이오분야에서는 기술특례를 통해 총 37개 기업이 상장되었다.
2005년 제도 도입 이후로 바이오기업 위주로 상장되고, 2014년 최초로 非바이오기업이 상장에 성공한 이후 영화, 원자현미경, IT, 철강 등으로 업종이 다변화 되고 있으나 여전히 바이오기업 중심으로 상장되고 있다.
바이오분야 기술특례상장기업의 시가총액 비중도 2016년 말 4.41%로 코스닥 시장에서 의미 있는 비중을 차지하고 있으며, 2017년 11월 현재 코스닥 시가총액 상위 10위 안에 2개의 기업이 포함되어 있다.
[표 2-66] 연도별 코스닥 기술특례기업 상장 현황
|
구 분 |
2005∼2013 |
2014 |
2015 |
2016 |
2017.10. |
|
기업 수(개) |
13 |
2 |
12 |
10 |
6 |
|
바이오 |
13 |
1 |
10 |
9 |
4 |
|
非바이오 |
- |
1 |
2 |
1 |
2 |

[그림 2-46] 바이오분야 기술특례기업 상장년도 및 시총 현황(2017년 11월 기준)
1) 바이오 산업분야 12-5규획(’13∼’15, 1.8조 원), 2025년까지 제조강국에 진입하는 것을 목표로 하는 ‘중국제조 2025’ 발표(’15)
2) 중관촌은 중국 최초로 지정된 첨단 기술 개발구로 첨단과학기술 및 IT 기업이 주류
3) http://www.who.int/gho/mortality_burden_disease/life_tables/situation_trends/en/
4) http://www.oecd.org/els/health-systems/health-data.htm
5) https://www.23andme.com/
6) https://www.ibm.com/watson/health/oncology-and-genomics/oncology/
7) Dewey FE, Gusarova V, O'Dushlaine C et al. Inactivating Variants in ANGPTL4 and Risk of Coronary Artery Disease. N Engl J Med. 2016 Mar 24;374(12):1123-33.
8) Cohen JD, Javed AA, Thoburn C et al. Combined circulating tumor DNA and protein biomarker-based liquid biopsy for the earlier detection of pancreatic cancers. Proc Natl Acad Sci U S A. 2017 Sep 19;114(38):10202-10207.
9) Price ND, Magis AT, Earls JC et al. A wellness study of 108 individuals using personal, dense, dynamic data clouds. Nat Biotechnol. 2017 Aug;35(8):747-756.
10) 바이오의약품, 바이오의약품 관련 서비스, 의료연구, 임상시험 등 보건・건강 분야의 산업으로, 농업, 환경 분야 관련 산업은 포함하지 않음.
11) European Biotechnology (2017.05.08.) GMO acreage growing
12) Evaluate Ltd. (2017) Orphan drug report 2017
13) Science Business (2017.06.01.) Horizon 2020 would need €62.4B more to fund all research rated as top quality
14) EC(2017.07) LAB – FAB – APP — Investing in the European future we want
15) European Biotechnology (2017.07.11.) Bavaria and Germany push digital medicine
16) Swiss Biotech (2017) Swiss Biotech Report 2017
17) BIOCOM AG (2017) The German Biotechnology Sector, 2017 Facts & Figure
18) Business France (2017) Biotech in France
19) Labiotech (2015.04.23.) What is the landscape of biotech industry in France?
20) European Biotechnology (2017.06.01.) EC and EMA provide Brexit guidance
21) Fierce Biotech (2017.03.29.) Brexit: Why U.K. life science is optimistic in the face of threats to R&D, funding
22) PwC (2017) The economic contribution of the UK Life Sciences industry
23) House of Commons Science and Technology Committe (2016.06) EU regulation of the life sciences
24) EC(2017.07) LAB – FAB – APP — Investing in the European future we want
25) EC(2017) Results of Horizon 2020 Stakeholder Consultation
26) 시사통신사(https://www.jiji.com)
27) 아베총리가 취임(2012.12.26.) 하면서 일본의 경제 재생을 위해 필요한 경제대책의 실행과 성장전략의 실현을 위한 사령탑으로 총리 직속인 내각부에 설치(https://www.kantei.go.jp/jp/singi/keizaisaisei).
28) 일본경제재생본부에서 제조업의 국제경쟁력 강화나 고부가가치 서비스산업의 창출에 의해 산업기반을 강화하고 의료・에너지 등의 전략분야의 시장창조, 국제경제 연대의 추진과 해외시장 확대 등을 목적으로 2013부터 매년 각의 결정으로 발표(https://www.kantei.go.jp/jp/singi/keizaisaisei/kettei.html).
29) Yomiuri신문(http://www.yomiuri.co.jp), Asahi신문(https://www.asahi.com)
30) ‘투자전략회의의 향후 검토과제’, 미래투자회의(제11회), 내각부 일본경제재생본부, 2017.09.08
31) Yomiuri신문(http://www.yomiuri.co.jp)
32) '미래투자전략 2017', 내각부 일본경제재생본부, 2017.06.09.(https://www.kantei.go.jp/jp/singi/ keizaisaisei/ pdf/miraitousi2017_t.pdf)
33) 과학기술・이노베이션회의의 본 명칭은 '총합과학기술・이노베이션회의'임. 2001년 1월 내각부설치법에 근거해 일본 전체의 과학기술을 조망하고 범부처적으로 종합적이고 기본적인 과학기술정책을 기획・입안 및 종합조정을 목적으로 '총합과학기술회의'로 설치. 아베총리 취임 후인 2014년 5월 법 개정에 의해 '총합과학기술・이노베이션회의'로 명칭 변경 및 기능 강화(http://www8.cao.go.jp/cstp/).
34) 과학기술기본계획은 1995년에 제정된 과학기술기본법에 근거해 '총합과학기술・이노베이션회의'에서 제1기 과학기술기본계획(1996~2000)을 시작으로 5년마다 기본계획을 수립 (http://www8.cao.go.jp/cstp/kihonkeikaku/ index5.html).
35) 아베수상 취임과 동시에 발족된 일본경제재생본부에서 추진한 아베노믹스 경제성장전략을 통해 단행된 의료개혁, 에너지 개혁, 농업개혁 관련 법제도 및 구조개혁을 지칭.
36) “일본인의 노벨상수상자”, 일본 위키피디아(https://ja.wikipedia.org)
37) 일본학술진흥회(JSPS, Japan Society for the Promotion of Science)는 1932년에 대학의 학술연구비를 배분하는 총괄기관으로 설립, 재단법인과 특수법인 형태를 거쳐 2003년 10월부터 독립행정법인로 확대 개편(https://www.jsps.go.jp)
38) '과학기술이노베이션전략'의 본 명칭은 '과학기술이노베이션총합전략'임. 일본의 경제재생, 인구감소 및 저출산의 급속한 진행, 지구환경문제 등의 난제를 극복하기 위해 과학기술이노베이션의 잠재력을 집중해서 발휘하고 이러한 시국을 타파하기 위해 과학기술이노베이션 정책의 총괄하여 매년'과학기술이노베이션총합전략'을 수립・시행하고 있음.
39) 수상 직속의 경제재정자문회와 과학기술・이노베이션회의 산하에 설치된 '경제사회・과학기술이노베이션활성화위원회'가 2016년 12월에 최종 보고한 안건임. 관민에서 민간투자유발효과가 높은 타깃영역을 성정하고 CSTI/산업계가 선정한 각부처 제안사업에 추진비를 추가하는 관민연구개발투자확대프로그램(PRISM, Public/Private R&D Investment Strategic Expansion PrograM) 창설(http://www8.cao.go.jp/cstp/tyousakai/keizai/index.html)
40) 일본 과학기술기본법(1995년 법률제130호 제8조)에 근거하여 문부과학성이 발간하는 과학기술진흥을 위한 정책 등에 관한 연간보고서 (http://www.mext.go.jp/b_menu/hakusho/html/hpaa201701/1379096.htm)
41) 일경바이오테크 온라인(https://bio.nikkeibp.co.jp/atclyb/17/120700004/)
42) 일본 바이오인더스트리협회(JBA, Japan Bioindustry Association)는 1942년 주정협회로 창립되어 발효협회의 명칭을 거쳐 1987년에 현재의 바이오인더스트리협회로 개편(https://www.jba.or.jp/)
43) 일본바이오산업인회의(JABEX, Japan Association of Bioindustries Executives)는 1999년 6월에 바이오인더스트리협회내에 설치. 2009년에 '바이오 성장전략', 2013년에 '바이오이노베이션총합전략' 등을 발표
44)'진화를 진화를 계속하는 바이오산업의 사회공헌 비전-새로운 기간산업의 창출과 글로벌 규모의 과제해결을 향하여', 일본바이오산업인회의, 2016.03.
45) 산업경쟁력간담회(COCN, Council on Competitiveness-Nippon)는 2007년에 주요 기업들이 모여 창설. 국가의 지속적인 산업경쟁력 제고를 위해 산업계의 목소리를 과학기술・산업기술의 정책에 반영하기 위한 포럼임.
46) 'Society 5.0의 실현을 위한 중요과제를 위한 중요과제에 대하여', 산업경쟁력간담회(COCN), 2017.11.16. (http://www8.cao.go.jp/cstp/gaiyo/yusikisha/20171116/siryo4.pdf)
47) 일본의료연구개발기구(AMED, Japan Agency for Medical Research and Development)는 초고령사회를 맞이하는 일본에서 국민이 보다 더 건강한 생활과 장수를 누릴 수 있는 사회(건강장수사회)를 만들기 위해 2013년의 '일본재흥전략'에서 의료분야의 연구개발 사령탑으로 설립제안. 2014년 5월 '건강・의료전략추진법'/'독립행정법인 일본의료연구개발기구법' 성립, 동년 7월에 건강・의료전략추진본부에서 '건강・의료전략'/'의료분야 연구개발추진계획' 등의 기본방침을 정리. 2015년 4월에 국립연구개발법인 일본의료연구개발기구(AMED)가 설립. 생명(LIFE1), 생활(LIFE2), 인생(LIFE3) 등의 '3가지의 LIFE'를 주요 주제로 표방(https://www.amed.go.jp/)
48) 경제사회의 구조개혁을 추진하기 위해 필요한 규제개혁을 위해 2018년 7월 32일까지 한시적으로 설치. (http://www8.cao.go.jp/kisei-kaikaku/index.html)
49) IBM's Watson - Best Doctor In The World?, World Health Net(2017)
50) 2006년 매출 상위 100대 의약품 중 21개에 불과했던 바이오의약품의 수가 급속히 증가하여 2020년에는 매출 상위 의약품의 절반 정도가 바이오의약품일 것으로 예상된다.
51)2015년도 연구개발활동조사보고서, 2015년도 국가연구개발사업 조사/분석 보고서, 미래창조과학부/KISTEP (2016). 바이오 분야의 범위에 따라 통계에 차이가 있다.
52)의약품산업연구개발비재원, 보건산업정보통계센터/KHIDI, 2014년 신약개발 정부연구개발 투자포트폴리오, KISTEP통계브리프 (2014)
53) 한미약품(면역질환치료제기술), 보령제약 카나브정(신약기술), 대웅제약 나보타(바이오시밀러), 셀트리온 램시마(바이오시밀러) 등 1억불 이상 수출 계약 사례가 있다.
54) 국민이 인식하는 보건복지정책 성과 : 의료비 부담 경감(40.5%), 보건산업 육성(14.0%), 감염병 등으로 안전한 보건의료 체계(11.1%) 순 (2015년 보건복지정책 수요조사 및 분석, 한국보건사회연구원)
55) 의료현장에서 인공지능 활용 세계시장은 US$ 8.1억(약 9,453억 원)(’15) → US$ 66억(약 7조 7,022억 원)(’21)로 연평균 42%↑ 전망(Frost&Sullivan, ’15.12)
56) 세계시장규모는 US$ 290억(약 33.8조 원)(’15) → US$ 1,126억(약 131.4조 원)(’25)까지 연평균 11.2%씩 증가할 것으로 전망(LG경제연구원, ’16.12)
57) 세계시장규모는 US$ 138억(약 16.1조 원)(’15) → US$ 494억(약 57.6조 원)(’21)으로 연평균 23.7%씩 성장할 전망(Markets and Markets, ’12.6)
58) 새 정부 공약・국정과제 중 ‘과학기술(R&D) 진흥: 자율과 책임성이 강화된 연구개발 생태계, 제약・바이오・의료기기산업육성, 공익적 가치 중심의 의료 연구기반 확대(안) 등 해당
59) 제1호 글로벌제약펀드(785억 원 투자/1,000억 원 조성), 제2호(502억 원 투자/ 1,350억 원 조성), 한국의료 글로벌진출펀드(-/500억 원 조성), 글로벌헬스케어펀드(200억 원 투자/1,500억 원 조성)
60) 진흥원-펀드운용사(인터베스트, 한국투자파트너스, KB인베스트먼트/솔리더스인베스트먼트 등)간 R&D 투자 및 기술동향, 우수 연구과제, R&D 수요동향 등 정보 공유
61) 유전자 변형기술(유전자공학), 세포 융합기술(세포공학), 세포 대량 배양기술(세포배양공학), 생물공정기술(효소공학), 미생물 이용기술(미생물공학)
62) 환경의 자정능력(自淨能力)을 향상시키고 사람과 자연에 대한 환경피해 유발 요인을 억제・제거하는 기술로서 환경오염을 사전에 예방 또는 감소시키거나 오염 및 훼손된 환경을 복원하는 등 환경의 보전과 관리에 필요한 기술 (「환경기술 및 환경산업 지원법」)
63) 대기, 수질, 상・하수도, 폐기물, 소음・진동 등과 같은 환경적 유해요인을 측정・예방・제어・복구하거나 환경피해를 최소화하기 위한 제품 생산 또는 서비스를 제공하는 산업 활동
64) 생물다양성협약, 기후변화협약, 사막화방지협약 등
65) 물리적, 화학적, 생물학적, 광학적 정보를 센서에서 인식하여 전기적 신호나 소리, 광 등을 이용하여 대상 오염물질을 감지하는 기술
66) 지구상에 존재하는 생물(동식물, 미생물, 인간세포 등), 생물의 구성물(DNA, 유전체 등) 및 이들의 정보를 포함하며, 그 구체적인 대상은 생물자원, 생물다양성, 생명정보이다(국가 생명자원 확보・관리 및 활용 마스터플랜, 2007.12., 국과위)
67) 「생명연구자원의 확보・관리 및 활용에 관한 법률」에 근거, 5년마다 범부처 기본계획 수립
68) 생물다양성협약(‘94.10 가입) : 각국의 생물자원에 대한 주권적 권리 인정, 생물 서식처의 파괴행위에 대한 규제, 생물다양성의 보전과 지속가능한 이용을 위한 국가전략의 수립, 유전자원 제공국과 이용국과의 공정한 이익 공유 등 규정
69) 국제백신연구소는 국제개발도상국을 위한 안전하고 효과적이며 저렴한 백신의 발굴, 개발 및 보급을 위해 UN개발계획이 설립을 제안하여 1996년도에 국내에 설립된 국제기구이다.
70) 기술분야별 투자 현황은 인문사회 분야를 제외한 과학기술 분야와 국방(비공개 세부과제 포함)분야 세부과제 47,789개, 정부연구비 17조 7,005억 원을 분석대상으로 함
71) 6T 기술분류 소분류를 기준으로 BT분야에서 중점 기술 분야 9개를 선별함.
72) 생명공학 특허동향 p14 특허청, 2003
73) 무성생식이란 씨(seeds)를 통한 번식(production)을 제외한 접목생식(grafting), 절단생식(rooting of cuttings) 등의 방식을 이용한 개량식물의 번식을 의미한다.
74) CII(Current Impact Index)란 현재시점을 기준으로 과거 5년간의 특허가 당해 연도에 얼마나 인용되었는지를 조사하여 상대적으로 비교한 값
75) 국가과학기술심의회(2013), 제3차 과학기술기본계획(2013∼2017)
제3장 분야별 연구개발 및 관련 산업 현황
![]() 제1절
기초생명과학
제1절
기초생명과학
1. 유전체
가. 개요
유전체 연구는 생명체를 구성하고 있는 염색체 전체의 완전한 염기서열인 유전체 및 관련 정보를 종합적・체계적으로 분석하여 질병을 포함한 다양한 문제 해결에 유전체 정보를 활용하는 분야이다.
유전체 연구의 핵심기술에는 1) NGS 장비를 이용한 초고속 대용량 유전체 해독 기술, 2) 유전체정보/빅데이터 분석 소프트웨어 및 알고리즘 개발 기술, 이를 활용한 유용 정보 분석/도출 기술 및 다양한 데이터 관리 기술, 3) 유전체 염기서열 해독 서비스, 유전체 정보 기반 정밀의료 개발 기술 등의 유전체 실용화 기술 등이 있다.
최근 유전체 해독/분석 기술의 발전으로 다양한 생물체에서 생산되는 유전체 빅데이터는 IT 기술 등과 융합되어 학문적으로 풀지 못한 의학적/생물학적 문제 해결과 새로운 의약학/바이오제품 개발 및 기존 산업을 혁신시키는 매개체 역할을 할 것으로 기대되고 있다.

[그림 3-1] 유전체 연구의 핵심기술
나. 해외 동향
(1) 기술 및 연구 동향
최근 개발되고 있는 3세대 염기서열분석법(Pacific Bioscience: PacBio RS, Oxford Nanopore Technologies: Nanopore)은 PCR 증폭 과정을 생략하고 DNA 단일분자를 그대로 해독할 수 있는 기술로, 기존 NGS의 한계점을 극복할 수 있는 새로운 방법으로 주목받고 있다. 2016년 Illumina사는 NGS 기반의 새로운 플랫폼인 노바섹(NovaSeq) 시리즈를 공개하여 100달러 유전체시대를 선언하였다. 이러한 NGS 기술발달로 Single-Cell Sequencing 기술이 개발되어 종양세포 이질성(tumor cell heterogeneity) 등의 다양한 유전체 연구에 활용되고 있다.
전 세계적으로 NGS 유전체 데이터의 비약적 증가로 인해 유전체정보/빅데이터 분석 기술 개발이 활발히 진행되고 있다. 특히, 맞춤의료를 위해 인공지능 기반의 임상의사결정지원시스템(Clinical Decision Support System, CDSS)과 같은 IT 기반의 클라우드 컴퓨팅 분석 파이프라인 및 서비스 시스템 개발 등이 진행되고 있다. 또한, 정보의 수집・연계・개방을 위한 각종 데이터의 표준화 및 정보보안 시스템을 구축하고 있다.
[표 3-1] 국가별 주요 유전체 연구 현황
|
국가 |
프로젝트/기관 |
투자예산 |
주요 내용 |
|
미국 |
정밀의료 이니셔티브 (PMI/NIH) |
2억 1500만 달러 /2016년 |
-100만 명 미국인 정밀의료 코호트 구축을 통해 유전체・생체시료・ 환경정보・의무기록 등 수집 추진 |
|
MSSNG project |
5억 6000만 달러 |
-1만 명 자폐증 환자와 가족 유전체 분석 및 자폐증 진단/맞춤 치료법 개발 |
|
|
영국 |
10만 Genome Project (Sanger Institute) |
총 3억 파운드 /2014∼2017년 |
-희귀질환, 유전질환, 암, 전염병 환자 및 가족 7만 명으로부터 10만 유전체 분석 및 질환 맞춤형 정밀의료 실현 |
|
프랑스 |
Genomics, personalized medicine |
670만 유로 /2016∼2021년 |
-초기에는 암, 당뇨, 희귀질환, 2020년 이후는 만성질환으로 확대하여 유전체학 및 정밀의료 연구 수행 |
|
일본 |
질병극복을 위한 게놈의료 실현화 프로젝트 (AMED) |
93억 엔 /2016년 |
-난치성 아동 질환 등의 정밀의료 수행 -중장기계획(∼2020년) 중점분야 9개 중 하나로 선정 |
|
중국 |
중국형 정밀의료 이니셔티브 (중국과학원) |
92억 달러 /15년 |
-100만 명 유전체 분석에 의한 정밀 의료 연구 수행 |
정밀의료 실현을 위해 세계 각국은 자국민의 대규모 유전체 분석 프로젝트를 공격적으로 투자하고 있으며, 초기에는 암 중심의 연구가 진행되고 이후 만성질환 및 희귀질환으로 확대 추진되고 있다. 정밀의료 프로젝트의 성공을 위해 각 나라는 정밀의료 추진 거버넌스의 일원화・통합화(중국과학원, 일본 AMED 등) 및 국제 공조를 추진하고 있다.
(2) 시장 및 산업 동향
NGS 기술 발전으로 인해 유전체 분석 효율이 높아지고 비용이 급감함에 따라 유전체 분석 서비스 시장이 급속히 성장하고 있으며, 23andME, Human Longevity社 등의 기존기업 뿐 아니라 글로벌 ICT 기업들도 유전체 분석 서비스 산업에 진입하고 있다.
(단위: USD Mn)

[그림 3-2] 글로벌 개인 의뢰 유전자 검사(DTC) 서비스 시장 전망(2014∼2022)1)
글로벌 정밀의료 시장은 2015년 384.5억 달러에서 연평균 13.3%로 성장하여 2025년 1,322.4억 달러 규모로 성장할 것으로 전망되며 분자진단, 동반진단, CDSS, 디지털 헬스케어 등 직간접적 유관산업의 폭발적 성장이 예상된다.
(단위: 억 달러)
|
연도 |
2015 |
2016 |
2017 |
2018 |
2019 |
2020 |
2021 |
2022 |
2023 |
2024 |
2025 |
CAGR (%) |
|
세계시장 |
384.5 |
427.0 |
474.7 |
529.1 |
591.0 |
661.7 |
758.2 |
870.2 |
1002.5 |
1158.3 |
1322.4 |
13.3 |

|
연도 |
|
|
|
|
|
|
2015 |
260.7 |
74.3 |
22.9 |
19.6 |
7.1 |
|
2016 |
288.6 |
83.3 |
24.3 |
23.2 |
7.6 |
|
2017 |
319.6 |
94.2 |
25.8 |
26.8 |
8.2 |
|
2018 |
354.3 |
107.2 |
27.6 |
31.1 |
8.9 |
|
2019 |
392.7 |
123.1 |
29.5 |
36.0 |
9.6 |
|
2020 |
435.3 |
142.5 |
31.8 |
41.7 |
10.3 |
|
2021 |
497.6 |
166.6 |
34.5 |
48.4 |
11.2 |
|
2022 |
568.4 |
196.7 |
37.5 |
56.1 |
12.0 |
|
2023 |
649.3 |
234.1 |
41.1 |
65.0 |
13.0 |
|
2024 |
741.8 |
282.1 |
45.0 |
75.4 |
14.0 |
|
2025 |
847.5 |
342.7 |
49.6 |
87.5 |
15.1 |
자료: Global Precision Medicine Growth Opportunities, Forecast to 2025, 2017, Frost&Sullivan
[그림 3-3] 글로벌 정밀의료 시장규모 전망
Google, Apple, Nike 등 ICT 기업 중심으로 건강정보 측정을 위한 모바일・웨어러블 디바이스가 출시되고 있다. 또한, 빅데이터 및 인공지능 기술의 발전, IBM Watson의 등장으로 인해 CDSS 산업 발전이 가속화되고 있으며, 대표적인 예로 IBM Watson, DXplain, VisualDX, POEMS, GRIP 등이 있다.
이와 더불어 디지털 헬스케어 산업 발전으로 ‘질병치료’ 위주 서비스에서 ‘예방 및 관리’ 중심 서비스로 전환되며, 미국, 일본, 호주 등에서는 공공기관과 민간기업 중심으로 건강관리서비스 산업이 확장되고 다양한 프로그램이 개발되고 있다.
다. 국내동향
(1) 국내 연구개발 현황
국가차원에서 전략적으로 유전체 연구를 수행하기 위해 5개 정부 부처가 시행하는 ‘포스트게놈 다부처유전체사업’(2014∼2021년, 총 5,788억 원 투자)이 수행되고 있으며, 9대 국가전략프로젝트의 하나인 정밀의료사업으로 ‘정밀의료 기반 암 진단 및 치료법 개발(K-MASTER) 사업단’과 ‘정밀의료 병원정보시스템(P-HIS) 개발 사업단’(고려대학교의료원, 2017년 6월, 총 624억 원/5년 투자)이 선정되어 수행되고 있다.
서울대학교병원, 삼성서울병원, 서울아산병원 등의 병원은 맞춤의료에 대비해서 ‘맞춤치료센터’를 운영하고, 암 기초연구자, 임상의사, 제약사 등 분야별 협력 네트워크를 구축하여 유전체기반 암 치료법을 개발하기 위해 기초-임상 중개연구를 활성화하고 있다.
[표 3-2] 해외 유전체 주요 기업 현황
|
기관명 |
주요 내용 |
|
|
-Google ventures 바이오헬스분야 투자 -건강한 성인 유전체 정보를 수집하여 건강한 인체 기준을 정의하는 ‘베이스라인 스터디 사업’ 추진 및 구글 핏(Google fit) 출시 |
|
Apple |
-의료연구 플랫폼 ‘리서치키트(ResearchKit)’ 및 헬스케어 앱 개발도구 ‘케어키트(CareKit)’ 출시 - 모바일을 통해 환자데이터 수집 및 연구 활용 |
|
IBM |
-슈퍼컴퓨터 watson의 빅데이터 분석 능력을 활용한 의료결정 지원 서비스 제공 |
|
Qualcomm |
-Qualcomm life Inc. 설립 -의료기기장비/서비스 산업 및 디지털 병원 사업 투자 |
|
Kaiser Permanennte |
-미국 대표 건강보험회사, 병원 체인기관으로 DNA 정보, 전자의료 기록 및 환경 정보 데이터베이스 구축 |
|
Ancestry.com |
-미국과 해외 9개국의 역사와 족보를 기록/제공하는 네트워크 서비스 및 축적된 DNA 데이터 기반 의학연구로 영역 확대 |
|
23andMe |
-2015년 희귀유전질환 보인자 테스트 허가 획득 -Genentech, Pfizer와 같은 대형 회사와 신약개발 파트너십 계약 (파킨슨병 환자 12,000명에 대한 정보 제공) |
|
Human Longevity Inc. |
-남아공 보험회사 Discovery와 유전체분석 서비스 협약 |
|
Foundation Medicine |
-암환자 유전체 빅데이터 분석을 통한 암환자 맞춤 표적 항암제 서비스 제공 -유전자변이 검사인 ‘Foundation One’(고형종양과 혈액암) 판매 |
|
Pathway Genomics |
-유전적 특징 분석 서비스 제공(특정질환 위험도, 특정 약물 반응성 등) -개인 맞춤형 건강 가이드라인 제공 서비스 개발 중 |
|
Counsyl |
-가족계획검사 서비스 제공(태아 희귀질환 검사 등) |
[표 3-3] 국내 주요 유전체 연구 현황
|
프로젝트명 |
주요 내용 |
|
포스트 게놈 다부처 유전체 사업 |
-인간・농생명자원・산림자원・수산생명자원 유전체 연구를 통해 과학적 탁월성에 기반을 둔 유전체 연구 성과창출 및 임상현장 적용에 의한 미충족 의료수요 해결 |
|
정밀의료사업 |
-정밀의료 기반 새로운 암 치료법 개발 및 ICT기술 활용/클라우드 기반 병원정보시스템 구축 |
|
10만 명 유전체 분석사업 |
-유전체 기반 헬스케어 신산업 창출을 위해 2021년까지 한국인 10만 명 유전체 자원 확보 및 KOBIC에서의 중앙 관리 |
|
한국인 참조 유전체 정보구축 사업 |
-일반인 400명 염기서열 해독/분석하여 한국인 참조유전체 정보 구축 |
|
국가생명연구자원 통합정보 시스템 |
-생명연구자원과 관련된 공개자료의 체계적인 수집 및 관리를 통한 유전체 활용성 증대 |
|
마크로젠 아시안 게놈 프로젝트 |
-아시안 게놈 프로젝트는 일본, 중국, 몽고 등 다수 국가가 참여하여 북방계 아시아인 10,000명에 대한 유전체정보 확보 |
(2) 국내 산업 현황
국내 유전체 관련 시장의 경우 맞춤의료 연구 및 서비스 플랫폼 구축에 필수적인 유전체 분석시장을 중심으로 형성되어 있다. 그 예로 민간 유전자검사 업체도 의료기관의 의뢰 없이 미용・웰니스와 관련된 12개 항목 42개 유전자에 대한 유전자검사가 가능하게 되어(2016년 6월) 일부 개인 의뢰 유전자 검사(direct-to-consumer, DTC) 서비스 산업이 허용되었다.
또한, 보건복지부는 고형암・혈액암・유전질환 등 3종 질환에 대해 NGS 기반 유전자패널검사를 병・의원 포함 22곳에 승인/허용하고(2017년 3월) 건강 보험을 적용함으로써 유전자검사 분야에서 새로운 서비스 시장이 형성되고 맞춤형 정밀의료 산업이 활성화되고 있다.
이와 더불어, 가천대길병원 등 국내 대형병원 5곳은 암치료에 암 치료용 인공지능(AI)인 IBM의 왓슨(Watson)을 이용하고 있다.
[표 3-4] 국내 DTC 서비스 현황2)
|
회사명 |
브랜드명 |
주요 내용 |
|
DNALink |
DNA GPS |
피부, 혈관, 헬스뷰티 등 3종 |
|
테라젠이텍스 |
진스타일 |
이너뷰티, 아웃핏뷰티 등 2종 |
|
이원다이애그노믹스게놈센터 |
진투미 |
12가지 항목 모두 검사하는 단일 상품 |
|
메디젠휴먼케어 |
엠보이저 |
원하는 항목 선택하는 DIT형 상품 |
|
랩지노믹스 |
제노팩 |
다이어트와 건강 관리 특화 |
|
마크로젠 / LG생활건강 |
젠스토리 |
피부/모발 등 뷰티, 생활습관 개선, 건강 관리 |
라. 발전 전망
NGS 기술을 활용한 동물, 식물, 미생물, 인간의 다양한 유전체 연구에서 생산되는 빅데이터는 비단 산업적인 측면뿐만 아니라, 인류가 직면한 식량 문제와 지구 환경, 더 나아가 인간의 전반적인 생활 및 존엄에 대한 인식 등을 바꿔놓을 수 있는 4차 산업혁명의 기반이 될 것으로 예상한다.
특히, 계속적인 유전체 해독/분석기술의 발전으로 질병의 예방, 진단, 치료의 정밀의료가 가능하게 되며, 이러한 데이터 기반의 정밀의료는 보건의료의 패러다임을 변화시켜 보건의료/헬스케어 산업을 폭발적으로 변화시킬 것으로 예상된다. 이를 실현하기 위해 국제적으로 유전체 분석의 표준화, 데이터의 통합・연계 등이 실행되며, 관련법・제도가 개선될 것으로 예상된다.
유전체 연구는 국가 경쟁력을 향상시킬 수 있는 필수 분야이며, 유전체 연구 결과가 실생활에 적용되기 시작하는 현 시점에서, 정부와 산업체는 지속적이고 주도적인 유전체 연구를 위해 과감하고 공격적인 투자와 기술개발을 해야 할 것이다.
2. 단백질체
가. 개요
(1) 단백질체학이란?
단백질체학(Proteomics)은 세포, 조직, 혈액 등에서 발현되는 모든 단백질의 총합인 단백질체에 대한 총체적인 연구로, 생체 활동, 질병, 노화 등에 따른 단백질 패턴 및 발현 정량뿐 아니라 단백질의 위치와 변화, 상호작용, 기능과 구조 분석을 포함하며, 유전체 서열과 생명 현상을 연결하는 정보를 제공하기 때문에 임상 진단과 신약개발 분야에서 가장 강력한 도구로 사용되고 있다.
(2) 단백질체학의 핵심기술

단백질체학 기술은 크게 프로테옴 분석기술, 단백질기능 규명기술, 단백질체 정보기술로 나뉘며, 핵심기술인 프로테옴 분석기술은 프로테옴 분리분획기술과 질량분석을 이용한 단백질 동정 및 정량기술이 주를 이룬다. 단백질기능 분석은 단백질 상호작용 및 경로 분석, 단백질구조 규명 및 디자인, 세포 및 개체 기반 단백질 기능 검증기술 등으로 구분되며, 단백질체 정보기술은 단백질체학 전 과정에서의 자료 분석 및 결과 해석에 기반이 되는 기술이다.
나. 해외 동향
(1) 기술개발동향
(가) 분리분획기술
프로테옴 시료의 복잡성을 극복하고, 폭넓은 프로테옴 분석범위를 확보하기 위해 단백질과 펩티드 수준에서 다양한 분획법이 사용되고 있다. 초기 이차원 전기영동(2D-PAGE) 단백질 분리법의 낮은 분석효율 및 낮은 재현성과 질량분석기와의 비효율적 연계 등의 문제를 극복하기 위해 액체크로마토그래피(LC) 기반의 분리분획 기술들이 활발히 적용되어, 역상액체크로마토그래피(RPLC) 기술은 오늘날 단백질체 연구의 표준이 되었다. 또한 고정상 충진물 소형화, 컬럼 길이 증가, 그리고 컬럼 내경 소형화를 통해 분해능과 검출 한도가 크게 향상된 초고압액체크로마토그래피(UHPLC) 기술은 나노전기분무이온원과 효과적으로 결합되어 단일 실험으로 수(십)만 종의 펩티드와 수천 종의 단백질을 동정할 수 있는 수준까지 개발되었다. 더 나아가 시료 수의 증가와 시료분획으로 인해 요구되는 높은 LC-MS/MS 실험 효율성을 실현할 수 있는 이중온라인 LC 기술 등 재현성 높은 high-throughput UHPLC 기술 개발이 주목을 받고 있다.
한편 RPLC와 분리직교성을 갖는 강양이온교환 크로마토그래피(SCX), 음이온교환 크로마토그래피(SAX, WAX), 친수성 상호작용 크로마토그래피(HILIC), high-pH RPLC 등과 연계한 2D-LC 분리 기술을 포함하는 다차원 분리(MDLC) 기술을 통해 프로테옴의 분석범위가 더욱 확장되고 있다. 최근에는 RP-RPLC 기반의 2D-LC 분리기술의 단점인 불완전한 분리직교성을 극복하고 분획시료의 복잡성을 균등화시켜주는 비연속적 시료분획 및 통합이 offline과 online 방식으로 광범위하게 활용되고 있는데, 이는 지금까지 보고된 2D-LC 방식 중에서 가장 효과적인 분리분획법으로 평가받고 있다.
이 외에도 단백질 수준에서 복잡성을 낮추는 분획 방법으로 gel 기반의 off-gel electrophoresis 기술이 개발되어 혈장시료 분석에 적용된 바 있으며, chromato- focusing과 RPLC에 기반한 이차원 분획 기술인 PF2D가 선보였고, 자유흐름식 전기영동(free-flow electrophoresis) 기반 또는 크기배제 크로마토그래피(size-exclusion chromatography) 기반의 offline 단백질 분획법이 사용되고 있다. 그리고 분자량 기반의 GELFREE 분획법이 시료의 복잡성을 획기적으로 줄여줌에 따라 top-down 프로테오믹스의 coverage를 높이는데 성공적으로 적용되고 있다. 한편 모세관등전집중(CIEF) 기술과 RPLC 기술은 전기분무이온원을 통해 질량분석장비에 직접 연계하여 단백질 수준의 LC-MS/MS 실험을 할 수 있는 online 분리기술로 가장 유력한 방법이다. 이들 기술은 다양한 단백질 분획기술과 분리직교성이 뛰어나, 각종 형태의 offline 2D 단백질 분리기술로 개발되고 있다.
(나) 질량분석기술
최근에는 새로운 ion source 및 analyzer의 개발과 같은 질량분석기기 하드웨어 개선에 대한 주목할 만한 큰 변화는 감지되고 있지 않으나, 대용량 데이터의 처리 기술, 다중오믹스 데이터 혼합 처리 기술 등 기존의 기기들을 혼합하여 특정 목표를 위하여 운영체계를 구성하여 운전하는 방향으로 진행되고 있다. 특히 빅데이터 분석으로 대표되는 컴퓨팅 기술의 발달로 목표 지향적인 데이터 처리 알고리즘 및 플랫폼에 대한 최적화 기술들이 다양하게 발전하고 있다. 또한 최대 100만의 질량 분해능과 10Hz의 속도에 이르는 현재의 analyzer는 10년 전 대비 분해능과 속도가 10배 증가하였고, UVPD(ultraviolet photodissociation)와 같은 새로운 fragmentation 기술의 상용화에 힘입어, 생화학적 패턴을 분석하는데 있어서 질량분석기술의 활용성이 괄목할 만큼 증대되고 있다. 데이터 분석 기술의 발달과 접목되어 DIA(data independent analysis)나 hyper reaction monitoring과 같은 진보된 컴퓨팅 알고리즘 없이는 분석이 불가능한 형태의 질량분석기술이 활용되고 있고, DDA(data dependent analysis)나 MRM(multiple reaction monitoring)과 같은 기술도 새로운 분석 소프트웨어의 발전으로 특정한 표지법 없이도 상대정량 분석에 있어 신뢰도 높은 결과를 얻을 수 있게 되었다.
진보된 질량분석기술 기반의 프로테옴 프로파일링 연구를 통해 도출된 바이오마커 후보 및 주요 질병관련 신호전달체계에 대한 타겟지향적 질량분석기술로는 여전히 MRM 기반의 타겟지향적 질량분석 에세이가 개발되고 있고, 최근에는 개선된 질량분해능의 딸이온 스펙트럼 데이터를 활용하여 펩티드 특이성과 정량성을 높이는 질량분석 에세이 기술이 주목을 받고 있다. 특히 사중극자-오비트랩 질량분석기술의 도입으로 가능하게 된 PRM 기술의 발전이 두드러진다. 또한 실험에 최적화된 실험방법 제어기술의 발전과 함께 단일 실험을 통해 검증되는 단백질 및 펩티드 수가 크게 증가하고 있어, 암질환 subtyping 등 기존 질환진단의 패러다임 변화를 이끌 수 있는 기술들이 활발히 개발되고 있다. 기존 프로테오믹스 기법과 별도로 ICP MS기술과 cytometry 기법을 결합한 mass cytometry(cyTOF)가 세포간의 생물질 콘텐츠의 변이를 규명할 수 있는 단일세포 분석기술로 활용되고 있다.
2017년 현재 질량분석기술의 지배적인 동향은 ‘다양한 mass analyzer, ion optics, 그리고 fragmentation 기술들의 혼성화를 통한 다차원 질량분석 데이터 생산’으로 요약될 수 있다. 기존 삼중-사중극자(Triple Quad), 사중극자-TOF 결합(Q-TOF)을 필두로 하여 이온트랩과 사중극자(Q-TRAP), 이온트랩과 FT-ICR MS의 결합(LTQ-FT)에 이어, 이온트랩-오비트랩(LTQ-Orbitrap), 사중극자-오비트랩(Q-Exactive), 사중극자-오비트랩-이온트랩(Fusion Orbitrap) 등 다양한 혼성화 기술들이 이용되고 있다. 나노전기분무법은 LC 기술과 연계하여 프로테오믹스의 지배적인 이온원으로 사용되고 있다. 이온깔대기 기술이 이온전달계로 도입되어 기존의 skimmer-다중극자 장치기반에 비해 증가된 이온 전달효율을 얻고 있어, 최근 주요 질량분석장비의 차별화된 이온전달기술로 사용되고 있다. 검출기술의 개발도 다양하게 진행되고 있어, Q-TOF 등 TOF 기술 기반의 질량분석기술은 검출기술의 속도 및 신호 감도 기술 개선 등에서 큰 발전을 이루고 있으며, 오비트랩 기술은 high-field 오비트랩 기술과 개선된 후리에 변환 기술의 개발 등으로 측정 속도 및 검출 감도, 질량분해능의 획기적 개선을 이루고 있다. 최근에는 분석 속도가 40Hz 달하는 오비트랩 장비(QE-HFX)가 도입되어, undersampling 문제를 크게 개선하고, 검출되는 펩티드 및 단백질 수가 증가할 것으로 기대된다.
Ion mobility spectrometry는 측정 시간의 호환성 등을 이유로 주로 TOF와 연계하여 사용되었으나, 최근 오비트랩과도 연계한 기술이 개발되어 추가적인 분리차원을 제공하고, 기존에 얻지 못한 물질의 구조 정보를 제공하고 있다. FT-ICR 기술은 dynamic harmonization 기술을 채용한 ParaCell과 초고속 ICR 신호 검출 기술의 개발을 통해 질량분해능과 질량측정정확도가 크게 개선되었다. FT-ICR은 높은 감도, 높은 질량분해능, 0.01 ppm 이하의 높은 질량측정정확도 등으로 단백질 혼합물의 동정을 개선하고, ECD, ETD 등 단백질 분해 기술의 개선으로 전단백질에 대한 더 정확한 화학적 정보를 제공한다. 펩티드 수준의 bottom-up 분석의 한계를 극복하기 위한 middle-down 혹은 top-down 방식은 지속적으로 주목받고 있는 프로테오믹스 기술인데, 추가로 UVPD, EThcD, ETciD 등이 개발되어 protein sequence coverage의 획기적인 개선을 이루고 있다. 이와 같은 고분해능/고정확성 FT 질량분석계 및 GELFREE 분획분리기술의 발달과 high-field 오비트랩 기술의 발전은 다양한 질량분석기술의 혼성화를 통해, 1,000개 이상 원형 단백질들의 동정이 가능하게 되었고, 그에 대한 다양한 단백질 아형들을 검출하는 연구가 확대되고 있다. 또한 native top-down 질량분석 방법으로 non-covalent protein complex를 분석하는 연구도 증가되고 있다.
(다) Informatics 기술
질량분석에서 얻어진 방대한 데이터로부터 펩티드의 서열, 정량, PTM 정보를 해석하고, 생물학적 의미를 추출하는 informatics 기술은 미국의 Scripps, ISB와 PNNL 그리고 독일 MPI 등의 유수 연구기관을 중심으로 활발하게 개발되고 있다. 이들 기관에서는 분석의 자동화와 생산된 질량스펙트럼의 해석을 위한 소프트웨어(TPP, MS-GF+, Skyline, MaxQuant 등) 환경을 구축하고, 이를 공개하여 문제점 개선을 위해 노력하고 있다. 또한 펩티드 서열로부터 단백질을 동정하고 정량적으로 해석하는 다양한 프로그램의 개발과 단백질의 PTM 분석을 위한 알고리즘(MODi, MSFragger, PeaksPTM 등)의 개발도 활발히 진행되고 있다.
단편적인 펩티드 정보를 조합하여 정확한 proteoform을 동정하고 더 나아가 정량적으로 분석하는 문제는 여전히 어려운 문제로 남아있다. 특히 modification의 정확한 해석과 정량은 질량분석이 해결해야 하는 난제 중 하나이다. 이에 대응하기 위한 top-down 방식의 질량분석과 데이터 해석기술이 발전하고 있으며 현재는 절충의 middle-down 분석이 종종 행해지나, top-down 및 middle-down 프로테오믹스에서 PTM 해석을 위한 기술 개발은 답보 상태에 있다. 그 외에도 단백질의 구조와 관련된 정보를 유추할 수 있게 하는 HDX-MS나 crosslinking에 의한 분석 등의 다양한 질량분석 기반의 분석기술이 개발되면서 이의 해석을 돕는 소프트웨어의 개발도 주목받고 있고, 항체를 이용한 단백질 상호작용을 분석하는 AP-MS(affinity purification mass spectrometry) 등에서는 기질 단백질의 정량을 위한 데이터 분석 기술 개발이 함께 진행되면서 단백질체 연구의 정확성을 높이고 다양한 활용을 가능하게 하였다.
최근에는 단백질체와 유전체 연구를 병행하여 종합적으로 해석하기 위한 유전단백체 연구가 활성화되면서, 질량분석을 통해 확인하고자 하는 proteoform을 DB search를 통해 동정 가능하도록 유전체 DB를 표현하고 구축하는 방법에 대한 연구가 진행되고 있다. 단순하게는 whole genome sequence에 기반을 둔 6-frame translation에서 시작하여, NGS나 알려진 mutation DB로부터 구한 non-synonymous SNP, 더 나아가 alternative splice variant를 쉽게 포함할 수 있도록 하는 exon graph, splice graph 등이 제안되었으며, 이들 유전체 기반의 아미노산 서열 DB에 포함된 서열 간의 중복을 최소화하는 알고리즘도 제안된 바가 있다. 유전단백체 연구에서는 이들 DB가 다양한 point mutation 및 structural variation의 가능성을 포함하게 되어 필연적으로 커지는 DB의 크기로 인해, search 시간이 늘어나고, random hit에 의한 false positive의 가능성이 높아지는 문제를 해결하기 위한 다양한 방안이 제시되고 있다. 고도로 분획화 된 시료에서 얻어진 단백질체 프로파일링 데이터분석에 많은 시간이 소요되는데, 유전단백체 DB 크기의 증가는 계산적 부담을 배가하고 있어, 신속한 분석을 위해 분산 또는 병렬 컴퓨팅 환경을 활용한 소프트웨어 분석 환경이 중요하다.
또한 CPTAC과 같은 대규모 과제의 연구결과로 생산된 단백질체 데이터의 축적에 따라 PRIDE와 같은 데이터 repository가 활성화되고, 대규모의 데이터분석이 가능해졌다. 앞으로 단백질체 빅데이터를 이용해서 pan-cancer 데이터 분석을 수행하거나, 대규모 클러스터링을 통한 네트워크 분석, deep learning을 활용한 문제 해결 등의 연구개발이 활발히 진행 중이다.
(라) 단백질체 정량기술
단백질체 정량은 LC와 질량분석기로만 정량하는 추세로, 안정 동위원소 치환 펩티드를 내부 표준물질로 사용하여 상대정량하거나 무거운 동위원소 치환 펩티드가 동일한 이온화 효율을 갖는 가정 하에 절대정량하는 접근법이 있다. 상대정량기술에는 ICAT, iTRAQTM, SILAC, IDBESTTM, TMT 등이 있는데 불완전 표지, 반응 부산물 발생, 시료의 복잡성 증가와 같은 문제점을 보이기도 하였으나, 최근에는 사용법의 표준화가 상당히 진행되어 정량성이 개선되었고, 특히 단백질체 연구의 효율성을 크게 개선함으로써 그 적용 사례가 증가하고 있다. SILAC 방법의 효율성을 높이기 위해 BONCAT 방법을 병행하여 새롭게 합성되는 단백질들을 click chemistry 방식으로 선별한 후 SILAC방법으로 정량할 수 있는 QuaNCAT방법이 개발되었으며, 최근에는 SILAC과 BONCAT 방법을 결합한 새로운 기법으로 메티오닌 아날로그를 안정 동위원소로 치환시켜 새로 합성되는 단백질을 정량하는 HILAC 방법이 개발되어 정량 방법의 효율이 높아지고 있다. 또한 새로운 안정 동위원소를 사용하여 동시에 최대 10개의 서로 다른 시료 분석이 가능한 10-plex TMT와, cysteine에 표지되어 산화 환원 반응에 주요한 단백질을 정량할 수 있는 iodo6plex TMT가 개발되어 적용되고 있다.
또 다른 방법인 비표지 정량법은 펩티드들의 상이한 이온화 효율, 존재량과 peak 세기 간의 비선형 관계, 데이터 처리 부분에서 여러 가지 난제를 안고 있으나, spectral counting을 이용한 emPAI, NASF, APEX 등과 extracted ion chromatogram 기반의 MaxLFQ, iBAQ 등의 알고리즘이 개발되어 문제점을 개선해 바이오마커 발굴에 활용되고 있다. 특히 단백질체를 얻는데 필요한 단계를 극단적으로 압축하여 3시간 만에 질량분석용 시료를 얻는 기술이 개발되어 비표지법의 장점인 시료처리과정의 단순함에 따른 높은 재현성에 최적화된 방법들의 적용으로 우수한 성과가 도출되고 있다. 또한 재현성과 분석시간에 영향을 미치는 fractionation 과정 없이 단 한 번의 시료 주입만으로 최대한의 단백질체를 얻을 수 있는 50cm 이상의 나노플로우 역상컬럼이 활발히 적용되고 있다. 절대정량기술에는 SISCAPA, QCAT proteotypic peptide, mTRAQTM(Applied Biosystems사) 기술 등이 사용되고 있으며, SIS를 사용한 Triple Quad 기반 SRM 기술 이용이 크게 증가하고 있다. 최근 SRM에 비해 transition 선정 소요 시간이 짧은 PRM과 SWATH(DIA) 방법이 개발되어 적용되고 있다. 특히 Orbitrap 장비에서의 DIA 실험을 통한 펩티드 동정 및 정량 기법이 부각되고 있으며, 이에 맞춰 Skyline, SpectronautTM, DIA-Umpire 같은 분석 소프트웨어가 개발되었다.
(마) PTM(Post-translational modification) 분석 기술
질량분석기를 이용한 PTM 분석에서의 낮은 stoichiometry 문제를 해결하기 위해, 각 PTM이 지닌 특이적인 물리화학적 성질을 이용하여 특정 PTM 단백질 혹은 펩티드를 농축하는 기술이 활발하게 개발되어 정착되고 있다. 인산화 펩티드 농축기술로는 가장 널리 쓰이는 IMAC 또는 TiO2를 이용한 affinity 분리 기술과 SCX 또는 SAX, high-pH RPLC 활용기술 그리고 인산화자리의 화학적 변환을 이용한 분리 기술이 있으며, 최근에는 항체를 이용하여 인산화 된 tyrosine을 농축하는 기술이 개발되었다. 또한 ProPacTM IMAC LC column을 이용하면 iron, gallium, zirconium 등 사용자가 원하는 금속이온을 컬럼에 충전시킨 후 LC 장비와 연계하여 산성용액과 염기성용액의 gradient 진행에 따라 비인산화 펩티드와 인산화 펩티드를 분리할 수 있다. 당쇄화는 asparagine 잔기의 amide에 결합하는 N-linked glycoprotein과 serine과 threonine의 수산기에 결합하는 O-linked glycoprotein 분석이 진행되고 있으며, hydrazide resin을 이용한 화학적 농축법과 lectin을 이용한 affinity 기반 농축법이 활용되고 있다. 최근에는 membrane filter와 lectin affinity 분리를 결합한 FACE 기법이 다양한 당쇄화 프로테옴 분석에 적용되고 있으며, 당쇄화의 데이터분석 프로그램의 개발과 DB 구축으로 glycan의 구조가 발견되어 여러 분야에 적용되고 있다. 아세틸화에서는 N-terminome과 acetylome의 발굴을 위한 COFRADIC, C-TAIL 등의 방법으로 유전자의 새로운 번역시작점을 발굴하거나 후성유전적 유전자 발현 조절에 관한 연구로 활용되고 있다. 최근에는 top-down 프로테오믹스 분석기술이 하나의 단백질에 나타나는 복잡한 PTM의 조합을 규명하는데 활용되고 있다. 이렇듯 생물학적인 기능에 매우 중요한 역할을 담당하는 다양한 PTM을 분석하는 것은 필수적이지만 임상시료의 경우 시료의 양이 제한적이기에 이를 해결하고자 하나의 시료로부터 phosphorylation-ubiquitination-acetylation/phosphorylation-glycosylation-acetylation을 순차적으로 분석하는 기법들이 개발되었다.
PTM 분석의 또 다른 특징은 PTM의 조합이 무궁무진함에 따른 DB의 거대화 및 장기간의 분석 요구 시간의 한계이다. 데이터 분석기술의 진보로 현재 일반적으로 사용되는 0.001Da 수준이 아닌 ±500Da 이상의 차이를 빠른 시간에 분석하는 unrestrictive modification 알고리즘이 새로이 개발되었다. MODplus와 MSfragger가 대표적인 방법인데, MSfragger의 경우 일반적인 modification 분석에 소요되는 시간만으로 분석을 해내는 최적 알고리즘을 사용하고 있다. 또한 두 펩티드가 연결되어 있는 cross-link 질량 분석의 해석에도 새로운 알고리즘이 개발되어 disulfide linkage 뿐만 아닌 다른 조합의 protein-protein interaction 연구에도 사용 중이다.
(바) 바이오마커 연구
질병의 조기진단, 예후, 약물치료에 대한 반응, 신약 후보물질에 대한 평가 등에 활용되는 오믹스 기반 바이오마커 중 단백질 마커는 표현형 바이오마커로서 생리 상태를 직접 반영하며, 체액에서 쉽게 분석이 가능한 이점이 있다. 그러나 암과 같은 질병에 대한 진단과 치료를 위한 새로운 바이오마커를 발굴하고 검증하려는 노력에도 불구하고 바이오마커가 실제 환자 치료에 사용되는 사례가 늘어나고 있지는 않다. 이에 대응하여 미국 AACR-FDA-NCI Cancer Biomarker Collaborative는 지속적으로 바이오마커의 효율적인 개발 과정을 촉진하고 있으며, NCI의 EDRN에서는 각종 암에 대한 단백질 바이오마커군의 평가를 수행하고 있다. 2012년부터는 유전체와 단백체 데이터를 통합하는 프로테오지노믹스 기술 기반의 바이오마커 개발 방법론이 본격적으로 태동되어 NCI의 Clinical Proteomic Tumor Analysis Consortium (CPTAC)은 TCGA 유전체와 단백질체 정보를 통합하는 유전단백체 이니셔티브 프로그램을 진행하였다.
2015년 미국에서 시작된 Precision Medicine Initiative는 그동안 개발된 오믹스 데이터, 특히 유전체 데이터를 임상 연구개발에 이용하려는 시도이다. 이러한 유전체 데이터 기반 연구개발은 점차적으로 단백질체 데이터 기반의 확충과 그 신뢰도의 향상에 따라 유전체와 단백체의 상호 보완적 적용으로 병행 진행될 것으로 예상된다. 특히 2016년에 론칭된 미국의 Cancer Moonshot 프로그램에서는 암 치료에 대한 보다 많은 치료제 및 기술 스펙트럼을 제공하기 위해 Best Science 적용을 계획하고 있으며, NCI 주도의 오믹스 데이터 기술을 포함한 각종 첨단 기술 개발이 크게 부상하였다. 그 일환으로 미국을 포함한 10개국이 참여하는 International Proteogenome Consortium(ICPC)은 CPTAC의 유전단백체 바이오마커 발굴 기술을 기반으로 참여 기관들과 유전체, 단백질체, 영상 데이터를 공유할 예정이다. 또한 2017년 2월에 시작한 미국 NCI/CPTAC 중심의 Applied Proteogenomics Organizationaℓ Learning and Outcomes(APOLLO) 프로젝트를 통하여 암 마커로 쓰일 수 있는 주요 단백질체 측정 에세이 개발을 론칭하는 등, 데이터 및 테크닉이 임상 환자의 치료제 개발에 직접 이용되는 기술적인 진전이 이루어지고 있다.
단백질체 분석에 요구되는 시료량 때문에 FFPE 조직 시료, biopsy 시료, Cyst 혹은 마우스 뇌와 같은 동물모델의 미량 시료와 같이 미세 시료 대상의 프로테옴 프로파일링이나 타겟 단백질 정량 연구가 제한적이었다. 최근 FFPE 1장의 슬라이드에서 deparaffinization 등의 일련의 과정을 통해 조직 시료를 처리하여 50㎍ 이상의 펩티드 시료를 얻는 기술이 발전하게 되어, 미세 시료로 단백질 동정 및 타겟티드 정량을 수행하는 micro-scale 프로테오믹스가 태동, 향후 바이오마커 활용 연구에 이용될 것으로 기대된다.
(2) 시장 동향 및 전망3)
(가) 시장 개요
단백질체 기술은 지난 수년간 지속적으로 발전하면서 임상 진단과 신약 발굴 및 개발 분야에서 강력한 도구임이 증명되어 왔다. 이러한 기술은 질병 감지, 질병 예후 예측 뿐 아니라 새로운 치료전략을 위한 약물 타겟 동정에 크게 도움이 된다. 따라서 신약개발과 임상 진단에서 단백질체 기술의 활용이 상업적으로 증가되고 있다.
2016년 세계 단백질체학 시장은 약 125억 불이고, 연평균 약 11.7%씩 성장하여 2021년 약 218억 불로 예측된다. 단백질체학 시장을 활용 분야에 따라 분류하면, 임상 진단 부문은 2015년에 세계 시장의 51.7%를 차지하고 있고 연평균 약 11.6%씩 성장하여 2021년에는 약 112억 불의 시장을 형성할 것으로 예측된다. 신약개발 부문은 2015년에는 전체시장의 40.8% 정도인데, 연평균 약 12.3%씩 성장하여 2021년에는 약 92억 불의 시장 규모로 크게 성장할 것으로 보인다.

[그림 3-4] 활용 분야에 따른 단백질체 시장 전망
아직 시장 점유율은 다소 낮은 편이나 아시아-태평양 지역의 단백질체학 시장 성장률이 세계 평균을 훨씬 웃돌 것으로 예상(CAGR 인도 16.8%, 중국 17.4%)되는 점은 주목할 만하다.
(나) 주요 시장 역학
개인 맞춤의학에 대한 수요 증가와 단백질체 연구의 기술적인 진보는 전 세계 단백질체 시장의 성장을 주도하고 있다. 바이오마커 탐지 및 암 프로파일링에서의 프로테오믹스 기반 접근법의 사용은 단백질체 시장의 성장에 중요한 역할을 할 것으로 예상되고 있다. 또한 기기의 혁신과 발전, 기존 단백질체 기술 기반 접근 방식의 고도화, 연구개발 비용의 증가, 다양한 연구비 지원 등이 프로테오믹스 시장의 성장을 주도하고 있으나, 고가의 기기 및 바이오마커 발견과 규제 당국의 바이오마커 승인 간의 괴리는 이 시장의 성장을 어느 정도 제한할 것으로 예측된다.
단백질체 시장 분야 기업들은 점점 더 고성장 시장에서의 입지 확대 및 다른 플레이어와의 합병 또는 협력을 통해 기술 경쟁력을 강화하는데 주력하고 있다. 시장 성장을 좌우하는 또 다른 추세는 유전체 연구에서 단백질체 연구로의 전환이다. 단백질체 기술이 대학과 산업체에서 성공적으로 적용되고 있으나, 단백질체 연구에서 생성된 많은 양의 데이터를 분석할 숙련된 연구자의 부족이 시장의 주요 과제라 할 수 있다.

[그림 3-5] 주요 시장 역학 요인
다. 국내 현황
(1) 연구개발 투자 현황
포스트게놈다부처유전체사업으로 다양한 단백질체 관련 연구사업이 계획되었으나, 2017년에 유전단백체 원천기술을 개발하는 다중오믹스신기술개발사업이 종료되었고 현재는 소규모의 유전단백체 융합정보기반 난치암 제어기술 개발사업(과학기술정보통신부, 수행기간 2017∼2022년, 연 10억 원, 주관기관 고려대학교)과 미국 NCI와 연계된 글로벌 바이오 연계기술 개발사업(과학기술정보통신부, 수행기간 2017년∼2022년, 연 10억 원, 주관기관 한국과학기술연구원)이 진행되고 있다. 이러한 두 개의 사업은 모두 Cancer Moonshot의 일환으로 진행 중인 대규모 유전단백체 연구 이니셔티브인 ICPC를 통한 공동연구 및 활용에 참여하고 있으나. 다른 나라에 비해 국내 투자가 현저하게 미미한 편이다. 현재 보건복지부에서 Cancer Moonshot에 참여하기 위한 기획 작업을 진행하고 있어서, 암 유전체 연구와 더불어 유전단백체 연구 투자가 다소 확대될 가능성은 있다. 그 외에 대형 사업단인 글로벌프론티어연구개발사업 중 의약바이오컨버젼스연구단과 기초과학연구원 연구단(RNA 연구단, 식물 노화・수명 연구단)에서 프로테옴 분석 인프라를 갖추고 연구에 활용하고 있으며, 기 구축된 질량분석기기 등을 활용한 연구가 산발적으로 진행 중이다.
(2) 관련 산업 현황
[표 3-5] 국내 대표적 단백질체 벤처기업 현황
|
기업명 |
주요 업종 |
설립연도 |
|
(주)영인프런티어 |
항체, 단백질, ELISA키트 생산 및 판매, 각종 과학기기 판매, HUPO Antibody Initiative에 참여 (에이비프론티어 합병) www.younginfrontier.com |
1994 |
|
(주)팹트론 |
주문형 펩타이드 제조 서비스, 기능성 및 약효 지속성 의약품 제형 기술 개발, 펩타이드 개발 및 생산 www.peptron.co.kr |
1997 |
|
(주)프로테옴텍 |
다중 알러지 진단키트 개발 및 판매, 프로테옴 분리 및 질량분석, 단백질 동정 및 확인법 개발, 진단키트 개발 www.proteometech.com |
2000 |
|
(주)노바셀테크놀로지 |
프로테오믹스 기술과 펩타이드 라이브러리 기술 기반으로 바이오의약품과 바이오소재 개발 www.novacelltech.com |
2000 |
|
다이아텍코리아(주) |
질량분석 기반 진단 제품 개발, 프로테오믹스 기술 이용 바이오마커 발굴, 면역항암제 액체생검 동반진단법 개발 www.diatech.co.kr |
2000 |
|
(주)진메트릭스 |
MALDI-TOF를 이용한 바이러스 및 미생물 유전자 진단 기술 개발 및 서비스 www.genematrix.net |
2000 |
|
(주)바이오인프라 |
빅데이터 기반 혈액 다중표지자 검사, 진단키트 개발, 바이오마커 발굴, 항암용 표적약물 전달 시스템 개발 등 www.bio-infra.com |
2001 |
|
(주)아스타 |
병원성 미생물 신속 진단법 개발, MALDI-TOF 진단 기기 (로봇기술 활용 최초 국산화), MALDI plate 생산 판매, 시료전처리 기기 개발 생산 www.maldiplate.com |
2006 |
|
프로테인웍스 |
단백질의약품 특성 분석 서비스, 천연물 분석 서비스, 프로테옴분석 proteinworks.co.kr |
2008 |
|
바이오앤시스템즈(주) |
단백질의약품 특성 분석 서비스 www.bionsystems.co.kr |
2009 |
|
(주)라이프사이언스 래보러토리 |
단백질분석서비스, LC/MS/MS 분석 서비스 N-말단서열분석 서비스, 각종 질량분석기술 교육 www.proteinlab.co.kr |
2013 |
출처: 자체검색
라. 발전과제
전 세계적으로 단백질체 연구는 정밀의료기술의 개발로 지향점을 바꾸고 있다. 환자별 차이를 고려한 치료 및 진단예측기술인 정밀의료기술의 핵심데이터는 유전단백체 데이터이다. 미국의 보건부를 중심으로 국방부 등의 다부처 정밀의료사업의 첫 모델인 APOLLO 과제는 DoD와 VA의 병원네트워크 내 6,000명 폐암환자에 대한 유전단백체 데이터 생산을 목표로 진행되고 있으며, ICPC 중심의 유전단백체 연구가 전 세계에서 다양한 암에 대해 진행되고 있다. 유전단백체 기술은 유전체정보와 단백체 정보들을 체계적으로 통합하여 질병 유의한 바이오마커를 발굴하고 검증하는 미래원천 다중오믹스 신기술로 각광받고 있다. 또한 NGS 혹은 microarray 수준의 분석이 가능한 정도의 micro-scale 프로테옴 분석 기술의 발전으로 환자 개개인의 치료 진단 등에 활용될 것으로 보인다. 나아가 궁극적으로 미량 시료에서의 유전체 및 단백질체 정보 동시 획득을 통하여 환자의 치료 진단 및 약물반응 예측 등 개별 유전체-단백체 기술의 비효율성과 한계를 극복하고 진정한 의미의 정밀의료를 구현하는 기반 기술로 활용 가능할 것으로 기대된다.
유전단백체 기술이 인간질병에 대한 정밀의료기술의 개발을 위한 지식기반을 제공한다면, 정밀의료기술의 구현은 단백질 다중 어세이기술을 통해 가능할 것이다. 현재까지 MRM, PRM, DIA 방법 등이 제안되어 검증되고 있으나, 제한된 감도와 정보력, 효율적 데이터분석법 부재 등 기술장벽은 여전히 극복되어야 할 과제이다. 최근 미국 FDA와 유전단백체 어세이 개발연구를 주도하고 있는 CPTAC이 공동으로 단백질 다중 어세이 기술의 신의료기술확립 기준과 의료보험적용을 위한 논의가 진행 중이다.
한편, 단백체 분석기술의 미니멀리즘이 오늘날 국제적인 트렌드인데, PTM 분석과 같은 농축이 필요한 기술들은 미니멀리즘을 적용하기 어렵기 때문에 도전과제로 남아 있다. 따라서 각 PTM에 특화된 단순화 분석기술이 개발되면 해당 PTM 연구의 활성화로 생명현상 및 질병에 대한 새로운 생화학적 특징을 지니거나 새로운 바이오마커를 발굴할 가능성이 높다.
3. 세포체
가. 개요
(1) 세포체(줄기세포 포함) 연구
(가) 세포체 활용 재생의료시장의 성장
줄기세포치료제로 대변되는 세계 세포치료제 시장은 2009∼2019년 연평균 18.8%의 성장률로 성장하여 2009년 350억 달러에서 2019년 1,960억 달러의 시장을 형성할 것으로 전망4)하였다. 글로벌 줄기세포 시장은 2013년 기준 400억 달러 수준에 불과

[그림 3-6] 세계 줄기세포 치료제 상용화 현황
했으나 연평균 24.1%의 성장률로 급속하게 성장하여 2018년에는 1,177억 달러 규모에 이를 것으로 예상된다. 줄기세포치료제 및 치료기술 관련 임상시험의 증가와 줄기세포은행 서비스 산업의 활성화가 줄기세포 치료제 시장의 급속한 성장을 이끌 것으로 예상되고, 또한 기존의 의약품들이 접근하지 못했던 의료 미충족 수요(medical unmet needs)로의 접근을 통한 새로운 시장 창출이 가능할 수 있다. 줄기세포 관련 기술은 세포치료제, 신약개발, 생체조직공학 등의 형태로 개발되어 매우 광범위하게 질환 치료에 이용될 것으로 예상된다.
2017년 기준 전 세계적으로 상용화 실현된 줄기세포 치료제는 7건이며 이 중 4건이 한국 기업을 통해 개발되어 줄기세포 치료제 개발을 선도하고 있다.
(나) 차세대 세포치료제 개발
2005년 생명윤리법 제정 이후 국내 수립된 98종의 인간배아줄기세포와 유도만능줄기세포에 대한 국가등록제 및 기탁이 성공적으로 수행되었고 국내 임상시험 활성화를 위한 국가인프라 확보와 운영을 위해 국가재생의료센터 건립이 진행되었다.
[표 3-6] 세계 배아줄기세포 유래 세포치료제 임상시험 현황
|
세포종류 |
적응증 |
임상단계 |
환자수 |
임상건수 |
|
Retinal Pigment Epithelium (RPE, 망막색소상피세포) |
황반병증 (노인성 황반병증, 스타가르트병) |
임상 I/II 상 |
141 |
111 |
|
CD15-Isl-1+ (심근전구세포) |
심근경색 |
임상 I 상 |
6 |
1 |
|
Pancreatic cells (췌장베타세포) |
제1형 당뇨병 |
임상 I/II 상 |
40 |
1 |
출처: www.clinicalTrials.gov
인간 배아줄기세포 유래 세포치료제 임상시험이 성공하였다. 대표적인 실명증인 노인성 황반변성증과 희귀질환인 스타가르트병에 대한 세포치료제가 개발되어 임상1상 및 2상 일부가 성공적으로 진행되었다. 미국, 영국과 함께 공동 진행되는 임상시험을 통해 세포이식 후 부작용 발생 없이 시력개선효과를 나타냄을 발표하여 차세대 치료제로서의 개발 가능성이 높아지고 있다. 현재 세계적으로 배아줄기세포 임상시험은 3건이며 점차 임상적용이 확대될 전망이다.
유도만능줄기세포 치료제 개발은 일본이 유일하며 RIKEN 연구팀에 의해 2013년 망막세포를 황반변성 환자에 이식하였으나 세포의 유전적 문제로 중단되었다가 2017년 동종 유도만능줄기세포 유래 망막세포를 이용하여 황반변성증 환자에 세포이식을 진행하는 등 전략적으로 임상시험 진행을 진행하고 있다. 특히 향후 12년 내 파킨슨씨병, 척수손상 등 신경계질환에 대한 임상시험계획을 발표하는 등 세계 주도권 장악을 위한 노력을 진행하고 있다.
(다) 세포체(줄기세포 포함) 활용기술의 확대 및 다양화 진행
줄기세포를 포함한 세포체 연구는 세포치료기술 외에 질환-특이세포주개발, 질환 모델링, 바이오 오가노이드, 신약개발 및 독성평가 연구 등 비세포치료 분야로 다양하게 확대되고 있는 추세이다.
또한 만능성을 지닌 전분화능 줄기세포를 활용하여 이를 신약개발에 활용하는 연구가 매우 활발하게 진행되고 있다. 2016년 다국적제약사인 GSK는 하버드 대학 연구팀과 공동으로 줄기세포를 활용한 drug reposition을 통해 루게릭병(ALS) 치료제에 대한 임상시험에 진입한다는 발표(2016 ISSCR meeting)를 하여 인체 세포와 동일한 줄기세포를 활용한 새로운 약물탐색이나 동물을 대체하는 비임상 수준의 독성평가 기술의 가능성을 제시하였다. 국내의 경우 신경세포를 활용하여 희귀질환인 부신백질이영양증의 원인물질(VLCFA) 규명을 통한 신규 치료물질을 발굴(2016년, Nature Communication)하는 등 세포활용을 통한 새로운 제약산업으로의 가능성을 타진하고 있다.
조직장기는 다양한 세포로 구성되어 세포-세포 또는 세포-세포기질 상호작용에 의해 기능이 작동되므로 최근 줄기세포 등을 활용하여 실제 인간 장기를 모사하는 바이오 오가노이드 연구가 활발히 추진되고 있다. 2015년 MIT에서 선정한 10대 미래유망기술로 뇌 유사기관이 선정된 바 있다. 2013년 미니 뇌가 제작된 후 오가노이드 제작연구가 활발하게 진행되었으며 이후 미니 심장, 갑상선, 간 등 다양한 오가노이드 개발 성공사례가 발표 되었다. 이러한 오가노이드 연구는 인체장기를 모사하여 질병의 발병기전의 해석, 치료기술 및 약물에 대한 독성평가 및 대체 장기 등의 바이오 의료분야에 활발히 적용될 수 있다.
(2) 줄기세포-재생의료 임상적용 및 산업화를 위한 규제개선
세계는 획기적 규제개선과 투자촉진을 통해 줄기세포-재생의료의 산업화 촉진을 유도하고 있다. 일본은 2013년 약사법 개정을 통해 재생의료법을 신설 줄기세포의약품의 허가요건을 대폭 완화하여 안정성만 확보될 경우 치료제로 허용하는 제도를 채택하고 있다. 세포의 안전성 정도에 따라 3종으로 분류하고 초기 임상시험(임상 1상 또는 2a상) 후 부작용 발생이 없을 경우 품목허가를 상용화가 가능할 수 있도록 제도 개선하였다. 유럽의 경우 ATMP(Advanced Therapy Medicinal Products)법을 통해 세포치료제, 유전자치료제, 조직공학제제 및 복합치료제에 대해 첨단치료의약품법으로 지정하여 우선심사 및 승인제도를 채택하여 기술개발 촉진 및 상용화를 주도하고 있다. 미국의 경우도 2017년 1월 RMAT(Regenerative Medicine Advanced Therapies)법 제정을 통해 줄기세포 치료제를 포함한 첨단의약품에 대해 미충족 의료수요가 있는 제품에 허가기준을 대폭 완화하는 정책을 추진하고 있다. 반면, 한국의 경우 가칭 ‘재생의료법’과 ‘첨단바이오의약품법’ 제정을 통해 국내 세포치료 및 재생의료 활성화를 위한 입법화를 추진하고 있으나 아직 국회에 계류되어 있는 상태다.
각 국가들은 세포치료제-재생의료 연구개발 및 산업화 촉진을 위한 투자 포트폴리오의 전략적 배분 및 연구단계 및 분야별 특성을 고려한 R&D 투자를 강화하고 있다. 한국의 경우 정부주도의 R&D에 전적으로 의존하고 있으며 미래창조과학부(現 과학기술정보통신부), 보건복지부, 산업통상자원부 및 농림축산식품부를 통해 연간 1,000억 원 수준의 연구지원을 진행하고 있다.

[그림 3-7] 세계 세포치료-재생의료 규제개선 현황
[표 3-7] 주요국 세포치료-재생의료분야 R&D 투자 현황
|
국가 |
정부지원 |
지원 규모 |
|
미국 |
-미국 NIH 줄기세포 연간예산은 약 13억 달러이며, 2010년 재생의학센터 설립하여 연간 1천만 달러 지원 -캘리포니아 재생의료기구(CIRM)는 연간 3억 달러 투자 * 2012년부터 연구인프라 및 기초연구 지원에서 치료제 개발 실용화 심의 지원으로 전환 |
2012년 기준 약 16억 달러 (약 1.7조 원) |
|
일본 |
-범정부차원의 재생의료분야 적극지원 및 선택과 집중의 투자전략 추진 -2009년 기준 연간 109억 엔 투자하고 있으며 이중 80% 이상을 iPSC 연구에 집중 -향후 10년간 iPSC 연구에 연 111억 엔 지원예정 |
2013년 기준 약 160억 엔 (약 1,700억 원) |
|
영국 |
-2006∼2015년 동안 총 약 1조 4,000억 원 투자 -BBSRC 및 MRC 주도하에 연구지원 추진 -2012년 재생의료 중개/임상연구 활성화를 위해 ‘Cell therapy catapult’ 신설: 치료제 임상개발연구 등에 2백만 파운드 지원 |
2010년 기준 약 1억 달러 (약 1,088억 원) |
|
중국 |
-줄기세포 국가 중대과학연구계획(2011∼2015) 수립 -2011년 기준 약 3,800억 원 투자 |
2011년 기준 약 3,800억 원 |
나. 해외 동향
(1) 글로벌 세포치료제 개발 현황


출처: GSRAC 질환중심 줄기세포/재생의료 치료기술 개발 전략로드맵
[그림 3-8] 질환별, 세포별 치료제 임상시험 현황
글로벌 세포치료제 연구개발은 지속적 성장을 나타내고 있다. 글로벌 세포치료제 임상시험 건수는 지속적으로 증가되는 추세이며 세포의 기원역시 다양화 되는 추세에
|
단계별 분류 |
SIT |
IIT |
||
|
Global(%) |
국내(%) |
Global(%) |
국내(%) |
|
|
Phase I |
67 (13.9%) |
18 (39.1%) |
589 (81.9%) |
- |
|
Phase II |
208 (43.2%) |
11 (23.9%) |
399 (35.2%) |
- |
|
Phase III |
65 (13.5%) |
11 (23.9%) |
74 (6.5%) |
- |
|
Marketed |
138 (28.6%) |
3 (6.5%) |
2 (0.2%) |
- |
|
기타 |
4 (0.8%) |
3 (6.5%) |
70 (6.2%) |
24 (100%) |
|
총계 |
482 |
46 |
1,134 |
24 |
출처: GSRAC 질환중심 줄기세포/재생의료 치료기술 개발 전략로드맵
[그림 3-9] 임상시험 종류별, 단계별 개발 현황
있다. 전 세계적으로 상업임상(SIT) 건수는 528건이며 연구자주도 임상(IIT)건수는 1,158건이 진행 중이다. 외국에 비해 한국은 IIT 건수가 상대적으로 적은 특징을 나타내고 있다. 글로벌 임상시험 중 세포기반 치료제는 75.6%이며 재생의료 치료제는 24.4%를 차지하고 있으며. 국내의 경우 모두 세포기반 치료만 수행 중에 있다.
[표 3-8] 세포기반치료제와 재생의료치료제 개발 현황
|
제품 유형 |
SIT |
IIT |
총합계 |
||
|
Global |
국내 |
Global |
국내 |
||
|
세포기반 치료제 |
260(53.9%) |
46(100%) |
645(83.3%) |
24(100%) |
1,274(75.6%) |
|
재생의료 치료제 |
222(46.1%) |
0(0%) |
189(16.7) |
0(0%) |
412(24.4%) |
|
총합계 |
482(100%) |
46(100%) |
1,134(100%) |
24(100%) |
1,686(100%) |

출처: GSRAC 질환중심 줄기세포/재생의료 치료기술 개발 전략로드맵
[그림 3-10] 세포기반 치료제 중 중간엽줄기세포(MSC;Blue)를 이용한 국가별 임상승인 현황
(2) 다양한 연구확대를 통한 세포체 연구 활성화 및 산업화 진행
전분화능 줄기세포 치료제 개발을 통한 차세대 치료연구가 확대되고 있다. 미국 ACT사를 중심으로 실명질환 치료제 임상진입(2011년) 성공 이후 미국, 한국, 영국 연구팀에 의해 장기간 임상시험을 통해 전분화능 줄기세포 치료제의 안전성 확보 및 의미 있는 치료능이 확인되어 차세대 치료제로의 개발 가능성을 확인하였다(Lancet, 2011, 2014). 이어 프랑스 연구팀은 심근경색 질환에, 미국 연구팀은 제1형 당뇨병 치료제를 개발하여 임상시험에 진입하였다. 일본의 경우 2013년 유도만능줄기세포 유래 세포치료제 개발을 집중하여 실명증인 황반변성증에 대한 임상시험을 진행하였으나 세포의 유전적 이상으로 중단되었다가 2017년 동종유래 유도만능줄기세포를 활용하여 임상시험을 재개하였으며 향후 10년 내 신경계질환에 대한 임상진입을 발표하는 등 세계주도권 확보를 위한 노력을 진행하고 있다.
대체 세포 공급원 확보를 위한 기초-원천연구가 활발하게 진행되고 있다. 기존 성체조직유래 세포 및 배아줄기세포와 유도만능줄기세포와 같은 전분화능 줄기세포 생산 외에도 직접교차분화(Direct conversion) 기술을 활용한 세포 생산기술 연구가 활발하다. 2010년 Wering 연구팀에 의해 신경세포로의 직접교차가 최초보고 된 이래 거의 대부분의 세포가 직접교차분화가 가능한 것으로 알려져 있다. 국내의 경우도 고려대 유승권 교수팀을 비롯한 다수의 연구팀에 의해서 신규 세포공급원으로서의 직접교차 연구 및 이를 활용한 세포치료연구 성과가 발표되었다.
또한 세포활용 연구의 적용 다양성 확대 연구가 활발해지고 있다. 만능성을 지닌 전분화능 줄기세포 또는 직접교차분화 세포 등을 활용한 신약개발 및 독성평가 연구 등 신규 줄기세포 연구개발 분야가 확대되는 추세다. 2016년 GSK는 줄기세포 활용 drug reposition을 통해 루게릭병(ALS) 치료제에 대한 임상시험에 진입한다고 발표(2016 ISSCR meeting) 하였고 국내의 경우 신경세포를 활용하여 희귀질환인 부신백질이영양증의 원인물질(VLCFA) 규명을 통한 신규 치료물질을 발굴(2016년, Nature Communication)하는 등 세포활용을 통한 새로운 제약산업으로의 가능성을 타진하고 있다. 또한 인체와 거의 동일수준의 세포를 활용하여 신약개발 초기단계의 비임상 독성평가 시스템개발연구도 매우 활발하게 진행되고 있다. 또한, 인체유래 세포를 활용하여 3차원 기관배양 또는 조직공학 기술 및 3D printing 기술 등과 융합된 인체모사 유사기관인 오가노이드(organoid) 연구도 매우 활발하게 진행되어 2013년 미니 뇌 제작 성공 이후 미니 심장(UC Berkley대, 2015), 미니 뇌(Johns Hopkins대, 2016), 인공장관 (Harvard대, 2016), 인공 귀(Tokyo & Ky대, 2016), 인공 눈(오사카대, 2016) 및 인공 피부(RIKEN, 2016) 등 다양한 오가노이드 개발 성공사례가 발표 되었다. 이러한 오가노이드 연구는 인체장기를 모사하여 질병의 발병기전 해석, 치료기술 및 약물에 대한 독성평가, 대체 장기 등의 바이오 의료분야에 활발히 적용될 수 있다.
다. 국내 현황
(1) 지속적 세포치료 연구개발 진행
국내의 경우 2011년 세계 최초로 줄기세포 치료제 상용화를 실현한 이후 지속적인 연구개발을 통해 총 4건의 줄기세포 치료제의 상용화가 실현되는 등 이 분야의 선도적 위치를 점하고 있다. 또한 줄기세포 치료제의 상업화 임상건수가 미국에 이어 세계 2위 수준으로 많은 임상시험을 진행하는 국가로 향후 재생의료시장 확대에 따른 의료시장 내 선점 가능성이 높다고 할 수 있다. 또한 전 세계적으로 매우 드문 전분화능 줄기세포 치료제 연구도 진행되어 인간배아줄기세포 유래 망막세포를 활용한 실명질환 치료제가 성공적으로 임상시험을 진행하여 안전성 치료능을 입증하였다. 일부 세포치료 전문기업의 경우 미국 식약처의 임상시험 승인을 통해 해외 시장 진출에 성공하는 등 지속적 세포치료 시장 확산이 진행되고 있다.
(2) 신규 세포치료제 공급원 개발 및 응용기술의 다변화
현재 임상진입 된 성체줄기세포와 배아줄기세포 치료제 외에도 신규 세포공급원으로 동형접합 유전자 유도만능줄기세포(Homozygous iPSC) 생산 성공(가톨릭의대, 2016), 체세포 활용 직접교차분화 기술개발, 줄기세포 기반 오가노이드 기법을 활용한 인체모사 기관 생산기술 개발 및 줄기세포 활용 신약기술 개발 등 연구기법의 다양화와 응용범위가 확대되고 있다.
[표 3-9] 국내 직접교차분화 연구 성공사례
|
초기세포 (Initial Cells) |
목적세포 (Target Cells) |
사용된 전사인자 |
연구팀 |
발표년도 |
|
생쥐 성상세포 (astrocyte) |
신경줄기세포 (neural stem cell) |
BMI1 |
고려대 유승권 |
2008 |
|
인간 섬유아세포 (fibroblast) |
신경줄기세포 (neural stem cell) |
OCT4 |
생명(연) 김장환 |
2012 |
|
생쥐 섬유아세포 (fibroblast) |
신경줄기세포 (neural stem cell) |
BRN4, SOX2, KLF4, MYC, E47 |
건국대 한동욱 |
2012 (viralvector) /2016 (episomal vector) |
|
생쥐 섬유아세포 (fibroblast) |
혈관내피세포 (endothelial cell) |
FOXO1, ER71, KLF2, TAL1, LMO2 |
서울대 김효수 |
2014 |
|
인간 섬유아세포 (fibroblast) |
신경줄기세포 (neural stem cell) |
HMGA2 |
서울대 강경선 |
2015 |
|
인간 섬유아세포 (fibroblast) |
혈관내피세포 (endothelial cell) |
ETV2 |
연세대 윤영섭 |
2017 |
라. 발전 과제
세포체 연구는 전 세계적으로 세포치료제 개발을 포함한 신약개발, 오가노이드 활용기술 및 유전자 및 조직재생 융합 연구를 포함하여 대부분의 바이오분야의 연구에 중요한 연구재료 및 연구방향으로 확대되고 있는 상황이다. 새로운 신성장동력 산업으로 세계적인 경쟁 하에서 연구개발이 촉진됨과 동시에 규제완화를 통한 신속한 제품화 및 산업화를 유도하고 있어 우리나라도 이에 대한 대응전략이 요구된다. 기존 세포치료제 개발의 지속적 확대 및 기 상용화된 세포치료제의 적응증 확대를 위한 임상중개연구 확대지원을 통한 산업화 촉진 연구 지원이 필요하다.
안전성을 기반으로 특정 분화세포를 활용하는 차세대 세포치료제 개발을 위한 국가 인프라 시설의 활용증대 및 배아, 유도만능줄기세포, 직접교차분화 세포를 활용하는 세포치료기술 개발 지원이 필요하다.
난치병 치료를 위한 세포치료기술개발 외에 세포연구의 응용확대와 향후 신산업 창출이 가능할 것으로 판단되는 신약 발굴, 독성평가 시스템 원천기술 확보, 오가노이드 활용 미니장기 및 대체장기 개발 연구, 줄기세포 활용 조직재생 및 유전자치료기술 등의 융복합 연구 등 세계적으로 초입단계의 연구부분에 선제적으로 대응할 수 있는 연구지원 프로그램 신설 및 운영이 필요하다.
4. 대사체
가. 개요
대사체학(Metabolomics)은 세포 대사로부터 파생된 작은 분자의 프로파일을 생성하고 생화학 반응의 복잡한 네트워크의 결과를 직접 반영하여 세포 생리의 여러 측면에 대한 통찰력을 제공한다. 대사체학은 생리학 및 병태 생리학의 종말점을 묘사하기 위해 전반적인 또는 네트워크 규모에서의 세포 및 유기 신진 대사 활동 및 상태를 조사한다. 이는 생물학적 시스템 내에서 화학 반응의 생성물 및 기질인 내인성 및 외인성 분자를 포함한 소분자 화합물의 측정을 포함한다. 대사체학 실험은 대사체의 활성을 직접적으로 반영하여 생산을 유도하고 해당 시스템의 근본적인 생물학적 상태에 대한 필수 정보를 산출한다. 따라서 특정 실험에 의해 정의되지는 않지만 포괄적인 방법으로 신진대사 연구를 반영한다. 여기에는 알려지지 않은 기능을 확인하고 두 조건 또는 모집단 전체의 상대적인 차이를 측정하는 non-targeted profiling이 포함될 수 있다. 이러한 실험은 유전 상태 또는 새로 조작된 대사 경로에 존재할 수 있는 새로운 대사체의 확인에 유용하며, 특히 정량화를 포함하는 semi-targeted 실험은 종종 더 유용하다. 이 프로세스를 통해 사용자는 네트워크 또는 경로의 특성을 특성화하기 위해 수백 가지의 별도의 생화학 분석법에서 얻은 데이터를 생성할 수 있다. Targeted 실험은 분자의 절대 농도가 측정되거나 한 분자가 다른 분자로 전환되는 속도 또는 플럭스가 얻어지기 때문에 특정 가설을 시험함으로써 더 깊은 통찰력을 제공한다. 따라서 targeted metabolomics 분석은 상당한 기존지식을 필요로 하며 그 성공은 테스트되는 가설의 강도에 달려있다. Nuclear magnetic resonance(NMR)와 mass spectrometer(MS)는 시료의 분자 구성을 분석하는 효과적인 도구이다. NMR은 화학적 환경과 분자 구조에 대한 정보를 인코딩하는 원자핵의 고유 자기 특성을 측정함으로써 분자의 특징을 감지한다. MS는 보다 민감하고 높은 처리량을 가지며 복잡한 생물학적 샘플에서 더 많은 분자를 측정할 수 있기 때문에 semi-targeted 또는 non-targeted metabolomics에 보다 일반적으로 사용된다. NMR의 장점은 샘플 분자의 수가 샘플 핵의 수와 정량적으로 일치한다는 점인데, MS에서의 이러한 제한은 추출 전에 내부 표준을 통합함으로써 극복될 수 있다. 대사체 분리에는 liquid chromatography(LC)와 gas chromatography(GC)가 모두 사용된다. 이러한 상이한 장비를 조합하여 구조의 해명을 진전시키려는 노력도 있었다. 또한, metabolomics에 필요한 샘플의 양이 줄어들어 세포 또는 조직 내에서 단일 세포 대사체 프로파일링 또는 조직이나 셀 내에서의 공간적 분해능을 가능하게 한다. 그러나 데이터 수집은 단순히 첫 번째 단계일 뿐이며 metabolomics는 궁극적으로 계측, 화학, 통계 및 컴퓨터 과학과 생물학적 문제의 통합이다.

출처: Trends in Biochemical Sciences, 2017
[그림 3-11] Metabolomics 접근기법으로서의 Targeted, semi-targeted 및 non-targeted 분석
나. 해외 연구 동향
(1) Clinical metabolomics 분야
미국의 Andrei Goga 박사팀은 삼중 음성 유방암(TNBC) 대사에서 종양 전사 인자 MYC의 역할을 규명하기 위해 targeted metabolomics 접근법을 사용했다. 지방산 산화(FAO) 중간체가 TNBC의 MYC 구동 모델에서 극적으로 상향 조절되는 것을 관찰하고, Cancer Genome Atlas 데이터베이스와 여러 임상 데이터 세트에서 확인된 TNBC 환자의 지질 대사 유전자 표지를 확인하였다. FAO의 약리학적 억제가 MYC를 과발현하는 TNBC 세포에서 에너지 대사를 급격히 감소시키고 MYC 구동 형질 전환 TNBC 모델 및 MYC 과발현 TNBC 환자 유래 이종 이식에서 종양 성장을 차단함을 발견했다.

(a) TN 및 RP 종양에서 336 지방산 대사 유전자에 대한 771명의 유방암 환자로부터의 TCGA RNA-seq 샘플의 계층적 클러스터링 (b) TN 및 RP 인간 세포 (RP 라인) 패널에서 FAO 활성제인 PGC-1α 및 BBOX1 및 지방산 합성 효소인 FASN, ACC1, ACC2 및 인산화된 ACC1 및 ACC2 (pACC)의 발현 수준을 보여주는 immunoblot 분석 (c) TN MYChigh, TN MYClow 및 RP 세포에서의 FAO 분석의 정량 (d) 종양이 있는 환자(좌측) 또는 합병된 신 보조 화학요법 치료 cohort에서 TN(중간) 또는 RP(우측) 종양이 있는 환자에 대한 Kaplan-Meier 생존 그래프를 ACACB(ACC2) mRNA를 기준으로 그룹화 백분위 수로 표시되는 최적의 임계값에서의 표현
출처: Nature Medicine, 2016
[그림 3-12] 사람 TNBC는 조절 기능이 없는 FAO를 보임
미국의 Frank B. Hu 교수팀은 Prevención con Dieta Mediterrnea(PREDIMED)에서 226 건의 심혈관 질환과 744 건의 난소암이 발생한 case-cohort 연구를 개발했다. Liquid chromatography-tandem mass spectrometry(LC-MS/MS)를 사용하여 혈장 BCAAs(leucine, isoleucine, valine)를 측정하였고 BCAAs의 높은 농도는 심혈관 질환 위험이 높은 집단, 특히 흡연자에서 심혈관 질환의 위험 증가와 관련 있으며 지중해 양식의 식이 요법이BCAAs의 1년 변화에 미치는 영향은 미미하지만 BCAAs가 뇌졸중에 미치는 해로운 영향을 예방할 수 있음을 확인했다.

출처: Clinical Chemistry, 2016
[그림 3-53] 중재 그룹에 의한 1년간의 개입 후 leucine, isoleucine과 valine의 변화. 변화는 연령(세), 성별(남성, 여성), 체질량 지수(kg/m2)로 조정
싱가폴의 Tien Yin Wong 교수팀은 당뇨병 환자 40명과 대조군 40명에서 gas chromatography-mass spectrometry(GC-MS)를 사용하여 nested population 기반의 case-control 대사 연구를 수행하였다. 11가지 대사체가 당뇨망막병증과 상관관계가 있는 것을 확인했으며 대사체 마커 2-deoxyribonic acid; 3,4-dihydroxybutyric acid; erythritol; gluconic acid; ribose를 40건의 당뇨망막병증 사례, 40명의 당뇨병 대조군, 40명의 당뇨병 환자가 없는 독립적인 표본 세트에서 검증했다.

출처: Diabetes, 2016
[그림 3-13] Discovery metabolomic profiling으로 확인된 대사체 마커의 상대 피크 면적을 보여주는 Heatmap
오스트레일리아의 Gilles J. Guillemin 교수팀은 염증, kynurenine 경로(KP) 및 다발성 경화증(MS) 병인의 연관성에 대한 통찰력을 얻기 위해 MS 환자의 KP 대사체 프로파일을 조사했다. 이들은 두 가지 중요 KP 대사체인 kynurenic acid(KA)와 quinolinic acid(QA)의 비정상적인 수준을 발견했으며 환자의 혈청 KP 대사성 표지가 높은 민감도와 특이성으로 임상 MS subtype을 식별할 수 있음을 확인했다.

* NADPH 생성 반응. 녹색 화살표; Brownlee에 의해 제안 된 바와 같이, 당뇨병 합병증을 일으키는 통합 메커니즘에서 polyol, hexosamine, protein kinase C 및 advanced glycosylation 최종 생성물 pathway의 활성화를 유도하는 당 대사체의 축적을 나타냄.
출처: Diabetes, 2016
[그림 3-14] 발견 및 검증 세트에서 DR 사례 중 gluconic acid와 ribose의 수치 상승으로 확인된 pentose phosphate pathway(PPP)의 활성화
오스트리아의 Christoph Magnes 박사팀은 bariatric surgery 직후 (Roux-en-Y gastric bypass)와 최대 1년까지 non-targeted metabolomics를 사용하여 관련 대사 변화를 확인했다. 제2형 당뇨병을 가진 24명의 환자, 1년 후에 당뇨병이 완화된 9명의 혈청을 고분해능 질량분석기와 결합된 액체 크로마토그래피(LC-HRMS, HILIC-QExactive)를 사용하여 분석하였으며 랜덤 포레스트(Random Forests)와 단변량 테스트 (univariate testing)를 통해 177개의 metabolic feature를 선택하고 심혈관 질환 위험에 대해 알려진 마커인 trimethylamine-N-oxide, alanine, phenylalanine 및 indoxyl-sulfate를 포함하는 36가지 대사체를 확인했다. 또한 당뇨병이 완화된 환자군에서 1년 후에 non-remission과 비교하여 알라닌이 유의하게 감소한 것을 관찰했다.

* tryptophan (A), kynurenine (B), kynurenine/tryptophan 비율 (C), kynurenic acid (D), quinolinic acid (E) NAD+ (F)와 quinolinic acid/kynurenic acid 비율 (G)
출처: Scientific Reports, 2017
[그림 3-15] Box plot이 있는 kynurenine pathway

출처: PLOS ONE, 2016
[그림 3-16] 세 가지 샘플링 포인트 모두에서 177개의 선택된 metabolic feature를 사용한 unsupervised Random Forests 다차원 스케일링 도표
미국의 Stewart F. Graham 교수팀은 안정한 오베스타틴 유사체(PEG-OB (Cys10, Cys13))를 사용한 치료가 식이 유도성 비만 (DIO) C57BL6/J 마우스의 혈장 대사체 수준에 미치는 영향을 LC-HRMS와 non-targeted metabolomics를 사용하여 연구했다. 분석 데이터를 정규화하고, 다변수 및 단변량 통계 분석을 수행하고, 예상되는 대사체를 추정하여 조사했다. 이들은 obestatin의 지질 대사에 관한 식이 유발성 손상 증거를 제공하고 obestatin 처리가 인지질 전환율에 영향을 미치며 지질의 항상성에 영향을 미치는 것을 입증했다.

출처: Metabolomics, 2016
[그림 3-17] 마른 마우스 (a) DIO 마우스 (b)의 관심 이온의 S-plot
(2) Lipidomics 분야

출처: Oncotarget, 2016
[그림 3-18] 유방암 및 양성질환시료에서의 C19 : 1 CE의 질량 스펙트럼
미국 Youping Deng 교수팀은 조기 유방암 환자 (0기-II기) 84명과 양성 유방 질환 환자 110명을 대상으로 training set 및 validation set를 통해 얻은 plasma의 지질 프로파일링을 통해 유방암 진단을 위한 잠재적 바이오 마커로서 지질종을 평가하는 예측 모델을 구축하였다. 예측 모델에 따르면, 15종의 지질종의 조합이 유방암 진단을 위한 plasma 바이오마커로 사용될 수 있음을 확인하였다.

출처: Oncotarget, 2016
[그림 3-19] 전체 세트에서 선택된 지질 종의 혈장 농도
중국의 Xijun Wang 교수 그룹은 1차 간세포에서 scoparone 노출 후 세포 지질 변화를 결정하기 위한 표 non-targeted lipidomics 전략을 제시했다. 지질 대사 프로파일은 high-performance liquid chromatography-time-of-flight mass spectrometry(HPLC-TOF)를 사용하여 분석되었으며 데이터 전처리, 시각화, 자동식별 등의 고해상도 MS 데이터 분석을 위한 새로운 이미징 TransOmics 툴을 개발했다. 제안된 10가지 지질은 scoparone이 간세포의 지질 대사에 미치는 영향의 이해를 도왔으며 1차 간세포의 지질 대사는 scoparone 치료로 크게 변화됨을 확인했다.

* (A) 양성 이온 모드에서 대조군, 모델 및 scoparone군을 분류하기 위한 세포질 리포좀의 PCA Score plot; (B) 음이온 모드에서 대조군, 모델 및 scoparone군의 군집을 위한 세포질 리포좀의 PCA Score plot
출처: Scientific Reports, 2016
[그림 3-20] Scoparone에 의한 지질 대사 프로파일링 변화
이탈리아의 Andrea Armirotti 교수팀은 LC-MS와 이온 이동도 질량 분석기의 결합을 기반으로 복잡한 조직 샘플에서 저강도 지질 신호를 검출하는 간단한 방법을 제시했다. 이 방법은 중첩된 모빌로그램의 시각 및 소프트웨어 보조 분석에 의존하며 신경 조직 손상시 생성된 드문 종류의 인지질(N-acyl phosphatidylethanolamines)의 비교적 작은 변화를 검출하기 위한 마우스 뇌 조직의 non-targeted lipidomics 분석에 성공적으로 적용되었다.

* 병변 (A) 및 대조 (B) 선조체 조직의 DT 대 m/z mobilogram. (C) 대조군 (황색에서 적색)과 병변 (청색에서 보라색)의 조직 mobilogram을 겹쳐 얻은 융합지도. (D) 손상된 striatum에서 명백하게 상승된 5개의 피크. (E) 상응하는 상향 조절된 m/z 값
출처: Metabolomics, 2016
[그림 3-21] Mobilogram 분석

* A. 다이어트에서 0%(녹색), 25%(파란색) 및 50%(빨간색) 옥수수 곡물을 먹은 염소의 반추위 체액을 구별하는 부분 최소 자승 판별 분석 score plot. B. PLS-DA 모델에 투영된 91가지의 공통적으로 검출된 화합물의 loading plot.
출처: Environmental Microbiology, 2016
[그림 3-22] 제1위 화합물 데이터에 기초한 부분 최소 제곱 판별 분석(PLS-DA)
(3) Microbial metabolomics 분야
중국의 Wei-Yun Zhu 교수 그룹은 454 pyrosequencing 전략과 MS 기반 metabolomics기술을 조합하여 식이 곡물 (0%, 25% 및 50% 옥수수 곡물)의 증가가 전체 반추위 미생물 및 그 대사체의 변화에 미치는 영향을 염소 모델을 이용하여 연구했다. 이들은 데이터 세트에 대한 상관관계 분석을 통해 반추위 대사체와 특정 미생물 종 사이의 잠재적인 관계를 밝혀냈다.

* (A) hematoxylin과 eosin(H&E) 염색의 대표적인 이미지 (B) 간 triglyceride (TG) 수준 (C) 혈장 alanine aminotransferase (ALT) 수준 (D) 혈장 lipopolysaccharide (LPS) 수준
출처: International Journal of Medical Microbiology, 2016
[그림 3-23] 만성 알콜 섭취에 대한 간 지방증, 상해 및 독소 혈증에 대한 다양한 식이 지방 분포의 영향
미국의 Craig J. McClain 박사팀은 간 조직 검사 및 염색과 GC×GC-TOF를 사용하여 다양한 종류의 식이 지방과 에탄올이 장내 미생물 구성 및 대사 활동에 미치는 영향과 이러한 변화가 알콜성 간 질환(ALD)의 간 손상에 미치는 영향을 평가했다. 불포화 지방이 풍부한 식이 요법은 알코올로 유발 된 간 손상을 증가 시키고 관찰된 간 손상에서 병인학적인 역할을 할 수 있는 대변 변인 및 대사 변화를 일으키는 것을 확인했다.

(A) 8주 동안 에탄올과 다른 유형의 식이 지질을 먹인 쥐의 장내 세균 풍부도에 대한 비교 분석
(B) Firmicutes : 실험의 끝에서 Bacteroidetes 비율
(C) 장내 박테리아 문의 변화는 8주 동안의 에탄올 섭취에 대응하여 일어남
출처: International journal of medical microbiology, 2016
[그림 3-24] 장내 미생물 구성에 대한 다양한 종류의 식이 지질 및 만성 에탄올 (EtOH) 투여의 효과
스위스의 Jean-Luc Wolfender 교수팀은 분자 네트워킹(MN)과 MN의 광범위한 in-silico MS/MS fragmentation 데이터베이스를 결합하여 혁신적인 중복 제거 전략을 제안했다. 식물 및 진균 균주 추출물을 사용한 두 가지 사례 연구를 통해 결합된 접근법은 복잡한 NP 추출물의 화학 작용 탐색 및 대사체 복제뿐만 아니라 데이터베이스 항목의 아날로그에 주석을 다는 강력한 도구를 제공하였다.

출처: Anal. Chem., 2016
[그림 3-25] In-Silico MS/MS 데이터베이스(ISDB)를 이용한 분자 네트워크(MN) 기반 복제의 개념도
미국의 Nadja B. Cech 교수팀은 분별 과정 초기에 활성 성분 확인을 향상시키기 위해 통합된 생물학적 및 화학적 데이터 세트의 통계적 모델링을 통한 생물학적 검정 유도 분획과 non-targeted metabolite profiling의 조합을 평가했다. 테스트 케이스로 Staphylococcus aureus에 대한 항균 활성을 가진 내생 곰팡이 Alternaria sp.와 Pyrenochaeta sp.의 추출물을 사용하여 생체 활성 혼합물 구성 요소를 확인하고 연구의 생체 측정법의 잠재적 가능성을 보였다.

출처: J. Nat. Prod., 2016
[그림 3-26] Biochemometric data set를 통한 Pyrenochaeta sp.의 생체 활성 원리의 확인
(4) Food & plant metabolomics 분야
스페인의 Tomás Barberán 박사팀은 절단 후 상추의 상처 반응을 설명하고 갈변의 원인이 되는 대사체를 확인하기 위해 ltra-performance liquid chromatography-electrospray ionization-quadrupole-time-of-flight mass spectrometry(UPLC-ESI-Q-TOF)를 사용하여 non-targeted metabolomics 접근법을 수행하였다. lysophospholipids, oxylipin/jasmonate 대사체와 페놀 화합물에 속하는 15가지 대사체가 갈변 과정을 설명할 수 있음을 확인하였고 절단 직후 빠르게 갈변하는 품종은 15가지 갈변 관련 대사체 중 11가지를 함유하는 반면, 느리게 갈변하는 품종은 5가지만 함유하고 있음을 확인하였다.

* 모양에 따른 품종 : FB(■) 및 SB(▲). 색상별로 0°(적색), 2시간(갈색), 6시간(분홍색), 24시간(회색), 48시간(녹색), 72시간(청록색), 96시간(진한 파란색) 및 120시간(하늘색)
출처: J. Agric. Food Chem., 2017
[그림 3-27] 빠른 갈변(FB) 및 느린 갈변(SB) 양상추 재배 품종의 대사체의 주성분 분석(PCA) score plots
미국의 Elizabeth P. Ryan 교수팀은 소화관 미생물 대사 프로파일을 통합하고 GC-MS 및 UPLC-MS를 이용한 non-targeted metabolomics를 사용하여 대장암의 화학적 예방을 위한 대사경로 네트워크 확인을 통해 쌀겨 섭취가 쥐의 대장암 성장을 감소시키고 human stool microbiome을 변형시키는 것을 확인했다.


* (a) 배수 변화 값이 ≥5.00인 4주 및 기준 시점 사이에 유의한 차이가 있는 대변 대사체 및 (b) 배수 변화 값이 <5.00 인 4주 및 기준 시점 사이에 유의하게 다른 대변 대사체
출처: British Journal of Nutrition, 2017
[그림 3-28] 시간에 따른 쌀겨 그룹의 대변 대사 곡선 프로필 차이


* (a) 스테로이드, (b) 담즙산, (c) 이노시톨, (d) 보조 인자 및 비타민 대사에 대한 경로 특정 네트워크 뷰(Cytoscape).
출처: British Journal of Nutrition, 2017
[그림 3-29] 4주째에 쌀겨 섭취자들의 지질, 보조 인자 및 비타민 대사체의 대변 대사 경로 네트워크 분석
이탈리아의 Fulvio Mattivi 박사팀은 포도주와 산소 사이의 상호작용의 화학적 성질에 관한 새로운 실험적 증거를 얻기 위한 연구를 진행했다. 6가지 품종(Inzolia, Muller Thurgau, Chardonnay, Grillo, Traminer 및 Pinot gris)에서 생산된 12종류의 화이트 와인 216병을 LC-MS를 사용하여 non-targeted metabolomics 방법으로 분석했다. 유도된 35가지 대사체 중에는 아스코르브산, 타르타르산 및 와인에서 처음으로 관찰되는 다양한 설폰화 화합물이 포함되었다. 설폰화 반응에 의해 중재되는 SO2의 소비는 보틀링에서 일어나는 높은 농도의 산소에 의해 촉진됨을 확인했다.

* 산소의 존재 하에 glutathione(GSH)은 glutathione disulfide(GSSG)를, GSSG는 SO3H-와 반응하여 S-sulfonated glutathione(GSSO3H)을 형성. GSSG/SO2 반응은 GSSO3H(A)와 GSH(C)를 생산했지만 GSH/SO2 반응 생성물 사이에는 GSSG가 검출되지 않았음
출처: J. Chromatogr. A, 2016
[그림 3-30] 설폰화 반응에 의해 중재되는 SO2의 소비는 보틀링에서 일어나는 높은 농도의 산소에 의해 촉진됨을 확인
다. 국내 연구 동향
(1) 한국과학기술연구원
6세에서 14세 사이의 소아 199명의 혈청에서 cholesterol, pregnenolone 및 dehydroepiandrosterone(DHEA)와 그 sulfate conjugate의 농도를 정량적으로 분석하여 청소년의 성 이형성 및 사춘기 단계와 스테로이드 대사의 상관관계를 연구하였다. 사춘기 전 단계에서는 여아의 DHEA 수치가 보다 높았으며 사춘기 발달 중에는 남아의 DHEA 수치가 유의하게 증가하였고 pregnenolone 수치는 여아에서, sulfate conjugate 수치는 남아에서 유의하게 높았다. Sulfotransferase 활성을 나타내는 대사율은 남아에서 유의하게 높았으며 사춘기 발달로 증가하였으나 여아에서는 증가하지 않았고, CYP11A1 활성 수준은 사춘기 발달과 함께 남녀 모두에서 유의하게 증가함을 확인하였다.

출처: Clinica Chimica Acta, 2016
[그림 3-31] Cholesterol에서 dehydroepiandrosterone까지의 대사 경로와 관련 효소

출처: Journal of Steroid Biochemistry & Molecular Biology, 2016
[그림 3-32] 수정된 표본 수집 후의 hair sterol 분석으로부터 얻어진 OPLS-DA와 VIP score plots
19가지 hair sterol의 정량적 프로파일링을 다변수 데이터 분석과 GC-MS 분석을 사용하여 개발하고, 가벼운 인지 손상, 알츠하이머 질환군 및 건강한 대조군을 포함한 여성 참가자의 hair에서 8개의 hair sterol(HCs)을 정량적으로 검출하였다. 인지 손상은 7b-hydroxycholesterol 기반의 HCs보다 높은 대사율과 상관관계가 있음을 확인하였고 미니 정신 상태 검사(MMSE) 점수와 결합된 HCs 특성을 사용하여 향상된 진단 값을 얻었다.
(2) 한국기초과학지원연구원

* (A) 지방산 대사에서 카르니틴과 아실 카르니틴의 역할 (B) 1시간, 1일 및 10일에서 MI 쥐의 카르니틴 및 아실 카르니틴 심장 조직 수준의 변화. NGS 데이터에서 fold-changes로 표현된 acyl-CoA dehydrogenasem RNA 레벨의 heatmap.
출처: International Journal of Cardiology, 2017
[그림 3-33] 카르니틴 및 아실 카르니틴 대사 조절 불량
대사체학에 근거한 global profiling을 이용하여 관상 동맥 연결 후 1시간, 1일 및 10일 경과 후에 sham 및 심근 경색증 rat의 심장 조직에서 대사 및 지질 변화를 평가하였다. Transcriptome 분석 결과, sadenosylmethionine의 조절 장애가 COD 생합성 경로의 감소와 관련 있음을 확인했다. Ischemia 동안 β산화의 결함으로 인한 단쇄(C3)와 중간 사슬(C4-C12) 아실 카르니틴 수준의 감소와 장쇄 아실 카르니틴(C14-18) 수준의 증가는 에너지 의존적 대사 경로와 관련이 있음을 확인했으며 adenosine triphosphate 농도의 감소를 관찰하였다.
(3) 연세대학교

출처: Scientific Reports, 2017
[그림 3-34] WT 및 KO 생쥐의 Gas 또는 Sol 조직에서 중대한 변화를 보이는 지질 종을 나타내는 heatmap
종양 억제 인자 p53 녹아웃(KO) 생쥐의 골격 근육 조직 gastrocnemius 및 soleus에서 329개의 지질종을 nanoflow ultrahigh performance liquid chromatography tandem mass spectrometry(nUPLC-MS/MS)를 사용하여 정량분석했다. 전반적으로, soleus 조직으로부터의 지질은 대부분의 지질 프로파일에서 비복근으로부터의 지질보다 p53 KO에 의해 더 영향을 받는 것을 확인하였고 이는 근육 조직에서 p53 부족이 지방 조직을 유의하게 변화시킴을 시사하였다.
(4) 서울대학교
양성(proton) NMR 분광기를 이용하여 갑상선 유두암(n = 35)과 양성 여포 결절(n = 69)의 fine-needle aspiration(FNA) 샘플의 대사체를 분석 하여 갑상선 암의 수술 전 진단을 위한 경피적 FNA 표본의 핵 자기 공명(NMR) 분석의 가능성을 평가했다. 대사체 프로파일은 양성과 악성 결절 사이에 상당한 차별을 보였고 receiver operating characteristic(ROC) 곡선 분석은 7가지 대사체가 판별자로 사용될 수 있음을 확인했다.

* (A) 양성 결절과 악성 결절 (유두 상 갑상선암)의 대사체를 나타내는 OPLS-DA loading plot. (B) 각 NMR 변수에 대한 모델 계수를 보여주는 OPLS-DA loading plot.
출처: Scientific Reports, 2016
[그림 3-35] 차별 모델에 기여하는 대사체 identification
저, 중, 고 농도-시간 곡선(AUC)군으로 분류 된 세 군으로 나누어 진 59명의 소아환자에서 busulfan 투여 전 소변을 분석하고 global metabolomics를 통해 busulfan 노출을 예측하기 위한 바이오 마커를 조사했다. 고 AUC 군에서는 deferoxamine 대사체가 검출되고 저 AUC군에 비해 phenylacetylglutamine과 acyl carnitine이 낮게 검출되었다. 이로 인해 busulfan 노출이 간 기능 손상에 영향을 미칠 수 있음과 노출을 예측할 수 있는 잠재적 바이오 마커를 확인하였다.

* 16가지 deferoxamine 유래 대사체, acylcarnitines 및 phenylacetylglutamine은 pharmacometabolomics에 의해 확인되었고 busulfan에 대한 높은 노출과 유의한 관련이 있음
* (A) 양이온 및 (B) 음이온 모드에서의 2차원 자율 주성분 분석, (C) 양이온 및 (D) 음이온 모드에서의 잠정 구조 판별 분석 (PLS-DA) 및 (E) 양이온 및 (F) 음이온 모드에서의 S-plot에 따른 orthogonal PLS-DA.
출처: Scientific Reports, 2017
[그림 3-36] busulfan 노출이 간 기능 손상에 영향을 미칠 수 있음과 노출을 예측할 수 있는 잠재적 바이오 마커를 확인
(5) 건국대학교
solid-state fermentation(SSF)와 submerged fermentation(SmF) 하에서 UPLC-Q-TOF와 다변량 분석을 사용하여 Penicillium expansum 40815의 대사체 프로파일링과 전사체 분석을 수행하였다. SmF 조건 하에서 polyketide 대사체인 agonodepside B, rotiorin, verrucosidin, ochrephilone과 상응하는 유전자 전사체인 polyketide synthase, aromatic prenyltransferase, terpenoid synthase가 주로 검출되었다. SSF 조건 하에서 meroterpenoid 화합물 및 유전자 전사체가 독점적으로 검출되었다. 이를 통해 P. expansum 40815에서의 대사체 생산과 이에 상응하는 유전자 발현 수준이 다양한 성장 인자와 즉각적인 환경에 의해 유의하게 영향을 받는다는 것을 증명했다.

출처: PLOS ONE, 2016
[그림 3-37] P. expansum 40815의 SSF 및 SmF로부터의 변이형 대사체 생산 프로파일
Mass spectrometry(MS) 기반의 대사 기술을 사용하여 고지방식(HFD)을 투여한 생쥐에서 Platycodon grandiflorum(PG)의 항비만 효과와 관련된 대사체를 확인했다. 8주 후, HFD 그룹은 ND 그룹보다 더 많은 체중을 얻었고, 식이성 5% PG 추출물은 이 변화를 약화시킴을 확인하였다. 또한 아미노산 대사, TCA주기, 지질 대사에 강하게 관여하는 HFD 투여 생쥐에 첨가된 고용량 PG의 효과를 설명할 수 있는 잠재 바이오 마커로서 혈청 및 간에서 각각 10가지 및 32가지 대사체를 확인했다.

출처: Nutrients, 2017
[그림 3-38] MW 및 DM 추출에 대한 음이온 모드에서의 GC-TOF-MS 및 UPLC-Q-TOF-MS 데이터 세트 및 Platycodon grandiflorum을 포함한 HFD 생쥐의 간의 direct infusion nanoelectrospray-MS 데이터 세트로부터 유도된 3차원 PLS-DA score plots
(6) 고려대학교
1H-NMR 기반 대사체 분석을 이용하여 piperine에 대한 인간의 대사 반응과 그 기본 분자 메커니즘의 세부적인 특성을 설명했다. 골격근에 piperine이 미치는 대사 효과를 확인한 결과, 미토콘드리아 활성에 관여하는 여러 유전자의 발현을 조절하는 신진 대사 중간물질인 세포 내 젖산의 농도를 증가시키는 것을 확인했다. 또한 AMP 활성화 단백질 키나아제(AMPK) 의존성 방식으로 포도당 섭취를 추가로 자극하면서 AMPK와 그 하류 표적인 acetyl-CoA carboxylase(ACC)의 인산화를 유도하고 AMPK 억제제인 p38 mitogen-activated protein kinase(p38 MAPK)를 자극하는 것을 확인했다. 젖산염의 증가는 에너지 소비, 열 생성 및 지방 갈변을 조절하는 미토콘드리아 uncoupling protein 1(UCP1)의 증가된 발현을 가져왔다. AMPK의

* C2C12 세포를 30 μM piperine으로 3시간 동안 자극한 뒤 (A) 대조군 및 (B) piperine의 세포 추출물의 대표적인 1H-NMR 스펙트럼. (C) metabolome 분석을 위한 세포 대사체 추출물 수준의 1H-NMR 스펙트럼에 대한 PCA score plot. (D) 세포 대사체 추출물에서 isoleucine, leucine 및 valine의 BCAAs 수준
출처: Scientific Reports, 2017
[그림 3-39] Piperine은 세포 에너지 대사에 영향을 미침
knock-down은 piperine에 의해 유도 된 UCP1의 상향 조절을 차단하여 AMPK의 필수 역할을 나타냈다. 이 결과는 piperine이 AMPK-p38 MAPK 신호 전달 경로와 골격근에서 세포 내 젖산 생산을 활성화시켜 UCP1 발현을 활성화시킴으로써 양성 대사 효과를 유도함을 확인했다.
Furfural이 효모에 미치는 영향과 furfural에 대한 지속적인 노출에 대한 대사 반응을 결정하기 위해 진화 공학 및 대사체학적 분석을 적용했다. Furfural이 있는 환경에서 50회 연속 배양한 후 진화된 균주는 furfural 스트레스 하에서 생리적 상태를 안정적으로 관리할 수 있는 능력을 획득했으며, 총 98개의 대사체를 확인하였고 이들의 풍부도 프로파일은 효모 대사가 전반적으로 규제되었음을 암시했다. Furfural 스트레스 하에서 S. cerevisiae는 스트레스를 신속하게 극복하기 위해 에너지 생성, 보조인자 재생 및 세포손상으로부터의 회복과 관련된 대사체를 보다 높은 수준으로 유지함으로써 전반적 대사 변화를 신속하게 극복함을 확인했다.

* (A) parental 및 (B) 진화된 계통
출처: Microbial Biotechnology, 2016
[그림 3-40] NAD(P)H pool 대사
라. 발전 전망
대사체학 연구의 발전전망은 다음 그림과 같이 크게 세 가지 분야로 나눠질 것으로 판단된다. 그동안 Metabolomics연구의 많은 진전이 이루어졌으며 대사체 프로파일을 얻거나 대사 플럭스(metabolic flux)를 측정하는 것은 이제 표준 관행이다. 더 적은 물질이나 노력으로 더 많은 대사체를 처리하거나 공간 분해능을 달성하고, multiomics를 통해 현장을 발전시키기 위한 노력도 이루어지고 있다.

출처: Trends in Biochemical Sciences, 2017
[그림 3-41] 대사체학의 트렌드
그럼에도 불구하고 여러 영역에서 문제는 남아 있다. 대사체학의 가장 큰 과제는 적절한 실험 설계로 생물학적 통찰력을 얻는 최선의 방법이다. 실험 모델의 선택은 이 과정에서 필수적인 요소이다. 예를 들어 생체 내 대사를 성공적으로 모델링할 수 있는 생체 외 시스템이 중요하다. 세포 배양으로부터 얻은 결론은 생체 의학 지식을 실질적으로 향상시켰지만 전형적인 배양 조건이 구성하는 고영양 환경과 같은 모델의 가정에 대해 평가해야 한다.
또 다른 중요한 도전은 세포이하 구획화이다. 대사체학 데이터는 다양한 세포 소기관의 대사체의 합을 반영하기 때문이다. 특정 세포 기관에서 대사체를 측정하는 것이 바람직할지라도, 세포 기관을 분리하고 이들 구조의 대사 상태를 보존하는 것은 매우 어렵다. 최근의 연구들은 cytosol과 같은 특정 구획에서 발생하는 cofactor를 조사하기 위해 영리한 동위 원소 추적 전략을 사용했다.
대사 플럭스 분석은 또한 구획을 가로 질러 공유되는 대사체를 포함하는 플럭스를 추정하는데 사용될 수 있다. 대사 이질성은 신진 대사를 이해하는 또 다른 문제이며 단일 세포 수준에서 metabolomics를 수행하려는 노력이 진행 중이다.
대사체학 연구에서 특히 흥미진진한 프론티어는 대량 세포 연구에서 가려진 정보를 얻기 위한 단일 세포의 분석이다. 지난 10년 동안 식물, 신경 세포, 효모, 세균 및 동물 세포에 다양한 접근법이 개발되어 성공적으로 적용되었다. 단세포는 바늘로 또는 마이크로 유체 장치를 통해 단리 될 수 있으며, 이어서 대사체 추출 및 HRMS 또는 MS/MS를 이용한 추가 분석이 가능하다. 손상되지 않은 세포 또는 조직 샘플은 또한 직접 이온화 소스와 상호 작용하여 이온을 생성할 수 있으며, 이온은 이어서 MS에 의해 분석된다. 이러한 기술은 원칙적으로 서브 마이크로미터 공간 해상도를 달성할 수 있으며 따라서 metabolomics imaging 및 세포 내 소기관의 분석을 수행할 수 있다. 그러나 이 극도로 미세한 공간 분해능으로 인해 데이터 수집 시간과 데이터 크기가 크게 증가하여 고효율 방식으로 단일 세포 대사체학(single cell metabolomics)을 수행하기가 어려운 실정이다.
또한 견고성, 적용되는 대사체의 수 및 정확성을 향상시키기 위한 노력이 필요하다. 대사체학 데이터를 표준화하는 더 나은 방법은 현장을 발전시키는데 필수적이며, 세포를 평균 내는 표준 metabolomics 기술이 중심이 된다. 따라서 대사체의 절대 농도 값을 신속하게 얻는 더 나은 표준화 절차 및 더 나은 프로토콜을 만들기 위한 노력이 진행되고 있다. 플럭스 분석을 위해서는 수학적 프레임 워크와 알고리즘이 일반적인 이상으로 잘 구현되어 있고 대규모 커뮤니티가 접근할 수 있다. 이러한 역량을 더욱 널리 보급하려는 노력은 가치 있는 일이 될 것이다.
5. 시스템생물
가. 개요
시스템생물학(Systems biology)은 시스템이론을 생명과학에 적용하여 생체 구성인자간의 상호관계와 상호작용의 원리를 이해케 하고 나아가 동역학적 특성을 규명함으로써 그 속에 잠재된 지배원리를 시스템 차원에서 이해케 하는 학제간 신기술 융합분야로, 시스템생물학의 본질은 개별요소가 독립적으로 존재시 나타나지 않지만 집단, 즉 시스템을 형성하여 주변의 다른 요소와 상호작용을 할 때 비로소 표출되는 ‘창발적 속성(Emergent property)’을 이해케 하는 것이다. 다시 말해, 기존의 생물학이 생물체의 구성요소 하나하나를 분해하여 유전자 혹은 단백질의 개별적 기능을 알아내는 환원주의적(Reductionism) 접근방식이었다면, 시스템생물학은 생명현상을 총괄적이고 체계적으로 분석하기 위한 전체론적(Holism)인 관점의 접근방식이라 할 수 있다.

[그림 3-42] 융합연구를 통한 시스템생물학 연구
시스템생물학이란 개념은 이미 오래 전부터 존재해왔으나, 시스템의 구성인자에 관한 정보획득과정의 어려움 때문에 시스템생물학적 접근법이 본격적으로 사용된 것은 21세기에 들어와서라고 볼 수 있다. 이는 복잡한 생물체를 단순화된 실험적 재현의 틀 안에서 이해하려는 기존 환원주의적 접근법의 한계성에 대한 인식과 더불어, 그 동안 축적되어온 소위 오믹스(omics)로 표현되는 다층적인 대량의 데이터발굴(high-throughput, HT)과 컴퓨팅능력의 조합이 시스템적 접근을 가능케 하였다.
시스템생물학에 의하면 전체기능계(whole functional system)는 그것을 이루는 구성인자들(components) 사이의 상호관계(relationship)를 통해 이해할 수 있고, 역으로 각각의 구성인자들의 기능은 전체기능계 안에서 다른 구성인자들과의 관계성에 의해 이해가 되는 것이다. 일반적으로 시스템생물학에서 던지는 질문들은 다음으로 요약된다. 첫째, 생체 네트워크의 기본적인 구조와 특성들은 무엇인가? 둘째, 생체 시스템은 다양한 환경 안에서 시간에 따라 어떻게 동작하는가? 셋째, 생체 시스템은 어떻게 안정성(stability)과 견고성(robustness)을 유지하는가? 넷째, 어떻게 하면 생체 시스템을 우리가 원하는 바람직한 특성을 갖도록 변형할 수 있을까?
2000년대 초 일본과 미국 등을 중심으로 시작된 시스템생물학은 불과 10여년 사이에 주요 연구기관 및 연구그룹을 중심으로 중요성이 급속히 확산되었고, Pubmed에 등록된 시스템생물학관련 연구결과를 보면, 과거 3년간 발표된 논문 수(16,565건)가 전체 누적 논문 수(35,696편)의 절반(46.4%)에 육박하며, 특히 2016년에는 한 해 동안 출판된 시스템생물학관련 논문 수가 6,000편에 달할 만큼 관련연구가 전 세계적으로 급격히 증가하고 있음을 알 수 있다.
시스템생물학 연구분야는 최근 급격히 성장하여 미생물을 대상으로 새로운 유전자 회로 설계 및 변경과 같은 엔지니어링 기술을 이용한 실용적 목적을 추구하는 합성생물학(synthetic biology)을 발전시켰고, 최근에는 다세포 동식물체를 대상으로 유전자의 신기능 예측 및 효과적인 치료제 개발을 목표로 활발한 연구를 하고 있다.

[그림 3-43] 시스템생물학 관련 논문의 연도별 발표 현황ᅠ
나. 해외 동향
시스템생물학은 2000년대에 들어와 새롭게 연구가 시작되었지만, 현재는 선진국을 중심으로 매우 활발한 연구가 진행되고 있으며, 그 중요도에 대한 인식이 급속도로 확산되었다. 포스트 게놈시대에 축적된 방대한 데이터와 기술적 진보로 인해 시스템생물학은 향후 인간의 질병 메커니즘에 대한 새로운 이해와 체계적인 신약후보물질 발굴에 중요한 역할을 하게 될 것으로 판단된다.
시스템생물학은 최근 개인수준의 인식을 넘어서 연구기관과 대학, 그리고 국가주도의 연구프로그램으로 확대되어 왔는데, 일본에서는 Systems Biology Institute(SBI, http://sbi.jp)가 설립되었고, ERATO-SORST Kitano Symbiotic Systems Project (http://www.symbio.jst.go.jp)를 통해 시스템생물학이 정립된 이후 여러 생명체의 모델개발이 이루어질 때를 대비하여 세계적 표준안을 마련하여 왔으며, 기술적 우위를 선점하기 위한 투자와 노력을 지속적으로 진행하고 있다. 특히, 2010년부터 GARUDA를 통해 시스템생물학 소프트웨어개발을 위한 플랫폼을 제공하여 GUI, API를 통합하고 소프트웨어간 데이터 공유를 위한 노력을 기울이고 있다. 미국도 댈러스(Dallas)의 AfCS(Allliance for Cellular Signalling), 시애틀의 시스템생물학연구소(Institute for Systems Biology, ISB), 버클리의 분자과학연구소(Molecular Sciences Institute) 등을 설립하고 시스템생물학 연구를 주도해 나가기 위한 투자를 해오고 있다. AfCS는 미국과 영국의 7개 연구소가 공동으로 2000년 설립하였고, 노벨상 수상자인 Alfred Gilman을 회장으로 한 운영이사회가 이끌고 있다. ISB도 2000년 초 유전자 염기서열 자동분석법의 개발자 가운데 한 사람인 Leroy Hood가 Reudi Aebersold, Alan Aderem과 함께 설립하여 현재는 전산, 소프트웨어, 데이터베이스, 생물학, 물리학, 화학, 수학, 의학, 유전학 등 다양한 분야를 전공한 다수의 전문가들이 모여 연구하고 있으며, 시스템생물학 관련 우수 연구성과를 산출하고 있다. 버클리 분자과학연구소는 1996년 노벨상 수상자인 Sidney Brenner에 의해 설립되어 생물정보학과 컴퓨터 모델링을 바탕으로 한 예측 생물학(Predictive biology)을 선도하고 있다. Harvard-MIT broad institute(https://www.broadinstitute.org)는 인간질병과 관련된 유전자 탐색 및 질병치료제 개발을 위해 connectivity map(CMap) 및 클라우드 기반의 웹어플리케이션(CLUE)을 구축하는 연구를 수행하고 있다. 유럽에서는 독일이 가장 먼저 정부(BMBF) 차원의 시스템생물학 연구 과제를 주도하고 있으며 독일 전역의 9개 연구센터를 중심으로 약 8,700만 유로(1,242억)의 연구비를 집중투자하고 있다(참조: http://www.systembiologie.de). 스위스는 스위스 정부 역대 가장 큰 연구단(SystemsX)을 구성하여 시스템생물학 연구를 지원하고 있고, 영국 또한 다양한 시스템생물학 연구주제를 바탕으로 여러 정부기관(예: BBSRC, EPSRC)과 사설재단의 연구비를 수주하고 있다. 유럽연합은 2007년부터 핵심프로젝트로 VPH(Virtual
Physiological Human) 프로젝트를 선정하여 환자 특이적 컴퓨터 모델 개발 및 이를 이용한 환자 맞춤형 치료를 위해 바이오시뮬레이션 분야에 집중 투자하고 있다.
[표 3-10] 국외 시스템생물학 관련 주요 연구기관 및 프로그램
|
관련기관(국가 또는 URL) |
내 용 |
|
Institute for Systems Biology (미국, http://www.systemsbiology.org) |
2000년 미국 시애틀에 설립됨. 다수의 생물학자, 공학자, 전산학자, 물리학자들이 유전체학, 단백체학 기법을 통해 당뇨병, 헌팅턴병, 프리온병 등을 타겟으로 시스템생물학의 선도적인 연구를 수행하고 있음. 또한 cytoscape, Systems Biology Markup Language 등의 시스템생물학 연구를 위한 소프트웨어 개발에 앞장서고 있음 |
|
Systems Biology Institute (일본, http://www.sbi.jp) |
2000년 일본 동경에 설립됨. Luxembourg Centre for Systems Biomedicine 과 함께 파킨슨병 공동연구를 수행하고 있으며, SBI Australia 를 설립하여 불임에 관한 시스템생물학 연구를 수행 |
|
Luxembourg Centre for Systems Biomedicine (룩셈부르크, http://wwwen.uni.lu/lcsb) |
Institute for Systems Biology, Systems Biology Institute 등과 협력하여 난치성 질병에 관한 연구 (주로 파킨슨병과 같은 신경질환과 대사질환 연구를 수행) |
|
SystemsX.ch (스위스, http://www.systemsx.ch) |
스위스 최대의 연구 과제로 기초 연구분야로부터 학제간 연구까지 다양한 시스템생물학 연구를 지원 |
|
Institute of Molecular Systems Biology (스위스, http://www.imsb.ethz.ch) |
2005년 취리히에 설립됨. 생물학, 화학, 생물정보학의 연구들을 결합하는데 목적을 두고 있음. SystemsX.ch의 한 파트 |
|
Institute for Genomics and Systems Biology (미국, http://www.igsb.anl.gov) |
2006년 시카고에서 발족되었고 유전체학 연구를 토대로, 실제적인 이익의 증대를 위한 연구. 유방암, 대사성 질환 및 당뇨병, 염증성 장 질환 등에 대한 연구를 진행 |
|
Center for Systems Biology at IGSP (미국, http://www.genome. duke.edu/centers/csb) |
2004년에 발족. 효모와 사람의 세포주기, 식물 뿌리와 성게의 발생에 대한 연구가 진행되고 효모와 성게에서의 진화를 networking하는 연구도 진행 중임 |
|
Ottawa Institute of Systems Biology (캐나다, http://www.med.uottawa.ca/oisb/) |
2004년 오타와에서 발족. 인간 질병에 관한 시스템 이해 및 고속 대용량 실험 테크닉 개발에 집중 |
|
Department of Systems Biology at Harvard Medical School (미국, http://sysbio.med.harvard.edu) |
2003년 설립되어 세계 최초의 본격적인 시스템생물학과를 표방하고 있으며 M. Kirschner를 중심으로 다수의 faculty를 확보하고 있음 |
|
Manchester Centre for Integrative Systems Biology (영국, http://www.mcisb.org) |
2005년 맨체스터 대학에서 시작. 전체 유전체를 대상으로 정량 데이터 산출을 목표로 새로운 기술 개발과 오믹스 데이터 생산에 집중. 정량적 데이터 생산과 더불어 대사과정 모델링과 데이터 통합 기술 개발 |
|
Cambridge Systems Biology Centre (영국, http://www.sysbiol.cam.ac.uk) |
2006년 캠브리지 대학에서 시작. 세균주화성 (bacterial chemotaxis)의 생화학 회로의 시뮬레이션. 마이크로어레이 기반의 유전체학 기술, 질량분석 등 단백질체학 고속대용량데이타 산출 기술, 데이터 분석 기법 연구를 주도 |
|
INBIOSIS institute of systems biology (말레이시아, http://www.inbiosis.ukm.my) |
다양한 오믹스 데이터를 통합하여 식물 생산량 및 체내에서 유용하게 사용되는 대사 산물의 합성과 생산 증가를 위한 유전자 변형기술 개발 |
|
Berlin Institute for Medical Systems Biology at MDC (독일, http://www.mdc-berlin.de/en/bimsb) |
2008년 본격적 연구 시작. 전사 조절 메커니즘, 신호전달계, 단백질-단백질 결합 네트워크에 관한 연구가 주로 이루어지고 있음 |
|
Quantitative Analysis of Molecular and Cellular Biosystems Center (BioQuant) (독일, http://www.bioquant.uni-heidelberg.de/proposal.php) |
2007년 독일 하이델베르크에 설립됨. 복잡한 생명시스템에 대해 수학적 모델을 만들고, 수립된 가설을 신속하게 실험적으로 검증하는 플랫폼을 구축. 약 40 여개의 대학 및 연구기관이 소속됨 |
|
Integrative Bioinformatics and Systems Biology (iBioS) (독일, https://ibios.dkfz.de/tbi/) |
암 진단 및 치료에 대한 새로운 접근법의 개발을 위해 게놈과 임상데이터의 생물정보학 접근법, 최첨단 자동화 live-cell imaging, 세포 메커니즘에 대한 이론적/실험적 접근법, 새로운 생물학적 도구 개발 |
|
EMBL/CRG Systems Biology Research Unit(스페인, http://www.crg.eu/en/ programme/programmes-groups/systems-biology) |
2006년 EMBL과 CRG의 협력, 스페인 정부의 지원으로 설립. 학제 간 교류를 통해 Multicellular patterning, 주화성, 시스템 신경과학, 전체 생물수준에서의 진화론적 네트워크에 대한 연구를 진행 |
|
CAS-MPG Partner Institute for Computational Biology (중국, www.picb.ac.cn/) |
2005년에 중국 상해에 설립. 컴퓨터 기반의 분자네트워크 모델링에 중점을 두고있으며 수학적 진화론, 집단유전학 및 인류 진화 등에 대한 연구를 진행 |
출처: 2015 생명공학백서 내용 수정・보완
최근 다양한 시스템생물학 관련 국제 학술대회가 개최되고 있는데, 국외 시스템생물학 관련 주요 학술대회를 보면, 미국과 더불어 정부차원의 대규모 연구비를 투자하고 있는 독일에서 관련 학술대회가 활발하게 진행되고 있다.
다. 국내 현황
국내에서는 2002년도에 시스템생물학 연구회 구성으로 그룹화, 상호연계연구, 연구대상 생체시스템의 체계적인 선정 등이 이루어지기 시작했으며, 2003년 4월에 서울대 문화관에서 국내에서는 처음으로 시스템생물학 국제학술대회(Seoul Symposium on Systems Biology 2003)가 개최되었다. 2003년 6월부터는 시스템생물학을 국책연구사업과제로 선정하여 ‘시스템생물학사업단’을 출범시켰으며 11개 세부과제를 중심으로 시스템생물학연구가 시작되었다. 2005년에 2단계 사업으로 진핵세포를 대상으로 ‘칼슘대사 시스템생물학연구(KOSBI)’와 원핵세포를 대상으로 한 ‘대사회로분석 및 가상세포시스템연구’가 선정되었으며, 2008년부터 3 단계, 2010년부터 4단계 사업으로 이어져 연구가 마무리 되었다. 이들 연구 과제를 통해 신규 인자의 체계적 발굴, 구성인자들 간의 상호작용 계측, 네트워크 규명, 수학적 모델링, 미생물 대사회로의 정성적, 정량적 분석, 시스템재설계 기술 및 가상세포 시스템 개발 등이 이루어졌다. 또한 2009년에는 GIST에 시스템생물학연구소가 설립되어, 이화여대시스템생물학연구소, 국가생명연구자원정보센터(KOBIC)와 함께 시스템생물학 인프라구축사업을 추진하여 왔다. 이를 통해 국내 시스템생물학 연구를 위한 기반기술을 개발하고 인프라를 구축함으로써 우리나라 시스템생물학의 국제적 경쟁력 향상을 위해 노력하여 왔다.
국내 시스템생물학 관련 주요 학술대회 및 학술 활동은 2011년부터 한국생물정보시스템생물학회에서 매년 Translational Bioinformatics Conference를 개최하여 유전체학, 생물정보학, 의료정보학 분야의 핵심현안에 대한 활발한 학술적 교류가 이루어지고 있다.
라. 발전 과제
2003년 IEEE Control Systems Magazine에 첫 리뷰논문이 등장한 이래 전 세계적으로 시스템생물학 관련논문 수가 급증하였고, 시스템생물학을 적용한 질병 진단 및 치료와 관련된 시장의 규모도 급격한 성장이 예상되고 있다. 우리나라의 경우도 연구 성과는 가시적으로 늘어나고 있으나 이미 10여 년 전부터 막대한 연구비투자를 해온 선진국에 비하면 그 중요도의 인식이나 투자규모 면에서 아직 미미한 수준에 있으며 시스템생물학관련 인프라를 구축하는 단계에 있다.
시스템생물학은 생명과학, 정보과학, 컴퓨터 기술 등의 새로운 기술의 집약과 다양한 학문 분야의 협력이 요구되는 자본기술 집약적인 분야인 만큼, 연구자 중심의 Bottom-up 방식의 아이디어 발굴보다는 정부차원에서의 Top-down 방식의 기획이 필요할 것으로 판단되며 특히, 미국, 독일, 영국, 일본 등, 이 분야 선진국의 경우와 같이 일관성 있고 체계적인 연구가 수행될 수 있도록 국가차원의 시스템생물학 연구소의 설립이 시급하다고 볼 수 있다. 뿐만 아니라 시스템생물학이 실효를 거두어 나가기 위해서는 무엇보다 실험생물학자가 전통적인 접근방법의 고수에서 벗어나 실험계획의 단계에서부터 시스템과학 전공자와 의논할 수 있는 학문적 분위기가 조성되어야 하고, 열린 생각(Open-mind)과 진정한 공동연구수행을 위한 상호노력이 이루어져야 할 것이다.
키워드 ‘Systems Biology’로 검색한 논문의 국가별 통계 자료를 보면, 2016년 기준 시스템생물학 관련 국가별 누적 SCI 논문발표 수에 있어서 미국이 11,741편으로 2위 영국과는 약 3배의 차이를 보이고, 전체 상위 15개국 누적 논문수(35,297편)에서도 33.2%를 차지할 만큼 여전히 압도적인 연구성과를 내고 있음을 알 수 있다. 한편, 최근 1년간 논문 증가율은 호주가 2014년에 이어 여전히 46.8%로 가장 높은 증가율을 보였고, 이탈리아(37.0%)와 프랑스(35.5%)가 그 뒤를 이었다. 우리나라는 누적 SCI 논문수에 있어서 2014년 전체 16위에서 2016년 기준 전체 6위로 뛰어올라 시스템생물학 연구분야에서 매우 고무적인 성과를 내고 있다.
[표 3-11] 키워드 ‘Systems Biology’로 검색한 국가별 누적 논문 통계
|
순위 |
국가 |
∼2015년 |
∼2016년 |
1년간 논문증가율 |
|
1 |
미국 |
9,756 |
11,741 |
20.3% |
|
2 |
영국 |
3,229 |
3,986 |
23.4% |
|
3 |
독일 |
2,590 |
3,451 |
33.2% |
|
4 |
중국 |
2,192 |
2,866 |
30.7% |
|
5 |
캐나다 |
1,510 |
1,920 |
27.2% |
|
6 |
대한민국 |
1,073 |
1,398 |
30.3% |
|
7 |
벨기에 |
1,073 |
1,331 |
24.0% |
|
8 |
덴마크 |
956 |
1,234 |
29.1% |
|
9 |
스위스 |
860 |
1,137 |
32.2% |
|
10 |
이탈리아 |
828 |
1,134 |
37.0% |
|
11 |
일본 |
921 |
1,132 |
22.9% |
|
12 |
프랑스 |
799 |
1,083 |
35.5% |
|
13 |
스페인 |
798 |
1,064 |
33.3% |
|
14 |
네덜란드 |
771 |
1,029 |
33.5% |
|
15 |
호주 |
539 |
791 |
46.8% |
출처: 자체자료
시스템생물학적 연구를 통한 효과적 질병원인 규명, 약물의 효과 예측, 신약후보물질 및 바이오마커 발굴은 신약개발의 새로운 패러다임으로써 기대되는 바가 크다. 따라서 비용과 시간이 많이 소모되고 위험부담이 많은 신약개발에 큰 영향을 미치고 있는데, 이미 세계 10대 제약업체 중 많은 수가 신약개발에 있어 시스템생물학적 접근법을 직접 도입하거나 시스템생물학 기술을 가진 업체와 협력 또는 인수・합병하여 신약개발에 시스템생물학 연구 활용을 본격화하고 있다. 현재 국제적인 시스템생물학관련 기업에서 추구하는 주요 연구 현황은 아래 표와 같다.
[표 3-12] 신약관련 기업의 시스템생물학 연구 현황
|
연구센터 |
주 소 |
연구내용 |
|
AstraZeneca |
www.astrazeneca.com |
MIT (Doug Lauffenburger’s systems biology lab)와 함께 암 및 염증 질환에 대한 컴퓨터 모델 연구 |
|
Bioseek |
www.bioseekinc.com |
시스템생물학 기법을 이용하여 인간의 주요 세포 질환 모델들을 연구하고 안전한 신약 후보물질 개발 |
|
CytoPathFinder |
www.cytopathfinder.com |
세포기반 스크리닝을 위한 transfection microarray를 개발 |
|
Eli Lilly Center for Systems biology |
www.lilly.com |
회사의 신약개발 노력을 지원하기 위한 단백질 및 유전체 기술의 통합에 주력 |
|
GSK |
http://www.gsk.com/ |
신약 표적 발굴, 검증 기술을 가진 Chemical proteomics 전문 연구업체인 Cellzome을 인수하여 신약 개발 능력을 확충 |
|
Ingenuity |
www.ingenuity.com |
시스템생물학 통합 소프트웨어 및 지식 DB 개발 (omics data와 model biological system을 분석하는 툴 제공) |
|
Johnson & Johnson |
www.jnj.com |
Georgia Institute of Technology와 연구협력을 체결하고 의과학 연구에 중점을 둔 다학제간 협력연구를 수행 |
|
Roche |
www.roche.com |
스위스의 SystemsX 프로그램과 3년간 연구협력을 체결하여 베타세포(beta cell) 손상을 진단하는 바이오마커 발굴과 신약개발을 수행 |
출처: 2015 생명공학백서 내용 수정・보완
짧은 역사를 가진 시스템생물학은 주로 복잡한 생체시스템을 이해하는데 역점을 두고 발전하여 왔고, 의약 및 바이오산업을 위한 활용에는 아직 초기 단계에 있다. 2005년 454 life sciences(2007년 로슈가 인수)가 최초의 차세대염기서열분석기(Next Generation Sequencing, NGS)인 GS20 system을 출시한 이후 NGS 기술은 급속도로 발달하여 게놈 시퀀싱 비용은 마이크로 칩의 밀도가 18개월마다 2배로 늘어난다는 무어의 법칙(Moore’s Law)마저 능가하는 속도로 감소되어 2015년을 기점으로 1,000달러에 근접하게 되었다. 이로 인해 앞으로 시스템생물학의 활용 가치는 더욱더 높아지게 될 것으로 예상된다.

* 출처: National Human Genome Research Institute (NHGRI)
[그림 3-44] 게놈 시퀀싱 비용 추세
최근에는 질병의 치료보다는 질병이 발생하기 전에 발병 가능성을 가늠케 하는 예측진단(Predictive testing)과 약물에 대한 환자의 민감도를 시뮬레이션 하는 의약 맞춤처방이 확대될 것으로 전망되어, 시스템생물학을 주요 기술로 하는 맞춤의료(Personalized medicine) 사업이 향후 제약시장에서 큰 비중을 차지할 것으로 사료된다. 또한, 산업 미생물 개발 분야에서도 시스템생물학의 활용 가치가 크게 대두되고 있다. 시스템생물학 기술은 이미 이론상 가능한 최대 수율에 근접한 산업 미생물 개발에 가상세포 시뮬레이션을 도입하여 효율을 획기적으로 끌어올리는가 하면, 미생물 균주를 이용한 바이오 대체에너지 생산기술에도 전통적 대사공학 기법과 더불어 시스템생물학 기법이 활용되어 향후 화석 에너지 자원 고갈문제를 해결하는데도 큰 역할을 할 것으로 기대하고 있다.
6. 구조생물
가. 개요
구조생물학은 중요단백질의 구조를 구명, 생물학적 기능을 설명하는 것에서 발전하여 최근에는 단백질의 기능을 산업적으로 이용하는 바이오신약, 바이오센서, 신소재, 단백질설계 분야에 중요하게 응용되고 있다. 단백질의 기능을 이용하고 유용하게 설계 또는 변형하기 위해서는 원자수준의 정보 확보가 필수적이며, 이는 구조생물학의 기법을 이용하는 것에 의해 가능하다. 단백질 결정화나 저온전자현미경 등의 기술을 이용하여 단백질의 구조분석을 하기 위해서는 위해 연구대상 단백질의 물리-화학적 및 기능적 특성을 분석하는 것이 선행되어야 할 경우가 많은데, 이러한 과정은 항체치료제 등 단백질 치료제/신약을 개발하는 데 필수적인 전문성이어서 제약 및 생명공학 기업에서 적극적으로 활용하고 있다.
나. 해외 동향
(1) 거대단백질 및 막단백질 구조연구의 활성화
저온전자현미경(Cryo-EM)의 기술적 진보로 인해 원자수준 구조구명의 대상이 되는 단백질의 크기가 수 메가달톤(MDal) 이상으로 커졌다. 특히 저온전자현미경의 경우 단백질을 결정화할 필요가 없어 더욱 더 활용범위가 넓어지고 있다. 최근 발표된 대표적인 거대단백질 및 막단백질의 구조는 다음 표와 같다.
[표 3-13] 저온전자현미경으로 구명된 대표적인 거대단백질 및 막단백질을 나타낸 연구결과
|
번호 |
논문제목 |
발표학술지 |
발표연도 |
|
1 |
The architecture of respiratory supercomplexes |
Nature 537, 644-648 |
2016 |
|
2 |
Structure of Mammalian Respiratory Supercomplex I1III2IV1 |
Cell 167, 1598-1609 |
2016 |
|
3 |
An atomic structure of human spliceosome |
Cell 169, 918-929 |
2017 |
|
4 |
Cryo-EM structure of a human spliceosome activated for step 2 of splicing |
Nature 542, 318-323 |
2017 |
|
5 |
Identification of Phosphorylation Codes for Arrestin Recruitment by G Protein-Coupled Receptors |
Cell 170, 457-469 |
2017 |
|
6 |
Crystal structure of the potassium-importing KdpFABC membrane complex |
Nature 546, 681-685 |
2017 |
|
7 |
Crystal Structure of an LSD-Bound Human Serotonin Receptor |
Cell 168, 377-389 |
2017 |
|
8 |
Structural insights into ligand recognition by the lysophosphatidic acid receptor LPA6 |
Nature 548, 356-360 |
2017 |
|
9 |
Structural basis for selectivity and diversity in angiotensin II receptors |
Nature 544, 327-332 |
2017 |
|
10 |
Structural insights into adiponectin receptors suggest ceramidase activity |
Nature 544, 120-123 |
2017 |
(가) 미토콘드리아 호흡초복합체 및 스플라이소좀
미토콘드리아에서 생체에너지인 ATP를 만들어내는 호흡초복합체(respiratory supercomplex)는 단백질 서브유닛이 50개 이상으로 이루어진 수 메가달톤에 이르는 거대단백질 복합체이다. 이 복합체는 미토콘드리아 내막에서 활동하는 막단백질인데 NADH의 상태로 만들어진 전자의 에너지를 추출해 내기 위해 전자전달과정을 매개하는 역할을 한다. 특히 이 과정은 생체내의 활성산소를 만들어내는 주요 메커니즘으로 알려져 있다. 지난 수십 년 동안 호흡초복합체의 부분들에 대해서만 삼차구조연구가 진행되어 왔는데 최근의 저온전자현미경의 발전으로 인해 전체복합체의 구조가 구명되었다. 이는 지금까지 그 존재 자체가 학술적인 논란이었던 호흡초복합체의 기능을 설명하는데 핵심적인 정보를 제공하는 중요한 계기가 되었다.
스플라이싱(splicing)은 유전자에서 전사가 일어나서 메신저-RNA(mRNA)가 만들어진 후 단백질 합성에 필요한 부분의 mRNA만 남기고 나머지는 잘라내는 과정이다. 이 과정은 생명현상의 센트럴 도그마의 하나이면서도 이해가 잘 안되어 있는 부분이며, 수십 개의 단백질 서브유닛으로 이루어진 거대복합체가 진행한다. 최근에 저온전자현미경 기술을 이용해서 이 거대복합체의 삼차구조가 전자현미경 구조로는 상당히 고해상도인 3.7옹스트롬 해상도로 구명되었다(표 1, #3,4). 이 구조를 통해서 인트론(intron)이 잘려져 나가는 단계에서 100옹스트롬 길이의 긴 알파 헬릭스가 작용한다는 것을 발견하였고, 인트론이 잘려져 나간 다음 엑손이 다시 연결되는 기작에 대해서도 원자수준의 이해가 가능하게 되었다.
(나) 이온통로 및 수용체
단백질 결정학을 이용한 막단백질 연구도 가속화되었으며 신약개발 표적이 되는 이온통로 단백질 및 수용체 단백질 위주의 구조가 많이 구명되었다. 특히 4세대 가속기(X-ray free laser, XFEL)를 활용한 막단백질 연구가 실용화 단계에 들어서서 G-단백질 커플 수용체(GPCR)인 로돕신과 어레스틴의 복합체 구조가 XFEL 을 이용하여 구명되었는데 나노결정을 이용한 연속펩토 초결정학기술(serial femtosecond crystallography)이 사용되었다. 이 구조를 통하여 로돕신의 인산화와 어레스틴 결합의 상관관계가 구명되었다. GPCR과 같이 생체막에 둘러싸인 부분이 많은 막단백질들은 단백질결정이 크게 자라지 않는 경우가 많아, 나노미터 크기의 결정만 있으면 적용 가능한 XFEL이 앞으로 GPCR 구조구명에 많이 적용될 것으로 보인다.
전통적인 단백질결정학을 이용한 막단백질 연구도 많이 진행되었다. 농도 역구배를 극복하는 포타지움 이온통로 복합체의 구조가 구명되어 기존에 농도구배에 순응하는 이온통로에 있는 선택성 필터와 에너지를 이용한 농도역구배 극복기작을 설명하였다. 대표적인 환각제인 LSD(lysergic acid diethylamide)와 이의 표적단백질인 세로토닌 수용체의 복합체 구조도 구명되었는데 이 복합체의 결정화를 위해 LCP(lipidic cubic phase)기술이 활용되었다. 이 복합체 구조구명을 통하여 LSD 구조의 디에틸아미드(diethyl amide)부위가 세로토닌과 선택적인 결합을 하는데 중요하다는 것이 구명되었다. 이들 이외에도 다양한 막단백질의 구조가 결정학에 의해 구명되었다.
(2) 단백질 구조설계
구조생물학의 응용분야로서 단백질 폴드를 de novo로 설계하려는 노력이 최근 활성화되고 있다. 자연계에 존재하는 구조적 폴드를 갖고 있는 단백질 구조에 기초해서 약간의 아미노산 잔기를 치환하거나 변형해서 새로운 효소기능, 단백질 안정성 증대 등의 기능향상을 추구하는 단백질공학(protein engineering)은 수십 년간 진행되어 왔으나 최근 들어 기존에 축적된 단백질 구조정보를 바탕으로 자연계에 존재하지 않는 폴드를 설계하는 분야가 시도되고 있고 앞으로 다양한 응용분야에 사용될 것으로 보인다.
한 예로 인플루엔자 바이러스의 막단백질인 헤마글루티닌은 인플루엔자 바이러스의 면역백신을 개발하는데 중요한 단백질인데 면역반응을 최대화 할 수 있는 헤마글루티닌의 단백질 부위에 결합하는 단백질을 de novo로 설계할 수 있다면 효과적인 백신으로 사용하는 것이 가능하다. 이러한 원칙을 가지고 미국의 데이비드 베이커 그룹에서는 다양한 시도를 진행하였는데 최근에는 헤마글루티닌 복합체를 인식할 수 있는 삼중체 단백질을 컴퓨터로 설계하였다. 이렇게 해서 만들어진 삼중체 단백질이 인플루엔자 바이러스를 세포수준에서 중화할 수 있고 동물실험에서 인플루엔자 바이러스로부터 동물을 보호하는 효과를 가진다는 것을 증명하였다.
이 이외에도 다양한 구조와 응용성을 갖는 단백질의 폴드를 설계 및 생산하여 그 유용성을 검증하는 연구가 진행되었다.

[그림 3-45] 인플루엔자 중화 단백질의 de novo 설계(Nature Biotechnology 35, 667-671(2017))
(3) 구조기반 신약개발
전통적으로 단백질탈인산화 효소 단백질 패밀리는 활성부위가 깊지 않고 구조적 차이가 그다지 많지 않으므로 선택적이고 효과적인 저해제를 개발하는 것에 어려움을 겪어 왔다. 그러나 단백질탈인산화 효소가 생체기능의 다양한 측면에서 중요한 역할을 하고 암, 당뇨병, 신경질환 등 주요 질병에 중요한 신약표적으로 예상되고 있기 때문에 선택적이고 효과적인 저해제를 개발하기 위하여 다양한 노력이 진행되고 있다. 대표적으로 구조를 이용한 알로스테릭 저해제 개발이다. 즉, 패밀리 단백질 사이에 그다지 구조적 차이가 없는 활성부위를 표적하는 기존의 시도 대신 활성부위와는 떨어져 있으면서 활성에 영향을 미치는 알로스테릭 구조부위를 표적으로 하며 이러한 전략의 성공적인 적용 사례가 최근 발표되었다. 탈인산화 효소 패밀리의 한 종류이며 항암제 개발표적 단백질인 SHP2 단백질의 활성에 효소활성도메인과 조절도메인과의 결합 상호작용은 중요하다. 이 결합상태가 효소활성을 저해하고 있다가 결합이 부서져 상호작용이 없어지게 되면 효소활성이 나타나게 되는데, 이 결합을 이루는 부위에 작은 공간이 있어 적절한 물질을 넣으면 활성도메인과 조절도메인의 해리가 잘 일어나지 않게 된다. 이러한 이론을 기반으로 미국의 노바티스 제약회사 연구팀에서는 효소활성도메인이 활성화되지 못해 항암효과가 나올 것이라는 가정 하에 구조기반으로 화합물설계를 진행, 선택적이며 항암효과가 우수한 저해제를 개발하는 데 성공하였다.
[그림 3-46] SHP2 구조를 표적으로 한 항암제 설계(Nature 535, 148-152(2016))
다. 국내 현황
(1) 연구 및 기술 현황
국내에서도 신약개발의 중요 표적인 막단백질인 GPCR 연구가 활성화되고 있다. 연세대의 조현수 교수 연구팀에서는 GPCR의 한 종류인 염소이온펌프 로돕신 단백질의 구조를 구명하여 이 막단백질이 빛에 의해서 염소이온을 수송하는 기작을 설명하였다(Nature Comm 7, 12677(2016)). 이 연구결과는 향후 빛유전학(optogenetics)을 이용하여 생체기능을 연구하고 응용하는데 유용한 기초정보가 될 것이다. 건국대의 허용석 교수 연구팀에서는 항암 면역치료에 사용되는 치료용 항체인 pembrolizumab, nicolumab 등 4종의 항체들과 이들의 세포표적단백질의 복합체 구조를 구명하여 이들 치료용 항체의 작용기작을 설명하고 항체의 개선을 위한 전략수립의 기초자료를 제공하였다.(Nature Comm 7, 13354(2016)). 한국과학기술원의 김호민 교수 연구팀에서는 박테리아의 엔도톡신인 LPS(lipopolysaccharide)가 선천면역반응(innate immune response)을 일으키는 원자수준기작을 설명하기 위하여 LPS와 CD14, TLR(tall-like receptor)이 상호작용하는 마이셀(micelle)을 만들고 이들의 역동적인 결합을 전자현미경 및 단분자분석기술로 추적 및 분석하였다(Immunity 46, 38-50(2017)). 한편 포항가속기에서는 단백질 결정학을 이용한 신약개발을 가속화하기 위하여 FDD(fragment-based drug development)기술을 개발하고 있으며 1∼2년 안에 국내의 구조기반 신약개발 연구팀에게 제공할 계획으로 있다.
(2) 신규 인프라구축 현황
대표적인 인프라시설인 포항가속기연구소의 4세대 가속기 건설이 2016년에 완료되어 빔라인 건설이 진행되었고 올해 하반기에 연속펨토초결정학 빔라인의 유저 서비스가 개시될 예정으로 있다. 연속펨토초빔라인에서는 나노미터 크기의 결정을 이용해서 구조를 구명할 수 있으므로 GPCR의 여러 종류를 비롯한 신약개발 막단백질의 구조구명에 사용될 것으로 기대된다. 또한 기존의 3세대 가속기 설비에는 마이크로포커스 빔라인이 구축되었는데 이 빔라인을 이용하여 마이크로미터 크기의 결정으로부터 구조를 구명할 수 있어 결정이 크게 자라지 않는 다양한 종류의 단백질 결정을 이용한 실험에 공헌할 것으로 기대된다. 3세대 가속기에 바이오이미징 빔라인이 구축되어 생체의 미세한 구조를 관찰하는데 사용될 수 있다. 한편 저온전자현미경 실험에서 나오는 막대한 양의 데이터를 저장하고 구조계산을 수행하기 위해서 KISTI의 수퍼컴퓨터센터에서는 구조분석용 수퍼컴퓨터 시간을 할당하기로 하고 한국구조생물학회와 협의하고 있다.

[그림 3-47] 포항가속기의 바이오이미징 빔라인(Biodesign 5, 53-61(2017))
라. 발전 과제
구조생물학은 중요단백질의 구조를 구명해서 생물학적 기능을 설명하는 것에서 발전해서 최근에는 단백질의 기능을 산업적으로 이용하는 바이오신약, 바이오센서, 신소재, 단백질설계 분야에 중요하게 응용되고 있다. 국내의 구조생물학은 세계수준의 인프라를 갖추고 있으며 그에 걸맞은 기초연구결과를 생산해 왔다. 이제 기초연구결과에 기반을 둔 응용분야가 활성화되는 단계에 있으며 제약기업과 바이오텍 기업에서 점차로 구조기반 신약설계의 응용을 확대해 나가고 있으며 학계 및 연구계에서도 기초연구결과를 바탕으로 한 응용연구를 시작하고 있다.
세계에서 세 번째로 구축된 4세대 가속기를 이용하여 앞으로 많은 신약표적 막단백질의 구조가 구명될 것으로 기대되며 향후 추가적인 가속기 기술개발로 단분자 회절 기술로 이어진다면 국제적인 구조생물학 연구를 선도할 것으로 기대된다. 저온전자현미경의 응용분야에서도 국내연구가 활성화 되고는 있지만 현재 단백질구조용 저온전자현미경이 국내에 한 대 밖에 없는 상태여서 국제적인 수준의 발전에는 미흡하다. 향후 저온전자현미경 시설의 확충이 시급한 상태이다.
7. 뇌과학
가. 개요
뇌는 외부세계와 몸 속 환경을 감지/인지하고, 이에 반응하여 정보를 분석/처리하여 행동을 선택 및 조절하는 중요한 기관이다. 인간의 뇌는 현대의학과 과학기술의 발전에도 불구하고 아직까지 미개척지가 많은 분야로 한국이 미래 선진국으로 도약할 수 있는 기회를 제공할 수 있는 도전적 영역이다.
뇌연구는 뇌신경생물학과 인지과학적 이해를 바탕으로 뇌 작동의 근본 원리를 파악하여 뇌질환 극복 및 공학적 응용에 활용하는 분야이다. 따라서 뇌과학은 뇌신경계의 형성과 기능에 대한 생물학적 운영원리를 구명하는 바이오기술(BT), 분자와 세포 수준의 접근이 가능한 나노기술(NT)과 컴퓨터와 기기를 활용한 정보기술(IT)의 유기적 연결을 통한 융합연구의 핵심이다. 또한 정서와 감정을 이용한 감성형 문화콘텐츠 기술(CT)까지 추가되어 뇌과학은 그야말로 초융합 학문의 꽃이라고 할 수 있다.
최근에는 다면적, 다차원적, 초정밀 연구 방법을 통하여 뇌신경회로망의 구조와 기능의 이해를 바탕으로 행동/시스템뿐 아니라 유전체 분석 기술을 통한 단일세포의 기능까지 이해할 수 있다. 이를 바탕으로 뇌질환 발병원인의 기전연구에서부터 빅데이터를 활용한 실시간 환자의 정보를 수집하여 개인 맞춤형 뇌질환 극복을 위한 치료제 개발까지 힘쓰고 있다. 더욱이 컴퓨터 알고리즘을 통한 분석방법으로 뇌에 대한 방대한 정보의 수집과 줄기세포 기술을 이용한 미니뇌(오가노이드)배양의 성공은 뇌지도 작성과 뇌질환 치료 연구를 가속화하여 뇌의 근본적인 이해 및 뇌질환 극복에 큰 도움을 줄 것으로 기대된다. 이러한 기술의 혁신은 연구개발 성과를 활용하고 실용화하여 아직 태동기에 있는 뇌산업을 촉진하고 국민의 건강한 삶의 질 보장이라는 뇌연구의 궁극적 비전에 더욱 가까워지게 할 것이다.
나. 해외 동향
세계 각국은 글로벌 경제위기에도 불구하고, R&D를 기반으로 하는 과학기술 혁신을 급변하는 사회에서 직면하게 되는 다양한 사회문제 극복을 위한 원천이자 지속가능한 성장 동력으로 인식하고, R&D에 막대한 투자를 하고 있다. 특히나 인구 고령화에 따른 사회문제는 선진국에서는 물론 개발도상국에서까지도 가장 문제가 되고 부각되는 글로벌 관심사이다. 이에 대해 미국, EU 등 주요 선진국들은 인구고령화에 따른 사회경제적 문제를 해결하기 위해 일찍부터 뇌연구의 중요성을 인식하고 국가 차원의 예산투입과 정책수립을 이어오고 있다. 이들은 뇌연구의 기술, 산업적 파급효과를 고려해 뇌연구를 국가경쟁력과 직결되는 유망 과학기술로 지목하고 21세기 첨단과학기술을 기반으로 한 범국가적 대형 프로젝트를 추진하고 있다.
최근 전개되고 있는 세계적 뇌연구 동향은 천억 개의 신경세포와 수백 조 개의 시냅스를 통한 뇌 연결성 분석 등 뇌의 구조와 기능의 근원적 이해 및 응용을 위한 연구에 초점이 맞춰져 있다. 이러한 흐름은 세계 주요국들이 2013년부터 국가 차원의 대규모 뇌연구 프로젝트를 추진하면서 시작되었다. 미국과 유럽이 각각 Brain Initiative와 Human Brain Project(향후 10년간 각각 5.2조 원과 1.4조 원 지원 예정)를 진행 중에 있으며, 일본과 중국이 각각 Brain/MINDS(향후 10년간 4,000억 원 이상 투입 예정)와 China Brain Project를 착수하였다.
이러한 국가주도의 연구개발 사업뿐 아니라, 미국의 카블리 재단(Kavli Foundation)과 영국의 민간기금(Welcome Trust)등에서 뇌과학을 포함한 과학기술 혁신을 민간 하에 활발히 지원하고 있다.
[표 3-14] 주요 국가별 뇌연구 시스템 비교
|
구분 |
미국 |
유럽(EU) |
일본 |
한국 |
|
정책 수립 |
Decade of Brain (’90) -NIH주도 뇌연구추진 국가알츠하이머 프로젝트법(’11) Brain Initiative(’13) -국가주도 뇌연구 추진 -MICrONS 프로젝트 추진(’15) |
유럽연합의 Human Brain Project (’13∼’22) -슈퍼 컴퓨터를 이용한 시뮬레인션을 통한 인간의 뇌 재구성 |
뇌의 세기(’96) 뇌연구개발에대한 장기적구상(’97) 뇌과학연구 르네상스(’07) 뇌과학연구전략 프로그램(’08) Brain/MINDS 프로젝트 추진(’14) -마모셋 원숭이를 이용한 인간 뇌 이해 증진 및 뇌질환 극복 |
뇌연구촉진법(’98) 뇌과학원천기술개발사업(’06∼) 국가 뇌연구 발전 로드맵(’08) 제2차 뇌연구촉진 2단계기본계획 (’13∼’17) 뇌과학 발전전략 수립(’16) 제3차 뇌연구촉진 기본계획수립추진中 (’17) |
|
투자 규모 |
10년간 5.2조 원 투입 |
10년간 1.4조 원 투입 |
1차년 300억 원/ 2차년 400억 원 |
1,367억 원(’17)
|
|
연구 기관 |
NIH 산하 27개 기관 및 센터 연합 |
|
RIKEN BSI (’98년 설립) |
한국뇌연구원/KIST 뇌과학연구소 설립(’11년) IBS뇌과학연구단 (3개)선정(’12∼’13) |
|
연구 체계 |
NIH 주도 |
유럽연합 소속의 연구기관 주도 |
뇌과학위원회 이화학연구소 |
생명공학 종합정책심의회 |
|
민간 연구 기관 |
카블리 재단등의 후원으로 글로벌 뇌연구 이니셔티브(’16∼) -신경과학 통합 정보 관리 및 클라우드 기반 오픈 플랫폼 구축 |
영국 민간기금 (Welcome Trust)을 통한 연구 활성화 -국제 만능유도 줄기세포은행 추진을 통한 질환타겟형 연구 |
|
|
출처: 자체 자료 검색
다. 국내 현황
한국 뇌과학은 1998년 제정된 ‘뇌연구촉진법’ 및 ‘뇌연구촉진법시행령’ 등 법적 기반을 바탕으로 범정부적 뇌연구 지원 사업이 추진되면서 본격적으로 발전하였다. 뇌연구촉진법에 근거하여 과기정통부, 산업부, 복지부 등 5개 부처가 1999년 7월에 공동으로 수립한 제1차 뇌연구촉진기본계획(1998∼2007)은 기초연구기반을 조성하고 뇌연구 주체별 기술역량을 강화하는 방향으로 기본목표가 설정되었으며, 이에 따른 다양한 시책들이 국내 뇌과학 육성을 위해 추진되었다. 이어서 수립된 제2차 뇌연구촉진기본계획(2008∼2017)에는 그동안 조성된 연구기반을 바탕으로 중장기 뇌연구 발전비전과 추진목표가 제시되었으며, ‘창조적 뇌연구’를 통한 삶의 질 향상과 미래신사업 창출이라는 비전아래 ‘R&D 핵심역량 강화’, ‘연구개발 시스템 혁신’, ‘산학연 협력 및 인프라 기반구축’ 등 3대 추진전략이 강조되었다. 또한, 기본계획 기간(2008∼2017) 중 정부는 2018년 제3차 뇌연구촉진기본계획과 연계하고, 초고령화 사회 대비 및 뇌산업 분야의 새로운 성장동력 확보를 위한 ‘뇌과학 발전전략’을 2016년에 수립하였다. 뇌과학 발전전략은 2023년까지 뇌과학 신흥강국 도약 준비를 비전으로 제시하였으며, ‘특화뇌지도 등 핵심뇌기술 조기확보’와 ‘뇌연구 생태계 확충’을 2대 세부목표로 설정하여, 범국가적 차원에서의 뇌연구 육성 정책 추진 및 원천기술 확보에 노력을 기울이고 있다. 이에 따라 2017년부터 뇌과학원천기술개발 사업 중 뇌지도 구축 및 뇌융합 챌린지 프로젝트(85억 원)가 착수되어 진행되고 있다. 이와 더불어, 제2차 생명공학육성기본계획 2단계에서 뇌연구가 향후 집중지원 원천기술로 선정됨에 따라 신산업 창출을 위한 핵심기술로서 뇌연구의 중요성이 재조명되었다.
|
연도 |
추진내용 |
|
’98년 |
‘뇌연구촉진법’ 제정 |
|
’99년 |
범부처 차원의 ‘제1차 뇌연구촉진 기본계획(BRAINTECH21)’ 수립, 시행 ‘뇌신경생물학사업단’, ‘뇌의약학사업단’, ‘뇌신경정보학사업단’ 3개 국책사업단 발족 |
|
’03년 |
21세기가 프론티어연구개발사업의 일환으로 뇌기능활용 및 뇌질환치료기술 개발연구 사업단 출범 |
|
’08년 |
‘제2차 뇌연구촉진 기본계획(’08∼’17)’ 수립, 시행 연구기반 조성에서 탈피하여 원천기술 확보를 목표로 함 뇌과학 분야의 세계적인 추세를 반영하여 연구 분야에 있어서 기존의 뇌신경생물, 뇌의약학, 뇌신경정보학 외에 뇌인지과학 및 뇌 융합연구 분야 신설 학제간 융합을 위한 ‘한국 뇌연구원 설립추진기획단’ 발족 |
|
’11년 |
‘한국뇌연구원’ 설립 유치기관 선정(대구․경북-DGIST 컨소시움) |
|
’13년 |
‘제2차 뇌연구촉진 2단계 기본계획(’13∼’17)’ 수립 ‘뇌기능활용 및 뇌질환치료기술 개발연구사업단’ 종료(’13.9) 기초과학지원연구원(IBS) 뇌연구 분야 지원 개시(시냅스 뇌질환 연구단, 인지 및 사회성 연구단에 총 200억 원 지원, 성균관대 뇌영상 연구단 신규 선정) ‘창조경제 실현을 위한 미래부 BT분야 투자전략(’13.11)’에 의하여 BT 5대 중점투자분야 중 하나로 뇌연구 선정 ‘치매 예측을 위한 뇌지도 구축 및 치매조기진단 방법 확립 사업’ 신규과제 선정, 향후 5년간 약 250∼300억 원 지원 예정 및 2017년부터 실시됨 ‘치매조기진단 대국민서비스’ 계획 수립 |
|
’14년 |
‘생애 단계별 8대 건강문제 해결(VIP 연두업무보고)’에 의거, 생애 전 주기별 뇌질환 극복 연구 추진 뇌은행사업 착수(한국뇌연구원 내 설치) |
|
’15년 |
‘바이오헬스 미래 신산업 육성 전략 – 바이오미래전략‘의 일환으로 신규과제 선정, 뇌과학에 약 415억 원 규모 예산 투자 |
|
’16년 |
‘뇌과학발전전략’ 수립, 시행 |
|
’17년 |
‘제3차 뇌연구촉진 시행계획’ 수립 |
출처: 자체 자료 검색

출처: 자체 자료 검색 및 가공
[그림 3-48] 뇌연구촉진 기본계획의 추진 방향

출처: 연도별 뇌연구촉진 시행계획, 과학기술정보통신부
[그림 3-49] 정부 뇌연구 투자실적 추이
정부의 뇌연구 투자를 살펴보면, 뇌연구가 본격화된 1998년부터 2016년까지 총 10,683억 원이 투자되었고 연도별 2001년 259억 원에서 2016년 1,367억 원으로 연평균 12.5% 증가되었으며, 2013∼2016년에는 22.1% 증가됐다.
부처별 2016년 뇌연구 투자비중을 살펴보면 과학기술정보통신부(前 미래창조과학부) 및 출연연이 각각 37.3%, 46.7%를 담당하였으며 보건복지부 10.4%, 산업통상자원부 2.1%, 교육부 3.4% 순으로 투자하고 있다. 2017년 국내 뇌연구 투자규모는 전년 규모와 유사한 1,367억 원으로 과학기술정보통신부가 전체의 41.1%(562억 원)을 차지하고 있으며, 출연(연)이 45.0%(615억 원), 보건복지부 7.0%(96억 원), 산업통상자원부 3.8%(53억 원), 교육부 3.1%(42억 원) 순으로 투자될 예정이다.

출처: 2017년도 뇌연구촉진 시행계획(안) 과학기술정보통신부, 2017.3
[그림 3-50] 2016년 부처별 뇌연구 투자 비중
국내 뇌연구를 통한 SCI 논문 수는 2006년 13위에서 2016년 세계 10위로 상승했으며, IF10 이상의 우수논문의 수에서도 2016년 36편으로 전 단계 대비 증가되는 추세이다. 국내 특허출원의 경우 2013년 63건에서 2016년 215건으로 급속한 성장세를 보이고 있으며, 특허기술경쟁력도 세계 6위를 달성했다. 이러한 양적 성장에도 불구하고, R&D생산성은 현저히 낮은 수준으로, 기초연구를 바탕으로 실용화와 산업화까지 고려한 뇌연구의 질적 향상을 추구해야한다.
[표 3-16] 제2차 뇌연구촉진 기본계획의 성과내용
|
구분 |
논문(건) |
특허(건) |
기술 이전 (건) |
기술료 (백만 원) |
인력양성(명) |
참여 인력 |
|||||
|
상위 1% ∼10% |
SCI 논문수 |
국내 |
국외 |
석사 |
박사 |
||||||
|
출원 |
등록 |
출원 |
등록 |
||||||||
|
’13 |
12 |
525 |
63 |
49 |
52 |
16 |
3 |
25 |
142 |
61 |
2,306 |
|
’14 |
84 |
6,724* |
157 |
94 |
45 |
10 |
5 |
82 |
197 |
113 |
2,426 |
|
’15 |
124 |
1,012 |
196 |
39 |
55 |
12 |
4 |
613 |
196 |
96 |
2,739 |
|
’16 |
228 |
975 |
215 |
55 |
54 |
15 |
6 |
818 |
126 |
84 |
3,113 |
|
합계 |
448 |
2,512** |
631 |
237 |
206 |
53 |
18 |
1,538 |
661 |
354 |
10,584 |
*2014년도의 경우, 연구재단 제공한 뇌관련 논문 포함 총논문수 6,118건
** 2014년도 논문수 제외
출처: 2017년 뇌연구 촉진시행계획(안) 과학기술정보통신부, 2017.3
[표 3-17] 2016/2017년 뇌연구 투자 실적 및 계획
(단위 : 백만 원)
|
기관 |
사 업 명 |
사업기간 |
’16 실적 |
’17 계획 |
|
미래 창조 과학부 |
○ 뇌과학원천기술개발사업 |
’06∼계속 |
32,628 |
41,750 |
|
○ 개인연구자 지원사업 |
’86∼계속 |
17,326 |
13,432 |
|
|
○ 선도연구센터(MRC) 지원사업 |
’02∼계속 |
1,000 |
1,000 |
|
|
○ 기초과학연구원(IBS) |
|
24,858 |
22,991 |
|
|
-인지 및 사회성 연구 |
’12∼’17 |
8,879 |
7,000 |
|
|
-시냅스 뇌질환 연구 |
’12∼’17 |
7,979 |
7,991 |
|
|
-기초뇌과학 및 생물물리학 융합연구 |
’13∼’17 |
8,000 |
8,000 |
|
|
○ 한국뇌연구원 |
|
23,925 |
24,974 |
|
|
-뇌신경망 구조-기능 이해 기반 뇌손상 제어기술 개발 |
’13∼계속 |
2,300 |
2,800 |
|
|
-뇌발달 및 뇌질환 원인구명, 진단, 제어법 개발사업 |
’13∼계속 |
2,300 |
2,900 |
|
|
-고위뇌기능활용 및 장애극복 기술개발(대뇌피질중심) |
’16∼계속 |
1,000 |
2,100 |
|
|
-뇌연구 허브 구축 사업 |
’13∼계속 |
1,205 |
1,105 |
|
|
-국가 뇌연구 인프라 구축 사업 |
’13∼계속 |
17,120 |
16,069 |
|
|
○ KIST 뇌과학연구소 |
|
9,327 |
8,392 |
|
|
-융합기술 기반 자폐 뇌 발달 장애 연구 |
’17∼’19 |
- |
1,000 |
|
|
-뇌 인지/감각기능의 신경과학적 연구 |
’16∼’18 |
1,228 |
1,228 |
|
|
-우울모델을 이용한 우울증 작용회로구명 및 변화연구 |
’16∼’18 |
510 |
510 |
|
|
-화학적 뇌신경 영상제 개발 |
’17∼’19 |
- |
1,144 |
|
|
-체액기반 신경계질환 분석을 위한 마이크로 소자 연구 |
’16∼’18 |
1,300 |
1,300 |
|
|
-멀티스케일 기능커넥토믹스 연구 |
’15∼’17 |
3,210 |
3,210 |
|
|
-뇌 회로 작성 및 조절 기술 개발 |
’11∼’16 |
1,835 |
- |
|
|
미래 창조 과학부 |
-신경염증성 뇌질환 조절 물질 개발 |
’14∼’16 |
1,244 |
- |
|
○ 한국생명공학연구원 |
|
4,089 |
4,089 |
|
|
-노인성 뇌질환 형질전환 동물모델 개발사업 |
’15∼’18 |
2,024 |
2,024 |
|
|
-원숭이 뇌경색유발 모델의 유효성평가 기반구축 등 |
’13∼’15 |
320 |
320 |
|
|
-혈관화 뇌 오가노이드 배양기술 개발 등 |
’15∼’18 |
192 |
192 |
|
|
-뇌발달장애 조기대응 위한 단백체표지자 발굴, 진단기술 실용화 |
’15∼’18 |
425 |
425 |
|
|
-국가영장류센터사업 |
|
1,128 |
1,128 |
|
|
○ 한국표준과학연구원 |
’16∼’18 |
1,212 |
585 |
|
|
-차세대 생체자기공명 측정기술개발 |
1,212 |
585 |
||
|
○ 한국한의학연구원 |
’15∼’19 |
475 |
441 |
|
|
-노인성 인지장애 예방 및 치료 한약소재 개발연구 |
475 |
441 |
||
|
소계 |
|
114,840 |
117,654 |
|
|
[출연연] |
|
[63,886] |
[61,472] |
|
|
교육부 |
○ 이공학학술연구조성(개인기초) |
’89∼계속 |
3,163 |
2,635 |
|
○ BK21플러스 |
’13∼’20 |
1,537 |
1,537 |
|
|
소계 |
|
4,700 |
4,172 |
|
|
산업 통상 자원부 |
○ 미래산업선도기술개발사업 |
|
2,375 |
4,275 |
|
-바이오산업 핵심기술 개발사업 |
’09∼’27 |
1,700 |
2,100 |
|
|
-전자시스템산업 핵심기술 개발사업 |
’09∼계속 |
675 |
2,175 |
|
|
소계 ([민간] ’16년 516백만 원, ’17년 979백만 원 포함) |
|
2,891 |
5,254 |
|
|
보건 복지부 |
○ 만성병관리기술개발연구 |
’10∼계속 |
1,046 |
1,227 |
|
○ 질환극복기술개발 |
|
12,603 |
8,343 |
|
|
-질병중심 중개연구 |
’13∼’18 |
4,690 |
2,830 |
|
|
보건 복지부 |
-뇌의학연구 |
’13∼’18 |
6,513 |
4,513 |
|
-한영국제협력기술교류사업 |
’13∼’18 |
1,400 |
1,000 |
|
|
소계(2016년 민간 611백만 원 포함) |
|
14,260 |
9,570 |
|
|
총계(민간 포함) |
|
136,691 |
136,650 |
|
|
(민간) |
|
(1,127) |
(979) |
|
출처: 2017년 뇌연구 촉진시행계획(안) 과학기술정보통신부, 2017.3
라. 산업 현황
뇌연구의 학문적 성과는 실용화/산업화를 거쳐 일상생활 전반에 큰 영향을 미치고 있다. 최근에 뇌파(EEG)와 fMRI 측정 결과를 활용한 감성 디자인, 뉴로 마케팅과 뇌자극 기반의 가상현실(VR, Virtual Reality)을 이용한 새로운 형태의 영화를 사례로 들 수 있다. 이처럼 뇌연구는 큰 부가가치를 창출하는 미래지향적 신시장을 개척하고 있다.
뇌관련 산업시장은 뇌의약품, 연구용 장비, 뇌질환 진단 및 치료용 장비를 비롯하여 뇌파-바이브라 이미지를 바탕으로 정신적 웰니스/스트레스 지수를 이용하는 브레인 휘트니스 기술 등 세계적으로 100조 원이 넘으며, 매년 성장하고 있다. The Neuro- technology Industry 2015∼2016 Report에 따르면 뇌의약품이 연 5%의 성장률을 기록하며 시장의 대부분(83%)을 차지하고 있지만, 연구장비와 치료용 임상장비도 각각 연 5%와 10%이상 꾸준히 늘고 있다. 주목할 만 한 점은, 집중력 향상 뇌자극기와 웨어러블 EEG등 일반인 대상 제품시장이 약 1조 원으로 연간 11.5%의 성장률로 팽창하고 있다는 것이다.
IBM은 시냅스 연결을 모방하여 기존 CPU의 40% 전력으로 4배 집적도의 뉴로모픽 칩을 개발했으며, 국내에서도 오비이랩과 뉴로스카이가 각각 휴대용 고해상도 뇌영상장비와 뇌파측정장치를 상용화해서 제품으로 출시했다. 그 밖에, 로고스 바이오시스템스가 세계 최초로 뇌투명화 기술 상용화에 성공했다.
또한, 급속한 고령화 사회 진입으로 뇌질환 치료, 인지능력활용을 통한 제품들이 늘고 있는데 외국의 경우 소규모 기업 주도의 뇌질환 치료제 개발이 증가하고 있는 것을 주목할 만하다. 한국은 전 세계에서 노령화가 가장 빠르게 진행되고 있는 국가로서 뇌질환 관련 사회경제적 비용이 23조 원에 달한다. 따라서 국가차원의 뇌질환 문제 해결을 위한 대응이 절실히 요구되고, 사회문제 해결을 위한 뇌연구의 중요성이 높아지고 있다. 정부출연 연구기관들은 뇌질환 분야 뿐 아니라 관련기기 분야의 기술이전을 추진하고 있으며, 메디포스트와 일동제약 등 국내 제약회사들도 알츠하이머, 치매 억제제 및 치료제의 특허를 획득하여 임상시험 중에 있다.
[표 3-18] 뇌 연구 관련 장비의 산업화 현황
|
분야 |
미국 |
유럽 |
일본 |
한국 |
|
|
의료용 Neuroimaging Neurodiagnostics |
CT |
GE Healthcare |
Siemens, Philips |
Shimadzu, Toshiba (TMSC) |
삼성메디슨 |
|
MRI |
GE Healthcare |
Esaote SpA |
Hitachi, Shimadzu, Hamamatsu |
사이메딕스, 메리너스, 이솔테크놀로지 |
|
|
EEG |
Medtronic, Natus Medical, EGI |
ANT Neuro, Neuroscan (호주) |
Nihon Kohden |
x |
|
|
Transcranial Doppler |
GE Healthcare, Medtronic |
Siemens, Philips |
(Unknown) |
에이모션 (개발 중) |
|
|
PET |
GE Healthcare |
Siemens, Philips |
x |
||
|
fNIRS/ Ceretral oximeter |
Medtronic, Nonin, Massimo |
OxiPrem |
Hitachi, Shimadzu, Hamamatsu |
(주)오비이랩 |
|
|
의료용 Neurostimulation /Neuromodulation |
TMS |
Magstim, Boston Scientific, St. Jude Medical |
Nextim |
(Unknown) |
리메드 |
|
TDCS |
Soterix |
Neuroconn |
와이브레인 |
||
|
의료용 Neurointervention |
Stent |
Medtronic, Stryker, Blockade Medical, Johnson& Johnson |
Neuravi, BALT |
(Unknown) |
x |
|
Catether |
|||||
|
Coiling |
|||||
|
Balloon |
|||||
|
의료용 Intracranial Pressure (ICP) |
Drainage Catheter |
Integra, DePuy Synthes |
Raumedic, Sophysa, Linet |
(Unknown) |
x |
|
Monitor |
Integra, Codman, Medtronic |
Vittamed |
|||
|
Probes |
Integra, Codman |
Spiegelberg |
|||
|
기타 의료용 기기 |
Hemorrhage Detection |
Infrascan |
x |
x |
x |
|
비 의료용 Brain Machine Interface |
EEG |
Emotiv, Neurosky, Choosemuse, Integra, Natus |
Brain Vision, ANT Neuro, Compumedics |
Nihon Kohden |
(Neurosky) |
|
삽입형 Chip |
DARPA (미국국방성, 개발 중) |
휴먼브레인 프로젝트 |
과학기술청 (뇌파로 움직이는 로봇 개발 중) |
과기부 뇌과학 원천기술개발 사업(나노탐침형 뇌센서용 무선 시스템 개발) |
|
|
Neural Recording system |
Paradromics |
(Unknown) |
(Unknown) |
(Unknown) |
|
|
비의료용 Artificial Intellig- ence |
Imaging |
IBM, Microsoft, Google, NVIDIA, Intel, General Vision |
FinGenius |
(Unknown) |
제이엘케이인스펙션 |
출처 : 자체 자료 검색
[표 3-19] 뇌질환 관련 최근 주요 기술내용
|
구분 |
주요내용 |
|
한국과학기술연구원 (KIST) |
알피니언 메디칼시스템(주)에 혈액기반 치매조기진단 기술이전 (3,300억 원 규모, 2016.2.1) |
|
한국표준과학연구원 (KRISS) |
호주 컴퓨메딕스社(Compumedics Limited)에 뇌지도 의료기기 국제 기술이전(312억 원 규모, 2016.6.6) |
|
한양대 |
휴온스(주)에 ‘SAPK3’저해제로 퇴행성 뇌질환에 적용하는 기술이전 (2016.2.22) |
|
일동제약 |
치매치료제 ‘ID1201’추출을 국내 및 중국, 유럽 특허 등록하고 임상 2상 진행 中(2013∼) |
|
메디포스트 |
알츠하이머성 치매 세포 치료제 ‘뉴로스템 ’유럽 6개국 특허 등록하고 임상 1상과 2a상 동시에 진행 中(2013∼) |
출처 : 자체 자료 검색
마. 발전 전망
미국, EU, 일본 및 중국 등 세계 주요 선진국들은 뇌과학이 미래산업의 새로운 패러다임을 제시할 수 있는 가장 강력한 블루오션으로 보고 대규모 장기 연구 프로젝트에 착수하여 기술 선점에 나서고 있다. 뇌연구는 미래사회를 선도하고 삶의 질을 혁신할 유망기술로 국가차원의 체계적이고 종합적인 뇌연구 육성이 절실히 요구된다. 이에 맞춰, 2017년부터 시범적으로 착수된 뇌지도 사업은 뇌의 구조 작동원리에 대한 이해와 회로망기반의 새로운 차원의 뇌질환 극복 등 차세대 뇌연구를 위한 필수 정보를 제공할 전망이다. 여기서 파생되는 핵심기술은 뇌지도 작성기술을 최적화, 고도화하여 뇌지도 작성에 활용될 뿐만 아니라, 뇌산업을 촉진하고 육성하여 뇌 관련 시장을 활성화할 것으로 예측된다. 또한 산학연 네트워크 강화를 통한 뇌연구 인프라 구축과 국가주도의 대규모 사업을 추진하고 뇌연구 정책방향을 설정하고자 한국뇌연구원(KBRI)이 설립되어 유기적 협력체계를 바탕으로 한국과학기술연구원(KIST), 기초과학연구원(IBS)등과 더불어 뇌연구 전문기관으로 한국 뇌과학의 구심적/통합적 역할을 담당하고 있다.
뇌과학은 학술융합을 넘어 세상의 융합을 통하여 새로운 부가가치를 창출함으로써 새로운 성장동력과 일자리를 만들어 낼 것으로 기대된다. 뇌연구개발의 성과가 국민에게 활용될 수 있도록 관련 부처의 협력 하에 연구성과의 질적 향상과 함께 원천기술의 실용화 촉진 프로그램 개발과 창업지원 등이 필요하다고 보인다. 특히, 인공지능 및 빅데이터 등을 중심으로 한 4차 산업혁명의 핵심 기반기술인 뇌연구의 새로운 도약을 위해서 산업화를 고려한 발전방안을 도출할 필요가 있다. 또한, 국제 네트워크를 통한 활발한 공동연구로 뇌연구에 대한 도전을 함께 할 수 있도록 국가차원의 뇌연구 프로젝트가 시작되어야 하는 시점이다.
8. 노화과학
가. 개요
우리나라는 65세 이상의 노인이 전체 인구에서 차지하는 비율이 2000년에 7%를 넘어 고령화 사회에 접어들었고, 올해 2017년에는 예상보다 빠르게 14%를 넘어 고령사회에 진입할 것으로 전망하고 있다. 고령화 사회로 들어선지 17년만으로 2016년에는 65세 이상 노인 인구가 15세 미만 유소년 인구를 처음으로 넘어섰다.
급속한 인구 고령화는 노인의 신체・정신적 건강 등 개인의 문제뿐만 아니라 정치, 경제, 보건의료 등 사회 전반의 변화와 새로운 위기를 초래하는 국가의 현안으로 부각되고 있다. 우리나라뿐만 아니라 전 세계적으로 인구 고령화가 진행 중이며 세계 각국에서는 이를 해결하기 위해서 노화과학 연구에 많은 관심을 가지고 많은 예산을 투입하고 있다. 기존의 노화과학 연구는 노인성 질환의 발생 기전 중심으로 연구가 이루어져왔지만 급속한 고령인구의 증가로 인한 사회 전반의 문제로 노화과학 연구의 필요성이 더욱 부각되고 있다.
노화과학 연구는 노화의 기전을 규명하기 위한 생물학적 연구, 노화에 따른 노인성 질환의 예방과 치료를 위한 기술개발 연구, 고령사회 대응을 위한 정책적 연구, 사회・경제적 연구 등을 모두 포함한다. 노화기전 연구분야는 노화유전자를 발굴하고 분자 세포수준에서 노화 기전 규명하고, 노화를 제어할 수 있는 항노화 원천기술개발 연구이다. 노인성 질환 연구는 치매, 신경퇴행성 질환, 뇌질환, 근감소증 등 노화와 함께 발병 가능성이 높은 질환의 예방과 치료를 위한 의학적 연구를 말한다. 정책적 노화연구는 고령화 사회에 예상되는 여러 문제에 대응하기 위해서 노인관련 심리학, 행동학, 노인학 등 인문사회적・생물학적 노화에 대한 정책 발굴을 의미한다.
오늘날 노화과학은 단순한 수명연장이 아닌 건강한 노년을 추구한다. 노화과학은 급속한 고령화에 따른 경제활동인구의 감소, 복지재정의 증가 등 여러 사회・경제적 문제를 해결할 대안으로 떠오르고 있다. 고령화 사회를 대비하는 노화과학 정책을 강화하여 건강수명과 기대수명의 격차를 줄이고 건강한 노화를 이루어 내는 것은 가파른 속도로 고령화가 진행되는 우리나라에서 매우 시급한 일이다.
(1) 급속한 고령화에 따른 노인 의료비용 증가
우리나라는 2000년에 이미 65세 이상 인구가 7.2%를 넘어서며 UN이 정한 고령화 사회에 진입하였고, 2017년 8월말에 14%가 넘어 예상보다 빠르게 고령사회로 진입했다. 더욱 심각한 인구문제는 지난해 고령인구가 유소년 인구를 처음으로 추월했다는 것이다. 9년 뒤인 2026년경에는 초고령 사회 진입이 예상된다.

출처: 통계청, 2016.9.
[그림 3-51] 연령대별 인구 구성비
이러한 급속한 인구 고령화는 국민의 건강문제를 발생시키고, 경제 활력을 저하시키는 등 국가발전과 사회 안정을 위협하는 잠재적 불안요인으로 여겨지고 있다. OECD는 한국의 급속한 고령화가 사회보장 및 의료비 지출 증가와 세수감소로 이어질 것이 예상되므로 이에 대한 정책을 강화하고 공공부분의 효율성을 높여야 한다고 평가했다. 급속한 고령화에 따른 노인 인구의 증가는 의료비용 및 건강보험의 재정 부담을 증가시키는 주요 원인으로 작용하고 있다. 2016년 건강보험에서 전체 진료비 64조 6,623억 원이며, 이 중 65세 이상 고령자 진료비는 38%인 24조 5,643억 원으로 전년보다 15%가 증가했다. 2015년 고령자 1인당 진료비는 381만 1천 원으로 전년에 비해 11% 증가하였으며, 전체 1인당 진료비 127만 4천 원 보다 3배 정도 많은 것으로 나타났다.

출처: 건강보험심사평가원 보도자료, 2017
[그림 3-52] 노인 의료비의 연도별 증가 현황
(2) 노화연구 및 항노화 산업의 발전 현황
전 세계적인 고령화로 인해서 노화R&D 예산이 매년 증가하고 있으며 항노화 산업에 대한 수요도 높아지고 있다. 최근 발표된 논문들을 통해서 노화가 다양한 관점에서 연구되고 있다는 것을 알 수 있다. 올해 4월 Wyss-Coray 박사 연구팀이 네이처(Nature)에 발표한 연구결과에서 인간 제대혈에 있는 혈장 단백질들 중에 팀프 2 (TIMP2 : tissue inhibitor of metalloproteinases 2)라는 특정 단백질이 늙은 생쥐의 뇌 인지 기능을 향상시켰다(Nature, 2017). 젊은 혈액을 늙은 생쥐에서 주사하여 노화 증상이 역전될 수 있다는 새로운 증거라고 할 수 있다. 노화세포를 표적・제거하여 노화증상을 늦추는 연구도 활발하게 진행 중이다. Daren Baker 박사와 Jan Van Deursen 박사 연구팀은 노화 세포 제거를 통해 생쥐의 수명이 25% 증가함을 확인했고(Nature, 2016), Willigenburg 박사 연구팀은 세포노화에 관여하는 단백질의 기능적 결합을 억제하는 펩타이드를 개발하여 노화세포를 제거하는데 성공했다(Cell, 2017). 이 뿐만 아니라 노화에서 면역세포의 부조화, 장내 미생물의 영향 등 다양한 노화관련 연구들이 활발히 진행되고 있다. 최근 노화 연구에는 학계・제약업계 뿐 아니라 거대 IT기업들과 창업주들이 적극적인 투자・지원을 하고 있다. 이러한 노화 연구의 선두 주자는 미국으로 연구 논문수가 전체 약 40%를 차지하고 있으며, 우리나라의 경우 1∼2%에 머물고 있는 실정이다.
고령화로 인해 기능성식품, 의약품, 의료기기, 화장품, 뷰티서비스 등 항노화 산업이 최근 급성장하고 있다. 항노화 산업은 ‘노화 기전에 대한 예방 및 관리와 노화로 인한 신체적 질병을 예방, 관리, 치료하는 모든 제품과 서비스를 포함’으로 정의할 수 있다. 시장조사기관 트랜스페어렌시 마켓 리서치(Transparency Market Research)의 2015년 보고서에 따르면 글로벌 항노화 시장 규모는 오는 2019년 1,917억 달러에 이를 것으로 전망했다. 국내 시장의 경우도 이러한 증가 추세는 동일하게 나타나고 있다. 특히 항노화 화장품 등의 일부 분야에서는 글로벌 시장에서 차지하는 점유율이 높은 편에 속한다. 또한 의료분야에서도 높은 서비스 수준과 우수한 인력을 기반으로 경쟁력을 충분히 가지고 있다. 하지만 노화 관련 기술개발 및 산업 기반이 미비한 실정이며, 통합화된 지원 시스템이 부족하다. 현재 우리나라도 고령화에 대응하고자 여러 가지 정책과 지원을 늘려나가고 있다. 이에 보건복지부의 2017년 세계 10대 보건산업 강국 달성의 주요추진과제에 ‘항노화・친고령산업 육성’을 포함시켰다. 고령화에 대한 인식의 변화와 국가 차원의 지속적인 지원은 우리나라가 항노화 산업 및 노화연구에 글로벌 경쟁력을 갖추는데 필수적이다.
나. 해외 동향
(1) 글로벌 IT 대표 기업

출처: 조선일보 (2017.05.09.)
[그림 3-53] 글로벌 IT업체들의 노화 연구 지원
세계 최고 IT 기업들이 수명 연장을 목표로 질병과 노화 연구에 투자하기 시작했다. 인터넷 기업 구글의 공동 창업자인 Sergey Brin과 Larry Page는 2013년 바이오 기업 칼리코(Calico)를 세워 노화의 비밀을 규명하여 인간수명 연장이라는 목표를 제시하였다. 구글은 글로벌 제약사 애브비와 칼리코의 노화 연구에 15억 달러(약 1조 8,000억 원)을 공동 투자하는 계약을 맺었다. 애플은 빛으로만 당뇨병 환자의 혈당을 측정하는 스마트 워치를 개발하고 있다. 오러클의 공동창업자인 Larry Ellison은 의학재단을 세워 노화연구에 3,000억 원 이상을 투자하였다. 아마존 창업자인 Jeff Bezo와 페이팔 창업자인 Peter Thiel은 노화세포를 제거하여 수명을 연장하는 연구에 1,300억 원을 투자했다.
(2) 미국
미국은 전 세계 노화과학 연구에서 주도적인 역할을 하고 있다. 미국은 일찍이 공중보건법(Public Health Service Act) 제9조(Title IX)를 수정하여 ‘Healthcare Research and Quality Act of 1999’ 법안을 마련하고, 노인건강 증진 및 건강한 삶의 영위를 위해 노화의 근본 이해에 대한 국가 차원의 과학적 연구를 제안하고 있다. 최근 2015년에는 백악관 주재 고령화 컨퍼런스를 준비하며 건강한 노화, 은퇴 후 사회보장, 노인에 대한 인식 개선 등 다양한 논의를 수렴하였다. 미국은 고령화 관련 질병의 연구와 이해를 위한 선도적 전문기관으로 NIH(National Institutes of Health)를 구성하는 27개 연구소 중 하나인 국립노화연구소 (National Institute on Aging, NIA)와 Administration for community living(ACL) 내에 노화연구지원센터(Administration on Aging, AOA) 등 공공기관을 중심으로 노화에 대한 과학적 근거 생산에 주력하고 있다. NIA의 2015년 예산은 11억 9,746억 달러이었고, 2016년에는 15억 9,826억 달러로 33.5% 증가하였다. 2016년 ACL 예산은 19억 6,485만 달러이며 그 중 고령자 지원 예산은 14억 8,337만 달러로 75.5%를 차지하고 있다. 미국은 국립기관이외에도 하버드대, 존스홉킨스대, 워싱턴대를 포함한 대학교와 미국의 대표 IT 기업들이 투자하는 연구소에서 노화 연구가 활발히 진행되고 있다.
(3) 일본
일본은 노인연구에 대한 지원 법령을 ‘고령사회대책기본법 제13조 (조사연구 등의 추진)’에 명시하고, 고령자의 특유질병 및 건강증진을 위한 치매, 암, 만성질환 연구에 중점을 두고 있다. 2003년 건강증진법 시행을 통해 ‘건강일본 21’을 적극적으로 추진할 법적인 기반을 마련하였으며, 고령화의 진행, 생활습관 병의 증가, 치매/병상 노인의 증가 등을 국민 건강과제로 꼽기도 하였다. 노화 관련 전문 연구기관으로 국립장수의료센터 산하에 NCGG(National Center for Geriatrics and Gerontology)를 통해서 병원, 연구소, 사회학자 등 다학제간 융복합 노화연구와 산업육성을 도모하고 있다. 이 밖에도 일본 정부는 ‘인생 90년 시대’를 목표로 건강 노화 구현을 위해 국가 및 사회 정책지원을 강화하고 있다. 일본 문부과학성은 노화 연구를 본격화하기 위해 2016년에 사령탑 역할을 할 추진 회의를 정부 안에 설치하였다. 또한 2017년 예산안에 수백억 원 예산도 반영하였고 일본의료연구개발기구(AMED)를 통해서 노화기전, 제어, 질환 예방 및 치료 등 노화관련 연구비를 지원할 예정이다.
(4) 영국
영국은 1948년 국민부조법에 의거하여 노인에 대한 재가서비스가 의무적으로 실시된 이후로 노인건강보장과 관련된 법들이 다수 제정되었다. 고령화 대응을 위한 10개년 중장기 계획인 ‘노인을 위한 국가서비스 협약’을 수립하고, 노화에 대한 장기적 연구, 치료서비스 제공에 대한 평가, 지속적인 치료서비스에 대한 연구 등을 연구과제로 제시하고 있다. 영국의 노화 관련 연구는 다른 선진국과 달리 노화 전담 연구기관을 두고 있지 않고, 개별적인 연구 과제를 수행한다. 노화 연구는 2001년 전략지침서 NSF(National Service Frameworks)의 제정 시 노화 연구가 중점 분야로 선정되어 예산이 지원되고 있다. 아직 노화종합 관련 전문 연구기관은 설립되지 않고 있으나, 정부 관련기관인 노화 연구 위원회를 주축으로 교육기관 및 자선 기관에서 프로젝트 형식의 컨소시엄 연구를 수행 중에 있다. 영국 의학연구회와 생명공학・생물학연구협의회는 노화관련 연구 및 대한 지원 역할을 수행하고 있으며, 두 연구회는 5년간(2010∼2014) 연평균 한화 약 9,892억 원과 6,430억 원을 각각 배정하였다.
(5) 유럽연합(EU)
유럽연합도 급속한 고령화로 경제활동인구가 줄고 만성질환자 증가함에 따라 사회적 문제로 대두되고 있다. 이와 관련하여 고령 관련 공공 지출은 2012년 GDP의 1.8%에서 2060년 4.1%로 2배 이상 증가할 것으로 예상하고 있다. 이에 유럽연합은 ‘Health 2020’, ‘2012∼2020 유럽에서 건강노화 전략 및 활동 계획’을 수립・운영하고 있으며, ‘유럽 실버경제 성장’ 등 다양한 계획 및 정책을 수립하였다. 이를 통해서 인구고령화를 건강노화로 해결하면서 실버경제를 위한 기회 요소로 활용하고자 노력 중이다.
다. 국내 현황
우리나라는 저출산・고령화로 심각한 인구 문제에 직면해 있으며, 이로 인한 사회 전반에 부정정인 영향을 피할 수 없게 되었다. 이에 대응하고자 정부는 꾸준히 법과 제도의 정비를 추진해왔다. 지난 10년간 대응을 살펴보면, 2004년에 저출산・고령화 문제를 국가적 의제로 설정하고, 2005년에 저출산・고령사회기본법 제정, 저출산・고령사회위원회 출범하였다. 또한 제1차(2006∼2010), 제2차(2011∼2015), 제3차(2016∼2020) 저출산・고령사회기본계획을 수립하여 추진해 나가고 있다. 하지만, 1, 2차 계획 추진에도 저출산・고령화에 대한 대응은 여전히 미흡하다고 평가하고 있다. 정부는 지속적으로 노화 및 항노화 R&D 투자도 늘려가고 있다. 지난 3년(2012∼2014년) 동안 총 14개 부처가 노화 및 항노화 R&D에 총 5,719억 원을 지원하였다. 이 중 대부분의 연구비는 기초 노화연구 보다는 항노화 연구에 치중되어 있다. R&D 투자에 따라 노화 분야 특허등록 및 논문 편수는 증가하였다. 하지만 노화과학 기술과 관련하여 주요 우선권은 우리나라의 경우 1∼2%수준이다. 노화 분야 논문 편수는 분야에 따라 12∼25위 수준이다. 여전히 국가 차원의 인구 고령화 대응 기초 및 원천기술 노화과학 R&D에 대한 지원은 부족하며, 근본적인 지원 정책 수립이 필요한 실정이다.
세계적인 추세와 병행하여 우리나라도 항노화 산업이 급성장하였다. 2010년 10조 9,000억 원, 2011년 약 11.9조 원 규모로 연평균 10.1%가 증가 했으며, 2020년에는 27조 원에 달할 것으로 전망하고 있다. 항노화 산업은 인구고령화를 위기로 인식함과 동시에 새로운 성장을 이끌 기회가 될 수 있다. 따라서 노화 관련 과학기술 혁신은 단순히 보건・복지 분야의 노인성 질병 극복에 국한시키지 말고 보다 적극적인 고령인구의 활용과 신시장 창출의 잠재력을 이끌어 낼 필요가 있다. 또한 고령화 대비 R&D 정책도 개별적이며 산발적인 노화 연구가 아닌 체계적이고 통합적인 연구가 될 수 있도록 장기적 노화 연구지원 체계가 구축되어야 한다. 우리나라의 고령화 현실을 감안해볼 때 우리나라의 노화연구는 국가위기극복 차원에서 지금보다 많은 투자와 국가적인 뒷받침이 있어야 할 것이다.
라. 발전 과제
고령화 사회를 대비하는 가장 효율적인 방안은 건강한 노화를 실현하는 것이다. 전 세계적으로 활발한 노화과학연구를 통해서 노화를 제어 및 회복 가능한 질병으로 인식해 가고 있으며, 노인성질환의 예방 및 치료에 대한 기술개발이 발전해 가고 있다. 하지만 우리나라의 노화과학연구는 양적 및 질적 향상에도 불구하고 아직도 선진국과 격차가 매우 크다. 따라서 우리나라의 노화연구의 활성화 및 효용성 증대를 위해서는 중장기적인 시각으로 노화과학연구에 접근하는 것이 바람직할 것이다.
미국의 국립노화 연구소와 일본의 국립장수의료연구센터와 같은 노화 관련 전문 연구기관들은 국가차원에서 노화R&D를 전폭적으로 지원 받아 노화관련 원천기술을 확보하고 연구기반을 다지고 있다. 뿐만 아니라 여러 분야의 통합적이며 유기적인 R&D 지원 체계를 마련해 나가고 있다. 대표적으로 일본의 오부시 항노화 연구단지에서는 노화관련 연구기관과 병원 휴양시설이 접목된 클러스터로 시너지 효과를 내고 있다. 우리도 노화연구자 네트워크를 구축하여 노화자원, 연구기반, 데이터베이스를 공유하여 연구의 효율과 활성을 증대시켜야 한다. 이를 위해서 국가차원에서 인구 고령화가 실버경제와 고령친화 산업을 위한 새로운 미래 성장동력임을 인식하고 노화 R&D분야에 대한 지원을 늘려나가야 할 것이다. 성공적인 노화과학연구는 노인의 삶을 보다 윤택하게 하고 노년기 삶의 질을 높여 행복한 노년을 이룰 수 있는 초석이 되며 이는 국가 발전에 이바지 하게 될 것이다.
![]() 제2절
보건의료
제2절
보건의료
1. 합성신약
가. 개요
2015년에는 총 33개의 합성신약이 미국 FDA의 승인을 받아(생물학적 제제는 12개) 2000년 이래 2012년과(33개) 동일하게 가장 많았으며, 2016년에는 15개로 전년대비 50% 이상 감소하였으나, 2017년에는 다시 상승하여 상반기에만 17개의 허가를 받았다. 2016년 15개 승인 의약품 중 7개가 orphan 지정을 받아 희귀질환 치료제의 강세가 지속되고 있다. 국내 합성신약도 2016년, 2017년 각각 1건의 허가를 받아 신약 파이프라인을 지속적으로 확장하고 있다. 면역항암제 부각으로 항체치료제와 병용요법에 의해 상승효과를 나타낼 수 있는 합성 항암제에 대한 국내외 연구가 매우 활발하며, 동아제약은 2016년 12월 미국 AbbVie 바이오텍과 면역 항암제인 MerTK 저해제의 기술수출 계약을 체결하였다. 보수적인 제약시장, 특히 합성의약품 시장에서 신생 기업들의 성장이 극히 제한적이었으나 길리어드는 항바이러스 시장의 최대 강자가 되었고, 레블리미드를 선두로 오테즐라(PDE4 저해제)를 확보한 셀진은 면역치료제 시장의 신흥 강자로 고속 성장 중이다.
나. 해외 동향
(1) 미국 FDA 신약 승인
2016년 미국 FDA 승인건수(15개) 감소는 일시적 현상으로 보이며, 2017년 상반기(17개)에 다시 회복되었다.

NME; new molecular entity; BLA biologics license applications; 자료: Nature Reviews/ Drug Discovery 2017, p75
[그림 3-54] 미국 FDA 신약 승인 수
간암으로의 진행 및 사망률이 높았던 C형 간염 치료제는 2014년 첫 허가 승인된 이후, 복합제인 머크의 Elvasvir과 길리어드의 Epclusa 2종이 2016년 추가 승인되어 C형 간염의 거의 모든 환자 유형에 대한 치료법이 완성되었다. C형 간염 치료제는 임상단계에서부터 유전형에 따라 복합제 및 병용치료요법을 개발하여 허가를 받았으며, rucaparib(BRCA 양성), ribociclib(HR 양성, Her2 음성), midostaurin(Flt3 양성), brigatinib(Alk 양성) 등의 항암제도 특정 유전체형의 환자를 대상으로 승인되어 환자선택이 신약개발 성공의 주요 요인이 되고 있다.
전통적인 신약 이외에 진단신약과 펩타이드 또는 올리고뉴클리오타이드 등의 합성신약이 승인되었고 확대 추세이다. 2016년 전체 승인 건수의 80%인 12건이 우선 심사 대상이었다. 2017년도 상반기 6개월 동안 17건의 합성신약이 미국 FDA의 허가를 받았으며, 희귀질환 치료제의 지속적 강세가 확인되었다. 최초로 수소(H)가 이중수소(D)로 치환되어 대사안정성이 증진된 의약품이(Deutetrabenazine) 승인되었다.
[표 3-20] 2016년도 미국 FDA 승인 합성신약 리스트
|
일반명(상품명) |
회사 |
기전 |
적응증 |
심사형태* |
|
Elbasvir grazoprevir (Zepater) |
Merck & Co. |
NS5A 저해제 NS3/4A 저해제 |
1형 및 4형 C형간염 |
P, B |
|
Brivaracetam (Briviact) |
UCB |
SV2A 결합, 기전모름 |
부분발작 |
S |
|
Defibrotide Na(Defitelio) |
Gentium |
호섬유질용해 |
간정맥 폐쇄증 |
P, O |
|
Venetoclax (Venclexta) |
AbbVie |
BCL2 저해제 |
만성 림프구성 백혈병 |
P, O, B, A |
|
Pimavanserin (Nuplazid) |
Acadia |
비정형 항정신병 |
파킨슨 연계 망상 |
P, B |
|
Obeticholic acid(Ocaliva) |
Intercept |
FXR 효능제 |
원발성 담즙성 담관염 |
P, O, A |
|
Fluciclovine-F18(Axumin) |
Blue earth |
PET 진단 |
전립선암 재발 진단 |
P |
|
Ga68dotatate (Netspot) |
Advanced Accelerator |
진단 |
신경내분비세포종양 진단 |
P, O |
|
Sofosbuvir velpatasvir (Epclusa) |
Gilead |
NS5B 저해제 NS5A 저해제 |
1∼6형 C형간염 |
P, B |
|
Lifitegrast (Xiidra) |
Shire |
LFA1 길항제 |
안구 건조증 |
P |
|
Kixisenatide (Adlyxin) |
Sanofi |
GLP1 효능제 |
당뇨 |
S |
|
Eteplirsen (Exondys51) |
Sarepta |
Antisense oligonucleotide |
듀시엔형 근이영양증 |
P, O, A |
|
Crisaborole (Eucrisa) |
Pfizer/ Anacore |
PDE4 저해제 |
아토피성 피부염 |
S |
|
Rucaparib (Rubraca) |
Clovis |
PARP 저해제 |
BRCA양성 난소암 |
P, O, B, A |
|
Nusinersen (Spinraza) |
Boehringer Ingelheim |
Antisense oligonucleotide |
척수근육위측 |
P, O |
자료: Nature Reviews/ Drug Discovery 2017, p74
* A: accelerated approval, B: breakthrough designation, O: Orphan designation, P: Priority review, S: standard review
[표 3-21] 2017년도 상반기 미국 FDA 승인 합성신약 리스트
|
일반명 (상품명) |
회사 |
적응증 |
|
Plecanatide (Trulance) |
Synergy |
만성변비 |
|
Elecaletide(Parsabiv) |
Amgen |
속발성 부갑상샘 항진증 |
|
Deflzacort (Emflaza) |
PTC |
듀시엔형 근이영양증 |
|
Telotristat etiprate (Xermelto) |
Lexicon |
카르시노이드 증후군 설사 |
|
Ribociclib(Kisqali) |
Novartis |
HR(+), Her2(-) 유방암 |
|
Safinamide (Xadago) |
US WorldMed |
파킨슨 |
|
Naldemedine(Symproic) |
Shionogi |
opioid 유도 변비 |
|
Niraparib (Zejula) |
Tesaro |
상피 난소암,복막암 |
|
Cerliponaseα(Brineura) |
BioMarin |
tripeptidyl peptidase 결핍 |
|
Midostaurin (Rydapt) |
Novartis |
flt3(+) 급성골수성 백혈병 |
|
Deutetrabenazine(Austedo) |
Teva |
헌팅턴 무도병 |
|
Valbenazine (Ingrezza) |
Neurocrine |
지연성 운동장애 |
|
Brigatinib (Alunbrig) |
Ariad |
ALK 양성 비소세포성폐암 |
|
Abaloparatide(Tymlos) |
Radius |
골다공증 |
|
Edarabone (Radicave) |
Mitsubishi |
근위축성측삭경화증(루게릭) |
|
delafloxacin (Baxdela) |
Melinta |
급성 박테리아성 피부감염 |
|
betrixabab (bevyxxa) |
Potola |
정맥 혈전색전증 예방 |
자료: Nature Reviews/ Drug Discovery 2017, p519
HR (hormone receptor); ALK (anaplastic lymphoma kinase)
(2) 질환별 연구개발 및 산업동향
(가) 항암제
1957년에 승인된 thalidomide는 기형유발의 부작용으로 시장에서 퇴출되었으나, 1990년대 후반기부터 신생혈관형성 억제 등의 기전을 통한 항암효과 등이 발표되면서 유도체에 대한 연구가 진행되었다. 셀진사는 thalidomide의 구조를 약간 변형한 lenalidomide를 2004년 승인허가 받았으며, 최근 면역조절에 대한 효과가 입증되면서 급성장하여 2016년 약 70억 달러의 세계 시장을 형성하였고, 2022년 140억 달러로 휴미라에 이어 전 세계 판매 2위 의약품으로 전망되고 있다. 역시 탈리도마이드 유도체인 pomalidomide도 2013년 다발성 골수종으로 허가를 받았으며 2016년 13억달러의 시장을 형성한 거대 의약품이다.
[표 3-22] 상위 판매 예측 항암제
|
일반명 (상품명) |
회사 |
기전 |
세계시장($m) |
개발단계 |
|
|
2016 |
2022 (예측) |
||||
|
lenalidomide (Revlomid) |
Celgene |
면역조절 |
6,974 |
14,197 |
판매 |
|
ibrutinib (Ibruvica) |
AbbVie/J&J |
BTK저해제 |
4,735 |
9,912 |
판매 |
|
palbociclib (Ibrance) |
Pfizer |
CDK 4/6 저해제 |
2,135 |
7,074 |
판매 |
|
enzalutamide (Xtandi) |
Astellas |
Androgen수용체 길항제 |
2,322 |
4,883 |
판매 |
|
osimertinib (Tagrisso) |
AstraZeneca |
T790M EGFR kinase 저해제 |
423 |
2,505 |
판매 |
|
ademaciclib |
Eli Lilly |
CDK 4/6 저해제 |
|
1,792 |
3상 |
|
epacadostat |
Incyte |
IDO1 저해제 |
|
1,728 |
3상 |
|
apalutamide |
J&J |
항안드로젠 |
|
1,629 |
3상 |
|
selinexor |
Karyopharm |
CRM1 저해제 |
|
920 |
3상 |
자료: EvaluatePharma* World Review 2017

[그림 3-55] 탈리도마이드 유도체 구조
AstraZeneca는 자사 EGFR kinase 저해제인 이레사의 내성 세포주(T790M) 치료제 osimertinib를 가속 승인절차에 따라 연구 시작 6년만인 2015년에 승인 허가를 받았고, 2016년 첫 발매년도에 4억 달러의 판매를 하였으며, 2022년도에는 25억 달러의 판매가 예측된다.
인사이트의 IDO1 저해제 epacadostat는 항체 면역항암제와의 병용투여에 의한 긍정적 임상결과를 기반으로 시장에서 가장 기대되는 면역 합성항암제 중의 하나이다.
(나) 면역질환 치료제(류머티즘, 건선)
바이오의약품이 대세인 면역질환 치료제 시장에서 Jak1/2 저해제인 ruxolitinib은 14억 달러 이상의 판매로 시장에 안착하였고, 후속으로 개발되는 JAK1 선택적 저해제도 시장에서의 성공이 전망된다. Celgene의 PDE4 저해제도 2016년 10억 달러 이상의 시장을 형성하였으며 지속 성장이 예측된다.
오래 전부터 알려진 물질인 dimethyl fumarate는 경구용 다발성 경화증 치료제로 2013년 미국 FDA 승인을 받았으며, 2016년 40억 달러의 거대 품목으로 성장하였다.
[표 3-23] 상위 판매 예측 면역질환 치료제
|
일반명(상품명) |
회사 |
기전 |
세계시장($m) |
개발 단계 |
|
|
2016 |
2022 (예측) |
||||
|
dimethyl fumarate (Tecfidera) |
Biogen |
다발성 경화증 |
3,968 |
4,078 |
판매 |
|
apremilast (Otezla) |
Celgene |
PDE4 저해제 |
1,017 |
3,673 |
판매 |
|
ruxolitinib (Jkafi) |
Incyte/Novartis |
JAK1/2 저해제 |
1,434 |
3,228 |
판매 |
|
upadacitinib |
AbbVie |
JAK1 저해제 |
|
1,214 |
3상 |
|
filgotinib |
Gilead/Galapagos |
JAK1 저해제 |
|
227 |
3상 |
자료: EvaluatePharma* World Review 2017
(다) 바이러스 감염증 치료제
[표 3-24] 상위 바이러스 감염증 치료제 회사
|
회사 |
2016 판매 ($m) |
2022 판매 ($m, 예측) |
|
Gilead |
27,727 |
19,789 |
|
GlaxoSmithKline |
5,260 |
9,347 |
|
Merck & Co |
2,097 |
2,844 |
|
Johnson & Johnson |
2,680 |
2,566 |
|
Abbvie |
3,004 |
2,396 |
|
바이러스 세계 시장 |
48,540 |
42,831 |
자료: EvaluatePharma, World Review 2017
C형간염 치료제 시장을 석권한 길리아드는 2022년에는 판매 감소가 예측되지만, 에이즈 치료제 시장을 GSK와 양분하면서 바이러스 감염증 치료제 시장의 절대 강자위치를 유지할 것으로 전망된다. 내성발현을 지연시키고, 환자의 유전형 및 보유 질환에 따른 치료법의 제공을 위해 복합제가 시장을 주도하고 있다.
(라) 심혈관계/대사 질환 치료제
특허만기로 전통적인 블록버스터의 시장이 축소되었고, 혈전 예방효과가 있는 신규 항응혈제가 성장세에 있다.
[표 3-25] 상위 판매 예측 심혈관계/대사 질환 치료제
|
일반명 (상품명) |
회사 |
기전 |
세계시장($m) |
개발 단계 |
|
|
2016 |
2022(예측) |
||||
|
Januvia/Janumet |
Merck |
DPP4 저해제 |
6,440 |
5,989 |
|
|
apixaban(Eliquis) |
BMS |
factor Xa 저해제 |
3,443 |
8,486 |
판매 |
|
ribaroxaban (Xarelto) |
Bayer/ J&J |
factor Xa 저해제 |
4,986 |
8,131 |
판매 |
|
(Entreso) |
Novartis |
AT1 길항제/ neprilysin 저해제 |
170 |
3,963 |
판매 |
자료: EvaluatePharma World Review 2017
다. 국내 현황
(1) 신약 승인 현황
2016년, 2017년 각각 1개씩의 국내 신약이 승인되면서 파이프라인이 지속적으로 확대되고 있다. 2016년 LG화학의 제미글로는 500억 원 이상의 매출을 기록했으며, 보령제약의 카나브도 2017년에는 500억 원 이상의 매출이 기대되어 국내 신약의 시장 점유율이 신장하고 있다. 각각 단일 품목뿐 아니라 복합제의 개발로 제품 가치의 상승 및 성장이 기대된다.
[표 3-26] 국내신약 리스트
|
제품명 |
회사명 |
주성분 |
효능ㆍ효과 |
허가년도 |
|
베시보정 |
일동제약(주) |
베시포비르 |
만성B형간염 |
2017 |
|
올리타정 |
한미약품(주) |
올무티닙염산염1수화물 |
항암제 |
2016 |
자료: 신약개발조합
(2) 연구개발 현황
신생벤처기업(Start-up)의 활성화로 산・학・연 협동연구가 활성화되고 있으며, 정부과제 및 기업 자체의 게이트 심사가 엄격해지면서 국내 합성신약 연구가 양질의 발전을 지속하고 있으며 세계적인 추세이지만 항암제, 특히 면역항암제 연구에 대한 집중도가 매우 높다. 동아에스티의 MerTK 저해제가 아비브 바이오텍에 기술이전된 것을 포함하여 글로벌 기술계약 및 협업이 꾸준히 증대되고 있다.
라. 발전전망
국내에서도 해외와 거의 동일한 시기에 연구를 진행하였지만 초기 적응증에 대한 연구에서 뚜렷한 효과를 보이지 못했던 PDE4 저해제가 천식에서 류머티즘으로(셀젠사), PRAP 저해제가 허혈성 질환 치료제에서 항암제로(클로비스사) 적응증을 변경하여 성공한 사례는 디스커버리와 임상의 연계 중요성을 나타낸다. 국내에서도 기초단계 연구가 임상환자, 적응증 및 지표 등을 고려하여 추진되고 있으며 신약개발 연구생산성 증대로 나타나길 기대하고 있다.
복합형 질환의 증가와, 내성발현의 억제를 위해 복합제를 통해 의료 미충족 수요를 극복하려는 연구가 활성화되었고 임상 및 신약 허가건수도 증가추세이다. 특정 유전형의 환자에 대한 임상연구 및 승인이 확대되고 병용투여 연구에 대한 필요성이 증대되면서 맞춤의료, 병용투여를 위한 빅데이터 활용에 대한 연구자의 수요가 급증하고 있다.
항체, 세포 및 바이러스를 활용한 치료법 등 생물학적 치료법이 다양하게 확대되면서 유효성 및 안전성 확보를 위한 합성 의약품과의 협동연구가 활성화되고 있다.
2. 바이오의약품
가. 개요
바이오의약품은 백신, 혈액 제제 및 혈액 성분, 세포 기반 의약품, 유전자치료제, 조직 기반 의약품, 그리고 각종 재조합 단백질 의약품을 포함한다. 바이오의약품은 단백질, 당, 핵산 혹은 이들의 조합이 가능하며, 혹은 세포나 조직과 같은 생체 유래 물질도 가능하다. 이러한 바이오 의약품의 생산 수단으로서 인간 혹은 동물 유래의 세포 혹은 미생물 등의 천연자원으로부터 생산되고 질병의 치료뿐만 아니라 예방 및 진단에도 이용될 수 있다. 제약회사 및 바이오텍 회사가 고전적인 방법으로 수행해 온 합성 의약품의 개발과 비교한다면, 바이오 의약품은 종래의 신약개발 방식의 난점과 약점을 뛰어넘을 다양한 장점을 보유하고 있다. 예를 들면, 항체 의약품의 경우 합성 의약품에서 찾아보기 힘든 타겟 선택성과 결합능력을 보이며, 이로 인해 상대적으로 높은 수준의 치료지수 (therapeutic index)를 보일 가능성이 높다. 최근 10년 간 이러한 바이오 의약품의 개발 진척도 면에서 큰 개발 진전을 보이고 있으며, 국내외 수많은 회사들이 이러한 새로운 분야에 대한 도전과 투자를 아끼지 않고 있다.
나. 해외 동향
최근 바이오의약품 개발의 트렌드와 향후 방향을 이끌어가는 가장 큰 성과에 해당되는 제품은 면역항암제로서의 항체치료제와 2017년도에 미FDA의 승인을 득한 CAR-T 세포치료제, 그리고 역사적인 임상성공사례를 기록한 RNAi 치료제 등이 있다.
(1) PD-1/PD-L1 항체치료제와 그 외의 면역관문억제제의 개발 동향
최근 항암제 개발의 트렌드는 크게 변화하고 있으며, 이의 중심에 있는 것이 암 면역체계를 조절하는 기전을 이용한 면역항암제에 해당된다. 2017년 10월 현재 PD-1/PD-L1 타겟의 항체로 시장에 출시된 제품은 Bristol-Myers Squibb(BMS)사의 Opdivo(nivolumab), Merck사의 Keytruda(pembrolizumab), Roche사의 Tecentriq (atezolizumab), Pfizer사의 Bavencio(avelumab), 그리고 가장 최근인 2017년 5월에 미국 FDA의 승인을 득한 AstraZeneca사의 Infimzi(durvalumab) 등이 있다.
현재 승인된 면역관문저해제가 모두 CTLA-4와 PD-1/PD-L1을 타겟으로 하는 항체의약품이지만, 향후 출시를 위해 연구개발 중인 면역관문저해제를 통하여 다양한 항암면역 기전으로의 확장을 시도하고 있으며, 단독요법으로서의 효능뿐만 아니라 다양한 병용요법에서도 효능을 보일 수 있도록 고안되고 있다. 현재 임상 혹은 전임상 개발이 진행 중인 신규 면역항암제는 암환자의 면역저해를 억제하는 방향뿐만 아니라 좀 더 공격적인 방법으로 기존 면역항암제와 병용 시 강력한 효능을 제시하는 방향으로 진행 중이며, 차세대 면역항암제로 활발한 연구가 진행되는 타겟으로는 granulocyte-macrophage CSF(GM-CSF) 혹은 그 수용체(GM-CSFR), lymphocyte-activation gene 3(LAG3), T-cell immunoglobulin and mucin domain 3 (TIM3), toll-like receptor(TLR) family, indoleamine 2,3-dioxygenase (IDO), cluster of differentiation 47(CD47), CD40, OX40(CD134), 4-1BB (CD137) 등이 있다.
현재 항암제 연구개발의 판도는 PD-1/PD-L1 타겟 항체를 한 축으로 한 다양한 면역항암제의 병용 투여, 혹은 기존 표적항암제 및 화학요법과의 병용투여를 통해 기존의 면역관문저해제 단독 투여보다 높은 효능, 확장된 암종 및 환자군, 개선된 안전성을 추구하는 방향으로 진행되고 있다. clinicaltrial.gov에 등재된 임상시험 기준으로 총 700여건 이상의 임상이 면역항암제 및 면역항암제와의 병용투여에 관한 임상이 진행될 정도로 폭발적인 연구개발이 이루어지고 있다.

출처 : QuitilesIMS institute 2017 report
[그림 3-56] 현재 진행 중인 신규 기전의 면역항암제 병용 연구

출처 : Evaluate Pharma report 2017, May
[그림 3-57] 2015년도 대비 2017년도에 진행 중인 PD-1/PD-L1항체와의 병용요법 임상시험의 수
(2) CAR-T (chimeric antigen receptor-T) 세포치료제의 승인 및 개발 동향
2017년 8월 Novartis사는 소아 급성림프구성 백혈병(pediatric acute lymphoblastic leukemia) 대상으로 최초의 CAR-T 제품인 Kymriah(tisagenlecleucel)의 미국 FDA 의 승인을 득하였다. CAR-T 기반 세포치료제는 면역항암제의 일종으로서, 환자 유래 혈액으로부터 분리한 T세포에 암세포를 공격할 수 있는 유전자를 탑재한 바이러스를 장착시켜 임상 2상 결과에서 Kymriah 투여 후 3개월 이내에 총 63명의 환자 중 52명이 완전관해를 보였다.
Kymriah의 뒤를 이은 CAR-T 제품으로서 최근 Gilead사에 인수된 Kite Pharma의 비호지킨림프종(on-Hodgkin lymphoma) 적응증으로 미국 FDA의 승인 절차를 진행 중에 있으며, 2017년 2월 데이터에 의하면 101명 대상의 임상시험 결과, 투여 6개월 후에도 36%의 환자가 완전관해를 보였고, 향후 출시 후 매출 고려 블록버스터급 항암신약으로 자리 잡을 것으로 전망하고 있다.
현재 개발 진행 중인 CAR-T 세포치료제 및 관련 세포치료제들은 항암 면역의 기전을 활용하여 기존의 항암 치료요법에서는 볼 수 없었던 높은 효능과 낮은 재발률을 보이고 있으나, 싸이토카인 방출 증후군(cytokine release syndrome, CRS) 등의 강한 면역 반응에 의한 부작용의 문제, 암 공격 타겟으로부터 유래된 타겟 특이적 독성(on-target toxicity), 철저한 개인맞춤의약품으로서의 공정 및 시료 이동의 난점, 과도한 약가 등의 문제점이 여전히 해결해야 할 숙제로 남아 있다.
(3) RNAi (RNA interference) 기반 치료제의 임상 성공 및 개발 동향
2017년 9월 Alnylam사가 Sanofi사와 협력하여 임상개발 진행 중인 RNAi 제제인 patisiran의 임상 3상 시험이 성공적으로 끝났다고 밝혔다. 전 세계적으로 약 5만 명이 앓고 있는 희귀질환의 일종인 hereditary ATTR amyloidosis with polyneuropathy 환자 대상으로 한 이 임상시험에서 Alnylam사가 개발한 RNAi 기반 치료제는 투여 시작 후 18개월 후까지 신경 손상 등을 평가하여 전체적으로 질병 개선 효능이 뛰어나고 안전성도 우수한 것으로 보고하였다. 이 결과를 토대로 Alnylam사는 2017년 말 미국 FDA의 승인 신청을 할 예정이다. 2010년도를 전후로 하여 개발의 난점, 타겟 조직으로의 약물 전달의 허점, 예상치 못한 부작용 등을 이유로 많은 글로벌 제약사가 RNAi 제제에 대한 투자를 회수하고, 여러 RNAi 기반 신약들이 임상시험에서 고전을 면치 못하는 등, 지난 10년 간 어려움을 겪었던 이후라 더욱 더 값진 역사적 쾌거로 간주된다.
다. 국내 현황
국내의 제약 R&D 부문에서 전반적으로 신약개발에 대한 관심도와 투자가 증대하면서, 자연스럽게 바이오의약품의 연구개발에 대한 기대도 커지고 있다. 일례로 2016년 3월 유한양행은 미국의 항체신약 회사인 Sorrento사와 협력하여 이뮨온시아 라는 이름의 합작투자회사를 설립하여 다수의 면역관해저해제 항체신약의 개발 및 상업화를 합의했다. 이는 소렌토의 면역항암제 초기 기술과 유한양행의 비임상, 임상연구의 협업을 기획하여 조기에 동아시아 시장으로 항체신약을 공급하는 것을 목표로 삼은 것이다. 또 다른 예로서, 녹십자의 희귀질환 치료제인 헌터라제는 단백질 의약품으로서 미국 FDA의 희귀의약품으로 지정되었고, 2016년도 매출 기준 해외 매출 55억 원 포함 총 228억 원의 매출을 기록하였다. 헌터라제는 제2형 뮤코다당증인 헌터증후군을 적응증으로 하여 녹십자가 자체 연구개발한 바이오신약이고 국내 환자 수가 불과 70∼80명에 불과하지만, 세계적으로는 샤이어사의 엘라프라제에 이어 두 번째의 신약에 해당된다. 그 외에도 신라젠, 다이노나, 파맵신, 앱클론, 와이바이오로직스, 에이비엘바이오 등의 국내 소재의 바이오벤처가 바이오신약의 연구개발에 매진하고 있다.
라. 발전 전망
고전적인 의약품 시장의 전체 매출을 고려해 보았을 때, 여전히 합성신약의 매출이 우세한 반면, 지난 3년 간 미국 FDA의 바이오의약품 승인 절차인 Biologics License Approvals(BLAs)의 승인 현황을 살펴보면, 2014년도, 2015년도, 2016년도에 각각 11, 12, 8종의 바이오의약품이 승인을 득했으며, 이는 지난 20년 간 6종 이하를 득한 바와 크게 대조적인 현상이다. 이는, 최근에 바이오의약품의 연구개발이 크게 성과로 이어졌음을 반증하는 것이고, 특히 합성신약의 영역으로 도달하지 못할 치료영역이 가능한 부분을 고려한다면 향후 10년 간 큰 시장 확장이 예상된다. 이러한 바이오의약품의 큰 성공은 특히 기존 시장의 주력 약품 대비 바이오의약품이 가지는 특성으로 인해 주요 만성질환, 특정 암종 및 자가면역질환에서의 높은 효능과 낮은 부작용에 기인한 것이다. 향후 고령화로 인한 시장 증대를 고려해 본다면, 이러한 바이오의약품의 선전은 글로벌 시장의 대대적인 확장으로 이어질 전망이다. Transparency market research analysis 2016 report에 따르면 2016년도에서 2024년도 기간 동안 바이오의약품 시장의 CAGR은 10.9%에 이를 것으로 전망하며, 2024년도에는 전 세계 바이오의약품 시장의 전체 가치가 약 4천 8백억 달러에 이를 것으로 예측한다.
2022년도 매출 순위 20위권 이내일 것으로 전망되는 의약품의 목록을 살펴보면 20종 중 총 11종이 바이오의약품에 해당된다. 개발 및 공정상의 고비용의 문제 및 CMC(chemistry, manufacturing, control)상의 난점에도 불구하고 바이오의약품은 개발에 성공한 후에는 높은 효능과 안전성으로 인해 시장 잠식력이 뛰어남을 보여주며, 이 추세는 향후 10년 간 지속될 전망이다.
[표 3-27] 2022년도 Top 20 매출 의약품 전망
|
Rank |
Product |
Generic Name |
Company |
Pharmacological Class |
WW Product Sales($m) |
Market Status |
||
|
2015 |
2022 |
CAGR |
||||||
|
1. |
Opdivo |
nivolumab |
Bristol-Myers Squibb + Ono Pharmaceutical |
Anti-Programmed death-1 (PD-1) MAb |
1,119 |
14,634 |
+44% |
Marketed |
|
2. |
Humira |
adalimumab |
AbbVie + Elsai |
Anti-tumor necrosis factor alpha(TNFa) MAb |
14,359 |
13,645 |
-1% |
Marketed |
|
3. |
Revlimid |
lenalidomide |
Celgene |
Immunodulator |
5,801 |
13,024 |
+12% |
Marketed |
|
4. |
Xarelto |
rivaroxaban |
Bayer + Johnson & Johnson |
Factor Xa inhibitor |
3,930 |
7,827 |
+10% |
Marketed |
|
5. |
Eylea |
aflibercept |
Regeneron Pharmaceuticals + Bayer + Santen Pharmaceutical |
Vascular endothelial growth factor receptor (VEGFr) kinase inhibitor |
4,372 |
7,702 |
+8% |
Marketed |
|
6. |
Imbruvica |
ibrutinib |
AbbVie + Johnson & Johnson |
Bruton’s tyrosine kinase (BTK) inhibitor |
1,299 |
7,287 |
+28% |
Marketed |
|
7. |
Enbrel |
etanercept |
Amgen + Pfizer + Takeda |
Tumour necrosis factor alpha (TNFa) inhibitor |
9,037 |
7,177 |
-3% |
Marketed |
|
8. |
Prevenar 13 |
pneumococcal vaccine |
Pfizer + Daewoong Pharmaceutical |
Pneumococcal vaccine |
6,328 |
6,069 |
-1% |
Marketed |
|
9. |
Keytruda |
pembrolizumab |
Merck & Co |
Anti-programmed death-1 (PD-1) MAb |
566 |
5,959 |
+40% |
Marketed |
|
10. |
Januvia/ Janumet |
sitagliptin phosphate |
Merck & Co + Ono Pharmaceutical +Almirall+Daewoong Pharmaceutical |
Dipeptidyl peptidase IV (DPP-IV) inhibitor |
6,333 |
5,913 |
-1% |
Marketed |
|
11. |
Ibrance |
palbociclib |
Pfizer |
Cyclin-dependent kinase (CDK) 4 & 6 inhibitor |
723 |
5,709 |
+34% |
Marketed |
|
12. |
Soliris |
eculizumab |
Alexion Pharmaceuticals |
Anti-complement factor C5 MAb |
2,590 |
5,657 |
+12% |
Marketed |
|
13. |
Eliquis |
apixaban |
Bristol-Myers Squibb |
Factor Xa inhibitor |
1,860 |
5,422 |
+17% |
Marketed |
|
14. |
Tecentriq |
atezolizumab |
Roche |
Anti-programmed death-1 ligand-1 (PD-L1) MAb |
- |
5,331 |
|
Marketed |
|
15. |
Avastin |
bevacizumab |
Roche |
Anti-vascular endothelial growth factor receptor (VEGFr) MAb |
6,945 |
5,178 |
-4% |
Marketed |
|
16. |
Prolia/Xgeva |
denosumab |
Amgen+Dalichi Sankyo |
Anti-RANKL MAb |
2,925 |
5,148 |
+8% |
Marketed |
|
17. |
Victoza /Saxenda |
liraglutide [rDNA origin] |
Novo Nordisk |
Glucagon-like peptide 1 (GLP-1) agonist |
2,701 |
4,918 |
+9% |
Marketed |
|
18. |
Darzalex |
daratumumab |
Johnson & Johnson |
Anti-CD38 MAb |
9 |
4,909 |
+146% |
Marketed |
|
19. |
Botox |
onabotulinumtoxinA |
Allergen + GlaxoSmithKline |
Botulinum toxin |
2,808 |
4,823 |
+8% |
Marketed |
|
20. |
Perjeta |
pertuzumab |
Roche |
Anti-HER2 (ErbB-2) MAb |
1,502 |
4,775 |
+18% |
Marketed |
출처 : Evaluate Pharma 2016 Aug report
시장의 성장세와 맞물려 제약 업계가 이러한 혁신적인 바이오 의약품에 거는 기대치는 전무후무할 정도로 매우 크며, 실제로 글로벌 제약사 및 바이오텍사의 R&D 활동의 상당 부분을 바이오 의약품의 개발에 투자하고 있는 실정이다. 바이오 의약품은 대부분 최신의 혁신적 과학 검증 결과를 토대로 중개 연구를 통하여 고안된 새로운 방법의 치료제에 해당되므로, 오랜 연구에 대한 결실로서 최근 인체와 질병에 대한 과학적 이해도가 급증함에 따라, 향후 큰 성과로 결실을 맺을 것으로 예상되며, 바이오 의약품의 시장 성장세에 따른 기대치 증가 및 개발에 대한 투자 규모의 상승세를 고려해 본다면 미래에는 다양한 종류의 획기적이고도 혁신적인 바이오의약품이 지속적으로 등장하여 의약품 시장의 변화를 주도할 것으로 전망한다.
3. 바이오장기
가. 개요
(1) 바이오장기의 정의
바이오장기란 기능을 잃은 인간의 조직과 장기를 복원, 재생, 대체하기 위해 생명 공학적 기법을 이용하여 인간생체의 장기와 같은 기능을 갖는 기기를 인공적으로 만든 것을 말한다. 줄기세포, 조직공학, 바이오인공장기, 바이오이종장기연구 분야 등을 포함하며, 이를 위해서는 세포활용기술, 이종장기생산기술, 면역조절기술, 장기이식기술, 생체조직공학기술 등의 생명공학 핵심기술이 요구된다.
(2) 바이오장기의 필요성
고령화에 따라 장기부전환자의 수가 기하급수적으로 증가하고 있으며, 이들 환자에게는 장기이식수술이 유일한 치료법이지만 타인으로부터 공급되는 장기의 절대수가 부족한 상황이다.
(가) 장기이식 수요 및 공급 현황
국내외적으로 장기이식 대기자 수는 매년 증가하고 있는데 반해 장기공급은 제한적이다. 국내에서 장기이식을 대기하고 있는 환자는 2000년 이후 계속적으로 증가하여 2016년에는 약 30,268명5)에 이르고 있다. 장기기증을 희망하는 사람의 수는 저조한 반면, 대기 중인 환자 수가 늘어남에 따라 이식 대기 중에 사망하는 환자 또한 증가하고 있는 실정이다. 이 같은 현상은 미국을 비롯하여 전 세계적으로 나타나고 있다. 특히 국내에서는 성인병의 증가, 고령화, 유교문화, 핵가족화의 영향으로 외국보다 이식 장기의 수요와 공급의 불균형 현상이 심각하다. 이러한 결과로 불법 장기 매매가 성행하고 있으며, 최근에는 국내보다 의료기술 수준이 낮은 외국에서 장기이식을 받는 사례가 증가하여 심각한 사회문제를 일으키고 있다.

출처: 국립장기이식관리센터(KONOS), 2016
[그림 3-58] 연도별 국내 장기이식대기자 추이
(나) 대체장기로써 바이오 이종장기
부족한 수의 대체장기를 확보하는 방법으로 줄기세포 분화, 생체조직공학을 이용한 조직재생, 바이오 이종장기 등이 있다. 하지만 줄기세포는 아직 복잡한 세포분화과정을 조작하는 것에 대한 이론적 토대가 마련되어 있지 않으며, 대량생산이 어렵기 때문에 상용화까지 많은 시간이 걸릴 것으로 예상된다. 또한 생체조직 공학적 방법을 이용해 사람의 연골, 뼈, 피부를 생산하는 방법이 있으나, 복잡한 기능을 수행하는 장기를 제작하는 데에 많은 어려움이 있다. 이에 반해 바이오 이종장기는 사람이 아닌 다른 종의 동물로부터 이식을 목적으로 생산된 장기를 사람에게 이식함으로써 부전된 기능을 빠르게 회복시킬 수 있기 때문에 대체장기로 가장 적합하다.

출처: http://www.organdonor.gov/about/data.html
[그림 3-59] 연도별 미국 내 이식대기자(Waiting List), 이식환자(Transplants), 장기공여자(Donors) 수
(다) 바이오장기 공급원
사람에게 제공될 장기를 제작하기 위해서는 사람과 생리적인 면에서 유사점이 많아야 하고, 또한 대량 공급을 위해 번식이 잘 되어야 한다. 그러나 사람과 가장 유사한 영장류는 번식에 오랜 시간이 걸리고, 사람에게 치명적인 바이러스를 보유할 위험이 있으며, 전 세계적으로 희귀동물로 지정되었기 때문에 이종장기 제공 대상에서 제외되었다.
[표 3-28] 부족한 장기를 대체할 수 있는 방법
|
장기 대체방법 |
심장 |
신장 |
간장 |
폐 |
|
동종이식 |
현재 적용 중 |
현재 적용 중 |
현재 적용 중 |
현재 적용 중 |
|
인공장기 (기계적장기) |
현재 적용 중 |
개발 중 |
현재 적용 중 |
개발 중 |
|
세포치료 |
개발 중 |
- |
개발 중 |
- |
|
조직공학 |
개발 중 |
개발 중 |
개발 중 |
- |
|
인공장기 (바이오장기) |
- |
개발 중 |
- |
- |
|
이종장기 |
개발 중 |
개발 중 |
개발 중 |
개발 중 |
출처: J Korean Soc Transplant 2009;23: 203-213
[표 3-29] 장기부족에 대처하기 위한 해결책
|
해결책 |
적용 가능한 장기 |
현재 상태 |
|
돼지 이종장기 이식 |
대부분의 장기 (간은 더 많은 연구가 필요) |
전임상시험 중 (돼지 췌도는 일부 임상적용) |
|
기계적 장치 |
대부분 심장환자 |
동종이식시까지 임시 방편으로 사용 |
|
바이오 인공 신장 |
급성신부전증 환자의 세뇨관 보조기구 |
체외 투석 |
|
줄기세포에서 분화된 조직 |
모든 장기 |
세포치료는 실험단계(일부 임상시험) 고형장기는 초기단계 |
출처: J Korean Soc Transplant 2009;23: 203-213
미니돼지의 경우 인간과 비슷한 크기의 장기를 갖고 있으며, 생리적으로 유사점이 많기 때문에 현재 가장 많이 사용되고 있다. 또한 어미 1두가 연간 20마리 이상의 새끼돼지를 생산할 수 있어, 이식용 장기의 대량공급이 가능하여 이식 대기시간이 단축된다. 또한 간염이나 AIDS 바이러스와 같은 치명적인 감염원의 회피가 가능하다는 장점이 있다.
하지만 미니돼지를 이용할 때 대두되는 문제점으로 돼지 세포 표면에 존재하는 당 (sugar)에 의한 초급성 면역거부반응이 있으나 유전공학기법을 통한 형질전환돼지 생산이 가능하게 됨으로써 이를 극복할 수 있게 되었다.
(3) 바이오 이종장기 산업 발전을 위해 극복되어야 할 난관
(가) 장기이식 거부반응 및 복제 기술의 불안정성
이종장기 이식 후에 일어날 수 있는 주된 문제점으로는 조직의 이식거부반응이 있으며 이것은 동종이식보다 훨씬 빠르고 강하게 일어남이 임상시험을 통하여 밝혀졌다. 이식거부반응이란, 이식된 장기가 수혜자의 체내에서 초급성 거부반응, 급성혈관성 거부반응, 세포매개성 거부반응, 만성 거부반응을 일으켜 장기로서의 제 기능을 하지 못하고 괴사해버리는 것을 말한다. 활발한 연구를 통하여 이러한 이식거부반응의 기전은 비교적 많이 밝혀졌으며 이를 토대로 이식거부반응을 제어하기 위한 유전자 적중기술 및 형질전환돼지의 생산이 연구되어 왔다.
돼지 세포 표면에 존재하는 당(sugar) 성분인 알파-갈(1,3-α-Galactose)에 의해 혈청보체계와 혈액응고계가 활성화되어 이식 후 수 분 이내에 초급성 거부반응이 나타난다. 이것을 극복하는 방법이 활발히 연구 중인데, 2002년 미국에서 알파-갈 전이효소가 제거된 형질전환돼지가 개발되었으며(Science 2002;295:1089), 국내에서도 2009년 4월 알파-갈 합성효소 유전자 중 하나가 제거된 미니돼지 지노, 지노 2의 개발에 성공하였다. 현재도 형질전환돼지에 관한 연구가 활발히 이루어지고 있으며 향후 이종이식 연구에 초석이 될 것으로 예상된다.

출처: 2015 생명공학백서, 미래창조과학부, 2015
[그림 3-60] 체세포복제에 의한 형질전환돼지 제조방법
급성혈관성 거부반응은 자연항체, 자연살해세포, 단핵구에 의해 혈관내피세포가 활성화됨에 따라 나타나는 반응이다. 이는 혈청보체 조절인자가 형질전환 된 돼지를 제작함으로써 혈관내피세포의 안정화, 내피세포유래 면역 매개물질 조절 및 혈소판 기능조절이 가능할 것이라 예상되고 있다.
세포매개성 거부반응은 이종항원에 의해 면역세포가 활성화되어 나타나는 반응으로 동종이식에 사용되고 있는 면역억제방법과 면역관용유도 기술을 통하여 극복하려는 노력이 시도되고 있다. 특히 조절 T세포(Treg cell)을 체외에서 대량 배양한 후, 환자에게 다시 투여하는 치료법은 임상 시험에서 안전성과 일부 효과가 인정되고 있다.
이와 같이 초급성 거부반응, 급성혈관성 거부반응 및 세포매개성 거부반응을 제어하기 위해 관련 유전자들의 적중이 시도되고 있다. 또한 복제된 동물들이 유산, 사산, 태어난 지 며칠 되지 않아 죽는 등 의 문제를 극복하기 위해 형질전환 복제동물의 생산성 안정화 및 생산효율 증진을 위한 기술도 개발 중에 있다.
위와 같이 이종장기 이식에 적합한 형질전환 복제돼지를 생산하는 기술은 관련 유전자의 발굴과 체세포 유전자 적중기술 등을 통하여 어느 정도 기반이 확립된 상태이다. 앞으로는 현존하는 몇 가지 문제점을 개선하는 것과 산업화를 위한 연구가 필요할 것으로 전망된다.
(나) 안전성 문제
인수공통감염병원체는 돼지의 무균화를 통해 차단할 수 있다. 그러나 돼지의 내인성 레트로바이러스 (PERV)의 경우 바이러스 유전자가 돼지세포의 염색체내에 삽입되어 다음 세대로 유전되므로 무균화 작업을 통해서 제거되지 않는다. 이는 이종이식의 임상 적용에 있어서 해결해야 할 문제 중 하나로 대두되고 있다. 그러나 현재까지 다수의 영장류 이식실험과 이종이식을 받은 환자에서 돼지 내인성 레트로바이러스 감염이 확인되진 않았다. 또한 형질전환 돼지 생산 전문회사인 미국의 eGenesis사는 돼지 내인성 레트로바이러스가 제거된 돼지를 성공적으로 개발하였다.
(다) 사회적, 생명윤리적 문제
아직까지는 이종이식이 초기 단계인 만큼 이종이식을 받은 수여자들에 대한 추적관리가 요구될 것으로 전망된다. 이는 수여자들의 혈액이나 조직 기증에 제한되지 않고 성생활이나 출산에도 영향을 미칠 수 있다. 따라서 피험자의 인권 보호를 위하여 사회적, 생명윤리적 공감대를 논의하는 장이 필요할 것으로 생각된다.
일본은 2013년 5월 ‘재생의료를 국민이 신속하고 안전하게 받을 수 있도록 하기 위한 종합시책 추진에 관한 법률’을 제정했고, 2013년 11월에 ‘재생의료 등의 안전성확보 등에 관한 법률’을 제정해 2014년 11월부터 시행 중이다. 국내의 경우 첨단재생의료관리 및 지원에 관한 법률안이 2016년 6월과 11월 발의되어, 각각 10월과 12월에 국회 전체회의에 상정되었으나 표결이 이루어지지 않아 폐기되었고, 2017년 다시 국회에 발의된 상태이다.
나. 국내 기술 동향
국내에서는 보건복지부와 농촌진흥청에서 주관하는 ‘바이오이종장기개발사업단’과 ‘동물바이오신약장기개발사업단’에서 이종장기 이식용 복제 돼지를 생산하기 위한 노력을 하고 있다. ‘바이오이종장기개발사업단’은 2004년 출범하여 2012년도까지 1단계에서 WHO(세계보건기구)의 장기이식원 권고기준을 만족시키는 미니돼지를 생산하였다. 2013년도부터 시작되는 2단계에는 이종장기용 돼지 생산과 면역거부반응 조절을 위한 이종장기의 전임상 및 임상적용에 대한 연구를 진행하고 있다.

출처: 바이오이종장기개발사업단 www.xenokorea.org
[그림 3-61] 바이오이종장기개발사업단 사업개요
또한 ‘동물바이오신약장기개발사업단’은 차세대바이오그린21사업의 일환으로 이종장기 이식용 형질전환 돼지의 제작 및 생산에 노력을 하고 있으며 최종적으로 바이오장기의 실용화를 사업의 목적으로 하고 있다.
(1) 형질전환 돼지의 개발
2001년 초급성 거부반응을 극복할 수 있는 알파-갈 전이효소 결핍 돼지가 개발된 이래 Revivicor 등의 이종이식 관련회사들이 많이 생겨났으나, 그 이후 10여 년 동안 기대했던 것만큼 영장류 전임상 결과가 개선되지 않았다. 현재까지 개발된 형질전환돼지는 보체활성 조절(CD39,CD55, CD59), 응고조절(thrombomodulin, EPCR), 염증반응조절(A20, TNFR Fc) 등 비특이적인 염증 반응을 제어하는 것이 주된 목적이었다. 최근 CISPR/Cas9에 의한 다중 유전자 조작 돼지 개발 기술이 급속히 발전하면서 형질전환 돼지의 생산 기간이 기존 2∼3년에서 5개월로 획기적으로 단축되었고, 2015년 11월 네이처(Nature)지에서는 이종 이식 제2의 전성기가 도래하고 있다고 보고하였다(Nature 2015;527;152). 이러한 전성기를 맞아 United Therapeutics, eGenesis 등 이종이식 전문 회사들이 다시 생겨나고 있다.
국내에서는 2015년도에는 2단계 바이오이종장기개발사업단과 ㈜엠젠플러스가 연구협력 MOU를 체결하였으며 이종장기 이식용 형질전환돼지에 관한 공동연구에 나섰다. 이외에도 ㈜옵티팜, ㈜메디키네틱스 등의 회사가 형질전환돼지 생산 연구를 진행하고 있다.
최근 포배 보상법(blastocyst complementation) 기술을 이용하여 두 종간 chimera 생산이 가능해졌으며(Nature 2016; 540; 51), 이는 이종면역반응을 근본적으로 동종면역반응과 비슷한 정도로 감소시키는 기술이기 때문에 키메라 돼지 생산은 향후 이종이식의 지향점이 되고 있다. 하지만, 이런 키메라를 생산하기 위해서는 특정 장기가 결핍된 돼지의 생산이 필요하기 때문에 돼지 줄기세포를 이용한 targeting vector 개발, CRISPR/Cas9 시스템 개발, blastocyst injection 등의 기반 기술 개발이 선행되어야 한다.
(2) 이종 이식 전임상 시험
국제적으로 심장의 경우 3년 이상, 신장 1년 이상, 간 25일 이상, 췌도 2년 이상, 각막 2년 이상 등 우수한 성적들이 발표되면서 제2의 이종이식 전성기가 도래하고 있다. 특히 미국 국립보건원은 형질전환돼지의 심장을 개코원숭이에 이식하여 3년간 생존하였다고 보고하였다(Nature Communications 2016; 7; 11138). 일본 오츠카 제약은 2014년에 인수한 LCT사(Living Cell Technologies)를 통하여 이종 췌도 이식 연구를 지속하여 왔으며, 2016년 3월 일본 재생의료학회에서 당뇨병환자에게 돼지의 췌도 세포를 이식한 임상 연구결과를 발표하였다. 오츠카 제약은 현재 돼지캡슐췌도를 이용한 임상 1/2a 시험을 진행하고 있다.
국내 2단계 바이오이종장기개발사업단 또한 이종장기이식에서 세계적 선도그룹으로 인정받고 있으며 원숭이 전임상시험에서 세계이종이식학회의 이종 췌도이식 임상시험 진입 조건을 충족한 결과를 발표하고 있다. 아울러 영장류 전임상실험에서 부분층 및 전층각막을 이식하여 2년 이상 각막 투명도를 유지한 결과를 발표하였고, 2018년도에는 이종 각막 및 췌도 연구자 임상 시험을 계획하고 있다.
다. 발전과제와 전망
(1) 발전과제
이종장기이식은 인공장기 및 줄기세포 분화 기술을 이용한 장기이식에 비해 빠르게 임상에 적용할 수 있는 기술이다. 최근 영장류 실험에서 이식된 이종장기가 거부반응 없이 장시간 제 기능이 유지되는 것이 관찰되었으며 수혜 동물의 생존기간 또한 연장되었다. 이것은 이종장기이식의 가능성을 입증한 연구였다. 향후 보체 활성, 응고증, 세포 매개성 거부반응과 같은 남아있는 장벽을 하나씩 극복해 간다면 가까운 미래에 이종장기이식은 생명을 구하는 치료수단으로 자리 잡을 것이다.
과학기술의 개발과 이종장기이식의 안정성 확보와 더불어 윤리적 문제 역시도 반드시 고려해야 할 사항이다. 연구자들은 이종장기이식이 가져올 수 있는 위험성을 염두에 두고 세계이종이식학회나 WHO에서 제시하는 국제적인 가이드라인에 따라 이종장기의 임상시험을 수행해야만 한다. 뿐만 아니라 이종이식의 안전성을 확보하는 동시에 연구대상자와 사회를 보호하기 위하여 연구대상자 선정, 임상시험 관리・감독, 공여동물 사육시설 관리 등에 대한 규제를 임상시험 실시 전에 반드시 마련해야 할 것이다.
(2) 전망
장기이식 수요의 폭발적 증가에 따른 수급 불균형으로 인하여 바이오 이종장기 시장의 규모는 급속도로 커질 것으로 전망된다. 바이오 이종장기는 장기 이식만을 기다리는 환자에게 고통을 덜어주고 희망을 줄 수 있을 뿐만 아니라, 우리나라를 미래 바이오의약품 선진국가로 도약하게 할 미래 산업이 될 것이다. 현재까지 이루어온 바이오 이종장기 연구 성과와 기반 시설을 지속적으로 유지 및 발전시키고, 바이오장기 생산 규제와 가이드라인을 갖춘다면 향후 학문, 산업, 경제적으로 큰 기여를 할 것으로 예상된다.
4. 진단 및 의료기기
가. 개요
세계적으로 고령화에 따른 의료비 증가, 경제 저성장 등에 대응하기 위해 의료 패러다임이 질병치료에서 진단・예방・모니터링으로 전환되면서 바이오와 모바일, 사물인터넷(IoT: Internet of Things), 빅데이터, 인공지능(AI: Artificial Intelligence) 등 정보통신기술(ICT: Information and Communications Technologies)과 융합한 바이오-ICT 융복합헬스케어 산업이 집중 육성되고 있다. 그 중 혁신적인 차세대 유전체 분석기술과 디지털기술 기반 현장진단기술(POCT: Point-of-care testing) 등이 융합한 개인맞춤형 정밀의학 헬스케어시스템이 여기에 포함된다.
융복합헬스케어는 사물인터넷(IoT) 스마트센서와 연계한 스마트홈, 스마트자동차 서비스로 수집한 데이터를 클라우드에 저장하고 빅데이터 분석 기술로 결과를 분석해 모바일로 서비스를 해주는 ICBM(IoT-Cloud-Big data-Mobile) 융합 서비스로 구현할 수 있다. 특히 IoT 기술은 사물과 사물 간의 유무선 통신 기술 접목과 실시간 생체정보 측정분석 및 활용으로 헬스케어 산업의 패러다임을 전환하고 있다.
정밀의료는 유전체정보, 진료・임상정보, 생활습관정보 등을 통합 분석해 환자의 특성에 맞는 진료를 제공하며, 미래의 암 진단과 치료에서 인공지능이 최고품질의 정밀의료 기반을 제공하게 될 것이다. 정교하고 정량적인 질병유형 측정과 생존기간 예측을 위해 머신러닝 등 AI기술을 적용하는 것이 효과적일 수 있다. 궁극적으로 AI기술은 주요 병리학적 특성자료와 X레이, 컴퓨터단층촬영(CT)스캔 또는 자기공명영상(MRI) 데이터 등의 영상분석 자료를 연결해 암 등 질병의 분자메커니즘 규명을 가능하게 할 것으로 예측된다.
빅데이터와 AI 기반의 정밀의학 등 융복합헬스케어 산업의 내재화를 위해서는 개인정보의 빅데이터 기반 구축과 함께 머신러닝 등 AI 및 유전체 데이터의 개인정보 활용에 대한 보안 이슈 등 관련 규제 개선, 의료기관의 역할 및 비즈니스 모델 정립, 빅데이터 중심의 의료협력 활성화 등이 필요할 것이다.
나. 해외 동향
바이오-ICT 융복합헬스케어 산업은 보건의료 분야에서 다양한 비즈니스 모델을 창출하고 있으며 전 세계적으로 시장선점을 위한 경쟁이 치열해지고 있다. 특히 미국 정부는 산학연 연구개발(R&D) 연계, 정부와 민간의 통합지원에 따른 정밀의학 이니셔티브를 통해 유전체정보 기반 개인맞춤형 의료분야의 육성을 선언하며 환경변화에 대응하고 있다.
개인의 유전체정보와 함께 웨어러블기기로 취합되는 라이프로그데이터는 의료정보와 융합해 의료빅데이터로 통합되고 있으며, 빅데이터 기반 제품 및 서비스 개발을 위한 오픈이노베이션 플랫폼이 구축되고 있다. 첨단기술 간의 융합으로 새로운 의료서비스에 대한 수요가 커지면서 의료현장의 아이디어가 의약품, 진단 및 치료기기 개발로 이어지는 등 통합형 비즈니스모델이 형성되고 있으며, 특히 정밀의학 기반의 환자맞춤형 의약품 개발・탐색시스템, 세포치료제 및 인공장기의 개발은 병원을 중심으로 진행되고 있다. 구글・애플・IBM 등 정보기술(IT) 기업들도 머신러닝시스템의 첨단 데이터 분석으로 최적의 치료법을 선택하고 환자별 치료결과 예측에도 활용하는 AI기반의 환자맞춤형 진료서비스를 제공하고 있다.
전 세계 바이오헬스 분야의 규제를 선도하는 미국 식품의약국(FDA)은 규제과학(Regulatory Science)을 ‘FDA 관리대상 제품의 안전성・유효성・성능을 입증하기 위한 새로운 기준 및 시험방법을 개발하는 것’으로 정의하고 있으며, 이는 FDA의 제품 판매승인 결정을 위한 유익성(Benefit)・위험성(Risk) 평가에 활용되고 있다.
규제정립 과정에서 새로운 제품에 대한 평가기준은 많은 과학적 사실과 원칙에 근거하게 되는데, 과학은 속성상 끊임없이 발전하고 있어 태생적 불확실성이 내포돼 있다. 따라서 합리적 규제를 정립하기 위해서는 과학적 사실과 함께 관련 산업계・학계・사용자・소비자 등 다양한 이해관계자의 의견을 조율할 수밖에 없는 상황이 발생한다. 이는 새로운 규제가 이해관계자 각각에 따라 부담일 수도, 이익일 수도 있기 때문이다.
중요한 것은 정부의 규제철학이 무엇이냐에 기업의 글로벌 경쟁력과 국민의 안전이 달려 있다는 점이다. 최근 전 세계적인 융복합 바이오헬스 산업의 비약적 발전은 각국 규제당국의 통제범위를 넘어서는 상황이다. 물론 미국 FDA나 유럽 등 선진국 규제당국은 제품의 안전성 확보에 최우선 방점을 두고 있으나, 전체적인 규제철학은 기업의 글로벌 경쟁력 확보와 사용자・소비자 이익을 위한 시장경제 중심으로 변화하고 있는 듯하다.
일례로 모바일 헬스케어와 웨어러블 디바이스 시대가 도래하면서 새로운 유형의 융복합 웰니스기기와 앱 등이 등장하게 됐고 FDA는 이에 대한 의료기기 규제적용 여부의 명확화 또는 관련 제품 및 서비스에 관한 규제완화를 가장 선제적으로 진행하고 있다. 지난 2015년 1월 모바일메디컬앱(Mobile Medical App) 가이던스와 제너럴웰니스(General Wellness) 가이던스를 각각 발표했으며, 의료용이 아닌 운동・레저용 등 비의료 목적인 제품에 대한 구분관리 기준을 제시해 관련 기업 입장에서 신규 비즈니스모델 개발 및 제공에 장애가 되는 불필요한 규제를 완화했다. 그럼에도 구분관리 기준에는 사용자・소비자가 사용하는 과정에서 발생 가능한 위험도가 매우 낮은 경우의 제품으로 한정해 안전성을 최대한 확보하도록 했다.
다. 국내 현황
전 세계 주요 선진국의 바이오헬스 분야 육성에 발맞춰 대한민국 정부도 ‘바이오헬스산업 규제개혁 및 활성화 방안’을 발표해 신의료기술, 첨단재생 의료제품, 웰니스 제품의 신속한 시장진입을 지원하고 유전자, 보건의료 빅데이터 등 신규 유망분야 창출 지원을 확대하는 방안을 발표했다. 특히 유전자검사제도 개선 내용 가운데는 질병 예측을 위한 유전자분석 및 진단기술 개발에 널리 활용되는 차세대 염기서열분석(NGS : Next Generation Sequencing)을 개인맞춤 암유전자 분석 등 임상에 활용될 수 있도록 관련 장비를 신속히 인허가하고 건강보험 급여도 확대 적용하는 등 개선해 나갈 계획이라고 한다.
아울러 식품의약품안전처는 미국 FDA의 의료용과 비의료용 목적 제품 구분관리 기준과 동등한 수준으로 의료기기와 개인용 건강관리 제품을 구분할 수 있는 ‘의료기기와 개인용 건강관리 제품 판단기준’을 마련해 2015년 7월부터 시행해 왔다.
지난해 제약・바이오 업계의 대규모 기술수출 계약과 세계 최고 수준의 바이오의약품 생산 전문기업 탄생을 계기로 바이오헬스 산업 발전에 대한 민간과 정부의 협력 필요성이 더욱 부각되고 있다.
라. 발전전망
(1) 개인맞춤 정밀의학
최근 암 진료에 대한 기술적 진보에도 여전히 치료불응을 보이는 진행성 암의 경우 기존 치료로는 해결되지 않고 높은 사망률을 보이고 있다. 또한, 진단・치료 및 후처리 비용이 증가함에도 환자체감 의료 서비스의 품질은 저하되고 있어 이에 대응할 맞춤형 진료・의료서비스에 대한 사회적 요구가 점차 늘어나는 추세다.
2015년 들어 의료 서비스 분야에서 가치 중심의 헬스케어 모델이 발전되어 다국적 생명과학 회사들은 빅데이터 분석, 기술통합 및 산업 간 협력을 필요로 하는 개인맞춤 정밀의학 분야에 역량을 집중하고 있다.
과거의 진단의학은 환자의 질병을 확인하는 데 그친 반면 현재의 진단의학은 환자의 DNA 염기서열을 분석함으로써 해당 질병의 진행상황을 예측할 수 있어 환자특이적인 진단 및 치료가 가능하다. 의료 소비자들에게도 개인맞춤 정밀의학 등을 근간으로 하는 디지털 헬스케어 서비스 등장이 현실로 다가오고 있어 향후 지속적 발전이 예상된다.
의료용 애플리케이션이 탑재된 웨어러블기기의 사용이 증가함에 따라 관련업체들은 제품개발의 혁신과 함께 수집된 데이터의 적정한 관리방법 및 개인정보 보안유지를 위한 연구를 진행하고 있으며, 제품 허가 및 서비스 시행에 대한 적정한 정부 규제 마련을 요구하고 있다.
융복합헬스케어 산업은 더 많은 기술이 융복합 되고 소비자 중심으로 변화하면서 의료서비스 방식도 변화하고 있다. 기존 전통의학의 개념이 개인맞춤 정밀의학 분야를 포괄적으로 아우르는 ‘예측, 예방, 맞춤 및 환자참여형 의학(Predictive, Preventive, Personalized and Participatory Medicine)’을 포함하는 ‘4P 의학(P4 Medicine)’으로 변화하는 추세다.
4P 의학의 등장으로 건강한 웰니스 상태에서 환자맞춤으로 질병 발생을 예방 또는 예측하는 것이 가능해지고 질병이 발생하더라도 쉽게 진료할 수 있게 됐으며, 수년 내에 개인의 유전체(Individual’s Genome) 분석을 미화 1,000달러 이하로 수행할 수 있을 것으로 예측된다. 개인의 유전자 특성 차이는 고유의 외형적 특성뿐 아니라 질병에 대한 감수성 차이를 유발한다. 따라서 이러한 유전자 특성을 이용한 의학 발전으로 개인의 환경적 요인과 함께 환자맞춤으로 질병을 예방, 진단 및 치료할 수 있을 것이다.
(2) 가상현실(VR: Virtual Reality)
가상현실(VR)은 컴퓨팅 기술로 생성한 3차원(3D) 가상공간과 사용자 간의 상호작용을 가능하게 하는 인터페이스 기술로서 최근 들어 관련 기술의 발달과 원가절감으로 전 세계적으로 상용화가 가속화하고 있다.
정부의 정보기술(IT)・생명공학(BT) 융복합 분야 육성지원에 따라 헬스케어 산업의 빠른 성장이 기대되는 가운데 최근 VR의 대중화와 함께 관련 하드웨어・플랫폼 및 콘텐츠・소프트웨어(앱) 개발 활성화로 헬스케어 분야로의 적용이 진행되고 있다.
헬스케어 영역에서 VR는 3D로 구현된 환자의 수술 부위를 자유자재로 돌려가며 시뮬레이션할 수 있는 3D 가상수술 시뮬레이터를 통한 외과수술의 교육과 훈련에 활용돼 의사가 VR를 이용해 실제 환자에게서 경험하지 않더라도 정교한 수술이 가능하도록 하고 있다. 그뿐 아니라 불안, 공포증, 외상 후 스트레스 장애(PTSD), 자폐증 등 장애 유발 환경을 체계적으로 간접 체험하게 함으로써 증상을 완화시키는 노출치료(Exposure Therapy) 등 정신과 영역에서의 활용이 기대되는 등 시장의 관심이 증가하고 있다. 또 미국에서는 알코올 중독 환자에게 VR 시스템을 치료에 활용하기도 했다. 화상 환자에게 통증은 피하기 어려운 문제인데 통증관리를 위해 의료 VR 비디오 게임을 활용한 주의분산치료(Distraction Therapy)는 통증관리에 효과가 있음이 입증됐으며, 암 환자에게 항암제 치료 전 VR를 통해 항암치료를 사전에 경험하게 해 오심 등 항암제 부작용의 고통을 완화했다. 이 외에도 VR는 알츠하이머병과 어린이 주의력결핍과잉행동장애(ADHD) 관리에도 활용될 수 있을 것이다.
헬스케어 영역에서 VR는 혁신적인 치료 패러다임의 관점에서는 아직 초기 단계에 있으나 향후 임상적 유용성의 지속적인 입증을 통해 활성화할 것으로 전망되며, 가까운 미래에 VR는 인공지능(AI), 딥러닝, 빅데이터 분석 등의 기술과 융합돼 환자중심의 맞춤형 가상 시뮬레이션을 기반으로 다양한 융합 플랫폼을 구축해 기존 의료시스템의 변화를 가져올 것이다.
(3) 클라우드 컴퓨팅과 헬스케어
의료서비스 분야에서 가치 중심의 헬스케어 모델이 발전되어 감에 따라 전 세계 글로벌 헬스케어 기업들은 대규모의 데이터 분석, 기술통합 및 산업 간의 협력을 필요로 하는 개인맞춤 정밀의학 분야에 역량을 집중하고 있다. 이에 따라 개인별 건강정보를 이용한 진단 및 치료에 대한 신뢰성 향상에 대한 요구가 증가하고 있으며, 대량의 환자정보를 효율적으로 관리할 수 있는 환자감시장치의 등장은 환자 관리의 질을 향상시킬 수 있는 계기가 되었다.
전자의무기록(EMR : Electnonic Medical Record) 등을 활용하여 많은 의료기록을 통합관리 함으로써 진료의 객관성 확보와 의료진 간의 효율적인 협진을 가능케 하고 있다. 아울러 의료현장에서 웨어러블기기의 사용이 증가함에 따라 관리대상 의료데이터의 양이 증가할 것으로 예상된다. 또한 헬스케어 산업에 클라우드 컴퓨팅(CLOUD COMPUTING)서비스가 도입됨으로써 의료기관은 저비용으로 보건의료 빅데이터를 효율적으로 관리할 수 있게 되었으며, 이를 기반으로 의사는 환자의 의료기록을 실시간으로 활용할 수 있게 되어 진료서비스 수준이 향상될 것으로 기대된다.
(4) 인공지능(AI)・빅데이터 기반 디지털헬스케어
디지털헬스는 의료전달체계의 효율성을 높이고 개인맞춤 의료구현을 목적으로 탄생한 건강관리시스템과 디지털 기술의 융합 산물이며 환자는 직면한 건강문제를 해결하기 위해 하드웨어・소프트웨어 솔루션과 서비스 등 정보통신 기술을 이용한다.
디지털헬스케어는 컴퓨터 분석기술, 웨어러블기기 및 진료 또는 모니터링 방법의 개선을 통해 의료진이나 환자가 건강의 위험을 상시관리 하도록 해준다. 모바일헬스, 건강정보기술, 웨어러블기기, 원격의료와 맞춤의학을 통해 의료비용은 줄이고, 의료품질은 높여 개인맞춤 의료를 구현한다.
의료・헬스케어 영역에서 AI는 모든 가용정보 분석으로 환자 치료방법과 계획을 탐색해 의사가 최선의 결정을 내리는 데 도움을 줄 수 있다. 개인의 건강기록과 의료 데이터 기반의 온라인 AI 의료컨설팅서비스는 진료 대기시간을 획기적으로 줄이고 환자에게 적합한 효율적 진료방안을 제공하며 유전체 분석에서도 AI는 유전정보와 의료기록의 빅데이터 패턴을 확인해 질병과 돌연변이의 연관성을 찾고 유전자 변이에 따른 차세대 세포 내 변화 예측기술 개발에 활용돼 초기 암 또는 혈관 질환을 발견할 수 있도록 한다. 또한 임상시험을 통한 의약품 개발에는 통상 10년 이상이 걸리고 수십억 달러의 비용이 드는데, AI 기술을 활용해 기존의 안전성이 확보된 의약품을 리포지셔닝하면 현재 세계적으로 의약산업이 직면해 있는 신약개발 투자대비 생산성 저하와 파이프라인 부족 문제를 해결하는 신약개발이 가능할 것이다.
(5) 3D 프린팅 환자맞춤형 의료기술
3D 프린팅 기술은 외과용이나 치과 임플란트 등 의료산업에 선도적으로 활용되기 시작하면서 기존 의료분야의 패러다임을 변화시키고 있다. 3D 프린팅은 소형이면서 상대적으로 가격이 비싼 의료기기 생산에 적합하고 자기공명영상(MRI)장치나 컴퓨터단층촬영(CT) 등 환자의 3D 의료영상 데이터를 활용해 환자맞춤 생산을 가능하게 한다는 점에서 주목받고 있다. 아울러 수술의 위험을 낮추기 위한 외과의사 연습용 환자별 맞춤 교육 및 수술 시뮬레이션용 모형 제작에도 활용돼 수술시간을 단축하며 성공률을 높이고 있다.
5. 감염병 대응
가. 개요
(1) 감염병의 정의
감염병이란 세균 스피로헤타, 리케차, 바이러스, 진균, 기생충과 같은 여러 병원체에 의해 감염되어 발병하는 질환으로서 음식의 섭취, 호흡에 의한 병원체의 흡입, 다른 사람과의 접촉 등 다양한 경로를 통해 발생하며 이 중에서도 여러 사람에게 전파되는 감염병을 전염병이라고 한다. 법정감염병은 ‘감염병의 예방 및 관리에 관한 법률’ 제2조제2호 내지 제7호에 명시된 감염병을 의미, 질병으로 인한 사회적인 손실을 최소화하기 위해 법률로써 이의 예방 및 확산을 방지하는 감염병을 말한다. 환자와 그 가족, 의료인 및 국가의 권리와 의무를 명시한 감염병으로 제1군감염병, 제2군감염병, 제3군감염병, 제4군감염병, 제5군감염병 및 지정감염병으로 구분된다. 이 밖에 세계보건기구 감시대상 감염병, 생물테러감염병, 성매개감염병, 인수공통감염병, 의료관련 감염병 등이 있으며, 이는 보건복지부장관이 각 필요와 목적에 따라 고시한다. 해외 교류의 급증과 기후변화로 인한 감염병 매개체의 서식 변화를 고려하여 국내 질병뿐만 아니라, 과거 전 세계적으로 유행한 질병, 신종 감염병 및 재출현 감염병 등 자연 및 인위적으로 전파될 수 있는 모든 감염병을 포함하고 있다.
(2) 감염병의 발생 현황
최근 베트남에서 폭발적으로 발생한 뎅기열은 뎅기열 바이러스에 의해 발생하며 모기를 매개로 하는 감염병이다. WHO에 따르면 전 세계 인구의 40%가 뎅기 감염 위험지역에 살고 있으며, 연간 3억 9천만 명이 감염되어 2만여 명이 목숨을 잃고 있다. 뎅기열을 전파하는 이집트숲모기 (Aedes aegypti)는 주로 열대와 아열대지역에 분포하여 주로 동남아시아를 중심으로 뎅기열을 유행시키며 고열과 출혈성향을 동반하는 열성질환을 일으킨다. 현재 백신이 개발되어 일부 국가에서 상용화 되었지만, 부작용과 낮은 효능으로 사용이 제한적이며 항바이러스제제는 없는 상황이다.
뎅기출혈열이나 뎅기쇼크의 경우 집중적인 치료시에는 치사율이 1∼2.5%이나 적절한 치료를 받지 못하면 사망률이 20%가 넘는다고 보고되었다. 국내의 뎅기열 환자 발생은 모두 뎅기열 위험지역을 여행하거나 방문했던 사람으로 아직까지 국내에서 직접 발생 환자는 없다. 2014년 여름에는 도쿄 중심부의 요요기공원을 중심으로 뎅기열 환자가 113명 발생하였고 유럽에서도 2012∼2013년 대서양의 포르투갈령 마데이라섬에서 뎅기열의 대규모 유행이 발생하여 총 환자수가 3,000여 명 발생하였다. 2010년에는 프랑스와 크로아티아에서는 각각 2명, 17명 환자가 발생하였는데 모두 해외여행 경력이 없는 자체 발생 환자로 이는 1928년 이후 유럽에서 발생한 최초의 자생적 발생 사례로 기후변화와 더불어 유럽지역에서 뎅기열의 유행 가능성을 시사하고 있다.

[그림 3-62] 열대성 소외질환 세계적 및 동북아시아의 분포 및 대응 상황
흰줄숲모기는 치쿤군야, 웨스트나일열, 황열 등 다른 열성 바이러스 질환의 주매개체로 작용하는데 이러한 질환은 이미 유럽과 미국에 화물선이나 항공기를 통해 유입되어 이미 정착하거나 유행을 일으킨 사례가 있다. 해외무역이 활발하고 세계적인 허브 공항을 보유하고 있는 국내의 사정을 감안하여 장기적으로 볼 때 이러한 질환 유행이 국내에서 발생할 가능성은 낮지 않으며 이에 대한 적극적인 대비가 필요하다.

[그림 3-63] 전 세계 뎅기바이러스 확산(좌) 및 국내 뎅기열 환자 발생 현황(우)
2015년 5월 한국에서 발생한 Middle East Respiratory Syndrome (중동호흡기증후군, MERS)는 2012년 중동 지역을 중심으로 변종 코로나바이러스(coronavirus)에 의해 감염되는 호흡기 질환으로서 중증폐렴과 함께 신부전, 호흡곤란을 유발하여, 사우디아라비아에서만 282명의 사망자가 보고되었고, 세계적으로 20개국에서 700여건 이상의 감염 사례, 250명 이상의 사망자가 발생을 초래하였다. MERS 바이러스 경우처럼 최근 재난형 감염병은 대부분 동물에서 기인하며 사람에게 전파되어 인수(人獸)공통의 감염 특징을 가지고 있다.
2000년대 초반 중국 남부에서 최초 발생한 신종 코로나 바이러스인 SARS(Severe Acute Respiratoy Syndrome: 중증급성호흡기증후군) 바이러스 경우, 박쥐에서 시작하여 사향고양이에 전파된 변종 코로나바이러스가 사람에게 감염된 사례이다. SARS 환자를 치료하다 감염된 한 중국인 의사에 의해 같은 호텔 같은 층에 묵었던 12명의 투숙객이 사스에 감염된 상태로 미국, 캐나다, 싱가포르, 베트남, 아일랜드로 가면서 3월 26일까지 249명을 감염시킨 것이 초기 전염병 확산의 원인이었다. WHO의 통계에 따르면 중국 광둥성에서 첫 환자가 발생한 이래 2003년 4월 22일까지 전 세계 27개 국가에서 3천 9백 47명의 사스 환자가 발생했으며 사망자는 2백 29명에 달하였다. WHO는 2003년 4월 16일 코로나 바이러스가 사스의 발병 원인으로 확인됐다고 밝히고 바이러스가 동물의 몸속에서 돌연변이를 일으켜 치명적인 바이러스로 변한 것이라고 결론지었다.
[표 3-30] 감염병 위기 경보 수준
|
단계 |
판단기준 |
주요 대응 조치 |
|
관심 (BLUE) |
해외 신종 전염병 발생 국내의 원인불명 감염환자 발생 국내 가금류에 조류인플루엔자 발생 |
징후감시활동 중앙방역대책본부(질병관리본부) 운영 해외동향 신속 파악 및 대응 환자 조기발견 감시체계 가동 환자 진단 및 발생대비 체계 수립 |
|
주의 (YELLOW) |
해외 신종 전염병의 국내 도입 국내에서 신종 전염병 발생 (사람간 전파는 없었음) 국내 인플루엔자 인체감염발생 해외 사람간 전파가 소규모 또는 대규모 |
협조체계가동 중앙방역대책본부 운영(질병관리본부) 상황모니터링 및 위기경보발령 전염병 감시체계 강화(일일보고) 신속 진단 실험실 진단체계 구축 국가방역 인프라 준비태세 점검 |
|
경계 (ORANGE) |
해외 신종 전염병의 국내 유입후 타지역으로 전파 국내 신종 전염병의 타 지역 전파 해외에서 일반인구 사이에 유행 |
대비계획점검 중앙인플루엔자 대책본부 운영(보건복지부) 국가방역검역체계강화(24시간 비상방역체계) 필요물자 비축확대, 국가방역・검역 인력 보강 대국민 홍보 강화 |
|
심각 (RED) |
해외 신종 전염병의 전국적 확산 징후 국내 신종 전염병의 전국적 확산 징후 국내 일반인구 사이 유행 |
즉각대응태세돌입 중앙재난안전대책본부 운영(행정안전부) 범정부적 대응체계 구축, 운영 강화 국가 가용자원 동원방안 마련 : 의료인 지도명령권 발동, 군 의료인력 지원 등 국내외 입출국자 관리강화 |
2003년 SARS, 2009년 H1N1 조류인플루엔자, 2012년 메르스(MERS), 2014년 에볼라, 2015년 지카바이러스 등 최근 발생하는 신종감염병의 75%가 인수공통 감염병으로서 이들은 인구학적 변화(고령화, 국제 교역 증가 및 운송 수단의 발달), 환경적 변화(온난화, 자연파괴) 등의 인간, 동물, 환경요인의 변화에 영향을 받아 사회적 피해를 증폭시키고 있다. 이러한 이유로 최근 인간, 동물, 환경의 관계를 고려한 One health 관점에 따른 감염병 대응 체계를 강화하고 있다.
나. 국외 감염병 대응 동향
(1) 감염병 매개체 대응 노력
‘빌 앤드 멜린다 게이츠 재단’은 브라질에서 지카바이러스와 뎅기・치쿤구니아 열병의 매개체인 이집트숲모기를 퇴치하려는 브라질 정부의 프로젝트에 투자할 것으로 발표하였다. 재단은 콜롬비아 안티오키아와 브라질 리우데자네이루, 인도네시아 등에서 바이러스 저항력을 가진 모기를 퍼트리는 실험을 통해 바이러스 감염력을 줄이는 세균인 ‘월바키아’를 주입한 모기를 이용해 이집트숲모기가 옮기는 전염병을 억제하는 방식을 선택하였다.
브라질 보건부는 전국 4만1,688개 보건소를 중심으로 이집트숲모기 퇴치 활동에 박차를 가하고 있으며, 보건부는 매주 벌어지는 ‘모기 없는 금요일’ 캠페인을 통해 각 가정과 학교, 작업장 등에서 발견되는 모기 서식지를 없애는 방역활동을 벌이고 있다. ‘모기 없는 금요일’ 캠페인은 전국 5,500여개 시 정부의 협력 아래 진행된다.
Google의 생명공학 자회사 베릴리(Verily)가 지카바이러스, 뎅기열의 발병 원인인 이집트숲모기 퇴치를 위해 ‘디버그 프레즈노(Debug Fresno)’ 프로젝트를 발표하였다. 특수 박테리아에 감염된 수컷 모기를 방출하게 되는데 이 수컷 모기와 교미한 암컷의 알은 부화하지 못하게 된다. 박테리아에 감염된 암컷 모기가 다른 수컷 모기와 교미를 해도 그 알은 부화하지 못한다. 이런 방식으로 모기 개체 수 증식을 막고 적정 수준으로 관리하는 것이 목표다. 베릴리는 이미 2016년 10월 이 방식에 대해 제안을 했고 캘리포니아 프레즈노 당국과 협력으로 실제 테스트를 시작한다. 20주 동안 매주 100만 마리씩 총 2,000만 마리의 박테리아 수컷 모기를 프레즈노 2개 구역에 방출한다. 방출된 구역과 다른 구역의 모기 개체 수를 비교해 효과를 검증하고 다양한 데이터를 수집한다는 계획이다.
싱가포르는 나라 전체를 지역단위로 나누고, 500개 이상의 뎅기 관리팀을 두고 있다. 특정 지역에서 2주간 2명 이상의 뎅기열 환자가 발생하면 그 일대를 ‘클러스터(Cluster)’로 지정하여 특별 관리를 한다. 2주간 뎅기열 환자 발생이 없으면 클러스터를 해제하는데, 2017년 6월 16일 기준 싱가포르 전역에 77개의 클러스터가 지정된 상태다. 싱가포르의 보건요원은 가정과 직장 어느 곳이든 예고 없이 방문하여 모기가 번식할만한 여건이 방치되어 있는지 조사한다. 또한 돼지를 기르는 일이 모기번식을 유발할 수 있다고 해서 싱가포르에서는 양돈이 법으로 금지되어 전량 수입에 의존하고 있다.
(2) 세계보건기구(WHO)
아시아-태평양 뎅기열 관리자 회의를 통해 ‘Dengue Strategic Plan for the Asia Pacific Region(2008∼2015)’을 수립하여 아태지역 국가들의 뎅기에 대한 방어력 고양, 신속한 환자 발견 및 조치 등 국가 간 협력 네트워크를 구축하고 뎅기 유행을 방지하여 증가추세에 있는 뎅기열 발생 감소를 도모하고자 하였다. 그리고 2010년 제61차, 2011년 제62차 WHO, 2014년 제65차 서태평양 지역 총회에서 서태평양지역에서 풍토화되어 지속 발생중인 뎅기열이 심각한 공중보건학적 문제를 야기하고 있음을 언급하였으며, 2008년에 수립된 Dengue Strategic Plan for the Asia Pacific Region(2008∼2015)에 따라 뎅기 감시강화, 회원국 간 뎅기 발생 정보 공유, 매개체 감시 및 관리, 발생 관리 및 대책, 뎅기 연구 등에 대해 지속적으로 노력해줄 것을 촉구하였다. 또한 2015년 제136차 WHO 집행이사회에서는 뎅기열 발생이 증가함에 따라 글로벌 공중보건학적 문제임을 확인하고, 뎅기 예방 및 관리에 대한 국제사회의 참여와 협력의 중요성을 제기한 바 있다.
WHO 뎅기 예방 및 관리를 위한 글로벌 관리전략 2012∼2020(Global strategy for dengue prevention and control 2012∼2020)은 2012년 대비 2020년까지 뎅기열 사망률 50% 및 발생률 25% 이상 감소를 목표로 하여 이를 달성하기 위해서 다음의 5가지 요소를 제시하고 있다.
|
5대 항목 |
요소 |
|
Diagnosis and case management
|
초기 임상 및 실험실적 진단과 적절하고 신속한 치료, 임상에서 뎅기열을 관리하는 의료 종사자에 대한 교육 등을 통해 뎅기열 사망 케이스를 제로에 가깝게 감소시킬 수 있으며, 효율적인 환자관리는 중증질환에 대한 조기 대응 및 진단이 필수 |
|
Integrated surveillance and outbreak preparedness |
감시는 뎅기 예방 및 관리를 위한 프로그램의 핵심요소로서 감염병에 대한 위험평가 및 역학적 양상 등을 포함한 가이드를 제공할 수 있으며, 역학 및 매개체 감시는 뎅기 유행기간 동안 지속되어야 하고, 뎅기 감시 시스템은 국가 정보 시스템의 일부로서 모든 감시 시스템과 조화 필요 |
|
Sustainable vector control |
현재 뎅기열 발생 감소를 도모하기 위해 사용할 수 있는 가장 효과적인 방법으로 실제로 매개체 관리를 수행함으로서 질병을 예방할 수 있다. 또한 발생 초기 단계에서 뎅기를 예방하는 효과적인 방법으로 이용가능하나, 발생초기 이후 단계에서는 효과적이지 못할 수 있으며, 현재 매개체 관리는 오랫동안 지속가능하지 않으므로 오랫동안 지속가능한 방법으로 변화하는 것이 필요 |
|
Future vaccine implementation |
뎅기를 예방함에 있어 가장 효과적인 방법은 백신을 활용하는 것으로 현재 개발중인 3개의 생균백신은 2상 및 3상 임상 시험단계에 있으며, 다른 3개의 백신은 임상 개발 초기 단계에 있다. 이중 가장 좋은 백신후보는 황열 바이러스에 기반하여 개발되었으며, 해당 백신은 아시아 및 라틴 아메리카에서 두 번의 3상 임상시험을 거쳤으며 WHO는 해당 백신의 안전성과 효과성에 대해 매우 만족하고 있으며, 백신이 허가된다면 예방접종 전문가 그룹은 이 WHO에 뎅기 백신에 대해 조언 |
|
Basic operational and implementation research |
새로운 진단방법 및 매개체 관리 도구가 필요하며, 연구의 우선순위를 정하고 매개체 내성관리, 백신 연구 등에 집중하며, 새로운 매개체 관리도구 개발 및 뎅기 감염에 대한 기본적인 과학적 연구를 지원하는 것이 필요 |
WHO는 2014년 에볼라 대유행을 시작으로 기후 감염병, 신종감염병, 인수공통감염병과 같이 최근 이슈로 떠오른 감염병에 대한 정책 전략 수립에 대대적인 개혁을 착수하였다. 이에 WHO는 2015년 5월 ‘감염병 R&D BluePrint’ 개발을 시작하였고, 이는 감염병 대응을 위한 가이드라인뿐만 아니라 전 세계적으로 관련 전문가들을 결집시키는 플랫폼으로 역할을 할 것으로 보인다. Blueprint 개발을 위해서 2015년 선행작업으로 병원체 우선순위 선정, 연구 우선순위 도출, 이해관계자 종합 조정, 대비대응에 대한 평가, 혁신 투자방안 개발을 진행하였고, 이로부터 2016년 6월 3대 목표 및 9개 과제를 발표했다. 3대 목표는 아래 도표와 같으며 첫째, 감염병 발생시, 신속하고 유연하게 대처할 수 있는 재원, 커뮤니케이션 경로 등의 환경 확보이며, 둘째, 감염병 유행시 위험도 평가, 연구 우선순위 도출 및 그에 따른 진단, 치료, 백신 개발할 수 있는 로드맵과 법적틀을 마련하는 것이다. 끝으로 세 번째는 연구개발을 뒷받침 할 수 있는 새로운 규범과 표준을 개발하는 것이다.
이 밖에도 WHO에서는 선행 작업을 통해 7대 우선순위(크리미안 콩고 출혈열, 에볼라, 마버그, 라사열, 고병원성 코로나 바이러스, 니파, 리프트밸리열) 및 3대 추가 병원체(치쿤구니아, 중증 열성 혈소판 감소 증후군, 지카)를 선정하여 고위험감염병원체로 인한 위기상황 대비 대응 R&D 청사진으로 발표하였으며(2015.12), 2016년 8월 감염병 플랫폼 기술 공청회를 개최하여 백신, 진단기술, 면역치료법에 대한 민간 부분 역량을 적극 반영하였다.
에볼라로 인한 국제적 비난을 받은 WHO는 2016년 1월부터 응급상황 시스템을 개혁하였으며 글로벌 감시 체계로서 경고대응 국제역량부서(GCR)을 중심으로 해외감염병발생경고 대응네트워크(GOARN)을 운영하고 있다. GCR은 국제적 궁중보건 사건을 모니터링하여 감염병 발병 국가의 기술적 지원과 긴급상황실(EOC) 운영을 위한 가이드라인을 제공하고 있으며 GOARN은 감염병의 국제적 확산을 막고, 감염병 발생국가에서 적시에 대비할 수 있는 역량을 강화하는데 도움을 주고 있다.
[표 3-31] ‘WHO R&D Blueprint’ 주요 선행 작업 및 3대 목표・9개 과제
|
5대 선행 작업 (2016년 5월 이전) |
||||||
|
|
병원체 우선순위 선정 |
연구 우선순위 도출 |
이해관계자 종합 조정 |
대비대응에 대한 평가 |
혁신적 투자 방안 개발 |
|
⟱
|
3대 목표와 9대 과제 (2016년 5월 이후) |
||
|
3대 목표 |
9대 과제 |
|
|
1. 감염병이 유행하는 동안 신속한 연구개발 착수를 위한 조정능력 강화 및 환경 조성 |
1 |
효과적인 조정의 틀 수립 |
|
2 |
투명한 재원마련 절차 마련 |
|
|
3 |
효과적 커뮤니케이션 장려 |
|
|
2. 안전, 효과적, 시의적절한 연구를 위한 R&D 가속화 |
4 |
감염병 유행의 위험도 평가 및 우선순위 병원체 도출 |
|
5 |
진단기술, 치료제, 백신의 신속평가를 위한 R&D 로드맵 개발 |
|
|
6 |
규제와 윤리적 틀 마련 |
|
|
3. 감염병 유행 상황에 신속히 대처할 수 있는 새로운 규범과 표준 개발 |
7 |
연구설계를 위한 역량 강화 |
|
8 |
협력을 위한 가이드 및 기술 개발 |
|
|
9 |
규제 및 정책 장벽을 극복하기 위한 자료 예측 및 사전 준비 |
|
자료: WHO(2016.5). 14∼15쪽 요약 및 정리
(3) 주요 국제기구의 One Health 관점 감염병 대비 대응 사례
① OFFLU : UN식량농업기구(FAO)와 세계동물보건기구(OIE)의 동물 인플루엔자 전문가 네트워크로서, 동물 인플루엔자의 연구분야 발굴 및 감시에 주력하고 있으며, WHO의 글로벌 인플루엔자 프로그램과 연계하여 강력한 네트워크를 구성하고 있다.
②GLEWS(Global Early Warning System for Major Animal Disease, including Zoonoses) : FAO, OIE, WHO가 one health 관점을 바탕으로 인수공통 감염병에 대한 조기 감시 및 경고를 위해 구축한 국제 협력 시스템
③ GloPID-R(Global Research Collaboration for Infectious Disease Preparedness) : 2013년 2월 출범한 WHO 및 각국의 연구 펀딩 기관으로 구축된 감염병 대비 글로벌 연구 협동 네트워크로 대유행 가능성이 있는 감염병 대응 연구 활성화 및 정보교환을 도모함
다. 국내 감염병 대응 동향
(1) 제2차 감염병 위기대응 연구개발 추진전략(국가과학기술심의회, 2016)
2012년 1차 추진전략에 이어 국과심은 2016년 2차 추진안(2017∼2021)을 의결하였으며, 그 추진 배경은 1)지카바이러스, 메르스 등 신종 및 원인불명 감염병과 인수공통 감염병의 국내 발생 증가 추세와 2)감염병 발생으로 인한 보건, 경제적, 사회적 심각한 손실과 국가신뢰도 하락이라는 경험을 바탕으로 3)국내 감염병 위기현실을 반영하고 국가방역체계에 부합하는 범부처 R&D 추진 전략 수립 및 투자 효과성 극대화를 목표로 하고 있다.
1차 추진전략에서 선정된 8개 중점 분야에 예방접종/백신과 재난대비/관리를 추가하여 3대 유형 10대 중점 분야를 선정하였다. 4대 목표로서 국내 현황을 고려하여 ①국가방역체계와 연계한 감염병 R&D 지원강화, ②감염병 R&D의 부처간 연계 및 범부처 총괄 조정강화, ③민관 협력 및 R&D 성과관리 강화, ④ 국제협력 및 연구인프라 강화를 선정하였다.
[표 3-32] 제2차 감염병 위기대응 연구개발 추진전략
|
3대 유형 |
10대 중점분야 |
범위 |
|
신/변종 및 해외유입 감염병 |
신종/원인불명 감염병 |
MERS, Ebola, 해외 유입 신종 감염병 등 |
|
기후변화감염병 |
지카바이러스, SFTS, 쯔쯔가무시증, 뎅기열 등 |
|
|
인수공통감염병 |
동물과 사람간에 서로 전파되는 감염병 중 10종 지정 |
|
|
인플루엔자 |
계절/신종/조류 인플루엔자 |
|
|
미해결 감염병 |
다제내성균 |
|
|
결핵 |
|
|
|
만성감염 |
|
|
|
국가감염병 안전망 구축 |
재난/대비 |
-감염병(가축포함)에 따른 사회적 재난 |
|
예방접종/백신 |
국가예방접종사업의 대상이 되는 10개질환 및 백신기반기술 |
|
|
생물테러 |
감염병 예방법 상의 생물테러 지정감염병 및 고위험병원체 |
(2) 국내 감염병 연구의 한계점 및 대응정책의 방향
2015년 기준 미국 정부의 신종 및 종간전파 감염병 연구 투자규모는 1조 6천억 원이며, 국내 투자규모는 약 2천억 원으로 전체 R&D 비용의 1.1%에 해당한다. 감염병의 종류를 인체감염병, 동물감염병, 인수공통감염병 세 가지로 분류하면 우리나라는 전체 감염병 연구비의 70%가 인체감염병에 압도적으로 투자되고 있다. 하지만 인수공통감염병의 경우 전체 감염병 투자의 12.3%에 불과하며, 더욱이 인수공통감염병을 좁게 정의할 경우엔 1.4% 그친다. 전 세계적으로 One Health 관점을 바탕으로 인간, 동물, 환경을 하나의 시스템으로 바라보고 주목하고 있는 반면, 우리나라의 경우 인체 감염병의 연구에만 연구비가 집중되어 있는 실정이다.
2015년 기준 감염병 연구분야별 투자규모를 비교해보면 기초/기전(22.2%), 치료기술(22.2%), 백신(17.7%) 순으로 투자가 많이 이루어졌으며, 이 세 가지 연구 분야가 전체 연구비의 총 60%이상을 차지했다. 메르스 사태의 국가방역시스템 및 감시시스템의 실패의 원인은 방제/방역, 감시/역학, 인프라와 같은 분야의 연구비 투자가 매우 저조하여 방역체계와 연구의 방향이 연계되지 못했기 때문으로 이에 대비 가능토록 감염병 R&D와 국가방역체계를 잇는 노력 시작되었다. 이에 따라 2차 추진전략에서는 1)유입 차단을 위한 감염병 매개체 감시 및 방제기술 연구, 2)현장 수요를 반영할 수 있는 고감도 진단 등의 현장 적용 기술의 개발, 3)확산방지를 위한 차세대 소독제 및 방역기기의 개발, 4)의료현장 감염경로를 분석케 하는 인프라 강화 등의 목표를 선정하여 국가방역체계와 연계된 R&D에 지원을 확대하는 정책 방향을 수립하였다.
우리나라 연구개발 사업구조를 고려할 때, 부처별로 R&D 사업이 분절적으로 일어나기 때문에 투자의 효율성이 낮다는 기존의 견해를 고려하여, 정부에서는 감염병 대비 및 대응을 위한 범부처 총괄, 조정 기능의 강화를 시도하고 있다. 이러한 정책의 방향은 최근 미국국립보건원(NIH)에서도 투자비용의 중복 낭비를 방지하기 위해 산하의 20여개 국립 연구소의 총괄조정을 강화를 나섰다는 사실에도 근거하고 있다.
(3) 감염병의 진단, 치료 및 예방
(가) 진단
감염병에 대한 항원 제작을 통해 다양한 진단시스템을 개발하고 신속, 정확한 바이러스 검출 기술을 활용함으로써 병원 내 혹은 공공장소에 적용하여 잠재적 전파자 선별 및 확산을 방지해야 한다. 현재 감염자 확진 방법으로 사용되고 있는 실시간 중합효소연쇄반응(Real-Time PCR) 기법 등을 활용하여 바이러스 감염 진단이 이루어지고 있으나, 신/변종 바이러스를 빠르게 검출할 수 있는 신속하고 특이도와 민감도가 향상된 최신 기법 연구를 지속적으로 진행할 필요가 있다. 감염환자의 검체를 확보하여 진단기관에 의뢰 후 유전자 추출, Real-Time PCR 등 일련의 과정동안 소요되는 시간을 단축하기 위해서는 신속진단시스템이 필요하기 때문이다. 이는 감염자 격리 조치나 치료 시점을 획기적으로 앞당길 수 있으며 감염병의 전파를 효과적으로 막을 수 있다.
(나) 예방
전 세계적으로, 바이러스 백신 생산량 증가와 보급이 이루어지고 있지만 주요 국가에서 소비되는 반면, 저개발국가에는 공급이 원활히 이루어지고 있지 않은 실정이다. 인플루엔자 백신의 경우, 백신 생산이 가능한 나라는 현재 약 10개국 정도로 미국, 영국, 캐나다, 독일, 프랑스, 이탈리아, 네덜란드, 스위스, 호주, 일본 등의 선진국이며 생산시설을 갖추지 못한 국가는 백신 수급이 어려울 수 있어 국가적인 위기를 초래할 수 있다.
우리나라의 경우 현재까지 외국의 바이러스백신 원액 수입이 주를 이루며 이를 분주하여 판매하는 수준에 머물고 있다. 또한 인플루엔자 백신 대량생산을 위한 대책과 대체 생산 방안 등에 대한 대비가 부족하고, 대유행 가능성 바이러스에 대한 시험단계 백신의 개발도 미흡한 실정이다.
선제적인 백신 대응기반을 수립하기 위해서는 감염병 출현 예측모델 연구를 통해 급변하는 바이러스의 변이패턴 및 출현속도를 대처하여 사전에 백신을 개발하여야 한다. 신/변종 바이러스가 일으키는 위기상황 발생시, 주변국에서 대응하기 위한 가장 좋은 방법은 위험 구간에 속하는 사람을 대상으로 한 백신 접종이라 할 수 있다. 이를 위해서는 국가적으로 발 빠르게 백신의 개발 및 상용화를 할 수 있는 체계를 갖추어야 한다. 또한 다양한 신/변종 바이러스 아형에 대응 가능한 범용백신의 개발이 필요하다. 고위험성 신/변종 바이러스를 분리 배양하여 백신주를 확보할 수 있는 BSL-3 이상의 실험환경 구축뿐만 아니라, 사람에서 안전하고 효과적으로 방어능을 부여할 수 있는 첨단 백신 개발 및 제품 생산 시설 구축이 병행될 필요가 있다. 이러한 바이러스 질병연구 및 백신개발은 중동호흡기증후군, 에볼라, 신종인플루엔자 같은 고위험성 바이러스 발생 위기상황에 대응하기 위한 가장 좋은 방법이며 백신의 안정성과 효능이 균형 있게 개발되어야한다.

출처: The Global Vaccines Market 2008-2023,visiongain(좌), 국내백신산업 국산화의 시작, 하이투자증권 리서처(2012, 우)
[그림 3-64] 백신 시장 현황
(다) 치료
세균 감염에 빠르게 대처할 수 있는 항생제와 달리 시판 중인 항바이러스 제제는 매우 제한적인 만큼 신/변종 바이러스에 감염된 환자 치료를 위해 1차적으로 즉시 적용할 수 있는 다양하고 효과적인 항바이러스 제제의 개발이 필요하다. 항바이러스 제제의 경우, 항바이러스 약물이 신/변종 바이러스의 전파를 차단할 수는 없지만 감염의 합병증과 증상의 중증도는 경감시킬 수 있으며 대유행 백신 개발을 위한 시간을 벌 수 있는 수단이 될 수 있기 때문에 항바이러스 제제에 대한 국가적 차원의 연구지원은 매우 중요하다. 뿐만 아니라 항바이러스 제제에 대해 내성을 가진 바이러스 출현을 보완할 수 있는 새로운 치료제 개발도 필요하다.
라. 해외 동향
(1) 국외 연구개발 동향
미국은 1990년대부터 감염병 대응 정책기조를 수립하기 위하여 정책보고서를 발간하고 있다. NIH 및 CDC를 중심으로 감염병 대응 연구 및 지원을 강화하고 있으며 국립알레르기전염병연구소(NIAID)는 미국립보건연구원의 기관 중 3위로 예산을 받고 있으며(2010년 기준 48억불), 이 중 약 83%는 주로 AIDS, 결핵, 말라리아, 인플루엔자, 슈퍼박테리아(항생제내성), 생화학테러 등의 연구에 대하여 대학, 병원 등 외부연구에 지원하고 있다. 질병통제예방센터(CDC)는 AIDS 및 신종 감염병의 증가를 반영하여 2010년 예산 중 약 18.6억 달러를 감염병 분야에 사용하고 있으며, 전 세계의 감염병 정보를 파악하고 감염성 질병의 효과적인 연구 활동을 위해 인수공통감염병센터(NCEZID)를 설립하였다.

출처: I&Company Analysis, PubMed
[그림 3-65] 진단, 치료, 백신 분야의 핵심 연구 영역 변화
유럽의 경우, EU차원에서 질병예방통제센터(ECDC)를 중심으로 감염병에 대한 질병감시체계를 구축하고 대응전략을 마련함으로써, EU와 주변국의 데이터수집 표준화, 검증, 저장, 보급, 원스톱 시스템, 국가간 링크 역할 수행 등 업무 효율성 증대 및 국가 차원에서의 감시체계 강화를 위해 노력하고 있다. 일본은 신종 및 재출현 감염증의 연구를 위해 내각부, 후생노동성, 문부과학성의 주도로 정부부처별 전략을 마련하고 투자를 확대하였다. 일본 후생노동성은 국립감염증연구소(NIID)에 감염병에 대한 기초 및 응용 연구, 표준화, 감시, 정보 수집 및 분석, 정부차원의 검정 및 검사, 백신관련 품질관리, 국제협력 등을 추진하기 위해 2010년 약 75억 엔을 투자하였고, 산하 결핵연구소를 설립하여 최근 BCG백신을 대신할 DNA 및 재조합 백신의 개발에 성공하였으며, 진단기술 프로젝트도 추진 중에 있다. 또한, 문부과학성은 신흥・재출현 감염증 극복 기술개발을 위해 감염연구를 위한 국제 네트워크 추진 프로그램(J-GRID) 2단계에 착수(2010∼2014년)하였으며, 2010년 약 20억 엔을 투자하였다. 농림수산성은 2003년 광우병 연구를 시작으로 조류인플루엔자 등 주요 인수공통감염병 발생 및 만연 방지를 위해 노력하고 있으며 질병메커니즘 규명, 검사체계의 신속화 및 정확도 향상, 방제기술개발, 감시 시스템 구축 등을 목표로 연구를 추진하고 있다. 중국은 백신개발을 위한 국가적 지원을 확대하고 연구를 강화하고 있으며 2010년 백신개발에 약 1,800만 달러를 투자하고 있다. 현재 30여개 업체에서 연간 10억 명에 투약할 수 있는 백신 생산능력을 보유하고 있다.
(2) 국외 산업 동향
글로벌 제약 시장의 매출 및 R&D 투자비용은 지속적으로 증가하고 있으며, 감염병 대응에 필요한 백신 및 항바이러스제 등의 비중도 점차 늘어나고 있는 추세이다. 특히 2008년 이후 인플루엔자 대유행을 통해 주요 제약사들의 관련 의약품 개발 및 생산도가 높아졌다. 글로벌 제약 시장 내 감염병 예방 및 치료에 쓰이는 백신과 항바이러스제의 비중이 높아짐에 따라 해당 업체들도 많은 성장세를 보이고 있다. 전체 제약시장이 3%대의 성장을 이룰 것으로 예상되는 반면, 백신과 항바이러스제는 각각 7%와 6%의 성장률을 보이며 제약제품 중 성장률이 가장 클 것으로 기대된다. 전 세계 백신 시장의 규모는 2011년도 317억 달러(약 35조 원)에 이르며, 연평균 11.5% 성장하여 2017년도에는 567억 달러(약65조 원)에 도달할 것으로 전망된다. 전체 제약 시장 성장률인 6∼7%를 크게 웃도는 성장속도를 보이고 있으며, 특히 인플루엔자 백신, 폐렴구균 백신, 자궁경부암 백신, 로타바이러스 백신 등과 같은 고부가가치 프리미엄 백신이 그 성장을 이끌고 있다. 2013년 글로벌 백신시장은 281억 달러로 추산되었으며 오는 2015년에는 642억 달러의 시장으로 크게 확대될 것으로 전망되고 있다. 백신시장을 사람용 백신과 동물용 백신 두 섹션으로 나눠 전망했을 경우, 사람용 백신시장은 작년 239억 달러에서 2015년 586억 달러의 시장으로 매우 큰 폭의 성장세가 전망된 것으로 나타났다. 예상 연평균성장률인 19.6%는 전체 백신시장 평균인 17.9%를 상회하며 글로벌 시장의 성장세를 주도할 것이란 전망이 나타났다.
(단위 : 백만 원)

출처: BCC Research
[그림 3-66] 글로벌 백신 시장 변화
또한 개발도상국의 경제성장에 따른 백신 접종률 증가, 선진국의 고령화에 따른 성인 백신 및 치료백신 수요증가를 비롯하여 충분한 개발 여지가 존재한다. 특히 전 세계적으로 백신 관련 감염병이 8백여 종 존재하나, 현재까지 개발된 백신은 아직 30여 종에 불과하므로 개발 가능성이 많은 산업 분야이다. 현재 제약 시장의 잠재력을 보유한 주요 품목은 질병의 감염을 사전에 방지하는 예방백신이라고 판단된다. 최근 백신 개발은 기존 백신의 부작용 및 단점을 해결하기 위한 새로운 패러다임에 주목하고 있으며 백신 개발에 대한 트렌드도 기존의 예방 백신에서 최근에는 치료백신의 발달이 두드러졌으며, 앞으로는 중독치료 백신 등 다양한 분야에 목적을 둔 새로운 종류의 백신 개발로 이어질 것으로 예상된다.
마. 국내 현황
(1) 국내 연구개발 동향
2009년 기준 정부의 총 연구개발 투자(약 12조 3천억 원) 중 감염병 분야는 이의 0.5%에 해당하는 574억 원을 투자받고 있으며, 연평균 13.1%씩 지속적으로 확대되고 있다(전체 보건 분야 중 약 5.3%). 연구 분야별 분포를 보면 치료기술(25.6%), 기초/기전(22.7%), 백신(19.2%) 중심으로 연구가 수행되고 있고(전체의 76.7%), 진단기술(9.7%), 감시/역학(7.2%), 임상/정책(2.7%) 분야는 상대적으로 투자가 적은 것으로 나타나고 있다. 인체 감염병 연구의 질환별 분포를 보면 법정 감염병에 대한 연구와 그 외 연구가 절반 정도씩 차지하며, 특히 법정 감염병 중에서는 2군과 3군에 연구가 집중되어 있다. 그 외의 연구에서는 질환이 특정되지 않은 치료법(항생제 등) 및 백신 연구, 항생제 내성 연구, 바이러스 등 병원체에 대한 기초연구가 많은 상태이다. ‘기타 인체 감염병 연구’로 분류된 연구에는 주로 ‘호흡기 질환’과 같이 특정 질환군에 대한 연구가 많았으며, 단일 질환에 대한 연구비 지원 순위는 신종인플루엔자, 인플루엔자, 노로바이러스 등의 장관감염증군, 결핵, AIDS, 패혈증, 자궁경부암, B형간염, C형간염, 인간광우병, 폐렴알균 등의 급성호흡기감염증군, 파상풍, 말라리아, SARS 순으로 나타나 있다.
(2) 국내 산업 동향
현 수준의 국내 제약 산업은 국내 제약시장의 특성에 따라 국내 자체 연구개발을 통한 의약품 생산보다 해외 의존도가 높은 실정이다. 국내 상위 5개 제약회사의 전체 매출 규모는 약 3조 원으로 글로벌 상위 5위 단일 제약회사 매출규모인 약 50조 원의 6%에 불과한 실정이다. 국내 상위 5개 제약사의 R&D 투자규모의 합이 글로벌 상위 5위 단일 제약회사의 단 4.8%에 불과하여 국내 R&D 기반은 매우 미흡한 반면, 해외 제약시장은 지속적인 매출 증대와 R&D 투자비 확대를 통해 감염병 대응에 필요한 백신 및 항바이러스 연구에 적극적인 모습을 보여주고 있다. 국내 유통되는 66개의 백신 중 완제품 수입 및 원료 수입 백신이 50개로 75.8%의 백신이 수입되어 오는 바와 같이, 국내 자체 연구개발을 통한 의약품 생산보다 해외 의존도가 크게 높은 것으로 나타나고 있다.
바. 발전 과제
향후 발생가능한 감염병 대응을 위해서는 앞서 언급한 진단, 예방, 치료 3원칙의 대응전략이 잘 갖추어져야한다. 바이러스 감염병 원인체들은 빠르게 변이하고 있어 선제적인 예측모델 연구를 통해 급변하는 바이러스의 변이패턴 및 출현속도를 따라 잡아야하며 이를 통해 사전에 진단 시스템을 구축해놓아야 한다. 안정적으로 백신을 생산할 수 있는 기술과 국내에 충분한 생산 시설을 갖추는 것이 시급하며 차세대 백신 연구를 위해 신/변종 바이러스 병원체에 대한 감시와 예측 인프라 구축은 반드시 갖추어야할 대응기반이다. 동시에, 항원 선발기술 개발을 통해 기존의 긴 시간이 소요되는 바이러스 배양방식을 극복하게 함으로써 대유행 상황에 빠르게 대처할 수 있는 여건을 마련하여야 한다. 이러한 신/변종 바이러스 발생에 대비한 사전 개발 백신 연구뿐만 아니라, 특히 비강백신 또는 경구백신 연구를 통해 바늘을 이용하지 않은 새로운 백신접종 기법을 개발하여야 하고 의료기반시설이 미흡한 국가에서 효율적인 백신접종도 가능케 하여 국내 뿐 아니라 주요 해외발생국에 공급할 수 있어야 한다. 바이러스 질병 및 대응기반 연구는 단순한 질병치료가 아닌 국가의 경제 사회적 안정 유지와 위기 극복에 대비한 매우 중요한 필수 연구 분야로, 국가차원의 사업 추진과 구체적인 장기 계획 수립 및 이의 시행이 시급하다. 또한 체계적이고 종합적인 연구개발 추진이 필요하며 산발적이고 중복 되지 않도록 효율적으로 진행되어야 한다. 안전하고 효과적인 바이러스질병 대응에 대한 국가적 차원의 연구 지원이 감염자와 사망자를 최소화하고 국민 건강에 기반을 둔 국가 경제 사회적 안정 유지에 필수적이기 때문이다.
![]() 제3절
농림축산식품
제3절
농림축산식품
1. 농림
가. 농림 유전체 연구
(1) 개요
정부가 2014년부터 지원하기 시작한 ‘포스트게놈다부처유전체사업’에서 농림 유전체연구가 집중적으로 수행 중에 있으며, 농림축산식품부의 ‘미생물유전체전략연구사업단’(농림식품기술기획평가원)과 농진청, 산림청에서 작물, 가축, 버섯 등의 품목을 대상으로 진행되고 있다.
‘포스트게놈다부처유전체사업’은 현재 전 부처 R&D 사업 중 유일하게 다부처사업으로 기획되었으며 기획재정부의 예비타당성심사를 통과하여 2014년부터 각 부처에서 예산을 투입하기 시작, 2022년까지 8년간 지원한다. 이 사업에서는 연구 대상을 인간(human)과 비인간(non-human)으로 나누어 인간유전체 연구는 복지부, 산업부, 과기정통부(구 미래부)가 지원하고 비인간 유전체 연구는 농식품부, 농진청, 산림청, 해수부에서 지원하고 있다.
농림분야의 유전체연구는 작물 중심의 식물유전체, 가축, 곤충 등 경제동물 중심의 동물유전체, 농업 및 연관 산업에서 유용하게 활용되고 있는 미생물유전체 분야로 생물군을 중심으로 나눌 수 있다.
농진청은 ‘밀레니엄 농생명자원 유전체 해독사업’으로 40품목의 작물, 동물, 곤충 등을 정하고 해독(sequencing)과 생명정보분석(bioinformatics)을 수행 중에 있다. 식물, 동물 등의 유전체 연구는 유전체의 크기가 미생물과 비교하여 매우 크고 복잡하기 때문에 해독 후 유용한 정보를 분석하여 활용하는 것이 큰 과제로 남아있다. 유전체 연구를 통하여 생산된 생명정보, 유전자, 분자마커 등은 고품질 신품종 육성 및 육종 효율 증진 등을 제공하는 핵심 요소로 작용할 것으로 보이며 NGS로 생산되는 유전체 정보량의 폭발적 증가에 따라 빅데이터의 분석능력과 유용한 정보를 탐색, 발굴하여 기술을 접목하고 산업적으로 활용하는 것이 관건이라 할 수 있겠다.
여기서는 비교적 유전체의 크기가 작은 농업유용 미생물의 유전체를 해독하고 생명정보를 분석하여 산업적으로 활용하는 연구 분야에 대하여 살펴보도록 하겠다.
(2) 해외 동향
차세대유전체기술(NGS)이 도입된 후 미국, 일본, 중국에서는 정부 주도로 다양한 미생물유전체의 해독, 분석연구를 집중하여 지원하고 있다. 미국은 정부(DOE)와 민간 기업들이 협력(JGI, Joint Genome Institute)하여 ‘1,000 Fungal Genome(MycoCosm)’, ‘Earth Microbiom Project’ 등을 추진 중이며 독일 미생물 자원센터인 DSMZ와도 협력하여 주로 많은 세균, 진균의 type strain의 해독(sequencing)을 진행 중에 있다.
중국은 2009년부터 BGI(Beijing Genome Institute) 주도로 ‘10,000 Microbial Genome Project’를 진행하고 있는데 전 세계에서 수집한 10,000여종의 미생물 유전체 서열을 밝히는 것을 목표로 현재 약 1,000여점의 draft 유전체 서열 분석을 완료하였다. 일본은 NITE(National Institute of Health)가 주관으로 식품안전, 에너지, 환경 관련 미생물의 유전체를 분석하여 정보를 모으는 일을 진행하고 있다. 최근에는 미국 NIH에서 인간 미생물 군집 연구 프로젝트(Human Microbiom Project)를 수행하여 인체의 다양한 기관(organ)에서의 미생물 군집 분포와 건강과의 상관성 연구를 진행 중이며 유럽연합(EU) 역시 유사한 인간 마이크로바이옴 연구를 수행 중이다. 미생물과 관련된 유전체 연구는 나라마다 앞 다투어 진행 중에 있음을 알 수 있으며 나아가 이러한 미생물 유전체 정보를 활용하여 새로운 항생제를 개발(미국 일리노이대학)하고 병원세균의 약제내성 연구 등과 접목하고 있는 추세이다.
(3) 국내 현황
정부는 21C 프론티어사업의 일환으로 2002∼2012년까지 ‘미생물유전체활용기술개발사업’(총 1,104억 원)을 추진하였으며 고부가가치 미생물 자원의 발굴과 활용을 위한 기반기술을 확립하고자 하였다. 실질적으로 농림분야의 미생물유전체 연구는 2009∼2014년 사이 ‘유전체 분석을 활용한 전통발효식품의 표준화’ 주제의 과제 수준으로 지원되었던 것 외에는 투자가 미미하였고 본격적인 NGS 기반의 유전체 연구는 2014년부터 시작된 ‘미생물유전체전략연구사업단’(연 48억 원, 2014∼2022)을 중심으로 활발히 진행 중에 있다.
이 사업단에서는 주로 농업에 유용한 미생물 균주들에 대한 유전체 해독 및 유용유전자 발굴을 주제로 대학 및 연구기관이 산업체와 협력하여 그들의 전략균주들에 대한 유전체를 해독하고 분석하여 산업적 활용도를 높일 수 있는 연구를 수행 중에 있으며 유전체연구의 수월성을 바탕으로 수준 높은 미생물유전체 연구의 역량 강화를 위한 목적으로 참조유전체, 메타유전체, 다중오믹스 등의 주제로 국내 우수한 연구진들이 지난 3년간 연구를 수행하여 매우 우수한 결과들을 창출하고 있다.
농진청은 2011년 출범한 차세대바이오그린 21사업에 일부 유전체연구 사업을 포함하고 있었고 본격적인 NGS 기반의 유전체 해독 및 분석 연구는 2014년 다부처포스트게놈사업에 참여하면서 시작하였다. 유전체해독 및 분석 대상은 주로 식량작물, 원예작물, 가축자원, 곤충자원, 버섯, 식물병원균 등 다양한 농림분야의 자원들에 대하여 진행되고 있다.
(4) 발전 전망
정부의 포스트게놈다부처유전체사업은 NGS 기반의 유전체 정보생산 및 분석, 이를 활용한 신산업창출로 이어지는 체계적인 장기 연구개발 지원 사업으로 특히 농림분야에서 작물, 경제동물, 산업미생물 등의 유용자원의 유전체연구를 산업적인 응용분야에 확장하여 적용할 수 있다는 점에서 매우 긍정적으로 평가된다.
또한 농림 유전체 연구가 활용될 수 있는 농산업의 세계시장 규모는 2016년 25억 달러에서 2022년 64억 달러로 연평균 17.1% 성장할 것으로 예상하고 있다(한국미생물학회, 2017). 이에 대한 몇 가지 예를 들어보면, 미생물사료첨가제, 생물비료 등을 포함하는 농산업 시장은 2016년부터 2021년까지 연평균 7% 이상의 성장세를 예측하고 있으며 그 중 생물비료산업은 약 62%로 가장 큰 비중을 차지하고 있다. 국내 미생물 산업 시장규모는 2010년 기준으로 7,714억 원으로 추정되며 발효식품시장을 포함하면 약 4조 5천억 원이 넘을 것으로 예상되고 있다.
출처: 한국미생물학회, 미생물유전체 R&D 2단계 추진계획
[그림 3-67] 농업분야의 미생물 관련 세계 산업 시장규모
특히, 우리나라 기업들은 오랫동안 개발하여 확보하고 있는 전통 발효식품관련 기술을 바탕으로 식품 및 사료용 아미노산의 세계시장 점유율은 약 30%에 이르고 있는데, 이 분야에서 미생물 유전체연구를 접목하게 된다면 멀지 않은 미래에 세계적으로 다양한 산업 분야에서 경쟁력을 확보할 수 있을 것으로 기대된다. 특히 토종 우수미생물균주 발굴 및 개발, 미생물을 활용한 산업용 효소 대량생산, 유용대사물질 생산 등에 집중 투자한다면 보다 높은 수준의 세계 시장점유 및 기술력을 확보할 수 있을 것으로 기대된다.
나. 농생명 소재 연구
(1) 개요
농생명소재는 ‘농생명자원에 생명공학기술을 융복합하여 새로운 부가가치를 창출한 산업소재 또는 농생명산업에 활용 가능한 소재’로 정의하고 있다(농림축산식품부, 2017). 인류는 벼, 밀 등의 식량자원 뿐 아니라 오랜 기간 병을 고치는 천연약재 등을

출처: 농림축산식품부, 2011
[그림 3-68] 생명자원소재산업 시장 규모 및 전망
자연으로부터 확보해 왔으며 지구상에 널리 분포하고 있는 다양한 생명자원들은 다양한 기능과 가치를 가진 소재로 개발될 가능성을 가진다고 볼 수 있다. 특히 생물다양성협약(나고야의정서)에 의하여 각국이 자국의 생물자원들에 대한 권리를 가지게 됨으로써 자원에 대한 확보, 이동이 어렵게 된 현 상황에서 자국의 우수한 생물자원을 발굴하고 첨단기술을 접목하여 독보적인 소재로써 가치를 창출해 가는 것이 바이오산업의 육성과 경쟁력에 직결된다고 하겠다. 농식품부에 따르면 화학산업시장 규모 대비 생명자원소재산업의 시장규모가 2025년경 약 40%를 차지할 것으로 전망하고 있다.
(2) 해외 동향
우리나라 뿐 아니라 글로벌 시장도 건강, 환경기능성 제품에 대한 소비자들의 선호도가 높아가는 추세에 따라 기존 석유화학기반 소재가 바이오소재로 대체되고 있는 경향이다. 미국은 정책적으로 2012년 바이오경제의 잠재력을 극대화하기 위한 목적으로 ‘National Bio-Economy Blueprint’를 발표하였고 바이오의료 R&D 예산은 국방예산을 제외하고 가장 많은 투자(전체 R&D 예산 중 23.4%)가 이루어지고 있다. 또한 바이오기반 제품을 우선 구매하는 프로그램(BioPreferred)을 동원하여 정부차원에서 시장을 창출하려는 노력을 기울이고 있다. 가까운 일본의 바이오정책은 저출산, 고령화 사회에 대응하고 지속가능한 사회형성 정책으로 세계 최첨단 헬스 및 건강 기술 실현을 위하여 바이오산업의 개혁을 추진 중인데 2030년까지 바이오산업 관련 시장을 지금의 6배인 약 182조 원 규모로 육성하려는 목표를 수립하였고 농업, 에너지, 재생의료, 농생명 소재 개발 기업지원 등을 확대 해 나갈 계획이다.
또한 세계의 바이오소재 산업 점유율은 미국 등 아메리카 지역이 전체 산업체의 44.5%, 유럽 28.8%, 오세아니아 24% 등으로 집계되고 있다(Marketkine, Global biotechnology, 2015.2.). 농생명소재산업 분야의 세계시장 규모는 2015년 기준 기능성 식품분야가 약 61%로 가장 높은 시장 점유율을 차지하고 있고 천연바이오화장품이 약 21%로 큰 시장을 점유하고 있다.
|
산업 분류 |
시장점유율 |
|
|
기능성 식품 |
60.6% |
|
|
천연 바이오 의약품 |
1.6% |
|
|
천연 바이오 화장품 |
20.8% |
|
|
천연 바이오 비료 농약 |
1.0% |
|
|
바이오 플라스틱(섬유) |
3.5% |
|
|
바이오 사료 |
0.5% |
|
|
기타 농생명 소재 산업 |
12.0% |
출처: Datamonitor
[그림 3-69] 2015년 기준 산업분야별 농생명소재산업 세계 시장 점유율
(3) 국내 현황
우리나라에서는 오래 전부터 고서나 구전으로 전해 내려오는 전통지식 기반의 농생명자원 활용이 이루어져 왔다. 정부의 소규모 R&D 지원으로 민간에서 기능성 식품, 화장품 등을 개발하여 왔지만 원료를 확보하고 있는 농업 기반 기업의 영세성, 자금력 부족 등으로 인해 시장에 확산되지 못하고 우수 소재들이 충분히 그 가치를 발휘하지 못하고 있다. 몇 가지의 성공사례 조차도 소재 원료의 대량 생산 및 확보의 어려움과 함께 원료의 유효성분을 과학적으로 분석하여 표준화한 매뉴얼이 부재하여 실질적으로 산업화되어 시장을 창출한 경우는 많지 않은 실정이다.
이에 농림축산식품부는 2014년도에 세계 5대 농생명 자원강국 실현을 목표로 ‘제2차 농업생명자원 기본계획’을 발표하고 제도개선, 통합 DB 구축(BRIS) 등 인프라 조성과 지속적인 R&D 투자에 노력하고 있으며 농생명자원의 생산 및 이용을 통해 국가 차원의 전략적 R&D 투자 확대를 위해 새로운 영역의 기술개발투자를 위한 대형 R&D 프로그램을 기획 중이다. 그간 농생명자원을 활용한 기능성 식품소재, 의약소재, 생활소재 등이 지속적으로 개발되어 왔으나 일부 민간 대기업의 자체개발 소재 외에는 글로벌 시장을 점유할만한 고부가가치 스타 소재의 개발은 미흡하였으며 소재의 다양한 기능성을 밝히기 위한 노력들은 미미하였다.
따라서 우리나라에서 자생 또는 농업기반으로 생산되고 있는 다양한 생물자원의 고부가가치 기능성을 밝히고, 보다 우수한 생물소재를 지속적으로 발굴하며, 첨단과학기술을 접목한 유효성분의 분리, 천연물질의 대량생산 시스템 구축 등에 힘써야 한다.
(4) 발전 과제 및 전망
세계적인 추세와 우리나라의 고령화 사회구조 및 웰빙 트렌드로 인하여 국내 농생명소재산업 부문별 현황을 보면 기능성 식품 생산액은 2014년 대비 2015년 약 16억 달러로 11.8% 증가하였으며 35개 주요 제약기업의 238개 파이프라인 중 55개가 천연물신약(23.1%) 개발을 목표로 연구개발 중이나 이 분야에서 선진국인 미국과의 기술격차는 4년 이상(2014년 기준)으로 추정되고 있어 다양하고 기능성 높은 농생명자원을 활용한 식의약 소재 부분에 대한 집중적인 투자와 연구개발이 이루어져야 할 것이다.
또한 밝혀진 생명자원의 기능성을 첨단기술을 접목하여 보다 시장 친화적인 활용처와 생산단가 등에서의 경쟁력을 확보하고 국내 시장 뿐 아니라 글로벌 시장에서 경쟁력을 확보할 수 있도록 지속적인 관심과 지원이 필요하다.
다. 첨단 농산업연구
(1) 첨단 농산업 글로벌 동향
최근 세계적으로 농업에 대한 관심이 높아지는 가운데 관련 산업계의 변화가 두드러지게 나타나고 있다. 농산업(농화학, 종자산업 등)의 규모는 2014년 1,000억 달러에서 2020년 1,400억 달러 이상으로 연간 6% 이상 성장할 것으로 예상(노무라증권)하고 있으며 미국의 경제전문지 포브스도 향후 10년간 가장 유망한 6개 투자분야의 하나로 농업을 선정하였다. 세계적인 투자의 귀재인 짐 로저스는 2017년 한국 방문 때 강연을 통하여 한반도가 통일이 되면 전 세계에서 가장 희망적인 투자국이라는 평가를 했으며 특히, 1순위로 투자하고자 하는 분야가 ‘농업’이라고 언급한 바 있다 (KBS, 2017.8.11.방송).
이와 같이 농업이 첨단산업화 되고 있는 추세는 국내 뿐 아니라 전 세계적인 트렌드이며 향후 폭발적으로 증가하는 아시아 국가와 아프리카 국가들의 인구를 먹여 살리기 위한 농림축산업의 역할은 매우 중요하다고 볼 수 있다. 첨단농산업분야에서 무엇보다도 중요한 것은 연관 타기술 분야에서 개발한 우수한 기술들을 농업분야에서 어떻게 적절히 적용하여 최대의 효과를 이끌어낼 것인가가 관건이다.
(2) 해외 산업계 동향
최근 몇 년간 세계적인 다국적 기업들, 특히 화학기반의 농약회사 또는 제약기업들이 농업분야의 종자회사 등을 합병, 인수하여 투자를 확대해 나가는 추세를 감지할 수 있다. 독일의 바이엘(Bayer)사는 세계 최대 종자회사인 몬산토(Monsanto)를 인수(2016년 9월)하여 유전자변형 종자 시장의 점유권 확대, 유전자가위를 활용한 정밀 육종 신기술의 기술특허와 상용화를 통해 시장을 선점하고자 하고 있다. 또한 무서운 속도로 성장하고 있는 중국의 기업 중 켐차이나(Chem China)는 2017년 4월 약 49조 원에 신젠타(Syngenta)를 인수하여 미국과 유럽연합으로부터 승인을 획득, M&A를 진행 중이다.
최근 식량이 국가의 중요한 안보문제로 부각되면서 해외 각국은 생산량이 높고 병충해에 강한 종자를 확보하기 위한 정책을 추진 중이다. 특징적인 것은 화학회사, 제약기반의 기업들이 농업기반의 종자회사, 식물보호제 회사 등과의 M&A를 적극 추진하고 있다는 것이다.
(3) 국내 기술도입 현황
정부는 육종분야의 첨단기술 접목을 위해 2000년대 중후반, 주요 품종에 대하여 ‘DNA 마커개발’을 통한 전통육종 기간의 축소를 목표로 ‘분자마커사업단’을 지원하여 각 품목에서 우수한 형질관련 유전자를 가진 품종을 개발하는데 필요한 육종 시간을 단축하고자 노력하였다. 이미 글로벌 기업인 몬산토, 신젠타 등에서 분자육종으로 개발한 신품종 유전자변형 종자 제품들이 시장을 점유하고 있었지만 적어도 채소육종 분야에서는 경쟁력을 가질 수 있는 계기가 되었다.
2010년 무렵부터 등장한 ‘식물공장’의 개념은 최근 여러 농산업분야에 적용할 수 있는 포괄적인 농업 개념으로서 ‘스마트 팜’이라는 영역으로 포함되었다. 스마트 팜에는 시설원예, 시설축산 등이 포함되는데 시설원예에서 스마트 팜 ICT 제어기술 수준이 가장 높은 것은 딸기, 토마토, 포도 등이며 축산분야에서는 낙농과 양돈분야에서 기술접목 수준이 높은 편으로 나타났다(농촌경제연구원, 2016). 스마트 팜의 도입효과 및 경제성은 초기 시설투자비가 높기 때문에 품목당 손익분기점을 보면 토마토 5∼6.2년, 딸기 4.1∼4.5년, 양돈 5.5년 등으로 조사되었다(농촌경제연구원, 2016).
(4) 발전 과제
첨단농산업 구현을 위한 기술접목의 예로는 최근 국내외에서의 드론을 활용한 정밀농업 시도, 기후변화 등 급격한 환경변화에서 다양한 개념과 형태의 식물공장, 스마트축사 등 스마트팜이 지속 가능한 농법으로 제시되고 있다. 정밀농업에 접목되는 기술은 위성, 혠, 드론, 빅데이터, 인공지능 등 현대의 IT 기술들이 모두 접목될 수 있는 분야이며 일부는 이미 현장에서 시도되고 있다.
또한 오랫동안 이슈가 되어온 유전자 변형 기술은 이미 시장에서 생산성의 혁신을 가져왔지만 식품, 먹거리의 안전에 대한 소비자들의 신뢰를 얻지 못한 이유로 많은 생산 농산물이 가축의 사료 등으로 이용되고 있다. 이런 면에서 최근 알려진 CRISPR/ Cas9(유전자가위) 기술을 육종분야에 적용한 사례는 매우 고무적이며 국내에서도 활발히 진행 중인 작물유전체 해독 및 분석이 완료된 후 우선적으로 적용하여 활용이 가능한 기술 중 하나가 될 것으로 전망한다.
2. 축산
가. 축산 연구의 개요
체세포를 난자의 핵과 치환하는 체세포 복제 방법으로 복제양 돌리(1996년)가 생산된 이후로 목표유전자가 넉아웃 된 세포주를 공여세포로 활용하여 넉아웃 된 중대가축 개발이 가능해졌다. 이 기술은 이종이식용 돼지를 개발하는데 크게 기여하여, 원숭이에 이 돼지의 장기를 이식했을 때 나타나는 거부반응을 억제시킬 수 있었다. 최근에는 유전자를 쉽고 효과적으로 편집할 수 있는 CRISPR/Cas9(Clustered Regulatory Interspaced Short Palindromic Repeat-CRISR Associated Protein 9) 방법이 확립되어 유전적으로 좀 더 사람과 가까운 돼지의 개발이 가능해졌다.
이 같은 기술의 진보는 축산이 동물성 단백질을 제공하는데 제한되지 않고 더 높은 가치를 창출할 수 있는 산업으로 패러다임 전환을 가능하게 해줄 수 있을 것이다. 실제로 관리자의 안전과 가축의 상해 방지를 목적으로 뿔이 없는 젖소가 개발되었고, 생식기호흡기증후군(Porcine reproductive and respiratory syndrome, PRRS)과 같이 돼지 산업에 치명적인 손상을 입히는 고전염성 질병을 억제시키기 위한 돼지가 개발되었다. 또한 이미 오래전부터 생쥐는 모든 사람의 질병을 재현하는 모델이 될 수 없다고 알려져 이의 해결 방안으로 사람과 생리・해부학적인 관점에서 더 유사한 돼지를 활용하는 방안이 제시되었으며 사람 암 모델, 퇴행성 질환 모델 돼지 등이 개발되었다.
유전자 기능제거 및 돌연변이를 만들 수 있는 유전자 편집 기술인 CRISPR/Cas9 시스템은 가축의 유전형질을 전환시키기 위하여 유전자가 도입된 공여세포를 체세포복제 방법으로 복제하는 정교한 기술 없이 목표유전자의 guide RNA와 Cas9 단백질을 수정란에 미세 주입하는 방법으로 목표유전자의 서열을 변경한 돼지를 개발하는 수준까지 발달하여, 이 기술을 적용한 가축의 개량이 가속화될 것으로 전망된다.
나. 해외 동향
(1) 사람 의료용 가축 개발
미국은 이종이식 돼지 개발과 개발된 돼지의 장기를 원숭이에 이식하는 전임상 연구를 활발하게 수행하고 있는 국가로서 임상 연구 및 시장 진입에 대비하여 산업체에서 투자를 시작하였다. 돼지를 이종이식 소재로 활용하기 위해 반드시 극복해야 할 초급성 거부반응 원인 유전자인 α-1,3-galsctosyltaransferase(GGTA)가 넉아웃 된 돼지도 미국에서 최초로 개발되었고, 이에 추가로 급성 혈관성, 세포성 거부반응 억제 유전자가 도입된 다양한 복합형질전환 이종이식용 돼지들이 개발되고 있다.
최근에는 미국의 생명공학 기업인 ㈜Revivicor사가 돼지의 개발 및 이종이식 전임상 연구를 실시하여 돼지의 심장을 바분원숭이에 이식한 결과, 945일 동안 생존하였고, 신장을 이식한 원숭이는 136일 동안 생존하는 연구 결과를 보고하였다. 세계 최고의 돼지 생산기업인 Smithfield사도 2017년에 이종이식을 위한 돼지개발에 투자하기로 결정하고 생명공학 유닛을 창설하여, 미국 국방부에서 조성한 8,000만 달러 규모의 공-사 조직공학 컨소시엄에 참여한다고 발표하였다.
또한 최근에 이종이식 시 돼지에 존재하는 내인성레트로바이러스(Porcine Endogenous Retrovirus, PERV)의 인체 감염에 대한 위험성을 해결하기 위하여 미국 메사추세추 의과대학의 George Church 박사가 벤처 기금 3,800만 달러로 설립한 ㈜eGenesis에서 중국의 Yunnan 농과대학과 공동으로 CRISPR/Cas9 시스템을 활용하여 PERV유전자를 완전히 제거한 돼지를 개발하였다.
미국과 더불어 이종이식을 위한 돼지개발 연구를 활발히 진행하고 있는 국가는 독일이다. 독일 연방 소속의 프레드리히 뢰플러 연구소(The Friedrich-Loeffler-Institute) 산하 기관인 가축 유전학연구소(Institute of Farm Animal Genetics)와 뮌헨 대학교에서 주도적으로 연구를 수행하고 있다. 돼지의 ROSA26 유전자에 거부반응 억제 유전자 Heme Oxygenase 1(HO-1)과 CD55를 연속적으로 도입한 복합 형질전환 돼지를 생산한 후, CRISPR/Cas9 유전자 편집 시스템을 활용하여 GGTA 유전자와 Cytidine Monophospho-N-acetylneuraminic Acid Hydroxylase(CMAH) 유전자가 동시에 완전 제거된 복합형질전환 돼지를 개발하였다. 특히 독일에서는CRISPR/Cas9 유전자 편집기능을 가진 유전자를 직접 돼지 수정란에 미세 주입하여 GGTA 유전자가 완전히 제거된 돼지를 개발하여, 넉아웃 돼지 생산 효율을 크게 증진시키는 기술적인 진보를 선보였다.
생쥐와 같은 소형동물에서 질환모델 동물이 개발되어 치료방법, 치료제 개발 등의 발전에 기여해왔지만, 일부 질환의 경우 생쥐 모델의 표현형과 사람 환자의 증상이 달라 다른 종류의 동물모델 개발이 요구되고 있다. 2008년 미주리 주립대학교에서 최초로 낭포성 섬유증 모델 돼지가 개발되었고, 그 표현형이 사람 환자의 증상과 동일하다고 보고된 이래, 돼지가 질환 모델 동물로 각광 받고 있다. 2016년에는 독일 뮌헨 대학교에서 대부분의 암 환자에서 발견되는 유전자의 돌연변이와 동일한 TP53과 KRAS 유전자 돌연변이에 MYC 유전자가 발현되는 돼지를 개발하여 뼈에서 발생하는 악성종양인 골육종(Osteosarcoma) 모델 돼지를 개발하였다. 일본의 메이지 대학교는 골격계에 이상을 초래하는 우성 유전병인 Marfan syndrome 모델을 개발하기 위하여 그 원인 유전자인 fibrillin-1의 돌연변이를 모사한 돼지를 개발하여 실제 사람 질환과 동일한 표현형을 나타낸다고 보고하였다. 미국의 메릴랜드 대학교에서는 정자 형성과정 연구와 남성 불임 연구를 목적으로 정소의 발달은 정상이지만 정자가 발생하지 않은 모델 돼지를 개발하였다. 이 연구팀은 돼지 NANOS2 유전자의 guide RNA와 Cas9 단백질을 돼지 수정란에 미세 주입하여 NANOS2 유전자의 기능이 제거된 돼지를 개발하였다.
(2) 가축 경제 형질 개량
가축은 오랜 기간 생산성을 향상시키는 방향으로 개량되어 왔다. 그런데, 일부 바이러스에 의해 발생하는 질병은 생산성을 크게 저해시키는 작용을 한다. 돼지의 대표적인 질병은 PRRS로, 이 질병에 걸리면 반복 유산과 같은 번식 장애와 태어난 자손들의 폐사율이 크게 증가한다. 바이러스 감염에 의해 발생되는 이 질병은 현재까지 치료 방법이 없다. 이 질병을 방지하고자 영국의 로슬린연구소와 미국의 미주리 주립대학교에서는 PRRS 바이러스의 수용체로 알려진 CD163 유전자의 기능을 CRISPR/ Cas9 시스템을 활용하여 제거한 돼지를 개발하였다. 또한 중국의 Northwest agricultural and forestry 대학교에서 우리나라의 제2종 법정 가축전염병의 하나이며, 인수공통전염병인 결핵균의 침입을 막을 수 있는 소를 개발하였다. 이 소는 CRISPR/Cas9 유전자 편집기능을 활용하여 Natural resistance-associated macro-phage protein-1 유전자가 도입된 것으로, 결핵균을 접종했을 때 전염이 크게 감소하였다.
돼지의 경제 형질 중의 하나인 근육 생산량을 증가시키기 위하여 일본의 메이지 대학교에서는 근육형성을 저해하는 Myostatin 유전자를 제2세대 유전자 편집기술인 Transcription Activator-Like Effector Nuclease(TALEN) 방법으로 제거한 돼지를 개발하여, 근육이 170% 증가하였다고 보고하였다.
미국에서는 관리자의 안전과 가축간의 사고 예방을 목적으로 매년 젖소의 80%가 인위적으로 뿔을 제거하고 있으며, 육우의 경우 뿔이 없는 방향으로 육종되고 있는데, 그 형질은 우성 POLLED 유전자 때문이라고 알려져 있다. 미국의 생명공학회사인 ㈜Recombinetics에서 TALEN 방법으로 젖소에 POLLED 유전자를 도입하여 뿔이 없는 소를 개발하였다.
다. 국내 현황
국내에서는 생명공학기술을 활용한 형질전환 가축 개발 연구가 농촌진흥청 차세대바이오그린21사업과 국립축산과학원에서 질환 모델과 이종이식용 돼지 개발을 제한적으로 수행하고 있다.
이종이식에 활용할 돼지를 개발하기 위하여 국립축산과학원에서는 기존에 개발된 GGTA 유전자 제거와 동시에 보체 조절단백질(Membrane cofactor protein, MCP)을 발현하는 돼지(GGTA KO+MCP, 믿음이)와 혈액 응고를 억제시키기 위해 개발된 돼지 CD73(소망이) 간의 교배를 통해 3개의 유전자가 조절된 돼지를 개발하였다. 또한 GGTA 유전자의 기능이 완전히 제거되었다 하더라도, 약한 수준에서 Gal 항원이 발현되는데 이의 원인유전자인 isogloboside 3(iGB3)를 믿음이 세포에서 추가로 넉아웃 시킨 돼지를 개발하였다. 한편 국립축산과학원에서 개발된 믿음이 돼지의 심장과 각막을 건국대학교 병원과 공동으로 cynomolus monkey에 이식하여 각각 60일, 234일 생존하는 결과를 발표하였다. 체세포복제로 이종이식에 활용할 돼지를 개발하기 위해서는 공여세포 제작과정에서 유전자가 도입된 세포의 선별이 필요하여 항생제 저항성 유전자도 도입하기 때문에 실제 임상에 적용시 환자에게 사용할 수 있는 항생제 사용이 제한되게 된다. 이를 방지하기 위하여 국립축산과학원은 한국생명공학연구원, 충북대학교와 공동으로 항생제 유전자를 사용하지 않고 GGTA 유전자 기능을 제거한 돼지를 개발하였다. 국내 대표적인 생명공학 기업인 ㈜옵티팜에서는 차세대바이오그린21사업으로 GGTA 유전자 좌위에 혈액 응고 억제 단백질의 하나인 CD39 유전자가 도입된 돼지를 개발하였다. 서울대학교는 염증 반응과 허혈성 반응을 억제시키기 위한 soluble human Tumor Necrosis Factor Receptor 1(shTNFR1)과 HO-1을 동시에 발현하는 돼지를 개발하였고, 이 돼지의 세포에 2세대 유전자 편집 시스템인 TALEN 방법으로 GGTA 유전자와 CMAH 유전자의 기능을 완전히 제거한 돼지를 개발하였다.
국내 질환 모델 가축 개발 연구는 퇴행성 신경계 질환 모델을 목적으로 수행되고 있다. 국립축산과학원은 제주대학교와 공동으로 알츠하이머 질병의 원인 물질이라고 알려진 3개의 유전자(Amyloid precursor protein, tau, Presenilin 1)가 동시에 도입된 질환 모델 돼지를 개발하였다. 또한, 국립축산과학원과 중앙대학교, 경북대학교와 공동으로 파킨슨 질환 유발 유전자 2개(PTEN-induced putative kinase1, alpha- synuclein)를 동시에 발현하는 개 모델을 개발하였다. 경상대학교에서는 feline APOBEC3H(fA3H)와 fA3CH 유전자를 CRISPR/Cas9 유전자 편집 기술을 활용하여 AIDS 모델 고양이를 개발하였다.
[표 3-33] 국내 생명공학 기술을 활용하여 개발된 가축 현황
|
연도 |
개발기관명 |
가축 |
변형 유전자명 |
개발 목적 |
|
2016 |
서울대학교 |
돼지 |
APP 발현 |
알츠하이머 질환 모델 |
|
2016 |
국립축산과학원 |
돼지 |
APP, tau, Presenilin 1 발현 |
알츠하이머 질환 모델 |
|
2016 |
국립축산과학원 |
개 |
PINK1, alpha-synuclein 발현 |
파킨슨 질환 모델 |
|
2016 |
국립축산과학원 |
돼지 |
GGTA 넉아웃, MCP, CD73 발현 |
이종이식 |
|
2016 |
서울대학교 |
돼지 |
GGTA, CMAH 넉아웃, shTNFRI와 HO-1 발현 |
이종이식 |
|
2016 |
㈜옵티팜 |
돼지 |
GGTA 넉아웃, CD39 발현 |
이종이식 |
|
2016 |
경상대학교 |
고양이 |
fA3H, fA3CH 돌연변이 |
AIDS 모델 |
라. 전망
중국에서는 일반 돼지의 각막을 사람 환자에게 이식하는 것을 승인하였고, 미국에서 임상 실험 중인 일반 돼지의 피막화 췌도의 경우도 러시아와 같은 몇몇 국가에서는 이미 승인되었다고 알려져 있다. 그러나 이종이식의 안정성을 고려하여 거부반응이 유전적으로 제어된 돼지가 향후 임상에 활용될 가능성이 더 크다. 이종이식 연구를 선도하고 있는 미국의 경우 산업체에서 돼지 개발과 원숭이에 돼지의 조직 및 장기를 이식하는 연구를 주도하고 있어 상용화 가능성이 점차 커지고 있다.
돼지의 장기를 원숭이에게 이식할 때 발생하는 거부반응이 복잡하여 GGTA 유전자 기능 제거 돼지를 포함하여 이를 부분적으로 제어하기 위한 다양한 종류의 돼지가 개발되었고, 원숭이에 이종이식 연구를 통해 제어 효과도 검증되었다. 향후 이종이식을 위한 새로운 유전자가 도입된 돼지 개발보다는 기존에 개발된 돼지 간 교배, 또는 그 돼지의 체세포에 이미 검증된 거부반응 제어 유전자를 추가한 돼지가 개발될 전망이다.
물론 이 경우 임상적용에 대비하여 유전자의 교정과정을 거쳐 동일한 유전자라 할지라도 안정성과 효율성을 증가시킨 돼지가 개발될 것이다. 한 예로 독일에서는 기존에 개발된 HO-1유전자와 CD55 유전자가 염색체에 무작위로 도입된 돼지와 별개로 이 유전자들을 ROSA26 유전자 좌위에 동시에 도입한 형질전환 돼지를 개발하였고, 추가로 GGTA와 CMAH 유전자 기능이 완전히 제거된 돼지를 개발하였는데, 이러한 방식으로 유전자 조절이 개선된 이종이식을 위한 돼지가 개발될 것으로 예상된다.
목적으로 하는 유전자의 guide RNA와 Cas9 단백질을 수정란에 미세 주입하는 방법으로 유전자 돌연변이 가축이나 기능이 제거된 가축의 생산이 가능해져 유전자의 형질을 변형시킨 가축 개발의 효율이 매우 크게 개선되었고, 우리나라를 포함하여 전 세계에 이 기술을 제공하는 기업이 증가하고 있다. 이러한 이유로, 질환 모델 개발, 가축 형질 개량 등 아이디어만 있다면 목적에 맞는 가축의 개발이 보다 수월해 질 것으로 판단된다. 특히 중개 연구를 위한 질환 모델로서 돼지와 개의 개발이 가속화 될 것으로 예상된다.
생명공학 산업을 주도하고 있는 미국에서 최근 뿔 없는 젖소를 개발한 것에 주목 할 필요가 있다. 미국에서 홀스타인과 같은 젖소와는 다르게 앵거스와 같은 육용 소는 오랜 기간 동안 뿔이 없는 소를 선발하는 육종 프로그램에 적용하여 뿔 없는 소로 유전형을 고정하였기 때문에 75%의 뿔이 없는 소가 시장에서 판매되고 있다. 이는 생명공학 기술을 활용하면 단기간에 가축의 경제 형질을 바꿀 수 있다는 것을 의미하며, 향후 생산성이 크게 향상되고 급속도로 전염되는 바이러스에 대한 질병에 저항하며, 관리가 편한 가축 등 형질이 크게 개량된 가축이 개발될 것으로 기대된다.
3. 식품
가. 개요
식품산업은 농・축・수산물을 가공 생산하여 국민에게 먹거리를 공급하는 분야이다. 최근에는 건강 유지 및 만성질환 예방을 위한 식품의 기능적 역할이 확대됨에 따라 전통적 식품관련 기술과 첨단 생명공학 기술의 융복합이 가속화되고 있다. 이런 추세는 식품의 소비패턴을 변화시킬 뿐 아니라, 식품산업을 부가가치가 높은 미래 유망산업으로 부상시키는 기반이 되고 있다.
식품산업의 성장 가능성을 예측한 세계 주요 국가들은 식품산업을 국가 성장 동력 산업으로 분류하고 지속 성장의 확보와 글로벌 경쟁력을 강화하기 위해 관련 규정을 정비하고 있으며 국가 R&D 지원에 주력하고 있다. 또한 글로벌 기업들도 자체 R&D 투자를 확대하고 시장 선점에 나서고 있다.
특히 첨단 생명공학 기술이 적용되는 대표적인 고부가가치 식품산업 분야로는 기능성식품과 발효식품이 있다. 기능성식품은 동식물 및 미생물을 원재료로 사용하여 건강에 유효하게 작용하도록 설계한 식품이다. 사회가 고령화되면서 식품을 통한 건강유지에 관심이 증대되고 있으며, 국가는 만성질환 증가로 인한 의료재정의 압박을 해소하기 위한 방안으로 기능성식품을 정책적으로 지원하고 있다. 그러나 기능성식품 산업은 국가별로 다른 법률 체계와 규정을 가지고 있으므로 최신 생명공학기술 뿐 아니라 각국의 법률 체계와 관리 시스템에 대한 이해 등 보다 전문화된 역량이 필요한 분야이다.
발효식품은 미생물을 이용하여 농축수산물 성분을 원하는 대사물질로 전환시켜 만들어지는 식품이다. 전통식품의 대부분은 발효식품으로, 전통지식과 자원에 대한 종주권을 주장할 수 있는 중요한 분야이므로 첨단 생명공학 기술을 적용하여 과학화 하는 전략이 강조되고 있다. 전통 발효식품 외에 1)아미노산, 핵산, 유기산 및 그 유도체 등의 1차 대사물질, 2)항생물질, 색소, 독소, 알카로이드 등의 2차 대사물질, 3)프로바이오틱스, 비타민, 당류 등 건강소재, 4)효소류, 그리고 5)바이오 에너지 등 발효로 만들어지는 제품은 매우 다양하다.
인구 고령화는 만성질환의 높은 유병률과 관계가 있으므로, 생명공학 기술을 융합한 새로운 식품산업 분야로 환자용 식품이 각광받고 있다. 환자용 식품은 메디칼푸드(medical food), 특수의료용도식품 등의 이름으로 규제되고 있다. 환자용식품이란 일반적인 식사를 섭취, 소화, 흡수, 또는 대사하기 어려운 환자들이나 질병으로 인해 일반인과는 다른 영양섭취가 필요한 환자들을 대상으로 식사의 일부 또는 전부를 대신할 목적으로 설계된 식품이다. 정상적인 음식 섭취가 어려운 경우에는 튜브를 사용하여 소화기관에 유동식을 공급하거나 정맥에 영양액을 넣어주는 경장영양식(enteral nutrition food)도 이에 포함된다.
나. 해외동향
(1) 식품산업 현황
세계 국가들은 식품산업의 새로운 가치에 주목하여 식품산업의 육성과 고부가가치를 통해 국제 경쟁력 확보를 꾀하고 있다. 2015년 기준 세계 식품 시장의 규모는 약 5조 6,000억 달러로 이미 정보통신기기 및 자동차 시장을 합한 것 보다 크다. 연평균성장률은 4.2%로 꾸준히 증가하여 2018년이 되면 6조 3,000억 달러 규모에 도달할 것으로 예상된다. 국가별로는 미국이 시장 점유율 19%로 세계 1위를 점유하여 왔으나, 2015년부터는 중국의 식품 시장 규모가 1조 달러가 넘어서면서 현재까지 계속 세계 최대의 식품 시장으로 자리매김하고 있다. 우리나라의 식품 시장 성장률은 3.5%로 이는 세계 식품 시장 성장률보다 낮은 수준이며, 세계 식품 시장 점유율은 1.2% 수준에 불과하다. 대륙별로는 유럽이 가장 규모가 컸으나, 중국의 식품시장 규모가 계속 커짐에 따라 아시아-태평양 지역이 세계 최대 식품시장으로 우뚝 서고 있다. 그 다음은 미국과 캐나다를 합친 북미 그리고 중남미의 순서이다. 중동과 아프리카는 가장 규모가 작은 시장을 형성하고 있다.
[표 3-34] 세계 식품 시장의 규모
(단위 : 억 달러, %)
|
구분 |
2015 |
2016 |
2017 |
2018 |
증가율 |
|
세계 |
55,639 |
5,7882 |
6,0308 |
62,910 |
4.2 |
|
아시아-태평양 |
19,482 |
20,674 |
21,966 |
23,380 |
6.3 |
|
-중국 |
11,040 |
11,967 |
12,979 |
14,084 |
8.5 |
|
-일본 |
3,336 |
3,342 |
3,344 |
3,353 |
0.2 |
|
-한국 |
689 |
712 |
738 |
765 |
3.5 |
|
유럽 |
18,471 |
18,916 |
19,396 |
19,883 |
2.5 |
|
북미 |
11,235 |
11,434 |
11,624 |
11,795 |
1.6 |
|
중남미 |
5,491 |
5,860 |
6,282 |
6,765 |
7.2 |
|
중동 |
959 |
998 |
1,040 |
1,087 |
4.3 |
자료: Datamonitor
생활습관의 변화를 반영해 식품산업 트렌드도 변화되고 있다. 최근 글로벌 식품산업이 주목하고 있는 키워드는 ‘개인화’와 ‘고령화’이다. 이는 여성의 경제활동 참여 그리고 노인 인구와 1인 가구의 비중이 점차 커짐에 따라 소비자의 취향이 고급화, 편의성, 안전성, 기호 다양성을 추구하게 되었기 때문이다. 이런 트렌드를 반영하여 미국, 유럽, 중국, 일본, 그리고 우리나라를 포함한 세계 시장에서 폭발적인 성장률을 기록하고 있는 새로운 식품 시장으로는 가정간편식(Home Meal Replacement, HMR) 시장 그리고 클린라벨(Clean Label) 제품 시장이 있다. 특별히 웰빙 트렌드를 합친 고품질의 HMR 개발 그리고 화학적 첨가물이 없는 클린라벨 제품을 만들기 위해 필요한 천연 첨가물의 개발에는 생명공학 기술의 적용이 필수적이다.
(2) 기능성식품 현황
세계 기능성식품의 시장규모는 2015년 기준 1,179억 달러이며, 2020년에는 1,677억 달러의 규모로 성장할 것으로 전망된다. 지역별로 보면 세계 시장에서 가장 큰 규모는 미국으로 2015년 기준 386억 달러로 추정된다. 이어서 유럽, 일본, 중국 시장이 크다. 한국은 21억 달러 규모의 시장을 형성하여 세계 시장 점유율은 1.78%를 차지하고 있다. 이미 상당 수준에 도달한 선진국은 상대적으로 성장률이 둔화될 것으로 예상되고, 라틴아메리카, 동유럽, 아시아 등은 경제발전에 따른 소득의 증가로 선진국 대비 성장률이 높을 것으로 전망하고 있다.

출처: NBJ’s global supplement & nutrition industry report, Nutrition Business Journal, 2014
[그림 3-70] 세계 기능성식품 시장 규모 및 성장률
주요 국가별 기능성식품 산업 트렌드를 살펴보면, 미국은 스포츠 시장과의 연계, 어린이 시장의 확대, 맞춤형 제품 확대, 체중 및 식욕조절 제품의 성장, 자연식품에 집중하고 있다. 중국은 국민 건강의 중점을 치료가 아닌 예방에 두고 있으며, 칼슘 보충 그리고 면역력 강화, 항피로, 항노화, 혈중 지방 조절 등의 기능으로 집중되어 있다. 일본은 국가가 아닌 사업자가 식품의 기능과 안전성을 입증하면 건강 효과를 제품 표면에 표기할 수 있는 기능성표시식품제도를 2015년 새롭게 제정하였다. 이는 아베 정권의 성장전략의 일환으로 국민의 건강 증진에 기여할 수 있는 기업의 노하우를 이끌어내 경제를 활성화시키는 것을 목적으로 한다. 2017년 4월 기준으로 총 282개 제품을 승인하였다. 이 중 영양보충제는 135개 품목, 가공식품은 144개 품목, 신선식품은 3개 품목이다.
(3) 환자용 식품 현황
정확한 자료는 없지만, 환자용 식품의 세계 시장 규모는 2013년 93.6억 달러이며, 2018년에는 133.4억 달러로 성장할 것으로 추정하고 있다. 가장 큰 시장을 형성하고 있는 국가는 미국으로, 환자용 식품(medical food) 시장의 규모는 2014년 기준 48.9억이다. 주요 제조사는 애보트, 네슬레, 비브라운 등이며, 2010년 ‘오바마 케어’의 시행으로 환자용 식품에 대한 보험 적용 범위도 확대되면서 수요가 크게 증가하였다. 또한 소비자의 관심도가 높아지면서 유기농 원료의 사용 등 고급화 추세가 형성되고 있다.
일본의 환자용 식품의 경우 수량은 감소하고 있으나 금액은 지속적으로 증가하고 있다. 이는 일본의 고령층이 가진 경제력에 기인하는 것으로 보이며 주요 제조사는 모리나가, 크리니코, 메지, 네슬레 저팬, 테루모가 있다. 고령층이 계속 증가되면서 고령친화용식품으로 확대되고 있다. 유럽의 환자용 식품은 Commission directive 1999/21/EC에 의해 관리되고 있으나, 정의와 규제가 아직까지 명확하지 않다. 주요 제조사는 다농, 프레지니우스카비가 있다. 경장영양식에 대해서는 보험 적용이 보편화되어 있으나, 적용범위와 소비 형태는 국가별로 다르다.
(4) 발효식품 현황
발효식품 분야에서 각국은 전통식품을 기초로 하여 세계적 상품 개발을 목표로 하고 있다. 우리나라와 일본을 포함한 아시아 지역에서는 콩 발효 식품의 연구에 집중하고 있는 반면, 유럽을 중심으로 한 서구에서는 치즈, 와인, 맥주 등에 연구가 집중되고 있다. 일본은 종균 연구 등 기초 발효연구를 꾸준히 발전시킴과 동시에 연구시스템의 변화를 통해 전반적인 기술 수준을 크게 향상시켜왔다. 유럽은 투르푸드(Traditional United Europe Food: TRUEFOOD) 프로젝트로 전통식품 생산 시스템에 혁신을 도입하였으며, 그 결과 위생과 품질 수준을 향상시켰다. 미국의 대표적 음료기업 펩시코는 프로바이오틱 음료 제조사를 인수하여 발효식품 시장에 관심을 보이고 공격적인 발전계획을 세우고 있다.
글리신, 메티오닌, 시스테인, 발린을 제외한 대부분의 아미노산은 발효법으로 생산할 수 있다. 가장 많이 사용하는 균종은 코리네형 세균, 고초균, 대장균 및 세라샤균 등이다. 전통적인 균주 개량방법은 크게 발전하여 최근에는 원형질체에 대한 형질전환, 핵산셔플링, 대사공학, 마이크로어레이 등에 기초한 시스템적 접근이 사용되고 있다. 생산된 아미노산의 95% 이상은 식・사료용으로 사용되고 있으나 가격은 전체 아미노산의 50% 전후로 부가가치가 낮다. 반면, 의약용 아미노산은 양적으로는 5% 미만이지만, 금액으로는 25% 이상을 점유한다. 식료용 아미노산의 세계 최대 생산업체는 일본의 아지노모토사이다. 의약용 아미노산은 아지노모토, 쿄와발효, 렉심(데구사) 등 대부분 일본과 유럽에서 독점 생산되고 있다.
핵산조미료의 생산은 대부분 우리나라와 일본이 독점하였으나, 최근에는 중국, 미국, 대만이 생산에 참여하여 다국 경쟁체제를 구축하였다. 각국은 경쟁력 유지를 위해 제조원가 절감, 핵산 유도체 개발 등 다각도의 노력을 기울이고 있다.
발효로 생산되는 유기산은 초산, 젖산, 구연산, 후마르산, 주석산, 능금산, 글루콘산 등 70여종이 있다. 구연산의 세계 시장은 미국의 화이자와 마일스, 벨지움의 벤키샤 및 중국의 강소성 구연산제조창 등이 주도하고 있으며 우리나라는 전량 수입에 의존하고 있다. 젖산의 세계시장은 카길-다우케미컬이, 글루콘산은 일본의 후지자와사가 주도하고 있다.
발효로 생산한 효소의 특이성 증대, 신속한 반응, 부작용 제거, 활성 증대를 위해 유전공학 기법이 사용되고 있다. 아울러 제조원가 절감을 위해 효소 생산균의 유전자조작에 의한 개량과 배양 조건의 최적화도 주요 연구대상이 되고 있다.
다. 국내동향
(1) 식품산업 현황
2015년 기준 우리나라 식품 시장의 규모는 142.25조 원으로 최근 5년 연평균 성장률은 4.06%이다. 이는 국내총생산대비 2.98%의 수준으로 정보통신기기(5.25%), 자동차제조업(12.75%)에 비해 매우 낮은 수준이다. 생산액은 122.86조 원으로 전년 대비 1.10% 증가, 수출액은 6.97조 원으로 전년 대비 3.73% 증가, 그리고 수입액은 26.36조 원으로 전년 대비 8.29% 증가하여 수출대비 수입이 4배 이상의 규모인 것으로 나타났다.
고부가가치식품으로 주목받고 있는 식품 영역으로는 건강기능식품, 고령친화제품, 웰빙 전통식품, 친환경 편의제품 등이 있다. 건강기능식품과 편의성이 강조된 HMR 시장은 경쟁적으로 계속 성장하고 있으나, 상대적으로 고령 친화 제품에 대한 식품 산업계의 대응은 매우 미흡하다. 이는 고령친화식품에 대한 정부의 관리 소관이 명확하지 않고, 관련된 직접적인 제도가 없어서 기업들이 안정적으로 기업 활동을 할 수 없기 때문이다.

자료: 2016 식품의약품 산업동향통계, 식품의약품안전처
[그림 3-71] 연도별 식품산업 통계
(2) 건강기능식품 산업 현황
2015년 기준 건강기능식품 1.54조 원으로 최근 5년 연평균 성장률은 4.26%이다. 수출액은 0.09조 원으로 전년대비 35.05% 증가하였으며 수입액은 0.50조 원으로 13.11% 증가하였다. 그러나 여전히 수출에 비해 수입이 5∼6배 높은 것으로 나타났다. 2015년 건강기능식품 제조업체 수는 487개소로 작년 대비 6% 증가하였으며, 이 중 90%가 전문제조업체이다. 수입업체는 3,596개로 서울 지역에 전체의 58.1%가 위치하고 있다.
2016년 12월 말 기준으로 개별인정형 기능성 원료는 총 263종이며, 기능성 분야는 신체 부위별 건강유지(간, 위, 장, 관절/뼈, 눈, 질, 요로, 전립선, 체지방, 치아, 피부), 대사촉진(칼슘흡수, 항산화, 혈당, 혈압, 중성지방, 콜레스테롤, 혈행), 생애주기별 건강 유지(어린이 성장발육, 월경상태, 갱년기(남, 여)), 생리기능 정상 유지(과민피부상태, 긴장, 기억력, 면역, 배뇨, 수면, 정자운동, 운동수행능력, 인지능력, 피로)로 구분된다.

출처: 2016 식품의약품통계연보, 식품의약품안전처
[그림 3-72] 2011~2015 건강기능식품 산업 현황
2015년 건강기능식품 시장은 면역기능 개선 제품과 비타민/무기질 제품의 생산 큰 폭 상승 그리고 다양해지는 개별인정형 제품 개발로 특징된다. 품목별로는 비타민과 홍삼의 판매가 가장 많으며, 이어서 개별인정형 제품과 유산균의 비중이 높았다. 수출 상위 5개 품목은 프로바이오틱스, 홍삼, 개별인정형 제품, 인삼, 클로렐라의 순서이며, 총 수출액의 약 79%를 점유한다. 개별인정형 제품 중에는 당귀혼합추출물이 가장 많이 수출되었으며, 그 다음으로는 인삼가수분해 농축액, 헛개나무과병 추출분말, 피브로인효소 가수분해물, 피니톨의 순서로 많았다. 수입 상위 품목으로는 비타민/무기질 제품과 오메가3 지방산 제품이 있다. 수입국은 미국이 75.7%로 가장 많았으며, 이어서 캐나다>호주>중국>인도, 스페인>일본>프랑스, 뉴질랜드, 독일의 순서이었다.
[표 3-35] 건강기능식품 품목별 판매 현황: 국내 출하액 기준
(단위: 억 원)
|
품목명 |
2011년 |
2012년 |
2013년 |
2014년 |
2015년 |
|
홍삼 |
6,980 |
6,294 |
5,627 |
6,093 |
6,685 |
|
개별인정제품 |
1,419 |
1,790 |
2,296 |
3,128 |
3,123 |
|
비타민 및 무기질 |
1,555 |
1,622 |
1,726 |
1,397 |
2,041 |
|
프로바이오틱스 |
278 |
373 |
618 |
1,214 |
1,320 |
|
밀크씨슬 추출물 |
- |
- |
308 |
676 |
698 |
|
알로에 |
691 |
687 |
628 |
565 |
530 |
|
EPA 및 DHA 함유 유지 |
- |
- |
- |
- |
474 |
|
가르시니아캄보지아추출물 |
206 |
440 |
95 |
217 |
259 |
|
인삼 |
231 |
318 |
272 |
333 |
239 |
|
식이섬유 |
116 |
168 |
167 |
171 |
235 |
|
상위10개 품목 소계 |
11,476 |
11,692 |
11,736 |
13,793 |
15,605 |
|
기타 |
1,650 |
1,815 |
2,329 |
1,847 |
1,721 |
|
합계 |
13,126 |
13,507 |
14,066 |
15,640 |
17,326 |
출처: 2016 식품의약품통계연보, 식품의약품안전처
[표 3-36] 건강기능식품 품목별 수출액
(단위: 억 원)
|
순위 |
품목명 |
2011년 |
2012년 |
2013년 |
2014년 |
2015년 |
|
1 |
프로바이오틱스 |
126 |
146 |
186 |
175 |
258 |
|
2 |
홍삼 |
210 |
190 |
242 |
237 |
258 |
|
3 |
개별인정제품 |
16 |
17 |
28 |
48 |
72 |
|
4 |
인삼 |
151 |
132 |
195 |
93 |
68 |
|
5 |
클로렐라 |
27 |
51 |
56 |
54 |
58 |
|
6 |
비타민 및 무기질 |
6 |
24 |
20 |
19 |
37 |
|
7 |
알로에 |
1 |
0 |
1 |
10 |
30 |
|
8 |
N-아세틸글루코사민 |
8 |
8 |
10 |
12 |
30 |
|
9 |
식이섬유 |
- |
- |
- |
- |
26 |
|
10 |
가르시니아캄보지아추출물 |
1 |
- |
1 |
4 |
18 |
|
상위 10개 품목 소계 |
546 |
568 |
739 |
652 |
854 |
|
|
기타 |
20 |
16 |
15 |
18 |
50 |
|
|
합계 |
566 |
584 |
754 |
670 |
904 |
|
출처: 2016 식품의약품통계연보, 식품의약품안전처
[표 3-37] 건강기능식품 품목별 수입액
|
순위 |
품목명 |
수입량(톤) |
수입액(억 원) |
|
1 |
비타민 및 무기질 |
2,629 |
2,791 |
|
2 |
EPA 및 DHA 함유 유지 |
1,435 |
652 |
|
3 |
프로바이오틱스 |
198 |
519 |
|
4 |
개별인정형 |
558 |
432 |
|
5 |
단백질 |
1,232 |
205 |
|
6 |
밀크씨슬 추출물 |
90 |
124 |
|
7 |
알로에 |
217 |
120 |
|
8 |
귀리식이섬유 |
113 |
98 |
|
9 |
가르시니아캄보지아 추출물 |
284 |
96 |
|
10 |
스피루리나 |
231 |
89 |
|
상위 10개 품목 소계 |
6,988 |
5,126 |
|
|
기타 |
2,519 |
839 |
|
|
합계 |
9,507 |
5,965 |
|
출처: 2016 식품의약품통계연보, 식품의약품안전처
(3) 특수의료용도식품산업 현황
1991년에는 정식품에서, 1995년에는 대상에서 특수의료용도식품을 첫 출시하였다. 2009년 이후 부터는 매년 5∼10% 정도의 수준으로 시장이 지속적으로 성장하고 있다. 2014년 기준 특수의료용도식품으로 국내에서 생산되는 환자식의 시장은 약 600억 원 정도의 규모이며, 해외에서 수입되는 환자식은 200억 원 정도이다. 해외에서 수입되는 것은 의약품으로 구분되어 환자식으로 구분하기도 어렵다. 국내 생산량은 대부분 내수 중심으로 판매되고 있으며, 제외국에도 관련 법규가 명확하지 않으므로 수출은 거의 없다.
[표 3-38] 특수의료용도식품 산업 현황
|
연도 |
생산실적 |
출하실적 |
||
|
생산량(톤) |
생산액(백만 원) |
출하량(톤) |
출하액(백만 원) |
|
|
2009 |
7,633 |
16,455 |
6,292 |
23,769 |
|
2010 |
8,490 |
17,381 |
7,249 |
27,302 |
|
2011 |
10,028 |
20,319 |
8,350 |
29,305 |
|
2012 |
12,907 |
25,404 |
9,765 |
33,724 |
|
2013 |
14,439 |
28,934 |
11,350 |
39,240 |
|
2014 |
17,799 |
33,999 |
12,496 |
44,135 |
출처: 2015 식품 및 식품첨가물 생산실적, 식품의약품안전처
사회의 고령화가 심화되면서 특수의료용도식품의 범위가 고령친화식품으로 확대되어야 한다는 의견이 제기 되고 있다. 이에 따라 시장 성장에 대한 기대가 높아져 식품기업들의 진입 시도가 활발해지고 있다. 아울러 환자식의 범위를 체계화하고, 관리기준을 강화하여 의료보험 적용이 필요하다는 주장도 제기되고 있다. 아직까지는 특수의료용도식품의 생산, 영양기준, 임상적 유용성을 종합적으로 심사하는 규정이 없다.
(4) 발효식품산업 현황
우리나라 전통발효식품은 김치류, 장류(간장, 된장, 고추장, 청국장, 기타 특수장), 젓갈류, 식초류, 주류, 기타(장아찌류 부각, 튀각 등)로 분류할 수 있다. 채소와 콩을 기본으로 하여 발효되므로 기능성과 맛, 그리고 저장성이 좋은 건강식품으로 대두되고 있다. 매출 수준은 주류를 제외하고 식품산업 전체의 약 2% 정도이나, 성장 가능성이 매우 높다. 전통발효식품의 세계화를 위해서는 생리활성성분의 분리 및 동정을 통한 기능성 제고, 원료작물인 무, 배추, 양념에 대한 품질 개량 및 제조원가의 절감, 효율적 마케팅, 보존법 개선, 포장 개선, 현대화된 공업화율 상승 등의 문제 해결이 필요하다.
미생물을 사용한 국내 발효식품의 대표적 기업으로는 아미노산, 핵산, 유기산, 전통식품 등을 생산하는 대상과 CJ가 있다. 이와는 별도로 OB, 하이트, 진로, 두산, 국순당 등은 발효 주류를 생산하는 기업이다. 효소분야 기업으로는 태평양화학, 유한화학 등을 들 수 있다.
라. 발전전망
경제가 불황이어도 먹거리 산업은 흔들림 없이 성장되어 왔다. 식품산업과 관련된 현대 사회의 특징은 고령화 사회, 식이를 통한 만성질환의 1차 예방, 식품의 기능성을 규명하는 과학의 발전이 있다. 이런 환경을 비추어볼 때, 기능성식품, 환자용식품, 발효식품 분야를 중심으로 식품산업의 발전은 긍정적인 전망을 가지고 있다. 더 나아가 전통적인 식품산업 기술에 생명공학기술이 융합되면서 식품산업은 고부가가치의 국가 경제 성장동력 산업으로 이미 자리매김하였다. 이제는 식품의 생산부터 판매에 이르는 전 과정에서 사물인터넷(Internet of Thing, IoT) 시대에 맞는 혁신적 기술이 도입되면서 이력추적 안전관리가 실현되고 있다. 가까운 미래에는 IoT 기술과 함께 가상현실 기술이 식품산업에 융합될 것으로 예상되면서 개인 맞춤형 식품산업 분야가 본격적으로 실현될 것으로 기대한다.
전통 발효식품 산업에 생명공학 기술을 접목하여 시스템화하고 과학적 기반을 갖추는 일은 새로운 수요 창출을 이루는데 필요할 뿐 아니라, 우리 식문화를 계승, 발전시켜 세계화를 이루는 의미도 가지고 있다. 이와는 반대 방향으로 발효식품 산업을 국가 BT 산업의 기반으로 정하는 것도 국가 R&D 전략에 효과적일 수 있다. 일본은 발효 산업을 기반으로 BT 강국으로 도약한 좋은 예시이다. 발효를 기반으로 한 BT 산업으로부터 선도물질의 발굴과 고부가가치화, 발효 부산물을 이용한 신규 생리활성물질의 검색과 분리・정제, 미래 부족이 예상되는 식량과 에너지원의 생산을 기대한다.
![]() 제4절
환경・해양수산
제4절
환경・해양수산
1. 환경 생명공학
가. 서론
(1) 개요
환경 생명공학(Environmental Biotechnology)이란 생명공학 기술(Biotechnology, BT)을 환경공학(Environmental Technology, ET) 분야에 이용하여 환경오염을 방지하고 환경을 효율적으로 보전하고 관리하는데 활용되는 모든 기술 또는 학문을 의미한다. 이 분야는 21세기 첨단기술로 주목되는 것 중 하나로써 분자생물학, 환경과학, 생태학 등의 분야와 융화하여 빠르게 발전하고 있다.
환경 생명공학기술은 국가과학기술 표준분류체계에서 미래유망 신기술 6가지 중 2개 분야(생명공학, 환경・에너지기술)에 걸쳐 있는 중요한 분야이며1), 2017년 KISTEP에서 발표한 미래유망기술 선정에서도 10대 미래유망기술에 포함되어 있다2). 이러한 기술들은 전 세계적으로 환경 분야의 핵심기술로 연구개발을 통해 실용화를 추진하고 있다.
본 장에서는 환경생명공학기술 중 환경오염제어 및 관리기술에 해당하는 생물정화(Bioremediation)를 중심으로 관련 내용을 조사하여 정리하였다.
(2) 환경생명공학 기술개발의 필요성
환경문제는 21세기 인류생존을 위협하는 최대 현안문제 중 하나로써 기존의 환경문제를 해결하기 위해 물리적, 물리・화학적, 생물학적 방법을 이용하였으나 여기에 첨단기술로 주목받고 있는 생명공학기술까지 도입되어 환경문제를 해결하기 위해서 전 세계적인 노력을 기울이고 있다. 생물정화기술은 미생물이나 식물에 의한 난분해성 물질 및 환경오염물질의 분해 촉진 및 생물전환(Biotransformation) 등을 통해 오염물질의 농도가 근본적으로 감소되고, 2차 오염을 방지할 수 있으며, 장기적인 면에서 고려할 때 물리적, 화학적 또는 물리・화학적 방법보다 환경관리 비용이 적게 든다는 경제적인 장점을 가지고 있다.
[표 3-39] BT 분야 세부기술 분류표, 미래유망 신기술 중 환경생명공학 포함 분야
|
구분 (중분류) |
코드값 |
기술명(소분류) |
분류기준 |
|
농업・해양・환경 관련 응용 |
020312 |
농업・해양 생물자원의 보존 및 이용기술 |
생물 다양성 활용기술, 국가 생물다양성 조사・보전, 농업・해양 생물자원 확보 및 유전체 분석・활용기술, 분자표지를 이용한 작물 및 가축의 분자육종 체계 확립, 해양자원을 이용한 신의약・신소재 탐색 개발 및 활용기술 등 |
|
020314 |
환경 생명공학기술 |
환경 친화형 생물소재 개발, Bioremediation 등 |
출처: 2015국가연구개발 조사・분석보고서, 미래창조과학부
[표 3-40] ET 분야 세부기술 분류표, 미래유망 신기술 중 환경생명공학 포함 분야
|
구분 (중분류) |
코드값 |
기술명(소분류) |
분류기준 |
|
환경 기반 |
050112 |
자연환경 ・오염토양 ・지하수의 정화 ・복원기술 |
오염토양・지하수 정화 및 복원기술(불량매립지 복원기술, 폐광지역 환경복원기술, 유해화합물, 오염지역 정화기술, 자연정화 촉진기술, 오염지하수 확산방지기술), 하천정화 및 호수 부영양화 저감기술, 토양・지하수 복원 요소기술(난분해성 유독물질 정화를 위한 혁신기술・기기・장비 개발), 토양・지하수 통합관리기술(GIS를 이용한 토양지하수 오염 통합관리기술) 등 |
|
050113 |
수질오염처리 및 재이용기술 |
질소・인 제거기술, 고도처리기술, 하수처리장 자동화를 위한 Fuzzy 이론의 적용 등 전문가 시스템, 산업폐수 고도처리기술, 정수장・하수처리장 효율향상기술, 오수・분뇨・축산폐수 복합처리기술 등 |
|
|
050114 |
폐기물 처리 및 활용기술 |
폐타이어의 재생기술, 폐기물의 자원화 기술, 폐기물 발생 저감 및 매립지 안정화기술, 소각 및 열분해・용융기술, 음식물 찌꺼기의 퇴비화・사료화를 위한 염분제거기술 등, |
출처: 2015국가연구개발 조사・분석보고서, 미래창조과학부
|
분야 |
미래유망기술 |
|
|
생활공해 |
IoT기반 상황인식형 조광기술 AI 팩트 체킹 보조기술 |
능동제어 소음 저감기술 |
|
방사능리스크 |
원전사고 대응 시스템 |
비방사성 비파괴 검사기술 |
|
환경오염 |
초미세먼지 제거기술 |
환경변화 실시간 입체관측기술 |
|
생활폐기물 첨단 분류・재활용 시스템 |
||
|
친환경 녹조・적조 제거기술 |
미생물 활용 환경복원기술 |
|
* 음영부분 환경생명공학 포함분야
나. 연구개발 동향
국제적으로 활발히 연구가 진행되고 있는 환경생명공학분야에는 바이오플라스틱, 바이오디젤(바이오에너지), 기능성섬유(거미줄 단백질생산을 이용한 방탄복 생산 등) 등과 같은 석유화학성분을 대체하기 위한 분야와 식물 또는 미생물을 이용해 폐기물 및 오염물질을 저감하거나 제어하는 생물정화분야의 연구가 활발히 진행 되고 있으며, 바이오가스 생산 분야, 폐기물 처리 분야 등 각 분야별 효율성이 증가되는 연구결과들이 계속적으로 보고되고 있다3).
국내에서는 2017년 KISTEP 10대 미래유망기술의 2개 분야에 환경생명공학분야가 포함되어 있을 정도로 관련분야의 연구가 지속적으로 진행되고 있다. 선정 결과에서 보듯이 친환경 녹조・적조 제거 기술 분야는 최근 증가하고 있는 녹조・적조 등 유해조류와 그 원인이 되는 영양염류를 효과적으로 제거하는데 있어서 환경적으로 부작용이 없는 환경 친화적 기술이다.
하천 및 호소는 산업 발달과 도시화 그리고 기후변화의 요인으로 인해 수질 악화와 녹조 현상의 심각성이 대두됨에 따라 근본적인 해결책이 필요한 상황으로 이를 위해 미세조류를 활용한 다양한 수계 오염원 저감에 관한 연구가 진행되고 있다4). 예로써 자연물질에서 유래한 조류제거제를 이용하여 특정 유해조류만 선택적으로 제거함으로써 녹조와 적조를 부작용 없이 빠른 시간 내에 효과적으로 제거할 수 있다. 미생물 활용 환경복원기술 분야는 미생물을 활용해 오염된 환경의 독성물질이나 분해가 어려운 물질들을 분해함으로써 환경을 복원시키는 기술인데 원유 유출 사고 시 미생물을 이용한 기름분해, 해양 원생생물 이용 음식물 쓰레기의 친환경적 처리, 바이오매스로부터 바이오 디젤 및 각종 화학물질 생산, 폐자원에서 효율적・친환경적 유기 금속 추출 등에 관한 연구가 활발히 진행 중이다2),7).
또한, 하・폐수 및 토양 정화를 위해 미생물에서 효소를 추출 또는 선별을 통하여 처리효율을 향상시킨 기술들이 개발되고 있다. 그 예로 국내 토착미생물에서 유래한 생물계면활성제를 이용하여 효율적인 유류 오염 제거를 위한 기술이 개발되고 있으며, 염소화방향족 유기물질 분해 효소를 이용한 바이오촉매제 개발을 통해 유기물질 제거 기술 등이 있다5). 미세조류 기반의 바이오 플라스틱 생산은 연소과정 시 유독가스 발생량이 적어 대기오염원을 저감시키고 폐기 시 짧은 분해시간으로 매립지 면적을 감소시킬 수 있는 이점이 있다6).
[표 3-42] 생물학적 정화의 주요 연구개발 동향
|
정화 분야 |
기술개발 동향 |
|
미생물을 이용한 생물정화 |
・중금속 저항성, 금속 분해능을 도입한 생물정화용 형질전환 미생물 개발 ・PCB 분해용 신규미생물 분리 ・생체물질 진단도구 및 방법 개발 ・독성물질 검출도구 및 수질 모니터링 시스템 개발 ・생분해성・환경친화적 필름 및 용도 ・미생물 분해성 폴리머 조성에 대한 연구 ・유기물질 고속 분해 방법 ・철산화 세균을 이용한 수은오염토양 정화 ・호기성 바이오공법을 통한 오염토양 정화 ・계면활성제를 이용한 미생물 복원 |
|
식물을 이용한 생물정화 |
・수경식물 재배방법 및 재배구조 ・식물생장 촉진 인자 탐색 연구 ・포플러 나무와 인디언 겨자의 특성을 이용하여 미국의 무기 시험장 및 군사지역의 오염물질 정화에 적용 ・400종 이상의 중금속 과축적 식물이 발견되었으며, 많은 연구기관과 회사에서 보다 향상된 과축적 식물을 찾기 위해 연구 진행 ・과축적 식물들의 기능향상을 위한 형질전환 식물체를 이용한 환경정화 기술개발이 활발히 진행 |
초기 산성광산배수 처리방법은 물리화학적 처리에 의존을 했지만, 황산염환원균이나 철산화균의 작용이 보고되면서 생물학적 처리로 진행된 것이다8). 식물을 이용한 생물정화(Phytoremediation)는 환경 친화적이며 비용이 절감되는 측면이 있고, 다양한 오염물질 정화 그리고 지하수로의 오염물질 누출을 방지하는 등의 2차 오염이 없는 장점을 지니며, Phytoremediation 최근 연구는 식물의 독성 금속물질 수송기작과 특정식물의 독성금속 흡수와 저항성 연구 분야 및 기능이 규명된 유전자를 식물에 삽입・발현시켜 금속오염에 저항성을 보이는 형질전환 식물체를 개발하는 분야가 활발히 진행 중이다9).
생물정화에서는 형질전환 미생물 이용기술, 생물학적 투과장벽(Biowell) 및 Bio- capping 기술, Biobeads 기술, 복합기술/Phasic 정화방법, 신규 영양 첨가물을 통한 정화능력향상 기술 등이 향후 유망기술로 발전할 것으로 여겨진다.
다. 환경정화를 위한 유전자변형생물체 기술 현황 및 전망
생물정화분야의 최근 동향 중 한 흐름은 유전자변형생물체를 생물정화에 이용하는 것이다. 따라서 환경정화를 위해 연구개발 되고 있는 대표적인 몇 가지 사례를 기술하고자 한다.
(1) 오염물질의 정화를 위한 유전자변형미생물 개발연구
미생물은 다양한 화합물을 분해할 수 있는 능력을 가지고 있기 때문에 오염물질의 정화에 이상적인 활용방안이다. 또한 활발한 신진대사 능력을 가지고 있어 천연 및 합성화합물의 에너지원으로 이용 가능하다. 이러한 분해 능력에 관여하는 수백여 개의 유전자정보들을 이용하여 형질전환 미생물을 개발하고 이를 생물정화에 적용한다.
생명공학을 이용한 형질전환 기술은 일반 미생물을 생물정화에 이용할 경우 각종 오염물질 분해 시에 발생되는 한계점들을 개선시킬 수 있는 해결방안을 제시하고 있다. 일반 미생물들은 대부분 난분해성 오염화합물을 분해하는데 필요한 대상경로를 갖추고 있지 않다. 그러나 형질전환 기술은 일반 미생물의 이화학적 대사경로를 개선하거나 해당경로를 확장하여 일반 미생물이 분해할 수 없는 오염물질을 분해 가능하게 할 수도 있으며 특정 오염물질이나 대사산물의 독성이나 미생물 생육억제 작용을 극복하는데도 이용할 수 있다.
(2) 오염물질 모니터링을 위한 유전자변형미생물의 연구개발
미생물은 환경 내에서 오염물질의 분해, 존재, 독성을 관찰하는데 이용될 수 있다. 미생물은 독성물질에 대해 빠르게 반응하며, 오염물질이 존재하는 나쁜 환경에서도 생존하기 때문에 오염물질의 모니터링에 사용가능한 이상적인 대상이다. 또한 미생물은 광범위한 환경오염물질의 분해와 더불어 특정오염물질을 관찰하고 오염된 환경에 존재하는 실제 독성수준을 분석하는 용도로 사용하기 위한 연구개발이 활발히 진행 중에 있다.
형질전환 기술을 이용하여 luc, lux, gfp 등의 리포트 유전자를 해당 미생물로 삽입하여 오염물질을 모니터링하는 유전자변형 미생물의 연구개발이 지속되고 있다. 이러한 바이오센스의 중요한 장점은 특정 오염물에만 반응하는 센서라는 특이성이다. 오염지역의 예비 평가에서 lux를 포함하고 있는 유전자변형미생물을 이용하여 그 지역에 존재하는 독성오염물질의 위치와 농도를 파악할 수 있는 현장 적용이 수행되었다. 이를 통하여 정화효율을 증가시키고 정화비용을 절감하는 접근방법에 한층 접근하는 효과를 가져왔다. 최근에는 광섬유 케이블에 오염물질을 모니터링 할 수 있는 유전자변형미생물을 고정시키기 위한 연구개발이 진행되고 있다.
(3) 오염물질의 정화를 위한 유전자변형식물의 연구개발
생명공학 기술과 육종학 기술의 발달은 환경을 파괴하지 않고 지속가능한 성장을 위한 요구에 따라 비용절감과 환경 친화적인 기술로 여겨지는 유전자변형식물의 개발을 활발하게 만들었다. 이는 전통적인 식물육종 방법을 대신할 빠르고 개량된 방법으로 다양한 종류의 유전자형질과 적용할 식물의 다양성에 관한 연구개발이 진행 중에 있다. 이런 유전자변형식물의 장점은 미생물과 비교할 때 특정한 영양분이나 배양조건이 필요하지 않으며, 살균처리과정을 생략할 수 있고, 환경적응력이 미생물에 비해 높다는 것이다. 폐수처리, 중금속처리, 탄화수소 처리, 염소화합물 처리, 방사성물질 처리 등에 활용하기 위한 유전자변형 식물의 연구개발이 활발히 진행 중이다. 환경정화용 유전자변형식물의 연구는 상당히 진전 중에 있으며 토양오염, 지하수를 포함한 수질오염, 방사성물질 오염 등의 환경오염 문제를 해결해 줄 수 있는 친환경 대안기술로 여겨지고 있다.
라. 향후전망 및 발전방향
환경 생명공학 기술은 에너지 절약형이면서 환경 친화형 기술로 지속가능한 성장과 환경보전을 동시에 추구하는 미래 산업으로, 쾌적한 환경을 확보하여 삶의 질 향상에 큰 영향을 미칠 것으로 기대된다. 전 세계적으로 생물학적 환경정화를 위한 기술 개발이 지속적으로 성장하고 있으며, 국내 또한 매년 연구개발과 현장 적용에 관한 연구가 증가하고 있는 추세이다. 새로운 정화 기술 중 일부는 현장적용 단계까지 연구개발이 진행되고 있으나, 대부분의 기술들은 원천기술 확보 단계로 지속적인 투자가 필요한 실정이다.
생물정화 관련 국내 특허 상황을 살펴보면 해외 출원 기관의 특허는 국내에 거의 진입하지 못한 상황으로 국내 기술 시장을 보호하기에 상대적으로 유리하여 21세기 국가 핵심 산업으로 인식되고 있는 BT와 ET가 융합된 환경 생명공학 기술은 산업화 및 발전 가능성이 높은 분야라 생각된다.
따라서 다음과 같은 점들을 고려하여 국내 환경 생명공학의 발전방향을 지속적으로 모색하여야 할 것이다. 첫째, 환경정화의 공익성을 고려하여 효과적인 생물정화를 위한 기초연구부터 산업적 활용까지 총괄적인 전략과 국가차원의 지원이 필요할 것이다. 둘째, 생물정화의 기초연구분야의 국내 기술수준은 높은 수준인 것으로 평가되고 있기 때문에 지속적인 투자와 교육을 통해 관련 기술의 축적과 인재 양성 프로그램 개발이 병행되어져야 한다. 셋째, 생물정화를 통한 환경복원 기술은 오염지역의 자연환경 특성에 따라 그 세부방법이 달라지기 때문에 국내에서 개발된 기술을 국내 자연환경에 도입하면 성공할 확률이 높을 것이며, 국내 오염지역 뿐만 아니라 환경이 유사한 해외의 오염지역에도 적용이 가능할 것이다. 넷째, 탄소배출권 규제와 같은 국제적인 환경보전에 대한 책임이 국가와 기업들에게 부가되어 질 것이므로 이와 관련한 대비와 투자가 필요할 것이다. 다섯째, 환경정화를 위한 최종 산물인 LMO의 위해성 평가 기술 확보 및 안전관리 방안 마련을 위한 노력과 투자도 늘려야 할 것이다.
1) 미래창조과학부, “2015년도 국가연구개발사업 조사・분석보고서”
2) 국과학기술기획평가원, “2017년 KISTEP 미래유망기술 선정에 관한 연구”
3) A review on the state of the art of physical/chemical and biological technologies for biogas upgrading. Rev Environ Sci Biotechnol(2015)
4) 한국환경정책・평가연구원, “미세조류 바이오매스의 자원화 활용에 대한 연구”(2016)
5) 신우석 외 1명, “생물촉매에 의한 오염퇴적물 정화기술”(2014)
6) 과학기술정책연구원, “미생물을 활용한 투명 바이오플라스틱”(2016)
7) 김종섭 외 4명, “온도에 따른 원유분해미생물의 생물학적 정화효율 평가”(2016)
8) 산성광산배수 자연정화에서의 생물공학, 한국지형공학회지 vol 49(6) 844-854, 2012
9) 이재홍(2012), 한국생명공학회지 (27)281-288, 식물정화기술의 개요와 환경오염 제어에의 용용 현황
10) 융합연구정책센터, “바이오화학산업의 현황 및 전망”(2016)
11) BT기술동향 보고서 환경생명공학(Bioremidiation을 중심으로), 생명공학정책연구센터(총서 68권, 2008)
12) 2017 환경백서, 환경부
13) 2015 바이오안전성백서, 한국바이오안전성정보센터
2. 해양 생명공학
가. 개요
(1) 정의
해양생물 소재, 생산물, 기능, 프로세스, 유전정보 등을 대상으로 첨단 생명공학기술을 활용・연구하여 상품 혹은 서비스 형태로 제공하는 분야의 학문 혹은 기술로 정의된다(해양과학용어사전 참고). OECD(2013)에서는 해양생물자원에 발달된 생명공학기술을 적용하여 생태계 관리, 기초연구 및 생물정화에 서비스를 제공하거나 의약품, 바이오연료, 전기, 식품, 효소, 활성물질 등의 산물을 생산하여 부가가치를 증대시키는 분야로 해석하고 있으며(1) 해양 생태계 건강성을 측정하기 위한 바이오센서로 이용된 경우라면 육상생물자원을 활용하였다고 하더라도 해양 생명공학 분야로 간주하기도 한다(2).
(2) 발전 가능성
(가) 해양유전자원의 다양성과 신규성
최근의 해양생명공학에 대한 관심은 해양생태계의 생물다양성 특히, 유전적 다양성에 기인한다. Craig Venter 박사가 주도한 Global Ocean Sampling Expedition (GOS)을 통해 6백만 개의 유전자와 1,700여개의 특이한 잠재적 단백질을 발굴하여 해양 유전자원이 새로운 바이오 소재로써의 활용 가능성을 입증하였고(3) 이후 2009년에서 2012년 사이 진행된 해양탐사(Tara Ocean expedition)에서 7.2TB의 환경유전체 정보를 확보하기도 하였다(4). 2010년까지 4,900여 개의 해양생물 유래 유전자 특허가 출원되었으며 특히 최근 들어 해양유전자 특허 출원 증가 속도가 연간 12%에 달할 정도로 관심도가 집중되고 있다(3). 생물종 수에 대한 유전자 특허율을 비교하면 육상생물종(0.19%)에 비해 해양생물종(0.38%)이 더 높으며(5) 의약품의 경우 평균적으로 3,140개 해양 추출물 가운데 1개 신약이 개발되는데 이는 다른 의약기업 평균(5,000에서 10,000개 중 1개 신약개발)의 1.7∼3.3배 높은 성공률을 보인다(6). 이는 해양생물로부터 신규성이 높은 유용 물질을 얻어 산업화할 가능성이 높음을 의미한다.
(나) 관련 기반 기술의 발전
① 유전자 해독 기술 발전
차세대 염기서열 분석(NGS, Next Generation Sequencing)과 생물정보처리기술의 발전으로 많은 수의 DNA 조각을 병렬로 처리하면서 저렴하게 대량으로 유전체 정보를 신속히 해독하게 되었다. 이 기술은 생명공학 분야에 매우 큰 변화를 가지고 왔으며 시료의 접근성이 떨어지고 유전자의 농도가 낮은 해양 유전자원의 확보와 활용에 크게 기여하며 해양생명공학 발전의 기반을 제공하고 있다.
② 게놈 편집 기술 및 합성생물학의 발전
CRISPR 게놈 편집기술은 유전체에서 원하는 유전자를 제거하거나 삽입하는 기술로 필요한 표현형을 갖도록 한다. 이 기술을 제브라피시에 적용하면(7) 수산 분야에서 분자 양식(molecular aquaculture) 발전에 크게 기여할 것으로 기대되며 이 기술을 활용한 합성생물학의 발전은 해양 생리 활성 물질의 대량 생산에 활용되면서 산업화를 가속시키고 있다.
③ 해양 탐사기술 개발
해양탐사는 배를 타고 직접 바다에 나가 바다 속에 관측기기를 넣어 탐사하는 방법과 잠수정을 타고 심해까지 들어가 해저 지형이나 생물자원, 퇴적물 등을 조사하는 방법이 있으며, 인공위성을 이용하여 단시간에 넓은 영역의 자료를 얻는 방법이 있다. 온누리호가 1992년부터 본격적인 한국 해양과학 조사선으로 운항 중이며 2017년에는 5,900톤급 이사부호가 취항하였다. 국내 기술로 심해 무인잠수정(Remotely Operated Vehicle; ROV) 해미래와 천해용 자율무인잠수정 Autonomous Underwater Vehicle (AUV, 이심이)를 개발하였으며 이를 기반으로 주 소재가 될 열수구 탐사와 해저 생물자원 확보가 용이해졌다.
(다) 국가별 자원 확보 필요성
나고야의정서는 유전자원의 접근과 그 이용으로부터 나오는 이익을 자원제공국과 이용국이 상호 합의 조건에 따라 공정하게 나누도록 하는 국제협약으로 우리나라는 2017년 8월 17일에 발효되었다. 해외 유전자원을 이용하고 있는 농식품업계에서는 각국의 보호조치에 따른 수급 불안과 유전자원 사용료 상승 등의 어려움이 발생할 가능성이 제기되고 있으며, 생물유전자원 제공국인 중국이 이르면 올해 자국산 원료에 대한 최대 10% 로열티를 요구할 것으로 예상되면서 생물자원의 개발 및 활용이 시급한 과제로 부상하였다(8).
나. 해외 동향
(1) 해양 생물 유래 의약품
(가) 개발 개요
해양생물자원은 의약용 천연물 연구의 주요 대상으로 이용되었다. 2012년 기준으로 세계적으로 의약품 개발 파이프라인에 있는 해양 천연 화합물이 8,940종, 전임상 공급단계 1,458종이다. 2017년 8월 현재 미국 FDA 승인 의약품이 7종이며 임상 3상에 5종, 임상 2상에 8종, 임상 1상에 14종 해양 유래 신약 후보물질의 실험이 진행 중으로 대상 신약 후보물질이 꾸준히 증가하고 있다(9). 현재까지는 항암제, 항감염제, 대사질환치료제가 주로 개발되었다.
[표 3-43] FDA 승인된 해양 생물 유래 신약
|
성분명 |
상표 (FDA승인 년도) |
생 물 |
적응증 |
|
Trabectedin (ET-743) |
Yondelis® (2015) |
멍게 |
항암제 |
|
Brentuximab vedotin (SGN-35) |
Adcetris® (2011) |
연체동물 |
항암제 |
|
Eribulin Mesylate (E7389) |
Halaven® (2010) |
해면동물 |
항암제 |
|
Omega-3-acid ethyl esters |
Lovaza® (2004) |
어류 |
고중성지방혈증 |
|
Ziconotide |
Prialt® (2004) |
청자고둥 |
진통제 |
|
Vidarabine (Ara-A) |
Vira-A® (1976) |
해면동물 |
항바이러스 |
|
Cytarabine (Ara-C) |
Cytosar-U® (1969) |
해면동물 |
항암제 |
(나) 해양 생물 유래 의약 시장 및 활용
해양생물 유래 의약품 시장은 평균적으로 약 12.5%의 증가율을 보일 것으로 추정되며, 이러한 추세가 지속될 경우 2024년의 세계 해양바이오 의약시장 규모는 223억 달러(한화 약 25조 원 규모)에 달할 것으로 예측된다(10). Halaven는 2019년에 5.3억 달러의 매출을 올릴 것으로 예상되며, 고중성지방혈증에 사용되는 Lovaza는 이미 2016년 기준으로 4.3천만 유로가 판매되었다. 연어 칼시토닌(calcitonin)이 1975년 파제트병의 처방약으로 최초 승인되었으며 골다공증 치료제로도 처방되었고 스프레이(Miacalcin)와 주사제(Calcimar)용이 있다. 사람의 칼시토닌과 단백질 서열의 유사도는 50% 정도이지만 체내 체류시간이 길고 수용체에 대한 친화도(affinity)가 높아서 사람의 칼시토닌을 대체하였다. 최근 청자 고둥(cone snail, Conus geographus)이 분비하는 인슐린은 어류에게 순간적으로 저혈당 쇼크를 일으켜 포획한다고 밝혀졌고 인간 인슐린보다 3배 빠른 효능이 있어 치료제로 개발 중이다(11).
(2) 수산 양식
수산물 남획으로 인한 공급 문제로 향후 세계 수산물의 50% 이상이 양식으로 생산될 것으로 예측되어 양식기술 및 산업의 중요성이 높아지면서 기술개발 필요성이 매우 높다(1). 양식생물의 질병 같은 안전성 등의 지속가능성에 대한 문제도 풀어야 하는데 양식용 백신개발, 수산생물 질병의 분자진단기술 개발의 필요성이 더욱 높아진다. 수산 선진국인 노르웨이는 연어 양식에 전혀 항생제를 사용하지 않는 기술을 개발하였다. 현재 빠르게 발전하고 있는 유전체 연구 및 기술은 분자 양식(molecular aquaculture) 형태로 발전하고 있으며, 유전체 기술을 활용하여 신속 성장 및 질병에 저항성 있는 종자 개발을 위한 분자육종기술 개발로 활용될 수 있다. 또한 새로운 게놈 편집 기술의 개발은 수산 양식 발전을 가속화 할 것이다. 대구와 대서양 연어에 대한 전장 유전체 해독이 완료되었고, 유전체 정보는 새로운 종 개발로 활용될 수 있다. 이미 DNA 재조합 기술을 이용한 유전자변형생물(LMO, Living modified organism) 생산 기술이 개발되고 있다. 미국의 수산생명공학 회사인 AquaBounty Technologies는 성장이 2배 빠른 유전자 변형 연어를 개발하고 미국 식품의약청(FDA)에 2015년 승인을 받았다. 인체 유해성 문제에 대한 논란이 있는 가운데 2017년 캐나다에서 판매되기 시작했다(12).
(3) 해양바이오 에너지
바이오에너지는 기후온난화 문제로 인한 온실가스인 이산화탄소를 저감하기 위한 수단으로 인식되고 있다. 해조류 기반의 3세대 해양바이오연료가 대안으로 떠오르면서 해양바이오에너지에 대한 관심이 높아지고 있다. 미세조류를 활용하는 바이오디젤, 거대조류를 원료로 하는 바이오에탄올, 바이오가스, 바이오수소 등이 있다. 해조류 기반의 바이오연료는 난분해성 리그닌 성분이 거의 없고, 경작지, 용수, 비료 등의 투입이 필요 없는 환경적인 장점을 지니고 있으나 경제성과 규모의 문제는 계속 개선 중이다. 2018년 예상되는 세계 조류 바이오에너지 매출은 59.6억 달러로 예상된다(13). 또한 미국의 엑손모빌(ExxonMobil)과 Synthetic Genomics Inc는 공동개발을 통해 조류(Nannochloropsis gaditana)의 지방 성분을 20%에서 40%로 증가시키는데 성공하여 해양 바이오에너지 산업의 발전 가능성을 높였다(14).
다. 국내 현황
(1) 연구 개발 사업
[표 3-44] 2017년 기준 해양생명공학 분야 주요한 국가연구개발사업의 연구내용
|
부처 |
사업명/과제명 |
연구내용 |
|
해양 수산부 |
해양수산 생명공학 기술개발 사업 |
|
|
해외해양 생물자원 개발 및 활용기반 구축 |
해외해양생물자원 확보와 분류, 생태, 보존, DB 구축 및 자원분양과 국제네트워크 구축, 해양생물 관련 국제협약 대응 |
|
|
해양바이오 산업 신소재 기술개발 |
해양바이오매스 기반 바이오플라스틱, 카르복실산 생산, 바이오나노 섬유소재, 창상치료제, 의약용 복합소재 생산기술 개발 |
|
|
해양초고온 고세균 이용 바이오수소 생산기술개발 |
해양 초고온 고세균 이용 바이오수소생산기술개발 |
|
|
해양 융복합 바이오닉스 소재 상용화 기술개발 연구단 |
해양생물로부터 광반응성, 생리활성, 생체적합성을 보유한 기능성 물질들을 활용하여 조영제 및 광감각제를 개발하고, 이를 기반으로 생체 진단・치료용 바이오닉스 디바이스를 개발 |
|
|
포스트게놈 다부처 유전체 사업 |
||
|
해양수산 생물 유전체 정보분석 및 활용기반연구 |
해양 동물, 식물, 미생물 메타게놈 등의 차세대 유전체 연구 및 유전체 정보센터 구축 |
|
|
Golden Seed 프로젝트 |
||
|
수산 종자 사업단 |
넙치, 전복, 바리과 및 김 등의 전략형 수산종자 개발 |
|
|
과학 기술 정보 통신부 |
해양극지 기초원천 기술개발 사업 |
|
|
해양바이오 기초원천 기술개발 사업 |
해양생물 유전체 분석을 통한 해양 생명현상 원리 규명, 해양 생물의 생체기능 활용 및 신의약 소재 및 기초 활성 연구, 해양 원생생물 생명현상 연구 |
|
우리나라의 해양 생명공학 연구는 2004년 해양수산부의 ‘마린바이오21 사업’의 추진을 통해 본격적으로 시작되었다. 2017년 기준으로 해양생명공학 분야에 해양수산부가 해양수산생명공학기술개발사업에 306억 원, 과학기술정보통신부(舊 미래창조과학부)가 81.7억 원을 투자하고 있지만, 여전히 연구개발비는 부족한 현실이다. 해양 생명공학분야 국가연구개발사업의 주요한 연구 과제와 연구 내용을 표와 같으며, 최근 주요한 성과를 살펴보면 인플루엔자 바이러스 감염을 막는 탄수화물 나노체 개발(15), 돌기 해삼 유전체 해독(16) 등의 성과를 보여주었다. 지금까지 해양 생명공학 연구는 국내의 타 연구개발사업과 비교해 질적, 양적으로 우수한 성과를 달성하고 있는 것으로 평가되고 있고, 연구인력 저변 확대에 기여한 것으로 평가되고 있다.
라. 발전 과제
세계 해양 생명공학 시장에서 경쟁력을 확보하기 위해서는 해양 생물자원 확보와 주권화 등 국제적 환경과 발전하는 해양 생명공학 기술에 적극적으로 대응하여야 한다. 국내 바이오시장 중 제약, 화장품, 식품업계의 약 70%가 외국생물자원을 이용하고 있으며 나고야 의정서 발효에 따라 연간 3,900억 원에서 5,000억 원의 경제적 손실이 예상되고 있다. 하지만 의정서와 관련한 대책을 마련 중인 기업은 지난해 기준 9%에 불과하다. 그리고 유전적 다양성이 높은 해양생물에 대해 첨단 생명공학 기술을 적용하는 노력이 이루어져야 하며 이를 위해서는 기존 연구 인력들이 해양 생명공학분야로 진출할 수 있도록 환경 조성이 필요하다. 산업화 부분에선 아직은 영세한 해양 생명공학 기업을 위한 선제적 지원책으로 해양생물 원료소재 부문을 공급하는 새로운 기업 맞춤형 서비스, 정책 지원, 법 제도 개선 등이 이루어져야 할 것이다.
1)OECD(2013) Marine Biotechnology: Enabling Solutions for Ocean Productivity and Sustainability. OECD Publishing. (http://dz.doi.org/10.1787/9789264194243-en)
2) Marine Board-Europe Science Foundation (2010) Marine Biotechnology: A New Vision and Strategy for Europe.
3) Venter J.C. et al, (2004) Environmental genome shotgun sequencing of the Sargasso Sea. Science 304:66-74
4) Armbrust, E.V. and Palumbi, S.R. (2015) Uncovering hidden worlds of ocean biodiversity Science 348:865-867
5) Arrieta J.M. et al. (2010) What lies underneath: Conserving the oceans’ genetic resources. Proc. Natl. Acad. Sci. U. S. A. 107(43):18318-18324
6) Gerwick W.H. & Moore B.S. (2012) Lessons from the Past and Charting the Future of Marine Natural Products Drug Discovery and Chemical Biology. Chemistry & Biology 19:85-98
7) Hwang W.Y. et al. (2013) Efficient genome editing in zebrafish using a CRISPR-Cas system. Nature Biotechnology 31(3):227-229
8) 헤럴드경제 (2017) http://news.heraldcorp.com/view.php?ud= 20170813000017
9) http://marinepharmacology.midwestern.edu/
10) BCC Research (2011) Global Markets for Marine-Derived Pharmaceuticals
11) Safavi-Hemami H. et al. (2015) Specialized insulin is used for chemical warfare by fish-hunting cone snails. Proc. Natl. Acad. Sci. U. S. A. 112(6):1743-1748
12) Emily Waltz (2017) First genetically engineered salmon sold in Canada. Nature 548:148
13) Market Research Report (2017) Algae Biofuel Market Estimates & Trend Analysis By Application (Transportation, Others), By Region (North America, Europe, Asia Pacific, Rest of World), By Country, And Segment Forecasts, 2018 - 2025.
14) Imad Ajjawi et al. (2017) Lipid production in Nannochloropsis gaditana is doubled by decreasing expression of a single transcriptional regulator. Nature Biotechnology 35;647–652
15) Kwon, S.-J. et al. (2017) Nanostructured glycan architecture is important in the inhibition of influenza A virus infection. Nature Nanotechnology 12:48-54
16) Jo, J. et al. (2017) Draft genome of the sea cucumber Apostichopus japonicus and genetic polymorphism among color variants. Gigascience 6(1):1-6
![]() 제5절
바이오 공정 및 융합
제5절
바이오 공정 및 융합
1. 산업바이오
가. 개요
화석연료 기반의 산업체계6)는 19세기 영국에서 시작되어 오늘날 전 세계 에너지 소비의 약 80%를 차지하고 있다. 하지만 1970년대 에너지 위기, 1990년대 지구 온난화에 따른 환경변화로 다양한 이슈가 발생하였다. 이러한 문제 제기에 따라 1992년 브라질 리우데자네이루에서 개최된 환경과 개발에 관한 유엔회의(UNCED)에서 ‘리우 선언’과 ‘의제 21(Agenda 21)’이 채택되었다. 그 후 ‘지구 온난화 방지 협약’ 및 ‘생물다양성 보존 협약’ 등이 체결되어 ‘산업성장과 지구환경보호 그리고 인류 복지의 조화(long-term balance between the environment, the economy, and the social well-being of humanity)’라는 개념이 등장하였다.
산업바이오(White BT or Industrial Biotechnology IB)는 이러한 지속가능한 경제체계(sustainable economy)의 필요성에 따라 2001년 OECD의 지속가능한 산업으로써의 생물공학 테스크포스팀(Task Force on Biotechnology for Sustainable Industrial Development of the OECD’s Working Party on Biotechnology)에서 제안되고7) 2004년 OECD 과기장관회의에서 정립된 기술이며 ‘바이오기술(생촉매)을 이용한 바이오매스를 원료로 바이오기반 화학제품(유기산, 아미노산, 폴리올, 바이오폴리머 등) 또는 바이오연료(바이오 에탄올, 바이오디젤, 바이오부탄올)를 생산하는 분야’이다8).
한편, 2004년 미국 에너지부(Department of Energy)에는 바이오매스로부터 생산할 수 있는 12가지의 플랫폼 화학물질에 대한 보고서 ‘Top Value Added Chemicals from Biomass’를 발간8)하여 산업바이오의 성장 가능성을 제시하였다. 산업바이오는 재생 가능한 바이오기반 원료 물질을 사용하여 기존의 석유화학산업 원료물질 공급한다. 이런 바이오매스 유래 원료물질은 화학, 플라스틱, 식품, 계면활성제, 펄프 제지산업, 전자, 자동차, 섬유 및 수송용 원료 등을 생산하는 기술・지식 집약적 산업분야로 사용이 확대되고 있다.
[그림 3-73] 산업바이오의 개념 및 활용분야

산업바이오의 개념정립 이후 OECD는 경제적 관점에서 생물학적 기반의 석유화학제품의 개발과 생산 등 일련의 환경 친화적 경제활동을 바이오경제라 정의하고 이와 관련된 정책을 제안하고 있다9). 2012년 미국 바이오산업협회(Biotechnology Industry Organization: BIO) 보고에 따르면 미국의 바이오경제 규모는 1조 2,500억 달러 규모로 보고되었으며, 유럽공동체의 2014년 보고에 따르면 바이오경제의 규모는 2009년 기준 약 2.7조 달러에 약 2,000만 규모의 고용효과(전체 고용의 약 9%)가 추정 되었다10). 또한 최근 보고된 문헌에 따르면 유럽의 바이오경제의 발전을 통하여 약 400만 개의 새로운 일자리가 창출되고 약 50%의 온실가스 저감 효과가 있을 것으로 예측 되었다11). 산업바이오의 발전에 따라 연간 약 1.5억 갤런의 수송용 에너지 부분의 원유가 바이오 리파이너리에 의해 대체 저감되고, 바이오기반 석유화학제품의 개발 및 사용에 따라 연간 1.5억 갤런의 원유 사용이 저감될 것으로 예측되고 있으며 향후 연간 약 3억 갤런의 원유가 산업바이오의 발전에 따라 저감될 수 있을 것으로 추정하고 있다12).
나. 해외 동향
(1) 정책동향
산업바이오 연구개발 동향의 가장 큰 특징은 정부나 학계 주도의 연구개발 보다는 기업 주도의 개발이 이루어지고 있다는 것이다. 미국의 경우 농무부(USDA)나 에너지부(DOE)에서 다양한 정책을 수립하여 수행하고 있으나 산업바이오 관련 회사를 주축으로 전 세계 30개국 산업계와 학계가 가입되어 운영되는 미국 바이오산업협회(BIO)의 활동이 주도적이다. 미국 농무부은 바이오기반 제품의 생산과 사용을 증가시키고 농촌지역의 일자리 창출을 위하여 2002년 농장법과 2008년 에너지법 그리고 2014년 농업법을 기반으로 BioPreferred® 프로그램을 시행하였다. 이 프로그램은 연방 정부의 구매 사업에 바이오기반 제품(예 : 청소, 카펫, 윤활제, 페인트 등 97종류 14,000여 가지 제품)을 우선 구매하도록 하는 한편, 일반 소비자가 쉽게 바이오기반 제품을 식별할 수 있도록 USDA 인증 바이오기반 제품 라벨을 부착하는 제도를 시행하고 있다13).

[그림 3-74] 미국 농무성에서 시행중인 바이오기반제품 인증라벨
유럽은 2013년 9월 FP7 프로젝트14)의 하나로 약 280만 유로 규모의 프로젝트로 BIO-TIC을 출발시켰다. BIO-TIC은 유럽의 산업바이오 분야 기술 혁신을 위한 목적으로 온라인 산업바이오 커뮤니티 구축, 산업 바이오분야의 지속 가능성 평가 및 유럽의 산업바이오 분야의 실행 계획 수립을 진행하고 있다15).

[그림 3-75] BioConSepT 프로그램의 실증연구분야
한편 2012년에 산업바이오 민간 컨소시엄(Bio-based Industries Consortium, BIC)이 발족되었고, 2014년 유럽 집행위원회는 이를 기반으로 BBI Joint Under -taking(BBI)을 발족시켰다. BBI는 EU 집행위원회와 산업바이오 민간 컨소시엄(BIC) 간에 2020년까지 약 37억 유로 규모(EC: 10억 유로, 민간 27억 유로)의 산업바이오 협력 프로젝트를 발족시켰다16). 또한 2012년 FP-7-KBBE programme 중 하나로 BioConSepT 프로그램17)을 시작하였다. 2015년 종료된 BioConSepT 프로그램은 Biotechnology, Conversion, Separation Technology의 합성어로 유럽 12개국, 30여 개의 파트너가 참여한 프로그램으로 프라운호퍼, ADM, Evonik을 비롯한 유수의 연구기관과 대기업, 그리고 중소기업으로 구성되어 있다. BioConSepT는 각 파트너 기관과의 협력을 통해 제2세대 바이오매스로부터 각 5∼6단계의 공정이 필요한 레진, 폴리머, 플라스틱, 유기용제 등 6개 석유화학소재들의 시험생산을 목표로 하였다.
일본정부는 2002년 12월 중장기 계획인 ‘바이오테크놀로지 전략 대강(大綱)’과 ‘바이오매스 일본 종합전략’을 수립하고 2009년에는 ‘바이오매스활용추진기본법’을, 2010년에는 ‘바이오매스활용추진 기본계획’을 발표하였다18). 이 계획에 따라 바이오매스 플라스틱의 개발・보급을 추진하는 촉진하기 위한 민간 단체인 ‘일본바이오매스제품협의회’를 발족하였다. 인증 프로그램도 정부차원이 아닌 민간에서 운영 중이다.
(2) 시장 및 산업동향
2013년도 기준 전 세계 발효기반 산업규모는 1,270억 달러 이상으로 보고되고 있으며 연간 생산량 규모로 볼 때는 약 1억 100만 톤 규모로 알려져 있다. 전체 산업바이오 제품 중 약 94%(약 9천 980만 톤)가 바이오에탄올이 차지하고 있으며 시장규모로 볼 때는 약 87%(1,100억 달러) 비중을 차지하고 있다. 바이오에탄올을 제외한 다른 주요 산업바이오 소재로는 라이신이나 MSG와 같은 아미노산류가 약 710만 톤(약 110억 달러)이고 이후 락틱산과 같은 유기산은 290만 톤(35억 달러)을 차지하고 있다. 2020년까지 산업 바이오분야의 시장 성장률은 약 4.6%로 예측되며 바이오에탄올을 제외하면 약 6.5%로 예측 된다. 특히 2016년 약 130억 유로(660만 톤/년) 시장 규모인 바이오기반 폴리머 분야는 2015∼2016년도 약 4%의 시장 성장률을 기록하며 전체 폴리머 시장의 약 2%를 차지였다19). 또 다른 보고에 의하면 2015년 현재 약 40,000여 종의 바이오기반 제품이 판매 중에 있으며 2013년 기준 약 1,260억 달러 정도의 시장규모가 제시되어 있다20).
바이오기반 플라스틱은 현재 전 세계 합성 플라스틱 시장, 즉 256만 톤의 2% 이하를 차지하고 있으나 매년 20∼30%로 성장하고 있다. 바이오기반 플라스틱21)은 현재 전 세계적으로 PLA(폴리 락틱산)과 폴리 트리메틸렌 테레프탈레이트(PTT), 폴리아미드(나일론)등 약 20여 종 이상이 생산되고 있다22).
 출처: Nova Institute, 2017
출처: Nova Institute, 2017
[그림 3-76] 바이오기반 플라스틱 생산량 추정
2013년도 기준 산업바이오 제품의 생산지역별 분포23)를 보면, 유럽지역이 28.8%를 차지하고 있으며 미국(15.4%), 중국(12.2%)순으로 나타나고 있다. 유럽 지역 내에서는 독일(7.3%), 네덜란드(6.8%) 프랑스(4.7%)순으로 나타나고 있다.
바이오기반 플라스틱 시장을 주도하고 있는 제품은 polyethylene terephthalate (PET)와 polyethylene(PE) 제품으로 알려져 있다. 2013년과 2018년 바이오폴리머 시장 변화의 특징은 향후 생분해성 플라스틱 시장 규모가 줄어들고 바이오기반 플라스틱 즉, 석유화학제품(화학적으로 동일한 석유화학 제품과 동일한 바이오기반 폴리머) 시장으로 확대 된다는 점이다. 이러한 변화는 코카콜라가 주도하고 있는 Plant PET Technology Collaborative에 의해 2013년 연간 60만 톤의 생산성이 2020년에 약 700만 톤으로 증가될 것으로 예측 된다24).
[표 3-45] 세계 주요 기업의 분야별 진출 현황
|
|
Plastics |
Developers |
|
Novelty |
PHA |
Metabolix, Jiangsu, Nantian, Tianan Biologic, ADM Biomer DSM, Micromidas |
|
PLA |
NatureWorks, PURAC, Toray, Sulzer, Synbra, Toyobo, Zhejiang Hisun |
|
|
Starch based |
PSM, Plantic, Biograde, Livan, Wuhan Huali |
|
|
Cellulose based |
FKuR, Formosa, Innovia, Lenzing, SK chemical, Teijin |
|
|
Drop-in |
PE |
Braskem, Dow, PSM, Solvay, Limagrain |
|
PP |
Braskem / Novozymes |
|
|
PA |
Arkema, Hipro Polymers(Suzhou) |
|
|
Drop-in |
Isobutanol |
Gevo |
|
n-Butanol |
Butamax, Cathay Industrial Bio, Cobalt, Green Biologics, Old Town Fuel & Fiber |
|
|
PBS |
Mitsubishi, Anquing Hexing, BioAmber, PIT |
|
|
Adipic acid |
DSM, Rennovia, Verdezyne |
|
|
PDO |
Dupont, Inventure, MetEx |
|
|
Others (includes platform chemical) |
Succinate |
BASF, BioAmber, Bluestar, DSM, LANXESS, Mitsubishi, Mitsui, Roquette |
|
Lactic acid |
PURAC, Galactic |
|
|
BDO |
BioAmber, Chemtex, Genomatica, Mitsubishi, Myrant, Novamont |
|
|
PUR |
Cargill, IFS Chemical, Mitsui Chemicals |
|
|
Polyester |
Avantium, BASF, Kaneka |
|
|
Epichloro-hydrin |
Dow, Slovay |
출처: Luxresearch(2011), Global Bio-based Chemical Capacity Springo to Scale을 토대로 산업연구원에서 재구성.
(가) 바이오기반 플라스틱 시장동향
2013년 산업연구원의 바이오플라스틱 시장분석 자료에 따르면 PLA를 포함한 생분해성 플라스틱 생산은 NatureWorks, PURAC, Metabolix 등이 생산하고 있으며 바이오기반 플라스틱과 전구체의 경우 BASF, DSM 등 대부분이 다국적 석유화학 회사들이 생산 예정에 있거나 시험 생산 중인 것으로 보고되었다25). 각 바이오 기반 플라스틱의 시장 현황을 살펴보면,
◦폴리에틸렌테레프탈레이트(PET)는 바이오 기반 모노 에틸렌글리콜(MEG)과 석유기반 테레프탈산(TPA)의 중합을 통하여 생산되는 폴리머로 20% 바이오 기반 폴리머이다. 세계 시장은 2013년도에 60만 톤이 생산되었으며 2020년도 기준으로 약 700만 톤 정도로 예측되고 있다26). 석유기반으로 생산되는 TPA는 현재 지속적인 연구가 이루어져 파일럿 스케일에서 바이오 기반 TPA가 생산되고 있다. 아시아 국가에서 대부분의 바이오기반 PET와 MEG가 생산되고 현재까지 가장 큰 생산 규모와 시장을 가지고 있으며 시장형성에는 코카콜라 회사에 의해 시작된 PTC 이니셔티브27)가 크게 기여하고 있다.
◦에폭시는 바이오 기반 모노머인 에피클로로히드린(epichlorohydrin)으로부터 합성되며 에폭시의 약 30%가 바이오 기반의 폴리머로 합성되고 있다. 현재는 기술과 시장이 성숙된 제품이다.
◦폴리우레탄(PUR)은 식물성오일을 원료로 하여 합성되는 폴리머로써 10∼100%는 바이오기반 폴리머이다. 바이오기반 숙신산을 석유기반 아디프산으로 대체하여 생산할 수 있으며, 바이오 기반 PUR 시장은 석유기반 PUR 시장보다 빠르게 성장할 것으로 예상된다.
◦폴리에틸렌피란노익산(PEF)는 2,5-furandicarboxylic산(2,5-FDCA) 및 MEG의 중합을 통해 생산되는 100% 바이오기반 바이오폴리머로서 PEF는 PTT, PEF는 PET와 유사한 물리적 특성을 가진 새로운 폴리머로써 Avantium에 의하여 2017년에 시장 진입이 예상되고 있다.
◦에틸렌 프로필렌 디엔 단량체(EPDM)은 바이오기반 에틸렌을 이용해 50∼70%는 바이오기반으로 생산되며 프랑스의 바이오화학기업 랑세스가 현재 브라질에서 생산하고 있다.

[그림 3-77] 2018년 기준 전세계 세계 바이오기반 플라스틱 생산규모
◦폴리에틸렌(PE)는 100% 바이오기 반 중합체로 사탕수수로부터 만든 에틸렌을 이용해 브라질의 석유 화학 회사 Braskem에 의해 생산된다.
◦폴리부틸렌숙시네이트(PBS)는 생분해 플라스틱으로 현재 석유화학 기반으로 생산되고 있으나 이론적으로는 100% 바이오 기반으로 생산이 가능한 제품이다. PBS는 석유기반 1,4-부탄디올(1,4-BDO) 및 숙신산을 중합하여 현재 1,4-BDO는 석유기반으로 생산되며 바이오기반으로 2015년 상업생산이 예상된다. 현재 PBS 전량 아시아 지역에서 생산되고 있다.
◦폴리트리메틸렌테레프탈레이트(PTT)는 바이오기술로 합성된 1,3-프로판 디올 (1,3-PDO)을 기반으로 합성되는 폴리머로 PTT의 27%가 바이오기반 폴리머다. PTT는 PET와 마찬가지로 석유기반의 TPA를 활용하여 합성되며 바이오기반 PTT 및 1,3-PDO은 Dupont에서 생산하고 있다.
◦폴리유산(PLA)은 현재 전 세계 25개 회사에서 개발 완료되어 연산 18만 톤 규모의 생산 능력을 가지고 있다. PLA의 가장 큰 생산자인 NatureWorks사는 2011년 기준 약 14만 톤 정도 생산용량을 보유하고 있고 나머지 생산자는 연간 1,500~ 10,000톤의 생산 능력을 보유하고 있다.
◦생분해성 플라스틱으로 100% 발효공정을 통하여 생산되는 폴리 하이드록시 알카노에이트(PHA)는 이미 상용화된 폴리머로 2013년 현재 약 3만여 톤의 시장을 가지고 있으나 연간 10~30%(IEA 바이오 에너지)의 성장률을 보이고 있다.
(나) 바이오기반 플라스틱 전구체 생산 현황
바이오기반 석유화학소재를 생산하기 위해서는 바이오매스로부터 폴리머를 합성하기 위한 전구체를 생산하여야 한다. 이 분야의 선도적인 연구를 수행하고 있는 기업은 GENO BDO 공정으로 유명한 Genomatica이다. Genomatica는 전 세계 약 170만 톤 규모의 시장을 가지고 있는 1,4-BDO를 바이오매스로부터 생산하는 공정을 수립하여 2016년 Novamont와 합작을 통하여 이태리 Venoto에 연간 3만 톤 규모의 공장을 건설 중이다28). 또한 85톤 규모의 1,3-butylene glycol 시험공정을 시험 중인 것으로 알려져 있다29).
현재 상용화되어 생산되고 있거나 생산 예정인 전구체는 주로 알콜과 다이엑시드(Diacids)류로 이들 모노머의 선두는 succinic acid이다. 2013년 현재 전 세계적으로 5개 업체가 succinic acid의 상업 생산에 들어가 2018년도에는 연간 25만 톤 이상이 생산될 것으로 기대되며 이들 기업 중 가장 선두 업체는 BioAmber이다. BioAmber는 Mitsui&Co.와 함께 2015년 8월 캐나다 온타리오주 사니아(Sarnia)에 연간 3만 톤 규모의 숙신산(Succinic Acid) 플랜트를 가동하였다.
현재 기준으로 가장 많은 생산량을 보이고 있는 모노머는 코카콜라가 주도하고 있는 Plant PET Technology Collaborative에 의해 탄력을 받아 폴리에틸렌테레프탈레이트(PET)의 모노머인 모노 에틸렌 글라이콜이 2013년 현재 4개 기업에서 연간 40만 톤이 생산되고 있으며 2020년도에 160만 톤 이상이 생산될 것으로 기대된다.

[그림 3-78] 전 세계 주요 바이오기반 모노머 생산기업 현황
현재 대부분의 플라스틱 전구체 생산은 cellulosic 바이오매스를 원료로 생산되고 있으며, plant oil기반 바이오매스 유래 생산 가능한 모노머는 Long Chain Dicarboxylic Acids(LCDAs)가 있다. LCDAs는 일반적으로 탄소가 10개 이상인 Diacid를 의미하는데, Sebacic Acids(C10), Dodecanedioic acid(C12) 등이 포함된다. 이들은 각각 나일론 610, 612의 원료로 활용되며 고분자 중합 시 기존의 Short Chain Diacids에 비해 유연하고 높은 강도의 물성을 나타낸다. 대표적인 생산 기업은 Verdezyne과 Cathay Biotechnologies로, Verdezyne은 식물성유지를 생산하고 있다. Cathay Biotechnologies는 원료로부터 효모(Candida 속)를 이용하여 LCDAs를 생물 전환 공정을 통하여 파라핀을 생산하고 있다30). Verdezyne은 현재 말레이시아에 연간 3천만 파운드 규모의 상용화 플랜트를 건설 중이다. Cathay Biotechnologies는 중국 산둥성에 연간 2만 톤 규모의 생산 플랜트를 갖고 있다.
[표 3-46] 전 세계 바이오기반 폴리머 전구체 생산 현황(2011~2020)
|
Bio-based building blocks |
Producing companies worldwide until 2013* |
Production capacities worldwide 2011*(t/a) |
Production capacities worldwide 2013*(t/a) |
Production capacities worldwide 2020*(t/a) |
|
1,3 Propanediol |
2 |
confidential |
78,000 |
120,000 |
|
1,4-Butanediol |
0 |
0 |
0 |
216,010 |
|
2,3-Butanediol |
1 |
80,000 |
80,000 |
80,000 |
|
Adipic acid |
3 |
0 |
n.a. |
n.a. |
|
Azelaic acid |
1 |
0 |
0 |
n.a. |
|
Paraxylene |
3 |
33 |
1,473 |
201,473 |
|
Butanol |
1 |
64,500 |
64,500 |
100,000 |
|
Epichlorohydrin |
6 |
44,000 |
395,000 |
495,000 |
|
Ethylene |
4 |
300,000 |
478,000 |
840,000 |
|
Furanic building blocks |
1 |
30,000 |
30,000 |
30,000 |
|
Isobutanol |
1 |
0 |
169,500 |
169,500 |
|
Isosorbide |
1 |
3,000 |
3,000 |
3,000 |
|
Lactic acid(L-D-L+D) |
6 |
209,000 |
284,000 |
375,000 |
|
Monoethylene glycol |
4 |
300,000 |
400,000 |
1,605,000 |
|
Natural oil polyols |
4 |
46,200 |
46,200 |
47,200 |
|
Polyether polyol |
4 |
55,000 |
85,000 |
85,000 |
|
Propylene |
0 |
0 |
0 |
50,000 |
|
Propylene glycol |
2 |
200,000 |
395,000 |
395,000 |
|
Sebacic acid |
1 |
22,000 |
22,000 |
22,000 |
|
Succinic acid |
5 |
3,200 |
25,000 |
250,000 |
|
Terephtalic acid |
1 |
0 |
10 |
110 |
|
Other building blocks |
4 |
85,000 |
85,000 |
85,000 |
|
Total |
55 |
ca. 1.222.000 |
2,641,783 |
5,169,293 |
출처: Markets and Trends of Bio-based Products: Market Developments of and Opportunities for biobased products and chemicals(2013), nova-Institute
(다) 기타 산업바이오 소재 현황
◦Biolubricants는 유채오일 또는 미네랄오일 기반의 제품으로 식물성 오일을 에스터 반응화시켜서 생산한다. Biolubricants는 항공, 자동차, 해양 응용 프로그램뿐만 아니라 전동 공구 윤활제 및 해양 시추장비에 사용될 수 있다.
◦Biosolvents는 대두유 메틸 에스테르, 락트산 에스테르(발효 유래 락트산을 메탄올 또는 에탄올과 에스테르 반응을 통하여 생산) 및 감귤류의 표피로부터 추출된 limonene 등이 있다. Biosolvents의 주요 장점 중 하나는 휘발성 유기 화합물 (VOC)이 방출되지 않으며 주로 금속 및 직물용 탈지제로 사용된다. 또한 접착제와 페인트를 제거 용제 및 희석제로 사용될 수 있으며 향수와 의약품의 추출 용매로 사용된다.
◦Biosurfactants는 팜유, 코코넛 등 식물성 오일과 소르비톨, 포도당, 설탕 등 식물성 탄수화물을 이용해 생산된다. 현재 Biosurfactants는 가정용 세제, 퍼스널 케어 제품, 식품 가공 제품, 섬유, 코팅, 펄프 및 종이 제품, 농약, 산업용 청소기를 만들 때 사용된다.
◦Vanilin은 우리에게 익숙한 ‘바닐라향’을 내는 원료로 스위스의 벤처기업인 Evolva가 효모를 이용한 발효공정을 통하여 바닐린을 생산함으로써 美 FDA로부터 식품/식품소재와 동등하게 ‘Natural Flavor’로 인정받았다. Amyris 역시 효모로부터 생산된 Farnesene을 기반으로 글로벌 F&F기업과 파트너십을 맺고 Biotech F&F를 개발하고 있다.
◦Levulinic Acid : GFBiochemical은 2015년 7월 캐나다 몬트리올에서 열린 ‘BIO World Congress on Industrial Biotechnology’에서 세계 최초로 Levulinic Acid의 상용화 생산을 시작하였음을 공식 발표하였는데 이탈리아 카세르타(Caserta)에 연간 1만 톤 규모의 플랜트를 건설하여 연간 2천 톤 규모로 시작, 2017년 8천 톤까지 생산을 늘릴 계획이다.
◦Bioisoprene과 Biobutylene 등은 향후 석유화학을 대체할 수 있는 인조고무 전구체 소재로 자동차 타이어, 승용차, 모터오일, 해양 윤활제, 풍력 터빈, 식품 등급 윤활제, 유전 유체, 냉동 냉매, 스킨케어, 헤어 케어 제품 등에 활용될 수 있다.
◦잉크와 염료로 사용되는 바이오기반 연료소재는, 현재 신문 인쇄에 필요한 잉크의 90% 이상 그리고 프린터와 복사기, 볼펜용 잉크, 리소그래피 잉크 등 상업용 프린터에 소모되는 25% 이상의 잉크 및 토너는 콩기름 잉크 토너를 사용하고 있다. 식물성오일 기반 잉크의 시장 점유율은 1989년 5%에서 2002년 약 25%로 증가했다.
◦산업용 효소류는 식품, 섬유, 가죽 제품, 펄프 및 종이, 곡물, 세제 등의 생산에 사용된다. 현재 산업용 효소 시장의 구조는 Novozyme과 Genenco/Danisco로 양분되어 거의 세계시장의 2/3를 차지하고 있고, 기타 DMS, BASF, ABF, AB Enzymes, Amano Enzyme이 나머지 주요 시장을 차지하고 있다.
(3) 바이오화학제품 인증제31)
바이오화학산업에 대한 국제적 관심 증가와 더불어 바이오화학제품에 대한 인증제 도입의 필요성도 강하게 대두되고 있다. 바이오화학제품 인증제는 국내 바이오화학 산업 발전에 필요한 제도적 인프라로 친환경 녹색인증제와 구별되는 차별화되고 독자적 인증제도의 도입이 필요한 실정이다.
미국은 2002년 농업법을 근거로 바이오화학제품 인증제, 우선구매제 및 표시제를 시행하고 있다. 유럽연합은 2002년 유럽 6대 선도시장 중 하나로 바이오화학제품 시장을 선정하고, 2009년 이후 민간 차원의 바이오화학제품 인증과 표시제를 시행 중이며, 최근 유럽연합 차원의 인증제 필요성에 대한 본격적인 논의를 시작하였다. 일본은 BT전략대강(2002), 바이오매스종합전략(2002) 등 정책을 통해 정부 차원의 바이오화학산업 육성 정책을 적극 추진 중이며, 2006년부터는 민간협회에서 바이오매스플라스틱 인증・표시제를 시작하였다.
[표 3-47] 세계 각국 바이오유래 플라스틱 인증 기준
|
|
인증 대상 |
함량 기준 |
환경 기준 |
비고 |
|
|
미국 |
USDA |
바이오매스에서 유래한 모든 제품 |
카테고리별 함량 지정(카테고리 이외 제품은 함량 25% 이상) |
- |
환경평가 정보 제공 (제품 선택시 참고 활용) |
|
EU |
Din Certco |
바이오매스에서 유래한 모든 제품 |
바이오매스탄소 함량 20% 이상 |
환경 위해 제품 제외 (중금속 농도 등) |
- |
|
VinCotte |
바이오매스에서 유래한 모든 제품 |
바이오매스탄소 함량 20% 이상 |
- |
환경평가에 대한 정보제공 의무 없음 |
|
|
일본 |
JBPA |
바이오매스에서 유래한 바이오플라스틱 제품 |
바이오매스탄소 함량 25% 이상 |
독성물질 최대 허용농도 준수 (납, 카드뮴, 수은, 6가 크롬) |
- |
|
한국 |
한국바이오 플라스틱협회 |
바이오매스에서 유래한 고분자 재료 |
바이오매스탄소 함량 25% 이상 |
독성물질 최대 허용농도 준수 (납, 카드뮴, 수은, 6가 크롬) |
- |
|
한국소재 패키징협회 |
바이오매스 원료와 이를 사용한 제품 및 포장재 |
・바이오매스 탄소 함량 25% 이상 ・투명 및 발포제품은 함량 5% 이상 |
・비스페놀A 사용 금지 ・독성물질 최대 허용농도 준수 (납, 카드뮴, 수은, 6가 크롬) |
- |
|
다. 국내 현황
국내 산업바이오분야의 육성은 산업통상자원부 주도로 관련 정책이 추진되고 있으며 2010년 12월 ‘바이오분야 산업화 촉진을 위한 중장기 전략 및 세부 추진방안 연구’를 수행하여 2020년까지 세계 5위권 바이오화학 산업 강국으로 도약하기 위한 바이오화학 발전과제를 수립하였다. 또한 2012년에는 ‘바이오화학 육성전략’을 발표하고 산업핵심기술 개발사업 중 산업바이오 분야에 매년 100억 원의 R&D지원을 하고 있다. 2014년 신규 사업으로 ‘바이오화학 산업화 촉진기술개발사업’을 5년(2014∼2018)동안 총사업비 2,155억 원(국비 842억 원) 규모로 바이오화학 원료개발, 주력산업 소재개발, 데모플랜트 구축에 지원하고 있다. 또한 바이오기술 융합 인력 양성을 위해 바이오화학 전문대학원 교육과정을 개설하여 산학연 석박사 합동 특성화 대학원을 운영하고 있으며 바이오화학 개발을 위한 울산 실증화 시설이 367억 원 규모 진행되고 있다. 현재 산업통상부 주관으로 추진되고 있는 산업바이오분야 중 바이오화학 주요 사업은 다음 표와 같다.
[표 3-48] 바이오화학산업화촉진기술개발사업(2017년 예산 약160억 원)
|
사업명 |
비고 |
|
비식용 그린카본 기반 바이오슈가 대량 생산 공통 활용 기술 개발 |
|
|
산업 미생물 발효에 적합한 고농도 바이오슈가 제조 기술 개발 |
|
|
공정 부산물의 고부가가치 응용제품용 중간 원료화 기술 개발 |
|
|
그린카본 함유량 25% 이상의 자동차 내장부품용 바이오 폴리우레탄 소재 개발 |
|
|
고함량 비식용 그린카본 이용 바이오폴리올 생산, 개질기술 및 자동자용 폼 개발 |
|
|
그린카본을 이용한 폴리우레탄용 바이오 이소시아네이트 및 대체 바이오 화합물 생산 기술개발 |
|
|
그린카본 함유량 25% 이상의 자동차 내장부품용 바이오 폴리우레탄 소재 개발 |
|
|
바이오플라스틱(PLA) 원스톱 융합공정기술 개발 |
|
|
Stereocomplex PLA 중합을 위한D형 모노머 생산의 상업화 기술 개발 |
|
|
일1톤 이상PLA 중합 및 가공응용제품 생산 기술 개발 |
|
|
바이오화학제품 생산을 위한 통합공정용 바이오콤비나트 기술개발 |
|
[표 3-49] 2017년 현재 산업통상자원부 바이오핵심기술개발사업 내 산업바이오 지원 현황과 주요 추진사업
|
사업명 |
비고 |
|
|
고유가시대 대비 생물공정을 통한 섬유/엔지니어링 플라스틱용 바이오 PTT 생산기술개발 |
’17년종료 |
|
|
|
바이오-뮤코닉산 생산기술개발 |
|
|
바이오-뮤코닉산으로부터 테레프탈산으로의 전환 공정 개발 |
||
|
바이오 TPA를 이용한 PTT 중합기술 및 섬유/엔지니어링 플라스틱 소재개발 |
||
|
Long-chain diacids (DC9∼DC13)의 생물학적 생산 기술 개발 |
|
|
|
|
지방/지방산으로부터 장쇄디카르복실산의 생물/화학적 전환 기술 개발 |
|
|
장쇄 카르복실산 생산공정 및 분리정제 기술 개발 |
||
|
장쇄 디카르복실산(C9∼C13) 활용 고분자 합성 및 기능성 제품화 기술 개발 |
||
|
ICT용 바이오 폴리아마이드 510의 생물학적 생산기술 개발 |
|
|
|
|
폴리아마이드 510의 단량체 세바식산의 생물학적 생산기술 개발 |
|
|
폴리아마이드 510의 단랑체 카다베린의 생물학적 생산기술 및 바이오 폴리아마이드 510 중합기술개발 |
||
|
고부가가치 바이오 부틸고무 제조 기술 개발 |
|
|
|
|
바이오 기반 이소부틸렌 생산기술 개발 |
|
|
바이오 기반 고무배합첨가제 및 부틸고무 제품 생산기술 개발 |
||
|
바이오매스 기반의 친환경 폴리에스테르계 분체도료 개발 |
|
|
|
바이오플라스틱용 신규 C6 단량체 생물학적 생산기술 |
|
|
|
코리네박테리움을 이용한 고부가 바이오플라스틱용 신규 단량체인 Heme의 생물학적 전환 및 이에 기반을 둔 Hemozoin 중합 공정 개발 |
|
|
|
생물전환기술을 이용한 식물오일 또는 포도당으로부터 나일론12의 단량체인 오메가-아미노라우르산의 대량생산 |
|
|
산업측면에서는 기존의 석유화학회사(SK, GS칼텍스, LG화학 등)와 발효 전문회사(CJ제일제당, 대상 등)를 중심으로 발효를 통한 산업바이오 관련 제품의 연구 개발이 진행 중이다. 바이오플라스틱을 중심으로 살펴 볼 때 국내 바이오플라스틱의 수요는 2013년까지 연 6.6%의 점진적인 성장 이후 2018년에는 4만 톤의 수요량을 기록, 아시아 시장전체에서 6%의 비중을 차지할 것으로 예상되어 국내 바이오플라스틱 시장규모는 약 1억 달러에 도달할 것으로 전망하고 있다32).
플라스틱의 시장동향은 생분해성 바이오플라스틱에서 석유화학제품 대체 바이오기반 플라스틱으로 점차 전환되고 있다. 이는 소비재 중심의 생분해성 플라스틱 보다는 산업분야에서 필요로 하는 바이오기반 플라스틱 소재가 부가가치가 높을 뿐 아니라 개발 범위가 넓고 다양하기 때문이다.
대표적인 생분해성 바이오플라스틱 제품인 PLA를 기준으로 보았을 때, 국내의 바이오플라스틱 소재 공급은 대부분 수입에 의존하고 있으며 국내에서는 이를 활용한 제품의 생산에 주력하고 있다. 주요 기업(제품)으로는 웅진케미칼(에코웨이-B), 에콜바이오텍(에콜그린), 도레이새한(Ecodear), 삼성정밀화학(Enpol)이 있다.
석유화학 대체 바이오기반 플라스틱분야의 선두는 해외 동향과 같이 바이오 PET 분야이다. 국내에서는 롯데케미칼이 토요타 통상(원료제공)과 협력하여 바이오 PET를 생산하고 있으며 현대자동차의 경우 자동차 내장재를 바이오 기반의 플라스틱으로 대체하기 위한 연구개발을 진행 중이다. GS칼텍스의 경우에도 바이오 원료 기반의 2,3-BDO와 폴리 트리메틸렌 테레프탈레이트의 합성에 사용되는 1,3-PDO, butanol을 연구개발 중에 있다. 또한 대상은 현재 lysine으로부터 cadaverine을 생산하여 polyamide의 전구체로 쓰기 위한 연구를 수행 중이다.
국내 산업바이오를 전체적인 측면에서 바라볼 때 아미노산과 같은 전통 발효산업기반의 산업바이오 분야는 해외 다국적기업들과 대등한 경쟁력을 가지고 있으나 생분해성 바이오플라스틱 산업은 원료수입을 통한 가공생산에 머물러 있고, 바이오기반 플라스틱 분야는 현재 플라스틱 전구체 생산을 위한 연구개발 중으로 알려져 있다. 현재 국내업체들의 바이오플라스틱 진출 현황은 다음과 같다.
[표 3-50] 국내업체들의 바이오플라스틱 진출 현황
|
업체명 |
사업영역 및 주요 내용 |
|
|
도요타 통상(원료제공)과 협력을 통해 바이오 PET를 생산하여, 바이오 PET병용으로 납품하고 있음 |
|
|
기존 폴리에스터 섬유에 옥수수에서 추출한 PTT를 첨가하여 신축성을 높인 신섬유(PET/PTT 복합방사 단섬유) 개발 |
|
|
기존 TPA에 바이오매스 기반 물질을 첨가하여 바이오 폴리에스터 수지를 개발(상품명 : ECOZEN) |
|
|
옥수수 전분 기반의 PLA를 활용한 다양한 친환경 생분해성 플라스틱 소재 개발(상품명 : 에콜그린) |
|
|
PLA를 원료로 사용한 이축연신필름 생산 |
|
LG 하우시스
|
옥수수 전분을 활용하여 광고용 접착필름 생산 |
|
도레이첨단소재
|
옥수수 전분을 원료로 이용한 PLA 생분해 플라스틱 생산(상품명 : Ecodear) |
|
|
생분해가 가능한 폴리에스테르 수지 생산(상품명 : Enpol) |
|
|
Lysine, methionine등의 사료 첨가용 아미노산과 바이오매스 기반의 xylose(다이어트 슈가 개념) 등을 생산하여 제품화함 |
|
대상
|
건강식품 소재로서의 미세조류(클로렐라) 등을 제품화하였고 PLA, pyrrolidone 등을 연구개발 중임 |
|
Lysine를 생산하여 제품화하였고 현재 lysine으로부터 cadaverine을 생산하여 polyamide의 전구체로 쓰기 위한 산업부 연구 사업을 수행 중임 |
|
|
삼양사
|
sorbitol을 isosorbide로 전환하여 바이오플라스틱 단량체로 생산 공정 개발 중. 울산에 연 10만 톤 규모의 isosorbide 파일럿 플랜트 건설 중 |
|
현대자동차
|
자동차 내장재를 바이오 기반의 플라스틱으로 대체하기 위한 연구개발을 진행 중임 |
|
|
바이오 원료 기반의 2,3-BDO, 1,3-PDO, butanol을 연구개발 중임 |
출처: 2016년 생명공학육성시행계획 자료, 탈석유화학산업 바이오플라스틱의 창조적 역할과 발전방안(2013), 산업연구원
라. 발전 과제
산업바이오분야는 아미노산과 항생제로 대표되는 전통 발효산업인 바이오소재부터 미래 석유화학산업 성장의 기반기술로 발전해 나갈 바이오에너지, 바이오기반 플라스틱 그리고 정밀화학소재 분야까지 점차 그 규모와 시장이 확대되어 가고 있다. 우리나라의 항생제와 아미노산 분야 발효기술은 1980년대 이미 선진국 대비 90% 이상의 경쟁력을 갖춘 분야이기도 하며 석유화학산업 또한 산업규모면에서 세계 순위 4~5위권에 위치하고 있는 경쟁력 있는 산업이다.
그러나 최근 이들 두 분야는 중국의 급속한 생산능력 확대와 경기 침체로 인하여 급격하게 경쟁력을 잃어가고 있다. 또한 국제 사회의 온실가스 감축 압박과 친환경 규제의 강화에 따른 친환경 화학제품 생산에 대한 필요성 증대는 우리나라의 발효산업과 석유화학 산업에 새로운 혁신적인 변화와 함께 정부의 관련 산업 정책에 있어서도 과감한 R&D 투자와 전략을 요구하고 있다.
이러한 측면에서 가장 중요한 점은 산업바이오의 체계적 육성을 위한 법・제도적 체계 마련이 시급하다는 것이다. 미국의 경우 2000년부터 추진해온 다양한 법체계를 기반으로 BioPreferred® 프로그램 등을 추진해 오고 있으며, 이는 우리나라 산업바이오 분야를 육성하기 위한 좋은 예로 활용할 수 있다.
또한 우리에게 가장 필요한 역량은 산업바이오 관련 산학연 주체간의 협력이다. 산업바이오 분야는 기술과 산업의 특성으로 인하여 바이오 기업이나 석유화학 기업 간 서로의 협력이 없이 단독으로는 성공하기 매우 어려운 분야이다. 때문에 선진국의 다국적 기업들은 대부분 산학연 공동연구, 화학회사와 바이오회사의 제휴 등 다양한 형태의 협력 프로그램과 공동 투자 전략을 수립하고 있다.
마지막으로 바이오화학제품의 시장 확대를 위한 인증제 도입이 시급하다. 최근 몇 년 간 저유가 기조 유지로 인하여 석유화학제품 가격이 하락하고 이에 따라 바이오화학제품의 시장경쟁력이 급격히 나빠지면서 국내 석유화학 관련기업의 바이오화학 분야 투자가 위축되고 있다. 하지만 해외 다국적 석유화학 기업들은 이를 타개하고 시장 경쟁력을 확보하기 위하여 연구개발 투자를 강화하고 있으며 우리나라의 바이오화학 산업의 경쟁력을 높이고 투자를 촉진할 수 있는 유일한 방법은 바로 바이오화학제품의 인증제와 의무혼합제의 시행이다. 즉 바이오디젤과 같이 기존의 석유화학 제품에 일정 비율의 바이오화학소재를 혼합하도록 의무화함으로써 국내 석유화학산업이 점차 바이오화학 산업으로 전환해 가는 촉진제가 될 수 있을 것이다.
정부의 과감한 투자와 시장경쟁력 강화를 위한 적극적인 인센티브 및 소비 장려 정책 그리고 바이오・화학 산업 간의 협력이 석유화학 산업과 바이오산업의 융합산업인 산업바이오 강국 진입을 위한 초석이 될 수 있을 것이다.
2. BT + ICT
가. 개요
4차 산업혁명은 정보통신기술(ICT)의 융합으로 새로운 산업의 시대를 여는 디지털 혁명의 시대이며, 디지털 세계와의 접목은 다양한 방법을 통하여 얻어진 빅데이터를 통합하여 새로운 가치를 창조하는 것이다.
특히 바이오 의료 분야는 인공지능과 빅데이터 분석 기술 등 ICT 기술과의 접목을 통하여 질병을 치료하고 수명을 연장하는 분야까지 확대될 것이다. 차세대 시퀀싱 장비의 개발로 누구나 1,000달러 정도면 자신의 유전자를 분석하여 평생 어떤 질병에 걸릴지를 예측하고 생활 습관의 개선을 통하여 발병의 위험을 줄일 수 있는 시대가 다가오고 있다. 바이오 의료 분야는 지금까지 경험하지 못한 거대한 데이터를 다뤄야 하며 미래 바이오 의료의 핵심은 이러한 바이오 빅데이터를 처리할 수 있는 능력에 달려있다고 해도 과언이 아닐 것이다.
매우 빠르게 진행되는 고령화로 노인 인구의 증가와 함께 암 등의 만성질환이 증가하면서 의료비 부담이 증가되고 있으며 의료복지의 확대로 건강보험재정 부담이 가중되고 있다. 때문에 현재 치료법의 부작용과 낮은 치료 효율을 고려할 때 환자 특성을 고려한 맞춤 치료로 치료효율의 개선이 필요한 상황이다.
정밀의료는 유전체정보, 건강정보, 생활습관 등 개인의 다양한 정보를 기반으로 질병을 정밀하게 치료하고 예방하는 것이다. 정밀의료가 일상생활에서 실현이 되면 정확하고 빠른 진단을 통한 질병 예방 전략을 수립할 수 있고 진단 및 치료 과정에서 적절한 치료법과 의약품을 선택하게 되어 치료 효과가 증진될 것이다. 또한 부작용이 최소화되어 개인의 건강 수명이 연장되고 의료비용이 절감될 것이다.
정밀의료를 실현하기 위한 필수 요소는 인구집단 코호트, 유전체 정보, 건강정보기록, 빅데이터 분석기술, 스마트 헬스케어 기술 등이다. 스마트폰의 보급과 웨어러블 기술의 발전으로 다양한 센서가 개발되어 우리는 일상생활 속에서 자신의 건강, 생활습관, 생활환경 등에 대한 모든 정보를 디지털화 할 수 있는 기술을 보유하게 되었다. 또한 차세대염기서열분석(NGS)기술의 발전으로 개인의 유전정보를 저렴하게 분석할 수 있는 기반이 마련되었다. 이미 많은 병원에서는 전자의무기록을 도입하여 환자의 임상데이터를 디지털화하여 저장하고 있다. 인공지능 등 데이터 분석기술의 발전으로 방대한 양의 유전체, 임상, 건강 데이터를 자동으로 분석 가능한 임상 결정 지원 기술이 개발되고 있다. 이러한 기술이 활용될 때 새로운 치료법으로 질병을 능동적으로 예방할 수 있는 방법을 찾게 될 것이다.
정밀의료에서 요구되는 기술들은 대부분 BT+ICT 융합기술로 바이오 의료 산업이 활성화됨에 따라서 관련 기술과 산업도 함께 발전할 것으로 예상된다. 본 장에서는 정밀의료 실현을 위한 BT+ICT 주요 분야에 대해서 살펴보고자 한다.
나. 해외 동향
(1) 빅데이터 분석 기술
세계 의료 산업은 비용 절감에 대한 요구, 인구 고령화와 만성질환 증가에 대한 의료 문제 해결, 치료에서 예방으로 건강관리의 패러다임 변화 등 세 가지 핵심 과제에 직면 해 있다. P4 Medicine(Personalized, Precise, Participatory 및 Predictive)의 개념은 IT 및 분석 도구를 활용하여 데이터의 축적, 저장, 관리 및 효과적인 분석을 통하여 달성할 수 있다. 바이오・헬스케어 빅데이터 활용에 대한 관심이 높아지면서 데이터를 수집, 분석하고 이를 위한 IT플랫폼을 제공하는 산업이 빠르게 성장할 것으로 예상된다.
빅데이터 분석은 바이오마커 디스커버리, 신약개발, 원격 환자 모니터링, 공공보건 등에서 데이터를 실시간으로 대량 수집하고 분석하여 약물의 부작용을 발견하거나, 환자의 건강상태를 모니터링하고 질병 발생 및 전파를 추적하여 공중 보건 감시를 향상시키는데 도움을 줄 수 있다. 미국을 비롯한 의료 선진국에서는 빅데이터 분석을 활용한 다양한 보건 의료 서비스를 제공하고 있다.
◦Pillbox는 다양한 약에 대한 정보 제공을 통해 약물의 복용량, 부작용, 주의사항 등 의학정보를 제공하여 부작용으로 인한 불필요한 의료비를 연간 5,000만 달러 이상 절감시킬 수 있으며 사용자의 정보 검색 로그를 분석해서 유행하는 질병, 전염 속도, 질병의 지역별 분포에 대한 예측이 가능하다.
◦Clinical Query는 투약, 진단 및 실험실 가치를 포함하여 220만 명의 환자에게 2억 개의 데이터 포인트를 포함하는 저장소를 이용하여 질병을 일으키는 원인에 대한 가설을 테스트하거나 약물, 식이 또는 생활 습관 변수로 인해 발생할 수 있는 위험을 줄일 수 있는지 테스트 가능한 환자 기록의 대용량 데이터베이스 검색 엔진을 개발하였다.
◦Pervasive는 의료업계의 보험사기 퇴치를 위해 멀티 코어 컴퓨터 및 여러 컴퓨터 클러스터에서 고속 병렬 데이터 처리를 위한 응용 프로그램 프레임 워크 및 분석 엔진인 DataRush를 사용하여 주 기관과 계약을 맺은 서비스 제공 업체가 메디케이드 사기를 탐지할 수 있다.
◦GNS Healthcare는 약물 부적합, 대사 증후군, 당뇨병, 조기 출산 및 전문 의약품과 관련된 진단을 향상시키기 위한 클라우드 솔루션으로, 질병의 진행을 막고 효과적이고 정확한 치료 방법을 찾아 낼 수 있도록 도와주는 분석 솔루션을 제공한다.
◦OmedaRH는 고객(병원, 의사, 건강관리 공급자 및 제약 회사 등)에게 가장 적합하고 효과적인 약품을 결정하기 위한 Big Data 솔루션을 제공한다. OmedaRH는 미국의 아이다호, 유타, 워싱턴 및 오레곤에서 160만 명에 달하는 건강보험 가입자의 약물 순응도를 돕기 위한 솔루션을 제공한다.
(2) 인공지능 기술
환자의 유전정보, 임상정보, 건강정보 등으로 구성된 빅데이터를 인공지능을 통해 분석하여 임상의의 진단 및 처방을 지원하는 임상의사결정지원기술(CDSS)이 미래 정밀의료의 핵심 요소로 대두될 것으로 예상된다. 방대한 양의 정밀의료 연구자원에 인공지능 기술을 접목하여 임상현장에서 진단의 정확성・속도를 향상시킴으로써 보건의료시스템의 실질적 개선을 가져올 것이다. 인공지능(AI)기술은 의료진이 처리하기 어려운 방대한 양의 개인 빅데이터를 신속하게 취합・분석하기 때문에 기존 치료 중심에서 예방 및 예측 중심으로 헬스케어 산업이 전환되도록 지원하여 패러다임을 전환시킬 것으로 예상된다. CDSS 세계 시장규모는 2015년 4.1억 달러(약 0.48조 원)에서 연평균 21.5%씩 급속히 성장하여 2020년에는 16.04억 달러(약 1.88조 원)에 달할 전망이다.33) 인공지능기술 관련 서비스는 다음과 같다.
◦IBM의 Watson은 자연어 형식으로 된 질문들에 대한 답할 수 있는 인공지능 질의응답 시스템으로, 미국 메모리얼 슬론 케터링 암센터는 IBM과 협약을 맺고 Watson에게 60만 여건의 의학자료, 200만 페이지의 의학서적, 2만 5,000여 건의 환자 기록을 학습시켜 폐암 치료진단에 사용 중이다. 이를 통하여 IBM은 의료서비스 데이터를 활용하는 ‘Watson Health’사업부를 통해 인공지능을 이용한 의료서비스 개발을 추진하고 있다.
◦POEMS(Post Operative Expert Medical System)은 영국의 St. James University Hospital에서 개발한 프로그램으로 시술 후 환자의 예후변화, 의료기록, 시술기록 등을 바탕으로 가장 적합한 진단과 치료 방법을 제시해주는 프로그램이다.
◦엔리틱(Enlitic)은 의사들이 방대한 규모의 의료 데이터를 진단에 활용할 수 있도록 딥러닝(deep learning)기술과 이미지 분석기술을 통해 신속하고 정확하며 쉽게 의료영상, 의사 처방전, 연구실 실험 데이터 등 자료에 접근할 수 있는 의료 진단 서비스를 개시하였다.
◦ 메드어웨어(MedAware)는 AI기술을 통해 리스크 관리에 대한 의사결정 지원 구조를 구축하고 처방오류 문제를 실시간으로 예측, 환자 안전 보호 및 헬스케어 비용 절감에 기여할 수 있는 솔루션을 제공한다.
◦진저.io(Ginger.io)는 개인이 언제든 자신의 정신적 상태를 분석하고 의료 전문가들이 개발한 치유전략을 학습하며 필요할 경우 추가적인 치료 과정에 나설 수 있도록 MIT대에서 개발한 첨단 예측 모델을 적용, 우울증과 분노조절장애 등의 정신질환 진단 및 치료 서비스를 개시하였다.
(3) 웨어러블 기술
웨어러블 기기는 사용하는 동안 신체에 착용 또는 부착이 가능하고 앱으로 구동되는 컴퓨팅 디바이스이다. 헬스케어 웨어러블 기기는 현재의 착용형 기기에서 신체 부착형 기기로 발전할 것으로 전망된다. 최근에는 Stretchable/flexible 특성의 웨어러블 기기에 대한 연구가 진행 중이며, 표피 전기 시스템(EES)으로 심박, 뇌파, 온도, 압력 등의 측정을 연구하는 것으로 박막형 tattoo형태로 피부에 부착이 가능한 형태로 발전하고 있다.
일상생활 속에서 자신의 건강, 생활습관, 환경 등에 대한 모든 정보를 디지털화하기 위해서는 일상 생활기록인 라이프로그 데이터의 수집과 분석을 해야 한다. 웨어러블 기기가 생산하는 데이터의 장점은 사용자의 상황에 기반을 둔 다양한 경험을 정보화 할 수 있다는 것이다. 이를 위해서는 데이터의 분석과 분석에 기반을 둔 정확한 예측 기술이 필요하며 이를 통하여 상황에 기반을 둔 다양한 피드백과 서비스를 제공할 수 있다. 웨어러블 기기의 보급과 함께 확보되어야 하는 기술이 빅데이터 분석 기술이다.34)
Nike, Google, Apple, 삼성 등 ICT 기업 중심으로 건강데이터 수집을 위한 모바일・웨어러블 디바이스를 출시하고 있다. 운동량, 보행, 심박수, 칼로리 등 다양한 활동 데이터를 수집할 수 있는 웨어러블 센서가 개발되고 있고 데이터 통합・분석 및 활용을 위한 플랫폼은 주요 업체를 중심으로 생태계가 조성되고 있다.
구글은 피트니스 데이터를 한 곳에서 관리하는 안드로이드 기반의 헬스케어 플랫폼인 구글 핏(Google Fit)을 발표하였다. 의료영역보다는 개인 건강관리분야에 집중하여, 걷기, 달리기 등 활동을 감지하고, 이러한 데이터를 기록해 모니터링 할 수 있게 한다.
애플은 디지털 헬스케어 플랫폼 헬스키트(HealthKit)와 대쉬보드 형태의 어플리케이션 헬스를 발표하였다. 웨어러블 디바이스, 스마트폰 어플리케이션 등에서 측정된 데이터는 헬스키트(HealthKit) 플랫폼을 통해 통합적으로 관리되며, 일반 사용자들은 헬스(Health)라는 통합 어플리케이션을 통해 자신의 건강정보에 접근이 가능하다.
(4) 바이오센서・칩 기술
정밀의료의 부상과 함께 다양한 질병을 진단하고 약물의 적합성을 시험할 수 있는 바이오칩은 그 발전 가능성이 크다. 바이오칩은 유전자 분석, 독성학, 단백질 분석, 생화학 연구, 맞춤의학 등 다양한 분야에서 활용되고 있으며 질병 예측 및 임상 진단, 신약개발 등의 연구에 이르기까지 빠르게 보급・확산되고 있다.
DNA칩 세계 시장은 2015년 3,433.5백만 달러 규모에서 연평균 16.3%로 성장하여 2020년에는 7,312.1백만 달러에 이를 것으로 전망되었다. 또한 Lab-on-a-chip은 제약 및 생명공학 기업, 연구실 등에서 체외진단 및 현장 진단(POC) 등의 분야에서 이용이 늘어나고 있는 추세로 시장 예측 기간 동안 성장률이 가장 높을 것으로 전망되었다. 2015년 Lab-on-a-chip은 2,609.5백만 달러 규모였으며 연평균 20.6%로 성장하여 2020년 6,655.4백만 달러 규모에 이를 것으로 전망되었다.35)
[표 3-51] 종류별 바이오칩 시장규모 및 전망
(단위: 백만 달러)
|
연도 구분 |
시장 규모 |
CAGR(%) |
|||
|
2013년 |
2014년 |
2015년 |
2020년 |
||
|
DNA칩 |
2,389.3 |
2,865.8 |
3,433.5 |
7,312.1 |
16.3 |
|
Lab-on-a-chip |
1,735.9 |
2,129.5 |
2,609.5 |
6,655.4 |
20.6 |
|
단백질칩 |
763.8 |
929.3 |
1,129.3 |
2,768.7 |
19.6 |
|
기타* |
327.3 |
388.6 |
457.7 |
1,011.6 |
17.2 |
|
합계 |
5,216.3 |
6,313.1 |
7,630.0 |
17,747.8 |
18.4 |
*기타: call array와 tissue array를 포함하는 기타 arrays
자료: Biochip market_forecast to 2020(2016), MarketsandMarkets
출처: 황지나, 바이오칩, KISTI 마켓리포트 2016-46
다. 국내 현황
(1) 빅데이터 분석 기술
국내 빅데이터 분석 기술 관련 활동은 주로 데이터를 확보하고 있는 기관들을 중심으로 이루어지고 있다. 국민건강보험공단은 질병관리본부와 SNS, 건강보험 청구자료, 의료기관 의무기록 등을 실시간 분석하는 시스템을 구축하여 감염병 빅데이터 분석 플랫폼 구축 사업을 진행 중이며, 건강보험심사평가원은 보건의료 빅데이터 개방시스템 구축을 통해 보건복지부, 식품의약품안전처, 보건소, 국민건강보험공단의 데이터를 통합・가공하여 의료 빅테이터를 제공하고 있다. 서울아산병원은 한국전자통신연구원(ETRI)과 공동연구로 보건의료 빅데이터 분석 플랫폼 기술을 개발하여 한국형 빅데이터 분석 플랫폼 기술을 개발 중이다. 심혈관질환에 관한 의료 빅데이터 분석기술을 개발하여 심장마비 및 심혈관계 질환 위험도 사전예측, 진단 정확도 향상, 약제 순응도 및 부작용 모니터링 예측 등에 활용 예정이다. 가천대길병원은 한국IBM의 빅테이터 분석 솔루션 PDA(PureData System for Analytics)를 이용한 플랫폼인 임상연구 검색시스템(CRDW: Clinical Research DW)을 구축하여 서비스 중이다. 이를 통하여 임상정보 빅데이터를 구축 중이며 감염관리, 퇴원분석, 임상 질 지표 등의 분석・관리를 통해 환자안전과 진료의 질 향상을 기대하고 있다.36)
(2) 인공지능 기술
국내 인공지능 기술기반 임상결정지원 기술은 학습데이터 및 임상 데이터 확보가 다소 용이한 의료 영상 분야를 중심으로 발전하고 있다.
◦Lunit은 흉부 엑스레이와 유방촬영술(Mammography)에 특화된 머신러닝기반 영상의료 진단솔루션 개발 벤처 기업으로, 자체적으로 개발한 Weakly Supervised Learning 알고리즘을 이용하여 엑스레이, MRI, CT 등의 원데이터에 전처리 과정을 생략하여 기술력과 경쟁력을 확보하였다. DIB(Data-driven Imaging Biomarker)는 결핵 분야에서 96%이상의 정확도를 보인다.
◦Vuno는 딥러닝 알고리즘을 이용하여 엑스레이(X-ray), 컴퓨터단층촬영(CT), 자기공명영상(MRI) 및 의료정보를 바탕으로 임상 진단을 하는 기업이다. 딥러닝 기술과 의료 데이터를 접목, 의사가 보다 정확한 진단을 내릴 수 있게 돕고 질병 예측을 가능하게 하는 의료용 소프트웨어 ‘뷰노 메드 (VUNO-Med)’를 개발하였다. 서울아산병원과 공동연구 결과 폐질환 진단 정확도는 97% 수준이다.
(3) 웨어러블 기술
국내에서 웨어러블 기기와 통합 분석 플랫폼을 확보한 기업은 스마트폰 제조업체인 삼성전자가 대표적이다. 삼성전자의 Simband는 사용자의 심장 박동수, 호흡, 혈압 등 인체의 각종 생체신호를 감지할 수 있는 하드웨어 플랫폼이며 수집된 인체 건강 데이터는 클라우드 기반의 소프트웨어 플랫폼인 사미(SAMI: Samsung Architecture for Multi-modal Interactions)와 연동되어 빅데이터 알고리즘으로 분석된다.

출처: 삼성전자
[그림 3-79] 삼성전자의 SAMI 플랫폼 개념도
(4) 바이오센서・칩 기술
국내 바이오칩의 아이템으로는 질병 진단용 칩이 대부분이다. 국내에서는 그동안 진단용 DNA칩, 단백질칩 등을 분석할 수 있는 장비에 대한 연구가 상대적으로 미비한 상태였으며 주로 수입 장비에 의존해왔다. 주요 기업으로는 마크로젠, 바이오니아, 나노엔텍, 엔에스비포스텍, 올스바이오메드 등 기업들이 바이오칩 관련 질병 진단 및 분석 제품들을 시장에 공급하고 있다. 우리나라는 세계 최고 수준의 ICT 기술과 인프라를 보유한 국가로서 BT와 ICT가 접목된 바이오칩 기술은 부가가치가 큰 의료산업 및 실버산업 등 블루오션 산업의 경쟁력을 크게 올릴 수 있는 핵심 기술로 향후 높은 성장이 예상된다.37)
라. 발전 과제
의료 산업은 중요한 패러다임 전환을 하고 있다. 생명과학 분야의 놀라운 발전으로 인해 수많은 새로운 진단 및 치료법 기회가 창출되었으며 다른 분야의 연구와 연계된 ICT 기술은 의료 분야에 힘을 실어주고 있다. 스마트한 건강 및 데이터 관리를 가능하게 하는 디지털 혁신은 건강관리에 있어서 의학을 발전시키고 있다.
빅데이터가 의료 산업의 기회가 될 수 있지만 궁극적인 목표는 단순히 경쟁 우위를 위한 것이 아닌 인간의 건강한 삶을 목표로 해야 한다. 전체 의료 업계는 빅데이터를 통하여 건강 분석을 위한 포괄적이고 예측 가능한 모델을 달성하고, 보다 개선된 솔루션, 종합적인 플랫폼으로 높은 비용을 절감하고 궁극적으로는 전체 의료 산업을 위한 효율적인 전략과 조치를 달성할 수 있는 방법을 모색해야한다. 장기적으로 의료 분야에서 빅데이터의 과제는 모든 이해 관계자에 따라 경쟁 우위를 위한 기회로 전환시켜 궁극적으로 최적의 결과를 얻는 것이다. 따라서 새로운 패러다임의 실현에 필요한 이해 관계자의 준비와 환경조성, 인력 보완 및 정책이 필요하다.
또한 최신 기술의 도입은 새로운 문제를 야기하므로 프라이버시와 정책, 혁신의 균형을 유지하는 것이 중요하다. 의료기록을 디지털화하고 통합하면 환자 프로필, 병원기록, 보험기록, 주민번호, 청구정보, 유전기록 등 민감한 정보가 위험에 노출되므로 환자 개인정보 보호에 대한 우려가 있다. 개인정보의 침해를 방지하고 관련 산업이 활성화 될 수 있는 제도 마련이 시급하다.
3. BT + NT
가. 개요
나노기술(Nanotechnology)은 원자 수준에서 물질을 합성, 제어하거나 그 성질을 측정하고 규명하는 기술을 말한다. 이러한 나노기술을 생명공학(Biotechnology)에 접목하여 생체분자를 관찰하고 인위적으로 조작하고 응용하는 것을 나노바이오기술(Nanobiotechnology)이라고 일컫는다. 특히 생체 내 대사는 나노스케일(nanoscale)에서 이루어지므로, 나노바이오기술을 적용하면 생물학적 현상을 더욱 효과적으로 이해할 수 있다. 이러한 기술을 바탕으로 새로운 신약의 개발, 효과적인 진단 및 치료 수요에 답하여, 유전물질에 작용하는 의료품이나 개개인이 상비할 수 있는 진단장치의 개발에 박차가 가해지고 있다.
현재 산업화로 연결되는 대표적인 바이오나노기술로 나노바이오센서와 나노생체소재 분야를 들 수 있다. 나노바이오센서를 통해서 매우 작은 생체유래 물질들을 고감도로 검출하고, 생체 대사의 변화를 민감하게 추적하여 질병의 예후를 추정할 수 있다. 이 외에도 적용 분야에 따라서 응용할 수 있는 범위가 무궁무진하다. 나노생체소재는 나노스케일의 생체적합성 구조체를 아우르는 말로 생체 내에 주입하여 원하는 부분을 이미징하거나 특정 부위에 약물을 전달하며, 원하는 부위에 부착하여 환자가 일상생활을 하는 와중에 생체 대사를 추적할 수 있다.
위의 간단한 예시들처럼 바이오나노기술은 이전에 가능하지 않았던 물질의 검출을 가능하게 하고 더욱 세밀하고 지속적으로 환경 변화를 추적하게 하여 생체분자의 대사 작용 연구와 의약학 분야에 효율적이고 효과적이다.
나. 연구 동향
(1) 나노바이오센서
바이오센서는 분석 물질을 감지하기 위해 효소, 항체, 항원, 수용체, DNA 등의 생체감지물질(Bio-receptor)을 이용해 물질을 검출하고, 물리화학적 신호변환기(Signal Transducer)를 통해 생체감지물질과 분석물질 간의 상호작용 및 반응을 신호로 변환한다. 나노바이오센서란 나노기술을 통해 바이오센서의 성능을 개선하거나 분자 수준에서 물질을 검출하는 센서를 말한다. 최근의 연구개발에 힘입어 다양한 고효율의 상용화된 센서가 나오고 있으며, 특히 비침습적인 방법의 액체생체검사(Liquid biopsy)와 IoT(Internet of Things)가 연계되어 다양한 생체 정보를 집적하고 분석하여 사용자에 제공하는 스마트 헬스 케어, 그리고 현장에서 샘플을 채취하여 바로 분석・관찰이 가능한 현장진단검사가 대두되고 있다.
(가) 소량의 체액으로 검사 가능한 액체생체검사
액체생체검사(Liquid biopsy)는 비침습적인 진단 방법으로 비교적 간편하게 혈액이나 복수 등 체액을 추출하여 질병 여부를 확인할 수 있다. 액체생체검사 이전의 생체검사는 침습적인 병리조직검사로, 주로 암 진단에 활용되어 질병이 의심되는 부위에서 일정량의 샘플을 적출하여 검사하기 때문에 환자에게 부담이 많고 회복에 시간이 걸렸다. 또한 현 생체검사는 폐・유방・대장・골수 등 특정 부위의 이상 유무만 분석이 가능한데다 검사 시간이 오래 걸리는 단점이 있어 이를 보완하는 기술로 액체생체 검사가 떠오르고 있다.
액체생체검사는 환자의 체액으로 검사 및 진단이 이루어져 빠른 검사가 가능하고 질병의 일부만 분석할 수 있었던 병리조직검사와는 달리 다각적인 분석으로 질병에 대해 전반적인 정보를 얻을 수 있는 장점이 있다. 액체생체검사의 주요 표적은 혈액 중에 떠돌아다니는 암세포 관련 돌연변이 핵산이나 종양세포로, 채취할 조직샘플이 충분하지 않거나 채취하기 힘든 조직을 검사해야하는 상황에서 매우 유용하다. 특히 이 검사 방법은 2017년 세계경제포럼에서 선정한 10대 미래 유망기술 중의 하나로, 현장진단, 재택진단 등 의료관련 분야 시장에서 지속적인 확대가 있을 것으로 보인다.
Market Research Future는 2022년까지 2,500억 달러의 시장을 예상했으며, RNCOS는 2020년까지 액체 생체 검사 매출이 10억 달러를 넘어설 것으로 전망했다. Grand View Research는 2030년까지 시장 규모가 56억 달러로 증가하고, 그 중에서 circulating tumor DNA(ctDNA)가 큰 비중을 차지할 것으로 예상했다. ctDNA 외에도 circulating tumor cells(CTCs), extracellular vesicles(exosomes) 등의 액체 생체 검사가 있다. 그 중에서 Bill Gates와 Amazon.com의 CEO인 Jeff Bezos의 투자로 초기 암을 진단할 수 있는 혈액 기반 ctDNA 스크리닝 테스트의 개발이 주목받고 있다. 액체 생체 검사의 상용화에 앞서고 있는 업체들을 보면, 총자본금액 순으로 Grail, Guardant Health, Biodesix, Pathway Genomics, Exosome Diagnostics 등의 회사가 있다.
최근 액체 생체검사와 관련된 국내 연구로는 눈물의 성분에서 요산농도를 측정하고 이를 혈중 요산 농도와 비교해 통풍을 진단하는 종이 검사지(Park et al. 2017)와 소량의 소변으로부터 전립선암을 진단할 수 있는 바이오 바코드(Hyojin Lee et al. 2017), 그리고 땀에서 혈당을 측정할 수 있는 다공성 금으로 설계한 센서(Hyunjae Lee et al. 2017)가 있다.
국외에서도 활발한 연구가 진행되고 있다. 세포정보를 포함하고 있는 엑소좀(exosome)을 검출하는 nano-DLD(nanoscale deterministic lateral displacement) 랩온어칩(Lap on a chip) 기술(Wunsch et al. 2016), 그리고 항체가 달린 단일벽 탄소나노튜브로 전이성 종양세포를 포착 및 분석하는 액체 생검칩(Khosravi et al. 2016)이 개발되었다. 이 외에도 혈액 샘플 내 여러 가지의 질병 표시기를 감지하는 광-전기 바이오센서(Juan-Colás et al. 2016)와 알츠하이머와 전립선암에 존재하는 mRNA 표적 검출을 위한 그래핀 산화물-상향 전환 나노입자(Graphene Oxide-Upconversion Nanoparticle)을 이용한 광학센서(Vilela et al. 2017)가 개발되었다.
|
병리조직검사 Biopsy |
액체생체검사 Liquid biopsy |
|
|
|
|
침습성 검사 |
비침습성 검사 |
|
장기 회복 기간 필요 |
회복 기간 필요 없음 |
|
고가의 검사 비용 |
저가의 검사 비용 |
|
검사시간 소요 많음 |
검사시간 소요 적음 |
|
제한적 정보 |
전반적 정보 |
|
입원 치료 필요 |
입원 치료 불필요 |
(나) 실시간으로 생체정보를 수집하는 착용형 센서
착용형 장치(Wearable device)는 몸에 밀착하여 지속적으로 생체정보를 파악할 수 있도록 하여 개개인의 건강・보건 상태를 상시 체크할 수 있게 해준다. 최근 wearable device의 하나로 나노피부(electronic tattoo)의 연구가 활발하다. 나노피부는 피부에 부착 가능한 신축성 있는 초소형 전자 장치로 장시간 생체 신호를 측정할 수 있다.
국내에서 연구된 wearable device로 피부에 붙이는 생체신호 측정 소자(Jaemin Kim et al. 2016), 포유류 촉각 원리를 활용하여 외부압력을 센싱하는 전자피부(Jin et al. 2017), 당뇨병 및 녹내장 진단 가능한 스마트 콘택트렌즈 센서(J. Kim et al. 2017) 등이 있다.
국외에서도 생체 신호를 모니터링하는 다양한 wearable device가 연구되고 있다. 혈중 알코올 농도 측정하는 전자 피부 패치(Jayoung Kim et al. 2016), 뇌 장애를 진단하는 유연한 센서(Hussain & Hussain 2016), 전도성 나노와이어 격자와 탄성 고분자의 얇은 층을 이용하여 치료 효율을 높이는 전자붕대(S. Han et al. 2016), 가정용 종이로 만든 다중 감각의 종이 스킨(Nassar et al. 2017), 피부에 부착되어 땀을 분석하는 미세유체역학 장치(Koh et al. 2016) 등의 연구가 이루어지며 더욱 간편하고 지속적으로 모니터링이 가능한 제품들이 개발되고 있다.
이러한 wearable device와 ICT가 접목되어 생체정보를 데이터로 치환하여 언제 어디서나 예방, 진단, 치료, 사후 관리 등 개개인 맞춤형 의료 서비스를 제공하는 기술을 스마트 헬스 케어라고 한다.

출처: Frost & Sullivan
[그림 3-80] 스마트 헬스 케어
스마트 헬스케어의 핵심 기술로 바이오 인포매틱스, 바이오전자, 생체정보 인터페이스, 생체정보보호, 바이오컴퓨터를 들 수 있는데, 이 중에서 바이오전자는 바이오칩/센서, 생체 이미징 등을 아우르는 것으로 생체로부터 획득한 데이터를 기반으로 판단하여 종합적인 정보를 제공한다. 특히 이러한 신체 건강상태 정보를 실시간으로 파악하고 관리해 주는 개인건강정보 관리 시스템(Personal Health Records, PHR)으로 질병의 치료에서 예방하는 것으로 의료 형태가 바뀌고 있다.
[표 3-52] 의료서비스의 변화
|
구분 |
Tele-헬스 |
e-헬스 |
u-헬스 |
smart-헬스 |
|
시기 |
1990년 중반 |
2000년 |
2006년 |
2010년 이후 |
|
서비스 내용 |
원내 치료 |
치료 및 정보제공 |
치료 및 예방 관리 |
치료. 예방, 복지, 안전 |
|
주 참여자 |
병원 |
병원 |
병원, ICT 기업 |
병원, ICT 기업, 보험사, 서비스기업 |
|
주 이용자 |
의료인 |
의료인, 환자 |
의료인, 환자, 일반인 |
의료인, 환자, 일반인 |
|
주요 시스템 |
병원 운영(HIS, PACS) |
의무기복(EMR) 웹사이트 |
건강기록(EHR) 모니터링 |
개인건강기록기반 맞춤형 서비스 |
출처: 스마트 헬스케어 산업 활성화 방안, 바이오분야 산업엔진 프로젝트, 산업통상자원부, 2015.01.30.
(다) 현장에서 검출하는 센서
현대 사회의 사람들은 편리한 일상을 영위하는 반대급부로 생활 전반에 걸쳐 다양한 화학물질에 둘러싸여 살아간다. 그 중에서 유해화학물질은 호르몬 장애, 신경계질환 등을 유발할 수 있으므로 인체에 부정적인 영향이 없도록 사용을 금지하거나 허용기준을 정하는 것이 중요하다. 특히, 2011년에 발생한 가습기살균제 사건의 경우 뒤늦게 유해판정을 받아 피해자가 급증하였다. 이에 화학물질이 인체에 어떤 영향을 끼치는지, 인체에 안전한 정도는 어느 정도인지 연구하고 유해물질을 효과적으로 검출하기 위한 연구가 필수불가결한 상황이다. 미세먼지, 살균제, 멸균제, 조류유래 독성물질(마이크로시스틴), 곰팡이 유래 독성물질(오클라톡신) 등 다양한 물질에 대해 활발한 연구가 진행 중이며, 이러한 연구 결과를 바탕으로 빠르고 간단한 검출 기술들이 개발되고 있다.
인체 유해물질 검출기술은 나날이 발전하고 있으며, 국내에서는 천식 및 알레르기의 원인 중 하나인 공기 중의 곰팡이균을 실시간으로 감지하는 기술(Junhyup Kim et al. 2016), 새집・새차 증후군의 원인인 톨루엔을 초고감도로 검출할 수 있는 다공성 금속유기구조체(Koo et al. 2016), 용액 중 방사성 요오드를 99.9% 제거 가능한 정화 기술(Choi et al. 2017), 누구나 쉽게 현장에서 수은을 검출할 수 있는 고감도 종이칩(Han et al. 2017)이 개발되었다.
국외에서는 휘발성 유기 화합물(Volatile Organic Compounds. VOCs)을 검출하는 고감도 가스 검출기(Kida et al. 2016), 경제적이고 생물 분해가 가능한 환경 친화적인 콩 바이오나노 공기필터(Liu et al. 2017) 등 공기오염에 대한 연구개발이 이루어졌으며 고체-기체 계면에서 마찰력을 기하급수적으로 증가시켜 유해 화학물질을 검출하는 공명기(Phani et al. 2016)에 대한 연구가 있었다. 그리고 용수오염을 검출하고 정화하는 발광성 결정(Rudd et al. 2016)과 PI(propidium iodide)-GFP 이중형광마커를 통한 나노입자의 독성 검출 방법(Hong et al. 2016)이 나왔으며 다공성 나노복합체(NH2/SnO2-RTIL)를 이용하여 Cd(Ⅱ)에 대한 높은 감광도와 선택적 검출법(Yang et al. 2017)이 연구되었다. 폭발물 관련 연구에서 폭발물 흔적(Picric acid)에 대한 고감광도 플렉시블 SERS 기판(Wang et al. 2016)과 비표준 폭발물 및 원자재에 대한 인식 및 탐지 가능한 황화아연 나노결정센서(Wu et al. 2016)의 개발이 있다.
현장에서 표적 물질을 검출하는 기술이 의료에 적용되면 특별히 현장진단(Point of Care Testing, POCT)이라고 부르며, 구급차, 가정, 현장 또는 병원에서 환자 진료 시 환자 근처에서 행하는 진단을 일컫는다. POCT 관련 진단 키트들이 등장하기 전에는 환자의 샘플은 병원 혹은 연구소 내 실험실 등 특정 장소에서만 분석할 수 있어 샘플 채취에서부터 분석 및 진단까지 많은 시간이 걸려 환자 상태가 악화되는 경우가 많았다. 그러나 POCT에 대한 연구들이 활발해지면서 다양한 제품들이 나와 진료 시점에서 진단을 내릴 수 있어 의료 서비스에 큰 도움이 되며, 치료를 하는데 있어 환자 맞춤 의료의 가능성이 열렸다.
국내에서는 노로바이러스 진단 종이 키트(K. N. Han et al. 2016), 병원 감염균의 총체적 정보를 분석할 수 있는 플라스틱 칩(K. S. Park et al. 2016), 피 한 방울로 심근경색을 진단하는 센서(Sharma et al. 2016)가 개발되어 있으며 농산물 식중독균 5종 검출키트가 상용화를 앞두고 있다.
국외에서의 연구로 나노플라워를 이용하여 대장균을 검출하는 휴대용 바이오센서(Ye et al. 2016)와 탄소 나노튜브 어레이(carbon nanotube array) 속에 바이러스를 포집하고 농축하여 초고감도 바이러스를 검출(Yeh et al. 2016)하는 방법이 알려졌다.
(2) 나노생체재료
생체재료는 넓은 의미로 생체에 직접 접촉하고 있는 재료로, 생체에 유해한 영향을 미치지 않고 생체와 밀접하게 접촉하여 사용되며 의약품을 제외한 인공, 천연 또는 이들의 복합체로 인체 내에서 조직이나 기관의 기능을 치료, 보강, 대치, 또는 회복하는데 사용되는 재료를 말한다. 생체재료를 체내에 주입하거나 치료용 이식재로 응용되면 체내에 원하는 기간만큼 존재해야하므로 진단 장치에 사용되는 것보다 생체적합성이 뛰어나야하며, 일정 기간 후에는 체내에서 안전하게 배출되거나 체내에 안정적으로 존재할 수 있어야 한다. 생체재료에 응용되는 소재로 동물 유래 소재(콜라겐, 젤라틴, 라미닌, 엘라스틴, 피브린, 히알루론산 등), 식물・해조류 유래 소재(알지네이트 등), 갑각류 유래 소재(키틴, 키토산 등)가 있다.
(가) 바이오재료를 이용한 생체조직공학
과거에는 생체장기가 물리적으로나 기능적으로 손상을 입으면 외과적 수술로 손상된 부위를 제거한 후 남은 부위의 기능으로 살아갔었으나 생체재료 연구가 진행되면서 인체의 재활에 도움이 되는 다양한 생체재료가 연구개발 되고 있다. 특히 초기 연구는 증식하는 세포를 위한 공간에 초점이 맞춰져 있었으나 최근에는 의료기술과 의학공학의 발전으로 손상된 부위의 대체재부터 기능회복까지 바라볼 수 있게 되었으며 생체재료에 조직형성을 촉진하는 기능을 부여하여 환자에게 거부반응이 없는 생체재료 연구도 활발하다.

[그림 3-81] 바이오재료를 이용한 생체조직공학
국외에서 생체 이식재료에 대해 진행된 연구로, 인공 관절의 감염을 예방하는 나노섬유 코팅 방법(Ashbaugh et al. 2016)과 의료용 이식물에 의한 혈액응고를 막기 위해 혈액에 반발하는 슈퍼헤모포빅(superhemophobic) 티타늄 표면(titanium surface)(Movafaghi et al. 2017)에 대한 논문이 있다. 그리고 손상된 말초 신경에 직접 감아 재생을 촉진하고 기능을 회복할 수 있는 나노섬유 메시(Suzuki et al. 2017)가 개발되어 임상 응용을 검토하고 있다. 이외에 척수 조직에 삽입이 가능할 정도로 잘 구부러지고 광학자극(optical impulses)을 제공할 수 있는 섬유(Lu et al. 2017)가 개발되었다.
(나) 지능형 약물 전달 장치
지능형 약물 전달 시스템(Smart Drug Delivery System)은 생체 내에 특정한 질환세포에 선택적으로 약물을 전달하여 의약품의 효능을 극대화시키고 부작용은 최소화하여 치료 효율을 높이는 것이다. 치료 대상의 투여 약물이 효율적으로 작용하는 상황은, 일정량의 약물이 일정 기간에 걸쳐 전달되거나 투여 후 일정 시간 경과 후 약물의 체외 방출이 있어야 한다거나 체내 특정 부위에 도달해야만 약물의 전달이 있어야 하는 등 여러 가지의 경우가 있으므로 그에 맞추어 약물이 전달되도록 해야 한다. 특히 나노입자기반 약물전달시스템은 여러 동물실험에서 보다 효과적으로 약물을 전달하여 치료 효능을 높이는 것으로 나타났다. 이는 나노입자의 크기 및 물성을 조절하여 약물의 생체 내 작용을 최적화할 수 있는 점과 기존 항암제의 비선택적인 작용으로 인한 부작용을 줄일 수 있다는 점에서 크게 각광받고 있다.
약물 전달 시스템으로 여러 형태의 나노입자가 연구되었다. 동맥 경화성 플라크(atherosclerotic plaques) 속의 염증을 억제하는 siRNA(silencing RNA)를 포함하는 나노입자(Sager et al. 2016)나 종양 혈관에 발현된 p-셀렉틴(selectin)을 표적하는 후코이단(fucoidan)이라고 불리는 당 기반의 화합물로 만든 약물전달 나노입자(Shamay et al. 2016), 췌장의 종양 성장을 억제하는 나노입자(Teo et al. 2016)가 개발되었다. HDA(macromolecule histidine-capped-9,10-dialkoxy-anthracene)와 siRNA를 결합한 생체 적합성 나노물질(Patil et al. 2016)과 지카(Zika) 바이러스 백신인 프로그램화 된 RNA 나노입자(Chahal et al. 2017)가 연구되었으며, 약물을 암 세포 내로 효율적으로 전달하는 식물-바이러스 기반의 캐리어(Czapar et al. 2016)와 고형 종양 치료를 위해 프로드러그(prodrug)가 탑재된 나노구조 플랫폼(Shah et al. 2017)이 개발되었다.
다. 발전 전망

나노바이오기술이 다양한 목적의 연구에 응용되어 발전하면서 이전의 생활에서는 불편하거나 불가능하다 여겼던 부분들이 개선되고 산업을 변화시키고 있으며, 나노바이오 센서와 고성능 촉매 등의 일부 분야는 상용화 단계에까지 이르렀다. 나노바이오 기술의 비가역적인 발전을 위해서는 물리화학재료, 전자, 생물, 기계 등 과학과 공학 등 거의 전 분야의 상호융합과 소통이 필수적이며, 인공지능과 스마트 팩토리 등의 4차 산업혁명의 밑거름이 될 것이다. 하지만 융합연구의 강조가 자연적으로 물리, 화학, 생물 등의 기초연구의 소홀함으로 연결된다면 사상누각의 국가과학기술 체계로써 국민경제에 도움이 되지 못할 것이다.
한편 주변 생활에서 노출되는 각종 물질들의 검출에서부터 의료・보건 분야에 이르기까지 여러 분야에 나노바이오기술이 활발히 개발・적용되면서 삶은 빠르게 편리해지고 있으나, 발전하는 나노바이오 기술만큼 새롭게 개발되는 나노소재나 나노디바이스의 독성과 환경학적 영향에 대한 충분한 연구와 함께 사회가 이를 흡수・소화할 수 있는 숙고의 시간이 충분히 필요하다.
-Ashbaugh, A.G. et al., 2016. Polymeric nanofiber coating with tunable combinatorial antibiotic delivery prevents biofilm-associated infection in vivo. Proceedings of the National Academy of Sciences of the United States of America, 113(45), p.E6919.
-Chahal, J.S. et al., 2017. An RNA nanoparticle vaccine against Zika virus elicits antibody and CD8+ T cell responses in a mouse model. Scientific reports, 7(1), p.252.
-Choi, M.H. et al., 2017. Efficient bioremediation of radioactive iodine using biogenic gold nanomaterial-containing radiation-resistant bacterium, Deinococcus radiodurans R1. Chem. Commun., 53(28), pp.3937–3940.
-Czapar, A.E. et al., 2016. Tobacco Mosaic Virus Delivery of Phenanthriplatin for Cancer therapy. ACS Nano, 10(4), pp.4119–4126.
-Go, G. et al., 2017. A Magnetically Actuated Microscaffold Containing Mesenchymal Stem Cells for Articular Cartilage Repair. Advanced Healthcare Materials, 6(13), p.1601378.
-Han, K.N., Choi, J.-S. & Kwon, J., 2017. Gold nanozyme-based paper chip for colorimetric detection of mercury ions. Scientific Reports, 7(1), p.2806.
-Han, K.N., Choi, J.-S. & Kwon, J., 2016. Three-dimensional paper-based slip device for one-step point-of-care testing. , 6, p.25710.
-Han, S. et al., 2016. Mechanically Reinforced Skin-Electronics with Networked Nanocomposite Elastomer. Advanced Materials, 28(46), pp.10257–10265.
-Hong, W. et al., 2016. Investigating the environmental factors affecting the toxicity of silver nanoparticles in Escherichia coli with dual fluorescence analysis. Chemosphere, 155, pp.329–335.
-Hussain, A.M. & Hussain, M.M., 2016. Deterministic Integration of Out-of-Plane Sensor Arrays for Flexible Electronic Applications. Small, 12(37), pp.5141–5145.
-Jin, M.L. et al., 2017. An Ultrasensitive, Visco-Poroelastic Artificial Mechanotransducer Skin Inspired by Piezo2 Protein in Mammalian Merkel Cells. Advanced Materials, 29(13), p.1605973.
-Juan-Colás, J. et al., 2016. The electrophotonic silicon biosensor., 7, p.12769.
-Khosravi, F. et al., 2016. Static micro-array isolation, dynamic time series classification, capture and enumeration of spiked breast cancer cells in blood: the nanotube–CTC chip. Nanotechnology, 27(44), p.44LT03.
-Kida, T. et al., 2016. Ultrasensitive Detection of Volatile Organic Compounds by a Pore Tuning Approach Using Anisotropically Shaped SnO 2 Nanocrystals. ACS Applied Materials & Interfaces, 8(51), pp.35485–35495.
-Kim, D. et al., 2017. Multiscale Modulation of Nanocrystalline Cellulose Hydrogel via Nanocarbon Hybridization for 3D Neuronal Bilayer Formation. Small, 13(26), p.1700331.
-Kim, J. et al., 2016. A wearable multiplexed silicon nonvolatile memory array using nanocrystal charge confinement. Science Advances, 2(1).
-Kim, J. et al., 2016. Fully Automated Field-Deployable Bioaerosol Monitoring System Using Carbon Nanotube-Based Biosensors. Environmental Science & Technology, 50(10), pp.5163–5171.
-Kim, J. et al., 2016. Noninvasive Alcohol Monitoring Using a Wearable Tattoo-Based Iontophoretic-Biosensing System. ACS Sensors, 1(8), pp.1011–1019.
-Kim, J. et al., 2017. Wearable smart sensor systems integrated on soft contact lenses for wireless ocular diagnostics. , 8, p.14997.
-Koh, A. et al., 2016. A soft, wearable microfluidic device for the capture, storage, and colorimetric sensing of sweat. Science translational medicine, 8(366), p.366ra165.
-Koo, W.-T. et al., 2016. Heterogeneous Sensitization of Metal–Organic Framework Driven Metal@Metal Oxide Complex Catalysts on an Oxide Nanofiber Scaffold Toward Superior Gas Sensors. Journal of the American Chemical Society, 138(40), pp.13431–13437.
-Lee, H. et al., 2017. High throughput differential identification of TMPRSS2-ERG fusion genes in prostate cancer patient urine. Biomaterials, 135, pp.23–29.
-Lee, H. et al., 2017. Wearable/disposable sweat-based glucose monitoring device with multistage transdermal drug delivery module. Science Advances, 3(3).
-Lee, J.H. et al., 2015. Enhanced Osteogenesis by Reduced Graphene Oxide/Hydroxyapatite Nanocomposites. Scientific reports, 5, p.18833.
-Liu, X. et al., 2017. Soy protein isolate/bacterial cellulose composite membranes for high efficiency particulate air filtration. Composites Science and Technology, 138, pp.124–133.
-Lu, C. et al., 2017. Flexible and stretchable nanowire-coated fibers for optoelectronic probing of spinal cord circuits. Science Advances, 3(3).
-Movafaghi, S. et al., 2017. Hemocompatibility of Superhemophobic Titania Surfaces. Advanced Healthcare Materials, 6(4), p.1600717.
-Nassar, J.M. et al., 2017. Recyclable Nonfunctionalized Paper-Based Ultralow-Cost Wearable Health Monitoring System. Advanced Materials Technologies, 2(4), p.1600228.
-Park, J. et al., 2016. Electromechanical cardioplasty using a wrapped elasto-conductive epicardial mesh. Science Translational Medicine, 8(344).
-Park, K.S. et al., 2016. Rapid identification of health care–associated infections with an integrated fluorescence anisotropy system. Science Advances, 2(5).
-Park, M. et al., 2017. Plasmonic Schirmer Strip for Human Tear-Based Gouty Arthritis Diagnosis Using Surface-Enhanced Raman Scattering. ACS Nano, 11(1), pp.438–443.
-Patil, S.P. et al., 2016. Supramolecular Self-Assembly of Histidine-Capped-Dialkoxy-Anthracene: A Visible-Light-Triggered Platform for Facile siRNA Delivery. Chemistry - A European Journal, 22(39), pp.13789–13793.
-Phani, A. et al., 2016. A nanostructured surface increases friction exponentially at the solid-gas interface. , 6, p.32996.
-Rudd, N.D. et al., 2016. Highly Efficient Luminescent Metal–Organic Framework for the Simultaneous Detection and Removal of Heavy Metals from Water. ACS Applied Materials & Interfaces, 8(44), pp.30294–30303.
-Sager, H.B. et al., 2016. RNAi targeting multiple cell adhesion molecules reduces immune cell recruitment and vascular inflammation after myocardial infarction. Science translational medicine, 8(342), p.342ra80.
-Shah, V.M. et al., 2017. Characterization of pegylated and non-pegylated liposomal formulation for the delivery of hypoxia activated vinblastine- N -oxide for the treatment of solid tumors. Journal of Controlled Release, 253, pp.37–45.
-Shamay, Y. et al., 2016. P-selectin is a nanotherapeutic delivery target in the tumor microenvironment. Science translational medicine, 8(345), p.345ra87.
-Sharma, A., Han, C.-H. & Jang, J., 2016. Rapid electrical immunoassay of the cardiac biomarker troponin I through dielectrophoretic concentration using imbedded electrodes. Biosensors and Bioelectronics, 82, pp.78–84.
-Suzuki, K. et al., 2017. Electrospun nanofiber sheets incorporating methylcobalamin promote nerve regeneration and functional recovery in a rat sciatic nerve crush injury model. Acta Biomaterialia, 53, pp.250–259.
-Teo, J. et al., 2016. A Rationally Optimized Nanoparticle System for the Delivery of RNA Interference Therapeutics into Pancreatic Tumors in Vivo. Biomacromolecules, 17(7), pp.2337–2351.
-Vilela, P. et al., 2017. Graphene Oxide-Upconversion Nanoparticle Based Optical Sensors for Targeted Detection of mRNA Biomarkers Present in Alzheimer’s Disease and Prostate Cancer. ACS Sensors, 2(1), pp.52–56.
-Wang, C., Liu, B. & Dou, X., 2016. Silver nanotriangles-loaded filter paper for ultrasensitive SERS detection application benefited by interspacing of sharp edges. Sensors and Actuators B: Chemical, 231, pp.357–364.
-Wu, Z. et al., 2016. Contactless and Rapid Discrimination of Improvised Explosives Realized by Mn 2+ Doping Tailored ZnS Nanocrystals. Advanced Functional Materials, 26(25), pp.4578–4586.
-Wunsch, B.H. et al., 2016. Nanoscale lateral displacement arrays for the separation of exosomes and colloids down to 20 nm. Nat Nano, 11(11), pp.936–940.
-Yang, M. et al., 2017. Sensitivity and selectivity sensing cadmium(II) using amination functionalized porous SnO 2 nanowire bundles-room temperature ionic liquid nanocomposite: Combined efficient cation capture with control experimental conditions. Sensors and Actuators B: Chemical, 240, pp.887–894.
-Ye, R. et al., 2016. Bioinspired Synthesis of All-in-One Organic-Inorganic Hybrid Nanoflowers Combined with a Handheld pH Meter for On-Site Detection of Food Pathogen. Small, 12(23), pp.3094–3100.
-Yeh, Y.-T. et al., 2016. Tunable and label-free virus enrichment for ultrasensitive virus detection using carbon nanotube arrays. Science advances, 2(10), p.e1601026.
![]() 제6절
생명연구자원
제6절
생명연구자원
1. 개요
생명연구자원은 바이오경제 시대를 창출하는 핵심자원으로써 무궁한 가치를 가지고 있으며 이에 대한 중요성을 인식한 각국은 자원의 확보를 위한 치열한 경쟁을 벌이고 있다. 지난 2014년 유전자원에 대한 자원소유국의 주권을 인정한 나고야의정서38)가 발효되면서 바이오분야의 새로운 국제 규범이 출현하게 되었으며 이에 따라 국제적으로 자국의 유전자원에 대한 보호와 통제가 더욱 강화되고 있다. 또한 2017년 8월 비준된 의정서에 따라 외국 자원을 이용할 경우 자원 취득에 대한 소유국가의 승인을 받아야 하며, 자원 이용에 따른 경제적 이익(유무형의 결과물)에 대하여 공정하고 공평하게 이익을 공유해야하는 새로운 장이 열리게 되었다. 이러한 새로운 국제적 환경이 도래함에 따라 유전자원, 생물자원 등 생명연구자원을 기초소재로 이용하는 생명공학 연구 및 바이오산업에 막대한 영향이 예상되고 있으며 타국의 자원을 이용할 경우 막대한 로얄티를 지불해야하는 새로운 환경에 대한 대응방안이 필요한 상황이다.
생명공학 발전을 위한 핵심재료인 생명연구자원의 중요성을 인식한 OECD는, 2001년 세계 각국에 고품질의 생물자원 및 정보를 관리 보급하는 생물자원센터(Biological Resource Center, BRC)의 설치를 권고하였다. 자원센터는 국가차원에서 지원해야 할 중요 연구기반으로 생명공학 및 관련 산업의 성장을 견인하는 핵심 인프라 기관으로 제시한 바 있다.
우리나라 역시 생명공학산업의 핵심소재인 생명자원의 중요성을 인식하고 법률 및 제도 정비를 통하여 생명자원의 효율적인 관리 및 활용을 위한 기반을 조성하고자 노력하고 있다. 2007년 건강하고 풍요로운 바이오경제 기반조성을 위하여 과학기술부(現 과기정통부)를 중심으로 농림부, 복지부, 환경부, 해수부 등 5개 부처 공동으로 ʻ국가 생명자원 확보・관리 및 활용 마스터플랜ʼ(2007년 12월)을 수립하였다. 이는 생명자원의 국가적인 종합 관리체계를 구축하고, 생명자원 관련 육성정책의 커다란 근간을 마련하는 획기적인 전환점이 되었다.
이러한 토대위에 기본법적인 성격의 ʻ생명연구자원의 확보・관리 및 활용에 관한 법률’ (2009년, 이하 생명연구자원법)이 제정되었고, 농림축산식품부의 ʻ농수산생명자원의 보존・관리 및 이용에 관한법률ʼ(2007)과 해수부의 ʻ해양생명자원 확보・관리 및 활용 등에 관한 법률ʼ(2012) 등이 제정되었다. 마스터플랜과 생명연구자원법을 근거로 범부처 차원의 생명연구자원관리기본계획(2011∼2020)이 국가과학기술위원회에서 확정(2011년 5월)되어, 매년 시행계획을 통해 범부처 차원의 생명자원 정책을 종합적으로 추진하고 있다. 또한 생명연구자원법 시행령에 따라 과기정통부 주관으로 6개 부처가 참여하는 책임기관협의회가 운영되고 있으며, 산하에 정보시스템실무위원회와 자원별실무위원회(동물, 식물, 미생물, 인체유래자원)를 두어 생명자원 관련 현안에 대한 효율적인 논의를 진행하고 있다.
2. 연구동향
가. 생명연구자원의 정의
OECD는 생물자원센터에서 관리되는 자원의 정의를 ‘배양 가능한 생물체(미생물, 식물, 동물, 인간세포)와 생물다양성 부분 중 복제 가능한 부분, 배양 불가능한 생물체 및 이와 관련된 분자, 생리, 구조적 정보를 포함’하며, 또한 ‘이들로부터 유래되는 유전체, 전사체, 단백체, 대사체, 생물학적 화합물, 추출물, cDNA clone or library, Amplicon, Metagenome 등’으로 규정하고 하고 있다.
현재 우리나라의 생명자원의 근간이 되는 ʻ국가 생명자원 마스터플랜ʼ에 따르면 생명자원(Bioresource)이란 생물자원, 생물다양성자원, 생명정보자원을 총칭하며, 생명공학 연구기반이 되는 생물체 및 이를 구성하고 있는 구성체를 의미한다고 정의하고 있다. 이를 근거로 생명연구자원법에서도 생명연구자원을 ʻ생명공학연구의 기반이 되는 자원으로써 산업적으로 유용한 동물, 식물, 미생물, 인체유래 연구자원 등 생물체의 실물(實物)과 정보ʼ로 정의하고 있어, 이에 준하여 이후 용어 사용은 생명연구자원으로 서술하기로 한다.
우리나라의 생명연구자원에 대한 전체 현황은 국가생명연구자원을 총괄 관리하는 국가생명연구자원정보센터(KOBIC)의 통계자료에 잘 나타나 있다. KOBIC의 국가생명연구자원통합정보시스템(KOBIS) 자료에 따르면, 국내 생명연구자원은 동물, 식물, 미생물, 인체유래자원 등 실물자원과 생명정보자원을 합쳐 총 15만 3천여 종, 1천 1백 8십만 건을 보유하고 있는 것으로 나타났다. 이 중 실물자원은 약 12만 7천여 종 450만 건을 보존하고 있고, 종류별 통계를 보면 동물 38,000종 181만 건, 식물 50,800종 210만 건, 미생물은 약 25,100종 23만 건, 인체유래물 12만 건을 보유하고 있다. 또 생명정보의 자원 종류별 통계에 따르면 동물 5,850종 166만 건, 식물 4,400종 175만 건, 미생물은 약 12,300종 343만 건, 인체유래물 60,000여 건 등의 생명정보가 등록되어 있는 것으로 나타났다.
나. 생물자원
국가생명연구자원통합정보시스템(KOBIS) 통계에 따른 국내 실물자원 중 생물자원의 종류별·부처별 자원보유량을 보면, 미생물자원은 과학기술정보통신부(이하 과기정통부) 약 11,835종 87,636여 건, 농림축산식품부 약 5,457종 42,647건, 환경부 약 5,051종 70,291건, 해양수산부 약 2,773종 28,241건 등을 보존하고 있다. 식물자원은 과기정통부 약 17,604종 129,781건, 농림부 약 13,680종 1,421,064건, 환경부 약 18,696종 527,709건, 해수부 약 851종 20,397건 등을 보유하고 있다. 동물자원은 과기정통부 약 5,694종 730,815건, 농림부 약 6,573종 252,539건, 환경부 약 23,058종 790,008건, 해수부 약 2,743종 40,766건 등이 등록되어 있다. 인체유래물자원은 과기정통부만이 약 12만 건을 보유하고 있다.
그러나 아직 부처별로 정보 연계가 진행 중이고, 기관별로 분류체계와 정량적 기준에 차이가 있어, 통계지표 표준화를 위한 실물자원 및 정보자원 등 자원 분야별로 분류정보 표준화 위원회를 구성하여 운영 중에 있다. 미생물자원의 대표 관리기관은 한국의 유전자은행으로 알려진 한국생명공학연구원 바이오의약인프라사업부 산하의 생물자원센터(KCTC)이다. KCTC는 1985년 한국과학기술연구원(KIST)내 설립되어 다양한 국제 공인균주를 확보 관리하여 산학연 연구자에 보급하는 자원은행 역할을 수행하며 국내 생명공학연구의 역사와 궤를 같이하는 최대 자원센터로 발전해 왔다. 현재 약 3만여 주의 세균, 효모, 곰팡이 등 공인균주를 보유하여 세계 8위권 자원센터로서의 위상을 보이고 있다.
매년 PubMed 등재 논문에서 KCTC자원이 활용된 인용지수를 살펴보면, 세계 자원센터 중 독일 DSMZ, 미국 ATCC, 네덜란드 CBS, 일본 JCM에 이어 세계 5위권을 유지하고 있다. 또 전 세계에서 새롭게 발굴 보고되는 신종미생물의 확보 수준은 독일, 일본에 이어 세계 3위의 신종미생물 보유기관으로 국제적인 위상을 보이고 있다. KCTC는 부다페스트조약에 의한 국제특허미생물보존기관(IDA)으로서 국내 특허미생물기탁의 절반 이상을 담당하고 있다.
더불어 ‘국가연구개발사업의 관리 등에 관한 규정(2008년 5월)’에 의해 국가연구개발 사업을 통해 확보된 생명자원 연구 성과물의 기탁 전담기관으로 지정된 바이오의약인프라사업부 산하의 보존기관으로 활용기반을 마련하고 있다. 이 외에도 과기정통부가 지원하는 국가지정연구소재은행사업을 통해 대학중심으로 특화된 여러 종류의 연구용 미생물이 관리되고 있다.
각 부처별로 운영되는 생명연구자원 정보센터에 공개되는 통계에 따르면, 과기정통부의 생명연구자원정보센터(ARIS)에 나타난 식물자원은 약 17,953종 124,553건(별도로 식물정보는 4,111종, 623,669건)을 보유하고 있고, 농림부의 생명자원정보서비스(BRIS)에서는 농진청, 산림청 등의 농업식량작물 및 삼림자원을 중심으로 종자, 영양체 등 약 21,441종 1,422,203건을 보존하는 것으로 나타났다.
그리고 과기정통부의 한국생명공학연구원 식물추출물은행, 해외생물소재센터, 연구소재은행 등에서 주로 연구자에게 필요한 식물추출물 형태의 연구자원 약 119,435건을 관리하고 있으며, 환경부의 국립생물자원관에서 식물표본 646,173점을, 해수부의 해양생물자원관(MBRIS)에서 해산식물 약 877종 21,139건을 관리하고 있다. 그러나 우리나라가 확보한 식물종자는 약 15만 점으로 미국(50만 점)의 1/3, 중국(38만 점)의 1/2.5, 일본(28만 점)의 1/1.8수준에 불과하다. 전체 보유 종자 중에서 식량작물의 비중이 가장 높으며 채소, 특용작물, 사료작물 등 타 작물과 야생 식물의 종자 보유는 상대적으로 저조한 실정이다.
국내 동물자원 인프라는 선진국에 비해 아직 미흡한 수준이나 신약개발 관련 연구들이 진행되면서 투자가 확대되고 있는 상황이다. 한국생명공학연구원은 국제공인 모니터링센터(ICLAS Monitoring Subcenter Korea)를 운영하여 국내 실험동물시설에 대한 병원성미생물 감염모니터링을 지원하고 있다. 2013년 시작된 국가마우스표현형분석사업단(Korea Mouse Phenotyping Center)은 국제마우스표현형분석컨소시움(IMPC) 등 국제협력기구와의 적극적인 공조를 통해 마우스 표현형 분석기술의 표준화 및 선진화를 구현하고 세계적 수준의 마우스 표현형분석 서비스의 기반 구축을 위해 운영되고 있다. 더불어 최근 신약연구에 필요한 인프라인 국가영장류센터가 설립되어 원숭이, 침팬지 등 7종 718개체의 영장류 관리시설이 가동 중이며, 이들의 생산 기반시설이 한국생명공학연구원 전북분원에 새로이 구축되고 있다.
농림부의 농진청, 산림청, 수산과학원 등의 기관에서 가축 3종 19,256점을 비롯하여 곤충, 수생생물 등 다양한 동물자원들이 관리되고 있다. 최근 개관한 해수부의 해양생물자원관에서 약 2,725종 199,079건의 해양척추 및 무척추동물을 관리 보존하고 있다.
국가 생명자원을 관리하는 ‘생명연구자원법’에 따라 각 부처별로 지정 운영되는 생명연구자원 국가책임기관 및 기탁등록보존기관은 다음과 같다. 과기정통부는 한국생명공학연구원을 책임기관으로 지정하고, 국립중앙과학관, 국가생명연구자원정보센터, (재)연구소재중앙센터, 한국생명공학연구원 바이오의약인프라사업부, 서울대 한국세포주은행, 한국뇌연구원 한국뇌은행, KIST 천연물연구소 등 7개 기탁기관을 운영 중이다.
농림부는 농진청 산하 국립농업과학원과 국립축산과학원, 산림청 산하 국립수목원, 국립산림과학원, 국립산림품종관리센터, 그리고 농림축산검역본부 등 6개소의 책임기관을 지정하고, 농진청 산하 109개 기관과 산림청 산하 29개 기관 등 총 138개의 기탁기관을 운영하고 있다.
복지부는 질병관리본부 생물자원은행과를 책임기관으로, 국가병원체자원은행 등 총 19개소의 기탁기관을 지정 운영 중이다. 환경부는 국립생물자원관을 책임기관으로 지정하고, 국립생태원 등 총 39개소를 기탁기관으로 운영하고 있다. 해양수산부의 국립수산과학원과 국립해양생물자원관을 책임기관으로 지정하고, 한국해양과학기술원 등 총 14개소를 기탁기관으로 운영 중이다.
다. 생물다양성자원
우리나라의 자생생물은 약 10만 종으로 추정되고 있다. 2016년 말 기준으로 ‘국가 생물종 목록’에 등재된 생물은 척추동물 1,971종, 곤충 16,993종, 무척추동물 8,504종, 식물 5,379종, 균류와 지의류 4,840종, 원생생물 2,098종, 조류(algae) 5,857종, 원핵생물 1,709종으로 총 47,003종에 이른다. 약 10만 종의 한반도 전체 생물종 추정치의 47% 정도에 불과하다. 더욱이 생물다양성 연구가 관련 부처의 각 기관별로 분산되어 있어 국가 전체에 대한 정확한 통계를 확보하는 데 어려움이 있다.
과기정통부는 국립중앙과학관을 중심으로 국내 생물다양성에 대한 표본 확보 및 정보의 수집 관리를 주도하고 있다. 생물다양성 통합DB 및 네트워크 구축 운영사업을 통하여 생물다양성 정보를 구축하고 있으며, 국내 자연사 표본을 소장하고 있는 과학관, 자연사박물관, 자원관 등 48개 관련 부처 기관과의 네트워크인 ʻ국가생물다양성기관연합ʼ의 주관기관으로서 활동하고 있다. 또한 자연사참조표본 확보 및 활용지원 기반기술 개발 사업을 통해 국내 자연사자원의 인벤토리 구축, 참조표본의 확보 및 분양, DNA 연구 등을 수행하고 있다. 현재 국립중앙과학관은 국가자연사연구종합정보시스템(NARIS) 운영과 세계생물다양성정보기구(GBIF)의 한국사무국(KBIF) 역할 수행을 통하여 200만여 건의 생물다양성 정보를 구축하고, 이를 국가생명연구자원통합시스템(KOBIS)에 연계하고 있다. 한국과학기술정보연구원은 GBIF 정보 포탈에 대한 아시아권역 미러사이트를 운영하고 있다.
농림부는 농진청 국립농업과학원에서 식물, 곤충, 누에 등에 대한 국내 야생종, 재래종 등 농업자원의 다양성을 확보하고 있다. 또한 곤충에 대한 유전적 다양성 보존을 위한 자원을 수집하고 있으며, 보존자원에 대한 내병충성 및 주요성분 분석을 통하여 식물자원의 특성 평가 사업을 수행 중에 있다. 가장 많은 자원을 보유한 산림청 국립수목원은 국가생물종지식정보시스템(Nature)을 통해 식물, 곤충, 버섯, 그리고 야생조수류에 대한 생물다양성 데이터베이스를 구축하고 있으며, 식물표본 100만점을 DB화를 목표로 정보화를 추진 중에 있다.
환경부는 국립생물자원관을 중심으로 자생생물 서식지를 대상으로 생물다양성자원을 수집하고 신종・미기록종을 조사하는 사업을 수행하고 있으며, 주요 생물자원의 유전자 분석연구를 통해 생물다양성의 보전, 관리의 기초자료를 확보하고 있다. 한반도 자생생물의 생태 등 다양한 정보를 종합적으로 수록한 종합 생물지 발간, 법적보호대상종, 수집자원을 중심으로 한반도 주요생물 계통수 및 동정서비스시스템을 운영을 하고 있다. 또한 확보 자원의 DB화 및 한반도생물자원포털(Species Korea)을 구축하여 생물표본 정보 약 200만 여건과 자생생물 유전정보 약 1.2만 건을 관리하고 있다.
해수부는 국립해양생물자원관을 중심으로 국내 다양한 해양자원의 체계적 연구를 위해 해양생물종 표본 및 기타 생물재료를 확보하고 있다. 해양생명자원통합정보시스템(MBRIS)을 중심으로 해양생명자원정보를 표준화하고 기관별로 분산된 정보를 통합하여 해양생명연구정보 6,446종 263,910건의 DB를 구축하고, 분양, 기탁 등의 역할을 수행하고 있다.
라. 생명정보자원
우리나라 유전체연구사업이 시작된 2001년 10월 국무조정실 주관으로 생명정보는 과학기술부에서 총괄관리 하는 것으로 결정된 이후, ‘국가생명자원 마스터플랜’과 ‘생명연구자원법’을 근거로 국가생명연구자원정보센터(KOBIC)가 출범하고 국가생명연구자원통합정보시스템(KOBIS)이 운영되고 있다. KOBIC은 2010년 9월부터 시작된 1단계 국가생명연구자원 통합체계 구축사업을 통해 다양한 역할과 성과를 도출하였다. 범부처 정보연계표준안을 근간으로 KOBIS를 구축하여 기관들의 정보연계를 추진하였으며, 범부처 정보연계사업으로 농림부 생명자원정보서비스(BRIS), 해수부, 환경부 등과 정보연계를 진행 중이며, 복지부 등과의 정보연계도 추진하고 있다.
범부처 차원에서 협력을 위해 생명연구자원법에 따라 범부처 정보연계 및 통합을 추진하고, 효과적인 정보공유를 위해 관련부처의 책임기관들로 범부처 책임기관협의회를 운영하고 있다. 최근의 KOBIS 통계에 따르면, 국내 생명정보는 동물 5,845종 166만 건, 식물 4,441종 175만 건, 미생물 13,275종 343만 건, 인체유래물 6만여 건, 기타 40여만 건 등 총 25,708종 724만여 건의 자원정보를 보유하고 있는 것으로 나타났다.
농림부는 농작물개발 관련 분야 연구개발 투자를 확대하고 있으며, 부처 내 기관들에 의해 기 구축된 다양한 자원 관련 정보를 통합하여 통합시스템인 생명자원서비스(BRIS)를 구축 운영하고 있다. 환경부는 고유 업무인 생태조사와 기후 변화에 따른 환경조사 및 모니터링을 위해 국내 다양한 지역의 생태조사를 추진하고 있다. 생물다양성 관련법을 마련하여 국가생물다양성센터, 국립생태원, 낙동강생물자원관 등을 설치하였다.
보건복지부는 국내 보건의료 R&D 발전과 국민의 건강 증진을 목표로 2008년 한국인체자원은행사업(Korea Biobank Project, KBP)이 추진되었다. 질병관리본부 국립중앙인체자원은행을 중심으로 17개 대학병원소재 인체자원 단위은행이 한국인체자원은행네트워크(Korea Biobank Network, KBN)를 구성하였으며, 대규모 인구집단 기반(중앙은행) 및 질병 기반 인체자원(17단위은행)을 수집, 관리하여 국내 연구자들에게 분양 중에 있다.
해수부는 해양생물자원관 건립을 통해 해양생명자원 분야 거버넌스 확보와 첨단 생명공학기술 및 융합기술을 통해 새로운 도약을 추진하고 있다. 해양생물자원관 건립을 통해 해양 자원 확보와 관리시스템을 구축하고 있으며, 2014년 발표된 해양수산 R&D 중장기계획(2014∼2020)을 통해 첨단기술의 활용뿐만 아니라 융합기술의 접목을 통해 해양수산업 지원뿐만 아니라 새로운 가치 창출을 통해 산업화에 주력하고 있다.
3. 발전과제
생명연구자원 또는 생명자원은 이러한 바이오 분야의 발전과 혁신을 위한 필수적인 연구소재이며 바이오경제 창출을 위한 핵심 원천재료로 인식되고 있다. 유용 생명연구자원은 과거에는 인류공동의 자산으로 인식되어 누구나 자유롭게 사용할 수 있었으나, 최근에는 자원을 소유한 국가의 자원주권이 인정되면서 자원의 중요성이 더욱 조명되고, 특히 나고야의정서 발효로 국가 자산 및 국익적 관점이 부각되고 있다. 2018년 8월 국내에서도 의정서가 본격적으로 적용될 경우 국내 생명공학 연구경쟁력 제고와 바이오산업의 지속적 발전에 막대한 파급효과를 미칠 것으로 예상하고 있다. 의정서에 따라, 향후 바이오 연구개발 및 산업화 과정에서 다른 나라의 유전자원을 취득할 경우, 반드시 자원제공국의 사전승인을 받아야 하며 상호합의조건에 따라 이익을 서로 공유해야 하는 법적 통제체제하에 놓이게 됨을 의미한다.
현재 국제적으로 100여 국가가 비준을 마치고 국가별로 이행체계를 마련 중인 상황에서, 이에 대비한 관련 기관의 대응노력과 더불어 국민 및 관련자에 대한 인식제고 활동을 벌이고 있다. 이러한 국내외적인 상황변화에 따라 국내 생명연구자원의 활용도를 높이기 위한 인식전환이 필요하며, 국내 생명자원의 확보를 통한 국내 자산화 연구가 필요할 것이다. 더불어 나고야의정서에 대한 자원 관련 연구자들의 인식제고를 통해 국제현안에 대한 대내외적 대응능력을 강화하고, 각계 관계자들의 의견 수렴을 통한 효과적인 대응전략을 마련해야 하는 상황이다. 생명자원의 성격상 연구과정을 통하여 산출된 결과물로써, 최종 산출물이기도 하고 제품생산을 위한 중간제적 존재물인 양면적 특성을 반영하여, 도출된 유무형의 이익을 연구자 개인과 국가가 어떻게 적정하게 분배할지에 관한 논의가 필요할 것으로 생각된다. 또한 외국자원을 이용할 경우 자원 소유국과 어떻게 어느 수준으로 이익을 공유해야 하는지 국가 또는 기관 수준의 적정한 가이드라인을 제시할 필요가 있으며, 이에 대한 심층적 논의가 요구되는 상황이다.
-바이오경제시대 과학기술정책의제 연구사업; 바이오 연구 인프라 관리 활용 실태 및 개선방안, 신은정, 2015. STEPI
-생명공학연구자를 위한 ABS GUIDE 4: 아메리카와 오세아니아, 장영효 외, 2017, 한국생명공학연구원
-생명공학연구자를 위한 ABS GUIDE 5: 스위스 ABS 모범사례 가이드, 장영효외, 2017, 한국생명공학연구원
-Bioin 스페셜웹진, 생명연구자원 창조경제의 핵심기반. 장영효. 2013. 제36호
-Bioin 스페셜웹진, 생명연구자원 연구개발 동향. 정동수. 2013. 제36호
-Bioin 스페셜웹진, 생명연구자원 생물다양성 연구 동향 백운기. 2013. 제36호
-국가생명연구자원통합정보시스템 KOBIS(www.kobis.re.kr)
-과기정통부 생명연구자원정보시스템 ARIS(www.aris.re.kr)
-농림부 생명자원정보서비스 BRIS(www.bris.go.kr)
-복지부 한국인체자원은행네트워크 KBN(www.cdc.go.kr)
-환경부 국가생물다양성센터 KBR(www.kbr.go.kr)
-해양부 해양생명자원통합정보시스템 MBRIS(www.mbris.kr)
-과기정통부 국가자연사연구종합정보시스템 NARIS(www.naris.go.kr)
![]() 제7절
생명공학 인프라(장비・시설)
제7절
생명공학 인프라(장비・시설)
1. 개요
일반적으로 생명공학 분야의 경쟁력을 강화하기 위해서는 핵심기술개발 뿐만 아니라 산업에 대한 경쟁력 확보에 징검다리 역할을 할 수 있는 생명공학 인프라의 확충 및 내실화가 매우 중요하다. 특히 생명공학 제품의 고부가가치화, 안전성확보, 인류의 건강 등에 대한 이슈가 더욱 중요해지면서, 생명공학 인프라는 실용화기술개발 및 산업화에 필요한 강건한 뼈대 역할을 해주기 때문이다.
실용화기술개발 단계의 세부과정은 ① 순수연구 및 독창적・창의적 ‘기초연구(Basic research)’ 과정, ② 개발가능성 확보 및 효능확인의 ‘응용연구(Applied research)’ 과정, ③ Prototype 및 시제품 제작의 ‘개발(Development)’ 과정, ④ 대량생산의 가능성 확보 및 제품성능평가의 ‘시생산(Pilot-plant)’ 과정, ⑤ 대량생산 및 품질관리의 ‘산업화(Manufacturing)’ 과정 등으로 세분화 할 수 있으나, 생물산업의 경우에는 타 산업 분야와 달리 차별성 및 특이성이 존재하게 되는데, 이는 개발과정→시생산과정→산업화과정 등을 거치면서 개발될 제품(의약품 및 식품 등)을 최종적으로 인체에 적용하기 위하여 체내 안전성・유효성 등에 대한 신뢰성평가(비임상 GLP, 임상 GCP, 우수제조기준 GMP 등)를 필수적으로 거치면서 객관적인 성능에 대한 검증을 받아야 한다는 것이다. 이러한 생물산업의 실용화기술개발 단계에서 ‘R&D 기능’을 전-후, 좌-우, 상-하에서 적기에 지원해주는 기술하부구조인 ‘인프라구조(Infra- structure)’의 효율적인 체계구축은 생물산업의 지속가능한 성장을 촉진시키는 필수요인이 된다.
생명공학 인프라 분야와 관련하여, ① 실용화기술개발의 ‘응용연구’ 과정까지는 주로 한국생명공학연구원, 한국화학연구원, 한국식품연구원, 한국한의약연구원, 한국기초과학지원연구원, 한국표준과학연구원, 한국과학기술연구원, 한국전자통신연구원 등의 정부출연기관과 정부에서 지원하는 연구소재은행 및 한국세포주은행(과학기술정보통신부), 줄기세포・재생연구센터(보건복지부) 등을 중심으로 R&D 인프라가 구축・운영되고 있고, ② ‘응용연구’ 과정 이후부터는 산업화에 특화된 지원을 위해 산업통상자원부를 중심으로 R&D 및 시제품 제작・생산에 필요한 고가의 시설・장비, 관련 기업의 창업∼성장 단계별 지원을 위한 인프라인 산학연공동연구기반구축센터, 바이오벤처기업지원센터(BVC; Bio Venture Center), 지역특화센터, 한국바이오협회 코리아바이오허브센터(Korea Bio-Hub Center) 등과 우수의약품 제조기준(cGMP)에 맞는 (주)바이넥스(舊 한국생산기술연구원) 생물산업기술실용화센터 등이 구축・운영되고 있으며, ③ 특히 생물산업(의약품 등) 제품의 신뢰성평가에 특화된 인프라는 안전성평가연구소(KIT)를 포함하여 보건복지부 식품의약품안전처에서 지정된 비임상(GLP) 기관과 임상(GLP) 기관이 구축・운영되고 있다. 또한 의약품 개발 R&D 비용 중 2/3 정도의 비용이 (비)임상시험 비용 등에 소요되고 있고, 그 중 30% 이상이 전문연구용역기관(CRO)에서 사용되는 것으로 추정되고 있으며, CRO의 주요 성장기반이 되는 제약분야가 지속적으로 확대됨39)에 따라, 바이오산업 글로벌 진출을 위한 CRO육성의 중요성이 어느 때 보다도 강조되고 있다. CRO는 기업 입장에서는 의약품 개발 과정에서 소요되는 비용절감을, CRO 회사 입장에서는 수익창출로 서로에게 이익이 될 수 있다.
[표 3-53] 실용화기술개발 단계별 생물산업 관련 주요 인프라 현황
|
인프라단계 |
세부구분 |
인프라기관 |
주요역할 |
|
Research (기초연구 및 응용연구) |
의약 바이오
|
한국한의약연구원 한국표준과학연구원 한국과학기술연구원 |
한의학표준화기반 연구 바이오분야 측정표준 연구 표적지향형 신규항암제 후보물질 연구 |
|
산업/그린/융합 바이오
|
한국생명공학연구원 한국생명공학연구원 한국생명공학연구원 한국생명공학연구원 한국식품연구원 한국화학연구원 한국전자통신연구원 한국과학기술연구원 한국뇌연구원 |
바이오제품 안전성평가 및 정보관리 국가영장류센터 운영 바이오융합 연구 국가생물자원정보 관리 식품기능성 및 신소재・신공정 연구 화학기술분야 연구 및 성과 보급 유비쿼터스건강관리모듈/시스템개발 실시간분자영상 스마트센서기술 개발 뇌손상기전 등 다학제융합기술 기반 뇌연구 |
|
|
종합분야
|
한국기초과학지원연구원 한국세포주은행 한국생명공학연구원 한국생명공학연구원 |
고가의 바이오 연구기자재 활용 미생물 및 세포주은행(관리 및 공급) 해외생물소재(식물) 허브센터 국가생명공학정책연구 및 확산 |
|
|
Development Pilot-plant Manufacturing
(개발, 시생산 및 산업화) |
산기반 공동장비/연구지원 |
경기바이오센터 등 5개 한국식품연구원 한국화학연구원 한국화학연구원 부산대학교 항노화센터 |
산학연공동연구기반구축 건강기능식품플랫폼 신약개발플랫폼, 바이오화학실용화 Drug Repositioning 연구지원 항노화산업 제품화 연구지원 |
|
벤처기업 지원 |
한국생명공학연구원 등 9개 |
바이오벤처기업지원센터(TIC를 포함 BVC) 구축 |
|
|
지역 클러스터
|
대전테크노파크 등 22개 (지원기반정비 13개 별도)
|
지역특화산업 분야 혁신역량 제고 (시설・장비지원, 기술지원, 교육훈련, 시생산(Pilot plant, GMP 등) 및 공인검사지원 등 수행) |
|
|
종합분야
|
(주)바이넥스(舊 생기원) 한국생명공학연구원 한국바이오협회 순창군 장류사업소 |
생물산업기술실용화센터건립(cGMP) 바이오안전성정보센터(LMO관련) 코리아바이오허브구축(Networking) 발효미생물종합활용센터건립(전통식품) |
|
|
GLP(비임상) GCP(임상) (신뢰성평가) |
GLP (비임상) |
식약처 지정 GLP 25개 (안전성평가연구소 등) |
비임상 시험항목별 허가기관 (’17.4) |
|
GCP(임상) |
식약처 지정 GCP 184개 |
임상1상, 임상2상, 임상3상(’16.12) |
* 의약바이오: 바이오신약, 바이오장기 등 바이오기술을 보건의료 분야에 응용한 것
* 산업/그린바이오: 건강기능식품, 바이오매스, 바이오플라스틱 등 바이오기술을 농축산, 식품, 바이오플라스틱, 바이오연료 등에 응용한 것
* 융합바이오: 바이오공정, 바이오환경, 바이오에너지 등 바이오기술을 산업공정/생산 및 환경 분야에 응용한 것
* BVC : 바이오벤처기업지원센터(Bio Venture Center), 전국 바이오벤처기업지원센터간 협력네트워크 및 전략적 연계운영시스템 구축을 통한 효율적 기업지원시스템 구축, 바이오산업의 지역별 균형발전을 도모하기 위해 설립・운영(지역대학 중심으로 지원한 TIC (Technology Innovation Center) 포함
* 지역클러스터(지역특화센터): 지역특화산업 분야의 혁신역량을 제고하기 위하여 지역 내 설치 운영되는 센터이며, 지역의 기획 및 기술개발역량의 중재자 기능을 수행
* 산기반 공동장비/연구지원: 산업부 산업기술기반조성/산업핵심기술개발 등으로 지원된 인프라
2. 현황
가. 기초・응용연구 단계 인프라
기초・응용연구 단계 인프라는 기초이론 및 실험, 실용 목적의 아이디어 특허 등 개념정립, 연구실 규모의 기본성능 검증, 연구실 규모의 부품 및 시스템 핵심성능 평가 등을 지원하는 인프라에 해당되며, 주로 국책연구원을 중심으로 인프라가 형성되어 기술개발을 지원하고 있다.
특히 기초・응용연구 단계에서 가장 큰 비중을 차지하는 한국생명공학연구원은 바이오제품 안전성평가 및 정보관리, 국가영장류센터 운영, 바이오융합 연구, 해외생물소재 허브센터 운영, 국가생명공학정책연구 및 확산 등의 기능을 담당하고 있다. 한국식품연구원은 식품기능성 및 신소재・신공정 연구를 담당하고 있고, 한국화학연구원은 바이오분야를 포함한 화학기술분야 연구 및 성과보급을 담당하고 있으며, 한국과학기술연구원은 표적지향형 신규항암제 후보물질 연구, 실시간 분자영상 스마트센서기술 연구 등의 기능을 담당하고 있다. 한국뇌연구원은 뇌손상기전 등 다학제적인 융합기술기반의 뇌연구를 담당하고 있고, 기타 한국한의약연구원의 한의학표준화연구, 한국전자통신연구원의 유비쿼터스 건강관리시스템 연구 등도 중요한 인프라 기능을 담당하고 있다.
그러나 기초・응용연구 환경에 종합적으로 필요한 2개의 핵심 인프라로는 분석기능을 지원하고 있는 한국기초과학지원연구원과 연구개발 검증에 필요한 세포주를 지원하고 있는 한국세포주은행을 꼽을 수 있다. 한국기초과학연구원은 1988년 기초과학 진흥을 위한 연구지원 및 공동연구 수행을 목적으로 설립되어 국가적 대형공동연구장비 개발・설치・운영, 첨단연구장비 이용자교육, 범국가적 연구장비 정보수집・분석 등의 기능을 담당하고 있으며, 2015년 현재 대덕 및 오창 본원, 지역특화산업을 기반으로 10개 분원(서울, 서울서부, 부산, 대구, 광주, 전주, 춘천, 순천, 강릉, 제주)에 총 254명의 인력 및 170종의 지원장비(BT, NT, ET 분야로 구분하여 분석포털시스템(USE-KBSI)을 통해 인프라 지원 중)를 보유하고 있다. 한국세포주은행은 1982년 전국의 연구기관에 필요한 세포주 개발・공급을 목적으로 설립되어 세포주 자원에 관련 정보 수집・보존・공급, 세포주 관련 각종 교육・연수・학술회의 실시, 특허출원 세포주의 기탁 및 보존 등의 기능을 담당하고 있다. 세포주 품질관리에 필요한 각종 실험기자재 및 실험 보조장치를 확보하고 있으며, 1993년 UN산하 세계지적재산권기구로부터 특허미생물의 국제기탁기관의 지위를 취득하였고, 현재 자체개발 세포주 330여종, 외국도입 세포주 430여종을 보유하고 있는 세계 5대 은행으로 꼽히는 규모이다.
나. 개발・생산 및 산업화 단계 인프라
개발・시생산 및 산업화 단계 인프라는 기초단계 이후의 효능검증 연구・확인, 확정된 부품・시스템의 시작품 제작・평가, Pilot 규모의 시작품 제작 및 성능 평가 등을 지원하는 인프라에 해당되며, 대부분 산업통상자원부 지원기관을 중심으로 인프라가 형성되어 의약바이오, 산업바이오, 융합바이오 분야의 산업화를 지원하고 있다.
산업화 지원 인프라는 기본적으로 기업성장 단계별 지원(창업보육 등), 시설・장비구축・활용, 교육훈련, 정보교류, 기술지도 등을 담당하고 있고, 인프라구축 형태로 크게 구분하면, ①생물산업실용화기반(cGMP, 발효미생물활용센터), ②바이오안전성정보 및 바이오분야국제협약운영기반(LMO), ③연계협력기반(Korea Bio-Hub), ④산업기술기반조성(BVC, 산학연공동연구기반, 플랫폼센터, DR센터), ⑤지역클러스터(지역특화센터) 등으로 구분될 수 있으며, 국내 생물산업의 여건 및 경쟁력을 고려하여 산업통상자원부 중심으로 전략적으로 구축되었다.
생물산업실용화기반 부분을 살펴보면, 1998년 국내 생물의약 분야의 성장에도 불구하고 미국 FDA의 인증을 받은 우수의약품 제조 및 품질관리기준인 cGMP40)기준의 생산 공장이 전무한 실정을 감안하여 선진국 수출지원 등을 위하여 미국 FDA와 유럽 EMA가 요구하는 기술적 사항을 종합적으로 반영하여 국제적으로 인정된 기준에 맞는 생물의약품 전문생산시설(생물산업기술실용화센터(1998∼2007))41)이 구축되었으며 현재 바이넥스에서 운영하고 있고, 2007년 국내 발효식품산업 육성을 위해 전통발효식품(고추장, 된장 등)의 안전성 확보 및 발효미생물자원의 허브 구축을 위하여 발효미생물종합활용센터(2007∼2010)42)가 구축되었다.
바이오안전성기반 부분을 살펴보면, 2002년 LMO(유전자변형생물체)를 중심으로 대두된 국제무역질서에 대응하기 위한 의무사항・교육・홍보 등을 위하여 바이오안전성정보센터(2002∼), 바이오분야국제협약운영센터(2008∼), 바이오안전성평가관리사업(2008∼) 등이 구축되었으며, 연계협력기반 부분을 살펴보면, 국내외 바이오네트워크 구축・활성화 및 웹포털 구축・운영을 통한 각종 협업기관 지원을 위하여 코리아바이오허브센터(2004∼)가 구축되었다.
또한, 산업기술기반조성 및 지역클러스터 부분을 살펴보면 수도권을 포함한 각 지역에 소재한 중소 바이오벤처기업 등의 특성화 지원 및 현장 밀착형 지원을 위해 산업정책 차원에서의 바이오벤처기업지원센터(BVC, 1998∼2007)43)와 산학연공동연구기반구축(2004∼2011)44), 지역균형발전 차원에서의 지역 바이오클러스터(지역특화센터, 2002∼2012)45), 건강식품개발 및 신약개발을 위한 플랫폼구축(2009∼2014), Drug Repositioning 기술을 이용한 신약개발 활용시스템 구축(2010∼2015), 바이오화학실용화센터 구축(2010∼2014)46), 지역산업 육성을 위한 융복합 연구지원(2012∼2015) 및 항노화제품개발 인프라(2011∼2015)47) 등이 구축되었다.
(1) 산업화 인프라 지원 현황
산업화 지원 인프라는 국비지원 종료 후 대부분 운영자립화 단계에 있으며, 지역내외의 산학연 고객수요, 정부/지자체 등 (비)R&D 자금 수주 등을 통해 전국적으로 생물산업 제품의 산업화를 직・간접적으로 지원하고 있고, 2017년까지 지급한 국비지원금은 29개 기관, 60개 과제(2단계 13개 포함)에 총 6,279.31억 원이 지원되었으며, 60개 과제는 cGMP 1개, LMO 3개, 산기반 3개, 네트워킹 1개, 발효산업 1개, BVC 9개, 지역특화센터 36개(2단계 13개 포함), 산업핵심 및 산기반 인프라 7개로 구성되어 있다.
광역경제권역별로 2017년까지의 정부 지원 금액(지원과제수 포함) 비중을 살펴본 결과, 호남권이 23%(1,441억 원, 14개) 지원되었으며, 충청권이 22.7%(1,428억 원, 16개), 수도권이 19.5%(1,226억 원, 4개), 대경권이 10.07%(631억 원, 9개), 동남권이 8.8%(555억 원, 9개), 강원권이 8.1%(511억 원, 5개), 제주권이 7.8%(487억 원, 3개) 순으로 지원되었으며, 지원분야별 지원금액(지원과제수 포함) 비중을 살펴본 결과, 각각 산업/그린바이오 분야가 52.7%(3,310억 원, 36개), 의약바이오 분야가 33.8%(2,121억 원, 15개), 복합지원(의약/산업/그린) 분야가 8.8%(552억 원, 5개), 융합바이오 분야가 4.7%(296억 원, 4개) 등의 비중을 차지하고 있다.
60개 지원과제별 지원서비스 분야별 현황(2개 이상 지원 역할 포함)을 살펴보면, Pilot Plant 지원이 70.0%(42개), GMP 지원이 56.7%(34개), 공인인증검사(식품위생검사 등 포함)가 45.0%(27개), 기타(연구지원, 정보제공 등)가 20.0%(12개) 등으로 주요 역할이 생물산업 제품화 지원을 위한 시제품생산 및 공인시험 인증지원에 큰 비중을 두고 있다.

[그림 3-82] 광역경제권역별 산업화 인프라 지원 현황(∼2017)

[그림 3-83] 지원분야별 산업화 인프라 지원 현황(∼2017)
(2) 산업화 인프라 지원 성과
생물산업 제품화 지원 인프라 구축을 통해 2017년 8월말 현재 총 341,821평의 부지가 사용되었으며 행정동, 연구동, 장비지원동, Pilot Plant, 기업입주 공간 등의 건물 규모는 총 128,243평이고, 인프라 지원 상주인력은 총 1,152명(기관 평균 39.7명의 전담인력을 보유)에 이르고 있다.
구체적으로 광역경제권역별로 구분하면, 수도권이 부지 15,973평, 건물 13,099평, 전담인력 178명, 충청권이 부지 20,138평, 건물 12,961평, 전담인력 204명, 호남권이 부지 174,074평, 건물 43,890평, 전담인력 365명, 동남권이 부지 38,621평, 건물 10,306평, 전담인력 90명, 대경권이 부지 48,585평, 건물 15,876평, 전담인력 186명, 강원권이 부지 38,905평, 건물 28,098평, 전담인력 79명, 제주권이 부지 5,525평, 건물 4,013평, 전담인력 50명 등으로 구성되어 있으며, 지원분야별로 비중을 살펴보면, 산업/그린바이오 분야 부지가 54.7%(186,891평), 건물이 46.9%(60,187평), 전담인력이 51.5%(593명), 의약바이오 분야 부지가 36.0%(123,216평), 건물이 30.3%(38,920평), 전담인력이 33.8%(389명), 융합바이오 분야 부지가 2.1%(7,230평), 건물이 3.0% (3,875평), 전담인력이 2.4%(28명), 복합지원 분야 부지가 7.2%(24,484평), 건물이 19.7% (25,261평), 전담인력이 12.3%(142명) 등의 비중을 차지하고 있다.
또한, 2017년 8월까지의 산학연 등 지원성과를 보면, 입주기업수가 808개, 장비구축건수가 7,733건, 기술지도 및 기술상담 건수가 11,589건, 세미나 및 교육훈련 건수가 3,575건, 각종 산업화 지원 등을 통한 수익금 현황이 674억 원 등으로 지속적으로 생물산업 관련 지원역할을 충실히 하고 있다. 지원분야별로 2017년 8월 기준 성과비중을 살펴보면, 산업/그린바이오 분야 입주기업이 66.0%(533개), 장비구축 건수가 73.0%(5,644건), 기술지도 및 기술상담 건수가 48.9%(5,669건), 세미나 및 교육훈련 건수가 54.9%(1,962건), 수익금 규모가 42.36%(285억 원), 의약바이오 분야 입주기업이 22.6%(183개), 장비구축 건수가 19.7%(1,520건), 기술지도 및 기술상담 건수가 23.9%(2,764건), 세미나 및 교육훈련 건수가 22.7%(813건), 수익금 규모가 41.8% (282억 원), 융합바이오 분야 입주기업이 3.1%(25개), 장비구축건수가 1.5%(116건), 기술지도 및 기술상담 건수가 2.8%(320건), 세미나 및 교육훈련 건수가 2.0%(72건), 수익금 규모가 1.6%(10.6억 원), 복합지원 분야 입주기업이 8.3%(67개), 장비구축 건수가 5.9%(453건), 기술지도 및 기술상담 건수가 24.5%(2,836건), 세미나 및 교육훈련 건수가 20.4%(728건), 수익금 규모가 14.3%(9.6억 원) 등의 비중을 차지하고 있다.

[그림 3-84] 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과(입주기업)

[그림 3-85] 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과(장비구축)

[그림 3-86] 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과(기술지도)

[그림 3-87] 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과(교육훈련)

[그림 3-88] 광역경제권역별/연도별(누계) 산업화 인프라 지원 성과(수익금발생)

[그림 3-89] 지원분야별 산업화 인프라 지원 성과(2015년 9월말 누계치)
다. 신뢰성평가 단계 인프라
신뢰성평가 단계 인프라는 최종 개발제품의 산업화 전후 단계에서의 인체 적용을 통하여 체내 안전성・유효성 등에 대한 신뢰성(비임상, 임상 등) 확보를 지원하는 인프라에 해당되며, 대부분 보건복지부(식품의약품안전처)의 인허가를 득한 지원기관을 중심으로 인프라가 형성되어 지원하고 있다. 구체적으로 식품의약품안전처로부터 GLP(비임상시험관리기준, Good Laboratory Practice) 시험기관으로 지정된 기관은 1988년부터 2017년 4월까지 31개 기관이었으나, 6개 기관의 지정취하로 인해 2017년 8월말 현재 25개 기관이 운영 중에 있으며, GCP(임상시험관리기준, Good Clinical Practice) 기준에 맞는 자격기준을 갖추고 있고 식품의약품안전처에서 임상시험실시기관으로 지정된 국내기관은 199개가 지정되었으나, 2017년 8월말 현재 184개 기관이 운영 중에 있다. 특히 GLP 기관은 수도권에 전체의 56%에 해당하는 14개가 위치하여 비임상 지원을 하고 있으며, 충청권에 28%에 해당하는 7개, 호남권에 2개, 대경권에 1개, 강원권에 1개씩 위치하고 있다.
특히 산업통상자원부에서는 2010년부터 대규모 투자가 이루어지고 있는 의약품에 관한 임상 수요를 국내 임상 CRO(전문연구용역기관, Contracted Research Organization)를 통해 충족시킴으로써 국내 개발사에 대한 전문 서비스를 신속하고 저비용으로 제공하는 동시에 국내 임상 CRO산업의 육성을 위해 ㈜드림씨아이에스, ㈜씨엔알리서치, ㈜지디에프아이, ㈜엘에스케이글로벌파마서비스 등 4개의 국내 대표적인 임상 CRO회사를 중심으로 핵심 인프라 구축을 지원하였으며, 국내 CRO관련 산업의 성장과 발전을 도모하고 국내 임상 CRO의 활성도를 제고하여 바이오의약품의 해외진출을 지원하는 역할을 담당하고 있다. 주요 서비스 내용으로는 ① 글로벌 기준에 맞는 임상시험자료 관리시스템(CDM) 구축, ② 다국적 임상시험 진행시 원활한 진행을 위한 임상시험 관리시스템(PM) 구축, ③ 글로벌수준의 임상시험 신뢰성보증시스템(QA) 구축과 임상시험 모니터요원(CRA) 교육, ④ 구축된 기반을 활용한 바이오시밀러 제품에 대한 임상시험 시범수행 등을 추진한 바 있다.
3. 발전 과제
분명 생명공학 분야의 인프라 기관은 우리나라의 생물산업 발전을 위한 기술 및 제품화 지원의 하부구조를 구성하며 기초연구에서 사업화까지의 전 과정에 걸쳐 제 역할을 담당하고 있음을 부정할 수는 없다.
그러나 지난 20년간 정부지원을 통해 구축된 지역 중심의 인프라는 지속적인 운영자립화 및 기업지원 경쟁력 강화를 위해 효율성 강구가 필요한 시점이라 판단된다. 의약바이오 분야의 경우 후보물질(경기), 백신(경북), 바이오시밀러GMP(대전) 등 국가 전체를 대상으로 단계별, 형태별 특성화가 되어 있는 반면, 산업/그린바이오 분야의 경우 상대적으로 지역기업의 인프라 활용 촉진에 더욱 강조되어 있기 때문이다.
향후 기초 단계(공공연구기관), 신뢰성평가 단계((비)임상GLP 등)를 연결해 주는 산업화 인프라에 대해서는 국가 단위의 성과를 창출할 수 있도록 중점분야별(의약, 식품 등), 단계별(후보물질∼시생산∼생산), 서비스별(백신, 바이오시밀러, 소재단백질 등) 인프라 연계 및 통합 서비스 체계구축 지원을 고려할 필요가 있으며, 이를 통해 중소・중견기업 등의 연구결과를 조기 제품화하고 지역별 기 구축된 산업화 인프라의 활용도와 전문성을 동시에 제고할 수 있을 것으로 판단된다.
제4장 생명공학 관련 법제도 현황
![]() 제1절
바이오안전성 동향
제1절
바이오안전성 동향
1. 서 론
유전자변형생물체(Living Modified Organisms, LMO)는 작물, 동물, 화훼, 미생물 등 다양한 분야에서 개발・이용되고 있다. 특히 GM작물의 경우 1996년 상업적 재배가 시작된 이래로 꾸준히 재배면적이 증가하고 있으며, 2016년 기준 1억 8,510만 ha에서 GM작물이 재배되었고 전체 재배면적의 54%는 개발도상국이 차지하고 있다. 또한 GM연어가 상업화되어 GM동물을 식용으로 이용하는 첫 사례가 되었으며, 갈변방지 GM사과, 발암물질 감소 GM감자 등 소비자 지향적 GM작물들도 상업화되어 그 저변이 확대되고 있다.
그러나 해외에서 미승인 GM밀, GM페튜니아가 발견된 사례가 있으며 국내에서는 미승인 GM유채가 지역 축제 행사장에서 발견되는 등 LMO 안전관리에 경각심을 일깨우는 사례가 있었다. GMO 의무표시제를 시행하지 않던 미국에서 의무표시제를 도입하였고, EU에서는 개별국가들이 GM작물 재배에 대하여 결정권을 행사할 수 있는 제도적 변화가 있었다. 일련의 사례들은 모두 LMO의 잠재적 위해성에 대한 우려가 그 기저에 있다고 할 수 있다.
한국바이오안전성정보센터(이하 KBCH)에서는 전문조사기관인 한국리서치를 통해 진행한 대국민 LMO 인식조사 결과 응답자 10명중 8.5명 꼴(85%)로 유전자변형생물체 및 그 외 관련 용어를 인지하고 있는 것으로 나타났다. 그 중 유전자변형생물체에 대하여 들어본 적이 있는 응답자들을 대상으로 유전자변형생물체에 대한 이해정도를 묻는 문항에는 유전자변형생물체 인지자의 45.5%가 유전자변형생물체의 생산과정과 활용분야에 대하여 “잘 알지 못한다.”고 응답하였고, “꽤/아주 많이 알고 있다.”는 응답은 3.9%로 LMO에 대한 이해정도는 여전히 낮은 수준으로 나타났으며 유전자변형생물체에 대한 우려도 높게 나타나고 있다.
유전자변형생물체, 유전자변형기술에 우려가 존재함에 따라 국제사회에서는 유전자변형생물체의 국가간 이동의 규제에 초점을 두어 유전자변형생물체의 안전한 이동, 취급 및 이용에 관한 규정과 절차를 확립함으로써 바이오안전성을 확보하고자 바이오안전성의정서(Cartagena Protocol on Biosafety, 이하 의정서)를 채택하였다. 국내에서는 의정서의 국내 이행을 위해 2001년 3월 산업자원부(現 산업통상자원부)가 주관이 되어 ‘유전자변형생물체의 국가 간 이동 등에 관한 법률(이하 LMO법)’을 제정・공포・시행하고 있다.
‘생물다양성협약(Convention on Biodiversity, 이하 CBD)’에서 채택된 의정서(이하 의정서)는 CBD의 부속 의정서로서 유전자변형생물체의 국가간 이동을 규제하는 최초의 국제협약이다. 의정서는 ‘사전예방적 접근방식(Precautionary Approach)’에 따라 잠재적 위해성에 관한 과학적 확실성이 없더라도 환경피해를 방지하기 위한 비용효과적인 조치를 취할 수 있도록 하였으며, ‘사전통보합의절차(Advance Informed Agreement)’를 규정하여 수출국(자)이 환경방출 LMO에 대하여 의도적으로 국가간 이동하기 전에 수입국에 사전 통보하여 수입국의 동의를 획득하도록 하였다. 아울러 LMO에 관한 다양한 정보 수집 및 공유를 위해 바이오안전성정보센터(BCH, Biosafety Clearing-House)를 구축하고, LMO의 위해성 평가・관리, 공공인식・교육・참여, 능력형성 등을 강조하고 있다. 의정서는 50번째 가입국인 팔라우가 비준서를 기탁한 90일 이후인 2003년 9월 11일부터 국제적으로 발효되었으며, 2017년 5월 현재 170개국(유럽연합 포함)이 가입하고 있다.
[표 4-1] 의정서 가입 현황(2017년 5월 기준 170개국)
|
구분1) 지역 |
의정서 발효 기준 50개국2) |
발효 기준일 이후 가입국 |
국가 수 |
|
아프리카 |
보츠와나, 카메룬, 지부티, 가나, 케냐, 레소토, 라이베리아, 말리, 모리셔스, 모잠비크, 탄자니아, 튀니지, 우간다(13) |
나이지리아, 부르키나파소, 남아공, 세네갈, 에티오피아, 마다가스카르, 이집트, 잠비아, 세이셸, 감비아, 토고, 르완다, 알제리, 니제르, 나미비아, 짐바브웨, 베냉, 에리트레아, 콩고민주공화국, 수단, 리비아, 모리타니, 카보베르데, 스와질란드, 콩고, 차드, 가봉, 기니, 부룬디, 중앙아프리카 공화국, 말라위, 코모로, 앙골라, 기니비사우, 소말리아, 모로코, 코트디브아르(37) |
50 |
|
아시아・ 태평양 |
부탄, 피지, 인도, 몰디브, 마샬군도, 나우루, 니우에, 오만, 팔라우, 사모아(10) |
몽고, 북한, 말레이시아, 캄보디아, 통가, 요르단, 이란, 일본, 키프로스, 베트남, 방글라데시, 타지키스탄, 시리아, 키리바시, 스리랑카, 솔로몬, 라오스, 인도네시아, 중국, 파푸아뉴기니, 태국, 예맨, 필리핀, 카타르, 키르키즈스탄, 사우디아라비아, 대한민국, 미얀마, 투르크메니스탄, 카자흐스탄, 파키스탄, 바레인, 레바논, 아프가니스탄, 이라크, 아랍에미레이트, 팔레스타인(37) |
47 |
|
중남미・ 카리브해 |
바베이도스, 볼리비아, 콜롬비아, 쿠바, 에콰도르, 멕시코, 니카라과, 파나마, 세인트키트네비스, 트리니다드토바고, 베네수엘라(11) |
세인트 빈센트, 앤티카바부다, 엘살바도르, 브라질, 바하마, 그레나다, 벨리즈, 파라과이, 페루, 도미니카, 과테말라, 세인트루시아, 도미니카공화국, 코스타리카, 가이아나, 수리남, 온두라스, 우루과이, 자메이카(19) |
30 |
|
중앙・동유럽 |
벨로루시, 불가리아, 크로아티아, 체코, 몰도바, 슬로베니아, 우크라이나(7) |
루마니아, 리투아니아, 슬로바키아, 폴란드, 헝가리, 라트비아, 에스토니아, 아르메니아, 알바니아, 아제르바이잔, 유고, 세르비아, 몬테네그로, 그루지야, 보스니아(15) |
22 |
|
서유럽・ 기타 |
오스트리아, 덴마크, 유럽연합, 프랑스, 룩셈부르크, 노르웨이, 스페인, 스웨덴, 스위스, 네덜란드(10) |
터키, 아일랜드, 영국, 독일, 이탈리아, 벨기에, 그리스, 핀란드, 포르투갈, 뉴질랜드, 몰타공화국(11) |
21 |
출처: 의정서 홈페이지(www.biodiv.org/biosafety/)내용 재구성
우리나라는 2000년 9월 6일 의정서에 향후 비준 의사가 있음을 표명(의정서 서명)하였고, 2001년 3월 의정서 이행을 위해 ‘유전자변형생물체의 국가간 이동 등에 관한 법률(이하 LMO법)’을 제정・공포하였다. LMO법 제정・공포 이후 각 관계기관별로 동법 시행에 필요한 하위 법령 제정을 위해 노력해 왔고, 2007년 8월 이러한 노력의 마지막 단계로서 LMO법 통합고시안이 입법예고 되었다. 이후 2007년 10월 3일 의정서에 비준함으로써 143번째 가입국이 되었으며 그로부터 90일 이후인 2008년 1월 1일에 의정서 및 LMO국내법이 시행되었다.
LMO법의 제정・공포 시기와 발효시기 사이에 약 7년의 차이가 있다 보니, 그 사이에 생명공학기술의 발전에 따른 현실과 법의 내용에 이질적 요소가 존재하였으며, 법 시행 이후 유전자변형미생물의 개발 및 산업화가 본격적으로 이루어지며 법률 개정 수요가 발생하여 각 부처의 LMO 안전관리 실무 현황을 반영한 통합고시를 개정하여 2014년 7월 30일 개정・공포하면서 이른바 LMO 안전관리의 정착기에 들어서게 되었다.
2. 국제 LMO 법・제도 및 바이오안전성 동향
2015년부터 2017년 상반기까지의 LMO를 둘러싼 국제법적 논의 동향과 더불어 우리나라가 동 의정서의 이행과 국내 바이오안전성 확보를 위해 어떠한 노력을 전개해왔는지 등에 대해 기술하고자 한다.
가. 제8차 의정서 당사국총회 개최 및 논의동향
의정서 당사국들의 의정서 이행사항을 점검하고 필요시 결정문을 통해 추가 규정을 제정하는 역할을 수행하고 있는 의정서 당사국회의는 2004년부터 개최되고 있으며, 제8차 당사국회의는 2016년 12월 4일부터 17일까지 총 2주간 멕시코 칸쿤(Moon Place Golf and Spa Resort)에서 개최되었다. 이번 회의는 회의 진행의 효율성을 증진하고, 3가지 회의의 통합적 운영을 촉진하기 위하여 제13차 CBD 당사국총회(COP 13), 제2차 나고야의정서 당사국회의(COP-MOP 2), 제8차 의정서 당사국회의(COP-MOP 8)가 2주간 동시에 개최된 첫 번째 회의이다. 향후 2018년 11월로 예정되어 있는 COP 14, COP-MOP 9, COP-MOP 3는 이집트에서 2주간 동시 개최 될 계획이다.
우리 정부는 총 3차에 걸쳐 관계기관회의 및 대표단 회의 등을 통해 COP-MOP 8을 준비했으며, 국가책임기관인 산업통상자원부 서성태 서기관을 수석대표로 하여 이창학 사무관(차석대표, 농식품부), 장호민 센터장(차석대표, KBCH) 등 다수의 관계자 17명이 대표단으로 참석하였다.
당사국회의에서는 워킹그룹회의와 본회의 등의 과정을 거쳐 19개 의제에 대한 보고서와 결정문을 채택하였으며, 특히 우리나라는 의무준수위원회, 재정 및 재원, 역량 강화, 공공인식 및 참여, 바이오안전성정보센터, 경유 및 밀폐 사용 등의 의제에 대해 우리나라 입장을 발언하고, 최종 결정문에 반영되는 성과를 거두었다. 또한, COP-MOP 8 대표단, CBD 사무국, 의무준수위원 등 총 100여 명이 참석한 가운데 아시아 BCH 패밀리 활동 및 아시아 지역 의정서 이행 촉진 관련 부대행사를 성공리에 개최하였다.
나. 책임・구제 추가의정서
의정서 제27조(책임 및 구제)를 근거로 제1차 의정서 당사국회의(2004년 2월, 쿠알라룸푸르)부터 논의를 시작하여 제5차 당사국회의(2010년 10월, 나고야)에서 채택된 ‘책임 및 구제에 대한 나고야・쿠알라룸푸르 추가의정서(이하 추가의정서)’는 유전자변형생물체와 관련된 책임과 구제 분야에 있어 국제 규칙 및 절차를 제공함으로써 인체 건강에 대한 위해를 고려함과 동시에 생물다양성의 보전과 지속가능한 이용에 기여하는 것을 목적으로 하고 있다. 이 추가의정서에 적용되는 범위는 의정서와 마찬가지로 식품・사료・가공 목적 LMO, 밀폐이용 LMO, 환경방출 LMO 모두를 포괄하고 있다.
이외에도 추가의정서에는 LMO와 피해간의 인과관계, 피해가 발생할 경우의 대응 조치, 책임의 면제와 시효, 구상권, 재정 보증, 국제 불법행위에 대한 국가책임, 이행 및 민사책임 관계 등을 규정하고 있으며, 인과관계 등 많은 부분을 국내법에 위임하고 있다. 추가의정서 제18조에 따라 의정서 당사국만이 추가의정서에 가입할 수 있으며, 40번째 비준서가 기탁된 날로부터 90일 이후에 발효한다. 현재 총 38개국이 가입하고 있으며 발효 조건인 40개국 가입을 현재 3개국(EU 제외)을 남겨 놓고 있는 상황이어서 머지않아 국제적으로 추가의정서가 발효될 것으로 전망된다.
다. 경제개발협력기구(OECD) 논의 동향
경제협력개발기구(OECD)는 의정서의 이행과 OECD 회원국 간의 생명공학기술 규제법 및 제도와 관련한 국가 간 규제에 대해 조화를 유지하고 수출입에 따른 무역마찰을 최소화하기 위하여 1995년 4월 전문가 그룹회의를 처음 구성한 이후 ‘생명공학 규제감시조화 작업반(Working group on Harmonization of Regulatory Oversight in Biotechnology)’과 ‘신규 식품사료 안전성 작업반(Task Force for the Safety of Novel Foods and Feeds)’을 운영하고 있다. 현재 작업반은 1년 간격으로 OECD 본부에서 실무회의를 개최하고 있다.
(1) 생명공학 규제감시조화 작업반 회의
OECD ‘생명공학 규제감시조화 작업반’은 우리나라를 포함한 21개 회원국, 유엔환경계획(UNEP), 국제연합농업기구(FAO), 경제산업자문위원회(BIAC, Business and Industry Advisory Committee), ILSI-CERA(International Life Sciences Institute-Center for Environment Risk Assessment) 등 국제기구와 러시아 등 비회원국에서 약 90명이 참여한 가운데 개최되었다.
OECD에서는 기술합의서 개발을 위해 수년간 작물, 화훼, 나무 등 식물분야에 대해 35개의 기술합의서를 발간하였으며, 2015∼2016년에는 강낭콩, 동부, 수수 및 토마토 기술합의서를 발간하였다.1) 캐나다와 미국의 주도로 준비 중인 미세조류(micro-algae)의 기술합의서 경과가 보고되었으며, 미세조류의 세부 계통 분류법 및 정의 등이 새롭게 반영된 초안을 OECD 사무국에 제출하여 회람할 예정이다.
동물분야에서는 노르웨이가 대서양 연어의 생물학 기술합의서가 마무리 단계에 있음을 보고하였다. 2004년 노르웨이, 핀란드, 미국의 주도로 시작된 대서양 연어의 기술합의서는 동물분야의 첫 번째 사례로 작업반은 기 제출된 기술합의서 최종안에 대해 검토의견을 제출하고 2016년 하반기에 최종적으로 공개할 것을 합의하였다. 멕시코, 브라질, ILSI-CERA는 2015년 전문가들이 참여한 운영위원회 워크숍을 통하여 모기의 생물학 기술합의서 초안을 제출하였다. 상반기 중에 작업반의 의견을 취합하여 차기 작업반(제31차)에서 최종 공개할 예정이다.
(2) 신규식품사료안전성작업반회의
‘신규식품사료안전성작업반’은 유전자변형작물에서부터 유래된 식품 및 사료의 안전성 평가를 논의하기 위하여 1999년부터 운영되고 있다. 신규 식품사료 기술합의서 개발을 위해 수년간 기술합의서 작성을 준비하고 있으며, 현재까지 28개의 기술합의서를 발간하였다.
3. 국내 LMO 법・제도 및 바이오안전성 동향
가. 유전자변형생물체의 국가간 이동 등에 관한 법률(LMO법)
의정서의 국내 이행법으로 2001년 3월 28일 법률 제6448호로 제정・공포된 LMO법이 시행된 것은 그로부터 7년이 지난 2008년 1월 1일이었다. 다시 그로부터 5년이 지난 2013년 12월 12일에는 개정 LMO법이 시행되었다.
우리나라 LMO법의 제정・공포 시기와 발효시기 사이에 약 7년의 차이가 있다 보니, 그 사이에 생명공학기술의 발전에 따른 현실과 법의 내용에 이질적 요소가 존재하였으며, 법 시행 이후 유전자변형미생물의 개발 및 산업화가 본격적으로 이루어지며 법률 개정 수요가 발생하게 되었다. 법 시행 이후, 각 부처의 유전자변형생물체(LMO) 안전관리 실무 현황을 반영한 통합고시를 개정하여 2014년 7월 30일 개정・공포하면서 이른바 LMO 안전관리의 정착기에 들어서게 되었다. 이후 개정 시행령 가운데 시험연구용 LMO의 수입승인 기간이 준용규정의 오류로 인하여 현행 60일에서 30일로 단축되었던 사항을 60일로 바로잡은 추가개정이 있었다. LMO법의 제정 및 개정 경과는 아래와 같다.
[표 4-2] LMO법 정비 경위(지난 5년간)
|
구분 |
추진내용 |
|
2013년 6월 |
LMO법 하위규정(시행령, 시행규칙, 통합고시) 개정 추진 |
|
2013년 12월 |
개정 LMO법 시행 |
|
2013년 12월 |
개정 LMO법 시행령, 시행규칙 시행 |
|
2014년 7월 |
LMO 통합고시 개정 공포 |
|
2015년 6월 |
LMO 통합고시 중 경미한 자구수정을 위한 개정 공포 |
|
2016년 3월 |
LMO법 시행령 개정 공포(시험연구용 LMO 수입승인 기간 오류 정정) |
나. LMO법 시행 및 LMO 안전관리
우리나라 LMO 안전관리의 특징은 용도에 따라 해당 LMO의 안전관리를 책임지고 있는 관계 중앙행정기관이 지정되어 있는 것이다. 이에 따라 시험·연구용 LMO는 과학기술정보통신부(舊 미래창조과학부), 농림축산업용 LMO는 농림축산식품부, 산업용 LMO는 산업통상자원부, 보건의료용 LMO는 보건복지부, 환경정화용 LMO는 환경부, 해양·수산용 LMO는 해양수산부, 식품·의료기기용 LMO는 식품의약품안전처에서 안전관리를 책임지고 있다.
[그림 4-1] 바이오안전성 국가관리 체계
또한 의정서 이행에 대한 국가책임기관 역할은 산업통상자원부가, 의정서 이행을 위한 국가연락기관 역할은 외교부에서 담당하고 있다. 그리고 국제 바이오안전성정보센터(BCH)와의 정보 교류 및 LMO관련 국내외 정보의 수집, 관리, 제공 등의 업무는 LMO법 제32조에 따라 국가책임기관에서 지정한 한국바이오안전성정보센터(KBCH)에서 담당하고 있다.
우리나라는 유전자변형생물체의 안전관리를 위하여 LMO법에 근거한 통합고시를 제정하여 운영하고 있다. 통합고시는 생명공학기술의 발달과 바이오산업의 발전에 부응하기 위하여 2007년 통합고시 제정 이후 첫 개정을 통하여 유전자변형생물체의 위해성심사 항목을 보다 구체화하고 체계화하여 현재 작물위주의 위해성심사를 동물까지 포함하여 모든 유전자변형생물체의 위해성심사를 진행할 수 있도록 하였으며, 생산공정 이용시설의 설치・운영 기준 및 유전자변형미생물의 안전한 이용절차를 확보하기 위한 기준 등을 마련하였다. 개정 LMO 통합고시는 2014년 7월 30일 최종 공포되어 발효되었다.
2016년 3월 22일, 일부개정으로 공포된 시행령에서는 시험・연구용 등의 유전자변형생물체의 수입승인기간을 60일로 정하였으며, 연구시설 허가사항 변경허가 요건을 명확히 하고, 개인정보보호규정을 신설하였다.
다. 산업용 LMO 안전관리 제도
시험・연구용, 농림축산업용, 보건의료용, 환경정화용, 해양・수산용, 식품・의료기기용 LMO를 제외한 섬유・기계・화학・전자・에너지・자원 등의 산업분야에 이용되는 LMO를 말하며, 앞에서 언급한 시험・연구용, 농림축산업용, 보건의료용, 환경정화용, 해양・수산용, 식품・의료기기용 LMO를 제외한 모든 LMO는 산업용 LMO이다.

[그림 4-2] 산업용 LMO 국가 안전관리
그러나 LMO의 종류가 많아지고 그 용도 또한 매우 다양해지고 있어, 위해성심사 및 승인신청을 준비하는 민원인의 입장에서는 해당 LMO의 용도가 무엇인지 확정하기 어려운 경우가 발생하며 이 경우 산업통상자원부는 7개의 LMO소관 관계부처와 협의를 통하여 해당 LMO의 소관부처를 확정할 수 있도록 하고 있다.
우리나라의 산업용 LMO에 대한 안전관리는 다섯 단계로 구분할 수 있다. 개발 및 연구 단계는 연구기관의 자체적 안전관리와 과학기술정보통신부 또는 보건복지부의 안전관리가 필요한 단계이다. 산업용 LMO의 개발 이후는 산업통상자원부의 안전관리 업무가 시작되는 단계이다. 산업통상자원부 소관 안전관리 업무는 산업용 LMO를 생산 또는 이용하려는 시설의 국가등록, 개발된 산업용 LMO의 위해성심사, 위해성심사를 통해 적합 판정을 받은 산업용 LMO의 생산・수입・이용 승인, 마지막으로 취급관리 및 모니터링 업무이다.
라. 국내 LMO 수출입 현황
2008년 1월 1일부터 LMO법이 시행됨에 따라 해당 관계 중앙행정기관을 통해 시험・연구용 유전자변형생물체, 식용 유전자변형생물체, 농업용 유전자변형생물체에 대한 수입승인 또는 수입신고가 이루어지고 있다. 전체적으로 살펴보면, 시험・연구용 유전자변형생물체의 수입신고는 지속적으로 증가하는 반면, 식용・농업용 유전자변형생물체의 수입승인은 국제 곡물가격과 재배여건 변화, 국내 보유재고량에 따라 변화하는 추세를 보이고 있다.
시험・연구용으로 수입신고된 유전자변형생물체는 2015년 2,166건, 2016년에는 3,573건으로 크게 증가하는 경향을 보여주었다. 식용・농업용으로 수입승인 된 유전자변형생물체는 2015년 1,024만 톤, 2016년 974만 톤 이며, 2014년 1,077만 톤 수입 승인되어 LMO법 시행 이후로 가장 많이 수입승인 된 이후 국내 재고량 증가 및 국제 소맥가격 하락, AI, 구제역 등 가축질병 발병으로 인한 배합사료 수요 감소로 지속적인 하락추세를 보이고 있다.

[그림 4-3] 연도별 식용/사료용 LMO 수입량
마. 국내 LMO 연구개발 및 산업화 동향
국내 LMO 연구개발은 작물, 화훼, 동물, 곤충 등 다양한 분야에서 추진되고 있다. 작물분야에서는 기초연구, 상업화를 위한 GM작물 개발연구가 진행되고 있는데 기초연구는 대학에서 유전자 발굴 또는 식물의 생리기작 구명 등의 연구가 애기장대, 담배 등 모델작물과 벼 등의 식량작물, 원예작물 및 특용작물 등 다양한 작물을 대상으로 진행되고 있다. 상업화를 위한 GM작물 개발 연구는 대학 또는 연구소 단독으로 상업용 GM작물을 개발하기에는 한계가 있기 때문에 산・학・관・연 공동 국책연구개발 프로그램인 ‘GM작물개발사업단’을 통해 상업용 GM작물에 대한 국가 기술경쟁력 확보를 목표로 연구가 진행되고 있다. 사업단에서는 국내외 20개 대학과 국공립 및 민간 연구소의 전문연구팀을 중심으로 안전성심사 기준을 충족하면서 향후 우리 농업의 문제 해결에 기여 가능한 GM작물을 개발하고 있으며 대상작물은 벼, 콩, 배추, 고추, 국화, 잔디 등 12종으로 불량환경에 내성을 갖거나 의약원료와 같은 고부가 산업소재 생산 등의 목적을 가지고 진행되고 있다.
화훼분야에서는 대기환경오염 저항성 및 실내공기 오염원 제거능력 증진 페튜니아 개발에 관한 2건의 연구가 보고 되었는데 포름알데히드 제거 능력을 가진 유전자를 도입한 페튜니아, 아황산가스 저항성 페튜니아가 이에 해당한다. 나무분야에서는 2014년 ‘포스트게놈 다부처유전체사업’을 시작으로 국립산림과학원이 주관하여 소나무, 밤나무 및 사시나무의 유전체 해독 프로젝트가 시작되어 진행 중이며 이는 국내 GM나무 개발에 밑거름이 될 것으로 전망되고 있다. GM동물의 생산에 관한 연구동향은 유전자 편집기술을 이용하여 비교적 간단하고 기존 방식보다 빠르고 효율적으로 GM동물을 생산하려는 연구와 개발된 GM동물의 표현형을 체계적으로 분석하여 새로운 활용성을 찾아 다변화시키려는 연구가 진행되고 있다. 곤충 분야에서는 농촌진흥청에서 우리 고유의 독자적 누에 형질전환체 제작 기술을 통해 녹색, 적색, 청색, 황색 등 다양한 천연 형광단백질이 실크에 융합된 형광실크 GM누에를 개발하였으며 GM누에의 위해성평가를 위한 연구가 추진되고 있다.
LMO를 섬유・기계・화학・전자・에너지・자원 등의 산업분야에 활용하고자 하는 연구도 진행되고 있으며 개정 LMO법에서는 생산공정이용시설에 대한 허가/신고 및 유전자변형미생물(Living Modified Micro-organism)에 대한 이용 승인에 대한 계도와 관련 업무를 수행할 수 있는 근거를 마련한 바 있다. 이와 관련해 2016년 상피세포성장인자 생산용 벼 캘러스, 생분해성 금속이온봉쇄제 원료소재 생산 대장균 등 생산공정 중 LMO를 이용하기 위한 위해성심사가 2건 완료되었다. 또한 효소 생산에 활용되는 GM미생물이 식품용으로 3건의 승인이 완료되어 이용되고 있다.
바. 국내 바이오안전성 이슈
2015∼2017년 국내 바이오안전성 이슈로는 GM벼 개발과 시험재배와 관련된 시민사회단체의 반대운동 및 미승인 GM유채 발견 이슈가 있었으며 관계행정기관의 유기적 협조를 바탕으로 이에 대한 조치가 이루어졌다.
2015년 9월 농촌진흥청의 GM벼 산업용 위해성심사 준비 중에 있다는 학회발표 이후 GMO를 반대하는 시민사회단체를 중심으로 GMO 반대운동이 진행되었다. 이들 GMO반대 시민사회단체는 ‘유전자 조작 벼 시험재배 규탄 기자회견과 대규모 집회’를 통해 GMO 연구 및 시험재배 중단을 요구하였으며 이후 전국 7개 지역에서 10여개 품목의 GMO 연구 및 시험재배에 따라 반대여론이 높아졌다. 이에 농촌진흥청은 안전관리 강화와 GMO 연구시설 및 시험재배지를 언론에 공개하는 등 소통을 시도하였으나 반대운동은 지속적으로 진행되었다. 2017년 9월 이후 농촌진흥청은 GMO 연구는 지속 추진하되, 시민사회단체, 학계 등이 참여하는 농생명위원회 운영 등을 통해 GMO 안전성 확보 및 안전관리 강화 등에 대한 적극적인 의견수렴과 갈등해소를 추진하고 있다.
한편 국립종자원의 종자용 LMO 환경방출 감시 조사활동 중 2017년 5월 강원도 태백시 소재 유채꽃 축제장에서 미승인 GM유채가 발견된 바 있다. 이에 농림축산식품부 등 관계 행정기관에서는 발견된 GM유채를 폐기하고 해당 유채의 유통경로 파악 및 전국 미승인 LMO 유채 실태조사, 검역강화 등의 조치를 취하였다. 실태조사 결과 전국 13개 시․도 98개 지역에서 미승인 LMO 유채가 발견되어 모두 폐기처리 하였으며 향후 2년간 유채가 재배되지 않도록 특별 관리조치 할 방침이다. 또한 농림축산식품부, 환경부, 농촌진흥청 등 관계기관 및 시민단체가 참여하는 민관 합동 점검팀을 운영하여 지속적인 사후관리 및 환경영향 조사를 실시하고 있다.
4. 바이오안전성 정보관리
바이오안전성정보센터(이하 BCH)는 바이오안전성 정보관리를 위한 정보협력 메커니즘의 효율적 수행을 지원하는 핵심이라 할 수 있다. 이를 위해 의정서 제20조에서는 관련 정보와 경험의 교환 촉진, 개발도상국 등의 의정서 이행 지원 등을 위해 BCH를 설치하며, BCH로의 정보제공 등을 규정하고 있다. 아울러 의정서 정부간위원회에서는 유전자변형생물체 정보의 효율적 관리 및 유통을 위해 국가별 BCH 구축 및 운영을 권고하고 있다. 국가별 BCH는 각국의 의정서 국가이행사항 및 국내 안전성정보의 통합관리, 대국민 교육 및 홍보를 담당하고 있다. BCH와 국가별 BCH는 지속적인 상호 정보교류를 통한 전 세계 바이오안전성 확보를 위해 노력하고 있다.
우리나라는 국제법적 정보의무사항 이행과 바이오산업의 건전한 발전을 위한 유전자변형생물체 정보의 체계적・통합적 관리 및 정보공개의 필요성을 LMO법의 규정에 반영하였다. 의정서 제19조에 따라 국가연락기관은 외교부로 하고 국가책임기관은 산업통상자원부로 정하였으며, 국가책임기관인 산업통상자원부는 2002년부터 한국생명공학연구원 내에 바이오안전성정보센터(이하 KBCH)를 설치하여 의정서 및 LMO법의 이행과 그 지원을 위한 관련능력 형성을 지원해 왔다. 2008년부터 LMO법이 시행됨에 따라, KBCH는 국내외 유전자변형생물체 관련정보를 수집・관리・제공・홍보하기 위한 업무를 수행하고 있으며, 바이오안전성 정보시스템 체계 및 바이오안전성포탈을 구축・운영하고 있다. LMO법에서 정한 7개 관계중앙행정기관들은 LMO의 용도별로 LMO의 개발・생산・수입・수출・판매・운반・보관 등(이하 수출입등)의 업무를 수행하고 있으며, 바이오안전성 정보시스템 체계를 통해 LMO 정보를 공유하고 있다.
가. 유전자변형생물체 발생정보 관리
BCH는 의정서 및 LMO법의 정보의무사항 준수 및 이행을 위해 LMO관련 개발・실험, 위해성평가 및 심사, 생산, 수출입과 기타 안전관리 등에 필요한 정보를 관리하고 있다. 유전자변형생물체관련 정보를 실무적으로 관리하는 관계기관에는 과학기술정보통신부, 산업통상자원부, 식품의약품안전처, 농촌진흥청, 국립농산물품질관리원, 농림축산검역본부, 국립종자원, 질병관리본부, 식품의약품안전평가원, 국립수산과학원, 국립생태원 등이 있으며, 지속적인 유전자변형생물체 관련 정보교류와 회의 등을 통해 관계기관 간의 유기적인 협조 체계를 유지하고 있다.
KBCH는 2008년 LMO법 시행에 대비하여 관계기관 간의 회의를 다수 개최하여 관계기관에서 보유하는 LMO 발생정보에 대한 제공방안을 논의하였다. 유전자변형생물체관련 정보담당자 회의에서는 정보제공 방식과 수준, 취급정보 목록, 관계기관별 발생정보, 시스템 연동, 기타 애로사항 등에 관한 논의를 진행하였다. 또한, 정보담당자들 간의 원활한 정보교환을 돕고, 특정 중요사안 발생 시의 빠른 대처가 가능하도록 정보담당자 회의를 정기적으로 개최하고 있으며, 정보담당자 회의 이외에도 LMO관련 정보 발생 현황 파악 및 정보전달을 위해 관계기관 간의 신속・정확한 정보전달을 위한 유기적인 관계를 유지하고 있다.
이러한 정보관리 노력을 통해 수집・관리되는 정보들 중 국제바이오안전성정보센터에 등록해야하는 항목들(국가결정사항, 위해성심사결과, 전문가명부 등)에 대해서는 발생 시 바로 관련 정보를 제공하고 있으며, 매년 발생하고 있는 식품용・사료용・가공용 유전자변형생물체 위해성심사결과 및 CBD 사무국의 정보 요청 등의 상황에 따라 제공 건수에 변화가 있다.
[표 4-3] 국제바이오안전성정보센터 정보제공
(단위: 건)
|
년도 |
2009 |
2010 |
2011 |
2012 |
2013 |
2014 |
2015 |
2016 |
2017.6. |
|
건수 |
103 |
29 |
40 |
39 |
74 |
63 |
111 |
41 |
50 |
나. 바이오안전성포털
KBCH에서는 일반인과 LMO 이해당사자들을 대상으로 각 계층별 정보요구에 맞는 콘텐츠를 제작・제공하는 창구로 국내 유일의 LMO 정보제공 전문 사이트인 ‘바이오안전성포탈’(www.biosafety.or.kr)을 운영하고 있다. KBCH는 2015년 이용자들의 정보이용 효율성 증대와 차별화된 정보제공을 목적으로 바이오안전성포탈을 새롭게 단장하고 2016년 4월 전면 개편된 사이트를 오픈하였다. 개편된 바이오안전성포탈 주요 특징은 웹로그 분석결과를 바탕으로 신규 방문자가 많이 찾는 디렉토리, LMO 이해당사자의 주요이용 디렉토리를 파악 등 이용자의 정보이용 패턴을 분석하여 주요 이용메뉴를 각 메인페이지에 배치하는 등 이용자별 메인페이지를 운용하는 것과 홈페이지 내 별도의 검색엔진을 설치해 키워드 검색시 해당 게시물의 제목 및 내용, 첨부파일까지 검색하여 카테고리 별로 표출하는 기능을 구현한 것이다. 또한 접속하는 디지털기기를 인식하고 기기의 해상도에 맞는 페이지를 구성하는 반응형 웹페이지로 구성하여 언제 어디서나 다양한 기기를 통해 바이오안전성포탈의 정보를 이용할 수 있도록 하였다.

[그림 4-4] 바이오안전성 정보시스템 체계
5. 바이오안전성 커뮤니케이션
의정서는 LMO의 안전한 이동, 취급, 이용에 대한 공공인식을 촉진할 수 있도록 협력해야 함을 규정하고 있다. 의정서 제23조(공공인식 및 참여)에서 당사국은 LMO와 관련된 의사결정 과정에서 자국의 법령에 따라 공중과 협의하고, 공중이 그러한 결정의 결과를 이용할 수 있도록 규정하고 있다. 또한 공공인식 및 교육을 통하여 수입가능성이 있고 확인된 LMO의 정보에 접근할 수 있도록 보장하는 것을 당사국이 노력해야 한다고 정하고 있다. 이 규정에 따라 우리나라를 비롯한 각국 정부는 국가적 차원에서 일반대중에게 바이오안전성 및 LMO에 대한 정보를 투명하고 올바르게 제공하고자 다양한 방식의 커뮤니케이션 활동을 펼치고 있다.
가. LMO포럼 세미나
2008년 LMO법의 시행과 LMO 수입・이용에 대한 정보가 공개됨에 따라 LMO 이해당사자는 물론, 전문가, NGO 및 일반시민들이 LMO 정보를 공유하고 소통하는 커뮤니케이션의 필요성이 대두되었고, 이에 LMO관계자 및 일반시민 누구나 자유롭게 LMO 정보를 공유하고 LMO 궁금증을 해결하거나 자신의 의견을 낼 수 있는 토론의 장을 제공하고자 LMO 포럼세미나를 2010년부터 정기적으로 개최하고 있다.
2015년에는 국내 GM작물 개발동향 소개를 통한 향후 전망 및 발전방향을 모색함과 동시에 미국의 GM연어 승인과 같은 최신 이슈를 반영하여 GM동물 국제세미나를 개최하였다. 특히 GM동물 국제세미나는 GM동물 개발 현황 및 향후 전망에 대하여 공론화함으로써 올바른 정보제공과 대중 및 전문가와의 효과적인 커뮤니케이션을 증진하는 성과를 거두었다. 2016년에는 새로운 생명공학기술(유전자가위기술, 합성생물학)을 주제로 선정하여 생명공학기술 전반에 대한 대중의 인식을 넓히는데 기여하였다.
[표 4-4] LMO포럼 세미나(2015∼2016)
|
회차 |
날짜 |
주제 |
|
16차 |
2015년 9월 8일 |
우리나라 GM식물 개발 현황과 전망 |
|
17차 |
2015년 11월 6일 |
LMO 추가의정서 가입 필요성과 손해배상 특별법 제정에 관한 대국민 토론회 |
|
18차 |
2015년 12월 2일 |
대중과 함께하는 GMO 이야기 : 유전자변형동물 |
|
19차 |
2016년 7월 28일 |
새로운 생명공학기술 토론회Ⅰ: 유전자가위(Genome Editing) |
|
20차 |
2016년 10월 6일 |
새로운 생명공학기술 토론회Ⅱ: 합성생물학기술(Synthetic Biology) |
|
21차 |
2016년 10월 27일 |
MOP8 대응 관계기관회의 |
나. 각 계층별 커뮤니케이션 활동
KBCH에서는 2009년 시범적으로 개최한 토론대회를 시작으로 2010년부터 ‘전국 고등학생 바이오안전성-바이오산업 토론대회(이하 토론대회)’를 개최하고 있다.
2015년 토론대회는 본선 참가팀 중 탈락한 팀을 대상으로 ‘패자부활전’(최종 2팀에게 동상수여), ‘토론 및 바이오전문가와의 만남’을 진행하는 등 단순한 수상만을 위한 경쟁이 아닌 생명공학 관련 지식의 폭을 넓히고 생명공학 관련 진로를 탐색할 수 있는 기회를 제공하였다. 2016년에는 공동주최인 서울대학교 농생명과학공동기기원의 ‘생명과학 체험학습’을 진행하여 토론대회 참여 학생들이 첨단 실험기기 체험을 통해 생명공학에 대한 흥미 유발과 진로 탐색의 기회를 제공하였다.
[표 4-5] 바이오안전성-바이오산업 토론대회 개요(2015∼2016)
|
제6회 토론대회 |
논제 |
LMO의 이용은 지속가능발전에 바람직한가? |
|
접수 |
전국 61개교 101팀(202명) |
|
|
일시 |
2015년 7월 10일 |
|
|
장소 |
건국대학교 산학협동관 |
|
|
제7회 토론대회 |
논제 |
GM벼의 국내 연구개발 추진은 바람직한가? |
|
접수 |
전국 71개교 114팀(228명) |
|
|
일시 |
2016년 8월 16일 |
|
|
장소 |
서울대학교 농생명과학공동기기원 |
이 밖에도 주부, 교사, 공무원, 학생 등 다양한 계층을 대상으로 맞춤형 정보를 제공하는 ‘GMO 바로알기 설명회’를 2012년부터 정기적으로 개최하고 있다. 또한 사회적 영향력 및 활동이 증가할 대학생을 대상으로 ‘GMO 바로알기’ 프로그램의 필요성을 인식하고 생명공학 및 GMO에 관심 있는 대학생을 대상으로 ‘KBCH 대학생 기자단’ 을 선발하여 운영하고 있다.
다. 관계 중앙행정기관의 LMO 커뮤니케이션
시험・연구용 LMO에 대한 안전관리를 담당하고 있는 과학기술정보통신부에서는 생물안전관리(책임)자, 연구종사자들을 위한 맞춤형 프로그램을 신설・확대 운영하고 있고 안전문화 확산을 위하여 학회대상 안전문화 홍보활동 및 대국민 공모전, 워크숍 등 다양한 홍보활동을 실시하고 있다. 농림수산용 LMO안전관리를 담당하고 있는 농림축산식품부에서는 LMO 이해당사자 들을 대상으로 간담회, 세미나 및 법령설명회 등을 개최하는 등 LMO에 대국민 이해증진을 도모하였다. 식품의약품안전처는 ‘식품안전나라 사이트’ 및 페이스북 페이지를 통해 GMO의 이해, GMO 안전성, GMO 표시, GMO 자료실, GMO 소식 등의 메뉴를 바탕으로 GMO에 대한 정보를 제공하고 있다.
6. 향후전망
2017년 LMO법이 시행 된 지 10년이 되었으며 의정서 발효 14년이 되었다. 그동안 LMO법 총괄기관인 산업통상자원부를 비롯한 관계 중앙행정기관 및 바이오안전성정보센터에서는 국제협약과 국내법을 근거로 LMO 안전관리를 시행해 왔으며 제1・2차 LMO 안전관리 계획을 수립하여 시행함으로써 LMO로 인한 국민의 건강과 생물다양성 보전 및 지속적인 이용에 미치는 위해를 사전에 방지하고자 노력해왔다.
2017년 9월 현재 제3차 LMO 안전관리 계획 수립이 진행되고 있으며 GM벼 시험재배 반대운동, 미승인 GM유채 발견과 같은 바이오안전성 이슈에 효과적으로 대응할 수 있는 부처별 세부시행계획이 제3차 LMO 안전관리 계획 반영될 수 있도록 추진하고 있다. 관계중앙행정기관 및 KBCH에서는 워크숍 개최 및 협조체계를 바탕으로 효과적인 LMO 안전관리 계획이 수립 될 수 있도록 노력하고 있다. 또한 급변하는 현대 생명공학기술 발전이 법・제도에 반영되어 효과적인 관리가 이루어 질 수 있도록 LMO법 개정수요에 대한 조사와 수렴을 통해 LMO법 개정을 준비하고 있으며 이는 관계중앙행정기관과의 원활한 소통을 통해 협력이 이루어 질 수 있도록 노력할 예정이다.
2018년 제9차 의정서 당사국회의(이집트)의 개최 예정에 따라 우리나라 입장을 적극 개진, 반영하기 위해 바이오안전성 이슈별 전문가 확보, 관계 공무원 및 전문가의 정기적 정보 교류 및 역량 강화 프로그램이 추진될 예정이다. 또한 2017년 9월 현재, LMO 책임구제 추가 의정서의 국제적 발효를 위한 정족수에 3개국이 부족한 37개국이 비준서 및 가입서를 기탁한 가운데, 조속한 시일에 추가의정서의 발효가 예상됨에 따라 국내 입법 및 시행도 준비할 필요성이 있다.
국제협력 분야에서는 제7차 의정서 당사국회의에서 제안하여 채택된 ‘코리아 바이오안전성 역량강화 이니셔티브’를 통해 국제사회의 바이오안전성형성에 기여하고 있다. 향후 정기적으로 진행되어온 지역별 ‘바이오안전성정보센터 능력형성 워크숍’과 ‘LMO 안전관리 포럼’ 등 다양한 프로그램을 통해 바이오안전성 확보를 위한 노력을 지속적으로 추진할 예정이다.
LMO 연구개발 및 이용분야에서는 산・학・연・관・민 각 이해당사자 간의 원활한 커뮤니케이션의 중요성이 강조되고 있다. GM작물 시험재배 반대운동 이슈에서와 같이 이해당사자들의 첨예한 입장대립이 LMO 연구개발에 걸림돌로 작용하고 있으며 이를 해결하기 위한 커뮤니케이션이 필요한 상황이다. KBCH에서는 LMO포럼 세미나 등 이해당사자들이 직접 참여하여 서로 소통할 수 있는 참여의 장을 마련하고 있으며 이를 통해 합의가 이루어 질 수 있도록 적극 노력할 예정이다. 또한 비교적 안전관리 이슈 정도가 낮은 산업용 LMO의 연구개발과 이용 신청이 증가할 것으로 예상되고 있어 철저한 안전관리 체계를 마련하고 이를 시행할 것이다.
산업통상자원부를 비롯한 우리 정부는 LMO로 인한 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 대한 위해를 방지하기 위하여 LMO의 위해성심사, 수입승인, 운송・보관・유통, 연구개발 등과 관련한 안전관리에 최선을 다하고 있다. LMO 관계기관뿐만 아니라 LMO의 개발・생산・수입・수출・판매・운반 및 보관 등의 관련활동에 종사하고 있는 이해당사자, 그리고 시민단체를 포함한 우리나라 국민 모두가 LMO법의 시행에 적극 협조하여 바이오안전성의 확보 및 바이오산업의 건전한 발전의 토대가 형성될 수 있기를 기대한다.
![]() 제2절
생명윤리 동향
제2절
생명윤리 동향
가. 개요
생명공학 기술의 급속한 발전은 질병극복, 식량문제 해결 등 인류에 상당한 혜택이 될 것으로 예견되지만, 한편으로는 무분별한 기술 개발로 인해 인간존엄성을 훼손하거나 사회 혼란을 야기할 것이라는 우려도 존재한다. 국내에서는 2004년 1월 제정된 생명윤리 및 안전에 관한 법률(이하, 생명윤리법)을 중심으로, 다양한 법적, 제도적 노력들을 기울이고 있으나, 여전히 기술발전의 양면성에 대한 논쟁은 계속되고 있다. 여기에서는 2015년 하반기부터 2017년 상반기까지 대두되었던 생명윤리 논쟁들 중에서 특히 유전자조작 연구, 개인정보 활용, 인체유래물 연구를 둘러싼 국내외 논의 동향 및 정책 변화들을 살펴보려고 한다.
나. 해외 동향
(1) 유전자조작 연구 관련 해외 동향
유전자조작 기술이 농작물이나 식품에 적용되는 경우는 식품안전이나 주변 환경에 영향 차원에서 주로 우려가 제기되지만, 최근 유전자가위(gene editing) 기술처럼 인체에 적용가능한 유전자조작 기술이 발전하면서 새로운 이슈들이 제기되고 있다. 유전자가위는 ‘변형된 핵산분해효소를 사용하여 특정부위의 DNA를 제거・첨가・수정하는 기술을 의미’2)하는데, 이 기술이 치료의 목적을 넘어 기능개선(Human Enhancement)의 차원에서 활용되거나, 인간배아에 적용될 경우 다음 세대에까지 영향을 미칠 가능성이 있어, 윤리적 이슈들이 제기된다.
우선, 유전자조작 기술을 치료 목적이 아닌 기능개선을 위해 활용하는 경우를 살펴보면, 이미 해외에서는 여러 보고서에서 관련 윤리적 이슈가 제기된 바 있다. 너필드 생명윤리위원회(Nuffield Council on Bioethics)에서는 도덕적 규범, 인권, 복지, 사회적 정의 등 관점에서 유전자가위 기술의 의미를 분석하였고3), 퓨연구센터(Pew Research Center)에서는 유전자가위 기술을 통해 ‘humanity plus’(월등한 능력을 지닌 인간) 혹은 ‘post-humanity’(인지능력이 있는 기계)가 도래할 것이라는 우려를 언급하기도 하였다.4)
최근 시작된 제2 인간게놈프로젝트(HGP: Human Genome Project)에 대한 우려도 존재한다. 예를 들면, 미국은 1993년부터 2003년까지 HGP를 수행하여 30억 쌍의 인간 DNA 염기서열 지도를 완성한 이후, 2016년 5월에는 모든 인간 DNA를 인공적으로 합성하는 것을 목표로 하는 제2 HGP를 시작할 것이라고 발표하였다5). 이에 제2 HGP로 인해 월등한 인간을 창조하거나, 복제할 수 있을 것이라는 우려가 제기되었는데, 특히 관련 회의가 하버드 대학에서 비밀리에 개최된 것이 알려지면서 더욱 비판을 받기도 하였다.6)
다음으로 유전자조작기술이 다음 세대로 유전될 수 있는 경우에는 또다른 윤리적 논란이 제기된다. 특히 인간 배아에 대한 유전자조작은 맞춤아기(Designed baby)의 출현 가능성이나 예기치 않은 부작용 등 문제가 있어 허용하지 말아야 한다는 주장이 존재한다. 예를 들면, 2015년 3월 국제학술지 네이처(Nature)에 인간배아에 유전자가위기술을 적용하는 것을 반대하는 의료유전학자들의 입장이 실렸는데 이들은 인간배아의 유전자조작은 미래세대에 영향을 줄 수 있으며, 예기치 못한 문제를 야기할 수 있다고 언급하였다7).
한편 인간 배아의 유전자 조작에 대해 여전히 반대 의견이 많은 편이지만, 2015년 4월에 중국 연구진이 인간 배아 속 빈혈 유전자를 절단하여 정상 유전자로 변환시키는 데 성공한 이후, 영국에서도 2016년 2월 인간 배아에 유전자 가위 기술을 적용하는 연구계획을 승인하는 등 변화가 생기고 있는 상황이다8).
(2) 개인정보 활용 관련 해외 동향
질병치료를 위한 연구나 새로운 비즈니스 모델을 창출하기 위해 최근 개인 유전정보, 병원 진료기록 등이 점점 더 중요해짐에 따라 개인정보 유출에 따른 프라이버시 침해나 정보 오남용에 대한 우려들이 제기되고 있다. 이에 대해 미국은 주로 개인정보 관련 우려들에 대해 ‘건강보험 양도와 책임에 관한 법’(HIPPA: Health Insurance Portability and Accountability Act)과 2008년 ‘유전정보차별금지법’(GINA: Genetic Information Nondiscrimination Act)을 통해 대응해 왔다. HIPPA의 프라이버시 규칙(Privacy Rule)에서는 개인이 특정될 수 없도록 비식별화 조치를 한 의료정보의 경우에 이용을 허용하고 있으며9), GINA에서는 유전정보로 인해 개인이 고용이나 보험가입 시 차별을 받지 않도록 하였다.10)
최근 미국에서는 2016년 12월에 통과된 21세기 치료법(21st Century Cures Act)에 프라이버시 보호 규정이 포함되면서, 개인정보 활용에 관한 규제를 재정비할 것으로 보인다. 21세기 치료법은 HIPPA의 규정들을 큰 틀에서는 바꾸지 않을 것으로 예상되지만, 정밀의료 발전 측면에서 프라이버시 보호와 데이터 보안을 위해 NIH, FDA, DHHS 등 관련 기관들이 적절한 정책을 마련해야 한다는 내용과 함께, 21세기 치료법 제정 이후 1년 안에 데이터 접근 정책 및 절차를 수립할 것을 명시하고 있다.11)
일본에서는 2015년 9월 ‘개인정보보호법’을 개정하여 개인정보 정의를 명확히 하고, ‘익명가공정보’라는 개념을 신설하여 빅데이터 시대에 대응하고자 하였다.12) 익명가공정보란 특정인을 식별할 수 없고 해당 정보를 복원할 수 없도록 가공한 정보로서, 제3자에게 제공할 때 정보주체의 동의를 받지 않아도 되기 때문에 개인정보활용을 활성화할 수 있다. 또한 법 개정을 통해 ‘개인정보보호 위원회’를 신설하여 개인정보의 남용을 방지하도록 하였다.
(3) 인체유래물 연구 관련 해외 동향
바이오 분야 연구를 수행하는 데 있어서 우수한 생명연구자원 확보는 매우 중요한데, 이 중에서 혈액이나 조직, 세포 등 인체유래물을 연구에 활용하는 경우에는 윤리적인 이슈들이 제기된다. 예를 들면, 인체를 실험도구화 하여 인간의 존엄성을 훼손시킬 수 있다는 우려나 상업적인 거래의 대상이 되어 경제적으로 취약한 계층이 인체유래물의 제공자로 전락할 수 있다는 주장도 존재한다. 또한 유도만능줄기세포(iPS cell)의 등장으로 인간배아가 아니더라도 일반 세포에서 전혀 다른 기능의 세포・조직으로 분화가 가능하다는 것이 증명된 이후, 종국에는 일반세포로부터 인간 개체의 복제까지 가능해질지도 모른다는 우려도 제기된다.13) 이에 인체유래물이 단순한 물건이 아닌 인간의 신체에 준하는 법적 지위를 지녀야 하는가도 논란이 되고 있다.
인체유래물의 법적 지위에 관한 논쟁 이외에도, 연구를 위해 인체유래물을 수집, 저장하는 인체유래물 구축사업의 증가에 따라 인체유래물 은행에서 발생하는 윤리적 이슈들을 어떻게 다루어야 하는지에 대한 논의도 등장하고 있다. 이미 영국에서는 50만 명이 참가한 UK 바이오뱅크(UK Biobank) 사업에서 윤리적 이슈들을 전담하는 ‘UK 바이오뱅크 윤리 및 거버넌스 위원회’(ESC: UK Biobank Ethics and Governance Council)가 설치되어, 참여자들의 모집 방식, 참여자의 정보와 자원을 획득하고 동의를 구하는 방식 등에 대해 윤리적 지침을 마련하거나 구축된 인체 유래물을 활용하려는 연구계획서에 대해 윤리적 자문을 제공하는 등의 역할을 수행하고 있다.14)
다. 국내 현황
(1) 유전자조작 연구 관련 국내 동향
국내에서 유전자조작 연구에 대한 윤리적 논쟁은 최근 주로 유전자치료 연구에 대한 법적 규제를 중심으로 대두되고 있는 상황이다. 우리나라에서는 생명윤리법에 유전자치료 연구의 허용범위가 제한되어 있는데, 규제 완화에 대한 요구가 높아 2014년과 2016년 두 차례에 걸쳐 대통령 직속 자문기구인 국가과학기술자문회의에서 개선방향이 발표되었다. 2014년 발표이후, 생명윤리법 47조는 2015년 12월에 개정되었으나, 개정된 규정에 대해 재개정 요구가 또다시 제기된 것이다.15) 2015년 개정안에서는 유전자치료를 재정의하여, 연구 허용범위를 일부 확대한 측면은 있었으나, 최근 유전자치료 연구가 점점 더 중요해지는 현실을 따라가지 못하고 여전히 연구를 과도하게 제한하고 있다는 비판이 존재한다.
뿐만 아니라, 생명윤리법에서는 “유전자치료는 배아, 난자, 정자 및 태아에 대하여 시행하여서는 아니 된다”(생명윤리법 47조 ②항)로 규정하고 있는데, 서울대학교 김진수 교수와 미국 연구진이 유전자가위 기술을 인간 배아에 적용한 연구가 국제 학술지 네이처(Nature)에 게재된 이후, 유전자치료에 대한 규제 완화 요구가 더욱 확대되고 있다.16) 하지만, 여전히 인간 배아를 연구에 활용하는 것에 대한 윤리적 측면의 우려도 여전히 남아있다.17)
(2) 개인정보활용 관련 국내 동향
우리나라의 경우 프라이버시 침해나 개인정보의 오남용 문제를 방지하기 위해 개인정보보호법과 생명윤리법이 존재하는데, 최근 유전정보를 포함한 개인정보가 바이오의료 연구에 큰 의미를 지니게 되면서 기존 법을 개정하거나 보완하려는 여러 시도들이 있었다. 예를 들면, 국가과학기술자문회의에서는 2015년 4월 현행 개인정보보호법에 명시된 ‘민감정보’에 건강 정보가 포함됨에 따라 산업적 활용이 제한될 수 있음을 제기하고, 민감정보에 포함되는 ‘건강’ 정보에 대한 명확한 기준과 함께, 개인정보 비식별화 가이드라인 강화가 필요하다는 내용을 제기하였다18). 이후 2015년 6월 관계부처 합동으로 ‘개인정보 비식별 조치 가이드라인’이 마련되었고, 이 가이드라인에 따라 비식별 조치를 취한 정보는 개인정보 관련 규제를 적용받지 않을 수 있게 되었다.19) 하지만, 이 가이드라인에 대해 한편에서는 법적 효력이 없고, 비식별화 조치에도 재식별 가능성이 있다는 비판이 제기되기도 하였다.20)
(3) 인체유래물 연구 관련 국내 동향
국내 판례에서는 줄기세포를 의료시술이 아닌 의약품으로 취급하고 있으며, 약사법과 ‘생물학적 제제 등의 제조・판매 규칙’에서도 의약품으로 규정하고 있어, 인체유래물에 대해 ‘물건’으로서의 법적 지위가 부여된 것으로 보인다.21) 반면, 생명윤리법에서는 인체유래물을 무상 혹은 실비 수준으로 제공해야 한다고 규정하고 있어(생명윤리법 38조 ③항), 인체유래물에 대해 물건이 아닌 인격성을 부여하고 있는 것으로 해석된다.22) 이처럼 국내에서는 인체유래물에 대한 법적 지위가 혼재되어 있는 듯하다.
인체유래물에 대한 법적 지위 논란과 별도로 인체유래물의 제공 조건에 대한 생명윤리법의 규정은 또 다른 이슈를 제기해 왔다. 글로벌 차원에서 인체유래물 제공 서비스가 하나의 산업으로 성장함에 따라 공공성의 관점이 아닌 산업적 가치를 고려해야 할 필요성이 증가했기 때문이다. 이에 2016년 4월 국가과학기술자문회의에서 상업적 연구 목적의 인체자원 분양을 허용할 것을 요구하여, 국립중앙인체자원은행의 분양지침이 개정되었다.23) 또한 일부에서는 인체유래물 제공을 무상이나 실비변상 수준이 아닌 우수 품질의 자원에 대해 고가의 가격을 부과할 수 있어야 한다는 주장도 제기해왔다24). 이를 통해 고품질 인체자원 관리를 위한 유인이 생겨 산업적 경쟁력을 높일 수 있다는 입장이다.
라. 향후 전망
유전자가위 기술 등 유전자조작 연구와 유전정보를 활용한 다양한 서비스들은 앞으로도 지속적으로 확대될 것으로 보인다. 이에 따라 연구를 위한 인체유래물의 활용도 증대할 것으로 보인다. 하지만 연구 자율성, 질병극복, 신산업 창출 등 관점에서 관련 연구들이 보다 활성화되어야 한다는 주장만큼 이들 연구로 인해 인간성의 본질이 변화되고 프라이버시 침해 등 혼란이 생길 것이라는 비판도 여전히 제기되는 상황이다. 그 결과 관련 법제도들을 수립, 개정하는 등의 시도들이 순조롭게 이루어지지 못하는 경우들이 발생하기도 한다.
생명존중, 인권보호 등은 누구나 지향하는 절대적 가치이지만, 특정 연구활동과 관련된 윤리 논쟁은 쉽게 결론을 내기 어렵고 설사 결론이 나더라도 경제사회적 변화에 따라 변화될 수 있는 특징을 지닌다. 가장 우려가 많았던 인간배아를 대상으로 하는 연구도 최근 연구성과들이 등장하면서 연구를 허용해야 한다는 목소리가 커지고 있는 것처럼, 기술발전에 대한 인식은 끊임없이 변화할 것으로 보인다.
마지막으로, 과학기술의 사회적 수용성이 점점 더 중요해지고 있는 만큼 바이오 기술이 시대 흐름에 맞게 사회적으로 수용 가능한 방향으로 개발될 수 있도록 생명윤리 이슈에 대한 논의는 보다 활발해져야 할 것으로 보인다. 생명윤리 이슈에 대한 논의를 통해 연구자율성을 최대한 보장하면서도 우려가 되는 부분들을 최소화할 수 있는 다양한 대안들이 모색될 수 있길 기대한다.
![]() 제3절
생명공학 지적재산권 제도 동향
제3절
생명공학 지적재산권 제도 동향
1. 개요
최근 4차 산업혁명 시대가 본격화됨에 따라 지식기반의 인공지능(AI), 빅데이터, 사물인터넷(IoT) 및 지능형 네트워크 기술과 같은 정보통신 기술이 생명공학 기술과 융합하여 혁신적인 변화를 유도할 수 있다는 것이 다양한 전문가 그룹들 사이의 일반적인 견해로 정착되고 있다. 이러한 변화는 지금까지 우리가 접해보지 못했던 새로운 장르의 생명공학 기술을 발생시킬 뿐만 아니라, 이러한 새로운 기술은 기존의 생명공학 특허출원 형식을 크게 변화시킬 것으로 예상된다. 예를 들면, 지속적으로 출원 건수가 증가되고 있는 순수 생명공학 기술과 융합된 빅데이터 기술을 기반으로 하는 바이오 인포메틱스 출원이 그 대표적인 경우라 하겠다. 또한, 빠른 시일 내에 우리가 예상하지 못한 인공지능에 의한 특허출원도 가능할 것으로 전망되어, 이에 대한 사전 준비단계의 하나로 특허 심사기준의 체계적인 정비가 불가피할 것이다.
세계적으로 생명공학 발명의 특허출원은 날로 증가하고 있으며, 생명공학 기술수준이 상대적으로 높은 국내출원 현황을 보더라도 특허출원 건수는 다른 분야에 비해 증가율이 높고, 가치 있는 권리획득과 관계된 출원 명세서의 질적 수준도 기존에 비해 비약적으로 발전하고 있는 추세이다.
생명공학 분야 특허는 급속한 기술 발전에 대응하기 위해 심사 실무나 청구범위의 해석, 침해 여부의 판단에 이르기까지 모든 단계에서 발전되는 기술변화에 신속하게 부응하는 심사기준의 정비가 요구되고 있다. 이런 특수성을 갖는 생명공학 기술을 파악하고, 효율적으로 심사를 진행하기 위해 특허청 심사관의 전문성 함양 및 체계적으로 정비된 심사기준의 정립이 무엇보다도 중요하다고 할 것이다. 또한 생명공학 분야의 특허는 살아 있는 생물체를 발명의 대상으로 하고 있다는 특성 때문에 다른 기술 분야와는 별도의 독특한 지식재산권 제도를 운영하고 있다. 인간의 유전자나 생물체 자체, 그로부터 분리된 물질과 진단・수술・치료 등 의료 관련 방법에 대해 특허 대상 여부를 놓고 국가별로 상당한 논란이 계속되고 있다. 현재 생명공학 분야의 특허 대상 여부 및 발명의 성립성에 대해서는 국가별로 독자적인 기준을 마련하여 판단하고 있는 실정이다. 또한 급속한 생명공학의 발전이 가져온 배아복제나 배아줄기세포 관련 발명 등은 인류의 의료기술에 획기적인 기여를 할 것으로 예상되는 반면, 일각에서는 인간 복제의 가능성 등에 따른 사회윤리적인 문제를 제기하고 있다.
인간 유전체 연구(Human Genome Project)의 완성 이후, 지난 10여 년간 국가 간에 유전체 관련 핵심기술을 선점하기 위한 경쟁이 치열하게 전개되어 왔다. 질병의 조기진단과 개인별 맞춤형 의료 및 바이오 의약품 개발을 위한 기반 기술인 유전정보 분석기술, 약물 유전체학 및 줄기세포 연구 등이 포스트 게놈 시대의 신산업 성장 동력으로 자리 잡고 있음에 따라, 원천・핵심기술의 확보와 이를 위한 국가 차원의 장기적이고 안정적인 투자가 생명공학 분야의 산업 경쟁력 확보에 있어 필수적 요소라 할 것이다.
생명공학 분야는 기술의 특성상 고비용・장기간의 연구 개발을 통해 특허가 창출되므로 효과적으로 연구개발 결과물을 보호하고 장려할 필요가 있으며, 생명공학 기술이 사회 전반에 직・간접적으로 크게 영향을 미치게 될 4차 산업혁명 시대가 도래함에 따라 국제 경쟁력 확보를 위해서는 기술의 파급력과 영향력이 높은 생명공학 분야의 원천특허의 창출이 절실히 요구된다. 과제의 발굴 단계에서부터 유망 R&D 과제를 선정함으로써, 4차 산업혁명 시대에 대비한 강한 원천특허 창출이 가능하도록 정부의 장기적 로드맵 작성과 효율적인 R&D 투자가 필요하며, 개발된 모든 연구 성과물들에 대해서는 필수적으로 지식재산권 또는 영업비밀로 보호・활용하는 등의 산업 육성 전략을 통해 국내 생명공학 산업을 성장・발전시킬 수 있도록 체계적인 특허정책 추진이 지속될 필요가 있다.
2. 생명공학 분야 특허출원 및 등록 현황
가. 특허출원 현황
생명공학 분야는 그 응용기술에 따라 크게 4개 분야로 구분되는데, 이는 유전체, 단백질, 생물자원 관련 기술인 ‘기초 분야’, 측정・진단 등의 ‘생물공정 분야’, ‘의약 분야’ 및 바이오 농약, 신규 동・식물 개발 기술인 ‘농업 분야’를 들 수 있다. 생명공학 분야의 특허출원은 2012년에 6,506건, 2016년에 8,074건이 출원되었는데. 이는 전체 특허출원이 증가되지 않는 것과 대비하면 그 시사하는 바가 크다고 할 것이다.
[표 4-6] 연도별 생명공학 분야 특허출원 현황
(단위 : 건)
|
구 분 |
2012 |
2013 |
2014 |
2015 |
2016 |
2017.8.* |
연평균 증가율 |
|
|
특허출원 건수 |
전체 특허 |
188,915 |
204,589 |
210,292 |
213,694 |
208,830 |
124,870 |
2.5% |
|
생명 공학 |
6,506 |
7,081 |
7,429 |
7,616 |
8,074 |
4,779 |
5.5% |
|
|
비중 (%) |
3.4% |
3.5% |
3.5% |
3.6% |
3.9% |
3.8% |
3.6% (평균) |
|
* 2017년은 연평균 증가율 및 평균에서 제외하였음
나. 특허등록 현황
특허청은 IP5 회원국의 위상에 걸맞게 전문성을 갖춘 심사인력을 꾸준히 확보하고 있으며 심사시스템의 효율화를 통해 심사처리기간을 큰 폭으로 단축시킨 결과, 심사착수 시간을 심사청구 후 평균 10개월로 유지하고 있다.
[표 4-7] 연도별 생명공학 분야 특허등록 현황
(단위 : 건)
|
분류* |
2012 |
2013 |
2014 |
2015 |
2016 |
2017.8.* |
연평균 증가율 |
|
A01H(식물 신품종) |
74 |
155 |
149 |
65 |
67 |
17 |
Δ2.5% |
|
A01K(신규 동물) |
30 |
32 |
46 |
30 |
35 |
51 |
3.9% |
|
A01N(바이오 농약) |
36 |
34 |
34 |
22 |
23 |
19 |
Δ10.6% |
|
A61K(바이오 의약품) |
1,112 |
1,203 |
1,342 |
1,130 |
1,229 |
1,162 |
2.5% |
|
C02F(미생물 폐수처리) |
235 |
272 |
146 |
97 |
94 |
74 |
Δ20.5% |
|
C07H(당류) |
15 |
22 |
17 |
15 |
18 |
9 |
4.7% |
|
C07K(단백질) |
361 |
413 |
438 |
466 |
546 |
332 |
10.9% |
|
C12C∼M (발효 및 장치) |
279 |
301 |
389 |
165 |
207 |
225 |
Δ7.2% |
|
C12N(미생물, 효소 및 유전공학) |
930 |
1,131 |
1,202 |
1,097 |
1,047 |
799 |
3.0% |
|
C12P(발효 생성물) |
118 |
128 |
143 |
121 |
70 |
104 |
Δ12.2% |
|
C12Q, S (시험 및 분리정제) |
290 |
286 |
379 |
421 |
412 |
546 |
9.2% |
|
G01N(진단 시약) |
228 |
306 |
245 |
145 |
158 |
146 |
Δ8.8% |
|
계 |
3,708 |
4,283 |
4,530 |
3,774 |
3,906 |
3,484 |
1.3% |
* 각 CPC 중 BT에 해당되는 기술분야(서브그룹)의 특허만 계수함. (연평균 증가율 및 평균에서 2017년 자료는 제외함)
생명공학 분야의 2016년 특허등록 현황은 기술 분류별로 선진특허분류(CPC)25) A61K(바이오 의약품 관련 발명)와 C12N(미생물・효소・유전공학 관련 발명)이 각각 1,229건(전체 비중 31.5%)과 1,047건(전체 비중 26.8%)으로 전체 생명공학 분야 특허등록 건의 약 58.3%로 높은 비중을 차지하고 있다. 또한 생명공학 분야의 핵심기술의 하나인 단백질 관련 발명은 연평균 10.9% 등록 증가율을 보이며 꾸준한 증가세를 보이고 있고, 당류, 시험 및 분리・정제 관련 발명 또한 증가세를 보이고 있다. 반면 바이오 농약, 미생물 이용 폐수처리, 발효 및 진단 시약 관련 발명은 연평균 등록률이 감소하고 있어 대조를 보인다.
생명공학 분야 특허출원의 연평균 증가율은 5.5%로 전체 특허출원의 연평균 증가율 2.5%와 비교하여 2배 이상의 차이를 보이고 있다. 이러한 증가율 상승에 중요한 축을 차지하고 있는 줄기세포를 포함하는 세포치료제 및 항체치료제 시장은 대량생산 공정 발전 및 항암 적용분야 확대와 더불어 의료산업 전반을 이끌 차세대 유망 분야로, 현시점의 우리나라 R&D 역량으로 앞서가는 선진기술을 따라잡기 위해서는 선택과 집중 전략을 통한 R&D 과제 발굴과 실질적으로 강한 원천특허 창출에 힘을 기울일 필요가 있다.
3. 생명공학 분야 관련 주요 특허제도
특허청은 급속히 발전하고 있는 생명공학 분야의 새로운 기술을 보호하는 한편 국제화 추세에 발맞추어 특허미생물 기탁제도, 핵산염기 및 아미노산 서열목록 제출제도, 특허권 존속기간 연장등록출원 제도, 의약품허가-특허연계 제도 등 생명공학 특허출원 관련 제도와 인프라를 확충함으로써 첨단 분야인 생명공학관련 특허품질 향상에 심혈을 기울이고 있다.
가. 특허미생물 기탁제도

[그림 4-5] 미생물 기탁 및 출원 절차 개요
특허미생물 기탁제도는 유전자, 세균 등 미생물 발명에 관한 특허출원에 있어서, 해당 미생물을 공인된 기탁기관에 기탁하게 하는 제도로서 미생물은 그 구성 및 성질을 특허 명세서에 표현하기 어려운 점을 고려하여 실제 미생물을 공인된 기탁기관에 기탁하게 하고, 기탁된 미생물을 제3자가 분양받아 해당 발명을 재현할 수 있게 하는 제도를 말한다.
현재, 국내에는 한국생명공학연구원 생물자원센터(KCTC), 한국미생물보존센터(KCCM), 한국세포주연구재단(KCLRF), 농촌진흥청 국립농업과학원(KACC)의 4개 특허미생물 기탁기관이 지정되어 있고, 현재 총 11,781건(2017년 6월 기준)이 기탁되어 있다.
나. 핵산염기 및 아미노산 서열목록 제출제도
핵산염기 및 아미노산 서열목록 제출제도는 핵산염기 및 아미노산 서열을 포함한 특허(실용신안) 출원의 증가에 대처하여 심사처리를 신속히 하고, 서열 데이터의 공개를 원활히 하기 위하여, 특허출원시 서열목록과 함께 이의 컴퓨터 판독이 가능한 형태의 전자파일을 제출하도록 하는 제도를 말한다.
서열목록은 WIPO 표준 ST.25를 채택한 특허청 고시 제2016-5호의 ‘핵산염기 서열목록 또는 아미노산 서열목록 작성기준’에 따라 특허청에서 무료로 배포하는 프로그램(KoPatentIn)으로 작성할 수 있다. ‘핵산염기 서열목록 또는 아미노산 서열목록 작성기준’은 WIPO 표준 ST.25를 채택하였으므로 이에 의하여 작성된 서열목록은 국내 특허출원뿐 아니라 국제 특허출원시의 국제조사 및 예비심사기관, 그리고 지정국 및 선택국에서 각각 요구하는 서열목록 작성 요건을 충족시킬 수 있다. 또한 특허청은 신속하고 효율적인 서열검색이 가능하도록 GenBank, EMBL-Bank, DDBJ와 같은 세계 3대 서열목록 관리기관과 유기적인 협조관계를 구축하고 있다.

[그림 4-5] 세계 3대 서열목록 관리기관과 각국 특허청 협조 체계도
다. 특허권 존속기간 연장등록출원 제도
특허권 존속기간 연장등록출원 제도는 의약품이나 농약의 경우 통상의 공산품과는 달리 발명을 실시하기 위하여 약사법이나 농약 관리법 등 관계법령에 의거 허가 또는 등록을 받아야 하며, 이에 필요한 임상시험에 일정시간이 소요되므로 다른 공산품과의 형평을 맞추기 위해서 발명을 실시할 수 없었던 기간을 5년의 기간 내에서 보상해 주는 제도를 말한다.
연장등록 출원시에는 의약품 등의 허가 관청인 식품의약품안전처 등에 제출하였던 임상시험 계획서 및 시험 결과 보고서 등의 자료를 제출함으로써 특허권 설정 후에도 허가기관에서 요구하는 임상시험 등에 시일이 소요되어서 특허권을 실시하지 못했음을 입증하면 심사관이 그 내용을 심사하여 연장등록 여부 및 적정 연장기간을 결정하게 된다.

[그림 4-6] 특허권 존속기간 연장등록출원 제도
라. 의약품허가-특허연계 제도
의약품허가-특허연계제도는 신약의 안전성・유효성 자료에 의존한 의약품의 품목허가절차에서 신약에 관한 특허권 침해 여부를 고려하는 단계를 둠으로써, 신약의 안전성・유효성 자료 이용을 확대하면서도 그에 관한 특허권을 보다 적극적으로 보호하려는 취지로 마련되었으며, 우리나라는 미국과의 자유무역협정(FTA)을 계기로 동 제도를 도입하게 되었다.
한-미 FTA가 발효(2012년 3월 15일)됨에 따라 의약품허가-특허연계제도를 규정한 개정 약사법(법률 제11118호)이 시행되었다. 동 개정법은 제31조의3(의약품 특허목록) 및 제31조의4(품목허가 신청 사실 통지)를 신설하는 것을 주요 내용으로 한다. 제31조의3은 의약품의 품목허가를 받은 자가 품목허가를 받은 의약품에 관한 특허권의 특허권자, 존속기간 등의 정보를 의약품 특허목록에 등재 받으려면 식품의약품안전처장에게 신청하여야 하고, 식품의약품안전처장은 특허권이 일정한 대상 및 기준을 충족하면 의약품 특허목록에 등재하고 그 내용을 공고하도록 하였으며, 제31조의4는 특허목록에 등재된 의약품의 안전성・유효성에 관한 자료를 근거로 의약품의 품목허가를 신청한 자는 그 사실을 의약품 특허목록에 등재된 의약품의 품목허가를 받은 자 및 특허권자에게 통지하도록 하였다.
실무적으로 제도 도입 전과 후를 살펴보면, 제도 도입 전에는 복제약의 허가단계에서 신약 특허에 대한 특허침해 여부를 확인하지 않은 채, 안전성・유효성이 인정되면 허가되었으나, 제도 도입 후에는 복제약의 허가단계에서 복제약 신청자가 오리지널 약의 특허권자에게 허가신청 사실을 통지하도록 하고, 오리지널 약 특허권자가 특허침해로 심판 또는 소송을 제기할 경우, 일정 기간 내에 심결 또는 판결이 있으면, 그 기간 동안 복제약에 대한 허가가 보류된다.

[그림 4-7] 의약품허가-특허 연계 제도
4. 생명공학 특허 분쟁 사례
가. 산업상 이용가능성이 없다고 판단한 사례
- 의료행위를 포함하는 방법발명 (특허법원 2012. 1. 13. 선고 2011허6772 판결)
본 발명은 대량생산이 가능한 콜라겐 등 뼈 기질 혼합물을 환자의 골수 유래 유핵세포와 혼합하여 골 재생이 필요한 환자에게 사용할 수 있도록 하는 것으로, 골 충전재와 골 재생용 세포를 동시에 포함하는 주사 가능한 조성물 및 그 방법에 관한 것이며, 본 발명은 그 특허청구범위에 ‘동물(일반적으로 특허심사기준에서는 동물의 범위에 사람도 포함되는 것으로 판단)의 조직으로부터 골수를 채취하는 단계’, 즉 인체를 필수 구성요건으로 하는 사람을 수술하는 방법을 그 구성요소로 포함하고 있으므로, 의료행위에 관한 발명에 해당하여 산업상 이용가능성이 없다고 판단되어 특허를 받을 수 없다.
나. 진보성 없다고 판단한 사례 1
- 중간엽 줄기세포를 포함한 루게릭병(ALS) 치료용 약제학적 조성물 (특허법원 2011. 11. 3. 선고 2011허3124 판결)
선행발명에 골수 유래 자가 중간엽 줄기세포가 ALS 환자의 척수에 직접 이식된 후의 치료효과와 안전성을 알아보기 위한 실험 결과 및 골수에서 유래된 미분화된 중간엽 줄기세포를 ALS 환자 7명에게 이식한 결과에 대한 내용이 실시되어 있고, 그 실시 결과로 환자 모두 심각한 부작용을 나타내지 않았으며, 4명의 환자에서는 유익한 결과를 얻었다고 기재되어 있으므로, 상기 결과가 ALS 치료 효능을 가진다는 명확한 증거가 될 수는 없다고 하더라도, 통상의 기술자라면 위와 같은 기재로부터 미분화된 중간엽 줄기세포가 투여용량 및 환자 상태에 따라서는 ALS 치료 효과를 나타낼 수 있음을 충분히 예측할 수는 있으므로, 본 발명의 결과는 선행발명으로부터 충분히 예측할 수 있는 정도의 작용효과를 확인한 것이고, 나아가 선행발명과 마찬가지로 미분화된 중간엽 줄기세포가 ALS 치료에 효능을 갖는다는 명확한 약리학적 증거가 된다고 보기는 어려우므로, 본 발명이 선행발명에 비해 현저히 우수한 작용효과가 있다고 판단되지 않아, 진보성이 부정된다.
다. 진보성 없다고 판단한 사례 2
- 자가면역 장애 치료에 이용되는 모노클로날 항체 (특허법원 2016. 2. 4. 선고 2014허7608 판결)
본 발명의 항체는 아미노산 서열에서 선행발명의 항체 서열과 ‘약간 상이한’ 서열을 갖는 것으로 기재되어 있으나, 표적 CD6에 대해 동일하게 완전한 기능적 활성을 지니는 것이고, 그러한 약간 상이한 서열에 의해 어떠한 활성 차이가 있는지에 대해서는 명세서로부터 전혀 알 수 없다. 더욱이 항체를 구성하는 아미노산은 공지의 돌연변이 방법에 의해 변형할 수 있는 것이고, T1h 모노클로날 항체는 아미노산 서열을 부분적으로 변형한 항체까지도 아우르는 것으로, 약 65% 내지 99%의 아미노산 서열 상동성을 갖는 항체들까지도 포함하는 것임을 알 수 있다. 따라서 본 발명의 항체는 선행발명의 항체 중 일부 아미노산이 치환 또는 결실된 것으로 선행발명의 항체와 동일한 기능을 하는 것이어서, 통상의 기술자라면 선행발명으로부터 쉽게 발명할 수 있어 그 진보성이 부정된다.
![]() 제4절
바이오의약품의 허가 현황과 과제
제4절
바이오의약품의 허가 현황과 과제
가. 서론
바이오는 바로 지금 현재이며, 가까운 미래이면서 먼 미래에 딱 맞는 단어라고 생각한다. 모든 것이 바이오로 시작해서 바이오로 끝난다고 해도 과언이 아니다. 특히 의약품의 경우는 더욱 그러하다. 우리를 비롯한 모든 나라가 바이오의약품으로 희귀・난치질환을 정복할 수 있을 것이며, 화학합성의약품의 한계를 극복하고 새로운 제약시장을 선점하여 미래를 책임져 줄 신산업으로 육성하고자 국가적 지원정책을 추진하고 있다. 더욱이 바이오의약품시장은 많은 부분에서 명확한 선점 국가가 없는 상황이어서 우리에게는 더없이 희망적인 분야라고 할 수 있다. 또한 우리나라의 바이오의약품 생산능력은 세계 최고 수준(2017년 현재, 총 35만L)이며, 기술수준의 경우 추격국가에
[표 4-8] 주요 국가별 바이오 기술수준 비교
|
분야 |
한국 |
중국 |
일본 |
EU |
미국 |
||||||||||
|
기술 수준br>그룹 |
기술수준 (%) |
기술격차 (년) |
기술 수준 그룹 |
기술수준 (%) |
기술격차 (년) |
기술 수준 그룹 |
기술수준 (%) |
기술격차 (년) |
기술 수준 그룹 |
기술수준 (%) |
기술격차 (년) |
기술 수준 그룹 |
기술수준 (%) |
기술격차 (년) |
|
|
바이오 |
추격 |
77.4 |
4.3 |
추격 |
69.4 |
5.8 |
선도 |
92.5 |
1.7 |
선도 |
94.5 |
1.2 |
최고 |
100 |
0 |
* 국가별 바이오 기술수준 * 최고기술 보유국 대비 기술격차 : 줄기세포기술 2.5년
출처: 2016년 기술수준평가(KISTEP, ‘17.7)
해당하여, 타 분야에 비해 태동기 바이오 분야는 기술 선도그룹에 위치하고 있는 점이 우리를 흥분하게 한다. 그러나 그 흥분을 잠시 가라앉히고 냉정히 우리의 현재와 미래를 설계하고 준비해야 한다.
우리가 국제적인 경쟁력에서 우위를 점하기 위해서는 여러 가지 정책이 필요하겠지만 특별히 ①규제 선진화, ②규제 서비스 확대, ③규제 인프라 강화가 선행되어야 한다. 그간 규제개선과 선제적 기준 마련 등으로 경쟁력 토대는 마련했으나, 글로벌시장 선점을 위해서는 규제의 선진화가 필요하다. 우리나라에서 허가를 받은 의약품은 미국 유럽을 비롯한 세계 어느 나라에서나 추가적인 자료 없이도 신속히 허가를 받을 수 있도록 규제수준을 글로벌화 하여야 하며, 바이오시밀러와 같은 특정 분야에서는 국제규제를 선도해 다른 나라에서 우리나라의 규제수준에 맞추도록 함으로써 우리 기업의 해외진출을 적극 지원하여야 한다. 또한 바이오의약품의 규제, 특히 첨단바이오의약품의 규제는 매우 복잡하고 최신 과학기술을 포함하고 있어 고도의 전문성을 요하는 분야이다. 따라서 연구개발 단계부터 허가 생산 수출까지 전주기적인 규제관련 서비스가 체계적으로 이루어져야 한다. 이와 같이 규제를 선진화하고 서비스를 확대하기 위해서는 인프라 확대가 필요하다. 우선 허가심사 역량을 강화하여 허가심사의 국제적 신뢰도를 제고하여야 하며, 미래에 개발될 제품을 포함하는 첨단바이오의약품을 규제할 수 있는 가칭 첨단바이오의약품법 제정 등 미래를 대비하는 선제적 규제체계를 갖추어야 한다.
나. 본론
(1) 규제 선진화
줄기세포, 유전자교정・치료, 3D바이오프린팅 제품 등의 글로벌 허가 획득을 위해서 첨단융복합기술제품에 대비한 과학적 규제기반 구축이 필요하다. 우리나라의 R&D는 증가하고 있으나 기초・원천기술에 집중되어 상용화가 미흡하다. 따라서 차세대・융・복합기술 기반 혁신제품에 대한 규제과학 연구 강화를 위하여 혁신 바이오신약 개발 지원을 위한 전략적 연구계획 수립이 시급하다. 바이오신약, 정밀의료, 감염병백신 등 각 분야별 중장기적 과제로 분류하여 평가기술 및 가이드라인 개발 연구를 확대해야 한다. 우선 바이오신약 분야에서는 바이오시밀러 등 항체의약품 평가기술 고도화 연구, 유전자치료제, 줄기세포치료제, 조직공학제제의 품질관리 표준화 및 평가기반 연구, 3D 바이오프린팅기술을 이용한 바이오장기 평가 기반 연구, 빅데이터를 활용한 바이오의약품 평가 모델 개발 연구 등 혁신적 바이오신약 평가 기반 구축 연구가 시급하다. 또한 정밀의료 분야에서는 바이오이미징기술 관련 표준화 및 유효성평가 연구, 약물유전체관련 윤리적・법적문제, 생체지표 검증 등 연구, 약물유전정보관련 윤리적・법적 제도 및 시스템 개발 연구 등, 개인맞춤형 의약품 개발에 대비한 평가기반 구축이 빠른 시일 내에 이루어져야 한다. 마지막으로 감염병 백신 분야에서는 BCG, DTaP, IPV, 자궁경부암 등 자급화 백신의 품질・임상・비임상 평가기술 개발 연구, 첨단기술을 활용한 백신에 대한 가이드라인 개발 및 제도개선 연구 등, 선진국 수준의 백신 평가체계를 구축하여 백신자급화 시기를 앞당겨야 한다.
이와 같은 평가기술의 수준향상과 새로운 기술개발을 바탕으로 규제관리를 선진화하여 미래에 대한 예측가능성과 투명성을 제고함으로써 연구자와 기업가에게 바이오의약품의 개발동기를 부여하여야 한다. 바이오의약품 품목별 GMP 평가제도(2008), PIC/s 가입(2014), 위해성관리제도(2015), 위해도 중심의 국가출하승인 제도(2016) 도입, ICH 가입(2016) 등 선진관리체계를 도입・운영 중에 있으나 지속적인 규제 선진화를 통한 Global Standard 규제가 필요하다. 세포치료제 및 유전자치료제 등 바이오의약품의 안전성・유효성평가 가이드라인을 제・개정하는 등 국제조화된 합리적・과학적 허가심사 기준을 제시하고 있으며, 바이오의약품 예비심사제도 도입, 유전자치료제 특성을 반영하여 정의 개선, 생명을 위협하거나 중증의 비가역적 질환에 사용하는 세포치료제를 치료적 탐색임상시험자료를 근거로 허가하는 조건부허가 확대, 환자수가 극히 적어 임상시험이 어려운 희귀의약품의 경우 임상시험 대상자 수의 합리적 조정, 신속심사 대상 확대와 처리절차 구체화, 개량생물의약품 명확화, 위해성관리계획 도입, 줄기세포치료제 장기추적조사 의무화 등 규제를 합리화하거나 국제적 수준으로 선진화하고 있다. 규제선진화에는 규제개선, 규제합리화, 규제선도 등이 모두 포함된다. 얼마 전까지는 선진국의 규제를 따라가기 급급했으나 이제는 특정분야서는 국제규제를 선도하고 있으며, 앞으로 그 분야가 확대되도록 노력하여야 한다. 그 대표적인 예로 바이오시밀러 평가 가이드라인을 들 수 있다. 국제의약품규제자포럼(IPRF)에서 워킹그룹의장국으로 활동하는 등 적극적인 국제협력을 통해 가이드라인을 다른 선진국보다 앞서 만들었으며, 이 가이드라인이 국제기준으로 활용되도록 노력한 결과 우리나라가 바이오시밀러 최대 강국이 되었다.
|
구분 |
한국(MFDS) |
미국(FDA) |
유럽(EMA) |
일본(PMDA) |
|
임상 |
상업화임상, 연구자임상승인 *제출자료는 원칙적으로 차이 없음 |
상업화임상, 연구자임상승인 *제출자료는 원칙적으로 차이 없음 |
상업화임상, 연구자임상승인 *제출자료는 원칙적으로 차이 없음 |
상업화임상, 연구자임상 (상업화연계) 승인 *연구자임상은 규제 기관 승인불필요 (세포유전자제외) |
|
임상시험용의약품 예외적 사용허용 (응급/치료적사용)
|
임상시험용의약품 예외적 사용허용 Expanded Access Program(EAP) (응급/치료적사용) |
임상시험용의약품 예외적 사용허용 Compassionate Use Program (응급/치료적사용) |
임상시험용의약품 예외적 사용제도 없음
|
|
|
임상승인 수수료 있음 |
임상승인 수수료 없음 (허가신청에 반영) |
임상승인 수수료 있음(국가별) |
임상승인 수수료 있음 |
|
|
허가심사 |
‣신속심사 |
‣우선허가 (Priority review) ‣신속트랙 (Fast track) |
‣신속허가 (Accelerated assessment) |
‣선구심사 지정제도(사키가케) |
|
허가심사 |
|
‣혁신의약품 지정 (Breakthrough designation) |
|
|
|
‣조건부 허가 |
‣조건부 허가 (Accelerated approval) |
‣조건부 허가 (Conditional approval) |
‣조건기한부 승인(재생의료제품) ‣조건부 허가 |
|
|
자료보호(재심사 연계, 10년, 6년, 4년) |
자료보호 (5년, 12년 + ɑ) |
자료보호 (5년, 8년 + ɑ) |
자료보호 (8년) |
|
|
수수료 (약 6백 2십만 원) |
수수료 (약 28억 원) |
수수료 (약 3억 5천만 원) |
수수료 (약 3억 3천만 원) |
|
|
심사결과공개 |
심사결과공개 |
심사결과공개 |
심사결과공개 |
|
|
CTD 자료제출 *허가증 있음 |
CTD 자료제출 *허가증 없음 |
CTD 자료제출 *허가증 없음 |
CTD 자료제출 *허가증 있음 |
|
|
G M P |
허가전 GMP평가 PIC/S가입(’14.7) |
허가전 GMP평가 PIC/S*가입(’11.1) |
허가전 GMP평가 PIC/S결성(’95.11) |
허가전 GMP평가 PIC/S가입(’14.7)
|
|
희귀 의약품 |
R&D 지원 |
세제 및 R&D 지원 |
세제 및 R&D 지원 (회원국별) |
세제 및 R&D 지원 |
|
3상 임상시험 조건 품목허가 |
3상 임상시험의 경우 최소 1개로 가능 |
조건부 허가 (Conditional) |
임상시험증례수 탄력적용 |
|
|
각종 수수료 감면 |
각종 수수료 면제 |
대기업 10% 경감, 중소기업 면제 |
25% 경감 |
|
|
자료보호 (10년, 6년, 4년) |
독점판매권(7년) |
독점판매권(10년) |
독점판매권(10년) |
|
|
품질관리 |
국가출하승인 |
국가출하승인 Lot release program |
국가출하승인 Official control authority batch release |
국가검정제도 |
[표 4-9] 주요 국가별 바이오의약품 규제비교
(2) 규제지원 서비스 확대
첨단바이오의약품은 소규모 벤처나 연구자 주도로 개발되고 있어, 허가심 자료준비에 많은 어려움과 시행착오를 경험하고 있다. 따라서 바이오의약품 제제별, 개발단계별 맞춤형 협의체를 운영하는 등 전주기 지원을 강화하고 있다. 초기/기초연구단계에서는 첨단바이오의약품 허가 교육, 항체바이오의약품 개발지원 워크숍, 임상통계 워크숍 등 허가 기초교육을 분야별로 제공함으로써 연구개발 단계 시행착오를 최소화하고 있다. 비임상/임상시험 단계에서는 제품개발 경험이 부족한 연구・개발자 대상 규제과학 상담의 날을 운영하여 개발초기(비임상, 초기임상) 중심의 기술을 제공하며, 맞춤형 협의체 운영으로 제제특성에 맞게 임상시험, 생산시설 및 GMP, 제조방법 등에 대한 1:1 집중 지원을 하고 있다. 허가심사 단계에서는 산업계 대상의 수요조사 및 국제 동향의 지속적 모니터링을 통해 허가심사 가이드라인을 적시에 제공하고, 민원상담 전산이력시스템을 구축하여 허가심사 투명성・일관성을 제고하고 있다. 마지막으로 수출단계에서는 ‘바이오 IT 플랫폼(www.bpis.or.kr)’ 확대를 통해 국가별 규제정보, 시장정보, 컨설팅 제공으로 해외진출 지원체계를 구축하였으며, 백신 제조업체 1:1 맞춤형 기술 지원 및 WHO와 PQ 관련 협력 강화로 WHO를 통한 백신 수출증진을 추진하고 있다. 이와 같은 전주기 규제지원서비스를 더욱 확대 강화해야 하며, 특히 첨단바이오의약품의 제품화지원시스템을 선제적으로 마련하여야 한다.
(3) 규제 인프라 강화
허가심사 역량강화를 위한 분야별・경력별 심사자 교육훈련 프로그램을 개발・운영하고, 바이오의약품 신규심사자 공동심사제를 도입하여 신규심사자는 필수교육 이수 후 6개월 이상 선임심사자와 공동심사를 실시하도록 함으로써 심사수준을 제고하며, 선진 심사기술 습득기회 확보를 위해 미 FDA, 캐나다 HC 등 선진규제기관에 심사자 장기연수를 확대 실시하고 있다. 또한 심사관(계약직) 채용확대를 통해 제품 개발・심사경험이 있는 국내외 고급 전문인력을 확보하여 우리나라 허가・심사의 국제적 신뢰도를 제고함으로써 국내 허가제품의 국외 진출에 어려움이 없도록 인프라 구축을 지속 추진하고 있다. 한편 과학기술 혁신과 의료기술 결합으로 신개념 의료제품 개발이 가속화되고 있다. 생체 재료로 가공된 조직공학제제, 세포・지지체・성장인자 등을 결합시켜 만든 융복합제제, 세포를 이용한 3D프린팅 제품 등 인체의 구조・기능을 재건・회복하거나 손상된 장기・조직을 대체・보조하는 다양한 형태의 제품이 개발 중에 있다. 따라서 살아있는 세포・조직을 기반으로 한 첨단바이오의약품의 특성을 반영하고 기술발전 속도에 유연하게 대응하기 위하여 별도 관리체계 필요하다. 즉 살아있는 물질의 특이성・복잡성, 장기간 체내 유지, 짧은 유효기간, 인체 투여 후 배설 제한, 의학적 불확실성, 환자 맞춤형으로 단기간 내 대규모 임상불가한 점 등을 고려한 관리체계가 필요하며, 특히 미래에 출현할 제품에 대한 규제로드맵이 반드시 제시되어야 한다.
(4) 바이오의약품 허가 현황
2015년부터 2017년 9월까지 바이오의약품(생물학적제제 등, 유전자재조합의약품, 세포・유전자 치료제) 전반에 걸쳐 총 126품목이 허가되었다. 유전자재조합의약품이 77품목, 백신이 31품목 등 대부분을 차지하였으며 혈액제제 8품목, 보툴리눔제제 8품목, 세포치료제 및 유전자치료제가 각 1품목씩 허가되었다. 2015년은 그간 백신 자급화를 위해 추진해 온 글로벌백신제품화지원단의 성과를 확인할 수 있다. 지원 품목인 세포배양 인플루엔자 4가 백신, H5N1 대유행 전단계 인플루엔자 바이러스 백신, 콜레라백신(수출용) 등 허가된 7품목 중 6품목이 국내 개발 백신이다. 2016년에는 국내 개발 인플루엔자 4가 백신(A형, B형) 8품목(원액 포함)을 포함하여 총 16품목이 허가되었으며, 국내 기술로 개발된 디프테리아・파상풍 혼합백신 및 폐렴구균・디프테리아 단백 접합백신이 최초로 허가되었으며, 2017년 9월까지 인플루엔자 백신 6품목을 포함하여 총 8품목이 허가되었다. 유전자재조합의약품의 경우 총 77품목이 허가되었으며, 수입품목이 국내 제조 품목 에 비해 약 3배 많았다. 또한 유전자재조합의약품은 고셔병, 효소대체제 등 희귀질환치료제가 20품목으로 약 35%정도를 차지하고 있다. 항체의약품을 포함하는 유전자재조합의약품은 항암제와 류마티스 관절염치료제 뿐 아니라 당뇨병, 호르몬대체제, 황반변성치료제 등 다양한 의약품이 허가되었다. 아울러 국내개발 바이오시밀러의 경우 2012년 ㈜셀트리온 램시마주(인플릭시맵) 허가 이후 꾸준히 늘어나고 있으며, 2015년에 삼성바이오에피스(주) 브렌시스주(에타너셉트) 등 2품목, 2016년에 ㈜셀트리온 트룩시마주(리툭시맙) 1품목, 2017년 9월까지 삼성바이오에피스(주) 하드리마주(아달리무맙) 1품목이 허가되었다. 국내 개발 바이오시밀러 허가로 글로벌 시장 진출 및 수출이 활성화되어 수입대체효과를 기대할 수 있었다. 마지막으로 세포치료제는 2015년 ㈜바이오솔루션 케라힐-알로(동종피부유래각질세포) 허가되었으며, 2017년에는 퇴행성 질환인 무릎 골관절염 치료를 위한 유전자치료제가 국내 최초 허가되었다.
[표 4-10] 바이오의약품 허가 현황(건수, 2015∼2017.9.30)
|
분류 |
백신 |
보툴리눔 |
혈액제제 |
유전자재조합 의약품 |
세포/유전자 치료제 |
총계 |
|
2015 |
7 |
2 |
3 |
38 |
1 |
51 |
|
2016 |
16 |
4 |
1 |
23 |
0 |
44 |
|
2017 |
8 |
2 |
4 |
16 |
1 |
31 |
|
총계 |
31 |
8 |
8 |
77 |
2 |
126 |
[표 4-11] 백신 효능별 허가 현황(건수, 2015∼2017.9.30)
|
분류 |
백신 |
|||||||
|
인플루엔자백신 |
폐렴구균 |
콜레라 |
비씨지 |
인유두종 |
원료 |
기타 |
총계 |
|
|
2015 |
4 |
- |
1 |
- |
- |
1 |
1 |
7 |
|
2016 |
5 |
2 |
|
1 |
2 |
4 |
2 |
16 |
|
2017 |
6 |
- |
1 |
- |
- |
- |
1 |
8 |
|
총계 |
15 |
2 |
2 |
1 |
2 |
5 |
4 |
31 |
[표 4-12] 유전자재조합의약품 효능별 허가 현황(건수, 2015∼2017.9.30)
|
분류 |
유전자재조합의약품 |
||||||||
|
천식 |
류마티스 관절염등 |
항악성 종양제 |
호르몬 대체제 |
건선 |
당뇨병 |
원료 |
기타 |
총계 |
|
|
2015 |
4 |
3 |
4 |
2 |
1 |
- |
7 |
17 |
38 |
|
2016 |
- |
4 |
1 |
2 |
3 |
5 |
2 |
6 |
23 |
|
2017 |
- |
2 |
4 |
1 |
- |
4 |
0 |
5 |
16 |
|
총계 |
4 |
9 |
9 |
5 |
4 |
9 |
9 |
28 |
77 |
[표 4-13] 제조 및 수입 품목별 허가 현황(건수, 2015∼2017.9.30)
|
분류 |
백신 |
보툴리눔 |
혈액제제 |
유전자재조합 의약품 |
세포/유전자 치료제 |
총계 |
|||||
|
제조 |
수입 |
제조 |
수입 |
제조 |
수입 |
제조 |
수입 |
제조 |
수입 |
||
|
2015 |
6 |
1 |
2 |
- |
1 |
2 |
7 |
31 |
1 |
- |
51 |
|
2016 |
11 |
5 |
4 |
- |
1 |
0 |
7 |
16 |
- |
- |
44 |
|
2017 |
7 |
1 |
2 |
- |
2 |
2 |
4 |
12 |
1 |
- |
31 |
|
총계 |
24 |
7 |
8 |
0 |
4 |
4 |
18 |
59 |
2 |
0 |
126 |
(5) 결론
바이오의약품의 시대가 다가오고 있다. 우리는 준비하고 있는가? 무엇을 준비하고 있고 준비해야 하는가? 앞으로 국가는 희귀난치질환이나 대체치료제가 없는 질환의 치료기회 확대를 통한 국민건강 및 삶의 질 향상과 이에 따른 산업발전을 통해 고급 일자리창출 등 미래경제의 견인차 역할을 하여야 한다. 바이오의약품 산업 전반이 건강하게 성장하려면 규제 역시 중요하다. 기술발전과 산업변화에 발맞추어 국제기준의 합리적 규제방안을 마련해 나가야한다. 바이오의약품 산업은 수익성뿐만 아니라 공공성도 중요한 가치이다. 수익성과 공공성의 가치가 골고루 지켜질 때, 바이오의약품 산업의 지속적인 성장이 가능할 것이다. 따라서 규제선진화, 규제 서비스 확대, 규제 인프라 강화를 통해 예측 가능하고 투명한 규제시스템을 갖추어야 한다. 특히 첨단바이오의약품의 경우 이제 기초연구 단계에 있는 것부터 제품화가 가시적인 단계에 있는 것, 더 나아가 아직 모르나 개발될 가능성이 있는 것 등 앞으로 규제가 필요한 영역에 대한 규제로드맵을 선제적으로 제공하여야 한다. 그래야 우리나라에서 세계 최초의 첨단바이오의약품이 허가 받을 수 있을 것이며, 그 의약품이 미국, 유럽 등 다른 나라에서도 즉시 쉽게 허가 받을 수 있을 것이다. 바로 지금 첨단바이오의약품법 제정 등 새로운 관리체계를 마련해야 한다. 3D 바이오프린팅기술을 이용한 조직공학제제, 유전자가위기술을 이용한 유전질환치료제, 성체줄기세포를 이용한 알츠하이머 등 희귀난치질환 치료제 등이 세계 최초로 우리국민에게 사용되는 날이 곧 올 것으로 기대한다.
![]() 제5절
생명공학 기업 현황과 지원제도
제5절
생명공학 기업 현황과 지원제도
1. 국내외 바이오기업 현황
가. OECD 바이오기업 현황
OECD에서는 바이오 관련 제품생산이나 서비스 또는 R&D를 수행하는 기업을 바이오기업(Biotechnology firm)으로, 이 기업 중에서 생산이나 서비스 또는 R&D의 75% 이상이 바이오에 집중된 기업을 바이오집중기업(Dedicated Biotechnology firm)으로 정의하고 각 국가에서 제공받은 데이터를 토대로 ‘OECD Key Biotech Indicators’를 발표하고 있다.
2016년 10월 발표된 2014년 기준 OECD 바이오기업 현황을 보면, 미국이 11,554개사로 가장 많고 우리나라는 미국, 스페인, 프랑스에 이어 4위인 940개사로 발표되었다. 바이오집중기업의 수는 프랑스가 1,284개사로 가장 많았고, 우리나라는 456개사로 프랑스, 미국, 독일, 스페인 다음으로 많았다. 이스라엘은 총 233개사 중 92.7%인 216개사가 바이오집중기업이라고 응답하여 응답국가 중 가장 높은 비율을 보였다.

출처: OECD Key Biotech Indicators, October 2016
[그림 4-8] OECD 바이오기업 현황
나. 상장 바이오기업 현황
해외 시장조사컨설팅기업인 Ernst&Young사 자료에 따르면, 2016년 기준 미국 및 유럽의 상장 바이오기업은 총 708개사로 이들 기업들은 전년 대비 7% 증가한 1,394억 달러의 매출을 기록했다. 비록 순이익은 전년 대비 52%나 감소하였으나 R&D에 대한 투자는 전년 대비 12%가 증가한 457억 달러를 투자하였으며 이는 전체 매출액의 32.8%에 해당된다. 총 종사자 수는 전년 대비 14% 증가하여 200,000명을 넘었다.
[표 4-14] 미국 및 유럽의 상장 바이오기업 현황
|
구 분 |
2016년 |
2015년 |
증감율(%) |
|
상장기업 수(개) |
708 |
680 |
4% |
|
매출액($ bln) |
139.4 |
130.3 |
7% |
|
연구개발비($ bln) |
45.7 |
40.6 |
12% |
|
순이익($ bln) |
7.9 |
16.3 |
Δ52% |
|
시장가치($ bln) |
862.5 |
1041.2 |
Δ17% |
|
종사자 수(명) |
203,210 |
178,690 |
14% |
출처: Biotechnology Report 2017, Ernst & Young, 2017
나라별로 살펴보면, 최근 몇 년간 미국 상장 바이오기업들의 재무성과는 항바이러스 전문기업인 Gilead Sciences사의 실적에 따라 큰 영향을 받았다. 2013년부터 2015년까지 미국은 매출액, 순이익, 시장가치에서 Gilead사의 영향을 받아 높은 성장을 기록했으나, 2016년은 Gilead사의 매출이 7% 하락하면서 전체 상장 바이오기업들의 재무성과도 하락했다.
[표 4-15] 미국 상장 바이오기업 현황
|
구 분 |
2016년 |
2015년 |
증감율(%) |
|
상장기업 수(개) |
449 |
442 |
2% |
|
매출액($ bln) |
112.2 |
107.4 |
4% |
|
연구개발비($ bln) |
38.8 |
34.0 |
14% |
|
순이익($ bln) |
9.2 |
15.3 |
Δ40% |
|
시장가치($ bln) |
698.6 |
891.2 |
Δ22% |
|
종사자 수(명) |
135,750 |
130,100 |
4% |
출처: Biotechnology Report 2017, Ernst & Young, 2017
미국에는 2016년 기준 총 449개사의 상장 바이오기업이 있으며, 이들 상장기업들은 전년 대비 4%가 증가한 1,122억 달러의 매출을 올렸으며, 매출액의 34.6%인 388억 달러를 연구개발비에 투자한 것으로 나타났다.
유럽의 상장 바이오기업들 전체 재무성과는 2016년에 Shire사가 미국 Baxalta사를 M&A한 영향으로 매출, 시장가치 및 종사사 수 면에서 큰 폭의 성장을 기록했다. 2016년 기준 유럽 상장 바이오기업 매출은 전년 대비 19%가 증가한 272억 달러를 기록했으며, 매출액의 25.4%인 69억 달러를 연구개발비에 투자한 것으로 나타났다. 종사자 수도 전년 대비 39% 증가한 67,460명으로 나타났다.
[표 4-16] 유럽 상장 바이오기업 현황
|
구 분 |
2016년 |
2015년 |
증감율(%) |
|
상장기업 수(개) |
259 |
238 |
9% |
|
매출액($ bln) |
27.2 |
22.8 |
19% |
|
연구개발비($ bln) |
6.9 |
6.7 |
3% |
|
순이익($ bln) |
(1.3) |
1.0 |
Δ235% |
|
시장가치($ bln) |
164.2 |
150.1 |
9% |
|
종사자 수(명) |
67,460 |
48,590 |
39% |
출처: Biotechnology Report 2017, Ernst & Young, 2017
우리나라의 경우, 국내 유일한 바이오산업 통계인 ‘국내 바이오산업 실태조사’로 보면 2015년 기준 총 978개 기업 중 상장기업은 총 186개사로 코스닥에 99개사, 유가증권시장에 87개사가 상장되어 있는 것으로 조사되었다. 이들 상장기업의 2015년 기준 바이오부문 매출액은 6조 7,237억 원으로 전년대비 12.7%가 증가하였으며, 투자비는 전년대비 8.6% 증가한 9,708억 원으로 매출액의 14.4%를 투자한 것으로 나타났다.
[표 4-17] 우리나라 상장 바이오기업 현황
|
구 분 |
2014년 |
2015년 |
증감율(%) |
|
|
상장기업 수(개) |
176 |
186 |
5.7 |
|
|
매출액(억 원) |
국내판매 |
31,682 |
30,709 |
Δ3.1 |
|
해외수출 |
27,972 |
36,528 |
30.6 |
|
|
(소계) |
59,654 |
67,237 |
12.7 |
|
|
투자비(억 원) |
연구개발비 |
7,862 |
8,398 |
6.8 |
|
시설투자비 |
1,077 |
1,310 |
21.6 |
|
|
(소계) |
8,939 |
9,708 |
8.6 |
|
|
종사자 수(명) |
18,816 |
19,949 |
6.0 |
|
출처: 2015년기준 국내바이오산업실태조사, 산업통상자원부/한국바이오협회
한편, 각 나라별로 바이오 기술 및 기업에 대한 정의와 범위가 달라 우리나라와 해외 상장 바이오기업 현황을 직접 비교하는 것은 한계가 있다.
2. 바이오기업 지원 제도
가. 창업 및 초기 바이오기업 지원
(1) 창업 지원
보건복지부와 중소벤처기업부는 2017년 초 바이오헬스 창업 활성화를 위한 업무협약을 체결하였다. 이를 위해 연구중심병원이 바이오분야 TIPS 프로그램, 창업보육센터 지정, 창업선도대학 선정 등 중소벤처기업부 창업지원 사업에 참여하는 경우 가점을 제공하는 등 우대하고 있다. TIPS는 중소벤처기업부가 민간투자와 연계하여 유망한 기술창업 기술을 발굴, 보육 및 R&D를 지원하는 프로그램이다.
아울러, 보건복지부는 연구중심병원의 장비와 공간 등 인프라를 창업기업에게 개방할 수 있도록 지원하고, TIPS 프로그램 창업팀에게 신개발 의료기기의 허가 등에 소요되는 임상시험 비용지원 사업에 우선 참여토록 하고 의료기기산업 종합지원센터의 인허가 지원을 활용하여 빨리 시장에 진입할 수 있도록 지원하고 있다.
한편, 한국벤처캐피탈협회는 벤처투자붐을 전국으로 확산할 목적으로 지역을 순회하며 찾아가는 투자 IR 행사를 개최하여 투자설명회 및 투자상담을 진행하고 있으며, 한국바이오협회에서도 병원 등과 연계하여 바이오분야 창업기업 발굴 및 창업에 필요한 교육을 실시하고 있다.
(2) 초기 바이오기업 지원
산업통상자원부는 2016년 11월에 385억 원 규모의 초기 바이오기업 육성펀드를 조성하였다. 이 펀드는 창업 초기에 자금난을 겪고 있는 바이오벤처기업들에게 투자자금을 원활히 공급하기 위한 정책 펀드이다. 2017년 상반기까지 초기 바이오펀드로부터 투자를 받은 9개 기업 중 7개 기업은 창업 5년 미만의 기업이다.
또한, 산업통상자원부는 2015년부터 중소・벤처나 대학 등이 보유한 잠재 유망 바이오 지식재산권(IP)을 기업에 이전해 우수한 IP의 사업화를 지원하는 사업을 시행하고 있으며, 특히 2017년부터는 창업 3년 미만의 스타트업 기업을 전담 지원하기 위한 과제를 시범도입하여 해당 스타트업의 성공적인 1차 투자(시리즈A 펀등) 유치를 지원한다.
나. 기술개발 지원
(1) 의약바이오(Red BT)
과학기술정보통신부는 바이오분야 원천기술 확보와 미래 유망 기술 확보시장 창출을 위해 신약, 의료기기, 뇌과학 등 6대 주요 투자분야를 선정해 지원하고 있다. 신약 타겟 발굴부터 후보물질 도출에 이르는 초기단계 R&D, 신개념 의료기기 개발을 위한 산학연병원 컨소시엄형 기술개발과, 뇌과학분야 핵심원천기술개발 등을 추진하고 있다.
보건복지부는 국가 관리대상 감염병 대응 등 공익적 기반기술 개발과 희귀질환이나 저출산대응 등 질환극복 및 공공보건을 위한 기술개발을 추진하고 있으며, 만성병 관리를 위한 코호트 운영・연구, 인체자원수집・분양, 줄기세포은행 운영 등 임상연구를 위한 인프라 확충도 추진하고 있다.
이외에도 산업통상자원부는 바이오산업핵심기술개발사업을 통해 의약바이오분야 바이오기업들의 기술개발을 지원하고 있으며, 식품의약품안전처는 세포치료제, 유전자치료제 등에 대한 가이드라인을 제・개정하는 등 규제관리를 선진화해 기업들의 인허가를 지원하고 있다.
한편, 과학기술정보통신부, 산업통상자원부, 보건복지부 등 3개 부처는 범부처신약개발사업을 통해 2020년까지 글로벌 신약 10개 이상 개발과 글로벌 시장을 겨냥한 신약 연구개발을 지원하고 있다.
(2) 화학바이오(White BT)
산업통상자원부는 온실가스 배출규제 등 친환경 무역규제 환경에 대응하고 신성장동력으로 바이오화학산업을 육성하기 위해 2014년부터 5년간 842억 원(총사업비 2,155억 원)을 투자하는 ‘바이오화학 산업화촉진기술개발’을 지원하고 있다. 동 사업은 바이오화학의 원료가 되는 바이오슈가(sugar) 대량생산기술부터 제품국산화를 위한 소재개발, 바이오화학제품 양산체제 마련을 위한 데모플랜트 구축까지 바이오화학 전주기 기술개발을 위한 6대 전략과제를 지원하고 있다.
환경부 환경기술의 고도화 및 난제해결을 위한 환경융합 원천기술개발사업을 지원하고 있으며, 국립생물자원관을 통해 바이오기업들이 활용할 수 있는 다양한 생물자원을 발굴・DB화를 통해 산업계가 활용할 수 있도록 지원하고 있다.
해양수산부는 해양수산생명자원의 확보 및 활용 기반 구축을 추진하고 있으며, 해양바이오에너지 생산기술 개발과 해양 수산생물 유래 바이오신소재개발사업을 지원하고 있다.
(3) 농식품바이오(Green BT)
농림수산식품부는 2012년부터 2021년까지 육종 기반기술 확보 및 품종개발 등 종자 국산화를 위한 Golden Seed 프로젝트를 추진하고 있다. 이는 분자육종 등 전통적 교배기술에 첨단바이오기술을 접목시켜 고품질의 종자 개발 및 대량생산을 위한 산업화를 촉진하기 위한 것이다.
한편, 농림수산식품부, 과학기술정보통신부 등 6개 부처는 경제적 파급효과가 큰 스타 농생명소재 발굴을 2017년부터 추진하고 있다. 이를 위해 2017년에 농생명소재발굴추진단을 구성하여 소재별 기술로드맵을 마련하고, 민간이 주도하는 C&D (Connect&Development)형 프로젝트로 연계하여 스타 농생명소재를 발굴하고 사업화 촉진을 위해 기술사업화자금지원 확대, 임상시험 비용지원 등 전주기 사업화 지원방안도 마련할 계획이다.
(4) 융합바이오(Fusion BT)
과학기술정보통신부는 융합연구를 통한 치료기술 및 바이오닉스 기술개발, 산업통상자원부는 웰니스 생활건강 서비스 모델 및 기반기술 개발을, 보건복지부는 바이오프린팅 등 융복합첨단의료기술개발사업을 지원하고 있다.
범부처사업으로는 국제수준의 유전체 연구자원・정보 확보 및 맞춤형 예방・진단・치료기술 개발을 위해 과학기술정보통신부, 보건복지부, 산업통상자원부, 농림수산식품부 등 7개 부처의 참여하여 2014년부터 8년간 5,788억 원이 투자되는 ‘포스트게놈다부처유전체사업’이 지원되고 있다. 빅데이터 분석・활용을 위한 혁신적인 분석 프로그램을 개발 등을 통해 바이오기업 등이 유전체 정보 활용을 촉진하도록 지원하고 있다.
다. 산업화 환경 조성
(1) 네트워킹 및 수출 활성화
한국보건산업진흥원 및 충청북도는 컨퍼런스, 전시회, 비즈니스 포럼과 기타 잡페어 등 부대행사로 구성되는 Bio Korea 국제행사를 매년 개최하여 국내외 기업간 협력기회를 제공하고 있다. 산업통상자원부와 한국바이오협회는 코리아바이오플러스 행사를 매년 개최하여 바이오산업에 대한 분야별 최신동향을 공유하고 참석자간 네트워킹을 제공하며 중국기업 등과의 파트너링을 지원하고 하고 있다.
한편, 식품의약품안전처는 2014년부터 첨단 의약품을 신속하게 제품화하고 글로벌 수출로 연계하기 위한 ‘팜 나비(Pharm Navi)’사업을 추진하고 있다. 이는 의약품 허가심사자가 내비게이터가 되어 실시간으로 개발부터 허가까지 안내자 역할을 하여 신속한 허가심사가 이루어질 수 있도록 하기 위한 것이다. 아울러, 주요 수출국가 규제정보 및 WHO 사전적격성평가(PQ) 인증 기술지원, 의약품 GMP 상호인정 협약국가 확대 등을 통해 기업의 수출 확대를 지원하고 있다.
(2) 규제 개선
국무조정실에서는 신산업규제혁신위원회에 바이오헬스 분과위원회를 두고 의약품, 의료기기 등 헬스케어 산업분야에 대한 기존규제의 정비, 기업현장의 애로사항 및 불합리한 규제 발굴과 개선을 추진하고 있다.
또한, 정부는 중소기업 규제 및 애로를 상시적・체계적으로 정비하기 위해 2009년부터 ‘중소기업 옴부즈만’ 제도를 도입・운영하고 있다. 옴부즈만 활동을 보좌하기 위해 중소벤처기업부에 옴부즈만지원단을 운영하고 있으며 바이오분야 및 바이오분야와의 융합분야 등에 대한 규제를 조사・발굴하여 소관부처에 건의하여 규제를 개선하고 있다.
라. 세제 및 관세 지원
바이오산업은 신약개발 등 연구개발에 투자하는 비용이 높아 연구개발 및 시설투자비 등에 관련된 기업 지원이 필요하며, 우리나라는 조세특례제한법 및 관세법에 따라 세제 및 관세 분야 혜택을 지원하고 있다.
조세특례제한법에서는 신성장동력・원천기술의 연구・인력개발비에 대한 세액 공제를 지원하고 있다(법 제10조). 바이오헬스분야 신성장동력・원천기술에는 바이오・화합물의약, 의료기기・헬스케어, 바이오 농수산・식품, 바이오화장품소재가 포함되어 있다(시행령 별표7).
또한, 생산성 향상시설 투자의 경우는 2017년 12월 31일까지 투자금의 100분의 3(중소기업은 100분의 7)에 상당액에 대한 세액공제를 받을 수 있으며(제24조), 의약품 품질관리 개선시설에는 2019년 12월 31일까지 투자한 금액의 100분의 1(중소기업은 100분의 6) 상당액에 대한 세액공제 받을 수 있다(제25조의4). 특히, 신성장기술의 사업화를 위한 시설투자의 경우 2018년 12월 31일까지 한 금액의 100분의 5(중소기업은 100분의 10) 상당액에 대한 세액공제가 2016년 말에 신설되어 법에서 정한 요건을 충족하는 기업은 지원받게 되었다(제25조의5).
한편, 관세법에서는 장애인보조기구, 만성신부전증환자가 사용할 물품, 희귀병치료제 등 시행규칙 별표2에서 정한 물품에 대해 관세를 면제해 주고 있으며(제91조제4호), 시행규칙 별표2의4에서 정한 국내제작이 곤란한 공장자동화 물품에 대해서도 관세를 감면하고 있다(제95조제1항제3호).
마. 바이오기업(제품) 인증・지원
(1) 혁신형 제약기업 인증・지원
보건복지부는 국내 제약기업의 글로벌 경쟁력을 확보하고, 제약산업을 미래 신성장동력으로 육성하기 위해 혁신형 제약기업 인증 등을 지원하고 있다. 신약 연구개발 등에 일정규모 이상의 투자를 하는 기업을 대상으로 선정되면 2017년 8월 현재 45개사가 인증을 받았다.
인증 받은 기업은 약가 우대, R&D 참여시 가점 부여, 연구개발 비용에 대한 법인세액 공제, 의약품 품질관리 개선 시설투자비용 세액공제 및 연구시설 건축시 입지 지역 규제완화 및 부담금 면제 등에 대한 지원을 받는다.
(2) 월드클래스300 기업 인증・지원
중소벤처기업부는 취약한 산업의 허리를 강화하고 성장동력을 지속적으로 확충하며 질 좋은 일자리를 창출하고자 2011년부터 성장 잠재력과 혁신성이 뛰어난 중소・중견기업을 선정하여 지원하는 월드클래스300 프로젝트를 추진하고 있다. 2016년까지 선정된 230개 기업 중 바이오의료/의약품 기업은 22개사다.
신청 기업은 매출액 400억 원∼1조 원 규모의 중소・중견기업으로 최근 5년간 연평균 매출증가율이 15% 이상 또는 최근 3년간 매출액 대비 R&D 투자비율이 평균 2% 이상 등의 기준을 통과해야 하며, 선정시에는 연구개발비 지원, 연구인력 파견 지원, 해외시장 확대를 위한 금액 지원, 금융기관과 연계한 투자지원, 경영컨설팅 등 다양한 지원을 받게 된다.
(3) 세계일류상품 및 생산기업 인증・지원
산업통상자원부와 코트라는 수출 품목의 다양화・고급화 및 미래 수출동력 확충을 위해 세계일류상품육성사업을 시행하고 있다. 점유율 규모에 따라 현재일류(점유율 5위 이내) 및 차세대일류상품(7년 이내 진입 가능), 인증대상에 따라 품목과 생산기업으로 나누어 선정하며, 업종별 추천위원회 및 일류상품발전심의위원회 심의를 거쳐 최종 선정된다. 바이오분야는 한국바이오협회가 맡아 추천위원회를 구성한다.
선정된 기업에게는 한국산업기술평가관리원 ATC 사업 등 선정시 가점 부여, 무역보험공사・신용보증기금・기술보증기금 수출보증・보험 우대, 한국지식재산전략원 전략지원사업 선정시 가점 등이 주어지며, 이외 조달청과 IBK기업은행・한국수출입은행 등과 연계한 지원을 받게 된다.
부록
부록 1 생명공학연표
⋙ 기원전 8000년
◦인간이 농작물과 가축을 경작하고 사육하기 시작
◦최초로 감자를 식용으로 경작
⋙ 기원전 4000~2000년
◦이집트에서 효모를 사용해 빵과 맥주의 발효 시작
◦수메리아, 중국, 이집트에서 치즈를 생산하고 포도주를 발효시킴
◦바빌로니아인들은 몇 그루 수술 나무의 꽃가루를 가지고 선별적으로 암술나무에 수정하여 대추야자를 생산
⋙ 기원전 500년
◦중국에서 항생물질을 가진 곰팡이가 핀 두부로 종기를 치료
⋙ 서기 100년
◦중국에서 최초로 살충제를 국화에 살포함
⋙ 1322년
◦아랍에서 우성 말을 생산하기 위해 최초로 인공수정을 사용
⋙ 1590년
◦Janssen, 현미경 발명
⋙ 1663년
◦Hooke, 세포의 존재 발견
⋙ 1675년
◦Leeuwenhoek, 박테리아를 발견
⋙ 1761년
◦Koelreuter, 다른 종의 농작물을 성공적으로 이종교배 하였음을 보고
⋙ 1797년
◦Jenner, 아이들에게 천연두를 막기 위한 바이러스성 백신을 접종
⋙ 1830~1833년
◦1830년 단백질 발견
◦1833년 최초로 효소가 발견되고 분리됨
⋙ 1835~1855년
◦Schleiden와 Schwann, 모든 유기체는 세포들로 구성되어 있다고 제안
◦Virchow, ʻʻ모든 세포는 세포에서 생겼다ʼʼ고 선언
⋙ 1857년
◦Pasteur, 미생물들이 발효를 유발한다고 제안
⋙ 1859년
◦Charles Darwin, 자연 도태의 진화론을 발표(1800년대 후반 유전학의 무지에도 불구하고 선택된 부모와 도태된 다양한 자손에 대한 개념은 동식물 사육사들에게 매우 큰 영향을 줌)
⋙ 1865년
◦유전학 연구 시작
◦Gregor Mendel, 오스트리아인 수도사인 그는 완두를 연구하여 유전법칙에 의해 유전적 특징이 부모로부터 자손에게 물려진다는 점을 발견함
⋙ 1870~1890년
◦Darwin의 이론을 이용하여 면화를 이종교배하고 수백 가지의 우성품종을 개발
◦최초로 농부들이 수확량을 늘리기 위해 농지에 질소고정 박테리아 미생물을 섞음
◦William James Beal, 최초로 실험실에서 실험용 옥수수 잡종 생산
⋙ 1877년
◦Koch, 박테리아를 염색하고 동정하기 위한 기술 개발
⋙ 1878년
◦Laval, 최초로 원심분리기 개발
⋙ 1879년
◦Fleming, 후에 염색체라 불려지는 세포핵 안쪽의 봉모양의 염색질을 발견
⋙ 1900년
◦초파리가 유전연구에 사용
⋙ 1902년
◦면역학이라는 용어가 처음으로 나타남
⋙ 1906년
◦유전학이라는 용어가 소개됨
⋙ 1911년
◦Rous, 최초로 암을 유발하는 바이러스 발견
⋙ 1914년
◦최초로 박테리아를 영국 맨체스터의 하수처리에 사용
⋙ 1915년
◦Phage(박테리아성 바이러스)발견
⋙ 1919년
◦최초로 생명공학(Biotechnology)이라는 단어가 출판물에 사용
⋙ 1920년
◦Evans와 Long, 인간성장 호르몬 발견
⋙ 1928년
◦Alexander Fleming, 항생물질인 페니실린 발견
◦유럽에서 조명충 나방제어를 위한 소규모의 Bacillus thuringiensis(Bt) 테스트 시작
◦1938년 프랑스에서 미생물 살충제의 상업적 생산 시작
◦Karpechenko, 무와 양배추를 교배하여 서로 다른 속(屬)의 식물 사이에서 번식력이 강한 자손을 만듦
◦Laibach, 최초로 오늘날 이종교배라 알려진 광범위한 교배로부터 잡종을 얻기 위해 배구제(embryo rescue)를 사용
⋙ 1930년
◦美의회에서 식물육종생산의 특허를 가능하게 하는 식물특허법(Plant Patent Act) 통과
⋙ 1933년
◦1920년대 Henry Wallace에 의해 개발된 잡종옥수수가 상업화 됨 (1945년에는 엄청난 매출액은 증가된 연 종자구입비를 능가했고 잡종 옥수수는 미국 전체 옥수수 생산량의 78%를 차지)
⋙ 1938년
◦분자 생물학이란 용어가 생김
⋙ 1941년
◦유전공학이란 용어가 폴란드 Lwow의 기술연구소에서 효모복제에 관한 강의를 맡고 있는 덴마크의 미생물학자 A. Jost에 의해 최초로 사용
⋙ 1942년
◦박테리아를 감염시키는 박테리오파지를 구명하고 확인하기 위해 전자 현미경을 사용
◦페니실린을 미생물에서 생산함
⋙ 1944년
◦Avery와 그 외 다른 사람들에 의해 DNA가 유전정보를 운반한다는 점이 입증됨
◦Waksman, 결핵에 효과적인 항생제인 streptomycin을 분리(추출)
⋙ 1946년
◦새로운 타입의 바이러스를 형성하기 위해 서로 다른 바이러스로부터의 유전물질이 결합할 수 있다는 일종의 유전자 재조합이 발견
◦유전적 다양성의 상실로 인한 위협을 인식한 미의회는 식물수집과 보존 그리고 이러한 인식의 홍보에 막대한 자금을 제공함
⋙ 1947년
◦McClintock, 옥수수에서 소위 움직이는 유전자(jumping genes)라 불리는 전이요소를 발견
⋙ 1949년
◦Pauling, 겸상(鎌狀) 적혈구 빈혈증(흑인의 유전병)이 헤모글로빈 내 단백질분자의 돌연변이로 야기된 ʻ분자병ʼ임을 밝혀냄
⋙ 1951년
◦냉동정액을 사용한 가축의 인공수정이 성공적으로 수행됨.
⋙ 1953년
◦과학저널 Nature는 현대 유전학의 출발을 상징하는 DNA의 이중나선 구조를 묘사한 James Watson과 Francis Crick의 원고를 출판
⋙ 1955년
◦핵산 합성에 관한 효소가 처음으로 추출됨
⋙ 1956년
◦Kornberg, DNA 복제에 필요한 효소 DNA 중합효소Ⅰ(DNA polymeraseⅠ) 발견
⋙ 1958년
◦겸상 적혈구 빈혈증이 단일 아미노산의 변화 때문에 발생한다고 밝혀짐
◦DNA가 처음으로 시험관에서 만들어짐
⋙ 1959년
◦조직 살균제가 개발됨
◦단백질 생합성의 첫 단계가 그려짐
⋙ 1950년대
◦바이러스 증식억제 물질(interferon) 발견
◦최초 합성 항생 물질 개발
⋙ 1960년
◦시냅시스(세포의 감수분열 초기에 있는 상동염색체의 병렬접착)를 이용해 DNA-RNA 잡종 분자가 만들어짐
◦메신저 리보 핵산(Messenger RNA) 발견
⋙ 1961년
◦美 농림부가 최초 미생물 살충제인 Bacillus thuringiensis를 등록함
⋙ 1963년
◦Norman Borlaug에 의해 신품종 밀이 개발됨으로 인해 생산량이 70% 상승함
⋙ 1964년
◦필리핀의 국제 벼 연구소(The International Rice Research Institute)는 새로운 품종을 개발하여 충분한 비료를 주면 이전의 생산량보다 2배 많은 수확량을 얻을 수 있는 녹색 혁명을 일으킴
⋙ 1965년
◦Harris와 Watkins가 성공적으로 생쥐와 사람 세포를 융합시킴
⋙ 1966년
◦유전암호가 해독되고 일련의 3개의 뉴클리오티드가 하나의 아미노산을 결정한다는 사실이 밝혀짐
⋙ 1967년
◦최초로 자동 단백질 서열 분석기 완성
⋙ 1969년
◦처음으로 효소가 생체 외에서 합성됨
⋙ 1970년
◦노르만인 Borlaug, 노벨 평화상 수상(1963년 참조)
◦유전물질을 자르는 제한 효소(두 줄 사슬 DNA를 특정 부위에서 절단하는 효소)의 발견으로 유전자 복제의 장이 열림
⋙ 1971년
◦처음으로 유전자가 완벽하게 합성됨
⋙ 1972년
◦인간의 DNA 구성이 침팬지와 고릴라의 DNA와 99% 유사함이 발견됨
◦최초로 배이식(胚移植)이 시도됨
⋙ 1973년
◦Stanley Cohen와 Herbert Boyer, 제한효소와 리가제(ligases)를 사용해서 DNA를 자르고 붙이는 기술과 박테리아에서 새로운 DNA를 복제하는 기술을 완성함
⋙ 1974년
◦미국 NIH는 유전자 재조합 연구를 총괄하기 위해 재조합 DNA 자문위원회 (Recombinant DNA Advisory Committee) 구성
⋙ 1975년
◦최초로 미국 정부가 캘리포니아 Asilomar 회의에서 유전자재조합실험을 규제하기 위한 가이드라인 개발을 주장함
◦단일클론항체가 생산됨
⋙ 1976년
◦유전자 재조합 기술이 유전 장애인에 최초로 적용
◦분자교배가 태아의 alpha thalassemia 진단에 사용됨
◦효모의 유전자가 대장균(E.coli)에서 발현됨
◦최초로 특정유전자의 염기쌍 순서가 결정됨(A, C, T, G)
◦美國재조합 DNA 자문위원회(NIH Recombinant DNA Advisory Committee)에 의해 유전자 재조합 실험에 대한 가이드라인이 처음으로 발표
⋙ 1977년
◦인간유전자를 박테리아에서 처음으로 발현시킴
◦전기영동을 이용해 DNA의 긴 마디를 빠르게 나열하기 위한 연구수행
⋙ 1978년
◦바이러스의 고방사선 구조가 최초로 확인됨
◦재조합 인간 인슐린이 최초로 생산됨
◦미국 노스캐롤라이나 과학자들이 DNA 분자상의 특정 위치에 특정 돌연변이를 일으키는 것이 가능하다는 것을 보여줌
⋙ 1979년
◦최초로 인간성장 호르몬이 합성됨
⋙ 1970년대
◦유전공학 제품을 개발하기 위해 최초의 상업적 회사가 설립
◦중합효소(polymerases)의 발견
◦뉴클리오티드(nucleotides)의 빠른 나열기술 완성
◦유전자 표적화
◦RNA splicing
⋙ 1980년
◦Diamond v. Chakrabarty 재판에서 미 연방법원은 유전자재조합생물형태에 대한 특허를 인정했으며, Exxon 석유회사가 기름 먹는 미생물에 대한 특허 취득
◦美國정부 유전자복제에 대한 권한을 Cohen과 Boyer에게 부여
◦최초의 유전자합성 기계 개발
◦인간인터페론유전자를 박테리아로 형질전환(Transformation) 시킴
◦노벨 화학상이 유전자 재조합분자를 개발한 Berg, Gilbert, Sanger에게 수여됨
⋙ 1981년
◦오하이오 대학의 과학자들이 다른 동물의 유전자를 쥐에 이식함으로써 최초로 유전자 이식동물을 생산함
◦중국의 과학자가 최초로 복제 물고기 금잉어를 만듦
⋙ 1982년
◦미국의 Applied Biosystems社는 단백질 서열분석에 필요한 샘플의 양을 획기적으로 줄일 수 있는 상업적 가스 상 단백질 서열분석기를 발표
◦가축을 위한 최초의 유전자 재조합 DNA 백신 개발
◦유전적 변이를 거친 박테리아에서 생산된 인간인슐린이 미국 FDA로부터 최초의 생명공학 기술에 의한 의약품으로 승인 받음
◦최초의 유전자 변형식물인 피튜니아 생산
⋙ 1983년
◦중합효소연쇄반응(PCR) 기술이 소개(유전자와 유전자 조각의 복제를 위해 열과 효소를 사용하는 PCR 기술은 이후 유전공학에서의 연구와 개발에 광범위하게 쓰이는 중요한 도구가 됨)
◦TI 플라스미드(plasmid: 염색체와는 따로 증식할 수 있는 유전인자)에 의한 식물 세포들의 유전학적인 변형이 수행됨
◦최초로 인공염색체 합성
◦특정유전병 유발인자 발견
◦생명공학기술을 이용해 피튜니아를 완전 성장시킴
◦피튜니아 식물을 통해 유전자변형식물의 새로운 특징이 자손에게 전달됨을 확인함
⋙ 1984년
◦DNA 지문검색 기술이 개발
◦HIV 바이러스의 전체 게놈이 복제되고 서열 결정됨
⋙ 1985년
◦신장병과 낭포성 섬유증을 유발하는 유전인자 발견
◦법적 증거로서 유전자 지문법이 도입
◦최초로 곤충과 박테리아, 바이러스에 저항력이 있는 유전자 변형식물이 시험됨
◦미국 NIH는 인간을 대상으로 하는 유전자 치료법 실험수행에 대한 가이드라인을 정함
⋙ 1986년
◦유전자 재조합 B형 간염 백신 최초 개발
◦최초의 유전공학 항암치료제 인터페론 생산
◦미국 정부는 유전자 재조합 유기체에 대해 전통적인 유전자재조합기술로 만들어진 제품에 적용된 규정보다 더 엄격한 ʻʻThe Coordinated Framework for Regulation of Biotechnologyʼʼ 규정 확립
◦California Berkeley 대학의 화학자가 신약을 개발하기 위해 항체와 효소를 결합하는 방법(abzymes) 제시
◦유전자 변형식물(담배)의 실제 실험이 수행됨
◦최초로 환경 보호국이 유전자변형 담배의 판매를 승인
⋙ 1987년
◦바이러스에 내성이 있는 토마토의 field test를 최초로 승인함
◦캘리포니아에서 농작물의 서리 형성을 억제하는 유전자 변형 박테리아인 Frostban을 딸기와 감자를 통해 시험하였는데 이것이 처음으로 공식 승인된 유전자 재조합 박테리아 외부 실험임
⋙ 1988년
◦미국 정부는 하버드대학 분자유전학자에게 유전자 변형동물 즉, 유전자변형 쥐에 대한 특허권을 부여함
◦세제에 사용할 수 있는 표백제 내성을 지닌 단백질 분해효소를 만드는 공정에 대한 특허권이 부여됨
◦미국 의회가 다른 종의 게놈 뿐만 아니라 인간유전자 암호를 해독하고 지도를 만드는 인간 게놈 프로젝트 연구비를 승인함
⋙ 1989년
◦최초로 유전자변형 해충방지 면화의 field test 승인
◦식물 게놈 프로젝트 시작
⋙ 1980년대
◦진화의 역사를 밝히기 위한 DNA 연구 시작
◦유럽에서 유전자 재조합 동물백신의 사용 승인
◦기름 청소에 미생물을 이용한 생물학적 정화기술 사용
⋙ 1990년
◦미국 최초로 유전자재조합 기술을 이용하여 치즈제조에 쓰이는 인공적으로 제조된 chymosin 효소인 Chy-MaxTM이 소개됨
◦인체의 모든 유전자 지도를 제작하려는 국제적인 노력인 인간 게놈 프로젝트가 시작됨
◦면역장애를 앓고 있는 4살 여자 어린이를 대상으로 실시한 유전자 치료가 성공적으로 수행됨
◦유아 조유용 우유 단백질을 만드는 유전자 변형 젖소 탄생
◦해충에 강한 옥수수인 Bt 옥수수 생산
◦영국 최초로 유전자변형 효모식품이 승인됨
◦유전자 변형 척추동물 송어의 실지실험이 수행됨
⋙ 1992년
◦미국과 영국의 과학자들이 시험관 내에서 배아에 낭포성 섬유증과 혈우병과 같은 유전적 기형을 테스트하는 기법을 밝힘
◦미국 FDA는 유전자 이식 음식이 유전적으로 위험하지도 않고 특별한 규정도 필요 없다고 선언함
⋙ 1993년
◦미국 FDA, 낙농가의 우유생산 촉진을 위해 BST(Borine Somatotropin)를 승인
⋙ 1994년
◦미국 FDA, 생명공학으로 만들어진 FLAVRSAVRTM tomato 승인
◦최초로 유방암 유전자 발견
◦CF 환자의 폐에 단백질이 쌓이지 않게 하는 재조합 인간 DNase 승인
◦소 성장호르몬(POSILAC)이 상용화됨
⋙ 1995년
◦에이즈 환자에게 최초로 비비의 골수가 이식됨
◦최초로 바이러스 이외의 살아있는 유기체(Hemophilus Influenzae)의 완벽한 유전자 배열이 완성됨
◦암정복을 위해 면역시스템 모듈, 유전자 재조합 항체형성과 같은 유전자 치료가 도입됨
⋙ 1996년
◦파킨슨병과 관련된 유전자의 발견으로 퇴행성 신경질환의 잠재 가능한 치료와 그 원인 연구의 중요한 이정표를 제시함
⋙ 1997년
◦스코틀랜드에서 어른세포로 복제된 최초의 복제양 Dolly 탄생
◦해충방지 농작물인 Roundup ReadyTM 콩과 BollgardTM 해충방지 면화와 같은 작물이 상업화 됨
◦아르헨티나, 호주, 캐나다, 중국, 멕시코와 미국 등 전 세계적으로 500만 에이커 면적에서 유전자조작 작물이 재배됨
◦Oregon주 연구자들은 두 마리의 붉은 털 원숭이를 복제했다고 주장함
◦유전병 연구의 새로운 기술을 창조하기 위해 PCR, DNA 칩과 컴퓨터를 결합한 새로운 DNA기술 탄생
⋙ 1998년
◦하와이대학 연구진이 어른의 난소 적(cumulus)세포 핵으로부터 쥐를 복제함
◦인간 배아줄기세포주가 확립됨
◦일본 Kinki 대학 연구진은 한 마리 어른암소로부터 얻은 세포를 이용하여 8마리의 동일 송아지 복제함
◦최초로 C. elegans 벌레에 대한 동물 게놈 염기서열 해독 완료
◦30,000개 이상의 유전자 위치를 보여주는 인간 게놈지도의 초안 완성
◦동남아시아 다섯 나라가 병에 강한 파파야 나무를 개발하기 위해 컨소시엄을 구성
⋙ 1990년대
◦최초로 영국에서 유전자 지문법을 이용해 유죄를 판결함
◦규정 질량의 일반적 융기에 착상된 유전자 분리성공
◦유전성 대장암이 DNA 치료 유전자의 결핍으로 야기된다는 사실 발견
◦유전자 재조합 광견병 백신을 너구리에 실험
◦미국에서 농약을 기본으로 한 생명공학 제품판매 승인
◦특수이식 유전자를 가진 쥐에 관한 특허 허용
◦최초로 유럽에서 발암물질에 민감한 유전자변형 쥐에 관한 특허 제기
◦유방암 유전자 복제
⋙ 2000년
◦최초로 애기장대(학명 Arabidopsis thaliana)의 게놈지도 개발
◦13개 나라에서 총 1억 89만 에이커 면적에서 생물공학 농작물이 재배됨
◦최초로 바이러스에 강한 고구마가 케냐에서 실질 시험됨
◦인간게놈 배열의 초안 발표
⋙ 2001년
◦최초로 벼 게놈지도 완성
◦오스트리아 연구진들은 Barley Yellow Dwarf Virus와 같은 바이러스 예방백신에 사용되는 hairpin RNA를 이용한 기술개발을 보고함
◦Chinese National Hybrid 연구진들은 일반 쌀 생산량보다 두 배 많은 super rice종 개발을 보고함
◦유럽위원회(The European Commission)가 모든 유전자 변형 식품에 라벨을 붙일 것을 제기함
◦농업적으로 중요한 시노라이조비움 멜리로티(Sinorhizobium meliloti) 박테리아의 DNA배열 완성
◦염분이 있는 물과 땅에서 성장 가능한 최초의 농작물을 만들기 위해 애기장대로부터 추출된 유전자를 토마토에 이식함
◦농업에 중요한 식물병원균 Agrobacterium tumefaciens의 게놈서열이 공표됨
◦스트레스에 더 강한 농작물 개발의 실마리로서, 손상을 입거나 스트레스를 받았을 때 빛을 발하는 세일 크레스(thale cress)라 불리는 실험용 식물 재배
◦최초로 땅콩의 종합적 분자지도가 완성됨
⋙ 2002년
◦완성된 인간 게놈 배열을 과학전문지에 게재함
◦효모의 프로테옴(Proteome: 단백질 간 상호작용과 네트워크의 총합)의 기능지도(functional map)의 초안 완성, 효모의 게놈지도는 1996년에 발표되었음
◦줄기세포의 분화에 관여하는 조절인자 연구에 큰 발전이 있었으며, 이에 관여하는 200여개의 유전자가 밝혀짐
◦생명공학 농작물이 16개국, 1억 4천 5백만 에이커에서 재배되고 있으며 이는 2001년보다 12% 증가한 것임
◦자궁경부암에 대한 백신 개발에 성공하였으며 이는 특정 암에 대한 예방백신이 가능함을 처음으로 보여준 성과임
⋙ 2003년
◦인간게놈 완전 해독(4월)
◦정신분열증과 우울증 등 정신병의 발병 위험을 증가시키는 특정유전자 변형을 확인한 연구결과 발표
◦美최초의 GM 애완동물로 광고된 붉은 빛 형광물고기 GloFish 상업화
◦세계적으로 생명공학작물 이용의 활성화 증대
◦영국은 최초로 상업적인 생명공학작물인 제초제 저항옥수수를 인정
◦미국 환경 보호국은 최초로 형질전환 해충저항성 옥수수를 승인함
◦2003년 banteng 들소가 최초로 복제되었으며, 노새, 말, 사슴도 복제되었음
◦1997년 포유동물의 최초 복제양 돌리는 폐병연구 후에 안락사 됨
◦일본 연구팀은 자연적으로 카페인을 제거하는 생명공학 커피를 개발함
◦RNA 형태는 유전자 형식을 지시, 변형시키며 줄기세포와 배(胚)의 성장에 영향을 미침을 밝힘
◦쥐의 배 세포줄기가 정자나 난자 세포로 성장할 수 있음을 확인
◦남성을 결정짓는 Y염색체가 동일한 유전자를 함유하고 있음을 발견
◦종양으로 하여금 암의 전이에 필요한 혈관을 생성하지 못하도록 하는 약물의 개발
⋙ 2004년
◦미국 식품의약국(FDA)은 아바스틴이라는 최초의 신세대 항암제를 승인함.
◦FDA는 다양한 종류의 약물치료와 질병을 위해 첫 DNA칩 및 유전자칩 개발
◦RNA 방해 제품으로, 임상 시험에 들어가는 첫 번째 RNAi 제품 생산
◦국제연합 식량농업기구(FAO)의 생명공학 작물 승인
◦국립과학연구원 산하 의학연구소에서는 ʻ생명공학작물이 건강에 해를 끼치지 않는다.ʼ라고 밝힘.
◦FDA는 식품안전성 검토 후 생명공학 밀의 안전성 밝힘.
◦몬산토사는 지방산을 감소 삭제한 low-linolenic 콩을 소개함
◦닭 게놈 DNA 완전 해독
◦최초로 애완 새끼고양이 복제
◦ʻ쓸모없는 DNA(junk DNA)ʼ 구명
◦인간의 유전자 DNA 중 단백질을 합성하는 DNA는 전체 게놈의 10%에 불과하며 아무런 기능이 없는 DNA에 대한 구명 이루어짐
◦지난 3월 영국의 과학자들, 지난 20년간 나비 58종의 개체 수가 71% 줄었으며, 조류는 54% 감소했다고 보고
◦新의약품 개발 활발
◦유엔(UN), 대학, 민간자선단체, 제약업체 등 공공단체와 민간기업이 손을 잡고 미개발국의 환자를 위해 의약품을 개발하는 새로운 움직임이 일어남.
◦미생물게놈 추출성공, 인간게놈프로젝트 주역인 미국 크레이크 벤터 박사는 3월 사이언스에 바닷물에서 미생물 게놈을 추출해 10억 5,000만 염기쌍을 한꺼번에 분석하는 데 성공했다고 밝힘
⋙ 2005년
◦게놈지도와 야외 관찰로 진화가 일어나는 복잡한 과정을 밝힘
◦유럽 호이겐스 탐사선이 토성의 달 타이탄에 착륙하고, NASA의 Deep Impact가 혜성에 충돌한 실험 등
◦분자 생물학자들이 봄에 꽃이 다양한 색깔을 내게 하는 원리를 발견
◦위성과 지상망원경으로 도시 크기의 죽은 별들인 중성자별 관찰
◦정신분열증, 난독증, 안면경련증과 같은 뇌 신경질환 연구
◦외계에서 온 암석과 지구의 암석을 비교 분석한 결과 지구 생성에 대해 새로운 이론 설립
◦volage-gated potassium channel의 분자 구조 밝힘
◦인간 활동에 의한 지구 온난화의 증거 추가 발견
◦분자 생물학자들이 복잡한 시스템의 행태를 이해하기 위해 엔지니어 기술 이용
◦120억 달러 규모의 국제 핵융합 실험로(International Thermonuclear Ex-perimenta Reactor) 위치가 18개월의 논란 끝에 프랑스 Cadarache로 결정
◦Z 나선형 DNA와 B 나선형 DNA의 결합구조 구명, 네이처지 게재
⋙ 2006년
◦네안데르탈인 DNA 염기서열 분석
◦급진전되는 지구 온난화 전망 제기
◦땅위를 걸어다닌 물고기 화석 발견
◦시력감퇴 치료제 개발
◦생물 다양성의 재발견
◦최첨단 현미경 기술 개발
◦기억메커니즘 구명 단초 발견
◦마이크로 RNA와 siRNA보다 약간 긴 새로운 RNA를 발견
◦미연방정부 연구비 천만 달러를 받아 일리노이 대학 연구팀이 진행하고 있는 돼지 게놈 해독은 2년 안에 완성될 것으로 기대
◦미 부시 대통령이 상하원 합동연설에서 농업 페기물로부터 바이오에탄올 생산 지원
◦미 NIH가 유방암 재발을 예측하기 위해 10년간, 만 명의 환자에 대해 유전자 검사를 실시하는 연구를 개시
◦미국 당뇨병 협회(ADA)가 농업 및 식량분야 생명공학에 대한 지원을 재확인
◦다우사가 최초의 식물 생산 백신에 대한 허가를 취득
◦Renessen사가 생명공학 기술을 이용하여 유용성이 추가된 작물에 대해 최초로 동물 사료로 판매할 수 있는 허가를 취득
◦USDA가 밀의 게놈연구를 위해 18개 대학 밀번식 컨소시엄에 연구비 오백만 달러 지원
◦오메가-3 지방산을 생산하는 형질전환 돼지 개발
◦세계무역기구는 EU가 21가지의 농업 생명공학제품에 대해 통상약정을 위반 했다고 발표
◦프랑스 농무부가 생명공학 옥수수 및 담배 작물에 대해 17가지의 새로운 실지 시험을 허가
◦마이크로RNA의 초기프로세싱 기전 구명
◦암 발생 억제기능 SUSP4 유전자의 분리 및 작용 메커니즘 구명
◦저분자화합물을 이용한 세포노화의 가역적 재프로그래밍
⋙ 2007년
◦AMPK 효소 항암기능 최초 구명. AMPK 활성화를 통해 대장암 세포가 정상으로 변화
◦체내 면역반응 조절 ʻ브레이크 장치ʼ 물질 발견
◦ʻ스페인감기ʼ 바이러스를 이용해 조류독감을 치료할 수 있는 길이 열림
◦화성에 물 존재 증거 발견
◦자연계에 존재하지 않는 D-아미노산을 손쉽게 합성할 수 있는 신기술 개발
◦수명이 다하거나 손상을 입은 세포에 죽음의 신호를 보내는 메커니즘 구명
◦암 발병을 억제하는 유전자의 기능 구명
⋙ 2008년
◦조류독감 인체 간 감염 유발 경로 찾았다(출처: Nature Biotechnology)
◦모유수유가 천식 등을 유발하는 항원에 대해 아이들을 어떻게 보호하는지에 대한 기전 구명(출처: Nature Medicine)
◦장내 세균과의 공생 기제 밝혀냈다(출처: Science)
◦인간배아줄기세포로 당뇨병 쥐 치료 성공(출처: Nature Biotechnology)
◦탈모유발 유전자 발견, 새 탈모약 개발기대(출처: Nature Genetics)
◦암 세포를 무제한 자라게 하는 ʻ효소단백질ʼ 확인(출처: Nature)
◦비만 원인 ʻ유전자 네트워크 이상ʼ(출처: Nature)
◦루게릭병 유발 ʻ유전자ʼ 찾았다(출처: Nature Genetics)
◦운동신경세포 분화과정 구명(출처: Developmental Cell)
◦알즈하이머치매 ʻ기억력ʼ 떨어뜨리는 핵심 단백질 구명(출처: Nature Genetics)
◦배꼽시계 등 생체회로 조절원리 구명(출처: Science)
◦예방법 없는 ʻ말라리아ʼ 백신 개발된다(출처: Nature Medicine)
◦물체 인식과정 구명, 실명치료 도움(출처: Nature)
◦항생제 ʻ페니실린ʼ 만드는 균 ʻ유전자서열ʼ 구명(출처: Nature Biotechnology)
◦유전자 제어 마이크로RNA 조절·사멸 메커니즘 구명(출처: Molecular Cell)
◦ʻ소리ʼ 잘 듣게 하는 귀 속 ʻ단백질ʼ 구명(출처: Nature)
◦인체 세포 죽이는 단백질 구명, 새로운 항암제 개발(출처: Nature)
◦日 연구팀 ʻ암세포ʼ 추적자 영상촬영물질 개발(출처: Nature Medicine)
⋙ 2009년
◦파킨슨병 등 신경퇴행성질환 유발 기전 구명(출처: Nature Medicine)
◦염색체 응축 ʻ단백질 복합체ʼ 분자구조 구명(출처: Cell)
◦마이크로 RNA 메커니즘 구명(출처: Cell)
◦ʻ고혈압ʼ 유발 유전자 변이 구명(출처: Nature Genetics)
◦단백질과 패혈증의 원인 물질인 세균의 내독소가 결합된 복합체의 분자구조를 세계 최초로 구명(출처: Nature)
◦당뇨 원인 인슐린 저항성 유발인자 발견(출처: Cell Metabolism)
◦장(腸) 세포의 세균 제거 기전 구명(출처: Developmental Cell)
◦소 유전자 지도 완성 ʻ축산혁명ʼ(출처: Science)
◦미칠 듯한 가려움증 ʻ긁어주면 좋아지는 이유ʼ 구명(출처: Nature Neurons)
◦다운증후군 ʻ암ʼ 잘 안 걸리는 이유 구명(출처: Nature)
◦자도 자도 졸린 ʻ기면증ʼ 면역계 기능 부전이 원인(출처: Nature Genetics)
◦체내 자연 발생 ʻ표백성분ʼ 상처회복 돕는다(출처: Nature)
◦사람 줄기세포로 뇌졸중 쥐 치료성공(출처: Gene Therapy)
◦한국 남성 ʻ유전자 서열ʼ 밝혔다(출처: Nature)
◦NMR로 생체막 단백질 구조 구명(출처: Science)
◦줄기세포 분화조절 단백질 발견(출처: Cell)
◦ʻ새벽잠 없는 이유 있다ʼ, 적게 자게 하는 유전자 발견(출처: Science)
⋙ 2010년
◦배아줄기세포 치매치료제 국내서 첫 임상 실시
◦혈관치료용 마이크로 로봇 개발(세계 최초로 살아있는 미니돼지의 혈관에 주입돼 이동하는 실험 성공)
◦0.3mm 핏줄까지 보이는 세계에서 가장 선명한 사람 뇌지도『7.0 Tesla MRI Brain Atlas』 발간
◦나노 소재로 인공 광합성 성공
◦세계 최초 암 관련 신규 유전자 발굴
◦암 진행과 전이 매커니즘 구명
⋙ 2011년
◦인체면역결핍바이러스 예방 치료 네트워크(HPTN) 052
◦밝혀진 인간의 기원 : 현생 인류의 DNA 일부가 네안데르탈인 게놈과 연관되었다는 사실 발견
◦식물광합성 촉매 구조 구명 : 물 분해 촉매가 되는 막단백질 복합체의 구조 구명
◦말라리아 백신 : ʻRTS,Sʼ 말라리아 백신이 아프리카 영유아의 말라리아 감염률을 50% 이상 감소시킴
◦인간 장 속 미생물 : 인간의 장속 미생물이 혈액형과 같이 크게 3가지로 나뉨. 군집 종류에 따라 질병, 체질, 식습관이 달라짐
◦노화세포제거 : 실험쥐의 노화세포를 제거하자 백내장, 근육 손실 등의 현상이 사라지고 나이 들어도 운동능력 저하되지 않는다는 사실 발견
⋙ 2012년
◦한국 식약청서 동종(타가) 줄기세포 치료제 판매를 세계최초로 승인.
◦유럽의약청(EMA)이 서구 최초로 유전자치료제를 승인하고 희귀유전질환 지단백지질분해효소결핍증(LPLD) 치료제 글리베라(Glybera)를 판매를 허가
◦먹는 C형간염치료제, 미국 FDA 승인.
◦한국기업 셀트리온, 세계 최초의 항체 바이오시밀러인 ʻ램시마ʼ 출시
◦뇌신경세포 신호전달 원리 구명
◦체세포를 성체줄기세포로 직접교차분화를 유도하는데 성공
◦아시아인 당뇨-비만에 관계하는 새로운 유전변이 현상 및 요인 발견
◦자폐증에 관여하는 새로운 유전자 및 발병원인 발견
⋙ 2013년
◦인간 배아줄기세포 복제 성공. 태아의 피부세포를 핵을 제거한 난자에 융합시켜 인간 배아줄기세포를 만들고, 이후 심장세포로 자라게 하는 데 성공.
◦ʻDNA 백과사전ʼ 완성. 기능이 거의 없어 98%의 쓰레기 DNA(Junk DNA)의 기능이 거의 없고 정체가 불투명한 쓸모없는 유전자들로 ʻ쓰레기ʼ 가 인간 질병과 돌연변이에 관여한다는 사실 구명.
◦유도만능줄기세포(iPS) 임상 연구를 세계 최초로 승인. 삼출형가령황반변성 (滲出型加齢黄斑変性)이라는 눈의 난치병의 환자로부터 만들어낸 iPS를 망막색소 상피세포로 변화시켜 손상된 부분에 이식하는 방식.
◦iPS 이용해 인간의 ʻ간ʼ 조직 배양 성공
◦대사공학 기술을 이용해 대장균으로 휘발유 및 벤젠의 인공합성에 성공
◦태아 중뇌에서 추출한 줄기세포로 만든 ʻ도파민 신경전구세포ʼ를 파킨슨병 환자의 뇌 피각부에 이식하는데 성공.
◦mRNA의 비정상적인 기능 인식과 제거에 관한 메커니즘 구명.
◦포유류 신경 재생 메커니즘 구명. 포유류의 말초신경 재생 메커니즘 구명. 중추신경에 적용할 경우 하반신 및 전신 마비환자 치료가능성 열려.
⋙ 2014년
◦N-말단 메티오닌, 세포내 단백질 분해 신호의 발견(Cell, 2014/01/16)
◦고추 유전체서열 국내 독자 기술로 완성(Nature Genetics, 2014/01/19)
◦혈액암의 한 유형인 악성림프종 돌연변이 유전자 구명(Nature Genetics, 2014/03/03)
◦비만 조절하는 핵심 수용체 발견(Cell Metabolism, 2014/03/04)
◦철 대사를 조절하여 병원성 세균의 증식을 억제하는 항균제제 후보물질 발견(Nature Medicine, 2014/03/23)
◦성인체세포 이용한 줄기세포주 세계 최초 확립(Cell Stem Cell, 2014 /04/18)
◦빛으로 세포 내 단백질을 원격 조정한다(Nature Methods, 2014/05/04)
◦C형간염바이러스의 면역회피 메커니즘 구명(Gastroenterology, 2014/05/19)
◦면역억제제 부작용 유발하는 유전자 발견(Nature Genetics, 2014/08/11)
◦초기 배아 단계의 마이크로RNA 조절 현상 구명(Molecular Cell, 2014/ 11/13)
⋙ 2015년
◦표적유전자만 제거, ‘크리스퍼 유전자 가위’ 정확성 입증(Nature Methods, 2015/02/10)
◦혈압 조절에 중요한 단백질 세포 속 분해과정(Science, 2015/03/13)
◦한의학 처방 원리(군신좌사) 구명(Nature Biotechnology, 2015/03/06)
◦피로물질 젖산, 세포신호물질로 새로운 기전 발견(Cell, 2015/04/16)
◦유해 단백질의 분해 작용원리와 최종 변화과정 구명(Nature Cell Biology, 2015/06/15)
◦암줄기세포 에너지 대사 구명(Gastroenterology, 2015/06/16)
◦급성 골수성 백혈병의 새로운 신호 전달 경로 구명(Cell Stem Cell, 2015/07/23)
◦항암 효과 뛰어난 GITR 항체의 작용기전 밝혀(Nature Medicine, 2015/ 08/17)
◦뇌종양 재발위치에 따른 유전체 변이 패턴 세계최초 구명(Cancer Cell, 2015/09/14)
◦빛으로 칼슘 농도 조절하고 기억력 높여(Nature Biotechnology, 2015/ 09/15)
⋙ 2016년
◦microRNA(이하 miRNA) 생성에 결정적 역할을 하는 드로셔(DROSHA) 단백질의 3차원 구조를 세계 최초 구명(Cell, 2015/12/31)
◦음식물에 든 항원(음식 유래 항원)들이 소장 내 면역 반응 억제에 큰 역할을 담당한다는 사실 구명(Science, 2016/01/29)
◦가장 젊고 분화능력이 뛰어난 최상위 혈액-줄기세포의 선별 방법을 개발(Cell Stem Cell, 2016/03/18)
◦세계 최대 규모의 유방암 환자 전장유전체(全長遺傳體, 전체 유전자 염기서열)를 분석(Nature, 2016/05/3)
◦생존에 필수적인 오토파지(자가포식)작용을 조절하는 새로운 신호를 발견하여 오토파지의 작동 기전을 세계 최초 구명(Nature, 2016/06/15)
◦뇌신경망을 형성・유지하는 새로운 기전을 세계 최초 발견(Cell, 2016/06/16)
◦생체조직과 무기물의 결합으로 전기 없이 움직일 수 있는 바이오 하이브리드 로봇을 세계 최초 개발(Science, 2016/07/8)
◦당뇨병 발병에 직접적으로 영향을 주는 혈당, 체내 대사조절관련 16개 신규 유전요인(부모로부터 물려받은 유전정보 중 질병 발생과 관련된 요인)을 발굴(Natrue, 2016/7월호)
◦암과 치매 등 각종 질병을 유발시키는 것으로 알려진 단백질의 비정상적인 변형을 구현할 수 있는 맞춤형 단백질 변형기술을 세계 최초 개발(Science, 2016/09/29)
◦우리 몸에서 병을 일으키는 감염원을 제거하는 초기 방어 시스템을 세계 최초 구명(Nature Microbiology, 2016/10/17)
⋙ 2017년
◦조울증 일으키는 핵심 단백질의 작용 메커니즘 구명(Molecular Psychiatry, 2017/01/31)
◦무독성 살모넬라균에 의한 암 치료 강화기술 개발(Science Translational Medicine, 2017/02/09)
◦뇌종양 유전체의 시공간적 구조 분석을 통해 최적의 표적치료 전략 제시(Nature Genetics, 2017/04/01)
◦홍합의 접착 단백질과 인체 조직에서 추출한 자연치유 성분을 결합하여, 상처 치료 기능과 흉터 방지 기능을 함께 갖춘 혁신적인 의료용 접착제를 개발(Biomaterials, 2017/04/26)
◦문어 빨판의 독특한 돌기 원리를 밝히고, 이를 모사하여 습한 환경에서도 접착제 없이 탈부착할 수 있는 고점착 패치 소재를 세계 최초로 개발(Nature, 2017/06/15)
◦빅데이터 분석을 통해 종양 주변의 면역세포가 종양의 진화 및 항암 치료에 미치는 영향을 구명(Cancer Cell, 2017/07/10)
◦나노 일렉트로닉스라는 개념의 전자기화 된 금 나노입자를 활용한 신개념 ‘세포 직접교차분화 리프로그래밍’ 기술을 세계 최초 개발(Nature Nanotechnology, 2017/07/18)
◦간경화 환자의 몸에서 간암이 유발되는 신규 신호경로 규명(Gastroenterology, 2017/07/20)
◦인간배아에서 비후성 심근증의 원인이 되는 돌연변이 유전자를 크리스퍼 유전자 가위(CRISPR Cas9)로 교정하는데 성공(Nature, 2017/08/03)
◦IT-BT 융합연구를 통한 간암 치료효과 제고 방법 발견(Hepatology, 2017/ 08/23)
부록2
생명공학 주요 통계
1. 예산투자

주1) ʼ07~ʼ12년의 투자실적에는 출연기관의 투자실적(932억 원, 1,046억 원, 913억 원, 1,218억 원, 1,542억 원, 1,676억 원)이 포함됨
주2) ʼ94~ʼ16년 기간 동안의 정부투자는 총 22조 5,472억 원
주3) ʼ17년도 수치는 실적치가 아닌 ʼ17년도 생명공학육성시행계획상의 계획치임
주4) 보건복지부 ʻ첨단의료복합단지조성사업ʼ의 시설 및 기반구축 완료로 ʼ13년 대비 ʼ14년 정부부문 생명공학 투자액 감소(약 2천억 원 감소)
출처 : 연도별 생명공학육성시행계획 자료가공
[그림 부록 1] 정부부문 생명공학 BT 투자 실적(1994∼2017년)
[표 부록 1] 국내 부처별 BT 투자 실적 및 계획(2016∼2017)
(단위 : 백만 원, %)
|
구분 |
’17년 투자계획 |
’16년 실적(B) |
증감율 ((A-B)/B) |
|||
|
연구개발 |
인프라 |
인력양성 |
합계(A) |
|||
|
과학기술 정보통신부 |
1,193,281.9 |
82,651 |
- |
1,275,932.9 (40.9%) |
1,171,347.8 |
8.9 |
|
교육부 |
111,710 |
- |
112,316 |
224,026 (7.2%) |
273,806 |
Δ18.2 |
|
농림축산식품부 |
640,528 |
4,800 |
- |
645,328 (20.7%) |
665,157 |
Δ3.0 |
|
산업통상자원부 |
226,186 |
49,037 |
2,480 |
277,703 (8.9%) |
290,422 |
Δ4.4 |
|
보건복지부 |
437,876 |
21,670 |
- |
459,546 (14.7%) |
469,591 |
Δ2.1 |
|
환경부 |
29,873 |
1,034 |
- |
30,907 (0.9%) |
30,966 |
Δ0.2 |
|
해양수산부 |
138,027 |
22,353 |
- |
160,380 (5.2%) |
154,496 |
3.8 |
|
식품의약품 안전처 |
39,231 |
917 |
- |
40,148 (1.3%) |
37,098 |
8.2 |
|
총계 |
2,816,713.2 |
182,462 |
114,796.0 |
3,113,971.2 |
3,092,883.8 |
0.7 |
출처: 2017년도 생명공학육성시행계획(2017.12)

-’17년 예산 비중은 과학기술정보통신부 41.0%, 농식품부 20.7%, 복지부 14.8%, 산업부 8.9%, 교육부 7.2%, 해수부 5.2%, 식약처 1.3%, 환경부 1.0%를 투자
출처 : 2017년도 생명공학육성시행계획(2017.12)
[그림 부록 2] 부처별 생명공학분야 연구개발비 투자 비중(2017)

-5대 기술분야별 투자는 생명과학(44.77%), RED(20.76%), GREEN(20.15%), White(7.61%), 융합신산업(6.71%) 순으로 나타남
출처 : 2017년도 생명공학육성시행계획(2017.12)
[그림 부록 3] 5대 분야별 연구개발 투자 비중(2017)
[표 부록 2] 5대 분야별 연구개발 투자 비교(2016∼2017)
(단위 : 백만 원)
|
구분 |
2016 실적 |
2017 계획 |
증감율(%) |
|
생명과학 |
1,221,322.0 |
1,261,076.0 |
3.25 |
|
RED 분야 |
586,045.4 |
584,883.4 |
Δ0.2 |
|
Green 분야 |
579654.0 |
567597.1 |
Δ2.08 |
|
White 분야 |
214,991.1 |
214,217.2 |
Δ0.36 |
|
융합신산업 분야 |
183,997.9 |
188,940.1 |
2.69 |
|
합계 |
2,786,010.4 |
2,816,713.8 |
1.1 |
출처 : 2017년도 생명공학육성시행계획(2017.12)
[표 부록 3] 부처별 BT분야 연구개발 투자 비교(2016∼2017)
(단위 : 백만 원)
|
구분 |
2016 실적 |
2017 계획 |
증감율(%) |
|
과학기술정보통신부 |
1,091,713.8 |
1,193,281.9 |
9.30 |
|
교육부 |
160,529 |
111,710 |
Δ30.41 |
|
농립축산식품부 |
660,357 |
640,528.3 |
Δ3.00 |
|
산업통상자원부 |
227,680 |
226,186 |
Δ0.66 |
|
보건복지부 |
448,766 |
437,876 |
Δ2.43 |
|
환경부 |
29,582 |
29,873 |
0.98 |
|
해양수산부 |
131,106 |
138,027 |
5.28 |
|
식품의약품안전처 |
36,277 |
39,231 |
8.14 |
|
합계 |
2,786,010.8 |
2,816,713.2 |
1.1 |
출처 : 2017년도 생명공학육성시행계획(2017.12)
[표 부록 4] 정부 및 민간 바이오 연구개발 투자 현황(2012∼2015)
(단위 : 억 원)
|
구분 |
2012 |
2013 |
2014 |
2015 |
|
정부 |
27,509 |
28,770 |
29,730 |
33,019 |
|
민간 |
14,950 |
16,273 |
18,367 |
26,927 |
|
합계 |
42,459 |
45,043 |
48,097 |
59,946 |
출처 : 한국과학기술기획평가원, 2015년도 연구개발활동조사보고서(2017.1), NTIS 과학 기술통계서비스, 생명공학정책연구센터 재가공
(단위 : 억 원)

출처 : 한국과학기술기획평가원, 2015년도 연구개발활동조사보고서(2017.1), NTIS 과학 기술통계서비스, 생명공학정책연구센터 재가공
[그림 부록 4] 정부 및 민간 바이오 연구개발 투자(2012∼2015)
2. 시설 및 인프라

-부처별 시설 및 기반구축 투자는 과학기술정보통신부 45.3%, 산업통상자원부 26.9%, 해양수산부 12.3%, 보건복지부 11.9%, 환경부 0.6%, 식품의약품안전처 0.5% 순으로 나타남 ※ 시설 및 기반구축 영역에 대한 실적/계획이 없는 부처는 제외
출처 : 2017년도 생명공학육성시행계획(2017.12)
[그림 부록 5] 부처별 시설 및 기반구축 투자 계획(2017)
[표 부록 5] 부처별 시설 및 기반구축 투자 계획
(단위 : 백만 원)
|
구 분 |
과기정통부 |
농식품부 |
산업부 |
복지부 |
환경부 |
해수부 |
식약처 |
합계 |
|
2016실적 |
79,634 |
4,800 |
60,062 |
20,825 |
1,384 |
23,390 |
821 |
190,916 |
|
2017계획 |
82,651 |
4,800 |
49,037 |
21,670 |
1,034 |
22,353 |
917 |
182,462 |
|
증감률(%) |
3.8 |
0.0 |
Δ18.4 |
4.1 |
Δ25.3 |
Δ4.4 |
11.7 |
Δ4.43 |
출처 : 2017년도 생명공학육성시행계획(2017.12)
3. 인력양성
[표 부록 6] 생명공학분야 인력양성 실적(2012∼2016)
(단위 : 명, 건)
|
구 분 |
2012 |
2013 |
2014 |
2015 |
2016 |
|
|
우수인력 배출 |
석사 |
2,990 |
2,351 |
2,581 |
2,263 |
2,048 |
|
박사 |
1,407 |
1,153 |
1,270 |
1,233 |
4,374 |
|
|
국제교류 인력 |
해외연구자 유치 |
407 |
772 |
384 |
286 |
319 |
|
국내연구자 파견 |
170 |
233 |
250 |
663 |
230 |
|
|
참여연구 인력 |
68,244 |
36,273 |
68,954 |
95,763 |
104,088 |
|
|
국제 학술대회 개최 |
428 |
1,019 |
1058 |
1,126 |
906 |
|
출처: 연도별 생명공학육성시행계획 자료가공

-기관별 인력양성 투자는 교육부 97.8%, 산업부 2.2% 순으로 나타남 ※ 인력양성 영역에 대한 실적/계획이 없는 부처는 제외
출처: 2017년도 생명공학육성시행계획(2017.12)
[그림 부록 6] 기관별 인력양성 투자 계획(2017)
[표 부록 7] 인력양성 영역의 관계부처별 투자실적 및 계획(2016∼2017)
(단위 : 백만 원)
|
구분 |
교육부 |
산업부 |
합계 |
|
2016실적 |
113,277 |
2,680 |
115,957 |
|
2017계획 |
112,316 |
2,480 |
114,796 |
|
증감률(%) |
Δ0.9 |
Δ7.5 |
Δ1.0 |
출처: 2017년도 생명공학육성시행계획(2017.12)
(단위: 명)

주) 생명공학분야: 교육통계에 제시된 소계열 분류 중 12개 소계열이 해당(농업학, 동물·수의학, 보건학, 산림·원예학, 생명과학, 생물학, 약학, 의료공학, 의학, 재활학, 치의학, 한의학)
출처 : 생명공학정책연구센터, 교육통계서비스(http://cesi.kedi.re.kr/index) 자료 가공(2018.1)
[그림 부록 7] 국내 생명공학분야 졸업자 현황(2012∼2016)
[표 부록 8] 국내 바이오 졸업자의 학위별/성별 현황(2012∼2016)
(단위 : 명)
|
구분 |
석사 |
박사 |
총계 |
||||||
|
남자 |
여자 |
소계 |
남자 |
여자 |
소계 |
||||
|
2012 |
4,283 |
4,717 |
9,000 |
1,958 |
1,131 |
3,089 |
12,089 |
||
|
2013 |
4,554 |
5,083 |
9,637 |
1,915 |
1,218 |
3,133 |
12,770 |
||
|
2014 |
4,665 |
5,168 |
9,833 |
1,905 |
1,282 |
3,187 |
13,020 |
||
|
2015 |
4,593 |
5,190 |
9,783 |
1,749 |
1,204 |
2,953 |
12,736 |
||
|
2016 |
4,629 |
5,271 |
9,900 |
1,900 |
1,316 |
3,216 |
13,116 |
||
출처 : 생명공학정책연구센터, 교육통계서비스(http://cesi.kedi.re.kr/index) 자료 가공(2018.1)
4. 산업
1) 글로벌 바이오산업
(단위 : 십억 달러, %)

출처 : MarketLine, MarketLine Industry Profile Global Biotechnology(2017.10), 생명공학정책연구센터 재가공
[그림 부록 8] 글로벌 바이오시장 현황 및 전망(MarketLine 기준)
[표 부록 9] 글로벌 바이오 시장 현황 및 전망(MarketLine 기준)
(단위 : 십억 달러, %)
|
구 분 |
2016 |
2017 |
2018 |
2019 |
2020 |
2021 |
|
시장 규모 |
353.9 |
376.6 |
405.2 |
440.7 |
483.6 |
533.9 |
|
성장률 |
5.9 |
6.4 |
7.6 |
8.8 |
9.7 |
10.4 |
출처 : MarketLine, MarketLine Industry Profile Global Biotechnology(2017.10), 생명공학정책연구센터 재가공
[표 부록 10] 주요 국가별 바이오 분야 활동 기업 수(2011∼2015)
(단위: 개)
|
주요 국가 |
2011 |
2012 |
2013 |
2014 |
2015 |
|
Austria |
- |
128 |
- |
143 |
- |
|
Belgium |
350 |
- |
362 |
- |
- |
|
Brazil1) |
160 |
- |
- |
309 |
- |
|
Czech Republic |
109 |
124 |
109 |
113 |
126 |
|
Denmark2) |
127 |
- |
134 |
- |
118 |
|
Estonia |
45 |
42 |
42 |
31 |
- |
|
Finland |
157 |
- |
- |
- |
170 |
|
France |
1,638 |
1,944 |
1,884 |
1,805 |
- |
|
Germany |
678 |
693 |
700 |
710 |
726 |
|
Ireland |
237 |
- |
- |
- |
- |
|
Italy |
488 |
499 |
517 |
524 |
526 |
|
Korea |
890 |
935 |
939 |
944 |
948 |
|
Mexico1) |
- |
- |
154 |
- |
- |
|
Norway |
182 |
184 |
200 |
225 |
268 |
|
Poland |
91 |
90 |
122 |
126 |
160 |
|
Portugal |
151 |
134 |
131 |
151 |
- |
|
Slovak Republic |
15 |
- |
- |
- |
- |
|
Slovenia |
33 |
36 |
36 |
24 |
28 |
|
Spain |
3,025 |
3,070 |
2,831 |
2,742 |
2,981 |
|
Sweden1) |
94 |
- |
105 |
- |
133 |
|
Switzerland |
- |
233 |
- |
- |
265 |
|
United States3) |
- |
- |
- |
2,673 |
- |
주1) 브라질과 스웨덴은 직원이 10명 이상인 기업만을 산출, 멕시코는 직원이 20명 이상인 기업만을 산출
주2) 덴마크의 2015년 데이터는 예비 데이터
주3) 미국은 설문조사에 응한 기업만을 대상으로 직원이 5명 이상인 기업만을 산출(설문에 응하지 않은 기업에 대한 가중치 조정 미포함)
출처: OECD, Key Biotechnology Indicators-Number of firms active in biotechnology(2017.5)
2) 국내 바이오산업
(단위: 억 원)

출처: 산업통상자원부, 한국바이오협회, 2015년 기준 국내 바이오산업 실태조사 결과 보고서(2017.01)
[그림 부록 9] 바이오산업 수급 현황(2011∼2015)
[표 부록 11] 바이오산업 수급 현황(2011∼2015)
(단위 : 억 원, %)
|
구분 |
2011 |
2012 |
2013년 |
2014 |
2015 |
연평균 증감률 |
|
|
수급 (생산+수입) |
금액 |
79,574 |
85,756 |
88,980 |
90,076 |
98,694 |
5.5 |
|
증감률 |
10.6 |
7.8 |
3.8 |
1.2 |
9.6 |
||
|
생산 (국내판매+ 수출) |
금액 |
63,963 |
71,445 |
75,108 |
76,070 |
84,607 |
7.2 |
|
증감률 |
10.5 |
11.7 |
5.1 |
1.3 |
11.2 |
||
|
내수 (국내판매+ 수입) |
금액 |
52,081 |
55,281 |
57,337 |
56,024 |
56,181 |
1.9 |
|
증감률 |
9.6 |
6.1 |
3.7 |
Δ2.3 |
0.3 |
||
출처 : 산업통상자원부, 한국바이오협회, 2015년 기준 국내 바이오산업 실태조사 결과 보고서(2017.01)
[표 부록 12] 바이오산업 분야별 생산 현황(2011∼2015)
(단위 : 억 원, %)
|
구분 |
생산 |
||||||
|
2011 |
2012 |
2013 |
2014 |
2015 |
전년대비 증감률 |
연평균 증감률 |
|
|
전체 |
63,964 |
71,445 |
75,108 |
76,070 |
84,607 |
11.2 |
7.2 |
|
바이오의약산업 |
24,607 |
27,087 |
27,635 |
28,709 |
34,251 |
19.3 |
8.6 |
|
바이오화학산업 |
4,305 |
5,030 |
5,622 |
5,484 |
5,714 |
4.2 |
7.3 |
|
바이오식품산업 |
25,978 |
28,579 |
30,211 |
30,392 |
32,174 |
5.9 |
5.5 |
|
바이오환경산업 |
1,092 |
275 |
301 |
306 |
306 |
0.0 |
Δ27.2 |
|
바이오전자산업 |
1,164 |
1,238 |
1,517 |
1,543 |
1,602 |
3.8 |
8.3 |
|
바이오공정 및 기기산업 |
811 |
1,219 |
1,216 |
1,255 |
1,626 |
29.5 |
19.0 |
|
바이오에너지 및 자원산업 |
4,387 |
6,122 |
6,659 |
6,217 |
6,468 |
4.0 |
10.2 |
|
바이오검정, 정보서비스 및 연구개발산업 |
1,620 |
1,895 |
1,947 |
2,161 |
2,466 |
14.1 |
11.1 |
출처 : 산업통상자원부, 한국바이오협회, 2015년 기준 국내 바이오산업 실태조사 결과 보고서(2017.01)
[표 부록 13] 바이오산업 분야별 내수 현황(2011∼2015)
(단위 : 억 원, %)
|
구분 |
내수 |
||||||
|
2011 |
2012 |
2013 |
2014 |
2015 |
전년대비 증감률 |
연평균증감률 |
|
|
전체 |
52,081 |
55,281 |
57,337 |
56,024 |
56,181 |
0.3 |
1.9 |
|
바이오의약산업 |
27,367 |
28,194 |
28,490 |
27,514 |
27,514 |
0.0 |
0.1 |
|
바이오화학산업 |
4,354 |
4,749 |
5,147 |
4,972 |
5,239 |
5.4 |
4.7 |
|
바이오식품산업 |
10,989 |
13,019 |
13,666 |
14,032 |
13,275 |
Δ5.4 |
4.8 |
|
바이오환경산업 |
1,066 |
277 |
303 |
306 |
304 |
Δ0.7 |
Δ26.9 |
|
바이오전자산업 |
239 |
242 |
373 |
363 |
315 |
Δ13.1 |
7.2 |
|
바이오공정 및 기기산업 |
2,496 |
1,308 |
1,294 |
1,203 |
1,428 |
18.7 |
Δ13.0 |
|
바이오에너지 및 자원산업 |
4,237 |
5,959 |
6,504 |
5,870 |
6,083 |
3.6 |
9.5 |
|
바이오검정, 정보서비스 및 연구개발산업 |
1,333 |
1,533 |
1,560 |
1,764 |
2,022 |
14.6 |
11.0 |
출처: 산업통상자원부, 한국바이오협회, 2015년 기준 국내 바이오산업 실태조사 결과 보고서(2017.01)
[표 부록 14] 바이오산업 수출입 현황(2011∼2015)
(단위 : 억 원, %)
|
구 분 |
2011 |
2012 |
2013 |
2014 |
2015 |
연평균 증감률 |
|
|
수 출 |
금액 |
27,494 |
30,475 |
31,642 |
34,052 |
42,513 |
11.5 |
|
증감률 |
12.6 |
10.8 |
3.8 |
7.6 |
24.8 |
||
|
수 입 |
금액 |
15,612 |
14,311 |
13,872 |
14,006 |
14,087 |
Δ2.5 |
|
증감률 |
11.1 |
Δ8.3 |
Δ3.1 |
1.0 |
0.6 |
||
출처 : 산업통상자원부, 한국바이오협회, 2015년 기준 국내 바이오산업 실태조사 결과 보고서(2017.01)
(단위 : 개)

출처 : 산업통상자원부, 한국바이오협회, 2015년 기준 국내 바이오산업 실태조사 결과 보고서(2017.01)
주) 바이오사업장의 경우 공장 > 연구소 > 본사의 순서로 소재지 분석
[그림 부록 10] 2015년 바이오산업체 소재지별 분포
부록 3
생명공학 관계법령
|
소관부처 |
법률(34개) |
QR코드 |
|
과학기술 정보통신부 |
생명공학육성법(1983) |
|
|
뇌연구촉진법(1998) |
|
|
|
생명연구자원의확보관리및활용에관한법률(2009) |
|
|
|
농림축산식품부 |
가축전염병예방법(1961) |
|
|
동물보호법(1991) |
|
|
|
농림축산식품부 |
종자산업법(1995) |
|
|
친환경농어업육성및유기식품등의관리지원에관한법률(1997)(농식품부/해수부) |
|
|
|
산림자원의조성및관리에관한법률(2005)(산림청) |
|
|
|
농업생명자원의보존관리및이용에관한법률(2007) |
|
|
|
식품산업진흥법(2007)(농식품부/해수부) |
|
|
|
농림식품과학기술육성법(2009) |
|
|
|
산업통상자원부 |
신에너지및재생에너지개발이용보급촉진법(1987) |
|
|
산업통상자원부 |
산업기술혁신촉진법(1994) |
|
|
화학무기·생물무기의 금지와 특정화학물질·생물작용제 등의 제조·수출입 규제 등에 관한 법률(1996) |
|
|
|
유전자변형생물체의국가간이동등에관한법률(2001) |
|
|
|
보건복지부 |
감염병의예방및관리에관한법률(1954) |
|
|
보건의료기술진흥법(1995) |
|
|
|
천연물신약연구개발촉진법(2000) |
|
|
|
한의약육성법(2003) |
|
|
|
보건복지부 |
암관리법(2003) |
|
|
생명윤리및안전에관한법률(2004) |
|
|
|
저출산고령사회기본법(2005 |
|
|
|
첨단의료복합단지지정및지원에관한특별법 (2008)(복지부/과기정통부/산업부) |
|
|
|
제약산업육성및지원에관한특별법(2011) |
|
|
|
환경부 |
환경기술 및 환경산업 지원법(1994) |
|
|
생물다양성보전 및 이용에 관한 법률(2012) |
|
|
|
해양수산부 |
해양수산발전 기본법(2002) |
|
|
해양생태계의보전및관리에관한법률(2006) |
|
|
|
수산종자산업육성법(2015). |
|
|
|
해양수산생명자원의 확보ㆍ관리 및 이용 등에 관한 법률(2017) |
|
|
|
식품의약품 안전처 |
약사법(1954) |
|
|
의료기기법(2003) |
|
|
|
실험동물에관한법률(2008) |
|
|
|
식품・의약품등의안전기술진흥법(2015) |
|
※ 부처별 제정 연도순
부록 4 생명공학 용어정리
▶ 생명공학 관련 학문(-omics)
◎ 글라이코믹스(Glycomics)
당쇄를 인위적으로 목적한 기능을 갖게 변화시킴으로써 의약품 개발에 응용하려는 연구 분야이다.
※ 당쇄 : 단당류가 연쇄상으로 다수 결합된 분자로 일반적으로 생체의 세포 표면에 존재하는 당쇄를 지칭한다. 이러한 당은 당화(Glycosylation)되는 과정에서 단백질의 기능을 결정하거나 안정화시키는 데 중요한 역할을 한다.
◎ 기능유전체학(Functional genomics)
유전자와 유전자 산물의 기능, 유전자 산물 간의 상호작용을 밝히는 학문 분야이다. 이러한 연구를 통해 인간 유전자를 기능상으로 분류할 수 있으며, 이를 통해 질병 진단과 예후 예측, 치료제 개발에 유익한 정보를 제공할 수 있다.
◎ 단백질체학(Proteomics)
단백질의 3차원 구조분석, 기능 확인, 다른 생체물질과의 상호작용 등에 대한 연구를 통해 질병의 작용기구를 파악하고 신약개발에 활용하는 분야이다.
◎ 대사체학(Metabolomics)
세포 내에 존재하는 대사물의 총체인 대사체를 연구하는 학문이다.
◎ 독성유전체학(Toxicogenomics)
독성물질에 의해 발현양성이 변하는 유전자를 유전체학(genomics) 기법을 동원하여 대량으로 동정한 후 이 결과를 활용하여 개체의 독성물질 피폭 여부 등을 조사하는 학문 또는 기술이다. 이 기술을 이용하면 동물 또는 기타 시험관 내 방법에 비해 신속하고 정확하게 독성물질을 스크리닝할 수 있으며 한 번의 실험으로 다수 유전자의 변화를 분석할 수 있다.
◎ 약리유전체학(Pharmacogenomics)
개체 간에 나타나는 약물 효과, 독성 등의 차이를 개체의 유전적 요인과 관련지어 연구하는 학문 분야로, 개개인의 유전적인 요인을 파악해 약에 대한 반응성을 예측할 수 있도록 하는 것이 목표이다.
◎ 유전체학(Genomics)
게놈(genome)은 유전자(gene)와 염색체(chromosome)의 합성어로, 염색체에 담긴 유전자를 총칭하는 말이며, Genomics는 유전정보 전체(유전체)를 연구하는 학문분야를 말한다.
◎ 합성생물학(Synthetic Biology)
새로운 생물학적 부분(Part), 장치(Device), 시스템(System)을 디자인하고 구축하기 위해 또는 기존에 존재하는 자연 상태의 생물학적 시스템을 새로운 생물학적 시스템이나 인공생명체를 만드는 등 특정 목적으로 재설계(Redesign)하기 위해 사용하는 기술이다.
◎ 화학유전체학(Chemical Genomics)
Genomics와 조합화학이 결합된 분야로 유전자 분석을 통하여 특정 질환에 관련된 단백질 등 생체 내 타깃을 찾고 이와 반응할 수 있는 구조의 화합물들을 대량으로 합성하여 Lead(신약 후보의 구조적 출발물질)를 찾아내는 분야이다.
▶ 생명공학 관련 기타 학문
◎ 구조생물학(Structural biology)
단백질의 3차원 구조로부터 기능의 정보를 얻으려고 하는 학문적 영역이다.
◎ 나노기술(Nanotechnology)
10억 분의 1 수준의 정밀도를 요구하는 극미세가공 과학기술분야이다.
◎ 나노바이오
생명공학과 나노기술 상호간의 접목을 통하여 생명현상에 대해 분자수준의 이해를 증진시키며, 생명체 유래의 각종 물질들을 나노소재로 응용하는 연구이다.
◎ 뇌과학(Brain science)
뇌의 신비를 밝혀냄으로써 궁극적으로는 인간이 갖는 물리적·정신적 기능성의 전반을 심층적으로 탐구하는 응용 학문분야이다.
◎ 단백질공학(Protein engineering)
기존 단백질 구조와 기능 간의 관계를 규명하고 새로운 단백질을 설계하고 창출하는 기술이다. 아미노산 서열 결정, 유전자조작, 단백질 입체 구조 규명, 단백질의 분리와 정제, 컴퓨터 그래픽스 등의 기술이 요구된다. 신기능 효소, 고활성 효소, 의약용 단백질 개발에 이용된다.
◎ 당쇄공학(Glyco engineering)
천연에 존재하는 당쇄 구조 화합물의 기능․활성 규명, 구조 수식, 유도체 합성 등에 관련된 기술 분야이다. 당쇄 구조 화합물은 세포 간 인식, 정보 전달에 중요한 역할을 하는 것으로 알려져 있다.
◎ 대사공학(Metabolic engineering, Metabolomics)
생명체 대사과정의 네트워크를 각종 정보와 유전자조작 기술을 이용하여 유익한 방향으로 조절하려는 기술분야이다.
◎ 면역유전학(Immunogenetics)
개체간의 면역학적 차이를 연구하는 유전학 분야. 혈액형, 조직적합성, 면역 응답 등에 관련된 정보를 이용한다.
◎ 생명공학
생명공학은 생명과학으로부터의 과학적 발견에 기반하여 응용기술을 창출하여 산업에 적용하는 분야를 말한다. 생명공학은 농업에서의 품종개량 유전자공학등에 뿌리를 두고 있다.
◎ 생명과학
생명현상의 규명으로부터 생물기능의 응용연구에 이르기까지 생명체에 관련된 모든 연구분야를 총괄하는 과학군이다.
◎ 생물정보학(Bioinfomatics)
컴퓨터 기술을 활용하여 유전자와 관련된 정보를 해석하고, 기능과 구조를 밝혀내는 학문분야이다.
◎ 생체공학(Bionics)
생체 기작과 기능에 대한 공학적 지식을 응용하는 학문이다. 생체의 기능을 모방해 생체와 같이 동작하는 기계를 제작하는 기술 등이 포함된다.
◎ 세포공학(Cell engineering)
염색체나 유전자의 인위적인 조작 또는 이전 기술을 통해 유용한 유전자 형질을 발현할 수 있는 새로운 세포를 만들어 내는 기술이다. 세포융합에 의한 잡종 세포 형성을 이용하는 연구나 하이브리도마세포 제작을 비롯해 돌연변이주의 분리법이나 조직배양, 세포배양 기술 등이 포함된다.
◎ 시스템생물학(Systems biology)
생물 시스템을 구성하는 각각 요소의 행동을 해석할 뿐만 아니라, 전 구성 요소의 동적인 상호 관계를 시스템 전체 수준으로 분석해 고차적인 특성을 총체적으로 연구하는 학문이다.
◎ 의약 바이오(Red Biotechnology)
질병 치료 등에 활용되는 의약품을 개발하는 분야로 재조합 바이오 의약품(단백질 의약품, 치료용 항체, 백신, 유전자의약품 등), 재생 의약품(세포치료제, 조직 치료제, 바이오 인공장기 등), 저분자 및 천연물의약품, 바이오 의약 기반 구축 기술 등을 포함한다.
◎ 조직공학(Tissue engineering)
생명과학, 의학, 공학의 기본 개념과 기술을 바탕으로 하여 인공생체조직 또는 기관을 만들어 이용함으로써 생체 기능의 유지, 향상, 복원을 목표로 하는 학문 분야이다.
◎ 진화생물학(Tissue engineering)
지구 상의 생물의 진화를 연구하는 학문으로서, 찰스 다윈의 진화론의 영향으로 현대 생물학에서 빼놓을 수 없는 분과이다. 다윈의 진화론에 따르면 생물의 진화란 생물의 발전 과정을 뜻하며, 이 발전 과정을 더듬어 보는 일은 우선 생물이 무엇에서 발생하였는가를 밝히는 데에서부터 시작하여야 할 것이다.
◎ 해양생명공학(Marine biotechnology)
식량으로서의 어패류, 해조류의 이용, 조류 등의 에너지원으로서의 이용, 해양 생물로부터의 화학제품, 의약품 등의 추출, 정제 등이 포함되며, 이러한 목적을 위해 조직배양, 세포융합, 재조합DNA 기술 등을 활용하는 것을 해양생명공학이라 한다.
◎ 환경생명공학(Environmental biotechnology)
생명공학 기술을 이용한 오염물의 제거, 오염지역의 복원, 오염 탐지 및 측정, 생태 시스템 영향 평가 등 환경 관련 기술분야이다.
◎ 혈액학(Hematology)
혈액과 조혈기관에 관련된 사항을 다루는 학문분야이다.
▶ 생명공학 용어
◎ 게놈(Genome)
게놈은 유전자(gene)와 염색체(chromosome)의 합성어로서 한 생물체가 지닌 모든 유전정보(DNA)의 집합체를 뜻한다.
◎ 계대배양(Subculture)
미생물이나 동식물 세포를 증식 또는 유지할 때 그 일부를 새로운 배지에 계속 옮겨 배양하는 것을 말한다.
◎ 공통서열(Consensus sequence)
DNA, RNA 및 단백질의 일차 구조상에서, 특정 기능에 관계된 영역에 공통적으로 존재하는 염기나 아미노산 서열이다. DNA와 RNA의 경우, 특정 단백질의 결합 부위인 것이 일반적이다. 예를 들면, RNA중합효소의 결합 부위인 프로모터나 각종 전사 조절 단백질의 결합 부위에서, 각각의 단백질이 결합하는 특정 공통서열을 볼 수 있다.
◎ 과변이(Hypervariability)
셋 이상의 대립형이 나타나는 DNA 염기서열의 변화를 뜻한다.
◎ 광학분할(Optical resolution)
광학 이성질체 혼합물에서 원하는 광학 활성체를 분리하는 것이다. 광학 활성을 지닌 산 또는 염기를 이용하여 한 가지 광학 활성체에 대해서만 광학 활성염을 만든 다음 분리하는 방법이다. 광학 활성 분리용 담체에 의한 크로마토그래피법, 또는 미생물이나 효소에 의해 한 가지 광학 활성체에만 반응을 선택적으로 진행시킨 후 분리하는 방법 등이 있다.
◎ 균사체(Mycelium)
곰팡이나 버섯 등 균류의 몸체를 구성하는 실 모양의 구조체이다.
◎ 글루코사민(Glucosamine)
포도당에 아미노기가 결합된 대표적인 아미노당이다. 자연계에는 키틴을 비롯해 세균의 세포벽, 동물의 연골, 피부를 구성하는 뮤코다당류 등 다당류의 성분으로 널리 분포한다. 혈액이나 점액 속에도 이것과 결합한 당단백질, 당지질이 존재한다. 관절염 치료를 위한 건강식품으로 널리 사용된다.
◎ 기능성식품(Functional food)
생체 방어, 생체 리듬 조절, 질병 예방 등 생체 조절 기능을 충분히 발휘할 수 있도록 설계되고 가공된 식품을 말한다.
◎ 나노바이오센서(Nano-Biosensor)
IT, NT 기술과 BT기술을 융합한 U-헬스케어의 핵심 기반으로 나노바이오센서 기술은 대부분의 건강정보가 담겨 있는 혈액을 채취해 실시간으로 심근경색 등의 질환을 검사하고 조기에 예방할 수 있는 3세대 U-헬스케어 기술을 의미한다.
◎ 나노바이오테크놀로지(Nanobiotechnology)
나노기술과 생명공학기술이 접합된 형태의 기술 분야. DNA칩, 단백질칩, 초소형 바이오센서, 고속대량스크리닝(HTS) 시스템의 개발과 적용에 핵심적인 분야이다.
◎ 나선포자(helicospore)
1개의 주축으로 이루어지는데 180。이상 만곡되어 많은 경우 2~3회 소용돌이모양 또는 나선형으로 감겨 있는 포자. 모기향처럼 평면적으로 감는 것과 스프링처럼 입체적으로 감는 것이 있다. 무격벽 또는 유격벽으로 단실포자와 사상포자가 소용돌이모양으로 된 것이다.
◎ 내포체(Inclusion body)
외래 단백질이 숙주세포 내에서 과량 발현될 때 흔히 형성되는 불용성 단백질 덩어리이다. 내포체를 형성하면 단백질이 활성을 잃게 되므로 재접힘(refolding)을 통해 활성화시켜야 한다.
◎ 다기능효소(multifunctional enzyme)
하나의 효소가 2개 또는 3개 이상의 반응을 촉매하는 효소의 총칭. E.coli의 트립토판에서 유도 형성한 균체로부터 정제한 결정효소는 인돌+L-세린→L- 트립토판+H2O, L-트립토판+H2O→인돌+피루브산+NH3, L-세린→피루브산+NH3, L-시스테인+H2O→피루브산+NH3+H2S, 인돌+L-시스테인→L-트립토판+H2S의 여러 가지 반응을 촉매하는 것이다.
◎ 다운증후군(Down syndrome)
상염색체 중에서 가장 소형인G군에 속하는 제21염색체가 정상보다 1개가 많아 합계 3개 존재하는 것(21=염색체성)에서 나타나는 선천성 이상증후군. 정신지체, 낮은 코, 몸통에 비해 사지가 짧아 땅달막한 체형, 수지가 짧은 심기형 합병이 빈도 높게 나타나는 것이 특징이다.
◎ 다당류(Polysaccharide)
다수의 단당이 글리코시드결합에 의해 탈수축합한 고분자화합물. 여러 가지 방법으로 분류한다. 예를 들면 1종류의 구성당으로 된 단순다당(호모다당), 2종류 이상의 구성당으로 구성한 복합다당(헤테로다당), 중성당만으로 구성된 중성다당, 우론산이나 황산기를 포함하는 산성다당 등이다.
◎ 단백질(Protein)
아미노산을 단량체로 하는 고분자 유기화합물의 총칭으로 세포의 주요 구성 성분이다. 생명현상에 관여하는 효소, 항체, 호르몬 등이 포함된다.
◎ 단백질삼차구조(Tertiary structure of protein)
단백질 사슬 내에서 비교적 멀리 떨어진 기능기 간의 수소 결합, 이황화결합, 소수성 상호작용(hydrophobic interaction)등에 의하여 형성되는 입체 구조. 효소의 활성, 특이성 등 단백질의 기능과 밀접한 관계가 있다.
◎ 단백질칩(Protein chip)
실리콘, 유리 등의 표면에 여러 종류의 단백질을 고밀도로 고정화시킨 바이오칩의 일종이다. 단백질-단백질(항원-항체), 단백질-리간드, 단백질-DNA, 효소-기질 등 단백질이 관여하는 모든 상호작용의 분석에 이용된다. 이를 통해 생명 현상의 이해, 질병의 진단과 원인 규명, 신호 전달 체계의 이해가 가능하며, 궁극적으로 질병의 예방 및 치료법을 개발할 수 있다.
◎ 단세포단백질(Single-cell protein(SCP))
세균, 효모, 사상균, 방선균, 곰팡이, 조류 등의 미생물을 대량 배양하여 균체로부터 추출한 단백질, 사료첨가물이나 식품첨가물, 증량제로 사용된다.
◎ 단일클론항체(Monoclonal antibody)
단 하나의 항원성결정기에만 작용하는 항체로 하이브리도마 또는 재조합 미생물 배양을 통해 생산된다. 미량 물질의 분리, 감염증이나 암 진단과 치료 등과 같은 의료 분야에 있어서 중요한 역할을 한다.
◎ 당뇨망막병증
만성적으로 고혈당이 지속되면 혈관 내피세포의 기능 이상을 초래, 망막 혈관의 폐쇄로 의한 망막허혈이 발생하고, 그 결과 비정상적인 혈관증식 및 출혈을 초래하여 실명으로 이어질 수 있는 질환
◎ 돌연변이(Mutation)
한 개체의 유전체를 구성하는 염색체나 DNA의 일부에 생긴 영구적인 변화, 염기서열 상의 염기 1개가 다른 염기로 치환된 경우를 점 돌연변이라고 한다. 여러 개의 염기를 포함하는 DNA 영역에 걸쳐 변화가 일어나는 경우도 있다. 생식세포에 생긴 돌연변이는 후대에 전달된다. 체세포돌연변이는 후대에 전달되지 않는다.
◎ 동물자원기술(Animal resources technology)
동물이 생산하는 산물 및 축산 동물의 효율적 생산을 위한 자원 동물의 육종, 사육, 관리 등과 관련된 기술이다.
◎ 동형접합체(Homokaryon)
하나의 세포 내에 유전자형이 다른 두 개 이상의 핵이 존재하는 상태이다. 핵융합이 일어나지 않으므로 세포질 유전 연구에 이용된다.
◎ 루틴(Rutin)
루티노오즈(글루코오즈와 만노오즈가 결합한 이당류)가 결합된 배당체 형태의 플라보노이드. 콩, 팥, 메밀, 토마토, 감귤류 등에 함유되어 있다. 모세혈관의 기능을 정상으로 유지하고 혈관을 튼튼히 하는 비타민P의 작용이 있어 고혈압이나 뇌일혈을 예방하는 데 쓰인다.
◎ 마이코톡신(Mycotoxins)
곰팡이류가 생산하는 독성 물질의 총칭이다. 사람이나 동물에게 급성 또는 만성 장해를 유발한다. 대표적인 것으로 Aspergillus flavus가 생산하는 aflatoxin류가 있다.
◎ 마이크로어레이(Microarray)
기판 위에 DNA나 단백질과 같은 포획 탐침(capture probe)이 미세한 점으로 고정화된 어레이 장치이다. 특정 DNA나 단백질의 분석을 통해 유전질환의 진단, 유전자 발현 모니터링 등에 사용된다.
◎ 맞춤의료(order-made medicine, tailored medicine)
개인의 체질·약물에 대한 반응에 따라 각각 다른 투약이나 치료하는 의료 행위.
◎ 면역억제제(Immunosuppressive agents/immunosuppressants)
생체의 면역 반응을 억제하는 활성을 지닌 물질이다. 대표적으로 사이클로스포린 A(cyclosporin A) 등이 있으며 장기 이식 시 거부반응을 억제하기 위해 사용된다.
◎ 면역세포(Immunocyte)
면역담당세포의 총칭. 림프구계 면역세포의 유약형(幼若型)은 대형 호피로닌세포이며 면역아구라고 한다.
◎ 면역치료제(Immunotherapeutic)
체내의 면역반응에 관여하는 세포로 단백질로서 치료제로 사용되는 물질이다. 인터페론, 인터루킨 등이 대표적인 예이다.
◎ 미생물(Microorganism)
육안으로는 관찰이 불가능한 미세한 생물체. 일반적으로 크기 0.1mm 이하인 생물체를 의미한다. 주로 단일 세포 또는 균사체로 존재하며, 최소 생활 단위를 유지한다. 세균류, 사상균류, 효모류, 조류, 원생동물류, 바이러스 등이 이에 속한다.
◎ 바이러스(Virus)
숙주세포 내에서만 증식할 수 있는 비세포성 생물체이다. DNA나 RNA 중 하나를 게놈으로 갖는 감염세포 내에서만 증식하는 감염성 미소구조체이다.
◎ 바이오디젤(Biodiesel)
지방산 메틸에스터. 식물성 또는 동물성 지방과 메탄올의 산 또는 염기촉매반응에 의해 생산된다. 그 자체 또는 석유 디젤과 혼합해 연료로 사용되며, 바이오디젤은 재생가능자원인 바이오매스로부터 생산되므로 에너지 자원의 고갈 문제가 없으며, 연소 시 이산화탄소 및 미세분진의 배출량이 경유에 비해 현저히 낮고, SOx는 전혀 배출되지 않는다.
◎ 바이오리파이너리(Biorefinery)
석유 대신 바이오매스로부터 연료와 화학 원료를 제조하는데 필요한 기술의 집합이다.
◎ 바이오매스(Biomass)
식물이나 미생물 등을 에너지원으로 이용하는 생물체를 말한다.
◎ 바이오멤스(BioMEMS)
생물학적 시스템에 극미세 전자 기계 시스템(micro-electro-mechanical systems, MEMS) 기술을 결합한 새로운 기술 분야. 고성능의 극소형 생물 측정 장치나 생화학 반응 장치 등의 제작이 이에 속한다.
◎ 바이오센서(Biosensor)
생체 물질이 갖는 반응 특성과 그 반응에 의해 발생되는 전기 화학적 또는 광학적 신호 등을 이용해 특정 물질을 검출하거나 정량 분석하는 장치이다.
◎ 바이오에너지(Bioenergy)
바이오매스(biomass)와 이를 원료로 하여 생물학적 또는 열화학적으로 생산되는 연료로부터 얻어지는 에너지를 말한다. 경우에 따라서 바이오매스로부터 생산되는 연료를 지칭하기도 한다.
◎ 바이오연료(Biofuel)
생물체(바이오매스 자원)에서 만들어지는 연료이다. 액체 연료로는 에탄올, 메탄올, 바이오디젤, 피셔-트롭쉬(Fischer-Tropsch) 디젤이 있고 기체 연료로는 수소와 메탄이 있다.
◎ 바이오플라스틱(Bioplastic)
생물체(바이오매스 자원)에서 만들어지는 연료이다. 액체 연료로는 에탄올, 메탄올, 바이오디젤, 피셔-트롭쉬(Fischer-Tropsch) 디젤이 있고 기체 연료로는 수소와 메탄이 있다.
◎ 바이오칩(Biochip)
1) 유리, 실리콘 등의 재질로 된 작은 고체 기판 위에 DNA, 단백질 등의 생체 물질을 고밀도로 고정화시킨 마이크로어레이칩이다. 유전자 발현 양상, 유전자 결함, 단백질 분포, 반응 양상 등을 분석하는데 이용된다.
2) 단백질이나 지질, 신경세포 등의 생체 물질로 구성되며, 기본적인 연산이나 정보 처리 기능을 갖는 소자이다. 현재는 싸이토크롬이나 박테리오로돕신 등이 갖는 전자/광 스위치 특성을 이용한 소자들이 개발되고 있다.
◎ 바이오필터(Biofilter)
담체에 고정화된 미생물을 이용해 여러 가지 독성 물질이나 악취 물질을 제거하는 환경 처리장치이다.
◎ 박테리오신(Bacteriocin)
세균에 의해서 생합성되는 단백질로서 항균 효과가 있는 물질의 총칭이다.
◎ 발현벡터(Expression vector)
목적 유전자의 효율적인 발현을 위해 제작된 벡터이다. 전사가 효율적으로 이루어지도록 강력한 프로모터와 적절한 조절 유전자를 갖는다.
◎ 배아
난자와 정자의 수정이 이루어진 후 8주까지(인간의 경우)를 말하며 후에 태아가 된다.
◎ 배아줄기세포(Embryonic stem cell(ESC))
발생 초기의 배반포에서 얻어지는 미분화 상태의 세포로 자가 재생산 능력이 뛰어나 대부분의 조직과 세포로 분화할 수 있다.
◎ 복제 DNA(Cloned DNA)
공여체로부터 분리, 동정된 후 벡터에 삽입된 DNA를 말한다.
◎ 복제동물(Cloned animal)
무성적으로 복제되어 유전적으로 모체와 동일한 동물 개체를 말한다. 난세포에서 핵을 제거하고 모체 체세포의 핵을 이식하는 과정을 거쳐서 복제된다.
◎ 복제장기(Cloned organ)
인간 또는 동물의 장기의 일부분 또는 세포를 이용하여 장기로서의 기능이 가능하도록 배양된 생물학적 인공장기이다. 복제동물의 사육을 통하여 얻을 수도 있다.
◎ 생명윤리(Bioethics)
생명을 의미하는 바이오(bio)와 윤리를 뜻하는 에식스(ethics)의 합성어로 생명윤리 또는 생물윤리로 번역된다. 생명에 관한 윤리와 생물학의 기본원칙에 입각한 윤리의 2가지로 생각할 수 있다. 생명에 관한 윤리는 이제까지 ʻ의사의 윤리ʼ, 또는 ʻ의료의 윤리ʼ라고 일컬어왔는데, 의료의 발전과 인권의식이 서로 연관되어 넓은 입장에서 생명, 특히 인간의 생명에 대한 간섭의 시비를 검토하게 되었다.
◎ 생명자원
생명자원은 지구상에 존재하는 생물(동·식물, 미생물, 인간세포 등), 생물의 구성물(DNA, 유전체 등) 및 이들의 정보를 포함하는 것으로 배양 가능한 생물체, 복제 가능한 부분, 유전자원, 배양 불가능한 생물체 및 이와 관련된 분자, 생리, 구조적 정보를 포함한다.
◎ 생명정보
생물자원(유전체, 전사체, 단백질체 포함)과 생물다양성으로부터 유래된 정보와 그것의 가공처리 결과물을 말한다.
◎ 생물공정(Bioprocess)
생물체, 또는 생물체로부터 유래된 물질을 이용하거나 대상으로 하는 공정의 총칭이다.
◎ 생물다양성
육상, 해양 등의 수중 생태계와 이들 유기체가 서식하는 생태계를 말하며, 이는 종과 종사이, 또는 종과 생태계 사이의 다양성도 포함한다.
◎ 생물다양성보존(Biodiversity conservation)
생태계에 있어서 종 구성의 다양성과 다양한 종들 사이의 상호작용, 그리고 그 기능과의 상관관계를 활용해 자연 환경을 안정하게 유지하는 것이다.
◎ 생물산업(Bioindustry)
생명공학 기술을 이용하거나 이에 관련된 산업의 총칭이다.
◎ 생물안전성(Biosafety)
생명공학기술과 그 생산물로부터 유래하는 잠재적 위해성을 감소시키기 위한 노력을 지칭하는 용어이다.
◎ 생물융합기술(Biohybrid technology)
생명공학, 마이크로시스템, 센서시스템 등 여러 가지 분야의 기술이 융합된 것이다. 생명공학 연구에 필요한 여러 가지 방법을 자동화, 병렬화, 동기화하기 위해서 개발된 기술이다.
◎ 생물의약(Biopharmaceutical)
생물체 또는 이로부터 유래된 물질을 이용해 생산되는 의약품의 총칭이다. 단백질 치료제, 백신, 항생제, 세포 치료제, 유전자치료제 등이 포함된다.
◎ 생물학적지표(Biological indicator)
생리활성 물질의 효능을 말한다. 환경오염 또는 독성의 정도를 특정 생물을 대상으로 하여 수량적으로 표시하는 지표이다.
◎ 생체고분자(Biomolecule)
생체 내에서 합성되는 거대분자의 총칭이다. 단백질, 핵산, 지질, 다당류가 있다.
◎ 생체모방기술(Biomimetics)
생체의 기능을 다른 재료로 대체하거나 생체 기능을 모방, 이용하는 기술이다. 생체모방화학, 바이오일렉트로닉스, 바이오미캐닉스 등이 포함된다.
◎ 성체줄기세포(Adult stem cell)
조혈기관 상피조직 등의 세포재생계에서 세포생산의 기초가 되는 세포의 줄기세포를 추출하여 치료목적의 조직 세포로 분화한 것.
◎ 생체지표(Biomarker)
발암, 유전질환, 노화 등이 진행되는 단계 중 특징적으로 나타나는 형태학적· 생화학적·분자생물학적 변화. 생체지표를 검색함으로써 물질의 위해성을 판단할 수 있다.
◎ 세포공장(Biofactory)
세포의 유전자를 조작하여 원하는 화합물을 대량으로 생산하도록 만든 것이다. 세포 공장은 화합물 생산을 조절하는 효소 및 다양한 유전자의 발현을 억제, 활성화 시키고 이로써 생산 수율을 향상시킴으로써 제작된다. 세포 공장이 향후 현재의 화학공장과 같은 수준으로 생산 수율이 향상될 경우 기존 화학산업을 바이오산업으로 변화시킬 수 있을 것으로 기대되는 기술이다.
◎ 세포융합(Cell fusion)
두 개의 서로 다른 세포의 원형질체(protoplast)를 융합하는 것을 말한다. 동시다발적 유전 형질 변환이 가능하다. 식물세포에서는 육종 기술로서 동물세포에서는 단일클론항체 생산을 위한 하이브리도마 세포주를 만드는 데 사용된다. 미생물 분야에 있어서는 곰팡이와 방선균 등의 균주 개발에 이용된다.
◎ 세포치료기술
손상된 조직 또는 기관 부위를 치료할 목적으로 체외에서 세포를 배양하여 체내에 투여하는 치료법이다.
◎ 시냅스
하나의 신경세포의 축삭돌기 말단과 다른 신경세포의 수상돌기가 만나는 세포간 연접부위로서 신경세포 사이에 전기적, 화학적 신호를 전달하는 대화창구 역할을 수행한다.
◎ 알츠하이머병(Alzheimer’s disease)
퇴행성 뇌질환의 하나로 치매의 원인 중 가장 흔한 형태이다. 병리 조직학적으로는 뇌의 전반적인 위축, 뇌실의 확장, 신경 섬유의 다발성 병변(neurofibrillary tangle)과 초로성 반점(neuriticplaque) 등이 특징이다.
◎ 약물전달시스템(Drug delivery system(DDS))
약물 방출 속도를 조절하거나 약물을 목표 부위에 효율적으로 전달시키는 방법 등을 통해 의약품의 부작용을 최소화하고 효능 및 효과를 극대화시키는 기술 및 시스템이다.
◎ 염기서열
아데닌(A), 구아닌(G), 시토신(C), 티닌(T) 4개의 상이한 코드(염기)로 이루어진 특정 서열로 DNA에 유전정보를 저장한다.
◎ 유도만능줄기세포(iPS, induced Pluripotent Stem cell)
사람 성체세포에 역분화 유도 인자를 도입하여 제작한 배아줄기세포와 비슷한 특성(우수한 분화능 및 증식력)의 줄기세포로 ʻ역분화 줄기세포ʼ라고도 하며, 수정란이나 난자를 사용하지 않아 윤리 문제에서 비교적 자유로움
◎ 유전공학(Genetic Engineering)
생물체에 주어진 유전형질을 인위적으로 변형․개조시켜 새로운 형질을 가진 생물체를 만들어내는 기술(세포융합핵치환 단백질공학 유전자 재조합)이다.
◎ 유전자 재조합(Genetic recombination)
DNA나 RNA와 같이 유전자를 이루는 요소가 해체와 재조립 과정에서 원래의 서열과는 다르게 뒤바뀌는 과정을 가리키는 유전학 용어이다. 진핵생물의 경우 DNA 수리의 과정에서 유사 분열이 발생하는 경우, 그리고 감수 분열의 과정에서 일어나는 염색체 접합에 의해 이루어진다.
◎ 인간화항체(Humanized antibody)
항원을 다른 동물에 주입했을 때 생성되는 항체 구조 중 항원이 결합하는 부위인 상보성결정부위(CDR)에 해당되는 유전자 배열만을 인간 항체 유전자에 대체하는 과정을 통하여, 인간 항체와 특징이 유사하도록 제조된 재조합 항체동물로부터 유래된 부분이 적기 때문에 체내 투여용 항체치료제로 사용하기에 적합하다.
◎ 인공장기(Artificial organ)
장기의 인공적인 대체물을 말한다. 심장, 신장, 간장 등의 대체 장기 외에도 인공혈관, 인공혈관 밸브 등도 포함된다. 인공 재료와 배양 세포를 결합시킨 혼성(hybrid)형도 있다.
◎ 인터페론(Interferon(IFN))
인체세포 내에서 바이러스 RNA와 단백질의 생성을 억제하는 항바이러스 단백질의 발현을 유도하는 기능을 갖는 당단백질의 총칭이다. 생성장소와 기능이 각기 다른 3가지가 있는데 IFNα는 주로 백혈구, IFNβ는 섬유모세포 그리고 IFNy는 주로 림프구에서 생성된다. 항바이러스 작용 외에 면역조절작용도 갖는다. IFNα와 IFNβ는 주로 항바이러스활성을 나타내는 반면 IFNy는 주로 면역조절작용을 한다. IFNα는 자연살해세포의 활성을 증강시키는 작용도 지니고 있다. 산업적으로는 유전공학적인 방법으로 생산이 가능해졌으며, 바이러스 간염의 치료에 사용되며 IFNα는 모발상세포 백혈병의 치료에도 유효하게 사용된다.
◎ 자가면역질환(Autoimmune disease)
자가면역에 의해 생체방어기능을 담당하는 면역계가 자기 세포를 공격해 발생하는 질병. 만성 류마티스성 질환이 대표적인 예이다.
◎ 자가생식(Selfing)
동일 개체 또는 동일 계통에 유래하는 배우자간의 교배. 교배형에 의한 자웅이체성이 확인되고있는 미생물의 일부 계통으로, 동일 교배형의 클론 내에서 한정적으로 교배가 일어나는 것이다.
◎ 자살유전자(Suicide gene)
발생과정의 어느 시기에 특정한 세포 내에서 발현하여 그 세포를 세포예상사 시키는 치사유전자의 일종. 이 유전자의 작용으로 살생단백질을 합성하고, 이것이 어떤 기작으로 세포를 죽게 하는 기능을 하는 것으로 보고 있는데 아직도 불분명한 점이 많다. 자살유전자는 초기에는 그 발현이 억제되지만 특정한 사이에 발현하는데 그 방아쇠가 되는 요인은 다양한 것으로 알려져 있다.
◎ 자세포(Cnidoblast)
자포동물에서 자포를 만들고 대부분의 경우 이를 마지막까지 내장하는 세포. 간세포(I세포)에서 유래하는 것으로 알려져 있다. 자세포는 1개의 독립효과기로 기능하는 것으로, 특정한 지질성분에 대한 접촉화학적 반응이 종종 그 원래의 흥분형태가 된다.
◎ 재구성핵(Restitution nucleus)
유사분열의 중기 또는 후기에 핵분열의 착오에 의해 딸 염색체가 분배되지 않고 하나로 된 핵. 그 결과, 염색체수가 배가된 핵이 형성된다. 감수분열에서는 1가염색체, 염색분체다리 등에 의한 염색체 지체가 원인이 된다.
◎ 재조합 DNA 기술(Recombinant DNA technology)
목적 유전자를 제한효소를 이용해 잘라내고 이를 벡터에 삽입해 재조합 DNA를 제작한 후, 숙주에 도입해 발현시키는 과정에 관련되는 기술의 총칭이다.
◎ 전임상(Preclinical)
실험실 차원 및 동물을 대상으로 약물의 생리적 특성과 대상 질병에 대한 효능을 검증하는 것이다.
◎ 제대혈(Cord blood)
태반과 탯줄에 있는 혈액으로 백혈구, 적혈구, 혈소판 등을 만드는 조혈모세포를 다량 함유하고, 연골, 뼈, 근육, 신경 등을 만드는 간엽줄기세포를 가지고 있다.
◎ 줄기세포(Stem Cell)
조직분화 과정에서 볼 수 있는 미분화된 세포. 줄기세포는 신체 내 모든 조직으로 분화될 수 있는 가능성을 가지고 있다.
◎ 줄기세포치료(Stem cell therapy)
미분화된 줄기세포를 적당한 조건 하에서 특정 세포나 조직으로 분화하도록 유도해 손상된 조직이나 장기를 치료하는 기술이다.
◎ 제네릭(Generic) 약품
특허 보호중인 의약품에 반대되는 개념으로 특허가 만료됐거나 특허보호를 받지 않는 의약품을 통칭한다.
◎ 진세노사이드(Ginsenoside)
인삼 사포닌을 구성하는 물질의 총칭으로 현재 약 30여 종이 알려져 있으며 건조 인삼 중 약 3.2% 정도 함유되어 있다. 화학구조의 특성에 따라 프로토파낙사디올 (protopanaxadiol, PD)계, 프로토파낙사트리올(protopanaxatriol, PT)계, 올레안(oleanane)계 사포닌으로 구분되며 항암, 혈액 순환 개선, 당뇨의 예방 및 치료, 신장 보호, 치매 예방, 간장 보호, 동맥 경화, 고지혈증, 체질 개선, 피로 회복, 면역 기능 증진과 노화 방지 등에 효과가 있다고 알려져 있다.
◎ 진핵생물(Eukaryote)
핵막으로 둘러싸인 핵과 다양한 세포 소기관을 가지는 세포로 구성되어 있는 생물을 말한다. 원생생물, 조류, 사상곰팡이, 효모, 식물, 동물이 포함된다. 원핵생물과 대응된다.
◎ 체세포돌연변이(Somatic mutation)
발생이 진행 중인 개체 또는 완전한 개체 내에서 방사선이나 다른 원인들에 의해 일부의 체세포에 변화가 일어나 새로운 형질이 만들어지는 현상이다.
◎ 체세포변이(Somaclonal variation)
한 개체에서 단일세포를 떼어내어 재배양했을 때 얻어진 새로운 개체가 원래의 개체와 유전적으로 동일하지 않은 현상이다.
◎ 체세포융합(Somatic cell hybridization)
유전자가 다른 체세포를 접합하여 새로운 유전자형의 세포를 만드는 기술이다.
◎ 치료용효소(Therapeutic enzyme)
치료제로 이용되는 효소 또는 그 제제이다. 혈전용해제로 사용되는 조직플라스미노젠 활성인자 (TPA: tissue plasminogen activator), 스트렙토카이네이즈(streptokinase), 유로카이네이즈(urokinase)와 항혈액응고제인 안티트롬빈 III(antithrombin III) 등이 대표적인 예이다.
◎ 카로티노이드(Carotenoid)
녹색식물과 어떤 종의 곰팡이, 효모, 버섯, 세균 등이 만드는 황색, 적색, 자색(흡수극대 400~550nm) 등의 불용성 폴리엔색소. 대부분 탄소수가 40(때로는C30, C45, C50 등)이고 좌우대칭에 가까운 구조인 테트라테르페노이드 이다. 토마토과실에 많은 리코펜(φ,φ-카로틴)을 원형(原型)으로 하여 그 분자의 양끝폐환(閉環), 산소화 등으로 생기는 500종 이상의 색소가 알려져 있다.
◎ 캡사이신(Capsaicin)
고추의 매운맛을 내는 무색의 휘발성 알칼로이드 화합물로 약용과 향료로 이용된다. 진통작용과 체지방 감소 효과가 있는 것으로 알려져 있다.
◎ 클로렐라(Chlorella)
클로렐라과의 비운동성 담수 조류로 건강 보조 식품, 유제품의 원료로 주로 사용된다.
◎ 키토산(Chitosan)
키틴을 탈아세틸화한 물질로 의약 분야에서는 인공 피부, 약물전달시스템 등에 응용되며 환경 분야에서는 응집제로도 사용된다. 세포를 활성화해 노화를 억제하고 면역력을 강화해 주며 질병을 예방해 주는 것으로 알려져 있어 건강 기능 식품의 소재로 사용된다.
◎ 타닌(Tannin)
다가페놀을 포함하며 유피성(鞣皮性)의 복잡한조성을 가진 식물 성분. 식물계에는 농도의 차이는 있으나 널리 분포하며 물관부, 수피, 잎, 과실, 뿌리 등에 들어 있다. 유혁작용의 주체는 다가페놀로서 단백질, 특히 콜라겐과 결합하여 동물의 생피를 안정된 가죽으로 변성하게 한다. 알칼로이드와 침전반응을 하고 3가의 철이온과 결합하여 녹색 또는 흑자색의 착화합물을 형성한다.
◎ 페니실린(Penicillin)
푸른곰팡이(penicillium)가 생산하는 β-락탐계의 4원자 고리화합물의 항생 물질로 세균의 세포벽 구성 성분인 펩티도글리칸의 합성을 저해하는 대표적인 세균 감염증 치료제이다. 모핵은 6-아미노페니실란산(6-amino penicillanic acid, 6-APA)으로, 치환기를 화학적으로 수식한 많은 종류의 유도체(반합성 페니실린)가 개발되었다. Flemming(1928)에 의해서 최초로 발견된 후, 생물공학기술에 의해 대량 생산이 가능하게 된 대표적인 생물산업 제품이다.
◎ 펙틴(Pectin)
식물의 세포벽이나 세포벽 사이에 존재하는 다당류의 하나로 주성분은 D-갈락투론산이 α-1,4 결합한 고분자이다. 팽윤성이 뛰어난 수용성 식이섬유로서 섭취 시 포만감을 주나 칼로리는 매우 낮다. 배변활동을 원활하게 하고, 지방흡수 저하, 지방합성 저해, 체지방 분해 등의 작용을 하므로 다이어트 식품의 원료로 사용된다.
◎ 폴리펩타이드(Polypeptide)
대략 10개 이상의 아미노산잔기로 이루어진 펩타이드이다. 단백질과 같은 뜻으로 쓰기도 하나 보통 분자량이 작은 단백질을 가리킬 때 쓰인다.
◎ 표지단백질(Marker protein)
특정 질병 진단의 척도로 사용되는 단백질로 특정 질병 상태에서 발현된다. 일례로 간암의 경우 혈액 내의 알파태아단백(AFP: α-fetoprotein)을 표지단백질로 사용한다.
◎ 표지유전자(Marker gene)
특정 형질에 대한 유전적 해석의 척도로 이용되는 유전자, 유전질환, 약제내성(항생물질 내성 등), 염도 감수성, 영양 요구성 등을 유전적으로 판단하는데 이용된다.
◎ 프로바이오틱(Probiotic)
인간의 건강에 이로운 생균제 식이보조물 또는 생균 성분이다. 유산균 식품과 표모 체제가 대표적이다. Pro(촉진하는) biotic(생명체)의 합성어이다.
◎ 플랫폼 기술(Platform Technology )
신제품 개발과 생산 시스템에 범용적으로 활용되는 표준화된 하드웨어 및 소프트웨어 기술. 핵심 기술을 표준화, 모듈화, 공용화 함으로써 개방형 혁신 활동을 촉진하는 기술.
◎ 항상성효소(Constitutive enzyme)
세포의 생존, 성장과 함께 항상 발현되는 효소. 일상적인 배양조건 하에서 세포의 일상적인 기능을 수행하기 위한 효소들이 이에 해당된다. 이들의 유전자는 특정 대사물질에 의해 조절되는 작동 유전자(operator)를 가지고 있지 않다.
◎ 항체(Antibody)
생체 내에 들어온 항원에 반응해 만들어지는 당단백질이다. 해당 항원에 특이적으로 결합하며 면역글로블린(Ig)이라고도 한다.
◎ 항체바이오시밀러
항체의약품이란 체내에서 병을 유발하는 원인 단백질에 항체처럼 작용해 그 단백질만을 무력화시키는 의약품을 말한다. 특정 단백질에만 반응하기 때문에 효과가 뛰어나고 타깃 질병 이외에는 반응하지 않아 화학의약품에 비해 부작용이 적다. 특허가 끝난 항체바이오의약품을 오리지널과 동일한 효능을 갖도록 만든 복제 의약품이 항체바이오시밀러다. 램시마의 오리지널은 존슨앤존슨사의 레미케이드다. 류머티즘 관절염, 강직성 척추염, 건성, 소아 크론병을 포함, 7개 병에 대한 적응증을 유럽당국에서 승인받았다.
◎ 핵산(Nucleic acid)
푸린 또는 피리미딘 염기, 오탄당(디옥시리보오스 또는 리보오스), 인산기로 이루어진 뉴클레오타이드 중합체이다. 당부분이 디옥시리보오스인 DNA와 당부분이 리보오스인 RNA 두 종류로 대별된다.
◎ 핵이식
어떤 세포로부터 핵을 떼어낸 뒤 다른 세포(핵을 제거한 것)에 이식하는 조작이다.
◎ 형질전환(Transformation)
어느 주의 유전형질 일부를 다른 주에 옮겨 넣는 유전교배의 한 형태로, 공여체로부터 추출한 고분자 DNA를 직접 수용체에 거두어 넣어 그 세포 중에서 재조합하는 경우이다.
◎ 형질전환생물(Transgenic organism)
인위적인 방법에 의하여 외래 유전자가 도입된 동식물과 미생물의 총칭이다. 보통 교잡육종으로는 얻어질 수 없는 형질을 가진 생물체를 말한다.
◎ 호르몬(Hormone)
미량으로도 효능을 나타내는 생리활성 조절 물질이다. 척추동물의 호르몬은 펩타이드계(인슐린, 글루카곤, 뇌하수체 호르몬, 부갑상선 호르몬), 아미노산 유도체계(아드레날린, 갑상선 호르몬), 스테로이드계(성 호르몬, 부신피질 호르몬)로 나누어진다.
◎ 효모(Yeast)
구형의 단세포로 존재하며 주로 출아법에 의해 증식하는 진균류(fungi)의 한 종류로 양조, 제빵 등에 이용되는 Saccharomyces cerevisiae가 대표적이다. Saccharomyces, Hansenula, Pichia 속에 속하는 효모는 재조합 단백질 생산에 이용한다.
◎ 효소(Enzyme)
생체 내에서 만들어지는 단백질 생촉매. 생체 내의 화학반응은 거의 모두가 효소 반응에 의해 촉진된다. 산화환원효소, 전이효소, 가수분해효소, 라이에이즈, 이성질화효소, 라이게이즈의 여섯 가지 종류로 분류한다.
◎ 효소공학(Enzyme engineering)
효소 촉매의 특성, 관련 기술, 물질, 장비를 수단으로 하는 방법과 기술의 총체이다.
◎ 휴면세포(Resting cell)
살아 있기는 하나 증식은 하지 않는 상태의 세포를 말한다. 배양액으로부터 세포를 수확하여 적당한 완충액에 현탁시킬 경우 세포들이 분열 증식을 하지 않는 상태로 상당기간 유지될 수 있다. 포자 등의 휴면형의 세포나 핵분열 사이클의 간기에 있는 세포를 지칭하는 경우도 있다.
◎ B-세포(B-cell)
골수 모세포로부터 유래한 림프구의 일종이다. 일반적으로 골수에서 면역세포로 성숙한다. 항원과 반응해 체액성 면역에 관여하는 항체를 분비하는 형질 세포(plasma cell)가 된다. B-림프구라고도 한다.
◎ DNA중합효소(DNA polymerase)
DNA 중합을 촉진하는 효소이다. 주형(template)DNA의 염기 배열 순서에 맞추어서 이에 서로 상보적인 염기를 지닌 디옥시리보뉴클레오타이드(deoxyribonucleotide, dNTP)를 인산이중 에스터(phosphodiester) 결합으로 연결함으로써 새로운 DNA 사슬을 5ʼ에서 3ʼ 방향으로 합성한다. DNA의 복제와 회복에 관여하는 중요한 효소이다.
◎ RNA(Ribonucleic acid (RNA))
리보오스, 염기(구아닌, 아데닌, 시토신, 우라실), 인산기로 이루어진 뉴클레오타이드의 중합체로 DNA와 함께 핵산의 일종이다. 전령RNA, 운반RNA, 리보좀RNA (rRNA: ribosomal RNA)의 세 종류가 대표적이다.
◎ T-세포(T-cell (T-lymphocyte))
흉선에서 유래하는 면역 관련 림프구이다. B-세포의 항체생산을 촉진하는 헬퍼 T-세포, 억제하는 억제 T-세포, 특이적으로 표적세포를 상해하는 킬러 T-세포 등으로 나누어진다.
▶ 생물산업 용어
◎ 가교결합(Cross-linking)
선형 고분자 곁가지 간의 화학결합. 폴리펩타이드 사슬 간의 이황화(disulfide) 결합이나 라이신 가교 등이 예이다. 두개 이상의 관능기를 갖는 화합물을 가교제로 하여 효소 분자 간에 공유결합을 형성시킴으로써 효소를 고정화시키는 방법도 있다.
◎ 가벼운사슬(Light chain, L-chain)
면역글로블린 분자를 구성하는 두 종류의 폴리펩타이드 사슬 중 분자량이 작은 짧은 사슬.
◎ 가변부위(Variable region)
항체들의 분자 구조에 있어서 대상 항원의 종류에 따라 아미노산 서열이 달라지는 부위. Fv로 나타낸다. 특정 항체의 특이성을 결정한다.
◎ 가성양성(Flase positive)
양성(+)반응 테스트에서 양성으로 결과가 나왔지만 실제로는 양성이 아닌 것. 100% 완벽한 테스트가 아닌 경우에 발생하며 통계적으로는 유의한 테스트이기 때문에 테스트 자체가 잘못되었다고 말할 수 없을 때 사용된다.
◎ 가성음성(Flase negative)
음성(-)반응 테스트에서 음성으로 결과가 나왔지만 실제로는 음성이 아닌 것. 100% 완벽한 테스트가 아닌 경우에 발생하며 통계적으로는 유의한 테스트이기 때문에 테스트 자체가 잘못되었다고 말할 수 없을 때 사용된다.
◎ 가소홀(Gasohol)
무연 휘발유 90%와 에탄올 10%를 섞어서 만든 자동차 연료.
◎ 가수분해(Hydrolysis)
물의 첨가에 의해 물질이 분해되는 현상. 효소 또는 산의 촉매 작용에 의해 전분, 단백질 등과 같은 고분자 물질이 포도당, 아미노산 등과 같은 저분자 물질로 분해되는 반응이다.
◎ 가수분해효소(Hydrolase)
가수분해 반응을 촉진하는 효소의 총칭. 에스터 결합을 분해하는 지질분해효소. DNA 가수분해효소, 글리코사이드결합을 가수분해하는 아밀레이즈, 펩타이드결합에 작용하는 단백질분해효소 등 종류가 많고 중요성이 높은 효소군이다.
◎ 가압멸균(Autoclaving)
고압 용기를 사용하는 멸균법. 주로 수증기를 사용해 121℃, 2기압에서 수행되며 실험실 등에서 소규모로 이루어지는 가장 일반적인 멸균 방법이다.
◎ 간헐멸균(Intermittent sterilization)
습열 멸균 시 간헐적으로 멸균 조작을 반복함으로써 멸균이 어려운 포자를 멸균이 용이한 생세포로 유도한 후 멸균하는 방법.
◎ 갈락토만난(Galactomannan)
만노오즈와 갈락토오즈로 이루어져 있는 식물 유래의 식이섬유의 일종. 구아 검과 로커스트 콩 검의 주성분이다. 주로 만노오즈가 1→4 결합으로 연결된 주사슬에 갈락토오즈가 1→6 결합으로 곁사슬을 이루는 구조로 되어 있다. 수용액에서 수화되어 점도가 큰 콜로이드를 형성하므로 식품에서 안정제, 증점제 등으로 사용된다.
◎ 갈락토시데이즈(Galactosidase)
갈락토사이드 결합을 가수분해해 갈락토오즈를 생성하는 효소. α-갈락토시데이즈는 α-갈락토사이드 결합을 분해하고 β-갈락토시데이즈는 β-갈락토사이드 결합을 분해한다. β-갈락토시데이즈는 유당을 갈락토오즈와 포도당으로 분해하기 때문에 유당분해효소라고도 한다. 이들은, 가수분해 외에도 갈락토오즈 잔기를 다른 당, 알코올 및 페놀에 전이하는 갈락토사이드 전달효소로도 작용한다.
◎ 갈락토오즈(Galactose)
헥소오스 계 육탄당의 하나. 유당(lactose)을 분해하면 갈락토오즈와 포도당이 생성된다.
◎ 갈락토올리고당(Galactooligosaccharide)
포도당 한 분자에 여러 개의 갈락토오즈 분자가 결합된 올리고당. 사람의 모유에 소량 함유되어 있는 천연의 당질이다. 산업적으로는 유당에 갈락토스 전이 활성이 우수한 β-갈락토시데이즈(β-galactosidase)를 작용시켜 유당의 갈락토오즈 잔기에 1~3개의 갈락토오즈를 결합시켜 제조한다. 체내에서 소화되지 않는 난소화성 당으로 장내 유용세균을 선택적으로 증식시켜 장내 균총을 개선시키는 효과가 우수하며 충치와도 무관한 기능성 소재이다. 부드러운 맛을 내며 감미도는 설탕의 20~40%로 낮은 단점이 있으나 높은 온도와 산성조건에서 안정해 내열성과 내산성이 우수한 장점이 있어 각종 음료, 건강기능식품 등에 소재로 이용되고 있다.
◎ 갈산(Gallic acid)
페놀카르복실산의 일종. 타닌(tannin)을 알칼리 가수분해함으로써 생기며 냄새는 없고 맛이 떫으며 약간 산성을 띤다. 찬 물에는 잘 녹지 않으나, 뜨거운 물, 알코올, 아세톤에는 녹으며, 철(Ⅲ)염에 의해서 암청색 침전을 생성한다. 잎을 비롯한 식물체 내에 유리 상태로 존재한다. 잉크 및 염료의 원료, 지혈제 등으로 사용된다.
◎ 개시코돈(Initiation codon)
전령RNA가 단백질로 번역될 때 단백질 생합성의 개시점이 되는 코돈. 일반적으로 AUG가 개시코돈이지만 GUG나 UUG등 그 밖의 코돈이 개시코돈으로서 사용되고 있는 예도 알려져 있다.
◎ 건조균체중량(Dry cell weight)
수분이 제거된 세포시료의 중량. 보통의 경우 시료를 100℃ 부근에서 충분히 건조해 측정한다. 발효배양액 중의 세포 농도(g/L)를 나타내기 위해 사용된다.
◎ 고과당시럽(High fructose corn syrup, HFCS)
옥수수 전분으로부터 얻어진 포도당을 포도당이성화효소로 처리해 과당으로 전환시켜 얻은 포도당과 과당의 혼합물. 과당의 함량이 높은 감미료로 설탕보다 75% 정도 더 달다. 음료, 제과, 제빵 산업에 광범위하게 대량으로 사용된다.
◎ 고세균(Archaebacteria / Archae)
생물 분류에서 진핵생물(eukaryotes), 진정세균(eubacteria)과 병립하는 메탄세균, 호염균, 초호열균 등을 포함하는 미생물군. 세포막이 에테르 지질로 이루어져 있으며 인트론을 가지는 등 진정세균보다 진핵생물에 가까운 성질도 가진다.
◎ 고초균(Bacillus subtilis)
바실러스속의 대표적인 균종. 호기성의 그램양성균으로 내생 포자를 만든다. 산업적으로는 효소 생산, 장류 발효 등에 널리 이용된다.
◎ 공정흐름도(Process flow diagram, PFD)
공정을 구성하는 단위 조작기기의 구성과 공정 흐름을 상세하게 표시한 도면.
◎ 과산화효소(Peroxidase)
과산화수소에 의한 산화 반응 또는 탈수소화 반응을 촉진하는 효소. 고추냉이, 호스라디쉬(horse raddish)에 다량으로 함유되어 있다. 한 분자당 한개의 프로토헤마틴(프로토포피린에 3가의 철이 결합한 것)을 함유하는 복합단백질이다. 페놀성 화합물의 합성에 사용된다.
◎ 관류공정(Perfusion process)
공급액의 주입과 동시에 세포 또는 고형물이 배제된 동량의 반응액을 배출하는 연속공정. 동물, 식물, 고정화 미생물 세포를 배양할 때 흔히 사용된다.
◎ 관류배양(Perfusion culture)
공급액의 주입과 동시에, 세포 또는 고형물이 배제된 동량의 반응액을 배출하는 배양 방법. 동물, 식물, 고정화 미생물 세포를 배양할 때 흔히 사용된다.
◎ 교차혼성화반응(Cross-hybridization)
단일 사슬의 DNA 프로브를 사용하여 특정 DNA와의 혼성화를 유도할 때, 원하는 DNA가 아닌 다른 DNA와 혼성화되는 현상. 목적 DNA와 염기서열 상동성(homology)이 높은 DNA가 존재할 경우 흔히 일어난다.
◎ 구아검(Guar gum)
콩과식물인 Cyamopsis tetragonolobus의 종자 배유에 함유되어 있는 갈락토만난의 일종. 냉수에서도 신속하게 수화되어 균일하고 점성이 높은 교질 용액을 형성한다. 점도가 높은 검이므로 식품에서는 아이스크림 안정제, 증점제 등으로 사용된다.
◎ 그램염색법(Gram’s staining method)
세포를 크리스탈 바이올렛과 요오드 용액을 사용하여 염색한 후, 알코올로 세척하였을 때의 탈색 여부에 따라 세균을 분류하는 기법. 그램 양성과 그램 음성으로 구분한다. 이러한 특성상의 차이는 세포벽의 성분과 구조에 기인한다.
◎ 그램음성균(Gram negative cell)
그램염색법으로 염색되지 않는 세균. 세포막(cell membrane), 세포질 주변 공간(periplasmic space), 펩티도글리칸(peptidoglycan) 층, 외막(outer membrane)으로 세포질이 둘러싸인 구조를 갖는다. 대장균이 대표적인 예이다.
◎ 글루코아밀레이즈(glucoamylase)
‘아밀레이즈’ 참조.
◎ 글루콘산(Gluconic acid)
포도당의 알데하이드기가 카르복실기로 치환된 화합물. 신맛의 결정성 물질이다. D-글루콘산이 중요한데 일반적으로 D-포도당의 산화에 의해 생성되며 산업적으로는 Aspergillus 균에 의한 발효로 생산된다. 칼슘, 철 등을 섭취하기 쉬운 화합물로 바꾸기 때문에 글루콘산염은 의약품으로 사용된다.
◎ 글루타민(Glutamine)
중성 아미노산의 일종. 글루탐산의 카르복실기가 아마이드기로 치환된 구조로 생체 내에서는 질소 대사에 중요한 역할을 한다. 식물의 질소원으로서 암모니아를 다량으로 주면 글루타민의 생성량이 증가하며, 동물체 내에서도 신장 및 기타 조직 속에서 글루탐산과 암모니아로부터 합성된다.
◎ 글리세로인지질(Glycerophospholipid)
글리세로인산을 골격으로서 갖는 인지질의 총칭. 포스파티딘산, 포스파티딜글리세롤, 포스파티딜콜린, 포스파티딜에탄올아민, 포스파티딜세린, 포스파티딜이노시톨 등이 알려져 있다. 친수성과 소수성의 성질을 모두 갖는 양친매성 물질이다. 생체막의 주요 구성 성분이므로 모든 동, 식물성 식품에 존재한다. 세포 내 정보 전달 기작에 중요한 역할을 하는 것이 밝혀졌다.
◎ 글리시닌(Glycinin)
대두 단백질의 일종. 콘글리시닌(conglycinin)과 함께 대두 단백질의 대부분을 차지한다. 16종의 아미노산들이 함유되어 있으며 특히 각종 필수아미노산이 골고루 함유되어 있어 식물성 단백질로서 영양가가 매우 높다.
◎ 글리시리진(Glycyrrhizine)
글리시린산(glycyrrhic acid)의 나트륨염. 감초의 뿌리에 존재하는 감미성분으로 감미도는 설탕의 약 50배 정도이나 설탕과는 다른 단맛을 가지고 있으며 입안에서 단맛을 느끼는데 시간이 걸린다. 글리시리진은 식품에는 된장 및 간장 이외에는 사용할 수 없으며, 담배, 향료, 의약품 등으로 사용되고 있다. 글리시리진의 함량이 낮은 감초 추출물은 된장, 간장, 음료, 과자와 같은 식품에 사용할 수 있다.
◎ 나이신(Nanoparticle)
Lactococcus lactis가 생산하는 34개의 아미노산으로 되어있는 펩타이드. 그램양성균의 생육을 효과적으로 저해하는 항생작용을 하며 미국 FDA에 의해 안전성 인정 등급 (GRAS)로 분류된 천연보존료이다. 세포벽 구성 성분인 펩티도글리칸(peptidoglycan)의 합성을 저해한다. 내열성과 내산성이 우수하며 인체 내에서는 단백질분해효소에 의해 분해되므로 무해하다. 식품에 대한 사용이 일부 허가되어 영국에서는 치즈, 통조림, 응고시킨 크림(clotted cream), 미국에서는 저온 살균한 치즈에 사용이 허용되어 있다.
◎ 남조세균(Cyanobacteria)
엽록소(chlorophyll)를 함유하고 있어 광합성을 하는 원핵생물. 원래 광합성 능력에 기초해 예전에는 남조류(blue-green algae)로 명명되었지만 현재는 세균의 일종으로 간주된다.
◎ 내약성(Tolerance)
생체가 비정상적으로 많은 양의 약물 또는 독성물질을 견뎌낼 수 있는 능력. 정상적인 양의 약물이라 하더라도 지속적으로 투여하면 약물 반응이 감소하여 결국 원하는 반응을 얻기 위해서는 약물의 양을 늘려야 하는 경우가 발생하는데 이를 획득 내약성(acquired tolerance)이라고 한다.
◎ 내포체(Inclusion body)
외래 단백질이 숙주세포 내에서 과량 발현될 때 흔히 형성되는 불용성 단백질 덩어리. 내포체를 형성하면 단백질이 활성을 잃게 되므로 재접힘(refolding)을 통해 활성화시켜야 한다.
◎ 노던블롯(Northern blot)
‘블로팅법’ 참조
◎ 뉴클레오좀(Nucleosome)
DNA와 히스톤 단백질로 이루어져 있는 염색사(chromatin)를 구성하는 가장 기본적인 반복 단위. DNA가 차지하는 부피를 극소화시켜 세포핵 안에 보관하기 위한 것 외에 히스톤과 DNA 결합 상태에 따라 유전자 발현을 조절하는 기능을 가진다.
◎ 뉴클레오타이드(Nucleotide)
푸린 또는 피리미딘 염기, 오탄당(디옥시리보오스 또는 리보오스), 인산기로 이루어진 물질. 염기가 아데닌(A), 구아닌(G), 시토신(C), 티민(T), 우라실(U)일 때 각각 ATP(adenosine triphosphate), GTP(guanosine triphosphate), CTP(cytidine triphosphate), TTP(thymidine triphosphate), UTP(uridine triphosphate)라고 부른다.
◎ 능동수송(Active transport)
세포 내외의 화학 포텐셜 또는 전기 화학 포텐셜 구배에 역행해 물질을 도입하거나 배출하는 기작. 운반체 단백질과 에너지를 필요로 한다.
◎ 다운스트림공정(Downstream process)
생물공정에서 발효 이후의 공정. 주로 제품 회수 및 정제 공정이 이에 해당된다.
◎ 다중불포화지방산(Polyunsaturated fatty acid, PUFA)
이중결합이 두 개 이상 함유되어 있는 지방산. 화학 구조에서 첫번째 이중결합이 말단 메틸기로부터 세번째 탄소에 존재하는 ω-3계 지방산과 여섯번째 탄소에 존재하는 ω-6계 지방산의 두 종류로 분류된다. 다중불포화지방산은 리롤렌산, 리놀레산, 아라키돈산, DHA, EPA 등이 있으며 생리적으로 중요한 기능을 한다.
◎ 다차원펩타이드 분리(Ultidimensional peptide separation)
다차원 고성능액체크로마토그래피(multidimensional HPLC)를 이용하여 단백질 혼합물을 분리하는 방법. 단백질 혼합물을 트립신(trypsin) 등 단백질분해효소로 절단한 후 생성된 펩타이드 혼합물을 일차 크로마토그래피로 부분 정제 한 후 각 분획을 이차 크로마토그래피로 분리하여 질량분석기로 각각의 펩타이드를 동정한다. 일반적으로 일차 크로마토그래피에서는 이온교환컬럼, 이차 크로마토그래피에서는 역상(reverse-phase) 컬럼이 사용된다.
◎ 단계적폭기(Step feed aeration)
폐수를 플러그 흐름(plug flow) 반응기의 여러 지점에 분산 유입시켜 슬러지의 배지/미생물(F/M) 비를 일정하게 유지하는 폐수처리 방법. 전통 방식인 플러그 흐름 폐수처리 공정의 변형이다. 최대 산소요구량을 감소시키는 효과가 있다.
◎ 단당류(Monosaccharide)
탄수화물의 단위체. 다당류를 산 또는 효소로 가수분해했을 때 생기는 구성 단위인 당류를 말한다. 중요한 것으로는 포도당, 과당, 만노오스, 갈락토오즈, 리보오스 등이 있다.
◎ 단백질분해효소(Protease)
펩타이드결합을 가수분해하는 효소류의 총칭. Proteolytic enzyme, proteinase, peptidase라고도 한다. 작용양식에 따라서, 폴리펩타이드 사슬의 말단에서 펩타이드결합을 절단하는 펩타이드외부분해효소(exopeptidase)와 내부에서 절단하는 펩타이드내부분해효소(endopeptidase)로 분류된다. 엑소펩티데이즈는 아미노말단에 작용하는 아미노펩티데이즈와, 카르복시말단에 작용하는 카르복시펩티데이즈로 구분된다. 단백질분해효소를 활성 발현 기작에 따라 분류하면, 세린프로테이즈(트립신 등), 산성프로테이즈(펩신 등), 메탈로프로테이즈(카르복시펩티데이즈 등)로 나뉜다. 프로테이즈는 소화제, 항염증제, 혈전 용해제, 효소 세제, 식품 단백질의 가수분해효소 등으로 널리 사용된다.
◎ 단백질재접힘(Protein refolding)
내포체(inclusion body) 형태로 얻어진 단백질을 원래의 활성 구조를 가진 형태로 변화시키는 과정. 가용화 공정(solubilization)과 활성회복(renatuation) 공정으로 이루어진다. 가용화 공정에서는 urea, GuHCl 등의 변성제(chaotropic agents)를 사용하여 분자 간의 소수성 결합과 비정상적인 이황화결합(disulfide bond)을 끊어 줌으로써 구조를 와해시킨다. 활성회복 공정에서는 가해진 변성제를 제거하여 올바른 삼차 구조의 형성을 유도한다.
◎ 단백질접힘(Protein folding)
리보좀에 의해 만들어진 단백질 사슬이 접혀 고유의 구조를 형성하는 과정. 세포 내에서 단백질 분자가 최종적으로 형성되는 삼차원 구조는 기본적으로 단백질 분자상의 아미노산 서열(단백질일차구조)에 의해 결정된다. 세포 내에서 단백질접힘 과정의 오류는 분자 샤페론이라 불리는 단백질에 의해 교정된다. 생체 내에서의 단백질의 부적절한 접힘은 종종 질병과 연관되어 있으며 알츠하이머병, 광우병, 낭성 섬유증(cystic fibrosis) 등이 대표적인 예이다.
◎ 당단백질(Glycoprotein)
당을 함유하는 복합단백질. 세린 또는 트레오닌의 수산기에 당쇄가 결합한 O-결합형, 아스파라긴의 아민기에 당쇄가 결합한 N-결합형 등이 있다.
◎ 당에테르(Sugar ether)
당의 수산기와 당 이외의 화합물의 수산기 사이의 탈수축합반응으로 생성되는 에테르 결합을 갖는 화합물의 총칭.
◎ 당지질(Glycolipid)
당을 함유하는 지질군의 총칭. 스핑고신 염기를 공통 성분으로 하는 스핑고 당지질과, 글리세롤을 공통 성분으로 하는 글리세로당지질로 대별되는데 전자는 주로 동물에, 후자는 주로 식물과 세균에 존재한다. 대부분 생체막의 주요한 구성 성분으로서 막의 표면에 존재하고, 막 항원, 혈액형 물질, 세포 간 상호 식별, 세포 증식 제어 등의 중요한 생체 기능에 관련된다.
◎ 대립유전자(Allele)
부계와 모계로부터 유래한 동족 염색체쌍의 같은 위치(locus)에 있는 한 쌍의 대립되는 유전자. 동형접합체(homozygote)에서는 대립유전자가 동일하고 이형 접합체(heterozygote)에서는 서로 다르다.
◎ 대수증식기(Eponential growth phase)
영양분이 충분히 공급되는 조건에서 미생물 집단이 주어진 환경에 적응해 일정한 비성장속도로 증식하는 단계. 이 단계에서는 세포 농도가 지수적으로(exponentially) 증가한다. Log phase라고도 한다.
◎ 대장균(Escherichia coli, E.coli)
Escherichia속에 속하며 사람을 포함하는 포유류 등의 결장에 기생하는 통성혐기성 그램음성균. 유전자조작의 숙주로서 널리 이용된다. 산업적으로는 인간 인슐린, 인터페론 등의 재조합 단백질 생산을 위한 숙주세포로 이용된다.
◎ 덱스트란(Dextran)
효모, 세균에서 발견되는 포도당으로 이루어진 분지다당. 분자량은 천연 상태에서 400만 정도이다. 녹말이나 글리코겐과 유사한 구조를 가지고 있으며, 포도당이 α-1,6 결합으로 주사슬을 형성하고 불규칙적으로 α-1,4 결합에 의해 분지가 이루어진다. 이것은 녹말이나 글리코겐이 α-1,4 결합에 의해 주사슬을 형성하는 가운데 분지점이 α-1,6 결합인 것과 대조적이다. 산으로 부분적 가수분해해 생리적 식염수에 6% 정도로 녹인 것을 대용 혈청으로 사용한다. 또한 덱스트란을 가교결합에 의해 불용화시킨 것은 젤 여과, 전기영동의 레진으로 많이 사용된다.
◎ 독립영양생물(Autotroph)
탄소원으로 이산화탄소만을 유일하게 사용하는 미생물. 종속영양 생물과 대응된다. 에너지원으로서 화학반응의 에너지를 이용하는 ‘화학 독립영양생물(chemoautotroph)’과 빛 에너지를 이용하는 ‘광합성 독립영양생물(photosynthetic autotroph)’로 구분된다.
◎ 돌연변이원(Mutagen)
자연 돌연변이 빈도보다도 높은 돌연변이 빈도를 일으키는 물리적 또는 화학적 돌연변이 유발 요인. 물리적인 요인으로는 방사선, 자외선이 대표적이며 화학물질로는 NTG(nitrosoguanidine)가 대표적이다.
◎ 동종효소(Allozyme / Alloenzyme)
서로 다른 생물 종에서 동일한 기능을 수행하는 효소
◎ 등전점(Isoelectric point)
단백질 등과 같이 음이온단과 양이온단을 동시에 함유하는 양성 전해질의 알짜 전하량(net charge)이 0이 되는 특정 pH. pI로 약기한다.
◎ 등전점전기영동(Isoelectric focusing)
대상 물질들을 pI값의 차이에 따라 분리하는 전기영동법의 일종. 위치에 따라 pH가 점진적으로 변하는 젤을 사용한다. 시료 중의 각 성분은 자신의 pI와 같은 pH를 갖는 위치에 도달하여 정지하여 폭이 좁은 밴드 형태로 농축된다. 단백질 혼합물을 분석하는 주요한 수단이며, 분획 정제의 목적으로도 사용된다.
◎ 라세미혼합물(Racemic mixture)
우회전성 및 좌회전성의 거울상 이성질체가 동일한 양으로 섞여있는 혼합물. 광학 이성질체는 서로 반대 방향으로 편광을 회전시키는 성질을 가지고 있으므로, 라세미혼합물은 편광을 회전시키지 않는다.
◎ 라세미화효소(Racemase)
D이성체나 L이성체의 한 형태를 기질로 해서 라세미체 형성 반응을 촉진하는 효소.
◎ 라이소자임(Lysozyme)
미생물 세포벽 다당류 내 n-아세틸뮤람산(NAM)과 n-아세틸글루코사민(NAG) 사이의 β-1, 4-글리코사이드 결합을 가수분해하는 효소. 살균, 효모추출물 생산 등 세포파괴가 요구되는 작업 또는 공정에 사용된다.
◎ 라이신(L-Lysine)
염기성 아미노산 중의 하나. 발효법, 반합성법 등으로 생산된다. 사료첨가제와 환자의 영양 보급용 아미노산 수액 성분으로 사용된다.
◎ 락토코커스(Lactococcus)
호모 유산 발효를 하는 연쇄상 구균의 속(genus). 우유 등에 존재하는 구형의 유산균으로 주로 치즈 제조 시에 사용된다. 락토바실러스나 비피도박테리아가 사람의 체온과 같은 37℃에서 잘 자라는 반면, 이 유산균은 이 보다 낮은 20∼25℃에서 잘 자라는 특성이 있으며 발효 과정 중 풍미성분(flavor, aroma)을 생산하여 치즈 특유의 냄새를 나게 한다. 이 속에 속하는 유산균들 중에는 니신(nisin)이라는 항균 물질을 생산하는 유산균이 존재한다. 대표적으로 Lactococcus lactis가 있다.
◎ 락토페리신(Lactoferricin)
락토페린을 단백질분해효소인 펩신으로 분해해 생성되는 분해물 중 항균성과 항바이러스성을 갖는 40~70개의 아미노산으로 구성된 펩타이드. 락토페린보다 2배 정도 높은 항균성을 보인다.
◎ 락트알부민(Lactalbumin)
우유의 pH를 4.7로 조절하였을 때 침전되지 않는 유청 단백질(whey protein)의 한 종류. 우유 단백질의 9~18%를 차지한다. 산이나 레닌(rennin)에 의해 응고되지 않으며 열에 의해 응고되는 단백질로, 우유를 가열하면 우유 표면에 형성되는 얇은 막의 주성분이다. 유아식이나 노인용 유동식에 첨가물로 사용된다.
◎ 락티톨(Lactitol)
유당의 포도당 잔기가 환원되어 솔비톨기로 전환된 이당류 당알코올. 유당에 수소를 첨가해 제조한다. 유당은 감미도와 용해도가 낮아 용도가 제한적이나 락티톨은 설탕과 유사한 단맛에 감미도는 설탕의 30~40%로 용해성이 좋고 설탕과 유사한 성질을 가지고 있어 설탕을 대체해 사용되는 저감미 기능성 소재이다. 내열성, 내산성이 우수하며 갈변현상도 없고 소장에서 거의 소화되지 않는 특징이 있다.
◎ 랄테스트(LAL) [limulus amebocyte lysate (LAL) test]
LAL 시약을 사용하여 내독소(endotoxin)을 검출 또는 정량하는 시험. 내독소와 LAL 시약이 반응하여 젤을 형성하는 원리를 이용한다.
◎ 레닌(Rennin)
어린 반추동물의 위액 속에 존재하는 단백질분해효소(protease)의 일종. 치즈 제조에 사용되는 응유 효소로서 키모신이라고도 한다. 원래 레닌은 프로레닌(prorennin) 상태로 존재하며, 산성 pH에서 그 일부가 가수분해되어 분자량이 감소되면서 레닌으로 활성화된다.
◎ 레시틴(Lecithin)
1,2-디아실-L-3-글리세릴포스포릴콜린. 가수분해되면 콜린, 인산, 글리세롤, 지방산이 생성되는 인지질의 한 종류이다. 구성 지방산은 주로 스테아르산, 팔미트산, 올레산, 리놀레산 등이며, 포유동물에는 주로 뇌수, 신경, 혈구, 난황 등에 들어 있으며, 식물에서는 대두, 해바라기씨, 밀배아 등에 함유되어 있고 박테리아에서는 거의 찾아볼 수 없다. 분자내에 친수성과 소수성의 성질을 모두 갖는 양친매성 물질로 알코올과 에테르에 용해되며 물에서는 유화액을 만들수 있으므로 천연 유화제로 사용된다. 생리적인 기능으로는 신경 전달 물질의 원료인 콜린의 주요 공급원으로 뇌와 신체의 활성을 유지시키며, 혈중 콜레스테롤을 저하시키는 효과가 알려져 있다. 식품첨가물과 건강 식품 소재로 사용된다.
◎ 렌넷(Rennet)
우유를 먹는 어린 송아지(생후 5개월 미만)의 4번째 위에서 추출한 응유효소. 주성분은 단백질분해효소의 일종인 레닌이다. 치즈를 만드는데 사용된다.
◎ 루시퍼레이즈(Luciferase)
생물발광에 중요한 역할을 하는 효소. 세균, 원생동물, 버섯, 반디불이의 발광기관에 분포한다. 산소분자에 의한 루시페린의 산화를 촉진함으로써 발광을 유도한다. 종류에 따라서는 산소분자 외에 ATP 등의 물질을 필요로 하기 때문에 미량 ATP의 검출에 이용된다.
◎ 리세르그산(Lysergic acid)
맥각(ergot) 알칼로이드(에르고메트린, 에르고타민, 에르고크리스틴 등)의 알칼리 가수분해로 생성되는 유기산. 물, 묽은 황산, 일반 유기용매에 잘 녹지 않고, 피리딘, 수산화나트륨, 암모니아, 묽은 염산에 녹는다. 교감 신경 마비, 혈관 수축 등의 작용을 한다. 환각제인 리세르그산디에틸아마이드(LSD: lysergic acid diethylamde)의 원료로도 사용된다.
◎ 리켓챠(Rickettsia)
리켓챠과에 속하는 세균류의 총칭. 사람이나 동물의 병의 원인이 되는 미생물 병원체이다. 대부분 길이가 0.3∼0.5μm이며 지름이 0.3μm 정도이다. 구조는 일반 세균 세포와 비슷하지만, 일반 세균과 달리 살아 있는 세포 내에서만 증식이 가능하고 인공배지에서는 증식하지 못한다는 점은 바이러스에 가깝다. 발진 티푸스, 쯔쯔가무시 병 등의 원인균이다.
◎ 마스트세포(Mast cell)
세포질에 커다란 과립을 갖고 있는 혈액 내 다형핵 세포. 세포질에는 헤파린, 세로토닌, 히스타민 등이 풍부하게 들어 있는 과립구가 있으며 세포막에는 IgE 수용체를 가지고 있다. 항원이 마스트세포의 표면 IgE에 결합하면 염증을 일으키는 화학물질들이 분비되어 알러지 반응이 개시된다. 따라서 알러지 질환이나 감염에서 숙주를 보호하는 중요한 역할을 담당한다.
◎ 마이켈리스상수(Michaelis constant)
마이켈리스-멘텐 반응속도론(Michaelis-Menten kinetics)에 있어서 효소 기질 복합체 형성에 관한 유리 평형상수. 효소와 기질과의 친화성을 나타낸다. 반응속도가 최대속도(Vmax)의 1/2이 될 때의 기질 농도에 해당된다. Km으로 표기한다.
◎ 만난(Mannan)
만노오스를 주성분으로 하는 다당류의 총칭. 포도당 또는 유당을 다량 함유한 것은 각각 글루코만난, 갈락토만난으로 불리운다. 미생물과 식물에 존재하며, 효모의 세포벽을 구성하는 만난은 α-1,6결합으로 이루어지는 주사슬에 α-1,2결합과 α-1,3결합을 포함하는 곁사슬이 붙은 분지구조를 갖는다. 고등식물 중 상아 야자의 종자에 함유된 것은 β-1,4결합을 가지는 만노오스로 이루어진 거의 순수한 만난이다. 곤약의 지하 구경에 존재하는 만난은 β-1,4결합에 의해 연결된 만노오스와 포도당(3:2)으로 이루어진 곧은 사슬 모양의 글루코만난이다. β-1,4결합한 만난의 곧은 사슬에 유당이 α-1,6결합한 구조를 갖는 갈락토만난이 커피콩 등의 콩과식물 종자에 함유되어 있다. 식이섬유로 건강 식품, 다이어트 식품의 소재로 사용된다.
◎ 말디토프질량분석기(MALDI-TOF-MS, matrix-assisted laser desorptionionization -time-of-flight mass spectrometer)
분자량이 비교적 큰 시료와 매트릭스 (matrix)가 혼합된 결정에 레이저를 조사하여 이온화시킨 후, 전하를 띤 이온들을 비행시간형 (time-of-flight) 질량분석기를 통과시켜 검출기까지의 도달시간을 측정하여 분자량을 분석하는 분석장치. 단백질이나 DNA 단편의 분자량을 측정하는데 광범위하게 사용된다. 분자량의 측정범위는 1,000에서 500,000달 톤까지이며 펩타이드 질량 지문 추적법 (PMF)기법을 이용하여 단백질을 동정하는 가장 보편적인 단백체 분석 방법이다. 최근에는 두개의 분석기가 장착된 MALDI- QTOF이나 MALDI-TOF/TOF가 널리 이용된다.
◎ 말론산(Malonic acid)
지방족 디카르복실산의 하나. 사탕무, 사과, 콩과 식물의 잎 등에 칼슘염 형태로 존재한다. 말론산에틸은 염료, 의약, 향료 등의 합성 원료로서 중요하다. 숙신산과 구조가 비슷하기 때문에 숙신산탈수소효소와 결합, 그 작용을 길항적으로 저해하므로 결과적으로 TCA 회로를 저해하는 작용을 한다.
◎ 맥아당(Maltose)
두 개의 포도당 분자가 α-1,4-글리코사이드 결합에 의해 축합되어 생성된 이당류. 전분 당화효소인 β-아밀레이즈를 사용해 얻을 수 있다. 발아 중의 곡물 종자 속에 많이 함유되어 있으므로 맥아당이라고 부른다. 맥아물엿의 주성분이며 분말 맥아당은 단 맛이 적은 과자류에, 결정 맥아당은 정맥 주사용 당 보급액 성분으로 사용된다.
◎ 맥아효소(Malt enzyme)
보리를 발아시킨 맥아 내에 들어 있는 효소군. 곡류의 전분을 분해해 발효당으로 전환시키는 아밀레이즈원이다. 맥주 제조 시 담금 과정에서 전분을 발효당과 덱스트린으로 분해한다.
◎ 밀도구배원심분리(Density gradient centrifugation)
초고속원심분리 C82시 설탕이나 염화세슘(CsCl) 용액에 의해 형성되는 밀도 구배를 이용해 밀도 차이에 따라 물질을 분리하는 방법.
◎ 바실러스속(Bacillus)
Bacillaceae과 세균의 한 속(genus). 호기성 또는 통성혐기성의 간균으로 보통 그램 양성이다. 환경 조건에 따라서 균체 내에 구조적 변화가 생겨서 전포자(forespore)의 단계를 거쳐서 완성된 한 개의 아포 포자를 형성한다. 포자는 열, 방사선, 화학물질 등에 대한 저항성이 강하다.
◎ 바이오셀룰로오스(Biocellulose)
박테리아에 의해서 생합성되는 셀룰로오스. 박테리아 셀룰로오스라고도 한다. 식물 셀룰로오스와 박테리아 셀룰로오스는 화학구조가 거의 비슷하지만 물리적, 화학적 물성은 다르다. 바이오셀룰로오스는 식물 셀룰로오스에 비해 매우 가늘며 높은 강도를 갖는 기능성 생분해성 고분자이다.
◎ 박테리오로돕신(Bacteriorhodopsin)
호염성 미생물의 세포벽에 존재하는 색소 단백질의 일종. 특정 파장의 빛에 의해 발색단의 구조변화가 일어나면서 적자색에서 황색으로 변한다. 이러한 색 변환 특성은 가역적이며 바이오메모리칩의 개발에 이용될 수 있다.
◎ 반경쟁적저해(Uncompetitive inhibition)
저해물질이 효소-기질 복합체와 결합해 불활성인 결합체를 형성함으로 인해 야기되는 저해.
◎ 배당체(Glycoside)
당의 환원기와 당 또는 당 이외의 화합물의 히드록시기가 탈수축합해 생긴 물질. 당과 당이 축합한 것을 홀로사이드(holoside)라 하며 소당류와 다당류가 포함된다. 당과 당 이외의 성분(아글리콘)으로 된 것은 헤테로사이드(heteroside)라고 한다. 좁은 뜻의 글리코사이드는 이 헤테로사이드만을 가리킨다.
◎ 벡터(Vector)
재조합DNA기술 분야에 있어서, 외래 목적 DNA의 단편을 숙주 내로 도입하기 위해서 사용되는, 운반체 역할을 하는 자가 복제 능력을 갖는 DNA 분자. 대상 DNA의 증폭을 목적으로 하는 클로닝벡터(cloning vector)와 대상 유전자의 발현을 목적으로 하는 발현벡터로 나뉜다. 서로 다른 두 종의 숙주 내에서 복제될 수 있는 벡터를 셔틀벡터(shuttle vector)라고 부른다.
◎ 변생구배전기영동(Denaturing gradient gel electrophoresis, DGGE)
전기영동할 때 젤 내의 변성제 농도에 구배를 주어, DNA 염기서열 차이로 인한 이중 나선의 구조 변화와 이에 따른 이동 속도의 차이를 극대화해 유전자를 분석하는 방법. 염기서열 내의 돌연변이를 검색함으로써 유전적 다양성을 연구하는데 사용된다.
◎ 보결분자단(Prosthetic group)
복합단백질의 단백질에 결합되어 있는 비단백질성 분자 또는 분자단. 예를 들면, 핵단백질의 핵산 부분, 당단백질의 당 부분, 헤모글로빈이나 시토크롬의 힘, 플라보 단백질의 플라빈 부분, 리포단백질의 인지질 부분 등이다. 금속 원자가 단백질과 결합해 보결 분자단과 같은 구실을 하는 것도 있으나, 이를 보결분자단이라 하지는 않는다.
◎ 복합배지(Complex medium)
화학적 조성이 불명확한 성분을 함유하는 배지. 당밀(molasses), 맥아즙(malt extract), 효모추출물(yeast extract), 펩톤(peptone), 육즙(meat extract), 옥수수침지농축액(corn steep liquor) 등이 대표적이다.
◎ 블로팅법(Blotting method)
시료 중의 핵산이나 단백질들을 전기영동으로 분리하고 멤브레인에 전사(transfer)한 후 탐침(probe) 물질과의 특이적인 결합을 이용해 특정 핵산이나 단백질을 검출하는 방법. 단백질 검출은 웨스턴블로팅법(Western blotting), DNA 검출은 사우던블로팅법(Southern blotting), RNA 검출은 노던블로팅법(Northern blotting)에 의해 수행된다.
◎ 비변성단백질(Native protein)
본래의 구조를 유지하고 있는 단백질. 삼차원구조가 열, 화학물질에 의해 비가역적으로 파괴된 변성단백질(denatured protein)에 상대되는 용어이다.
◎ 비성장속도(Specific growth rate)
단위 세포당 세포성장속도. 세포의 성장 활성을 나타내는 기본 지표이다. 회분식배양에 있어서 세포성장속도를 세포 농도로 나눈 값으로 정의된다.
◎ 비타민B12(Vitamin B12)
네개의 파이롤(pyrrole) 핵을 가지는 테트라파이롤(tetrapyrrole) 구조가 코발트와 착염 형태인 코리노이드(corrinoid). 일반적으로 코발라민(cobalamin)이라 부른다. 수용성이며 동물성 식품에 주로 많고, 체내에서 메틸코발라민(methylcobalamine)과 아데노실코발라민(adenosylcobalamine) 형태로 전환되어 작용한다. 비타민B12는 인체의 장내 세균에 의해 합성되므로 결핍증이 희귀하나 부족하면 악성빈혈이 나타난다.
◎ 비타민B2(Vitamin B2)
5탄당 당알코올인 리비톨(ribitol)이 플라빈(flavin)과 연결된 구조의 수용성 비타민. ‘리보플라빈(riboflavin)’이라고도 한다. 성장인자라는 의미로는 비타민G라고도 한다. 간, 어류, 우유, 채소 등 동·식물계에 널리 분포하고 있다. 체내에서 FMN(flavin mononucleotide)과 FAD(flavin adenine dinucleotide) 형태로 전환되어 산화, 환원 반응의 조효소(coenzyme)로 작용한다. 비타민B2가 부족하면 성장 정지, 피로, 구각염, 설염, 피부염 등의 증상이 나타난다.
◎ 사면배양(Slant culture)
시험관 안에 한천 등의 고형배지로 사면을 형성하여 그 위에 미생물을 배양하는 것 또는 이로부터 얻어진 배양체. 비교적 단기간 동안의 균주 보관에 사용된다.
◎ 사이클로덱스트린(Cyclodextrin)
포도당이 환상 구조로 결합된 고분자 물질. 도너츠 형태의 구조를 하고 있고 내부가 소수성을 띠고 있기 때문에 유기분자를 그 안에 포집할 수 있다. 식품산업에서 향기 물질의 포집이나 의약품의 수용성을 증가시키기 위한 물질로서 사용된다.
◎ 산소섭취속도(Oxygen uptake rate, OUR)
세포가 산소를 섭취하는 속도. 미생물 발효의 경우 성장속도, 기질 종류에 따라 달라진다.
◎ 산소전달속도(Oxygen transfer rate, OTR)
반응기에서 기상으로부터 세포로 산소가 전달되는 속도. 산소는 보통 배양액에 공기를 불어넣어 줌으로써 공급된다. 주로 산소분압, 교반속도, 포기속도, 액체의 점도 등에 의해서 영향을 받는다.
◎ 상보성결정부위(Complementarity determining region, CDR)
항체가 항원과 결합할 때 특정적으로 결합하는 부위. 다양한 항원과 결합하는 항체의 특징을 결정짓는 부위이기 때문에 HV region (hypervariable region)이라고도 한다.
◎ 상용표준폼(Working standard)
의약품 등의 생물학적 또는 이화학적 시험을 할 때 그 역가 또는 함량을 정하기 위해 표준으로 사용하는 물질. 표준품을 기준으로 하여 제조된다.
◎ 생물안전도(Biosafety)
감염성 생물체로부터 실험자의 피폭에 의한 피해를 최소화하기 위한 목적으로, 감염성이 증명되었거나 잠재적 감염의 위험이 있는 생물체를 위해성의 정도에 따라 분류하고 이에 필요한 차폐시설을 차등하여 분류하는 기준. 생물체의 위해성 및 차폐시설의 등급은 통상 국제보건기구(WHO) 또는 미국 질병통제센터(CDC)의 기준을 따라 4단계의 생물안전도(BL: biosafety level), 즉 BL-1, BL-2, BL-3 및 BL-4로 분류된다. 작업공간 내의 청정공기의 필요성, 공기의 청정도를 유지할 HEPA필터의 성능, 실험실 내 공기의 외부로의 유출방지를 위한 음압형성 여부 및 실험자의 감염방지를 위해 특수제작된 예방복 착용 여부, 에어샤워 설치여부 등을 규정한다.
◎ 서던블롯(Southern blot)
‘블로팅법’ 참조
◎ 선도서열(Leader sequence)
전령RNA의 5‘ 말단과 아미노산 중합 개시코돈사이에 존재하는, 번역되지 않으나 유전자 발현을 조절하는 서열. SD (Shine-Dalgano) sequence, attenuation sequence 등이 포함된다.
◎ 세균(Bacteria)
원핵생물 중 시아노박테리아(cyanobacteria)와 고세균을 제외한 미생물군. 엽록소가 없어서 광합성을 하지 못하는 종속영양생물이다. 대부분 단세포로 존재하며 이분법에 의해 증식한다. 넓은 뜻으로는 시아노박테리아와 고세균을 모두 포함하는 원핵생물을 통칭하기도 한다.
◎ 세포반수감염용량(Tissue culture infective dose 50%, TCID50)
세포배양 시 세포의 50%를 감염시킬 수 있는 바이러스의 양. 세포에 존재하는 바이러스의 정량분석에 이용된다
◎ 세포병변효과(Cytopathic effect, CPE)
바이러스 감염에 의해서 세포의 병변이나 이상을 보이는 현상.
◎ 셀레늄(Selenium)
원자번호 34의 주기율표 제6B족에 속하는 산소족 비금속 무기물 원소의 하나. 현미 등의 가공되지 않은 곡류나 마늘, 해조류, 인삼, 파슬리, 후추, 연어, 닭고기 등에 함유되어 있다. 항산화효소 중 하나인 글루타치온퍼옥시데이즈(glutathione peroxidase)의 구성 성분으로 세포내 성분의 산화적 손상을 방지하는 기능이 있다. 항산화 효과가 천연 토코페롤의 약 2000배 정도이며, 암 억제 유전자의 활성을 유도함으로써 항암 효과를 가진다. 중금속을 무독한 형태로 변형시켜 몸 밖으로 배출시키는 기능도 있다. 과잉 섭취할 경우 위장병이나 탈모, 가벼운 신경계 손상 등의 부작용을 유발한다.
◎ 소포제(Antiforming agent)
거품을 제거시켜 주는 물질. 주로 통기 발효 중에 생기는 거품을 제거하기 위해 사용된다. 고급 알코올류, 지방산 에스터, 식물성 유지, 실리콘 수지, 폴리프로필렌글리콜(PPG) 등이 대표적이다.
◎ 슈크랄로오스(Sucralose)
설탕의 수산기 세개가 염소로 치환된 인공 감미료. 감미도는 설탕의 450~600배이며 단맛은 설탕과 유사하나 단맛이 오래 지속되는 특징이 있다. 내열성과 내산성이 우수해 고온으로 혹은 낮은 pH에서 제조되는 식품에도 사용할 수 있다. 제과, 제빵, 통조림, 음료, 유가공품 등 다양한 식품에 사용이 가능하며, 당뇨환자, 임산부 등 모든 사람을 위한 식품에 적용된다.
◎ 스파이킹실험(Spiking experiment)
대상 시료에 특정 물질이 포함되어 있는지 여부를 확인하기 위하여, 해당 표준 물질을 시료에 첨가한 후 얻어진 분석 결과를 원래 시료의 분석 결과와 비교하는 실험.
◎ 스페로플라스트(Spheroplast)
‘원형질체’ 참조
◎ 슬러지벌킹(Sludge bulking)
침전성이 불량한 슬러지 상태. 이러한 상태에서는 슬러지의 침전 및 재순환이 어려워지며 슬러지 유출이 야기된다. 통기조(aeration tank) 내의 용존산소, 영양소 부족, 유기물 부하량의 급격한 변화, 낮은 먹이-미생물비 (F/M) 등이 원인이다.
◎ 시료잔존(데드렉) 영역(Dead leg zone)
샘플링 작업 후 잔존액이 존재하는 샘플링 라인의 일부 구간. 이 구간에 차 있는 액은 차기 샘플링 시 대상 장치 내의 상태를 대표하지 못하기 때문에 사전에 반드시 제거되어야 한다.
◎ 아가로오스(Agarose)
아가바이오즈(agabiose)가 α-1,3 결합을 통해 연결된 직선 구조를 갖는 해조 다당류의 일종. 아가로펙틴과 함께 한천의 주성분이다. 젤 여과, 전기영동 등에 쓰인다.
◎ 아가로펙틴(Agaropectin)
알콕시 글리세롤의 구성 단위인 아가로바이오즈 10~50개마다 한 개씩 존재하는 갈락토오즈에 황산기가 결합되어 있는 다당류. 독자적인 용도는 미미하고 알콕시글리세롤과의 혼합물인 한천의 형태로 이용된다. 식품 안정제, 미생물 배양용 배지로 널리 사용된다.
◎ 아드레날린/에피네프린(Adrenalin/Epinephrine)
부신수질의 아드레날린 세포와 아드레날린 작동성 뉴런에서 분비되는 카테콜아민계 호르몬. 글리코겐의 분해를 증대시킴으로써 혈당치를 높이고, 유리 지방산의 작용을 촉진해 심장 혈관계나 근육 조직에 여러 가지 효과를 미친다. 교감 신경 흥분제, 혈관 수축제, 혈압 상승제로 사용되며, 출혈을 멎게 하고 기관지 천식의 발작에 효과가 있다.
◎ 아미노기전이효소(Aminotransferase)
α-아미노산의 아미노기를 α-케톤산으로 전이해 다른 케톤산과 아미노산을 생성하는 반응을 촉진하는 효소의 총칭. 트랜스아미네이즈(transaminase)라고도 한다.
◎ 아미노당(Amino sugar)
수산기가 아미노기로 치환된 당. 자연계에 널리 존재하는 것은 글루코사민과 갈락토사민이며, 주로 다당류의 성분으로서 발견된다. 아미노당을 함유하는 다당류를 특히 뮤코다당류라 하며, 동물의 결합조직이나 세포막의 성분으로서 널리 분포한다.
◎ 아미노산(Amino acid)
아미노기와 카르복실기를 동시에 가지는 유기화합물의 총칭. 단백질의 기본 구성 단위이다. 아미노산은 글라이신을 제외하고 일반적으로 광학 이성질체를 가지는데, 단백질 속에 있는 모든 아미노산(NH2-CH(R)-COOH)은 α-탄소에 아미노기가 결합되어 있으며 L-형이다. 그러나 D-아미노산도 또한 천연으로 존재하며, 미생물의 세포벽에 많이 함유되어 있다. D-아미노산을 함유하는 펩타이드는 강한 항균작용 또는 독성을 보이는 것이 많고 의약품의 원료나 중간체로서 이용된다. 단백질을 구성하는 주요 아미노산은 글라이신, 알라닌, 발린, 루이신, 아이소루이신, 트레오닌, 세린, 시스테인, 메티오닌, 아스팔트산, 아스파라긴산, 글루탐산, 글루타민, 라이신, 알지닌, 히스티딘, 페닐알라닌, 타이로신, 트립토판, 프롤린의 20종이다.
◎ 아밀레이즈(Amylase)
전분(아밀로오스 및 아밀로펙틴)이나 글리코겐과 같이 α-1,4 결합의 글루코오즈로 구성되어 있는 다당을 가수분해하는 효소. 작용하는 양식에 따라 α-아밀레이즈, β-아밀레이즈, 글루코아밀레이즈의 3종으로 나눈다. 【α-아밀레이즈】전분을 포도당, 맥아당, 덱스트린으로 가수분해하는 효소로 액화효소라고도 한다. 【β-아밀레이즈】전분, 글리코겐 등의 포도당 잔기를 끝에서부터 차례로 가수분해해 맥아당을 유리시키는 효소이다. 【글루코아밀레이즈】전분, 글리코겐 등의 포도당 잔기를 끝에서부터 차례로 가수분해해 포도당을 유리시키는 효소이다. α-l,6-결합에도 작용한다. 아밀로글루코시데이즈(amyloglucosidase)라고도 한다.
◎ 아세설팜칼륨(Acesulfame K)
인공 감미료의 일종. 감미도는 설탕의 200배이다. 섭취하였을 경우 칼로리가 없고, 내열성, 내산성이 우수하다. 다른 감미료와 혼합사용하면 단맛의 상승 효과가 있다. 주로 저칼로리, 다이어트 식품에 사용된다. 1967년 독일 훽스트사에서 개발하였다.
◎ 아세톤(Acetone)
디메틸케톤. 무색의 휘발성 액체로 물, 알코올이나 에테르에는 잘 녹는 유기 용매이다. 마취 작용이 있다. 혐기성미생물에 의한 아세톤-부탄올 발효를 통해 생산되거나 쿠멘페놀법 등의 화학 공정에 의해 생산된다. 화학 산업 분야에서 사용되는 대표적인 세정 용매이다.
◎ 아세틸콜린분해효소저해제
신경 전달 물질인 아세틸콜린을 분해하는 효소의 작용을 저해하는 물질. 아세틸콜린의 분해를 막아 주어 감퇴된 인지기능을 개선시켜 주는 효과를 가지고 있으므로 알츠하이머병의 치료제로 사용된다. FDA의 승인을 거친 타크린(tetrahydro-aminoacridine, THA, Tacrine)과 아리셉트(donepezil, Aricept)이 대표적인 예다.
◎ 아스파라긴(Asparagine)
아스파라거스에서 최초로 발견된 아미노산의 일종. 약호는 Asn 또는 N이다. 식물계에 널리 분포하며, 사탕무 뿌리, 발아한 콩류, 감자 등에 많다. 아스파라긴은 생체 내에서 아스파라긴 합성효소(asparagine synthetase)에 의해서 아스파르트산, 암모니아, ATP로부터 생성된다.
◎ 아스파트산(Aspartic acid)
산성 아미노산의 일종. 약호는 Asp 또는 D이다. 효소법으로 제조되는 대표적인 아미노산으로 L-아스파트산은 퓨마르산을 원료로 하여 아스팔테이즈(aspartase)에 의해 제조되며 아스파탐의 주원료이다.
◎ 아크릴아마이드(Acrylamide)
아크릴로나이트릴의 화학적 또는 생물학적 수화반응(hydration)을 통해 만들어진다. 무색 결정의 화합물로서 수용성이며 독성이 강하다. 중합체인 폴리아크릴아마이드는 접합제, 도료, 수처리용 응집제, 종이·섬유의 마감제 등으로 사용된다. 특히, 생물공학적으로는 효소 및 세포 고정화용 담체와 단백질 또는 핵산 분리를 위한 전기영동 젤 등으로 사용된다.
◎ 아포효소(Apoenzyme)
보조효소(coenzyme)나 보조인자(cofactor)와의 결합을 통해서만 활성을 나타내는 효소. 아포효소와 조효소(coenzyme)의 결합체를 완전효소(holoenzyme)라고 한다.
◎ 안정성시험(Stability test)
제품의 안정성을 평가하는 시험. 시험목적에 따라 장기보존시험(long-term test), 가혹시험(stress test), 가속시험(accelerated test)으로 구분한다. 장기보존시험은 유효기간(또는 사용기간) 중의 품질을 보증하기 위한 시험이며, 가혹시험은 가혹조건에서 분해산물의 생성여부 등을 확인하기 위한 시험이며, 가속시험은 일정한 유통기간중의 품질을 단기간에 추정하기 위한 시험이다.
◎ 안티센스RNA(Antisense RNA)
특정 RNA 서열과 상보적인 결합을 해 표적 RNA의 작용을 억제하는 단일 사슬 RNA.
◎ 알긴산(Alginic acid)
ß-1,4결합의 D-만유론산(D-mannuronic acid)과 α-1,4결합의 L-글루론산(L-guluronic acid)으로 이루어진 사슬구조의 점질 다당. 조류의 세포벽의 주성분이다. 해초산이라고도 한다.
◎ 알돌레이즈(Aldolase)
하이드록실 그룹과 카보닐 그룹을 동시에 갖는 분자의 C-C 결합을 절단해 두 개의 작은 물질, 즉, 알데하이드와 케톤으로 분해하는 효소로서 라이에이즈(lyase)의 일종. 예를 들어, fructose bisphosphate aldolase는 Embden-Meyerhof 대사 경로 상에서 과당-1,6-이인산(fructose 1,6-bisphosphate)을 디하이드록시아세톤포스페이트(dihydroxyacetone phosphate)과 글리세르알데히드-3-포스페이트(glyceraldehyde 3-phosphate)으로 분해한다.
◎ 알부민(Albumin)
생체 세포나 체액 중에 널리 함유되어 있는 아미노산만으로 구성된 단순 단백질의 총칭. 대표적인 것으로는 혈청 알부민이 있다. 난백 알부민의 경우 단순 단백질로 알려져 알부민으로 분류되었으나, 실제로는 당과 인산을 포함한 복합단백질로 밝혀졌다. 알부민은 한냉 알코올(cold ethanol) 분획 침전법(fractional precipitation)에 의해 혈장으로부터 분리된다. 순환 혈액량 감소증 및 저알부민 혈증의 치료에 사용되며 혈장 교환 시술 시 보충 용액으로 사용된다.
◎ 알지네이트(Alginate)
알긴산의 금속염. 알긴산 나트륨, 알긴산 칼슘이 대표적이다. 나트륨염은 물에 녹으며 점도가 매우 높기 때문에 용도가 넓다. 직물 제조용 접착제, 수성 도료, 유화제, 식품 첨가제로 이용된다. 칼슘염은 불용성 젤을 형성하므로 미생물 배양에 있어서 세포 고정화 담체 등으로 사용된다.
◎ 알칼리성탈인산화효소(Alkaline phosphatase)
pH 8 이상의 알칼리 환경에서 인산 에스터(phosphate ester) 결합을 가수분해함으로써 대상 분자로부터 인산기를 제거하는 효소군. 대부분의 일인산에스터 결합을 거의 같은 속도로 분해하는 등 특이성이 넓다.
◎ 알파헬릭스(α-helix)
단백질 구조에 있어서 시계방향 나선형의 부분적 접힘 양상을 나타내는 이차 구조의 한 형태. 하나의 펩타이드 결합의 카르보닐 그룹과 다른 펩타이드결합의 아마이드 그룹이 매 네 번째 잔기마다 수소결합을 함으로써 형성된다.
◎ 액티노마이신(Actinomycin)
방선균이 생산하는 항생 물질의 일종. 항종양성이 있으며 DNA 의존성의 RNA 합성을 저해하는 특성을 가진다.
◎ 에임즈시험(Ames test)
Salmonella typhimurium을 사용해 히스티딘 요구성의 복귀 돌연변이 유발을 간편하게 플레이트법으로 시험함으로써 변이원 물질을 검색하는 방법. 살모넬라 변이원 테스트라고도 한다. 발암물질의 일차 스크리닝법으로서 널리 사용되고 있다.
◎ 역마이셀(Reverse micelle)
양친성 물질의 소수성 부위는 외부로 향하고, 친수성 부위는 내부로 향하는 폐쇄형 미세 구조. 비극성 용매 내에서 계면 활성제 등에 의해서 형성되는 구조로서 그 내부에 친수성 물질을 함유한다. 마이셀과 반대되는 개념이다. 생물분리정제, 나노구조 형성 등에 사용된다.
◎ 연속교반조반응기(Continuous-flow stirred tank reactor, CSTR)
원료의 주입과 반응액의 유출이 연속적으로 이루어지는 교반형 반응기. 정상상태에서는 일정한 화학적 환경이 유지된다는 의미에서 키모스탯(chemostat)이라고도 한다.
◎ 열충격단백질(Heat-shock protein)
세포가 고온, 산소 부족 등과 같은 다양한 스트레스 상황을 겪을 때, 다량 발현되는 단백질의 총칭. 이들은 정상적 환경 하에서도 세포 내에 존재하며 세포 내 단백질들의 구조 형성을 돕는 분자 샤페론의 역할을 수행한다. 대부분의 고등세포와 미생물에서 발견되는 Hsp70 이 대표적인 열충격단백질이다. 스트레스 단백질(stress protein)이라고도 한다.
◎ 염기쌍(Base pair)
수소 결합으로 이루어진 핵산 내의 특정 염기의 쌍. DNA에서는 아데닌과 티민, 구아닌과 시토신, RNA에서는 아데닌과 우라실, 구아닌과 시토신이 특이적으로 결합한다.
◎ 엽산(Folic acid)
테리딘(pteridine), 파라아미노벤조산(p-aminobenzoic acid), 글루탐산(glutamic acid)이 결합된 구조로 된 수용성 비타민. 비타민B9이라고도 한다. 채소, 동물의 간 등에 함유되어 있다. 체내에서 테트라하이드로폴레이트(tetrahydrofolate, THF)로 전환되어 단일탄소 수송 반응의 조효소(coenzyme)로 작용한다. 장내 세균에 의해 합성되며 부족한 경우 악성 빈혈이 나타난다.
◎ 옥수수침지액(Corn steep liquor)
옥수수 녹말 제조 시 침지 과정에서 발생하는 액상 부산물. 각종 아미노산, 비타민, 무기물을 함유하고 있으며 미생물 발효 배지의 질소원으로 널리 이용된다.
◎ 올리고뉴클레오타이드(Oligonucleotide)
소수(일반적으로 50개 이하)의 뉴클레오타이드가 인산디에스테르 결합으로 연결된 중합체. 핵산의 효소적 분해에 의해 생성되거나 화학적으로 합성된다.
◎ 올리고당(Oligosaccharide)
두 개에서 열 개 정도까지의 단당이 글리코사이드 결합에 의해 연결된 물질. 다당(polysaccharide)과 구별해 소당이라고도 한다. 때로는 단당이 20개 정도인 것까지를 포함하기도 하며 다당과의 경계는 명확하지 않다. 단당의 수에 따라서 이당류, 삼당류, 사당류 등으로 분류된다. 말토올리고당, 이소말토올리고당, 프락토올리고당, 갈락토올리고당, 대두올리고당 등은 식품첨가물로서 이용되는 대표적인 올리고당으로 비피도박테리아 증식을 촉진함으로써 정장 효과를 갖는다.
◎ 용원성파아지(Lysogenic phage)
유전체가 숙주 염색체에 편입(용원화)되어 그 일부로서 복제되는 박테리오파아지. 용원화한 프로파아지는 자연적 요인, 또는 자외선 조사 등의 인위적인 요인에 의해 용균화된다.
◎ 원평광이색성(Cicular dichroism)
물질이 동일 파장의 좌원편광과 우원편광에 대해 다른 흡광도를 보이는 현상. 광학 활성 분자의 입체구조나 단백질의 구조를 분석하는 데 이용된다.
◎ 유가식배양(Fed batch culture)
회분식배양의 변형된 형태로서, 제한 기질을 연속적, 또는 간헐적으로 공급해주는 발효 방법. 기질저해나 대사산물저해를 효율적으로 극복할 수 있으며 세포나 특정 대사산물 생산을 극대화하기 위해 사용된다. 기질 공급의 방법에 따라 DO-stat, pH-stat, RQ-stat, 지수적 유가식배양 등이 있다.
◎ 육탄당(Hexose)
탄소원자 6개를 가진 단당류. 알도오즈와 케토오즈가 있고 생물계에 가장 널리 분포하는 단당류다. D-글루코오즈(포도당)를 비롯해 D-갈락토오즈, D-만노오즈, D-프락토오즈 등이 대표적이다.
◎ 이노시톨(Inositol)
사이클로헥산 골격을 가지는 6가 알코올의 총칭. 이론적으로는 9종의 이성질체가 가능하지만, 보통 천연에서 발견할 수 있는 것은 4종으로 각각 D-카이로이노시톨, L-카이로이노시톨(chiro-inositol), 미오이노시톨(myo-inositol), 실로이노시톨(scyllo-inositol)이라고 불리운다. 동물, 식물이나 효모 등의 미생물에 널리 분포한다. 동물 및 일부 미생물의 성장인자이다. 탈모 방지, 혈중 콜레스테롤치 저하 효과가 있으며, 심근의 건강을 돕고 뇌세포에 영양을 준다. 간경변 치료제로도 사용된다.
◎ 이소말토올리고당(Isomaltooligosaccharide)
포도당 분자간에 α-1,6결합이 1개 이상 존재하는 말토올리고당 혼합물. 이소말토오스, 이소말토트리오스, 파노오스 등이 주성분이다. 효모가 이용하지 못하는 비발효성 당으로 청주, 된장, 간장 등에 소량 함유되어 있다. 산업적으로는 전분을 아밀레이즈로 분해한 후 당전이효소(transglucosidase)를 작용시켜 제조한다. 감미도는 설탕의 약 50%이며 보습성, 전분의 노화 방지, 충치 방지, 비피도박테리아의 증식 효과가 있는 저감미 감미료로 캔디, 과자류, 음료, 아이스크림에 많이 사용된다. 분지올리고당이라고도 한다.
◎ 이소플라빈(Isoflavin)
플라보노이드(flavonoid)의 일종. 여성 호르몬인 에스트로겐과 구조적으로 뿐만 아니라, 생물학적 작용도 유사하기 때문에 식물성 에스트로겐이라 불리기도 하며 콩과 식물에 가장 많이 함유되어 있다. 생리적인 기능은 이소플라본과 유사하며 그 활성은 이소플라본보다 약하다.
◎ 이온운반체(Ionophore)
세포막 또는 인공 지질 막에 작용해서 이온 투과성을 높이는 작용을 하는 물질. 특정 이온과 소수성의 복합체를 만들어 막의 소수성 영역을 통과함으로써 이온 투과성을 높인다. 발리노마이신, 모넨신 등의 항생물질이 이에 속한다.
◎ 이화대사산물억제(Catabolic repression)
포도당과 같은 이화대사가 용이한 탄소원이 배지 중에 존재할 때 특정 효소의 생합성이 억제되는 현상. 예를 들어 포도당과 유당이 공존할 때 포도당의 이화대사의 결과에 의해 유당이화대사에 필요한 효소들의 합성이 억제되어 결과적으로 유당이 미생물에 의해 이용되지 못하는 현상이 있으며 이 경우 포도당 효과(glucose effect)라고도 한다.
◎ 이황화결합(Disulfide bond)
두 개의 SH기가 산화되어 형성되는 결합. 단백질의 경우, 두 개의 시스테인(cysteine) 잔기의 SH간의 결합으로 생긴 시스틴(cystine)은 단백질의 삼차원구조의 유지에 중요한 역할을 한다.
◎ 인간융모성선자극호르몬(Human chorionic gonadotrophin, HCG)
임신 초기에 태반의 융합세포 영양막에서 분비되는 호르몬의 하나. 에스트로젠과 황체호르몬(progestogen)의 생성을 촉진하며, 남아 태아의 고환에서는 테스토스테론의 생성을 촉진하는 작용을 갖는다. 수정 후 며칠 후부터 임신부의 뇨에서 검출되기 때문에 이 호르몬에 대한 항체를 이용한 임신진단 시약이 널리 이용되고 있다. 분비성 무배란 불임여성의 배란과 임신을 유도할 목적으로 사용되며 또한 남성의 잠복고환증이나 남성성선기능저하증 등의 치료에 사용되기도 한다.
◎ 자가조립단분자층(Self-assembled monolayer, SAM)
분자의 특정 부위와 고체 기질 표면 간의 결합을 통해 형성되는, 높은 규칙성를 가지는 단분자층. 자가조립에 사용되는 분자는 일반적으로 양친매성(amphiphilic)이다. 자가조립층의 형성은, 기질과 분자의 흡착 부위간의 결합력과 흡착된 분자들 간의 상호작용에 의해 영향을 받는다. 예를 들어 긴 사슬 구조의 티올(thiols)이나 이황화물(disulfides)은 금 표면에 매우 밀집되고 규칙적이며 안정한 단분자층을 자발적으로 형성한다.
◎ 자기부양염기서열복제반응(Self-sustained sequence replication, 3SR reaction)
RNA → DNA → RNA의 형태로 진행되는 레트로 바이러스의 유전자 복제 과정을 모사한 등온 유전자증폭법의 한 종류. 전사 기반 증폭 시스템(in vitro transcription- based amplification system, TAS)의 변형된 형태이다. 이 반응의 결과, 목적 RNA 서열과 이로부터 역전사된 cDNA 가 동시에 증폭된다. NASBA(Nucleic Acid Sequence Based Amplification)라고도 한다.
◎ 자일리톨(Xylitol)
자일로오스의 환원을 통해 얻어지는 오탄당 당알코올. 천연에는 자두, 딸기, 양배추 등에 존재하며, 산업적으로는 고압 하에서 자일로오스에 수소를 첨가하여 제조한다. 비발효성 당알코올이며 청량감을 준다. 과자류, 다이어트 식품, 당뇨병 환자용 식품, 구강 위생용품, 화장품 등에 첨가물로 사용된다.
◎ 잔탄검(Xantham gum)
미생물 배양에 의하여 생산되는 대표적인 생고분자(biopolymer)의 하나. 계면활성제, 유화제로서 아이스크림이나 치즈 등 액상 혼합물을 안정화시키거나 유동성 식품을 젤화시키는데 사용한다. Xanthomonas campestris의 호기 배양에 의한 것이 상업적 생산의 대표적인 예이다.
◎ 전구효소(Proenzyme)
그 자체로서는 활성이 없으나 생화학적 수식과정에 의해 활성이 나타나는, 효소의 전구체. 예를 들어 트립시노젠(trypsinogen)은 엔테로카이네이즈(enterokinase)에 의해 가수분해되어 트립신으로 활성화된다. 자이모겐(zymogen)이라고도 불린다.
◎ 전기영동(Electrophoresis)
전하를 가진 물질이 전기장 하에서 한 쪽 극을 향해 이동할 때, 전하량 또는 분자 크기와 형상에 따라 이동 속도가 다른 현상을 이용해 물질을 분리하는 기술. 단백질과 핵산 등의 분석, 정제 및 순도 검정에 사용된다. 특히 폴리아크릴아마이드 젤이나 아가로오스 젤을 담체로 하는 젤전기영동(gel electrophoresis)은 대단히 높은 분리능을 나타내기 때문에 널리 이용된다. 단백질 분석에는 폴리아크릴아마이드 젤이, 핵산과 같은 큰 분자량을 갖는 물질의 분리, 분석에는 아가로오스 젤이 주로 이용된다.
◎ 전기천공법(Electroporation)
DNA를 세포 내로 도입시키기 위해 전기 충격을 가해 세포막에 일시적인 구멍을 만드는 방법. 동물, 식물, 미생물 세포에 적용이 가능하며 높은 효율로 유전자 도입이 가능하므로 널리 사용되고 있다.
◎ 전화효소(Invertase)
‘설탕분해효소’ 참조.
◎ 점착성말단(Sticky end)
제한효소로 이중사DNA가 절단될 때, 두 사슬 상의 서로 다른 위치에서 절단됨으로써 생기는, 여러 개의 염기가 단일 사슬로서 돌출해 있는 DNA의 말단. Cohesive end라고도 한다.
◎ 젤투과크로마토그래피(Gel permeation chromatography, GPC)
다공성 젤을 컬럼에 충진시켜 분자량의 차이에 의해 물질을 분리하는 방법. 일반적으로 분자량이 큰 물질은 젤 내의 기공을 통과하지 못하고 배출되므로 체류시간이 짧고, 반면 분자량이 작은 물질은 젤 기공을 통과한 후 배출되므로 체류시간이 길어지는 현상을 이용한다.
◎ 종속영양생물(Heterotroph)
유기 화합물을 탄소원으로 이용하는 미생물. 독립영양생물(autotroph)과 대응된다. 유기물의 분해로부터 에너지를 취하는 것을 화학종속영양생물(chemoheterotroph), 빛 에너지를 이용하는 것을 광종속영양생물(photoheterotroph)이라고 부른다.
◎ 주변세포질공간(Periplasmic space)
그랩음성균의 세포막과 세포벽 사이의 공간. 영양분 흡수와 관련된 효소, 펩티도글리칸 합성 효소 등이 존재한다. 생성물의 저장 공간이 되기도 한다.
◎ 중쇄중성지방(Medium-chain triglycerides, MCTs)
탄소수 6~12개의 지방산으로 구성된 중성 지방의 총칭. 코코넛유, 팜유 등에 많이 함유되어 있다. 일반적으로 섭취하는 장쇄중성지방(long chain triglyceride)보다 단위무게당 열량이 적으나, 수용성이기 때문에 보다 용이하게 가수분해되어 흡수되므로 병원식에 사용된다. 환자들에게 효과적으로 지방과 고단위의 열량을 공급하기 위하여 사용된다. 일반적으로 외상, 화상, 암 등의 고열량식 요구 환자, 위산 분비 저하, 담도계 질환, 췌장 질환, 장 질환등으로 지방 흡수 불량 장애를 겪는 환자, 단백질, 탄수화물의 대사 이상 또는 장애가 있는 환자의 열량 공급원으로 사용된다.
◎ 지질단백질(Lipoprotein)
지질이 결합된 단백질 복합체의 총칭. 비중이 낮은 것으로부터 차례대로 킬로마이크론(chylomicron), 초저밀도리포단백질(very low density lipoprotein, VLDL), 저밀도리포단백질(LDL), 고밀도리포단백질(HDL), 초고밀도리포단백질(very high density lipoprotein, VHDL)로 분류된다. VLDL과 LDL의 증가는 동맥경화를 촉진하지만 HDL은 동맥경화를 예방하는 것으로 알려져 있다.
◎ 천자배양(Stab culture)
미생물 배양물을 백금선의 끝에 붙여 한천이나 젤라틴 등의 고형배지에 깊게 삽입, 접종하여 배양하는 것. 통성혐기성미생물의 보존이나 효모 세포의 생리적 성질의 관찰에 이용된다.
◎ 초임계유체추출(Supercriticial fluid extraction)
유체를 임계점 이상으로 가온, 가압했을 때 형성되는 초임계유체를 이용한 추출 방법. 비교적 온화한 조건 하에서 효율적으로 목적물을 추출할 수 있다. 천연물 유래 생리활성물질의 추출 등에 사용된다.
◎ 최대비성장속도(Maximum specific growth rate)
Monod 식에 포함되는 매개변수의 하나로서 기질 농도가 충분히 높을 때의 단위균체량 당 최대 증식속도. μmax로 표기한다.
◎ 최소저해농도(Minimum inhibitiry concentration, MIC)
항생 물질이 대상 미생물의 생장을 저지할 수 있는 최소 농도. 항생 물질의 효능 시험에 사용된다. 항생 물질의 역가를 나타내는 지표로서 중요하다.
◎ 카르복실메틸셀룰로오스(Carboxyl methyl cellulose, CMC)
카르복실메틸 그룹이 붙어 있는 셀룰로오스 유도체. 음전하를 띠므로 양이온교환수지로 널리 사용된다. 식품용 유화제, 증점제, 안정제로 사용된다.
◎ 카이모신(Chymosin)
‘레닌(rennin)’ 참조.
◎ 카이모트립신(Chymotrpsin)
단백질분해효소(protease)의 일종. 척추동물의 주요 소화 효소 중의 하나로서 췌장에서 전구체인 카이모트립시노젠으로 생합성되어 소장으로 분비된다. 소장에서 트립신과 카이모트립신에 의해 분해되어 활성 카이모트립신이 된다. 주로 폴리펩타이드 사슬 내의 방향족 아미노산잔기의 카르복실기 쪽을 절단한다.
◎ 카제이네이트(Caseinate)
카제인을 가성소다 또는 탄산나트륨 수용액에 용해해 건조한 것. 물에 용해하기 쉽고 pH는 중성이다. 수용액을 산으로 처리하면 카제인이 분리되어 침전된다. 열에 안정하고 유화 작용이 강해 주로 육류 연제품의 안정제, 증량제 등으로 사용된다. 또한 아이스크림의 기포 안정제, 곡류제품의 단백질 보강제로 사용된다.
◎ 카테콜아민(Catecholamine)
타이로신을 전구체로 하여 생성되는 아민류의 총칭. 아드레날린, 노르아드레날린, 도파민, 세로토닌 등이 대표적인 예이다. 부신수질이나 뇌, 신경 등에서 분비되며 호르몬 또는 신경 신호 전달 물질로 작용한다.
◎ 케피어(Kefir)
코카시안(caucasian) 산악지대에서 유래한 발효유의 한 종류. 우유, 양유, 염소유 등을 원료로 케피어 그레인(kefir grain)을 스타터로 접종하여 제조되며 발효유의 전형적인 신맛과 약간의 알코올을 함유하고 있는 알코올 발효유이다. 다른 발효유와 같이 유산균 스타터를 사용하지 않고 Torula keffir와 Saccharomyces kefir 같은 효모와 Lactobacillus caucasium과 Lactococcus lactis ssp. lactis같은 유산균으로 이루어진 젤라틴 모양의 미생물 덩어리인 케피어 그레인으로 발효시켜 만드는데 유산균들에 의한 유산 발효와 효모에 의한 알코올 발효가 동시에 일어난다. 케피어 그레인은 티벳버섯이라고도 하며 건강 식품으로 이용된다.
◎ 코돈(Codon)
전령RNA 상의 세 염기의 조합으로 이루어진 유전 암호 단위. 각 코돈은 특정 아미노산, 또는 단백질 합성 상의 조절 기능에 대응된다. 예를 들어, AUG는 중합 개시코돈이고 UAG, UGA, UAA는 중합 종료를 지정한다.
◎ 콜로니혼성화(Colony hybridization)
고체 배지 상에 형성된 다수의 콜로니 중에서 목적 DNA를 함유하는 콜로니를 탐색하는 방법. 세포 용해를 통해 콜로니 내의 DNA를 노출시켜 탐침 DNA와 상보적 결합 여부를 확인해 목적 DNA를 검출한다.
◎ 쿰스검사(Coomb’s test)
적혈구와 반응시켜 육안으로 쉽게 관찰되지 않는 불완전 항체와 IgG를 항 글로불린을 사용하여 응집을 증강시켜 육안으로 쉽게 관찰할 수 있게 하는 방법.
◎ 퀜칭(Quenching)
형광물질의 발광에 있어서 양자 수율이 저하되는 현상. 여기과정과 발광과정을 통하여 빛으로 방출되어야 할 에너지가 인접한 분자에 흡수되어 발광이 감소하는 현상을 가리킨다.
◎ 크로마토그래피(Chromatography)
이동상 내의 시료와 고정상 간의 상호작용을 이용해 시료 중의 성분들을 분리 또는 분석하는 방법. 흡착, 이온교환, 친화성, 소수성, 젤여과크로마토그래피 등이 있다.
◎ 타타박스(TATA box)
진핵생물에서 전령RNA의 전사 개시코돈으로부터 30개 정도의 염기 상류에 공통적으로 존재하는 서열(5‘-TATAAA-3’). RNA중합효소 H가 인식해 결합하는 부위이다.
◎ 탄닌(Tannin)
식물에 널리 분포되어 있는 폴리페놀 성분의 통칭. 가수분해성 탄닌과 축합 탄닌으로 구분한다. 가수분해성 탄닌은 떫은 맛을 내며 효소에 의하여 포도당 등으로 가수분해된다. 탄닌산이 대표적인 가수분해성 탄닌이다. 축합 탄닌은 플라보노이드 화합물의 중합체이다. 탄닌은 주로 식물의 잎이나 줄기,뿌리,열매 등에 널리 분포되어 있으며, 특히 감,밤,녹차 그리고 덜 익은 과일류에 많이 함유되어 있다.
◎ 탈수소효소(Dehydrogenase)
기질로부터 수소를 분리해 전자 받개에 전달하는 탈수소 반응을 촉진하는 산화환원효소의 총칭. 알코올 탈수소효소, 유산 탈수소효소 등이 있다.
◎ 탈아미노반응(Deamination)
아미노산 등 아미노기를 갖는 화합물로부터 아미노기를 제거하는 반응. 아미노산 탈아미노반응에서는 암모니아와 카르복실산이 생성된다. 예를 들어 아스파라진으로부터 아스파트산이 만들어 지는 반응이 대표적인 예이다.
◎ 테이코플라닌(Teicoplanin)
Actinoplanes teichomyceticus 균으로부터 생산되는 글라이코 펩타이드계열의 항생제. 반코마이신(vancomycin)과 유사한 화학구조, 항균기작 및 항균력을 갖는다. 주로 페니실린에 내성을 보이는 그램양성균에 의한 감염 치료에 사용된다.
◎ 통성혐기성생물(Facultative anaerobe)
산소를 최종 전자 수용체로 사용하는 호흡에 의해서도 증식하지만 산소 분자가 없을 경우는 발효 또는 질산염 환원 등의 에너지 획득 반응을 통해 무산소적으로도 증식할 수 있는 생물. 대장균, 효모, 유산균이 대표적인 예로서, 효모의 경우 산소가 있을 때는 당을 주로 이산화탄소로 전환시키지만 산소가 부족해질수록 에탄올 생산이 증가한다.
◎ 트리할로오스(Trehalose)
D-글루코오스 두 분자가 α,α-, α,β- 또는 β,β-1,1 결합으로 연결된 비환원성 이당. 천연에서 얻을 수 있는 것은 α,α-형이다. 곤충의 에너지원이나 저장 물질로서 중요한 역할을 한다. 산업적으로는 전분의 액화, 당화, 결정화, 건조 단계를 거쳐서 제조한다.
◎ 파이테이즈(Phytase)
파이테이트(phytate)를 가수분해하여 미오이노시톨과 무기인산을 생성하는 인산분해효소의 일종. 사료 중의 식물성 인 성분의 체내이용성 향상을 위한 사료첨가물로 널리 사용되며 결과적으로 축산폐수 중의 인 성분의 농도를 낮추어 주는 역할을 한다.
◎ 파이토알렉신(Phytoalexin)
식물 세포배양에서 배지에 일리시터가 첨가되었을 때 방어 기작에 의해 생성되는 이차대사산물의 총칭. 항암제인 파클리탁셀이 대표적인 예이다.
◎ 파클리탁셀(Paclitaxel)
탁산(taxane) 계열의 천연 디테르페노이드(diterpenoid). 난소암, 유방암, AIDS 관련 카포시 육종의 치료제로 사용된다. 생산방법으로는 주목 나무에서 직접 추출하는 방법, 주목 잎으로부터 전구체를 추출한 후 화학적으로 합성하는 반합성법, 식물 세포배양법이 대표적이다.
◎ 판토텐산(Pantothenic acid)
비타민B 복합체의 한 종류. β-알라닌과 D-판토산이 아마이드 결합으로 연결된 구조를 가지며 동식물조직에 널리 분포한다. 생체 내에서는 아세틸 CoA를 이루는 성분으로 각종 대사에 관여한다. 동물의 경우 결핍 증상으로는 피부, 부신, 말초신경, 소화관, 항체생산, 생식기능 등에 관한 장애가 알려져 있으나, 사람의 경우 장내세균에 의하여 합성되고, 그 일부는 장으로부터 체내에 흡수되어 이용되므로 결핍증상이 쉽게 나타나지 않는다. 칼슘염의 형태로 종합비타민제에 함유되어 이용된다.
◎ 팔라티노오스(Palatinose)
포도당과 과당으로 구성된 이당류. 벌꿀이나 사탕수수 등에 소량 함유되어 있다. 산업적으로는 설탕에 포도당 전이효소(α-glucosyltransferase)를 작용시켜 포도당과 과당 간의 α-1,2 결합을 α-1,6결합으로 변환시켜 제조한다. 설탕과 유사한 감미질을 내며 감미도는 설탕의 40~50%이다. 구강 내에서 충치 원인균들에 의하여 이용되지 않으므로 충치 예방에 탁월한 효과가 있다. 미질이 우수하고 충치를 유발하지 않는 감미료로 설탕 대용으로 사용되는 기능성 소재이다.
◎ 팔미트산(Palmitic acid)
탄소수 16개의 포화지방산. 팜유에 많이 함유되어 있다. 물에 잘 녹지 않으며, 뜨거운 에틸알코올, 에테르, 사염화탄소에 녹는다. 유기합성, 화장품, 페인트, 그리스, 비누 등의 원료로 사용된다.
◎ 펄스필드젤전기영동법(Pulsed field gel electrophoresis, PFGE)
전기영동 도중, 가해지는 전장의 방향을 변화시킴으로써 DNA 분자를 재배열시켜 아가로오스 매트릭스를 통과할 수 있도록 하는 방법. 거대 분자량의 DNA 분리를 위해 사용된다. 일반적인 전기영동 방법은 30 kbp 이상의 크기에는 사용될 수 없으나, PFGE는 200~3000 kbp에 이르는 큰 분자의 DNA 분리에 적용될 수 있다. 이를 활용한 장치는 디자인에 따라 traverse alternating field electrophoresis (TAFE), field inversion gel electrophoresis (FIGE), rotating gels 및 contour-clamped homogeneous electric field (CHEF) 등으로 구분된다.
◎ 펩타이드결합(Peptide bond)
하나의 아미노산 분자 상의 카르복실(carboxyl)기와 다른 아미노산 분자 상의 아미노(amino)기 간의 탈수축합반응에 의하여 생기는 아마이드(amide) 결합. 모든 단백질은 펩타이드결합에 의해 형성된다.
◎ 평활성말단(Blunt end)
제한효소에 의해 이중가닥 DNA가 절단될 때 두 사슬상의 동일한 위치가 절단되기 때문에 생기는 뭉툭한 구조의 DNA 말단. 점착성말단에 대응하는 개념이다.
◎ 포도당(Glucose)
알도오즈계 육탄당의 하나. 자연계에 가장 많이 존재하는 대표적인 6탄당이다. 전분, 셀룰로오스 등을 구성하는 기본 물질이다. 산업적으로는 옥수수 등의 전분으로부터 산 가수분해 또는 효소적 가수분해에 의해 제조된다. 미생물 및 동물세포배양에 가장 널리 쓰이는 탄소원이다. 식품첨가물, 의약용 수액의 주성분으로도 사용된다. D-glucose를 덱스트로오스(dextrose)라고도 한다.
◎ 포도당이성화효소(Glucose isomerase)
포도당을 과당으로 이성화시키는 반응을 촉진하는 효소. 산업적으로는 전분가수분해로 얻어진 포도당으로부터 고과당시럽을 생산하는데 사용된다.
◎ 표준작업절차서(Standard operating procedures, SOP)
제조, 품질 관리 등의 작업에 필요한 사항을 구체적으로 성문화하여 실무자가 그 업무 수행에 지침이 되도록 하는 절차서. 작업(일)의 순서, 절차, 방법 등을 정하는 작업 방법에 대한 규정이다. 작업 표준서라고도 한다. 작업 표준화를 통하여 균일 품질 확보, 기술 축적, 안전 확보, 의사 소통 등 현장의 목적을 효율적으로 달성할 수 있게 되며 또한 각종 허가 및 인증 획득에 있어서도 필수 요소이다. 작업자가 반드시 표준작업절차서에 따라 작업하는 것이 매우 중요하며 또한 지속적으로 개정되어야 한다.
◎ 프라이머(Primer)
특정 DNA의 합성을 개시할 때에 요구되는 폴리뉴클레오타이드 단편. 목표로 하는 DNA 합성 반응 시 폴리뉴클레오타이드 사슬이 신장하는 출발점으로서 작용한다.
◎ 프렌치프레스(French press)
세포파쇄장치의 일종. 세포현탁액을 좁은 노즐을 통하여 고압으로 밀어낼 때 형성되는 높은 전단력에 의해서 세포가 파쇄되는 원리를 이용한다.
◎ 프로인슐린(Proinsulin)
인슐린 전구체. 췌장의 랭어한스섬(islets of Langerhans) β-세포에서 생합성된 프레프로인슐린(preproinsulin)의 시그널펩타이드가 가수분해에 의해 제거되어 프로인슐린이 만들어진다. 프로인슐린의 C-펩타이드가 단백질분해효소에 의해 가수분해되어 제거됨으로써 인슐린이 만들어진다. 프로인슐린의 호르몬 활성은 극히 미약하다.
◎ 프립나우박스(Pribnow box)
원핵생물 DNA 상에서 RNA중합효소가 인식 결합하는 부위에 있는 (5‘) TATAAT (3') 염기서열. 전사개시점으로부터 5'쪽으로 10 염기쌍 앞쪽에 위치하므로 ‘-10 박스’라고도 한다.
◎ 플라스미드부적합성(Plasmid incompatibility)
도입되는 플라스미드가 숙주 내에 이미 존재하는 특정 플라스미드의 복제를 방해하는 현상.
◎ 플라크형성단위(Plaque forming unit, PFU)
단층배양된 세포에서 한 개의 플라크를 형성하는 바이러스의 감염단위. 바이러스의 종류에 따라 크기와 모양이 다르다. 바이러스의 정량분석과 순수분리에 이용된다.
◎ 피라나용액(Piranha solution)
황산과 과산화수소가 4:1에서 2:1의 비율로 혼합된 용액. 바이오칩 제조 시 유리 등 고체 기질 표면의 유기오염물질을 제거하기 위한 세척제 등으로 사용된다.
◎ 피틴산(Phytic acid)
이노시톨에 여섯 분자의 인산이 에스터 결합으로 결합된 미오이노시톨-6-인산(myo-inositol hexaphosphate). 피틴산의 칼슘, 마그네슘염은 물에 불용성으로 피틴(phytin)이라고 불리운다. 식물에 있어서 주요 인산저장 물질이다. 식품의 변질, 변색 및 산화 방지용 첨가제로 사용된다.
◎ 피페린(Piperine)
알칼로이드의 일종. 후추 매운맛의 주성분이다. 혈액 순환 개선, 신진 대사 촉진 등의 기능성이 있다.
◎ 하이브리도마(Hybridoma)
넓은 의미로는 두 종류의 세포를 인공적으로 융합시켜 만든 종양성을 갖는 잡종 세포. 일반적으로는 암세포와 B-세포(B-림프구)의 잡종 세포를 가리킨다. 면역된 개체로부터 분리된 B-세포는 암세포와 융합됨으로써 계속 항체를 만든다. 질병의 진단과 치료에 이용되는 단일클론항체를 만드는데 이용된다.
◎ 한계희석법(Limiting dilution method)
세포 또는 바이러스를 포함하는 배양액을 개체수가 한 방울에 하나 또는 그 이하가 되도록 희석하는 것. Single colony를 얻기 위해 사용된다.
◎ 한천(Agar)
갈락토오즈와 이의 유도체로 구성되는 점질성 다당체. 아가로오스 70%, 아가로펙틴 30%의 혼합물이다. 우뭇가사리 등 홍조류의 열수 추출물로부터 냉각, 응고 및 동결건조를 통해 제조된다. 식용, 공업용 외 실험실에서는 미생물 배양을 위한 고체 배지를 만드는데 쓰인다.
◎ 항생제(Antibiotic)
특정 미생물을 죽이거나 성장을 멈추게 하는 물질의 총칭. 세포벽 합성을 억제하는 페니실린류와 세팔로스포린류, 단백질 합성을 억제하는 아미노글리코사이드류와 테트라사이클린류, DNA에 작용하는 광범위 항생제인 퀴놀론류 등이 대표적이다.
◎ 항응고제(Anticoagulant)
혈액 응고를 저해하는 물질의 총칭. 대부분의 항응혈 물질은 혈액 응고에 필요한 칼슘 이온을 고갈시키거나 혈액 응고 효소인 트롬빈 활성을 저해함으로써 작용한다. 산업적으로는 심혈관 질환 예방 의약품이나 수혈에 의해 제공된 혈액 보존제로 사용된다.
◎ 해트선택배지(HAT medium)
하이포잔틴(hypoxanthin), 아미노페린(aminoperin), 티미딘(thymidin)을 포함하는 선택성 배지. 단일군항체 생산용 하이브리도마 선별 등에 이용된다.
◎ 핵산내부분해효소(Endonuclease)
폴리뉴클레오타이드 사슬의 내부를 절단하는 효소. DNA를 절단하는 DNase, RNA를 절단하는 RNAse, DNA와 RNA를 모두 절단하는 nuclease가 있다. DNase의 일종인 제한효소들은 다양한 염기서열 특이성을 보이기 때문에 DNA 분석, 유전자조작 등에 널리 이용된다.
◎ 햅틴(Hapten)
항체와 결합할 수 있는 입체구조를 가지지만, 검출 가능한 양의 항체 형성을 야기하지 않는 물질. 매체(porter) 단백질과 결합하면 면역 반응을 일으킨다.
◎ 향미증진제(Flavour enhancer)
자체로는 특별한 맛이 없거나 미미하지만 조리식품에 소량 첨가하면 식품의 맛을 향상시켜주는 작용을 하는 물질. 글루탐산소다(monosodium glutamate, MSG), 핵산 조미료, 효모추출물, 간장추출물 등이 있다.
◎ 헤미셀룰로오스(Hemicellulose)
식물 세포벽에서 셀룰로오스 미섬유(microfiber) 사이를 채우고 있는 다당류 중 펙틴질 이외의 다당류의 총칭. 주성분은 오탄당으로 이루어진 자일란, 글루칸, 자일로글루칸, 글루코만난 등이다.
◎ 헤파린(Heparin)
D-글루쿠론산 (D-glucuronic acid)과 D-글루코사민 (D-glucosamine)으로 구성된 산성 뮤코다당류의 하나. 간과 폐에 존재하며 강력한 항응고 작용을 나타낸다. 이는 프로트롬빈이 트롬빈으로 전환되는 것을 억제하여, 피브리노겐이 피브린으로 전환되지 못하게 함으로써 항응고 작용을 나타내는 것으로 알려져 있다.
◎ 혈소판(Thrombocyte)
혈액의 유형성분인 혈구의 하나. 혈액의 응고나 지혈에 있어서 중요한 역할을 한다. 혈소판이 부족하면 출혈이 쉽게 일어난다.
◎ 혈청(Serum)
혈장에서 섬유소원(피브리노겐)을 제거한 것. 동물세포배양의 배지의 주요 성분으로 사용된다.
◎ 혐기성미생물(Anaerobe)
산소가 없는 상태에서 살 수 있는 미생물. 산소가 있어도 살 수 있는 통성혐기성미생물과 산소가 없어야만 살 수 있는 절대혐기성미생물로 나뉜다.
◎ 혐기성소화(Anaerobic digestion)
산소가 없는 상태에서 일어나는 미생물에 의한 유기물질의 분해 공정. 대표적으로 슬러지의 부피 감소를 위해 혐기성 상태에서 슬러지의 자산화(autooxidation)를 유발하고 이 과정에서 메탄, 이산화탄소 등의 바이오가스를 생성된다.
◎ 혐기성호흡(Anaerobic respiration)
전자 전달계에서 최종 전자 수용체로 산소가 아닌 질산, 황산 등의 무기물을 이용해 에너지를 생산하는 호흡.
◎ 형광이용세포분류기(Fluorescence-activated cell sorter, FACS)
레이저 광선을 세포에 조사할 때 발생하는 형광을 이용해 세포 특성을 파악하고 이에 따라 세포를 분리하는 장치.
◎ 호기성미생물(Aerobe)
산소가 있는 곳에서 생육, 번식하는 미생물. 혐기성미생물에 대응되는 용어이다. 호기성미생물은 산소를 요구하는 정도에 따라, 산소가 있어야만 생육과 번식이 가능한 절대 호기성미생물, 산소의 양이 공기 중의 산소량보다 적은 곳에서 잘 생육하는 미 호기성미생물로 구분된다. 절대 호기성미생물에는 초산균(Acetobacter), 고초균(Bacillus), 결핵균, 아조토박터 등이 있다.
◎ 호기성소화(Aerobic digestion)
호기성 조건 하에서 미생물의 내생호흡(endogeneous respiration)에 의한 세포질 대사 또는 소모를 유도하는 방법. 폐수처리장 슬러지의 부피 감량 및 안정화를 위해 혐기성소화와 함께 많이 이용된다.
◎ 호산성균(Acidophile)
산성 조건에서 최적의 생장을 보이는 미생물. 대개의 경우 최적 pH가 6 이하이며 pH 7 이상에서는 생장이 현격히 느려지거나 멈춘다.
◎ 호염기성미생물(Alkalophilic bacteria / Alkalophile)
알칼리 조건 하에서 잘 자라는 미생물.
◎ 호염성세균(Halophilic bacteria / Halophile)
생육에 비교적 고농도의 염분을 필요로 하는 세균. 2~5%의 식염을 요구하는 약호염균과 5~20%의 중정도의 호염균, 20% 이상의 고도호염균으로 분류된다.
◎ 화학영양생물(Chemoreceptor)
필요한 에너지를 화학물질의 산화로부터 얻는 생물. 광영양생물에 대응하는 용어이다.
◎ 활성산소종(Reactive oxygen species, ROS)
생체의 에너지 생산을 위한 호기적 대사 과정에서 부산물로 생성되는 반응성이 강한 산소의 여러 가지 화학종. 슈퍼옥사이드, 과산화수소, 일중항(singlet) 산소, 수산화 라디칼, 과산화 라디칼 등이 있다. 단백질, 지방, 당, DNA 등과 같은 생체의 구성 성분을, 비선택적, 비가역적 산화 반응을 통해 파괴함으로써 각종 기능 장애를 유발하며 여러 가지 질병과 노화의 원인으로 알려져 있다.
◎ 황국균(Aspergillus oryzae)
자낭균류에 속하는 코지용 곰팡이의 일종. 군체가 처음에는 백색이었다가 포자가 생기면서 황록색으로 변하므로 황국균이라 부른다. 쌀, 보리, 콩 등에 잘 생육하며 전분 및 단백질분해효소를 생산하는 능력이 우수하다. 청주, 간장, 된장의 제조에 이용된다.
◎ 효모인공염색체라이브러리(YAC library)
YAC(Yeast Artificial Chromosome) 벡터를 사용하여 제조된 유전자 라이브러리. 인간 게놈 프로젝트와 같이 커다란 DNA 조각(100 kb 이상)으로 이루어진 유전체 라이브러리를 제조할 때 사용된다.
◎ 효모인공염색체벡터(YAC vector)
효모 세포 내에서 증폭되고 유지될 수 있도록 효모 유래의 염색체 양쪽 말단 (telomere) 및 센트로미어(centromere)로 구성된 벡터. 커다란 DNA 조각(100 kb 이상)을 클로닝할 때 사용된다.
◎ 효모추출물(Yeast extract)
제빵용 효모의 가수분해물. 효모를 배양하고 회수한 후 효모의 자기소화 또는 효소에 의한 의한 분해를 통해 얻어지는 결과물을 건조하여 페이스트(paste) 또는 분말 형태로 제조한 것이다. 식품용 조미소재 또는 미생물 배양용으로 사용된다. 아미노산, 펩타이드, 탄수화물, 비타민 및 염류인 수용성 성분들로 이루어져 있다.
◎ 효소저해(enzyme inhibition)
효소가 특정 물질의 작용에 의해 활성이 저하되는 현상. 저해물질이 효소의 활성자리 부위에 기질과 경쟁적으로 작용하는 경쟁적저해(competitive inhibition), 저해물질이 활성부위가 아닌 다른 부위에 결합해 효소의 입체 구조를 변화시켜 효소활성이 저해되는 비경쟁적저해(noncompetitive inhibition)가 대표적이다.
◎ 후각전도(Electroolfactogram)
후각상피가 냄새 자극을 받을 때 발생하는 전위를 기록한 그림
◎ 휘발성부유물질(Volatile suspended solid, VSS)
유리섬유 여과지에 걸리는 부유고형물(suspended solid) 중 유기물 부분. 여과지에 걸린 부유물질의 무게를 105℃에서 건조시킨 후 측정한 무게와, 이것을 다시 550℃에서 태운 후 측정한 무게와의 차이로서 측정한다.
◎ 흑국균(Aspergillus niger)
자낭균류에 속하는 코지용 곰팡이의 일종. 흑색의 분생포자를 형성하므로 흑국균이라 부른다. 당액을 발효해 구연산 등과 같은 유기산을 생산하는 균주가 많으므로 주로 유기산 발효공업에 이용된다. 또한 아밀레이즈, 셀룰레이즈, 펙티네이즈 등의 효소 제조용으로도 이용된다.
◎ 히알루론산(Hyaluronic acid)
글루크론산(glucronic acid)과 N-아세틸글루코자민(N-acetyl glucosamine)이 연결된 구조가 반복되는 글리코자미노글리칸의 일종. 주로 동물의 관절액이나 안구 유리체액, 탯줄, 결합 조직 등에 분포한다. 점성이 크고 세균의 침입이나 독성 물질의 침투를 막는데 중요한 역할을 하며 뛰어난 보습 효과를 가진다. 관절 주사액의 주성분, 보습제, 약물전달 제제로 사용된다. 산업적으로는 발효에 의해 생산된다.
◎ 힘(Heme)
철과 포피린류 착염의 총칭. 좁은 뜻으로는 헤모글로빈에 존재하는, 철을 함유하는 프로토포피린을 의미한다. 힘을 보결분자단으로 하는 단백질을 힘 단백질이라고 한다. 헤모글로빈, 시토크롬, 카탈레이즈, 과산화효소 등이 대표적인 힘 단백질이다. 산업적으로는 동물 혈액으로부터 효소적인 단백질가수분해공정을 통해 제조된다. 빈혈 치료제로 사용된다.
◎ Bacillus thurengiens(Bacillus thurengiens)
살충성 독소를 생산하는 아포 세균. 아포 낭 내에 독소 단백질 결정을 형성한다. 이 독소 단백질은 곤충(특히 인시목 및 쌍시목)에 대한 강한 독성을 나타내지만, 인축 및 식물에 대해서는 무해하므로 미생물 살충제로 사용된다.
◎ C4식물(C4 plant)
대기 중에서 흡수한 이산화탄소가 C3물질인 포스포에놀피루브산(phosphoenol pyruvate, PEP)와 결합해 4탄당인 옥살아세트산으로 된 뒤에 말산을 거쳐 캘빈 회로로 공급되는 C4 경로를 가짐으로써 이산화탄소 이용 효율과 성장속도가 높은 식물. 사탕수수, 옥수수 등과 비름과, 국화과, 남가새과 등의 일부 식물을 포함한 200여 종이 있다.
◎ CHO셀
중국 햄스터의 난소 조직에서 분리된 동물세포주. 부착성세포이지만 부유 상태에서도 생육할 수 있다. 에리스로포이에틴(EPO), 인간화항체 등의 당단백질의 생산에 이용되고 있다.
◎ DNA셔플링(DNA shuffling)
비슷한 염기서열을 가지고 있는 DNA 유전자 조각들을 무작위로 절단하고 순서 없이 섞은 후 중합효소연쇄반응을 수행해 매우 다양한 염기서열을 지닌 돌연변이 유전자 라이브러리를 구축하는 방법.
◎ DNA염기서열결정(DNA sequencing)
생화학적 방법을 사용해 DNA의 염기서열을 결정하는 과정. 전통적으로는 화학적 방법인 Maxam-Gilbert 법과 효소적 방법인 Sanger-Coulson 법이 있다. 최근에는 Shot gun 방법이 개발되었다.
◎ DNA염기서열분석기(DNA sequencer)
DNA 염기서열 자동 분석에 사용되는 장치. 주로 효소적 방법인 Sanger 법이 이용된다.
◎ DNA칩(DNA chip)
실리콘, 유리 등의 고체 기판 표면에 여러 종류의 DNA를 고밀도로 고정화시킨 바이오칩의 일종. 돌연변이 검색과 유전자 발현 수준 모니터링 등에 주로 사용되며, 사우던블로팅법(Southern blotting), 노던블로팅법(Northern blotting), DNA 염기서열 결정 등도 DNA칩의 사용으로 대신할 수 있다. DNA칩을 이용하는 경우 수백 개 이상의 유전자를 동시에 신속하게 검색할 수 있다는 장점이 있다.
◎ DNA탐침(DNA probe)
DNA 검색 용도로 사용되는, 서열이 이미 알려진 짧은 길이의 DNA 조각. 검출이 용이하도록 표지 인자가 결합되어 있어 특정 유전자의 탐색이나 재조합 벡터의 스크리닝 등에 사용된다.
◎ F-인자(Fertility factor, F-factor)
대장균 개체 간에 전달이 가능한 플라스미드의 일종. F-인자를 가진 F+균이 선모를 매체로 하여 F- 균과 접촉, 접합해 F-인자를 전달한다.
◎ FISH(Fluorescent in situ hybridization, FISH)
형광물질을 이용하여 특정 염색체나 유전자를 원위치에서 분석하는 방법. 분석하고자 하는 유전자 서열과 상보적이며 상대적으로 짧은 길이의 탐침 DNA 서열에 형광물질을 표지시키고 이를 대상 생물체에 주입시켜 혼성화를 유도하고 목적유전자의 위치를 확인하는 기술이다. 염색체 분석을 위한 대부분의 방법들이 활발하게 분열하는 세포를 대상으로 하는 반면, 이 방법은 분열하고 있지 않은 세포에도 유용하게 사용될 수 있다.
◎ GMP(Disodium 5'-guanylate, GMP)
구아닌 모노포스페이트에 두 개의 나트륨 원자가 치환된 형태의 화합물. IMP와 함께 뉴클레오타이드조미료(핵산조미료)의 주요 성분이다. 산업적으로는 발효에 의해 생산된 XMP(xanthine monophosphate)로부터 화학 합성에 의해 생산된다.
◎ in vitro(in vitro)
시험관 내, 생체 외, ‘유리 용기(vitrum) 속에서’라는 의미의 라틴어. 생체의 일부분이 ‘생체 밖으로’ 적출, 유리되고 있는 상태를 나타낸다. ‘인비보’에 대응되는 용어이다. 물질의 효능, 독성 등을 실제 생체에 적용하기 위한 예비 테스트에 널리 사용된다.
◎ in vivo(in vivo)
생체(vivum) 내에서, ‘자연 그대로 둔 상태’라는 의미의 라틴어. 인비트로에 대응되는 용어이다.
◎ k-평균클러스터링(k-means clustering)
비계층적클러스터링 알고리즘 중의 한가지. 처음에 주어지는 클러스터 개수에 맞추어 각 멤버들의 소속 클러스터를 나누는 방법이다.
◎ Lactobacillus bulgaricus(Lactobacillus bulgaricus)
호모형(homolactic) 유산균. 요구르트의 제조에 널리 이용되고 있다.
◎ N-말단분석(N-terminal analysis)
단백질, 펩타이드의 아미노산 서열에서 아미노기측의 말단 아미노산 서열을 분석하는 작업.
◎ P/O비(P / O ratio)
호기성 대사에서 단위 산소 소모량 당 생성되는 ATP의 양을 나타내는 지표.
◎ PHA(Polyhydroxyalkanoate, PHA)
미생물이 합성하여 세포 내에 축적하는 대표적인 생고분자 물질군. 탄소원은 풍부하지만 질소, 인, 마그네슘 등 다른 필수 영양소가 제한될 때 주로 합성된다. 난분해성의 기존 합성고분자를 대체할 수 있는 생분해성 고분자이다. PHB(polyhy droxybutyrate), PHV(polyhydroxyvalerate)가 대표적인 예이다.
◎ PLA(Polylactic acid, PLA)
젖산 중합체. 분해성 고분자의 일종이다. 체내에서 효소의 작용없이 단순 가수분해된다. 흡수성 봉합사, 약물전달 등 생체의료용 재료로 이용된다.
◎ Saccaromyces cerevisiae(Saccharomyces cerevisiae)
효모의 대표적인 한 종. 양조 또는 에탄올의 생산, 제빵에 이용된다. 제빵 효모(baker’s yeast) 또는 양조 효모(brewer’s yeast) 라고도 한다. 안전성 인정 등급(GRAS) 미생물로서 재조합 단백질 생산에도 널리 이용된다.
◎ β-글루칸분해효소(β-glucanase)
β-글루칸을 가수분해하는 효소류의 총칭. 작용 방식에 따라, β-글루칸의 말단에서 결합을 절단하는 엑소글루카네이즈(exo-β-glucanase)와 내부에서 절단하는 엔도글루카네이즈(endo-glucanase)로 분류된다. 맥주 제조 시 보리 β-glucan의 분해, 효모추출물 제조 시 세포벽 분해효소로 사용된다.
◎ β-글루코시데이즈(β-glucosidase)
포도당에 연결된 β-glycosidic 결합의 가수분해를 촉진하는 효소. 셀로바이오스를 분해하여 포도당을 생성시키거나, 배당체로부터 비당질 부분(aglycon)을 유리시키는 작용을 한다. 인체 내에서 결핍될 경우 고셔병(Gaucher’s disease)을 야기한다.
![]() 집필진
집필진
◮ 특집 기사
|
1. 지난 10년간의 기록: 생명공학육성기본계획 |
한양대학교/이영식 |
|
2. 4차 산업혁명: 융합의 가속화 |
충남대학교/김연수 |
|
3. 의료패러다임의 변화: 미래의학 |
삼성서울병원/박웅양 |
◮ 제1장 생명공학의 변화와 도전
|
제1절|생명공학의 변곡점 |
|
|
1. 미국 |
한국생명공학연구원/김정석 |
|
2. 유럽연합 |
한국과학기술연구원/변재선 |
|
3. 중국 |
한국생명공학연구원/곽상수 |
|
4. 일본 |
한국과학기술정보연구원/이상필 |
|
제2절|생명공학의 도전과 노력 |
|
|
1. 한국 바이오산업 현황과 발전방향 |
산업연구원/최윤희 |
|
2. 바이오 경제 실현을 위한 도전: 거버넌스 변화 |
과학기술정책연구원/김석관 |
◮ 제2장 : 국가 생명공학 육성 정책
|
제1절 : 생명공학 육성 정책 |
|
|
1. 생명공학 연구개발 지원 |
과기정통부/생명기술과 |
|
2. 생명공학산업 육성 |
산업부/바이오나노과 |
|
3. 생명공학 기초과학진흥 |
과기정통부/기초연구진흥과 |
|
4. 생명공학 인력양성 |
교육부/학술진흥과 |
|
5. 농림축산식품분야 생명공학 육성 |
농식품부/종자생명산업과 |
|
6. 보건의료분야 생명공학 육성 |
복지부/보건의료기술개발과 |
|
7. 환경분야 생명공학 육성 |
환경부/환경산업기술과 |
|
8. 해양수산분야 생명공학 육성 |
해수부/해양수산생명자원과 |
|
9. 생명자원분야의 육성 및 관리 |
과기정통부/KOBIC, 농식품부/종자생명산업과, 복지부/보건산업정책과, 산업부/바이오나노과, 환경부/국립생물자원관, 해수부/해양수산생명자원과 |
|
10. 국제협력 R&D 및 국가간 협력 |
한국연구재단/김석호 |
|
제2절 : 생명공학 경쟁력지표 |
|
|
1. 투자 |
한국과학기술기획평가원/김은정 |
|
2. 인력 |
|
|
- 학과별 배출인력 |
생명공학정책연구센터 |
|
- 산업인력 |
한국바이오협회/손지호 |
|
3. 특허 |
특허정보진흥센터/김봉진 |
|
4. 논문(질적지표) |
한국연구재단/조석민 |
|
5. 산업 |
한국바이오협회/오기환 |
◮ 제3장 : 분야별 연구개발 및 관련 산업 현황
|
제1절|기초생명과학 |
|
|
1. 유전체 |
한국생명공학연구원/김남순 |
|
2. 단백질체 |
한국과학기술연구원/양은경 |
|
3. 세포체 |
건국대학교/정형민 |
|
4. 대사체 |
한국과학기술연구원/정봉철 |
|
5. 시스템생물 |
광주과학기술원/김도한 |
|
6. 구조생물 |
한양대학교/류성언 |
|
7. 뇌과학 |
한국뇌연구원/정성진 |
|
8. 노화과학 |
한국생명공학연구원/권기선 |
|
제2절|보건의료 |
|
|
1. 합성신약 |
한국화학연구원/이선경 |
|
2. 바이오의약품 |
㈜퍼스트바이오테라퓨틱스/김재은 |
|
3. 바이오장기 |
서울대학교/정준호 |
|
4. 진단 및 의료기기 |
성균관대학교/류규하 |
|
5. 감염병 대응 |
고려대학교/송대섭 |
|
제3절|농림축산식품 |
|
|
1. 농림 |
숭실대학교/서정아 |
|
2. 축산 |
국립축산과학원/임기순 |
|
3. 식품 |
이화여자대학교/권오란 |
|
제4절|환경·해양수산 |
|
|
1. 환경 생명공학 |
국립환경과학원/김태성 |
|
2. 해양 생명공학 |
한국해양과학기술원/이정현 |
|
제5절|바이오 공정 및 융합 |
|
|
1. 산업바이오 |
한국생명공학연구원/이홍원 |
|
2. BT + ICT |
한국전자통신연구원/박수준 |
|
3. BT + NT |
한국생명공학연구원/하태환 |
|
제6절|생명연구자원 |
한국생명공학연구원/장영효 |
|
제7절|생명공학 인프라(장비・시설) |
한국산업기술평가관리원/이강우 |
◮ 제4장 : 생명공학 관련 법제도 현황
|
제1절|바이오 안전성 동향 |
한국생명공학연구원/장호민 |
|
제2절|생명윤리 동향 |
과학기술정책연구원/이명화 |
|
제3절|생명공학 지적재산권 제도 동향 |
특허청/박정웅 |
|
제4절|생명공학 제품 인허가 현황과 과제 |
식품의약품안전처/김영옥 |
|
제5절|생명공학 기업 현황과 지원제도 |
한국바이오협회/오기환 |
◮ 부록
|
1) 생명공학 연표 |
생명공학정책연구센터 |
|
2) 생명공학 주요통계 |
생명공학정책연구센터 |
|
3) 생명공학 관계법령 |
생명공학정책연구센터 |
|
4) 생명공학 용어정리 |
생명공학정책연구센터 |
![]() 편찬위원회
편찬위원회
|
공동위원장 |
김정원 |
과학기술정보통신부 기초원천연구정책관 |
|
|
오구택 |
국가과학기술심의회 생명의료전문위원장 |
|
위 원 |
김장성 |
한국생명공학연구원 부원장 |
|
|
김재상 |
한국연구재단 단장 |
|
|
박장환 |
한국연구재단 단장 |
|
|
서경춘 |
과학기술정보통신부 생명기술과장 |
|
|
이승규 |
한국바이오협회 부회장 |
|
|
이영식 |
한양대학교 교수 |
|
|
최문정 |
한국과학기술기획평가원 센터장 |
|
|
최윤희 |
산업연구원 선임연구위원 |
|
|
허성오 |
한국연구재단 단장 |
|
간 사 |
김흥열 |
생명공학정책연구센터 센터장 |
|
실 무 팀 |
이호준 |
과학기술정보통신부 생명기술과 사무관 |
|
|
김재훈 |
과학기술정보통신부 생명기술과 주무관 |
|
|
문성훈 |
생명공학정책연구센터 정책연구개발실장 |
|
|
김민정 |
생명공학정책연구센터 정책연구팀장 |
|
|
이지현 |
생명공학정책연구센터 연구원 |

 생명공학백서 01_목차.pdf
생명공학백서 01_목차.pdf
 2017 생명공학백서 바로가기
2017 생명공학백서 바로가기
 2017 생명공학백서 바로가기
2017 생명공학백서 바로가기






























































