2019 생명공학백서

- 발행일 2019-12-31
- 출처 과학기술정보통신부
- 담당자 이지현 ( 042-879-8366 / ljih@kribb.re.kr )
- 조회수 19004
-
키워드
#생명공학백서
- 첨부파일
-
차트+
개요
과학기술정보통신부는 생명공학 분야의 정책과 국내.외 연구동향 등을 한눈에 살펴 볼 수 있는 ‘2019 생명공학백서’를 발간하였습니다.
아홉 번째로 발간되는 올해 생명공학백서는 지난 2년간의 우리나라의 변화와 도전과 더불어 세계 주요국의 동향, 관련제도, R&D 성과 등 생명공학 분야의 현황과 향후 방향을 가늠할 수 있는 다양하고 유용한 정보를 담고 있습니다. 특히 현재 여러 가지 이슈가 되고 있는 바이오 빅데이터의 현황과 전망을 특집으로 마련하였습니다. 아무쪼록 이 백서를 통하여 생명공학계에는 과거를 돌아보고 앞을 내다볼 수 있는 계기가, 국민에게는 바이오가 열어가는 행복하고 희망찬 미래상 제시를 통해 바이오 미래유망기술을 공감할 수 있는 좋은 참고자료로 활용되기를 기대합니다.
<목차>
특집 : '바이오 빅데이터'
제1장 : 생명공학의 변화와 도전
제2장 : 국가 생명공학 육성 정책 및 지표
제3장 : 분야별 연구개발 및 산업 현황
제4장 : 생명공학 관련 법·제도 현황
부록 (1) 생명공학 연표
(2) 생명공학 주요통계
(3) 생명공학 관계법령
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
제 4유형 : 출처표시 + 상업적 이용금지 + 변경금지

이용자는 이 공공저작물을 이용할 경우 저작물의 출처표시, 비영리 목적으로만 이용가능하며 저작물의 변경 혹은 2차 저작물 작성을 금지합니다.

발간사

생명공학은 사람의 생명과 건강을 지키는 동시에 미래 경제의 핵심으로 부상하고 있습니다. 생명공학은 질병극복, 안전한 먹거리, 쾌적한 환경을 제공하여 인류 복지 향상에 크게 기여함과 동시에 바이오 산업을 추동하여 새로운 시장과 일자리를 창출하고 있습니다.
이에 정부는 바이오헬스 산업을 시스템반도체, 미래차와 함께 3대 중점분야로 선정하고 범정부적 지원을 강화하고 있습니다. 2019년 5월에 발표한 ‘바이오헬스 산업 혁신전략’에 따라 바이오헬스 산업을 사람중심의 혁신성장을 실현할 핵심 산업으로 발전시키고자 노력하고 있습니다. 정부는 R&D 투자를 2025년까지 연간 4조원 이상 투자하여 바이오헬스 산업을 글로벌 수준으로 육성할 계획입니다. 이와 더불어 자원, 환경, 에너지 관련 바이오 산업에 대한 지원도 가속화하고 있습니다.
이러한 노력에 힘입어 바이오 산업에 대한 투자와 창업이 꾸준히 증가하고 있으며, 우수한 신약 개발과 관련해서는 괄목할 만한 성과를 거두고 있습니다. 이러한 성과들이 지속될 수 있도록 앞으로는 민간 역할을 더욱 강화하고 정부는 뒷받침하는 방향으로 지원해 나갈 계획입니다. 특히 바이오 분야 원천기술의 확보, 우수한 인력 양성, 바이오 기반시설 지원 등의 지원 역할을 더욱 충실히 해나갈 것입니다.
아홉 번째로 발간되는 올해 생명공학백서는 지난 2년간 생명공학 분야에서 있었던 우리나라의 변화와 도전, 세계 주요국의 동향, 관련제도, R&D 성과 등 생명공학 분야의 현황과 향후 방향을 가늠할 수 있는 다양하고 유용한 정보를 담고 있습니다. 특히 현재 여러 가지 이슈가 제기되고 있는 바이오 빅데이터의 현황과 전망을 특집으로 마련하였습니다. 아무쪼록 이 백서가 생명공학계에는 과거를 돌아보고 앞을 내다볼 수 있는 계기가, 국민에게는 생명공학이 열어가는 행복하고 희망찬 미래상을 통해 미래유망 바이오 기술에 공감할 수 있는 좋은 참고자료로 활용되기를 기대합니다.
끝으로 백서 발간을 위해 수고해 주신 각 분야 전문가 여러분 및 관계자께 감사의 말씀을 드립니다.
2019. 12.
과학기술정보통신부 장관 최기영
편찬사

현재 우리는 본격적으로 바이오경제의 물결 속으로 진입했습니다. 고도한 지식기반의 생명공학 기술은 인공지능, 빅데이터, 사물인터넷, 지능형네트워크 기술과 함께 4차 산업혁명 시대의 혁신적 변화를 주도하고 있습니다. 생명공학 분야의 미래 산업 경쟁력은 원천기술의 확보, 이를 위한 국가차원의 장기적 투자, 연구 성과의 산업적 활용에 따라 좌우될 것으로 보입니다.
인간유전체연구(Human Genome Project) 완료에 이어, 차세대염기서열분석(Next Generation Sequencing) 기술과 크리스퍼(CRISPR) 유전자가위 기술 등 최근 비약적인 성장을 보이고 있으며, 이와 같은 유전정보분석 기술과 유전자재조합 및 약물유전체 연구 성과물들은 4차 산업혁명 시대를 이끌어낼 바이오 유전체 빅데이터, 질병의 조기진단과 개인별 맞춤형 의료, 바이오헬스 산업의 신성장 동력으로서 그 가치가 매우 높습니다.
또한 생명공학 분야는 장기간 연구를 통해서 새로운 기술 개발과 연구 성과물을 얻게 되기 때문에, 개발된 연구 성과물들의 국내·외 경쟁력 확보와 나아가 산업적 성과를 위해서는 국내 생명공학 산업을 지속적으로 성장·발전시킬 필요성이 있습니다. 특히 신약개발의 경우 시장에 나오기까지 매우 오랜 시간이 필요합니다. 연구 성과 중 글로벌 신약으로서 성공 가능성을 높이기 위해서는 산학연의 장벽을 허물고 신약개발 초기단계의 지원을 확대하여 연구중심 신약개발 바이오벤처를 키워 선순환적인 생태계 조성이 필요합니다. 이를 통해 원천기술을 선점하여 우리나라가 생명공학 산업의 미래 시장에서 세계 속의 강국이 되기를 기대합니다.
과학기술정통부에서 발간하는 ‘2019 생명공학백서’에서는 생명공학 분야의 주요 이슈, 정책추진 현황, 연구개발 및 산업 동향과 전망 등 방대한 생명공학 정보를 체계적으로 종합하여 수록하였습니다. 생명공학 분야의 종합 안내서인 이 백서를 통해 관련 분야 전문가는 물론 일반인들이 조금이나마 서로 소통할 수 있는 자료가 되기를 희망합니다.
다시 한 번 생명공학백서 발간을 축하드리며, 그동안 수고를 해 주신 과학기술정보통신부 및 생명공학정책연구센터 관계자 분들과 집필에 참여하신 모든 전문가 분들께 깊은 감사의 말씀을 드립니다.
감사합니다.
2019. 12.
2019 생명공학백서 편찬위원장 하재두
축하의 글

4차 산업혁명의 시대에서는 데이터가 금융‧인적 자본과 동등하게 인식되어 새로운 자본과 생산요소로 취급되고 있습니다. 특히, 다가올 바이오경제 시대에서의 기술 혁신과 융합의 중심에는 ‘바이오 빅데이터’가 있습니다. ‘바이오 빅데이터’는 미래형 신산업‧서비스 등 고부가가치 창출의 핵심 요건이며, 바이오 빅데이터를 활용한 미래 정밀의료는 치료에서 예방‧관리 중심으로의 새로운 의료 패러다임을 제시합니다. 궁극적으로 인간의 삶의 질 향상은 물론이고, 많은 생명을 구할 수 있을 것으로 기대되어 세계 각국은 앞다투어 국가적 미래기술에 투자하고, 관련 기술개발에 앞장서고 있습니다. 즉, ‘바이오 빅데이터’는 암 및 희귀‧난치질환과 같은 의료난제 해결의 실마리이자, 유망 신산업인 바이오헬스 산업 발전의 기반역할을 할 것입니다.
이러한 시대적 흐름과 변화 속에서 새로운 생명공학 트랜드에 선제적으로 대응하기 위해 한국생명공학연구원은 바이오 빅데이터 기반의 맞춤의약과 관련 플랫폼 기술개발 및 생명정보의 통합, 시스템 고도화 등을 기관 주요 R&R(Role and Responsibility, 역할과 책임)로 선정하여 분야별 연구에 집중하고 있습니다. 또한, 국내 생명공학 연구의 허브(hub) 역할을 통해 미래 바이오 성장동력 창출, 국가 아젠다 해결 및 바이오 인프라 선진화 등을 통해 국민의 건강한 삶과 바이오경제를 구현하는 연구기관이 되도록 최선을 다하겠습니다.
지난 5월 정부는 바이오헬스 산업을 3대 혁신산업의 하나로 선정하여 혁신전략안을 발표하는 등 바이오경제 시대의 글로벌 경쟁력 확보에 노력을 하고 있으며, 10월에는 바이오산업을 ‘포스트 반도체’ 산업으로 육성하기 위한 범정부 TF운영계획을 밝히기도 하였습니다. 즉, 바이오산업을 미래 핵심산업으로 중점 투자하고 육성하겠다고 강력한 의지를 천명하였습니다.
하지만, 생명공학기술의 중요성과 관련 연구개발 지원정책의 필요성이 국민들에게 제대로 알려지지 못하면 결국 지지를 받지 못하게 되어, 미래의 새로운 성장동력을 확보할 수 없고 나아가 어떠한 외부상황에도 흔들리지 않은 기술경쟁력이 강한 국가가 될 수 없을 것입니다.
생명공학백서는 생명공학정책에 대한 대국민 인지도 향상을 위해 정부와 과학자 그리고 일반국민 간의 상호이해와 소통, 교류를 위한 공식적인 채널의 의미로 격년으로 발간되고 있습니다. 생명공학에 대한 체계적이고 종합적인 안내서 기능뿐 만 아니라, 일반 국민들의 생명공학에 대한 이해의 폭을 넓히고, 긍정적인 인식을 제고하는데 큰 역할을 할 것으로 기대합니다.
2019 생명공학백서의 발간을 진심으로 축하드리며, 그동안 수고해주신 과학기술정보통신부와 집필에 참여하신 모든 전문가분들께 감사의 말씀을 전합니다.
감사합니다
2019. 12.
한국생명공학연구원 원장 김장성
축하의 글

글로벌 경제가 전반적으로 저성장시대로 진입하고 있음에도 불구하고 바이오 분야는 계속 높은 성장세를 보이고 있습니다. 유럽, 아시아 등에서 바이오 분야의 벤처투자가 급격하게 증가하고 있고 미국의 작년 바이오 분야 벤처투자가 1,309억 달러(약 150조 원)로 전년 대비 57.8%로 급증하고 있습니다. 국내에서는 바이오 분야 신규 벤처투자 규모가 지난 해의 8,417억 원을 넘어서 1조 원을 돌파할 것으로 전망되고 있습니다. 이는 투자자의 눈길이 저성장으로 위축되고 있는 기존 주력 산업에서 미래 성장 가능성과 시장 잠재력이 높은 바이오 분야로 옮겨가는 것으로 해석되고 있습니다.
이러한 바이오 투자 증가 추세는 국내 바이오 산업의 경쟁력 향상에도 큰 영향을 주고 있습니다. 최근에는 초대형 기술이전 계약 등 투자 회수까지의 기간이 줄어들 것으로 기대되면서 초기투자 비중이 30% 이상으로 증가하고 있으며 올해 상반기 IPO 시장에 신규 상장기업 7곳 중 6곳이 바이오 업체로 나타났습니다.
바이오 분야가 산업화의 길로 들어서고 있는 중요한 시점에 정부가 바이오 산업에 대한 육성 의지와 함께 다양한 전략을 발표하고 있어 매우 고무적입니다. 정부는 지난 4월 한국 경제를 추격형 경제에서 선도형 경제로 전환하고 혁신성장을 주도할 3대 중점육성산업으로 ‘미래형 자동차’, ‘비메모리 반도체’와 함께 ‘바이오’분야를 선정했습니다. 이어 5월에는 연구개발비를 연 4조 원으로 확대하고 국가 바이오 빅데이터 구축 및 규제 철폐 등을 통해 바이오헬스 분야를 한국의 5대 수출 주력산업으로 육성하는 ‘바이오헬스 산업 혁신전략’을 발표했습니다.
그리고 연이어 6월에 발표된 ‘제조업 르네상스 비전 및 전략’은 세계 4대 제조강국 도약을 위해 융합제품과 서비스에 대한 규제를 완화하는 내용을 담고 있어 바이오 분야가 보건과 환경, 식량, 에너지 등 중대 당면과제를 해결하고 IT 등 다양한 분야와의 융합을 통해 고부가가치 산업 창출을 주도할 수 있는 비전을 제시했습니다.
한국바이오협회는 여러 난관 속에서도 빠른 성장을 이루고 있는 바이오 산업계의 자체 노력과 4차 산업혁명 전략에 발맞추어 바이오 산업을 국가 핵심 산업으로 육성하고자 정부와 함께 바이오 산업기반 확충을 위해 노력하고 있습니다. 특히 바이오 빅데이터 전문가 등 미래 바이오산업의 핵심인력 양성과 우수 초기기업 및 예비창업자 지원 등 창업 활성화 촉진을 통해 바이오 산업의 지속 가능한 생태계 형성에 주력하고 있습니다. 뿐만 아니라, 바이오 경제 아시아 네트워킹 활동을 통해 미래 잠재력이 큰 아시아 시장 확대와 이를 통한 글로벌 시장 확대를 지원하고 있습니다.
국내 생명공학 및 바이오 산업 발전과정을 돌아보고 향후 비전과 전망을 제시하는 이번 ‘생명공학백서’의 발간은 한국 바이오 산업의 발전에 큰 역할을 할 것으로 믿어 의심치 않습니다. 이번 백서가 생명공학 육성의 중요성에 대한 국민의 이해를 높이고 참여와 지지를 이끌어낼 수 있기를 바랍니다. 또한 연구계와 산업계, 정책 당국자 등 주요 관계자들이 앞날을 설계하는 데에 중요한 참고자료가 되고 앞에 놓인 난관을 극복하고 힘을 합쳐 도약할 수 있는 희망을 제시하기를 바랍니다.
2019. 12.
한국바이오협회 회장 서정선
사진으로 보는 바이오
정부 정책 수립
-4차 산업혁명과 바이오+ICT 융합 대응-
![]()
■ 바이오헬스 산업 혁신전략 대통령 비전 선포(2019.05.22.)
|
출처: 대한민국 정책브리핑, 바이오헬스 산업 혁신전략 |
우리나라는 바이오헬스 분야에 충분한 경쟁력을 갖추고 있다. 정부는 바이오헬스 산업의 경쟁력을 바탕으로 비메모리 반도체, 미래형 자동차와 함께 차세대 3대 주력 산업 분야로 중점 육성하여, 세계시장 선도기업 창출 및 산업생태계를 조성할 계획이다.
바이오헬스 혁신 민관 공동 간담회(2019.05.15.)
출처: 과학기술정보통신부
산업부-복지부 공동 바이오헬스 발전전략 민관회의 (2018.07.04.)
출처: 산업통상자원부, 보건복지부 |
■ 바이오 육성을 위한 정책 수립 활동
|
바이오특별위원회(2기)
제1회 바이오특별위원회(2018.05.11.)
출처: 과학기술정보통신부
|
|
|
|
||||||||||
|
출처: 과학기술정보통신부 |
생명공학종합정책심의회
제31회 생명공학종합정책심의회(2019.02.18.)
|
|||||||||
제4차산업혁명위원회 제10차 헬스케어특별위원회(2018.11.21)
|
대통령직속 4차산업혁명위원회 헬스케어특별위원회에서는 4차산업혁명을 선도하기 위한 미래 헬스케어의 비전을 제시하고, 헬스케어특위 6대 프로젝트의 구체적 실행방안을 종합해 헬스케어 발전전략을 마련(2018.12.10.)하였다. *6대 프로젝트: ① 헬스케어산업 생태계 조성, ② 헬스케어 빅데이터 쇼케이스 구축, ③ 인공지능 활용 신약개발, ④ 스마트 임상시험센터, ⑤ 융복합 헬스케어기기, ⑥ 체외진단기기 출처: 메디컬타임즈, 2018.11.22, 헬스케어특위가 남긴 1년의 발자취 '성과와 과제'
|
헬스케어 특별위원회, 헬스케어 분야 현장 방문 (2018.08.23.) ▼
출처: 대통령직속 4차산업혁명위원회; 전자신문, 2018.08.23. 대통령직속 4차산업혁명위원회 헬스케어특위, 융기원 방문 |
제2차 보건의료기술육성 기본계획(안) 대국민 공청회(2018.01.11.)
|
출처: 보건복지부; 의학신문, 2018.01.11, 보건의료기술육성기본계획(안) 윤곽 |
보건복지부(장관 박능후)는 제2차 보건의료기술육성 기본계획(안)에 대한 대국민 공청회를 개최하였다. 이번 공청회는 향후 5년간(2018~2022)의 보건의료 연구개발(R&D) 추진전략과 중점과제(안)에 대하여 관련 전문가와 국민의 의견을 폭넓게 수렴하여 기본계획에 반영하고자 마련되었다.
|
분야별 주요 활동
![]()
![]() 산업육성 및 생태계 조성을 위한 노력
산업육성 및 생태계 조성을 위한 노력
① 글로벌 진출 여건 마련
JP모건 헬스케어 컨퍼런스 2019에서 글로벌 빅파마와 어깨를 나란히(2019.01.09.)
|
|
|
2019 JP 모건 헬스케어 컨퍼런스에 초청된 국내 제약바이오사는 삼성바이오로직스, 셀트리온, 한미약품 등 총 26곳으로 삼성바이오로직스와 셀트리온이 메인 트랙 (Main Track)에 배정되어 글로벌 빅 파마와 어깨를 나란히 하는 뜻 깊은 자리가 되었다.
◀ 2019년 1월 9일 미국 샌프란시스코에서 한미약품 권세창 사장(왼쪽 위), 삼성바이오로직스 김태한 사장(왼쪽 아래), 셀트리온 서정진 회장(오른쪽 위, 아래)이 발표를 하고 있다.
|
|
|
|
|
|
출처: 뉴데일리경제, 2018.12.14, ‘JP모건 헬스케어 컨퍼런스’ 26개사 참여… 삼바・셀트리온 메인트랙; 셀트리온; 삼성바이오로직스; 한미약품 |
|
|
2018 BIO International Convention(2018.06.04∼07.)
|
|
|
|
|
|
출처: 파이낸셜뉴스, 2018.06.06, 막 오른 '바이오 USA'..韓기업 글로벌 파트너 확보 집중; 약업신문, 2018.06.08, '2018 바이오USA' 성료... 국내 제약바이오기업 알찬 성과; 코트라, 2018년도 바이오 USA 한국관 전경 |
|||
2019 BIO International Convention(2019.06.03∼06.)
|
|
|
|
출처: 뉴스1코리아, 2019.06.05, 바이오 USA 2019 삼성바이오로직스; 더벨, 2019.06.10., 삼성바이오・셀트리온 등 약 30개사 참가 코트라・거래소 등도 한국 알리기; 뉴스1, 2019.06.05, 바이오USA 2019에 마련된 한국관 부스
② 국내 바이오 생태계 조성 노력
바이오경제 구현을 위한 기업인 간담회(2018.12.10.)


출처: 과학기술정보통신부
인공지능 신약개발지원센터 개소식(2019.03.20.)


인공지능 신약개발지원센터는 제약기업 등이 신약을 신속하고 안전하게 개발하기 위해 인공지능을 적극 활용하도록 관련지식을 공유하고, 제약기업 관계자 등을 대상으로 일반・전문 교육을 지원하며, 성공사례와 정보를 공유하는 등 공익적 구심점 역할을 수행한다.
출처: 보건복지부
|
|
도전! K-스타트업 2019 왕중왕전(2019.11.28.)
대상에 창업리그 디자인노블(대통령상, 인공지능 패션 디자인 생성서비스), 예비창업리그 뉴아이비(국무총리상, 폴대가 필요 없는 스마트 수액・주사액 투여장치)! 200:1(총 3,894팀 참가)에 가까운 경쟁을 뚫고 올라온 20개 팀, 최종 왕중왕전 겨뤄 출처: 중소벤처기업부;대한민국 정책브리핑, 내가 미래의 유니콘 기업이다! |
![]() 일자리 창출 노력
일자리 창출 노력
바이오경제 2025 일자리 기업 간담회(2018.05.29.)
|
|
|
출처: 과학기술정보통신부
2018 한국 제약바이오산업 채용박람회(2018.09.07.)
|
|
|
출처: 보건복지부
2019 한국 제약바이오산업 채용박람회(2019.09.03)
|
|
|
출처: 한국제약바이오협회, http://kpbma.or.kr/index.php
기타 주요 이슈
|
제5차 연구기관 역할 재정립 협약식 (2018.09.07.)
|
|
|
출처: 과학기술정보통신부
|
|
|
남북 보건의료 분과회담 (2018.11.07.)
남북 전염병 정보교환, 대응체계 구축 등 보건의료협력 합의 |
|
출처: 보건복지부 |
|
|
감염병 예방을 위한 첫걸음, 공공백신 개발・지원센터 기공식(2018.12.19.)
|
|
|
|
|
출처: 보건복지부 |
|
유전자원 이익공유 대응 부처합동 법률지원단 발족(2019.04.03.)
나고야의정서 제도 해석의 오류를 방지하고 보다 효과적으로 대응하기 위하여 법률지원단 발족
|
|
|
출처: COS'IN, 2019.04.09, 정부, 나고야 의정서 대응 지원 'ABS법률지원단' 발족
|
|
|
일본의 수출통제 관련 관계기관 회의 (2019.07.04.)
유명희 본부장, 일본 조치의 국제규범상 문제점 지적, 일본 조치의 철회와 수출통제 양자협의 촉구
|
|
|
출처: 산업통상자원부 |
|
생물무기금지협약(BWC) 당사국회의(2019.12.03.∼05.)

스위스 제네바 유엔에서 개최된 생물무기금지협약 당사국회의에 한국을 포함한 122개 당사국과 4개 서명국, 국제기구, 전문기관 및 비정부기구 등이 참석하였다. 우리나라 대표단은 전문가회의 결과를 토대로 해당분야(생물테러감염병 대비・대응 정책 수립, 인적자원 개발・훈련 및 강화, 국제협력체계 구축, 질병감시・진단・통제 등) 의제를 중점 검토, 논의, 발언문 제출, 관련 발언 등을 실시하였다.
출처: 한국바이오협회, 질병관리본부
주요 행사
![]()
2018 바이오 혁신성장대전(2018.11.28.∼29.)
|
|
||
|
|
|
|
2019 바이오미래포럼(2019.12.16.∼17.)
|
|
|
|
|
출처: 과학기술정보통신부, http://www.bioforum.kr/
|
2018 코리아 바이오플러스 (2018.09.06.∼07.)
|
|
|
|
출처: 산업통상자원부 |
||
|
|
|
2019 코리아 바이오플러스 (2019.11.12.∼13.) |
|
출처: 바이오플러스, https://www.bioplus.kr/fairDash.do?hl=KOR |
||
2018 바이오코리아(2018.05.09~11.)
|
|
|
|
|
|
|
출처: 대한민국 정책 브리핑, 2018 바이오 코리아 개막식; 동양일보, 2018.05.09, 2018 바이오 코리아 개막 |
|
2019 바이오코리아(2019.04.17.∼19.)
|
|
|
|
|
|
|
출처: 대한민국 정책브리핑, 바이오코리아 2019 개회식; 의사신문, 2019.04.17, 바이오 코리아 2019 개막…50개국·750여 개 기업 참가 |
|
2018 국제종자박람회(2018.10.23.∼26.)
|
|
|
2019 국제종자박람회(2019.10.16.∼18.)
|
|
|
|
출처: 국제종자박람회, http://www.koreaseedexpo.com/ |
|
바이오자원은행 운영 국제포럼(2019.06.18.)
|
|
|
ISO 20387이 국제 표준에 이어 국내 KS로 제정됨에 따라 국내 생물소재 현황을 공유하고 국내 다양한 생물소재은행의 소개 및 대응 방향 모색
출처: 산업통상자원부
G20 환경장관회의(2019.06.15.∼16.)
|
|
|
에너지 전환과 환경 보호, 자원효율성 촉진, 해양 플라스틱 저감, 기후 적응·회복 등에 대한 논의에 참여하고 우리 정책사례 소개
출처: 환경부
'바다가 미래다' 2019 씨팜쇼(2019.06.20.)
|
|
|
‘바다가 미래다’를 주제로 열리는 이번 박람회에서는 스마트 양식 등 세계시장을 선도하는 우리나라의 해양수산기술과, ‘케이피시(K-Fish)’로 수산물 한류를 이끌고 있는 국내 해양수산・양식・식품 분야 우수 기업들의 활약상을 소개
출처: 해양수산부
2018년 주요연구성과 국가연구개발우수성과 100선의 '생명.해양' 분야에 선정된 성과를 기준으로 소개
▮생명・해양 분야
|
연구자명 |
소속기관 |
성과명 |
|
서우덕 |
국립식량과학원 |
보리의 새로운 발견! 새싹보리의 기능성물질 구명 및 산업화 |
|
김호민 |
한국과학기술원 |
시냅스형성을 조절하는 핵심단백질의 3차구조와 분자기전 규명 |
|
구복경 |
농림축산검역본부 |
세계 최초 구제역 감별진단킷트 개발 |
|
김명권 |
토마토연구소 |
토마토 신품종의 육성으로 종자수출에 기여 |
|
김세리 |
국립농업과학원 |
세계 최초 IoT 적용 식중독세균 검출・제어 기술 |
|
김주곤 |
서울대학교 |
뿌리 구조 재구성을 통한 가뭄 저항성 벼 개발 |
|
남은영 |
국립원예특작과학원 |
전세계 소비자를 겨냥한 핵과류(복숭아・플럼코트) 신품종 개발 |
|
류성무 |
㈜케이엔알시스템 |
해저 수중 작업용 유압 로봇팔 개발 |
|
박기덕 |
한국과학기술연구원 |
반응성 교세포 조절기반 신규 치매치료제 개발 |
|
방창현 |
성균관대학교 |
최초 문어빨판 비밀 밝혀 물속에서 떼고 붙이는 의료용 패치 소재 개발 |
|
백명기 |
서울대학교 |
한웅 경제형질별 맞춤형 사양을 위한 유전정보 분석 기술 개발 |
|
신경철 |
건국대학교 |
설탕 대체제 기능성 알로스의 대량생산 및 실용화 기술 개발 |
|
유재홍 |
국립농업과학원 |
김치에서 분리한 효모와 버려지는 잣송이 활용, 돈분악취 가스 감소기술 개발 |
|
이미자 |
국립식량과학원 |
보리의 변신은 어디까지? |
|
이상섭 |
경기대학교 |
해양 환경 정화 시스템 |
|
이제희 |
제주대학교 |
넙치의 바이러스성, 기생충성, 세균성 질병을 예방하는 고기능성 복합백신개발 |
|
이주한 |
보령제약(주) |
고혈압과 고지혈증 치료용 복합제의 국내발매 및 해외 기술이전 |
|
최순호 |
농우바이오 |
지중해권, 미주권에서 사랑받는 고추 신품종 개발 |
|
최연웅 |
한국유나이티즈제약(주) |
복용횟수를 1일 3회에서 1일 2회 투여로 줄여 복용 편의성을 증대시킨 호흡기 질환 치료제 레보틱스 CR 서방정 개발 |
|
최윤정 |
국립원예특작과학원 |
국내육성 프리지아, 국내시장 넘어 세계로! |
|
한정구 |
㈜에이유 |
생분해가능 식품포장 신소재 개발로 국민 식생활 안전과 환경보호에 기여 |
|
허문석 |
국립생물자원관 |
친환경・생물학정 환경정화 기술개발을 위한 비소 독성 저감 신종 세균 발굴 |
|
황인환 |
포항공과대학교 |
발아시 단백질 분배과정과 세포질 에너지대사 과정의 networking을 통한 발아효율 조절 기작 규명 |
▮기술이전・사업화・창업 우수기관
|
기관명 |
성과명 |
비고 |
|
고려대학교 |
인간 줄기세포로부터 고효율 간세포 생산 |
최우수 (기술이전) |
|
한국과학기술 연구원 |
해양오염 방제 유수분리기술/ 플라즈마전해 양극산화 코팅기술 |
|
|
CFRP(탄소섬유복합소재) 재활용 기술 |
|
|
|
알파아미노이드 유도체 화합물 |
|
|
|
한국해양과학기술원 |
(총괄) 해양수산 분야 우수기술 사업화의 디딤돌 역할 수행 |
|
출처: 2018 국가연구개발 우수성과 100선 중(과기정통부, KISTEP)
2019년 주요연구성과 국가연구개발우수성과 100선의 '생명.해양' 분야에 선정된 성과를 기준으로 소개
▮생명・해양 분야(23개)
|
성과명 |
연구자 |
소속기관 |
비고 |
|
YH25448(Lazertinib)의 글로벌제약사 기술수출 |
오세웅 |
유한양행 |
최우수 |
|
간암치료를 목적으로 비수술적 치료법인 동맥화학색전술에 사용되는 미세구체의 개발 |
김정민 |
제일약품 |
최우수 |
|
뇌에서 기억이 저장되는 장소 규명 |
강봉균 |
서울대학교 |
|
|
해외 수출 및 수입 대체를 위한 고품질 양파 품종 개발 |
김규현 |
㈜농우바이오 |
|
|
배아줄기세포 또는 유도만능줄기세포(iPS cells)로부터 고효율 신경세포분화 방법을 이용한 난치성 세포치료제 개발 |
김동욱 |
연세대학교 |
|
|
이베리코 열풍! 한국형 흑돼지 신품종 ‘우리흑돈’으로 잠재운다 |
김용민 |
국립축산과학원 |
|
|
차세대 신성장 동력 스마트팜 원천기술 개발 및 제품 국산화 |
김현태 |
경상대학교 |
|
|
전복 유전체 완전해독에 의한 고부가 기능성 소재 및 고수온내성 전복 선발기술 개발 |
남보혜 |
국립수산과학원 |
|
|
세계 최초 복숭아 꽃눈 제거용 「맥동형 직분사 분무건」 개발 및 사업화 |
박영식 |
강원도농업기술원 |
|
|
세계 1위 제품보다 우수한 world best 제초제 개발 및 사업화 |
성순기 |
㈜팜한농 |
|
|
세포분열 조절 신규 인자 발굴 |
송은주 |
과학기술연구원 |
|
|
알츠하이머, 파킨슨병의 공통적인 병인현상으로 미토콘드리아 칼슘 증가 규명 |
이규선 |
한국생명 공학연구원 |
|
|
100% 천연 풍미 발효조미소재 다양한 제품(볶음용, 육수용, 범용) 개발 및 사업화 |
이대희 |
샘표식품㈜ |
|
|
악성 뇌종양, 소아 뇌종양의 근본 원인 규명 및 혁신 치료법 개발 |
이정호 |
한국과학기술원 |
|
|
세계 최초 알러지 저감밀 개발로 종자기술 강국 실현하다. |
이종렬 |
국립농업과학원 |
|
|
ICT와의 만남으로 어미돼지의 동물복지 실현 |
이준엽 |
국립축산과학원 |
|
|
공공백신(수족구병) 후보주 민간 기술이전 |
이준우 |
질병관리본부 |
|
|
단백체학 기술을 이용한 공진화(共進化) 잔해물의 단백질 분해신호 발굴 |
이철주 |
과학기술연구원 |
|
|
TNIK 저해제를 FutuRx에 기술이전, FutuRx는 TNIK Therapeutics 설립하여 TNIK 저해 항암제 개발 시작 |
이혁 |
한국화학연구원 |
|
|
고지혈과 자가면역질환의 연관성규명 |
정연석 |
서울대학교 |
|
|
현장진단용 미세칩 전자동 밸브제어 기술 |
조윤경 |
울산과학기술원 |
|
|
김치 유통기한 연장기술 개발을 통한 유럽과 이슬람 지역 김치 수출 |
차성관 |
㈜한성식품 |
|
|
위암 고위험군에서 헬리코박터 감염과 위암 발생 |
최일주 |
국립암센터 |
|
▮융합기술 분야(4개)
|
성과명 |
연구자 |
소속기관 |
비고 |
|
췌장암 및 담도암을 보면서 빛으로 표적치료하는 형광복강경 및 광역학 치료 시스템 개발 |
배수진 |
한국전기연구원 |
최우수 |
|
레이저 프린터를 통한 정밀 3D DNA 암 지도 구현 |
권성훈 |
서울대학교 |
|
|
인공지능을 이용한 CRISPR-Cpf1 유전자가위 활성 예측 알고리즘 제작 |
김형범 |
연세대학교 |
|
|
근적외선 신호 기반 현장검출용 조류인플루엔자 바이러스 진단기술 개발 |
이준석 |
한국과학기술연구원 |
|
▮순수기초・인프라 분야(6개)
|
성과명 |
연구자 |
소속기관 |
비고 |
|
식물의 꽃잎과 열매가 왜 항상 일정한 위치에서 탈리하는지에 대한 이유와 원리 규명 |
곽준명 |
기초과학연구원 |
|
|
유전자 조절의 실마리, RNA 보호하는 '혼합 꼬리' 발견 |
김빛내리 |
기초과학연구원 |
|
|
병저항성과 관련된 식물 마이크로바이옴의 구조・기능 세계 최초 구명 |
김지현 |
연세대학교 |
|
|
스스로 에너지를 생산해 단백질을 합성하는 인공세포 구현 |
신관우 |
서강대학교 |
|
|
고혈압 유발 단백질 CTRP1의 기능 규명 / 신규 고혈압 생체지표 및 혈압조절제 신약 타겟물질 발굴 |
양영 |
숙명여자대학교 |
|
|
지표 탄소플럭스의 이해를 위한 생태계 및 탄소 변화 분석 방법론 개발 |
정수종 |
서울대학교 |
|
출처: 2019 국가연구개발 우수성과 100선 중(과기정통부, KISTEP)
바이오미래유망기술
|
바이오미래유망기술을 발굴하는 것은 생명과학과 바이오텍의 상호혁신을 유도할 수 있는 혁신기술을 발명한다는 점에서 매우 중요한 의미를 가진다. 한국생명공학연구원은 지난 2015년부터 바이오미래유망기술 발굴연구를 추진해오고 있으며, 2019년에는 네 번째 연구결과를 발표하였다.
[바이오 미래유망기술 발굴 추진방안 변화] |
2015년 바이오 10대 미래유망기술
|
미래유망기술 |
미래유망기술 주요 내용 |
|
|
차세대 유전체분석 칩 (NGS-on-a-chip) |
∙칩 상에서 극소량의 시료로부터 유전체 서열 정보를 초고속으로 분석 ∙초고속/저비용/대용량 유전체 분석으로 언제, 어디서나 신속하고 정확한 진단, 치료, 예측에 활용 가능 |
|
|
체내 이식형 스마트 바이오센서 |
∙신체에 직접 이식하거나 복용할 수 있는 형태의 바이오센서 ∙ICT 기술을 활용, 의사와 환자를 실시간으로 연결하여 진단, 치료, 예방, 관리 구현 |
|
|
사이버 메이트 헬스케어 |
∙개인 바이오헬스 데이터(유전체 정보 등)를 재구성하여 사이버 상의 헬스케어 관리 시스템 구현 ∙사이버 메이트 헬스케어를 통해 취약 질환에 대한 대응 및 게임 앱 등을 통한 건강 가이드라인 제시 |
|
|
미래유망기술 |
미래유망기술 주요 내용 |
|
|
개인 맞춤형 마이크로바이옴 |
∙개인 특이적 다양성을 가진 인체 공생 마이크로바이옴 특성 규명을 통한 마이크로바이옴 치료제 개발 ∙인체-마이크로바이옴 상호작용은 건강과 질환에 직접 연관되어 면역 질환 등 다양한 질환 치료에 활용 가능 |
|
|
유전자 교정세포 3D 프린팅 |
∙체외에서 유전자 교정 후 3차원 세포 프린팅으로 원하는 조직이나 장기를 제작하여 재생하는 기술 ∙난치 유전성 질환 치료 및 근본적인 장기 재생을 통한 질환 치료 |
|
|
퍼스널 노화속도계 |
∙신체 기능별 노화속도를 정확하게 측정할 수 있는 마커 발굴로 개인별 노화속도를 예측하고 진단하는 기술 ∙개인별 노화속도 예측에 따라 적극적인 건강관리, 정확한 노인성 질환 발병 시기 예측을 통한 예방 |
|
|
지능형 환자 맞춤약 |
∙신기술(환자 맞춤형 줄기세포, 지능형 약물 방출 등)과 바이오 빅데이터를 지능형 컴퓨팅으로 처리하여 최적의 약물 개발 ∙환자 맞춤형 의약 처방 및 신약개발 효율화에 기여 |
|
|
4D 세포 추적기술 |
∙분화, 증식에 따른 세포들의 3차원적인 변화 정보를 추적, 세포의 상호작용을 분석하는 기술 ∙고해상도의 3D, 4D 생명체 지도를 확보하여 생물학뿐 아니라 의학적, 공학적으로 획기적인 전환점 제공 |
|
|
운동효과 바이오닉스 |
∙노화에 따른 근육감소 예방 및 근기능 유지를 위한 스마트 근력증강 바이오닉스 ∙실제 운동을 하지 않아도 운동을 통해 형성되는 근육 생성 및 유지 |
|
|
인지/감각기능 증강용 가상현실 |
∙인지 및 감각기능 향상을 위한 가상현실 하드웨어 /소프트웨어 개발 ∙치매, 노안 등 대표적 노인성 인지/감각기능 장애 예방 가능 |
|
2017년 바이오 10대 미래유망기술
|
이슈 |
주요 내용 |
|
보건의료 빅데이터 플랫폼 구축
|
대규모 임상 유전체 정보관리기술 (Clinico-genomic big data management) ∙질병 예방·치료를 위한 임상 및 유전체 정보를 통합 관리하는 기술 ∙기존의 임상 기반의 치료에서 개인 유전체 정보의 통합 활용을 통해 질병을 예방하고 환자를 치료하는 정밀의료 구현에 기여 |
|
개인 유전체 기반 맞춤형 치료제 개발
|
단일세포 유전체 분석기술(Single cell genomics) ∙다세포 생물의 조직을 이루는 개개의 세포 수준에서 DNA, RNA 등의 유전체 정보를 분석하는 기술 ∙개별 세포의 서로 다른 분자적인 특징을 이해함으로써 암세포 등 질병 세포 이질성에 따른 맞춤형 치료 가능 |
|
신종 바이러스와 슈퍼 박테리아의 전 세계 확산
|
역학정보분석기술(Infoepidemiology) ∙인공지능 및 빅데이터 분석기술을 활용한 감염병 발생과 바이러스 확산을 예측하는 기술 ∙효율적인 감염병 예방 관리 시스템 구축을 바탕으로 미래 예측형 감염병 대응 실현 가능 |
|
모바일 기기로 질병 예측・예방・진단 및 관리
|
모바일 인공지능 진단기술(Mobile AI diagnostics) ∙모바일기기 내장 센서에 의한 데이터와 문자, 음성, 통신 등 빅데이터 분석을 통해 질병의 예방·진단·관리에 응용 ∙특정 질병의 원인 추적 및 치료 경과 관찰, 감염성 질환의 전파 차단 등 국민 건강 증진에 기여 |
|
애플・구글 등 스마트 헬스케어 전쟁
|
웨어러블 건강관리기술(Wearable health device) ∙생체신호(맥박, 체온, 혈압, 심전도 등)의 실시간 수집을 위한 웨어러블기기의 제조 및 데이터 분석을 통한 건강 관리기술 ∙생체신호의 지속적인 수집을 통해 다양한 급/만성질환의 조기 진단 및 예방 가능 |
2
|
이슈 |
주요 내용 |
|
|
표적유전자를 편집하는 유전자 가위기술의 혁신
|
∙유전자 가위를 이용해 세포 내 유전자를 편집하여 질병을 치료하는 기술 ∙근본적인 해결이 없는 희귀 유전질환 등 치료 효율이 낮은 난치질환에 대해 효과적인 치료법 제공 |
|
|
혁신적 진단기술, 액체생체검사 대두
|
∙암 환자의 말초 혈액 내에서 순환하는 암세포와 순환 DNA를 탐지하는 기술 ∙환자의 혈액 내 순환하고 있는 종양 세포나 DNA를 적은 고통으로 추출 가능하고 정확한 분석결과 확보 가능 |
|
|
원격의료 시범사업 확산
|
∙혈액 채취 없이 비침습적인 방법으로 혈당을 연속적으로 측정하는 센서의 고도화 기술 ∙채혈 및 여러 단계를 거치는 불편한 과정 없이 혈당 측정이 가능하여 당뇨 환자의 삶의 질 향상에 기여 |
|
|
재생의료 융합화 및 기술개발 확대
|
∙세포의 체외조작 없이 생체 내에서 직접교차분화를 유도하여 세포의 운명을 바꾸는 기술 ∙생체 내에서 재생이 필요한 세포를 직접 만드는 기술로 재생의학의 패러다임을 전환시킬 수 있을 것으로 기대 |
|
|
유전체 발현 지휘 단백질 발견
|
∙후성유전학적 방법으로 발생 및 분화 과정에서 광범위한 유전자들의 발현을 조절하는 기술 ∙발생 및 분화 과정의 정교한 조절을 통해 원하는 세포를 제작하고, 3차원적인 발생·분화 등 생명현상 이해에 기여 |
2018년 바이오 10대 미래유망기술
|
분야 |
미래유망기술 주요 내용 |
|
|
코어 바이오 Core Bio |
단일뉴런 분석기술(Single neuron analysis) |
|
|
|
∙단일뉴런의 유전자 발현, 단백체 결합, 연결성, 신경활성 변화 등을 종합하여 신경조직 간 네트워킹을 파악하는 기술 ∙개별뉴런을 표식하고 각각의 활동양상을 분석할 수 있는 틀을 제공하여 복잡한 뇌 기능 이해 및 활용에 기여 |
|
|
유전자 복원기술(Genetic remediation) |
||
|
|
∙생태계 및 시스템 내에서 원치 않는 유전자 변이를 제거하여 유전적 기준선(genetic baseline states) 상태로 복원하는 기술 ∙유전자 편집기술의 과용 및 오용으로 유발될 수 있는 유전자 풀(pool)의 비의도적 변화를 막고 보다 안전한 유전자 편집 시스템 활용 가능 |
|
|
합성배아(Synthetic embryo) |
||
|
|
∙줄기세포를 이용하여 인공적으로 배아 및 배아성장에 필요한 태반과 유사 구조체를 제작하는 기술 ∙실제 배아를 사용하지 않고 발생과정을 연구할 수 있는 실험체를 제작하여 발생 및 불임 연구 가능 |
|
|
레드 바이오 Red Bio |
생체 내 유전체 편집기술(in vivo Genome editing) |
|
|
|
∙유전자 가위기술을 이용하여 개체 내 세포를 대상으로, 그 내부의 특정 유전자를 편집하여 질병을 치료하는 기술 ∙근본적인 해결책이 없는 희귀유전질환이나 치료효율이 낮은 난치질환에 대해 효과적인 치료법 제공 |
|
|
오가노이드 기반 생체모사기술(Organoids-based biomimetics) |
||
|
|
∙줄기세포, 3D 프린팅기술 융합 등을 통해 제작된 오가노이드를 이용하여 복잡한 생체시스템(순환계, 신경계, 소화계, 개체 전체 등)을 모사하는 기술 ∙기초연구, 신약개발, 장기대체 치료법에 이르기까지 인간화 모델 시스템에서의 효과적인 연구 가능 |
|
|
분야 |
미래유망기술 주요 내용 |
|
|
그린 바이오 Green Bio |
식품 유해성분 동시검출 센서(Simultaneous hazards-detecting sensors) |
|
|
|
∙식품 내 미량 포함된 인공색소, 중금속, 마이코톡신, 환경호르몬 등을 동시에 검출하는 기술 ∙식품의 보관·운송·판매 단계에서 손쉽게 다양한 유해물질의 정량측정을 가능하게 하여 안전한 먹거리 검증에 기여 |
|
|
유전체 편집 기반 양적형질 조절기술(QT engineering by genome editing) |
||
|
|
∙양적형질(quantitative traits)*에 관여된 여러 개의 타겟 유전자를 동시에 편집하여 동·식물의 형질을 강화/개량하는 기술 *무게, 길이, 생산성 등의 형질에 여러 개의 유전자가 관여하여 각 유전자의 기능이 잘 드러나지 않는 형질 ∙혁신적으로 육종기간이 단축될 수 있고, 전통적인 방법으로 불가능했던 형질 도입이 가능 |
|
|
화이트 바이오 White Bio |
인공효소 체인(Artificial enzyme chain) |
|
|
|
∙세포 내 연쇄반응인 생합성 대사경로를 이용, 인공적으로 합성한 체인형식의 효소 연쇄반응 공정을 통해 바이오연료 및 다양한 소재 생산효율을 극대화하는 기술 ∙분리정제가 필요 없는 다중효소반응으로 생산공정의 효율성과 생산성을 획기적으로 향상하는 데에 기여 |
|
|
탄소자원화 광합성 세포공장(Carbon utilizing photosynthetic cell factory) |
||
|
|
∙이산화탄소 저감 및 탄소자원화 능력을 갖는 광합성 세포공장 시스템을 구축, 이를 활용하여 고부가 소재를 생산하는 기술 ∙급변하는 기후변화에 대응하여 지속가능한 차세대 바이오연료 및 탄소자원 공급원으로 활용 가능 |
|
2019년 바이오 10대 미래유망기술
|
분야 |
미래유망기술 주요 내용 |
|
|
플랫폼 바이오 (Platform Bio) |
DNA 기록기술/분자레코딩(DNA writer/Molecular recording) |
|
|
|
∙생물학적∙인공적 정보를 살아있는 세포 내에서 처리하고 저장할 수 있도록 DNA를 역동적인 기록 매개체로 활용하는 기술 ∙생물시스템의 분자적인 현상과 정보를 DNA에 기록하고 저장함으로써 생명현상을 이해하는데 큰 도움이 될 뿐만 아니라 질병치료, 품종개량 등 실용적인 면에서도 활용 가능 |
|
|
조직별 면역세포 세포체 지도(Cellomics map of tissue-resident immune cells) |
||
|
|
∙조직 특이적 면역세포의 종류, 기능 및 상호 관계를 이해하기 위해 세포체의 전체상을 파악하고 시각화하는 기술 ∙조직별 면역세포의 기능과 발병기전을 연계하여 이해하고, 이를 바탕으로 효과적인 면역세포 기반 치료제 개발에 기여 |
|
|
자기조직화 다세포 구조(Self-organizing multicelluar structures) |
||
|
|
∙합성유전회로(synthetic genetic circuits)를 설계하여 생물의 능력을 모방할 수 있는 맞춤형의 3D 구조(조직)를 제작하는 기술 ∙생물의 능력을 모방할 수 있는 재료 제작이 가능하여 맞춤형 생체물질, 조직 및 대체장기 개발에 기여 |
|
|
레드 바이오 Red Bio |
逆노화성 운동모방 약물(Exercise-mimicking medicine for anti-aging) |
|
|
|
∙실제 운동을 하지 않아도 운동효과를 나타내어 근육노쇠 등 노인성질환을 예방할 수 있는 약물 ∙건강증진에 가장 효과적이라고 증명된 운동의 좋은 효능을 모방하는 약물개발을 통해 건강노화와 노화예방에 기여 |
|
|
광의학 치료기술(Photodynamic/Photothermal therapy) |
||
|
|
∙특정 파장대의 빛과 광민감제(photosensitizer)를 암세포의 내부로 도입시켜 그 빛을 이용하여 암세포를 제거하는 기술 ∙특정 암세포만을 선택적으로 파괴할 수 있어 비교적 고통과 후유증이 없고, 보다 안전하고 효율적인 차세대 암 치료기술 |
|
|
분야 |
미래유망기술 주요 내용 |
|
|
레드 바이오 Red Bio |
암 오가노이드 연계 면역세포 치료기술(Canceroid-mediated immune cell therapy) |
|
|
|
∙암환자 세포 유래 암 오가노이드를 이용하여 환자 맞춤형 면역세포치료제를 생산하고, 이를 항암치료에 활용하는 기술 ∙암 오가노이드는 다양한 암종에 대한 환자 맞춤형 면역세포치료제 생산으로 항암치료에 기여할 뿐만 아니라 최적의 항암효과를 평가하는 플랫폼으로도 이용 가능 |
|
|
그린 바이오 Green Bio |
미토콘드리아 유전체편집을 통한 대사조절기술 (Metabolic modification by mitochondrial genome editing) |
|
|
|
∙에너지 생산기관인 미토콘드리아 유전체편집을 통해 식물의 물질대사를 조절하고 생산성을 증대시키는 기술 ∙급격한 환경변화에도 식물 대사조절을 통해 지속가능한 작물 재배가 가능하여 안정적인 식량자원 확보에 기여 |
|
|
식물공장형 그린백신(Plant-based vaccine production in plant factory) |
||
|
|
∙식물공장 생산방식을 적용하여 부작용이 적고 효율적인 식물백신을 대량으로 생산하는 기술 ∙밀폐형의 식물 기반의 생산시스템은 비교적 단기간 내에 백신의 대량생산이 가능하여 감염병에 대한 신속한 대응이 가능 |
|
|
화이트 바이오 White Bio |
플라스틱 분해 인공미생물(Plastic degrading artificial microorganism) |
|
|
|
∙합성생물학을 통해 플라스틱 분해능을 보유한 미생물을 상향식(bottom-up) 방식으로 개발하는 기술 ∙플라스틱 분해능이 우수한 미생물의 유전체를 디자인(design) -빌드(build)-테스트(test)-런(learn) 사이클로 합성하여 해양 등에 심각한 환경오염을 일으키는 플라스틱 문제해결에 기여 |
|
|
유전자회로 공정 예측기술(Predictable genetic circuit engineering) |
||
|
|
∙빅데이터로 기계학습 된 시뮬레이션으로 합성유전자회로의 최종출력(소재∙물질 생산능 등)을 예측하는 기술 ∙예측 가능하며, 엄격한 제어가 가능한 유전자회로 설계로 생물시스템의 불확실성을 줄여 반복실험의 비용과 시간을 절감하여 바이오 기반의 지속가능한 산업으로의 전환을 촉진 |
|
특집
특집 1
바이오 빅데이터 정책
가. 개요
지난 반세기 동안 인간의 수명은 꾸준히 증가 해 왔다. 세계은행의 보고에 따르면 1960년 52.6세에 불과했던 전 세계 평균 기대수명은 2017년 72.2세로 20년 가까이 연장되었다고 한다.1) 이러한 수명증가는 공중보건 향상, 식량생산의 증가 및 환경의 개선과 함께 의료기술의 발전이 기여한 바가 크다. 최근 생명공학기술의 발달로 의료 수준은 날로 향상되고 있는데, 임상정보 등 바이오 빅데이터와 이를 활용한 디지털 헬스 등 새로운 기술의 등장은 의료서비스 패러다임을 다음과 같이 변화시키고 있다.
첫째, 치료중심에서 예방과 조기진단으로 서비스 시장이 확대되고 있다. 위암 환자에서 정기 검진을 통한 조기진단이나 고지혈증 환자에서의 지질저하제 투여, 금연치료를 이용한 심혈관질환의 예방은 그 대표적인 예이다.
둘째, 표준 치료에서 개인의 특성에 적합한 맞춤 서비스로 바뀌고 있다. 정밀의료라는 개념으로 널리 알려지고 있는 개인의 유전체, 생활습관, 환경 등 차이를 고려한 개인
맞춤형 예방 혹은 치료기술 적용이 점차 확대되고 있다. 유전형에 따른 항암제 처방은 이미 의료서비스에 적용되고 있다.
셋째, 공급자 즉 의료인 중심에서 소비자 중심으로 의료서비스 주도권이 바뀌고 있다. 의학정보가 인터넷 등을 통해 확산되고 다양한 방법으로 환자들 사이의 소통이 이루어짐에 따라 의료서비스에서도 환자들의 자기결정권이 확대되는 양상이다. 건강관리 앱(App)이나 소비자직접 의뢰 유전자검사도 이러한 흐름의 하나이다.
이러한 흐름과 동반하여 유전체분석, 이미징(Imaging), 생체모니터링 및 디지털헬스 기술과 이로 인해 축적되는 방대한 데이터는 바이오분야의 4차 산업혁명에서 핵심역할을 담당할 것이다. 인간 수명의 연장과 더불어 건강한 삶에 대한 열망으로 인해 바이오산업의 비중이 지속적으로 증가하고 있는데, 현재 세계 경제를 주도하고 있는 여러 국가들에서는 경제성장과 국민의 건강을 위해 바이오분야 특히 바이오 빅데이터의 수집과 이를 활용하기 위한 정책과 투자를 확대하고 있다.
나. 바이오 빅데이터 수집
앞에서 언급한 정밀의료가 현실화되기 위해서는 무엇보다도 충분한 양의 데이터 확보가 선행되어야 한다. 미국에서는 2015년 오바마 행정부가 정밀의료 이니셔티브를 발표한 후 정밀의료 코호트, 암 및 희귀질환에 대한 정밀의료연구에 막대한 투자를 하고 있다. 예산의 60% 이상을 ‘All of Us’라고 명명한 정밀의료 코호트에 투자하고 있는데, 미국에 거주하는 일반인을 대상으로 연구에 참여하고자 하는 자원자 100만 명으로부터 생체 시료를 포함한 유전정보, 검진, 생활습관, 환경정보, 라이프로그 정보와 더불어 의무기록 등 방대한 데이터를 수집하고 있다.2) 예산 규모는 2016년 1억 3,000만 달러, 2018년에는 2억 9,000만 달러이다.
정밀의료 코호트는 맞춤약물치료, 질병 치료와 예방을 위한 새로운 타깃을 발굴하고 모바일 기기 등 새로운 기술이 건강행태에 미치는 영향을 분석한다. 이를 통한 유용성을 평가하고 다양한 질병으로부터 미래 정밀의료를 위한 과학적 지식을 축적하는 것을 목적으로 whole genome sequencing(WGS)과 더불어 생애주기에 걸친 설문과 임상정보를 수집하고 있다.
영국에서는 정밀의료를 위해 2006∼2010년까지 5년 동안 40∼69세의 연구 참여자를 모집하였고 향후 20년 이상 추적조사를 목표로 하고 있다. UK Biobank로 알려져 있는 이 대규모 코호트는 모집당시 사회 환경, 생활습관, 건강상태, 인지기능, 정신건강, 가족력 등에 대한 조사와 더불어 혈압과 신체계측, 악력, 골밀도, 혈관탄력, 안검사 결과 등을 수집해왔다. 또한, 정기적 추적조사, 의무기록 연계 및 주요 질병발생, 이미지 정보, 식습관 등 광범위한 자료를 지속적으로 수집하면서 데이터를 연구자들에게 제공하고 있다.3) 또한 80만 개 이상의 유전형에 대한 어레이(array)데이터, 리제네론(Regeneron) 등과 같은 기업들의 지원으로 전장엑솜분석(WES: whole exome sequencing)을 시행하여 최근 일부자료를 공개하고 있으며, MRC는 작년에 UK Biobank 연구대상자 중 5만 명에 대한 whole genome sequencing(WGS) 계획을 발표하였다.4)
또한 영국에서는 희귀질환 및 암의 정밀진단과 치료를 위해 2013년부터 10만 명을 대상으로 WGS 분석을 시행하는‘Genomic England’ 프로그램을 시작하였으며 2018년 말 유전체분석을 완료하였다.5) National Health Service(NHS)의 지원으로 Genomic England는 13개의 NHS Genomic Medicine Center로부터 참여자를 모집하였고 이 프로그램을 통해 기존에 진단이 되지 않았던 희귀질환 환자 중 약 25%를 추가로 진단하고 유전상담을 제공함으로써 유전체기반 의료서비스를 위한 국가 인프라를 구축하였다. Genomic England도 NHS England, Public Health England 의료정보와 연계하여 진료정보를 수집하여 여러 연구자들이 새로운 질병유전자를 찾아내고 이를 유전자진단이나 맞춤치료에 응용할 수 있도록 하였으며 UK NHS는 이 결과를 바탕으로 2018년 10월부터 유전자진단 서비스를 지원하고 있다.
일본에서도 Biobank Japan, National Center Biobank Network 등을 통해 기반자료, 검체를 수집하고 임상정보를 지속적으로 수집하고 있다. Biobank Japan의 경우 47개 질환자 약 20만 명을 대상으로 기초자료, 검체수집과 함께 의무기록 추적조사 하고 있으며 Riken연구소, 대학 및 기업에서 활용할 수 있도록 하고 있다.6) 중국에서도 Kadoori 바이오뱅크를 통해 50만 명 이상을 대상으로 설문, 임상정보, 검체를 수집하고 정기적 추적조사와 함께 수집된 검체로부터 유전체, 대사체, 단백체 정보 등 빅데이터를 생산하여 연구에 활용하고 있다.7) 핀란드에서도 50만 명 이상을 대상으로 디지털헬스 정보와 바이오뱅크를 연계하여 기업 등의 지원을 받아 유전체정보를 생산하고 공유하고 있다.
이와 같이 전 세계 여러 나라에서 대규모 대상자로부터 방대한 임상 및 유전체정보를 포함하는 바이오데이터를 수집함으로써 정밀의료 시대에 대비하고 있다. 우리나라에서도 2001년부터 유전체역학조사사업을 통해 23만 5,000명으로부터 건강 및 생활습관에 대한 설문, 검진결과, 검체 등을 수집하고 전장유전체분석(GWAS) 등 유전체정보 생산을 통해 국내 연구자들과 제공해오고 있으나 추적조사의 한계, 임상정보 연계가 건강보험공단 청구 자료로 제한되어 있어 정밀의료 연구에 활용하기에 충분하지 않다. 특히 일반인을 대상으로 특정 질병의 발생을 보기에는 추적기간이나 대상자 규모가 제한적이다. 안타깝게도 유전체역학조사사업 외 국내 연구자들이 공동으로 활용할 수 있는 빅데이터는 제한적이고 더욱이 의료서비스 활용 목적의 오믹스 연구를 수행하기 위한 임상정보가 풍부한 공공자원은 전무하다고 할 수 있다.
지난 5월 22일 바이오헬스 국가비전 선포식에서 문재인정부도 최대 100만 명 규모의 국가 바이오 빅데이터를 구축하겠다고 발표하였다. 2021년까지 1단계는 희귀질환과 기존 유전체연구사업 참여자 2만 명을 대상으로 WGS 데이터를 확보하여 공유하고, 2단계부터 난치성질환자와 일반인을 포함하여 2029년까지 100만 명으로 확대할 계획이다. 추가로 난치성질환과 일반인의 기반 조사 외 추적조사, 의무기록 연계 등에 대한 상세 계획이 필요하다. 건강보험공단자료 등 2차 자료의 연계나 질병 발생 등을 확인하기 위한 의무기록조사의 경우 본인동의를 받았다 하더라도 개인정보보호법 등으로 인해 자료 연계에 어려움이 예상되어 관련 정책과 제도 개선도 동반되어야 할 것이다.
다. 바이오 빅데이터의 공유
바이오 빅데이터로부터 맞춤약물치료, 신약개발 타깃발굴, AI기반 의료서비스 기술 등을 개발하기 위해서는 데이터 공유가 필수적이다. 따라서 수집단계에서부터 연구 참여자 혹은 데이터 제공자로부터의 동의 확보와 더불어 데이터 공유를 위한 법적・제도적 기반, 시스템과 운영체계가 고려되어야 한다. 국내에서는 2000년 초반부터 유전체를 비롯한 오믹스데이터 생산, 임상연구에 대한 정부지원이 확대되어 왔으나 데이터 공유에 대한 R&D 정책의 부재로 인하여 일부 데이터가 소실되거나 공유가 된다 하더라도 개별 연구자간 공동연구 형태로 제한적으로 이루어졌다.
최근 다부처 포스트게놈 사업에서 생산된 유전체 데이터의 일부가 국립보건연구원에서 운영하는 Clinical & Omics data Archive 및 한국생명공학연구원에 기탁되었으나 임상정보가 극히 제한되어 있어 정밀의료연구 등 의료서비스 기술 개발에 활용하기가 어렵다. 국립보건연구원에서 구축한 유전체역학조사사업의 역학 및 유전체정보는 국내 연구자들에게 공유되고 있으나 2013년 이전 초기 수집단계에서 현재의 생명윤리 및 안전에 관한 법률 기준에 맞는 유전정보 제3자 제공 동의를 획득하지 못한 일부자료는 여전히 제한적으로 활용되고 있다. 그러므로 향후 정부에서 지원하는 정밀의료 연구데이터는 수집단계에서부터 정보공유에 대해 참여자의 동의를 확보하여야 하고 2차 자료 연계 등을 통해 지속적으로 임상정보를 축적할 수 있는 제도적 근거 마련과 함께 서비스플랫폼 개발 등 공유체계가 구축되어야 할 것이다.
2020년부터 시작되는 국가 바이오 빅데이터 구축사업에서는 데이터 공유에 대한 사전 동의와 더불어 폐쇄망을 통해 유전체데이터 등을 국내 연구자들이 활용할 수 있도록 운영체계를 준비하고 있으나 아직도 법적・제도적으로 풀어야 할 숙제가 많다.
미국 정밀의료코호트는 수집된 바이오 빅데이터를 관련 연구자와 공유하는데 수집된 정보의 민감성과 복잡성으로 데이터의 보안과 관리에 많은 투자를 하고 있으며 데이터 활용을 위한 툴(tool)을 함께 제공함으로써 연구자들이 보다 편리하게 활용할 수 있도록 하고 있다. 영국은 UK Biobank, Genomic England 프로그램을 통해 생산된 데이터를 다양한 절차를 통해 영국 연구자들 뿐 아니라 다른 나라의 연구자들과도 공유하고 있으며 학계와 공공영역을 넘어 산업계에서도 자료를 활용할 수 있다. Genomic England의 경우 NHS England, Public Health England 등으로부터 자료연계를 통해 임상정보를 수집하였는데 유전질환의 특성상 연구자들이 진단에 필요한 제한된 임상정보만 제공받고 있으며 개인식별정보는 엄격한 보안체계에 따라 관리하고 있다.
국외에서는 정밀의료와 관련된 바이오 빅데이터 뿐 아니라 공적 자금으로 지원된 연구에 대해서는 데이터 공유정책이 일반화되어 있다. 2007년 OECD에서는 공공재원의 투자를 통해 얻어진 연구데이터에 대해 데이터 활용촉진 및 공유와 관련된 13개 기본원칙을 담은 가이드라인을 발표하였다.8)
미국 국립보건원(NIH)에서는 2003년 NIH가 지원한 연구에 대해 성과를 공유하고 타 연구자들이 이용할 수 있도록 데이터 공유정책을 발표하였다. 일정 금액이상의 지원과제나 대규모 유전체나 임상데이터를 생산하는 경우 연구과제의 선정단계에서부터 데이터 공유계획을 심의하고 공유와 관련한 계약을 따르도록 하고 있으며, 공유 계획을 이행하지 않은 경우 불이익을 가할 수 있다고 명시하고 있다.9) 영국에서도 MRC, Wellcome Trust 등 연구지원기관에서 데이터 관리 및 공유 정책을 실시하고 있고 유럽 연합도 동일한 정책을 펼치고 있다. 또한 데이터 보존과 공유를 위한 자원과 시스템에 대한 지원도 함께 이루어지고 있다.
국내에서는 바이오분야 빅데이터 공유와 관련된 구체적 정책이나 지원은 이루어지지 못하였다. 과학기술기본법 제11조 3에 ‘연구개발성과를 공공이익의 목적으로 활용하기 위한 경우 국가의 소유로 할 수 있도록 하고 중앙행정기관의 장은 국가가 소유하게 된 연구개발성과를 전문기관 등에 위탁하여 관리하게 할 수 있다’고 명시되어 있으나 이와 관련하여 각 부처에서 구체적 정책이나 관리체계가 수립되어 있지 않은 실정이다. 현재 보건복지부에서는 임상정보, 유전체정보 등 바이오 빅데이터에 대한 공유를 위한 제도 개선을 준비 중에 있다.
국가 바이오 빅데이터 사업은 이미 언급한 바와 같이 기획단계에서부터 수집된 데이터의 공유를 기본으로 하고 있다. 이를 위해서는 다음과 같은 사항이 고려되고 충분한 사전 준비가 필요하다.
첫째, 연구 참여자로부터 유전체정보 등 수집된 데이터의 공유에 대한 동의를 반드시 확보하여야 한다. 추후 수집될 정보에 대해 추가 동의, 유전체 정보 등 다소 민감할 수 있는 정보의 공유, 민감정보 활용 시 참여자에게 사전공지 등 dynamic consent를 포함한 다양한 방법에 대한 모색과 참여자들의 사전이해가 이루어져야 한다. 둘째, 연구자들이 데이터를 활용할 수 있되 보안이 보장될 수 있도록 시스템 구축과 더불어 체계적 운영절차가 필요하다. 국가 바이오 빅데이터 사업 외에도 정부 및 민간에서 지원하는 다양한 연구사업과 의료서비스 현장에서 방대한 양의 데이터가 생산되고 있으며 이를 활용한 의료서비스의 혁신과 바이오산업 성장가능성은 무한할 것으로 기대된다.
그러나 국내에서는 의료정보 등이 ‘개인정보보호법’에 의해정보 주체의 사전 동의 없이는 수집・활용 및 제3자 제공이 금지되어 있어 빅데이터 활용에 큰 제약이 되고 있다. 이러한 한계를 인지하고 2016년 정부에서는 개인정보 비식별조치 가이드라인을 수립하면서 비식별조치 기준과 함께 이 기준에 따라 비식별화된 데이터는 사전동의 없이 연구나 상업적으로 활용할 수 있다고 명시하였으나 법적 근거가 없어 빅데이터 활용에 소극적일 수밖에 없는 현실이다.10) 현재 국회에 발의11)된 개인정보보호법 일부 개정법률안에 가명정보의 도입과 더불어 산업적 목적을 포함하는 과학적 연구 등의 목적으로 적절한 안전조치 하에서 이용할 수 있도록 발의하였으나 아직도 계류 중에 있다.
반면 미국・유럽・중국 등에서는 개인정보를 보호하면서도 데이터 활용을 장려하기 위해 규제를 지속적으로 정비해 왔다. 비식별 조치 조항이 포함된 개인정보보호법을 개정하여 데이터 활용을 장려하고 있으며, 연구목적의 경우 개인정보 활용이 국내에 비해 보다 원활하다. 생산된 바이오 빅데이터를 보다 가치 있게 활용하기 위해서는 이러한 정보 활용에 따른 법적 제약과 더불어 국민 인식 개선이 우선 해결되어야 한다.
인구고령화, 건강에 대한 국민적 관심과 더불어 최상의 의료서비스를 받고자 하는 국민들의 니즈는 어느 때보다 높으며 IT와 생명과학 융합기술의 발달은 의료 환경을 급격히 변화시키고 있다. 보건의료분야에서 빅데이터를 활용한 인공지능 기술개발, 새로운 의학적 지식의 발굴은 신약창출 등 바이오산업으로 이어지는 중요한 영역으로 기대를 모으고 있다. 그 간 바이오분야 연구개발에 대한 정부투자에도 불구하고 공동으로 활용할 수 있는 데이터는 극히 제한적이어서 데이터 기반 바이오산업이 성장하기 어려웠다. 늦었지만 국가 바이오 빅데이터 사업을 통해 질병진단과 예측, 맞춤의료, 질병・유전자발굴을 통한 타깃발굴 등 다양한 연구가 가능한 바이오 빅데이터가 생산됨은 다행이다.
그러나 데이터 생산과 공유는 국내 바이오산업이 성장할 수 있는 인프라로 그 자체가 모든 것을 해결 해 주지는 못한다. 따라서 데이터 분석에 대한 지원, 의료서비스에 적용하기 위한 툴, AI 기반 서비스플랫폼 구축, 의료기관에서 활용할 수 있도록 데이터 표준화, 모바일기술 등을 활용한 라이프로그정보의 유용성에 대한 연구 등 미래의료를 선도적으로 열어가기 위한 전략적 투자가 함께 이루어져야 한다. 또한 연구개발성과가 의료현장에 진입할 수 있도록 제도 개선도 동반되어야 한다.
바이오 빅데이터에 기반을 둔 정밀의료 기술발전은 질병 예방과 관리의 패러다임을 바꿀 것으로 기대한다. 이에 대한 정부, 학계, 기업을 비롯한 민간이 함께 데이터를 확보・공유하고 연구자들은 이를 활용하여 서비스 기술을 개발하여 국민건강을 증진시키고 나아가 보건의료 산업의 강국으로 성장할 수 있기를 바란다.
특집 2
바이오 빅데이터 산업의 규제 현황과 과제
가. 바이오 빅데이터 산업의 최근 동향
세계 무역질서의 재편을 예고하는 미・중간의 무역전쟁, 미・중・러・일의 패권다툼 격화, 일본의 한국에 대한 화이트리스트(식별된 일부 실체들이 특정 권한, 서비스, 이동, 접근, 인식에 대해 명시적으로 허가하는 목록) 배제 등으로 자유무역의 기조가 흔들리고 있는 위기적 상황이 계속되고 있다. 소재부품산업의 취약성으로 인해 국내총생산(GDP)을 견인했던 반도체산업의 미래가 불안정하고, 조선・철강 등 제조업 전반에 걸쳐 추동력이 약화되고 있다.
2016년 다보스포럼에서 4차 산업에 대한 논의가 본격화 된 이후, 신성장동력을 발굴하기 위한 정부 및 민간 차원의 노력이 가속화되었고, 특히 문재인정부 들어 대통령 직속 ‘4차 산업혁명위원회’를 설치하여 관련 정책들을 보다 중점적으로 추진하고 있다. 4차 산업의 완결판이라고 할 수 있는 빅데이터 기술의 촉진을 위해 과학기술정보통신부・산업통상자원부 등 관련 부처들도 국내 기업들과 미래 기술전망 및 개발 방향 등을 공유하며 제도 개선과 재정지원에 박차를 가하고 있다.
국내 빅데이터 시장은 향후 5년간 연평균 10.9% 성장해 2022년 2조 2,000억 원 규모에 이를 것이라는 전망이 나오고 있고, 일자리 창출효과도 매우 큰 것으로 보고되고 있다.12) 빅데이터는 제조, IT, 금융, 통신 등 광범위한 영역에서 활용되고 있고 바이오산업 분야에서도 미래시대 맞춤형 의료서비스를 개선하는 등 획기적인 기여를 할 것으로 예상된다.
지난 5월 22일, 문재인 대통령은 ‘바이오 헬스 국가비전 선포식’에서 100만 명 국가 바이오 빅데이터 구축 및 연간 4조 원 R&D 투자 등 바이오헬스산업의 기술개발부터 인허가・생산・시장 출시까지 성장 전주기에 걸쳐 혁신 생태계를 조성하기 위한 전방위적인 대책을 발표한 바 있다. 다만, 관련 업계에서는 정책 추진의 기초가 되는 병원의 의료데이터 접근에 대한 규제 완화가 포함되지 않았다며 빅데이터 구축 사업에 대한 부정적인 의견을 제시하기도 한다.13)
우리나라는 국민건강보험공단 등에서 보유한 건강정보는 6조 4,000억여 건, 국내 대형병원 역시 200∼500만 명분의 진료정보를 보유할 만큼 세계 최고 수준의 바이오 빅데이터 구축을 위한 잠재력을 가지고 있지만,14) 이를 산업적으로 활용하려는 시도는 거의 이뤄지지 않았다. 이는 개인정보보호법을 비롯한 관련 법령의 제약적 요소에 연유하는 바가 크다. 개인정보의 보호와 개인정보의 활용을 통한 산업경쟁력 강화라는 이익이 충돌하는 지점에서 합리적 정책대안을 제시하기란 여간 어려운 일이 아니다. 개인정보의 ‘보호’와 ‘활용’에 대한 기업・정부, 시민단체 간의 입장이 팽팽히 맞서고 있는 현 시점에서 바이오 빅데이터 분야의 선진국들이 어떤 규제정책들을 시행하고 있는지, 개인정보보호법을 중심으로 한 국내 규제현황과 특징은 어떠한지, 바이오 중심의 혁신성장을 위한 관련 제도의 방향은 어떻게 설정되어야 하는지를 살펴보는 것은 중요한 의미를 갖는다.
나. 주요국의 규제 현황 및 특징
(1) 미국
미국은 개인정보보호와 관련하여, 공공기관, 금융정보, 의료정보 등에 대해서는 법적 규제를, 그 외의 민간부문에 대해서는 자율규제에 맡기고 있다.15) 따라서 개인의료정보를 보호하기 위한 법률이 따로 제정・시행되고 있으며, 의료분야의 기관이 처리하는 의료정보만이 그 규율대상이다.16)
개인의 의료정보를 보호하기 위해 제정된 최초의 연방법률이 1996년의 의료정보보호법(HIPAA: Health Insurance Portability and Accountability Act)이다. 이에 따라 보건사회복지부(HHS: Department of Health and Human Services)는 2003년부터 의료 프라이버시에 관한 규정(Privacy Rule)을 행정입법의 형식으로 제정・시행하고 있으며, 개인의료정보는 HIPPA의 프라이버시 규칙을 중심으로 관리되고 있다.17)
프라이버시 규칙의 보호대상이 되는 의료정보는 개별적으로 개인을 식별할 수 있는 의료정보(individually identifiable health information)이며,18) 비식별 정보는 보호대상에 포함되지 않는다.19) 위 규칙은 비식별화 방식에 대한 구체적인 내용을 담고 있다는 점에서 우리나라 개인정보보호법, 생명윤리법 등과 차별성이 존재한다.
비식별화 방식에는 ‘전문가 결정 방식(expert determination method)’과 ‘세이프 하버 방식(safe harbor method)’이 있다. 전자는 적절한 지식과 경험을 갖춘 전문가가 정보주체의 식별 위험성이 낮다고 결정할 경우 비식별화된 것으로 인정하는 방식인 반면, 후자는 18가지 식별자(identifier)20)를 제거하고 남은 정보가 그 자체 또는 다른 정보와 결합하여 정보주체를 식별하는데 이용될 수 있다는 점을 적용기관이 실제로 인식하지 못할 경우 비식별화된 것으로 인정하는 방식이다.
미국에서는 정보주체의 동의를 허용 사유의 하나로 보고 있지만,21) 모든 경우에 동의를 얻어야 하는 것은 아니므로 이를 원칙적 사유로 보기는 어렵다. 가령 의료기관의 일상적 업무에 해당하는 진료와 지불, 기관 운영을 위해 개인정보를 이용 또는 제공하는 경우에는 환자의 동의가 필요하지 않지만, 기관 자체에서 필요하다고 자발적으로 동의를 받는 절차를 구성할 수 있다.
또한 정보주체의 동의 없이도 제3자에게 이용・제공이 가능한 사유가 있는데 환자 본인에게 제공하는 경우, 진료, 지불, 기관운영을 위해 필요한 경우, 정보의 이용・제공이 허용될 때 이에 부수하여 이용・제공하는 경우, 환자에게 찬성 또는 반대의 기회를 제공한 경우, 마지막으로 공익을 위한 활동으로서 12가지 우선목적22)에 해당하는 경우이다.23) 연구목적을 위한 개인의료정보의 이용・제공은 기관심사위원회 또는 프라이버시 위원회에서 동의면제 승인을 한 경우에 동의 없이도 가능하다. 이 경우 위원회는 사생활 침해의 위험이 최소화되고, 개인의료정보의 이용과 그에 대한 동의면제 없이는 연구 수행이 현실적으로 불가능한 때에 한하여 동의를 면제할 수 있다.24)
(2) 유럽연합
2018년 5월부터 시행되고 있는 개인정보보호일반규정(GDPR: General Data Protection Regulation)은 민감정보인 바이오정보25)에 대한 정보보호를 매우 중요한 사안으로 보고, 정보보호주체의 보호를 위한 여러 제도를 추가적으로 규정하고 있다. 그 중 제25조(데이터 보호 중심 설계 및 데이터 보호 설정)는 ‘개인정보처리자는 개인정보 처리방법 결정시점 및 처리당시 시점에서 정보 최소화 등 개인정보보호의 원칙을 이행하고 처리에 필요한 안전조치를 포함하기 위해 고안된 가명처리 등 적절한 기술 및 관리 조치를 이행해야 한다’고 규정하고 있다.26)
GDPR에서 최초로 ‘가명화(pseudonymisation)’ 개념이 도입되었지만, 추가적인 다른 정보를 이용하면 여전히 개인을 식별할 수 있는 정보이므로 여전히 개인정보로 개인정보보호에 대한 규제를 받는다.27) 다만 공익을 위한 기록보존, 학문적・역사적 연구, 통계를 목적으로 하는 정보처리는 처음의 수집목적과 다르더라도 정보주체의 동의 없이 가능하다. 다만 이 경우에도 적절한 안전장치를 갖추어야 하는데, 가명화가 그러한 장치의 하나로 예시된 것이다.28)
개인정보가 건강에 관한 정보에 해당하면 민감정보로 분류되어 정보주체의 명시적 동의가 추가로 요구된다.29) 전체적으로 보면 GDPR은 동의의 요건을 강화하였지만, 그 전문에서는 유연한 입장을 보이고 있다. 즉, 연구목적에 대해서는 다소간 ‘광범위한 동의(broad consent)’가 허용되고,30) 민감정보에 대한 서면동의 면제사유도 열거하고 있다. 정보주체 또는 다른 사람의 중요한 이익 보호를 위해 필요한 경우로서 정보주체가 동의를 하는 것이 육체적 또는 법적으로 불가능한 경우,31) 의학적 목적을 위한 민감정보를 처리하는 경우,32) 공중보건 영역에서 공익을 위하며 민감정보를 처리하는 경우,33) 공익을 위한 기록보존, 학문적・역사적 연구, 통계 목적을 위한 경우에는 서면동의 없이 민감정보 처리가 허용된다.34)
최초 개인정보를 수집한 목적과 다른 목적으로 이용하고자 하는 경우 별도의 정보주체의 동의가 필요하지만, 연구목적을 위한 경우에는 그 예외가 인정되어 목적 외 이용에 대한
동의가 실질적으로 면제된다.35) 다만, 위와 같은 목적의 처리를 위해서는 정보주체의 권리와 자유를 보호하기 위한 적절한 안전장치36)를 갖출 것을 요구한다.
(3) 국내 바이오・의료 데이터 관련 규제 현황 및 과제
개인정보보호법을 포함한 다양한 개인정보관련 법령들은 개인정보의 ‘보호’가 주된 입법 목적이므로, 빅데이터 등 개인정보의 수집・이용을 촉진하는 영역과는 충돌할 수밖에 없다. 개인정보의 활용을 통해 얻을 수 있는 개인적・국가적 이익이 현격하게 증가하고 있음에도 개인정보보호에만 집착하여 국가의 성장동력을 저하시키는 것은 바람직하지 않다. 미래사회의 핵심 자원인 데이터 이용의 활성화를 통한 신산업 육성이 범국가적 과제로 대두되고 있는 가운데 안전한 데이터 이용을 위한 법규범 정립이 시급한 상황이다.
차세대 혁신산업으로 각광받고 있는 바이오 빅데이터는 미래시대 맞춤형 의료서비스의 제공, 생명과학과 헬스케어의 융합에 크게 기여할 것으로 보인다. 실제로 IBM 왓슨, 구글, 존슨앤존슨과 같은 글로벌 ICT기업들의 바이오 빅데이터 플랫폼 구축 경쟁은 매우 치열하다. 미국의 경우, 빅데이터 이니셔티브에서 빅데이터 R&D에 2억 달러의 투자계획을 밝힌 바 있고, 국립보건원(NIH)을 중심으로 생물・화학적 데이터 처리기술의 고도화를 통해 바이오・보건의료 최첨단 R&D 분야에서 야심찬 성과를 기획하고 있다. 우리 정부도 ‘4차 산업혁명 주도를 위한 바이오헬스 산업 발전전략’을 발표한 바 있고, 데이터 전문기업과 병원들이 바이오 빅데이터 플랫폼 구축에 시동을 걸었다. 공공・민간 영역의 보건의료 행정과 임상 데이터, 인간 유전체 및 단백질 연구 데이터 등이 하나로 연결되어 빅데이터 분석이 이루어지게 되면, 바이오・의료분야에서 새로운 지식을 창출하여 맞춤형 치료, 바이오 신약 개발 등에 획기적으로 기여하게 될 것이다.
다만 바이오・의료 빅데이터를 분석하여 활용하기 위해서는 무엇보다 민감정보를 처리함에 있어 부딪히는 장애(개인정보 보호주체의 프라이버시 보호)를 극복해야 한다. 또한 동의 원칙과 관련하여 바이오・의료 정보는 개인정보이자 민감정보에 해당하므로, 개인정보처리에 대하여는 정보주체로부터 사전 동의를 받고, 민감정보에 대하여는 별도의 동의를 받아야 하는데 현실적으로 불가능하다는 것이 문제이다. 민감정보가 포함될 수밖에 없는 바이오・의료 빅데이터 분석을 위해서는 사전에 정보주체로부터 동의를 받는 현재의 규제방식(옵트인)37)보다는 제한적이나마 사후적 처리가 가능한 방식(옵트아웃)으로 동의를 받도록 전환할 필요가 있다
바이오・의료 빅데이터 분석에서는 개인정보 최소화 및 목적 명확성의 원칙38)이 적용되기 어려운 면이 있다. 바이오・의료 빅데이터는 수집목적과 다른 처리과정을 통해 통찰력이나 새로운 지식을 얻기 위한 것이기 때문이다. 또한 특정 개인을 식별할 수 있는 정보가 단독 또는 다른 정보와 결합하여 특정 개인을 식별할 수 있거나 개인정보 규범이 적용되고 특정 개인을 식별할 수 없도록 익명처리가 된다면 개인정보 규범의 적용을 받지 않게 되는데, 완전한 익명화는 현실적으로 불가능하다. 또한 바이오・빅데이터 분석에 있어 데이터의 익명화 자체가 빅데이터의 효용가치를 떨어트리는 내재적 한계를 내포한다는 문제점도 있다.
빅데이터 처리에 있어 개인정보보호에 대한 국민의 신뢰가 낮고, 영리 목적의 바이오・의료정보 제공뿐만 아니라 통계나 학술목적의 의료정보 제공에 대해서도 반대하는 경향이 강하다.39) 박근혜정부 당시 ‘개인정보 비식별조치 가이드라인’을 제정하여 사업화를 추진하였으나, 시민단체의 고발 조치로 발목이 잡혀 기술발전과 산업 경쟁력에 제동이 걸린 전례가 있다. 미국과 유럽 등에서와 같이 개인정보보호의 원칙을 보다 융통성 있고 개방적으로 적용하는 입법적 조치는 많은 시사를 준다. 바이오・의료 빅데이터의 활용에 대한 과도한 규제는 정부 주도의 효율적인 데이터 관리시스템의 도입과 함께 입법을 통해 완화될 필요가 있다.
특히 개인정보 침해의 위험성을 낮추기 위한 적절한 안전장치를 강구함과 동시에 연구에 필요한 한도 내에서는 동의 요건을 크게 완화하는 입법적 개선이 요구된다. 바이오 빅데이터 산업의 활성화를 통한 신성장 동력의 확보를 위해서는 개인정보보호법과 생명윤리법 등에 의해 이루어지고 있는 과도한 규제를 완화하고, 관련 법령 간에 논리적・체계적 정합성이 보장될 수 있도록 종합적이고 체계적인 법률 개정작업이 조기에 달성되어야 한다.
특집 3
![]()
바이오 빅데이터 기술 및 수요현장
가. 개요
최근 의료 패러다임이 표준적인 의료 서비스에서 유전체 분석을 활용한 개인 맞춤의료로 전환되고 있다. 2019년 정부는 바이오 헬스산업 혁신전략을 통해 5개 빅데이터(국가 바이오 빅데이터, 데이터 중심병원, 신약 후보물질 빅데이터, 바이오특허 빅데이터, 공공기관 빅데이터) 플랫폼 구축계획을 발표하였다. 빅데이터는 4차 산업혁명의 핵심 분야로 언급되고 있으며, 바이오 빅데이터는 생활 습관, 임상, 약물반응성, 유전체 정보 등 매우 다양한 형태로 나뉜다. 이러한 특징을 가지는 바이오 빅데이터를 효율적으로 생산・수집하고 관리 및 통합・분석하는 것이 바이오 빅데이터의 과제이다. 특히 분석기술은 보건의료에 적용되어 의료 기술 개발, 의료 정책 결정, 의료비용 절감 등 다양한 영역에서 혁신이 기대된다.
나. 바이오 빅테이터 기술현황
(1) 암유전체지도 프로젝트(TCGA: The Cancer Genome Atlas)
2005년부터 미국 국립 암 연구소(National Cancer Institute)와 국립 인간유전체 연구소(National Human Genome Research Institute)의 공동연구로 대규모 암유전체지도 프로젝트를 시작하였으며 1만여 명 이상의 암환자에서 얻어진 약 30개의 암종 샘플을 통해 유전체, 전사체, 후성유전체, 단백체 등의 다중오믹스 분석을 진행하였다. 이를 통하여 암 유발에 관련성이 있는 체세포 돌연변이 정보를 데이터베이스화하였다. 생산된 데이터는 성격에 따라 접근 권한을 차별적으로 부여하는 데이터 분양 시스템을 통해 관리하고

출처: https://cancergenome.nih.gov/abouttcga
[그림 특집-1] TCGA 프로젝트를 통해 생산된 데이터의 규모와 암종 및 참여자, 데이터 타입
있으며, 돌연변이 정보, 유전자 발현량 데이터와 같은 일부 데이터를 공개함으로써 누구나 손쉽게 접근하여 데이터를 확보하고 분석에 활용할 수 있게 하였다. 공개된 데이터는 빅데이터 분석을 통하여 특정 암을 유발하는 돌연변이(driver mutation)들을 다수 밝혀냈을 뿐만 아니라 진단과 예후 예측에 활용될 수 있는 다양한 분자마커들을 확보하는 성과를 얻을 수 있었다.
(2) International Cancer Genome Consortium(ICGC)
TCGA 프로젝트에서 생산된 빅데이터들은 다양한 암 연구에 활용되어 오고 있으며 특히 인공지능을 이용한 암종 예측, 암진단 및 예후 예측, 항암제 반응성 예측 모델 개발 등에 매우 중요한 데이터로 이용되고 있다. 비록 TCGA 프로젝트는 2018년 종료되었지만 이후 국제공동협력연구인 ICGC으로 확대되어 보다 대규모의 암유전체 빅데이터 구축이 진행되고 있다. ICGC 데이터 역시 데이터 공개를 통해 많은 연구자들이 이를 이용한 다양한 연구를 진행하고 있으며 의료 및 제약 기업계에서도 암유전체의 표준 데이터로 활용하고 있다.
(3) Precision Medicine Initiative
2015년 미국 오바마정부는 2억 1,500만 달러를 투자하여 정밀의료 이니셔티브(Precision Medicine Initiative) 사업을 시작하였으며 2018년 미국 국립보건원에서 ‘All of us’라는 명칭으로 정식으로 착수하였다. All of us는 백만 명 이상의 유전체 분석을 목표로 하고 있으며 이를 통해 생산된 대규모 유전체 빅데이터로부터 특정 질병의 원인을 파악하게 될 것으로 기대된다. 또한 환자에 따른 치료의 반응성 데이터를 확보하여 치료의 반응성의 차이를 이해하고 의료 혁신을 가속화하는데 도움을 줄 것으로 전망된다.
출처: https://icgc.org/about-us
[그림 특집-2] ICGC 프로젝트 참여 국가 및 국가별 암종 정보

(4) UK Biobank project
영국은 40∼69세 사이의 성인 50만 명 이상의 유전체 및 표현형 데이터를 수집하는 UK Biobank project를 진행하였으며 개인 건강정보 및 유전체 빅데이터를 활용하여 다양한 질병에 대한 연구를 진행하고 있다. 최근에는 퇴행성관절염과 관련된 52개의 새로운 유전변이를 밝혔으며, 인체의 체지방 분포도가 성별 특이적인 유전 영향에 따라 달라짐을 밝혔다.
(5) 100,000 Genomes Project
2012년 영국 보건부(Genomics England)는 100K 프로젝트(100,000 Genomes Project)를 시작하였다. 100K 프로젝트는 2017년까지 암환자 또는 희귀병을 가진 환자와 가족들을 대상으로 10만 명의 유전체를 분석하여 더 효율적인 치료 및 신약개발 가능성을 확보하기 위한 것이다. 또한 개인 정보를 보호하기 위하여 개인 정보를 고유한 번호로 대체하였고 컨소시엄의 모든 연구자들에게 데이터를 제공하였다.
(6) Clinical Genome Resource
미국 보건복지부 산하 US National Human Genome Research Institute(NHGRI)는 질병에 연관성이 있는 돌연변이와 변이에 따른 치료 반응성과 같은 연구결과들을 데이터베이스화하여 공개하는 것을 목적으로 하고 있다. 이는 환자들의 치료 방법을 결정하기 위한 자료로 사용된다.
다. 바이오 빅테이터 수요현장
TCGA와 ICGC 등에서 생산된 대규모 바이오 빅데이터는 다양한 분야에서 기초 데이터로 활용하고 있다. 바이오 빅데이터는 분석을 통하여 암 발병 원인 및 진행과 중요한 연관성을 가지는 유전자 및 변이 정보들을 이용한 암 진단 상품을 개발하거나 대규모의 임상연계 프로젝트에 활용되고 있다.
(1) 환자 맞춤형 의료 서비스
최근, 유전체 정보를 바탕으로 실제 환자 맞춤형 의학을 시도하는 연구들이 지속적으로 진행되고 있다. 대표적으로 미국의 메모리얼 슬론 케터링 암센터(MSKCC: Memorial Sloan Kettering Cancer Center)에서는 암환자 1만 336명에 대해 400여 개의 잘 알려진 암 연관 유전자들(MSKCC-IMPACT panel)의 코딩영역과 재발 유전자들의 인트론 영역을 선별한 후 타깃 시퀀싱(targeted sequencing)을 진행하여 대규모 암유전자 돌연변이 빅데이터를
확보하였으며 이러한 빅데이터 분석 결과를 바탕으로 환자별 최적 표적 항암제를 처방하는 연구를 활발히 진행하고 있다.
(2) 신약 개발
글로벌 제약회사인 화이자(Pfizer)는 2015년 미국의 게놈 분석업체인 23andMe와 연구 목적의 데이터 제공에 동의한 65만 명의 대규모 데이터를 공유하기로 협의하였다. 이를 통해 화이자는 바이오 빅데이터를 이용해 질환 치료 타깃을 발굴하고 관련 임상시험을 설계하기로 하였다. 또한 글로벌 제약회사 로슈(Roche)의 자회사인 제넨테크(Genetech)도 23andMe의 바이오 빅데이터를 이용하여 파킨슨 치료 타깃을 찾는 연구제휴를 체결하였다.
2018년에는 글락소스미스클라인(GSK) 글로벌 제약회사가 23andMe와 약 3억 달러 규모의 투자 계약을 체결하고 향후 4년간 500만 명 이상의 개인 유전체 정보를 공유하기로 하였다. 이뿐만 아니라 전 세계적으로 이미 많은 제약회사들이 바이오 빅데이터를 활용하여 신약 개발을 추진하고 있다.
라. 바이오 빅테이터 활용을 위한 개선방안
바이오 빅데이터를 활용하기 위해서는 몇 가지 해결해야 할 과제가 있다. 먼저, 양질의 바이오 빅데이터 확보 및 통합관리이다. 지금까지 많은 양의 유전체 데이터가 다양한 정부과제 등을 통해 생산되었으나, 데이터가 분산되어 있고 임상정보 등의 자료 부족으로 인해 바이오 빅데이터로 활용하기에는 다소 미흡하다.
다음은 바이오 빅데이터 생산의 표준화이다. 의료 정보의 경우 의료 데이터의 전달 및 통합을 위하여 국제표준화기구에서 제시한 가이드라인을 따르고 있으며 다양한 표준화 방법들이 개발되고 있다. 하지만 아직 바이오 빅테이터 생산에 관련된 표준화 가이드 라인이 부재한 상황이며, 바이오 빅데이터가 생산되었더라도 개인정보 제공 동의가 되어
있지 않은 바이오 빅데이터는 차후 활용 부분에서 많은 제약이 따른다. 따라서 바이오 빅데이터의 연계적 활용을 위한 표준화 노력과 체계적이고 통합적인 데이터 생산 가이드라인을 세우기 위해 국가 차원의 관심과 지원이 필요하다. 빅데이터 구축 및 활용을 고려한 데이터 생산 체계뿐만 아니라 차후 분석에 필요한 임상정보, 건강검진 정보 등을 함께 확보할 수 있어야 한다.
다음으로는 데이터 생산의 규모이다. 바이오 빅데이터 활용분야 중 하나인 인공지능 연계분야에서 바이오 빅데이터는 차원은 높으나 N수가 부족한(High Dimemsion, Low Sample Size) 데이터로 취급되고 있다. 이를 극복하기 위해 각 선진국 및 글로벌 제약회사들은 대규모의 예산을 투자하여 대형 게놈 사업을 추진하고 있다. 우리나라도 국가 차원의 게놈 사업을 통한 양질의 바이오 빅데이터 구축이 절실하다.
끝으로 바이오 빅데이터의 공유 및 배포이다. 바이오 빅데이터는 차후 활용 목적으로 생산되는 것이 아니기 때문에 현행 법제의 지속적인 개선이 제기되고 있다. 공유 및 배포과정에서 개인 식별 정보가 제거되는 개인정보 비식별화가 이루어지지만, 명확한 가이드라인 부재로 개인정보 유출 사고 위험이 높은 상황이다. 바이오 빅데이터의 공유 및 배포는 공공의 이익실현이라는 긍정적인 효과도 있지만 정보공개에 따른 부작용 역시 심각하게 고려해야 한다.
참고자료
-TACHMAZIDOU, Ioanna, et al. Identification of new therapeutic targets for osteoarthritis through genome-wide analyses of UK Biobank data. Nature Genetics, 2019, 1.
-RASK-ANDERSEN, Mathias, et al. Genome-wide association study of body fat distribution identifies adiposity loci and sex-specific genetic effects. Nature Communications, 2019, 10.1: 339.
-ZEHIR, Ahmet, et al. Mutational landscape of metastatic cancer revealed from prospective clinical sequencing of 10,000 patients. Nature medicine, 2017, 23.6: 703.
제1장 생명공학의 변화와 도전
![]()
|
구분 |
미국 |
유럽 |
|
사회적 이슈 |
트럼프 정부는 미국우선주의를 기치로 미래지향적인 연구보다는 당면한 현안과제 해결 우선 시
|
브렉시트가 가져올 유럽 내 생명공학 분야 이슈들과 파급력 전망 |
|
정책 동향 |
국가 바이오경제 청사진(2012.4)을 수립하고, 범정부 차원의 ‘Lab-to-Market’ 정책을 우선 목표로 추진
|
Horizon 2020을 대체할 새로운 프로그램인 ‘Horizon Europe’을 통하여 집중할 생명공학관련 주요 6개 분야 동향 |
|
기술 및 산업동향 |
연간 예산이 약 40조 원인 NIH뿐만 아니라 NSF, FDA, DOE, DARPA, USDA 등 다양한 부처에서 바이오 관련 정책을 수립하고 연구개발을 지원 미국은 QS 세계 대학순위 상위 5개 대학 중 4개를 보유하여 첨단 연구개발을 이끌고 있고, 과학적 혁신에 크게 의존하는 바이오 특성으로 산학협력이 매우 활발 세계 바이오의약품 시장의 약 40%와 매출액 기준 상위 10대 제약사 중 6개(2017)를 보유하고 있으며, 지난 10년 동안 연구에 5,000억 달러 이상을 투자 |
지속적 성장세인 헬스케어 및 생명공학관련 기술과 산업 동향 및 제약산업을 주요 전략분야로 선택한 유럽연합 |
|
법제도 동향 |
바이돌법, 21세기 치료법, 희귀의약품법 등과 세계 최초의 R&D 세액공제 제도, 친기업적 약가결정체계 등 바이오산업 활성화를 위한 법과 제도를 도입
|
생명공학분야 규제들이 더욱 강화되고 있는 흐름 및 유럽연합 내 법적 제도적 일관성 향상을 위한 변화 없음 |
|
중국 |
일본 |
|
2020년 샤오캉(小康)사회를 실현하기 위해 과학기술기반 ‘국민경제 사회발전 13차 5개년 계획(2016∼2020)’의 목표와 주요내용
|
고령화・저출산에 따른 사회적 문제를 해결하기 위한 비용(사회보장 예산 34.2%) 등을 반영하여 일본정부 예산이 사상 처음으로 100조 엔을 돌파 |
|
뉴 노멀(新常態)시대에 대응하기 위한 13차 5개년 계획에 기반을 둔 중국의 과학기술 혁신정책동향
|
종합과학기술・이노베이션회의, 고도정보통신네트워크사회추진전략본부, 건강・의료전략추진본부, 우주개발전략본부, 종합해양정책본부 등의 정책조정과 전략추진을 위해 내각에 ‘통합이노베이션전략추진회의’를 설치 |
|
13차 5개년 계획에 기반을 둔 바이오 분야 (보건, 농업, 환경/에너지)의 기술과 산업동향
|
‘통합이노베이션전략추진회의’는 2030년에 세계 최첨단의 바이오이코노미사회 실현을 목표로 설정하고, 이를 실현하기 위한 3가지 요소로써 바이오퍼스트 발상, 바이오커뮤니티 형성, 바이오데이터 구동을 제시 |
|
13차 5개년 계획에 따른 의약산업발전계획지침, 중국농업현대화계획 등의 법제도 동향
|
의료분야 연구개발의 활성화를 위해 익명가공의료정보에 관한 법률(차세대의료기반법)을 시행, 인간 수정배아에서 유전정보개변기술 등을 이용한 연구에 관한 윤리지침을 고시 |
제1절
생명공학의 변곡점: 글로벌 트렌드
1. 미국
가. 사회적 이슈
트럼프행정부는 미국 우선주의(America First)를 기치로 미래지향적인 연구보다는 미국 사회가 당면한 현안과제 해결을 우선 시하고 있다. 백악관 과학기술정책실(OSTP)이 발표한 과학기술 정책의 연차별 성과를 보면, 새롭고 혁신적인 의약품 및 치료제 승인, 전염병 연구개발 투자확대, 정밀의료 발전 등이 눈에 띈다. 또한 최근 큰 사회문제로 떠오른 마약성 진통제(Opioid) 남용에 대응하기 위한 노력의 성과를 강조하고 있다.
트럼프정부는 2020년도 연구개발 배분 시 의료혁신, 농업 등 8대 우선지원 분야를 제시(2018.7.31.)하였다. 이 중 의료혁신 분야에서는 정밀의료를 포함한 기초의학 연구, 산업계 관심이 적은 분야, 질병 예방 및 보건 촉진, 기초성과의 사업화 중계연구, 감염병 등 국민건강 위협 대응에 관한 연구, 농업 분야에서는 센서, 데이터 분석, 기계학습 등을
[표 1-1] 트럼프행정부의 바이오 분야 주요 과학기술 성과
|
구분 |
1차(2018.3) |
2차(2019.2) |
|
인공지능 |
∙머신러닝을 환자 건강증진에 활용 |
∙최초의 AI 기반 의료진단기기 승인 |
|
보건의료 |
∙새롭고 혁신적인 의약품・치료제 승인 ∙바이오의료사업 지원 절차 간소화 ∙디지털헬스 제품 감독 절차 간소화 ∙보건 분야 정보기술 활용도 제고 |
∙글로벌 전염병 대응 연구 선도 ∙정밀의료 발전 ∙연구 인프라 지원(NIH STRIDES 등) ∙의료데이터 상호호환성 향상 등 |
|
마약성 진통제 (Opioid) 대응 |
∙연방정부의 약물중독 대응 강화 |
∙마약성 진통제(Opioid) 관련 R&D 지원 확대 |
|
과학적 발견 |
∙노벨상급 연구지원(CRISPR-Cas9 등) |
|
통한 첨단 정밀농업 및 이를 통한 농작물의 양과 질의 향상을 위한 연구, 유전자교정 기술을 통해 개발된 동식물 관련 경쟁전(pre-competitive) 연구에 우선적으로 지원한다고 발표하였다.
나. 정책동향
미국의 바이오 정책은 오바마 정부에서 2012년 4월 수립한 ‘국가 바이오경제 청사진(National Bioeconomy Blueprint)’에 기반을 두고 있다. 이 보고서는 미국이 보유한 자원을 최대한 활용하여 바이오경제의 잠재력을 극대화하기 위한 방안을 제시하였으며, 이를 위해 연구개발 역량 강화, 연구성과의 상업화 촉진, 규제개혁, 인력양성, 그리고 공공-민간 파트너십 촉진 등 5대 전략 목표를 제시하였다. 트럼프 정부에서는 오바마 정부에서부터 이어지고 있는 ‘Lab-to-Market’ 정책을 범정부 차원의 우선 목표로 설정하고, 기술이전 관련 행정・규제 부담 경감 및 민간투자 확대 유인, 연방기관에 적용 가능한 협력모델과 기술이전 기작 개발 및 실행, 기술이전의 효과를 높이기 위해 노력하고 있다.
다. 연방정부 동향
(1) 국립보건원(NIH: National Institutes of Health)
(가) 개요
미국 연방정부의 바이오의료 분야 R&D 예산의 약 90%가 NIH를 통해 집행된다. NIH는 2만 명 이상이 27개의 연구소와 센터에 근무하는 거대 조직으로 2019년 예산은 미국 전체 국민총생산(GDP)의 0.2% 수준인 392억 달러이다. 예산의 80% 이상은 그랜트, 수탁과제의 형태로 외부의 2,500개 이상의 연구주체(대학, 연구소, 병원 등)에서 종사하는 30만 명 이상에게 지원된다. NIH 연구비의 대부분은 새로운 바이오의학 연구를 위한 기초연구에 투자되고, 약 1/3이 보다 응용적 측면이 강한 임상연구에 투자된다.
2018년 주요 분야별 예산을 보면, 임상연구 137억 2,000만 달러, 유전학 90억 8,000만 달러, 예방 85억 7,000만 달러, 신경과학 81억 3,000만 달러, 암 66억 6,000만 달러, 감염병 60억 2,000만 달러, 뇌질환 57억 5,000만 달러, 희귀질환 49억 4,000만 달러, 노화 37억 8,000만 달러 등이다. 또한 2016년 한 해 동안 9,500명 이상의 박사후 과정 학생과 약 5,900명의 박사후 연구원의 교육훈련을 지원하였다. 주요 성과로는 NIH 연구비를 지원받은 노벨상 수상자가 153명이고, 과제를 통해 글리백, 레미케이드, 엠브렐, 아바스틴 등과 같은 블록버스터 신약이 발굴되었다.
(나) 범국가적 이니셔티브 주관
① BRAIN(Brain Research through Advancing Innovative Neurotechnology) Initiative
뇌세포와 신경회로의 상호작용을 통해 뇌 기능을 규명하기 위한 신기술을 개발・응용하고, 뇌와 행동의 복잡한 관계를 규명하는 것을 목표로 2013년 착수된 민관 연구협력 프로젝트이다. 이 사업에는 6개 연방정부기관(NIH, NSF, DARPA, IARPA, FDA)과 재단(뇌・행동연구재단, 시몬스재단), 대학(피츠버그대학), 기업(GE, 구글, GSK, Inscopix), National Photonics Initiative 등이 참여하고 있다. 연방정부는 2017년부터 2026년까지 10년 간 총 15억 달러를 투입할 예정이며, 2019년 예산은 4억 2,900만 달러이다.
② All of Us 연구 프로그램
유전체 정보와 생활습관에 기초한 빅데이터 분석을 통해 질병을 예측하고, 개인 맞춤형 치료를 제공하는 정밀의료를 구현하기 위한 사업으로 2015년에 착수되었다. 이를 위해 100만 명의 건강상태를 10년간 추적 관찰하고, 이를 토대로 유전자, 생활습관, 건강과의 연관성 자료를 구축함으로써 맞춤형 질병 치료와 질병 예방을 목표로 하고 있다. 이 사업에는 5개 연방정부기관(NIH, FDA, ONC, DOD, VA), 빌&멀린다게이츠재단, 브로드연구소, 기업(화이자, 아마존, IBM, 인텔, MS), 병원 등이 참여하고 있다. 연방정부는 2017년부터 2026년까지 10년 동안 총 15억 달러를 지원할 예정이며, 2019년 예산은 3억 7,900만 달러이다.
③ Cancer Moonshot
정부연방기관과 대형 제약사, 보험사, 병원들이 연합하여 암의 예방, 진단, 치료 관련 연구를 수행하여 최종적으로 암을 정복하겠다는 것을 목표로 2016년에 시작되었다. 환자의 면역세포를 이용하여 암세포를 죽인다는 항암면역치료의 원리를 이용한 새로운 항암제를 개발하는 것이 목표이다. 이 사업에는 7개 연방정부기관(NIH, FDA, NCI, DOD, DPA, NASA, CD)을 비롯하여 빌&멀린다게이츠재단, 브로드연구소, 기업(아마존, MS, 우버, 리프트, BMS재단), 병원 등이 참여하고 있다. 연방정부는 2017년부터 2023년까지 7년 동안 총 18억 달러를 투자할 예정이며, 2019년도 예산은 4억 달러이다.
④ Regenerative Medicine Innovation Project
성체줄기세포의 연구와 임상연구를 지원하여 산업화를 촉진하기 위한 사업으로 2017년에 시작되었다. 구체적으로는 NIH와 미국 식품의약국(FDA: Food and Drug Administration)가 참여하여 성체줄기세포의 성장, 분화의 기능을 연구하고, 치료를 촉진하는 생물제제(성장인자, 사이토카인 등)와 성체재료(세포 외 매트릭스, 배지)에 관한 연구를 수행한다. 연방
정부는 2017∼2020년까지 4년 동안 총 3,000만 달러를 투자할 예정이고, 2019년도 예산은 1,000만 달러이다.
(다) 국립첨단중개과학센터(NCATS: National Center for Advancing Translational Sciences)
NIH는 신약개발의 낮은 R&D 생산성 문제를 극복하기 위한 전담조직이 필요하다고 인식하여 2011년에 국립첨단중개과학센터를 설립하였다. NCATS는 중개연구 과정에서 발생하는 시스템적인 병목들을 경감・제거・회피하기 위한 방법, 실험실 연구결과의 임상 연계 프로세스에 집중한다. 또한 대학 및 연구소, 병원, 제약업체 등을 연계하는 협력 플랫폼인 임상 및 번역과학상(CTSA: Clinical and Translational Science Award) 프로그램을 만들어 기초연구 수행(대학・연구소)→임상연구 추진(병원)→신약개발(제약기업)로 이어지는 것을 촉진한다. NIH는 국립첨단중개과학센터로 지정된 병원에 5년 간 약 1,000억 원을 지원한다.
(라) 중소기업 지원 프로그램
다른 10개의 연방정부 기관과 마찬가지로 NIH도 중소기업혁신연구(SBIR: Small Business Innovation Research) 프로그램과 중소기업기술이전(STTR: Small Business Technology Transfer Program) 프로그램을 지원한다. NIH의 중소기업혁신연구 프로그램은 바이오의료 분야에서 혁신적인 기술을 사업화하고자하는 초기 중소기업을 지원하며, 중소기업기술이전 프로그램은 이와 유사하지만 연구기관과의 협력연구 형태로 지원하는 특징을 가지고 있다.
NIH 소속 24개의 연구소(센터)가 참여하고, 2017년에 두 프로그램을 통해 1,520개 회사에 총 10억 달러(SBIR은 8억 6,100만 달러, STTR은 1억 2,100만 달러)를 지원하였다. 2019년에는 중소기업혁신연구에 10억 달러, 중소기업기술이전에 1억 4,100만 달러를 지원할 계획이다. 지원 형태는 특별한 조건이 없는 보조금이나 수탁연구(1단계, 2단계 합 최대 19억 원) 형태이며, 특허와 같은 지식재산권은 스타트업이 소유하고, 성공적 Exit을 하더라도 기술료 등을 정부에 상환할 의무가 없다.
(마) 기술사업화 지원
NIH는 바이오 기술혁신을 촉진하기 위해 혁신가속화센터(NIH NCAI: Centers for Accelerated Innovations)와 평가사업화허브(NIH REACH: Research Evaluation and Commercialization Hubs)를 운영하고 있다. 혁신가속화센터와 평가사업화허브는 연방정부, 대학, 민간부문의 전문성과 자원을 총동원하기 위한 민관 협력사업으로 과학적 발견의 사업화를 촉진하기 위한 중개연구를 가속화하는데 중점을 두고 있다. 혁신가속화센터 프로그램은 국립심장폐혈액연구소(NHLBI: National Heart, Lung, and Blood Institute)가 2013년 9월 착수하였고 보스톤(B-BIC: Boston Biomedical Innovation Center), 오하이오(NCAI-CC: NCAI at Cleveland Clinic), 캘리포니아 지역에 3개의 센터를 운영 중이다. 평가사업화허브 프로그램은 사업화 및 기업운영과 관련된 이슈들을 기초연구 단계에서 미리 고려하고, 기업방식의 go/no-go 마일스톤 관리를 통해 기술이전이나 스타트업 창업을 목표로 한다. 뉴욕(Long Island Bioscience Hub), 캔터키(ExCITE), 미네소타(MNREACH)에 3개의 허브를 운영하고 있다.
(바) Accelerating Medicines Partnership
새로운 치료・진단법을 개발하는데 소요되는 시간과 비용을 절감하기 위한 목표로 2014년 출범한 관민 파트너십이다. 정부에서는 미국국립보건원과 미국식품의약국(FDA), 산업계에서는 12개 기업과(Abbvie, Biogen, BMS, Celgene, GSK, J&J, Lilly, Merck, Pfizer, Sanofi, Verily, Takeda) 다수의 비영리기관이 참여한다. 2014년부터 5년 동안 보건원이 2억 2,600만 달러, 산업계가 7,240억 달러를 투자하며 알츠하이머, 2형 당뇨병, 관절염 등 자가면역질환, 파킨슨 등의 질병을 대상으로 한다.
(사) Common Fund
국가적 차원의 중요 문제 해결을 위해 다수의 산하 기관이 참여하는 범보건원 차원의 연구개발 프로그램으로, 선정기준은 ① 향후 10년 내 생물의학 분야에 막대한 파급효과가 기대되고, ② 5∼10년 내 구체적으로 달성할 목표가 설정되어야 하며 ③ 미션달성에 기여할 수 있는 산하기관 간 협력이 필요하다. ④ 또한 범보건원 차원에서 조정이 필요한 복수의 질병을 포함하여 타기관이 담당할 수 없는 독창성의 보유이다. 2019년 예산은 6억 1,000만 달러로 현재 4D Nucleome, Big Data to Knowledge, Extracellular RNA Communication, Genotype-Tissue Expression(GTEx), Glycoscience 등 20개 프로젝트가 진행 중이다.
(2) 국립보건원 재단(FNIH: Foundation for the National Institutes of Health)
국립보건원 재단은 1996년 미국 의회가 설립한 비영리기관으로 NIH 출신 과학자, 자선가, 부유한 개인으로부터 기부를 받아 바이오의료 연구를 가속화하기 위한 민관 협력사업을 만들고 관리하는 역할을 수행한다. 설립 이후 9,200명의 기부자로부터 10억 달러 이상을 모금하였고, 600개 이상의 연구 프로그램을 만들어 지원해 왔다. 대표적인 사례로 바이오마커를 신속하게 발굴・개발・품질검정을 위한 바이오 마커 컨소시엄(Biomarkers Consortium)을 들 수 있다. 뿐만 아니라, 신진 연구자에 대한 교육훈련을 제공하고 다양한 교육 행사와 심포지엄을 개최하고 있다.
(3) 국립과학재단(NSF)
국립과학재단의 2018년 예산은 77억 7,000만 달러이며, 이 중 바이오 관련 부서인 Biological Sciences(BIO)의 예산은 7억 5,000만 달러이다. 주요 프로그램으로는 NSF 10 Big Ideas 중 하나인 Understanding the Rules of Life(URoL)로 유전자형으로부터 표현형을 예측하기 위한 사업으로 수학, 물리, 컴퓨터공학 등과의 기술융합을 통해 생명의 법칙을 규명하는 연구이다. 2020년 예산(요구)은 3,000만 달러이다. Understanding the Brain(UtB) 사업은 뇌신경과학 분야의 중개연구, 인프라, 교육훈련 지원을 위해 NIH의 BRAIN Initiative와 공동으로 추진하는 사업으로 2019년 예산은 4,556만 달러이고, 2020년 예산으로 4,321만 달러를 신청하였다.
(4) 식품의약국(FDA)
시간이 돈인 기업 입장에서는 임상시험의 기간을 줄이고 빨리 승인을 받아 신약을 출시하는 것이 매우 중요하다. FDA는 희귀의약품, 중증 질병 치료제들의 개발을 촉진하기 위해 승인기간을 단축하는 가속승인(Accelerated Approval), 신속심사(Fast Track), 혁신적 치료제(Breakthrough Therapy), 우선심사(Priority Review) 제도를 도입해 운영하고 있다. 2018년의 경우 59개 품목이 FDA으로부터 신약 승인을 획득하였고, 이 중 24품목이 신속심사(Fast Track), 14품목이 획기적 치료제(Breakthrough therapies), 43품목이 우선심사(Priority Review), 4품목은 가속승인(Accelerated Approval) 지정 약물이었다.
(5) 에너지부(DOE)
2019년 에너지부의 전체 연구개발 예산은 65억 9,000만 달러이다. 에너지부는 산하에 6개 연구 부문 중 바이오와 관련된 Biological and Environmental Research(BER)의 예산은 7억 1,000만 달러이다. 연구영역은 분자생물학의 마이크로 수준에서 생태환경의 매크로 수준까지 다양하며 ① 게놈, 대사, 조절 네트워크 연구 등을 통한 지속가능한 바이오연료 생산을 위한 미생물 및 식물 디자인, ② 대기, 토양, 해양 관련 생물시스템 이해에 관한 연구를 지원하고 있다. 2019년에 유전체 연구에 2억 1,000만 달러, Joint Genome Institute 운영비 7,000만 달러, 환경분자과학연구소에 4,200만 달러를 지원할 예정이다.
(6) 국방첨단연구사업청(DARPA)
국방첨단연구사업청은 국방부 산하의 연구개발 담당 조직으로 국방 분야의 혁신적인 새로운 기술을 개발하는 것을 목표로 하고 있다. 2019년 전체 예산은 34억 달러이다. 7개 부서로 구성되어 있는데 바이오 분야를 담당하는 생물기술국(BTO: Biological Tech- nologies Office)의 예산은 3억 달러 내외이다. 생물기술국은 신경과학, 인간-기계 인터페이스, 감염증, 유전자교정, 합성생물학 등의 분야에 30개 내외의 프로그램을 지원하고 있다.
(7) 보훈청(VA)
보훈청의 2018년 의료 분야 연구개발 예산은 6억 4,000만 달러이다. 외상 후 스트레스 장애(PTSD), 재활, 의수의족, 약물중독 등의 분야를 다루고 있고, 부처의 특성상 퇴역 군인이나 그 가족, 유족에 대한 보건서비스로서의 측면이 강하다. Million Veteran Program(MVP)은 All of Us 연구사업(Precision Medicine Initiative)과 연계된 프로그램으로 2017년 2월 현재 544,000명 이상의 퇴역군인의 유전정보・환경・건강상태 데이터를 모았다. 이러한 대규모 코호트로부터 얻어진 데이터를 바탕으로 미국국립보건원의 국립암연구소(NCI)와 공동연구를 수행하고 있다.
(8) 농무부(USDA)
2018년 농부무의 총 연구개발 예산은 약 33억 달러이다. 주요 연구조직으로 농업연구부(ARS: Agricultural Research Service)와 국립식품농업연구소(NIFA: National Institute of Food and Agriculture)가 있다. 예산은 농업연구부가 13억 4,000만 달러, 국립식품농업연구소가 14억 1,000만 달러이다. NIFA는 농업식품연구사업(Agricultural and Food Research Initiative)을 지원하고 있는데 2018년 예산은 4억 달러이고, 6개 중점분야(식물 건강・생산성, 동물 건강・생산성, 식품 안전・영양, 바이오에너지, 농업기술, 농업경제)를 중심으로 지원하고 있다.
라. 대학 동향
미국은 QS 세계 대학순위(QS World University Rankings) 상위 5개 대학 중 4개(MIT, 스탠퍼드대, 캘리포니아공대, 하버드대)를 보유하고 있다. 2015년 미국 대학은 R&D에 총 688억 달러를 사용하였는데, 바이오 분야는 이 중 68.5%를 차지하였다. 신약개발은 과학적 혁신에 크게 의존하기 때문에 산학 협력이 중요하고, 많은 기업이 대학에 연구를 지원한다. 2017년에 바이오제약기업은 미국 대학에 25억 달러 이상의 연구비를 제공하였는데, 이는 산업계가 대학에 지원한 총 연구비의 60%가 넘는다. 암젠, GSK, 노바티스, 버텍스는 듀크대학에 연구개발과 임상시험을 위한 연구비를, AbbVie는 시카고대학에 암연구 협력을 진행 중이다. 아스텔라스는 휴스턴의 MD앤더슨암센터에 급성 골수성 백혈병 치료를 위해 2,600만 달러를 지원하고 있고, 노바티스는 하버드대학을 비롯한 대학들과 300개 이상의 산학협력을 수행 중이다. 화이자는 캘리포니아대학 샌프란시스코분교에 8,500만 달러 규모의 글로벌치료혁신센터(CTI)를 설치하여 운영 중이다.
마. 산업 동향
미국의 바이오제약 시장 규모는 브랜드 의약품을 기준으로 2018년 1,741억 달러이며, 지난 5년간 연평균 3.9%의 성장률을 보이고 있다. 2015년 의약품・의료기기 생산액은 미국 국내총생산의 거의 4%에 달하는 6,750억 달러이고, 2016년 약 5백만 명의 종업원을 고용하였는데 이 중 직접고용 120만, 간접고용 350만 명이었다. 세계 바이오제약 시장에서 차지하는 비중은 약 40%에 달한다.
지난 20년 동안 미국은 전 세계 바이오헬스 R&D의 80%를 투자하였다. 미국 제약기업은 지난 10년 동안 연구개발에 5,000억 달러 이상을 투자하였고, 350개 이상의 신약이 식품의약국에서 승인되었다. 2000년대 이후 세계에서 가장 많은 신약(NCE)을 개발하였고, 2∼6위 5개국(스위스, 일본, 영국, 독일, 프랑스)의 신약 수를 합한 것보다도 많다. 또한 미국에 본사를 둔 기업이 1997∼2016 동안 출시한 신약은 세계 시장의 42%를 차지하였다. 2017년 매출액 기준 상위 10개 제약사 중 6개가 미국기업이다.
세계적으로 바이오제약 산업은 신약개발의 높은 실패율, 장기의 회임기간, 막대한 소요비용 등의 이유로 R&D 집약도가 높다는 특징을 가지고 있다. 세계적으로 총 매출의 20.4%, 미국에서는 21% 이상을 R&D에 투자한다. 이는 미국 기업 전체의 국내 R&D 투자의 1/4(23%)에 해당한다. 미국 기업의 종업원 1인당 R&D 투자액을 기준으로 할 때 바이오 분야는 제조업 평균보다 10배 이상 높다.
미국 바이오제약 기업의 2/3이 스타트업이라고 추산되는데, 이들은 R&D 집약도가 매우 높은 특징을 갖는다. 평균 바이오기업이 매출(revenue)의 20%를 R&D에 투자하는데 비해 스타트업은 62%를 투자하고, 더욱 중요한 것은 미국에서 승인된 신약의 절반 이상이 소기업들에 의해 개발된다는 것이다.
바. 법・제도 동향
대학과 연구기관이 연방정부의 지원을 받아 수행한 과제에서 창출된 지식재산권을 보유할 수 있도록 한 바이-돌법(Bayh-DoleAct: 특허 및 상표법의 개정안)이 미국 바이오산업 발전에 핵심적인 역할을 하였다. 1980년 통과된 이 법은 연방정부의 위탁을 받아 연구를 수행한 대학, 중소기업, 비영리연구기관이 특허와 같은 형태로 지식재산권을 가질 수 있고, 이 지식재산권을 다시 스타트업, 바이오제약기업과 같은 민간기업에 이전할 수 있도록 하였다.
또 하나의 이정표가 오바마정부에서 채택(2016.12)된 21세기 치료법(21st Century Cures Act)이다. 이 법에 근거하여 미국 정부가 바이오의료 연구의 추진뿐만 아니라 의약품 개발 등을 촉진하기 위한 정책을 수립하고 지원한다. 또한 NIH를 중심으로 BRAIN Initiative(2013년∼), All of Us Research Program(Precision Medicine Initiative에서 명칭변경, 2015년∼), Cancer Moonshot(2016년∼)와 같은 대형 이니셔티브 사업이 진행되고 있다.
또한, 미국은 1983년 희귀의약품법(Orphan Drug Act)을 도입해 공익을 위해 희귀의약품을 생산하는 제약회사에 7년간의 마케팅 독점권을 부여하였고, 1981년에는 세계 최초로 R&D 세액공제 제도를 도입하여 민간부문 연구개발 투자를 촉진하였다. 1986년에는 희귀의약품(20만 명 이하의 미국인이 걸리는 희귀질환 치료약) 개발을 위한 연구개발비에 대한 세액공제제도를 도입하였고, 1992년에는 제약기업이 신약 허가 신청 시 고액의 허가심사 수수료를 받아 더 많은 허가심사 인력을 채용하는 전문의약품 허가 신청자 비용부담법(PDUFA: Prescription Drug User Fee Act) 법안을 채택하였다. 이를 통해 심사시간을 1980년대 중반 30개월 이상에서 오늘날 10개월 미만으로 단축시킬 수 있었다.
미국은 또한 기업이 바이오혁신으로부터 충분한 수익을 얻어 다음 혁신에 재투자 할 수 있도록 허용하는 친기업적인 약가결정체계(drug pricing system)를 가지고 있어, 신약가격이 국내 대비 6배나 비싸다. 2009년도에는 ‘생물의약품의 가격경쟁 및 혁신법(Biologics Price Competition and Innovation ACT of 2009)’을 제정해 바이오의약품에 대해 12년의 자료독점권을 부여(유럽은 10년, 우리나라는 6년)하였는데, 이것은 합성의약품의 5년 기간보다 훨씬 길다.
참고자료
-한국산업기술평가관리원, 미국 정부의 바이오의약 지원 정책, 2017.12.
-QS 세계 대학 랭킹, https://ko.wikipedia.org/wiki/QS_%EC%84%B8%EA%B3%84_%EB%8C%80%ED%95%99_%EB%9E%AD%ED%82%B9
-Information Technology & Innovation Foundation, The Bayh-Dole Act’s Vital Importance to the U.S. Life-Sciences Innovation System, March 2019
-National Science Foundation, FY 2020 Budget Request to Congress, March 18, 2019
-The FY 2020 Budget Request: Life Science Research https://www.aaas.org/news/fy-2020-budget-request-life-science-research
-White House, FY 2020 Administration Research and Development Budget Priorities https://www.whitehouse.gov/wp-content/uploads/2018/07/M-18-22.pdf
-White House, National Biotechnology Blueprint, 2012
-White House, Science & Technology Highlights in the First Year of the Trump Administration, March 2018
-White House, Science & Technology Highlights in the Second Year of the Trump Administration, February 2019
-国立研究開発法人科学技術振興機構 研究開発戦略センター, 研究開発の俯瞰報告書 ライフサイエンス・臨床医学分野, 2019
2. EU
가. 사회적 이슈
(1) 브렉시트의 한시적 연기
2019년 4월 11일 도날드 투스크(Donald Tusk) 유럽이사회 의장은 영국과 유럽연합(EU: European Union)이 브렉시트(영국의 유럽연합 탈퇴)를 2019년 10월 31일까지 연기하기로 합의했다고 공표하였다. 영국 의회 내부의 길고도 혼란스러운 논의는 결론을 내리지 못하고 탈퇴 시한인 2019년 3월 31일을 넘겨 유럽연합에 연기를 요청하였고, 유럽연합은 각 회원국들의 동의를 얻어 연기에 합의하였다. 이번 연기로 인해 브렉시트의 향방은 더욱 미궁 속으로 빠져들 것으로 보인다. 그럼에도 불구하고 브렉시트는 여전히 유럽 전체의 사회, 경제, 정치 등 모든 면에 있어 가장 중요한 이슈이다. 특히 영국이 지금까지 유럽 내 생명과학의 허브였기 때문에 생명과학분야에 있어서 그 영향이 더욱 클 것으로 전망되고 있다.
(2) 브렉시트와 생명공학
유럽 내 생명공학 분야에서 영국이 차지하는 영향력이 큰 탓에 브렉시트가 생명공학 분야에 큰 영향을 미칠 것으로 전망된다. 영국이 중요한 이유로는 첫째, 우수한 연구 환경에 있다. 임상, 전임상 및 헬스케어 관련 연구를 위한 세계 6대 대학 중 4개 대학(케임브리지, 임페리얼컬리지, 옥스포드 및 UCL)이 영국에 기반을 두고 있고 치매 및 항생제 저항성과 같은 세계 공중 보건 문제와 유전체학 같은 새로운 기술 분야의 선두 주자이다.
둘째, 영국정부는 제약 업계를 국가 전략적으로 가장 중요하다고 밝힐 정도로 이 분야의 중요성을 충분히 인식하고 있어 매우 적극적 지원하고 있다. 이를 통해 제약산업 및 바이오테크 관련 회사는 영국정부로부터 정교한 규제 및 IP 보호 시스템의 혜택을 받아 왔다.
셋째, 영국은 자생적으로 조성된 바이오테크 산업 생태계를 가지고 있다. 영국에는 남동부의 MedCity, 영국 북부의NHSA 및 스코틀랜드의 IBioIC 등 전국 각지에 바이오테크 회사 클러스터들이 입지해 있으며, 자연히 유럽 내에서 가장 큰 생명공학 파이프라인을 가지고 있다.
이러한 영국 내 생태계는 유럽 이외의 지역에 있는 회사들과는 몇 가지 비교 우위를 제공한다. 우선, 고용을 위한 법률이 일반적인 경우보다 융통성이 높고 강력하여 우수한 인재를 고용·유지하기 쉽기 때문에 다양한 바이오테크의 전문성 접근에 용이하다. 아울러 IP를 위한 좋은 법적 프레임 워크가 갖추어져 있으며, 공용어가 영어이므로 자연스레 장소 이전의 목적지로써의 영국은 매우 좋은 입지조건을 가지고 있다. 넷째, 런던은 최근 엔터테인먼트 및 관광 명소 등으로 1위를 차지할 정도로 활발하고 국제적으로 인정받는 미디어, 예술 및 문화의 현장이며, 런던의 교통 허브는 전 세계로의 이동을 용이하게 해준다는 장점이 있다.
미국 및 유럽의 다국적 기업들은 유럽연합 진입을 위한 전략 수립과 수행에 있어 유럽경제지역(EEA: European Economic Area) 회원국을 활용할 수 있기 때문에 영국은 입지조건이 훌륭한 국가이며, 실제로 많은 기업들이 영국에 유럽본사 또는 R&D 및 제조 시설을 두고 있다.
이렇게 중요한 역할을 하던 영국이 유럽연합에서 탈퇴하게 될 경우, 생명과학 관련 법규와 자금 조달 및 이민과 무역에 이르기까지 다양한 이슈들이 발생하게 될 것이며, 제약 및 바이오테크 산업 전반에도 영향을 미칠 것으로 예상되어 대응이 필요한 상황이다.
나. 정책동향
(1) Horizon Europe
유럽위원회(European Commission)는 2018년 5월 2일 현 프로그램인 Horizon 2020을 이어갈 Framework 9에 해당하는 새로운 프로그램인 ‘Horizon Europe’이라는 예산안을 발표했다. ‘Horizon Europe’은 Horizon 2020 이후 2021∼2027년까지 유럽연합의 차기 주요 연구자금을 조달할 프로그램으로 1,000억 유로(미화 약 1,200억 달러)를 쓸 계획이다. 이는 기존 Horizon 2020보다 최대 60%까지 증액될 것이란 기대에는 못 미치며, 여기에는 브렉시트로 인해 유럽연합을 탈퇴할 가능성이 높은 영국의 기부금이 포함되어 있지 않다. 이로 인하여 유럽연합 27개국에 분배될 기금에 변동이 있을 것으로 보인다.
유럽위원회의 발표 이후 유력한 학계 및 업계 전문가들의 보고서는 Horizon Europe의 예산을 두 배로 늘릴 것을 촉구해 왔다. 또한 800개 이상의 기관을 대표하는 유럽대학협회(EUA: European University Association)를 포함한 13개 과학 및 고등교육기관에서 1,600억 유로의 예산을 요구하기도 했다. 그러나 2019년 7월 발표된 첫 초안에 따르면 Horizon Europe의 총 예산은 오히려 1,000억 유로에 조금 못 미치는 914억 유로로 책정되어 있다.
(2) Health Cluster
생명공학이 주요한 기여를 하게 될 분야는 Horizon Europe 전체 예산의 절반 이상이 책정된 Global Challenges&Industrial Competitiveness의 6개 주요 분야 중 하나이다.
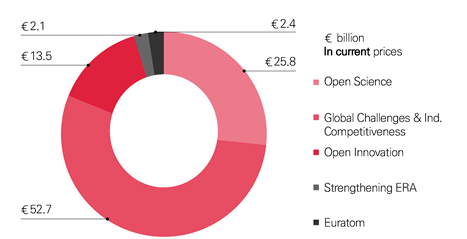
출처: https://ec.europa.eu/commission/publications/research-and-innovation-including-horizon-europe-iter-and-euratom-legal-texts-and-factsheets_en
[그림 1-1] Horizon Europe 프로그램 및 예산(2021∼2027)
(3) 6개 주요 분야
(가) 요람부터 무덤까지 삶 전체를 위한 건강
유아기와 노년기에 있는 사람들, 임산부와 유아들, 청소년들, 장애인 및 부상자 등 건강에 취약한 사람들은 더 나은 진단과 맞춤 솔루션이 필요하다. 예를 들어 노인을 위한 활동적인 삶, 건강 교육 및 디지털 건강 교육 등에 집중한다.
(나) 건강에 영향을 미치는 환경적 및 사회적 요인들
사회・경제・물리적 환경이 우리의 건강에 어떻게 영향을 미치는지, 그리고 건강 위험과 위협을 완화시키는 방법을 더 잘 이해할 필요가 있다. 예를 들어, 화학 물질이나 오염 물질, 환경 스트레스 요인에 의한 건강 위험과 이러한 위험에 노출된 정도에 대한 데이터를 건강 및 질병과 함께 수집・공유・결합하기 위한 역량과 인프라가 요구된다. 또한, 신체적・정신적 건강에 영향을 미치는 환경・직업・사회・행동적 요인에 대한 위험평가와 관리 그리고 의사소통을 통한 건강 증진 및 예방에 집중한다.
(다) 비전염성 희귀 질환
비전염성 희귀 질병은 개인 맞춤형 치료법을 요하기 때문에 여전히 주요한 헬스케어 및 사회적 문제로 남아 있다. 더 빠르고 정확한 진단을 통해 이를 예방하는 검사 프로그램으로 치료법과 완화 치료, 그리고 보다 효과적이고 규모가 큰 의료 개입에 집중한다.
(라) 전염병
전염병과 항생제 내성은 여전히 큰 위협으로 남아있다. 이를 해결하기 위해 감염성 질병의 출현과 재발을 촉진하는 요인을 파악하며 전염병 및 항생제 내성을 일으키는 병원균을 예측하거나 조기발견하고 감시해야 한다. 또한 백신과 진단 및 치료는 물론 응급 대비와 대응 및 복구 조치를 개선 시켜야 한다. 임상 실습과 보건 시스템에서 의료
개입의 이해가 더 요구되며, 저소득 및 중간소득 국가들(LMICs: Low and middle income countries)이 직면하고 있는 여러 문제점들을 해결하기 위해 집중한다.
(마) 건강관리를 위한 도구와 기술 및 디지털 솔루션
새로운 기술은 공중 보건 및 유럽 헬스케어 관련 산업의 경쟁력을 위해 필수적이다. 의학적 증상을 검사하기 위한 도구나 기술, 모바일 및 원격 건강관리 시스템 등 건강을 위한 통합 솔루션들이 개발되어야 한다. 또한 일반적 생활 안에서 용이하게 활용될 수 있는 의료 기술 및 도구들이 시범 운용되고 대규모로 배포될 필요가 있다. 개발과 제조 및 신속한 납품을 위한 혁신적인 프로세스가 개발되어야 하며 안전・효능・품질 및 윤리・사회적 영향 역시 면밀히 검토되어야 한다. 규제 과학에 대한 접근법 고찰이 요구된다.
(바) 건강관리 시스템
보건시스템은 유럽연합 사회시스템의 핵심 자산이다. 이 시스템이 모든 유럽연합 회원국 사람들에게 접근 가능하고 신속히 대응하며 안정적으로 유지됨은 물론 데이터 중심 및 디지털 혁신의 잠재력을 활용할 수 있도록 발전되어야 한다. 이를 위해 공중보건시스템 및 정책들이 개혁되어야 하며, 새로운 건강관리 시스템에 적응할 인력 육성을 위한 새로운 모델이 개발되어야 한다. 또한 건강 기술 평가가 개선되어야 하며, 개인 정보 보호 및 상호 운용성과 관련된 건강데이터 사용이 안전하게 활용될 수 있는 보안시스템 마련이 시급하다. 더 나아가 건강시스템 복원력 및 위기 대처 능력 향상을 위한 혁신이 지속되어야 한다. 환자들이 직접 자체 모니터링을 하는 등의 자발적・적극적 참여는 물론 사용자 중심의 통합치료시스템 개발이 이루어져야 한다.
다. 기술 및 산업동향
(1) 현황
헬스케어와 생명공학 분야에 대한 지출은 전 세계적으로 증가하고 있다. 60개국의 의료비 지출은 지난 5년(2013∼2017)간 연평균 성장률(CAGR) 2.9% 대비 2018∼2022년까지 5.4% 증가할 것으로 예상되며, 헬스케어에 투입되는 국내 총생산(GDP)에서의 전체 비중은 2019년에 10.5%로 예측 된다(World Industry Outlook, Healthcare and Pharmaceuticals, Economic Intelligence Unit, June 2018).
유럽 내에서도 이러한 동향은 이어지는데, 특히 의약품의 주요 수출국인 영국의 의약품 판매량은 매년 5.7% 증가 되었으며, 향후 영국 의약품 판매의 연평균 성장률은 4% 증가
[표 1-2] 유럽 제약산업 동향
Values in €million unless otherwise stated
|
|
2000 |
2010 |
2017 |
2018 |
|
Production |
127,504 |
199,400 |
250,868 |
260,000 (e) |
|
Exports |
90,935 |
276,357 |
396,036 |
410,000 (e) |
|
Imports |
68,841 |
204,824 |
294,632 |
305,000 (e) |
|
Trade balance |
22,094 |
71,533 |
101,404 |
105,000 (e) |
|
R&D expenditure |
17,849 |
27,920 |
35,318 |
36,500 (e) |
|
Employment (units) |
554,186 |
670,088 |
760,795 |
765,000 (e) |
|
R&D employment (units) |
88,397 |
117,035 |
114,655 |
115,000 (e) |
|
Total pharmaceutical market value at ex-factory prices |
89,449 |
153,685 |
208,949 |
220,000 (e) |
|
Payment for pharmaceuticals by statutory health insurance systems(ambulatory care only) |
76,909 |
129,464 |
133,775 |
137,000 (e) |
출처: EFPIAmember associations (official figures)-(e): EFPIA estimate; Eurostat (EU-28trade data 2000∼2018)
할 것으로 예상된다. 치매(특히 알츠하이머병), 파킨슨병, 류마티스, 골다공증 및 대사장애를 비롯한 연령 관련 질병이 증가하고 있으며, 영국의 비만율은 유럽에서 가장 높다. 당뇨병 환자의 수는 2016년 50만 명에서 2025년까지 520만 명에 달할 것으로 예상되며, 암과 순환기 계통의 질병이 여전히 주요 사망 원인이다(Industry Report, Healthcare United Kingdom, Economic Intelligence Unit, 3rd Quarter 2018).
특히 유럽은 연구기반 제약산업이 유럽 경제를 성장세로 회복시킴으로써 세계 경제 무대에서 미래 경쟁력을 확보하는 데 중요한 역할을 할 수 있다고 판단하고 있다. 2018년에 유럽은 R&D에 3억 6,500만 유로를 투자했다. 또한 유럽 제약회사들은 76만 5,000명의 직원을 직접 고용하였으며, 이보다 4배 더 많은 인력을 간접 고용하였다.
(2) 난관
그러나 이 분야는 여러 도전에 직면해 있다. 추가적인 규제와 연구개발 비용의 급상승 외에도 2010년 이후로 유럽의 많은 국가는 정부의 재정 긴축 조치의 영향으로 인해 심각한 타격을 입고 있다. 또한, 브라질과 중국, 인도와 같은 신흥 경제 국가의 시장과 연구 환경이 급속히 성장하면서 유럽의 경제 및 연구 활동이 점진적으로 신흥 경제 국가들로 이전되고 있다. 2014∼2018년 사이 평균 시장 성장률을 살펴보면 유럽연합 시장의 상위 5개국은 5.0%, 미국 시장은 7.8%의 성장세를 보인 반면, 브라질과 중국, 인도 시장은 각각 11.4%, 7.3% 및 11.2%의 성장세를 보이고 있다(IQVIA MIDAS, May 2011). 한편 2018년 북미는 세계 제약 판매의 48.9%를 차지했으며 유럽은 23.2%를 차지했다. 또한 2013∼2018년 기간 동안 출시된 신약 판매량의 65.2%는 미국 시장이었으며 유럽시장(상위 5개 시장)은 17.7%를 차지하였다(IQVIAMIDAS, May 2011).
라. 법・제도 동향
(1) 규제 강화 및 유럽연합 내 일관성 향상
바이오테크 관련 산업은 세계에서 가장 규제가 엄격할 뿐 아니라 세계적・지역적・국가적 수준에서 관련 지침과 규정을 면밀히 탐색하여 준수해야 한다. 최근 지속적인 유럽의 규제 변화는 세계 생명공학 업계에 미치는 파급력이 상당히 클 것으로 전망된다. 의약품 개발 및 감시・감독 프로세스 등에 관한 규제 플랫폼을 강화하고, 유럽연합의 모든 회원국에게 일관성을 유지하는 한편 조화롭게 하기 위해 변화가 진행 중이다. 유럽연합 전역에 걸쳐 새롭고 향상된 유럽연합 법안은 이 분야에 속한 기업들의 조직구조, 거버넌스, 프로세스 및 기술 등에 있어 전반적인 변화를 보이고 있다. 국제표준을 위한 의약품 식별표준(IDMP: Identificationof Medicinal Product)을 시행하여 임상시험에 대한 새로운 규제를 강화하였다.
(2) 의료 기기에 대한 새로운 규제 발동
기존의 의료기기(MDD: Medical Device Directive(93/42/EEC)), 능동이식형의료기기(Active Implantable Medical Devices Directive(90/385/EEC)) 및 체외진단의료기기(In Vitro Diagnostic Device Directive(98/79/EC))의 인증제도를 대체하기 위해 EU Medical Device Regulation(MDR)과 In Vitro Diagnostics Regulation(IVDR)으로 변경되어 2017년 5월에 발효되었다. 이 규정들은 MDR은 3년, IVDR은 5년간의 과도기를 둔다. 스위스는 자국 기업들이 유럽시장과 다른 지역에서 경쟁력을 유지할 수 있도록 이러한 변화를 채택하였다. 이 사업의 핵심 목표 중 하나는 의료기기의 품질과 안전성을 개선하고 유럽연합 내에서 법안을 조화시킴으로써 환자 안전을 향상시키는 것이다. 이는 임상시험 및 성능 테스트에 영향을 미칠 뿐 아니라 제품의 식별 및 추적과 같은 기본적인 측면에도 영향을 미치고 있다.
3. 중국
가. 사회적 이슈
중국은 2016년 3월 중국 발전개혁위원회는 ‘국민경제사회발전 제13차 5개년 계획(2016∼2020)(이하 13.5계획)’을 공식 발표하면서 경제, 사회, 과학기술, 교육 등 전 분야에 대해 2020년까지의 목표를 제시하였다. 중국정부는 13.5계획이 마무리되는 2020년에 모든 국민이 중산층 수준의 생활을 영위하는 샤오캉(小康)사회 실현을 대내외에 천명하였다. 제14차 5개년 계획(2021∼2025)(이하 14.5계획)’은 제13차 5개년 규획의 성과를 토대로 새로운 목표가 도출될 것이다.
네이처(Nature)가 2019년 6월 20일 ‘네이처 Index’ 발표에서 연구기관 가운데 중국과학원(CAS)이 2년 연속 1위를 차지하였고, 국가별 순위에서 미국에 이어 2위를 기록하여 중국이 자연과학 연구성과 도출에 굴기하고 있음을 반증한다.
(1) 13차 5개년 계획(2016∼2020)
13.5계획의 가장 큰 특징은 혁신(創新)을 강조하고 있다.
(가) 13.5계획의 목표
13.5계획의 목표는 경제의 중고속 성장유지, 혁신드라이브 발전효과의 가시화, 발전협력 증가, 생활수준과 질 향상, 국민소양과 사회문명 향상, 생태환경 수준 개선, 각 제도의 성숙과 안착 등 총 7가지로 정리 된다.
[표 1-3] 13차 5개년 계획(13.5계획)의 목표
|
목표 |
세부목표 및 수치 |
|
경제의 중고속 성장유지 |
-GDP 증가율 6.5% 이상 -2020년까지 GDP와 도농주민소득 두 배 이상 상승(2015 대비) |
|
혁신드라이브 발전효과의 가시화 |
-2020년까지 경제성장에서 과학기술이 차지하는 공헌도 60%까지 상승 -혁신형 국가와 인재강국 진입 |
|
발전협력 증가 |
-2020년까지 상주인구 도시화율 60% -80% 이상의 대도시에 고속철도 구축 |
|
생활수준과 질 향상 |
-모든 농촌빈곤층의 빈곤탈피 -도시 낙후지역 주택 개조 2,000만 채 -기대수명 1세 증가 |
|
국민소양과 사회문명 향상 |
-공공문화서비스 시스템 기본 형성 -문화산업을 지주산업으로 양성 |
|
생태환경 수준 개선 |
-단위GDP 에너지소모 15% 감소 -대도시 공기가 깨끗한 날이 80% 이상 될 것 |
|
각 제도의 성숙과 안착 |
-각 기초제도 시스템 기본 형성 -법치정보 기본 형성 |
(나) 13.5계획의 주요내용
13.5계획은 신 농촌 건설과 산업전환 및 업그레이드를 강조한 12.5계획에 비해 전 분야의 혁신을 강조하고 있다. 이와 관련한 13.5계획 주요 내용은 과학기술혁신을 핵심으로 인재발전을 지원하여 과학기술 혁신과 ‘대중창업(大衆創業), 만중혁신(萬衆創新)’의 유기적인 결합 등을 추진하는 혁신드라이브 발전전략을 명시하였다.
(다) 2018년 중국 생명과학분야 10대 성과
2018년 1월 2일, 2018년 ‘중국 생명과학분야 10대 성과’를 발표했다. 해당성과는 중국과학기술협회 생명과학학회 연합회 조직의 22학회에서 추천하고 동종업계 전문가의 선발/심사를 거쳤으며 ‘Cell’, ‘Nature’, ‘Science’에 게재된 논문으로 10대 성과는 다음과 같다.
① 자연면역 응답 및 염증반응에 대한 새로운 조절 메커니즘
② 세계 첫 인공 단일염색체 진핵세포
③ 세계 첫 체세포 복제 원숭이 탄생
④ 모계 인자 Huluwa 유도에 의한 척추동물 배아층 형성
⑤ 중국 피자식물군의 진화 역사 연구
⑥ 뇌의 글루탐산 합성 경로의 학습 기억개선 작용 메커니즘 규명
⑦ 새로운 유전 코딩 신경전달물질 형광탐침 개발
⑧ 영장류 동물 발육 및 수명 조절 핵심 경로 규명
⑨ 포진 바이러스의 조립 및 발병 메커니즘
⑩ 다차원 유전체학 빅데이터 지원에 의한 속발성 교모세포종 정밀치료
나. 정책동향
중국은 현재의 환경을 ‘신창타이(新常態, 뉴노멀1))’로 규정하고 이러한 환경변화로 발생하는 다양한 사회문제를 해결하면서 경제발전을 지속하기 위한 새로운 과학기술정책에 직면하고 있다.
(1) 중국 과학기술정책의 환경변화
중국정부의 과학기술육성은 경제적 목표와 함께 정치적 정당성의 제고도 포함되어 있다. 중국정부의 주도하에 추진되는 과학기술육성은 상당한 성과를 거두고 있다. 중국의 과학기술지표는 지난 20여 년간 크게 향상되었다. 중국정부는 2016년에 ‘13.5계획’과 ‘국가혁신드라이브 발전전략 강요’에서 제시한 것처럼 중국이 안고 있는 제반 한계를 분석하고 극복하기 위한 구체적인 과학기술정책과 행정체계의 변화를 추구하고 있다.
(2) 뉴노멀 시대의 과학기술 혁신정책
중국의 새로운 과학기술정책 방향은 크게 두 가지이다. 첫째, 경제성장을 위해 강력한 ‘혁신드라이브 전략’이 필요함을 인식하고 혁신능력 강화를 적극 추진하고 있다. 이는 3차 산업의 구조변화와 4차 산업에 대한 대비가 필요함을 인식한 결과이다. 2016년 5월 ‘국가혁신 드라이브 발전전략 강요’를 발표하면서 2050년까지 3단계의 구체적인 목표를 설정하고 일사불란하게 추진하고 있다.
(3) 중국의 과학기술 행정체제
중국은 과학기술혁신과 혁신성과를 경제사회 여러 분야에 확산시키기 위해 과학기술 행정체제 변화도 추진하고 있다. ‘국무원 기구 개혁안’이 2018년 3월 13일 제13차 전국인민대표회의 제1차 회의에서 심의되어 1913년 이래 5년 만에 대대적인 부처 통폐합이 추진되었다. 과학기술부는 국가외국전문가국의 기능을 통합한 신규 과학기술부로 3월 19일 전국인민대표회의 제7차 전체 회의에서 결정되었다.
다. 기술 및 산업동향
(1) 보건바이오
중국은 소득이 증가하고 건강에 대한 관심이 높아지면서 보건바이오 분야에 큰 관심과 투자를 하고 있다. 특히 2015년 개똥쑥에서 말라리아 치료제 ‘아르테미시닌(artemisinin)’ 개발 공적으로 노벨의약상을 수상한 중의과학원 투유유 명예교수가 항말라리아 메커니즘연구, 양물내성 형성원인, 치료수단 등 새 성과를 창출하였다. ‘중국제조 20252)’에서 바이오・의약을 중점분야로 지정하였고, 정부가 추진 중인 ‘의료 인프라 정비’와 고령화 진전에 따라 보건바이오분야의 전망은 매우 밝다.
(가) 의약품
중국 의약품시장은 지난 6년간 연평균 성장률 17%의 고속성장을 지속하면서 2015년 약 730억 달러 규모로 2016년 세계 2위 시장으로 성장하였다. 2020년 시장규모가 1,670억 달러에 이를 것으로 전망하고 있다. 2018년 3월 제13차 전국인민대표회의에서 의약분야와 긴밀하게 연결된 국무원기구 개혁안을 발표하였다. 대(大)건강, 인구고령화 및 중대질병 예방에 초점을 맞춘 ‘건강 중국전략’ 추진 및 전 방위위적 및 전체 주기의 건강서비스를 지향하기 위해 국가위생・계획생육위원회를 철폐하고 국가위생건강위원회를 신설, 국가식품약품감독관리총국(CFDA: China Food And Drug Administration)를 철폐하고 국가시장감독관리총국(国家市场监督管理总局)을 신설하였다.
(나) 의료기기
중국의 의료기기 시장은 정부가 추진 중인 ‘의료 인프라 정비’와 고령화 진전에 따른 의료수요 증가로 연간 20% 전후의 성장을 기록하고 있다. 2015년 시장규모는 약 3,080억 위안(약 460억 달러)을 기록하여 미국에 이어 세계 2위 시장으로 성장하였다. 영국 조사기관인 Espicom Healthcare Intelligence에 따르면 중국시장은 향후 2020년까지 연평균 8∼9%의 성장을 예상했다.
(다) 생물자원
나고야의정서에선 생물자원에 관한 이익공유나 의무준수(이하 ABS)를 당사국과의 합의 및 규정에 따르도록 하고 있다. 중국은 생물다양성 세계 8위, 북반구 생물다양성 1위인 국가로 고등식물 30,000여 종(세계의 10%), 척추동물 6,347종(세계의 14%)을 보유하고 있다. 관리조례(안)에 따르면 외국기업 및 개인이 중국 생물유전자원을 이용 시 반드시
중국기업과 합작으로 진행하고 중국 내에서 중국 직원이 실질적인 연구개발 활동에 참여하도록 하는 내용으로 중국은 ABS에 적극적이다.
(2) 농업바이오
중국은 정부수립부터 13.5계획에 이르기까지 식량정책의 수립, 목표, 방법 등이 명확히 제시되고 일관성 있는 정책을 추진하고 있다. 중국정부는 13.5계획이 마무리되는 2020년에 모든 국민이 중산층 수준의 생활을 영위하는 소강사회(小康社會) 실현을 대내외에 제시하였다. 이러한 목표에 걸림돌이 되고 있는 농촌, 농민, 농업의 삼농(三農)문제를 해결하는 것이 중국 지도자들의 공통된 인식이다. 매년 초 중국공산당과 국무원이 공동으로 발표하는 중공중앙1호 문건이 2004년부터 2019년까지 줄곧 삼농문제를 다루고 있어 농업과 식량안보를 국가 최우선 과제로 하고 있다. 2019년 6월 화중농업대학에서 열린 국가863계획 현대농업기술 분야 ‘친환경 슈퍼 벼 새 품종 선택육종’ 중대프로젝트 관련 전문가회의에서 41개 벼 품종이 친환경 슈퍼 벼 인증을 획득하는 등 신품종 분야에서 좋은 성과를 창출하고 있다.
(가) 식량안보
중국 13.5계획 시기는 2020년 소강사회가 완성단계에 들어설 것이고, 농업부문도 새로운 복잡한 형세에 직면하게 될 것이다. 경제 전반의 뉴노멀 진입, 농산물 공급구조의 개혁, 재배업 구조조정, 식량안보 확보, 중요 농산물의 효과적 공급 등이 중요한 이슈로 전개될 전망이다. 중국 농업부는 2016년 중공중앙1호문건의 정신과 13.5계획에 의거하여 ‘전국 재배업 구조조정 계획(2016∼2020)’에서 식량정책을 종합적이고 체계적으로 제시하였다.
2016년 10월 17일 국무원은 ‘전국 농업 현대화 계획(2016∼2020)’을 발표하면서 다음과 같은 9개 사항에 대하여 구체적으로 실행방안을 제시하였다.
[표 1-4] 전국 농업 현대화 계획의 9개 실행방안
1 |
상황을 정확히 인식하고, 발전의 새로운 특징을 파악 |
2 |
이념을 갱신하고, 발전의 새로운 방안을 과학적으로 모색 |
3 |
혁신강농: 농업 발전양식 전환 및 업그레이드를 추진 |
4 |
협조혜농: 농업의 균형적 발전을 모색 |
5 |
녹색흥농: 농업의 지속가능한 발전 수준을 제고 |
6 |
개방조농: 농업 대외협력 확대 |
7 |
공유부농: 민생복지 증진 |
8 |
자원확대: 간옹・혜농・부농정책 강화 |
9 |
책임완수: 계획의 순조로운 실시가 이루어질 수 있도록 할 것 |
이 가운데 3번째 혁신강농(革新强農)을 위한 주요 프로젝트로는
1) 고표준 농경지 개발 프로젝트, 2) 현대 종자산업 개발 프로젝트, 3) 현대농업 과학기술 혁신 프로젝트, 4) 스마트농업 프로젝트, 5) 재배와 사육이 결합된 순환형 농업발전 프로젝트로 나누어 구체적인 실현방안을 포함하고 있다.
(나) 종자산업
종자산업은 농업의 가장 중요한 원천이다. 2016년 2월 국영기업 중국화공집단공사(CHEMCHINA)는 스위스에 본부를 둔 세계 3대 종자회사 신젠타를 4,300억 달러로 인수・합병하여, 중국이 부족하다고 평가받던 종자산업의 원천기술을 다수 확보하였다. 중국이 보유하고 있던 종자의 다양성, 소비시장과 신젠타의 원천기술이 접목됨에 따라 중국은 종자산업 강국으로 성장할 수 있는 계기를 마련하였다. 중국의 종자산업은 향후 우리나라 종자시장에도 큰 영향을 미칠 것으로 전망된다. 중국 종자산업의 규모는 1999년 330억 위안에서 2006년 500억 위안, 2011년 990억 위안, 2015년 1,170억 위안으로 지속적으로 성장하고 있다.
(3) 환경・에너지바이오
중국은 국내 정책상으로도 경제발전 13.5계획을 통해 녹색발전을 천명한 후, 후속계획을 통해 신재생 에너지 개발 등 적극적인 온실가스 감축을 추진하고 있다. ‘에너지발전 13.5계획’을 통해 2020년 에너지 소비총량을 50억 톤 표준석탄 이내로, 석탄 소비총량을 41억 톤 이내로 규제하는 방안을 명시하고 있다.
중국은 개발도상국에서 저탄소 시범 구 10곳, 기후변화 적응 및 감축 프로젝트 100개, 기후변화 대응 인력양성 1,000명의 협력프로젝트를 추진하고 있다. 중국이 대외적으로 추진하는 일대일로(一對一路)3) 전략도 개도국의 자원을 확보하면서 기후변화 대응을 펼치는 것으로 간주된다. 중국과학원도 13.5계획을 기반으로 제시한 저탄소 경제관련 에너지

출처: 중국과학원
[그림 1-2] 저탄소 경제관련 에너지기술 분야
기술 분야의 기술발전의 중장기 전략은 고효율 비화석연료 지상교통기술, 석탄의 청정과 고부가가치 이용기술, 그리드의 안전 및 안정을 위한 주요기술이 2020∼2035년 사이에 완성될 전망이다.
라. 법・제도동향
중국 사회의 인구노령화와 두 자녀 정책 시행 등 사회적, 정책적 요인에 힘입어 바이오의약, 바이오농업, 바이오환경・에너지 등 전반에 걸쳐 필요한 법제도는 13.5계획의 분야별 후속조치에서 구체적으로 제시하고 있다.
‘중국제조2025’에서 바이오의약과 고성능 의료기기를 중점 발전분야로 지원하고, 신약개발 등 과학기술 방면에서도 특별사업을 추진 중으로 제약업계에 대한 정부 지원이 지속될 전망이다. 남방과기대 허젠쿠이 박사가 탄생시킨 에이즈면역 유전자 편집 아기에 대해 중국과학원학부 과학도덕구축위원회는 해당사건에 높은 관심을 가지며 인간배아 유전자 편집의 임상응용을 반대한다고 밝혔다.
2016년 10월 17일 국무원은 ‘전국 농업 현대화 계획(2016∼2020)’을 발표하면서 혁신강농, 책임완수 등 9개 사항에 대하여 구체적으로 실행방안을 제시하였다. 특히 계획의 순조로운 실시가 이루어질 수 있도록 제도개선 등 책임완수를 강조하고 있다.
4. 일본
가. 사회적 이슈
현재 일본의 가장 큰 사회적 이슈는 고령화 및 저출산에 따른 인구감소라고 볼 수 있다. 일본 총무성의 발표에 의하면 2018년 10월 기준으로 생산가능 인구(15∼64세)가 전체인구의 59.7%로 사상 최저이고, 70세 이상 고령자는 20%를 넘었으며, 전체인구도 8년 연속 감소해 1억 2,644만여 명인 것으로 나타났다.4) 특히 일본의 베이비붐세대(단카이세대, 1947∼1949년생) 전원이 2022년부터 후기 고령자(만 75세 이상)가 될 것으로 예측되어 이에 따른 사회적 비용의 급증 등, 여러 가지 문제가 발생하고 있다.5) 금년 4월에 치러진 지방의회선거에서 41개 지자체의 945개 선거구 가운데 27%가 무투표 당선되었고6), 작년 12월에 농업, 어업, 항공업, 숙박업 등 14개 업종의 외국인 노동자를 향후 5년간 최대 34만 5,000명을 받아들이겠다는 출입국관리법 개정안이 통과되었다.7), 2019년도 정부 예산이 고령화에 따른 사회적 비용 증가 등으로 사상 처음으로 100조 엔(사회보장 예산 34.2%)을 돌파하였으며8), 심지어 정부에서는 65세 이상 인구가 전체인구의 30%를 넘는 2035년까지 간병인이 860만 명이 부족할 것으로 예상되어 이를 간병로봇으로 대체한다는 계획을 발표하였다.9)
2018년 9월 20일 아베 총리는 집권당인 자민당 총재선거에서 약 70%의 지지율로 압승하며 총리 3년임에 성공하여 역대 최장수 총리로 되었다.10) 일본 정부는 아베노믹스를 성공적으로 마무리하기 위해 대담한 양적완화와 재정지출 확대라는 앞서 쏘아 올린 두 개의 화살에 이어 이른바 ‘세 번째 화살’로 불리는 성장전략의 정비를 서두르고 있다.11) 그리고 올해 4월 30일 아키히토(明人) 일왕이 즉위 30년을 넘기고 건강 악화의 이유로 퇴위하여 큰아들인 나루히토(德仁) 왕세자가 즉위하였다. 일본의 연호는 2019년 5월 1일 0시를 기해 헤이세이(平成)에서 레이와(令和)로 바뀌면서 10일간 계속되는 연휴가 이어져 결혼, 관광, 기념품 판매 등에 힘입어 특수를 맞고 있다.12)
이외에도 2013년 개정된 고령자고용안전법에는 정년 폐지, 정년 연장, 계약직으로 재고용 등 3가지 중 한 개를 실시하게 되어 있는데, 2018년 기준으로 65세 정년 제도를 실시하는 기업은 전체기업의 99.9%에 달하는 것으로 나타났다.13) 도교올림픽에 맞춰 개정된 건강증진법에 따라 2020년 4월부터 금연법이 전국적으로 시행되어 사무실, 음식점 등의 실내와 학교, 병원, 공공기관 등에서 전면적인 금연이 시행될 예정인데, 다만 100m2 이하 소규모 음식점은 예외로 허용된다.14)
나. 정책동향
(1) 과학기술기본계획
2020년까지는 2016년 과학기술・이노베이션회의(CSTI, Council for Science, Technology and Innovation)를 거쳐 각의에서 결정된 제5기 과학기술기본계획(2016∼2020년)15)이 시행된다. 제5기 과학기술기본계획은 ‘4차 산업혁명’, ‘초스마트사회’, ‘Society 5.0’ 등이 핵심개념으로 되어 있다.
(2) 통합이노베이션전략추진회의
2018년 6월 15일 일본 각의 결정에 따라 종합과학기술・이노베이션회의, 고도정보통신네트워크사회추진전략본부, 지적재산전략본부, 건강・의료전략추진본부, 우주개발전략본부, 종합해양정책본부, 지리공간정보활용추진회의에 대해 횡단적이고 실질적인 정책조정을 도모하는 것과 동시에, 이 전략을 추진하기 위해 내각에 통합이노베이션전략추진회의가 설치되었다.16)
2016년에 시행된 제5기 과학기술기본계획에 따라 매년 과학기술이노베이션종합전략이 수립・시행되어17) 상당한 성과를 거둔 것으로 평가되고 있으나, 전 세계적으로 종래의 연장선이 아닌 파괴적 이노베이션이 진전되고 있으며, 일본의 과학기술 이노베이션 능력이 상대적으로 뒤떨어지는 것으로 판단하고, 이에 대응하기 위한 전략으로써 통합이노베이션전략을 채택하였다.18) ‘통합이노베이션전략 2019’에서 ①Society5.0 사회의 실현, 창업・정부사업의 혁신 추진 ②연구력 강화 ③국제협력 강화 ④최첨단(중요) 분야의 중점적 전략구축 등의 4가지 기준으로 검토하여, 강화해야 할 기반기술 분야로 AI기술, 바이오테크놀로지, 양자기술을 선정하고, 응용분야로는 환경・에너지, 안전・안심, 농업, 기타 중점분야(위성데이터, 해양데이터 활용, 우주벤처지원, 해양 플라스틱 쓰레기 대책)를 채택하였다.19)
(3) 미래투자전략 2018
2018년 6월 일본경제재생본부 산하의 미래투자회의에서 ‘Society 5.0’‘데이터구동사회’로의 변혁이라는 소제목을 붙인 ‘미래투자전략 2018’을 발표하였다.20) 디지털혁명, 데이터・인재의 쟁탈전, 데이터 패권주의 강화라는 전 세계 흐름을 근거로, 풍부한 연구 인력과 고령화, 에너지 빈약 등의 사회적 과제 직면, 현장의 풍부한 실데이터 보유, 인구감소로 인해 AI나 로봇시스템 도입이 쉽다는 점 등을 일본이 가진 장점으로 보고, ‘Society 5.0’의 실현을 위한 전략적 조치와 ①생활, 산업 ②경제 활동의 양 ③행정, 인프라 ④지역, 커뮤니티, 중소기업 ⑤인재를 변화시킨다는 목표를 제시하였다(아래 그림 참조).
중점분야와 플래그쉽 프로젝트로는 차세대 모빌리티 시스템의 구축, 차세대 헬스케어 시스템 구축, 에너지전환・탈탄소화를 위한 이노베이션, 전자정부의 추진, 농림수산업의 스마트화, 중소・소규모사업자의 생산성 혁명의 새로운 강화 등을 제시하고 있다. 이들 혁신사업이 성공적인 성과를 거두기 위해서는 데이터 구동형 사회의 공통 인프라의 정비(기반시스템・기술에 투자 촉진, AI시대에 대응한 인재육성과 최적 활용, 이노베이션을 창출하는 대학개혁과 산학관 연대)와 대담한 규제・제도의 개혁(샌드박스제도의 활용과 종단적 규제로부터의 전환, 플랫폼형 비즈니스의 대두에 대응한 법규의 정비, 경제사회구조의 변화에 대응한 경쟁정책의 기본방향 검토) 등이 병행되어야 할 사항으로 보고 있다.

출처: 「미래투자전략 2018(안) 개요, 내각부 일본경제재생본부, 2017.06.09.(http://www.kantei.go.jp/jp/singi/keizaisaisei/miraitoshikaigi/dai18/siryou3-1.pdf)
[그림 1-3] 미래투자전략 2018 개요
다. 기술 및 산업동향
(1) 노벨상 수상
2018년 10월 1일 미국 텍사스주립대 제임스 앨리슨 교수와 혼조 다스쿠(本庶 佑) 일본 교토대 의대 명예교수를 차세대 항암제인 ‘면역관문억제제’의 원리를 발견한 업적으로 노벨 생리의학상 수상자로 선정하였다.21) 2년 만에 노벨과학상 수상자를 다시 배출함으로써 23명의 일본인 노벨과학상 수상자를 가진 일본은 과학기술 강국임을 알리게 되었다.
전문가들은 일본이 유독 노벨과학상 수상자를 많이 배출하는 주요 원인으로 기초과학에 대한 집중적인 투자와 오랜 기간 연구에 몰입할 수 있는 연구 환경을 들고 있다.22) “일본 기초과학 분야의 젊은이들이 힘을 얻기 바란다.”, “불가능은 없으니 반드시 길이 있다는 생각으로 연구를 해 왔다.”, “시대를 바꾸는 연구를 하려면 호기심, 용기, 도전, 확신, 집중, 지속이 필요하다.”, “과학은 다수결이 아니다. 기존 개념을 깨뜨리는 소수파 속에서 새로운 성과가 나온다.”라고 혼조 교수는 기초연구의 중요성을 강조하였다. 일본이 2014년부터 연속 3년간 노벨과학상을 수상하고 또다시 2년 만에 다시 노벨과학상을 받은 것은 일본 기초과학의 수준이 높다는 것을 느낄 수 있다.
또한, 2018년 1월에 일본 NHK 뉴스에 의하면 다이이치(第一) 생명보험회사가 2017년 7∼9월 사이에 전국의 초등학교 6학년까지를 대상으로 실시한 희망직업 설문조사에서 남자 아이들은 ‘학자・박사’를 1위로 선택하였다. 다이이치생명은 1989년부터 매년 설문조사를 실시해 왔는데, 학자・박사가 1위가 된 것은 2003년 이후 15년만 이다.23) 이는 일본인의 노벨상과학상 수상 등이 영향을 미친 것으로 보고 있다.
(2) 과학기술동향
① 과학기술예측조사
일본 문부과학성 과학기술・학술심의회의 발표에 의하면, 과학기술기본법에 의해 과학기술이노베이션 전략・정책 입안을 위한 근거를 제공하고 미래사회나 과학기술이노베이션을 논의하기 위해 5년마다 과학기술예측조사를 실시하고 있는데, 11회 과학기술예측조사를 위해 작년에 미래사회의 비전을 도출하였고 올해 전문가 델파이조사를 거쳐 연말에 완료할 예정이다.24) 조사대상 분야는 ①건강・의료・생명과학 ②농림수산・식품・생명공학 ③환경・자원・에너지 ④ICT・어넬리틱스・서비스 ⑤머티리얼・디바이스・프로세스 ⑥도시・건축・토목・교통 ⑦우주・해양・지구・과학기반 등이다.


출처: 과학기술예측조사에 대하여, 문부과학성 과학기술・학술심의회-종합정책특별위원회( 제23회)(http://www.mext.go.jp/kaigisiryo/2018/12/__icsFiles/afieldfile/2018/12/20/1411791_02.pdf)
[그림 1-4] 11회 과학기술예측조사 대상분야
② 바이오전략 2019
2018년 6월에 설치된 통합이노베이션전략추진회의는 7월 27일 1차 회의를 시작으로 2019년 6월 11일 5차 회의까지 개최되었다. 2018년 12월 14일에 개최된 3차 회의에서 향후 이노베이션을 추진할 중요분야로 AI, 바이오, 광・양자를 결정하였으며25), 2019년 3월 29일에 개최된 4차 회의에서 AI전략이 확정되었다. ‘바이오전략 2019’는 2019년 2월부터 전문가 자문회의를 시작하여 3차례의 회의를 거쳐 6월에 개최된 5차 통합이노베이션전략추진회의에서 확정되었다.26)
‘바이오전략 2019’에서 전체 목표를 ‘2030년에 세계 최첨단의 바이오이코노미사회를 실현’으로 설정하고, 이를 실현하기 위한 3가지 요소로서 바이오퍼스트 발상, 바이오커뮤니티 형성, 바이오데이터 구동으로 제시하였다. 그리고 전략목표를 달성하기 위한 기본방침으로는 시장영역 설정・백캐스팅・계속적인 책무, 바이오와 디지털의 융합, 국제거점화・지역네트워크화・투자촉진, 국제 전략의 강화, 윤리적・법적・사회적 문제에 대한 대응 등, 5가지를 들었다. 또한, 구체적인 조치사항으로는 ①바이오와 디지털 융합을 위한 데이터기반의 정비 ②세계의 인재・투자를 유치하는 국제거점의 형성 ③지역에서 실증・연구와 네트워크화 ④창업・투자환경의 강화 ⑤규제・공공조달・표준의 활용 ⑥연구개발・인재육성의 강화 ⑦지적재산・유전자자원의 확보 ⑧국제 전략의 강화 ⑨윤리적・법적・사회적 문제(ELSI)에 대응 등, 9가지를 제시하였다.
보고서의 결론 부분에서 바이오전략은 적어도 2030년까지 팔로업을 계속 실시, 통합이노베이션전략추진회의 틀을 근거로 한 테스크포스 및 바이오전략전문가회의 상설화27), 건강・의료전략과 바이오전략의 연계 추진, 국내외 상황분석을 바탕으로 전략의 구체화・팔로업을 산학연 합동으로 실시28), 2019년도 내에 바이오전략에 근거하여 시장영역마다 로드맵을 채택29), 바이오분야의 사업화・연구개발을 위해 관계부처가 장기간, 안정적, 유기적으로 연계하여 추진하기 위한 시스템을 검토(기존 사업의 재구축도 포함), 자금배분기관 등에서 바이오분야의 평가, 검증이 가능한 체제 정비를 촉진 등, 통합이노베이션전략추진회의의 사령탑 기능 강화를 제언하고 있다.
③ 문샷형(Moonshot) 연구개발
2018년 6월에 종합과학기술이노베이션회의에서 문샷형 연구의 추진에 대해, 12월에는 문샷형 연구개발제도의 기본방향이 의결되었다. 이는 2013년부터 5년간 한시적으로 시행된 혁신적 연구개발추진 프로그램(ImPACT, Impulsing Paradigm Change through Disrupytive Technology Program)의 종료를 앞두고 대체 프로그램으로 새롭게 구상한 것이 문샷형 연구개발제도라고 볼 수 있다.
문샷형 연구개발제도는 일본발 파괴적 이노베이션의 창출을 목표로 과학기술・이노베이션회의 산하에 관련 부처가 합동으로 추진하는 새로운 연구개발제도로서, 종래의 국가 프로그램에서는 다루어지지 않았던 하이리스크・하이임팩트인 연구개발을 대상으로 하며30), 문샷형 연구개발을 위한 재원은 2018년 1,000억 엔(문부과학성 800억 엔, 경제산업성 200억 엔), 2019년 20억 엔(문부과학성 16억 엔, 경제산업성 4억 엔)을 반영시켰다. 2019년 3월 15일에 전국민 대상으로 문샷형 제안・아이디어를 공모하였으며, 이후에 문샷형 연구개발에 대한 비저너리회의가 계속되고 있다.
④ 일본 2019년 바이오 관련 예산
올해 일본 정부 예산이 처음으로 100조 엔을 넘었는데, 이 중에서 바이오 관련 예산은 2,235억 1,900만엔(약 2.4조원)으로 전년 대비 19.2%가 증액되었다.31) 문부과학성의 2019년 예산 요구액은 약 1,008억 엔으로 유전자치료・유전자편집, 뇌과학연구 등에 79억 엔, 후생노동성은 일본의료연구개발기구(AMED) 지원과 의료계 벤처육성지원 등에 약 620억 엔을 투자하는 것으로 나타났다. 그리고 경제산업성과 농림수산성, 환경성은 의료기기사업의 대형화와 스마트농업 및 게놈편집기술을 활용한 작물 품종 개량연구 지원, 석유 유래 플라스틱을 바이오매스 플라스틱으로 대체하기 위한 사업 등에 각각 약 220억 엔, 23억 엔, 10억 엔을 편성하였다.
일본판 NIH를 표방하고 의료분야 기초연구 성과의 실용화 촉진을 위한 사령탑으로 2015년 4월에 설립된 국립연구개발법인 일본의료연구개발기구(AMED: Japan Agency for Medical Research and Development, “에이메드”)의 2019년 예산은 1,515억 엔으로 전년 대비 19.7%가 증가하였다.32) 주요연구 분야는 ①의약품 창출 ②의료기기개발 ③혁신적인 의료기술창출거점 정비 ④재생의료 ⑤맞춤형 게놈의료 ⑥암 ⑦정신·신경질환 ⑧신종・재발 감염병 ⑨난치질환 등이다.
[표 1-5] 일본 의료분야 연구개발 관련 예산 요구액(단위: 억 엔)
|
|
2018년도 개산요구 |
2018년도 예산 |
2019년도 개산요구 |
|
일본의료연구개발기구(AMED) 대상 경비 |
1,483 |
1,266 |
1,515 |
|
문부과학성 |
703 |
601 |
721 |
|
후생노동성 |
556 |
475 |
564 |
|
경제산업성 |
217 |
183 |
223 |
|
총무성 |
|
4 |
7 |
|
인하우스연구 기관경비 |
841 |
759 |
826 |
|
문부과학성 |
306 |
260 |
304 |
|
후생노동성 |
450 |
414 |
437 |
|
경제산업성 |
85 |
85 |
85 |
출처: 일본 정부의 2019년 바이오분야 예산 현황, BioINwatch, 생명공학정책센터(https://www.bioin.or.kr/board.do?num=287850&cmd=view&bid=issue)
(3) 바이오산업동향
일경바이오연감에 의하면 2018년 일본 바이오산업(바이오제품・서비스)의 시장규모는 2017년에 대비 3.7.1% 증가한 3조 6,725억 엔으로 추정하고 있다. 이 중에서 유전자재조합 단백질, 백신 등의 생물학적 제제, 재생의료제품, 핵산의학 등을 포함한 ‘바이오테크놀로지 이용제품’의 시장은 2017년에 비해 4.2% 증가한 2조 9,711억 엔으로 추정하였으며, 바이오테크놀로지 이용제품을 제외한 ‘기타 바이오 관련제품’의 시장은 1.6% 증가한 7,014억 엔으로 집계하였다.33)
일본 바이오인더스트리협회(JBA: Japan Bioindustry Association)에서는 2015년까지 바이오벤처 통계・동향조사보고서를 발간하였으나 그 이후에는 발간하지 않았다. 최근 바이오 분야가 디지털헬스나 의료기기 등의 분야로 확대되고 있어 금년 상반기에 바이오 관련 벤처에 대해 실태조사를 실시하였다.34) 2019년 4월 기준으로 파악된 일본 내의 바이오 관련 벤처기업 2,010개사였으며, 전체의 60%가 헬스케어 관련(신약개발 및 디지털헬스) 벤처기업으로 나타났다. 수탁시험・제조, 시약・실험기기제조 등의 연구지원 분야의 벤처기업은 전체의 20%를 차지하고 있었다.
그리고 바이오 관련 벤처기업의 설립 시기는 5년 이내(2014년 이후)가 3분의 1 이상이었다. 사업 내용별로 보면, 디지털헬스 분야는 5년 이내에 설립된 기업이 60%에 달해 최근 이 분야에서 창업이 활성화되고 있는 것으로 나타났다. 이 밖에도, 5년 이내 설립된 벤처기업이 전체 평균보다 많은 분야는 진단・검사수탁(특히 질환 리스크, 체질, 장내환경, 멘탈검사 등이 포함된 본인 부담 건강검사 분야), 농림수산업・수의학분야(특히 농업분야) 및 신약개발 분야인 것으로 조사되었다. 특히, 바이오분야의 벤처기업은 학계 유래 벤처기업이 약 40%에 달했으며, 이들의 60%가 신약개발 분야였다. 바이오분야의 벤처 창업이 왕성한 데 비해 상장된 벤처기업수가 3%에도 미치지 못하는 것으로 이번 조사에서 밝혀졌다. 이는 여러 보고서에서 이미 지적하고 있는 것처럼 일본 벤처기업의 투자환경이 해외에 비해 좋지 않은 것으로 해석되고 있다.
라. 법・제도동향
아베정부는 Society5.0의 성공적 달성을 위해 2016년 9월 기존의 규제개혁 관련 회의를 통합하여 총리 직속으로 3년 한시적인 규제개혁추진회를 설치하였다. 2019년 6월 6일에 발표된 ‘규제개혁 추진에 관한 보고서’는 이 조치에 대한 아베 총리의 답변서로서, 약 3년간 추진해온 규제개혁 항목에 대한 심의결과와 주요 실적 등이 포함되어 있다.35)
의료・간병 분야의 규제개혁의 추진사례로는 ①의료분야에서의 데이터 활용 촉진(개개인이 스스로의 건강검진정보를 활용하기 위한 환경정비, 데이터 활용을 위한 표준규격의 확립, 데이터를 활용한 최적 의료서비스 제공을 위한 포괄적인 환경정비, 병명을 포함한 의학용어의 통일, 지역의료 제휴 네트워크에서의 환자정보 공유 시 동의의 기본방향, 건강・의료・간병 관련 빅데이터의 민간 개방, 환자 본인에 의한 진료 및 치료기록 등의 개인정보 본인 청구의 기본방향) ②환자에 의한 의약품정보 접속 개선 ③기능성표시식품제도의 운용 개선(기능성표시식품에 대한 법집행 방침의 명확화, 기능성표시식품 제도의 운용권 협력 강화) ④일본의료연구개발기구(AMED)의 연구개발에 관련된 각종 절차의 소화 ⑤건강보험 진료수가지불기금에 관한 재검토 ⑥중점적으로 추적해야 할 조치(온라인의료의 보급 촉진, 건강보험 진료수가지불기금에 관한 재검토, 의약품의료기기종합기구(PMDA: Pharmaceuticals and Medical Devices Agency)의 행정절차 간소화, 환자신고요양제도의 보급, 기능성표시식품제도 등의 재검토, 간병보험의 서비스 유연화 실현 등을 예시로 들고 있다.
의료분야의 연구개발 활성화를 위한 익명가공의료정보에 관한 법률(약칭; 차세대의료기반법)의 시행령 및 시행규칙(내각부・문부과학성・후생노동성・경제산업성 공동 법령)이 2018년 5월 11일에 시행되었다.36) 이 법은 개인의 권리 및 이익을 보호하면서 익명으로 가공된 의료정보를 적정하게 활용할 수 있도록, 고도의 정보보안이 확보된 정보시스템을 마련하는 것과 동시에 의료기관 등의 의료정보취급사업자는 사전에 본인에게 통지하여 본인이 제공을 거부하지 않는 경우, 익명으로 가공하여 의료분야의 연구개발용으로 제공하다는 취지이다. 의료정보에는 병원, 보건소, 약국 등의 정보 외에, 보험자의 각종 건강진단 데이터 등이 포함된다. 수집된 의료정보를 활용함으로써 최적의 의료 제공, 의약품・의료기기의 연구개발이나 안전대책의 향상, 빅데이터를 활용한 인공지능에 의한 진료지원서비스나 과학적 근거에 기초하여 각 개인에게 최적의 건강관리를 제공하는 등, 새로운 헬스케어 서비스를 포함한 신산업을 창출할 수 있을 것으로 기대하고 있다.
일본 문부과학성과 후생노동성은 종합과학기술・이노베이션회의에서 발표한 인간 수정배아의 취급에 관한 기본개념에 관한 보고서를 바탕으로 대국민 등의 의견을 수렴하여, ‘인간 수정배아에서 유전정보 개변기술 등을 이용한 연구에 관한 윤리지침’을 2019년 4월 1일 관보에 고시하였다.37) 이 지침은 생물의 유전자를 원하는 대로 쉽게 개변시킬 수 있는 게놈편집기술에 의해 생식보조의료 등의 근본적인 치료법이 개발되어 질환의 치료에 기여할 가능성이 있으나, 인간 수정배아의 발생 초기 및 발육 등에 관해 아직 해명되지 않은 부분이 많고, 게놈편집기술에 의해 다음 세대에 유전적인 영향을 미칠 수도 있어, 적절한 연구를 실시하기 위한 시스템의 구축이라는 관점에서 검토된 것이다. 연구요건을 생식보조의료 향상을 위한 기초연구에 한정하고 수정배아의 취급에 관해서는 생식보조의료 과정에서 사용되지 않게 된 인간 수정배아(잉여배아) 및 원시선조(primitive streak) 출현까지(최장 14일간)로 한정하였다. 그리고 인간 수정배아의 태내 이식에 대해서는 게놈편집 등을 실시한 인간 수정배아를 사람이나 동물의 태반에 이식하는 것을 금지하였고, 연구계획은 연구기관과 국가의 2단계 심사에서 지침에 의거 연구계획의 적합성을 확인토록 했다.
올해 3월 18일 일본 후생노동성의 약사・식품위생심의회에서 게놈편집기술을 사용해 품종을 개량한 농수산물이 많아져 안전성 심사를 하지 않고 국가에 신고하는 것만으로도 식품으로 판매해도 좋다는 보고서를 발표하였다.38) 2013년에 DNA 절단효소인 CRISPR/ Cas9이 개발되어 응용할 수 있는 분야나 가능성이 확대되었다. 종래에는 유전자재조합기술을 이용해 다른 생물의 유전자를 옥수수나 대두 등의 농작물에 집어넣어 농약이나 해충에 강한 품종을 만들어 왔다. 최근, 게놈편집기술을 이용해 품종을 개량시킨 농산물이 개발되어 식품 등으로서 유통될 수 있을 단계에 접어들고 있다. 게놈편집기술은 도입 유전자가 잔류하지 않아 식품위생법상의 유전자재조합기술에 해당되지 않을 가능성이 있어 이의 취급에 대해 논의가 시작되었다. 또한, 이 보고서에서 관련 기술이 특정 기준을 충족하는 한 안전성 평가를 하지 않고 유전자편집 식품을 소비자에게 판매할 수 있도록 허용하고, 가축이나 수산물과 농작물을 포함해 목표 유전자를 제거하는 방법은 규제대상에서 제외하며, 일본 국내 제품 및 수입 제품에 모두 동일하게 적용할 예정이다.
제2절
생명공학의 도전과 노력
1. 우리나라 바이오 육성을 위한 노력
가. 트렌드 변화 및 국내 주요 이슈
바이오는 헬스케어뿐만 아니라 에너지・자원・환경까지 광범위한 영역을 포괄하며, 신기술과 융합하여 제조・서비스업에까지 이르는 융복합 산업이다. 또한 2025년 바이오산업은 글로벌 시장규모가 14조 4,000억 원으로 전망되는, 높은 성장성과 고용 창출력을 가진 신산업이다. 우리나라는 세계 최고 수준의 ICT, 의・약학 인프라 보유와 함께 바이오산업에 가장 집중39)되는 등의 붐이 조성되고 있다.
최근 4차 산업혁명과 함께 이런 광범위한 분야를 포괄하는 바이오산업 기반의 바이오경제 시대가 왔으며, 바이오기술(BT)과 정보통신(ICT) 융합을 시작으로 모든 산업 영역의 경계가 허물어질 것으로 전망하고 있다. 4차 산업혁명은 기계보다는 바이오가, 효율성보다는 회복성과 생명성에 기반을 둔 바이오 분야의 폭발적인 변화가 예상되는 생태혁명이며, 바이오와 디지털의 융합이 바로 그 핵심 열쇠이다.
이를 대비하기 위하여 우리나라는 갈수록 방대해지는 바이오 빅데이터를 효율적으로 관리하고 활용할 수 있도록 인공지능의 적용방안을 모색하고, 바이오 신기술의 활용을 뒷받침할 수 있는 제도개선과 교육이 필요하며, 이를 통해 4차 산업혁명에 대응해야 한다고 입을 모으고 있다.
그리고 ’NGS, 유전자가위, DNA 합성’의 3대 기술혁신으로 합성생물학40)이 본격적으로 진화하고 있으며 학문적인 가능성을 넘어 실용화 단계로 나아가고 있다. 이를 통해 세포치료제, 유전자치료제, 면역치료제 분야 등으로 적용범위가 확대될 것으로 전망된다. 또한 사람 몸속에 있는 미생물과 이들의 유전체 정보를 의미하는 마이크로바이옴41)은 미생물이 사람의 신진대사와 면역조절 등 다양한 활동에 관여하는 것으로 밝혀지면서 현재 세계적으로 주목받고 있는 연구 분야로 꼽히고 있다. 국내에서도 ‘제2의 게놈’이라 불리는 마이크로바이옴으로 질병치료・신약개발이 본격화 되고 있다.
또한 AI를 활용한 신약개발은 글로벌 헬스케어 산업의 핵심분야로 부상하고 있다. 이러한 대응을 위해 과기정통부는 AI와 빅데이터를 활용한 신약개발을 촉진하기 위해 4대 선도분야(후보물질 발굴, 임상시험, 스마트 약물감시, 약물 재창출)를 지원하는 전략을 수립하였고, 복지부는 인공지능 신약개발지원센터를 열어 제약사와 AI기업을 연결해 실제 현장에 필요한 협력과제를 추진하고 있다.
이러한 국내 트렌드 변화에 맞춰 우리 정부의 연구개발 투자도 ‘융합신기술’로의 패러다임에 대응한 전략적 지원을 추진하고 있으며, 바이오산업의 활성화를 위한 자생적인 생태계 조성을 위한 노력도 지속적으로 이루어지고 있다.
나. 정책적 변화 및 추진방향
정부는 2017년 12월 ‘13대 혁신성장동력’에 맞춤형 헬스케어, 혁신신약을 선정하고, 2018년 8월 ‘혁신성장 8대 선도 사업’ 중 하나로 ‘바이오헬스’를 포함하였으며, 2019년 3월 ‘국가 3대 신산업’에 시스템반도체, 미래 자동차와 함께 바이오헬스를 선정하여 2019년 5월 ‘바이오헬스 국가비전’을 선포하는 등 정부 주요 정책방향에 바이오 분야를 지속적으로 포함하고 중점적으로 지원・육성하고 있다.
바이오 분야의 전주기적 연구지원과 사업화 역량 강화 및 혁신적 연구환경 조성 등을 위해 ‘생명공학육성법 개정안’42)을 발의(2018.5.)하였으며, 뇌연구자원・뇌은행 정의 및 뇌연구자원의 확보・분양 등에 대한 근거를 마련하기 위해 ‘뇌연구촉진법 개정안’을 발의(2018.3.)하여 법 개정을 추진하고 있다.
2019년 8월에는 기존의 합성의약품과 다른 특성을 지니는 바이오의약품 및 재생의료를 미국, 일본 등과 같이 별도 법안으로 관리하기 위한 목적으로 제정된 ‘첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률안’43)이 통과되었으며, 2019년 4월에는 ‘의료기기육성 및 혁신의료기기 지원법’도 통과되었다. 적극적으로 연구개발에 투자하는 기업을 혁신형 의료기기 기업으로 인증해 국가연구개발사업 우대, 연구시설 건축 특례, 각종 부담금 면제 등을 지원토록 하는 것이 주요 내용이며, 기존의 의료기기에 비해 안전성・유효성이 현저히 개선된 의료기기를 혁신의료기기로 지정해 우선 심사 등 신속히 제품화할 수 있도록 지원하고자 한다.
과기정통부는 ‘생명공학육성법’ 제4조에 근거하여 바이오 경제를 주도하는 글로벌 바이오 강국실현을 위해 제3차 생명공학육성기본계획(2017∼2026, 바이오경제 혁신전략 2025)’을 수립(2017.9.)하였다. 2019년도 생명공학육성시행계획에 따르면 생명공학분야 정부 투자계획은 총 약 2조 9,312억 원으로 전년 투자(2조 8,483억 원) 대비 2.91% 증가하였다.
보건복지부는 ‘보건의료기술진흥법’ 제4조에 근거한 제2차 보건의료기술육성기본계획(2018~2022)을 수립하였으며, 보건의료문제 해결을 위한 공공성 강화에 중점을 두고 있다. 국민의 목소리를 반영하고 해결요구 문제에 전략적으로 투자하여 연구 성과 실용화를 촉진하며, 연구개발 사업 중심의 관리보다 보건의료 정책・기술・인프라・규제의 종합적 접근을 통해 연구개발과 정책 간 연계성을 높였다.
또한 복건복지부와 관계부처는 바이오헬스 산업 발전을 위해 ‘사람중심 혁신성장’의 비전을 수립하고, 수출 확대의 경제 활력 제고 및 일자리 창출, 혁신적 신약・의료기기, 치료기술개발을 통한 희귀난치질환 극복과 국민의 생명・건강 보장을 목표로 ‘바이오헬스 산업혁신전략’을 발표하였다. 정부는 비메모리 반도체, 미래형 자동차와 함께 바이오헬스를 차세대 3대 주력산업 분야로 육성하여, 세계시장 선도기업 창출 및 산업생태계를 조성할 방침이다.
이 외에도 바이오산업의 지원과 육성을 위한 다양한 전략들이 추진되었으며 규제개선을 위해 ‘바이오 규제선진화 TF(2017.10.)’를 운영하였으며 과학기술계 의견수렴, 국회 공청회 등을 통해 바이오분야에서 ‘규제 개선이 시급한 10대 과제(국정현안점검조정회의 상정, 2018.6.)’를 선정하고 개선방안을 마련하였다.
[표 1-6] 과기정통부의 지난 2년간 바이오관련 지원・육성 전략
|
지원・육성 전략명 |
발표일 |
|
AI・구제역 대응 범부처 R&D 추진 전략 |
2017.9. |
|
한반도 천연물 혁신성장 전략 |
2018.4. |
|
과학기술 기반 바이오경제 2025 일자리 전략 |
2018.5. |
|
연구의사 양성 및 병원 혁신 전략 |
2018.7. |
|
국가 치매연구개발 중장기 추진전략 |
2018.11. |
|
국가전략생명연구자원 선정 |
2018.12. |
|
4차 산업혁명 기반 헬스케어 발전방안 |
2018.12. |
|
인공지능 기반 신약개발 추진전략 |
2018.12. |
|
바이오경제를 선도할 우수인재 육성방안 |
2018.12. |
최근 2019년 11월에는 바이오산업의 성장가능성, 강한 추진체계 필요성 등에 따라 부총리 주재 혁신성장전략회의 산하 기획재정부 1차관 주재로 바이오산업 혁신 테스크포스(TF)를 설치하였다.
그간 우리나라의 바이오정책은 신약개발・헬스케어 등 바이오헬스분야(레드바이오) 및 기술혁신・연구개발(Science Push) 중심으로 추진되어왔다. 하지만 지속가능한 생산・소비를 위해서는 자원, 환경, 에너지까지 논의 범위를 확대(Green+White)하고, 사회적 요구(Social Pull)까지 균형 있게 다룰 필요가 있음을 절감하였다. 이에 혁신적인 파급효과, 과제의 시급성 등을 고려하여 후보리스트 마련 후, 부처 협의와 전문가 회의를 통해 핵심과제를 선정하여 국민수용 가능성, 쟁점・갈등의 강도 등을 고려하여 과제의 성격을 구분한 후 전략적으로 추진할 예정이다. 이를 통해 바이오산업 분야별로 핵심과제를 발굴하여 추진할 뿐만 아니라 산업기반 관련 사항은 산업 전반적 차원에서 접근하여 혁신 추진동력을 확보하고자 한다.
다. 제도 개선
바이오산업은 대표적인 규제산업이다. 실제로 바이오분야는 인간의 생명을 위협하는 사고가 발생할 수 있기 때문에 이를 원천적으로 방지하기 위한 사전규제가 발달되어 왔다.44) 하지만 이런 사전규제 방식은 과학기술에 대한 부정적 인식과 필요 이상의 규제를 양산할 수 있기 때문에 신중한 접근이 필요하다.45) 미국의 21세기 치료법 제정, EU의 개인정보보호법 개정, 일본의 차세대의료기반법 제정 등 선진국과 주변국들은 법과 제도를 개선하고 관련 정책들을 수립하면서 미래 산업을 키우기 위해 노력하고 있으며 바이오기술과 산업분야의 선점과 가속화를 위해 노력을 하고 있다.
하지만 4차 산업혁명 시대에 미래 먹거리와 성장동력으로 주목받고 있는 국내 바이오산업은 다양한 시도를 보장하고 창의성과 자율성을 뒷받침하는 환경이 필요하지만 과거 ‘개발형’ 경제 중심에서 제정되었던 제도와 규제들은 ‘개방형’ 혁신에 제대로 대응하지 못한 실정으로 규제가 혁신의 발목을 잡고 있다.
이에 과기정통부에서는 2017년 10월부터 혁신적 기술개발과 사업화를 저해하는 규제이슈를 발굴하기 위한 바이오 규제개선 태스크포스(TF)를 운영하여 신약, 생명연구자원, 의료기기 등 7개 분야에서 51개의 규제이슈46)를 발굴하였다. 이 중 ‘인체유래물 정의 재정립’, ‘시험‧연구용 LM 어류의 수입 절차 개선’, ‘동등기능 의료기기의 등급차이’ 등 12개의 핵심과제에 대해서는 개선안을 마련하여 바이오특별위원회 안건(2018.5.)으로 상정하였으며, 소관부처와 함께 지속적으로 추진 상황을 점검 중이다. 2019년 12월 현재 12개의 규제개선 과제 중에 4건47)은 개선 완료, 3건48)은 개선 중에 있다.
지속적인 바이오 발전의 혁신을 추진하기 위해서는 신생 기술에 대한 규제 합리화, 기술과 규제간의 선순환 구조 형성 등에 규제정책의 방향 정립이 필요하다. 우리나라도 미국 21세기 치료법(2016.12.)을 근간으로 포괄적 재생의학 정책방향 제시(2017.11.), 디지털 헬스케어 혁신계획(2017.7.), 유전자검사규제완화방침(2017.11.), 유전자치료제 규제완화방향(2018.8.), FDA의 기술현대화 사업계획(2019.9.) 등 다양한 규제정책 프레임들이 만들어지고 시행되고 있다.
우리는 바이오 규제의 원칙과 기본방향을 세심하게 살펴 수립하여야 하며 이를 통해 연구개발(R&D) 혁신의 연속성을 확보하고 바이오 생태계 활성화에 기여할 필요가 있다.
2. 우리나라 바이오의 혁신 성장과 향후 과제
가. 우리나라 바이오의 현황
(1) 2017년에서 2019년까지 우리나라 바이오의 성과
(가) 바이오제약 분야의 성과
① 혁신 신약
2015년 한미약품이 4건의 신약프로젝트를 글로벌 제약사에 기술이전한 이후 바이오산업에 대한 사회적 관심과 기대가 커졌고, 바이오 연구자들도 바이오 창업에 대한 부정적인 인식이 줄어들었으며 실제 창업이 늘어났다.
이러한 한미약품의 글로벌라이센싱 성공사례는 우리나라 기업들이 생산한 연구개발 데이터에 대하여 글로벌 기업들이 신뢰하기 시작했음을 보여준다. 실제로 2016년 12월 동아에스티가 애브비바이오테크놀로지에 기술이전한 항암제, MerTK저해제는 후보물질 탐색 단계라는 개발 초기 단계에서 기술이전이 되어 미화 4,000만 달러의 계약금을 받았다.
[표 1-7] 2018년 주요 라이선스 딜 사례
|
|
기업명(개발사) |
물질명 및 적응증 |
계약상대 |
계약규모 |
계약범위 |
|
1월 |
동아ST |
DA-9801 (당뇨병성신경병증) |
미국, 뉴로보파마슈티컬스 |
1억 8,000만$ 계약금 200만$ |
글로벌판권 (한국 제외) |
|
2월 |
SK케미칼 |
독감 백신 |
미국, 사노피파스퇴르 |
1억 5,500만$ 계약금 1,500만$ |
미국, 유럽 |
|
6월 |
크리스탈지노믹스 |
CG026806 (급성골수성백혈병) |
미국, 앱토즈바이오사이언스 |
1억 2,500만$ 계약금 300만$ |
중국 |
|
7월 |
ABL 바이오 |
ABL001 외 4종 (항암 항체신약물질) |
미국, 트리거테라퓨틱스 |
5억 5,000만$ 계약금 430만$ |
글로벌판권 (한국 제외) |
|
7월 |
유한양행 |
YH14618 (퇴행성디스크) |
미국, 스파인바이오파마 |
2억 1,815만$ 계약금 65만$ |
글로벌판권 (한국 제외) |
|
8월 |
JW중외제약 |
JW1601 (아토피) |
덴마크, 레오파마 |
4억 200만$ 계약금 1,700만$ |
글로벌판권 (한국제외) |
|
11월 |
앱클론 |
AC101 (항암 항체신약물질) |
중국, 상하이헨리우스 |
4,000만$ 계약금 1,000만$ |
글로벌판권 |
|
11월 |
유한양행 |
레이저티닙 (폐암) |
얀센 |
12억 5,500만$ 계약금 5,000만$ |
글로벌판권 (한국 제외) |
|
11월 |
코오롱생명과학 |
인보사 (골관절염) |
일본, 먼디파마 |
5억 9,160만$ 계약금 300억 원 |
일본 |
|
11월 |
인트론바이오 |
SAL200 (슈퍼박테리아) |
로이반트 |
6억 6,750만$ 계약금 1,000만$ |
글로벌판권 |
출처: 전자공시, 한양증권 리서치센터
유한양행은 2018년 11월 항암제로 개발하는 레이저티닙을 비임상시험 단계에서 얀센에 총 12억 5,000만 달러 규모의 기술이전 계약을 하였고, 2019년 7월에는 비알코올성 지방간염(NASH) 신약후보물질을 베링거인겔하임에 8억 7,000만 달러 규모로 기술이전 하였다.
유한양행은 각각 바이오벤처기업인 제노스코, 제넥신에서 기술을 도입하고 자체 연구개발 역량을 더하여 프로젝트의 가치를 높임으로써 성공사례를 만들었다.
개발전문회사(NRDO: No Research Development Only)인 브릿지바이오테라퓨틱스도 2019년 7월 섬유증치료제를 임상1상시험 단계에서 베링거인겔하임에 약 1조 5,000억 원 규모로 기술이전하였다. 특히 이 섬유증치료제는 바이오벤처기업인 레고켐바이오사이언스에서 기술이전을 하여 공동 개발하는 프로젝트로서 국내 벤처기업간 협업모델이라는 특징이 있다.
② 바이오제약의 수익모델
이처럼 2000년대 이후 우리나라 바이오제약산업의 수익모델로 제시되었던 ‘글로벌 기술이전 모델’이 최근 들어 성공사례를 도출하고 있다.
글로벌 제약산업의 오랜 난제인 연구개발 생산성 문제에 대한 해결책으로서 외부에서 신약후보물질을 아웃소싱(outsourcing: 기업의 내부 프로젝트나 제품의 생산, 유통, 용역 등을 외부의 제3자에게 위탁, 처리하는 것)하는 전략이 일반화되면서 우리나라 기업들의 프로젝트들이 조명을 받기 시작하고 있다. 우리나라로서는 글로벌 신약개발의 전 과정을 직접 추진할 수 있는 경험과 자금력이 부족하기 때문에 향후에도 유효한 사업전략으로 보인다.
이와 대비하여 신약개발을 끝까지 직접 수행하는 모델들도 나타났다. SK바이오팜은 뇌전증치료제인 세노바메이트(Cenobamate)에 대하여 2018년 미국에서 임상3상시험을 직접 마치고 미국 식품의약국(FDA)에 신약판매허가신청서(NDA: New Drug Application)를 제출하였다. 바이오벤처기업인 헬릭스미스(前 바이로메드)도 당뇨병성 신경병증 유전자치료제에 대한 미국 임상3상시험 결과를 2019년 내에 발표할 예정이다.
한미약품 기술수출건의 일부 권리 반환, 일부 국내 신약개발프로젝트의 임상실패 등의 악재도 나타나고 있지만, 신약개발의 성공 확률이 매우 낮기 때문에 우리나라 바이오제약 산업의 한계라고 보기는 어렵다. 오히려 잇따른 국내 기업들의 글로벌 기술이전 및 글로벌 시장에서의 판매 허가 등의 사례는 우리나라 바이오제약 산업이 글로벌 수준으로 도약하고 있음을 보여준다고 할 수 있다.
물론 삼성바이오로직스의 분식회계 논란, 코오롱티슈진의 인보사 사태는 무형자산이 가치의 대부분을 차지하는 바이오제약 산업의 특성을 감안할 때, 신뢰의 문제를 건드리고 있기에 산업전반에 부정적인 영향을 끼칠 수 있으리라 본다.
③ 기타 바이오제약
신약개발 이외에 우리나라가 글로벌 가치사슬에서 역할을 할 수 있는 분야는 CRO (Contract Research Organization)와 CMO(Contract Manufacturing Organization)이다. CRO의 경우 중국의 성장이 두드러지고 있어서 우리나라는 주도권을 잡기 보다는 특정 영역에서 경쟁력을 확보할 수 있겠다. 개발전문회사(NRDO)와 협력하여 성과를 창출하는 모델이 국내에서도 나타나고 있으며, 향후 보다 많은 역할이 기대된다. CMO의 경우에는 셀트리온과 삼성바이오로직스가 글로벌시장에서 일정한 경쟁력을 확보하고 있다. 장치산업적인 성격을 감안한다면 새로운 국내 CMO 기업들이 대두되기는 어려울 수 있으나 기존 CMO들과 국내 신약개발 기업들과의 협업 모델이 우리나라의 바이오제약 산업을 한 단계 도약시키는 역할을 할 수 있으리라 본다.
(나) 바이오 창업 및 투자
① 바이오투자의 활성화
2013년 이후 글로벌 바이오투자는 지속적인 증가세를 보여주고 있다. 미국의 2018년도 바이오분야 벤처투자 규모는 230억 달러로 늘어났는데, 초기 단계 투자가 40억 달러로 높은 비중을 차지했다. 우리나라의 벤처투자 규모도 꾸준히 늘어나고 있는데, 2018년에는 3조 4,000억 원으로 전년 대비 44%가 증가하였다. 이중 바이오가 약 25%에 해당하는 8,417억 원의 투자를 유치했다. 2019년에는 5월까지 4,048억 원이 투자되어 증가세가 지속되고 있다. 2018년에는 코스닥상장 바이오기업에 대한 투자도 대폭 증가하여 비상장 및 상장 바이오기업에 대한 투자액이 2조 원을 넘어선 것으로 보고되고 있다.

출처: 한국벤처캐피탈협회, Venture Capital Market Brief, 2019
[그림 1-5] 업종별 신규투자 비중
[표 1-8] 업종별 신규투자 금액(단위: 억 원)
|
|
2015 |
2016 |
2017 |
2018 |
2019.5 |
|
ICT 제조 |
1,463 |
959 |
1,566 |
1,489 |
412 |
|
ICT 서비스 |
4,019 |
4,062 |
5,159 |
7,468 |
3,278 |
|
전기/기계/장비 |
1,620 |
2,125 |
2,407 |
2,990 |
752 |
|
화학/소재 |
1,486 |
1,502 |
1,270 |
1,351 |
505 |
|
바이오/의료 |
3,170 |
4,686 |
3,788 |
8,417 |
4,048 |
|
영상/공연/음반 |
2,706 |
2,678 |
2,874 |
3,321 |
1,474 |
|
게임 |
1,683 |
1,427 |
1,269 |
1,411 |
434 |
|
유통/서비스 |
3,043 |
2,494 |
4,187 |
5,726 |
2,896 |
|
기타 |
1,668 |
1,570 |
1,283 |
2,077 |
1,095 |
|
합계 |
20,858 |
21,503 |
23,803 |
34,249 |
14,894 |
출처: 한국벤처캐피탈협회, Venture Capital Market Brief, 2019
② 창업 주체의 다양화 및 네트워크 확대
최근 바이오창업의 주체가 다변화되고 있다. 여전히 기업 출신 연구자의 개인 창업이 주를 이루고 있지만, 국책연구소나 한국보건산업진흥원 등 정부 산하기관에서의 보육을 통한 창업, 대학 산학협력단이나 대학 기술지주의 자회사 창업 및 병원에서의 창업 등이 활성화되고 있다.
특히 선도형특성화센터, 연구중심병원 등 병원에서의 연구개발사업에 대한 정부의 지원성과가 가시화되면서 병원에서의 창업이 늘어나고 있는 점에 주목할 만하다. 임상의사와 연구자들의 협업을 통하여 창업 아이템이 도출되고 조직적인 창업 지원을 통하여 주요 병원에서도 창업이 본격화되고 있다. 병원은 명확한 의학적 미충족수요(Medical Unmet Needs)를 발굴하고, 의료정보 및 중개연구에 기반을 둔 차별적인 데이터 확보를 통하여 바이오기업들의 글로벌 경쟁력 강화에 대한 기여도가 높다.
창업이 조직적으로 이루어지면서 초기 단계에서의 회사 운영 및 개발의 시행착오가 줄어들고 창업에 대한 인식을 바꾸고 있다. 한국바이오협회, 한국보건산업진흥원, 범부처신약개발사업단 등의 창업관련 교육 및 컨설팅도 연구자들의 창업을 지원하였다. 직접적인 창업 이외에 대학, 출연연구소 등이 보유한 기술이 국내 벤처 및 제약사에 기술이전되어 사업화되는 경향도 증가하였다.
매년 한국생명공학연구원, 신약개발연구조합 등이 주관하여 개최되는 인터비즈바이오파트너링에는 2019년 1,300명이 참가하여 550여 개의 기술에 대한 기술협상이 이루어졌으며 통상적으로 30건의 기술이전이 이루어진다. 민간 주도의 네트워크도 활발해지고 있다. 2015년 대전에서 시작된 ‘혁신 살롱’은 혁신살롱판교에 이어 2019년 혁신살롱오송, 혁신살롱대구, 혁신살롱송도가 자생적으로 조직화되어 정보 공유와 참가자간 자발적인 논의가 활성화되고 있다.
③ 스타트업의 성장
바이오 창업은 2015년 이후 꾸준히 늘어나는 추세이다. 2017년 창업기업 중 의약품 분야가 43%로 가장 많은 비중을 차지하고 있으며 뒤이어 지원서비스가 20% 차지하고 있다.
창업기업의 증가보다 고무적인 사항은 이들 기업에 대한 초기 투자액의 규모가 늘어나고 있다는 점이다. 초기 투자단계에서 100억 원 이상의 투자유치에 성공하는 기업들이 2017년 이후 지속적으로 증가하고 있다. 2018년에 이어 2019년에도 10개 이상의 바이오벤처들이 100억 원 이상의 투자유치에 성공하였고, 이들 중 오름테라퓨틱은 설립 단계 90억 원 투자유치에 이어 350억 원 규모의 시리즈A 투자를 받았다. 2018년 미국 초기 신약개발벤처 143개사에 33억 달러이 투자되어 1개사 당 평균 260억 원이 투자유치된 것에는 미치지 못하지만, 글로벌 초기 신약개발 경쟁에 참여할 수 있는 자금력을 확보한 것 이외에 투자사들의 지속적인 투자 양상이 더해지면서 우리나라 바이오 스타트업들의 경쟁력도 높아질 것으로 보인다.


주1) 설립현황 분석을 위한 기업DB는 본 보고서 분석에 활용되는 기업DB와 별개로 확보, 신규기업들은 대부분 재무정보(매출액, 연구개발비 등)가 미흡하므로 설립현황 분석을 위한 기업DB는 본 보고서 분석을 위한 기업DB와 다르게 재무정보가 부족한 기업들도 포함
주2) 휴・폐업 모두 포함
주3) 바이오 중소・벤처기업DB는 매년 DB 정제 및 업데이트를 하는 과정에서 기존DB 중 일부가 삭제되거나 새로운 기업이 추가되므로, 작년 분석 결과(기업 수)와 차이 존재
출처: 생명공학정책연구센터, 2017년 국내 바이오 중소・벤처기업 현황 통계, 2018.12.
[그림 1-6] 연도별 바이오 중소・벤처기업의 설립 현황
나. 우리나라 바이오의 향후 과제
(1) 전문인력 확충
(가) 연구개발 및 생산
우리나라 바이오의 가치사슬에서 볼 때, 기초 연구의 폭과 깊이에 대한 지원이 더욱 필요하다. 크리스퍼(CRIPR) 기술과 CAR-T, 면역관문치료제(Immune Checkpoint Inhibitor)와 같은 면역치료제 등의 사례에서 볼 수 있는 것처럼 바이오산업은 과학기술의 성과가 바로 사업화로 이어지는 경향이 심화되고 있다. 따라서 국가 경쟁력을 제고하기 위해서 정부의 지원은 기초 연구 강화에 집중될 필요가 있다.
산업 측면에서는 학교 교육 내용과 기업 수요의 불일치 해소가 중요하다. 학위 과정의 연구가 기업에서 바로 쓰이지 못하고 대부분 재교육을 필요로 한다. 특히 생산, 임상 전문인력에 대한 수요가 급증하고 있지만, 이에 대한 전문인력 공급은 부족한 형편이다.
(나) 사업개발 및 기획
바이오산업은 수익 발생까지 장기간의 투자와 개발이 요구되고 대부분의 가치가 무형자산의 형태로 존재하는 등 다른 산업분야와 상이한 특징을 보인다. 따라서 타 분야에서 축적한 역량과 경험이 바이오기업에서 적용되는 데에는 다소간의 제약이 있다. 수익모델도 기술이전에 의한 수익이 주를 이루고 있어서 이에 대한 사업기획을 하고 사업개발을 위해서는 바이오에 대한 이해와 일정한 지식이 필요하다. 학위과정에서 바이오를 전공한 인력들이 기업에서 실무 경험을 쌓기 위해서는 기업의 수와 개발 단계의 심화가 필요하다. 이러한 인력 양성에 대한 지원은 직접적인 교육보다는 바이오벤처기업 지원을 통한 간접 지원 형태가 적절하다고 본다.
(2) 제도 및 인프라
바이오는 사람을 대상으로 하기 때문에 규제가 필수적이다. 다만 과학기술 발전의 속도가 매우 빨라 규제의 틀이 금새 진부화되는 경향이 있다. 따라서 규제의 방식으로서 네거티브 방식을 도입하는 것은 필수불가결하다고 본다. 이 과정 속에서 끊임없이 안전성을 체크하고 문제가 생기면 조정하는 작업이 필요하다.
바이오 제품의 개발기간은 신약의 경우 통상 10년 이상이 소요되고 의료기기의 경우에도 통상 3년 이상이 소요되는데 비하여 투자 규모는 다른 산업 대비 매우 큰 편이므로 규제의 예측 가능성이 필요하다. 이를 위해서는 대표적인 인허가 기관인 한국식품의약품안전처(KFDA)의 심사 역량을 대폭 늘리고 고도화하는 일이 급선무이다.
바이오는 개인별 맞춤의료의 형태로 진화하고 있다. 개인별 정보의 차이가 가치를 만들고 의료의 편익을 높이게 된다. 이를 위해서는 비식별 개인정보에 대한 접근이 요구된다.
(3) 투자 및 기업 지원
민간의 바이오 투자는 꾸준히 증가하고 있다. 이에 따라 정부의 지원 방식도 기존의 직접 지원에서 간접 지원으로 전환될 시점으로 판단한다. 보건복지부에서 직접 출자한 3개의 바이오펀드도 가시적인 성과를 내고 있다. 정부가 직접 출자하거나 지원하는 사업은 설립 초기단계에서 인큐베이팅에 역량을 집중하는 펀드와 우리나라의 힘으로 신약개발을 끝까지 수행하는 사업에 집중한다고 할 수 있겠다. 민간의 자금이 흘러들어가기 어렵거나 민간 자금만으로는 성공의 임계치에 도달하기 어려운 분야에 지원을 하는 형태이다.
우리나라 기업에 대한 투자의 회수 방식은 여전히 기업공개(IPO)에 집중되어 있다. 따라서 장기적으로는 기업 인수합병(M&A)에 대한 지원을 강화하는 것이 중요하다. 대기업이나 중견제약사가 인수합병하는 형태보다는 성공한 바이오벤처기업이 다른 바이오기업이나 제약사를 인수합병하는 형태가 더 많아질 것으로 본다. 어떤 경우이든 인수합병에 따른 세제 지원 등 간접적인 지원이 필요하며, 국내 기업이 해외 바이오기업을 인수합병하는 경우의 지원도 마찬가지이다.
기업공개 역시 예측가능성과 일관성이 중요하다. 기술성특례상장은 우리나라 바이오산업의 글로벌 경쟁력을 높이는데 기여해왔다. 글로벌 기술력을 보유한 기업들이 적기에 성장할 수 있도록 지속적으로 상장의 기회를 넓혀 주어야 한다. 한편으로는 상장의 문호를 넓히되, 신뢰를 잃거나 성장 동력을 잃는 기업에 대해서는 바로 퇴출시킴으로써 기업 생태계를 건강하게 유지하는 것 또한 필요하다.
제2장 국가 생명공학 육성 정책 (부처별 투자현황 및 계획 등)
![]()
|
구분 |
연구개발 지원 |
산업육성 |
|
개요 |
‘바이오헬스 국가비전’을 선포하는 등 정부 주요 정책 방향에 바이오분야를 지속적으로 포함하며 바이오분야를 중점 지원‧육성 등 바이오경제 시대를 대비 |
생명공학 산업의 정의, 분류, 육성 필요성
|
|
추진경과 |
3차 생명공학육성기본계획(’17∼’26) 수립(’17.9) 헬스케어 특별위원회 설치(’17.12) 과학기술 관계 장관회의 복원(’18.11) 바이오헬스 산업 혁신전략 수립(’19.5) |
산업통상자원부 R&D 지원 사업 추진 경과
|
|
주요정책 |
3차 생명공학육성기본계획 (’17∼’26) 3차 뇌연구촉진 기본계획(’18∼’27) 바이오헬스 산업 혁신전략(’19.5) |
바이오헬스산업 혁신전략(2019.5.22) -빅데이터 구축, 규제 개선, 생태계 조성 등
|
|
주요사업 |
바이오의료기술개발사업, 뇌과학원천 기술개발사업, 포스트게놈신산업육성을 위한 다부처유전체 사업, 범부처전주기 신약개발사업, 혁신신약 파이프라인 발굴사업, 오믹스 기반 정밀의료 기술 개발 사업 |
R&D(바이오산업핵심기술개발, 전자시스템산업핵심기술개발 등), 바이오산업 생태계 구축, 국제 협약이행, 지역 바이오 활성화 기반구축 등 |
|
향후계획 |
바이오 분야 정부 R&D 투자를 2025년 까지 4조 원 이상으로 확대, 범부처 차원의 대형 프로젝트로 전주기 지원을 추진하고, 데이터‧AI 중심의 패러다임 전환에 대응하며 신기술‧시장을 선점 |
빅데이터 구축 및 이를 통한 서비스 발굴, 신약・디지털 헬스케어 산업 및 전후방산업 기술개발 적극 지원 예정
|
|
기초과학진흥 |
인력양성 |
|
생명공학의 성과는 기초생명과학의 다양한 실험에서 기인한 성과로 연구개발사업도 기초과학의 선행이 전제되어야 함 |
생명공학 분야의 경쟁력 확보를 위해서 장기적 관점에서 연구의 지속가능성이 중요하다고 판단하고, 기초연구 분야에 대한 저변 확대와 우수 연구인력의 양성에 정책 역량을 집중하여 생명공학 분야의 연구 인력양성 역량 강화
|
|
2004년 과학기술부 ‘과학기술혁신본부’ 설치 (부총리급 격상)를 시작으로, 2008년 교육과학 기술부, 2013년 미래창조과학부 출범을 거치며 일관성 있는 창조적 기초연구 추진전략이 마련. 現 문재인 정부에서 과학기술정보통신부는 전주기적 우수 연구과제 중심, 교육부는 인력양성 및 인프라 지원 중심으로 역할분담하여 추진 중 |
(1982년) 박사후연구자의 연구경험을 축적하고자 학문후속세대를 지원하고 있으며, 국가 연구역량 제고를 위한 연구저변 확대를 위해 1989년부터 풀뿌리 기초연구를 지원 (1999년) 미래 인재 양성을 위한 대학원의 교육・연구역량 강화 기반 조성을 위한 BK21사업을 시작하여 현재 BK21플러스 사업까지 지속 지원 (2008년) 의과학자 육성지원 사업을 시작하여 미래 성장 동력인 바이오산업 분야 경쟁력 확보를 위한 중개연구를 활성화하고, 이를 수행할 의과학자를 적극 양성 |
|
제4차 기초연구진흥종합계획(2018~2022)을 통한 연구자 주도 기초연구지원 예산 2배 확대, 연구 자율성 보장 등을 단계적으로 추진 |
다양한 생명공학 분야에 대한 개인 및 대학 연구소 단위의 균형 잡힌 기초연구를 지원하여 연구 저변을 지속적으로 넓혀 나감과 동시에 석・박사 연구 인력에 대한 연수기회 부여, 연구경험 제공 및 장학금 지원을 통해 미래 한국을 책임질 학문후속세대를 육성
|
|
기초연구를 중점 지원. ‘개인연구(신진・중견・ 리더 등)’, ‘집단연구(선도연구센터・기초연구실)’, ‘기반구축(전문연구정보활용사업 등)’으로 구분하여 연구자 역량단계 및 참여연구원 규모에 따른 세부 프로그램을 통해 추진. 생명공학분야 기초연구는 한국연구재단에서 지원 |
이공학개인기초연구, 이공학학술연구기반구축, BK21플러스, 의과학자 육성지원
|
|
생명과학의 메커니즘 연구를 집중 수행하는 생명 과학자를 양성, 글로벌 수준으로 연구역량 제고, 관련 연구기반 확충으로 미래 첨단 기초생명과학 연구를 선점 |
생명공학 분야의 연구와 인력양성을 위한 지원을 확충하여 기초연구와 인력양성 간 긴밀한 연계를 통해 시너지를 창출하기 위한 대학 지원 확대 추진
|
![]()
|
구분 |
농림축산식품 |
보건의료 |
|
개요 |
그린바이오 기술은 농업의 부가가치와 생산성 향상, 친환경 농업에 기여. 농식품부는 관련 R&D 투자 지속할 것
|
고령화 사회 가속화, 기대수명의 증가, 질병의 다양화 등으로 의료수요가 증가하고 있어, 바이오헬스 분야는 4차 산업혁명시대 혁신 성장이 예상 되는 주요한 산업 중 하나로 보건의료 연구개발 시스템을 구축하고, 보건의료 산업을 육성이 필요 |
|
추진경과 |
현재 농식품부, 농진청 합동 제2차 농림식품과학기술 종합계획에 따라 R&D 추진, 연말까지 제3차 계획 수립 계획 |
제1차 보건의료기술육성 기본계획 (’13∼’17)이 종료됨에 따라 제2차 보건의료기술육성 기본계획(’18∼’22)을 수립하였으며, 관계부처 합동 ‘바이오 헬스산업 혁신 전략’ 발표(’19.5) |
|
주요정책 |
고부가가치 생물소재 개발, 스마트농업 연구, 지속가능한 농업기술 등 R&D 지원, 기업 지원, 제도 개선 등 추진
|
제2차 보건의료기술육성기본계획 (’18∼’22)은 ‘보건의료기술 혁신으로 국민 모두가 건강한 내일’이라는 비전을 설정하고 3대 전략을 중심으로 9대 중점과제를 추진 ‘바이오헬스 산업 혁신전략‘은 사람중심 혁신 성장’의 비전을 수립하고, 3대 목표를 달성하기 위해 13개 중점 과제를 추진 |
|
주요사업 |
생명산업기술개발, 첨단생산기술개발, 골드시드프로젝트 등 농업생명공학 관련 R&D사업에 3,146억 원 투자(2018) |
보건의료기술연구개발사업, 암정복추진사업 및 국립암센터 기관고유사업, 질병관리연구사업 등
|
|
향후계획 |
제3차 종합계획을 수립해 중장기 비전을 제시하고 생명소재, 스마트팜, 첨단육종 등 유망분야에 전략적 투자 확대 |
고령화, 감염병, 의료비 부담 등 고비용 보건의료 문제를 해결하고, 예방・관리 및 맞춤의료 실현을 위한 연구개발 지원을 강화할 것이며, 바이오헬스 산업 혁신전략’을 법령 제・개정, 예산반영, 제도개선 과제로 나누어 이행해 나갈 계획 |
|
환경 |
해양수산 |
|
생명공학기술 개발의 필요성 및 각국의 환경연구개발 동향 소개 |
해양수산생명자원은 이용 잠재력이 큰 차세대 신물질 개발의 보루이며 해양생물체의 시스템, 구성성분 및 기능을 활용한 제품화 기술개발 중점 지원
|
|
사후처리기술에서 사전예방기술로 전환하였으며, 현재는 환경융합신기술개발 추진 중 |
2004년 ‘마린바이오21 사업(2004〜2013)’을 시작으로 꾸준히 육성하여, 2015년 ‘국립해양생물자원관의 설립 및 운영에 관한 법률’을 제정하고 국립해양생물자원관을 설립
|
|
환경기술 육성정책 및 환경-생명공학 연계 정책, 중장기 계획 소개 |
해양수산생명자원의 보존・관리 및 이용 등에 관한 법률 마련(2017), 해양바이오 산업 육성전략 마련(2018), 제1차 해양수산생명자원 관리기본계획(2019∼2023)에 따른 해양수산생명공학 육성 추진
|
|
융합기반 청정기술, 환경오염제어 및 관리기술, 폐자원 에너지화 및 고부가가치 자원화 기술, 생물자원을 활용한 환경복원・정화기술
|
해양수산생명공학기술개발사업, 포스트게놈다부처유전체사업, 해양바이오 전략소재개발 및 상용화 지원사업 등 |
|
환경기술로드맵 및 환경R&D 중장기 계획에 따라 투자 확대 계획 |
상용화에 중점을 둔 해양수산생물유래 전략 소재 개발, 산・학・연의 연구체계 강화 및 해양수산생명공학 육성관련 체계적인 정책운영 추진
|
제1절
생명공학 육성 정책
1. 생명공학 연구개발 지원
가. 개요
바이오 기술은 경제성장과 함께 질병 극복(레드바이오), 풍요로운 먹거리 제공(그린바이오), 쾌적한 환경 조성(화이트바이오)를 통해 국민 삶의 질 향상까지 달성 가능한 미래유망분야이다. 이는 고령화, 질병극복 등 미래 글로벌 난제에 대응하기 위한 선제적 투자가 필수적이다.
특히 바이오는 R&D 성과가 시장 독식으로 이어지는 ‘과학기술 집약적 미래유망분야’이므로 바이오 분야의 전략적인 정책지원과 지속적인 연구개발사업 추진이 더욱 중요하다.
이에 문재인정부는 국정과제에 ‘고부가가치 창출 미래형 신산업 발굴・육성(국정과제 34번)’의 세부 실천과제로 ‘제약・바이오・의료기기 산업 육성’을 두고 ‘치매국가책임제(국정과제 43번)’와 함께 바이오 관련 지원・육성 정책으로 집중 관리하고 있다.
2017년 12월 ‘13대 혁신성장동력’에 맞춤형 헬스케어, 혁신신약을 선정하고, 2018년 8월 ‘혁신성장 8대 선도 사업’ 중 하나로 ‘바이오헬스’를 포함하였으며, 2019년 3월 ‘국가
3대 신산업’에 시스템반도체, 미래 자동차와 함께 바이오헬스를 선정하여 ‘바이오헬스 국가비전(2019.5.)’을 선포하는 등 정부 주요 정책방향에 바이오 분야를 지속적으로 포함하고 중점적으로 지원・육성하고 있다.
특히 과학기술정보통신부는 ‘AI・구제역 대응 범부처 R&D 추진 전략(2017.9.)’, ‘과학기술 기반 바이오경제 2025 일자리 전략(2018.5.)’, ‘국가 치매연구개발 중장기 추진전략 (2018.11.)’ 등 현실문제 해결을 위한 정책 마련과 함께, ‘한반도 천연물 가치혁신 전략’ (2018.4.), ‘연구의사 양성 및 병원 혁신전략’(2018.7.), ‘인공지능 기반 신약개발 추진전략’ (2018.12.) 등 미래 바이오경제 시대를 대비하고 있다.
나. 추진경과
정부는 바이오 혁신성장을 선도하기 위해 10년의 바이오 중장기 청사진을 담은 ‘제3차 생명공학육성기본계획(2017∼2026, 바이오경제 혁신전략 2025)’을 수립(2017.9.) 하였다. 이에 정부는 해당 기본계획을 국회 공청회 개최(2017.9.) 및 국무회의 보고(2017.10.)를 통해 범정부 차원의 추진동력을 확보하며 내실 있는 집행에 역량을 집중하고 있다.
아울러, 과학기술정보통신부와 보건복지부는 국가 전략적 관점에서 헬스케어 발전을 선도하기 위해 대통령 직속의 4차 산업혁명위원회에 ‘헬스케어 특별위원회’(2017.12.)를 설치하고, 글로벌헬스케어 산업성장에 대응하기 위해 ‘4차 산업혁명기반 헬스케어 발전방안(2018.12.)’을 마련하였다.
또한 문재인정부는 최근 국가 R&D 혁신과 4차 산업혁명 대응에 있어 과학기술의 역할이 중요해짐에 따라 11년 만에 과학기술관계장관회의를 복원(2018.11.)하였다. 과학기술관계장관회의에서 생명공학 분야의 주요 안건으로 ‘국가 치매연구개발 중장기 추진전략(제1회, 2018.11.)’, ‘국가유전체 빅데이터 구축 추진계획(안)(제2회, 2019.1.)’, ‘국가 바이오 빅데이터 구축 추진계획(안)’ 및 ‘지능형 식물공장-바이오산업 융합 프로젝트 추진 방안(안)(제4회, 2019.4.)’을 논의하여 정책의 실행력을 높이고 부처 간에 협력을 강화하였다.
특히 올해 정부는 제약・바이오를 중심으로 바이오헬스 산업의 기술개발부터 인허가・생산・시장출시에 이르는 산업 전주기의 혁신 생태계를 조성한다는 전략 아래 2019년 5월 관계부처 합동으로 ‘바이오헬스 산업 혁신전략’을 수립하였다.
이에 따라, 혁신신약과 의료기기 개발 등을 위한 정부 R&D 투자를 2025년까지 연간 4조 원 이상으로 늘리고, 5대 빅데이터 플랫폼, 정책금융 및 세제지원, 글로벌 수준의 규제 합리화에 역점을 두고 법령 제・개정, 예산 반영, 제도개선을 차질 없이 이행해 나갈 계획이다.
다. 주요정책
(1) 법령
바이오 분야의 전주기적 연구지원과 사업화 역량 강화 및 혁신적 연구환경 조성 등을 위해 ‘생명공학육성법 개정안’1)을 발의(박홍근 의원 대표발의, 2018.5.)하였으며, 뇌연구자원・뇌은행 정의 및 뇌연구자원의 확보・분양 등에 대한 근거를 마련하기 위해 ‘뇌연구촉진법 개정안’을 발의(주호영 의원 대표발의, 2018.3.)하여 법 개정을 추진하고 있다.
또한 나고야 의정서2) 이행 및 생물자원에 대한 주권 강화, 생명연구자원의 체계적인 관리를 위해 ‘생명연구자원의 확보・관리 및 활용에 관한 법률’을 개정(2018.12.)하였으며, 동법 시행령을 개정(2019.6.)하여 생명연구자원에 대한 국외 반출 승인(변경・취소) 기준・절차, 생명연구자원 현황 조사 등을 마련하였다.
(2) 기본계획 및 시행계획 수립
(가) 생명공학육성기본계획
정부는 ‘생명공학육성법’ 제4조에 근거하여 바이오 경제를 주도하는 글로벌 바이오 강국실현을 위해 제3차 생명공학육성기본계획(2017∼2026, 바이오경제 혁신전략 2025)’을 수립(2017.9.)하였다.
동 계획은 우리나라의 글로벌 바이오 시장 점유율을 2015년 기준 1.7%(생산 기준 27조 원)에서 2025년 5%(생산 기준 152조 원) 수준까지 달성하는 것을 최종 목표로 설정하고, ① 글로벌 신약 후보물질 신규 100개(현 85개), 1조 원 매출 국산 블록버스터 신약 5개 창출, ② 바이오 기술기반 신규 일자리 12만 명 창출(2015년 2만 6,000명→2025년 14만 5,000명), ③ 글로벌 기술수출액 500% 증가(2015년 522M$→2025년 2,732M$), ④ 사회문제 해결에 기여하는 바이오 R&D 1만 건(2015년 7,000건→2025년 1만 건) 등 국민 생활에 직결되는 4대 세부 목표를 제시하였다.
(나) 생명공학육성 연도별 시행계획
정부는 ‘생명공학육성법’ 제5조에 근거하여 관계부처와 합동으로 생명공학육성기본계획에 따른 연도별 ‘생명공학육성 연도별 시행계획’을 매년 수립하여 시행하고 있다. 2019년도 생명공학분야 정부 투자계획은 총 약 2조 9,312억 원으로 전년 투자(2조 8,483억 원) 대비 2.91% 증가하였다.
혁신신약, 융복합 의료기기, 맞춤형 헬스케어 등 신기술 개발을 지원하고, 바이오 기술과 인공지능, 빅데이터를 결합하여 정밀의료, 스마트팜 등 융복합 기술 개발을 촉진하며, 치매, 감염병, 생활환경 등 국민건강 및 생활편익 증진에 기여하기 위한 진단・치료기술 개발을 중점적으로 지원할 계획이다.
또한 국민이 체감할 수 있는 규제 개선 노력과 함께 사업화 촉진 및 바이오 혁신 생태계의 조성을 위한 지원을 확대하였다.
[표 2-1] 2019년도 생명공학분야 부처별 투자계획(단위: 백만 원, %)
|
구분 |
연구개발 |
인프라 |
인력양성 |
합계 |
비중(%) |
’18년 실적 |
증가율(%) |
|
과학기술정보통신부 |
1,113,424 |
44,110 |
0 |
1,157,534 |
37.75 |
1,075,354 |
7.64 |
|
교육부 |
266,836 |
0 |
272,710 |
539,546 |
17.76 |
505,694 |
6.69 |
|
농림축산식품부 |
305,634 |
0 |
0 |
305,634 |
11.45 |
326,184 |
Δ6.30 |
|
산업통상자원부 |
180,549 |
71,633 |
1,637 |
253,819 |
9.43 |
268,596 |
Δ5.50 |
|
보건복지부 |
410,824 |
39,176 |
7,192 |
457,192 |
15.70 |
447,195 |
2.24 |
|
환경부 |
67,326 |
1,200 |
0 |
68,526 |
1.92 |
54,798 |
25.05 |
|
해양수산부 |
88,395 |
23,456 |
0 |
111,851 |
4.67 |
133,004 |
Δ15.90 |
|
식품의약품안전처 |
36,280 |
546 |
265 |
37,091 |
1.32 |
37,543 |
Δ1.20 |
|
합 계 |
2,469,268 |
180,121 |
275,653 |
2,931,193 |
100 |
2,848,368 |
2.91% |
[표 2-2] 2019년도 생명공학분야 세부분야별 투자계획(단위: 백만 원)
|
구분 |
생명과학 |
의료(Red) |
농업(Green) |
환경(White) |
융합신산업 |
합계 |
|
과학기술정보통신부 |
913,241 |
108,539 |
29,044 |
20,732 |
41,866 |
1,113,424 |
|
교육부 |
266,836 |
0 |
0 |
0 |
0 |
266,836 |
|
농림축산식품부 |
76,417 |
0 |
186,080 |
16,913 |
26,224 |
305,634 |
|
산업통상자원부 |
3,236 |
71,117 |
8,005 |
17,230 |
80,960 |
180,549 |
|
보건복지부 |
54,824 |
335,697 |
0 |
0 |
20,304 |
410,824 |
|
환경부 |
16,699 |
356 |
4,001 |
46,270 |
0 |
67,326 |
|
해양수산부 |
30,915 |
5,950 |
35,848 |
8,423 |
7,260 |
88,395 |
|
식품의약품안전처 |
362 |
17,494 |
18,424 |
0 |
0 |
36,280 |
|
합 계 |
1,362,530 |
539,153 |
281,402 |
109,568 |
176,614 |
2,469,268 |
(다) 뇌연구촉진 기본계획
정부는 ‘뇌연구촉진법’ 제5조에 근거하여 과학기술정보통신부, 교육부, 보건복지부, 산업통상자원부가 공동으로 뇌탐구를 통한 미래사회 혁신 및 고령화 사회를 대응하기 위해 ‘제3차 뇌연구촉진 기본계획(2018∼2027, 뇌연구혁신 2030)’을 수립(2018.5.)하였다.
동 계획은 뇌에 대한 근원적 이해와 도전, 뇌질환 극복을 통한 국민 부담 경감 및 삶의 질 제고, 뇌연구 기반 신기술 창출을 3대 목표로 설정하고, ① 2023년까지 뇌 분야 기초연구를 2배로 확대, 뇌신경망 구축을 통한 뇌연구 고도화, ② 치매발병 5년 지연 및 치매 증가속도 50% 감소를 통해 뇌건강의 실현, ③ 차세대 인공지능, 전자약 등 5대 핵심기술의 글로벌 Top 기술력 확보, ④ 신경윤리위원회 설치, 뇌연구 특화 병원 지정을 통한 생태계 조성, ⑤ 매출 1,000억 규모의 기업 10개 창출을 통한 뇌산업 육성 등을 세부목표로 제시하였다.
(3) 지원・육성 전략
(가) AI・구제역 대응 범부처 R&D 추진 전략
국가 재난형 가축 질병인 AI・구제역이 지속 발생됨에 따라 범부처 합동으로 ‘AI・구제역 대응 범부처 R&D 추진 전략’(2017.9.)을 마련하여 ‘가축질병 R&D 협의체’를 신설하고, 부처별 강점분야를 중심으로 역할 분담 및 협력연구를 강화하여 과학기술에 기반을 두고 예방 및 신속대응 체계를 구축하였다.
(나) 한반도 천연물 혁신성장 전략
한반도 천연물자원에 대한 통합관리 및 과학화・표준화를 통한 글로벌 수준의 천연물 제품 창출을 목표로 ‘한반도 천연물 혁신전략’(2018.4.)을 수립하여 한반도 천연물 확보, 과학적 원리 규명, 혁신성장 생태계 조성을 중점적으로 추진하여 과학기술로 한국이 가지고 있는 천연물의 가치를 재발견할 계획이다.
(다) 과학기술 기반 바이오경제 2025 일자리 전략
바이오 혁신기술의 개발과 창업 및 성장을 지원하기 위해 ‘과학기술 기반 바이오경제 2025 일자리 전략’(2018.5.)을 수립하여, 바이오 실험실 창업 지원 확대를 통해 2022년까지 실험실 창업기업을 500개까지 양성할 계획이다.
(라) 연구의사 양성 및 병원 혁신 전략
병원 및 의사가 바이오메디컬 산업분야에서 혁신 성장의 주역이 될 수 있도록 ‘연구의사 양성 및 병원 혁신 전략(2018.7.)’을 수립하여, 연구의사(의사과학자) 양성체계 강화, 산・학・연・병원 간 협력 활성화, 지역 병원의 연구역량 강화 등 의사와 병원 중심의 혁신적 의료기술연구 및 실용화・창업 지원 방안을 마련하였다.
(마) 국가 치매연구개발 중장기 추진전략
치매로 인한 국민의 고통을 경감하기 위해 ‘국가 치매연구개발 중장기 추진전략(2018. 11.)’을 마련하여, 치매 원인규명과 치료기술 확립을 통해 ‘치매발병 시기를 5년 지연하고 치매 증가속도를 50% 감소’를 목표로 과학기술 기반의 치매 연구개발을 추진한다.
(바) 국가전략생명연구자원 선정
국가차원의 전략적 관리가 필요한 10대 생명연구자원3)(2018.12.)을 선정하여, 국가전략생명연구자원을 안정적으로 확보하고 활용가치를 확립할 계획이다. 이에 따라 전략자원별 전담기관 지정, 자원관리체계 구축, 전략자원에 대한 공유・활용 촉진, 신규 전략자원 후보군의 지속적인 발굴을 추진한다.
(사) 4차 산업혁명 기반 헬스케어 발전방안
4차 산업혁명위원회 산하 헬스케어 특별위원회에서 헬스케어 분야의 주요 아젠다를 논의하여 ‘4차 산업혁명 기반 헬스케어 발전방안(2018.12.)’을 마련하였다.
헬스케어 빅데이터 생산・관리 시범체계 운영, 인공지능 활용 신약개발, 스마트 임상시험 체계 구축 등 헬스케어 분야 4차 산업혁명을 선도하기 위해 구체적인 실행 방안이 포함되어 있다.
(아) 인공지능 기반 신약개발 추진전략
인공지능(AI)・빅데이터를 활용한 신약개발을 촉진하기 위해 ‘인공지능 기반 신약개발 추진전략(2018.12.)’을 마련하여, 4대 선도 분야(후보물질 발굴, 임상시험, 스마트 약물감시, 약물 재창출)를 집중적으로 지원하고 BT-IT 융합형 신약개발 전문인력의 양성 등을 통해 신약개발에 소요되는 시간・비용을 절반 이상으로 단축하고자 한다.
(자) 바이오경제를 선도할 우수인재 육성방안
바이오산업 수요에 대응하는 인력의 역량제고와 선순환 생태계를 구축하기 위해 ‘바이오경제를 선도할 우수인재 육성방안(2018.12.)’을 수립하여, 교과과정 강화 및 진로탐색 지원, 핵심 연구인력 양성, 수요기반의 인프라 구축 등을 추진한다.
(차) 바이오헬스 산업 혁신전략
바이오헬스를 사람중심 혁신성장의 대표 산업으로 선언하고 수출 주력산업으로 육성하는 ‘바이오헬스 산업 혁신전략(2019.5.)’을 마련하여, 세계시장 점유율 3배 확대, 수출 500억 달러 달성, 일자리 30만 개 창출을 목표로 5대 빅데이터 플랫폼 구축, 2025년까지 R&D 투자를 연 4조 원으로 확대, 혁신 의약품・의료기기 R&D 등을 중점적으로 지원・육성할 계획이다.
(4) 규제 개선
과학기술정보통신부는 바이오 연구활동을 저해하는 규제를 개선하기 위해 ‘바이오 규제 선진화 TF(2017.10.)’를 운영하였으며 과학기술계 의견수렴, 국회 공청회 등을 통해 바이오 분야에서 ‘규제 개선이 시급한 10대 과제(국정현안점검조정회의 상정, 2018.6.)’를 선정하고 개선방안을 마련하였다.
이를 통해, 의료기기 시장의 진입을 촉진하기 위한 규제혁신 정책(2018.7.)을 마련하였으며, 뇌연구자원(시신 유래물)의 연구목적 사용 등을 위한 뇌연구촉진법 개정안(주호영 의원 대표발의, 2018.3.)을 발의하였다.
또한 국가생명윤리심의위는 유전자 치료 연구의 질환제한을 완화하고 DTC 유전자 검사서비스의 인증제를 도입하도록 권고(2018.12.)하였으며 이를 반영한 생명윤리법 개정안(윤일규 의원 대표발의, 2019.4.)을 발의하였다.
라. 주요사업
과학기술정보통신부는 미래유망 바이오 원천기술 개발을 목표로 관련 바이오분야 연구개발사업을 폭넓게 추진 중이다. 주요 사업으로는 바이오・의료기술개발사업, 뇌과학 원천기술 개발사업, 포스트게놈 신산업 육성을 위한 다부처 유전체사업, 범부처 전주기 신약개발사업, 혁신신약 파이프라인 발굴사업, 오믹스기반 정밀의료 기술개발 사업 등이 있으며 2019년 예산은 4,009억 원으로 2018년 대비(3,766억 원) 6.4% 증가하였다.
(1) 바이오의료기술개발사업
신약, 줄기세포, 첨단의료기반기술 등 미래유망 바이오 분야에 대한 연구개발을 통하여 고부가가치 창출이 가능한 핵심원천기술 확보 및 선진화 기반 확충을 목표로 2019년 2,657억 원을 투자하였다.
[표 2-3] 바이오의료기술개발사업 내역별 개요
|
내역사업 |
사업개요 |
|
신약개발 |
신약타깃검증 및 신약 기초물질 개발에서부터 신약 R&D 생산성을 향상시키는 기반기술개발에 이르기까지 글로벌 신약 개발 지원 |
|
차세대의료 기술개발 |
국민건강 이슈에 선제적으로 대응하고 의료현장의 수요를 반영, 헬스케어・의료기기 등 차세대의료기술 개발 |
|
줄기세포/조직재생 |
난치성 질환치료제 개발에 응용 가능한 줄기세포 요소기술(세포재생, 장기조직재생 기술 등) 개발 |
|
차세대바이오 |
생명현상 발현 관련 질환 제어 및 시스템생물학적 생체정보 해석 등 국민 삶의 질 향상을 위한 미래유망 차세대 바이오기술 개발 |
|
바이오인프라 |
생명연구자원(동물, 식물, 미생물 등)을 효율적으로 확보・등록・활용하고 활용분야 확대 등 생명연구자원 가치 제고 |
|
국가마우스표현형 분석기반구축사업 |
국내 바이오 연구 및 신약개발 분야 실험에 필수적인 유전자변형마우스(GEM) 자원의 생산 및 이를 활용한 질환 분석 |
|
전통천연물기반 유전자동의보감사업 |
전통천연물 기반으로 천연물 신약, 기능성 소재 등 개발을 위한 융복합원천기술개발 |
|
미래감염병 |
국가경제 및 국민건강에 위협이 되는 신・변종 및 해외유입 감염병 대응 역량 강화를 위한 핵심기술개발 |
|
바이오융복합 |
바이오 기술과 IT・NT 등 타 분야와의 융합을 통해 4차 산업혁명을 주도하는 바이오 융・복합 핵심원천기술 확보 |
|
미래의료혁신 |
의료현장을 중심으로 한 혁신형 공동연구 지원을 통해 개방형 혁신을 촉진하고 시장으로 연계되는 혁신기술 개발 |
|
첨단GW바이오 |
천연물・장내미생물・바이오에너지 등 향후 빠른 성장이 예상되는 그린・화이트바이오 분야 핵심기술 개발 |
(2) 뇌과학원천기술개발사업
태동기 유망분야인 뇌연구를 통해 뇌질환 예방・치료 기술, 신체장애 극복기술, 뇌기능 강화 기술 등의 뇌과학 핵심 4대 원천기술 확보 및 BT, IT, CS(인지과학) 융합을 통한 신시장 선점을 목표로 하며 2019년 515억 원을 지원하였다.
(3) 포스트게놈 신산업육성을 위한 다부처유전체사업
미래수요(맞춤의료 등)에 대비한 유전체 유망분야 기초・원천기술 확보 및 인프라 구축(과기정통부, 복지부, 산업부, 농림부, 산림청, 해수부, 농진청 공동 추진)을 목표로 하며, 2019년 147억 원을 지원하였다.
(4) 범부처 전주기 신약개발사업
부처 간 단절 없는 전주기적 신약개발 지원을 위해 3개 부처(과기정통부, 복지부, 산업부) 합동으로 출연한 ‘범부처신약개발사업단’을 통해 향후 시장성이 유망한 신약개발 프로젝트를 발굴하여 지원 및 관리하는 사업으로 2019년 95억 원을 지원하였다.
(5) 혁신신약 파이프라인 발굴사업
글로벌 수준의 혁신신약 개발을 위한 후보물질 파이프라인 발굴을 위해 대학・연구소 등을 대상으로 신약개발 초기단계를 지원하여 항암제, 당뇨치료제 등 기업에 기술이전이 가능한 유망 후보물질의 발굴을 지원하는 사업으로, 2019년 80억 원을 지원하였다.
(6) 오믹스 기반 정밀의료기술개발사업
유전체・단백체 등의 생체정보(오믹스)를 대량 분석하여 난치성 질환과 관계된 생체지표(바이오마커) 발굴 및 예측・진단기술을 개발하는 사업으로, 2019년 60억 원을 지원하였다.
마. 향후 계획
과학기술정보통신부는 국가 생명공학분야의 주무부처로서 생명공학분야의 핵심 원천기술을 확보하고 적극적인 R&D 투자와 정책 지원으로 바이오 경제시대를 준비하고 있다.
중장기 종합계획인 제3차 생명공학육성기본계획(바이오경제 혁신전략 2025, 2017∼2026)과 범부처 전략인 ‘바이오헬스 산업 혁신전략(2019.5.)’에 맞추어 바이오 분야의 정부 R&D 투자를 2025년까지 4조 원 이상으로 확대할 계획이다. 또한, 의약품, 의료기기, 재생의료 등을 중심으로 범부처 차원의 대형 프로젝트를 기획하여 기초원천→응용→사업화의 전주기 지원을 추진한다. 국내 우수 ICT 역량을 바이오헬스 전반에 접목해 데이터・AI 중심의 패러다임 전환에 대응하며 신기술・시장을 선점할 계획이다.
특히 기초연구 확대 기조(2017년 2조 6,000억 원→2025년 4조 원)에 맞춰 바이오헬스의 기초・응용 연구비를 균형 있게 확대하며 기초와 허리가 튼튼한 R&D 구조로 개편한다. 연구자 중심의 창의적 연구를 통해 10∼15년 후에 시장을 지배할 면역제어, 유전자가위, 마이크로바이옴 등의 원천기술을 개발할 계획이다.
또한 혁신적인 신약 후보물질 및 기술을 발굴하는 투자를 지속적으로 강화하고 빅데이터, AI, 3D프린팅 등 4차 산업혁명 시대를 대응할 차세대 융복합 의료기기를 개발하고 개인 맞춤형 정밀의료 및 첨단재생의료를 육성할 것이다.
아울러, 치매, 감염병, 바이오 플라스틱 등 국민생활 이슈를 해결하기 위해 치매극복 기술개발사업, A형 간염 등 바이러스, 항생제 내성 수퍼박테리아 등 핵심 원천기술을 확보하고, 플라스틱 오염으로부터 자유로운 생태계 조성을 위해 노력할 계획이다.
4차 산업혁명 시대를 선도하기 위한 바이오 생태계를 구축하기 위해 병원과 연계하여 100만 명 규모의 유전・임상・건강 빅데이터를 확보하고 인공지능, 인체장기 모사 조직 칩 등을 활용한 신약개발 플랫폼을 구축하여 신약개발 기간 및 비용(10년, 1조 원)을 획기적으로 단축하고 혁신형 의사과학자, 바이오데이터 전문가 등 핵심 연구인재를 육성하여 다가올 미래를 준비하고 세계 바이오 시장을 선점할 계획이다.
2. 생명공학 산업 육성
가. 개요
(1) 생명공학 산업
생명공학 산업(바이오산업)은 생명공학기술(Biotechnology)을 기반으로 생물체의 기능과 정보를 활용하여 제품 및 서비스 등 다양한 고부가가치를 생산하는 산업을 의미한다. 생명공학 산업은 일반적으로 분야에 따라 의약바이오(의약품 등), 산업바이오(바이오화학제품 등), 그린바이오(유전자변형생물체 등), 융합바이오(디지털 헬스케어 등)로 분류하고 있다. 생물체의 기능을 이용하여 제품을 만들거나 유전적 구조를 변형시켜 새로운 특성을 나타내게 하는 생명공학기술은 제약 산업, 농업, 화학 산업 등에 직접 응용될 뿐만 아니라 IT・NT 등의 기술과 융합하면서 그 적용 범위가 확대되고 있다.
특히, 최근 유전자분석기술, 생체신호 측정기술 등 다양한 생물체 분석 및 진단기술 발전과 함께 빅데이터 저장・분석기술, 인공지능(AI) 등 이른바 4차 산업혁명 기술의 급격한 발전으로 개인 맞춤형 치료・건강관리 등 새로운 제품과 서비스를 제공하는 신산업이 빠르게 등장하고 있다.
(2) 생명공학 산업 육성 필요성
생명공학 산업은 의약, 환경, 식품, 에너지, 농업, 해양 등 산업 전반에 걸쳐 성장을 주도함과 동시에 건강・식량・환경 문제 등 인류 난제를 해결함으로써 삶의 질을 향상시킬 수 있는 유망 산업으로 주목받고 있다. 그러나 다른 산업과 달리 생명공학 산업은 연구개발 중심의 기술집약적 산업으로 생명공학기술에 대한 기초연구에서부터 신제품 출시라는
산업화에 성공하기까지는 소요 기간이 길고 개발비용도 큰 반면, 성공 확률은 낮아 정부의 전략적 지원이 필요하다. 이러한 이유로 미국, 유럽, 일본, 중국 등 주요국들은 생명공학 산업을 핵심투자분야로 선정하여 산업화를 위한 중장기 계획을 수립하고 집중지원하고 있다.
전 세계적인 인구고령화와 건강에 대한 수요 증가를 고려하였을 때 생명공학 산업은 시장이 빠르게 확대될 것으로 기대되는 분야이다. 또한 미래성장가능성과 고용 효과가 크고, 국민건강에도 기여하는 미래 산업으로 각광받고 있다. 이에 정부는 생명공학 산업(바이오산업)을 3대 유망신산업으로 지정하고 적극 육성하고자 노력하고 있다.
나. 추진경과(연혁)
산업통상자원부는 과거 중기거점기술개발사업, 성장동력기술개발사업, 차세대신기술개발사업, 전략기술개발사업 등으로 분산되어 있던 R&D 사업구조를 2008년부터 통합하였고, 생명공학 산업 분야의 R&D도 바이오의료기기 산업핵심기술개발사업으로 일원화하여 운영하였다. 2016년부터는 바이오 분야와 의료기기 분야의 특성과 전문성을 고려하여 바이오의료기기 산업핵심기술개발사업을 바이오산업핵심기술개발사업과 전자시스템산업핵심기술개발사업으로 분리하여 운영 중이다.
또한, 산업통상자원부는 기존 석유화학 산업을 보완하고, 바이오공정 기술을 활용한 친환경 바이오화학 제품 개발 및 민간투자를 유도하고자 2014년부터 바이오화학 산업화촉진사업을 바이오산업 핵심기술개발사업의 내역사업으로 신설하여 바이오화학제품의 조기 산업화를 위해 기술개발을 지원하고 있다. 생명공학 산업에 대한 R&D 지원뿐만 아니라 생명공학기술의 산업화를 촉진하고 지속적인 산업성장의 생태계를 구축하기 위해 2016년 유망바이오 IP사업화촉진사업을 바이오산업 핵심기술개발사업의 내역사업으로 신설하여 바이오벤처 비즈니스 활성화에 필수 요소인 창업 활성화, 투자 유치, 기술사업화, 글로벌 파트너십을 지원하기 시작하였다.
다. 주요정책 및 사업
2019년 5월 정부는 ‘바이오헬스 산업 혁신전략’을 통해 ‘기술개발-인허가-생산-시장 출시’까지 전주기적인 지원정책을 발표하였다. 주요 내용으로는 바이오헬스 산업의 기술개발 생태계 조성을 위한 빅데이터 구축, 병원의 혁신거점화, 신약・의료기기 정부 R&D 확대 등이 있으며, 글로벌 수준의 인허가 규제 합리화를 위해 식약처 전문성 강화 및 인허가 신속 처리, 재생의료・바이오의약품 임상연구 활성화 및 안전관리 강화, 글로벌 스탠다드 관점의 규제 선진화 등이 있다. 또한 바이오헬스 생산활력 제고 및 동반성장을 위해 공동 IR, 창업지원 등 선도기업과 창업・벤처기업 협력체계를 구축하고, 전문인력 양성 및 전후방산업 동반성장을 지원할 계획이다. 2019년 산업통상자원부에서 지원하고 있는 분야 및 주요 사업 현황은 다음과 같다.
(1) 바이오산업 분야별 R&D 지원
(가) 바이오산업 핵심기술 개발
산업통상자원부는 세계 최고 수준의 바이오산업 핵심기술을 개발하고, 이를 기반으로 한 글로벌 사업화 제품출시를 목표로 의약바이오, 융합바이오, 산업바이오 등 주요 전략 분야별 정부정책 및 기업수요를 반영하여 글로벌 수준의 사업화・제품화 촉진 기술개발을 지원하고 있다.
의약바이오 분야에서는 개량 바이오의약품(바이오베터) 및 평가기반 기술개발을 통하여 바이오의약품의 제품화・검증을 지원한다. 융합바이오 분야에서는 융복합 헬스케어 서비스 개발 및 빅데이터 기반 플랫폼 기술 등 바이오기술에 기반을 둔 새로운 융복합 시장을 창출하며, 화학바이오 분야에서는 바이오매스를 활용한 친환경 화학제품 및 신소재 생산을 지원한다.
한편, 유망바이오IP 사업화 촉진 사업을 통해 기업, 대학, 연구소 등이 보유한 우수한 바이오 IP의 기술이전 및 제품화를 지원하고 최종 사업화 성공률 제고를 위해 중소기업의 글로벌 시장 진출 시 주요 애로사항인 기술이전・사업화 단계를 전략적으로 지원하고 있다.
(나) 전자시스템산업핵심기술개발
국가 성장전략 기반 의료기기 분야 핵심・첨단기술 개발에 대한 집중지원을 통해 미래 신산업 육성 및 산업경쟁력을 제고하고, 의료기기 개발 및 사업화에 필수적인 임상유효성 및 신뢰성 확보, 국내외 인허가 획득 지원을 통해 국산 의료기기 확산 촉진을 목적으로 하는 사업이다.
세부 지원 내용으로는 미래 신산업 육성을 위한 산・학・연・병원 협력 및 상시연계를 통한 첨단 융복합 의료기기 개발 지원, 대구경북・오송 첨단의료기기 개발지원센터의 기구축 첨단인프라를 활용한 제품 신뢰성 향상과 의료현장 맞춤형 제품개발, 국산 의료기기 해외시장 진출 촉진 및 경쟁력 강화를 위한 국가별 해외인증 획득 맞춤형 지원 등이 있다.
(다) 현장수요반영 의료기기 고도화 기술개발
산업통상자원부는 기업들이 병원(의료인) 수요를 기반으로 의료기기를 개발하여 제품화 성공률을 제고할 수 있도록 의료현장 수요를 반영한 의료기기 기술개발을 지원하고 있다. 동 사업은 아이디어 발굴 단계부터 제품기획, 시제품 제작, 임상시험, 인허가까지 전주기에 걸쳐 병원과 기업이 협력할 수 있는 지원체계를 구축하였다. 또한, 개발한 의료기기가 과제에 참여한 병원에서 사용될 수 있도록 과제 선발 단계부터 구매의사를 확인하는 등 병원들의 국산의료기기 사용률 제고에도 기여할 것으로 기대된다.
(라) 범부처 전주기 신약개발
동 사업은 2011∼2020년까지 산업부・복지부・과기부 공동으로 신약개발 및 제품화를 목표로 하는 범부처사업이다. 효과적인 신약개발 전주기 지원을 위해 (재)범부처신약개발사업단을 설립했으며, 사업단을 기반으로 신약개발 지원, 기술이전 촉진, 성과확산 및 관리 등을 수행하고 있다.
동 사업에서는 누적기준 SCI급 논문 60여 건 이상, 특허출원 300여 건 이상, 기술이전 40여 건 이상 및 기술이전료 약 7조 원(계약당시 기준) 등의 성과를 보이고 있으며, 미국 FDA 희귀의약품 지정 7건, 식약처 신약 시판 승인 허가 1건, 국가연구개발사업 우수성과 2건 등의 사업화에도 성과를 보여 명실공히 국가신약 개발 및 생태계 형성에 기여하고 있다. 사업 종료 후에도 별도의 범부처 사업추진을 통해 국내 신약개발 역량강화 및 성과창출을 계속할 예정이다.
(마) 인공지능・바이오・로봇의료융합기술개발
인공지능, 로봇기술 등 4차 산업혁명의 핵심기술이 융합된 ICT 융합 의료기기를 개발하는 사업이다. ‘기초・원천연구→제품개발→임상시험 및 허가’로 이어지는 전주기적 지원을 위하여 과기부, 산업부, 복지부, 식약처가 범부처 협력체계를 구축하고 있다. 중점 투자분야는 지능형 인체삽입형 의료기기, 스마트 진단・치료 통합솔루션, AI 기반 로봇 융합 의료기기이다.
동 사업은 4개 부처가 협업하여 의료기기 개발 전주기를 지원하는 사업인 만큼 사업화전문기관과 기술개발 지원기관이 상호 협력을 통해 진행하고 있다. 사업화전문기관은 중점 투자분야 기술에 해당하는 의료기기의 기술개발 및 제품화를 주도하며, 기술개발 지원기관은 시제품 제작 및 임상・인허가 컨설팅, 표준화, 신의료기술평가, 보험등재 등을 지원한다. 각 부처의 전문기관・설비인프라・지원인력・병원네트워크 등을 활용한 전주기 협력 관리체계 하에 기존에 없던 신기능이 구현된 혁신적인 의료기기 개발을 통해 새로운 산업생태계 창출이 기대된다.
(바) CDM 기반 정밀의료데이터 통합 플랫폼 기술개발
산업통상자원부는 보건복지부와 공동으로 의료기관별 각기 관리하고 있는 의료데이터를 공통데이터모델(CDM)로 표준화하고, 비식별화된 의료데이터를 분석하여 이를 활용한 비즈니스 모델을 개발하기 위해 올해부터 CDM 기반 정밀의료데이터 통합 플랫폼 기술개발을 지원한다. 의료기관 데이터의 활용을 저해하는 요소를 기술적으로 해소할 수 있는 분산형 빅테이터 분석 플랫폼을 구축하고, 의료정보 뿐 아니라 다양한 유전체, 생체정보 데이터를 연계・분석하여 개인 맞춤형 의료・건강관리 서비스 등 여러 서비스 비즈니스 모델을 발굴・사업화까지 연계할 계획이다.
(2) 바이오산업의 지속성장 생태계 구축
최근 국내 바이오기업은 대규모 기술이전 등 가시적 성과를 나타내고 있으나 우수한 기술을 산업화하기 위한 비즈니스 기반 및 성공경험은 여전히 부족한 기업들이 많아 기술력을 보유한 기업의 사업화를 촉진하고 지속적인 성장의 기반이 되는 산업 생태계 조성이 필요하다. 이에 산업통상자원부는 바이오 사업화촉진지원 사업을 통해 바이오벤처 창업 활성화 지원, 국내외 바이오 비즈니스 네트워크 구축을 통한 바이오벤처의 기술이전 및 투자유치, 바이오산업 생태계 활성화를 위한 정책 콘텐츠 개발 등을 지원하고 있다.
또한, 바이오인력양성 사업을 통해 생명공학기술의 산업화 가속에 따른 바이오공정기술인력 수요와 BT-IT-NT 융합 추세에 따른 전문 인력의 수요 증가에 대응한 인력양성도 지속 확대해 나가고 있다.
(3) 바이오분야 국제협약이행
산업통상자원부는 바이오분야의 다양한 국제협약에 대한 국가의무를 이행하기 위해 관련 법령 및 사업을 수행, 관리하고 있다.
첫째, 생물다양성협약(CBD: Convention on Biological Diversity) 중 하나인 바이오안전성의정서(카르타헤나의정서)는 생물다양성 보존을 위하여 유전자변형생물체(LMO: Living Modified Organisms)로 인한 환경 및 인체건강에 대한 악역향을 방지하는 국제협약이다. 이러한 국제협약에 대한 국내이행법인 ‘유전자변형생물체법’을 제정・관리하고 있으며, 용도별로 관계부처와 함께 위해성 심사 등을 통해 LMO에 대한 안전관리 업무를 수행하고 있다.
둘째, 나고야의정서는 유전자원의 이용으로부터 발생하는 이익의 공정하고 공평한 공유를 목적으로 하는 국제협약이다. 이러한 국제협약을 기반으로 제정된 유전자원법(환경부 주관)의 국가점점기관으로서 관계부처와 함께 유전자원 보호 및 이용에 힘쓰고 있으며, 특히 산업용 유전자원에 대한 국가 관리를 담당하고 있다.
셋째, 생물 및 독소무기의 개발・생산・비축 등을 금지할 목적으로 발효된 생물무기금지협약(BWC: Biological Weapons Convetion)의 국내 이행법인 ‘생화학무기금지법’을 관리하고 있다. 생물작용제 등은 생물무기 용도와 질병예방・치료 등 평화적 용도로 사용될 수 있는 이중용도(dual-use) 물질이어서 생물무기 전용 가능성의 사전억제와 산업적 활용가치 고려 등의 균형점을 고려하는 것이 필요하다. 현재 산업부는 총 67종의 생물작용제에 대해 수입・인수・제조・폐기・수출 등의 전주기 관리를 통해 생물무기 용도로의 전용방지와 산업활성화를 목표로 관련 법령 및 사업을 전개하고 있다.
(4) 생물자원의 산업적 활용 지원
산업통상자원부는 바이오산업의 발전을 견인하는 원천 재료인 생물자원의 중요성을 인식하고 ʻ생명연구자원의 확보・관리 및 활용에 관한 법률ʼ의 시행계획에 따라 바이오 연구개발 사업과의 연계를 지원하고 있다. 지난 2017년에는 산업부 유전체 정보센터로 한국생명공학연구원에 ‘한국바이오안전성정보센터(KBCH)’를 지정하여 2018년 생명정보 등록을 위한 시스템을 구축하였으며, 2019년부터 한국바이오협회를 통해 산업체 중심 유전체 데이터 분석 역량 고도화 플랫폼 개발을 지원 중이다.
또한 글로벌 수준의 천연물 원료의 생산시설과 품질관리 시스템 구축 및 프로그램 운영, 천연물 원료 기업의 해외수출 지원, 해외자원 확보를 위한 네트워크 구축을 위해 충북테크노파크를 통해 ‘천연물 원료제조 거점시설 구축사업’을 완료하였다. 또한, 환경에 구애받지 않는 천연 원료를 상시 공급하기 위하여 식물 조직배양 기술을 활용하여 천연 원료를 대량생산할 수 있는 ‘천연물 조직배양 상용화 시설 구축사업’을 지원하고 있다. 이를 통해 국제 규격에 적합한 생물자원 원료생산, 품질관리, 인허가 국내외 시장 확보 등 천연물 원료 산업 분야에 특화된 지원 시스템이 구축될 것으로 기대된다.
(5) 지역바이오 활성화 기반구축
산업통상자원부는 생명공학 산업의 저변 확대 및 경쟁력 강화 등을 목적으로 1998∼2010년까지 지역특성을 바탕으로 지역바이오산업 지원 클러스터(특화센터)를 구축하였으며, 지역 센터별 차별화, 특성화를 통한 지역경제 활성화를 선도해 오고 있다. 현재 전국에 위치한 총 22개의 바이오특화센터가 기 구축된 인프라 시설을 활용하여 기업의 성장을 위한 기술사업화・인력양성・네트워킹・마케팅 지원에 집중하고 있다.
최근 바이오산업이 국가 핵심 산업으로 급속히 성장하면서 지역에 특화된 바이오산업 경쟁력 강화를 위한 지역 신규 사업에 대한 수요가 급격히 증가하고 있다. 이러한 지역의 바이오산업의 지속성장과 발전을 위해 산업통상자원부와 지역의 바이오특화센터가 행정적・재정적 지원을 통해 유기적이면서 선도적으로 지역바이오 산업 활성화에 기여하고 있다.
지역바이오 기업의 규모를 고려해 볼 때 국내외 바이오산업 시장의 수요에 대응한 자생적 활성화의 어려움이 내재하므로, 지역의 기술혁신역량 강화와 사업화 촉진을 지원해 온 지역 바이오 기반구축사업을 지속적으로 지원해 나갈 예정이다.
[표 2-4] 지역별 바이오 인프라 현황
|
권역별 |
연번 |
센터명(소재지) |
중점분야 |
특화분야 |
|
충청권 |
1 |
대전TP 바이오산업지원센터(대전) |
의약 |
생물의약 기능성식품 |
|
2 |
충북TP 바이오센터(충북오창) |
의약, 식품 |
의약소재 기능성식품 |
|
|
3 |
충북TP 한방천연물센터(충북제천) |
한방, 식품 |
한방제품 한약제제 |
|
|
4 |
충남TP 바이오센터(충남예산) |
식품, 소재 |
기능성식품 화장품 |
|
|
호남권 |
5 |
천연자원연구센터(전남장흥) |
전통, 소재 |
천연물소재, 기능성 규명 |
|
6 |
식품산업연구센터(전남나주) |
전통, 식품 |
건강기능성식품 |
|
|
7 |
생물의약연구센터(전남화순) |
의약 |
세포・유전자 |
|
|
8 |
생물방제연구센터(전남곡성) |
그린, 방제제 |
생물방제, 생물농약 |
|
|
9 |
전라북도생물산업진흥원(전북전주) |
전통, 식품 |
건강기능성식품 |
|
|
10 |
발효미생물산업진흥원(전북순창) |
전통, 식품 |
발효, 미생물 |
|
|
동남권 |
11 |
진주바이오산업진흥원(경남진주) |
전통, 식품 |
바이오식품, 생물화학 |
|
12 |
부산TP 해양생물산업육성센터(부산) |
해양, 식품 |
해양생태독성 해양기능성식품 |
|
|
13 |
김해산업진흥의생명융합재단(경남김해) |
의료기기 |
비전자의료기기, 융합부품소재 |
|
|
대경권 |
14 |
대구TP 바이오헬스융합센터(대구) |
전통, 식품 |
전통생물소재, 액상식품 |
|
15 |
대구TP 한방산업지원센터(대구) |
전통, 한방 |
한약재효능검증,한방임상평가 |
|
|
16 |
경북바이오산업연구원(경북안동) |
전통, 식품 |
일반식품, 건강기능식품 |
|
|
17 |
환동해산업연구원(경북울진) |
해양, 식품 |
해양・식품・바이오소재 |
|
|
18 |
포항TP 바이오정보지원센터(경북포항) |
바이오소재효능검증 |
화장품 효능검증 |
|
|
강원권 |
19 |
춘천바이오산업진흥원(강원춘천) |
의약, 소재 |
건강기능식품 생물의약소재 |
|
20 |
강릉과학산업진흥원 해양바이오사업단(강원강릉) |
해양, 식품 |
기능성식품, 바이오화장품 |
|
|
21 |
원주의료기기테크노밸리(강원원주) |
의료기기 |
첨단의료기기 |
|
|
제주권 |
22 |
제주TP 바이오융합센터(제주) |
화장품 |
천연소재향장 |
|
23 |
제주TP 용암해수산업화지원센터(제주) |
해수 |
용암해수 담수화장비 |
|
|
경기권 |
24 |
경기도경제과학진흥원 바이오센터(경기수원) |
의약 |
신약개발 지원 |
라. 향후 계획
4차 산업혁명 시대를 맞아 생명공학 산업도 빠르게 변화하고 있다. 개인의 의료정보, 유전체정보, 라이프로그(생체정보) 등 바이오 빅데이터와 인공지능이 결합해 경험 기반의 범용 제품과 서비스에서 데이터 기반의 개인 맞춤형 제품과 서비스로 진화하고 있다. 이러한 급격한 산업환경 변화에 대응하여 국내 생명공학 산업이 글로벌 경쟁력을 확보할 수 있도록 산업통상자원부는 선제적인 지원을 해 나갈 예정이다.
바이오 빅데이터를 기반으로 새로운 비즈니스가 조기에 창출될 수 있도록 데이터 활용 체계를 구축해 나가고, 빅데이터를 활용한 다양한 유망 서비스를 발굴해 시범사업 등을 지원해 나갈 예정이다. 또한 빅데이터 및 유전체 정보를 활용한 맞춤 신약개발 및 디지털 헬스케어 산업 육성을 적극 지원해 나갈 계획이다. 더불어, 바이오산업 전후방산업이 함께 성장할 수 있도록 향후 원부자재, 장비 등 국산화 기술개발에도 박차를 가할 것이다.
3. 생명공학 기초과학진흥
가. 개요
최근 유전체학/단백체학 및 세포체학/대사체학 연구 등에서 급속한 진전을 보이고 있는 생명공학은 우리의 미래 생활에 큰 변화를 주도하고 있으며, 우리 삶의 질 향상에 크게 기여하고 있다. 의약품 개발, 진단・세포/유전자 치료법 기술 개발, 유전체 대량 분석과 정보를 활용한 난치병 예방・진단・치료법 기술 개발, 세포 치료제 개발 등으로 인해 많은 질병을 치료하고 수명을 연장하는 길이 열리고 있다.
생명공학의 성과는 생물학, 생화학, 생리학, 생물물리학 등 관련 기초생명과학의 다양한 실험에서 기인한 성과로 관련 분야의 기초과학 발전이 있었기에 가능한 것이었다. 최근의 생명공학분야에서 코스닥 상장기업의 성장 등의 사례에서 보듯이 많은 연구자들은 기초과학을 통해 개발한 항암제 후보물질, 항비만 신약 후보물질 등을 기업으로 기술이전 및 상용화 추진에 노력하고 있다. 이를 통해 볼 때, 미래유망 분야에 대한 핵심원천기술개발 확보 및 선진화 기반 확충을 위해 추진되고 있는 바이오・의료기술개발사업 및 첨단의료기반기술개발 등과 같은 연구개발사업도 기초과학의 선행이 전제되어야 한다고 할 수 있다.
나. 정부의 기초연구진흥 추진 과정
OECD에서 발간된 프라스카티 매뉴얼(Frascati Manual, 2015)에 따르면 기초연구는 ‘어떤 특정한 응용이나 사용 계획 없이 현상들이나 관찰 가능한 사실들의 근본 원리에 대한 새로운 지식을 얻기 위해 행해진 실험적 또는 이론적 작업’으로 정의된다. 기초연구는 세부적으로 순수 기초연구와 목적 기초연구로 나뉘는데, 순수 기초연구는 ‘경제사회적 편익을 추구하거나, 연구결과를 실제 문제에 적용하거나, 또는 연구 결과의 응용을 위한 관련 부문으로의 이전 없이 지식의 진보를 위해서만 수행되는 연구’로 정의되며, 목적 기초연구는 ‘이미 알려졌거나 예상되는 현재 또는 미래의 문제와 가능성에 있어, 그 해결책의 기초가 되는 광범위한 지식기반의 마련을 위해 수행되는 연구’로 정의된다.
기초연구는 특정 목표나 목적에 초점을 두는 응용연구나 새로운 제품・공정의 생산, 기존 제품과 공정의 개선 등을 목적으로 하는 개발연구와 대비된다. 기초연구-응용연구-개발연구 간에는 상호 많은 정보와 지식의 흐름으로 인해 개발연구가 기초연구에 지식을 제공하기도 하며, 기초연구가 새로운 상품이나 공정으로 이어지기도 한다.
2004년 과학기술부(現 과학기술정보통신부)에 ʻ과학기술혁신본부ʼ를 설치하고 부총리급으로 격상하여 과학기술 컨트롤 타워를 강화하였다. 과학기술부의 기초연구 사업은 정부 간 합의를 거쳐 3개 유형으로 나누고 부처 간 역할분담을 하였다. 교육인적자원부(現 교육부)는 순수 기초연구와 기초과학기반구축사업을 주관하였고, 과학기술부는 목적기초연구를 주관하였다. 응용연구 사업의 경우 산업자원부(現 산업통상자원부)와 정보통신부(現 과학기술정보통신부)에서 주관하도록 조정하였다. 이와 더불어 교육인적자원부는 대학연구의 제도 및 기반을 구축하고 대학의 우수 연구 인력양성을 지원하는 역할도 담당하였다.
정부는 기초연구의 진흥을 위한 여건 조성을 위하여 기초연구에 관하여 ①대학교수, 연구원 등 관계 전문가의 연수 및 연구비 지원, ②석사 및 박사 과정 학생의 연구・장학금 지원, ③연구교수(연구조교 포함)제도, 교수의 연구휴가제도, 객원교수제도 및 객원연구원제도의 활용, ④대학의 연구시설 및 기자재 지원, ⑤대학부설연구소 및 우수연구집단 형성 지원, ⑥대학, 국공립 연구기관, 정부출연연구기관, 기업부설 연구소와의 공동연구, 인력교류, 연구 시설・장비 공동 활용 등 산업계・학계 및 연구소 간의 교류 촉진, ⑦기업 등의 대학 기초연구 지원 촉진, ⑧그 밖에 기초연구환경 조성 및 기초연구기반 구축에 필요한 사항 등을 의무적으로 마련하도록 기초연구진흥 및 기술개발지원에 관한 법률 제7조에 명시하고 있다. 또한 동 법에 따라, 기초연구진흥종합계획 및 시행계획을 수립하여 국가의 기초연구진흥을 위한 정책적 노력을 계속해 나가고 있다.
2008년 2월 교육인적자원부와 과학기술부의 통합으로 교육과학기술부가 출범하였다. 두 기관의 통합은 2009년 관련 연구지원 통합기관인 한국연구재단의 출범과 더불어 기초연구에 관한 다양한 정책이 일관성 있게 추진될 수 있는 기회를 제공하였다. 2013년 미래창조과학부(現과학기술정보통신부)의 출범으로 창조적 기초연구 추진전략이 마련되어 상상력・창의력을 기반으로 한 과학기술과 ICT의 융합을 바탕으로 기초연구진흥을 추진하였다.
2017년 문재인정부 출범 및 2018년 제4차 기초연구진흥종합계획(2018∼2022) 수립을 통해 연구자 주도 기초연구지원 예산 2배 확대, 연구 자율성 보장 등을 단계적으로 추진해 나가고 있으며, 이를 통해 기초연구 과제 수혜율이 확대되고 창의적 아이디어 기반의 창의적・도전적 연구에 매진할 수 있는 연구자 친화적 연구환경이 조성될 것으로 기대된다.
다. 과학기술정보통신부의 기초연구지원 현황
과학기술정보통신부와 한국연구재단은 우리나라 연구력의 근본이라 할 수 있는 기초연구를 중점 지원하고 있다. 기초연구 지원은 개인 및 소규모 공동연구를 지원하는 ‘개인연구’, 우수 연구 인력을 조직화하여 지원하는 ‘집단연구’, 전문연구정보 및 연구 인프라를 지원하는 ‘기반구축’으로 구분하여 연구자 역량단계 및 참여연구원 규모에 따른 세부 프로그램을 통해 추진되고 있다.
생명공학분야 기초연구는 한국연구재단 기초연구본부의 생명과학단, 의약학단, ICT・융합연구단에서 지원하고 있으며, 대단위 국책연구사업의 경우 한국연구재단 국책연구본부 생명공학팀에서 지원하고 있다. 이 중에서도 생명공학 분야는 기초연구본부 생명과학단과 관련성이 높으며, 1) 분자생물학, 신경생물학, 발생생물학, 유전자발현, 면역학 등의 분자생명분야, 2) 세포생물학, 유전학, 생화학, 생리학, 식물학, 미생물학 등의 기초생명분야, 3) 생물공학, 식량작물 및 원예작물, 동물자원학, 수의학, 식품학 등의 기반생명 분야를 지원하고 있다. 이를 통해 생명과학의 메커니즘 연구를 집중 수행하는 생명 과학자를 양성하고, 노벨상 수상 수준으로 연구역량을 제고하며, 관련 연구기반을 확충하여 미래 첨단 기초생명과학 연구를 선점하고자 한다.
(1) 기초연구지원 사업 현황
[표 2-5] 과학기술정보통신부 기초연구지원 사업내용(2018∼2019)(단위: 백만 원)
|
사업 |
2018년 예산 (A) |
2019년 예산 (B) |
증감액 (B-A) |
증감률 |
|
|
합계 |
982,520 |
1,211,357 |
228,837 |
23.3% |
|
|
【개인연구】 |
773,012 |
979,600 |
206,588 |
26.7% |
|
|
우수 연구 |
ㅇ리더연구 |
53,407 |
55,205 |
1,798 |
Δ0.8% |
|
ㅇ중견연구 |
533,592 |
647,027 |
113,435 |
21.3% |
|
|
ㅇ신진연구 (최초혁신실험실 포함) |
139,645 |
143,368 |
3,723 |
2.7% |
|
|
생애 기본연구 |
ㅇ재도약연구 |
- |
20,000 |
20,000 |
순증 |
|
ㅇ기본연구 |
- |
60,000 |
60,000 |
순증 |
|
|
ㅇ생애첫연구 |
46,368 |
54,000 |
7,632 |
16.5% |
|
|
【집단연구】 |
198,845 |
221,025 |
22,180 |
11.2% |
|
|
ㅇ선도연구센터 |
128,959 |
151,044 |
22,085 |
17.1% |
|
|
-이학분야(SRC) |
33,713 |
37,994 |
4,281 |
12.7% |
|
|
-공학분야(ERC) |
49,851 |
55,910 |
6,059 |
12.2% |
|
|
-기초의과학분야(MRC) |
33,565 |
40,765 |
7,200 |
21.5% |
|
|
-융합분야(CRC) |
11,830 |
13,000 |
1,170 |
9.9% |
|
|
-지역특화분야(RLRC) |
- |
3,375 |
3,375 |
순증 |
|
|
ㅇ기초연구실 |
69,886 |
69,981 |
95 |
0.1% |
|
|
【기반구축】 |
10,663 |
10,732 |
69 |
0.6% |
|
|
ㅇ 전문연구정보활용 |
2,100 |
1,850 |
Δ250 |
Δ11.9% |
|
|
ㅇ 기초연구실험데이터글로벌허브구축 |
2,565 |
2,777 |
212 |
8.3% |
|
|
ㅇ 유럽핵입자물리연구소(CERN)협력 |
4,417 |
4,741 |
324 |
7.3% |
|
|
ㅇ 해외대형연구시설활용연구지원 |
1,581 |
1,364 |
Δ217 |
Δ13.7% |
|
과학기술정보통신부는 신진연구→중견연구→리더연구 등 역량단계별로 개인연구를 지원하고 있다. 2016년부터 연구자 맞춤형 지원제도를 도입하여 연구자가 필요한 연구비, 연구기간을 신청할 수 있도록 유연하게 개선하였다. 아울러, 2019년부터는 생애기본연구를 신설하여 많은 연구자가 안정적으로 연구를 수행할 수 있는 환경을 조성하였다. 집단연구는 기초연구실→선도연구센터 등 규모별로 지원하고 있으며, 기초연구기반구축 사업을 통해 생물학연구정보센터(BRIC) 등 연구 인프라를 지원하고 있다.
(2) 생명공학분야 사업 지원 현황
2018년 정부에서 이공분야에 지원하는 총 R&D 투자액 중 생명공학 분야 범주에 속하는 생명과학, 농림수산, 보건의료 부문에 지원되는 총투자 금액은 3조 5,494억 원으로 정부R&D 투자액의 19.2%를 차지하고 있다.
[표 2-6] 과학기술표준분류별 투자 추이(2018)(단위: 억 원, %)
|
구분 |
금액 |
비중 |
|
수학 |
821 |
0.4 |
|
물리학 |
5,490 |
3.0 |
|
화학 |
3,326 |
1.8 |
|
지구과학 |
5,351 |
2.9 |
|
생명과학 |
8,262 |
4.5 |
|
농림수산식품 |
1조 2,509 |
6.8 |
|
보건의료 |
1조 6,845 |
9.1 |
|
기계 |
3조 2,039 |
17.4 |
|
재료 |
6,433 |
3.5 |
|
화공 |
4,313 |
2.3 |
|
전기 / 전자 |
1조 7,520 |
9.5 |
|
정보 / 통신 |
1조 8,267 |
9.9 |
|
에너지 / 자원 |
9,948 |
5.4 |
|
원자력 |
5,035 |
2.7 |
|
환경 |
4,882 |
2.6 |
|
건설 / 교통 |
8,459 |
4.6 |
|
과학기술과 인문사회 |
8,225 |
4.5 |
|
기타 |
1조 6,863 |
9.1 |
|
합계 |
18조 4,588 |
100 |
출처: 2018년도 국가연구개발사업 조사・분석 보고서
2018년 신진연구를 통해 신청 및 선정된 생명과학 분야별 과제 현황은 다음 표와 같다. 신진연구는 이공학 분야 교원 및 연구원 중 박사학위 취득 7년 이내 또는 만 39세 이하의 신진연구자를 대상으로 최장 5년간 연평균 1억 원 이내를 지원하는 사업이다. 초기 연구실 구축 등이 필요한 신진연구자 특성을 감안하여 별도 심사를 통해 1년간 0.5∼1억 원을 연구환경 구축비로 추가 지원한다.
[표 2-7] 신진연구 중 생명과학분야 중분야별 선정 현황(2018)(단위: 건)
|
구분 |
신진연구 |
||
|
신청 과제 수 |
선정 과제 수 |
||
|
분자생명 |
분자생물학 |
12 |
2 |
|
신경생물학 |
10 |
2 |
|
|
발생생물학 |
7 |
1 |
|
|
유전자발현 |
14 |
5 |
|
|
감염생물학 |
6 |
1 |
|
|
노화암생물학 |
26 |
5 |
|
|
면역학 |
15 |
4 |
|
|
기타 |
9 |
1 |
|
|
소계 |
99 |
21 |
|
|
기초생명 |
세포생물학 |
13 |
3 |
|
유전학 |
17 |
4 |
|
|
생화학 |
8 |
3 |
|
|
생리학 |
11 |
3 |
|
|
미생물학 |
14 |
3 |
|
|
기타 |
34 |
9 |
|
|
소계 |
97 |
25 |
|
|
기반생명 |
식량작물 및 원예작물 |
13 |
4 |
|
응용생물화학 |
11 |
3 |
|
|
농림생태환경 |
7 |
1 |
|
|
동물자원학 |
16 |
4 |
|
|
수의학 |
18 |
3 |
|
|
수산학 |
13 |
3 |
|
|
식품학 |
31 |
8 |
|
|
영양학 |
14 |
6 |
|
|
기타 |
26 |
4 |
|
|
소계 |
149 |
36 |
|
|
총합계 |
345 |
82 |
|
중견연구는 이공학 분야 교원(전임・비전임) 및 공공・민간연구소 연구원을 대상으로 최장 5년간 연평균 4억 원 이내를 지원하는 사업으로 2018년 신청 및 선정된 생명과학 분야별 과제 현황은 다음 표와 같다.
[표 2-8] 중견연구 중 생명과학분야 중분야별 선정 현황(2018)(단위: 건)
|
구분 |
중견연구 |
||
|
신청 과제 수 |
선정 과제 수 |
||
|
분자생명 |
분자생물학 |
33 |
7 |
|
신경생물학 |
30 |
9 |
|
|
발생생물학 |
30 |
7 |
|
|
유전자발현 |
32 |
6 |
|
|
분자생명 |
감염생물학 |
11 |
4 |
|
노화암생물학 |
73 |
15 |
|
|
면역학 |
31 |
6 |
|
|
기타 |
21 |
6 |
|
|
소계 |
261 |
60 |
|
|
기초생명 |
세포생물학 |
37 |
7 |
|
유전학 |
25 |
5 |
|
|
생화학 |
20 |
6 |
|
|
생리학 |
23 |
4 |
|
|
미생물학 |
41 |
9 |
|
|
기타 |
66 |
18 |
|
|
소계 |
212 |
49 |
|
|
기반생명 |
식량작물 및 원예작물 |
28 |
8 |
|
응용생물화학 |
32 |
6 |
|
|
농림생태환경 |
22 |
4 |
|
|
동물자원학 |
25 |
3 |
|
|
수의학 |
40 |
10 |
|
|
수산학 |
19 |
4 |
|
|
식품학 |
60 |
13 |
|
|
영양학 |
27 |
4 |
|
|
기타 |
37 |
9 |
|
|
소계 |
290 |
61 |
|
|
총합계 |
763 |
170 |
|
4. 생명공학 인력양성
가. 개요
정부는 ‘기초연구진흥 및 기술개발지원에 관한 법률’에 따라, 5년 주기로 기초연구 진흥에 관한 중장기 정책목표와 방향 설정을 위한 ‘기초연구진흥종합계획’을 수립하여 시행하고 있으며, 2022년까지 연구자 주도 기초연구 예산 2조 5,000억 원을 목표로 매년 투자를 확대해가고 있다.
[표 2-9] 정부 R&D 중 기초연구비 투자 추이(단위: 조 원, %)
|
구 분 |
2013 |
2014 |
2015 |
2016 |
2017 |
|
정부 R&D예산 |
16.9 |
17.7 |
18.9 |
19.1 |
19.4 |
|
정부 기초연구비 |
4.06 |
4.68 |
4.99 |
5.20 |
5.46 |
|
(정부 R&D 중 비중) |
(35.4) |
(37.1) |
(38.1) |
(39.0) |
(40.2) |
|
연구자 주도 기초연구비* |
1.02 |
1.02 |
1.07 |
1.10 |
1.26 |
|
(정부 R&D 중 비중) |
(6.0) |
(5.8) |
(5.7) |
(5.8) |
(6.5) |
|
(정부 기초연구비 중 비중) |
(25.1) |
(21.8) |
(21.4) |
(21.2) |
(23.3) |
* 과기정통부 및 교육부의 기초연구사업(개인연구, 집단연구, 이공학학술연구기반구축)
출처: 제4차 기초연구진흥종합계획, 2018.6.29.
정부의 기초연구 확대 기조 속에 교육부는 생명공학 분야의 경쟁력 확보를 위해서는 장기적 관점에서 연구의 지속가능성이 중요하다고 판단하고, 기초연구 분야에 대한 저변 확대와 우수 연구인력의 양성에 보다 정책 역량을 집중하고자 하였다.
특히 이러한 장기적 관점의 연구역량 제고에서는 무엇보다 생명공학 분야의 선진국과 같이 대학이 연구와 인력 양성에 핵심적인 역할을 담당할 필요가 있기 때문에 대학의 연구역량을 강화하기 위해 노력하고 있다.
나. 추진경과
교육부는 대학의 연구역량 강화를 위해 1982년부터 박사후연구자의 연구경험을 축적하고자 학문후속세대를 지원하고 있으며, 국가 연구역량 제고를 위한 연구저변 확대를 위해 1989년부터 풀뿌리 기초연구를 지원해오고 있다.
1999년부터는 미래 인재 양성을 위한 대학원의 교육・연구역량 강화 기반 조성을 위한 BK21사업을 시작하여 현재 BK21플러스 사업까지 지속하고 있으며, 대학연구소의 특성화・전문화 유도 및 전임 연구인력 확충을 위해 대학중점연구소를 지원해 오고 있다.
아울러 2008년부터는 의과학자 육성지원 사업을 시작하여 미래 성장 동력인 바이오산업 분야 경쟁력 확보를 위한 중개연구를 활성화하고, 이를 수행할 의과학자를 적극 양성해 오고 있다.
다. 주요정책
교육부는 인력양성 총괄 부처로서 다양한 초・중등에서 대학에 걸쳐 전주기적 인재 양성을 지원하고 있다. 특히 최근에는 생명공학 등 과학기술 분야에 대한 중요성이 높아짐에 따라 초・중등교육에서 융합인재교육(STEAM: Science, technology, engineering, arts and mathematics)을 통해 실생활 문제를 창의적으로 해결하는 방법으로 과학에 대한 흥미도를 제고하고 있으며, 이는 과학기술 선도 인재 양성의 초석이 되고 있으며, 이와 함께 고등교육 단계에서도 고급인력을 양성하기 위한 노력을 기울이고 있다.
교육부는 다양한 생명공학 분야에 대한 개인 및 대학 연구소 단위의 균형 잡힌 기초연구를 지원하여 연구 저변을 지속적으로 넓혀 나감과 동시에 석・박사 연구 인력에 대한 연수기회 부여, 연구경험 제공 및 장학금 지원을 통해 미래 한국을 책임질 학문후속세대를 육성해 나가고 있다.
라. 주요사업
(1) 기초연구지원사업
교육부는 2018년 이공학개인기초연구 지원사업에 3,484억 원, 학문후속세대 및 대학중점연구소 지원사업에 1,039억 원으로 총 4,524억 원을 투자하여 이공학분야의 기초연구가 보다 활성화될 수 있도록 노력하였다.
[표 2-10] 교육부 기초연구지원사업(단위: 백만 원, %)
|
사업명 |
2017년 예산 (A) |
2018년 예산 (B) |
증감 |
||
|
차액(B-A) |
증감률(%) |
||||
|
이공학개인기초연구 |
303,400 |
348,491 |
45,091 |
12.9 |
|
|
|
기본연구 |
261,492 |
303,168 |
41,676 |
13.7 |
|
보호연구 |
1,250 |
1,533 |
283 |
18.5 |
|
|
지역대학우수과학자 |
40,658 |
43,790 |
3,132 |
7.2 |
|
|
이공학학술연구기반구축 |
84,091 |
103,980 |
19,889 |
19.1 |
|
|
|
대학중점연구소 |
27,729 |
38,123 |
10,394 |
27.3 |
|
학문후속세대 |
56,362 |
65,857 |
9,495 |
14.4 |
|
|
합계 |
387,491 |
452,471 |
64,980 |
14.4 |
|
(가) 이공학개인기초연구지원
교육부는 이공학개인기초연구지원을 통해 이공학분야 개인연구자에게 5,000만 원 내외의 연구비를 폭넓게 지원하여 생명공학 분야 연구자가 창의적이고 혁신적인 연구에 전념할 수 있는 환경을 제공하고 있다. 세부사업인 기본연구 지원을 통해 풀뿌리 개인기초연구를 폭넓게 지원하고 있으며, 보호연구 지원을 통해 국가차원의 보호육성이 필요한 분야를, 지역대학우수과학자 지원을 통해 지역의 연구역량제고 및 우수인력 양성을 지원하고 있다.
[표 2-11] 이공학개인기초연구사업 생명공학분야 지원 현황(단위: 개, 백만 원)
|
분야 |
2017년 |
2018년 |
||
|
지원과제 수 |
사업비 |
지원과제 수 |
사업비 |
|
|
분자세포생물학 |
300 |
12,969 |
341 |
15,197 |
|
유전학・유전공학 |
184 |
8,145 |
218 |
9,608 |
|
발생・신경생물학 |
70 |
3,138 |
75 |
3,491 |
|
면역학・생리학 |
43 |
1,947 |
47 |
2,168 |
|
분류・생태・환경생물학 |
69 |
2,988 |
74 |
3,200 |
|
생화학・구조생물학 |
26 |
1,123 |
34 |
1,479 |
|
융합바이오 |
9 |
372 |
9 |
408 |
|
생물공학 |
78 |
3,363 |
89 |
3,952 |
|
산업바이오 |
34 |
1,464 |
40 |
1,903 |
|
바이오공정・기기 |
6 |
246 |
8 |
346 |
|
생물유해성 |
3 |
137 |
3 |
113 |
|
기타생명과학 |
51 |
2,225 |
58 |
2,602 |
|
계 |
873 |
38,117 |
996 |
44,467 |
(나) 이공학학술연구기반구축
교육부는 이공학학술연구기반구축사업을 통해 생명공학분야를 포함한 이공학분야의 연구 기반 확충을 지원하고 있다. 세부사업인 대학중점연구소지원사업을 통해서는 대학부설연구소의 인프라 지원을 통해 대학의 연구거점을 구축하고, 대학연구소의 특성화・전문화를 유도하며 중점연구소를 통해 우수 신진연구인력이 육성될 수 있도록 지원하고 있다. 학문후속세대 지원을 통해 이공학분야 박사 후 연구자에게 국내외 대학 및 연구소에서의 연수 기회를 제공하여 학술연구의 지속성 유지 및 연구 능력의 질적 향상을 유도하고 있다.
[표 2-12] 이공학학술연구기반구축사업 생명공학분야 지원 현황(단위: 개, 백만 원)
|
분야 |
2017년 |
2018년 |
||
|
지원과제 수 |
사업비 |
지원과제 수 |
사업비 |
|
|
분자세포생물학 |
141 |
7,069 |
145 |
7,024 |
|
유전학・유전공학 |
58 |
3,440 |
62 |
3,416 |
|
발생・신경생물학 |
37 |
1,762 |
40 |
1,944 |
|
면역학・생리학 |
20 |
1,258 |
16 |
1,088 |
|
분류・생태・환경생물학 |
18 |
1,683 |
27 |
2,187 |
|
생화학・구조생물학 |
11 |
514 |
10 |
460 |
|
융합바이오 |
2 |
592 |
1 |
550 |
|
생물공학 |
29 |
2,243 |
23 |
1,546 |
|
산업바이오 |
9 |
1,493 |
14 |
1,694 |
|
바이오공정・기기 |
1 |
98 |
1 |
130 |
|
기타생명과학 |
19 |
1,277 |
23 |
1,534 |
|
계 |
345 |
21,429 |
362 |
21,573 |
(다) 주요성과
2017년도 교육부 학술연구지원사업 성과분석보고서에 따르면, 2017년 생명공학 분야에서 발표한 SCI 논문은 987건, 상위 10% 논문은 112건이고, 특허 출원은 186건, 등록은 74건이었다.
[표 2-13] 생명공학 분야 SCI 논문 발표 현황(단위: 개)
|
분야 |
2016년 |
2017년 |
||
|
전체 |
상위10% |
전체 |
상위10% |
|
|
이공학개인기초연구 |
687 |
56 |
719 |
77 |
|
이공학학술기반구축사업 |
288 |
42 |
268 |
35 |
출처: 각 연도별 주요 연구개발사업 성과분석보고서 기초 자료
[표 2-14] 생명공학 분야 특허 출원・등록 현황(단위: 개)
|
분야 |
2016년 |
2017년 |
||
|
출원 |
등록 |
출원 |
등록 |
|
|
이공학개인기초연구 |
125 |
48 |
120 |
53 |
|
이공학학술기반구축사업 |
58 |
14 |
66 |
21 |
출처: 각 연도별 주요 연구개발사업 성과분석보고서 기초 자료
(2) 고급인력 양성사업
2013년 9월부터 추진하고 있는 BK21 플러스 사업에서는 농생명 및 생명공학 분야 사업단(팀)에 약 576억 원을 투자하여, 약 6,500여 명의 대학원생에게 연구장학금, 국제화경비 등을 지원하였다. 또한 2018년 성과점검평가 추진 시 의약학, 농・생명 등 분야 평가지표를 별도로 적용하여 각 분야의 특성을 반영한 질적 성과를 제고하였다. 이를 통해 생명공학분야 연구성과의 사회적 기여를 증진하고, 산학협력을 활성화할 수 있을 것으로 기대하고 있다.
[표 2-15] BK21 및 BK21플러스 사업 지원 현황(단위: 개, 백만 원)
|
분야 |
BK21 |
BK21 플러스 |
||
|
지원 과제 수 |
사업비 |
지원 과제 수 |
사업비 |
|
|
농생명 분야 |
30 |
3,232 |
39 |
16,229 |
|
생물학 분야 |
15 |
12,317 |
23 |
13,105 |
|
약학 등 분야 |
22 |
2,862 |
15 |
9,264 |
|
응용생명 분야 |
17 |
14,972 |
16 |
3,685 |
|
의학/치의/한의학 분야 |
18 |
2,645 |
23 |
15,338 |
|
계 |
102 |
36,028 |
116 |
57,621 |
주) BK21사업은 2012년, BK21플러스는 2018년 지원액 기준임.
[표 2-16] BK21 플러스 성과점검 평가 지표(의약학, 농・생명・수산・해양 분야) 특징(2018)
|
분야 |
평가지표 특징 |
|
의약학 |
기초 의약학 연구 활성화를 위한 연구지표 강화, 사회적 기여 지표 신설 |
|
농・생명・수산・해양 |
연구진(참여교수 등) 구성의 우수성 강조, 산학협력 지표 강화 |
의약학 및 생명과학 분야에 특화한 의과학자 육성지원 사업도 추진 중이다. 의과학자 과정(의사면허증(M.D/DDS)과 박사학위(Ph.D)를 동시에 또는 연계하여 취득하는 과정)을 이수하는 153명의 우수 전문대학원생에 등록금 전액과 연간 500만 원의 교육연구비를 최대 7년간 장기 지원하여 전문 임상경험과 기초의학 연구력을 겸비한 신진 의과학자로 양성하고 있다.
마. 향후 계획
교육부는 기초연구 진흥과 인력양성을 담당하는 부처로서 생명공학 분야의 연구와 인력양성을 위한 지원을 확충하는 것이 무엇보다 필요하다. 기초연구와 인력양성 간 긴밀한 연계를 통해 시너지를 창출하기 위한 노력을 강구해야 하며, 특히 이러한 시너지가 가장 효과적으로 나타날 수 있는 현장이 대학이므로 대학에 대한 지원을 확대할 필요가 있다.
아울러 교육부는 생명공학 분야 중에서 장래에 성장가능성이 있으나 현재 투자가 미흡한 분야나 다른 분야의 성장을 위해서는 반드시 필요한 기반 분야 등 민간에서 투자가 소홀할 수 있는 부분을 적극적으로 발굴하고 정책적인 배려를 해 나갈 예정이다.
5. 농림축산식품분야 생명공학 육성
가. 개요
농림축산식품 분야의 생명공학, 즉 그린바이오 기술은 농업의 부가가치와 생산성을 높이고 안전한 친환경 먹거리 생산에 기여하여 지속가능한 농업 기반 마련에 핵심적인 역할을 하고 있다. 육종기술, 분자생물학, ICT 융복합 기술 및 빅데이터 분석 등 다양한 기술이 농업 분야와 결합하여 새로운 기회를 창출하고 있으며 이러한 과학기술에 기반을 둔 스마트 농업은 기존 농업의 한계를 극복하고 신성장분야로 주목받고 있다.
농림축산식품부(농식품부)는 생명공학의 근간이 되는 농업생명자원의 체계적인 보존・관리 및 활용 기반 마련, 농생명 빅데이터 확충, 고부가가치 농생명 소재 개발 및 융복합 혁신 기술에 대한 R&D 지원과 관련 산업 인프라 구축 등 종합적인 정책 추진을 통해 농업생명공학 기술 및 산업 경쟁력을 강화할 계획이다.
나. 추진경과
농림축산식품 분야의 과학기술 육성정책은 농촌진흥청(농진청)의 1991년 ‘제1차 농업과학기술 중장기 연구개발 계획’을 시작으로 2009년 ‘농림식품 과학기술육성법’ 제정에 따라 부・청 공동계획인 ‘농림식품과학기술 육성 종합계획’수립과 함께 현 체계가 마련되었다. 현재 제2차 종합계획(2015∼2019)에 따라 매년 시행계획을 수립하여 연구개발 지원을 추진하고 있으며 향후 2019년 연말까지 제3차 종합계획을 수립해 미래 농업 수요를 반영한 효율적 농업 과학기술 육성정책을 마련할 계획이다. 농촌진흥청의 ‘농업과학기술 중장기 연구개발 계획’과 ‘농업생명공학육성 중장기 기본계획’은 각각 제7차 및 제4차 계획이 수립되어 시행되고 있다.

[그림 2-1] 농림축산식품분야 생명공학 육성정책 체계
다. 주요정책
농식품부와 농진청, 산림청은 농업생명공학 분야에 다양한 연구개발 및 산업 지원 정책을 추진하고 있으며 특히 고부가가치 생물소재 개발, ICT 융복합 기술육성, 지속가능한 농업을 위한 기술개발을 주요 목표로 하고 있다.
첫째, 농업생명자원을 이용한 고부가가치 생물소재 연구 개발 및 산업 육성을 지원한다. ‘금보다 비싼 종자 개발’을 모토로 골든 시드 프로젝트(GSP: Golden Seed: 글로벌 종자 강국 도약과 종자 산업 기반 구축을 위한 농식품부・해양수산부・농진청・산림청 공동의 국가 전략형 종자 R&BD사업)를 비롯해 유망 품종 육성을 위한 다양한 연구개발을 지원하고 있다. 가축, 곤충, 미생물, 산림자원 등을 이용한 다양한 기능성 생물소재 연구개발도 지원하고 있다.
또한 농업생명자원법을 개정하여 농생명 기술개발 및 관련 산업 지원을 위한 법적 근거를 강화하고 곤충(14종)을 가축에 포함하도록 축산법 시행규칙 위임 고시 ‘가축으로 정하는 기타 동물’을 개정하는 등 제도개선을 추진하고 있으며 민간육종연구단지, 곤충종자보급센터, 농축산용 미생물산업육성지원센터 등 관련 산업 인프라도 구축하고 있다.
둘째, ICT 기술 융복합을 통해 데이터 기반 스마트 농업을 육성한다. 스마트팜 ICT 기자재 및 생육모델 R&D 지원, 장비 표준화, 빅데이터 수집, 분석 체계 마련 등을 추진하고 있으며 관련 기술 검증과 개선을 위한 실증단지를 포함한 스마트팜 혁신밸리를 구축하여 융복합 기술혁신의 거점으로 육성하고 있다.
셋째, 지속가능한 농업을 위한 기술개발을 지원한다. 미생물, 곤충 등을 활용한 친환경농업 생산, 자원 재활용, 폐비닐・농약 등 유해물질 분해기술 등을 연구하고 있으며 이 외에도 에너지 절약 및 신재생 에너지 생산・활용 기술, 농업생물다양성 보존 등 다양한 R&D 지원을 통해 지속가능한 농업 기반을 마련하고 있다.
라. 주요사업
농식품부, 농진청, 산림청은 생명산업기술개발, 첨단생산기술개발, 골든시드 프로젝트 등 생명공학 기술 분야에 2018년 기준 28개 사업에 총 3,145억 9,900만 원을 투자하였다. 이는 농림축산식품 R&D 전체 예산(8,731억 2,100만 원) 중 약 36%에 달하는 규모로, 농업 R&D의 핵심 축을 이루고 있다.
농림축산식품부의 주요 생명공학 육성사업은 다음과 같으며, 농식품부는 농정 이슈, 기술・산업 동향, 기존 사업 일몰 등에 대응하여 지속적으로 새로운 R&D 사업을 발굴해나갈 계획이다.
(1) 농생명산업기술개발
기존 농림기술개발사업에서 농생명자원의 부가가치 제고와 산업육성을 집중적으로 지원하기 위해 2011년 농생명산업기술개발로 분리하여 추진 중에 있다. 농생명자원의 부가가치를 제고하기 위한 핵심기술 개발과 농생명자원의 생산・관리 고도화에 필요한 기술개발을 중점적으로 지원하고 있다. 앞으로는 생물소재를 이용한 친환경 농자재 및 고부가가치 농생명소재 개발을 지원하기 위한 신규 R&D 사업을 기획・추진할 예정이다.
(2) 고부가가치식품기술개발
‘식품산업 R&D 중장기계획수립(2009)’ 따라 기존 농림기술개발사업에서 식품부문을 분리・확대하여 2010년부터 추진하였다. 농축산업과 식품산업의 동반성장과 우리 식품산업의 국제경쟁력 제고를 위한 핵심응용기술 분야(기능성 전통식품, 식품 품질관리기술, 식품 핵심소재 및 식품기자재 개발 등)를 집중 지원하고 있다.
(3) 첨단생산기술개발
시장개방에 대응하여 우리 농산업의 첨단화・자동화를 촉진시키고 농기계・농자재・농업시스템 등의 기술개발을 지원하기 위해 2011년 시작되었다. 농업용 무인헬기 등 첨단 농기계, 발열필름 등 첨단 농자재 등은 물론, ICT 기술을 접목한 첨단 농업시스템과 관련된 기술개발을 지원하고 있다. 앞으로는 4차 산업혁명 시대의 혁신기술로 주목받는 인공지능, 사물인터넷, 빅데이터, 3D 프린팅, 로보틱스 등을 접목하여 농업 분야의 난제를 해결하기 위한 기술개발 영역을 발굴・지원할 예정이다.
(4) 골든시드 프로젝트
농생명 산업의 근간이 되는 종자(seed)에 대한 주권을 확보하고 나아가 종자산업을 수출전략산업으로 육성하기 위해 예비타당성조사를 거쳐 2012년 부・청 공동사업으로 착수하였다. 금(Gold)값 보다 비싼 종자를 개발한다는 목표로 식량・원예・채소・종축・수산종자 등 5개의 사업단 체제로 운영하여 2016년 사업 1단계(2012∼2016)가 종료되고 현재 2단계(2017∼2021) 사업을 추진하고 있다.
(5) 작물 및 미생물 유전체 연구
주요작물 및 미생물 등을 대상으로 유전체 해독 및 정보분석과 이를 통한 유용유전자 및 분자마커 발굴 연구를 수행하고 있다. 국제공동연구를 통하여 벼, 배추, 무 유전체 완전해독에 참여하였으며 현재는 들깨, 배, 국화 등 국내 주요작물에 대한 신규 및 비교유전체 연구를 추진하고 있다. 유전체분석으로 생산된 빅데이터는 생물정보 통합분석시스템이 구축된 농업생명공학정보센터(NABIC)를 통해 대학, 연구소, 산업체 등에 대국민 서비스를 제공하고 있다.
(6) 식물유전자원관리 및 활용성 제고기술 개발
식물유전자원의 활용체계 구축을 위해 국내외 유용자원의 전략적 확보를 통해 24만 6,000 자원에 대한 국가등록번호를 부여하였고 특히 우즈벡, 러시아, 조지아 등과의 국가협력사업을 통해 다양성을 확보하였다. 보존자원의 지속적 활용을 위해 저활력, 소량자원에 대한 증식과 영양체(감귤류, 국화, 마늘 등) 및 단명종자(인삼, 양파 종자 등)에 대한 초저온동결보존을 통해 장기보존 체계를 구축하였다. 또한 유전자원의 유용자원 발굴을 위해 농업적 형질, 성분 및 기능성, 내병성 및 재해저항성 등의 특성평가를 수행하였다. 수요자에게 유용정보 제공을 위해 누리집 및 농업유전자원 정보 시스템의 고도화를 추진하여 연간 1만여 자원 이상의 분양을 실시하고 있다. 나고야의정서 비준(2017.8.)에 따른 종자산업 및 농생명바이오산업의 지원을 강화하기 위해 산・학・연 공동사업을 통해 농업생명자원의 유용형질 특성평가를 추진하고 있다.
(7) BT 이용 고부가 가축 생산기술 개발
분자생물학 및 체세포복제와 같은 첨단 생명공학기술과의 기술융합을 통해 축산을 고부가가치 신성장동력산업으로 육성하기 위해 1990년부터 추진 중인 사업이다. 사람에게 이식 가능한 장기 및 각종 조직을 공급하기 위한 바이오이종장기용 형질전환돼지 개발, 바이러스 저항성 미니항체단백질 및 저항성 가축 개발, 사람질병 기초연구 및 신약검증을 위한 사람질환 모델가축 개발 등의 성과를 달성하였다. 사례로 돼지의 각막을 원숭이에 이식하여 4마리가 6개월 생존하였으며 그 중 1마리는 2년 2개월 이상 생존하고 있는 등 실질적인 성과를 거두었고, 추가실험을 통해 국제임상기준 충족을 추진하고 있다. 또한 정부 운영 우수 특수목적견을 복제 생산하여 정부기관에 보급하였다.
향후 다양한 면역반응 유전자가 제어된 바이오이종장기용 돼지 개발을 통한 돼지-영장류 이종장기 이식기술, 이종간 면역거부반응 억제기술, 사람질환모델 중소가축을 활용한 유전질병 교정(치료)기술 개발, 항바이러스 단백질 기능검증, 유용단백질 등 바이오의료용 소재 생산성 향상을 위한 벡터 기술 등의 분야를 지속적으로 지원할 계획이다. 이와
함께 이종이식에 필수조건인 병원균 제어 바이오이종장기용 형질전환 돼지 생산시스템을 구축해 나갈 것이다.
(8) 동물유전정보 활용 실용화 기술 개발
재래가축의 유전체 해독 및 표준유전체 지도 작성, 가축의 바이오마커 개발 및 실용화, 유용 유전자 발굴 및 생물신소재 개발을 위하여 농업과학기술연구개발사업으로 추진하고 있다. 그동안 한우 동일성 검사 방법, 한우 고기 판별기술 등을 실용화하였고 한우, 재래돼지, 오골계, 제주마등 재래가축에 대한 표준유전체 지도를 작성하고, 한우 및 돼지의 경제형질 관련 바이오마커의 개발 및 산업재산권을 확보하였다. 미래 대비 축산분야 신규 수요 가치 창출을 위하여 반추위 미생물 유래 섬유소 분해효소 유전자를 발굴하는 등의 성과를 거두었으며, 최근에는 4차 산업혁명에 대비하기 위한 동물유전체 빅데이터 구축 및 분석기술을 개발하고 있다. 향후 농업분야에서 이러한 가축의 동물유전체 빅데이터가 정밀육종, 정밀사양 등 축산 현장에서 활용될 수 있도록 실용화하는 연구를 지속적으로 추진해 나갈 것이다.
(9) 산림과학연구
산림자원의 지속가능한 조성・이용 및 선순환적 가치 확산을 위해 1949년부터 시작된 산림 분야 대표 연구개발 사업이다. 건강하고 안전한 산림생태계의 유지・증진, 산림생명자원의 보존・육성 및 이용 활성화를 위한 기술개발과 산림산업을 육성하기 위한 기반기술, 산림복지 증진을 위한 연구개발을 지원하고 있다.
(10) 산림생명자원 소재발굴 연구
산림 내 미활용되고 있거나, 잠재가치가 큰 산림생명자원 소재를 발굴・고부가가치화하기 위해 2017년부터 새롭게 착수한 사업이다. 자생 산림생명자원(산채류, 목본, 버섯류 등)
으로부터 새로운 기능성 소재 탐색, 효능 구명 및 유효성분 함량 증대 기술개발 등을 지원한다.
(11) 융복합 기반 임산업의 신산업화 기술개발
임업과 산림의 안정적인 자원공급 기지화 및 미래 신산업・시장 창출을 위해 2016년부터 새롭게 착수한 사업이다. ICT 등 융복합 첨단기술개발과 임산업 기반의 6차 산업 모델 및 고부가가치화 기술 분야를 2020년까지 중점 지원한다.
마. 향후 계획
향후 농식품부는 제3차 농림식품과학기술 육성 종합계획을 수립하여 농업 분야의 중장기 R&D 비전을 제시하고, 특히 고부가가치 농생명소재, 스마트팜, 첨단육종기술 등 유망 농업생명공학 분야에 전략적 투자 확대를 추진할 계획이다. 이러한 첨단 기술육성을 통해 농업생산성 및 농산물 부가가치 향상, 친환경 저투입 농업, 데이터 기반 정밀농업 등 농업 혁신을 이룩하고 국민에게 안전하고 건강한 먹거리를 공급하는 지속가능한 농업의 저변을 확대할 것이다.
|
기관명 |
사업명 |
사업기간 |
2018 실적 |
2019 예산 |
|
농림축산 식품부 |
농생명산업기술개발 |
’94∼’20 |
34,250 |
23,903 |
|
고부가가치식품기술개발 |
’10∼’19 |
32,508 |
20,981 |
|
|
첨단생산기술개발 |
’11∼’21 |
30,678 |
28,505 |
|
|
수출전략기술개발 |
’11∼’19 |
16,551 |
13,010 |
|
|
농림축산식품연구센터지원 |
’10∼’20 |
7,989 |
7,794 |
|
|
가축질병대응기술개발 |
’12∼계속 |
13,347 |
13,581 |
|
|
농림축산 식품부 |
포스트게놈 다부처 유전체사업 |
’14∼’21 |
4,775 |
6,355 |
|
골든시드 프로젝트 |
’12∼’21 |
20,450 |
26,199 |
|
|
소계 |
|
160,548 |
140,328 |
|
|
농진청 |
작물 및 미생물 유전체 연구 |
’90∼계속 |
1,239 |
694 |
|
기능성물질 생산 유전자 소재 발굴 및 개량 |
’90∼계속 |
892 |
562 |
|
|
BT 이용 농업형질 개선 기반기술 및 활용 |
’90∼계속 |
1,065 |
659 |
|
|
GM작물 안전성 평가기술 및 평가시스템 확립 |
’90∼계속 |
911 |
615 |
|
|
식물유전자원 관리 및 활용성 제고기술 개발 |
’90∼계속 |
6,465 |
4,319 |
|
|
BT 이용 고부가 가축 생산기술 개발 |
’90∼계속 |
2,337 |
2,135 |
|
|
동물유전정보 활용 실용화 기술 개발 |
’90∼계속 |
1,548 |
1,382 |
|
|
농생물게놈활용연구사업 |
’11∼’20 |
8,271 |
8,287 |
|
|
농업생명공학연구 |
’11∼’20 |
8,471 |
8,487 |
|
|
동물분자유전육종사업 |
’11∼’20 |
7,255 |
7,269 |
|
|
식물분자육종사업 |
’11∼’20 |
8,955 |
8,972 |
|
|
농생명바이오식의약소재개발사업 |
’11∼’20 |
9,387 |
9,405 |
|
|
시스템합성 농생명공학사업 |
’11∼’20 |
8,467 |
8,483 |
|
|
포스트게놈다부처유전체사업 |
’14∼’21 |
7,660 |
7,690 |
|
|
우장춘프로젝트 |
’10∼’19 |
3,010 |
3,017 |
|
|
소계 |
|
75,933 |
71,976 |
|
|
산림청 |
융복합 기반 임산업의 신산업화 기술개발 |
’16∼’20 |
8,410 |
8,412 |
|
산림과학연구 |
’49∼계속 |
41,786 |
40,615 |
|
|
산림생물종연구 |
’08∼계속 |
14,810 |
14,428 |
|
|
산림생명자원 소재발굴 연구 |
’17∼’21 |
5,202 |
5,201 |
|
|
소계 |
|
70,208 |
68,656 |
|
|
|
합계 |
|
306,689 |
280,960 |
출처: 농림축산식품부
6. 보건의료분야 연구개발 지원 정책
가. 개요
(1) 필요성
우리나라는 고령화 사회 가속화, 기대수명의 증가, 질병의 다양화 등으로 의료수요가 증가하고 있어, 바이오헬스분야는 성장이 예상되는 주요한 산업 중 하나로 부상하고 있다. 조선, 자동차산업 등 기존 주력산업의 성장이 정체를 보이고 있는 반면 바이오산업은 가파른 성장세를 이어가고 있다. 일자리 창출에서도 제약・의료기기 등 제조업과 보건의료서비스 분야에서 최근 5년 간 17만 개의 일자리가 증가했으며 그만큼 고용기여도도 높다.
세계 최고 수준인 ICT 기반 의료 및 병원시스템, 반도체, 의・약학 인재 등 첨단산업을 운영한 경험을 가진 우리나라는 최근 가시적인 성과를 도출하고 있다. 신약 기술이전은 지난해 5조 3,000억 원을 기록하며 전년 대비 4배 성장하고, 제약・의료기기 등 수출은 144억 달러로 전년 대비 19% 증가해 사업화 초기 성과가 나타나고 있다.
따라서 우리정부는 4차 산업혁명 시대 혁신성장을 선도할 수 있는 보건의료 연구개발 시스템을 구축하고, 보건의료 산업을 육성하고자 노력 중이다. 국가 간 연구자원 및 인프라 개방・공유를 통해 기술혁신을 가속화하고 건강한 삶 구현, 사회문제 해결, 데이터 기반 연구개발 등을 핵심전략으로 제시하고 국가적으로 대응하기 위해 중장기 계획을 수립・추진 중이다.
(2) 보건복지부 연구개발 사업 추진체계
보건복지부에서는 매년 보건의료 연구개발 통합시행계획을 수립하여 보건의료기술정책심의위원회 심의를 받아 시행하고 있으며, 이후 3개 전문기관(한국보건산업진흥원, 국립보건연구원, 국립암센터)이 연구개발 사업을 관리・수행하고 있다.

[그림 2-2] 보건복지부 연구개발 사업 추진체계
나. 추진경과
‘보건의료기술진흥법’에 근거한 정부 법정계획인 제1차 보건의료기술육성 기본계획(2013∼2017)이 종료됨에 따라 제1차 계획의 성과와 정책여건 분석 및 국민의 목소리를 종합적으로 고려하여 제2차 보건의료기술육성 기본계획(2018∼2022)을 수립하였다. 제1차 기본계획(2013∼2017) 연구개발에서는 산업별 세계시장 확대에 중점을 두었다면 2차 기본계획(2018∼2022)은 보건의료문제 해결을 위한 공공성 강화에 중점을 두었다. 고령화, 감염병 등 고비용 보건의료문제에 국가적으로 대응하여 더 건강한 삶과 의료의 지속가능성 확보를 위한 대안을 창출하고자 민・관 합동 중장기전략기획단을 구성(2017.3.∼12.)하여 기본계획을 수립하였고, 관계 부처 협의・작성(2017.11.), 보건의료기술정책심의위원회의 보고(2017.5., 2017.12.)를 거쳐 ‘국가과학기술자문회의’ 심의로 확정(2018.4.)하였다.
이 외에 바이오헬스 선도국가로 나아가기 위한 관계부처 합동 ‘바이오헬스산업 혁신 전략’을 발표하였다. 제약・바이오를 중심으로 한 바이오헬스 산업의 기술개발부터 인허가, 생산, 시장출시 단계까지 전 주기 혁신 생태계를 조성한다는 전략 아래, 제약・의료기기 업계 간담회(2018∼2019.5., 총15회), 규제개선 TF(2018.5.∼7.), 바이오헬스 발전전략 TF(2019.1.) 등을 통해 현장 의견을 수렴하였다.
2019년 5월 22일 문재인 대통령은 바이오헬스산업 발전으로 사람 중심 혁신성장을 실현하는 ‘바이오헬스 국가 비전 선포식’을 직접 주재하고 전략을 발표하였다. 바이오헬스가 경제성장과 일자리 창출은 물론, 혁신적인 치료제 개발 등 국민 생명과 건강을 보장하기 위한 핵심 산업으로 보고, 이를 차세대 선도 산업으로 육성해 나갈 계획이다.
다. 주요정책
(1) 제2차 보건의료기술육성기본계획(2018∼2022)
보건복지부 제2차 보건의료기술육성기본계획은 ‘보건의료기술진흥법’ 제4조에 근거한 정부 법정계획으로 8개 중앙행정기관(7부, 1처)4)이 참여하여 보건의료기술 진흥에 관한 중장기 목표, 기본방향 및 중점과제 등을 수립한다. 개방・융합을 통한 혁신적 연구개발 시스템으로 4차 산업혁명을 뒷받침하고, 좋은 일자리・새로운 성장동력 창출을 위한 신산업 육성 추진 전략 및 중점 과제에 해당하는 관계 부처 연구개발 및 정책 사업을 대상으로 한다.
2차 기본계획(2018∼2022)은 보건의료문제 해결을 위한 공공성 강화에 중점을 두고 있다. 국민의 목소리를 반영하고 해결요구 문제에 전략적으로 투자하여 연구 성과 실용화를 촉진하며, 연구개발 사업 중심의 관리보다 보건의료 정책・기술・인프라・규제의 종합적 접근을 통해 연구개발과 정책 간 연계성을 높였다. 다음 3대 전략을 중심으로 9대 중점과제를 추진하고 있다.
첫째로 보건의료 주요 문제 해결 연구개발 투자 및 예방・관리 중심 미래의료 대응을 위한 정밀의료, 디지털 헬스케어 기반 구축 강화의 공익적 가치중심 연구개발 투자강화를 추진한다. 또한, 의료정보・연구자원의 연계・활용・활성화를 위한 플랫폼 고도화, 법・제도적 기반 마련 및 연구개발 단계 간 연계 강화 연구개발 혁신시스템 구축을 목표로 한다. 마지막으로 미래 신산업 선점을 위한 기술개발 투자 확대 기반을 마련하고, 우수 연구개발 성과물 사업화 촉진을 위한 법・제도・규제 측면의 지원을 강화하고자 한다.
보건복지부는 제2차 보건의료기술육성기본계획과 정책의 연계성 강화를 위해 2019년도 통합시행계획을 수립하여, 총 44개 연구개발 사업에 총 4,670억 원 규모의 예산을 지원하고 있다. 주요 사업내용은 다음과 같다.
공익적 가치 중심의 연구개발 투자 강화를 위해 1,793억 원을(2019년 기준) 지원 중이며, 치매, 정신건강, 감염병 등 고비용 보건의료문제 해결 및 제약・바이오산업을 혁신성장으로 육성하는 것을 주요 내용으로 한다. 정부는 향후 5년간 치매, 정신건강, 환경성 질환, 감염병, 국민의료비 절감 연구 등 5대 고비용 보건의료문제 해결을 위한 전략적 투자를 추진한다. 특히 향후 10년간 약 1조 원 규모의 국가 치매극복 연구개발 사업을 기획・추진
[표 2-18] 보건의료기술육성기본계획 비전 및 목표
|
비전 : 보건의료기술 혁신으로 국민 모두가 건강한 내일 |
|||
|
목표 |
현재 |
|
미래 |
|
1. 건강수명 연장 |
73.2세('15) |
⇨ |
76세('22) |
|
2. 보건산업 수출 증대 |
117억 달러('17) |
⇨ |
210억 달러('22) |
|
3. 신규 일자리 창출 |
17만 명('16) |
⇨ |
27만 명('22) |
|
|
|
|
|
|
3대 전략 및 9대 중점과제 |
|||
|
3대 전략 |
9대 중점과제 |
||
|
1. 공익적 가치 중심의 R&D 투자 강화 |
1. 고비용 보건의료문제 해결, 전략적 R&D 투자 |
||
|
2. 질환・계층・남북 주민 간 건강 형평성 강화 |
|||
|
3. 예방・관리 중심의 미래의료 기반 확충 |
|||
|
2. 개방・연결・융합을 통한 R&D 혁신 |
4. 보건의료 연구자원의 개방・공유 강화 |
||
|
5. 연구・정책협력 네트워크 강화 |
|||
|
6. 혁신 뒷받침 R&D 지원시스템 |
|||
|
3. 좋은 일자리 창출을 위한 미래신산업 육성 |
7. 혁신성장을 선도하는 미래형 신산업 육성 |
||
|
8. R&D 성과의 가치 성장 촉진 |
|||
|
9. 신산업 육성을 지원하는 글로벌 수준의 규제 합리화 |
|||
하는 것을 목표로 하고 있다. 또한 첨단 재생의료 임상연구 활성화 및 바이오의약품 신속 출시를 지원할 수 있는 법률 마련 등 미래의료 기반을 확충할 계획이다.
예방・관리중심의 미래의료 기반 확충을 위한 보건의료 빅데이터 보호 및 연계・활용, 지역 거점 병원 중심의 연구협력 네트워크 구축, 연구 전 단계에 걸친 평가・관리제도 개선 등 혁신을 뒷받침하는 연구개발 지원시스템 구축에 1,372억 원(2019년 기준)을 지원하고 있다.
마지막으로 좋은 일자리 창출을 위한 미래 신산업 육성을 위하여 1,503억 원(2019년 기준)을 지원 중이다. 신약・의료기기 연구개발을 범부처 사업으로 개편하고 글로벌 수준의 규제 합리화로 제약・바이오・의료기기 산업을 미래 신산업으로 육성하고자 한다. 동 계획은 2022년까지 국민 건강수명 3세 연장과 제약・의료기기・화장품 산업 신규 일자리 10만 개 창출을 목표로 한다.
[표 2-19] 보건복지부 R&D 사업 예산(단위: 백만 원)
|
사업명 |
2019 예산 |
|
|
한국보건산업진흥원 |
환자중심 의료기술 최적화연구 등 33개 사업 |
347,753 |
|
질병관리본부(국립보건원) |
감염병 관리기술 개발연구 등 7개 사업 |
74,913 |
|
국립암센터 |
암 연구소 및 국가 암관리 사업본부 주요사업 |
33,433 |
|
첨단의료복합단지 |
첨단의료복합단지 기반기술구축 등 2개 사업 |
5,460 |
|
국립재활원 |
재활연구개발용역사업 |
5,367 |
|
총계 |
466,926 |
|
출처: 2019년도 보건의료통합시행계획 자료 재구성
(2) 바이오헬스산업 혁신전략
보건복지부와 관계부처는 바이오헬스 산업 발전을 위해 ‘사람중심 혁신성장’의 비전을 수립하고, 수출 확대의 경제 활력 제고 및 일자리 창출, 혁신적 신약・의료기기, 치료기술 개발을 통한 희귀난치질환 극복과 국민의 생명・건강 보장을 목표로 바이오헬스 산업 혁신전략을 발표하였다. 정부는 비메모리 반도체, 미래형 자동차와 함께 바이오헬스를 차세대 3대 주력산업 분야로 육성하여, 세계시장 선도기업 창출 및 산업생태계를 조성할
[표 2-20] 바이오헬스산업 혁신전략 비전 및 목표
|
비전 : 바이오헬스 산업 발전으로 사람중심 혁신성장 실현 |
||||||
|
목표 |
현재 |
|
미래 |
|||
|
1. 혁신신약・의료기기 세계시장 점유율 3배 확대 |
제약・의료기기 등 세계시장 점유율(%) |
|||||
|
1.8('18) |
⇨ |
3('22) |
⇨ |
6('30) |
||
|
2. 바이오헬스 산업을 5대 수출 주력산업으로 육성 |
제약・의료기기 등 수출액(억 달러) |
|||||
|
144('18) |
⇨ |
200('22) |
⇨ |
500('30) |
||
|
3. 신규 일자리 30만 명 창출 |
바이오헬스 일자리(만 명) |
|||||
|
87('18) |
⇨ |
97('22) |
⇨ |
117('30) |
||
|
바이오헬스산업 혁신전략 주요 과제 |
||||||
|
기술개발 |
바이오헬스 기술혁신 생태계 조성 |
|||||
|
1. 5대 빅데이터 플랫폼 구축 2. 병원 혁신 거점화 3. 신약・의료기기 정부 R&D 4. 금융・세제 지원 |
||||||
|
인허가 |
글로벌 수준의 인허가 규제 합리화 |
|||||
|
1. 식약처 전문성 강화 및 인허가 신속 처리 2. 바이오의약품 안전관리 강화 3. 글로벌 관점 규제 선진화 |
||||||
|
생산 |
바이오헬스 생산활력 제고 및 동반성장 지원 |
|||||
|
1. 대기업・창업・벤처기업상생・협력체계 2. 제약・바이오 전문인력 양성 3. 원・부자재 국산화로 전후방 동반성장 |
||||||
|
시장 출시 |
시장진입 지원 및 해외진출 촉진 |
|||||
|
1. 시장진입 지원 2. 해외시장 교두보 마련 3. 플랜트・패키지 수출 |
||||||
방침이다. 주요 내용으로 5대 의료 빅데이터 플랫폼 구축, 신기술・신약에 대한 인허가 규제 완화, 바이오헬스 산업 육성지원을 포함하였다.
바이오헬스산업은 다른 제조・서비스업과 달리 제품 생산까지 장기간의 연구개발 기간이 소요되고, 병원・의사・환자 등 다양한 이해관계자 사이에서 소비가 작동되는 특수성을 보유한다. 기술・자본집약 산업으로 연구개발이 성패를 좌우하고, 기업 역량만으로는 국제경쟁력 확보에 한계가 있어 협력을 필요로 하며 국민의 생명・건강・안전 확보를 위한 규제를 형성하는 규제 산업이다. 이에 연간 2조 6,000억 원 수준인 바이오헬스 정부 연구개발 투자를 2025년까지 4조 원 이상으로 확대하는 것을 목표로 혁신적 신약・의료기기 개발을 통한 산업성장 및 질병극복, 글로벌 수준으로의 규제 합리화, 생산 활력 제고 및 동반 성장, 트랙 레코드 형성 및 해외시장 진출 촉진을 주요 과제로 수행한다.
2021년까지 2만 명에 달하는 희귀질환 환자 등의 유전체 빅데이터를 시작으로 향후 10년 내 100만 명 규모 데이터 구축으로 환자 맞춤형 신약・신의료기술 연구개발에 활용하며, 세계시장을 선도할 수 있는 차세대유망 혁신 신약・의료기기 개발을 중점 지원할 예정이다. 혁신형 제약기업 신약의 신속한 시장 진입을 위한 우선・신속 심사제를 도입하고, 주요 분야별로 선진국 수준에 맞는 규제개선 로드맵을 마련할 계획이다. 보건산업혁신창업센터를 통해 연구개발부터 인허가, 창업, 판로개척에 이르는 사업화 전주기 지원을 강화하며 융합형 의사과학자 양성 및 해외 우수 연구기관과 연계하여 4차 산업혁명에 걸맞은 바이오메디컬 핵심기술 글로벌 인재 양성을 추진 중이다. 마지막으로 신기술 활용 촉진 및 평가를 통해 사용을 확대하고 해외시장 진출 기반을 강화할 수 있는 인프라 마련으로 해외진출을 촉진시키고자 노력하고 있다.
라. 주요사업
보건복지부 2019년도 주요사업의 특징으로는 치매, 정신건강, 취약계층 돌봄・재활 등 국민 부담이 높은 분야와 근거기반 의료비 절감을 위해 임상연구 지원을 확대하고 로봇, 인공지능, 가상현실 등 4차 산업 핵심기술을 접목한 바이오헬스 연구개발을 강화한다는 것이다. 또한 의료데이터 등 연구자원・인프라를 연구자 중심으로 개방하고, 의사과학자, 바이오메디컬 핵심인재양성 등을 중점 지원하기 위해 총 440억 원 규모의 신규 사업에 투자할 계획이다. 2019년도 보건복지부 R&D는 ‘국민의 고비용 보건의료 문제를 해결’하고 ‘국가의 혁신성장을 견인하는 헬스케어 산업 R&D 투자 확대’를 목표로 3대 전략, 6대 중점 투자방향을 설정하였으며 주요사업은 다음과 같다.
(1) 보건의료기술연구개발사업
(가) 개요
보건복지부는 21세기 지식기반경제의 핵심 산업으로 등장하는 보건의료분야를 국민건강 증진과 국가경제 발전에 이바지하는 고부가가치 국가전략산업으로 육성・발전시키기 위하여 ‘보건의료기술진흥법(1995)’을 제정하여 ʻ보건의료기술연구개발사업ʼ을 추진해 오고 있으며, 지난 22년간(1995〜2019) 약 4조 9,000억 원의 정부 연구개발자금을 지원하였다. 보건복지부는 연도별 연구개발사업 시행계획을 수립하고, 전문기관인 한국보건산업진흥원에서 보건의료기술연구개발사업을 시행하고 있다.
[표 2-21] 보건의료연구개발사업 추진경과
|
연도 |
주요 내용 |
|
|
1995 |
보건의료기술연구기획평가단 설립 |
보건의료기술연구개발사업(128억 원) 시행 |
|
보건의료기술진흥법 제정(법률 제5017호) |
|
|
|
1998 |
한의약선도기술개발사업(24억 원) 시행 |
|
|
2008 |
임상연구인프라조성사업(350억 원) 시행 |
|
|
2009 |
임상의과학자양성사업(12억 5,000만 원) 시행 |
|
|
2010 |
글로벌화장품 신소재 연구개발사업(60억 원) 시행 |
|
|
2011 |
범부처 전주기 신약개발(50억 원), 시스템통합적 항암신약개발(50억 원) 시행 |
|
|
의료기기기술개발사업(40억 원) 시행 |
||
|
2014 |
연구중심병원 육성사업(100억 원) 시행 |
|
|
2015 |
감염병위기대응 기술개발사업(70억 원, 추경) 확대 시행 |
|
|
2016 |
국가전략프로젝트(정밀의료기술개발)(32억 원) 시행 |
|
|
2017 |
연구자주도질병극복연구, 공익적 질병극복연구, 국가치매극복기술개발 등 6개 사업(322억 원) 시행 |
|
|
2018 |
환자중심의료기술최적화연구, 스마트임상시험플랫폼기반구축, 바이오메디컬글로벌인재양성 등 10개 사업(389억 원) 시행 |
|
(나) 지원내용
한국보건산업진흥원에서 관리하고 있는 2019년도 ‘보건의료기술연구개발사업’ 현황을 살펴보면 다음과 같다. 2019년도 주요 연구개발 사업 예산의 특징은 치매, 정신건강, 취약계층 돌봄・재활 등 국민 부담이 높은 분야와 근거기반 의료비 절감을 위해 임상연구 지원을 확대하고 로봇, 인공지능, 가상현실 등 4차 산업혁명 핵심기술을 접목한 바이오헬스 연구개발을 강화한다. 의료데이터 등 연구자원・인프라를 연구자 중심으로 개방하고 의사과학자, 바이오메디컬 핵심인재 양성 등을 중점 지원하기 위해 총 407억 원 규모의 신규 사업에 투자할 계획이다.
[표 2-22] 보건의료연구개발사업 세부사업(단위: 백만 원)
|
세부사업명 |
지원분야 |
2019 예산 |
|
환자중심 의료기술 최적화 연구사업 |
의료기술 비교평가 연구, 의료기술 근거생성 연구 |
5,990 |
|
CDM기반정밀의료데이터통합플랫폼기술개발사업 |
CDM 규약 및 품질개선, 공공목적 활용연구 |
3,495 |
|
돌봄로봇 중개연구 및 서비스모델개발사업 |
돌봄로봇 중개연구 및 서비스모델개발 |
1,300 |
|
마이크로 의료로봇 실용화 기술개발사업 |
마이크로의료로봇 실용화 공통기반 기술개발, 마이크로의료로봇 실용화개발 |
7,693 |
|
스마트임상시험플랫폼기반구축사업 |
첨단 융복합 임상시험 기술개발 |
2,780 |
|
인공지능 신약개발 플랫폼 구축사업 |
인공지능 신약개발 플랫폼 구축 |
2,500 |
|
의료데이터 보호・활용 기술개발사업 |
보건의료빅데이터 활용기반연구, 블록체인 기술 등을 활용한 의료데이터 관리체계 및 역동적 동의체계 연구, 프라이버시 보존 컴퓨팅 기술연구, 디지털헬스케어 효과검증연구 |
3,743 |
|
혁신형 의사과학자 공동연구사업 |
혁신형 의사과학자 공동연구, 지역거점 혁신형 의사과학자 공동연구 |
1,875 |
|
바이오메디컬 글로벌 인재양성사업 |
기관자율형, 연구자협력형 |
6,000 |
|
정신건강 문제해결 연구사업 |
알코올 중독 및 자살예방 기술개발, 정신질환 및 특수집단 코호트 구축 및 활용, 연구성과 검증 및 표준화 |
3,511 |
|
100세 사회 대응 고령친화제품 연구개발 |
100세 사회대응 고령친화제품중점기술개발지원, Active Aging을 위한 고령자자립생활 지원, 노인노쇠 코호트 구축 및 중재연구개발, 고령화 대응 기술개발 |
2,795 |
|
사회서비스 R&D 사업 |
사회서비스 개발 및 프로세스 혁신 |
311 |
|
임상연구 인프라 조성사업 |
희귀난치성질환 유전자치료, 나노의학인프라연구, 국가임상시험사업, 질환유효성평가기반구축, 의료기기인프라지원 |
23,614 |
|
연구중심병원육성사업 |
연구중심병원 육성사업 R&D |
34,050 |
|
포스트게놈 신산업육성을 위한 다부처 유전체 사업 |
인간유전체 이행연구, 유전체 이행연구지원, 질환유전자 분플랫폼 기술개발, 한국인 유전체 연구자원 정보생산 및 활용, 다부처 공동연구 |
10,100 |
|
혁신성장동력프로젝트 |
정밀의료 기반 암 진단・치료법 개발, 정밀의료 병원정보시스템(P-HIS) 개발 |
11,261 |
|
양・한방융합기반기술개발사업 |
양・한방융합 전임상연구, 양・한방융합 임상연구, 양・한방융합 협력 치료기술 개발 |
2,060 |
|
정신건강기술개발사업 |
사회문제해결형 정신건강기술개발, 재난충격 해결을 위한 연구개발, 중독 예방・탐지・치료 및 관리 기술개발, 생애주기별 정신건강증진 기술개발, 지역사회 중심의 정신장애 및 사회문제해결 기술개발, 국가정신건강 R&D기반 역량강화 |
857 |
|
심혈관계질환 첨단 의료기술 가상훈련 시스템 기술개발사업 |
가상 의료훈련기술 개발, 표준 의료훈련체계 개발 |
778 |
|
라이프케어융합서비스개발사업 |
사회적약자통합케어서비스, 국민건강관리서비스개발, 생애주기별맞춤형서비스 |
8,152 |
|
연구자 주도 질병극복연구사업 |
의료기술 혁신기반 연구, 의료기술 심화연구, 면역중개연구 |
14,680 |
|
공익적 질병극복 연구지원사업 |
희귀질환 진단・치료기술개발, 저출산 대응기술개발 |
6,036 |
|
국가치매극복기술개발사업 |
원인 규명 및 예방기술 개발, 진단기술개발, 치료기술개발, 돌봄기술개발 |
12,029 |
|
인공지능 바이오로봇 의료융합기술개발사업 |
인공지능 바이오로봇 의료융합기술개발 |
2,800 |
|
한의기반융합기술개발사업 |
한의융합 다빈도 난치성 질환 대응기술개발, 한의융합 제품기술개발 |
3,565 |
|
한의약선도기술개발사업 |
한약제제개발, 한의약임상인프라구축, 한의약근거창출임상연구, 한의국제협력연구 |
9,945 |
|
질환극복기술개발사업 |
창의적 중개연구, 문제해결형 중개연구, 공공보건기술개발, 임상의과학자 연구역량 강화 |
29,975 |
|
선도형특성화연구사업 |
선도형특성화연구사업단(Ⅱ단계) |
5,170 |
|
감염병위기대응기술개발사업 |
면역백신개발, 국가감염병 위기대응, 방역연계 범부처 감염병 R&D |
25,172 |
|
첨단의료기술개발사업 |
인공지능 정보의학, 융복합 보건의료기술, 줄기세포・재생의료 실용화, 신약개발지원, 제약산업특화지원, 정밀의료인력양성 |
52,164 |
|
의료기기기술개발사업 |
미래융합 의료기기 개발, 의료기기 임상시험지원, 신의료기술수반 의료기기 시장 진출 지원, 치과의료 및 치과산업기술개발, 보건의료 빅데이터 연계・활용 강화연구 |
29,579 |
|
국가항암신약개발사업 |
후보물질 개발 |
14,224 |
|
범부처전주기신약개발사업 |
신약개발 전주기 지원, 사업성과 확산 |
9,549 |
|
합계 |
347,753 |
|
세부사업 지원 현황을 살펴보면, 감염병 R&D분야에 252억 원을 지원하고 있으며, 백신주권 확보 및 의료비 절감을 위한 면역백신 개발, 신・변종 감염병 대응을 위한 유입차단, 현장대응, 확산방지 등 국가 방역체계구축 지원확대를 목표로 하고 있다. 더 나아가 백신 자급화(국산화)를 위한 백신개발 지원을 확대하고, 환자 맞춤형 진단기술 및 치료제 개발을 위해 향후 10년간(2020∼2029) 총 6,240억 원 규모로 지원할 예정이다.
치매 예방 프로그램 개발, 치매 조기진단 바이오마커, 치매 치료제, 치매환자 일상생활 보조기술개발 등 치매의 예방・진단・치료부터 돌봄까지 전주기적 치매극복 연구 투자 확대를 위해 120억 원을 지원 중이다. 좋은 일자리 창출을 위한 미래 신산업 육성 전략을 통해서 정밀의료 R&D를 179억 원을 지원한다. 이는 치료 효과를 높이고 부작용은 낮춘 최적의 개인 맞춤형 미래의료 실현을 위한 진료정보, 유전정보, 생활환경・습관 정보(Life log) 등 건강 관련 데이터를 통합・분석하는 연구 지원 및 병원 의료정보시스템 개발 지원을 목표로 하고 있다.
이 뿐 아니라 희귀질환 R&D 면역계 희귀질환의 원인 규명을 위한 중개연구 지원, 진단・치료에 유용한 바이오마커 및 진단기술 개발을 지원하고 있다. 글로벌 인재양성 사업으로 바이오메디컬 분야(재생의료, 정밀의료, 신약, 의료기기, 보건의료 빅데이터, 보건의료기술 인프라) 글로벌 선도 기관에서 미래 핵심 분야의 공동프로젝트 수행을 통해 글로벌 감각을 갖춘 융합형 고급인재로 육성하고자 60억 원을 지원한다.
(2) 질병관리연구
(가) 개요
질병관리본부는 국가 전염병 연구 및 관리와 생명과학 연구를 수행하는 곳으로 기관 산하의 국립보건연구원을 주축으로 질병관리 연구를 지원하고 있다. 주요 기능은 감염병 대응 및 예방, 감염병에 대한 진단 및 조사・연구, 국가 만성질환 감시체계 구축, 장기기증 지원 및 이식 관리, 감염병, 만성 질환, 희귀 난치성 질환 및 손상 질환에 관한 시험・연구업무, 질병관리, 유전체실용화 등 국가 연구개발 사업, 검역을 통한 해외유입 감염병의 국내 및 국외 전파방지 등이다.
또한, 질병관리본부는 다양한 분야의 새로운 접근방식을 도입해 연구와 성과를 내고 있다. 질병관리의 과학적 근거기반 마련, 공익가치 지향 기초기반 연구, 미래 질병위험 대응기술 개발, 미래질병 위험 대응 기술개발, 연구자 중심의 R&D지원기반 구축, 감염병 극복에 필요한 연구기술 역량확보, 건강수명 연장을 위한 국가 만성병 연구, 정밀의료 실현을 위한 보건의료 연구 강화를 통해 연구 인프라를 구축하는 등 질병관리의 중장기 계획을 세워 실행 중이다.
(나) 지원내용
2019년 연구개발 사업에 투자된 총예산 749억 원은 국민건강을 위협하는 질병(신변종, 소외질환, 노인성질환 등)에 대한 적극적인 대처를 통해 신・변종 및 미해결 감염병 대응
[표 2-23] 질병관리본부 세부사업(단위: 백만 원)
|
세부사업명 |
지원분야 |
2019 예산 |
|
미세먼지 기인질병대응 연구사업 |
미세먼지 기인 질병 예방 및 중재연구, 미세먼지 노출인구 집단 분석 및 연구 인프라 구축 |
3,250 |
|
국가보건의료연구인프라구축사업 |
줄기세포은행 운영 및 표준화기반 구축, 여성건강 기반기술개발연구, 기후변화 급만성 질병연구, 질병극복임상연구 데이터지원, 희귀질환연구인프라구축, 장애극복을 위한 난치성질환 치료기반 구축 |
13,635 |
|
공공백신개발지원센터 건립 및 운영 사업 |
공공백신개발・지원센터 건립 |
18,997 |
|
보건의료생물자원종합관리사업 |
인체자원은행지원, 인체자원연구지원센터운영, 인체자원은행 고도화 |
5,244 |
|
감염병관리기술개발연구사업 |
신・변종 및 국가관리감염병연구, 국가표준병원체 자원 개발 및 활용, 감염병예측 및 조기 감시 시스템 구축, One-Health 개념의 항생제 내성균 조사연구, 미해결 및 만성감염질환연구 |
20,395 |
|
형질분석연구사업 |
한국인 형질분석연구, 주요 만성질환 관련 오믹스정보 생산 및 분석 |
2,170 |
|
만성병관리기술개발사업 |
고령사회 대비 만성질환 극복연구, 만성질환예방관리 인프라 구축, 생활위험인자기인 만성질환 연구 |
11,222 |
|
합계 |
74,913 |
|
수단을 구축하고 만성질환증가로 사회경제적 부담이 증가하면서 정밀의료 실현을 위한 자원 인프라 구축을 목표로 한다. 과학적 근거 기반 미세먼지 기인 질병 예방 및 관리기술 개발을 목적으로 미세먼지 기인질병 치료 및 중재연구(중증 질환자의 미세먼지 노출정도에 따른 피해 예방 및 중재연구)와 미세먼지 노출인구 집단분석 및 연구 인프라 구축(미세먼지 노출에 따른 취약계층 노인, 지역사회 등)에 대한 질병 영향 평가 및 원인규명을 통해 위험을 예측하고 예방하는 기술개발에 힘쓰고 있다.
(3) 암연구사업
(가) 개요
보건복지부는 국민보건 향상을 목적으로 암에 관한 전문적인 연구와 암환자의 진료 등을 위해 2000년에 ‘국립암센터법’을 제정하여 국립암센터를 설립・운영하고 있다. 암의 발생・예방・진단・치료 및 관리 등에 관한 연구 활동을 지원하는 국립암센터 ‘기관고유연구사업’과 국내 산・학・연・의료계 소속 암 연구자의 연구활동을 지원하는 ‘암정복추진연구개발사업’ 관리업무를 각각 수행하고 있다.
[표 2-24] 국가암관리종합계획 비전 및 목표
|
비전 : 전 국민을 암으로부터 보호하고 암 전주기에 걸친 환자와 가족의 삶의 질 향상 |
|||
|
목표 |
1. 암 발생률을 OECD 평균 수준으로 감소 2. 암 조기발견 및 생존율 증가 3. 암 생존자 및 말기암환자의 삶의 질 향상 4. 맞춤형 정밀의료 기반 구축 |
||
|
추진과제 |
1. 감시와 예방(Surveillance & Prevention) 2. 조기검진(Early Detection) 3. 진단, 치료 및 생존자 지원(Diagnosis, Treatment & Survivorship) 4. 완화의료(Palliative Care) 5. 인프라(Infrastructure) 6. 연구(Research & Development) |
||
국민 사망원인 1위인 암 질환을 국가 차원에서 장기적・종합적으로 관리하기 위한 ‘제1차 국가암관리종합계획’(1996∼2005) 시행으로 국립암센터설립(2001), 암관리법 제정(2003) 등 국가암관리체계를 구축하고 암등록통계사업, 5대 암검진사업 등 기틀을 마련하였다. ‘제2차 국가암관리종합계획’(2006∼2015)에서는 고령화와 생활습관의 서구화에 따른 질병구조 변화에 대응하기 위해 사전예방을 강조해 암예방・검진사업 등을 강화하였다. 현재는 암환자・가족의 높아진 기대수준과 재정 확충 등 변화된 국내외 정책 환경을 반영하여 ‘제3차 국가암관리종합계획’(2016∼2020)이 수립되어 시행 중이다. 2001∼2019년까지 국립암센터 기관고유연구사업과 암 정복 추진연구개발사업으로 총 5,039억 원의 국가연구개발자금이 지원되었다.
(나) 지원내용
국립암센터는 국가 암관리정책 개발 및 각종 국가암관리사업의 기획・관리・평가 등을 적극 지원함으로써 국민의 암 부담의 획기적인 감소와 삶의 질 향상에 기여하고 있다. 국립암센터는 내부 연구자의 연구 활동을 지원하는 ‘기관고유연구사업(Intramural Program)’과 산・학・연・의료계 소속 암연구자의 연구 활동을 지원하는 ‘암정복추진연구개발사업(Extra- mural Program)’ 관리업무를 수행하며 주요 암 발생률 및 사망률을 낮추고 암 치료율을 제고시킬 수 있는 이행성 연구(또는 중개연구, translational research) 등 실용화 연구를 중점으로 추진하고 있다. 2019년 기관고유연구사업은 공익적 핵심 암 융합연구, 정밀
[표 2-25] 국립암센터 세부사업(단위: 백만 원)
|
세부 사업명 |
지원 분야 |
2019 예산 |
|
암 연구소 및 국가 암관리사업본부 주요사업비 |
<기관고유연구사업> 공익적 핵심 암 융합연구, 정밀의학 실현 암 기반연구, 근거기반 전주기적 암관리 연구, 공공 개방형 암 연구 인프라 운영 |
24,617 |
|
<암정복추진연구개발사업> 공익적 다기관 암 임상연구, 암 예방・관리・서비스 연구, 암 중개융합연구, 기획연구 |
8,816 |
|
|
합계 |
33,433 |
|
의학 실현 암 기반연구 등에 246억 원을 지원하였고, 암정복추진연구개발사업을 통해 공익적 다기관 암 임상연구, 암 예방・관리・서비스 연구 등에 88억 원을 지원하였다.
마. 추진방향
보건복지부는 고령화, 감염병, 의료비 부담 등 고비용 보건의료 문제를 해결하고 예방・관리 및 맞춤의료 실현을 위한 연구개발 지원을 강화할 것이다. 이를 위해 다음 분야에서 연구개발 지원을 확대하고, ‘바이오헬스 산업 혁신전략’ 이행을 위한 기반을 마련할 계획이다.
첫째, 치매, 재활・돌봄, 감염병 등 고비용 보건의료 문제해결을 중심으로 원인규명, 예방, 조기진단, 치료까지 전주기 연구개발 투자를 확대할 것이다. 치매발병률을 절반으로 단축하기 위해 치매 전주기에 걸친 연구개발을 지원한다. 또한 건강・의료 관련 취약계층을 위한 재활・돌봄 연구와 질병예방 및 의료비 절감을 위한 스마트 헬스케어 서비스를 강화할 계획이다.이뿐 아니라 신종 감염병, 항생제 다제내성균 등에 대한 예방・진단 솔루션 기술을 개발할 예정이다.
둘째, 상시적 건강관리 및 질병 예방중심의 환자 맞춤형 헬스케어 R&D 지원을 확대하고자 한다. 국가 유전체 빅데이터를 구축하고, 정밀의료 데이터 플랫폼 기술개발 등을 통해 건강・의료데이터 기반의 맞춤형 헬스케어를 실현할 것이다. 또한 줄기세포치료 등 첨단재생의료를 활용한 임상연구 및 실용화 연계 연구개발 지원을 확대할 계획이다.
셋째, 4차 산업혁명 융합기술을 기반으로 한 효율적 신약개발 및 첨단 의료기기개발을 강화할 것이다. 인공지능 신약개발플랫폼, 임상현장중심 중개연구, 항체신약 개발 등을 통해 후보물질 발굴부터 비임상・임상시험까지 전주기 R&D 지원 및 신약재창출(Drug Repositioning) 등 효율적 신약개발을 지원할 계획이다. 이뿐 아니라 AI 등 4차 산업혁명 선도 기술과 바이오 기술을 융합하여 맞춤형 예방・관리가 가능한 첨단 의료기기를 개발할 것이다.
마지막으로 관계부처 합동으로 마련된 ‘바이오헬스 산업 혁신전략’을 법령 제・개정, 예산반영, 제도개선 과제로 나누어 이행해 나갈 계획이다. 혁신 신약을 개발하여 희귀난치 질환을 극복하고 제약・의료기기 기술 국산화로 건강주권을 수호하여 국민생명・건강보장 강화, 경제 성장과 일자리 창출을 통한 ‘사람 중심의 혁신성장’을 이끌 것이다.
[표 2-26] 바이오헬스 산업 혁신전략 향후 계획
|
법령 제・개정 |
첨단재생의료・의약품법(제정), 보건의료기술진흥법(개정), 기술이전촉진법 시행령(개정), 조세특례제한법 및 하위법령(개정) 등 |
|
예산 반영 |
바이오 빅데이터('20∼), 데이터 중심병원('20∼), 범부처 의료기기 개발('20∼), 국가 신약개발('21∼), 미래의료 선도사업단('21∼) 등 |
|
제도개선 |
규제개선 로드맵('19), 인력양성 마스터플랜 수립('19) 등 |
7. 환경분야 생명공학 육성
가. 개요
(1) 기술개발 필요성
(가) 환경생명공학기술
환경생명공학기술(EBT: environmental biotechnology)이란 생명공학기술(BT: biotechnology)을 환경기술(ET: environmental technology)에 접목하거나 융합하는 기술이다. 즉, 생물학적・분자생물학적 기법이나 생물학적 처리공정을 이용하여 환경오염을 예방(prevention)하거나 감시(monitoring)하는 기술, 오염된 환경을 복원(restoration)하고 정화(remediation) 하는 기술을 의미한다. 환경생명공학기술은 환경과학, 생태학, 분자생물학 간의 유기적인 협조가 필요한 기술 분야다. 생명공학기술의 핵심기술5) 가운데 생물공정기술(발효공정제어, 분리정제, 배양기 설계・제작)과 미생물이용기술(미생물분리・배양, 항암물질 탐색기술)을 주로 활용하고 있다.
환경생명공학기술은 청정기술, 환경오염제어 및 관리기술, 바이오에너지기술을 포함한다. 그 밖에도 생물학적 방법을 이용한 환경오염물질의 검출(detection), 친환경 소재・제품 개발, 생태계 건전성 및 생물다양성 유지, 토양・지하수 복원, 온실가스 감축, 기후변화 적응 등에 필요한 기술까지로 그 범위가 확대되고 있다. 환경생명공학기술은 근래 각 분야에서 개발되고 있는 첨단기술과 융합하며 기존의 환경기술로는 극복하기 어려운 한계를 해결할 수 있다는 점에서 그 중요성이 부각되고 있다.
2030년까지 세계 발전과 인류 공영을 위해 유엔 총회에서 채택된 지속가능발전목표(SDGs) 17개 중 8개가 환경과 밀접히 관련되어 있으며, 세계경제포럼(WEF)에서 발간한 글로벌리스크보고서(2019. The Global Risks Report)에 따르면 발생가능성(likelihood)과 영향(impact)에 따라 평가한 글로벌 5대 위협요소 중 3∼4개가 2009년에는 경제문제였으나 2019년에는 환경문제로 선정되었다.
(나) 환경산업 및 환경기술의 변화
환경기술6)을 개발하는 목적은 기본적으로는 현안 환경문제를 해결하기 위함이지만, 환경문제를 안정적으로 해결하기 위하여 추진하는 환경산업7) 육성정책과도 밀접하게 연관되어 있다.
1960년대부터 형성되기 시작한 환경산업은 초기에는 배출된 환경오염물질을 처리하는 ‘사후처리’ 중심의 산업이 대부분이었다. 그러나 1990년대부터는 환경오염물질의 발생을 사전에 예방하는 사전예방 중심의 산업으로 범위가 확대되었다. 최근에는 환경오염에 따른 인체・생태계 영향을 줄이기 위한 환경오염 적응산업, 훼손된 환경을 복원하는 생태계 복원・재생산업, 소모성 자원・에너지 사용을 억제하는 자원순환 및 재생에너지 산업으로 환경산업의 성장축이 이동하고 있다.
이에 따라 환경기술 개발도 사후처리기술 중심에서 사전예방기술・청정기술을 거쳐, 수용체(인체 및 생태계) 중심의 환경영향저감기술, 친환경소재・제품기술, 환경복원기술, 자원순환기술, 재생에너지기술 쪽으로 방향을 틀어가고 있다.
세계 각국이 환경관련 국제협약8)을 체결해 공동으로 이행하며, 지구환경 문제가 국제사회에서 중요한 의제로 대두되는 것도 환경기술 변화의 한 요인이다. 기후변화 대응기술, 재생에너지 확보기술, 자연환경보전・복원기술, 자원순환기술, 황사・미세먼지 대응기술 등은 특히 지구환경문제 해결 요구가 해를 거듭하며 강화되고 있어 기존의 환경기술 개발 방식만으로는 적절히 대응하기 어려운 실정이다. 이를 극복하기 위해 환경기술(ET)과 생명공학기술(BT), 정보기술(IT: information technology) 및 나노기술(NT: nanotechnology) 등을 접목 또는 융합하는 환경융합기술 개발의 중요성이 더욱 증가하고 있다.
특히 수용체(인체 및 생태계)에 미치는 환경영향을 평가하기 위한 위해성평가(risk assessment)기술을 개발하거나 4차 산업혁명 시대에 대응하기 위하여 현재의 환경기술 및 환경생명공학기술도 ICT, IoT 등을 접목한 플랫폼, 스마트 환경관리기술 등 융・복합 첨단기술로 전환할 필요성이 요구되고 있다.
(2) 각국의 환경연구개발동향
1990년대 이후, 기후변화 및 환경오염으로 인한 생태계 훼손으로 인해 자연보전 및 복원의 중요성이 부각되었고, 토양과 지하수의 환경적 순기능에 대한 중요성이 강조되었다. 또한 생태계 및 토양, 지하수는 한번 오염되면 개선이 어려울 뿐만 아니라, 복원하는데 많은 시간과 비용을 필요로 한다. 이러한 문제들이 중요하게 부각되면서 이에 대응하기 위하여 생태계 복원기술 개발, 토양・지하수 보전・복원을 위한 자연친화적 정화기술도 집중 개발되고 있다. 생명과학 발전에 따른 유전자변형생물체(LMO: Living Modified Organism), 내분비계 장애물질의 환경(인체, 생태계) 위해성이 부각됨에 따라 새로운 화학물질에 대한 위해성 평가 연구도 중요성이 커지고 있다.
EU에서는 기후 및 대기, 생태계 수질 등 환경, 자원순환 및 에너지 등 매체 중심 연구개발 프로그램을 운영 중이며, EU 집행위원회는 ‘Horizon 2020’의 기후변화 대응, 자원 효율성 및 원료, 안전하고 깨끗하며 효율적인 에너지 분야에서 환경기술개발을 추진 중이다. ‘Horizon 2020’의 일환으로 환경생명공학분야에서는 EU와 유럽환경청 공동으로 2017∼2020년까지 European Human Biomonitoring Initiative(HBM4EU Project)를 통해 비스페놀, 프탈레이트 등으로 인한 인체 위해성 관련 환경보건분야 연구개발을 지원하고 있다.
미국 환경보호청(US EPA)에서는 지속가능발전, 기후변화 적응, 물 환경, 환경보건, 자원순환, 자연보전 등 6개 환경R&D 프로그램을 수행하고 있으며, 2016∼2019년 핵심통합연구주제로 환경정의, 환경보건, 기후변화, 질소 및 오염물질을 설정하여 중점 지원 중이다. 미국 에너지부(DOE)는 ‘생물환경연구 프로그램(BER)’을 통해 대기시스템, 환경시스템, 기후 및 지구시스템 등 기후변화와 관련된 연구를 추진하고 있다. 미국 환경보호청(EPA), 국립환경보건과학원(NIEHS) 등에서 어린이 환경성질환을 중점이슈로 환경보건로드맵(CEHRR 2016∼2019)과 국가차원의 항생제 내성 박테리아 근절 프로젝트를 발표하였다.
일본 환경성에서는 저탄소, 자원순환, 자연공생, 안전확보 등 매체별 영역 외에 영역 간 연구 연속성 확보를 위해 통합영역과 전략적 연구개발 영역을 추가하여 기술개발을 추진 중이다. 경제산업성에서는 이산화탄소 분리・회수 분야 사업과 바이오연료 생산 기술개발사업을 추진 중이다. 최근 환경생명공학과 관련하여 월경성(越境性, 국가간의 경계를 넘어 일어나는) 대기오염물질 등에 따른 건강영향평가 및 위해성평가와 실내공기질 등을 주요 이슈로 다루고 있다.
독일 연방환경부(BMUB)는 연방환경청(UBA)과 연방자연보전청(BFN)을 통해 환경보호 7개 주제(기후, 자원재활용, 국제환경보호, 물질위험, 청정대기, 지하수, 기후변화영향)와 자연보전 3개 분야(자연보호 및 생물다양성, 국내 및 국제종 보호, 서식지의 국제적 보호)의 연구를 추진하고 있다.
중국은 2020년까지 신재생에너지를 전체 에너지 소비량의 15%까지 확대하겠다는 목표를 세우고 2008년에 생물연료(biomass)에 대한 연구개발과 실증을 위하여 2억 9,000만 달러를 투자하였다. 이처럼 세계 주요 국가들은 미래 국가경쟁력 확보를 위하여 국가 주도의 융합기술에 대한 투자를 가속화하고 있으며, 자국의 산업경쟁력 확보 차원에서 국제규모의 환경문제 대응기술 개발을 적극적으로 추진하고 있다.
또한 생물자원을 활용하여 환경을 복원하고 정화하기 위한 기술개발도 활발하게 진행되고 있다. 환경오염물질을 분해할 수 있는 세균 등 미생물에 대한 기능 연구를 통해 친환경 환경산업이 성장하고 있으며, 천적 생물종 연구를 통해 환경생태계 보전 기반도 강화되고 있다. 생물-생물, 생물-무생물 환경 간 상호작용 연구를 통해 훼손 환경・생태계 복원 사업의 시장규모도 점차 커지고 있다.
나. 추진경과
(1) 1990년대(G7환경공학기술개발사업)
1990년대 초반 낙동강 페놀유출사고 등을 계기로 원인규명과 대책마련 등에 있어서 과학기술에 기반을 둔 환경정책 수립 요구가 증가하게 되었다. 이러한 시대적 배경과 더불어 정부 주도의 G7선도기술개발사업(2000년대 과학기술 선진 7개국권 수준 진입을 위한 사업) 추진을 계기로 1992년부터 환경공학기술개발사업을 추진하였다.
(2) 2000년대(차세대 핵심 환경기술개발사업)
종래의 사후처리 위주였던 환경관리 방식은 2000년대 들어서면서 사전예방 중심으로 환경정책 기조가 전환됨에 따라, 환경기술개발사업도 보전, 복원 기술 중심의 차세대 핵심 환경기술개발사업을 추진하게 되었다. Eco-Star Project 등을 추진하면서 사업단 체제를 도입하는 등 환경기술개발사업을 고도화하였다.
(3) 2010년대(차세대 에코이노베이션 기술개발사업)
글로벌 수준의 환경기술 확보와 해외시장 진출을 위한 글로벌탑 환경기술개발사업 등 차세대 에코이노베이션 기술개발사업(EI사업)을 주력사업으로 추진하였으며, 환경융합신기술개발사업을 통해 ET, BT, IT 등 타 분야와의 융합을 적극적으로 시도하였다. 한편 2010년대 들어서면서 구미 불산사고, 녹조, 가습기살균제 등 환경이슈가 다변화됨에 따라 환경기술개발사업도 이슈 중심으로 다각화하였다.

[그림 2-3] BT 관련 환경기술 개발사업 추진 경과
다. 주요정책
(1) 환경기술 육성정책
국민의 안전이라는 국책 기조 및 제4차 과학기술기본계획 중점방향에 따라 ‘환경안전 강화 통합 환경관리 기술개발’을 중점 전략으로 법정계획인 제4차 환경기술・환경산업・환경기술인력 육성계획(2018∼2022)을 2018년 4월 수립하였다. 환경안전사회 구축 기반 기술개발, 국민 체감형 환경서비스 기술개발, 친환경 경제 기술개발을 3대 전략과제로 설정하여 5년간 집중 투자할 계획이다.

[그림 2-4] 환경기술개발계획 연차별 중점추진사항
(2) 환경-생명공학 연계 정책
특히 동 계획에서는 화학물질 등으로부터 국민의 건강보호를 위한 환경보건 분야와 공공성 확보 차원에서 생태계 보전 분야가 첫 번째 전략과제로 대폭 강화되었다. 환경보건 분야 세부추진 과제로는 화학물질 및 제품안전 관리 기술, 환경성 질환 안심 기술, 환경재난・재해 방지 및 대응 기술이 도출되었다. 또한, 생태계 분야에서는 육상 및 수생태계보전 기술, 생태계 서비스 평가・활용기술 등이 세부과제로 집중 지원될 예정이다.
(3) 중장기 계획
미래 환경이슈 및 현안 대응을 위해 환경R&D 중장기 추진 전략(2019∼2028)을 수립(2018.9.)하여 2020년대 이후에도 선제적으로 대비하고 있다. 동 전략은 ‘사전예방 강화’, ‘지속가능성 제고’, ‘자연・경제의 선순환’을 3대 기본방향으로 2019∼2028년까지 14개 사업에 총 2조 5,000억 원을 투자할 계획이다. 생명공학 관련 중점사업으로 수생태계 건강성 확보, 생태모방 및 자원화 기술이 추진될 예정이다.
라. 주요사업
(1) 융합기반 청정기술
환경오염물질을 처리하는 사후처리 방식만으로는 해결이 불가능할 정도로 환경오염 문제가 심각한 사회문제로 대두되면서 환경오염물질의 발생을 사전에 예방하는 사전오염 예방 기술이나 사업장 등 생산단계 또는 제품 소비단계에서 오염물질 배출을 억제하는 청정기술의 중요성이 부각되고 있다.
특히 청정기술은 순수한 환경기술(ET)만이 아닌 생명공학기술(BT) 등 여러 분야의 기술이 접목되거나 융합된 기술이 대부분이다. 청정기술에는 공정관련 청정기술, 생물농약 제조기술, 생분해성 소재 제조기술, 청정 유기용제 개발 및 생산기술, 미세먼지 등 유해물질 위해관리기술 등이 포함된다.
한편, 지중환경오염 위해관리 기술개발사업을 통해 오염된 토양 정화에 생물학적 기술을 활용하고 있다. 현재 수행하고 있는 기술개발 과제의 예는 아래 표와 같다.
[표 2-27] 융합기반 청정기술의 주요 연구과제
|
|
◈ 토양미생물의 biomineralization과 산업폐기물을 이용한 국내외 중금속 오염부지의 hybrid형 불용화 기술 개발(2015.7∼2018.3) |
|
◦토양미생물, 불용화제를 활용하여 오염토양(광물찌꺼기)을 고결하는 오염정화 기술 개발 |
|
|
|
◈ 미생물 매개 탄산칼슘 침전을 활용한 중금속 오염토양 유실 방지기술 개발(2016.4∼2018.3) |
|
◦미생물 탄산칼슘 침전을 활용한 중금속 오염토양 유실방지 기술 개발 |
|
|
|
◈ 미세먼지(PM10, PM2.5) 및 VOC 노출에 의한 환경성 눈질환 발생 메커니즘 규명 동물모델 기술개발(2016.5∼2018.12) |
|
◦환경성 눈질환 모델 구축 및 발 임상, 세포 및 동물실험결과 기반 다차원 예측모델 평가, 미세먼지 등에 의한 환경성 눈질환 발생 기전 및 바이오마커 개발 |
|
|
|
◈ 환경유해인자(미세먼지, 중금속 등)에 의한 상부호흡기 유발・악화 메커니즘 규명 및 환자 중심 관리기술 개발(2016.5∼2018.12) |
|
◦미세먼지 등에 의한 상부 호흡기 과민성 염증성 질환 유발 악화 기전 규명, 유발악화 메커니즘 규명, 환자군별 상부 호흡기 질환 유발악화 예방관리 가이드라인개발 |
|
|
|
◈ 생물학적 모기방제 기술의 현장적용, 생태계 영향평가 및 유지관리 기술 개발(2016.11∼2019.6) |
|
◦모기 천적개체군인 잔물땡땡이 서식처 유지관리 및 종합적 모기방제 방법(IMM)을 연계한 생물학적 모기방제 기술 개발 |
|
|
|
◈ 바이오황을 이용한 골프장 잔디 및 토양환경관리용 친환경 대체소재 개발(2017.4∼2018.12) |
|
◦매립가스 중 황화수소의 생물학적 제거 공정에서 생성되는 다량의 바이오황을 이용하여 골프장 전용 토양환경 및 잔디병 방제용 친환경 대체소재 개발 |
(2) 환경오염제어 및 관리기술
기존에 잘 알려진 환경오염물질 외에도 미량 함유 유해물질을 포함한 신(新)환경오염물질에 대한 새로운 환경모니터링 기술9)이 요구되고 있다. 이에 따라 세포 칩 개발 등 세포 내 유해성 관리 모니터링까지 필요한 환경오염 제어 및 관리 기술의 범위가 확대되고 있다. 나노기술(NT), 정보기술(IT)이 융합한 환경 바이오모니터링 기술을 개발함에 따라 나노수준의 환경문제 발현 메커니즘도 규명할 수 있게 되었다. 환경오염제어 및 관리기술에는 식・생물 정화기술, 환경오염측정 기술, 생태계복원 기술, 녹조제어 및 관리기술 등이 포함된다. 가습기살균제 등 살생물제(Biocide)로부터 국민 건강 보호를 위해 2018년도부터는 안심 살생물제관리 기반기술개발사업을 착수하였다. 현재 수행하고 있는 기술개발 과제의 예는 다음 표와 같다.
[표 2-28] 환경오염제어 및 관리기술의 주요 연구과제
|
|
◈ 하폐수 처리용 분리막-생물 반응 시스템의 에너지 저감을 위한 정족수 감지 억제제 개발(2012.10∼2017.3) |
|
◦환경분야 생물막 오염 문제에 정족수 감지 억제 기술을 적용하여 기존기술 대비 40% 이상의 에너지 절약 효과의 원천기술 개발 |
|
|
|
◈ 정수장 유입조류 제어를 위한 실시간 모니터링(조류독소, 이취미 자동분석 기술) 및 고효율 전처리 공정 개발(2014.7∼2017.6) |
|
◦정수 원수 중 이취미물질, 조류독소를 자동 분석하여 최적의 약품 투입량을 제시하는 의사결정 시스템 |
|
|
|
◈ 바이오 고분자 기반 광학 센서 개발을 통한 중금속 및 유기오염물질 검출 현장측정용 kit 및 중금속 정화공정 개발(2015.4∼2018.3) |
|
◦오염물질과 선택적 결합・분리 특성이 높은 바이오 고분자를 활용하여 현장내의 중금속 및 잔류성 유기오염물질의 측정센서 개발 |
|
|
|
◈ SOURCE(Slow, Optimized and Uniformized Release Control for Environment) 기술을 이용한 고강도 질산성질소 오염원 통합 관리기술 개발(2015.4∼2018.3) |
|
◦정화용 복합소재 개발 및 생산 공정기술 최적화 |
|
|
|
◈ 환경 내 항생물질 내성 발생 파악 및 국가 감시체계 구축 기술 개발 (2016.5∼2020.12) |
|
◦항생제 내성의 발생 및 전파의 주요 원인이 되는 점오염원 등을 파악함으로써 향후 환경에서 잠재적 위험요소가 되는 지역에 대한 중점적인 관리 방안 마련 및 항생제 내성 추적 시스템(AR-tracking system) 기반 구축 |
|
|
|
◈ 야생동물 매개 인수공통감염병 대응을 위한 신속 현장적용 진단 기술 개발 (2016.11∼2019.6) |
|
◦실시간 중합효소연쇄반응 기법 개발을 통한 야생동물 매개 24개 질병의 어레이카드 기반 패널화 및 진단 기법 개발 등 온증폭기법을 활용한 간이 진단키트 시제품 개발 |
|
|
|
◈ EDCs 통합위해관리를 위한 한국형 환경 및 생태 유해성 평가 기술 개발 (2016.5∼2019.12) |
|
◦환경 및 생태 내 내분비계장애물질(EDCs) 맞춤형 생태 및 인체 위해관리 시스템 구축으로 생태계 민감 수용체 파악과 위해관리 대책 및 EDCs의 노출저감 정책 기반 마련 |
|
|
|
◈ 호수의 자정기능 복원 및 지속가능한 관리를 위한 나노-마이크로 연계 시스템 개발(2016.11∼2019.6) |
|
◦지속가능한 호수 생태계 복원 및 유지관리 기술개발 |
|
|
|
◈ 생물학적 공정개선을 통한 하・폐수 미량 유해물질 처리효율 향상 기술 (2016.11∼2019.6) |
|
◦기존 생물학적 처리공정에서 미량유해물질 생물분해 메커니즘을 파악하고 유용미생물을 활성화하여 처리대상 미량유해물질 처리효율을 향상할 수 있도록 기존 생물학적 처리공정 개선을 위한 최적 설계 및 운영 시스템 확립 |
(3) 폐자원 에너지화 및 고부가가치 자원화 기술
폐자원 에너지화 기술은 가연성 폐기물, 유기성 폐기물, 매립가스, 산업 폐가스 등을 열화학적 또는 생물학적 방법으로 열, 전력, 수송연료 등으로 에너지화하거나 폐화학제품의 화학전환에 의해 화학원료로 전환하는 기술이다. 혐기성 폐수 처리과정에서 발생하는 바이오가스를 대체에너지로 사용하고자 하는 연구와 친환경적인 바이오소재를 이용하여 금속을 제거 회수하는 연구가 증가하고 있는데, 이는 촉매 사용량을 최소화하고 오염물질은 효과적으로 제어할 수 있는 기술이다. 뿐만 아니라 회수된 자원을 다시 환경기술(ET), 정보기술(IT), 나노기술(NT) 분야에 활용하여 고부가가치 소재를 만들어 낼 수도 있다. 현재 수행하고 있는 기술개발 과제의 예는 아래 표와 같다.
[표 2-29] 폐자원 에너지화 및 고부가가치 자원화 기술의 주요 연구과제
|
|
◈ 미세조류를 이용한 가축분뇨 고도처리 및 Bio-fuel 생성 기술 개발(2011.11∼2015.9) |
|
◦가축분뇨 공공처리장에서 발생하는 이산화탄소를 고정하는 미세조류를 배양하여 질소, 인의 고도처리, 바이오디젤 생산용 lipid 생산, 잔류조류 바이오매스를 활용한 혐기성 바이오가스 생산을 동시에 구현하는 폐수처리 공정 기술 개발 |
|
|
|
◈ 한국형 유기성 폐자원 바이오가스 에너지화 기술 및 복합악취 제어기술 개발(2013.12∼2019.5) |
|
◦유기성폐자원(음식물 폐자원, 가축분뇨 등)을 혐기소화, 가스정제, 악취제어 등을 통하여 바이오가스를 생산할 수 있는 한국형 기술개발 |
|
|
|
◈ 유기성폐자원을 이용한 바이오부탄올 연료화 기술 개발(2013.12∼2019.5) |
|
◦혼합당 발효균주를 통해 폐목재 등 유기성폐자원으로부터 자동차 연료 등으로 활용 가능한 바이오부탄올을 생산할 수 있는 기술 개발 |
|
|
|
◈ 한국형 유기성 폐자원 바이오가스 에너지화 시스템 및 운영기술 개발(2013.12.∼2019.5) |
|
◦고품질 바이오가스 생산 및 저악취 80톤/일급 규모 음식물 폐기물 처리 시설의 설계, 시공 및 운영기술 개발(혐기성 소화) |
(4) 생물자원을 활용한 환경복원・정화기술
환경부는 2004년부터 최근까지 ‘국가 장기생태 연구사업’ 및 ‘생물자원 보존 종합대책 사업’을 통해 생태계 변화를 모니터링하고, 생태계 변화 예측모델을 개발하며 생태계 변화에 따른 영향평가를 수행해 왔다. 기후변화에 따른 과학적이고 장기적인 한반도 생태계 변화 관리 체계와 생물다양성 보전대책을 수립하기 위함이었다.
최근 들어서는 국내 고유생태계를 보호하기 위해 외래생물종 관리를 강화하기 위한‘생물자원 발굴・분류 연구사업’, ‘생물다양성 위협 외래생물 관리 기술개발사업’을 실시하고 있다. 이들 사업을 통해 자생생물과 고유종, 그리고 해외 생물자원의 발굴・확보 관리 인프라를 구축하고, 외래생물 모니터링 및 변화예측・위해성 평가 기술, 생태계 교란생물 제거기술 개발 계획을 수립하였다.
2019년부터는 ‘생태모방기반 환경관리기술개발사업’을 추진하여 생명공학과 환경기술 간의 접목을 시도하며 ‘도시생태계 건강성 증진 기술개발사업’을 통해 생물을 활용한 도시환경의 개선을 도모한다. 또한 앞으로는 한반도 생물종・생물자원 다양성을 관리하고 생물자원 산업화 육성기반을 마련하기 위하여 유용생물자원 기능별 실용화 기술개발에 투자를 집중할 계획이다. 현재 수행하고 있는 기술개발 과제의 예는 다음 표와 같다.
[표 2-30] 생물자원을 활용한 환경복원・정화기술의 주요 연구과제
|
|
◈ DMZ 일원 훼손지역의 자생종 활용 생태복원기술 개발(2014.5∼2017.3) |
|
◦DMZ 일원을 포함한 생태적 중요도가 높은 지역의 현지 식물자원 확보 및 종자를 이용하여 생태복원용 소재 및 특수묘목 생산시스템 구축 |
|
|
|
◈ 드론을 이용한 식생입체 정보 분석 및 정책활용 기술(2016.11∼2019.6) |
|
◦드론 및 기존 영상을 이용한 식생 분석 체계 구축 및 정책적 활용가능성 분석 기존 영상을 이용한 식생판별, 입체구조분석 기술 개발 및 정책 방안 시범 적용, 기존 영상을 이용한 식생입체구조 정보 기술 고도화, 플랫폼 개발 |
|
|
|
◈ 인공지능 및 기계학습 기반 동물 울음소리를 통한 동물종 구별 원천 기술(2017.4∼2020.12) |
|
◦세부종 구별 기술 심화 및 animal log 기술을 활용하여 전문가 분석 보조를 위한 audio summarization 요약기술 연구, 종구별 기술 연구를 통해 양서류, 조류, 포유류, 곤충류 종구별 정확도 95% 달성 목표 |
|
|
|
◈ 생태계교란 식물 물리적 제거기술 개발(2017.12∼2020.12) |
|
◦제거된 생태계교란 식물의 추가번식 방지를 위한 토양 내 외래식물 종자 사멸장치 개발 |
|
|
|
◈ 생태계교란 어류 퇴치기술 개발(2017.12∼2020.12) |
|
◦큰입배스와 블루길을 선택적으로 제거할 수 있는 유인기술에 기반으로 제거장치 개발 |
|
|
|
◈ 환경호르몬 검출을 위한 생체모사기술 기반 펩타이드 수용체 합성 및 휴대형 측정기기 개발(2019.4∼2023.12) |
|
◦다양한 종류의 파지(phage, 세균을 숙주로 하는 바이러스)를 이용해 타깃 환경호르몬과 선택적 결합하는 펩타이드 수용체 제작(파지디스플레이 기술)을 통해 휴대형 환경호르몬 측정기기 개발 |
마. 향후 계획
환경기술은 현안인 환경오염문제를 해결하기 위하여 기술을 개발할 필요가 있다. 뿐만 아니라 점차 강화되고 있는 국가 간 무역과 연계한 환경규제, 즉 국제무역환경규제에 효과적으로 대응하기 위해서도 그 중요성이 점차 커지고 있다. 개발과 보전이 조화를 이루는 ‘지속가능한 사회’ 구현을 위하여 환경기술 개발은 국가경쟁력 확보의 필수요소가 되고 있는 것이다.
특히 다변화되고 복잡한 국제관계가 지속되는 현 시점에서 국제무역환경규제는 물론, 환경산업이 국제경쟁력을 확보하기 위해서는 국내 환경기술 수준을 선도권인 최고기술보유국 대비 80%까지 제고하는 한편, 4차 산업혁명의 핵심기술을 접목한 새로운 융합형 환경기술 개발에 적극적으로 투자할 필요가 있다.
환경부는 중장기적 관점의 환경기술 전략으로서 국내외 정책 수요와 시장 동향, 미래환경기술 전망 등을 토대로 ‘환경기술로드맵(Eco-TRM2022, 2013∼2022)’에 따라 2022년까지 41대 중점기술과 112대 세부기술을 중심으로 기술개발을 진행 중이다. 향후 장기적으로 ‘환경R&D중장기 전략(2019∼2028)에 따라 지속적으로 투자를 확대할 계획이다.
한편, 동 계획에 따라 환경생명공학기술 분야의 다양한 세부사업도 기획 중에 있다. 2020년 착수 예정인 ‘생활화학제품 안전관리기술개발사업’(2020∼2027, 1,458억 원)을 통해 화학제품 사용에 따른 국민 보건상의 위해를 관리・저감하기 위한 기술을 개발할 계획이다. 또한 ‘수생태계 건강성 확보 기술개발사업’(2020∼2027, 866억 원)을 통해 국내 고유 수생생물의 다양성 등 수생태계건강성 증진을 위한 노력에도 매진할 계획이다.
8. 해양수산분야 생명공학 육성
가. 개요
해양수산생명공학기술(MBT: Marine Biotechnology)란 ‘해양 생물체 내에서 일어나는 현상, 구조 및 기능을 이해하고 그로부터 얻어진 지식을 활용하여 제품을 생산하거나 서비스를 제공함으로써 산업 및 인류복지 증진에 응용하는 과학기술’을 총칭한다. 해양바이오산업은 건강・식량・환경 분야의 당면과제를 해결할 수 있는 미래경제의 핵심 산업으로 원천기술 확보를 위한 연구개발 지원과 동시에 실용화를 위한 지원이 적극적으로 이루어져야 하는 분야이다.
(1) 해양수산생명자원의 가치
해양수산생명공학기술의 원천이라 할 수 있는 해양수산생명자원은 이용 잠재력이 큰 차세대 신물질 개발의 보루이다. 해양은 지구 표면적의 70% 정도를 차지하고 있으며, 지구 생물종의 80% 정도가 서식하고 있다. 한편 매년 지구상에서 생산되는 2,000억 톤의 광합성량 중 90%가 해양에서 이루어지고 있다. 갯벌 및 연안에서부터 심해, 열대, 한대에 이르기까지 다양한 해양공간에 광범위하게 분포하는 해양생물들의 가치는 기후조절, 오염물질 자정능력만 계산되어도 육상의 2배인 연간 26조 달러에 이르는 경제적 가치를 지니는 것으로 추정된다.
해양수산생명자원은 해양생물자원, 해양생물다양성 및 해양생명정보를 포함하며, 생명공학연구 또는 산업을 위하여 실제적이거나 잠재적인 가치가 있는 자원을 포함한다.
해양에 서식하는 생물은 육지에서와는 달리 높은 수압과 염도, 저온에 적응하고 진화하며 살아 왔기 때문에 육상생물에서 발견할 수 없는 특이한 대사물질 및 생리활성물질 등을 생산한다. 이러한 해양생물에서 유래한 유용물질은 식품, 의약 및 화학 등의 분야에서 관심을 받으며, 해양생명공학의 주요 자원으로 급부상하고 있다. 해양수산생명공학 산업은 정보통신산업 이후 국가 경제성장의 핵심 산업이 될 분야이며, 고도성장의 잠재력을 가지고 향후 경제발전을 이끌 부가가치산업으로 기술・정보・지식 집약형 첨단산업이다.
(2) 해양수산생명공학 분야 특징
해양수산생명공학 분야는 해양천연물 또는 해양생물에서 기원한 의약재와 고분자 물질, 화학소재 등을 생산하며, 원천기술 확보가 용이하여 독점적 물질특허권 확보가 가능하다는 특징이 있다. 또한 유용 신물질 발견과 제품화 가능성이 높으며 고압, 저온, 수중이라는 극한환경에 서식하는 미생물의 생체기능을 이용하기 위해서 특수 기술을 필요로 한다. 그리고 대량배양 등의 고유한 영역을 지닌다. 이러한 특징들은 해양생물자원을 활용하여 창출할 수 있는 분야의 다양성이 매우 높다는 것을 의미한다.
특히 육상 생명자원의 경우 이미 기작이 밝혀져 있는 경우가 대부분이고, 대다수 선진국들이 특허를 선점하고 있는 경우가 많다. 그러나 해양수산생명자원의 경우 아직 국제적으로 연구와 산업화가 미진한 분야이므로 우리의 노력 여하에 따라 원천기술 확보의 가능성이 높은 분야이다. 해양수산생명자원의 가치는 자원 확보 관리부터 표준화 및 대량생산기술개발, 효능의 과학적 검증을 통해 100배 이상의 부가가치 상승을 기대할 수 있다.
나. 추진경과(연혁)
해양수산부는 2004년 ‘마린바이오21 사업(2004〜2013)’을 시작으로 해양생명공학분야를 꾸준히 육성하고 있다. 2008년 ‘해양생명공학육성기본계획(2008〜2016)’, 2009년에는 ‘해양바이오 연구개발 활성화 대책(2010∼2014)’, 2018년 ‘해양바이오 산업육성 전략(안)’을 수립하였다. 뿐만 아니라 해양생명자원의 보존・관리 및 이용 등에 관한 법률을 제정(2012.7.)하여 해양생명자원의 확보와 체계적이고 효율적인 관리 및 이용을 위한 제도를 마련하였다. 특히, ‘국립해양생물자원관의 설립 및 운영에 관한 법률’을 제정(2015.4.)하고, 해양생물자원의 수집・보존・전시 및 연구 등을 체계적으로 수행하기 위한 국립해양생물자원관을 설립(2015.4.)하여 해양생명자원을 통한 해양생명공학의 체계적 육성을 추진하고 있다.
[표 2-31] 해양 생명공학분야 육성 정책 추진경과(1993∼2019)
|
연도 |
내용 |
주관 |
|
1993 |
∙생명공학육성기본계획 수립(1993∼2006) |
해양수산부 |
|
2003 |
∙해양바이오21 사업 기획연구 실시 |
해양수산부 (해양생태과) |
|
2004 |
∙마린바이오21 사업 3개 연구단 연구 착수 |
해양수산부 (해양생태과) |
|
2006 |
∙한국해양과학기술진흥원으로 관리업무 이관 |
해양수산부 |
|
2007 |
∙해양생명자원종합관리 마스터플랜 수립 |
해양수산부 (해양생태과) |
|
2008 |
∙해양생명공학육성 기본계획(Blue-Bio 2016) 수립 |
국토해양부 (해양생태과) |
|
2009 |
∙해양바이오산업 활성화를 위한 간담회 ∙해양바이오 R&D 투자 확대 후속 조치 지시 |
국토해양부 (해양생태과) |
|
2014 |
∙해양수산 R&D 중장기 계획(2014∼2020) 국가과학기술위원회 의결 |
해양수산부 |
|
2015 |
∙국립해양생물자원관 설립 |
해양수산부 (해양수산생명자원과) |
|
2017 |
∙해양수산 생명자원의 확보・관리 및 이용 등에 관한 법률 |
해양수산부 (해양수산생명자원과) |
|
2018 |
∙해양바이오 산업 육성 전략(안) 마련 |
해양수산부 (해양수산생명자원과) |
|
2019 |
∙제1차 해양수산생명자원 관리 기본계획(2019∼2023) 수립 |
해양수산부 (해양수산생명자원과) |
다. 주요정책
(1) 해양수산생명자원의 보존・관리 및 이용을 위한 통합 법령체계 마련
해양수산부는 해양생명자원과 수산생명자원으로 이원화된 법령을 정비해 해양수산 생명자원의 확보・관리 및 이용 등에 관한 법률(2017.6.)을 마련하였다. 이에 따라, 유사한 내용의 두 개의 법률을 운용함에 따른 업무중복 및 혼선을 방지하게 되었다. 동 법에는 나고야의정서 발효(2014.10.)에 따른 해양수산생명자원의 이용에 대한 이익공유의 근거규정과 국내 해양생명자원의 해외반출 등에 대한 보호 강화 규정이 추가되었다.
(2) 해양수산생명공학 유망분야 핵심기술 개발
해양수산부는 해양생명공학 유망분야 핵심기술 개발에 집중 투자하고 있다. 고부가가치 신소재 개발을 목표로 해양 생명자원의 기능성분 규명과 대량생산 및 표준화 기술개발을 통한 건강기능 식품・화장품 및 의료소재 등 개발을 추진하고 있다. 또한 온실가스 감축과 친환경 해양바이오에너지 생산 원천기술 확보를 목표로 해양미세조류를 이용한 바이오디젤 생산성 향상을 위한 실증생산연구를 추진하고 있으며, 심해 열수구에 발견된 해양 고세균 이용 해양바이오 수소 생산연구는 기업을 주관으로 기술 상용화를 위해 실증플랜트 규모 확대 및 연속생산 실증을 추진하고 있다.
한편, 해양생물의 독특한 생명현상을 유전자 수준에서 규명하여 고부가 바이오 원료의 대량생산 및 의약 소재개발에 적용하는 연구를 추진하고 있다. 해양 와편모류의 섭식능력을 활용한 양식장 기생충 제어 기반기술을 개발하고 있으며, 해양 포유류인 고래의 생리적 특성인 저산소증 저항성, 빠른 상처 치유능과 관련된 유전자(단백질)의 분자진화 및 조절 기작 규명을 통한 바이오 메디컬 소재 개발연구를 추진하고 있다.
[표 2-32] 해양수산생명공학 주요 핵심기술 분야
|
기술분야 |
주요내용 |
|
해양수산생명자원 확보 및 활용기반구축 |
국내외 해양수산생명자원을 확보・보존하고 자원의 정보화 및 통합 DB 구축 |
|
해양수산바이오신소재 개발 |
유용한 해양수산생물이 생산하는 대사물질 또는 생체 기능을 이용한 산업용 바이오 신소재 개발 |
|
해양바이오에너지개발 |
해양생물 유래 친환경 바이오에너지(바이오알콜, 디젤 및 수소) 생산 원천기술 확보 및 대량생산 |
|
해양생명현상활용연구 |
해양생물자원 및 유전자원을 활용하여 생명현상 기능 규명 등 유용 생명시스템 개발 |
|
포스트게놈 다부처 유전체 |
유용 유전자원의 산업적 가치 발굴을 위한 해양생물 전장유전체 대량 해독 및 발굴, 수산양식생물 고부가가치 신품종 개발을 위한 유용유전자 확보 |
|
해양바이오 전략소재 개발 |
해양생물자원을 대상으로 제품개발에 활용가능 한 핵심성분(지표성분, 효능성분 등)을 지닌 소재개발 |
|
대량생산시스템 및 고도화 공정개발 |
산업적 활용가치가 높은 해양생물 유래 유용물질 대량 생산 및 고도화, 소재의 표준화 및 대량생산공정 시스템 개발 |
|
기술 상용화 지원 |
대량생산이 가능한 유용 해양생물소재의 작용 기전(대사과정) 연구 및 제품화 연구 |
(3) 해양바이오산업 육성
해양바이오산업은 해양생물의 대사물질 또는 생리기능을 토대로 개발 및 생산이 이루어지므로 해양생명자원에 대한 의존성이 높은 분야이다. 해양생물 확보를 위해서는 해양에 접근하기 위한 선박 등 전문 인프라가 필요하며 산업화를 위한 자원의 대량확보에 어려움이 있다. 이에 해양수산부는 해양바이오 산업진흥을 위해 산업화 기반 정책을 추진하고 있다.
2016년 6월에 해양 바이오산업 분류체계를 마련하고, 2017년 1월부터는 국내 해양바이오기업의 기술수준, 매출액, 보유인력 등 현황 파악을 위한 해양바이오 산업 실태조사를 실시하였다. 아울러 해양수산부 산하 국립해양생물자원관의 전문인력과 확보된 유용 해양생물 자원을 활용하여 산업화 헬프데스크를 구축하고, 해양생명자원 정보, 기술 산업화 정보서비스 및 산업화 지원 컨설팅 등을 제공한 바 있다.
2018년 8월에는 해양바이오 산업육성 전략을 수립하여 체계적 자원확보 기반구축, 자원 통합관리 및 활용도 제고, 맞춤형 R&D 추진, 해양바이오산업 생태계 조성을 위한 정책을 마련하였다. 특히 2019년에는 기업중심의 소규모・경쟁형 R&D 추진을 통해 소재 대량생산 시스템 구축 및 실용화 성과창출에 더욱 박차를 가하고 있다.
라. 주요사업
(1) 해양수산생명공학기술개발사업
해양수산부는 해양수산생명공학의 원천기술 확보를 통한 해양바이오분야 기술경쟁력 강화를 위해 2004년부터 2019년까지 총 3,160억 원을 해양생명공학 R&D사업에 투자하였다. 각 분야별로 해양수산생명자원 확보 및 활용기반구축 796억 원, 해양수산바이오 신소재 개발 1,216억 원, 해양바이오 에너지 개발 734억 원, 해양생명현상 활용연구에 415억 원을 투자하였다. 이러한 투자를 통해 해양생명공학 분야에서 많은 성과를 이룰 수 있었다.
우선, 해양생명자원 통합정보시스템(MBRIS) 구축을 통해 해양생명자원 1만 727종 57만 5,336점(2019.7. 기준)을 확보하였으며, 2018년까지 SCI 논문 1,837편, 특허 등록 549건(국내 472건, 국외 77건), 기술이전 44건을 달성하였다. 주요 성과로는 홍합 접착단백질 활용 의료용 복합 지혈소재 개발, 기능성 식・의약소재 개발, 미세조류를 이용한 바이오디젤 생산기술개발, 해양 고세균을 이용한 바이오수소 생산기술개발, 해양와편모류 신종 발굴 등이 있다.
[표 2-33] 해양수산생명공학 주요성과
|
|
해양소재유래 ICG 대체 화합물 개발 및 상용화(2018.12.) |
|
해양유래 물질인 키토산 나노 입자에 수용성 반응기를 가지는 신규 NIR 염료 2종을 개발함. 개발 된 염료의 분석을 통하여 2종의 염료를 FSD680 NHS ester, FSD750 NHS ester의 상표명으로 상용화(300만 원 판매). 개발된 신규 NIR 염료는 기존 임상에 사용되고 있는 ICG에 비해 150% 이상의 양자효율을 가지는 염료로 높은 형광 강도와 높은 양자효율, 낮은 광 분해능, 낮은 세포 독성을 가지는 것으로 확인됨 |
|
|
|
홍합접착단백질을 활용한 스프레이형 나노항암제 기반 국소약물전달 시스템 개발(2018.9.) |
|
홍합접착단백질기반 나노항암제를 암 조직에 스프레이 분사를 통하여 항암제를 국소적으로 투여 시 나노입자가 암 조직에 접착되어 체류성을 증진시킴. 또한 산성 환경을 지닌 암세포 내에서 선택적으로 약물을 방출하여 세포의 사멸을 유도하고 재발을 방지함. |
|
|
|
미세조류 유래 고순도 푸코잔틴 및 이로부터 표준화된 개별인정형 건강기능식품 소재 기술이전(2018.10.) |
|
기존 해조류에서만 생산하던 고부가 해양 색소인 푸코잔틴을 미세조류에서 생산하여 건강기능식품 소재화하였음. -차별성: 해조 유래 푸코잔틴 분리, 생산은 고순도 분리가 경제성이 낮아, 단순 추출물 형태로 생산되어 식품 등 다른 산업 분야에 응용이 힘들지만, 미세조류 유래 ‘페오닥틸럼 추출물’은 경제성 있는 고순도 푸코잔틴으로부터 제조되어 향후 식품, 향장 등 다양한 분야에 활용도가 높음. |
|
|
|
해양 와편모류를 이용한 식물성 오메가-3의 생산기반 기술 개발 (2018) |
|
해양 와편모류인 파라짐노디니움 시화엔스(Paragymnodinium shiwhaense) 식물성 오메가-3 영양제 개발의 가능성 발견. 기존의 사용 중인 다른 미세조류 보다 함량이 좋거나 유사하며, EPA(Eicosapentaenoic acid)와 DHA(Docosahexaenoic acid)를 동시에 다량으로 가지고 있음. 오메가-3의 생산을 위한 최적의 배양조건을 확립 및 오메가-3의 합성 기작에 관여하는 유전정보 분석을 완료함. |
|
|
|
우리바다 어린물고기 도감 발간(2018.12.) |
|
국내 최초로 우리 바다에 살고 있는 유어(어린 물고기) 12목 46과 85종을 대상으로 사진을 비롯하여 다양한 정보를 수록함. 해양어류의 전생활사 중에서 생존에 가장 취약한 시기인 유어 시기를 대상으로 이들 자원의 적극적인 보호 관리를 위해 유어 시기의 형태 사진과 채집 정보, 분포 정보, IUCN의 자원상태 등을 소개한 도감임. |
|
|
|
해양식물플랑크톤 배양주 보존실에 적용된 자체개발 랙 시스템기술이전 및 도면 특허등록(2018. 2.) |
|
기존의 해양식물플랑크톤 자원의 보존 방법은 식물플랑크톤의 생리적 특성을 고려하지 하지 않은 보존법으로 배양주의 오염과 사멸이 자주 발생하였으나 ‘해양식물플랑크톤 기탁등록보존기관’에 적용된 특수 랙 시스템은 종 특이성 성장 조건을 고려하여 제작되었기 때문에, 자원의 보존에 안정성을 확보하였음(특허 등록 및 기술 이전) |
(2) 포스트게놈다부처 유전체사업
해양수산부는 해양생물의 차세대 유전체 연구 기반을 구축하고 해양유전체 유래 기초원천 기술 개발을 위한 포스트게놈 다부처 유전체사업(2014∼2021)을 추진하고 있다. 해양동물, 해양식물, 해양미생물, 해양메타유전체, 수산생물 유전체 분석 및 활용기반 연구와 해양수산생물 유전체정보센터 구축・운영 등 6개의 주요 세부과제를 중심으로 해양수산생물 유전체 정보 생산, 해양수산생물 유전체 정보 분석을 진행 중에 있다. 사업 추진을 통해 2018년까지 해양수산 유전체분야 관련 SCI논문 142편, 국내 특허등록 11건을 달성하였다. 최근에는 세계 최초 남방큰돌고래 유전체 해독(2018), 참돔 표준유전체 완성(2018) 및 어류성장속도 조절 유전자 발굴(2019), 말레이해파리 유전자 및 대사변화 예측법 독일특허 등록(2019)등 활용을 위한 다양한 성과 창출에 힘쓰고 있다.
(3) 해양바이오 전략소재개발
2019년에는 해양바이오 전략소재개발 및 상용화 지원 사업에 착수하여 해양수산생물자원 유래 기능성식품, 기능성 화장품, 의료기기 활용소재의 식약처 허가를 통한 실용화 기술개발을 추진 중이다. 본 사업은 해양수산생명공학 기술개발사업의 일몰 후속사업으로 대학 및 연구소 중심의 R&D 지원으로 확보된 원천기술을 활용하여 기업중심의 상용화 연구를 지원한다. 해양생물자원을 활용한 기능성분 확보기술, 대량생산 및 표준화기술, 효능검증 기술개발을 통해 단기 실용화 성과 창출에 박차를 가하고 있다.

[그림 2-5] 해양수산생명공학사업 추진체계
마. 향후 계획
해양바이오 산업은 전 세계적으로 신생산업 분야이며 대표적인 하이 리스크 하이 리턴(High Risk, High Return) 분야이다. 따라서 이윤추구를 근본 목적으로 하는 기업에 R&D 투자를 맡겨둘 경우 필연적으로 과소공급에 따른 시장실패가 예상된다는 한계점이 존재한다. 그러나 해양바이오 산업은 미래 성장동력 산업으로 미래 우리나라의 경쟁력 제고를 위해 반드시 필요한 산업이다. 그리고 현재 해양바이오 산업은 초기 단계에 있기 때문에 기초원천기술 분야에 대한 지속적인 투자가 필요하며, 자원의 확보부터 소재개발에 이르는 전 단계에 대한 집중적인 육성 및 지원이 절실하다. 또한 UN해양법, 나고야의정서 등 국제적으로 생명자원 이용제한 추세에 따라 국내외 해양생물자원 확보와 보존을 위한 국가 주도의 체계적인 사업 추진이 필요할 것으로 전망된다.
해양수산부는 해양생물에 관한 수집・연구 및 활용기반 구축 등의 업무를 전담할 국립해양생물자원관이 개관(2015.4.)됨에 따라 자원관리를 바탕으로 한 해양수산생명공학에 대한 체계적인 정책운영을 추진해 나갈 계획이다. 또한 산・학・연의 연구체계를 강화하는 등 민간이 할 수 없는 다양한 공공분야의 투자와 인프라 구축을 적극적으로 주도하여 해양생명 자원을 보존 및 활용방안을 수립할 계획이다.
국내외 해양수산생명자원의 국가자산화와 기반기술 개발 등 해양바이오산업 육성을 위한 해양바이오 네트워크 구축, 유망 소재・기술의 사업화 촉진 및 해양바이오 전문인력 양성 등 민・관 협력을 통해 해양바이오 산업 생태계를 조성하는 등 해양수산생명공학 산업이 활성화될 수 있도록 지속적으로 지원하고 육성해 나갈 것이다.
특히 기업의 기술・특허인증 지원 등 사업화 지원 플랫폼, 벤처창업 컨설팅 등 기업육성, 원료소재 수입 대체기술 산업화 지원 등 해양바이오 산업육성을 위한 인큐베이터 설립 기본계획을 마련하고 해양바이오 분야의 지속적인 수요 발굴 및 중장기 투자전략을 마련하는 한편 후속사업을 위한 기획을 지속 추진할 방침이다.
9. 생명자원분야의 육성 및 관리
가. 개요
생명자원10)은 기후변화, 환경오염, 에너지 위기, 식량부족 등 인류가 직면하고 있는 난제를 해결하는 생명공학의 핵심 소재로 식품, 의약품, 농업 등의 산업에서 고부가가치 창출이 가능하다. 이러한 잠재적 가치로 인해 전 세계적으로 생명자원의 확보를 강화하고 있다.
미국은 국가 바이오경제 청사진 실현을 위하여, 미국표준균주은행(ATCC: American Type Culture Collection), 국가생명공학정보센터(NCBI: National Center for Biotechnology Information), 국가암센터(NCI: National Cancer Institute) 등 다양한 거점기관을 운영하며 분야별 연구개발을 강화하고 있다.
유럽은 ʻHorizon 2020ʼ의 재조정을 통해 생명자원 인프라 구축 및 나고야의정서 대응 방안을 마련하고 있으며, 식량안보, 지속가능한 농업, 어업 및 해양연구를 위하여 유럽 전체 생명자원의 정보화 및 관리 기능을 강화하고 있으며 미생물자원연구인프라(MIRRI: Microbial Resource Research Infrastructure), 유럽생물정보연구소(EBI: European Bioinformatics Institute) 등을 통한 생물자원 및 관련 정보에 대한 네트워크를 구축하였다.
일본은 제5차 과학기술기본계획(2016∼2020)에 따라 제4기 국가생물자원프로젝트(National Biological Resource Project, NBRP)를 진행하고 있으며, 이에 따라 동물, 식물, 미생물 등 총 30개 생명자원에 대해 국가 차원의 체계적인 수집, 보존, 제공 등의 서비스를 제공하고 있다.
우리나라는 2011년 수립된 ‘생명연구자원관리 기본계획’을 바탕으로 2011년부터 매년 ʻ생명연구자원관리 시행계획ʼ을 수6립하고 있으며, 관계부처는 소관 자원의 발굴・확보, 보존・관리, 활용을 위한 연구개발과 관련 인프라 구축을 활발하게 진행하고 있다. 2018년 총 투자액은 1,508억 원이며, 표에서 보는 바와 같이 과기정통부, 해수부, 환경부, 농식품부, 복지부, 산업부, 식약처 순으로 투자하고 있다.
[표 2-34] 생명연구자원 분야 부처별/분야별 투자실적(2018)(단위: 백만 원)
|
부처명 |
생물자원 |
생물다양성 |
생명정보 |
소계 |
|
과학기술정보통신부 |
22,629 |
21,052 |
1,050 |
44,731 |
|
농림축산식품부 |
21,234 |
661 |
- |
21,895 |
|
산업통상자원부 |
- |
6,675 |
2,261 |
8,936 |
|
보건복지부 |
11,341 |
- |
- |
11,341 |
|
환경부 |
14,616 |
- |
7,823 |
22,439 |
|
해양수산부 |
5,787 |
28,046 |
|
33,833 |
|
식품의약품안전처 |
7,627 |
- |
- |
7,627 |
|
합계 |
83,234 |
56,434 |
11,134 |
150,802 |
주) 농식품부는 농진청, 산림청 포함
출처: 2019년도 생명공학육성시행계획, 2019.4.

출처: 2019년도 생명연구자원관리 시행계획, 2019
[그림 2-6] 생명연구자원 관련 관계부처별 역할
관계부처의 역할을 보면, ʻ생명연구자원의 확보・관리 및 활용에 관한 법률’ 제6조에 따라 과기정통부가 국가 차원의 생명연구자원통합정보시스템 구축 및 기초・원천 연구분야를 담당하고 있다. 교육부는 전문인력양성 분야, 농식품부는 농업 분야, 산업부는 산업 분야, 복지부・식약처는 보건・의료분야, 환경부는 야생생물 분야, 해수부는 해양・수산 분야 생명연구자원을 담당하고 있다.
나. 생명연구자원 및 통합정보시스템 관리(과기정통부)
(1) 국가전략생명연구자원의 안정적 확보
감염병, 생물다양성 감소 등 글로벌 이슈, 기술발전에 따른 미래수요, 산업적 잠재력, 한국적 희소성 등을 고려하여, 10종의 제1차 국가전략생명연구자원이 2018년 12월에 선정되었다. 2019년에는 10종의 제1차 국가전략생명연구자원별 책임부처와 전담기관을 지정이 추진되고 있으며, 향후 각 자원 보유기관과의 협력・관리체계를 마련하여, 국가전략생명연구자원의 전략적 관리체계를 정비할 예정이다. 또한, 2020년까지 2차 국가전략생명연구자원을 선정하고, 기술발전이나 환경변화를 감안하여, 3∼5년 주기로 국가전략생명연구자원을 정비할 예정이다.
(2) 생명연구자원의 발굴・확보 및 활용 확대
국가연구개발사업을 통해 생산된 고품질 자원의 기탁・공유가 활성화될 수 있도록, 연구현장이 공감하는 공유체계를 마련하고, 개인 연구자가 보유한 고품질 자원 공유를 촉진하기 위해 자원분양 실적이 높은 자원에 필요한 비용의 지원을 추진할 예정이다.
(3) 생명연구자원 관리체계 고도화
국가생명연구자원통합정보시스템 고도화를 통해, 생명연구자원 범부처 통합관리체계를 구축함으로써 오픈사이언스 기반을 조성할 예정이다. 개별 연구소재은행 중심의 자원 관리 체계를 개편하여 중앙 관리를 강화하고, 개별 은행이 보유한 자원의 품질 관리를 실시할 예정이다. 또한 연구 현장 수요와 민간 공급 상황 등을 고려하여 국가적 확보・관리가 필수적인 자원 중심으로 소재은행 관리 자원을 재편하고, 필요한 자원을 쉽게 찾을 수 있도록 ‘자원 전문 멘토단’을 운영하고자 한다.
(4) 향후 추진 계획
국내외 환경변화를 반영한 ʻ제2차 생명연구자원관리 기본계획(2016∼2020)ʼ을 바탕으로 전략적 생명연구자원 확보, 생명연구자원의 이용가치 제고, 생명연구자원 통합관리체계 고도화 등을 추진해 왔다. 향후에는 국가전략생명연구자원별 관리체계 확립, 고품질 생명연구자원의 기탁・공유 활성화, 유전체 정보를 포함한 생명연구자원 정보의 범부처 통합관리체계 구축 등을 적극 추진할 예정이다.
다. 농업분야의 육성 및 관리(농림축산식품부)
농림축산식품 분야는 1987년 농촌진흥청에 종자은행을 설립하는 등 일찍부터 생명자원의 중요성을 인식하고 선도적으로 자원 보존 및 관리를 시작해왔다. 2007년 ‘농업유전자원의 보존・관리 및 이용에 관한 법률’을 제정하여 종합적인 농업생명자원 관리의 제도적 기반을 마련하게 되었다. 이후 정부조직 개편 등에 따라 몇 차례 개정을 거쳐 현재의 ‘농업생명자원의 보존, 관리 및 이용에 관한 법률’로 개정(2017.6.)되었으며 본 법령에 따라 산림생명자원은 산림청, 수의병원체 생명자원은 농림축산검역본부에서 관리하고 있다.
그 외 농업생명자원은 농촌진흥청에서 전문적으로 관리하고 있으며 농림축산식품부에서는 제도 및 정책을 총괄하고 있다. 또한 민간 연구소, 대학, 지자체 농업기술센터 등의 역량을 활용하기 위해 132개의 농업생명자원 관리기관을 지정하여 농업생명자원의 수집, 보존, 분석 및 연구를 지원하고 있다.
[표 2-35] 농업생명자원 관리기관 지정 현황
|
구분 |
계 |
종자 |
영양체 |
미생물 |
가축 |
곤충 |
|
합계 |
132 |
38 |
68 |
11 |
12 |
3 |
|
지자체 |
64 |
9 |
44 |
- |
9 |
2 |
|
대학・민간 |
68 |
29 |
24 |
11 |
3 |
1 |
또한 상기 법령에 의거 법정 종합계획인 ‘농업생명자원 보존・관리 및 이용활성화를 위한 기본계획’에 따라 자원관리 정책을 추진하고 있다. 이에 2014∼2018년까지 추진한 제2차 기본계획을 통해 자원 보유점수가 128만 점에서 294만 점으로 두 배 이상 증가하였으며 2019년에 새로 수립된 제3차 기본계획은 이러한 자원을 이용한 육종, 소재 개발 등 ‘농업생명자원의 고부가가치 산업화 촉진’을 목표로 2023년까지 5년간 추진될 계획이다.

[그림 2-7] 제3차 농생명자원 보존・관리 및 이용 활성화를 위한 기본계획의 4대 추진전략
제3차 기본계획은 양질의 자원 확보, 자원 보존・관리 강화, 수요자 중심의 정보 제공, 자원 이용 활성화의 4대 전략으로 구성되어 있다. 우선 양질의 자원 확보를 위해 다양한 자원을 수집하고 수집 자원에 대한 특성 평가를 확대하고 특성평가 기준을 표준화하는 등 내실화 할 계획이다. 또한 보유자원의 증식 및 안전 중복・보존을 확대하고 관련 기술을 고도화하는 한편 농업생명자원 관리기관의 성과・관리 등을 강화하고 관련 법・제도 개정 수요 등의 의견을 수렴하여 관리체계를 정비할 계획이다.
한편 농림축산식품부(농식품부)는 기관별로 분산 관리되고 있는 생명자원 DB를 통합해 수요자 중심의 정보 제공을 위한 생명자원정보서비스(BRIS.go.kr)를 구축・운영하고 있다. 농식품부는 생명자원 DB 및 관련 특허, 전통지식 등 정보와 카드뉴스, 교육 콘텐츠 등을 지속적으로 확충할 계획이며 특히 2018년 8월부터 본격적으로 국내에도 관련 법령이 시행된 나고야 의정서관련 정보제공을 강화할 계획이다. 마지막으로 자원 이용활성화를 위해 농업생명자원의 분양 및 사후관리를 강화하고 관련 연구 및 인력양성에 대한 지원을 확대할 계획이다.
2018년 말 기준 농식품부 및 관계 기관에서 보유한 자원은 농촌진흥청(농진청) 64만 8,453점, 산림청 232만 7,333점, 검역본부 8,193점 등 총 298만 3,979점으로 세부 분류별 보유현황은 아래와 같다.
[표 2-36] 농업생명자원 보존 현황
|
기관 |
분야 |
종수 |
보존점수 |
|
농진청 |
종자 |
1,594 |
228,358 |
|
영양체 |
1,527 |
27,125 |
|
|
미생물 |
7,726 |
24,105 |
|
|
가축 |
11 |
368,488 |
|
|
곤충 |
20 |
377 |
|
|
계 |
10,814 |
648,453 |
|
|
산림청
|
종자 |
5,536 |
54,524 |
|
영양체 |
8,187 |
926,192 |
|
|
산림청 |
미생물 |
923 |
6,742 |
|
DNA |
740 |
136,852 |
|
|
현지내보존집단 |
19 |
3,181ha |
|
|
표본 |
23,428 |
1,203,023 |
|
|
계 |
38,814 |
2,327,333(3,181ha) |
|
|
검역본부 |
병원균 |
298 |
7,097 |
|
항혈청 |
2 |
257 |
|
|
세포주 |
43 |
115 |
|
|
기타 |
130 |
724 |
|
|
계 |
473 |
8,193 |
|
|
합계 |
50,101 |
2,983,979(3,181ha) |
|
주) 농업생명자원 종 수는 단순합산으로 일부 중복이 있을 수 있음.
라. 보건의료분야의 육성 및 관리(보건복지부)
미래 보건의료연구의 핵심 인프라인 인체자원의 국가적 종합관리를 위해 한국인체자원은행사업(KBP: Korea Biobank Project)을 추진하고 있으며, KBP 1, 2기(2008∼2015)의 성과를 바탕으로, 미래 보건의료 연구 및 관련 기술개발에 있어 산・학・연 전반에 걸친 적극적인 지원을 목표로 KBP 3기(2016∼2020)를 추진하고 있다.
(1) 추진배경
(가) 개인별 유전체 연구의 급속한 발전에 따라 보건의료연구 및 산업계의 대량 인체자원 수요 증가
(나) 그간 성과를 바탕으로 보다 강화된 고품질 특화자원의 수집체계 마련, 분양 확대 등을 통해 구체적 성과창출 필요
(2) 추진전략

[그림 2-8] 3기 한국인체자원은행사업(KBP) 추진전략 및 과제
(가) 바이오뱅크 포럼 운영, 인체자원은행-보건의료 R&D 연계 등 수요자 친화적 바이오뱅크 운영
(나) 질환중심형 바이오뱅크 구축・운영, 산업계 분양 확대 등 바이오뱅크의 보건의료 R&D 전주기 지원 성공모델 제시
(다) 바이오뱅크 국제협력 체계 구축, 인체자원 관리 기술 및 시스템 강화, 인체자원단위은행별 자원 수집・활용체계 강화 등 바이오뱅크 운영 고도화
(3) 추진 현황 및 성과

[그림 2-9] 한국인체자원은행네트워크 운영 현황
(가) 국립중앙인체자원은행과 17개 인체자원단위은행 및 2개 협력병원이 네트워크를 구성하여 다양한 코호트 및 질환군 인체자원 수집
(나) 2018년 12월 기준, 85만여 명분 인체자원 확보, 2,706여 개 과제에 분양, 논문(1,062여 편) 및 특허(66건) 성과 창출
(다) 인체자원 분양데스크, 인체자원연구지원센터 운영 등 연구자 중심의 분양지원 체계 구축 및 실무자 교육, 인체자원은행 운영지원 등 인체자원 관리 표준화를 통해 인체자원 국가 종합관리체계 마련
(라) 특정질환 극복을 목적으로 보건의료 R&D 연구를 위한 고부가가치 자원을 계획적으로 확보하기 위한 ‘질환중심형 바이오뱅크’ 구축

[그림 2-10] 중앙은행 및 인체자원단위은행 수집・활용성과
(4) 향후 추진계획
(가) 바이오뱅크 포럼 운영 등 수요자 중심의 소통채널 마련 및 바이오뱅크 인지도 향상을 위한 홍보사업 지속 전개
(나) 인체자원 품질관리기술 개발, 자원 및 정보 품질 관리 확대 등 지속적인 자원 신뢰도 제고
(다) 체액자원, 질환패널자원 등 분양대상자원 지속 확대
(라) 산업체 분양 확대 등 다양한 연구・개발 분야의 효율적 지원
(마) 질환중심형 바이오뱅크 지속 운영
마. 야생생물자원 분야의 관리(환경부)
(1) 자생 생물자원 관리 정책
환경부는 ‘생물다양성협약(CBD)’11)에 따라 생물다양성 보전과 생물자원의 지속가능한 이용 정책을 보다 체계적으로 추진하고, 생물주권을 강화하려는 국제적 추세에 대응하기 위하여 ‘생물다양성 보전 및 이용에 관한 법률’을 제정(2012.2.1.)하였다. 정부는 동법 제7조에 따라 생물다양성의 보전과 그 구성요소의 지속가능한 이용을 위한 범부처 법정전략으로 국가생물다양성전략을 5년마다 수립하고 있으며, 제3차 국가생물다양성전략(2014∼2018)에 이은 제4차 국가생물다양성전략(2019∼2023)을 수립(2018.11.)하고 매년 시행계획을 수립・시행하고 있다.
(2) 자생 생물자원의 확보・관리・활용 연구현황
환경부는 국가생물자원의 조사・보전・관리와 현명한 이용을 위한 정책을 추진하고 있다. 현재까지 지속적인 투자와 연구를 통해 5만 2,628종의 국가생물종목록(2018.12.)을 구축하고 309만 점의 표본을 확보하여 관리하고 있다. 자생생물 1만 5,162종의 종속지적 연구 수행하여 국문과 영문으로 기재문을 작성(2018)하였고, 2009년부터 2018년까지 한국 생물지를 국문과 영문으로 총 387권 발간하여 배포하였다. 생물종 정보, 유전자원 정보, 유용성 정보 등 각 부처에서 따로 관리되는 정보를 통합하여 표준화한 1만 2,467만여 건(2018.12.)의 정보를 ‘국가생물다양성 정보공유체계(www.kbr.go.kr)’를 통해 필요한 부처에 제공하고 있다.
나고야의정서 비준(2017.5.19.) 이후, 국가책임・점검기관 같은 주요기관의 지정, 유전자원정보관리센터 설치・운영, 국내 유전자원 접근신고, 내국인이 해외 유전자원을 이용하는 경우의 절차준수신고, ABS 정보공유체계 운영 등을 담은 ‘유전자원의 접근・이용 및 이익 공유에 관한 법률(이하 유전자원법)’을 제정(2017.1.17.)하는 등 구체적인 국내 이행・지원 체계를 구축해 나가고 있다. 나고야의정서 이행 법률 제정을 통해 국내 유전자원에 대한 주권을 강화하고, 유전자원정보관리센터 설치(2018.3.30.) 및 부처 합동 통합신고시스템(2018.8.18.)을 구축하여 운영하는 등 산업계 지원 정책을 단계적으로 추진하고 있다.
국립생물자원관에서는 내부적으로 생물자원의 보전과 지속가능한 이용을 위해 생물다양성 우수지역 등에서 전해져 내려오거나, 의서, 농서 등 주요 고문헌 30여 종에 기술된 전통지식 총 10만여 건을 수집하고, 전통지식 대상종, 해외활용사례 생물종 근연종 대상 등의 효능・성분 분석 및 유전체 분석을 수행하여 환경생물산업을 지원하고 있다. 2018년까지 국내 자생생물 516종에 대한 항산화, 항염 등을 연구하여 유용성 정보를 확보하였으며, 최근에는 자생 미생물을 활용한 천연식물보호제 발굴 등 환경보전・관리와 관련한 자생생물 활용 연구를 진행하고 있다.
다양한 자생생물 생물소재의 안정적 보존과 지속가능한 이용을 위해 4개의 야생생물소재은행(유전자원, 종자, 천연물, 배양체)을 운영하고 있다. 고품질 및 수요자 맞춤형 생물소재를 확보하여 관리해서 다양한 생물소재를 산업계, 학계, 연구소에 맞춤형 분양서비스로 제공하고 있다. 현재까지 기원이 정확한 다양한 생물소재 1만 9,100종 19만 9,358점을 확보・관리하고 있으며 고품질 생물소재 8,970점을 분양하고 있다. 잠재적 활용가치가 높은 해외 생물자원 소재 접근을 위해 캄보디아, 베트남, 미얀마, 탄자니아 등 9개국 12개 기관과 MOU/MOA를 체결하여 해외 네트워크를 확장하고 있다. 특히, 지금까지 이들 국가와 공동연구를 통해 자국 생물다양성 도감과 자료집 32권을 발간하여 기증하였고 28건의 특허도 공동출원하여 국가 간 신뢰도를 높이고 있다. 캄보디아와 공동연구로 현지 식물의 미백 효능을 확인하고 국내 기업에 기술을 이전하여 화장품을 개발한 것은 해외생물자원 활용의 좋은 방향성을 제시해 주고 있다.
(3) 향후 계획
앞으로 자생생물종의 신규 발굴 난이도는 점차 증가할 것으로 예상되고, 이를 뒷받침해줄 국내 전문인력도 부족한 상황이다. 이러한 문제를 극복하기 위해, 발굴 가능성이 높은 분류군인 곤충, 무척추동물, 균류, 지의류 등에 대한 조사연구에 집중하며 생물다양성 전문인력 양성사업을 통해 국내 연구자 인프라가 부족한 생물분류군 전문가를 양성하고, 생물다양성협약 대응 전문인력 양성사업을 통해 급변하는 국내외 생물다양성 정책에 대응을 위한 전문인력을 양성하는 등의 교육 인프라를 구축해 나갈 예정이다. 또한, 분류전문가가 국내에 적거나 없는 분류군에 대해서는 해외 공동연구를 통한 지속적인 발굴 노력을 통해 2023년까지 국가생물종목록 6만 종 구축 목표에 기여하고자 노력하고 있다.
이러한 생물종 정보를 기반으로 지금까지 알려지지 않았던 생물자원의 가치를 발굴하는 유용성 연구 결과는 생물주권확보의 기반이 됨과 더불어 식품, 의약품, 향장품, 환경보호 등 다양한 분야에서 새로운 생물자원 활용 가능성을 열어줄 수 있을 것으로 기대된다. 동시에 부족한 국내 생물자원을 대체할 해외생물자원 확보를 강화하기 위해 협력국을 동남아시아에서 남미, 아프리카까지 확대하고 국내 생물산업 지원을 위한 영역을 넓혀가고자 한다. 자생생물 생물소재의 이용 기반 확대 및 품질강화를 위해 생물소재 특화 전문연구시설인 야생생물소재연구동 건립 추진하고 있다. 신축되는 연구동은 기존 4개 생물소재은행 운영 강화를 위해 다양한 전용 저장시설과 소재 특화 전문연구실이 갖추어지며, 2019년 9월에 착공하여 2021년 2월에 완공될 예정이다.
나고야의정서 대응 및 유전자원법 이행 지원을 위해 주요 당사국의 ABS 관련 법령 제공 및 산업계 인식제고 사업을 지속적으로 추진하고자 하며, 국내외 유관기관 및 민간이 보유하고 있는 생물다양성 및 생물자원 정보를 종합 관리하여 국가 차원의 정보 연계・구축・운영 등 수요자 맞춤정보 제공 체계를 마련하고자 한다.
바. 해양수산생명자원 분야의 육성 및 관리(해양수산부)
(1) 해양수산생명자원 육성 및 관리정책
해양수산부는 해양수산생명자원의 중요성을 인식하고 이에 대한 체계적인 육성 및 관리를 추진하고 있다. 2016년 12월 28일 ‘해양수산생명자원의 확보・관리 및 이용 등에 관한 법률’ 전부 개정에 이어 우리나라 해양수산생명자원의 무분별한 국외 반출을 방지하기 위해 국외반출 승인대상 해양수산생명자원 지정 고시(2017.10.31. 제정)를 마련하였으며, 11개 분류군 1,127종의 자원을 국외반출 승인대상으로 지정한 바 있다. 또한 2019년 1월에는 제1차 해양수산생명자원 관리 기본계획(2019∼2023)을 수립하여 해양바이오 산업의 근간인 해양수산생명자원의 체계적인 관리를 위한 정책을 추진하고 있다.
해양수산생명자원에 대한 육성 및 관리에 대한 총괄기관인 국립해양생물 자원관이 개관(2015.4.)함에 따라 해양수산생명자원조사, 해외해양생물자원 개발 및 활용기반구축(3단계) 사업 등 국가해양수산생명자원의 실물 및 관련정보의 지속가능한 보존관리를 위한 인프라 체계를 구축하고 있다. 또한 국립해양생물자원관과 함께 국립수산과학원을 책임기관으로 지정하여 해양수산생명자원의 확보・관리 및 연구, 통합정보시스템 운영, 기탁등록기관 간의 정보교류 등의 업무를 수행하고 있다.

[그림 2-11] 제1차 해양수산생명자원 관리 기본계획(2019∼2023)
(2) 해양수산생명자원의 확보 현황
해양수산부는 2008년부터 해양수산생명자원 기탁등록보존기관 사업으로 해양수산 생명자원에 대한 관리 사업을 시작하였으며 2008년부터 2019년까지 국내해양생명자원 확보 및 활용기반 구축에 796억 원을 투자하였다. 해양생물자원관을 중심으로 2019년에는 19개 해양생명자원 기탁등록보존기관을 지정・운영하고 있으며, 국내 대학 및 연구기관 등에 주요해양수산생명자원 분류군별 자원의 채집・기탁 및 분양이 이루어지도록 관리하고 있다.
또한 글로벌 자원협력을 통해 해외 유용자원 선점 추진 및 기존에 확보된 해양수산생명자원을 활용한 연구의 거점사업을 지속 추진해 나가고 있다. 2009년부터 2016년까지 해외 해양생물자원 개발 및 활용기반 구축 1, 2단계 사업으로 마이크로네시아, 베트남, 필리핀, 인도양, 통가 해역, 동중국해 등지에서 해양양생물자원을 확보하였으며 인도네시아(LIPI). 러시아(PIBOC), 베트남(IMBC), 필리핀(UPV), 콜롬비아 등의 해외연구기관과 양해각서(MOU)를 체결하였다. 2017년에는 3단계사업 추진을 통해 해외 인적네트워크 구축과 지역연구거점 확보를 위해 노력하고 있으며 2019년 3월에는 말레이시아 사바대학과 공동연구실을 개소하여 해양생물자원의 공동확보 뿐만 아니라 채집해양생물시료의 안전한 국내반입을 위한 안정적 루트 개척에 힘쓰고 있다.
한편, 해양수산부는 해양 수산생명자원의 확보에 그치지 않고, 확보한 해양생명자원의 표준화 및 통합 DB 구축을 통해 분산된 실물정보 연계 및 통합검색에 의한 국가 해양생명자원 관리기반 구축을 2011년부터 추진해오고 있다. 이 사업을 통해 해양생명자원 통합정보시스템(MBRIS)을 구축하였으며 1만 727종, 57만 5,336점(2019.7. 기준)의 자원을 정보화하였다.
[표 2-37] 국내외 해양수산생명자원 확보현황(2018.12.)
|
구 분 |
전 세계 기록종수* (A) |
해외자원 확보종수 (B) |
확보율 (%) (B/A) |
국내 기록종수** (C) |
국내 확보종수 (D) |
확보율 (%) (D/C) |
|
|
척추 동물 |
해양어류 |
18,862 |
466 |
2.47 |
1,179 |
882 |
75 |
|
해양포유류 |
139 |
- |
- |
42 |
29 |
69 |
|
|
해양파충류 |
108 |
- |
- |
9 |
6 |
67 |
|
|
바닷새 |
676 |
- |
- |
150 |
13 |
9 |
|
|
무척추 동물 |
연체동물 |
47,610 |
421 |
0.88 |
1,714 |
987 |
58 |
|
자포동물 |
11,686 |
85 |
0.73 |
367 |
285 |
78 |
|
|
절지동물 |
57,194 |
281 |
0.49 |
1,905 |
972 |
51 |
|
|
선형동물 |
6,917 |
29 |
0.42 |
53 |
42 |
79 |
|
|
환형동물 |
13,926 |
31 |
0.22 |
363 |
234 |
64 |
|
|
극피동물 |
7,332 |
79 |
1.08 |
204 |
132 |
65 |
|
|
해면동물 |
8,657 |
83 |
0.96 |
379 |
163 |
43 |
|
|
태형동물 |
6,116 |
1 |
0.02 |
163 |
102 |
63 |
|
|
윤형동물 |
201 |
- |
- |
39 |
3 |
8 |
|
|
미삭동물 |
3,093 |
- |
- |
111 |
35 |
32 |
|
|
모악동물 |
131 |
1 |
0.76 |
20 |
8 |
40 |
|
|
기타 |
17,711 |
18 |
- |
143 |
28 |
20 |
|
|
해산 식물 |
홍조류 |
8,044 |
144 |
1.79 |
567 |
450 |
79 |
|
녹조류 |
2,077 |
174 |
8.39 |
117 |
103 |
88 |
|
|
갈조류 |
2,978 |
- |
- |
191 |
142 |
74 |
|
|
관속식물 |
313 |
37 |
11.82 |
136 |
43 |
32 |
|
|
원생생물 |
25,246 |
215 |
0.85 |
2,873 |
709 |
25 |
|
|
균류 |
1,673 |
51 |
3.0 |
495 |
448 |
91 |
|
|
원핵생물 |
2,263 |
1,207 |
55.34 |
2,136 |
1,805 |
85 |
|
|
합계 |
242,953 |
3,323 |
1.37 |
13,356 |
7,621 |
57 |
|
* World Register of Marine Species(2017.12. 기준)
** 제1차 해양수산생명자원 관리기본계획(2019∼2023)
(3) 향후 계획
생명자원의 주권화 및 이익공유를 인정하는 나고야의정서(ABS)가 발효(2014.10.)됨에 따라 해양수산생명자원의 이용에 관한 국제지침 마련의 움직임 등 세계적으로 해양수산생명자원의 중요성이 날로 증가하는 추세이다. 세계 각국은 더 많은 해양수산생명자원을 확보하기 위해 치열한 경쟁을 벌이고 있으며 해양수산부는 국제적인 환경변화와 미래의 수요를 반영할 수 있는 국가차원의 해양수산생명자원의 확보・관리 및 자원을 이용하기 위한 다양한 정책을 지속적으로 마련하고 있다.
또한, 국내외 환경변화를 반영한 제2차 생명연구자원관리 기본계획(2016∼2020)을 바탕으로 선택과 집중을 통한 고부가가치 생명연구자원의 확보・활용 및 산업기반 조성, 생명연구자원 통합관리체계 고도화 등을 추진하고자 한다. 아울러 생명자원의 공유 및 정보 네트워크 구축을 통해 수요자 기반의 자원 가치제고 및 유용 생명연구자원의 활용을 강화하고, 고부가가치 생명연구자원의 전략적 확보 및 국가 차원의 연구자원 관리의 체계화 등을 위한 범부처 협력을 더욱 강화할 계획이다.
우선 국내 자원 확보의 경우, 기존 연안중심의 자원조사 범위를 연근해와 배타적 경제수역까지 확대하고, 환경유전자 분석 등 효율적인 조사방식을 도입하여 우리 바다에 서식하는 해양수산생명자원을 효과적으로 확보해 나갈 예정이다. 또한 서식지 훼손이 의심되는 지역을 정밀조사 대상으로 선정하고 체계적 정밀조사 실시를 위한 ‘해양수산생명자원 정밀조사 지침’을 마련할 계획이며 이를 통해 서식지 훼손지역에 대한 자연복원 가능성 등을 검토하여 복원 방안을 마련할 방침이다.
또한 나고야 의정서 국내 발효(2017.8.) 이후 어려워진 해외자원 확보 대응을 위해 나고야의정서 국내 이행 관련 법령을 정비하고, 생명연구자원의 연구・산업적 활용 촉진을 위한 글로벌 수준에 부합하는 제도・규제 개선을 추진할 예정이다. 특히 안정적인 해외자원 확보를 위해 미개척 지역의 해외거점 확대 및 이익 공유모델을 개발하는 한편 주요 선진국과의 협력 네트워크 강화를 통한 국제 컨소시엄 및 공동연구 수행 등 해외 생명자원 확보 및 국제적 이슈 대응을 위한 국제협력을 강화할 방침이다. 아울러 해외자원을 활용해 신소재, 신약 등을 개발 시 자원보유국과 이익 공유에 따른 개발이익 감소방지를 위해, 유용성분을 함유한 해외생명자원을 국내생명자원으로 대체 활용할 수 있도록 연구개발할 계획이다.
또한 국가연구개발사업을 통해 확보・생산된 생명자원 기탁・등록 활성화로 고품질자원의 공동활용 촉진 및 R&D 생산성을 제고할 예정이다. 자원의 활용성 증대와 관련하여 해양수산생명자원 등급제를 마련하여 경제적・생태적・연구개발 가치 등급이 높은 자원을 우선 확보하고 업계 수요가 높은 생명자원을 안정적으로 제공하는 한편, 자원별 특성분석을 통해 자원 가치를 제고하고 특성정보 기반 유용자원 개발・공급으로 자원의 활용성 증대, 관련 기술을 개발할 계획이다. 국내외 연구논문과 보고서 등 자원 활용성 관련 종합 정보를 제공하는 해양바이오뱅크를 구축하여 바이오 제품화 등에 적극 활용하도록 할 것이며 특히 국가생명연구자원통합정보시스템 고도화를 통한 자원정보 통합검색, 다차원 통계 분석 제공 등 사용자 중심 시스템 구축에 힘쓸 예정이다.
마지막으로 해양바이오 연구개발 성과의 실용화 촉진 및 산업생태계 조성을 위한 해양바이오 산업화 인큐베이터 설립과 자원관리기관의 기업 지원을 위한 개방형 연구지원 시스템 운영, 벤처・중소기업 연구개발 인큐베이팅 및 컨설팅 지원을 추진할 방침이다. 그리하여 해양수산부는 위와 같은 일련의 정책들을 통하여 우리나라가 세계적으로 경쟁이 가속화되고 있는 해양수산생명자원 확보에서 우위를 선점할 수 있도록 할 계획이다.
10-1. 국제협력 R&D 및 국가 간 협력
가. 과학기술 국제협력 개요
기후변화, 에너지, 식량, 감염병 등 범국가적인 문제가 점차 증가하고 개방형 기술혁신이 가속화됨에 따라 과학기술 국제협력의 중요성이 한층 부각되고 있다. 아직까지 국내에서는 과학기술 국제협력의 정의가 명확하지 않은 실정이다. 과학기술정보통신부가 매년 추진하는 정부 연구개발사업에 대한 조사・분석의 정의를 따르면 국제협력은 과학기술 외국연구기관(외국인)이 참여하는 위탁연구와 외국 연구자 유치, 연구자 해외 파견, 정보 교환, 기술 연수, 국제협약의 참여 형태로 추진되는 공동연구개발 활동을 의미한다.
2017년 5월 출범한 문재인정부는 국정운영 5개년 계획에서 더불어 잘 사는 경제를 이룩하기 위해 과학기술의 발전과 미래 성장산업을 적극적으로 지원할 계획임을 밝혔다. 이어 2018년 발표한 ‘2040년을 향한 국가과학기술 혁신과 도전, 제4차 과학기술기본계획(2018∼2022)’에서 과학기술 외교의 전략성 강화를 주요 추진과제 중 하나로 설정하며 기후변화, 지진, 에너지, 환경 등 글로벌 이슈와 관련된 국제공동연구를 강화하고 과학기술혁신 공적개발원조(ODA) 프로그램의 체계성과 효과성을 제고해나갈 것임을 밝혔다. 더불어 문재인정부는 미국, 중국, 독일 등 4차 산업혁명 선도국가를 중심으로 글로벌 파트너십 벨트를 구축하여 국내기업들의 현지진출을 지원할 계획이다.
하지만 정부 연구개발 예산이 매년 증가하고 있는 데 반해, 국제협력분야 예산은 2016년 3,019억 원으로 전년 대비 515억 원 감소하였다. 부처별 예산현황을 기준으로 보면 2016년 국제협력 R&D 사업에 과학기술정보통신부(1,709억 원), 산업통상자원부(828억 원), 농촌진흥청(203억 원) 순으로 투자했다.
[표 2-38] 국제협력사업 부처별 예산현황(2012∼2016)(단위: 억 원,%)
|
구분 |
사업수 |
2012 |
2013 |
2014 |
2015 |
2016 |
|
교육부 |
4 |
423 |
399 |
143 |
124 |
133 |
|
국무총리실 |
7 |
44 |
48 |
48 |
46 |
46 |
|
기상청 |
1 |
59 |
55 |
70 |
75 |
78 |
|
농촌진흥청 |
2 |
158 |
178 |
193 |
195 |
203 |
|
과학기술정보통신부 |
19 |
1,930 |
2,381 |
2,210 |
2,249 |
1,709 |
|
산림청 |
1 |
3 |
2 |
2 |
2 |
2 |
|
산업통상자원부 |
3 |
721 |
776 |
787 |
825 |
828 |
|
해양수산부 |
1 |
0 |
16 |
16 |
18 |
20 |
|
총합계 |
38 |
3,354 |
3,855 |
3,469 |
3,534 |
3,019 |
출처: 신애리, 문관식, 김은정(2016). 국제협력분야 정부 R&D 전략적 투자를 위한 정책제안
또한 한국과학기술기획평가원이 경제협력개발기구(OECD) 회원국을 대상으로 매년 실시하는 국가 과학기술혁신역량평가에 따르면 2018년 한국의 과학기술혁신역량지수(Composite Science and Technology Innovation Index)는 11.558점으로 OECD 35개국 중 7위를 차지했으나, 기업 간 협력과 국제 협력 항목 및 하위 지표들의 최근 5년간 순위는 하락한 것으로 나타났다.

출처: 과학기술정보통신부 KISTEP(2018). 2018년 국가 과학기술혁신역량평가
[그림 2-12] 2018년 국가별 과학기술혁신역량지수(COSTII)
특히 국제협력은 지난 10년간 순위가 하위권에 고착된 상태이다. 국제협력 항목순위는 전년 대비 2단계 상승했으나 최근 5년간 추이에서 하락세를 보였고, 하위항목인 GDP 대비 ‘해외투자+외국인투자’ 비중 순위 또한 최근 5년간 다소 큰 폭으로 하락하여 OECD 평가대상국 중 최저 수준에 이르렀다.
[표 2-39] 네트워크 부문 지표별 순위 추이
|
항목 |
지표 |
한국 순위 |
||||
|
2014 |
2015 |
2016 |
2017 |
2018 |
||
|
국제협력 |
연구원 천 명당 국제공동특허 수 |
26 |
28 |
28 |
29 |
27 |
|
GDP 대비(해외투자+외국인투자) 비중 |
22 |
23 |
29 |
31 |
28 |
|
|
국제협력 |
27 |
29 |
28 |
31 |
29 |
|
주) 2018년 분석에 사용한 자료원은 평가대상년도인 2018년 및 과거 5년 시계열(2014∼2018)까지 업데이트한 통계임
출처: 과학기술정보통신부 KISTEP(2018), 2018년 국가 과학기술혁신역량평가
나. 해외 동향
2018년 과학기술정보통신부와 한국과학기술기획평가원이 공동으로 실시한 ‘2017년도 국가연구개발사업 조사・분석보고서’에 따르면 주요국의 국제 공동연구 과제 유형 중 국제협약(50.6%)이 가장 많으며 정보교환(26.6%), 외국 연구자 유치(22.8%) 등의 순이다. 국가별 수행 건수를 살펴보면 미국(223건)이 가장 많으며 그 다음으로 중국(41건), 프랑스(41건), 독일(36건)이 뒤를 이었다. 전년대비 증감현황을 살펴보면 미국이 22건으로 가장 많이 증가한 반면, 독일(-30건), 중국(-13건), 프랑스(-12)건 등은 감소하였다.
주요 선진국의 과학기술 정책 및 협력 현황을 살펴보면, 먼저 미국은 국가 차원에서 장기적이며 경제성장에 중요한 역할을 할 수 있는 목표지향적인 전략과제를 중점적으로 지원하고 있다. 특히 과학기술정책실(OSTP)이 주도적으로 과학기술에 필요한 핵심 국가

출처: 2017년도 국가연구개발사업 조사・분석보고서
[그림 2-13] 주요 국가별 국제 공동・위탁연구 추이(2016∼2017)
전략을 추진하며 국가 최대 과제를 해결하고 국민에게 혜택을 제공하고자 한다. 동시에 다양한 유형의 과학외교를 추진하고 있는데, 정부-기관 간 협력 뿐 아니라 다양한 학술단체, 대학, 재단, 민간회사, 비영리기구를 포괄하는 거시적 틀에서 과학외교를 수행하고 있다.
미국은 과학외교를 강화하기 위해 2000년에 국무부 과학기술자문관실을 신설하였고, 외교정책 수립 시 포괄적이고 정확한 최신의 과학기술 전문지식을 장관에게 제공토록 하고 있다. 2008년에는 미국과학진흥협회(American Association for Advancement of Science)에 과학외교센터를 설립하여 미국 과학기술계의 과학외교 활동을 증진하고, 과학기술 관련 주요 이슈를 분석해 미국의 과학외교 전략수립을 지원하고 있다.
트럼프(Donald Trump)행정부의 예산 삭감 제안에도 불구하고 여전히 미국은 거의 모든 분야에서 세계 최고의 기술수준을 확보하고 있다. 트럼프정부는 ‘제조업 부활’ 정책을 지원하기 위한 첨단제조 청사진 및 기존 첨단 제조업 지원 정책을 확대하였고, 2019년 신년 국정연설을 통해 5G, AI 등 미래 기술에 집중적으로 투자하겠다는 의지를 표명했다. 2017년부터 2018년까지 추진된 과학기술 성과를 비교해보면 2018년 성과로 AI, 5G 등 첨단산업에 대한 전략이 구체화되었으며 양자정보과학(Quantum Information Science, 量子情報科學)과 첨단제조업이 추가되었다.
중국의 경우는 1980년대 이후 정부 주도의 과학기술 연구발전 계획이 본격적으로 시행되어 상대적으로 기초과학 분야가 취약한 것으로 평가되고 있지만, 최근 들어 기초연구의 국제적 선진화 달성을 위해 중점적으로 투자를 확대하고 있다. 2018년에는 ‘기초과학연구 전면 강화 방안’을 발표하며 세계적 과학 허브와 혁신거점 도약 등 기초연구 3단계 목표를 2050년까지 달성할 계획임을 밝혔다.
이에 따라 중국은 기초연구분야의 전략적 배치, 높은 수준의 연구기지 구축, 인력그룹 양성 강화, 국제적 수준 향상 등의 중점업무를 추진할 계획이다. 또한 차세대 AI 산업발전과 우주전략을 수립하여 AI 기술과 실물경제간 심층융합을 촉진하고 달기지 구축, 화성탐사 프로젝트 등을 수행할 계획이다. 더불어 급격한 도시 인구 증가에 따른 인프라 부족, 도시 간 발전 격차 해소를 위해 스마트 시티(Smart city) 발전 전략을 마련하여 스마트 시티 건설을 가속화하고 있다.
다음으로 유럽연합(EU: European Union)의 경우는 환경, 에너지 등 회원국의 공동 문제 해결을 위한 Horizon 2020에서 EU 내의 협력뿐만 아니라 EU에 속하지 않은 국가들과의 협력을 통해 EU의 과학기술 경쟁력을 높이는 프로그램에 예산 투입을 늘렸다. 특히 EU는 중국을 과학기술 분야의 전략적 협력 파트너로 인식하고 협력대상국으로서의 중국의 지위를 신흥국에서 선진국으로 격상시켰다. 과거 개별적 중국 연구자 참여방식을 뛰어넘어 전략분야에서의 양국 간 공동협력을 모색하고 있다.
마지막으로 일본의 경우는, 과학기술을 경제사회적 활력의 핵심 요소이며 사회의 요구와 미래에 대한 선행 투자로 인식하고 인재육성과 연구성과의 산업화를 위한 시스템 개혁을 적극적으로 추진하고 있다. 특히 2019년 레이와(금화: 令和, れいわ) 시대를 맞아 발표한 새로운 경제성장 전략에서 첨단과학기술을 기반으로 한 데이터 구동기반 사회구축을 주요 과제 중 하나로 삼았다. 일본은 2018년도 노벨생리의학상(교토대 타수쿠 혼조 명예교수)을 수상했고, 과학 분야에서 노벨상을 총 20회 수상했을 정도로 기초과학이 발달해 있으므로 일본과 인접해있다는 지리적 장점을 살려 인력교류를 확대, 심화 공동연구를 강화하고 첨단산업 분야의 국제 협력을 확대해나가야 한다.
다. 국내 현황
한국정부는 2018년 8월 4차 산업혁명을 조기에 가시화할 수 있는 전략 투자분야로 3개 플랫폼・혁신인재 및 8대 선도사업을 선정하여 집중 지원하기로 하였다.12) 또한 과학기술정부통신부는 ‘2018년도 과학기술・ICT 분야 R&D사업 종합시행계획’에서 신약, 의료기기, 신변종 감염병 대응, 뇌연구 등 바이오경제 시대 핵심 선도 분야에 전년 대비 207억 원이 증액된 3,490억 원을 투자할 계획임을 밝혔다. 이어 2019년 정부는 경제정책방향에서 4차 산업혁명 관련 기술개발, 인프라 조성, 인력양성에 대한 중점 지원 정책을 수립하였고, 스마트공장・산단, 미래차, 핀테크, 바이오헬스의 ‘4대 신산업 지원’을 중점 추진 과제 중 하나로 선정하였다.
정부가 국제협력 활성화를 위해 추진하고 있는 사업은 부처별로 매우 다양하지만 본 백서에서는 그 중 과학기술정보통신부와 교육부의 주요 사업들에 대한 지원 현황과 우수성과를 분석하였다. 연구개발은 과학기술정보통신부와 산업통상자원부에서 주도하고 있으며, 교육부에서는 연구 네트워크 확대 사업을 시행하고 있다.
2019년 과학기술정보통신부는 국제 연구인력 교류에 203억 2,000만 원, 과학기술국제화사업에 403억 1,500만 원, 국제과학 비즈니스 벨트조성에 4,890억 1,700만 원을 배정했다. 산업통산자원부는 2018년 산업기술국제협력사업에 전년 대비 약 42억 원 증가한 약 599억 원을 배정하였다. 교육부는 2019년 글로벌연구네트워크지원사업(Global Research Network)에 약 50억 원을 배정하였다.
과학기술정보통신부는 인력양성사업 분야에서 해외고급과학자초빙사업(Brain Pool)과 해외우수신진연구자유치사업(KRF)를 추진한다. 해외고급과학자초빙사업은 유형에 따라 6개월에서 3년 동안 연 최대 2억 원 수준의 인건비 및 유치경비를 지원하고, 해외우수신진연구자유치사업은 유형에 따라 3∼5년 동안 연 4,000∼7,000만 원 수준의 인건비 및 체재비를 지원한다. 2018년에 115억 8,800만 원의 예산으로 219과제(BP 53, KRF 166)를 통해 국제연구 인력교류를 지원했고, 2019년에는 203억 2,000만 원의 예산으로 346과제(BP 100, KRF 246)를 지원할 계획이다.
과학기술국제화사업으로 국제화기반조성사업(국가간협력기반조성, 과학기술국제부담금, 국제교류협력연구기획평가), 동북아 R&D허브기반구축사업(해외우수연구기관유치), 글로벌협력기반조성(개도국과학기술지원, 개도국과학기술부담금), 그리고 과학기술국제협력네트워크지원사업이 추진된다. 세부사업별 예산은 다음과 같다.
[표 2-40] 2019년 과학기술정보통신부 과학기술국제화사업(단위: 백만 원)
|
구분 |
사업명 |
2018 예산 (A) |
2019 예산 (B) |
증 감 |
|
|
(B-A) |
% |
||||
|
국제협력 |
소 계 |
41,745 |
40,315 |
Δ1,430 |
Δ3.4 |
|
국가간협력기반조성 |
17,100 |
15,510 |
Δ1,590 |
Δ9.3 |
|
|
과학기술국제부담금 |
3,095 |
2,625 |
Δ470 |
Δ15 |
|
|
국제교류협력연구기획평가사업 |
2,600 |
2,460 |
Δ140 |
Δ5.3 |
|
|
해외우수연구기관유치사업 |
10,067 |
9,060 |
Δ1,007 |
Δ10 |
|
|
개도국과학기술지원 |
3,335 |
3,385 |
50 |
1.5 |
|
|
개도국과학기술부담금 |
755 |
768 |
13 |
1.7 |
|
|
과학기술국제협력네트워크지원사업 |
4,793 |
6,507 |
1,714 |
35.8 |
|
이외에 국제과학비즈니스벨트 조성사업과 기초과학연구원 연구운영비 지원사업에 4,890억 1,700만 원의 예상을 편성하여 글로벌 과학 연구거점 구축을 지원하고 있다.
과학기술정보통신부의 국제협력사업 중 한국연구재단을 전문기관으로 지정하여 추진하고 있는 국제협력 연구개발사업은 크게 글로벌연구실지원사업(Global Research Laboratory), 국제화기반조성, 글로벌협력기반조성(ODA), 해외우수연구기관 유치(Global Research and Development Center), 과학기술네트워크지원사업 등의 내역사업으로 구분할 수 있다. 이외에도 한국연구재단은 교육부가 시행하고 있는 글로벌연구네트워크지원사업, 한-EU 교육협력사업, 국제협력선도대학사업 등을 추진하고 있다. 또한 한국연구재단은 약 89억 원의 출연금으로 한・중・일 교류협력사업, 한독공동기금지원, 한・스웨덴 공동기금지원, 연구교류지원사업, 개도국지원사업, 국제응용시스템분석연구원(IIASA)협력사업 등도 추진하고 있다.
교육부가 지원하는 글로벌연구네트워크지원사업은 해외우수 연구자들과의 공동연구 및 네트워크 확대를 통한 국내 연구역량 제고와 세계 수준의 연구성과 창출을 목표로 삼고 있다. 지원규모는 과제당 약 8천만 원이며 최대 3년간 지원한다. 2017년에는 53억 2,000만 원의 예산으로 총 69과제(신규 37, 계속 32)를 지원했으며, 2018년에는 47억 8,800만 원의 예산으로 총 65과제(계속 65)를 지원했다. 2019년도에는 전략적 지역과 학술교류 협력 체계를 강화하고자 신규 연구 과제를 신북방 및 신남방 지역으로 지정하여 공모를 진행하였고, 한국연구재단 주관으로 신북방 3개, 신남방 3개의 총 6개 연구 과제를 선정하였다. 2017년도에 도출된 글로벌연구네트워크지원사업의 대표 우수 사례는 아래와 같다.
[표 2-41] 글로벌연구네트워크지원사업 우수성과 사례
|
성과명/연구자명 |
생체모사 자기조립구조를 위한 하이브리드 패치입자 연구/이기라, Davd J. Pine 등 (성균관대, 미국 뉴욕대) |
|
핵심 연구성과 |
DNA를 이용하여 콜로이드 입자로 구성된 다이아몬드구조 광결정 구현 |
|
연구의 파급효과 |
광결정 구조 기반의 디스플레이, 레이저, 센서 분야 등의 기초기술로 활용될 수 있으며, 나아가 광소자부터 광컴퓨터에 이르기까지 광범위하게 활용될 것으로 기대 |
주) NATURE MATERIALS에 논문 게재(2017.6.)(논문제목: Colloidal alloys with preassembled clusters and spheres)
라. 발전 과제
생명공학 분야의 경우 최근 10년을 살펴보면, 생명과학 분야에서 국제공동연구의 비중은 매년 증가하고 있는 것으로 나타나고 있다. 하지만 국내 연구자들의 국제협력 비중은 주요국(중국, 독일, 미국, 일본 등)에 비해 낮은 것으로 조사되고 있다. 이러한 추세는 국내 연구자의 연구역량 및 국내 연구환경이 주요국에 비해 상대적으로 비교 우위에 있지 않으며 무엇보다 생명과학 분야에서의 연구생태계가 국내 전문가 중심으로 운영된다는 점을 반증하는 것이다.

출처: 최근 5년간 SCOPUS DB에 등재된 논문 재구성
[그림 2-14] 최근 10년간 Life Science 및 Medicine 주제 분야 기준 국제협력비율
과학기술 국제협력 분야에 속한 연구개발사업의 경우 과학기술정책연구원(STEPI)의 보고서(김기국, 최효민, 2013)도 지적하고 있는 바와 같이, 평가체계를 글로벌 표준에 맞추어 분야별 전문성과 유연한 제도 운영, 그리고 각 단계별로 부합하는 성과를 달성할 수 있도록 평가구조의 효율성을 높여야 하는 당면과제를 해결해야 한다. 국제협력사업의 고유한 특성을 반영한 평가체계와 평가지표를 통해 사업을 관리해야 하며, 사업 수행을 통한 명백한 실적(outputs)과 잠재된 실적(outcomes)에 대하여 차별화된 성과 측정 방식이 도입되어야 할 것이다.
앞으로 생명공학 분야 국제협력을 위해서는 미국, 유럽 등과 같은 전통적 협력국가 외에 신흥강국과의 다양한 협력 기회를 모색하여 글로벌 리더십을 강화할 필요가 있다. 국가별 특성을 반영한 R&D 국제협력을 다변화하기 위한 대표적인 사업으로는 미국과 바이오, 뇌연구, 나노・소재 등 첨단기술 분야에 대해 공동연구가 추진될 수 있도록 미 정부 및 연구기관과 협의가 필요하다.
중국과는 바이오(감염병, 뇌연구 포함), ICT(첨단제조 포함), 신재생에너지 등과 같은 분야에서 2건의 산・학・연 실용화 대형연구과제를 선정하는 등 공동연구를 심화시킬 필요성이 높다. 특히, 선진국 중에서는 캐나다와 과학기술협력의 전망이 밝다. 2016년 12월 한국-캐나다가 과학기술공동협정을 체결한 이후, 2017년 8월 캐나다 몬트리올에서 한국-캐나다 혁신포럼을 개최하여 과학기술공동협정에서 정했던 의료생명, 의료기기, 나노소재 등의 분야에 대한 협력 방안을 모색함으로써 앞으로 좋은 성과가 기대된다.
더불어 다자협력활동과 관련하여 과학기술정보통신부는 2005년부터 생명과학(뇌과학, 인체기능) 분야의 기초연구 지원을 목적으로 다학제간・다대륙 간 연구 및 펠로우십 프로그램을 운영하는 국제기구인 휴먼 프론티어 과학 프로그램(HFSP: Human Frontier Science Program)에 가입하여 부담금을 납부하면서 우리나라 생명과학 분야 과학자의 참여를 확대해왔다. 2017년부터 한국연구재단이 주도적으로 HFSP에 참여하여 한국 과학자의 수혜를 늘리고 한국의 위상을 높여나가고 있다. 2019년 HFSP 한국 국적 연구자 선정 결과는 아래와 같다.
[표 2-42] Program Grant 선정자 리스트(2개팀 3명)
|
Single-molecule protein sequencing(2 PI, 모두 한국인) |
|||
|
1 |
JOO Chirlmin |
Dept. of BioNanoScience-Kavli Institute of NanoScience & Delft Univ. of Technology |
THE NETHERLANDS (KOREA) |
|
2 |
LEE Sang Wook |
Dept. of Physics, Ewha Womans University Seoul |
KOREA |
|
Elucidating the development of biological optical nanostructures(3 PI중 1인) |
|||
|
1 |
SHAWKEY Matthew |
Ghent University |
BELGIUM(USA) |
|
2 |
MANCEAU Marie |
Center for Interdisciplinary Research in Biology College de France Paris |
FRANCE |
|
3 |
YEO Jong-Souk |
School of Integrated Technology/ Nano Convergence Systems Group Yonsei Univ Incheon |
KOREA |
[표 2-43] Long-Term Fellowships: 5명(미국 2, 스위스 2, 오스트리아 1)
|
|
성 명 |
현 소속기관/국가 |
연수기관/국가 |
|
1 |
JEONG Dae-Eun (미국) |
Dept of Life Sciences Pohang University of S&T KOREA |
Dept of Pathology Stanford University USA |
|
Dissecting functional long non-coding RNAs and their working mechanismsSupervisor: FIRE Andrew |
|||
|
2 |
KIM Geundon (유럽, 스위스) |
Dept of Life Science Korea University KOREA |
Dept of Biochemistry Univ. of Lausanne Epalinges SWITZERLAND |
|
Unraveling an interdependency between metabolic cluster for the homeostasis of cellular ATP and Pi Supervisor: MAYER Andreas |
|||
|
3 |
KIM Jaeryung (유럽, 스위스) |
Dept of Ophthalmology Sungkyunkwan University School of Medicine Seoul KOREA |
Dept of Fundamental Oncology University of Lausanne SWITZERLAND |
|
Dissecting the role of intestinal lymphatics in bacteria-derived metabolite transport and signaling Supervisor: PETROVA Tatiana |
|||
|
4 |
LEE Junmo (유럽, 오스트리아) |
Dept of Biological Sciences Sungkyunkwan University Suwon KOREA |
Gregor Mendel Institute of Molecular Plant Biology Vienna AUSTRIA |
|
Evolution of functional organization of the eukaryotic genome Supervisor: BERGER Frederic |
|||
|
5 |
YANG Aerin (미국) |
Dept of Chemistry Korea Advanced Institute of S&T Daejeon KOREA |
Dept of Molecular & Cellular Physiology Stanford University USA |
|
Designing a new class of protein ligands to control cell surface receptor signaling Supervisor: GARCIA Christopher |
|||
마. 국가 간 협력 현황
한국연구재단은 2017년 10월 현재 51개국 80개 기관과 협력관계를 유지하고 있으며, 한-미, 한-영, 한-독일, 한-스위스, 한-스웨덴, 한-프랑스, 한-중 등과 같은 양자 간 과학기술 협력사업뿐만 아니라 한-ASEAN(동남아시아국가연합), 한・중・일, 한국-EU(유럽연합), 한-V4(비세그라드 그룹_헝가리, 체코, 폴란드, 슬로바키아) 등과 같은 다자 간 과학기술 협력사업을 추진하고 있다. 본 백서에서는 한국연구재단이 지원하고 있는 양자 및 다자 간 과학기술 협력사업의 현황과 주요 성과, 특히 생명공학 분야의 우수성과를 소개하고자 한다.
(1) 한국-미국
한국과 미국 사이의 과학기술 협력을 활성화하기 위한 사업은 크게 4가지를 들 수 있다. 과학기술 교육・교류 사업으로 미국 국립과학재단(NSF)과의 협력사업으로 추진하는 미국 우수 대학원생 한국방문연구사업과 미국의 선진 기술사업화 사업 및 국제협력 정책을 학습하기 위한 연구관리・국제협력 전문가 교육과정을 운영하고 있으며, 2019년도에 새로 추진하는 한국 이공계 여성대학원생 미국연수 프로그램이 있다. 이 3가지 사업에 2019년도 지원예산은 2억 3,000만 원이다. 또한 미국과의 국제협력 네트워크를 강화하고 효율적으로 미래핵심기술을 확보하기 위해 나노융합 및 첨단소재분야에서 미공군연구실과 협력사업을 추진하고 있으며, 2019년 지원예산은 4억 4,000만 원이다.
(2) 한국-독일
한국과 독일은 과학기술 협력을 활성화하기 위해 한-독 협력기반조성사업을 운영하고 있다. 인력교류사업의 과제당 연간 지원예산은 1,500만 원이며 2년 동안 한-독 연구자간 교류활동을 지원하였다. 2016년에는 한-독 협력기반조성사업을 통해 대학중심의 산학연 공동연구 프로그램을 추진하여 다양한 분야에서 장기적으로 국제협력을 추진할 수 있는 기반을 마련하였으며, 과제당 연간 1억 5,000만 원씩 총 3과제를 선정・지원하였다.
한-독 협력기반조성사업을 수행한 연구자 중에서 동국대학교 남기창 교수는 인공심장 기능 모니터링 시스템 관련 국제 워크숍을 3차례 개최함으로써 독일의 인공심장 시뮬레이터와 한국의 혈관 시뮬레이터를 접목하는 공동연구 방향을 수립하였으며, 독일 아헨병원에서 국내 맥박 측정 기기의 임상 실험을 추진하였다. 한국화학연구원 부설 안정성평가연구소의 윤석주 박사는 독일 연구자와의 교류・협력을 통해 ‘비알콜성 지방간암 치료 및 진단용 암줄기세포 바이오마커’에 대한 특허를 출원하는 성과를 거두었다.
(3) 한국-프랑스
한국과 프랑스는 한-프 협력기반조성사업을 운영하여 과학기술 협력을 활성화하였다. 과제당 연간 지원 예산은 1,500만 원이며 2년 동안 지원하였다. 2002년 제1차 한-프 과학기술공동위원회에서 사업개시에 합의하여 2003년 신규과제를 선정하였고 매년 15과제 내외를 선정한다.
2017∼2019년에 한-프 협력기반조성사업을 수행한 연구자 중 인천대학교 김광택 교수는 프랑스 측 연구자와 이 과제를 바탕으로 후속 공동연구를 추진하기로 합의하였으며 프랑스 University of Paris-Est Cretei(빠히-에스뜨 크레테유 대학)와 복수박사학위(Dual Degree) 프로그램을 개설하여 운영하는 등의 성과를 거두었다. 또한 2018년에 제7차 한-프 과학기술공동위원회를 서울에서 개최하여 기후변화 대응기술 및 에너지, 인공지능, 대학 간 인력교류 등의 분야에서 양국 과학기술협력 현안에 대해 논의하였다.
특히 인공지능 기초연구 분야에서 공동연구를 시범적으로 추진(2019 하반기 신규과제 선정 예정)하고 그 성과를 바탕으로 협력 규모를 확대하는 방안을 논의하였으며 2020년 프랑스에서 제8차 한-프 과학기술공동위원회를 개최하기로 합의하였다.
(4) 한국-영국
한국과 영국 사이의 과학기술 협력을 활성화하기 위해 한-영 협력창구(Focal Point)사업을 운영하고 있다. 과제당 연간 6,000만 원을 2년 동안 지원한다. 2017년 3월에는 한-영 과학기술공동위원회(국장급)를 영국에서 개최하였으며, 3과제를 선정・지원하였다.
2017년에 선정한 한-영 협력창구사업(2017.9.1.∼2019.8.31.)을 수행하고 있는 연구자 중 연세대 김종학 교수는 2017∼2018년에 걸쳐 한-영 국제교류 워크숍을 2차례 개최하고, 2018년 6월에는 영국 University of Bath에서 주최한 Centre for Sustainable Chemical Technologies(CSCT) 하계 Showcase에서 지속가능한 화공기술의 최근 동향에 대해 강연하는 등 영국과 과학기술교류를 촉진하였다. 또한, 이러한 한-영 연구교류를 바탕으로 SCI 논문을 3건 게재하는 정량적 연구 성과도 이루었다.
(5) 한국-스위스
한국과 스위스는 과학기술 협력을 활성화하기 위해 한-스위스 협력기반조성사업을 운영하고 있다. 과제당 연간 지원예산은 9,000만 원이며 3년 동안 지원한다. 2015년에는 신규 12과제를 지원한 바 있으며, 2019년에 신규 12과제를 추가 지원할 예정이다.
뿐만 아니라, 2016년에는 양국 간 신진과학도(박사, 박사 후 과정생)의 상호 방문연구를 지원하기 위해 한-스위스 박사과정생 연수사업을 추진하여 2016∼2018년 간 총 32인의 한국 연구자와 17인의 스위스 연구자를 선정하여 상호 간 방문을 지원하였다.
2019년에는 공동연구사업의 연구기간과 분야를 확대(4년간 지원, 디지털 헬스분야 학제 간 융합연구 포함)하였고, 연수사업을 통해 9인의 국내 신진연구자와 9인의 스위스 신진연구자를 모집・지원할 계획이다.
한-스위스 협력기반조성사업을 수행한 연구자 중에서 서울대학교 전누리 교수는 스위스 연구팀과의 공동연구를 통해 다양한 프로파일의 성장인자 자극이 가능한 미세유체소자 및 장기간 라이브 이미징 기술을 개발하였으며, 이를 통해 줄기세포의 분화 또는 분열을 유도하는 최적의 자극 프로파일 데이터베이스를 구축하는 성과를 거두었다.
(6) 한국-스웨덴
한국과 스웨덴은 한-스웨덴 과학기술 공동연구사업을 운영하여 과학기술 협력을 활성화 했다. 과제당 5,000만 원을 2년 동안 지원한다. 상대 기관인 스웨덴 연구협의회(VR: Vetenskapsrådet)와 2019년에는 ‘한-스웨덴 연구자원 공동 활용’을 주제로 5과제를 지원하기로 합의하고, 양국의 연구기반시설 공유를 통한 과학기술 공동연구 5과제를 선정하였다. 또한 2015년부터 연 1회 한-스웨덴 공동워크숍을 개최하여 연구 성과를 공유하고 해당 분야의 연구 동향을 파악하는 등 양국 연구자 간 교류의 장을 마련하고 있다.
(7) 한국-러시아
과기부와 한국연구재단은 한국과 러시아 간의 과학기술협력을 위해 2007년 3월에 한-러 과학기술협력센터를 설립하여 현재까지 운영하고 있다. 한-러 센터는 현지 과학기술정보의 수집・제공, 과학기술자 국내유치, 상호 방문 알선, 기술사업화 등의 업무를 추진하고 있다.
한-러 센터는 한-러 정상회담(2018.6. 러시아)에서 양국 정상이 합의한 사항(4차 산업혁명 공동대응 및 첨단 과학기술 사업화 협력 확대) 이행과 관련하여 제3회 한-러 과학기술의 날(2019.5. 모스크바)을 개최하였고, 4차 산업혁명 시대의 핵심기술 분야인 인공지능(AI), 생명공학, 첨단소재 분야에서 양국 간 실질적 협력 방안을 모색하였다. 특히 동 행사를 통해 생명공학연구원은 자체 유전자 디자인 기술과 러시아과학아카데미 Shemyakin &Ovchinnikov 바이오 유기화학 연구소의 NK 세포 증폭 분석 기술을 결합한 NK 세포 치료제 개발 분야 공동연구 협력 의사를 표명하였다. 향후 러시아의 강점 분야인 우주환경 생물과학(Space-Biology) 등으로 세부 연구 분야를 확대할 수 있을 것으로 기대한다.
(8) 한국-중국
한국과 중국 사이의 과학기술 협력을 활성화하기 위해 한-중 핵심공동연구지원사업을 운영하고 있다. 본 사업은 한-중 간 대형 공동연구 추진을 통해 양국의 공통 문제 해결에 기여할 수 있는 실질적인 연구 성과를 도출하기 위해 양국에서 전략분야를 지정・지원함으로써 연구 성과를 제고하고 있다. 이에 한국연구재단과 중국 국가자연과학기금위원회(NSFC) 간에 체결한 양해각서에 의거, 양 기관이 공동으로 승인한 과제를 지원하고 있으며, 2016년도에는 IoT(Internet of Things), Big Data 분야에 대한 모두 3과제를 선정하였으며, 2017년도에는 ‘Mechanistic Approach on Photocatalysis’ 분야에 대한 2과제를 선정할 예정이며, 해당 과제는 연간 6천만 원 이내로 3년간 지원할 예정이다.
이외에도 한-중 협력사업으로 2016년도에는 신규 34과제, 2017년도에는 신규 31과제를 각각 선정・지원하였다. 한-중 신진과학자교류사업으로는 2016년도에 7명의 중국인 과학자를 초청하고 5명의 국내 연구자를 파견하였으며, 2017년도에는 10명을 초청, 8명을 파견하여 연구교류를 확대해 나갈 예정이다.
한국연구재단은 한・중・일 3국이 참여하는 공동연구지원사업으로 A3 Foresight 프로그램을 운영하고 있다. 2016년도에는 화학생물학(Chemical Biology) 분야에 대한 2과제를 선정하였다. 2017년도에는 Molecular Imaging-based Precision Medicine 분야에 대한 2과제를 선정하여, 연간 5,000만 원 내외로 총 5년 동안 지원할 예정이다.
(9) 한국-일본
한국과 일본 사이의 과학기술 협력사업으로는 한-일 협력사업을 운영하고 있으며, 협력연구와 공동 세미나를 지원한다. 2016년도에는 신규 30과제를 선정하였고, 2017년 12월에 신규 30과제를 선정・지원할 예정이다.
한-일 협력사업을 수행한 연구자 중에서 충북대 지운식 교수는 ‘비가환 확률 해석학: 양자 백색잡음과 양자 워크의 새로운 전망’에 대해 연구하였다.
이 연구를 통해 비가환 랜덤현상의 특성적 성질에 따라 관심의 대상이 되는 문제들을 분류하고 공간화하고 그 공간의 대수적, 해석적 및 기하학적 구조와 성질들을 규명함으로써 관심의 대상인 문제들을 총체적으로 해결함은 물론 새로운 연구방법과 연구분야를 개발하였다. 연구결과는 ‘Analytic Characterizations of Infinite Dimensional Distributions (비 가환 확률 해석학: 양자 백색잡음과 양자 워크의 새로운 전망)’이라는 제목의 논문으로 학술지에 게재되었고, ‘Characterization of S-Transform for General Construction of Infinite Dimensional Distributions(교신저자)’라는 제목으로 SCI급 학술지에 제출될 예정이다. 이 연구의 결과는 양자 장론, 시스템 생물학, 네트워크 과학, 정보 과학, 금융 공학 등 불확실성을 내포하고 있는 연구 분야에 큰 공헌을 할 것으로 기대되며, 젊은
연구자들에게 창의적인 연구 분위기를 조성하는데 크게 이바지 할 수 있을 것으로 생각된다.
이외에도 한국과 일본 사이의 협력 증진을 위해 일본학술진흥회(JSPS) HOPE Meeting 참가 지원사업이 있다. HOPE Meeting은 한국연구재단(National Research Foundation of Korea)에서는 일본학술진흥회(JSPS) 간 협력사업의 일환으로 추진되는 사업으로, 국내 신진 과학도들에게 일본의 노벨상 수상자 및 저명 과학자와의 만남의 장을 제공하고, 아시아-태평양 지역의 우수한 신진 과학도들 간의 협력 네트워크를 구축하는 데 기여하고 있으며, 재단은 매년 6명의 우수한 신진과학도를 선발하여 동 프로그램에 참여시키고 있다.
(10) 한국-유럽연합(EU)
한국과 유럽연합(EU) 간의 협력 활성화를 위해 2020년 개최 예정인 제7차 한-EU 과기공동위원회에서는 한-EU 간 전략 분야인 나노, 바이오, 에너지, ICT 및 위성항법 분야에 대한 연구협력 현황을 점검하고 향후 협력방향에 대해 논의할 계획이다. 특히 바이오 분야에서는 2014년부터 감염병 연구기관 간 컨소시엄(GloPID-R: Global Research Colla- boration for Infectious Disease Preparedness)에 참여하여 공동연구가 진행된바 있다.
한국연구재단은 유럽연합과의 협력을 강화하고 핵심 원천기술을 확보하며 다자간 국제협력 네트워크를 구축하기 위해 Horizon2020에 선정이 확정된 연구자들의 공동연구를 지원하고 있다. ‘한-EU 공동연구지원사업’은 ‘인력교류’ 분야에는 연간 5,000만 원 이내, ‘공동연구’ 분야에는 연간 1억 5,000만 원 이내의 연구비를 2∼4년간 지원하여 유럽연합 내 선도적인 연구집단 사이의 지속적인 연구교류와 협력을 촉진하고 있다. 2019년도 신규과제 지원예산은 약 6억 원이며, 4월과 10월 연 2회에 걸친 공모를 통해 총 4과제 내외를 선정・지원할 계획이다.
한-EU 공동연구지원사업 수혜 연구자 중 연세대학교의 신성재 교수는 2014년에 ‘마우스를 이용한 다양한 결핵백신 평가용 모델 개발과 새로운 백신의 효능평가’ 과제에 선정되어 2017년까지 지원받았다. 네덜란드의 Stichting TuBerculosis Vaccine Initiative 등 14개국 40개 기관의 우수 연구자들과 연구협력 네트워크를 구축하여 국제적으로 선두에 있는 새로운 백신후보들을 효능평가하고 국내 결핵백신 개발의 경쟁력을 확보하였다. 협력 대상인 14개국 연구기관은 아래 표와 같다.
[표 2-44] EU Horizon2020 공동연구(연세대 신성재) 컨소시엄 참여국가 및 연구기관 현황
|
국가명 |
연구기관 |
|
Australia |
THE UNIVERSITY OF SYDNEY |
|
Belgium |
INSTITUT SCIENTIFIQUE DE SANTE PUBLIQUE |
|
Belgium |
UNIVERSITEIT GENT |
|
Belgium |
UNIVERSITE LIBRE DE BRUXELLES |
|
Denmark |
STATENS SERUM INSTITUT |
|
France |
INSTITUT PASTEUR |
|
France |
CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE |
|
France |
INSTITUT PASTEUR DE LILLE FONDATION |
|
Germany |
MAX PLANCK GESELLSCHAFT ZUR FOERDERUNG DER WISSENSCHAFTEN E.V. |
|
Germany |
UNIVERSITAET ULM |
|
Germany |
BUNDESINSTITUT FUR IMPFSTOFFE UND BIOMEDIZINISCHE ARZNEIMITTEL |
|
Ireland |
UNIVERSITY COLLEGE DUBLIN, NATIONAL UNIVERSITY OF IRELAND, DUBLIN |
|
Italy |
AZIENDA OSPEDALIERA UNIVERSITARIA POLICLINICO PAOLO GIACCONE DI PALERMO |
|
Italy |
ISTITUTO NAZIONALE MALATTIE INFETTIVE L.SPALLANZANI-IRCCS |
|
Italy |
ISTITUTO SUPERIORE DI SANITA |
|
Netherlands |
STICHTING TUBERCULOSIS VACCINE INITIATIVE |
|
Netherlands |
STICHTING BIOMEDICAL PRIMATE RESEARCH CENTER |
|
Netherlands |
ACADEMISCH ZIEKENHUIS LEIDEN-LEIDS UNIVERSITAIR MEDISCH CENTRUM |
|
Republic of Korea |
YONSEI UNIVERSITY |
|
Republic of Korea |
INTERNATIONAL TUBERCULOSIS RESEARCH CENTER |
|
South Africa |
STELLENBOSCH UNIVERSITY |
|
South Africa |
UNIVERSITY OF CAPE TOWN |
|
South Africa |
KWAZULU NATAL RESEARCH INSTITUTE FOR TB-HIV(K-RITH) NPC |
|
Spain |
UNIVERSIDAD DE ZARAGOZA |
|
Spain |
INSTITUT DE INVESTIGACIO EN CIENCIES DE LA SALUT GERMANS TRIAS I PUJOL |
|
Switzerland |
UNIVERSITE DE GENEVE |
|
Switzerland |
EIDGENOESSISCHE TECHNISCHE HOCHSCHULE ZUERICH |
|
Switzerland |
UNIVERSITAET ZUERICH |
|
Switzerland |
HOSPICES CANTONAUX CHUV |
|
Switzerland |
UNIVERSITE DE LAUSANNE |
|
Switzerland |
UNIVERSITAT BASEL |
|
United Kingdom |
ASTON UNIVERSITY |
|
United Kingdom |
BANGOR UNIVERSITY |
|
United Kingdom |
DEPARTMENT OF HEALTH |
|
United Kingdom |
MEDICAL RESEARCH COUNCIL |
|
United Kingdom |
LONDON SCHOOL OF HYGIENE AND TROPICAL MEDICINE |
|
United Kingdom |
IMPERIAL COLLEGE OF SCIENCE, TECHNOLOGY AND MEDICINE |
|
United Kingdom |
THE CHANCELLOR, MASTERS AND SCHOLARS OF THE UNIVERSITY OF OXFORD |
|
United Kingdom |
THE SECRETARY OF STATE FOR ENVIRONMENT, FOOD AND RURAL AFFAIRS |
|
United States |
AERAS GLOBAL TB VACCINE FOUNDATION |
한편, 한국연구재단은 2014년도부터 추진되고 있는 ‘Horizon 2020’ 프로그램에 참여 기회를 늘리기 위한 노력을 경주하고 있다. 2008년 금융위기 이후 촉발된 유럽의 경기침체 해소와 경제 시스템의 안정화, 미래를 위한 경제적 기회 창출의 필요성이 대두됨에 따라 유럽연합은 유럽의 글로벌 경쟁력 확보와 현재 직면하고 있는 사회문제 해결을 위해 연구 및 혁신 분야에 대한 지속적인 투자의 필요성을 인식하게 되었다.
‘Horizon 2020’ 프로그램은 유럽연합에 부가가치를 창출하는 사항에 자원을 집중하는 원칙에 따라 과학적 탁월성, 산업 리더십, 사회적 과제 해결을 3대 중점 추진 과제로 삼고 있다. 총예산은 약 786억 유로(한화 약 98조 6,000억 원)인데, 이는 7차 프레임워크 프로그램(Framework Program)에서 투입된 약 253억 유로보다 약 47.6% 증가한 규모이다. 특히 녹색에너지, 보건, 건강 등을 사회적 과제 부분에 전체 투입 금액의 39%(약 296억 유로)라는 최대 예산을 배정하였다.
또한, 한국연구재단은 한-EU 과기협력을 심화・확대하기 위한 협력 인프라를 구축하고 미래 협력분야를 발굴함으로써 국내 연구자의 참여 기회를 늘리기 위한 ‘한-EU 과학기술혁신 협력사업(KONNECT)을 2013년부터 2017년 3월까지 성공적으로 수행했다.
한국(NRF, KIAT, KISTEP), 독일(DLR, KIST_Europe), 네덜란드(RVO), 스페인(CDTi), 터키(TUBITAK) 등 5개국 8개 기관 간 컨소시엄 형태로 진행된 이 프로젝트에서 한국연구재단이 연구책임자로 활동하여 EU측으로부터 3년간 사업비 20억 원을 수주하고 한-EU 과기혁신 정책분석, 수요 맞춤형 네트워킹 구축, 신규 프로그램 출시, 국제공동연구 평가모형 개발 등 많은 성과를 이뤘다. 이 프로젝트의 결과를 기반으로 네트워크 확장 및 지속가능성을 확보하기 위하여 Post-KONNECT를 추진한 바 있다.
(11) 한국 정부의 개발협력
2015년 UN에서 SDGs(지속가능개발목표: Sustainable Development Goals)가 채택된 이후 국제 사회의 최대 공동 목표를 달성하기 위한 수단으로 과학기술의 중요성이 점차 높아짐에 따라 과학기술정보통신부에서는 한국의 국제적 위상에 부합하는 역할 수행을 위해 개도국의 과학기술 역량을 제고시키는 일에 적극 참여하고 있다.
과기부와 한국연구재단이 시행하는 ‘개도국과학기술지원사업’은 국내 연구기관과 개도국 연구기관과의 협력 활동을 통해 개도국의 과학기술 역량을 향상시키고, 이공계 전문 인력의 양성을 지원하는 것 뿐 아니라 현지 주민의 삶의 질 제고에도 앞장서고 있다. 특히 글로벌문제해결거점(구, 적정과학기술거점센터) 사업의 경우 물, 에너지, 농업 등 생존의 문제에 직접적인 영향을 줄 수 있는 분야를 대상으로 현지에 적합한 적정기술 개발을 통해 현지 문제를 해결하고 있다. 과학기술정보통신부는 2018년에 개도국과학기술지원사업 예산 33억 3,500만 원으로 16과제를 지원하여 네팔, 탄자니아, 에티오피아, 베트남 등 개도국의 과학기술 발전에 기여하고 있다.
생명공학 분야와 관련해서는 탄자니아 거점을 통해 백신냉장고 모니터링 및 전달시스템을 구축함으로써 현지 보건 역량을 강화하고 있다. 사업 시작연도인 2017년에는 이동형 백신캐리어 1차 모델을 개발하고 현지에 3대의 백신 캐리어를 보급한 바 있으며, 2018년에는 이동형 백신캐리어 2차 모델을 개발하고 3대의 백신 캐리어를 추가 보급하였다. 아울러 현지의 열악한 전력 사정을 감안하여 에너지 분야 문제 해결도 추진하고 있다.
탄자니아는 수도와 지역 도시를 제외하고는 대부분이 전력을 공급받지 못하고 있는 실정이며, 농촌 지역의 보건소는 백신 저장을 비롯하여 보건의료 위생상 전기 수요가 많음에도 불구하고 전기 공급이 되지 못하여 제대로 된 서비스를 제공하지 못하고 있다. 탄자니아 거점에서는 소규모 분산형 발전을 통해 지역 수요에 따른 전기를 공급하는 사업도 함께 추진함으로써 에너지 문제 해결을 통한 보건 역량 강화에도 기여하고 있다.
한편 교육부와 한국연구재단은 정부와 국내 대학이 공동으로 대학의 자원 및 학문적・교육적 역량을 활용하여 개도국 개발을 지원하는 ‘국제협력선도대학육성지원사업’을 2012년부터 시행하고 있다. 개도국 대학에 학과나 단과대학을 설치하거나 리모델링하는 프로그램으로 2019년 현재 약 40억 원의 예산으로 총 11과제(계속 7, 신규 2, 후속 2)를 지원하고 있다. 사업단별로 연간 약 4억 원의 예산으로 최대 4년까지 지원받으며, 사업이 종료된 이후에는 출구전략의 일환으로 1∼2년 간 후속지원을 받을 수 있다. 2020년부터는 사업기간을 7년(3+2+2)으로 확대하여 실시할 예정이다.
국제협력선도대학 사업단 중 조선대학교 사업단은 2017년부터 시작하여 몽골 민족대학교 간호학과 발전을 위해 성과중심 간호학과 교육과정을 개발해 시행 중이며 교육환경 개선사업과 교수법 훈련을 진행하고 있다. 기존 몽골의 간호교육과정은 3년제와 4년제 교육과정이 혼재되어 있고 국제적 간호고등교육기준과 간호교육인증평가기준(2010)에 근접하지 못한다는 한계와 전공별 교수 및 간호학 석・박사 학위를 가진 양질의 간호 교수인력 부족이라는 문제가 있었다.
그러나 조선대는 동 사업을 통해 국제 표준수준의 간호학과 성과중심 교육과정 도입 및 운영을 위한 기반을 다지고 있다. 이와 더불어 신 교육과정 적용을 위한 강의계획서 개발, 전공교재 및 실습지침서 개발, 교수인력의 교수역량 강화, 교육환경 인프라 구축 등을 통하여 몽골 정부의 보건의료 인력양성 계획에 기여 하고 있으며 몽골 표준 간호학과 교육과정으로 자리매김하기 위해 총력을 기울이고 있다.
그 결과 지난 2018년 5월, 몽골민족대학교 간호학과 1회 졸업생을 배출하였고 졸업생의 국가고시 합격률은 93.3%였으며, 취업률은 78.6%, 취업처는 제1병원, 제2병원, 국립암센터로 몽골의 대표적 의료기관에 졸업생들이 진출하였다. SDGs(지속가능개발목표: Sustainable Development Goals)가 채택된 이후 국제 사회의 최대 공동 목표를 달성하기 위한 수단으로 과학기술의 중요성이 점차 높아짐에 따라 과기부에서는 한국의 국제적 위상에 부합하는 역할 수행을 위해 개도국의 과학기술 역량을 제고시키는 일에 적극 참여하고 있다.
10-2. OECD BNCT 활동 현황
가. 개요
OECD는 1990년 대 말부터 BT 분야 중요성을 인지하고 주요 이슈 대응을 위해 관련 작업반(WPB: working party on Biotechnology) 운영하고 있다. 2014년 BT와 NT 2개 기술 작업반을 병합하여 BNCT 작업반(The OECD Working Party on Biotechnology, Nano- technology and Converging Technologies)을 신설하였다.
OECD BNCT 작업반은 독창적인 정책 분석 및 메시지를 전 세계 커뮤니티에 기여하고 정책 입안자들에게 획기적인 제안을 하는 것을 목표로 한다. 생명공학, 나노 기술 및 융합 기술의 책임 있는 개발과 관련된 새로운 정책 문제에 대해 조언하고, 회원국이 변화하는 연구, 개발 및 혁신의 본질을 이해하고 관리하는 데 도움을 주고자 한다.13)
한국은 한국생명공학연구원(이하 생명연)을 중심으로 WPB에 이어 BNCT 작업반에 지속적으로 참가하고 있으며, 부의장 국가로서 BT 분야의 중심적인 활동을 이어가고 있다.
나. 추진경과
OECD BNCT는 프랑스 파리 OECD본부에서 매년 2차례 정기총회가 개최되며 우리정부는 핵심이슈별 전문가를 중심으로 대표단(Delegates)을 구성하여 참가하고 있다. 또한 주요국
동향 모니터링을 통해 전문을 작성하여 전문가들에게 핵심 이슈를 전파하는데 주력하고 있다.
다. 주요사업
OECD BNCT는 2019∼2020년 주요 사업으로 3대 프로젝트 중심의 핵심의제를 선정하여 진행 중이다. ‘프로젝트 1’에서는 융합기술간 협력 플랫폼의 3개 분야로 ① 바이오뱅크 및 유전체 기반 개인 맞춤형 의료, ② Engineerng Biology, ③ 신소재를 다루고 있으며, ‘프로젝트 2’에서는 신경기술의 책임 있는 혁신을, ‘프로젝트 3’에서는 순환 바이오경제 실현을 의제로 추진하고 있다.
[표 2-45] OECD BNCT 차기 주요 계획(2019∼2020) 및 세부 내용
|
프로젝트 1 |
프로젝트 2 |
프로젝트 3 |
|
융합기술의 협력 플랫폼 |
신경기술의 책임혁신 |
순환 바이오경제 실현 |
|
1-1. 바이오뱅크, 유전체 기반 개인맞춤형 의료 ∙(Review) 바이오뱅크와 유전체 연구 ∙(Review) 유전적 발명의 라이센싱 |
∙신경기술의 책임 있는 혁신을 위한 원칙(Principles) 도출 * STEPI 중심으로 기여금 제공(VC) 등 적극적인 활동 추진 |
∙국가 바이오경제의 지표 ∙순환과 지속가능성 ∙바이오 기반 제품의 지속가능성 평가 |
|
1-2. Engineering Biology |
||
|
1-3. 신소재 |
OECD BNCT에서 제시한 3대 프로젝트 중 한국에서 적극적인 대응이 필요한 프로젝트로는 프로젝트 1(융합기술의 협력 플랫폼) 중 1-1과 1-2이다.
(1) 프로젝트 1-1: 바이오뱅크, 유전체 기반 개인맞춤형 의료(Biobank and Genomics for personalized medicine)
이 프로젝트는 혁신적인 보건시스템 구축을 위해 개인 맞춤형 의료의 데이터 접근과 지식재산권(IP), 그리고 유전체 분야 이니셔티브, 바이오뱅크에 대한 정보 수집과 아젠다 발굴을 주요 목표로 하고 있다. 2019년 5월에 문재인정부는 ‘바이오헬스 산업 혁신 전략’에서 향후 10년 내 100만 명 규모 유전체 빅데이터를 구축하겠다 발표하였다. 이는 기존 질병의 치료중심에서 유전자 분석을 통한 개인 맞춤형(정밀의료) 예방 중심으로의 패러다임 전환에 따른 전략이지만 개인 맞춤형 의료 연구데이터의 공유·관리·활용 등은 아직 초기단계로 해외의 동향과는 속도뿐만 아니라 수준에 차이가 있으므로 지속적인 모니터링과 함께 선진사례 학습도 필요하다. 또한 연구데이터 및 지식재산권(IP) 등의 활용을 위한 국제 사회의 동향 모니터링 및 적극적인 대응이 필요하다. OECD BNCT 사무국에서는 2020년 본 프로젝트의 보고서 초안 발간을 목표로 회원국 대상 설문조사, 전문가 회의 및 워크숍 등이 예정되어 있다.
이 프로젝트와 관련하여 주요 회원국의 동향을 살펴보면, 영국은 최근 100K genome project를 성공적으로 마치면서 영국이 참여할 수 있는 기회가 많아졌음을 인지하고 설문지 개발 작업에 참여 의사를 밝혀왔으며, 노르웨이는 이해관계자와의 관계(신뢰) 유지가 매우 중요하다고 생각하고 있으며, 정밀의료를 위해서는 유전체 데이터뿐만 아니라, 생활정보 및 병원에서의 임상정보가 함께 모여야 가치가 있는 것이기 때문에 이들을 제공해 줄 이해관계자와의 신뢰도 유지가 관건임을 밝혔다. 또한, 이렇게 모인 데이터의 ownership 문제도 함께 다루어야 한다고 재차 강조하였다. 프랑스는 만성질환, 희귀질환 등 유전체 분석의 대상이 되는 질환의 우선순위를 정하는 문제 등을 함께 다루어야 한다고 강조하였고, 스페인은 유전체 정보 수집을 위해 환자/가족 대상으로 참여채널을 제공하고 독려함으로써 많은 연계 부분들이 시작되어 정밀의료의 범위가 확대되고 연구 역량이 강화되는 등의 효과를 기대할 수 있을 것이라고 하였다.
※ (2019) Q1-설문지 배포 통한 국가별 정보수집, Q2-전문가회의 / Q3-설문지 결과 회수 및 워크숍 개최, (2020) Q1/Q2-보고서(바이오뱅크/유전체) 초안 작성 예정
|
< 설문조사 개요 > ① Human Biobanks and Genetic Research Databases -(목적) 2017년 추진된 설문조사에 응답한 21개국을 제외한 나머지 회원국을 대상으로 보다 폭 넓은 설문조사를 통한 증거자료를 확보하고자 함 -(주요 내용) 총 12개 항목으로 인간 바이오뱅크 및 유전 연구 데이터베이스의 확립, 인간 생물학적 물질 및 데이터의 보호, 인간의 생물학적 자료에 대한 접근, 혜택 공유 및 지적 재산권 등이 포함 ☞ 2009년 최초의 권고안 시행 이후 국가별 이행 결과 조사→국가별 실정에 맞는 활용 및 수행 방안을 수립 할 예정 ② Licensing of Genetic Inventions -(목적) 본 권고안은 치료제와 진단과 같은 제품과 서비스 시장의 개발을 강화하기 위해 효율성을 제고하고 헬스케어 수요에 부합할 수 있는 방법을 모색 -(주요 내용) 총 4개 항목으로 국가별 권고안 시행 여부 및 분야별 영향력(법, 제도, 정책 등), 국가별 유전체 발명 관련 그 영향력이 과학・기술적 진보에 끼친 영향력 여부 등 ☞ 2005년 최초의 권고안을 시행한지 10년이 지난 시점에서 국가별 영향력 조사→국가별 실정에 맞는 활용 및 수행 방안을 수립 할 예정 |
상기 설문조사에 대한 우리나라의 대응방안으로는 우리나라의 관심사인 바이오뱅크, IP 등과 연계된 부분에서 실무위원회(steering group)에 참여하겠다는 의사를 밝혔다. 이에 대응하기 위해 전문가 그룹을 구성하여 의견 수렴 및 대응방안을 마련하여 추진하고 있으며, 미국, 영국, 노르웨이, 이탈리아, 프랑스, 스페인 등이 적극적인 참여 의사를 개진한 상황이다.
(2) 프로젝트 1-2: Engineering Biology(Biofoundry)
이 프로젝트는 ‘Engineering biology의 상용화가 왜 잘 이루어지지 않고 있는가’에서 출발하였으며 9차 총회에서는 혁신을 가속화하고 비용과 위기를 줄이기 위한 Biofoundry의 역할 및 협업방안에 대해 논의하였다.
Engineering Biology(Biofoundry)이란 Biofoundry(생산공장)에서 합성생물학(기술)을 이용하여 생산한 생물체, 구성체, 상품 등을 생산하여 산업적(Engineering Biology)으로 활용하는 개념이다. 합성생물학은 유전자를 읽고 디자인, 합성, 제작하는 기술이며 Biofoundry는 합성생물학을 위한 플랫폼(인프라)으로, 유전자 합성, 제작하는 공정이 자동화 되어 대량생산이 가능한 공장을 의미한다. Engineering Biology는 합성생물학 기술에 산업적 개념을 접목한 것으로 가장 넓은 범위의 개념이라고 할 수 있다.
국내에는 Biofoundry 개념의 연구 혹은 인프라가 없는 실정으로 관련 분야인 합성생물학 연구의 경우 정부정책에 따라 기술사업화・표준화 등에 집중하고 있으며, Tool로써의 합성생물학 기술 연구는 충분히 이루어져 있으나, 시민사회의 참여, Genome(전체 유전체) 합성 연구는 부족한 실정이다.
OECD BNCT 사무국은 본 연구를 산업 응용과 보다 잘 연계시키기 위해 Engineering biology 기반 기술에 중점을 둔 하위 분야의 개요를 그림으로 설명하고 있다.

출처: OECD BNCT 자료
[그림 2-15] Engineering Biology 개요
이와 관련하여 주요 회원국 의견으로 미국은 협력 플랫폼에는 지역사회가 반드시 함께 참여되어야 한다는 점과 더불어 융합인력 교육도 함께 고려해야 한다고 제언하였다. 또한 일본은 바이오파운더리의 탄탄한 콘셉트 개발이 바이오경제의 표준화, 비용 이슈 등을 해결하는 데에 매우 중요하다고 생각한다고 발언하며 적극적인 참여 의사를 밝혔다.
이 프로젝트를 위해 실무위원회 구성과 국제 워크숍 개최 등을 준비하고 있다. 이 실무
위원회에는 미국, 영국, 프랑스, 일본, 노르웨이, 이탈리아, 스위스, 코스타리카 등이 참여의사를 밝히는 등 관심을 표명하였으며 한국도 9차 총회에서 참가 의사를 밝혀 국제적
활동에 적극적으로 참여 할 예정이다.
이 프로젝트와 관련하여 2019년 5월에 일본 고베에서 Global Biofoundry Alliance(GBA)가 개최되었다. 한국에서는 개별 연구자로 발표 및 토론자로 참가하였지만 기관차원의 공식적인 참여는 없었다. GBA에서 참여기관 간 실제로 논의되는 회의에 참석하여 Biofoundry 이슈에 실시간으로 대응하기 위한 전문가(기관) 참여가 필요한 상황이다.
|
< Global Biofoundry Alliance(GBA) 개요 > ∙(목적) 다양한 유형의 비상업적인 바이오파운드리 개발, 홍보, 지원 ※ (출범) 2018년 창설, 18년 런던 및 19년 고베 개최, 20년 북미(미국/캐나다)에서 개최 예정 ∙(기대 효과) ① engineering/synthetic biology 연구를 가속화하고 향상, ② 광범위한 공익을 창출하는 강력한 engineering/synthetic biology 산업 구축, ③ engineering/synthetic biology 분야의 자동화, 고효율 장비 및 새로운 워크플로우 및 도구의 유익한 사용 촉진 ∙(참여기관/총 16개 기관) 미국 DOE Agile BioFoundry, 영국 Edinburgh Genome Foundry, 중국 BioFoundry(Tianjin), 일본 Engineering Biology Research Center(Kobe), 싱가폴 Synthetic Biology Foundry(SynCTI), Australian Genome Foundry 등 |
(3) 프로젝트 2: 신경기술의 책임 있는 혁신
BNCT 사무국은 이 프로젝트를 위해 2년 간(2019∼2020) ‘Responsible Innovation in Neurotechnology(신경기술의 책임 있는 혁신)’라는 주제로 뇌과학과 신경기술이 윤리적, 법적, 사회적으로 바람직한 방향으로 발전할 수 있도록 원칙과 권고안 작성을 계획하고 있다.
한국에서도 뇌과학 분야에 대한 투자가 지속적으로 증가하고, 윤리적・법적・사회적 이슈들에 대한 관심이 증대함에 따라 이번 OECD 연구에 자발적 기여금을 제공하였으며, 원칙과 권고안, 그리고 관련 보고서(companion document)를 작성하는데 참여하고 있다.
추진 현황으로는 사무국에서 Draft Working Paper인 ‘신경기술의 책임 있는 혁신’ 원칙(principle)을 공개하고, 원칙 2차 초안에 대해 2019년 5월 31일까지 서면의견 제출을 요청하였으며 한국에서는 STEPI를 중심으로 관련분야 전문가 및 부처 검토의견을 받아 한국의 의견을 제출한 상황이다.
미국, 독일, 프랑스 등 주요국들은 신경기술의 책임 있는 혁신 원칙 수립의 필요성을 공감하며, 원칙보다 발전된 형태의 권고안 수립과 구체적인 이행방안을 담은 보고서(companion document) 작성에 동의하였다. 또한 신경기술의 책임 있는 혁신 원칙(안)이 수차례 실무위원회와 2019년 5월 프랑스 파리에서 개최된 워크숍에서 충분히 논의된 만큼 주요국들은 전반적인 내용에 대한 공감대가 형성되어 있다.
(4) 프로젝트 3: 순환 바이오경제 실현
본 프로젝트의 추진 배경은 UN SDG14)와 대전선언문(2015)을 통해 OECD 과학기술분야 최고 심의의결기구인 CSTP(Committe of Science & Technology Policy, 과학기술위원회)는 ‘지속가능한 경제 동반성장’을 목표로 바이오경제 실현을 위한 기술개발, 산업정책 및 거버넌스 강화 등 다양한 STI(Science, Technology Innovation) 정책 과제 연구가 필요한 상황으로, 지속가능성 확보를 위해 순환경제(자원효율성 증대 등)를 구축하고 석유기반 산업에서 재생산 가능한 유기 공급원료 산업(바이오경제 등)으로 전환해야 함을 강조하였다.
OECD BNCT 사무국은 바이오기반 제품의 지속 가능성 평가위원회의 권고 사항15)에 대한 모니터링 일정을 소개하고 다음 사항에 대한 모니터링 일정을 논의하였으며, 본 검토를 통해 지속 가능한 바이오경제를 위한 국가 평가 프레임의 개발에 대한 시너지 효과를 발휘할 것이라고 밝혔다.

[그림 2-16] 기존 및 새롭게 제안된 최신 일정표
향후 일정으로는 완성된 설문지의 첫 번째 초안의 적합성에 대한 의견을 수렴 할 예정이다. 10개의 특별한 설문조사 항목에 대하여 권고가 있었으며 이 질문이 적절한지 혹은 더 선호하는 형식이 있는지 등의 질문을 할 예정이다. 이 설문지는 2019년 3분기에 시작하여 2019∼2020년 1분기 말까지 회원국의 피드백을 요청할 예정이다.
미국, 이탈리아, 일본, 벨기에, 남아공 등 회원국 및 참관국은 본 프로젝트에 대한 강한 지지를 표하며 Engineering Biology에 대한 진전된 내용의 측정, 분산된 제조 모델 및 Engineering Biology의 임무와 어떻게 연계되어 있는지 등의 작업을 제안하였다. 또한 보다 순환적인 바이오경제를 달성하기 위한 방법으로 지속 가능성 지표와 분산 제조(distributed manufacturing)를 보는 것 사이에 프로젝트 강조점이 남아 있음을 언급하였다.
OECD BNCT 사무국은 캐나다와 잠재적인 작업을 추진할 예정임을 밝히고, 3개 프로젝트에 대한 개요를 설명하였다.
프로젝트 1(Bio-economy Satellite Account Proposal)에서는 바이오경제의 경제적 공헌을 분석, 즉 바이오경제는 그 자체로 산업이 아니고 오히려 다른 산업 전반에 걸쳐 활동하는 것이기 때문에 이 프로젝트는 바이오경제 활동의 규모와 영향을 측정하는 데 필요한 지표를 제공할 것임을 밝혔다.
프로젝트 2(Life-cycle analysis of bio-based products)에서는 바이오연료의 라이프 사이클 환경 영향에 대한 Clean Fuel Standard의 일환으로 수행되는 작업을 확대할 예정이며, 이 확장된 연구에서 동 프로젝트는 기존의 석유 기반 제품과 달리 다양한 산업 바이오제품 흐름(예: 바이오 고분자, 바이오에너지, 바이오화학)의 환경 영향을 조사하고 있다. 프로젝트 3(Developing Indicators of Circularity in a Circular Bioeconomy)에서는 순환형 바이오경제 실현을 측정하는 데 사용할 수 있는 순환성 지역적 지표를 개발하고자 한다.
이 프로젝트는 두 단계로 진행되며 첫 번째 단계는 문헌 연구, 이해 관계자 자문 및 데이터 가용성 연구를 통해 지표 개발에 초점을 맞추고 두 번째 단계는 농업 및 산림 바이오 경제 활동이 진행 중인 캐나다 지역에 대한 지표를 측정하고자 동 프로젝트를 진행하고 있다.
라. 우리의 준비
OECD 핵심 의제 대응을 위해 우리나라는 핵심 주제별 국내전문가 소그룹의 상시적 운영을 통해 OECD 글로벌 이슈 및 국내 정책적 시사점을 적극적으로 도출하고자 2018년부터 구성하여 운영하고 있다.
[표 2-46] 핵심 의제별 2019∼2020의 소그룹 구성 운영
|
BNCT 연구주제 |
전문가 |
|
(프로젝트1) 융합기술의 협력플랫폼 유전체 기반 개인맞춤형 의료 |
한국생명공학연구원, 특허청 및 한국보건산업진흥원 등 |
|
(프로젝트1) 융합기술의 협력플랫폼 Engineering Biology 인프라(Biofoundry) |
한국생명공학연구원 및 KAIST 등 |
|
(프로젝트2) 신경기술의 책임 있는 혁신 |
STEPI, 한국뇌연구원, 한국생명공학연구원, 한국법제연구원 등 |
2019년 OECD BNCT 국내전문가 워크숍을 개최(2019.1.)하여 2018년 활동보고 및 차기사업 계획(2019∼2020)의 공유를 통한 관련 국내전문가 의견수렴 및 대응방안 논의를 추진하였다. 또한 OECD BNCT 9차 총회(2019.5.) 전에 국내회의를 진행함으로써 총회 의제에 대해 효율적으로 국내 업무를 진행, 총회에 사전에 대응하고자 총회 직전에 주요 의제들을 파악하고 분야별 전문가로 구성된 소그룹 회의를 동년 4월에 개인 맞춤형 의료와 Biofoundry 두 분야에 대하여 진행하였다.
또한, OECD BNCT 총회 후 대응을 위해 2019년 5월에 전문가 회의를 진행하였으며 본 회의에서는 9차 총회 주요 의제인 개인 맞춤형 의료 및 Engineering biology(Biofoundry)에 대한 관련분야 원내 전문가 의견수렴 및 대응방안을 논의하였다. 이에 개인 맞춤형의료와 Engineering biology(Biofoundry)에 대응할 수 있는 전문가를 선정하고 설문조사 및 관련 분야 이슈들에 대해 대응하고 있다.
마. 향후 계획
OECD BNCT의 향후 계획은 3대 프로젝트의 실천적인 이행을 염두에 두고 추진하는 것이다. 먼저 ‘(프로젝트 1) 융합 협력 플랫폼’에서는 핵심 분야인 개인 맞춤형 의료를 위한 유전체와 바이오뱅크와 Engineering biology 2개 파트에서 진행되는 협력 플랫폼 사례연구의 결과를 취합하여, 10차 총회 전 개최되는 스웨덴 스톡홀름에서의 워크숍(유전체학 및 개인건강, 2019.9.)에서 프로젝트 결과를 공유하고 발전시킬 예정이며 한국은 실무위원회에 참가할 계획이다.
다음으로 ‘(프로젝트 2) 신경기술의 책임 있는 혁신’ 분야에서는 ‘신경기술의 책임 있는 혁신 원칙’과 권고안이 OECD 과학기술위원회 정기총회(2019.10.)에서 최종 승인되면, 이를 정책적으로 이행할 수 있도록 안내하는 보고서(companion document)가 작성될 예정이며, 이 보고서에 한국의 입장이 반영될 수 있도록 OECD 사무국과 협력할 예정이다.
마지막으로 ‘(프로젝트 3) 순환 바이오경제’에서는 바이오 기반 제품의 지속 가능성 평가에 대한 위원회 권고 사항(Recommendation of the Council on Assessing the Sustainability of Bio-Based Products)에 대한 모니터링 일정을 소개하고 설문지 초안 의견 수렴 및 설문 조사를 2019년 3사분기에 실시할 예정으로 있다.
또한, 제8차 총회에서 진행된 3개 권고안 중 2019년에 우선 착수해야 하는 아래 2개 권고안에 대한 설문조사 작업이 우선 수행될 예정임을 공지하였다.
① Monitoring report of the Recommendation of the Council on Human Biobanks and Genetic Research Databases: 2019년 10월까지 feedback
② Review report of the Recommendation of the Council on the Licensing of Genetic Inventions: 2019년 11월까지 feedback
바. 시사점
최근 OECD BNCT에서 집중 논의되고 있는 BT 분야 중점 이슈와 관련하여 정부 및 전문가를 통한 이슈 대응이 절실한 상황이다. 특히 주요 이슈로 제시되고 있는 ‘개인 맞춤형 의료’, ‘마이크로바이옴’ 및 ‘Engineering Biology’ 등에 대한 체계적인 국내 대응이 필요한 상황이다.
특히, ‘개인 맞춤형 의료’, ‘마이크로바이옴’ 분야는 국내에서도 연구자 외 바이오헬스산업 전략 등에서 정부 정책의 핵심 이슈로 부각되고 있고, 또한 새롭게 떠오르고 있는 Engineering Biology(Biofoundry) 분야는 국내에서도 합성생물학 등 관련 분야의 기술력은 충분한 잠재력을 보유하고 있어 이제 우리도 동등한 위치에서 국제적 이슈를 논의할 수 있는 수준이 되었다고 판단된다.
이에 OECD BNCT 총회를 글로벌 이슈 모니터링 및 학습의 창구로 적극 활용하고자 하며 이를 위해 국내 정부 및 관련 기관의 적극적인 대응이 필요한 시점이라고 할 수 있다.
제2절
생명공학 경쟁력 지표 현황
1. 투자현황
가. 정부 연구개발예산 중 미래유망신기술(6T) 분야별 투자
2018년도 정부 연구개발 투자액은 19조 7,759억 원으로 총 667개 사업, 6만 3,697개 과제에 투자되었다. 이는 일반회계, 특별회계, 기금을 모두 포함한 금액으로 2016년 19조 44억 원 대비 7,715억 원(4.1%) 증가하였다.
최근 5년간(2014년∼2018) 정부 연구개발 투자는 연평균 2.9% 증가하였으며, 중소・중견기업 지원, 지방 R&D에 대한 투자가 지속해서 증가추세인 것으로 나타났다.
2018년도 미래유망신기술(6T) 분야 투자액은 전년 대비 360억 원 증가한 총 11조 6,670억 원으로 전체 정부연구개발 투자 중 59.0%의 비중을 차지하였다.16) 생명공학기술(BT) 분야 투자액은 총 3조 5,494억 원으로 전년 대비 548억 원(1.6%) 증가하였으며, 최근 5년간 연평균 증가율은 4.5%로 나타났다.

출처: 2018년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP)
[그림 2-17] 국가연구개발사업 투자 추이(2014∼2018)

출처: 2018년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP)
[그림 2-18] 6T 분야별 투자 추이(2014∼2018)
생명공학기술(BT) 분야는 2017년 이후 미래유망신기술(6T) 분야 중 가장 높은 비중으로 투자되고 있으며 2018년도 투자 비중은 19.2%이다. 정보기술(IT) 분야는 18.1%의 비중으로 뒤를 이었다.
생명공학기술(BT) 분야에서 2016년도 총 115개 사업, 1만 8,820개 과제가 수행되었고 2018년도 총 143개 사업, 2만 2,386개 과제가 수행되어 사업과 과제 수가 모두 증가하였다.

|
6T |
사업수 |
과제수 |
정부연구비 |
|
|
억 원 |
% |
|||
|
BT |
143 |
22,386 |
35,494 |
19.2 |
|
CT |
13 |
851 |
2,423 |
1.3 |
|
ET |
78 |
6,982 |
22,294 |
12.1 |
|
IT |
80 |
10,364 |
33,451 |
18.1 |
|
NT |
16 |
4,114 |
8,133 |
4.4 |
|
ST |
23 |
676 |
14,875 |
8.1 |
|
기타연구 |
258 |
11,396 |
67,919 |
36.8 |
|
총합계 |
611 |
56,769 |
184,589 |
|
출처: 2018년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP)
[그림 2-19] 미래유망신기술(6T) 분야별 투자현황
나. BT 분야 상세 투자현황 및 주요특징
(1) 부처별 투자현황
2018년도 생명공학기술(BT) 분야 부처별 투자현황은 과학기술정보통신부(1조 3,437억 원, 37.9%)가 가장 높은 비중을 차지하고 있으며, 다음으로 농촌진흥청(5,225억 원, 14.7%), 보건복지부(4,521억 원, 12.7%), 산업통상자원부(2,981억 원, 8.4%), 교육부(2,693억 원,
7.6%) 순으로 투자가 이루어졌다. 2018년도 산업통상자원부 투자는 2016년도 투자(3,779억 원, 11.3%) 대비 금액과 비중 모두 감소한 것으로 나타났다.

출처: 2018년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP)
[그림 2-20] BT분야 부처별 투자현황
(2) 연구개발단계/연구수행 주체별 투자현황
생명공학기술(BT) 분야의 연구개발단계별 투자는 기초연구(1조 4,504억 원, 40.9%), 개발연구(9,351억 원, 26.3%), 응용연구(5,888억 원, 16.6%)의 비중으로 이루어졌다. 전체 미래유망신기술(6T) 분야에서는 개발연구에 가장 많은 투자가 이루어졌지만, 생명공학기술(BT) 분야는 기초연구에 대한 투자 비중이 높았다. 2016년 투자와 비교하면 기초연구, 개발연구의 비중이 감소하였고 응용연구의 투자 비중이 증가한 것으로 나타났다.
연구수행주체는 대학(1조 5,030억 원, 42.3%), 출연연구소(6,713억 원, 18.9%), 국공립연구소(5,789억 원, 16.3%), 중소기업(5,497억 원, 15.5%), 중견기업(564억 원, 1.6%)의 순으로 많은 투자가 이루어졌다. 2016년 투자 대비 대학과 중소기업에 대한 지원은 증가했지만, 출연연구소 및 국공립연구소에 대한 지원은 소폭 감소하였다.


출처: 2018년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP)
[그림 2-21] BT분야 연구개발단계별(상)/연구수행주체별(하) 투자현황
(3) 적용분야별 투자 현황
생명공학기술(BT) 분야의 투자는 공공분야(2조 504억 원, 57.8%), 산업분야(1조 4,990억 원, 42.2%)으로 구성된 것으로 나타났다.
세부분야별 투자 현황을 살펴보면, 공공분야에서는 건강(1조 4,412억 원, 40.6%), 지식의 진보(비목적 연구)(2,633억 원, 7.4%), 기타 공공목적(2,098억 원, 5.9%), 환경(636억 원, 1.8%) 순으로 투자되고 있으며, 산업분야에서는 농업, 임업 및 어업(7,299억 원, 20.6%), 제조업(의료용 물질 및 의약품/ 2,177억 원, 6.1%), 제조업(의료, 정밀, 광학기기 및 시계/ 1,944억 원, 5.5%), 기타 산업(888억 원, 2.5%) 순으로 투자되고 있는 것으로 나타났다.

출처: 2018년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP)
[그림 2-22] BT분야 적용분야별 투자현황
(4) 기술분류별(유망기술・과학기술표준분류) 투자 현황
생명공학기술(BT) 분야 투자액 3조 5,494억 중 유망기술 9개 분야17)의 투자액은 1조 4,431억 원으로 40.7%의 비중을 차지하고 있다. 이 분야는 2014년부터 2018년까지 연평균 증가율(5.7%)을 보이며, 생명공학기술(BT) 분야 연평균 증가율(4.5%)을 상회하는 것으로 나타났다.
2018년 투자규모는 바이오신약개발기술(2,706억 원, 18.8%), 의과학・의공학기술(2,664억 원, 18.5%), 농업・해양 생물자원의 보존 및 이용기술(2,554억 원, 17.7%) 순이며, 최근 5년간 투자 규모의 연평균 증가율이 높은 분야는 난치성 질환치료기술(13.2%), 뇌신경과학연구(9.3%), 바이오신약개발기술(9.2%) 순이다.

출처: 2018년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP)
[그림 2-23] BT분야 유망기술 투자추이
국가과학기술표준분류 대분류 기준 투자현황은 보건의료(1조 4,217억 원, 40.1%), 농림수산식품(8,921억 원, 25.1%), 생명과학(7,335억 원, 20.7%), 뇌과학(1,140억 원, 3.2%) 순이었다.

출처: 2018년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP)
[그림 2-24] BT분야 국가과학기술표준분류별 투자현황
생명공학기술(BT) 분야에서 중점적으로 투자되고 있는 보건의료, 농림수산, 생명과학 분야를 국가표준과학기술분류 중분류를 기준으로 분석하였다. 보건의료 분야에서는 의약품・의약품개발(3,580억 원, 10.1%), 임상의학(2,351억 원, 6.6%), 의생명과학(2,206억 원, 6.2%) 순으로 투자되고 있으며, 농림수산식품분야는 원예특용작물과학(1,589억 원, 4.5%), 동물자원과학(1,255억 원, 3.5%), 식량작물과학(1,083억 원, 3.1%) 순으로 투자되고 있는 것으로 나타났다. 생명과학 분야에서는 분자세포생물학(1,617억 원, 4.6%), 융합바이오(959억 원, 2.7%), 산업바이오(905억 원, 2.6%) 순으로 많은 투자가 이루어졌다.
[표 2-47] BT분야 표준과학기술분류별(중분류) 중점투자 현황
|
보건의료 분야 정부연구비 |
농림수산 분야 정부연구비 |
생명과학 분야 정부연구비 |
||||||
|
|
억 원 |
비중 |
|
억 원 |
비중 |
|
억 원 |
비중 |
|
의약품/ 의약품개발 |
3,580 |
10.1% |
원예특용작물과학 |
1,589 |
4.5% |
분자세포생물학 |
1,617 |
4.6% |
|
임상의학 |
2,351 |
6.6% |
동물자원과학 |
1,255 |
3.5% |
융합바이오 |
959 |
2.7% |
|
의생명과학 |
2,206 |
6.2% |
식량작물과학 |
1,083 |
3.1% |
산업바이오 |
905 |
2.6% |
|
치료/진단기기 |
2,050 |
5.8% |
기타농림수산식품 |
979 |
2.8% |
유전학/유전공학 |
834 |
2.4% |
|
보건의료전체 |
14,217 |
40.1% |
농림수산전체 |
8,921 |
25.1% |
생명과학전체 |
7,335 |
20.7% |
주) 비중은 BT분야 정부연구비 35,494억 원 중 해당 기술분야가 차지하는 비중을 나타냄.
출처: 2018년도 국가연구개발사업 조사분석 보고서 재가공(미래창조과학부/KISTEP)
(5) 기타 BT 분야 투자의 주요 특징
(가) 산학 공동연구 비중이 높음
생명공학기술(BT) 분야 투자에서 협력유형이 있는 비중(9,024억 원, 25.4%)이 협력유형이 없는 비중(2조 4,770억 원, 69.8%)보다 낮은 것으로 나타났다. 협력유형별 세부 투자 현황은, 산학 공동연구(2,732억 원, 7.7%), 학연 공동연구(2,295억 원, 6.5%), 산학연 공동연구(1,361억 원, 3.8%) 순으로 투자되고 있으며 기업과 대학의 협력 비중이 가장 높은 것으로 나타났다. 2016년도 유형별 투자는 산학 공동연구(2,573억 원, 7.7%), 산학연 공동연구(893억 원, 2.7%) 순으로 2018년도 해당 유형의 투자가 증가했지만 학연 공동연구의 경우 2016년 투자(2,897억 원, 8.7%) 대비 2018년도 투자가 줄어들었다.

출처: 2018년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP)
[그림 2-25] BT분야 협력유형별 공동연구 투자현황
(나) 수도권의 투자비중이 높음
생명공학기술(BT) 분야의 17개 시・도별 투자는 서울(9,916억 원, 27.9%), 경기(4,834억 원, 13.6%), 대전(4,249억 원, 12.0%), 전북(3,982억 원, 11.2%)순 이었다. 2016년도 지역별 투자는 서울(8,909억 원, 26.7%), 경기(5,210억 원, 15.6%), 대전(4,313억 원, 12.9%), 전북(3,650억 원, 10.9%)으로 서울, 전북의 투자는 증가했지만 경기, 대전의 투자는 감소한 것으로 나타났다.
미래유망신기술(6T) 분야 전체 투자는 수도권(6조 1,894억 원, 33.5%), 대전(5조 6,089억 원, 30.4%), 지방 및 기타(6조 6,606억 원, 36.1%) 비중으로 지역별로 분산되어 투자된 것에 반해, 생명공학기술(BT) 분야는 수도권(1조 5,352억 원, 43.3%)에 집중된 모습을 보였다.

출처: 2018년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP)
[그림 2-26] BT분야 지역별 투자현황
(다) 여성 연구책임자 비중이 증가함
생명공학기술(BT) 분야 2018년도 연구책임자의 성별 비율은 남성(81.4%), 여성(18.5%), 무응답(0.1%)이었다. 2016년도 생명공학기술(BT) 분야 연구책임자 성별 비율은 남성(83.1%), 여성(16.9%)으로 2018년도 BT분야 여성 연구책임자 비중이 증가한 것으로 나타났다.

출처: 2018년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP)
[그림 2-27] BT분야 연구책임자 성별 현황
(라) 생명공학기술(BT) 분야 과제 평균 연구비는 가장 낮음
미래유망신기술(6T) 분야 2018년도 과제 평균 연구비는 3억 2,500만 원으로 나타났다. 생명공학기술(BT) 분야의 과제 수 비중은 2만 2,386개(39.4%)로 가장 높았지만 과제 평균 연구비는 1억 5,900만 원으로 가장 낮게 나타났다. 우주항공기술(ST) 분야의 과제 수 비중은 676개(1.2%)로 가장 낮았지만, 과제 평균 연구비는 22억 원으로 가장 높은 것으로 나타났다.

출처: 2018년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP)
[그림 2-28] 과제당 평균 연구비 현황
2. 인력현황
가. 학과별 배출인력
교육통계연구센터의 교육통계서비스에 따르면 2018년 기준 전문대학의 바이오 분야 학사 재적현황에서 보건 분야의 학사 재적생 수(4만 252명)가 가장 많은 것으로 조사되었다.
학과별 학사 재적생수의 성별 현황을 살펴보면, 자원, 보건 및 재활학과를 제외한 나머지 분야에서 남성 비중이 높게 나타났으며 특히 환경학과가 남성 비중이 82%로 가장 높았다.
여성 비중이 높게 나타난 자원학과와 보건학과의 여성 비중은 57%, 재활학과는 52%로 남성보다 소폭 높은 비중을 차지하는 것으로 조사되었다.

주) 전문대학의 바이오 분야 학사 재적현황
출처: 교육통계서비스(http://kess.kedi.re.kr/index)
[그림 2-29] 2018년 기준 바이오 분야 학과별 학사 재적현황
[표 2-48] 2018년 기준 바이오 분야 학과별 학사 재적생 수의 성별 현황
|
학과 |
학사 재적생(명) |
||
|
남자 |
여자 |
소계 |
|
|
농수산 |
1,909 |
739 |
2,648 |
|
생물 |
2,276 |
1,532 |
3,808 |
|
자원 |
127 |
166 |
293 |
|
환경 |
3,312 |
717 |
4,029 |
|
보건 |
17,307 |
22,945 |
40,252 |
|
재활 |
8,939 |
9,669 |
18,608 |
|
의료장비 |
4,394 |
1,943 |
6,337 |
주) 전문대학의 바이오 분야 학사 재적현황
출처: 교육통계서비스(http://kess.kedi.re.kr/index)
교육통계연구센터의 교육통계서비스에 따르면 2018년 기준 바이오 분야 학과 중 의학 석사(2,863명) 및 박사(1,010명) 졸업자가 가장 많은 것으로 조사되었다.
학과별 석・박사 졸업자의 성별 현황을 살펴보면 석사 졸업자에서는 보건학과 재활학의 여성 비중이 월등히 높았고 박사 졸업자에서는 보건학과를 제외한 모든 학과에서 남성 비중이 높은 것으로 나타났다.

출처: 교육통계서비스(http://kess.kedi.re.kr/index)
[그림 2-30] 2018년 기준 바이오 분야 학과별 석・박사 졸업자 현황
[표 2-49] 2018년 기준 바이오 분야 학과별 석・박사 졸업자의 성별 현황
|
학과 |
석사 졸업자(명) |
박사 졸업자(명) |
||||
|
남자 |
여자 |
소계 |
남자 |
여자 |
소계 |
|
|
농업학 |
144 |
82 |
226 |
40 |
18 |
58 |
|
동물・수의학 |
127 |
86 |
213 |
61 |
27 |
88 |
|
보건학 |
264 |
792 |
1,056 |
65 |
116 |
181 |
|
산림・원예학 |
95 |
88 |
183 |
32 |
15 |
47 |
|
생명과학 |
795 |
889 |
1,684 |
475 |
283 |
758 |
|
생물학 |
187 |
163 |
350 |
133 |
88 |
221 |
|
약학 |
230 |
320 |
550 |
143 |
106 |
249 |
|
의료공학 |
194 |
198 |
392 |
98 |
55 |
153 |
|
의학 |
1,665 |
1,198 |
2,863 |
607 |
403 |
1,010 |
|
재활학 |
302 |
1,050 |
1,352 |
52 |
36 |
88 |
|
치의학 |
479 |
338 |
817 |
108 |
96 |
204 |
|
한의학 |
120 |
124 |
244 |
84 |
58 |
142 |
출처: 교육통계서비스(http://kess.kedi.re.kr/index)
2017년과 2018년의 바이오 분야 학과별 학사 재적생 수 변화를 살펴보면 농수산 및 생물학과를 제외한 모든 학과에서 전년대비 재적생 수 감소를 보였고 이 중 보건학과의 재적생 수가 가장 많이 감소(508명 감소)하였다. 반면, 농수산학과는 전년대비 472명 증가, 생물학과는 전년대비 113명이 증가하였다.

출처: 교육통계서비스(http://kess.kedi.re.kr/index)
[그림 2-31] 바이오 분야 학과별 학사 재적생 수 비교(2017, 2018)
2017년과 2018년의 바이오 분야 학과별 석사 졸업자 변화를 살펴보면 산림・원예학, 생물학, 의학, 치의학, 한의학, 약학, 의료공학에서 졸업생 수가 감소하였고 이 중 의학 졸업생이 가장 많이 감소(272명 감소)하였다.
나머지 학과에서는 졸업생이 증가하였으며 특히 재활학에서 가장 많은 증가(48명 증가)를 보였다.

출처: 교육통계서비스(http://kess.kedi.re.kr/index)
[그림 2-32] 바이오 분야 학과별 석사 졸업자 비교(2017, 2018)
2017년과 2018년의 바이오 분야 학과별 박사 졸업자 변화를 살펴보면 생명과학, 생물학, 의학, 치의학, 한의학, 보건학, 재활학, 의료공학에서 졸업생 수가 감소하였고 의학 졸업생이 가장 많이 감소(46명 감소)하였다.
이들 학과를 제외한 나머지 학과에서는 졸업생이 증가하였으며 특히 약학 졸업생이 26명으로 가장 많이 증가하였다.

출처: 교육통계서비스(http://kess.kedi.re.kr/index)
[그림 2-33] 바이오 분야 학과별 박사 졸업자 비교(2017, 2018)
나. 바이오산업 인력 현황
산업통상자원부와 한국바이오협회가 조사하여 발표한 ‘2017년 기준 국내 바이오산업 실태조사’에 따르면, 국내 984개 바이오기업에 종사하는 인력 수는 4만 4,269명으로 2016년 대비 2,410명(6.5%) 증가하였고 1개 업체당 평균 45명이 근무하고 있는 것으로 조사되었으며, 2013년 이후 2017년까지 최근 5년간 연평균 4.8%의 증가율을 나타났다.
[표 2-50] 바이오산업 연도별 종사자 수(단위: 명, %)
|
구분 |
2013 |
2014 |
2015 |
2016 |
2017 |
연평균 증감률 |
|
종사자수 |
36,684 |
37,801 |
40,298 |
41,559 |
44,269 |
4.8 |
|
증 감 률 |
Δ2.4 |
3.0 |
6.6 |
3.1 |
6.5 |
(1) 분야 및 직종별 인력 현황
국내 바이오산업 분야의 인력을 직종별로 보면 연구인력이 1만 3,613명(30.8%), 생산인력 1만 5,776명(35.6%), 기타인력 1만 4,879명(33.6%)으로 구성되어 있다.
[표 2-51] 바이오산업 분야별 종사자 인력 분포(단위: 명, %)
|
구분 |
업체수 |
연구 인력 |
생산 인력 |
기타 인력 |
계 |
산업별 구성비 |
|
|
전 체 |
인력 |
984 |
13,613 |
15,777 |
14,879 |
44,269 |
100.0 |
|
비율 |
100.0 |
30.8 |
35.6 |
33.6 |
100.0 |
||
|
바이오의약산업 |
322 |
6,326 |
6,875 |
7,283 |
20,484 |
46.3 |
|
|
바이오화학・에너지산업 |
201 |
2,233 |
1,465 |
1,331 |
5,029 |
11.4 |
|
|
바이오식품산업 |
189 |
1,682 |
2,835 |
2,084 |
6,601 |
14.9 |
|
|
바이오환경산업 |
75 |
354 |
344 |
486 |
1,184 |
2.7 |
|
|
바이오의료기기산업 |
66 |
866 |
1,525 |
1,466 |
3,857 |
8.7 |
|
|
바이오장비 및 기기산업 |
57 |
322 |
369 |
543 |
1,234 |
2.8 |
|
|
바이오자원산업 |
20 |
327 |
340 |
330 |
997 |
2.3 |
|
|
바이오서비스산업 |
54 |
1,503 |
2,024 |
1,356 |
4,883 |
11.0 |
|
출처: 2017년 기준 국내 바이오산업 실태조사(산업통상자원부, 한국바이오협회)
(2) 학위별 인력 분포
2017년 기준 산업계 종사자 중 학사졸업자는 1만 9,437명(43.9%)으로 가장 많았으며, 석사 8,640명(19.5%), 박사 2,559명(5.8%) 순으로 나타났다.
[표 2-52] 바이오산업 종사자 학위별 분포(2017)(단위: 명, %)
|
구분 |
박사 |
석사 |
학사 |
기타 |
계 |
산업별 구성비 |
|
|
전 체 |
인력 |
2,559 |
8,640 |
19,437 |
13,633 |
44,269 |
100.0 |
|
비율 |
5.8 |
19.5 |
43.9 |
30.8 |
100.0 |
||
|
바이오의약산업 |
1,353 |
4,204 |
8,972 |
5,955 |
20,484 |
46.3 |
|
|
바이오화학・에너지산업 |
345 |
1,318 |
2,163 |
1,203 |
5,029 |
11.4 |
|
|
바이오식품산업 |
329 |
1,081 |
2,585 |
2,606 |
6,601 |
14.9 |
|
|
바이오환경산업 |
47 |
159 |
762 |
216 |
1,184 |
2.7 |
|
|
바이오의료기기산업 |
158 |
603 |
1,528 |
1,568 |
3,857 |
8.7 |
|
|
바이오장비 및 기기산업 |
66 |
183 |
549 |
436 |
1,234 |
2.8 |
|
|
바이오자원산업 |
55 |
155 |
347 |
440 |
997 |
2.3 |
|
|
바이오서비스산업 |
206 |
937 |
2,531 |
1,209 |
4,883 |
11.0 |
|
출처: 2017년 기준 국내 바이오산업 실태조사(산업통상자원부, 한국바이오협회)
2015년부터 2017년까지 바이오산업 분야 종사자의 학위 변화를 살펴보면 학사 인력이 2015년 대비 13.9%로 가장 높은 증가율을 보였으며, 기타 인력(고졸∼전문학사)의 경우 2015년 대비 7.0% 증가한 것으로 나타나 고급인력(석・박사)에 비해 높은 증가 추세를 보였다.
 [그림 2-34] 바이오산업 종사자 학위별 인력 변화 추이(2015~2017)
[그림 2-34] 바이오산업 종사자 학위별 인력 변화 추이(2015~2017)
(3) 바이오산업 분야 인력수급 현황
바이오산업 인적자원개발협의체 운영기관인 한국바이오협회에서 산업통상자원부의 지원으로 조사한 ‘인력수급 실태조사’에 따르면 2018년 기준 바이오기업의 신규・대체인원에 대한 구인 충족률은 개발직이 77.2%로 인력 확보에 어려움을 가장 어려움을 겪은 것으로 나타났으며, 나머지 직종에서는 80%대로 조사되었다.

[그림 2-35] 바이오기업 직종별 신규.대체 인원 충족률(2018)
2018년 말 기준 바이오기업의 향후 1년간 채용수요는 영업 및 관리직이 860명(기업별 평균 4.3명)으로 가장 높은 수요를 나타냈으며, 다음으로는 연구직 348명(기업별 평균 1.7명)・생산 및 시설직 325명(기업별 평균 1.6명) 등의 순으로 조사되었다.

[그림 2-36] 향후 1년간 바이오기업 채용수요(2018)
3. 특허현황
가. 생명공학 특허 개요
생명공학기술은 의약품, 식량, 환경 등 다양한 분야에 활용될 수 있는 중요한 기술 분야이다. 1982년 미국 식품의약국(FDA: Food and Drug Administration)의 승인을 획득한 유전자 재조합 인슐린이 지식재산권으로 승인 허가가 내려진 이후로 생명공학기술은 급속도로 발전해가기 시작했다. 생명공학 산업화의 주도권은 원천기술을 바탕으로 하는 지식재산권 확보에 의존하므로 지식재산권보호의 중요성에 대한 국제적 인식은 나날이 증대되어 왔으며, 이에 따라 관련제도 구축 및 적정 보호를 위한 국제적인 노력이 끊임없이 계속되어 왔다.
한국 특허청은 1988년에 생명공학분야 특허심사기준을 제정한 후, 급증하는 특허출원에 부응하여 유전자 서열 전자출원제도를 도입하였고, 유전자서열 데이터베이스(DB) 및 생명공학 검색시스템을 구축하였다. 특허는 권리행사로서의 기능뿐만 아니라 기술개발의 흐름을 이해하고 혁신과정의 역동성을 이해하는데 매우 중요한 역할을 한다. 특허지표는 기술 분야, 국가 간, 기업 간 지식의 확산정도 뿐만 아니라 R&D 성과와 산업구조를 측정하는데 유용한 도구이기 때문이다(Compendium of patent ststistics, 200818)). 또한, 특허지표는 혁신의 산출물을 측정할 수 있는 유일한 도구라고 할 수 있다(Grilches,1990).19)
이에 한국과 미국에 출원 또는 등록된 생명공학분야 특허데이터를 추출하고 국가・기술별 주요출원인 분석을 거쳐 연구개발 성과를 측정하며 국가별 기술 집중도와 세부 기술별 현황분석을 통해 생명공학분야에 대한 집중도를 살피도록 하겠다.
나. 분석기준
생명공학 분야의 기술분류는 2004년 8월 발행된 ‘생명공학 특허동향’에서 사용된 것이다. 이는 경제협력개발기구(OECD)가 작성한 생명공학분야 특허현황에 관한 보고서와 이를 기초로 작성된 OECD의 생명공학분야 분류체계(국제특허분류를 이용한 분류체계), 유럽 특허청에서 정의한 생명공학관련 국제특허분류, 국가과학기술기본계획상의 생명공학분류체계를 참조하여 특허청과 외부 생명공학 분야 전문가 그룹의 자문을 통해 결정되었다.
분석대상 국가로는 한국과, 세계적 동향을 파악하기 위해 시장규모도 크고 특허를 가장 강하게 보호하는 미국특허를 대상으로 하였다. 시간적 기준으로 한국은 출원시점을 2009∼2017년까지20), 미국특허는 등록기준으로 2009∼2018년까지의 특허를 바탕으로 동향을 파악하였다.
주요 국가들의 기술집중도를 살펴보기 위해 현시기술우위지수(RTA: Revealed Techno- logical Advantage)를 사용하여 분석을 수행하였다. 현시기술우위지수(RTA)는 기술 특화(specialization) 현황의 파악을 위해 가장 많이 사용되는 지수 중 하나이다. 우리가 관심 대상으로 삼는 특정 주체가 다른 주체와 비교하여 상대적으로 어떤 기술 분야에 기술혁신 활동을 집중하고 있는가를 분석할 때 활용되는 지표이다. RTA 지수의 산출방법은 아래와 같다. 아래의 수식에서 분자는 ![]() 의 특허에서
의 특허에서 ![]() 분야가 차지하는 비율을 의미하며, 분모는 전 분야의 특허에서
분야가 차지하는 비율을 의미하며, 분모는 전 분야의 특허에서 ![]() 분야가 차지하는 비율을 의미한다.
분야가 차지하는 비율을 의미한다.
 (Pij는
(Pij는 ![]() 분야에 대한
분야에 대한 ![]() 의 특허 수)
의 특허 수)
RTA 지수 값이 1보다 크면 기술집중도가 높음을 의미하며 1보다 작으면 기술집중도가 낮음을 의미한다.
[표 2-53] 생명공학분야 기술 분류
|
산업 |
세부기술 |
국제특허분류 |
설명 |
|
기초 |
생물자원탐색기술 |
C12N 1/00-3/00 |
미생물 |
|
C12N 7/00-7/08 |
바이러스 |
||
|
동식물세포배양기술 |
C12N 5/00-5/28 |
동식물 세포 |
|
|
효소공학기술 |
C12N 9/00-13/00 |
효소 |
|
|
유전체기술 |
C12N 15/00-15/90 |
유전공학 |
|
|
C07H 19/00-21/04 |
당류기 함유 핵산 |
||
|
단백질체기술 |
C07K 1/00-14/825 |
펩티드 |
|
|
C07K 17/00-17/14 |
고정화 펩티드 |
||
|
C07K 19/00 |
하이브리드 펩티드 |
||
|
항체이용기술 |
C07K 16/00-16/46 |
면역글로불린 |
|
|
공정 |
생물공정기술 |
C12M 1/00-1/42 |
효소 미생물 관련 장치 |
|
C12M 3/00-3/10 |
동식물 세포 배양장치 |
||
|
C12P 1/00-41/00 |
생물학적 합성 |
||
|
C12S 1/00-13/00 |
분리 정제 |
||
|
측정진단기술 |
C12Q 1/00-3/00 |
측정 시험 |
|
|
G01N 33/50-33/98 |
조사 분석 |
||
|
의약 |
생물의약개발기술 |
A61K 35/12-35/84, 7/26 |
신약 후보물질 |
|
A61K 38/00-38/58, 7/28 |
단백질 치료제 |
||
|
A61K 39/00-39/44 |
치료용 항체 |
||
|
A61K 48/00 |
유전자 치료 |
||
|
A61K 51/00-51/10 |
방사선 의약 |
||
|
농업 |
생물농약개발기술 |
A01N 63/00-65/02 |
생물 농약 |
|
형질전환동식물개발기술 |
A01H |
신규한 식물 |
|
|
A01K 67/00-67/04 |
신규한 동물 |
||
|
환경 |
발효식품개발기술 |
C12C - C12L |
알코올 발효 및 장치 |
|
환경생물공학기술 |
C02F 3/00-3/34 |
생물학적 수처리 |
|
|
C02F 11/02-11/04 |
슬러지 처리 |
다. 분석결과
(1) 한국에 출원한 생명공학 특허동향
한국에 출원한 생명공학분야의 특허출원 건수를 국가별로 살펴보면, 한국국적이 생명공학분야 전체 특허의 약 71%를 차지하고 있다. 2013년 이후 한국은 매년 5,000여 건의 특허를 출원하고 있는 것으로 나타났다. 일본은 2010년 초반에는 매년 400여 건의 특허를 출원하고 있으나, 최근 들어오면서 건수가 지속적으로 감소하고 있음을 알 수 있다. 2010∼2016년까지 생명공학분야 특허출원의 연평균 증가율은 1.27%를 보이고 있으며, 중국이 15.30%로 가장 높은 연평균 증가율을 보이고 있다. 다출원 상위 15개국 대부분이 연평균 증가율이 마이너스를 보이고 있어 한국출원 건수가 조금씩 감소하고 있는 것으로 드러났다. 2017년도 특허의 경우 분석시점에 공개가 되지 않은 특허들이 있어 건수가 적게 나타났다.
[표 2-54] 한국특허출원의 국가별・연도별 현황(단위: 건, %)
|
국가 |
2010∼ 2011 |
2012∼ 2013 |
2014 |
2015 |
2016 |
2017 |
연평균 증가율 (2010∼2016) |
|
한 국 |
9,322 |
10,180 |
5,125 |
5,144 |
5,140 |
4,041 |
1.78% |
|
미 국 |
2,181 |
1,592 |
818 |
803 |
883 |
610 |
Δ3.91% |
|
일 본 |
878 |
664 |
229 |
253 |
228 |
181 |
Δ7.85% |
|
스위스 |
435 |
312 |
130 |
136 |
103 |
78 |
Δ9.43% |
|
독 일 |
352 |
236 |
100 |
120 |
164 |
89 |
Δ2.23% |
|
프랑스 |
242 |
165 |
93 |
81 |
84 |
41 |
Δ4.51% |
|
중 국 |
95 |
158 |
68 |
71 |
84 |
59 |
15.30% |
|
영 국 |
139 |
134 |
69 |
78 |
111 |
79 |
5.96% |
|
네덜란드 |
145 |
87 |
41 |
47 |
57 |
41 |
Δ6.61% |
|
덴마크 |
91 |
88 |
33 |
22 |
29 |
21 |
Δ3.04% |
|
오스트레일리아 |
81 |
66 |
32 |
24 |
26 |
21 |
Δ8.92% |
|
이스라엘 |
61 |
56 |
17 |
16 |
14 |
22 |
Δ11.53% |
|
벨기에 |
87 |
50 |
28 |
36 |
36 |
22 |
Δ2.83% |
|
캐나다 |
66 |
57 |
40 |
23 |
28 |
19 |
Δ1.44% |
|
스페인 |
70 |
46 |
14 |
17 |
19 |
9 |
Δ10.09% |
|
전 체 |
14,619 |
14,261 |
6,997 |
7,054 |
7,182 |
5,447 |
1.27% |
국가별로 전 산업 분야와 비교하여 생명공학분야의 기술집중도가 얼마나 되는지에 대해 살펴보기 위해 특허데이터를 가지고 2년 단위로 RTA지수를 구해보았다. 상위 15개국의 RTA 산출결과, 대부분의 국가의 RTA지수가 1보다 높게 나타나, 다른 기술 분야에 비해 생명공학분야의 기술집중도가 높은 것으로 나타났다. 한국은 특허출원 건수가 가장 많으나, 전체 기술분야에 비해서는 아직 평균보다 낮은 것으로 조사되었다. 생명공학 분야의 기술집중도가 평균보다 낮은 국가는 한국 외에 일본과 독일이 있는 것으로 나타났다.

[그림 2-37] 한국특허출원의 주요국의 구간별 RTA지수변화
연도별・기술별 특허출원현황을 살펴보면, 측정진단분야의 조사・분석분야와 측정・시험분야의 특허출원 건수가 가장 많음을 보여주고 있다. 측정・시험분야는 최근에 오면서 매년 1,000여 건 이상 출원하는 기술 분야이다. 유전체의 유전공학분야도 특허출원 건수가 많은 분야이나 최근에 오면서 출원 건수가 조금씩 감소하고 있다. 기초기술의 단백질체에서는 펩티드와 관련된 분야의 특허출원 건수가 점차 증가하고 있는 것으로 나타났다. 의약기술의 생물의약분야에서는 단백질치료제와 신약후보물질과 관련된 특허출원이 많은 것으로 조사되었다.
[표 2-55] 한국에 출원한 생명공학분야의 기술분류별・연도별 특허출원현황(단위: 건)
|
기술분류 |
2010∼ 2011 |
2012∼ 2013 |
2014 |
2015 |
2016 |
2017 |
||
|
공 정 |
생물공정 |
분리정제 |
0 |
0 |
0 |
0 |
0 |
0 |
|
생물학적합성 |
552 |
561 |
234 |
230 |
197 |
157 |
||
|
동식물세포배양장치 |
211 |
254 |
141 |
98 |
48 |
36 |
||
|
효소,미생물관련장치 |
372 |
456 |
234 |
256 |
191 |
197 |
||
|
측정진단 |
조사,분석 |
1269 |
1038 |
452 |
585 |
741 |
500 |
|
|
측정,시험 |
1254 |
1565 |
983 |
1072 |
1018 |
946 |
||
|
기 초 |
유전체 |
유전공학 |
2045 |
2117 |
847 |
758 |
719 |
445 |
|
당류기함유핵산 |
79 |
57 |
28 |
33 |
32 |
35 |
||
|
단백질체 |
펩티드 |
958 |
973 |
574 |
593 |
758 |
546 |
|
|
고정화펩티드 |
21 |
13 |
5 |
2 |
5 |
4 |
||
|
하이브리드펩티드 |
186 |
236 |
79 |
43 |
16 |
4 |
||
|
항체이용 |
면역글로불린 |
801 |
696 |
350 |
417 |
466 |
383 |
|
|
효소공학 |
효소 |
434 |
447 |
256 |
218 |
229 |
167 |
|
|
생물자원탐색 |
미생물 |
1182 |
1340 |
592 |
531 |
445 |
345 |
|
|
바이러스 |
120 |
154 |
91 |
62 |
77 |
77 |
||
|
동식물세포배양 |
동식물세포 |
702 |
586 |
395 |
361 |
410 |
356 |
|
|
농 업 |
생물농약개발 |
생물농약 |
252 |
298 |
135 |
149 |
155 |
82 |
|
형질전환동식물개발 |
신규한동물 |
177 |
186 |
106 |
147 |
189 |
114 |
|
|
신규한식물 |
506 |
441 |
111 |
71 |
102 |
46 |
||
|
식 품 |
발효식품개발 |
알코올발효및장치 |
642 |
453 |
224 |
265 |
242 |
172 |
|
의 약 |
생물의약개발 |
방사선의약 |
42 |
40 |
13 |
19 |
13 |
19 |
|
유전자치료 |
80 |
235 |
111 |
148 |
128 |
88 |
||
|
치료용항체 |
644 |
462 |
224 |
210 |
220 |
125 |
||
|
단백질치료제 |
784 |
668 |
321 |
323 |
252 |
189 |
||
|
신약후보물질 |
473 |
411 |
227 |
220 |
268 |
236 |
||
|
환 경 |
환경생물공학 |
슬러지처리 |
184 |
128 |
79 |
41 |
44 |
29 |
|
생물학적수처리 |
649 |
446 |
185 |
202 |
217 |
149 |
||
|
계 |
14,619 |
14,261 |
6,997 |
7,054 |
7,182 |
5,447 |
||
생명공학분야의 국내 상위 10개 출원인을 살펴보면(출원인인 대한민국은 제외), 서울대학교와 연세대학교를 비롯한 대학들의 특허출원이 많은 것으로 나타났다. 2016∼2017년에는 상위 10위 내에 대학이 6곳, 출연연이 2곳, 기업 1곳, 농촌진흥청이 포함된 것으로 나타났다.
[표 2-56] 국내 상위 15대 다 출원인 현황(단위: 건)
|
2014∼2015 |
건수 |
2016∼2017 |
건수 |
|
서울대학교산학협력단 |
389 |
서울대학교산학협력단 |
293 |
|
한국생명공학연구원 |
344 |
연세대학교 산학협력단 |
262 |
|
대한민국(농촌진흥청장) |
303 |
고려대학교 산학협력단 |
255 |
|
연세대학교 산학협력단 |
285 |
대한민국(농촌진흥청장) |
215 |
|
고려대학교 산학협력단 |
265 |
주식회사 엘지생활건강 |
184 |
|
한국과학기술연구원 |
216 |
경북대학교 산학협력단 |
172 |
|
건국대학교 산학협력단 |
199 |
한국과학기술연구원 |
167 |
|
경북대학교 산학협력단 |
187 |
한국생명공학연구원 |
160 |
|
한국과학기술원 |
180 |
건국대학교 산학협력단 |
146 |
|
경희대학교 산학협력단 |
179 |
가톨릭대학교 산학협력단 |
146 |
(2) 미국에 등록된 생명공학 특허동향
최근 10년간 미국에 등록된 특허건수를 기준으로 다등록 상위 15개 국가들에 대한 특허 건수를 살펴보았다. 미국이 2017∼2018년 모두 압도적으로 많은 특허등록 건수를 보였다. 이는 홈 어드벤티지(Home Advantage)가 있어 나타나는 현상이다.
다음으로 일본이 많은 특허등록 건수를 보여주고 있으나 2015∼2016년에 비해 등록 건수가 줄어들고 있다. 한국은 특허등록 건수가 꾸준히 증가하여 2018년에는 354건의 특허가 등록되었다. 2016년에 다등록 국가 7위에서 2018년에는 6위로 올라섰다. 10년간의 연평균 증가율을 살펴보면, 생명공학 특허 전체의 연평균 증가율은 4.92%로 나타났다. 중국이 25.41%의 연평균 증가율을 보여 가장 높은 특허 건수 증가세를 보여주고 있다. 2009∼2010년에는 상위 15위 내에 들지 않던 중국은 2018년에는 231건의 특허가 등록되면서 10위로 올라섰다. 한국은 중국에 이어 14.06%의 연평균 증가율을 나타냈다.
[표 2-57] 미국에 등록된 생명공학특허의 국가별 특허등록 건수 현황(단위: 건, %)
|
국가 |
2009∼ 2010 |
2011∼ 2012 |
2013∼ 2014 |
2015 |
2016 |
2017 |
2018 |
연평균 증가율 (10년) |
|
미 국 |
9,860 |
11,087 |
12,930 |
6,482 |
6,470 |
5,924 |
6,781 |
4.30% |
|
일 본 |
1,227 |
1,554 |
1,624 |
793 |
777 |
562 |
635 |
1.79% |
|
독 일 |
796 |
862 |
902 |
525 |
490 |
438 |
517 |
3.43% |
|
네덜란드 |
502 |
519 |
699 |
476 |
484 |
422 |
484 |
8.20% |
|
스위스 |
418 |
498 |
665 |
343 |
338 |
342 |
379 |
11.91% |
|
대한민국 |
251 |
323 |
466 |
255 |
266 |
301 |
354 |
14.06% |
|
프랑스 |
375 |
436 |
585 |
326 |
351 |
305 |
324 |
7.11% |
|
영 국 |
345 |
422 |
532 |
287 |
246 |
216 |
285 |
6.42% |
|
덴마크 |
210 |
333 |
463 |
206 |
230 |
169 |
239 |
10.51% |
|
중 국 |
73 |
113 |
206 |
129 |
170 |
164 |
231 |
25.41% |
|
캐나다 |
337 |
397 |
366 |
204 |
173 |
142 |
192 |
1.84% |
|
이스라엘 |
190 |
248 |
303 |
174 |
172 |
168 |
175 |
7.36% |
|
벨기에 |
176 |
219 |
210 |
124 |
162 |
137 |
159 |
6.85% |
|
오스트레일리아 |
218 |
252 |
263 |
115 |
122 |
110 |
130 |
3.08% |
|
대 만 |
159 |
206 |
257 |
115 |
99 |
111 |
117 |
6.39% |
|
전 체 |
17,148 |
19,520 |
22,761 |
11,746 |
11,912 |
12,434 |
12,328 |
4.92% |
국가별로 전 산업 분야와 비교하여 생명공학분야의 기술집중도가 얼마나 되는지에 대해 살펴보기 위해 최근 10년간의 특허데이터를 가지고 2년 단위로 RTA지수를 구해보았다. 유럽국가인 네덜란드, 스위스, 덴마크, 벨기에 등의 기술집중도가 1보다 높게 나타났다. 특허 건수가 가장 많은 미국도 1 이상의 기술집중도를 보여주었다. 한국은 기술집중도가 조금씩 증가하고 있으나, 2017∼2018년의 기술집중도가 0.38로 여전히 낮은 것으로 분석되었다.

[그림 2-38] 미국특허의 주요국의 구간별 RTA지수변화
한국국적의 특허현황을 연도별・기술별로 살펴보면, 생물공정의 생물학적 합성분야와 측정진단의 측정・시험분야, 유전체의 유전공학분야, 생물의약개발의 단백질 치료제 분야의 특허가 많은 것으로 나타났다. 2017∼2018년에는 단백질 치료제의 특허건수가 다른 기술들에 비해 가장 많은 등록 건수를 보여주고 있다.
[표 2-58] 미국에 등록된 한국 생명공학특허의 기술분류별-연도별 특허등록 건수 현황(단위: 건)
|
기술분류 |
2009∼ 2010 |
2011∼ 2012 |
2013∼ 2014 |
2015 |
2016 |
2017 |
2018 |
||
|
공 정 |
생물공정 |
분리정제 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
|
생물학적합성 |
31 |
39 |
65 |
34 |
32 |
36 |
39 |
||
|
동식물세포배양장치 |
4 |
1 |
1 |
3 |
3 |
0 |
0 |
||
|
효소,미생물관련장치 |
22 |
16 |
24 |
15 |
4 |
8 |
12 |
||
|
측정진단 |
조사,분석 |
15 |
22 |
37 |
21 |
14 |
15 |
29 |
|
|
측정,시험 |
35 |
40 |
42 |
32 |
29 |
34 |
34 |
||
|
기 초 |
유전체 |
유전공학 |
17 |
19 |
43 |
16 |
26 |
26 |
28 |
|
당류기함유핵산 |
19 |
21 |
24 |
12 |
7 |
6 |
7 |
||
|
단백질체 |
펩티드 |
14 |
12 |
28 |
19 |
15 |
24 |
26 |
|
|
고정화펩티드 |
0 |
0 |
0 |
1 |
0 |
2 |
0 |
||
|
하이브리드펩티드 |
0 |
1 |
1 |
0 |
0 |
3 |
0 |
||
|
항체이용 |
면역글로불린 |
3 |
5 |
14 |
4 |
14 |
17 |
22 |
|
|
효소공학 |
효소 |
6 |
9 |
14 |
12 |
13 |
15 |
17 |
|
|
생물자원탐색 |
미생물 |
10 |
10 |
25 |
6 |
10 |
10 |
19 |
|
|
바이러스 |
0 |
5 |
1 |
1 |
6 |
3 |
5 |
||
|
동식물세포배양 |
동식물세포 |
12 |
14 |
21 |
12 |
10 |
20 |
18 |
|
|
농 업 |
생물농약개발 |
생물농약 |
10 |
13 |
22 |
10 |
12 |
2 |
4 |
|
형질전환동식물개발 |
신규한동물 |
3 |
3 |
4 |
2 |
2 |
3 |
1 |
|
|
신규한식물 |
4 |
8 |
4 |
1 |
0 |
4 |
5 |
||
|
식 품 |
발효식품개발 |
알코올발효및장치 |
1 |
1 |
1 |
0 |
0 |
0 |
0 |
|
의 약 |
생물의약개발 |
방사선의약 |
1 |
2 |
1 |
1 |
3 |
3 |
0 |
|
유전자치료 |
2 |
6 |
5 |
8 |
6 |
5 |
6 |
||
|
치료용항체 |
12 |
27 |
27 |
11 |
19 |
15 |
23 |
||
|
단백질치료제 |
17 |
42 |
51 |
27 |
33 |
39 |
42 |
||
|
신약후보물질 |
3 |
2 |
3 |
4 |
8 |
11 |
16 |
||
|
환 경 |
환경생물공학 |
슬러지처리 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
|
생물학적수처리 |
9 |
5 |
7 |
3 |
0 |
0 |
1 |
||
|
계 |
251 |
323 |
466 |
255 |
266 |
301 |
354 |
||
한국국적의 상위 10개의 다등록권자를 살펴보면 미국특허에서는 삼성전자와 CJ 제일제당의 특허 건수가 많은 것으로 조사되었다. 상위 10개의 다등록권자에는 기업이 3곳, 대학이 5곳, 출연연구소가 2곳이 포함된 것으로 조사되었다.
[표 2-59] 미국에 등록된 생명공학분야 특허의 한국국적 다등록권자 현황(2015~2018)(단위: 건)
|
2015∼2016 |
건수 |
2017∼2018 |
건수 |
|
삼성전자 |
72 |
삼성전자 |
72 |
|
CJ 제일제당 |
26 |
CJ 제일제당 |
48 |
|
서울대학교 |
26 |
고려대학교 |
31 |
|
한국생명공학연구원 |
24 |
서울대학교 |
22 |
|
한국과학기술원 |
20 |
한국생명공학연구원 |
20 |
|
포스텍 |
20 |
연세대학교 |
18 |
|
한미약품 |
15 |
한국과학기술연구원 |
18 |
|
고려대학교 |
14 |
한국과학기술원 |
18 |
|
한국과학기술연구원 |
12 |
한미약품 |
14 |
|
가톨릭대학교 |
12 |
가톨릭대학교 |
11 |
4. 논문현황
가. 개요
연구개발 결과는 논문을 통해 전파되고 이를 통해 학문이 발전하며 응용연구로 연결된다. 연구자는 논문발표를 통해 연구결과에 대한 객관적인 비판과 평가를 받으며, 자신의 축적된 연구역량을 스스로 확인할 수 있는 주요 수단이 되기도 한다. 이러한 논문의 현황분석은 우리나라 생명공학의 수준과 역량을 보다 객관적으로 진단하는데 유용하다. 특히, 파괴적 혁신을 일으키는 R&D21)를 위해서는 논문의 양적수준 뿐 아니라 질적 수준에 대한 객관적인 분석이 필요하다.
논문분석을 수행하기 위해서는 논문 데이터베이스(DB)가 필요하다. Clarivate Analytics에서 발간하는 SCI(Science Citation Index) DB는 학계에 널리 알려진 DB로서 SCI등재 학술지 논문 수는 한 나라의 국제적인 연구개발 활동의 지표로서 널리 인식되고 있다. SCI DB는 30년 이상 엄정한 심사를 통과한 학술지에 대한 DB를 구축하여 제공함으로써 세계적인 권위를 인정받고 있다. 논문현황 분석은 SCI DB의 일종인 In Cites B&A(Benchmarking & Analysis, 1981∼2015)와 WoS(Web of Science), ESI(Essential Science Indicators, 2005∼2015)를 기반으로 하였다. 전체 과학기술분야 중 생명공학분야를 분석하기 위해 SCI 과학기술 18개 분야 중 관련 6개 분야를 대상으로 하였으며 논문 타입은 Article, Review만으로 한정하였다.
나. 한국의 SCI논문 현황
2017년 우리나라 SCI 논문 수는 6만 1,163편으로 세계 12위 수준이다. 세계 점유율도 2008년 대비 0.59% 증가하는 등 매년 양적으로 점진적인 증가 추세를 나타내고 있다.
[표 2-60] 최근 10년간 한국의 SCI논문 발표 현황
|
구분 |
2008 |
2009 |
2010 |
2011 |
2012 |
|
논문발표 수(편) |
34,516 |
38,052 |
41,994 |
46,278 |
50,367 |
|
세계 총 논문 수(편) |
1,221,403 |
1,299,926 |
1,349,963 |
1,443,352 |
1,495,081 |
|
세계 점유율(%) |
2.83 |
2.93 |
3.11 |
3.21 |
3.37 |
|
세계 순위 |
12위 |
12위 |
12위 |
12위 |
12위 |
|
구분 |
2013 |
2014 |
2015 |
2016 |
2017 |
|
논문발표 수(편) |
52,827 |
55,791 |
58,832 |
60,471 |
61,163 |
|
세계 총 논문 수(편) |
1,572,889 |
1,622,978 |
1,670,162 |
1,733,431 |
1,790,016 |
|
세계 점유율(%) |
3.36 |
3.44 |
3.52 |
3.49 |
3.42 |
|
세계 순위 |
12위 |
12위 |
12위 |
12위 |
12위 |
우리나라 SCI논문의 최근 5년간(2013∼2017) 평균 피인용 횟수는 5.84회로 세계 평균(5.71회)과 비교했을 때 질적 수준에서 약간 높은 수준을 보였다. 과거에는 세계 평균에 비해 다소 낮은 편이었으나 최근 세계 평균을 넘어서면서, 논문의 양적 성장은 줄어들었지만 질적으로는 점차 향상되고 있다는 것을 알 수 있다.
[표 2-61] 5년 주기별 한국의 SCI논문 1편당 평균 피인용 현황(단위: %)
|
구분 |
2008∼2012 |
2009∼2013 |
2010∼2014 |
2011∼2015 |
2012∼2016 |
2013∼2017 |
|
한국 |
4.46 |
4.74 |
5.07 |
5.33 |
5.65 |
5.84 |
|
세계평균 |
5.1 |
5.18 |
5.29 |
5.4 |
5.57 |
5.71 |
|
세계대비 |
87.45 |
91.51 |
95.84 |
98.70 |
101.44 |
102.28 |
다. 바이오분야 SCI논문 현황
우리나라 바이오 6개 분야의 최근 5년간(2013∼2017) SCI 논문 수는 아래 표와 같다. 약리학 분야가 논문수로 세계 8위, 미생물학이 세계 9위 수준이며 점유율도 우리나라 평균(3.46%)보다 높은 것으로 나타났다. 국가별로는 미국이 6개 분야 모두 월등히 앞서 있으며 중국, 영국, 독일, 일본, 프랑스 순으로 나타났다.
[표 2-62] 최근 5년간(2013∼2017) 한국의 바이오분야 SCI 논문 현황
|
분야명 |
분야 논문 수 |
세계 순위 |
한국 대비 |
세계 대비 |
||
|
총논문 수 |
점유율 |
세계분야 총논문 수 |
점유율 |
|||
|
면역학 |
3,166 |
16위 |
289,084 |
1.09% |
130,935 |
2.42% |
|
미생물학 |
4,467 |
9위 |
289,084 |
1.55% |
105,516 |
4.23% |
|
분자생물학&유전학 |
8,584 |
10위 |
289,084 |
2.97% |
248,787 |
3.45% |
|
생물학&생화학 |
14,157 |
11위 |
289,084 |
4.90% |
371,701 |
3.81% |
|
신경과학&행동과학 |
6,995 |
13위 |
289,084 |
2.42% |
261,125 |
2.68% |
|
약리학 |
8,438 |
8위 |
289,084 |
2.92% |
204,311 |
4.13% |
|
생명공학 합계 |
45,807 |
12위 |
289,084 |
15.84% |
1,322,375 |
3.46% |

[그림 2-39] 최근 5년간(2013∼2017) 국가별 바이오분야 SCI 논문 수
한국의 바이오분야 SCI 논문을 연도별 살펴보면 분자생물학 및 유전학 분야의 SCI 논문 수가 최근 10년간 9.3%의 연평균 증가율을 보이며 대략 2.2배 정도 증가하였고, 면역학(7.7%), 신경과학 및 행동학(7.2%), 생물학 및 생화학(4.3%), 미생물학(3.4%), 약리학(3.2%) 순으로 SCI 논문이 증가하고 있는 것으로 나타났다
[표 2-63] 최근 10년간 한국의 생명공학분야 SCI 논문 현황
|
분야명 |
구분 |
2008 |
2009 |
2010 |
2011 |
2012 |
|
면역학 |
논문 수 |
327 |
369 |
473 |
522 |
620 |
|
피인용 수 |
13,965 |
11,545 |
12,945 |
12,102 |
12,355 |
|
|
평균피인용 |
42.71 |
31.29 |
27.37 |
23.18 |
19.93 |
|
|
미생물학 |
논문 수 |
751 |
668 |
667 |
757 |
920 |
|
피인용수 |
15,317 |
12,617 |
13,716 |
12,163 |
14,697 |
|
|
평균 피인용 |
20.40 |
18.89 |
20.56 |
16.07 |
15.98 |
|
|
분자생물학& 유전학 |
논문 수 |
894 |
1,006 |
991 |
1,196 |
1,329 |
|
피인용 수 |
29,422 |
33,051 |
36,985 |
30,755 |
42,039 |
|
|
평균 피인용 |
32.91 |
32.85 |
37.32 |
25.71 |
31.63 |
|
|
생물학& 생화학 |
논문 수 |
1,877 |
1,898 |
2,176 |
2,280 |
2,469 |
|
피인용 수 |
55,878 |
48,570 |
53,784 |
53,477 |
52,417 |
|
|
평균 피인용 |
29.77 |
25.59 |
24.72 |
23.45 |
21.23 |
|
|
신경과학& 행동과학 |
논문 수 |
815 |
851 |
1,006 |
1,037 |
1,223 |
|
피인용 수 |
24,705 |
24,201 |
24,543 |
23,506 |
23,625 |
|
|
평균 피인용 |
30.31 |
28.44 |
24.40 |
22.67 |
19.32 |
|
|
약리학 |
논문 수 |
1,256 |
1,336 |
1,477 |
1,598 |
1,658 |
|
피인용 수 |
34,614 |
34,114 |
32,779 |
29,141 |
28,221 |
|
|
평균 피인용 |
27.56 |
25.53 |
22.19 |
18.24 |
17.02 |
|
분야명 |
구분 |
2013 |
2014 |
2015 |
2016 |
2017 |
|
면역학 |
논문 수 |
593 |
645 |
657 |
633 |
638 |
|
피인용 수 |
10,486 |
9,904 |
7,695 |
5,666 |
3,474 |
|
|
평균 피인용 |
17.68 |
15.36 |
11.71 |
8.95 |
5.45 |
|
|
미생물학 |
논문 수 |
807 |
848 |
919 |
884 |
1,009 |
|
피인용 수 |
8,400 |
8,844 |
6,745 |
5,747 |
4,198 |
|
|
평균 피인용 |
10.41 |
10.43 |
7.34 |
6.50 |
4.16 |
|
|
분자생물학& 유전학 |
논문 수 |
1,342 |
1,535 |
1,727 |
1,990 |
1,990 |
|
피인용 수 |
30,852 |
33,461 |
29,893 |
24,086 |
11,157 |
|
|
평균 피인용 |
22.99 |
21.80 |
17.31 |
12.10 |
5.61 |
|
|
생물학& 생화학 |
논문 수 |
2,753 |
2,861 |
2,961 |
2,844 |
2,738 |
|
피인용수 |
48,027 |
42,444 |
34,207 |
24,567 |
14,252 |
|
|
평균피인용 |
17.45 |
14.84 |
11.55 |
8.64 |
5.21 |
|
|
신경과학& 행동과학 |
논문수 |
1,289 |
1,292 |
1,403 |
1,492 |
1,519 |
|
피인용 수 |
23,089 |
19,193 |
15,695 |
11,159 |
7,563 |
|
|
평균 피인용 |
17.91 |
14.86 |
11.19 |
7.48 |
4.98 |
|
|
약리학 |
논문 수 |
1,653 |
1,625 |
1,809 |
1,682 |
1,669 |
|
피인용 수 |
26,410 |
20,633 |
17,160 |
12,260 |
6,728 |
|
|
평균 피인용 |
15.98 |
12.70 |
9.49 |
7.29 |
4.03 |

[그림 2-40] 한국의 연도별 바이오분야 SCI 논문수 추이
최근 5년간 우리나라에서 발표한 바이오 6개 분야 SCI 논문 4만 5,807편 중 1회 이상 피인용 된 논문은 4만 2,266편이다. 논문의 피인용율은 92.3% 수준이며 대부분의 분야에서 세계 평균과 비슷하게 나타났다.
[표 2-64] 최근 5년(2013∼2017) 한국의 바이오분야 SCI 논문 피인용율
|
구분 |
한국 바이오분야 논문 |
세계대비 |
|||
|
논문 수 |
피인용된 논문 수 |
피인용율 (a) |
세계 피인용율(b) |
세계대비 (a/b) |
|
|
면역학 |
3,166 |
3,028 |
95.64% |
94.27% |
1.01 |
|
미생물학 |
4,467 |
4,032 |
90.26% |
93.59% |
0.96 |
|
분자생물학 & 유전학 |
8,584 |
7,789 |
90.74% |
93.59% |
0.97 |
|
생물학 & 생화학 |
14,157 |
13,085 |
92.43% |
91.93% |
1.01 |
|
신경과학 & 행동과학 |
6,995 |
6,441 |
92.08% |
93.58% |
0.98 |
|
약리학 |
8,438 |
7,891 |
93.52% |
90.95% |
1.03 |
|
생명공학 합계 |
45,807 |
42,266 |
92.27% |
92.78% |
0.99 |
최근 5년간 우리나라 SCI 논문의 바이오 6개 분야 평균 피인용 수는 11.44회로 세계 평균(13.87)대비 82% 수준으로 나타났다. 10년 전(2003∼2007) 67% 수준과 비교했을 때 질적으로 성장하고 있는 것으로 나타났다. 최근 5년간 6개 분야 중 약리학 분야의 평균 피인용 수가 세계 평균 대비 95% 수준으로 가장 높았다.
[표 2-65] 최근 15년(2003∼2017) 한국의 바이오분야 SCI 논문 피인용율(단위: %)
|
분야명 |
2003∼2007 |
2008∼2012 |
2013∼2017 |
||||||
|
한국 평균(a) |
세계 평균(b) |
비율 (a/b) |
한국 평균(a) |
세계 평균(b) |
비율 (a/b) |
한국 평균(a) |
세계 평균(b) |
비율 (a/b) |
|
|
면역학 |
35.98 |
50.79 |
0.71 |
27.22 |
34.78 |
0.78 |
11.76 |
14.76 |
0.80 |
|
미생물학 |
21.80 |
43.61 |
0.50 |
18.21 |
28.37 |
0.64 |
7.60 |
12.43 |
0.61 |
|
분자생물학 &유전학 |
50.51 |
71.17 |
0.71 |
31.80 |
46.91 |
0.68 |
15.08 |
17.67 |
0.85 |
|
생물학 &생화학 |
33.79 |
46.04 |
0.73 |
24.68 |
31.87 |
0.77 |
11.55 |
13.36 |
0.86 |
|
신경과학 &행동과학 |
35.48 |
50.19 |
0.71 |
24.45 |
34.09 |
0.72 |
10.96 |
13.85 |
0.79 |
|
약리학 |
28.89 |
34.65 |
0.83 |
21.69 |
23.98 |
0.90 |
9.86 |
10.39 |
0.95 |
|
생명공학 합계 |
33.60 |
49.83 |
0.67 |
24.60 |
33.73 |
0.73 |
11.44 |
13.87 |
0.82 |
주) InCites DB 특성상 과거시점 5년 주기 평균 피인용율을 구할 수 없어 현재시점 피인용율을 나타냄
라. 바이오분야 SCI 고(高)피인용(상위1%) 논문 현황
최근 11년간 우리나라의 바이오 6개 분야 피인용 상위1% SCI 논문 수는 4편으로 세계 19위 수준이며 피인용 상위1% SCI 논문 비율은 0.56%로 세계 평균(1%)에 미치지 못하는 것으로 나타났다. 하지만 연도별 현황을 분석하면 피인용 상위1% 논문비율은 2007∼2011년 0.47%에서 2013∼2017년 0.57%로 점진적으로 증가하고 있는 것으로 나타났다. 최근 5년간 분야별로는 분자생물학 및 유전학분야가 피인용 상위1% SCI 논문 비율이 0.79%로 세계 평균(1%)에 가장 근접한 것으로 나타났다.
[표 2-66] 최근 11년간(2007∼2017) 바이오 분야 피인용 상위 1% 논문
|
구분 |
한국 바이오분야 논문 |
1% 세계 논문 수 |
|||
|
1% 논문 수 |
전체 논문 수 |
1% 논문 비중(%) |
1% 논문 세계 순위 |
||
|
면역학 |
101 |
5,763 |
1.75 |
26 |
2,474 |
|
미생물학 |
49 |
8,942 |
0.55 |
24 |
2,028 |
|
분자생물학&유전학 |
112 |
14,691 |
0.76 |
20 |
4,703 |
|
생물학&생화학 |
155 |
26,521 |
0.58 |
16 |
7,205 |
|
신경과학&행동과학 |
27 |
12,646 |
0.21 |
23 |
5,143 |
|
약리학 |
31 |
16,754 |
0.19 |
13 |
3,795 |
|
생명공학 합계 |
475 |
85,317 |
0.56 |
19 |
25,348 |
[표 2-67] 세계 대비 5년 주기별 한국의 피인용 상위 1% 논문 비중(단위: %)
|
구분 |
2007∼ 2011 |
2008∼ 2012 |
2009∼ 2013 |
2010∼ 2014 |
2011∼ 2015 |
2012∼ 2016 |
2013∼ 2017 |
|
면역학 |
0.51 |
0.56 |
0.50 |
0.46 |
0.46 |
0.54 |
0.57 |
|
미생물학 |
0.23 |
0.21 |
0.24 |
0.25 |
0.26 |
0.30 |
0.40 |
|
분자생물학 &유전학 |
0.57 |
0.66 |
0.82 |
0.91 |
0.90 |
0.92 |
0.79 |
|
생물학 &생화학 |
0.60 |
0.56 |
0.53 |
0.49 |
0.56 |
0.56 |
0.62 |
|
신경과학 &행동과학 |
0.20 |
0.26 |
0.33 |
0.41 |
0.50 |
0.48 |
0.50 |
|
약리학 |
0.71 |
0.74 |
0.69 |
0.64 |
0.54 |
0.57 |
0.53 |
|
생명공학 합계 |
0.47 |
0.50 |
0.52 |
0.53 |
0.54 |
0.56 |
0.57 |

[그림 2-41] 연도별 한국의 피인용 상위 1%논문 비율 추이
5. 산업현황
산업통상자원부와 한국바이오협회가 국가표준 KS J 1009(바이오산업 분류체계)에 따라 국내 바이오기업 984개사를 대상으로 조사한 ‘2017년 기준 국내 바이오산업 실태조사’ 결과(2018.12), 국내 바이오 산업 생산규모가 사상 최초로 10조 원대를 돌파한 것으로 나타났다.
가. 바이오기업 규모 및 매출발생 현황
2017년 기준 국내 바이오기업은 총 984개사로 기업 전체 종사자 규모를 기준으로 보면, ‘1∼50명 미만’ 기업이 544개(57.1%)로 가장 많고 1,000명 이상의 기업은 43개(4.5%)인 것으로 나타났다. 매출발생 현황을 살펴보면 전체 984개 기업에서 미응답기업 95개를 제외한 889개 기업 중 245개 기업(27.6%)이 2017년 현재 ‘매출 발생 이전’ 단계인 것으로 조사되었으며 매출 발생이 있는 644개 기업 중 344개 기업(38.7%)은 ‘손익분기점 미만’인 것으로 조사되었다. 2017년 매출 발생이 있는 644개 기업 중 2017년 처음 매출이 발생한 기업은 13개(2.0%), 매출 발생이 10년 이상인 기업은 298개(46.3%)로 조사되었다.

[그림 2-42] 국내 바이오기업 규모 및 매출발생 현황
나. 외부 협력 현황
전체 984개 기업 중 2017년 기준 타 기관과의 협력관계가 있었던 기업은 290개로 29.5%의 비율을 보였다. 290개 협력실적이 있는 업체는 주로 국내 기관과의 협력을 하고 있으며(90.0%), 10건 중 1건 정도는 해외와 협력을 하고 있다. 바이오의약, 바이오식품, 바이오화학・에너지 등 3개 분야의 기업이 협력기업 수의 76.5%, 협력 건수의 76.6%를 차지하고 있다. 바이오의약과 바이오식품은 기업체와의 협력이 많은 반면 바이오화학・에너지는 상대적으로 연구기관과의 협력 건수가 많은 특징을 보이고 있다.
협력관계 형태는 공동연구 개발계약이 81.7%로 가장 많았으며, 다음으로 기술제휴-라이센싱(24.1%), 국내외 기술인력 교류(11.4%), 합작 투자(5.5%) 순으로 나타났다. 단계별로는 실험단계가 총 1,148건 중 364건으로 31.7%의 가장 큰 비중을 보였으며, 그 다음으로 기초연구단계가 354건으로 29.1%로 높았다. 전체 단계 중 마지막 단계인 사업화단계는 89건으로 7.8%의 비율을 보여 사업 초기단계에서 주로 타 기관과의 협력을 진행하는 것으로 나타났다.
분야별 및 단계별 협력 건수는 바이오의약산업, 바이오식품산업, 바이오화학・에너지산업은 실험단계의 비중이 높은 반면, 나머지 산업분야는 기초연구단계 비중이 더 높았다.
[표 2-68] 2017년 기준 바이오산업 분야별 협력 단계별 협력 건수(단위: 건)
|
구분 |
전체 업체 수 |
협력 관계 보유 업체 |
협력관계 단계 |
||||||
|
기초 연구 단계 |
실험 단계 |
시작품 단계 |
제품화 단계 |
사업화 단계 |
합계 |
||||
|
전 체 |
984 |
290 |
334 |
364 |
204 |
157 |
89 |
1,148 |
(100.0%) |
|
바이오의약산업 |
322 |
96 |
104 |
137 |
86 |
50 |
21 |
398 |
(34.7%) |
|
바이오화학・에너지산업 |
201 |
61 |
50 |
60 |
47 |
37 |
34 |
228 |
(19.9%) |
|
바이오식품산업 |
189 |
63 |
54 |
116 |
27 |
42 |
13 |
252 |
(22.0%) |
|
바이오환경산업 |
75 |
16 |
10 |
6 |
6 |
3 |
7 |
32 |
(2.8%) |
|
바이오의료기기산업 |
66 |
23 |
62 |
23 |
20 |
19 |
12 |
136 |
(11.8%) |
|
바이오장비 및 기기산업 |
57 |
8 |
11 |
5 |
2 |
3 |
- |
21 |
(1.8%) |
|
바이오자원산업 |
20 |
7 |
9 |
8 |
4 |
1 |
- |
22 |
(1.9%) |
|
바이오서비스산업 |
54 |
16 |
34 |
9 |
12 |
2 |
2 |
59 |
(5.1%) |
다. 바이오산업 수급 현황
2017년 국내 바이오산업의 생산 규모는 10조 1,264억 원으로 국내 판매 4조 9,767억 원(49.1%), 수출 5조 1,497억 원(50.9%)으로 나타났다. 국내 판매와 수입에 따른 내수시장 규모는 6조 6,223억 원으로 조사되었다.
바이오산업의 생산규모에서 바이오의약산업이 3조 8,501억 원으로 전체 산업의 38.0%를 차지하였고, 바이오식품산업이 3조 889억 원으로 30.5%의 비중을 보였다. 내수시장에서 가장 큰 비중을 차지하고 있는 산업은 바이오의약산업이며, 전체 시장의 48.4%인 3조 2,056억 원 규모로 조사되었다.
2015∼2017년 바이오산업의 수급변화 추이를 보면 생산과 내수규모는 지속적인 성장을 보이고 있었다. 2015년 이후 연평균 증감률은 수급 9.0%, 생산 9.1%, 내수 8.5%로 나타났다. 2017년의 생산 부문은 전년 대비하여 9.3%가 증가하였으며 바이오서비스산업의 성장률이 39.3%로 가장 높게 나타났다. 2017년의 내수 부문은 전년 대비하여 8.7% 증가하였으며, 바이오의약산업과 바이오화학・에너지산업이 각각 11.1%와 10.1% 증가하여 증가폭이 컸다.
[표 2-69] 2015∼2017년 바이오 산업 생산 및 내수 변화 추이(단위: 억 원, %)
|
구분 |
생산 |
내수 |
||||||||
|
2015 |
2016 |
2017 |
전년 대비 증감률 |
연평균 증감률 |
2015 |
2016 |
2017 |
전년 대비 증감률 |
연평균 증감률 |
|
|
전 체 |
85,039 |
92,611 |
101,264 |
9.3 |
9.1 |
56,266 |
60,898 |
66,223 |
8.7 |
8.5 |
|
바이오의약산업 |
34,639 |
35,176 |
38,501 |
9.5 |
5.4 |
27,550 |
28,793 |
32,056 |
11.3 |
7.9 |
|
바이오화학・에너지산업 |
5,737 |
13,335 |
14,564 |
9.2 |
59.3 |
5,262 |
12,836 |
14,264 |
11.1 |
64.6 |
|
바이오식품산업 |
32,174 |
29,182 |
30,889 |
5.8 |
Δ2.0 |
13,279 |
12,331 |
12,548 |
1.8 |
Δ2.8 |
|
바이오환경산업 |
306 |
295 |
294 |
Δ0.1 |
Δ1.9 |
304 |
293 |
292 |
Δ0.1 |
Δ2.0 |
|
바이오의료기기산업 |
1,602 |
5,895 |
6,047 |
2.6 |
94.3 |
315 |
1,502 |
1,634 |
8.8 |
127.6 |
|
바이오장비 및 기기산업 |
1,626 |
1,199 |
1,130 |
Δ5.7 |
Δ16.6 |
1428 |
1,163 |
1,174 |
1 |
Δ9.3 |
|
바이오자원산업 |
6,468 |
1,689 |
1,703 |
0.8 |
Δ48.7 |
6,083 |
1,527 |
1,554 |
1.7 |
Δ49.5 |
|
바이오서비스산업 |
2,487 |
5,842 |
8,136 |
39.3 |
80.9 |
2,043 |
2,453 |
2,702 |
10.1 |
15.0 |
주) 2016년 기준 결과는 분류체계 변경으로 인해 일부 산업분야의 시계열 확인 시 주의가 필요함.
라. 바이오산업 국내 판매 현황
2017년 바이오제품의 국내 판매 규모는 4조 9,767억 원으로 바이오의약산업이 1조 7,889억 원(35.9%)으로 국내 판매 부분에서 가장 큰 비중을 차지하고 있었다. 다음으로는 바이오화학・에너지산업이 1조 3,431억 원(27.0%), 바이오식품산업 1조 2,087억 원(24.3%)으로 이들 세 개 분야는 전체 국내 판매액의 87.2%를 차지하는 것으로 조사되었다. 국내 판매 추이를 보면 2017년은 전년 대비 3,466억 원(7.5%)이 증가하였다. 분야별로는 바이오화학・에너지산업이 전년 대비 12.4%, 바이오의료기기산업도 11.2% 성장한 것으로 조사되었다.
반면에, 바이오환경산업은 전년 대비 0.1% 감소하였다. 바이오의약산업은 전년대비 9.0% 증가하였으며 전체 바이오산업에서 차지하는 비중은 35.9%로 다른 산업에 비해 가장 크다. 2017년 기준 주요 바이오제품의 국내 판매 현황을 보면, 바이오연료의 국내 판매 규모가 9,072억 원으로 전체 바이오제품 판매액 중 18.2%의 비중을 차지하였다. 다음으로는 사료첨가제(12.7%), 기타바이오의약품(11.9%), 백신(7.8%), 혈액제제(7.8%) 순으로 조사되었다.
[표 2-70] 2015∼2017년 바이오 산업 분야별 국내 판매 추이(단위: 백만 원, %)
|
구분 |
2015 |
2016 |
2017 |
전년 대비 증감 |
연평균 증감률 |
||||
|
국내판매 |
비중 |
국내판매 |
비중 |
국내판매 |
비중 |
국내판매 |
증감률 |
||
|
전 체 |
4,217,863 |
100.0 |
4,630,133 |
100.0 |
4,976,744 |
100.0 |
346,611 |
7.5 |
8.6 |
|
바이오의약산업 |
1,534,788 |
36.4 |
1,640,767 |
35.4 |
1,788,874 |
35.9 |
148,107 |
9.0 |
8.0 |
|
바이오화학・에너지산업 |
438,539 |
10.4 |
1,194,963 |
25.8 |
1,343,138 |
27.0 |
148,175 |
12.4 |
75.0 |
|
바이오식품산업 |
1,291,411 |
30.6 |
1,191,934 |
25.7 |
1,208,702 |
24.3 |
16,768 |
1.4 |
Δ3.3 |
|
바이오환경산업 |
30,311 |
0.7 |
29,047 |
0.6 |
29,024 |
0.6 |
Δ23 |
Δ0.1 |
Δ2.1 |
|
바이오의료기기산업 |
30,774 |
0.7 |
117,952 |
2.5 |
131,150 |
2.6 |
13,198 |
11.2 |
106.4 |
|
바이오장비 및 기기산업 |
89,044 |
2.1 |
63,815 |
1.4 |
66,024 |
1.3 |
2,209 |
3.5 |
Δ13.9 |
|
바이오자원산업 |
600,073 |
14.2 |
147,258 |
3.2 |
149,053 |
3.0 |
1,795 |
1.2 |
Δ50.2 |
|
바이오서비스산업 |
202,923 |
4.8 |
244,397 |
5.3 |
260,779 |
5.2 |
16,382 |
6.7 |
13.4 |
주) 2016년 기준 결과는 분류체계 변경으로 인해 일부 산업분야의 시계열 확인 시 주의가 필요함.
마. 바이오산업 수출입 현황
2017년 기준 바이오산업의 수출규모는 5조 1,497억 원으로 조사되었다. 분야별로 보면, 바이오의약산업이 2조 613억 원(40.0%)으로 가장 컸으며, 다음으로 바이오식품산업이 1조 8,802억 원(36.5%)을 수출하였다.
수출제품별로 보면 사료첨가제가 1조 4,312억 원 수출되어 전체 수출액의 27.8%를 차지하였으며, 다음으로 치료용 항체 및 사이토카인제제(23.4%), 바이오위탁생산・대행서비스(9.1%), 체외진단(8.5%), 식품첨가물(7.7%) 순이었다. 수출상위 10개 제품 중 6개는
[표 2-71] 2017년 기준 주요 바이오제품 수출입 현황(단위: 백만 원, %)
|
주요 수출제품 |
주요 수입제품 |
||||||
|
순위 |
제품명 |
수출액 |
구성비 |
순위 |
제품명 |
수입액 |
구성비 |
|
1 |
사료첨가제 |
1,431,200 |
27.8 |
1 |
치료용항체 및 사이토카인제제 |
547,334 |
33.3 |
|
2 |
치료용항체 및 사이토카인제제 |
1,203,690 |
23.4 |
2 |
백신 |
364,041 |
22.1 |
|
3 |
바이오위탁생산・ 대행서비스 |
466,534 |
9.1 |
3 |
호르몬제 |
195,586 |
11.9 |
|
4 |
체외진단 |
439,075 |
8.5 |
4 |
혈액제제 |
181,346 |
11.0 |
|
5 |
식품첨가물 |
395,399 |
7.7 |
5 |
기타 바이오의약품 |
108,562 |
6.6 |
|
6 |
기타바이오의약품 |
207,252 |
4.0 |
6 |
다기능 및 기타 분석기기 |
49,940 |
3.0 |
|
7 |
백신 |
192,696 |
3.7 |
7 |
연구・실험용 효소 및 시약류 |
44,650 |
2.7 |
|
8 |
바이오소재의약품 |
145,835 |
2.8 |
8 |
체외진단 |
31,089 |
1.9 |
|
9 |
혈액제제 |
100,504 |
2.0 |
9 |
건강기능식품 |
22,129 |
1.3 |
|
10 |
바이오항생제 |
97,050 |
1.9 |
10 |
산업용 효소 및 시약류 |
16,975 |
1.0 |
바이오의약제품, 2개는 바이오식품이었으며, 바이오서비스와 바이오의료기기가 각각 1개로, 이들 10개 제품이 전체 수출액의 90.9%를 차지하였다.
2017년 기준 바이오산업의 수입규모는 1조 6,456억 원으로 조사되었다. 분야별로 보면 바이오의약산업이 1조 4,167억 원으로 전체 수입액의 대부분(86.1%)을 차지하였다. 수입을 보면 치료용 항체 및 사이토카인제제가 5,473억 원이 수입되어 전체 수입의 33.3%를 차지하였으며, 다음으로 백신 3,640억 원(22.1%), 호르몬제 1,956억 원(11.9%), 혈액제제 1,813억 원(11.0%) 순이었다. 수입상위 10개 제품 중 5개가 바이오의약제품, 2개는 바이오화학제품, 바이오식품, 바이오의료기기, 바이오장비 및 기기가 각각 1개로, 이들 10개 제품이 전체 수입액의 94.8%를 차지하고 있다.
바. 바이오헬스케어 기업 기술특례상장 현황
코스닥 시장에서는 2005년부터 기술성과 성장성을 보유한 벤처기업의 상장예비심사 시 일반기업과 차별화된 예비심사요건을 적용하는 기술성장기업 상장예비심사 특례를 시행하고 있다. 2019년 6월 현재까지 바이오분야에서는 기술특례를 통해 총 60개 기업이 상장되었다. 특히, 바이오분야 2018년 코스닥시장 기술특례 상장기업은 역대 최고치인 17개에 달했다.
2005년 제도 도입 이후 바이오기업 위주로 상장되고, 2014년 최초로 비(非)바이오기업이 상장에 성공한 이후 영화, IT, 로봇 등으로 업종이 다변화 되고 있으나 여전히 바이오기업 중심으로 상장되고 있다. 2019년 6월 28일 현재 코스닥 시가총액 상위 10위 안에 2개 바이오 기술특례상장기업이 포함되어 있다.
[표 2-72] 바이오분야 기술특례기업 상장년도 및 시총 현황(2019.6.)


제3장 분야별 연구개발 및 관련 산업 현황
![]()
|
구분 |
유전체 |
단백질체 |
세포체(줄기세포) |
|
개요 |
유전체 연구는 유전체 해독, 정보 분석 및 이를 활용하는 실용화 등을 포함 |
세포, 조직, 체액 등에 존재하는 모든 단백질의 총합인 단백질체에 대한 총체적인 연구로, 기초생물학 및 임상 진단과 신약개발 분야에서 강력한 도구로 사용 |
세포치료제 출시 급증 |
|
해외 동향 |
전 세계 여러 나라에서 10만 명 이상의 유전체를 분석하는 대규모 국가 유전체 프로젝트를 진행 중이며, 한편으로는 유전체 분야 산업과 시장이 연평균 10% 이상 빠르게 성장하여 여러 분야로 파급되고 있음 |
단백질체 분리, 분획, 정량 및 PTM 분석 기술, 질량분석기술, 바이오마커 발굴기술 등이 지속적인 개발 응용되고 있으며 시약 및 신약개발시장이 크게 성장하였고 아시아 지역의 연평균 성장률이 두드러짐 |
각국의 전략적 투자 및 육성시스템 운영을 통한 경쟁력 확보 방안 |
|
국내 현황 |
유전체를 포함하는 바이오 빅데이터를 3대 주력산업 으로 선포하고 투자를 확대하고 있으며, 규제 개혁 등을 통해 신산업을 창출하고자 노력하고 있음 |
다중오믹스 및 정밀의료 분야 일부에서 비영리 연구개발이 있으며, 단백질체 관련 바이오산업 규모는 미미한 실정 |
제도개선을 통한 신속한 임상진입 및 상용화 촉진 진행 중, 중소 벤처기업 중심에서 거대 제약사 등의 참여 확대 중 |
|
발전 전망/과제 |
유전체 빅데이터는 의학, 농학, 환경 등 다양한 분야에서 새로운 산업을 창출하며 혁신을 이루고자 노력 중 |
정밀의료를 위한 단백유전체학이 시장 확장에 큰 영향을 줄 것이며, 비변성조건 질량분석을 활용한 단백질복합체 분석기술 및 동적변화 분석기술, 그 외 메타단백체학(metaproteomics), 단세포 단백질체학의 기술 발전이 있을 것으로 전망하며 국내 투자 확대 필요 |
혁신적 제도개선 진행 중 |
|
대사체 |
구조생물 |
|
대사체학은 바이오마커(biomarker) 발굴분야에서 필수기술로 성장하고 있고 세계적으로 대사체학 관련 논문게재 급증
|
초저온 전자현미경과 4세대 가속기 XFEL를 활용한 혁신적인 구조생물학 연구 변화가 이루어지고 있음 |
|
미국, 유럽 등을 중심으로 임상대사체학, 미생물대사체학, 식물대사체학, 리피도믹스 등의 성장세 뚜렷. 타 오믹스와의 연계 연구가 본격적으로 시작
|
초저온 전자현미경 기술을 활용한 막단백질과 거대 복합체 단백질 구조 분석에 집중된 연구 진행 |
|
국내 학계와 연구계 등에서 대사체학 관련 많은 우수연구 진행 |
초저온 전자현미경 환경 미흡, 여전히 3세대 가속기 시설에 의존적으로 구조생물학 연구가 진행, 그렇지만 세계 3번째로 구축한 4세대가속기 XFEL 활용 연구 발전 기대 |
|
향후 타 오믹스와의 연계연구가 활발할 것으로 판단되며 단순히 생체표지의 발굴이 아닌 과정을 탐색하는 대사체학으로의 발전 예상됨
|
초저온 전자현미경 기술 활용 주요 신약 타깃인 막단백질 및 생명 유지에 필수적인 거대 단백질 복합체 구조생물학 연구에 집중될 전망 |
![]()
|
구분 |
뇌과학 |
노화과학 |
|
개요 |
뇌과학은 다학제 테마의 유기적 연결을 통한 융합연구의 핵심으로 기술의 혁신을 통해 아직 미개척지로 남아있는 인간의 뇌연구를 궁극적 목표로 함. 세계 주요 선진국들은 뇌연구를 미래유망 과학기술로 지목하고 국가차원의 뇌과학 프로젝트 착수 및 뇌신경과학 기술로 인해 발생될 뇌신경 윤리 대응 등 정책수립에 힘쓰고 있음. |
급속한 고령화는 한국 사회의 생존과 지속 가능한 발전을 위협하고 있으며 사회 전반에 걸친 문제가 될 것으로 전망함. 이에 궁극적인 방안은 도전적이고 혁신적인 국가차원의 정책 변화와 더불어 노화과학 R&D를 통한 건강한 노화를 추구하는 정책이 필요함. |
|
해외 동향 |
공학기술의 발달로 뇌공학분야가 눈부시게 발전 중이며, 진보된 뇌과학기술로 발생할 수 있는 법적・사회적ㆍ윤리적 문제 대응을 위해 뇌신경윤리에 대한 연구와 협력이 활발함 |
선진국가는 인구 고령화를 대비하여 국가차원의 전략적 대응 체계를 구축・운영하고 있으며, 전문연구기관을 설립하고 노화 R&D를 지속적으로 확대 지원하고 있음. 고령인구의 증가로 의료서비스 수요도 증가하고 항노화 바이오 기술 시장이 점차 확대되는 추세
|
|
국내 현황 |
1998년 제정된 ‘뇌연구촉진법’을 기반으로 10년마다 뇌연구촉진기본계획을 수립해 왔으며, 2018년 제3차 뇌연구촉진 기본 계획을 마련함으로써 정부차원에서의 새로운 뇌연구 지원 전략을 추진. 이에 관련 예산의 증가와 함께 연구개발 성과를 활용한 뇌관련 의약품 및 기기 등의 산업시장이 태동
|
노화 R&D에 대한 필요성이 지속적으로 대두되고 있으나, 실질적인 투자 규모가 작고 통합적・체계적인 중장기 전략이 부재한 상황임. 고령사회에 따른 산업지형이 바뀜에 따라 고령친화산업 육성 및 노화 R&D 투자와 전문인력 양성이 필요 |
|
발전 전망/ 과제 |
뇌연구는 인공지능 및 빅데이터를 중심으로 한 4차 산업혁명 시대 대응과 혁신적 미래과학의 기반기술으로서 새로운 성장동력과 일자리를 창출할 것으로 기대. 이에 활발한 국내외 네트워크를 통해 뇌과학 선진국의 대열에 합류해야 할 시점으로 보임
|
전 세계적인 인구 고령화로 실버경제와 고령친화산업 발전이 필수이며, 새로운 미래 성장동력이 될 것임. 국가차원의 통합적・ 체계적인 지원을 통해 노화연구와 고령친화 관련 기술의 경제우위를 구축해야 함. |
|
합성신약 |
바이오의약품 |
바이오장기 |
|
승인된 합성신약 개수 기록 경신 |
최근 바이오의약품 개발의 큰 진전으로 국내외 많은 회사들이 새분야에 대한 도전과 함께 투자를 유도 중임 |
장기이식 수요의 폭발적 증가로 바이오장기 시장이 급속도로 성장하고 있음. 바이오장기 중에서도 유전자편집기술의 발전으로 이종장기가 가장 빠른 시간 내에 현실화될 것으로 예상
|
|
승인약물 증가, M&A |
PD-1/PD-L1 항체치료제와 그 외 면역관문억제제, 바이오시밀러 (FDA 허가건수 총 23개 중 9개는 미국 내 발매중), 빅파마들의 CAR-T 개발 활발(노바티스 졸겐스마 비용은 212만 5000달러로 책정), RNAi 기반 치료제 Alnylam 파티시란 미FDA 승인(2018.8) |
최근 CISPR/Cas9 등 유전자편집기술의 발전으로 형질전환 돼지 생산기간이 획기적으로 단축. 또한 이종 장기 영장류 전임상 시험에서 우수한 성과들이 발표되고, 이종 장기이식 전문회사가 설립되는 등 제2의 이종이식 전성기 도래 |
|
베시포비르, 테고프라잔 |
항체치료제 및 그 외 면역관문억제제의 경우 제넥신, 이뮨온시아, 신라젠, 메드펙토, 파맵신 등의 연구개발이 활발. 바이오시밀러의 경우 FDA허가 품목 23개 중 7개는 셀트리온, 삼성바이오에피스를 통해 승인 |
국내 연구진은 영장류 전임상시험에서 임상시험 진입조건을 충족하는 결과를 발표하는 등 이종 장기이식에서 세계적 선도그룹으로 인정받고 있으며 2020년도에는 이종 각막 및 췌도 연구자임상 시험 실시 계획 |
|
표적단백질분해유도제, AI, |
합성신약 매출이 여전히 우세 하지만 바이오의약품도 지속 상승중. 전체 의약품 매출순위 10위권 내 바이오의약품 5개 가량 랭크될 것으로 예상되며 미래에는 다양한 종류의 혁신적 바이오의약품이 시장변화를 주도할 것 |
국내 바이오이종장기 이식분야 연구는 꾸준한 투자와 연구로 경쟁력을 갖추었으며 그간의 성과와 기반 시설의 지속적 유지・발전, 바이오장기 생산 규제와 가이드라인 제정 등을 통해 국내 이종장기기술의 산업화 가능성 기대 |
![]()
|
구분 |
진단 및 의료기기 |
감염병 대응 |
농림 |
|
개요 |
정밀의료는 유전체정보, 진료・임상정보, 생활습관정보 등 의료 빅데이터를 AI를 활용하여 통합 분석해 환자의 특성에 맞는 진료를 제공 |
교통의 발달과 국가 간 교류의 증가, 기후의 변화로 감염병의 유입 위험이 증가하고 있는 시점에 감염병 발생의 관리는 국가의 안보만이 아니라 국제적 안보와도 직결 |
농림축산식품부, 농진청, 산림청 등 3개 부청이 R&D 종합계획 및 중장기계획을 수립하여 체계적으로 투자 |
|
해외 동향 |
전 세계적인 고령화 추세에 따른 의료비 부담 증가, 만성중증질환 증가로 미국, 유럽 등은 정부차원의 정밀의료 중점지원정책 추진 |
신변종감염병 발생에 선제적 대응을 위해 우선순위 감염병(Disease X 등)을 선정하고 대응체계 확립 |
해외 선도국에서는 유전자 가위 기술 등 신기술이 적용된 작물에 대한 GMO 규제여부 발표 중 |
|
국내 현황 |
정부는 의료기기 연구개발 성과가 우수한 기업을 혁신형 의료기기 기업으로 인증하여 지원하고, 첨단기술 적용으로 안전성・유효성이 현저히 개선된 의료기기 등을 혁신의료기기로 지정 하여 허가・심사 등의 특례를 부여하는 등 제품화 촉진을 위한 ‘의료기기산업 육성 및 혁신의료기기 지원법(법률 제16405호, 2019.4.30 제정)’을 공표하여 오는 2020.5.1부터 시행 예정 |
감염병 발생 시 컨트롤 타워의 역량 강화를 위해 질병관리본부 중심으로 대응체제를 개편하고 원헬스 기반의 범부처적 연계를 위한 지속적인 노력을 기울임 |
2022년까지 농식품부 전체 예산의 10% 수준으로 R&D 투자 확대 |
|
발전 전망/ 과제 |
국가 차원의 정밀의료 육성・추진, NGS 기술 발전에 따른 유전체분석 비용 절감, AI기술 활용 빅데이터 분석기술의 발전이 정밀의료 시장성장 견인, 개인 유전체정보 활용 관련 규제 및 윤리적 문제, 표준화 미비 등은 해결해야 할 과제 |
4차 산업혁명 기술을 접목한 감염병 대응기술개발을 위한 다양한 시도가 이루어지고 있으며 치료제, 백신의 개발과 국가 방역체계가 연계될 수 있도록 역학, 감시, 방역분야에 대한 연구개발투자가 확대될 전망 |
대내외적인 변화에 대응한 연구개발 투자 확대로 농림산업의 경쟁력을 강화하고 부가가치 제고 |
|
축산 |
식품 |
|
가축의 경제형질을 개선하거나 추가하는 연구가 활발히 진행 |
식품 분야에서는 발효식품 및 건강기능식품을 중심으로 국내의 연구동향과 산업현황, 해외의 공공 부문 연구동향 및 산업현황을 서술함
|
|
유전자 변형 가축 개발 연구의 대부분은 중국에서 보고되었고, 개발 목적 또한 다양 |
각국 정부는 농업과 식품을 항상 연계 취급하며 식품의 안전, 영양, 건강을 중시함. 식품산업의 중심축은 아시아로 이동 중
|
|
매우 제한적으로 새로운 유전자 변형 가축 개발 |
식품 연구는 정부 지원이 대폭 축소되었음. 식품은 필수재라 수요는 안정적이나, 식품산업은 인구 및 경제 성장률 둔화에 따라 저성장 국면 지속 중
|
|
전 세계적으로 유전자 변형 가축의 규제에 관한 규정 제정에 따라 연구 방향이 결정 |
정부는 식품 분야 연구를 지속적으로 지원해야 하며, 향후 개인 맞춤형 식품의 연구개발 및 이와 관련된 가공・공정 기술의 발전이 예상
|
![]()
|
구분 |
환경 생명공학 |
해양 생명공학 |
|
개요 |
환경 생명공학기술은 생명공학기술을 이용하여 환경오염을 예방, 복원 및 정화하는 기술로서, 전 세계적으로 추구하고 있는 지속 가능한 발전의 핵심기술
|
탐사, 양식 및 배양, 생명공학 기술의 발전과 바이오경제 시대 도래로 해양 생명공학 발전 기대 |
|
해외 동향 |
이코지노믹스(생태유전체학)의 활용성이 강조되며, 해양 기름유출의 생물정화, 배가스 중 이산화탄소의 생물학적 저감, 식물-미생물 상호작용을 이용한 식물정화, 플라스틱의 생분해 등이 활발히 진행
|
세계 해양생명 공학은 미국, EU, 일본을 중심으로 의약품, 식품 및 화장품 분야가 주도 |
|
국내 현황 |
정부는 국민생활(사회)문제 중 생활 폐기물, 실내 공기오염, 수질 오염, 환경 호르몬, 산업폐기물, 미세먼지 등 6개를 우선 해결해야 할 환경문제로 선정하였으며, 바이오센서분야의 산업적 성장잠재력을 높이 평가 |
해양수산과학기술육성기본계획, 해양바이오 산업 육성전략 등을 기반으로 정부주도의 육성 |
|
발전 전망/ 과제 |
오믹스 자료, AI를 이용한 빅데이터 분석, 마이크로바이옴 등을 활용한 생물정화 기술개발이 유망하며, 난분해성 물질의 생분해를 위한 GMO 기술개발, GMO 사용에 대비한 환경 안전성 평가, 법・제도 마련 등이 필요 |
바이오경제 구현에서 해양 생명공학의 역할에 대한 기본계획 수립과 투자 필요 |
|
산업바이오 |
BT+ICT |
BT+NT |
|
탈(脫) 석유경제의 해법으로 바이오경제가 주목 받으며, 전 세계적으로 산업바이오에 대한 연구개발 확대 |
건강한 삶과 사회로의 지향을 목표로 추진하고 있는 정밀의료, 지능형 의료, 디지털 헬스케어 등을 중심으로 BT+ICT 주요 현황 및 이슈에 대해 살펴봄으로써 의료-ICT 융합산업 활성화를 위한 발전방향을 제시하고자 함 |
바이오나노 인터페이스 융합기술은 다양한 질환의 진단 및 치료효과 극대화를 위한 약물전달체계에 폭넓게 활용 |
|
바이오경제 성장을 목표로 산업바이오 분야에 대한 정책적, 산업적 노력 지속 |
우리나라를 비롯한 해외 주요국들은 정밀의료를 미래 핵심 성장산업의 주축으로 인식하고 R&D 투자 확대 및 선순환의 산업생태계 조성을 위해 적극적인 정책적 지원을 강화하고 있음 인공지능을 활용한 의료서비스 패러다임의 혁신적인 변화로 주요국들은 글로벌 시장선점을 위한 기술개발과 산업적 활용을 위한 정책적 지원을 강화하고 있으며 글로벌 IT 기업 및 스타트업을 중심으로 혁신적인 의료서비스를 개발하고 있음 |
바이오나노기술은 최근 새롭게 개발되는 유전자편집기술, 합성생물학 등의 신기술과 접목되어 새로운 진단 치료 플랫폼이 제시 |
|
산업바이오의 전 주기적 요소기술 부재 및 산업생태계 구축 미비로 인해 특정 분야에 의존도가 높은 상황 |
언제 어디서나 실시간 건강관리 제공을 위해 의료접근성을 높이는 바이오・의료-ICT 융합을 통한 R&D 및 산업활성화 정책을 강화함과 동시에 기업에서는 이용편리성 높은 웨어러블 기기 및 서비스를 개발하고 있음 |
분자진단 및 면역진단 국내 산업기반이 정착되어 가며, 나노소재를 활용한 진단 치료 신기술 개발이 활발 |
|
산업바이오 생태계 구축을 위한 육성 및 지원 정책 확대 필요 |
의료와 ICT의 융합은 의료산업의 디지털화(Digitalization)를 가속화하고 있으며 이를 토대로 국가의 핵심 성장산업으로 한 단계 도약시키기 위한 기술개발, 인력양성, 데이터 활용, 개인 정보보호 및 가치사슬 참여자간 협력 등을 중심으로 전략적 방향을 제시함 |
미래 유망 산업을 위한 바이오나노기술은 무독성, 친환경, 다기능, 무전력 등의 키워드 중심의 기술 개발이 주목 받을 것으로 예측 |
![]()
|
구분 |
생명연구자원 |
생명공학 인프라(장비.시설) |
|
개요 |
생명연구자원 분야의 국내외 정책동향과 국내 부처별 생명연구자원 및 정보 관리・통계, 연구개발 현황에 대한 개설 |
국내에는 정부지원을 토대로 기초-응용-개발-생산 연구 지원을 위해 단계별 지원 인프라를 구축・운영 중 |
|
해외 동향 |
최근 나고야의정서가 발효됨에 따라 세계 각국은 자국 이익 중심의 전략적인 생명연구자원 관리 강화 |
|
|
국내 현황 |
국내 각 부처별로 동물, 식물, 미생물, 생명정보 등 생명연구자원 분야별로 발굴, 보존, 관리의 강화 |
의약・산업・융합바이오 제품의 산업화 지원을 위한 인프라로는 국공립연구소와 더불어 29개 산업화지원센터, 20개 비임상 GLP 및 208개 임상 GLP가 대표적. 바이오 빅데이터를 위한 인프라로는 PHR(개인건강정보) 기반 개인맞춤형 건강관리시스템 구축, CDM(질병정보 활용 공통데이터모델)기반 정밀의료 데이터통합플랫폼 구축 등을 추진 중 |
|
발전 전망/ 과제 |
내년 8월 국내에서 나고야의정서가 시행됨에 따라 이에 대비한 국내 생명공학 연구 및 산업계의 준비 필요 |
국가 단위의 성과를 창출할 수 있도록 기 구축 지역 인프라 연계 및 통합 서비스체계 구축, 제조업 중심의 인프라에 바이오 빅데이터 등이 효율적으로 접목될 필요가 있음 |
제1절
![]()
기초생명과학
1. 유전체
가. 개요
유전체 연구는 생명체를 구성하고 있는 유전정보인 유전체 및 관련 정보를 분석하여 생명체를 이해하고 질병을 포함한 다양한 문제 해결에 그 정보를 활용하는 분야이다. 유전체 연구의 핵심기술은 1) NGS 장비를 이용한 유전체 해독 기술, 2) 유전체 빅데이터 분석 소프트웨어 및 알고리즘 개발 기술과 이를 활용한 정보 분석 및 데이터 관리 기술, 3) 유전체 정보 기반 정밀의료 개발 기술, 4) 유전체 정보 기반 유용 동식물 혹은 해양생물 유래 자원 확보와 같은 유전체 실용화 기술 등이 있다.
유전체 해독・분석 비용이 급격하게 감소하면서 인간, 동식물, 미생물 등 다양한 생물체에서 생산되는 유전체 빅데이터는 데이터마이닝, 인공지능 등 최신 IT 기술과 융합하여 개인 맞춤형 정밀의료 구현부터 새로운 생물소재 개발 및 환경문제 해결에 이르기까지 다양한 분야에서 인류의 문제를 해결하고 새로운 산업과 시장을 창출하는 역할을 하고 있다.
나. 해외 동향
(1) 기술 및 연구 동향
유전체 분석 기술이 발달하고 분석 비용이 급격하게 감소하면서 전 세계적으로 대규모 국가 유전체 프로젝트가 활발하게 진행되고 있다. 특히 지금까지의 유전체 프로젝트들이 주로 서구인 중심으로 진행되어 왔다면, 최근에는 국가 및 민족 간 유전적인 다양성의 중요성을 인식하면서 각 국가들이 전략적인 프로젝트로 유전체 프로젝트들을 진행하고 있다.
[표 3-1] 국가별 주요 유전체 연구 현황
|
국가 |
프로젝트/기관 |
주요 내용 |
|
미국 |
All of US program /NIH |
-100만 명 미국인 정밀의료 코호트 구축 -전장유전체, 생체시료, 환경정보, 의무기록 등 구축 -2019년 유전체 분석 기관으로 3곳 지정 |
|
영국 |
10만 명 게놈프로젝트 /지노믹스 잉글랜드 |
-암 및 희귀질환 환자 10만 명의 전장유전체 분석 완료 -50만 명 전장유전체 분석으로 프로젝트를 확대하여 진행 중 |
|
유럽 연합 |
Million European Genomes Alliance (MEGA) /European Alliance for Personalized Medicine (EAPM) |
-2022년까지 유럽연합 국민들 100만 명의 전장유전체, 전자의료 기록, 의료 영상 정보 등을 수집하고 분석 -EU Horizon 2020 및 Innovative Medicine Initiative 등 기관의 연구비 지원으로 수행 |
|
프랑스 |
정밀의료 2025 |
-암, 희귀질환, 당뇨병 등 환자 20만 명 이상의 전장유전체 분석 진행 |
|
핀란드 |
FinnGen 프로젝트 |
-핀란드 국민의 10%인 50만 명의 유전체 분석을 2023년까지 완성 -2019년 현재 15만 명 유전체 분석 완성 -다양한 질환을 포함하며 환자기록과의 통합 분석 진행 |
|
중국 |
10만 명 게놈프로젝트 |
-중국 내 다양한 지역 및 민족을 반영한 10만 명 게놈 분석 |
|
일본 |
질병극복을 위한 게놈의료 실현 프로젝트(MED) |
-난치성 아동 질환 등의 정밀의료 연구 수행 |
|
호주 |
Genomics Health Future Mission (GHFM) |
-2018년에 시작하였고 10년 동안 총 5억 달러를 투입하여 호주인 20만 명의 전장유전체 분석 -암, 희귀질환 및 아동질환 등의 유전체 분석 진행 |
|
사우디아라비아 |
Saudi Human Genome Program |
-2013년에 시작하였고 사우디 국민 10만 명의 유전체 분석 진행 -사우디 국민의 유전적 변이 및 질병 연관성 연구 |
|
에스토니아 |
Estonian Personalized Medicine Programme |
-에스토니아 국민 10만 명 이상의 유전체 분석 프로그램 |
|
두바이 |
Dubai Genomics |
-두바이 시에 거주하는 모든 시민의 유전체 분석 프로젝트 |
|
터키 |
Turkish Genome Project |
-1단계 3년 동안 터키인 10만 명의 전장유전체를 분석(2018∼2020) -2단계에는 2023년까지 100만 명의 유전체 분석(2021∼2023) -비만, 당뇨, 심혈관 질환, 신경계질환 등 복합 질환 연구 |
|
카타르 |
Qatar Genome |
-2015년에 1단계로 1만 명의 카타르인 전장유전체 분석으로 프로젝트 시작 -2단계에는 카타르 전체 인구의 10%, 3단계에는 대부분의 카타르인의 전장유전체 분석을 목표로 진행 중 |
|
홍콩 |
Hong Kong Genome Project |
-2만 명 홍콩인의 전장유전체 분석 프로젝트로 암 및 희귀질환을 포함한 여러 질환 연구 -2019년에 시작하여 6년 동안 진행하며 홍콩정부 소유 회사인 Hong Kong Genome Institute에서 진행 |
최근의 유전체 분야에서 중요한 분야로 부각되는 연구는 단일세포 분석 기반 인간세포지도 작성(Human Cell Atlas) 연구이다. 인간세포지도 컨소시엄은 인간의 신체를 이루고 있는 34조 개 이상 세포의 분자적 특성 및 공간적 특성을 규명하는 것을 목표로 출발한 프로젝트로 2019년 현재 전 세계 1,500명 이상의 연구자들이 참여하는 대규모 협업 프로젝트로 성장하면서 빠르게 발전하고 있다.
(2) 시장 및 산업 동향
유전체 분석 및 정밀의료 시장은 연평균 10% 이상 빠르게 성장하는 시장으로 분자진단, 동반진단, 디지털 헬스케어 등 여러 관련 분야의 성장도 견인하고 있다.
유전체 시장 중 핵심 분야인 NGS 장비 시장의 경우 지난 10년 이상 Illumina가 독점적인 지위를 차지하였다. 중국의 BGI가 미국의 Complete Genomics를 인수한 후 그 핵심 기술을 바탕으로 개발한 MGI 장비들이 Illumina의 장비들과 가격 및 성능이 비슷한 수준이어서 새로운 경쟁사로 떠오르고 있다. 또 나노포어(nanopore) 기술을 바탕으로 한 Oxford Nanopore의 장비들도 여러 가지 장점을 바탕으로 시장에서 영역을 넓혀가고 있다.
한편, 단일세포 분석 기술의 발전 속에서 droplet(액적) 기술을 바탕으로 한 10X Genomics의 장비 및 실험 기술이 급속도로 보급되면서 단일세포 분야 시장의 주 회사로 성장하고 있다.
[표 3-2] 해외 유전체 주요 기업 현황
|
회사명 |
년 매출액 |
주요 내용 |
|
|
Illumina |
$3.33 billion |
-기존의 HiSeq 및 NextSeq 시리즈에 이어 NovaSeq 등 최신 유전체 분석 장비 개발 -유전체 분석 기반 진단 시장 등 다양한 영역으로 사업을 확대 중 -새로운 경쟁사인 BGI사와 특허 분쟁을 제기하며 경쟁사 진입을 차단하고자 함(미국, 덴마크, 독일, 스위스, 터키 등 여러 국가에서 소송 진행 중) |
|
|
Thermo Fisher Scientific |
$418.4 million |
-Ion torrent 기반의 NGS 장비 개발 및 판매 -다양한 NGS 라이브러리, 시약 및 소프트웨어 개발 및 판매 |
|
|
BGI Genomics |
$366.3 million |
-미국의 Complete Genomics 회사를 인수한 후 자체 NGS 장비들을 개발하여 2018년부터 판매 시작 -최고 사양 장비인 MGISEQ-T7 장비의 경우 하루에 6TB (60명의 인간 게놈) 정보를 한 명 당 600달러의 비용으로 생산 가능 -NGS 관련 특허 문제로 Illumina사와 여러 국가에서 특허 소송 진행 중 |
|
|
Agilent Technologies |
$250 million |
-NGS 기반 라이브러리 제작 시약, 기기 및 분석 소프트웨어 개발 및 판매 |
|
|
10x Genomics |
$146 million |
-단일세포 분석 분야에서 새롭게 떠오른 회사로 단일세포 전사체, 후성유전체, 단백체 등 다양한 단일세포 분석을 위한 장비, 시약 및 소프트웨어의 개발 및 판매 |
|
|
QIAGEN |
$140 million |
-NGS 기반 라이브러리 제작 시약, 기기 및 분석 소프트웨어 개발 및 판매 |
|
|
GENEWIZ (Brooks Automation) |
$121 million |
-NGS 서비스, 유전자 합성, 올리고 합성, 임상유전체 분석 서비스 등 다양한 유전체 분석 서비스 제공 |
|
|
Macrogen |
$97.1 million |
-유전체 분석 서비스로 시작하여 DTC 및 임상유전체 분석으로 사업 영역을 확대 |
|
|
Pacific Biosciences of California(PacBio) |
$78.6 million |
-3세대 염기서열 분석 기술 기반의 장비 개발 및 판매 -2019년 Illumina사가 인수를 진행하고 있음 |
|
|
Oxford Nanopore Technologies |
$18.1 million |
-나노포어 기술 기반의 3세대 염기서열 분석기술 기반 장비 개발: MinION, GridON, PromethION 등 판매 -기존의 NGS와 달리 1 Mb 길이 정도까지 길게 sequencing 가능 |
|
출처: GEN(Genetic Engineering & Biotechnology News), Top 10 Sequencing Companies, 2019.4.8.
다. 국내 현황
(1) 기술 및 연구 동향
2014년에서 시작한 ‘포스트게놈 다부처유전체사업’(2014∼2022)이 활발하게 수행되고 있으며, 정밀의료사업으로 ‘정밀의료 기반 암 진단 및 치료법 개발(K-MASTER) 사업단’과 ‘정밀의료 병원정보시스템(P-HIS) 개발 사업단’이 선정되어 수행되고 있다. 또, 다중오믹스 기반 정밀의료 기술개발 사업이 추진되어 대장암(2017선정, 40억/년), 폐암(2019선정, 20억/년) 등 한국인 호발암(好發癌)을 연구하는 정밀의료사업단이 선정되어 수행되고 있다. 산업부는 유전체분석 기반 산업 경쟁력 강화를 위해 유전체분석시스템구축 사업(2019∼2022년, 총 140억 원)을 추진하고 있다. 또 과기정통부, 복지부, 산업부는 2020년부터 10년 동안 한국인 100만 명의 유전체를 분석하는 K-DNA 프로젝트를 추진하고 있다.
한편, 최근 그 중요성이 부각되고 있는 단일세포 기반 오믹스 연구의 중요성을 반영한 단일세포 오믹스 기술개발 사업이 추진되어 2019년 3개의 과제를 선정하였고 향후에도 지속적으로 투자를 확대하고 있다.
[표 3-3] 국내 주요 유전체 연구 현황
|
프로젝트명 |
주요 내용 |
|
포스트 게놈 다부처 유전체 사업 |
-인간・농생명자원・산림자원・수산생명자원 유전체 연구를 통한 성과 창출 및 유전체 기반 산업 발전 |
|
정밀의료 사업 |
-정밀의료 기반의 새로운 암 치료법 개발 및 ICT 기술 활용/클라우드 기반 병원정보시스템 구축 |
|
K-DNA 프로젝트 |
-한국인 100만 명의 유전체 및 임상정보 통합 바이오 빅데이터 구축 및 정밀의료 구현 -2020년 시범 사업으로 시작하고 향후 10년간 추진 |
|
다중오믹스 기반 정밀의료 기술 개발사업 |
-유전체, 단백체, 대사체 등 다중오믹스 분석을 통한 질환 바이오마커 개발 및 치료 기술 개발 사업 -대장암, 폐암 등 한국인 호발 질환에 대한 정밀의료 기술 개발 진행 |
|
단일세포 오믹스 사업 |
-단일세포 다중 오믹스 분석 기반 질환 바이오마커 개발 -인간세포지도 작성 |
|
유전체분석시스템구축사업 |
-유전체 정보 생산 및 분석 기반 구축 -대규모 유전체 분석을 통한 질환 바이오마커 개발 및 사업화 지원 |
|
한국인 참조 유전체 정보구축 사업 |
-한국인 정상인 1,700명의 전장유전체 분석을 통한 한국인 참조유전체 정보 구축 |
(2) 시장 및 산업 동향
정부는 2019년 5월 ‘바이오헬스 산업 혁신전략’을 발표하면서 유전체 기반 바이오 빅데이터를 차세대 3대 주력산업 중 하나로 선정하고 산업육성을 위한 여러 전략을 발표하였다. 우선 2020년부터 향후 10년 동안 한국인 100만 명의 유전체 빅데이터 플랫폼을 구축하고, 임상 진료 데이터를 활용할 수 있는 ‘데이터 중심병원’을 지정할 계획이다. 또한 바이오헬스 산업의 발전을 가로막는 여러 규제들을 개선하기 위한 제도도 도입하여 추진하고 있다.
유전체 분야의 핵심 사업 분야 중 하나인 개인 의뢰 유전자 검사(DTC: direct-to-consumer) 서비스 산업을 확대하기 위해 DTC 유전자검사 인증제 시범 사업을 추진하면서 기업들을 선정하여 50여 개 항목에 대한 유전자 검사 시범 사업을 추진하고 있다. 또한 산업통상자원부의 규제샌드박스(신제품이나 새로운 서비스를 출시할 때 일정기간 기존 규제를 면제하거나 유예하는 제도) 사업을 통해 생명윤리법에서 금지하는 DTC 서비스의 각종 질병 대상 서비스도 개발 및 검증하고 있다.
[표 3-4] 국내 DTC 서비스 현황
|
회사명 |
브랜드 명 |
주요 내용 |
|
마크로젠 |
마이지놈스토리 블루 |
주요 암 15종, 일반질환 23종 등을 포함하는 질병예측 유전자 검사 서비스 |
|
마이지놈스토리 그린 |
다이어트 관련 17개 항목, 영양 관련 16개 항목을 포함하는 건강 생활습관 관련 유전자 검사 서비스 |
|
|
마이지놈스토리 골드 |
질병과 건강 생활습관을 포함하는 종합 유전자 검사 서비스 |
|
|
테라젠이텍스 |
헬로진 |
암, 일반질환 등 질병 관련 유전자 검사 서비스 |
|
진스타일 |
체질량 지수, 혈압, 혈당 등 유전적 질병 예방 및 건강 관련 유전자 검사 서비스 |
|
|
웰니스 뷰티 |
유전자 맞춤형 피부 관련 검사 서비스 |
|
|
메디젠휴먼케어 |
M-check |
유전적 질병 위험도 분석 서비스 |
|
Melthy |
운동, 피부미용, 건강관리 등 생활건강 유전체 서비스 |
|
|
DNA링크 |
DNAGPS |
생활 습관, 환경 관련 질환 및 약물감수성 관련 유전자 분석 서비스 |
|
랩지노믹스 |
WithGENE |
건강, 모발, 피부 관련 44개 유전자 검사 서비스 |
유전성 환자 진단 및 암환자 치료를 위한 NGS 검사는 2017년 건강보험 항목에 포함된 이래 많은 의료기관에 도입되어 널리 사용되고 있는데 2019년 3월 기준으로 57개 기관이 승인되어 NGS 검사 서비스를 제공하고 있다. 일부 병원들은 병원 정보시스템에 임상 정보와 유전체 정보를 통합하여 분석할 수 있는 시스템들을 개발하며 정밀의료 구현을 위한 플랫폼으로 발전시키고 있다.
라. 발전 과제 및 전망
21세기는 바이오의 시대로 바이오와 그 관련 분야는 빠르게 성장하면서 새로운 시장을 창출하고 있으며 인류가 직면한 여러 가지 문제를 해결하는 주요 분야로 떠오르고 있다. 그 중에서도 NGS를 이용한 유전체 분석은 생명공학의 모든 분야에서 가장 기초적인 도구로써 널리 활용되고 있으며, 정밀의료를 비롯하여 농수산학 및 환경생물학 등 다양한 분야에서 적용되고 있다.
세계의 많은 나라들은 자국민 유전체 정보의 중요성을 깨닫고는 스스로 자국민의 유전체 정보를 확보하고 각 나라에 맞는 정밀의료를 구현하기 위한 국가적인 프로젝트들을 활발하게 진행하고 있다. 유전체 정보와 더불어 최신 IT 기술을 접목한 의료 정보, 생활 습관 정보 등 다양한 정보를 체계적으로 수집하고 통합 분석하여 유전체, 환경 및 생활 습관을 아우르는 데이터 기반 정밀의료 체계를 구축하기 위해 치열한 경쟁을 하고 있다. 이러한 환경에서 우리나라도 유전체 기반 정밀의료 체계 구축 및 국가 경쟁력 확보를 위해 유전체 분야에 대한 투자를 지속적으로 늘리면서 해당 분야를 발전시키는 것이 중요하다.
한편으로 개인 유전체 정보를 포함한 민감한 개인정보의 보호, 의료 현장에서의 유전자 분석의 유용성 여부 등 윤리적・법적・사회적 이슈들도 많이 존재하고 있으며, 관련 규제들도 엄격하게 만들어지고 있다. 데이터 기반의 새로운 산업 창출이라는 긍정적인 측면과 개인정보보호 및 유전자 검사의 유효성과 안전성을 확보하기 위한 규제 등 서로 상충되는 면을 고려하여 올바른 방향을 찾기 위해서는 정부와 산・학・연・병 등 관련 기관 그리고 국민들이 함께 논의하면서 합의점을 찾는 것이 중요할 것이다.
2. 단백질체
가. 개요
(1) 단백질체학이란?
단백질체학(proteomics)은 세포, 조직, 체액 등에 존재하는 모든 단백질체에 대한 총체적인 연구로서 단백질 동정 및 발현량 측정뿐 아니라 단백질의 생체・세포 내 위치와 변화, 상호작용, 기능과 구조 분석을 포함하며 생명활동과 직결되는 정보를 제공하기 때문에 임상 진단과 신약개발 분야에서 강력한 학문적 근거로 사용되고 있다.
(2) 단백질체학의 핵심기술
단백질체학 기술은 크게 단백질 분석기술, 단백질기능 규명기술, 단백질체 정보기술로 나뉘며, 핵심기술인 단백질 분석기술은 단백체 분리분획기술과 질량분석을 이용한 단백질 동정 및 정량기술이 주를 이룬다. 단백질기능 규명기술은 단백질 상호작용 및 경로 분석, 단백질구조 규명 및 디자인, 세포 및 개체 기반 단백질 기능 검증기술 등으로 구분되며, 단백질체 정보기술은 단백질체학 전 과정에 있어 자료 분석 및 결과 해석에 기반이 된다.
나. 해외 동향
(1) 기술개발 동향
(가) 분리분획기술
복잡한 단백질체 시료를 폭넓게 분석하기 위해 단백질과 펩티드 수준의 다양한 분획법이 사용되고 있다. 단백질체학의 태동에 큰 역할을 한 이차원 전기영동(2DE)은 단백질 수준에서 개별 단백질로 분리하는 방법으로 말디토프(MALDI-TOF: 항체, 생체조직에서부터 전자소재까지 다양한 종류의 시료를 분석할 수 있는 질량분석기) 질량분석기와 어울려 폭넓게 이용되었지만, 낮은 분석효율 및 재현성으로 사용빈도가 점점 낮아지고 있다.
이에 비해 펩티드 수준에서 주로 이용되는 액체크로마토그래피(LC) 기반의 분리분획 기술들이 활발히 개발되어, 역상액체크로마토그래피(RPLC) 기술은 단백질체 연구의 표준이 되었다. 또한 분해능과 검출민감도를 높여 동일한 시료에서 더 많은 펩티드를 분석하기 위해 고정상 충진물 소형화, 컬럼 길이 증가, 컬럼 내경 소형화가 필요하게 되었고, 이를 뒷받침하기 위해 초고압액체크로마토그래피(UHPLC) 기술이 개발되었다.
한편 RPLC의 일차원 분해능을 극복하기 위해 RPLC와 분리직교성을 갖는 양이온교환 크로마토그래피(SCX), 음이온교환 크로마토그래피(SAX, WAX), 친수성 상호작용 크로마토그래피(HILIC), high-pH RPLC 등과 연계한 다차원크로마토그래피(MDLC) 기술을 통해 단백질체의 분석범위가 더욱 확장되고 있다. 이러한 다차원크로마토그래피는 오프라인(offline) 방식으로 연결하여 사용하기 시작하다가 시료의 손실을 최소화하고 편리성을 증대하기 위해 온라인(online) 방식의 연결방법이 개발되었다. 다차원단백질식별기술(MudPIT)은 SCX와 RPLC가 펩티드를 전혀 다른 성질에 따라 분리하는 원리를 활용하여 단일 컬럼 내에서 직접 연결하는 방법이며, high-pH RPLC와 low-pH RPLC를 온라인(online)으로 연결하기 위해서는 복잡한 크로마토그래피 밸브시스템을 활용한다.
단백질 수준에서 복잡성을 낮추는 분획 방법으로 일반적인 폴리아크릴아마이드 겔 전기영동(SDS-PAGE)와 겔 내 소화(in-gel digestion)를 결합한 GeLC 방법이 오래전부터 개발되어 활용되고 있으며, 그 외에도 off-gel electrophoresis, PF2D, size-exclusion chromatography가 이용되지만 활용도는 GeLC에 비해 그리 높지 않다. SDS-PAGE의 원리를 이용하면서 분획된 단백질을 용액상태로 수득하는 GELFREE 분획법이 개발되어 top-down proteomics의 coverage를 높이는데 성공적으로 적용되고 있다.
(나) 질량분석기술
질량분석은 단백질・펩티드의 이온화(ion source), 질량-전하비(m/z)에 따른 이온의 분리(mass analyzer), 특정 질량 값에 해당하는 이온의 선택(ion optics), 기체상태에서 이온 파편화(fragmentation)를 복합적으로 활용하기 때문에 각 부문의 작동방식에 따라 실로 다양한 질량분석 기기가 개발되었다. 기존 삼중-사중극자(Triple Quad), 사중극자-TOF 결합(QTOF)을 필두로 하여 이온트랩과 사중극자(Q-TRAP), 이온트랩과 FT-ICR MS의 결합(LTQ-FT)에 이어, 이온트랩-오비트랩(LTQ-Orbitrap), 사중극자-오비트랩(Q-Exactive), 사중극자-오비트랩-이온트랩(Fusion Orbitrap) 등 질량 분석기의 성능을 향상시키기 위한 일반적인 전략으로 하이브리드 기기를 지속적으로 개발하였다.
이처럼 질량 분석기의 발전은 다양했지만 고해상도 및 고정확도 질량분석기를 도입하려는 뚜렷한 흐름에 따라 오빗랩 Orbitrap과 TOF가 양대 산맥이 되어 꾸준히 개선되고 널리 활용되고 있다. 최근의 하이브리드 질량분석기 Orbitrap Fusion Lumos Tribrid는 사중극자, ion routing multipole, 선형이온트랩, 오비트랩 등 이온 분리・저장 장치를 5개나 포함하고 있어서 민감도와 분석속도가 획기적으로 향상되었다.
최근의 두드러진 특징의 하나는 이온 이동도 분광계(ion mobility spectrometer) 장치를 질량분석기에 추가하는 것이다. 고압가스와 전기전압을 이용해 m/z 이외의 특징으로 이온을 분리하므로 질량 분석기 앞에 결합하여 활용된다. 오비트랩에 연계한 기술이 개발되었지만, 주로 TOF와 연계되어 사용된다. 더 나아가 trapped ion mobility spectrometer(TIMS)는 이온을 포집하는 기능을 더해 더 향상된 분해능을 제공한다. 그리하여 펩타이드 이온을
대량 선택적으로 방출하는 TIMS/PASEF(parallel accumulation serial fragmentation), 특정 m/z의 이온만 장치의 출구로 통과시키는 FAIMS(field asymmetric IMS), 모서리 주변에서 이온을 돌려서 매우 긴 경로로 이온을 분리하는 SLIMs(structures for lossless ion manipula- tions) 등이 개발되었다.
middle-down 혹은 top-down proteomics에서는 bottom-up 펩티드보다 훨씬 큰 폴리펩티드・단백질의 아미드 결합을 끊어내기 위해 더 강력한 절편화 방법이 필요하다. 전자 전달 해리법(ETD)과 자외선 광분해법(UVPD)의 개발은 top-down 단백질체 연구에 획기적으로 기여하였다. 진보된 컴퓨팅 알고리즘을 활용한 데이터 분석 기술의 발달로 DIA(data independent analysis)나 HRM(hyper reaction monitoring)과 같은 질량분석기술이 활용되고 있고 DDA(data dependent analysis)나 MRM(multiple reaction monitoring)과 같은 기술도 특정한 표지법 없이도 상대정량 분석에 있어 신뢰도 높은 결과를 얻을 수 있게 되었다.
DIA 기술은 Q-TOF와 만나서 m/z 전 구간을 구획하여 복합적인 스펙트럼을 얻어 분석하는 SWATH를 개발할 수 있게 하였으며, 이온 이동도 기술과 결합하여 DIA-TIMS를 가능케 함으로써 단백질체 분석범위를 획기적으로 증가시켰다. 사중극자-오비트랩 질량분석기의 등장으로 PRM(parallel reaction monitoring) 기술이 개발돼 단백질체 프로파일링과 타깃 단백질의 정량분석이 동일 기기에서 가능해졌다.
한편, 질량분석 기반의 이미징 기술인 IMS(imaging mass spectrometry)이 개발되어 in situ에서 단백질・펩티드의 공간 분포를 탐색하는 접근법으로 활용된다. 다른 생화학 영상 기술과 달리, IMS는 잠재적 표적 종에 대한 선험적 지식 없이 비표적으로 분석한다는 장점이 있다. MALDI 기반 IMS 외에도, ToF-SIMSimaging, DESI-IMS 등이 개발되었다. 금속을 측정하던 ICP MS기술과 세포계산(cytometry) 기법을 결합한 mass cytometry(cyTOF)는 세포간의 생물질 콘텐츠의 변이를 규명할 수 있어서 외과의(FACS: Fluorescence activated cell sorter)를 대체하는 기술로 각광받고 있다. 질량분석기술의 민감도 향상, 멀티플렉싱을 통한 동일펩티드 이온증가, carrier를 이용하는 신호증폭, 시료처리의 간편화 전략을 이용해 single cell proteomics를 위한 기초연구도 활발히 진행되고 있다.
(다) Informatics 기술
질량분석에서 얻어진 방대한 데이터로부터 펩티드의 서열, 정량, 단백질 번역 후 변형(PTM: post-translational modification) 정보를 해석하고, 생물학적 의미를 추출하는 정보학 기술은 미국의 Scripps, ISB와 PNNL 그리고 독일 MPI 등의 유수 연구기관을 중심으로 활발하게 개발되고 있다. 이들 기관에서는 분석의 자동화와 생산된 질량스펙트럼의 해석을 위한 소프트웨어(TPP, MSGF+, Skyline, MaxQuant, ProLuCID 등) 환경을 구축하였다. 또한 펩티드 서열로부터 단백질을 동정하고 정량적으로 해석하는 다양한 프로그램의 개발과 단백질의 PTM 분석을 위한 알고리즘(MODi, MSFragger, PeaksPTM 등)의 개발도 활발히 진행되고 있다. 스펙트럼을 해석할 때, 단백질 서열 DB를 사용하지 않고, 기존에 얻어진 스페트럼 라이브러리를 활용하는 알고리즘도 오래전부터 꾸준히 개발되었다. TPP 파이프라인의 SpectraST, GPM 프로젝트로 개발된 X1Hunter, 미표준원의 MSPepSearch 등이 대표적이다. 그 외에도 단백질의 구조와 관련된 정보를 유추할 수 있게 하는 HDX-MS나 crosslinking에 의한 분석 등 다양한 질량분석 기반의 분석기술이 개발되면서 이를 해석할 수 있는 소프트웨어도 개발되고 있다.
최근에는 단백질체와 유전체 연구를 병행하여 종합적으로 해석하기 위한 단백유전체(proteogenomics) 연구가 활성화되면서, 질량분석을 통해 확인하고자 하는 단백질체를 DB 검색을 통해 동정 가능하도록 유전체 DB를 표현하고 구축하는 방법에 대한 연구가 진행되고 있다. 유전자 서열분석으로 얻어진 유전체 정보에 기반하여 질량분석 데이터를 해석하며, 서열 간의 중복을 최소화하기 위해 non-synonymous SNP나 alternative splice variant를 exon graph, splice graph 등으로 표현하여 해석하기도 한다. 또한 CPTAC과 같은 대규모 과제의 연구결과로 생산된 단백질체 데이터의 축적에 따라 PRIDE와 같은 데이터 저장소가 활성화되고, 대규모의 데이터분석이 가능해졌다.
(라) 단백질체 정량기술
초기 이차원전기영동에 기반을 둔 정량기술은 거의 사라져가고, LC와 질량분석기만 사용하여 정량하는 추세로, 안정 동위원소를 표지하는 방식(stable isotope labeling)과 비표지방식이 사용된다. 시료간의 상대적 양을 비교하는 상대정량기술에는ICAT, iTRAQ, SILAC, IDBEST, TMT 등과 같은 표지식 방법이 있으며, 단백질체 분석 적합성을 크게 개선함으로써 그 적용 사례가 증가하고 있다. TMT의 경우에는 최대 11개의 서로 다른 시료 분석이 가능한 11-plex TMT와, cysteine에 표지되어 산화 환원 반응에 주요한 단백질을 정량할 수 있는 iodo6plex TMT가 개발되어 적용되고 있다. 비표지 상대정량법은 펩티드들의 상이한 이온화 효율, 존재량과 peak 세기 간의 비선형 관계, 데이터 처리 부분에서 여러 가지 난제를 안고 있으나, spectral counting을 이용한 emPAI, NASF 등과 extracted ion chromatogram 기반의 MaxLFQ, iBAQ 등의 알고리즘이 개발되어 문제점을 개선해 다양한 정량분석에 활용되고 있다. 또한 재현성이 떨어지고 분석시간이 긴 MDLC 대신 한번의 RPLC로 최대한의 단백질체를 얻을 수 있는 50cm 이상의 칼럼이 활발히 적용되고 있다.
절대정량기술에는 SISCAPA, QCAT proteotypic peptide, mTRAQ 기술 등이 사용되고 있으며, SIS(stable isotope standard)를 사용한 삼중-사중극자 기반 MRM 기술 이용이 크게 증가하고 있다. 최근 MRM에 비해 transition 선정 소요 시간이 짧은 PRM과 SWATH 방법이 개발되어 적용되고 있다. 이에 맞춰 Skyline, Spectronaut, DIA-Umpire 같은 분석 소프트웨어가 개발되었다.
(마) PTM(Post-translational modification) 분석 기술
질량분석기를 이용한 PTM 분석에서의 낮은 stoichiometry 문제를 해결하기 위해, 각 PTM이 지닌 특이적인 물리화학적 성질을 이용하여 특정 PTM 단백질 혹은 펩티드를 농축하는 기술이 활발하게 개발되어 정착되고 있다. 인산화 펩티드 농축기술로는 IMAC, TiO2를 이용한 유연분리 기술이 있으며, SCX 또는 SAX 등과 복합하여 효율을 증가시킬 수 있다. 항체를 이용하여 phosphotyrosine을 갖는 단백질/펩티드를 농축하는 기술도 개발되었다. 당쇄화는 periodate 산화 후 hydrazide resin을 이용하는 화학적 농축법과 lectin을 이용한 affinity 기반 농축법이 활용되고 있으며 membrane filter와 lectin affinity 분리를 결합한 FACE 기법도 등장하였다. 라이신 잔기에 acetylation된 acetylome이나 ubiquitytlation된 ubiquitylome은 트립신을 이용하여 펩티드로 절편화한 후 각각에 맞는 항체를 이용하여 농축할 수 있게 되었다.
단백질의 N-말단 상태를 분석하기 위한 N-terminomics기술이 개발되어 N-terminal PTM과 alternative translational initiation site를 맵핑하거나, degradome을 관찰하는데 활용되고 있다. 대표적으로 COFRADIC, TAILS, Nrich 등이 있다. 하나의 단백질에 나타나는 복잡한 PTM의 조합을 규명하는데 top-down proteomics가 활용되고 있다. 질량분석 결과에서 PTM 정보를 해석하는 방법으로 일반적인 DB 서치 프로그램을 사용할 수 있지만, PTM의 조합이 무궁무진함에 따라 MODplus와 MSfragger같이 unrestrictive modification 알고리즘이나, 두 펩티드가 연결되어 있는 cross-link를 표적하여 발굴하는 알고리즘도 개발되었다.
(바) 단백질체 동적변화 분석 기술
단백질은 시공간적으로 변하고 복합체를 형성한다. 단백질 복합체 연구는 APMS(affinity pull-down mass spectrometry)가 가장 기본적이고 널리 활용되는 분석방법이다. 개별 단백질을 항체를 이용해 풀다운(pull-downs)하면 복합체를 형성하는 다른 단백질도 따라 나와 복합체를 분석할 수 있다. 약하게 결합하여 복합체 얻기가 이려운 경우에는 cross- linking을 유도하여 분석한다. AP-MS는 한 종류의 복합체 연구에 적당하나 대규모 연구나 동적변화 연구에는 실용적이지 않다. 반면에, 질량분석 자체 기술의 발전으로 막단백질이나 단백질 복합체 분석이 훨씬 용이해졌다. surface-induced dissociation을 이용해 단백질 복합체에서 꺼풀을 벗기듯이 요소단백질을 분리할 수 있으며, top-down proteomics나 MS3 기술을 원용하고 UVPD와 HCD 파편화 방법을 결합하여 복합체 내 단백질의 proteoform을 결정할 수 있게 되었다.
protein correlation profiling(PCP) 방법은 비변성 조건에서 단백질복합체가 서로 다른 크로마토그래피 조건에서 단백질이 동시에 용출된다면 전제하에 확률적으로 계산하는 방식이다. 이 전략은 질병이나 약물 치료와 같이 시스템에 교란이 있을 때 단백질 복합체의 역동성을 신속하게 측정할 수 있는 수단을 제공하며 대규모 연구에 효과적이다. AP-MS의 변형법으로 APEX, BioID 방법이 개발되어 spacial proteomics로 자리 잡았다. 상호 작용하는 단백질간의 높은 친화성을 요구하지 않고 주변에 있는 단백질을 동정하는 방법이다. APEX는 ascorbate peroxidase라는 효소를 활용해 히드록실 라디칼로 비오틴을 주변 단백질을 표지하며, BioID은 biotin ligase 효소 BirA를 사용하여 주변 단백질에 비오틴을 표지한다. 비오틴이 붙은 단백질을 동정하여 소위 ‘공간적 복합체’를 규명한다.
단백질체의 생성과 분해에 따른 동적 정량변화를 보기 위해 pulsed SILAC를 활용하게 되었다. pulse-chase처럼 특정 시간동안만 stable isotope labeling을 하는 것이다. pulsed SILAC과 달리 일정한 시간동안 새로 합성된 단백질만 농축하는 BONCAT 기술도 등장하였다. 세포성장 시 메티오닌 대신 미국심장협회(AHA: American Heart Association)를 표지해 생물직교화학(bioorthogonal chemistry)으로 비오틴을 붙여 친화력 풀다운 할 수 있는 것이다. 최근에는 실락(SILAC)1)과 BONCAT2) 방법을 결합한 새로운 기법으로 HILAC 방법이 개발되어 농축과 정량을 동시에 수행하여 효율적인 분석이 가능해졌다.
(사) 바이오마커(bio-marker) 연구
질병의 조기진단, 예후, 약물치료에 대한 반응, 신약 후보물질에 대한 평가 등에 활용되는 오믹스 기반 바이오마커 중 단백질 마커는 표현형 바이오마커로서 생리 상태를 직접 반영하며, 체액에서 쉽게 분석이 가능한 이점이 있다. 초창기 미국 국립암연구소(NCI: National Cancer Institute)에서는 조기발견연구 네트워크(EDRN)을 조직하여 조기진단 바이오마커 연구를 시작하였다. 최근 유전체와 단백체 데이터를 통합하는 단백유전체 기술 기반의 바이오마커 개발 방법론이 본격적으로 태동되어 NCI의 Clinical Proteomic Tumor Analysis Consortium(CPTAC)은 TCGA 유전체와 단백질체 정보를 통합하는 단백유전체 이니셔티브 프로그램을 진행하였다.
2016년에 론칭된 미국의 암 문샷(Cancer Moonshot) 프로그램에서는 암 치료에 대한 보다 많은 치료제 및 기술 스펙트럼을 제공하기 위한 프로그램을 구성하고 있다. 그 중심에 단백질체학 기술이 있으며, 미국을 포함한 10개국이 참여하는 International Proteogenome Consortium(ICPC)은 CPTAC의 단백유전체 바이오마커 발굴 기술을 기반으로 종양의 단백질 유전체학 복잡성(proteogenomic complexity)에 대한 전반적인 연구협력, 종양 치료에 대한 반응연구 협력, NCI의 Proteogenomic Translational Research Centers 기술지원, 혁신적인 데이터 분석법을 개발하고 단백유전체 정보를 공유하며, 필요한 경우 분석에 들어가는 자원도 공유하려고 한다.
또한 2017년 2월에 시작한 CPTAC 중심의 Applied Proteogenomics OrganizationaL Learning and Outcomes(APOLLO) 네트워크는 NCI, 미 국방부, 재향군인회와의 협력을 통해 환자-병원-연구를 연결하는 네트워크를 구성하고 환자가 치료에 어떻게 반응 할 것인지를 더 잘 예측하는 것을 목표로 종양의 단백유전체연구를 진행 중이다. 임상기관의 IHC 병리 연구에 오랫동안 이용되어 왔던 FFPE 조직시료에서 microdissection 후에도 다량의 펩티드를 추출하는 기술이 발달함에 따라, FFPE를 대상으로 항체없이 MRM만으로 단백질을 직접 검출하게 되었다. 이는 바이오마커 개발 연구에 활용되는 시료대상을 대폭 확정하는 효과를 가져왔다.
(2) 시장 동향 및 전망
(가) 시장 개요
전세계 단백질체 시장은 2019년 195억 달러에서 2024년 387억 달러로 연평균 14.7% 성장할 것으로 전망된다(MarketsAndMarkets, Proteomics Markets-Global Forecast to 2024). 이 시장의 성장은 맞춤의학 및 신약개발 분야연구 활동의 증가에 기인한다. 다른 시장 요인으로는 제약 및 생명공학 연구 개발비 증가, 단백질체에 대한 각국 정부의 자금지원 및 기술발전 등이 있다.
제품별로 봤을 때, 단백질체 시장은 계측장비 기술분야(instrument), 시약분야(reagent), 서비스 및 소프트웨어분야(service)로 구분할 수 있는데, 시약 분야가 2019년 시장점유율 1위를 차지할 것으로 예상되며, 이러한 추세는 2024년까지 계속 유지될 것이다. 시약분야가 큰 비중을 차지하는 원인으로는 복잡한 혼합물 및 기타 단백질체 분석과정에서
단백질을 분리 정제하기 위한 다양한 시약의 사용증가로 볼 수 있다. 응용면으로 나누어 보면 신약개발, 임상진단 및 기타 응용으로 구분할 수 있으며, 신약개발이 가장 큰 시장 점유율을 차지하고 있다. 바이오의약 시장의 성장으로 정밀의학기술 개발의 기회가 창출되었고, 이는 단백질체를 이용한 신약개발 시장을 가속화시킬 것으로 기대된다. 특히 단백질체 기술의 발전으로 각종 화학 합성 및 약물의 생물학적 테스트의 비용, 시간 및 자원에 대한 필요부분이 최소화되고 있다.

[그림 3-1] 제품별 및 응용분야별 세계 단백질체 시장 규모
지역별로는 다양한 조직의 풍부한 자금지원을 받는 북미시장이 가장 크며, 그 다음으로 유럽, 아시아-태평양 순이다. 반면에 연평균 성장률로 보면 오히려 아시아 태평양 지역이 가장 높을 것으로 추정된다.

[그림 3-2] 지역별 단백질체 시장규모
(나) 시장 동향
세계 단백질체 분야 주요 기업으로는 Thermo Fisher Scientific(미국), Agilent Technologies(미국), GE Healthcare(미국), Danaher Corporation(미국), Merck KGaA(독일) 등이 있다. 2018년 Thermo Fisher Scientific사와 Symphogen사는 협약을 맺고, Symphogen이 개발한 치료용 단클론 항체를 분석하는 시스템을 Thermo사의 Q Exactive Plus Orbitrap을 이용하여 구축하기로 하였다. 또한 같은 해에 Agilent Technologies는 단백체 기술기반을 강화함과 동시에, 차세대염기서열분석을 포함한 단백체-유전체 포괄적인 서비스를 제공하기 위해 Advanced Analytical Technologies, Inc.를 인수하였다. 2017년 한국의 삼성바이오로직스는 독일의 Merck KGaA사와 생물 의약품 제조 및 생물학적 공정 개발에 관한 전략적 제휴를 위해 양해 각서(MOU)를 체결하였다. 이 협약에 따라 Merck는 Mobius 시스템, 세포주, 세포 배양배지 및 크로마토그래피 시스템 전반을 제공하여 삼성바이오로직스의 생물학적 약제의 개발을 가속화한다.
다. 국내 현황
(1) 연구개발 투자 현황
포스트게놈 다부처유전체 사업으로 다양한 단백질체 관련 연구사업이 계획되었으나, 2017년에 단백유전체 원천기술을 개발하는 다중 오믹스 신기술개발사업이 종료되었고 현재는 소규모의 유전단백체 융합정보기반 난치암 제어기술 개발사업(과기정통부, 수행기간 2017∼2022년, 연 10억 원, 주관기관 고려대학교)과 미국 NCI와 연계된 글로벌 바이오 연계기술 개발사업(과기정통부, 수행기간 2017∼2022년, 연 10억 원, 주관기관 한국과학기술연구원)이 진행되고 있다. 이러한 두 개의 사업은 모두 Cancer Moonshot의 일환으로 진행 중인 대규모 유전단백체 연구 이니셔티브인 ICPC를 통한 공동연구 및 활용에 참여하고 있으나, 다른 나라에 비해 국내 투자가 현저하게 미미한 편이다. 별개로 2019년에는 다중 오믹스 기반 정밀의료 사업이 새로 시작할 예정이지만 단백질체연구 부분이 어느 정도 포함될지는 미지수이다. 보건복지부에서는 Cancer Moonshot에 참여하기 위한 기획 작업의 일환으로 2018년 국립암센터 중심으로 단백유전체연구단을 꾸려 외부의 단백질체 연구그룹과 컨소시엄 형태의 사업을 진행 중이다. 그 외에 대형 사업단인 글로벌프론티어연구개발사업 중 의약바이오컨버젼스연구단과 기초과학연구원 연구단(RNA 연구단)에서 단백질체 연구 인프라를 갖추고 연구에 활용하고 있으며, 이미 구축된 질량분석기기 등을 활용한 연구가 산발적으로 진행 중이다.
(2) 관련 산업 현황
[표 3-5] 국내 단백질체 관련 기업 현황
|
기업명 |
업종 |
설립연도 |
|
(주)영인프런티어 |
항체, 단백질, ELISA키트 생산 및 판매, 각종과학기기 판매, HUPO Antibody Initiative에 참여(www.younginfrontier.com) |
1994 |
|
(주)팹트론 |
주문형 펩타이드 제조 서비스, 기능성 및 약효 지속성의약품 제형 기술 개발, 펩타이드 개발 및 생산(www.peptron.co.kr) |
1997 |
|
(주)프로테옴텍 |
다중 알러지 진단키트 개발 및 판매, 프로테옴 분리 및질량분석, 단백질 동정 및 확인법 개발, 진단키트 개발(www.proteometech.com) |
2000 |
|
(주)노바셀테크놀로지 |
프로테오믹스 기술과 펩타이드 라이브러리 기술 기반으로 바이오 의약품과 바이오소재 개발(www.novacelltech.com) |
2000 |
|
다이아텍코리아(주) |
질량분석 기반 진단 제품 개발, 프로테오믹스 기술 이용 바이오마커 발굴, 면역항암제 액체생검 동반진단법 개발(www.diatech.co.kr) |
2000 |
|
(주)진메트릭스 |
MALDI-TOF를 이용한 바이러스 및 미생물 유전자 진단 기술 개발 및 서비스(www.genematrix.net) |
2000 |
|
(주)바이오인프라 |
빅데이터 기반 혈액 다중표지자 검사, 진단키트 개발, 바이오마커 발굴, 항암용 표적약물 전달 시스템 개발 등(www.bio-infra.com) |
2001 |
|
㈜프로탄바이오 |
인간용 암진단키드, 동물용 진단키트, 진단용 항원항체제작, 단백체 분석 서비스(www.protanbio.co.kr) |
2005 |
|
(주)아스타 |
병원성 미생물 신속 진단법 개발, MALDI-TOF 진단기기(로봇기술 활용 최초 국산화), MALDI plate 생산 판매, 시료전처리 기기 개발 생산 (www.astams.com) |
2006 |
|
프로테인웍스 |
단백질의약품 특성 분석 서비스, 천연물 분석 서비스, 프로테옴분석 (proteinworks.co.kr) |
2008 |
|
바이오앤시스템즈(주) |
단백질의약품 특성 분석 서비스(www.bionsystems.co.kr) |
2009 |
|
(주)라이프사이언스 래보러토리 |
단백질분석서비스, LC/MS/MS 분석 서비스, 각종 질량분석기술 교육 (www.proteinlab.co.kr) |
2013 |
|
㈜레티마크 |
단백체 기반 안질환 진단시스템 개발(www.retimark.com) |
2016 |
라. 발전과제
단백질체 연구는 기초와 응용에서 다양하게 진행되고 있다. 노화자체나 알츠하이머 및 퇴행성 뇌질환 같은 노화관련 질병연구, 화학단백질체학 및 신약개발 응용연구, 면역 및 감염성질환에 대한 연구, 시간과 공간에 따라 달라지는 단백질체 연구, 다양한 PTM 및 proteoform에 대한 연구, 유전체연구로 접근하기 어려운 세포외소포체 및 막표면 단백질체 연구, 단백질 분해효소와 그 산물을 복합적으로 연구하는 degradomics 등은 단백질체학의 꾸준한 연구주제이다. 단백질체를 넘어서는 다양한 오믹스 정보를 융합하기 위한 정보과학, 세포신호전달 및 단백질 복합체를 해석하기 위한 생물정보학도 핵심 주제에 속한다.
무엇보다도 최근에 주목받는 분야로서 임상단백질체학(clinical proteomics), metaproteomics, 단세포 단백질체학, 비변성조건 질량분석을 할용한 구조단백질체학이 있다. 임상단백질체학은 임상연구의 모든 측면에 단백질체 기술을 응용하는데 중점을 둔 중개연구로 단백질 기반 임상시료 분석 및 임상화학 분석을 위한 단백질 처리기술 개발을 포함한다. 군집에 존재하는 다양한 미생물의 구성에 대한 정보는 metagenomics가 주이지만, 집단 내에서 발생하는 대사 활동에 대한 정보는 제공하지 않기에 metaproteomics를 이용해 생물의 대사활동 정보를 확보하고 미생물과 숙주의 생화학적 관계도 밝힐 수 있다. 단세포전사체학 기술이 세포의 분화과정이나 질병의 발생과정에서 세포 분포를 보여주고 있지만, 단백질체학 기술은 아직 단세포 수준까지 내려가지 못하고 있다. 시료확보와 신호증폭 부분에서의 꾸준한 기술개발로 머지않아 단세포단백질체학도 일상적 분석도구가 될 것이다.
단백질체학의 가장 큰 응용분야로서는 정밀의료(precision medicine)가 있다. 약물을 적임자에게 적시에 제공하기 위해서는 사람의 질병상태를 먼저 파악하고 해당 치료법이 있는지 알아본 후 그 중 적절한 치료법을 찾을 수 있는 정확한 바이오마커(bio-marker)가 존재해야 한다. 따라서 단백질체 연구는 앞으로도 지속적으로 확장될 것이다. 다중오믹스, 특히, 유전체와 단백체를 통합적으로 바라보는 단백유전체는 Cancer Moonshot의 핵심부분이다. 정밀의료는 질병 유발 경로를 파악하고 결과를 모니터링하는 데 도움이 될 수 있을 것이며, 나아가 일상적 모니터링의 정밀건강(precision health)으로까지 확장될 것이다. 정밀의료의 진척을 위해서는 국제적 컨소시엄을 통한 단백질체 연구의 확대와 데이터 공유가 필요하다. 단백질체 연구는 정밀의료의 핵심기술로 정부, 의료기관, 산업계의 지속적인 관심이 필요하며 과감한 투자로 기술개발을 촉진해야 한다.
3. 세포체(줄기세포 포함)
가. 개요
(1) 세포체 관련 재생의료 연구
(가) 재생의료 시장의 성장
재생의료는 손상된 조직과 장기의 재생 또는 이식을 통해 질병완치에 기여할 수 있는 신의료 분야의 연구이다. 재생의료는 궁극적으로 작용기전 등에 따라 질병의 한시적 완화를 뛰어넘어 완치를 기대할 수 있는 신의료기술로, 이 기술의 개발 성공시 국민 의료복지의 향상과 더불어 관련 유관 산업의 발전을 창출할 수 있어 범세계적으로 정부와 민간영역에서 지속적인 투자와 규제완화 등의 진입 장벽 해소를 위한 노력이 진행되고 있다.
① 재생의료 분야의 지속적 수요증가와 제품 상용화로 인한 시장 확대
글로벌 재생의료 시장은 연평균 성장률이 평균 22.7%에 달하는 고성장 분야로 2017년 기준 약 226억 달러(약 25조 원)규모에서 2028년 2,142억 달러(약 236조 원) 규모로 확대될 것으로 예상된다(Global Translational Medicine Market Respects 2018∼2028). 미국이 세계시장의 약 52%를 차지하고 있어 절대적 우위를 점하고 있으며 유럽의 경우 영국 8%, 독일 7% 및 프랑스 4% 등이 그 뒤를 차지하고 있다. 아시아의 경우 일본이 7%, 한국이 4%를 점하고 있는 상황이다(Frost & Sullivan, The New Age of Regenerative Medicinem 2015).
② 재생의료 제품 출시와 지속적인 임상시험 진행
재생의료 제품의 개발은 2000년부터 시작되었으며, 짧은 기간임에도 불구하고 2011년 ㈜파미셀이 ‘하티셀그램-AM’을 세계최초 세포치료제로 출시한 이래 현재까지 총 15개의 재생
의료 치료제 개발이 성공적으로 출시되었고 이 중 5건이 국내에서 개발되어 상용화 되었다.
줄기세포에 대한 국가별 상업 임상 건수는 미국에 이어 한국이 15%(46건)의 비율로 정량적 2위를 위치하고 있으나 최근 3년간 현황을 살펴보면 임상승인 건수는 중국에 역전되고 있는 상황이다.

출처: MDFS, EMA, MHLW 홈페이지, GSRAC 재가공, 2017
[그림 3-3] 세계 줄기세포 및 주요 재생의료 치료제 개발 현황(2011∼2017)

출처: 줄기세포치료제 개발 및 규제 동향(식품의약품안전처, 2016.3.)
[그림 3-4] 국가별 재생의료 관련 세포치료제 임상연구 수행현황(1998∼2015)
③ 성체줄기세포 위주의 개발에서 차세대 세포치료제로 개발 확대
그동안의 재생의료 관련 세포체의 연구개발은 주로 안전성을 담보로 하는 성체조직 유래의 줄기세포를 활용하는 연구가 주류를 이루고 있었으나 최근에는 인간배아줄기세포(ESCs: embryonic stem cells) 또는 역분화줄기세포(iPSCs: induced pluripotent stem cells: 다 자란 체세포에 특정 유전자를 주입하는 등 인위적 자극을 가해 인체 모든 장기로 자랄 수 있도록 만든 세포)로 부터 특정분화세포를 활용한 세포치료제 개발 연구가 활발하게 진행되고 있어 차세대 고기능성 치료제로서의 가능성을 타진하고 있는 상황이다. 인간배아줄기세포 유래 세포치료제의 경우 고순도로 분화 유도된 망막색소상피세포(RPE: retinal pigment epithelial cells)를 이용하여 2011년 노인성 황반변성질환에 대한 세포치료제 임상시험이 진행된 이래 최근 들어 심혈관전구세포와 신경세포 등을 이용한 허혈성 심장질환, 루게릭병 및 파킨슨병 등으로 대상 질환이 확대되고 있는 상황이다.
특히 안과질환의 경우 임상시험의 결과로 치료제의 안전성과 효력에 대한 의미 있는 성과가 발표되는 등 이를 바탕으로 다수의 기관에서 임상시험이 진행되고 있는 상황이며 국내에서도 진행되고 있다. 한편, 일본의 경우 역분화줄기세포 개발성공을 바탕으로 전략적으로 역분화줄기세포 유래의 자가 및 동종 망막색소상피세포를 활용한 황반변성질환 치료제, 신경전구세포를 이용한 파킨슨병 치료제 및 운동신경세포를 활용한 척수손상 치료제에 대한 임상시험을 세계에서 유일하게 진행하는 등 10년 내 10개 질환에 대한 세포치료제 개발을 진행하겠다고 발표한 바 있다.
[표 3-6] 인간배아줄기세포 유래 세포치료제 임상시험 현황
|
Cell type |
Target Disease |
Clinical Phase |
Location |
Patient No. |
Year |
|
Retinal Pigment Epithelium(RPE) |
Stargadt's Marcular Dystrophy(SMD) |
Phase I/IIa (NCT01469832) |
Astellas Pharma Inc., USA |
12 |
2011.11 |
|
RPE |
SMD |
Phase I (NCT01625559) |
ChaBiotech, Korea |
3 |
2012.9 |
|
RPE |
Dry Age-related Marcular Degeneration(Dry-AMD) |
Phase I (NCT01674829) |
ChaBiotech, Korea |
12 |
2012.9 |
|
RPE |
SMD |
Phase I/IIa (NCT02941991) |
Astellas Pharma Inc., USA |
11 |
2013.1 |
|
CD15+Isl1+ Progenitor |
ISchemic Heart Disease |
Phase I (NCT02057900) |
Hospotaux de Paris, France |
10 |
2013.5 |
|
CPCB-RPE1 |
Dry-AMD |
Phase I, II (NCT02590692) |
Regenerative Patch Technology, LLC., USA |
16 |
2015.10 |
|
RPE(SCNT-hESC) |
Dry-AMD |
Phase I (NCT03305029) |
CHA University, Korea |
3 |
2016.5 |
|
RPE |
AMD |
Phase I (NCT03102138) |
Pfizer, UK |
2 |
2016.9 |
|
Neural Precursor Cells |
Parkinson's Disease |
Phase I, II (NCT03119636) |
Chinese Academy of Science, China |
50 |
2017.5 |
|
RPE |
Dry-AMD |
Phase I, II (NCT03046497) |
Chinese Academy of Science, China |
10 |
2017.9 |
|
RPE |
Marcular Degenerative Disease |
Phase I/IIa (NCT03167203) |
Astellas Pharma Inc., USA |
36 |
2018.1 |
|
Astrocyte |
ALS(Amyotrophic Lateral Sclerosis) |
Phase I,II (NCT03482050) |
Kasmastem, Israel |
21 |
2018.4 |
출처: www.clinicaltrial.gov(편집)
④ 세포체(줄기세포 포함) 활용기술 확대 및 다양화 진행
줄기세포를 포함하는 세포체 연구는 치료적 목적을 위한 세포치료제 개발 외에도 최근 다양한 융복합 연구를 통해 특정 질환 모델링, 바이오 오가노이드, 신약개발 및 독성평가 등 치료 외 분야로의 연구영역이 확대되고 있는 추세이다. 2016년 다국적 제약사인 GSK는 하버드대 연구팀과의 공동연구로 기존약물에 대한 적응증 확대연구를 통해 신규 루게릭병 치료제에 대한 임상시험 진입을 발표한 바 있다.
국제의약품규제조화위원회(ICH: International Conference on Harmonization)에서는 기존 신약개발 시 임상과정에서 가장 큰 실패요인 중 하나인 심독성 평가기술을 기존의 이온채널 에세이 기술에서 인간 전분화능 유래 심근세포를 활용하는 새로운 독성평가 시스템을 구축하고 이를 표준화하기 위한 신규 프로젝트가 2016년부터 추진되고 있다(Comprehensive in vitro proarrhythmia assay project: CiPA project). 국내의 경우 줄기세포 유래 신경세포를 활용하여 희귀질환인 부신백질이영양증(점진적인 뇌손상, 부신기능 부전, 사망에 이르는 희귀 유전병)의 원인물질(VLCFA) 규명을 통한 신규 치료물질을 발굴(Nature Communication, 2016)하는 등 세포활용을 통한 신규 제약 산업으로의 발전 가능성을 타진하고 있다. 조직장기는 다양한 세포로 구성되어 세포-세포 또는 세포-세포기질 간의 상호작용에 의해 그 기능이 작동하기 때문에 최근 세포체(줄기세포 포함)를 활용하여 실제 인간 장기를 모사할 수 있는 오가노이드 연구가 활발히 연구되고 있다.
오가노이드 기술은 2015년 MIT에서 선정한 10대 미래유망기술로, 2013년 미니뇌가 제작된 이래 다양한 인체 장기를 모사할 수 있는 뇌, 안구, 간, 심장 등 각종 오가노이드 연구성과가 발표되고 있어 향후 조직 및 장기 발생과정의 이해, 질병의 발병기전의 해석, 치료기술 개발, 약물에 대한 독성평가, 궁극적으로는 대체장기 개발 등의 바이오의료분야에 활용될 것으로 예측된다.
(2) 첨단바이오의약품으로서 재생의료제품 개발에 대한 혁신적 규제개선
(가) 재생의료 제품 관련 규제개선
주요 각국은 새로운 규제 시스템 정비를 통해 신의료기술을 통한 성과를 조기에 상용화하기 위한 방안으로 재생의료분야 연구를 체계적으로 지원하고자 대대적인 제도 및 법률적 정비를 진행하고 있다. 첨단 바이오의약품이라고 할 수 있는 세포치료제, 유전자치료제 및 조직공학 치료제에 대한 신속심사와 조기승인 등의 제도는 기존의 의약품 심사기준과 부합하지 않는 인허가 절차를 획기적으로 개선하는 것이다.
미국은 21세기 치료법(21st Century Cures Act) 제정을 통해 재생의료 제품 개발, 승인관련 규제개혁을 포함하는 법률안을 발효(2016.12)하여 시행하고 있으며, 유럽연합은 희귀난치성 질환에 대한 미충족 의학적 수요를 해결하고 신속한 첨단 바이오의약품 개발 및 신속개발을 촉진하기 위한 지원제도(PRIME: PRIority MEdicine)를 신설 운영하고 있다.
일본은 재생의료기술개발 및 상용화를 위해 여타 선진국에 앞서 가장 획기적인 제도 및 법률적 기반을 마련하여 시행하고 있다. 재생의료 상업화 절차의 간소화와 연구개발 촉진을 위한 R&D 전담기관을 운영하고 있으며, 특히 재생의료추진법 및 재생의료안전확보법의 입법을 통한 연구개발과 실용화를 전면적으로 지원할 수 있는 근거를 마련하고 있다. 동시에 재생의료의 안전성을 담보하기 위한 실시계획의 승인 경로를 체계화하여 운영 중이다. 반면, 우리나라의 경우 2005년 제정된 생명윤리 및 안전에 관한 법률에 근거하여 세포치료제 개발 및 정부 지원의 당위성을 확보하고 있으나 급속히 발전하는 기술적 진보에 대응하는 데에는 한계가 있다. 최근 기존의 의약품 개발과는 별도의 규제로 재생의료 제품개발 촉진을 위한 가칭 ‘첨단의료 및 첨단재생의료법률안’이 상정되어 있으나 입법화는 되지 못하는 상황이다.
(나) 재생의료 연구개발의 정부 및 민간 투자
재생의료 연구개발은 과학적으로 급속한 발전을 하고 있으나 산업으로 연계되기까지는 많은 장애요인을 가지고 있어 각국에서는 이러한 문제를 극복하기 위해 다양한 노력을 기울이고 있다. 특히 선진국의 경우 유망기술의 발굴과 지원 및 산업화를 위한 전문인력, IP 확보, 투자 등을 지원하는 기관을 국가가 선정하여 운영하고 있다. 대표적으로 산업화 촉진을 위해 캐나다의 CCRM(Centre for Commercialization of Regenerative Medicine), 영국의 CGTC(The Cell and Gene Therapy Catapult), 미국의 CIRM 2.0(California Institute
for Regenerative Medicine) 등이 설립되어 연구개발에서 상용화에 이르는 전주기적 지원 시스템을 운영 중에 있다.
[표 3-7] 국가별 재생의료연구개발 촉진 기관현황
|
국가 |
미국 |
영국 |
캐나다 |
|
기관명 |
CIRM 2.0 (California Institute for Regenerative Medicine) |
CGTC (The Cell and Gene Therapy Catapult) |
CCRM (Centre for Commercialization of Regenerative Medicine) |
|
목적 |
캘리포니아주 내 줄기세포 관련 연구기반시설에 대한 투자부터 최근 중개 임상연구까지 지원 |
영국을 세포치료제(cell therapy) 분야에 있어서 제조부터 상업화까지 총괄, 글로벌 리더로 육성 |
지식과 최첨단의 과학적 발견들을 시장출시를 위한 상업화 제품으로 전환하기 위함 |
|
설립 |
2015년(2.0) |
2012년 |
2011년 |
|
지원규모* |
2020년까지 $890million (약 1조 78억 원) |
2018년 3월까지 £70million (약 1,042억 원) 확보 |
2011∼2017 $15million (약 169억 원) 투자 |
|
연구 및 산업화 추진 및 지원 |
-Accelerating Center, Translating Center 설립 예정 -기초연구 중심에서 임상연구에 대한 비중이 높아짐 |
공동 연구기관-UK stem cell initiative(UKSCI), MRC(Medical Research Council), BBSRC(Biotechnology andBiological Sciences Research Council) |
45개 회사와 산업 컨소시엄 구축 |
|
비고 |
-Alpha Stem Cell Clinic**: 2013년 시작되었으며, 환자에게 안전하고, 효과적으로 접근가능한 치료기회 제공 및 치료법을 확립하기 위한 통합 임상연구 인프라 및 지원 역할 수행 -총예산에서 임상연구비중이 50%를 차지 함 |
-연구자, 연구기관과 네트워크 -비임상/임상시험 지원 -투자연결 -제품개발 및 기업설립 -보건경제성・시장조사 -제품개발 및 기업설립 ※ (기업설립)CAR-T세포 치료제 개발 위한 신생기업 Chimeric Therapeutics Ltd 설립 |
-임상 지원 -기술 및 IP 확보 플랫폼 구축 -GMP 시설 보유 및 운영 -기술 및 상업화 전략 수행 -투자자-스타트업 기업 연계 시스템 마련/창업 지원 -학-산 컨소시엄 구축 -투자네트워크 구축 -기술개발・평가/사업화 컨설팅 -제조 솔루션 개발 |
* 원화환산기준: 1달러($)는 1,133원, 1파운드(£)는 1,489원으로 환산(2017.10. 기준)
** http://stemcellstm.alphamedpress.org/site/misc/PerspectiveTrounson.xhtml
출처: 줄기세포 재생의료 분야 국내외 R&D 투자 동향, GSRAC report, 2016.12.
일본은 2012년 야마나카 신야 교수의 노벨상 수상을 기점으로 줄기세포 연구개발의 혁신과 실용화를 가속화하기 위해 부처 간 협력강화, 연구프로젝트 및 예산 등의 연계 및 집중화를 도모하기 위해 2015년 일본의료연구개발기구(AMED: apan Agency for MedicalResearch and Development)를 설립하여 적극 지원하고 있다. 의료분야 R&D 예산관리 및 기초연구에서 실용화 지원, 규제 혁신 등에 범정부적 집중을 위해 각 부처의 예산을 통합하여 연구와 기업에 분배하고 있다. 특히 역분화줄기세포 연구지원을 위한 예산을 약 10억 달러를 보유하고 있으며 교토대학교를 중심으로 4대 거점 기관을 선정하여 총 439억 엔(약 4,900억 원)을 투자하는 등 기술개발에 필요한 거의 모든 지원을 진행하고 있다.
[표 3-8] 일본의 의료분야 연구개발(2015)
|
구분 |
주요 전략 |
예산 |
주요 사업 |
|
의약품/ 의료기기 개발 |
All-Japan 의약품창출 |
211억 엔 |
-생명과학 연구지원 기반사업 -최첨단 기반개발연구 -임상응용기반연구 -희귀질환 치료제 개발지원 -혁신적 바이오의약품 -개발기반기술개발 사업 |
|
All-Japan 의료기기 개발 |
145억 엔 |
-첨단 계측 분석기술・기기개발 프로그램 -미래의료를 실현하는 의료기기・시스템 연구개발사업 -의공연계 사업화 추진 사업 -국산 의료기기 개발촉진 기반정비사업 -심사의 신속화・질의 향상 및 안전대책 강화 |
|
|
세계 최첨단 의료 실현 |
재생의료 실현화 고속도로 구상 |
143억 엔 |
-재생의료 실현화 거점 네트워크 프로그램 -재생의료 실용화 연구사업 -재생의료 실용화 연구실시 거점 정비사업 |
|
질병극복을 위한 유전체의료 실현화 프로젝트 |
59억 엔 |
-맞춤의료 실현 프로그램 -토호쿠 메디컬・메가뱅크 계획 -메디컬게놈 센터 |
|
|
임상연구/ 임상시험 |
혁신적 의료기술 창출 거점 프로젝트 |
106억 엔 |
-임상연구 가속화 네트워크 프로그램 -임상연구 중심병원 정비사업 |
|
질병영역 |
Japan Cancer Research 프로젝트 |
162억 엔 |
-차세대 암연구 우수성과 전략적 육성 프로그램 -혁신적 암 의료 실용화 연구사업 -암 조기진단・치료를 위한 의료기기개발 |
|
뇌영역 건강대국 실현 프로젝트 |
68억 엔 |
-분자 이미징 연구전략 추진 프로그램 -뇌영상・임상・IT 융합에 의한 알츠하이머 조기진단 실현 -인지증 연구개발 사업 -뇌과학 연구전략 추진 프로그램 -혁신적 기술에 의한 뇌기능 네트워크 전체해석 프로젝트 |
|
|
신흥 재생 감염병 제어 프로젝트 |
41억 엔 |
-감염병 국제연구 네트워크 추진프로그램 -신종 인플루엔자 등 감염병 연구사업 |
|
|
난치병 극복 프로젝트 |
96억 엔 |
-난치병 극복 연구사업 -질환특이적 iPS세포에서 분화유도된 세포를 이용한 치료법 개발 연구 -질환특이적 iPS세포를 활용한 난치병 연구 |
출처:http://scienceadvice.ca/uploads/eng/assessmentspublicationsnewsreleases/regenmed/regenmed_fullreport_en.pdf; http://www.asahi.com/articles/ASJDB2JH3JDBUBQU005.html
한편, 우리나라는 2006년 줄기세포종합추진계획 수립을 기점으로 본격적으로 체계적인 연구지원을 강화해 왔다. 특히 2012년에 정부의 관련 예산규모를 연간 1,004억 원 규모로 확대하면서 연구개발을 촉진하고 있다. 이러한 정부지원에 힘입어 4건의 세포치료제의 개발이 성공적으로 이루어져 관련 분야에서 세계적 경쟁력을 확보할 수 있었으며, 지속적인 세포치료제 개발로 임상시험 건수도 증가하고 있다. 그럼에도 불구하고 재생의료분야의 R&D 예산규모는 미국의 1/20, 일본의 1/3 수준으로 상대적으로 여전히 낮은 수준에 머무르고 있다.
나. 해외 동향
글로벌 첨단재생의료시장은 예측기관에 따라 다소 상이하나 지속적으로 15% 이상의 연간 성장률을 나타내는 초고속 산업으로 발전할 것으로 예측된다. 2014년부터 2026년까지는 대부분 줄기세포치료제가 주류를 차지할 것으로 예상되나 조직공학치료제와 유전자치료제의 경우 연평균 성장률이 이보다 더 높을 것으로 예상되고 있다.
[표 3-9] 세계 연도별 재생의료 시장현황 및 전망(2014∼2026)(단위: 억 달러)
|
구 분 (시장점유율) |
2014 |
2016 |
2018 |
2020 |
2022 |
2024 |
2026 |
연평균 성장률 |
|
줄기세포치료제 |
36 (80%) |
45 |
63 |
85 (70.4%) |
114 |
155 |
194 (63%) |
15.0% |
|
조직공학치료제 |
9 (19.8%) |
12 |
18 |
27 (22.6%) |
41 |
61 |
93 (30.2%) |
21.5% |
|
유전자치료제 |
0.08 (0.2%) |
1 |
2 |
8 (7.1%) |
15 |
18 |
21 (6.8%) |
60.0% |
|
계 |
45 |
58 |
83 |
120 |
170 |
234 |
308 (100%) |
17.3% |
출처: Translational Regenerative Medicine: Market Prospects 2014∼2026(Visiongain, 2016), GSRAC 재가공

출처: Translational Regenerative Medicine: Market Prospects 2014∼2026(Visiongain, 2016), GSRAC 재가공
[그림 3-5] 세계 지역별 재생의료 시장현황 및 전망(2014∼2026)
재생의료 산업은 관련 유관산업으로의 파급효과가 커 세포치료제 연구에서 요구되는 각종 배지(培地)를 포함한 기반산업 역시 동시에 급속히 성장하는 추세이다. 전 세계적으로 줄기세포를 포함하는 세포체 배양시장 규모는 인간세포만 하더라도 2014년 63억 달러에서 2020년 172억 달러로 연평균 18.7%의 고성장을 나타낼 것으로 예측된다. 특히 아시아 지역은 연평균 23.1%의 고성장을 나타낼 것으로 보인다.

출처: Cell expansion technologies and global markets(2015), BBC research, GSRAC 재가공
[그림 3-6] 전 세계 세포종류별 배양시장 규모(2015∼2020)
이밖에도 2015년 기준 소모성 물품(Consumables)은 72억 달러, 장비 20억 달러 및 기기 5억 달러의 시장이 형성되어 있는 것으로 알려져 있다(BBC research, 2015).
다. 국내 현황
(1) 국내 세포체 관련 시장전망
국내 재생의료를 포함하는 세포체 시장은 2014년 약 3,200만 달러로 글로벌 시장의 0.7%를 차지하나 이후 연평균 20.4%로 성장하여 2026년에는 약 3억 2,400만 달러(세계점유율 1.0%)에 이를 것으로 전망된다.

[그림 3-7] 연도별 국내 세포체 관련 시장규모(2014∼2026)
[표 3-10] 국내 세포체 시장 예측(2014∼2026)(단위: 백만 달러)
|
구분 |
2014 |
2016 |
2018 |
2020 |
2022 |
2024 |
2026 |
연평균 성장률 |
|
글로벌 |
4,556 |
5,847 |
8,373 |
12,091 |
17,046 |
23,470 |
30,862 |
17.3% |
|
국내 |
32 |
51 |
73 |
106 |
154 |
223 |
324 |
20.4% |
|
점유율 |
0.7% |
0.9% |
0.9% |
0.9% |
0.9% |
1.0% |
1.0% |
|
출처: Translational Regenerative Medicine: Market Prospects 2014∼2026(Visiongain, 2016); 금융감독원 & GSRAC 조사・분석
(2) 국내 세포체 기술현황
국내 세포체 연구개발 기업은 대다수가 중소・벤처기업이며 기술의 대부분이 연골 혹은 피부재생 치료제에 집중되고 있는 실정이다. 최근 항암면역 세포치료제 개발 성과가 두드러지고 있는데 1세대 항암면역 세포치료제로 크레아젠사가 개발한 수지상 세포치료제, 이노셀사가 개발한 간암 자가활성 T-림프구 치료제 등이 상업화에 성공하였으며 최근에는 NK 세포치료제, CAR-T 세포치료제 등이 개발 중이다.
(3) 국내 세포체 연구의 국가 경쟁력 수준
줄기세포・재생의료 기술경쟁력 및 연구자 네트워크 분석에 의하면 특허와 논문을 기준으로 재생의료 기술경쟁력을 분석한 결과 미국이 가장 경쟁력이 앞서고 있는 것으로 나타났으며, 우리나라는 특허와 논문지수 모두 8위 정도의 기술경쟁력을 갖고 있는 것으로 조사되었다.

[그림 3-8] 세계 각국의 줄기세포/재생의료 논문지수

출처: 줄기세포/재생의료 기술경쟁력 및 연구자 네트워크 분석(GSRAC, 2016)
[그림 3-9] 세계 각국의 줄기세포/재생의료 특허지수
[표 3-11] 줄기세포・재생의료 분야의 특허 및 논문 기반 경쟁력 순위
|
구분 |
미국 |
영국 |
일본 |
독일 |
캐나다 |
프랑스 |
호주 |
한국 |
|||||||||
|
특허 |
논문 |
특허 |
논문 |
특허 |
논문 |
특허 |
논문 |
특허 |
논문 |
특허 |
논문 |
특허 |
논문 |
특허 |
논문 |
||
|
성체 줄기세포 |
점수 |
100 |
100 |
30 |
28 |
22 |
48 |
53 |
42 |
15 |
45 |
24 |
29 |
15 |
38 |
49 |
53 |
|
순위 |
1 |
1 |
4 |
8 |
6 |
3 |
2 |
5 |
7 |
4 |
5 |
7 |
7 |
6 |
3 |
2 |
|
|
배아 줄기세포 |
점수 |
100 |
100 |
50 |
80 |
30 |
54 |
42 |
24 |
17 |
41 |
13 |
25 |
13 |
49 |
15 |
7 |
|
순위 |
1 |
1 |
2 |
2 |
4 |
3 |
3 |
7 |
5 |
5 |
7 |
6 |
7 |
4 |
6 |
8 |
|
|
iPSc |
점수 |
85 |
100 |
10 |
35 |
100 |
95 |
74 |
43 |
0 |
10 |
22 |
0 |
0 |
23 |
26 |
22 |
|
순위 |
2 |
1 |
6 |
4 |
1 |
2 |
3 |
3 |
7 |
7 |
5 |
8 |
7 |
5 |
4 |
6 |
|
|
유전자+ 세포치료 |
점수 |
100 |
100 |
38 |
0 |
6 |
51 |
11 |
53 |
69 |
60 |
45 |
59 |
59 |
48 |
8 |
40 |
|
순위 |
1 |
1 |
5 |
8 |
8 |
5 |
6 |
4 |
2 |
2 |
4 |
3 |
3 |
6 |
7 |
7 |
|
|
내재성 줄기세포 |
점수 |
100 |
100 |
0 |
57 |
0 |
23 |
50 |
31 |
38 |
86 |
0 |
32 |
0 |
45 |
0 |
10 |
|
순위 |
1 |
1 |
4 |
3 |
4 |
7 |
2 |
6 |
3 |
2 |
4 |
5 |
4 |
4 |
4 |
8 |
|
|
조직 공학 |
점수 |
100 |
100 |
48 |
45 |
33 |
61 |
37 |
39 |
18 |
48 |
60 |
21 |
89 |
38 |
19 |
45 |
|
순위 |
1 |
1 |
4 |
4 |
6 |
2 |
5 |
6 |
8 |
3 |
3 |
8 |
2 |
7 |
7 |
5 |
|
|
신약 개발 |
점수 |
100 |
100 |
0 |
84 |
14 |
27 |
0 |
59 |
64 |
49 |
0 |
17 |
0 |
15 |
0 |
1 |
|
순위 |
1 |
1 |
4 |
2 |
3 |
5 |
4 |
3 |
2 |
4 |
4 |
6 |
4 |
7 |
4 |
8 |
|
|
실용화 공통기술 |
점수 |
100 |
100 |
34 |
50 |
20 |
5 |
27 |
51 |
62 |
50 |
59 |
58 |
50 |
55 |
- |
23 |
|
순위 |
1 |
1 |
5 |
6 |
7 |
8 |
6 |
4 |
2 |
5 |
3 |
2 |
4 |
3 |
8 |
7 |
|
|
질환 치료제 |
점수 |
100 |
100 |
32 |
60 |
38 |
29 |
72 |
56 |
67 |
58 |
65 |
52 |
37 |
36 |
22 |
0 |
|
순위 |
1 |
1 |
7 |
2 |
5 |
7 |
2 |
4 |
3 |
3 |
4 |
5 |
6 |
6 |
8 |
8 |
|
|
점수평균 |
98.3 |
100 |
26.9 |
54.7 |
29.2 |
40.6 |
40.7 |
41.3 |
38.9 |
48.4 |
32 |
31.3 |
29.2 |
35.3 |
15.4 |
18 |
|
|
종합순위 |
1 |
1 |
7 |
2 |
5∼6 |
5 |
2 |
4 |
3 |
3 |
4 |
7 |
5∼6 |
6 |
8 |
8 |
|
출처: 줄기세포/재생의료 기술경쟁력 및 연구자 네트워크 분석(GSRAC, 2016)
(4) 세포체 연구개발을 위한 인프라 구축 및 운영
우리나라는 2015년 바이오헬스 미래 신산업 육성전략을 통해 투자 생산성 및 실용화 촉진을 위한 인프라 구축을 제시하였고, 그 결과 복지부는 2016년 질병관리본부 내에 줄기세포재생센터를 건립하였다. 줄기세포재생센터에는 세포치료제 의약품생산시설(GMP) 및 품질평가 기반시설 등을 확보하고 있으며 국가줄기세포은행과 연계하여 첨단재생의료 중개연구의 임상연구 및 사업화 촉진을 위한 인프라를 제공하고 있다.
라. 발전 과제
줄기세포로 대별되는 세포체 연구는 단순히 학문적 연구에 그치는 것이 아니라 실제 난치 및 희귀질환으로 고통 받는 환자의 근원적 치료방법을 제시할 것으로 기대되는 재생의료 분야의 핵심연구이다. 이미 2000년대 초기부터 거의 모든 국가에서 중점 연구개발 분야로 지정하여 다양한 형태의 연구투자와 지원을 해오고 있다. 우리나라 역시 줄기세포연구 종합추진계획 수립을 통해 체계적이고 종합적인 연구개발 촉진을 진행해오고 있으나 타 선진국에 비해 상대적으로 연구투자가 부족한 면이 있다. 그럼에도 불구하고 세계 최초의 세포치료제 개발을 포함하여 5건의 치료제 개발로 세계 선도적 위치를 점하고 있어 향후의 추가적인 발전 가능성을 높이고 있다.
다만, 새로운 의약품으로서 세포치료제, 유전자치료제 및 조직공학치료제는 첨단학문연구 성과를 포함하고 있다. 기존의 합성의약품 등과 같은 의약품개발 과정과는 다소 상이한 점이 있어 실제 의약품으로 개발하는데 상당한 문제점을 내포하고 있고, 이 중 가장 문제가 되는 것이 바로 인허가 절차이다. 이를 위해 각국은 신속한 연구개발, 조기 임상진입 및 상용화 실현을 위한 혁신적인 제도개선으로 법률적・제도적 정비를 하고 있는 상황이다. 우리나라 역시 이를 위해 적극적인 노력이 필요할 것이다.
줄기세포를 포함하는 세포체 연구는 단순히 환자의 치료를 위한 세포치료제 또는 치료기술 개발에만 활용하는 것이 아니다. 최근 신약개발 과정에서 요구되는 독성평가 기술을 기본으로 암세포 혹은 동물을 대상으로 하는 시스템을 인간 줄기세포 유래의 특정세포를 이용하여 보다 정교한 독성평가 시스템을 적용하려는 노력이 진행되고 있다. 나아가 줄기세포를 활용한 약품의 적응증 확대 및 후보물질 개발 등의 연구에 적극 활용하고 있는 상황이다.
또한 기존의 2D상태의 세포연구에서 바이오프린팅 등의 기술을 접목한 3D, 4D 형태의 인공조직 및 장기 유사체라고 할 수 있는 다양한 오가노이드 연구가 활발히 진행되고 있다. 실제 20여 종의 인간 조직 혹은 장기 유사체가 개발되고 있는 상황으로 이를 활용한 인간 발생기전의 이해, 약물의 대사연구 및 독성평가 등 매우 다양한 분야에서 활용될 것으로 보인다.
이처럼 줄기세포와 같은 세포체 연구는 그 연구영역의 다양성이 매우 확대될 것이며 나아가 새로운 사업군으로 발전할 것으로 전망된다. 아직 국내 연구개발의 인력 및 인프라가 선진국에 비해 다소 부족하고 상용화를 위한 기업들의 영세성이 존재하지만 여전히 세계적 경쟁력을 확보할 수 있는 충분한 역량을 갖추고 있다고 본다. 도약기를 지나 성장기에 이를 것으로 예측되는 세포체 연구에 대한 정부차원의 중장기적 육성방안의 구축과 다른 국가에서 성공적으로 추진하는 혁신적 제도 개혁 등에 더욱 노력을 기울여야 한다.
4. 대사체
가. 개요
대사체학은 시스템 생물학인 세포, 조직, 장기 및 생명체 내의 여러 옴들(omes), 즉 유전체, 전사체, 단백제들의 변화들이 반영된 표현형인 저분자 대사체(분자량<1,500 Da)들의 변화를 프로파일링함으로써 복잡한 생명체의 유전체 기능 및 세포반응을 규명하려는 연구분야이다. 대사체학은 생체표지발굴 및 맞춤의학을 위한 핵심기술로 발전하였고 유전체적 과정의 궁극적인 산물을 설명해 줄 수 있는 능력을 가져 현재 임상실험실에서의 중요한 역할을 담당하고 있다. 대사체학과 다른 오믹스 즉, 유전체학, 단백체학 등과 협업연구는 대상 임상질환의 병리생태학과 그 질환의 메커니즘을 이해하는 데 상당한 기여를 하게 될 것으로 기대되어 맞춤의약을 위한 최적 접근방법으로의 자리매김 하고 있다.

[그림 3-10] 생체표지를 발굴하기 위한 pipeline의 예
대사체학의 연구는 이후 바이오연구 중 생체표지발굴 분야에서는 유망기술이 아닌 필수기술로 성장하여 최근에는 다양한 연구 분야에 활용 되고 있다. 건강 및 질병진단에 있어서 생체지표 선정, 시스템 생물학, 동위원소 이성질체를 활용한 경로발견(pathway discovery), 신약개발, 그리고 식물, 미생물, 영양학 및 환경 대사체학 등 그 적용 범위가 확대되어 가고 있으며 이러한 추세는 앞으로도 계속될 전망이다. 주로 미국, 유럽, 일본 등 선진국 위주로 진행되어 왔으며, 지난 10년간 대사체학 연구에 대한 논문 발표 횟수도 꾸준히 증가하고 있다.

출처: Mass Spectrometry Review, 2017
[그림 3-11] 연도별 대사체학 관련 SCI급 논문 발표 수
나. 해외 연구 동향
(1) Clinical metabolomics 분야
영국의 Brian D. Green 박사팀은 알츠하이머병(AD: Alzheimer’s disease)이 내인성 담즙산의 농도에 영향을 미치는지 확인하기 위하여 액체 크로마토 그래피-탠덤질량분석(LC-MS/MS: Liquid chromatography-tandem mass spectrometry)을 이용하여 AD 환자와 연령대가 일치하는 대조군의 뇌 추출물과 혈장에서 22개의 담즙산을 분석하였다. APP・PS1 및 WT 쥐의 뇌・혈장 샘플도 함께 분석한 결과, AD의 발병에 따라 담즙산의 농도 변화가 발생하는 것을 확인했다.

출처: Metabolites, 2017
[그림 3-12] 사람 및 쥐의 혈장, 뇌 샘플에서 유형에 따라 유의하게 차이나는 담즙산의 종류
미국의 Sarah H. Elsea 박사팀은 표적화되지 않은 대사체학(untargeted metabolomics) 플랫폼을 사용하여 ethylenediaminetetraacetic acid 혈장 표본을 분석하고 소아 중심 인구 집단과 비교하여 aromatic amino acid decarboxylase(AADC) 결핍과 도파민 약물 치료와 관련된 분석물의 변화를 조사했다. 혈장의 대사성 표현형을 이용하여 AADC 결핍 환자의 대사 프로파일링 변화를 확인하고 특히 3-methoxytyrosine의 증가를 통해 AADC가 아닌 사람과 비교할 수 있음을 확인했다.

주) 괄호 안의 숫자는 aromatic l-amino acid decarboxylase(AADC) 환자의 혈장에서 발견된 페닐알라닌 대사물질의 z score
출처: Pediatric Neurology, 2017
[그림 3-13] phenylalanine 및 tryptophan metabolism pathway
미국의 스테븐 제이 슈와츠(Steven J. Schwartz) 박사팀은 LC-MS를 사용하여 임상 중재를 위한 토마토 주스 사이의 카로티노이드 및 기타 식물의 화학물질 유사점과 차이점을 광범위하게 평가했다. 이들은 인간 임상 시험에서 사용되는 2종의 토마토 제품 간에 더 많은 phytochemical(식물에서 자연적으로 만들어지는 모든 화학물질) 차이를 확인했다.
이 분석을 통해 카로티노이드 조성의 차이점을 발견할 수 있었으며 이를 통해 영양 및 식이 중재를 향상시키기 위한 식품의 화학적 조성을 광범위하게 특성화 했다.
사우디 아라비아의 아나스 엠 압델 라만(Anas M. Abdel Rahman) 교수팀은 표적화된 대사체학(targeted metabolomics) 방법을 사용하여, 대사 장애의 선천적 오류와 관련된 가장 관련 있는 경로를 확인했다. 임상 연구를 위해 표준화된 LC-MS/MS를 사용하여 220개의 임상 관련 대사산물에 대한 포괄적인 표적 대사체학 방법을 소개했다. 각 표적 대사산물(아미노산, 유기산, 아실 카르니틴, 당, 담즙산, 신경전달물질, 폴리아민 및 호르몬)의 감도, 재현성 및 분자 안정성을 평가했다. 이를 다양한 선천성대사증후군(inborn errors of metabolism, IEMs)이 있는 것으로 알려진 환자로부터 채취한 혈액을 샘플에 적용하였다.
브라질의 아나 캐롤라이나 데 마토스 제리(Ana Carolina de Mattos Zeri) 박사팀은 이식 후 사망률의 주요 원인인 이식 대 숙주질환(GVHD: graft vs. host disease)의 진단에 사용할 수 있는 바이오 마커 패널을 개발의 중요성을 설명하였다. nuclear magnetic resonance (NMR) 및 gas chromatography coupled to time-of-flight(GC-TOF)를 사용하여 hematopoietic stem cell transplantation(HSCT)을 받은 18명의 브라질 환자의 혈청 대사 물질 이식 날을 기준으로 –10일 , 0일, +10일, +100일로 나누어 분석하였다. 환자들은 +10일과 +100일에 branched-chain amino acids(BCAAs)인 leucine과 isoleucine이 감소하였고, 황 함유 대사산물인 cystein은 증가하였다. BCAAs 결과는 이식 후 +100일인 49명의 북미 환자들에게서 liquid chromatography coupled to tandem mass spectrometry(LC-MS/MS)를 통해 검증 되었다. 이 연구는 cGVHD를 예측하고 이해하기 위해서 다변량 바이오 마커 패널의 중요성을 강조한다.

주) (A) methylmalonic aciduria(MMA)에서의 대사 이상; (B) MMA는 비오틴 결핍 및 호모시스테인 혈증을 비롯한 여러 중요한 대사 이상과 관련; (C) 선천적인 신생아 신진 대사의 특징적인 대사 산물 프로파일
출처: Analytica Chimica Acta, 2018
[그림 3-14] IEMs 환자의 혈액 샘플에서 표적화된 대사체 프로파일링

주) (A) +10일 및 +100일에 시스틴 및 루신 농도를 나타낸 heat map; (B-F) 각 대사 산물의 receiver operating characteristic(ROC) curves; (G) 대사 산물의 composite를 나타낸 ROC curve.
출처: Frontiers in Oncology, 2019
[그림 3-15] cGVHD가 없는 환자의 BCAA와 cGVHD 환자의 차이를 확인할 수 있는 clustering analysis
미국의 윌리엄 알 셀러(William R. Sellers) 교수팀은 암의 대사 다양성을 이해하기 위해 liquid chromatography–mass spectrometry(LC-MS)를 이용하여 cancer cell line encyclopedia (CCLE)에 있는 20개 이상의 암 형태에서 928개 세포주의 225개 대사체를 분석하였다. 바코드화 된 세포주를 스크리닝함으로써, 비정상적인 ASNS hypermethylation이 위암 및 간암의 일부에서 asparaginase therapy를 sensitize함을 확인하였다. 또한 모델 암세포 주에서 면역 억제성 대사 산물인 kynurenine의 독특한 합성 및 분비 패턴이 나타냄을 드러냈다. 이 연구 결과는 암 대사를 명확하게 하는데 도움이 될 자원을 제공한다.


주) (A) CCLE cell line의 중앙값을 갖는 kynurenine 농도; (B) 선택된 세포주에서 분비된 kynurenine 수준과 비교하여 세포 내 kynurenine 수준을 나타내는 scatter plot; (C) 모든 유전자 전사체와 주요 계통에서 컨디셔닝된 kynurenine의 기초수준에 근거한 통계치; (D) IDO1 또는 TDO의 mRNA 수준; (E) IDO1과 TDO의 발현을 기준으로 kynurenine 수준이 높은 세포주의 분류; (F) IDO1/TDO mRNA 전사체에 근거한 TCGA 종양 샘플의 분류; (G) IDO1, TDO 또는 둘 다의 발현을 갖는 세포주에서 kynurenine의 분비. ELISA 분석의 검출 한계는 0.1 µM.
출처: Nature Medicine, 2019
[그림 3-16] CCLE에서 kynurenine metabolism
(2) Lipidomics 분야
주) 각 box의 색상은 임상 진단의 단변수 로지스틱 회귀 베타 계수(log [OR]) 또는 공변량을 보장한 후 인지 저하 및 뇌 위축율에 대한 단변량 선형 회귀 베타 계수를 나타냄. 각 box에서의 star은 결합의 세기 정도를 표현.
출처: Alzehimer’s & Dementia, 2017
[그림 3-17] 각 표현형에 대한 random forest analyses 중에 선택된 특징 간의 단변량 연관의 heatmap
영국의 Petroula Proitsi 박사팀은 untargeted lipidomic analysis를 사용하여 148명의 AD 환자와 152명의 대조군을 분석하였다. 지질 분자와 모든 표현형 사이의 새로운 연관성을 확인하였으며 콜레스테롤 에스테르・트리글리세리드(cholestryl esters/triglycerides)와 포스파티딜콜린(phosphatidylcholines)을 비롯한 많은 대사 기능을 추정하여 확인하였다. 혈중 지질을 AD의 새로운 치료 전략으로 이어질 수 있는 유망한 바이오마커로 제시한다.
미국의 존 에이 보든(John A. Bowden) 박사팀은 Standard Reference Material(SRM) 1,950개의 사물을 사용하여 인간 혈장의 지질에 대한 실험실 간 비교 실험을 진행하였다. 모든 실험실에서 총 1,527개의 독특한 지방질이 측정되었다. 또한, 5개 이상의 참여 실험실에 의해 측정된 339개의 지질에 대해 일치된 위치 추정 및 불확실성이 결정되었다. 이는 실험실 간 품질관리 및 방법 검증을 위한 표준화 역할을 한다.

주) 5개 이상의 실험실에서 조사된 지질 평균의 중간 값(median of means)의 분산계수를 퍼센트로 나타낸 값. 그림의 각 점은 단일 총 지질 구성을 나타냄. 이는 표준 불확도를 최종 평균의 중간 값으로 나눔으로써 계산
출처: Journal of Lipid Research, 2017
[그림 3-18] 인간 혈장의 지질에 대한 실험실 간 비교 실험 값
프랑스의 에이치 블라스코(H. Blasco) 교수팀은 Amyotrophic lateral sclerosis(ALS) 환자의 뇌척수액(CSF)에서 lipidomic signature을 질량 분석법을 통하여 질병의 진단 및 예측 값을 평가했다. 임상에서 병의 진화와 관계있는 중요한 마커로 스핑고마이엘린(sphingomyelins)과 중성지방(triglyceride)을 주장한다.

주) ALS 환자를 구별하기 위해서 다변량 분석으로 강조된 지질로 구성된 벤다이어그램. 특히 이 플롯에서 ALS, 즉 triglyceride(16:0/16:0/18:1) 및 triglyceride(18:0/16:0/18:1)의 경우 생존과 관련 있는 지질임을 보여줌.
출처: Scientific Reports, 2017
[그림 3-19] 질량 분석법을 통한 ALS 질병 진단 벤다이어그램
미국의 찰스 안송(Charles Ansong) 박사팀은 정상적인 폐 발달지질체(lipidome)의 변화에 대한 특성분석을 진행했다. 정상적인 출생 후의 폐 발달 동안 쥐의 lipidome을 조사하기 위해 liquid chromatography-tandem mass spectrometry(LC-MS/MS)를 사용했다. 6∼8주령 쥐의 폐에 대한 lipidomics 분석 결과 21개의 지질 하위 클래스에 924개의 독특한 지질이 확인되었으며, 발달 단계를 거쳐 지질의 급격한 변화가 발생했다.

주) Pro-apoptotic sphingolipid종은 성인 폐에 비해 active alveolarization을 겪고 있는 마우스 폐에서 가장 풍부하게 관찰됨.
출처: Scientific Reports, 2017
[그림 3-20] 마우스 폐에 대한 lipidomics 분석 결과
스페인의 오스카르 파스토르(Óscar Pastor) 박사팀은 인간에서 오메가3 지방산 보충제의 효과를 평가하기 위한 체내에서의 적절한 바이오마커 동정 및 특성을 규명하기 위해 도코사핵사엔산(DHA: docosahexaenoic acid)이 풍부한 해초 기름을 보충한 후 무작위로 조절된 낭포성 섬유증 환자(![]() =50)의 혈장 지질을 분석하였다. 지방산 보충 12개월 후, DHA는 고도로 불포화된 콜레스테롤 에스테르와 포스파티딜콜린에 주로 포함되었으며, 포스타티딜에탄올아민(phosphatidylethanolamine) 및 트리글리세라이드에는 적었다. 또한 DHA/아라키돈산(arachidonic acid) 비율을 신속하게 측정하여 DHA가 풍부한 식품의 영양관리를 간소화 하였다.
=50)의 혈장 지질을 분석하였다. 지방산 보충 12개월 후, DHA는 고도로 불포화된 콜레스테롤 에스테르와 포스파티딜콜린에 주로 포함되었으며, 포스타티딜에탄올아민(phosphatidylethanolamine) 및 트리글리세라이드에는 적었다. 또한 DHA/아라키돈산(arachidonic acid) 비율을 신속하게 측정하여 DHA가 풍부한 식품의 영양관리를 간소화 하였다.

주) (A) LC-MS; (B) GC-MS로 분석한 placebo와 DHA 보충 환자의 혈장 농도
출처: The Journal of Nutritional Biochemistry, 2019
[그림 3-21] LC-MS와 GC-MS 간의 지방산 비교 분석
(3) Microbial 분야

주) (A) 대조군과 Pex5-i, Pex7-i cell에서 대장균에 감염되었을 때 H2O2 상대적 양 비교; (B) Rod-shaped mCherrv-E.coli와 접촉한 Pex5-i, Pex7-i 세포는 ROS의 양이 증가됨.; (C) 감염되지 않은 대조군을 1로 normalize 시킨 후 ROS 값 나타냄.; (D) 지정된 유전자형 및 조건의 세포에 의해 표면 내재 된 대장균 세포의 백분율; (E) 10mM H2O2로 16시간 동안 처리된 대조군 세포에서 actin(녹색)의 분포는 더 disorganized 됨.; (F) 각 샘플에서 H2O2의 양 비교.
출처: Immunity, 2017
[그림 3-22] Peroxisome은 세균 감염 동안 H2O2 turnover를 조절
캐나다의 앤드류 제이 시몬즈(Andrew J. Simmonds) 교수팀은 선천적 면역반응(innate immune response)에서 초파리 및 마우스 대식세포(mouse macrophages)에 의한 박테리아의 engulfment에 지방산(peroxisome)이 필수임을 확인했다. Peroxisome은 또한 canonical innate immune 신호를 통한 박테리아의 감염의 해결에 필요함을 확인했다. 감소된

주) 주요 발효 미생물인 G. apicola와 Lactobacillus sp.를 포함한 기존의 내장 미생물은 숙주 성장을 촉진 시키는 SCFAs 생성. 소화관 벽과 관련된 S. alvi는 창자에서 가장 풍부한 SCFA인 acetate를 사용하여 장으로 침투하는 O2를 효율적으로 제거하고 안정적인 구배 유지. 창자 microbiota의 존재는 host의 체중 증가, 호르몬 신호와 관련된 유전자의 발현 증가 자극.
출처: PNAS, 2017
[그림 3-23] 미생물이 꿀벌 건강에 미치는 영향
peroxisome 기능은 감염과 싸우기 위해서 필요한 산화폭발의 turnover를 손상시켰고 이는 세포 및 생체의 생존에 영향을 주었다.
독일의 하오 젱(Hao Zheng) 교수팀은 병원균 보호 및 영양 기능에 있어서 honey bee gut communities의 잠재적 개입과 관련해 꿀벌 건강에 미생물이 끼치는 영향을 확인했다. 특히 소화관 미생물군(microbiota)이 개개의 전신과 내장 모두에서 체중 증가를 촉진한다는 것을 확인했다. 미생물 대사가 휘발성지방산의 생성을 통해 장내 수소이온농도지수(pH)와 산화 환원 전위를 현저하게 감소시키고 장벽에 인접한 박테리아가 장내에서 산소 구배(기울기)를 형성한다는 것을 발견했다. 이를 통해 꿀벌 내장의 미생물이 다른 동물에서 발견되는 것과 유사한 기본적인 역할을 하여 숙주-미생물 상호 작용 연구에 모델이 됨을 알았다.
중국의 아 지예(Jiye Aa)교수 팀과 왕 광지(Guangji Wang) 교수 팀의 공동 연구는 베르베린(berberine)의 주 작용 부위가 장(gut) 및 장 파네소이드 수용체(FXR: intestinal farnesoid X receptor)이기 때문에 지질대사에 중요한 역할을 함을 가정하여, 장내 FXR 신호에 대한 berberine의 효과를 토대로 약리학적 효과를 설명할 수 있다고 가정하였다. 연구의 결과로 berberine이 담즙산의 전환을 조절하고 그 결과 ileal FXR 신호전달 경로를 조절함으로써 장내에서 주로 지질 강하 효과를 나타낼 수 있음을 알 수 있다. 이 연구는 장에서의 berberine의 역할에 대한 새로운 매커니즘을 제시하고, 이는 bile salt hydrolase를 억제시키고 tauro-cholic acid를 증가시켜 farnesoid X receptor을 활성화 시켜 Cd36의 간염 발현을 억제함을 제시한다.

주1)(A) 간에서 Ppara, Srehp-1c, Acc 및 Fas 유전자의 상대적인 mRNA 수준; (B) 간에 있는 Cyp4a10, Mtp, ApoB 및 Cd36 유전자의 상대적 mRNA 수준; (C) Distal ileum의 Fgf15, ibabp 및 OSTb 유전자의 상대적 mRNA 수준; (D) 간에서 Fxr, Shp 및 Cyp7a1 유전자의 상대적 mRNA 수준
주2) Berberine은 장내 Fernesoid X receptor의 신호 전달 경로를 억제하였으나, FXRint2/2 mice에서 Cd36의 발현을 변화시키지는 않음. BBR 또는 vehicle(CMC-Na) 처리 후 8주 간 FXRint2/2 마우스 간장에서 total RNA를 분리하고 RT-qPCR을 수행하여 유전자의 발현을 측정.
출처: Molecular Pharmacology, 2017
[그림 3-24] 장내 FXR 신호 전달 경로 조절에 따른 유전자 발현 측정값
스페인의 수잔 차모르(Susana Chamorro) 박사팀은 2.5 및 5.0g/kg의 포도종자추출물(GE: grape extract)의 식이보충제가 폴리페놀의 장내 이용 및 닭의 장 건강에 미치는 영향을 측정하였다. 벤조산, 페닐아트산, 하이드로신남산, 계피산과 phenyl-γ-valerolactone phenolic 대사체들이 GE 사료에서 높았으며, 이는 포도 폴리페놀의 미생물 대사 때문임을 확인했다. GE 사료를 먹은 새에서 대장균과 유산균의 박테리아 개수가 감소하였고 전반적으로 닭에서 포도 폴리페놀의 광범위한 장내 이용 및 미생물 대사를 확인 할 수 있었다. 또한, 21일 동안 지속적으로 포도 폴리페놀을 섭취하면 항균제와 mucin-modulation 효과가 있음을 관찰하였다.

출처: Royal Society of Chemistry, 2019
[그림 3-25] 포도 추출물(GE) 2.5와 5g/kg를 먹은 병아리에서 폴리 페놀류의 ileal과 excreta에서의 digestibility
(4) Food & Plant 분야
독일의 마르쿠스 피셔(Markus Fischer) 교수팀은 20가지 비극성 대사 산물을 기반으로 한 지리적 원산지 구별을 위한 표적 대사체학(targeted metabolomics) LC-ESI-QqQ-MS 응용 프로그램을 개발하여 승인된 가이드라인에 따라 검증하고, 6개국의 202개 정통 헤즐럿(authentic hazelnut)의 정량분석을 진행했다. 국가 간 대사 산물 수준의 유의한 변화를 탐지하였으며, 100%의 훈련정확도와 97%의 교차검증 정확도를 얻었다. 이는 헤즐럿(hazelnut)의 지리적인 기원을 확인 할 수 있고, 일상 분석에서의 적용 가능성에 대한 적합성을 입증한다.

출처: Journal of Agricultural and Food Chemistry, 2017
[그림 3-26] 스케일링된 값으로 표시된 각 국가에 대한 hazelnut sample의 spider diagram
필리핀의 유테 로에스너(Ute Roessner) 교수팀은 기체 크로마토그래피-질량분석(GC-MS: gas chromatography-mass spectrometry)을 이용한 비표적 대사체학(untargeted metabolomics) 방법을 사용하여 더 일반적인 생강(ginger)인 zingiber officinal rosc의 잎과 뿌리줄기(rhizomes)의 대사 구성을 비교했다. 주성분 분석(PCA)은 다른 종들의 상당한 화학적 분포를

주)(A) PCA score plot; (B) loading plot; (C) VIP value 상위 60개 metabolite.
출처: Phytochemistry, 2017
[그림 3-27] GC-MS를 이용한 생강과 대사 분석
보여주며, 다른 생강과 식물들 사이에 잠재적 마커를 밝혀냈다. 이는 희귀식물에 대한 최초의 대사체학 연구이며, 일반적인 생강 잎의 가능성을 평가하고 조사가 미흡한 식물을 탐구할 때, 비표적 대사체학 프로파일링의 유용성을 확인했다.
미국의 마리 씨 플레이돈(Mary C. Playdon) 박사팀은 식이 요법과 유방암 사이의 연관성에 대한 역학적 증거가 거의 없고 병인 기작이 불분명하기 때문에 유방암의 위험과 식이 관련 대사 물질의 관련성을 평가했다. 113가지 식이 관련 대사 산물 중 3가지가 유방암 위험도와 관련이 있었고, 이는 대위(capate), Y-토코페롤 γ-carboxyethyl hydro- chroman, 4-androsten-3β, 17β-diol-monosulfate이다. 특히 알콜, 비타민 E 및 동물성 지방과 관련된 전립선 혈청 농도의 대사 물질은 ER+ 유방암 위험과 비교적 밀접한 관련이 있음을 확인했고, 영양 대사체가 암 위험을 조절하는 식이 관련 노출을 식별할 수 있음을 시사한다.

주) 대사 산물은 육각형으로 그려지고, 조건 상관> 0.2 의 절댓값을 갖는 쌍은 서로 선으로 연결. 분홍색 선은 양의 조건 상관을 나타냄. 분홍색으로 강조 표시된 대사산물은 ER+ 유방암과 관련 있음.
출처: The American Journal of Clinical Nutrition, 2017
[그림 3-28] 암 검진 임상 시험 내에서 중첩 된 환자-대조 연구에서 측정된 113가지 식이 관련 대사산물의 Gaussian graphical model
독일의 마르쿠스 피셔(Markus Fischer) 교수팀은 식물 대사체학(plant metabolomics)에서 광범위하게 적용되는 ultrahigh-performance liquid chromatogrphy-electrospray ionization/quadrupole-time-of-flight mass spectrometry를 사용한 nontargeted 방법에서 이온화 공정을 개선했다. 또한, 양이온 및 음이온 모드에서 가능한 많은 피크 농도로 많은 대사산물을 검출하기 위해 다양한 이동상 첨가제를 시험하고, 어느 이동상을 사용 하였을 때 최상의 peak를 얻을 수 있는지 확인했다. positive mode에서 극성 대사산물에 대한 최상의 결과는 0.1% acetic acid를 사용하였을 때이고, negative mode에서는 0.1% formic acid를 사용하였을 때 최상의 결과를 보였다. 비극성 대사산물의 분석에서는 positive mode를 사용하였을 때는 10mol/L ammonium formate를 사용하였을 때가, negative mode에서는 0.02% acetic acid를 사용하였을 때가 최상의 결과를 보였다.

출처: Analytical Chemistry, 2017
[그림 3-29] non polar한 화합물을 positive ionization mode에서 확인하였을 때의 상대적인 intensity 비교
중국의 Xujin Wu 박사팀은 딸기의 성숙을 조절하는데 일반적으로 사용되는 plant growth regulator(PGRs) metabolomic 효과의 포괄적인 평가를 확인하기 위해 nuclear magnetic resonance(NMR) 기반의 접근법을 사용하여, 딸기의 대사산물 발현에 대한 두 가지 성숙 단계에서 적용된 gibberellin과 forchlorfenuron 및 brassinolide의 규제 효과를 평가 했다. PGR이 신진 대사에 영향을 미친다는 것을 입증하였으며, 동일한 성장 기간에 적용 했을 때, 이들 PGR이 유사한 대사 경향을 나타냄을 발견했다.

주) 이 네트워크에서 node는 상관된 대사 경로를 나타내며, 두 node 사이의 선은 두 경로 관련 대사 산물 간의 생물학적 관계를 나타냄.
출처: Food Chemistry, 2018
[그림 3-30] 주요 경로와 관련된 pathway enrichment analysis
인도의 디네시 쿠마르(Dinesh Kumar)박사팀은 대사 산물의 flux와 quality control purpose를 위해 식물 조직 내의 화학적 조성 연구가 필요하기 때문에, NMR을 사용하여 다양한 tissue(leaves, flowers, stems, fruits, seed)의 metabolite profiling을 진행했다. amygdalin(seeds), rutin(flowers), isovitexin(fruits), shikimic acid(leaves) 그리고 epicatechin (stems)이 상대적으로 C. rhipidophylla tissues를 구별하는 마커로서 확인되었다. NMR 기반의 포괄적인 대사산물 정보를 사용하여 C. rhipidophylla tissues의 화학적 다양성, chemical signature, quality control chemical markers을 이해하는 데에 도움이 될 수 있다.

주) C. rhipidophylla의 다른 부분에 있는 탄수화물, 아미노산, 유기산 및 페놀산의 농도. LA, 잎; FrA, fruit; FlA, flower; SeA, seed; StA, stems
출처: Analytical and Bioanalytical Chemistry, 2019
[그림 3-31] 다양한 tissue의 metabolite profiling

주) C. rhipidophylla의 다른 부분에 있는 플라보노이드, triterpenic acids, verbascoside, amygdalin, choline 및 stigmasterol의 농도. LA, 잎; FrA, fruit; FlA, flower; SeA, seed; StA, stems
출처: Analytical and Bioanalytical Chemistry, 2019
[그림 3-32] C. rhipidophylla tissue의 화학적 다양성
다. 국내 연구 동향
한국기초과학지원연구원에서는 나이 관련 골다공증은 뼈의 무기화 감소와 뼈의 강도 감소로 골절의 위험이 증가함으로 5개월과 28개월의 수컷 C57BL/6J 생쥐의 경골 및 대퇴골 뼈 조직에서 지질과 극성 대사 물질을 프로파일링하여 연령 관련 골 손실과 관련된 대사 변화를 조사했다. 젊은 생쥐와 늙은 생쥐의 뼈 조직에서 대사산물 수준의 차이가 나타났다. 특히 쥐 독소 대사 물질(p-cresyl sulfate, hippuric acid, indoxylsulfate)은 어린 생쥐보다 늙은 생쥐의 골 조직에서 더 높았다. 이 연구를 통해 연령 관련 골 손실 동안 발생하는 대사 변화를 확인하고, 골다공증의 잠재적인 바이오마커를 식별 할 수 있음을 입증한다.

주) (A) 골 조직 추출물의 총 이온 크로마토그램 및 MRM 크로마토그램; (B) 뼈 조직 추출물에서 p-cresyl sulfate, indoxyl sulfate, and hippuric acid의 농도
출처: Scientific reports, 2018
[그림 3-33] 뼈 조직에서의 요독 독소 대사 물질 정량
연세대학교에서는 일반적으로 발견되는 5개의 암(간, 폐)에서 얻은 환자 혈액 샘플의 지질 프로파일을 밝히기 위해 나노 수준의 초고성능 액체 크로마토그래피-전기 분무 이온화 텐덤 질량분석(nUHPLC-ESI-MS/MS)을 사용하여 분자 수준에서 포괄적인 지질 분석을
수행했다. 위장, 결장, 직장 및 갑상선을 건강한 대조군의 지질 프로파일과 비교했다. 지질종은 두 종류 이상의 암과 유의한 관련이 있으며, 리소포스파티딜에탄올아민 앤 폴리에틸렌 플라스말로겐(lysophosphatidylethanolamine and PE plasmalogen)을 포함한 포스파티딜 에탄올 아민 종은 4가지 암종에서 유의하게 낮았지만 갑상선암에서는 높았다. 이 결과로 높은 진단 능력을 가진 특정 암 지질 마커의 미래 검증을 위한 기초를 제공함을 시사한다.
국민대학교에서는 Guillain–Barré syndrome(GBS)은 주로 말초 신경계에 영향을 미치는 자가 면역 기전에 의한 급성 치명적인 진행성 질환이지만 각 유형의 특정 생체 표지 및 정확한 병적 메커니즘이 알려지지 않음에 기반을 두어 통합 대사 및 지질 프로필을 86명의 GBS 뇌척수액 샘플로부터 획득하여 분석했다. 리소-포스파티딜콜린 앤 스핑고마이엘린(lyso-phosphatidylcholines and sphingomyelins)의 유의적 상승이 AIDP(급성 염증성 탈수 초성 다발성 신경 병증)와 AMAN(급성 운동 신경 축산 신경 병증)에 각각 독특한 GBS 변이종 특이적인 변화를 나타냄을 확인했다. 이 결과로 1차 대사산물과 지질의 구조에 대한 bayesian 네트워크 분석이 병리학과 관련된 잠재적인 생화학적 연계와 대사 허브와 관련 있음을 시사한다.
건국대학교에서는 누룩곰팡이(Aspergillus oryzae) 및 세균(Bacillus amyloliquefaciens)의 다양한 순열을 이용하여 발효된 누룩의 효소 활성 및 대사산물 프로파일링을 조사했다. 누룩곰팡이속(Aspergillus)으로 접종된 누룩샘플(MA), Aspergillus 먼저 접종 후 순차적으로 Bacillus로 접종된 누룩샘플(SA) 및 공동 접종(CO)한 샘플에서 설탕 및 당 알코올의 상대적 수준이 높을수록 주요 대사산물의 양이 많았으며, 이는 각 샘플의 상대적 아밀라아제 활동에 상응함을 나타냈다. 이 결과로 산업 효소 준비를 위한 발효성 접종의 최적 순열을 달성하기 위한 통합 생화학 대사 방법의 유용성을 강조한다.

출처: Analytica Chimica Acta, 2019
[그림 3-34] 여러 종류의 암에서 대조군과 비교하여 각 지질 종의 유의적인 배수 변화(>2배) 확인

주) (A) AIDP, (B) AMAN, 그리고 (C) MFS에서의 가장 높은 (분홍색) 및 가장 낮은 (하늘색) 대사산물이 다른 그룹과 각각 비교됨.
출처: Scientific reports, 2019
[그림 3-35] GBS 변이종 특이적 지질 분자의 동정

주) 다양한 접종 순열을 가지고 72시간 후에 발효됨.
출처: J. Microbiol. Biotechnol, 2018
[그림 3-36] Koji에서의 주요 대사 경로
고려대학교에서는 갈조류의 주요 단량체 당류인 L-fucone(푸코스)가 바이오기반 제품의 대규모 생산에 사용될 가능성이 높지만 아직까지 대장균과 같은 산업 미생물의 세포 내 대사에 대한 탄소원으로써의 fucose의 효과가 아직 밝혀지지 않아, 세포 대사에 미치는 영향을 밝히고 바이오기반 제품으로 효율적으로 전환시키기 위해 대장균에서 L-fucose와 D-glucose(글루코스)를 대조군으로 하여 비교대사 및 전사체 분석을 진행했다. 이 연구 결과를 통해 fucose를 함유한 갈색 거대 조류를 사용하여 대장균이 바이오 기반 제품을 생산하는 대사 공학을 돕는데 사용될 수 있음을 확인했다.

주) fucose 및 glucose로 배양된 exponential phase의 (A) 중심 탄소 대사 및 (B) 대장균의 보조 인자 존재량의 전사체 농도 비교. 전사 수준의 유의한 변화는 색상의 변화로 확인할 수 있음.
출처: Marine Drugs, 2019
[그림 3-37] L-fucose와 D-glucose의 비교대사 및 전사체 분석
라. 발전 과제
향후 대사체학 연구는 크게 네 가지 적용분야로 발전될 가능성이 있다. 먼저, 다양한 시료 수집에 맞는 시료 채취 절차의 표준화와 시료분석 단계에서 시료 전처리 방법 및 초정밀 기기분석법의 표준화 정립에 적용될 수 있다. 또한, 대용량의 데이터를 단순화하고 상관성을 찾을 수 있는 데이터 마이닝 기술, 통계기법, 단세포 대사체학(single cell metabolomics)를 위한 하드웨어 및 소프트웨어 기술이 발전될 것으로 보인다. 한편, microbiome-metabolome interraction의 발전을 유도하는 다중오믹스(multi-omics) 연구와 관련한 적용 기술로서도 주목받을 전망이다.
이렇듯 다양한 대사체학 연구의 발전을 통해 기존의 생물학, 생화학적인 이론에 적용하고 질병의 원인 및 기전을 규명함으로써 맞춤의학 발전이 활발해질 전망이다. 안정적인 동위원소비율(stable isotope)을 이용하는 동위원소 대사체학(isotopomer metabolomics)의 신진대사플럭스(metabolic flux) 연구는 환경 분야에서의 노출정도 평가, 식품분야에서의 원산지 판별, GMO 식품의 위해도 평가 연구 등에 적용 가능성이 점차 대두되고 있다. 또한 다중오믹스(multi-omics) 연계 연구는 질병의 원인 규명을 더욱 명확히 설명할 수 있을 것이며, 단순히 바이오마커를 도출하는 목적이 아닌 생물학적 과정(biological process)을 해결할 수 있는 활동 대사체학(activity metabolomics)의 발전도 기대된다.

출처: Nature Review, 2019
[그림 3-38] 대사체 활동을 설명하는 activity metabolomics의 개념 및 흐름도
5. 구조생물
가. 구조생물학의 개요
구조생물학은 1950년대에 X-선 결정학(X-ray crystallography) 기술에 의한 DNA 이중나선과 미오글로빈의 입체구조 규명을 시작으로 생명현상의 비밀을 밝히는 생물학을 현대생물학으로 발전시키는데 중요한 역할을 했을 뿐 아니라 신약개발에도 크게 기여해 온 학문이다. 중요 단백질의 생물학적 기능을 이해하고 설계 또는 변형을 위해서는 원자수준의 정보 확보가 필수적이기 때문에 구조생물학 기법을 이용해야만 가능하다. 구조생물학에 사용되는 구조 분석 기술은 X-선 결정학을 비롯하여 다양한 방법이 있고 기술특성에 따라 분석되는 단백질 구조 해상도의 범위가 다르다. 최근 구조생물학은 두 가지 새로운 기술인, 결정화가 되지 않는 단백질의 구조를 규명할 수 있는 초저온 전자현미경법(cryo-EM: cryo-transmission electron microsope)을 이용한 단일입자분석(single particle analysis) 기술과, 나노미터 크기의 작은 단백질 결정도 구조 규명이 가능한 4세대 가속기(XFEL: X-ray free electron laser)를 활용한 기술 방법이 개발되면서 혁명적인 연구 변화가 이루어지고 있다. 이러한 혁신적인 기술 변화는 고난이도의 세포막 단백질이나 대형 복합체 단백질 구조 분석에 획기적인 돌파구를 열어 놓고 있다.

[그림 3-39] 생물 시료에 따른 구조 분석 기술 분류와 해상도 분포
나. 해외 동향
2019년 7월 기준 단백질구조 데이터 뱅크(Protein Data Bank)에 등록된 단백질 구조는 약 15만 4,000개로 이중 X-선 결정학 기술에 의해 분석된 구조는 13만 7,000개, 핵자기공명분광학(NMRNuclear Magnetic Resonance Spectroscopy) 기술에 의해 1만 3,000개 그리고 cryo-EM 방법에 의한 3,700개의 구조가 분석되었다. 매우 특징적인 변화는 2013년 이후 cryo-TEM을 활용하여 밝힌 구조의 수가 급격히 증가하고 있는 것이다.

[그림 3-40] Cryo-EM 기술에 의해 분석되어 단밸질구조 데이터 뱅크(Protein Data Bank)에 등록된 구조 수(2019.8.)
Cryo-EM 기술로 혁신적인 구조생물학 분야의 발전을 이루게 되어 기존에 X-선 결정학 또는 NMR과 같은 기술을 통해 분석하기 어려웠던 막단백질3)과 거대 단백질 복합체 구조 규명이 가능하게 되어 생명 현상의 새로운 기전 규명이 가속화 되고 있다.

[그림 3-41] Cryo-EM 기술에 의해 분석되는 거대 단백질 복합체
특히 세포 전체 단백체 중 30%을 차지하는 막단백질은 의약품 타깃의 50% 이상을 차지하는 핵심으로 이 중 G protein-coupled receptor가 신약 개발 타깃의 30% 이상을 차지하고 있다. 이러한 막단백질의 중요성에도 불구하고 단백질 생산 및 결정화가 매우 어려운 문제점으로 인해 막단백질 구조는 전체 단백질 구조의 1%(약 700 개)가 분석된 상황이다. 따라서 결정화 과정이 필요 없고 소량의 정제된 단백질 용액으로 구조 분석을 할 수 있는 특성의 cryo-EM 기술로 인해 막단백질의 구조 분석이 가속화되고 있다.
이러한 이유로 다수의 대형 제약사들이 컨소시엄을 구성하여 초기 신약 개발 단계부터cryo-EM 기술을 도입하여 활용하고 있고 대표적인 예로서 Thermo Fisher는 Astex Pharmaceuticals, AstraZeneca, GlaxoSmithKline, Heptares Therapeutics, UCB와 캠브리지 대학교의 MRC 분자생물학연구실과의 최첨단 cryo-EM 장비 활용 컨소시엄 구성을 통해 신약 개발을 시도하고 있다(Nature Reviews Drug Discovery, 2018). 결론적으로 최신 구조생물학의 연구 기술은 X-선 결정학과 NMR 기술로부터 cryo-EM 기술 기반 연구 방향으로 급속히 전환되었다.
다. 국내 현황
미국, 유럽, 일본, 중국 등의 연구 환경과는 매우 다르게 국내 cryo-EM을 활용한 구조생물학 연구는 매우 뒤떨어진 상황으로 열악한 국내 연구 환경에 기인한 결과로 사료된다. 2019년 현재 한국기초과학지원연구원에 DDD 카메라가 탑재된 고성능 cryo-EM 장비(Titan Krios, Thermo Fisher Scientific, Inc.)가 유일하게 활용되고 있고 초기 스크리닝 분석부터 데이터 수집 및 분석까지 국내 모든 구조생물학 연구자가 의존하고 있는 실정이다.

[그림 3-42] Thermo Fisher 생산 기준 국가별 Cryo-EM 설치 현황
한편 포항가속기연구소(PAL)은 3세대 가속기 운영에 이어 첨단 기술의 집약체인 4세대 방사광 가속기 XFEL 시설(PAL-XFEL)을 2016년에 미국과 일본에 이어 세계 3번째로 설치하여 운영 중에 있다. XFEL은 펨토초(10∼15초)의 짧은 시간 X-선 펄스를 이용하여 현대 구조생물학의 한계인 분자세계에서 일어나는 신속한 반응을 규명할 수 있는 새로운 물리학적 방법이다.
기존의 3세대 가속기를 이용한 구조 분석 연구를 위해서는 10∼50 마이크론 사이즈의 단백질 결정이 필요한 반면 XFEL은 획기적으로 나노 사이즈의 결정을 이용하여서도 구조 규명이 가능한 기술이다. 생물학에서 가장 중요한 고난이도 막단백질이나 거대 단백질 복합체의 경우 3세대 가속기를 활용 구조 분석을 위한 사이즈의 결정 형성이 매우 어렵거나 불가능하다. 이러한 면에서 4세대 가속기는 기존의 3세대 가속기와 비교 시 수억 배 더 강한 빔을 내기 때문에 1마이크론 이하의 나노 사이즈 결정으로도 구조 규명이 가능하여 막단백질이나 거대 복합체 단백질 구조 연구에서 더욱 큰 파급효과가 있을 것으로 예상된다.
또한 XFEL은 단백질 시분해 동력학 연구가 가능한 기술이다. 단백질 결정을 이용한 단백질 동력학 연구는 기술적인 한계가 있었다. 생물학적으로 중요한 단백질의 구조 변화는 마이크로에서 밀리초 단위에서 이루어지므로 이렇게 빠른 구조 변화를 연구하기 위해서는 결정의 회절 능력이 정지상 구조 연구에 비하여 월등히 강하여야 하며, 회절 패턴도 더욱 뚜렷하게 확보하여야 한다.
이러한 한계로 인해 결정 상태에서의 단백질 동력학 연구의 광범위한 파급 효과를 기대하기는 어려운 상황이었다. 4세대 XFEL 가속기를 활용하면 3세대 가속기에 비하여 훨씬 작은 크기와 열악한 회절 패턴을 가지는 대부분의 결정을 가지고도 동적인 단백질 구조 변화를 연구할 수 있어 다양한 단백질들의 동력학 연구가 가능해질 것으로 기대하고 있다.

[그림 3-43] 포항가속기연구소에 설치된 4세대 방사광가속기 PAL-XFEL
라. 전망
최근 구조생물학 연구는 X-선 결정학 및 NMR 기술과 더불어 cryo-EM 기술 도입으로 인해 급변화가 이루어지고 있다. Cryo-EM의 혁신적인 기술 발전으로 소위 ‘Resolution Revolution’이라는 고해상도 구조 규명이 가능해지면서 특히 막단백질 구조생물학 연구에 큰 변화를 가져올 것으로 예상된다. 또한 생명 유지를 위해 필요한 기능의 DNA복제, 전사, 단백질 합성, 단백질 수식, 유비퀴틴화 등은 매우 정교한 조절이 필요한 과정으로 거대 단백질 복합체에 의해 조절되고 있다. 이러한 생명 현상들은 그동안 기술적 한계로 인해 대부분 정확하게 밝혀지지 않은 상황으로 cryo-EM 기술 활용 연구는 단백질 복합체들의 구조, 기능, 생명 조절 연구에서 큰 변화 및 발전을 가져올 것으로 기대하고 있다. 따라서 이러한 변화는 기초과학으로부터 신약 개발 전반에 필요한 생물학 및 의과학 연구 분야에 지대한 영향을 끼칠 것으로 전망한다.
또한 세포 내에서 단백질은 구조를 변화시키면서 생물학적 시스템을 조절함에도 불구하고 현재까지 대부분 단백질 구조 연구가 정적인 상태의 구조에 집중되어 있었던 상황과 다르게 XFEL의 강한 X-선 빔을 활용하여 다양한 단백질들의 시분해 구조 변화 연구가 활발히 이루어져 세포 환경에 따른 단백질 구조 변화의 핵심 원리를 이해할 수 있게 될 것으로 기대한다. 아울러 이와 관련해서 질환 발생 원인을 정확하게 규명하는 계기를 마련할 수 있을 것으로 전망한다. 이러한 연구 환경 및 방향 변화에 따른 국내 구조생물학 연구도 혁신과 변화가 필요한 중요한 시기인 점을 고려해야 한다.
참고자료
-Cheng Y, Single-particle cryo-EM-How did it get here and where will it go. Science 361(6405): 876-880, 2018
-Clare DK, Siebert CA, Hecksel C, Hagen C, Mordhorst V, Grange M, Ashton AW, Walsh MA, Grunewald K, Saibil HR, Stuart DI, Zhang P, Electron Bio-Imaging Centre(eBIC): the UK national research facility for biological electron microscopy. Acta Crystallogr D Struct Biol. 73(Pt 6):488-495, 2017
-Ceska T, Chung CW, Cooke R, Phillips C, Williams PA, Cryo-EM in drug discovery. Biochem Soc Trans. 47(1):281-293, 2019
-Shimada I, Ueda T, Kofuku Y, Eddy MT, Wuthrich K, GPCR drug discovery: integrating solution NMR data with crystal and cryo-EM structures. Nat Rev Drug Discov. 18(1):59-82, 2019
-Costa TRD, Ignatiou A, Orlova EV, Structural Analysis of Protein Complexes by Cryo Electron Microscopy. Methods Mol Biol. 1615:377-413, 2017
-Subramaniam S, Earl LA, Falconieri V, Milne JL, Egelman EH, Resolution advances in cryo-EM enable application to drug discovery. Curr Opin Struct Biol. 41:194-202, 2016
-Mishin A, Gusach A, Luginina A, Marin E, Borshchevskiy V, Cherezov V, An outlook on using serial femtosecond crystallography in drug discovery. Expert Opin Drug Discov. 14(9):933-945, 2019
-Johansson LC, Stauch B, Ishchenko A, Cherezov V, A Bright Future for Serial Femtosecond Crystallography with XFELs. Trends Biochem Sci. 42(9):749-762, 2017
-Neutze R, Branden G, Schertler GF, Membrane protein structural biology using X-ray free electron lasers. Curr Opin Struct Biol. 33:115-25, 2015
-Feld GK, Frank M, Enabling membrane protein structure and dynamics with X-ray free electron lasers. Curr Opin Struct Biol. 27:69-78, 2014
6. 뇌과학
가. 개요
뇌는 동물의 중추 신경계를 관장하는 기관으로서 성인의 뇌 무게는 약 1.4∼1.6kg이며, 평균 1,350cc의 부피를 가진다. 뇌는 행동과 움직임을 관장하고 신체의 항상성을 유지시키며 인지, 감정, 기억, 학습 등을 담당한다. 인간의 뇌는 현대의학과 과학기술의 발전에도 불구하고 아직까지 우주과학과 함께 미개척지로 알려져 있으며, 한국이 미래 선진국으로 도약할 수 있는 기회의 분야이면서 도전적 영역이다.
뇌연구는 뇌신경생물학과 인지과학적 이해를 바탕으로 뇌 작동의 근본 원리를 파악하여 뇌질환 극복 및 공학적 응용에 활용하는 분야이다. 최근 뇌과학 분야가 핵심 분야로 떠오를 수 있었던 것은 현대 과학에서의 생물, 화학, 수학, 물리 등 기초과학 기술과 나노기술, 컴퓨터공학기술, 정보기술 등의 응용기술의 근간이 되는 요소기술을 이용하여 뇌를 이해할 수 있는 학문적 기반이 마련되었기 때문이다. 더불어 유전체 기술의 발전으로 환자로부터의 유전정보 뿐 아니라 뇌세포의 단일세포 수준에서 유전적 정보를 얻고 이를 분석할 수 있는 기술이 바탕이 됨으로써 뇌과학에서도 빅데이터를 활용할 수 있는 시대를 맞이하게 되었다. 이를 바탕으로 뇌질환 발병원인의 기전연구에서부터 실시간 환자의 정보를 수집하여 개인 맞춤형 뇌질환 극복을 위한 치료제 개발까지 힘쓰고 있으며, 더욱이 컴퓨터 알고리즘을 통한 분석방법으로 뇌의 부위별 단일세포 수준에서의 유전정보를 통한 방대한 정보를 기반으로 뇌에 대한 기본적 이해가 가능하게 되었다. 이러한 기술의 혁신은 뇌과학의 기초과학 분야뿐만 아니라 진단 및 치료 등과 같은 응용분야, 그리고 아직은 태동기인 뇌산업을 촉진하고 인류의 평생 건강한 삶을 추구할 수 있는 뇌연구의 궁극적 비전을 가시화 할 수 있을 것이라 기대한다.
나. 해외 동향
최근 전개되고 있는 세계적 뇌연구 동향은 1,000억 개의 신경세포와 수백조 개의 시냅스를 통한 뇌 연결성 분석 등 뇌의 구조와 기능의 근원적 이해 및 응용을 위한 연구에 초점이 맞춰져 있다. 이러한 흐름은 세계 주요국들이 2013년부터 국가 차원의 대규모 뇌연구 프로젝트를 추진하면서 시작되었다. 미국은 향후 10년간 각각 5조 2,000억 원과 1조 4,000억 원을 지원하는 BRAIN Initiative와 유럽연합의 Human Brain Project를 필두로, 일본의 경우 2014년에 향후 10년간 4,000억 원 이상 투입될 Brain/MINDS가 시작되었다. 한국도 2017년에 Korea Brain Initiative를 착수하였지만 예산은 선진국 대비 많이 낮은 편이다. 현재 중국, 캐나다, 호주 등 많은 국가에서 뇌과학 프로젝트를 준비하고 있다. 위의 7개 국가에서는 2016년 UN의 주도아래 International Brain Initiative에 참여하여 글로벌 뇌과학 연합체를 결성함으로써 향후 뇌과학 기술의 공유와 발전을 위해 협력하고 있다.
또한 뇌과학에서 일반적으로 연구되어 온 치매, 파킨슨병 등 퇴행성 및 신경학적 질환과 더불어 최근 각국에서는 국가주도의 뇌과학 프로젝트를 통해 자폐증, 우울증 등을 발달 및 정서 질환으로 영역을 확장하는 추세이다. 이에 공학기술의 발달과 더불어 뇌공학 분야가 눈부시게 발전하고 있으며, 특히 인간 뇌와 컴퓨터, 혹은 기계를 연결하는 Brain-Machine(Computer)-Interface(BMI) 기술, 미세탐침을 이용해 뇌의 특정부위를 자극함으로써 뇌활성을 조절하여 치료기술에 이용하는 Deep Brain Stimulation(DBS), 인간지능을 모사한 인공지능 등 혁신적이고 다양한 뇌과학 기술은 최근 더 주목 받는 기술로 부상했다.
이와 같이 국가 주도의 뇌과학 프로젝트가 착수된 이후 눈부시게 발전한 뇌과학 기술은 진보된 뇌과학 기술로 인해 발생할 수 있는 주요 7개국에서는 법적, 사회적, 윤리적인 문제를 대응하기 위해 뇌신경윤리에 대한 연구와 협력이 활발하게 진행 중이다. 또한, 한국과 미국의 주도로 2017년부터 뇌신경윤리 연합체인 Global Neuroethics Summit을 결성하여 뇌신경윤리 가이드라인을 제시하고 국제협력의 발판을 마련하였다. 최근, 국제경제협력기구(OECD), 세계경제포럼(WEF: World Economic Forum) 등 국제기구들이 관심을 가지면서 뇌산업에서도 뇌신경윤리적인 측면의 대응을 함께 모색하는 등 새로운 뇌과학 분야에 적극적으로 참여하고 있다.
다. 국내 현황
한국 뇌과학은 1998년 제정된 ‘뇌연구촉진법’ 및 ‘뇌연구촉진법시행령’ 등 법적 기반을 바탕으로 범정부적 뇌연구 지원 사업이 추진되면서 본격적으로 발전하였다. 뇌연구촉진법에 근거하여 현재 과기정통부, 산자부, 복지부, 교육부 등 4개 부처가 공동으로 뇌연구촉진기본계획을 수립하도록 되어있다. 1999년 7월에 제1차 뇌연구촉진기본계획(1998∼2007)이 수립된 이후 기초연구기반을 조성하고 뇌연구 주체별 기술역량을 강화하는 방향으로 기본목표가 설정되었으며, 이에 따른 다양한 시책들이 국내 뇌과학 육성을 위해 추진되었다.
이어 수립된 제2차 뇌연구촉진기본계획(2008∼2017)에는 그동안 조성된 연구기반을 바탕으로 중장기 뇌연구 발전비전과 추진목표가 제시되었으며 ‘창조적 뇌연구’를 통한 삶의 질 향상과 미래신사업 창출이라는 비전 아래 ‘R&D 핵심역량 강화’, ‘연구개발 시스템 혁신’, ‘산학연 협력 및 인프라 기반구축’ 등 3대 추진전략이 강조되었다. 또한, 기본계획 기간(2008∼2017) 중 정부는 2018년 제3차 뇌연구촉진기본계획과 연계하고 초고령화 사회 대비 및 뇌산업 분야의 새로운 성장동력 확보를 위한 ‘뇌과학 발전전략’을 2016년에 수립하였다. 뇌과학 발전전략은 2023년까지 뇌과학 신흥강국 도약 준비를 비전으로 제시하였으며, ‘특화뇌지도 등 핵심뇌기술 조기확보’와 ‘뇌연구 생태계 확충’을 2대 세부목표로 설정하여 범국가적 차원에서의 뇌연구 육성 정책 추진 및 원천기술 확보에 노력을 기울이고 있다.
이에 따라 2017년부터 뇌과학원천기술개발 사업 중 뇌지도 구축 및 뇌융합 챌린지 프로젝트(85억 원)가 착수되었으며 이 프로젝트는 Korea Brain Initiative의 일환이라고
할 수 있는 국가차원의 뇌연구 프로젝트로 시작했다. 2018년부터 시작된 제3차 뇌연구촉진기본계획(2018∼2027)은 ‘뇌이해 고도화와 뇌활용의 시대 진입’을 위한 비전 아래 ‘인간의 이해에 다가가는 뇌과학’, ‘사회문제를 해결하는 뇌과학’, ‘미래사회를 대비하는 뇌과학’의

[그림 3-44] 제3차 뇌연구촉진기본계획 비전과 목표
추진방향으로 향후 10년 동안 뇌과학을 발전시켜 나아갈 청사진을 완성하였다.
최근 뇌과학기술의 고도화, 인공지능의 등장, 머리-신체 이식기술 등 뇌과학기술 발달로 예측 가능한 법적・사회적・윤리적 문제의식이 생기기 시작하였고 이에 대응하기 위한 융합적 고찰이 국제사회에서 이슈가 되고 있다. 이에 과기정통부는 뇌신경윤리에 대한 연구 및 거버넌스를 지원하기 시작했으며, 한국뇌연구원도 2017년부터 뇌신경윤리연구회를 운영 및 지원하고 있다. 한편, 2019년에는 뇌신경과학 분야의 최대 학술대회인 ‘국제 뇌신경과학총회(IBRO: International Brain Research Organization)4)’가 한국에서 개최되는 만큼 한국의 글로벌 리더십 강화 및 산업계의 기술정보 교류 활성화를 위한 기회가 마련될 것이다.
[표 3-12] 국내 뇌연구 주요정책 동향
|
연도 |
추진내용 |
|
1998 |
-‘뇌연구촉진법’ 제정 |
|
1999 |
-범부처 차원의 ‘제1차 뇌연구촉진 기본계획(BRAINTECH21)’ 수립, 시행 -‘뇌신경생물학사업단’, ‘뇌의약학사업단’, ‘뇌신경정보학사업단’ 3개 국책사업단 발족 |
|
2003 |
-21세기가 프론티어연구개발사업의 일환으로 뇌기능활용 및 뇌질환치료기술 개발연구 -사업단 출범 |
|
2008 |
-‘제2차 뇌연구촉진 기본계획(2008∼2017)’ 수립, 시행 -연구기반 조성에서 탈피하여 원천기술 확보를 목표로 함 -뇌과학 분야의 세계적인 추세를 반영하여 연구 분야에 있어서 기존의 뇌신경생물, 뇌의약학, 뇌신경정보학 외에 뇌인지과학 및 뇌 융합연구 분야 신설 -학제간 융합을 위한 ‘한국 뇌연구원 설립추진기획단’ 발족 |
|
2011 |
-‘한국뇌연구원’ 설립 유치기관 선정(대구・경북-DGIST 컨소시엄) |
|
2013 |
-‘제2차 뇌연구촉진 2단계 기본계획(2013∼2017)’ 수립 -‘뇌기능활용 및 뇌질환치료기술 개발연구사업단’ 종료(2013.9.) -기초과학지원연구원(IBS) 뇌연구 분야 지원 개시(시냅스 뇌질환 연구단, 인지 및 사회성 연구단에 총 200억 원 지원, 성균관대 뇌영상 연구단 신규선정) -‘창조경제 실현을 위한 미래부 BT분야 투자전략(2013.11.)’에 의하여 BT 5대 중점투자분야 중 하나로 뇌연구 선정 |
|
2014 |
-‘생애 단계별 8대 건강문제 해결(VIP 연두업무보고)’에 의거, 생애 전 주기별 뇌질환 극복 연구 추진 -뇌은행사업 착수(한국뇌연구원 내 설치) -치매 조기진단(치매예측뇌지도) 및 인터넷・게임디톡스사업 신설(2014) |
|
2015 |
-‘바이오헬스 미래 신산업 육성 전략 – 바이오미래전략’의 일환으로 신규과제 선정, 뇌과학에 약 415억 원 규모 예산 투자 -뇌 발달장애 및 외상 후 스트레스장애 극복기술과제 등 착수 |
|
2016 |
-‘뇌과학발전전략’ 수립, 시행 -뇌혈관장애 극복 기술개발 과제 등 착수 |
|
2017 |
-뇌과학 4대 분야 및 뇌융합(뇌지도, 챌린지기술, AI연계) 기술개발 등 Korea Brain Initiative 신규 사업 추진 |
|
2018 |
-‘제3차 뇌연구촉진 기본계획(뇌연구혁신 2030)’ 수립 |
|
2019 |
-‘치매국가책임제’ 국가 치매극복 연구개발사업 수립 -미래뇌융합기술개발사업 인공지능, 계산뇌신경과학, 뇌신경윤리 등 착수 |

출처: 제3차 뇌연구 촉진 기본계획, 2018
[그림 3-45] 뇌연구촉진 기본계획 주요목표 및 성과

정부의 뇌연구 투자를 살펴보면, 뇌연구가 본격화된 1998년부터 2018년까지 총 1만 4,276억 원 투자되었고 연도별 2001년 259억 원에서 2018년 약 1,946억 원으로 약 7.5배가 증가되었다.
2018년 뇌연구 총 투자액(약 1,946억 원)의 부처별 투자 비중을 살펴보면 과학기술정보통신부(전 미래창조과학부) 및 출연연이 각각 46.4%(907억 1,000만 원), 40.4%(785억 9,000만 원)를 담당하였으며 보건복지부 7.9%(153억 2,000만 원), 교육부 3.2%(62억 8,000만 원), 산업통상자원부 1.9%(36억 9,000만 원) 순으로 투자하고 있다.
2019년 국내 뇌연구 투자규모는 전년대비 7.5% 증가한 2,092억 원(민간포함 2,119억 원)으로 과학기술정보통신부 87.4%(1,827억 3,000만 원, 출연(연) 45%, 615억 원 포함), 보건복지부 8.2%(170억 6,000만 원), 교육부 2.6%(55억 1,000만 원), 산업통상자원부 1.9%(33억 8,000만 원) 순으로 투자될 예정이다.

[그림 3-46] 2018년도 부처별 투자비중
국내 뇌연구를 통한 SCI 논문 수는 2018년에 총 1,005건이며, IF 10 이상의 우수논문 수도 210건으로 2016년(36편) 대비 5.8배 증가되는 등 뇌연구의 질적 성장이 이루어지고 있다. 국내 특허출원의 경우 2016년 215건에서 2018년 270건으로 성장세를 꾸준히 이어나가고 있다.
라. 산업 현황
뇌연구의 학문적 성과는 실용화・산업화를 거쳐 일상생활 전반에 큰 영향을 미치고 있다. 최근에 뇌파(EEG)와 기능적자기공명영상(fMRI) 측정 결과를 활용한 감성 디자인, 뉴로 마케팅과 뇌자극 기반의 가상현실(VR: Virtual Reality)을 이용한 새로운 형태의 영화를 사례로 들 수 있다. 이처럼, 뇌연구는 큰 부가가치를 창출하는 미래지향적 신시장을 개척하고 있다.
뇌관련 산업시장은 뇌의약품, 연구용 장비, 뇌질환 진단 및 치료용 장비를 비롯하여 뇌파-바이브라 이미지를 바탕으로 정신적 웰니스・스트레스 지수를 이용하는 브레인 휘트니스 기술 등 세계적으로 100조 원이 넘으며, 매년 성장하고 있다. The Neurotechnology Industry 2015∼2016 Report에 따르면 뇌의약품이 연 5%의 성장률을 기록하며 시장의 대부분(83%)을 차지하고 있으며, 연구장비와 치료용 임상장비도 각각 연 5%와 10% 이상 꾸준히 증가하고 있다. 주목할 점은 집중력 향상 뇌자극기와 웨어러블 EEG등 일반인 대상 제품시장이 약 1조 원으로 연간 11.5%의 성장률로 팽창하고 있다는 것이다. 또한, 구글과 테슬라와 같은 혁신적 기업들이 앞다투어 뇌과학 기술 개발에 뛰어들면서 향후 뇌과학 분야는 산업화의 방향과 속도를 예측하기 어려울 만큼 변화해 가고 있다.
IBM은 시냅스 연결을 모방하여 기존 CPU의 40% 전력으로 4배 집적도를 가진 뉴로모픽 칩5)을 개발했으며, 국내에서도 오비이랩과 뉴로스카이가 각각 휴대용 고해상도 뇌영상장비와 뇌파측정장치를 상용화하여 제품으로 출시했다. 최근 ㈜메도니카는 MRI 기반 뇌질환 및 비뇨생식기 질환 치료용 고강도 집속 초음파 시스템을 개발하였고, ㈜마이다스아이티는 인지기능 장애 환자의 인지기능 평가 및 인지 증진 의료기기를, ㈜녹십자지놈은 한국인 특이적 운동 신경원 질환 유전자 및 돌연변이를 발굴하고 데이트베이스를 구축하는 성과를 올렸다.
또한, 급속한 고령화 사회 진입으로 뇌질환 치료, 인지능력 활용을 통한 제품들이 늘고 있으며 치료제개발에 비해 진단에 대한 기대감 상승으로 디바이스 개발 분야가 증가하고 있는 것은 주목할 만하다. 한국은 전 세계에서 노령화가 가장 빠르게 진행되고 있는 국가로서 뇌질환 관련 사회경제적 비용이 23조 원에 달한다. 따라서 국가차원의 뇌질환 문제 해결을 위한 대응이 절실히 요구되고, 조기진단을 통해 예방으로 치매속도를 늦출 수 있는 연구의 필요성이 대두되고 있다. 2019년 정부는 국가치매책임제 시행을 위해 예비타당성을 통과시켜 2020년부터는 본격적으로 치매 등 사회문제 해결을 위한 실질적 투자 전략을 마련했다.
마. 발전 전망
미국, EU, 일본 및 중국 등 세계 주요 선진국들은 뇌과학을 우주산업과 함께 미래산업의 새로운 패러다임을 제시할 수 있는 가장 강력한 블루오션으로 보고 있다. 대규모 10년 장기 연구 프로젝트를 착수한 이후 5년이 경과한 2019년에는 그간의 성과를 점검하고 남은 5년에 대한 계획에 집중하고 있다. 우리나라는 2017년부터 시작한 Korea Brain Initiative인 뇌회로망사업 및 챌린지 기술개발사업의 뇌 구조와 작동원리에 대한 이해와 회로망기반의 새로운 차원의 뇌질환 극복 등은 차세대 뇌연구를 위한 필수 정보를 제공할 수 있을 것으로 전망한다.
또한, 2019년부터 착수된 인공지능-인간지능의 초연결 연구와 계산신경과학 연구는 향후 우리나라의 뇌과학 분야에 새로운 지평을 열어줄 것이라 기대하고 있다. 치매 등 뇌질환 극복을 위한 투자가 2020년부터 본격적으로 시작되는 만큼 국민들에게 삶의 질을 높여줄 수 있는 과학기술로 뇌분야가 자리매김할 것이다. 국내외 연구네트워크 측면에서 국가가 설립한 한국뇌연구원(KBRI), 한국과학기술연구원(KIST), 기초과학연구원(IBS) 등이 기관의 역할과 책임을 공유하여 뇌연구 전문기관으로 한국 뇌과학의 연합체를 형성함으로써 뇌과학 연구발전에 시너지 역할을 담당하고 있다. 또한, 주요 뇌과학 선진국들과의 International Brain Initiative 참여 및 국제 뇌신경윤리 회의(Global Neuroethics Summit)를 한국이 주도해 나감으로써 활발한 국제협력연구를 통해 한국의 뇌과학기술이 인류에 공헌할 수 있는 장이 마련될 것으로 기대된다.
아직 산업화 수준이 미진한 뇌과학 분야는 향후 10년 이내 산업의 주요 분야로 자리 매김할 것으로 예측되는 바, 이에 대비하기 위한 국내 연구 인력을 양성하는 것이 매우 중요한 숙제가 될 것이다. 기존의 생물학 등 기초분야에 의지했던 뇌연구의 문화를 넘어 인문사회학부터 첨단공학 및 인공지능에 이르기까지 폭넓은 학술적 융합을 위해서 다양한 전문가를 양성해야할 시점이다. 이를 통해 새로운 부가가치와 일자리를 창출하는 것 또한 당면과제이다. 특히, 산업부와 교육부의 뇌과학 분야에 대한 투자액이 증가되길 바라며, 이를 통해 혁신적 융합인력 양성과 함께 산업화를 고려한 발전방안을 도출해야 할 것이다. 안전하고 책임감 있는 뇌과학 기술개발을 통해 국민들에게 뇌연구에 대한 신뢰를 얻고, 혁신적 뇌과학기술이 인류에 공헌할 수 있는 기회가 되기를 기대한다.
7. 노화
가. 노화연구의 개요
세계는 지금 늙어가고 있다. 2018년 말 기준, 전 세계의 65세 이상 인구수는 약 7억 500만 명으로 세계는 ‘고령화’ 단계에 들어섰다. 반면 0세∼4세 인구는 약 6억 8,000만 명에 그쳐 인류역사상 최초로 전 세계 노년 인구가 유아 인구를 넘어섰다. 세계보건기구(WHO: World Health Organization) 보고서(Global Health and Aging)에 따르면, 노인 인구는 2050년에는 15억 명으로 증가할 것으로 전망하고 있다. 우리나라는 2016년에 노인 인구가 15세 미만 유소년 인구를 처음으로 넘어섰고 2017년에는 예상보다 1년 빠르게 14%를 넘어 ‘고령사회’에 진입했다. 고령인구 비율이 주요 경쟁 상대국보다 급속하게 증가하여 2050년에는 일본보다도 높아질 전망이다.
급속한 인구 고령화는 정치, 경제, 보건의료 등 사회 전반의 문제를 초래하여 우리 경제의 성장잠재력 및 대외경쟁력을 약화시킬 것으로 전망된다. 세계 주요선진국에서는 이를 해결하기 위해 정부차원에서 다양한 분야의 새로운 정책들을 추진하여 사회제도를 재수립하고 고령친화산업 육성을 위해 많은 투자를 하고 있다. 또한 고령화에 따른 노인의 의료서비스 수요가 증가하여 바이오기술 시장규모가 급속히 확대되고 있다.
한국도 고령화로 인한 부정적인 영향을 최소화하기 위해서 범정부 차원의 제도개혁이 이루어져야 할 것이다. 그 한 분야로서 노화연구는 노인 개인이 신체적・정신적으로 건강을 유지하여 삶의 질을 높이고, 이에 따른 생산가능인구 증가로 경제 성장에도 기여할 것이다.
최근 노화를 바라보는 시각이 바뀌면서 ‘노화’의 새로운 패러다임이 제시되었다. 노화는 피할 수 없는 자연현상이 아니라 노화과학 원천기술로 제어가 가능함을 다양한 노화연구관련 결과들이 증명해 보이고 있다. 실질적인 연구사례를 들어보면, 젊은 피에는 노화를 제어할 수 있는 인자가 있고 이러한 인자를 발굴하여 노화모델 마우스에 주입했을 때 회춘효과가 나타났다. 또한 노화가 되면 인체에는 노화세포가 쌓여 여러 질병을 유발하는데 동물모델에서 노화세포를 기술적으로 제거하면 수명이 연장되고 노화 관련 질병 증상이 완화되었다. 정확한 기전이 밝혀지진 않았지만 노화를 억제하여 생쥐 수명을 연장시키는 약물들도 재발견되었다. 이 뿐만 아니라 다양한 생물분야에서 노화제어 원천기술이 개발 중이다. 이러한 원천기술을 기반으로 건강노화 바이오벤처기업들이 증가하고 있으며 임상연구도 활발히 진행되고 있다.
한국인의 기대수명은 계속 증가하고 있지만 건강수명은 오히려 줄어들고 있다. 노화연구는 단순한 수명연장이 아닌 건강한 노년을 추구한다. 건강수명의 증가는 고령화에 따른 경제활동인구의 감소, 복지・의료비 증가 등 여러 사회・경제적 문제를 해결할 근본적인 대안으로 떠오르고 있다. 고령화 사회를 대비하는 노화과학 정책을 강화하여 건강수명과 기대수명의 격차를 줄이고 건강한 노화를 이루어 내는 것은 가파른 속도로 고령화가 진행되는 우리나라에서 매우 시급한 일이다.
(1) 급속한 고령화에 따른 노인 의료비용 증가
우리나라는 2016년에 고령인구가 유소년 인구를 처음으로 추월했고, 2017년 8월말에 14%가 넘어 고령사회에 진입했다. 2019년 현재 고령인구는 15%에 이른다. 2026년부터는 노인인구가 20%이상으로 1,000만 명을 넘어설 것으로 전망된다.

주) 2017년 이후는 ‘장래인구추계 2010∼2060년’(중위가정)을 인용
출처: 통계청
[그림 3-47] 연령대별 인구 구성비
2018년 노년부양비율은 19.6명에서 저출산・고령화로 2060년에는 82.6명으로 증가할 것으로 전망하고 있다. 노령화 지수는 2016년 100.1명으로 0∼14세 인구를 넘어서, 2018년 110.5명으로 나타났다. 이러한 급속한 인구 고령화는 국민들의 건강에 문제를 발생시키고 경제 활력을 저하시키는 등 국가발전과 사회 안정을 위협하는 잠재적 불안요인이 되었다. OECD는 한국의 급속한 고령화가 사회보장 및 의료비 지출 증가와 세수감소로 이어질 것이 예상됨에 따라 정책을 강화하고 공공부분의 효율성을 높여야 한다고 평가했다.

주) 노년부양비: 생산가능인구(15∼64세 인구) 100명당 65세 이상 인구 노령화지수: 유소년인구(0∼14세 인구) 100명당 65세 이상 인구
출처: 통계청, 인구주택총조사, 장래인구추계
[그림 3-48] 노년부양비 및 노령화 지수
급속한 고령화에 따른 노인 인구의 증가는 의료비용 및 건강보험의 재정 부담을 증가시키는 주요 원인으로 작용하고 있다. 2017년 건강보험상 전체 진료비는 69조 6,271억 원이며, 이 중 65세 이상 고령자 진료비는 39%인 27조 1,357억 원으로 전년보다 10.5%가 증가했다. 고령자 1인당 진료비는 398만 7,000원으로 전체 1인당 진료비 136만 7,000원 보다 3배 정도 많은 것으로 나타났다.

출처: 건강보험심사평가원, 진료비통계지표
[그림 3-49] 건강보험상 노인 진료비
(2) 노화연구 및 고령친화 산업의 발전 현황
누구나 무병장수를 소망한다. 오늘날 사람들의 최고 관심사는 장수라고 해도 과언이 아니다. 기초과학을 통한 노화과학 원천기술은 노화를 억제하고 질병을 극복하여 건강수명을 연장할 수 있음을 시사했다. WHO에 따르면 최근 2000∼2019년 기간에 전 세계 평균수명은 66.5세에서 72세로 늘었고, 세계건강수명은 58.5세에서 2016년 63.3세로 늘었다. 우리나라 기대수명의 경우, 2000년에는 74.3세에서 현재 83세로 약 9년이 늘었다. 하지만 건강수명은 65세에서 64.9세로 오히려 줄었다. 결국 의학기술의 발달이 수명연장의 큰 요인이 되었으며 노인인구가 늘어가는 현 시점에서는 향후 사회전반에 걸친 여러 문제가 발생할 것이 우려된다.
최근 노화연구에 학계・제약업계 뿐 아니라 거대 IT기업들과 창업주들까지 직접 투자 혹은 지원에 나서고 있고, 주요 선진국들은 노화R&D 예산을 매년 늘리고 있다. 이러한 노화연구의 선두 주자는 미국으로 연구 논문수가 전체 약 40%를 차지하고 있으며, 우리나라의 경우 1∼2%에 머물고 있는 실정이다. 소득 수준이 향상되는 나라일수록 건강에 대한 관심이 높아지고 있다. 이에 따라 고령친화산업도 빠르게 성장하고 있으며 국가・사회적으로 매우 중요한 분야로 떠오르고 있다. 고령친화산업은 ‘노화 기전에 대한 예방 및 관리와 노화로 인한 신체적 질병을 예방, 관리, 치료하는 모든 제품과 서비스를 포함하는 것’으로 정의할 수 있다.
현재 고령친화산업으로 기능성식품, 의약품, 의료기기, 화장품, 뷰티서비스 등의 분야가 급부상 하고 있다. 고령친화 산업의 글로벌 시장 성장률이 연평균 11%를 상회하는 등 급속한 성장을 보이고 있다. 국내 시장의 경우도 이러한 증가 추세는 동일하게 나타나고 있다. 국내 시장의 경우는 지난 2016년 약 20조 원에서 연평균 약 13.2% 성장 하는 중이며, 오는 2020년에는 약 38조 원 규모로 확대될 전망이다.
나. 해외 동향
(1) 노화연구
고령화에 맞춰 노화연구 및 관련 기술 개발도 속도를 더하고 있다. 노화연구의 결과가 축적되면서 노화 현상에 대한 이해가 깊어졌고, 다양한 수명연장 실험에서 의미 있는 결과가 나왔다. 이러한 결과들이 노화에 대한 인식을 바꾸고 있고, 건강수명 연장에 대한 기대감을 높이고 있다. 최근 발표된 결과들을 살펴보면, 노화연구는 노화세포 제거, 혈액 내 노화조절인자, 노화억제 물질, 장내미생물과 수명에 대한 연구 등으로 진행되고 있다. 이를 통해 노화연구가 다양한 관점에서 연구되고 있다는 것을 알 수 있다.
(가) 노화세포 제거
세포는 적재적소에 분열해 새로운 세포를 만들어 우리 몸을 유지한다. 나이가 들면 우리 몸속에는 더 이상 분열할 수 없는 노화세포가 축적된다. 정상적인 몸에서 불필요하고 해가 되는 노화세포는 면역 시스템을 통해 제거 된다. 하지만 노화가 진행 되면서 면역 시스템이 약화되어 노화 세포가 제거되지 못하고 쌓여 만성 염증반응이 생기는 환경을 만든다. 이에 따라 주변 조직과 세포도 쉽게 손상 받아 질병을 유발하게 된다. 노화세포를 제거하면 수명이 연장되고 질병이 완화된다는 사실이 여러 생쥐모델에서 입증되었고, 이러한 기술을 기반으로 최근에는 임상 실험까지 진행되고 있다. 2011년과 2016년에 미국과 영국의 공동연구팀이 유전자 조작 기술로 체내 노화된 세포의 자살을 유도해 노화를 늦추고 건강수명을 늘릴 수 있다는 사실을 발견하고 각각 네이처에 결과를 게재했다. 보통 생쥐의 수명은 600여 일 정도인데 유전적으로 노화세포가 제거된 마우스는 800여 일로 약 30%정도 증가하였다.
다른 연구그룹에서는 노화세포를 제거하는 약물인 세놀리틱스(senolytics)를 발견하였다. ‘Senolytics’는 노화라는 단어의 ‘senescence’와 분해시킨다는 의미의 ‘lytic’을 합성하여 만들어진 것으로 ‘노화세포 제거’라는 의미가 있다. 지난 2018년에 미국 메이요클리닉의 한 연구팀은 노화를 지연시켜 줄 세놀리틱스를 발견하여 네이처 메디슨에 결과를 소개했다. 연구팀은 세놀리틱스로 항암제인 다사티닙(dasatinib)과 소염제인 퀘세틴(quercetin)을 발굴하였다. 두 물질을 생쥐에 투여했을 때, 노화된 세포들의 사멸을 유도하여 노화가 지연되었고 수명이 연장되었다.
올 해에는 첫 환자 임상시험을 통해 세놀리틱스의 효능을 확인했다. 미국 메이오 병원의 제임스 커클랜드 박사 연구진은 폐섬유화증을 앓고 있는 70세 환자들이 다사티닙과 퀘세틴을 복용했을 때 신체기능이 개선되는 것을 이바이오메디슨(EBioMedicine) 저널에 보고하였다. 노화연구에 활발한 유니티 바이오테크놀로지(UNITY Biotechnology)라는 회사는 퇴행성 질환 중 하나인 퇴행성 관절염 치료를 목적으로 UBX0101이라는 노화세포제거 효능 물질을 발굴하였다. 2018년 6월 첫 퇴행성 관절염환자에 투여하였고 현재 임상시험을 진행 중이다. 최근에는 노인성 비만, 퇴행성 뇌질환 등 다양한 노인성 질병에서 노화세포제거 기술이 적용될 수 있다는 결과들이 발표되고 있다. 이 결과들은 건강수명 연장의 꿈을 이루는 데 기여할 것이라 예상된다.
(나) 혈액 내 노화조절 인자
혈액에는 여러 조직의 세포에서 분비되는 다양한 종류의 단백질이 포함되어 있다. 혈액 단백질들은 혈관을 통해 모든 조직에 도달할 수 있으며 특정 단백질은 조직의 기능을 조절하는 데 필수적이다. 나이가 들어감에 따라 신체 기능 유지에 관여하는 혈액 내 단백질의 양은 점차 줄어든다. 최근 많은 노화연구진들이 혈액 내 노화조절인자를 발굴하고
그 기능을 밝히는 연구가 활발히 진행 중이다. 아직까지 검증된 인자는 소수이지만, 향후 이를 활용한 노인성 질환 극복 기술이 개발될 것으로 전망하였다.
2017년에 미국 스탠퍼드 대학 연구진은 신생아 탯줄 혈액에 존재하며 노화에 따라 혈액 내에서 감소하는 팀프2(TIMP2: tissue inhibitor of metalloproteinases 2)를 발굴하였고, 이 단백질은 늙은 생쥐의 뇌 인지 기능을 향상 시켰다. 2018년에 프랑스 폴사바띠에 대학 연구팀은 노화되면 감소하지만 운동하면 증가하는 아펠린(Apelin)이라는 단백질을 발굴하였고, 이 단백질은 노화성 근감소증 증상을 완화시키고 운동능력을 향상시키는 효능이 있다고 보고하였다.
미국의 바이오벤처기업 ‘알카히스트(Alkahest)’와 미국 스탠퍼드 의대 토니 위스코레이 박사 연구팀은 2017년 11월에 18∼30세의 혈액을 알츠하이머병 환자들에게 주사했더니 부작용 없이 일상생활 영위 능력이 유의미하게 좋아졌다는 소규모 임상시험 결과를 처음으로 발표하였다. 또한 알카히스트는 퇴행성 뇌질환의 치료를 목적으로 특정 혈액 내 노화조절인자를 발굴하였고 임상시험을 준비 중이다.
(다) 노화억제 물질
오래 전부터 노화를 지연시킬 약물개발이 진행되었는데 세포수준에서 노화 촉진 경로를 차단하는 방법으로 후보물질을 발굴하기 시작했다. 라파마이신(rapamycin)이라는 물질이 동물모델에서 수명 연장 효과가 있다는 사실이 입증되었지만, 여러 부작용을 초래할 것이라는 예상을 하고 있어 인간 수명연장에 대한 기대는 반신반의 하는 입장이다. 이에 비해 당뇨병 치료제로 잘 알려진 메트포민(metformin)은 노화를 지연하는 효능이 있다고 알려졌다. 미국 알버트 아인슈타인대학교의 노화방지 연구팀은 지난 2014년 영국인 18만 명의 의료 기록을 조사해 메트포민을 복용한 환자의 사망률이 다른 약물을 복용한 환자보다 낮은 것으로 보고하였다. 현재 임상시험을 진행 중인 노화방지를 위한 첫 번째 약물이다.
또 다른 노화억제 물질은 천연 화합물인 ‘NMN(nicotinamid e mono nucleotide)’으로서 NAD+(nicotinamide adenine dinucleotide) 생합성을 증가시키는 데 효과가 있다. 미국
워싱턴 대학 의대팀은 NMN을 투여하면 노화에 따라 에너지 생산량의 감소를 방지해서 노화의 징후를 줄 일 수 있다고 밝혔다. 현재 하버드 의과대학 연구진에서 임상시험을 진행하고 있으며, 올해 2019년에 첫 임상시험 결과가 발표될 예정이다.
(2) 글로벌 IT 대표 기업
전 세계 헬스케어 시장 규모가 반도체・자동차를 합친 것보다 커지고 있다. 미래의 먹거리 산업이 고령친화산업으로 인식되면서 글로벌 IT 대표 기업들이 질병과 노화 원인을 찾아 인간의 수명을 늘리겠다고 나섰다. 인터넷 기업 구글이 2013년 설립한 칼리코(Calico)는 세계 7위 제약사 애브비(AbbVie)와 노화연구에 15억 달러(약 1조 8,000억 원)를 공동 투자하는 계약을 맺었다. 칼리코는 인간 수명을 500세까지 연장시키는 프로젝트를 진행 중이며 노화 방지, 질병 퇴치를 통한 생명 연장이 목표이다. 100만 명 이상의 유전자 데이터와 700만 개 이상의 가계도를 활용해 유전자 패턴을 분석하여 난치병 연구에 활용하고 있다. 칼리코는 주로 효모, 선충, 벌거숭이 두더지쥐에 대한 연구를 진행하고 있다.
칼리코 연구팀이 발표한 최근 논문에 따르면 벌거숭이 두더지쥐는 수명이 35년으로 다른 쥐에 비해 10배 이상 오래 사는 것으로 밝혀졌다. 그 비결은 DNA나 단백질 손상을 바로잡는 능력이 뛰어나고 나이가 들어도 그 능력이 계속 유지되기 때문인데, 연구팀은 그 기전을 밝히는 연구를 진행 중이다.
오라클(Oracle Corporation)의 공동창업자인 래리 엘리슨은 캘리포니아 대학 내 연구소 설립 자금 2,100억 원을 포함해 앨리슨 의료재단 설립 투자비용 등 5,300억 원을 수명연장 연구에 지원하고 있다. 페이팔(PayPal Holdings, Inc.) 창업자인 피터 틸은 노화와 재생의료연구를 위한 기금인 파운더스 펀드(Founders Fund: 샌프란시스코 기반 벤처 캐피탈 회사)를 조성해 14개의 바이오테크 기업과 연구자에게 거액을 투자하며 연구를 지원하고 있다. 노화연구에 많은 관심을 표명하며 대규모 투자가 이루어지는 만큼 향후 가시적인 성과가 나올 것이며 고령친화 산업의 시장 규모는 빠른 속도로 확대될 것으로 전망한다.
(가) 미국
미국은 2050년에 노인인구가 22.1%에 이를 것으로 전망하고 있다. 이에 대응하고자 미국은 고령화 관련 정책을 시행해 오고 있다. 사회보장법, 노인복지법, 연령차별금지법 등 고령자의 경제・사회적 안정을 보장하는 정책을 추진 중이다. 또한 고령화 문제 해결을 위한 정책 논의를 위해 관련분야의 학자, 서비스 제공자, 공무원, 입법 의원 등이 모여 백악관 고령화 컨퍼런스를 진행해 오고 있다. 미국은 전 세계 노화과학 연구에서 주도적인 역할을 하며, 노화관련 주요 연구성과를 내고 있다.
미국은 고령화 관련 질병의 연구와 이해를 위한 선도적 전문기관으로 NIH(National Institutes of Health)를 구성하는 27개 연구소 중 하나인 국립노화연구소(NIA: National Institute on Aging)와 보건복지부(Department of Health and Human Services)의 일원인 Administration for Community Living(ACL) 내에 노화연구지원센터(AOA: Administration on Aging) 등 공공기관을 중심으로 노화에 대한 과학적 근거 생산에 주력하고 있다. NIA의 예산은 2016년 12억 6,710억 달러에서 2019년 19억 8,820억 달러로 약 36%가 증가하였다. 미국은 국립기관 이외에도 하버드, 존스홉킨스, 워싱턴 대학을 포함한 대학교와 미국의 대표 IT 기업들이 투자하는 연구소에서 노화연구가 활발히 진행되면서 전 세계 노화연구를 주도하고 있다.
미국의 바이오기술 시장은 2013년부터 꾸준히 상승해 2018년 시장규모가 1,076억 달러를 기록했다. 경제적으로 여유가 있고 건강한 노인인구의 노화에 따른 증상 개선과 예방 및 선택적 치료에 대한 수요 증가로 의료서비스, 특히 원격진료 시장이 성장하고 있다는데 주목해야 한다. 고령화에 따라 전문 의료인력이 부족해지고 있어 원격진료의 수요는 증가할 것으로 예상된다. 원격진료 시장은 2022년까지 연 9.8%로 성장하여 30억 달러에 다다를 것으로 전망하였다.
(나) 일본
일본은 2017년도 기준으로 65살 이상이 27%인 초고령사회에 해당한다. 일본의 최초 고령사회 대응 정책 추진은 1966년이었다. 과거에는 고령자만을 위한 복지정책이었으나, 이제는 고령자를 포함한 전 세대를 아우르는 정책을 수립하고 추진 중이다. 그 정책에는 고령사회 대책대강, 일본재흥전략, 미래투자전략, 제5기 과학기술기본계획(2016∼2020)을 포함하고 있다. 2014년에는 연구정책과 관련한 건강의료전략추진본부를 설치하여 9가지 의료분야를 집중적으로 연구하였다. 이 중 노화연구 분야로는 재생의료, 맞춤형 게놈의료, 정신・신경질환이 포함되어 있다.
일본은 고령비율이 7%정도인 1972년에 노인종합연구소가 설치되었다. 14%가 넘는 우리나라에 아직 국립노화연구소가 없는 것에 비하면, 굉장히 빠른 시기에 노화연구소를 세워 고령화에 대비하고자 한 것이다. 게다가 일본은 1988년에 장수과학진흥재단, 2004년에는 국립장수의료센터가 설치되었다. 국립장수의료센터 산하의 NCGG(National Center for Geriatrics and Gerontology)는 병원, 연구소, 사회학자 등 다학제간 융복합 노화연구와 산업육성을 도모하고 있다.
일본의 실버산업은 매우 급성장하고 있다. 노인들을 위한 간호 전동침대, 보행・이동・재활훈련을 위한 로봇, 노인 커뮤니케이션 로봇, 기저귀, 노인 식품 등 의료・개호・생활 산업 전반에 걸쳐 이미 고령친화산업 시장이 확대되어 있다. 일본정부는 사회보장보험을 통해 이러한 산업에 지원을 하고 있다.
또한 일본정부는 고령화 시대를 맞아 원격진료를 계획 중이다. 입원 중심 진료에서 가정의 첨단장비를 사용한 재택진료로 전환할 계획이다. 재택진료를 통해서 의료보수 시스템을 개편하여 제반 비용을 줄이고자 하는 것이다. 이에 따라 원격진료에 대한 시장규모가 급성장 할 것으로 전망하고 있다. 향후, 일본은 고령친화산업 기반을 바탕으로 세계시장을 선점할 것으로 전망되며 우리나라도 이에 체계적으로 대응할 필요가 있다.
(다) 중국
2017년 말 중국의 65세 이상 고령인구는 1억 5,832만 명으로 전체의 11.4%에 이르렀다. 2016년부터 두 자녀 정책을 시작한 중국의 인구 고령화는 우리나라와 비슷한 양상을 보인다. 중국은 2025년에 고령사회에 진입할 것으로 전망하고 있다. 중국은 고령화 추세에 따라 고령친화산업을 육성하고 시장 확보를 위해 정부차원에서 관련 정책을 수립하여 추진 중이다. 중국에서는 특히 고령층 노인들이 건강, 미용・패션 분야에 대한 관심도와 구매력이 상승하고 있다. 코트라 중국 텐진무역관 발표에 따르면, 중국 실버산업 시장의 규모는 2020년 7조 8,000억 위안에 이어 2021년에는 9조 6,000억 위안으로 급성장할 것으로 전망 하였다.
(라) 유럽연합(EU)
EU 공식 통계기구인 유로스타트(Eurostat)에 따르면 2017년 기준으로 EU 28개 회원국의 65세 이상 인구는 약 1억 명에 이르러 전체 유럽 인구의 19.4%를 차지하는 것으로 나타났다. 유럽연합도 경제활동인구가 크게 감소되고 있어 사회적 문제로 대두되고 있다. EU는 고령화를 실버 경제 관점에서 위기이자 새로운 성장 기회로 규정하고 이와 관련된 다양한 정책을 추진 중이다. 고령화를 비롯한 사회적 문제해결을 하고자 ‘Horizon 2020’과 고령화와 관련된 서비스 수요의 대응 방향을 제시하기 위한 ‘실버경제’ 정책을 추진 중이다. 또한 ‘유럽 건강노화 전략 및 활동 계획’ 정책을 추진하면서 건강노화를 위한 대책을 마련 중이다. 건강한 고령화 사회 조성을 위해 유럽집행위원회(EC)는 European Innovation Partnership on Active and Healthy Ageing(EIP-AHA)이라는 이니셔티브를 운영하고 연구개발을 지원하고 있다.
다. 국내 현황
국제통화기금은 아시아 국가들이 당면한 가장 큰 경제적 리스크로 고령화를 꼽았고, 특히 한국을 생산 인구 대비 노인 비중이 급속히 증가하고 생산인구 절대 규모마저 감소하는 국가군으로 분류했다. 우리나라는 저출산・고령화로 심각한 인구 문제에 직면해 있으며, 이로 인한 사회 전반에 부정적인 영향을 피할 수 없게 되었다. 이에 대응하고자 정부는 꾸준히 법과 제도의 정비를 추진해왔다.
지난 10년간 대응을 살펴보면 2004년에 저출산・고령화 문제를 국가적 의제로 설정하고, 2005년에 저출산・고령사회기본법을 제정, 저출산・고령사회위원회를 출범하였다. 또한 제1차(2006∼2010), 제2차(2011∼2015), 제3차(2016∼2020) 저출산・고령사회기본계획을 수립하여 추진해 나가고 있다. 제3차 계획에는 실버경제 육성, 생산인구 확충 등 고용・산업의 구조 개편으로 고령사회 대책을 위한 정책 기본방향이 설정되어 있다.
정부는 지속적으로 노화 및 고령친화 R&D 투자도 늘려가고 있다. 이 중 대부분의 연구비는 기초 노화연구보다는 항노화연구에 치중되어 있다. R&D 투자에 따라 노화 분야 특허등록 및 논문 편수는 증가하였으나, 노화과학 기술과 관련한 기술수준은 우리나라의 경우 1∼2% 수준이다. 노화 분야 논문 편수 또한 매우 미비한 수준이다. 여전히 국가 차원의 인구 고령화 대응 기초 및 원천기술 노화과학 R&D에 대한 지원은 부족하며, 근본적인 지원 정책 수립이 필요한 실정이다.
세계적인 추세와 병행하여 우리나라도 고령친화산업이 급성장하였다. 국내 항노화 시장은 2015년 기준 약 20조 원에 가까운 규모였고, 2020년에는 약 38조 원으로 증가할 것으로 전망하고 있다. 국내시장은 주로 화장품이 약 75%로 성장을 주도하고 있고 그 뒤로는 의료분야, 서비스분야가 점유할 전망이다. 하지만 국내는 항노화산업에 대한 개념과 분류체계가 정립되지 않고 초기단계에 머물고 있고 비즈니스 모델이 부재하여 타 산업과의 연계를 통한 동반성장의 기회가 부족한 실정이다.
라. 발전 과제
세계보건기구가 발표한 한국인의 건강수명은 기대수명보다 8∼9년이 짧았다. 단순히 오래 사는 것보다 기대수명과 건강수명의 격차를 줄여 건강하게 오래 사는 것이 고령사회를 대비하는 자세일 것이다. WHO는 2018년 노화에 대해 질병코드를 부여했다. 이제는 사람이 늙는 것이 단순한 자연현상이 아니라 각종 질병의 유발 원인임을 인정한 것이다. 노화가 질병 코드로 분류된 것은 의료산업 및 고령친화산업에 엄청난 영향을 미칠 것이다. 따라서 앞으로 노화를 적극적으로 제어하고 극복하려는 노력이 전 분야에 걸쳐 더 가속화 될 것으로 전망된다.
전 세계적으로 활발한 노화연구를 통해서 노화를 제어 및 회복 가능한 질병으로 인식해 가고 있으며, 노인성질환의 예방 및 치료에 대한 기술개발이 발전해 가고 있다. 하지만 우리나라의 노화연구는 양적 및 질적 향상에도 불구하고 아직도 선진국과 격차가 매우 크다. 따라서 우리나라의 노화연구의 활성화 및 효용성 증대를 위해서는 중장기적인 시각으로 노화연구에 접근하는 것이 바람직할 것이다.
주요 선진국처럼 국내 또한 고령친화산업에 대한 수요가 높은 편이고 향후 발전가능성이 높다. 따라서 국가차원에서 고령친화산업이 새로운 미래 성장동력임을 인식하고 노화 R&D분야에 대한 지원을 늘려나가야 할 것이다. 성공적인 노화연구는 노인의 기대수명과 건강수명의 격차를 줄여 행복한 노년을 이룰 수 있는 초석이 될 것이며 이는 국가 발전에 크게 이바지 하게 될 것이다.
제2절
보건의료
1. 합성신약
가. 개요
미국 FDA에 승인된 합성신약(NME)은 2017년에는 34개로 전년 대비 두 배 이상 증가하였고, 2018년에는 42개로 전년 대비 24% 증가했다. 합성신약 대비 생물학적 제제(BLA)의 비율이 점차 높아지고 있는 추세이다. 지난 2년간 승인된 합성신약 중 항암제가 가장 많았고, 그 다음 감염증 치료제, 뇌질환 치료제 순으로 높은 비율을 차지하고 있다. 최초로 암 대사경로를 표적으로 하는 Enasidenib이 2017년에 개발되었으며, 2018년에도 Ivosidenib이 개발되어, 암 대사 표적 분야가 검증된 타깃으로 자리 잡았다. 최근 2년 동안 신약개발의 새로운 접근방법인 표적단백질분해 연구가 전 세계적으로 활발히 진행되었고, 드디어 2019년 임상 1상 연구가 시작되었다. 지난 2년간 국내 합성신약은 2017년 일동제약의 베시보정과 2018년 CJ헬스케어의 케이캡정 등 총 2개가 승인을 받았다.
국내 제약산업은 문재인정부의 2018년 100대 국정과제로 선정되어 일자리 창출을 위한 핵심 분야로 지원할 것이 기대되는 상황이다. 신약개발의 패러다임 전환을 가져올 기술로 인공지능을 통한 신약개발에 대한 기대감이 높아지고 있다. 세포 및 유전자 치료와 같은 신기술의 출현에 따라 합성신약의 역할이 확대될 것으로 기대된다.
나. 해외 동향
(1) 미국 FDA 합성신약 승인
미국 FDA에 승인된 합성신약은 2016년 15개 대비 2017년에는 34개로 두 배 이상 증가하였고, 2018년에는 42개로 전년 대비 24% 증가했다. 1996년에 당시 최대인 53개(합성:생물제제 89:11)의 신약이 승인된 이래 2017년의 46개(합성:생물제제 74:26)가 최대이며, 2018년 59개(합성:생물제제 71:29)는 역대 최다이다. 최근 들어 합성신약 대비 생물학적 제제의 비율이 점차 높아지고 있는 경향이 있다. 승인된 희귀질환(orphan) 치료제와 항암제의 숫자도 증가 추세이며, 2012년에 처음 시작된 혁신치료제(breakthrough therapy)도 지정 이후 꾸준히 증가하고 있다.
기념비적인 합성신약으로는 2017년에 Agios/Celgene에서 개발한 IDH2 저해제인 Enasidenib이 있으며, 이는 암 특이적인 대사경로를 억제하여 암 세포를 사멸시킬 수 있다는

주) NME: new molecular entities, BLA: biologics license applications
출처: Nature Reviews Drug Discovery 2019, 19, 85-89.
[그림 3-50] 연도별 미국 FDA 신약 승인 수
것을 임상에서 입증한 첫 사례로 큰 의미가 있다. 곧바로 2018년에 Agios에서 IDH1 저해제인 Ivosidenib을 승인 받아, 검증된 표적으로서 암 대사 분야 연구가 더욱 활발해질 것으로 기대된다. Novartis의 Ribociclib(2017)과 Eli Lilly의 Abemaciclib(2017)은 CDK 억제제로 각각 두, 세 번째로 승인 받은 약물이다. 2017년에 Eli Lilly에서 류마티스 관절염 치료제로 개발한 JAK 저해제 Baricitinib의 승인이 거절되었으나, 다시 NDA에 도전하여 2018년 승인되었다.
(2) 블록버스터
(가) 2017∼2018년 개발된 블록버스터 예상 합성신약
해가 갈수록 First-in-class 약물 개발이 희소해짐에 따라 블록버스터 감소 추세가 계속되는 상황에서, 2017년 승인된 합성신약 10개와 2018년 7개가 각각 승인 6년 후에 블록버스터로 예상되었으며, 이중 항암제가 6개로 가장 높은 비율을 차지했다. 2017년 승인된 약물 중 예상 매출액이 가장 높은 것은 Novo Nordisk의 제2형 당뇨병 치료제인 Semaglutide 이며, 이 약물은 6번째로 승인된 GLP1 작용제로써 2023년 4억 7,000만 달러의 매출이 예상된다. Gilead의 HIV(인간면역결핍바이러스) 치료제인 Biktarvy는 6년 후 예상 매출액이 6억 7,000만 달러로 2018년 개발된 약물 중 가장 높았다.
[표 3-13] 2017∼2018년 개발된 블록버스터 예상 합성신약
|
약물명 (상품명) |
개발사 |
작용기전 |
적응증 |
6년 후 예상 매출 (USBD) |
|
Ribociclib (Kisqali) |
Novartis |
CDK4/6 저해제 |
HR-(+), HER2-(-) 유방암 |
1.7 |
|
Niraparib (Zejula) |
Tesaro |
PARP 저해제 |
상피난소암, 나팔관암, 복막암 |
1.3 |
|
Valbenazine (Ingrezza) |
Neurocrine Biosciences |
VMAT2 저해제 |
지연성 안면마비 |
1.5 |
|
Betrixaban (Bevyxxa) |
Portola Pharmaceuticals |
FXa 저해제 |
심부정맥 혈전증 예방 |
1.0 |
|
Neratinib (Nerlynx) |
Puma Biotechnology |
EGFR, HER2, HER4 비가역 저해제 |
HER2-과발현 유방암 |
2.1 |
|
Glecaprevir, pibrentasvir (Mavyret) |
AbbVie |
NS3/4A protease NS5A 저해제 |
HCV |
1.4 |
|
Abemaciclib (Verzenio) |
Eliy Lilly |
CDK4/6 저해제 |
HR-(+), HER2-(-) 유방암 |
1.7 |
|
Acalabrutinib (Calquence) |
AstraZeneca/Acerta Pharma |
BTK 저해제 |
맨틀세포 림프종 |
1.0 |
|
Semaglutide (Ozempic) |
Novo Nordisk |
GLP1 수용체 작용제 |
제2형당뇨병 |
4.7 |
|
Ertugliflozine (Steglatro) |
Merck & Co./Pfizer |
SGLT2 저해제 |
제2형당뇨병 |
1.0 |
|
Bictegravir, emtricitabine and tenofovir alafenamide (Biktarvy) |
Gilead Sciences |
HIV-1 integrase, HIV-1 nucleoside/nucleotide reverse transcriptase 저해제 |
HIV |
6.7 |
|
Tezacaftor and ivacaftor (Symdeko) |
Vertex Pharmaceuticals |
CFTR corrector, CFTR potentiator |
Cystic fibrosis |
2.0 |
|
Apalutamide (Erleada) |
Johnson & Johnson |
Androgen 수용체 작용제 |
전립선암 |
1.6 |
|
Baricitinib (Olumiant) |
Incyte/Eli Lilly |
JAK 저해제 |
류마티스 관절염 |
1.2 |
|
Cannabidiol (Epidiolex) |
GW Pharmaceuticals |
Cannabinoid |
Dravet syndrome, Lennox-Gastaut syndrome |
1.0 |
|
Elagolix sodium (Orilissa) |
AbbVie |
GnRH 수용체 길항제 |
Pain associated with endometriosis |
1.7 |
|
Inotersen (Tegsedi) |
Ionis Pharmaceuticlas |
TTR-directed antisense oligonucleotide |
Hereditary TTR-mediated 아밀로이드증 |
1.0 |
출처: Nature Reviews Drug Discovery 2019, 19, 85-89; Nature Reviews Drug Discovery 2018, 19, 81-85.
(나) 2018년 매출액 상위 합성신약
2018년 매출액 상위 15위 약물 중 11개는 생물학제제이고 합성신약은 총 4개에 불과하다. BMS와 Pfizer의 항응고제인 Apixaban이 2017년 73억 9,000만 달러(6위)에서 2018년 98억 7,000만 달러(2위)로 매출액이 33% 이상 급증했다. 다발성경화증과 맨틀셀 림프종 치료제인 Celgene의 Lenalidomide도 96억 9,000만 달러로 매출액 증가 추세를 이어가며 3위를 차지했다. Bayer와 J&J의 항응고제 Rivaroxaban이 65억 9,000만 달러로 10위, 매출이 감소한 Pfizer의 신경병 치료제 Pregabalin이 5억 달러로 15위를 유지했다.
[표 3-14] 2018년 매출액 상위 합성신약
|
제약사 |
제품명 |
효능・효과 |
2017년 매출액 (USBD) |
2018년 매출액 (USBD) |
전년대비 증감률 (%) |
|
BMS/Pfizer |
Eliquis® (apixaban) |
항응고제 |
7.395 |
9.872 |
33.5 |
|
Celgene |
Revlimid® (lenalidomide) |
다발성경화증, MCL |
8.187 |
9.685 |
18.3 |
|
Bayer/J&J |
Xarelto® (rivaroxaban) |
항응고제 |
6.234 |
6.589 |
5.8 |
|
Pfizer |
Lyrica® (pregabalin) |
신경병치료제 |
5.605 |
4.970 |
Δ1.9 |
주) USBD: US billion dollar
출처: C&EN 2019.03.11.

[그림 3-51] 2018년 매출액 상위 합성신약의 구조
(3) 질환별 연구개발
질환별 하나의 평균 약물 개발비는 항암제 7억 달러, 항생제 및 감염증 치료제 2억 달러, 심혈관 치료제는 임상시험 규모가 커서 10억 달러로 가장 많은 개발비가 소요된다. 그러나 약물 하나당 순 현재가치(net present value)는 항암제 782억 달러, 감염증 치료제 83억 달러, 심혈관 치료제 56억 달러로 알려져 있으며, 이러한 데이터는 제약사에서 항암제 개발에 주력하는 현실을 뒷받침하고 있다.6)
항암제 타깃 발굴이나 임상 연구 시에 인공지능을 이용하여 효율을 높이려는 시도가 진행되고 있다. 2019년 1월 표적단백질 분해제로는 최초로 Arvinas의 경구용 안드로젠 수용체 분해제 ARV-110을 이용한 전립선암 치료제 임상연구가 승인을 받았고, 7월에는 Arvinas의 에스트로젠 수용체 분해제 ARV-471을 이용한 유방암 치료제 임상연구 허가를 받았다.
지난 2년간 개발된 블록버스터급 항암제로는 CDK4/6 저해제인 Ribociclib과 Abemaciclib은 HR-(+), HER2-(-) 유방암, PARP 저해제인 Niraparib은 나팔관암, EGFR//HER2/2 저해제인 Neratinib은 HER2-과발현 유방암, BTK 저해제인 Acalabrutinib은 멘틀세포 림프종 치료제 등이 있다.
C형 간염치료제인 Glecaprevir와 HIV 치료제인 Bictegravir 등이 지난 2년간 승인된 블록버스터급 감염증치료제이다. FXa 저해제인 Betrixaban은 블록버스터급 심부정맥 혈전증 예방약으로 승인받았다. GLP1 수용체 작용제인 Semaglutide와 SGLT2 저해제인 Ertugliflozin은 제2형 당뇨병 치료제로 허가되었다.
(4) 산업동향
다양한 형태의 인수 합병이 계속되고 있다. 2019년 1월 Takeda는 아일랜드의 Shire를 460억 파운드에 인수하였고 업계 10위권 제약사로 도약했고, 2019년 4월 BMS는 Celgene을 740억 달러에 인수해 업계 3위로 부상할 전망이다. Pfizer의 매출이 2024년에 512억 달러로 Novartis나 Roche를 앞지를 것으로 예견된다. AI를 이용한 신약개발, 표적단백질분해 연구가 각광을 받으며 이를 통한 신약개발의 패러다임 전환을 위한 노력이 제약산업 전반에 걸쳐 진행되고 있다.
다. 국내 현황
(1) 합성신약 승인 현황
2017년 일동제약에서 개발한 만성B형 간염치료제 베시보정과 2018년 CJ헬스케어에서 개발한 위식도역류질환 치료제 케이켑정이 각각 28번째와 30번째로 승인된 국내신약이다(국산 신약 29호는 인보사). 베시보정은 2017년 매출이 4,500만 원에서 2018년 4억 4,000만 원으로 10배가량 증가했다. 케이켑정의 2018년 매출은 700만 원에 그쳤으나, 2019년 베트남과 멕시코 및 중남미 제약사와 공급 계약 체결로 매출이 급증할 것이다.
[표 3-15] 2017∼2018년 국내 합성신약 승인 현황
|
연번 |
제품명 |
회사명 |
주성분 |
효능・효과 |
허가일자 |
|
30 |
케이캡정 |
CJ헬스케어(주) |
테고프라잔 |
위식도역류질환 치료제 |
2018.7.5. |
|
28 |
베시보정 |
일동제약(주) |
베시포비르 |
만선 B형 간염치료제 |
2017.5.15. |
출처: 한국신약개발연구조합
(2) 합성신약 매출 현황
2018년까지 개발된 국내신약 총 30개 중에서 23개 품목의 2017년 총 매출액은 1,852억 원으로 전년 대비 10.1% 증가했고, 2018년 총 매출액은 2,233억 원으로 전년 대비 20.5% 증가했다. 국내 개발 신약 중 매출 100억 원 이상의 약물을 블록버스터급이라고 하는데, 2018년에 100억 원 이상의 처방 실적을 기록한 합성신약은 총 5종이다. 제미글로(LG, 국산 신약 19호), 카나브(보령, 국산 신약 19호), 듀비에(종근당, 국산 신약 20호)는 각각 제미메트와 제미로우, 듀카브와 투베로, 듀비메트 등의 복합제를 추가 발매함으로써, 놀텍(국산 신약 14호)과 펠루비(국산 신약 12호)는 적응증 확장 및 해외시장 개척으로 처방이 급증했다.
[표 3-16] 국내 합성신약 블록버스터 매출 현황
|
제약사 |
제품명 |
효능・효과 |
생산금액(억 원) |
허가일자 |
|
|
2017 |
2018 |
||||
|
LG생명과학 |
제미글로군 |
당뇨치료제 |
621.8 |
701.8 |
2012.6.27. |
|
보령제약 |
카나브군 |
고혈압치료제 |
409.2 |
528.8 |
2010.9.9. |
|
대원제약 |
펠루비 |
소염진통제 |
110.9 |
208.3 |
2007.4.20. |
|
일양약품 |
놀텍 |
항궤양제 |
160.0 |
186.1 |
2008.10.28. |
|
종근당 |
듀비에군 |
당뇨치료제 |
122.8 |
135.1 |
2013.7.4. |
출처: 아이큐비아 데이터
(3) 연구개발 현황
한국제약바이오협회 주최로 2019년 1월 실시한 국내 100개 제약사 설문조사를 통해 개발 중인 합성신약이 총 225개로 파악되었다. 항암제가 가장 많았고, 이어서 감염성질환, 면역질환 순이었다. 해외 기술이전은 2017년 8건에 12억 3,400만 달러, 2018년 12건에 47억 9,500만 달러, 2019년 1분기에만 2조 1,000억 원을 달성하여 계속 성장세에 있다.
유한양행은 2018년 11월 비소세포폐암 신약후보물질 레이저티닙을 12억 5,500만 달러에 얀센 바이오테크로 기술 이전하여 현재 임상 3상 진행 중이다. 2019년 1월초 비알콜성 지방간염(NASH) 치료제 후보물질 2종을 대형 제약사인 길리어드사이언스에 7억 8,500만 달러, 7월에도 역시 NASH 후보물질(YH25724)을 베링거인겔하임에 총 8억 7,000만 달러 규모로 기술이전하였다.
2011년 Aerial에 기술이전한 SK바이오팜의 Solriamfetol은 수면장애치료제로 Jazz 제약사에 의해 2019년 3월 미국 FDA에 승인되었고, 뇌전증 치료제 Cenobamate가 임상3상을 완료하여 올해 11월 승인이 기대되고 있다. 특히 Solriamfetol은 국내 신약 중 미국 FDA의 허가를 받은 세 번째 신약이며, 2024년 매출이 5억 달러로 예측되고 있다.
티움바이오는 2018년 말 이탈리아 글로벌 제약사 키에지(Chiesi Farmaceutici) 그룹에 특발성 폐섬유증 치료 후보물질(TGF-β 저해제 NCE401)을 총 7,400만 달러에 기술이전 하였다. 에이치엘비의 말기위암 치료제 Apatinib의 임상 3상 결과에 따르면 FDA 승인이 어려운 것으로 보인다.
(4) 산업동향
최근 2년 동안 제약산업 관련 바이오벤쳐 창업과 역량이 증대되었고, 이에 따라 벤처캐피탈의 투자가 연 8,000억 원 이상으로 급증하였다. 보령제약과 라파스, 일동제약과 올릭스, 유한양행과 GC녹십자 등 제약사와 바이오벤처 간에 협업이 증가하였다. 동아에스티와 아스트라제네카의 면역항암제 공동연구와 같이 다국적 제약사와의 협업도 증가 추세이다.
라. 발전 전망
2018년 11월말 현재 43개의 NDA가 진행 중인 상황에서, 2019년 미국 FDA 승인 합성신약 수는 2018년 수준보다는 좀 낮거나 유사할 것으로 전망된다. 2018년 현재 전 세계 처방약 매출액 중 합성신약과 생물학제제의 비율이 72:28이며 2024년에는 32:68로 예견된다. 향후 5년 이내에 항암제 매출이 전체 신약 매출의 19% 이상이 될 것으로 예측된다. 특히, 면역항암제의 부상이 급증할 것이다. 전립선암 치료제로 androgen receptor 표적에 대한 PROTAC과 유방암 치료제로 estrogen receptor PROTAC이 각각 IND 승인을 받음에 따라, 향후 PROTAC 플랫폼 기술을 이용한 임상연구 결과에 귀추가 주목된다. 인공지능(AI)을 통한 신약개발에 대한 기대감이 높아지고 있으나, 2019년 4월 IBM이 Watson AI 판매를 중지한 것이 시사하는 바가 크다. 당분간 이 분야는 신약개발(discovery) 비용 절감과 임상 시험의 효율성 측면에서 계속 성장할 것으로 예상된다.
국내 제약산업은 2019년 1분기에만 기술이전 2조 1,000억 원을 달성하여 계속 성장세에 있다. 유한양행의 NASH 후보물질, SK바이오팜의 Solriamfetol 등의 등장을 바탕으로 국내 유래 합성신약의 개수가 증가할 것으로 전망된다.
2018년 삼성바이오로직스 분식 회계 논란과 코오롱생명과학 유전자 세포 치료제 인보사 사태가 국내 신약개발에 미치는 부정적 영향 극복이 필요한 상황이다. 바이오헬스 산업을 3대 신산업으로 선정한 문재인정부의 기조에 따라, 혁신신약과 의료기기 개발 등을 위한 연구개발에 향후 최소 5년간 연 4조 원 규모의 투자가 예견된다. 또한, 정부 주도로 국가 바이오 빅데이터를 구축하여 환자 맞춤형 신약개발 연구에 활용할 전망이다.
2. 바이오의약품
가. 정의
바이오의약품은 생물학적 제제, 유전자재조합의약품, 세포배양의약품, 세포치료제, 유전자치료제, 그외 식품의약품안전처장이 인정하는 제제를 포함한다. 바이오의약품은 합성의약품과 비교해 제조과정이 복잡하고, 인간 혹은 동물 유래의 세포 혹은 미생물 등의 생물유래 물질을 응용하여 생산할 수 있게 되었다. 또한 수익성과 고용창출효과가 높아 우리나라 산업의 중추 역할을 해 왔던 IT 산업에 이어 차세대 성장동력 산업으로 주목을 받고 있다. 이러한 배경에서, 최근 10년 간 바이오의약품 개발의 커다란 진전은 국내외 수많은 회사들로 하여금 새로운 분야에 대한 도전과 투자를 유도하고 있다.
나. 국내외 바이오의약품 개발 동향
최근의 바이오의약품 개발 트렌드와 향후 의약품 개발에 영향을 미칠 기술로는 면역항암치료제로서의 항체치료제 기술과 특허만료에 따라 급부상하고 있는 바이오시밀러, 2017년 미국 FDA의 승인 이후 세포치료제 기술개발을 주도하고 있는 CAR-T 세포치료제, 그리고 유전자치료제로서 역사적인 임상성공사례를 기록한 RNAi 치료제 등이 있다.
(1) PD-1/PD-L1 항체치료제와 그 외 면역관문억제제의 개발 동향
최근 항암제 개발의 트렌드는 크게 변화하고 있으며, 이의 중심에 PD-1/PD-L1, CTLA4 등의 면역관문(immune checkpoint)을 타깃하는 면역항암제가 있다. 2019년 6월 현재 PD-1/PD-L1 타깃의 항체치료제로 시장에 출시된 제품은 Bristol Myers Squibb(BMS)사의 Opdivo(nivolumab), Merck&Co.사의 Keytruda(pembrolizumab), Roche사의 Tecentriq (atezolizumab), Merck KGaA/Pfizer사의 Bavencio(avelumab), AstraZeneca사의 Imfinzi (durvalumab), Regeneron/Sanofi사의 Libtayo(cemiplimab-rwlc)가 있다. 현재까지 승인된 면역관문저해제는 모두 CTLA4와 PD-1/PD-L1을 타깃하는 항체의약품들이지만, 향후 출시를 위해 연구개발 중인 면역관문저해제들은 다양한 타깃을 통한 항암면역 기전으로의 확장을 시도하고 있으며, 단독요법으로서의 효능뿐만 아니라 다양한 병용요법에서도 효능을 보일 수 있도록 고안되고 있다. 현재 임상 혹은 전임상 개발이 진행 중인 신규 면역항암제는 암환자의 면역저해를 억제하는 방향뿐만 아니라 좀 더 공격적인 방법으로 기존 면역항암제와 병용 시 강력한 효능을 제시하는 방향으로 진행 중이며, 차세대 면역항암제로 활발한 연구가 진행되는 타깃으로는 granulocyte-macrophage CSF(GM-CSF) 혹은 그 수용체(GM-CSFR), lymphocyte-activation gene 3(LAG3), T-cell immunoglobulin and mucin domain 3(TIM3), V-domain Ig suppressor of T cell activation(VISTA), toll-like receptor(TLR) family, indoleamine 2,3-dioxygenase(IDO), cluster of differentiation 47(CD47), CD40, OX40(CD134), 4-1BB(CD137) 등이 있다. 현재 항암제 연구개발의 판도는 PD-1/PD-L1 타깃 항체를 한 축으로써, 다양한 면역항암제의 병용투여, 혹은 기존 표적항암제 및 화학요법과의 병용투여를 통해 기존의 면역관문저해제 단독투여보다 높은 효능, 확장된 적응증 및 환자군, 개선된 안전성을 추구하는 방향으로 진행되고 있다. Nature Reviews Drug Discovery(2018)에 따르면, 다음 그림과 같이 PD-1/PD-L1 관련 임상시험은 병용투여 임상을 포함하여 2018년 9월까지 2,250건으로, 폭발적인 연구개발이 이루어지고 있으며, 38개의 주요 타깃에 대한 병용투여 임상시험만 1,332건에 달한다.

주) 2017년 9월 기준 1,502건의 PD-1/PD-L1 임상이 2018년 9월 기준 2,250건까지 증가함.
[그림 3-52] PD-1/PD-L1 임상시험 현황(2017.9∼2018.9)

주) 2018년 기준 주요 38개 타깃에 대하여 1,332건의 PD-1/PD-L1 병용투여 임상시험이 진행되고 있으며, 전체 240개 타깃에 대하여 총 1,716건의 병용투여 임상이 진행됨.
[그림 3-53] 주요 38개 타깃에 대한 PD-1/PD-L1 병용투여 임상시험이 건수(2018)
2014년 흑색종을 시작으로 적응증을 확장하고 있는 PD-1/PD-L1 항체치료제의 연대기별 FDA 승인현황은 아래의 도표에서 확인할 수 있다.

[그림 3-54] FDA로부터 승인된 PD-1/PD-L1 적응증 관련 연대기별 요약(2014.9∼2019.6)
국내 연구개발의 경우, 제약 R&D 부문에서 전반적으로 신약개발에 대한 관심도와 투자가 증대하면서, 자연스럽게 바이오의약품의 연구개발에 대한 기대도 커지고 있다. 제넥신은 자궁경부암치료제 GX-188E와 Merck & Co.의 Keytruda 병용투여 국내 임상2a를 성공리에 마치고 현재 국내에서 임상2b를 진행하고 있다. 또한, 유한양행과 미국 소렌토사와의 합작투자회사인 이뮨온시아는 다수의 면역관문저해제 항체신약을 개발하고 있는 가운데 올해 초 국내에서 PD-L1을 타깃으로 하는 임상1상을 성공리에 마쳤으며, 후속 임상을 준비하고 있다.
뿐만 아니라 신라젠은 Pexa-Vec 이라는 항암바이러스에 Regeneron/Sanofi의 Libtayo를 병용투여하는 임상1b, AstraZeneca의 Imfinzi를 병용투여하는 임상1/2상, BMS의 Opdivo와 병용투여하는 임상 1/2상, BMS의 Yervoy와 병용투여하는 임상1상, 그리고 PD-L1 항체와 병용투여하는 임상1상까지 5건의 병용투여 임상을 진행하고 있다. 코스닥 상장을 준비 중인 메드팩토는 TGF-beta를 표적하는 항암후보물질 벡토서팁(Vactosertib)에 Merck& Co.의 Keytruda와 병용투여하는 임상1b/2a상을 국내에서 진행하고 있으며, 같은 물질에 대해 AstraZeneca의 Imfinzi와 병용투여하는 국내 1b/2a상을 진행하고 있다. 재발성 뇌종양 및 전이성 삼중음성유방암 대상으로 Olinvacimab(anti-VEGFR2 mAb)과 Merck&Co.의 Keytruda 병용투여 임상1b상을 호주에서 진행 중인 파멥신은 연내에 해당 임상을 마치고 차년도에 글로벌 수준에서의 확대 임상을 계획하고 있다.
한편, 임상과는 별개로 후보물질 도출 및 전임상 단계에서 다수의 바이오텍 및 제약사들이 연구개발에 몰두하고 있다. 한미약품은 PD-L1/CD47, PD-1/PD-L1, PD-L1/Her2 타깃의 이중표적항체를 전임상 단계에서 개발 중에 있으며, 동아ST는 AstraZeneca와의 공동연구계약을 통해 면역항암 관련 3개의 후보물질 도출에 합의한 바 있고, 파멥신, 앱클론, 에이비엘바이오, 유틸렉스, 와이바이오로직스 등 다수의 회사들이 이중표적항체와 같은 항체치료제 기반 기술을 통해 연구개발을 이어가고 있다.
(2) 바이오시밀러 개발 동향
바이오시밀러(biosimilar) 또는 동등생물의약품은 특허가 만료된 생물의약품에 대한 복제약을 말한다. 동일 성분 화합물의 화학적 합성을 통해 제네릭이라 불리는 복제약을 만드는 일반의약품과는 달리 살아있는 생물체를 통해 합성되기 때문에 original 제품과 100% 동일한 제품을 생산하는 것은 불가능하다. 따라서, 일반의약품의 그것과 비교하기 위해서 바이오복제약 또는 바이오제네릭(Biogeneric)이라 부르기도 한다. 바이오시밀러의 경우 바이오신약과 비교하였을 때 비슷한 효능을 가지고 있으나, 가격이 상대적으로 경제적이기 때문에 효용가치가 있는 의약품으로 인식된다.
2019년 7월 기준 FDA 허가 바이오시밀러 품목은 총 23개이며, 그 가운데 약 1/3인 7개 품목이 셀트리온 및 삼성바이오에피스를 통해 승인되었다. 승인된 품목 23개 가운데 오리지널 개발사와 합의에 따라 미국 내에서 현재 발매 중인 품목은 9개이다. 그 가운데 셀트리온의 ‘인플렉트라’, 삼성바이오에피스의 ‘렌플렉시스’가 시판되고 있고, 2019년 말과 2020년 초에 각각 셀트리온의 ‘트룩시마’와 ‘허쥬마’가 발매될 것으로 예상되고 있다.
[표 3-17] FDA 바이오시밀러 허가 현황(2019.7.24.)
|
순번 |
바이오시밀러 제품명 |
승인시점 |
개발기업 |
오리지널제품 |
|
1 |
Zarxio(filgrastim-sndz) |
2015.03 |
Novartis(Sandoz) |
Neupogen |
|
2 |
Inflextra(infliximab-dyyb) |
2016.04 |
Celltrion |
Remicade |
|
3 |
Erelzi(etanercept-szzs) |
2016.08 |
Novartis(Sandoz) |
Enbrel |
|
4 |
Amjevita(adalimumab-atto) |
2016.09 |
Amgen |
Humira |
|
5 |
Renflexis(infliximab-abda) |
2017.04 |
Samsung Bioepis |
Remicade |
|
6 |
Cyltezo(adalimumab-adbm) |
2017.08 |
Boehringer Ingelheim |
Humira |
|
7 |
Mvasi(bevacizumab-awwb) |
2017.09 |
Amgen & Allergan |
Avastin |
|
8 |
Ogivri(trastuzumab-dkst) |
2017.12 |
Mylan & Biocon |
Herceptin |
|
9 |
Ixifi(infliximab-qbtx) |
2017.12 |
Pfizer |
Remicade |
|
10 |
Retacrit(epoetin alfa-epbx) |
2018.05 |
Pfizer & Hospira |
Epogen |
|
11 |
Fulphila(pegfilgrastim-jmdb) |
2018.06 |
Mylan |
Neulasta |
|
12 |
Nivestym(filgrastim-aafi) |
2018.07 |
Pfizer & Hospira |
Neupogen |
|
13 |
Hyrimoz(adalimumab-adaz) |
2018.10 |
Novartis(Sandoz) |
Humira |
|
14 |
Udenyca(pegfilgrastim-cbqv) |
2018.11 |
Coherus Biosciences |
Neulasta |
|
15 |
Truxima(rituximab-abbs) |
2018.11 |
Celltrion |
Rituxan |
|
16 |
Herzuma(trastuzumab-pkrb) |
2018.12 |
Celltrion |
Herceptin |
|
17 |
Ontruzant(trastuzumab-dttb) |
2019.01 |
Samsung Bioepis |
Herceptin |
|
18 |
Trazimera(trastuzumab-qyyb) |
2019.03 |
Pfizer |
Herceptin |
|
19 |
Eticovo(etanercept-ykro) |
2019.04 |
Samsung Bioepis |
Enbrel |
|
20 |
Kanjinti(trastuzumab-anns) |
2019.06 |
Amgen & Allergan |
Herceptin |
|
21 |
Zirabeb(bevacizumab-bczr) |
2019.06 |
Pfizer |
Avastin |
|
22 |
Hadlima(adalimumab-bwwd) |
2019.07 |
Samsung Bioepis |
Humira |
|
23 |
Ruxience(rituximab-pvvr) |
2019.07 |
Pfizer |
Rituxan |
*음영은 국내 개발 제품임.
(3) CAR-T(chimeric antigen receptor-T) 세포치료제와 개발 동향
CAR-T 세포란 T세포에 암세포를 항원으로 인식하는 수용체 유전자를 도입하여 암세포를 파괴할 수 있도록 유전자가 재조합된 T세포로서, 암 환자 혈액에서 T세포를 추출한 뒤 바이러스 벡터를 이용하여 암 세포 특이적 키메릭 수용체(CAR: Chimeric Antigen Receptor)를 발현하도록 한 뒤 환자에 재주입하는 방식이다. 기존 CAR-T 세포의 한계점 및 부작용 극복을 위한 기술이 지속적으로 개발되어 현재 3세대 기술에 대한 연구개발이 진행 중에 있다. 3세대 CAR-T 세포는 보조 자극신호 역할을 하는 신호 도메인 2개와 인공 수용체도 추가되어 항원 인식 능력이 높아져 부작용이 최소화 되었다.
CAR-T 치료제로서 세계에서 최초로 허가를 받은 제품은 2017년 8월 미국 식품의약국(FDA)으로부터 허가를 받은 Novartis의 Kymriah(성분명 tisagenlecleucel)였으며, 그로부터 두 달 후, Gilead의 Yescarta(성분명 axicabtagene ciloleucel)가 허가를 받았다. CAR-T
[표 3-18] CAR-T 기술협력 현황
|
회사명 |
주요내용 |
|
Baxalta |
17억 달러에 Precision Biosciences와 CAR-T 관련 기술개발 협력을 체결 |
|
Regeneron |
Adicet Bio의 기술이전을 위하여 2억 5,000만 달러의 선급금 지불 |
|
Takeda |
Noile-immune과 전략적 파트너쉽 구축 |
|
Genentech |
Bellicum을 주식인수 방식으로 M&A 진행 |
|
Gilead Sciences |
Kite Pharmaceuticals를 120억 달러에 인수한 뒤 Yescarta의 시판승인 획득 Gene Swithc CAR-T 기술보유한 Cell Design Labs를 5억 7,000만 달러에 인수 유전자 편집기술을 보유한 미국의 Sangamo Biosciences와 협력 |
|
Celgene |
Juno Therapeutics를 주식인수 방식으로 90억 달러에 인수 Bluebird bio와 협력하여 BCMA(B cell maturation antigen) 타깃 CAR-T 연구 Agios Pharmceuticals와 파트너쉽 구축 |
|
Pfizer |
Cellectis, Sevier와 협력하여 Allogenic CAR-T 치료제 개발 |
|
Janssen |
Nanjing Legend Biotech의 BCMA 타깃 CAR-T 치료제 3억 9,000만 달러 선급금 지불 |
출처: CAR-T 시장의 미래(KDDF 기고_이선정)
치료제의 등장은 항암제 개발에 있어서 하나의 기념비적 사건으로 인식되고 있는데, 그 이유는 재발/불응성 B세포 림프구성 백혈병 환자 80%에서 완전관해(CR: complete remission)의 효능을 보임에 따라 혈액암 치료제의 새로운 패러다임을 제시하였기 때문이다.
CAR-T의 임상 파이프라인은 2007년 3개, 2014년 30여 개에 불과하였으나, 2017년 1월 373개로 급증하였으며, 이러한 흐름을 반영하여 Baxalta, Genentech, Takeda, Pfizer 등 빅파마들도 기술거래 및 M&A 등을 통하여 CAR-T 개발에 박차를 가하고 있다.
한국에서도 CAR-T 개발 열풍이 불고 있으나 허가된 CAR-T 세포치료제는 아직 없다. 국내 기업 중에선 GC녹십자셀 외에도 헬릭스미스(옛 바이로메드), 앱클론, 큐로셀, 파멥신, 툴젠, 유틸렉스, 바이오큐어팜 등이 CAR-T를 개발 중인 것으로 알려져 있다. 국내 연구의 특징은 아직 연구개발이 진행되는 기술로서 주로 바이오벤처 기업이 개발을 주도하고 있으며, 현재까지 임상시험에 진입한 기업은 없는 것으로 파악된다.
현재 개발 진행 중인 CAR-T 세포치료제 및 관련 세포치료제들은 항암면역의 기전을 활용하여 기존의 혈액암 치료대비 높은 효능과 낮은 재발률을 보이고 있으나, 고형암에서의 낮은 효능, 싸이토카인 방출 증후군(CRS: cytokine release syndrome) 등과 같은 강한 면역반응에 의한 부작용 문제, 암 공격 타깃으로부터 유래된 타깃 특이적 독성(on-target toxicity), 철저한 개인 맞춤의약품으로서의 공정 및 시료이동의 난맥상, 과도한 약가 등의 문제점이 여전히 해결해야 할 숙제로 남아 있다.
(4) 유전자 치료제 개발 동향
유전자 치료제란 잘못된 유전자를 정상 유전자로 바꾸거나 치료 효과가 있는 유전자를 환부에 투입해 증상을 고치는 차세대 바이오의약품을 말한다. 노바티스(Novartis)는 2019년 5월 24일 FDA가 졸겐스마(Zolgensma)를 생존운동신경원1(SMN1: Survival Motor Neuron) 유전자의 이중 대립형질 돌연변이를 가진 2세 이상의 척수성 근위축증(SMA: Spinal Muscular Atrophy) 소아 환자를 위한 치료제로 승인 받았다. 졸겐스마(Zolgensma)는 지속적인 SMN 단백질 발현을 통한 질병 진행을 중단시키기 위해 인간 SMN 유전자의 기능적 카피를 1회 정맥 주입으로 제공하면서 척수성 근위축증(SMA: Spinal Muscular Atrophy)의 유전적 근본 원인을 치료하도록 만들어졌다. 졸겐스마(Zolgensma)의 가격은 212만 5,000달러(약 25억 2,500만 원)로 정해졌다. 미국 스파크 테라퓨틱스(Spark Therapeutics)가 희귀 질환인 유전성 망막질환 치료를 위해 개발한 ‘럭스터나(Luxturna)’ 역시 약가가 8억 5,000만 원∼9억 원 정도의 고가에 형성됐다. 국내 유전자 치료제 개발 대표 주자로는 핼릭스미스, 제넥신, 신라젠 등이 있다.
한편, 최근에 유전자치료제로서 역사적인 임상 성공사례를 기록한 RNAi 치료제가 차세대 기술로서 급부상하고 있다. RNAi(RNA interference)란 RNA가 특정 유전자의 발현 등에 영향을 끼치는 현상으로, 이를 활용해 신체 현상을 조절하거나 질병 치료가 가능하다. RNAi 치료제는 모든 유전자를 특이적으로 공략하므로 치료제가 없는 난치 질환의 새로운 해결책으로 부상하고 있으며, 다양한 질병에 적용이 가능하다는 점에서 차세대 미래 신약 기술로 인정받고 있다. 첫 RNAi 기반 치료제 약물은 Alnylam사의 ‘파티시란(Patisiran)’으로 hATTR 아밀로이드증을 치료하는데 사용하며 2018년 8월 미국 FDA의 승인을 받았다. 같은 회사의 두 번째 RNAi 치료제인 ‘기보시란(Givosiran)’은 siRNA(Short- interfering RNA)로, ALAS1(Aminolevulinic Acid Synthase 1)의 RNA에 결합하여 신경독성 물질인 ALA가 생성되는 것을 저해함으로써 급성 간성 포르피린증 증상을 예방한다. ‘기보시란’은 급성 간성 포르피린증 치료제로 퍼스트 인 클래스(first-in-class) 신약이 될 전망이며, 이벨류에이트파마는 ‘기보시란’이 시장에 성공적으로 출시될 경우 2024년에는 전 세계 시장에서 3억 9,700만 달러의 매출을 올릴 것으로 예상했다. 한편, Alnylam사는 올해 초 ‘J.P Morgan healthcare conference’에서 2021년까지 5개의 RNAi 치료제를 출시할 것이라고 발표한 바 있다.
국내의 대표적 RNAi 치료제 업체로는 바이오니아, 올릭스 등이 있다. 바이오니아는 자사의 RNAi 치료제 원천기술(SAMiRNA)을 이용해 발굴한 고효율의 siRNA 후보물질에 대해 최근 임상시험심사위원회(IRB)로부터 인체적용시험 진행을 위한 승인을 받았다. 해당 기술은 나노입자형 RNAi 신약기술로 혈액 내 물질 안정성이 뛰어나고 생체 내 독성에 의한 부작용이 없다. 또한 나노입자형이라 기존 RNAi 치료제와 달리 전달체가 필요 없다.
인체적용시험은 안드로겐성 탈모증(유전적 탈모)으로 진단된 남녀 환자를 대상으로 진행되며 연내 식품의약품안전처 기능성화장품 승인을 목표로 하고 있다.
올릭스는 2019년 3월 전임상 단계의 황반변성(AMD: Dry and Wet Age-related Macular Degeneration) 치료제 ‘OLX301A’를 프랑스 안과전문기업 ‘라보라토리 떼아(Laboratoires THEA S.A.S)’ 계열사 ‘떼아 오픈 이노베이션(Thea Open Innovation)’과 총 800억 상당의 기술이전 계약을 체결했다. 황반변성은 망막 중심부의 조직이 괴사해 시력을 잃는 질환으로 건성과 습성 황반변성으로 나뉘는데, 건성의 경우 치료제가 전무하고 습성의 경우 기존치료제의 내성 또는 불응 환자가 발생하는 등 부작용이 보고되어 의학적 미충족 수요가 큰 질환이다. 올릭스의 ‘OLX301A’ 프로그램은 건성 및 습성 황반변성 질환을 동시에 치료할 수 있는 혁신 신약(First in Class)으로 올해 하반기 미국 FDA에 임상1상 시험계획서를 신청할 계획이다.
다. 발전 전망
고전적인 의약품 시장의 전체 매출을 고려해 보았을 때, 여전히 합성신약의 매출이 우세한 반면, 지난 3년 간 미국 FDA의 바이오의약품 승인 절차인 Biologics License Approvals(BLAs)의 승인 현황을 살펴보면 2016년 7종, 2017년도 12종, 2018년 17종의 바이오의약품이 승인되었다. 이는 2014년 이전 약 20년 간 6종 이하의 바이오의약품이 승인되었던 사실을 볼 때 매우 고무적인 현상이다.
이러한 바이오의약품의 큰 성공요인 중의 하나는 주요 만성질환, 특정 암종 및 자가면역질환에서 기존 시장의 주력 약품에 비해 바이오의약품의 경우 효능은 높고 부작용 낮은 특성 때문이다. 고령화로 인한 시장 증대를 고려해 본다면 이러한 바이오의약품의 선전은 향후 10년간 글로벌 시장의 대대적인 확장으로 이어질 전망이다.

출처: Nature Reviews Drug Discovery, 2019
[그림 3-55] 미국 FDA 의약품 승인 건수(1993∼2018)
EvaluatePharma World Preview 2019에 따르면 2018∼2024년까지 전체 의약품 시장의 연평균성장률(CAGR)은 6.5%에 이를 것으로 전망된다. 특히, 2024년도 전체의약품 매출 순위 상위 10위권 이내에 바이오의약품이 5개가량 랭크될 것으로 예상되는 가운데, 이들의 예상 매출 총합계는 약 $56B로 상위 10개 품목 매출액의 약 56%를 차지할 것으로 추정된다.
[표 3-19] 전체 의약품 매출 순위 상위 10위권 이내 매출 규모 전망(2018∼2024)
|
Rank |
Product |
Generic Name |
Company |
Mechanism of Action |
WW Product Sales($m) |
Market Status |
||
|
2018 |
2024 |
CAGR (%) |
||||||
|
1 |
Keytruda |
pembrolizumab |
Merck & Co +Otsuka Holdings |
PD1 antibody |
7,198 |
17,009 |
+15.4 |
Marketed |
|
2 |
Humira |
adalimumab |
AbbVie + Eisai |
TNF-a antibody |
20,485 |
12,403 |
-8.0 |
Marketed |
|
3 |
Eliquis |
apixaban |
BMS |
Coagulation factor Xa Inhibitor |
6,438 |
12,021 |
+11.0 |
Marketed |
|
4 |
Opdivo |
nivolumab |
BMS +Ono Pharma |
PD1 antibody |
7,574 |
11,323 |
+6.9 |
Marketed |
|
5 |
Imbruvica |
Ibrutinib |
AbbVie +J & J |
Bruton’s tyrosine kin ase(BTK) Inhibitor |
4,454 |
9,514 |
+13.5 |
Marketed |
|
6 |
Ibrance |
palbociclib |
Pfizer |
CDK4 Inhibitor, CDK 6 Inhibitor |
4,118 |
9,128 |
+14.2 |
Marketed |
|
7 |
Revlimid |
lenalidomide |
Celgene |
IL-6 antagonist, NK cell stimulant, NKT cell stimulant: TNF-a Inhibitor, VEGF Inhibitor |
9,816 |
8,057 |
-3.2 |
Marketed |
|
8 |
Stelara |
ustekinumab |
J & J +Mitsubishi Tanabe Pharma |
IL-12 antibody: IL-23 receptor antib ody |
5,293 |
7,791 |
+6.7 |
Marketed |
|
9 |
Eylea |
aflibercept |
Regeneron Pharmaceuticals +Bayer +Santen Pharmaceutical |
VEGFR antagonist |
7,159 |
7,313 |
+0.4 |
Marketed |
|
10 |
Biktarvy |
emtricitabine |
Gilead Sciences |
HIV-1 Integrase Inhi bitor; HIV-1 nucleo side reverse transcri ptase Inhibitor(NRT) |
1,184 |
6,977 |
+34.4 |
Marketed |
|
|
Total |
73,719 |
101,536 |
+5.5 |
Marketed |
|||
|
|
Total WW Individual Products Forecast |
676,147 |
989,099 |
+6.5 |
|
|||
시장의 성장세와 맞물려 제약업계가 이러한 혁신적인 바이오의약품에 거는 기대치는 매우 크며, 실제로 글로벌 제약사 및 바이오텍사 R&D 활동의 상당 부분이 바이오의약품 개발에 투자되고 있는 실정이다. 바이오의약품은 대부분 최신의 혁신적 과학 검증 결과를 토대로 중개연구를 통해 고안된 새로운 방법의 치료제이기 때문이다.
오랜 연구에 대한 결실과 함께 최근 인체와 질병에 대한 과학적 이해도가 높아짐에 따라, 향후 더 큰 성과로 결실을 맺을 것으로 예상된다. 바이오의약품의 시장 성장세에 따른 그 기대치 증가와 개발에 대한 투자 규모의 증가는 미래 바이오의약품이 더 다양하고 획기적이며 혁신적인 제품이 지속적으로 등장하여 의약품 시장의 변화를 주도할 것으로 기대한다.
3. 바이오장기
가. 개요
(1) 바이오장기의 정의
바이오장기란 기능을 소실한 인간의 조직과 장기를 복원・재생・대체하기 위해 생명공학적 기법을 이용하여 인간생체와 같은 기능의 장기를 인공적으로 만든 것을 말한다. 줄기세포, 조직공학, 바이오인공장기, 바이오이종장기 연구 분야 등을 포함하며, 이를 위해서는 세포활용기술, 유전자편집기술, 이종장기생산기술, 면역조절기술, 장기이식기술, 생체조직공학기술 등의 생명공학 핵심기술이 요구된다.
(2) 바이오장기의 필요성
인간 수명이 늘어나고 고령 인구가 증가함에 따라 장기부전환자의 수도 기하급수적으로 증가하고 있다. 이 환자들을 치료할 수 있는 유일한 방법이 손상된 장기를 교체해주는 장기이식이지만 타인으로부터 공급되는 장기의 절대 수가 부족한 상황이다.
(가) 장기이식 수요 및 공급 현황
국내외적으로 장기이식 대기자 수는 매년 증가하고 있는데 반해 장기공급은 제한적이다. 국내에서 장기이식을 대기하고 있는 환자는 2000년 이후 계속적으로 증가하여 2017년에는 약 3만 4,187명7)에 이르고 있다. 이러한 장기의 수급 불균형으로 인해 이식
대기 중에 사망하는 환자 또한 증가하고 있는 실정이다. 이 같은 현상은 미국을 비롯하여 전 세계적으로 나타나고 있다.
특히 국내에서는 성인병의 증가 고령화, 유교문화, 출산율 감소 등의 영향으로 외국보다 이식 장기의 수요와 공급의 불균형 현상이 더 심각하다. 이러한 결과로 불법 장기 매매가 성행하고 있으며, 최근에는 국내보다 의료기술 수준이 낮은 외국에서 장기이식을 받는 사례가 증가하여 심각한 사회문제를 일으키고 있다.

출처: 국립장기이식관리센터(KONOS), 2018
[그림 3-56] 장기 등 이식대기자 추이(장기별)(2000∼2017)

출처: https://www.organdonor.gov/statistics-stories/statistics.html#glance
[그림 3-57] 연도별 미국 내 이식대기자(Waiting List), 이식환자(Transplants), 장기공여자(Donors) 수
(나) 대체장기로서 바이오장기
부족한 수의 대체장기를 확보하는 방법으로 줄기세포 분화, 생체조직공학을 이용한 조직재생, 바이오 이종장기 등이 있다. 줄기세포분화 분야에 있어서는 조직이나 장기로의 분화 과정, 분화 조건 등에 대한 연구를 통해 뇌, 장관(intestine), 신장, 폐 등의 유사장기(organoids) 개발에 큰 진전이 있었다. 이를 이용하여 질환모델을 개발하거나, 신약 개발을 위한 스크리닝 방법으로 사용되고 있다. 그러나 아직 혈관 생성 등의 여러 가지 문제가
해결되어야 하고 완전한 장기의 형태를 갖추기까지는 더 많은 연구가 필요하므로 대체장기로서 상용화까지는 많은 시간이 걸릴 것으로 예상된다.
또한 세포를 잉크로 사용하는 3D 바이오프린팅과 같은 생체조직 공학적 방법을 이용해 사람의 심장조직(cardiac patch), 젖꼭지, 뼈 등을 생산하는 방법에 많은 진전이 있으나, 복잡한 기능을 수행하는 장기를 제작하는 데에는 아직 해결해야 할 문제들이 많이 있다. 바이오 이종장기는 사람이 아닌 다른 종의 동물(돼지)로부터 이식을 목적으로 생산된 장기를 사람에게 이식함으로써 부전된 기능을 빠르게 회복시킬 수 있기 때문에 시기적으로 볼 때 가장 빠른 시간 내에 대체장기로서의 역할을 수행할 것으로 기대한다.
(다) 바이오이종장기 공급원
사람에게 제공될 장기를 제작하기 위해서는 장기 공급원(동물)이 사람과 생리적인 면에서 유사점이 많아야 하고, 또한 대량 공급을 위해 번식이 잘되어야 한다. 그러나 사람과 가장 유사한 영장류는 번식에 오랜 시간이 걸리고, 사람에게 치명적인 바이러스를 보유할 위험이 있으며, 전 세계적으로 희귀동물로 지정되었기 때문에 이종장기 제공 대상에서 제외되었다.
[표 3-20] 부족한 장기를 대체할 수 있는 방법
|
기술 |
공급 |
현재 적용 가능 여부 |
극복되어야 할 난관 |
비용 |
|
동종장기 |
제한 |
가능 |
공급/면역거부반응 |
중 |
|
배아줄기세포 |
무제한 |
불가능 |
장기형성/면역거부반응 |
중 혹은 고 |
|
역분화줄기세포 |
무제한 |
불가능 |
장기형성 |
고 |
|
시험관내 기관발생 |
? |
불가능 |
크기/성숙/기능 |
고 |
|
생체내 기관발생 |
? |
불가능 |
성숙/기능 |
? 중 |
|
기계장치 |
무제한 |
가능(심장, 신장) |
독성/내구성 |
고 |
|
바이오이종장기 |
무제한 |
가능(췌도, 각막) |
면역거부반응 |
저 |
출처: Curr Opin Organ Transplant. 2013 April; 18(2): 179.185.
미니돼지의 경우 인간과 비슷한 크기의 장기를 갖고 있으며, 생리적으로 유사점이 많기 때문에 현재 가장 많이 사용되고 있다. 또한 어미 1마리가 연간 20마리 이상의 새끼돼지를 생산할 수 있어, 이식용 장기의 대량공급이 가능하며 다른 장기대체기술에 비해 비용이 적게 든다. 또한 간염이나 AIDS 바이러스와 같은 치명적인 감염원의 회피가 가능하다는 장점이 있다.
(3) 바이오 이종장기 산업 발전을 위해 극복되어야 할 난관
(가) 장기이식 거부반응 및 복제 기술의 불안정성
이종장기 이식 후에 일어날 수 있는 주된 문제점으로는 조직의 이식거부반응이 있으며 이것은 동종이식보다 훨씬 빠르고 강하게 일어남이 임상시험을 통하여 밝혀졌다. 이식거부반응이란, 이식된 장기가 수혜자의 체내에서 초급성 거부반응, 급성혈관성 거부반응, 세포매개성 거부반응, 만성 거부반응을 일으켜 장기로서의 제 기능을 하지 못하고 괴사해버리는 것을 말한다. 활발한 연구를 통하여 이러한 이식거부반응의 기전은 비교적 많이 밝혀졌으며 이를 토대로 이식거부반응을 제어하기 위한 유전자 적중기술 및 형질전환돼지의 생산이 연구되어 왔다.
경우에 따라 돼지세포 표면에 존재하는 당(sugar) 성분인 알파-갈(1,3-α-Galactose)에 의해 혈청보체계와 혈액응고계가 활성화되어 이식 후 수분 이내에 초급성 거부반응이 나타날 수 있다. 이에, 2002년 미국에서 알파-갈 전이효소가 제거된 형질전환돼지가 개발되었으며(Science 2002;295:1089), 국내에서도 2009년 4월 알파-갈 합성효소 유전자 중 하나가 제거된 미니돼지가 개발되어 초급성거부반응을 극복할 수 있게 되었다.
현재는 CRISPR/Cas-9과 같은 유전자편집 기술의 발전으로 알파-갈 외에 N-glycolylne- uraminic acid(Neu5Gc), β-1,4-N-acetyl-galactosamine와 같은 당을 만드는 전이효소가 모두 제거된 형질전환돼지가 개발되어 당 성분이 상이하여 발생하는 대부분의 면역반응을 조절할 수 있게 되었다.
출처: 2015 생명공학백서, 미래창조과학부, 2015
[그림 3-58] 체세포복제에 의한 형질전환돼지 제조방법
급성혈관성 거부반응은 자연항체, 자연살해세포, 단핵구에 의해 혈관내피세포가 활성화됨에 따라 나타나는 반응이다. 이는 사람의 혈청보체 조절인자, 자연살해세포 억제인자가 발현되도록 형질전환된 돼지를 제작하여 혈관내피세포의 안정화, 내피세포유래 면역 매개물질 조절, 자연살해세포 활성화 억제 및 혈소판 기능조절을 통하여 극복하고 있다.
세포매개성 거부반응은 이종항원에 의해 면역세포가 활성화되어 나타나는 반응으로 동종이식에 사용되고 있는 면역억제방법과 면역관용유도 기술을 통하여 극복하려는 노력이 시도되고 있다.
이와 같이 초급성 거부반응, 급성혈관성 거부반응 및 세포매개성 거부반응을 제어하기 위해 관련 유전자들을 제거하거나 발현시키는 형질전환돼지의 개발이 활발히 이루어지고 있다. 또한 복제된 동물들이 유산, 사산, 태어난 지 며칠 되지 않아 죽는 등의 문제를 극복하기 위해 형질전환 복제동물의 생산성 안정화 및 생산효율 증진을 위한 기술도 개발 중에 있다.
위와 같이 이종장기 이식에 적합한 형질전환 복제돼지의 생산은 관련 유전자의 발굴, 유전자편집기술, 핵이식 기술 등을 통하여 다양한 종류가 개발되어 있다. 앞으로는 생산된 돼지를 임상적용하기 위한 허가 및 산업화를 위한 연구가 필요할 것으로 전망된다.
(나) 안전성 문제
인수공통감염병원체는 돼지의 무균화를 통해 차단할 수 있다. 그러나 돼지의 내인성 레트로바이러스(PERV)의 경우 바이러스 유전자가 돼지세포의 염색체 내에 삽입되어 다음 세대로 유전되므로 무균화 작업을 통해서 제거되지 않는다. 이는 이종이식의 임상 적용에 있어서 해결해야 할 문제 중 하나로 대두되어 왔다. 그러나 현재까지 다수의 영장류 이식실험과 이종이식을 받은 환자(2005. 중국 시행)에서 돼지 내인성 레트로바이러스 감염이 확인되진 않았다. 또한 형질전환 돼지 생산 전문회사인 미국의 eGenesis사는 유전자 편집기술을 이용하여 돼지 내인성 레트로바이러스가 제거된 돼지를 성공적으로 개발하였다.
(다) 법적, 사회적, 생명윤리적 문제
아직까지는 이종이식이 초기 단계인 만큼 이종이식을 받은 수여자들에 대한 추적 관리가 요구될 것으로 전망된다. 이는 수여자들의 혈액이나 조직 기증에 제한되지 않고 성생활이나 출산에도 영향을 미칠 수 있다. 따라서 피험자의 인권 보호를 위하여 사회적, 생명윤리적 공감대를 논의하는 장이 필요할 것으로 생각된다.
미국은 FDA(식품의약청), 유럽은 EMA(European Medicines Agency)가 이종장기를 하나의 의약품으로 취급하여 임상적용에 대한 관리를 하고 있다. 일본은 2013년 11월에 ‘재생의료 등의 안전성확보 등에 관한 법률’을 제정해 2014년 11월부터 이종이식의 임상적용을 관리하고 있다.
국내 경우는 2019년 8월 2일 ‘첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률’이 제정되었다. 이 법에서는 첨단재생의료의 안전성 확보 체계 및 기술 혁신, 실용화 방안을 마련하고 첨단바이오의약품의 품질과 안전성확보 및 제품화 지원을 위하여 필요한 사항을 규정하고 있다.
제2조 2항은 첨단재생의료의 대상인 ‘인체세포등’을 정의하고 있는데 ‘인체세포등’이란 인체에서 유래한 줄기세포, 조혈모세포, 체세포, 면역세포, 이종세포 등 대통령령으로 정하는 세포, 조직 및 장기를 말한다.’로 되어있다. 시행령이 마련되면 이 법으로 이종이식 임상적용이 관리될 수 있다. 이와는 별도로 보건복지부 지원을 받고 있는 바이오이종장기개발사업단은 식품의약품안전처의 세포치료제 규제 아래 연구자주도 이종췌도 및 이종각막 임상시험을 준비 중에 있다.
나. 해외 기술 동향
(1) 형질전환 돼지의 개발
2002년 알파갈합성효소 유전자가 제거된 돼지가 생산된 이래 Revivicor, Avantea등의 이종이식 관련회사들과 학계를 중심으로 다양한 종류의 형질전환돼지들이 개발되었으나, 기대했던 것만큼 영장류 전임상 결과가 개선되지 않았다. 현재까지 개발된 형질전환 돼지는, 돼지 특이 당항원을 제거한 유전형질을 기반으로 보체활성 조절(CD39, CD55, CD59), 응고조절(thrombomodulin, EPCR), 염증반응조절(A20, TNFR Fc) 등 비특이적인 염증 반응을 제어할 수 있는 유전자를 적중하여 개발되었다.
최근 CISPR/Cas9에 의한 다중 유전자 조작 돼지 개발 기술이 급속히 발전하면서 형질전환 돼지의 생산 기간이 기존 2∼3년에서 5개월로 획기적으로 단축되었고, 2015년 11월 네이처(Nature)지에서는 이종 이식 제2의 전성기가 도래하고 있다고 보고하였다(Nature 2015;527;152). 이러한 전성기를 맞아 United Therapeutics, eGenesis 등 이종이식 전문 회사들이 다시 생겨나고 있다. 현재 미국, 호주, 독일, 이태리를 중심으로 다양한 종류의 형질전환돼지가 생산되고 있다.
최근 포배 보상법(blastocyst complementation) 기술을 이용하여 두 종간 키메라(chimera) 생산이 가능해졌으며(Nature 2016; 540; 51), 이는 이종면역반응을 근본적으로 동종면역반응과 비슷한 정도로 감소시키는 기술이기 때문에 키메라 돼지 생산은 향후 이종이식의 지향점이 되고 있다. 하지만, 이런 키메라를 생산하기 위해서는 특정 장기가 결핍된 돼지의 생산이 필요하기 때문에 돼지 줄기세포를 이용한 targeting vector 개발, CRISPR/Cas9 시스템 개발, blastocyst injection 등의 기반 기술 개발이 선행되어야 한다.
[표 3-21] 해외에서 개발된 이종 장기이식을 위한 유전자 변형 돼지
|
해외 개발 유전자변형 돼지 |
|
|
돼지 내인성 레트로바이러스(PERV)의 제거 돼지 |
|
|
PERV 발현 억제(Knock down) |
(Miyagawa et al., 2005; Dieckhoff et al., 2008; Ramsoondar et al., 2009) |
|
PERV pol 유전자를 전체 유전체 수준에서(Genome-wide) 비활성화 |
(Niu et al., 2017) |
|
다중 유전자변형 돼지 |
|
|
GGTA1-KO / hCD55-tg / hCD59-tg / human fucosyltransferase(HT)-tg |
(Le Bas-Bernardet et al., 2011) |
|
GGTA1-KO / hCD55-tg / hCD59-tg |
(Hawthorne et al., 2014) |
|
GGTA1-KO / hCD46-tg / hCD39-tg |
(Bottino et al., 2014) |
|
GGTA1-KO / hCD46-tg / hTFPI-tg / pCTLA4-Ig-tg |
(Bottino et al., 2014) |
|
GGTA1-KO / hCD46-tg / hTFPI-tg / pCTL4-Ig-tg / hCD39-tg |
(Bottino et al., 2014) |
|
GGTA1-KO / hCD46-tg / hCD55-tg / hCD39-tg / hTBM-tg / hEPCR-tg |
(Iwase et al., 2015) |
|
GGTA1-KO / CMAH-KO / hCD46-tg / hCD55-tg / hCD59-tg / hA20-tg / hHO1-tg |
(Fischer et al., 2016) |
|
GGTA1-KO / CMAH-KO / shTNFRI-Fc-tg / hHO-1-tg |
(Kim et al., 2017) |
|
GGTA1-KO / hCD55-tg / hCD39-tg / hTFPI-tg / hC1-INH-tg / hTNFAIP3-tg |
(Kwon et al., 2017) |
|
GGTA1-KO / hCD46-tg / hCD55-tg / hCD47-tg / hTFPI-tg / hEPCR-tg |
(Iwase et al., 2017) |
|
GGTA1-KO / CMAH-KO / B4GalNT2-KO |
(Dai et al., 2018) |
(2) 이종장기이식 전임상 및 임상시험
이종장기이식 전임상시험 결과를 살펴보면, 심장의 경우 3년 이상, 신장 1년 이상, 간 25일 이상, 췌도 2년 이상, 각막 2년 이상 등 우수한 성적들이 발표되면서 제2의 이종이식 전성기가 도래하고 있다. 미국 국립보건원은 형질전환돼지의 심장을 개코원숭이의 복부에 이식(heterotopic transplantation)하여 3년간 생존하였다고 보고하였다(Nature Communi- cations 2016; 7; 11138). 최근 독일의 Dr. Brenner 그룹은 형질전환돼지의 심장을 개코원숭이에게 이식하였는데 미국 국립보건원팀과는 달리 흉곽에 원숭이 심장을 제거하고 이식하여(orthotopic transplantation, life supporting) 6개월 이상 생존하였음을 보고하였다(Nature. 2018 Dec;564(7736):430-433).
이는 이식된 돼지 심장이 원숭이의 심장을 대신하여 기능을 한 것으로 미국 국립보건원의 결과보다 더 진일보된 획기적인 결과라고 할 수 있다. 일본 오츠카 제약은 2014년에 인수한 LCT사(Living Cell Technologies)를 통하여 이종 췌도 이식 연구를 지속하여 왔으며, 2016년 3월 일본 재생의료학회에서 당뇨병환자에게 돼지의 췌도 세포를 이식한 임상 연구결과를 발표하였다. 오츠카 제약은 현재 돼지 캡슐췌도를 이용한 임상 1/2a 시험을 진행하고 있다.
다. 국내 기술 동향
(1) 형질전환 돼지의 개발
국내에서는 농촌진흥청에서 주관하는 ‘동물바이오신약장기개발사업단’과 민간기업으로 ㈜옵티팜, ㈜엠젠바이오, ㈜제넨바이오 등의 회사가 형질전환돼지 생산 연구를 진행하고 있다. 국내에서 생산된 형질전환돼지의 현황은 다음과 같다.
[표 3-22] 국내에서 개발된 이종 장기이식을 위한 유전자 변형 돼지
|
국내 개발 형질전환 돼지 |
|
|
다중 유전자변형 돼지 |
|
|
hCD46-tg / hCD73-tg |
(축산과학기술연구소) |
|
GGTA1-KO / hCD55-tg |
(엠젠플러스) |
|
GGTA1-KO / hCD46-tg / hTBM-tg |
(축산과학기술연구소) |
|
GGTA1-KO / hCD46-tg / hCD73-tg / hTBM-tg |
(축산과학기술연구소) |
|
GGTA1-KO / hCD39-tg/ hCD55-tg |
(옵티팜) |
|
GGTA1-KO / CMAH-KO |
(엠젠플러스) |
|
GGTA1-KO / CMAH-KO / hCD46-tg |
(엠젠플러스) |
|
GGTA1-KO / CMAH-KO / hTBM-tg |
(엠젠플러스) |
|
GGTA1-KO / CMAH-KO / hCD46-tg / hTBM-tg |
(엠젠플러스) |
|
GGTA1-KO / CMAH-KO / B4GalNT2 KO |
(옵티팜, 엠젠플러스) |
|
GGTA1-KO / CMAH-KO / B4GalNT2 KO / hCD46-tg / hTBM-tg |
(옵티팜) |
(2) 이종 이식 전임상 및 임상시험
‘바이오이종장기개발사업단’은 보건복지부의 지원을 받아 2004년 출범하여 2012년도까지 1단계에서 WHO(세계보건기구)의 장기이식원 권고기준을 만족시키는 미니돼지를 생산하였다. 2013년도부터 시작되는 2단계에는 이종장기용 돼지 생산을 계속하며, 면역거부반응 조절을 통한 이종장기의 전임상 및 임상적용에 대한 연구를 진행하고 있다.
특히 이 사업단은 2단계에 진입하면서 이종장기이식 분야에서 세계적 선도그룹으로 인정받고 있으며 영장류 전임상시험에서 세계이종이식학회의 이종 췌도이식 임상시험 진입 조건을 충족한 결과를 발표하고 있다. 아울러 영장류 전임상실험에서 부분층 및 전층각막을 이식하여 2년 이상 각막 투명도를 유지한 결과를 발표하였고, 2018년 시행예정이었던 이종 각막 및 췌도 연구자 임상 시험은 현재 식품의약품안전처와 기준을 마련하고 2020년 초에 시행을 계획하고 있다.

출처: 바이오이종장기개발사업단 www.xenokorea.org
[그림 3-59] 바이오이종장기개발사업단 사업개요
라. 발전과제와 전망
이종장기이식은 인공장기 및 줄기세포 분화 기술을 이용한 장기이식에 비해 빠르게 임상에 적용할 수 있는 기술이다. 최근 영장류 실험에서 이식된 이종장기가 거부반응 없이 장시간 제 기능이 유지되는 것이 관찰되었으며 수혜 동물의 생존기간 또한 연장되었다. 이것은 이종장기이식의 가능성을 입증한 연구였다. 향후 안전하고 투명한 임상시험을 통해 많은 사람들이 혜택을 받을 수 있도록 유전자편집기술, 면역조절기법을 이용하여 위험요소는 낮춘다면 미래에 이종장기이식은 생명을 구하는 치료수단으로 자리 잡을 것이다.
과학기술의 개발과 이종장기이식의 안정성 확보와 더불어 윤리적 문제 역시도 반드시 고려해야 할 사항이다. 연구자들은 이종장기이식이 가져올 수 있는 위험성을 염두에 두고 세계이종이식학회나 WHO에서 제시하는 국제적인 가이드라인에 따라 이종장기의 임상시험을 수행해야만 한다. 뿐만 아니라 이종이식의 안전성을 확보하는 동시에 연구 대상자와 사회를 보호하기 위하여 연구대상자 선정, 임상시험 관리・감독, 공여동물 사육시설 관리 등에 대한 규제를 임상시험 실시 전에 반드시 마련하고 준수해야 할 것이다.
장기이식 수요의 폭발적 증가에 따른 수급 불균형으로 인하여 바이오 이종장기 시장의 규모는 급속도로 커질 것으로 전망된다. 바이오 이종장기는 장기 이식만을 기다리는 환자에게 고통을 덜어주고 희망을 줄 수 있을 뿐만 아니라, 우리나라를 미래 바이오의약품 선진국가로 도약하는 미래 산업이 될 것이다. 현재까지 이루어온 바이오 이종장기 연구 성과와 기반 시설을 지속적으로 유지 및 발전시키고, 최근 마련된 바이오장기 생산 규제와 가이드라인을 잘 적용시킨다면 향후 학문, 산업, 경제발전에 크게 기여할 것으로 예상된다.
4. 진단 및 의료기기
가. 개요
헬스케어 분야는 고령화의 가속화와 만성질환자 증가에 따른 공공 및 개인의 의료비 지출 부담을 헬스케어 산업 전반의 효율성 및 효과성 개선을 통해 줄이도록 하는 시장의 요구에 따라, 과거의 치료・병원 중심에서 인공지능(AI: Artificial Intelligence), 빅데이터 분석, 사물인터넷(IoT: Internet of Things), 클라우드, 가상・증강현실, 웨어러블기기, 3D프린팅, 로봇, 블록체인 등 다양한 첨단 기술과 융복합한 의료기술의 발전으로 진단・예방・예측의 환자 중심으로 의료 패러다임이 급격히 변화되고 있다.
이에 따라 기존 보건의료시스템에서는 병원, 제약・의료기기 업체, 보험회사, 환자 등 치료중심의 한정적인 이해관계자로만 구성되어 있었으나, 건강관리 전문서비스사, 통신사, 바이오센서 포함 웨어러블기기 제조업체, 헬스케어앱 솔루션 제공자 등 다양한 신규 이해관계자가 모여 새로운 생태계를 구성하게 되었다.
생명현상과 질병에 대한 이해도 향상으로 유전체 정보가 축적되면서 중증질환의 발병원인이 유전자 수준에서 규명되고 있으며, 정보통신기술의 혁신으로 질병관리방법 등이 획기적으로 개선되어 헬스케어 관련 빅데이터 분석을 통해 발병을 예측하고 건강을 관리할 수 있게 되었다. 또한 고객의 다양한 요구를 만족시키기 위해 기술간 융복합이 활발하게 진행되고 있어 AI가 접목된 컴퓨터 보조진단은 영상진단의 정확성을 향상시키고, 조기진단을 실현시키고 있다. 특히 혁신적인 차세대 유전체 염기서열분석(NGS: Next Generation Sequencing) 기술과 디지털헬스케어 기술 등이 융합한 개인맞춤형 정밀의료 헬스케어시스템이 떠오르고 있다.
정밀의료는 다양한 요인과 질병의 생물학적 근거를 파악하여 질병과 예후를 통합함으로써 환자에게 가장 적합한 헬스케어 서비스를 제공하는 새로운 개념으로 유전체정보, 진료・임상정보, 생활습관정보 등 의료 빅데이터를 기반으로 이루어진다. 또한 빅데이터 분석에는 AI가 활용되어 최고품질의 정밀의료 기반을 제공하게 될 것이다. 정밀의료 구현을 위한 통합 빅데이터 중에서 유전체정보, 진료・임상정보, 생활습관정보의 비중은 각각 30%, 10%, 60%로 생활습관정보의 비중이 가장 큰 것으로 판명되었다. 이에 정밀의료시스템 구축을 위해서는 웨어러블기기 등을 통해 수집된 생활습관정보가 필수적이다.
기존의 널리 적용(one-size-fits-all)되는 전략으로 개발된 천편일률적인 의료제품은 개인별, 민족별, 인종별 특징에 따른 유전적 차이에 근간한 정밀의료 패러다임을 적용함으로써 개인별 부작용을 감소시킬 수 있게 되었으며 안전한 치료법 개발, 질병에 대한 정확한 예측, 초기 질병감지가 가능해져 향후 경제적인 측면에서도 기대감이 상승하고 있다. 아울러 유전체정보에 근간한 위험 유전인자 유무에 따른 질병감수성 분석, 예상되는 약물반응에 대한 효과 분석, 식습관 다이어트 및 운동 효과와 같은 건강관리정보 분석 등 개인별 맞춤 건강관리가 가능하게 될 것이다.
또한 희귀질환 유전체를 분석하여 질병의 원인별 맞춤형 치료제 개발이 가능하다. 이는 전통적인 약물이나 의료기기 중심의 임상시험 개념을 벗어나 환자맞춤형 1인 피험자 임상시험(N-of-1 Clinical Trial)을 통해 정밀의료시스템을 구축하게 할 것이다. 정밀의료는 유전체정보 이외에도 다양한 의료 빅데이터가 인공지능, 디지털헬스케어 기술과 만나 통합분석 된다는 점에서 기존의 맞춤의료와 차별화 된다. 빅데이터와 AI 기반의 정밀의료 등 융복합 헬스케어 산업의 내수화를 위해서는 개인정보의 빅데이터 기반 구축과 함께 AI를 통한 유전체정보 등 개인정보의 활용에 대한 관련 규제 개선 등이 필요할 것이다.
정밀의료는 초기 단계의 유망시장으로 차세대 유전체분석 등 오믹스 분석기술과 빅데이터, AI 기술의 발전이 정밀의료 시장의 성장을 견인할 것으로 예측된다. 주요 선진국에서는 정밀의료 실현을 위해 국가 차원의 이니셔티브를 발표하며 적극적인 투자를 추진하고 있으며, 차세대염기서열분석법(NGS: Next Generation Sequencing) 기술의 발전으로 개인 유전체 분석비용이 빠르게 감소하면서 정밀의료의 기반이 되는 방대한 유전체정보도 축적되고 있다. 그러나 개인 유전체정보 활용 등 규제 및 윤리적 문제, 표준화 미비, 정밀의료에 대한 고비용과 현장 의사들의 의식 정립이 정밀의료 산업발전을 위해 시급한 개선과제로 남아있다.
이에 향후 정밀의료 기술개발 및 산업은 비-유전체(Non-Genomic) 분야로 확대될 것이며 생활습관 및 환경적 요인과 데이터의 중요성이 더욱 부각될 것이다. 나아가 건강과 웰니스(wellness)에 대한 소비자 관심이 증대하면서 소비자 중심의 새로운 헬스케어 비즈니스 모델이 주목받을 것으로 예측된다.
나. 첨단 융복합 의료기기 해외 동향
(1) 미국
(가) 정밀의료 이니셔티브(PMI: Precision Medicine Initiative)
오바마정부는 2015년 1월 환자의 유전체정보, 환경, 생활습관 등의 차이를 체계적이고 종합적으로 고려한 개인 맞춤형 진료 및 예방법을 위한 계획인 PMI 발표를 통해 2016년 2억 2,000달러 투자해 의료의 새로운 장(場)을 열 것을 선언했다.
(나) 21세기치유법(21st Century Cures Act, 2016)
미국은 정밀의료, 재생의료, 뇌 연구에 있어 R&D 지원 및 바이오의약품, 혁신의료기기, 융복합제품 등 혁신적 의료제품의 심사기간 단축과 인허가 규제개혁, 연구개발에 소요되는 자금조성 지원, 건강정보의 공유를 장려하기 위해서 첨단 의료기술의 혁신을 촉진하는 법안을 공표했다. 여기에는 혁신의약품, 의료기기의 허가기간 단축, 환자 의료데이터 공유 및 분석, 의료용 앱 개발, 유전자 분석관련 규제완화 등의 내용이 포함되어 있다.
아울러 디지털헬스케어의 기술 적용을 통해 웨어러블기기 등을 활용한 실제 진료기반 데이터(RWD: Real World Data)를 전자건강기록(EHR: Electronic Health Record)에 수집하여 활용할 것을 권장하고 있으며, 향후 FDA는 이 RWD를 통해 제품의 판매승인 또는 허가자료로 활용할 것으로 판단된다.
(다) 의사결정 지원 소프트웨어(Clinical and Patient Decision Support Software, 2017)
미국은 의사결정 지원 소프트웨어 기능을 식별하기 위한 가이던스로서 임상 의사결정 지원 소프트웨어와 환자 및 간병인을 위한 환자 의사결정 지원 소프트웨어에 대한 규제범위를 명확히 규정하고 있다.
(라) 디지털헬스 혁신전략 계획(Digital Health Innovation Action Plan, 2017)
미국은 의료기기 소프트웨어에 특화된 가이던스를 마련하고 사전인증프로그램을 개발했다. 주목할 점은 디지털헬스케어 규제대상을 ‘제품(Product)’이 아닌 ‘개발사(Developer)’로 전환하였다는 것이다. 일정요건을 충족시킨 의료용 소프트웨어 개발사에게 자격(Pre- Certify)을 부여함으로써, 해당 기업에서 출시한 제품은 인허가 과정이 면제 되거나 간소화된 인허가 절차(Streamlined Pre-market Review)가 적용되도록 했다. 이는 미국의 네거티브(negative) 규제 철학을 적용한 사례 중의 하나로, 자격을 부여받은 업체들은 제품 출시 기회를 전통적인 임상시험 범위 밖에서 얻어진 데이터(Retrospective Database Study, Case Report, EMR, Public Health Surveillance, Registries 등)인 실제 진료기반 자료(RWE: Real-World Evidence) 확보에 활용하여 추후 추가적인 인허가 과정을 위한 데이터로 사용이 가능하게 될 것이다.
(마) 임상평가 가이던스(SaMD: Software as a Medical Device, 2017)
미국은 소프트웨어에 적용 가능한 품질경영시스템을 개발하고, 임상평가를 위한 가이던스를 발표하여 디지털헬스케어 산업발전을 도모했다.
(2) 유럽 연합(EU)
유럽연합은 ‘의료정보기술 플랫폼 구축’ 및 ‘유전체 분석을 강화한 정밀의료’ 제공을 추진하며 AI기술 개발을 적극 유도하고 있다. ‘의료정보기술 플랫폼 구축’은 정보통신 기술과 빅데이터, AI기술을 적극 활용하여 병원, 보건소 등 의료기관에서 수집된 다양한 형태의 데이터를 분석하고 뇌질환 등의 진단 예방, 신약개발, 새로운 치료법 개발에 활용하는 프로젝트이다.
(가) 인간두뇌 프로젝트(2013)
영국은 암, 감염질환 치료를 목적으로 ‘10만 명의 유전체 분석 프로젝트’에 투자하고, 정밀의료 R&D 및 실용화를 위한 빅데이터 확보와 AI의 유전체분석 활용에 집중하고 있다.
(나) e-Health 실행전략
유럽 연합은 의료정보시스템 간의 상호운용성을 확보하여, 전자의무기록 확산을 통해 유럽 내 국가 간 환자와 의료진의 자유로운 이동을 통한 의료서비스 이용을 목표로 하고 있다.
(다) 의료기기법(MDR: Medical Device Regulation), 체외진단의료기기법(IVDR: In Vitro Diagnostic Regulation) 제정(2017)
유럽 연합은 기존의 의료기기 지침(MDD: Medical Device Directive)을 법으로 상향하고, 고위험도 제품의 경우 전문가패널 심사 실시, 임상시험 강화 및 CE 인증기관(NB: Notified Body) 관리 강화 등을 규정했다.
(3) 일본
(가) 유망제품 우선심사 제도(사키가케(SAKIGAKE) 지정 시스템) 도입(2015)
일본은 사키가케 심사지정 제도를 신설하고 세계를 선도하는 혁신의약품, 의료기기, 재생의료 등의 제품에 대한 신속심사를 통해 조기 상용화를 지원하고 있다. 혁신의료기기라 함은 획기적인 치료기술로서 중대한 질환에 사용되고 기존 치료법이 없으며 유효성이 높은 제품으로 세계 최초로 일본에서 개발된 제품으로 정의했다.
(나) 일본 의료연구 개발기구(AMED: Japan Agency for Medical Research and Development) 설립(2015)
일본은 문부과학성, 후생노동성, 경제산업성 등 각 부처에 배분된 예산을 통합해 기초연구, 임상연구, 실용화 단계 등 연구 관리를 하나의 통제기구로 일원화 하고자 AMED를 설립했다. 설립 이후 5년 간 수술지원로봇시스템, 인공조직 및 인공장기, 최소 침습 의료기기, 영상진단기기, 재택 의료기기 등 5종류 이상의 혁신적 의료기기 실용화에 주력하겠다는 계획을 발표했다.
(다) 개인정보보호법 개정(2015)
일본정부는 빅데이터 활용을 위하여 비식별화된 정보는 개인정보로 취급하지 않고, 주체의 동의 없이 사용 가능하도록 개정했다.
(4) 중국
(가) 의료기기 혁신 촉진 및 허가심사 가속화 정책(2017)
중국은 희귀질환 치료, 악성종양 진단, 다발성 노인질환, 임상 긴급도입 필요, 국가 연구개발로 개발된 제품 등 우선 심사 대상 의료기기에 대한 신속하고 투명한 심사를 추진하겠다는 계획을 발표했다.
(나) 중국제조 2025
제조업 기반 육성과 기술 혁신, 녹색 성장 등을 통해 중국의 경제 모델을 ‘양적 성장’에서 ‘질적 성장’으로 바꾸겠다는 중국 정부의 산업 전략이다. 제13차 경제사회 발전 5개년 계획(2016∼2020)에 4차 산업혁명 대응정책을 반영하여 웨어러블기기, 원격진료 등 모바일 의료서비스에 필요한 제품 개발, 바이오 3D프린팅 등 첨단기술 개발 확대를 추진하고 있다.
다. 첨단 융복합 의료기기 국내 현황
첨단 융복합 의료기기에 대한 국내 규제동향으로는 2013년 첨단 의료복합단지 연구개발 제품 및 산업융합 신제품 신속허가 지원에 대한 지침 마련과 2015년 미래 신성장동력인 헬스케어 산업에 대한 규제혁신방안을 꼽는다. 식품의약품안전처는 의료기기와 비의료기기의 분류기준을 마련하여 의료기기 적용범위를 의료용으로 한정하고, 의료용 및 비의료용 정의를 규정했다. 이를 근거로 데이터의 단순한 표시, 저장, 전송을 위한 소프트웨어 앱은 의료기기 관리대상에서 제외되었고, 의료기기와 개인용 건강관리(wellness) 제품 판단기준이 마련되었다.
2016년 첨단 의료기기 단계별 심사제도를 도입하여 IT(정보기술), BT(바이오 기술), NT(나노 기술) 등의 기술이 접목된 혁신의료기기 시장의 성장을 위해 산업육성 및 신속제품화를 위한 허가심사 제도를 마련했다. 아울러 2017년 ‘빅데이터 및 인공지능(AI) 기술이 적용된 의료기기의 허가심사 가이드라인’, 2018년 ‘VR, AR기술이 적용된 의료기기의 허가심사 가이드라인’을 각각 발간했다. 기술발전에 부응하기 위한 정부의 규제개선 노력에도 불구하고 법적 구속력이 없는 가이드라인을 통한 규제 개선은 실효성에 한계가 있다.
우리나라는 세계 최고수준의 네트워크 인프라 구축과 IT기술을 보유하고 있어 ICT 기반 의료기기 시장을 선도할 수 있는 좋은 환경을 갖고 있으나 개인정보보호법, 의료법 등 규제로 인해 의료산업에서 기술개발이 활발히 이루어지지 못하고 있다. 데이터의 단순한 표시, 저장, 전송을 위한 앱은 의료기기 관리대상에 제외되어 국내에서도 사용이 가능하지만 진단 및 치료를 위해 사용되는 의료기기의 경우에는 개인 의료정보의 정의나 활용범위 등에 대한 제도 및 정책개선이 없이는 실효성을 확보하기 어려운 상황이다. 선진국의 법규는 예외적 금지로 규정된 것 이외에는 원칙적으로 모두 허용되는 네거티브(negative) 규제방식이나, 국내 법규는 법에서 규정한 것만 합법이고 이외에는 모두 불법으로 간주하는 포지티브(positive) 규제방식에 머물러 있다.
보건의료 빅데이터의 활용은 개인정보보호법과 의료법에 따라 비식별 정보에 대한 정의가 불명확하고 주체의 사전 동의가 요구되는 등의 규제에 막혀있어 유전체정보 이용 및 관련 연구개발은 생명윤리법의 규제에 제한을 받고 있는 현실이다. 신산업은 선례가 없어 금지와 허용을 미리 정하는 것이 불가능하여 네거티브 규제방식으로의 신속한 전환이 요구되는 시점이기도 하다. 고무적인 점은 의료기기 연구개발 성과가 우수한 기업을 혁신형 의료기기 기업으로 인증하여 지원하고, 첨단기술 적용으로 안전성・유효성이 현저히 개선된 의료기기를 혁신의료기기로 지정하여 허가・심사의 특례를 부여하는 등 의료기기산업 육성 및 혁신의료기기의 제품화 촉진을 위한 ‘의료기기산업 육성 및 혁신의료기기 지원법(법률 제16405호, 2019.4.30 제정)’이 공표되어 오는 2020.5.1부터 시행 예정이다.
라. 발전 전망
(1) 개인맞춤 정밀의료
최근 맞춤의료 등 의료기술의 발전에도 불구하고 치료불응을 보이는 진행성 난치질환의 경우 기존 치료로는 해결되지 않아 이에 대응할 맞춤형 진료・의료서비스에 대한 사회적 요구가 점차 늘어나는 추세이다. 개인맞춤 정밀의료의 등장은 과거 환자의 질병을 확인하는 데 그치지 않고 환자의 유전체정보, 진료・임상정보, 생활습관정보 등을 통합 분석함으로써 해당 질병의 진행상황을 예측할 수 있어 환자 특이적인 진단 및 치료가 가능하다.
차세대 염기서열분석(NGS: Next Generation Sequencing) 기반의 분자진단은 향후 지속적으로 높은 성장률을 보일 것으로 전망되며, 암 진단뿐만 아니라 전염병 진단과 같은 비종양학 분야로도 확장되어 성장할 것으로 기대된다. 액체생체검사(Liquid Biopsy) 기반의 동반진단검사는 미국 FDA의 승인절차 간소화에 따라 본격적으로 시장이 확대될 것으로 전망되며, 종양 프로파일링에 활용될 것으로 기대된다. 간편하면서도 높은 정확도가 요구되는 현장진단시스템(POCT: Point of Care Testing)의 수요 또한 지속적으로 증가할 것으로 전망되며, 유전자 POCT와 암 POCT가 핵심 진단서비스 모델이 될 것으로 예측된다.
네트워크 연계 기반의 의료기기는 전 세계적으로 수요가 증가하고 있으며 병원환자 모니터링 분야에서 데이터 분석 및 실시간 환자 모니터링 기능이 핵심 기술이 될 것이고, 병원 중심의 환자 모니터링은 특히 무선・실시간으로 전환되어 임상의학이 더욱 발전할 수 있을 것으로 전망된다. 정밀의료가 발전함에 따라 종양치료 관련 의료기기업체는 치료의 디지털화를 통한 진료의 정확도를 향상시키고, 수술기법 개선 및 통합 진료 플랫폼 구축에 집중할 것으로 예상된다.
고령화 속도가 가파른 핀란드정부의 경우, 최근 국민의 공공의료와 사회보장 정보를 자유롭게 활용할 수 있도록 의료 규제를 풀어 헬스케어 산업을 집중 육성하고 있다. 이에 따라 핀란드 내 민간기업과 연구소, 정부기관들이 국민의 의료정보와 사회보장정보를 연구개발과 통계, 교육 등 다양한 목적으로 활용할 수 있게 되었으나 우리나라는 여전히 의료법과 개인정보보호법 등에 가로막혀 개인의 의료정보 활용이 어려운 상황이다.
(2) 가상현실(VR: Virtual Reality), 증강현실(AR: Augmented Reality)
가상현실(VR)은 컴퓨팅 기술로 생성한 3차원(3D) 가상공간과 사용자 간의 상호작용을 가능하게 하는 인터페이스 기술로, 최근 들어 관련 기술의 발달과 원가절감으로 전 세계적으로 상용화가 가속화되고 있다. 최근 VR의 대중화와 함께 관련 하드웨어・플랫폼 및 콘텐츠・소프트웨어 앱 개발이 활성화되어 헬스케어 분야로의 적용이 진행되고 있다. VR은 환자의 수술 부위를 3D로 자유자재로 돌려가며 시뮬레이션 할 수 있는 3D 가상수술 시뮬레이터를 통한 외과수술의 교육과 훈련 및 재활에 활용되고 있다. 뿐만 아니라 각종 중독, 불안, 공포증, 외상 후 스트레스 장애(PTSD), 자폐증 등 장애 유발 환경을 체계적으로 간접 체험하게 함으로써 증상을 완화시키는 노출치료(Exposure Therapy) 등 정신과 영역에서 활용된다. 헬스케어 영역에서 VR은 향후 임상적 유용성의 지속적인 입증을 통해 활성화할 것으로 전망되며, 가까운 미래에 VR은 AI, 빅데이터 분석 등의 기술과 융합되어 환자중심의 맞춤형 가상 시뮬레이션 플랫폼 구축으로 기존 의료시스템을 혁신할 것으로 예측된다.
AR은 사용자가 눈으로 보는 현실 세계 이미지나 배경에 3차원 가상 이미지를 겹쳐 하나의 영상으로 보여주는 기술로, 현실세계에 실시간으로 부가정보를 갖는 가상세계를 합쳐 하나의 인터페이스로 제시한다. 현실과 가상세계를 혼합해 표출하기 위해 스마트 안경, 헤드업 디스플레이 등의 장치와 호환되어 활용된다. 의료영역에서는 외과수술의 훈련, 재활, 진단 및 심리치료에 이르기까지 적용이 확대되고 있다. 다만, AR의 활성화를 위해서는 하드웨어 및 소프트웨어의 표준화로 상호운용이 가능하도록 해야 할 것이다.
한국보건산업진흥원은 최근 보건산업브리프 ‘보건산업 4차 산업혁명 시리즈: 메디컬 증강현실(AR) 시장동향 분석’을 통해 만성 질환의 증가와 인구 고령화, 인프라 스트럭처 제한 및 전문 인력 부족과 같은 문제를 해결하고, 더욱 효율적인 헬스케어를 위해 AR 제품과 서비스를 채택하는 움직임이 더욱 활발해 질 것이라고 전망했다.
(3) AI・빅데이터・클라우드 컴퓨팅 기반 디지털 헬스케어
디지털 헬스케어는 의료전달체계의 효율성을 높이고 개인맞춤 의료구현을 목적으로 탄생한 건강관리시스템과 디지털 기술의 융합 산물이다. 환자가 직면한 건강문제를 해결하기 위해 하드웨어・소프트웨어 솔루션과 서비스 등 정보통신 기술을 이용하며 의료・헬스케어 영역에서 AI는 모든 가용정보 분석으로 환자 치료방법과 계획을 탐색해 의사가 최선의 결정을 내리는 데 도움을 줄 수 있다. 또한 의료영상 판독부터 다양한 의료기술에 활용되고 있고 딥러닝, 머신러닝 기술 등을 통해 분석결과를 보완하여 예방, 진단 및 치료분야로 더욱 의료 적용이 확대될 것으로 예측된다. 특히, 초음파 등 휴대용 소형 진단기기는 AI기술이 적용되어 기존의 기술을 넘어 현장진단, 1차 진료, 응급진료, 마취, 통증관리 등에 활용이 확대될 것으로 예측된다.
AI기술을 활용하여 환자의 유전체정보, 진료・임상정보, 생활습관정보 등 의료 빅데이터를 통합 분석하고 관리 플랫폼을 통해 질병의 원인을 규명함으로써 정밀의료 구현이 가능할 것이며, 향후 새로운 치료제 후보물질 스크리닝과 만성질환 관리 개선을 통한 정밀의학 솔루션으로 개인맞춤형 건강관리가 실현될 것으로 기대된다. 일각에서는 AI 기술이 고도화됨에 따라 AI가 의사를 대체하지는 않을까 하는 우려도 제기되었으나 대다수 미래 의학자는 ‘결코 AI는 의사를 대체하지는 않을 것이며, 단지 AI를 활용하는 의사가 활용하지 않는 의사를 대체하게 될 것이다’라는 의견을 피력하고 있다. 그만큼 AI는 의료시스템 전반으로 급속히 파급되어 활용되고 있다. 이는 메가트렌드로서 반드시 효율적으로 활용될 수 있도록 해야 할 것이다.
최근 들어 글로벌 의료서비스는 과거의 진료를 많이 해야 보험청구와 급여를 많이 받을 수 있는 환경에서 치료결과 중심으로 급여체계를 개편하는 가치기반 지불제도(Value- Based Payment System)로 전환되고 있다. 이는 의료품질을 높이고 의료비용을 절감하는 의사에게 인센티브를 제공한다는 것이 핵심이다. 이에 따라 의료기기 시장도 양질의 의료서비스와 더 나은 가치를 제공하기 위한 제품중심으로 재편될 것으로 예측된다.
IoT(사물인터넷) 기술이 의료분야에서 활용되기 시작함에 따라 병원은 원격임상 모니터링, 만성질환 관리, 건강상태 모니터링 측면에서 더욱 효율적인 시스템을 구축할 수 있게 되었다. 우리나라를 포함하여 세계 각국은 이러한 스마트 병실을 확대하여 중앙집중식 디지털 전문 진료센터를 구축하고 있으며, 이를 통해 정보 상호운용을 위한 사이버 보안을 강화하고 있다. 디지털 기술의 발달과 함께 환자가 생성하는 의료 빅데이터 축적이 중요해지고 있으며, 데이터의 복잡성 및 다양성으로 인해 클라우드 플랫폼 도입의 중요성 또한 부각되고 있다. 환자에게서 수집된 빅데이터와 기업의 분석 기술을 결합하면 새로운 치료 경로 및 위험도를 높은 정확도로 판별할 수 있어 더 많은 가치가 부여될 수 있다.
시장 흐름도 이를 반영하듯 최근 웨어러블기기와 스마트폰 앱 데이터를 활용한 모바일헬스 기술의 적용으로 임상시험 비용이 절감되고 절차가 합리화되고 있다. 또한 헬스케어 산업에 클라우드 컴퓨팅 서비스가 도입됨으로써 의료기관은 저비용으로 보건의료 빅데이터를 효율적으로 관리할 수 있게 되었으며, 이를 기반으로 의사는 환자의 의료기록을 실시간으로 활용할 수 있게 되어 진료서비스 수준이 향상될 것으로 기대된다.
(4) 블록체인(Blockchain) 기술의 의료적용
블록체인이란 블록이라는 소규모 데이터들이 분산병렬형 네트워크인 P2P방식(peer- to-peer: 기존의 서버와 클라이언트 개념에서 벗어나 개인 컴퓨터들이 네트워크로 연결되어 서로 정보와 자료를 공유하는 것을 말한다)을 기반으로 생성된 체인형태의 연결고리 기반 분산 데이터 저장환경에 저장되며 누구도 임의로 수정할 수 없으나, 누구나 변경의 결과를 열람할 수 있는 분산컴퓨팅 기술기반의 데이터 위변조 방지기술이다. 블록체인의 대표적 특징은 탈 중앙성, 보안성, 투명성이라 할 수 있다. 최근 들어 의료 헬스케어 분야에 블록체인 기술을 적용하여 개인의 의료정보 활용을 촉진하는 방안이 부각되고 있으며 의료정보의 보안성 및 투명성 확보, 진단 및 치료의 정확도 향상 등을 통한 의료정보의 교류 확대도 기대되고 있다.
해외 각국의 의료 관련 업체에서는 정부기관, 병원 등과의 협력을 통하여 블록체인 기술을 도입하고 안전하고 정확한 의료정보의 활용을 시도하고 있으며, 이를 통해 환자중심의 의료 실현과 공공성 확대에 기여할 수 있을 것으로 기대하고 있다. 스마트폰, 웨어러블기기 등을 활용하여 라이프로그데이터, 건강이력, 생체정보, 생활습관정보 등 환자가 자발적으로 생산한 건강데이터(PGHD: Patients Generated Health Data)를 블록체인에 담아 서비스 하는 PGHD 데이터 비즈니스가 최근 들어 부각되고 있으며, 개인 건강관리 서비스 지원과 커뮤니티를 통해 난치병이나 희귀질환 환자들의 건강정보를 모으고, 데이터를 가공해 제약・의료기기 업체나 관련 연구자 등 데이터를 필요로 하는 사람에게 제공하는 업체도 새롭게 등장하고 있다.
5. 감염병 대응
가. 개요
(1) 감염병의 정의
감염병이란 세균, 바이러스, 진균, 기생충과 같은 여러 병원체에 의해 감염되어 발병하는 질환으로서 감염된 음식의 섭취, 호흡에 의한 병원체의 흡입, 감염자와의 접촉, 곤충이나 동물의 매개로 인한 전파 등 다양한 직・간접적인 경로를 통해 전파될 수 있다.
국가와 국가를 이어주는 교통의 발달 및 교류의 증가, 해외여행의 증가로 지구 반대편에서 발생한 감염병이 반나절이면 국내로 유입될 수 있으며, 지구온난화로 인한 기후변화로 감염병을 옮기는 매개체들의 서식지가 변화되어 이로 인한 신종 감염병의 발생 위험성도 늘 도사리고 있다. 감염병의 발생은 국민의 건강과 국가의 안전을 위협할 뿐 아니라 사회・경제 전반에 큰 피해를 유발하기 때문에 지구촌이라고 불리는 이 시대에 감염병 발생의 관리는 국가의 안보만이 아니라 국제적 안보와도 직결된다.
(2) 감염병 관리 및 법정 전염병의 개편
우리나라는 국민 건강에 위해가 되는 감염병의 발병과 유행을 방지하고, 그에 대한 예방 및 관리를 위하여 80종의 법정감염병을 지정하여 관리하고 있으며, 보건복지부장관이 국내에서 발생한 질병뿐만 아니라, 과거 전 세계적으로 유행한 질병, 신종 감염병 및 재출현 감염병, 세계보건기구 감시대상 감염병, 생물테러감염병, 성매개감염병, 인수공통감염병, 의료관련 감염병 등 자연 및 인위적으로 전파될 수 있는 모든 감염병을 포함하여 각 필요와 목적에 따라 고시하여 관리하고 있다.
이 중 법정감염병은 ‘감염병의 예방 및 관리에 관한 법률’ 제2조 제2호 또는 제7호에 명시된 감염병을 의미하며 질병으로 인한 사회적인 손실을 최소화하기 위해 법률로써 이의 예방 및 확산을 방지하는 감염병을 말한다. 현재 6개군 80종(제1군 6종, 제2군 12종, 제3군 22종, 제4군 20종, 제5군 6종, 지정감염병 14종)감염병이 법정감염병으로 지정되어 관리되고 있다.
[표 3-23] 80종의 법정감염병
|
그룹 |
분류기준 |
|
|
1군 |
주로 먹는 물에 의해 전염되는 병으로, 한번 발생하면 전염 속도가 빠르고 사회적 파급력이 매우 큰 감염병 |
콜레라, 세균성 이질, 장티푸스, A형 간염 등 |
|
2군 |
전염 속도가 빠르지만 예방접종을 통해 예방할 수 있는 것들로, 국가 예방접종 사업의 대상이 되는 감염병 |
홍역, 파상풍, 풍진, B형 간염, 수두, 일본뇌염 등 |
|
3군 |
파급효과가 크지는 않지만, 반복적으로 유행할 가능성이 있어 지속적인 감시가 필요한 병들 |
말라리아, 결핵, 비브리오패혈증, 쯔쯔가무시증, 탄저, 매독, 한센병 등 |
|
4군 |
국내에서 새롭게 발생하거나 유입될 가능성이 있는 해외의 감염병 |
뎅기열, 신종 인플루엔자, 페스트, 사스(SARS・급성호흡기 증후군) 등 |
|
5군 |
기생충에 의해 발생하는 감염병 |
회충증, 편충증, 요충증, 장흡충증 등 |
|
지정 감염병 |
1∼5군 전염병 외에, 유행 여부를 판단하기 위해 감시가 필요한 병 |
C형 간염, 클라미디아 감염증, 임질, 수족구병 등 |
출처: 질병관리본부
그러나 현재의 법정감염병은 감염경로 및 질환의 특성에 따라 ‘군’으로 분류되어 있어 2018년 개정된 감염병의 예방 및 관리에 관한 법률에 따라 2020년부터는 감염병의 심각도・전파력・격리수준・이신 시기 등을 중심으로 한 ‘급’별 분류체계로 개편하여 1급 감염병(17종), 2급 감염병(20종), 3급 감염병(26종), 4급 감염병(22종)으로 분류하여 관리할 예정이다.
◦‘제1급감염병’이란 생물테러감염병 또는 치명률이 높거나 집단 발생의 우려가 커서 발생 또는 유행 즉시 신고하여야 하며, 음압격리8)와 같은 높은 수준의 격리가 필요한 감염병을 말한다. 다만, 갑작스러운 국내 유입 또는 유행이 예견되어 긴급한 예방・관리가 필요하여 보건복지부장관이 지정하는 감염병을 포함한다.(에볼라, 마버그, 두창, 페스트 등)
◦‘제2급감염병’이란 전파 가능성을 고려하여 발생 또는 유행 시 24시간 이내에 신고하여야 하고, 격리가 필요한 감염병을 말한다. 다만, 갑작스러운 국내 유입 또는 유행이 예견되어 긴급한 예방・관리가 필요하여 보건복지부장관이 지정하는 감염병을 포함한다(결핵, 수두, 콜레라, A형간염 등).
◦‘제3급감염병’이란 그 발생을 계속 감시할 필요가 있어 발생 또는 유행 시 24시간 이내에 신고하여야 하는 감염병을 말한다. 다만, 갑작스러운 국내 유입 또는 유행이 예견되어 긴급한 예방・관리가 필요하여 보건복지부장관이 지정하는 감염병을 포함한다(B형감염, 말라리아, 일본뇌염, 황열 등).
◦‘제4급감염병’이란 제1급감염병부터 제3급감염병까지의 감염병 외에 유행 여부를 조사하기 위하여 표본감시 활동이 필요한 감염병을 말한다(인플루엔자, 매독, 수족구, 임질 등).
질병관리본부는 감염병 발생 시 예방 및 대비 태세를 사전에 구축하고, 위기상황을 조기 종식시키기 위해 기준에 따라 위기경보를 발령하고 경보 수준에 맞게 신속히 대응하여 추가확산을 차단하고 국민 불안을 해소시킬 수 있도록 위기대응체계를 운용하고 있다.
(3) 국내 발생 대비 감염병
(가) 인수공통감염병
인수공통감염병이란 사람과 동물이 모두 감염될 수 있는 전염병으로 현재까지 약 250종의 인수공통감염병이 알려져 있다. 대표적으로 탄저, 큐열, 브루셀라, 장출혈성 대장균감염증, 광견병, 일본뇌염이 있으며 최근 발생한 신종 인수공통감염병은 고병원성 조류인플루엔자, 중동호흡기증후군(MERS), 니파바이러스감염증, 헨드라바이러스감염증 등이 있다. 21세기 들어 세계적으로 확산된 조류인플루엔자, 에볼라, 사스, 신종인플루엔자는 많은 인명 피해를 초래하였으며 지난 10년 간 간접적 경제손실은 2,000억 달러를 초과할 것으로 추측된다.
[표 3-24] 감염병 위기 경보 수준
|
구분 |
|
|
● 관심(Blue) ∙위기유형 -해외에서의 신종감염병의 발생 및 유행 -국내 원인불명・재출현 감염병의 발생 ∙주요 대응 활동 -감염병별 대책반 운영(질본) -위기징후 모니터링 및 감시 대응 역량 정비 -필요 시 현장 방역 조치 및 방역 인프라 가동
|
● 주의(Yellow) ∙위기유형 -해외에서의 신종감염병의 국내 유입 -국내 원인불명・재출현 감염병의 제한적 전파 ∙주요 대응 활동 -중앙방역대책본부(질본) 설치・운영 -유관기관 협조체계 가동 -현장 방역 조치 및 방역 인프라 가동 -모니터링 및 감시 강화 |
|
● 경계(Orange) ∙위기유형 -국내 유입된 해외 신종감염병의 제한적 전파 -국내 원인불명・재출현 감염병의 지역사회 전파 ∙주요 대응 활동 -중앙방역대책본부(질본) 운영 지속 -중앙사고수습본부(복지부) 설치・운영 -필요 시 총리주재 범정부 회의 개최 -(행안부) 범정부 지원본부 운영 검토 -유관기관 협조체계 강화 -방역 및 감시 강화 등 |
● 심각(Red) ∙위기유형 -국내 유입된 해외 신종감염병의 지역사회 전파 또는 전국적 확산 -국내 원인불명・재출현 감염병의 전국적 확산 ∙주요 대응 활동 -범정부적 총력 대응 -필요시 중앙재난안전대책본부 운영 |
출처: 질병관리본부
국내에서도 지난 2015년 5월 발생한 메르스로 인해 정부가 공식종결을 선언한 12월까지 7개월간 이어진 메르스로 인해 186명의 감염환자가 보고되었으며, 국립재난안전원구원이 추산한 경제적 손실 추정치는 개인・기업・국가 등의 보상금과, 노동생산성 손실액, 전 산업에 파급된 피해액을 포함하면 약 2조 3,010억 원에 이른다.9)
그 외에도 동물로부터 감염되는 부르셀라증 환자가 농축산업종사자나, 도축업 관련 종사자에게서 꾸준히 발생・보고되고 있으며, 큐열에 의한 감염환자도 2015년 이후 증가하고 있는 추세이다. 공수병 환자의 경우 2011년부터 ‘공수병 교상 환자 발생 감시 시스템(NABPS: National Animal Bite Patient Surveillance10))’을 개발하여 운영하고 있으며, 2011년 이후 현재까지 인체감염 환자는 발생하지 않았다.
[표 3-25] 인수공통감염병 연도별 신고 현황(2011∼2017)(단위: 명)
|
질환명 |
2011 |
2012 |
2013 |
2014 |
2015 |
2016 |
2017 |
|
브루셀라증 |
19 |
17 |
16 |
8 |
5 |
4 |
6 |
|
공수병 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
조류 인플루엔자 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
큐열 |
8 |
10 |
11 |
8 |
27 |
81 |
96 |
주) 2017년 신고현황은 잠정통계임.
인수공통감염병에 대비하기 위해 질병관리본부는 감염병감시시스템과 농림축산검역본부의 ‘국가동물방역통합관리시스템’, 국립환경과학원의 ‘야생동물 질병발생정보시스템’을 연계하여 종합질병감시 플랫폼을 구축하여 운영하고 있다.
(나) 매개체 전파 감염병
진드기나 설치류의 서식지 확대로 매개체 전파 감염병 발생이 증가하고 있으며, 해외 전염병 유입의 위험성도 증가하고 있다. 매개체에 의해 전파되는 대표적인 감염병으로는 말라리아, 뎅기열, 치쿤군야열, 지카바이러스감염증, 쯔쯔가무시병, 중증열성혈소판감소증후군(SFTS) 등이 있다. 이 중 일부 감염병은 국내에서도 매년 일정 수준 발생되고 있으며, 해외 유입사례도 늘어나고 있다.
매년 5∼10월 중 휴전선 접경지역에서는 한해 평균 600여 명의 말라리아 환자가 발생하고 있으나, 북한에서 발생하는 말라리아 근절 없이는 이에 대한 예방이 어려운 실정이다.
특히, 세계보건기구(WHO)에서 발표한 ‘2019년 세계 건강 10대 위험’ 중 하나인 뎅기열은 최근 가까운 말레이시아, 베트남, 싱가폴, 태국 등 동남아시아를 중심으로 크게 유행하고 있으며 해외 여행객의 증가, 국제 교류의 활성화로 전년대비 국내 발생률이 2배 이상 증가되었다. 현재까지 국내 자체 발생 건은 없지만 매년 지속적으로 발생하고 있어 주의가 필요하다. 이러한 매개체 전파 감염병에 대응하기 위해 해외여행 시 감염예방, 해외 유입환자 발생 시 조치사항, 국내 자체 환자 발생 및 유행 시 조치사항으로 구분하여 대응체계를 구축하였으며, 질병관리본부에 의해 해외유입 모기매개 감염병 감시체계가 시범 운영 중에 있다.
[표 3-26] 매개체 전파 감염병 연도별 신고 현황(2012∼2017)(단위: 건수)
|
구분 |
2012 |
2013 |
2014 |
2015 |
2016 |
2017 |
|
|
모기 |
말라리아 |
542 |
445 |
638 |
699 |
673 |
515 |
|
황열 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
뎅기열 |
149 |
252 |
165 |
255 |
313 |
177 |
|
|
웨스트나일열 |
1 |
0 |
0 |
0 |
0 |
0 |
|
|
치쿤구니야열 |
0 |
2 |
1 |
2 |
10 |
5 |
|
|
지카바이러스감염증 |
0 |
0 |
0 |
0 |
16 |
11 |
|
|
진드기 |
발진티푸스 |
0 |
0 |
0 |
0 |
0 |
0 |
|
발진열 |
41 |
19 |
9 |
15 |
18 |
19 |
|
|
쯔쯔가무시병 |
8,604 |
10,365 |
8,130 |
9,513 |
11,105 |
10,578 |
|
|
중증열성혈소판감소증후군 |
0 |
36 |
55 |
79 |
165 |
272 |
|
|
라임병 |
3 |
11 |
13 |
9 |
27 |
31 |
|
|
진드기매개뇌염 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
설치류 |
렙토스피라증 |
28 |
50 |
58 |
104 |
117 |
129 |
|
신증후군출혈열 |
364 |
527 |
344 |
384 |
575 |
589 |
|
주) 2017년 신고현황은 잠정통계임.
또한 2009년 중국에서 발생한 이후 현재까지 중국, 우리나라, 일본에서 주로 발생하고 있는 중증열성혈소판감소증후군도 2013년 처음 국내에서 감염환자가 발생한 이후 매년 증가하고 있다. 주로 50대 이상의 연령에서 주로 발생하고 있으며, 고열, 백혈구 감소, 다발성 장기부전을 특징으로 한다. 현재까지 개발된 치료제나 예방약이 없고 감염 시 치사율이 높아(6∼30%) 대비가 필요하다. 매개체인 작은소피참진드기는 산간 일부지역을 제외한 전국에 걸쳐 서식하고 있어 매개체 감시 및 보고체계 강화 및 진드기 서식처 환경개선을 위한 사업이 진행 중이다.
(다) 항생제 내성관련 감염병
세계보건기구는 2015년부터 11월 셋째 주를 ‘세계 항생제 인식 주간’으로 정하고 나라별로 실정에 맞는 항생제 내성 예방 캠페인을 벌이도록 권고하고 있다. 1940년 페니실린을 시작으로 각종 항생제의 등장은 감염병으로부터 수많은 사람을 구했지만 항생제가 듣지 않는 내성균의 출현과 확산은 사망률 증가, 치료 기간 연장, 의료비용 상승 등으로 인류의

출처: 국가 항생제 내성 관리대책
[그림 3-60] 항생제 내성균의 발생 및 전파경로
공중보건에 큰 위협이 되면서 동시에 사회경제적 손실을 초래하였다. 치료법이 없는 항생제 내성균의 발생과 유행은 신종감염병 이상의 파급력을 가질 것으로 예상된다.
2013년 미국 질병통제예방센터(CDC: Centers for Disease Control and Prevention)의 보고에 의하면 미국은 연간 200만 명이 내성균에 감염되어 2만 3,000명이 사망, 200억 달러의 경제적 손실이 발생하였으며, 2016년 5월 발표된 영국 정부의 보고서에 따르면 2050년에는 전 세계적으로 연간 1,000만 명이 내성균에 의해 사망할 것으로 예측했다. 또 유엔 총회에서 항생제 내성 해결을 위한 결의안이 채택될 정도로 항생제 내성은 국제적 보건 이슈의 최우선 순위를 차지하고 있다.
우리나라 항생제 사용량은 31.5DDD11)/인구 1,000명/일로 OECD 평균(21.1DDD/인구 1,000명/일)보다 1.5배가량 높으며 국내 항생제 처방률은 전반적으로 감소하고 있음에도 항생제 사용량은 꾸준히 증가하는 양상을 보이고 있다.
[표 3-27] 급성상기도감염 항생제 처방률 및 항생제 사용량(단위: %, DDD/인구 1,000명/일)
|
구분 |
구분 |
2005 |
2006 |
2007 |
2008 |
2009 |
2010 |
2011 |
2012 |
2013 |
2014 |
2015 |
2016 |
|
급성상 기도감염 항생제 처방률 (%) |
전체 |
65.53 |
56.40 |
54.64 |
55.94 |
53.28 |
52.01 |
47.48 |
45.13 |
44.44 |
43.73 |
44.04 |
42.90 |
|
상급 종합 병원 |
53.89 |
46.66 |
39.63 |
38.49 |
31.40 |
31.03 |
30.49 |
26.32 |
25.17 |
23.38 |
21.10 |
15.31 |
|
|
종합 병원 |
55.88 |
49.65 |
45.94 |
47.19 |
45.05 |
45.77 |
44.51 |
43.37 |
42.21 |
39.94 |
40.04 |
38.32 |
|
|
병원 |
57.33 |
48.95 |
46.50 |
47.61 |
45.18 |
46.71 |
45.87 |
46.67 |
48.24 |
47.58 |
47.79 |
46.69 |
|
|
요양 병원 |
46.53 |
42.58 |
42.95 |
39.96 |
39.12 |
38.61 |
34.86 |
35.22 |
34.50 |
34.76 |
35.48 |
34.24 |
|
|
의원 |
65.94 |
56.75 |
55.12 |
56.52 |
53.97 |
52.58 |
47.73 |
45.18 |
44.33 |
43.65 |
43.96 |
42.82 |
|
|
항생제 사용량 (DDD/인구 1,000명/일) |
한국 |
- |
- |
- |
26.9 |
26.9 |
27.5 |
29.1 |
29.8 |
30.1 |
31.7 |
31.5 |
34.8 |
|
OECD 평균 |
20.6 |
20.2 |
20.9 |
21.3 |
21.4 |
21.0 |
21.3 |
21.3 |
21.5 |
21.3 |
21.1 |
- |
출처: 건강보험심사평가원 약제급여 적정성 평가 결과; OECD. OECD Health Statistics 2018
국내에서는 반코마이신12) 내성 중환자가 많은 종합병원과 의원, 요양병원에서의 내성률이 반코마이신 내성 장알균(E.faecium)이 36.5% 수준으로 선진국(영국 21.3%, 독일 9.1%, 프랑스 0.5%)보다 높았으며(국가 항균제내성정보 연보, 2014), 2007년에 비해서도 크게 증가한 것이 확인되었다. 중환자가 많은 종합병원 외 의원, 요양병원에서도 높은 내성률을 보였으며 내성균 환자들이 종합병원에서 요양병원 및 지역사회로 이동하면서 내성균이 확산되는 양상을 보였다.
[표 3-28] 요양기관별 반코마이신 내성 장알균(E.faecium)
|
연도 |
종합병원 |
병원 |
의원 |
요양병원 |
|
2007(%) |
26.0 |
15.5 |
5.0 |
20.5 |
|
2014(%) |
36.5 |
22.1 |
24.7 |
49.1 |
주) 산출방법: (반코마이신 내성 장알균 분리건수/장알균 분리건수)×100
출처: 국가 항균제내성정보 연보, 2014
축・수산용 항생제 판매량은 배합사료 첨가금지(전면금지, 2011)로 감소하였지만, 일부 주요 항생제의 판매는 증가(WHO 지정 최우선 관리 항생제인 3・4세대 세파계 6.8톤→9.3톤, 마크로라이드계 56톤→66톤, 2012∼2015)하였다. 축산 영역에서는 WHO 지정 최우선 중요 항생제 중 플로르퀴놀론계, 3세대 세파계의 내성률이 닭에서 높았다. 닭 대장균의 내성률은 플로르퀴놀론계 내성률은 한국 79.7%, 덴마크 6%, 일본 5.4%였으며, 2013년 세파계 내성률은 한국 9.1%, 덴마크 2%, 일본 4.8%로 일본이나 덴마크에 비해 월등히 높았다.13)
내성균의 확산을 방지하기 위하여 항생제 적정 사용, 내성균 확산 방지, 감시체계 강화, 항생제 인식 개선, 인프라 및 R&D 확충, 국제협력 활성화 등의 6대 분야를 주요 내용으로 하는 ‘국가 항생제 내성 관리대책(2016∼2020)’을 마련하였다. 이를 통해 항생제 내성균으로부터 국민의 건강을 보호하기 위한 범부처 국가대책을 수행 중으로 사람, 동물, 환경이
유기적으로 연결되어 있음을 인식하고 공동의 안전을 달성하기 위한 원헬스(One Health)적 접근을 추진 중이다.
나. 해외 동향
(1) 세계보건기구(WHO)
세계보건기구는 전 세계 각국의 감염병 대비・대응의 핵심 역할을 하는 국제기구로서, 우리나라의 감염병 정책 기획 및 수립에도 좋은 가이드라인 역할을 하고 있다. 세계보건기구는 재정 위기와 세계적 환경변화에 발맞추어 2011년부터 운영 프로그램, 거버넌스, 관리 3개 부문에 대한 ‘WHO 개혁’을 진행하고 있다. R&D 청사진을 제시하고 기술적 대응을 준비하는 등 감염병 대비를 위한 적극적인 개혁을 함께 추진하고 있다. 2015년 스위스 제네바에서 열린 68번째 세계보건총회에서 ‘R&D Blueprint’ 착수를 발표했다. 이 작업을 통해, R&D가 시급한 우선순위 병원체를 도출하고 그에 따른 진단기술, 치료제, 백신을 개발할 수 있는 연구개발 로드맵과 관련 법적 틀을 마련하고자 하였다.
[표 3-29] ‘WHO R&D Blueprint’ 3대 목표・9개 과제
|
3대 목표 |
9대 과제 |
|
|
1. 감염병이 유행하는 동안 신속한 연구개발 착수를 위한 조정능력 강화 및 환경 조성 |
1 |
효과적인 조정의 틀 수립 |
|
2 |
투명한 재원 마련 절차 수립 |
|
|
3 |
효과적 커뮤니케이션 장려 |
|
|
2. 안전, 효과적, 시의적절한 연구를 위한 R&D 가속화 |
4 |
감염병 유행의 위험도 평가 및 우선순위 병원체 도출 |
|
5 |
진단기술, 치료제, 백신의 신속평가를 위한 R&D 로드맵 개발 |
|
|
6 |
규제와 윤리적 틀 마련 |
|
|
3. 감염병 유행 상황에 신속히 대처할 수 있는 새로운 규범과 표준 개발 |
7 |
연구설계를 위한 역량 강화 |
|
8 |
협력을 위한 가이드 및 기술 개발 |
|
|
9 |
규제 및 정책 장벽을 극복하기 위한 자료 예측 및 사전 준비 |
|
출처: WHO
(2) 미국
미국의학한림원(IMO)은 1992년 ‘Emerging Infections: Microbial Threats to Health in the United States’ 보고서에서 신종감염병 및 재출현 감염병의 원인이 될 수 있는 병원체 54종을 처음으로 목록화 하였다. 목록에는 세균, 리케치아 및 클라미디아 17종, 바이러스 26종, 원충・기생충・곰팡이 11종이 포함되었으며 이를 토대로 감염병 감시체계 확보, 감염병 연구 체계화, 백신・치료제개발 역량 확보, 보건인력교육 등 4개 영역에 대한 개선안을 제시했다.
미국 질병통제센터는 1994년 보고서에서 신종감염병의 예를 미국과 해외로 구분하여 기술하였으며, 그 예방 전략으로 감시, 응용연구, 예방・방제 및 공중보건인프라 강화의 4가지 목표를 제시하였다. 현재 미국 질병통제센터의 신종감염병 관리는 2010년 설립된 신종감염병 및 인수공통감염병센터(NCEZID: National Center for Emerging and Zoonotic Infectious Diseases)에서 담당하고 있으며, 신종감염병을 발생지역의 특성과 연계하여 1) 완전히 새로운 감염병(메르스), 2) 완전히 새로운 지역으로의 유입(플로리다에서의 치쿤구니야), 3) 특정지역에서의 재출현(플로리다와 텍사스에서의 뎅기열), 4) 항생제내성 세균 유래(MRSA, CRE)의 4가지 유형으로 분류하고 있다. 이 중 특히 신종감염병의 중요한 이슈인 사회적 영향력이 큰 병원체를 ‘high-consequence pathogens’로 규정하고 있다.
[표 3-30] High-consequence pathogens(CDC)
|
Virus(8) |
Bacteria(9) |
Prion(3) |
|
Poxvirus infections |
Actinomycoses & nocardiosis |
Bovine spongiform encephalopathy |
|
Ebola virus disease |
Anthrax |
Chromic wasting disease |
|
Rabies |
Brucellosis |
Creutzfeldt-Jakob disease (classic and variant) |
|
Hantavirus pulmonary syndrome |
Buruli ulcer |
|
|
Marburg hemorrhagic fever |
Glanders |
|
|
Rift Valley fever |
Leprosy(Hansen disease) |
|
|
Smallpox |
Leptospirosis |
|
|
Zika |
Melioidosis |
|
미국은 2001년 9월 11일 생물테러 직후 생화학, 화학물질, 방사능 등 테러의 위협과 인플루엔자 대유행에 대비하기 위한 방안으로 캐나다, 유럽연합(EU), 프랑스, 독일, 이탈리아, 일본, 멕시코, 영국이 참여한 비공식적 조직인 국제보건안보 이니셔티브(GHSI: Global Health Security Initiative)를 출범시켰다. 이 기구를 모태로 미국은 2014년 2월 14일 28개 협력국가와 WHO, 국제식량농업기구(FAO), 국제수역사무국(OIE) 등의 국제기구들과 공동으로 Global Health Security Agend(GHSA)를 발족했다. 2015년에는 우리나라도 운영위원회의 회원국으로 선정되어 2015년 9월 한국에서 GHSA 회의를 개최하였다.
(3) 유럽
유럽은 각국이 저마다의 감염병 대응 전략을 펼치고 있는 한편, 여러 국가 간의 감염병 대응 능력을 결집시키고, 감염병 수집정보를 한 곳에 모으는 중심 기관으로서, 2005년 유럽연합 질병통제관리센터(ECDC: European Centre for Disease Prevention and Control)를 설립했다.
미국 질병통제예방센터(CDC)가 감염병을 포함하여 비감염병 등 타 질환도 관할하는 것과 달리 ECDC는 유럽연합 내 감염병 대비・대응을 핵심 업무로 삼고 있다. ECDC는 감염병을 7개 질환군(항생제내성・병원관련감염(HAIs), 신종감염병・매개질환(Emerging and Vector-borne Disease), 식품・식수매개질환 및 인수공통감염병, 성매개감염병, 인플루엔자, 결핵, 백신으로 예방가능한 질환)으로 분류하여 관리・감독하고 있다.
(4) 중국
중국은 2002년 CDC(Centers for Disease Control and Prevention)를 출범시켰다. 2003년 사스와 조류인플루엔자 인체감염사례라는 위기 상황이 발생하자, 이를 전후로 위기대응법령과 조직개선 등 많은 발전이 이루어졌다. 중국의 CDC는 중앙의 국가위생가족계획위원회(National Health and Family Planning Commission of PRC) 산하 기관으로서 7개 센터, 6개 연구소, 3개 담당관실, 1개 국가예방접종사업으로 구성돼 있으며, 각 성(省)과 대도시 위원회의 보건부서(Department of Health)와는 별개로 지방 CDC가 운영되고 있다. 중앙과 지방의 CDC는 감염병의 감시, 역학조사, 예방접종사업(백신개발과 공급 담당), 감염병 연구와 개발, 위기 등 기술적 지원 체계를 이루고 있으며, 최근 우수한 연구 성과를 바탕으로 국제적인 조직으로 거듭나고 있다.
다. 국내 현황
(1) 국가방역체계 개편
정부는 메르스 대응 과정에서 드러난 국가 방역체계의 문제점을 개선하기 위해 국가 방역체계 개편방안(2015.9.)을 마련하여 위기 수준과 관계없이 모든 감염병 위기대응 및 방역조치를 질병관리본부가 수행하게 하고 국내유입차단, 초기현장대응, 유행확산대응 등의 대응단계에서 신속하고 즉각적 대응이 가능하도록 국제감시체계, 진단체계 및 방역체계, 정보공유시스템을 구축하고, 진단시설 및 감염병 환자 선별진료 및 격리병상확보 등의 의료환경개선을 추진하였다.

출처: 대한민국 정책 브리핑
[그림 3-61] 국가방역체계 개편방안(2015.9.)
(2) 제2차 국가 감염병 위기대응 기술개발 추진전략
정부는 2012년부터 ‘국가 감염병 위기대응 기술개발 추진전략(2012∼2016)’을 통해 8대 중점 감염병(신종인플루엔자, 다제내성균, 결핵, 인수공통감염병, 만성감염질환, 기후변화감염병, 생물테러, 원인불명감염병)을 선정하고, 감염병에 대한 감시・역학, 임상・정책, 기초・기전, 진단기술, 치료제, 백신, 인프라에 대한 기술개발로드맵을 제시하였다. ‘제1차 국가 감염병 위기대응 기술개발 추진전략’의 종료와 변화된 국가 감염병 위기현황을 반영, 범부처 국가 감염병 R&D 정책방향 추진전략을 포함한 ‘제2차 국가 감염병 위기대응 기술개발 추진전략(2017∼2021)’이 수립되었다. 국가 감염병 위기 현실을 반영하고, 국가
방역체계에 부합하는 범부처 R&D 추진전략을 수립하여, 국가 감염병 R&D 투자 효과성을 극대화하고자 국민건강의 위협성, 대유행 가능성, 전략적 지원 필요성 등을 기준으로 주요 감염병을 3대 유형 및 10대 중점분야로 구분하여 집중 지원을 계획 중이다.
[표 3-31] 감염병 R&D 기술개발 중점 추진분야
|
3대 유형 |
10대 중점분야 |
범위 |
|
신・변종 및 해외유입 감염병 |
신종/원인불명 |
-MERS(급성호흡기), Ebola(고위험출혈열), 해외유입 신종감염병 등 |
|
기후변화 |
-지카 바이러스(Zika virus), SFTS, 쯔쯔가무시병, 뎅기열 등 |
|
|
인수공통 |
-‘동물과 사람간에 서로 전파되는 감염병’ 중 10종을 지정 |
|
|
인플루엔자 |
-계절 인플루엔자, 신종 인플루엔자, 조류 인플루엔자 등 |
|
|
미해결 감염병 |
다제내성균 |
-항생제에 내성을 가진 균에 의해 발생하는 감염질환 |
|
결핵 |
-결핵균에 의해 발생하는 폐결핵 및 폐외결핵 등 질환 |
|
|
만성감염 |
-HIV/AIDS, B형간염, C형간염, HPV, Herpes Virus 등 |
|
|
국가 감염병 안전망 구축 |
재난대비/관리 |
-감염병(가축포함)에 따른 사회적 재난(ICT기술 활용, 감염병환자인지시스템 구축) |
|
예방접종/백신 |
-국가예방접종사업의 대상이 되는 10개 질환 및 백신기반 기술 |
|
|
생물테러 |
-감염병 예방법 상의 “생물테러 지정 감염병” 및 “고위험병원체” |
출처: 제2차 국가 감염병 위기대응 기술개발 추진전략
(3) 제2차 감염병 예방관리 기본계획 수립
감염병 예방 및 관리에 관한 법률에 따라 보건복지부 장관은 감염병 예방관리를 위하여 5년마다 기본계획을 수립 추진하고 있다. 제1차 기본계획(2013∼2017) 종료에 따라 제2차 기본계획(2018∼2022)이 수립되었다. 2차 계획은 향후 5년간 국가가 주요하게 추진해야 할 감염병 위기대응 및 예방관리 강화대책을 담고 있다. 감염병 관련 주요 계획으로는 국가 방역체계 개편방안(2015.9), 감염병 위기관리 대책(2016.9), 국가 항생제 내성 관리대책(2016∼2020)이 있다.
(4) 미래감염병 41종 선정(2017.12.)
발생・유입 시 공중보건 위기상황 초래 가능성, 전파위험도, 질병치명도, 주요국 전문기관의견 및 그간의 연구결과를 토대로 법정감염병 25종, 비법정감염병 16종을 포함한 41종의 해외유입우선대비 감염병을 선정하였다. 해외 유입가능에 우선 대비가 필요한 비법정전염병 16종엔 니파바이러스 감염증, 리프트밸리열, 마비저, 크리미안콩고출혈열, 세인트루이스 뇌염바이러스, 에르리키아증, 하트랜드바이러스, E형간염, 선모충증, 림프구성 맥락수막염, 북아시아진드기열, 엘리자베킹키아, 인위반충병, 이매개재귀열, 진드기매개재귀열, 타히나열이 포함되었다.
라. 전망
(1) Disease X의 출현
세계보건기구(WHO)는 2014년 에볼라 유행 경험을 계기로 새로운 감염병에 의해 유발되는 새로운 위협에 신속하게 대응하기 위해 새로운 R&D 패러다임의 필요성을 인지하고, 2015년 감염병에 대한 R&D 청사진을 제시하였다. WHO는 감염병 우선순위 선정을 위한 요소로 인체 전파력, 치사율, 파급 가능성, 진화 가능성, 의학적 대응책 보유 여부, 감시 및 통제 난이도, 발생지역의 공중보건 상황, 국제사회로의 전파 위험성, 사회적 영향의 9가지 기준을 제시하였다. 전문가 그룹을 통해 가까운 미래에 공중보건위기를 초래할 수 있으나 현재 의학적 조치가 불충분하여 긴급 R&D 추진이 필요한 우선순위 감염병을 발표하고 정기적으로 모여 선정 방법론을 검증하고 목록의 재선정을 추진하고 있다. 2018년 2월 최종 개정된 WHO 2018 R&D 청사진에서 다음과 같은 8대 우선순위 감염병을 선정하여 발표하였고, 처음으로 ‘Disease X’라는 표현이 등장하였다.
-Crimean-Congo haemorrhagic fever(CCHF)
-Ebola virus disease and Marburg virus disease
-Lassa fever
-Middle East respiratory syndrome coronavirus(MERS-CoV) and Severe Acute Respiratorysyndrome(SARS)
-Nipah and henipaviral diseases
-Rift Valley fever(RVF)
-Zika
-Disease X
‘Disease X’는 현재는 치료제나 백신이 개발되어 있지 않은, 신종 감염병 혹은 재출현의 위험성이 있는 감염병으로 발생 시 범세계적으로 위협이 될 수 있는 감염병을 의미한다. 미지의 원인체나 상황으로부터 발생할 수 있는 감염병의 위험성을 상기시키고 이에 대응하기 위해 ‘Disease X’라고 명명하고 감염병의 우선순위에 두었으며 우리나라도 언제라도 이러한 ‘Disease X’가 될 수 있는 미지의 신종・재출현 바이러스의 출현에 대비하기 위해 기존의 백신 및 치료제에 집중되는 R&D 투자를 분산하여 감시, 진단, 방역, 방제, 역학에 대한 투자 지원을 확대하는 정책을 수립하였다.
(2) 4차 산업혁명 기술 기반으로 한 감염병 대응
다변화되는 신종 감염병 유형별 맞춤형 대응전략을 수립하기 위해 빅데이터, 인공지능, 정보통신기술 등 4차 산업혁명 기술을 활용하여 감염병의 조기감지, 현장진단, 위험분석, 정보공유 등 감염병 대응 플랫폼을 구축하여 감염병 관리에 적용하고자 하는 시도가 이루어지고 있다.
(가) 스마트검역시스템 구축 및 운영
우리나라 공항 및 항만 검역소에서 오염국가 입국자에 대한 검역 방식은 열감지카메라에 의한 발열감시 및 입국자가 작성한 건강상태질문서 확인 등에 의존하고 있다. 하지만 이러한 검역 방식은 입국 시 증상이 없을 경우 귀가 조치되기 때문에 2014년 에볼라(Ebola virus disease), 2015년 메르스(MERS), 2016년 지카바이러스병(Zika virus disease)까지 장기간의 잠복기와 빠른 전파력을 가진 해외 감염병을 효과적으로 대응하는 데는 많은 한계점을 가지고 있다. 점점 증가하는 해외 감염병을 효율적으로 관리하기 위하여 해외 오염국가 방문 후 잠복기간 동안 국내로 입국한 입국자를 대상으로 증상발현 시 조치방안 안내와 관리 방안이 필요하게 되었다. 스마트 검역이란 입국장 검역의 한계점을 보완하기 위하여 외교부, 건강보험심사평가원 등 유관기관과 IT기술을 통해 연계하여 오염국가 입국자 정보를 확보하고, 이를 활용하여 해외 감염병 신고 문자안내 및 의료기관 정보 공유 등 입국 후 감염병 잠복기간까지 관리하도록 지원하는 시스템이다.

출처: 질병관리본부
[그림 3-62] 스마트검역정보시스템 구축 및 운영
(나) 축산농가 방역・출입관리를 위한 스마트 디바이스
전남 나주시가 축산농가 방역・출입관리를 위해 도입예정인 농가 출입관리 스마트 디바이스는 사물에 센서를 부착해 데이터를 인터넷으로 실시간 주고받는 기술인 사물인터넷(IoT)을 활용한 기술이다. 이 기술은 축산농가 출입차량과 사람에 대한 통제는 물론, 빅데이터를 활용해 이동경로를 파악하는 등 해마다 발생하여 큰 경제적 피해를 유발하는 고병원성 조류인플루엔자(AI)와 구제역의 사전 예방 및 확산 방지에 활용될 전망이다. 스마트폰 앱(App)을 통해 소독이 완료된 차량은 소독필증이 전자발행 되며, 소독 유무를 인식해 거점소독시설 및 농가 앞 차단시설이 자동 개방된다.
또한 무허가 및 소독이 안 된 차량은 농가 접근 시 경보음과 함께 출입이 차단된다. 이 같은 기술을 통해 광범위한 방역 초소 운영에 따른 지자체 예산 절감을 비롯하여, 시스템의 데이터베이스를 통한 빅데이터 분석 기술을 활용해 농가 출입차량 및 인원에 대한 이동경로를 파악할 수 있을 것으로 기대하고 있다.
(3) 국가방역체계와 연계된 R&D에 지원을 확대
2016년도 감염병 특화 사업 총예산 중 진단(26.4%), 백신(28.2%)의 비중이 과반을 넘으며, 정부가 아니면 지원하기 어려운 공공적 성격의 연구 분야인 감시・역학(9.0%), 예방, 방제, 방역(2.7%), 임상・정책(2.8%)의 비중은 여전히 크게 낮은 상황이다. 메르스 사태의 국가방역시스템 및 감시시스템의 실패 원인은 방제・방역, 감시・역학, 인프라와 같은 분야의 연구비 투자가 저조하여 방역체계와 연구의 방향이 연계되지 못했기 때문이며, 이 같은 실수를 반복하지 않도록 감염병 R&D와 국가방역체계를 연결하는 노력이 시작되었다.
이에 따라 유입 차단을 위한 감염병 매개체 감시 및 방제기술 연구, 현장 수요를 반영할 수 있는 고감도 진단 등의 현장 적용 기술의 개발, 확산방지를 위한 차세대 소독제 및 방역 기기의 개발, 의료현장 감염경로를 분석할 수 있는 인프라 강화 등의 목표를 선정하여 국가방역체계와 연계된 R&D에 지원을 확대하는 정책 방향을 수립하고 실행할 전망이다.
제3절
농림축산식품
1. 농림
가. 농림연구의 개요
농림분야의 R&D 투자는 농림축산식품부(농식품부), 농촌진흥청(농진청), 산림청 등 3개 행정기관에서 이루어지고 있으며, 2009년 농림축산과학기술육성법을 제정하고 매 5년마다 농림식품과학기술 종합계획을 수립하고 매년 실행계획에 따라 농림분야 R&D를 지원하고 있다. 농식품부 R&D사업은 Golden Seed 프로젝트, 농생명산업기술개발, 수출전략기술개발, 첨단생산기술개발, 다부처유전체사업 등 15개여 사업으로 나뉘어져 분야별로 투자되고 있고 최근 2∼3년간 크게 투자가 증가된 분야는 스마트팜 기술개발 분야로 파악되었다.
농진청은 미래전략융복합 현안 및 미래 신산업 기술개발, 농업과학기반기술개발, 식량안정공급, 원예특작 품질 고급화 등의 분야에 투자하고 있으며, 산림청은 산림과학연구, 산림생물종연구, 임업기술연구개발, 산림생명자원 소재 발굴, 융복합 기반 임산업의 신산업화 기술개발 등에 예산을 지원하고 있다. 농식품부는 기업, 대학, 연구기관 등 민간의 연구개발을 지원하는 출연금 형태로 지원되고 있으며 농진청과 산림청은 산하 국립연구기관의 기본경비, 인건비, 기관 시험연구비 등과 일부 출연금 형태로 투자되고 있다.
(1) 새로운 생명공학 기술의 동향 및 전망
최근 개발된 새로운 생명공학 기술로는 유전자가위 기술(gene-editing), 합성생물학, RNAi 기술 등이 있으며 이 기술 분야는 지속적으로 성장하고 있다. 특히 유전자가위 기술은 2022년 2억 9,500만 달러 규모로 성장할 것으로 예측되는데 생명공학 전 분야에 있어 유전자를 삭제・활성・변형하기 위한 목적으로 DNA를 도입하거나 삭제 시 사용하고 있어, 향후 인체질병 분야에서도 혁신적인 변화를 가져올 것으로 기대하고 있다. 합성생물학 분야는 농업분야에서 신품종 육종을 위한 첨단기술로 적용이 가능하며 식량 및 비식량 공급원료 생산 분야에 적용이 가능할 것으로 보인다. 또한 RNAi 기술은 식물에서 중요한 기능성 유전자의 단백질 발현을 억제함으로써 친환경적인 농작물보호 분야에 적용이 가능할 것으로 전망하고 있다.
(2) 새로이 도입되는 생명공학 기술 관련 해외 동향
현재 미국을 포함한 유럽, 일본, 호주 등에서는 유전자가위 기술 적용을 포함한 신개념의 육종 기술에 대하여 GMO 규제 여부에 대하여 논의하고 이에 대한 입장을 내놓고 있다. 미국의 경우, 2018년 초에 유전자가위 기술을 포함한 신육종 기술에 대하여 식물 병해충(plant pest)이 아니거나 이를 이용하여 개발된 경우가 아니면 규제할 계획이 없음을 표명하였다. 반면 유럽에서는 이 기술이 적용된 생물체에 대하여 기존의 GMO와 동일한 규제 적용을 받아야 한다고 밝힌 바 있다. 일본은 유전자가위 기술을 이용하여 외부 유전자도입이 없는 경우, GMO 규제에 포함시키지 않는 방향의 규제범위를 제안하고 있으며 호주, 뉴질랜드의 경우 외부 유전자 도입 여부에 따라서 GMO 규제 포함 여부를 규정하려는 방향의 움직임이 있다.
이와 관련하여 우리나라에서는 논의의 시작도 없는 상황이며 기존의 GMO와는 다른 접근으로 첨단기술인 유전자가위 기술이 적용된 작물, 미생물에 대한 GMO 포함여부 및 규제와 관련한 논의가 심도 있게 이루어져야 할 것으로 보인다.
나. 국내 현황
(1) 농림식품과학기술 육성을 위한 종합계획 및 중장기계획 수립
(가) 농림식품과학기술 육성 종합계획 수립
농식품부는 2009년 12월, 제1차 농림식품과학기술육성종합계획 5개년 계획을 수립한 이후 2015년도에 두 번째 계획을 수립하여 농업의 첨단산업화, 기후변화 대응, 현장문제해결 등 7대 농정과제와 연계한 4대 분야 50대 핵심기술을 선정, 이 분야의 투자를 강화해 나가고 있다. 본 계획에 따르면 2017년도 농림축산식품분야 연구개발 투자는 총 9,500억 원으로 글로벌 경쟁력 강화, 신성장 동력 창출, 안정적 식량공급, 국민행복제고 등 주요 4대 분야에 약 58%(5,573억 원), 7대 농정과제에 46%(4,413억 원)를 투자하였는데 이것은 2015년도 이후 농식품부와 농진청・산림청 전체 예산대비 약 5.5% 수준을 유지하고 있는 규모이다.
연구개발 예산 투자에서 특이점은 농업의 첨단산업화 농정과제에 2016년 대비 2017년도 53.5%로 크게 증가한 743억 원을 투자하였다. 중점투자 분야는 스마트팜과 관련된 전 분야, 지능형 로봇개발, 스마트 온실 및 시설원예 환경제어 등 관련 분야의 투자가 크게 증가되었음을 알 수 있다.
[표 3-32] 2018년 농림식품분야 R&D 예산 현황(단위: 억 원, %)
|
구분 |
2014 |
2015 |
2016 |
2017(C) |
2018(D) |
증감 |
|
|
(D-C) |
% |
||||||
|
농림식품 R&D 예산(A) |
8,934 |
9,450 |
9,531 |
9,500 |
9,824 |
335 |
3.5 |
|
농식품부, 양 청 전체 예산(B) |
167,258 |
172,301 |
172,794 |
174,159 |
174,883 |
724 |
0.4 |
|
(A/B) |
5.3 |
5.5 |
5.5 |
5.4 |
5.6 |
- |
- |
반면 시장개방에 대응한 수출, 수입대체 품목 개발 등의 분야에 대한 투자는 3% 감소하여 1,012억 원이 투자되었고 50대 핵심기술 분야 중 10% 이상 투자가 감소한 분야는 농생명자원, 기후변화대응 분야로 나타났다.
[표 3-33] 2018년 4대 중점분야 투자예산 및 비중(단위: 억 원, %)
|
구분 |
2017 |
2018 |
차이(%p) |
||
|
예산 |
비중 |
예산 |
비중 |
||
|
글로벌 경쟁력강화 |
1,937 |
20.4 |
2,107 |
21.5 |
1.1 |
|
신성장동력 창출 |
1,457 |
15.3 |
1,522 |
15.5 |
0.2 |
|
안정적 식량공급 |
1,337 |
14.1 |
1,407 |
14.3 |
0.2 |
|
국민행복 제고 |
843 |
8.9 |
859 |
8.7 |
Δ0.2 |
|
4대 중점분야 합계 |
5,574 |
58.7 |
5,895 |
60 |
1.3 |
|
기타 ⃰ |
3,926 |
41.3 |
3,929 |
40 |
Δ1.3 |
|
총계 |
9,500 |
100 |
9,824 |
100.0 |
- |
주) ‘기타’는 중점연구분야 외 기초・기반 R&D, 시설장비비, 인건비 등의 합
[표 3-34] 7대 농정과제에 대한 예산 투자 현황 및 비중(단위: 백만 원, %)
|
7대 농정과제 |
2017 |
2018 |
증가액 |
전년대비 증가률 |
||
|
예산 |
비중 |
예산 |
비중 |
|||
|
농업의 첨단산업화 |
74,275 |
7.8 |
77,262 |
7.9 |
2,987 |
4.0 |
|
고부가가치 식품개발 |
50,038 |
5.3 |
50,594 |
5.2 |
556 |
1.1 |
|
시장개방 대응 |
101,161 |
10.7 |
104,427 |
10.6 |
3,266 |
3.2 |
|
농생명자원 가치제고 |
82,829 |
8.7 |
91,388 |
9.3 |
8,559 |
10.3 |
|
기후변화 대응 |
16,645 |
1.8 |
18,224 |
1.9 |
1,579 |
9.5 |
|
현장문제해결 |
90,610 |
9.5 |
92,283 |
9.4 |
1,673 |
1.8 |
|
농촌가치제고 |
25,789 |
2.7 |
26,407 |
2.7 |
618 |
2.4 |
|
7대 농정과제 합계 |
441,347 |
46.5 |
460,585 |
47 |
19,238 |
4.4 |
|
전체 R&D 예산 |
949,981 |
- |
982,414 |
- |
32,433 |
3.4 |
종합계획에 따르면 2019년도 달성 목표로 농업의 첨단산업화 및 현장문제 해결형 연구개발을 중점적으로 추진하여 농림업 부가가치액 33조 원 달성에 기여하고 선진국 대비 기술격차를 10% 이상 증대하며 농림업의 벤처 비중을 확대 등을 제시하고 있다. 2018년도 농림 분야의 연구개발 예산 배분의 특징은 다소 미흡했던 농생명자원의 가치 제고 분야에 대한 투자를 확대한 것이라 볼 수 있으며 농생명소재사업과 관련하여 농식품부는 큰 규모의 연구개발사업을 기획 중에 있다.
(나) 농림식품과학기술 육성 중장기계획
농식품부는 두 개의 청과 함께 2013년도에 향후 10년간(∼2022)의 농림 분야 주요 과학기술육성을 위한 중장기계획을 별도로 수립하여 추진 중에 있다. 이 계획은 정부투자의 양적확대에도 불구하고 투자방향의 설정이나 민간의 R&D 투자가 미흡함을 반성하고 그간 지속적인 문제점으로 지적되어 왔던 부・청 간 융합연구의 미진한 부분을 개선하였다. 소액, 다수 건의 백화점식 분산투자를 중대형 사업단으로 묶고 핵심기술개발을 위한 선택과 집중, 그리고 정부와 민간 투자의 균형을 위해 정부 주도의 투자를 목표로 하고 있다. 본 계획의 주요내용은 다음과 같다.
① 농가인구 감소, 기후변화, 가축질병 확산 등 농림 분야의 성장 저해요인에 대한 문제해결형 R&D투자를 확대하여 농・산업의 부가가치를 연 3% 성장시킬 수 있도록 R&D 투자를 이루어 간다는 것을 목표로 하고 있다.
② 연구개발투자 효율성 제고를 위해 농림식품 R&D예산을 지속적으로 확대하여 2022년까지 농식품부 전체예산 대비 비중을 10%로 확대 추진하며 민간 R&D 투자를 확대하고 기술산업화 및 실용화를 통하여 성과를 제고한다.
(2) 우리나라의 농림분야 기술수준
농림분야의 기술수준은 선도그룹을 100%로 비교하면 농산분야 85.4%, 산림자원분야 86.5% 수준으로 국내 타분야(축산 77.3%, 수의 76.2%, 농림식품융복합 76.4% 등)보다
비교적 기술수준 격차가 추격 추세에 있는 것을 볼 수 있었다.14)
농림 연구분야 중분류 수준에서 살펴보면 미국, 네덜란드, 일본의 기술수준이 가장 높았고 한국의 경우 특용작물과학분야의 기술수준(87%)이 상대적으로 가장 높은 것으로 분석되었다. 그 외 식량작물과학은 83.5%, 원예작물과학은 83% 정도로 분석되어 농림축산식품 전 분야에서는 상대적으로 높은 수준의 기술력을 보유하고 있는 것으로 나타났다.
산림분야는 최고기술보유국 대비 88.8%로 최상위 기술수준보유국인 미국, 일본과 큰 차이가 나지 않을 정도의 기술을 보유하고 있는 것으로 나타났으며 가장 큰 폭으로 기술이 향상된 분야는 비목재 임산물과학분야로 분석되었다. 특히, 이 분야의 성장을 막는 제한요인으로는 인재의 부족, 행정절차와 간섭, 연구자간 자유로운 교류 등이 제시되었다.
한편, 농생명 신소재 및 시스템분야의 기술수준은 선도그룹 대비 77.3% 정도였으며 에너지 자원분야는 그보다 낮은 73% 정도 수준에 머무르고 있었는데 그 원인으로는 전문 인력의 전문성 미흡, 산업생태계 조성 미흡, 열악한 연구환경 및 규제, 연구비 투자 미흡 등을 제시하였다.15)
(3) 농업과 기업 간 상생협력 사례 발굴 및 적극 지원
농식품부는 2018년 11월에 농업계와 기업이 협력하여 상호 경쟁력을 높이고 농산업의 부가가치 창출에 노력한 우수사례를 발굴하여 시상하고 이와 같은 운동을 확산하기 위해 노력하고 있다. 그 결과 대상을 수상한 오리온은 감자칩 원료인 감자를 전국 농가와 직접 계약, 재배하여 사용해 왔으며 자사제품에 적합한 감자의 재배기술을 보급하는 등 농가와 기업이 함께 이익을 창출하기 위해 노력하였다. 같은 대상 수상인 제주 구좌농업협동조합은 생산농가의 조직화, 공동품질관리 등을 통하여 고품질 당근 생산에 노력하는 한편, 당근가공제품을 개발하여 온오프라인 유통망을 구축・판매함으로써 원료의 부가가치를 창출했음을 인정받았다. 이와 같이 현장연계 중심형의 사례를 적극적으로 발굴하고 기업과 농업이 상호 상생할 수 있는 사례를 널리 알림으로써 산업육성의 긍정적인 효과가 기대되는 바이다.
다. 발전 전망
(1) 농림식품과학기술 개발에 대한 지속적인 투자 확대 노력
정부는 현재 농식품부 총예산의 5%를 상회하는 R&D 투자규모를 2022년까지 10%까지 상향하여 투자할 계획을 세우고 지속적으로 사업기획의 확대, 체계적인 관리, 새로운 주제발굴, 수요조사, 현장연계형 기술개발, 중대형 사업단 형태의 지원 등 다각도의 노력을 경주하고 있다. 이러한 정책 방향은 지난 수년간 백화점식 소형과제 위주의 지원을 탈피하여 선택과 집중으로 농업과학의 수월성을 확보하고 농업현장의 당면과제들을 해결해 나갈 수 있을 것으로 기대하며 정부 R&D 투자의 효율성을 극대화 해 나갈 수 있는 밑거름이 될 것으로 사료된다.
(2) 체계적인 투자계획 수립
정부는 중장기계획 및 종합계획을 수립하고 체계적인 연구개발 투자를 위해 지난 10년간 노력해왔다. 농림학의 분야가 매우 광범위하여 자칫 정부 투자 방향이 선택과 집중을 할 수 없는 경우도 있겠으나 기존에 예산투자를 해왔던 분야 또한 양성된 전문인력들을 활용하여 산업이 발전할 수 있도록 산업계와 연계할 필요가 있다. 또한 우리나라 연구인력의 경쟁력이 우수한 분야(농업미생물학, 발효미생물학, 분자육종, 한식 세계화 등)에는 더욱 적극적인 연구개발 지원으로 세계적인 경쟁력을 지속해 나갈 수 있도록 해야 할 것이다.
(3) 새로운 생명공학기술의 적극적인 도입
농림분야에 생명공학의 신기술을 도입, 적용하여 새로운 시장을 개척하기 위해 적극적이어야 한다. 해외 선진국들은 이미 유전자가위기술 등 첨단기술을 활용한 제품들에 대한 개발에 적극적이며 이미 규제여부를 논의 중이다. 하지만, 우리나라는 여전히 GMO의 대국민 인식전환이나 정확한 과학적 사실에 대한 전달, 교육, 홍보 등에 소극적으로 대응하고 있는 것이 현실이다. 점차 커지는 선진국과의 기술격차나 시장 확대에서 제외되는 경우, 농림과학분야에서의 새로운 기술 도입은 연구를 위한 연구로 끝날 뿐 시장창출의 결실을 맺을 수가 없을 것이다. 따라서 기술에 대한 정확한 설명과 이해, 국민적인 공감대를 이끌어 낼 수 있는 시작이 필요할 때라고 사료된다.
(4) 농림과학분야의 전문인력 양성에 대한 투자 확대 시급
농식품부의 농림축산식품연구센터지원(ARC)사업은 7∼10년간 집합연구를 할 수 있도록 대학을 직접 지원하여 농림 산업계에서 필요로 하는 인재양성을 추진하고 있다. 급격한 감소추세에 있는 농림과학분야의 전문인력이 꾸준히 양성되고 있을 만큼 파급효과가 큰 사업이므로 정부의 적극적인 지원확대가 필요할 것으로 보인다.
2. 축산
가. 축산연구의 개요
축산업의 생산성은 사료의 효율 개선, 번식, 육종 등의 고전적인 기술과 유전체를 통한 선발 기술의 발전을 통해 점점 향상되는 추세이며, 생산성을 크게 향상시킨 농장만이 살아남게 되면서 사업 규모도 점점 커지게 되었다. 또한 가축의 사육 방법도 집단화・집약화로 변해가고 있다. 하지만 축산업이 발전하는 만큼 환경오염 문제점이 점점 크게 대두되고, 전염성 질병도 더 빈번하게 발생하여 축산업뿐만 아니라 국가 전체의 경제에도 큰 피해를 야기하고 있다. 실제로 전 세계적으로 구제역과 조류인플루엔자가 발생하여 축산업에서 막대한 경제적 손실을 입은 바 있다.
최근에는 생산성 향상과 관계없이 농장에서 사육되는 가축의 복지도 고려해야 한다는 새로운 패러다임이 유럽에서부터 생겨나기 시작했다. 이로써 축산업에서 발생하는 환경 오염원도 감소시킬 수 있으며, 전염성 질병의 확산 방지에도 큰 역할을 할 것이라고 기대하고 있다.
이와 별개로 가축생명공학 연구자들은 중국을 중심으로 생명공학 기술을 적용하여 생산성 저하 없이 환경 오염원의 방출을 감소시키고, 전염성 질병의 감염 및 확산을 억제 시킬 수 있는 유전자 변형 가축을 개발하고 있다. 박테리아에서 분리한 당 분해효소와 인 분해효소 유전자가 도입된 돼지를 개발하여 분뇨로 배출되는 질소 및 인 함량을 감소시킴과 동시에 소화 효율도 증가시킬 수 있다고 보고하였다. 호흡기생식기증후군 바이러스 저항성 돼지가 미국과 영국에서 개발된 이래 중국에서는 돼지의 생산성을 크게 약화시키는 다양한 바이러스 질환 저항성 돼지를 개발하였다.
3세대 유전자 편집 CRISPR-Cas9(Cluster Regularly Interspaced Short Palindromic Repeats/CRISPR-associated protein 9) 기술이 2013년 개발된 이래 돼지와 같은 대동물을 대상으로 유전 질환 모델 개발, 이종이식 거부반응 제어 모델 동물 개발이 크게 증가할 것으로 기대되었지만 실제로 진행된 연구 개발은 많지 않다. 대신에 가축의 경제형질을 개선하거나 추가하는 많은 연구가 진행되었다. 이미 잘 알려진 모델인 근육의 발달을 억제시키는 myostatin 유전자 기능을 제거한 양을 개발하였고, 염기서열 치환을 통해 단산성인 중국의 양을 다산성으로 개량하는 연구도 진행되었다.
CRISPR-Cas9 유전자 편집 기술을 동물에서 활용하기 위한 도입 방법이 혁신적으로 개선되었다. 세포를 중간 매개체로 이용하는 단계를 생략한 채 직접 수정란에 미세주입 방법으로 개선되어 비용과 노동력을 크게 감소시킬 수 있었는데, 일본의 연구팀에서 세포에 유전자를 도입하는 전기천공법(electroporation)을 수정란에 적용하여 미세주입이라는 고도의 기술 없이도 유전자변형 가축의 생산이 가능하게 되었다.
최근 전 세계적으로 CRISPR-Cas9 유전자 편집 기술로 개발된 동물에 대하여 유전자변형 동물로 규정할 것인지에 대한 논의가 국가별로 진행 중이다. 특히 외래유전자 삽입이 없는 미국에서 개발된 PRRSV 및 aminopeptidase N 기능제거 돼지와 같은 SDN-1(Site- Directed Nuclease-1) 산물에 대하여 LMO(living modified organism) 동물로 규정하지 않으려는 국가가 증가하고 있다. 이는 곧 이제까지 식물에서의 유전자변형에 대한 논란만큼이나 가축에서도 유전자변형의 안정성과 환경 문제에 관한 많은 논란이 발생할 것으로 예측된다. 이러한 가운데 중국의 연구 동향을 주시할 필요가 있다. 그들은 연구용으로 매우 제한적이었던 유전자변형 가축의 개발에서 벗어나 생명공학 기술로 구현할 수 있는 모든 종류의 가축을 개발해 왔고, 더욱더 다양한 목적으로 유전자변형 가축을 개발할 것으로 기대하고 있다. 이러한 와중에 우리나라에서도 곧 오랜 기간 축척해 온 높은 수준의 동물생명공학기술을 어느 분야에 어떤 목적으로 적용하고 응용할 것인지 선택의 기로에 서게 될 것이다.
나. 해외 동향
(1) 유전자변형 동물 생산기술 동향
2013년도에 처음 소개된 CRISPR/Cas9 유전자 가위 기술은 유전자변형 대동물 개발 연구자들에게 최초의 복제 포유동물 ‘돌리’의 탄생만큼 혁명적인 기술로 다가왔다. 돌리가 개발되기 이전에는 기술적인 뒷받침이 되어 있지 않아 생쥐이외에는 특정 유전자의 기능을 제거하는 넉아웃 돼지, 소, 양 등 대동물을 개발할 수 없었다.
돌리에 사용된 체세포 복제 방법에 넉아웃 생쥐를 생산하는 데 사용된 유전자 적중(Gene target) 벡터를 도입하여, 유전자가 넉아웃된 체세포를 우선 제작한 후 그 체세포를 복제하여 유전자 넉아웃 대동물의 생산이 가능하게 되었다. 거의 20여 년간 복제 방법이 넉아웃 대동물을 생산하는 유일한 방법이었다. 하지만 이 방법의 가장 큰 단점은 넉아웃 체세포를 생산하기 위해서는 숙련된 고도의 기술력이 필요하고 많은 비용과 시간이 소요되는 것이다. 그런데 CRISPR/Cas9 유전자 가위 기술은 체세포 준비과정을 생략하고 수정란에 직접 목표유전자의 guide RNA와 Cas9 단백질을 주입하기만 하여도 넉아웃 대동물 개발이 가능하며 그 효율도 더 높아 더 많은 연구자들이 GM 동물 개발연구에 참여할 수 있게 되었다. 하지만 여전히 수정란 미세주입 기술은 숙련된 전문가와 고가의 장비 등이 필요하여 일반 실험실에서 GM 동물 개발 연구의 참여가 제한되고 있는 실정이었다.
일본의 토쿠시마 대학 연구팀은 체세포에 유전자를 도입하는데 가장 많이 사용하고 있는 전기천공법(electroporation)을 수정란에도 활용할 수 있는 수정란 전용 전기천공기를 개발하여 유전자 넉아웃 돼지를 성공적으로 생산 하였다(2018)16). 미국의 캘리포니아 대학의 연구팀은 더 나아가 비록 생쥐의 결과이지만 많은 실험실에서 체세포에 유전자를 도입하는데 활용하고 있는 일반 전기천공기를 활용하여 수정란에 도입하는 CGM 유전자 넉아웃 동물이 가능하며 상세한 방법을 제시하였다(2018)17). 이러한 기술 혁신으로 GM 대동물 개발에 참여하는 연구자의 수가 증가할 것으로 기대되며, 또한 GM 동물의 개발 목적도 더 다양해져 GM 동물 개발 연구가 촉진될 것으로 예측된다.
(2) 유전자 동물 개발 현황
최근 GM 동물 개발 동향의 가장 큰 특징은 개발 목적이 생체의학 연구를 위한 대동물 모델 보다는 가축이 가지고 있는 형질을 개량하거나 또는 그 가축이 갖고 있는 형질을 추가하기 위한 연구가 증가하고 있으며 이를 중국이 선도한다는 것이다. 그래서 본 장에서는 중국과 그 외의 국가에서 진행하고 있는 동물 개발 현황을 분리해서 알아보고자 한다.
(가) 중국의 현황
최근에 논문으로 보고된 유전자 변형 가축의 대부분은 중국에서 개발되었다. 개발의 목적 또한 사람의 질환 모델부터 최근 전 세계적으로 축산업에 큰 손실을 일으키는 전염병 저항성 가축과 고기의 양을 증가시키기 위한 가축 개발까지 다양하다. 유전자 변형 가축의 개발을 위하여 적용한 방법은 주로 체세포에 발현 카세트나 CRISPR-Cas 9 유전자를 도입 후 선별된 세포를 핵 치환하는 복제 방법이 주로 사용되었지만, 일부 연구팀은 guide RNA와 Cas9 단백질을 수정란에 미세주입하는 최고 수준의 유전자 편집기술을 사용하기도 하였다.
상세한 현황을 살펴보면, 의약품으로 활용이 가능한 latoferrin, bile salt-stimulated lipase를 우유로 생산하는 젖소와 사람 plasminogen activator를 생산하였다. 또한 의약품, 항산화제 보강 화장품 재료 및 우유 기능 강화를 위해 활용할 수 있는 cooper/zinc superoxide dismutase와 extracellular superoxide dismutase를 생산하는 유산양도 개발하였다. 2세대 유전자 편집 기술인 TALEN 방법을 활용하여 우유 알레르기의 한 원인으로 작용하는 beta-lactoglobulin을 제거한 유산과 우유를 섭취하지 못하게 하는 원인이 되는 유당(lactose)을 감소시키기 위하여 유당 분해효소인 lactase를 분비하는 유산양을 개발하였다.
질환 모델 가축 현황을 살펴보면 가장 대표적인 것이 희귀한 유전병의 하나인 바르덴부르크(Waardenburg syndrome) 모델 돼지이다. 베이징의 연구팀은 ethylnitrosourea 돌연변이 유도방법을 통해 microphthalmia-associated transcription factor 유전자의 247번째 아미노산 염기서열 lysine을 serin으로 치환된 돌연변이 돼지를 개발하여 피부, 털, 안구의 색소 변화, 청각 장애 증상이 발생하였다고 보고하였다. 동맥경화 모델로서 사람의 cholesteryl ester transfer protein을 발현하는 돼지를 개발하였다.

주) 미국의 캘리포니아 대학의 개발팀이 CRISPR-EZ(CRISPR-Electroporation of zygote) 기술이라고 명명 CRISPR/Ca9 유전자 가위기술을 일반 전기천공기를 활용하여 수정란에 도입하는 기술 모식도
출처: DOI:10.1038/nprot.2018.012
[그림 3-63] CRISPR-EZ 기술 모식도
근육량을 증가시키기 위하여 근육의 발달을 억제시킨다고 알려진 myostatin 유전자의 기능이 제거된 소와 돼지는 이미 2016년 이전에 개발이 보고되었는데, 최근에 중국에서는 양과 중국 고유의 돼지를 개발하였고, 추가로 사람 follistatin을 발현하는 돼지를 개발하여 근육이 증가하였다고 보고하였다. 2014년에 미국과 영국에서 돼지호흡기생식기증후군 바이러스(porcine respiratory and reproductive syndrome virus) 감염 방지를 위해 각각 개발한 CD163 기능제거 돼지 이래, 중국에서는 더 나아가 Transmisssible gastroenteritis virus와 porcine diarrhea virus 감염을 예방할 수 있는 aminopeptidase N 유전자 기능 제거 돼지와 classical swine fever virus 감염 억제를 위하여 antiviral small hairpin RNA를 rosa 26 유전자에 도입한 돼지를 개발하였다.
Booroola 양은 Booroola fecundity 유전자에 돌연변이가 발생하여 다산성의 특성을 가진다. 중국에서 양가죽 생산을 위하여 기르고 있는 중국 탄양(tan sheep)은 1마리의 새끼만 출산하는데, 다산성으로 개량하기 위하여 북서부 A&F 대학 연구팀은 CRISPR/Ca9 방법으로 oligonucloetides를 수정란에 도입하여 Booroola fecundity 좌위에 존재하는 bone morphogenetic protein receptor type 1B 돌연변이 탄양을 개발하였다.
돼지의 분과 뇨로 발생하는 환경오염 요인을 감소시키기 위하여 박테리아에 존재하는 beta-glucanase, beta-xylanse, phytase 유전자를 침샘에서 발현하는 돼지를 개발하여 질소와 인 배출이 감소한다고 보고하였다.
(나) 그 외 국가의 현황
전통적인 동물생명공학 강국인 미국조차도 2017년 이전에 개발된 유전자변형 가축의 수가 많지 않았고, 유럽을 포함 전체적으로 개발 숫자가 제한적이다. 미국에서는 중국의 현황에서 전술한 바이러스 감염 억제 aminopeptidase N 기능 제거 돼지를 체세포 복제 방법이 아닌 single guide RNA외 Cas 9 단백질을 수정란에 미세주입하는 유전자 편집기술을 사용하여 개발하였다. 희귀한 유전질병의 하나인 저인상증(hypophosphatasia) 모델 가축을 개발하기 위하여 single guide RNA, Cas9 단백질, single stranded DNA oligonucloetides를 수정란에 미세주입하는 유전자 편집기술을 사용하여 alkaline phosphatase 유전자의
특정 염기서열을 돌연변이 시킨 양을 개발하였다. 덴마크에서는 MYC, KRAS_G12D, SV40LT 유전자가 도입된 췌장암 모델 및 소장 암 모델 돼지, 사람 intergrin alpha S2/B1 유전자가 도입된 건성 피부염(Pasoriasiform skin disease) 모델 돼지를 개발하였다. 독일에서는 췌장의 발생 연구를 목적으로 insulin 유전자에 GFP를 연결한 유전자가 도입된 돼지를 개발하였고, 남성 여성 반전 증후군 질환 모델을 위하여 남성 유전자인 Sex- determining region 유전자의 기능을 제거한 돼지를 개발하였다. 일본은 가장 활발히 암 연구에 활용되는 TP53 유전자의 기능 제거 돼지를 개발하기 위하여 연구팀 자체에서 개발한 single guide RNA, Cas9 단백질을 수정란에 미세주입이 아닌 전기천공(electroporation) 법을 적용하였다. 그 외에 폴란드와 아르헨티나에서 유전자 변형 돼지와 젖소를 개발하였다.
다. 국내 현황
우리나라는 주로 이종이식에 활용하기 위한 유전자 변형 돼지를 개발하였다. 국립축산과학원은 혈관성 이종이식 거부반응을 억제시키기 위한 CD73 유전자가 도입된 돼지를 개발하였고, 생명공학연구원과 공동으로 사람 유래 5개의 유전자 DAF, CD39, TFPI, INH, TNFAIP3가 alpha 1,3-galactosyltransferase 유전자 좌위에서 발현되도록 고안된 유전자변형 돼지가 TALEN 유전자 편집 기술을 적용하여 개발하였다. 서울대 의대는 alpha 1,3-galactosyltransferase 유전자 기능이 제거된 돼지의 체세포에 거부반응 제어 TNFRI-Fc 유전자와 HO-1 유전자가 도입된 복제돼지를 개발하였다. 추가로 상기 유전자의 세포에 CMAH 유전자의 기능을 제거한 돼지도 개발하였다. 생명공학 기업인 옵티팜(주)은 이종이식에 활용하기 위하여 1,3-galactosyltransferase 유전자 좌위에 사람 CD39 유전자를 도입한 돼지를 개발하였고, 엠젠플러스㈜는 1형 당뇨병 모델 동물로서 insulin 유전자의 기능을 제거한 돼지를 유전자 편집 기술을 활용하여 생산하였다.
라. 향후 전망
그 동안 동물생명공학 기술의 발달로 가장 활발하게 진행된 연구 분야의 하나는 사람에 이식할 수 있는 대체장기용 돼지 개발일 것이다. 1996년 돌리의 개발로 유전자의 기능이 제거된 돼지의 개발이 가능해졌고, 21세기 진입 직후 반드시 해결해야만 할 초급성 거부반응 유발 유전자 1,3-galactosyltransferase 기능 제거 돼지가 개발되어 이종이식 연구에서 획기적인 진보를 이루었고, 그 이후로 단계별, 기증별 거부반응을 억제 시킬 수 있는 다양한 돼지가 개발되었다. 매우 효과적으로 유전자 조작이 가능한 CRISPR-Cas 9 유전자 편집 기술의 개발 및 도입으로 더 다양한 이종이식에 활용할 돼지가 개발될 것으로 기대하였으나, 개발된 돼지의 보고 건수는 매우 적었다. 이는 돼지의 장기를 원숭이에 이식하는 이종이식 연구가 활발히 진행되어 장기 및 조직별로 변형이 필요한 유전자가 결정되는 과정 중에 있기 때문이라고 판단된다. 실제로 2019년에 이종이식을 선도하는 연구자들은 이종이식학회지에 심장과 신장을 이종이식에 활용하기 위한 유전자의 조합을 제안한 바 있다18).
중국에서 개발된 유전자변형 가축의 현황을 살펴보면, 동물생명공학 기술은 전통적인 가축의 개량 방법인 선발로는 해결할 수 없는 방향으로 개량을 할 수 있다는 것을 보여준다. 특히 최근 전 세계적으로 축산업에 대규모로 피해를 주고 있는 구제역과 조류인플루엔자 등의 바이러스에 감염되지 않는 가축의 개발도 가능할 수 있을 것이다. 또한 돼지의 특성을 가진 소나 양의 개발도 가능할 것이다.
최근 동물생명공학 기술을 활용하는 연구 분야의 화두는 고도로 발달하고 있는CRISPR- Cas 9 등 유전자 편집 기술로 개발된 가축의 LMO 여부 규정이다. 특히 2017년 유럽식품안전위원회에서 1세대 Zinc Finger Nuclease(ZFN) 유전자 편집 기술로 개발된 식물이 안전한지에 대한 과학적 의견서에서 유전자 도입 형태에 따라 Site-directed nuclease-1, -2, -3(SDN-1, -2, -3) 구분하였는데, SDN-1의 경우 외래유전자가 남아있지 않아 국가에 따라 LMO로 볼 것인지 논의가 진행 중이다. SDN-1으로 규정할 수 있는 가축은 미국에서 개발된 aminopeptidase N 기능제거 돼지, 중국에서 개발한 beta- lactoglobulin 유산양 등이 있다. 이러한 논의가 연구자들이 더 다양한 목적의 유전자 변형 가축의 개발을 촉진할지 아니면 관련 연구를 위축시킬지 아직 속단하기 어렵다. 그렇지만, 중국은 연구를 위한 목적으로도 그리고 가축의 경제 형질을 추가 또는 개선할 목적으로 지속적으로 유전자변형 가축 개발을 시도할 것이라 예측된다.
[표 3-35] 중국의 유전자 변형 동물 개발 현황
|
유전자명 |
개발목적 |
동물 |
유전자 형태 |
발표년도 |
|
lysine-rech cDNA |
우유성분보강 |
소 |
무작위, 과발현 |
2019 |
|
anti-CD20 antibody |
자가면역질환 치료제로서 항체 생산( Rituxan의 바이오시밀러) |
소 |
무작위, 과발현 |
2018 |
|
lactase 발현 |
우유성분조정-lactose 감소 |
소 |
KI, TALEN |
2018 |
|
beta-glucanase (박테리아 유래 유전자) |
장소화 능력 향상 |
돼지 |
무작위, 과발현 |
2019 |
|
beta-xylanase (박테리아 유래 유전자) |
소화능력 향상 |
돼지 |
무작위, 과발현 |
2019 |
|
aminopeptidase N |
Transmisssiblegastroenteritis virus(TEGV) 및 porcine diarrhea virus(PEDV) 감염 억제-설사병 억제 |
돼지 |
KO, TALEN |
2019 |
|
leptin |
전신성홍반성 루푸스 (systemic lupus erythematosus) 질환 모델 |
돼지 |
무작위, 과발현 |
2018 |
|
Igf2 유전자 3번 인트론에 존재하는 zinc finger BED-type containing 6 domain결합부위의 SNP |
Igf2유전자의 기능을 억제시키는 단백질 결합 염기서열 제거하여육량증가 |
중국 돼지 |
KO, Crispr-Cas9 |
2019 |
|
antiviral small hairpin RNAs |
classicalswine fever virus(CSFV) 감염억제 |
돼지 |
KI, Crispr-Cas9 |
2018 |
|
beta-glucanase/ beta-xylanse/phytase (박테리아 유래 유전자) |
소화능력 향상, 환경 오염 억제(분과 뇨로 질소 및 인 배출 감소) |
돼지 |
무작위, 과발현, piggyBac |
2018 |
|
Fibroblast growth factor 2-IIIb |
폐발달 기전 연구 및 폐 손상 후 사람 폐 대체 장기 개발 |
돼지 |
무작위, 과발현 |
2019 |
|
fat-1(선충유래 유전자) |
육질개선, 질병저항성 |
돼지 |
KI, Crispr-Cas9 |
2018 |
|
Booroola fecundity gene |
면양의번식 효율 향상(다산성으로 개량) |
중국 양 |
pointmutation, Crispr-Cas9 |
2018 |
|
4-1BB |
백신반응 향상 |
돼지 |
KI, Crispr-Cas9 |
2017 |
|
human plasminogen activator(hPA) |
혈전용해제로서 단백질 의약품 |
유산양 |
무작위, 과발현 |
2018 |
|
Cooper/zinc superoxide dismutase(CuZn-SOD) & extracellularsuperoxide dismutase(EC-SOD) |
단백질 의약품,우유성분 보강, 화장품 재료로서 항산화제 생산 |
유산양 |
무작위, 과발현 |
2018 |
|
FMDV 유전자의 Capsid encoding VP1의 shRNA |
FMDV저항성 |
면양 |
무작위, 과발현, Sleepig Beauty transposon |
2017 |
|
FGF5(hair growth를 멈추게하는 인자를 억제하는 단백질) |
Wool성장 증가 |
중국 양 |
Lentivirus,미세주입 |
2017 |
|
toll-like receptor 4(TLR4) |
pathogen에 의한 염증반응 억제 |
양 |
무작위, 과발현 |
2017 |
|
사람 cholesteryl ester transfer protein (CETP) |
동맥경화모델 |
돼지 |
무작위, 과발현 |
2017 |
|
Dickkopt-related protein 1(DKK1) |
털없는 모델-피부연구용 |
돼지 |
무작위, 과발현 |
2017 |
|
Myostatin(MSTN) |
근육량증가 |
중국고유 돼지 |
KO, Crispr-Cas9 |
2017 |
|
microphthalmia-associated transcription factor(MITF) |
Waardenburgsyndrome type 2A(바르덴증후군) 유전병 모델 |
돼지 |
Lysin을 serin으로 변경(L247S) |
2017 |
|
Folicle-stimulating hormone a/b(FSHa/b) |
FHS의자성 번식 기능 분석 |
돼지 |
무작위, 과발현 |
2017 |
|
human follistatin |
근육량증가 |
돼지 |
무작위, 과발현 |
2017 |
|
Myostatin(MSTN) |
근육량증가 |
양 |
KO, Crispr-Cas9 |
2017 |
|
human alpha lactalbumin |
우유성분개선 |
유산양 |
KI, 유전자 적중 |
2017 |
|
thymosin beta-4 |
양모생산 증대 |
면양 |
무작위, 과발현 |
2017 |
|
human lactoferrin |
단백질 의약품 |
소 |
무작위, 과발현 |
2017 |
|
Bile salt-stimulated lipase |
단백질 의약품 |
소 |
무작위, 과발현 |
2017 |
|
beta-lactoglobulin |
우유성분 개선(allergen 제거) |
유산양 |
KO, Crispr-Cas9 |
2017 |
[표 3-36] 국내 유전자 변형 동물 개발 현황
|
유전자명 |
개발목적 |
동물 |
유전자 형태 |
발표년도 |
참여기관 |
|
TNFRI-Fc/HO-1 |
이종이식 거부반응 억제 |
돼지 |
단순 과발현 |
2019 |
서울대 |
|
Insulin |
1형 당뇨병 질환 모델 |
돼지 |
KO, Crispr-Cas9 |
2018 |
엠젠플러스㈜ |
|
GGTA/DAF/CD39/TFPI/C1-INH/TNFAIP3 |
이종이식 거부반응 억제 |
돼지 |
KI, TALEN |
2017 |
축산원, 생공원 |
|
GGTA/CD39 |
이종이식 거부반응 억제 |
돼지 |
KI, ZFN |
2017 |
옴티팜㈜, 생공원, 충남대 |
|
hAPP/hTau/hPS1 |
알츠하이머 모델 |
돼지 |
단순 과발현 |
2017 |
제주대, 축산원, 건국대, 차병원 |
|
CD73 |
이종이식 거부반응 억제 |
돼지 |
단순 과발현 |
2017 |
축산원 |
|
CMAH |
이종이식 거부반응 억제 |
돼지 |
KI, TALEN |
2017 |
서울대 |
[표 3-37] 해외(중국제외) 유전자 변형 동물 개발 현황
|
유전자명 |
개발목적 |
동물 |
유전자 형태 |
개발 국가 |
발표년도 |
|
aminopeptidaseN |
Transmisssiblegastroenteritis virus(TEGV) 및 porcine diarrhea virus(PEDV) 감염 억제-설사병 억제 |
돼지 |
KO, Crispr-Cas9 |
미국 |
2019 |
|
alpha-GalT(GGTA) |
alpha-Gal 항원 제거 |
돼지 |
KO, ZFN |
폴란드 |
2019 |
|
alkaline phosphatase(ALPL) single point mutation |
저인상증 모델 (hypophosphatasia) |
양 |
KO, Crispr-Cas9 |
미국 |
2018 |
|
TP53 |
암 모델 |
돼지 |
KO, Crispr-Cas9 |
일본 |
2018 |
|
Sex-determining region(SRY) |
남성 여성 반전 증후군 질환 모델 |
돼지 |
KO, Crispr-Cas9 |
독일 |
2019 |
|
MYC, KRAS_G12D, SV40LT |
췌장 암, 소장 모델 |
돼지 |
무작위, 과발현 |
덴마크 |
2017 |
|
human intergrin alpha s2/b1 |
Pasoriasiform skin disease(건선 피부염) |
돼지 |
무작위, 과발현 |
덴마크 |
2017 |
|
gonadotropin-releasing hormone2 receptor(GNRHR2) |
GNRH2 & GNRHR2 기능 분석 |
돼지 |
KD, shRNA |
미국 |
2017 |
|
INS-GFP |
췌장 발생 모델 |
돼지 |
무작위, 과발현 |
독일 |
2017 |
|
Histone 2B_eGFP fusion |
Chromosome dynamic 연구 |
돼지 |
KO, Crispr-Cas9 |
미국 |
2017 |
|
human lactoferrin & lysozyme |
우유 성분 개선 |
젖소 |
무작위, 과발현 |
아르헨티나 |
2017 |
3. 식품
가. 식품과 식품산업
식품위생법에 따르면 ‘식품이라 함은 모든 음식물을 말한다. 다만, 의약으로서 섭취하는 것은 제외한다’라고 정의하고 있다. 식품표준산업분류에서는 식품산업을 식료품 제조업과 음료 제조업으로 나누어 분류하는데 식음료산업이란 식품과 첨가물의 제조, 가공업과 냉동 보관업을 포함한다. 본 원고는 이 기준에 따라 작성하였고 식품 중 발효식품과 건강기능식품에 한하여 작성하였다.
나. 해외 현황
(1) 공공 부문 연구 동향
(가) 미국
미국 농무부(USDA)의 2018년 총예산은 1,370억 달러이며, 이 중 법에 따라 의무적으로 지출해야 하는 예산이 1,190억 달러이고 자유재량에 따라 지출할 수 있는 예산은 250억 달러이다. 총예산은 2019년 추정치 1,560억 달러이며 2020년 결정된 예산은 1,190억 달러로 감소될 예정이다. 이는 법적 지출의무가 있는 예산이 920억 달러로 감소됐기 때문이다. 미국 농무부(USDA) 예산 중 식품과 관련이 있는 식품농업연구소(NIFA: National Institute of Agriculture and Food)의 예산은 15억 6,000만 달러이다. NIFA는 농식품 관련 현안의 전 분야를 다루고 있다. 2012년 핵심 연구 분야로는 주로 공모형 연구개발 프로그램인 농식품연구 이니셔티브(AFRI: Agriculture and Food Research Initiative)를 통해 바이오에너지, 기후변화, 식량안보, 식품 안전, 영양 및 비만 예방 연구 등에 중점 투자하고 있다. 그리고 지역주민 지도 및 교육 분야에서는 지속가능한 생산 체계의 개발과 보급, 식품・영양 교육 프로그램 진행을 위한 지도 등에 투자하고 있으며, 농업인재양성을 위한 역량강화 지원 프로그램(교육 및 지도)에도 투자를 확대할 전망이다.
NIFA 예산 중 식품과 직접적인 관련성이 있는 AFRI 분야의 예산은 2018년 4억 달러이며 2019년과 2020년에는 모두 5억 달러로 증가될 계획이다. AFRI의 Farm Bill법(농업지원에 관한 미국 법률)에 따른 6대 우선 분야는 1) 식물 건강과 생산 및 식물 생산물, 2) 동물 건강과 생산 및 동물 생산물, 3) 식품 안전, 영양 및 건강, 4) 바이오에너지, 천연자원 및 환경, 5) 농업 시스템과 기술, 6) 농업 경제 및 지역 사회이다. 여기서 알 수 있듯이 미국 정부는 식품과 연관해서는 식품 안전을 최우선하며 다음이 영양과 건강이다. 여기서 말하는 건강은 식품 안전과 영양 공급에 의한 건강만을 의미하며, 질병과 관련된 건강은 FDA 소관이다.
미국은 농업과 식품을 분리하지 않고 꼭 함께 취급하며 식품의 개발은 거의 지원하지 않는데, 이는 전적으로 업계의 몫으로 보인다. 미국은 연방정부의 재정적자 증가에 따라 연구개발 투자의 우선순위를 종합 조정하는 기능이 강화되는 추세이다. 부처 간 중복투자의 방지에도 정책적 비중을 높이고 있고 동시에 범부처간 협력에 대한 요구도 강화하고 있다. 이러한 변화는 농식품 R&D 분야에서도 나타나고 있다.
최근 2∼3년간 미국의 농식품 R&D 행정체계 변화는 투자효율성 제고를 위한 종합조정의 강화와 프로그램 기획의 강화를 특징으로 한다. 농무부의 연구・교육 및 경제부문(REE) 차관으로 하여금 농식품 R&D를 총괄하게 하였다. 또한 유사기능을 가진 조직은 통합하는 한편, 연구기능과 연구관리 기능은 엄격히 분리하되, 대내외 평가는 강화시켜 나가고 있다. 국가의 주요 이슈에 대해서도 미션 부여형 지정연구가 아닌 공개경쟁을 통해 극복해 나가려는 의지가 강하다. USDA 예산이 2019년까지 증가하다가 2020년부터 감소되는 이유가 여기에 있다.
(나) 네덜란드
세계 각국의 농업・바이오 집중육성 사례 중 가장 성공적인 사례를 가진 국가는 네덜란드이다. 네덜란드 경제부(The Ministry of Economic Affairs)는 2011년 이후 선도산업 정책(Top Sector Policy)을 추진하고 있다. 9개 선도산업 중 농식품이 제일 높은 위치를 차지하고 있으며 2016년 부가가치는 422억 유로였으며, 고용은 64만 명으로 9개 분야 중 고용유발 효과가 가장 높았다. 기초과학연구원(NWO)을 통해 Top Sector R&D 프로젝트 자금을 지원하며 2016년∼2017년 중 5억 5,000만 유로가 투자되었다. 푸드밸리(Food Valley)는 네덜란드 식품산업의 심장이라 할 수 있으며 8,000여 명의 과학자, 1만 5,000명의 식품 종사자와 70개의 식품 회사, 1,440개의 식품 관련 회사, 20개 연구기관 및 바게닝겐(Wageningen) 대학 및 연구소로 구성된 세계적인 수준의 농식품 클러스터로 성장하였다.
농식품 분야에 국한된 정책은 아니지만 네덜란드의 민관학 협력은 민관합동 연구개발 컨소시엄을 토대로 이루어진다. 기업이 관련 주제를 제안하여 R&D가 이루어지거나 정부가 새로운 R&D 프로젝트를 제안할 수 있다. 우리나라에서는 IPET에서 시행하는 고부가가치식품개발사업에서 네덜란드의 정부 제안 프로젝트와 유사한 지정공모 과제가 운영되지만 아직도 자유공모 즉, 기업이 제안하는 주제를 사업 또는 과제로 추진하는 경향이 강하다. 하지만 앞으로는 농식품부 차원에서 국내 농식품 발전 또는 수출전략 품목 육성을 위해 하향식 접근(top-down) 방식의 과제를 많이 발굴할 필요가 있어 보인다.
우리나라와 네덜란드의 여건은 매우 비슷한 편이다. 강대국에 둘러싸인 국가이며, 내수 시장만으로는 자급자족이 어렵기 때문에 수출 의존도가 매우 높다. 그리고 우리나라의 면적과 인구는 네덜란드의 3배 정도지만 양구의 경작면적은 180만ha 안팎으로 비슷하다. 이러한 공통점 때문에 네덜란드의 지역 클러스터는 한국에 조성된 지역 클러스터의 롤 모델이 되기도 하였다.
(다) 독일
독일의 경우 프라운호퍼 연구협회에 속한 공정공학・포장 연구소에서 식품포장재 안전성 평가, 분석 및 식품공정 개발, 클레임 해결 등의 업무를 하고 있고 이중 농식품 분야와 가장 관련성이 높은 연합은 Food Chain Management Alliances(식품제조체인관리연합)인데 1차 생산부터 소비자에게 이르기까지 식품생산 최적화와 품질보존이 연구 주제이다. 연구프로젝트는 식물을 이용한 우유 대용품 및 소시지 개발 같은 동물식품 대체 가공
기술, 강화식품, 에너지 절감형 가공기술 등 지속가능한 식품 생산이 수행되고 있다. 공정공학・포장연구소(Fraunhofer Institute for Process Engineering and Packaging)는 2010년에 강릉시와 협약하여 강릉센터를 개소한 바 있다.
라이프니쯔 연구협회(WGL: Willhelm Leibniz-Gesellschaft)는 1997년 설립되어 수요 지향적이고 학제적 성향의 연구를 주로 수행하고 있다. 2016년 기준 동 연구협회의 예산은 18억 3,000만 유로 가량이다. 협회에 소속된 인력은 2016년 말 기준 1만 8,668명이다. 이 연구협회의 협력체계 중 농식품 분야와 가장 연관이 깊은 협력체계는 Halle 과학 캠퍼스, Rostock 과학 캠퍼스, 식품영양 연구연합(LRAFN: Libniz Research Alliances; Food& Nutrition) 총 3개이다. LRAFN은 14개 라이프니쯔 연구협회 소속 연구소가 참여하고 있으며, 30여 개 대학과 네트워크를 구축하고 있다. ‘지속가능한 식품 생산’과 ‘건강한 영양’을 주제로 여러 분야의 연구자들이 모여 학제 간 연구를 진행하고 있으며, 연구 주제는 식량안보, 지속가능한 농업, 농업 시장, 식품 품질・안전, 영양과 건강 등이다.
(라) 일본
일본 농림수산성(農林水産省)에서는 식품제조업을 포함한 문제, 향후 비전, 대응 방향에 대한 지식을 공유하고 전략적 대응 검토를 위해 2017년 5월부터 2018년 3월까지 식품산업전략회의를 진행하여 ‘식품산업전략-식품산업의 2020년대 비전’을 공표하였다. 국가농업식품연구기구(NARO: National Agriculture and Food Research Organization)는 일본 농식품 분야의 통합 연구기관으로 농식품 산업 및 농업지역에 대한 종합적인 연구개발을 수행하고 있다. 총 16개의 산하 연구기관을 두고 있는데 가장 대표적인 산하 연구기관은 중앙농업종합연구센터이다. NARO에는 작물연구소, 과수연구소, 화훼연구소, 채소・차 연구소, 축산・초지연구소, 동물위생연구소, 농촌공학연구소, 식품총합연구소 등 8개의 부문별 연구기관이 있다. 일본 정부 역시 식품의 개발보다는 안전, 영양, 건강을 중시하고 있다.
식품 제조 외에 일본농림수산성은 ‘식품 낭비 감소(食品ロスの削減, 2018. 2)’를 추진하고 있다. ‘식품 낭비’란 먹을 수 있음에도 불구하고 버려지는 식품을 말하며, 식품폐기물
발생 자체를 줄이는 발생억제가 중요하다. 2015년 식품 폐기물 발생량 추정치에 따르면, 일본 전체 식품 폐기량은 2,842만 톤이며 그 중에서 식품 낭비량은 646만 톤(사업관련 분야에서 식품 낭비는 약 357만 톤, 일반 가정에서 식품 낭비는 약 289만 톤)이었다. 이는 국제연합 유엔세계식량계획(WFP: United Nations Food Programme)의 세계 전체 식량 원조량(약 320만 톤)을 넘는 양이 낭비되고 있다고 한다. 일본 정부는 식품 낭비 발생 단계별로 식품 낭비 감소를 지원하고 소비자 개개인의 의식과 행동 개혁을 위해서 관민 협동으로 식품 낭비 감소 국민운동(NO-FOODLOSS PROJECT)을 추진하고 있다.
(2) 산업 현황
세계 식품시장의 성장세가 지속되는 가운데 2020년에는 7조 달러(약 7,813조 원)를 넘을 것이란 전망이 나왔다. 특히 ‘편의성’과 ‘건강’을 강조한 식품이 성장을 주도하고, 음료제품의 성장세가 가파를 것으로 예상했다. 한국농촌경제연구원(이하 농경연)은 최근 이 같은 내용을 포함한 세계 식품시장의 성장 추이분석 결과를 발표했다(농경연 보도자료, 2018). 농경연에 따르며 세계 식품시장은 최근 5년간 연 3.2% 성장했으며 지난해 세계 식품시장 규모는 전년 대비 3.6% 증가한 6조 3,520억 달러인 것으로 나타났다. 또 이 같은 성장세는 꾸준히 확대되어 세계 식품시장 규모는 향후 3년간 12.6%(7,980억 달러) 증가해 7조 달러를 넘어설 것으로 예측했다. 식품시장 규모(6조 1,000억 달러)는 2015년을 기준으로 타 주요 산업과 비교했을 때 자동차 시장(1.3조 달러)에 비해 약 4.9배, IT시장(1조 6,000억 달러) 대비 약 3.8배, 철강 시장(8,000억 달러)에 비해 약 7.3배 큰 것으로 나타났다.
식품시장은 크게 식품, 음료, 담배 부문으로 구성되어 있다. 식품 분류별 세계 시장규모는 식료품 3조 400억 달러, 음료 2조 6,900억 달러, 담배 6,200억 달러 수준이다. 음료의 비중이 증가하는 반면 담배는 감소하는 추세다. 지역별로 살펴보면 지난 5년간 식품시장 증가 규모는 아시아・태평양 4,290억 달러(26.7%), 북미 2,480억 달러(24.9%) 순으로 높게 나타났고, 지난해 기준 2020년 식품시장 증가 규모가 클 것으로 예상되는 지역은 아시아-태평양, 유럽, 북미, 중남미, 중동・아프리카 순으로 전망됐다. 아시아-태평양의 식품
시장이 빠르게 성장하면서 2015년 기준 이 지역의 식품 판매액은 2조 42억 달러를 기록, 전 세계의 33.2% 비중을 차지하여 기존의 최대 식품시장이었던 유럽을 능가하였다. 이러한 추세는 향후에도 지속될 것으로 전망되며, 2016년에는 지역별 시장간 격차가 더욱 커질 것으로 예상되고 있다.
2015년 기준 지역별 식품시장 점유율은 아시아-태평양에 이어 유럽 32.3%, 북미 21.3%, 중남미 10.3%, 중동 및 아프리카 2.8%를 차지하였다. 유럽과 중남미 지역은 성장률이 둔화되는 한편 인구와 경제력이 상승하고 있는 아시아 지역으로 세계 식품시장의 중심이 이동하고 있다. 2015년 기준 전 세계 식품시장의 국가별 규모 순위는 미국, 중국, 일본, 영국, 독일, 브라질, 러시아 순이었다.
국가별 2015년 기준 세계 최대 식품시장은 1조 1,700억 달러를 기록한 미국이며 연평균 성장률(CAGR, 2012∼2015)은 2.1%를 기록하였다. 중국 식품시장 규모는 2015년을 기준으로 1조 86억 달러를 기록해 5.2%의 가파른 연평균 성장률을 기록하였다. 글로벌 리서치 기관 Canadean Intelligence에 의하면 2017년 중국이 미국을 제치고 세계 최대의 식품시장으로 부상했다. 중국 외에 괄목할만한 성장을 달성하고 있는 국가는 연평균 성장률(CAGR, 2012∼2015)을 기준으로 아랍에미리트(6.5%), 사우디아라비아(5.0%), 이스라엘(3.9%), 홍콩(3.7%), 한국(3.6%), 인도(3.1%) 등이었다.
시장 규모가 3,000억 달러 이상이면서 향후 3년간 성장률도 큰 폭으로 증가할 품목으로는 청량음료, 증류주, 맥주 등의 음료류와 제과제빵 및 시리얼류 등으로 나타났다. 또 시장 규모는 각 2,000억 달러 미만으로 작지만 성장률이 높은 식품은 파스타와 면류, 짭짤한 스낵과자인 세이보리 스낵(Savory snack: 달지 않고 짭짤하며 바삭한 맛의 과자로 견과류과자, 감자칩, 전통스낵, 프레첼 등을 포함), 유지류, 해산물, 아이스크림 등으로 나타났다. 세계 식품시장의 성장을 주도하는 품목의 특징은 ‘편의성’과 ‘건강’으로 집약된다. 편의성을 추구하는 품목은 청량음료 등 음료류와 빵・시리얼, 과자류, 건조식품 등이며, 건강을 추구하는 품목은 해산물, 유제품・콩가공품 등이다. 특히 세이보리 제품(Savory Products)은 최근 저염・저칼로리를 지향하는 추세와 맞물려 빠른 성장세를 보이고 있다.
다. 국내 현황
(1) 연구 동향
농림축산식품부 산하 농림식품기술기획평가원(IPET)이 시행한 고부가가치식품기술개발사업의 2014∼2018년 5년 동안 식품 R&D 투자는 796개 과제, 1,733억 7,000만 원에 이른다. 유형별 R&D의 비중을 보면 제품개발에 41.4%, 기술개발에 31.9%, 소재개발에는 26.7%가 투자되었다. 연차별로는 제품개발에 대한 R&D는 점진적인 상향추세를 보여주고 있고, 기술개발에 대한 R&D는 점진적인 하향 추세를 보여준 반면 소재개발에 대한 R&D는 비교적 안정적이다.
동 사업의 분야별 R&D 투자동향을 보면, 가공 분야에 62.8%, 공정 분야에 7.2%, 발효 분야에 6.9%가 투자되었다. 또한 위생 분야에 6.7%, 포장 분야에 5.5%, 기계 분야에 4.1%, 분석분야에 3.9%, 유통 분야에 2.7%가 각각 투자되었다. 가장 큰 비중을 차지하는 가공 분야 R&D는 연차별로 하향추세를 보이고 있고, 공정 분야는 최근 증가 추세를 보였다.
건강기능식품, 기능성식품, 일반식품으로 세 가지로 구분하여 살펴본 R&D는 일반식품 분야에 53.9%, 기능성식품 분야에 29.6%가 투자된 반면 건강기능식품 분야에는 16.7%에 불과하였다. 그러나 지난 5년간 신장률을 보면 일반식품과 기능성식품의 투자는 감소 추세를 보여주고 있고, 건강기능식품 분야에 대한 R&D 투자는 증가추세를 보였다.
IPET(농림식품기술기획평가원)은 국내 식품 분야 연구를 위한 가장 규모가 큰 정부 사업을 하는 기관이다. IPET의 식품 연구 지원은 고부가가치식품기술개발사업으로 2018년 기능성 전통식품(66억 4,510만 원), 식품 품질관리(104억 원), 식품 핵심소재(67억 6,500만 원), 식품 기자재 신기술(81억 6,700만 원) 등 총 318억 원을 지원하였으나 동 사업은 성과가 부진하다는 사유로 2018년에 일몰사업으로 사라져 버렸다.
2019년에는 고부가가치식품기술개발사업(식품 소기업 현장 애로 해결기술(10억 원), 미래혁신형신식품기술개발사업 지정공모과제(16억 9,000만 원), 자유응모과제(37억 8,000만 원), 농식품연구성과후속지원 국가연구개발사업 후속지원과제(12억 원), 후속사업 벤처・창업바우처지원과제(17억 원)) 등 총 93억 7,000만 원으로 명맥을 유지하고 있으나, 사업 규모가 대폭 축소되어 2019년부터 공공부문 식품 관련 연구는 위축이 불가피한 상황이다.
(2) 산업 현황
식품산업은 필수재 성격상 수요기반 자체는 매우 안정적이나, 인구증가율 및 경제성장율 둔화에 따라 최근 5년간 식료품과 음료의 내수 성장률이 각각 1.3%, 2.3%를 기록하는 등 저성장 국면이 이어지고 있다.
식료품의 경우, 2016년에는 1인 가구 급증 및 업계의 경쟁적인 신제품 출시 등에 따른 편의식 시장 확대 추세, MERS(메르스) 기저효과 확대 등으로 성장률은 최근 5년 평균(1.3%)을 소폭 상회하는 1.6%를 나타냈다. 하지만 2017년 들어서는 MERS 기저효과 등 일시적인 요인이 해소되면서 예전과 비슷한 수준의 성장률을 유지하고 있다. 2016년 식품 생산액은 129조 1,500억 원으로 전년대비 1.43% 증가하였고, 수출액은 7조 6,700억 원으로 전년대비 10.08%, 수입액은 27조 2,000억 원으로 전년대비 3.18% 증가하였다.
발효식품 중 특히 장류는 장기간의 숙성, 발효과정을 필요로 하는 한국의 대표 발효식품이다. 전체 장류는 2016년 1조 562억 원으로 2015년 출하액 1조 531억 원 대비 0.3% 증가하는 양상을 보여 시장은 현상을 유지하고 있다. 같은 해 고추장의 출하액은 2,508억 원, 된장은 1,549억 원, 간장은 3,366억 원을 기록하고 있다. 관세청에 따르면 2017년 전통장류 전체 수출량은 3만 2,774톤이며, 수출금액은 5,317만 달러에 달한다. 2014년에 비하면 수출량은 약 20%, 수출금액은 약 6% 증가했다.
앞으로 국내 장류 시장은 소용량 제품의 약진, 기존 카테고리 내 업체간 M/S 경쟁 완화, 신규 카테고리 확대가 예상된다. 저용량 제품 구색이 늘어나고 가정간편식 트렌드에 따라 쉽게 맛있는 요리를 완성할 수 있는 소스를 찾는 소비자들이 늘면서 소비자의 다양한 기호와 니즈에 부합하는 용도형 제품들이 늘어날 것으로 보인다. 한국농촌경제연구원 소비자 조사 결과에 따르면 소비자가 된장 구입 시 국산 원료 사용 여부를 확인하는 비중이 28.7%에 달한다고 한다. 건강과 웰빙을 지향하는 소비자의 니즈가 지속될 전망으로 국산 원료로 만든 제품을 선호하는 경향이 늘어날 것으로 보인다.
탁주 소매시장 규모는 2014년 3,013억 원에서 2016년 3,147억 원으로 4.5%의 성장세를 보이고 있다. 이는 최근 다양한 마케팅 활동, 신제품 출시 등을 통한 이미지 쇄신으로 20∼30대로 막걸리 소비층이 확대되면서 시장 규모가 확대된 것으로 보인다.
배추김치 생산 및 출하 규모는 연도별로 등락을 반복하나 대체로 증가하는 추세이다. 2012년 대비 2017년 생산량은 32만 8,000톤에서 33만 4,000톤으로 1.8% 증가했으며, 같은 기간 출하량은 28만 6,000톤에서 30만 6,000톤으로 7.0% 증가하였다. 김치 수출 규모를 살펴보면 2007년에서 2017년까지 10년간 수출량은 2만 6,000톤에서 2만 3,000톤으로 11.5% 감소했으며, 같은 기간 수출액은 7,531만 달러에서 7,890만 달러로 4.8% 증가하였다. 이는 일본 엔화가 대폭 절상되어 일본으로의 수출액이 증가한데 기인한 것으로 보이며, 일본 이외의 국가에 대한 수출 규모도 증가했기 때문이다. 김치 수입 규모를 살펴보면, 2007년에서 2016년까지 10년간 수입량은 21만 9,000톤에서 25만 3,000톤으로 15.5% 증가했으며, 같은 기간 수입액은 1억 1,017만 달러에서 1억 2,149만 달러로 10.3% 증가하였다. 국내에 수입되는 김치는 99% 이상이 중국에서 수입된 것이며 대부분 국내 외식 및 급식업소에서 사용되고 있다.
해외 시장을 살펴보면 2015년 기준 일본의 김치 시장 규모는 5억 5,942만 달러이며 2011년 5억 8,183만 달러 대비 3.9% 감소하였다. 한국산 김치의 경우 2011년 5천 976만 달러에서 2015년 3,984만 달러로 33.3% 감소하며 시장 규모가 지속적으로 감소하고 있다. 일본 소비자들의 저염식 선호 영향으로 일본 김치 시장 규모가 점차 감소하는 것으로 보이며, 일본 종합식품업체와 유통업체 등에서 김치를 직접 제조하고 있어 한국산 김치의 비중 및 규모가 감소한 것으로 판단된다.
2011년 11월 풀무원 USA에 따르면, 미국의 경우 일반 소비자에게 판매되는 상품김치 시장 규모는 2,750만 달러로 추정되고 있으며 이 중 미국으로 수출된 한국산 김치는 약 550만 달러(20%)로 보고 있다. 중국의 김치 시장규모는 2015년 기준 74억 6,176만 달러이며, 이는 2011년 49억 9,232만 달러보다 49.5% 증가한 수치이다. 중국은 연간 약 30만 톤의 김치를 생산하는데 그 중 254만 톤은 수출용이며, 6만 톤은 내수용으로 소비하고 있다.
식품공전(Korean Food Standards Codex)상에는 식초를 ‘곡류, 과실류, 주류 등을 주원료로 하여 발효시켜 제조하거나 이에 곡물 당화액, 과실착즙액 등을 혼합, 숙성하여 만든 발효식초와, 빙초산 또는 초산을 먹는 물로 희석하여 만든 희석 초산을 말한다.’라고 정의하고 있다. 전체 소매시장 규모를 살펴보면 2016년 기준 조미용 및 음용이 포함된 과실식초 규모는 840억 원으로 2014년 844억 원 대비 0.5% 감소하며, 전체 과실식초 시장에서 음용이 차지하는 비중은 56.1%, 조미용이 차지하는 비중은 43.9%로 나타났다. 조미용은 음용에 비해 상대적으로 과실을 사용하여 만든 제품이 적고 판매 단가가 낮아 전체 시장에서의 차지하는 비중이 낮은 것으로 분석되었다.
2016년 수출액 기준으로 과실식초가 포함된 양조식초 주요 수출 국가는 일본(64.7%), 중국(12.9%), 미국(7.2%) 등의 순으로 나타났으며, 일본이 수출의 절반 이상을 차지하고 있다. 일본으로의 수출규모는 2014년까지 다소 등락을 보였으나 2015년 이후 큰 폭으로 증가한 양상이다. 이는 CJ제일제당에서 2015년에 일본에 ‘쁘띠첼 미초’를 출시한 것이 영향을 미친 것으로 분석된다.
2016년 수입액 기준으로 과실식초가 포함된 양조식초의 주요 수입 국가는 이탈리아(70.5%)가 주요 수입국으로 나타났으며, 그 다음으로 미국(19.8%) 등의 순이다. 이탈리아로부터 수입되는 양조식초는 2014년까지 증가세를 나타내다가 이후 감소세를 나타내고 있다. 이탈리아에서 수입되는 대표적 제품으로는 ‘올리타리아 발사믹식초’, ‘폰타나 모데나 발사믹 식초’가 있다. 최근 5년간 미국에서의 수입규모는 21만 9,000달러에서 69만 달러로 3배 이상 증가했다. 같은 기간 수입량도 354톤에서 947톤으로 2.5배 이상 증가했다. 이탈리아 제품에 비해 제품 단가는 낮지만, 2015년 이후 수입량은 이탈리아를 넘어선 상황이다. 주로 미국에서 수입해 오는 제품으로는 하인즈(HEINZ)의 ‘HEINZ APPLE CIDER VINEGAR’가 있다.
우리나라 건강기능식품 산업은 IPET의 기술개발 지원비 축소에 더하여 CJ제일제당이 건강식품사업부를 접으면서 향후 관련 산업의 위축이 불가피할 전망이다. 현재 건강기능식품 업체 현황을 보면 2016년까지 총 9만 5,792개 업체가 건강기능식품 제조 및 판매업 허가 및 신고를 하였다. 우수건강식품제조기준(GMP)은 2017년 말까지 총 225개 업체가 인증받았다. 2017년도 건강기능식품 생산실적 현황은 총 생산액 2조 2,374억 원으로 건강기능식품 제도가 도입된 2004년 2,506억 원보다 약 8배 증가하며 꾸준한 성장세를 보이고 있다. 수출액은 1,077억 원으로 2016년 1,084억 원보다 2.2% 감소하였다.
또한 수입액은 5,750억 원으로 2016년 5,880억 원보다 2.3% 감소하였다. 2017년 품목별 총 생산액 현황은 역시 홍삼이 1위(1조 358억 원)이며, 2위 개별인정형(2,450억 원), 3위 프로바이오틱스(2,259억 원), 4위 비타민 및 무기질(2,174억 원), 5위 밀크씨슬 추출물(1,042억 원) 순이었다. 생산액 상위 10개 품목 중 2016년 대비 생산이 가장 급증한 제품으로는 프로바이오틱스가 1,903억 원에서 2,259억 원으로 22.6% 증가하였으며, 반면 가장 감소한 제품으로는 인삼(가공제품 아님)이 311억 원에서 204억 원으로 34.4% 감소하였다.
세계 기능성식품 시장에 대해 Nutrition Business Journal(NBJ’s Global Supplements Business Report 2017) 자료에 따르면 국내 건강기능식품 개념과 유사한 보충제(Supplements) 시장 규모는 전년 대비(1,212억 달러) 6.3% 성장한 1,289억 달러이다. 이는 2009년을 제외한 지난 10년간(2007∼2017) 5% 이상의 성장률을 보이며 지속적으로 성장해왔고, 이러한 추세가 이어져 2020년에는 전년 대비(1,457억 달러) 6.4% 성장한 1,551억 달러 시장 규모가 전망된다. 이러한 세계 건강기능식품 시장 규모에 비하여 국내 건강기능식품의 세계 시장 점유율은 2014년 기준으로 1.5%로 매우 미흡한 실정이다. 국내 건강기능식품 시장은 농식품부가 추진하고 있는 기능성식품산업(건강기능식품과는 다른 개념임) 육성정책과 지원으로 지속적으로 성장할 것으로 전망되지만 ‘백수오 사건’ 이후 식품의약품안전처 2016년 및 2017년도 신규 개별인정 원료 인정 건수가 매년 2건으로 대폭 감소하여 고시형 제품과 개별인정 제품 성장에 비해 신규 개별인정 제품 시장은 위축이 불가피해 보인다.
건강한 생활을 영위하기 위한 양질의 보건의료서비스, 맞춤식 건강유지관리 프로그램, 안전한 식품에 대한 니즈가 주를 이루고 있으며, 앞으로 이러한 니즈에 맞추어 식품가공 기술도 발전할 것으로 전망된다. 특히, 맞춤형 식품가공기술은 향후 산업계에 확대 적용될 것이며 빠르게 파급・정착될 것으로 보여 기대되는 유망기술이다. 즉, 불특정 다수를 위한 가공식품의 개발보다는 개인의 체질과 기호도에 맞는 식품, 특정한 질병의 예방 등을 위한 맞춤형 식품이 등장, 발전해 나갈 것이다. 기능성 식품 소재의 탐색을 통한 생물소재의 개발 및 기술 확보를 통해 보다 건강한 삶을 영위해 나갈 수 있도록 도움을 줄 수 있는 맞춤형 식품의 개발은 국민의 삶의 질 추구, 웰빙 문화, 장수식생활에 기여할 수 있을 것이다. 맞춤형 식품의 예로는 장수식품, 항암식품, 면역증대식품, 성인병 예방식품, 비만방지식품, 미용식품, 알레르기 비유발 식품, 치매・암 예방 식품 등을 들 수 있으며 식품산업의 기술발전과 함께 특정 유효성분만을 추출, 분리, 정제, 농축 및 제형화 하는 등 관련 분야의 기술이 점점 더 확대되어 나갈 것이다.
한편, 조미료산업은 제조업 중 정제 및 발효에 해당되어 여기서 언급하고자 한다. 조미료는 장류, 식초, 식염, L-글루타민 나트륨(MSG), 핵산 및 기타 종합조미료 등이 있으나 국내 업계에서는 흔히 MSG 같은 발효조미료와 감치미, 맛나, 다시다 등의 종합조미료로 국한하여 통칭한다. 국내 조미료 시장은 2011년부터 지속적으로 감소 추세였으나, 최근에는 일정 수준을 유지하고 있다.
발효조미료는 2015년 1,483억 원, 2017년 1,491억 원을 기록하여 비슷한 수준이다. 종합조미료도 2015년 2,468억 원을 기록한 이후 2017년까지 3년 간 비슷한 수준을 유지하고 있다. 다만, 자연조미료는 2015년 362억 원을 기록한 이후 2017년에 334억 원을 기록해 정체기에 접어들었음을 알 수 있다. 2018년도를 기점으로 장기적인 경기 침체, 가계부채 증가, 원재료비 상승 등의 악재로 조미료 시장은 더 이상 발전하기 곤란한 상황이다.
특히, 가정용 조미료 시장은 1∼2인 가구의 증가, 조미료에 대한 부정적인 의식, 양념・소스・드레싱・가정간편식 등 편의형 제품으로 소비자 이탈이 지속되면서 시장 침체기를 벗어나기 어려울 것으로 보인다. 이에 업계는 조미료 범위를 점차 확대하고 다양한 편의형 양념・액상・소스・육수 등 제품을 출시하여 시장 재활성화를 위해 노력할 전망이다.
참고자료
-2018∼2019 한국식품연감, 농림축산신문 편집부, HNCOM
-미래식량자원 연구개발과 고부가 식품산업의 시장 동향, IPAI, 산업정책분석원, RIsearch 센터, 2018
-식품소재 및 반가공산업 현황조사 및 고부가가치 전략, 한국식품연구원, 농림축산식품부・한국농수산식품유통공사, 2019
-수출입무역통계, 관세청
-식품의약품안전처, 2017
-식품산업통계정보(www.atfis.or.kr)
-식품소비행태조사 기초분석보고서, 이계임 등, 농촌경제연구원
-주요국 농업・농촌・식품 동향-EU, 일본, 미국, 김용렬 등 농촌경제연구원
-국내외 식품 시장 정보 및 동향 분석, 서울대학교, 농림축산식품부, 2016
-식품외식경제(http://www.foodbank.co.kr)
-日, 새로운 트렌드 ‘저염’을 주목하라, KOTRA, 2015.2.25.
-품목정보 김치(일본), 농수산식품수출지원정보(KATI)
-농식품 RR&D 해외동향, 우물밖 개구리, 농림식품기굴기획평가원 전략기획실, 2017
-미국 농무부 홈페이지(www.usda.gov)
-네덜란드 푸드밸리 현황, 국가식품클러스터지원센터
-일본 농림수산성 ‘식품산업전략-식품산업 2020년대 비전’, 2018.4.6.
-Canadean Intelligence
제4절
환경・해양수산
1. 환경 생명공학
가. 서론
(1) 개요
환경 생명공학(Environmental Biotechnology)은 환경공학(Environmental Technology)과 생명공학(Biotechnology)의 융합 분야로서 생명공학기술을 이용하여 환경오염을 사전에 예방하는 기술과 오염된 환경을 복원 및 정화하는 기술 또는 학문을 의미한다(생명공학정책연구센터, 2013). 환경 생명공학기술은 미생물학, 식물학, 유전(체)학, 분자생물학, 생화학, 생리학, 생태학, 정보학 등의 다양한 첨단 과학기술을 기초로 하는 융・복합기술이다. 이에 필요한 기술적 요소로는 1) 환경용 생물자원의 확보, 개발 및 개량, 2) 생물분석 기술, 3) 최적화와 조절을 위한 환경계의 분석, 4) 처리공정의 평가 등이 있다(기초기술연구회, 2003).
(2) 환경 생명공학 기술 분류
환경 생명공학 기술은 전 세계적으로 추구하고 있는 지속개발(Sustainable Development)의 핵심기술이다. 최근 생물정화(Bioremediation) 기술 중 식물체를 이용한 생태계 복원 및 보전을 추구하는 식물정화(Phytoremediation) 기술개발이 활발히 진행되고 있다. 환경 생명공학의 기술군(Technology Cluster)은 생물정화(Bioremediation), 식물정화(Phytoremediation), 생물예방(Bioprevention), 생물모니터링(Biomonitoring)의 4가지로 구분된다. 이들 기술군은 12개의 핵심기술(Key technology)로 세분되며, 환경 생물산업을 주도할 핵심제품을 도출하였다(기초기술연구회, 2003).
[표 3-38] 환경 생명공학기술의 분류
|
기술군(Technology cluster) |
핵심기술(Key technology) |
산물(Products) |
|
생물정화 (Bioremediation) |
- 생물학적 폐수처리 기술 - 녹조, 적조 제어 기술 - 토양・지하수 생물정화 기술 - 생물학적 폐기물처리 기술 - 생물학적 배가스처리 기술 |
친환경 생물소재 미생물제재 생물정화 공정 생물정화 시스템 |
|
식물정화 (Phytoremediation) |
- 환경재해내성 유도 기술 - 식물정화 기술 |
생태복원용 식물 |
|
생물예방 (Bioprevention) |
- 청정 생물공정 기술 - 폐수 재활용 기술 |
청정 생물공정 |
|
생물모니터링 (Biomonitoring) |
- 오염물질 모니터링 기술 - 분자생태학적 모니터링 기술 - 환경위해성 평가 및 관리 기술 |
바이오센서 바이오칩 |
(3) 연구의 필요성
급속한 산업화와 인구증가에 따라, 다양한 환경오염 유발물질의 생성 및 이로 인한 지구적 환경문제는 21세기 인류생존을 위협하는 최대 현안문제로 대두되고 있다. 기존의 환경복원 관련 기술의 한계가 나타나고 있으며, 최근 생명공학 분야에서 유전체 정보 등을 포함한 수많은 정보가 축적되고 있기 때문에 이를 이용한 기술의 고급화 및 적용 분야의 확대가 필요하다.
최근에는 환경시료에서 전체 DNA를 추출하고 NGS(Next-Generation Sequencing) 기술을 이용하여 다량의 유전정보를 획득하며, 생물군집의 네트워크 분석 및 AI(Artificial Intelligence, 인공지능)를 이용한 빅데이터 분석 등을 기반으로 주요 미생물 및 생물상호 작용을 규명하는 오믹스(Omics) 기반 환경정화 및 모니터링 기술이 각광받고 있다.
나. 해외 동향
(1) 연구개발 동향
유럽연합(EU)은 환경과 경제를 동시에 고려하는 지속가능한 환경관리체계 구축을 위한 ‘환경관리 및 생태복원 분야에 지노믹스 활용’을 위한 환경바이오기술 연구개발 플랫폼을 마련하였다(OECD, 2013). 이코지노믹스는 유전체학을 생태와 환경과학에 적용하는 것으로 DNA, RNA, 그리고 단백질 수준에서 생물다양성을 정의하며, 기능적으로 다양한 환경에 존재하는 미생물의 신속한 동정과 이들의 상호작용 분석에 활용된다.
오믹스 기술 중에서 메타지노믹스(Metagenomics)는 배양과정 없이 물, 토양 등 환경시료 전체에 포함된 개체군의 유전체 분석을 의미한다. 기존의 배양법은 자연계 미생물 다양성의 약 1% 확보에 그침을 고려할 때, 배양이 어려운 대량의 미생물 자원이 자연계에 존재하며 새로운 의약물질, 산업적 화학물질, 효소 등의 개발 가능성을 의미한다.
환경 생명공학에서 폐수처리 또는 생물정화를 위해 유전적으로 개량된 GMO(Genetically Modified Organisms, 유전자변형생물)를 사용할 수 있으나 아직 대부분 사용되지 않고 있다(OECD, 2013). 실제로 폐수처리 시 GMO의 사용은 처리비용을 상승시키며 활성오니(activated sludge)와 같은 개방시스템에서의 효과는 미미한 것으로 알려져 있다. 생물정화 모니터링 목적의 GMO 사용량은 극히 적으면서 센서 내에 포함되어 있어 대부분 실험실에서 사용된다. 따라서 자연계 유출에 의한 문제는 크지 않을 것으로 판단된다.
(2) 환경 생명공학 기술적용 사례
(가) 해양 기름유출의 생물정화
해양 기름유출의 대표적 사례로 1989년 Exxon-Valdez의 기름 유출사고가 있다. 25만 마리 이상의 바닷새가 희생되었고, 경제적 손실은 US$61 billion(약 67조 원)으로 추정되었다. 세계적으로 에너지 수요가 증가하면서, 새로운 석유 탐사가 증가하므로 기름 유출사고 발생 위험이 높아지고 있다. 기름의 주요 성분인 탄화수소는 미생물에 의하여 분해될 수 있으므로, 생물촉진(Biostimulation)과 생물첨가(Bioaugmentation)의 방법으로 기름 유출지역을 정화할 수 있다.
(나) 배가스 중 이산화탄소의 생물학적 저감
미세조류는 수중에 용해된 탄산이온을 세포 내로 능동적으로 흡수 이동시키는 특이한 탄소농축기작(CCM: Carbon-Concentrating Mechanism)으로 높은 이산화탄소 고정능을 갖고 있다(Ghosh et al., 2017). 따라서 미세조류를 이용한 생물학적 이산화탄소 고정화 기술은 물리, 화학적 방법에 비하여 환경 친화적이며, 생산된 미세조류 바이오매스로부터 바이오 연료 또는 다양한 고부가 물질을 생산할 수 있는 장점이 있다. 현장에서 질적향상(scale-up)을 위해서는 우량조류주 탐색, 미세조류주의 유전적 개량, 생물반응기 개발 등에 더 많은 노력이 필요하다.
(다) 폐수처리와 동시에 인(P) 재순환
자동차 산업, 컴퓨터 제조업, 소화제 제조, 식품 생산 등의 분야에서 인(P)의 수요가 늘어 가까운 미래에는 인의 공급이 원활하지 않아 부족현상을 겪게 될 것이다. 인(P) 순환의 주요 근원은 제철 슬러지, 하수 슬러지, 식품 및 발효산업 폐기물 등이며 이들 폐기물은 유해 미세조류 번성(녹조, 적조) 등의 심각한 환경문제를 유발하게 된다. 따라서 대장균(E. coli)은 건량의 50%까지 인(P)을 축적할 수 있으므로 활성오니(activated sludge) 미생물조합은 폐수로부터 인(P)을 제거할 수 있는 최상의 방안이 될 수 있다. 일본에서는 4개의 부처가 협력하여 인(P) 재순환의 국가적 협력체가 운영 중이며 추가적으로 재순환 공장 건설비용 등이 과제로 남아 있다.
(라) 난분해성 폐기물의 생물정화
탄소나노관(CNT: Carbon nanotubes), 그래핀(GRA: Graphene) 유도체는 매우 유용한 특성을 지녔으며 약물 운반, 전자제품, 생물센서, 흡착제, 연료전지 등 다양한 분야에서 사용되고 있다. 이들 물질은 비활성, 안정적, 난분해성 등의 공통된 특징이 있으며, 환경에 잔류하고, 일부는 독성을 나타내기도 한다. 탄소나노물질인 GRA oxide(GO), graphite, 환원된 GO(RGO) 등은 Naphthalene 분해 미생물에 의해서 성공적으로 분해될 수 있음이 보고되었다(Ghosh et al., 2017). 미생물분해는 효소분해에 비해 온도, pH 등의 영향이 적다는 점에서 실제적 현장 적용이 용이하다. 또한 미생물은 다양한 환경조건에서 생장할 수 있으므로 적용 범위가 확대될 수 있다. 단일 미생물 또는 배양된 미생물의 나노물질 분해능은 낮을 수 있으나, 다수의 분해 미생물로 구성된 군집은 나노물질의 분해를 촉진하게 된다.
(마) 식물-미생물 상호작용을 이용한 식물정화
식물과 근계 미생물은 오염지 정화에 활용될 수 있다. 대부분의 오염지는 다수의 오염물질로 오염되었으므로 효과적 현장(on-site) 정화를 위해서는 다양한 분해능을 갖는 미생물 확보가 필요하다(Ghosh et al., 2017). 이때 차세대염기서열분석법(NGS: Next Generation Sequencing) 기법을 이용하여 미생물군집의 프로파일을 이상적으로 작성할 수 있으며 오염지 정화에 효과적인 미생물을 구분해 낼 수 있다. 미생물의 대사적 활성은 외부로부터 질소, 탄소 등의 영양을 추가하여 강화시킬 수도 있다. 여러 미생물의 조합(Consortia)은 단일 미생물보다 향상된 분해능을 보이며, 생물계면활성제(Biosurfactant)는 정화 목적으로 잘 활용될 수 있다.
(바) 플라스틱의 생분해
플라스틱은 우리 사회에 큰 변화를 일으킨 매우 유용한 물질이다. 그러나 플라스틱의 광범위한 사용은 인위적 또는 자연 환경에 플라스틱 오염의 문제를 일으키고 있다. 플라스틱의 생분해는 이와 같은 플라스틱 오염의 영향을 줄일 수 있는 핵심 열쇠이다. 생물은 비교적 난분해성의 플라스틱을 분해하도록 진화하고 있으며 생분해성 플라스틱은 미생물 분해가 좀 더 용이하도록 발전하고 있다. 난분해성 플라스틱의 대표적 물질로 알려진 폴리에틸렌이 곤충의 장에서 분리한 Bacillus sp.가 일부 분해할 수 있음이 알려졌다(Ghosh et al., 2017).
(사) 바이오센서
오염물질 및 생태독성 모니터링을 위해 생물학적 지식 활용이 증가하고 있다. 일례로 미국은 생활환경 개선 및 화학물질 관리에 관한 가이드라인을 통해 모니터링 방향을 화학적 측면에서 생물학적 측면으로 확대하고 있다. 생태독성 모니터링을 위해 박테리아, 물벼룩, 어류, 효모, 조류, 조직 배양세포 등을 사용하고 있다. 간편하게 선택적으로 검출할 수 있는 바이오센서의 개발로는 효소나 항체 또는 박테리아, 세포막, 신경수용체 또는 생물체 등을 전자공학 장치와 조합한 마이크로칩 개발・제조, 그리고 최근에는 유전자 재조합박테리아를 이용한 바이오칩 등이 많이 개발되고 있다(과학기술정보통신부 등, 2017).
EU는 환경오염의 독성을 탐지하기 위한 강력한 분석도구로써 저렴하고 편리한 바이오센서 기술을 제시하였고 관련 해외시장은 2014년 115억 달러에서 2021년 287억 달러 규모로의 성장이 전망된다. 특히 환경모니터링 분야의 바이오센서 시장은 연평균 16% 성장하여 2021년에는 45억 달러의 시장을 가질 것으로 전망된다.
다. 국내 현황
(1) 정책 방향
한국과학기술기획평가원(KISTEP)은 2017년 지속 가능한 발전을 위한 환경 분야의 정책 및 R&D 방향 수립을 위해 생활 공해 및 환경오염과 관련하여 10대 미래유망기술을 선정하였다. 환경 분야는 1) 초미세먼지 제거기술, 2) 친환경 녹조・적조 제거기술, 3) 생활폐기물 첨단 분류・재활용 시스템, 4) 환경변화 실시간 입체 관측기술, 5) 미생물 활용 환경복원 등 5개 기술이다.
과학기술정보통신부(과기정통부)를 주축으로 관련 부처의 참여로 ‘제2차 과학기술 기반 국민생활(사회)문제 해결 종합계획(2018∼2022)’을 수립하였다. 우선 해결할 40개 주요 사회문제로서 환경 분야는 1) 생활 폐기물, 2) 실내 공기오염, 3) 수질 오염, 4) 환경 호르몬, 5) 산업폐기물, 6) 미세먼지 등 6개를 선정하였다. 국가적으로 해결해야 할 사회문제 중 15%를 환경 분야에서 선정한 것은 건강피해 저감 및 환경오염방지에 대한 국민의 높은 우려와 관심을 반영한 결과로 판단된다. 정부는 앞으로 과학기술적 해결방안 및 범부처 추진방안 등을 도출하고, 국민이 체감할 수 있도록 실질적 해결 성과를 만들어 나갈 계획이다.
과기정통부, 환경부 등 관련부처의 합동작업으로 완성된 ‘제3차 생명공학육성기본계획(2017)’은 4차 산업혁명과 더불어 미래의 인류 난제를 해결하고 경제성장을 이끌 새로운 경제 패러다임으로서 바이오경제 시대의 도래를 예견하였다. 또한 기후변화와 자원 위기가 현실적 위협으로 등장하면서 환경문제가 국가경제의 미래를 결정짓는 주요 변수로 부각될 것으로 전망하였다. ‘제3차 생명공학육성기본계획(2017)’에 의하면 환경 바이오 분야 중에서 바이오센서 분야의 성장잠재력을 높이 평가하였고 오염물질 및 생태독성 모니터링을 위해 생물학적 지식 활용 증가를 예측하였다.
생명공학정책연구센터는 2015년부터 ‘바이오 미래유망기술’ 발굴연구를 추진하고 있다(생명공학정책연구센터, 2018). BT를 기반으로 향후 5∼10년 이내에 기술적 실현이 가능하며 기술적 혁신성, 산업적 혁신성에 대한 파급효과가 높게 전망되는 20개의 미래유망 후보기술을 도출하였다. 이 중 환경분야는 ‘탄소자원화 광합성 세포공장’과 ‘환경오염물질 분해 마이크로바이옴’을 선정하였으며, 10대 바이오 미래유망기술로 최종 선정된 ‘탄소자원화 광합성 세포공장’은 이산화탄소 저감 및 탄소자원화 능력을 갖는 광합성 세포공장시스템을 구축하고 이를 활용하여, 급변하는 기후변화에 대응하고 지속가능한 차세대 바이오연료 및 고부가 소재를 생산하는 것이다.
(2) 환경 생명공학 기술적용 사례
(가) 기름유출의 생물정화
국립생물자원관 보유균주 중에서 오염물질을 우수하게 분해하는 미생물자원을 확보하여 미생물제제를 제조하였다(국립생물자원관, 2016). 제조한 혼합균주는 Yarrowia, Acinetobacter, Corynebacterium, Pseudomonas, Rhodococcus, Micrococcus 등 총 7개 균주였다. 실험실 조건과 현장에서의 오염토양에 미생물제제를 적용한 결과, 대조군에 비해 오염물질의 빠른 분해가 일어남을 확인하였다.
(나) 녹조・적조 저감을 위한 생태공학적 기술
과학적 녹조 대응 체계 구축의 일환으로 환경부는 녹조발생의 원인 중 하나인 질소(N), 인(P) 등 영양염류의 유입을 사전에 차단하기 위해 하・폐수처리시설 등 환경기초시설의 방류수 수질기준을 강화해 왔으며 하수처리장 등에 질소・인 제거를 위한 고도처리시설의 단계적 확충, 비점오염저감 등을 추진하고 있다(환경부, 2018). 2013년부터는 녹조 발생의 근본적 해결을 위한 관계부처인 국립환경과학원, 한국환경산업기술원, 한국과학기술연구원, 수자원공사, 농어촌공사, 한국생명공학연구원은 협업 R&D를 통해 발생기작, 모니터링, 사후 제거에 이르는 전 과정 연구를 추진하고 있다.
또한, 환경부 씨앗기술성장지원사업(2017∼2019)의 일환으로 남조류의 생리・생태적 특성에 기반을 둔 수상태양광, 초음파 및 부착조류 복합시스템 개발과 현장 적용을 통하여 선택적 남조류 제어 기술개발을 추진하였다. 과기정통부 해양극지기초원천기술개발사업의 유해 미세조류의 생태공학적 제어기술개발(2016∼2020) 연구는 환경 유전자 분석기술을 기반으로 적조생물과 상호작용을 하는 다양한 미생물을 규명하고 네트워크 분석을 통해 이들의 상호작용을 밝히게 되었다. 이를 기반으로 적조의 생성과 소멸은 다양한 미생물의 협력적 작용에 의한 것으로 판단되며 이와 같은 조류-미생물 상호작용의 균형을 조절할 수 있는 수생식물의 도입(Srivastava et al., 2018), 환경인자의 변화 등에 의한 녹조・적조 발생의 저감을 고려해 볼 수 있다.
(다) 배가스 중 이산화탄소의 생물학적 저감
과기정통부 연구개발사업으로 열병합발전소, 화력발전소의 배가스를 이용한 미세조류 배양으로 이산화탄소의 저감과 동시에 유용물질 생산의 실증화연구가 수행 중이다. 한국이산화탄소포집 및 처리연구개발센터(KCRC: Korea Carbon Capture & Sequestration R&D Center) 연구진은 한국서부발전 태안발전본부에서 ‘이산화탄소 포집 및 전환(CCU) 실증 플랜트 준공식’을 가졌다(2019.5). 연구진은 이산화탄소의 생물학적 전환 기술 상용화를 위한 핵심기술인 우수 조류주를 확보하였으며 광투과율, 이동성, 기계적 강도가 우수하며 배양 규모의 확장이 용이한 대용량 광생물반응기를 개발하였다. 그리고 대규모 미세조류 배양 공정에 적용 가능한 공정기술 등을 확보하였다.
(라) 식물-미생물 상호작용을 이용한 식물정화
식물마이크로바이옴의 분석결과 식물 내부와 주변에 미생물이 서식하면서 식물의 생육에 큰 영향을 미치고 있음이 밝혀지고 있다. 중금속 오염지역의 토양정화에 적합한 식물을 선발하기 위해 국화과 식물을 중금속으로 오염된 토양에 재배한 다음 생육반응과 부위별 비소, 카드뮴, 구리, 납, 아연 등의 중금속의 축적능을 분석하였다(권혁준 등, 2019). 톱풀을 제외한 가새쑥부쟁이, 금계국, 감국, 각시취 등의 생육은 비교적 양호하였다. 비소(As) 축적능은 더위지기가 지하부에서 가장 높았고 지상부는 바위구절초가 가장 우수하였다. 카드뮴은 왕갯쑥부쟁이가 지상부에서 가장 높았다. 즉, 이들 식물에 의해 중금속 오염지역의 식물정화가 가능할 것으로 보고되었다.
(마) 플라스틱의 생분해
국내 플라스틱 폐기물 발생량은 2016년 기준 약 1,010만 톤이다(환경부, 2017). 폐기물 통계에서 집계되지 않는 양까지 포함하면 실제 플라스틱 폐기물량은 이것보다 훨씬 더 많을 것으로 추정된다. 최근 한국생명공학연구원 주요사업과 농촌진흥청 우장춘프로젝트 지원으로 수행된 연구에서 연구진이 꿀벌부채명나방의 유래 효소를 이용하여 세계적인 관심사인 플라스틱을 분해할 수 있는 새로운 방법을 발견하였다(Kong et al., 2019). 기존 미생물에 의한 플라스틱 분해 이외에 곤충의 효소에 의해서 플라스틱을 분해할 수 있다는 새로운 결과로 플라스틱 오염문제 해결의 새로운 전기를 맞이할 것으로 기대된다.
(바) 바이오센서
바이오센서, 생체를 활용한 모니터링, 군집 수준의 특성을 이용한 모니터링 등 생물학적 모니터링에 대한 관심과 활용 노력이 확대되고 있다. 생물 감시항목이 국가수질자동측정망의 선택적 측정항목에 포함되고 생물자원 기반의 환경모니터링 시스템 개발에 관심이 증가됨에 따라 ‘특정 유・무기 오염물질 반응성 미생물 발굴과 이를 이용한 오염물질 감지 시스템’ 등이 개발되었다(과학기술정보통신부, 2017). 이 외에 생물을 활용한 수환경평가기법, 수환경 변화예측을 위한 군집변화 모니터링 기법 등이 개발되었으나 활용은 다소 미흡한 실정이다.
라. 발전 전망
(1) 유망 기술 분야
정부 및 국책연구기관에서는 초미세먼지 제거, 친환경 녹조・적조 제거, 환경호르몬 제거, 생활폐기물 첨단 분류・재활용 시스템, 환경변화 실시간 입체 관측, 미생물 활용 환경복원 등을 우선적으로 해결해야 하는 환경기술로 선정하였다. 이에 오믹스 기술 발전에 따른 대량의 생물군집 및 네트워크 분석, AI를 이용한 대량의 생물 빅데이터 분석, 환경오염물질 분해 마이크로바이옴 등을 활용한 생물정화 기술개발, 오염물질 및 생태독성 모니터링이 유망 기술 분야로 부상했다. 또한 환경바이오 중 바이오센서 분야의 성장 잠재력을 높이 평가한 가운데 오염물질 및 생태독성 모니터링도 매우 유망하다고 할 수 있다. 실제로 주요 20개국 정상회의(G20)의 민간전문가 참여그룹인 SC20의 ‘Science 20 2019 Japan’이 2019년 3월 도쿄에서 개최되었다. 여기에서는 전 세계적 환경 이슈인 기후변화 및 해양 플라스틱 폐기물 등 해양생태계의 위협 및 해양환경보호를 위한 과학계의 역할에 대하여 집중 논의하였다(한국과학기술한림원, 2019).
(2) 지속가능한 환경정화 기술
전 세계적으로 생물정화는 오염지가 특이하며 생분해 속도가 느리고 처리 공정율이 안정적이지 못하다는 점 때문에 오염지 정화기술 시장에서 약 10∼15% 밖에 차지하지 못하는 것으로 추정된다(OECD, 2013). 그러나 다른 복원기술에 비해 환경복원기술로써의 생물정화는 지속가능성이 있고, 최근 이코지노믹스 등의 발전에 따른 처리효율의 증가 등으로 유망하다고 볼 수 있다. 환경 생명공학기술은 UN이 추진하는 새로운 글로벌 목표인 ‘지속 가능한 발전 목표’를 달성하기 위해서도 필요한 분야로 평가된다.
(3) GMO(유전자변형생물) 활용에 대비
현장에서 적용되는 많은 생물정화의 경우 영양분 또는 공기주입 등 미생물의 성장을 촉진할 수 있는 생물촉진이 사용되고 있다. 그 다음으로는 자연계에 서식하는 미생물을 추가하는 생물첨가가 적용되고 있으며, GMO를 사용하는 경우는 드물다(OECD, 2013). 특별히 GMO를 필요로 하는 분야는 PCBs(Polychlorinated biphenyls)와 같은 생분해가 어려운 난분해성 물질의 생분해이다. 오염지에서 오염물을 분해할 수 있는 미생물이 존재하지 않는 경우를 대비하여 환경 생명공학 분야에서도 GMO 기술, 또는 더 나가 합성생물학 연구가 필요하다. 또한 향후 GMO 사용에 대비한 환경 안전성 평가, 원활한 사용을 위한 법・제도 마련 등이 필요하다.
(4) 미래 산업에 대한 정책적 고려
환경 생명공학 기술은 에너지 절약형, 비공해형 기술로써 국제환경협약의 제약조건을 벗어날 수 있는 미래 산업의 선도적 역할을 담당할 기술이다. 또한 새로운 환경보전형 산업군을 유도하며 지속적 성장과 환경보전을 동시에 추구할 수 있는 이상적 미래 산업상을 창출할 것으로 기대된다. 따라서 환경 생명공학 기술의 확대 발전을 위해 연구개발 투자 증대 및 미래 산업으로 발전시키기 위한 정책적 고려가 필요하다.
참고자료
-과학기술정보통신부 등, ‘제3차 생명공학육성기본계획(과학기술 기반 바이오경제 혁신전략 2015’(2017)
-국립생물자원관, ‘국립생물자원관 발굴 자생미생물의 오염토양 정화특성 연구’(2016)
-권혁준 등, 식물환경복원 소재선발을 위한 국화과 15종의 생육 및 중금속 축적능 분석, Korean J. Plant Res.(2019)
-기초기술연구회, ‘생명공학 TRM 및 전략분야 기획 연구-제3권 환경 생명공학 TRM’(2003)
-생명공학정책연구센터, ‘BT기술동향 보고서: 환경 생명공학(Bioremediation을 중심으로)’(2013)
-생명공학정책연구센터, ‘2018 바이오 미래유망기술’(2018)
-융합연구정책센터, ‘바이오센서 글로벌 연구 동향 및 전망’(2016.6)
-한국과학기술한림원, ‘한림원의 창’(2019 봄)
-한국환경산업기술원, ‘2018년도 환경 R&D 추진방향’(2018)
-한국환경정책・평가연구원, ‘OECD가 본 한국의 환경정책: 10년의 성과와 새 정부를 향한 메시지. KEI 포커스 제5권 제3호’(2017)
-환경부, ‘2017 환경백서’(2017)
-환경부, ‘2018 환경백서’(2018)
-Ghosh, A. et al. Special Issue: Environmental Biotechnology. Trends in Biotechnology(2017)
-KISTEP, ‘KISTEP이 바라본 지속가능한 발전을 위한 공해・오염 대응 10대 미래유망기술’(2017)
-Kong, H.G. et al., The Galleria mellonella hologenome supports microbiota-independent metabolism of long-chain hydrocarbon beeswax. Cell Reports(2019)
-OECD, Biotechnology for the Environment in the Future: Science, Technology and Policy. OECD Science, Technology and Industry Policy Papers No. 3, OECD Publishing, Paris(2013)
-Srivastava, A. et al., Floating rice-culture system for nutrient remediation and feed production in a eutrophic lake. Journal of Environmental Management(2017)
2. 해양 생명공학
가. 개요
해양 생물자원을 이용하거나 해양 생물자원이 가지고 있는 구성성분, 시스템 공정, 기능, 유전정보 등을 생명공학기술을 활용하여 연구함으로써 궁극적으로 인간 복지를 위한 상품과 서비스를 제공하는 산업 혹은 학문을 총칭한다(1,2).
해양생물자원의 이용을 전제로 하기 때문에 지속가능한 자원 활용을 위한 자원의 탐색, 보전 및 관리가 중요하다. 또한, 해양 생물자원의 양적 확보가 용이하지 않은 경우가 많아서 제한된 양의 자원을 활용한 효율적 연구개발법이 필요하다. 따라서 전통의 해양학, 수산학, 생물학에 첨단 생명공학 기술의 접목이 요구된다. 산업화를 위하여 해당 자원 또는 자원 유래 물질의 대량 생산 방법이 함께 개발되어야 한다(2,3).
지구 표면의 50% 이상을 차지하는 해양의 극한 환경에서의 미소 동물상(육안으로 볼 수 없는 작은 동물)에 대한 연구(4)와 같이 해양 탐사기술의 발전으로 새로운 해양 생물자원이 계속 발견되어 자원의 다양성이 증가하고 있다. 배양이 어려운 미생물의 배양과 미세조류의 대량생산 시스템 구축과 같이 해양 생물자원의 양식 및 배양 기술을 통하여 자원의 가치가 높아지고 산업적 활용이 증가하는 추세이다(3,5). 또한 생물정보학, 계산생물학, 합성생물학과 같이 최신 생명공학 기술의 접목을 통하여 유용 유전자 및 기능성 물질의 발굴 가능성이 높아지고 있다(3). 이와 같은 기술의 발달과 바이오경제 구현을 위한 제3차 생명공학육성기본계획(6)의 추진을 통하여 지구 생물종의 90%를 차지하나(7), 활용률이 1% 미만에 불과한 해양 생물자원의 개발 가능성이 높아질 것이다.
나. 해외 동향
세계 해양 생명공학 시장은 연평균 성장률 5% 이상으로 2020년 5조 7,600억 원 규모로 전망된다. 국가별로는 미국(36%), EU(25%), 일본(14%)이 세계 시장의 약 75%를 차지하며, 이들 비중이 증가추세를 보이는 가운데 아시아-태평양 지역이 연평균 5.5%로 성장하여 새롭게 부상할 것으로 전망된다. 산업 분야별로는 의약품(54%), 식품 및 화장품 등의 소비재(33%), 환경(8%), 화학(3%), 자원(2%) 순의 점유율을 보이며, 미래 해양 생명공학 시장은 의약품, 기능성 식품, 화장품 분야가 80% 이상을 유지하며 주도할 것으로 전망되었다(8).
세계 해양 생명공학 시장의 54%를 차지하며, 미래의 성장을 주도할 것으로 전망되는 해양 생물자원 유래 의약품의 현황은 다음과 같다. 2018년까지 미국과 유럽에서 승인을 받은 해양 생물자원 유래 의약품은 10종이며, 임상 2상 및 3상 시험 중인 약물은 20종에 이르고 있다. 해양 생물자원 유래 의약품은 대부분 항암제 중심으로 개발되고 있다(9).
[표 3-39] 미국 및 유럽 승인 해양 생물자원 유래 의약품
|
약물명(의약품명) |
기원 해양생물군 |
효능 |
비고 |
|
Cytarabine(Cytosar-U◯R) |
Sponge |
항암(leukemia) |
천연물 유도체 |
|
Vidarabin(Vira-A◯R) |
Sponge |
항바이러스(Herpes) |
US discontinued |
|
Nelarabine(Arranon◯R) |
Sponge |
항암 (leukemia, lymphoma) |
천연물 유도체 |
|
Fludarabin Phosphate(Fludara◯R) |
Sponge |
항암 (leukemia, lymphoma) |
천연물 유도체 |
|
Trabectedin(Yondelis◯R) |
Sponge |
항암 (soft tissue sarcoma; ovarian cancer) |
천연물 유도체 |
|
Ziconotide(Prialt◯R) |
Cone Snail |
진통 |
천연물 |
|
Brentuximab Vedotin (Adcetris◯R) |
Mollusk /Cyanobacterium |
항암(Lymphoma) |
천연물 유도체 |
|
Eribulin Mesylate (Halaven◯R) |
Tunicate |
항암(Breast cancer) |
천연물 유도체 |
|
Omega-3-acid ethyl ester (Lovaza◯R) |
Fish |
혈중지방조절 |
천연물 유도체 |
|
Lota-carrageenan (Carragelose◯R) |
Seaweed |
항바이러스 |
천연물, OTC |
[표 3-40] 미국 및 유럽의 임상 2상 및 3상 시험 중인 해양 생물자원 유래 약물
|
약물명 |
기원 해양생물군 |
임상단계 |
효능 |
비고 |
|
Plinabulin |
Fungus |
3상 |
항암 |
천연물 유도체 |
|
Lurbinectedin |
Tunicate |
3상 |
항암 |
천연물 유도체 |
|
Polatuzumab vedotin |
Molusk/Cynobacterium |
3상 |
항암 |
천연물 유도체 |
|
Depatuxizumab mafodotin |
Molusk/Cynobacterium |
3상 |
항암 |
천연물 유도체 |
|
Tetrodotoxin |
Pufferfish |
3상 |
진통 |
천연물 |
|
Squalamine |
Dogfish Shark |
3상 |
노인성 황반변성 |
천연물 |
|
GTS-21(DMXBA) |
Worm |
2상 |
알츠하이머 질환 완화 |
천연물 유도체 |
|
Bryostatin 1 |
Bryozoan |
2상 |
알츠하이머 질환 완화 |
천연물 |
|
PM184 |
Sponge |
2상 |
항암 |
천연물 유도체 |
|
PM060184 |
Sponge |
2상 |
항암 |
천연물 |
|
Plitidepsin |
Tunicate |
2상 |
항암 |
천연물 |
|
Marizomib |
Bacterium |
2상 |
항암 |
천연물 |
|
CDX014 |
Molusk/Cynobacterium |
2상 |
항암 |
천연물 유도체 |
|
PSMA-ADC |
Molusk/Cynobacterium |
2상 |
항암 |
천연물 유도체 |
|
AGS-16C3F |
Molusk/Cynobacterium |
2상 |
항암 |
천연물 유도체 |
|
Tisotumab vedotin |
Molusk/Cynobacterium |
2상 |
항암 |
천연물 유도체 |
|
Enfortumab vedotin |
Molusk/Cynobacterium |
2상 |
항암 |
천연물 유도체 |
|
Ladiratuzumab vedotin |
Molusk/Cynobacterium |
2상 |
항암 |
천연물 유도체 |
|
Denintuzumab mafodotin |
Molusk/Cynobacterium |
2상 |
항암 |
천연물 유도체 |
|
Glembatumumab vedotin |
Molusk/Cynobacterium |
2상 |
항암 |
천연물 유도체 |
다. 국내 현황
우리나라의 해양 생명공학은 해양생명공학육성기본계획(2008∼2016) 이후에 해양수산발전계획(2011∼2020), 해양수산 R&D 중장기계획을 통하여 해양 생명공학 기술개발 및 해양수산 생명자원의 산업화를 제시하고 있다. 이후 해양수산부에서 2018년 해양수산과학기술 육성 기본계획, 해양바이오 산업 육성 전략(안)과 2019년 제1차 해양수산생명자원 관리기본계획(안)을 마련하였다.
2019년 기준으로 해양수산부의 해양 생명공학 분야 주요 국가연구개발사업은 해양수산생명공학기술개발사업, 포스트게놈 다부처 유전체사업, 해양바이오전략소재개발 및 상용화지원, Golden Seed 프로젝트 등으로 연간 383억 4,200만 원의 예산을 사용하고 있다(10).
한편 과학기술정보통신부에서도 미세조류 바이오매스의 생산 및 유용물질로의 전환에 필요한 기초・원천기술을 개발하는 글로벌 프런티어 사업의 차세대바이오매스연구단에 2018년 87억 1,200만 원의 예산을 사용하였다(11). 해양 생명공학에서 중요한 해양수산생명자원은 2018년까지 국내 기록종 1만 3,300여종 대비 57% 수준인 7,600여 종을 확보하고 있다(12). 관련 분야 투자로 2018년 논문, 특허 등록, 기술이전이 전년 대비 각각 5.3%, 12.3%, 9.6% 증가한 612건, 458건, 91건을 기록하였다(10).
[표 3-41] 2019년도 기준 해양수산부의 해양 생명공학 분야 주요 국가연구개발사업 현황(단위: 백만 원)
|
사업명 |
과제명 |
연구내용 |
예산 |
|
해양수산 생명공학 기술개발 사업 |
해외 해양생물자원 개발 및 활용기반 구축 |
-해외 해양생물 자원 확보 및 관리, 해외생물자원 추출물 활용기반 구축 |
3,406 |
|
해양생명자원 기탁등록보존기관 |
-19개 분류군별 국내 해양생명자원 확보 및 실물자원 정보화 |
3,360 |
|
|
해양바이오 지역특화 선도기술 개발 |
-동해안 해양생물자원 유래 기능성 생물소재 개발 -전남지역 해조류 유래 건강증진용 식품소재 개발 -해양 무척추동물 소재 기능성식품 상용화 기술개발 |
1,152 |
|
|
해양섬유복합소재 및 바이오플라스틱 소재 기술 개발 |
-해양수산생물이 생산하는 유용한 대사물질이나 생체기능을 이용하여 산업적 활용이 가능한 바이오신소재 개발 |
3,178 |
|
|
해양 융복합 바이오닉스 소재 상용화 기술 개발 |
-해양생물 소재를 이용한 첨단 바이오 융복합 바이오닉스 신소재 및 실용화 기술 개발 |
2,399 |
|
|
해양 미세조류 색소 기반 고부가 소재 및 활용 기술 개발 |
-해양 미세조류・색소 고생산 시스템 및 기능성 식품, 화장품 소재 산업화를 통한 고부가가치 신시장 창출 |
960 |
|
|
해양 미세조류 유래 인지능 관련 개별 인정형 소재개발 및 제품화 |
-해양미세조류 이용 인지능 개선 인체적용시험 및 식약처 개별인정 획득 |
480 |
|
|
해양자원유래고령친화형 글로벌 기능성 소재 개발 |
-고령화에 따른 신체 기능저하 개선을 위한 해양자원유래 건강기능식품 소재 3종 개발 및 제품화 |
960 |
|
|
해양단백질 기반 바이오메디컬소재 개발 |
-해양 단백질의 고유한 특성을 활용하여 인간질환의 생리활성을 조절하는 소재(분비형 단백질 치료제)를 개량하고 신규 바이오메디컬 소재를 발굴 |
1,439 |
|
|
해양자원기반 근적외선 조영물질 및 영상진단기기 개발 |
-해양유래 근적외선 기반의 신개념 광영상 진단 및 치료기법 개발 |
1,620 |
|
|
해양 고세균이용 바이오수소 생산 실용화 기술 개발 |
-바이오수소 전체공정 기본설계 패키지 완성, 100톤급 생산플랜트 구축 및 시운전 |
3,783 |
|
|
해양 와편모류 기반 이상세포 제어 및 유용세포 증식기술개발 |
-유용 와편모류 대량생산 시스템 개발, 병원성 기생충 제어 기술개발 및 환경안전성 검증 |
1,152 |
|
|
포스트 게놈 다부처 유전체 사업 |
해양수산생물 유전체정보 분석 및 활용기반 구축 |
-유용 유전자원의 산업적 가치 발굴을 위한 해양생물 전장유전체 대량 해독 및 발굴, 수산양식생물 고부가가치 신품종 개발을 위한 유용유전자 확보 |
4,139 |
|
해양 바이오 전략소재 개발 및 상용화 지원 |
해양바이오 전략소재 개발 |
-해양생물자원을 대상으로 제품개발에 활용가능한 핵심성능(지표, 표능성분) 규명 |
2,395 |
|
대량생산 시스템 및 고도화 공정 개발 |
-산업적 활용가치가 높은 해양생물 유래 유용물질 대량 생산 및 고도화 |
1,436 |
|
|
기술상용화 지원 |
-대량생산이 가능한 유용 해양생물소재의 작용 기전(대사과정) 연구 및 제품화 연구 지원 |
958 |
|
|
Golden Seed 프로젝트 |
수산종자사업단 |
-수산분야 수출종자 품목 3개(넙치, 전복, 바리과) 및 수입대체 종자 품목 1개(김) 개발 |
5,525 |
[표 3-42] 해양수산생명자원 확보 현황
|
구 분 |
전 세계 기록종수* (A) |
해외자원 확보종수 (B) |
확보율 (%) (B/A) |
국내 기록종수** (C) |
국내 확보종수 (D) |
확보율 (%) (D/C) |
|
|
척추 동물 |
해양어류 |
18,862 |
466 |
2.47 |
1,179 |
882 |
75 |
|
해양포유류 |
139 |
- |
- |
42 |
29 |
69 |
|
|
해양파충류 |
108 |
- |
- |
9 |
6 |
67 |
|
|
바닷새 |
676 |
- |
- |
150 |
13 |
9 |
|
|
무척추 동물 |
연체동물 |
47,610 |
421 |
0.88 |
1,714 |
987 |
58 |
|
자포동물 |
11,686 |
85 |
0.73 |
367 |
285 |
78 |
|
|
절지동물 |
57,194 |
281 |
0.49 |
1,905 |
972 |
51 |
|
|
선형동물 |
6,917 |
29 |
0.42 |
53 |
42 |
79 |
|
|
환형동물 |
13,926 |
31 |
0.22 |
363 |
234 |
64 |
|
|
극피동물 |
7,332 |
79 |
1.08 |
204 |
132 |
65 |
|
|
해면동물 |
8,657 |
83 |
0.96 |
379 |
163 |
43 |
|
|
태형동물 |
6,116 |
1 |
0.02 |
163 |
102 |
63 |
|
|
윤형동물 |
201 |
- |
- |
39 |
3 |
8 |
|
|
미삭동물 |
3,093 |
- |
- |
111 |
35 |
32 |
|
|
모악동물 |
131 |
1 |
0.76 |
20 |
8 |
40 |
|
|
기타 |
17,711 |
18 |
- |
143 |
28 |
20 |
|
|
해산 식물 |
홍조류 |
8,044 |
144 |
1.79 |
567 |
450 |
79 |
|
녹조류 |
2,077 |
174 |
8.39 |
117 |
103 |
88 |
|
|
갈조류 |
2,978 |
- |
- |
191 |
142 |
74 |
|
|
관속식물 |
313 |
37 |
11.82 |
136 |
43 |
32 |
|
|
원생생물 |
25,246 |
215 |
0.85 |
2,873 |
709 |
25 |
|
|
균류 |
1,673 |
51 |
3.0 |
495 |
448 |
91 |
|
|
원핵생물 |
2,263 |
1,207 |
55.34 |
2,136 |
1,805 |
85 |
|
|
합계 |
242,953 |
3,323 |
1.37 |
13,356 |
7,621 |
57 |
|
* World Register of Marine Species(2017.12. 기준) ** 국립해양생물자원관(2018.12. 기준)
라. 발전 과제 및 전망
우리나라의 해양 생명공학은 상위의 과학기술기본계획, 생명공학육성기본계획과 연계한 해양생명공학육성기본계획을 통하여 체계적 육성이 필요하다. 현재 제4차 과학기술기본계획(2018∼2022), 제3차 생명공학육성기본계획(2017∼2026)과 연계한 해양생명공학육성기본계획의 수립이 필요한 시점이다. 2018년 해양수산과학기술 육성 기본계획이 마련되어 있지만, 제3차 생명공학육성기본계획이 담고 있는 과학기술 기반의 바이오경제 구현을 위한 해양 생명공학의 기본계획 수립이 중요하다.
해양 생명공학의 산업적 활용 확대를 위하여, 자원 확보 및 관리에서 소재 발굴 및 대량 생산까지 체계적인 투자가 이루어져야 한다. 해양 생물자원과 이에 대한 정보를 집적하고 제공하기 위한 정부의 투자가 계속되고 있다. 이러한 투자가 빛을 발하여 연구자나 기업가들이 쉽게 자원과 정보를 얻어 활용할 수 있는 체계적 시스템이 빨리 마련되기를 기대한다. 해양 생명공학의 여러 분야에서 이러한 정보를 통하여 각 분야의 소재 발굴 속도를 가속화할 수 있을 것이다. 또한, 해양 생명공학의 산업적 활용에 있어 자원 또는 소재의 대량 공급이 병목으로 작용하는 경우가 많다. 이를 해결하기 위하여, 유전자 정보 활용, 유전자 가위, 합성생물학, 배양기술 고도화와 같은 최신 생명공학 기술의 적극 활용 방안에 대한 투자가 중요하다.
참고자료
-생명공학정책연구센터(2008), 해양 생명공학(BT 기술동향 보고서 제 82권)
-김세권(2013), 해양생명공학, 월드사이언스
-권학철(2019), 해양천연물의 한계 극복을 위한 최신 생명공학 연구 기법, BioNpro Vol. 63, 생명공학정책연구센터
-Zeppilli et al.(2018), Characteristics of meiofauna in extreme marine ecosystems: a review. Marine Biodiversity. 48:35–71
-김희식(2019), Marine cell factory: 해양미세조류, BioNpro Vol. 63, 생명공학정책연구센터
-관계부처 합동(2017), 제3차 생명공학육성기본계획
-Hurst et al.(2016), Marine biotechnology strategic research and innovation roadmap: Insights to the future direction of European marine biotechnology. Marine Biotechnology ERA-NET: Oostende
-해양수산부(2018), 해양바이오 산업 육성 전략
-Alves et al.(2018), From marine origin to therapeutics: The antitumor potential of marine algae-derived compounds. Frontiers in Pharmacology. 9:777
-해양수산부(2018), 2019년도 해양수산과학기술 육성 시행계획
-과학기술정보통신부(2018), 2018년도 과학기술정보통신부 연구개발사업 사업설명회
-해양수산부(2019), 제1차 해양수산생명자원 관리기본계획(안)
제5절
바이오 공정 및 융합
1. 생물공정(산업바이오)
가. 개요
바이오기술을 바탕으로 생물체의 기능 및 정보를 활용하여 제품, 서비스 등 다양한 고부가가치를 생산하는 바이오산업은 건강, 식량, 환경 등과 같은 인류 난제를 해결하고, 탈(脫)석유경제의 해법으로 주목받고 있다. 바이오경제의 토대가 되는 바이오산업은 질병의 예방・치료를 위한 의약품을 개발・생산하는 의약바이오 분야와 바이오기술과 IT, NT 등의 융・복합으로 질병의 조기발견 및 개인별 체질에 맞는 치료를 가능하게 하는 융합바이오 분야, 식물 등 재생 가능한 자원을 이용해 화학제품 대체 및 저탄소 연료를 생산하는 산업바이오 분야로 크게 나눌 수 있다.
특히, 산업바이오(Industrial Biotechnology)는 화이트바이오(White Biotechnology)로 불리며 환경규제 대응 및 친환경 자원의 지속 이용을 주도하는 분야로, 각종 포비아(Phobia) 환경에서 벗어나 깨끗한 사회 조성을 가능하게 하는 바이오산업 분야이다. 기후변화 대응뿐만 아니라 미세플라스틱 등 최근 환경문제 대응을 위해 산업바이오의 기초, 원천, 상용화 연구개발이 활발히 진행되고 있어, 2017년 2,480억 달러인 시장규모(바이오연료(Biofuel), 바이오화합물(Biochemical), 바이오고분자(Biopolymer) 등)는 2025년까지 연평균 10.2%의 급격히 성장할 것으로 예측된다.19)
산업바이오는 원료, 소재, 제품이 연계된 시장구조를 가지고 있어 바이오매스-바이오리파이너리-바이오화합물-최종 소비재로 연결되는 가치사슬의 각 단계별 기술개발 및 성숙이 매우 중요하다. 미국, 유럽 등 산업바이오 선진국은 각 단계 가치사슬의 상용화 기술을 확보하여 시장을 주도하고 있으나 국내의 경우 경제성이 확보된 일부 소재 및 제품에 대한 상용화만 이루어져 아직 글로벌 산업바이오 시장 진입에 어려움을 겪고 있다.

[그림 3-64] 국내외 산업바이오 시장의 가치 사슬 비교 : 바이오플라스틱
나. 해외 동향
(1) 정책 동향
미국, 유럽, 일본, 중국 등 주요 국가는 글로벌 바이오경제 주도권 확보를 위해 미래 수요를 분석하고, 국가역량 결집을 위해 바이오 컨트롤타워를 구축하며, 바이오경제 대응을 위한 R&D 전문성 강조 및 지원체계 일원화를 추진하고 있다. 산업바이오의 경우, 기후변화 및 환경문제 대응을 위해 바이오매스 확보 및 활용, 바이오제품 개발, 소비확산을 위한 정책적 지원을 적극 펼치고 있다.
미국은 바이오매스 연구개발법(Biomass R&D Act), 국가 바이오경제 청사진, 농업법을 통해 산업바이오를 지원하고, Biopreferred 프로그램 및 친환경인증제도(Biobased Product Certification)를 운영하여 바이오소재의 구매 촉진 및 일자리 창출을 통한 바이오경제 확대를 추진하고 있다.
유럽은 석유화학경제에서 바이오경제로의 전환을 선언하며 산업바이오 육성 재정・정책 지원을 가장 활발하게 추진하고 있다. 이를 위해 ‘Horizon 2020’의 일환으로 37억 유로 규모의 산업바이오 육성 프로그램 Bio-Based Industries Joint Undertaking을 지원하고 있다.20) 37억 유로 예산(9억 7,500만 유로(EU), 27억 유로(민간))을 EU Commission, 유럽 대・중・소 기업연합체 BIC(Bio-based Industries Consortium)가 공동 운영하고 있으며 원료(Feedstock), 공정(Process), 제품(Product), 정책(Policy) 등 전방위 R&D 분야에 2019년 101개의 과제가 지원되었다. 또한, Horizon 2020의 후속 프로그램인 ‘Horizon Europe (2021∼2027)’에 1,000억 유로를 투입하여 에너지, 환경, 보건, 소재, 식량 등 분야에서 산업바이오 경쟁력 강화를 위해 지속적인 연구개발을 추진할 계획이다.
일본은 바이오매스 일본종합전략을 통해 2020년까지의 전략로드맵 수립, 자급자족형 에너지도시(Biomass town)를 조성, 탄소세 도입 및 바이오플라스틱 인증시스템 적용 등의 정책지원을 추진 중에 있다.
중국은 바이오산업발전전략, 973계획, 13・5 국가전략성 신흥산업 발전규획(2016∼2020) 등을 통해 산업바이오의 기술 혁신, 지적 재산권 강화, 산업 경쟁력 강화를 지원하고 있다.
이처럼 세계 경제 주요국은 탄소감축과 더불어 바이오경제로의 패러다임 전환을 위해 종합적인 계획 및 제도를 마련하여 산업바이오를 더욱 집중적으로 육성할 것으로 보인다.
[표 3-43] 주요 국가의 산업바이오 육성 정책
|
국가 |
세부 정책 |
|
|
-바이오매스 연구개발법(Biomass R&D Act, 2000) 제정 후 연간 1억 5,000만 달러 투입, 국가 바이오경제 청사진(2012), 농업법 개정(2014) 등을 통해 바이오화학 분야 지원 -바이오연료, 바이오화학소재 등 개발을 위한 지속적 연구개발 투자를 통해 경제성장 및 에너지 안보 확보 추진 -2030년까지 석유소비량의 30%를 바이오화학제품으로 대체 목표 |
|
|
-Europe 2020 Strategy(2011∼2020)에서 지속가능한 발전 및 기후변화 대응을 위해 핵심 분야 중 하나로 바이오산업으로 선정하고, 'Horizon 2020'을 통한 R&D 지원, 탄소세 도입 등을 추진 -바이오기업과 석유화학기업의 연합체인 유로파바이오(EuropaBio)를 조직 -Horizon 2020 산하에 바이오기반 산업연합(Bio-Based Industries Joint Undertaking)을 설치해 총 37억 유로(EU예산 9억 7,500만, 민간 투자 27억)를 바이오매스 확보, 바이오리파이너리, 시장・제품・정책 개발 중심으로 투자 -Horizon 2020 후속 프로그램으로 Horizon Europe(2021∼2027)에 1,000억 유로를 투자하고 바이오경제 구축을 위한 에너지, 환경, 소재 등 산업바이오분야에 지속 연구개발 추진 |
|
|
-바이오매스 일본종합전략을 통해 2020년까지의 전략로드맵 및 200여 개의 세부과제를 설정하고 탄소세 도입 및 바이오플라스틱 인증시스템 적용 등의 정책지원 추진 중 -바이오매스를 활용한 자급자족형 에너지도시(Biomass town)를 조성하고 바이오매스 산업을 2020년까지 5,000억 엔 규모로 육성하고자 하는 7개 부처 공동계획수립 |
|
|
-바이오산업발전전략, 973계획, 13・5 국가전략성 신흥산업 발전규획 등을 통해 산업바이오 R&D 지원, 지적재산권 강화, 바이오제품 인증시스템 도입, 탄소세 도입, 탄소배출 감축기업에 대한 보조금 지원 등 추진 |
(2) 산업 동향
(가) 산업바이오 전반 동향
미국, 유럽, 일본 등 주요 선진국에서는 지속가능한 사회구축 및 바이오경제에 대한 관심이 높아져 기존 석유자원을 대체할 자원 또는 신규 물질로서 바이오화합물 및 바이오연료에 대한 수요가 급격히 증가하고 있다. 산업바이오 제품의 세계 화학시장 대비 점유율은 2017년에는 12%(3,490억 달러), 장기적으로 2050년에는 전체 화학시장의 50%에 이를 것으로 전망되고 있다.21) 기후변화대응 및 친환경 제품 이미지 제고 등을 위해 자동차・전기전자・화장품・생활용품 등 다양한 분야에서 산업바이오 제품 수요가 점차 증가하고 있다.
유럽은 바이오산업 매출 규모가 2016년 기준 약 2조 3,000억 유로이며 식품과 음료(50%), 농산품과 임산품(25%), 산업바이오 제품(25%)으로 구성된다. 특히, 산업바이오는 바이오화합물, 바이오플라스틱, 의약품, 바이오연료, 바이오에너지, 섬유, 제지 등 다양한 품목을 포함하고 있으며 총 7,000억 유로의 매출 규모로 빠르게 성장하고 있다.22)
미국은 바이오산업 매출 규모가 2012년 기준 약 3,240억 달러이며 생물의약품(28%, 910억 달러), 농작물(40%, 1,280억 달러), 산업바이오 제품(32%, 1,050억 달러)이다. 2017년 기준 바이오산업 매출 규모는 3,880억 달러(GDP의 2%수준)이며 생물의약품(35%, 1,370억 달러), 농작물(27%, 1,040억 달러), 산업바이오 제품(38%, 1,470억 달러)으로 구성되며, 산업바이오는 꾸준한 성장과 가장 높은 매출을 통해 미국 바이오산업의 핵심으로 부각되고 있다.23)24)
(a)
(b)

주) (a) 2016년 기준 유럽 산업바이오 매출액 7,000억 유로 (b) 2017년 기준 미국 산업바이오 매출액 1,470억 달러
출처: Robert Carlson(2016), Nature Biotechnology(2016) 34 (3) 247-255, Bioeconomy Capital(2019), BIOECONOMY DASHBOARD: ECONOMIC METRICS
[그림 3-65] 유럽과 미국 산업바이오의 매출 규모 분석
BASF, DuPont, Dow, DSM 등 세계 주요 화학기업들은 지속적인 R&D를 통해 범용화학소재(용제, 계면활성제, 가소제 등), 정밀화학소재(화장품 소재, 의약품 소재 등), 바이오플라스틱(생분해성, 비분해성) 등 다양한 산업바이오 분야의 시장 규모를 확대하고 있다.
석유계 소재를 사용하던 산업용 제품인 용제, 계면활성제 등도 바이오화합물로 대체되고 있다. 전 세계시장 규모는 2017년 기준 바이오용제 64억 달러(BASF, BioAmber, DuPont, Gevo, Cargill, Vertec Biosolvents 등)25), 바이오계면활성제 42억 달러(BASF, AkzoNobel, Evonik, Ecover, Jenil Biotec 등)26), 바이오가소제 14억 달러(Dow Chemical, Evnonik, Solvay, Danisco, Lanxess 등)27)의 시장을 형성하고 있다.
화장품 시장은 대표적인 기능성 바이오소재가 쓰이는 분야로 산업바이오 기술을 통해 생산된 다양한 바이오제품이 출시되고 있다. Evolva는 효모로부터 F&F(Flavor&Fragrance) 물질을 생산하고 있으며 가장 대표적인 제품은 바닐라향을 내는 원료인 고가의 바닐린(Vanilin)이다. 바닐린은 ‘Natural‘ 라벨링을 획득하여 천연 원료의 높은 가격과 수급 불안정을 해소할 수 있는 소재로 기대되며, Amyris 역시 효모로부터 생산된 Farnesene을 기반으로 F&F 기업과 파트너십을 맺고 바이오 기반 F&F를 제조(100% 바이오 기반 스쿠알렌(Neossance))하여 기능성 화장품 브랜드를 개발・제품화하는데 성공하였다.
또한, 이들 기능성 바이오 정밀화학 제품 이외에도 효소 기반 의약품 중간체(Active phar- maceutical ingredient) 생물전환공정은 Merck, Pfizer 등 소수의 선진 기업들만이 기술 개발 및 상용화에 성공하였다. 산업바이오 제품의 생산 가속화를 위해서, 고효율 미생물을 초고속으로 제조하는 Zymergen 등과 같은 핵심 벤처기업이 등장하고 있으며, 글로벌 기업은 합성생물학 기술을 활용하여 스마트 세포공장을 확보하고 산업바이오 제품의 시장 진입 및 생산성 향상을 가속화하고 있다.
합성생물학 기술, 로봇 기술과 인공지능을 결합하여 신개념의 바이오팩토리 제조 기술이 개발되고 있으며, 합성생물학 기반 기술 및 제품 시장 규모가 2017년 기준 44억 달러 규모에서 2022년까지 139억 달러 규모로 연평균 성장률 26%로 급속 성장할 것으로 예측되고 있다.28) 특히, 구글의 자회사 Deepmind는 단백질의 3차원 구조예측 인공지능 프로그램인 Alphafold를 개발하여 단백질의 구조예측 정확도를 비약적으로 높이면서 단백질 구조와 관련된 다양한 바이오산업 분야에 응용가능성을 열었다.
[표 3-44] 산업바이오 선도 해외 기업 현황
|
업체명 |
사업영역 및 주요 내용 |
|
|
-Dupont(미국의 화학기업)과 Tate&Lyle(네덜란드의 바이오기업)이 합작 Dupont Tate&Lyle BioProducts 설립하여 1,3-Propanediol을 생산 (4만 5,000톤) |
|
|
-BASF(독일의 화학기업)과 Corbion(네덜란드의 식품첨가물 기업)이 합작하여 Succinity GmbH 설립하여 바이오숙신산을 생산하고 있음 |
|
|
-NatureWorks는 생분해 바이오플라스틱의 핵심소재인 PLA를 주요 생산 기업(180,000 metric tons/year)이며, Corbion이 PLA 생산(7만 5,000 metric tons/year)을 시작함 |
|
|
-BASF는 생분해 바이오플라스틱 PBAT를 연산 7만 4,000톤 규모의 생산 공장을 가동하고 있으며 2배 규모로 증설을 검토 중 |
|
|
-Cathay Industrial Biotech(중국)은 TerrylTM 상표로 바이오유래가 26∼100%인 폴리아마이드 PA-56(45%), 510(100%), 511(31%), 512(29∼100%), 513(28∼100%), 514(26∼100%)를 시장에 출시 |
|
|
-효모로부터 Farnesene을 생산하여 글로벌 F&F 기업과 파트너십을 맺고 Biotech F&F를 개발하고 있으며, 특히 100% 바이오 기반의 스쿠알렌(NeossanceTM)은 Amyris에서 최초로 제품화된 기능성 화장품 원료로 Soliance에 공급하며 친환경적인 기업 이미지 구축 중 |
|
|
-Zymergen은 합성생물학, 로봇, 컴퓨팅 기반으로 하는 스마트 바이오팩토리를 제조하는 캘리포니아 소재의 벤처기업임 -다양한 유전공학툴과 로봇기기를 통한 자동화기술을 확보하고 있으며, 머신러닝 기법을 이용하여 최적의 바이오스마트팩토리(균주)를 개발하고 있음 -국내 대기업 CJ등과 다국적 기업들은 신규 비즈니스의 사업화를 위해서, 스마트 바이오팩토리를 아웃소싱하고 있음 |
|
|
-Deepmind는 인간과의 대국에서 승리를 거둔 인공지능(AI) 알파고(AlphaGo) 개발에 이어 단백질 구조 예측 정확도를 비약적으로 향상시킨 인공지능 알파폴드(AlphaFold)를 개발하여 산업용 효소 및 신약 개발 속도를 혁신적으로 단축시킬 것으로 기대되고 있음 |
(나) 바이오화합물(Biochemical)의 상용화 동향
바이오매스 기반 석유계 화합물 대체 또는 신규 바이오화합물을 생산하는 노력이 지속되고 있으며, 핵심 바이오화합물의 2017∼2022년까지 연평균 성장률 5∼6%를 유지하고 있다.29) 그러나 가격경쟁력 확보가 상용화의 핵심인 바이오화합물은 석유화학제품 가격 변동의 영향을 받고 있다. 여전히 낮은 유가로 상용화를 위해 지속적인 연구개발이 필요한 바이오화합물(Adipic acid, 1,3-butanediol, n-butanol, levulinic 등)도 있으며, 석유화학제품 수준의 가격 경쟁력을 확보하여 상용화에 근접하거나 생산량을 확대하고 있는 바이오화합물(Ethanol, lactic acid, 1,2-propanediol, 1,3-propanediol, 1,4-butanediol, isobutanol, 1,5-pentanediamine(cadaverine), 11-aminoundecanoic acid, dodecanedioic acid 등)도 있다.
Adipic acid와 1,6-hexanediamine은 연간 수백만 톤 이상의 사용되며 다양한 폴리아마이드(Polyamide; PA6, PA66, PA610, PA612 등)에 사용되고 있으며, 최근 Bio-Based Industries Joint Undertaking의 지원과제 EFFECTIVE를 통해 Genomatica, Aquafil SpA, Novamont SpA등이 TRL 7 수준의 생물학적 생산 기술을 개발하고 있다.
1,5-Pentanediamine의 경우, 1,6-hexanediamine의 대체가 가능한 바이오화합물로 주목을 받고 있으며 PA50, PA512 등에 사용이 가능하며 상용화에 근접하였으며 1,6-hexanediamine과 비교하여 가격경쟁력을 확보할 경우 시장 확대가 예상된다. Cathay Industrial Biotech에서 1,5-Pentanediamine 기반 다양한 바이오 폴리아마이드를 출시하였다.
n-Butanol의 경우 Green Biologics, Butamax, GS Caltex 등이 상용화를 위해 실증급 공장이 가동되고 있으나 가격경쟁력 확보에 어려움을 겪고 있다. Levulinic acid는 플랫폼화합물로 주목을 받고 있으며 GF Biochemicals이 상용화를 추진하고 있으나, 생산가격의 석유화학제품 수준으로 낮추고 용도 개발을 통한 잠재 시장의 확보가 필요하다. 또한, 1,4-Butanediol, succinic acid, Isobutanol 등은 바이오매스기반 소재 사용 확대와 가격경쟁력 확보를 통해서 상용화에 성공하였으나, 현재 시장규모가 크지 않아 추후 지속적인 시장 확대를 위한 노력이 필요하다.
이외에도 Monoethylene glycol, terephthalic acid, 2,5-furandicarboxylic acid는 Bio-PET 생산을 위한 주요단량체이다. Coca-Cola 바이오매스 유래 monoethylene glycol과 바이오매스 유래 para-xylene기반 terephthalic acid를 이용하여 100% Bio-PET를 생산하고 있으며, PET 시장을 대체하기 위한 바이오소재인 2,5-furandicarboxylic acid는 가격경쟁력 및 기존 PET 재활용 공정과의 적합성 등이 상용화를 위해 해결해야 할 주요 이슈이다. Sebacic acid, 11-aminoundecanoic acid, dodecanedioic acid는 지방산 유래 바이오화합물로 바이오매스 가격 변동에 영향을 받고 있으나 특수용도 바이오 폴리아미이드에 사용되고 지속적으로 시장이 확대될 것으로 예상된다.
[표 3-45] 주요 바이오화합물(Biochemical)의 상용화 추진 현황
|
바이오화합물 |
상용화 현황 |
|
Monoethylene glycol |
상업화 추진 중 (India Glycols Ltd 17만 5,000 metric tons/year) |
|
Ethanol |
상업적 생산 (Valero 14억 gallons/year, ADM 610만 gallons/year, POET 720만 metric tons/year, LanzaTech and Shougan Group 1,600만 gallons/year) |
|
Epichlorohydrin |
공장들이 건설되고 있으나 경제성이 빈약 (ABT, Solvay) |
|
Lactic acid, PLA |
상업적 생산 (NatureWorks 18만 metric tons/year, Corbion 7만 5,000 metric tons/year) |
|
1,2-Propanediol |
상업적 생산(ADM 10만 metric tons/year, Cargill and Ashland 6만 5,000 metric tons/year) |
|
1,3-Propanediol |
상업적 생산 및 글리세롤로부터 생산 중단(DuPont Tate & Lyle BioProducts 6만 3,000 metric tons/year) |
|
1,3-Butanediol |
다양한 연구개발 중(Genomatica) |
|
1,3-Butadiene |
다양한 연구개발 중(Geneomtica, Versalis, Braskem) |
|
1,4-Butanediol |
상업적 생산(Genomatica and BASF 7만 5,000 metric tons/year, Genomatica and Novamont 3,000 metric tons/year) |
|
1-Butanol |
상용화 추진 중이나 경제성 문제 극복 필요(Butamax, Green Biologics, GS Caltex) |
|
Isobutanol |
상업화 추진(Gevo 150만 gallons/year) |
|
Succinic acid |
상업적 생산(GC Innovation 1만 3,600 metric tons/year, Reverdia 1만 metric tons/year, BASF and Corbion 1만 metric tons/year) |
|
Itaconic acid |
다양한 연구개발 중(Itanonix) |
|
Levulinic acid |
상용화 추진 중(GF Biochemicals 1만 metric tons/year) |
|
1,5-Pentanediamine |
다양한 연구개발 및 일부 상용화 추진(Cathay Industrial Biotech, CJ CheilJedang, Daesang) |
|
Adipic Acid |
기술적으로 실현 가능하나 경제성이 빈약(Genomatica) |
|
1,6-Hexanediamine |
제한된 연구개발 중(Genomatica) |
|
2,5-Furandicarboxylic acid |
다양한 연구개발 중(Avantium) |
|
Terephthalic acid |
다양한 연구개발 중(Vrient) |
|
Sebacic acid |
오래된 시장으로 어려움을 겪고 있음(Arkema, Sebacic India, Cathay Industrial Biotech) |
|
11-Aminoundecanoic acid |
상업화 70년 지속(Arkema) |
|
Dodecanedioic acid |
상업화 생산단계에 접근(Evonik Industries, Cathay Industrial Biotech) |
출처: Sang Yup Lee et al.(2019), Nature Catalysis Nature Catalysi 2, 18–33, nova-Institute(2017), Commercialisation Updates on Bio-Based Building Blocks, 한국생명공학연구원 바이오안정성연구센터, 바이오화학산업동향지 77호(2017)
유럽은 RoadtoBio 프로젝트를 통해 바이오매스로부터 생산된 다양한 바이오화합물을 생산하여 기존 석유화학제품을 대체하려는 로드맵을 수립하였다.30) 이 로드맵은 2015년 기준 유럽 전체 화학제품에서 바이오매스 기반 제품의 점유율을 10%에서 2030년까지 25% 비중까지 향상시키기 위한 계획이다. 핵심 화학제품 9개 분야(화장품, 페인트・코팅, 농화학소재, 계면활성제, 윤활유, 인조섬유, 용제, 접착제, 플라스틱・고분자)를 선정하고 화학제품 9개 분야에서 바이오매스 기반 제품 점유율을 2015년 기준 4% 수준을 지속적으로 향상시키기 위한 분야별 전략로드맵을 제시하였다. 유럽은 바이오경제 구현을 위한 다양한 정책・산업적 노력으로 진행하고 있으며 산업바이오는 당분간 유럽이 주도할 것으로 예상된다.
(a)

(b)

(c)
|
화학제품분야 |
주요 회사 |
|
화장품(Cosmetics) |
Keracol Limited, Clariant Personal Care |
|
페인트 및 코팅(Paints&coatings) |
DSM, Corbion |
|
농화학소재(Agrochemicals) |
Corteva, Sipcam-Oxon |
|
계면활성제(Surfactants) |
Ecover, Henkel |
|
윤활유(Lubricants) |
Total, PANOLIN AG |
|
인조섬유(Man-made fibres) |
Sofila, Lenzing |
|
용제(Solvents) |
Green Biologics Limited, Roquette |
|
접착제(Solvents) |
VTT, Arkema |
|
플라스틱 및 고분자(Plastics&polymers) |
Novamont, BASF |
주) (a) 9개 화학제품분야, 목적 소재 및 결과물; (b) 2015년 기준 9개 화학제품분야의 바이오매스 기반 제품 점유율(5%); (c) 9개 화학제품분야에서 바이오매스 기반 제품을 생산하는 주요 기업
출처: RoadtoBio project, Roadmap for the Chemical Industry in Europe towards a Bioeconomy
[그림 3-66] 유럽 RoadtoBio 프로젝트 개요
(다) 바이오플라스틱(Bioplastic)의 상용화 동향
전 세계적으로 폐플라스틱과 미세플라스틱으로 인한 환경오염이 심화되어 일회용 플라스틱 제품 사용 규제를 강화하고 있다. 현재 프랑스, 이탈리아, 인도, UAE, 파키스탄 등 산화생분해 플라스틱(Oxo-degradable bioplastic) 포장재 사용에 대한 법령을 제정하고 있다. 유럽연합(EU)에서는 플라스틱 면봉, 빨대, 풍선 막대, 그릇, 식기, 병, 물티슈, 봉지, 포장지 등 일반인이 가장 많이 사용하는 10개 플라스틱 제품 사용을 금지하는 법안을 2021부터 발효하였다. 이에, 2025년까지 각 회원국은 전체 유통되는 플라스틱 음료수 병 중 90% 이상을 수거해야 한다. 또한, EU의 플라스틱 전략은 플라스틱 제품 재활용, 플라스틱 폐기물 발생량 감축, 투자 및 혁신 유도, 글로벌 대응으로 구분되며 이를 통해 2030년까지 플라스틱 분리수거 및 재활용 산업 분야에서 20만 개의 일자리를 창출한다는 목표를 제시하였다.
[표 3-46] 국내외 플라스틱제품 관련 환경 규제 현황
|
국내 |
[환경부 고시] -생분해성 제품은 1회용품 사용규제 대상에서 제외, 폐기물 부담금 제외 *생분해성 제품: ‘환경기술개발 및 지원에 관한 법률, 제1조에 따른 생분해성 수지 제품으로 환경표지 인증을 받은 제품 |
|
|
국외 |
유럽 |
-일회용 플라스틱 제품 사용 규제를 위한 지침 제정안 2021년부터 발효 -일회용 플라스틱 제품의 사용 금지 *플라스틱 식기류(cutlery), 접시(plate), 빨대(straw), 발포폴리스티렌 음식물 용기(food container), 음료 용기(food container), 음료용 컵(cup), 플라스틱으로 제조된 면봉용 막대, 산화생분해성(oxo-degradable) 플라스틱으로 제조된 제품 -2025년부터는 PET 음료 병의 25%는 재활용된 플라스틱으로 제조해야 하고, 2030년부터는 모든 플라스틱 병의 30%는 재활용 플라스틱으로 제조 -2029년까지 플라스틱 병의 90%를 의무적으로 수거 -플라스틱이 함유된 담배 필터의 제조업자는 생산자책임재활용제도(Extended Producer Responsibility Scheme) 대상 |
|
이탈리아 |
-비분해성 봉투 사용 규제 시행(2014.10): 90% 이상 쇼핑백에 사용 중 (세계 최대 시장) |
|
|
프랑스 |
-비분해성 일회용 쇼핑 봉투 사용 규제(2016.7), 바이오매스함량 30% 봉투만 사용 (2017.1) - 2020년부터 플라스틱 컵과 접시 사용 금지 |
|
|
국외 |
독일 |
-생분해성 봉투인 경우 Bio contents 비율 50% 고시 예정 |
|
미국 |
-캘리포니아주, 식품판매점에서 비닐봉지 제공 금지(2016), 식당에서 플라스틱 빨대 사용 금지(2018) -하와이주, 플라스틱 봉투 사용 금지(2015.7) -시애틀, 식당에서 빨대, 포트, 접시 등의 플라스틱 사용 금지(2018) 위반 시 벌금부과(250$) -텍사스, 플라스틱 봉투 사용 시 벌금부과(5c/장) |
|
|
캐나다 |
-몬트리올 지역 플라스틱 봉투 규제 예정(2018) -주 전역의 플라스틱 봉투 규제 검토 중 |
|
|
호주 |
-남호주(애들레이드, 시드니, 멜버른 등) 지역 플라스틱 봉투 규제 실시(2009.4) -북호주 지역 플라스틱 봉투 사용 금지(2011.9) (다중용도 플라스틱 봉투, 롤백, 종이봉투, 생분해성 봉투 허용) |
|
|
뉴질랜드 |
-일회용 비닐봉지 사용 전면금지(2019) |
|
|
중국 |
-길림성, 비분해성 봉투 사용 금지(2015.1): PLA 35%(15년) 30%(16년) 이상 사용 |
|
분해되지 않는 플라스틱으로 인한 환경문제를 해결하기 위해 전 세계 30여 개의 글로벌 기업(BASF, DSM, Dow, Braskem, ExxonMobil, Total, Shell, Mitsubishi Chemical Holdings, Mitsui Chemicals, Procter & Gamble 등)들은 해양 폐플라스틱 감소 및 제거를 위한 솔루션을 증진하는 ‘플라스틱 쓰레기 제거 연합(AEPW:Alliance to End Plastic Waste)’을 결성하였다.31) AEPW는 5년간 15억 달러 투자를 목표로 하며, 플라스틱 쓰레기 최소화를 위한 새로운 솔루션 개발은 물론, 폐플라스틱 재활용을 통해 순환경제에 기여하는 솔루션 또한 가속화할 예정이다. BASF는 플라스틱 재활용을 증진시키는 혁신적인 기술 개발을 목표로 켐사이클링(ChemCycling) 프로젝트를 진행하여, 2018년 폐플라스틱의 화학적 재활용을 통해 생산된 첫 파일럿 제품을 발표하였다.32)
|
(a) |
|
|
(b) |
|
주) (a) 플라스틱 쓰레기 제거 연합(AEPW, Alliance to End Plastic Waste): (b) BASF의 폐플라스틱의 화학적 재활용 공정 ChemCycling
출처: https://endplasticwaste.org/about-the-alliance-to-end-plastic-waste/, Dr. Stefan Gräter, BASF SE presentation The ChemCycling project–from plastic waste to high quality products)
[그림 3-67] 폐플라스틱 감소 및 제거를 위한 노력
산업바이오 분야의 대표 제품인 바이오플라스틱은 석유계 플라스틱을 대체하는 친환경 플라스틱으로 시장 규모가 빠르게 성장하고 있다. 유럽플라스틱협회는 세계 바이오플라스틱 생산 능력은 2018년 약 211만 톤에서 2023년 262만 톤으로 늘어날 것으로 예측하였다.33) 211만 톤 생산량의 56.8%는 바이오매스 기반 비분해성 바이오플라스틱이며, 43.2%는 생분해성 바이오플라스틱이다.
PLA(Polylactic acid)와 PHA(Polyhydroxyalkanoate)는 100% 바이오매스 기반 생분해성 바이오플라스틱으로 향후 생분해성 바이오플라스틱 시장을 주도할 것으로 예상된다. PHA는 최근 상업화 규모로 시장에 진입했으며 향후 5년 동안 생산 능력이 4배 증가할 것으로 예상되며, PLA는 PS(Polystyerene), PP(Polypropylene), ABS(Acrylonitrile Butadiene Styrene)의 대체 가능한 고기능성 바이오플라스틱 소재로 2018년 약 20만 톤 생산 규모가 5년 이내 2배로 증가할 것으로 예상된다.
바이오매스 기반 비분해성 바이오플라스틱(Bio-based, non-biodegradable bioplastic)은 바이오PE(bio-based polyethylene) 바이오PET(Bio-based polyethylene terephthalate), 바이오PA(Bio-based polyamide)가 전체 바이오플라스틱 생산 규모의 48%인 약 100만 톤을 차지하고 있다. 바이오PE 시장은 지속적으로 증가할 것으로 예상되며 PET를 대체하는 100% 바이오매스 기반 PEF(Polyethylene furanoate)는 2023년 상용화가 이루어질 것으로 예측된다. 석유계 PP(Polypropylene) 시장의 확대에 따라, 바이오PP도 2023년 상용화가 가능할 것으로 전망된다.
바이오플라스틱은 포장재, 소비재, 전자 기기, 자동차 분야, 농업 및 원예 분야 등 다양한 생활제품에 사용되고 있으며, 바이오플라스틱의 생산 규모의 상당량(65%, 120만 톤)이 포장재에 사용되고 있다. 현재 전 세계 바이오플라스틱의 55%가 아시아에서 생산되고 있으며, 유럽의 생산규모는 순환경제의 확산으로 2018년 19%에서 2023년 27%까지 증가할 것으로 예측된다.

출처: European Bioplastics, Bioplastic market data 2018
[그림 3-68] 글로벌 바이오플라스틱 생산 규모(2017∼2023)

출처: European Bioplastics, Bioplastic market data 2018
[그림 3-69] 바이오플라스틱 소재별 생산 규모

출처: European Bioplastics, Bioplastic market data 2018
[그림 3-70] 바이오플라스틱 용도별 생산 규모

출처: European Bioplastics, Bioplastic market data 2018
[그림 3-71] 바이오플라스틱 지역별 생산 규모
다. 국내 현황
(1) 정책 동향
바이오경제의 확대를 위해 산업바이오 분야의 정책적, 산업적 지원을 지속하고 있는 미국 및 유럽 등 선진국과 달리 우리나라는 산업바이오 생태계의 적극적 활성화가 필요한 상황이다. 우리나라는 ‘바이오화학 육성전략(2012)’에서 종합적인 산업바이오 지원정책을 발표하였고, ‘1차 기후변화대응 기본계획(2016)’에서 바이오연료 사용 확대를 위한 의무혼합제도시행(RFS: Renewable Fuel Standard, 바이오디젤 2.5%(2015.7∼2017), 3.0% (2018∼2020)) 및 탄소배출권거래제 활성화 등을 제시하였다.
유럽, 선진국 등은 바이오매스 유래 제품에 대한 인증제도와 우선구매 제도를 국가 주도로 시행하고 있다.34) 그러나 우리나라는 산업바이오 시장 활성화 촉진을 위한 의무사용・구매제도가 제한적으로 시행되고 있다. 바이오매스 기반 화학제품 및 바이오연료를 아우르는 통합적 계획이 없으며, 신재생에너지 연료(바이오연료) 의무혼합제도(RFS)와 바이오제품 의무구매제도는 외국에 비해 제한적이다. 바이오플라스틱의 경우 우리나라는 생분해성 수지(EL724)와 바이오매스 합성수지(EL727)에 대한 환경마크 인증제도를 실시하고 있으나 선진국과 같이 다양한 인증제도의 마련이 필요한 상황이다.
이에 산업바이오 분야의 원천 및 산업기술개발을 위한 R&D 예산을 투자하여 바이오화학산업화촉진기술개발사업(산업부, 2014∼2018), C1가스리파이너리사업(과기정통부, 2015∼2023) 등을 지원하였다. 바이오 분야 전체 정부 R&D 예산은 2017년 1조 9,000억 원을 초과하였으나, 레드바이오(의약)와 그린바이오(농업) 분야가 대부분의 예산을 차지하고 있으며, 산업바이오 분야 정부R&D 예산은 872억 원(바이오 전체의 4.5%)에 머물렀다.35)
정부는 2017년도 생명공학육성기본계획을 수립하여 글로벌 최초 지향 바이오 R&D 혁신, 미래 성장을 책임지는 바이오경제 창출, 민간 주도 바이오경제 구현을 위한 국가 생태계 기반 조성 등 3대 전략을 기반으로 생명공학 육성에 3조 원 규모의 예산 투자를 확정하였다.36) 2019년 연구개발 영역 예산은 약 2조 4,693억 원으로 생명과학(55%, 1조 3,625억 원), 레드바이오(의약 22%, 5,392억 원), 그린바이오(농업 11%, 2,814억 원), 화이트바이오(산업바이오 5%, 1,096억 원), 융합신산업(7%, 1,766억 원)에 투자된다. 산업바이오 분야(약 1,096억 원)는 환경부(약 463억 원), 과기정통부(약 207억 원), 산자부(약 172억 원) 순서로 투자를 하고 있다.
환경부는 미세먼지, 생활유해인자 관리, 환경모니터링 기술, 생활폐기물 재활용기술 등 사회문제해결 기술개발에 투자를 하고, 과기부는 C1가스리파이너리사업에 산자부는 바이오화학산업화촉진사업과 바이오에너지사업에 투자하고 있다. 그러나 산업바이오 관련한 중장기 R&D는 2015년 C1 가스리파이너리사업 이후 새로운 사업의 지원이 전무한 상황이다. 따라서, EU의 ‘Horizon 2020’과 ‘Horizon Europe’과 같은 바이오매스 기반 제품 생산에 필요한 산업원천 및 산업융합기술을 개발하는 중장기 R&D에 대한 정부지원이 필요한 상황이다.
산업바이오 관련 주요 분야의 우리나라 과학기술은 여전히 미국, 유럽, 일본 등의 선진국과 상당한 수준차이를 보이고 있으며, 최근 연구 활동에서 빠른 성장세를 보이고 있는 중국은 우리나라와 동등한 수준을 유지하고 있다. 특히, 산업바이오와 관련성이 높은 분야인 친환경 바이오소재 기술과 유용유전자 및 유전자원 개발 기술은 최고 기술국(미국) 대비 각 4.0년과 3.5년의 높은 기술격차를 보이고 있다. 선진국과 비교하여 우리나라는 산업생태계가 확립되지 않아 민간 기업이 최종 제품의 개발에 관련된 R&D에 집중하고 있으며, 바이오매스-원료소재-제품-재활용으로 이어지는 전주기적 요소기술개발이 아직 미미하여 선진국과의 높은 기술격차를 보이고 있다.
[표 3-47] 산업바이오 관련 주요 정부 R&D 사업 예산 추이(2015∼2019)
|
부처 |
세부사업 |
내역사업 |
예산(백만 원) |
||||
|
2015 |
2016 |
2017 |
2018 |
2019 |
|||
|
보건 복지부 |
글로벌화장품신소재・ 신기술 연구개발지원 |
(세부사업 전체) |
10,750 |
7,183 |
5,050 |
- |
- |
|
과학 기술 정보 통신부 |
글로벌프론티어지원 |
탄소순환형차세대바이오 매스 생산/전환기술연구단 |
10,370 |
9,584 |
9,484 |
8,712 |
5,337 |
|
지능형 바이오 시스템 설계 및 합성 연구 |
8,330 |
8,740 |
8,640 |
7,935 |
8,470 |
||
|
기후변화대응기술개발 |
C1가스리파이너리 |
4,000 |
14,000 |
13,142 |
15,278 |
16,278 |
|
|
바이오에너지 |
7,500 |
6,300 |
7,317 |
9,844 |
7,883 |
||
|
산업 통상 자원부 |
바이오산업핵심 기술개발 |
바이오화학산업화촉진 기술개발 |
15,510 |
16,780 |
10,000 |
8,700 |
- |
|
신재생에너지 핵심기술개발 |
바이오 |
17,585 |
17,763 |
20,413 |
21,625 |
16,146 |
|
|
해양 수산부 |
해양수산생명공학 기술개발 |
해양수산바이오신소재개발 |
4,946 |
5,700 |
11,600 |
12,550 |
11,036 |
|
해양바이오에너지개발 |
8,420 |
9,789 |
9,700 |
8,400 |
3,783 |
||
|
합 계 |
89,426 |
97,855 |
97,363 |
95,062 |
70,952 |
||
출처: KISTEP Issue Weekly 2017-06(Volume 212), 바이오경제로의 이행을 위한 화이트바이오 산업 육성 정책 제언 참고, 2018년, 2019년 자료 NTIS 활용
(2) 산업 동향
2017년 기준 국내 바이오산업 생산 규모는 사상 최초로 10조 원대를 돌파하여 총 10조 126억 원으로 2016년 총 9조 2,611억 원 대비 9.3% 증가하였다.37) 2016년 대비 수출은 11.2% 증가한 5조 1,497억 원, 수입은 12.7% 증가한 1조 6,456억 원으로 3조 5,041억 원의 무역수지 흑자를 냈다. 바이오산업의 국내 생산(판매+수출)은 바이오의약산업(38.0%, 3조 8,501억 원), 바이오화학・에너지산업(14.4%, 1조 4,564억 원), 바이오식품산업(30.5%, 3조 889억 원)이 대부분을 차지하였다. 산업바이오 관련 분야별 국내 생산의 경우, 바이오화학・에너지산업은 바이오연료(62.5%, 9,105억 원)와 바이오화장품 및 생활화학제품(27.6%, 4,024억 원)이 대부분이며, 바이오식품산업은 사료첨가제(66.8%, 2조 624억 원)가 대부분을 차지하였다.
산업바이오 분야 수출 품목 1위인 사료첨가제는 친환경 사료용 아미노산에 대한 글로벌 수요 증가로 전년대비 15.3% 증가한 1조 4,312억 원 규모로 나타났다. 그러나 우리나라의 산업바이오는 바이오연료(바이오디젤 등)와 사료첨가제(라이신 등) 등 특정 제품에 의존이 심하고, 미국, 유럽 등 선진국에서 산업바이오의 핵심으로 떠오르는 바이오고분자 분야는 우리나라는 486억 규모로 바이오화학・에너지산업의 3.3%에 미치고 있는 실정이다.
아미노산 제품에 치우진 산업바이오의 경쟁력을 강화하기 위해서는 기업에서 다양한 바이오 기반 제품의 개발이 필요하다. 그러나 아직까지 산업바이오 제품들은 국내시장에서의 단기 수익성이 낮고 정부의 재정・정책 지원이 부족하여 기업들의 적극적인 투자가 이루지지 않고 있다. 국내 산업바이오는 기존 석유화학회사(GS칼텍스, 롯데케미칼, LG화학, 노루 등)와 발효전문회사(CJ제일제당, 대상 등)를 중심으로 발효를 통한 친환경 제품 연구개발이 진행 중이며, 화장품 및 고부가가치 친환경 웰에이징(well-aging) 소재분야 기업이 성장 중이다. 국내 바이오플라스틱은 대기업 및 중소중견기업에서 대부분 연구개발단계이나 일부 품목의 경우 파일럿, 데모 스케일 연구가 진행되고 있어 상용화에 가까운 제품도 있다. 전 세계적으로 빠른 수요증가를 보이는 바이오플라스틱(PLA)의 경우 국내에서는 연구개발차원에서 오랜기간 연구를 진행하였으나 상업생산은 전무하여 대부분 수입에 의존하고 있는 상황이다. 따라서, 국내 산업바이오는 원료소재를 확보하기 위한 상용화 기술과 인프라가 부족한 실정이며 중간재를 수입하여 최종제품을 생산하는 가공중심의 산업으로 성장하고 있다.
[표 3-48] 산업바이오 관련 국내 기업 현황
|
업체명 |
사업영역 및 주요 내용 |
|
|
-2018년부터 연산 400톤 규모의 여수 바이오부탄올 데모공장 가동 -연산 300톤 규모의 2,3-BDO 데모공장 구축 중(대상, 창해에탄올, 전라북도 군산시와 산업통상자원부 바이오화학산업화촉진기술개발사업 진행 중) |
|
|
-도요타 통상(원료제공)과 협력을 통해 바이오 PET을 생산하여, 바이오 PET병 소재로 납품 중 -바이오플라스틱(폴리아마이이드, PLA 등) 컴파운드 기술을 확보하고, 현재 파일럿 규모 테스트 중 |
|
|
-고내열성, 고내화학성, 바이오매스 유래 폴리에스터인 에코젠(ECOZEN)을 개발하여, 내열 생활용기, 친환경 제품 포장재, 신용 카드 및 스포츠 용품의 코팅 필름 등으로 적용분야 확대 |
|
|
-바이오디젤 공정과 발효공정을 융합하여 바이오플라스틱 단량체인 세바식산 생산기술 확보하고, 현재 파일럿 규모 테스트 중 |
|
|
-프랑스 아케마(Arkema)와 손잡고 말레이시아에 8만 톤 규모 사료용 아미노산 메치오닌을 생산공정 가동 -미국 메타볼릭스(Metabolix)의 바이오플라스틱 폴리히드록시알카노에이트(PHA) 관련 자산인수(2016.9)를 통해 미국 보스턴에 위치한 연구시설과 고급 연구인력 및 네트워크 확보 |
|
|
-6년 동안 350억 원의 R&D 비용을 투자해 옥수수로부터 친환경 바이오플라스틱 소재인 ‘이소소르비드(Isosorbide)’의 상업생산에 성공(2014.3.). 군산에 연 1만 톤 규모의 isosorbide 파일럿 플랜트 건설 중 (2021년 준공 목표) |
|
|
-건강식품 소재 미세조류(클로렐라) 등을 제품판매, 피롤리돈(Pyrrolidone), 카다베린(Cadaverine) 등 바이오플라스틱 단량체 생산 연구개발 중 |
|
|
-자동차 내장재를 바이오매스 기반 플라스틱으로 대체하기 위한 연구개발 중 |
|
|
-천연물 기반 화장품 원료 소재 기술 확보 -화장품 할랄인증을 통해 이슬람권 진출 확대 추진 |
|
|
-진세노사이드 성분 등 국내 천연소재를 이용한 화장품 개발 -미백 기능성 소재를 자체 개발하여 일본 등으로부터 수입 대체 |
|
|
-Anti-aging, Moisturizing, Whitening, Skin protection 부문의 화장품원료 개발 및 생산 -국내 천연물화장품 원료 공급 1위 |
|
|
-히알루론산을 비롯한 생체적합성 고분자의 물성연구 및 개선을 통해 화장품 및 헬스케어 전반에 응용할 수 있는 제품 개발 중 |
|
|
-DNA합성기술과 분자진단시약 등 첨단 합성생물학 기술을 이용하여 생명과학제품과 분자시약제품을 판매하고 있음 -최근에는 효모유전체라이브러리 기반의 제품도 판매 |
|
|
-발효 및 효소전환 기술을 기반으로 비타민, 유기산 등 피부에 유리한 영양성분을 생산하여 건강관련 제품을 연구・출시 및 3-Hydroxypropionc acid 연구 개발 중 |
라. 발전 과제 및 전망
우리나라는 유럽, 미국 등 선진국과 비교할 때 석유화학경제에서 바이오경제로의 전환을 간접적으로 유도하는 탄소감축 정책과 산업바이오 시장 활성화를 위한 기업 직접지원 정책이 모두 미진한 상황이다.
우리나라의 산업바이오는 특정 분야에 의존도가 높으며, 유럽, 미국 등 선진국이 주도하고 있는 바이오매스 기반 석유화학 대체 소재의 국내 시장 규모는 매우 협소하다. 국내 산업바이오 시장은 바이오연료와 사료첨가제를 중심으로 형성되었으며, 수출은 사료첨가제(아미노산)에 대한 의존도가 높다. 바이오연료는 바이오디젤의 의무혼합제도를 통해 시장이 성장하였고, 사료첨가제인 아미노산은 기업의 꾸준한 투자를 통해 해외시장을 공략하여 성장하였다.
일정 규모 이상의 국내 시장 확보를 토대로 해외시장에 진출하는 기업의 일반적 글로벌화 전략에 비하면 아직 산업바이오의 국내 생태계가 활성화되지 않아 기업의 적극적인 투자가 어려운 상황이다. 산업바이오 관련 정부의 중장기 R&D 투자가 지속되지 못하고 선진국에 비해 정책 지원이 한정적인 상황에서, 중국의 급속한 성장은 또 다른 어려움으로 예상되고 있다.
바이오플라스틱은 석유계 플라스틱을 대체하고 플라스틱과 이산화탄소의 배출, 석유 의존도 저감에 기여하며, 제품의 가치사슬에 따른 원료생산, 소재생산, 제품생산을 위한 대・중・소기업의 협력으로 바이오경제의 지속 성장이 가능하다. 전 세계적으로 일회용 플라스틱 및 비닐봉투 사용의 규제, 생분해성 신소재 개발, 사용촉진제도의 도입 확대 등으로 바이오플라스틱은 산업바이오의 핵심 분야로 부상하고 있다.
그러나 우리나라는 협소한 국내 시장 규모 및 원료-소재-제품-재활용의 전주기 관련 기술의 부족으로 대・중・소기업 협력 체계가 구축되지 않아 바이오플라스틱의 대부분은 수입에 의존하고 있다. 따라서, 기업들의 바이오플라스틱을 포함한 산업바이오 분야 진출 활성화를 위한 정부의 적극적인 육성 및 지원 정책이 필요하다. 이를테면 미국 농부성(USDA)의 Biopreferred program의 연방 정부의 우선 구매제도 및 바이오매스 함량에 따른 소비자 마케팅용 자발적 라벨 제도 같은 것으로 생분해성 수지(EL724)와 바이오매스 합성수지(EL727)에 대한 환경마크 인증제도 이외에 바이오플라스틱산업 발전 속도를 고려한 인증제도 및 사용촉진 제도의 도입이 필요하다.
신규 소재 및 산업화 기술 개발, 플라스틱의 탄소자원화를 위한 기존 플라스틱의 upcycling 기술개발 등 순환형 바이오경제를 구현하기 위한 중장기 R&D 지원도 시급하다. 우리나라 석유화학산업의 글로벌 경쟁력을 확보하고 있으므로 바이오플라스틱을 포함한 바이오매스 기반 화학소재 분야의 기술 및 산업 경쟁력을 확보하여 기존 석유화학산업과 연계한다면 산업바이오의 특정 분야 의존성을 탈피하고 글로벌 시장을 개척할 수 있을 것이다.
2. BT + ICT
가. 개요
인공지능, 빅데이터, 사물인터넷, 유전체 분석 기술의 발전과 접목이 확대되면서 의료 산업의 패러다임이 기존의 질병 치료 중심에서 진단・예방・치료로 전환되고 있다. 이에 의료 및 헬스케어 관련 분야의 글로벌 시장이 고속으로 성장함에 따라 4차 산업혁명 시대 융합의 시장 파급력이 높은 혁신성장의 핵심 분야로 부각되고 있다.
특히, 유전체 정보, 의료 정보 및 생활로그 정보 등의 종합적 활용으로 개인화된 최적의 질병 예방 및 치료가 가능해지고 질환에 대한 정밀진단으로 조기발견 가능성이 높아져 의료의 질 향상 및 의료비 절감에 획기적으로 기여할 것으로 기대된다. 인공지능 기술의 활용이 확대됨에 따라 의사의 오진을 보완하고 보다 정밀한 진단과 처방으로 의료서비스의 질적 수준이 향상됨에 따라 의료산업 발전의 중요한 요소가 되었다. 한편 고령화로 독거노인의 증가로 고령자의 건강관리는 중요한 사회적 해결과제이며, 고령자를 대상으로 한 실시간 건강상태를 모니터링을 통해 질병을 예방・진단하고 관리하는 건강관리의 중요성이 부각되고 있다.
한편 새로운 의료 기술과 IT 기술의 접목을 통한 새로운 혁신적인 의료서비스가 부가가치 창출을 촉진할 것으로 예측된다. 유전체 분석 기술과 인공지능, 빅데이터, 웨어러블 기술 등의 결합을 통해 다양한 서비스 개발이 가능해질 전망이다. 예를 들어, 유전체 분석 기반 개인 맞춤형 질병 예측 및 신약개발, 질병을 진단하는 인공지능 보조의사, 실시간 고령자 건강관리 서비스 등을 들 수 있으며 이러한 기술 및 서비스가 확산될 경우 개인에게 보다 건강한 삶을 제공하게 될 것이다.
이에 본 장에서는 건강한 삶과 사회로의 지향을 목표로 추진하고 있는 정밀의료, 지능형 의료, 디지털 헬스케어 등을 중심으로 BT+ICT 주요 현황 및 이슈에 대해 살펴봄으로써 의료-ICT 융합산업 활성화를 위한 발전방향을 제시하였다.
나. 정밀의료
정밀의료는 개인의 유전체 정보, 진료 정보 등 의료 관련 정보뿐만 아니라 건강정보, 생활환경 및 습관 정보 등 개인의 다양한 정보를 기반으로 개인 맞춤형의 예방과 치료를 제공하는 것을 의미한다. 정밀의료에 대한 국내외 정책, 산업 및 시장 동향을 구체적으로 살펴보면 다음과 같다.
(1) 해외 동향
미국, 유럽, 중국, 일본 등 해외 주요국들은 정밀의료를 미래 핵심 성장산업의 주축으로 인식하고 글로벌 시장 선점을 위해 R&D 투자 확대 및 선순환의 산업생태계 조성을 위해 적극적인 정책적 지원을 강화하고 있다.
미국은 정밀의료 이니셔티브(PMI: Precision Medicine Initiative)를 통해 대규모 유전체 정보를 수집하여 환자에게 최적화된 질병 예방 및 치료법 중심의 맞춤형 의료 시스템으로 전환하는 것을 핵심 목표로 삼고 있다. 특히, 국립보건원(NIH)의 유전체 분석 및 100만 명 코호트 구축과 NCI의 개인 맞춤형 암 치료제 기술개발 환경을 구축 증이다. 유럽은 FP7(7th Framework Programme for Research and Technological Development)과 Horizon 2020 프로그램을 통해 정밀의료를 핵심 과제로 선정하여 추진하고 있다. 영국은 의료 데이터 기반 정부 주도의 10만 명 게놈 프로젝트(Genome Project)를 통해 2018년 희귀질환 환자 7만 명, 암환자 3만 명에 대한 유전체를 분석하였다38). 프랑스는 ‘Genom Medicine France 2025’를 통해 2020년까지 유전체 해독서비스 네트워크를 구축할 예정이다. 중국은 ‘국가정밀의료 전략 전문가 위원회’를 설립하여 2030년까지 약 600억 위안을 투자하며 정밀의료 5개년 발전계획(2016∼2020)을 통해 정밀의료 빅데이터 자원통합・저장・이용, 공유플랫폼 구축, 질병 예방・진단・치료 방안의 정밀화 연구, 차세대 임상용 생명체학 기술 연구개발 등을 제시하였다. 일본은 2012년부터 ‘의료 혁신 5개년 전략’ 및 ‘일본의료연구개발기구(AMED)’에서 정밀의료를 핵심 전략 과제로 선정하였으며, 바이오뱅크를 중심으로 수집한 유전체 데이터를 기반으로 데이터 저장・공유 및 유전자 진단 지원 등의 정밀의료 프로젝트를 추진하고 있다.
정밀의료 시장은 유전체 분석 기술의 빠른 발전과 이를 통한 분석 비용의 하락과 더불어 인공지능, 빅데이터 기술과의 결합하여 시장규모가 빠르게 확대될 것으로 전망된다. 세계 정밀의료 시장규모는 2017년 475억 달러에서 연평균 13.3% 성장하여 2025년 1,322억 달러로 크게 성장할 것으로 예측된다39).
해외 유수의 정밀의료 업체로는 23andMe와 Pathway Genomics가 대표적인데, 23andMe는 구글 벤처스로부터 투자를 받아 성장한 스타트업이다. 개인의 유전자정보 분석서비스를 제공하는 회사로서 2018년 4월 기준으로 23andMe에서 유전 정보를 분석한 고객 수는 500만 명에 이른다. 최근 23andMe는 다국적 제약사인 GSK에게 4년간 자사의 유전 정보 데이터베이스에 대한 독점권을 주고 300만 달러의 투자를 받았다. 이는 제약사가 막대한 데이터를 활용하여 임상 시험과 신약 개발을 촉진하는 것과 같은 요인이다.
Pathway Genomics는 암 유전자에 특화된 검사뿐만 아니라 개인의 식습관, 운동, 체중, 영양 등의 항목 위주로 분석하는 ‘Pathway FIT’ 서비스에 집중하고 있다. Pathway FIT은 Apple, IBM과의 협력을 통해 개인 유전 정보와 헬스케어 정보에 대한 인공지능 왓슨(Waston)으로 분석하여 사용자 효용을 극대화하는 맞춤형 건강 어드바이스 서비스를 제공한다.
(2) 국내 동향
우리나라 또한 해외 주요국과의 글로벌 경쟁에서 우위를 점하기 위해 정부주도로 국내 정밀의료 산업경쟁력 강화를 목표로 적극적인 R&D 투자 및 정책적 지원을 추진하고 있다.
국가과학기술전략회의(2016년)에서 정밀의료를 9대 과학기술 전략 프로젝트의 하나로 선정하였으며 2017년에는 개인맞춤형의료 실현을 목표로 정밀의료사업단을 설립하였다. 우리나라는 대형 대학병원과 국립암센터를 중심으로 암 질환을 대상으로 한 유전체 연구, 유전자 맞춤형 암 치료법 개발 등의 연구를 진행하고 있으며 정부 주도로 10만 명 규모의 정밀의료 코호트 구축으로 유전체 빅데이터 구축을 추진하고 있다. 서울대병원은 2018년 암 정밀의료 플랫폼 사이앱스(Syapse)를 도입하여 임상과 유전체 데이터를 통합하여 유전체 분석・해석을 한층 강화함으로써 암환자에게 보다 효과적이고 다양한 치료를 제공하고 있다.
국내 정밀의료 시장은 빠른 성장이 기대되고 있다. 국내 정밀의료 시장규모는 2017년 3억 달러에서 2.7배 성장하여 2025년 8억 1,000만 달러가 될 것으로 전망된다40). 국내 정밀의료 분야 업체로는 마크로젠, 디엔에이링크 등이 있으며, 주요 서비스로는 유전체 정보를 활용한 유전자 분석 서비스를 제공한다. 마크로젠은 국내외 의료기관들과 네트워크 구축을 통해 유전체 데이터와 의료 데이터를 통합한 빅데이터 기반 정밀의료 기술개발에 집중적으로 투자하고 있다.
특히 마크로젠은 수년간의 유전자 분석 경험을 바탕으로 다량의 유전자를 동시에 검사가 가능한 역량을 갖고 있다. 디엔에이링크는 5만 건 이상의 유전체 데이터베이스를 바탕으로 개인 유전체 분석 서비스를 제공하는 업체로 2019년에는 ‘마이23헬스케어’와 제휴하여 국내 최초로 DTC 유전자 검사 키트를 오프라인 채널을 통해 제공함으로써 유전자 분석 서비스의 대중화를 확대할 계획이다.
다. 지능형 의료
지능형 의료는 다량의 데이터를 인공지능을 활용하여 스스로 학습, 분석을 통해 질병 진단, 예측 및 개인 맞춤형 치료 등의 지능화된 의료 서비스 제공을 의미한다. 지능형 의료에 대한 국내외 정책, 산업 및 시장 동향을 구체적으로 살펴보면 다음과 같다.
(1) 해외 동향
세계 주요국들은 글로벌 시장에서의 선도적 위치를 선점하기 위해 기술개발 및 산업적 활용을 위한 정책적 지원 강화와 함께 구글, IBM 등의 글로벌 IT 기업과 스타트업을 중심으로 인공지능 의료 플랫폼 개발과 혁신적인 의료서비스 제공으로 시장 확산을 추진하고 있다.
미국은 브레인 이니셔티브를 통해 범정부 차원의 인공지능 활용 상용화 연구 지원과 ‘신 미국혁신전략(New Strategy for American Innovation)’에서 의료 데이터의 활용 혁신 및 투자 확대를 통한 보건의료 혁신 과제를 정부차원의 핵심 우선과제로 선정하였다. EU는 ‘인간 두뇌 프로젝트(Human Brain Project)’에서 의료정보 기술 플랫폼 구축 및 인공지능 활용 헬스케어 산업발전을 위한 기술개발을 적극적으로 추진하고 있다. 일본은 ‘미래전략투자 2017’과 ‘신산업구조비전’을 통해 인공지능 기술개발 및 상용화와 개인의 건강・의료 데이터 기반 인공지능 알고리즘 개발을 추진하고 있다. 중국은 ‘13차 5개년 계획’과 ‘건강중국 2030 규획요강’을 통해 빅데이터 지능형 로봇 프로젝트 및 지능형 의료 기술 혁신 강화 등의 실행방안을 마련하여 정부주도로 추진하고 있다.
개인 및 사회적 의료비용 절감과 혁신적인 고품질의 의료서비스 제공을 위해 의료분야에서 인공지능 기술 적용이 확대됨에 따라 글로벌 시장이 빠르게 성장할 것으로 기대된다. 인공지능 헬스케어 시장은 2017년 14억 4,000만 달러에서 42%의 연평균 성장을 통해 2021년 66억 6,000만 달러의 시장규모를 형성할 것으로 전망된다41).
인공지능을 활용한 의료 및 헬스케어 서비스는 질병 진단・예측, 개인맞춤형서비스를 중심으로 글로벌 IT 기업이 시장을 리딩하는 가운데 혁신적인 서비스를 기반으로 한 다양한 스타트업들이 신시장 개척을 통해 글로벌 시장을 확대하고 있다. IBM은 종양학 전문 인공지능 의사인 ‘왓슨 포 온콜리지(Waston for Oncology)’를 개발, 인공지능 학습을 기반으로 암환자에게 빅데이터 기반 치료 옵션을 제공했으며, 의료 영상데이터・정보
분석 전문 기업에 대한 M&A를 추진함으로써 왓슨 플랫폼 중심의 생태계 선도를 추진하고 있다.
구글은 딥러닝을 통해 3차원 영상인식률을 획기적으로 높였으며 수술로봇 등 인공지능을 활용한 다양한 기술 및 서비스 개발에 집중하고 있다. 한편 글로벌 대형 제약사는 인공지능 기업과 협력하여 개발비용・시간 절감 및 높은 효과의 신약을 개발하고 있다. 화이자-IBM은 신약 탐색용 왓슨을 통해 면역항암제 신약을 개발했으며 머크-Atomwise는 인공지능을 활용한 에볼라 치료에 효과가 있는 신약 후보를 발견하였다.
대표적인 스타트업인 Enlitic은 딥러닝 기술을 활용한 의료 이미지 데이터(X-ray, CT, MRI 등) 분석으로 질병 진단, 치료 서비스를 제공하고 있다. Aircure는 인공지능을 활용하여 처방 받은 약을 제 시간에 적정량을 복용할 수 있도록 관리 및 감독해주는 서비스를 개발하였다. Sense.ly는 인공지능 기술을 결합한 원격의료 플랫폼 제공서비스로 퇴원 후 집에서 환자에게 간호서비스를 제공하는 ‘몰리(Molly)’를 개발하였다.
(2) 국내 동향
우리나라는 정부주도의 인공지능과 빅데이터 연계의 기술개발 및 정책지원을 토대로 지능형 의료 산업의 성장기반을 구축하였으며 소수의 스타트업을 중심으로 영상 인식・진단, 신약 개발 등의 분야에서 혁신적인 서비스 개발에 주력하고 있다.
정부는 ‘빅데이터 마스터 플랜(2012)’, ‘데이터 산업 활성화 전략(2018)’, ‘의료기기 안전관리 방안(2016)’ 등을 통해 보건의료 분야의 빅데이터 활용의 기틀을 마련하였으며 인공지능을 활용한 신약개발, 인공지능과 의료용 빅데이터를 적용하여 개발되는 의료기기에 대한 안전관리 기본 방안을 마련하였다. 한편 ‘딥뷰(2014∼2024)’, ‘엑소브레인(Exobrain) 프로젝트(2013∼2023)’ 등의 SW 개발을 통해 향후 의료분야에서 인공지능을 활용한 서비스 개발 시 고품질의 의료서비스 제공이 기대된다.
국내 인공지능 헬스케어 시장 또한 기술발전 및 의료서비스에 대한 질적 수준의 혁신적인 향상을 요구하는 소비자 니즈 증대에 따라 빠른 시장 확산이 전망된다. 국내 인공지능 헬스케어 시장규모는 2017년 46억 7,000만 달러에서 약 5.5배 증가하여 2020년 256억 4,000만 달러의 시장이 형성될 것으로 예측된다42).
국내 인공지능 헬스케어 산업은 일부 대기업 및 소수의 스타트업을 중심으로 국내 산업의 성장을 견인하는 형국이다. 삼성전자는 딥러닝 기술을 영상의학과용 초음파 진단기기에 접목하였으며 유방조직의 빅데이터를 통해 환자의 질병 진단을 지원하는 서비스를 개발하였다. 스타트업인 뷰노는 ‘뷰노-메드본에이지’ SW를 개발하여 골 연령 측정 및 의료영상 인식 측정서비스를 제공하였으며, 루닛도 딥러닝 기술을 통해 실시간 폐질환 진단 등 고정밀의 영상 판독 서비스가 가능해졌다. 스탠다임은 생물학 기술과 인공지능의 결합을 신약개발에 활용하고 있으며, 네오팩트는 중추신경계 질환 환자의 재활을 지원하는 SW를 개발, 재활치료사의 도움 없이 인공지능이 스스로 환자 맞춤형 재활보조 서비스를 제공하고 있다.
라. 디지털 헬스케어
디지털 헬스케어는 언제 어디서나 유무선의 IT 기술 및 제품을 이용하여 실시간 안전하고 편리한 건강관리가 가능한 헬스케어 서비스 제공을 의미한다. 디지털 헬스케어에 대한 국내외 정책, 산업 및 시장 동향을 구체적으로 살펴보면 다음과 같다.
(1) 해외 동향
해외 주요국들은 원격진료를 도입하여 일반인 및 환자의 의료접근성을 높이고 글로벌 ICT 기업들은 개인의 건강 정보를 공유 및 활용하여 디지털・모바일 헬스케어 플랫폼 구축을 통한 산업생태계 구축에 자원과 역량을 집중하고 있다.
미국은 2019년 5대 R&D 우선 과제 중 하나로 건강을 제시하고 NIH의 예산 증액을 통해 효과적인 건강관리를 위한 정부의 R&D 투자를 강조하였다43). 미국은 원격진료 서비스가 활발하게 시행되고 있으며 2014년 6건의 진료 중 1건이 원격진료로 향후 2020년에는 원격진료가 2배 이상 증가할 것으로 전망된다. 영국은 ‘Industrial Strategy: Building a Britain fit for the future’(2017)을 통해 헬스케어 기초과학 지원, 헬스케어 창업 및 기업성장 장려, 연구와 더 나은 환자 보호를 위한 데이터와 디지털기기 활용 강화 등 향후 20년의 디지털 헬스케어 기술 트렌드를 활용하여 글로벌 시장을 리딩할 수 있는 정책 및 전략을 제시하였다. 일본은 ‘신산업구조비전’(2017)을 통해 데이터 기반 플랫폼 구축과 사회문제 해결을 위한 4대 전략분야의 하나로 개인의 건강, 의료 데이터 기반 인공지능 알고리즘 개발 등을 포함한 건강, 의료, 간병전략 로드맵을 제시하였다.
또한, 스마트 기기(폰, 태블릿 PC 등), 사물인터넷, 스마트 센서의 빠른 보급과 대중화로 개인의 건강관리・예방을 위한 모바일 중심의 헬스케어 서비스가 부각되고 있어 디지털 헬스케어 시장의 성장세가 빠르게 커질 것으로 예측된다. 특히, 원격의료, 모바일 건강관리 앱 및 의료기기 분야의 빠른 성장과 언제 어디서나 가능한 실시간 건강 모니터링 이용자의 증가는 디지털 헬스케어 시장의 확산을 촉진하고 있다. 이에 글로벌 모바일 헬스케어 웨어러블 디바이스 시장은 2017년 44억 3,000만 달러에서 연평균 37.4%의 고성장을 통해 2020년 120억 1,000만 달러의 시장규모가 형성될 것으로 전망된다.
대표적인 글로벌 기업으로는 구글과 애플로서 이들 업체는 스마트폰을 통한 건강관리 앱을 다양한 웨어러블 디바이스(스마트폰, 스마트 의류, 스마트 워치 등)와 접목하였다. 개인의 생체정보 등을 포함한 다양한 데이터를 수집하여 헬스케어 플랫폼을 구축함으로써 개인 맞춤형 건강관리 서비스 제공을 목표로 사업을 추진하고 있다. 필립스는 환자가 병원으로부터 받은 검사 정보를 자신의 스마트폰으로 확인하고 건강관리에 활용이 가능한 ‘디지털 헬스 플랫폼’ 솔루션을 개발하였다.
(2) 국내 동향
우리나라는 바이오・의료-ICT 융합을 통한 산업활성화 정책을 기반으로 모바일 건강관리 앱과 다양한 모바일・웨어러블 기기를 통해 개인의 건강정보(혈압, 심전도, 칼로리, 수면시간, 낙상, 섭취 약물, 라이프 로그 정보 등)를 실시간 모니터링하는 방식으로 일반인의 건강관리, 만성질환자의 질병 관리를 위한 산업생태계 활성화 전략을 꾸준히 제시해왔다.
기본적으로 우리나라는 ‘보건의료 빅데이터 플랫폼 구축(2015)’, ‘스마트 헬스케어 산업활성화 방안(2015)’, ‘보건산업발전전략(2016)’ 등을 통해 디지털 헬스케어 산업 활성화의 정책적 토대를 마련해 왔다. 한편, 이러한 정책적 토대 위에 4차 산업혁명의 패러다임을 반영하기 위해 다음과 같은 정책을 적극적으로 추진하고 있다.
‘4차 산업혁명위원회’에서 헬스케어 산・학・연 전문가 및 관계부처로 구성된 ‘헬스케어특별위원회’(2017)를 설치하여 헬스케어 발전을 선도하고 구체적 성과를 창출할 수 있게 하였다. 이에 프로젝트 발굴 및 4차 산업혁명 대응계획(2017)의 헬스케어 부문 이행계획 마련에 집중하고 있으며 이를 통해 ‘4차 산업혁명 기반 헬스케어 발전전략(2018)’을 발표하였다. ‘세계 시장을 선도하는 우리 기술로 누구나 건강한 사회 구현’을 비전으로 설정하고 건강수명 연장, 일자리 창출, 기술수준 향상 등을 달성하기 위한 목표로 헬스케어 빅데이터 생산・관리 시범 체계 운영, 스마트 융복합 의료기기 개발, 헬스케어 산업 혁신 생태계 조성 등 중점 추진과제를 제시하였다. 한편 ‘제3차 생명공학육성기본계획(2017∼2026)’을 통해 헬스케어 산업과 바이오 연구 산업을 융합형 신산업으로 육성과 개인의 건강정보와 IT를 융합한 새로운 의료서비스 및 비즈니스 모델 개발 등의 사업화 지원을 포함하였다.
우리나라의 디지털 헬스케어 산업은 글로벌 최고 수준의 IT기술과의 결합을 통해 스마트폰, 태블릿 PC, 웨어러블 기기 등을 활용한 모바일 헬스케어 산업의 높은 성장 잠재력을 갖고 있다. 이에 국내 모바일 헬스케어 웨어러블 디바이스 시장은 2017년 1,410억 원에서 약 37%의 고성장을 통해 2020년 3,606억 원의 시장규모가 될 것으로 전망된다44).
의료와 ICT 융합 확산을 위한 산업활성화의 정책・기술적 토대를 통해 국내 디지털 헬스케어 산업생태계는 대기업 중심의 헬스케어 플랫폼 개발과 사용자의 이용 편리성을 높이기 위해 착용하기 편리한 스마트 웨어러블 기기 개발을 지향하고 있다. 삼성전자는 개인의 건강정보 데이터를 수집・분석하여 사용자에게 전달하는 디지털 헬스 플랫폼 SAMI를 발표하였으며 다양한 생체신호 계측 센서개발을 위한 웨어러블형 하드웨어 형태의 심밴드를 개발하였다.
스마트폰과 웨어러블 기기 보급이 확대되면서 모바일 기반 의료 및 건강관리 앱이 빠르게 증가하고 있다. 비브로스의 ‘똑딱’앱은 위치기반 기술을 이용하여 병원을 찾을 수 있으며 실시간 예약・접수 기능을 통해 빠르고 편리한 병원 이용이 가능하다. 케어랩스는 국내 최초로 상장한 의료 관련 스타트업으로 병원과 약국 검색 앱인 ‘굿닥’과 뷰티케어 앱 ‘바비톡’을 운영하는 등 디지털 헬스케어 관련 모바일 앱 시장이 빠르게 확산되고 있다. 한편 세계 최초의 휴대용 체성분 측정기기를 개발한 인바디는 12가지 운동인식 트레이닝, 심박수 측정, 수면 분석이 가능한 손목형 웨어러블 기기인 ‘인바디 밴드’를 출시하였다.
마. 발전 과제
4차 산업혁명의 도래와 함께 인공지능・빅데이터・바이오 등의 기술과 ICT의 결합은 새로운 생태계 및 서비스 시장을 창출하는 등 의료 및 헬스케어 산업의 전환을 촉진하고 있다. 이에 의료와 ICT의 융합은 의료산업의 디지털화(Digitalization)를 가속화하고 있으며 이를 토대로 국가의 핵심 성장산업으로 한 단계 도약시키기 위한 전략적 방향은 다음과 같다.
우선, R&D 투자 확대를 통한 기술경쟁력을 확보해야 한다. 시장이 빠르게 성장하고 있는 정밀의료 및 인공지능 헬스케어 산업이 글로벌 시장에서 역량을 갖추기 위해서는 국가 차원의 R&D 투자뿐만 아니라 정부-민간 공동협력의 R&D 추진이 병행되어야 할 것이다. 둘째, 전문인력 양성이다. 유전제, 생물정보학, 인공지능, 빅데이터 등에 전문성을 가진 융합 인력양성을 위한 특성화된 교육과정 마련이 필요하다. 셋째, 양질의 의료 및 개인 데이터의 활용방안 마련이 요구된다. 기본적으로 의료 데이터의 공유・활용을 위한 정부의 가이드라인 제정이 필요하며 이러한 정책은 궁극적으로 민간부분에서 데이터 기반의 다양한 혁신적인 의료서비스 창출을 견인하는 동인이 될 것이다. 넷째, 개인 정보 보호에 대한 제도적 안전장치 마련이 중요하다. 개인 정보의 디지털화는 풀어야할 새로운 과제를 낳는다. 개인의 의료정보가 오용되고 해킹으로 인해 침해를 받게 된다면 서비스 이용의 심각한 장애요인이 될 수 있어 개인정보의 침해를 방지하고 관련 산업이 활성화 될 수 있는 개인 정보보호 및 보안 시스템의 안전성을 강화하는 제도적 개선 방안 마련이 시급하다. 마지막으로 의료-ICT 융합산업 참여자간 상생과 긴밀한 협력의 환경 조성이 필요하다. 의료기관, 연구기관, 보험사, 제약사, IT 기업 및 정부 등 의료-ICT 융합산업 내 이해관계자간 발생 가능한 이슈, 정책적 활성화 방안, R&D, 기업 투자 방안, 개인 정보보호 등에 대한 논의를 활성화하여 혁신적 의료서비스 창출의 토대를 제공해야 할 것이다.
3. BT + NT
가. 개요
나노바이오기술(Nanobiotechnology)는 나노 크기의 분자 및 물질 소재를 활용하는 나노기술(Nanotechnology)을 생명현상을 연구하기 위해 접목한 융합학문으로 정의되며, 기초 생물학에서 의생명공학에 이르는 분야에 광범위하게 적용되는 기술 분야를 일컫는다. 특히, 나노소재는 생명현상에 중요한 생체분자 및 생체 신호를 효과적으로 분석할 수 있는 탐침자(probe)나 센서로 활용되고 있으며, 다양한 약물 소재를 세포 내로 효과적으로 전달하는 약물 전달 소재 등으로 이용될 수 있어, 최근 신약개발과 진단 및 치료에 분야에 중요한 핵심 기술로 부각되고 있다. 특히, 기존의 바이오의료 기술이 가지고 있는 기술적 한계를 극복하기 위해서 나노소재 및 소자가 폭넓게 활용되고 있으며, 생체분자의 동태 및 생체 신호를 정밀하게 측정하고 분석하는 BT와 NT의 융복합 기술을 바이오인터페이스(Biointerface)라고 정의하고 있다.
최근 인간의 기대수명이 100세에 이르면서 ‘호모 헌드레드(Homo-hundred)’라는 신조어가 생겨났으며, 이에 따른 인간의 질병 극복과 개인 건강 관리에 대한 관심이 급격히 증가하고 있다. 특히 손쉽게 건강정보를 모니터링할 수 있는 ‘스마트헬스케어’에 관련된 다양한 기술이 개발되고 있다. BT와 NT 그리고 IT 및 IoT(사물인터넷) 기술이 융합된 바이오인터페이스는 휴대용 전자기기에 연계되어 건강정보를 실시간으로 모니터링하거나, 질병의 징후를 조기에 진단할 수 있으며 뿐만 아니라 환자의 치료 효과를 관리할 수 있게 되었다. 실제로 나노소재 및 센서기술이 접목된 웨어러블 스마트 센서, 생체이식형 의료기기 및 스마트 콘택트렌즈 등이 상용화를 목전에 두고 있다. 또한, 나노 기술은 신약개발 연구 분야에서도 다양하게 활용되고 있다.
치료 약물을 적용 부위에 쉽고 정확하게 전달하거나, 유전자치료제, 세포치료제 및 항체신약 등의 차세대 신약개발의 기술적인 어려움을 해결할 수 있는 바이오융합 기술로 활용되고 있다. 현재 70종 이상의 약물전달 효율을 높이는 나노메디신 의약품이 미국 FDA 승인을 받아 사용되고 있으며, 2018년 보건산업진흥원에서는 향후 10년 내 상용화가 가능한 나노융합 의료기술로 ‘체내이식형 초정밀 약물전달기기’를 포함해 암 조기 진단, AI 재활치료, 실시간 신체정보 활용 헬스케어 서비스, 항노화 요법, 생체 친화형 심혈관계 나노바이오 소재 등을 제시한 바 있다.
바이오나노인터페이스 융합기술은 크게 진단 및 치료 분야에 적용되고 있으며, 진단기술은 나노바이오센서, 나노바이오칩, 나노바이오디텍터, 나노바이오이미징 등을 포함하고 있으며, 치료기술은 나노메디슨, 나노약물전달, 나노재생의학소재, 나노조직공학소재 등을 포함한다.
나. 해외동향
(1) 진단용 바이오나노센서
의료 행위의 패러다임은 예측(Predictive), 예방(Preventive), 개인(Personalized), 참여(Parti- cipatory)의 4P 중심으로 질병의 발병을 미리 예측, 대비하고 개개인에 따라 맞춤형의 의료서비스를 제공하는 방향으로 변화되고 있으며(Leroy Hood, 2008), 영상진단기술, 인공지능(AI), 빅데이터 기술 및 차세대염기서열(NGS: Next Generation Sequencing) 기술의 출현으로 2015년 미국 정부에서 ‘정밀의료계획(Precision Medicine Initiative)’을 발표하였고, 의료기기 분야에서의 4P의 개념은 체외진단기기, 웨어러블 의료기기, 수술용 네비게이션 의료기기 및 스마트 헬스케어를 중심으로 구현되고 있다. 스마트나노센서는 IC와 나노기술의 융합으로 생겨난 고도화된 센서기술로서, 특히 생체신호 진단 및 바이오의료 분야에 활용되는 스마트나노센서를 나오바이오센서로 명하고 있다.
대표적 진단기술인 나노바이오센서는 효소, 항체, 항원, 유전자 등 다양한 종류의 생체수용체(bioreceptor)를 통해 수집되는 생체신호를 나노기술이 접목된 신호변환기(signal transducer)를 거쳐 광학적 또는 전기적으로 표시할 수 있는 통합적 장치이다. 특히 나노입자, 나노와이어 및 나노채널 등의 나노소재 및 구조를 활용하는 신호변환기를 사용하는 모든 종류의 바이오센서를 통칭하며, 신속, 정밀, 정확한 분석을 목표로 기술 개발이 이루어지고 있다. 바이오마커(Biomarker)란 생리활성, 건강정보, 질병 진행 상황, 치료방법에 대한 약물의 반응성을 객관적으로 측정하고 평가할 수 있는 지표로 정의되며 과거에는 혈압, 체온, 혈당 수치 같은 생리학적 지표가 바이오 마커로 주목받았다면, 최근에서는 융합기술과 나노바이오센서 기술의 발전으로 DNA, RNA와 같은 핵산, 단백질, 세균, 바이러스 등이 바이오마커로 주목받고 있다. 극미량의 혈액, 타액, 소변 등의 생체시료에서 바이오마커의 고감도 검출 바이오나노센서 진단기술개발은 암, 치매 등과 같은 난치성 질환의 조기진단과 심근경색과 같은 응급 질환의 골든타임 확보를 위해 질환의 발병을 예측하고 대처하기 위해서도 활용되고 있다.
기존의 생체정보 및 바이오마커 분석은 주로 대형 연구시설 및 연구기기가 집중된 실험실(lab)에서 주로 시행되었으나, 최근에는 병원의 침상(bedside)이나 현장에서 결과를 바로 볼 수 있는 현장진단 검사법(POCT: Point Of Care Test)으로 동향이 변화하고 있다. 의료현장에서는 질병의 진단과 예후, 건강 상태 판정, 질병 치료 효과 판정, 예방 등의 목적으로 인체에서 채취된 대상물을 이용한 검사에 사용되는 의료기기를 체외 진단기기(IVD: In Vitro Diagnostics)로 구분하고 있다. 전 세계 체외진단(IVD) 시장은 2018년 600억 5,451만 달러에서 연평균 성장률
6.73%로 증가하여, 2023년에는 831억 7,722만 달러에 이를 것으로 전망되고 있다(TechNavio, 2018). 2018년 체외진단 분야에서 기술별로는 면역화학/면역분석법이 전체 202억 5,000만 달러로 가장 점유율이 높았으며, 분자진단 분야가 연평균 성장률 8.7%로 가장 빠르게 성장하는 것으로 보고되었다. 활용분야에서는 전염병용 진단기기 시장이 167억 7,000만 달러로 가장 높은 점유율을 보였고 종양학용 진단기기가 연평균 성장률 8.4%로 나타났다(Marketsandmarkets, 2018).
최근 주목받고 있는 유전자편집과 합성생물학 기반기술과 바이오나노센서가 융합된 새로운 진단기술 개발도 시도되고 있다. Broad Institute의 Feng Zhang과 MIT의 James Collins가 공동으로 창업한 Sherlock Biosciences는 CRISPR 기반 기술인 SHEROLCK과 합성생물학 기반 도구인 INSPECTR(Internal splint-pairing expression cassette translation reaction)을 이용하여, 극미량의 Zika 바이러스와 병원성 박테리아를 검출하는 진단테스트 기기 개발을 목표로 하고 있다. SHERLOCK은 바이러스와 박테리아에 존재하는 특정 RNA를 인식하는 Cas13 효소 리포터 시스템을 이용하여, 휴대전화에 연결하여 전기화학신호 판독을 통해 감별하는 기술이다(Myhrvold et al., 2018). INSPECTR은 단일 염기쌍이 결합되는 감도로 Bioluminescence 신호와 결합된 DNA 또는 RNA를 검출하여 실온에서 시각화 할 수 있는 DNA 하이브리드화 센서의 상용화를 위해 연구가 진행 중이다(Stower et al., 2018)
전 세계적으로 생명을 가장 위협하는 암인 폐암에 대한 바이오마커에 대해서도 많은 연구가 진전되었다. 폐암의 조기진단에는 효과적이지 못한 기존 진단법을 개선하기 환자의 소변 냄새를 구별할 수 있는 개의 후각수용체를 이용하여, 암을 진단할 수 있는 센서를 개발하는 연구가 진행되고 있다. 영국의 Owlstone사는 ‘LuCID’라는 호흡측정기를 이용하여 폐암 질병과 관련된 휘발성 유기화합물(VOC)을 환자의 호흡에서 분석하고자 하고 있다(Van Der Schee et al., 2018). 얇은 이차원 박막소재를 이용한 유연성 스마트 분진(smart dust)이 최근 초소형 바이오나노센서로서의 가능성이 검증되고 있다. 최근 전자캡슐의 경구 투여를 통해 장관(gastrointestinal tract)에서 가스와 다양한 생체신호 검출에 성공하였으며(Kalantar-Zadeh et al., 2018), 박테리아에 전자기 센서를 융합한 IMBED (micro-bio-electroniuc device)를 이용해 장출혈 등의 위장 건강을 모니터링 하는데 성공하였다(Mimee et al. 2018). 또한, 경구 투여나 비강을 통해 흡입시킨 후에 생체신호를 모니터링하고 데이터를 전송할 수 있는 스마트분진을 이용한 sensotransmitter기술이 구현된 바 있다(Koman et al. 2018).
(2) 웨어러블/인플란터블 의료기기
바이오나오센서는 기존 POCT 진단에서 몸에 부착하는 웨어러블 스마트기기와 생체에 직접 이식할 수 있는 인체 이식형 의료기기(Implantable Medical Devices) 개발 기술로 옮겨가고 있으며 헬스케어를 포함한 일상생활 전분야로 활용이 기대되고 있다(이상대, 2018).

[그림 3-72] 차세대 바이오센서 연구개발 기술동향
차세대 웨어러블 디바이스 시장 규모가 2018년 45억에서 2022년 약 95억 달러에 이르는 고속 성장세가 예측되었다(IDC, 2018). 인체 이식형 의료기기(Implantable Medical Devices)란 인체에 이식되어 신체기능의 일부를 대체하거나 전기적 자극을 전달하거나 의약품을 주입하는 의료기기로, 심장질환자를 위한 이식형심장박동기, 이식형심장충격기, 항암치료 환자를 위한 항암제, 진통제 등을 일정하게 주입할 수 있는 이식형의약품주입펌프, 청각 장애의 회복을 위한 이식형와우시스템(인공달팽이관장치) 등이 있다. 미국 Alivecor사는 휴대용 심전도, 근전도 모니터링 밴드를 2017년 미국 FDA으로부터 승인받았으며, 일본의 Xenoma사는 전도성 소재를 피복 안에 프린팅하여 심전도, 근전도와 체온 등을 측정할 수 있는 E-skin제품을 CES 2018에서 공개하였다(하와 강, 2018). 웨어러블 혈당센서의 경우, 미국 University of Southern California의 Chongwu Zhou 연구그룹은 Indium oxide(In2O3) 나노 리본 기반 트랜지스터와 플로팅 게이트를 접목하여 매우 유연한 웨어러블 혈당 센서를 제작하여 바늘 없이 체액만으로 혈당을 검출하는 기술을 제시하였다(Liu et al., 2018). 일본 이화학연구소의 Someya 박사 연구팀은 초박형 유기 태양 전지를 유기 전기 화학 트랜지스터와 한 평면에 결합하여 전원이 필요 없는 ‘피부 부착형 심전도 측정 장치’를 개발하였다(Park et al., 2018, Nature).
(3) 치료용 나노메디슨 소재
임상연구 및 실제 치료 분야에 활용되는 나노소재로는 금나노입자(GNP: Gold nanoparticle), 양자점(Quantum dot), 산화철(Iron oxide) 등의 금속 및 무기나노입자와 더불어 리포좀, Dendrimer, Micelle 등의 유기나노입자 중합체 등이 활용되고 있다. 똑같은 약물이라도 전달하는 방법에 따라 효능을 극대화하고 부작용을 최소화할 수 있으며, 필요한 양의 약물을 효율적으로 전달하는 투여경로와 약의 형태를 ‘약물전달시스템’(DDS: Drug Delivery System)이라고 하며, 생체적합성, 저독성 및 생분해성 등을 고려하여 현재 약 80여 종의 나노약물전달체가 미국 FDA에 승인을 받아서 사용되고 있다. 글로벌 약물전달 시장규모는 2016년 1조 1,000억 달러에서 연평균 7.2% 증가하여 2020년에는 1조 6,000억 달러에 달할 것으로 전망된다. 글로벌 기준으로는 Johnson&Johnson이 시장점유율 25.5%로 1위(2016년 기준)를 차지하고 있고, 그 뒤를 Novartis와 Roche가 뒤따르고 있다(Marketsandmarkets, Drug Delivery Technology Market, 2016).

[그림 3-73] 지질기반 약물전달 나노파티클
지난 몇 년간 글로벌 신약 매출 1위를 차지하고 있는 관절염 치료제 ‘휴미라’는 대표적인 항체신약으로 주사제로만 투여할 수 있는 단점을 극복하기 위해 폴리에틸렌글리콜(PEG)과 같은 고분자 나노소재를 이용한 경구 투여제 등을 포함해, 다양한 나노약물전달 소재가 개발되고 있으며(Patra et al., 2018), 캘리포니아대학교 연구팀은 나노입자 기반의 항염증 치료법 개발하였다. 면역세포의 일종인 호중구 세포막으로 코팅된 생분해성 고분자 나노입자를 만들어 ‘나노스펀지’라고 명명하였다. 나노스펀지는 류마티스 관절염이 진행되면서 발생하는 염증성 사이토카인(cytokine)을 흡수하여 염증으로 인한 연골 손상을 최소화 할 수 있는 것으로 확인되었다 (Zhang et al., 2018). 이스라엘 텔아비브대학교 연구팀은 표적세포로 mRNA를 직접 전달할 수 있는 새로운 세포 내 유전자 도입 플랫폼인 ASSET (Anchored Secondary scFv Enable Targeting)을 개발, 이를 이용하여 항염증 단백질의 mRNA를 세포로 도입하여 대장염 증상을 완화시키는 효과를 확인하였다(Veiga et al., 2018). 미국 시티븐스 기술연구소 연구팀은 다공성 나노입자를 이용 항암효과를 지닌 독소루비신을 효과적으로 암세포로 전달할 수 있는 약물전달 기술 개발하였다 (Krausz et al., 2018).
[표 3-49] 대표적 FDA 승인 나노약물전달체 및 약품
|
약품명 (제약사) |
유효성분 |
나노약물 전달소재 |
적용증 |
승인년도 |
|
Doxil®/Caelyx™ (Janssen) |
Doxorubicin |
Liposomes |
Karposi’s sarcoma; Ovarian cancer; multiple myeloma |
1995 2008 |
|
PegIntron® (Merck) |
Interferon-alpha (IFN-α2b) |
PEGylated protein |
Hepatitis C |
2001 |
|
Cimzia® (UCB) |
Certolizumab pegol |
PEGylated antibody |
Crohn’s disease; rheumatoid arthritis; psoriatic arthritis |
2008 2013 |
|
ADYNOVATE (Baxalta) |
Factor VIII |
PEGylated factor VIII |
Hemophilia |
2015 |
|
Avinza® (Pfizer) |
Morphine sulfate |
Nanocrystals |
Mental stimulant |
2002 2015 |
|
Estrasorb™ (Novavax) |
Estradiol |
Micelles |
Menopause hormone therapy |
2003 |
|
DexIron® (Sanofi Avertis) |
Iron |
Iron dextran (high MW) |
Chronic kidney failure with iron deficiency |
1957 |
난양기술대학교 연구팀은 미세침이 포함된 컨텍트렌즈 형태의 안구패치를 개발하였다. 미세침은 각막에서 생분해되면서 약물을 방출하고, 장기적 치료가 요구되는 녹내장, 당뇨망막증과 같은 안구 질환에 새로운 치료 요법이 될 수 있음을 제시하였다(Than et al., 2018). 최근 ‘스마트알약(Smart pill)’으로도 불리는 스마트 약물전달 시스템에 대한 관심이 높아지고 있다. 실제로, 센서, 초소형카메라, 극소형 모터 등을 포함하는 경구용 캡슐 등의 기술개발이 집중되고 있으며, 2025년까지 스마트 알약 시장은 6억 5,000만 달러 시장을 형성할 것으로 기대된다. 핀란드 이위베스켈레 대학과 알토대학 공동연구팀은 주변의 pH(산성도)에 의해서 구조가 변하는 DNA 오리가미(종이접기) 기반 스마트 약물전달 나노 캡슐을 개발하여 특정 암세포에서만 선택적으로 개폐하는 방식으로 표적 치료 효율을 높일 수 있는 것으로 확인되었다(Ijas et al., 2019)
다. 국내현황
(1) 진단용 나노바이오센서
우리나라의 체외진단(IVD) 시장은 2018년 8억 940만 달러에서 연평균 성장률 7.7%로 증가하여, 2023년에는 11억 7,450만 달러에 이를 것으로 전망된다. 체외진단기기 및 POCT 시장은 다국적 기업의 시장 점유율이 매우 높은 시장으로 체외진단기기는 Roche, Alere 등의 다국적 기업이, POCT 현장진단은 Abbott 등이 주도하고 있으며, 국내 기업으로는 분자진단 분야의 랩지노믹스, 마크로젠 및 면역진단 분야의 프로테옴텍 등이 시장진입을 목표로 연구개발을 진행하고 있다.
[표 3-50] 바이오나노센서의 활용 진단기기 개발 국내 기업 현황(BIO SPECTATOR 연감, 2018)
|
기업명 |
대표진단기기 파이프라인 |
내용 |
|
랩지노믹스 |
MomGuard/EnfantGuard CancerSCAN WithGene |
산모의 혈액으로 태아의 기형진단/발달장애 염색체 진단 암환자 표적항암제 선정 동반진단 개인 유전자 분석을 통한 맞춤 건강관리 솔루션 제공 |
|
마크로젠 |
NGS/CES
Mutation Screening |
유전체 분석서비스 및 국내최초 ‘유전제분석 및 임상진단서비스에 대한 PIMS (개인정보관리)인증 획득 NGS 이용 암유전자 돌변변이 검사/반려동물 검사 |
|
바이오니아 |
AccuPower Series |
모기매개감염병, 결핵, 간염 등의 분자진단 |
|
바이오이즈 |
AptaSign Series |
최소혈액 이용 다중 질병진단 플랫폼 |
|
바이오인프라 생명과학 |
아이파인더 스마트암검사 MRM-MS 펩타이드 패널 |
혈액다중지표지자를 이용한 암위험도 예측서비스 다중 펩타이드 마커 분석을 통한 간암조기 진단 |
|
시선바이오 메터리얼즈 |
U-TOP HL Genotype U-TOP Series |
유전성 난청 돌변변이검사 PNA 기반 돌연변이 및 염색체 이상 정밀진단 |
|
신데카바이오 |
NGS-ARS |
차세대시퀀싱 기반 맞춤약물 선별 자동리포팅 시스템 |
|
옵토레인 |
Kaira ZIKA Detection |
모기매개질환 현장진단 Real-time PCR |
|
젠큐릭스 |
GenesWell BCT |
조기 유방암 환자의 예후진단 |
|
지노믹트리 |
EarlyTect Colon Cancer |
대장암조기진단을 비롯한 암진단 시리즈 |
|
테라젠이텍스 |
헬로진 Series 진스타일 |
유전자기반 질병 예측서비스 질병 조기발견을 통한 건강/미용 관리 |
|
파나진 |
PANAmutyper PNAClamp Series |
대장함 환자의 EGFR-TKI 약물저항성 예측 폐암/대장암 등 암유전자 돌연변이 진단 |
|
프로테옴텍 |
PROTIA Allergy-Q |
알레르기 진단검사 |
바이오센서 분야 국내 연구진에 의해서도 다양한 연구결과가 발표되었다. 고려대학교 심상준 교수팀은 광감응성 금나노입자를 이용하여 바이오센서를 개발, 유방암 원인 유전자 BRAC1의 단일염기 돌연변이를 검출하는데 성공하였다(Ma et al., 2019). 연세대학교 최현진 교수 연구팀은 혈액 내 존재하는 질병마커를 혈액 채취나 전처리 없이 실시간으로 감지할 수 있는 새로운 개념의 피부 부착형 모니터링 센서 시스템 및 기술을 개발하였다(Na et al., 2019). 재료연구소 박성규 박사 연구팀과 미국 하버드 의과대학 공동연구팀은 전염병이나 질병의 초기진단이 가능한 초고감도 3차원 바이오센서 칩을 개발하여 휴대용 진단기기를 이용하여 패혈증을 진단 시간을 단축하는데 성공하였다(Park et al., 2019).
(2) 웨어러블/임플란터블 의료기기
웨어러블 센서 및 기기 분야의 국내연구도 다양하게 진행되고 있다. 광운대학교 하태준 연구그룹은 탄소나노튜브 기반의 기능성 나노재료를 기반으로, 구겨지거나 원통으로 구부릴 수 있는 종이형태(paper-like)의 생체 전극을 개발하였다(Kang and Ha, 2018). 종이형태의 생체 전극을 이용하여 심전도 파형을 성공적으로 검출하였다. 연세대 박장웅 연구그룹에서는 2차원 그래핀 나노 구조와 은 나노 섬유를 이용하여 눈물에서 혈당을 바로 측정할 수 있는 콘택트렌즈형 혈당센서를 발표하였다(Park et al., 2018). 연세대학교 김형준 연구그룹에서는 이차원 Transition-Metal DichalCogenides(TMDCs) 박막 기반의 웨어러블 가스 센서를 제작하여 이산화질소를 10ppm 농도까지 검출할 수 있는 것으로 확인하였다(Ko et al., 2018). 한국과학기술원 김상욱 교수 연구팀은 홍합으로부터 분리된 생체고분자 ‘폴리 도파민(Poly-dopamine)’에 열을 가하면 그래핀과 유사한 구조를 형성하여 기존 그래핀 섬유보다 물성을 크게 향상시킨 신개념 탄소섬유를 구현. 특히 전기전도성도 가지고 있어 향후 직물 형태의 웨어러브 장치용 원천소재로 활용 가능한 것으로 확인되었다(Kim I et al., 2018)
(3) 치료용 나노메디슨
한국과학기술원 김인산박사 연구팀은 인체 면역세포를 활성화시키는 새로운 항암 면역 나노단백체 개발, 암세포의 면역세포를 회피반응을 차단시키기 위해 자가조립성 페리틴 나노입자에 특정 단백질(Sirp-alpha)를 표출하도록 설계된 이합체를 이용해 면역반응을 촉발시켜 암세포를 사멸시키는 기술을 개발하였다(Lee et al., 2018). 한국과학기술원 조성오 교수 연구팀은 탄소나노튜브를 이용해 진공밀봉형 초소형 X선 튜브를 개발하여 방사선을 이용한 근접암치료 장비를 개발하여 수술절개에 의한 흉터 없이 암세포를 정밀 타격할 수 있는 기술을 개발하였다(KAIST 2018 대표연구성과 10선). 서울대학교 이태우 교수 연구팀은 미국 스탠포드 대학교 공동연구를 통해 생물의 감각-운동을 모사하는 신축성 인공신경을 개발, 빛 수용체를 모사한 광센서와 생체 시냅스를 모방한 신축성 유기 나노선, 그리고 생체 근육섬유 역할을 하는 고분자 구동장치를 연결하여 인공 신경을 구현하였다(Kim Y et al., 2018). 서울대학교 최영빈 교수팀과 단국대학교 최진호 교수팀은 주사바늘이 필요 없이 근적외선으로 피부를 통해 약물을 전달할 수 있는 이식형 약물전달 디바이스를 개발하였다. 그래핀 기반의 나노입자가 열로 인해 변형되면서 약물을 방출하는 시스템으로 약물전달체를 피부에 이식하고 근적외선을 쪼여 약물이 방출되게 하는 장치를 제시하였다(Lee et al., 2019)
다. 발전 전망
나노소재는 임계성능(초고감도, 초정밀, 극소량, 고난도 제조기술 등) 구현하기 위한 대표적 한계 돌파 융합기술로, 미래 의료사회 실현을 가능하게 하는 필수 핵심소재이다. 나노기술은 재료, 전자, 에너지, 우주항공, 의학 등 거의 모든 산업분야에 응용이 가능하여 높은 경제적 파급성을 지니고 있을 뿐만 아니라 초미세 나노구조체 생산에 에너지효율의 극대화 및 환경유해 부산물 생성을 최소화할 수 있어 친환경 기술로서의 가능성도 크다고 할 수 있다.
미래 유망 산업 촉진을 위한 바이오나노기술은 고령화, 기후변화와 더불어 급속한 인구밀집화 등으로 인한 암과 같은 노인성질환의 증가와 전염성이 강한 감염병의 대규모 유행 가능성 등의 현대사회가 직면한 문제를 해결하는 방향으로 개발되어 가고 있다. 이를 위해 다양한 질병과 전염병을 즉각적으로 대처할 수 있는 현장형 초고감도 정밀진단 기술로의 발전과 즉각적인 치료가 동반될 수 있는 원격진료 및 개인별 맞춤의료를 위한 새로운 개념의 치료약물 모니터링 (therapeutic Drug monitoring), 나노기반 약물전달체, 영상진단 나노조영제, 나노기반 임플란팅 의료기기 등의 신시장이 형성될 것으로 예측되어, 향후 무독성, 친환경, 다기능, 무전력 등의 키워드를 중심으로 한 기술 개발이 주목 받을 것으로 예측된다.
참고자료
-이상대, 차세대 바이오센서 연구개발 기술동향 및 정책제언, 2018, KHIDI 전문가리포트
-하태준, 강병철, 원격의료 모니터링을 위한 ICT 융합 웨어러블 생체 센서, 정보통신평가원, 2018.
-BIO SPECTATOR 연감, 2018
-Ijas H, et al., Reconfigurable DNA Origami Nanocapsule for pH-Controlled Encapsulation and Display of Cargo, 2019, ASC Nano
-Kalantar-Zadeh, K. et al. A human pilot trial of ingestible electronic capsules capable of sensing different gases in the gut Nat. Electron. 1, 79–87 (2018).
-Kang B. C., Ha, T. J, Wearable carbon nanotube based dry-electrodes for electrophysiological sensors,” 2018 Jpn. J. Appl. Phys.
-Kim I, et al., Mussel-Inspired Defect Engineering of Graphene Liquid Crystalline Fibers for Synergistic Enhancement of Mechanical Strength and Electrical Conductivity, 2018, Advanced Materials
-Kim Y, et al., A bioinspired flexible organic artificial afferent nerve, 2018, Science
-Ko K, et al., High performance gas sensor using a large area WS2xSe2-2x Alloy for low power operation wearable applications, 2018 ACS Appl. Mater. Interfaces
-Koman, V. B. et al. Colloidal nanoelectronic state machines based on 2D materials for aerosolizable electronics Nat. Nanotech (2018)
-Krausz AE., et al, Nanoparticle-Encapsulated Doxorubicin Demonstrates Superior Tumor Cell Kill in Triple Negative Breast Cancer Subtypes Intrinsically Resistant to Doxorubicin, 2018. Precis Nanomed
-Lee E, et al., Nanocage-Therapeutics Prevailing Phagocytosis and Immunogenic Cell Death Awakens Immunity against Cancer, 2018, Advanced Materials
-Lee S, et al., Implantable multireservoir device with stimulus-responsive membrane for on- demand and pulsatile delivery of growth hormone, 2019, PNAS
-Liu, Q et al., Highly sensitive and wearable In2O3 nanoribbon transistor biosensors with integrated on chip gate for glucose monitoring in body fluids,” ACS Nano Vol.12(2), 2018, pp.1170-1178.
-Ma X., et al., Single gold-bridged nanoprobes for identification of single point DNA mutations, 2019, Nature commications
-MarketsandMarkets, In Vitro Diagnostics Market by Product-Forecast to 2023, 2018, Markets andMarkets
-Mimee, M. et al. An ingestible bacterial-electronic system to monitor gastrointestinal health Science 360, 915–918 (2018).
-Myhrvold, C et al., Field-deployable viral diagnostics using CRISPR-Cas13. 2018 Science
-Na j., et al., Real-Time Detection of Markers in Blood. 2019, Nano letters
-Park S. et al., Self-powered ultra-flexible electronics via nano-grating-patterned organic photovoltaics, 2018, Nature
-Park, J et al., Soft, smart contact lenses with integrations of wireless circuits, glucose sensors, and displays,” 2018 Sci. Adv.
-Park S., et al., Self‐Assembly of Nanoparticle‐Spiked Pillar Arrays for Plasmonic Biosensing, 2019, Advanced Functional Materials
-Patra et al., Nano based drug delivery systems:recent developments and future prospects. Journal of Nanobiotechnology volume 16, Article number: 71 (2018)
-Shin H, et al., Recent Advances in RNA Therapeutics and RNA Delivery Systems Based on Nanoparticles, 2018, Advanced Therapeutics
-Stower, H. CRISPR-based diagnostics. Nat Med 24, 702 (2018)
-Than A, et al., Self-implantable double-layered micro-drug-reservoirs for efficient and controlled ocular drug delivery, 2018, Nature Communications
-TechNavio, Global In-vitro Diagnostics Market 2019-2023, 2018, TechNavio
-Van Der Schee et al., MS29.04 LuCID Exhaled Breath Analysis, 2018, Journal of Thoraic Oncology
-Veiga N. et al., Cell specific delivery of modified mRNA expressing therapeutic proteins to leukocytes, 2018, Nature communications
-Zhang Q. et al., Neutrophil membrane-coated nanoparticles inhibit synovial inflammation and alleviate joint damage in inflammatory arthritis, 2018, Nature Nanotechnology
제6절
![]()
생명연구자원
1. 개요
2018년 8월 우리나라는 유전자원의 자유로운 활용에 전반적인 제약이 가해지는 나고야의정서를 비준한 바 있다. 지난 2014년 유전자원에 대한 자원소유국의 주권을 인정한 나고야의정서(생물다양성협약 부속 유전자원에 대한 접근 및 공평하고 공정한 이익 공유에 관한 나고야의정서)가 발효됨으로서 바이오분야의 새로운 국제 규범이 출현하게 되었다. 이에 국제적으로 자국의 유전자원에 대한 보호와 통제가 더욱 강화되어 외국 자원을 이용할 경우 자원 취득에 대한 소유국가의 승인을 받아야 한다. 또한 자원 이용에 따른 경제적 이익(유무형의 결과물)에 대하여 공정하고 공평하게 이익을 공유해야 하는 상황이다. 이러한 새로운 국제적 환경이 엄격해짐에 따라 유전자원, 생물자원 등 생명연구자원을 기초소재로 이용하는 생명공학 연구 및 바이오산업에 막대한 파장이 예상되고 있다.
일찍이 국제경제협력개발기구(OECD)는 생명공학기술(BT)이 정보통신(IT) 등 타 분야 기술들과 융합하여 2030년경에 글로벌 경제에 대규모 변화를 가져오는 ‘바이오경제시대’로 진입할 것으로 전망(The Bioeconomy to 2030: Designing a Policy Agenda, 2009)하며, 21세기 인류가 직면한 보건, 식량, 에너지, 환경 등 4대 문제를 해결하는데 바이오기술이 핵심적인 역할을 할 것으로 예측하였다. 보고서는 바이오경제에 대해 ʻ바이오 기술이 경제적 산출량의 상당부분에 기여하는 경제ʼ로 정의하고, 차세대 산업 분야로 주목 받고 있는 생명공학의 중요성을 강조하였다.
이에 앞서 생명공학 발전을 위한 핵심재료인 생명연구자원의 중요성을 인식한 OECD는, 2001년 세계 각국에 고품질의 생물자원 및 정보를 관리 보급하는 생물자원센터(BRC: Biological Resource Center)의 설치를 권고하였다. 생물자원 관리센터는 생명공학 및 관련 산업의 성장을 견인하는 핵심 인프라 기관으로서 국가차원에서 지원해야할 중요 연구기반으로 제시한 바 있다.
따라서 도래하는 바이오경제 시대를 창출하는 핵심자원으로서 무궁한 가치를 지닌 생명연구자원의 중요성을 인식한 각국은 자원의 확보를 위한 치열한 경쟁을 벌이고 있다. 최근 발효된 나고야의정서에 따라 타국의 자원을 이용할 경우 막대한 로얄티를 지불해야하는 새로운 환경에 대한 대응방안이 필요하다. 우리나라 역시 생명공학 산업의 핵심소재인 생명자원의 중요성을 인식하고 법률 및 제도 정비를 통하여 생명자원의 효율적인 관리 및 활용을 위한 기반을 조성하기 위해 노력해 오고 있다.
2007년 건강하고 풍요로운 바이오경제 기반조성을 위하여 과학기술부를 중심으로 농림수산식품부(농림부), 보건복지부(복지부), 환경부, 해양수산부(해수부) 등 5개 부처 공동으로 ʻ국가 생명자원 확보・관리 및 활용 마스터플랜(2007.12.)ʼ을 수립하였다. 이는 생명자원의 국가적인 종합 관리체계를 구축하고, 생명자원 관련 육성정책 수립에 있어 커다란 근간을 마련하는 획기적인 전환점이 되었다.
이러한 토대 위에 2019년 기본법적인 성격의 생명연구자원의 확보・관리 및 활용에 관한 법률(2018년 개정, 생명연구자원법)이 제정되었고, 농림축산식품부의 농수산생명자원의 보존・관리 및 이용에 관한 법률(2007)과 해수부의 해양생명자원 확보・관리 및 활용 등에 관한 법률(2012) 등이 제정되었다. 마스터플랜과 생명연구자원법을 근거로 범부처 차원의 생명연구자원관리 기본계획(2011∼2020)이 국가과학기술위원회에서 확정(2011.5.) 되어, 매년 시행계획을 통해 범부처 차원의 생명자원정책을 종합적으로 추진하고 있다. 또한 생명연구자원법 시행령에 따라 과기정통부 주관으로 6개 부처가 참여하는 책임기관협의회가 운영되고 있으며, 산하에 정보시스템실무위원회와 자원별실무위원회(동물, 식물, 미생물, 인체유래자원)를 두어 생명자원 관련 현안에 대한 효율적인 논의를 진행하고 있다.
2. 연구동향
가. 생명연구자원의 정의
OECD는 생물자원센터에서 관리되는 자원의 정의를 ‘배양 가능한 생물체(미생물, 식물, 동물, 인간세포)와 생물다양성 부분 중 복제 가능한 부분, 배양 불가능한 생물체 및 이와 관련된 분자, 생리, 구조적 정보를 포함하며, 또한 이들로부터 유래되는 유전체, 전사체, 단백체, 대사체, 생물학적 화합물, 추출물, cDNA clone or library, Amplicon, Metagenome 등’으로 규정하고 하고 있다.
현재 우리의 생명자원 정책의 근간이 되는 ʻ국가 생명자원 마스터플랜ʼ에 따르면 생명자원(Bioresource)이란 생물자원, 생물다양성자원, 생명정보자원을 총칭하며, 생명공학 연구기반이 되는 생물체 및 이를 구성하고 있는 구성체로 정의된다. 이를 근거로 생명연구자원법에서도 생명연구자원을 ʻ생명공학연구의 기반이 되는 자원으로서 산업적으로 유용한 동물, 식물, 미생물, 인체유래 연구자원 등 생물체의 실물(實物)과 관련 정보ʼ로 정의하고 있어, 이에 준하여 이후 용어 사용은 ‘생명연구자원’으로 서술하기로 한다.
우리나라의 생명연구자원에 대한 전체 현황은 국가 생명연구자원을 총괄・관리하고 있는 국가생명연구자원정보센터(KOBIC)에서 공개하는 통계자료에 잘 나타나 있다. KOBIC의 2019년 8월 국가생명연구자원통합정보시스템(KOBIS) 자료에 따르면, 국내 생명연구자원은 동물, 식물, 미생물, 인체유래자원 등 실물자원과 생명정보자원을 합쳐 총 7만 7,000여 종 1,610만 건을 보유하고 있는 것으로 나타났다. 이중 실물자원은 약 6만 1,000여 종 900만 건을 보존하고 있고, 종류별 통계를 보면 동물 1만 8,743종 239만 건, 식물 2만 2,989종 328만 건, 미생물은 약 2만 722종 52만 건, 인체유래물자원 274만 건을 보유하고 있다. 또 생명정보의 자원 종류별 통계에 따르면 동물 5,586종 123만 건, 식물 5,607종 240만 건, 미생물은 약 1만 5,057종 302만 건, 인체유래물 24만여 건 등의 생명정보가 등록되어 있는 것으로 나타났다.
나. 생물자원
국가생명연구자원통합정보시스템(KOBIS) 통계에 따른 국내 실물자원 중 생물자원의 종류별・부처별 자원보유량을 보면, 식물자원은 과학기술정보통신부(과기정통부) 약 9,571종 122만 3,713여 건, 농림부 약 10,956종 148만 1,789건, 환경부 약 11,635종 48만 6,742건, 해수부 약 666종 9만 1,950건 등을 보유하고 있다. 동물자원은 과기정통부 약 5,590종 92만 1,456건, 농림부 약 4,821종 28만 5,445건, 환경부 약 1만 4,280종 93만 9,638건, 해수부 약 3,698종 24만 1,535건 등이 등록되어 있다. 미생물자원은 과기정통부 약 1만 3,408종 22만 8,650건, 농림축산식품부(농식품부) 약 5,260종 4만 3,468건, 환경부 약 6,450종 17만 4,669건, 해수부 약 2,768종 7만 3,963건, 복지부 약 646종 3,036건 등을 보존하고 있고, 인체유래물자원은 과기정통부와 복지부가 약 19만 6,872건과 254만 6,584건을 각각 보유하고 있다. 그러나 아직 부처별로 정보 연계가 진행 중이고, 기관별로 분류체계와 정량적 표기단위나 기준에 차이가 있어, 통계지표 표준화를 위한 실물자원 및 정보자원 등 자원 분야별로 분류정보 표준화 위원회를 구성하여 운영 중에 있다.
미생물자원의 대표 관리기관은 한국의 유전자은행으로 알려진 한국생명공학연구원 바이오의약 인프라사업부 산하의 생물자원센터(KCTC)이다. KCTC는 1985년 한국과학기술연구원(KIST)내 설립되어 다양한 국제 공인균주를 확보・관리하여 산・학・연 연구자에 보급하는 자원은행 역할을 수행하며, 국내 생명공학연구의 역사와 궤를 같이하는 최대 자원센터로 발전해 왔다. 현재 약 3만여 주의 세균, 효모, 곰팡이 등 공인균주를 보유하여 세계 8위권 자원센터로서의 위상을 보이고 있다.
매년 PubMed 등재 논문에서 KCTC자원이 활용된 인용지수를 살펴보면, 세계 자원센터 중 독일 DSMZ, 미국 ATCC, 네덜란드 CBS, 일본 JCM에 이어 세계 5위권을 유지하고 있다. 또 전 세계에서 새롭게 발굴・보고되는 신종미생물의 확보 수준에서, 독일, 일본을 제치고 세계 1위의 신종미생물 보유기관으로 국제적인 위상을 보이고 있다.
KCTC는 부다페스트조약에 의한 국제특허미생물보존기관(IDA)로서 국내 특허미생물기탁의 절반 이상을 담당하고 있다. 더불어 ‘국가연구개발사업의 관리 등에 관한 규정(2008.5.)’에 의해 국가연구개발 사업을 통해 확보된 생명자원 연구성과물의 기탁 전담기관으로 지정된 바이오의약 인프라사업부 산하의 보존기관으로 활용기반을 마련하고 있다. 이 외에도 과기정통부가 지원하는 연구소재은행사업을 통해 대학중심으로 특화된 여러 종류의 연구용 생물들이 관리되고 있다.
각 부처별로 운영되는 생명연구자원 정보센터에 공개되는 통계에 따르면, 과기정통부의 생명연구자원정보센터(ARIS)에 공개된 식물자원은 약 2만 6,018종 147만 건을 보유하고 있고, 농림부의 생명자원정보서비스(BRIS)에서는 농촌진흥청(농진청), 산림청 등의 농업식량작물 및 삼림자원을 중심으로 종자, 영양체 등 약 2만 2,586종 242만 2,961건을 보존하는 것으로 나타났다.
과기정통부의 한국생명공학연구원 식물추출물은행, 해외생물소재센터, 연구소재은행 등에서 주로 연구자에게 필요한 식물추출물 형태의 연구자원 약 9만여 건을 관리하고 있으며, 환경부의 국립생물자원관에서 식물표본 729만 점을, 해수부의 해양생물자원관(MBRIS)에서 관속식물 48종을 보존・관리하고 있다. 그러나 우리나라가 확보한 식물종자는 약 15만 점으로 미국(50만 점)의 1/3, 중국(38만 점)의 1/2.5, 일본(28만 점)의 1/1.8수준에 불과하다. 전체 보유 종자 중에서 식량작물의 비중이 가장 높으며 채소, 특용작물, 사료작물 등 타 작물과 야생 식물의 종자 보유는 상대적으로 저조한 실정이다.
국내 동물자원 인프라는 선진국에 비해 아직 미흡한 수준이나, 신약개발 관련 연구들이 진행되면서 투자가 확대되고 있는 양상이다. 한국생명공학연구원은 국제공인 모니터링센터(ICLAS Monitoring Subcenter Korea)를 운영하여 국내 실험동물시설에 대한 병원성미생물 감염모니터링을 지원하고 있다. 2013년 시작된 국가마우스표현형분석사업단(Korea Mouse Phenotyping Center)은 국가마우스표현형분석 컨소시엄(IMPC) 등 국제협력기구와의 적극적인 공조를 통해 마우스 표현형 분석기술의 표준화 및 선진화를 구현하고 세계적 수준의 마우스 표현형분석 서비스의 기반 구축을 위해 운영되고 있다. 현재 마우스는 15만 7,223개체를 관리하며 연구자에게 분양・이용되고 있다. 더불어 최근 신약연구에 필요한 인프라인 국가영장류센터가 설립되어 원숭이 6종 1,031개체, 미니돼지 446개체를 사육・관리 중이며, 한국생명공학연구원 전북분원에 사육생산 시설을 새로 구축하여 약 1천여 마리를 사육・증식하고 있다.
농림부의 농진청, 산림청, 수산과학원 등의 기관에서 가축 3,103종 48만 3,174점을 비롯하여 곤충 6,628종 39만 9,960점, 수생생물 751종 12만 5,550점 등 다양한 동물자원들이 관리되고 있다. 최근 개관한 해수부의 해양생물자원관에서는 무척추동물, 어류 등 약 5,764종의 해양 동물을 관리・보존하고 있다.
국가 생명자원을 관리하는 생명연구자원법에 따라 각 부처별로 지정 운영되는 생명연구자원 국가책임기관 및 기탁등록보존기관은 다음과 같다. 과기정통부는 한국생명공학연구원을 책임기관으로 지정하고, 국립중앙과학관, 국가생명연구자원정보센터, 한국생명공학연구원 바이오의약 인프라사업부, 서울대 한국세포주은행, 한국뇌연구원 한국뇌은행, KIST 천연물연구소 등 6개 기탁기관을 지정 운영 중이다.
농림부는 농진청 산하국립농업과학원과 국립축산과학원, 산림청 산하 국립수목원, 국립산림과학원, 국립산림품종관리센터, 그리고 농림축산검역본부 등 6개소의 책임기관을 지정하고, 농진청 산하 91개 기관과 산림청 산하 33개 기관 등 총 124개의 기탁기관을 운영하고 있다.
보건복지부는 질병관리본부 바이오뱅크과를 책임기관으로, 국가병원체자원은행 등 총 24개소의 기탁기관을 지정・운영 중이다. 환경부는 국립생물자원관을 책임기관으로 지정하고, 국립생태원 등 총 39개소를 기탁기관으로 운영하고 있다. 해양수산부의 국립수산과학원과 국립해양생물자원관을 책임기관으로 지정하고, 한국해양과학기술원 등 총 19개소를 기탁기관으로 운영 중이다.
다. 생물다양성자원
우리나라에 자생하는 생물의 총수는 약 10만여 종으로 추산되고 있다. 2018년 말 기준으로 ‘국가 생물종 목록’에 등재된 생물은 척추동물 1,995종, 곤충 1만 8,158종, 무척추동물 9,410종, 미삭동물류 115종, 관속식물 4,552종, 선태류 925종, 조류(algae) 5,307종, 균류와 지의류 5,226종, 원생동물계 2,337종, 세균계 2,785종, 고세균계 17종 등 총 5만 827종에 이른다. 약 10만여 종의 한반도 전체 생물종 추정치의 50% 정도에 불과하다. 더욱이 생물다양성 연구가 관련 부처의 각 기관별로 분산되어 있어 국가 전체에 대한 정확한 통계를 확보하는 데 어려움이 있다.
과기정통부는 국립중앙과학관을 중심으로 국내 생물다양성에 대한 표본 확보 및 정보의 수집 관리를 주도하고 있다. 생물다양성 통합 DB 및 네트워크 구축 운영사업을 통하여 생물다양성 정보를 구축하고 있으며, 국내 자연사 표본을 소장하고 있는 과학관, 자연사박물관, 자원관 등 57개 관련 부처 기관과의 네트워크인 ʻ국가생물다양성기관연합ʼ의 주관기관으로서 활동하고 있다. 또한 자연사 참조표본 확보 및 활용지원 기반기술 개발 사업을 통해 국내 자연사자원의 인벤토리 구축, 참조표본의 확보 및 분양, DNA확보 연구 등을 수행하고 있다.
현재 국립중앙과학관은 국가자연사연구종합정보시스템(NARIS) 운영과 세계생물다양성정보기구(GBIF)의 한국사무국(KBIF) 역할 수행을 통하여 200만여 건의 생물다양성 정보를 구축하고, 이를 과기정통부 생명연구자원통합시스템(ARIS)에 연계하고 있다.
농림부는 농진청 국립농업과학원에서 식물, 곤충, 누에 등에 대한 국내 야생종, 재래종 등 농업자원의 다양성을 확보하고 있다. 또한 곤충에 대한 유전적 다양성 보존을 위한 자원을 수집하고 있으며, 보존자원에 대한 내병충성 및 주요성분 분석을 통하여 식물자원의 특성평가 사업을 수행 중에 있다.
가장 많은 식물자원 정보를 보유한 산림청 국립수목원은 국가생물종지식정보시스템(Nature)을 통해 식물, 곤충, 버섯, 그리고 야생조수류에 대한 생물다양성 데이터베이스를 구축하고 있으며, 식물표본 100만 점의 DB화를 목표로 정보화를 추진 중에 있다.
환경부는 국립생물자원관을 중심으로 한 자생생물 서식지를 대상으로 생물다양성자원을 수집하고 신종・미기록종을 조사하는 사업을 수행하고 있으며 주요 생물자원의 유전자 분석연구를 통해 생물다양성의 보전・관리의 기초자료를 확보하고 있다. 한반도 자생생물의 생태 등 다양한 정보를 종합적으로 수록한 국가생물종목록, 법적보호대상종, 수집자원을 중심으로 한반도 주요생물 계통수 등 확보 자원의 DB화 및 한반도의 생물다양성을 운영하고 있다.
또한 생물다양성협약 관련 국가의 생물다양성 정보를 공유하는 정보공유체계(CBD- CHM KOREA)를 통해 관련 정보를 제공하고 있으며, 생물다양성정보 17만 7,218건, 표본정보 1,116만 7,037건, 유전자원 28만 2,178건, 유전정보 3만 2,513건, 전통지식 8만 4,166건의 자원을 공개하고 있다.
해수부는 국립해양생물자원관을 중심으로 국내 다양한 해양자원의 체계적 연구를 위해 해양생물종 표본 및 기타 생물자원을 확보하고 있다. 해양생명자원통합정보시스템(MBRIS)을 중심으로 해양생명자원정보를 표준화하고 기관별로 분산된 정보를 통합하여 원생생물 2,273종, 균류와 세균류 2,654종 등 총 1만 740종 57만 5,343건의 해양생명연구정보를 관리하고, 분양, 기탁 등의 역할을 수행하고 있다.
라. 생명정보자원
생명정보는 우리나라 유전체 연구사업이 시작된 2001년 10월 국무조정실 주관으로 과학기술부에서 총괄관리하는 것으로 결정된 이후, ‘국가생명자원 마스터플랜’과 ‘생명연구자원법’을 근거로 국가생명연구자원정보센터(KOBIC)가 출범하고 국가생명연구자원통합정보시스템(KOBIS)이 운영되고 있다. KOBIC은 2010년 9월부터 시작된 1단계 국가생명연구자원 통합체계 구축사업을 통해 다양한 역할과 성과를 도출하였다. 범부처 정보연계표준안을 근간으로 KOBIS를 구축하여 기관들의 정보연계를 추진하였으며, 범부처 정보연계사업으로 농림부 생명자원정보서비스(BRIS), 과기정통부 생명연구자원정보통합시스템(ARIS), 복지부, 해수부 해양생명자원 통합정보시스템(MBRIS), 환경부 등과의 정보연계도 진행하고 있다.
범부처 차원의 협력을 위해 생명연구자원법에 따라 범부처 정보연계 및 통합을 추진하고, 효과적인 정보공유를 위해 관련부처의 책임기관들로 범부처 책임기관협의회를 운영하고 있다. 최근의 KOBIS 통계에 따르면, 국내 생명정보는 동물 5,586종 123만 건, 식물 5,607종 240만 건, 미생물 1만 5,075종 302만 건, 인체유래물 24만여 건, 기타 17여만 건 등 총 2만 6,905종 707만여 건의 자원정보를 보유하고 있는 것으로 나타났다.
농림부는 농작물개발 관련 분야 연구개발 투자를 확대하고 있으며, 부처 내 기관들에 의해 기 구축된 다양한 자원 관련 정보를 통합하여 통합시스템인 생명자원서비스(BRIS)를 구축・운영하고 있다. 환경부는 고유 업무인 야생 생태조사와 기후 변화에 따른 환경조사 및 모니터링을 위해 국내 다양한 지역의 생태조사를 추진하고 있다. 또한 생물다양성 관련법을 마련하여 국가생물다양성센터, 국립생태원, 낙동강생물자원관 등을 설치하였다.
복지부는 국내 보건의료 R&D 발전과 국민의 건강증진을 목표로 2008년 한국인체자원은행사업(KBP:Korea Biobank Project)이 추진되었다. 질병관리본부 국립중앙인체자원은행을 중심으로 17개 대학병원소재 인체자원 단위은행이 한국인체자원은행네트워크(KBN:Korea Biobank Network)를 구성하였으며, 대규모 인구집단 기반(중앙은행) 및 질병기반 인체자원(17단위 은행)을 수집, 관리하여 국내 연구자들에게 분양 중에 있다.
해수부는 해양생물자원관 건립을 통해 해양생명자원분야 거버넌스 확보와 첨단 생명공학기술 및 융합기술을 통해 새로운 도약을 추진하고 있다. 해양생물자원관 건립을 통해 해양자원 확보와 관리시스템을 구축하고 있으며, 2014년 발표된 해양수산 R&D 중장기계획(2014∼2020)을 통해 첨단기술을 활용하고 있다. 또한, 융합기술의 접목을 통해 해양수산업 지원뿐만 아니라 새로운 가치 창출을 통해 산업화에 주력하고 있다.
3. 발전과제
생명연구자원 또는 생명자원은 이러한 바이오 분야의 발전과 혁신을 위한 필수적인 연구소재이며 바이오경제 창출을 위한 핵심 원천재료로 인식되고 있다. 유용 생명연구자원은 과거에는 인류공동의 자산으로 인식되어 누구나 자유롭게 사용할 수 있었으나 최근에는 자원을 소유한 국가의 자원주권이 인정되면서 자원의 중요성이 더욱 조명되고, 특히 나고야의정서 발효 이후 각 국가의 국익적 관점이 부각되고 있다.
2018년 8월 국내에서도 의정서가 본격적으로 적용됨에 따라 국내 생명공학 연구경쟁력 제고와 바이오산업의 지속적 발전에 막대한 파급효과를 미칠 것으로 예상되고 있다. 의정서에 따라 향후 바이오 연구개발 및 산업화 과정에서 다른 나라의 유전자원을 취득할 경우 반드시 자원제공국의 사전승인을 받아야 하며 상호합의조건에 따라 이익을 서로 공유해야 하는 법적 통제체제하에 놓이게 됨을 의미한다.
현재 국제적으로 117개 국가가 의정서 비준을 마치고 국가별로 이행체계를 마련 중인데, 이에 대비한 관련 기관의 대응노력과 더불어 국민과 관련자에 대한 인식제고 활동이 활발하다. 이러한 국내외의 상황변화에 따라 국내 생명연구자원의 활용도를 높이기 위한 인식전환과 국내 생명자원의 확보를 통한 국내 자산화 연구가 필요할 것이다. 더불어 나고야의정서에 대한 자원 관련 연구자들의 인식제고를 통해 국제현안에 대한 대내외적 대응능력을 강화하고 각계 관계자들의 의견 수렴을 통한 효과적인 대응전략을 마련해야 하는 상황이다.
생명자원은 성격상 연구과정을 통하여 산출된 결과물로써 최종 산출물이면서 제품생산을 위한 중간재적 성격도 존재하는 양면적 특성을 반영하여, 도출된 유・무형의 이익을 연구자 개인과 국가가 어떻게 적정하게 분배할 지에 관한 논의가 필요하다. 또한 외국자원을 이용할 경우 자원 소유국과 어떻게 어느 수준으로 이익을 공유해야 하는지 국가 또는 기관 수준의 적정한 가이드라인을 제시할 필요가 있으며 이에 대한 심층적 논의가 요구되는 상황이다.
참고자료
-국가 생명자원 확보, 관리 및 활용 마스터플랜, 2008, 과학기술혁신본부
-생명연구자원관리 기본계획, 2011, 교육과학기술부
-생명연구자원관리 시행계획, 2018, 과학기술정통부
-국가생명연구자원 통계자료집, 2018, 국가생명연구자원정보센터
-바이오경제시대 과학기술정책의제 연구사업: 바이오 연구 인프라 관리 활용 실태 및 개선방안, 신은정, 2015. STEPI
-ABS Brief 나고야의정서 국내외 동향 88호, 장영효외, 2019, 한국생명공학연구원
-Bioin 스페셜웹진, 생명연구자원 창조경제의 핵심기반. 장영효. 2013. 제36호
-Bioin 스페셜웹진, 생명연구자원 연구개발 동향. 정동수. 2013. 제36호
-Bioin 스페셜웹진, 생명연구자원 생물다양성 연구 동향 백운기. 2013. 제36호
-국가생명연구자원통합정보시스템 KOBIS(www.kobis.re.kr)
-과기정통부 생명연구자원정보시스템 ARIS(www.aris.re.kr)
-농림부 생명자원정보서비스 BRIS(www.bris.go.kr)
-복지부 한국인체자원은행네트워크 KBN(www.cdc.go.kr)
-국가 생물다양성 정보공유체계 CBD-CHM KOREA(www.kbr.go.kr)
-국립생물자원관 한반도의 생물다양성(species.nibr.go.kr)
-해양부 해양생명자원통합정보시스템 MBRIS(www.mbris.kr)
-과기정통부 국가자연사연구종합정보시스템 NARIS(www.naris.go.kr)
제7절
생명공학 인프라(장비・시설)
가. 개요
일반적으로 생명공학 분야의 경쟁력을 강화하기 위해서는 핵심기술 개발뿐만 아니라 산업에 대한 경쟁력 확보를 위해 징검다리 역할을 할 수 있는 생명공학 인프라의 확충 및 내실화가 매우 중요하다. 특히 생명공학 제품의 고부가가치화, 안전성확보, 인류의 건강 등에 대한 이슈가 더욱 중요해지면서 생명공학 인프라는 실용화 기술개발 및 산업화에 필요한 강건한 뼈대 역할을 해주기 때문이다. 아울러 정부의 ‘바이오헬스산업 혁신전략 발표(2019.5)’를 통해 전 세계 바이오헬스 시장이 개인맞춤형 치료기술 중심으로 발전함에 따라 의료기술 혁신의 핵심기반이 ‘데이터’ 라는 인식 아래 바이오헬스 빅데이터 플랫폼 구축, 데이터 중심병원 등이 매우 강조되고 있는 시점이다.
실용화기술개발 단계의 세부과정은 순수연구 및 독창적・창의적 ‘기초연구(Basic research)’→개발가능성 확보 및 효능확인의 ‘응용연구(Applied research)’→Prototype 및 시제품 제작의 ‘개발(Development)’→대량생산의 가능성 확보 및 제품성능평가의 ‘시 생산(Pilot-plant)’→대량생산 및 품질관리의 ‘산업화(Manufacturing)’ 과정 등으로
세분화 할 수 있으나, 생물산업의 경우에는 타 산업 분야와 달리 차별성 및 특이성이 있다. 이는 개발→시 생산→산업화 등을 거치면서 개발될 제품(의약품 및 식품 등)을 최종적으로 인체에 적용하기 위하여 체내 안전성・유효성 등에 대한 신뢰성평가(비임상 GLP, 임상 GCP, 우수제조기준 GMP 등)를 필수적으로 거쳐 객관적인 성능 검증을 받아야 한다는 점이다. 또한 전체적인 연구과정에 필요한 데이터 플랫폼 활용(개인 건강정보 및 환자질병정보 등 바이오 빅데이터, 데이터중심병원, 신약후보물질 및 바이오특허 빅데이터 등)이 적절히 접목되어야 하는 특징이 있다. 이러한 생물산업의 실용화기술개발 단계에서 ‘R&D 기능’을 전-후, 좌-우, 상-하에서 적기에 지원해 주는 기술 하부구조인 ‘인프라 구조(Infra-structure)’의 효율적인 체계 구축은 생물산업의 지속가능한 성장을 촉진시키는 필수 요인이 된다.
생명공학 인프라 분야와 관련하여 실용화기술개발의 ‘응용연구’ 과정까지는 주로 한국생명공학연구원, 한국화학연구원, 한국식품연구원, 한국한의약연구원, 한국기초과학지원연구원, 한국표준과학연구원, 한국과학기술연구원, 한국전자통신연구원 등의 정부출연기관과 정부에서 지원하는 연구소재은행 및 한국세포주은행(과학기술정보통신부), 줄기세포・재생연구센터(보건복지부) 등을 중심으로 R&D 인프라가 구축・운영되고 있다.
‘응용연구’ 과정 이후부터는 산업화에 특화된 지원을 위해 산업통상자원부를 중심으로 R&D 및 시제품 제작・생산에 필요한 고가의 시설・장비, 관련 기업의 창업∼성장 단계별 지원을 위한 인프라인 산학연공동연구기반구축센터, 바이오벤처기업지원센터(BVC: Bio Venture Center), 지역특화센터, 한국바이오협회 코리아바이오허브센터(Korea Bio-Hub Center) 등과 우수의약품 제조기준(cGMP)에 맞는 (주)바이넥스(舊 한국생산기술연구원) 생물산업기술실용화센터 등이 구축・운영되고 있다.
특히, 생물산업(의약품 등)제품의 신뢰성평가에 특화된 인프라는 안전성평가연구소(KIT)를 포함하여 보건복지부 식품의약품안전처에서 지정된 비임상(GLP) 기관과 임상(GLP) 기관이 구축・운영되고 있다. 또한 의약품 개발 R&D 비용 중 2/3 정도를 비임상 시험 비용으로 사용하고 있으며, 그 중 30% 이상을 전문연구용역기관(CRO)에서 사용하는
것으로 추정되고 있다. CRO의 주요 성장기반이 되는 제약분야가 지속적으로 확대됨45)에 따라, 바이오산업 글로벌 진출을 위한 CRO 육성의 중요성이 어느 때 보다도 강조되고 있다. CRO는 기업 입장에서는 의약품 개발 과정에서 소요되는 비용의 절감을, CRO 회사 입장에서는 수익의 창출로 서로에게 이익이 될 수 있다.
최근 바이오데이터 플랫폼의 중요성이 강조되면서 개인 건강정보 활용 측면에서는 2015년부터 한국정보통신기술협회(PHR)기반 개인맞춤형 건강관리시스템 개발을 위해 서울대학교의 표준 및 가이드라인 개발, 라이프시맨틱스, 디케이아이테크놀로지 기업을 통한 정보 플랫폼 구축 및 활용, 병원 등과 연계한 다양한 기업을 통한 서비스 실증 연구체계를 구축하고 있다. 질병정보 활용 측면에서는 2018년부터 CDM기반 정밀의료데이터 통합플랫폼 기술개발을 위해 분당서울대병원, 서울아산병원, 아주대학교병원의 통합데이터 구축 및 플랫폼 고도화, 서울삼성병원의 표준 및 가이드라인 개발, 병원 등과 연계한 다양한 기업을 통한 서비스 실증 연구체계를 구축하고 있다.
[표 3-51] 실용화기술개발 단계별 생물산업 관련 주요 인프라 현황
|
인프라단계 |
세부구분 |
인프라기관 |
주요역할 |
|
Research
(기초연구 및 응용연구) |
의약바이오
|
한국한의약연구원 한국표준과학연구원 한국과학기술연구원 |
한의학표준화기반 연구 바이오분야 측정표준 연구 표적지향형 신규항암제 후보물질 연구 |
|
산업/그린/ 융합바이오
|
한국생명공학연구원 한국생명공학연구원 한국생명공학연구원 한국생명공학연구원 한국식품연구원 한국화학연구원 한국전자통신연구원 한국과학기술연구원 한국뇌연구원 |
바이오제품 안전성평가 및 정보관리 국가영장류센터 운영 바이오융합 연구 국가생물자원정보 관리 식품기능성 및 신소재・신공정 연구 화학기술 분야 연구 및 성과 보급 유비쿼터스 건강관리모듈/시스템개발 실시간 분자영상 스마트센서기술 개발 뇌손상기전 등 다학제융합기술 기반 뇌 연구 |
|
|
종합분야
|
한국기초과학지원연구원 한국세포주은행 한국생명공학연구원 한국생명공학연구원 |
고가의 바이오 연구기자재 활용 미생물 및 세포주은행(관리 및 공급) 해외생물소재(식물) 허브센터 국가생명공학정책연구 및 확산 |
|
|
Development Pilot-plant Manufacturing
(개발, 시생산 및 산업화) |
산기반 공동장비/연구지원
|
경기바이오센터 등 5개 한국식품연구원 한국화학연구원 한국화학연구원 부산대학교 항노화센터 |
산학연공동연구기반구축 건강기능식품플랫폼 신약개발플랫폼, 바이오화학실용화 Drug Repositioning 연구지원 항노화산업 제품화 연구지원 |
|
벤처기업지원 |
한국생명공학연구원 등 9개 |
바이오벤처기업지원센터(TIC를 포함 BVC) 구축 |
|
|
지역 클러스터
|
대전테크노파크 등 22개 (지원기반정비 13개 별도)
|
지역특화산업 분야 혁신역량 제고 (시설・장비지원, 기술지원, 교육훈련, 시생산(Pilot plant, GMP 등) 및 공인검사지원 등 수행) |
|
|
종합분야
|
(주)바이넥스(舊 생기원) 한국생명공학연구원 한국바이오협회 순창군 장류사업소 |
생물산업 기술실용화센터건립(cGMP) 바이오 안전성정보센터(LMO관련) 코리아 바이오허브 구축(Networking) 발효미생물종합활용센터건립(전통식품) |
|
|
GLP(비임상) GCP(임상) (신뢰성평가) |
GLP(비임상)
|
식약처 지정 GLP 25개 (안전성평가연구소 등) |
비임상 시험항목별 허가기관(’17.4.)
|
|
GCP(임상) |
식약처 지정 GCP 184개 |
임상1상, 임상2상, 임상3상(’16.12.) |
|
|
바이오 빅데이터
(데이터플랫폼) |
PHR (Personal Health Record)
|
서울대학교 병원(표준/가이드라인) 라이프시맨틱스(플랫폼) 디테이아이테크놀로지 (플랫폼) |
*실증체계 구축: 유비플러스, 비트컴퓨터, 피플앤드테크놀러지, 하이디어솔루션즈, 두브레인, 헬스맥스, 휴레이포지티브, 미디어젠, 소프트넷, 브이티더블유 및 다수병원 |
|
CDM(EMR의 Common Data Model)
|
분당서울대병원, 서울아산병원, 아주대학교병원(통합 데이터 구축 및 플랫폼 고도화) 서울삼성병원 (표준/가이드라인) |
*실증체계 구축: 엠투아이티, 셀바스에이아이, 씨앤텍시스템즈, 파미니티 및 다수병원
|
주) 의약 바이오: 바이오 신약, 바이오 장기 등 바이오 기술을 보건의료 분야에 응용한 것
산업/그린바이오: 건강기능식품, 바이오 매스, 바이오 플라스틱 등 바이오 기술을 농축산, 식품, 바이오 플라스틱, 바이오 연료 등에 응용한 것
융합 바이오: 바이오 공정, 바이오 환경, 바이오 에너지 등 바이오 기술을 산업공정/생산 및 환경 분야에 응용한 것
BVC : 바이오벤처기업지원센터(Bio Venture Center), 전국 바이오벤처기업지원센터 간 협력네트워크 및 전략적 연계운영시스템 구축을 통한 효율적 기업지원시스템 구축, 바이오산업의 지역별 균형발전을 도모하기 위해 설립・운영(지역대학 중심으로 지원한 TIC(Technology Innovation Center) 포함
지역클러스터(지역특화센터): 지역특화산업 분야의 혁신역량을 제고하기 위하여 지역내 설치 운영되는 센터이며, 지역의 기획 및 기술개발역량의 중재자 기능을 수행
산기반 공동장비/연구지원: 산업부 산업기술기반조성/산업핵심기술개발 등으로 지원된 인프라
나. 현황
(1) 기초・응용연구 단계 인프라
기초・응용연구 단계 인프라는 기초이론 및 실험, 실용 목적의 아이디어 특허 등 개념 정립, 연구실 규모의 기본성능 검증, 연구실 규모의 부품 및 시스템 핵심성능 평가 등을 지원하는 인프라에 해당되며 주로 국책연구원을 중심으로 인프라가 형성되어 기술개발을 지원하고 있다.
특히 기초・응용연구 단계에서 가장 큰 비중을 차지하는 한국생명공학연구원은 바이오제품 안전성평가 및 정보관리, 국가영장류센터 운영, 바이오 융합 연구, 해외생물소재 허브센터 운영, 국가생명공학정책연구 및 확산 등의 기능을 담당하고 있다. 한국식품연구원은 식품기능성 및 신소재・신공정 연구를 담당하고 있으며, 한국화학연구원은 바이오 분야를 포함한 화학기술분야 연구 및 성과보급을 담당하고 있다. 한국과학기술연구원은 표적지향형 신규항암제 후보물질 연구, 실시간 분자영상 스마트센서기술 연구 등의 기능을 담당하고 있으며, 한국뇌연구원은 뇌손상기전 등 다학제적인 융합기술기반의 뇌 연구를 담당하고 있다. 기타 한국한의약연구원의 한의학표준화연구, 한국전자통신연구원의 유비쿼터스 건강관리시스템 연구 등도 중요한 인프라 기능을 담당하고 있다.
또한, 기초・응용연구 환경에 종합적으로 필요한 2개의 핵심 인프라로 분석기능을 지원하고 있는 한국기초과학지원연구원과 연구개발 검증에 필요한 세포주를 지원하고 있는 한국세포주은행을 꼽을 수 있다. 한국기초과학연구원은 1988년 기초과학 진흥을 위한 연구지원 및 공동연구 수행을 목적으로 설립되어 국가적 대형 공동연구장비 개발・설치・운영, 첨단 연구장비 이용자 교육, 범국가적 연구장비 정보수집・분석 등의 기능을 담당하고 있다. 2015년 현재 대덕 및 오창 본원, 지역특화산업을 기반으로 한 10개 분원(서울, 서울서부, 부산, 대구, 광주, 전주, 춘천, 순천, 강릉, 제주)에 총 254명의 인력 및 170종의 지원장비(BT, NT, ET 분야로 구분하여 분석포털시스템(USE-KBSI)을 통해 인프라 지원 중)를 보유하고 있다. 한국세포주은행은 1982년 전국의 연구기관에 필요한 세포주 개발・공급을 목적으로 설립되어 세포주 자원에 관련 정보 수집・보존・공급, 세포주 관련 각종 교육・연수・학술회의 실시, 특허출원 세포주의 기탁 및 보존 등의 기능을 담당하고 있다. 세포주 품질관리에 필요한 각종 실험기자재 및 실험 보조장치를 확보하고 있으며, 1993년 UN 산하 세계지적재산권기구로부터 특허미생물의 국제기탁기관의 지위를 취득하였고, 현재 자체개발 세포주 330여 종, 외국도입 세포주 430여 종을 보유하고 있는 세계 5대 은행으로 꼽히는 규모이다.
(2) 개발・시생산 및 산업화 단계 인프라
개발・시생산 및 산업화 단계 인프라는 기초단계 이후의 효능검증 연구・확인, 확정된 부품・시스템의 시작품 제작・평가, Pilot 규모의 시작품 제작 및 성능 평가 등을 지원하는
인프라에 해당된다. 대부분 산업통상자원부 지원 기관을 중심으로 인프라가 형성되어 의약바이오, 산업바이오, 융합바이오 분야의 산업화를 지원하고 있다.
산업화 지원 인프라는 기본적으로 기업성장 단계별 지원(창업보육 등), 시설・장비구축・활용, 교육훈련, 정보교류, 기술지도 등을 담당하고 있다. 인프라 구축 형태로 크게 구분하면, ① 생물산업실용화기반(CGMP, 발효미생물활용센터), ② 바이오 안전성 정보 및 바이오 분야 국제 협약 운영기반(LMO), ③ 연계협력기반(Korea Bio-Hub), ④ 산업기술기반조성(BVC, 산학연공동연구기반, 플랫폼센터, DR센터), ⑤ 지역클러스터(지역특화센터) 등으로 구분될 수 있으며, 국내 생물산업의 여건 및 경쟁력을 고려하여 산업통상자원부 중심으로 전략적으로 구축되었다.
생물산업 실용화기반 부분을 살펴보면 1998년 국내 생물의약 분야의 성장에도 불구하고 미국 FDA의 인증을 받은 우수의약품 제조 및 품질 관리기준인 CGMP46)기준의 생산 공장이 전무한 실정이다. 이를 감안한 선진국 수출지원을 위하여 미국 FDA, 유럽 EMA가 요구하는 기술적 사항을 종합적으로 반영함으로써 국제적으로 인정된 기준에 맞는 생물의약품 전문생산시설 생물산업기술실용화센터(1998∼2007)47)가 구축되었다. 현재는 바이넥스에서 운영하고 있으며, 2007년 국내 발효식품산업 육성을 위해 전통발효식품(고추장, 된장 등)의 안전성 확보 및 발효미생물자원의 허브 구축을 위하여 발효미생물종합활용센터(2007∼2010)48)가 구축되었다.
바이오안전성기반 부분을 살펴보면, 2002년 LMO(유전자변형생물체)를 중심으로 대두된 국제무역질서에 대응하기 위한 의무사항・교육・홍보 등을 위하여 바이오안전성정보센터(2002∼), 바이오분야 국제협약운영센터(2008∼), 바이오안전성평가관리사업(2008년∼) 등이 구축되었으며, 연계협력기반 부분을 살펴보면, 국내외 바이오네트워크 구축・활성화
및 웹포털 구축・운영을 통한 각종 협업기관 지원을 위하여 코리아바이오허브센터(2004∼)가 구축되었다.
또한 산업기술기반조성 및 지역클러스터 부분을 살펴보면 수도권을 포함한 각 지역에 소재한 중소 바이오 벤처기업 등의 특성화 지원 및 현장 밀착형 지원을 위해 산업정책 차원에서의 바이오벤처기업지원센터(BVC, 1998∼2007)49)와 산학연공동연구기반구축(200년∼2011)50), 지역균형발전 차원에서의 지역 바이오 클러스터(지역특화센터, 2002∼ 2012)51), 건강식품개발 및 신약개발을 위한 플랫폼구축(2009∼2014), Drug Repositioning 기술을 이용한 신약개발 활용 시스템 구축(2010∼2015), 바이오화학실용화센터 구축(2010∼2014)52), 지역산업 육성을 위한 융복합 연구지원(2012∼2015) 및 항노화제품개발 인프라(2011∼2015)53) 등이 구축되었다.
(가) 산업화 인프라 지원 현황
산업화 지원 인프라는 국비지원 종료 후 대부분 운영자립화 단계에 있으며, 지역 내외의 산학연 고객 수요, 정부・지자체 등 비R&D 자금 수주 등을 통해 전국적으로 생물산업 제품의 산업화를 직간접적으로 지원하고 있다. 이는 2019년까지 큰 변동 없이 지속적으로 유지되고 있으며, 2017년 말까지의 규모로 잘 유지되고 있다. 2017년까지 지급한 국비지원금은 29개 기관, 60개 과제(2단계 13개 포함)에 총 6,279억 3,100만 원이 지원되었으며, 60개 과제는 CGMP 1개, LMO 3개, 산기반 3개, 네트워킹 1개, 발효산업 1개, BVC 9개, 지역특화센터 36개(2단계 13개 포함), 산업핵심 및 산기반 인프라 7개로 구성되어 있다.
광역경제권역별로 2017년까지의 정부 지원 금액(지원과제 수 포함) 비중을 살펴본 결과, 호남권이 23%(1,441억 원, 14개) 지원되었으며, 충청권이 22.7%(1,428억 원, 16개), 수도권이 19.5%(1,226억 원, 4개), 대경권이 10.07%(631억 원, 9개), 동남권이 8.8%(555억 원, 9개), 강원권이 8.1%(511억 원, 5개), 제주권이 7.8%(487억 원, 3개) 순으로 지원되었다.
한편, 지원 분야별 지원 금액(지원 과제수 포함) 비중을 살펴본 결과, 각각 산업/그린바이오 분야가 52.7%(3,310억 원, 36개), 의약바이오 분야가 33.8%(2,121억 원, 15개), 복합지원(의약/산업/그린) 분야가 8.8%(552억 원, 5개), 융합바이오 분야가 4.7%(296억 원, 4개) 등의 비중을 차지하고 있다.
60개 지원과제별 지원서비스 분야별 현황(2개 이상 지원 역할 포함)을 살펴보면, Pilot Plant 지원이 70.0%(42개), GMP 지원이 56.7%(34개), 공인인증검사(식품위생검사 등 포함)가 45.0%(27개), 기타(연구지원, 정보제공 등)가 20.0%(12개) 등으로 주요 역할이 생물산업 제품화 지원을 위한 시제품생산 및 공인시험 인증지원에 큰 비중을 두고 있다.

[그림 3-74] 광역경제권역별 산업화 인프라 지원 현황(∼2017)

[그림 3-75] 지원분야별 산업화 인프라 지원 현황(∼2017)
(나) 산업화 인프라 지원 성과
생물산업 제품화 지원 인프라 구축을 통해 2017년 8월말 현재 총 34만 1,821평의 부지가 사용되었으며 행정동, 연구동, 장비지원동, Pilot Plant, 기업입주 공간 등의 건물 규모는 총 12만 8,243평이고, 인프라 지원 상주인력은 총 1,152명(기관 평균 39.7명의 전담인력을 보유)에 이르고 있다.
구체적으로 광역경제권역별로 구분하면 수도권이 부지 1만 5,973평, 건물 1만 3,099평, 전담인력 178명, 충청권이 부지 2만 138평, 건물 1만 2,961평, 전담인력 204명, 호남권이 부지 17만 4,074평, 건물 4만 3,890평, 전담인력 365명, 동남권이 부지 3만 8,621평, 건물 1만 306평, 전담인력 90명, 대경권이 부지 4만 8,585평, 건물 1만 5,876평, 전담인력 186명, 강원권이 부지 3만 8,905평, 건물 2만 8,098평, 전담인력 79명, 제주권이 부지 5,525평, 건물 4,013평, 전담인력 50명 등으로 구성되어 있다.
지원분야별 비중을 살펴보면, 산업/그린바이오 분야 부지가 54.7%(186,891평), 건물이 46.9%(60,187평), 전담인력이 51.5%(593명), 의약바이오 분야 부지가 36.0%(123,216평), 건물이 30.3%(38,920평), 전담인력이 33.8%(389명), 융합바이오 분야 부지가 2.1%(7,230평), 건물이 3.0%(3,875평), 전담인력이 2.4%(28명), 복합지원 분야 부지가 7.2%(24,484평), 건물이 19.7%(25,261평), 전담인력이 12.3%(142명) 등의 비중을 차지하고 있다. 또한, 2017년 8월까지의 산・학・연 등 지원성과를 보면 입주기업 수가 808개, 장비구축 건수가 7,733건, 기술지도 및 기술상담 건수가 1만 1,589건, 세미나 및 교육훈련 건수가 3,575건, 각종 산업화 지원 등을 통한 수익금 현황이 674억 원 등으로 지속적으로 생물산업 관련 지원역할을 충실히 하고 있다.
지원분야별 2017년 8월 기준 성과 비중을 살펴보면, 산업/그린바이오 분야 입주기업이 66.0%(533개)이며, 장비구축 건수 73.0%(5,644건), 기술지도 및 기술상담 건수 48.9% (5,669건), 세미나 및 교육훈련 건수 54.9%(1,962건), 수익금 규모 42.36%(285억 원)이다. 한편, 의약바이오 분야 입주기업은 22.6%(183개)이고, 장비구축 건수 19.7%(1,520건), 기술지도 및 기술상담 건수 23.9%(2,764건), 세미나 및 교육훈련 건수 22.7%(813건), 수익금 규모 41.8%(282억 원)로 나타났다. 융합바이오 분야의 입주기업은 3.1%(25개)이고, 장비구축 건수 1.5%(116건), 기술지도 및 기술상담 건수 2.8%(320건), 세미나 및 교육훈련 건수 2.0%(72건), 수익금 규모 1.6%(10억 6,000만 원)이다. 복합지원 분야 입주기업은 8.3%(67개)이며, 장비구축 건수가 5.9%(453건), 기술지도 및 기술상담 건수 24.5%(2,836건), 세미나 및 교육훈련 건수 20.4%(728건), 수익금 규모 14.3%(9억 6,000만 원) 등의 비중을 차지하고 있다.
(3) 신뢰성 평가 단계 인프라
신뢰성 평가 단계 인프라는 최종 개발제품의 산업화 전후 단계에서의 인체 적용을 통하여 체내 안전성・유효성 등에 대한 신뢰성(비임상, 임상 등) 확보를 지원하는 인프라에 해당되며, 대부분 보건복지부(식품의약품안전처)의 인허가를 득한 지원기관을 중심으로 인프라가 형성되어 지원하고 있다. 구체적으로 식품의약품안전처로부터 비임상시험관리기준(GLP: Good Laboratory Practice) 시험기관으로 지정된 기관은 1988년∼2017년 4월까지 31개 기관이었으나, 6개 기관의 지정취하로 인해 2019년 5월 현재 20개 기관이 운영 중에 있다. 임상시험관리기준(GCP: Good Clinical Practice) 기준에 맞는 자격기준을 갖추고 있고 식품의약품안전처에서 임상시험실시기관으로 지정된 국내기관은 208개가 지정되었으나, 2019년 6월 현재 193개 기관이 운영 중에 있다. 특히 GLP 기관은 수도권에 전체의 55%에 해당하는 11개가 위치하여 비임상 지원을 하고 있으며, 충청권에 25%에 해당하는 5개, 호남권에 2개, 대경권에 1개, 강원권에 1개씩 위치하고 있다.
특히, 산업통상자원부는 2010년부터 대규모 투자가 이루어지고 있는 의약품에 관한 임상 수요를 국내 임상 전문연구용역기관(CRO: Contracted Research Organization)을 통해 충족시킴으로써 국내 개발사에 대한 전문 서비스를 저비용으로 신속하게 제공하고 있다. 동시에 국내 임상 CRO 산업의 육성을 위해 ㈜드림씨아이에스, ㈜씨엔알리서치, ㈜지디에프아이, ㈜엘에스케이글로벌파마서비스 등 4개의 국내 대표적인 임상 CRO 회사를 중심으로 핵심 인프라 구축을 지원하였다. 즉, 국내 CRO 관련 산업의 성장과 발전을 도모하고 국내 임상 CRO의 활성도를 제고하여 바이오 의약품의 해외진출을 지원하는 역할을 담당하고 있다. 주요 서비스 내용으로는 ① 글로벌 기준에 맞는 임상시험자료 관리시스템(CDM) 구축, ② 다국적 임상시험 진행시 원활한 진행을 위한 임상시험 관리시스템(PM) 구축, ③ 글로벌 수준의 임상시험 신뢰성보증시스템(QA) 구축과 임상시험 모니터요원(CRA) 교육, ④ 구축된 기반을 활용한 바이오시밀러 제품에 대한 임상시험 시범수행 등을 추진한 바 있다.
(4) 바이오 빅데이터 단계 인프라
산업화를 위한 바이오 빅데이터 단계 인프라는 개인건강정보, 병원질병정보로 크게 2가지로 구분되며 이를 위해 산업부에서는 개인건강정보에 대해서 2015년∼2021년까지 ‘PHR기반 개인맞춤형 건강관리시스템 개발사업’을 통해 약 221억 원을 투입하고 있다. 병원질병정보에 대해서는 2019년∼2022년까지 ‘CDM기반정밀의료 데이터통합플랫폼 기술개발’을 통해 약 207억 원을 투입하고 있다. PHR을 통해 개인이 스스로 자신의 개인건강기록(라이프로그, 유전체데이터, 진료데이터) 등 정밀 의료에 필요한 다양한 데이터를 통합 관리할 수 있는 개인주도형 플랫폼을 구축했다. 한편, 저전력 블루투스(BLE) 국제 표준 등을 적용해 IoT 헬스케어 기기(60여종)와 연동하여 진료기록, 라이프로그, 투약정보 등 PHR 데이터(200여개)를 측정하고 개인동의를 통해 수집된 PHR 데이터를 개방형 오픈 API를 활용하여 건강관리서비스를 개발하도록 지원하였다.
2018년부터는 국제 시장 경쟁력 향상을 위한 헬스케어 디바이스 연동 및 라이프로그 데이터 표준, 국내 및 국제 개인정보보호법에 위배되지 않는 보안, 국내 보건의료계의 실정을 고려한 국제 의료용어 표준을 따르는 의료용어 표준, PHR 사업자들의 글로벌 시장 진출 및 글로벌 스케어 기관・기업들과 협업을 위한 국제 의료정보 표준을 위한 각 가이드 라인을 마련하여 데이터 플랫폼을 활용한 다양한 기업형 서비스실증사업 등을 추진하고 있다.
또한 CDM을 통해서는 병원에서 보유한 분산형 의료데이터(EMR: Electronic Medical Record)를 공통데이터모델(CDM: Common Data Model)로 표준화하고 분석하는 SW 개발 등의 플랫폼을 구축하였다. 아주대병원, 강동성심병원, 국민건강보험 일산병원, 경북대병원, 칠곡경북대병원, 강원대병원, 이대목동병원, 전북대병원, 부산대병원, 원광대병원, 강동경희대병원, 동국대일산병원 등 12개 병원 임상데이터를 CDM으로 변환하였다. 그 결과 2018년부터 2019년 신규 참여기관까지 총 61개 병원(상급종합병원 28개, 종합병원 32개, 일반병원 1개)이 참여하여, 데이터 플랫폼을 활용한 다양한 기업형 서비스 실증사업 등을 추진하고 있다.
다. 발전 과제
바이오산업은 2017년도 생산규모 10조 원을 최초로 돌파하며 매년 급성장하고 있는 산업이다. 정부의 효율적인 정책수립, 산학연 모두의 몰입형 기술개발 추진 등을 통해 그 효과가 경제적 효과로 나타나는 것이다. 오랜 기간 동안 생명공학 분야 국책연구소와 인프라 기관은 우리나라의 생물산업 발전을 위한 기술 및 제품화 지원의 하부구조를 구성하며 기초연구에서 사업화까지 전 과정에 걸쳐 제 역할을 담당하고 있다.
그러나 지난 25년간 정부지원을 통해 구축된 지역 중심의 인프라는 지속적인 운영자립화 및 기업지원 경쟁력 강화를 위해 효율성 강구가 필요하다. 또한 기초 단계(공공연구기관), 신뢰성평가 단계(비임상GLP 등)를 연결해 주는 산업화 인프라에 대해서는 국가 단위의 성과를 창출할 수 있도록 중점분야별(의약, 식품 등), 단계별(후보물질∼시생산∼생산), 서비스별(백신, 바이오시밀러, 소재단백질 등) 인프라 연계 및 통합 서비스 체계의 구축 지원을 지속적으로 고려할 필요가 있다. 이를 통해 중소・중견기업 등의 연구결과를 조기 제품화하고 지역별 기 구축된 산업화 인프라의 활용도와 전문성을 동시에 제고할 수 있을 것으로 판단된다.
우리는 현재 4차 산업혁명 시대를 살아가고 있으며, AI 라는 초지능화, IoT 라는 초연결, Big Data 라는 신자본 등 파괴적 기술이 속도, 범위, 깊이 차원에서 과거 경험하지 못했던 수준으로 기술과 경제 시스템 전반에 변화를 촉발하는 시대에 있다. 모든 것이 연결되고 지능화 되면서 생활의 질과 편리성이 높아지고 업무생산성이 극대화되는 시대를 추구하고 있는 상황이다. 이러한 상황을 직시하여 기술개발 및 제조업 중심의 인프라에 바이오 빅데이터 구축, 데이터 중심 병원의 연결, 신약 후보물질 빅데이터의 구축, 바이오 특허 빅데이터의 활용, 국민건강 공공 빅데이터의 개방성 등 다양한 핵심 빅데이터의 효율적인 접목이 필수적이다.
[표 3-52] 생명공학분야 산업화 인프라 지원 현황 및 주요 성과(2017년 8월말 현재, 2019년까지 지속적으로 유지)
|
광 역 경 제 권 |
특화분야 |
사업구분 |
과제명(사업기간) /지원기능 |
주관기관(URL) |
정부 지원금 (∼’17) (억 원) |
2017년 8월말 현재 주요 실적(누계) |
||||||
|
건물 평수 |
인력수 |
입주 기업수 |
장비구축건수 |
기술지도건수 |
교육훈련건수 |
수익금 현황 (백만 원) |
||||||
|
수 도 권 |
복합지원(의약/산업/그린) |
네트워킹 |
코리아바이오허브구축(’04-)/[기타-연구장비] |
한국바이오협회 www.koreabio.org |
237.8 |
752 |
89 |
5 |
175 |
14 |
101 |
13 |
|
의약바이오 |
cGMP |
생물산업기술실용화센터건립(’98-’07)/[GMP] |
㈜바이넥스 www.bi-nex.com |
898 |
2,660 |
58 |
|
213 |
28 |
8 |
15,000 |
|
|
의약바이오 |
산기반 |
바이오개량신약제제화공동연구기반구축(’06-’11)/[PP, GMP] |
경기과학기술진흥원 www.ggbc.or.kr |
50 |
9,687 |
31 |
27 |
110 |
243 |
22 |
1,784 |
|
|
산업/그린바이오 |
산업융합원천 |
건강기능식품플랫폼(‘09-’14/[기타-연구장비] |
한국식품연구원 www.kfri.re.kr |
40 |
|
|
|
|
39 |
|
|
|
|
충 청 권 |
의약바이오 산업/그린바이오 산업/그린바이오 산업/그린바이오 산업/그린바이오 |
BVC LMO LMO LMO 산기반 |
(BVC)생물의약TIC(’99-’04)/[PP, GMP] 바이오안전성정보기반구축(’02-계속)/[기타-안전성정보] 바이오국제협약운영(’08-계속)/[기타-안전성정보] 바이오안전성평가관리사업(’04-’07)/[기타-안전성정보] 단백질소재의산업적활용 극대화를위한기반구축(’05-’10)/[기타-연구장비] |
한국생명공학연구원 bvc.kribb.re.kr www.biosafety.or.kr biocat.or.kr |
50.3 86.37 181.86 118.28 45.25 |
700 40 40
85 |
10 15 15 12 2 |
70
|
47 1
37 |
244
8 |
178 34
107 19 |
690
189 |
|
의약바이오 의약바이오 산업/그린바이오 |
산업핵심 산업핵심 산업핵심 |
신약개발플랫폼(‘09-’14)/[기타-연구장비] Drug Repositioning 기술을 이용한 신약개발 활용 시스템 구축(‘10-’15)/[기타-연구장비] 바이오화학실용화센터(‘10-’14)/[PP] |
한국화학연구원 ddpt.krict.re.kr www.krict.re.kr ulsan.krict.re.kr |
89 104 71 |
1,500 2,865 |
21 45 22 |
|
20 5
|
310 4
|
43
|
|
|
|
의약바이오 의약바이오 |
지역클러스터 지역클러스터 |
바이오벤처타운조성(’02-07)/[GMP] (2단계)바이오의약산업화허브구축사업(’08-’10)/[GMP] |
(재)대전테크노파크 www.daejeontp.or.kr |
260.66 49 |
3,427
|
23
|
37
|
351
|
109
|
401
|
5,034 591 |
|
|
복합지원(의약/산업/그린) |
BVC |
(BVC)생물의약및식품TIC(’01-(’06)/[PP, 공인검사] |
영동대학교 www.biotic.re.kr |
46.8 |
813 |
7 |
11 |
63 |
36 |
73 |
468 |
|
|
의약바이오 의약바이오 의약바이오 |
지역클러스터 지역클러스터 지역클러스터 |
보건의료산업종합지원센터건립(’04-’07)/[PP, GMP, 공인검사] 전통의약품개발지원센터건립(’03-’07)/[PP, 공인검사] (2단계)한방산업클러스터고도화사업(’08-’10)/[PP, 공인검사] |
(재)충북테크노파크 www.cbtp.or.kr/cbhic www.cbtp.or.kr/cbomc |
124.7 97.97 15.87 |
1,230 444 299 |
14 8
|
17 4 11 |
124 179 12 |
196 613
|
41 34
|
140 1,377
|
|
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
동물자원사업화지원센터건립(’03-’07)/[PP, GMP, 공인검사] (2단계)충남농축산바이오산업생산지원인프라구축사업(’08-’10)/ [PP, GMP, 공인검사] |
(재)충남동물자원센터 www.cnasc.or.kr |
47.87 40 |
1,518 |
10 |
14 |
249 |
33 |
107 |
278 |
|
|
호 남 권 |
산업/그린바이오 산업/그린바이오 산업/그린바이오 |
BVC 지역클러스터 지역클러스터 |
(BVC) 생물벤처기업지원센터설립(’00-’04)/[PP, GMP, 공인검사] 바이오파크인프라구축(’05-’08)/[PP, GMP, 공인검사] (2단계)발효식품소재완제품화일괄지원시스템구축사업(’08-’10)/ [PP, GMP, 공인검사] |
(재)전라북도생물산업진흥원 www.jjf.re.kr |
50.62 143.45 22.5 |
4,783 |
42 |
27 |
380 |
607 |
366 |
1,302 |
|
산업/그린바이오 |
산기반 |
기능성식품 임상시험지원센터설립(’04-’09)/[공인검사] |
전북대학교 www.ctcf2.com |
49.73 |
620 |
28 |
|
145 |
1,421 |
116 |
850 |
|
|
산업/그린바이오 |
발효산업 |
발효미생물종합활용센터건립(’07-’10)/[PP] |
순창군장류사업소 www.gochujang.go.kr |
234 |
3,956 |
30 |
5 |
250 |
25 |
42 |
2,590 |
|
|
산업/그린바이오 |
산기반 |
지역특화기술융복합연구지원(’12-’15)/[연구지원] |
(재)발효미생물산업진흥원 mifi.kr |
2.43 |
1,383 |
17 |
5 |
8 |
25 |
42 |
2,590 |
|
|
산업/그린바이오 |
BVC |
(BVC)생물산업산학연협동연구및실용화기반구축(’00-’04)/[PP] |
동신대학교 www.bic.re.kr |
50 |
1,600 |
6 |
131 |
359 |
384 |
191 |
358 |
|
|
산업/그린바이오 |
지역클러스터 |
전남생물식품사업화지원센터건립운영(’02-’07)/[PP,GMP] |
(재)전라남도생물산업진흥재단 |
304 |
4,114 |
26 |
18 |
602 |
451 |
27 |
1,638 |
|
|
광 역 경 제 권 |
특화분야 |
사업구분 |
과제명(사업기간) /지원기능 |
주관기관(URL) |
정부 지원금 (∼’17) (억 원) |
2017년 8월말 현재 주요 실적(누계) |
||||||
|
건물 평수 |
인력수 |
입주 기업수 |
장비구축건수 |
기술지도건수 |
교육훈련건수 |
수익금 현황 (백만 원) |
||||||
|
|
산업/그린바이오 의약바이오 의약바이오 의약바이오 산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 지역클러스터 지역클러스터 지역클러스터 지역클러스터 |
(2단계)건강기능식품소재산업지원기반구축사업(’08-’10)/[PP, GMP] 전남생물농업산학공동연구센터건립운영(’02-’07)/[PP,GMP] (2단계)생물의약품완제라인구축사업(’08-’10)/[PP, GMP] 독감백신원료생산기반구축(’05-’08)/[PP,GMP] 친환경생물산업클러스터구축(’07-’09)/[PP,공인검사] 전남특산자원산업화기반구축(’07-’10)/[PP] |
www.jbio.org www.jbrc.re.kr www.jbrc.re.kr www.jbrc.re.kr www.jbc.re.kr www.jinr.re.kr |
25 173.8 39.7 128.33 128.31 89.29 |
5,389 2,420 9,900 8,513 1,212 |
34
130 32 20 |
8
44 31 |
300 29 285 3 |
17
125 120 |
35
65 18 |
2,100
700 1,382 |
|
동 남 권 |
산업/그린바이오 |
BVC |
(BVC)마린바이오기능성물질연구기반구축(’02-’07)/[PP] |
신라대학교 mcbi.silla.ac.kr |
45.46 |
1,538 |
1 |
44 |
164 |
105 |
88 |
619 |
|
융합바이오 융합바이오 |
산업핵심 산기반 |
항노화 산업 제품화 기술개발('11-'15)/[연구개발지원] 항노화 산업기반 구축('12-'15)/[연구개발지원] |
부산대학교 anti-aging.re.kr |
37.56 112.87 |
221 |
12 |
|
64 |
18 |
6 |
16 |
|
|
융합바이오 융합바이오 |
지역클러스터 지역클러스터 |
차세대 의생명융합산업지원센터 구축사업(‘05-’08)/[PP, 공인검사] 첨단 의생명테크노타운 건립 사업(‘09-’11)/[PP, GMP, 공인검사] |
(재)김해시차세대의생명융합산업지원센터 www.gbmc.or.kr |
58 88 |
955 2,699 |
16
|
13 12 |
38 14 |
302
|
66
|
475 566 |
|
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
해양생물산업육성센터(’04-’08)/[PP, GLP, 공인검사] (2단계)해양산업안전성확보기반구축사업(’09-’11)/[PP, GLP, 공인검사] |
(재)부산테크노파크 www.mbdc.or.kr |
113.89 20 |
2,628 442 |
11 11 |
10
|
361 284 |
|
17
|
836 116 |
|
|
산업/그린바이오 산업/그린바이오 |
BVC 지역클러스터 |
(BVC) 생물화학소재산업지원센터설립(’00-’04)/[PP] 바이오벤처프라자건립(’04-’08)/[PP] |
(재)바이오21센터 www.bio21.or.kr |
50 28,89 |
1,071 752 |
28 |
39 |
286 |
75 |
63 |
376 |
|
|
대 경 권 |
산업/그린바이오 산업/그린바이오 의약바이오 의약바이오 |
지역클러스터 지역클러스터 지역클러스터 지역클러스터 |
전통생물소재산업화센터(’04-’08)/[PP, GMP, 공인검사] (2단계)건강기능소재산업육성기반정비사업(’09-’12)/[PP, GMP, 공인검사] 한방산업지원센터기반구축(’04-’08)/[PP, GMP, 공인검사] (2단계)한방산업육성기반정비사업(’09-’11)/[PP, GMP, 공인검사] |
(재)대구테크노파크 www.dbic.or.kr www.omisc.or.kr
|
106.4 20.08 34.46 5.24 |
4,300 1,277 1,264
|
37 38 15
|
4 9
|
31 89 93
|
10 1,000
|
51
|
265 1,496
|
|
산업/그린바이오 |
BVC |
(BVC)생물농업및식품용생물소재TIC(’01-’06)/[PP, GMP] |
경북대학교 www.knu.ac.kr |
42.07 |
550 |
4 |
7 |
100 |
115 |
61 |
338 |
|
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
생물건강산업사업화지원센터건립(’02-’07)/[PP, GMP, 공인검사] (2단계)경북기능성바이오소재산업기반정비사업(’08-’12)/[PP, GMP, 공인검사] |
(재)경북바이오산업연구원 www.gib.re.kr |
137.48 135.52 |
2,543 3,224 |
42 12 |
36 10 |
256 59 |
444 145 |
200 1 |
3,962 2,906 |
|
|
산업/그린바이오 |
지역클러스터 |
해양생명환경산업지원센터건립(’04-’07)/[PP, GMP] |
(재)경북해양바이오산업연구원 www.gimb.or.kr |
80 |
1,812 |
33 |
17 |
94 |
59 |
20 |
|
|
|
산업/그린바이오 |
지역클러스터 |
포항테크노(바이오)정보지원센터건립(’07-’10)/[공인검사] |
(재)포항테크노파크 www.pohangtp.org |
69.61 |
906 |
5 |
3 |
59 |
92 |
104 |
5,069 |
|
|
강 원 권 |
복합지원(의약/산업/그린) 복합지원(의약/산업/그린) 복합지원(의약/산업/그린) |
BVC 지역클러스터 지역클러스터 |
(BVC) 생물산업벤처기업지원기반조성(’98-’02)/[PP, GMP, 공인검사] 춘천바이오타운조성(’02-’07)/[PP, GMP, 공인검사] (2단계)생물의약소재시험생산지원기반정비(’08-’11)/[PP, GMP, 공인검사] |
(재)춘천바이오산업진흥원 www.cbf.or.kr |
58 172.3 37.2 |
5,927 |
46 |
51 |
215 |
2,786 |
554 |
9,164 |
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
강릉해양생물산업지원센터(’02-’07)/[PP, GMP, 공인검사] (2단계)해양의용식품사업화지원기반구축사업(’08-’11)/[PP, GMP, 공인검사] |
(재)강릉과학산업진흥원 www.gsif.or.kr |
225.87 17.9 |
2,127 2,275 |
16 17 |
32 |
355 |
300 |
13 |
1,178 |
|
|
제 주 권 |
산업/그린바이오 |
BVC |
(BVC)기능성바이오첨가제및생물자원TIC(’01-’06)/[PP,GMP, 공인검사] |
제주대학교 chejutic.cheju.ac.kr |
47.7 |
550 |
16 |
14 |
85 |
169 |
189 |
652 |
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
바이오사이언스파크(’02-’07)/[PP, GMP, 공인검사] (2단계)제주건강・뷰티생물산업기반정비사업(’08-’12)/[PP, GMP, 공인검사] |
(재)제주테크노파크 bio.jejutp.or.kr |
210.69 228.7 |
3,463 |
34 |
42 |
1,102 |
907 |
72 |
315 |
|
|
합계 |
6,279.31 |
128,243 |
1,152 |
808 |
7,733 |
11,589 |
3,575 |
67,423 |
||||
주) 각 기관자료 등 참고로 필자 자체조사 후 정리
[표 3-53] 국내 GLP 현황(2019.5.)
|
GLP기관 지정순서 |
1호 |
6호 |
7호 |
8호 |
10호 |
11호 |
13호 |
15호 |
17호 |
18호 |
19호 |
20호 |
21호 |
22호 |
23호 |
25호 |
27호 |
28호 |
30호 |
31호 |
|
|
시험기관
시험항목 (세부시험항목) |
안전성 평가 연구소 (KIT) |
바이오톡 스텍 |
산업 안전 보건 연구원 |
켐온 |
서울대 병원 |
한국 화학 융합 시험 연구원 (화순) |
바이오코아 |
대구 카톨릭 대학교 |
크리 스탈 지노 믹스 |
한국건설 생활 환경 시험 연구원 |
바이오 인프라 |
한국 원자력 의학원 |
한국 의약 연구소 |
호서 대학교 |
스카스 비티티 바이오 애널리시스 |
안전성 평가 연구소(전북 본부) |
인터 네셔널 사이언스 티픽스탠 다드 |
크로앤 리서치 |
우정 비에스씨 |
제니아 |
|
|
단회투여독성 |
설치류 |
○ |
○ |
- |
○ |
○ |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
- |
- |
○ |
- |
○ |
- |
○ |
|
비설치류 |
○ |
○ |
- |
○ |
○ |
○ |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
반복투여독성 |
설치류 |
○ |
○ |
- |
○ |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
|
비설치류 |
○ |
○ |
- |
○ |
○ |
○ |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
영장류 |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
|
생식발생독성 |
수태능 및 초기배발생시험 |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
출생전후발생/모체기능시험 |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
배태자발생시험 |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
유전독성 |
체외염색체이상 or 쥐림포마사 |
○ |
○ |
○ |
○ |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
○ |
○ |
- |
|
체내소핵시험 |
○ |
○ |
- |
○ |
○ |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
|
항원성독성 |
아나필락시스 쇼크반응 |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
수동피부아나 필락시스반응 |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
피부감작성시험 |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
면역독성 |
세포매개 및 체액성 |
○ |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
발암성 |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
국소독성 |
피부자극시험 |
○ |
○ |
- |
○ |
○ |
○ |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
안점막자극시험 |
○ |
○ |
- |
○ |
○ |
○ |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
기타독성 |
광감작성시험 |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
광독성시험 |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
국소내성 |
- |
○ |
- |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
설치류흡입독성(단회, 반복) |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
|
변이원성 |
복귀돌연변이 |
○ |
○ |
○ |
○ |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
○ |
○ |
○ |
|
독성동태시험中 분석시험 |
- |
- |
- |
- |
- |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
- |
- |
|
|
혈액조직병리 및 의존성(비GLP) |
- ○ |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
|
|
안전성약리 |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
국제인증 보유 |
- |
○ |
- |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
소재지 |
대전 |
충북 |
대전 |
경기 |
서울 |
전남 |
서울 |
경북 |
서울 |
인천 |
경기 |
서울 |
경기 |
충남 |
충북 |
전북 |
강원 |
경기 |
경기 |
경기 |
|
|
지정일 |
‘88. 7.22 |
‘02. 12.13 |
‘02. 6.4 |
‘02. 8.12 |
‘03. 1.9 |
‘03. 5.30 |
‘05. 5.24 |
‘05. 7.26 |
‘06. 7.21 |
‘06. 11.6 |
‘09. 1.15 |
‘09. 3.2 |
‘11. 5.23 |
‘11. 7.12 |
‘11. 7.12 |
‘12. 12.12 |
‘14. 10.1 |
‘14. 10.10 |
‘16. 6.1 |
‘17. 4.17 |
|
주) 식약처 임상제도과(∼‘19.5.2) 자료를 토대로 필자 작성하였으며, 지정 취하 등 유한양행(2호), 동아제약(3호), LG생명과학(4호), CJ(5호), 태평양기술연구원(9호), 메드빌(12호), 아이바이오팜(14호), 동아대병원(16호), 동아에스티(24호), 호서의과학분석연구소(26호), 엘리드(29호)는 제외함
[표 3-54] 국내 GCP 현황(2019.5.)
|
지정번호 |
기관명 |
지정일자 |
지정번호 |
기관명 |
지정일자 |
||||
|
임상1상 |
임상2상 |
임상3상 |
임상1상 |
임상2상 |
임상3상 |
||||
|
1 |
가톨릭대학교 서울성모병원 |
‘97.3.11 |
‘97. 3.11 |
‘97.3.11 |
44 |
충북대학교 병원 |
|
‘97.3.11 |
‘97.3.11 |
|
2 |
가톨릭대학교 대전성모병원 |
|
‘04. 4. 8 |
‘97.3.11 |
46 |
한국원자력연구소 원자력병원 |
|
‘97.3.11 |
‘97.3.11 |
|
3 |
가톨릭대학교 부천성모병원 |
|
‘05. 3.28 |
‘97.3.11 |
47 |
한전의료재단 한전병원 |
|
|
‘97.3.11 |
|
4 |
가톨릭대학교 여의도성모병원 |
‘97.3.11 |
‘97. 3.11 |
‘97.3.11 |
48 |
한림대학교 부속 강남성심병원 |
|
‘97.3.11 |
‘97.3.11 |
|
5 |
가톨릭대학교 인천성모병원 |
|
‘97. 3.11 |
‘97.3.11 |
49 |
한림대학교 부속 춘천성심병원 |
|
‘97.3.11 |
‘97.3.11 |
|
6 |
가톨릭대학교 성바오로병원 |
|
‘04. 2. 9 |
‘97.3.11 |
50 |
한림대학교 한강성심병원 |
|
‘97.3.11 |
‘97.3.11 |
|
7 |
가톨릭대학교 의정부성모병원 |
‘05.10.27 |
‘05. 1.13 |
‘97.3.11 |
51 |
한양대학교 구리병원 |
|
|
‘97.3.11 |
|
8 |
한림대학교 강동성심병원 |
|
‘97. 3.11 |
‘97.3.11 |
52 |
한양대학교 병원 |
‘05.12.13 |
‘97.4.29 |
‘97.3.11 |
|
9 |
경북대학교 병원 |
‘05.12.19 |
‘97. 3.11 |
‘97.3.11 |
53 |
원광대학교 부속 치과병원 |
|
|
‘97.6.11 |
|
10 |
경희대학교 병원 |
|
‘97. 3.11 |
‘97.3.11 |
55 |
가톨릭대학교 성빈센트병원 |
|
‘00.1.25 |
‘97.6.11 |
|
11 |
차의과대학교 분당차병원 |
|
‘97. 3.11 |
‘97.3.11 |
57 |
서울특별시 보라매병원 |
|
|
‘97.6.23 |
|
12 |
계명대학교 동산병원 |
|
‘99. 6.15 |
‘97.3.11 |
58 |
인하대학교 의대 부속병원 |
‘97.8.12 |
‘97.8.12 |
‘97.8.12 |
|
13 |
고려대학교 의대 부속 구로병원 |
|
‘99.11.26 |
‘97.3.11 |
59 |
경희대학교 치과병원 |
|
|
‘97.11.7 |
|
14 |
학교법인 고려중앙학원 고려대학교 의대 부속 병원 |
‘97.3.11 |
‘97. 3.11 |
‘97.3.11 |
60 |
경희대학교 한방병원 |
|
|
‘97.11.7 |
|
15 |
국립중앙의료원 |
|
|
‘97.3.11 |
61 |
대구가톨릭대학교 병원 |
|
‘03.7.29 |
‘98.5.28 |
|
16 |
단국대학교 의대 부속병원 |
‘97.3.11 |
‘97. 3.11 |
‘97.3.11 |
62 |
제일의료재단 제일병원 |
|
‘98.5.28 |
‘98.5.28 |
|
17 |
동아대학교 병원 |
‘03.11.10 |
‘97. 3.11 |
‘97.3.11 |
63 |
연세대학교 원주세브란스 기독병원 |
|
‘05.6.15 |
‘98.8.18 |
|
18 |
부산대학교 병원 |
‘03.11.10 |
‘97. 3.11 |
‘97.3.11 |
64 |
고신대학교 복음병원 |
|
‘06.5.22 |
‘99.2.6 |
|
19 |
삼성서울병원 |
‘97.3.11 |
‘97. 3.11 |
‘97.3.11 |
67 |
한림대학교 성심병원 |
|
‘00.7.22 |
‘99.7.19 |
|
20 |
서울대학교 병원 |
‘97.3.11 |
‘97. 3.11 |
‘97.3.11 |
68 |
경상대학교 병원 |
|
‘02.9.24 |
‘99.9.13 |
|
22 |
순천향대학교 서울병원 |
‘97.3.11 |
‘97. 3.11 |
‘97.3.11 |
69 |
충남대학교 병원 |
|
‘99.9.20 |
‘99.9.20 |
|
23 |
아산복지사업재단 서울아산병원 |
‘97.3.11 |
‘97. 3.11 |
‘97.3.11 |
70 |
고려대학교 부속 안산병원 |
‘06.2.21 |
‘00.1.25 |
‘00.1.25 |
|
24 |
아주대학교 병원 |
‘05.2.19 |
‘97. 3.11 |
‘97.3.11 |
71 |
국립마산병원 |
|
‘00.10.23 |
‘00.10.23 |
|
25 |
연세대학교 세브란스병원 |
‘97.3.11 |
‘97. 3.11 |
‘97.3.11 |
72 |
순천향대학교 부속 부천병원 |
‘01.5.22 |
‘01.5.22 |
‘01.5.22 |
|
27 |
연세대학교 강남세브란스병원 |
|
‘97. 3.11 |
‘97.3.11 |
73 |
단국대학교 치과대학 부속 치과병원 |
|
|
‘01.7.11 |
|
28 |
연세대학교 치과병원 |
‘97.3.11 |
‘97. 3.11 |
‘97.3.11 |
74 |
국립암센터 |
‘02.3.26 |
‘01.7.11 |
‘01.7.11 |
|
29 |
영남대학교 병원 |
‘97.3.11 |
‘97. 3.11 |
‘97.3.11 |
76 |
인제대학교 일산백병원 |
|
|
‘01.10.30 |
|
30 |
한국침례회의의료재단 왈레스기념침례병원 |
|
|
‘97.3.11 |
77 |
국민건강보험공단 일산병원 |
|
‘01.11.9 |
‘01.11.9 |
|
31 |
원광대학교 의과대학병원 |
|
‘97. 3.11 |
‘97.3.11 |
78 |
의료법인영훈의료재단 대전선병원 |
|
'02.5.31 |
'02.5.31 |
|
32 |
길병원 |
‘99.12.29 |
‘99.12.29 |
‘97.3.11 |
79 |
학교법인 울산공업학원 울산대학교 병원 |
‘06.2.14 |
‘02.9.24 |
‘02.9.24 |
|
33 |
삼성의료재단 강북삼성병원 |
|
‘97. 3.11 |
‘97.3.11 |
80 |
을지병원 |
|
‘02.9.24 |
‘02.9.24 |
|
34 |
이화여자대학교 부속 목동병원 |
‘97.3.11 |
‘97. 3.11 |
‘97.3.11 |
81 |
파티마병원 |
|
‘02.9.24 |
‘02.9.24 |
|
36 |
인제대학교 부속 부산백병원 |
‘97.3.11 |
‘97. 3.11 |
‘97.3.11 |
82 |
동국대학교 경주병원 |
|
‘03.3.31 |
‘03.3.31 |
|
37 |
인제대학교 상계백병원 |
|
‘97. 3.11 |
‘97.3.11 |
83 |
조선대학교병원 |
|
‘03.7.29 |
‘03.7.29 |
|
38 |
인제대학교 서울백병원 |
|
‘06.10.22 |
‘97.3.11 |
84 |
원광대학교 광주한방병원 |
|
‘03.9.25 |
‘03.9.25 |
|
39 |
전남대학교 병원 |
‘04.10.4 |
‘97. 3.11 |
‘97.3.11 |
85 |
분당서울대학교 병원 |
|
‘03.9.25 |
‘03.9.25 |
|
40 |
전북대학교 병원 |
‘06.4.10 |
‘97. 3.11 |
‘97.3.11 |
86 |
순천향대학교 부속 천안병원 |
‘04.2.9 |
‘04.2.9 |
‘04.2.9 |
|
41 |
중앙대학교 병원 |
|
‘05. 4.15 |
‘97.3.11 |
87 |
국립서울병원 |
|
|
‘04.2.9 |
|
43 |
서울특별시 서울의료원 |
|
|
‘97.3.11 |
88 |
을지의과대학교 병원 |
|
‘04.4.8 |
‘04.4.8 |
|
지정번호 |
기관명 |
지정일자 |
지정번호 |
기관명 |
지정일자 |
||||
|
임상1상 |
임상2상 |
임상3상 |
임상1상 |
임상2상 |
임상3상 |
||||
|
89 |
보훈복지의료공단 중앙보훈병원 |
|
‘05.6.15 |
‘04.4.8 |
130 |
우석대학교 전주부속 한방병원 |
|
‘08.12.23 |
‘08.12.23 |
|
91 |
제주대학교 병원 |
|
‘04.5.13 |
‘04.5.13 |
131 |
양산부산대학교병원 |
|
‘08.12.24 |
‘08.12.24 |
|
92 |
동의대학교 부속한방병원 |
|
‘04.6.3 |
‘04.6.3 |
132 |
광주보훈병원 |
|
‘09.1.9 |
‘09.1.9 |
|
93 |
건국대학교 충주병원 |
|
|
‘04.6.12 |
133 |
용인정신병원 |
|
‘09.3.6 |
‘09.3.6 |
|
94 |
화순 전남대학교 병원 |
|
‘04.11.11 |
‘04.6.12 |
134 |
동국대학교 한의대 분당한방병원 |
|
‘09.6.3 |
‘09.6.3 |
|
95 |
천주교부산교구유지재단 메리놀병원 |
|
|
‘04.6.18 |
135 |
국립공주병원 |
|
‘09.7.9 |
‘09.7.9 |
|
96 |
청주성모병원 |
|
‘06.5.19 |
‘04.9.6 |
136 |
대전대학교 둔산한방병원 |
|
‘09.7.22 |
‘09.7.22 |
|
97 |
대동병원 |
|
|
‘04.10.12 |
137 |
한국보훈복지의료공단 대구보훈병원 |
|
‘09.7.24 |
‘09.7.24 |
|
98 |
제주 한라병원 |
|
‘04.11.5 |
‘04.11.5 |
138 |
대항병원 |
|
‘09.7.30 |
‘09.7.30 |
|
99 |
건국대학교 병원 |
|
‘06.3.17 |
‘04.11.26 |
139 |
의료법인 동강의료재단 동강병원 |
|
‘09.8.19 |
‘09.8.19 |
|
100 |
건양대학교 병원 |
|
‘04.12.1 |
‘04.12.1 |
140 |
서울특별시 은평병원 |
|
‘09.11.9 |
‘09.11.9 |
|
101 |
차의과대학교 강남 차병원 |
|
‘05.1.13 |
‘05.1.13 |
141 |
한국보훈복지의료공단 부산보훈병원 |
|
‘09.12.15 |
‘09.12.15 |
|
102 |
명지의료재단 명지병원 |
|
‘05.1.19 |
‘05.1.19 |
143 |
글로리병원 |
|
‘10.3.9 |
‘10.3.9 |
|
103 |
강원대학교 병원 |
|
‘05.1.20 |
‘05.1.20 |
144 |
대전대학교 부속 천안한방병원 |
|
‘10.3.23 |
‘10.3.23 |
|
104 |
창원파티마병원 |
|
|
‘05.5.7 |
145 |
차의과대학교 부속 구미차병원 |
|
‘10.3.31 |
‘10.3.31 |
|
105 |
강릉아산병원 |
|
|
'05.8.11 |
147 |
서울송도병원 |
|
‘10.5.28 |
‘10.5.28 |
|
106 |
경원대학교부속 길한방병원 |
|
|
‘05.8.29 |
148 |
의료법인혜원의료재단 세종병원 |
|
‘10.5.31 |
‘10.5.31 |
|
107 |
동국대학교 일산불교병원 |
‘05.9.14 |
‘05.9.14. |
‘05.9.14. |
149 |
인제대학교 해운대백병원 |
|
‘10.6.14 |
‘10.6.14 |
|
108 |
효산의료재단 안양샘병원 |
|
|
‘05.10.24 |
150 |
동남권원자력의학원 |
|
‘11.3.8 |
‘11.3.8 |
|
109 |
대진의료재단 분당제생병원 |
‘05.11.04 |
‘05.11.4. |
‘05.11.4. |
151 |
동신대학교 부속 순천한방병원 |
|
‘11.3.28 |
‘11.3.28 |
|
110 |
대전대학교 대전한방병원 |
|
‘05.12.28 |
‘05.12.28 |
152 |
칠곡경북대학교병원 |
|
‘11.4.4 |
‘11.4.4 |
|
111 |
성균관대학교 삼성창원병원 |
|
|
‘06.5.23. |
153 |
예수병원유지재단 예수병원 |
|
‘11.4.29 |
‘11.4.29 |
|
112 |
상지대학교 부속 한방병원 |
|
|
‘06.6.2. |
154 |
부산대학교 한방병원 |
|
‘11.5.24 |
‘11.5.24 |
|
113 |
광주기독병원 |
|
‘06.6.5 |
‘06.6.5 |
155 |
순천성가롤로병원 |
|
‘11.7.6 |
‘11.7.6 |
|
114 |
강동경희대학교의대 병원 |
‘06.8.17 |
‘06.8.17 |
‘06.8.17 |
156 |
삼육서울병원 |
‘11.7.28 |
||
|
115 |
부산성모병원 |
|
‘06.12.26 |
‘06.12.26 |
157 |
순천향대학병원 부속 구미병원 |
‘11.8.18 |
||
|
117 |
경희대학교 강동한방병원 |
|
‘07.2.9 |
‘07.2.9 |
159 |
베데스다 삼성병원 |
‘12.1.10 |
||
|
118 |
동국대학교 일산불교 한방병원 |
|
‘07.2.9 |
‘07.2.9 |
160 |
원광대학교 익산한방병원 |
‘12.1.11 |
||
|
119 |
국립부곡병원 |
|
‘07.8.23 |
‘07.8.23 |
161 |
국립경찰병원 |
‘12.1.26 |
||
|
120 |
김원묵기념 봉생병원 |
|
‘07.10.29 |
‘07.10.29 |
162 |
미즈메디병원 |
‘12.3.19 |
||
|
121 |
국립나주병원 |
|
‘07.12.4 |
‘07.12.4 |
163 |
익산의료재단 메트로병원 |
‘12.5.30 |
||
|
122 |
자생한방병원 |
|
‘08.2.27 |
‘08.2.27 |
164 |
연세대학교 용인세브란스병원 |
‘12.5.30 |
||
|
123 |
대구한의대학교 대구한방병원 |
|
‘08.3.28 |
‘08.3.28 |
165 |
연세사랑병원 |
‘12.8.6 |
||
|
124 |
세명대학교 부속 한방병원 |
|
‘08.3.28 |
‘08.3.28 |
166 |
성애병원 |
‘12.9.10 |
||
|
125 |
세명대학교 부속 충주한방병원 |
|
‘08.5.20 |
‘08.5.20 |
167 |
의료법인대우의료재단 대우병원 |
‘12.11.1 |
||
|
126 |
동신대학교 광주한방병원 |
|
‘08.7.3 |
‘08.7.3 |
168 |
모커리한방병원 |
‘12.12.3 |
||
|
127 |
김안과병원 |
|
‘08.7.30 |
‘08.7.30 |
169 |
양지병원 |
‘13.2.4 |
||
|
128 |
베스티안병원 |
|
‘08.8.7 |
‘08.8.7 |
170 |
한림대학교 동탐성심병원 |
‘13.2.4 |
||
|
129 |
누네안과병원 |
|
‘08.8.20 |
‘08.8.20 |
171 |
비에이치에스한서병원 |
‘13.4.2 |
||
|
지정번호 |
기관명 |
지정일자 |
||
|
임상1상 |
임상2상 |
임상3상 |
||
|
172 |
씨엠충무병원 |
‘13.5.8 |
||
|
173 |
제일안과병원 |
‘13.7.10 |
||
|
174 |
나누리병원 |
‘13.11.1 |
||
|
175 |
효산의료재단 지샘병원 |
‘13.12.31 |
||
|
176 |
국립재활원 |
‘14.1.7 |
||
|
177 |
부산대학교 치과병원 |
‘14.3.3 |
||
|
178 |
원광대학교 전주한방병원 |
‘14.3.20 |
||
|
179 |
의료법인녹산의료재단 동수원병원 |
‘14.3.21 |
||
|
180 |
한길의료재단 한길안과병원 |
‘14.4.9 |
||
|
181 |
학교법인 동의병원 |
‘14.5.27 |
||
|
182 |
가톨릭관동대학교 국제성모병원 |
‘14.6.9 |
||
|
183 |
동신대학교부속 목포한방병원 |
‘14.6.19 |
||
|
184 |
의료법인 실로암안과병원 |
‘14.6.24 |
||
|
185 |
의료법인 광명성애병원 |
‘14.7.24 |
||
|
186 |
의료법인인당의료재단 부민병원 |
‘14.12.12 |
||
|
187 |
의료법인세광의료재단 성모안과병원 |
‘15.3.27 |
||
|
188 |
부민병원(서울) |
‘15.5.21 |
||
|
189 |
대구누네안과병원 |
‘15.9.11 |
||
|
190 |
세경의료재단 새빛안과병원 |
‘16.3.16 |
||
|
191 |
청연한방병원 |
‘16.526 |
||
|
192 |
창원경상대학교병원 |
‘16.7.1 |
||
|
193 |
대전자생한방병원 |
‘16.7.4 |
||
|
194 |
(재)자생의료재단 해운대자생한방병원 |
‘16.6.17 |
||
|
195 |
지생한방병원 |
‘16.7.4 |
||
|
196 |
밝은안과21병원 |
‘16.6.27 |
||
|
197 |
원광대학교 의과대학 산본병원 |
‘16.7.26 |
||
|
198 |
대전보훈병원 |
‘16.11.09 |
||
|
199 |
의료법인 안동병원 |
‘16.12.26 |
||
|
200 |
인천광역시의료원 |
‘17.8.10 |
||
|
201 |
의료법인인당의료재단해운대부민병원 |
‘17.11.15 |
||
|
202 |
분당제일여성병원 |
‘17.12.1 |
||
|
203 |
의료법인 우리의료재단 김포우리병원 |
‘17.12.14 |
||
|
204 |
메디플렉스 세종병원 |
‘18.5.17 |
||
|
205 |
의료법인 루가의료재단 나은병원 |
‘18.12.6 |
||
|
206 |
베스티안병원 |
‘19.1.3 |
||
|
207 |
이화여자대학교 의과대학부속 서울병원 |
‘19.3.11 |
||
|
208 |
의료법인 정선의료재단 온종합병원 |
‘19.4.29 |
||
|
임상시험실시기관 총 208개(지정) 중 193개(운영) |
||||
주) 식약처 임상제도과(∼‘19.6.11) 자료를 토대로 필자 작성하였으며, 지정기관 중 미운영 기관 제외함.
[표 3-55] 국내 대표적인 2개 비임상 CRO 회사 현황(2019.3.)
|
업체명 |
(주)바이오톡스텍 |
최근 5년 간 기업현황(단위: 천 원, 명) |
|||||||||||
|
구분 |
2014년 |
2015년 |
2016년 |
2017년 |
2018년 |
||||||||
|
총자산 |
48,328,060 |
45,379,011 |
48,007,296 |
59,770,502 |
63,135,803 |
||||||||
|
설 립 년 월 일 |
2000년 08월 23일 |
총자본 |
27,487,910 |
23,584,131 |
25,562,365 |
31,240,721 |
35,749,343 |
||||||
|
사업자등록번호 |
301-81-45781 |
총부채 |
20,840,150 |
21,794,880 |
22,444,931 |
28,529,781 |
27,386,460 |
||||||
|
법 인 등록번호 |
150111-0048707 |
매출액 |
14,213,991 |
14,835,792 |
20,300,373 |
25,564,709 |
32,582,096 |
||||||
|
대 표 자 성 명 |
강종구 |
총인원 |
172명 |
176명 |
179명 |
198명 |
196명 |
||||||
|
주소 |
본사 |
충북 청원군 오창읍 양청리 686-2 |
연락처 |
전화/팩스 |
043-210-7777 / 043-210-7778 |
||||||||
|
홈페이지 |
www.biotoxtech.com |
||||||||||||
|
주요생산품 (2018년 말 기준) |
산업분류 코드 |
시장규모(억 원) |
시장점유율(%) |
매출액(억 원) |
|||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
||||||||
|
비임상시험대행업 |
M70113 (의학 및 약학연구개발업) |
1,200(추정) |
미확인 |
18.6 |
|
220 |
17 |
||||||
|
비임상시험 과제수(2019년 3월 말 기준) |
주요 조직 |
네트워크 기관 |
|||||||||||
|
1,241건(국내 1,097, 해외 144) |
연구소(R&D컨설팅, 약효약리팀), 시험본부(QAxla, 시험관리팀, 독성1팀, 독성2팀, 병리팀, 조제팀), 영업본부(영업팀, 마케팅팀), 관리본부(경영관리팀), 공무팀 |
국내(한국과학기술연구원, 표준과학연구원, 한국생명공학연구원 등), 해외(일본 PPRC 등, 중국 Beijing Northland Biotech 등 |
|||||||||||
|
업체명 |
(주)켐온 |
최근 5년 간 기업현황(단위: 천 원, 명) |
|||||||||||
|
구분 |
2014년 |
2015년 |
2016년 |
2017년 |
2018년 |
||||||||
|
총자산 |
15,300,681 |
18,545,976 |
31,230,399 |
39,462,658,319 |
42,473,048,581 |
||||||||
|
설 립 년 월 일 |
2000년 01월 11일 |
총자본 |
10,410,238 |
12,987,364 |
26,754,380 |
33,144,143,067 |
34,051,912,726 |
||||||
|
사업자등록번호 |
108-81-19928 |
총부채 |
4,890,443 |
5,558,611 |
4,476,019 |
6,318,515,252 |
8,421,135,855 |
||||||
|
법 인 등록번호 |
110111-1848542 |
매출액 |
13,252,878 |
14,626,988 |
15,416,764 |
15,549,165,712 |
19,450,820,403 |
||||||
|
대 표 자 성 명 |
송시환 |
총인원 |
103명 |
121명 |
132명 |
177명 |
203명 |
||||||
|
주소 |
본사 |
경기 수원 영통 이의동 864-1 경기바이오센터 15층 |
연락처 |
전화/팩스 |
031-888-6634/031-888-6640 |
||||||||
|
홈페이지 |
www.chemon.co.kr |
||||||||||||
|
주요생산품 (2018년 말 기준) |
산업분류 코드 |
시장규모(억 원) |
시장점유율(%) |
매출액(억 원) |
|||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
||||||||
|
비임상시험 |
M70113 (의학 및 약학연구개발업 |
1,200(추정) |
미확인 |
12.8 |
- |
194 |
0 |
||||||
|
비임상시험 과제수(2019년 3월 말 기준) |
주요 조직 |
네트워크 기관 |
|||||||||||
|
268억 원 수주(178억 원 납품) |
경영지원본부, 사업개발본부, 비임상연구소(안정성평가센터, 독성병리센터, 연구지원센터, 시험물질평가센터, 효능평가센터, 춘천바이오센터) |
제약회사, 바이오벤처, 삼성서울병원, 한국생명공학연구원 등 |
|||||||||||
[표 3-56] 국내 대표적인 3개 임상 CRO 회사 현황(2019.3.)
|
업체명 |
(주)드림씨아이에스 |
최근 5년 간 기업현황(단위: 천 원, 명) |
||||||||||||
|
구분 |
2014년 |
2015년 |
2016년 |
2017년 |
2018년 |
|||||||||
|
총자산 |
15,503,285 |
15,064,193 |
14,145,469 |
13,542,500 |
17,685,996 |
|||||||||
|
설 립 년 월 일 |
2000년 04월 27일 |
총자본 |
10,172,591 |
8,785,232 |
3,940,622 |
2,820,854 |
6,505,192 |
|||||||
|
사업자등록번호 |
101-81-57329 |
총부채 |
5,330,694 |
6,278,961 |
10,204,847 |
10,721,646 |
11,180,804 |
|||||||
|
법 인 등록번호 |
110111-1953953 |
매출액 |
18,335,127 |
17,512,797 |
15,482,007 |
15,957,711 |
19,199,521 |
|||||||
|
대 표 자 성 명 |
지아리우 |
총인원 |
247명 |
261명 |
261명 |
181명 |
181명 |
|||||||
|
주소 |
본사 |
서울 종로 적선 80 적선현대빌딩 1010호 |
연락처 |
전화/팩스 |
02-2010-4504 / 02-720-5385 |
|||||||||
|
홈페이지 |
http://www.dreamcis.com |
|||||||||||||
|
주요생산품 (2018년 말 기준) |
산업분류 코드 |
시장규모(억 원) |
시장점유율(%) |
매출액(억 원) |
||||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
|||||||||
|
임상시험대행업 |
M70113 (의학 및 약학 연구 개발업) |
|
|
|
|
154 |
|
|||||||
|
임상시험 과제수(2019년 5월 말 기준) |
주요 조직 |
네트워크 기관 |
||||||||||||
|
813억 원 계약(432억 원 납품) |
품질유닛, 사업개발유닛, R&D유닛, 임상시험유닛, 후기임상연구유닛, 바이오메트릭스유닛, IT유닛 |
지역임상시험센터 및 다수 해외CRO |
||||||||||||
|
업체명 |
(주)씨엔알리서치 |
최근 5년 간 기업현황(단위: 천 원, 명) |
||||||||||||
|
구분 |
2012년 |
2013년 |
2014년 |
2017년 |
2018년 |
|||||||||
|
총자산 |
3,696,354 |
5,376,234 |
5,822,485 |
28,456,219 |
35,048,749 |
|||||||||
|
설 립 년 월 일 |
2000년 03월 |
총자본 |
507,766 |
1,056,398 |
1,735,918 |
(654,142) |
4,754,517 |
|||||||
|
사업자등록번호 |
214-86-50573 |
총부채 |
3,188,588 |
4,319,836 |
4,086,567 |
29,110,361 |
30,294,231 |
|||||||
|
법 인 등록번호 |
110111-1895999 |
매출액 |
13,269,793 |
17,758,830 |
18,980,353 |
25,460,911 |
24,599,944 |
|||||||
|
대 표 자 성 명 |
박 관 수 |
총인원 |
168명 |
180명 |
202명 |
253명 |
253명 |
|||||||
|
주소 |
본사 |
서울 강남구 역삼로 412 대치MS빌딩 6층 |
연락처 |
전화/팩스 |
02-6251-1500 / 02-6251-1504 |
|||||||||
|
홈페이지 |
http://www.cnrres.co.kr, http://www.cnracademy.org |
|||||||||||||
|
주요생산품 (2018년 말 기준) |
산업분류 코드 |
시장규모(억 원) |
시장점유율(%) |
매출액(억 원) |
||||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
|||||||||
|
임상시험대행업 |
N75999 (그 외 기타 분류 안 된 사업지원 서비스업) |
|
|
|
|
233 |
|
|||||||
|
임상시험 과제수(2019년 5월 말 기준) |
주요 조직 |
네트워크 기관 |
||||||||||||
|
850건 |
Clinical Operation(PM, CR1, CR2, CR3, Oncology), Business development(Local, Global, Marketing, Sales Management), Regulatory Affairs(IND/IRB, Consulting), Medical(Biostatistics, Medical writing), Data management(IT), Training & Operatipon Practice, Management Support |
국내: 녹십자의료재단, 안전성평가연구소, 메디팁, CRScube, 병원(충북대, 중앙대, 인제대, 고려대구로, 경북대, 서울대) 등 해외: 일본 ACM, 대만 VCRO, 중국 RUNDO사 |
||||||||||||
|
업체명 |
(주)엘에스케이글로벌파마서비스 |
최근 5년 간 기업현황(단위: 천 원, 명) |
||||||||||||
|
구분 |
2014년 |
2015년 |
2016년 |
2017년 |
2018년 |
|||||||||
|
총자산 |
7,750,620 |
8,249,643 |
11,883,859 |
13,765,228 |
15,927,458 |
|||||||||
|
설 립 년 월 일 |
2001년 10월 01일 |
총자본 |
-2,232,991 |
-1,491,375 |
-1,755,898 |
(3,223,719) |
(3,551,837) |
|||||||
|
사업자등록번호 |
211-87-01667 |
총부채 |
9,983,611 |
9,741,019 |
13,639,757 |
16,988,947 |
19,479,295 |
|||||||
|
법 인 등록번호 |
110111-2340646 |
매출액 |
12,347,754 |
16,571,825 |
19,492,374 |
21,390,769 |
25,098,530 |
|||||||
|
대 표 자 성 명 |
이영작 |
총인원 |
160명 |
200명 |
220명 |
310명 |
310명 |
|||||||
|
주소 |
본사 |
서울시 중구 퇴계로 97 고려대연각타워 16층 |
연락처 |
전화/팩스 |
Tel. 02-546-1008 / Fax. 02-584-9008 |
|||||||||
|
홈페이지 |
www.lskglobal.co.kr |
|||||||||||||
|
주요생산품 (2018년 말 기준) |
산업분류 코드 |
시장규모(억 원) |
시장점유율(%) |
매출액(억 원) |
||||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
|||||||||
|
임상시험대행업 |
M70113 (의학 및 약학 연구개발업) |
|
|
|
|
98억 |
25억 |
|||||||
|
임상시험 과제수(2019년 5월말 기준) |
주요 조직 |
네트워크 기관 |
||||||||||||
|
총 887개 프로젝트(해외 110) |
QM, Training, Corporate Communications, BD, SC, CM, MW&RES, CTM HQs, CDM HQs, PV, STAT/ER, F&A, 경영지원부 |
PRA International, MDS, Pharma Service, Covance, INC Research, Julius Clinica, Research, Cato Research, StatPlus, SLG, MPI, Target, Health, Medidata, LSK, Biopartners, George Clinical, Veras Research Japan, Semler, Research Center Pvt Ltd,Veras Research Sdn Bhd |
||||||||||||
주) 기업 자료, 금감원 전자공시시스템 등 토대로 필자 작성
[표 3-57] 산업부 추진 PHR 추진과제 현황(2019.6.)
|
구분 |
추진과제 |
주관기관 |
총개발기간 |
|
1 |
라이프로그-공공데이터를 활용한 PHR 기반 생애 주기별 맞춤형 건강관리 시스템 개발 및 비즈니스 모델 실증 |
라이프시맨틱스 |
’15.6.1∼’18.8.31 |
|
2 |
시장 경쟁력 향상을 위한 PHR 데이터 표준 및 가이드라인 개발 |
서울대학교병원 |
’18.11.1∼’22.4.30 |
|
3 |
PHR 기반 개인맞춤형 건강관리 서비스 플랫폼 기술 고도화 및 실증서비스 개발 연계지원 |
디케이아이테크놀로지 |
’18.11.1∼’22.4.30 |
|
4 |
고령자 건강관리 서비스 개발 및 실증 |
유비플러스 |
’18.11.1∼’21.3.31 |
|
5 |
PHR 플랫폼 기반의 근로자 맞춤형 건강관리 서비스 개발 및 사업화 |
비트컴퓨터 |
’18.11.1∼’21.3.31 |
|
6 |
개방형 PHR기반 치매 보호자용 건강관리 서비스 개발 및 실증 |
피플앤드테크놀러지 |
’19.4.1∼’21.12.31 |
|
7 |
퇴행성 근골격계 질환 1인가구 고령자의 자기주도적 재활의료 및 재가돌봄을 위한 상호운용 가능한 PHR 서비스플랫폼 개발 및 실증 |
하이디어솔루션즈 |
’19.4.1∼’21.12.31 |
|
8 |
글로벌 PHR기반 소아발달장애 관리 및 치료용 모바일 인공지능 플랫폼 |
두브레인 |
’19.4.1∼’21.12.31 |
|
9 |
개방형 PHR 기반 IoMT 기기를 활용한 공동주택 주민 맞춤형 통합건강관리서비스 개발 및 실증 |
헬스맥스 |
’19.4.1∼’21.12.31 |
|
10 |
개방형 PHR 플랫폼 환경에서 청진 IoMT를 활용한 심질환 진단지원서비스 고도화 모델 |
휴레이포지티브 |
’19.4.1∼’21.12.31 |
|
11 |
맞춤형 개인건강관리 서비스를 위한 헬스케어 음성 UI 플랫폼 기술 개발 |
미디어젠 |
’19.4.1∼’21.12.31 |
|
12 |
염증성장질환 개인주도형 라이프케어 맞춤형 건강관리서비스 플랫폼 개발 및 실증 |
소프트넷 |
’19.4.1∼’21.12.31 |
|
13 |
개방형 PHR기반 만성질환자 응급실용 관리 시스템 개발 및 실증 |
브이티더블유 |
’19.4.1∼’21.12.31 |
[표 3-58] 산업부 추진 CDM 추진과제 현황(2019.6.)
|
구분 |
추진과제 |
주관기관 |
총개발기간 |
|
1 |
CDM 기반 분산형 바이오헬스데이터 플랫폼 고도화 및 기관확장 |
분당서울대학교병원 |
’19.4.1∼’22.12.31 |
|
2 |
CDM기반 바이오헬스데이터 통합 플랫폼 고도화 및 검증 기술개발 |
서울아산병원 |
’19.4.1∼’22.12.31 |
|
3 |
CDM기반 바이오헬스 통합 데이터망 기관확장 구축 기술개발 |
아주대학교산학협력단 |
’19.4.1∼’22.12.31 |
|
4 |
공통데이터모델 기반 국내 표준화 및 익명화 가이드라인 수립 |
삼성서울병원 |
’19.4.1∼’22.12.31 |
|
5 |
CDM기반 만성질환 데이터를 활용한 지능형 진단처방 조회 서비스 시스템 |
엠투아이티 |
’19.5.1∼’22.1.31 |
|
6 |
사용자 편의성이 고도화된 CDM 기반 스마트 임상시험 설계 지원 시스템 |
셀바스에이아이 |
’19.5.1∼’22.1.31 |
|
7 |
CDM 기반의 지능형 진료 가이드 알고리즘 개발과 확산을 위한 CDSS 플랫폼 개발 |
씨앤텍시스템즈 |
’19.5.1∼’22.1.31 |
|
8 |
인공지능 딥러닝이 적용된 CDM 및 라이프로그 신규 디지털 바이오마커의 발굴 및 서비스 산업화 |
파미니티 |
’19.5.1∼’22.1.31 |
제4장 생명공학 관련 법제도 현황
![]()
|
구분 |
바이오안전성 |
생명윤리 |
지적재산권 |
|
개요 |
카르타헤나의정서와 LMO법을 통해 LMO로 인한 위해를 사전에 방지하고자 노력하고 있음 |
유전자편집, 개인정보 활용, 뇌과학 연구가 활발해지면서, 생명윤리 이슈들이 제기되고 있음 |
생명공학 분야 산업은 4차 산업혁명시대의 유망산업으로 지식재산권으로서 보호 필요 |
|
해외 동향 |
카르타헤나의정서 당사국회의 및 OECD 동향과 국외 주요 LMO 이슈 |
인간배아 유전자편집을 둘러싼 윤리적 가이드라인, 개인정보보호와 활용간의 균형, 뇌과학・신경기술 관련 윤리적 이슈와 관련하여 해외에서는 다양한 논의가 진행중 |
|
|
국내 현황 |
LMO법 하의 LMO 안전관리 및 커뮤니케이션 현황과 국내 주요 LMO 이슈 |
국내에서는 유전자편집 및 배아연구에 대해 법으로 규제 되고 있으며 개인정보보호 관련 개정안들이 국회에서 논의 중이며 신경윤리를 위한 제도적 장치들이 마련 중임 |
|
|
발전 과제 |
철저한 LMO 안전관리를 위해 관계행정기관의 노력과 더불어 국민들의 관심이 필요함 |
생명윤리 이슈는 최대한 일찍, 관련된 이해 당사자들과 충분한 시간을 두고 논의하는 것이 필요함 |
|
|
생명공학제품 인허가 현황과 과제 |
기업현황과 지원제도 |
|
첨단 바이오의약품과 첨단 IT기술이 융복합된 신개념 첨단의료기기들이 개인 맞춤형으로 새롭게 개발되면서 허가정책도 국제수준으로 변화 중
|
국내외 매출 상위 바이오기업의 현황과 그 비중을 분석하고, 국내 기업을 글로벌 기업으로 성장시키기 위한 각종 지원제도를 설명 |
|
국내 바이오시밀러의 세계시장 선점과 규제선도 성과에 이어 세포치료제 등 개발증가에 따라 신속한 제품화지원사업 활발 |
전 세계적으로 미국기업들이 글로벌 시가총액 및 매출면에서 선두를 달리고 있으며, 전문의약품과 바이오의약품에서 상위 10대 기업들이 높은 비중 차지
|
|
국내 높은 IT기술력으로 U-헬스케어와 3D프린팅 제품 허가가 대폭 증가하였고, 인공지능 융합형 첨단의료기기 및 첨단체외진단기기 개발과 함께 범부처 제품화 협력사업 활발
|
국내 바이오기업은 그 수 및 매출액 면에서 계속 증가하고 있으며, 우리 정부는 기술개발 및 산업생태계 조성 등을 통해 기업 성장을 적극 지원 |
|
첨단바이오의약품 및 첨단융복합제품에 대한 신속한 분류체계와 합리적 규제 필요하며, 신의료기술평가와 허가 연계 사업 가속화 필요
|
|
제1절
![]()
바이오 안전성 동향
1. 개요
유전자변형생물체의 개발과 이용은 꾸준히 증가하고 있지만 유전자변형생물체가 인체건강 및 환경에 미칠 영향에 대한 우려는 지속적으로 제기되고 있다. 이는 ‘유전자변형기술’이라는 새로운 기술에 대한 경험이 상대적으로 적고, 부정적 영향이 차후에 나타날 수도 있다는 가능성 때문에 고조되고 있다. 현재까지 유전자변형생물체의 잠재적 위해성과 혜택 또는 이익을 중심으로 논쟁이 지속되고 있으며, 유전자변형생물체에 대한 구체적인 우려는 생물다양성 보전과 관련하여 부각되어 왔다.
이에 국제사회에서는 유전자변형생물체의 국가간 이동의 규제에 초점을 두어 유전자변형생물체의 안전한 이동, 취급 및 이용에 관한 규정과 절차를 확립하여 바이오안전성을 확보하고자 생물다양성협약의 부속 의정서로 카르타헤나의정서(CPB:Cartagena Protocol on Biosafety)를 채택하였다. 국내에서는 카르타헤나의정서의 국내 이행을 위해 2001년 3월 산업자원부(산업통상자원부)가 주관이 되어 유전자변형생물체의 국가간 이동 등에 관한 법률(이하 LMO법)을 제정・공포・시행하고 있다.
본 절에서는 2017년 하반기부터 2019년 상반기까지의 유전자변형생물체를 둘러싼 국내외 법제도 동향 중 최근 이슈가 된 사안들과 함께 우리나라의 카르타헤나의정서 이행과 LMO법을 통하여 국내 바이오안전성 확보를 위해 어떠한 노력을 전개해 왔는지 등에 대하여 기술한다.
2. 해외 동향
가. 제9차 카르타헤나의정서 당사국회의 논의동향
카르타헤나의정서 사무국은 격년으로 당사국회의를 열어 그간의 의정서 이행상황을 점검하고 중요 의제들을 상정하여 논의하고 있다. 제9차 카르타헤나의정서 당사국회의(2018.11.17.∼29, 이하 제9차 당사국회의)는 이집트 샤름 엘 셰이크에서 개최되었다. 이번 당사국회의는 생물다양성협약 당사국총회, 나고야의정서 당사국회의와 함께 동시에 열렸으며, 형식적인 측면을 넘어 서로간의 연계성을 보다 강화할 수 있었다.
제9차 당사국회의에서는 위해성평가 및 관리, 사회경제적 고려, 비의도적 국가간 이동, 경유 및 밀폐이용, 바이오안전성정보센터(BCH: Biosafety Clearing House) 등이 의제로 올라 논의가 진행되었다.
‘위해성평가 및 관리’ 의제의 경우 유전자드라이브 기술로 개발된 유전자변형생물체와 유전자변형어류에 대한 잠재적 위해성에 대한 폭넓은 공감대를 형성하였다. 반면, 유전자가위기술로 개발된 유전자변형생물체에 대한 표준기술서 개발은 유전자변형생물체 개발・수출국과 수입국의 첨예한 대립 끝에 부결되었다. 아울러 많은 논의 끝에 위해성평가 특별전문가그룹 및 온라인포럼 활동 연장을 결정하였다.
‘사회・경제적 고려’에 대한 의제의 경우 ‘사회・경제적 고려 평가 가이던스’에 대해서는 모두 환영하였지만, 특별전문가그룹을 연장에 대해 첨예하게 대립하였으나 최종적으로는 연장하는 것으로 합의되었다.
‘유전자변형생물체의 비의도적 국가 간 이동’을 방지하기 위해 LMO 검출 및 식별을 위한 역량강화의 중요성이 강조되었다. 많은 당사국들이 이를 위한 예산 확보 및 교육 매뉴얼 작성 등을 요청하였는데 우리나라는 역량강화 중요성을 더욱 강조함과 동시에 Korea Biosafety Capacity Building Initiative를 통해 2015년부터 개도국 지원을 해왔으며 앞으로도 지속해 갈 것을 제안하였다.
‘경유 및 밀폐이용’과 관련해서는 시험포장에서 진행되는 실험재배(field trial, confined trial, experimental introduction)를 밀폐(contained use)와 구분하여 관리해야 하는 것인가에 대하여 집중적으로 논의하였다. 이에 대부분의 국가들은 밀폐이용과 구분하여 의도적 환경방출로 봐야 한다는 의제의 원안에 대하여 찬성하였다.
그 밖의 논의로는 당사국들이 의정서 이행에 바이오안전성정보센터(BCH: Biosafety Clearing House)의 역할이 중요함을 강조하고 생물다양성협약 및 나고야의정서 정보교류 체계와의 공동 운영방식을 승인하였다. 우리나라는 유엔환경계획(UNEP: United Nations Environment Program)이 바이오안전성정보센터와의 지역적 협력과 역량강화를 지속적으로 지원해 줄 것을 주장하여 반영되었다.
나. OECD
경제협력개발기구(OECD)는 생물다양성협약(CBD: Convention on Biological Diversity)의 부속 의정서인 카르타헤나의정서 이행과 국가간 생명공학기술 규제 및 제도의 조화를 유지하고 수출입에 따른 무역마찰을 최소화하기 위해 1995년 4월 전문가 그룹을 처음 구성한 이후 생명공학규제조화작업반(Working group on Harmonization of Regulatory Oversight in Biotechnology)과 신규식품사료안전성 작업반(Working group for the Safety of Novel Foods and Feeds)을 운영해 오고 있다. 이 작업반은 국가간 규제 조화를 위해 국가별 유전자변형생물체의 규제 동향을 공유하고, 작물별 위해성 평가 기술합의서(Consensus documents)를 개발하고 있다.
[표 4-1] OECD 생명공학 관련 작업반 연혁 및 현황
|
구분 |
생명공학규제조화 작업반 |
신규식품사료안전성 작업반 |
|
활동 |
∙위해성평가의 공통정보를 제공하는 생물학 기술합의서 개발 ∙65종의 기술합의서 개발 및 공개 |
∙영양성분, 독소, 알레르기 평가를 위한 성분분석 기술합의서 개발 ∙30종의 기술합의서 개발 및 공개 |
|
연혁 |
∙1995∼2008: 제1∼21차 ∙2009∼2018: 제22∼32차 |
∙1999∼2008: 제1∼14차 ∙2009∼2018: 제15∼25차 |
|
대표단 역할 |
∙LMO 위해성평가/심사체계 구축 및 국가정보 제공 ∙생물학 및 성분분석 기술합의서 개발 참여(십자화과, 버섯 등) |
|
공개된 기술합의서는 유전자변형생물체의 위해성 평가 기준으로 개발자들이 활용하고 있으며, 규제 당국의 위해성심사에도 활용되고 있다. 또한 LMO 데이터베이스(BioTrack Product Database)를 구축하여 회원국 및 비회원국의 유전자변형생물체 승인 현황을 제공하고 있다.
(1) 생명공학규제조화 작업반회의
1995년에 설립된 ‘생명공학규제조화 작업반’은 OECD 회원국 및 비회원국에서 현대 생명공학 산물의 안전성평가(심사)를 담당하는 규제 담당관들과 국제기구 및 생물 안전성 관련 전문가들이 참여하여 환경 위해성과 안전성 평가를 수행할 때 국가 간에 공통적으로 적용 가능한 기술합의서를 개발하고 있다.
식물분야 생물학 기술합의서는 현재까지 식물(작물, 화훼, 수목 등), 동물 및 미생물 등에 대한 65종의 기술합의서를 발간하였으며, 2017∼2018년에는 대서양연어와 모기(Aedes aegypti)의 생물학 기술합의서를 신규로 공개하였다1).
동물분야 생물학 기술합의서는 곤충 분야 첫 번째 기술합의서인 뎅기열 매개 모기(Aedes aegypti)의 생물학 기술합의서를 공개한 후속 작업으로 각국 대표는 말라리아 전염 매개 모기(Anopheles gambiae)의 생물학 기술합의서 개발을 제안하였다. 아프리카개발동맹(NEPAD: New Partnership for Africa's Development)과 국제생물과학회(ILSI: International Life Sciences Institute)는 OECD 사무국으로부터 추천 받은 전문가들과 함께 실무위원회를 구성하여 초안을 작성한 후 차기 작업반 회의에서 논의키로 하였다.
OECD 사무국은 유전자가위 기술을 포함한 신육종기술의 확장성에 주목하면서 OECD 과학기술정책위원회 산하 바이오 나노 융합기술(BNCT: Biotechnology, Nanotechnology, and Conversing Technology) 작업반에서 일부 논의되고 있는 국가별 규제 방향과 GMO로서의 규제 적용을 유발하는 요인에 대한 회원국의 의견을 요청하였다.
각국은 관련 기술개발 및 규제 현황에 대해 보고한 바, 해당 기술 선진국인 미국과 캐나다는 신육종기술을 식물육종 과정에 사용되는 하나의 기술로 간주하므로 별도의 규제는 필요 없으며, 호주는 신육종기술 중 SDN-1을 사용해 개발한 산물은 GMO 규제에서 제외한다는 정부의 방향을 보고하였다. 반면 유럽연합을 포함한 대부분의 국가는 별도 규제 여부에 대한 연구조사가 진행되고 있다고 보고하였다. 각국 대표는 관련 분야 동향을 계속 공유하고, 지속적인 논의가 가능하도록 추가 계획 마련을 합의하였다.
(2) 신규 식품사료안전성 작업반회의
OECD 과학기술정책위원회에서 창설한 생명공학 안전성 국제전문가 모임(GNE: Group of National Experts on safety in biotechnology)은 1990년에 현대 생명공학 관련 식품안전성을 다루는 작업반을 설립하였다. 작업반은 유전자변형생물체에서 유래된 식품 및 사료의 안전성 평가를 논의하기 위하여 회원국 및 비회원국의 위해성 평가 사례 및 분석 항목의 조화를 위해 관련 정보를 공유함으로써 신규 식품사료의 안전성을 확보하고 있다.
OECD에서는 신규 식품사료를 대상으로 성분분석 기술합의서(Composition Consensus Document)를 개발하고 있으며, 현재까지 30종을 발간하였다. 또한 OECD 사무국은 대상 작물과 저자 등에 따라 성분분석 기술합의서 내용이 달라지지 않도록 moisture, fiber, fat, protein 등 항목별 OECD 기술합의서를 조사, 정리한 결과를 발표하면서 동시에 성분분석 기술합의서 작성지침(instructions for authors)의 개정 필요성에 대해 회원국의 의견을 수렴하였다.
다. 해외 바이오안전성 이슈
(1) 미국 GM 의무표시제
미국은 ‘유전자변형 농산물과 그 가공식품은 일반농산물과 그 가공식품에 비해 표시해야 할 만큼 성분상 차이가 없다’는 식품의약품청(FDA: Food & Drug Administration)의 ‘실질적 동등성’ 원칙에 따라 연방차원의 유전자변형식품 의무표시제를 시행하지 않았다. 주(州)마다 표시제도를 도입하였지만 버몬트 주(州)의 의무표시제 시행(2016.7.1.)으로 연방차원의 의무표시제 필요성이 대두되었다.
이에 연방정부는 소비자에게 식품의 생명공학 정보를 공개하기 위하여 통일된 국가 기준을 마련하였다. 주(州) 차원의 개별적 유전자변형식품 정보공개 도입에 따른 규제비용 및 비효율성 방지를 위하여 주마다 상이한 유전자변형식품 표기법을 일원화하여 연방 상원에서 GMO 표시 개정안을 발의해 모든 주법에 우선하는 연방법인 국가생명공학식품공개기준법(NBFDS: National Bioengineered Food Disclosure Standard)을 2016년 7월 29일 제정하였다. NBFDS에 따라 미 농무부(USDA: United States Department of Agriculture) 산하의 농업마케팅국(AMS: Agricultural Marketing Service)에서는 하위 세부규정을 수립하기 위해표시방법에 관한 연구사업과 각계의 의견을 통해 2018년 5월 4일 세부규정(안)을 발표하였다. 이후 AMS 홈페이지를 통하여 세부규정(안)에 대한 충분한 의견수렴 과정을 거쳐 2018년 12월 21일에 하위 규정인 미국연방규정집(7CFR Part 66 National Bioengineered Food Disclosure Standard)을 제정하였다.
미국연방규정집은 유전자변형용어를 Bioengineered(BE)로 규정하고 있다. BE식품은 유전자변형기술을 통해 변형되어 그 유전물질이 검출되는 경우로, 전통 육종과 자연적으로 얻어질 수 없는 것으로 정의하였다. 이 법은 2019년 2월 19일 발효, 2022년 1월 1일부터는 의무적으로 이행되기 때문에 규제 대상자들은 2021년 12월 31일까지 NBFDS를 자발적으로 시행할 수 있다.
표시대상은 상업적 생산이 승인된 것으로 알팔파, 사과, 카놀라, 옥수수, 면화, 가지, 파파야, 파인애플, 감자, 연어, 대두, 호박, 사탕무가 해당되며 ArcticTM Apples, AquAdvantageⓇ과 같이 BE식품의 생산주체가 단일 기업일 경우 상품명으로 표기가 가능하다. 또한 유전자변형성분이 검출될 수 없는 고도로 정제된 식품 또는 성분은 BE식품으로 간주하지 않는다.
표시 예외 대상으로는 레스토랑 혹은 이동식당에서 제공되는 음식, 비의도적 혼입치 5% 미만 함유, 생명공학 사료를 먹인 동물에서 유래된 식품, 유기농 인증 받은 식품, 연매출 250만 달러 이하의 소규모 업체의 식품으로 정했다. 표시는 Bioengineered food 또는 Contain bioengineered food ingredients의 텍스트 표시와 전자 또는 디지털 링크로 표시하는 것이 가능하며, 아주 작은 포장에 대해서는 전화번호 또는 웹주소로 표시가 가능하다. 심볼로 표시하는 것도 가능하며 심벌은 다음 그림과 같다.

[그림 4-1] 미국의 BE식품 표시 심벌
(2) 미승인 GM작물 발견 및 조치
국외에서 GM밀, GM가지 등 미승인 GM작물이 발견되어 해당국가 정부의 조사와 사후조치가 진행되고 있다. GM밀의 경우 전 세계적으로 상업화된 사례가 없는 작물이며, GM가지는 상업화되어 재배되고 있는 작물로 차이점은 있으나 GM가지가 발견된 인도에서는 재배와 유통이 금지되어 있다. 각 국가 정부는 발견된 GM작물을 조사하여 원인을 파악하고 폐기한 후 사후 모니터링 계획 등을 발표하였다.
캐나다 식품검사청(CIFA: Canadian Food Inspection Agency)은 2018년 1월, 캐나다 앨버타 주(州) 남부지역에서 미승인 GM밀이 발견된 것을 확인하여 관련 조사 후 그 결과를 같은 해 6월에 발표하였다. 조사결과에 따르면 발견된 GM밀은 몬산토의 제초제내성 품종(MON71200)으로 앨버타 남부지역 외에서는 발견되지 않았으며, 해당 GM밀은 전부 폐기되었다.
CIFA는 무역 파트너들이 캐나다에서 수입한 밀을 검사할 수 있도록 해당 GM밀을 검출할 수 있는 방법을 개발하여 공유하였고, 보건부(Health Canada)와 함께 발견된 GM밀에 대한 위해성 평가를 실시하였다. 이에 식품안전성, 동물사료 및 환경 위해성을 나타내지 않는다고 결론을 내리고 향후 3년간 GM밀이 발견된 지역을 중심으로 모니터링을 진행할 예정이라고 발표하였다. 일본은 바로 캐나다산 밀에 대한 수입을 일시적으로 중단하겠다고 발표하였으며, 우리나라 식품의약품안전처도 국내로 수입되는 캐나다산 밀과 밀가루에 대해 수입 시마다 검사하여 미승인 GM밀이 검출되지 않은 것만 통관을 허용할 계획이라고 밝혔다.
2019년 6월에는 미국 워싱턴 주(州)에서는 파종되지 않은 농경지에서 자라고 있는 미승인 GM밀이 발견되었다는 미 농무부 동식물검역원(USDA APHIS)의 발표가 있었다. 같은 해 7월 12일 조사결과 발견된 GM밀은 제초제 내성 MON71300, MON71800으로 밝혀졌다. 해당 GM밀이 식품 유통망에 유입됐다는 증거는 없으며, FDA는 앞서 MON71800에 대한 안전성평가를 완료하였고 이것과 같은 유전자가 삽입된 MON71300도 안전하다는 입장을 내놓았다. 이어 APISH는 무역파트너들에게 이를 검출할 수 있는 키트를 제공할 예정이라고 밝혔다.
인도 하리아나 주(州)에서는 2019년 환경단체가 실시한 조사결과 인도 농부가 미승인 GM가지를 파종한 것이 확인되었다. 이들은 농민들이 이 종자를 2017년부터 이용해 왔다는 증언과 3개 지역에서 Bt가지가 재배되고 있는 것으로 보아, 주(州) 내의 많은 지역에서 재배되고 있음에 우려를 표하고, 중앙정부와 주정부에 즉각적인 조치를 요구했다.
하리아나 주(州)정부는 조사를 지시하였으며, 단속을 통하여 불법 파종된 Bt가지를 폐기했다고 밝혔다. 그러나 이를 계기로 농민단체들은 GM작물 재배금지에 반대하며 Bt가지와 제초제 내성・해충 저항성 면화를 재배하겠다고 선포하였으며 일부 지역에서 미승인 GM작물을 파종하였다. 이러한 움직임은 확산되고 있는 상황이며 연방정부는 미승인 GM작물의 파종은 불법이며 처벌될 수 있음을 강조하고 있다.
(3) 시장에 등장하는 GM사과, GM연어
오캐나건 스페셜티 과수원(OSF: Okanagan Specialty Fruits Inc.)에서 개발한 갈변방지 GM사과가 2017년 시장에 등장하였다. Arctic Apple이라는 상품명의 GM사과는 유전자 침묵(gene silencing) 기술을 활용해 갈변에 관여하는 효소인 폴리페놀옥시데이스(PPO: polyphenol oxidase)의 발현을 감소시켜 일반 사과보다 PPO가 10% 덜 발현되도록 만들어졌다. GM사과는 2015년 상반기 미국과 캐나다 규제당국으로부터 승인을 받아 재배가 시작되었으며, 2016년 10월 첫 번째 상업적 수확을 하였다. 2017년 상반기 미 중서부 10개 상점에서 6,500kg가량을 판매한 바 있고, 2017년 11월 캘리포니아 중서부 및 남부의

400여 매장에서 비닐팩에 포장된 조각형태의 GM사과가 시판되었다. 2018년 상반기에는 갈변하지 않는 GM사과로 만든, 감자튀김과 비슷하게 생긴 말린 사과 Arctic ApBitz가 아마존(Amazon.com)을 통해 판매 되었다.
한편, 아쿠아바운티(AquaBounty Technologies, Inc)에서 개발한 속성장 GM연어가 2017년 캐나다 소비자에게 판매되었다. 이 GM연어는 1년 내내 성장호르몬이 분비되어 일반 연어보다 약 2배 정도 빨리 자라는 연어로 2016년 캐나다 보건부로부터 식용 승인을 받았으며 승인 후 1년 후인 2017년 4∼6월까지 약 두 달간 1만 파운드(4,535kg)가 캐나다 시장에서 판매되었다. 미국에서는 2015년 식품이용 승인을 획득하였으나 같은 해 12월 17일, 미 의회는 연방정부의 지출 법안을 통해 FDA에게 GM연어 관련 표시제 마련을 지시하였고, FDA는 표시제가 마련되기 전까지 GM연어의 시장 유통을 금지하였다. 2019년 3월 미 농무부가 GMO표시제를 마련함에 따라 FDA는 GM연어의 수입을 허가하였고, 아쿠아바운티는 GM연어의 알을 수입하여 생산시설에서 양식할 수 있게 되었으며, 빠르면 내년 하반기에 상품화 될 수 있을 것으로 전망하고 있다.
3. 국내 현황
가. 유전자변형생물체 안전관리
유전자변형생물체의 안전관리를 위하여 2008년에 시행된 LMO법은 생물다양성협약(Convention on Biogical Diversity)의 부속의정서인 카르타헤나의정서(Cartagena Protocol on Biosafety)의 국내 이행법률의 성격을 지닌다.
LMO법은 유전자변형생물체의 안전관리에 대한 우리나라의 기본법적 역할을 담당한다. 카르타헤나의정서의 이행과 유전자변형생물체의 개발・생산・수입・수출・유통 등에 관한 안전성 확보를 위하여 필요한 사항을 정하였다. 이는 유전자변형생물체로 인한 국민의 건강과 생물다양성 보전 및 지속적인 이용에 미치는 위해를 사전에 방지하고 국민생활의 향상 및 국제협력을 증진할 것을 목적으로 하고 있다.
LMO법은 2008년 제정 시행된 이후 2019년 6월 12일에 13번째 개정법이 시행되었다. 2019년 5월 기준으로, 국회에는 유전자변형생물체 관련하여 협의심사제도 개선에 대한 의원입법안을 포함하여 9개의 개정법(안)이 상정, 소위에 계류 중에 있다.2)
LMO법에 따른 유전자변형생물체의 안전관리는 용도별로 구분되어 각 소관부처를 정하고 있으며 부처별 주요 역할은 다음과 같다.
[표 4-2] 부처별 LMO 안전관리
|
부처 |
대상 |
주요역할 |
|
과학기술 정보통신부 |
시험・연구용 유전자변형생물체 |
시험・연구용 유전자변형생물체의 수출입 등에 관한 안전관리 유전자변형생물체 연구시설의 설치・운영신고 및 허가 시험・연구용 유전자변형생물체의 개발・시험 승인 |
|
농림축산 식품부 |
농림축산업용 유전자변형생물체 |
농림축산업용 유전자변형생물체의 수출입 등에 관한 안전관리 유전자변형생물체 작물재배환경 위해성 심사・협의 농림축산업용 유전자변형생물체의 환경방출 실험 승인 |
|
산업통상 자원부 |
국가책임기관, 산업용 유전자변형생물체 |
산업용 유전자변형생물체의 수출입 등에 관한 안전관리 유전자변형생물체관련 정보의 관리 및 바이오안전성정보센터 운영 카르타헤나의정서 의무사항 등 이행에 필요한 업무수행 유전자변형생물체 관련 법・제도 개선 |
|
보건복지부 |
보건의료용 유전자변형생물체 |
보건의료용 유전자변형생물체의 수출입 등에 관한 안전관리 유전자변형생물체의 인체 위해성 심사・협의 유전자변형생물체의 개발・실험승인 유전자변형생물체 연구시설(인체위해 3・4등급)의 설치・운영 허가 |
|
환경부 |
환경정화용 유전자변형생물체 |
환경정화용 유전자변형생물체의 수출입 등에 관한 안전관리 유전자변형생물체의 자연생태계 위해성 심사・협의 |
|
해양수산부 |
해양수산용 유전자변형생물체 |
해양수산용 유전자변형생물체의 수출입 등에 관한 안전관리 유전자변형생물체의 해양생태계 위해성 심사・협의 |
|
식품의약품안전처 |
식품・의료기기용 유전자변형생물체 |
식품・의료기기용 유전자변형생물체의 수출입 등에 관한 안전관리 식품・의료기기용 유전자변형생물체의 인체 위해성 심사 |
|
외교부 |
국가연락기관 |
카르타헤나의정서 이행 국가연락기관 |
우리나라에서 신규 유전자변형생물체를 생산하거나 이용하려는 경우, 우리나라로 신규 유전자변형생물체를 수입하려는 경우에는 반드시 승인 전에 위해성심사를 용도에 따라 관계 중앙행정기관으로부터 받아야 한다. 농업용은 농림축산식품부, 산업용은 산업통상자원부, 보건의료용은 보건복지부, 환경정화용은 환경부, 해양수산용은 해양수산부에게 위해성심사를 신청하여야 한다.
수입하려는 유전자변형생물체가 비록 식품・사료・가공용(FFP: Food, Feed, for Processing)이라 할지라도 환경에 방출될 우려가 있거나 환경에 방출할 목적으로 수입하는 경우 용도별로 심사신청을 받은 기관(주관심사기관)은 국내 작물재배환경, 자연환경, 해양수산생태환경에 대한 위해성심사를 각각 농림축산식품부, 환경부, 해양수산부에 협의심사를 의뢰하여야 한다. 물론 우리나라에서 유전자변형생물체를 생산하려는 경우에는 환경 방출이 목적이기 때문에 반드시 환경위해성에 대하여 협의심사를 받아야 한다. 이를 도표로 나타내면 다음 그림과 같다.

[그림 4-2] LMO 위해성심사 체계
나. 바이오안전성 커뮤니케이션
카르타헤나의정서는 바이오안전성 확보를 위해 시민들이 LMO에 대한 국가적 결정과정을 이해하고, 참여하는 것을 매우 중요한 이슈로 판단하여 LMO의 안전한 이동, 취급, 이동에 대한 공공인식을 촉진할 수 있도록 협력해야 함을 제23조 공공인식 및 참여(Public Awareness & Participation)를 통해 규정하고 있다. 이 규정에 따라 카르타헤나의정서 당사국들은 일반대중에게 바이오안전성 및 LMO에 대한 정보를 투명하고 올바르게 제공하고자 다양한 방식의 커뮤니케이션 활동을 펼치고 있다. 우리나라의 LMO법에서도 의정서 제23조에서 규정하고 있는 대중에 대한 공공인식, 교육 및 참여를 보장하고 있으며 한국바이오안전성정보센터(KBCH: Korea Biosafety Clearing House)와 LMO 관계기관을 중심으로 다양한 바이오안전성 커뮤니케이션 활동을 수행하고 있다.
KBCH에서는 일반인과 LMO 이해당사자들을 대상으로 각 계층별 정보요구에 맞는 콘텐츠를 제작・제공하는 창구로 국내 유일의 LMO 정보제공 전문 사이트인 바이오안전성포탈(www.biosafety.or.kr)을 운영하고 있으며 2017∼2018년 기간 동안 바이오안전성포탈에 LMO관련 국내외 뉴스를 1,055건 등록하였다. 또한 최신 이슈 및 국가별・작물별 동향정보를 제공하는 KBCH 동향보고서를 총 12건 발간 등록하였고, LMO관련 이슈를 일반인들의 수준에서 쉽게 이해할 수 있도록 고안한 이슈 리플릿 총 4회, 이슈보고서 총 3회, 최신 LMO 이슈에 대한 정보를 심도 있게 분석하여 제공하는 뉴스&이슈를 신설해 총 11회 제작 등록하였다. 바이오안전성포탈 이외에도 블로그, 페이스북, 지식IN 등의 다양한 온라인 채널을 활용 LMO 정보를 제공하고 있다.
LMO관련 종사자들은 물론, 전문가 NGO 및 일반시민들이 LMO 정보를 공유하고 소통하는 지속적이며 개방된 형태의 논의의 장으로써 LMO포럼을 운영하고 있으며 정기적으로 LMO포럼 세미나를 개최하고 있다. LMO포럼 세미나는 유전자변형생물체 및 바이오안전성 관련 전문가 네트워크와 정보 교류 시스템을 구축하고, 대국민 커뮤니케이션 활성화를 통하여 바이오산업에 건전한 발전에 기여하는 것을 목적으로 2010년부터 총 25차례의 국내 및 국제 세미나를 개최하였다. 2017∼2018년에는 LMO 안전관리 및 유전자가위 기술을 주제로 세미나가 개최되었다.
[표 4-3] LMO포럼 개최 현황(2017∼2018)
|
회차 |
일시 |
주제 |
|
22차 |
2017.7.13. |
제3차 유전자변형생물체 안전관리계획 수립 워크숍 |
|
23차 |
2017.12.8. |
산업용 LMO 안전관리 법・제도 설명회 |
|
24차 |
2018.7.12. |
LMO로 인한 피해의 책임 및 구제에 대한 토론회 |
|
25차 |
2018.10.11. |
산업용 LMO 산업, 규제 현황 및 전망 |
|
26차 |
2018.11.1.∼2. |
제2차 아시아포럼: 유전자가위기술 |
계층별 차별화된 커뮤니케이션 활동으로 전국 고등학생 바이오안전성・바이오산업 토론대회를 해마다 개최하였다. 청소년들이 유전자변형생물체(LMO)와 바이오산업에 대해 다양한 정보에 입각한 올바른 가치판단을 할 수 있도록 유도하고, 다각적이고 심도 깊은 토론을 통해 생명과학에 대한 폭넓은 이해와 과학적 소양을 함양할 수 있도록 노력하였다.
GMO 및 바이오안전성 관련 국민적 소통을 증진하는 것을 목적으로 2014년부터 생명공학 및 GMO에 관심 있는 대학생을 선발해 KBCH 대학생 기자단을 운영하고 있다. 2017년부터는 유전자변형생물체(GMO)및 유전자가위 기술을 주제로 교사대상 GMO&Debate 세미나를 개최하여 최신 생명공학기술에 객관적이고 과학적인 지식전달을 통해 관련 이해도를 높이고, 교육현장에서 생명과학 토론의 효과적인 적용방안 모색에 기여하고 있다.
이 밖에도 바이오안전성 및 유전자변형생물체와 관련된 정보를 수집・분석하여 바이오안전성백서, LMO전문 정보지 BIOSAFETY 등 다양한 발간물을 제작해 관계중앙행정기관, 산업계, 학계, 연구계, LMO 이해당사자 및 일반국민들을 대상으로 배포하고 있다.
다. 국내 바이오안전성이슈
(1) GMO 완전표시 국민청원
우리나라는 유전자변형식품 등의 표시대상, 표시의무자 및 표시방법 등에 필요한 사항을 규정함으로써 소비자에게 올바른 정보를 제공하기 위해 유전자변형식품 표시제도를 운영하고 있다. 2015년 12월에는 원재료 함유 순위와 상관없이 최종제품에 유전자변형 DNA나 외래단백질이 남아 있으면 표시하도록 하는 식품위생법 일부 개정 법률안이 국회 본회의를 통과하여 2017년 2월 4일부터 시행되고 있다.
그러나 시민사회단체는 최종제품에 유전자변형 DNA 또는 외래단백질이 남아있지 않거나 검출이 불가능할 경우 표시 대상에서 제외되는 등의 예외 규정에 대해 지적했다. 이에 GMO 원료를 사용하였을 것으로 추정되지만 유전자변형식품 표시가 되지 않는 것은 문제가 있다며 ‘GMO 완전표시제’ 시행을 촉구하고 있다. 2018년 3월에는 57개 시민사회단체로 구성된 ‘GMO 완전표시제’ 시민청원단이 청와대 국민청원을 진행하였다. 국민청원은 총 21만 6,886명이 청원에 참여(한 달 이내 20만 명의 청원 신청이 완료된 경우 청와대 혹은 해당 정부 기관이 답변)하였으며 2018년 5월 8일 제25호 답변으로 청와대 사회정책 비서관의 청원답변이 이루어졌다. 답변 이후 정부에서는 GMO표시제도 개선을 위하여 2018년 12월 사회적 논의기구인 GMO 표시제도 개선 사회적 협의회를 구성하여 논의를 진행하고 있다.
|
∙GMO 완전표시제 촉구 청원 주요 내용
소비자 알 권리, 선택할 권리 보장과 생산자 보호를 위해 현행 GMO 표시 개정을 청원합니다. 첫째, GMO를 사용한 식품에는 예외없이 GMO표시를 해야 합니다. 둘째, 공공급식, 학교급식에는 GMO식품 사용을 금지해야 합니다. 셋째, Non-GMO 표시가 불가능한 현행 식약처 고시는 개정돼야 합니다. GMO 표시 강화와 학교급식에서의 퇴출은 대통령 공약사항이었습니다. 공약 이행을 촉구합니다.
∙청와대 답변의 주요 내용
“GMO를 사용한 식품에는 예외 없이 GMO 표시를 해야 합니다.”와 관련해 식용유, 전분, 전분당 등의 원료가 되는 옥수수, 콩(대두)의 국내 자급률이 낮아 수입에 의존하고 있기 때문에, GMO 완전표시제 도입으로 Non-GMO 원료를 사용할 경우 물가인상, 경제적 능력에 따른 계층간 위화감 조성 우려가 있으며, GMO 제품에 대한 실질적 차별로 통상마찰 가능성 등이 있어 종합적으로 고려할 필요가 있음. 이에 소비자단체의 의견을 경청해 전문성과 객관성이 보장된 협의체를 구성하고 관계부처도 협의체에 참여해 실질적인 협의가 이루어질 수 있도록 하겠음. 또한 물가인상, 통상마찰 등의 우려에 대해서도 이견이 존재하는데, 이를 해외사례와 비교하여 객관적으로 확인하기 위한 연구도 진행할 계획이며 연구 과정에도 청원에 참여한 소비자단체가 함께 할 수 있도록 하겠음.
“공공급식, 학교급식에는 GMO 식품 사용을 금지해야 합니다.”와 관련해 현재 학교와 어린이집 등 공공급식에 원재료 형태의 GMO 농산물은 공급되지 않고 있으며 기름, 전분, 당이 문제인데 GMO 단백질은 전혀 남아있지 않아서 현재 기준으로는 GMO식품은 공공급식에 쓰이지 않는 셈임. 원재료 GMO 여부까지 표시하도록 하는 ‘완전표시제’가 시행되어야 공공급식에서 GMO 식품을 제외 할지 여부를 논의 할 수 있음.
“Non-GMO 표시가 불가능한 현행 식약처 관련 고시는 개정돼야 합니다.”와 관련해 GMO 단백질 유전자가 조금이라도 남아 있는 제품은 Non-GMO 표시를 할 수 없도록 제한하는 것이 현재의 규정인데 이것을 완화해서, 0.9% 이내의 GMO 혼입은 Non-GMO 표시를 할 수 있도록 허용해 달라는 요청임. 그러나 소비자들은 Non-GMO 표시식품은 GMO가 전혀 포함되어 있지 않은 식품으로 인식하고 있어 소비자 혼란을 초래할 수 있고, 국제적인 추세를 보더라도 Non-GMO 기준을 완화하는 것은 어려움. |
(2) 국내 미승인 GM면화, GM유채 발견 및 조치
국내에서도 GM유채, GM면화 등 미승인 GM작물이 발견되어 폐기조치 및 사후 모니터링이 진행되었다. GM유채는 2017년 5월 11일 국립종자원의 조사로 태백시 체험공원에서 발견되었으며 몬산토사(社)가 개발한 GT73 품종으로 제초제 내성 형질의 유채로 식품용과 사료용으로는 승인되었지만 재배용으로는 승인되지 않아 미승인 GM유채로 확인되었다. 폐기를 위해 국립종자원 주관, 농촌진흥청이 입회하여 현장 격리 후 경운 처리와 손 제초를 통해 유채를 제거하였으며, 미승인 GM유채 사후관리를 위해 농림축산식품부 주관 안전관리대책팀이 구성・운영되었다.
안전관리대책팀은 2016년 1월 이후 수입된 유채종자, 유채축제지, 재배농가에 대한 전수조사, 현장 확인 및 폐기를 추진하였으며 중국산 수입업체를 조사한 결과 4개사에서 GM유채 혼입사례를 발견하였고 혼입 의심된 32.5톤 중 16톤은 이미 종자를 폐기하였거나 음성으로 확인되었고, 나머지 16.5톤은 재식된 것으로 파악되어 사후관리를 추진하였다. 최종적으로 16.5톤에 해당하는 유채 방출 지역은 전국 70개 시군구, 총 98개소로 파악되었으며 해당지역의 유채는 경운, 제초제 살포, 손 제초, 매몰, 소각 등의 방법으로 폐기처리 하였다.
폐기 이후 유관기관 및 시민단체와의 정보 공유 및 향후 개선방안 모색을 위한 국립종자원 주관으로 민관합동 환경영향조사가 총 4차례 진행되었다. 조사를 통해 GM유채가 발견된 지역을 중점관리지역으로 지정하여 지속적으로 관리한 결과 감소 추세를 보였다. 유채의 환경영향에 대한 연구도 진행되어 GM유채 발견지 및 주변 지역 근연종으로의 유전자 이동성을 조사한 결과 유채로부터 근연종으로의 유전자 이동이 발견되지 않음을 확인하였다.
환경부 국립생태원에서 매년 실시하고 있는 ‘유전자변형생물체(LMO) 모니터링’ 과정에서 전남 목포시 고하도 재배지에서 GM면화가 검출되어 2017년 11월 10일 농림축산식품부에 통보되었다. 농림축산식품부는 현장격리와 정밀검사를 통해 발견된 GM면화가 몬산토사(社) 이벤트명 MON531임을 확인하였고, 이후 전국 면화 재배 농가, 축제지, 농업경영체, 농진청 종자 제공처 및 수입종자 등을 대상으로 추적 조사하였다.
조사결과 LMO로 확인된 면화 방출 지역은 총 62개소로 파악되었으며 발견된 GM면화는 현장에서 소각・폐기 추진하였다. 사후조치로는 2018년 5월부터 농진청(국립농업과학원)주관으로 연 3회(자체조사 2회, 민관합동조사 1회)를 추진하고 있다. 2018년 11월 실시된 2차 자체조사(농과원, 종자원, 지자체)의 최종 조사 결과 총 57개소 중 미발견지 48개소, 발견지 9개소(음성 8, 양성1)로 확인되었다. 양성 발견지는 현장에서 모두 소각 폐기하였고, 지속적인 안전관리를 위해 발견지 소유주와 지자체 등 담당자 간에 협력과 소통을 추진하고 있다
4. 발전 과제 및 전망
LMO법 책임기관인 산업통상자원부를 비롯한 관계중앙행정기관 및 바이오안전성정보센터에서는 카르타헤나의정서 및 LMO법을 근거로 LMO안전관리를 시행해왔으며 제3차 LMO 안전관리 계획을 수립 시행함으로써 LMO로 인한 인체 위해 및 환경에 미칠 수 있는 위해를 사전에 방지하고자 지속적으로 노력해왔다.
최근 GM옥수수, GM대두, 면화, 캐놀라 등 널리 재배되어 왔던 주요작물 이외에도 GM가지, GM사과, GM감자 등 신규 GM작물 상업화가 이루어졌으며 식용으로 이용하는 최초의 GM동물인 GM연어가 시장에 등장하는 등 이용이 증가하고 있다. 반면 미승인 GM밀, GM가지, 국내에서는 GM유채, GM면화가 발견되는 LMO 안전관리에 대한 경각심을 일깨워 주는 사건도 있었다. LMO로 인한 혜택을 누리기 위해서는 철저한 안전관리가 이루어져야 함을 보여주는 사례라 할 수 있다.
시민사회단체를 중심으로 한 소비자들의 GMO 표시제 강화 요구 또한 주목할 만 하다. 국내에서는 GMO 완전표시제 도입에 대한 요구로 사회적 합의체가 구성되어 운영되고 있으며, GMO 의무표시제가 시행되지 않던 미국에서 GMO 표시제가 도입되는 등의 변화가 있었다. 그 기저에는 GM식품을 기피하는 소비자들의 인식이 바탕이 되었으며 GMO에 대한 올바른 정보제공 및 적극적인 커뮤니케이션이 필요한 상황이라 판단된다.
이런 상황 속에서 산업통상자원부를 비롯한 우리 정부는 LMO로 인한 국민의 건강과 생물다양성의 보전 및 지속적인 이용에 대한 위해를 방지하기 위하여 LMO의 위해성심사, 수입승인, 운송・보관・유통, 연구개발 등과 관련한 안전관리에 최선을 다하고 있다. LMO 관계기관뿐만 아니라 LMO의 개발・생산・수입・수출・판매・운반 및 보관 등의 관련활동에 종사하고 있는 이해당사자, 그리고 시민단체를 포함한 우리나라 국민 모두가 LMO법의 시행에 적극 협조하여 바이오안전성의 확보 및 바이오산업의 건전한 발전의 토대가 형성될 수 있기를 기대한다.
제2절
![]()
생명윤리 동향
1. 개요
질병극복, 식량문제 해결, 환경 보호 등 생명공학 기술 발전이 인류에 엄청난 기여를 할 것이라는 기대와 함께 다른 한편에서는 인간 존엄성 침해, 생태계 교란 등에 대한 우려도 존재한다. 특히 유전자편집 기술이 발전하고 개인건강정보가 새로운 제품・서비스를 개발하는 데 중요한 자원이 되고 뇌 과학에 대한 관심이 증대하면서 보다 세부적으로 생명윤리 논쟁들이 활발해지는 양상이다. 여기에서는 2017년 하반기부터 2019년 상반기까지 대두되었던 다양한 생명윤리 논쟁들 중에서 특히 인간배아 유전자편집 연구, 개인정보 활용, 신경윤리를 중심으로 국내외 논의 동향 및 정책 변화들을 살펴보려고 한다.
2. 해외 동향
가. 인간배아 유전자편집 연구 관련 해외 동향
최근 유전자편집 연구와 관련해서 가장 충격적인 사건을 꼽는다면 2018년 11월 28일 중국 남방과기대 허젠쿠이(賀建奎)교수가 발표한 유전자편집 맞춤형 아기의 탄생 소식일 것이다. 제2차 인간유전체교정 국제학회(Second International Summit on Human Genome Editing)에서 허젠쿠이 교수는 후천성 면역결핍증후군(AIIDS)이 발병하지 않도록 바이러스의 수용체 역할을 하는 CCR5 유전자를 제거한 아이를 임신하고 출산하는 데 성공하여 쌍둥이 아기들이 탄생하였다고 발표하면서 전 세계를 놀라게 했다.
인간배아를 활용한 연구는 인간 존엄과 정체성, 배아의 도덕적 지위와 같은 윤리적 이슈들이 결부되어 있는 만큼, 일찍이 여러 국가들은 유전될 수 있는 인간 생식세포(germline)를 조작하는 연구에 대한 규제를 수립해 왔다. 대표적인 예가 바로 유럽이사회에서 비준한 오비도협약이라 불리는 인권과 생의학에 관한 협약(The Oviedo Convention: protecting human rights in the biomedical field)이다. 오비도 협약에서는 유전자조작은 예방, 진단, 치료 목적으로 후손의 유전적 구성을 변화시키지 않는 경우에만 허용된다고 명시하고 있으며, 이에 대해 유럽 35개국이 승인하였다3). 미국의 경우 연방 정부 차원에서는 인간 배아를 이용하는 연구에 대한 법적 금지가 없지만 주(州) 정부의 경우 금지하거나 규제하는 주들이 일부 존재한다.
유전자편집 기술이 최근 몇 년 간 빠르게 발전하면서 법이나 정부 가이드라인이 아니라, 과학자 스스로 규범을 만드는 활동들도 활발하게 이루어지고 있다. 대표적인 사례가 바로 미국 한림원연합회(NASEM: The National Academies of Sciences, Engineering, and Medicine)4)에서 발표한 권고안일 것이다. NASEM은 2017년 ‘Human Genome Editing: Science, Ethics, and Governance’ 보고서에서 유전될 수 있는(heritable) 유전자편집에 대한 임상연구는 아래와 같은 조건일 때에만 제한적으로 허용되어야 한다고 권고한 바 있다.
|
Box 1. 유전될 수 있는 유전자편집 임상연구에 대한 NASEM의 권고안1)
미국 NASEM에서는 유전될 수 있는 유전자편집에 대한 임상연구는 아래와 같은 조건일 때에만 제한적으로 허용되어야 한다고 권고한다. 1) 합리적인 대안이 부재하고, 2) 중증 질환이나 증상(condition)을 예방하는 목적으로, 3) 중증 질병이나 증상을 직접 야기하거나 밀접하게 관련되는 것으로 증명된 유전자들에 한정해서, 4) 보편적으로 존재하고 부작용이 거의 없이 정상적인 건강과 관련되는 것으로 알려진 유전자들로 제한적으로 전환시키고, 5) 절차에 대한 위험과 잠재적인 건강상의 이익에 대해 믿을만한 비임상 혹은 임상 자료가 존재하며, 6) 연구 참여자들의 건강과 안전을 위해 임상 시험 동안 지속적이고 철저한 감시가 이루어지며, 7) 개인의 자율성을 배려하면서도 장기간 후손들까지 고려한 후속 계획이 있으며, 8) 환자 프라이버시를 보호하면서도 최대한의 투명성을 보장하며, 9) 광범위한 시민 참여와 함께 건강 및 사회적 이익과 위험을 지속적으로 재평가하고, 10) 심각한 질병이나 증상을 예방하는 것 외에 사용되지 않도록 믿을 만한 감시 메커니즘이 작동할 때 허용되어야 한다. |
NASEM 이외에도 국제줄기세포연구학회(ISSCR: International Society for Stem Cell Research)의 경우에는 2016년 재생의료연구를 위한 전문가 가이드라인에서 과학적, 윤리적 측면이 모두 명확해질 때까지, 출산(human reproduction)을 목적으로 하는 인간 배아의 유전자 조작은 현 시점에서는 금지되어야 한다고 명시하였다5). 뿐만 아니라 미국 인간유전학회(ASHG: American Society of Human Genetics)에서는 2017년 3월 ‘임신으로 이어지는 생식세포 유전자편집을 수행하는 것은 부적절하다(it is inappropriate to perform germline gene editing that culminates in human pregnancy)’라는 내용을 담은 성명서(statement)를 발표하였다. 이 성명서는 영국, 캐나다, 미국, 호주, 아시아, 남아프리카 등에서의 전문가 단체들이 서명한 것이다.6)
즉 글로벌 차원에서 아이의 임신・출산으로 이어지는 유전자편집 시도는 이번 허젠쿠이 교수가 최초라고 할 수 있으며, 그동안의 글로벌 규범을 파기한 것이었기 때문에 전세계를 당혹시킬 만한 사건이었다. 이 사건에 대해 2019년 1월 남방과기대는 허젠쿠이 교수를 해고하고 관련 연구계약들을 종료시켰다.
나. 개인정보 활용 관련 해외 동향
개인정보 관련해서 최근 2년간의 가장 큰 변화는 아마도 유럽연합(EU)이 개인정보보호법(GDPR: General Data Protection Regulation)을 개정하여, 2018년 5월부터 적용한 것이라고 할 수 있다. GDPR은 유럽연합 역내 디지털 경제 활성화와 개인정보보호 간의 균형을 맞추고 글로벌 디지털 시장 내 지위를 강화하기 위한 목적으로 수립되었다. 유럽연합 역내 국민들의 개인정보를 처리하는 역외 기업에게도 적용되는 만큼, 유럽인들을 대상으로 한 다양한 서비스를 제공하는 기업들이 모두 해당되는 조치라는 측면에서 눈여겨 보아야 할 정책변화이다(정일영 외, 2018).
GDPR의 주요 내용을 간단히 소개하면 다음과 같다7). ‘개인정보 처리의 6대 원칙’을 제시하였으며, 기업의 데이터 관리 책임성을 강화하고, 정보제공 주체의 권리 중에서 개인정보의 처리제한권, 개인정보 이동권, 반대권, 삭제권 등이 새롭게 추가되었다. 또한 GDPR이 적용되는 EU 역내에서는 데이터의 자유로운 전송을 허용하고, 역외 전송은 적정성 평가를 통과한 국가만 허용하였다. 마지막으로 GDPR 조치에 대한 중대한 위반이 발생할 경우 2,000만 유로 혹은 전년도 회계연도의 글로벌 총매출 4%에 해당하는 금액 중에서 높은 금액을 벌금으로 부과할 수 있도록 하는 등 위반에 대한 강력한 제재를 명시하였다.
GDPR에서 주목할 부분은 연구를 위해 데이터 활용을 허용하는 예외 조항들이 다수 포함되어 있다는 점이다8). 우리나라의 개인정보보호법에서 건강 정보를 민감정보로 분류하는 것처럼 GDPR에서도 건강 정보를 ‘특별한 범주의 개인정보(Special categories of personal data)’로 분류하여 원칙적으로 처리를 금지하고 있는데, 우리나라와 달리 과학적 연구 목적에 대해서는 활용이 가능하다는 예외규정을 두고 있다(GDPR 제9조 2항 J). 우리나라의 개인정보보호법에서는 개인의 동의를 별도로 받거나, 다른 법령에서 민감정보의 처리를 요구하거나 허용할 경우에 가능하다고 예외를 두고 있다(개인정보보호법 23조).
그 외에도 GDPR에서는 목적제한(Purpose limitation) 원칙, 보관기간 제한(Strorage limitation) 원칙과 제3자 활용 시 고지의무, 정보주체에게 제공되는 삭제권과 거부권의 경우에도 과학적 연구 목적을 위한 예외를 허용하고 있다. 가령 목적제한 원칙에 따라 당초 목적대로 개인정보를 처리해야 하지만, 추가적인 과학적 연구를 위해서는 개인정보의 목적 외 활용이 가능하다고 해석하는 것이다. 국내 개인정보보호법에서도 학술연구 등의 목적을 위한 개인정보의 ‘목적 외 활용’을 허용하고 있으나, 특정 개인을 알아 볼 수 없는 형태로 제공되어야 한다는 점에서 차이가 있다.
다. 신경윤리 관련 해외 동향
최근 뇌과학연구, 신경기술에 대한 연구활동이 활발해지면서, 치료 목적이 아닌 인간의 능력 증강을 위해 신경기술이 활용될 경우 발생할 수 있는 윤리적 이슈들이나 뇌 데이터를 활용할 때 생기는 개인정보보호 이슈 등 향후 미래에 발생할 수 있는 문제들에 미리 대비해야 한다는 논의들이 제기되고 있다. 주요국의 경우 뇌과학 관련 연구 프로젝트에 윤리위원회를 설치하는 방식으로 이러한 논의들을 본격적으로 다루고 있는데, 예를 들면, 미국 뇌과학이니셔티브(Brain Initiative)의 신경윤리 작업반(Neuroethics Working Group), 유럽연합 휴먼브레인 프로젝트의 윤리자문위원회 등이 있다.9)
또한 국제협력개발기구(OECD: Organization for Economic Cooperation and Development) 과학기술정책위원회(CSTP: Committee for Science and Technology Policy)의 산하 작업반 중 하나인 바이오나노융합기술반(BNCT: Bio, Nano, Converging Technology)에서는 2019∼ 2020년까지 2년 동안 ‘신경기술의 책임 있는 혁신(Responsible Innovation in Neurotechnology)’ 이라는 주제로 프로젝트를 추진하고 있다. 이 프로젝트의 주된 미션 중 하나가 바로 신경기술 분야의 책임 있는 혁신 원칙을 최종 공표하는 것이다. 2019년 5월 기준으로 논의되고 있는 신경기술 분야의 책임 있는 혁신 원칙(안)은 다음과 같다.
|
Box 2. OECD Draft Principles for Responsible Innovation in Neurotechnology2) (2019.5.17.버전)
원칙1. 건강 문제 해결을 위해 신경기술의 책임 있는 혁신을 촉진할 것 Promote responsible innovation in neurotechnology to address health challenges 원칙2. 신경기술의 발전과 활용에서 안전성 확보를 우선순위에 둘 것 Prioritise assessing safety in the development and use of neurotechnology 원칙3. 건강을 위해 신경기술의 포용성을 강화할 것 Promote the inclusivity of neurotechnology for health 원칙4. 국경이나 섹터, 학문분야를 넘어선 신경기술 혁신의 과학적 협력을 증진시킬 것 Foster scientific collaboration in neurotechnology innovation across countries, sectors, and disciplines 원칙5. 신경기술에 대한 사회적 숙의가 가능하도록 할 것 Enable societal deliberation on neurotechnology 원칙6. 감시기구나 자문기구들이 신경기술 분야의 새로운 이슈들을 다룰 수 있도록 할 것 Enable the capacity of oversight and advisory bodies to address novel issues in neurotechnology 원칙7. 신경기술을 통해 획득한 개인 뇌 데이터와 다른 정보들을 보호할 것 Safeguard personal brain data and other information gained through neurotechnology 원칙8. 공공과 민간 부문에 걸쳐 신경기술의 책임성과 신뢰 문화를 촉진시킬 것 Promote cultures of stewardship and trust in neurotechnology across the public and private sector 원칙9. 신경기술에 의한 의도치 않은 활용이나 남용 가능성을 예측하고 모니터할 것 Anticipate and monitor the potential unintended use and/or misuse of neurotechnology |
3. 국내 현황
가. 인간배아 유전자편집 연구 관련 국내 동향
국내에서 인간배아를 대상으로 한 유전자편집 연구는 생명윤리 및 안전에 관한 법률(이하, 생명윤리법)에 따라 규제된다. 생명윤리법 23조에 의거하여, 임신 외의 목적으로 배아를 생성하는 것이 금지되어 있으며, 동법 29조에 따라 배아의 보존기간이 지난 잔여배아의 경우 발생학적으로 원시선이 나타나기 전까지 법에 명시된 연구목적에 대해서만 제한적으로 활용할 수 있다. 생명윤리법에서 명시하는 연구목적이란, 난임치료법 및 피임기술의 개발을 위한 연구, 근이영양증과 그밖에 대통령령으로 정하는 희귀・난치병의 치료를 위한 연구, 그 밖에 국가위원회의 심의를 거쳐 대통령령으로 정하는 연구이다(생명윤리법 29조).
한편, 허젠쿠이 교수의 경우처럼, 유전자편집 배아를 착상시켜 출산하는 행위 자체는 생명윤리법에서 명확하게 규정되어 있지 않은 상황이다. 생명윤리법에서는 체세포복제배아 및 단성생식배아의 착상, 출산만을 금지하고 있기 때문이다(생명윤리법 20조). 다만 생명윤리법에서는 유전자치료에 대한 엄격한 규정을 두고 있는데 예를 들어, 인체 내에서 유전적 변이를 일으키는 일련의 행위에 해당하는 유전자치료 연구는 ‘유전질환, 암, 후천성면역결핍증, 그 밖에 생명을 위협하거나 심각한 장애를 불러일으키는 질병의 치료를 위한 연구’와 ‘현재 이용 가능한 치료법이 없거나 유전자치료의 효과가 다른 치료법과 비교하여 현저히 우수할 것으로 예측되는 치료를 위한 연구’라는 두 가지 조건을 모두 만족해야만 할 수 있도록 명시되어 있다(생명윤리법 47조).
나. 개인정보 활용 관련 국내 동향
최근 국내에서 개인정보 관련 가장 뜨거운 법적 쟁점은 개인정보의 정의에 대한 부분과 가명정보의 활용에 대한 것이다. 국회 의안정보시스템에 의하면 2018년 7월∼2019년 6월 말까지 개인정보보호법 일부개정법률안 24건이 발의되었으며 대부분 개인정보, 가명정보, 익명정보를 구분하고 가명정보의 활용 근거를 법적으로 명시하려는 내용들을 담고 있다. 이는 일본이 2015년 9월 ‘익명가공정보’의 경우 제3자에게 제공할 때 정보주체의 동의를 받지 않아도 되도록 ‘개인정보보호법’을 개정한 것이나, 2018년 5월부터 적용된 유럽 GDPR에서 공익적 기록보전 목적, 과학적・역사적 연구 목적 및 통계적 목적을 위해서는 가명정보의 활용을 허용하는 다양한 조치들을 포함한 것과 그 궤를 함께 한다고 볼 수 있다.
한편, 인간대상 연구나 인체유래물을 활용하는 연구를 위해 개인건강정보 등을 활용하는 경우에는 국내의 경우 개인정보보호법뿐만 아니라 생명윤리법과 의료법 등이 관련되어 있지만, 이와 관련한 법 개정 노력은 개인정보보호법 개정 노력에 비해 상대적으로 저조한 상황이다.
다. 신경윤리 관련 국내 동향
우리나라에서 뇌과학 분야의 연구개발에 대한 정부의 지원은 1998년 제정된 뇌연구 촉진법에 기반을 둔 1차 뇌연구촉진 기본계획(1998∼2007), 2차 뇌연구촉진 기본계획(2008∼2017)에 이어, 현재 3차 뇌연구촉진 기본계획(2018∼2027)에 이를 정도로 비교적 오랜 역사를 지니고 있으나, 신경윤리에 대한 관심은 최근에서야 본격화되기 시작했다.
대표적으로 3차 뇌연구촉진 기본계획에서 중점과제 중 하나로 신경윤리위원회 설치, 뇌신경윤리 가이드라인 마련, 뇌신경윤리정책센터 지정 등의 내용들이 포함되었다10). 또한 국내 대학에 ‘신경윤리’ 과목 신설과 신경윤리에 관한 대중의 인식 제고와 참여를 위한 교육과 홍보를 강화하겠다는 내용과 함께, 국제협력을 통한 뇌신경윤리 전문가 양성 프로그램 지원이 3차 뇌연구촉진 기본계획에 포함되었다. 뿐만 아니라 이러한 기본계획의 내용을 실현하고자 미래뇌융합기술개발사업의 일환으로 뇌신경윤리 연구사업이 2019∼2023년까지 매년 2억∼2억 7,000만 원 정도의 규모로 기획되었으며, 윤리적・법적・사회적 함의(ELSI: Ethical, Legal, Social Implication)를 다루는 위원회 운영과 뇌신경 윤리 거버넌스 구축, 뇌신경과학기술에 대한 ELSI 관련 중장기 계획 수립 등에 대한 연구가 올해 시작된 상황이다11).
4. 발전 과제
앞서 살펴본 중국 허젠쿠이 교수의 인간배아 유전자편집 시도는 글로벌 사회의 공통적인 규범이 존재하더라도, 개인의 일탈행위를 미연에 방지하지 못하는 기존 제도의 한계를 잘 보여준다. 생명윤리 영역은 법이나 제도의 문제이기 앞서, 생명을 어떻게 바라보는가에 대한 사람들의 인식과 문화적 요소들이 결부되는 만큼, 근본적인 해결방안을 찾기가 쉽지 않다.
다만 앞으로 지속적으로 생명공학 기술은 발전할 것이고, 수많은 윤리적 이슈들이 제기될 것이므로 문제 해결을 위해 도움이 될 수 있는 방안이라면 이슈가 제기되기 훨씬 이전 시점부터 사회적 논의를 시작하는 것이 바람직하다고 본다. 중국에서 허젠쿠이 교수와 같은 사건이 발생할 수 있었던 것은 제도적인 문제라기보다는 생명윤리 이슈들에 대해 충분히 논의하지 않았던 중국의 특수한 상황과 무관하지 않아 보인다. 그런 측면에서 신경윤리 이슈처럼 아직까지 본격적으로 문제시되고 있지 않지만 바람직한 방향으로 연구가 진행될 수 있도록 일찍부터 논의를 시작하는 국내외 시도들은 큰 의미가 있다고 볼 수 있다.
또한 생명윤리 이슈에 대해서는 다양한 관점이 부딪힐 수 밖에 없기 때문에 광범위한 이해당사자들과 충분한 시간을 두고 논의할 필요가 있다. 충분한 논의와 사회적 숙의과정을 통해, 기본적으로 연구자들의 연구자율성을 최대한 보장하면서도 그 연구결과가 인간의 존엄성을 훼손하거나, 개인 프라이버시를 침해하는 등 부정적인 문제들을 야기하지 않도록 안전장치를 마련하는 것이 제도의 수용성과 효과를 높이는 방안이 될 것이다.
제3절
생명공학 지적재산권 제도 동향
1. 개요
현재 우리는 본격적으로 4차 산업혁명기에 진입했다. 고도한 지식기반의 생명공학 기술은 인공지능, 빅데이터, 사물인터넷, 지능형네트워크 기술과 함께 4차 산업혁명 시대의 혁신적 변화를 주도하고 바이오경제 시대의 조기 도래를 유도할 것으로 전망된다. 생명공학 분야의 미래 산업 경쟁력은 원천기술의 확보, 이를 위한 국가차원의 장기적 투자, 연구 성과물의 보호와 산업에서의 활용에 따라 좌우될 것으로 본다.
생명공학 분야는 장기간 연구를 통해서 새로운 기술 개발과 연구 성과물을 얻게 되기 때문에, 개발된 연구 성과물들은 국내외 경쟁력 확보를 위해 기술적 파급력과 권리 영향력이 큰 ‘특허’라는 지식재산권의 창출로 귀결되는 것이 우선 필요하다. 인간유전체연구(Human Genome Project) 완료에 이어, 차세대염기서열분석(Next Generation Sequencing) 기술과 크리스퍼(CRISPR) 유전자가위 기술 등은 최근 비약적인 성장을 보이고 있다. 4차 산업혁명 시대를 이끌어낼 바이오 유전체 빅데이터, 질병의 조기진단과 개인별 맞춤형 의료, 바이오 의약품 산업의 신성장 동력으로써 이와 같은 유전정보분석 기술과 유전자재조합 및 약물유전체 연구 성과물들은 그 가치의 보호가 필수적인 분야이다. 생명공학 분야의 연구 성과물을 지식재산권으로 보호・활용하는 산업육성 전략을 통해 국내 생명 공학
산업을 지속적으로 성장・발전시킬 필요성은 4차 산업혁명 시대에 아무리 강조해도 지나치지 않는다.
이러한 시대적 요구에 발맞추어, 특허청에서는 산업・기술 혁신역량 제고를 통한 국가 미래경쟁력 강화를 궁극적 목표로 하는 ‘지식재산 생태계 혁신전략’을 발표한 바 있다(박원주 특허청장, 2019.3.27). 지식재산 생태계 혁신전략은 산업별 시장・산업 조사와 전 세계 4억여 건의 특허 빅데이터를 활용한 정량진단을 통해 유망기술을 도출하는 것과 더불어, 우리나라의 미래산업 경쟁력확보 방안과 정부・민간 R&D 전략, 인력양성・규제완화 등 산업육성 전략을 제시하였다. 특허청에서는 특허 빅데이터 분석방법론을 기반으로 우리나라 전체 산업의 10년 후 기술 분야별 모습을 예상했는데 ‘생명공학 산업분야’는 특허청이 정한 특허 빅데이터 기반 미래 예측・선도 전략 산업분야12)의 중심을 차지한다.
이에, 장기간의 노력과 연구의 결과물인 생명공학 분야의 신기술이나 새롭게 밝혀진 유전자・단백질의 기능・특성들을 단순히 연구 성과물로만 머물게 할 수 없다. 이제는 연구 성과물을 산업적으로 활용하고 지식재산으로서 경쟁우위를 강화시켜 직접 미래성장과 산업혁신을 이끄는 도구로 만들어야 할 때이다. 생명공학 분야의 지식재산 생태계 역동성을 강화하여 연구 성과물의 활용에 있어 시행착오를 줄이고 원천기술을 선점하여 생명공학 산업의 미래시장에서 최강국이 되기를 기대한다.
2. 생명공학 분야 특허심사제도
생명공학 분야의 특허 심사기준은 1998년 3월, 생명공학 분야 산업부문별 심사기준이 제정된 이후 2012년 1월, 심사실무가이드 통합 개정을 거쳐 현재는 각 기술 분야별 심사기준을 통합할 필요성에 따라 ‘특허・실용신안 심사기준’에 통합되어 운영되고 있다. 최근 4차 산업혁명 관련 바이오헬스 분야의 신기술 보호를 위해 생명공학 분야의 특허 심사기준을 새롭게 정비하였고, 이를 특허・실용신안 심사기준에 반영하였다.13)
가. 환자 맞춤형 정밀의료의 특허대상 명확화
의약용도발명에 있어 유효성분 및 대상 질환이 동일하더라도 특정 약물에 더 유효한 대상환자군을 찾은 발명에 대해서는 ‘대상 환자군’ 특정도 의약의 새로운 속성 발견에 기초한 새로운 용도발명으로 인정하여 의약발명의 특허대상을 확대하였다(2016허5026). 이에 따라 의약용도발명에서 그 용도를 특정 질병에 대해 적용하거나 투여용법, 투여용량 또는 대상 환자군이 한정된 특정 질병에 대해 적용하는 것으로 표현함을 심사기준에 명시하고 있다.
나. 지능형 신약개발 관련 발명의 판단기준 정비
바이오 빅데이터를 활용한 가상실험에서 신약 후보물질 확인방법이 컴퓨터나 소프트웨어 관련 발명임을 명시하고 관련 사례를 추가하였다. 또한, 컴퓨터상에서 가상실험으로 개발된 의약에도 화학분야의 물질발명과 동일하게 특정의 출발물질, 온도, 압력, 유입・유출량 등 그 물질발명을 제조하는 데에 필요한 구체적인 반응조건과 그 조건을 직접 적용하여 실시한 결과를 실시예로 기재하여야 명세서 기재요건이 적용됨을 명시하고 있다.
다. 디지털 수단에 의한 진단기술의 특허대상 명확화
임상적 판단의 주체를 의료인으로 한정하여 질병과의 상관관계 판단이 의료인이 아닌 디지털 수단에 의해 수행되는 경우에는 산업상 이용가능성을 인정하기로 하였다. 질병의 예측이나 진단에 정보를 제공하는 방법이 명세서 전반의 내용으로 보아 해당 결정단계들이 컴퓨터상에서 이루어지는 정보처리 방법임이 명백한 경우에는 산업상 이용 가능한 발명으로 본다.
라. 의료행위 관련 발명의 산업상 이용 가능성 판단기준 구체화
헬스케어 산업과 기술의 환경변화를 반영하고 산업상 이용가능성 판단의 실효성 제고를 위해 의료행위 및 임상적 판단에 대한 정의를 수정하였다. 수술・치료・진단방법, 측정분석방법, 미용방법 등에 대한 구체적인 판단기준을 제시하였으며 산업상 이용 가능성이 인정되는 21개 사례와 불인정되는 27개 사례를 정비・추가하였다. 이로써 의료행위 관련 심사기준을 전면 개정하였다(산업상 이용할 수 없는 발명으로써 의료행위 관련 부분, 심사기준 제3부제1장제5.1절).
마. 화장품 발명의 명세서 및 청구범위 기재요건 판단기준 정비
새로운 시장 창출이 기대되는 기능성 화장품을 포함하는 화장품 발명에 대해 발명의 설명 및 청구범위 기재요건 심사기준을 정비하였다. ‘발명의 설명 기재요건’과 관련하여 일반 화장품의 명세서 기재요건은 완화하고, 별도의 기능을 갖는 기능성 화장품은 기능적 유용성을 명세서에 입증하도록 명시하고 있다. ‘청구범위 기재요건’에서는 화장품 발명의 표현형식 및 화장품 발명의 용도 표시 항목을 신설하였다. 의약품에 해당되는 화장품의 경우엔 제외되므로 의약 용도와 오인・혼동하지 않기 위해 ‘치료용’과 같은 의학적 표현은 인정하지 않는다. 청구범위에 화장품의 용도는 속성 자체가 아닌 그 속성을 통해 실현하고자 하는 목적을 구체적으로 표현하도록 하고 있다.
[표 4-4] 화장품발명의 청구범위 기재요건
|
1. 화장품발명의 표현 형식 |
2. 화장품발명의 용도의 표시 |
||
|
불가능한 표현 |
가능한 표현 |
용도구성으로 불인정 |
용도구성으로 인정※ |
|
주름 치료용 탈모 치료용 피부염증 치료용 000 치료용 |
주름 개선용 탈모 예방용 피부염증 완화용 미백용 |
ATP 활성 촉진용 PKA 활성 억제용 |
티로시나제 활성 억제용(미백용) 멜라닌 생성 억제용(미백용) 콜라겐 합성 증가용(주름개선용) 모근강화용(탈모예방용) |
주) 해당 속성과 관련된 화장품의 궁극적인 용도를 직접적으로 유추 가능한 경우
3. 생명공학 분야의 주요 지식재산권 제도
가. 미생물 기탁제도
세균, 바이러스, 세포 등 미생물 발명을 포함하는 특허출원에 있어서 해당 특허출원 미생물을 공인기탁기관에 기탁하는 제도이다. 이는 출원 공개 후, 특허기탁 미생물을 제3자가 분양받아 실시할 수 있도록 함으로써 반복 재현이 곤란한 미생물 발명에 관한 명세서의 기재사항을 보완하기 위함이다.
특허법 시행령 제2조에서 미생물발명 관련 출원을 하고자 하는 자는 ‘출원 전’에 특허미생물을 기탁기관14) 중 1곳에 ‘특허기탁’ 하고, 출원할 때 특허출원서에 수탁증을 첨부하며, 특허출원서에 ‘미생물 기탁 정보(취지)’를 기재하도록 규정하고 있다(2015.1.1. 시행). 한편, 특허법 개정(제58조 전문기관의 등록 등, 2017.6.3. 시행)에 따라 미생물 기탁 관련 고시를 개정하여 미생물 기탁기관 등록의 근거를 마련하였고(특허청고시 제2017-16호, 2017.8.1. 개정), 관련 시행령과 시행규칙에 등록기준(시행령 제8조의4) 및 취소기준(시행규칙 제36조의3)도 함께 규정하였다.
또한 특허미생물을 연구 또는 시험 목적으로 분양받고자 하는 자는 원기탁자의 허락을 받거나 특허청에 미생물 분양 자격증명을 신청한 후, 기탁기관에서 분양받을 수 있다. 특허청은 기탁기관으로부터 분기별로 수탁 및 분양현황을 보고받고 있으며, 기탁된 미생물은 1만 3,159건이다(2018.12.31. 누계). 2013년 4월에 농촌진흥청 국립농업과학원을 ‘국가특허미생물 통합보존소’로 지정한 이후 4개 특허미생물 기탁기관에서 복제본 제작 및 통합보존을 완료하였으며 이에 따른 점검이 2017년 12월 완료되었다. 또한 2014년 5월, 특허미생물 훼손, 유출 등의 위기상황에서도 활용성 제고를 위해 특허미생물 기탁기관 공통의 안전관리규정 표준안을 마련하였으며, 이에 따라 민관합동 위기대응 훈련을 매년 실시하고 있다(제6차 훈련실시, 2019.5.).
[표 4-5] 기탁기관별 특허기탁 및 분양 현황
|
구분 |
한국생명공학연구원 생물자원센터 (KCTC) |
한국미생물 보존센터 (KCCM) |
한국세포주 연구재단 (KCLRF) |
농촌진흥청 국립농업과학원 (KACC) |
누계 (2018.12.31.) |
|
|
미생물 기탁 |
전체 |
6,542 |
4,240 |
460 |
1,917 |
13,159 |
|
국제 |
4,823 |
2,424 |
460 |
112 |
7,819 |
|
|
국내 |
1,719 |
1,816 |
- |
1,805 |
5,340 |
|
|
미생물 분양 |
824 |
556 |
331 |
588 |
2,299 |
|
주) 4개 기관 모두 부다페스트조약15)에 따른 국제기탁기관임
나. 서열목록 제출제도
서열목록 제출제도는 특허출원 시 컴퓨터 판독이 가능한 형태의 서열목록 전자파일을 제출하도록 하는 제도이다. 핵산염기 서열 또는 아미노산 서열을 포함한 특허 출원 증가에 대처하여 신속한 심사처리와 서열 데이터베이스 구축에 활용하기 위해 시행하고 있다. 관련규정은 특허법 시행규칙 제21조의 4(핵산염기 서열 또는 아미노산 서열을 포함한 출원 등, 2015.1.1. 시행) 및 핵산염기 서열목록 또는 아미노산 서열목록 작성기준(특허청고시 제2016-5호, 2016.3.1 시행)이 있다.
4개 이상의 아미노산 또는 10개 이상의 핵산염기를 포함하는 발명을 특허출원하는 자는 국내 및 국제 특허출원 시에 요구되는 서열목록 작성요건을 충족시키기 위해서 세계지적재산권기구(WIPO:World Intellectual Property Organization) 표준(ST.25)에 따라 작성된 서열목록을 제출하여야 한다. 이는 방대한 서열정보의 효율적인 선행기술 검색을 위해 컴퓨터 판독이 가능한 전자파일 형태의 서열목록이 필요하고, 이런 서열정보를 국제적으로 공유하고 활용하기 위해 국제적 기준에 따라 작성된 서열목록의 데이터베이스화가 필요하기 때문이다. 2016년 3월, WIPO 표준위원회는 서열목록 관련 현재 표준인 ST.25의 기능을 개선한 새로운 표준인 ST.26 제정안을 승인하였고, 이에 회원국들은 서열작성 소프트웨어 개발을 빠른 시일 내에 완료하여 2022년 1월부터 국내 및 국제 출원에 적용을 목표로 하고 있다.
우리나라 특허청은 신속하고 효율적인 서열검색 및 서열목록정보의 국제적 관리와 공유를 위해 세계 3대 서열목록 관리기관인 DDBJ(일본)16), GenBank(미국)17), EMBL(유럽)18)과 유기적인 협조관계를 구축하고 있다. 특허청은 KOBIC19)을 통해 DDBJ에 서열목록 정보를 제공키로 합의함에 따라(2006.6), 서열목록을 2개월 주기로 CD 형태로 KOBIC에 제공하고, KOBIC은 연 2회 DDBJ 측에 서열목록 정보를 제공하고 있다(2007년 8월 이후).

[그림 4-3] 각국 특허청 협조 체계도
다. 허가 등에 따른 특허권 존속기간 연장등록출원제도
의약품 및 농약은 특허발명을 실시하기 위해서 관련 기관의 허가나 등록(이하 '허가 등')을 받아야 하고, 허가 등을 받기 위해서는 유효성 및 안전성 시험 등 관련 절차를 수행해야 한다. 이를 수행하는 데에 상당한 기간이 소요되고 특허권자는 그 기간만큼 특허발명을 실시할 수 없게 된다. 이런 경우 특허권 존속기간은 ‘설정등록 후 출원일로 부터 20년’으로 변함이 없기 때문에 타 특허권자와 비교하여 형평성에 문제가 발생할 수 있다. 이러한 문제점을 해결하기 위해 일정한 조건을 만족하는 의약품 및 농약에 대하여 5년 범위 내에서 그 특허권의 존속기간을 1회에 한하여 연장해주는 ‘허가 등에 따른 특허권 존속기간 연장등록출원제도(특허법 제89조)’를 마련하고 있다.
특허권 존속기간 연장등록출원은 주체, 대상 및 시기에 제한을 두고 있다(특허법 제91조). 연장등록 출원인은 특허권자이어야 하며, 특허권이 공유인 경우에는 공유자 전원이 공동으로 출원하여야 한다. 또한 그 발명을 실시하게 하기 위하여 다른 법령에 의하여 허가 등을 받을 필요가 있어야 하고, 그 허가 등을 위하여 필요한 유효성・안정성 등의 시험으로 인하여 장기간이 소요되는 발명이여야 한다. 특허권자 자신이 허가 등을 받았거나, 연장등록의 결정 전까지 전용실시권자 또는 등록된 통상실시권자가 허가 등을 받았음을 확인할 수 있어야 한다.
연장등록출원의 대상이 되는 특허는 물질, 제법, 용도 및 조성물 특허이고 중간체, 촉매 및 제조 장치에 관한 특허는 제외되며 약사법 및 농약관리법에 의하여 최초의 허가 등을 받은 유효성분이 특허청구 범위에 기재되어 있어야 한다. 연장의 대상이 되는 출원의 특허권은 특허청에 계속 중이어야 하고, 허가 등을 받은 날부터 3월 내, 존속기간 만료 전, 6월 내 연장등록출원을 해야 한다. 특허권 설정 후에도 허가기관에서 요구하는 임상시험 등에 시일이 소요되어 특허권을 실시하지 못했음을 입증하면 그 내용을 심사하여 연장등록 여부와 적정 연장기간을 결정하고, 그에 따라 특허권의 존속기간이 연장 된다.
라. 유전자원의 접근・이용 및 이익 공유에 관한 법률
생물다양성협약(CBD: Convention on Biological Diversity)은 생물다양성을 생태계, 종, 유전자 수준에서 파악하고 생물다양성의 보존, 생물자원의 지속가능한 이용 및 유전자원의 이용으로 발생하는 이익의 공정하고 공평한 공유를 목적으로, 1992년 리우 정상 회의에서 채택된 국제협약이다. 가입국의 생물다양성 보전을 위한 의무와 더불어, 타국 보유 유전자원에 접근할 때에 해당국의 사전승인을 받도록 하는 제도(PIC: Prior Informed Consent)의 도입, 생명공학기술 등 생물다양성 보전기술을 다른 가입국에게 이전 촉진, 유전자변형 생물체(LMOs: living modified organisms)의 안전한 국가 간 이동・관리를 위한 의정서 채택 검토, 개도국의 협약이행을 위한 재정지원 조항 등 생물다양성 보전을 위한 가입국 간 협력을 주요내용으로 하고 있다.
지식재산권과 연계한 유전자원 보호 방안에 대한 자원제공국과 자원이용국간의 다자간, 양자 간 국제 논의20)가 활발히 진행 중인 가운데 제12차 생물다양성협약 당사국총회 및 제1차 나고야의정서 당사국회의(강원도 평창, 2014.10.)에서 유전자원 이용 시 이용자는 유전자원 제공국으로부터 사전통보승인(PIC)을 받아야 하고, 해당 유전자원 이용으로 발생한 이익을 상호 합의한 조건(MAT: Mutually Agreed Term)에 따라 공유하기로 결정되었다.
이에 따라 ‘유전자원에 대한 접근 및 그 이용으로부터 발생하는 이익의 공정하고 공평한 공유에 관한 생물다양성협약과 나고야의정서’의 시행에 필요한 사항과 유전자원 및 이와 관련된 전통지식에 대한 접근・이용으로부터 발생하는 이익의 공정하고 공평한 공유를 위하여 필요한 사항을 정함으로써 생물다양성의 보전 및 지속가능한 이용에 기여하였다. 이어, 국민생활의 향상과 국제협력 증진을 목적으로 유전자원의 접근・이용 및 이익 공유에 관한 법률이 2017년 1월 17일에 제정되었다(법률 제14533호, 2018.8.18 시행).
한편, 나고야의정서 이행법률의 제정 및 시행은 유전자원의 이용에 따른 이익공유가 의무화되고, 자원부국의 국내 조치 강화로 해외 생물유전자원 확보・이용에 있어 우리나라 생명공학 산업계의 부담이 증가될 것으로 예상된다. 또한 생물・유전자원 보호의 국제적인 움직임과 선진국의 기술이전 기피 현상은 이를 이용한 국내 생명공학 산업계의 기술 개발에 부정적 영향을 미칠 수 있다. 이에 국내 고유 동・식물 자원과 유전자원의 보전 및 확보, 이를 이용한 생명공학 분야의 원천기술 개발의 계기로 삼아야 할 것이다. 정부는 국내 산업계의 피해를 최소화하기 위해 주요 자원제공국과의 자유무역협정(FTA: Free Trade Agreement) 지재권분야 협상과정에 적극 대응하고, 바이오기업을 대상으로 유전자원 이용과 관련한 국제동향 홍보를 지속적으로 추진해야 한다.
4. 생명공학 특허 분쟁 동향
가. 크리스퍼 유전자가위 특허분쟁
(1) 배경
2012년 미국 UC버클리 다우드나 그룹은 크리스퍼 유전자가위(CRISPR/Cas9)가 세균에서 발견한 DNA를 선택적으로 자를 수 있음을 사이언스지에 최초 발표했고, 2012년 5월에 최초로 크리스퍼 유전자가위 관련 특허를 미국 특허청에 가출원했다. 2012년 10월과 12월에는 한국 기초과학연구소 김진수 그룹과 미국 MIT 브로드연구소 장펑(Feng Zhang) 그룹이 각각 CRISPR/Cas9이 상업적으로 가치가 큰 인간세포 및 진핵세포(동식물)에서 작동한다는 크리스퍼 유전자가위 기술 관련 발명을 미국 특허청에 가출원했다.
(2) 발단
UC버클리가 특허출원은 빠르지만, 브로드연구소는 진핵세포 실험자료를 포함하여 특허출원을 하고, 우선 심사를 신청하여 2014년 4월 15일에 특허권을 먼저 획득했다. 이에, UC버클리는 미국 특허청에 저촉심사(Interference)21)를 신청하여 ‘누가 선발명자인지에 대한 결정’을 요청하였다.
(3) 경과
2015년 4월, UC버클리측은 원천기술을 발명하고 처음 특허를 낸 것은 다우드나 팀이므로, 브로드연구소의 특허는 무효라고 주장했다. 그러나 2017년 2월 15일, 미국특허청 특허심판항소위원회(PTAB)는 브로드연구소의 특허가 UC버클리보다 후출원이기는 하지만 진핵세포 유도 등에 대해 신규성이 있고 진핵세포에서 크리스퍼의 작동을 입증한 브로드연구소의 특허는 기술적으로 진보한 면이 있으므로 특허를 인정한다는 심판을 내렸다. 이에 대해 UC버클리가 불복하여 제기한 항소심에서도 원심대로 브로드연구소 특허의 진보성이 인정되었고, 2018년 9월 10일, 브로드연구소의 특허가 UC버클리 특허를 침해하지 않는 것으로 판결하였다.

[그림 4-4] 크리스퍼 특허분쟁 관련 주요 사건
(4) 한국 툴젠의 특허와의 관계
브로드연구소의 특허를 인정한다고 해서, UC버클리의 특허가 유효하지 않은 것은 아니다. 2018년 6월, UC버클리의 특허도 미국에서 등록을 받았고 유럽, 일본, 중국, 호주 등에서 특허등록을 받았으며, 우리나라에서는 특허 심사 중에 있다. 한편, UC버클리의 특허는 한국 툴젠의 크리스퍼 유전자가위 기술 관련 발명과도 분쟁의 여지가 남아 있다. 툴젠은 김진수 그룹의 진핵세포 발명을 승계해 2012년 10월, 미국에 가출원하고 이를 기초로 2013년 10월, 국제출원 하였으며, 한국・호주에서 2016년 9월 특허등록이 되었다.
툴젠 특허는 선출원주의 국가에서 유리한 위치에 있으나 미국 선발명주의에서의 특허등록 여부는 저촉심사를 거쳐야하므로 권리 확정 예측에 어려움이 있다. UC버클리, 브로드연구소와 툴젠은 미국, 한국, 유럽, 중국 등에서 자신의 특허에 대한 출원・등록 경쟁뿐 아니라 상대방의 특허를 취소 또는 무효화하려는 공방을 치열하게 벌이고 있다. 최종 결론이 나려면 앞으로 몇 년은 더 걸릴 것이고 특허독립의 원칙에 따라 국가별로 서로 다른 결과가 나올 수도 있다.
나. 쿠션화장품 특허분쟁
(1) 배경
일명 쿠션화장품은 파운데이션 등 기초화장품을 쿠션 형태의 특수 스폰지 재질에 흡수시켜 팩트형 용기에 담아낸 것으로, 아모레퍼시픽이 2008년 처음 시장에 선보였다. 액체 화장품을 스폰지에 함침(含浸)시켜 퍼프를 이용해 사용이 편리하고 휴대성이 좋으며, 피부도포 및 흡수력도 개선되었다. 화장품 시장에서 2014년 한 해 쿠션화장품 매출은 2,000억 원을 달성했고, 2016년 4월까지 누적판매량 3,000만 개를 돌파하였다(헤럴드 경제, 2016.6.14. 기사).
(2) 발단
‘화장료 조성물이 함침된 발포 우레탄 폼을 포함하는 화장품’ 특허(특허번호 제1,257,628호, 특허권자 ㈜아모레퍼시픽, 출원일 2011.3.24. 등록일 2013.4.17.)에 대해서, 2015년 10월 코스맥스를 비롯하여 국내 화장품업체 네이처리퍼블릭, 토니모리, 에이블씨엔씨, 투쿨포스쿨, 에프앤코는 아모레퍼시픽을 상대로 특허심판원에 무효심판을 청구했다. 한편, 아모레퍼시픽은 2016년 5월 서울중앙지법에 코스맥스를 상대로 특허권 침해금지 소송을 제기했다.
(3) 경과
특허심판원은 아모레퍼시픽의 발포우레탄 쿠션화장품 특허발명이 발포우레탄폼을 종래의 에스테르폴리머가 아닌 에테르폴리머를 선택 사용하여 오랜 시간 화장품 액에 함침 되어도 안정적으로 화장품 액을 유지하는 효과가 있고, 구조의 차이도 존재하여 진보성이 있다고 심결하였다(특허심판원 2015당4865 심결). 그러나 특허법원은 아모레퍼시픽의 특허발명은 선행발명의 발포우레탄폼 중에서 에테르폼을 선택한 것 정도이어서 통상의 창작능력을 넘는 기술적 사항의 창작으로서 고도한 것이라고 평가하기 어렵고, 통상의 기술자가 선행발명으로부터 구성요소를 용이하게 도출할 수 있다고 봄이 타당하므로 진보성이 부정된다고 판결을 내렸다(특허법원 2016허8667 판결). 이에, 아모레퍼시픽은 대법원에 상고하였으나, 대법원은 ‘심리불속행 기각’ 결정을 내렸다(대법원 2018후10596 판결).
[표 4-6] 쿠션화장품 특허분쟁 관련 주요 사건
|
특허번호 |
관련 사건 |
심판청구인 |
청구일 |
청구취지 |
심결/판결 |
|
제1,257,628호 (2013.4.17등록) |
2015당4865 등 7건 병합 |
코스맥스 등 7개 기업 |
2015.10.12. |
특허무효 |
특허심판원 등록유지(2016.10.24.) |
|
2016허8667 |
코스맥스 등 6개 기업 |
2016.11.22. |
심결취소 |
특허법원 전부무효(2018.2.8.) |
|
|
2018후10596 |
아모레퍼시픽 |
2018.3.6. |
판결취소 |
대법원 심불기각(2018.5.31.) |
|
|
2018정49 |
아모레퍼시픽 |
2018.5.4. |
청구범위 정정 |
특허심판원 정정인정(2019.4.22.) |
(4) 현황
발포우레탄 쿠션화장품 특허발명의 무효심판과 별도로, 무효심판의 심결취소소송 계속 중에 아모레퍼시픽은 특허발명의 권리범위를 축소하는 정정심판을 특허심판원에 청구하였다. 특허심판원에서 정정을 인용하는 심결이 있었고(2019.4.22), 특허 제1,257,628호의 특허권은 청구범위가 감축된 상태로 유지되었다. 이에 따라 특허권자와 이해관계자 간 다툼의 여지가 남은 상태다.
제4절
생명공학제품 인허가 현황과 과제
1. 서론
가. 최근 의료 환경의 변화
(1) 4차 산업혁명 기술에 동승한 맞춤형 바이오헬스
최근 유전체 분석 및 컴퓨터공학기술(ICT)의 발전으로 유전자 등 데이터를 활용한 개인별 맞춤 의료(정밀의료)로 의료 패러다임이 전환되고 있다.
특히 인공지능을 활용한 암 치료에서의 AI 닥터, 영상 진단, 수술 로봇 등의 도입으로 진단・치료 등 의료서비스의 상당 부분이 자동화・효율화되는 의료기술혁신이 일어나고 있다. 세포치료, 유전자치료 등을 통해 인간의 세포, 조직, 장기를 대체 또는 재생하는 재생의료가 일상화되어, 희귀・난치성 질환 등에 대한 질병 극복 가능성 또한 증대하고 있다.
이에 따라 바이오헬스 시장의 구도가 합성의약품에서 바이오의약품 중심으로 재편되고 있다. 특허 만료, R&D 비용이 증가되고 있는 화학의약품과 달리 바이오의약품은 세포배양 등 제조 비용이 높고 진입장벽이 높은 데 비해 약가를 상대적으로 높게 받을 수 있기 때문에, 최근 세계적인 거대 제약사들은 세포치료제 등 특정 질환 맞춤 바이오신약 개발, AI 활용, 후보물질 매입 및 M&A 등을 통해 생산성 경쟁 중에 있다.
(2) 신개념 의료기기의 등장
최근 인공지능, 로봇, 3D프린팅 등 첨단기술의 발전과 함께 세계 의료기기 산업이 지속 발전되고 있으며, 이러한 기술들이 접목된 융복합 의료기기 시장이 빠르게 성장하고 있다. 인공지능 수술로봇 등 ICT 기업들과 의료기기 산업의 협업이 기술혁신을 주도하고 디지털 헬스케어기기 시장 선점을 위한 투자가 활발히 이루어지고 있다.
나. 정부 관리정책의 중요성
(1) 첨단 바이오 및 첨단 의료기기 특화된 규제혁신
바이오헬스 산업은 제품 생산까지 장기간의 R&D 기간이 소요되고, 부작용 발생시 비가역성(非可逆性)이 많아, 사회적·윤리적 파급력이 크다. 뿐만 아니라 국민의 생명・건강・안전에 미치는 영향이 크기 때문에, 우수품질의 제품을 신속히 제품화하고 시장진입을 촉진하기 위해 정부의 허가 및 유통관리 정책이 매우 중요하다.
정부는 ‘의료기기 규제혁신방안(2018.7.)‘에 따른 신의료기술평가제도 개선 등 규제 개혁을 추진 중에 있다. 2019년 3월부터 혁신기술 별도 트랙을 신설・도입하고, 체외진단 기기 시장의 선(先)진입 후(後)평가를 실시하며, 신의료기술평가와 건강보험 등재를 동시에 진행할 수 있도록 추진 중이다.
2019년 4월 5일에는 ‘의료기기산업 육성 및 혁신의료기기 지원법’이 국회에서 입법・제정되었다. 희귀 난치성 질환 치료를 위하여 첨단기술을 기반으로 안전성・유효성이 획기적으로 개선된 혁신의료기기를 지정하고, 신속한 제품화를 지원하고 있다. 이에 개발 단계별 심사제와 우선심사제를 운영함으로써, 국내 의료기기산업 육성을 지원하고 새로운 치료기회를 제공할 수 있게 되었다.
또한 체외진단의료기기법이 2019년 4월 30일 입법・제정되어 2020년 5월 1일부터 시행될 예정이다. 체외진단의료기기의 특성에 맞도록 임상적 성능시험 체계를 도입하고 임상검사실 내 체외진단기기 사용을 허용하며, 의약품과 함께 개발된 동반진단의료기기의 허가 심사를 동시에 신청, 심사할 수 있도록 하였다. 체외진단의료기기의 등급분류기준을 개인과 공중보건에 미치는 잠재성 위해성의 차이에 따라 정하는 등, 체외진단기기에 특화된 허가관리체계를 통해 개발과 제품화 촉진을 통한 국제 경쟁력을 강화를 추진하고 있다.
아울러 정부에서는 2019년 5월 바이오헬스산업 혁신전략을 발표하고, 2019년 8월 2일 ‘첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률’이 국회에서 제정・공포되었다(2020.5. 시행). 이 법에서는 첨단바이오의약품의 특성에 맞는 선진화된 허가시스템을 구축하고 원료채취부터 판매 이후 투여환자까지 전주기 안전관리를 강화하였다. 이에 따라 생산시설이 없는 벤처기업도 위탁제조를 통해 품목허가가 가능해졌으며, 대체치료제가 없는 질환 등 의료수요가 높은 제품에 대한 신속 허가처리절차가 운영된다.안전성관리 측면에서는 감염병 전파 방지를 위한 준수사항(동의규정, 병력조사, 혈액검사등)이 강화되며, 줄기세포치료제, 동물의 조직・세포를 이용한 첨단바이오의약품, 유전자치료제 등 투여 이후 장기간의 유효성 및 이상사례 추적관찰이 강화된다.
(2) 세계 규제의 변화
여러 선진국에서도 경쟁적으로 바이오의약품 산업 지원정책을 강화하고 있다. 미국 FDA는 2015년 2월부터 개인 맞춤형 정밀의료계획(Precision Medicine Initiative)을 발표하고, 2017년 3월 NIH 산하 국립중개과학발전센터(NCATS: National Center for Advancing Translational Sciences)에서는 새로운 치료법 개발 중 중복되는 임상시험에 대한 기관생명윤리위원회의 허가절차 간소화를 추진하고 있다. 또한 재생의약첨단치료제 지정(Re- generative Medicine Advanced Thearapy Designation) 제도를 2017년도부터 시행하고 있다. 이는 세포치료제 중에서 생명을 위협하거나 심각한 질환 및 상태를 치료・호전시키는 의약품 지정을 통해 임상시험계획 승인 단계부터 우선심사와 신속심사를 하고 있다.
유럽연합(EU)은 EU Horizon 2020(2014∼2020)을 통해 2014년부터 본격적으로 개인 맞춤형 헬스케어 신약개발 패키지에 투자하고 있다. 2017년 3월에는 신속의약품개발지원 제도(PRIME: PRIority MEdicine)를 신설하여 유럽의약품기구(EMA: European Medicines Agency)의 약물사용자문위원회(CHMP: Committee for Human Medical Product) 또는 첨단치료제위원회(CAT: Committee for Advanced Therapies) 소속 담당자, EMA 과학위원회 등 관련 전문가가 함께 첨단의약품개발계획과 규제전략을 안내하고 있다.
일본은 2015년 ‘보건의료 2035’ 발표를 통해 세계 최고 수준의 건강과 의료보장이 지속적으로 가능한 의료시스템 구축을 목표로 린 헬스케어(Lean Healthcare), 라이프디자인, 글로벌 헬스리더를 비전으로 설정하여 중장기 계획(2015∼2035)을 추진하고 있다. 또한, 의약품의료기기종합기구(PMDA: Pharmaceuticals and Medical Devices Agency)는 ‘약사전략상담’ 제도운영을 통해 혁신제품 실용화를 위해 개발 초기부터 비임상 임상시험 관련 상담을 제공하고 있다.
(3) 국내 바이오헬스산업 역량 및 글로벌시장 진출 지원
국내 IT・BT 융합기술의 수준은 세계시장을 선점할 수 있는 수준으로 평가되므로, 국내 개발 바이오융합제품들이 선진 외국에서도 허가를 쉽게 받을 수 있도록 정부의 허가 품질 수준이 국제수준으로 합리화되어야 하며, 이를 국제적으로 인정받을 수 있는 국제협력이 꾸준히 이루어져야 한다.
우리나라도 바이오산업을 미래 신성장 동력산업으로 선정하여 매년 연구개발비 등 정부투자를 늘려가고 있고, 식약처는 바이오의약품 마중물사업과 맞춤형 협의체, 의료기기 멘토링 및 허가도우미 제도 등을 통하여 첨단생명공학제품의 개발 및 글로벌시장진출 지원함으로써 세계시장 선점, 국가경쟁력 확보를 위해 다방면으로 노력을 기울이고 있다.
글로벌 시장의 확대와 함께, 세계 각국에서는 동일한 기준으로 허가심사를 받기 위하여 의약품규제당국자 국제연합 내에 바이오시밀러, 세포치료제, 유전자치료제에 대해 작업반(working group)을 만들어 동일한 눈높이의 심사를 추진하고 있으며, 바이오시밀러 등 일부 가이드라인은 세계보건기구(WHO)에서도 협조하여 만들고, 세포치료제와 유전자치료제 가이드라인은 의약품국제규제조화위원회(ICH) 전문가위원회에서도 논의 중에 있다.
또한 세계 의료제품 규제당국 정상회의에서는 각 나라별 환경에 따라 다른 정책을 가지고 있는 재생의료와 의약품허가 사이의 차이를 공유하고, 공통 기준의 범위 및 정책 결정의 근거 등에 대해 생산적 논의·협조 체계를 가동하고 있다.
2. 바이오의약품 인허가 현황
가. 바이오시밀러 글로벌 허가 가속화
우리나라는 2011년 줄기세포치료제를 최초로 허가하였고 2016년에는 세계 최초로 국내에서 개발한 항체 바이오시밀러(특허가 만료된 생물의약품에 대한 복제약) 렘시마주(Remsima Inj., 인플릭시맙)가 미국 FDA의 허가를 획득하는 등 국내기업이 세계시장으로 진출할 수 있는 기반을 마련하였다. 국내개발 바이오시밀러 8품목이 유럽, 미국, 캐나다, 일본 등에 허가되어 있다.
[표 4-7] 국내개발 바이오시밀러 해외 허가 현황(2018.12.31.)
|
업체명 |
한국허가 성분명(허가년도) |
ICH 국가 허가 현황 |
|
셀트리온 |
인플릭시맙(2012) 트라스트주맙(2014) 리툭시맙(2016) |
유럽(2013), 캐나다(2014), 일본(2014), 미국(2016) 유럽(2018) 유럽(2017), 미국(2018) |
|
삼성바이오에피스 |
에타너셉트(2015) 인플릭시맙(2015) 아달리무맙(2017) 트라스트주맙(2017) |
유럽(2016), 캐나다(2016) 유럽(2016), 미국(2017) 유럽(2017) 유럽(2017) |
|
LG생명과학 |
에타너셉트(2018) |
일본(2018) |
나. 첨단 융복합 제품 허가 및 맞춤형 지원 확대
(1) 유전자재조합의약품 허가현황
2017년도에 신규 허가된 유전자재조합의약품22)은 총 29품목(제조 5품목, 수입 24품목)으로 신약(희귀신약 포함) 7개 성분, 13품목이었고, 2018년도에 신규 허가된 유전자재조합의약품은 총 22품목(제조 12품목, 수입 10품목)으로, 신약은 4개 성분, 4품목이었다. 희귀의약품(희귀신약 3품목 제외)은 2017년 2품목, 2018년 1품목이 허가되었다. 동등생물의약품은 2017년 2품목, 2018년에는 3종류 성분, 8품목이 허가되었다. 2012년 세계 최초 단클론항체 동등생물의약품 품목허가 이후 2018년까지 총 13종류 21개 품목이 허가되었고, 이 중 국내 개발 동등생물의약품은 총 9종류 15품목이다.
(2) 세포치료제 허가현황
2001년 국내에서 개발한 ‘콘드론’이 국내 최초 세포치료제로 품목허가를 받은 이후 현재까지 총 15개의 제품이 허가되었다. 2017년 ‘로스마르’ 허가 이후, 2018년에는 허가된 세포치료제가 없으나 생명을 위협하는 질환 또는 중증의 비가역적 질환 치료를 위한 세포치료제에 대하여 신설된 조건부허가제도(2016.7.〜) 및 첨단재생의료 및 첨단바이오의약품의 안전 및 지원에 관한 법률(2019.8.2) 제정・공포에 힘입어 허가가 증가할 것으로 전망된다.
(3) 유전자치료제 허가 현황
국내 개발 최초 유전자치료제인 코오롱생명과학(주)의 ‘인보사케이주’는 항염증 작용을 나타내는 ‘TGF-β1 유전자’가 도입된 동종연골유래연골세포를 주성분으로 하며, 29번째 국내 개발 신약으로 허가(2017.7.12.) 받았으나, 주성분 중 2액인 형질전환세포가 허가받은 연골세포가 아닌 신장세포임이 밝혀짐에 따라 2019년 7월 허가 취소되었다.
(4) 첨단 융복합 제품 개발 맞춤형 지원 확대
4차 산업혁명 시대를 맞아 첨단 바이오 및 융복합 기술을 이용한 제품개발이 활발히 이루어지고 있다. 첨단 융복합 제품은 개발 초기부터 품목을 분류하여 규제장벽을 해소하고 개발 방향을 제시하기 위하여 식약처, 복지부, 산자부, 농식품부로 구성된 다부처 ‘혁신제품 기술지원 협의체’ 및 분야별 전문가로 구성된 ‘혁신제품 기술지원 자문단’을 운영하고 있다.
식약처는 2014년부터 개발 단계별 제품화 지원사업인 ‘바이오의약품 마중물 사업’을 진행하고 있다. 국내 제약 개발사들과 협의체를 구성하여 업계의 제품화 추진 장애 요인들을 모니터링하고 해결방안을 논의하고 있으며, 1:1 맞춤형 컨설팅을 하고 있다. 2018년에도 첨단바이오의약품, 유전자재조합, 글로벌 백신, 혈액제제 등 4개의 맞춤형 협의체를 운영하여, 세포・유전자치료제 실용화에 임박한 6개 제품에 대해 법령・규정 이행사항을 지원하였고, 유전자재조합 신약 9개 품목에 대하여 1:1 컨설팅을 진행하였다.
바이오시밀러의 경우는 2011년부터 ‘바이오시밀러 민・관 실무협의체’를 34개 품목에 대하여 실시하였으며 2018년까지 국내 바이오시밀러 임상시험 승인 건수는 총 63건에 달한다. 2018년 12월 31일 기준 국내에서 개발 중인 바이오의약품 임상시험은 백신(26개), 바이오시밀러(37개), 항체의약품(16개), 유전자치료제(60개), 세포치료제(153개), 줄기세포치료제(68개) 등으로 향후 다수의 국내개발 제품의 출시가 예상되고 있으며, 백신, 바이오시밀러, 줄기세포치료제 등 국제경쟁력 비교우위에 있는 분야에 다수의 파이프라인이 형성되어 이 같은 전망을 뒷받침하고 있다.
(5) 수출지원 및 국제 협력
식약처는 2014년부터 ‘바이오 IT플랫폼’을 통해 바이오의약품 업계에 해외 인허가 규제정보, 산업정보를 제공하고, 기업별 맞춤형 컨설팅을 해왔다. 2018년에는 EU, 대만, 러시아, 말레이시아, 멕시코, 미국, 베트남, 브라질, 사우디아라비아, 이란, 인도, 인도네시아, 일본, 중국, 캐나다, 태국, 터키, 파키스탄, 호주 등 19개국의 정보를 통합 검색할 수 있게 하였으며, APEC 규제조화센터 홈페이지에서는 APEC 경제협력국가 21개 회원국의 허가제도에 대한 정보를 제공하고 있다.
① 국제의약품규제조화위원회(ICH: The International Council on Harmonization of Technical Requirements for Registration of Pharmaceutiocals for Human Use)
우리나라는 2016년 11월 미국, 유럽, 일본, 스위스, 캐나다에 이어 6번째로 ICH 정회원국으로 가입되었으며, 2018년 6월에는 관리위원으로 선출되어 ICH 중장기 계획 수립, 의약품 안전관리 가이드라인 주제선정 등 국제적인 규제기준 선도그룹에서 적극 활동하고 있다.
② 세계보건기구(WHO) 협력센터
식약처는 2011년부터 생물의약품 표준화 및 평가 분야 WHO 협력센터로 지정되어 WHO 가이드라인 개발, 국제 표준품 및 시험법 개발을 위한 국제공동연구, 교육프로그램 운영 등 규제기관 역량 강화 지원 및 서태평양과 그 외 지역을 대상으로 WHO 국제기준 전파에 주 역할을 하고 있다.
③ 국제 의약품 규제당국자 협의회(IPRP: International Pharmaceutical Regulators Program)
2013년 11월부터 식약처는 국제 의약품 규제당국자 협의회 바이오시밀러 작업반의 의장국을 맡아 바이오시밀러 허가・심사기준, 지역・국가별 규제현황의 차이점 파악, WHO 등 국제기구 바이오시밀러 관련 중복활동 방지, 약물 감시등에 대한 규제조화를 선도하고 있다. 2017년에는 각국이 규제기관별로 운영 중인 바이오시밀러 적응증 외삽(外揷)에 대한 통일된 심사기준을 마련하기 위하여 바이오시밀러 적응증 외삽에 대한 과학적 지침서를 마련, IPRP 홈페이지 및 식약처 영문 홈페이지에 게재하였다. 2018년에는 각 규제기관의 바이오시밀러에 대한 규제정보 및 허가심사 경험을 공유하는 ‘IPRP 바이오시밀러 규제정보 공유 플랫폼’을 개설하여 바이오시밀러 작업반 회원국 간 소통 채널을 운영하고 있다.
④ 양자협력
독일 연방생물의약품평가원(PEI: Paul-Ehrlich Institute)과는 2013년 10월, 캐나다 보건부(Health Canada) 바이오의약품국과는 2015년부터, 일본 후생노동성과는 2015년, 페루 보건부와 아르헨티나 식품의약품의료기술청과는 2016년, 영국 국립 바이오의약품 표준화연구소(NIBSC: National Institute of Biological Standard and Control)와는 2016년, 일본 국립감염병연구소(NIID: National Institute of Infectious Diseases)와는 2017년에 MOU를 체결하여 인력교류 및 정보공유와 협력을 도모하고 있다.
3. 신개념 의료기기 허가현황
가. 4차 산업혁명 시대의 첨단 신개념 의료기기 허가 및 선제적 안전기준 구축
최근 자동화(인공지능), 정밀화(3D프린터), 일상화(디지털 헬스케어)로 대표되는 4차 산업 혁명 기술이 접목되어, 2018년에는 국내 최초로 인공지능 기반 의료기기 4개 품목이 허가되었고, 3D 프린팅 및 수술용 로봇 등 첨단의료기기가 꾸준하게 허가되었다.
(1) 인공지능 의료기기
식약처에서는 ‘빅데이터 및 인공지능기술이 적용된 의료기기의 허가심사 가이드라인(2016)’과 ‘인공지능기반 의료기기의 임상 유효성 평가 가이드라인(2017)’을 개발・공개하였다. 인공지능기반 의료기기(소프트웨어)는 미리 확보된 의료데이터를 이용하여 평가하는 후향적 임상시험으로도 가능하므로 의료데이터 선정과 통합 분석방법, 유효성 평가방법 등 다양한 고려사항을 제시하였다.
[표 4-8] 인공지능 의료기기(2018.12.31.)
|
품목명(등급) |
사용목적 |
|
의료영상검출보조 소프트웨어(2) |
흉부 X-ray 영상에서 폐 결절 부위를 검출하여 의료진의 판독을 보조하는 소프트웨어 |
|
의료영상분석장치 소프트웨어(2) |
환자의 손 X-ray 영상을 분석하여 의료진의 환자 골연령 판단을 지원하는 소프트웨어 |
|
의료영상진단보조 소프트웨어(3) |
환자의 뇌 MR 영상자료를 분석하여 의료진의 뇌경색 진단 결정을 보조하는 소프트웨어 |
|
의료영상전송장치 소프트웨어(2) |
CT 영상을 전송 받아 딥러닝 방식으로 잡음이 제거된 이미지를 전송하는 소프트웨어 |
2018년에는 골연령 판단을 지원하는 X-ray 영상분석 소프트웨어와 같이 의료영상분석을 보조・지원하는 소프트웨어가 장착된 인공지능 기반 의료기기 4개 품목이 국내 최초로 허가되었다.
식약처에서는 인공지능 기반 의료기기 적용대상을 11개 품목에서 범용초음파영상진단장치, X-ray 등 153개 품목으로 확대하였다.
(2) 재활로봇 의료기기
로봇산업의 발전과 인구 고령화, 소비층 변화(의료인에서 개인 환자) 등으로 로봇기술이 적용된 재활의료기기에 대한 전 세계적인 수요가 2018년 5억 2,000달러 시장에서 2020년 18억 달러로 증대될 것으로 전망된다. 식약처에서는 ‘재활로봇 허가심사 가이드라인23)’을 발간하여 재활로봇의 품목분류, 특성에 따른 재활로봇의 세분화방법, 의료기기 재활로봇 허가신청서 작성시 요령, 재활로봇의 기본 안전 및 필수성능시험을 안내하였다. 허가현황은 2016년 2건, 2017년 5건, 2018년 2건으로 꾸준하게 허가되고 있다.
(3) 3D프린팅 의료기기
3D 프린터로 제조되는 의료기기는 기존의 제조방식과 달리 원재료를 층층이 적층하여 쌓아나가는 방식이기 때문에 제품의 외형 뿐 아니라 내부도 원하는 형상으로 제작할 수 있다. 때문에 복잡한 3차원 구조를 비교적 간단하게 제작할 수 있다는 특성이 있으며, 주형 없이 개개 제품마다 형상을 다르게 제작할 수 있기 때문에 환자맞춤형 의료기기를 제조하는데 유용하다. 식약처에서는 2015년부터 ‘3D 프린터를 이용하여 제조되는 맞춤형 의료기기 허가심사 가이드라인’을 개발하여 제공하였고, 2016년에는 품목별 특성을 반영하여 ‘3D프린터로 제조되는 환자맞춤형 정형용 임플란트의 허가심사 가이드라인’과 ‘3D프린터로 제조되는 환자맞춤형 치과용 임플란트 고정제의 허가심사 가이드라인’을 발간하였다. 그후 종합교육을 통해 개발업체와 의견을 듣고 지속적으로 제품별 특성을 반영한 가이드라인 개발을 진행하고 있다.
3D 프린터를 이용하여 환자의 뼈나 관절 등을 맞춤으로 치료할 수 있는 3D 프린팅 의료기기는 허가 건수24)는 꾸준한 증가 추세를 유지하고 있다. 특히 국내 제조가 강세를 보이고 있으며, 품목으로는 광대뼈나 두개골 등 결손부위에 사용하는 인공 광대뼈, 두개골성형재료, 인공무릎관절 등이 있다. 2018년 3D 프린팅 품목은 의료용가이드 8건, 트레이용레진 3건, 치과용임플란트가이드 2건, 침습형일회용의료용가이드 2건 등이다.
(4) U-헬스케어 의료기기
통신기술이 적용된 의료기기 개발이 증가함에 따라, 식약처에서는 의료기기 해킹, 정보 유출 등으로부터 환자를 보호하기 위하여 ‘의료기기 사이버 보안 허가심사 가이드라인’과 ‘의료기기 사이버 보안 적용방법 및 사례집(2018)’을 개발하였다. 태블릿 PC, 모바일 앱 등 IT기술을 접목시켜 혈당, 혈압, 콜레스테롤 등의 환자 생체정보를 측정・확인하여 장소에 제약 없이 건강 관리를 할 수 있는 U-헬스케어 의료기기 허가25)가 증가되는 추세에 있다.
U-헬스케어 의료기기는 환자의 생체정보를 측정하는 U-헬스케어 측정기기와 생체정보의 수집・전송 또는 수집・조회 및 분석하거나 감시하고 전송하는 U-헬스케어 게이트웨이, 환자의 정보를 전송받아 생체정보 분석 등의 결과를 의료진에게 제공하는 U-헬스케어 진단지원시스템으로 구성된다. 2017년도에는 1등급 U-헬스케어게이트웨이가 10건, U-헬스케어 진단지원시스템 4건, 2등급 U-헬스케어 게이트웨이 2건, U-헬스케어 혈압계 2건이었고, 그 중 모바일 의료용 앱 제품은 12건에 해당하였다.
(5) 범부처 협력을 통한 융복합 신개발 의료기기 신속 제품화 지원 성과
의료기기 산업 육성을 위하여 각 부처별로 연구개발 지원을 하고 있으나 제품화 성공 사례는 저조하였다. 국내 품목허가 사례가 전무하거나 매우 제한적이어서 평가기술이 개발되어 있지 않은 경우가 대부분이어서 품목허가까지 장기간 제품화 지연이 발생할 수 있었다.
이에 식약처에서는 제품에 적용된 기술적 특성을 반영하여 융복합 신개발 의료기기의 시험방법 개발, 안전성・성능평가 및 임상시험계획서・허가심사 자료 제출 범위를 선제적으로 개발 지원하는 사업을 2015년부터 지속적으로 수행하여 왔다. 2015년 5건, 2016년 7건, 2017년 5건, 2018년 4건 등 총 21건의 신개발의료기기에 대한 평가기술 가이드라인을 발간하였고, 이 가이드라인을 토대로 허가가 완료되거나 현재 진행 중인 제품은 2018.12. 31.기준 총 7건(33.3%)이며, 임상시험계획이 승인되어 임상시험을 진행 중인 건은 총 6건(28.6%)으로 범부처 평가기술 개발대상 제품 중 제품화가 임박한 제품이 61.9%가 되는 등 첨단의료기기에 대한 신속한 제품화 성과가 높았다. 또한 과학기술정보통신부, 산업통상자원부, 보건복지부, 중소벤처기업부, 식품의약품안전처가 첨단의료기기의 신속한 제품화지원을 위해 업무협약을 체결하고, 의료기기 R&D 기획부터 시장 출시까지 맞춤형 기술지원을 위해 분기별로 범부처 실무협의회를 운영 중이며 연 1회 범부처 공동 워크숍을 개최하여 신속 제품과 성과를 공유하고 있다.
나. 정밀의료산업을 선도하는 체외진단제품 허가・심사
최근 단백체학, 유전체학 및 생물정보학 기술의 급속한 발달과 융복합으로 질병 진단과 치료에 많은 변화가 발생하고 있다. 이는 개인 맞춤형 정밀의료에 활용되고 있다.
(1) 의료현장 검사 임상검사실 인증제 정착
최첨단 차세대염기서열분석(NGS: Next Generation Sequencing)과 같은 유전체 분석 기술을 현장에서 인증받은 검사실별로 허용하기 위한 임상검사실 인증제가 2016년 6월 도입되어 NGS장비는 개별허가를 받지 않아도 임상검사실의 품질관리체계, 숙련도, 검사성능을 종합평가 인증 후 임상검사실에서 사용이 가능하게 되었다. 임상검사실 인증시 고려해야할 사항은 체세포 변이(Somatic variants), 생식세포 변이(Germline variants), 비침습적 산전 기형아 검사(Non-Invasive Prenatal Test) NGS 검사분야별로 가이드라인(2017)이 제공되고 있다.
(2) 빅데이터기반 체외진단용 의료기기의 허가・심사 현황
체외진단 분야에서도 질환과 연관된 특정 생체표지자만이 사용되다가 여러 개의 생체표지자를 이용한 체외진단 다지표검사용 의료기기 개발 사례가 증가하였다. 조기 유방암 환자의 10년 내 전이 위험도를 예측하는 차세대유전자서열검사(NGS) 기반 유방암 진단제품(2016), 비소세포성 폐암 위험도 정보 동반진단기기(2017), 위암 환자의 5년 생존율 예후 예측을 하는 제품(2017), 대장암 진단의 보조검사시약(2018) 등 4개의 3등급 의료기기 제품들이 신개발의료기기로 지정되어 재심사대상으로 허가 후 4년간 안전성・유효성이 추적 조사 중에 있다.
식약처에서는 2018년 6월 의료기기 품목군으로 체외진단용 소프트웨어를 신설하였고, 소분류로는 질환예후・예측검사 및 암예후・예측검사 등으로 구분하여 4개의 소분류를 마련하였다. 그리고 허가신청서 작성요령, 알고리즘 검정 평가, 분석적 및 임상적 성능 평가 시 고려사항 등 기술문서 작성 및 자료요건을 안내하는 ‘질병의 예후・예측에 사용되는 체외진단용 의료기기 허가・심사 가이드라인’을 발간하였다.
(다) 체외진단용 의료기기의 혁신적 규제 변화
첨단 분석 기술의 출현 등 신개념 체외진단 제품의 개발이 확대되면서, 식약처에서는 2019년 2월 의료기기 허가・신고・심사 등에 관한 규정 개정을 통해 체외진단용 의료기기의 특성상 제품의 성능 및 안전성에 영향을 미치는 않는 경미한 변경에 대한 사항은 업체가 자율적으로 관리하도록 하였고, 안내서를 발간하였다(2019.3.). 또한 이 안내서와는 별도로 업체의 변경사항이 경미한 사항인지 중대한 사항인지를 질의할 수 있는 온라인 창구를 운영하고 있다.
(4) 의료기기 통합정보시스템 운영
2016년 12월 의료기기법 개정을 통해 제조・수입되는 모든 의료기기에 국제적으로 표준화된 표준코드를 부착하고 통합정보를 등록하도록 하여 허가부터 유통, 사용에 이르기까지 전 과정을 추적관리 할 수 있는 의료기기 통합정보시스템을 구축하고 단계적으로 운영하도록 하였다. 통합정보센터는 한국의료기기안전정보원으로 지정되었으며, 2018년 추적관리대상 의료기기 등을 대상으로 시범사업 결과 분석 후, 2019년부터는 단계적으로 통합정보시스템을 운영할 예정이다.
다. 수출 지원 및 국제 협력
의료기기규제 관련 국제기구 중 국제의료기기당국자포럼(IMDRF: International Medical Device Regulatros Forum)은 전 세계 의료기기의 가장 큰 시장(약 86%)과 규제 영향력을 가지고 있으므로, 한국 의료기기규제 위상을 제고하고 업계의 수출을 지원하기 위해서는 IMDRF 회원국 가입과 활발한 국제 협력 활동이 필수적이다. 식약처는 2017년 12월 세계 10번째로 IMDRF 정회원국으로 가입하였다. 또 캐나다와는 2018년 11월 의료기기분야 협력 강화를 위해 MOU를 체결하였다. 한국은 2021년도 IMDRF의장으로 선임되어 의료기기규제의 글로벌 선도에 박차를 가할 계획이다.
최근 IT기술이 접목된 첨단 융복합 의료기기의 발전 속도에 맞춰 적시에 제품화하고 세계시장을 선점하기 위해서는 의료기기 개발부터 수출까지 다양한 맞춤형 지원체계를 운영하는 것이 필요하다. 우선 개발부터 수출까지 정보를 제공하는 ‘의료기기 통합정보 BANK’ 사이트를 통해 새로운 수출시장 개척을 위하여 2017년에는 신흥 수출 유망국인 베트남, 멕시코, 캐나다 등에 대한 정보를 추가하여 총 13개국에 대한 시장동향 및 허가정보를 제공하였고, 호주, 싱가포르, 인도네시아 등에 대한 정보 추가 등 지속적으로 허가 및 산업시장 정보를 제공할 예정이다.
4. 발전 과제
가. 첨단바이오의약품 및 융복합제품에 대한 합리적 규제 추진
‘첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률’, ‘의료기기산업 육성 및 혁신의료기기 지원법’, ‘체외진단의료기기법’이 2020년부터 시행될 예정이다. 법의 취지를 잘 살려 국민들이 국제적 수준의 안전하고 유효한 의료기회를 가질 수 있도록 시행규칙 등 규정이 명확히 만들어져야 한다. 더욱이 세포를 이용한 3D프린팅 제품 등 다양한 형태의 융복합 제품 출현이 예상됨에 따라 바이오 융복합 제품에 대한 분류기준, 절차 등을 마련하여 융복합 제품, 경계영역 제품 개발을 적극 지원하는 것이 필요하다.
나. 의료기기 허가 및 신의료기술평가 통합 운영 가속화
급속히 발전하는 첨단 과학기술을 응용한 신기술 의료기기의 등장이 가속화되고 있다.허가된 의료기기가 신의료기술평가에 소요되는 시간이 오래 걸려 시장진입이 지연되는 어려움이 있었다.
2016년부터 시범적으로 운영되는 의료기기 허가 및 신의료기술 평가 통합 운영을 가속화하여, 절차를 간소화하고 중복 업무는 최대한 줄여서, 첨단의료기술의 신속한 혜택이 국민에게 돌아갈 수 있길 기대한다.
참고자료
1) 2016, 2017, 2018년 의약품, 의료기기 허가보고서, 식약처
2) 2018년 식품의약품안전백서, 식약처
제5절
생명공학 기업 현황과 지원제도
1. 국내외 바이오기업 현황
가. 글로벌 상위 바이오기업 현황
(1) 글로벌 시가총액 상위 바이오기업
생명공학전문지 GEN에서 2018년 기준 시가총액 상위 25개 바이오기업 명단을 발표하였다. 이들 기업들의 전체 시가총액은 전년 대비 8.8% 감소한 9,188억 달러였다. 시가총액이 감소한 이유는 임상 실패, 특허만료, 제네릭기업과의 경쟁, 정부의 약가인하 압력 등에 기인하였다.
25개 기업 중 미국 기업이 11개, 미국 이외의 기업은 14개 회사였다. 미국 이외의 국가중에는 중국에 5개 기업이 소재하고 있으며 한국 및 아일랜드에 각각 2개사, 그리고 호주, 벨기에, 덴마크, 인도 및 이스라엘에 각각 1개사가 소재하고 있다. 한국기업에는 셀트리온과 삼성바이오로직스가 포함되었다.
[표 4-9] 2018년 기준 글로벌 상위 25개 바이오기업 명단
|
순위 |
기업명 |
시가총액(억 달러) |
국가 |
|
1 |
Amgen |
1,227 |
미국 |
|
2 |
Gilead Science |
924 |
미국 |
|
3 |
Novo Nordisk |
840 |
덴마크 |
|
4 |
Biogen |
615 |
미국 |
|
5 |
CSL |
603 |
호주 |
|
6 |
Allergan |
589 |
미국 |
|
7 |
Shire |
528 |
미국(영국*) |
|
8 |
Celgene |
501 |
미국 |
|
9 |
Vertex Pharmaceuticals |
433 |
미국 |
|
10 |
Regeneron Pharmaceuticals |
367 |
미국 |
|
11 |
Jiangsu Hengrui Medicine |
309 |
중국 |
|
12 |
Alexion Pharmaceuticals |
250 |
미국 |
|
13 |
Celltrion |
248 |
한국 |
|
14 |
Samsung Biologics |
231 |
한국 |
|
15 |
Teva Pharmaceutical |
204 |
이스라엘 |
|
16 |
Sun Pharmaceutical |
183 |
인도 |
|
17 |
Biomarin Pharmaceutical |
163 |
미국 |
|
18 |
Mylan |
159 |
미국 |
|
19 |
UCB |
159 |
벨기에 |
|
20 |
Sinopharm Group |
128 |
중국 |
|
21 |
Incyte |
126 |
미국 |
|
22 |
Wuxi Apptec |
125 |
중국 |
|
23 |
Yunnan Baiyao Group |
105 |
중국 |
|
24 |
China Resources Pharmaceutical |
104 |
중국 |
|
25 |
Perrigo |
94 |
미국 |
주) 본사는 미국에 있으나 세금 등으로 영국에 근거지를 둠.
출처: Top 25 Biotech Companies of 2018, GEN, 2019.1.
(2) 전문의약품 및 바이오의약품 매출 상위 10대 기업
글로벌 의약품 시장조사기관 EvaluatePharma사에 따르면, 2018년 기준 글로벌 전문의약품 시장은 8,278억 달러였으며 1위 기업은 453억 달러의 매출을 기록한 미국의 화이자가 차지했다. 전문의약품 매출 상위 10대 기업의 총매출은 3,454억 달러로 글로벌 전체 전문의약품 매출의 41.7% 비중을 차지하였다. 이들 전문의약품 매출 상위 10대 기업이 소재한 국가를 보면 미국이 4개, 스위스 및 영국이 각각 2개, 프랑스 및 일본이 각각 1개이다.
2018년 기준 글로벌 바이오의약품 시장은 2,430억 달러였으며 1위 기업은 375억 달러의 매출을 기록한 스위스의 로슈가 차지했다. 바이오의약품 매출 상위 10대 기업의 총 매출은 1,776억 달러로 글로벌 전체 바이오의약품 매출의 73.1% 비중을 차지하였다. 이들 바이오의약품 매출 상위 10대 기업이 소재한 국가를 보면 미국이 7개로 가장 많고, 스위스, 덴마크, 프랑스가 각각 1개이다.
[표 4-10] 2018년 기준 전문의약품 및 바이오의약품 매출 상위 10대 기업(단위: 억 달러)
|
전문의약품 |
바이오의약품 |
||||
|
순위 |
기업명 |
매출액 |
순위 |
기업명 |
매출액 |
|
1 |
Pfizer |
453 |
1 |
Roche |
375 |
|
2 |
Roche |
446 |
2 |
AbbVie |
207 |
|
3 |
Novartis |
435 |
3 |
Amgen |
192 |
|
4 |
Johnson & Johnson |
388 |
4 |
Novo Nordisk |
171 |
|
5 |
Merck & Co. |
374 |
5 |
Sanofi |
168 |
|
6 |
Sanofi |
351 |
6 |
Johnson & Johnson |
160 |
|
7 |
AbbVie |
321 |
7 |
Merck & Co. |
153 |
|
8 |
GSK |
306 |
8 |
Eli Lilly |
128 |
|
9 |
AstraZeneca |
207 |
9 |
Bristol-Myers Squibb |
112 |
|
10 |
Takeda |
174 |
10 |
Pfizer |
110 |
출처: World Preview 2019, outlook to 2024, EvaluatePharma, 2019.6.
나. 국내 바이오기업 현황
(1) 국내 바이오기업 현황
통계청 승인 국내 바이오산업 통계인 ‘국내 바이오산업 실태조사’를 보면 2017년 기준 총 984개의 바이오기업이 있다. 이 중 벤처기업으로 인증 받은 기업은 344개사, 이노비즈 인증기업은 313개사가 포함되어 있다. 984개 기업 중 상장기업은 총 234개사로 코스닥에 124개사, 유가증권시장에 84개사, 코넥스에 26개사가 상장되어 있는 것으로 조사되었다.
이들 기업들의 소재지를 보면 경기도에 320개사, 서울 207개사, 충북 78개사, 대전 76개사, 강원 53개사 등의 순으로 대부분 서울과 경기도에 소재하고 있다.
(2) 국내 바이오의약품 매출 상위 기업 현황
식품의약품안전처 자료에 따르면, 2017년 기준 바이오의약품 생산실적은 2조 6,015억 원으로 전년(2조 79억 원) 대비 29.6% 증가하였으며, 최근 제품 개발이 활발히 이루어지 있는 유전자재조합의약품, 독소・항독소, 세포치료제의 성장세가 두드러졌다.
2017년 기준 국내 바이오의약품 제조기업(생산실적 보고 기준)은 총 50개 기업 55개 제조소였다. 생산실적 1위 기업은 셀트리온으로 9,023억 원의 생산실적을 기록하여 국내 바이오의약품 전체 생산실적의 35%를 차지하였다. 다음으로는 녹십자가 5,782억 원으로 2위를 차지하였으며, 상위 2개 업체가 국내 바이오의약품 생산액의 약 60%를 차지하였다.
[표 4-11] 국내 바이오의약품 업체 수 현황(단위: 개, 억 원)
|
구분 |
제조소 |
생산금액 |
|
2013년 |
48 |
18,654 |
|
2014년 |
47 |
16,818 |
|
2015년 |
51 |
17,209 |
|
2016년 |
55 |
20,079 |
|
2017년 |
55 |
26,015 |
출처: 식품의약품안전처, 2018
[표 4-12] 국내 바이오의약품 생산실적 상위 기업
|
순위 |
업체명 |
생산액(억 원) |
전년대비 증감률(%) |
||
|
2016년 |
2017년 |
2017년 비중(%) |
|||
|
1 |
셀트리온 |
4,285 |
9,023 |
35 |
111 |
|
2 |
녹십자 |
5,068 |
5,782 |
22 |
14 |
|
3 |
엘지화학 |
1,604 |
1,605 |
6 |
0 |
|
4 |
메디톡스 |
544 |
1,045 |
4 |
92 |
|
5 |
에스케이케미칼 |
748 |
839 |
3 |
12 |
|
6 |
동아에스티 |
1,165 |
758 |
3 |
-35 |
|
7 |
에스케이플라즈마 |
458 |
680 |
3 |
48 |
|
8 |
씨제이헬스케어 |
442 |
517 |
2 |
17 |
|
9 |
휴젤 |
329 |
483 |
2 |
47 |
|
10 |
얀센백신 |
1,071 |
454 |
2 |
-58 |
|
소계(상위 10개사) |
15,715 |
21,184 |
81 |
35 |
|
|
총 생산실적 |
200,789 |
260,146 |
100 |
30 |
|
출처: 식품의약품안전처, 2018
2. 바이오기업 지원 제도
가. 창업 및 초기 바이오기업 지원
그간 정부는 혁신성장의 핵심 축으로 벤처・창업 선순환 생태계 조성을 위한 혁신창업 생태계 조성방안, 민간중심의 벤처생태계 혁신대책, 혁신창업 붐 조성방안 등 일련의 정책을 마련하여 창업・투자・회수 환경을 개선하는 노력을 추진해 오고 있으며, 그 결과 2018년 기준으로 창업과 벤처캐피탈 투자액면에서 역대 최대를 기록하였다.
정부는 바이오헬스 사업초기 부담 완화 및 투자 강화를 위해, 병원・실험실 등 의료 인프라의 개방공유 확대로 R&D, 임상, 데이터 등 바이오헬스 스타트업의 사업초기 부담 완화를 추진하고 있으며 이를 위해 첨단 설비를 갖춘 클러스터・의료기관에 스타트업 입주・사업화를 지원하고 ‘헬스케어 빅데이터 쇼케이스’ 사업 등 표준화된 개인 건강・연구데이터 공유로 스타트업의 신서비스개발을 지원하고 있다. 아울러, 바이오 벤처투자에 특화해 기 조성된 정책펀드 6,000억 원을 집중 투자하고 유망 바이오벤처에 R&D연계 등을 지원하고 있다.
특히 정부는 2019년 5월 바이오헬스 혁신전략 발표를 통해 연매출 1조 원 이상의 블록버스터 국산 신약개발을 지원하기 위해 2022년까지 총 15조 원 규모로 조성 중인 ‘스케일업 펀드’를 활용해 향후 5년간 2조 원 이상의 정책금융을 바이오헬스 분야에 투자하기로 했다.
한편 중소벤처기업부는 정부의 창업지원사업을 통합공고하고 있다. 공고 내용에는 부처별 지원대상, 전담기관, 사업규모, 일정 등이 포함되어 있으며, 지원유형별로 사업화, 연구개발, 시설공간, 창업교육, 멘토링, 네트워크 등으로 구분되어 있다. 세부사항에 대해서는 창업정보 포탈시스템(www.k-startup.go.kr)을 통해 확인이 가능하다.
또한, 한국바이오협회에서는 ‘바이오스타트업 지원 가이드북’을 발간하여 바이오기업들의 예비창업단계, 창업초기단계, 성장단계별 정책자금, 금융지원, 입주・시설・공간, 창업교육・멘토링・컨설팅, 인허가, 판로・해외진출 등에 대한 정부지원사업을 안내하고 있다.
나. 기술개발 지원
정부는 바이오분야에 대한 효율적・체계적 추진을 위해 관계부처 공동으로 매년 시행계획을 마련하고 생명과학, 의료, 농업, 환경, 융합신산업 등의 분야별 연구개발 투자를 시행하고 있다. 2018년에는 총 2조 4,133억 원의 연구개발 투자가 진행되었으며, 2019년에는 2조 4,692억 원의 투자를 계획하고 있다. 동 계획에 따라 2019년에는 신기술개발, 정밀의료 및 스마트팜 등 융복합 기술개발, 치매・감염병・생활환경 등 국민건강 및 생활편익 증진에 기여하기 위한 진단・치료기술 개발이 추진될 예정이다.
특별히 바이오헬스 분야에 대해서는 2019년 5월 발표된 바이오헬스 혁신전략에 따라 정부 R&D 투자를 2025년까지 4조 원 이상으로 확대 추진할 계획이다. 바이오헬스 분야는 의약품, 의료기기 등 제조업과 의료・건강관리 서비스업을 포함하고 있다.
이를 통해 면역세포 활용 표적항암제 등 재생의료・바이오의약품 개발, 신약개발 전주기 지원을 통한 유망 후보물질 발굴 및 중개연구 지원, AI 영상진단기기 등 융복합 의료기기 및 수출 주력품목 기술고도화 등 세계시장을 선도할 수 있는 차세대 유망기술 개발을 중점 지원할 계획이다. 또한, 신약개발 R&D 성공률 제고를 위해 민간 벤처투자와 공동으로 우수 물질을 선별 투자하는 ‘투자연계형 R&D’를 신설하고, 범부처 R&D 협업 및 공동기획을 확대할 계획이다.
다. 산업화 환경 조성
(1) 바이오 빅데이터 구축
정부는 전 세계 바이오헬스 시장이 표적항암제 등 개인 맞춤형 치료기술 중심으로 발전해 가고 있으며 이러한 의료기술 혁신의 핵심기반이 “데이터”라는 인식 아래 5대 빅데이터 플랫폼을 구축해 혁신신약 개발과 의료기술 연구를 통해 국민 생명・건강을 지키는 국가 인프라로 활용할 계획이다. 5대 빅데이터에는 국가 바이오 빅데이터, 데이터 중심병원, 신약 후보물질 빅데이터, 바이오특허 빅데이터, 공공기관 빅데이터가 포함되었다.
정부는 이를 위해 먼저 최대 100만 명 규모의 ‘국가 바이오 빅데이터’를 구축할 계획이다. 희망자를 대상으로 유전체 정보, 의료이용・건강상태 정보를 수집하고, 수집된 인체정보는 국립중앙인체자원은행 등에 안전하게 보관하면서, 환자 맞춤형 신약・신의료기술 연구개발에 활용할 계획이다. 1단계로 2020년부터 2021년까지 2만 명 규모로 사업을 시작하여 2029년까지 100만 명 규모의 빅데이터 구축 완료를 목표로 할 계획이다.
(2) 오픈이노베이션 네트워킹 및 수출 활성화
정부는 선도기업과 창업・벤처기업 오픈이노베이션 협력체계를 구축할 계획이다. 창업・벤처기업들이 보유한 유망 기술과 선도기업의 자금, 글로벌 네트워크 등을 결합하고, 이를 기반으로 공동으로 해외 IR 등에 나설 수 있도록 지원할 계획이다.
또한 식품의약품안전처는 2014년부터 첨단 의약품을 신속하게 제품화하고 글로벌 수출로 연계하기 위한 ‘팜 나비(Pharm Navi)’ 사업을 추진하고 있다. 이는 의약품 허가심사자가 내비게이터가 되어 실시간으로 개발부터 허가까지 안내자 역할을 하여 신속한 허가심사가 이루어질 수 있도록 하기 위한 것이다. 아울러, 주요 수출국가 규제정보 및 WHO 사전적격성평가(PQ) 인증 기술지원, 의약품 GMP 상호인정 협약국가 확대 등을 통해 기업의 수출 확대를 지원하고 있다.
한편, 한국보건산업진흥원 및 충청북도는 컨퍼런스, 전시회, 비즈니스 포럼과 기타 잡페어 등 부대행사로 구성되는 Bio Korea 국제행사를 매년 개최하여 국내외 기업간 협력기회를 제공하고 있다. 산업통상자원부와 한국바이오협회는 바이오플러스 행사를 매년 개최하여 바이오산업에 대한 분야별 최신동향을 공유하고 참석자간 네트워킹을 제공하며 전시회 및 파트너링 등을 통해 국내외 기업간 전략적 제휴 활성화를 지원하고 있다.
(3) 규제 및 인허가 절차 개선
정부는 규제 샌드박스, 규제자유특구 제도를 적극적으로 활용하여 혁신기술을 실증하고 그 결과를 법령 개선에 반영하는 한편, 2019년 하반기 중 제약・의료기기 등 주요 분야별로 선진국 수준에 맞는 규제개선 로드맵을 마련할 계획이다. 아울러, 국무조정실을 중심으로 기획재정부, 과학기술정보통신부, 산업통상자원부, 보건복지부, 중소벤처기업부, 식품의약품안전처 등 바이오산업 관련 각 부처별로 기업현장의 애로사항 및 불합리한 규제 발굴과 개선을 추진하고 있다.
의약품・의료기기 인허가 기간을 단축하기 위해 신기술 분야에 대한 심사 전문성을 강화하고, 심사 전담인력을 확충하는 한편, 융복합 제품에 대해 개발단계부터 사전상담 및 신속한 품목 분류를 통해 인허가 예측가능성을 높일 계획이다. 또한, 의료기기산업 육성 및 혁신의료기기 지원법과 체외진단의료기기법이 2019년 4월 제정되어 2020년 5월부터 시행됨에 따라 희귀난치질환 치료 등 혁신 의료기기에 대한 인증제를 도입하여 인증받은 기기에 대해서는 허가 심사 특례 등을 지원하고, 의약품과 함께 개발되는 동반진단 의료기기의 경우 의약품과 의료기기의 허가 심사를 동시에 진행할 계획이다.
아울러, 세포・유전자 등을 활용하는 재생의료 및 바이오의약품의 특성에 맞도록 관리체계를 선진화할 계획이다. 의약품 임상시험과 구분되는 재생의료 임상연구 제도를 도입하여, 임상연구 활성화 및 안전관리 체계를 마련하고, ‘인체세포등 관리업’ 제도를 신설, 별도 안전관리기준 마련, 세포의 동질성 확보 등 강화된 허가・생산 관리기준 등 첨단바이오의약품에 대한 전주기 안전관리체계를 강화할 계획이다.
라. 세제 및 관세 지원
바이오산업은 신약개발 등 연구개발에 투자하는 비용이 높아 연구개발 및 시설투자비 등에 관련된 기업 지원이 필요하며, 우리나라는 조세특례제한법 및 관세법에 따라 세제 및 관세 분야 혜택을 지원하고 있다.
조세특례제한법에서는 신성장동력・원천기술의 연구・인력개발비에 대한 세액 공제를 지원하고 있다(법 제10조). 바이오헬스분야 신성장동력・원천기술에는 바이오・화합물의약, 의료기기・헬스케어, 바이오 농수산・식품, 바이오화장품소재가 포함되어 있다(시행령 별표7). 특히 정부는 제약・바이오 기업 연구개발 투자를 촉진하기 위하여 신성장동력・원천기술 R&D 세액공제 대상에 바이오베터 임상시험비를 추가하고 현행 5년인 이월기간을 연장 추진할 계획이다.
또한, 생산성향상시설 투자의 경우는 2021년 12월 31일까지 투자금의 100분의 1(중소기업은 100분의 7)에 상당액에 대한 세액공제를 받을 수 있으며(법 제25조), 의약품 품질관리 개선시설에는 2019년 12월 31일까지 투자한 금액의 100분의 1(중소기업은 100분의 6) 상당액에 대한 세액공제 받을 수 있다(법 제25조의4). 특히 신성장기술의 사업화를 위한 시설투자의 경우 2021년 12월 31일까지 한 금액의 100분의 5(중소기업은 100분의 10) 상당액에 대한 세액공제를 받게 되었다(제25조의5).
한편, 관세법에서는 장애인보조기구에 대한 물품과, 인공신장기 등 만성신부전증환자 및 세레자임 등 고셔병환자가 사용할 희귀병치료제 등 시행규칙 별표2에서 정한 물품에 대해 관세를 면제해 주고 있으며(법 제91조제4호), 시행규칙 별표2의4에서 정한 국내제작이 곤란한 공장자동화 물품에 대해서도 관세를 감면하고 있다(제95조제1항제3호).
마. 바이오기업(제품) 인증・지원
(1) 혁신형 제약기업 인증・지원
보건복지부는 국내 제약기업의 글로벌 경쟁력을 확보하고, 제약산업을 미래 신성장동력으로 육성하기 위해 혁신형 제약기업 인증 등을 지원하고 있다. 신약 연구개발 등에 일정규모 이상의 투자를 하는 기업을 대상으로 선정되며 2019년 2월 기준 47개사가 인증을 받았다.
인증 받은 기업은 R&D 참여시 가점 부여, 연구개발 비용에 대한 법인세액 공제, 의약품 품질관리 개선 시설투자비용 세액공제 및 연구시설 건축시 입지 지역 규제완화 및 부담금 면제, 수출촉진자금대출 등 정책자금 융자에 대한 지원을 받는다.
(2) 월드클래스300 기업 인증・지원
중소벤처기업부와 산업통상자원부는 취약한 산업의 허리를 강화하고 성장동력을 지속적으로 확충하며 질 좋은 일자리를 창출하고자 2011년부터 성장 잠재력고 혁신성이 뛰어난 중소・중견기업을 선정하여 지원하는 월드클래스300 프로젝트를 추진하고 있다. 2018년 5월까지 300개 기업 선정이 완료되었고 선정된 기업 중에는 의약품, 의료기기, 식품, 유전체분석 기업 등이 포함되었다.
신청 기업은 매출액 400억∼1조 원 규모의 중소・중견기업으로 직전년도 직간접 수출비중 20% 이상이면서 최근 5년간 연평균 매출증가율이 15% 이상 또는 최근 3년간 매출액 대비 R&D 투자비율이 평균 2% 이상 등의 기준을 통과해야 하며, 선정시에는 연구개발비(연 15억 원, 5년) 지원, 전주기 특허전략 지원, 해외마케팅(연 7억 5,000만 원, 5년) 지원, 채용박람회 무료 참가와 금융・컨설팅・인력채용 등에 있어 다양한 지원을 받게 된다.
(3) 세계일류상품 및 생산기업 인증・지원
산업통상자원부와 코트라는 수출 품목의 다양화・고급화 및 미래 수출동력 확충을 위해 세계일류상품 육성사업을 시행하고 있다. 점유율 기준에 따라 현재일류(점유율 5위 이내) 및 차세대일류상품(7년 이내 현재일류상품 진입 가능), 인증대상에 따라 품목과 생산기업으로 나누어 선정하며, 업종별 추천위원회 및 일류상품발전심의위원회 심의를 거쳐 최종 선정된다. 바이오분야는 한국바이오협회가, 보건산업은 한국제약바이오협회・한국의료기기공업협동조합・대한화장품협회・한국식품산업협회가 맡아 추천위원회를 구성한다.
선정된 기업에게는 해외시장 개척활동, 기술 및 브랜드 개발, 국내외 컨벤션 참가비용 지원, 세계일류상품 로고 사용 등의 혜택이 주어진다.
부록
부록 1
![]()
생명공학 연표
⋙ 기원전 8000년
◦인간이 농작물과 가축을 경작하고 사육하기 시작
◦최초로 감자를 식용으로 경작
⋙ 기원전 4000∼2000년
◦이집트에서 효모를 사용해 빵과 맥주의 발효 시작
◦수메리아, 중국, 이집트에서 치즈를 생산하고 포도주를 발효시킴
◦바빌로니아인들은 몇 그루 수술 나무의 꽃가루를 가지고 선별적으로 암술나무에 수정하여 대추야자를 생산
⋙ 기원전 500년
◦중국에서 항생물질을 가진 곰팡이가 핀 두부로 종기를 치료
⋙ 서기 100년
◦중국에서 최초로 살충제를 국화에 살포함
⋙ 1322년
◦아랍에서 우성 말을 생산하기 위해 최초로 인공수정을 사용
⋙ 1590년
◦Janssen, 현미경 발명
⋙ 1663년
◦Hooke, 세포의 존재 발견
⋙ 1675년
◦Leeuwenhoek, 박테리아를 발견
⋙ 1761년
◦Koelreuter, 다른 종의 농작물을 성공적으로 이종교배 하였음을 보고
⋙ 1797년
◦Jenner, 아이들에게 천연두를 막기 위한 바이러스성 백신을 접종
⋙ 1830∼1833년
◦1830년 단백질 발견
◦1833년 최초로 효소가 발견되고 분리됨
⋙ 1835∼1855년
◦Schleiden와 Schwann, 모든 유기체는 세포들로 구성되어 있다고 제안
◦Virchow, ʻʻ모든 세포는 세포에서 생겼다ʼʼ고 선언
⋙ 1857년
◦Pasteur, 미생물들이 발효를 유발한다고 제안
⋙ 1859년
◦Charles Darwin, 자연 도태의 진화론을 발표(1800년대 후반 유전학의 무지에도 불구하고 선택된 부모와 도태된 다양한 자손에 대한 개념은 동식물 사육사들에게 매우 큰 영향을 줌)
⋙ 1865년
◦유전학 연구 시작
◦Gregor Mendel, 오스트리아인 수도사인 그는 완두를 연구하여 유전법칙에 의해 유전적 특징이 부모로부터 자손에게 물려진다는 점을 발견함
⋙ 1870∼1890년
◦Darwin의 이론을 이용하여 면화를 이종교배하고 수백 가지의 우성품종을 개발
◦최초로 농부들이 수확량을 늘리기 위해 농지에 질소고정 박테리아 미생물을 섞음
◦William James Beal, 최초로 실험실에서 실험용 옥수수 잡종 생산
⋙ 1877년
◦Koch, 박테리아를 염색하고 동정하기 위한 기술 개발
⋙ 1878년
◦Laval, 최초로 원심분리기 개발
⋙ 1879년
◦Fleming, 후에 염색체라 불려지는 세포핵 안쪽의 봉모양의 염색질을 발견
⋙ 1900년
◦초파리가 유전연구에 사용
⋙ 1902년
◦면역학이라는 용어가 처음으로 나타남
⋙ 1906년
◦유전학이라는 용어가 소개됨
⋙ 1911년
◦Rous, 최초로 암을 유발하는 바이러스 발견
⋙ 1914년
◦최초로 박테리아를 영국 맨체스터의 하수처리에 사용
⋙ 1915년
◦Phage(박테리아성 바이러스)발견
⋙ 1919년
◦최초로 생명공학(Biotechnology)이라는 단어가 출판물에 사용
⋙ 1920년
◦Evans와 Long, 인간성장 호르몬 발견
⋙ 1928년
◦Alexander Fleming, 항생물질인 페니실린 발견
◦유럽에서 조명충 나방제어를 위한 소규모의 Bacillus thuringiensis(Bt) 테스트 시작
◦1938년 프랑스에서 미생물 살충제의 상업적 생산 시작
◦Karpechenko, 무와 양배추를 교배하여 서로 다른 속(屬)의 식물 사이에서 번식력이 강한 자손을 만듦
◦Laibach, 최초로 오늘날 이종교배라 알려진 광범위한 교배로부터 잡종을 얻기 위해 배구제(embryo rescue)를 사용
⋙ 1930년
◦美의회에서 식물육종생산의 특허를 가능하게 하는 식물특허법(Plant Patent Act) 통과
⋙ 1933년
◦1920년대 Henry Wallace에 의해 개발된 잡종옥수수가 상업화 됨(1945년에는 엄청난 매출액은 증가된 연 종자구입비를 능가했고 잡종 옥수수는 미국 전체 옥수수 생산량의 78%를 차지)
⋙ 1938년
◦분자 생물학이란 용어가 생김
⋙ 1941년
◦유전공학이란 용어가 폴란드 Lwow의 기술연구소에서 효모복제에 관한 강의를 맡고 있는 덴마크의 미생물학자 A. Jost에 의해 최초로 사용
⋙ 1942년
◦박테리아를 감염시키는 박테리오파지를 구명하고 확인하기 위해 전자 현미경을 사용
◦페니실린을 미생물에서 생산함
⋙ 1944년
◦Avery와 그 외 다른 사람들에 의해 DNA가 유전정보를 운반한다는 점이 입증됨
◦Waksman, 결핵에 효과적인 항생제인 streptomycin을 분리(추출)
⋙ 1946년
◦새로운 타입의 바이러스를 형성하기 위해 서로 다른 바이러스로부터의 유전물질이 결합할 수 있다는 일종의 유전자 재조합이 발견
◦유전적 다양성의 상실로 인한 위협을 인식한 미의회는 식물수집과 보존 그리고 이러한 인식의 홍보에 막대한 자금을 제공함
⋙ 1947년
◦McClintock, 옥수수에서 소위 움직이는 유전자(jumping genes)라 불리는 전이요소를 발견
⋙ 1949년
◦Pauling, 겸상(鎌狀) 적혈구 빈혈증(흑인의 유전병)이 헤모글로빈 내 단백질분자의 돌연변이로 야기된 ʻ분자병ʼ임을 밝혀냄
⋙ 1951년
◦냉동정액을 사용한 가축의 인공수정이 성공적으로 수행됨.
⋙ 1953년
◦과학저널 Nature는 현대 유전학의 출발을 상징하는 DNA의 이중나선 구조를 묘사한 James Watson과 Francis Crick의 원고를 출판
⋙ 1955년
◦핵산 합성에 관한 효소가 처음으로 추출됨
⋙ 1956년
◦Kornberg, DNA 복제에 필요한 효소 DNA 중합효소Ⅰ(DNA polymeraseⅠ) 발견
⋙ 1958년
◦겸상 적혈구 빈혈증이 단일 아미노산의 변화 때문에 발생한다고 밝혀짐
◦DNA가 처음으로 시험관에서 만들어짐
⋙ 1959년
◦조직 살균제가 개발됨
◦단백질 생합성의 첫 단계가 그려짐
⋙ 1950년대
◦바이러스 증식억제 물질(interferon) 발견
◦최초 합성 항생 물질 개발
⋙ 1960년
◦시냅시스(세포의 감수분열 초기에 있는 상동염색체의 병렬접착)를 이용해 DNA-RNA 잡종 분자가 만들어짐
◦메신저 리보 핵산(Messenger RNA) 발견
⋙ 1961년
◦美 농림부가 최초 미생물 살충제인 Bacillus thuringiensis를 등록함
⋙ 1963년
◦Norman Borlaug에 의해 신품종 밀이 개발됨으로 인해 생산량이 70% 상승함
⋙ 1964년
◦필리핀의 국제 벼 연구소(The International Rice Research Institute)는 새로운 품종을 개발하여 충분한 비료를 주면 이전의 생산량보다 2배 많은 수확량을 얻을 수 있는 녹색 혁명을 일으킴
⋙ 1965년
◦Harris와 Watkins가 성공적으로 생쥐와 사람 세포를 융합시킴
⋙ 1966년
◦유전암호가 해독되고 일련의 3개의 뉴클리오티드가 하나의 아미노산을 결정한다는 사실이 밝혀짐
⋙ 1967년
◦최초로 자동 단백질 서열 분석기 완성
⋙ 1969년
◦처음으로 효소가 생체 외에서 합성됨
⋙ 1970년
◦노르만인 Borlaug, 노벨 평화상 수상(1963년 참조)
◦유전물질을 자르는 제한 효소(두 줄 사슬 DNA를 특정 부위에서 절단하는 효소)의 발견으로 유전자 복제의 장이 열림
⋙ 1971년
◦처음으로 유전자가 완벽하게 합성됨
⋙ 1972년
◦인간의 DNA 구성이 침팬지와 고릴라의 DNA와 99% 유사함이 발견됨
◦최초로 배이식(胚移植)이 시도됨
⋙ 1973년
◦Stanley Cohen와 Herbert Boyer, 제한효소와 리가제(ligases)를 사용해서 DNA를 자르고 붙이는 기술과 박테리아에서 새로운 DNA를 복제하는 기술을 완성함
⋙ 1974년
◦미국 NIH는 유전자 재조합 연구를 총괄하기 위해 재조합 DNA 자문위원회(Recombinant DNA Advisory Committee) 구성
⋙ 1975년
◦최초로 미국 정부가 캘리포니아 Asilomar 회의에서 유전자재조합실험을 규제하기 위한 가이드라인 개발을 주장함
◦단일클론항체가 생산됨
⋙ 1976년
◦유전자 재조합 기술이 유전 장애인에 최초로 적용
◦분자교배가 태아의 alpha thalassemia 진단에 사용됨
◦효모의 유전자가 대장균(E.coli)에서 발현됨
◦최초로 특정유전자의 염기쌍 순서가 결정됨(A, C, T, G)
◦美國재조합 DNA 자문위원회(NIH Recombinant DNA Advisory Committee)에 의해 유전자 재조합 실험에 대한 가이드라인이 처음으로 발표
⋙ 1977년
◦인간유전자를 박테리아에서 처음으로 발현시킴
◦전기영동을 이용해 DNA의 긴 마디를 빠르게 나열하기 위한 연구수행
⋙ 1978년
◦바이러스의 고방사선 구조가 최초로 확인됨
◦재조합 인간 인슐린이 최초로 생산됨
◦미국 노스캐롤라이나 과학자들이 DNA 분자상의 특정 위치에 특정 돌연변이를 일으키는 것이 가능하다는 것을 보여줌
⋙ 1979년
◦최초로 인간성장 호르몬이 합성됨
⋙ 1970년대
◦유전공학 제품을 개발하기 위해 최초의 상업적 회사가 설립
◦중합효소(polymerases)의 발견
◦뉴클리오티드(nucleotides)의 빠른 나열기술 완성
◦유전자 표적화
◦RNA splicing
⋙ 1980년
◦Diamond v. Chakrabarty 재판에서 미 연방법원은 유전자재조합생물형태에 대한 특허를 인정했으며, Exxon 석유회사가 기름 먹는 미생물에 대한 특허 취득
◦美國정부 유전자복제에 대한 권한을 Cohen과 Boyer에게 부여
◦최초의 유전자합성 기계 개발
◦인간인터페론유전자를 박테리아로 형질전환(Transformation) 시킴
◦노벨 화학상이 유전자 재조합분자를 개발한 Berg, Gilbert, Sanger에게 수여됨
⋙ 1981년
◦오하이오 대학의 과학자들이 다른 동물의 유전자를 쥐에 이식함으로써 최초로 유전자 이식동물을 생산함
◦중국의 과학자가 최초로 복제 물고기 금잉어를 만듦
⋙ 1982년
◦미국의 Applied Biosystems社는 단백질 서열분석에 필요한 샘플의 양을 획기적으로 줄일 수 있는 상업적 가스 상 단백질 서열분석기를 발표
◦가축을 위한 최초의 유전자 재조합 DNA 백신 개발
◦유전적 변이를 거친 박테리아에서 생산된 인간인슐린이 미국 FDA로부터 최초의 생명공학 기술에 의한 의약품으로 승인 받음
◦최초의 유전자 변형식물인 피튜니아 생산
⋙ 1983년
◦중합효소연쇄반응(PCR) 기술이 소개(유전자와 유전자 조각의 복제를 위해 열과 효소를 사용하는 PCR 기술은 이후 유전공학에서의 연구와 개발에 광범위하게 쓰이는 중요한 도구가 됨)
◦TI 플라스미드(plasmid: 염색체와는 따로 증식할 수 있는 유전인자)에 의한 식물 세포들의 유전학적인 변형이 수행됨
◦최초로 인공염색체 합성
◦특정유전병 유발인자 발견
◦생명공학기술을 이용해 피튜니아를 완전 성장시킴
◦피튜니아 식물을 통해 유전자변형식물의 새로운 특징이 자손에게 전달됨을 확인함
⋙ 1984년
◦DNA 지문검색 기술이 개발
◦HIV 바이러스의 전체 게놈이 복제되고 서열 결정됨
⋙ 1985년
◦신장병과 낭포성 섬유증을 유발하는 유전인자 발견
◦법적 증거로서 유전자 지문법이 도입
◦최초로 곤충과 박테리아, 바이러스에 저항력이 있는 유전자 변형식물이 시험됨
◦미국 NIH는 인간을 대상으로 하는 유전자 치료법 실험수행에 대한 가이드라인을 정함
⋙ 1986년
◦유전자 재조합 B형 간염 백신 최초 개발
◦최초의 유전공학 항암치료제 인터페론 생산
◦미국 정부는 유전자 재조합 유기체에 대해 전통적인 유전자재조합기술로 만들어진 제품에 적용된 규정보다 더 엄격한 ʻʻThe Coordinated Framework for Regulation of Biotechnologyʼʼ 규정 확립
◦California Berkeley 대학의 화학자가 신약을 개발하기 위해 항체와 효소를 결합하는 방법(abzymes) 제시
◦유전자 변형식물(담배)의 실제 실험이 수행됨
◦최초로 환경 보호국이 유전자변형 담배의 판매를 승인
⋙ 1987년
◦바이러스에 내성이 있는 토마토의 field test를 최초로 승인함
◦캘리포니아에서 농작물의 서리 형성을 억제하는 유전자 변형 박테리아인 Frostban을 딸기와 감자를 통해 시험하였는데 이것이 처음으로 공식 승인된 유전자 재조합 박테리아 외부 실험임
⋙ 1988년
◦미국 정부는 하버드대학 분자유전학자에게 유전자 변형동물 즉, 유전자변형 쥐에 대한 특허권을 부여함
◦세제에 사용할 수 있는 표백제 내성을 지닌 단백질 분해효소를 만드는 공정에 대한 특허권이 부여됨
◦미국 의회가 다른 종의 게놈뿐만 아니라 인간유전자 암호를 해독하고 지도를 만드는 인간 게놈 프로젝트 연구비를 승인함
⋙ 1989년
◦최초로 유전자변형 해충방지 면화의 field test 승인
◦식물 게놈 프로젝트 시작
⋙ 1980년대
◦진화의 역사를 밝히기 위한 DNA 연구 시작
◦유럽에서 유전자 재조합 동물백신의 사용 승인
◦기름 청소에 미생물을 이용한 생물학적 정화기술 사용
⋙ 1990년
◦미국 최초로 유전자재조합 기술을 이용하여 치즈제조에 쓰이는 인공적으로 제조된 chymosin 효소인 Chy-MaxTM이 소개됨
◦인체의 모든 유전자 지도를 제작하려는 국제적인 노력인 인간 게놈 프로젝트가 시작됨
◦면역장애를 앓고 있는 4살 여자 어린이를 대상으로 실시한 유전자 치료가 성공적으로 수행됨
◦유아 조유용 우유 단백질을 만드는 유전자 변형 젖소 탄생
◦해충에 강한 옥수수인 Bt 옥수수 생산
◦영국 최초로 유전자변형 효모식품이 승인됨
◦유전자 변형 척추동물 송어의 실지실험이 수행됨
⋙ 1992년
◦미국과 영국의 과학자들이 시험관 내에서 배아에 낭포성 섬유증과 혈우병과 같은 유전적 기형을 테스트하는 기법을 밝힘
◦미국 FDA는 유전자 이식 음식이 유전적으로 위험하지도 않고 특별한 규정도 필요 없다고 선언함
⋙ 1993년
◦미국 FDA, 낙농가의 우유생산 촉진을 위해 BST(Borine Somatotropin)를 승인
⋙ 1994년
◦미국 FDA, 생명공학으로 만들어진 FLAVRSAVRTM tomato 승인
◦최초로 유방암 유전자 발견
◦CF 환자의 폐에 단백질이 쌓이지 않게 하는 재조합 인간 DNase 승인
◦소 성장호르몬(POSILAC)이 상용화됨
⋙ 1995년
◦에이즈 환자에게 최초로 비비의 골수가 이식됨
◦최초로 바이러스 이외의 살아있는 유기체(Hemophilus Influenzae)의 완벽한 유전자 배열이 완성됨
◦암정복을 위해 면역시스템 모듈, 유전자 재조합 항체형성과 같은 유전자 치료가 도입됨
⋙ 1996년
◦파킨슨병과 관련된 유전자의 발견으로 퇴행성 신경질환의 잠재 가능한 치료와 그 원인 연구의 중요한 이정표를 제시함
⋙ 1997년
◦스코틀랜드에서 어른세포로 복제된 최초의 복제양 Dolly 탄생
◦해충방지 농작물인 Roundup ReadyTM 콩과 BollgardTM 해충방지 면화와 같은 작물이 상업화 됨
◦아르헨티나, 호주, 캐나다, 중국, 멕시코와 미국 등 전 세계적으로 500만 에이커 면적에서 유전자조작 작물이 재배됨
◦Oregon주 연구자들은 두 마리의 붉은 털 원숭이를 복제했다고 주장함
◦유전병 연구의 새로운 기술을 창조하기 위해 PCR, DNA 칩과 컴퓨터를 결합한 새로운 DNA기술 탄생
⋙ 1998년
◦하와이대학 연구진이 어른의 난소 적(cumulus)세포 핵으로부터 쥐를 복제함
◦인간 배아줄기세포주가 확립됨
◦일본 Kinki 대학 연구진은 한 마리 어른암소로부터 얻은 세포를 이용하여 8마리의 동일 송아지 복제함
◦최초로 C. elegans 벌레에 대한 동물 게놈 염기서열 해독 완료
◦3만 개 이상의 유전자 위치를 보여주는 인간 게놈지도의 초안 완성
◦동남아시아 다섯 나라가 병에 강한 파파야 나무를 개발하기 위해 컨소시엄을 구성
⋙ 1990년대
◦최초로 영국에서 유전자 지문법을 이용해 유죄를 판결함
◦규정 질량의 일반적 융기에 착상된 유전자 분리성공
◦유전성 대장암이 DNA 치료 유전자의 결핍으로 야기된다는 사실 발견
◦유전자 재조합 광견병 백신을 너구리에 실험
◦미국에서 농약을 기본으로 한 생명공학 제품판매 승인
◦특수이식 유전자를 가진 쥐에 관한 특허 허용
◦최초로 유럽에서 발암물질에 민감한 유전자변형 쥐에 관한 특허 제기
◦유방암 유전자 복제
⋙ 2000년
◦최초로 애기장대(학명 Arabidopsis thaliana)의 게놈지도 개발
◦13개 나라에서 총 1억 89만 에이커 면적에서 생물공학 농작물이 재배됨
◦최초로 바이러스에 강한 고구마가 케냐에서 실질 시험됨
◦인간게놈 배열의 초안 발표
⋙ 2001년
◦최초로 벼 게놈지도 완성
◦오스트리아 연구진들은 Barley Yellow Dwarf Virus와 같은 바이러스 예방백신에 사용되는 hairpin RNA를 이용한 기술개발을 보고함
◦Chinese National Hybrid 연구진들은 일반 쌀 생산량보다 두 배 많은 super rice종 개발을 보고함
◦유럽위원회(The European Commission)가 모든 유전자 변형 식품에 라벨을 붙일 것을 제기함
◦농업적으로 중요한 시노라이조비움 멜리로티(Sinorhizobium meliloti) 박테리아의 DNA배열 완성
◦염분이 있는 물과 땅에서 성장 가능한 최초의 농작물을 만들기 위해 애기장대로부터 추출된 유전자를 토마토에 이식함
◦농업에 중요한 식물병원균 Agrobacterium tumefaciens의 게놈서열이 공표됨
◦스트레스에 더 강한 농작물 개발의 실마리로서, 손상을 입거나 스트레스를 받았을 때 빛을 발하는 세일 크레스(thale cress)라 불리는 실험용 식물 재배
◦최초로 땅콩의 종합적 분자지도가 완성됨
⋙ 2002년
◦완성된 인간 게놈 배열을 과학전문지에 게재함
◦효모의 프로테옴(Proteome: 단백질 간 상호작용과 네트워크의 총합)의 기능지도(functional map)의 초안 완성, 효모의 게놈지도는 1996년에 발표되었음
◦줄기세포의 분화에 관여하는 조절인자 연구에 큰 발전이 있었으며, 이에 관여하는 200여개의 유전자가 밝혀짐
◦생명공학 농작물이 16개국, 1억 4,500만 에이커에서 재배되고 있으며 이는 2001년보다 12% 증가한 것임
◦자궁경부암에 대한 백신 개발에 성공하였으며 이는 특정 암에 대한 예방백신이 가능함을 처음으로 보여준 성과임
⋙ 2003년
◦인간게놈 완전 해독(2003.4.)
◦정신분열증과 우울증 등 정신병의 발병 위험을 증가시키는 특정유전자 변형을 확인한 연구결과 발표
◦美최초의 GM 애완동물로 광고된 붉은 빛 형광물고기 GloFish 상업화
◦세계적으로 생명공학작물 이용의 활성화 증대
◦영국은 최초로 상업적인 생명공학작물인 제초제 저항옥수수를 인정
◦미국 환경 보호국은 최초로 형질전환 해충저항성 옥수수를 승인함
◦2003년 banteng 들소가 최초로 복제되었으며, 노새, 말, 사슴도 복제되었음
◦1997년 포유동물의 최초 복제양 돌리는 폐병연구 후에 안락사 됨
◦일본 연구팀은 자연적으로 카페인을 제거하는 생명공학 커피를 개발함
◦RNA 형태는 유전자 형식을 지시, 변형시키며 줄기세포와 배(胚)의 성장에 영향을 미침을 밝힘
◦쥐의 배 세포줄기가 정자나 난자 세포로 성장할 수 있음을 확인
◦남성을 결정짓는 Y염색체가 동일한 유전자를 함유하고 있음을 발견
◦종양으로 하여금 암의 전이에 필요한 혈관을 생성하지 못하도록 하는 약물의 개발
⋙ 2004년
◦미국 식품의약국(FDA)은 아바스틴이라는 최초의 신세대 항암제를 승인함
◦FDA는 다양한 종류의 약물치료와 질병을 위해 첫 DNA칩 및 유전자칩 개발
◦RNA 방해 제품으로, 임상 시험에 들어가는 첫 번째 RNAi 제품 생산
◦국제연합 식량농업기구(FAO)의 생명공학 작물 승인
◦국립과학연구원 산하 의학연구소에서는 ʻ생명공학작물이 건강에 해를 끼치지 않는다.ʼ라고 밝힘.
◦FDA는 식품안전성 검토 후 생명공학 밀의 안전성 밝힘
◦몬산토사는 지방산을 감소 삭제한 low-linolenic 콩을 소개함
◦닭 게놈 DNA 완전 해독
◦최초로 애완 새끼고양이 복제
◦ʻ쓸모없는 DNA(junk DNA)ʼ 구명
◦인간의 유전자 DNA 중 단백질을 합성하는 DNA는 전체 게놈의 10%에 불과하며 아무런 기능이 없는 DNA에 대한 구명 이루어짐
◦지난 3월 영국의 과학자들, 지난 20년간 나비 58종의 개체 수가 71% 줄었으며, 조류는 54% 감소했다고 보고
◦新의약품 개발 활발
◦유엔(UN), 대학, 민간자선단체, 제약업체 등 공공단체와 민간기업이 손을 잡고 미개발국의 환자를 위해 의약품을 개발하는 새로운 움직임이 일어남.
◦미생물게놈 추출성공, 인간게놈프로젝트 주역인 미국 크레이크 벤터 박사는 3월 사이언스에 바닷물에서 미생물 게놈을 추출해 10억 5,000만 염기쌍을 한꺼번에 분석하는 데 성공했다고 밝힘
⋙ 2005년
◦게놈지도와 야외 관찰로 진화가 일어나는 복잡한 과정을 밝힘
◦유럽 호이겐스 탐사선이 토성의 달 타이탄에 착륙하고, NASA의 Deep Impact가 혜성에 충돌한 실험 등
◦분자 생물학자들이 봄에 꽃이 다양한 색깔을 내게 하는 원리를 발견
◦위성과 지상망원경으로 도시 크기의 죽은 별들인 중성자별 관찰
◦정신분열증, 난독증, 안면경련증과 같은 뇌 신경질환 연구
◦외계에서 온 암석과 지구의 암석을 비교 분석한 결과 지구 생성에 대해 새로운 이론 설립
◦volage-gated potassium channel의 분자 구조 밝힘
◦인간 활동에 의한 지구 온난화의 증거 추가 발견
◦분자 생물학자들이 복잡한 시스템의 행태를 이해하기 위해 엔지니어 기술 이용
◦120억 달러 규모의 국제 핵융합 실험로(International Thermonuclear Ex-perimenta Reactor) 위치가 18개월의 논란 끝에 프랑스 Cadarache로 결정
◦Z 나선형 DNA와 B 나선형 DNA의 결합구조 구명, 네이처지 게재
⋙ 2006년
◦네안데르탈인 DNA 염기서열 분석
◦급진전되는 지구 온난화 전망 제기
◦땅위를 걸어다닌 물고기 화석 발견
◦시력감퇴 치료제 개발
◦생물 다양성의 재발견
◦최첨단 현미경 기술 개발
◦기억메커니즘 구명 단초 발견
◦마이크로 RNA와 siRNA보다 약간 긴 새로운 RNA를 발견
◦미연방정부 연구비 천만 달러를 받아 일리노이 대학 연구팀이 진행하고 있는 돼지 게놈 해독은 2년 안에 완성될 것으로 기대
◦미 부시 대통령이 상하원 합동연설에서 농업 페기물로부터 바이오에탄올 생산 지원
◦미 NIH가 유방암 재발을 예측하기 위해 10년간, 1만 명의 환자에 대해 유전자 검사를 실시하는 연구를 개시
◦미국 당뇨병 협회(ADA)가 농업 및 식량분야 생명공학에 대한 지원을 재확인
◦다우사가 최초의 식물 생산 백신에 대한 허가를 취득
◦Renessen사가 생명공학 기술을 이용하여 유용성이 추가된 작물에 대해 최초로 동물 사료로 판매할 수 있는 허가를 취득
◦USDA가 밀의 게놈연구를 위해 18개 대학 밀번식 컨소시엄에 연구비 500만 달러 지원
◦오메가-3 지방산을 생산하는 형질전환 돼지 개발
◦세계무역기구는 EU가 21가지의 농업 생명공학제품에 대해 통상약정을 위반 했다고 발표
◦프랑스 농무부가 생명공학 옥수수 및 담배 작물에 대해 17가지의 새로운 실지 시험을 허가
◦마이크로RNA의 초기프로세싱 기전 구명
◦암 발생 억제기능 SUSP4 유전자의 분리 및 작용 메커니즘 구명
◦저분자화합물을 이용한 세포노화의 가역적 재프로그래밍
⋙ 2007년
◦AMPK 효소 항암기능 최초 구명. AMPK 활성화를 통해 대장암 세포가 정상으로 변화
◦체내 면역반응 조절 ʻ브레이크 장치ʼ 물질 발견
◦ʻ스페인감기ʼ 바이러스를 이용해 조류독감을 치료할 수 있는 길이 열림
◦화성에 물 존재 증거 발견
◦자연계에 존재하지 않는 D-아미노산을 손쉽게 합성할 수 있는 신기술 개발
◦수명이 다하거나 손상을 입은 세포에 죽음의 신호를 보내는 메커니즘 구명
◦암 발병을 억제하는 유전자의 기능 구명
⋙ 2008년
◦조류독감 인체 간 감염 유발 경로 찾았다(출처: Nature Biotechnology)
◦모유수유가 천식 등을 유발하는 항원에 대해 아이들을 어떻게 보호하는지에 대한 기전 구명(출처: Nature Medicine)
◦장내 세균과의 공생 기제 밝혀냈다(출처: Science)
◦인간배아줄기세포로 당뇨병 쥐 치료 성공(출처: Nature Biotechnology)
◦탈모유발 유전자 발견, 새 탈모약 개발기대(출처: Nature Genetics)
◦암 세포를 무제한 자라게 하는 ʻ효소단백질ʼ 확인(출처: Nature)
◦비만 원인 ʻ유전자 네트워크 이상ʼ(출처: Nature)
◦루게릭병 유발 ʻ유전자ʼ 찾았다(출처: Nature Genetics)
◦운동신경세포 분화과정 구명(출처: Developmental Cell)
◦알즈하이머치매 ʻ기억력ʼ 떨어뜨리는 핵심 단백질 구명(출처: Nature Genetics)
◦배꼽시계 등 생체회로 조절원리 구명(출처: Science)
◦예방법 없는 ʻ말라리아ʼ 백신 개발된다(출처: Nature Medicine)
◦물체 인식과정 구명, 실명치료 도움(출처: Nature)
◦항생제 ʻ페니실린ʼ 만드는 균 ʻ유전자서열ʼ 구명(출처: Nature Biotechnology)
◦유전자 제어 마이크로RNA 조절·사멸 메커니즘 구명(출처: Molecular Cell)
◦ʻ소리ʼ 잘 듣게 하는 귀 속 ʻ단백질ʼ 구명(출처: Nature)
◦인체 세포 죽이는 단백질 구명, 새로운 항암제 개발(출처: Nature)
◦日 연구팀 ʻ암세포ʼ 추적자 영상촬영물질 개발(출처: Nature Medicine)
⋙ 2009년
◦파킨슨병 등 신경퇴행성질환 유발 기전 구명(출처: Nature Medicine)
◦염색체 응축 ʻ단백질 복합체ʼ 분자구조 구명(출처: Cell)
◦마이크로 RNA 메커니즘 구명(출처: Cell)
◦ʻ고혈압ʼ 유발 유전자 변이 구명(출처: Nature Genetics)
◦단백질과 패혈증의 원인 물질인 세균의 내독소가 결합된 복합체의 분자구조를 세계 최초로 구명(출처: Nature)
◦당뇨 원인 인슐린 저항성 유발인자 발견(출처: Cell Metabolism)
◦장(腸) 세포의 세균 제거 기전 구명(출처: Developmental Cell)
◦소 유전자 지도 완성 ʻ축산혁명ʼ(출처: Science)
◦미칠 듯한 가려움증 ʻ긁어주면 좋아지는 이유ʼ 구명(출처: Nature Neurons)
◦다운증후군 ʻ암ʼ 잘 안 걸리는 이유 구명(출처: Nature)
◦자도 자도 졸린 ʻ기면증ʼ 면역계 기능 부전이 원인(출처: Nature Genetics)
◦체내 자연 발생 ʻ표백성분ʼ 상처회복 돕는다(출처: Nature)
◦사람 줄기세포로 뇌졸중 쥐 치료성공(출처: Gene Therapy)
◦한국 남성 ʻ유전자 서열ʼ 밝혔다(출처: Nature)
◦NMR로 생체막 단백질 구조 구명(출처: Science)
◦줄기세포 분화조절 단백질 발견(출처: Cell)
◦ʻ새벽잠 없는 이유 있다ʼ, 적게 자게 하는 유전자 발견(출처: Science)
⋙ 2010년
◦배아줄기세포 치매치료제 국내서 첫 임상 실시
◦혈관치료용 마이크로 로봇 개발(세계 최초로 살아있는 미니돼지의 혈관에 주입돼 이동하는 실험 성공)
◦0.3mm 핏줄까지 보이는 세계에서 가장 선명한 사람 뇌지도 7.0 Tesla MRI Brain Atlas 발간
◦나노 소재로 인공 광합성 성공
◦세계 최초 암 관련 신규 유전자 발굴
◦암 진행과 전이 매커니즘 구명
⋙ 2011년
◦인체면역결핍바이러스 예방 치료 네트워크(HPTN) 052
◦밝혀진 인간의 기원 : 현생 인류의 DNA 일부가 네안데르탈인 게놈과 연관되었다는 사실 발견
◦식물광합성 촉매 구조 구명 : 물 분해 촉매가 되는 막단백질 복합체의 구조 구명
◦말라리아 백신 : ʻRTS,Sʼ 말라리아 백신이 아프리카 영유아의 말라리아 감염률을 50% 이상 감소시킴
◦인간 장 속 미생물 : 인간의 장속 미생물이 혈액형과 같이 크게 3가지로 나뉨. 군집 종류에 따라 질병, 체질, 식습관이 달라짐
◦노화세포제거 : 실험쥐의 노화세포를 제거하자 백내장, 근육 손실 등의 현상이 사라지고 나이 들어도 운동능력 저하되지 않는다는 사실 발견
⋙ 2012년
◦한국 식약청서 동종(타가) 줄기세포 치료제 판매를 세계최초로 승인.
◦유럽의약청(EMA)이 서구 최초로 유전자치료제를 승인하고 희귀유전질환 지단백지질분해효소결핍증(LPLD) 치료제 글리베라(Glybera)를 판매를 허가
◦먹는 C형간염치료제, 미국 FDA 승인.
◦한국기업 셀트리온, 세계 최초의 항체 바이오시밀러인 ʻ램시마ʼ 출시
◦뇌신경세포 신호전달 원리 구명
◦체세포를 성체줄기세포로 직접교차분화를 유도하는데 성공
◦아시아인 당뇨-비만에 관계하는 새로운 유전변이 현상 및 요인 발견
◦자폐증에 관여하는 새로운 유전자 및 발병원인 발견
⋙ 2013년
◦인간 배아줄기세포 복제 성공. 태아의 피부세포를 핵을 제거한 난자에 융합시켜 인간 배아줄기세포를 만들고, 이후 심장세포로 자라게 하는 데 성공.
◦ʻDNA 백과사전ʼ 완성. 기능이 거의 없어 98%의 쓰레기 DNA(Junk DNA)의 기능이 거의 없고 정체가 불투명한 쓸모없는 유전자들로 ʻ쓰레기ʼ 가 인간 질병과 돌연변이에 관여한다는 사실 구명.
◦유도만능줄기세포(iPS) 임상 연구를 세계 최초로 승인. 삼출형가령황반변성(滲出型加齢黄斑変性)이라는 눈의 난치병의 환자로부터 만들어낸 iPS를 망막색소 상피세포로 변화시켜 손상된 부분에 이식하는 방식.
◦iPS 이용해 인간의 ʻ간ʼ 조직 배양 성공
◦대사공학 기술을 이용해 대장균으로 휘발유 및 벤젠의 인공합성에 성공
◦태아 중뇌에서 추출한 줄기세포로 만든 ʻ도파민 신경전구세포ʼ를 파킨슨병 환자의 뇌 피각부에 이식하는데 성공.
◦mRNA의 비정상적인 기능 인식과 제거에 관한 메커니즘 구명.
◦포유류 신경 재생 메커니즘 구명. 포유류의 말초신경 재생 메커니즘 구명. 중추신경에 적용할 경우 하반신 및 전신 마비환자 치료가능성 열려.
⋙ 2014년
◦N-말단 메티오닌, 세포내 단백질 분해 신호의 발견(Cell, 2014.1.16.)
◦고추 유전체서열 국내 독자 기술로 완성(Nature Genetics, 2014.1.19.)
◦혈액암의 한 유형인 악성림프종 돌연변이 유전자 구명(Nature Genetics, 2014.3.3.)
◦비만 조절하는 핵심 수용체 발견(Cell Metabolism, 2014.3.4.)
◦철 대사를 조절하여 병원성 세균의 증식을 억제하는 항균제제 후보물질 발견(Nature Medicine, 2014.3.23.)
◦성인체세포 이용한 줄기세포주 세계 최초 확립(Cell Stem Cell, 2014.4.18.)
◦빛으로 세포 내 단백질을 원격 조정한다(Nature Methods, 2014.5.4.)
◦C형간염바이러스의 면역회피 메커니즘 구명(Gastroenterology, 2014.5.19.)
◦면역억제제 부작용 유발하는 유전자 발견(Nature Genetics, 2014.8.11.)
◦초기 배아 단계의 마이크로RNA 조절 현상 구명(Molecular Cell, 2014.11.13.)
⋙ 2015년
◦표적유전자만 제거, ‘크리스퍼 유전자 가위’ 정확성 입증(Nature Methods, 2015.2.10.)
◦혈압 조절에 중요한 단백질 세포 속 분해과정(Science, 2015.3.13.)
◦한의학 처방 원리(군신좌사) 구명(Nature Biotechnology, 2015.3.6.)
◦피로물질 젖산, 세포신호물질로 새로운 기전 발견(Cell, 2015.4.16.)
◦유해 단백질의 분해 작용원리와 최종 변화과정 구명(Nature Cell Biology, 2015.6.15.)
◦암줄기세포 에너지 대사 구명(Gastroenterology, 2015.6.16.)
◦급성 골수성 백혈병의 새로운 신호 전달 경로 구명(Cell Stem Cell, 2015.7.23.)
◦항암 효과 뛰어난 GITR 항체의 작용기전 밝혀(Nature Medicine, 2015.8.17.)
◦뇌종양 재발위치에 따른 유전체 변이 패턴 세계최초 구명(Cancer Cell, 2015.9.14.)
◦빛으로 칼슘 농도 조절하고 기억력 높여(Nature Biotechnology, 2015.9.15.)
⋙ 2016년
◦microRNA(이하 miRNA) 생성에 결정적 역할을 하는 드로셔(DROSHA) 단백질의 3차원 구조를 세계 최초 구명(Cell, 2015.12.31.)
◦음식물에 든 항원(음식 유래 항원)들이 소장 내 면역 반응 억제에 큰 역할을 담당한다는 사실 구명(Science, 2016.1.29.)
◦가장 젊고 분화능력이 뛰어난 최상위 혈액-줄기세포의 선별 방법을 개발(Cell Stem Cell, 2016.3.18.)
◦세계 최대 규모의 유방암 환자 전장유전체(全長遺傳體, 전체 유전자 염기서열)를 분석(Nature, 2016.5.3.)
◦생존에 필수적인 오토파지(자가포식)작용을 조절하는 새로운 신호를 발견하여 오토파지의 작동 기전을 세계 최초 구명(Nature, 2016.6.15.)
◦뇌신경망을 형성・유지하는 새로운 기전을 세계 최초 발견(Cell, 2016.6.16.)
◦생체조직과 무기물의 결합으로 전기 없이 움직일 수 있는 바이오 하이브리드 로봇을 세계 최초 개발(Science, 2016.7.8.)
◦당뇨병 발병에 직접적으로 영향을 주는 혈당, 체내 대사조절관련 16개 신규 유전요인(부모로부터 물려받은 유전정보 중 질병 발생과 관련된 요인)을 발굴(Natrue, 2016년 7월호)
◦암과 치매 등 각종 질병을 유발시키는 것으로 알려진 단백질의 비정상적인 변형을 구현할 수 있는 맞춤형 단백질 변형기술을 세계 최초 개발(Science, 2016.9.29.)
◦우리 몸에서 병을 일으키는 감염원을 제거하는 초기 방어 시스템을 세계 최초 구명(Nature Microbiology, 2016.10.17.)
⋙ 2017년
◦조울증 일으키는 핵심 단백질의 작용 메커니즘 구명(Molecular Psychiatry, 2017.1.31.)
◦무독성 살모넬라균에 의한 암 치료 강화기술 개발(Science Translational Medicine, 2017.2.9.)
◦뇌종양 유전체의 시공간적 구조 분석을 통해 최적의 표적치료 전략 제시(Nature Genetics, 2017.4.1.)
◦홍합의 접착 단백질과 인체 조직에서 추출한 자연치유 성분을 결합하여, 상처 치료 기능과 흉터 방지 기능을 함께 갖춘 혁신적인 의료용 접착제를 개발(Biomaterials, 2017.4.26.)
◦문어 빨판의 독특한 돌기 원리를 밝히고, 이를 모사하여 습한 환경에서도 접착제 없이 탈부착할 수 있는 고점착 패치 소재를 세계 최초로 개발(Nature, 2017.6.15.)
◦빅데이터 분석을 통해 종양 주변의 면역세포가 종양의 진화 및 항암 치료에 미치는 영향을 구명(Cancer Cell, 2017.7.10.)
◦나노 일렉트로닉스라는 개념의 전자기화 된 금 나노입자를 활용한 신개념 ‘세포 직접교차분화 리프로그래밍’ 기술을 세계 최초 개발(Nature Nanotechnology, 2017.7.18.)
◦간경화 환자의 몸에서 간암이 유발되는 신규 신호경로 규명(Gastroenterology, 2017.7.20.)
◦인간배아에서 비후성 심근증의 원인이 되는 돌연변이 유전자를 크리스퍼 유전자 가위(CRISPR Cas9)로 교정하는데 성공(Nature, 2017.8.3.)
◦IT-BT 융합연구를 통한 간암 치료효과 제고 방법 발견(Hepatology, 2017.8.23.)
⋙ 2018년
액체방울 자유롭게 조종하는 나노 계면활성제 발명(Nature, 2018.1.11.)
간암치료를 목적으로 비수술적 치료법인 동맥화학색전술에 사용되는 미세구체의 개발(해외 PCT 특허 3건에 대해 6개국 등록 완료 2018.2.16.)
자연에 풍부한 탄화수소로 신약 원료 감마/락탐 합성 성공(Science, 2018.3.2.)
뇌에서 기억이 저장되는 장소 규명(Science, 2018.4.27.)
고지혈에 의한 루푸스 발병기전 규명(Nature Immunology, 2018.4.30.)
눈에서 47종의 시각 채널을 찾다(Cell, 2018.5.17.)
스스로 광합성하는 인공세포 제작(Nature Biotechnology, 2018.5.28.)
급성심장질환에 동반된 외상후증후군 치료를 통하여 심장질환 재발률을 획기적으로 감소(Journal of the American Medical Association, 2018.7.25.)
종양 스페로이드를 활용한 암 표적치료 혁신의 길 열려(Nature Genetics, 2018.9.27.)
병에 강한 식물에는 '보디가드 미생물'이 있다(Nature Biotechnology, 2018.10.8.)
YH25448(Lazertinib)의 글로벌제약사 기술수출(얀센 바이오텍, 2018.11.1.)
⋙ 2019년
40대 전후에 발생하는 조기발병위암 원인 규명(Cancer Cell, 2019.1.15.)
항생제 젠타마이신 B의 생합성 과정 규명(Nature chemical Biology, 2019.1.15.)
퇴행성관절염의 원인은 콜레스테롤(Nature, 2019.2.7.)
암세포의 림프절 전이, 지방산이 핵심 연료(Science, 2019.2.8.)
내 머리 속 공포기억, 시각자극으로 사라진다(Nature, 2019.2.14.)
간암세포 굶겨 죽이는 방법 제시(Cell Metabolism, 2019.4.5.)
의약품 수용체의 신호전달 과정 규명(Cell, 2019.5.10.)
서울대, 알츠하이머병 예방 및 치료 가능성 열어(Cell Metabolism, 2019.6.28.)
심장질환 발병원인 규명 및 새로운 치료 표적 제시(Nature, 2019.7.18.)
류마티스 관절염 발생과정의 수수께끼 풀어(Nature Immunology, 2019.8.13.)
생쥐모델을 활용한 알코올성 지방간 치료 표적 제시(Cell Metabolism, 2019.8.30.)
면역억제세포 리프로그래밍 약물전달체 개발(Advanced Materials, 2019.9.6.)
부록 2
![]()
생명공학 주요통계
1. 예산투자

주1) 2007∼2012년의 투자실적에는 출연기관의 투자실적(932억 원, 1,046억 원, 913억 원, 1,218억 원, 1,542억 원, 1,676억 원)이 포함됨
주2) 1994∼2018년 기간 동안의 정부투자는 총 28조 7,998억 원
주3) 2019년도 수치는 실적치가 아닌 2019년도 생명공학육성시행계획상의 계획치임
출처: 연도별 생명공학육성시행계획 자료가공
[그림 부록 1] 정부부문 생명공학 투자 실적(1994∼2019)
[표 부록 1] 국내 부처별 BT 투자실적 및 계획(2018∼2019)(단위: 백만 원, %)
|
구 분 |
2019 투자계획 |
2018 실적 (B) |
증감율 (%) ((A-B)/B) |
|||
|
연구 개발 |
인프라 |
인력 양성 |
합계 (A) |
|||
|
과학기술 정보통신부 |
1,113,423.5 |
44,110 |
0 |
1,157,534 (39.49%) |
1,075,354 |
7.64 |
|
교육부 |
266,836 |
0 |
272,710 |
539,546 (18.41%) |
505,694 |
6.69 |
|
농림축산 식품부 |
305,634 |
0 |
0 |
305,634 (10.43%) |
326,184 |
Δ6.30 |
|
산업통상 자원부 |
180,549 |
71,633 |
1,637 |
253,819 (8.66%) |
268,596 |
Δ5.50 |
|
보건복지부 |
410,824 |
39,176 |
7,192 |
457,192 (15.60%) |
447,195 |
2.24 |
|
환경부 |
67,326 |
1,200 |
0 |
68,526 (2.34%) |
54,798 |
25.05 |
|
해양수산부 |
88,395 |
23,456 |
0 |
111,851 (3.82%) |
133,004 |
Δ15.90 |
|
식품의약품 안전처 |
36,280 |
546 |
265 |
37,091 (1.27%) |
37,543 |
Δ1.20 |
|
총 계 |
2,469,267.5 (84.24%) |
180,121 (6.14%) |
281,804 (9.61%) |
2,931,193 (100%) |
2,848,368 |
2.91% |
출처: 2019년도 생명공학육성시행계획, 2019.2.
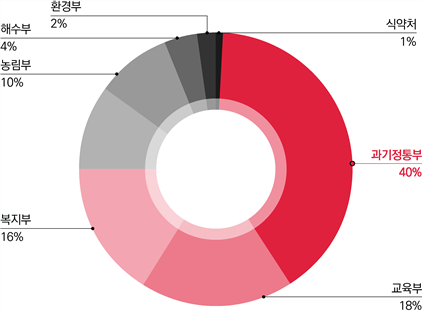
출처: 2019년도 생명공학육성시행계획, 2019.2.
[그림 부록 2] 부처별 생명공학분야 연구개발비 투자계획 비중(2019)
[표 부록 2] 부처별 BT분야 연구개발 투자 비교(2018∼2019)(단위: 백만 원)
|
구 분 |
2018 실적 |
2019 계획 |
증감률(%) |
|
과학기술정보통신부 |
820,064.7 |
913,241.4 |
11.36 |
|
교육부 |
232,797 |
266,836 |
14.62 |
|
농림축산식품부 |
81,453 |
76,417.6 |
Δ6.18 |
|
산업통상자원부 |
3,423.25 |
3,235.75 |
Δ5.48 |
|
보건복지부 |
51,803.2 |
54,823.8 |
5.83 |
|
환경부 |
15,264.9 |
16,699.1 |
9.40 |
|
해양수산부 |
35,185.6 |
30,914.9 |
Δ12.14 |
|
식품의약품안전처 |
780 |
361.8 |
Δ53.62 |
|
합계 |
1,240,771.65 |
1,362,530.35 |
9.81 |
출처: 2019년도 생명공학육성시행계획, 2019.2.
[표 부록 3] 5대 분야별 연구개발 투자 비교(2018∼2019)(단위: 백만 원)
|
구 분 |
2018 실적 |
2019 계획 |
증감률(%) |
|
생명과학 |
1,240,771.65 |
1,362,530.35 |
9.81 |
|
RED 분야 |
579,568.39 |
539,153.27 |
Δ6.97 |
|
Green 분야 |
304,176.78 |
281,402.16 |
Δ7.49 |
|
White 분야 |
109,280.15 |
109,568.15 |
0.26 |
|
융합신산업 분야 |
179,554.10 |
176,613.52 |
Δ1.64 |
|
합계 |
2,413,351.07 |
2,469,267.45 |
2.32 |
출처: 2019년도 생명공학육성시행계획, 2019.2.
[표 부록 4] 정부 및 민간 BT 연구개발 투자(2013∼2017)(단위: 억 원)
|
구 분 |
2013 |
2014 |
2015 |
2016 |
2017 |
|
정부 |
28,770 |
29,730 |
33,019 |
33,341 |
34,946 |
|
민간 |
16,273 |
18,367 |
26,927 |
22,796 |
27,165 |
|
합계 |
45,043 |
48,097 |
59,946 |
56,137 |
62,111 |
주1) 정부 BT 연구개발비는 NTIS 과학기술통계서비스 참고
주2) 합계액은 ‘연구개발활동조사보고서’를 참고(민간 BT 연구개발비 = 합계액–정부 BT 연구개발비)
출처: 한국과학기술기획평가원, 연도별 연구개발활동조사보고서, NTIS 과학기술통계서비스, 생명공학정책연구센터 재가공

출처: 한국과학기술기획평가원, 연도별 연구개발활동조사보고서, NTIS 과학기술통계서비스, 생명공학정책연구센터 재가공
[그림 부록 3] 정부 및 민간 BT 연구개발 투자(2013∼2017)
2. 시설 및 기반구축(인프라)

출처: 2019년도 생명공학육성시행계획, 2019.2.
[그림 부록 4] 부처별 시설 및 기반구축(인프라) 투자계획 비중(2019)
[표 부록 5] 부처별 시설 및 기반구축(인프라) 투자실적 및 계획(단위: 백만 원)
|
구 분 |
과기정통부 |
산업부 |
복지부 |
환경부 |
해수부 |
식약처 |
합계 |
|
2018 실적 |
45,519 |
60,348 |
28,615 |
1,200 |
23,104 |
578 |
159,364 |
|
2019 계획 |
44,110 |
71,633 |
39,176 |
1,200 |
23,456 |
546 |
180,121 |
|
증감률(%) |
Δ3.1 |
18.7 |
36.91 |
0 |
1.52 |
5.86 |
13.02 |
출처: 2019년도 생명공학육성시행계획, 2019.2.
3. 인력 양성
[표 부록 6] 생명공학분야 인력양성 실적(2014∼2018)(단위: 명, 건)
|
구 분 |
2014 |
2015 |
2016 |
2017 |
2018 |
|
|
우수 인력 배출 |
석사 |
2,581 |
2,263 |
4,374 |
6,958 |
5,611 |
|
박사 |
1,270 |
1,233 |
2,048 |
2,516 |
2,094 |
|
|
국제 교류 인력 |
해외연구자 유치 |
384 |
286 |
319 |
507 |
274 |
|
국내연구자 파견 |
250 |
663 |
230 |
209 |
316 |
|
|
참여연구 인력 |
68,954 |
95,763 |
104,088 |
89,964 |
104,896 |
|
|
국제 학술대회 개최(건) |
1,058 |
1,126 |
906 |
812 |
1,040 |
|
출처: 연도별 생명공학육성시행계획 자료가공

출처: 2019년도 생명공학육성시행계획, 2019.2.
[그림 부록 5] 부처별 인력양성 투자계획(2019)
[표 부록 7] 부처별 인력양성 투자실적 및 계획(단위: 백만 원)
|
구분 |
교육부 |
산업부 |
복지부 |
식약처 |
합계 |
|
2018 실적 |
272,897 |
1,460 |
1,000 |
296 |
275,653 |
|
2019 계획 |
272,710 |
1,637 |
7,192 |
265 |
281,804 |
|
증감률(%) |
Δ0.07 |
12.12 |
619.2 |
Δ10.47 |
2.23 |
출처: 2019년도 생명공학육성시행계획, 2019.2.

주) 생명공학분야 : 교육통계에 제시된 소계열 분류 중 12개 소계열이 해당(농업학, 동물・수의학, 보건학, 산림・원예학, 생명과학, 생물학, 약학, 의료공학, 의학, 재활학, 치의학, 한의학)
출처: 교육통계서비스(http://cesi.kedi.re.kr/index) 자료, 생명공학정책 연구센터 재가공
[그림 부록 6] 국내 생명공학분야 졸업자 현황(2014∼2018)
[표 부록 8] 국내 생명공학분야 졸업자의 학위별 성별 현황(2014∼2018)(단위: 명)
|
구분 |
2014 |
2015 |
2016 |
2017 |
2018 |
|
|
석사 |
남자 |
4,665 |
4,593 |
4,629 |
4,858 |
4,602 |
|
여자 |
5,168 |
5,190 |
5,271 |
5,430 |
5,328 |
|
|
소계 |
9,833 |
9,783 |
9,900 |
10,288 |
9,930 |
|
|
박사 |
남자 |
1,905 |
1,749 |
1,900 |
1,943 |
1,898 |
|
여자 |
1,282 |
1,204 |
1,316 |
1,384 |
1,301 |
|
|
소계 |
3,187 |
2,953 |
3,216 |
3,327 |
3,199 |
|
|
총계 |
13,020 |
12,736 |
13,116 |
13,615 |
13,129 |
|
출처: 교육통계서비스(http://cesi.kedi.re.kr/index) 자료, 생명공학정책 연구센터 재가공
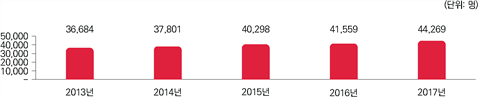
출처: 산업통상자원부, 한국바이오협회, 2017년 국내 바이오산업 실태조사 결과 보고서, 2018.12.
[그림 부록 7] 국내 바이오산업 종사자 현황(2013∼2017)
[표 부록 9] 국내 바이오산업 업무별 종사자 인력 분포(2017)(단위: 명, %)
|
구분 |
소계(명) |
비율(%) |
|
연구직 |
13,613 |
30.75 |
|
생산직 |
15,777 |
35.64 |
|
영업/관리직 |
14,879 |
33.61 |
|
전체 |
44,269 |
100 |
출처: 산업통상자원부, 한국바이오협회, 2017년 국내 바이오산업 실태조사 결과 보고서, 2018.12.
[표 부록 10] 국내 바이오산업 학위별 종사자 인력 분포(2017)(단위: 명, %)
|
구분 |
소계(명) |
비율(%) |
|
박사 |
2,559 |
5.78 |
|
석사 |
8,640 |
19.52 |
|
학사 |
19,437 |
43.91 |
|
기타 |
13,633 |
30.80 |
|
전체 |
44,269 |
100.00 |
출처: 산업통상자원부, 한국바이오협회, 2017년 국내 바이오산업 실태조사 결과 보고서, 2018.12.
[표 부록 11] 국내 바이오 중소・벤처기업의 총 근로자 및 평균 근로자 수(2016∼2017)(단위: 명)
|
구분 |
총 근로자 수 |
기업당 평균 근로자 수 |
|
2017 |
48,041 |
28.5 |
|
2016 |
44,678 |
29.5 |
출처: 생명공학정책연구센터, 2017년 국내 바이오 중소・벤처기업 현황 통계, 2018.12.; 2016년 국내 바이오 중소・벤처기업 현황 통계, 2017.11.
[표 부록 12] 국내 바이오 중소・벤처기업의 분야별 평균 근로자 수(2016∼2017)(단위: 명)
|
대분류 |
중분류 |
2016 |
2017 |
|
레드 |
의약품 |
40.7 |
40.0 |
|
진단의료기기 |
30.2 |
34.5 |
|
|
그린 |
농업 |
15.2 |
14.1 |
|
식품 |
27.4 |
26.5 |
|
|
화이트 |
화학 |
25.1 |
25.7 |
|
환경 |
23.3 |
20.6 |
|
|
에너지 |
27.8 |
28.5 |
|
|
플랫폼 |
지원서비스 |
31.3 |
28.8 |
|
기타 |
32.4 |
30.8 |
출처: 생명공학정책연구센터, 2017년 국내 바이오 중소・벤처기업 현황 통계, 2018.12.; 2016년 국내 바이오 중소・벤처기업 현황 통계, 2017.11.
[표 부록 13] 국내 바이오 벤처기업의 총 근로자 및 평균 근로자 수(2016∼2017)(단위: 명)
|
구분 |
총 근로자 수 |
기업당 평균 근로자 수 |
|
2017 |
31,347 |
30.3 |
|
2016 |
29,117 |
29.9 |
출처: 생명공학정책연구센터, 2017년 국내 바이오 중소・벤처기업 현황 통계, 2018.12.; 2016년 국내 바이오 중소・벤처기업 현황 통계, 2017.11.
[표 부록 14] 국내 바이오 벤처기업의 분야별 평균 근로자 수(2016∼2017)(단위: 명)
|
대분류 |
중분류 |
2016 |
2017 |
|
레드 |
의약품 |
40.0 |
41.5 |
|
진단의료기기 |
32.3 |
40.3 |
|
|
그린 |
농업 |
14.1 |
13.3 |
|
식품 |
26.4 |
26.0 |
|
|
화이트 |
화학 |
26.3 |
28.0 |
|
환경 |
26.7 |
23.1 |
|
|
에너지 |
23.4 |
21.3 |
|
|
플랫폼 |
지원서비스 |
32.8 |
30.4 |
|
기타 |
28.5 |
29.0 |
출처: 생명공학정책연구센터, 2017년 국내 바이오 중소・벤처기업 현황 통계, 2018.12,; 2016년 국내 바이오 중소・벤처기업 현황 통계, 2017.11.
4. 산업
광의의 개념(의약품, 의료기기 포함)*으로 바이오시장을 추산할 경우에, 2017년 글로벌 바이오시장 규모는 1,737조 원으로 추정
* 글로벌 ‘의약품’, ‘의료기기’ 시장과 글로벌 바이오시장 중 그린바이오(Food&Agriculture) 및 화이트바이오(Environment&Industrial processing) 시장을 합산
|
구분 |
시장규모 |
비고 |
출처 |
|
|
글로벌 바이오시장 |
407조 원 (3,802억 달러) |
2017 환율 적용 환산 Medical/Healthcare, Food & Agriculture, Environment & Industrial processing, Service provider, Technology Service 시장으로 구성 |
MarketLine |
|
|
글로벌 보건 산업 |
의약품 |
1,258조 원 (1조 1,750억 달러) |
2017 환율 적용 환산 |
BMI Espicom |
|
의료 기기 |
381조 원 (3,560억 달러) |
2017 환율 적용 환산 |
BMI Espicom |
|
|
의료 서비스 |
1,893조 원 (1조 7,686억 달러) |
2017 환율 적용 환산 Medical Imaging Equipment,In-vitro Diagnostics, Healthcare IT, Medical Technologies, Pharma and Biotech 시장으로 구성 국내 의료서비스 시장 규모와는 다른 기준 |
Frost&Sullivan |
|
출처: MarketLine, Global Biotechnology, 2018.6. 한국보건산업진흥원, 보건산업통계(https://www.khiss.go.kr/) > 통계지표(원출처: BMI Espicom) Frost & Sullivan, Global Healthcare Industry Outlook 2018, 2018.1.
광의의 개념(의약품, 의료기기 포함)으로 바이오시장을 추산할 경우에, 2017년 국내 바이오시장 규모는 32조 원으로 추정(글로벌 시장의 1.8% 규모)
* 보건산업진흥원의 ‘의약품’, ‘의료기기’ 생산 규모와 바이오산업실태조사 보고서의 ‘바이오산업 분야별 생산 현황’ 중 ‘바이오의약’, ‘바이오의료기기’ 산업을 제외한 생산규모 합산
|
구분 |
시장규모 |
비고 |
출처 |
|
|
국내 바이오시장 |
10조 원 |
바이오산업분야 유효표본 984개 기업, 2017년 국내 바이오산업 생산 규모 바이오의약, 바이오화학・에너지, 바이오식품, 바이오환경, 바이오 의료기기, 바이오장비 및 기기, 바이오자원, 바이오서비스산업으로 구성 |
바이오산업 실태조사 보고서 |
|
|
국내 보건산업 |
의약품 |
22조 원 |
시장규모=생산-수출+수입 |
보건산업 통계 |
|
의료기기 |
6조 원 |
시장규모=생산-수출+수입 |
||
|
의료서비스 |
80조 원 |
OECD Health Data 자료 |
||
출처: 산업통상자원부, 한국바이오협회, 2017년 기준 국내 바이오산업 실태조사 결과 보고서, 2018.12. 한국보건산업진흥원, 보건산업통계(https://www.khiss.go.kr/) > 통계지표

주) 생존기업 대상
출처: 생명공학정책연구센터, 2017년 국내 바이오 중소・벤처기업 현황 통계, 2018.12.
[그림 부록 8] 바이오 중소・벤처기업의 분야별 분포
[표 부록 17] 바이오 중소・벤처기업의 분야별 분포(단위: 개)
|
대분류 |
레드 |
그린 |
||||
|
중분류 |
의약품 |
진단의료기기 |
농업 |
식품 |
||
|
개수 |
362 |
163 |
175 |
447 |
||
|
합계 |
525 |
622 |
||||
|
대분류 |
화이트 |
플랫폼 |
||||
|
중분류 |
화학 |
환경 |
에너지 |
지원서비스 |
기타 |
|
|
개수 |
247 |
81 |
13 |
216 |
126 |
|
|
합계 |
341 |
342 |
||||
주) 생존기업 대상
출처: 생명공학정책연구센터, 2017년 국내 바이오 중소・벤처기업 현황 통계, 2018.12.

주) 벤처인증 경험이 있는 기업 대상
출처: 생명공학정책연구센터, 2017년 국내 바이오 중소・벤처기업 현황 통계, 2018.12.
[그림 부록 9] 바이오 벤처기업의 분야별 분포
[표 부록 18] 바이오 벤처기업의 분야별 분포(단위: 개)
|
대분류 |
레드 |
그린 |
||||
|
중분류 |
의약품 |
진단의료기기 |
농업 |
식품 |
||
|
개수 |
221 |
108 |
94 |
217 |
||
|
합계 |
329 |
311 |
||||
|
대분류 |
화이트 |
플랫폼 |
||||
|
중분류 |
화학 |
환경 |
에너지 |
지원서비스 |
기타 |
|
|
개수 |
150 |
46 |
7 |
142 |
82 |
|
|
합계 |
203 |
224 |
||||
주) 벤처인증 경험이 있는 기업 대상
출처: 생명공학정책연구센터, 2017년 국내 바이오 중소・벤처기업 현황 통계, 2018.12.
부록 3
생명공학 관련법령
1. 관련 법률
|
소관부처 |
법률(34개) |
QR코드 |
|
과기 정통부 |
생명공학육성법(1983) |
|
|
뇌연구촉진법(1998) |
|
|
|
생명연구자원의 확보・관리 및 활용에 관한 법률(2009) |
|
|
|
농식품부 |
가축전염병 예방법(1961) |
|
|
동물보호법(1991) |
|
|
|
종자산업법(1995) |
|
|
|
농식품부 |
친환경농어업 육성 및 유기식품 등의 관리・지원에 관한 법률(1997)(농식품부/해수부) |
|
|
산림자원의 조성 및 관리에 관한 법률(2005)(산림청) |
|
|
|
농업생명자원의 보존・관리 및 이용에 관한 법률(16543)(2007) |
|
|
|
식품산업진흥법(2007)(농식품부/해수부) |
|
|
|
농림식품과학기술 육성법(2009) |
|
|
|
산업부 |
신에너지 및 재생에너지 개발・이용・보급 촉진법(1987) |
|
|
산업기술혁신 촉진법(1994) |
|
|
|
화학무기・생물무기의 금지와 특정화학물질・생물작용제 등의 제조・수출입 규제 등에 관한 법률(1996) |
|
|
|
유전자변형생물체의 국가간 이동 등에 관한 법률(2001) |
|
|
|
복지부 |
감염병의 예방 및 관리에 관한 법률(1954) |
|
|
보건의료기술 진흥법(1995) |
|
|
|
천연물신약 연구개발 촉진법(2000) |
|
|
|
복지부 |
한의약 육성법(2003) |
|
|
암관리법(2003) |
|
|
|
생명윤리 및 안전에 관한 법률(2004) |
|
|
|
저출산・고령사회기본법(2005 |
|
|
|
첨단의료복합단지 지정 및 지원에 관한 특별법(2008) (복지부/과기정통부/산업부) |
|
|
|
제약산업 육성 및 지원에 관한 특별법(2011) |
|
|
|
환경부 |
환경기술 및 환경산업 지원법(1994) |
|
|
생물다양성 보전 및 이용에 관한 법률(2012) |
|
|
|
해수부 |
해양수산발전 기본법(2002) |
|
|
해양생태계의 보전 및 관리에 관한 법률(2006) |
|
|
|
수산종자산업육성법(2015) |
|
|
|
해양수산생명자원의 확보・관리 및 이용 등에 관한 법률(2017) |
|
|
|
식약처 |
약사법(1954) |
|
|
의료기기법(2003) |
|
|
|
실험동물에 관한 법률(2008) |
|
|
|
식품・의약품 등의 안전기술 진흥법(2015) |
|
주) 부처별 제정 연도순
출처: 과학기술정보통신부(편), 제3차 생명공학육성기본계획, 2017
2. 관련 계획
|
소관부처 |
계획(29개) |
비고 |
|
과기정통부 |
생명연구자원 관리 기본계획 |
|
|
제2차 뇌연구 촉진 2단계 기본계획 |
|
|
|
줄기세포연구 종합 추진계획 |
|
|
|
농식품부 |
제2차 농림식품과학기술 육성 종합계획 |
|
|
곤충산업육성 5개년 계획 |
|
|
|
국가 식품클러스터 종합계획 |
|
|
|
기능성양장산업 육성계획 |
|
|
|
농림축산검역검사 기술개발 |
|
|
|
농업기계화 기본계획 |
|
|
|
농식품부 |
식품산업진흥 기본계획 |
|
|
종자산업 육성 5개년 계획 |
|
|
|
친환경농업 육성 5개년 계획 |
|
|
|
농식품부 |
제3차 농업생명공학 육성 중장기 기본계획 |
|
|
제6차 농업과학기술 중장기연구 개발계획 |
|
|
|
산업부 |
제6차 산업기술 혁신계획 |
|
|
제4차 신・재생에너지 기본계획 |
|
|
소관부처 |
계획(29개) |
비고 |
|
복지부 |
감염병 예방 및 관리에 관한 기본계획 |
|
|
제2차 국가 감염병 위기대응 기술개발 추진전략 |
|
|
|
제1차 보건의료 기술육성 기본계획 |
|
|
|
보건산업 종합 발전전략 |
|
|
|
제3차 국가 암 관리 종합계획 |
|
|
|
제3차 한의약 육성 발전 종합계획 |
|
|
|
제3차 천연물신약 연구개발 촉진계획 |
|
|
|
환경부 |
제3차 환경기술 및 환경산업 육성계획 |
|
|
환경보건 종합계획 |
|
|
|
해수부 |
해양수산 R&D 중장기계획 |
|
|
해양생명공학 육성 기본계획 |
|
|
|
해양과학기술(MT) 개발계획 |
|
|
|
식약처 |
제1차 식품・의약품 등의 안전기술 진흥 기본계획 |
|
출처: 과학기술정보통신부(편), 제3차 생명공학육성기본계획, 2017

출처: 2018년도 과학기술분야 중장기계획조사분석, KISTEP, 2018.12.
● 집필진
|
특집 |
|
|
특집 1 바이오 빅데이터 정책 |
질병관리본부 국립보건연구원/박현영 |
|
특집 2 바이오 빅데이터 산업의 규제 현황과 과제 |
충북대학교/이재목 |
|
특집 3 바이오 빅데이터 기술 및 수요현장 |
울산과학기술원/이세민 |
|
제1장: 생명공학의 변화와 도전 |
|
|
제1절: 생명공학의 변곡점: 글로벌 트렌드 |
|
|
1. 미국 |
한국생명공학연구원/김정석 |
|
2. EU |
영국캠프리지 의과대학 밀너연구소/한남식 |
|
3. 중국 |
한국생명공학연구원/곽상수 |
|
4. 일본 |
前 한국과학기술정보연구원/이상필 |
|
제2절: 생명공학의 도전과 노력 |
|
|
1. 우리나라 바이오 육성을 위한 노력 |
생명공학정책연구센터 |
|
2. 우리나라 바이오의 혁신 성장과 향후 과제 |
KB인베스트먼트/신정섭 |
|
제2장: 국가 생명공학 육성 정책 |
|
|
제1절: 생명공학 육성 정책 |
|
|
1. 생명공학 연구개발 지원 |
과기정통부/생명기술과 |
|
2. 생명공학 산업 육성 |
산업부/바이오융합산업과 |
|
3. 생명공학 기초과학진흥 |
과기정통부/기초연구진흥과 |
|
4. 생명공학 인력양성 |
교육부/학술진흥과 |
|
5. 농림축산식품분야 생명공학 육성 |
농식품부/종자생명산업과 |
|
6. 보건의료 연구개발 지원 |
복지부/보건의료기술개발과 |
|
7. 환경분야 생명공학 육성 |
환경부/한국환경산업기술원/전창화 |
|
8. 해양수산분야 생명공학 육성 |
해수부/해양수산과기진흥원/김정애 |
● 집필진
|
9. 생명자원 분야의 육성 및 관리 |
과기정통부/KOBIC/진태은 농식품부/종자생명산업과 복지부/질병관리본부 산업부/바이오융합산업과 환경부/국립생물자원관/김태호 해수부/해양수산과기진흥원/김정애 |
|
10-1. 국제협력 R&D 및 국가간 협력 |
한국연구재단/최원근 |
|
10-2. OECD BNCT 등 활동 현황 |
과기정통부/다자협력과 |
|
제2절: 생명공학 경쟁력 지표 현황 |
|
|
1. 투자현황 |
한국과학기술기획평가원/김은정 |
|
2. 인력현황 |
생명공학정책연구센터, 한국바이오협회/손지호 |
|
3. 특허현황 |
특허정보진흥센터/김봉진 |
|
4. 논문현황(질적지표) |
한국연구재단/조석민 |
|
5. 산업현황 |
한국바이오협회/오기환 |
|
제3장: 분야별 연구개발 및 관련 산업 현황 |
|
|
제1절: 기초생명과학 |
|
|
1. 유전체 |
한국생명공학연구원/김선영 |
|
2. 단백질체 |
한국과학기술연구원/이철주 |
|
3. 세포체(줄기세포 포함) |
건국대학교/정형민 |
|
4. 대사체 |
한국과학기술연구원/정봉철 |
|
5. 구조생물 |
한국생명공학연구원/김명희 |
|
6. 뇌과학 |
한국뇌연구원/정성진 |
|
7. 노화 |
한국생명공학연구원/권은수 |
|
제2절: 보건의료 |
|
|
1. 합성신약 |
한국화학연구원/김필호 |
|
2. 바이오의약품 |
㈜파멥신/유진산 |
|
3. 바이오장기 |
바이오이종장기개발사업단/박정규 |
|
4. 진단 및 의료기기 |
성균관대학교/유규하 |
|
5. 감염병 대응 |
고려대학교/송대섭 |
|
제3절: 농림축산식품 |
|
|
1. 농림 |
숭실대학교/서정아 |
|
2. 축산 |
국립축산과학원/오건봉 |
|
3. 식품 |
한국식품연구원/한대석 |
|
제4절: 환경·해양수산 |
|
|
1. 환경 생명공학 |
한국생명공학연구원/오희목 |
|
2. 해양 생명공학 |
한국과학기술연구원/판철호 |
|
제5절: 바이오 공정 및 융합 |
|
|
1. 생물공정(산업바이오) |
한국화학연구원/주정찬 |
|
2. BT + ICT |
한국전자통신연구원/박종현 |
|
3. BT + NT |
한국생명공학연구원/이규선 |
|
제6절: 생명연구자원 |
한국생명공학연구원/장영효 |
|
제7절: 생명공학 인프라(장비・시설) |
한국산업기술평가관리원/이강우 |
|
제4장: 생명공학 관련 법제도 현황 |
|
|
제1절: 바이오 안전성 동향 |
한국생명공학연구원/이효석 |
|
제2절: 생명윤리 동향 |
과학기술정책연구원/이명화 |
|
제3절: 생명공학 지적재산권 제도동향 |
특허청/노은주 |
|
제4절: 생명공학 제품 인허가 현황과 과제 |
이화여자대학교/이선희 |
|
제5절: 생명공학 기업 현황과 지원제도 |
한국바이오협회/오기환 |
|
부록 |
|
|
생명공학 연표 |
생명공학정책연구센터 |
|
생명공학 주요통계 |
생명공학정책연구센터 |
|
생명공학 관계법령 |
생명공학정책연구센터 |
● 편찬위원회
|
공동위원장 |
고서곤 |
과기정통부 기초원천연구정책관 |
|
|
하재두 |
국가과학기술자문회의 생명의료전문위원장 |
|
위원 |
김승준 |
한국생명공학연구원 부원장 |
|
|
서경석 |
한국해양과학기술진흥원 단장 |
|
|
이명화 |
과학기술정책연구원 단장 |
|
|
권오란 |
이화여자대학교 식품영양학과 교수 |
|
|
박윤정 |
서울대 치의학대학원 교수 |
|
|
송효학 |
GS칼텍스 수석연구원 |
|
|
이승규 |
한국바이오협회 부회장 |
|
|
김선원 |
한국연구재단 차세대바이오단장 |
|
|
김 현 |
한국연구재단 뇌・첨단의공학단장 |
|
|
조사연 |
한국연구재단 신약단장 |
|
간사 |
김흥열 |
생명공학정책연구센터장 |
|
실무팀 |
한승오 |
과기정통부 생명기술과 사무관 |
|
|
조수진 |
과기정통부 생명기술과 주무관 |
|
|
문성훈 |
생명공학정책연구센터 정책연구실장 |
|
|
이지현 |
생명공학정책연구센터 연구원 |

 2019생명공학백서_전체.pdf
2019생명공학백서_전체.pdf
 2019 생명공학백서 바로가기
2019 생명공학백서 바로가기
 2019 생명공학백서 바로가기
2019 생명공학백서 바로가기

















































































































































