2021 생명공학백서

- 발행일 2021-12-31
- 출처 과학기술정보통신부
- 담당자 이지현 ( 042-879-8366 / ljih@kribb.re.kr )
- 조회수 7721
-
키워드
#백서 #포스트코로나 #현황
-
첨부파일
-
 (웹용)2021생명공학백서_최종_0225.pdf
(다운로드 1679회)
바로보기
(웹용)2021생명공학백서_최종_0225.pdf
(다운로드 1679회)
바로보기
-
 2021생명공학백서-1.pdf
(다운로드 597회)
바로보기
2021생명공학백서-1.pdf
(다운로드 597회)
바로보기
-
 2021생명공학백서-2-특집.pdf
(다운로드 480회)
바로보기
2021생명공학백서-2-특집.pdf
(다운로드 480회)
바로보기
-
 2021생명공학백서-3-1장.pdf
(다운로드 472회)
바로보기
2021생명공학백서-3-1장.pdf
(다운로드 472회)
바로보기
-
 2021생명공학백서-4-2장.pdf
(다운로드 439회)
바로보기
2021생명공학백서-4-2장.pdf
(다운로드 439회)
바로보기
-
 2021생명공학백서-5-3장.pdf
(다운로드 451회)
바로보기
2021생명공학백서-5-3장.pdf
(다운로드 451회)
바로보기
-
 2021생명공학백서-6-4장.pdf
(다운로드 429회)
바로보기
2021생명공학백서-6-4장.pdf
(다운로드 429회)
바로보기
-
 2021생명공학백서-7-부록.pdf
(다운로드 473회)
바로보기
2021생명공학백서-7-부록.pdf
(다운로드 473회)
바로보기
-
-
차트+
개요
과학기술정보통신부는 생명공학 분야의 정책과 국내.외 연구동향 등을 한눈에 살펴 볼 수 있는 ‘2021 생명공학백서’를 발간하였습니다. 올해 열 번째로 발간되는 생명공학백서에서는 글로벌 트랜드와 지난 2년간 우리나라의 생명공학 육성정책 및 R&D 성과 등 생명공학의 변화와 도전, 그리고 향후 나아가야 할 방향을 가늠할 수 있는 다양하고 유용한 정보를 담았습니다. 특히, 일반 국민과 연구자들의 관심을 반영하여 '코로나19의 대응과 포스트 코로나 전략'을 특집으로 마련하였습니다.
아무쪼록 이 백서를 통하여 바이오분야의 산학연 전문가들에게는 과거를 돌아보고 앞을 내다볼 수 있는 계기가 되고, 국민에게는 바이오가 열어가는 행복하고 희망찬 미래상을 함께 공감할 수 있는 자료로 활용되기를 기대합니다.
<목차>
특집 : '코로나19' 대응성과와 포스트 코로나 전략
제1장 : 생명공학의 변화와 도전
제2장 : 국가 생명공학 육성 정책 및 지표
제3장 : 분야별 연구개발 및 산업 현황
제4장 : 생명공학 관련 법·제도 현황
부록 (1) 생명공학 연표
(2) 생명공학 주요통계
(3) 생명공학 관계법령
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
제 4유형 : 출처표시 + 상업적 이용금지 + 변경금지
이용자는 이 공공저작물을 이용할 경우 저작물의 출처표시, 비영리 목적으로만 이용가능하며 저작물의 변경 혹은 2차 저작물 작성을 금지합니다.


발간사

코로나19 팬데믹과 디지털 기술의 급진적인 발전이 우리 삶의 많은 부분을 바꾸어 놓았습니다. 코로나19로 인해 건강, 안전, 환경에 대한 가치가 더욱 중요해지고, 4차 산업혁명 시대에 진입하면서 인공지능, 빅데이터 등 첨단 디지털 기술의 활용이 국가 경쟁력의 핵심요소로 부상하였습니다.
생명공학분야에서도 미래 신ㆍ변종 감염병, 고령화 등에 대응하기 위한 치료제ㆍ백신 및 디지털 헬스케어의 중요성이 강조되고 있으며, 친환경 소재와 에너지 구현 등을 위한 바이오 기술의 적용 영역이 점점 확대되고 있습니다.
나아가 생명시스템 설계․제작 기술의 발전으로 유전체를 해독하는 시대에서 합성하는 시대로 패러다임이 전환되고 있으며, 바이오 기술에 기반한 제조 혁신이 의약품, 화학, 에너지 등 다양한 산업에 활용됨으로써 관련 산업의 혁신을 촉발할 것으로 기대하고 있습니다.
또한, 최근 美-中 기술패권 경쟁 및 글로벌 기술 블록화의 핵심으로 바이오 기술이 자리 잡게 되었고, 앞으로는 바이오 분야 핵심기술의 확보 여부가 국가 경쟁력을 좌우하는 시대가 될 것입니다.
이러한 바이오 분야의 가치영역 확장에 대비하고 사회‧경제적 변화에 선제적으로 대응하기 위해서는 정부와 민간의 투자와 기술혁신 노력이 중요합니다.
이에 정부는 ’19년부터 바이오 기술을 미래차, 시스템반도체와 함께 3대 중점산업으로 선정하여 집중 육성하고 있으며, 빅데이터, 인공지능 등 디지털 기술과 융합을 통한 기술 혁신을 가속화 하고 있습니다.
또한 지난 25년간 바이오 R&D에 지속적으로 투자하여 민간 R&D를 유도하기 위한 마중물이 되어 왔으며, 2014년을 기점으로 민간 투자규모가 정부 투자규모를 넘어서는 자생적 생태계가 조성되었습니다. 이러한 민관의 지속적인 노력으로 말미암아 국내 바이오 기술 수준은 지속적으로 성장하여 최근 7년간 약 31조 원 이상의 기술수출 성과를 창출하였습니다.
이러한 성과들이 지속될 수 있도록 앞으로도 민간 역할을 더욱 강화하고 바이오 원천기술 확보와 우수한 인력 양성, 바이오 기반시설 지원 등 정부역할을 더욱 충실히 해나갈 것입니다.
올해 열 번째로 발간되는 생명공학백서에는 글로벌 트랜드와 지난 2년간 우리나라의 생명공학 육성정책 및 R&D 성과 등 생명공학의 변화와 도전, 그리고 향후 나아가야 할 방향을 가늠할 수 있는 다양하고 유용한 정보를 담았습니다. 특히, 일반국민과 연구자들의 관심을 반영하여 ‘코로나19의 대응과 포스트 코로나 전략’을 특집으로 마련하였습니다.
아무쪼록 이 백서를 통하여 바이오분야의 산학연 전문가들에게는 과거를 돌아보고 앞을 내다볼 수 있는 계기가 되고, 국민에게는 바이오가 열어가는 행복하고 희망찬 미래상을 함께 공감할 수 있는 자료로 활용되기를 기대합니다.
끝으로 백서 발간을 위해 수고해 주신 각 분야 전문가 여러분 및 관계자께 감사의 말씀을 드립니다.
2021. 12.
과학기술정보통신부 장관 임혜숙
편찬사

지금 우리는 바이오경제 가속에 새로운 변곡점을 맞이하고 있습니다. 인공지능(AI), 빅데이터 등 디지털 기술의 급진적 발전에 바이오가 긴밀히 결합하면서 새로운 가치사슬과 성장의 기회가 형성되고 있으며, 코로나19로 비대면 확산, 재난 일상화 우려, 글로벌 가치사슬 변화 등 그동안 경험해보지 못한 넥스트 노멀(next normal) 시대에 직면하고 있습니다. 특히 감염병이 인간-동물-환경이 하나로 연결되는 원헬스로 강조되고 국가질병으로 인식되어, 생명안보 관점으로 접근이 필요해졌으며, 기후변화, 식량부족, 건강 등 국민 삶의 질 향상과 얽혀있는 사회문제 해결을 위해 유연하게 대처할 수 있는 바이오기술의 혁신 강화가 필요해지고 있습니다.
미래 바이오산업의 경쟁력은 바이오 핵심기술 확보와 직결되어 있습니다. 바이오기술은 기반기술로 타분야와 접목하고, 디지털 기술과 융합하며, 사회시스템에 적용되는 등 바이오 융합을 통해 신기술과 신산업을 창출하고 있습니다. 우리 정부는 2019년 범부처 계획으로 수립된 바이오 산업혁신 전략과 함께 바이오헬스 분야를 3대 신산업 중 하나로 선정하고 바이오를 차세대 성장산업으로 육성하기 위해 투자와 노력을 아끼지 않고 있습니다.
바이오기술은 이미 우리의 일상 속으로 깊숙이 들어와 있으며 무궁무진한 잠재력 또한 가지고 있습니다. 최근 일어나고 있는 복잡다양한 사회문제를 효과적으로 대응하기 위해 꾸준한 관심과 지원을 통해 바이오기술이 우리의 삶에 좀 더 안전하고 건강하게 안착하고, 또 미래세대를 위한 밑거름이 되기를 기원합니다.
생명공학백서는 생명공학 분야의 주요 이슈, 정책추진 현황, 연구개발 및 산업 동향과 전망 등 방대한 생명공학 정보를 체계적으로 종합하여 수록하였습니다. 생명공학 분야의 종합 안내서인 이 백서를 통해 관련 분야 전문가는 물론 일반인들이 조금이나마 서로 소통할 수 있는 자료가 되기를 희망합니다.
다시 한번 2021 생명공학백서 발간을 축하하며, 그동안 수고해 주신 과학기술정보통신부 및 국가생명공학정책연구센터 관계자분들, 그리고 집필에 참여해 주신 모든 전문가분들께 깊은 감사의 말씀을 드립니다.
감사합니다.
2021. 12.
2021 생명공학백서 편찬위원장 최 선
축하의 글

오늘날 사회는 초연결, 초지능 등 4차 산업혁명의 거대한 물결과 함께 에너지․자원 고갈, 기후변화, 감염병, 노화 등 글로벌 난제에 직면하고 있습니다. 2030년 바이오경제 시대가 도래할 것이라는 OECD의 전망은 현실이 되고 있고, 글로벌 난제 해결과 4차 산업혁명을 이끌어 갈 핵심기술로서 ‘바이오’에 대한 기대와 중요성은 커져만 가고 있습니다.
2019년 발생한 코로나19 팬데믹은 사회․경제적으로 많은 변화를 일으키며, 글로벌 위기 상황 극복을 위한 과학기술의 역할 강화를 요구하고 있습니다. 언택트 시대로의 사회적 변화는 전산업 분야의 디지털 전환과 함께 바이오․의료 패러다임을 치료․병원 중심에서 예방․환자 중심으로 빠르게 변화시키고 있습니다. 이에 따라, 주요 선진국은 바이오 분야의 디지털화를 활성화하기 위한 정책을 통해 전략적으로 AI, 빅데이터 등 4차 산업혁명 기술과 바이오 기술과의 융합으로 미래 바이오․헬스 시장을 선점하기 위한 국가 차원의 노력을 하고 있습니다.
한편, 우리나라도 작년 4월 수립된 ‘한국판 뉴딜’ 정책과 연계하여 바이오 분야의 디지털 전환을 본격화하기 위한 ‘바이오 디지털 뉴딜 추진계획’을 수립하여 국가 바이오 R&D 혁신을 촉진하고 있습니다. 이와 함께, 정부는 반도체, 미래형자동차와 함께 바이오를 BIG3 산업으로 육성하기 위한 의지를 천명하고, 2019년 ‘바이오․헬스 산업 혁신전략’을 시작으로 ‘바이오․헬스 연구개발 투자전략’ 등 실행전략을 수립하여 바이오에 대한 투자와 혁신을 강화하고 있습니다. 이러한 정부의 적극적 지원과 함께 민간 투자도 지속적으로 확대되어 국내 바이오제약 기업의 기술 수출이 2018년 3.8조 원에서 2020년 10.2조 원으로 크게 증가하는 등 K-바이오의 위상은 나날이 높아지고 있습니다.
이에 부응하여 한국생명공학연구원도 국가 바이오 R&D의 첨병으로서 기관 미션과 국가 성장전략에 기반하여 바이오 분야의 핵심․원천기술 개발에 대한 집중 지원을 통해 바이오산업의 국가 경쟁력을 제고하고, 개방형 협력을 통해 국가․사회현안을 해결하는데 앞장서고 있습니다. 특히, 코로나 사태가 장기화되면서 디지털 전환이 전세계적 화두로 떠오른 가운데 한국생명공학연구원은 바이오 분야의 디지털 혁신을 선도함으로써 미래 신산업을 창출하고, 나아가 국민의 삶의 질이 향상될 수 있도록 최선의 노력을 다하겠습니다.
이러한 바이오 패러다임 전환기에 과학기술정보통신부에서 발간하는 생명공학백서는 우리나라 생명공학 분야의 과거와 현재를 기록하여 현세대와 미래세대의 대화의 창구로서 국가 바이오 발전의 디딤돌 역할을 할 수 있을 것입니다. 무엇보다, 이번 생명공학백서에는 전 국민의 최대 관심사인 ‘코로나19 대응 및 포스트 코로나 시대를 대비한 바이오 전략’을 특집으로 구성함으로써 국가적 위기 상황에서 바이오가 어떤 역할을 했고 부족했던 부분이 무엇인지 돌아볼 수 있는 기회가 될 수 있을 것입니다. 아울러, 최근 기술패권 경쟁으로 인해 심화되고 있는 글로벌 기술블록화, 백신 자국주의 확대 등 기술 보호주의가 강화되는 환경 속에서 우리의 현주소를 진단하고, 국가적 산업 위기를 기회로 전환하기 위한 기술자립 방안을 국민과 함께 고민하는 계기가 되기를 기대합니다.
끝으로 2021년 생명공학백서의 발간을 진심으로 축하드리며, 그동안 고생하신 과학기술정보통신부와 집필에 참여하신 전문가 여러분들께 감사의 말씀을 전합니다. 감사합니다.
2021. 12.
한국생명공학연구원 원장 김장성
축하의 글

1970년대 미국 학자에 의하여 최초로 성공한 유전자 재조합 기술이 우리나라 언론매체를 통하여 소개된 것이 1980년대 초입니다. 소위 유전공학으로 알려진 이 기술이 산업화 되었을 때 사회경제에 미칠 막대한 영향을 전망하고 선진 각국이 이 분야의 선두주자가 되기 위하여 치열한 경쟁을 벌이고 있을 그런 시기였습니다.
그러나 당시 우리나라에는 유전공학 분야를 연구하거나 관심을 가진 과학자 수는 손꼽을 정도였고 산업계는 거의 관심이 없었던 때입니다. 40년 전 우리나라의 유전공학 기반은 거의 황무지와 같았습니다. 그러나 그 사이 학계, 산업계 그리고 정부의 적극적인 육성정책으로 유전공학이 생명공학으로 그리고 바이오산업으로 발전하게 되었습니다.
산업계는 한국유전공학연구조합(現 한국바이오협회)을 구성하여 생명공학기술의 산업화에 투자하였고, 학계는 유전공학학술협의회를 조직하여 연구환경 조성에 뼈를 깎는 노력을 하였으며, 국회는 유전공학육성법(現 생명공학육성법)을 제정하였고 정부는 이 법에 근거하여 인력양성과 지속적인 연구지원 등 국가적 차원의 총체적 육성 의지가 있었기에 우리나라가 현재 세계적 수준의 바이오 국가로 진입할 수 있는 토대가 되었습니다.
코로나19로 어려운 시기에 국내 바이오산업은 신속하게 코로나19 진단키트를 만들어 전 세계에 수출하였고 바이오의약품 생산과 수출도 대폭 증가하는 등 지속적인 성장을 하고 있습니다.
코로나19를 계기로 대부분의 국가들은 감염성 질환에 대한 진단기기, 치료제, 백신개발에 전력을 다하고 있는 등 그 어느 때보다 바이오산업에 대한 각국들의 관심과 투자가 많아지고 있습니다.
우리 정부도 반도체, 미래자동차와 함께 바이오산업을 3대 중점육성 산업으로 선정하고 범정부 차원의 정책역량을 집중하고 있습니다. 국내 바이오산업 대표단체인 한국바이오협회도 국내 바이오벤처의 창업과 성장을 촉진하고, 우리 기업들이 글로벌 경쟁력을 가질 수 있도록 오픈 이노베이션 등 다양한 기업지원 프로그램을 운영해 나가겠습니다.
2003년 창간 이래 격년으로 발간되고 있는 생명공학백서는 그간 생명공학의 성과와 국내외 육성 정책, 산업 현황, 그리고 중요한 이슈 등을 다루고 있어 국내 바이오산업계에 유용한 자료로 활용되고 있습니다. 특히, 이번에는 코로나19 대응 성과와 포스트 코로나 대응 전략을 다루고 있어 시의적절한 주제가 선정되었다고 생각합니다.
2021 생명공학백서의 발간을 축하드리며, 소중한 백서 발간을 위해 애쓰신 관계자 및 집필에 참여해 주신 전문가 등 여러분들께 감사드립니다.
2021. 12.
한국바이오협회 회장 고한승













2020년 주요연구성과
국가연구개발 우수성과 100의 ‘생명ㆍ해양’분야에 선정된 성과를 기준으로 소개
ㅇ 생명․해양 분야(25개)
|
대표연구자 |
소속기관 |
성과명 |
|
이기호 |
SK바이오팜(주) |
세노바이트, 미국 FDA 시판허가 및 유럽지역 기술수출 계약 |
|
류제황 |
전남대학교 |
콜레스테롤 대사이상이 퇴행성관절염의 원인임을 규명 |
|
곽효선 |
전 식품의약품안전평가원 |
식중독균 유전체 통합 데이터베이스 구축 및 활용 확산 |
|
권순일 |
국립원예특작과학원 |
소비 및 생산 환경 변화에 대응한 사과 신품종 개발ㆍ보급 |
|
김건화 |
한국기초과학지원연구원 |
간 대사질환 혁신 치료제 후보 발굴 개발 |
|
김민영 |
국립농업과학원 |
작물 수분스트레스 진단 및 적정 수분공급을 위한 인공지능 관개시스템 개발 |
|
김선광 |
경희대학교 |
항암제 부작용으로 인한 통증의 치료 한약제제 개발과 기술이전 및 임상2상 진입 |
|
김성우 |
국립축산과학원 |
가축유전자원 동결 보존 시스템 구축 |
|
김지연 |
대웅제약 연구소 |
고지혈/고혈압 치료용 복합제 개발 |
|
문대혁 |
서울아산병원 |
유방암환자의 여성호르몬수용체 영상진단법 개발 |
|
박숭현 |
극지연구소 |
남극권에서 새로운 타입의 질란디아-남극 맨틀 발견 및 특성 규명 |
|
박종은 |
국립축산과학원 |
기후변화에 대응한 닭의 고온 스트레스 적응 유전자 발굴 및 기작 구명 |
|
박찬규 |
건국대학교 |
잔류 가능성이 없는 천연물질 기반의 항균 및 세균독소 펩타이드 대량생산기술 개발 |
|
변명희 |
(주)대상 중앙연구소 |
영양과 식감을 개선한 고령자 맞춤형 기호식품 개발 성공 |
|
봉연식 |
한국기초과학지원연구원 |
농산물 원산지를 정확하게 판별할 수 있는 동위원소 지도 개발 성공 |
|
심재설 |
한국해양과학기술원 |
고품질 장기 해양관측정보 확보와 국제 대양관측네트워크의 대륙붕 최초 관측정점 등록 |
|
이남혁 |
한국식품연구원 |
산업용 초음파 원천기술을 활용한 고부가가치 기능성 소재개발 |
|
임한규 |
국립목포대학교 |
슈퍼왕전복 종자 개발을 통한 어가소득 증대 및 수출시장 확대 기여 |
|
장석복 |
기초과학연구원 |
두 얼굴의 ‘거울상 이성질체’, 하나만 선택해 만든다 |
|
장춘곤 |
성균관대학교 |
마약류 지정을 위한 과학적 평가 및 신속예측평가법 개발 |
|
조계만 |
경남과학기술대학교 |
생물공정기술 기반 유효성분(인체흡수형 진세노사이드 등) 극대화 활성산양삼 제조 기술 |
|
조병철 |
연세대학교 |
First-in-class IL-2/CB80 이중접합 면역항암제 GI-101의 중개연구와 7억 9,000만 달러 글로벌 기술이전 성과 |
|
주영석 |
한국과학기술원 |
비흡연자에서 발생하는 폐암의 발암 유전체 돌연변이 규명 |
|
최용수 |
국립농업과학원 |
토종벌 멸종 위기 바이러스병 저항성품종 개발 및 사업화 |
|
최혜선 |
국립식량과학원 |
토종 유산균 활용 순식물성 쌀 발표 新소재 개발 및 산업화 |
2021년 주요연구성과
국가연구개발 우수성과 100의 ‘생명ㆍ해양’분야에 선정된 성과를 기준으로 소개
ㅇ 생명․해양 분야(26개)
|
성과명 |
연구자 |
소속기관 |
비고 |
|
인체장기 재현한 조립형 미니장기 ‘어셈블로이드’ 개발을 통한 조직재생 및 암발생 기작 규명 |
신근유 |
포항공과대학교 |
최우수 |
|
PCSK9이 LDL-Receptor를 분해하는 기전 규명:대사증후군 신치료제 개발 플랫폼 확립 |
김효수 |
서울대학교병원 |
최우수 |
|
장내 미생물 기반 알코올성 지방간 치료용 핵심 소재 개발 |
고광표 |
서울대학교 |
|
|
고령화 대응 노인성 근감소증 제어 약물 개발 및 기술이전 |
권기선 |
한국생명공학연구원 |
|
|
세계 최초 과수에만 농약 살포가 가능한 지능형 로봇 방제기 개발 |
김국환 |
국립농업과학원 |
|
|
항생제 내성 특성 분석 및 제어기술 개발 |
김미경 |
식품의약품안전평가원 |
|
|
물리적 포만감의 신경과학: 식욕을 조절하는 장-뇌 신호전달 연구 |
김성연 |
서울대학교 |
|
|
국내 최초 개별인정형 여성 갱년기 증상 완화 프로바이오틱스 상용화 성공 |
김윤태 |
한국식품연구원 |
|
|
해양 환경내 잔류성 독성물질의 잠재 독성 예측가능한 생-물리 연계 모델의 개발 |
김종성 |
서울대학교 |
|
|
밀싹의 유용대사체 구명을 통한 건강기능식품 소재 원천기술 개발 |
김현영 |
국립식량과학원 |
|
|
아프리카 토착 소의 유전체 진화 규명 |
김희발 |
서울대학교 |
|
|
대장암 단일세포 분석을 통한 면역항암치료 기전 규명 |
박웅양 |
삼성서울병원 |
|
|
ADC 항암제(DLK1-ADC), 미국 ‘픽시스’사에 글로벌 기술 이전 계약 |
박창식 |
㈜레고켐바이오사이언스 |
|
|
선박운항 시뮬레이터 선박 운동성능 예측용 동역학 모델 개발 |
안성필 |
㈜세이프텍리서치 |
|
|
URI-T, 국산 해저 케이블/파이프라인 매설 로봇 상용화 성공 및 해외시장 진출 쾌거 |
이계홍 |
한국로봇융합연구원 |
|
|
중국 고추 시장 진출을 위한 성공적 R&D 체계 확립 및 해외 시장 확대 개발 |
이도현 |
대일국제종묘 |
|
|
개미산과 이산화탄소만으로 잘 증식하는 대장균 개발 |
이상엽 |
한국과학기술원 |
|
|
국내 자생 수국을 이용한 이너뷰티 건강기능식품의 글로벌 산업화 |
이선희 |
코스맥스바이오㈜ |
|
|
국산 3D 홀로토모그래피·인공지능 기술로 질환 치료제 개발의 새로운 패러다임을 제시하다 |
이성수 |
한국기초과학지원연구원 |
|
|
세계 최초, SUPER 항노화(抗老化) 식품자원의 발굴 및 산업화 |
이성현 |
국립농업과학원 |
|
|
새로운 육종기술 지원을 통한 민간육종기반구축 및 사업화 |
임기병 |
경북대학교 |
|
|
의료용 생분해성 폴리에스터 국산화를 위한 국제인증, 사업화 및 기술 수출 계약 |
전흥재 |
가톨릭대학교 |
|
|
노화된 인간의 피부세포를 다시 젊은 세포로 되돌리는 역노화 원천기술 개발 |
조광현 |
한국과학기술원 |
|
|
브랜드 쌀 원료곡 국산화를 위한 수요자 참여형 벼 품종개발 및 사업화 |
현웅조 |
국립식량과학원 |
|
|
국내최초 선진국 수준의 코로나19 영장류 감염모델 개발 및 산학연 지원 |
홍정주 |
한국생명공학연구원 |
|
|
휴대 가능한 디지털 X-ray 검출기 디자인 기술 개발 및 사업화 |
황강민 |
레이언스 |
|
바이오미래유망기술(2020∼2021)
바이오미래유망기술을 발굴하는 것은 바이오 분야의 미래비전을 제시할 수 있다는 점에서 매우 중요한 의미를 가진다. 이에 한국생명공학연구원은 지난 2015년부터 바이오 미래유망기술 발굴 연구를 추진해오고 있으며, 올해 혁신공감형의 발굴 방법으로 여섯 번째 연구결과를 발표했다.
|
|
공통 핵심기술의 후보가 되는 플랫폼, 레드, 그린, 화이트 바이오 분야의 총 10개의 미래유망기술을 발표하였으며, 이를 기반으로 연구한 결과가 일반인, 연구자, 정책 입안자 등 다양한 관점에서 활용될 수 있을 것으로 기대된다.
전 세계를 혼란 속으로 몰아 넣은 코로나19뿐만 아니라 앞으로 닥칠 포스트 팬데믹을 대비할 수 있는 혁신기술에는 바이오 미래유망기술의 집합체가 될 것으로 예상된다. 이에, 포스트 팬데믹을 포함한 향후 우리의 삶과 생활에 중요한 바이오 미래유망기술 발굴에 관한 연구방법론을 구축하고, 그 연구결과로써 바이오 미래유망기술을 제시하고자 하였다.
2020년 10대 바이오미래유망기술

|
분야 |
|
주요 내용 |
|
|
플랫폼 바이오 Platform Bio |
|
▹살아있는 세포 내에서 특정 유전자 서열을 고효율로 첨가, 삭제, 치환하는 기술 ▹기존의 유전자 편집 효율을 크게 향상시키고 베이스 에디팅(Base editing)이 가지는 염기치환 및 교정 범위의 한계를 극복하여 생명현상 연구뿐만 아니라 질병 치료, 품종개량 등에 활용 가능 |
|
|
|
▹기술의 한계로 분석이 어려웠던 거대 단백질 복합체, 막단백질 등을 초저온-전자현미경을 통해 고해상도 3차원 입체구조를 분석하는 기술 ▹생명 조절에 핵심적인 거대 단백질 복합체 및 막단백질 등의 분석을 통해 새로운 생명 현상과 질환 원인 규명 및 신약 개발을 촉진 |
||
|
|
▹생체 기관이나 조직 내 개별 세포의 위치정보를 유지한 상태에서 오믹스 데이터를 확보하여 3차원적인 공간 정보를 파악하는 기술 ▹장기나 기관 내 개별 세포의 위치에 따른 특성과 세포 간 상호작용을 이해하고 질환을 유발하는 세포의 3차원 위치를 파악하여 정밀한 진단 및 치료 표적 발굴이 가능 |
||
|
레드 바이오 Red Bio |
|
▹조직의 노화 및 기능 이상을 유발하는 노화세포를 선택적으로 제거하여 조직 항상성을 유지하고 질병을 치료하는 기술 ▹조직 내 노화세포만을 선택적으로 사멸시킴으로써 조직 노화를 억제할 수 있을 뿐 아니라 노화 관련 다양한 질병의 치료에도 활용 가능 |
|
|
|
▹기존의 먹는 알약이나 주사제가 아닌 디지털기술(소프트웨어)을 기반으로 질병 예방, 관리 및 치료하는 신개념 의약품 ▹의약품과 IT의 융합을 통해 표적 부위에 약물을 정확하게 전달하거나 질병의 상태, 환자의 복약 여부 등을 실시간으로 모니터링 함으로써, 질병의 진단 및 치료 효과를 제고 |
||
|
|
▹혈액, 소변 등에 존재하는 핵산 조각들을 분석하여 실시간 질병의 진행을 추적하는 기술 ▹비침습적 방법으로 환자로부터 시료를 얻기 용이하며, 질병의 발생 및 진행 과정을 예측하여 추적 관찰이 가능. 특히 암 분야의 개인 맞춤 치료에 사용 가능 |
|
분야 |
|
주요 내용 |
|
|
그린 바이오 Green Bio |
|
▹식물 세포 소기관인 엽록체를 이용하여 유용한 외래 단백질 등을 대량 생산하는 기술 ▹식물에서 바이오 물질을 생산할 경우 독소가 생성될 위험이 적고 엽록체는 많은 양의 바이오 물질을 생산 및 저장할 수 있어 대량생산이 가능 |
|
|
|
▹식물 생식기관에서 종간 장벽 역할을 하는 단백질의 재설계와 도입을 통해 교배가 어려운 두 종간의 교배 효율을 향상시키는 기술 ▹전통육종 방식의 품종 개발 과정에서 큰 어려움 중 하나인 종간 장벽을 제거함으로써 교배가 어려운 우수품종 간의 교배를 통해 우수 형질의 식물을 개발 |
||
|
화이트 바이오 White Bio |
|
▹로봇과 AI 기술을 융합한 바이오 첨단기술로서 DNA 조립에서부터 세포 개량까지의 복잡한 과정을 빠른 순환 공정으로 구현하는 기술 ▹느리고 복잡한 생물 실험 과정을 빠르고 정밀한 로봇과 IT 기반 기술로 극복하고, 수집된 빅데이터의 AI 분석을 통해 바이오 제조 공정의 생산효율을 향상 |
|
|
|
▹생명활동에 필요한 최소요소(DNA, 단백질 등)로 구성된 무세포 환경에서 유용한 기능을 수행하는 생명 시스템을 제작하는 기술 ▹복잡한 세포활동 제어의 어려움을 극복하고, 기존의 자연 세포에서 구현되지 않는 합성경로를 통해 신규 화학소재 등을 제조 가능 |
2021년 10대 바이오미래유망기술

|
분야 |
|
주요 내용 |
|
|
플랫폼 바이오 Platform Bio |
|
▹심해 등 극한 환경에서 살아가는 생물과 그 안에 함께 있는 마이크로바이옴이 생산하는 다양한 물질을 확보하는 기술 ▹그간 인류가 접근하기 힘들었던 극한 환경 속 생물로부터 화학 다양성 확보를 통해 발굴한 새로운 천연물질은 신개념 항생제 등 신약 및 혁신 바이오소재 개발에 활용 |
|
|
|
▹개인 맞춤형 오가노이드에 면역세포 공배양 등을 통해 체외에서 개인의 면역체계를 모사하는 기술 ▹개인별 면역 특성이 반영된 체외 시스템을 통해 면역반응의 기초연구부터 개인 맞춤형 치료제 개발, 효과적인 백신 개발백신개발에 기여 |
||
|
|
▹분자물리학적 접근 방법과 딥러닝 인공지능을 활용하여 단백질 구조뿐만 아니라 세포 내 단백질 작용을 예측하는 기술 ▹단백질 간의 네트워크 규명을 통해 그간 알지 못했던 생명현상을 밝힐 수 있고, 신속한 약물 표적 발굴을 통해 신약개발의 생산성을 향상 |
||
|
레드 바이오 Red Bio |
|
▹유전적으로 면역 회로를 합성하여 면역세포의 활성을 높이거나 면역물질 생성을 조절하는 기술 ▹기존 면역세포 치료의 효능을 극대화하고, 사이토카인 방출 증후군과 같은 부작용에 대한 한계를 극복하여 감염병, 암 및 다양한 질환 치료제 개발에 활용 |
|
|
|
▹유전자 교정기술 등을 활용하여 단일세포 수준에서 질병을 치료하는 기술 ▹조직을 치료대상으로 할 경우 발생하는 유전자전달, 면역반응, 낮은 교정 효율, 세포 이질성의 문제를 극복하고 효율적이고 안전한 치료가 가능 |
||
|
|
▹나노구조체 표면에 다량, 다종의 항원을 노출시키거나, 기존 항체보다 작고 효과적인 치료제를 제작하는 기술 ▹크기가 작아 안정성, 용해도가 높고, 제조하기 용이하며, 조직 침투력이 높아 기존의 백신/항체치료제의 타깃이 되지 못하는 틈새 치료 영역에 적용 가능 |
|
분야 |
|
주요 내용 |
|
|
그린 바이오 Green Bio |
|
▹팬데믹 등으로 공급 문제가 발생할 수 있는 축산업을 대체하기 위해 세포배양 기반으로 육류나 우유를 제조하는 기술 ▹지속가능한 녹색축산을 실현하고, 전통 축산업에서 발생하는 환경문제 완화 및 증가하는 축산물 수요에 대응 가능 |
|
|
|
▹식물 공생 미생물체, 병원성 미생물체 분석으로 식물 마이크로바이옴 기능 조절을 통해 작물 성장을 돕거나 멸종위기 보호종을 보전하는 기술 ▹우수한 성장성 및 병충해에 강한 식물 자원을 생산, 유지하는 기술의 한계를 극복하여 생명현상 연구뿐만 아니라 품종개량 등에 활용 |
||
|
화이트 바이오 White Bio |
|
▹일회용품 및 미세플라스틱 문제를 해결하기 위해 미생물로부터 완전 친환경 고분자 재료를 생산하는 기술 ▹친환경 소재 산업 고도화를 통한 탄소발자국(carbon footprint) 저감 및 난분해 플라스틱 유래 환경오염 문제 해결에 기여 |
|
|
|
▹바이오 빅데이터(특히, 미생물 군집구조)를 포함한 환경, 생태 데이터를 통합하여 생태계의 건강성을 평가하는 기술 ▹미생물총의 오믹스를 이용한 평가기법은 샘플링이 간단하고, 이후 빅데이터 분석 공정도 상당히 표준화되어 있어, 보다 객관적이고 정확하며 세밀한 평가가 가능 |
















가. 지난 경험과 교훈
(1) 감염병의 위협
감염병은 지난 수십 년 동안 계속 증가해 왔으며 국제 공중보건에 위협이 되고 있다. 감염병의 확산 요인으로는 인구 증가와 그에 따른 환경적 부담, 기후변화, 밀집된 도시화, 강제적 또는 자발적 국제 여행과 이주의 기하급수적 증가 등이 있으며, 기본적인 의료시설, 위생적인 물, 기반시설 등의 부족으로 인해 감염병의 확산 및 통제의 어려움을 겪을 수 있다.
감염병의 발생으로 인명손실은 계속되고 있으며 특히 호흡기 감염병은 급격히 증가하여 이로 인해 5,000만에서 8,000만 명의 인구가 사망하였을 것으로 추산되고 있다. 감염병은 사망자 발생 외에도 경제를 황폐화 시킨다. 2014~2016년 서아프리카 에볼라 발병으로 인한 경제적, 사회적 영향으로 530억 달러 손실, 2009년 H1N1 인플루엔자 대유행으로 인한 손실 비용은 450억~550억 달러이다(그림 1-1). 세계은행은 1918년의 규모와 병독성과 유사한 세계적 대유행 인플루엔자가 3조 달러 또는 국내 총생산(GDP)의 최대 4.8%의 경제적 손실을 입힐 것으로 추정하였다. 중간 정도의 치명적인 인플루엔자 대유행의 경우에도 비용은 GDP의 2.2%가 될 것으로 추정하였다.
(단위: Billions($))

자료: Resolve to Save Lives (www.resolvetosavelives.org)
[그림 특집1-1] 감염병 발생으로 인한 손실 (2001~2017)
세계보건기구(WHO)는 이와 같은 감염병 발생에 대비하여 잠재적인 감염병을 감지하고 통제하기 위한 시스템을 구축하기 위해 지속적인 노력을 하고 있다. 그 일환으로 GPMB(Global Preparedness Monitoring Board)는 2009년 H1N1 인플루엔자 대유행 및 2014~2016년 에볼라 발병 이후 이전 고위급 패널과 위원회의 권장사항의 반영 여부를 검토하여 첫 번째 보고서를 발표하였다. 그 결과 검토된 많은 권장 사항이 제대로 구현되지 않았거나 전혀 구현되지 않았으며 심각한 격차가 지속되고 있었다.
오랫동안 감염병 발생과 관련하여 공황과 방치의 순환이 계속되고 있었으며, 심각한 위협이 있을 때만 노력하고 위협이 가라앉으면 빠르게 잊어버리는 상황이 반복되고 있었다. GPMB는 백신 및 치료제 개발, 생산 능력 증대, 광범위한 항바이러스제에 대한 적절한 투자와 함께 모든 국가는 공중보건 목적으로 새로운 감염병의 게놈 염기서열을 즉시 공유하는 시스템과 제한된 의료 대책을 국가 간에 공유할 수 있는 수단의 개발 필요성을 제시하였으며, 감염병 대유행에 대비하기 위해 정치적, 재정적 및 사회적인 지원이 정치적 의제에 우선하도록 최고 수준에서 옹호할 것이며 후속 조치에 대한 책임질 것을 약속했다.1)
WHO는 2011년과 2018년 사이에 172개국에서 발생한 1,483건의 전염병을 추적했다. 인플루엔자, 중증급성호흡기증후군(SARS), 중동호흡기증후군(MERS), 에볼라, 지카, 흑사병, 황열병 등과 같은 유행성 질병은 잠재적으로 빠르게 확산될 수 있는 강한 영향을 미치는 새로운 시대의 선구자이다. 다음 그림은 자연적으로 발생한 병원체와 의도적으로 발생시킨 병원체를 포함하여 지난 50년 동안 세계적으로 발생한 병원체를 나타낸다.

주) C. difficile: Clostridium difficile; CRE: Carbapenem-Resistant Enterobacteriaceae; E. coli: Escherichia coli; MDR: Multidrugresistant [tuberculosis]; MERS-CoV: Middle East Respiratory Syndrome Coronavirus; MRSA: Meticillin-Resistant Staphylococcus Aureus; N. gonorrhoeae; Neisseria gonorrhoeae; SFTSV: Severe Fever with Thrombocytopenia Syndrome Virus; XDR: extensively Drug-Resistant [tuberculosis].
자료: United States National Institutes of Health, National Institute for Allergies and Infectious Diseases.
[그림 특집1-2] 신종 및 재출현 질병의 글로벌 사례
WHO는 2014년 에볼라유행 경험을 계기로 신종 감염병에 의해 유발되는 새로운 위협에 신속하게 대응하기 위해 새로운 R&D 패러다임의 필요성을 인지하고, 2015년 감염병에 대한 R&D 청사진을 제시하였다. WHO는 감염병 우선순위 선정을 위한 요소로 인체 전파력, 치사율, 파급 가능성, 진화 가능성, 의학적 대응책 보유 여부, 감시 및 통제 난이도, 발생지역의 공중보건 상황, 국제사회로의 전파 위험성, 사회적 영향의 9가지 기준을 제시하였다.
이 9가지 기준으로 전문가 그룹은 가까운 미래에 공중보건위기를 초래할 수 있으나 현재 의학적 조치가 불충분하여 긴급 R&D 추진이 필요한 우선순위 감염병을 발표하고 정기적으로 모여 선정 방법론을 검증하고 목록의 재선정을 추진하고 있다. 2018년 2월 최종 개정된 WHO 2018 R&D 청사진에서 8대 우선순위 감염병(▴Crimean-Congo Haemorrhagic Fever (CCHF), ▴Ebola virus disease and ▴Marburg virus disease, Lassa fever, ▴Middle East Respiratory Syndrome Coronavirus (MERS-CoV) and ▴Severe Acute Respiratory Syndrome (SARS), ▴Nipah and henipaviral diseases, ▴Rift Valley fever (RVF), ▴Zika)과 더불어 ‘Disease X’를 우선순위 감염병으로 선정하게 되었다. ‘Disease X’는 현재는 치료제나 백신이 개발되어 있지 않은, 신종 감염병 혹은 재출현의 위험성이 있는 감염병으로 발생 시 범세계적으로 위협이 될 수 있는 미지의 감염병을 의미한다.
GPMB는 2019년 발표한 ‘A World at Risk’라는 보고서에서 비말을 통해 빠르게 전파되는 치명적인 호흡기 RNA 바이러스 병원체의 출현에 대한 위험에 대하여 경고하였으며, 2019년 코로나19의 발생으로 전 세계는 첫 번째 Disease X의 발생을 목도하게 되었다.
(2) 코로나19의 발생과 팬데믹
코로나19는 2019년 말 중국 우환에서 최초로 발생한 이후 전 세계로 전파되었다. 2020년 3월 11일 코로나19는 114개국 12만 명의 감염자와 4,000여 명의 사망자를 발생시키며 확산세를 이어갔고 WHO는 세계적 대유행, 팬데믹(pandemic)을 선언했다. 코로나19는 2021년 7월 31일 현재 전 세계 확진자 1억 9,700만 명, 사망자 420만에 이르며 21세기 인류 최악의 재앙으로 손꼽히고 있다. 최근 몇 년간 과학기술과 의학이 엄청나게 발전하였음에도 불구하고 코로나19는 감염병을 일으키는 미생물이 여전히 인류 역사에 치명적인 영향력을 행사할 수 있다는 사실을 상기시켜 주었다. 역사적으로 팬데믹을 일으켰던 질병들은 14세기 중국에서 발원해 실크로드를 거쳐 유럽에 도래한 흑사병이 있다. 흑사병으로 인해 당시 유럽 인구의 60%가 사망했다고 추정된다. 당시 흑사병은 Yersinia pestis(페스트균)라는 세균에 의해 발생하였는데 이 세균은 동양쥐벼룩(Xenopsylla cheopis)의 장에 침범하여 감염을 일으켰고 세균에 감염된 벼룩은 다시 인간을 감염시켜 질병을 전파할 수 있었다.2) 최근까지도 산발적인 감염이 발생하고 있으나 예방과 치료에 효과적인 항생제가 있어 향후 전 세계 대유행의 가능성은 낮은 것으로 알려져 있다. 이후 16세기 잉카제국을 멸망시켰다고 알려진 인류 역사에서 가장 오래된 감염병 중 하나인 천연두도 팬데믹 사례 중 하나이다. 고대 이집트 미라에서 천연두 흔적이 발견되었으며 과거에는 사망률이 높은 무서운 질병이었지만 1980년에 WHO가 천연두의 근절을 선언함으로써 인류가 최초이자 유일하게 정복한 팬데믹 질병으로 남아있다.
진정한 세계적 대유행이자 현대 의학 발전 단계에서 발생한 최초의 전염병은 20세기 초반에 발생한 스페인독감으로 역학과 같은 감염병 전문 분야가 발달하는 계기가 되었다. 1차 세계대전 중 군대의 이동과 인구의 과밀화가 대규모 확산에 원인이 되었던 유럽 외에도 바이러스는 미국, 아시아, 아프리카 및 태평양 제도로 전파되어 전 세계가 황폐해졌다. 당시 한국에서도 유행한 독감은 ‘무오년 감기’로 불렸으며 조선인의 약 1,700만 명 중 절반에 가까운 742만 명이 감염되어 14만 명이 사망했다고 기록되어 있다. 스페인독감의 사망률은 10%에서 20% 사이였으며 당시 전 세계 인구의 4분의 1 이상이 독감에 걸리면서 사망자 수는 불어났다. 이는 흑사병이 유행하였던 한 세기 동안 발생한 사망자 수보다 더 많은 사람들이 1년 만에 사망하였을 정도로 피해가 심각하였다. 1948년 세계보건기구 설립 이후 최초의 팬데믹이 선언된 사례는 1968년 홍콩독감으로 코로나19 팬데믹은 2009년 신종플루 팬데믹 이후 세 번째 팬데믹 사례이다.
|
순위 |
팬데믹명 |
질병명 |
사망자 수 |
전 세계 인구대비 사망자 비율 |
Date |
|
1 |
Black Death (흑사병, 페스트) |
Bubonic plague |
75~200 million (7,500만~2억 명) |
[1] |
1346~1353 |
|
2 |
Spanish flu (스페인독감) |
Influenza A/H1N1 |
17~100 million (1,700만~1억 명) |
1~5.4% |
1918~1920 |
|
3 |
Plague of Justinian (유스티아누스 역병) |
Bubonic plague |
15~100 million (1,500만~1억 명) |
[1] |
541~549 |
|
4 |
HIV/AIDS pandemic (에이즈) |
HIV/AIDS |
35 million+ (2018년 기준, 3,500만 명 이상) |
[1] |
1981~present |
|
5 |
Third plague pandemic (3차 대역병) |
Bubonic Plague |
12~15 million (1,200만~1,500만 명) |
[1] |
1855~1960 |
|
6 |
Cocoliztli Epidemic (코코리츨리 유행병) |
Cocoliztli |
5~15 million (500만~1,500만 명 이상) |
[1] |
1545~1548 |
|
7 |
Antonine Plague (안토니우스 역병) |
Smallpox or measles |
5~10 million (500만~1,000만명 이상) |
3~6% |
165~180 (possibly up to 190) |
|
8 |
COVID-19 pandemic (COVID-19) |
COVID-19 |
4.1~8.5 million+ (7월 19일 기준, 400만~800만명 이상) |
0.05%~ 0.1% |
2019 –present |
|
9 |
1520 Mexico smallpox epidemic (멕시코 천연두 유행병) |
Smallpox |
5~8 million (500만~800만 명 이상) |
[1] |
1519~1520 |
|
10 |
1918–1922 Russia typhus epidemic (러시아 티푸스 유행병) |
Typhus |
2~3 million (200만~300만 명) |
0.1~0.16% |
1918~1922 |
|
11 |
1957–1958 influenza pandemic (인플루엔자 대유행) |
Influenza A/H2N2 |
1~4 million (100만~400만 명) |
1957~1958 |
|
|
Hong Kong flu (홍콩독감) |
Influenza A/H3N2 |
1~4 million (100만~400만 명) |
0.03~0.1% |
1968~1969 |
[표 특집1-1] 최소 백만명 이상의 사망자가 발생한 에피데믹(유행병)과 팬데믹(범유행병)의 역사적 사례
주) [1] 당시 세계 인구 추정치가 매우 다양함(합의되지 않음)
자료: https://en.wikipedia.org/wiki/List_of_epidemics#cite_note-Worldp-8)
(3) 감염병에 대한 대응
감염병의 발생은 사망자 발생으로 인한 국민들의 불안과 공포 극대화 외에도 경제 및 사회적 공황을 일으키며 국가 안보를 불안정하게 한다. 이는 일부 국가에 국한되는 것이 아니라 세계 경제와 보건안보에 심각한 영향을 미친다. 국가 간 장기적이고 지속적인 소통은 발병을 조기에 감지하고, 감염병의 확산을 제어하고, 신뢰와 사회적 결속을 보장하고, 효과적인 대응을 촉진할 것이다. 감염병에 대한 대비는 성공적인 대응 및 통제를 가능하게 하고 축적된 역량과 지식으로 다음 위협을 대비하기 위한 기반이 된다. 국가들은 각국의 모범 사례를 공유하기 위한 환경과 메커니즘 활성화 및 감염병 관련 정책 수립을 통해 백신, 진단, 치료와 함께 감시 체계 마련, 신속한 정보전달 체계 확립과 같은 다양한 분야의 연구개발을 지원하고 있다.
나. 코로나19 대응
(1) 코로나19 치료제
2019년 겨울 중국 우한에서 시작된 코로나19의 완전극복을 위하여 정부는 치료제와 백신은 ‘반드시 넘어야 할 산’으로 규정하고 ‘치료제와 백신개발의 끝’을 보는 한편, 다가올 ‘제2의 코로나19’에 대한 대응 태세를 선제적으로 구축하기 위해 로드맵을 수립하고 범정부적 지원체계를 구축하였다.
(가) 구성 및 역할
우리나라는 정부주도 체제로서 코로나19 치료제․백신개발 범정부지원단(이하 ‘범정부지원단’)을 구성하고 코로나19 대응 체제 구축과 치료제 개발, 백신의 국내개발생산 및 해외 개발 백신의 수급 확보라는 two-track 전략을 추진하여 왔다. 범정부지원단은 보건복지부 장관과 과기정통부 장관을 공동단장으로 구성하여 2020년 4월 24일 출범하였다. 아울러 실무추진단 회의(과기부 복지부 1급 주재)가 2020년 4월 17일 첫 회의를 시작으로 산하에 3개의 분과(백신, 치료제, 방역물품․기기)를 두고 현재까지 진행되어 오고 있다.
① 구성
국무총리 훈령 공포(코로나19 치료제ㆍ백신 개발 범정부지원위원회 설치․운영 규정)에 범정부지원위원회 및 실무추진위원회의 설치․운영 근거는 마련하였다. 초기의 범정부지원단에서 ‘지원위원회’로 명칭을 변경하고, 6개 부처(복지․과기․산업․중기․식약․금융) 합동으로 지원조직을 구성․추진해오고 있다. 아울러 범정부실무추진단을 ‘실무추진위원회’로 명칭을 변경하고, 전문적인 검토를 위하여 치료제, 백신, 방역물품 각 분야별로 전문위원회가 구성되어 있다.
② 역할 및 내용
코로나19 치료제․백신개발과 방역물품․기기 국산화로 감염병 대응전략(주권) 확보 및 바이오헬스 산업 육성을 목표로 한다. 접근 전략으로는 국내 선제적 개발과 수급 안정화라는 two-track 전략을 동시에 구사한다. 정부는 복지부 코로나19 백신 임상지원사업, 코로나19 치료제․백신 비임상지원사업 등을 통해 제넥신, SK바이오사이언스, 진원생명과학 등 국내 백신 개발 기업의 비임상 및 임상 시험 관련 R&D 자금을 지원하고 있다. 또한 임상시험 과정에서 피험자 모집 및 기관윤리심사위원회(IRB) 등의 애로사항 해결을 돕고 임상시험 진행을 신속하게 지원하기 위해 국가감염병임상시험센터를
|
|
코로나19 치료제․백신개발 범정부 지원단 (단장) 복지부장관․과기정통부장관 / (간사) 복지부 보건의료정책실장, 과기정통부 연구개발정책실장 |
|
|||||||
|
|
(위원) 기재․산업․중기․국무조정실 차관, 식약처장, 질병관리청장, 민간전문가 등 |
|
|||||||
|
|
|
|
|
|
|
|
|
||
|
|
기업 애로사항 해소 지원센터 (한국보건산업진흥원) |
|
|
지원단 사무국 |
|
||||
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||
|
|
실무추진단 (단장) 국립보건연구원장, 과기정통부 연구개발정책실장 / (간사) 연구기획과장, 생명기술과장 |
|
|||||||
|
|
(산) 주요 개발기업 및 협회 / (학) 학회 및 학계 전문가 / (연) 출연 및 민간연구소 / (병) 중앙임상지원TF, 의료계 / (정) 각 부처 국장급 |
|
|||||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
|
치료계 분과 (분과장: 민간전문가) 산․학․연․병․정 실무자 참여 |
|
백신 분과 (분과장: 민간전문가) 산․학․연․병․정 실무자 참여 |
|
방역물품․기기분과 (분과장: 민간전문가) 산․학․연․병․정 실무자 참여 |
|||||
가동하였다. 본 국가감염병임상시험센터는 임상역량을 보유한 거점병원과 환자확보를 담당한 감염병 전담 병원 간 컨소시엄으로 구성하여 기업의 임상시험 진행을 지원한다. 여기에는 국립중앙의료원, 아주대병원, 경북대병원 등을 거점으로 하는 3개의 컨소시엄 운영이 포함된다. 식약처는 코로나19 백신 개발 초기 단계부터 임상준비, 허가신청 등 전 단계에 걸쳐 전담 심사팀을 운영하고 허가신청 예정 90일 전부터 1:1 사전 상담과 허가자료 사전검토, 신속 심사․허가 등을 지원 중이다.
(2) 치료제․백신․방역 전방위적 대응
(가) 치료제
전 세계적으로 코로나19 치료제가 없는 가운데 전문가 권고안을 바탕으로 타질환 치료제 7종을 허가범위 초과사용(off-label use) 의약품으로 지정하여 임시적으로 사용함을 허용하였다. 이는 환자별 임상의사 판단으로 제한적인 활용이 가능하나 효과는 불확실하다.
이와는 별도로 기존 약물의 사용범위를 확대하는 약물재창출(drug re-positioning) 방식으로 신속개발을 지원해오고 있다. 긴밀한 산학연 협력을 바탕으로 한국파스퇴르연구소, 한국화학연구원이 성과를 창출 중이다. 국내 주도 임상시험약물과 해외 글로벌 임상시험 국내 참여 건을 포함하여 총 14건이 식약처에 승인되어 임상이 진행되고 있다. 대웅제약을 중심으로 카모스타트 등이 저분자의약품으로 지원받고 있다. 이와는 별도로 코로나 환자로부터 추출, 정제한 고면역글로불린(녹십자)과 특이 단클론항체(셀트리온)가 개발되어 임상연구를 거쳐 허가를 받았다. 이 경우 감염 초기에 사용할 경우 중증으로의 이행을 저지하는 등 부분적인 치료효과가 검증되었다.
(나) 백신
팬데믹 대비 백신은 개발의 위험성 및 수요의 불확실성으로 인해 정부주도형 지원정책이 필요하다. 아울러 비임상 단계로부터 개발을 가속화하기 위한 신속생산 및 인허가 전략이 필요하다. 이를 위해 정부부처별로 후보 발굴, 비임상, 임상 및 임상시료 생산과 인허가에 이르는 단계별로 추진하고 있다.

[그림 특집1-4] 코로나19 백신 국내개발 범정부 지원단의 부처별 역할
① 해외백신 수급전략
코로나19 발생초기 2020년도 중반까지는 ‘코로나19 백신 도입방안’에 따라 1단계로 국민의 60%(약 3,000만 명) 분량 백신을 우선 확보하고 이 중 20%를 코백스 퍼실리티(COVAX-Facility)를 통해 확보할 계획을 추진한 바 있다. WHO가 제안하듯 공공재 성격의 백신을 ‘공정한 할당 메커니즘’에 따라 백신은 1단계로 코백스 퍼실리티에 참여하는 모든 국가(우리나라 포함 76개국)에 제공되고 인구수에 비례하게 제공한다. 코백스 퍼실리티에 참여하는 국가는 늘고 있으나, 백신 최대 생산국인 미국과 중국은 가입 하지 않은 상황에서 세계 각국은 별도로 개별적인 백신 구매 계획을 세우고 있다. 이에 따라 우리나라도 코백스 퍼실리티 외에 해외기업으로 직접 우리나라 기업 및 정부가 구매계획을 별도로 추진해오고 있다. 해외 허가백신 긴급수입을 통한 물량을 확보하고 전문위원회 검토와 심의를 거쳐 도입을 결정해오고 있다. 이와는 별도로 정부가 해외기업으로부터 직접 물량을 공급받는 별도의 방안을 추진하여 2021년 7월 현재 우리나라는 전 국민 대상 접종량의 2배에 가까운 백신물량을 확보하였다(계약 수준).
② 국내 백신신속개발 지원
백신개발 전주기를 포괄하는 R&D 투자를 확대하여 임상 3상 연구까지 정부가 지원한다. 다양한 후보군 중에서 해외 R&D자금을 수주한 경험 등 국제적 인지도가 확보된 후보를 중심으로 집중 지원한다. 아울러 정부가 백신 비축정책을 수립하여 민간 개발참여를 적극적으로 유도한다. 현재 국내 5개사의 총 7개 제품(DNA백신, 합성항원백신 및 벡터형 백신 포함)이 임상연구 허가를 받아 진행 중이다.
③ 접종
백신접종 관련하여 질병청은 기존 중앙방역대책본부 인력 중심의 예방접종대응단을
|
|
|
코로나19 예방접종 대응 추진 단장 (질병관리청장) |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
전문가 그룹 (기존 위원회 및 자문위원단 등) |
|
|
|
|
|
|
대응 협의회 (관계부처 실장급) |
|||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
의료계 협의체 |
|
|
|
부단장 (질병관리청 차장) |
|
|
백신도입지원관 |
|||||||
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
상황총괄반 |
|
|
예방접종관리반 |
|
|
자원관리반 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
상황총괄팀 |
|
|
예방접종관리팀 |
|
|
백신도입팀 |
||||||||
|
상황 관리 및 대외 협력 총괄 |
|
|
예방접종 계획․시행 총괄 |
|
|
백신도입 및 구매계획 총괄 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
홍보관리팀 |
|
|
접종기관관리팀 |
|
|
백신유통관리팀 |
||||||||
|
예방접종 홍보 계획․시행 총괄 |
|
|
접종기관 교육․관리 총괄 |
|
|
백신유통 및 수급관리 총괄 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
시스템관리팀 |
|
|
접종자원관리팀 |
|
|
피해보상심사반 |
||||||||
|
|
||||||||||||||
|
접종 관련 시스템 구축 관리 총괄 |
|
|
접종인력 및 자원 관리 총괄 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
이상반응관리팀 |
||||||
|
|
|
|
|
|
|
|
|
이상반응 감시․관리 총괄 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
피해보상심사팀 |
||||||
|
|
|
|
|
|
|
|
|
이상반응 피해보상 심사 총괄 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
지자체 예방접종 추진단 (시․도, 시․군․구) |
|
|||||||||||
자료: KISTEP, 기술동향브리프, 2021.08
[그림 특집1-5] 코로나19 예방접종 대응 추진단 구성
확대한 ‘코로나19 예방접종 대응 추진단’을 출범하였다. 추진단은 질병청장이 단장을 맡고 질병청 내 4반, 1관, 10개 팀으로 구성되며, 4개 반은 상황 총괄반과 예방접종관리반, 자원관리반, 피해보상심사반으로 구성되어 있다. 현재 2021년 11월말까지 인구의 70%를 대상으로 집단면역을 실현하는 목표로 진행 중이다.
(다) 방역물자
단기적으로 국내생산이 불가능한 제품은 수입을 통한 재고 확보에 주력한다. 비용상 국내생산이 어려운 경우(예: 방호복) 국내 유사업체 활용을 검토한다. 생산 가능 품목은 정부비축, 공장증설을 통해 생산여력 극대화 및 안정적 원부자재 수급을 지원한다. 중장기적으로 국산제품이 부재하거나 성능개선이 필요한 경우 연구개발 지원, 활용이 저조한 경우 사용자 평가 등을 통해 신뢰성 확보와 전략적 수출을 지원한다. 아울러 연구중심병원의 요청을 토대로 하여 중앙사고수습본부 관리물자 리스트 및 방역물품/장비목록을 중심으로 국내수요 추산과 현장 수요조사를 거쳐 주요 품목별 지원대책 도출을 진행한다. 이에는 1) 핵심방역장비, 2) 진단장비 및 키트, 3) 기타의료장비 별로 의료기기 해당 여부와 국산 대체 가능성을 타진하고 확보방안을 마련하였다.
(2) 코로나19 대응 주요성과
과학기술 분야에서는 코로나19의 예방, 진단, 추적, 격리․치료, 백신 및 치료제 개발, 코로나19 정보 제공 등 국내 과학기술의 역량을 집대성하여 다양한 성과를 창출함으로써 현재 코로나19 종식과 더불어 향후 신․변종 감염병에 대처하기 위한 중요한 역할을 담당하였다.
[표 특집1-2] 코로나19 대응 전주기별 주요 성과
|
구분 |
성과 |
개요 |
|
예방 |
코로나19 바이러스 유전자 지도 완성 |
차세대염기서열분석장비를 기반으로, △바이러스가 숙주세포 내에서 생산한 전사체 분석, △바이러스 RNA의 화학적 변형 발견 * 세계적인 학술지 ‘Cell’에 논문 게재(2020.4.) |
|
CCTV를 활용한 발열자 조기 발견 솔루션 개발 |
열화상 카메라를 통해 체온 측정, 마스크 착용 감지 기능 구현과 함께 마스크 미착용 등의 이벤트 발생 시 알림 기능 개발 |
|
|
질병관리본부 콜센터 지원 |
청각․언어장애인이 코로나19의 불안으로부터 원활하게 의사소통할 수 있도록 중계서비스를 제공 |
|
|
항균․항바이러스 공조장치 개발 |
공기청정기, 공기살균기, 공조시스템 등 다양한 공조 장치에 활용 가능한 항균․항바이러스 공조 필터 기술 개발 |
|
|
진단 |
항체․항원 진단키트 개발 |
액세스바이오(2020.10)와 셀트리온(2020.10.)이 항원 신속 진단키트와 항원 면역진단키트의 FDA EUAs를 획득, SD 바이오센서(2020.11)는 항원, 항체 신속진단키트에 대해 식약처의 일반 허가를 획득 |
|
신개념 기법 활용 진단법 |
나노엔텍, 랩온어칩(lab-on-a-chip) 기술을 적용한 코로나19 및 독감 항원 동시 진단 키트를 유럽 시장 출시 (2020.12) |
|
|
추적 |
통신 데이터(위치정보) 제공 |
위치정보 제공 과정에 혼란이 발생하지 않도록 선제적으로 감염병 예방법의 개정 사항을 적극적으로 알리고, 원활한 업무협조를 전기통신 사업자에게 요청하는 등 방역당국의 위치정보 확인을 위한 필요사항에 적극 협조․지원 |
|
전자출입명부 도입 지원 |
QR코드 생성 시 개인정보 비식별 처리, 개인정보의 암호화 및 분산 저장, 전송 시 보안 적용 및 이상 모니터링 등 전반적으로 양호한 보안 수준으로 안전하게 서비스를 운영 |
|
|
치료제 |
마우스 및 영장류 모델 개발 등 전임상시험 지원 |
국내 산․학․연의 코로나19 치료제 후보물질의 효능을 신속하게 확인할 수 있는 영장류 동물모델개발 및 지원(한국생명공학연구원), 그리고 코로나19 마우스 모델 개발 확립 및 지원(국가마우스표현형분석사업단) 등 코로나19 치료제 전임상 전주기 지원체계 구축 |
|
약물재창출 연구 및 신개념 치료제 개발 지원 |
한국파스퇴르연구소 및 한국화학연구원을 중심으로 약물재창출 연구의 핵심인 약물스크리닝 연구를 수행 - (파스퇴르연) 약 3,000여 개의 약물스크리닝을 통해 시클레소니드 등 효능이 있는 후보 약물 20여 종 발굴 - (화학연) 우선적으로 국내 의료현장에서 요청하는 관심 약물에 대한 스크리닝을 수행하고 또한 1,500개의 약물에 대한 대규모 스크리닝 진행 |
|
|
백신 |
출연연(화학연, 생명연) 합성항원 백신 개발 |
- (생명연) 고려대와의 공동연구를 통해 코로나19의 재조합 단백질 백신 연구를 진행하여 백신 후보물질 개발 - (화학연) 백신 항원을 인체 내로 효과적으로 전달할 수 있는 기술을 개발하여 체액성 면역반응 및 세포성 면역반응을 동시에 향상시킬 수 있는 백신 개발 신규 플랫폼 기술을 확립 |
|
신개념 백신 개발 지원 (전달체 백신 등) |
(휴벡바이오) RBD(Recepter Binding Domain) 기반으로 항원을 제작 (건국대) 코로나19 예방용 백신 개발을 위한 재조합 단백질 항원 및 면역증강제 플랫폼 기술 개발 (에이치케이이노엔) 백신 효능 향상을 위해 세포투과 펩타이드(CPP: Cell Penetrating Peptide)를 면역원과 결합하여 세포에 직접 전달될 수 있도록 제작 (셀리드) 아데노바이러스 전달체 기반 코로나19 백신 개발 중 |
|
|
근거기반 코로나19 정보제공 |
코로나19 연구정보 통합 제공 |
(질병청) 코로나19 임상역학정보 공개(질병보건 통합 관리시스템, https://is.cdc.go.kr) 및 유전체 정보 생산 작업 착수 (생명연) 전 세계에 흩어져 있는 코로나19 연구 관련 정보들을 수집하고 이를 분석하여 국내 연구자들에게 제공하려는 목적으로 ‘코로나19 연구정보 포털’ 제공 (https://www.kobic.re.kr/covid19) |
|
기초과학연구원(IBS) 코로나19 과학리포트 |
△코로나19 분석 보고서 ‘코로나 사이언스’ 발간, △IBS 데이터 사이언스 그룹을 중심으로 코로나19 관련 가짜뉴스의 특성을 분석 |
자료: 범부처 코로나19 대응지원 보도자료 등 참조.
우리나라의 코로나19 대응은 세계적 위기 속에서 상대적으로 우수하다는 평가를 받으며, K-방역이라는 브랜드를 만들어 냈으며, 이를 위해 과학기술과 ICT 또한 적극적으로 활용되었다. 정부는 무엇보다 코로나19 대응을 하기 위하여 국내 치료제․백신 개발 등에 2020년 기준으로 2,186억 원을 지원하였으며 2021년에는 441억 원이 증가한 2,627억 원을 지원할 예정이다.
[표 특집1-3] 코로나19 백신 및 치료제 개발을 위한 정부 예산 규모
|
사업내역 |
’20년 예산(추경포함) |
’21년 예산 |
비고 |
|
코로나19 치료제․백신 개발 |
1,115억원 |
1,528억원 |
복지․과기 |
|
연구․생산 인프라 구축 |
662억원 |
564억원 |
산업․과기․복지․식약․질병 |
|
방역물품․기기 고도화 |
327억원 |
345억원 |
복지․과기․중기 |
|
기초연구 강화 |
82억원 |
190억원 |
과기․복지․산업․식약․특허 |
|
합계 |
2,186억원 |
2,627억원 |
|
자료: 관계부처 합동 보도자료(2021.2.20)
정부는 코로나19 완전 극복을 위한 치료제․백신 등 개발지원 대책을 발표(2020.6.)하고, 개발단계별로 전주기에 걸쳐 기업 등을 집중 지원하고 있다. 특히 국산 백신․치료제의 개발과 활용을 지원하는 동시에 해외에서 개발된 우수 치료제인 렘데시비르를 도입하고(특례수입 승인(2020.6.3.)), 백신을 신속히 확보하기 위해 식약처 허가(2020.7.24.) 및 해외 백신(아스트라제네카, 화이자, 모더나 등)을 우선 구매를 추진하는 등 ‘투트랙(two-track) 전략’을 실행하고 있다. 또한 방역물품․기기의 수급 안정화 및 11대 핵심 의료기기의 국산화를 지원하였다. 또한, 고위험군 경증․중등증 성인 환자의 임상 증상을 개선하는 효과를 나타낸 국내 최초 항체치료제인 셀트리온의 렉키로나주는 임상 3상 결과를 제출하는 조건으로 허가(2020.2.5.)를 받았으며, 2021년 5월 기준으로 14여 개의 기업이 치료제 개발에 매진하고 있다.
[표 특집1-4] 현재 진행 중인 국내 코로나19 치료제 임상시험 현황(2021.5.28. 기준)
|
연번 |
의뢰자 |
제품명(성분명) |
임상시험 내용(요약) |
단계 |
승인일 |
|
1 |
크리스탈 지노믹스(주) |
CG-CAM20 (카모스타트) |
코로나19 환자 대상 시판 의약품(췌장염약)의 안전성․유효성 평가 |
2상 |
2020.07.01 |
|
2 |
(주)대웅제약 |
DWJ1248정 (카모스타트) |
경증 및 중등증 코로나19 환자 대상 시판 의약품(췌장염약) 안전성․유효성 평가 |
2․3상 |
2020.07.06 |
|
중증 코로나19 환자 대상 DWJ1248과 Remdesivir 병용요법 안전성․유효성 평가 |
3상 |
2020.12.31 |
|||
|
코로나19 확진자와 접촉한 자 등 대상으로 코로나19 바이러스 노출 후 예방에 대한 DWJ1248 안전성․유효성 평가 |
3상 |
2021.01.22 |
|||
|
건강한 성인 대상 DWJ1248 투여 후 용량에 따른 안전성․약동학적 특성 평가 |
1상 |
2021.02.23 |
|||
|
3 |
(주)제넥신 |
GX-I7 |
코로나19 환자 대상, 임상시험 의약품(항암제)의 안전성․예비 효과 탐색 |
1b상 |
2020.08.07 |
|
4 |
(주)셀트리온 |
CT-P59 (레그단비맙) |
경증, 중등증 코로나19 환자 대상 표준 치료와 병행하여 안전성․유효성 평가 |
2․3상 |
2020.09.17 |
|
5 |
(주)대웅제약 |
DWRX2003 (니클로사미드) |
건강한 성인 대상 시판 의약품(구충제)의 안전성․내약성 및 약동학적 특성 평가 |
1상 |
2020.10.08 |
|
6 |
한국 엠에스디(주) |
MK-4482 |
코로나19 성인 입원 환자 대상 임상시험 의약품 (인플루엔자약)의 안전성․유효성, 약동학 평가 |
2․3상 |
2020.10.29 |
|
7 |
뉴젠 테라퓨틱스 |
뉴젠나파모 스타트정 (나파모스타트) |
건강한 성인 남성 대상 시판 의약품(항응고제)의 안전성․내약성 및 약동학적 특성 평가 |
1상 |
2020.11.03 |
|
8 |
동화약품(주) |
DW2008S |
중등증 코로나19 환자 대상 임상시험 의약품(천식약)의 안전성․유효성 비교 평가 |
2상 |
2020.11.23 |
|
9 |
(주)이뮨메드 |
hzVSF-v13 |
코로나19 중등증 및 중증 환자 대상 임상시험 의약품(인플루엔자약)의 표준 요법과 각 용량별 hzVSF-v13 병용투여 시 안전성․유효성 및 안전성을 단독 표준 요법군과 비교 평가 |
2상 |
2020.12.07 |
|
10 |
부광약품(주) |
레보비르 캡슐30mg (클레부딘) |
경증 및 중등증 코로나19 환자 대상 시판 의약품(B형간염약)의 안전성․유효성 평가 |
2상 |
2021.01.07 |
|
11 |
(주)녹십자웰빙 |
라이넥주 (자하거 가수분해물) |
중등증 코로나19 환자 대상 시판의약품 (간기능개선약)의 안전성․유효성 평가 |
2a상 |
2021.02.26 |
|
12 |
(주)종근당 |
CKD-314 (나파모스타트) |
코로나19 폐렴 입원환자 대상 시판 의약품 (항응고제)의 안전성․유효성 평가 |
3상 |
2021.04.15 |
|
13 |
(주)글락소 스미스클라인 |
VIR-7831 (GSK4182136) |
경증 및 중등증 코로나19 환자 대상 임상 시험 의약품의 안전성․내약성․약동학 평가 |
2상 |
2021.05.04 |
|
14 |
한국유나이 티드제약(주) |
UI030 (부데소니드/ 아포르모테롤) |
코로나19 입원환자 대상 임상시험 의약품의 안전성․유효성 평가 |
2상 |
2021.05.28 |
자료: 식약처 보도자료, 2021.5.28.
백신의 경우 국제백신연구소, SK바이오사이언스(주), ㈜유바이오로직스, 셀리드, (주)제넥신, 진원생명과학(주) 등의 6개 기업이 임상 1상 이상에 진입하는 성과를 달성하였다.
[표 특집1-5] 백신 관련 각 기업별 국내 임상 추진 현황 및 계획
|
구분 |
SK바이오 사이언스 |
유바이오로직스 |
제넥신 |
진원생명과학 |
셀리드 |
|
플랫폼 |
합성항원백신 |
DNA백신 |
바이러스벡터 |
||
|
진행 현황 |
임상 1/2상 |
임상 1/2상 |
임상 1/2a상 |
임상 1상 |
임상 1/2a상 |
자료: 관계부처 합동 보도자료, 2021.2.20.
[표 특집1-6] 현재 진행 중인 국내 코로나19 백신 임상시험 현황(2021.1.21. 기준)
|
연번 |
의뢰자 |
제품명 |
임상시험 내용(요약) |
단계 |
승인일 |
|
1 |
국제백신연구소 |
INO-4800 |
건강한 성인 대상으로 피내 접종 후 전기천공법(EP: Electroporation)을 이용하는 코로나19 백신의 안전성, 내약성 및 면역원성 평가 |
1․2a상 |
2020.06.02 |
|
2 |
에스케이바이오 사이언스(주) |
NBP2001 |
건강한 만 19~55세 성인을 대상으로 코로나19 백신의 안전성, 내약성 및 면역원성 평가 |
1상 |
2020.11.23 |
|
3 |
(주)셀리드 |
AdCLD- CoV19 |
건강한 성인 자원자를 대상으로 코로나19 백신의 안전성, 면역원성 확인 |
1․2a상 |
2020.12.04 |
|
4 |
진원생명과학(주) |
GLS-5310 |
건강한 성인에게 피내 접종하는 코로나19 백신의 안전성, 내약성 및 면역원성 평가 |
1․2a상 |
2020.12.04 |
|
5 |
(주)제넥신 |
GX-19N |
건강한 성인을 대상으로 코로나19 백신의 안전성, 내약성 및 면역원성 탐색 |
1․2a상 |
2020.12.11 |
|
6 |
에스케이바이오 사이언스(주) |
GBP510 |
건강한 성인 및 고령자를 대상으로 코로나19 백신의 안전성, 내약성 및 면역원성 평가 |
1․2상 |
2020.12.31 |
|
7 |
㈜유바이오 로직스 |
유코백-19 |
건강한 성인을 대상으로 코로나19 백신의 안전성, 내약성 및 면역원성 평가 |
1․2상 |
2021.01.20 |
자료: 식약처 보도자료 참조, 2021.1.21.
(3) 향후 과제
(가) 집단면역 실현
가장 큰 과제는 정부의 목표대로 2021년 11월 말까지 인구의 70%를 대상으로 접종을 완료하여 집단면역의 실현이 가능할 것이냐이다. 실제 우리나라는 방역을 선제적으로 진행하여 바이러스의 초기진압에 큰 성공을 거둔 것은 사실이다. 그러나 전 세계의 다른 나라들이 신속하게 백신의 선구매를 추진하였지만, 우리나라는 상대적으로 해외백신 확보에 뒤처지는 상황이 초래되었다. 현재 아스트라제네카, 화이자 및 존슨앤존슨 제품의 확보와 이의 접종이 확대되고 있으나 2021년 7월 초 현재 1회 접종자 30% 정도, 2회 접종완료자 10% 정도에 불과하다. 2회 접종 후 2주 후에 방어면역이 완성됨을 가정할 경우 11월 초까지 3,000만 명 대상 2회 접종 완료를 위한 백신 분량의 확보와 접종계획에 차질이 없이 진행될 수 있도록 만전을 기해야 한다.
(나) 국내임상 연구완료
코로나의 상시화를 대비하여 국내 백신 임상과 출시가 절실하다. 선진국의 예를 살펴볼 때 자체적으로 임상연구(위약임상) 진행시 백신의 임상연구에 3만 명 및 최소 5,000억 원~1조 원의 비용이 예상된다. 현재 방역이 철저한 우리나라의 경우 환자의 발생 수가 적기도 하거니와 한정적인 정부자금으로는 국내임상은 절대적으로 불가하다. 위약임상을 대체하는 방안으로 최근 식약처는 비교임상 방안 가이드라인을 제정하였다. 이 경우 모집인원을 5~6,000명으로 축소하고 임상비용을 1,000억 원 정도로 대폭 간소화하여 진행이 가능할 것으로 예상된다. 그럼에도 불구하고 비교대상이 되는 해외백신의 유형선택이 어려우며 아울러 해외개발사로부터 비교약물 확보에 대한 양해가 필요한 상황이기 때문에 이를 원활히 할 수 있는 정부의 외교적 노력이 필요하다.
(다) 국내 원천기술 확보
향후 다양한 변이주 발생으로 인하여 현재 사용하는 백신의 효능저하가 예상되며 이에 따라 변이주 및 변종에 대한 추가개발이 필요하다. 이를 위해 코로나 사태에서 백신의 선두주자로 부상한 mRNA 백신기술의 국내 조기 확보가 절실하다.
mRNA백신은 크게 3가지의 주요 요소기술(mRNA 원천기술, 안정성 증강기술 및 백신항원디자인 기술)의 조합이 요구된다. 3개 기술 모두 지난 20여 년 간 미국 대학과 국립연구소에서 개발되어 주요회사(모더나, 큐어백, 바이오앤테크 등)에 기술 이전을 통해 개발된 것으로서 코로나에 대응하는 이러한 삼지창 기술은 거미줄 같이 촘촘한 지적재산권 보호막으로 가려져 있다. 본 기술의 국내 조기 정착을 위해 국내 제약사들 간의 컨소시엄이 구성되어 있으나 우리나라와 같은 후발주자에게는 엄청난 배타적 요소로서 난관이 예상된다.
(라) 글로벌 백신허브 구축
현재 우리나라에는 포스트 코로나 대비 글로벌 백신 허브구축이 구상되고 있다. K-방역의 성공을 백신의 성공으로 연결한 이어달리기를 준비하고 있는 것이다. 이에 글로벌 연구투자 움직임과 mRNA 백신성공 사례를 깊이 조명할 필요가 있다. mRNA백신은 신속생산 플랫폼으로서 실상 개발 자체는 장기간(약 20년)에 걸친 투자(약 15조 원)의 산물임을 상기할 필요가 있다. 신속대응 기술은 말 그대로 신속하게 개발된 것이 아니며, 눈에 보이는 빙산(가시화 된 기술)은 실상 훨씬 더 큰 모습(장기간의 투자)의 극히 일부일 뿐이다. 최근 CEPI(전염병대비혁신연합)는 팬데믹 발생 100일 이내에 활용 가능한 신속기술과 변종대비 범용백신 및 미래 발생가능 팬데믹 백신후보 발굴에 4조 원의 연구개발비 투자를 결정했다. 이는 향후 10년을 대처하는 백신허브 구축과 글로벌 리더십 확보에 필수적 고려사항이다.

코로나바이러스는 인간을 포함한 다양한 동물에서 호흡기 질환을 일으키는 RNA바이러스의 일종으로 비교적 가벼운 감기 등의 원인이 되는 것으로 알려져 있다. 그러나, 2002년 최초 보고된 SARS-CoV, 2012년의 MERS-CoV와 2019년 말 발생한 SARS-CoV-2는 강력한 전파력과 높은 치사율을 동반하는 신변종 감염병으로 전세계적 대유행(팬더믹)으로 이어졌다.
중국 우한에서 처음 보고된 SARS-CoV-2는 최초 2019-nCoV (2019-novel coronavirus)로 불리었다가 2002년에 대유행한 SARS-CoV와 계통학적으로 유사하여 SARS-CoV-2로 명명되었고 이들간의 핵산 염기서열의 유사성은 79.6%이고 숙주 세포막의 수용체인 ACE2 (Angiotensin-Converting Enzyme 2)를 통해 세포로 침입하는 공통적인 특징을 가진다. 특히 SARS-CoV-2에 의한 중증 호흡기 증후군을 코로나19(COVID-19)로 호칭하여 관리하고 있다.
바이러스의 진단기술은 전염병 대응 초기 단계의 방역에 가장 핵심적이므로, 신속하고 정확한 감염 여부 판정을 통해 감염환자 격리와 치료로써 전파를 늦출 수 있다.
코로나19는 RNA를 유전물질로 가지고 있는 대표적인 RNA 바이러스의 일종으로 분자진단, 면역진단 및 영상학적 진단법에 코로나19의 병리 및 진단에 활용되고 있다. (Lippi와 Plebani, 2020, [그림 2-1])
코로나19의 원인인 SARS-CoV-2를 포함한 바이러스의 검출에는 직접적으로 핵산을 증폭하는 방식의 ‘분자진단(molecular test)’ 방식과 바이러스와 인체의 면역반응을 이용하는 ‘면역진단(immunological test)’ 방식으로 크게 구분된다.
면역진단에서는 바이러스의 항원을 직접적으로 검출하는 ‘항원진단(antigen test)’과 바이러스 감염으로 생성된 항체를 검출하는 ‘항체진단(antibody test)’으로 구분되며, 샘플 채취 방식, 측정방식 및 정확도 민감도에서 그 활용방법과 적용법이 결정된다 (Vandenberg 등, 2020)
|
|
자료:Lippi와 Plebani, 2020.
[그림 특집2-1] 코로나 19 감염 진행에 따른 병리 및 진단
가. 대응성과
코로나19의 양성 환자의 진단과 판정 분야에서는 우리나라를 포함한 여러 국가에서 조기 진단을 위한 분자진단법을 개발하여 공개하였으며, WHO에서도 홈페이지를 통해 각 국가의 진단법을 모아서 공개하여 전 세계가 공동 대처할 수 있도록 하고 있다.
감염병 초기 대응에서 양성환자를 판정할 수 있는 진단검사 시약과 진단장비의 보급은 필수적이나, 진단의료기기의 현장 투입을 위해서는 임상성능평가를 포함하는 승인 절차에 오랜 시간이 소요된다. 따라서, 코로나19와 같은 대유행 감염병에 빠르게 대응하기 위해서 미국 FDA에서는 긴급사용승인 (Emergency-Use-Authorization)제도를 통해 초기 방역에 필요한 진단시약을 보급하고 있다. 특히 이번 코로나19 사태에서 긴급사용 승인제도는 의약품, 백신, 방호기, 의료기기 등에 확대 적용되고 있으며, 우리나라에서도 이번 코로나19를 계기로 긴급사용승인제도가 도입되었다.
국내 진단기기는 코로나19 발생초기 방역당국과 기업을 주도로 정확도와 민감도가 가장 확실하게 보장되는 분자진단 키트 개발에 착수하여, 빠르게 현장에 도입이 되었다. 방역 당국은 2020년 1월 20일에 국내 첫 확진자가 발생된 시점에 진단기기 개발 검토를 시작하여, 코로나19 확진자가 20명이 넘기 전인 2월 4일 7건의 분자진단키트를 1차 긴급사용승인하여 코로나19 선별진료소에 투입하였다. 같은 해 6월 25일에는 1시간 이내에 결과를 판정할 수 있는 응급용 분자 진단키트 9건을 추가 승인하였다.
특히, 우리나라는 2020년 5월 1일에 코로나19 진단의료기기의 신속한 정식승인 검토 정책을 발표하여 신뢰도가 높은 분자진단키트를 다수 확보하여 방역현장에 투입하였다. 같은 해 4월 정부는 ‘범정부 코로나19 지원협의회’를 통해 진단기기의 확보, 연구개발 및 기업 밀착 지원을 통해 국가적인 진단역량 강화와 더불어 국내 기업주도의 진단기기 개발의 활성화를 촉진하였다. 이러한 결과로 최근 우리나라는 국내 1일 약 60만명 이상 분자진단을 통해 진단검사를 시행하는 등 K-방역을 통해 국내 진단 역량을 제고하는 계기가 되었다. 그 결과 미국 FDA와 유럽의 CE 인증 사례 증가로 이어졌으며, 2020년 말 221종(분자진단 105, 항원 44, 항체 72)이 식약처의 수출제조승인 제품으로 허가되어, 전세계 170여 국가에에 총 4억 9,679만 명분이 수출되었고, 약 2조 5천억 원 상당의 수출성과도 이루었다(식약처-관세청 보도자료).
코로나19 대응을 위해 과기정통부는 출연연 주도의 산학연병이 참여하는 감염병 의료기기 협의체를 구성하였으며 연구개발지원협의체를 통해 52개 진단기업에 진단기기의 진단소재 공급, 유효성평가 및 임상검체 제공 등 350건 이상의 기업 수요에 대응하였다. 특히 생명(연)의 H-GAURD 글로벌프론티어 사업단에서는 2021년 6월까지 36개 기업에 코로나19에 대한 항원 4종을 항체진단기기 개발을 위해 공급하였고, 화학(연) 및 나노종기원에서 자체 개발된 분자진단키트는 기업으로 기술이전 되어 미국 FDA의 긴급사용승인으로 이어졌다.
나. 향후과제
신병종 및 원인불명 바이러스 대비를 위해 예측-진단-치료-예방(백신) 분야에 국가 차원의 신속 대응 체계 확립과 새로운 바이러스에 대처할 수 있는 신속한 연구개발과 기존 기술의 한계를 돌파할 수 있는 새로운 기술이 적극적으로 도입되어야 한다. 그 예로 이번 코로나19의 경우, mRNA 백신 기술이 이례적인 개발 속도와 빠른 임상시험을 통해 감염병 대응의 새로운 전기를 마련하였으며, 인공지능 활용 등 새로운 신약개발의 패러다임이 도입되어 다양한 치료제 후보물질들이 현재 최종 사용 허가를 목전에 두고 있다.
특히, 해외로부터 신변종 감염병이 유입될 때, 초기 대응에 실패할 경우 국민의 안전 및 국가경제에 심각한 위협으로 작용하기 때문에, 진단분야에서는 초기에 신속 대응할 수 있는 초고속, 고감도의 현장형 진단기술 필요하다. 또한, 감염병의 장기화에 대비해서 방역뿐만 아니라, 국민이 현장에서 안전하게 빠르게 검사를 받을 수 있는 진단시설 및 진단장비와 같은 기반 시설의 선제적 구축도 매우 중요하다.
이러한 이유로 다양한 진단기기들이 국내외에 도입되어 활용되고 있으나, 진단기기의 특성에서 발생하는 한계 기술을 해소하기 위한 다양한 신기술의 개발에 대한 필요성은 지속적으로 제시되고 있다.
미국은 긴급사용승인제도를 현재까지 운영하고 있으며, 코로나19 일일 감염자가 폭발적으로 증가하고 있는 상황에서 기존에 보편화된 분자진단과 면역진단 이외에 다양한 진단기술의 승인 검토를 적극적으로 하여 현장에 도입하고 있다. 특히 현장진단, 자가 검체 채취(self home collection), 다중진단 등의 이슈 해결을 위해서, 등온유전자증폭, 타액 검체 진단, 자가 검체 채취, 유전자가위진단 등 새로운 진단기술을 적극적으로 도입하고 있으며, 검체 채취에서 진단 결과 판독까지 집에서 실시할 수 있는 home testing 키트로 Lucira사의 All-In-One 키트가 승인되어 의료진 처방에 의해 개인이 사용할 수 있게 되었다.
하지만, 해당 기기 특이도(양성환자 판정율)는 94%, 민감도(음성환자 판정율)는 98%로서 타 분자진단 키트에 비해 특이도와 민감도가 다소 낮아, 전문가들은 증상이 있을 경우에는 반드시 의료진의 재검진이 필요하다는 의견을 제시하고 있어 추가적인 기술 개발이 필요한 상황이다.
더불어, 미국 FDA에서는 8월 15일 자로 기존 상기도 검체(면봉 swap)를 대상으로 하는 RT-PCR 방식과 더불어, 타액기반 분자진단법(Saliva Direct COVID-19)을 추가 긴급사용승인하여, 면봉으로 인한 환자의 불편함 해소, 자가 수집으로 검체 수집 의료 종사자에게 부과되는 위험을 잠재적으로 낮출 수 있으며, 감염원의 이동을 최소화할 수 있는 기술을 도입하였다. 또한, Mammoth사와 Sherlock사의 유전자가위(CRISPR) 기반 분자진단키트가 LAMP 방식을 채택하여 FDA 승인된 바 있다.
양성환자 확진에 사용되는 분자진단기술 이외에, 코로나19의 항원과 코로나 19 바이러스에 감염되어 나타나는 항체 IgG와 IgM을 진단하는 항체진단기기와 더불어, 인체 ACE2 수용체에 결합하는 것으로 알려진 코로나19 바이러스의 표면 spike 단백질의 RBD(Receptor Binding Domain)를 항원으로 사용하는 중화항체(neutralization antibody) 진단기기를 승인하여, 백신 유효성 평가에 활용하고 있다.
또한, 중화항체 평가를 보다 간편하게 할 수 있는 대체 진단법으로서 싱가포르 듀크-NUS 의학대학원에서는 기존에 사용되는 cVNT(conventional Virus Neutralization Test)나 pVNT(psuedovirus-based VNT)를 대체할 수 있는 sVNT(surrogate VNT) 실험법을 제시하였고, 개발사인 GenScript의 제품으로 긴급사용 승인되었다 (Tan 등, 2020). 연구진이 제시한 sVNT 방식은 고위험도 바이러스를 대상으로 하는 BSL3(Bio Safety Level 3)가 필요 없는 중화항체 분석법으로 다양한 기초연구와 임상실험에 폭넓게 활용 가능할 것으로 예상된다.
|
|
자료 : 자체제작
[그림 특집2-2] 미국 FDA에 긴급사용 승인된 진단 신기술 현황
최근 코로나19 감염증에서 변이 바이러스의 지속적인 출현으로 팬더믹의 장기화와 종식에 어려움을 겪고 있다. 최초 발생한 우한에서 분리된 원종에서 알파, 베타, 감마, 및 델타의 4종의 변이주가 순차적 나타났으며, 인도에서 최초 보고된 델타 변이주의 경우, 기존 호흡기 바이러스 감염병과 비교하여 극도로 높은 전파력을 보임으로써 코로나19 감염병의 새로운 국면을 만들어 냈다.
이외에도 전세계에서 국지적 특성에 따라 새로운 변이주의 출현이 관찰되고 있고, 백신의 효용성, 전파력, 치명율의 변화뿐만 아니라, 기존 진단 방법의 효용성이 재검토되고 있다. 따라서 변이바이러스 진단에 대한 능동적인 연구개발과 대처를 통해 코로나19 장기화에 따른 방역관리에 있어서 적극적인 진단검사와 추적이 더욱 중요하게 제기되고 있다.
최근 국내 선도 진단기업의 분자진단키트는 미국 FDA와 국내 식약처의 승인을 취득하여 현장 방역 및 수출증대에 기여하고 있다. 그러나, 진단 과정 전체에 필요한 필수 진단 소재‧부품‧장비(형광시약, 핵산, 핵산추출키트, 유전자증폭장비 등)의 높은 수입의존도는 여전히 존재하고 있어 우리나라의 진단기술 및 역량 강화를 위해서는 진단소재 및 진단 장비 개발에 대한 투자 확대가 필요하다.
코로나19의 확진자 관리와 감염전파 관리에 중요한 진단키트 및 기술은 이제 치료제 개발 및 백신개발 이후의 시점에서 필요한 진단기술이 적극적으로 검토되어야 한다. 신․변종 바이러스 감염병의 출현에 신속하게 대응하기 위해서 확진자 선별을 위한 분자진단기술과 더불어, 치료제 및 백신의 효능 검증, 무증상감염자 선별을 위한 역학조사를 위해 필요한 신속하고 간편한 현장형 진단기술의 개발은 우리가 살고 있는 ‘감염병의 시대’에 반드시 해결해야 할 가장 시급한 문제이다.
|
참고문헌 |
Gitman et al., (2021) Laboratory Diagnosis of SARS-CoV-2 Pneumonia, Diagnostics 11(7), 1270.
Kevadiya et al., (2021) Diagnostics for SARS-CoV-2 infections, Nature Materials 20: 593-605.
Kim et al., (2020) Diagnostic Techniquies for SARS-CoV-2 Detection
Journal of Life Science, 30(8): 731-741.
Mardian et al., (2021) Review of Current COVID-19 Diagnostics and Opportunities for Further Development, Frontiers in Medicine 615099.
Singh et al., (2021) A comprehensive review on current COVID-19 detection methods: From lab care to Point of care diagnosis, Sensors International 100119.

가. 모델동물(마우스)을 중심으로
(1) 개발 성과
(가) COVID-19 치료제․백신 개발의 배경 및 필요성
COVID-19는 2019년 12월 최초 감염이 보고된 이후, 전 세계적으로 확진자와 사망자 수가 증가하여 WHO에 의해 ‘세계적 대유행(Pandemic)’으로 선포되었다.
2021년 3월 기준, 코로나19 바이러스 퇴치를 위한 글로벌 치료제․백신 개발 임상시험은 총 1,613건에 달한다. 치료제․백신 개발을 위한 핵심 단계 중 하나가 전임상 연구이다. 감염병 전임상 연구에는 사람을 대신할 수 있는 감염 모델동물 확보, 감염증 증상 및 병리 분석기술 및 감염병 연구가 가능한 생물안전시설의 확보 등의 감염병 대응 전임상시험 인프라 구축이 필수적이다. 이를 통해 신속한 감염병 치료제․백신 후보물질의 효능평가가 가능해진다.
(나) 주요 대응 성과
① COVID-19 모델동물 개발 및 확보
㉮ hACE2 형질전환 마우스 모델
COVID-19 바이러스(SARS-CoV-2)는 ACE2 수용체를 통해서 감염된다. 실험동물로 가장 많이 사용되는 마우스는 사람 hACE2와 다른 ACE2를 갖고 있어서 COVID-19에 감염이 되지 않는다.
(재)국가마우스표현형분석사업단(KMPC: Korea Mouse Phenotyping Center)에서는 유전자편집 기술을 이용해서 hACE2를 발현하는 유전자변형마우스 4종(10개 라인)을 개발하여 COVID-19 감염이 가능한 마우스 모델을 확보하였다. SFTPB, CCSP, CAG 라인의 경우는 세계 최초로 개발된 마우스 모델로서 기존의 마우스 모델과는 달리 사람의 COVID-19 감염증의 주요 폐 병변 및 장기별 병변 감수성 증가, 그리고 전 장기에 증상을 보이는 마우스까지 각각의 발현 조직과 발현 양이 달라 치료제 및 백신의 전임상시험에 있어 각 물질의 작용 기전과 특성에 맞는 실험 지원이 가능하다.
㉯ 햄스터 모델(Golden Syrian Hamster)
햄스터는 사람과 유사한 ACE2를 갖고 있어서 별도의 조작 없이 자연적으로 COVID-19 감염이 가능한 모델로서, 폐병변을 보이며 자연 치유되는 모델이다. KMPC에서는 국내 분리 환자의 COVID-19 햄스터 감염모델 시스템을 구축하여, 치료제 및 백신 후보물질의 효능 테스트를 지원하였다.
|
|
자료: 국가마우스표현형분석사업단
[그림 특집3-1] 유전자 편집기술 활용 COVID② COVID-19 치료제 및 백신 효능 검증 플랫폼 구축
㉮ COVID-19 감염병 연구 협력 시스템 구축 및 운용
감염병 전임상시험을 실시하기 위해서는 동물생물안전3등급 연구시설(이하 ABSL-3 시설)이 필수적이다.
KMPC는 국가적으로 시급을 요하는 상황에서 국내 ABSL-3 감염 실험이 가능한 7개 기관(건국대학교, 고려대학교 의과대학, 고려대학교 약학대학, 국제백신연구소, 서울대학교, 서울대 분당병원, 연세대학교 의과대학)과 협력하여 전임상 지원 체계를 구축하였다.
이러한 협력체계를 중심으로 시험물질 선정 및 계약, 모델동물 개발 및 공유, 표준화된 시험법의 운용, 병리 분석의 표준화와 동료심사/평가(peer review) 등을 진행하였다. 시험 기관의 특성에 따라 병리 분석(강원대, 연세의대), 분자영상 분석(분당 서울대 병원), 에어로졸 감염 실험(연세의대), 오믹스 분석(서울대) 등 고급 수요에 대응하는 감염병 전임상 분석 기술도 축적하였다.
㉯ COVID-19 치료제 및 백신 유효성 평가 시험법 확립
KMPC는 협력체계를 구축한 7개 기관과 함께 COVID-19 마우스 모델을 기반으로 치료제․백신 전임상시험 표준 시험법을 확립하였다.
모델동물에 SARS-CoV-2를 감염시킨 후 체온, 체중, 장기 무게 변화와 생존율을 측정하고, 주요 장기 조직의 병리 분석을 시행하였다. 감염 후 조직에서 바이러스 역가와 중화항체가도 측정하였다. 기관별로 차이가 없도록 표준화된 프로토콜을 기반으로 ABSL-3 협력 기관에서 동일한 방법으로 연구를 수행하였다.
㉰ 전임상시험 신청 시스템 및 전임상시험 프로세스 구축
효율적인 후보물질 테스트 신청 접수를 위하여 온라인 기반 전임상시험 신청 시스템을 개설하여, 언제나 COVID-19 치료제․백신 후보물질의 효능 평가를 신청할 수 있는 환경을 구축 제공하였다.
표준화된 10단계의 전임상시험 표준 프로세스를 구축하여 이에 근거해 후보 물질의 선정과 시험을 진행하여 수요자들이 원하는 선정 및 시험을 효과적이고 신속하게 진행하였다. KMPC에서 구축한 전임상시험 데이터 입력․분석 관리 시스템(LIMS)을 이용하여 각 시험의 결과를 전산으로 확보하여 비교 분석이 가능한 연구환경을 구성하였다. 시험 후 병리분석, 결과 논의 미팅을 거쳐서 객관화된 연구 결과를 의뢰기관에 제공하였다. 비대면 시대에 맞추어서 효율적이고 합리적인 온라인 기반 전임상시험 전체 프로세스의 공정 관리가 가능하게 되었다.
|
|
자료: 국가마우스표현형분석사업단
[그림 특집3-2] COVID
③ 치료제 및 백신 후보물질 전임상시험
2020년 과학기술정보통신부의 COVID-19 감염병 치료제․백신 비임상시험 인프라 구축 및 활용 과제를 통하여 전체 128건의 치료제․백신 후보 물질이 전임상시험을 신청하였다. 신청 건에서 중복신청을 제외한 101건 중 총 32건의 물질이 선정되어 물질의 유효성 평가가 이루어졌다.
효능 평가 선정 물질 32건은 치료제 26건, 백신 6건으로 구성되었다. 치료제 지원 물질의 작용 기전으로는 항바이러스와 항체치료제가 18건, 염증과 면역억제 기전 치료제가 7건으로 그 다음을 차지했다. 백신 지원 물질을 살펴보면 재조합 백신 3건, 바이러스 벡터 백신 1건, DNA 백신 1건, 기타 1건으로 재조합 백신의 비율이 높게 나타났다.
32건의 선정 물질 전임상시험에서는 치료제 5건, 백신 2건의 총 7건이 효능이 있는 것으로 평가되었다. 효능이 있는 것으로 평가된 한 백신 후보 물질 A의 경우, 바이러스 비감염 대조군에 비하여 SARS-CoV-2 바이러스 감염군 마우스의 체중은 약 15% 감소한 반면, 백신투여군은 유의미한 체중감소, 활동성의 감소가 전혀 관찰되지 않았다.
|
|
자료: 국가마우스표현형분석사업단
[그림 특집3-3] 과학기술통신부 지원 COVID
생존율 역시 백신투여 3군에서 100%의 생존율을 보였다. 중화항체가의 경우 저농도 보다 고농도 백신투여군이 10배 이상의 항체가 형성됨을 보였고 고농도 백신투여군의 경우 바이러스 접종 이후 중화항체가의 형성이 계속 늘어나는 양상을 보였다. 폐의 경우, 바이러스 감염군에 비해 백신투여군에서 COVID-19 마우스 모델에서 특징적으로 관찰되는 염증세포의 침윤(浸潤), 부종, 모세혈관의 확장에서 유의한 병변 감소 혹은 예방 효과가 관찰되었다.
효능이 있는 것으로 평가된 백신 후보 물질 B의 경우, 바이러스 비감염 대조군에 비하여 SARS-CoV-2 바이러스 감염군 마우스의 체중은 약 20% 감소한 반면, 백신투여군은 감염 5일 후 체중이 회복되고, 폐사한 개체가 없었다. 중화항체가의 경우도 백신 1회 접종군에 비해 백신 2회 접종군에서 2배 이상 높은 수치를 나타내었으며, 접종 14일 후에 비해 접종 25일 후에 확보한 혈청에서의 중화항체가가 더 높은 것이 확인되었다.
④ 감염병 대응 전임상시험 정보 활용 기반 구축
㉮ COVID-19 전임상시험 데이터 입력․분석 관리 플랫폼 구축
COVID-19 관련 기관별 연구가 활성화됨에 따라 다기관 실험실 데이터 관리의 필요성이 증대되었다. 따라서 KMPC에서는 실험데이터의 전사적 공유가 가능한 자동화된 전임상 데이터 입력․분석 온라인 관리 시스템(LIMS: Laboratory Information Management System)을 구축하였다. 수행된 모든 전임상시험 결과는 LIMS에 입력․관리되고 데이터베이스화되어 향후 국내 연구진들이 활용할 수 있는 기반을 마련하였다.
|
|
자료: 국가마우스표현형분석사업단
[그림 특집3-4] COVID-19 전임상시험 데이터 관리 분석시스템(LIMS)
요약하면, KMPC에서는 COVID-19 대응 전임상시험을 위해 모델동물의 개발, 감염병 연구 협력 시스템 구축 및 시설 지원, 전임상시험 시험법 확립과 전임상시험 프로세스 구축을 통한 전임상시험 지원 인프라를 확립한 것이다. 이를 통해 치료제․백신 후보 물질의 신속한 스크리닝를 수행하였고, 유효성을 보인 물질이 약물 개발의 다음 단계로 진행되도록 하여 치료제․백신 개발 및 상용화에 기여하였다.
(2) 향후과제: 포스트 코로나 시대의 대비
이번 COVID-19 사태는 신속한 감염병 대응을 위한 감염 동물 모델 및 ABSL-3 시설과 같은 인프라에 대한 지속적인 지원과 육성이 필요하다는 사실을 여실히 드러냈다.
(가) 신변종 감염병 대응 전임상시험 지원 시스템 구축 지원
감염병 치료제․백신 개발의 지속적인 수요와 신변종 감염병 도래 가능성을 고려할 때, 치료제․백신의 신속하고 효과적인 유효성 평가를 위한 감염 동물 모델 개발과 ABSL-3 시설을 포함한 전임상시험 인프라 구축에 대한 지속적인 지원은 매우 중요하다. 아울러 감염병 혹은 전임상시험 효능 평가 분야와 관련된 전문 인력의 양성도 필요하다.
(나) 축적된 감염병 전임상시험 자료 데이터베이스화 및 빅데이터 활용
현재 KMPC에서 진행 중인 전임상 데이터 구축사업을 통해 COVID-19 바이러스 기초연구와 변종 바이러스(SARS-CoV-X)를 대비하기 위한 연구에 다양한 오믹스 분석, 조직병리 분석, 생체 분자영상 분석기술 등을 이용할 수 있다.
COVID-19를 비롯한 감염병의 기전 및 생체 내에서 감염 후 일어나는 다양한 현상을 분석하고 이해하기 위하여 기초연구 데이터를 수집하고 데이터베이스를 구축하는 일은 감염병에 대한 이해와 예측, 감염병의 신속한 진단과 치료제 및 백신 개발에 중요하다. 따라서 감염병 연구결과뿐 아니라 후보 물질/개발 정보와 전임상시험의 후보물질 스크리닝 프로세스에 대한 과정정보의 데이터베이스화가 또한 필요하다. 나아가 연구자 또는 수요자에게 열람 가능한 형태로 데이터를 가공하여 감염병 연구에 의미 있는 빅데이터로 활용하는 정보 인프라 구축이 병행되어야 한다.
나. 모델동물(영장류)을 중심으로
(1) 대응 성과
선진국에서는 국가적 공중보건 비상사태를 초래할 수 있는 신․변종 감염병의 창궐 시 신속하고 현실적이며 전략적인 선제적 대응이 가능한 영장류를 기반으로 한 감염병 연구 인프라를 모두 보유하고 있다.
특히 미국에서는 NIH 뿐만 아니라 정부 지원을 받는 국가영장류센터 7개가 존재한다. 이들은 코로나19 팬데믹 전부터 국가 보건을 위협하는 위기 발생 시에 영장류 감염병 모델 개발을 신속하게 진행하여 면역․병리 메커니즘 및 치료․백신 관련 과학적 핵심 정보를 확보하는 모습을 보여 왔다. 2015년 에볼라의 위협과 2016년 지카 바이러스의 대응이 그 예라고 할 수 있다.
대한민국의 경우 2015년 국내에서 발생한 메르스 사태에서 39명의 사망자, 9조 원가량의 경제적 손실 및 사회적 불안이 발생함으로써 감염병에 대한 선제적 대응이 실패할 경우 국민 건강은 물론 막대한 사회적 비용이 발생한다는 것을 경험하였다.
대한민국은 선진국과 비교했을 때 치료제와 백신 승인을 위한 기초 실험에서 임상시험까지의 긴 파이프라인 중 영장류 전임상 테스트 부분이 결여되어 있었다. 하지만 2015년 한국생명공학연구원 오창분원에 영장류 감염 실험이 가능한 생물안전 3등급 시설이 만들어진 이후 2018년에 국가 재난형 신변종 감염을 대비하기 위한 맞춤형 영장류감염모델 개발 및 산․학․연․관 활용 기술 개발을 위한 사업이 착수되었다.
|
|
자료: KRIBB Focus 8th.
[그림 특집3-5] 국가 재난형 감염병 발생 대비 맞춤형 영장류 모델 개발 및 활용 추진 전략
(나) 코로나19 영장류 감염모델 개발
코로나19 감염을 테스트 해야 할 유망한 약물들과 백신 후보물질의 유효성 검증을 위해 영장류 감염모델 개발이 전 세계적으로 신속하게 이루어졌다. 실제 2020년부터 신속하게 승인된 약물과 백신들 모두 영장류 실험을 거친 사실만으로 초기 영장류 모델링의 중요성을 알 수 있다. WHO R&D 블루프린트에서도 코로나19의 약물 테스트에서 영장류 사용이 의무사항으로 되어 있으며 국내 식약처의 경우에도 면역 후 공격 시험에서 현재까지 영장류가 가장 적절한 동물종으로 평가된다고 백신 개발 상담사례집에서 밝히고 있다.
코로나19 대유행이 가장 먼저 일어난 중국의 경우 비록 동료 심사 평가가 없는 인터넷 논문 형태이지만 전 세계적으로 가장 먼저 영장류 감염모델을 신속하게 제작하고 결과를 발표하였다.
유럽의 경우는 사스와 메르스 등의 코로나 영장류 모델을 항상 선두적으로 발표하였던 네덜란드 연구팀이 영장류 코로나 감염모델 비교 결과를 사이언스에 발표하였다. 미국도 거의 동시에 정부 기관인 NIH 주도로 코로나19 영장류 감염 모델 결과를 네이처에 발표하였다.
그 외에도 영국과 미국 7개의 국가영장류센터들은 각각 자신들만의 가설로 2020년 후반과 2021년 초반까지 코로나19 영장류 감염모델 결과를 속속 감염 전문 논문들에 발표하였다. 모델마다 약간의 차이가 있지만 이들의 결과는 향후 치료제와 백신 후보물질의 유효성 검증 연구에 사용될 영장류 모델의 기초 데이터를 제공하였다.
국내에서는 유일하게 한국생명공학연구원(이하 생명연)에서 게잡이 원숭이와 붉은털 원숭이를 동시에 모델링하여 기존의 감염 양상뿐만 아니라 세계 최초로 인간 환자의 혈관염과 유사한 병리적 소견과 함께 일시적인 면역세포의 감소를 미국 감염학지에 발표하였으며 이는 표지논문으로 선정되었다. 코로나19 감염 모델의 발표는 세계적으로 중국, 네덜란드, 미국에 이어서 네 번째였다.
(다) 국내 코로나19 영장류 감염모델 기반 치료제 및 백신 개발 지원
① 개요
우리나라는 이미 구축된 코로나19 감염 영장류 모델을 활용하여 효능평가 체계를 구축하고 이를 통해 치료제와 백신개발을 지원하는 것을 목표로 삼고 있다. 세부적으로는 영장류를 기반으로 하는 치료제와 약동력 분석을 원하는 기업을 지원하였고 백신의 경우에는 후보물질이 감염 전에 보이는 면역원성 분석과 더불어 감염 후 코로나19의 바이러스를 효과적으로 제어하는지에 대한 효능평가를 지원하였다.
또한 의료 현장에서 이슈가 되지만 인간에게서 확인할 수 없는 조건을 실험 디자인하여 임상에서 적용할 수 있는 정보를 획득하는데 노력하였다. 마지막으로 위험한 감염체에 대한 다양한 분석의 니즈가 요구되는 바 이를 가능하게 하기 위한 생물안전시설의 최적화를 수행하였다.
② 코로나19 동물모델 시험 대상 선정위원회 운영
영장류 코로나19 감염모델이 개발된 이후에 국내 기업, 대학 및 연구소의 치료제 및 백신의 유효성 검증 수요에 대응하기 위해 이들을 대상으로 수요 조사를 실시하였다. 생명연 감염병연구센터에서 수시로 접수하였으며 우선 협의 대상자를 선정하였다. 선정위원회의 경우 식약처(치료제 및 백신 분과), 감염내과 전문의, 바이러스 전문가, 영장류 감염모델 지원 실무진들로 구성하여 활용 적절성, 중요성, 시급성 등 평가 지표별 검토 및 선정 평가를 실시하였다. 패스트트랙(fast-track)에 적합한 후보물질 선정이 목표이기 때문에 바로 임상에 적용할 수 있는 가능성 높은 치료제 및 백신 선정에 주안점을 두었다.
우선 협의 대상자가 선정되면 생명연은 세부 시험 방법을 협의하여 조율하였고 최종 합의한 동물실험 계획서를 선정위원회에서 최종 심의하였다. ‘영장류 기반 COVID-19 감염모델 활용사업’ 개시 전부터 운영해 온 선정위원회를 전문화하여 총 9차에 걸쳐 133개의 수요 조사를 접수하였고 이 중 14건이 예비 선정되었다. 지원 업체별로 심화 논의 후 최종 10개의 치료제 및 백신의 후보물질 지원을 결정하였다.
③ 코로나19 치료제와 백신의 전임상 테스트 및 성과
㉮ 생명연 코로나19 영장류 감염모델 지원 평가 항목
치료제의 경우에는 감염 후 치료제 투여의 효과를 확인하였다. 백신의 경우 감염 전 백신 투여 후에 일어나는 면역반응을 측정하였고 특별히 바이러스를 중화하는 정도를 확인할 수 있는 중화항체 형성 분석을 실시하였다. 감염 동물에서는 공통적으로 감염 후 체온, 체중, 호흡률 등의 임상 증상 분석과 swab 샘플링을 통한 상부 및 하부 호흡기계에서 바이러스 역가 및 혈액학적 분석을 수행하였다. 추가 분석을 원할 경우 조직학적 분석 및 혈청학적 분석이 추가되었다.
㉯ 생명연 코로나19 영장류 감염모델 지원 현황 및 성과
최종 지원하는 10개의 후보물질 중에 치료제는 총 4건으로 전체 건수의 36%, 백신은 총 4건으로 전체 건수의 36%, 약동학(pharmacokinetics)의 경우 전체 건수의 27%를 차지하였다.
치료제는 항체 치료제 2건과 약물 재창출 2건이 선정되었다. 백신은 DNA 백신 2건, 서브유닛 백신 1건, 바이러스벡터 기반의 백신이 선정되었다. 약동학은 약물 재창출 2건이 선정되었다. 이 중 영장류 결과를 토대로 치료제 1건과 백신 3건에서 임상 진입을 하였으며, 유의적인 결과를 얻은 후보물질들 모두는 동료 심사를 통하여 논문화가 진행되었다. 이 중 3건은 과학적 우수성을 입증 받아 세계적인 논문들(Nature Communications, Vaccines, Science Advance)에 게재되었으며 치료제 1건은 실제 조건부 승인 및 상용화가 되었다.

자료: 한국생명공학연구원.
[그림 특집3-6] 한국생명공학연구원 코로나19 영장류 감염모델 실험 지원 항목
(2) 향후 과제
21세기 들어 출현한 신변종 감염병들은 교통수단의 발달과 더불어 국경에 제약을 받지 않고 확산되어 지엽적인 감염에서 팬데믹으로 전 세계를 위협하였다. 선진국은 면역 및 감염 연구를 위해 영장류 기반의 감염시설을 구축해 왔으며, 자국의 보건 위기 때마다 치료제와 백신의 신속한 개발을 위해 이런 감염시설을 효과적으로 사용해 왔다.
이번 코로나19 팬데믹에서 대한민국은 선진국 수준의 코로나19 영장류 모델 개발을 성공하였고 이를 기반으로 기업에서 요구하는 치료제와 백신 후보물질들을 과거와 비교할 수 없는 속도로 빠르게 임상시험 진입에 성공시켰다. 이는 새로운 질병으로 인한 국가 공중 보건 비상사태 시 해외에 의존하지 않고 영장류기반의 신속지원이 가능하다는 의미를 가진다.
향후 대한민국이 선진국 수준의 영장류 기반의 인프라를 유지할 필요성에 대해 정부와 산․학․연․병의 관련 기관 간 동의를 통하여 심층적으로 고려해야 할 사항을 다음과 같이 제안한다.
첫째, 영장류를 과거 ‘소부장’의 예시와 같이 전략적으로 관리해야 한다. 이미 전 세계적으로 코로나19 실험용 원숭이의 수요 급증으로 공급 부족이 심화되어 전략물자 차원으로 다루어지고 있다. 특별히 감염에 민감한 반응을 보이는 모델인 게잡이 원숭이, 붉은 털 원숭이의 확보에 신경을 쓰지 않는다면 더 이상 영장류를 기반으로 한 효과적인 감염연구 지원이 불가능하게 된다. 정부에서는 매년 수입이 가능한 원숭이 수와 국내 시설에서 번식해서 감염 연구 지원이 가능한 나이까지 얼마나 확보될 수 있는지 정확하게 파악하고 있어야 한다. 또한 정부는 선진국의 영장류 시설에서 연구에 투입되는 연구용 원숭이의 양적 혹은 질적 분포에 대한 정확한 파악을 통하여 연구목적이 떨어지는 원숭이 종에 대한 연구비 투입을 재고해야 한다.
둘째, 코로나19의 관련 임상 연구와의 연계 강화가 절실하다. 영장류는 다른 전임상 동물 모델과 비교하여 인간의 면역과 상당한 유사성을 가지고 있고 이러한 특징을 기반으로 하여 감염 연구에 특화되어 있는 동물 모델이다. 이러한 이유로 영장류 연구에서는 인간 연구에 사용되는 항체들이 대부분 함께 사용 가능하며, 관련 항체 정보 등이 접근 용이하게 오픈되어 있는 등 인간과의 비교 연구에 지대한 강점을 가지고 있다.
하지만 연구에 있어서 국가적 차원의 후보물질 유효성 지원 사업에 대부분을 집중하게 되면 기본적인 영장류 감염동물모델의 장점을 살리지 못하게 되어 실제 임상의들이 필요한 핵심 정보 등의 선점에 실패하게 된다. 이러한 정보는 다시 후보물질 유효성 검증에서 적용할 수 있기 때문에 선순환을 유도할 수 있다.
예를 들어 폐의 손상을 입었으나 회복 중인 환자를 모사하는 영장류를 이용하여 임상에서 장기적인 호흡기 건강에 대한 기본 모델로 사용이 가능하고 환자에서 얻을 수 없는 장기들의 조직 정보를 쉽게 얻을 수 있다. 또한 사망하지 않는 영장류의 특성과 사망에 이르는 환자와의 비교 연구를 통해 중증으로 넘어가는 의학적 메커니즘을 밝히고 치료에 적용할 수 있는 핵심 정보를 신속하게 얻을 수 있다.
셋째, 다양한 감염병에 대한 영장류 연구 기반 확충이 절실하다. 현재 코로나19 외에도 WHO에서는 댕기, 중증열성혈소판감소증후군과 같은 대한민국을 위협하는 기후변화 감염병 리스트를 이미 발표한 상태이다. 이들에 대한 치료제와 백신에 대해 선제적으로 대비하기 위해 영장류 감염모델 및 관련 연구의 진행이 가능할 수 있도록 국가적으로 전략적 투자가 필요하다. 이러한 다양한 감염병 각각에 대한 영장류 모델 구축 기술이 축적된다면 신종감염병 혹은 재출현의 위험성이 있는 감염병인 Disease X에 대해 언제든지 선제적으로 대응할 수 있다.

가. 바이오 표준 현황
표준(standard)이란 사물의 정도를 정하는 근거나 기준을 말한다. 이러한 기준 혹은 시험방법이나 양식들은 이해 당사자 간의 합의에 따라 만들어지게 된다. 표준화(standardization)는 실제적이거나 잠재적인 문제들을 주어진 범위 내에서 최적의 수준을 성취할 목적으로, 공통적이고 반복적으로 사용하기 위한 규정을 만드는 활동이다(KS A ISO/IEC Guide 2).
일반적으로 표준은 ‘국제표준’, ‘국가표준’ 및 ‘단체표준’으로 나뉘는데, ‘국제표준’은 국가를 대표하는 표준화 단체로 구성된 표준화 기관인 ISO, IEC 또는 국제적으로 공인된 전문분야별 표준화 기관에 의해 채택되어 공개되는 표준을 말한다.
우리나라의 ‘국가표준’인 한국산업표준(KS: Korean Industrial Standards)은 국가 사회의 모든 분야에서 정확성, 합리성 및 국제성을 높이기 위하여 국가가 공인한 과학적, 기술적 공공기준으로, 산업표준, 측정표준, 참조표준 등 ‘국가표준기본법’에서 규정하는 모든 표준을 말한다. ‘단체표준’이란 산업표준화와 관련된 단체 중 산업통상자원부령으로 정하는 단체가 공공의 안전성 확보, 소비자 보호 및 구성원들의 편의를 도모하기 위하여 특정의 전문분야에 적용되는 기호․용어․성능․절차․방법․기술 등에 대해 제정한 표준을 말한다. 이런 표준들은 기계, 전기, 화학 등 다양한 분야를 아우르면서 생산 현장, 건설 현장 및 시험, 연구 분야 등 산업 전반에 걸쳐 활용되고 있다.
바이오표준의 경우 구체적이고 명확한 정의나 범위가 특정되어 있지는 않지만, 바이오제품, 바이오기술 및 서비스와 관련된 표준으로 이해할 수 있다. 특히 제약, 의료, 생체유래 제품 및 서비스(비타민, 호르몬, 항체, 유전자 등) 등을 대상으로 하는 표준들로 그 범위를 구분할 수 있을 것이다.
최근 빠르게 성장한 바이오산업 분야는 기술집약적 산업의 특성으로 인해 기술의 연구개발과 활용이 우선시되어 해당 기술이 관련 분야 전반에 선제적으로 보급되었다. 때문에 바이오기술과 제품의 경우는 표준개발 이전에 국가별 허가 규정이 먼저 공표되고 활용되었다. 이러한 기술 활용에 대한 우선적 관심으로 바이오표준은 전문가들에게 적은 관심을 받게 되고 그 중요도도 상대적으로 낮게 평가되어 왔다.
그러나 최근 바이오 분야의 표준은 산업계의 수요를 바탕으로 의료체계, 의료기기 및 바이오기술 분야를 중심으로 조직화되어 빠르게 활성화되고 있다. 또한 우리나라 표준 전반을 담당하고 있는 국가기술표준원의 4차 산업혁명시대 국제표준화 선점전략 중 혁신산업 10개 분야3)에 바이오․헬스 분야가 포함되는 등 바이오 표준에 대한 국가적 관심도 증가하고 있어 다행스럽다.
나. 바이오 표준화 조직
산업통상자원부 국가기술표준원에서 산업표준화법에 따라 총괄 관리되던 국내의 산업표준은 2008년 민간 표준개발협력기관(COSD: Co-operating Organization for Standards Development)이 출범됨에 따라 민간에서 실질적인 표준에 대한 제․개정 등의 운영을 수행하게 되었다. 이와 더불어 관련분야 전문가로 구성되어 표준을 검토하는 전문위원회4)의 구조를 국제표준화기구(ISO, IEC)의 기술위원회(TC: Technical Committee)와 같은 형태로 개편하였다.

자료: 저자 작성.
[그림 특집4-1] 우리나라의 표준관리 구조
또한 2015년 범부처 참여형 국가표준 체계가 개편되면서 국가기술표준원에서 전담하던 분야별 표준개발 운영 업무의 일부가 소관부처로 이관하였다. 이에 따라 바이오표준 분야 중 의료제품(의료기기 등)과 관련된 일부 분야가 식품의약품안전처로 이관되었고, 바이오표준의 전문위원회는 국가기술표준원과 식품의약품안전처가 분리하여 관리하는 구조를 갖게 되었다.
[표 특집4-1] 바이오 표준관리 전문위원회
|
전문위원회 |
관리품목 |
COSD관리 |
관리부처 |
비고 |
|
ISO TC 215 |
보건의료정보 |
한국보건의료정보원 |
국가기술표준원 |
|
|
ISO TC 276 |
바이오기술 |
한국화학융합시험연구원 |
|
|
|
ISO TC 304 WG5 |
감염병 위기대응 |
표준협회 |
|
|
|
IEC TC 62/SC A∼D |
의료용 전기제품 |
대구경북첨단의료산업 진흥재단 |
식품의약품안전처 |
SC별 관리기관 (COSD) 존재 |
|
ISO TC 76, 84, 106, 121, 150, 157, 170, 172(SC7), 173(SC1/SC2/SC6), 194, 198, 210, 212, 249 |
의료제품 |
한국화학융합시험연구원 |
TC별 관리기관 (COSD) 존재 |
이후, 국제적으로 활동하던 많은 바이오분야 표준전문가들은 개별 전문위원회, 담당 COSD 간사기관 및 관련 전문위원 활동을 통해 국내 산업표준 및 국제표준에 대해 대응하게 되었다. 현재 국내에서 바이오 표준을 관리하는 대표적인 전문위원회는 [표 4-1]과 같다.
다. 코로나19 사태와 표준화 활동
2020년 코로나19 사태로 인해 국가별로 제약들이 발생하고 국제적인 이동이 제한됨에 따라 많은 사회적 활동에 타격을 받게 되었다. 표준화 관련 활동 역시 전문가들의 토의와 토론을 기본으로 하고 있어서 기존에 예정되었던 회의들이 잠정 연기되는 등 국내외적인 표준화 활동이 어려워졌다.
국제 표준화 활동도 전반적으로 정체되는 상황을 맞게 되는데, 특히 ISO는 코로나19 사태의 국제상황에 따라 2021년 10월 31일까지 계획된 모든 ISO 거버넌스 및 기술 회의를 가상으로 개최하거나 그 이후로 연기해야 한다고 결정하였다. 그 결과 2020년 2월 1일부터 2021년 10월 3분기 사이에 개최 예정이었던 약 275회의 ISO 회의가 취소되었다. 이에 ISO는 2020년 6월 코로나19 사태로 인한 표준제정 관련 기술 작업의 경우 예외적 조치사항을 두어 계획된 일정이 제약 없이 지속될 수 있도록 6개월간의 작업 활동의 보류를 신청할 수 있도록 조처하였다.
그러나 최근 비대면 회의시스템(화상회의 등)의 보급 및 안정화로 비대면 전문가회의 개최가 활성화되면서 국내 표준화활동이 재개되고 정상화되는 양상을 보인다. 국제회의 역시 코로나19 사태가 장기화하면서 필수적인 안건만을 화상회의로 처리하는 방식에서 기술위원회의 계획에 따라 전문가 기술회의를 개최하는 등 국제 표준화활동도 재개되고 있다.
주목할 만한 점은 코로나19 팬데믹에 대처하고 그 이전으로 복구하기 위해 적용 가능한 표준에 대한 국제 표준화 기구의 관심이 증가하고 있다는 것이다. 이런 상황들은 코로나19 사태에 대응할 수 있는 많은 새로운 표준의 개발, 특히 방역과 관련한 바이오표준들의 개발을 독려하게 되었고, 현재 ISO에서는 다양한 다른 표준들과도 연계되어 개발이 진행되고 있다.5)
라. K-방역 관련 한국의 국제표준 제정–ISO 17822
2020년 12월 2일 우리나라가 국제표준화기구(ISO) TC 212에 제안한 코로나19 등 감염병 진단검사기법이 국제표준(International Standard)6)으로 제정되었다.
해당 표준은 당시 중앙대병원 진단검사의학과 박애자 교수(현 (주)바이오메듀스 연구소장)가 2009년 신종플루가 유행할 때 분자유전학적 접근 방법에 대한 국제표준이 없어 대한민국의 분자유전학적 진단검사에 대한 우수성을 알리고자 최초로 제안한 표준이다. 이 국제표준은 상당한 기간 독일, 미국 등 세계 각국의 국제표준화기구 기술위원들과 긴밀히 협력하여 국제표준화 논의를 성공적으로 이끌어왔으며, 그 결과 2020년 10월에 최종 국제표준안(FDIS) 투표에서 전원 찬성하여 통과된 이후 회원국 간 최종 조율을 거쳐 국제표준으로 등록되었다.
해당 표준은 ‘유전자 증폭방식’의 체외진단검사를 수행하는 검사실의 운영절차 및 방법을 정의한 것으로, 유전자 진단검사를 주로 실시하는 코로나19 진단에서 바로 적용할 수 있고 향후 발생할 수 있는 다양한 감염병 진단검사에도 적용할 수 있다.
이번 국제표준의 제정은 코로나19 등 감염병 진단검사의 정확도 향상에 이바지할 것으로 예상되며 우리나라 감염병 진단제품에 대한 국제 신뢰도를 한층 높여 향후 글로벌 시장을 주도해 나가는 데 큰 도움이 될 것으로 기대된다.
마. K-방역 표준화 진행
코로나19 팬데믹은 국가별로 다양한 소요를 일으켰고 국가별 다양한 대응이 각기 다른 형태의 결과를 나타내었다. 우수한 진단시스템과 적절한 방역지침 등을 통해 다른 국가와 대비하여 상대적으로 우수한 코로나19 사태의 대응을 보였던 한국의 상황은 국제적으로도 인정을 받게 되었다(미국 FDA Report 등).
산업통상자원부는 제6차 비상경제 중앙대책본부 회의(2020.6.11.)에서 ‘K-방역모델’을 세계의 표준으로 만들기 위한 범정부 차원의 로드맵을 확정하였다고 밝혔다. 로드맵은 ‘① 검사․확진→② 역학․추적→③ 격리․치료’로 이어지는 3T(Test-Trace-Treat)를 ‘K-방역모델’로 체계화하였고 18종의 국제표준을 ISO 등 국제표준화기구에 제안하는 방향으로 추진되고 있다.
[표 특집4-2] K-방역 3T(Test-Trace-Treat) 국제표준화 분야(18종)
|
① 검사․확진(Test) : 6종 |
② 역학․추적(Trace) : 4종 |
③ 격리․치료(Treat) : 8종 |
|
◦ 감염병 진단기법 : 2종 - 유전자 증폭기반 진단기법(RT-PCR) - 진단기법 관련 시약․장비 및 테스트 방법 등 ◦ 선별진료소 운영시스템 : 4종 - 자동차 이동형(Drive Thru) 선별진료소 운영 절차 - 도보 이동형(Walk Thru) 선별진료소 운영 절차 등 |
◦ 모바일 자가진단․격리관리 앱(App) 요구사항 ◦ 역학조사 지원시스템 기능 및 개인정보 보호 ◦ 자가진단․문진 결과와 전자의무기록(EMR) 연동 방법 등 |
◦ 감염병 생활치료센터 운영 표준모형 ◦ 개인위생 관리 및 사회적 거리두기 운영 지침 ◦ 취약계층 필수 사회복지서비스 및 의료지원 ◦ 감염병 교차감염 차단을 위한 지침 등 |
국제표준 ISO 17822의 제정은 2020년 6월 정부가 발표한 ‘K-방역 3T(Test-Trace-Treat) 국제표준화 추진전략’ 이후, K-방역모델 국제표준화에 성공한 첫 사례라는 점에서 의의가 있다. 이후 우리나라 주도로 국제표준화기구인 ISO에 팬데믹 대응 국제표준화를 전담하여 추진하기 위한 작업반(WG: Working Group)7)을 신설하게 된다.
작업반은 ISO의 보건경영 분야 기술위원회(ISO/TC 304) 내에 설치되었으며, 국내전문가가 의장(convener, 대구경북첨단의료산업진흥재단 김종원 센터장)을 맡아 국제표준화 작업을 이끌고 있다. 작업반 신설과 더불어, 성균관대 안선주 교수를 중심으로 2020년 6월 초에 제안된 ‘도보 이동형(Walk-Thru) 선별진료소 표준 운영 절차’가 3개월여의 국제투표를 거쳐 신규작업표준안(NP: New work item Proposal)으로 채택되었다. 앞으로도 지속적인 K-방역 표준의 국제표준화가 해당 작업반을 통해 진행될 것으로 기대된다.
바. K-방역 표준화의 향후 과제
K-방역 표준 국제화의 의의는 전 세계적으로 코로나19 팬데믹 대응에 즉시 활용할 수 있는 국제표준을 제정해 국제 사회에 이바지하였다는 점이다. 또한 K-방역모델의 국제표준화를 통해 표준의 수용국에서 표준의 개발국으로서 글로벌 리더십을 보여줌으로써 새로운 국제질서를 주도하는 발판을 마련하였다고 볼 수도 있다.
이러한 K-방역 표준화 전략의 성공을 위해서는,
첫째, 개발 표준들에 대한 발 빠른 진행을 도모해야 한다. 최근 중국 등 일부 국가의 표준 제안에 대한 적극성을 고려해 볼 때 충분히 주도권 경쟁에서 밀려날 가능성이 있으므로 국제표준을 적극적으로 제안하여 타 국가보다 앞서서 주도권을 선점해야 할 것이다.
둘째, 바이오 표준전문가 네트워크의 형성과 도움이 필요하다. 바이오 분야의 기술적 지식과 표준 운영 지식을 모두 갖춘 전문가를 찾기 어렵다. 하지만 국제적 표준 네트워크를 형성하고 있는 국내 바이오 표준전문가 그룹의 도움은 K-방역 표준을 빠르게 국제화하는 데 많은 도움이 될 것으로 보인다. 또한 현재 산업통상자원부에서 표준기술력향상사업을 통해 추진하고 있는 K-방역 표준개발 주체들 간의 긴밀한 협력 네트워크도 중요할 것으로 보인다. 이를 위해서는 국가기술표준원이나 산업기술평가관리원과 같은 운영주체가 필요하다.
셋째, 표준개발 및 국제표준 제정에 대한 정부의 지속적 지원이다. 코로나 시대를 고려하지 않더라도 한 개의 국제표준이 정상적으로 제정되기 위해서는 3.5년 이상의 시간이 소요된다. 만약 특정 국가의 이해관계가 문제가 되는 경우, 그 기간은 훨씬 더 증가하는 것이 일반적이다. K-방역의 성공적인 표준화를 위해서는 표준화 제정이 진행되는 동안 정부의 지속적 지원 보장이 필요하다.
넷째, K-방역에 대한 국내표준의 제정이 필요하다. 국제표준의 진행과 함께 상대적으로 더 빠른 속도로 K-방역 운영시스템을 KS 규격으로 제정하여 국내의 K-방역 표준체계를 정립하기를 권장한다. 이렇게 형성된 국내 K-방역 KS 표준체계는 국제표준화의 방향과 지속적으로 비교 검토하면서 향후 K-방역 표준화를 위한 초석으로써 자리잡을 수 있을 것이다.
코로나19 사태는 세계 누구나 처음 겪게 된 상황이다. 이런 상황에서 대응체계에 대한 표준을 국내외적으로 문서화하는 것은 향후 또다시 겪게 될지 모르는 팬데믹 상황을 극복할 수 있는 길잡이 역할을 할 수 있을 것이다. K-방역 표준화의 추진이 그러한 방향을 제시해줄 것으로 기대한다.

가. WHO 코로나19 긴급위원회
2020년 1월 22일∼23일에 ‘새로운 코로나바이러스19 폐렴 긴급위원회’라는 이름으로 최초의 WHO 코로나19 긴급위원회가 개최되었고 당시 557명의 코로나19 환자가 발생한 중국과 함께 1∼2명의 환자가 발생한 일본, 한국, 태국 정부가 각국의 상황을 발표하였다.
2020년 1월 23일 중국은 최대의 명절인 구정에 우한 폐쇄화 이동제한(lockdown)이라는 초유의 조치를 발표하였으나 그 당시만 해도 코로나19의 사람간 전파나 무증상 전파에 대한 정보가 확실치 않아 비상사태가 선포되지는 않았다.
다만 10일 이내에 다시 긴급위원회를 개최하여 상황을 논의하기로 하였고 2차 위원회가 2020년 1월 30일 개최되어 비상사태, 즉 국제적공중보건위기(PHIEIC: Public Health Emergency of International Concern)를 선포하였다. 전 세계적으로 바이러스 전파가 본격화되면서 2020년 1월 30일 당시 7,819명이 실험실 확진되었고 이 중 중국이 7,736명, 중국 외 국가 18개국(한국 4명, 일본 11명, 싱가포르 10명, 태국이 14명, 미국 5명을 포함)에서 83명이 확진되었다. 긴급위원회에 참여한 위원들은 사스나 메르스 때와 비교하여 상당히 빠른 속도로 전 세계적인 전파가 일어나고 있음을 인지하고 중국내 전파를 차단하고 해외로 확산되는 것을 막기 위한 조치를 집중적으로 논의하였다.
이후 WHO 긴급위원회는 국제보건규약(IHR: International Health Regulations)에 의거하여 3개월에 한 번씩 개최되고 있으며 현재까지 8차례의 긴급위원회가 개최되어 WHO와 전 세계 국가들에 필요한 권고사항을 논의하고 발표해왔다.
2021년 7월 14일 개최된 8차 긴급위원회에서는 변이주 확산에 대한 감시와 모니터링, 변이주 검출 실험실 인프라 강화, 저개발국 백신 공급 부족 문제를 해결하기 위한 노력의 필요성, 마스크 착용이나 거리두기 등 개인방역이 지속되어야 한다는 점과 일부 국가에서 추진 중인 백신 접종 증명서에 대한 논의가 진행되었다. 특히 국가간 여행 시 백신 접종 증명서 요구는 WHO가 공식적으로 권고하지 않으나 기본적으로는 WHO가 긴급사용을 승인한 백신을 각국이 인정할 것을 논의하였다.
한국은 2020년 코로나19 발생 초기부터 2월 말부터 3월까지 국내 환자 급증 시기를 포함하여 2021년 7월 현재까지 국내 신규 환자 발생 현황과 분석 자료를 WHO에 신속하게 공유하였다. 아울러 WHO가 코로나19 비상사태를 선포한 1월 30일 이전에 이미 식약처와 코로나19 진단키트 생산회사와의 논의를 거쳐 긴급사용이 승인된 코로나19 유전자 검출키트를 전국적으로 보급하였다.
이로 인해 우리나라는 전 세계 많은 국가 중 완전한 국경 폐쇄나 이동제한(lockdown) 조치 없이 코로나19에 대한 대응을 성공적으로 한 대표적인 국가로 분류되었다. 다만 최근 국내 비수도권 확산과 젊은 연령층에서의 델타 변이주 확산에 의한 4차 유행이 얼마나 또 어떤 규모로 지속될 것인지가 변수로 떠오르고 있다.
나. WHO R&D 블루프린트, 워킹그룹 참여 및 GLOPID-R과의 협력
WHO는 국제보건규약에 의거하여 2020년 1월 30일 비상사태를 선포한 이후 코로나19 관련 백신, 치료제 개발 등 연구개발을 촉진하기 위하여 WHO R&D 블루프린트팀을 가동하기 시작하였고 2월 11∼12일 코로나19 연구개발 로드맵 개발을 위한 연구포럼을 개최하였다. 이 포럼에서는 1) 백신, 2) 치료제, 3) 임상, 4) 바이러스자연사 및 진단, 5) 역학, 6) 감염관리, 7) 동물과 사람 간 감염, 8) 윤리, 9) 사회과학 등 분야에서 워킹그룹을 구성하여 현재까지 운영해 오고 있다.
한국파스퇴르연구소, 국제백신연구소, 한국생명공학연구원, 한국화학연구원 등 국내 감염병 연구기관의 전문가도 이 워킹 그룹 중 백신, 치료제, 임상, 윤리 등 몇 개 분야에 지속적으로 참여하고 있으며, 한국생명공학연구원 감염병연구센터가 주도적으로 참여하고 있는 글로피드-알(GloPID-R:Global Research Collaboration for Infectious Disease Preparedness)이 주관하는 네트워크 미팅에도 적극적으로 참여하고 있다.
WHO R&D 블루프린트팀은 어떤 신종 감염병 병원체가 전세계적인 유행(팬데믹) 또는 지역 내 감염병 유행을 유발할 수 있을지 미리 예측하고 준비해야 백신이나 치료제 등 연구개발 결과를 현장에 적용할 수 있다는 취지로 출범하였다. 이 팀은 EU 중심으로 구성된 감염병 펀더(funder) 국제 네트워크인 GloPID-R과 파트너십을 이루며 운영되고 있다.
한국은 코로나19 위기상황에서 인정된 국제적인 인지도와 아시아 지역 내 지정학적인 조건을 바탕으로 아시아 지역 연구개발을 주도적으로 이끌어 가는 리더십을 발휘하기 위한 과제를 도출하고 수행해 나가야 할 것이다. 이러한 역할을 선도적으로 수행하기 위해 아시아 지역 국가에 지역거점연구센터를 1∼2개 구축하여 운영할 것을 제안한다.
한편 한국파스퇴르연구소는 2020년과 2021년 코로나19 치료제와 백신 개발을 위한 전임상 또는 임상시험을 지원하기 위한 GloPID-R 과제를 수행해 왔으며 향후 다양한 과제가 추가로 GloPID-R 과제로 수행되어 아시아 지역을 포함한 글로벌 연구 네트워킹의 기반으로 활용될 수 있기를 기대한다.
다. 파스퇴르연구소 국제네트워크 참여 현황
한국파스퇴르연구소는 파스퇴르연구소 국제 네트워크의 일원으로 2004년 설립된 이후 프랑스 파스퇴르연구소를 포함 4개 대륙, 25개국에 위치한 32개의 파스퇴르연구소와 협력관계를 유지하고 있다.
특히 2020년 약물재창출 방식으로 코로나19 치료제 후보 4종(나파모스타트, 카모스타트, 시클레소니드, 니클로사마이드)을 발굴하여 국내외에서 임상시험을 진행 중이며 나파모스타트의 해외임상시험 추진을 위해 파스퇴르국제네트워크의 일환인 세네갈의 다카파스퇴르연구소, 그리고 멕시코 국가 연구소, 호주 피터도허티연구소와도 협력하고 있다. 또한 제넥신에서 개발 중인 코로나19 DNA 백신의 전임상시험 및 해외임상시험을 지원하기 위한 GloPID-R 과제도 현재 수행 중이다.
한편 한국파스퇴르연구소 소장은 4개 대륙 25개 국가에 위치한 33개의 파스퇴르연구소 중 아시아 태평양지역에 소재한 10개의 파스퇴르연구소를 대표하는 이사회 위원으로 선출되어 해당 지역의 감염병 연구개발을 선도하는 역할을 수행할 계획이다. 앞서 언급한 GloPID-R 네트워크에서 한국이 아시아 지역에서 리더십을 발휘하는 데도 파스퇴르 국제 네트워크가 활용될 수 있을 것이다.
라. 국내 감염병 연구 국제협력 현황
2015년부터 과학기술정보통신부가 지원해온 한국감염병국제협력연구센터사업(KOICID: Korea International Cooperation for infectious Diseases)은 전세계 15개국의 연구소, 대학, 병원과 연계하여 임상시료 공유, 연구인력 교류, 임상자료 및 정보 공유, 공동 비임상 및 임상연구 등 감염병 국제공동연구를 추진 중이다. 이 사업의 일환으로 감염성물질바이오뱅크를 구축하여 국내 연구자나 관련 기업에게 제공하는 업무도 수행해왔다.
또한 감염병 분야 국제공동연구 네트워크 구축사업(C3BIRD: International Collaboration Center for Capacity Building in Infectious Disease R&D) 또한 국내 3개 병원 컨소시움을 중심으로 아시아 4개국과 연계한 감염병 공동연구와 신진연구자 교육 훈련 등을 추진해왔으며, KOICID 사업의 후속 사업으로 고위험감염병자원확보 국제네트워크 고도화 및 활용사업(INID-K: International Network for Infectious Disease Research and Development of Korea, 2020∼2024)이 진행되고 있다.
이러한 사업을 통해 감염병 진단, 치료제, 백신 개발에 필요한 해외 연구 자원을 확보하여 감염병 대응능력을 강화한다는 목표를 가지고 있으나 나고야의정서 참여국과의 검체 공유를 위해 법적인 제한을 극복하기 위한 노력이 동시에 필요할 것이다.
마. 글로벌 백신 허브화 추진
2021년 5월 21일 한미 정상회의 이후 범정부 ‘글로벌 백신허브화 추진 태스크포(TF)’가 구성되어 백신 개발 관련 연구개발 추진계획 및 10개 과제가 부처별로 추진되고 있으며 특히, 정부는 해외 유수 백신 기업의 투자를 유치하기 위한 세제 혜택 강화 등 투자환경 개선 계획을 발표하였다.

자료: Nature Biotechnology vol.39(2021).
[그림 특집5-1] 코로나19 백신 특허 네트워크 분석
과학기술정보통신부는 백신 원천기술 개발과 바이러스 기초연구 등 백신 생산의 기초역량 강화를 위한 과제를 추진하며, 보건복지부는 한미 글로벌 백신 파트너 전문가 그룹 운영, 백신 허브화 TF 운영, 백신기업 협의체 구성, 백신 생산기반 마련을 위한 기업 지원 및 인프라 구축 등의 계획을 발표하였다.
또한 2021년 6월 말 국내 mRNA 백신 자체 개발을 위한 컨소시움(K-mRNA 컨소시엄)이 한미약품, 에스티팜, GC녹십자를 중심으로 결성되어 2022년까지 국내 mRNA 백신 자체 개발을 위해 7,000억 원 이상의 투자계획을 발표하였다. 이 컨소시엄 운영을 통해 2022년까지 1억 도스의 mRNA 백신 확보, 2023년까지 연 10억 도스 이상의 mRNA 백신 생산 능력을 확보하겠다는 계획이다.
이러한 계획이 실현되기 위해서는 현재 mRNA 백신 개발과 관련된 글로벌 특허 생태계와 국내 자체 기술력 현황에 대한 철저한 분석을 통해 전략적인 연구개발과 생산력 확보 전략이 수립되고 이행되어야 할 것이다.
한국의 글로벌 백신 허브화 목표를 달성하기 위해서는 개발도상국 백신 제조사 네트워크(DCVMN: Developing Country Vaccine Manufacturers’ Network)에 참여하고 있는 베트남, 인도 등 아시아 국가들과의 파트너십을 정립할 필요가 있다. 특히 최근 WHO가 남아공과 RNA 백신 기술이전 컨소시엄 구성과 베트남과도 mRNA 백신 생산을 위한 협력 계획을 발표한 바 있다. 한국도 WHO나 글로벌 회사와의 긴밀한 소통을 통해 한국이 보유하고 있는 기술력과 백신 생산능력이 최대한 활용될 수 있도록 노력해야 한다.
바. 국내 감염병 연구개발 글로벌 이니셔티브
국내 최초로 유치된 국제기구인 국제백신연구소(IVI: International Vaccine Institute)는 스웨덴, 한국, 게이츠재단과 협력하여 베트남, 인도, 한국에서 저가 콜레라 백신을 개발하는 데 성공하였다. 특히 한국기업인 유바이오로직스에서 생산된 유비콜이라는 콜레라 백신이 2015년 WHO 사용승인을 받음으로써 유니세프(UNICEF)를 통해 전 세계 개발도상국에 공급되는 계기가 마련되었다. 최근 코로나19 백신 개발과 관련 IVI는 국내 또는 국외에서 개발되는 다양한 백신의 임상시험을 지원하는 역할도 하고 있다.
국내 백신 제조사 중 코로나19 백신을 개발하고 있는 여러 기업 중 현재 가장 주목을 받고 있는 SK바이오사이언스의 경우 아스트라제네카와 노바박스의 코로나19 백신 글로벌 생산사 중 하나일 뿐 아니라 자체적으로도 코로나19 백신을 생산하고 있으며 이 자체 개발 백신 중 하나는 CEPI(Coalition for Epidemic Preparedness Innovations)가 예산을 지원한 10종의 코로나19 백신 중 하나이다.
국내 바이오기업의 글로벌 시장 진출을 지원하기 위해 2018년 설립된 라이트펀드(RIGHT Fund: Research Investment Global Health Technology Fund)는 한국의 보건복지부가 50%, 게이츠재단이 25%, 국내 기업이 25%의 예산을 각각 지원하고 있으며, 전세계적으로 문제가 되고 있는 주요 감염병의 백신, 치료제, 진단제 개발과 디지털 헬스 연구과제를 지원하고 있다. 라이트펀드가 지원한 과제의 성과가 가시화되어 글로벌 시장에서 실제로 사용될 수 있도록 펀드 규모 확대 등 정부의 적극적인 지원이 필요하다.
사. 감염병 국제협력 향후 발전방향
코로나19 팬데믹 위기에서 한국이 비교적 잘 대응하면서 한국에 대한 국제사회의 평가가 상당히 긍정적인 것은 사실이나 감염병 연구개발네트워크에서는 큰 역할을 하지 못하고 있다.
향후 연구개발 분야에서도 한국의 주도적 역할을 기대한다면 정부는 글로벌 역량을 보유한 민간 전문가를 중심으로 한 국제협력이 이루어지도록 전문가 중심의 산학연관 네트워킹을 추진할 필요가 있다. 또한 현재 진행 중인 INID-K 등 국제협력 사업 이외에 중장기적으로 아시아 지역을 포함한 몇 개 국가에 전략적 해외거점 연구센터를 설립하여 운영할 것을 제안하며 이러한 신규 거점센터 설립 이외에도 이미 가지고 있는 파스퇴르연구소 국제네트워크도 적극 활용할 필요가 있다.

자료: 저자 작성
[그림 특집5-2] 감염병연구개발 추진방향
감염병 유행이 지속되는 동안 백신, 치료제 등 감염병 연구개발의 성과물이 활용되기 위해서는 국가 수준의 노력을 넘어 글로벌 파트너십이 반드시 요구되며 이러한 파트너십은 민관의 긴밀한 협력을 통해 추진되어야 할 것이다. 코로나19 펜데믹은 글로벌 감염병 연구개발 생태계에도 큰 변화를 가져올 것이며 한국도 이러한 변화에 적극적으로 동참해야 한다.


가. 인문사회학적 측면
(1) 포스트 코로나시대, 더 편리한 ‘언택트’ 문화, 더 안전한 ‘콘택트’ 사회로
2019년 말 이후, 전 세계 사람들의 생활은 크게 달라졌다. 이웃 나라로 여행을 가는 일, 학교에 가서 친구들과 수업을 듣는 일, 친한 친구나 가족들과 모여서 식사를 하는 당연한 일상이 하나씩 지워져 나갔다. 언젠가는 지긋지긋한 이 질병(COVID-19, 코로나19)도 인간의 통제 속으로 들어오겠지만, 그 이후에도 우리의 생활은 과거와 같지 않을 것으로 보인다. 우리의 미래는 어떻게 바뀌어갈까. 우리는 어떤 미래에 대비해 나가야 하는 걸까.
(2) 코로나19, ‘완전 종식’은 가능할까
주위에서 “코로나19의 완전 종식이 언제쯤 가능할까?”라는 질문을 자주 받는다. 이와 비슷한 사례는 코로나19와 비교할 수 있는 1918년 인플루엔자 범유행, 즉 ‘스페인 독감’ 사례를 들 수 있을 것이다. 당시 WHO는 지금의 코로나19와 마찬가지로 ‘팬데믹(세계적 대유행)’을 선포했으며, 이 병이 전 세계로 퍼져나가 1,700만∼5,000만 명의 사람이 목숨을 잃었다. 2020년 12월 11일 현재 코로나19의 전 세계 누적 사망자 숫자가 590만 명 정도인 것을 감안하면, 스페인 독감에 의한 피해는 실로 막대하다고 할 수 있다. 스페인 독감은 1917년 말에 발생해 몇 번의 대대적 확산을 반복하다 1919년 4월에 마치 눈 녹듯 소멸했다.
스페인 독감이 어떻게 끝났는지는 아직까지 수수께끼이지만, 유사 형질의 바이러스가 인플루엔자 바이러스의 한 형태로 여전히 유행하고 있다는 점을 고려하면 ① 많은 사람이 죽거나 회복되어 결과적으로 사회 전체 면역력이 올라갔으며 ② 바이러스가 약하게 변이하면서 심각성이 줄어든 점 등이 원인이라는 분석이 많다. 주변의 숙주가 다 죽어 없어지면 안 되니, 바이러스 스스로 치명률을 낮추는 전략을 취했다는 것이다.
이 사례대로라면 코로나19도 앞으로 1∼2년 사이 조용히 종식될 거라고 기대할 만할까. 더 두고 보아야 알 수 있지만 희망적으로 보기는 힘들어 보인다. 현재 유행 중인 질병 중 코로나19와 자주 비교되는 것으로는 ‘인플루엔자(독감)’가 꼽히는데, 스페인 독감과 동종의 바이러스도 인플루엔자의 일종으로 여전히 유행하고 있다. 인플루엔자의 경우 아무리 강력한 변종이 나와도 이것 때문에 외출을 금지하거나, 전 국민의 마스크 착용을 법으로 규정하는 경우는 없는데, 이는 백신과 치료제가 나와 있어 통제가 가능하고, 전염력의 수준이(개개인이 아닌) 사회 전체적으로 볼 때는 대규모 팬데믹으로 빠질 위험은 낮기 때문이다.
그러나 인플루엔자 등의 사례를 두고 ‘코로나19도 백신과 치료제가 보급되기 시작했으니 조만간 인플루엔자처럼 통제 없는 세상이 가능해질 것’이라고 기대하는 건 어렵다는 이야기다. 우선 코로나19는 유례없이 강력한 전염성을 가지고 있으면서도, 동시에 치사율도 인플루엔자보다 대단히 높기 때문이다.
코로나19의 치사율은 의학저널 란셋(LANCET)에서 찾아볼 수 있는데, 코로나와 인플루엔자 간의 치명률을 직접 비교한 대규모 연구 결과8)에 따르면 대략 3배 정도 높은 것으로 나타났으며, 때에 따라 10배까지도 늘어났다.
전파력은 어떨까? 바이러스의 변종도 많고 제각각 이야기가 많아 정확한 비교는 어렵지만 대략 계절성 인플루엔자의 경우 전염력이 1.3(환자 1명이 1.4명에게 전파) 정도인 것에 비해 코로나19는 2.2 정도로 높다.9) 물론 감안해야 할 변수가 있는데, 코로나19가 초기 통제되지 않은 상태에서 급격히 전파된 수치가 포함됐다는 점을 고려해 이보다 감염력이 더 낮다고 볼 수 있고, 무증상자 등을 생각하면 도리어 이보다 훨씬 더 강력한 전파력을 가졌을 것이라고 볼 수도 있다. 이런 점을 두루 생각해 보면 코로나19의 치사율과 전파력은 어쨌든 인플루엔자에 비해 압도적으로 높다고 볼 수 있다. 코로나19는 증세가 심한 환자의 경우 사망에 이를 만큼 강력하지만, 증세가 거의 없는 환자도 많아 주위에 전파 역시 잘 일어나는, 병원체의 양면성을 모두 갖고 있다. 이 상황에서 코로나19 바이러스가 살아남기 위해 스스로 치사율을 낮추는 형태로 변이한다는 건 생각하기 어려운 일이다.
그렇다면 세상은 어떻게 바뀌어 갈까. 물론 우리의 상황은 점차 개선되어 나갈 것이다. 그러나 현재의 ‘통제’에 가까운 불편함이 종식될 수 있을 뿐, 사회 시스템의 변화가 생기는 것을 피할 수는 없어 보인다. 지금은 코로나19를 완전히 종식하기보다, 불편을 감수하며 살아가는 세상으로 넘어가고 있는 ‘전환기’인 셈이다.
(3) 생명과학적 노력이 첫걸음
포스트 코로나 시대를 살기 위한 사회적 흐름은 크게 세 가지다. 첫째는 생명과학과 의학기술 영역에서 지속적으로 백신과 치료약의 개발이 진행될 것이다.
이미 전 지구에 퍼져있는 코로나19의 완전 종식이 어렵다면, 나 자신, 우리 가족, 우리 주변, 조금 더 나아가 우리 사회 전체가 ‘코로나19’에 저항할 수 있도록 면역과 치료능력을 확보해야 한다.
면역 확보와 치료 능력은 감염병에 대응하는 기본적인 역량이다. 이 능력이 없이 팬데믹, 그리고 그 이후의 세상에 효율적으로 대처하는 것은 불가능한 일이다. 기본적인 예방, 치료 능력의 수준이 정해져야 이후에는 다양한 사회 문화적 대응도 이뤄질 수 있으며, 이런 흐름에 부합한 각종 사회적 기술 역시 등장할 것이다.
우선 백신의 등장을 보자. 코로나19가 처음 등장한 것은 2019년 말로, 본격적으로 확산하기 시작한 것은 2020년 초로 볼 수 있다. 그리고 화이자에서 첫 백신이 등장한 것은 2020년 말이다. 기존에 없던 신종 바이러스 백신을 단 1년 사이에 개발해 실용화시킨 것은 세계적으로 유례가 없는 일이다. 이 과정에서 빠른 백신 개발을 위해 과감하게 메신저RNA(mRNA) 방식을 도입한 것은 잘 알려진 이야기다. 코로나19의 전 세계적 유행이 백신 기술의 급진전을 가져온 경우로도 볼 수 있다.
“바이러스는 변종이 생기기 때문에 결국 백신도 효과가 없는 것 아니냐?” 는 이야기도 있지만 변종이 생겨난다고 해서 과학과 의학의 영역에서 할 수 있는 대응을 포기해선 안 된다. 다음 두 가지가 현재로서 예측 가능한 기술이다.
첫째, 여기에 대응할 수 있는 기술적 대안으로서 ① 변형이 거의 일어나지 않는 바이러스의 핵심 부위만을 타깃으로 하는 기술, ② 유전자명령물질(RNA)을 이용해 바이러스의 변이에 즉시 대응하는 약을 만들 수 있는 기술, ③ 바이러스의 변이를 예측할 수 있는 기술 등이 이미 다양하게 존재한다. 인플루엔자 사례를 보면 아예 여러 형태에 모두 대응할 수 있는 복합 백신 형태로 개발하기도 한다. 여기서 더 나아가 새로운 바이러스가 등장할 때마다 발 빠르게 대응할 수 있는 백신 및 치료제 개발법을 확보하는 과정, 백신과 치료약을 지속적으로 접종하고 유통하는 의료시스템의 확보 등이 필요하다.
둘째, 주목받는 차세대 백신 기술도 이미 연구개발에 들어갔다. 화이자나 모더나 백신의 효과를 더욱 높일 수 있도록, 복제 유전자 기법을 통해 1회만 맞아도 효과를 기대할 수 있는 자가증폭RNA(self-amplifying RNA) 백신, 기존 재조합백신의 성능을 한층 높여 코로나19에도 대응할 수 있도록 만드는 아단위단백질(protein subunit) 백신, 바이러스의 표면이나 세포막을 구성하는 특정 단백질 조각(펩타이드, peptide), 다당류 등을 주요 성분으로 하는 백신, 바이러스의 수용체 결합 도메인(RBD)을 분석해 코로나19의 표면 단백질(스파이크단백질)의 일부 형태만 항원으로 제작하는 나노입자(designed protein nanoparticle) 백신 등이 주목받고 있다. 이 백신은 맞춤형 작은 조각으로 만들기 때문에 최소 10배 더 높은 항체반응 유도가 가능한 것으로 알려져 있다.
그러나 무한으로 백신 기술이 좋아져서 결국 코로나19의 완전 종식이 가능해질 것이라는 기대는 현실적으로 무리가 있는데, 어느 경우나 기술적 한계는 있기 때문이다. 인플루엔자의 경우도 불활성화 방식의 백신이 개발되고 십 수 년이 지났지만 여전히 뾰족한 진전이 없는 것을 생각해 본다면, 코로나19 백신도 일정 기술 수준 이상 진보하면 기술적 정체기가 도달할 것은 자명하다. 그 선이 어디에 그어지느냐에 따라 사회적 대응 수준도 결정될 것이다.
(4) ‘언택트’ 넘어 ‘인택트’ 시대
두 번째로 짚어보고 싶은 것이 ‘언택트(untact)10)’, 그리고 ‘인택트(intact)’ 문화의 등장이다.
코로나19로 ‘전 세계적인 고통’을 겪은 사람들이, 앞으로는 과거와는 다른 생활양식을 기본으로 삼는 것을 선호하거나, 혹은 강요받기 때문이다. 이번 사태로 사람들은 전 세계 모든 사람이 ‘질병에 대응하기 위한 사회 시스템’으로 변화하는 과정을 급격하게 경험했다. 이는 분명 좋지 않은 경험이지만, 이 경험으로서 새롭게 알게 된 것들이 적지 않다. 과거엔 불가능할 것만 같았는데, 이번 사태를 계기로 ‘한번 해 보니’ 의외로 편리하고 좋은 것들도 많았다.
예를 들어 과거에는 국제회의를 위해 어쩔 수 없이 전 세계에서 비행기를 타고 모여야 했다. 인터넷 회의 기술은 과거부터 있었지만 공식회의를 이런 것으로 진행하자는 말은 그저 농담처럼 여겨졌었다. 중간에 끊김이 심하고, 회의 진행이 원활하지 않을 수 있다. 또 회의에 참석한 사람들끼리 ‘얼굴을 맞대고’ 서로 친밀감을 쌓기도 어려웠다. 하지만 사람들은 코로나19 이후 어쩔 수 없이 이 시스템을 사용해야 했고, 과거와는 다르게 ‘지금은 의외로 쓸 만하다’는 것을 체감하기 시작했다. 앞으로 코로나19에 대한 통제가 가능해지면 서로 얼굴을 맞대고 진행하는 국제회의는 당연히 지금보다 늘어나겠지만, ‘온라인의 장점’을 체감한 사람들은 여전히 사람들을 만나지 않고 편리하게 회의하는 ‘언택트’ 방식을 선호하게 될 여지가 크다.
재택근무 역시 마찬가지인데, 한편으로는 무의미한 출퇴근이 사라지고, 기업 입장에선 사무공간을 확보하고 운영하는데 많은 비용을 쏟지 않아도 되므로 장점이 크다. 실제로 코로나19가 완전히 종식되더라도 기업들은 재택근무 형태를 버리지 않을 것으로 보인다. 글로벌 워크플레이스 애널리틱스(Global Workplace Analytics)11)는 ‘코로나19 위기가 사라진 후에도 25% 이상의 직원들이 일주일 내내 재택근무 할 것’이라고 예상하기도 했다. 관습적으로 서로 얼굴을 마주 보고 처리하던 업무 중, 많은 것들이 언택트 기반 문화로 넘어가게 되는 것이다.
이는 언젠가 다시 등장할지 모를 새로운 감염병 유행에 능동적으로 대응할 수 있는 기반이기도 하다. 많은 직원이 언택트 기반으로 근무해 왔던 기업이라면, 제2의 코로나, 즉 ‘포스트 코로나’가 찾아와도 업무에 별다른 차질을 겪지 않을 것이다.
요즘 인택트라는 말이 인기를 얻고 있다. 언택트에서 다양한 기술력을 적용해 보다 능동적으로 상호작용을 할 수 있는 경우를 뜻한다. 전자회의를 한다고 가정하면, 지금까지는 얼굴과 회의자료 정도를 들여다보는 경우인데, 인택트의 경우 여러 대의 모니터와 촬영장비를 이용해 서로 메시지를 주고받거나 자료를 활용하는데 불편함을 크게 줄이는 등의 기술이 포함된다.
이 기술은 크게 4단계로 구분하는데, 1세대는 이동전화로 통화하고 이메일로 자료를 주고받는 형태, 2세대는 인터넷 화상전화(VoIP) 형태이며, 3세대는 각각의 컴퓨터 또는 스마트폰에 관련 앱을 설치해 이를 이용해 소통하는 ‘클라우드’ 방식이다. 4세대부터는 이 기반 위에 인공지능 시스템, 가상 및 증강현실 시스템을 활용할 수 있게 된다.
이런 인택트 상호 소통 시스템은 통합 커뮤니케이션 및 협업(UC&C: Unified Communications and Collaboration )이라고도 하는데, 관련 시장이 급속도로 발전할 것으로 예상되고 있다. 이 시장은 연평균 성장률 7.1%, 2023년까지 483억 달러 규모까지 성장할 것이라는 전망이 많다. 이 예측은 코로나19 팬데믹 시작 이전인 2019년 나온 것이므로, 훨씬 더 가파른 상승이 예상된다.
유사한 분야로 ‘원격의료’ 발전도 기대되고 있다. 환자를 직접 눈으로 보고, 손으로 만져보며 진료하길 원하는 의료진들은 원격의료의 도입을 반대하는 경우가 많은데, 이미 시대의 흐름은 빠르게 원격의료를 향해 가고 있어 이런 부작용을 최소화하려는 노력은 필수적이다.
여기에 ‘원격교육 시스템’도 한층 더 발전할 것이다. 현재 코로나19 확산으로 세계적으로 온라인 원격교육 장려 및 지원하고 있으나 관련 시스템은 아직 불편함을 낳고 있다. 그러나 “온라인 수업을 해 보니 장점도 있다.”는 평가도 있어 팬데믹이 종료되더라도 사실상 온라인 수업의 비율은 점점 늘어날 것이다.
(5) 더 안전한 콘택트 기술 주목
세 번째로 꼽을 수 있는 것이 안전한 콘택트 문화다.
언텍트가 아닌 ‘콘택트’ 상황, 즉 서로 대면하여 업무를 처리하거나 여가를 갖는 것이 완전히 사라질 수 없으며 바람직하지도 않다. 이 상황을 기술로 해결하려는 노력은 계속해서 등장할 것이다. 서로 만나지 말라는 것이 아니라, 그 과정에서 혹시 일어날지 모를 감염에 대비하는 장치가 지속적으로 늘어날 것으로 보인다.
현재는 단순히 마스크나 고글, 안경 등을 쓰고, 회의장 책상이나 식탁 등에 가림막 등을 설치하는 것, 택배를 문 앞에 두고 가는 것, 바이러스 전파 위험도가 낮아지는 2m 거리두기를 시행하는 것 등이 대표적이다. ‘포스트 코로나 시대엔 언택트 문화와 기술이 강조될 것’이라고 이야기하는 것은 일정 부분 사실이다. 그러나 그 때문에 콘택트 문화가 극단적으로 축소될 것이라는 판단은 수긍하기 어렵다. 언택트이기 때문에 더 편리한 점은 적극적으로 수용해 나가야겠지만, 콘택트이기 때문에 더 편리하고, 더 행복하며, 경우에 따라 감염으로부터 더 안전할 수 있는 것을 애써 포기할 필요는 없다. 안타깝게도 포스트 코로나 시대에 대한 이야기 중 ‘콘택트’ 문화의 변화에 초점을 맞춘 시각은 찾기 어렵고, 용어도 명확하지 않다. 이러한 기술은 더 안전한 콘택트 문화를 지향하는 것이므로 ‘세이프 콘택트 기술’이라고 부르고 있다.
앞으로는 다양한 신기술들이 개발됨으로써 한층 더 안전한 사회를 만들기 위한 노력이 배가될 것으로 보인다. 외출시 마스크를 착용하고 사람을 만나는 사회로 남을 것이냐는 사회적 합의에 달려 있지만, 다른 여러 가지 아이디어와 기술을 동원한다면 ‘서로 대면한 사람들이 불편하지 않게 감염 가능성을 낮추는’ 기술은 여러 가지를 생각해 볼 수 있다. 즉 콘택트로 얻을 수 있는 이점은 취하면서, 감염은 막을 방법을 최대한 궁리할 필요가 생겨나는 것이다.
먼 미래에 새롭게 등장할 신기술을 고려하지 않더라도, 찾아보면 현재의 기술만으로도 할 수 있는 것은 많이 있는데, 우선 요식업 자영업자들을 도울 방법으로 어떤 아이디어를 낼 수 있을까. 당장 생각나는 아이디어로는 테이블마다 공기 순환 장치를 설치해 주는 것을 고려할 수 있다. 바이러스는 공기를 떠도는 비말 등에 섞여 이동하므로, 인공적으로라도 공기의 흐름을 만들어 주기만 하면 바람을 타고 흘러간다. 테이블 아래로 빨아들인 공기는 차단 효과가 좋은 헤파필터 등으로 여과해 다시 내보낸다면 이 식당 내에서 감염률은 크게 떨어질 것이다. 이런 부분은 단순한 개인의 아이디어이지만, 실제로 과학적으로도 검증된 방법이다. 비슷한 방식으로 공기순환을 하는 비행기 탑승객 사이에선 감염이 크게 줄어든다는 연구결과가 있다.
사회를 자세히 보면 이와 비슷하게, 막상 콘택트 상황을 안전하게 만들기 위한 효과적인 시도보다는 ‘방역지침’을 요식적으로 맞추는데 급급한 경우가 적지 않다. 따라서 세이프 콘택트를 효과적으로 연구하고, 대응하려는 노력이 절실한 시기다. 앞부분은 투명 플라스틱으로 되어 있어 서로의 얼굴을 알아볼 수 있고, 옆쪽으로 필터가 붙은 송풍장치를 설치해 공기를 순환시키는 인식형 전자 마스크, 공항이나 항만에서 출입국과 동시에 실시간으로 백신 접종 여부를 확인할 수 있는 감지 시스템의 등장도 기대해 볼 만하다.
현재 한국을 포함해 많은 나라가 전자여권을 채용하고 있는데, 이를 더 진보시켜 ‘최신 감염증 예방 내역과 진료 정보’를 업데이트해 넣는 방법도 고려할 수 있다. 이렇게 된다면 해외여행 전에 여권 유효기간 등을 확인하듯이, 최신 예방접종 여부를 확인해 출입이 가능한 국가를 사전에 확인하는 문화가 생길 수 있다.
코로나19는 세계적인 사회․경제적 위기를 가져 왔지만 한편으로는 값진 경험을 쌓았으며, 이는 인류의 생활양식을 새롭게 바꿔나가는 계기가 되어가고 있다. 지금은 질병의 예방과 치료에 집중하는 것은 물론, 한편으로 편리한 ‘인택트’ 문화, 더 안전한 ‘세이프 콘택트’ 관련 기술을 연구하고 실용화하기 위해 노력해 나가야 할 때가 아닐까 생각해 본다.
나. 연구개발 및 산업적 측면
(1) 산업적 측면
(가) 환경 변화
① 포스트 코로나 시대의 제약 및 생명공학 산업의 명암
㉮ 포스트 코로나 유망 플랫폼기술
2009년 신종플루, 2015년 메르스, 2019년 코로나19 등 주기적으로 팬데믹이 도래하고 있다. 이에 따라, 팬데믹 상황에 대응하기 위한 백신․치료제 플랫폼 개발의 필요성이 대두되고 있으며, 신규 플랫폼기술을 활용한 백신․치료제 개발이 진행 중이다.
백신의 경우 코로나19 팬데믹에 대응하기 위해 mRNA백신, 아데노바이러스 벡터 백신 등 신규 플랫폼 기술을 활용한 백신의 상업화에 성공하였다. 특히 mRNA백신 및 재조합 단백질 백신의 경우 나노파티클 플랫폼을 활용하여 백신의 면역원성을 높이고 백신 효과를 극대화하는 기술을 적용하여 임상에서의 예방능이 기존 백신 기술에 비해 월등히 개선되는 효과를 보였다.
mRNA백신의 경우, 화이자/바이오엔텍, 모더나, 큐어백이 개발을 진행, 가장 빠르게 상업화되었다. 이 백신은 현재 글로벌 백신 접종에 활용되고 있으며 이를 통해 기업 가치가 급격히 상승하였다. 재조합 백신의 경우, 노바박스의 곤충세포를 이용한 재조합 백신 생산 플랫폼 기술과 나노파티클 신기술을 적용한 백신의 임상을 통해 유효성 및 안전성을 확보하여 상업화가 진행 중이다. 이외에도 항암․면역치료제로 사용되는 항체공학 기술을 이용한 항체치료제도 상업화에도 성공하였다.
㉯ 기존 백신 및 치료제 기술의 한계
기존 글로벌 백신 제조사의 코로나19 백신개발이 지연되면서 글로벌 백신 제조사인 사노피/GSK, 머크 등은 기존 백신 제조기술을 적용한 코로나19 백신 상업화에 어려움을 겪었다. 국내 백신 제조사인 녹십자, SK바이오사이언스, 일양의 경우에도 신속한 백신개발을 위한 mRNA플랫폼기술을 보유하고 있지 않아 개발이 보류되거나 지연되었다.
불활화 백신의 경우, 중국 시노백사에 의해 상업화되었으나 신기술인 mRNA 백신, 아데노바이러스 벡터 백신에 비해 임상적 효능에서 열등한 결과를 보였다. 치료제의 경우, 기존 항바이러스제의 약물 재창출을 통한 임상에서는 뚜렷한 효능을 보이지 않고 있으며, 특히 경구용 제제는 약물 후보의 안전성․유효성 검증에 시간이 많이 소요되어 조기 상업화에 어려움을 겪고 있다. 중증치료제의 경우, 램데시비어와 덱사메타손과 같은 제한된 약물의 효능 입증을 제외하고는 신약 개발에 어려움을 겪고 있으며 대부분은 경증․중등도 약물 개발에 집중되고 있다.
(나) 향후 전망
① 포스트 코로나 시대의 제약 및 생명공학 산업 전망
㉮ 팬데믹 상황 대응을 위한 플랫폼기술 적용 범위 확대
새로운 플랫폼을 적용하여 임상 효능의 우수성과 안전성을 확보할 경우 백신개발의 패러다임이 변화될 가능성이 있어 향후 주기적 팬데믹 상황을 고려한 플랫폼 기술 확립이 필요하다. 아울러 mRNA플랫폼, 아데노바이러스 벡터 플랫폼의 대규모 안전성 확보를 통한 타적응증에 대한 적용 범위 확대가 필요하다.
따라서, 현재 임상적 효능과 안전성을 확보한 모더나, 화이자/바이오엔텍, 큐어백 등의 mRNA플랫폼 기술에 대한 국내외 제약․바이오 기업의 관심도가 높아지고 있으며, 해당 기술을 자체적으로 확립하거나 기술이전을 통한 CDMO 사업화를 고려하는 기업이 다수 존재하고 있다. 아데노바이러스 벡터의 경우, 유전자치료제의 벡터로 적용 가능하여 코로나19 백신 임상에서 안전성․효능 데이터를 활용한 적응증 확대가 가능할 것으로 보인다.
㉯ 플랫폼 기술 적용을 위한 제조기술 확립 필요성
mRNA플랫폼 기술의 적용 범위 확대에 따라 제약 및 생명공학 기업의 관심이 증가하고 있으며, mRNA플랫폼 제조 기술 확립을 위해 자체 인프라 구축 및 기술을 도입하는 등 활발한 투자가 진행되고 있다.
국내의 경우 녹십자, 한미, 에스티팜과 같은 제약기업 및 아이진, 큐라티스와 같은 벤처기업의 mRNA플랫폼 제조기술에 대한 투자가 진행 중이다. 또한 삼성바이오로직스, SK바이오사이언스의 경우 모더나의 완제 CMO, 아스트라제네카, 노바박스의 원액, 완제 CMO 등 제조기술 이전을 통한 기술 확립이 진행 중이다. 국외의 경우, 론자, 써모피셔 등의 CMO 업체가 mRNA 제조기술을 확립하여 모더나, 화이자/바이오엔텍과의 장기 공급 계약을 맺고 팬데믹 상황에서 CMO 사업의 영역 확대를 통한 이윤을 창출하고 있다.
㉰ 진단 영역에서의 글로벌 기업화
코로나19 팬데믹 상황으로 국내 진단업체가 비약적으로 성장하였다. 코로나19 팬데믹 이전에 비해 씨젠, 에스디바이오센서 등의 분자진단․신속진단키트 개발 기업의 경우 매출액 및 순이익의 수십 배의 성장을 이루어냈으며, 이를 통한 상장 추진 및 미래를 위한 투자가 진행 중이다. 글로벌 진단업체와의 경쟁에 필요한 기술의 고도화, 글로벌 유통 채널의 지분투자 혹은 M&A를 통한 경영권 확보를 추진하는 등 진단업계는 글로벌 기업으로의 도약을 모색하고 있다.
더불어 국내외 기업은 진단사업에서의 신기술 확보를 위해 투자하고 있으며, 이를 통해 글로벌 수준의 진단기술을 고도화 할 것으로 예상된다.
특히, 다양한 질환에 대한 동시진단기술 영역은 미래 진단기술의 핵심기술이며, 이에 대한 투자 여력과 함께 국내 벤처기업과 급성장한 진단기업들의 협업이 이루어진다면 진단사업 영역의 글로벌화는 가속화될 것으로 예상된다. 하지만 현재의 글로벌 진단업체는 IT를 접목하는 등 기술융합 측면에서 비교우위가 있으므로 국내 기업도 글로벌 진출을 위해서는 IT기업, 진단기기 제조업체 및 진단키트 개발 업체 간의 협업이 이루어져야 글로벌 경쟁력을 확보할 수 있을 것으로 보인다.
㉱ 디지털 헬스케어 확대 전망
코로나19 팬데믹 상황에서 원격진료의 필요성이 대두되고 있으며 이는 디지털 헬스케어의 향후 발전에 긍정적인 요소로 작용하고 있다. 디지털 헬스케어는 현재 당뇨와 같은 만성질환의 원격관리앱, ADHD 등의 정신질환에 집중된 디지털치료제 개발, 원격진료와 이를 활용한 처방 등의 단계로 발전하고 있으며 전세계 시장 규모가 2027년까지 꾸준히 증가하여 2조 원에 이를 것으로 전망하고 있다.
국내의 경우 벤처 중심의 디지털 헬스케어 시장이 형성되고 있다. 주로 당뇨와 같은 만성질환 관리앱을 개발하고 있으며, 삼성에서 자폐증 질환의 디지털치료제 개발을 초기 단계에서 진행하고 있다. 디지털 헬스케어 시장은 IBT 융합 기술을 적용하여 환자․보험재정에 긍정적 영향을 줄 수 있는 미래 사업 분야로서 선진국의 경우 이미 다양한 만성질환 관리앱이 상용화되어 있고, 2종의 디지털 치료제(ADHD, 약물 오남용)가 미국 FDA의 승인을 받아 상용화 된 바 있다.
디지털치료제 시장의 발전을 위해서는 과감한 규제혁신이 필요하며, 이를 통해 고도화된 IBT 융합기술을 실제 임상에서 그 효용성을 확인하고 이를 실제 의료 환경에 과감하게 적용함으로써 글로벌 경쟁에서 앞서 나갈 수 있는 입지를 다지는 것이 중요하다. 국내는 이미 정부 주도의 연구개발을 통해 만성질환 관리를 통한 환자의 증상 개선에 대한 긍정적 결과를 보여주고 있다. 앞으로 이러한 노력을 디지털 헬스케어와 연계하여 전국 병원으로 확대하고 정부․산업계․병원․약국 등과 연계한 협의체를 운영하여 글로벌 디지털 헬스케어 시장 진출의 밑그림을 그리기 위한 실질적인 논의가 이루어져야 할 것이다.
㉲ 과감한 규제 혁신을 통한 신약개발 경쟁력 확보
코로나19 팬데믹 상황은 치료제 개발 과정에서 요구되는 자료들을 최소화하는 등 개발기간을 단축하였으며, 이러한 규제혁신은 향후에도 신약개발 속도를 높이고 개발비를 최소화하는 데 도움이 될 것으로 보인다.
특히 우리나라는 바이오시밀러 항체치료제의 세계 최초 허가과정을 통해 해당 분야 규제 선도국 위치를 자리매김한 경험이 있다. 최근 발표된 백신 ICP 임상 가이드라인의 경우도 플라시보 임상이 어려운 상황에서 백신개발을 지원하기 위한 정부의 적극적 규제개선 노력의 결과였다.
㉳ 팬데믹 감염질환 치료제 영역에서 다양한 대안 제시
항체치료제는 RSV, C-difficile치료제 상업화를 제외하면 시장이 미미한 편이다. 하지만 항체치료제 개발은 코로나19 팬데믹 상황에서 감염자 혈액의 B세포에서 강력한 중화능을 갖는 후보항체를 직접 스크리닝 하거나, 파지디스플레이(phage display)기술 등을 활용하여 빠르고 신속한 후보 항체를 스크리닝하고 기존 항체 생산 플랫폼을 활용하여 비교적 빠른 임상 및 상업생산을 가능하게 한다.
특히 미국의 경우 정부 주도의 OWS(Operation Warp Speed)와 게이츠 재단에서 주도하는 CoVIC 프로그램을 통해 다양한 항체치료제 개발이 성공적으로 이루어졌으며 릴리, 리제네론, GSK의 경우 미국 정부 지원 아래 개발을 가속화하여 코로나19 팬데믹 상황을 완화하는데 기여하였다. 국내의 경우 셀트리온 렉키로나의 조건부 승인을 받아서 2021년 7월 30일 현재 85개 병원 7,829명의 환자 투여가 이루어졌으며 확진자의 중증 악화를 막아주어 코로나19 치료제 대안으로 자리매김하였다.
향후 회복 환자의 B세포를 직접 스크리닝하여 강한 중화능을 스크리닝 하는 기술을 확립하면 감염질환에 대한 좀 더 다양한 항체치료제 플랫폼 확립이 가능할 것으로 예상된다.
② 주기적 팬데믹에 대비하기 위한 치료제 및 백신개발 연구 필요성
코로나19 팬데믹을 계기로 잠재적인 팬데믹 출현에 대비한 광범위한 항바이러스 치료제 개발을 위한 미국 및 유럽의 주요 글로벌 제약사가 참여하여 벤처기업과 혹은 글로벌 제약사간 공동 연구를 진행 중이며, 국가 차원의 재정을 투입하여 신약 개발을 진행 중이다.
백신의 경우에도 글로벌 백신연구를 위한 비영리재단 CEPI의 지원을 받아 다양한 형태의 백신개발이 이루어지고 있으며, 특히 변이가 진행되면서 기존 백신의 효능이 무력화되는 상황을 대비하기 위한 다양한 대안(부스트샷, 다가 백신) 연구도 진행 중이다.
치료제의 경우에는 경구용 치료제 개발이 화이자, 머크 등 글로벌 제약사를 통해 현재 후기 임상 단계에 있으며, 기존 램데시비어 이외의 다양한 작용기전 접근(예를 들어, 항 IL-6항체인 악템라를 활용하여 사이토카인 분비를 억제 폐렴 증상을 완화하는 치료법 등)을 통하여 중증환자의 사망률을 낮추기 위한 치료제 개발도 진행되고 있다.
③ 바이오시밀러/제네릭 등을 활용한 의료재정 부담을 최소화하기 위한 노력
현재 코로나19 팬데믹 상황을 극복하기 위한 미국 및 유럽 정부의 재정지출 규모는 수십에서 수백조 원 규모로 추정되지만 향후 코로나19 팬데믹 이전으로 급속하게 회복하기 위해서는 적극적인 재정투자가 필요한 상황이다.
의료 영역의 경우, 기존 치료제의 고비용 구조에 대한 정부재정의 집행 분야 및 그 규모가 커짐에 따라 상대적으로 보건의료 분야에서 정부의 재정압박이 예상된다. 따라서 바이오시밀러의 경쟁을 통한 약가 인하 등 각국 정부의 노력이 가시화될 것으로 보이며, 향후 특허 만료에 따른 바이오시밀러의 적극적 활용이 예상되고 있다.
미국의 경우 오바마 액트의 부활로 바이오시밀러의 시장 점유율이 높아질 것으로 예상하고 있다. 이러한 예상은 최근 바이든 행정부의 오리지널 의약품을 가진 회사의 특허남용을 억제하는 법안 등의 통과가능성이 높아지면서 현실화되고 있다. 국내 바이오시밀러 개발업체인 셀트리온과 삼성바이오에피스의 경우 미국 시장의 확대를 기대해 볼만한 변화이다.
④ 국가 주도의 감염병 연구기관 활약 기대
우리나라의 경우 질병청 산하에 국립감염병연구소가 신설되어 감염병 전문인력을 보강하고 예산을 투자하는 등 국가적 차원에서 감염병 대응을 위한 다양한 기초 및 임상 연구가 진행될 예정이다.
과학기술정보통신부는 기초과학연구원에 한국바이러스기초연구소를 신설하여 다양한 신변종 바이러스의 기초과학 연구가 수행될 예정이며, 이를 통해 신규 감염바이러스에 대한 기초연구가 가능할 것으로 보인다. 더불어 mRNA백신개발을 위한 mRNA백신개발 전문위원회를 구성하고 정부차원의 지원을 강화하고 있으며, 이를 통해 국내 녹십자, 한미, 에스티팜 등 기업을 중심으로 mRNA백신을 빠른 시간 내에 국산화하려는 노력이 진행 중이다.
⑤ 글로벌 백신 허브 구축을 통한 백신 산업 부흥
최근 정부는 미국 정부와 협력하여 글로벌 백신 허브를 위한 국가간 협력에 대해 논의하였으며, 이를 통해 기존의 SK바이오사이언스에서 수행하고 있던 노바박스, 아스트라제네카의 위탁생산과 더불어 삼성바이오로직스도 모더나의 백신 생산 CMO역할을 수행하게 되었다.
우리나라는 장기적인 관점에서 자체적으로 mRNA백신 제조에 필요한 기술을 확보하여 감염병 발병 시 조기에 자체 백신을 확보할 수 있는 기술력을 갖추기 위해 준비하고 있다. 기존 SK바이오사이언스, 녹십자 등의 생산 인프라를 활용하고 국내 기업들의 적극적인 투자를 통해 향후 mRNA백신 생산설비를 확충하게 되면, 글로벌 수준의 백신 생산설비를 갖추게 되어 글로벌 백신 허브로서의 역할을 기대할 수 있을 것으로 보인다. 이를 위해 보건복지부 내 K-mRNA컨소시엄 구성과 함께 실무 추진을 위한 조직을 신설하여 구체적인 업무를 추진하고 있다.
⑥ 신약개발을 위한 임상 인프라 확보
정부의 지원 아래 국내 임상기관들과 협조하여 국가적으로 임상을 진행하기 위한 인프라 구축을 진행하고 있다. 코로나19 팬데믹 상황에서 국내 임상을 진행하는데 행정적인 절차나 임상운영을 위한 인력 부족 등 여러 문제점이 노출되었다. 그러나 감염병 임상 연구 시험을 위한 전문가협의체를 구성하여 임상 진행 시 필요한 규제 완화나 임상 운영에 필요한 인력 양성을 위한 투자 방안을 마련하는 등 실질적인 개선안을 도출하고 이를 통해 향후 감염병 발생 시 국가적인 차원에서 지원할 수 있도록 할 예정이다.


|
주요 내용 요약 |
|
|
||
|
|
|
|
||
|
구분 |
미국 |
EU |
||
|
사회적 이슈 |
코로나19에 신속 대응을 위한 연구개발 예산을 긴급 지원하고, 바이든 정부는 바이오 혁신 가속화 전략을 제시 |
코로나 팬데믹, 기후 변화, 경제 침체로 인한 불평등 및 차별 증가 |
||
|
정책 동향 |
그동안 국민의 건강증진이나 산업 육성에 초점을 두고 있었지만 최근에는 국가 안보 측면도 강조 |
연구 및 혁신 전략 2020∼2024 수립, 유럽 보건 연합 구축, 유럽 제약 전략 강화 |
||
|
기술 및 산업동향 |
(연방정부)25개 이상의 연방기관이 지원하는 다원화 체제. 국립보건원(NIH), 국립과학재단(NSF), 농림부(USDA) 등이 분야별 지원 (산업) 전세계 바이오의약품 시장의 61%를 차지. 타 국가에 비해 월등히 높은 점유율로 전세계 시장을 주도 |
EU의 16개 첨단 기술들, 산업 생명 공학 |
||
|
법제도 동향 |
바이오경제 선점을 위해 생물공학연구개발법, 바이오경제 연구개발법, 미국 혁신경쟁법 등 다수의 법률을 제정 |
코로나19 팬데믹 대응 긴급 재정 승인, EU 장기예산 및 NextGeneration EU 승인, EU 기관 변동 사항 |
||
|
|
|
|
||
|
|
|
|
||
|
중국 |
일본 |
|||
|
현대화 국가 건설을 위한 제14차 5개년계획(2021∼2025) 및 2035년 비전 목표 발표 |
장기집권하던 아베수상이 퇴임하고 새로운 스가수상이 취임. 코로나19로 인한 대규모 환자의 발생, 올림픽 연기 등의 경제사회적 충격을 이겨내고 있는 상황 |
|||
|
제14차 5개년계획(2021∼2025)의 생물산업 육성. 국가 바이오기술 산업기지와 생물 산업기지 등 바이오 클러스터 육성 |
과학기술기본계획을 과학기술․이노베이션기본계획으로 변경하고, 제6기 과학기술․이노베이션기본계획과 이에 근거한 통합이노베이션전략 2021을 수립․추진 |
|||
|
지식재산권과 산업경제를 융합한 생물의약 산업 발전 추진. 생물의약, 바이오농업, 바이오산업 주요동향 |
통합이노베이션전략추진회의는 ‘바이오전략 2019’에 이어, 바이오전략 2020을 수립․시행. 범부처적으로 파괴적 이노베이션의 창출을 목표로 설정한 문샷형 연구개발 프로젝트는 7개의 연구목표를 선정․추진. 일본의료연구개발기구(AMED)는 코로나19 관련 연구개발과제를 총괄하고 있으며, 현재 약 340개 과제를 지원 |
|||
|
2021년 4월, 생물안전법의 시행으로 바이오기술의 오남용 방지와 유전자원 등의 관리체계 마련 |
총리 자문기구인 규제계획추진위원회에서 제출한 안을 바탕으로 디지털정부의 추진, 디지털시대를 위한 규제의 재검토, 기타 횡단적 과제 등을 주요 골자로 하는 ‘2021년도 규제개혁실시계획’을 확정․추진. 경제 4단체에 대해 코로나19 확대 방지라는 관점에서, 긴급히 조치해야 하는 규제․제도 등에 대한 의견 수렴 |
|||

1. 미국
가. 사회적 이슈
미국은 코로나19에 대응하기 위해 2020년 3월 추경 법안과 코로나바이러스 지원구제경제안정법(CARES Act: The Coronavirus Aid, Relief, and Economic Security Act)을 통과시키고 진단, 백신, 치료제 등 연구개발 예산을 긴급 지원하였다. 5월에는 민관이 공동으로 백신 개발 단계를 동시에 수행하여 개발 기간을 반으로 단축하기 위해 100억 달러 규모의 일명 ‘초고속 작전(Operation Warp Speed)’을 착수하였다. 이러한 노력의 결과로 2020년 12월 18일 식품의약청(FDA)이 모더나가 개발한 코로나19 백신을 긴급 사용승인하고 접종을 시작할 수 있었다.
2021년 1월 취임한 제46대 조 바이든 대통령은 당선 이후 단기적으로 코로나19 극복에 역량을 집중하는 한편, 바이오 혁신을 가속화하기 위한 전략도 제시하였다. 구체적으로는 바이오 관련 연방 부처 연구개발에 향후 4년간 3,000억 달러를 투자할 계획이며, 국립보건원(NIH) 산하에 첨단보건연구기구(ARPA-H) 설치를 추진하고 있다.
무엇보다 트럼프정부에서 축소․침체되었던 과학기술 분야를 국정운영의 중심으로 설정하고, 백악관 과학기술정책실(OSTP)을 행정부 부처 지위로 격상하였다. 또한 그동안 주로 물리학자들이 임명되던 과학기술정책실장에 최초로 바이오 전문가인 에릭 랜더(Eric Lander) MIT 교수를 임명하고, 대통령 과학기술보좌관을 겸임하도록 하였다.
나. 정책동향
백악관 과학기술정책실은 2020년 8월에 발표한 ‘2022년도 연구개발 예산 우선사항’에 바이오를 비롯하여 5대 우선 투자분야의 하나로 제시했다. 바이오 분야에서의 중점 투자분야는 (1) 진단, 백신, 치료제 연구개발, (2) 전염병 모델링 및 예측, (3) 바이오의약품 및 생명공학, (4) 바이오경제이다.
2021년 4월에 의회에 제출한 ‘2022년 과학예산’에서도 ‘공공보건 인프라 강화와 코로나19 위기대응’을 최우선 분야로 제시하였고, 보건분야의 예산도 전년 대비 23.1% 증액을 요청하였다.
그동안 미국의 바이오 정책은 국민의 건강증진이나 산업 육성에 초점을 두고 있었지만 최근에는 국가 안보 측면도 강조되고 있다. 특히 2000년대 이후 지속되고 있는 중국과의 기술 패권 경쟁에 대응하기 위해 2021년 6월에 통과된 ‘미국 혁신경쟁법’(U.S. Innovation and Competition Act)에 근거하여 생명공학, 합성생물학, 유전체학, 바이오매트릭스 등 핵심기술 분야의 연구개발과 인력양성에 집중 지원하고 있다.
다. 연방정부 동향
바이오 연구개발은 25개가 넘는 연방정부 부처와 기관이 지원하는 다원화 체제를 가지고 있다. 바이오․헬스는 국립보건원(NIH), 기초 생명과학은 국립과학재단(NSF)이 주로 지원한다. 그 외에 에너지부(DOE), 국방부(DOD), 농림부(USDA) 등이 해당 분야의 연구개발을 지원하고 있다.
(1) 국립보건원(NIH)
NIH(National Institutes of Health)의 2020년 예산은 417억 달러이며, 코로나19 신속 대응 예산 35억 9,000만 달러가 추가되어 총 453억 달러가 지원되었다. 총예산의 80%는 외부공모(extramural)로 외부 대학, 연구소 등에 지원되고, 나머지 20%는 내부연구(intramural)로 산하 27개 연구소(센터)에서 사용한다.
NIH는 2016년 제정된 21세기 치료법(21st Century Cures Act)에 명시된 정밀의료(All of Us), 뇌이해(BRAIN), 암정복(Cancer Moonshot), 재생의료(RMIP) 등의 이니셔티브를 주관하고 있다.
[표 1-1] 21세기 치료법에 따른 NIH 주관 주요 국가 이니셔티브
(단위: 억 달러)
|
명칭 |
목표 |
기간 |
참여기관 |
예산 |
|
|
총액 |
2020 |
||||
|
All of Us |
바이오 빅데이터 분석을 통해 정밀 의료 구현. 100만 명 건강 상태를 10년간 추적 관찰 |
2017∼26 (10년) |
5개 연방정부기관(NIH, FDA 등), 빌&멀린다게이츠재단, 브로드연구소, 기업(화이자, 아마존, IBM, 인텔, MS), 병원 |
14.55 |
1.49 |
|
BRAIN |
뇌세포와 신경회로의 상호작용을 통해 뇌 기능을 규명하기 위한 신기술을 개발․응용 |
2017∼26 (10년) |
6개 연방정부기관(NIH, NSF, FDA 등)과 민간재단(시몬스재단 등), 대학(피츠버그대학), 기업(GE, 구글, GSK 등) |
15.11 |
1.4 |
|
Cancer Moonshot |
암 연구를 통합적으로 수행하여 새로운 항암면역치료제를 개발 |
2017∼23 (7년) |
7개 연방정부기관(NIH, FDA, NCI, DOD 등), 빌&멀린다게이츠재단, 브로드연구소, 기업(아마존, MS 등), 병원 등 |
18 |
1.95 |
|
Regenerative Medicine |
성체줄기세포 연구와 임상 연구를 지원하여 산업화를 촉진 |
2017∼20 (4년) |
NIH, FDA |
0.3 |
0.8 |
자료: https://www.nih.gov/research-training/medical-research-initiatives/cures
NIH는 코로나19에 대응하기 위해 민관공동으로 참여하여 백신과 치료제의 임상개발을 위한 유망한 후보물질을 선정하고 임상단계 진입을 촉진하기 위한 ‘코로나19 치료제․백신 개발 촉진’(ACTIV: Accelerating COVID-19 Therapeutic Interventions and Vaccines) 프로그램을 신설하고, ‘신속진단촉진’(RADX: Rapid Acceleration of Diagnostics) 프로그램을 통해 32개 기술 플랫폼 개발을 지원하였다.
한편, 바이오․헬스 분야에서 전통적인 방식의 연구개발로는 추진하기 어려운 고위험, 혁신적 아이디어를 지원하기 위해 국방부의 국방첨단연구청(DARPA) 모델을 벤치마킹한 첨단보건연구기구(ARPA-H) 설치를 위해 2022년 예산으로 65억 달러를 요구하고 있다.1)
(2) 국립과학재단(NSF)
국립과학재단(NSF: National Science Foundation)은 생물과학국(BIO)을 통해 의과학을 제외한 ① 분자․세포 기작, 기능 및 진화 이해, ② 유기체의 구조, 기능, 상호작용 및 행동 이해, ③ 생물 다양성, ④ 감염병 생태 및 진화 등 기초 생명과학 연구를 지원한다.
2020년 바이오 예산은 전체 연구개발 예산의 10%인 약 8억 1,000만 달러이며, 2022년 예산으로 2021년보다 약 16% 증액된 약 9억 5,000만 달러를 요구하였다.
주요 프로그램으로는 ‘10대 빅 아이디어 프로그램’의 하나로 유전자형으로부터 표현형을 예측하는 ‘생명법칙의 이해’(Understanding the Rules of Life) 사업과 NIH의 BRAIN 이니셔티브와 공동으로 추진하는 ‘뇌이해’(UtB) 사업이 있다.
[표 1-2] NSF 바이오 예산 현황
(단위: 백만 달러)
|
항목 |
바이오 예산 |
|||
|
2020 |
2021(추정) |
2022(요구) |
증가율 |
|
|
Molecular & Cellular Biosciences(MCB) |
153.54 |
155.64 |
170.74 |
9.7% |
|
Integrative Organismal Systems(IOS) |
204.05 |
206.98 |
227.07 |
9.7% |
|
Environmental Biology(DEB) |
171.31 |
178.86 |
196.22 |
9.7% |
|
Biological Infrastructure(DBI) |
181.85 |
167.08 |
204.89 |
22.6% |
|
Emerging Frontiers(EF) |
99.71 |
110.79 |
149.59 |
36.5% |
|
|
810.46 |
819.35 |
948.51 |
15.9% |
자료: National Science Foundation FY 2022 Budget Request to Congress.
(3) 에너지부(DOE)
에너지부(DOE: Department of Energy)는 ① 지속 가능한 바이오 연료 생산을 위한 미생물 및 식물 디자인, ② 대기, 토양, 해양 관련 생물시스템 이해에 관한 연구를 지원하고 있다. 2021년 생명환경(BER) 예산 중 지구환경시스템 예산을 제외한 순수 바이오 분야 예산은 4억 달러이다. 에너지부의 대표적인 연구기관 중 하나인 JGI(Joint Genome Institute)의 2021년 예산은 8,000만 달러이다.
[표 1-3] DOE 생명환경(BER) 예산 현황
(단위: 천 달러)
|
항목 |
바이오 예산 |
||
|
2020 |
2021 |
2022(요구) |
|
|
유전체 과학 |
268,235 |
277,574 |
277,000 |
|
생물분자 동정 및 이미징 과학 |
45,000 |
45,000 |
45,000 |
|
생물시스템 시설 및 인프라 |
77,000 |
80,000 |
84,500 |
|
생물시스템 과학(SBIR/STTR) |
14,544 |
- |
- |
|
합계 |
404,779 |
402,574 |
406,500 |
자료: DOE FY 2022 Congressional Budget Justification.
(4) 농무부(USDA)
농무부(USDA: United States Department of Agriculture)의 농업연구부(ARS)는 2021년 6,000여 명의 인력이 전국 90개 및 해외 다수 연구시설에서 690개 연구과제를 수행하고 있다. 기초연구에 중점을 두고 있지만 연구개발 성과의 산업화를 촉진하기 위해 노력하고 있다.
2021년 예산은 14억 5,000만 달러이며, 이 중 외래 인수공통전염병 연구를 위한 첨단 바이오 격리시설인 국가 바이오농업국방시설(NBAF: National Bio and Agro-Defense Facility) 구축비 1억 달러가 포함되어 있다. 국립식품농업연구소(NIFA)에서는 동․식물의 건강 및 생산성, 식품안전과 영양, 바이오에너지․자원․환경, 농업기술 등을 중점적으로 연구개발하고 있고, 2021년 예산은 14억 7,000만 달러이다.
[표 1-4] USDA 바이오 관련 예산 현황
(단위: 백만 달러)
|
항목 |
바이오 예산 |
||
|
2020 |
2021(추정) |
2022(요구) |
|
|
농업연구부(ARS) |
1,348 |
1,453 |
2,266 |
|
국립식품농업연구소(NIFA) |
1,388 |
1,466 |
2,683 |
자료: 2021 USDA BUDGET SUMMARY.
(5) 국방부(DOD)
국방부(DOD: Department of Defense)는 산하 기관인 국방첨단연구사업청(DARPA)을 통해 혁신적 신기술 개발을 지원한다. 바이오 분야를 담당하는 생물기술국(BTO)은 신경과학, 감염병, 휴먼-머신 인터페이스, 유전자 교정, 합성생물학 등과 관련된 30개 내외의 프로그램을 지원한다. 이 외에도 기초 바이오메디컬 기술, 생물무기방위 등의 연구개발을 지원한다.
[표 1-5] DOD 바이오 관련 예산 현황
(단위: 천 달러)
|
항목 |
바이오 예산 |
||
|
2020 |
2021(추정) |
2022(요구) |
|
|
바이오메디컬 기술 |
131,017 |
107,568 |
108,698 |
|
생물무기 방어 |
30,011 |
26,950 |
31,421 |
|
소재․바이오 기술 |
260,831 |
245,017 |
317,024 |
자료: DOD Fiscal Year(FY) 2022 Budget Estimates.
특히, 국방부는 2014년 제정된 미국 제조업 부흥 및 혁신법에 근거하여 바이오의 산업 플랫폼 구축을 위한 연구기관을 설립․운영하고 있다.
[표 1-6] 미국 국방성 지원 바이오 제조 연구소 설립 현황
|
명칭 |
분야 |
위치 |
설립년도 |
|
BioFabUSA(Advanced Regenerative Manufacturing Institute) |
줄기세포, 조직재생, 조직 관련 제조 |
맨체스터, 뉴햄프셔 |
2017. 2. |
|
NIIMBL(The National Institute for Innovation in Manufacturing Biopharmaceuticals) |
바이오 의약품 제조 |
뉴와크, 델라웨어 |
2017. 3. |
|
BioMADE(Bioindustrial Manufacturing and Design Ecosystem) |
합성생물학 기반 바이오 산업 제조 |
미네소타대학 |
2020.10. |
자료: 저자 작성.
(6) 식품의약품안전청(FDA)
식품의약품안전청(FDA: Food and Drug Administration)은 희귀의약품, 중증 질병 치료제들의 개발을 촉진하기 위해 승인 기간을 단축하는 가속승인, 신속심사, 혁신적 치료제, 우선심사 제도를 도입해 운영하고 있다. 코로나19 신속 대응을 위해 2020년 코로나바이러스 치료 촉진 프로그램(CTAP: Coronavirus Treatment Acceleration Program)을 신설하여 임상 전단계 610개 이상, 임상 진입 이상 단계 450개 이상, 긴급 사용승인 치료제 9건, FDA 승인 치료제 1건 등을 심사했다.
(7) 보훈청(VA)
보훈청(VA: Department of Veterans Affairs)은 퇴역 군인이나 가족, 유족에 대한 보건서비스 측면에서 연구개발을 지원한다. 백만퇴역군인프로그램(Million Veteran Program)은 NIH의 정밀의료 프로그램(All of Us)과 연계되어 운영되며, NIH 국립암연구소(NCI)와 공동으로 대규모 코호트 데이터 분석연구를 수행하고 있다.
라. 산업동향
미국의 2019년 매출액 기준 바이오의약품 시장은 2,104억 9,100만 달러로 전 세계 시장의 61%를 차지하였다. 타 국가에 비해 월등히 높은 점유율로 전 세계 바이오의약품 시장을 주도하고 있다. 최근 5년 동안 연평균 14% 성장하였다. 전체 의약품 대비 바이오의약품 비중은 2015년 30%에서 2019년 42%로 큰 폭으로 증가하였다.
2019년 바이오의약품 상위 10위 제품 모두 항체의약품을 포함한 유전자재조합 의약품으로 나타났고, 매출 1위 제품은 ‘HUMIRA’로 2019년 기준 215억 2,497만 달러를 기록하였으며, 그다음으로는 ‘ENBREL’, ‘LANTUS’, ‘STELARA’가 뒤를 이었다.
미국은 FDA를 통해 2019년 48개의 신약을 승인하여 전세계 승인 신약의 57%를 배출하였다. 2020년 코로나19 상황에서도 미국 FDA는 희귀의약품 등 신속심사 허가 제도를 적극적으로 활용하여 역대 2번째로 많은 53개의 신약을 승인하였다.
마. 법제도 동향
미국 의회는 과학기술 분야의 국제 경쟁이 치열해지면서 필요한 자원을 전략적으로 투자하지 않고서는 그동안 미국이 선도한 바이오 분야 기술 경쟁력을 잃을 위험에 처해 있다고 인식하고, 2019년에 생물공학 연구개발법(Engineering Biology Research and Development Act)을 제정하였다.
이 법률은 백악관 과학기술정책실(OSTP)이 주관하여 국립과학재단, 에너지부, NASA, 국가표준연구소, 환경보호청, 농림부, 국립보건원 등이 참여하는 국가 생물공학 연구개발 이니셔티브를 시행, 사업 운영을 위한 조정 기구와 자문위원회를 설치하고 관계 부처가 참여하는 위원회를 운영하도록 규정하고 있다.
코로나19 팬데믹 상황을 겪으면서 바이오가 국민의 건강과 경제 안정을 위해 매우 중요하다는 것을 인식하고 2021년에 생물공학연구개발법을 일부 수정한 바이오경제 연구개발법(Bioeconomy Research and Development Act)이 발의되었다.
한편, 미중 간 기술 패권 경쟁이 가열되면서 바이오, AI, 5G 등 첨단 기술 분야에서의 기술 패권을 강화하기 위한 전략의 일환으로 2021년 6월 ‘미국 혁신경쟁법’(U.S. Innovation and Competition Act, 2021.6.8.)’이 통과되었다. 이 법안은 연구개발 및 산학협력 촉진을 위해 향후 5년간 2,500억 달러를 투자하고, 이 중 1,900억 달러를 생명공학, 합성생물학, 유전체학, 바이오메트릭스 등 핵심 기술 분야의 연구개발 육성에 투자하도록 규정하고 있다.
|
참고자료 |
-[KoBIA] 바이오의약품 산업동향 보고서 (2020.12.)
-2020 FDA drug approvals, Nature, vol.20 (2020.2.)
-2020년 BioINdustry 산업동향 보고서 (2021.1.)
-2021 USDA BUDGET SUMMARY
-2022 NIH Budget - Congressional Justification of the NIH
-Bioeconomy Research and Development Act of 2021
-BioINwatch21-37(5.27.)․바이든 행정부 미국의회(상원 하원) 미국 NSF 역할 확대와 예산 증액 제안
-BioINwatch21-38(6.1.)․2020년 미국 FDA 승인 신약 총 53개
-DOE BER FY 2022 Budget Request to Congress, Biological and Environmental Research
-DOE FY 2022 Budget Request to Congress (2021.6.)
-Engineering Biology Research and Development Act of 2019
-Fiscal Year (FY) 2022 Administration Research and Development Budget Priorities (2020.8.14.)
-NSF National Science Foundation FY 2022 Budget Request to Congress (2021.5.28.)
-USDA 2022-budget-summary
-미국 정부예산안, 과학기술&ICT 정책․기술동향 189호 (2021.4.23.)
2. EU
가. 사회적 이슈
(1) 코로나 팬데믹
전 세계를 강타한 COVID-19 전염병은 인류의 건강을 위협함과 동시에 사회의 폐쇄와 전례 없는 경제 침체로 이어졌다. 이 위기 속에서 EU 각 회원국은 서로 연대하여 즉각적이고 효과적으로 대응하고 있으며 이를 통해 유럽 시민들의 생명과 생계를 지원하고 보호하고 있다.
EU 외 지역에 발이 묶인 60만 명 이상의 EU 시민들이 집으로 돌아올 수 있게 지원하였고, 가장 긴급한 요구 사항에 대처하기 위해 모바일 의료팀이 각 EU회원국들에 파견하는 등 2020년 한 해 동안에만 무려 1,350개 이상의 신속한 조치가 이루어졌다. 더 나아가 EU 뿐 아니라 전 세계 모든 사람을 위해서 공공 및 민간 투자를 동원하여 안전하고 효과적인 백신을 개발하고 있다. 이를 위하여 EU는 유럽 총 GDP의 30% 정도에 해당하는 4조 2,000억 유로를 동원했다.
(2) 기후 변화
코로나바이러스 전염병보다 우리의 환경과 건강 및 생계에 더 큰 위협이 될 수 있는 기후 변화는 우리 시대가 여전히 해결해야 할 중요한 과제로 남아 있다.
지난 10년은 역사상 가장 따뜻한 10년으로 기록될 정도로 유럽을 넘어 전세계에 걸친 기후 변화로 인한 매우 심각한 폐해가 발생하여 녹색 전환을 신속히 진행할 필요성이 대두되었다. 2050년까지 유럽을 최초의 기후 중립적인 대륙으로 만들기 위해 EU가 이미 시작한 ‘유럽 그린 딜’과 팬데믹 기간 동안 필수 불가결한 디지털 기술이 핵심인 ‘디지털화’는 유럽의 환경을 개선하며 일자리 창출에 기여하고 우리 사회를 보다 탄력적으로 만들 것이다.
(3) 경제 침체로 인한 불평등 및 차별 증가
코로나19 팬데믹으로 야기된 경제 침체로 인해 빈곤과 불평등이 유럽 내에 만연하고 있다. EU는 유럽 시민들을 최우선적으로 고려하여 이를 해결하기 위한 포괄적이고 공정한 회복이 가능한 조치들을 결정하고 있다.
EU는 의료, 사회 통합, 안보 위협 등에 대응할 수 있는 새로운 이니셔티브들을 시작했다. 유럽인들의 66%는 EU가 보건 이슈에 더 큰 책임감을 느끼길 원하고 있는 것으로 나타났다. 이에 폰데어라이엔 EU 집행위원장은 9월 국정연설에서 코로나 팬데믹으로부터 얻은 교훈을 통해서 ‘유럽 보건 연합(European Health Union)’ 구축을 최우선 과제로 삼겠다고 발표했다. 이것은 보건 위기에 대한 EU의 대응을 강화하는 데 도움이 될 뿐만 아니라 더 나아가 유럽의 Beating Cancer Plan(2021.2.3. 채택)을 통해 암에 대처하고, Pharmaceutical Strategy(202011.25. 채택)를 통해 의약품의 가용성과 경제성 문제를 해결하는 데 이바지할 것이다.
나. 정책동향
(가) 연구 및 혁신 전략 2020∼2024 수립
EU내 최근 발생한 사회적 이슈들에 대응하고 보다 발전된 미래로 나아가기 위한 새로운 연구와 획기적인 혁신을 위한 전략을 수립하였다. 이 전략을 통해 이미 진행 중인 녹색 및 디지털 혁신을 주도하며 유럽 공동의 가치에 대한 연대와 존중을 기반으로 인류와 지구를 위한 지속가능하고 번영된 미래를 향해 더 빨리 나아가고자 한다.
또한 전 세계적인 코로나19 대유행으로 인한 도전에 대응하는 데 핵심적인 역할을 할 것이다. 더 나아가 지속적 경제성장을 바탕으로 현재의 위기를 벗어나 더 공정한 미래로 나아가는 길을 열어주는 유럽의 회복 계획을 실현하는 데 도움이 될 것이다. 연구 및 혁신 전략은 EU위원회가 설정한 다음의 6개의 광범위한 정책 목표를 달성하는 핵심 동인으로 작용할 것이다.
1. 환경과 기후: 환경 파괴와 기후 변화를 극복하기 위해 최초의 기후 중립 대륙이 될 새로운 성장 전략에 착수했다. 이를 위해 EU를 현대적이고 자원 효율적이며 경쟁력 있는 경제로 변화시킬 수 있는 정책들이 수립되고 있다. 이는 기후 변화를 퇴치하고 우리 산업을 더 친환경적으로 만들고 전염병으로부터 지속 가능한 회복을 달성하는 데 도움이 될 것이다.
2. 디지털 미래: EU는 차세대 기술을 제공할 디지털 전략을 수립하고 올해를 유럽의 ‘디지털 10년’으로 만들기로 결정했다. 디지털 전략은 데이터와 기술 및 인프라에 개발에 있어 다른 국가를 따르기보다 독자적 디지털 주권을 강화하고 표준을 설정할 것이다. 이를 위해 디지털 및 산업 혁신의 전반을 가속화시키는데 필요한 수준 높은 과학과 지식 및 혁신을 이뤄낼 수 있는 정책들을 수립하였다.
3. 일자리와 경제: EU경제가 유럽 시민들을 위해 작동할 때 비로소 개인과 기업 모두 번창할 수 있기 때문에 EU는 보다 매력적인 투자 환경을 구축하고 젊은 세대와 중소기업을 위해 양질의 일자리를 창출할 것이다. 특히 지식과 과학을 기반으로 한 전략과 혁신적인 도구를 개발함으로써 인류의 지속가능한 발전을 위해 반드시 보존해야 하는 영역들을 지켜낼 수 있는 강력하고 탄력적인 시장 경제를 구축하는데 기여할 것이다.
4. 시민과 가치 보호: 연구와 혁신은 새로운 위기에 대처하여 EU가 추구하는 유럽의 가치를 수호할 것이다. 유럽 시민 누구나 건강한 삶을 보장 받을 수 있게 되는 것이 최우선 과제로 암과 같은 질병에 대해 최상의 치료를 제공할 수 있는 유럽 보건 연합을 구축하고 있다. EU 모든 회원국들이 건강 위기에 연대하여 대응할 것이다.
5. 세계 속의 유럽: EU는 다자주의와 규칙에 기반한 글로벌 질서를 옹호하고 기후 변화와 보건 위기 등의 전세계적 이슈들에 대해 최선의 대응을 함으로써, EU가 글로벌 리더로서의 입지를 강화해 나갈 것이다. EU회원국들의 무역에 대한 공정하며 개방적인 접근 방식은 유럽을 비즈니스를 위한 매력적인 최적의 장소로 만들어 줄 것이다. 이를 위해 전략적 국제협력을 공고히 하고, 글로벌 다자간 이니셔티브에서 유럽의 역할을 강화하며, Horizon Europe에 국제적 참여도 제고를 위한 개정된 협회 정책을 수립하는 조치를 취해 나갈 것이다.
6. 민주주의와 권리: 과학은 유럽에서 시민의 참여와 사회적 포용 및 평등을 촉진하는 더 개선된 전략을 개발하는 데 기여함으로써 정치적 불신, 양극화 담론, 낮은 선거 참여율, 포퓰리즘적 내러티브 등의 난관에 봉착한 민주주의에 해결책을 제시해 준다. EU는 유럽 시민에게 더 큰 참여권을 부여하고 허위 정보 및 온라인 증오 메시지와 같은 문제들로부터 민주주의를 보호할 것이다.
(나) 유럽 보건 연합 구축
EU는 보건 위기에 충분히 대비하고 강력히 대응하기 위해 ‘유럽 보건 연합’ 세 가지 주요 규정이 포함된 패키지를 2020년 11월 11일 제안했다. 이 규정들은 유럽의약품청(European Medicines Agency)과 유럽 질병예방통제센터(European Center for Disease Prevention and Control)의 권한을 강화하고 EU 전체에 공중보건 비상사태를 선포할 수 있는 것을 포함하여 국경을 초월한 보건 위기에 대한 보다 강력한 연대 구축을 가능하게 한다.
2020년 12월 2일 화상으로 개최된 EU회원국들의 보건 장관 회의에서 유럽 보건 연합 구축이 논의되었다. 코로나19 사태가 지속되고 있는 상황에서 보건복지부 장관들은 코로나19 교훈에 대한 의견을 교환하고 공동 노력을 통해 올바른 결론을 도출하는 것은 더 강력하고 탄력적인 유럽연합을 향한 중요한 단계가 될 것임을 확인하였다. 이러한 공감대는 ‘유럽 보건 연합 구축: 국경을 초월한 건강 위협에 대한 EU의 회복력 강화’에 대한 합의로 연결되었다.
2021년 6월 15일 EU는 제안된 유럽 보건 연합 패키지를 채택하였다. 이 새로운 규정에 따라 유럽의약품청은 중요 의약품 및 의료기기 공급을 모니터링하여 부족 사태를 방지하고 조치를 취할 수 있다. 또한 위기를 유발하는 질병을 예방/진단/치료할 수 있는 의약품에 대한 과학적 조언을 제공하고, 백신의 효과와 안전성을 모니터링하기 위한 연구를 수행하며, 임상시험을 수행할 수 있게 되었다.
(다) 유럽 제약 전략 강화
EU 회원국들의 보건장관들은 유럽 제약 시스템의 대비와 회복력을 강화하기 위해 ‘유럽 제약 전략’을 제안 했고, EU는 2020년 11월 25일 이 전략을 채택하였다. 안전하고 저렴한 의약품 공급을 보장하고 유럽 제약산업이 혁신적 세계 리더로 남을 수 있도록 지원하기 위한 전략과 야심찬 목표에 대해 장관들은 지지를 표명했다. 그들은 또한 이 전략을 통해서 EU가 미래의 보건 관련 문제에 더 잘 대비할 수 있도록 하는 것을 목표로 해야 하며, 협력과 연대에 관해 모든 회원국들이 전략 이행의 맥락에서 적극적으로 참여하기를 희망하고 모든 이해당사자들과의 대화를 지속적으로 확대할 것을 촉구했다.
이 전략을 통해 유럽은 더욱 강력한 의약품 공급망을 구축하여 코로나와 같은 긴급 위기 상황에서도 안정적으로 의약품을 공급할 수 있게 되었다. 이 전략은 보다 강력한 유럽 보건 연합을 구축하는데 핵심적인 요소로서, 폰데어라이엔 EU 집행위원장이 EU국정연설(State of the Union Speech)에서 요구한 바와 같이 미래에 대비하고 위기에 강한 EU 제약 시스템을 구축하는 데 기여할 것이다. 유럽 제약 전략의 네 가지 주요 목표는 다음과 같다.
1.지불 가능한 저가의약품에 대한 접근성을 환자들에게 보장한다. 또한, 항균제 내성, 암, 희귀 질환 분야 등과 같이 의약품 개발이 미비한 질병 분야의 의료 요구를 충족시킨다.
2. 고품질의 안전하고 효과적이며 친환경적인 의약품 개발이 가능하도록 유럽 제약산업의 경쟁력과 혁신성 및 지속가능성을 제고할 수 있도록 지원한다.
3. 위기에 대비하고 대응할 수 있는 메커니즘을 강화하고 공급망 보안 문제를 해결한다.
4. 높은 수준의 품질과 효능 및 안전에 대한 표준화를 주도하여 강력한 유럽의 리더쉽을 전 세계적으로 확보한다.
이 전략은 코로나 팬데믹으로 인하여 위기 대응에 많은 부분이 집중되어 있지만 유럽의 제약 부문 전반적으로 강화시키고 탄력적으로 변화시킬 것이다. 또한 과학적 및 상업적으로 끊임없이 변화하는 제약업계 환경 안에서 EU의 제약 정책이 공중 보건에 지속적으로 기여할 수 있도록 보장할 것이다. 특히 디지털 기술 도입을 하여 환자 중심의 혁신을 지원할 것이다.
다. 기술 및 산업동향
(가) EU의 16개 첨단기술들
첨단기술의 초고속 발전에 의해 경제의 흥망이 결정되는 현상은 오늘날 전세계적인 현상이다. EU는 비즈니스와 사회환경을 실질적으로 변화시켜 유럽내 산업 현대화를 촉진시키고 유럽 산업정책의 우선 순위와 부합하는 16개 첨단기술들을 선정했다. 이 기술들은 첨단소재, 첨단제조, 인공지능, 증강 및 가상 현실, 빅데이터, 블록체인, 클라우드 기술, 연결성, 산업 생명 공학, 사물 인터넷, 마이크로 및 나노 전자 공학, 이동성, 나노 기술, 포토닉스, 로봇 공학 및 보안이다.
앞서 나열한 16개의 첨단기술 분야에서 유럽내 해당 산업들이 어느 정도의 경쟁력을 갖추고 있는지를 ‘산업을 위한 첨단기술(Advanced Technologies for Industry) 프로젝트’를 통해 조사했다. 글로벌 수준에서 기술 생성, 창업 창출 및 기술에 대한 전반적인 성과를 비교 분석한 결과를 보면 첨단제조, 사물 인터넷, 첨단재료, 산업 생명 공학 분야에서 유럽이 미국, 중국, 일본에 비해 경쟁력을 갖추고 있었다. 반면, 인공지능, 빅데이터, 사이버 보안, 마이크로 및 나노 전자 분야에서 뒤쳐져 있는 것으로 나타났다.
(나) 산업 생명 공학
근래 들어 유럽의 생명공학은 르네상스를 맞이했다는 평가를 받고 있다. 추세를 보면 2019년에는 전년 대비 35% 늘어난 33억 달러의 기록적인 민간투자가 이루어졌다. 2020년에는 코로나 팬데믹으로 인한 세계 경제의 전반적 침체기를 맞았으나 생명공학 분야에서 만큼은 그 영향이 적었고 신규 바이오테크 스타트업들이 살아남기에 충분한 자금투입이 이루어졌다.
실제로 암스테르담에 본사를 둔 투자회사인 LSP는 2020년 3월에 6억 2,000만 달러의 생명과학 펀드를 조성하였다. 특히 눈여겨볼 부분은 실제 투자가 성사된 횟수는 증가하지 않았으나 각 투자별 금액이 블록버스터 급으로 상향되어 총 투자금액에서 급격한 증가가 이루어졌다는 점이다. 이는 기존 벤처 캐피털 회사(VC) 사이의 펀드 규모 확대와 함께 사모 펀드와 국부 펀드 및 개인자산운용회사를 포함한 새로운 종류의 투자자들의 생명공학에 대한 관심이 급증하였기 때문이다. 그 결과로 유럽에는 전세계 다른 어느 지역들 보다 월등히 많은 바이오테크 스타트업들이 있고 산업 생명공학 기술을 보유한 전문가의 비율도 가장 높다.
EU는 연구 개발 및 혁신 활동에 지속적으로 투자해오고 있어서 특허 출원에서 다소 안정적인 글로벌 점유율로 경쟁력을 유지하고 있으나, 미국과 일본에 비해 뒤처져 있다. 지난 몇 년 동안 유럽의 바이오경제는 EU와 각 회원국들의 다양한 전략과 정책에 의한 여러 조치를 통해 지원되었다. EU는 ‘업데이트된 바이오경제 전략’을 발표했고 독일은 2020년에 ‘국가 바이오경제 전략’을 시작했다. 그러나 바이오경제, 특히 산업 생명공학 분야의 기술활동은 독일, 프랑스, 네덜란드, 덴마크, 스페인에 크게 집중된 반면 불가리아, 루마니아 등은 일부 예외를 제외하고는 대부분의 회원국들에서는 미진한 상황이다.
전 세계적 이슈로 부각되고 있는 기후변화에 대처하기 위한 주요 정책인 유럽 그린 딜에 바이오 기반 혁신이 중요한 역할을 할 것으로 기대되고 있다. 이 혁신을 이끌 환경 생명공학 뿐만 아니라 폐기물 및 부산물 사용에 대한 첨단 기술 기반을 유럽이 보유하고 있다. 이러한 유럽의 생명공학 기술력을 그린딜에 활용할 수 있는 지속 가능성 및 미션 지향적 혁신에 대한 개선된 전략 및 연구 정책에 대한 관심이 증가하고 있다.
생명공학 분야의 제조 역량을 살펴보면 효소나 바이오의약품 등 소량 생산 시장에서는 유럽이 우수한 역량을 보유하고 있지만, 라이신, 바이오플라스틱, 바이오연료 등 대량 생산 제품은 생산능력이 다소 제한적이다. 이를 개선하기 위해서 현재 주요 제조공장이 위치한 회원국가에 인접한 다른 회원국가들이 보완적인 바이오매스 생산을 제공하여 운송 비용을 절감하는 등의 회원국간의 연대와 EU차원의 지원이 요구된다. 즉, 범유럽 제조 및 유통 네트워크 및 가치사슬의 구축은 EU의 산업 생명공학의 발전을 가속화시킬 것이다.
라. 법제도 동향
(가) 코로나19 팬데믹 대응 긴급 재정 승인
코로나바이러스 대응 투자 이니셔티브(Coronavirus Response Investment Initiative) 및 의료 부문에 대한 긴급 재정 지원 승인과 EU 연대 기금이 공중 보건 비상 사태를 보장하도록 하는 승인이 매우 신속하게 내려졌다. 상임대표 위원회는 위원회 업무의 연속성을 보장하기 위해 연중 내내 브뤼셀 EU 본부에 직접 참석해왔다. 그러나 코로나 팬데믹의 심각성과 유럽 시민과 기업들을 위해 신속한 조치를 취하기 위해 브뤼셀에 거주하지 않을 경우 원격으로 합류하는 하이브리드 방식으로 전환되어 진행되었다.
코로나 팬데믹 위기는 유럽경제사회위원회(European Economic and Social Committee)와 유럽 지역 위원회(European Committee of the Regions)의 업무에도 큰 영향을 미쳤다. 유럽경제사회위원회는 코로나바이러스 위기에 대처하는 28개 이니셔티브를 장려하기 위한 시민 연대상(Civil Solidarity Prize)을 발족시켰다. 유럽 지역 위원회 역시 유럽 전역의 지역과 도시간의 코로나 대응 협력을 촉진하기 위한 교류 플랫폼을 2020년 4월부터 운영하기 시작했다.
(나) EU 장기예산 및 NextGenerationEU 승인
유럽 의회와 이사회는 유럽연합 집행위원회의 지원을 받아 2021∼2027년 동안 집행할 1조 8,000억 유로에 달하는 사상 최대 규모의 EU 장기 예산을 합의한 후 채택했다. 이 역대급 예산은 1조 740억 유로의 장기 예산과 코로나 복구를 위한 7,500억 유로 규모의 NextGenerationEU로 구성 되어있다.
아울러 Erasmus+, EU4Health 및 Horizon Europe을 포함한 주요 프로그램은 2020년 7월 특별 유럽 이사회에서의 합의와 비교하여 150억 유로를 추가로 투입하였다. 이 승인된 예산은 코로나 팬데믹을 해결하고 앞으로의 위기에 더 잘 대비할 수 있는 친환경적이고 디지털적이며 탄력적인 유럽을 재건하는 데 도움이 될 것이다.
예산의 50% 이상이 유럽의 현대화를 가속화 하는데 지출될 것이다. Horizon Europe을 통해 연구 및 혁신을 하고, Just Transition Fund와 Digital Europe programme을 통한 공정한 녹색 및 디지털 전환을 이루고, Recovery and Resilience Facility와 rescEU 및 EU4Health programme을 통한 대비와 회복 및 탄력성을 갖출 것이다.
Common Agricultural Policy과 같이 장기간 존재해 온 정책들은 현대화될 것이며 녹색 및 디지털 전환 지원을 목표로 상당한 EU 예산 자금이 지속적으로 투입될 것이다. 예산의 또 다른 30%는 기후 변화에 대처하는 데 지출될 것이다. 이 지출에는 생물다양성 보호와 성평등에 대한 부분도 포함된다.
(다) EU 기관 변동 사항
유럽연합 이사회 의장국(Presidency of the Council of the European Union)은 2020년에 크로아티아와 독일이, 2021년에는 포르투갈과 슬로베니아가 선출되었다. 신임 의장국들은 코로나바이러스 대응 투자 이니셔티브(Coronavirus Response Investment Initiatives), 실업 문제 완화를 위한 비상 지원, 비필수 여행 통제 등 이사회 권고사항들을 신속하게 채택하여 즉각적인 대응이 가능하도록 하였다.
유럽경제사회위원회와 유럽지역위원회 역시 내부적 변동이 2020년에 있었다. Christa Schweng은 2020년 10월 28일 유럽 경제 사회 위원회 의장으로 선출되었고, Apostolos Tzitzikostas는 2020년 2월 12일 유럽 지역 위원회 의장으로 선출되었다. 또한 두 기관의 회원 수는 브렉시트의 영향으로 350명에서 329명으로 줄었다.
|
참고자료 |
- The EU in 2020 - General report on the activities of the European Union (https://op.europa.eu/webpub/com/general-report-2020/en/#)
- Research and innovation (https://eur-lex.europa.eu/summary/chapter/research_innovation.html?root_default=sum_1_coded=27)
- European health union (https://ec.europa.eu/commission/presscorner/detail/en/ip_21_2963)
- Horizon 2020 biotechnology (https://ec.europa.eu/programmes/horizon2020/en/area/biotechnology)
- A pharmaceutical strategy for Europe (https://ec.europa.eu/health/human-use/strategy_en)
- Pharmaceutical strategy - timely patient access to affordable medicines (https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/12421-pharmaceutical-strategy-timely-patient-access-to-affordable-medicines_en)
- Affordable, accessible and safe medicines for all (https://ec.europa.eu/commission/presscorner/detail/en/ip_20_2173)
- Bio-economy policy (https://ec.europa.eu/research/bioeconomy/biotechnology/policy/index_en.htm)
- Research and innovation strategy 2020-2024 (https://ec.europa.eu/info/research-and-innovation/strategy/strategy-2020-2024_en)
- The EU’s 2021-2027 long-term budget & NextGenerationEU (https://op.europa.eu/en/publication-detail/-/publication/d3e77637-a963-11eb-9585-01aa75ed71a1/language-en)
- NextGenerationEU (https://europa.eu/next-generation-eu/index_en)
- Europe’s biotech renaissance (https://www.nature.com/articles/s41587-020-0483-6)
- EU report - technological trends and policies (https://ati.ec.europa.eu/reports/eu-reports/eu-report-technological-trends-and-policies)
- Advanced technologies for industry - methodological report (https://ati.ec.europa.eu/reports/eu-reports/advanced-technologies-industry-methodological-report)
3. 중국
가. 사회적 이슈
2021년 3월 13일 양회(제13차 전국인민대표회의 4차회의 및 전국정협 4차회의)에서 현대화 국가 건설을 위한 ‘중국 국민경제와 사회발전 제14차 5개년 계획(2021∼2025) 및 2035년 비전목표’를 공식 발표하였다.
중국은 2035년에 글로벌 과학기술혁신 선두그룹에 진입하는 것을 목표로 하고 있으며, 한편으로 빠르게 진행되는 과학기술 진보에 대한 사회 전체의 안정과 균형을 위해 ‘중국 교육현대화 2035계획’을 병행하여 시행하고 있다.
(1) 14․5계획의 주요내용
14․5계획(2021∼2025)기간은 4차 산업시대의 변혁기로 차세대정보기술, 생명건강, 청정에너지가 국가과기전략의 3대 초점이 되고 있으며, 특히 생물안전, 유전자치료, 백신연구개발 등의 생명건강 분야가 민생을 보장하는 과기전략으로 부상하고 있다.2)
13․5계획(2016∼2020)기간에는 유인 우주비행, 달 탐사, 양자 정보 등 첨단 기술 분야의 성과와 함께 생명공학 분야에서도 농업 현대화의 추진, 줄기세포연구, 우주미생물연구, 의료 위생 산업이 지속적으로 발전되었다.
[표 1-7] 14차 5개년 계획관련 주요 이슈와 내용
|
구 분 |
세부 내용 |
비고 |
|
코로나19 팬데믹 이후 경제안정과 체제정비 |
2020년 미중 전략경쟁과 코로나19 위기 대응을 위해 국내시장 중심의 대내외 경제가 순환하는 ‘쌍순환’ 전략 채택 |
GDP 증가율 6% 이상 |
|
국가와 시장의 이원적협력체제 |
차세대 인프라와 기간산업 등 국가 중장기 발전전략분야의 중앙정부의 역할 확대 |
과기혁신 2030 핵심 프로젝트 육성 |
|
적극적인 대외개방 |
포괄적․점진적 환태평양 경제동반자협정(CPTPP) 추진 등 대외경제개방 기조 피력 |
차세대 신산업 주도권 확보 |
|
도시화율 증가에 따른 주택임대 공급 확대 |
도시 이주 노동자와 청년취업자의 임대수요 충족을 위한 임대주택 공급 확대 |
2021년 개인 임대 소득 공제 추진 |
|
의료와 양로 결합의 노인복지 |
지역사회와 결합한 양로서비스 등 건강중국 2030계획의 이행 현행 퇴직연령(남성 60세, 여성 55세)의 점진적 연장 공식화 |
2025년에 60세 이상 인구 3억 명 예상 |
|
연구개발환경변화와 원천기술 확보 |
2030년까지 개발을 목표로 양자통신, 지능로봇, 심우주 및 심해탐사, 중점신소재, 신에너지, 뇌과학, 건강의료 등 국가중대과학기술프로젝트 추진 |
산학연 협동혁신과 과학기술성과전환 |
(2) 2020년 중국 생명과학분야 10대 성과
중국과학기술협회 생명과학학회 연합체는 2015년부터 매년 ‘중국 생명과학 10대 성과’를 발표하고 있으며, 생명과학 연구와 기술 혁신을 촉진하고, 중국 생명과학 분야의 성과를 전시하고 홍보하는 데에 목적을 두고 있다. 2021년 1월 13일에 중국과학기술협회 생명과학학회 연합체가 발표한 중국 생명과학 10대 성과는 다음과 같다.
[표 1-8] 2020년 중국 생명과학 10대 성과
|
구분 |
2020년 생명과학 10대 성과 |
기관명 |
|
1 |
메뚜기 떼가 피해를 보는 비밀: 4VA(4-Vinylanisole)는 메뚜기 떼의 페로몬 |
중국과학원 동물연구소 |
|
2 |
첫 코로나19 단백질 3차원 구조의 해석 및 2가지 임상후보 약물의 발견 |
상하이과학기술대학 (上海科技大学) |
|
3 |
기관이 노쇠의 메커니즘과 제어 |
중국과학원 동물연구소 |
|
4 |
코로나19 폐렴 동물 모델 구축 |
중국의학과학원 의학실험동물연구소 |
|
5 |
사람 뇌 발달의 핵심 세포와 제어 네트워크 |
중국과학원 생물물리연구소 |
|
6 |
항체 면역을 조절하는 뇌-비장 신경 통로 발견 |
칭화대학교(清华大学) |
|
7 |
식사 유도 콜레스테롤 합성 메커니즘 및 콜레스테롤 조절 신약 표적 발견 |
우한대학교(武汉大学) |
|
8 |
녹색혁명 작물 품종 질소비료 이용 효율을 높이는 새로운 메커니즘 |
중국과학원 유전과발육생물학연구소 |
|
9 |
밀 항 곰팡이병(Gibberella) 유전자 Fhb7의 클론, 메커니즘 해석 및 육종이용 |
산둥농업대학교 (山东农业大学) |
|
10 |
항원수용체 신호전도 메커니즘 및 CAR-T 치료 중의 응용 |
중국과학원 상하이생물화학과 세포생물학연구소 |
(3) 코로나19 영향과 백신개발
2019년 연말에 발생한 코로나19 사태로 인해 중국은 국가차원의 전염병통제와 연구개발투입으로 신종 코로나바이러스 감염증 치료와 백신 개발에 주력하였다. 중국과학원 우한바이러스연구소, 국약그룹의 우한과북경생물제품연구소 등 수많은 바이오기술 연구기관들이 잇달아 코로나 백신을 연구 개발하여 임상 시험을 진행하고 있다.
코로나19 사태 충격으로 인해 공중보건 및 생명 건강에 대한 관심이 높아지고 있으며, 생명공학 및 바이오경제는 전례 없이 중요하게 여겨지고 있다. 정책면에서 생물산업의 육성과 산업발전전문기금을 설립하여 바이오산업을 지원하며, 바이오첨단기술기업의 창업을 적극 지원하고 있다.
국가약품감독관리국은 2021년 6월 말 현재까지 신종 코로나바이러스 감염증 및 관련 적응증 치료성 25개 약물(백신 불포함)의 임상시험을 긴급 승인했다고 발표했다. 코로나19 백신은 현재 5개 기술 노선3)의 22개 백신 품목의 임상 시험을 긴급 승인했고, 4개의 코로나19 백신 출시를 승인했다.
[표 1-9] 중국의 조건부 시판 승인 백신
|
유형 |
승인 일자 |
개발기관 |
|
불활성화백신 |
2020.12.31. |
국약그룹 중국생물 베이징생물제품연구소유한공사 (国药集团中国生物北京生物制品研究所有限责任公司) |
|
불활성화백신 (Vero세포) |
2021. 2. 5. |
커싱 생물 제약 유한공사 (科兴生物制药股份有限公司) |
|
제조합백신 (5형 아데노바이러스 매개체) |
2021. 2.25. |
칸시노 바이오로직스 (康希诺生物股份公司) |
|
불활성화백신 (Vero세포) |
2021. 2.25. |
국약그룹 중국생물 우한생물제품연구소유한공사 (国药集团中国生物武汉生物制品研究所有限责任公司) |
자료: 중국 국가약품감독관리국.
나. 정책동향
(1) 제14차 5개년(2021∼2025) 계획의 생물산업 육성 방향
전략적 신흥 산업의 육성은 산업구조 업그레이드, 경제발전 방식의 전환을 위한 중대한 조치이며, 제14차 5개년(2021∼2025) 계획은 미래 산업 육성, 산업 융합화, 클러스터화, 생태화 발전을 통한 신흥산업 증가치가 GDP에서 차지하는 비율이 17%를 초과할 것을 목표로 한다.
제14차 5개년(2021∼2025) 계획은 생물의약 산업분야의 연구 개발부터 제약까지 전산업 사슬을 육성하고 유전자 치료, 세포 치료, 면역 치료 등 생물기술의 개발과 응용을 강화하고 있다.
[표 1-10] 제14차 5개년 계획의 생물산업 발전 관련 내용
|
분야 |
세부내용 |
|
신산업 체계 구축 |
- 생물기술을 차세대정보기술, 신에너지, 항공우주와 함께 전략적 신흥산업으로 육성 - 생물기술과 정보기술의 융합 추진과 생물의약, 생물육종, 생물소재, 생물에너지 등 산업 발전으로 바이오 경제를 강화함 |
|
미래 산업 육성 |
- 뉴로모픽 지능, 양자정보, 유전자 기술, 미래 네트워크, 심해 우주 개발, 수소에너지와 에너지저장 등 첨단 과학기술과 산업 변혁 분야의 미래 산업 육성 |
|
첨단 분야 투자 |
- 인공지능, 양자정보, 집적회로, 생명건강, 뇌과학, 생물육종, 우주기술, 심해 등 첨단 분야의 국가 중대 과학 기술 프로젝트 투자 |
|
핵심기술 확보 |
- 신종 감염병 발생과 생물 안전 위험 제어, 의약 및 의료 설비, 핵심 부품과 기초 소재, 석유 가스 탐사 개발 등의 분야의 핵심 기술 확보 |
|
첨단과학 기술 육성 |
- 유전자 및 생물기술, 게놈학 연구 응용, 유전세포와 유전육종, 합성생물, 생물약품 등 기술혁신, 백신, 체외진단, 항체약물 등 개발 등 |
|
현대 해양 산업 육성 |
- 해양공사, 해양자원, 해양환경 등 분야 핵심 기술 확보 - 해양 건설장비와 해양 생물의약품 산업 육성과 해수담수화와 해양에너지의 규모화를 추진하고 해양문화관광 개발 수준을 높임 |
(2) 바이오 클러스터 육성
중국의 생물산업 분포는 환보하이(环渤海), 장강 삼각주(长三角), 주강 삼각주(珠三角) 및 중서부 일부 지역에 집중되어 있다. 국가발전개혁위원회는 2005년 이후 총 24개 국가 바이오기술 산업기지를 승인하였으며, 과기부는 1997년부터 2020년까지 18개의 횃불 프로젝트 생물산업기지를 육성하였다.
2020년 현재 중국의 생물의약산업단지는 총 35개로, 17개가 동부 연해지역에 분포하여 전체의 48.57%를 차지하고 있으며, 3개는 동북지역, 9개는 중부지역, 6개는 서부지역에 분포한다.
환보하이(环渤海) 지역의 생물기술 분야의 수준이 가장 높으며, 양질의 임상 및 인재 자원을 보유하고 있다. 장강 삼각주(长三角) 지역은 생물산업의 혁신과 국제화 수준이 가장 높다. 주강 삼각주(珠三角) 지역은 교통이 발달하고, 홍콩과 마카오에 인접해 중소기업이 비교적 활발하다. 중서부 생물산업 클러스터 중에서 베이징(北京) 국가생물산업기지, 상하이(上海) 국가생물산업기지, 우한(武汉) 광구(光谷) 생물성은 인재확보와 투자지원으로 산업발전이 빠르게 진행되고 있다.
다. 기술 및 산업동향
(1) 바이오 기술동향
(가) 특허 동향
1993년 특허법을 개정하여 약품 제품의 특허를 포함한 이래, 생물의약 관련 특허출원이 크게 증가하고 있으며, 생물의약산업은 특허제도의 발전과 밀접한 연관을 보이고 있다. 특히, 생물의약산업의 지식재산권 보호를 강화한 ‘지식재산권 고품질 발전 추진 연도업무지침(2020)’의 핵심지표가 14․5개년 계획에 포함됨으로써, 지식재산권과 산업경제를 융합하여 생물의약 산업 발전을 추진하는 것이 포스트 코로나 시대의 새로운 척도가 되고 있다.
|
|
주) INNOJOY DB, Banktonak network의 특허 DB 및 SooPAT DB의 1995-2020년 동안 ‘생물의약’을 키워드 분석결과 총 3만 4,532건의 특허가 출원되었으며, 발명특허는 2만 2,913건으로 특허출원 총수의 66.35%를 차지함.
자료:李晓宇, 포스트 코로나 시대 바이오의약 산업 특허 현황 분석, China Med. Biotechnology, April 2021, Vol. 16, No. 2.
자료: 李晓宇, 2021.4.
[그림 1-1] 중국 바이오의약산업 IPC 기술 구성 분포도
중국 바이오의약업계의 특허출원 현황을 IPC분류체계에 따라 살펴보면, 바이오의약특허출원은 A61K(의료용, 치과용 또는 화장용 제제), C07K(펩타이드), C07D(이종원자 고리 화합물), C12N(미생물 또는 효소 또는 그 조성물), G01N(테스트 재료) 등에 집중되어 있다. 특히, A61K에 특허 출원이 집중되어 있으며, 세부내용은 A61K36/00(조류, 이끼, 진균 또는 식물 또는 그 파생물 유래)과 관련된 특허출원 및 A61K31/00(유기유효성분 함유 의약제품)이다. 코로나19 여파로 바이러스 진단과 검사, 항체 연구도 바이오의약 업계의 출원 이슈가 될 것으로 예상된다.
중국 생물의약산업의 생물의약산업 특허출원 수 상위기관은 대학과 과학연구기관에 집중되어 있으며, 성과 전환과 지식재산권 보호 등 기업주체의 바이오기술 및 산업체계로의 발전이 필요한 실정이다.
(나) 바이오 기술 주요 동향
① 줄기세포
제13차 5개년(2016∼2020) 계획 기간에는 줄기세포의 상용화와 함께 중국과학원, 국가자연과학기금위원회 등에 의한 줄기세포와 재생기술의 임상응용, 줄기세포 치료제품개발, 줄기세포 임상연구 지원 등을 활발하게 지원하였다.
과기부는 줄기세포 및 중개연구 중점프로젝트(2016)를 통해 2016∼2018년간 총 20억 1,200만 위안을 투자하여 중간엽줄기세포(MSC) 이식의 면역 배척 문제 등 난제해결과제를 지원하였으며, 국가자연과학기금위원회에서도 2019년도부터 100만 위안 규모의 자유탐색형 줄기세포연구과제를 지원하고 있다.
국가차원에서는 줄기세포 산업화를 위한 화동(華東)기지, 톈진(天津)기지, 칭다오(靑島)기지, 타이저우(泰州)기지, 우시(無錫)국제줄기세포공동연구센터(INCOSC) 등을 설립하였다. 중국의 줄기세포산업 규모는 2009년의 20억 위안에서 2017년에 525억 위안으로 증가(연간 성장률 50% 초과) 하였고, 2020년에는 800억 위안에 이를 것으로 추정되고 있다.
② 우주생물
중국의 우주생물과학은 우주산업과 더불어 발전하고 있으며, 2020년 말까지 13회의 귀환식 위성과 8회의 유인비행 임무의 우주비행 기회를 이용하여 우주생물 실험연구를 진행하였다.
우주생물연구는 1963년 중국과학원 생물물리연구소에 우주생물학연구실 설립으로 시작되었으며, 우주비행 의학 기초연구와 우주공간에서의 줄기세포연구와 배아발육연구 분야에서 성과를 보이고 있다. 1992년 9월 중국의 유인 우주 프로젝트의 시작으로, 우주공간에서의 세포 융합과 심근세포 배양 연구가 이루어졌으며, 2016년 9월에는 톈궁 2호를 이용하여 벼와 헛개나무 씨앗의 우주 식물 배양 실험에 성공하였다.
앞으로 중국 우주 정거장의 궤도 건설이 이루어지면 우주생물연구 플랫폼 구축과 CR증폭기술, 레이저스펙트럼 검측기술을 활용한 미생물 검사 기술의 발전이 예상된다.
(2) 바이오 산업동향
(가) 생물의약
중국은 생물의약을 12․5개년 계획 기간부터 전략적 신흥산업으로 육성한 이래, 세계 생물의약 산업의 두 번째 큰 시장으로 발전하고 있다. 2020년 현재 700여 개의 생물의약 회사가 있으며, 총 생산액은 2조 위안에 달한다.
연구개발 분야에서 인터루킨2(IL_2), 성장호르몬(GH), 적혈구생성촉진호르몬(EPO), Icotinib(폐암약물 EGFR 표적치료제) 등의 성과로 생물의약산업이 급속히 발전하고 있으며, 국가적으로는 바이오의약산업 클러스터의 혁신 발전을 장려하는 정책을 시행하고 있다.
생물 의약의 연구방향은 유전공학, 세포공학, 발효공학, 효소공학, 바이오칩기술과 바이오정보기술 개발과 생명과학과 제약과학 연구를 결합하여 새로운 약물을 생산하는 기술개발로 구분되고 있으며, 14․5계획 기간에는 세포면역치료, 약물연구개발, 면역세포요법, 줄기세포기술, 합성생물 및 정밀의료분야를 중심으로 투자가 이루어질 전망이다.
(나) 바이오농업
2020년 농업농촌부는 벼 유전체학 연구 및 응용의 국제적 선도, 슈퍼벼 1묘당 생산량 1,000kg 달성, H7N9 조류독감 백신 개발, 유전자 변형 옥수수와 콩 재배, 돼지 바이러스성 설사 3중 생백신 개발 등 농업과학기술 성과를 발표하였다.
세계지식재산권특허기구(WIPO)에 따르면, 바이오농업분야의 중국 관련 특허출원 수는 2011∼2020년 기간에 급성장하고 있으며, 미생물 효소 및 그 조성물 기술(CN12)의 특허출원 수는 미국 19만 783개, 중국 16만 3,833개로서, 중미 양국의 수가 세계 총수에서 차지하는 비율이 34%이다.
새로운 식물개발 방법 또는 조직배양기술을 통한 식물재생기술(A01H) 특허는 중국 3만 869개, 미국 2만 6,915개로서, 중미 양국이 세계 전체의 51.6%를 차지하는 등 바이오 농업기술분야에서 미국을 추격하고 있다.
① 종자산업
코로나19 사태의 여파로 중국의 종자산업은 육종연구, 육종기자재 관리, 교잡측정 작업, 신품종 시험 등의 부문에서 어려움이 발생했으나, 우량종자의 공급과 종자 시장의 발전으로 지속적인 성장을 유지하고 있다.
2012년 종자 생산량은 1,649만 8,000톤에 불과하였으나 2020년에는 2,058만 4,000톤으로 증가하였으며, 2012년 종자산업 규모는 1,038억 위안에서 2020년 1,300억 위안으로 증가하였다. 세부 시장별로는 옥수수 종자, 벼 종자, 밀 종자 순으로 전체 종자업계 시장 규모에서 차지하는 비중이 2020년 기준 각각 27.21%, 23.74%, 14.49%이다.
14․5개년 계획기간에는 농업우량종자 기술개발과 생물육종산업화를 육성할 예정이며, 비유전자변형 콩산업 발전계획에 따라 흑룡강 지역에 국가급 콩 우량종자 생산기지를 건설할 예정이다.
② 식량안보
2019년 중국식량안보 백서에 따르면, 중국 인구는 세계의 1/5을 차지하고, 식량 생산량은 세계의 약 1/4을 차지하여, 세계 식량 안보에도 공헌을 하고 있다고 평가하고 있다. 2020년 중국의 1인당 식량 점유량은 480Kg으로 국제 규정 1인당 식량안보 기준선 400Kg보다 높으며, 국가적으로 식량위기 비상체제가 완비되어 있다.
그러나 코로나19 사태의 영향과 식량 무역의 구조적 불균형, 자연자원과 생태환경의 문제, 종자분야의 원천기술 부재로 인한 외국기업의 가격과 기술독점4)으로 인해 식량안보의 잠재적 위험이 상존하고 있는 상황이다. 14․5계획 기간에는 농업발전과 국가 식량안보의 보장을 위해 식량안보 전략의 실시를 더욱 강조하고 있다.
(다) 바이오산업
중국은 바이오산업을 12․5개년 계획 기간부터 전략적 신흥산업으로 집중 육성하였으며, 2015년 5월 ‘중국제조 2025’에서 생물의약 제품 및 기술 분야에서 제조업 강국 실현과 생물산업의 녹색저탄소 발전을 대대적으로 촉진할 것을 명시하였다. 이후 ‘13차 5개년 바이오산업 발전규획(우리 용어로는 발전계획)(2016.12.)’에서는 바이오제조 규모화와 바이오에너지 발전모델을 제시하였으며, ‘13․5 바이오기술 혁신 전문 프로젝트 계획(2017.5.)’은 품질 제고를 통한 바이오기술 산업 발전을 제시하였다.
중국의 바이오산업은 생물기반 화학품, 생물기반 재료, 생물연료, 생물환경보호 등으로 구분하여 살펴볼 수 있으며, 생물 촉매와 생물 정제 기술의 발전으로 산업의 전망이 밝다. 응용범위가 광범위한 바이오 기반 화학품 분야에서는 호박산, D-젖산, 1,3-프로필렌글리콜, 바이오디젤, long chain dicarboxylic acid 등의 산업화 사슬 형성이 안정적으로 추진되고 있으며, 첨단 기능성 재료와 의료용 재료 분야에서 활용도가 높은 생물기초 재료산업은 장강삼각주, 주강삼각주 등 구역에서 산업클러스터가 활발히 형성되어 있다.
바이오에너지 잠재력은 매우 크며, 주로 바이오에탄올, 바이오에너지 발전분야에서 산업성장이 이루어지고 있다. 효소제제 분야는 생물사료 제조, 셀룰로오스 분야, temperature α-amylase을 중심으로 산업이 형성되어 있다. 수질오염, 대기오염, 토양오염 등 여러 분야에 관련된 환경보호 정책의 실행은 바이오 환경 보호 기술의 발전과 응용의 원동력이 되고 있다.
합성생물학 분야에서는 2018년에 시행된 국가중점연구개발 계획인 ‘합성생물학 중점 특별 프로젝트’를 통해 5년간 23억 위안(심천시 출자 5억 위안 포함)의 투자가 예상된다. 게놈 인공 합성과 고버전 플레이트 세포, 인공 소자와 유전자 라인, 인공 세포 합성 대사와 복잡 생물 시스템, 에너지 기술 체계와 생물 안전 평가 등 네 가지 분야를 육성할 계획이다.
라. 법제도 동향
(1) 생물안전법
2020년 1월 기준으로 중국의 법정전염병종은 코로나19를 포함하여 40종이며, 2021년 4월에 시행된 생물안전법은 생물안전 분야의 주요 리스크에 초점을 맞춰 생물안전 위험방지 체제를 정비하고, 생물안전관리 능력을 높이는 데 주력하고 있다.
생물안전법은 전염병통제와 바이오기술의 오남용방지, 유전자원과 생물자원의 관리 등 8개 방면에서 적용범위를 정하고 있다. 특히, 국가가 금지한 바이오기술연구와 중국 인류유전자원의 불법 채집 보관 시에 최고 1,000만 위안의 벌금과 위법소득의 20배의 벌금을 부과할 수 있다.
생물안전법의 시행은 중국의 생물안전분야 법률 체계를 구축하기 위한 시작 단계이며, 향후 국가 생물안전 법규와 제도 체계의 구축과 생물안전 감독관리, 법 집행 등이 더욱 강화될 것으로 예상된다.
(2) 인간 유전자원과 생물자원 안전관리
1998년에 ‘인류 유전자원 관리 잠행 방법’을 제정하여, 인류유전자원의 관리체제에 대한 허가절차를 마련하였으며, 2015년에는 ‘인류유전자원의 채취, 수집, 매매, 수출, 출국 행정허가에 관한 통지’를 실시하고, 중국 내에서의 인류유전자원에 대한 관리 규범을 제시하였다.
중국 내 인류유전자원의 사용에 대한 관리 강화를 위해, 2019년 6월 국무원은 인류유전자원관리 분야의 행정법규인 ‘인류유전자원 관리조례’를 공포하고 보호 강화와 합리적 이용 촉진, 서비스 감독 등 분야에서 인류유전자원 관리 기준을 마련하였다. 특히 2021년 6월, ‘데이터보안법’ 을 공포하고, 관련 기업이 개인 정보와 유전자원의 민감한 데이터를 합리적으로 처리할 수 있도록 가이드라인을 발표하였다.
병원미생물 실험실은 1980년대에 첫 번째 국가생물안전 3단계 실험실(BSL-3)을 설립한 이래, 2020년까지 우한(武汉) 국가생물안전연구실, 쿤밍(昆明) 고급생물안전 영장류 실험센터, 하얼빈(哈尔) 수의연구실 등 P4급 실험실 3곳, P3급 실험실 40여 개와 다수의 P1, P2급 실험실이 있다.
(3) 생물다양성 보전
중국은 1992년에 생물다양성협약(CBD)에 가입한 이래 생물다양성 보호에 큰 비중을 두고 있다. 2010년에 국무원이 발표한 ‘중국 생물다양성 보호전략 및 행동계획(2011∼2030)’은 국가의 중장기 생물다양성 보호의 목표와 전략을 명시하고 있으며, 제14차 5개년 계획은 녹색발전을 추진하고 인간과 자연의 조화로운 공생을 촉진한다고 명시하였다.
2019년 1월 현재, 중국의 각종 자연보호지 총 수량은 1만 1,800개에 달하고, 그 중 국립공원(시범)이 10개이고, 국가급 자연보호구가 474개이다. 각종 자연보호지의 면적은 1억 7,000헥타르를 초과하여 중국 국토 면적의 18%를 차지하고 있으며, 생물다양성협약이 제시한 2020년까지 17% 달성 목표를 앞당겨 달성하였다.
중국은 연도별 생물종 목록을 연속적으로 발표하고 갱신하는 세계 유일의 국가이며, 2008년부터 매년 ‘중국생물물종목록(Catalogue of Life, China)’을 전자버전으로 게시하여 관련 부문과 지방정부가 생물다양성 검측 및 보호 정책과 계획을 제정하는데 과학적 근거를 제공하고 있다.
‘중국생물물종목록2021판’5)은 총 12만 7,950개(물 종 11만 5,064개, 물 종 하위단위 1만 2,886개)의 종과 종자를 수록하고 있으며, 여기에는 5만 6,000개의 동물 종, 3만 8,394개의 식물 종, 1만 5,095개의 곰팡이 종이 포함된다. 중국과학원은 40여 개 연구소의 73개 생물자원 보관소에 2,900만 개 이상의 생물자원을 비축하고 있으며, 그 중 735만 개 이상이 디지털화되어 개방되고 있다.
2021년 10월 중국 쿤밍에서 개최될 예정인 제15차 생물다양성협약 당사국총회(COP15)는 2021∼2030년의 글로벌 생물다양성 보호의 청사진을 제시하고, 생물다양성 보전을 위한 이행 체제를 제정할 것으로 전망된다.
4. 일본
가. 사회적 이슈
최근 2년 사이에 일본 사회에 가장 큰 영향을 미친 사건은 우리나라를 포함한 전 세계와 마찬가지로 코로나19에 의한 경제․사회적인 현상이라고 볼 수 있을 것이다. 중국 우한에서 2020년 12월 31일 첫 확진자가 발생한지 20일만에 확진 환자가 중국 내에서만 200명을 넘어섰고6), 일본에서도 1월 6일 중국 우한에서 입국한 중국인 남성이 신종 코로나 바이러스에 최초 감염된 것이 확인되었으며,7) 우리나라에서도 중국 우한에서 입국한 중국인 여성이 신종 코로나바이러스 폐렴 확진자로 확진되었다.8)
일본 요미우리신문의 ‘2020년 일본의 10대 뉴스’에서 감염 확대 긴급사태선언(2020.4.)이 1위를 차지했으며, 도쿄올림픽 1년 연기(2위), 일본의 유명 개그맨 시무라 켄의 코로나19로 사망(5위), 전국 초중고 휴교(7위), 전국 최대의 고교야구대회인 고시엔야구대회가 96년만에 취소(8위) 등, 10대 뉴스의 절반이 코로나19 관련 뉴스로 채워졌다.10)
그리고 최장기 집권(2012.12.∼2021.8.)한 아베수상이 지병의 악화로 퇴임하고, 스가수상이 제99대 일본 수상으로 취임하였으며 아베내각에서 수립된 정책의 대부분은 현상유지 및 계승하게 되었다.
나. 정책동향
(1) 과학기술기본계획
장기적이고 체계적이며 일관된 과학기술정책을 추진하기 위해 1995년에 제정된 ‘과학기술 기본법’에 따라 과학기술․이노베이션 회의(CSTI: Council for Science, Technology and Innovation)는 제1기(1996∼2000)부터 제5기(2016∼2020)까지 과학기술 기본계획을 수립하고, 이를 통해 강력한 과학기술정책을 추진였다.11)
2020년 일본 국회에서 최근의 과학기술․이노베이션의 급속한 발전을 감안하여, 기존의 과학기술 기본법의 주요 골자를 유지하면서 연구자나 새로운 사업의 창출을 위한 인재의 확보․양성에 관한 시책을 명시하는 과학기술․이노베이션 기본법을 제정하였다. 이에 따라 과학기술․이노베이션 회의는 제6기 과학기술․이노베이션 기본계획(2021∼2025)을 수립하였고, 일본 정부는 2021년 3월 26일 각의에서 최종 결정하였다.
제6기 과학기술․이노베이션 기본계획12)은 코로나의 소용돌이 속에 국내외 정세변화의 가속화로 ① 이노베이션 추진력 강화, ② 연구력의 강화, ③ 교육․인재 육성 등의 세 가지지 항목을 근간으로 하고 있다.
첫째, 이노베이션 추진력 강화에는 사회의 디지털화, 탄소중립의 실현, 사회구현에 의한 과제 해결을 통해 지속가능한 강인한 사회로의 변혁을 목표로 설정하고 있다. 둘째, 연구력 강화에는 박사과정 학생이나 신진․여성 연구자의 지원강화, 기초연구․학술연구, 인문․사회과학의 진흥, 대학개혁(경영조직으로 전환), 10조엔 규모의 대학펀드를 통한 ‘지식’의 창조를 목표로 하고 있다. 셋째, 교육․인재 육성에서는 초중등교육단계부터 STEAM 교육13)이나 기가스케일 구상의 추진, 리커런트 교육을 촉진하는 환경․문화를 양성하고, 새로운 사회에 대한 대응을 통해 국민의 안심․안심이 확보된 사회나 한사람 한사람의 다양한 행복이 실현되는 사회를 지향하는 것을 목표로 제시하고 있다.

[그림 1-2] 제6기 과학기술
(2) 통합이노베이션 전략 2021년
2021년 6월에 일본정부 각의에서 결정된 ‘통합이노베이션 전략 2021’은 제6기 과학기술․이노베이션 기본계획의 실행계획에 연계된 최초의 연차전략이다.14) 제6기 과학기술․이노베이션 기본계획 책정 후, 세계 각국의 기술패권 투쟁이 치열해지고 기후변화 문제의 대응에 있어서 국내외에 큰 변화가 일어나, ‘국민의 안전과 안심을 확보하는 지속가능한 강인한 사회’와 ‘한사람 한사람의 다양한 행복(well-being)이 실현되는 사회’의 실현을 목표로 향후 1년간 실시해야 할 과학기술․이노베이션 정책을 구체화하였다.
통합이노베이션 전략 2021에서는 제6기 과학기술․이노베이션 기본계획과 Society 5.0의 구체화를 위해, ① 국민의 안전과 안심을 확보하는 지속가능한 강인한 사회로의 변혁 ② 지식의 프론티어를 개척하고 가치창조의 원천이 되는 연구력의 강화 ③ 한사람 한사람의 다양한 행복과 과제로의 도전을 실현하는 교육․인재 육성 ④ 관민 연대에 의한 분야별 전략의 추진 ⑤ 지식과 가치의 창출을 위한 자금순환의 활성화 ⑥ 종합과학기술․이노베이션회의 사령탑 기능의 강화 등의 6가지 주요 정책을 추진하고 있다.
다. 기술 및 산업 동향
(1) 노벨상 수상
2019년 노벨 화학상은 스마트폰과 노트북 등 무선기기를 비롯해 전기차에 대중적으로 활용되고 있는 리튬이온 2차 전지 개발에 기여한 일본의 화학업체 아사히카세이사(社)의 요시노 아키라(吉野 彰) 명예연구원겸 메이조대학(名城大学) 교수, 존 구디너프(John B. Goodenough) 미국 텍사스대학 교수와 스탠리 휘팅엄(Stanley Whittingham) 미국 뉴욕주립대 빙엄턴대학 교수가 공동 수상하였다.15)
휘팅엄 교수가 처음 개발한 리튬이온 배터리는 리튬금속의 산화환원반응이 생기는 과정에서 물질이 그물처럼 퍼져나가는 구조(수지상 구조)가 생겨 전기가 통하지 않는 단락 현상이 발생하는 문제가 있었다. 요시노 교수는 1985년 세계 첫 상용 리튬 이온 배터리를 만들었다. 음극으로 리튬금속을 쓰지 않는 대신 흑연을 음극으로 활용해 이 문제를 해결하고 리튬이온 배터리를 안정화하며 1985년 세계 첫 상용화에 성공했다.
일본인이 노벨상을 수상한 것은 미국 국적을 취득한 일본인을 포함하여 27번째(미국 국적 2명 포함), 화학상으로는 8번째이다. 요시노교수는 오사카 출신으로 교토대학 대학원을 졸업한 후, 아사히카세이사에 입사하여 전지 분야의 연구개발부문의 책임자로 근무한 후, 2017년부터 메이조대학 교수로 근무하고 있다.16)
(2) 바이오전략
통합이노베이션전략 추진회의는 ‘바이오전략 201917)’이어, 2020년 6월에 바이오전략 2020의 기반 시책,18) 2021년 1월에 바이오전략 2020의 시장영역 시책19)을 결정하였다.
바이오전략 2020의 기반시책은 ① 신종 코로나바이러스 감염증 대책에 관한 연구개발의 추진(진단법, 치료법, 백신개발, 기기․시스템의 개발 등) ② 시장획득을 실현하는 데이터 연계 촉진(바이오데이터 연계․활용에 관한 가이드라인의 채택) ③ 글로벌 바이오커뮤니티․지역 바이오커뮤니티의 형성(글로벌 바이오커뮤니티․지역 바이오커뮤니티 인정, 연계 촉진, 시장영역 추진, 국내외 정보 발신) ④ 바이오전략 2019를 따라 지체없이 조치해야 하는 시장영역에 관련된 기반적 시책의 추진(시장영역에 관련 데이터 기반의 정비, 바이오커뮤니티 형성, 제도 정비 등) ⑤ 바이오전략을 추진하는 사령탑 기능의 강화(전체 목표의 평가에 대해 KPI를 설정, 시장영역 로드맵 구축, 각부처 시책과 연계) 등의 주요 추진사항으로 설정하고 있다.
바이오전략 2020의 시장영역 시책은 2019년에 설정한 고기능성 바이오소재, 바이오플라스틱, 지속적 일차생산시스템, 유기폐기물․유기폐수처리, 생활습관 개선 헬스케어․기능성식품․디지털헬스, 바이오의약․재생의료․세포치료․유전자치료 관련산업, 바이오생산시스템(바이오파운드리), 바이오 관련 분석․측정․실험시스템, 목재 활용 대형건축․스마트임업 등의 9가지 시장영역의 전체규모를 2030년에 92조 엔까지 확대하는 것을 목표로 하고 있다.
각 시장영역별 시장규모는 고기능성 바이오소재/바이오플라스틱 등에서 53조 2,000억 엔, 지속적 일차생산시스템에서 1조 7,000억 엔, 목재 활용 대형건축에서 1조 엔, 생활습관 개선 헬스케어 등에서 33조 엔, 바이오의약․재생의료 등에서 3조 3,000억 엔 등으로 예측하고 있다.

[그림 1-3] 바이오전략 2020의 개요
(3) 문샷형(moonshot) 연구개발
일본 정부는 범부처적으로 종래의 국가 프로그램에서는 다루어지지 않았던 하이리스크․하이임팩트인 연구개발을 대상으로 파괴적 이노베이션의 창출을 목표로 문샷형 연구개발 프로젝트를 추진하였다. 착수된 일본의 문샷형 연구개발 프로젝트는 7개의 문샷 과제를 선정하고 2021년 2월에 연구책임자(47명) 모집을 실시하는 등, 본격적인 문샷형 프로젝트가 가동되기 시작하였다.20)
7개의 문샷과제의 목표는 ① 사람의 신체, 뇌, 공간, 시간의 제약으로부터 해방된 사회 실현(2050년까지) ② 초조기에 질환의 예측․예방이 가능한 사회 실현(2050년까지) ③ AI와 로봇의 공진화에 의해 스스로 학습․행동하고 인간과 공생하는 로봇 실현(2050년까지) ④ 지구환경 재생을 위한 지속 가능한 자원 순환 실현(2050년까지) ⑤ 미이용 생물 기능 등의 전체 활용에 의한 전 세계적으로 무리․낭비 없이 지속적인 식량 공급산업 창출(2050년까지) ⑥ 경제․산업․안전보장을 비약적으로 발전시키는 오류 대응형 범용 양자컴퓨터 실현(2050년까지) ⑦ 주요 질환을 예방․극복하여 100세까지 건강 걱정 없는 인생을 즐기기 위한 지속가능한 의료․간호시스템 실현(2040년까지) 등으로 구성되어 있다.
과제별 담당기관으로는 과학기술진흥기구(JST)는 1, 2, 3, 6번 과제, 신에너지․산업기술종합연구기구 생물계특정산업기술연구지원센터(NEDO)는 4번 과제, 농업․식품산업종합연구기구생물계특정산업기술연구지원센터(BRAIN)는 5번 과제, 일본의료연구개발기구(AMED)는 7번 과제를 담당한다.
(4) 일본의료연구개발기구(AMED)의 코로나19 관련 연구개발과제
2021년 6월 10일 현재, 일본의료연구개발기구(AMED)에서 주관하고 있는 신종 코로나바이러스 감염증 관련 연구개발과제는 치료법개발, 백신 개발, 진단법․검사기기 개발, 분자면역․병태 규명 등의 분야에서 약 340개에 달하는 것으로 알려져 있다.21)
그리고 코로나19 관련 일본 정부의 연구개발 예산은 1,930억 엔(AMED 예산은 1,386억 엔)이고, 이 중에서 백신개발 관련 예산이 602억 5,000만 엔으로 가장 큰 비중을 차지하고 있으며, 이어서 실용화지원(CiCLE) 프로그램에 380억 엔, 기기․시스템개발에 142억 1,000만 엔, 기반기술개발 및 환경정비에 130억 1,000만 엔 등을 지원하고 있다.

[그림 1-4] AMED 주관 코로나19 연구개발과제 현황
코로나19 관련 연구개발과제의 주요 성과로는 신종 코로나바이러스 감염증의 회복자 혈장 중 IgG의 중화활성에 관한 연구 및 신종 코로나바이러스에 대한 각종 항체의 새로운 정량시스템의 구축(국립국제의료연구센터․연구소), 신종 코로나바이러스의 신속검사가 가능한 PCR장치 GeneSoC의 도입 실증연구(교린제약), 신종 코로나바이러스 환자의 항체획득․추이에 관한 분석(국립국제의료연구센터), SARS-CoV-2 감염방어항체(중화항체)의 신속측정법(요코하마시립대학교 의학부), COVID-19 예후․예측인자의 검토(국립국제의료연구센터), 사람의 피부상에 존재하는 신종 코로나바이러스와 인플루엔자바이러스의 생존평가:COVID-19에서 손가락 위생의 중요성(교토부립의과대학)를 제시하고 있다.
라. 법제도 동향
일본 정부의 각의는 2021년 6월에 총리 자문기구인 규제계획추진위원회에서 제출한 안을 바탕으로 2021년도 규제개혁 실시계획을 확정하였다. 디지털정부의 추진, 디지털시대를 위한 규제의 재검토, 기타 횡단적 과제 등을 주요 골자로 하고 있다.
2021년도 규제개혁 실시계획 중에서 바이오 관련 분야로는 디지털시대를 위한 규제의 재검토분야에서 의료분야에서 DX화의 촉진(의료분야에서 전자인증수단의 재검토, 임상시험의 원활화, 환자의 의료정보 접근의 원활화), 의약품․의료기기 제공방법의 유연화․저코스트화(일반의약품 판매규제의 재검토, 중고 의료기기 매매의 원활화, 일회용 의료기기 재생품의 보급, 약제업무의 효율화), 최첨단 의료기기의 개발․도입의 촉진(최첨단 의료기기의 개발․도입의 촉진을 위한 11가지 세부 검토사항 설정), 의료․간병분야에서의 생산성 향상(산업의료진의 상주 및 겸직 조건의 완화, 디지털화의 발전 등에 대응하기 위한 치과기공업무의 재검토, 간병서비스의 생산성 향상), 온라인 진료․온라인 복약지도의 특별조치의 항구화(신종 코로나바이러스 감염증이 계속되는 기간에는 계속 조치하거나 일부 항목에 대해서는 추후 검토) 등이 포함되어 있다.
일본 정부의 규제개혁추진실은 2002년 4월에 경제 4단체(일본경제단체연합회, 경제동우회, 일본상공회의소, 신경제연맹)에 대해 신종 코로나바이러스 감염증 확대 방지라는 관점에서, 긴급히 조치해야 하는 규제․제도 등의 재검토 등에 대한 의견 제출을 의뢰했다. 이에 대해 일본 정부는 경제 4단체로부터 규제개혁 추진실에 제출된 것에 대해 관계 부처와 함께 대책을 정리하였다.22)
바이오 관련 주요 내용을 보면, 일본경제단체연합회는 감염증 확대에 대비한 간호간호사 상당의 일시적인 의료자격취득의 규제요화, 의료기기의 판매․대여․수리하는 계속적 연수의 전자화, 건강보험 온라인화, 온라인 진료의 항구화, 온라인 임상․온라인 복약 지도의 적용 완화의 부작용, 약사에 의한 1일 처방전 처리 매수 상한 규제 재검토, 우편형 혈액검사 등의 채택, 일본상공회의소는 간병소프트의 서식통일, 종이 기반의 서명․날인 등의 재검토, 간병지원전문원의 월 1회 모니터링 방문의 재검토, 원격면담․서비스 담당자 등의 웹회의 도입 실현, 경제동우회는 의약품 승인 시의 적합성 서면조사의 온라인화, 의약품부회용 자료의 후생성 반입의 철폐, GCP 적합성 조사결과 통지서 및 제조판매승인 서류의 디지털화, 신경제연맹은 약국 의약품 및 지도의약품의 대면규제의 철폐, 처방전의 완전 전자화 등을 요구하고 있다.

1. 우리나라 바이오 육성을 위한 노력
가. 범부처 지원 민관협력(신약)
수명 연장의 욕구와 삶의 질 향상을 위한 소비자의 요구가 증대됨에 따라 세계 의약품 시장은 2024년 최대 1조 1,810억 달러 규모, 연평균 6.9% 성장할 것으로 전망된다. 제약산업은 세계적인 제약회사(Big-Pharma)들을 중심으로 장악되고 있는 가운데, 하락하는 연구개발 생산성을 높이기 위하여 개방형 혁신(open innovation)기반의 비즈니스 모델이 확산되고 있으며, 블록버스터급 바이오의약품의 특허 만료를 대비하기 위한 세계 각국의 기술혁신 경쟁이 가속화되고 있다.
한편, 2010년 당시 국내 제약 산업의 연구개발 방향은 단기적인 성과 위주의 제네릭(복제의약품) 의약품생산이 주를 이루었고, 장기적인 투자와 오랜 연구개발 기간이 필요한 글로벌 블록 버스터 급의 혁신 신약 개발을 위한 경험과 역량이 부족했다. 이러한 상황 속에서 국내 제약기업들은 FTA 체결에 따라 개방된 의약품 시장에 대응하고 다국적 제약기업들과의 경쟁에서 살아남기 위한 방안이 절실하였다. 이와 같은 국내외 상황 속에 혁신 신약개발 할 수 있는 역량을 기르고, 국내 시장 규모의 한계를 극복하기 위해 글로벌 시장을 겨냥한 라이센싱 아웃 기반의 신약개발 전략이 필요했으며 국내 기업들의 글로벌 경험과 개발역량을 축적시킬 수 있는 새로운 R&D 체계 마련이 국가적인 과제로 대두되었다.
이전 우리나라 정부 연구개발사업은 과학기술정보통신부(前 미래창조과학부)의 기초․원천 영역, 산업통상자원부(前 지식경제부)의 상업화 및 생산기술영역, 보건복지부의 중개와 임상 시험 영역 등으로 나뉘어 분산적으로 추진되었다. 이로 인해 글로벌 관점의 전략적인 연구개발과 사업화 계획은 연결되지 못하고, 대학․연구소에서 보유한 신약후보물질과 원천기술들이 국내 또는 글로벌 제약기업의 임상-상용화 단계까지 연계되지 못하는 취약점을 가지고 있었다.
이에 정부는 기존의 과학기술정보통신부, 산업통상자원부, 보건복지부의 산발적인 연구개발 사업지원 방식을 초월한 ‘범부처전주기신약개발사업’을 마련하였다. 본 사업은 2011년부터 2020년까지 총사업비 1조 600억 원의 투자를 통해 2020년까지 10개 이상의 글로벌 신약을 개발할 수 있는 기업형 방식의 범부처신약개발사업단을 설립하고, 세계적인 제약기업들과 대등하게 경쟁하기 위한 계획을 체계적으로 준비하였다.
(1) 범부처신약개발사업단 추진경과
범부처신약개발사업단(이하, 사업단)은 “지속적인 국가 성장 동력 엔진”이라는 비전 아래, 신약개발 성공모델 마련을 위한 자체 과제관리체계를 구축하고 산․학․연 정부 간 채널 형성 및 전문가 네트워크 형성 등 국내 제약기업의 기술이전과 사업화를 촉진하기 위한 전문지원체계를 확립하고자 하였다.
(가) 1단계 : 시스템 구축기
사업의 1단계는 2020년 글로벌 신약을 10건 이상 개발하기 위한 기업형 신약개발 관리시스템을 마련하고자 미래에 씨앗이 될 수 있는 최대 수의 다양한 포트폴리오 구축을 목표로 설정하였다. 이를 달성하기 위해 세 가지 전략을 추진하였는데 첫째, 기업형 사업단 관리체계를 마련하고자 전체 과제를 직접 관리하는 체계를 확립하고 평가․지원․투자 관련 전문가 그룹을 발굴하였다. 사업단은 글로벌 제약사와 같은 방식으로 사업단장이 CEO의 권한을 부여받아 연중 상시 신약개발 프로젝트를 발굴․기획 및 투자에 대한 권한을 갖고 진행 프로젝트의 추진 여부를 결정할 수 있는 체계를 구축하였다. 또한 전체 과제를 직접 관리하기 위해 우수과제 발굴과 관리에 필요한 전문인력을 신약개발 단계, 물질, 질환별 전문성을 고려한 채용을 진행하고, 내부 과제관리가 가능한 조직체계를 확립하였다. 이를 통해 사업단장을 중심으로 외부의 영향을 최소화하여 과제를 직접 관리하는 체계를 마련함과 동시에 국가 R&D의 종합적인 조사․분석을 통해 추진현황과 관련 정책 및 사업기획 등의 기초자료로 활용할 수 있는 토대를 만들었다. 이는 곧 사업단 자원의 효율적인 배분 및 투자전략 수립으로 이어지도록 글로벌 제약산업의 전개 방향 분석과 국내 신약개발현황 분석을 통해 신약개발 R&D방향성을 제시하였다.
둘째, 국내 신약개발 현황을 분석하고 신약개발 포트폴리오를 관리하며 전주기 신약개발 파이프라인 체계를 마련하였다. 사업단은 부처 간 경계를 초월하여 개별 부처가 추진하는 사업의 우수성과가 사장 또는 단절․지체되지 않도록 전주기 투자체계를 확립하고자 하였다. 이를 위해 프로젝트 포트폴리오를 특정 단계로 제한하지 않고 전 단계에 걸쳐 투자될 수 있도록 국내 파이프라인을 점검하고, 사업에 참여할 수 있도록 국내․외 네트워크 활동에 집중하였다.
셋째, 산․학․네트워크 구성을 통해 사업단 지원 기능을 강화하고, 국제 네트워크를 활성화하였다. 기존 정부주도 R&D에서 탈피하여 기업형 R&D 투자 방식으로 연구비를 지원하고 관리할 수 있도록 국내 신약개발 성공경험을 가진 전문가 그룹과 미국 및 EU의 신약 인허가․등재 전문가 그룹을 자문단으로 구성․운영하며 국제 네트워크를 구축하였다. 또한 국내 신약개발 생태계를 고려하여 아웃소싱을 통한 생산․임상 지원 등 다양한 분야의 전문가와 협력할 수 있는 개방화된 운영체계를 구축하였다.
[표 1-11] 기존 사업단과 범부처신약개발사업단의 차이
|
구분 |
기존 사업단 |
범부처신약개발사업단 |
|
펀딩철학 |
R&D 보조금 |
신약 프로젝트 발굴, 투자 |
|
사업공모 |
연 1회(공모개념) |
연중 수시(발굴 개념) 타 유관산업 연계 |
|
과제평가 |
공정성, 전문성 |
공정성, 전문성, 사업성 |
|
최종선정 |
운영위원회 |
투자심의위원회 |
|
R&D관리 |
연차실적계획서 평가 |
마일스톤 검토(GO/NO GO 결정) |
|
인센티브 |
사업성과에 따른 인센티브 없음 |
사업성과에 따른 인센티브 제공 |
자료: KDDF 범부처신약개발사업단 백서(2011-2020)
(나) 2단계 : 사업화 촉진1단계 사업 종료 후 사업단의 전략적 운영 방향성에 부합한 과제 발굴이 다소 부족하다는 문제점이 있었으며, 사업의 운영체계를 최적화시키기 위해 매년 사업목표를 변화시킴에 따라 중장기적인 포트폴리오 운영전략이 구체화되지 못하는 등의 한계점이 있었다.
이러한 한계점을 극복하기 위해 사업 2단계에서는 사업단 포트폴리오를 점검하여 단계별 목표를 구체화하려는 노력과 함께 R&D 관리 중심에서 벗어나 더 적극적인 형태로 빅파마의 수요를 연계한 과제발굴(공모) Track을 신설하고, 글로벌 라이센싱 가능성을 촉진하기 위한 비즈니스 개발(Business Development) 중심의 전략을 마련하여 사업의 궁극적인 목표인 글로벌 라이센싱 아웃의 가능성을 높이는데 중요한 역할을 하였다.
사업단의 2단계 전략의 주안점은 R&BD 관점에서 라이센싱 가치의 극대화를 위해 투자 포트폴리오를 이원화하는 부분이다. 또한 이를 지원하기 위해 사업단의 전략기획과 비즈니스 개발 전문성을 강화하는 전략을 수립하고 적합한 조직형태로의 조정과 전문인력을 추가로 채용하며 사업단의 전문사업화 기능을 강화하였다. 포트폴리오 운영은 목적형 포트폴리오와 혁신형 포트폴리오로 이원화키며, 1단계의 Bottom-up 방식의 과제지원 결과가 주로 합성의약품 중심, 바이오의약품에서는 항체 중심으로 편중되는 문제점을 보완하였다. 혁신형 포트폴리오(Bottom-up) 방식과 함께 글로벌 빅파마가 요구하는 우수후보 물질 발굴을 위해 목적형 포트폴리오(Top-down) 방식도 함께 운영하여 라이센싱 아웃을 목적으로 하였다.
또한 글로벌 기술이전 성과에 집중하기 위해 R&BD 기능을 획기적으로 강화하기 위해 개방형 혁신(Open Innovation) 차원의 플랫폼 기능을 도입하여 연구생산성을 증대시키고 사업화 지원사업을 개발하였다. 또한 포트폴리오의 가치를 평가하여 마일스톤 관리와 연동된 전략을 같이 마련하였다. 자문의 실효성과 책임성을 확보하고자 우수약물 발굴, 약물 가치평가, 라이센싱 지원 등 고도의 전문성을 요구하는 기능 수행을 위해 기능별 외부 자문위원단을 구성하고 전담기관을 지정․서비스 용역계약을 체결하였다.
한편, 글로벌 C&D 사업을 기획하여 우수 기술 혹은 신약개발 성공 가능성이 있는 물질을 물질 이전 계약이나 공동개발협약을 통해 글로벌 소싱과 빅파마 물질 중 이미 시판 중이거나 임상 단계에서 안전성 이외의 이유로 상업화에 실패한 약물을 대상으로 새로운 적응증을 규명해 신약으로 개발할 수 있도록 연계하였다. 이 외에도 사업단이 보유한 파이프라인의 라이센싱 가치를 증대시키기 위해 글로벌 라이센싱 지원사업을 추진하고, 파이프라인 가치를 평가할 수 있는 글로벌 수준의 약물 가치평가 모델 적용을 위한 지원사업을 추진하였다.
사업단의 2단계는 라이센싱 성공 가능성을 높일 수 있도록 다양한 사업화 지원 프로그램을 시범 도입하며, 신약단계별 차별화된 평가지표체계, 컨설팅을 병행하는 심층평가 절차, 마일스톤 기반 과제 관리 등 타 사업들과 차별화되는 과제 선정․평가․관리 체계를 고도화시켰고, 이러한 사업 방향은 기존에 설정된 2단계 목표를 초과 달성하는 등 우수한 성과를 창출하였다.
(다) 3단계 : 성과 확산기
3단계 사업단은 과제 발굴보다는 1~2단계를 거친 사업단의 경험을 바탕으로 각 사업을 연속성 있게 추진하며 물질의 선별․평가의 고도화를 추진하였다. 또한 연구개발부터 사업화에 이르기까지 단계별로 병목되는 제약사항을 해소하기 위해 산․학․연․병 전문가 네트워크를 통해 지원하는 방안을 마련하고자 하였다. 사업 종료를 앞둔 시점에서도 오픈 이노베이션 중심으로 사업단의 성과를 산업계로 확장하였을 뿐 아니라 사업단이 축적한 노하우를 2기 사업단에서도 활용될 수 있도록 필요 사항에 대비하고 지원하고자 하였다.
R&D 사업의 고도화를 위해 기존 운영하던 혁신형 포트폴리오, 목적형 포트폴리오와 별도로 비임상 단계에서 기술이전이 가능한 BRIDGE Track을 마련하였다. BRIDGE Track은 대학에서 연구되어 사장되기 쉬웠던 혁신성이 높고 세계적으로 관심이 집중된 분야에 대하여 사업단이 혁신적 신약후보물질을 발굴하여 약물개발 가능성을 높이기 위해 연구개발 자금과 더불어 과정상의 제약사항을 극복할 수 있도록 전문가 풀을 통한 신약개발 전문인력을 지원하였다.
이 외에도 R&D 투자 방식의 다변화와 더불어, 이를 뒷받침하여 글로벌 기술이전으로 가속할 수 있는 사업화 지원 프로그램을 견고히 하였다. CIDD(Consulting for Innovation Drug Development) 프로그램을 통해 신약개발 전주기 컨설팅을 수행하였고, 개발물질의 특성과 시판승인 및 출시 후 시장경쟁력을 고려한 임상디자인 설계를 지원하기 위한 ACT(Advancing Clinical Trial) 지원사업 등을 추진하였다. 또한 기술이전 가능한 대상 과제가 누적되었고, 성과 창출이 본격화되며 국내 과제의 성숙도는 높아졌으나 글로벌 비즈니스 네트워크 및 맞춤형 전략 부재로 기술이전 성과 창출의 어려움이 있었다. 따라서 3단계에서는 글로벌 라이센싱 지원사업을 기술이전 가속화 지원사업으로 변경하여 신약개발 주요 장벽 중 하나인 기술이전 장벽 해소를 위해 전․현직 Big&Specialty Pharma의 사업개발 임원 및 글로벌 벤처캐피털 투자 전문가를 구성하였다. 기술이전 요구가 있는 사업단 지원과제를 대상으로 사업개발 전문업체 또는 사업단 네트워크를 활용하여 기술마케팅 업무를 수행함은 물론 시장현황, 경쟁현황 등을 분석하여 사업의 고도화 전략을 수립하였다.
(2) 사업단의 주요성과
(가) 연구개발 성과
사업단의 포트폴리오 확보 및 운영전략은 1단계부터 3단계까지 단계별로 설정된 목표에 따라 진화해왔다. 초기 1단계는 미래 씨앗이 될 수 있는 다수의 파이프라인을 확보하기 위해 Bottom-up 방식의 우수과제 선정을 위한 Innovation Track을 마련하여 3단계까지 지속 추진해왔다. 2단계부터는 빅파마의 수요관점에서 국내 우수연구를 연결할 수 있는 전략적인 Top-down 방식인 Joint Track을 마련했다. 3단계에서는 그 간의 투자방식을 고도화 시키면서 신약개발 단계별 병목을 제거하기 위해 산학연병이 협력할 수 있는 bridge Track을 운영하게 되었다.
[표 1-12] 범부처신약개발사업단 주요성과
(단위: 건, 억)
|
구분 |
1단계 |
2단계 |
3단계 |
합계 |
||
|
과제수 |
72건 |
63건 |
27건 |
135건 |
||
|
지원액 |
1,010 |
759 |
536 |
1,769 |
||
|
기술료 |
307.51 |
45,656 |
91,284 |
45,963.51 |
||
|
기술이전 |
해외 |
2 |
8 |
10 |
10 |
|
|
국내 |
8 |
7 |
15 |
15 |
||
|
특허성과 |
해외 |
출원 |
32 |
60 |
61 |
153 |
|
등록 |
11 |
17 |
22 |
50 |
||
|
계 |
43 |
77 |
83 |
203 |
||
|
국내 |
출원 |
38 |
171 |
88 |
297 |
|
|
등록 |
81 |
168 |
68 |
317 |
||
|
계 |
119 |
339 |
156 |
614 |
||
|
논문성과 |
SCI |
건수 |
16 |
36 |
28 |
80 |
|
IF |
6.485 |
5.787 |
7.573 |
6,552 |
||
|
마일스톤달성율 |
65.23 |
69.49 |
71.11 |
68.71 |
||
자료: KDDF 범부처신약개발사업단 백서(2011-2020)
(나) 신약 출시 성과
|
|
뇌전증 치료제(SK 바이오팜 뇌전증 혁신 신약) 2019년 11월 SK 바이오팜의 독자 개발한 혁신 신약 ‘엑소코프리’가 성인 대상 부분 발작 치료제로 미국 FDA 시판 허가를 받았다. 신약 출시까지 사업단은 글로벌 임상2상 시험을 지원하였다. 이를 토대로 유럽에서만 6,000억 원 수준의 기술체결을 하였으며, 해당 신약으로 1조 원 이상의 매출을 달성할 것으로 보인다. 이를 통해 국내 최초 글로벌 블록버스터 신약달성이 가능할 것으로 전망된다. |
|
|
위식도 역류질환(CJ 헬스케어) CJ 헬스케어의 ‘케이캡’이 위식도 역류질환 치료 신약으로 식품의약품안전처 신약 승인(2018년 7월, 대한민국 30번째 국산 신약)을 받아 국내 시장에 출시되었다. 뿐만 아니라 베트남 비메디멕스(Vimedimex Medi Pharma)와 기술수출 계약을 체결, 베트남 시장에 진출하였고, 멕시코 카르놋(Laboratorios Carnot) 등 중남미 17개국에 케이캡정을 독점 공급하는 라이센스 계약(1008억원 규모)를 체결하였다. 현재 품목 허가를 완료하고 시판 중이며, 향후 다양한 국가에 대한 추가적인 수출성과 달성이 기대된다. 사업단 지원을 통해 비임상을 시행하였고, 2019년 매출액은 264억원을 기록하였다.
|
출처: KDDF 범부처신약개발사업단 백서(2011-2020)
(3) 향후 방향
‘범부처전주기신약개발사업’의 주요 성과를 이어나가기 위해 국가신약개발사업단이 2021년 1월 출범하였다.
국가신약개발사업은 제약업계의 백신 등의 후보물질 발굴부터 임상, 사업화까지 신약개발을 지원하는 사업으로, 미국 식품의약국(FDA)와 유럽의약품청(EMA)의 신약 승인 4건과 글로벌 기술이전 60건 등을 목표로 한다. 향후 10년간 유효․선도물질과 후보물질을 발굴하고, 비임상, 임상1․2상, 사업화 등의 신약 개발 사업을 지원하고자 한다. 또한 후보물질 발굴과 임상 연구과제 기획․평가․관리 업무, 해외 제약사들과의 제휴 등의 대외협력 업무와 사업화 지원 업무 뿐만 아니라 바이오 의약품으로 무게 중심이 서서히 변해가는 현재의 신약개발 방향에 발맞추어 생산 및 시험법(CMC) 등의 지원도 포함된다. 더불어, 코로나19의 전 세계 대유행 상황에서 이를 극복하기 위한 국내 유망 치료제․백신 개발 기업을 지원함으로써 국내 자체 코로나19 치료제 및 백신 개발과 상용화를 촉진하고자 한다.
국가신약개발사업은 2030년까지 2조 1,758억 원(국비 1조 747억 원․민간 7,011억 원)이 투입될 예정이며, 코로나19 확산 이후 신약․백신의 중요성이 더더욱 부각됨에 따라 “향후 10년간 우리 제약․바이오 사업의 향배를 결정할 사업”으로 기대된다.
나. 범부처 지원 민관협력(줄기세포)
(1) 재생의료기술
(가) 국내동향
① 정책동향
1983년 생명공학 육성법이 제정된 이후 정부는 개인 연구자 단위의 줄기세포 연구를 꾸준히 지원해 왔다. 2000년대에 들어서는 체계적인 줄기세포 연구 지원을 위해 정부차원의 집단연구사업을 기획하여 지원하기 시작하였다.
과학기술부는 21세기 프런티어개발사업의 일환으로 난치성 질환 치료법 개발연구를 추진하기 위한 세포응용연구사업단(2002∼2012)을 선정 지원하였으며, 보건복지부는 보건의료진흥사업의 일환으로 고효율 성체줄기세포치료 기술개발 및 실용화를 통해 성체줄기세포의 활용 증진을 도모하고자 가톨릭중앙의료원의 기능성세포치료제개발센터(2004년부터 6년간)를 지정 지원하였다. 그러나 2005년 1월 생명윤리 및 안전에 관한 법률 제정과 그해 11월 황우석 교수의 논문 조작 사건 이후 관련 연구가 다소 위축되었으며, 대다수의 연구자들은 윤리적으로 논란이 적은 성체줄기세포분야 연구에 집중하게 되었다.
한편 줄기세포 연구진흥을 위해 정부는 관계 부처 합동으로 여러 차례 종합계획을 발표하였다. 2006년부터 2017년 문재인정부가 출범하기 전까지 정부가 마련한 종합계획을 정리하면 다음 표와 같다.
2017년 출범한 문재인정부의 국정운영 5개년 계획 100대 국정과제 중 바이오산업을 ‘과학기술 발전을 선도하는 4차 산업혁명’이라는 전략과제 및 ‘고부가가치 창출 미래형 신산업 발굴․육성과제’에 포함하여 핵심기술 개발, 사업화 지원 등 산업 성장 생태계 구축을 강조하였다. 또한 2018년 2월 마련된 제4차 과학기술기본계획(2018∼2022)에서는 4대 추진전략 중 ‘과학기술로 모두가 행복한 삶 구현’에 의료혁신을 위한 정밀의료 실현 등을 통해 건강하고 활기찬 삶 구현을 추진하는 것이 강조되었다.
|
연월 |
계획/방안/로드맵/전략명 |
내용 |
|
2006. 5 |
줄기세포연구 종합 추진계획 (2007∼2015) |
줄기세포연구의 글로벌 Top 3 진입을 목표로 원천기술 확보, 체계적인 임상연구, 인프라 구축, 생명윤리 정착의 4대 추진전략 |
|
2009. 7 |
줄기세포 연구 활성화 방안 |
교육과학기술부, 지식경제부, 보건복지부, 식품의약품안전처, 기획재정부 등 5개 부처가 함께 줄기세포분야 글로벌 Top 5 진입을 목표. 줄기세포 R&D 투자확대 및 국제협력을 통한 기술경쟁력 제고, 세계 수준 연구팀 집중육성, 줄기세포연구임상 및 산업화 기반구축, 생명윤리 제도 선진화 및 사회․문화적 기반확충 등 4대 추진방안 제시 |
|
2012. 1 |
줄기세포 R&D 투자 효율화 방안 |
줄기세포 연구개발의 효율성을 높이기 위해 범부처 차원의 전략적 투자 방향 및 사업체계 개편. 줄기세포 R&D 투자 포트폴리오의 전략적 안배, 부처별 역할분담 및 상호 연계성 강화, 사업추진체계 개편 등 |
|
2014. 4 |
국가중점과학기술 전략로드맵 |
신성장동력 창출과 삶의 질 향상 등에 필요한 5대 분야 30개 기술에 대한 국가 차원의 종합전략. 줄기세포기술은 30개 기술 중 건강 장수시대 구현을 위한 기술에 포함 |
|
2014. 7 |
성장과 복지를 위한 바이오미래전략 |
세포치료, 유전자치료 등 바이오 태동기 시장을 선점하기 위한 국가 전략을 수립. 의료기기․서비스 분야까지 확대한 종합적인 바이오산업 육성방안 제시 |
|
2015. 3 |
바이오․헬스 미래 신산업 육성 전략 |
미래창조과학부와 산업통상자원부, 보건복지부, 식품의약품안전처 등 4개 부처 공동 발표. 2015년 한해 총 3,400억 원을 투자. 2017년까지 줄기세포와 유전자치료제 분야에서 세계 최초로 내세울 만한 의약품 5개 출시 목표 |
|
2016. 9 |
바이오․헬스 7대 강국 진입을 위한 보건산업종합발전전략 |
정밀․재생의료 등 첨단의료 전략적 투자 강화의 일환으로 제도 개선 및 연구개발 선제적 투자 등을 추진 |
[표 1-13] 재생의료기술 관련 정부 종합계획(2006년∼문재인정부 출범전)
자료: 범부처재생의료기술개발사업단 내부자료, 2021.
한편 정부는 2019년 5월 ‘바이오․헬스 산업 혁신전략’을 발표하였다. 의약품․의료기기 등 바이오․헬스 산업의 혁신전략을 마련하여 기술 개발부터 인허가, 생산, 시장 출시에 이르는 산업 전주기의 혁신생태계 조성을 추진하는 데 초점을 두었다. 이 전략에는 세포․유전자 등을 활용하는 재생의료 및 바이오의약품의 특성에 맞도록 관리체계를 선진화하는 내용과 의약품 임상시험과 구분되는 재생의료 임상연구제도를 도입하여, 임상연구 활성화 및 안전관리체계가 포함되어 있다.
2019년 8월에는 국가적 차원에서 첨단재생의료 산업육성 및 안전관리 체계 구축을 위한 특별법인 ‘첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법(이하 첨단재생바이오법)’을 제정하였으며, 동법은 2019년 8월 시행되었다. 새로운 치료법이 절실한 환자들에게 안전한 관리 체계하에서 합법적인 치료기회를 임상연구를 통해 제공받을 수 있는 시스템이 마련된 것이다.
[표 1-14] 첨단재생바이오법 제정 전후 비교
|
내용 |
기존 |
법 제정 후 |
|
법 적용 |
- 기존 의료법 및 약사법으로 첨단재생의료 분야 치료기술 및 첨단바이오의약품 분야의 특수성 반영 어려움 |
- 재생의료분야 및 첨단바이오의약품 분야의 특수성 반영가능 |
|
중장기 계획 수립 |
- 과학기술기본계획, 국정과제 등에 바이오․헬스산업전반의 전략 마련 추진 |
- 재생의료분야의 특화된 전략 수립 가능 - 정책심의위원회 설치 운영 |
|
정책개발지원 |
- 없음 |
- 첨단재생의료지원기관 설립 또는 지정 가능 - 재생의료진흥재단 지정 |
|
연구개발지원 |
- 부처별 분산 지원 |
- 범부처 연계 협력 지원 가능 - 범부처재생의료기술개발사업단 설립 |
|
안전관리체계 |
- 없음 |
- 첨단재생의료안전관리기관 지정, -관리․감독, 안전성 모니터링과 이상반응 보고 - 첨단재생의료 임상연구 장기추적 조사 |
|
임상승인절차 |
- 병원 내 IRB심의 및 전문가 5인 의견 |
-첨단재생의료 및 첨단바이오의약품심의위원회의 설치 운영 |
|
범위 및 수준 |
- 불명확 |
- 정의, 범위, 분류, 위험도에 따른 구분 |
|
임상연구 의료기관 |
- 불명확 |
- 필요 시설, 장비 및 인력을 갖춘 첨단재생의료실시기관 지정 |
|
임상연구 장기추적조사 |
- 없음 |
- 안전성 모니터링과 장기추적조사 보고 의무 |
자료: 범부처재생의료기술개발사업단 내부자료, 2021
동법에서는 5년 단위 첨단재생의료 및 첨단바이오의약품 기본계획을 수립하고 매년 시행계획을 수립하도록 하고 있다. 그 외에 첨단재생의료 연구개발에 대한 투자 확대, 임상연구 승인, 연구대상자 안전관리, 전주기 안전관리체계, 신속처리제도 등의 내용이 담겨 있다. 동법의 시행을 통해 급속도로 성장하고 있는 재생의료 시장에서 우리나라 재생의료분야 의료기술의 기술경쟁력을 제고할 수 있는 토대가 마련되었다.
첨단재생바이오법에 따라 정책심의위원회를 거쳐 2021년 1월 제1차 첨단재생의료․첨단바이오의약품 5개년 기본계획(2021∼2025)이 마련되었다. 이 기본계획은 첨단재생바이오 기술을 통한 희귀 난치질환 극복을 목표로 하고 있으며, 이를 달성하기 위한 안전관리 체계 마련, 임상연구와 치료접근성 확대, 기술 촉진 혁신 생태계 구축 등을 주요 내용으로 담고 있다.
첫째, 안전관리체계 부문에서는 원료(세포) 채취부터 사용단계까지의 전주기 안전관리 규정을 마련하기로 했다. 임상연구와 치료접근성 확대부문에서는 일선 병원에 대한 ‘재생의료기관’ 지정과 예산 지원을 통해 임상연구를 활성화하기로 했다. 이를 통해 안전성․유효성이 입증된 기술을 다양한 환자 지원 프로그램에 적용함으로써 단계적으로 희귀․난치 질환자의 치료 기회가 확대되었다.
둘째, 기술촉진 혁신생태계 구축 부문에서는 빠른 속도로 변화하는 첨단재생의료 분야를 선도할 수 있도록 2020년 6월 예비타당성조사를 통과한 범부처 재생의료기술개발사업을 통해 오는 2030년까지 10년간 5,955억 원 규모의 국가 연구개발비를 과학기술정보통신부와 보건복지부가 공동으로 투자하게 된다. 한편 2021년 3월에는 동 사업 추진을 위한 연구지원관리 전담기관으로 범부처재생의료기술개발사업단을 설립하였으며, 동 전담 사업단을 통해 부처간, 사업간 연계 협력이 한층 강화되게 되었다.
② 국가 연구개발 투자 동향
2005년 이후 정부차원의 종합적인 지원계획 마련으로 줄기세포 연구비 투자가 증가하기 시작하였으며, 2012년 ‘줄기세포 R&D 투자 효율화 방안’에 따라 국가차원의 줄기세포 연구지원 전략을 마련하여 줄기세포 연구개발 투자가 꾸준히 확대되었다. 재생의료기술개발 예산은 과학기술정보통신부 및 보건복지부가 공동으로 지원하는 범부처재생의료기술개발사업으로 2021년 128억 2,200만 원이 투자될 예정이며, 예비 타당성조사 결과를 반영하여 향후 10년간 약 6,000억 규모의 예산이 지속적으로 투자된다.
한편 보건복지부는 첨단의료기술개발사업 내 줄기세포․재생의료실용화사업비로 2019년 123억 원, 2020년 253억 원, 2021년 348억 원으로 투자를 확대하였다. 재생의료실용화사업비는 재생의료분야 기초원천 연구성과의 임상적용을 위한 중개연구, 실용화 임상시험, 산업화 기반기술 등을 지원한다.
산업통상자원부는 첨단 재생바이오 연구개발에 필요한 범용 소재․부품․장비 자급화를 지원하는 바이오산업 기술개발사업 9개 품목에 2020년 101억 원에서 2021년 318억 원, 소재부품 개발사업 7개 품목에 2020년 73억 원에서 2021년에 391억 원을 각각 투자하게 된다. 특히, 산업통상자원부는 유전자치료에 필요한 바이러스벡터, 인체이식용 지지체 및 인공장기 개발용 생체소재 등을 미래선도 품목으로 선정하고 2022년 R&D신규 사업을 기획, 예산 반영을 위해 노력 중에 있다.
③ 기술분야별 연구동향
첨단재생의료란 첨단재생바이오법 2조 용어의 정의에 따라 세포치료(제), 유전자치료(제), 조직공학치료(제) 등으로 크게 분류할 수 있다.
국내의 줄기세포 활용치료기술은 성체줄기세포치료제에 개발역량이 집중되어 있으며, 최근 주목받는 세포유전자치료제 등 세계 기술발전 흐름과는 격차가 존재하고 있다. 식품의약품안전처의 자료에 따르면 재생의료 임상 건수로 볼 때 2007년에서 2018년까지 세포치료제 254건(81%), 세포유전자치료제 11건(4%), 조직공학치료제 6건(2%), 유전자치료제 41건(13%)을 각각 점유하고 있다.
우리나라는 유전자치료제로 승인받은 제품은 없으나 성체줄기세포의 경우 선진국 수준으로 평가받고 있으며 잠재력을 보유하고 있다. 2018년 기준 최고기술 보유국인 미국 대비 85% 정도의 수준을 보이고 있어 생명보건의료 분야에서 기술격차가 가장 작은 분야이다.
2019년 기준 전 세계 판매 승인된 줄기세포치료제 7건 가운데 4건(하티셀그램-AMI, 카티스템, 큐피스템, 뉴로나타-알주)이 한국 제품이다. 그러나 미국 FDA의 판매승인을 받지 못하고 있으며, 2015년 이후부터 가시적인 제품화 성과가 부진한 실정이다. 글로벌 임상 건수로 볼 때 세계 시장은 급속히 발전하고 있으나 글로벌 대비 국내 점유율은 오히려 하락하고 있다.
[표 1-15] 우리나라 세계 임상시험 시장 점유율(재생의료 승인건수 기준)(2010~2018)
|
구분 |
2010 |
2011 |
2012 |
2013 |
2014 |
2015 |
2016 |
2017 |
2018 |
|
|
글로벌 임상(건수) |
145 |
159 |
169 |
223 |
272 |
289 |
331 |
488 |
430 |
|
|
|
국내 임상(건수) |
(15) |
(12) |
(27) |
(28) |
(25) |
(26) |
(37) |
(28) |
(28) |
|
점유율(%) |
10% |
8% |
16% |
13% |
9% |
9% |
11% |
6% |
6% |
|
자료: 각 국가별 승인기관(한국 식약처, 미국 FDA, 유럽연합(EU) EMA 등) 조사, 첨단재생의료․첨단바이오의약품 기본계획, (2021.1.)
④ 산업동향
재생의료기술은 초기의 자가유래, 줄기세포기반 연구중심에서 최근에는 동종, 세포 분화기술 등 시장성이 높은 차세대 기술로 지속 발전하고 있다. 기존 합성의약품이나 의료기기와 다른 특성을 갖는 차세대 유망기술로서 재생의료 세계시장23)은 급격히 성장 중이다.

자료: 첨단재생의료․첨단바이오의약품 기본계획(2021.1.)
[그림 1-5] 글로벌 재생의료 시장규모(2017~2028)
[표 1-16] 첨단재생바이오 산업의 범위
|
대분류 |
중분류 |
해당 기술 |
|
치료제 산업 |
세포치료제 |
체세포, 성체줄기세포, 배아줄기세포(ESCs), 유도만능줄기세포(iPSCs) |
|
유전자치료제 |
Ex vivo 유전자치료제, In vivo 유전자치료제, 유전자편집 |
|
|
조직공학치료제 |
인공조직, 생체소재 기반 이식재, 융복합 치료제, 바이오닉스 |
|
|
기반 산업 |
툴 및 플랫폼 |
생산장비(배양기 등), 일회용품, 시약/배지, 공정기술, 모델링기술, 전산화기술 |
|
바이오 뱅킹 |
줄기세포, 제대혈, 인체조직(지방, 피부 등) 등의 수집 저장 유통 및 공급 |
|
|
서비스 관련 기업 |
CRO(임상시험 대행), CMO/CDMO(생산공정개발 및 생산 대행), 컨설팅(인허가, 상용화 등) |
자료: 첨단재생의료․첨단바이오의약품 기본계획(2021.1.)
또한 치료제 시장뿐만 아니라 장기․세포 등 생체소재 생산․공급부터 병원, 세포뱅크, 장비, 기반 제조시설, 서비스, 전문 인력 등 기반 산업 역시 막대한 경제적 부가가치 창출이 가능한 산업으로 인식되고 있다.
(나) 주요국 동향
① 정책 및 제도
선진국은 재생의료가 갖는 의약품과 의료기술의 복합적 성격을 고려하여 기존 합성의약품과 다른 새로운 영역으로 분류하고 관련 법률을 제정, 별도의 관리체계를 구축 운영하고 있다. 특히 불확실성이 있는 재생의료기술에 대한 별도의 안전관리체계를 구축하여, 안전하고 체계적인 임상연구를 시행하고 있다.
국가별 차이는 있으나 환자의 치료받을 권리를 보장하여 재생의료기술에 대한 접근성 확대를 위한 제도를 운영하고 있다. 미국과 EU는 재생의료기술을 임상연구 단계의 기술처럼 취급하여 허가 전의 치료법․치료제는 시한부 환자 등에 예외적으로 적용할 수 있도록 하는 별도 제도를 운영하고 있다. 일본은 임상연구를 통해 안전성․유효성이 입증된 치료기술 중에서 일부는 의약품이 아닌 병원의 의료시술로 별도 관리하면서, 일정 요건을 거치면 지정 의료기관에서 제공할 수 있도록 운영하고 있다.
[표 1-17] 해외 주요국의 재생의료 분류 및 치료접근성 관련 제도
|
구분 |
미국 |
유럽연합 |
일본 |
|
분류 |
RMAT(첨단치료제제) |
ATMP(첨단치료제품) |
재생의료 |
|
(근거) 21세기 치유법 (2016년 12월 제정) |
(근거) 첨단치료제제법 (2007년 11월 제정) |
(근거) 재생의료안전법 (2014년 11월 제정) |
|
|
치료 접근성 |
(근거)치료받을 권리법 (2018년 제정) |
(근거) 병원면제제도 |
(근거) 재생의료안전법 |
|
(대상자) 생명이 위협받는 말기환자로 기존 치료법으로 희망이 없는 환자 |
(대상자) 의사의 판단
|
(대상자) 제한 없음 (환자와 의료기관 간 동의) |
|
|
(제공 가능한 치료) 치료제 등으로 허가 전이지만 임상연구 등을 통해 안전성 유효성이 입증된 기술 |
(제공 가능한 치료) 치료제 등으로 허가 전이지만 임상연구 등을 통해 안전성 유효성이 입증된 기술 |
(제공 가능한 치료) 임상연구 등을 통해 중․저 위험으로 분류된 기술 중 지역재생의료위원회의 심의․승인을 받은 기술 |
|
|
특징 |
예외적 접근 원칙 아래 희귀 또는 난치질환자, 시한부 환자 등에 허용 |
승인된 기술 중 자유진료를 통해 허용 |
|
자료: 첨단재생의료
② 투자동향
선진국은 재생의료기술에 대한 R&D 투자를 확대하고 있으며, 분화줄기세포, 유전자치료, 인공생체조직, 이종장기 등 유망기술 파이프라인 다양화를 추진하고 있다.
각국의 R&D 투자현황은 미국 NIH 2019년 5조 7,000억 원, 캐나다 2017년 약 1조 원, 일본 의료연구개발기구(AMED) 2019년 약 1,700억 원이다. 특히 선진국은 축적된 임상자료 기반 민-관 기술발전 협력체계 구축 및 정책적 지원을 토대로 다양한 민간투자 유인전략을 추진하고 있다. 캐나다의 재생의료상용화센터(CCRM: Center for Commercialisation of RM), 영국의 CGTC(Cell and Gene Therapy Catapult) 등 정부 산하에 재생의료 특화 투자 촉진기관을 설립하여 국가 정책지원과 연계한 국제협력, 해외자본 유치 활성화 등 산업 활성화 기능을 수행하도록 하고 있다.
미국 재생의료연합(ARM)의 2020년 연간 보고서에 따르면 코로나19의 영향에도 불구하고 2020년 재생의료(첨단 바이오 의약품) 산업은 큰 폭으로 성장하였다. 미국, 유럽 등 선진국 규제기관에서는 첨단 바이오 의약품의 신속한 인허가 절차를 지원하는 패스트트랙 제도를 활성화하여 기업의 연구개발을 지원하고 있으며, 첨단 바이오 의약품의 개발과 생산을 지원하기 위한 위탁개발 생산기업(CDMO)들도 대폭 투자를 확대하고 있다. 2020년 세계 재생의료 산업에 전년대비 50% 증가한 199억 달러가 투자되었으며, 현재 세계적으로 1,220건의 재생의료(첨단 바이오 의약품) 임상이 이루어지고 있다. 그 중 152건이 3상 진행 중에 있으며, 2021년에는 미국, 유럽 등에서 최소 8개의 재생의약품 허가가 기대된다고 밝히고 있다.
(다) 문제점 및 향후 전략
첨단 재생의료 및 첨단 바이오 의약품의 안전 및 관리에 관한 법률이 제정되어 해외 주요국과 같이 재생의료 특성에 맞는 안전관리체계 아래 의약품과 구분되는 별도의 임상적용 경로가 마련되었다. 해외사례를 참고하여 새로운 법적기반은 마련하였으나 기존 다른 제도와의 조화, 제한된 치료 접근성 등 제도개선 과제가 여전히 다수 존재하고 있다. 따라서 빠르게 변화하는 첨단재생의료 분야에 적합한 규제 및 지원체계를 조속히 갖출 필요가 있다.
첨단 재생의료 기술은 살아있는 세포를 원료로 하는 첨단의료로, 사람을 대상으로 하는 기술적용을 위해서는 기술의 불확실성에 따른 예상치 못한 위험에 대비한 제도적 장치 마련이 우선될 필요가 있다. 혁신기술 개발을 장려하는 선제적 규제 합리화, 환자 안전중심 연구개발 지원, 부족한 산업기반 확충 등 범정부 차원의 지원이 필요하다.
성체줄기세포 치료제 등 안정적 파이프라인에만 집중되어 혁신기술 경쟁력이 오히려 저해되고 있어서 파이프라인을 다양화하여야 한다. 또한 현재처럼 치료제 내수시장에 치중하는 생태계를 지속하면 혁신 연구개발 역량이 취약해지고 세계시장에서의 경쟁력 확보에 애로가 있으므로 글로벌 시장 진출을 위한 노력이 필요하다. 임상연구 또는 임상시험을 주도할 의사과학자, 생산 전문인력, 규제전문가 등 인적자원의 부족 문제도 해결이 필요한 과제이다.
나. 범부처 지원 민관협력(의료기기)
(1) 의료기기 산업의 패러다임 전환
(가) 코로나19 팬데믹과 의료기기 산업의 4차 산업혁명 가속화
의료기기 산업은 인공지능, 빅데이터, 로봇 등 4차 산업혁명에 기반을 둔 첨단, 융합기술의 형태로 빠르게 진화하고 있으며, 코로나19 팬데믹 상황, 고령화 및 기대수명의 증가에 따라 공급자(병원․의사) 중심의 사후적 치료에서 수요자(환자) 중심의 예방적․맞춤형 치료로 패러다임이 확장되고 있다.24)
특히, 최근 우리나라는 체외진단의료기기 및 진단시약의 빠른 개발로 전 세계 방역에 중요한 역할을 하였으며, 국내외에 K-방역의 브랜드 가치를 제고하는데 크게 기여하였다. 더불어, 코로나19로 인한 비대면 의료 및 관련 산업 확대, 소프트웨어 의료기기 및 AI 의료기기 기술 등을 기반으로 한 환자 맞춤형 진단 및 치료, 질병의 예방 및 모니터링 관련 의료기기 출시 등을 통해 의료기기 산업은 4차 산업혁명의 핵심분야로 성장하고 있으며, 한국 경제의 미래 성장 동력이 될 것으로 기대되는 상황이다.
(나) 의료기기 산업육성을 위한 정부의 노력
정부는 혁신성장 BIG3 산업 육성을 위한 다양한 계획을 마련하고 있으며, 분야별로 여러 주체가 함께 참여하는 강력한 컨트롤 타워를 구축하여 운영 중이다. 특히, BIG3 산업 중 바이오․헬스 분야는 2022년 수출액 200억 달러, 세계시장 점유율 3%를 목표로 R&D 집중 지원, 전문인력 양성 등을 통한 지원체계를 구축하고 추진 중이며, 의료기기와 관련하여 범부처전주기의료기기연구개발사업단(약 1조 2,000억 원, ∼2025) 신설, 혁신의료기기 우선심사제도 도입 등을 주요 정책으로 삼아 미래시장 경쟁력 확보 및 전략품목 국산화를 도모하고 있다.25) 또한, 신시장 창출을 위한 규제혁신의 일부 지연 및 R&D의 사업화 연계가 미흡했던 문제를 극복하기 위해 민관합동 회의체를 정례화하였다.
홍남기 부총리 겸 기획재정부 장관이 주재하는 혁신성장 BIG3 추진회의는 지금까지 총 12차례 개최되었으며 의료기기와 관련하여 논의된 핵심 추진과제는 다음과 같다.
[표 1-18] 혁신성장 BIG3 추진회의 중 의료기기 관련 핵심 추진과제
|
구분 |
핵심 추진과제 |
|
제2차(2021. 1. 8.) |
- 의료기기 활용․지원체계 구축방안 - 의료기기 민간인증제 도입 추진 |
|
제5차(2021. 2.25.) |
- 한국형 K-Cancer 통합 빅데이터 구축방안 (유전체, 영상, 건강검진 등 이종 데이터 결합) |
|
제7차(2021. 4. 1.) |
- K-방역 맞춤형 수출지원 방안 (신속제품화-해외 인허가-양산체계 구축-해외수출수요 발굴) |
|
제11차(2021. 6.10.) |
- 국내 의료기기 전략분야 육성과 산업생태계 조성 - 미래 정밀의료 선도를 위한 바이오 빅데이터 구축 |
|
제12차(2021 .7. 1.) |
- 소프트웨어 의료기기 육성을 위한 제도 개선 방안 |
(다) 포스트 코로나 시대를 대비한 국내 의료기기 산업 발전 계획
포스트 코로나 시대의 국제경쟁력 강화를 위한 의료기기 산업의 국내 발전기반 조성 및 체계적․전략적 육성을 위해 코로나19를 계기로 급성장한 체외진단 의료기기 분야 및 기술경쟁력이 있는 기존 의료기기 분야를 전략 육성하고 해외진출 지원을 강화하는 방안을 마련 중에 있다. 이를 기반으로 2025년까지 의료기기 산업 세계시장 점유율 7위 달성을 위한 목표를 제시하였다.26)
(2) 정책동향
(가) 바이오․헬스 산업 혁신전략 및 한국판 뉴딜 2.0 시행계획
정부는 바이오․헬스 산업 혁신전략을 통해 2023년까지 민간투자(바이오․헬스 분야 주요 36개사 등) 약 10조 원을 계획하고 있고, ‘지원자’로서의 역할을 충실히 수행하여 민간투자 효과를 극대화하는 전략을 발표한 바 있다.
주요 내용으로는 범부처 협력연구에 대한 투자 확대, 내수시장 확보, 통합형 시장진출, 신의료기기 경쟁력 확보 등이 있으며, 사용경험 확대 및 보상체계 마련, 글로벌 경쟁력이 있는 전략 품목에 대한 지원 강화, 혁신성장을 위한 정책적 지원 등 세 가지 전략을 수립하였다. 이를 통해 2023년까지 연평균 약 20%의 생산 증가와 약 9,300여 명 규모의 신규 고용창출을 전망하고 있다.
또한, 지난 1년간 국제사회에서도 코로나19 대응 위기극복 등 대표적인 국가발전 전략으로 평가받은 한국판 뉴딜은, 최근 한국판 뉴딜 2.0 시행계획 발표로 이어져 2025년까지 누적 총사업비 규모를 기존 160조에서 220조 원으로 대폭 확대할 계획이다.27) 이를 기반으로 디지털 뉴딜 분야에서 의료 빅데이터․AI, 의료기기 관련 신산업 융합인재 2만 명 이상을 양성하고, 의료 디지털 인프라 고도화28) 등 국민이 체감 가능한 성과를 확대하고자 한다.
(나) 선도적 규제환경 조성을 위한 정부의 노력
식품의약품안전처는 인공지능 의료기기 개발을 지원하고 선도적인 규제환경을 조성하기 위해 2017년 세계 최초로 ‘인공지능 의료기기 허가․심사 가이드라인’을 마련하는 등 총 6개의 가이드라인을 제시한 바 있다. 이를 통해 국내에서 70개 품목(2021년 4월 기준)의 인공지능 의료기기가 허가되었다.
우리나라는 2021년도 국제의료기기규제당국자포럼29)(IMDRF: International Medical Device Regulators Forum)의 의장국으로 선임되어, 식품의약품안전처가 국제 의료기기 규제 정책 수립 및 인공지능 의료기기 등 IMDRF에서 제․개정하는 가이드라인 마련에도 주도적 역할을 하게 되었다. 이를 통해 우리나라 인공지능 의료기기의 규제역량을 국제적으로 인정받고 있으며, 국내 의료기기 산업의 수출 경쟁력 강화에도 도움이 될 것으로 전망된다.
(다) 정책 변화에 대한 대응 필요
2021년은 의료기기 산업에도 다양한 제도적․정책적 변화가 진행되고 있는 상황이다. 지난해 의료기기 산업의 큰 화두는 범부처 전주기 의료기기 연구개발사업과 혁신형 의료기기기업 인증 사업이었다. 이와 더불어 의료기기 영업자 행정 부담 개선, 소프트웨어 의료기기 수입절차 개선, 환자 맞춤형 의료기기 확대, 동일 품목의 병행 변경허가․심사 개선을 통해 신속 시장진입이 가능하도록 규제개선을 추진 중에 있어서 이에 대한 대비가 필요할 것이다. 국제적으로는 1년 유예기간을 두었던 유럽연합의 MDR(Medical Device Regulation)과 내년 시행 예정인 IVDR(In Vitro Diagnostic Devices Regulation)에 대비한 철저한 준비도 필요하다.30)
(라) 의료기기 산업 발전을 위한 범부처 차원의 노력
의료기기 R&D는 다학제간의 융합 연구가 필요하며, 연구․개발단계에서의 임상참여 체계를 구축하고, 안전성․유효성 측면에서 우수한 임상데이터를 확보하는 것이 중요하다. 또한, 적극적인 사후관리와 홍보를 통해 국산 의료기기의 인지도를 높이는 노력 또한 병행할 필요가 있다.
이를 위해 2020년 3월 의료기기 R&D 관련 국내 최초의 4개 부처 간 공동사업으로 범부처 전주기 의료기기 연구개발 사업을 시작하여, 연구개발 초기 단계부터 의료기기로 이어질 수 있는 품목인지 철저히 검증하고, 민관의 긴밀한 협력체계를 구축하여 연구개발의 성과물이 임상현장까지 도달하는데 거쳐야 하는 많은 장애물을 극복할 수 있도록 지원체계를 구축하고 있다.
본 사업은 ▴시장친화형 글로벌 경쟁력 확보 제품 개발 ▴4차 산업혁명 및 미래의료환경 선도 ▴의료공공복지 구현 및 사회문제 해결 ▴의료기기 사업화 역량 강화 등 4개 내역을 중점 투자 방향으로 설정하였으며, 이와 더불어 코로나19 대응을 목적으로 감염병방역기술개발사업(추경)을 지원하고 있다. 감염병방역기술개발사업은 신․변종 바이러스와 해외유입 감염병 대응역량 강화를 목적으로 하며, 이에 필요한 방역․진단기기의 국산화와 기술 고도화를 주요 내용으로 한다.
|
주요사업 |
시장친화형 글로벌 경쟁력 확보제품 개발 |
4차 산업혁명 및 미래 의료환경 선도(디지털뉴딜) |
의료공공복지 구현 및 사회문제해결 |
의료기기 사업화 역량강화 |
감염병방역기술 개발사업 |
|
지원목적 |
시장 수요가 높은 의료기기 등 국내 역량 및 강점을 보유한 제품 또는 수입의존도가 높은 제품의 국산화 기술 개발 지원 |
국내 우수한 ICT 기술을 비롯하여 인공지능, IoT 등의 미래 기술과 사용자 중심의 신기술․신개념 의료기기 개발 및 미래 의료 환경 생태계 구축 |
고령화에 따른 의료비용 부담 급증을 극복하고 의료 소외층을 배려하기 위한 의료기기 개발로 복지 구현 및 사회문제 해결 |
의료기기의 신속한 시장 진입을 위한 국내․외 허가용 임상시험 및 맞춤형 인허가 지원 |
코로나19 등 신․변종 해외유입 감염병 대비 국가방역체계 강화 및 감염병 조기 진단시스템 확립 및 글로벌 경쟁력 강화 |
|
사업방향 |
의료기기 기업 육성 |
미래의료환경 대응 |
국민복지 향상 |
사업화 기반 강화 |
국가방역체계 강화 |
|
사업내용 |
- 프리미엄 제품개발 - 전방위적 고도화지원 - 국산화 역량강화 - 핵심부품 국산화 |
- 미래형 신의료기기 사업화 - 신의료기기 서비스 생태계 구축 - 의료기기이슈 및 난제해결 |
- 재활의료기기 및 실버의료기기 개발 - 공공의료복지 지원기기 개발을 통한 의료 사각지대 지원 |
- 제품개발 단계별 임상시험 지원 - 맞춤형 인허가 지원 |
- 감염병 방역장비 기술개발 - 체외진단기기 기술개발 |
또한, 사업단에서는 의료기기의 개발부터 시장진출까지 단계별 허들 극복 및 의료기기 R&D의 사업화 효율성 제고를 위하여 전주기 통합 플랫폼(KMDF & Platforms, K&P)을 구축하고 운영중에 있다.31)
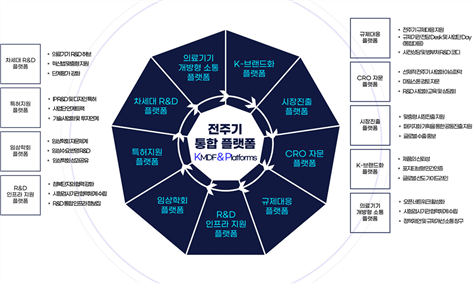
[그림 1-6] K&P 전주기 통합 지원 플랫폼
(3) 의료기기 산업의 지속 성장 및 기술혁신 가속화
(가) 사회 및 기술 환경 변화로 인한 의료기기 산업의 지속적 고성장 전망
의료기기 산업은 지속적으로 성장하는 미래 유망 산업분야로 전 세계적인 경제성장, 고령화, 기대수명 증가 및 기술 발전에 따라 규모와 범위가 확대되고 있는 분야이다. 또한, 타 산업에 비해 높은 영업이익률과 고용유발효과를 가지고 있어 의료산업 활성화를 통해 국내 기업구조, 고용 현황 등에 긍정적으로 작용할 것으로 기대된다.32)
(나) 의료기기 첫 무역수지 흑자 전환
2020년도 국내 의료기기 무역수지는 통계 집계 이후 최초로 흑자(2조 6,041억 원)로 전환되는 쾌거를 달성했다.
식품의약품안전처에 따르면 2020년 국내 의료기기 산업 생산실적은 총 10조 1,358억 원 규모로 전년대비 39.2% 증가하였으며, 특히 수출실적은 7조 8,315억 원으로 전년 대비 무려 81.1%의 상승률을 보였다. 코로나19 사태를 계기로 급성장한 국내 체외진단 의료기기 분야의 기술혁신과 발전이 큰 원동력이 되었으며, 그 외에도 기존 강세를 보인 치과용 임플란트 생산액이 꾸준한 상승률을 보였다.33)
(다) 영세한 기업 및 높은 수입의존도 대비 낮은 국산 의료기기 사용 비중
국내 의료기기 산업은 다품종 소량생산, 영세기업 위주로 구성된 산업 특성상 다양한 임상근거 축적, 각국의 인허가 획득과 시장진출 방안, 적극적인 사후 관리와 홍보가 이루어질 수 있는 민관협력 차원의 지원체계가 요구되고 있다.34)
또한, 수입의존도(62.1%, 2019년 기준)가 아직 높고, 품질 면에서 우수한 국산제품이 개발되고 있는 상황이나 사용경험 및 인지도 부족, 건강보험 미적용 등으로 국내 의료기관에서의 사용률은 현저히 저조한 상황이다.35)
(4) 법제도 동향
(가) 의료기기산업 육성 및 혁신의료기기 지원법
① 혁신의료기기 및 혁신형의료기기기업 인증 지원
우리나라는 의료기기 산업 발전을 위해 혁신의료기기와 혁신형의료기기기업 지정 및 지원을 주요 내용으로 하는 의료기기산업 육성 및 혁신의료기기 지원법(이하 의료기기산업법)을 2019년 4월에 제정하여 2020년 5월에 시행36)하였다.
혁신의료기기는 의료기기 중 기술집약도가 높고 혁신 속도가 빠른 분야의 첨단 기술의 적용이나 사용 방법의 개선 등을 통하여 기존의 의료기기나 치료법에 비하여 안전성․유효성을 현저히 개선하였거나 개선할 것으로 예상되는 의료기기이다.
2021년 7월까지 총 11개 제품이 지정되었으며, 혁신의료기기로 지정된 의료기기 중 8개가 인공지능 등의 기술이 융합된 소프트웨어 의료기기이다. 혁신의료기기로 지정된 경우 허가․심사 특례를 받으며 ‘단계별 심사’ 및 ‘우선심사’ 등의 혜택을 받을 수 있다.
혁신형의료기기기업은 의료기기 분야의 연구개발 역량과 실적을 갖춘 의료기기 기업에 대해서 보건복지부 장관으로부터 인증을 받은 기업이다. 제1차 혁신형의료기기기업 인증을 통해 혁신선도형37) 7개사, 혁신도약형38) 23개사 총 30개사 인증을 받았으며 2021년에 제2차 혁신형 의료기기 기업인증을 통해 20개사를 추가할 예정이다. 혁신형의료기기기업으로 지정될 경우 정부 R&D 및 시장진출 지원사업 선정시 가점이 부여되며 혁신형의료기기기업 전용 R&D사업39)에 참여 등의 혜택을 받을 수 있다.
② 범부처 차원의 의료기기 R&D 지원 전략
의료기기 산업은 생명공학 기술, 정보통신 기술 등의 발전에 따라 기술융합제품을 중심으로 시장이 확대되고 있으며, 수명 연장과 고령 인구 증가 등으로 의료서비스 수요 증가가 예상되어 미래 유망산업으로 발전할 잠재력이 큰 산업이다.
범부처 전주기 의료기기 연구개발 사업에서는 의료기기산업법에 따라 혁신의료기기 및 혁신형의료기기기업 지정서를 보유한 경우 과제 선정평가시 가산점을 부여하고, 국가연구개발사업 참여에 우대함으로 의료기기 연구개발 활동과 성과가 우수한 기업․기관 등을 지원하고 있다. 현재, 사업단 연구과제를 수행 중인 혁신형의료기기기업은 19개로 정부에서 인증한 혁신형 의료기기기업 중 약 60%를 차지하고 있다.
(나) 국가연구개발사업 혁신법 시행
① 국가연구개발사업 혁신법에 따른 범부처 차원의 의료기기 R&D 지원 전략
국가연구개발혁신법이 2021년 1월부터 시행40)되고 있다. 혁신법은 자율적이고 유연한 연구자 중심의 연구제도의 변화를 기본 방향으로 하고 있으며 부처별로 상이한 규정을 일원화한다는 의미를 포함한다. 연구비 정산 부담을 완화하고 연구비 사용의 효율성을 높이기 위해 연차 정산을 폐지하여 연구비를 단계 내 자동 이월하여 집행하고 있다. 또한 창의적인 연구에 과감하게 도전할 수 있도록 연차평가를 폐지하였으며 과정도 함께 평가 반영될 수 있도록 단계 평가가 강화된다. 사업단에서도 혁신법에 맞춘 과제 협약을 체결하여 연구기관과 연구자의 연구 자율성을 보장하고 있다.
국가연구개발사업 혁신법과 의료기기 산업법, 체외진단의료기기법 등 새로이 개정된 의료기기 관련 법의 시행으로 국가적 차원의 신규 기술개발 및 시장진출을 위한 체계적인 법적 근거가 마련된 상황에서, 의료기기 관련 기업이 첨단기술을 융합한 혁신적인 의료기기를 개발하고 실제 의료현장에서의 사용이 확대될 수 있도록 범부처 차원의 R&D 지원체계를 구축하고 지원을 강화해야 할 것이다.
2. 우리나라 바이오의 혁신 성장과 향후 과제
가. 우리나라 바이오의 현황
(1) 우리나라 바이오의 성과(2019~2021)
2020년 벽두부터 인류는 코로나19 바이러스의 팬데믹에 따른 미증유의 상황을 맞이하고 있다. 코로나19는 바이오산업을 넘어 세계의 모든 산업뿐만 아니라 인류의 삶까지 좌지우지하고 있다.
인류 역사상 공동의 적에 맞선 사례는 찾아보기 힘든 일로서, 바이오가 전 세계 인류의 생존과 삶에 얼마나 큰 영향을 미치는지를 목도하고 있다. 이에 바이오 연구개발 및 산업 분야에서도 코로나19 대응에 총력을 기울이고 있는 상황이다.
(가) 바이오제약 분야의 성과
① 글로벌 기술거래 본격화
2015년 이후 우리나라 바이오제약기업들의 기술수출은 꾸준히 늘어가고 있다. 2020년에만 9개사가 14건, 10조 1,500억 원 규모의 기술수출을 성사시켰다. 플랫폼 기술을 보유한 일부 기업은 하나의 플랫폼에서 비롯된 개별 프로젝트들을 다수 기술이전하는 모습도 보여주고 있다.
기술 거래의 주체도 다변화되어 국내 대형 제약사뿐만 아니라 상장, 비상장 바이오 벤처기업들이 라이센싱아웃 계약을 성사시켰으며 벤처와 벤처, 벤처와 제약사간 협업 프로젝트도 글로벌 기술수출이 되는 등 국내 기업들의 개발 및 사업 역량이 빠르게 글로벌 수준으로 도약하고 있다.
기술거래의 형태가 기술수출에 국한되지 않고, 사업 역량을 갖추었거나 플랫폼 기술력을 보유한 기업들을 중심으로 해외에서 기술을 도입하여 개발하는 양상도 나타나고 있다. SK가 프랑스 CDMO 회사를 인수한 것이 대표적인 사례이며, 코스닥 상장사인 레고켐바이오가 이태리 대학에서 신약프로젝트를 도입하였고 비상장 바이오벤처기업인 지피씨알은 대만 상장바이오회사에서 임상2상 단계의 항암제 프로젝트를 도입하였다.
② 후기 임상 개발 및 제품 허가로 가치사슬 고도화
혁신 신약 중 최초로 국내 기업이 미국 FDA 허가를 직접 받아 제품화에 이른 사례도 나타났다. SK바이오팜은 뇌전증치료제인 세노바메이트(제품명 엑스코프리)에 대하여 2019년 미국 식품의약국(FDA)에서 판매 승인을 받고 제품을 시판하였다. 이 약물은 유럽(EMA)에서도 허가를 받아 이태리 제약사에 기술이전 되었다. 국내 기업이 신약개발의 가치사슬을 처음부터 끝까지 직접 수행하여 완성시킨 첫번째 사례로서 자금과 개발 역량의 한계를 극복하고 글로벌 바이오기업으로 성장할 수 있는 기반을 갖추게 된 것이다.
바이오벤처기업인 헬릭스미스와 에이치엘비도 각각 당뇨병성 신경병증 유전자치료제와 항암제에 대한 후기 임상시험을 진행하고 있으나 아직까지 가시적인 성과를 도출하지 못했고 신라젠은 후기 임상시험에 실패하고 경영권이 바뀌는 등 아직은 도전이 좌절된 경우가 더 많다.
바이오시밀러 분야에서는 셀트리온과 삼성바이오로직스가 제품 포트폴리오를 구축하고 글로벌 시장의 주요 기업으로 부상하였다. 장치산업적인 특성으로 소수 기업들이 주요 시장을 장악하고 있어서 이들 기업의 경쟁력은 장기적으로 지속될 수 있을 것으로 예상된다.
정부에서도 2021년 국가신약개발사업단을 출범시켜 10년 내 글로벌 신약을 국내 기업이 직접 개발하여 글로벌 제약사로 성장하는 비전을 제시하고 있다. 전신인 범부처신약개발사업단이 지난 10년간 수십 건의 기술수출 및 SK바이오팜의 뇌전증치료제 개발에 기여하는 등 성과와 역량을 쌓아왔기에 동 사업단의 역할도 기대할 만한 것으로 보인다.
(나) 코로나19 진단 분야의 성과
코로나19가 창궐하기 시작한 2020년 상반기부터 전 세계적으로 진단 제품 공급에 차질이 빚어졌고, 국내 진단기업들의 발 빠른 대응이 이어졌다. PCR 진단제품을 선두로 래피드 항원 진단제품 등이 잇따라 개발되며 세계로 공급되었다. 씨젠, 수젠텍 등 진단 벤처기업들은 브라질, 이태리 등 초기에 코로나19가 심각했던 나라 등에 PCR 진단제품을 빠르게 공급하였다. SD바이오센서는 글로벌기업인 로슈(Roche)에 제품을 공급하여 래피드 항원진단 분야에서 애보트(Abott)와 세계 시장을 양분하고 있다.
짧은 기간 동안 인허가 사례가 축적되며 개발의 노하우를 얻게 되었고 대한민국 브랜드를 각인시킨 것은 보이지 않는 성과로 볼 수 있다. 아울러 이들 기업들이 세계 시장에서 창출한 수익을 기반으로 사업 확대에 나서는 것도 헬스케어 산업의 외연 확장 측면에서 주목할 만하다.
(다) 바이오 창업 및 투자
① 바이오 투자의 활성화
2021년 기준 코스피 시가총액 기준 상위 10개 기업 중 바이오기업이 2곳 포함되어 있고 코스닥 시가총액 기준 상위 10개 기업에서 바이오기업의 비중이 70%를 차지하고 있다. 코스닥 전체 시가총액 중에서도 바이오산업의 비중이 1/4을 차지하고 있다. 2020년 상장한 SK바이오팜의 공모금액이 9,000억 원에 이르는 등 바이오산업은 우리나라의 미래 신성장산업으로 자리매김하고 있다.
코스닥에 상장하는 바이오기업들의 공모 규모도 최근 3년간 300억 원을 상회하고 있으며, 상장시 기업가치도 평균 2,000억 원을 넘기고 있다.

출처: KRX, 2021.2.19. 기준.
[그림 1-7] 바이오 기술특례 상장기업 평균 공모규모 및 상장 시가 총액(2015∼2020)
바이오산업은 타 산업 대비 높은 기업가치를 인정받고 있다. 평균 주가수익비율(PER: Price Earning Ratio)이 90이 넘어 다른 업종에 비해 10배 이상 높은 양상을 보이고 있다. 2020년 한국거래소에서 발표한 KRX BBIG K-뉴딜지수를 구성하는 battery(2차 전지), bio(바이오), IT(정보통신, 인터넷), game(게임) 중에서도 바이오에 대한 성장 기대감이 높은 편이다.
벤처캐피탈의 바이오투자도 지속적으로 활발한 모습을 보이고 있다. 2019년 바이오벤처에 대한 투자액이 1조 원을 넘어섰다. 2020년 3월 코로나19의 여파로 잠시 위축되었으나, 미국 등 주요국에서 바이오투자가 활발해지고 국내 진단기업들이 글로벌 시장에서 선전하면서 전년 대비 더 높은 성장세를 보여 1조 2,000억 원에 이르렀다. 이는 벤처캐피탈 투자액에 국한된 것으로서, 신기술금융사 등에 의한 투자 및 상장사에 대한 투자 등을 포함하면 3∼4조 원에 이를 것으로 추정된다.
2005년 한 자릿수에 불과했던 바이오투자 심사역이 2015년 이후 급격히 늘어나 현재는 100여 명의 바이오심사역이 대부분의 벤처캐피탈에 포진해있다.
업종별 신규투자 금액
자료: Venture Capital Market Brief, 한국벤처캐피탈협회, 2021.3
[그림 1-8] 업종별 신규투자 비중 및 금액(2017~2021.3)
전략적 투자자(SI: Strategic Investor)의 참여도 늘어나고 있다. SK의 경우 2018년부터 우리나라를 비롯해 미국, 중국, 프랑스 벤처기업 8개사에 전략적 투자를 하고 있다. 스핀오프도 활발히 이루어져 혈액제제 전문기업인 SK플라즈마, 백신 전문기업인 SK바이오사이언스를 설립하였고 SK팜테코를 통하여 CMO사업 등 연관다각화를 추진하여 왔다.
제약사 중에서는 유한양행의 행보가 주목할 만하다. 2015년부터 25개사에 2,500억 원 가량을 투자하였다. 이 중 제노스코는 4세대 폐암치료제를 개발, 글로벌 제약사인 얀센에 약 1조 5,000억 원 규모의 기술이전을 성사시켰고 임상시험도 순항 중이다.
2000년대 후반부터 우리나라 바이오업계에서 회자되기 시작한 오픈이노베이션이 실질적인 성과를 창출한 것으로 평가할 수 있다. 바이오벤처가 초기에 연구개발을 시작하고 국내제약사가 바통을 이어받아 후기 개발을 맡아 계획제품의 가치를 높인 후 글로벌 제약사에 기술이전하는 한국형 오픈이노베이션 모델은 바이오벤처기업인 레고켐바이오가 처음 기획하여 녹십자, 한미약품 등과 협업함으로써 초석을 다져온 바 있다.
② 바이오창업 붐 및 자금 조달 규모의 확대
2015년 이후 바이오창업이 꾸준히 늘어나고 있으며 창업 주체 역시 다변화되고 있다. 컴퍼니빌더, 액셀러레이터 등 창업을 지원하고 보육하는 회사들의 등장도 이러한 양상을 가속화시키고 있다. 국책연구소, 병원, 한국보건산업진흥원 등 정부 유관기관들도 창업 보육에 적극적으로 나서면서 최근 3년간 1,500개가 넘는 바이오벤처가 생겨난 것으로 추산된다.
CRISPR, 면역항암제, mRNA백신 등 글로벌 바이오산업은 혁신 과학성과가 바로 기업의 자산으로 전환하는 추세를 보이고 있다. 국내에도 이 같은 흐름이 이어져, 대학이나 연구소의 첨단 연구성과가 창업이나 기술이전을 통하여 사업 자산화되고 있다. 기업 경력을 갖춘 사업개발 전문가들이 개발전문회사를 설립하여 이를 가속화하고 있다.
이들 기업에 대한 투자 규모도 늘어나, 초기 단계에서 100억 원 이상의 투자를 받는 기업들이 수십 개에 이른다. 임상시험에 진입하기 이전 단계에서는 미국 등 해외 스타트업에 뒤지지 않는 양상을 보이고 있으며 글로벌 시장을 목표로 하는 제품 개발이 이루어지면서 기업 경쟁력도 높아지고 있다. 다만 이러한 현상이 소수의 기업들에게만 집중되어 대부분의 스타트업들은 자금 부족으로 개발 및 회사 운영에 난항을 겪고 있다.
나. 우리나라 바이오의 향후 과제
우리나라 바이오의 향후 목표는 우선 두 가지 측면에서 볼 수 있다.
첫 번째는 바이오제약 분야에서 가치사슬을 완성하고 글로벌 경쟁에서 확고한 입지를 구축하는 것이다. 이는 기술수출을 통하여 수익을 창출하는 기존 사업 모델에만 머무르는 게 아니라 선도 기업들이 혁신 신약 및 헬스케어 제품을 끝까지 개발하고 글로벌 기업으로 도약할 수 있는가로 귀결된다.
두 번째는 바이오의 연구개발 역량을 고도화하여 바이오제약뿐만 아니라 다른 산업 분야에서도 산업 기반을 강화하고 글로벌 시장에서 도약하는 것이다. 이를 위해서는 각 기술 및 산업 분야뿐만 아니라 요소적인 측면에서 다양한 목표 설정 및 실행이 필요하다.
(1) 전문인력 확충
(가) 연구개발, 사업개발 및 생산인력 양성
바이오기업의 수가 급격하게 증가하면서 기업이 필요로 하는 인력 공급이 이미 부족한 상황이다. 향후 2∼3년 뒤에는 자금 부족이 아니라 인력 부족으로 개발이 지연되고 기업이 도태될 우려가 현실화될 것으로 예상된다. 일부 기업들은 인력 확보를 위하여 해외 진출을 모색하고 있으나, 장기적인 관점에서 필요한 인력을 양성하는 지원책이 민관 합동으로 추진되어야 한다.
(나) 기초연구 및 중개연구의 확대
바이오 연구개발에 대한 정부 지원은 꾸준히 증가하고 있으며, 환자들에게 실질적인 편익을 제공할 수 있도록 의사들의 참여 및 협업 체계를 갖추어가고 있다.
기업들의 수요도 늘어나서 상당수의 연구 성과들이 사업화 과제로 전환되고 있다. 그러나 글로벌 시장에서 이미 각광받고 있는 과제들을 새로 시작해서 빠르게 추격해서는 시장 경쟁력을 확보하기가 어렵다. 따라서 기초 연구 단계에서 연구자들이 자율적으로 주제를 선정함으로써 다양성을 확보하는 방향으로 전환할 시기가 도래한 것으로 보인다. 이후 의학적, 산업적 수요가 있는 과제에 대해서는 사업화를 통하여 집중적으로 개발함으로써 기술 차별성 및 경쟁력을 확보할 수 있으리라 판단한다.
(2) 제도 및 인프라
‘첨단재생의료 및 첨단바이오의 약품안전 및 지원에 관한 법률’(이하 첨단바이오법)이 제정, 시행되는 등 최근 2∼3년간 제도 분야에서의 변화도 상당하였다. 식품의약품안전처(KFDA)의 심사 인력을 늘리는 등 심사 역량도 강화하고 예측 가능한 규제 등 규제과학에도 힘을 들인 모습을 보였다. 다만 규제의 속도가 과학기술의 발전 속도를 따라가는 데에는 충분하지 않다는 반론도 여전하다.
미국 보스턴의 바이오 스타트업 지원기관인 랩 센트럴을 벤치마킹하여 국비만 2,500억 원이 투입되는 ‘K-바이오 랩허브’ 구축도 진행 중이다. 랩 센트럴이 민간 주도로 진행되어 높은 성과를 창출한 반면, ‘K-바이오 랩허브’는 관주도의 성격을 강하게 띠고 있어서 자율성에 기반한 산․학․연․병의 시너지 창출이라는 랩센트럴의 강점을 유지할 수 있을지에 대한 우려도 나타나고 있다.
바이오의 성과는 철저히 창의성에 비례하는 만큼 정부의 역할 및 지원 전략을 민간의 자율성을 극대화하는 방향으로 개선할 필요가 있다.
(3) 투자 및 기업 지원
이제 차세대 대한민국의 주력산업으로서 바이오산업을 포함하는 데 주저가 없으며, 민간의 바이오 투자는 수년간 다른 분야보다 많았고 향후에도 이러한 추세는 지속될 것으로 예상된다.
글로벌 시장에서의 경쟁력 확보를 위해 국내 제약사와 바이오벤처, 국내 바이오벤처간, 국내 대기업과 바이오기업의 M&A도 현실화될 것으로 보이며, 국내 바이오벤처와 해외 바이오기업간 M&A도 활성화될 것으로 보인다. 2019년 이후 이미 이러한 사례들이 나타나기 시작했으며, 정부의 지원은 이러한 M&A에 대한 제도적 정비를 통해 제약 요인을 해소하는 데 그 목적이 있다.
한편으로는 임상3상 시험 등 국내 기업들의 경험과 자본으로 수행하기 어려운 후기 임상에 투자하여 국내 기업들이 신약개발을 완성할 수 있는 대형 펀드를 기획하고 추진해야 한다.
정부 주도로 2005년에 만든 기술특례상장제도는 우리나라 바이오산업의 글로벌 경쟁력을 높이는데 기여하여, 중국 등에서 유사한 제도를 만들기도 하였다. 하지만 기술특례상장제도의 전문성을 높이는 다음 단계로 진화되어야 할 것이다. 기술특례상장제도의 문제로 꾸준히 지적되어온 ‘예측 불가능성 및 이에 따른 공신력 저하’의 이슈는 평가의 전문성을 높임으로써 해소될 수 있고, 바이오산업 생태계를 더욱 건강하게 만들어갈 수 있다.
2019년 이후 우리나라 바이오는 바이오제약산업을 필두로 글로벌 기술수출 등의 가시적인 성과를 창출하면서 글로벌 시장에서 주요 국가로 성장하였고, 바이오 창업이 활성화되면서 기초과학 연구개발 성과들이 기업으로 다수 유입되어 선순환 구조를 만들어가고 있다. 또한 코로나19 팬데믹에 빠르게 대응한 진단 제품들은 우리나라 바이오 및 헬스케어의 역량을 세계에 각인시키고 향후 글로벌 시장에서의 약진을 기대하게 한다. 이러한 바이오제약 및 진단 산업의 성장은 바이오 연구 및 인력의 역량 강화로 귀결되어 장기적으로는 다른 바이오 분야의 성장에 필요한 자산이 될 것으로 확신한다.

|
주요내용 요약 |
|
|
||
|
|
|
|
||
|
구분 |
연구개발 |
산업육성 |
||
|
개요 |
코로나19 극복 등 바이오 분야 R&D, 규제개선, 생태계 조성 및 인프라 구축 4가지 관점에서 집중 지원 등 정부 주요 정책 방향에 바이오분야를 지속적으로 포함하며 바이오분야를 중점 지원․육성 등 바이오경제 구현 노력 |
생명공학 산업의 정의, 분류, 육성 필요성
|
||
|
추진경과 |
범정부 바이오산업 혁신 TF 구성ㆍ운영 코로나19 치료제백신개발 범정부 지원위원회(’20.4.) 생명공학육성법 전면 개정(’20.5.) 혁신성장 BIG3 추진회의(’20.1.2) 바이오 연구개발 고도화전략(’20.11.) 한국바이러스기초연구소 설립(’21.7.) |
2020년부터 창의산업미래성장동력사업과 통합하여 바이오산업기술사업으로 운영 중이며, 바이오의약품 원부자재 및 장비 국산화를 위하여 바이오생산고도화사업을 지원 중 |
||
|
주요정책 |
생명공학육성 시행계획 및 뇌연구촉진 시행계획(매년) 바이오 연구개발 고도화 전략 수립(’20.11) 생명연구자원 빅데이터 구축전략 수립(’20.7.) 3기 바이오규제 TF(’20.7.~’21.6.)를 운영 |
바이오헬스산업 혁신전략(2019.5.22) -빅데이터 구축, 규제 개선, 생태계 조성 등
|
||
|
주요사업 |
신약, 의료기기, 재생의료 등 주력분야에 대한 연구개발 강화 및 뇌연구, 감염병 대응 등 국민건강과 직결되는 분야와 미생물, 합성생물학 등 미래유망분야의 핵심기술 확보하고자 선제적 지원 중 |
R&D(바이오산업기술개발 등), 바이오산업 생태계 구축, 국제 협약이행, 지역 바이오 활성화 기반구축 등 |
||
|
향후계획 |
생명공학분야의 핵심 원천기술을 확보하고 적극적인 R&D 투자와 정책 지원으로 바이오 경제시대를 준비. 제4차 생명공학육성 기본계획(’22~’31)을 수립을 추진하여 향후 10년간 바이오분야 중장기 비전과 목표 제시 예정 |
빅데이터 구축 및 이를 통한 서비스 발굴, 신약․디지털 헬스케어 산업 및 전후방산업 기술개발 적극 지원 예정
|
||
|
|
|
|
||
|
|
|
|
||
|
기초과학진흥 |
인력양성 |
|||
|
생명공학의 성과는 기초생명과학의 다양한 실험에서 기인한 성과로 연구개발사업도 기초과학의 선행이 전제되어야 함 |
생명공학 분야의 경쟁력 확보를 위해서 장기적 관점에서 연구의 지속가능성이 중요하다고 판단하고, 기초연구 분야에 대한 저변 확대와 우수 연구인력의 양성에 정책 역량을 집중하여 생명공학 분야의 연구 인력양성 역량 강화 |
|||
|
2004년 과학기술부 ‘과학기술혁신본부’ 설치 (부총리급 격상)를 시작으로, 2008년 교육과학 기술부, 2013년 미래창조과학부 출범을 거치며 일관성 있는 창조적 기초연구 추진전략이 마련. 現 문재인 정부에서 과학기술정보통신부는 전주기적 우수 연구과제 중심, 교육부는 인력양성 및 인프라 지원 중심으로 역할분담하여 추진 중 |
(1982년) 박사후연구자의 연구경험을 축적하고자 학문후속세대를 지원하고 있으며, 국가 연구역량 제고를 위한 연구저변 확대를 위해 1989년부터 풀뿌리 기초연구를 지원 (1999년) 미래 인재 양성을 위한 대학원의 교육․연구역량 강화 기반 조성을 위한 BK21사업을 시작 하여 현재 BK21플러스 사업까지 지속 지원 (2008년) 의과학자 육성지원 사업을 시작하여 미래 성장 동력인 바이오산업 분야 경쟁력 확보를 위한 중개연구를 활성화하고, 이를 수행할 의과학자를 적극 양성 |
|||
|
제4차 기초연구진흥 종합계획(’18~’22)을 통한 연구자 주도 기초연구지원 예산 2배 확대, 연구 자율성 보장 등을 단계적으로 추진 |
다양한 생명공학 분야에 대한 개인 및 대학 연구소 단위의 균형 잡힌 기초연구를 지원하여 연구 저변을 지속적으로 넓혀 나감과 동시에 석․박사 연구 인력에 대한 연수기회 부여, 연구경험 제공 및 장학금 지원을 통해 미래 한국을 책임질 학문후속세대를 육성 |
|||
|
기초연구를 중점 지원. ‘개인연구(신진․중견․리더 등)’, ‘집단연구(선도연구센터․기초연구실)’, ‘기반구축(전문연구정보활용사업 등)’으로 구분하여 연구자 역량단계 및 참여연구원 규모에 따른 세부 프로그램을 통해 추진. 생명공학분야 기초연구는 한국연구재단에서 지원 |
이공학 개인기초연구, 이공학 학술연구기반구축 4단계 BK21, 의과학자 육성지원 |
|||
|
연구자 수요를 반영한 기초연구사업 개편을 위한 기초연구사업 분야별지원체계 전환을 추진 중이며 전 분야가 각 분야의 특성을 반영해 기초연구사업을 운영할 예정 |
생명공학 분야의 연구와 인력양성을 위한 지원을 확충하여 기초연구와 인력양성간 긴밀한 연계를 통해 시너지를 창출하기 위한 대학 지원 확대 추진 |
|||
|
주요내용 요약 |
|
|
||
|
|
|
|
||
|
구분 |
농림축산식품 |
보건의료 |
||
|
개요 |
그린바이오 기술의 육성을 통해 기존 농업의 한계를 극복 |
바이오헬스 시장 선도를 위해 적극 지원 및 관련 법령 정비로 바이오헬스 산업 발전의 재도적 기반 마련. 포스트 코로나 시대 대비하여 보건의료 연구개발 및 산업을 육성하고자 함 |
||
|
추진경과 |
제3차 농림식품과학기술육성종합계획에 따라 정책 추진 중 |
제2차 보건의료기술육성 기본계획 (’18∼’22)수립 및 관계부처 합동 바이오 헬스산업 혁신 전략 발표(’19.5) |
||
|
주요정책 |
그린바이오 융합형 신산업 육성방안에 따라 정책 수립 및 계획 |
제2차 보건의료기술육성기본계획 (’18∼’22)은 ‘보건의료기술 혁신으로 국민 모두가 건강한 내일’이라는 비전을 설정하고 3대 전략을 중심으로 9대 중점과제를 추진. ‘바이오헬스 산업 혁신전략‘은 사람중심 혁신 성장’의 비전을 수립하고, 3대 목표를 달성하기 위해 13개 중점 과제를 추진 |
||
|
주요사업 |
골든시드 프로젝트 등 3대 전략, 21개 사업에 따라 추진 중 |
보건의료기술연구개발사업, 질병관리연구, 암연구사업 등 |
||
|
향후계획 |
농림식품과학기술육성종합계획과 그린바이오 융합형 신산업 육성방안에 따라 유망산업 분야에 집중 투자 계획 |
‘공익적 R&D 투자 강화로 국민 보건의료 문제 해결 및 첨단유망기술 육성을 통한 국가주력산업으로의 도약’을 목표로 감염병 위기 대응 역량 강화, 바이오헬스 첨단 유망기술 육성, 공익적 R&D 투자 강화, 의료현장 연계 R&D 지원을 4대 추진전략으로 정하고 주요 R&D를 추진해 나갈 계획 |
||
|
|
|
|
||
|
|
|
|
||
|
환경 |
해양수산 |
|||
|
환경생명공학기술의 개념 정의 |
해양바이오는 해양생물을 소재로 생명공학기술을 적용한 제품․서비스를 생산하는 산업으로 인류문제에 대응하면서 동시에 경제성장의 원동력이 될 것으로 전망되어 집중 투자가 필요 |
|||
|
법률 제정 및 전략 수립 등 환경분야 생명공학 육성을 위한 그간 추진 사항 |
2004년 ‘마린바이오21 사업(2004~2013)’을 시작으로 본격 육성하여 2021년 해양바이오기술 혁신을 통한 국가 성장동력 마련을 위하여 글로벌 해양바이오 선점전략(해양바이오산업 활성화 기본 계획)을 수립 |
|||
|
유전자원법, 기술개발, 생물산업 육성 등에 관한 정책 소개 |
제1차 해양수산생명자원 관리기본계획(2019~2023), 글로벌 해양바이오 시장 선점 전략(2021~2030) 등에 따라 유망분야 핵심 R&D 기술개발 및 해양바이오 산업 육성 추진 |
|||
|
기술개발사업, 생물자원 발굴 및 분류에 관한 주요 성과 및 사업 소개 |
해양수산생명공학기술개발사업, 포스트게놈다부처유전체사업, 해양바이오 전략소재개발 및 상용화 지원사업, 해양생명자원 소재활용 기반 구축사업(다부처), 빅데이터 기반 해양 바이러스 제어 및 마린바이오틱스 개발사업, 해양바이오 수소 생산 상용화 기술개발 사업 등 |
|||
|
나고야의정서 발효에 따른 유전자원법 이행을 위한 노력, 기술개발사업 등 지속 추진 계획 |
산업화에 중점을 둔 해양수산생명자원 확보 및 관리 체계화, 성과연계형 및 문제해결형 R&D 집중 투자 및 산업화 지원 강화관련 체계적인 정책운영 추진 |
|||

1. 생명공학 연구개발 지원
가. 개요
정부는 ‘생명공학육성법’에 근거한 생명공학육성기본계획(3차, 2017∼2026)에 따라 범부처 협력하여 바이오 기술․산업을 육성․지원 중이다. 관계 부처별 역할에 따라 기초․원천 연구부터 응용․사업화까지 R&D 전주기를 연계․지원하고 있다.
바이오 분야는 우수 R&D의 성과가 바로 시장에서 성공으로 연결되는 과학․기술집약적 산업으로 R&D가 성패를 좌우하는 핵심요소이다. 특히, 바이오․헬스는 미래 성장가능성과 고용효과가 크고 국민건강에도 기여하는 유망 신산업이다. 그래서 정부는 바이오․헬스를 차세대 주력산업으로 육성하기 위해 비메모리반도체, 미래형자동차와 함께 중점육성산업(BIG3)로 선정하고, ‘범정부 바이오산업 혁신 TF’를 구성․운영하여 5대 분야 10대 핵심과제를 선정하여 추진하고 있다.
2020년 4월 코로나19 확산으로 정부는 코로나19에 대응하고자 복지부․과기정통부 장관을 공동위원장으로 하는 관계부처․민간전문가로 구성된 ‘코로나19 치료제․백신개발 범정부 지원위원회’를 설치하여 치료제․백신 개발에 주력하였으며, 과기정통부는 국가차원의 바이러스 대응 기초․기반 연구 및 신․변종 바이러스 에 대한 선제적 대응을 위해 2021년 6월에 ‘한국바이러스기초연구소’를 설립하였다.
2020년 12월 코로나19로 인해 침체된 경제회복을 위해 혁신성장의 성과가 체감될 수 있도록 민관합동 컨트롤타워인 ‘혁신성장 BIG3 추진회의’를 설치하여 바이오 분야 R&D, 규제개선, 생태계 조성 및 인프라 구축 4가지 관점에서 집중 지원하고 있다.
과기정통부는 2020년 11월 바이오산업의 핵심인 바이오기술의 융합과 혁신을 선도하기 위한 ‘바이오 연구개발 고도화 전략’을 수립하고 바이오 기술 융합 가속화, 핵심기술의 선제적 확보 및 연구개발 기반 개선 등 바이오 연구개발 고도화를 통해 바이오산업의 도약을 견인하고 있다
나. 주요 정책
(1) 생명공학육성법 전면 개정
생명공학육성법은 바이오 분야 최상위 법률로서 1983년 제정된 이래 생명공학분야 육성을 위한 법률적 토대를 제공하고 있다. 2020년 5월 19일 생명공학육성법을 개정하여 생명공학육성 기반 강화 및 생명공학분야 연구개발과 사업화를 전주기적으로 지원하는 등 혁신적 바이오생태계 조성의 법적 근거를 마련하였으며 이어 시행령을 개정하여 세부적인 기준과 절차를 규정하였다. 이번 생명공학육성법 개정은 연구개발부터 산업화에 이르는 전주기적 역량강화, 혁신적인 연구환경 조성을 목적으로 미래 신성장동력인 생명공학의 실질적인 성과를 창출하고 체계적으로 육성하기 위해 법적 근거를 정비하였다는 점에서 의의1)가 있다.
(2) 생명공학육성기본계획에 근거한 시행계획 수립
정부는 ‘생명공학육성법’ 제5조 및 제6조에 근거하여 바이오 경제를 주도하는 글로벌 강국실현을 위해 제3차 생명공학육성기본계획(2017∼2025)를 수립하고, 기본계획의 효율적․체계적 추진을 위해 ‘생명공학육성 시행계획’을 매년 수립하여 이행하고 있다.
2020년에는 기본계획 이행을 위한 바이오분야 빅데이터 구축, 연구개발 고도화 전략 등 바이오분야 연구개발 및 산업발전을 위한 세부분야별 추진전략을 수립하였다.
2021년의 생명공학 분야 정부 투자계획은 과기정통부․복지부․농진청 등 8개 부․처․청의 3조 3,361억 원 규모로 전년 실적(2조 8,322억 원) 대비 17.8% 증가하였다.
[표 2-1] 부처별 생명공학 분야 투자계획(안)(2021)
(단위: 백만 원)
|
구분 |
연구개발 |
인프라 |
인력양성 |
합계 |
비중 (%) |
’20년 실적 |
증가율 (%) |
|
과학기술정보통신부 |
1,403,938 |
122,212 |
3,750 |
1,529,900 |
45.9 |
1,349,502 |
13.4 |
|
교육부 |
231,195 |
0 |
81,987 |
313,182 |
9.4 |
234,226 |
33.7 |
|
농림축산식품부 |
157,720 |
26,950 |
4,000 |
188,670 |
5.7 |
181,173 |
4.1 |
|
산업통상자원부 |
259,770 |
18,782 |
5,963 |
284,515 |
8.5 |
234,360 |
21.4 |
|
보건복지부 |
703,646 |
62,396 |
17,225 |
783,267 |
23.5 |
648,537 |
20.8 |
|
환경부 |
82,980 |
0 |
0 |
82,980 |
2.5 |
64,999 |
27.7 |
|
해양수산부 |
100,266 |
6,210 |
250 |
106,726 |
3.2 |
77,639 |
37.5 |
|
식품의약품안전처 |
46,012 |
553 |
265 |
46,830 |
1.4 |
41,774 |
12.1 |
|
합 계 |
2,985,527 |
237,103 |
113,440 |
3,336,070 |
100.0 |
2,832,210 |
17.8 |
자료: 2021년도 생명공학육성시행계획, 2021.2.
부처별로는 과기정통부 예산규모가 가장 크며(45.9%), 복지부(23.5%), 교육부(9.4%) 순이며, 연구개발 기술분야별로는 생명과학(63.0%), 레드바이오(22.9%), 융합신산업(6.4%), 그린바이오(4.9%), 화이트바이오(2.8%) 순이다.
[표 2-2]분야별 투자계획(안)(2021)
(단위: 백만 원)
|
구 분 |
생명과학 |
Red |
Green |
White |
융합신산업 |
합계 |
|
2020실적 |
1,614,752 |
578,823 |
114,483 |
70,372.2 |
170,995 |
2,549,425 |
|
2021계획 |
1,881,965 |
683,034 |
145,254 |
83,070 |
192,204 |
2,985,527 |
|
증감률(%) |
16.5 |
18.0 |
26.9 |
18.0 |
12.4 |
17.1 |
자료: 2021년도 생명공학육성시행계획, 2021.2.
범부처 차원의 신규사업으로 바이오․헬스 주력분야(신약, 의료기기 및 재생의료)의 글로벌 경쟁력 강화를 위해 대형 프로젝트를 기획하여 기초원천→응용→사업화의 전주기 R&D 등을 지원한다.
[표 2-3] 바이오 주력분야 범부처차원 신규사업(2020~2021)
|
사업명 |
주요내용 |
기간/예산 |
관계부처 |
|||||||||||||||||||||
|
’20년 신규 |
바이오 빅데이터 구축 시범사업 |
연구용 바이오․의료 빅데이터 축적․활용을 위한 추진체계 구축 |
’20∼’21/ 총300억원 |
과기부, 복지부, 산업부 |
||||||||||||||||||||
|
범부처 전주기 의료기기개발 |
전주기 의료기기 R&D 지원체계 구축을 통한 시장지향형 의료기기 개발 |
’20∼’25/ 총1.2조원 |
과기부, 복지부, 산업부, 식약처 |
|||||||||||||||||||||
|
’21년 신규 |
국가신약개발 |
우수한 신약 초기 파이프라인의 지속적 공급을 위한 유효물질 및 선도물질 연구개발 지원 |
’21∼’30/ 총2.2조원 |
과기부, 복지부, 산업부 |
||||||||||||||||||||
|
범부처재생의료 기술개발 |
재생의료 핵심 기초․원천기술에서 치료제․치료기술의 임상단계까지 전주기 연구개발 지원 |
’21∼’30/ 총6천억원 |
과기부, 복지부 |
|||||||||||||||||||||
|
바이오위해평가원팀리노베이션 |
바이오 연구산물의 위해성평가 심사 진입을 위한 기술개발 고도화, 용도․분야별 위해성평가기술 및 가이드라인 마련 등 |
’21∼’23/ 총296억원 |
과기부, 산업부, 질병청 |
|||||||||||||||||||||
|
실천과제 |
과기정통부 |
교육부 |
복지부 |
산업부 |
합계 |
비중(%) |
’20년 실적 |
증가율(%) |
|
인간 뇌 이해를 위한 뇌연구 고도화 |
55,917 |
997 |
375 |
0 |
57,289 |
32.0 |
63,821 |
89.8 |
|
생애주기별 맞춤형 건강뇌 실현 |
55,807 |
0 |
14,868 |
1,784 |
72,459 |
40.5 |
77,403 |
93.6 |
|
4차 산업혁명 대응 창의적 연구개발 |
15,062 |
0 |
0 |
870 |
15,933 |
8.9 |
16,030 |
99.4 |
|
혁신적 뇌연구 생태계 구축 |
8,092 |
1,164 |
749 |
0 |
10,005 |
5.6 |
7,055 |
141.8 |
|
뇌산업 육성 |
149 |
0 |
0 |
0 |
149 |
0.1 |
149 |
100 |
|
기관운영 및 인프라 구축 |
22,922 |
0 |
175 |
0 |
23,097 |
12.9 |
17,713 |
130.4 |
|
합 계 |
157,950 |
2,161 |
16,167 |
2,654 |
178,932 |
100 |
182,171 |
98.2 |
자료: 2021년도 뇌연구촉진시행계획, 2021.2.
(4) 바이오 연구개발 고도화 전략 수립(2020.11.)
바이오기술은 타 분야와의 접목, 디지털 기술과의 융합, 바이오의 사회 시스템 적용 등 바이오 융합을 통해 신기술․신산업을 창출하고 있으며, 정부는 차세대 주력산업으로 육성하기 위해 범정부 ‘바이오산업 혁신’을 추진 중이다.
이에 미래 파급력이 큰 핵심 바이오 기술의 경쟁력을 높이고 기술변화 추세에 부합하는 연구지원 체계를 개선하고자 관계부처 합동으로 ‘바이오 연구개발 고도화 전략’을 수립하였다. 중점 추진전략으로 4대 핵심분야2)와 첨단기술3)에 바이오기술을 융합하여 바이오 기술을 고부가가치화 및 고도화하고 방역시스템 고도화, 친환경 토양관리, 약물조기탐지 등 바이오기술을 사회시스템에 접목시켜 건강하고 안전한 사회를 구축하고자 한다. 또한 바이오 공통핵심기술 확보를 위해 중점 지원 대상의 공통핵심 기술을 선정하여 분야별 특성을 감안하여 전략적으로 지원, 미래 핵심기술을 확보한다는 전략이다.
이를 위해 과기정통부는 2021년 바이오․헬스 R&D에 2020년(1조 3,000억 원) 보다 15% 늘어난 1조 5,000억 원을 투자하고, 다부처 공동 협력연구를 확대(2020년 2,500억 원→2021년 5,100억 원) 지원한다.
(5) 생명연구자원 빅데이터 구축전략 수립(2020.7.)
최근 바이오 R&D의 재료(부분품)로만 인식되어 오던 생명연구자원(데이터+소재)이 R&D의 혁신을 견인하는 핵심요소로 부각되고 있다. 바이오경제 활성화를 촉진하기 위해 관계 부처 공동으로 수요자 중심의 생명연구자원 고도화 전략 수립을 추진하였다.
구체적인 추진전략으로 15대4) 연구 분야의 바이오 데이터 표준 등록 양식을 마련하는 등 범부처 데이터 통합 수집․활용을 위한 ‘바이오 데이터 스테이션’을 조성하고, 수요자 맞춤형 연구소재 개발․보급, 소재 분석 데이터 제공 등을 통해 인체 유래물, 모델동물 등 14대 바이오 소재 클러스터를 육성하고자 한다. 또한 최근 신․변종 전염병 조기 대응을 위한 바이오 데이터 및 소재의 중요성이 증대되고 있어 신․변종 감염병 대응에 필요한 데이터, 소재를 신속하게 제공하는 체계도 마련하고자 하였다.
(6) 규제 개선
과기정통부는 바이오 연구활동을 저해하는 규제를 개선하기 위해 ‘바이오 규제 선진화 TF(1기, 2017.10.)’를 시작으로 현재 3기 바이오규제 TF(2020.7.∼2021.6.)를 운영하고 있다. 1∼2기 바이오규제TF를 통해 발굴된 61개 규제개선 과제 중 38개(62%)를 개선하였으며, 제3기 바이오규제TF에서는 기발굴된 제안과제들에 대한 의견 공유 및 논의를 통해 핵심이슈로 구체화하고 ‘바이오 규제현황 및 개선방향(안)’을 마련하여 관련부처에 제안한다.
또한 국가생명공학정책연구센터를 중심으로 유관기관(한국연구재단 등)과의 공동설문조사를 추진하여 미래 발생 가능한 규제개선 과제를 발굴하고 DB를 관리하며, 이를 기반으로 규제개선 여부에 대한 지속적인 모니터링을 하고 있다.
지난 2020년 5월에는 생명공학육성법 개정을 통해 규제개선 활동에 대한 법적 근거를 확보하였으며, ‘규제 합동개선반’ 설치를 법제화하였다.
최근에는 이용빈 의원실에 유전정보 서면동의 완화 및 임상시험 대상자 기준 완화 등 연구현장에서 제기된 핵심 규제이슈안을 제안(2021.2.)하였으며, 국무조정실 ‘바이오․헬스 규제혁신 로드맵’ 수립을 위한 규제이슈를 제안(2021.6.)하는 등의 활동을 통해 바이오 규제혁신을 모색하였다.
다. 주요 사업
과학기술정보통신부는 신약, 의료기기, 재생의료 등 주력분야에 대한 연구개발 강화를 통해 바이오 분야 글로벌 경쟁력을 강화하고, 뇌연구, 감염병 대응 등 국민건강과 직결되는 분야와 미생물, 합성생물학 등 미래유망분야의 핵심기술 확보를 통한 미래시장창출을 위해 선제적으로 지원하고 있다.
(1) 신약개발 지원 분야
과기정통부는 국내 제약 산업의 신성장동력 제공 및 글로벌 신약 개발을 위해 신약 타겟발굴, 기반기술 확보 등 혁신신약 기초원천 기술에 투자하고 있으며, 신약개발 전주기 지원을 위해 범부처 사업으로 국가신약개발사업을 추진하고 있다.
신규 타겟 발굴․검증부터 신약 파이프라인 구축, 기반기술 개발 등 혁신신약(first-in-class) 개발을 위한 핵심 원천기술 개발부터 인공지능 신약개발 플랫폼 구축, 3D생체조직칩 기반 신약개발 지원 등 국내 신약개발 경쟁력을 높이기 위한 융합 신약개발을 지원하고 있으며, 최근 6년간(2015∼2020) 정부 R&D 약 1,073억 원을 투자하여 약 2조 원의 기술수출 성과를 창출하는 등 우수성과를 창출하였다.
2021년부터 ‘범부처 전주기 신약개발사업’(2011∼2020, 다부처)의 후속으로 새롭게 시작하는 ‘국가신약개발사업’은 신약개발 분야의 글로벌 실용화 성과창출 및 보건의료분야 공익적 성과창출을 위하여 과기정통부, 복지부, 산업부 공동으로 10년간 총 2조 1,758억 원을 지원하는 사업이다. 동 사업에서는 제약기업과 학․연․병의 협력을 바탕으로 유효물질 도출부터 임상 2상까지 신약개발 전주기를 통합적으로 지원할 계획이다.
(2) 뇌과학 연구 지원 분야
과기정통부는 국민건강을 증진하고 과학기술이 밝혀내지 못한 미래 유망분야로 원천기술 확보 및 미래시장 선점을 위해 뇌과학 및 뇌질환 분야를 지원하고 있다.
① 뇌과학 핵심 4대 분야(뇌신경생물, 뇌신경계 질환, 뇌인지, 뇌공학) 원천기술 개발을 지원하는 ‘뇌과학원천기술개발사업’(2006∼2020), ② 자연신경망(뇌)을 이해하여 AI 개발의 혁신적인 전환점이 되는 원천기술개발을 지원하는 ‘미래뇌융합기술개발사업’(2019∼2024), ③ 3대 핵심 뇌질환(뇌발달질환, 정신질환, 뇌손상)의 진단 및 치료기술 개발을 지원하는 ‘뇌질환극복연구사업’(2020∼2025), ④ 치매 조기 예측․진단 및 예방․치료기술 개발을 지원하는 ‘치매극복연구개발사업’(2020∼2028, 과기정통부․복지부 공동)을 추진하고 있다.
(3) 감염병 대응 지원 분야
과기정통부는 국가경제 및 국민건강에 위협이 되는 신․변종 감염병의 발생 빈도가 증가하고 감염병 확산으로 인한 사회적 비용이 사회문제로 대두되면서, 감염병 대응 지원을 위한 연구개발 투자를 확대하고 있다.
2020년에 코로나19 상황이 심각해지면서, 2020년 추경예산(196억 5,000만 원)을 시작으로 치료제․백신 개발의 후보물질 발굴부터 전임상 시험까지 연구개발을 지원하고 있으며, 출연(연)이 보유한 과학기술 자원을 총 동원하여 다양한 기업이 임상에 진입할 수 있도록 코로나19 치료제 및 백신 후보물질에 대한 전임상시험(동물실험, 독성평가 등)을 집중 지원 중이다.
2021년에는 코로나19 대응뿐만 아니라, 신․변종 감염병에 신속하게 대응할 수 있는 예측, 진단, 치료, 예방분야에 대한 핵심기술개발을 적극 지원하고 있으며, 바이러스 기초연구 역량 강화를 위하여 ‘한국바이러스기초연구소’를 설립(2021.7.)하였다.
한국바이러스기초연구소는 기초과학연구원(IBS)의 내부조직으로 설치하여 바이러스 분야에 대한 세계적인 기초연구를 수행하고, 대학, 기업, 출연(연) 등과 ‘바이러스 연구협력 협의체’를 구성하여 바이러스 연구의 거점기관 역할을 수행해 나갈 예정이다. 또한 바이러스 연구자원센터를 구축하여 생물안전연구시설 등 핵심연구시설의 공동 활용과 함께 연구자원을 적기에 지원하는 등 바이러스 감염병에 대응할 수 있는 연구기반을 지속적으로 확충해 나갈 계획이다.
(4) 의료기기 개발 지원 분야
의료기기 분야는 전 세계적인 경제성장, 고령화, 건강에 대한 관심 증가에 따라 지속적인 고성장이 전망되는 고부가가치 산업으로 중요성이 증대되고 있다. 이에 과기정통부, 산업부, 복지부, 식약처가 공동으로 2020∼2025년까지 약 1조 2,000억 원을 투자하여 글로벌 제품개발, 미래의료 선도, 의료 복지 구현 및 의료기기 사업화 역량강화 등을 실현하는 범부처 사업인 ‘범부처 전주기 의료기기 연구개발사업’을 추진하고 있다.
2020년 5월 (재)범부처전주기의료기기연구개발사업단을 출범하여 부처별로 분산된 의료기기 R&D 지원을 단일 범부처 R&D 지원체계를 구축하였다. 또한, 기초․응용․개발 연구, 제품화 연구, 인허가 지원 및 사업화로 구분되어 진행된 기존의 의료기기 개발 지원체계를 전주기 지원체계로 전환하고, 개념과 아이디어 단계에서 제품화 시장진출까지 연계되는 성과 이어달리기가 가능하도록 세부 사업간 연계하여 운영하고 있다. 이를 통하여 진료 현장에 최적화되고 즉시 적용 가능한 의료기기를 개발하고 상용화할 수 있을 것으로 기대된다.
(5) 재생의료 연구지원 분야
손상된 인체 세포와 조직을 대체하거나 재생해 정상 기능으로 회복시키는 재생의료의 안전성 확보와 기술혁신․실용화를 지원하기 위해 ‘첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률’이 2019년 8월에 제정(2020.8.28. 시행) 되어 재생의료 분야의 연구개발 여건 및 생태계가 새롭게 조성되었다.
또한, 2021년부터 10년간 총 5,955억 원 규모(국비 5,423억 원, 민자 532억 원)로 재생의료 분야의 핵심 기초․원천기술부터 치료제․치료기술 임상 단계까지 전주기적으로 지원하기 위한 ‘범부처 재생의료 기술개발 사업’이 예비타당성조사(2019.11.∼2020.6.)를 통과하였다. 이에 따라, 2021년에 ① 재생의료 원천기술개발, ② 재생의료 연계기술개발, ③ 재생의료 치료제․치료기술개발 등 3개 분야 51개 신규과제를 선정․지원하고 있다.
(6) 그린․화이트(GW) 바이오 연구 지원 분야
인구 고령화, 식량․환경․에너지 문제 등의 대안을 제시할 수 있는 차세대 바이오 성장동력 분야로서 그린․화이트 바이오 분야 원천기술의 중요성 확대되고 있다.
과기정통부는 생명 현상의 이해 및 생명 활동 기반으로 천연물, 장내미생물, 바이오에너지 등 다양한 분야로 활용 가능한 범용 원천기술 개발을 선제적으로 지원하고 있다
특히 마이크로바이옴 산업은 고부가가치 창출이 전망되는 신성장동력 분야이나 관련부처가 소규모․산발적으로 과제형태로 추진되고 있어, 기초․원천연구부터 산업화에 걸쳐 전주기를 체계적으로 지원하기 위해 과기정통부 주관의 범정부 혁신전략을 마련 중이다.
(7) 차세대바이오 분야 연구개발 지원
과기정통부는 신성장동력 확보를 위해 바이오 분야의 미래파급력을 가진 다양한 도전적․핵심적 기술 분야와 IT․NT 등 타분야와의 융합을 통해 4차 산업혁명을 주도할 수 있는 바이오 융․복합 핵심 원천기술 분야를 지원하고 있다. 특히 유전체 기반기술의 발전으로 유전체의 해독에서 합성으로 패러다임이 전환되면서 합성생물학 기술확보를 위한 경쟁이 치열해짐에 따라 미래 바이오산업 주도권을 선점하기 위해 발전전략을 수립 중이며, 향후 바이오 기술혁신을 촉진하고 다양한 산업부문의 혁신을 가속화할 수 있을 것으로 기대하고 있다
(8) 바이오의료 창업
과기정통부는 바이오 기술이 창업, 성장, 재투자로 선순환될 수 있도록 바이오 생태계 구축을 지원하고 있다. 의료현장의 우수 아이디어의 사업화 지원(현장 중심 MD-Ph.D. 혁신형 의료기술개발사업), 과기부(기초원천)-복지부(임상연구) 협업 기반의 우수 기초연구성과의 임상연구 지원(질병중심 중개연구사업(과기-복지부 공동)), 창업경험 제공 및 해외연구를 통한 창업지원(바이오 유망기술 글로벌 창업 지원사업) 등을 추진하고 있다.
[표 2-5] 과기정통부 바이오 분야 연구개발사업 추진현황
(단위: 백만 원)
|
지원분야 |
세부 사업명 |
’20년 예산 |
’21년 예산 |
비고 |
|
신약 분야 |
바이오의료기술_신약개발 |
59,571 |
55,875 |
|
|
범부처 전주기 신약개발(다부처) |
500 |
- |
|
|
|
국가신약개발사업(다부처) |
- |
15,048 |
’21년 신규 |
|
|
뇌과학 분야 |
뇌과학원천기술개발 |
47,831 |
35,859 |
|
|
미래뇌융합기술개발 |
4,722 |
9,667 |
|
|
|
치매극복연구개발 |
2,950 |
7,868 |
’20년 신규 |
|
|
뇌질환극복연구 |
3,000 |
7,750 |
’20년 신규 |
|
|
감염병 분야 |
미래감염병기술개발 |
44,030 |
31,659 |
|
|
신변종 감염병 대응 플랫폼 핵심기술개발 |
- |
10,200 |
’21년 신규 |
|
|
의료기기 분야 |
인공지능바이오로봇 의료융합사업 |
2,800 |
2,200 |
|
|
범부처전주기 의료기기 연구개발(다부처) |
29,599 |
59,609 |
’20년 신규 |
|
|
차세대의료기술 개발 |
18,269 |
12,388 |
|
|
|
재생의료 분야 |
바이오의료기술_줄기세포/조직재생 |
32,738 |
24,684 |
|
|
범부처재생의료기술개발(다부처) |
- |
6,411 |
’21년 신규 |
|
|
GW바이오 분야 |
전통 천연물 기반 유전자 동의보감 |
9,500 |
9,500 |
|
|
첨단 그린․바이오(GW) |
16,793 |
17,618 |
|
|
|
창업․사업화 지원 분야 |
미래의료혁신 |
29,730 |
36,409 |
|
|
첨복단지 미래의료산업 원스톱 지원사업 |
4,393 |
5,887 |
|
|
|
혁신형 의사과학자 공동연구 |
3,750 |
3,750 |
|
|
|
질병중심중개연구 |
- |
1,830 |
’21년 신규 |
|
|
차세대 바이오 분야 |
차세대바이오 기술개발 |
57,243 |
51,300 |
|
|
바이오융복합 기술개발 |
11,400 |
5,500 |
|
|
|
오믹스기반 정밀의료 기술개발 |
4,167 |
6,000 |
|
|
|
바이오혁신 기반조성 |
47,662 |
8,600 |
|
|
|
연구자원 선진화 분야 |
포스트게놈 다부처유전체사업 |
15,884 |
11,611 |
|
|
바이오의료_마우스표현형 |
11,776 |
- |
|
|
|
바이오 빅데이터 구축 시범사업 |
4,267 |
7,250 |
’20년 신규 |
|
|
다부처 생명연구자원 선진화 |
- |
93,278 |
’21년 개편 |
|
|
합계 |
462,575 |
537,751 |
|
|
라. 향후 계획
과기정통부는 국가생명공학분야의 총괄부처로서 관련 핵심 원천기술을 확보하고 적극적인 R&D 투자와 정책 지원으로 바이오 경제시대를 준비하고 있다.
바이오 중장기 종합계획인 제3차 생명공학육성기본계획(바이오경제 혁신전략 2025, 2017∼2026)과 범부처 전략인 ‘바이오․헬스 산업 혁신전략(2019.5.)’에 맞추어 바이오․헬스 산업을 주력산업으로 육성하고 있다. 이를 위해 의약품, 의료기기, 재생의료 등을 중심으로 범부처 차원의 대형 프로젝트를 기획하여 R&D 전주기를 지원하고 있으며, 이를 위해 정부 R&D 투자를 2025년까지 4조 원 이상으로 확대할 계획이다.
한편, ‘3차 생명공학육성기본계획’(2017∼2026)의 1단계 종료에 대비하여 ‘4차 생명공학육성기본계획(2022∼2031)’ 수립을 추진하고 있다. 2020년 5월 전면개정된 생명공학육성법의 제5조 및 동법 시행령 제2조에 근거하여 3차 기본계획의 수정․보완이 아닌, ‘제4차 생명공학육성기본계획’을 수립하여 국내외 환경변화, 디지털 가속화 등 혁신 패러다임 변화에 발맞춰 향후 10년간 바이오분야 중장기 비전과 목표를 제시할 계획이다.
세부 기술 분야별로는 바이오산업을 새로운 혁신성장 동력으로 육성하기 위해 합성생물학, 마이크로바이옴, 뇌과학, 혁신신약 등 미래유망분야에 대해 중장기 발전전략을 마련하고 예타사업을 기획․추진하고 있다. 또한 다양한 분야에서 활용가능한 공통기반기술개발에 선제적으로 지원하여 핵심 원천기술 확보에 주력할 계획이다.
2. 생명공학산업 육성
가. 개요
(1) 생명공학산업의 정의와 분야
생명공학산업(바이오산업)은 생명공학기술(biotechnology)을 기반으로 생물체의 기능과 정보를 활용하여 제품 및 서비스 등 다양한 고부가가치를 생산하는 산업을 의미한다.
생물체의 기능을 이용하여 제품을 만들거나 유전적 구조를 변형시켜 새로운 특성을 나타내게 하는 생명공학기술은 제약 산업, 농업, 화학 산업 등에 직접 응용될 뿐만 아니라 IT․NT 등의 기술과 융합하면서 산업적 적용 범위가 확대되고 있다. 특히, 최근 유전자진단․분석기술, 생체신호 측정기술 등 다양한 생물체 분석 및 진단기술 발전과 함께 빅데이터 저장․분석기술, 인공지능(AI) 등 이른바 4차 산업혁명 기술의 급격한 발전으로 개인 맞춤형 치료․건강관리, 급성 감염병 질환 진단 등 새로운 제품과 서비스를 제공하는 신산업이 빠르게 등장하고 있다.
생명공학산업은 일반적으로 분야에 따라 의약바이오(의약품 등), 산업바이오(바이오화학제품 등), 그린바이오(유전자변형생물체 등), 융합바이오(디지털 헬스케어 등)로 분류하고 있다.
(2) 생명공학산업의 육성 필요성
생명공학산업은 의약, 환경, 식품, 에너지, 농업, 해양 등 산업 전반에 걸쳐 성장을 주도함과 동시에, 건강․식량․환경 문제 등 인류 난제를 해결함으로써 삶의 질을 향상시킬 수 있는 유망산업으로 주목받고 있다.
그러나 다른 산업과 달리 생명공학산업은 연구개발 중심의 기술집약적 산업으로 생명공학기술에 대한 기초연구에서부터 신제품 출시라는 산업화에 성공하기까지는 소요 기간이 길고 개발비용도 큰 반면, 성공 확률은 낮으므로 정부의 전략적 지원이 필요하게 된다. 이러한 이유로 미국, 유럽, 일본, 중국 등 주요국들은 생명공학산업을 핵심투자분야로 선정하여 산업화를 위한 중장기 계획을 수립하고 집중 지원하고 있다.
나. 추진경과
산업통상자원부는 과거 중기거점기술개발사업, 성장동력기술개발사업, 차세대신기술개발사업, 전략기술개발사업 등으로 분산되어 있던 R&D 사업구조를 2008년부터 통합하였고, 생명공학산업 분야의 R&D도 바이오의료기기 산업핵심기술개발사업으로 일원화하여 운영하였다. 바이오의료기기 산업핵심기술개발사업은 산업통상자원부의 산업기술혁신계획(5개년), 핵심투자대상 및 테마, R&BD전략보고서 등에 기반한 하향식(top-down) 방식과 함께 정기․상시 기술수요조사에 기반 한 상향식(bottom-up) 방식을 동시에 고려하여 추진하는 것이 큰 특징이다.
2016년부터는 바이오 분야와 의료기기 분야의 특성과 전문성을 고려하여 바이오의료기기 산업핵심기술개발사업을 바이오산업핵심기술개발사업과 전자시스템산업핵심기술개발사업으로 분리하여 운영하였다. 2019년 바이오산업핵심기술개발사업은 일몰관리혁신 대상사업으로 지정되었고, 전자시스템산업핵심기술개발사업은 범부처의료기기기술개발사업 추진에 따라서 사업 일몰이 확정되었다. 2020년부터 창의산업미래성장동력사업과 통합하여 바이오산업기술사업으로 운영 중에 있다.
또한, 산업통상자원부는 생명공학산업에 대한 R&D 지원과 함께 생명공학기술의 산업화를 촉진하고 지속적인 산업 성장의 생태계를 구축하기 위해 2016년 유망바이오 사업화 촉진사업을 신설하여 바이오벤처 비즈니스 활성화에 필수요소인 창업 활성화, 투자 유치, 기술사업화, 글로벌 파트너십을 지원하기 시작하였다. 또한, 2020년부터는 바이오의약품 원부자재 및 장비 국산화를 위하여 바이오생산 고도화사업을 지원하고 바이오의약품 소재․부품․장비 수요․공급 기업간의 연대협력을 활성화하는 등 바이오 소부장(소재, 부품, 장비)을 본격적으로 지원하기 시작하였다.
이 밖에도 기존 벤처캐피털(VC)과 정책 펀드가 창업 초기 바이오벤처에 대한 투자가 상대적으로 미미했다는 한계를 극복하고, 우수 생명공학기술이 사업화로 이어지도록 지원하기 위한 초기 바이오기업 전문펀드를 2016년 말 조성하고 2017년부터 본격적인 투자에 착수했다. 그뿐만 아니라, 바이오 기업들의 성장단계별 IR을 개최하여 투자 유치를 지원하고, 예비창업자 등의 대상으로 교육프로그램 및 멘토링프로그램 등을 운영하고 있다.
다. 주요 정책 및 사업
(1) 생명공학산업 분야별 사업화 촉진 R&D 지원
(가) 바이오 핵심기술 개발
산업통상자원부는 세계 최고 수준의 산업화 핵심기술을 개발하고 이를 기반으로 한 글로벌 사업화 제품 출시 등 국내 바이오산업 활성화를 위하여 선택과 집중을 통해 산업바이오, 융합바이오, 의약바이오 등 분야별 사업화 촉진을 위한 기술 개발을 지원하고 있다.
구체적으로 바이오의약품 개발에 필수적인 평가기반기술 개발, 플랫폼기술 개발 등과 생물체 관련 검출․분석 기술과 IT․NT 등이 융합되어 다양한 분야로 확대되는 응용 연구 및 사업화 연구를 지원하고 있다. 또한 식물 등 바이오매스를 원료로 하는 화학제품 또는 바이오 기능성 신소재 생산기술 및 공정개발을 지원한다. 2016년부터는 고기능 생체정보 측정기기, AI 활용 바이오 빅데이터 분석, 개인 맞춤형 진단․치료법 등 4차 산업혁명 시대에 대응하기 위한 산업 핵심기술 개발에 집중해 지원 중이다.
(나) 유망 바이오 IP 사업화 촉진
정부의 지원과 민간의 자발적 투자를 통해 대학, 출연연 및 중소/벤처기업이 개발한 기술 중 유망한 우수 기술임에도 사업화로 이어지지 못하고 잠재된 IP(Intellectual Property)가 다수 존재한다. 산업통상자원부는 이러한 잠재 유망 IP가 사업화 수요 기업에 이전되는 것을 촉진하여 우수한 제품이 개발되는 개방형 혁신(open innovation) 생태계를 구축하기 위해 유망바이오IP사업화촉진사업을 2015년부터 운영하고 있다.
2016년에는 유망한 IP를 보유했음에도 불구하고 재정 여건 등으로 인해 사업화에 어려움을 겪고 있는 창업 초기 벤처기업들의 R&D를 지원하기 위한 전담 프로그램을 신설하여 운영중에 있다. 특히 동 사업은 개방형 과제 유형(품목지정형)의 지원을 통해 연구자의 도전성 및 창의성 제고, 가치사슬(value chain) 극대화를 유도하여 기초응용 연구기관과 바이오 기업의 자유로운 공동연구 문화 기반을 구축하는 것에 기여할 것으로 예상된다.
(다) 바이오화학 산업화 촉진
온실가스 감축과 환경 친화적 제품에 대한 기업의 책임이 커지고 인체에 무해한 친환경 소재에 대한 국민들의 관심이 급격히 커지면서 친환경 바이오화학제품에 대한 중요성이 더욱 커지고 있다. 바이오화학산업은 기존 석유화학 산업을 보완할 수 있어 높은 기술적 수요가 있으나, 바이오소재 개발, 공정 개발 등에 대한 투자 부담으로 인해 민간의 자발적인 투자는 아직 미흡한 상황이다.
이에 산업통상자원부는 바이오화학산업화촉진사업을 추진하여 바이오화학제품의 조기 산업화를 위한 생산기술 개발, 소재개발, 산업융합기술 개발을 지원하고 있다. 동 사업을 통해 수입에 전적으로 의존하고 있는 바이오화학 연료(바이오슈가)의 대량 생산기술 개발을 지원하고, 자동차 내외장재 등에 사용할 수 있는 친환경 바이오 폴리우레탄을 개발하고 있다. 또한 범용 바이오 플라스틱 소재를 중심으로 다양한 원료로부터 다양한 생산물을 만들어 낼 수 있는 데모급 콤비나트 플랜트 구축도 지원한다.
(2) 초기 바이오기업 전담 자금 지원
바이오․헬스산업 분야 벤처캐피털 신규 투자규모는 2015년 3,137억 원에서 2020년 1조 1,970억 원으로 연평균 35.6% 수준 이상으로 급성장하였다. 초기 투자금인 시드 및 시리즈A 기준의 투자금은 2020년에 3,200억 원 수준인데, 대부분 민간 벤처캐피털은 투자 수익 실현이 용이한 상장직전단계기업(후기기업) 또는 기술개발 성과가 알려진 기업(중기기업) 위주로 투자하고 있었음을 보여준다. 바이오 정책펀드도 그간 업력 구분 없이 바이오기업 전체에 대한 투자비율만을 규정하고 있어, 민간 펀드 실적과 유사하게 초기 기업에 대한 투자 실적이 미흡했다.
산업통상자원부는 이러한 초기 바이오기업들의 자금조달 애로를 해소하기 위해 초기 바이오기업 투자 전문 펀드 조성을 추진하였다. 그 결과 2016년 말 산업통상자원부가 100억 원을 출자하고 17개 민간 투자자들이 285억 원을 출자하여 총 385억 원 규모의 초기 바이오기업 육성펀드가 조성되었다. 당초 조성 목적을 달성하기 위해 조성 총액의 45% 이상을 창업 5년 미만 바이오 기업에 투자하도록 의무화하였고, 2017년부터 본격적인 투자에 착수하였다. 그뿐만 아니라, 연 매출 1조 원 이상의 블록버스터급 국산 신약개발 지원을 위해 보건복지부 등과 연계하여 ‘스케일업 펀드’를 활용하여 2조 원 이상의 정책금융을 투자할 예정이다.
(3) 바이오산업의 지속성장 생태계 구축
국내 바이오기업은 대규모 기술이전 등 가시적 성과를 나타내고 있으나 우수한 기술의 사업화를 촉진하고 지속적인 성장의 기반이 되는 산업 생태계 조성이 필요하다. 이에 산업통상자원부는 2016년에 바이오산업 활성화를 위한 사업을 신설하여 기업-VC 투자 연계, 국내외 파트너십 프로그램 운영 등을 통한 기업 네트워크 구축 및 확대, 맞춤형 사업화 지원 등을 실시하고 있다.
또한, 국내외 바이오 산업계의 기술인력 수요 증가로 기업 맞춤형 전문인력 양성 교육프로그램 운영과 바이오공정인력양성센터 설립을 통해 체계적인 교육 시스템을 구축하고 있다.
(4) 산업용 유전자변형생물체 안전관리
산업용 유전자변형생물체(LMO: Living Modified Organism)란 시험․연구용, 농림축산업용, 보건의료용, 환경정화용, 해양․수산용, 식품․의료기기용 LMO를 제외한 섬유․기계․화학․전자․에너지․자원 등의 산업분야에 이용되는 LMO를 말한다. LMO의 용도가 무엇인지 확정하기 어려운 경우, 산업통상자원부는 7개의 LMO 소관 관계부처와 협의를 통하여 해당 LMO의 소관부처를 확정할 수 있다.
산업통상자원부는 산업용 LMO의 안전관리업무를 ‘유전자변형생물체의 국가간 이동 등에 관한 법률’ 제37조의 2 및 통합고시 제1-4조(업무의 위탁)에 따라 한국생명공학연구원내 한국바이오안전성정보센터에 위탁하고 있다.
이에 따라 한국바이오안전성보센터는 산업용 LMO 위해성 심사의 접수 및 심사위원회 운영 등의 업무를 담당하고 있으며, 산업용 LMO의 수입승인신청, 생산승인신청, 이용승인신청 접수 및 산업용 LMO 관련 시설의 신고, 허가 업무를 맡고 있다. 특히 2017년부터는 산업용 LMO의 위해성 심사 신청 전에 사전 상담신청을 민원인으로부터 받아 위해성 심사에 필요한 서류 및 행정절차를 안내하고 있다.
(5) 지역바이오 활성화 기반 구축
산업통상자원부는 생명공학산업의 저변 확대 및 경쟁력 강화 등을 목적으로 1998∼2010년까지 지역특성을 바탕으로 지역바이오산업 지원 클러스터(특화센터)를 구축하였으며, 지역 센터별 차별화, 특성화를 통한 지역경제 활성화를 선도해 오고 있다. 현재 전국에 위치한 총 22개의 바이오특화센터가 기구축된 인프라 시설을 활용하여 기업의 성장을 위한 기술사업화․인력양성․네트워킹․마케팅 지원에 집중하고 있다.
최근 바이오산업이 국가 핵심산업으로 급속히 성장하면서 지역에 특화된 바이오산업 경쟁력 강화를 위한 지역 신규 사업에 대한 수요가 급격히 증가하고 있으며, 이러한 지역의 바이오산업의 지속성장과 진흥을 위해 산업통상자원부와 지역의 바이오특화센터가 유기적이고도 선도적으로 행정적․재정적 지원을 통해 지역바이오 산업 활성화에 기여하고 있다.
지역바이오 기업의 규모를 고려해 볼 때 국내외 바이오산업 시장의 수요에 대응한 자생적 활성화의 어려움이 내재하고 있으므로, 지역의 기술혁신역량 강화와 사업화 촉진을 지원해 온 지역 바이오 기반구축사업을 지속적으로 지원해 나갈 예정이다.
라. 향후 계획
4차 산업혁명 시대를 맞아 생명공학산업도 빠르게 변화하고 있다. 개인의 의료정보, 유전체정보, 라이프로그(생체정보) 등 바이오 빅데이터와 인공지능이 결합해 경험 기반의 범용 제품과 서비스에서 데이터 기반의 개인 맞춤형 제품과 서비스로 진화하고 있다. 이러한 급격한 산업 환경 변화에 대응하여 산업통상자원부는 국내 생명공학산업이 글로벌 경쟁력을 확보할 수 있도록 선제적으로 지원해 나갈 예정이다.
병원 등이 보유한 바이오 빅데이터를 기반으로 새로운 비즈니스가 조기에 창출될 수 있도록 데이터 활용 체계를 구축해 나가고, 빅데이터를 활용한 다양한 유망 서비스를 발굴하였던 사업에 대하여 플랫폼 고도화, 빅데이터 연계 강화, 응용 제품과 디지털헬스 서비스를 확대하여 지원할 예정이다. 또한 빅데이터 및 유전체 정보를 활용한 맞춤 신약개발을 적극 지원하고, 신약개발 역량 강화를 위한 전문 서비스기업 육성하고, 관련 산업적 인프라 구축도 확대할 예정이다.
또한, 코로나19 등 신종 감염병의 대유행, 미국 의약품 공급망 행정명령 등 바이오․헬스 산업의 글로벌 환경변화로 인해 첨단 바이오 의약품의 생산성 향상, 가격 및 품질경쟁력 강화 필요성이 증가하고 있다. 따라서, 바이오 의약품 생산 및 품질관리, 제품화 등에 대하여 글로벌 수준의 제조관리 기술 확보를 위하여 적극적으로 지원할 예정이다. 그뿐만 아니라, 탄소중립 2050 장기전략에 부합하고, 환경 문제를 해결하기 위하여 친환경 생분해성 바이오 플라스틱 제품화 및 바이오 기반 차세대 고부가가치 소재 개발을 지원할 예정이다.
[표 2-6] 지역별 바이오 인프라 시설
|
권역별 |
연번 |
센터명(소재지) |
중점분야 |
특화분야 |
|
충청권 |
1 |
대전TP 바이오센터(대전) |
바이오의약 |
생물의약, 바이오 소재, 분자진단 |
|
2 |
충북TP 바이오센터(충북오창) |
의약, 화장품 |
의약소재, 기능성화장품 |
|
|
3 |
충북TP 한방천연물센터(충북제천) |
한방, 식품 |
한방제품, 한약제제 |
|
|
4 |
충남TP 바이오센터(충남논산) |
동물식의약 |
동물약품, 사료 첨가제 |
|
|
호남권 |
5 |
천연자원연구센터(전남장흥) * 전남생물산업진흥원 |
전통, 소재 |
천연물소재, 기능성 규명 |
|
6 |
식품산업연구센터(전남나주) * 전남생물산업진흥원 |
전통, 식품 |
건강기능성식품 |
|
|
7 |
생물의약연구센터(전남화순) * 전남생물산업진흥원 |
의약 |
백신, 세포․유전자 |
|
|
8 |
나노바이오연구센터(전남장성) * 전남생물산업진흥원 |
융합, 소재 |
천연물 소재, 나노 소재 생물영감기술, 생물모방기술 |
|
|
9 |
전북바이오융합산업진흥원(전북전주) |
전통, 식품 |
건강기능성식품 |
|
|
10 |
발효미생물산업진흥원(전북순창) |
전통, 식품 |
발효, 미생물 |
|
|
동남권 |
11 |
진주바이오산업진흥원(경남진주) |
식품, 화장품 |
바이오식품, 생물화학, 항노화바이오 |
|
12 |
부산TP 해양생물산업센터(부산) |
해양, 식품 |
해양생태독성, 해양기능성식품 |
|
|
13 |
김해산업진흥의생명융합재단(경남김해) |
의료기기 |
비전자의료기기, 융합부품소재 |
|
|
대경권 |
14 |
대구TP 바이오․헬스융합센터(대구) |
식품, 의료기기 |
전통생물소재, 액상식품, 의료기기 |
|
15 |
대구TP 한방산업지원센터(대구) |
한방, 식품 |
한방임상평가, 한방식품제조 |
|
|
16 |
경북바이오산업연구원(경북안동) |
전통, 식품 |
일반식품, 건강기능식품 |
|
|
17 |
경북해양바이오산업연구원(경북울진) |
해양, 식품 |
해양․소재뷰티, 식품, 바이오소재 |
|
|
18 |
포항TP 첨단바이오융합센터(경북포항) |
바이오소재 |
화장품 효능검증 |
|
|
강원권 |
19 |
춘천바이오산업진흥원(강원춘천) |
의약소재,진단 |
체외진단, 생물의약소재, 건강기능식품 |
|
20 |
강릉과학산업진흥원 해양바이오융합사업단(강원강릉) |
해양, 식품 |
기능성식품, 바이오화장품 |
|
|
제주권 |
21 |
제주TP 바이오융합센터(제주) |
산업, 화장품 |
천연소재향장 |
|
경기권 |
22 |
경기도경제과학진흥원 바이오센터(경기수원) |
의약, 의료기기 |
신약개발 지원, 의료기기, 천연물의약품 |
3. 생명공학 기초과학 진흥
가. 개요
최근 유전체학/단백체학 및 바이러스의 작용 기전 등에서 급속한 진전을 보이고 있는 생명공학은 우리의 미래 생활에 큰 변화를 주도하고 있으며, 우리 삶의 질 향상에 크게 기여하고 있다. 유전체 대량 분석, 암 진단/검사법 개발과 진단키트 개발로 인해 감염병 진단을 신속하게 처리함으로써 K바이오 역량을 과시하고 있다.
이러한 생명공학의 성과는 생물학, 생화학, 생리학, 생물물리학 등 관련 기초생명과학의 다양한 실험을 통해서 얻은 성과로서 관련 분야 기초과학의 발전이 있었기에 가능한 것이었다. 최근의 생명공학분야에서 코스닥 상장기업의 성장 등의 사례에서 보듯이 많은 연구자들은 기초과학을 통해 개발한 줄기세포치료제, 차세대 면역치료 신약 등을 통해 기업의 성장잠재력을 보여주고 있다. 이를 통해 볼 때, 미래유망 분야에 대한 핵심원천기술개발 확보 및 선진화 기반 확충을 위해 추진되고 있는 바이오․의료기술개발사업 및 첨단의료기반 기술개발 등과 같은 연구개발사업도 기초과학의 선행이 전제되어야 한다고 말할 수 있다.
나. 추진 경과
정부는 기초연구의 진흥을 위한 여건 조성을 위하여 기초연구에 관하여 ①대학교수, 연구원 등 관계 전문가의 연수 및 연구비 지원, ②석사 및 박사 과정 학생의 연구․장학금 지원, ③연구교수(연구조교 포함)제도, 교수의 연구휴가제도, 객원교수제도 및 객원연구원제도의 활용, ④대학의 연구시설 및 기자재 지원, ⑤대학부설연구소 및 우수연구집단 형성 지원, ⑥대학, 국공립 연구기관, 정부출연연구기관, 기업부설 연구소와의 공동연구, 인력교류, 연구 시설․장비 공동 활용 등 산업계․학계 및 연구소 간의 교류 촉진, ⑦기업 등의 대학 기초연구 지원 촉진, ⑧그 밖에 기초연구환경 조성 및 기초연구기반 구축에 필요한 사항 등을 의무적으로 마련하도록 기초연구진흥 및 기술개발지원에 관한 법률 제7조에 명시하고 있다. 또한 동법에 따라, 기초연구진흥종합계획 및 시행계획을 수립하여 국가의 기초연구진흥을 위한 정책적 노력을 계속해 나가고 있다.
2008년 2월 교육인적자원부와 과학기술부의 통합으로 교육과학기술부가 출범하여 기초연구에 관한 다양한 정책이 일관성 있게 추진할 수 있는 기회가 열렸다. 2013년 미래창조과학부(현재의 과학기술정보통신부)의 출범으로 창조적 기초연구 추진전략이 마련되어 상상력․창의력을 기반으로 한 과학기술과 ICT의 융합을 바탕으로 기초연구진흥을 추진하였다.
다. 주요 정책
문재인정부는 기초과학에 대한 지원이 인류의 신지식을 창출하고, 새로운 연구분야나 신산업을 개척하는 토대가 된다는 인식하에, 연구자 주도 기초연구지원 예산을 2017년 1조 2,600억 원의 2배인 2조 5,200억 원을 2022년까지 달성하는 것을 국정과제로 정하고 적극 지원 중에 있다.
|
1. 투자 연구자 중심으로 기초연구 혁신 |
|
2. 지원 전주기 기초연구 지원 체계 구축 |
|
|
연구자 주도 기초연구 지원 확대 연구자 수요를 반영한 지원 개편 정부R&D 기초단계 연구 지원 강화 기초연구 종합 조정체계 개선 |
젊은 연구자의 조기 연구정착 지원 수월성과 다양성을 고려한 연구 지원 확대 생애기본연구비 지원 대학의 연구 역량 강화 기반 조성 세계적 선도 기초연구기관 육성 |
||
|
|
|
||
|
4. 효과 국민이 체감하는 기초연구 생태계 조성 |
|
3. 제도 자율과 책임에 기반한 연구 몰입 환경 조성 |
|
|
연구정보 공유체계 강화 우수성과 발굴․확산 강화 연구 장비․시설의 활용성 강화 국제 협력 강화 기초연구 사회적 역할 강화 |
연구수행의 유연성 강화 연구과제 평가제도 혁신 연구 행정 개선 성숙한 기초연구 문화 조성 |
||
[그림 2-1] 제4차 기초연구진흥종합계획(2018∼2022) 4대 전략 및 18대 중점 추진과제
이를 반영하여 제4차 기초연구진흥종합계획(2018∼2022)을 수립하였으며, 4대 전략 및 18대 중점 추진과제를 선정하여 지원을 확대하고 있다. 기초연구진흥종합계획에 기반한 지원 확대로 기초연구 과제 수혜율이 향상되고, 창의적 아이디어 기반의 창의적․도전적 연구에 매진할 수 있는 연구자 친화적 연구환경을 조성해 나가고 있다.
특히, ‘연구자 수요를 반영한 기초연구사업 지원 개편’을 추진과제로 제시하며 ‘분야별 지원체계’로의 단계적 전환을 추진 중에 있다. 이를 통해 생명공학 분야의 특성을 반영하여 중장기 포트폴리오 및 과학 로드맵을 수립하며, 연구기간․연구비․과제 수 등을 맞춤형으로 지원할 수 있게 되었다. 향후 생명공학분야 전반을 고려한 예산의 효율적 배분과 우수한 연구성과 달성이 가능할 것으로 기대된다.
라. 주요 사업
과학기술정보통신부와 한국연구재단은 과학기술연구력의 근본이라 할 수 있는 기초연구를 중점 지원하고 있다. 기초연구지원은 개인 및 소규모 공동연구를 지원하는 ‘개인연구’, 우수 연구 인력을 조직화하여 지원하는 ‘집단연구’, 전문연구정보 및 연구 인프라를 지원하는 ‘기반구축’으로 구분하여 연구자 역량단계 및 참여연구원 규모에 따른 세부 프로그램을 통해 추진되고 있다.
생명공학분야 기초연구는 한국연구재단 기초연구본부의 생명과학단, 의약학단, ICT․융합연구단에서 지원하고 있으며, 대단위 국책연구사업의 경우 한국연구재단 국책연구본부 생명공학팀에서 지원하고 있다. 이 중에서도 생명공학 분야는 기초연구본부 생명과학단과 관련성이 높으며, ① 분자생물학, 신경생물학, 발생생물학, 유전자발현, 면역학 등의 분자생명 분야, ② 세포생물학, 유전학, 생화학, 생리학, 식물학, 미생물학 등의 기초생명 분야, ③ 생물공학, 식량작물 및 원예작물, 동물자원학, 수의학, 식품학 등의 기반생명 분야를 지원하고 있다.
이를 통해 생명과학의 메커니즘 연구를 집중 수행하는 생명 과학자를 양성하고, 노벨상 수상 수준으로 연구역량을 제고하며, 관련 연구기반을 확충하여 미래 첨단 기초생명과학 연구를 선점하고자 한다.
(1) 기초연구지원 사업 현황
[표 2-7] 과학기술정보통신부 기초연구지원 사업내용(2020∼2021)
(단위: 백만 원)
|
사업 |
2020년 예산(A) |
2021년 예산(B) |
증감액(B-A) |
증감률 |
|
|
합계 |
1,511,230 |
1,802,941 |
291,711 |
19.3% |
|
|
【개인연구】 |
1,220,838 |
1,476,968 |
256,130 |
21.0% |
|
|
우수 |
ㅇ리더연구 |
63,756 |
69,250 |
5,494 |
8.6% |
|
ㅇ중견연구 |
751,888 |
893,902 |
142,014 |
18.9% |
|
|
ㅇ신진연구(최초혁신실험실 포함) |
214,565 |
248,497 |
33,932 |
15.8% |
|
|
생애 |
ㅇ재도약연구 |
12,605 |
5,000 |
△7,605 |
△60.3% |
|
ㅇ기본연구 |
141,530 |
226,931 |
85,401 |
60.3% |
|
|
ㅇ생애첫연구 |
36,494 |
33,388 |
△3,106 |
△8.5% |
|
|
【집단연구】 |
278,910 |
313,730 |
34,820 |
12.5% |
|
|
ㅇ선도연구센터 |
171,010 |
179,530 |
8,520 |
5.0% |
|
|
-이학분야(SRC) |
44,850 |
49,730 |
4,880 |
10.9% |
|
|
-공학분야(ERC) |
56,410 |
61,400 |
4,990 |
8.8% |
|
|
-기초의과학분야(MRC) |
46,250 |
45,400 |
△850 |
△1.8% |
|
|
-융합분야(CRC) |
13,000 |
8,000 |
△5,000 |
△38.5% |
|
|
-지역특화분야(RLRC) |
10,500 |
15,000 |
4,500 |
42.9% |
|
|
ㅇ기초연구실 |
107,900 |
134,200 |
26,300 |
24.4% |
|
|
【기반구축】 |
11,482 |
12,243 |
761 |
6.6% |
|
|
ㅇ전문연구정보활용 |
2,100 |
2,600 |
500 |
23.8% |
|
|
ㅇ기초연구실험데이터글로벌허브구축 |
2,777 |
3,188 |
411 |
14.8% |
|
|
ㅇ유럽핵입자물리연구소(CERN)협력 |
5,241 |
5,664 |
423 |
8.1% |
|
|
ㅇ해외대형연구시설활용연구지원 |
1,364 |
791 |
△573 |
△42.0% |
|
과학기술정보통신부는 신진연구→중견연구→리더연구 등 역량단계별로 개인연구를 지원하고 있다. 2016년부터 연구자 맞춤형 지원제도를 도입하여 연구자가 필요한 연구비, 연구기간을 신청할 수 있도록 유연하게 개선하였다. 아울러, 2019년부터는 생애기본연구를 신설하여 많은 연구자가 안정적으로 연구를 수행할 수 있는 환경을 조성하였다. 집단연구는 기초연구실→선도연구센터 등 규모별로 지원하고 있으며, 기초연구기반구축 사업을 통해 연구자가 국내․외 주요연구 정보에 접근 및 활용하도록 지원하고 있다.
(2) 생명공학 분야 사업 지원 현황
2019년 정부에서 이공 분야에 지원하는 총 R&D 투자액 중 생명공학 분야 범주에 속하는 생명과학, 농림수산, 보건의료 부문에 지원되는 총투자 금액은 3조 8,784억 원으로 정부 R&D 투자액의 20.1%를 차지하고 있다.
[표 2-8] 과학기술표준분류별 투자 추이(2019)
(단위: 억 원, %)
|
구분 |
금액 |
비중 |
|
수학 |
915 |
0.5 |
|
물리학 |
5,719 |
3.0 |
|
화학 |
3,542 |
1.8 |
|
지구과학 |
5,346 |
2.8 |
|
생명과학 |
8,252 |
4.3 |
|
농림수산식품 |
1조 2,814 |
6.7 |
|
보건의료 |
1조 7,718 |
9.2 |
|
기계 |
3조 3,637 |
17.5 |
|
재료 |
6,918 |
3.6 |
|
화공 |
4,207 |
2.2 |
|
전기 / 전자 |
1조 8,431 |
9.6 |
|
정보 / 통신 |
2조 373 |
10.6 |
|
에너지 / 자원 |
9,391 |
4.9 |
|
원자력 |
5,494 |
2.9 |
|
환경 |
5,100 |
2.6 |
|
건설 / 교통 |
7,699 |
4.0 |
|
과학기술과 인문사회 |
1조 2,158 |
6.3 |
|
기타 |
1조 4,882 |
7.7 |
|
합계 |
19조 2,596 |
100 |
자료: 2019년도 국가연구개발사업 조사
2020년 신진연구를 통해 신청 및 선정된 생명과학 분야별 과제 현황은 다음 표와 같다. 신진연구는 이공학 분야 교원 및 연구원 중 박사학위 취득 7년 이내 또는 만 39세 이하의 신진연구자를 대상으로 최장 5년간 연평균 1억 5,000만 원 이내를 지원하는 사업이다. 초기 연구실 구축 등이 필요한 신진연구자 특성을 감안하여 별도 심사를 통해 1년간 5,000만 원∼1억 원을 연구환경 구축비로 추가 지원한다.
[표 2-9] 신진연구 중 생명과학분야 중분야별 선정 현황(2020)
(단위: 건)
|
구분 |
신진연구 |
||
|
신청 과제 수 |
선정 과제 수 |
||
|
분자생명 |
분자생물학 |
16 |
4 |
|
신경생물학 |
16 |
4 |
|
|
발생생물학 |
13 |
4 |
|
|
유전자발현 |
20 |
7 |
|
|
감염생물학 |
8 |
2 |
|
|
노화암생물학 |
29 |
8 |
|
|
면역학 |
29 |
9 |
|
|
기타(구조생물 및 생물물리학) |
14 |
4 |
|
|
소계 |
145 |
42 |
|
|
기초생명 |
세포생물학 |
17 |
5 |
|
유전학 |
20 |
6 |
|
|
생화학 |
9 |
3 |
|
|
생리학 |
18 |
5 |
|
|
미생물학 |
28 |
9 |
|
|
식물학 |
11 |
3 |
|
|
기타(분류/생태/환경생물학) |
20 |
5 |
|
|
소계 |
123 |
36 |
|
|
기반생명 |
식량작물 및 원예작물 |
16 |
5 |
|
응용생물화학 |
25 |
7 |
|
|
농림생태환경 |
11 |
3 |
|
|
동물자원학 |
12 |
4 |
|
|
수의학 |
23 |
7 |
|
|
수산학 |
10 |
3 |
|
|
식품학 |
45 |
3 |
|
|
영양학 |
18 |
5 |
|
|
기타(생물공학) |
28 |
8 |
|
|
소계 |
188 |
55 |
|
|
총합계 |
456 |
133 |
|
중견연구는 이공학 분야 교원(전임․비전임) 및 공공․민간연구소 연구원을 대상으로 최장 5년간 연평균 4억 원 이내를 지원하는 사업으로 2020년 신청 및 선정된 생명과학 분야별 과제 현황은 다음 표와 같다.
[표 2-10] 중견연구 중 생명과학분야 중분야별 선정 현황(2020)
(단위: 건)
|
구분 |
중견연구 |
||
|
신청 과제 수 |
선정 과제 수 |
||
|
분자생명 |
분자생물학 |
54 |
14 |
|
신경생물학 |
55 |
17 |
|
|
발생생물학 |
43 |
11 |
|
|
유전자발현 |
45 |
16 |
|
|
감염생물학 |
18 |
7 |
|
|
노화암생물학 |
95 |
20 |
|
|
면역학 |
43 |
11 |
|
|
기타(구조생물 및 생물물리학) |
35 |
12 |
|
|
소계 |
388 |
108 |
|
|
기초생명 |
세포생물학 |
26 |
10 |
|
유전학 |
43 |
11 |
|
|
생화학 |
35 |
10 |
|
|
생리학 |
45 |
12 |
|
|
미생물학 |
50 |
11 |
|
|
식물학 |
44 |
14 |
|
|
기타(분류/생태/환경생물학) |
44 |
9 |
|
|
소계 |
287 |
77 |
|
|
기반생명 |
식량작물 및 원예작물 |
59 |
14 |
|
응용생물화학 |
69 |
18 |
|
|
농림생태환경 |
26 |
8 |
|
|
동물자원학 |
54 |
14 |
|
|
수의학 |
70 |
25 |
|
|
수산학 |
38 |
12 |
|
|
식품학 |
98 |
27 |
|
|
영양학 |
29 |
12 |
|
|
기타(생물공학) |
53 |
16 |
|
|
소계 |
496 |
146 |
|
|
총합계 |
1,171 |
331 |
|
마. 향후 계획
과학기술정보통신부는 연구자 수요를 반영한 기초연구사업 개편의 일환으로 기초연구사업 분야별 지원체계 전환을 추진하고 있다. 2020년 수학 분야의 시범적용을 시작으로, 2021년에는 기초/분자생명 분야도 적용을 시작하였다. 2022년에는 기반생명 분야까지 확대해 전 분야가 각 분야의 특성을 반영해 기초연구사업을 운영할 방침이다.
2021년 기초/분자생명 분야의 학문 분야별 지원체계 시행을 위해 한국분자세포생물학회, 생화학분자생물학회 등 총 13개의 각 분야별 학회 중심으로 정책연구, 설문조사, 춘/추계학술대회를 활용한 공청회를 통해 연구자들의 의견을 수렴해 중장기 포트폴리오와 과학로드맵을 마련하였고, 2022년 기반생명 분야까지 확대하기 위해 포트폴리오 초안 마련 후 연구자 공청회를 진행할 계획이다.
특히 분자생명 분야의 경우 타분야에 비해 평균 연구비가 높은 특성을 반영하여 중규모과제인 중견연구 유형2의 신규과제수를 확대하였고, 이 외에도 연구계 중심으로 도출한 과학로드맵 등을 활용하여 전략적 지원이 필요한 분야 발굴, 생명 분야 특화 프로그램 지원 검토 등 생명 분야만의 특성을 반영한 기초연구를 지원할 예정이다. 이와 함께 매년 학회, 연구자 만족도 조사 등을 통해 지속적으로 수정․보완할 계획이다.
4. 생명공학 인력양성
가. 개요
정부는 ‘기초연구진흥 및 기술개발지원에 관한 법률’에 따라, 5년 주기로 기초연구 진흥에 관한 중장기 정책목표와 방향 설정을 위한 ‘기초연구진흥종합계획’을 수립하여 시행하고 있으며, 2022년까지 연구자 주도 기초연구 예산 2조 5,000억 원을 목표로 매년 투자를 확대해가고 있다.
정부의 기초연구 확대 기조 속에 교육부는 생명공학 분야의 경쟁력 확보를 위해서는 장기적 관점에서 연구의 지속가능성이 중요하다고 판단하고, 기초연구 분야에 대한 저변 확대와 우수 연구인력의 양성에 보다 정책 역량을 집중하고자 하였다.
특히 이러한 장기적 관점의 연구역량 제고에서는 무엇보다 생명공학 분야의 선진국과 같이 대학이 연구와 인력 양성에 핵심적인 역할을 담당할 필요가 있기 때문에 대학의 연구역량을 강화하기 위해 노력하고 있다.
나. 추진 경과
교육부는 대학의 연구역량 강화를 위해 1982년부터 박사후연구자의 연구경험을 축적하고자 학문후속세대를 지원하고 있으며, 국가 연구역량 제고를 위한 연구저변 확대를 위해 1989년부터 풀뿌리 기초연구를 지원해오고 있다.
1999년부터는 미래 인재 양성을 위한 대학원의 교육․연구역량 강화 기반 조성을 위한 BK21사업을 시작으로 2020년부터는 4단계 두뇌한국21사업을 통해 대학연구소의 특성화․전문화 유도 및 전임 연구인력 확충을 위해 대학중점연구소를 지원해오고 있다.
아울러 2008년부터는 의과학자 육성지원 사업을 시작하여 미래 성장 동력인 바이오산업 분야 경쟁력 확보를 위한 중개연구를 활성화하고, 이를 수행할 의과학자를 적극 양성해오고 있다.
다. 주요 정책
교육부는 인력양성 총괄 부처로서 초․중등에서 대학에 걸쳐 전주기적 인재양성을 지원하고 있다. 특히 최근에는 생명공학 등 과학기술 분야에 대한 중요성이 높아짐에 따라 초․중등교육에서 융합인재교육(STEAM; Science, Technology, Engineering, Arts and Mathematics)을 통해 실생활 문제를 창의적으로 해결하는 방법으로 과학에 대한 흥미도를 제고하고 있고, 이는 과학기술 선도 인재 양성의 초석이 되고 있으며, 이와 함께 고등교육 단계에서도 고급인력을 양성하기 위한 노력을 기울이고 있다.
교육부는 다양한 생명공학 분야에 대한 개인 및 대학 연구소 단위의 균형 잡힌 기초연구를 지원하여 연구저변을 지속적으로 넓혀 나감과 동시에 석․박사 연구 인력에 대한 연수기회 부여, 연구경험 제공 및 장학금 지원을 통해 미래 한국을 책임질 학문후속세대를 육성해 나가고 있다.
라. 주요 사업
(1) 기초연구지원사업
교육부는 2020년 이공학개인기초연구 지원사업에 1,675억 원, 이공학학술연구기반구축사업에 3,347억 원으로 총 5,022억 원을 투자하여 이공학 분야의 기초연구가 보다 활성화될 수 있도록 노력하였다.
[표 2-11] 교육부 기초연구지원사업(2019~2020)
(단위: 백만 원, %)
|
사업명 |
2019년 예산 (A) |
2020년 예산 (B) |
증감 |
||
|
차액(B-A) |
증감률(%) |
||||
|
이공학개인기초연구 |
292,231 |
167,562 |
△124,669 |
△42.7 |
|
|
기본연구 |
292,231 |
167,562 |
△124,669 |
△42.7 |
|
|
이공학학술연구기반구축 |
217,669 |
334,718 |
117,049 |
53.8 |
|
|
|
학문후속세대지원 |
36,919 |
45,845 |
8,926 |
24.2 |
|
대학연구기반구축 |
66,226 |
95,893 |
29,667 |
44.8 |
|
|
학문균형발전지원 |
114,524 |
192,980 |
78,456 |
68.5 |
|
|
합계 |
509,900 |
502,280 |
△7,620 |
△1.5 |
|
※ ‘19년부터 기본연구는 과기정통부로 이관되어 계속과제만 지원.
(가) 이공학개인기초연구지원
교육부는 이공학개인기초연구지원을 통해 이공학분야 개인연구자에게 5,000만 원 내외의 연구비를 폭넓게 지원하여 생명공학 분야 연구자가 창의적이고 혁신적인 연구에 전념할 수 있는 환경을 제공하고 있다.
[표 2-12] 이공학개인기초연구사업 생명공학분야 지원 현황(2019~2020)
(단위: 개, 백만 원)
|
분야 |
2019년 |
2020년 |
||
|
지원과제 수 |
사업비 |
지원과제 수 |
사업비 |
|
|
분자세포생물학 |
280 |
12,261 |
212 |
6,842 |
|
유전학․유전공학 |
183 |
7,865 |
124 |
4,496 |
|
발생․신경생물학 |
61 |
2,328 |
38 |
1,158 |
|
면역학․생리학 |
37 |
1,839 |
29 |
975 |
|
분류․생태․환경생물학 |
38 |
1,533 |
27 |
1,117 |
|
생화학․구조생물학 |
29 |
1,293 |
25 |
826 |
|
융합바이오 |
9 |
342 |
6 |
150 |
|
생물공학 |
54 |
2,421 |
38 |
1,354 |
|
산업바이오 |
32 |
1,553 |
22 |
740 |
|
바이오공정․기기 |
6 |
229 |
3 |
113 |
|
생물유해성 |
2 |
92 |
2 |
100 |
|
기타생명과학 |
53 |
2,357 |
37 |
1,282 |
|
계 |
784 |
34,113 |
563 |
19,153 |
(나) 이공학학술연구기반구축
교육부는 이공학학술연구기반구축사업을 통해 생명공학분야를 포함한 이공학 분야의 연구기반 확충을 지원하고 있다. 학문후속세대지원을 통해 박사과정생, 박사후연구원 등 신진 연구자의 연구 역량 강화를 도모하고 학술연구의 지속성을 유지하며, 대학연구기반구축을 통해 대학부설연구소를 특성화․거점화하여 연구인력양성 및 연구장비의 집적화 등을 기반으로 공동연구 활성화를 지원하고 있다. 학문균형발전 지원은 비전임교원, 보호분야, 지역대학 등 상대적으로 연구비 지원이 부족한 연구자․분야를 지원하여 연구저변 확대를 목적으로 지원하고 있다.
[표 2-13] 이공학학술연구기반구축사업 생명공학분야 지원 현황(2019~2020)
(단위: 개, 백만 원)
|
분야 |
2019년 |
2020년 |
||
|
지원과제 수 |
사업비 |
지원과제 수 |
사업비 |
|
|
분자세포생물학 |
258 |
11,233 |
331 |
16,616 |
|
유전학․유전공학 |
131 |
5,777 |
163 |
8,618 |
|
발생․신경생물학 |
55 |
2,179 |
70 |
3,488 |
|
면역학․생리학 |
43 |
1,918 |
41 |
2,698 |
|
분류․생태․환경생물학 |
54 |
3,639 |
72 |
5,669 |
|
생화학․구조생물학 |
15 |
546 |
26 |
1,028 |
|
융합바이오 |
0 |
0 |
5 |
233 |
|
생물공학 |
56 |
2,715 |
68 |
3,766 |
|
산업바이오 |
19 |
1,809 |
23 |
2,320 |
|
바이오공정․기기 |
2 |
147 |
3 |
205 |
|
기타생명과학 |
38 |
2,146 |
52 |
3,118 |
|
계 |
671 |
32,109 |
854 |
47,759 |
(다) 주요성과
2019년도 교육부 학술연구지원사업 성과분석보고서에 따르면, 2019년 생명공학 분야에서 발표한 SCI 논문은 4,772건, 상위 10% 논문은 505건이고, 특허 출원은 790건, 등록은 255건이었다.
[표 2-14] 생명공학 분야 SCI 논문 발표 현황(2018~2019)
(단위:개)
|
분야 |
2018년 |
2019년 |
||
|
전체 |
상위10% |
전체 |
상위10% |
|
|
이공학개인기초연구 |
3,256 |
306 |
3,281 |
327 |
|
이공학학술연구기반구축 |
884 |
134 |
1,491 |
178 |
※ ‘19년 사업개편으로 보호연구, 지역대학우수과학자사업이 이공학개인기초연구에서 이공학학술연구기반구축사업으로 이관.
출처 : 각 연도별 주요 연구개발사업 성과분석보고서 기초 자료.
[표 2-15] 생명공학 분야 특허 출․등록 현황(2018~2019)
(단위:개)
|
분야 |
2018년 |
2019년 |
||
|
출원 |
등록 |
출원 |
등록 |
|
|
이공학개인기초연구 |
549 |
187 |
484 |
181 |
|
이공학학술기반구축사업 |
226 |
70 |
306 |
74 |
※ ‘19년 사업개편으로 보호연구, 지역대학우수과학자사업이 이공학개인기초연구에서 이공학학술연구기반구축사업으로 이관.
출처 : 각 연도별 주요 연구개발사업 성과분석보고서 기초 자료.
(2) 고급인력 양성사업
2020년 9월부터 추진하고 있는 4단계 BK21 사업에서는 농생명 및 생명공학 분야 교육연구단(팀)에 약 718억 원을 투자하여, 약 6,700여명의 대학원생에게 연구장학금, 국제화경비 등을 지원하였다. 4단계 BK21 사업에서는 2020년 신규 선정평가의 연구업적 평가 시 질적 평가 비중 확대 및 지표 다변화를 통해 연구경쟁력 강화를 유도하였다. 또한, 혁신인재양성사업 유형을 신설하여 생명공학 신산업 분야(맞춤형헬스케어/바이오헬스/혁신신약 등) 석․박사급 연구인력 양성 기반을 마련하였으며, 이를 통해 사회적 기여를 증진하고 산학협력을 활성화할 수 있을 것으로 기대하고 있다.
[표 2-16] BK21 사업 지원 현황(2~4단계, 2006~2027)
(단위:개, 백만 원)
|
분야 |
2단계 BK21(’06~’13) |
BK21 플러스(’13~’20) |
4단계 BK21(’20~’27) |
|||
|
지원과제 수 |
사업비 |
지원과제 수 |
사업비 |
지원과제 수 |
사업비 |
|
|
농생명 분야 |
30 |
3,232 |
33 |
16,046 |
16 |
7,122 |
|
생물학 분야 |
15 |
12,317 |
23 |
13,800 |
18 |
13,255 |
|
약학 등 분야 |
22 |
2,862 |
15 |
9,631 |
30 |
17,515 |
|
응용생명 분야 |
17 |
14,972 |
15 |
3,602 |
20 |
10,051 |
|
의학/치의/한의학 분야 |
18 |
2,645 |
23 |
15,987 |
34 |
23,839 |
|
계 |
102 |
36,028 |
109 |
59,066 |
118 |
71,781 |
※ 2단계 BK21사업은 2012년, BK21플러스는 2019년, 4단계 BK21은 2021년 지원액 기준.
[표 2-17] 4단계 BK21 사업 과학기술 분야 선정평가의 ‘연구업적 질적 평가’ 비중 확대 내용
|
구분 |
BK21 플러스 선정평가 (2013) |
4단계 BK21 선정평가 (2020) |
||
|
비율(점수) |
세부내용 |
비율(점수) |
세부내용 |
|
|
질에 대한평가 |
33.3%(10점) |
(정성)논문의 우수성 |
80%(40점) |
(정성) 대표연구업적 우수성 35점 (정량) FWCI 5점 |
|
양에 대한평가 |
66.6%(20점) |
(정량)논문 편수10점 (정량)IF, ES 10점 |
20%(10점) |
(정량)논문 편수, IF, ES |
|
합계 |
100%(30점) |
- |
100%(50점) |
- |
의약학 및 생명과학 분야에 특화한 의과학자 육성지원 사업도 추진 중이다. 의과학자 과정(의사면허증(M.D/DDS)과 박사학위(Ph.D)를 동시에 또는 연계하여 취득하는 과정)을 이수하는 153명의 우수 전문대학원생에 등록금 전액과 연간 5백만 원의 교육연구비를 최대 7년간 장기 지원하여 전문 임상경험과 기초의학 연구력을 겸비한 신진 의과학자로 양성하고 있다.
마. 향후 계획
교육부는 기초연구 진흥과 인력양성을 담당하는 부처로서 생명공학 분야의 연구와 인력양성을 위한 지원을 확충하기 위해 노력하고 있다. 기초연구와 인력양성간 긴밀한 연계를 통해 시너지를 창출하기 위한 노력을 강구해야 하며, 특히 이러한 시너지가 가장 효과적으로 나타날 수 있는 현장이 대학이므로 대학에 대한 지원을 확대할 필요가 있다.
아울러 교육부는 생명공학 분야 중에서 장래에 성장가능성이 있으나 현재 투자가 미흡한 분야나 다른 분야의 성장을 위해서는 반드시 필요한 기반 분야 등 민간에서 투자가 소홀할 수 있는 부분을 적극적으로 발굴하고 정책적인 배려를 해 나갈 예정이다.
5. 농림축산식품 분야 생명공학 육성
가. 개요
농림축산식품 분야의 생명공학, 즉 그린바이오 기술은 농업의 부가가치와 생산성을 높이고 안전한 친환경 먹거리 생산에 기여하여 지속가능한 농업기반 마련에 핵심적인 역할을 하고 있다. 육종기술, 분자생물학, ICT 융복합 기술 및 빅데이터 분석 등 다양한 기술이 농업 분야와 결합하여 새로운 기회를 창출하고 있으며 이러한 과학기술에 기반한 스마트 농업은 기존 농업의 한계를 극복하고 신성장 분야로 주목받고 있다.
농림축산식품부는 생명공학의 근간이 되는 농업생명자원의 체계적인 보존․관리 및 활용 기반 마련, 농생명 빅데이터 확충, 고부가가치 농생명 소재 개발 및 융복합 혁신 기술에 대한 R&D 지원과 관련 산업 인프라 구축 등 종합적인 정책 추진을 통해 농업생명공학 기술 및 산업 경쟁력을 강화할 계획이다.
나. 추진 경과
농림축산식품 분야의 과학기술 육성정책은 농촌진흥청의 1991년 ‘제1차 농업과학기술 중장기 연구개발 계획’을 시작으로 2009년 ‘농림식품과학기술 육성법’ 제정에 따라 ‘농림식품 과학기술 육성 종합계획’수립과 함께 현 체계가 마련되었다. 현재 제3차 종합계획(2020∼2024)에 따라 매년 시행계획을 수립하여 연구개발 지원을 추진하고 있으며 미래 농업 수요를 반영한 효율적 농업 과학기술 육성정책을 수립․추진하고 있다.
다. 주요 정책
농식품부와 농진청․산림청에서는 2020년 9월 관계부처 합동으로 그린바이오 융합형 신산업 육성방안을 발표하여 기술개발, 빅데이터, 인프라, 사업화 지원, 산업생태계 구축 등 5대 전략, 마이크로바이옴, 대체식품․메디푸드, 종자, 동물용 의약품, 기타 생명소재를 5대 핵심산업으로 선정하여 집중 육성하고 핵심 유망기술 선정․로드맵을 마련하였다. 정책 역시 이를 반영하여 유망기술분야에 선택과 집중을 추진하고 그린바이오 육성방안을 바탕으로 R&D․기업지원․제도 등 종합적 정책을 지원하고자 한다.
첫째, R&D부문 중 육종과 유전자 분야에서는 유전자 가위 기술, 표현체, 대사체 등 멀티오믹스 정보 분석기술, 디지털 육종기술, 미생물․동식물 유전체 정보분석 기술 등을 개발 및 지원하고 있으며, 동물용 의약품 분야에서는 구제역, 조류인플루엔자, 아프리카돼지열병 등 동물감염병에 대한 대응을 위한 예방, 검역, 진단, 방역 등을 위한 전주기적 기술개발 및 동물용의약품, 진단키트 등을 개발하고 있고, 식품과 소재 분야는 고령자용 영양식품․가공품, 기능성 간편․대체식품, 천연소재 활용 감미료, 생명자원을 이용한 기능성 소재 등의 산업화를 지원하고 있다.
둘째, 인프라 부문에서는 식물백신기업 지원시설, 융복합 전문인력 양성을 위해 수의방역대학원 설립지원, 기능성식품 전문인력 양성하는 계약학과, 데이터 분야에서는 농업생명공학정보센터(NABIC: National Agricultural Biotechnology Information Center)를 통한 빅데이터 관리 강화 및 슈퍼컴퓨팅 센터와 같은 전산자원 확충, 농축산용 미생물 산업 육성지원센터, 유용미생물은행 구축과 같은 마이크로바이옴 산업 인프라 구축, 산림 신품종 재배단지, 스마트산림바이오혁신 거점 등에 지원하고 있다.
셋째, 기업지원과 산업생태계 구축을 위해 그린바이오 우수기업, 제품 등에 대한 인증제 도입 등을 검토하고, 그린바이오 전용 펀드 운영, 산업화 기술 개발 등을 지원할 계획이며, 산업생태계를 구축하기 위해 그린바이오 벤처캠퍼스 조성 및 창업보육 사업 지원, 신산업 분야 제도 개선 과제 발굴 등의 지원 정책을 수립 및 계획하고 있다.
라. 주요 사업
농식품부, 농진청, 산림청은 생명산업기술개발, 골든시드프로젝트 등 생명공학 기술 분야에 2020년 기준 21개 사업에 총 1,548억 9,300만 원을 투자하고 있으며 생명공학 기본계획에 따라 R&D혁신, 바이오경제 창출, 생태계 기반 구축의 3대 전략에 따라 추진하고 있다.
특히 2021년 시행계획부터는 농림 분야 생명공학 육성정책의 종합적 검토 및 부․청간 협력 강화를 위해 농림식품과학기술위원회의 검토를 거쳐 계획을 수립하고 있으며, 향후 체계적 부․청 통합 생명공학 정책 수립․추진을 위해 2020년 12월 ‘농림 분야 생명공학육성계획 중장기 방향(2021∼2025)’을 수립하였다.
|
전략 분야 |
주요 내용 |
|
R&D 혁신 |
육종, 소재 개발, 유전체, 유전공학, 동식물 질병 R&D 등 추진 |
|
바이오경제 |
종자기업 수출 협의회, 해외 육종기지 및 시험․전시포 운영 등 |
|
생태계기반 |
농업생명공학 정보센터(NABIC) 시스템 고도화 및 유전체 빅데이터 구축 |
농림축산식품부․농진청․산림청의 주요 생명공학 육성사업은 다음과 같으며, 농식품부는 농정 이슈, 기술․산업 동향, 기존 사업 일몰 등에 대응하여 지속적으로 새로운 R&D 사업을 발굴해나갈 계획이다.
(1) 유용 농생명 자원산업화 기술개발
2020년부터 2022년까지 농생명 자원의 고부가가치 제품 개발과 원료 표준화, 안정적 공급까지 패키지화한 단기 산업화기술 개발을 위한 R&D사업을 추진하고 있다. 그 일환으로 2020년에는 친환경 복합재재 기술개발(농산물 부산물을 활용한 양돈용 액상비료, 곤충자원을 활용한 고부가가치 제품개발) 등의 연구성과가 있었다. 2021년에는 농생명 섬유자원을 이용한 고부가가치 천연섬유제품 개발, 친환경 복합재재 개발 등에 대한 개발과 지원을 할 예정이다.
(2) 맞춤형 혁신식품 및 천연 안심소재 기술개발
2019년부터 2021년까지 첨단 식품가공 및 바이오기술을 활용한 미래 혁신식품 및 천연첨가물을 개발하는 사업으로 대표적인 연구성과로 국내 녹황색 채소와 메리골드 꽃을 활용한 루테인 함유 소재와 토종 발효 미생물을 활용한 천연 조미․향미 소재를 개발하였다. 2021년에는 대체식품, 메디푸드 등 맞춤형 혁신식품과 천연 안심소재 개발에 지원할 계획이다.
(3) 골든시드 프로젝트
농생명 산업의 근간이 되는 종자(seed)에 대한 주권을 확보하고 나아가 종자산업을 수출전략산업으로 육성하기 위해 예비타당성 조사를 거친 골든시드 프로젝트는 2012년부터 부․청 공동사업으로 착수하여 2021년에 완료될 예정이다. 완료 후에는 후속사업인 디지털육종전환지원기술개발사업을 진행할 예정이다.
골든시드 프로젝트의 목표는 수출과 수입대체를 위한 20개의 전략 품목(고추, 배추, 무, 수박, 넙치, 전복, 바리과, 벼, 감자, 옥수수, 양배추, 양파, 토마토, 버섯, 백합, 감귤, 파프리카, 김, 종돈, 종계)을 설정하여 지원하는 것이다. 그 성과로서는 2020년 수출전략형 품종과 수입대체형 품종을 개발하여 수출과 수입대체를 성공적으로 달성하였고 2021년에는 비대면상담회 지원, 수출지원협의회 개최, 해외육종기지 등을 통한 수출 및 해외마케팅을 지원할 계획이다.
[표 2-18] 골든시드 프로젝트 성과
|
<7가지 색깔 대추형 토마토> |
다양한 색과 과형의 토마토 품종 개발 |
|
농림축산식품부의 골든시드 프로젝트사업의 지원을 받아 다양한 색과 과형의 토마토 품종을 개발하여 ‘전미주 품종상’을 수상(2020.2.)하였으며 선진시장 진출 및 기존에 일본품종이 주도하고 있던 국내 토마토 시장의 수입대체 및 다변화를 기대할 수 있게 되었다. |
|
|
<인도수출용 단옥수수> |
동남아 수출용 옥수수 품종 개발 |
|
농촌진흥청 골든시드 프로젝트사업(식량종자사업단)의 지원을 받아 수출용 단옥수수를 개발하여 다국적 기업 신젠타가 90% 이상을 점유하고 있던 인도시장에 진출하여 수출실적이 전무했던 인도 단옥수수 종자시장 진출 후 현재까지 12% 이상 시장점유율을 늘리고 있고, 향후 남미․중앙아시아 등으로의 시장진출 확대를 기대할 수 있게 되었다. |
(4) 디지털전환 육종
2021년부터 종자업체가 최신의 디지털 육종 기술을 적용할 수 있도록 생명연구기관과 종자기업간 육종 초기부터 분석결과에 대한 디지털 육종 컨설팅, 종자산업진흥센터 내 빅데이터 활용 분석 플랫폼, 첨단육종을 위한 유전자분석, 기능성성분 분석 지원 등 기업별 맞춤형 분석서비스 등 비용 및 기술․서비스를 지원하는 사업이다.
(5) 가축질병 대응 기술개발
2012년부터 2021년까지 구제역, 조류인플루엔자, 아프리카돼지열병 등 가축질병에 대응하기 위하여 신속진단, 동물의약품 개발 등의 기술개발 및 동물용의약품을 개발 지원하는 사업이다. 2019년에는 세계 최초로 광견병백신과 바이러스를 검진 가능한 진단시스템을 개발하였고, 2020년에는 인수공통전염병인 살모넬라증을 예방하는 백신을 개발하였다. 2021년에도 검역 및 방역을 위한 기술개발, 예방교육 훈련 등에 지원할 계획이다.
(6) 식물백신기업 지원시설 건립사업
유전자 재조합 기반의 동물용 식물 백신5)의 연구지원 및 바이오벤처 육성을 위해 완전밀폐형 식물 재배시설, 백신 생산시설, 독성․효능 평가시설을 포함한 식물백신기업 지원시설(2018∼2021)을 건립하는 사업이다.
(7) 농축산용미생물 효능평가 지원 등 미생물산업 기반조성
농림축산식품부에서는 농축산용미생물산업의 진흥을 위하여 관련 산업계에 효능평가․배양․시제품․산업화 지원, 교육, 컨설팅을 제공하는 농축산용미생물 효능평가 지원사업과 이를 지원하기 위한 복합미생물 분석장비 구축사업을 진행하여 안전성 평가를 위한 장비를 추가 구축하였다. 그리고 전북 순창군에 유용미생물은행(2019∼2023)을 구축하여 농토 등에서 미생물 군집 등을 수집, 보존, 배양 등을 하여 DB를 구축․분석하여 관련 연구와 산업을 지원할 계획이다.
(8) 차세대 바이오그린21 사업
차세대 바이오그린21 사업은 2011년부터 2020년까지 고부가가치 신품종 및 글로벌 소재 개발을 통한 식량안보 등 국가전략 대응기술의 확보와 생물자원 유전체 활용 및 합성생물체 개발 등을 통한 농업생명공학 원천기술의 확보로 농업기술의 한계를 극복하고자 추진되었다.
사업분야(동물분자, 식물분자, 농생물게놈, 시스템합성, 식의약소재, 농생명공학)별로 유전체 육종체계 구축 및 육종기술 개발, 유전체 정보 활용 시스템 구축, 기후변화 대응, 농업형질 및 기능성 소재 확보, 글로벌 종자 개발로 국제경쟁력 확보, 고부가가치 농작물 개발 등 다양한 성과를 산출하였다.
이들 성과의 연계 및 확산을 위해 2021년부터 바이오그린 연계 농생명혁신기술 개발사업이 추진되어 기술의 실용화 촉진을 꾀하고 있다.

[그림 2-2] 차세대 바이오그린21 사업 및 2021년 바이오그린 연계 사업 체계도
(9) 차세대 농작물 신육종기술 개발사업
2020년부터 2026년까지 진행되는 R&D사업으로 작물용 유전자교정기술 활용 돌연변이 집단 구축 및 차세대 신육종 원천기술 확보를 통해 가치증진 육종 소재 및 글로벌 진출 품종 육성을 목표로 하고 있다.
현재 기능성 물질을 함유한 벼, 브로콜리, 토마토 등을 대상으로 유전자교정기술을 개발하고 있으며 2021년에는 유전자교정기술기반 형질전환기술 집적화, 목표 형질별 파이프라인 구축 및 실용화 가치 소재 발굴을 위한 형질전환기술 서비스 제공 등을 통해 기술기반을 강화할 계획이다.
[표 2-19] 차세대 바이오그린21 사업 성과
|
|
오믹스 통합분석 기술로 개발한 고기능성 콩 기술이전 |
|
차세대 바이오그린21 사업의 성과로 유전체/대사체/기능에 분석 신기술로 우수자원 품종을 선발하여 기술이전을 하였으며 알코올성 지방간 예방, 피부염증 억제, 피부개화 개선능 등의 효과가 있어 기능성식품, 화장품 등의 개발 등이 기대된다. |
|
|
|
아프리카 소 유전체 정보분석을 통한 기후변화 대응 한우 육종기술 개발 |
|
아프리카의 다양한 기후 및 환경에 서식하는 아프리카 소의 유전체 정보분석을 통해 열저항성 등의 유용 유전자원을 발굴하여 기후변화에 대응하는 한우육종개량 활용기반을 구축하였다. ※「Nature Genetics」誌 게재(2020.10.) |
|
|
<식물 바이옴 시스템 개발> |
딸기꽃-수분곤충 간 정보 기반 유용미생물 전파 시스템 개발 |
|
꽃 미생물과 수분곤충의 상호공생적 바이옴 연구를 통해 곰팡이병 발병률 감소 시스템을 개발하고 잿빛곰팡이병 75% 경감, 꽃곰팡이병 50% 경감의 효과를 확인하였다. 식물체 내부에서의 바이옴 미생물의 공간이동 분석 결과로 특허출원(1) 및 등록(1), 기술이전(570만 원) 성과를 달성하였으며, 향후 농업생태계내 복합바이옴 미생물 역할 구명에 따른 친환경 농작물 사업에 기여할 것으로 기대한다. |


[그림 2-3] 차세대 농작물 신육종기술 개발사업 체계
(10) 산림생명자원 이용 임업소득 증대 연구
산림자원의 지속가능한 조성․이용 및 선순환적 가치 확산을 위해 1949년부터 시작된 산림 분야 대표 연구개발 사업이다. 건강하고 안전한 산림생태계의 유지․증진, 산림생명자원의 보존․육성 및 이용 활성화를 위한 기술개발과 산림산업을 육성하기 위한 기반기술, 산림복지 증진을 위한 연구개발을 지원하고 있다.
특히, 산림생명자원을 산업소재로 활용할 수 있는 원천기술을 개발하여 산림분야 신성장동력을 창출하고, 소득자원으로 이용할 수 있는 신품종 육성 및 재배 기술의 개발과 확산으로 소득증대에 기여할 수 있도록 하는 연구를 지속적으로 추진해 나갈 것이다.
[표 2-20] 농림축산식품분야 생명공학사업 투자계획(2021)
(단위: 백만 원)
|
기관명 |
사업명 |
사업기간(년) |
2020 실적 |
2021 예산 |
|
농림축산식품부 |
가축질병대응기술개발 |
2012∼2021 |
15,419 |
17,497 |
|
고부가가치식품기술개발 |
2010∼2025 |
6,708 |
20,100 |
|
|
유용농생명자원산업화기술개발 |
2020∼2022 |
3,500 |
8,663 |
|
|
맞춤형혁신식품 및 천연안심소재 기술개발 |
2019∼2021 |
10,509 |
10,263 |
|
|
작물바이러스 및 병해충대응산업화기술개발 |
2020∼2024 |
4,500 |
11,779 |
|
|
포스트게놈 신산업육성을 위한 다부처유전체 |
2014∼2021 |
6,446 |
6,813 |
|
|
디지털육종전환지원 |
2021∼계속 |
0 |
2,000 |
|
|
농축산용미생물효능평가지원 |
2017∼계속 |
435 |
435 |
|
|
유용미생물은행 |
2019∼2023 |
4,850 |
4,825 |
|
|
복합미생물분석장비구축 |
2020 |
1,000 |
0 |
|
|
식물백신기업지원시설건립 |
2018∼2021 |
2,760 |
690 |
|
|
동물용의약품효능안전성평가센터구축 |
2020∼2023 |
500 |
6,000 |
|
|
농식품기술융합창의인재양성(특수대학원) |
2020∼2023 |
2,000 |
4,000 |
|
|
Golden Seed 프로젝트(농식품부 소관) |
2012∼2021 |
7,814 |
7,814 |
|
|
소계 |
|
66,441 |
100,879 |
|
|
농진청 |
포스트게놈다부처유전체사업 |
2014∼2021 |
6,944 |
6,862 |
|
차세대바이오그린21사업 |
2011∼2020 |
53,787 |
0 |
|
|
차세대농작물신육종기술개발사업 |
2020∼2026 |
9,001 |
9,010 |
|
|
바이오그린연계 농생명혁신기술개발사업 |
2021∼2022 |
0 |
21,374 |
|
|
소계 |
|
69,732 |
37,246 |
|
|
산림청 |
산림생명자원 이용 임업소득 증대 연구 |
1949∼계속 |
10,117 |
9,666 |
|
야생화 사업기반 구축 |
2008∼2021 |
1,453 |
1,299 |
|
|
스마트 산림바이오 혁신성장거점 조성 |
2019∼2024 |
7,150 |
13,000 |
|
|
소계 |
|
18,720 |
23,965 |
|
|
|
합계 |
154,893 |
162,090 |
|
마. 향후 계획
향후 농식품부는 제3차 농림식품과학기술육성종합계획과 그린바이오 신산업육성방안에 의거하여 농업 분야의 중장기 R&D 비전 제시 및 유망기술분야 특히 고부가치 농생명소재, 첨단육종기술, 마이크로바이옴 등에 전략적 투자 확대를 추진할 계획이다.
이러한 첨단 기술육성을 통해 기존 농업분야에 다양한 생명공학 기반기술을 결합한 융복합 신기술을 중점 육성하고 그에 따른 인프라, 제도 등을 정비하여 미래 선도기술과 현장 문제 해결을 위한 기술개발을 동시에 추진할 계획이다.
6. 보건의료 생명공학 육성
가. 개요
(1) 필요성
바이오․헬스 시장 규모가 급속히 성장함에 따라 선도적 위치를 확보하기 위해 국가 차원의 전폭적인 지원이 지속되고 있다. 정부는 바이오․헬스 분야를 적극적으로 육성․지원하고, 2025년까지 연간 R&D 투자를 4조 원으로 확대하겠다는 비전(바이오․헬스산업 혁신전략, 2019.5.)을 발표하였다. 이어 바이오․헬스를 핵심 신산업 분야(BIG3)로 선정하고 중점 육성하겠다는 투자 방향(혁신성장 2020 전략투자방향, 2019.8.)을 발표하였다. 또한 ‘첨단재생바이오법’(2020.8.), ‘데이터 3법’(2020.8.)등 첨단의료, 보건의료 빅데이터 관련 법령 정비로 바이오․헬스 산업 발전의 제도적 기반을 마련하였다.
이뿐만 아니라 코로나19의 장기화로 인해 포스트 코로나 시대가 도래하였으며, 전 세계를 강타한 초유의 감염병 위기 상황에서 국가와 정부의 체계적인 대응 여부는 국민의 안전과 직결되고 있는 상황에서 우리나라는 유행의 심각성과 방역 강도에 따른 사회적 거리두기, 철저한 역학조사에 따른 선제적 진단 검사 등으로 대응하고 있다. 따라서 우리 정부는 포스트 코로나 시대를 대비하여 혁신성장을 선도할 수 있는 보건의료 연구개발 시스템을 구축하고, 보건의료 산업을 육성하고자 노력 중이다. 또한 국가 간 연구자원 및 인프라 개방․공유를 통한 기술혁신 가속화, 건강한 삶 구현, 사회문제 해결, 데이터 기반 연구개발 등의 전략을 제시하고 국가적으로 대응하기 위한 중장기 계획을 수립․추진 중이다.
(2) 보건복지부 연구개발 사업 추진체계
보건복지부에서는 매년 보건의료 연구개발 통합시행계획을 수립하여 보건의료기술정책심의위원회 심의를 받아 시행하고 있으며, 이후 3개 전문기관(한국보건산업진흥원, 국립보건연구원, 국립암센터)이 연구개발 사업을 관리․수행하고 있다.

[그림 2-4] 보건복지부 연구개발 사업 추진체계
나. 추진경과
‘보건의료기술 진흥법’에 근거한 정부 법정계획인 제1차 보건의료기술 육성 기본계획(2013∼2017)이 종료됨에 따라 제1차 계획의 성과와 정책여건 분석 및 국민의 목소리를 종합적으로 고려하여 제2차 보건의료기술 육성 기본계획(2018∼2022)을 수립하였다.
제1차 기본계획(2013∼2017) 연구개발에서는 산업별 세계시장 확대 중점을 두었다면 2차 기본계획(2018∼2022)은 보건의료문제 해결을 위한 공공성 강화에 중점을 두었다. 고령화, 감염병 등 고비용 보건의료문제에 국가적으로 대응하여 더 건강한 삶과 의료의 지속가능성 확보를 위한 대안을 창출하고자 민․관 합동 중장기전략기획단을 구성(2017.3.∼12.)하여 기본계획을 수립하였다. 이어서 관계 부처 협의․작성(2017.11.), ‘보건의료기술정책심의위원회’ 보고(2017.5., 2017.12.)를 거쳐 ‘국가과학기술자문회의’ 심의로 확정(2018.4.)하였다. 이를 이행하기 위해 연도별 시행계획을 수립하고 있다.
이 외에 바이오․헬스 선도국가로 나아가기 위한 관계부처 합동 ‘바이오․헬스산업 혁신 전략’을 발표하였다. 제약․바이오를 중심으로 바이오․헬스 산업의 기술개발부터 인허가, 생산, 시장출시 단계까지 전주기 혁신 생태계를 조성한다는 전략 아래, 제약․의료기기 업계 간담회(2018∼2019.5, 총15회), 규제개선 TF(2018.5.∼7.), 바이오․헬스 발전전략 TF(2019.1.) 등을 통해 현장 의견을 수렴하였다.
2019년 5월 22일 문재인 대통령은 바이오․헬스산업 발전으로 사람 중심 혁신성장을 실현하는 ‘바이오․헬스 국가 비전 선포식’을 직접 주재하고, 전략을 발표하였다. 바이오․헬스가 경제성장과 일자리 창출은 물론, 혁신적인 치료제 개발 등 국민 생명과 건강을 보장하기 위한 핵심산업으로 보고, 이를 차세대 선도 산업으로 육성해 나갈 계획이다.
다. 주요 정책
(1) 제2차 보건의료기술 육성 기본계획(2018∼2022)
보건복지부 제2차 보건의료기술 육성 기본계획은 ‘보건의료기술진흥법’ 제4조에 근거한 정부 법정계획으로 8개 중앙행정기관(7부, 1처)6)이 참여하여 보건의료기술 진흥에 관한 중장기 목표, 기본방향 및 중점과제 등을 수립한다. 개방․융합을 통한 혁신적 연구개발 시스템으로 4차 산업혁명을 뒷받침하고, 좋은 일자리․새로운 성장 동력 창출을 위한 신산업 육성 추진 전략 및 중점 과제에 해당하는 관계 부처 연구개발 및 정책 사업을 대상으로 한다.
2차 기본계획(2018∼2022)은 보건의료문제 해결을 위한 공공성 강화에 중점을 두고 있다. 국민의 목소리를 반영하고 해결 요구 문제에 전략적으로 투자하여 연구 성과 실용화에 촉진을 두며, 연구개발 사업 중심의 관리보다 보건의료정책․기술․인프라․규제의 종합적 접근을 통해 연구개발과 정책간 연계성을 높였다. 다음 3대 전략을 중심으로 9대 중점과제를 추진하고 있다.
[표 2-21] 보건의료기술 육성 기본계획(2018∼2022) 비전 및 목표
|
비전 : 보건의료기술 혁신으로 국민 모두가 건강한 내일 |
|||
|
목표 |
현재 |
|
미래 |
|
1. 건강수명 연장 |
73.2세(’15) |
⇨ |
76세(’22) |
|
2. 보건산업 수출 증대 |
117억 달러(’17) |
⇨ |
210억 달러(’22) |
|
3. 신규 일자리 창출 |
17만 명(’16) |
⇨ |
27만 명(’22) |
|
3대 전략 및 9대 중점과제 |
|
|
3대 전략 |
9대 중점과제 |
|
1. 공익적 가치 중심의 R&D 투자 강화 |
1. 고비용 보건의료문제 해결, 전략적 R&D 투자 |
|
2. 질환․계층․남북 주민 간 건강 형평성 강화 |
|
|
3. 예방․관리 중심의 미래의료 기반 확충 |
|
|
2. 개방․연결․융합을 통한 R&D 혁신 |
4. 보건의료 연구자원의 개방․공유 강화 |
|
5. 연구․정책협력 네트워크 강화 |
|
|
6. 혁신 뒷받침 R&D 지원시스템 |
|
|
3. 좋은 일자리 창출을 위한 미래신산업 육성 |
7. 혁신성장을 선도하는 미래형 신산업 육성 |
|
8. R&D 성과의 가치 성장 촉진 |
|
|
9. 신산업 육성을 지원하는 글로벌 수준의 규제 합리화 |
|
보건복지부는 제2차 보건의료기술 육성 기본계획과의 정책 연계성 강화를 위해 2020년도 시행계획을 수립하였다. 2020년 보건의료 R&D 예산은 전년 대비(1조 2,687억 원) 20.2% 증가한 총 1조 5,514억 원 규모이다. 부처별 투자규모는 과기정통부(5,514억 원, 35.5%), 복지부(5,278억 원, 34%), 산업부(1,954억 원, 12.6%), 농식품부(1,062억 원, 6.8%) 순이다.
공익적 가치 중심의 연구개발 투자 강화를 위해 6,920억 원을(2020년도 기준)지원 중이며, 국민의 건강과 직결되는 사회문제를 해결하고 예방․관리 중심의 개인 맞춤의료 기반 구축을 위해, AI․빅데이터 등 미래 유망기술과 보건의료의 융합연구를 강화할 것이다.
연구자와 산업계의 연구 효율성 제고를 위해 D.N.A 중심 4차 산업혁명 기반 기술의 플랫폼을 고도화하고, R&D 기획․관리 프로세스의 혁신을 지속 추진에 3,468억 원(2020년도 기준)을 지원하고 있다.
마지막으로 좋은 일자리 창출을 위한 미래 신산업 육성의 일환으로 5,125억 원(2020년도 기준)을 지원 중이다. 신약․의료기기 연구개발을 범부처 사업으로 개편하고, 글로벌 수준의 규제 합리화로 제약․바이오․의료기기 산업을 미래 신산업으로 육성하고자 한다.
[표 2-22] 보건의료 R&D 사업 예산(2020)
(단위: 백만 원)
|
사업명 |
2020년도 예산 |
|
|
공익적 가치 중심의 R&D 투자 강화 |
치매극복 연구개발 사업 등 |
692,023 |
|
개방․연결․융합을 통한 R&D 혁신 |
바이오빅데이터 구축 시범사업 등 |
346,894 |
|
좋은 일자리 창출을 위한 미래신산업 육성 |
범부처 전주기 의료기기 연구개발사업 등 |
512,539 |
|
총계 |
1,551,456 |
|
자료: 보건의료기술육성기본계획 2020년도 시행계획 자료 재구성.
(2) 바이오․헬스 산업 혁신전략
보건복지부와 관계부처는 바이오․헬스 산업 발전을 위해 ‘사람중심 혁신성장’의 비전을 수립하고, 수출 확대의 경제 활력 제고 및 일자리 창출, 혁신적 신약․의료기기, 치료기술 개발을 통한 희귀난치질환 극복과 국민의 생명․건강 보장을 목표로 바이오․헬스 산업 혁신전략을 발표하였다. 정부는 비메모리 반도체, 미래형 자동차와 함께 바이오․헬스를 차세대 3대 주력산업 분야로 육성하여, 세계시장 선도기업 창출 및 산업생태계를 조성할 방침이다.
주요 내용으로 5대 의료 빅데이터 플랫폼 구축, 신기술․신약에 대한 인허가 규제 완화, 바이오․헬스 육성지원을 포함하였다. 따라서 바이오․헬스 산업을 우리나라 차세대 주력산업으로 육성하고자 지난 5월에 발표한 ‘바이오․헬스 산업 혁신전략’을 반영하여, 바이오․헬스 산업 발전으로 사람 중심 혁신성장 실현 및 공익적 R&D 투자 강화로 국민 보건의료 문제 해결’을 목표로 통합시행계획을 수립하였다. ‘바이오․헬스산업 육성을 위한 혁신적인 유망기술의 전략적 투자 요구’와 ‘지속가능한 보건복지를 위한 공익적 연구 필요성에 대한 공감 확대’ 등 보건의료 R&D 정책 여건에 따라, 4대 추진전략과, 7대 중점 추진방향을 토대로 2020년 주요 R&D를 추진해 나갈 계획이다.
바이오․헬스 산업의 육성을 위하여 혁신 신약․의료기기․재생의료 등 차세대 유망기술을 중점 지원하고(총 1,281억 원 중 신규과제 592억 원), 100만 명 규모 ‘국가 바이오 빅데이터’ 구축, 인공지능, 정밀의료 등 4차 산업혁명 기반 의료기술을 적극 지원한다(총 588억 원 중 신규과제 51억 원). 신․변종 감염병, 치매, 정신질환 등 사회문제 해결을 위한 진단․치료기술 개발 및 지역사회 적용․확산을 수행하는 한편(총 1,041억 원 중 신규과제 230억 원), 의료취약계층의 재활․돌봄 서비스 및 만성질환, 생애주기별 건강관리를 위한 서비스 모델 개발 등 의료비 절감과 예방 중심 건강관리를 위한 국민 건강증진 R&D를 수행한다(총 1,022억 원 중 신규과제 214억 원). 산․학․연․병이 활용할 수 있는 병원 중심의 공동연구 기반(플랫폼) 구축 등 병원을 연구 생태계 혁신거점으로 집중 육성하고(총 674억 원 중 신규과제 100억 원), 해외 우수 연구기관과 연계 및 임상의사와 연구자․기업 간 협업 연구 지원 등 혁신성장을 견인할 보건의료 핵심 인재를 양성한다(총 192억 원 중 신규과제 17억 원). 해외 의존성이 높은 백신의 자체개발, 수입 의존 화장품 기초소재와 노인․장애인 보조기기 등 국산화 지원을 강화한다(총 448억 원 중 신규과제 291억 원).
이를 통해 정부는 질병 극복을 통해 국민의 건강을 증진시키고, 바이오․헬스 산업 육성으로 세계 시장을 선도할 수 있도록 바이오․헬스 분야 R&D 투자를 꾸준히 확대해 나갈 방침이다.
[표 2-23] 바이오․헬스 산업 혁신전략 비전 및 목표
|
비전 : 바이오․헬스 산업 발전으로 사람중심 혁신성장 실현 |
|||||
|
목표 |
현재 |
|
미래 |
||
|
1. 혁신신약․의료기기 세계시장 점유율 3배 확대 |
제약․의료기기 등 세계시장 점유율(%) |
||||
|
1.8(’18) |
⇨ |
3(’22) |
⇨ |
6(’30) |
|
|
2. 바이오․헬스 산업을 5대 수출 주력산업으로 육성 |
제약․의료기기 등 수출액(억 달러) |
||||
|
144(’18) |
⇨ |
200(’22) |
⇨ |
500(’30) |
|
|
3. 신규 일자리 30만 명 창출 |
바이오․헬스 일자리(만 명) |
||||
|
87(’18) |
⇨ |
97(’22) |
⇨ |
117(’30) |
|
[표 2-24] 복지부 R&D 예산(2020)
(단위: 백만 원)
|
사업명 |
2020년도 예산 |
|
|
한국보건산업진흥원 |
환자중심 의료기술 최적화연구 등 33개 사업 |
410,038 |
|
질병관리본부(국립보건원) |
감염병 관리기술 개발연구 등 7개 사업 |
78,955 |
|
국립암센터 |
암 연구소 및 국가 암관리 사업본부 주요사업 |
33,433 |
|
국립재활원 |
재활연구개발용역사업 |
5,395 |
|
총계 |
527,821 |
|
라. 주요 사업
미래 의료 시장을 선점하기 위한 글로벌 경쟁이 심화되고, 혁신 신약․의료기기 개발이 가속화되고 있으며 4차 산업혁명 기반기술과 보건의료기술과의 연계에도 관심이 높아지고 있다. 한편으로는 고비용 의료비 부담이 사회문제로 대두되고, 이에 따라 취약 계층의 건강 불균형이 심화됨에 따라 공익적 R&D 투자가 요구된다. 이에 미래 바이오․헬스 산업을 이끌 인재들을 양성하고, 산․학․연․병이 협력할 수 있는 플랫폼을 구축하여 우수한 연구개발 성과물이 창출될 수 있는 기반을 조성하고, 글로벌 불확실성에 대응하기 위해 그간 수입에 의존해 오던 원료․기기의 자립도 필요하다.
이러한 정책적 요구들을 반영하여, 2020년도 보건복지부 R&D는 ‘바이오․헬스 산업 발전으로 사람 중심 혁신 성장 실현, 공익적 R&D 투자 강화로 국민의 보건의료 문제 해결’을 목표로 4대 전략, 7대 중점투자방향을 설정하였다.
2020년 새로 시작되는 사업들 중 의료기기와 감염병 분야의 예산이 크게 증가하였다. 2019년 범부처 전주기 의료기기연구개발사업이 예비타당성조사를 통과함에 따라, 2020년부터 6년간 총 1조 1,971억 원이 지원될 예정이다.
해당 사업은 복지부를 비롯한 과기부, 산업부, 식약처 4개 부처가 참여하는 대형 사업으로, 범부처 차원의 R&D 지원을 통해 임상․인허가․제품화 전주기 지원으로 ① 글로벌 제품 개발, ② 미래의료 선도, ③ 의료 복지 구현을 목표로 한다. 또한 감염병 예방․치료기술개발사업도 동 기간 예비타당성조사를 통과하여, 2020년부터 10년간 총 6,240억 원이 지원된다. 해당 사업은 신․변종 감염병, 원인 불명의 감염병 등의 조기진단, 현장진단 등 진단기술 고도화와 미해결 치료제 기술개발을 목표로 한다.
첫째, 혁신 신약․의료기기, 재생의료 등 차세대 유망기술 중점 지원에 1,281억 원을 지원하였다. 범부처 전주기 의료기기 연구개발사업을 포함하여, 민간 벤처투자와 공동으로 우수 기술을 선별 투자하고 인프라를 연계하여 지원하는 투자․인프라 연계형 R&D 지원, 재생의료 기초 연구성과의 임상적용을 위한 중개연구, 실용화 지원 등이 포함된다.
둘째, 빅데이터, 인공지능 등 4차 산업혁명 기반 의료기술개발에 588억 원을 투자하였다. 100만 명 규모의 ‘국가 바이오 빅데이터’를 구축하여 유전체 및 임상정보를 치료기술, 신약개발 등에 활용할 수 있는 기반을 구축하고, 공공기관 의료 빅데이터를 공공적 목적 연구에 활용할 수 있도록 지원하였다.
셋째, 사회문제 해결을 위한 R&D를 확대하였다. 국민들이 최우선 사회문제로 인식하는 감염병, 치매, 정신건강 분야에도 1,041억 원을 투자하였다. 감염병 예방․치료기술개발사업을 비롯하여 치매 예방․진단․치료기술 개발까지 전주기적 치매 연구에 투자가 지속될 예정이다. 또한 중독과 자살 등 국민적 관심이 높은 주요 정신건강 분야 연구에도 지원을 확대하였다. 한편 미세먼지 등 질병을 유발하는 요인에도 투자를 확대하였다.
넷째, 의료비 절감과 예방 중심의 건강관리를 위해 국민 건강 증진에 1,022억 원을 투자하였다. 의료비 절감을 위한 환자중심 의료기술 최적화 연구와 희귀질환, 저출산 등 공익적 의료기술 연구에 투자를 확대하였다. 또한 노인․장애인 등 의료 취약계층에 대한 재활․돌봄 서비스, 생애주기별 건강관리 연구에도 투자를 지속하였다.
다섯째, 병원을 연구 생태계 혁신 거점으로 집중 육성하기 위한 사업에 674억 원을 투자하였다. 선진국은 병원을 의료기술의 성장 기반으로 활용하고, 이를 통해 유망기술을 적극 사업화 하는 데 집중하고 있다. 우리나라도 산․학․연․병이 의료기술․제품 개발에 활용할 수 있는 병원 중심의 공동연구 플랫폼을 구축하고, 연구성과의 상용화 촉진을 위해 질환 유효성 평가 및 의료기기 중개․임상시험을 지원하였다.
여섯째, 바이오․헬스 우수 인력을 양성하기 위한 투자로, 총 192억 원을 지원하였다.
일곱째, 백신․화장품 소재․보조기기 등의 국산화 지원에 448억 원을 지원하였다. 특히 국가 백신 주권을 확보하고, 수급 안정화를 위해 해외 의존성이 높은 백신의 자체개발 투자를 강화하였다. 또한 수입 의존도가 높은 화장품 기초소재의 국산화 및 노인․장애인의 일상생활에 꼭 필요한 보조기기의 국산화 지원도 새로 시작하였다.
(1) 보건의료기술 연구개발 사업
(가) 개요
보건복지부는 21세기 지식기반경제의 핵심산업으로 등장하는 보건의료분야를 국민건강 증진과 국가경제 발전에 이바지하는 고부가가치 국가전략산업으로 육성․발전시키기 위하여 ‘보건의료기술 진흥법’(1995)을 제정하여 ʻ보건의료기술 연구개발 사업ʼ을 추진해 오고 있으며, 지난 22년간(1995∼2020) 약 5조 4,000억 원의 정부 연구개발 자금을 지원했다. 보건복지부는 연도별 연구개발사업 시행계획을 수립하고, 전문기관인 한국보건산업진흥원에서 보건의료기술 연구개발 사업을 시행하고 있다.
[표 2-25] 보건의료기술 연구개발 사업 추진경과
|
연도 |
주요 내용 |
|
|
1995 |
보건의료기술연구기획평가단 설립 |
보건의료기술연구개발사업(128억 원) 시행 |
|
보건의료기술진흥법 제정(법률 제5017호) |
|
|
|
1998 |
한의약선도기술개발사업(24억 원) 시행 |
|
|
2008 |
임상연구인프라조성사업(350억 원) 시행 |
|
|
2009 |
임상의과학자양성사업(12억 5,000만 원) 시행 |
|
|
2010 |
글로벌화장품 신소재 연구개발사업(60억 원) 시행 |
|
|
2011 |
범부처 전주기 신약개발(50억 원), 시스템통합적 항암신약개발(50억 원) 시행 |
|
|
의료기기기술개발사업(40억 원) 시행 |
||
|
2014 |
연구중심병원 육성사업(100억 원) 시행 |
|
|
2015 |
감염병위기대응 기술개발사업(70억 원, 추경) 확대 시행 |
|
|
2016 |
국가전략프로젝트(정밀의료기술개발) (32억 원) 시행 |
|
|
2017 |
연구자주도질병극복연구, 공익적 질병극복연구, 국가치매극복기술개발 등 6개 사업(322억 원) 시행 |
|
|
2018 |
환자중심의료기술최적화연구, 스마트임상시험플랫폼기반구축, 바이오메디컬글로벌인재양성 등 10개 사업(389억 원) 시행 |
|
|
2019 |
환자중심의료기술최적화연구, 스마트임상시험플랫폼기반구축, 바이오메디컬글로벌인재양성 등 10개 사업(389억 원) 시행 |
|
|
2020 |
범부처전주기의료기기연구개발사업, 감염병예방치료기술개발사업, 치매극복연구개발사업 등 11개 사업(969억 원) 시행 |
|
(나) 지원내용
한국보건산업진흥원에서 관리하고 있는 2020년도 ‘보건의료기술 연구개발 사업’ 현황은 다음과 같다.
4차 산업혁명의 도래로 인해 최첨단 기술을 이용한 개인 맞춤형 의료로 의료의 패러다임이 변화하고, 인공지능, 빅데이터 등 4차 산업혁명 기반기술이 의료에 접목됨에 따라 바이오․헬스 혁신적 유망기술 개발에 중점 투자하였다. 또한 감염병, 치매, 정신건강 등의 사회문제 해결과 의료비 절감을 위한 공익적 R&D 투자에도 지원을 확대하였다. 민간 벤처와 함께 우수한 기술을 선별하여 투자하고, 연구 성과가 상용화로 이어질 수 있도록 질환 특화 유효성 평가와 중개․임상시험 지원에도 신규투자를 집행하였다.
[표 2-26] 보건의료기술 연구개발 사업 세부사업
(단위: 백만 원)
|
세부사업명 |
지원 내용 |
2020년도 예산 |
|
범부처 전주기 의료기기 연구개발사업 |
∙ 글로벌 제품 개발, 미래의료 선도 및 의료 복지 구현을 위해 범부처 차원의 의료기기 임상․인허가․제품화 전주기 지원 |
30,189 |
|
치매극복연구개발사업 |
∙ 치매의 예방부터 진단, 치료, 돌봄 분야에서 실용화 성과창출을 위한 단기 기술개발 지원 |
2,950 |
|
감염병 예방치료 기술개발사업 |
∙국민건강을 위협하는 감염병의 예방․치료․확산방지를 위한 백신, 진단, 치료제 개발 지원 |
25,532 |
|
국민건강 스마트관리 연구개발사업 |
∙ 국민의 건강증진을 위한 스마트 기술 기반의 이용자 중심 건강관리서비스 모델 개발 및 지역사회 기반의 건강관리 체계 구축 지원 |
2,966 |
|
노인장애인 보조기기 연구개발사업 |
∙ 체계적인 보조기기 R&D 생태계 기반 구축을 통해 보조기기 국산화 및 산업육성 |
4,800 |
|
바이오․헬스 투자인프라 연계형 R&D 사업 |
∙ 바이오․헬스 분야 창업기업의 성공 잠재력이 있는 기술의 빠른 상용화 촉진을 위해 정부와 민간이 공동으로 자금 및 인프라 연계 지원 |
2,236 |
|
피부과학 응용소재․선도기술 개발 |
∙ 소재 국산화, 기술 경쟁력 강화, 시장 다변화를 통해 화장품산업을 지속가능한 미래 성장동력으로 육성하기 위한 연구개발 지원 |
7,740 |
|
치의학 의료기술 연구개발 |
∙ 치과질환의 진단․치료․예후의 통합적 기술 및 ICT 기반 첨단기술 개발 |
2,008 |
|
바이오빅데이터구축 시범사업 |
∙ 동의․수집․활용 체계 마련을 위한 자발적 참여자의 유전체 정보를 바탕으로 바이오 의료 정보 빅데이터 구축 |
4,267 |
|
의료기술 상용화 지원센터 |
∙ 보건의료 기초연구 성과의 상용화 촉진을 위한 질환특화 유효성평가지원센터 및 의료기기 혁신지원센터 지원 |
6,450 |
|
한의약혁신기술개발 |
∙ 근거중심의 한의약 의료서비스 표준화․과학화로 한의 의료서비스 품질 제고 및 산업화 기반 마련 |
7,779 |
|
100세 사회 대응 고령친화제품 연구개발 |
∙ 고령자의 건강증진, 일상생활 지원 등 복지 증진을 위한 창의적인 고령친화용품 및 건강기능식품 분야 등의 기술 개발 투자 지원으로 고령친화산업 육성 및 고령자의 삶의 질 향상 지원 |
1,692 |
|
사회서비스 |
∙ 저출산․고령화 등 사회 변화에 따른 사회서비스 욕구에 대응하기 위해 사회서비스 개발 및 기존 사회서비스 품질 향상, 재정 효율성 제고를 위한 서비스 프로세스 개선 지원 |
150 |
|
임상연구 인프라 조성 |
∙ 신약 및 의료기기 개발 활성화를 위한 선진국 수준의 임상시험 인프라 구축, 의료기술의 과학적 근거 확보 위한 임상연구 지원을 통해 선진의료산업 기반을 마련하고 임상시험 허브로의 도약 및 제약산업 국제경쟁력 강화 |
12,668 |
|
국가 항암신약개발사업 |
∙ 최적의 조직, 인프라, 운영시스템확보를 통해 국내 항암 후보물질의 비임상, 임상 1상 및 임상 2상 시험을 직접 수행함으로써 항암제 개발을 가속화하고 국산 글로벌 항암 신약 개발․촉진에 기여 |
12,156 |
|
연구중심병원육성 |
∙ 글로벌 수준의 연구 역량 확보 및 사업화 성과 창출을 통해 보건의료산업 발전을 선도하며 국민 건강증진에 기여하는 세계적인 병원 육성 지원 |
37,170 |
|
혁신성장동력프로젝트 (복지부) |
∙개인의 유전체 및 임상데이터, 생활환경(Lifelog) 등을 고려한 최적의 맞춤형 예측 의료(예방․진단․치료)를 통한 암 진단․치료법 개발 및 클라우드 기반 병원정보시스템 개발 지원 |
11,261 |
|
심혈관계질환 첨단의료기술 가상훈련시스템 기술개발 |
∙ 심혈관계 질환 관련 의료기술 가상훈련 시스템 원천기술 개발 및 유효성․신뢰성 확보를 통한 국․내외 첨단의료기술 가상훈련 시장선도 및 선점 |
855 |
|
라이프케어융합서비스 개발사업 |
∙ 사회적 약자 중심으로 건강관리, 돌봄 등 맞춤형 통합서비스를 개발하고 질환 예방․만성질환 관리를 통한 의료비 절감 및 국민건강 증진 추진 |
9,072 |
|
연구자주도질병극복연구 |
∙ 질환의 기초 기전․탐색연구 결과를 바탕으로 질환에 대한 진단, 예방, 치료법 개발을 목적으로 하는 창의적 연구를 통해 기초연구의 실용화 연구로의 이행 촉진 지원 |
7,584 |
|
공익적 질병극복 연구 지원사업 |
∙ 저출산, 희귀질환 등 정책 우선순위가 높은 사회문제 해결을 위한 미충족 공공보건기술 개발 지원 |
6,960 |
|
국가치매극복 기술개발 |
∙ 치매의 예방부터 진단, 치료, 돌봄 분야에서 실용화 성과창출을 위한 단기 기술개발 지원 |
13,090 |
|
범부처전주기신약 개발 사업 |
∙과기정통부․산자부․복지부 3개 부처의 개별적인 신약개발 제품화 R&D 사업을 초월하여 글로벌 블록버스터 신약 개발 지원 |
500 |
|
포스트게놈 다부처 유전체 사업 (복지부) |
∙ 유전체 기술이 가져올 미래사회 변화에 적극적으로 대비하고 글로벌 경쟁력을 높이기 위해 범정부적 차원의 사업 지원(보건복지부는 개인별 맞춤의료를 실현하기 위한 질병 예방․진단․치료기술 개발 집중지원) |
9,232 |
|
인공지능바이오로봇 의료융합 기술개발(복지부) |
∙ 인공지능, 로봇기술 등 4차 산업혁명 핵심 기술을 의료산업에 융합한 신개념 의료융합기술을 부처협업(과기정통부, 산업부, 복지부)으로 전주기 지원 |
2,800 |
|
한의기반 융합기술 개발 |
∙ 한의약을 바탕으로 IT, BT, NT 등 현대과학기술을 응용하여 한의약의 외연을 확장하고, 질병을 예방․치료하는 실증적인 지식과 기술을 개발 지원 |
5,439 |
|
한의약선도기술개발 |
∙ 한의약 과학화․표준화․제품화 연구개발을 바탕으로 한의약산업의 신성장동력산업 육성 및 국민건강증진 |
7,235 |
|
질환극복기술개발 |
∙ 21세기 대표적 고부가가치 미래 성장산업인 보건의료 산업을 육성․발전시켜 국민의 생명․건강을 증진시키고 사람이 살기 편안한 건강․안전 사회 구현 |
2,785 |
|
선도형특성화연구 사업 |
∙ 기초연구 성과의 임상적용을 촉진하여 세계적 수준의 의료제품․기술 개발을 위한 임상 진입성과 창출 지원 |
3,120 |
|
감염병위기대응 기술개발 |
∙ 결핵, 대유행 인플루엔자 등 질병부담이 크거나 국가적 위기를 초래할 수 있는 감염병 대응을 위한 보건의료기술개발 및 백신의 국산화 사업 등 추진 |
16,192 |
|
첨단의료 기술개발 |
∙ 보건의료 산업의 첨단의료 수요 증가를 반영하고 산업경쟁력 확보를 위하여 재생의료, 신약개발 등 미래 유망 신기술 개발 지원 |
50,588 |
|
의료기기 기술개발 |
∙ 의료기기 핵심기술 개발 빛 임상적 근거창출 지원 등을 통해 기술경쟁력 강화 및 사업화 촉진을 이루어 냄으로써, 의료기기산업을 육성하고 국민 보건 향상에 기여 |
23,768 |
|
정신건강 문제해결 연구 |
∙ 중독, 자살, 주요정신질환 등 국민이 체감할 수 있는 사회문제해결형 R&D 수행과 지역사회 적용․확산을 통한 전 국민 정신건강 증진 |
6,244 |
|
스마트 임상시험 플랫폼 기반 구축사업 |
∙ 임상시험 효율성 및 품질 향상을 위한 차세대 임상시험 기반기술 개발을 통해 국내 임상시험산업의 글로벌 경쟁력 및 국내 신약개발 성공 가능성 제고 |
2,780 |
|
인공지능 신약개발 플랫폼 구축 |
∙ 글로벌 신약개발에 필요한 인공지능 플랫폼을 구축하여 신약개발에 소요되는 시간과 비용을 대폭 단축 |
2,778 |
|
의료데이터 보호․활용 기술개발 |
∙ 의료 빅데이터를 활용한 공공적 목적 연구 지원 및 의료데이터 기반의 연구 활성화를 위한 개인정보 보호․보안기술 활용 연구 지원 |
7,970 |
|
첨단의료복합단지 미래의료산업 원스톱 지원 |
∙첨단의료산업진흥재단이 의료연구개발기관과 공동R&D사업 수행을 통해 수요자 맞춤형 연구개발 및 제품화 지원 |
4,453 |
|
환자중심 의료기술 최적화 연구사업 |
∙ 임상현장의 다양한 의료기술을 대상으로, 최적의 의료서비스를 환자에게 제공하고, 보건의료체계의 지속가능성을 확보하기 위한 근거창출 |
19,105 |
|
CDM 기반 정밀의료 데이터 통합 플랫폼 기술개발 |
∙ 공통데이터모델(CDM)의 국내 표준모델 제시, 호환 방안 및 규약개선 마련과 CDM 활용 연구를 통해 개인정보 유출 우려가 없는 의료데이터 기반의 공공․산업적 연구 활성화 |
5,366 |
|
돌봄로봇 중개연구 및 서비스모델 개발 |
∙ 돌봄 수혜자의 일상생활 지원 및 돌봄 제공자의 돌봄 부담 경감을 통해 삶의 질을 향상시키고, 돌봄기술 산업 육성 |
2,201 |
|
마이크로의료로봇 실용화 기술개발 사업 |
∙ 마이크로의료로봇 공통활용기술 기반구축 및 마이크로의료로봇의 기술개발을 통해 고부가가치 의료기기 세계시장 선점 및 국가 의료복지 수준 향상 |
8,704 |
|
보건복지부 인재양성 사업(일반회계) |
∙바이오메디컬 분야의 혁신을 이끌 융합형 글로벌 핵심인재 육성 |
16,300 |
|
보건복지부 인재양성 사업 (국민건강증진기금) |
∙보건의료분야 전문인력 양성을 통한 신진 연구인력의 성장기반을 마련하고, 정기적인 인력교류 및 국제적 연구 네트워크 구축으로 국제 교류․협력 활성화, 국민의 건강증진과 4차 산업의 지속가능한 발전을 견인하기 위한 정밀의료 전문인재 양성 |
2,903 |
|
합계 |
410,038 |
|
(2) 질병관리 연구
(가) 개요
질병관리청(전 질병관리본부)은 국가 전염병 연구 및 관리와 생명과학 연구를 수행하는 곳으로 기관 산하의 국립보건연구원을 주축으로 질병관리 연구를 지원하고 있다.
주요 기능은 감염병 대응 및 예방, 감염병에 대한 진단 및 조사․연구, 국가 만성질환 감시체계 구축, 장기기증 지원 및 이식 관리, 감염병, 만성 질환, 희귀 난치성 질환 및 손상 질환에 관한 시험․연구업무, 질병관리, 유전체실용화 등 국가 연구개발 사업, 검역을 통한 해외유입 감염병의 국내 및 국외 전파방지 등이다.
또한, 질병관리본부는 다양한 분야의 새로운 접근방식을 도입해 연구와 성과를 내고 있다. 질병관리 과학적 근거기반 마련, 공익가치 지향 기초기반 연구, 미래 질병위험 대응 기술개발, 미래질병 위험 대응 기술개발, 연구자 중심의 R&D 지원 기반 구축, 감염병 극복에 필요한 연구기술 역량확보, 건강수명 연장을 위한 국가 만성병 연구, 정밀의료 실현을 위한 보건의료 연구 강화를 통해 연구 인프라를 구축하기 위해 질병관리의 중장기 계획을 세워 실행 중이다.
(나) 지원내용
질병관리청은 2020년 연구개발 사업에 총 790억 원을 투자하였다. 주된 투자 영역으로는 신․변종 감염병과 만성 감염병 등 국가가 관리해야 하는 감염병의 연구 지원, 백신 연구개발을 위해 생물안전 3등급 시설이 갖춰진 공공백신개발 지원센터 건립 등이 있다.
더불어 한국인이 많이 걸리는 주요 만성질환의 예측과 예방을 위한 형질분석연구 기반구축, 국민 건강을 위협하는 미세먼지 기인 질병 연구 등도 진행하고 있다. 또한 재생의료, 여성건강, 기후변화, 감염병, 희귀질환, 빅데이터 등의 연구 활성화를 위한 국가 보건의료 연구인프라 구축 사업을 수행 중이다.
[표 2-27] 질병관리청 세부사업
(단위: 백만 원)
|
세부사업명 |
지원 내용 |
2020년도 예산 |
|
미세먼지 기인질병대응 연구사업 |
∙ 미세먼지 기인 질병 예방 및 중재연구, 미세먼지 노출 인구 집단 분석 및 연구 인프라 구축 |
4,062 |
|
국가보건의료연구인프라 구축사업 |
∙ 줄기세포은행 운영 및 표준화기반 구축, 여성건강 기반기술개발연구, 기후변화 급만성 질병연구, 질병극복임상연구 데이터지원, 희귀질환연구인프라구축, 장애극복을 위한 난치성질환 치료기반 구축 |
17,619 |
|
공공백신개발지원센터 건립 및 운영 사업 |
∙ 공공백신개발․지원센터 건립 |
15,842 |
|
보건의료생물자원 종합관리사업 |
∙ 인체자원은행지원, 인체자원연구지원센터운영, 인체자원 은행고도화 |
5,249 |
|
감염병관리기술개발 연구사업 |
∙신․변종 및 국가관리감염병연구, 국가표준병원체 자원 개발 및 활용, 감염병예측 및 조기 감시 시스템 구축, One-Health 개념의 항생제 내성균 조사연구, 미해결 및 만성감염질환연구 |
20,492 |
|
형질분석 연구사업 |
∙ 한국인 형질분석연구, 주요 만성질환 관련 오믹스정보 생산 및 분석 |
2,206 |
|
만성병관리 기술개발사업 |
∙ 고령사회 대비 만성질환 극복연구, 만성질환예방관리 인프라 구축, 생활위험인자기인 만성질환 연구 |
13,485 |
|
합계 |
78,955 |
|
(3) 암연구 사업
(가) 개요
보건복지부는 국민보건 향상을 목적으로 암에 관한 전문적인 연구와 암환자의 진료 등을 위해 2000년 ‘국립암센터법’을 제정하여 국립암센터를 설립․운영하고 있으며, 암의 발생․예방․진단․치료 및 관리 등에 관한 연구 활동을 지원하는 국립암센터 ‘기관고유 연구 사업’과 국내 학․연․산․의료계 소속 암 연구자의 연구 활동을 지원하는 ‘암정복 추진 연구개발 사업’ 관리업무를 각각 수행하고 있다.
[표 2-28] 국가암관리 종합계획 비전 및 목표
|
비전 : 전 국민을 암으로부터 보호하고 암 전주기에 걸친 환자와 가족의 삶의 질 향상 |
|||
|
목표 |
암 발생률을 OECD 평균 수준으로 감소 암 조기발견 및 생존율 증가 암 생존자 및 말기암환자의 삶의 질 향상 맞춤형 정밀의료 기반 구축 |
||
|
추진과제 |
감시와 예방(Surveillance & Prevention) 조기검진(Early Detection) 진단, 치료 및 생존자 지원(Diagnosis, Treatment & Survivorship) 완화의료(Palliative Care) 인프라(Infrastructure) 연구(Research & Development) |
||
국민 사망원인 1위인 암질환을 국가 차원에서 장기적․종합적으로 관리하기 위해 ‘제1차 국가암관리종합계획’(1996∼2005) 시행으로 국립암센터 설립(2001), 암관리법 제정(2003) 등 국가암관리체계를 구축하고 암등록 통계사업, 5대 암검진사업 등 기틀을 마련하였다.
‘제2차 국가암관리종합계획’(2006∼2015)에서는 고령화와 생활습관의 서구화에 따른 질병구조 변화에 대응하기 위해 사전예방을 강조해 암예방․검진사업 등을 강화하였다.
현재는 암환자․가족의 높아진 기대수준과 재정 확충 등 변화된 국내외 정책 환경을 반영하여 ‘제3차 국가암관리종합계획’(2016∼2020)이 수립되어 시행 중이다.
(나) 지원 내용
국립암센터는 국가 암관리정책 개발 및 각종 국가암관리사업의 기획․관리․평가 등을 적극 지원함으로써 국민의 암 부담을 획기적으로 감소시키고, 삶의 질 향상에 기여하고 있다.
또한 내부 연구자의 연구 활동을 지원하는 ‘기관고유연구사업(intramural program)’과 학․연․산․의료계 소속 암연구자의 연구 활동을 지원하는 ‘암정복추진연구개발사업(extramural program)’ 관리업무를 수행하며, 주요 암 발생률 및 사망률을 낮추고 암 치료율을 제고시킬 수 있는 이행성 연구 등 실용화 연구를 중점으로 추진하고 있다.
2020년 기관고유 연구사업으로 공익적 핵심 암 융합연구, 정밀의학 실현 암 기반연구, 근거기반 전주기적 암관리 연구, 공공 개방형 암 연구 인프라 운영에 237억 원을 지원하였고, 암정복추진 연구개발 사업을 통해 공익적 다기관 암 임상연구, 암 예방․관리․서비스 연구, 암 중개융합연구, 지역암센터 연구지원 등에 97억 원을 지원하였다.
[표 2-29] 국립암센터 세부사업
(단위: 백만 원)
|
세부사업명 |
지원 내용 |
2020년도 예산 |
|
암 연구소 및 국가 암관리사업본부 주요사업비 |
<기관고유 연구 사업> ∙ 공익적 핵심 암 융합연구, 정밀의학 실현 암 기반연구, 근거기반 전주기적 암관리 연구, 공공 개방형 암 연구 인프라 운영 |
23,740 |
|
<암정복추진 연구개발 사업> ∙ 공익적 다기관 암 임상연구, 암 예방․관리․서비스 연구, 암 중개융합연구, 지역암센터 연구 지원, 기획연구 |
9,693 |
|
|
합계 |
33,433 |
|
마. 추진 방향
2021년도 보건복지부는 보건의료 분야의 범정부 R&D 종합계획인 ‘제2차 보건의료기술 육성 기본계획(2018∼2022)’과 ‘바이오․헬스 산업 혁신전략’의 이행을 위해 ‘공익적 R&D 투자 강화로 국민 보건의료 문제 해결 및 첨단유망기술 육성을 통한 국가주력산업으로의 도약’을 목표로 감염병 위기 대응 역량 강화, 바이오․헬스 첨단 유망기술 육성, 공익적 R&D 투자 강화, 의료현장 연계 R&D 지원을 4대 추진전략으로 정하고 주요 R&D를 추진해 나갈 계획이다.
먼저 코로나19 위기를 극복하고 미래 신종 감염병에 대비하여 감염병 위기 대응 역량을 강화한다. 포스트코로나 시대 혁신성장을 위한 장기․대형 사업을 신규 추진하고, 국민의 안전과 건강을 증진하는 R&D 투자를 확대할 계획이다.
바이오․헬스를 첨단유망기술로 육성하기 위한 연구개발과 관련해서는 난치 질환 극복 및 미래 바이오경제 시대의 글로벌 경쟁력 확보를 위해 재생의료 전주기 연구개발 지원 및 임상연구 분야 투자 강화를 위한 대규모 사업(예타 등)을 추진한다.
또한 사회문제 해결을 위해 노인․장애인 등 취약계층 맞춤형 R&D를 확대하고, 치매나 만성질환 등 고부담․난치성 질환 극복에도 중점을 둔 투자로 공익적 R&D를 확대한다. 마지막으로 병원을 의료 현장의 수요 발굴부터 연구개발, 임상적 안전성․유효성 확인, 개발된 기술의 최종 사용처로서 바이오․헬스 연구 생태계 혁신거점으로 육성하기 위한 지원도 확대할 예정이다.
7. 환경 분야 생명공학 육성
가. 개요
환경생명공학기술(EBT: Environmental Biotechnology Technology)이란 생명공학기술(BT: Bio Technology)을 환경기술(ET: Environmental Technology)에 접목하거나 융합하는 기술이다. 즉, 생물학적․분자생물학적 기법이나 생물학적 처리공정을 이용하여 환경오염을 예방(prevention)하거나 감시(monitoring)하는 기술, 오염된 환경을 복원(restoration)하고 정화(remediation)하는 기술을 의미한다.
환경생명공학기술은 청정기술, 환경오염제어 및 관리기술, 바이오에너지기술을 포함한다. 그 밖에도 생물학적 방법을 이용한 환경오염물질의 검출(detection), 친환경 소재․제품 개발, 생태계 건전성 및 생물다양성 유지, 토양․지하수 복원, 온실가스 감축, 기후변화 적응 등에 필요한 기술까지로 그 범위가 확대되고 있다. 환경생명공학기술은 근래 각 분야에서 개발되고 있는 첨단기술과 융합하며 기존의 환경기술로는 극복하기 어려운 한계를 해결할 수 있다는 점에서 그 중요성이 부각되고 있다.
2030년까지 세계 발전과 인류 공영을 위해 유엔 총회에서 채택된 지속가능발전목표(SDGs) 17개 중 8개가 환경과 밀접히 관련되어 있으며, 세계경제포럼(WEF)에서 발간한 글로벌리스크보고서(The Global Risks Report 2020)에 따르면 가장 영향력 있는 위기 중 3건이 환경문제(기후변화 대응 실패, 생물종다양성 소실, 극심한 기후현상 등)로 선정되었다.
나. 추진 경과(연혁)
환경부는 생물다양성의 보전과 그 구성요소의 지속가능한 이용을 위해 1997년부터 범부처 ‘국가생물 다양성 전략’을 수립하였고, 2012년 ‘생물다양성 보전 및 이용에 관한 법률’을 제정하였다. 또한, 2007년 국립생물자원의 확보․소장․전시 및 연구 등을 체계적으로 수행하기 위한 ‘국립생물자원관’을 설립하여 생물산업의 육성․지원기반 확립을 통해 국가경쟁력 강화에 노력하고 있다.
또한, 2013년에는 자연생태계 보전 및 생물다양성, 야생생물 관리를 위한 다양한 활동과 국토환경보전 기본정책 수립을 지원․협력하고 있는 환경부 산하 ‘국립생태원’을 출범하였으며, 2020년에는 환경부 소속 ‘국립야생동물질병관리원’이 개원함에 따라 야생동물 질병에 대한 총괄 중심역할을 수행하여 야생동물 질병의 예방과 확산을 차단하는 데 총력을 기울이고 있다.
아울러, 2012년 ‘환경기술 중장기 로드맵(2013∼2022)’, ‘2018년 환경R&D 중장기 추진전략(2019∼2028)’ 등을 통하여 생물자원의 지속가능한 이용․보전과 생물다양성 가치 제고를 위한 R&D사업을 추진 중에 있다.
[표 2-30] 주요 추진 경과
|
년도 |
내용 |
주관 |
|
1994 |
∙ 환경기술 및 환경산업 지원법 |
환경부 |
|
1997 |
∙ 제1차 국가생물다양성전략 수립 |
환경부(자연생태정책과) |
|
2007 |
∙ 환경부 소속 국립생물자원관 건립 |
환경부 |
|
2009 |
∙ 제2차 국가생물다양성전략 수립 |
환경부(자연생태정책과) |
|
2012 |
∙ 생물다양성보전 및 이용에 관한 법률 |
|
|
2012 |
∙ 환경기술로드맵(2013∼2022) 수립 |
환경부(녹색기술개발과) |
|
2013 |
∙ 제3차 국가생물다양성전략(2013∼2018) 수립 |
환경부(자연생태정책과) |
|
2013 |
∙ 환경부 산하 국립생태원 건립 |
환경부 |
|
2015 |
∙ 제1차 야생동물 질병관리 기본계획 수립(2016∼2020) |
환경부(생물다양성과) |
|
2017 |
∙ 유전자원의 접근․이용 및 이익 공유에 관한 법률 |
|
|
2018 |
∙ 환경R&D 중장기 추진전략(2019∼2028) 수립 |
환경부(녹색기술개발과) |
|
2019 |
∙ 제4차 국가생물다양성전략(2019∼2023) 수립 |
환경부(자연생태정책과) |
|
2019 |
∙ 생물자원관의 설립 및 운영에 관한 법률 |
환경부 |
|
2020 |
∙ 환경부 소속 국립야생동물질병관리원 건립 |
환경부 |
|
2020 |
∙ 제2차 야생동물 질병관리 기본계획 수립(2021∼2025) |
환경부(생물다양성과) |
다. 주요 정책
(1) 유전자원의 접근
2010년 제10차 생물다양성에 관한 협약(CBD: Convention on Biological Diversity) 당사국 총회에서 ‘유전자원에 대한 접근 및 유전자원의 이용으로부터 발생하는 이익의 공정하고 공평한 공유에 관한 나고야 의정서’가 채택되고 2014년 10월 12일에 발효되었다.
이에 따라 환경부는 자국의 생물자원에 대한 주권을 강화하려는 국제적 추세에 대응하기 위하여, 유전자원 등에 대한 접근과 이용을 위한 지원시책의 수립, 국내 유전자원 등에 대한 접근 신고 및 유전자원 등의 이용으로부터 발생한 이익의 공유 등에 관한 제도적 기반을 마련하기 위해 ‘유전자원의 접근․이용 및 이익 공유에 관한 법률(유전자원법)’을 제정(2017.1.)하여 2018년 8월 18일부터 시행 중이다.
(2) 환경 분야 생명공학 기술개발 추진
환경부는 환경오염 방지를 위한 환경생명공학 기술 유망분야에 투자하고 있다. 특히, 생물학적․분자생물학적 기법이나 생물학적 처리 공정 등을 활용하여 환경오염 예방, 감시, 복원 및 정화 기술을 위한 개발을 추진하고 있다.
그 일환으로 우선 환경보건과 관련된 유해인자의 상관성 규명을 위한 환경보건 기술개발과 생물다양성을 위협하는 외래생물을 제거하는 기술개발을 추진하였다. 탄소중립을 위한 유기성폐자원의 바이오가스화를 위한 실증 기술개발, 탄소저장량 산정을 통한 도시생태계 건강성 증진 기술개발, 야생 미생물을 활용한 수소 생산 등의 기술개발연구 등도 추진하고 있다.
또한, 야생생물의 독특한 생명현상 등을 다양한 분야의 소재와 공정에 적용시키기 위한 야생생물유래 친환경 신소재 및 공정기술개발 연구를 추진하고 있다. 여기에는 야생 미생물을 활용한 천연색소 대량생산 기술, 야생식물을 활용한 친환경필터 소재, 야생 동물을 활용한 친환경 유해조류 제어기술 등이 포함되어 있다.
[표 2-31] 환경생명공학 주요 핵심기술 분야
|
기술분야 |
주요내용 |
|
융합기반 청정기술 |
환경오염물질의 발생을 사전에 예방하는 사전오염 예방기술과 사업장 등 생산 및 소비단계의 오염물질 배출을 억제하는 기술 |
|
환경오염제어 및 관리기술 |
미량함유 물질 등 유해 물질들의 모니터링을 통한 관리기술 |
|
폐자원에너지화 및 고부가가치 자원화 기술 |
유기성 폐기물 등을 열화학적 또는 생물학적 방법으로 에너지화하는 기술 |
|
환경복원 및 정화기술 |
생물자원을 활용한 생태계 복원 및 정화, 유용생물자원의 기능별 실증화 기술 |
(3) 생물산업 육성
생물산업은 생물자원의 보전과 지속가능한 이용을 동시에 추진하고, 생물주권을 강화해야 하는 분야이다. 또한 위해서식지 등 생물다양성의 보전 노력과 지속가능한 이용을 위해 국가전략을 수립하고, 유전자원 제공국과 이용국과의 공정한 이익 공유 등을 규정하여야 한다. 또한 생물산업 대량확보에 한계가 분명하기 때문에 소재확보 및 대량증식에 대한 인프라 구축이 반드시 동반되어야 한다.
이에 환경부는 지속가능한 생물자원의 확보를 위해 국내외 생물다양성을 조사하고 신규종을 발굴하는 한편, 생물소재 확보와 대량증식, 유용성 탐색연구를 통해 생물산업을 지원하는 정책을 추진하고 있다.
환경부는 2006년부터 자생생물 발굴 및 분류 연구, 야생생물 첨단연구 등을 통해 국가 생물자원의 조사 및 보전․관리를 위한 기본연구를 수행하고 있으며, 생물소재은행 구축을 통해 생물소재를 확보하고, 대량증식연구를 수행 중에 있다. 국가생물다양성센터와 유전자원정보관리센터를 통해 부처별로 각자 운영하고 있는 다양한 생물관련 정보를 통합하여 빅데이터를 구축․운영하고 있으며, 나고야의정서 대응을 위한 생물산업 지원 플랫폼을 운영 중에 있다.
(4) 야생동물 질병연구 추진
환경부는 주요질병 백신치료제 개발을 위해서 야생멧돼지 아프리카돼지열병(ASF) 표적 단백질 선정, 바이러스 배양기법 개발 등의 기초연구와 더불어 백신 효능평가 및 동물 대상 임상실험 등을 추진하고 있다.
또한, 주요 야생동물 질병 진단기술 및 진단체계 강화를 위해 관리대상 질병에 대한 진단기법 개발 연구를 수행하고 있다. 2025년까지 주요 법정질병 40종에 대한 진단기법 개발을 목표로 표준화된 질병진단 체계를 구축할 계획이다.
|
연도 |
|
2020 |
|
2021 |
|
2022 |
|
2025 |
|
진단법 개발 수(누적) |
6종* |
10종 |
20종 |
40종 |
* 기 개발된 진단법 6종 : ① AI N형 ② AI H형 ③ SFTS ④ 코로나 ⑤ 살모넬라 ⑥ 광견병.
이 외에도 야생동물 질병에 대응하고자 야생멧돼지 아프리카돼지열병(ASF), 야생조류인플루엔자(AI) 등 대량 발생하는 질병과 중증열성혈소판감소증후군(SFTS) 등 관리가 필요한 야생동물 질병에 대해 집중적으로 조사․연구하고, 진단․대응기술을 개발하는 등의 연구를 중점 추진하고 있다.
[표 2-32] 야생동물 질병 연구 분야
|
추진 목표 |
주요 내용 |
|
야생동물 질병 감시체계 강화 |
․야생조류 감염병 감시연구(감시기술 개발, 서식지 정밀모니터링) ․야생포유류 감염병 감시연구(시공간적 분포특성 및 역학조사) ․주요 인수공통감염병 매개동물(멧돼지, 박쥐, 고라니 등) 시료분석 |
|
야생동물 질병진단 및 관리 선진화 |
․야생동물 질병 진단법 표준화 및 현장진단키트 개발 ․신변종 감염병 대응을 위한 진단기법 및 백신개발 연구 ․야생동물 질병관리정보시스템 구축․운영 |
라. 주요 사업
(1) 환경 분야 생명공학 기술개발 사업
환경부는 생명공학 관련 기술개발을 위해 2011년부터 환경산업 선진화 기술개발 사업, 생활공감 환경보건 기술개발 사업 등 다양한 환경 기술개발 사업들을 추진해왔다. 이를 통해 보건분야, 환경오염물질 사전예방, 생태계 복원 및 관리 등 다양한 분야에서 성과를 도출하였으며, 최근에는 탄소중립과 유용 생물자원의 구축 및 활용, 환경오염물질 저감 등을 중점으로 추진하고 있다.
[표 2-33] 환경 분야 생명공학기술 주요 성과
|
|
생물학적 분석기법 기반 신종 미량물질 검출기술(2020.12.) |
|
수계내 유해 미생물, 신종 미량물질 분석을 위한 진단키트를 개발하여 현장에서 시료 채취와 동시에 20분 이내로 분석결과 도출이 가능(기존에는 2∼3일 소요)하고 또한 분석비용도 기존 장비 대비 1/20 수준으로 절감이 가능하여 하폐수의 오염물질 모니터링을 효율화하는데 크게 기여함 |
|
|
|
유해 남조류, 독소물질 동시 측정 가능한 센서 개발을 위한 모델 설계(2020.12.) |
|
현재 유해 남조류 및 독소물질 정량․정성적 판별을 동시 수행 가능한 모니터링 시스템이 전무한 실정으로, 국내 최초로 분자생물학적 기법 기반 유해 남조류 및 독소물질을 동시에 판별 가능한 휴대용 바이오센서를 개발함 |
|
|
|
이미지 모니터링 장치 기반 미세조류 측정기술 개발 관련 저작권 등록(2020.10.) |
|
현재 미세조류 측정 시 현미경 분석 방법을 주로 활용하여 분석 연구자 간 숙련도 차이에 따른 오차 발생빈도가 크다는 단점이 존재함에 따라, 자동 연속 측정이 가능한 지능형 미세조류 측정장치 개발 및 현장 설치로 유역환경청과 지자체에서 수생태계 모니터링, 취․정수장 운영관리 업무의 효율화에 기여 |
|
|
|
다종 생물센서 기반 생태독성 측정장치 개발(시작품 제작, 2020.10.) |
|
현재 생태독성 통합관리제도의 평가 시험종으로 물벼룩이 주로 사용되고 있으나, 시험종에 따라 민감도가 달라 업종별 특성을 고려한 평가 시험종 확대가 필요한 실정으로, 동 과제를 통해 먹이사슬 단계를 대표하는 다종 생물을 이용한 생태독성 측정장비를 개발, 환경부 수질 원격감시시스템(TMS) 운영 효율화에 기여 |
|
|
|
Web-GIS 기반 수계별 항생제 내성 지도 구축(2020.12.) |
|
배양법(디스크 확산법)을 이용한 항생제 내성균 분리 및 판별, 비배양법(고용량 스마트칩 이용 Rt-PCR, NGS)을 이용한 내성균 유전자 분석 등의 결과를 데이터베이스로 구축하고 이를 토대로 한강 등 4대강 주요 지점의 항생제 내성균 분포 지도를 구축 |
|
|
|
외래 포유류 확산변화 예측 모델 개발(2020.1.) |
|
생태계 교란 외래 포유류 기초 행동특성, 이동특성, 서식지 환경특성 분석을 통해 정확도 높은 확산 및 변화예측 모델을 개발하여, 향후 생태계 교란 포유류 조절․퇴치 사업계획 수립에 활용하여 국내 생물다양성 손실 저감 가능 |
|
|
|
도시생태 탄소저장량 평가기술 개발(2020.1.) |
|
3차원 LiDAR 정보를 활용하여 딥러닝 기반의 토지피복분류 모델을 현장 자료에 적용하여 탄소 저장량 산정 결과를 검증하는 평가기술 |
|
|
|
균류-할로이사이트 복합 계층 구조에 기반 난분해성 폐수처리 시스템 개발(2020.1.) |
|
물질 흡착/흡수에 최적화된 식물뿌리 및 곰팡이 균사와 할로이사이트의 복합 계층구조를 모방한 균류-할로이사이트 복합 수처리 필터시스템을 개발하여 기존 공정으로 처리가 어려운 제지폐수 처리 공정에 적용 |
|
|
|
생태독성 저감을 위한 폐수처리 시스템 개발(2020.12.) |
|
생흡착제 기반의 산업폐수 처리흡착제와 폐수처리 소재(절수장치) 및 시스템 개발을 통한 생태독성 저감으로 생태계 보전에 기여하고, 국내 소규모 폐수처리장 현장실증을 통한 효율성 확보 및 위생안전 기준(KC) 인증(2020.8.) |
|
|
|
환경오염물 처리용 생태모방 소재 개발(2020.12.) |
|
자연생태 모방(BT) 기술로 이루어진 금속-유기 골격체를 이용하여 환경 유해 화합물(환경 중 의약품, 산업염료, 농약, 신경 장애물질 등)의 흡착 제거/분해 기술 개발 |
|
|
|
생태훼손지 유형별 조회 및 복원평가 시스템 개발(2020.12.) |
|
‘전국 생태훼손지(303개소)’를 대상으로 구축한 훼손 유형(원지형 변형 54%, 토양오염 16%, 식생쇠퇴 41개소 등), 토지이용현황 등을 고려한 사용자에 최적화된 복원대상지를 지도로 조회할 수 있도록 시스템 구현 |
(2) 생물자원 발굴 및 분류
환경부는 ‘나고야의정서’ 발효(2014.10.12.)에 따른 대응으로 생물자원 발굴, 확보로 생물자원 보유국(생물자원 주권국)의 입지 구축 및 해외 유용생물자원을 선점하고, 한반도 자생생물의 주권 강화를 위한 과학적․객관적 증거 확보 및 정보화를 토대로 한 국내․외 공표를 통해 생물산업을 지원하고자 2006년부터 2020년까지 총 1,462억 원을 생물자원 발굴 및 분류 사업(R&D)에 투자하였다.
최근 3년간(2018∼2020) 곤충, 무척추동물, 균류, 조류를 중심으로 4,044종 신종/미기록종 후보를 발굴하여 사업 초기에 3만 종에 불과한 자생생물 자원을 5만 4,428종(2020.12. 기준)으로, 사업 추진 이후 자생생물 자원이 1만 7,000천 종 이상 증가되는데 크게 기여하였다.
발굴 종에 대한 국제적 공인을 위한 학술논문도 3년간 632편 발표하였다. 특히 우리나라는 매년 200여 종의 원핵생물 신종을 발표하고 있는데, 이는 중국에 이어 세계 2위 수준이다. 또한, 2020년까지 자생생물의 종속지적 연구 수행 및 국․영문 생물지 원고 1만 6,346종 작성을 완료하고, 국․영문 총 430권을 발간하였다.
환경부는 범부처 생물다양성 정보 공유 및 활용 기반 구축․운영을 위해 생물 국명․학명의 디지털 표준정보인 ‘국가생물종목록연번체계(KTSN)’를 17만 건 구축․배포하였고, 정부․민간기관에서 보유 중인 생물다양성 정보를 약 1,300만 건 연계하여 대국민 서비스를 제공하고 있다. 환경부는 한반도 주요 생물자원(한반도 고유종, 국외반출 승인대상종, 법적보호종, 경제적 가치가 높은 종 등)의 종간/종내 유전적 다양성 정보, 유전자(체) 정보를 총 750건을 분석하고, 학술지 논문 188편의 출판을 완료하였다.
환경부는 2009년부터 생물다양성이 위협받고 있는 개도국 핫스팟 지역7)의 지구 생물권 보전을 통한 국제 네트워크 강화를 위해 캄보디아, 미얀마, 라오스, 베트남과 공동연구를 추진하여 2020년까지 1만 4,000여 종 해외생물자원을 확보하고, 생물다양성 도감을 32권 발간․기증하였다. 또한, 중복표본 기증 및 표본실 5개 지역을 설치 지원하고, 알레르기, 아토피, 미백, 주름개선 등 특허 33건 출원, 25건, 기술이전 5건을 완료하였다.
[표 2-34] 주요 성과
|
|
한-탄자니아 생물다양성 공동연구(2019.11.) |
|
2016년 탄자니아 야생생물연구소와 공동연구 협약을 맺고 탄자니아의 약용식물과 조류에 관한 생물다양성 연구를 수행 중에 있음. 탄자니아의 북부 5개 주요 부족이 전통적으로 활용해 온 약용식물을 체계적으로 정리하고, 유용성 분석결과 미백 효능이 있는 ‘마에루아 에둘리스(Maerua edulis)’를 발견하여 특허를 출원 및 기술을 이전하여 상품화를 추진 중에 있으며, 서부 탄자니아 보호 지역에 서식하는 723종의 새에 대한 조류 서식지와 생태정보를 체계적으로 정리 분석한 조류도감 발간 |
|
|
|
최근 3년간(2018∼2020) 자생생물 4,044종 신종/미기록종 후보 발굴(2020.12.) |
|
자생생물조사발굴 사업을 통해 3년간 4,044종 신종/미기록종 후보를 발굴하고, 발굴종에 대한 국제적 공인을 위해 학술논문 632편을 발표함. 연평균 1,348종 발굴로 세계 최고 수준의 성과를 달성함. 특히 매년 200여 종의 원핵생물 신종을 발표하였는데, 이는 중국에 이어 세계 2위 수준임. 우리나라에서 처음 발굴한 종에 대해서는 국가명 또는 지명을 이름으로 부여함으로써 우리의 고유성을 확보함 |
|
|
|
주요 온실가스인 메탄을 소비하는 메탄자화균 발굴(2020.12.) |
|
메탄자화균은 메탄을 메탄올로 산화하는 에너지원으로 살아가는 세균으로, 이를 통해 환경 내에서 메탄을 감소시키는 중요한 역할을 함. 현재까지 알려진 메탄자화균은 전세계적으로 약 60여 종이며 그 중 VC 분해능이 있는 것으로 알려진 종은 단 3종에 불과함. 국내 이탄습지인 무제치늪 등에서 메탄자화균 2종(Methylomonas sp. JS1 및 Methylocystis sp. MJC1)을 발굴. 두 메탄자화균은 산소가 있는 조건에서 VC와 메탄을 동시에 분해하였음. 기존 균은 pH 5.5 이하에서는 저해를 받지만, 이번에 발굴한 메탄자화균 2종은 약산성(pH 5.0~6.0)에서 메탄 및 염화비닐의 분해능이 우수한 것으로 나타남. |
|
|
|
고유종 미선나무의 유전다양성 연구로 보전기반 마련(2021.4.) |
|
미선나무 13개 곳(천연기념물 지정 4곳, 자생지 6곳, 복원지 2곳, 식재 1곳)에 서식하는 169개체를 대상으로 단일염기다형성(SNP) 영역 2,254개를 조사한 결과, 미선나무 집단 간 ‘유전자 다양성 지수’는 비슷한 값으로 측정되었으며, 복원지인 부안면 중계리, 진천군 용정리 집단은 지역 간 유전적 고유성과 건강도를 유지할 수 있을 정도로 복원된 것으로 평가되었으며, 천연기념물인 괴산군(147호 및 221호), 영동군(364호), 부안군(370호) 자생지 집단 4곳은 유전적 건강도가 다른 자생지보다 높게 평가되어 보전과 관리가 잘 이루어진 것으로 해석됨 |
마. 향후 계획
생물산업은 석유화학산업을 대체할 수 있는 그린뉴딜 신성장동력으로서 그 가치가 증대되고 있는 상황으로, 생명공학 기술의 발달로 생물자원을 이용한 산업의 세계 시장규모는 2조 1,000억 달러 이상 성장할 것으로 전망하고 있다. 그러나, 생물다양성 협약(1993.12.), 나고야의정서(2017.8.) 비준에 따른 각국의 생물자원 확보 및 이익 극대화를 위한 주권확보 경쟁이 가속화될 전망이므로, 생물다양성이 풍부한 개도국과의 협력 확대가 필요하다. 생물자원 또한 ‘보전’에서 ‘지속가능한 이용’으로 국제적 패러다임이 변화하고 있다. 또한, 기후변화에 따른 생물다양성 위협, 환경 변화에 따른 생물다양성 감소, 사스(2007), 메르스(2013), 코로나19(2019∼ ) 등 인수공통감염병의 지속 등 환경문제가 지속적으로 발생할 것으로 예상된다.
환경부는 야생생물 모니터링, 감염병 매개 동물 연구 등을 통한 보전․관리, 자생생물 대량증식․보급을 위한 생물소재 클러스터 조성, 유전 정보 확보, 기후변화로 인한 생물다양성 평가 및 변화 예측 등을 통해 탄소중립․환경오염 저감․환경복원 등 환경현안을 생물자원 기반으로 해결하고, 야생생물 활용 저탄소 신기술 발굴, 환경현안(곤충대발생, 교란 등) 해결 기술 등을 개발하여 새로운 부가가치 창출을 추진할 것이다.
나고야의정서 발효(2014.10.)에 따라 2017년 관계부처 합동으로 제정․공포된 유전자원의 접근․이용 및 이익공유에 관한 법률(유전자원법)이 2018년 8월부터 시행된 이후 제도 보완 필요성이 제기된 기관별 연계 절차 및 대국민서비스 방안 등의 개선을 위해, 국외반출 승인 시 유전자원관리기관과 사전 협의토록 하고 업무처리 결과를 DB화하는 등 업무 간 연계성 확보를 위해 관련 제도를 개선할 계획이다. 또한, 생물자원의 국외반출제도의 이용과 활용 홍보를 위해서 검역본부 또는 공항 내에서의 생물자원에 대한 국외반출 승인제도 안내 등을 추진할 예정이다.
환경부는 국제 동향 및 국내 현황 등을 반영한 중장기적 관점의 2030(제5차) 국가생물 다양성전략(2021∼2030)을 수립할 계획이며, 이를 기반으로 자연․생태 기반의 기후 위기 대응 및 생태계 보전을 위한 정책을 지속 추진할 예정이다.
한편, 환경기술개발사업 또한 2022년 착수 예정인 ‘습지생태계 가치평가 및 탄소흡수 가치증진 기술개발사업(398억 원, 2022∼2026)’을 통해 습지생태계의 지속가능한 보전을 위한 가치평가와 생물다양성 기반 탄소흡수능을 고려한 가치증진을 위한 기술을 개발할 계획이다. 또한, 생물주권, 화이트 바이오 경쟁에 대비한 생물자원 축적 등 생물다양성 제고를 위해 유관부처와 협력하여 ‘한반도 토종식물자원 생명정보 빅데이터 구축사업(2023∼2032)’, ‘국가 마이크로바이옴 이니셔티브 기술개발사업(2023∼2032)’ 등의 R&D 사업도 추진할 계획이다.
8. 해양수산 분야 생명공학 육성
가. 개요
해양바이오는 해양생물을 소재로 생명공학기술을 적용하여 제품․서비스를 생산하는 산업이다. 현재 육상자원 탐색이 상당 부분 완료됨에 따라 고염 등 극한 환경에 적응하고 특이 물질을 보유하고 있는 해양생물에 대한 글로벌 바이오기업들의 관심이 높아지고 있어 해양생물의 효능을 활용한 바이오 신소재 개발이 활발히 진행되고 있다. 해양 바이오는 현재 국내의 경우 기업들의 기술수준 및 주력 품목 등에 따라 기초연구부터 제품화 지원까지 정책수요가 다양하고, 고령화, 환경오염 등 글로벌 문제 해결과 경제 성장 원동력이 되는 유망분야로서 촉망받고 있으나, 정책지원은 주로 연구개발 지원에 집중되어 있다, 또한 해양생물에 대한 연구 역사가 짧아 임상시험 및 융복합 연구 등을 위한 정보 미비, 소재의 대량생산 지원 시스템도 부족하여 중소기업의 해양바이오 시장 진입장벽이 높은 상황이다.
이에 해양수산부는 해양바이오 산업기반 조성 및 해양바이오 R&D 혁신으로 해양바이오 산업 생태계를 구축하고 나아가 대표 성공사례를 창출하고자 글로벌 해양바이오 선점전략(2021)을 발표하고 산업 육성정책을 추진 중이다.
나. 추진 경과(연혁)
해양수산부는 2004년 ‘마린바이오21 사업(2004∼2013)’을 시작으로 해양생명공학 분야를 꾸준히 육성하고 있다. 2008년 ‘해양생명공학 육성 기본계획(2008∼2016)’, 2009년에는 ‘해양바이오 연구개발 활성화 대책(2010∼2014)’, 2018년 ‘해양바이오 산업육성 전략(안)’을 수립하였다.
뿐만 아니라 ‘해양수산생명자원의 확보․관리 및 이용 등에 관한 법률’을 제정(2012.7.)하여 해양생명자원의 확보와 체계적이고 효율적인 관리 및 이용을 위한 제도를 마련하였다. 특히, ‘국립해양생물자원관의 설립 및 운영에 관한 법률’을 제정(2014.10.)함으로써 해양생물자원의 수집․보존․전시 및 연구 등을 체계적으로 수행하기 위한 국립 해양생물자원관을 설립(2015.4.)하여 해양생명자원을 통한 해양생명공학의 체계적 육성을 추진하고 있다. 또한, 해양바이오기술 혁신을 통한 국가 성장동력 마련을 위하여 글로벌 해양바이오 선점전략(2021.1)을 수립함으로써 해양바이오 산업기반 조성과 해양바이오 R&D 혁신 방안을 추진하고 있다.
|
년도 |
내용 |
주관 |
|
1993 |
∙ 생명공학 육성 기본계획 수립(1993∼2006) |
해양수산부 |
|
2003 |
∙ 해양바이오21 사업 기획연구 실시 |
해양수산부 (해양생태과) |
|
2004 |
∙ ‘마린바이오21 사업’ 3개 연구단 연구 착수 |
해양수산부 (해양생태과) |
|
2006 |
∙ 한국해양과학기술진흥원으로 관리업무 이관 |
해양수산부 |
|
2007 |
∙ 해양생명자원 종합관리 마스터플랜 수립 |
해양수산부 (해양생태과) |
|
2008 |
∙ ‘해양생명공학 육성 기본계획(Blue-Bio 2016)’ 수립 |
국토해양부 (해양생태과) |
|
2009 |
∙ 해양바이오산업 활성화를 위한 간담회 - 해양바이오 R&D 투자 확대 후속 조치 지시 |
국토해양부 (해양생태과) |
|
2014 |
∙ 해양수산 R&D 중장기 계획(2014∼2020) 국가과학기술위원회 의결 |
해양수산부 |
|
2015 |
∙ 국립해양생물자원관 설립 |
해양수산부 (해양수산생명자원과) |
|
2017 |
∙ 해양수산생명자원의 확보․관리 및 이용 등에 관한 법률 |
해양수산부 (해양수산생명자원과) |
|
2018 |
∙ 해양바이오 산업 육성 전략(안) 마련 |
해양수산부 (해양수산생명자원과) |
|
2019 |
∙ 제1차 해양수산 생명자원 관리 기본계획(2019∼2023) 수립 |
해양수산부 (해양수산생명자원과) |
|
2021 |
∙ 글로벌 해양바이오 선점전략(2021∼2030) 수립(국정현안조정점검회의 의결) |
해양수산부 (해양수산생명자원과) |
다. 주요 정책
(1) 글로벌 해양바이오 선점전략 수립
해양수산부는 해양바이오 분야의 체계적ㆍ장기적 육성을 위해 2021년 초 글로벌 해양바이오 선점전략을 발표하였다. 해양바이오 산업기반을 조성하고 해양바이오 연구개발(R&D)을 혁신하여 선도국의 78.6% 수준에 머무는 국내 기술 수준을 2030년 80%까지 따라잡고 소재 수입의존도는 70%에서 50%로 낮춘다는 계획이다.
산업기반을 육성하기 위해 ① 해양수산생명자원 확보 및 관리 체계화(국립해양생물자원관이 수행 중이며 MBRIS에 해양유래 자원 DB 구축 중)를 통한 정보 전달, ② 중간소재의 대량 공급 시스템 구축, ③ 산업화 지원(인허가 지원, 기술이전 및 제품화 지원, 권역별 특성화 거점 마련)이 진행 중에 있다.
해양바이오 R&D 혁신을 위해서는 ① 성과 연계형 연구개발 지원, ② 문제해결형 R&D 집중 투자(해양환경 개선, 수산업 혁신, 신소재 개발)가 마련되어 수요자 중심의 R&D 투자와 전문가 그룹 간 연계를 강화하여 융복합 바이오연구 등을 추진하는 등 연구 성과가 사업화까지 이어질 수 있도록 지원한다.
이번 해양바이오 선점전략 수립을 통해 해양바이오 연구개발 분야, 해양바이오 정보 활용 분야 및 산업화 현장의 문제를 해결하여 연구개발의 혁신은 물론 새로운 소재를 적용한 식품, 화장품, 제약, 의료기기까지 산업화를 지원함으로써 국내 해양바이오의 부가가치를 제고하고 세계시장에서도 경쟁력을 확보할 수 있도록 정책을 추진할 예정이다.
(2) 해양수산 생명공학 분야 유망핵심기술 개발
해양수산부는 상용화 연계 R&D 미흡 등 한계를 극복하기 위해 성과연계형 연구개발 및 문제해결형 R&D 등 우선순위에 따른 전략적 투자를 추진 중이다. 특히, 고부가가치 신소재 개발을 목표로 해양 생명자원의 기능성분을 규명하는 해양수산 생명공학 개발사업, 바이오 소재의 대량생산 및 표준화 기술개발을 통한 건강기능식품․화장품 및 의료소재 등을 개발하는 전략소재 개발 및 상용화 지원 사업 등을 집중 추진하고 있다.
해양수산 생명공학 개발사업을 통해 2016년부터 추진 중인 ‘유용 해양 와편모류 증식 및 병원성 기생충 제어 기반기술 개발’ 과제 성과로 적조를 유발하는 와편모류의 증식 특성을 규명하였다. ‘해양단백질 기반 바이오메디컬 소재 개발(2017∼2022)’ 과제를 통해서는, 대표적인 해양 포유류인 고래의 생리적 특성인 저산소증 저항성․상처 치유능력과 관련된 섬유아세포성장인자(FGF: Fibroblast growth factor)와 기타 해양동물 유전자의 활성과 활용 방안에 대해 연구하여 안정성이 9.6배 향상된 ‘안정형 FGF2’를 개발하고, 지난 2019년 국내특허를 출원한 이후 2020년 1/4분기에 민간으로 기술이전까지 완료하여 의약소재 산업화를 발전시키고 있다.
해양바이오 전략소재 개발 및 상용화 지원을 통해서는 홍조류 유래 신소재 네오아가로올리고당(DY-NAO)의 면역기능 개선 기능성 인체적용시험 및 건강기능식품 시제품 개발, 연어핵산을 이용한 위건강 개선 건강기능식품 개발, 해양생물 유래 미세조류 유글레나의 건강기능식품 소재 개발, 발효굴 추출물을 이용한 운동능력 개선 개별인정형 기능성식품 개발 등 유망 바이오소재를 활용한 건강기능식품을 개발 중에 있으며 2021년에는 동 과제와 관련한 식약처 인증을 받을 계획이다.
또한, 2021년부터는 해양수산생명공학사업을 통해 해양 고세균을 이용한 바이오 수소생산의 원천기술을 개발한 바 있으며 해당 기술의 상용화를 위하여 기업들 주관으로 기술 상용화를 위해 실증플랜트 규모 확대 및 연속생산 실증을 추진하고 있다.8)
(3) 해양바이오 산업화 지원정책 추진
기초연구부터 제품화 지원까지 기업의 R&D 정책수요는 다양하나 그간 연구개발 지원에 집중되다 보니, 유망 R&D성과를 산업화까지 연계하는 산업화 지원정책이 상대적으로 부족한 면이 있었다. 이에 해수부는 해양바이오 기업의 death-valley 극복을 위해 인허가 단계부터 제품화까지 산업화 전 주기에 대한 특화 지원체계를 마련함으로써, 산업화 지원기반을 조성하고 있다.
먼저, 해양바이오 권역별 해양바이오 특성화 거점을 마련한다. 남해권은 국내 최대 해조류 생산지인 점을 활용하여 전남 완도에 해양바이오 소재 GMP 생산시설 등을 구축하여 소재 공급기지로 개발(2021∼2023)한다. 서해권은 충남 서천에 영세기업을 대상으로 입주공간 및 컨설팅 제공 등 산업화 전주기를 지원하는 ‘해양바이오 산업화 인큐베이터’(2020∼2023)를 건립하여 국립해양생물자원관(MABIK)과 연계 및 시너지 효과를 창출할 계획이다.
또한, 지속적으로 제기되어 온 전문인력 부족 및 인력양성 교육프로그램 부재를 해결하기 위해 2021년부터는 해양생물에 특화된 단기 실무실습교육을 제공함으로써 해양바이오산업의 전문성을 제고하고 경쟁력을 확보할 계획이다.
라. 주요 사업
(1) 해양수산 생명공학기술 개발사업
해양수산부는 해양수산 생명공학의 원천기술 확보를 통한 해양바이오 분야 기술경쟁력 강화를 위해 2004년부터 2021년까지 총 3,325억 원을 해양생명공학 R&D사업에 투자하였다.
분야별로 살펴보면 해양수산생명자원 확보 및 활용기반구축 863억 원, 해양수산바이오 신소재 개발 1,284억 원, 해양바이오 에너지 개발 734억 원, 해양생명현상 활용연구에 429억 원을 투자하였다. 이러한 투자를 통해 해양생명공학 분야에서 많은 성과를 이룰 수 있었다.
주요 성과로는 홍합 접착단백질 활용 의료용 복합 지혈소재 개발, 기능성 식․의약소재 개발, 미세조류를 이용한 바이오디젤 생산기술개발, 해양 고세균을 이용한 바이오수소 생산기술개발, 해양와편모류 신종 발굴 등이 있다.
[표 2-35] 해양수산 생명공학 주요 성과
|
|
(의료 소재) 해양물질 기반 근적외선 조영물질 개발, 형광영상 진단기기 시제품 제작(2019.10.) |
|
해양바이오 소재(미역 알긴산, 다시마 후코이단 등)를 활용한 암진단용 근적외선 조영제 개발 및 이를 이용한 영상진단기기 개발, 기술이전 (과제명 : 해양소재 기반 근적외선 조영물질 및 영상진단기기 개발) |
|
|
|
(의료 소재) 해조류(감태)를 활용해 기도협착증을 억제할 수 있는 기능성 물질(프로로탄닌) 및 의료기기 적용 기술 개발(동물 독성시험) |
|
동물(토끼) 실험을 통해 프로로탄닌이 코팅된 기도 삽입 튜브(카테터)의 안정성 인증 받고(한국건설생활환경연구원, 2018.7.19), 관련 기술이전((주)코웰메디) (과제명 : 해양융복합 바이오닉스 소재 상용화 기술개발) |
|
|
|
(신소재) 해양소재 키틴에 티타늄 성분을 추가한 치과용 차폐막 개발(2019.10.) |
|
해양 유기소재인 키틴에 티타늄 성분을 추가하여 치과용(임플란트) 차폐막을 개발, 기존 콜라겐 유래 차폐막 대비 강도, 항염성, 골재생 능력 증대 (과제명 : 해양 섬유복합소재 및 바이오플라스틱 소재 기술개발) |
|
|
|
(건강기능 소재) 해조류로부터 면역력, 인지능 및 기억력 개선 우수소재 발굴(2종/2021.2.) |
|
감태 추출물(인지능 개선), 미역귀 추출물(면역력 개선)
(과제명 : 해양자원유래 고령친화형 글로벌 기능성 소재개발) |
(2) 포스트게놈 다부처 유전체사업
해양수산부는 해양생물의 차세대 유전체 연구기반을 구축하고 해양유전체 유래 기초원천 기술개발을 위한 포스트게놈 다부처 유전체사업(2014∼2021)을 추진하고 있다.
해양동물, 해양식물, 해양미생물, 해양메타유전체, 수산생물 유전체 분석 및 활용기반 연구와 해양수산생물 유전체정보센터 구축․운영 등 6개의 주요 세부과제를 중심으로 해양수산생물 유전체 정보 생산, 해양수산생물 유전체 정보 분석을 진행 중에 있다. 사업 추진을 통해 2020년까지 해양수산 유전체분야 관련 SCI논문 308편, 국내 특허등록 39건을 달성하였다.
동 사업을 통해 세계 최초 남방큰돌고래 유전체 해독(2018), 참돔 표준유전체 완성(2018) 및 어류성장속도 조절 유전자 발굴(2019), 말레이해파리 유전자 및 대사변화 예측법 독일특허 등록(2019)등 활용을 위한 다양한 성과 창출에 힘쓰고 있다.
특히, 2020년에는 식물, 수산생물, 해양미생물 전체 유전체 해독(24종), 해양수산생물 유용유전자 확보(27건), 해양수산생물 유전체 전문인력 양성(42명)으로 목표치를 20% 이상 크게 초과 달성하였다. 또한 2020년도 논문 및 특허의 생산효율은 국가R&D 평균대비 우수한 성과를 달성하였으며, 특히 논문의 생산효율은 기초연구 유형의 사업임을 감안하더라도 매우 높은 수준을 달성하였다.
(3) 해양바이오 전략소재 개발 및 상용화 지원
2019년에는 해양바이오 전략소재 개발 및 상용화 지원 사업에 착수하여 해양수산생물자원 유래 기능성식품, 기능성 화장품, 의료기기 활용소재의 식약처 허가를 통한 실용화 기술개발을 추진 중에 있다.
본 사업은 해양수산생명공학 기술개발사업의 일몰 후속사업으로 대학 및 연구소 중심의 R&D 지원으로 확보된 원천기술을 활용하여 기업중심의 상용화 연구를 지원하는 것이다. 해양생물자원을 활용한 기능성분 확보기술, 대량생산 및 표준화기술, 효능검증 기술개발을 통해 단기 실용화 성과 창출에 박차를 가하고 있다.
2021년에는 홍조류 유래 신소재 네오아가로올리고당(DY-NAO)의 면역기능 개선 기능성 인체적용시험 및 건강기능식품 시제품 개발 등 식약처 인허가를 통해 성과를 본격 창출할 예정이다.
(4) 해양생명자원 소재활용 기반 구축(국가생명자원 선진화 (다부처)사업)
바다라는 공간적 특수성으로 인해 유용한 해양생명소재 확보에 어려움을 겪고 있는 산․학․연 연구자에게 해양동물․식물, 미생물, 공해상 자원으로부터 건강기능식품, 화장품, 의약품 등 제품개발에 필요한 소재(항암, 항산화, 항바이러스, 항염증, 항균 등)를 발굴하고 제공하기 위해 2021년 동 사업을 신규로 추진하였다. 동 사업을 통해 앞으로 해양생명자원 소재를 이용한 제품개발이 활성화될 것으로 기대된다.
<해양생물자원 소재정보시스템 구축 및 운영 개념도>
|
해양생물자원 데이터 체계화 및 확보 |
|
해양생물자원 소재 관리시스템 구축 |
|
포털 운영(해양생물자원 활용 촉진) |
|
|
||||
(5) 빅데이터 기반 해양 바이러스 제어 및 마린바이오틱스 개발
2021년 신규사업으로 해양 마이크로바이옴 연구를 통한 ① 항생제 대체물질 등 친환경 소재 개발, ② 해양환경내 감염성 바이러스 제어기술개발 및 ③ 해양소재(해조류) 유효성 실증 지원을 추진한다.
먼저 ① 해양생물 마이크로바이옴 분석, 확보, 검증 및 활용기술 개발을 통해 해양생물 마이크로바이옴 연구를 위한 기술개발 및 해양마이크로바이옴 빅데이터 플랫폼 구축, 해양동물/플랑크톤/거대조류 성장개선 마린바이오틱스 개발을 추진하고 ② 해양환경내 감염성 바이러스 빅데이터 기반 진단, 치료 및 제어기술 개발을 통해 해양에 서식하는 주요 감염성 바이러스 인벤토리 구축하여 감염성 해양바이러스 진단기술개발 및 해양생물 유래 항바이러스성 소재 발굴을 추진한다. 그리고 ③ 해조류 기반 바이오 헬스케어 유효성 소재 실증지원을 통해 해조류 생리활성물질 등을 활용한 신약 및 기능성 소재 개발, 해조류 기반 바이오헬스케어소재 표준화 플랫폼 개발을 추진한다. 해조류 기반 기능성 소재의 유효성 평가를 통한 표준화 플랫폼 개발 및 식의약 소재 개발이 될 수 있도록 임상 지원 CRO 기관과 프라임제약 및 일화 등의 제약사가 참여한다
(6) 해양바이오 수소 생산 상용화 기술개발(2021 신규)
해양수산부는 해양바이오수소 생산 플랜트 설계, 플랜트 운영 최적화 및 고효율 수소정제시스템 개발 등을 통하여 기 구축된 해양바이오수소 플랜트 운영 최적화 시스템 및 고효율 바이오 수소 정제시스템을 개발하여 상용화 기반을 마련한다. 원료 자동공급 시스템 개발과 99.8% 이상의 수소 생산을 위한 플랜트 맞춤형 정제기술을 개발하여 2023년도까지 3개월 이상 실증운전을 통해 바이오수소 플랜트 전체 공정 및 생산 수소에 대한 국내 KTL 인증완료를 목표로 하고 있다.
마. 향후 계획
2021년 1월 발표한 글로벌 해양바이오시장 선점 전략은 향후 10년간 해양바이오 육성전략을 담은 계획이다. 해양수산부는 동 계획을 바탕으로 해양자원의 경제적 가치를 실질적인 산업화에 적용하고 융복합 연구개발이 활발히 진행되도록 산업화 지원정책을 확대 추진할 계획이다.
특히, 해양환경, 탄소저감 등 글로벌 이슈에 대응하는 R&D개발에 우선 집중 투자한다. 일례로 새우각, 굴패각, 어류껍질 등 수산부산물의 기능성 바이오 소재로의 개발 및 친환경 플라스틱 바이오소재 개발 등을 통해 자원 선순환을 유도하고 탄소중립 정책에 부합하는 문제해결형 R&D 개발을 통해 수산업의 고부가가치화와 더불어 해양환경오염, 탄소저감 등 환경 문제해결에도 적극적으로 대응한다. 이와 더불어, 그간 중요 산업소재였으나 수입에 의존했던 바이오소재들의 국산화 기술개발을 통해 수입대체효과를 창출하고 국내 바이오소재산업 성장을 도모할 계획이다.
해양바이오는 단순히 육상자원의 활용 대체수단뿐만 아니라 육상자원 기능을 뛰어넘는 시너지 효과 및 새로운 기능성을 제시하는 역할을 해야 한다. 다양한 병원체의 출현에 다른 진단소재 및 신약 개발, 고령화에 따른 신체기능 강화 소재 및 헬스케어 제품 개발, 해양자원의 형태적․생리적 기능 모방 기술을 화학 소재, 센서, 로봇 등 타 기술 분야와 접목한 융복합 신소재 개발은 국산화가 시급한 분야이다. 이를 위해, 해양생명자원 소재정보관리 시스템 구축 및 운영기반 마련, 해양생물자원 소재 활용 고도화 모델 개발 등을 표준화하는 방안이 필요하다.
해양수산부는 해양생명자원 소재활용 기반 구축(국가생명자원 선진화: 다부처) 사업을 통해 국립해양생물자원관(MABIK)이 해양생물에 관한 수집․연구 및 활용기반 구축 등 업무를 표준화하고 자원관리를 바탕으로 한 해양수산생명공학에 대한 체계적인 정책을 운영해 나갈 계획이다. 또한 산․학․연의 연구체계 및 비R&D 연계를 강화하는 등 민간이 할 수 없는 다양한 공공분야의 투자와 인프라 구축을 적극적으로 주도하여 해양생명 자원의 보존 및 활용방안을 수립한다. 또한, 국내 산업과 시너지 효과가 기대되는 외국 연구에도 정보를 제공하여 국가 간의 다학제적인 연구개발이 도출되도록 지원해 나갈 것이다.
해양수산부는 이러한 다양한 산업육성정책 뿐만 아니라, 해양바이오 네트워크 구축, 해양바이오 전문인력 양성 등 기반체계 마련에도 힘써 민․관 협력을 통해 해양바이오 산업 생태계를 조성하는 등 해양바이오산업이 활성화 될 수 있도록 지속적으로 지원하고 육성해 나갈 방침이다. 특히 기업의 기술․특허인증 지원 등 사업화 지원 플랫폼, 벤처창업 컨설팅 등 기업육성, 원료소재 수입 대체기술 산업화 지원 등 산업화 지원체계를 강화하고 해양바이오 분야의 지속적인 수요 발굴 및 해양바이오 R&D 혁신을 달성하도록 정책기획과 지원 확대를 지속적으로 추진하여 해양바이오 분야를 미래 성장동력 산업으로 적극 발굴ㆍ지원할 계획이다.
9. 생명연구자원 분야의 육성 및 관리
가. 생명연구자원 및 통합관리(과기정통부)
(1) 개요
생명연구자원은 생명공학 연구의 기반이 되는 자원으로 인체유래물, 동물, 식물, 미생물 등 연구에 활용되는 실물 소재와 이로부터 산출된 유전체, 단백체, 구조, 건강 등의 정보를 포함한다.
코로나19와 같은 팬데믹 위기, 기후변화, 식량부족 등 인류가 직면한 난제를 해결하는 생명공학의 핵심소재인 생명연구자원은 의약품, 건강기능식품, 농업 등의 산업의 고부가가치를 창출할 수 있는 잠재적 가치를 가지고 있다. 이로 인해 전 세계적으로 생명연구자원에서 확보와 활용의 중요성이 증대되고 있으며, 미국, 독일, 일본, 우리나라 등 주요국들은 국내외 유용 생명연구자원을 확보하여 연구자 및 산업계에 제공하여 생명공학 연구 및 산업화를 지원하고 있다.
(2) 추진 경과
과학기술정보통신부는 관계부처 합동으로 2009년 제정된 ‘생명연구자원의 확보․관리 활용에 관한 법률’에 따라서 바이오 소재와 데이터를 포함한 개념인 생명연구자원의 효율적인 확보와 체계적인 관리를 통하여 지속가능한 활용을 도모하고, 생명공학의 발전 기반을 조성하기 위한 기본계획을 수립하고 이행을 주도해오고 있다.
2010년 수립된 ‘제1차 생명연구자원 관리 기본계획(2011∼2020)’에서는 소재의 확보 중심의 정책이 추진되었으며, ‘제2차 생명연구 자원관리 기본계획(2016∼2020)’이 수립되면서 세포주, 마우스 등의 국가 차원에서 중요한 국가전략 생명연구 자원을 중심으로 바이오 소재의 관리가 추진되었다. 최근 바이오기술의 급속한 발전으로 생명의 실체와 그 기능에 관한 데이터가 폭발적으로 증가함에 따라, 인공지능기술(AI) 등을 이용한 빅데이터 분석이 바이오 연구개발 및 산업 발전의 필수 요소가 되고 있다. 이러한 시대적 흐름에 맞추어 기존 소재 중심의 계획에서 바이오 소재와 데이터를 아우르는 ‘제3차 국가생명연구자원 관리․활용 기본계획’을 수립하였다.
(3) 주요 정책
‘제3차 국가생명연구자원 관리․활용 기본계획’은 2020년부터 2025년까지 6년간의 정책 방향성을 제시하는 계획으로 ‘바이오 강국 실현을 위한 생명연구자원 인프라 조성’이라는 비전을 제시하였다.
이를 달성하기 위해, 아래와 같이 데이터 기반 바이오 연구환경 구축, 수요자 맞춤형 바이오 소재 활용 촉진, 바이오 재난 대응을 위한 인프라 비상 운영 체계 정립 및 지속가능한 민관협력 기반조성을 주요 전략으로 수립하였다.
(가) 데이터 기반 바이오 연구환경 구축
과기정통부는 관계부처와 함께 부처․사업․연구자별로 흩어져 있는 바이오 연구 데이터를 통합 수집․공유 환경을 조성하기 위해 ‘국가 바이오 연구데이터 스테이션’ 구축 계획을 수립하였다. 이를 위해 국가 바이오 R&D사업을 데이터 중심으로 관리하기 위해 ‘국가생명연구자원 수집․관리 표준지침’을 제정하고, 데이터 등록 시 인센티브를 제공하여 신설 제도의 조기 착근을 유도할 계획이다.
또한, 데이터 활용을 증진시키기 위해 국제표준 및 국내 활용 수요를 기반으로 데이터 등록 양식을 표준화하고, 이를 기반으로 데이터 등록 품질을 관리하여 산․학․연에 제공할 계획이다. 또한, 수집된 데이터를 활용한 분석 및 협업 연구를 촉진하기 위해 다양한 데이터 분석 툴을 개발하고, 온라인 협업 공간 등도 함께 제공할 계획이다.
(나) 수요자 맞춤형 바이오 소재 활용 촉진
부처별 운영하던 기존 274개 소재자원은행을 구조 조정하여, 14개 분야의 소재 클러스터로 조성하고, 소재 클러스터별 맞춤형 육성전략을 수립하여 수요자 맞춤형 소재 및 서비스가 적시에 제공될 수 있도록 지원 확대를 추진하고 있다.
또한, 소재 품질관리 강화, 소재 특성정보 확보, 새로운 소재 개발 등을 통해 혁신형 R&D를 촉진하고, 소재자원은행의 운영을 정기적으로 점검하는 등 관리를 강화해 나갈 계획이다.
(다) 바이오 재난 대응을 위한 인프라 비상 운영 체계 정립
코로나19와 같은 바이오 재난 발생 시, 진단기기․치료제․백신 등을 신속히 개발할 수 있도록 감염병 대유행 전에 연구개발에 필요한 바이러스, 검체 등을 신속하게 확보하여 공급하기 위한 인프라 등을 확대하고, 표준화된 동물 실험 플랫폼을 사전에 구축하여 지원할 계획이다.
(라) 지속가능한 민관협력 기반조성
각 부처가 개별적으로 추진해 온 사업들의 구조를 개편하여 다부처사업으로 통합 운영함으로써, 범부처 정책 협력체계를 공고히 하고, 산․학․연․병의 생명연구자원 활용 인력을 양성하기 위해, 온․오프라인으로 기초과정에서부터 전문과정에 이르기까지 다양한 교육 프로그램을 운영할 계획이다.
(4) 주요 사업
과기정통부는 관계부처와 협력하여 바이오 연구․산업 활동에 필요한 생명연구자원의 활용 인프라를 선진화시키기 위해 부처별로 추진해 온 사업을 통합하여 ‘다부처 국가생명연구자원 선진화 사업’으로 재편하였다.
(가) 2020년까지 생명연구자원 관련 사업을 부처별로 수행
과기정통부 바이오․의료기술 개발사업, 복지부(질병청) 포스트게놈 다부처 유전체 사업, 해수부 해양수산 생명공학 기술개발 사업, 농진청 포스트게놈 다부처 유전체사 업 등 정부 부처는 2020년까지 생명연구자원 관련 사업을 개별적으로 추진해 왔다.
관계부처는 2020년 기준으로 생명연구자원 인프라의 운영․육성에 965억 원(바이오 데이터 엔지니어를 2,000명을 육성하는 2020년도 추경사업 예산 264억 원 포함)을 투자하였다. 그 결과 각 부처가 운영하는 인체유래물, 모델동물 등 14개 분야 소재자원은행을 통해 소재 자원 104만 6,027점 발굴․확보, 92만 413점 분양의 성과를 도출하였으며, 부처 주요 기관의 바이오 데이터를 3,439TB을 확보하였다.
(나) 다부처 국가 생명연구자원 선진화사업
과기정통부는 관계부처와 합동으로 범부처 생명연구자원 정책을 지속적으로 협력 추진할 수 있도록 국가 생명연구자원 관련 정부수탁사업(이하, 다부처사업)을 중심으로 생명연구자원 사업을 추진하고, 회계 불일치, 기관고유사업 등의 사유로 다부처사업 편성이 어려운 사업(이하, 연계사업)도 다부처사업과 동일 관리체계에서 협력하고 있다.
이를 위해, 다부처사업과 연계사업의 지속적인 협력체계 구축과 운영을 위해 관련 사업의 공동운영규정을 마련하여 자원 분야 단일의 사업계획을 수립하고, 사업의 주요 사항을 논의․협력․심의하는 사업 추진위원회 성격의 선진화위원회를 운영하고 있다.
또한, 분야별 사업 기획의 검토, 과제 선정․평가 결과를 심의하는 발전위원회와 부처간 협의사항을 논의․조정하기 위한 범부처 실무협의회도 구분․운영한다. 이를 통해 바이오 연구․산업 혁신을 촉진하기 위한 국가 생명연구자원(소재+데이터) 인프라 선진화하여, 바이오 연구 활동에 사용되는 실물 소재 자원과 R&D를 통해 생산되는 연구 데이터를 체계적으로 확보하여 산․학․연․병에 제공할 계획이다.
2021년 기준으로 ‘다부처 국가 생명연구자원 선진화사업’에 1,124억 원이 투자되었으며, 연계사업에는 433억 원이 투자되어, 총 1,557억 원이 투자되었다. 참고로, 정부수탁사업인 ‘다부처 국가 생명연구자원 선진화사업’은 소재자원은행 관련 사업인 ‘바이오 연구소재 활용기반조성’, 데이터 공유 플랫폼 구축 등에 대한 ‘바이오 연구데이터 활용기반 조성사업’, ‘국가 마우스 표현형 분석사업’으로 구성되어 있다.
(5) 향후 계획
‘제3차 국가생명연구자원 관리․활용 기본계획’을 통해 과기정통부를 중심으로 관계부처가 협력하여 ‘바이오 연구데이터 활용 환경을 조성’하고 ‘바이오 소재의 자립률 제고’를 추진할 계획이다.
바이오 연구데이터 측면에서는 바이오경제강국 실현 및 데이터 기반연구 혁신을 위해 국가 역량을 결집하고, 바이오 연구데이터의 생산․수집․관리․활용을 위한 데이터 공유 생태계를 조성할 계획이다. 이를 통해 바이오 연구데이터 재사용 및 통합 활용으로 연구 효율성을 제고하고, AI 등 신기술 기반으로 바이오 빅데이터 활용 및 연구성과 증진을 추진할 계획이다.
바이오 연구 소재 측면에서는 소재자원은행을 14대 분야로 클러스터화하고, 클러스터 내 또는 클러스터 간 협력을 통한 시너지를 창출하여, 소재 공급 및 소재 활용지원 서비스의 질을 향상시킬 계획이다. 이를 통해, 연구자가 원하는 바이오 소재를 신속 확보․제공하고, 양질의 바이오 소재 활용지원 서비스의 이용이 가능하도록 추진할 계획이다.
나. 농업 분야(농림축산식품부)
농림축산식품 분야는 1987년 농촌진흥청에 종자은행을 설립하는 등 일찍부터 생명자원의 중요성을 인식하고 선도적으로 자원 보존 및 관리를 시작해왔으며 이후 2007년 ‘농업유전자원의 보존․관리 및 이용에 관한 법률’을 제정하여 종합적인 농업생명자원관리의 제도적 기반을 마련하게 되었다.
이후 정부조직 개편 등에 따라 몇 차례 개정을 거쳐 현재의 ‘농업생명자원의 보존․관리 및 이용에 관한 법률’로 개정(2019.8.)되었으며, 본 법령에 따라 산림생명자원은 산림청, 수의생명자원은 농림축산검역본부, 그 외 농업생명자원은 농촌진흥청에서 각각 전담해 관리하고 있으며 농림축산식품부에서는 제도 및 정책을 총괄하고 있다. 또한, 민간 연구소, 대학, 지자체 농업기술센터 등의 역량을 활용하기 위해 138개의 농업생명자원 관리기관을 지정하여 농업생명자원의 수집, 보존, 분석 및 연구를 지원하고 있다.
[표 2-36] 농업생명자원 관리기관 지정 현황(2020.12. 기준)
|
구분 |
계 |
종자 |
영양체 |
미생물 |
가축 |
곤충 |
|
합계 |
138 |
30 |
82 |
11 |
12 |
3 |
|
지자체 |
69 |
6 |
51 |
0 |
9 |
3 |
|
대학․민간 |
69 |
24 |
31 |
11 |
3 |
- |
또한, 상기 법령에 따른 법정 종합계획인 ‘농업생명자원 보존, 관리 및 이용활성화를 위한 기본계획’에 따라 자원관리 정책을 추진하고 있다. 2014∼2018년까지 추진한 제2차 기본계획을 통해 자원 보유점수가 128만 점에서 294만 점으로 두 배 이상 증가하는 등 대폭 확충되었으며 2019년에 새로 수립된 제3차 기본계획은 이러한 자원을 이용한 육종, 소재 개발 등 ‘농업생명자원의 고부가가치 산업화 촉진’을 목표로 2023년까지 5년간 추진될 계획이다.

[그림 2-5] 제3차 농생명자원 보존
제3차 기본계획은 ① 양질의 자원 확보, ② 자원 보존․관리 강화, ③ 수요자 중심의 정보 제공 ④ 자원이용 활성화의 4대 전략으로 구성되어 있다. 유용․토종자원의 집중 수집 및 특성평가를 통한 우수자원을 확보하고 자원 보존․증식기술의 고도화, 국외반출, 자원관리 등의 규정을 개정하여 자원관리 강화를 하는 한편 생명자원 정보시스템 및 관련 콘텐츠 확충 및 유전자원 이익 공유에 관련된 국내외 쟁점 분석, 협력을 추진하고 유용미생물은행 등 자원활용 인프라 구축, 분양 활성화, 자원활용 기술개발 등을 추진할 계획이다.
한편 농식품부는 기관별로 분산 관리되고 있는 생명자원DB를 통합해 수요자 중심의 정보 제공을 위한 생명자원정보서비스(BRIS.go.kr)를 구축․운영하고 있다. 농식품부는 생명자원DB 및 관련 특허, 전통지식 등 정보와 카드뉴스, 교육 콘텐츠 등을 지속적으로 확충할 계획이며 특히 2018년 8월부터 본격적으로 국내에도 관련 법령이 시행된 나고야의정서 관련 정보제공을 강화할 계획이다. 마지막으로 자원 이용활성화를 위해 농업생명자원의 분양 및 사후관리를 강화하고 관련 연구 및 인력양성에 대한 지원을 확대할 계획이다.
2020년 말 기준 농식품부 및 관계 기관에서 보유한 자원은 농진청 71만 6,189점, 산림청 246만 4,228점, 검역본부 9,141점 등 총 318만 9,558점으로 세부 분류별 보유현황은 아래와 같다.
[표 2-37] 농업생명자원 보존 현황(2020.12. 기준)
|
기관 |
분야 |
종수 |
보존점수 |
|
농진청 |
종자 |
1,599 |
240,423 |
|
영양체 |
1,488 |
26,388 |
|
|
미생물 |
8,193 |
25,540 |
|
|
가축 |
17 |
423,459 |
|
|
곤충 |
21 |
379 |
|
|
계 |
11,318 |
716,189 |
|
|
산림청
|
종자 |
5,893 |
55,144 |
|
영양체 |
8,416 |
969,279 |
|
|
미생물 |
3,702 |
63,616 |
|
|
DNA |
641 |
160,740 |
|
|
현지내 보존집단 |
21 |
(3,405ha) |
|
|
표본 |
22,575 |
1,215,449 |
|
|
계 |
41,248 |
2,464,228 (3,405ha) |
|
|
검역본부 |
병원균 |
383 |
7,987 |
|
항혈청 |
2 |
285 |
|
|
세포주 |
61 |
132 |
|
|
기타 |
132 |
737 |
|
|
계 |
578 |
9,141 |
|
|
합계 |
53,144 |
3,189,558 |
|
주) 농업생명자원 종수는 단순 합산으로 일부 중복이 있을 수 있음.
다. 보건의료 분야(보건복지부)
미래 보건의료연구의 핵심 인프라인 인체자원의 국가적 종합관리를 위해 한국인체자원은행사업(KBP:Korea Biobank Project)을 추진하고 있으며, KBP 1, 2기(2008~2015)의 성과를 바탕으로, 미래 보건의료 연구 및 관련 기술개발에 있어 산․학․연 전반에 걸친 적극적인 지원을 목표로 KBP 3기(2016~2020)를 추진하고 있다.
(1) 추진배경
① 개인별 유전체 연구의 급속한 발전에 따라 보건의료연구 및 산업계의 대량 인체자원 수요 증가
② 그간 성과를 바탕으로 보다 강화된 고품질 특화자원의 수집체계 마련, 분양 확대 등을 통해 구체적 성과창출 필요
(2) 추진전략
① 바이오뱅크 포럼 운영, 인체자원은행-보건의료 R&D 연계 등 수요자 친화적 바이오뱅크 운영
② 질환중심형 바이오뱅크 구축․운영, 산업계 분양 확대 등 바이오뱅크의 보건의료 R&D 전주기 지원 성공모델 제시
③ 바이오뱅크 국제협력 체계 구축, 인체자원 관리 기술 및 시스템 강화, 인체자원단위은행별 자원 수집․활용체계 강화 등 바이오뱅크 운영 고도화
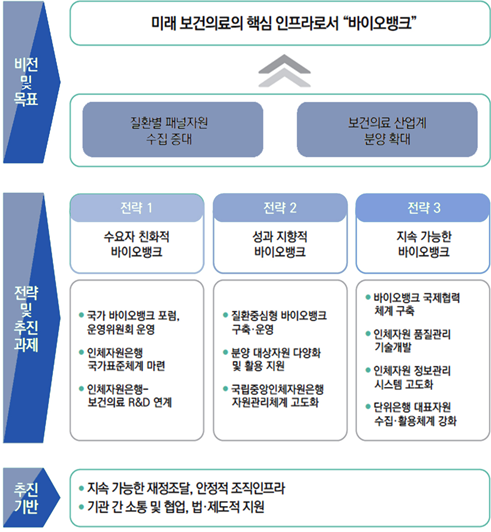
[그림 2-6] 3기 한국인체자원은행사업(KBP) 추진전략 및 과제
(3) 추진 현황 및 성과
①국립중앙인체자원은행과 17개 인체자원단위은행 및 2개 협력병원이 네트워크를 구성하여 다양한 코호트 및 질환군 인체자원 수집
②2020년 12월 기준, 99만여 명분 인체자원 확보, 3,597여 개 과제에 분양, 논문(1,365여 편) 및 특허(109건) 성과 창출
③인체자원 분양데스크, 인체자원연구지원센터 운영 등 연구자 중심의 분양지원 체계 구축 및 실무자 교육, 인체자원은행 운영지원 등 인체자원 관리 표준화를 통해 인체자원 국가 종합관리체계 마련
④특정질환 극복을 목적으로 보건의료 R&D 연구를 위한 고부가가치 자원을 계획적으로 확보하기 위한 ‘질환중심형 바이오뱅크’ 구축

[그림 2-7] 한국인체자원은행네트워크 운영 현황

[그림 2-8] 중앙은행 및 인체자원단위은행 수집
(4) 향후 추진계획
① 바이오뱅크 포럼 운영 등 수요자 중심의 소통채널 마련 및 바이오뱅크 인지도 향상을 위한 홍보사업 지속 전개
② 인체자원 품질관리기술 개발, 자원 및 정보 품질 관리 확대 등 지속적인 자원 신뢰도 제고
③ 체액자원, 질환패널자원 등 분양대상자원 지속 확대
④ 산업체 분양 확대 등 다양한 연구․개발 분야의 효율적 지원
⑤ 질환중심형 바이오뱅크 지속 운영
라. 야생생물자원 분야(환경부)
(1) 자생생물자원 관리정책
환경부는 ‘생물다양성협약(CBD: Convention on Biological Diversity)’9)에 따라 생물다양성 보전과 생물자원의 지속가능한 이용 정책을 보다 체계적으로 추진하고, 생물주권을 강화하려는 국제적 추세에 대응하기 위하여 ‘생물다양성보전 및 이용에 관한 법률’을 제정(2012.2.1.)하였다.
이에 따라 정부는 동 법 제7조에 생물다양성의 보전과 그 구성요소의 지속가능한 이용을 위한 범부처 법정전략으로 국가 생물다양성 전략을 5년마다 수립하고 있으며, 제4차 국가 생물다양성 전략(2019∼2023)에 따라 매년 시행계획을 수립․시행하고 있다. 또한, ‘생물자원관의 설립 및 운영에 관한 법률’ 제 4조에 따라 제1차 생물자원관 기본계획(2021∼2023)을 수립(2020.12.)하였다.
(2) 자생생물자원의 확보․관리․활용 연구현황
환경부는 국가생물자원의 조사, 보전, 관리와 현명한 이용을 위한 정책을 추진하고 있다. 2020년 12월 현재까지 지속적인 투자와 연구를 통해 5만 4,428종의 국가생물종목록을 구축하고 305만 점의 생물자원(표본, 생물소재)을 확보하여 관리하고 있다. 자생생물 1만 6,044종의 종속지적 연구를 수행하여 2020년까지 한국 생물지를 국문과 영문으로 총 430권 발간하여 배포하였다.
기후변화로 야기되는 환경문제 생물종 대응을 위해 9,530종에 대한 생물종 바코드 정보를 구축하였으며, 이를 통해 인천 등 전국 수돗물 유충 사태가 발생했을 때 종 동정(同定/Biological Identification) 정보를 제공한 바 있다. 아프리카돼지열병(ASF), 조류독감(AI) 등 방역관리를 위해 전국 280개소에서 철새 분포 및 이동을 모니터링, 멧돼지 등의 서식밀도 분석, 야생생물 수출입 정보화 사업 등을 수행하고 있다. 유전자원 정보, 유용성 정보 등 부처별로 관리되는 생물 다양성 정보를 통합하여 표준화한 1,340만여 건(2020.12.)의 정보를 국가생물다양성 정보공유체계(www.kbr.go.kr)를 통해 필요한 부처에 제공하고 있다.
나고야의정서 비준(2017.5.19.) 이후, 국가책임․점검기관 같은 주요 기관의 지정, 유전자원정보관리센터 설치․운영, 국내 유전자원 접근신고, 내국인이 해외 유전자원을 이용하는 경우의 절차준수 신고, ABS 정보공유체계 운영 등을 담은 ‘유전자원의 접근․이용 및 이익공유에 관한 법률(이하 유전자원법)’을 제정(2017.1.17.)하는 등 구체적인 국내 이행․지원 체계를 구축해 나가고 있다. 나고야의정서 이행 법률 제정을 통해 국내 유전자원에 대한 주권을 강화하고, 유전자원정보관리센터 설치(2018.3.30.) 및 부처 합동 통합신고시스템(2018.8.18.)을 구축하여 운영하는 등 산업계 지원정책을 단계적으로 추진하고 있다.
국립생물자원관에서는 생물자원의 보존과 지속가능한 이용을 위해 생물다양성 우수지역 등에서 전해져 내려오거나, 의서, 농서 등 주요 고문헌 30여 종에 기술된 전통지식 총 12만여 건을 수집하고, 전통지식 대상종, 해외활용사례생물종 근연종 대상 등의 효능․성분분석 및 유전체 분석을 수행하여 환경생물산업을 지원하고 있다. 2020년까지 국내 자생생물 797종에 대한 항산화, 항염 등을 연구하여 유용성 정보를 확보하였으며, 최근에는 자생 미생물을 활용한 천연식물보호제 발굴 등 환경보전․관리와 관련한 자생생물 활용 연구를 진행하고 있다.
다양한 자생생물 생물소재의 안정적 보존과 지속가능한 이용을 위해 4개의 야생생물소재은행(유전자원, 종자, 천연물, 배양체)을 운영하고 있다. 고품질 및 수요자 맞춤형 생물소재를 확보하고 관리하여 다양한 생물소재를 산업계, 학계, 연구소에 맞춤형 분양서비스로 제공하고 있다. 현재까지 기원이 명확한 다양한 생물소재 22만 493점을 확보․관리하고 있으며 고품질 생물소재 1만 1,470점을 분양하고 있다. 잠재적 활용가치가 높은 해외 생물자원 소재 접근을 위해 캄보디아, 베트남, 미얀마, 탄자니아 등 10개국 13개 기관과 MOU/MOA를 체결하여 해외 네트워크를 확장하고 있다. 특히, 지금까지 이들 국가와 공동연구를 통해 자국 생물다양성 도감과 자료집 27권을 발간하여 기증하였고 24건의 특허도 공동출원하여 국가 간 신뢰도를 높이고 있다. 캄보디아와 공동연구를 통해 현지 식물의 미백 효능을 확인하고 국내 기업에 기술을 이전하여 화장품을 개발한 것은 해외생물자원 활용의 좋은 방향성을 제시해 주고 있다.
(3) 향후 계획
앞으로 자생생물종의 신규 발굴 난이도는 점차 증가할 것으로 예상되고, 국내 전문인력도 부족한 실정이다. 이를 극복하기 위해, 곤충, 무척추동물, 균류 등 발굴 가능성이 크지만 전문가가 부족한 분야를 중심으로 생물다양성 전문인력 양성사업을 통해 부족한 생물분류군 전문가를 양성하고, 생물다양성 협약 대응 생물학, 국제학, 법학 등 다학제적 전문인력 인프라를 구축해 나갈 예정이다. 또한, 분류전문가가 국내에 적거나 없는 분류군에 관해서는 해외 공동연구를 통한 지속적인 발굴 노력을 통해 2025년까지 국가생물종목록 6만 2,600종 구축 목표에 이바지하고자 노력하고 있다.
향후 기후변화․생물종 감소 등 인류가 당면한 전 지구적 위기를 해결해 나가기 위해 기후변화 대응 등 생물다양성 평가 및 변화 예측, 마이크로바이옴 및 유전체 정보 확보, 환경문제 생물종의 선제적 대응체계 마련을 위한 대발생 생물의 분류․생태․특성 등을 활용한 종판별 체계 구축, 야생생물로 야기될 수 있는 질병에 대응하기 위한 야생생물 전주기 관리 기반 등을 마련하고자 한다.
이러한 생물종 정보를 기반으로 지금까지 알려지지 않았던 생물자원의 가치를 발굴하는 유용성 연구결과는 식품, 의약품, 향장품 등으로의 활용을 통한 생물주권 확보의 기반이 되고, 환경현안 대응 자생 유용생물 활용한 한반도 환경에 적합한 환경영향평가 기준 마련 등 다양한 분야에서 새로운 생물자원 활용 가능성을 열어줄 수 있을 것으로 기대된다. 동시에 부족한 국내 생물자원을 대체할 해외생물자원 확보를 강화하기 위해 협력국을 동남아시아에서 남미, 아프리카까지 확대하고 국내 생물산업 지원을 위한 영역을 넓혀가고자 한다. 생물자원의 가치 창출 및 지속가능한 이용기반을 위해 유용 생물소재를 확보하고, 우수 생물소재 산업의 성공적인 비즈니스 모델 창출 지원을 위한 ‘생물소재 클러스터’를 2021년 12월에 착공하여 2022년에 완공할 예정이다.
나고야의정서 대응 및 유전자원법 이행을 위한 관계부처 협력강화 및 법 제도 정비, 수요자 맞춤형 ABS 컨설팅을 통한 산업계 인식제고 사업을 지속적으로 추진하고자 하며, 국내․외 유관기관 및 민간이 보유하고 있는 생물다양성 및 생물자원 정보를 종합 관리하여 국가 차원의 정보 연계․구축․운영 등 수요자 맞춤 정보 제공 체계를 마련하고자 한다.
마. 해양수산 분야(해양수산부)
(1) 추진 배경
삼면이 바다로 둘러싸여 있는 우리나라에 있어서 해양은 국민의 주요 삶의 터전이다. 해양의 생명자원은 과거부터 우리나라 국민의 에너지원(음식)으로서 중요한 역할을 했을 뿐만 아니라 민간의술이나 전통문화에도 많은 영향을 끼쳐왔다. 그럼에도 불구하고 최근까지 해양수산생명자원의 육성 및 관리 인프라는 육상에 비해 매우 빈약하였다.
이를 해결하기 위해 해양수산부는 자원으로서의 해양생물의 중요성을 인식시키고, 효율적인 관리와 지속가능한 이용 및 해양수산생명공학의 경쟁력 확보를 위해서 ‘해양생명자원의 확보․관리 및 이용 등에 관한 법률’을 2012년에 제정하였다. 2017년에는 법률의 전부개정을 통해 해양생명자원과 수산자원으로 통합하였고, 2020년 5월에는 자원의 무분별한 해외반출을 막기 위해 외국인의 자원획득 및 국외반출과 관련된 조항을 개정하여 절차를 명확히 하였다.
(2) 추진전략 및 정책
해양수산부는 제1차 해양수산 생명자원관리 기본계획(2019∼2023)을 수립하고 4개 추진전략과 13개 추진과제를 통해 인프라 구축부터 활용까지 해양수산생명공학의 국제 경쟁력을 확보하기 위해 노력하고 있다.

(3) 추진 현황 및 성과
(가) 국내 해양수산생명자원
해양수산부는 해양수산생명자원 책임기관인 국립해양생물자원관(해양생물) 및 국립수산과학원(수산생물)과 함께 해양수산생명자원조사, 기탁등록보존기관(23개) 운영 사업 등을 통해 해양생명공학 인프라 지원 체계를 구축하고 있다.
2021년 3월 기준 국내에 기록된 해양수산생물종은 1만 4,507 종이며, 이와 관련된 정보는 해양생명자원통합정보시스템을 통해 확인할 수 있다. 또한, 등록된 종 중 연구를 위해 배양가능한 동식물 자원이나 미생물자원, 추출물 등은 연구를 위해 무료 분양 시스템도 운영하고 있다.
[표 2-38] 국내 해양수산생물종(2021.3월 기준)
|
구분 |
기록종수(종) |
실물표본 확보종수(종) |
확보율(%) |
|||||
|
2018년 |
2021년 |
2018년 |
2021년 |
2018년 |
2021년 |
|||
|
해양척추동물 |
1,380 |
1,458 |
930 |
894 |
67.4 |
61.3 |
||
|
해양무척추동물 |
5,461 |
5,815 |
2,991 |
3,503 |
54.8 |
60.2 |
||
|
해양식물 |
1,011 |
1,071 |
738 |
784 |
73.0 |
73.2 |
||
|
해양미생물 |
5,504 |
5,995 |
2,962 |
3,347 |
53.8 |
55.8 |
||
|
담수생물 |
171 |
168 |
104 |
132 |
60.8 |
78.6 |
||
|
합계 |
13,527 |
14,507 |
7,725 |
8,660 |
57.1 |
59.7 |
||
(나) 해외 해양수산생명자원
2014년에 생명자원의 주권화을 인정하는 나고야의정서(ABS)가 발효됨에 따라 해양수산생명자원을 확보하고 이를 활용하는데 여러 가지 절차들이 생겨나고 있다. 해양수산부는 해외 해양생명자원을 원활히 확보하기 위한 ‘해외 해양생물자원 개발 및 활용기반 구축’ R&D 사업을 추진하여 11개국 18개 해역에서 3,197종, 2만 2,700점을 확보하는 한편, 해양생물을 이용한 신소재 후보물질 개발, 화장품 원천소재 확보, 치료제 선도물질 도출 등 성과를 이루었다.
또한, 베트남, 말레이시아, 러시아 등과 지속적인 교류를 통해 해양생명자원을 법적 절차에 따라 우리나라에서 연구할 수 있는 인적네트워크를 확보하고 있으며, 노르웨이, 인도네시아, 베트남, 말레이시아, 일본 등에 서식하는 해외 해양생명자원을 이용할 수 있는 법적․제도적 방안을 지속적으로 탐색하여 안내서를 출판하였다. 또한, 공해상의 생명자원은 국제 옵저버 등을 활용하여 비파괴적인 방법으로 생물자원을 확보하려고 노력하고 있다.
(4) 향후 계획
우리나라는 아직까지 해양생물 다양성이 많이 알려져 있지 않으며, 일부 수산종을 제외하고는 생리․생태적 정보도 밝혀져 있지 않다. 2023년까지는 제1차 해양수산생명자원 관리 기본계획의 주요 목표(기록종 서식지 확인율 60 % 이상 등)를 달성하기 위해 자원조사를 체계화하고 해양수산생명자원종 목록집을 갱신하는 등 해양수산생명자원의 관리능력을 제고하고, 이를 통해 해양생명공학 소재확보 및 인프라 구축할 예정이다. 또한, 연구 및 산업계 지원을 위해 해양바이오뱅크를 운영․활성화하고 전략소재 대량생산 기술을 개발하는 등 자원의 이용가치 제고 및 업계 지원기반을 마련하기 위해 노력할 예정이다.
10. 국제협력
가. 국제협력 R&D 및 국가 간 협력
(1) 과학기술 국제협력 개요
미국, 영국, EU 등 주요 선진국들은 연구개발의 비용과 위험부담을 분산시키고 글로벌 표준을 장악하기 위한 수단으로 R&D 국제협력을 강화하며 이를 기반으로 자국 중심의 국제협력 네트워크를 확대하고 있다. 우리나라 또한 국가경쟁력 강화, 전략적 R&D 국제화 기반 마련, 대외 지향적 경제구조와 자원 부족 등을 개선하고 해외 연구자 및 우수한 연구그룹과의 네트워킹을 구축하기 위한 국제연구를 강화하고 있다.
이러한 R&D 국제협력에 대한 필요성 및 중요도가 확대되고 있는 시점에서 COVID-19의 등장은 이론적으로만 강조된 국제협력의 필요성을 실질적으로 확인할 수 있는 계기를 마련하였다. 2019년 12월 발생한 COVID-19는 국제협력의 중요성을 실질적으로 보여주었고, 국제협력을 이전과는 다른 새로운 방향으로 정립하였다.
지금까지 국제협력 및 국제공동연구의 당위성은 개방형 혁신 촉진, 빅 사이언스 출현, 과학기술의 대형화, 복합화, 시스템화 등 R&D 비용 감소 측면 중심으로 강조되어 왔다.하지만 COVID-19의 출현은 기존 감염병 극복 패턴과 달리 전 세계가 팬데믹을 경험하게 하여 연구개발 형태를 단순히 비용절감 차원이 아닌 새로운 패러다임을 요구하는 형태로 바뀌었다. 무엇보다 COVID-19의 장기화로 인해 과학기술 국제협력의 형태는 비대면으로 변경되고 있다.10) 신종 감염병을 효과적으로 대응하고 확산을 방지하기 위해서는 단일 국가만의 노력으로 불가능하므로 국가 간 협력은 과학기술 중심으로 가치가 더욱 높아지는 것이 사실이다.
또한 R&D 자체적인 활동과 더불어 사회적 활동 또한 매우 중요한 개념으로 자리 잡았고 과학기술과 이를 추진하는 체계 및 제도와의 공진화가 더욱 중요해짐을 확인할 수 있다. 국내 사례에서도 알 수 있듯이 한국의 경우 백신개발 및 백신 제조 과정에서 뚜렷한 성과를 이루지는 못하였지만 COVID-19 방역 시스템 및 확진자 관리 등은 우수 사례로 평가된다. 예컨대 워싱턴 포스트(The Washington Post)는 한국의 COVID-19에 대한 선제적 대응을 세계적으로 우수한 사례로 칭찬을 아끼지 않았으며 로이터(Reuters) 또한 한국의 방역대책이 다른 나라에 좋은 참고가 되었다고 보도하였다.
보다 구체적으로 과학기술 측면에서 한국은 COVID-19을 신속하게 진단할 수 있는 진단키트를 개발하였고, 정책적 측면에서는 정보통신 기술 기반 민관협력 3T(Test-Trace-Treat) 중심의 대응책을 마련하며 K-방역모델을 구축하였다. 이는 주요국과 더불어 한국 사례에 국제적 관심을 끌게 하는데 긍정적인 작용을 하였다.
결국 COVID-19의 등장은 해외 주요국들이 과학기술 역량을 확보하는 과정을 자국의 노력으로만 한정하지 않으며 국제적인 협업을 통해 연구역량을 확보할 수 있는 수단으로 인식하도록 하는 계기가 되었다. 과학기술 국제협력은 자국의 과학기술 역량 확보와 더불어 국제사회 내 과학기술 기반의 위상을 높일 수 있는 수단으로 작동하게 하였다. 특히 COVID-19는 국제사회 위기 상황에서 과학기술을 중심으로 국가 간 공조체계를 강조하며 다양한 글로벌 문제를 해결할 수 있는 새로운 시도를 하게 한 것은 사실이다.
과학기술정보통신부의 국제협력국은 세계 50개국 이상과 동시에 국제공동연구를 진행하며 국가별로 차별화된 연구 분야를 중심으로 공동연구를 수행할 수 있도록 기여한 바 있다. 정부연구개발 예산 차원뿐만 아니라 실질적인 해외국가와 과학기술 공동연구만을 수행하는 국가간 협력기반조성사업의 예산을 살펴보면 최근 3년간 실적은 매년 약 15% 이상 증가하고 있다.
최근 3년 동안 캐나다, 슬로바키아, 크로아티아, 호주, 튀니지, 벨라루스 등과 새롭게 국제공동연구를 진행하였고 무엇보다 인력교류와 공동연구를 국가별로 차별화하여 추진하였다는 점에서 의미를 찾을 수 있다.
[표 2-39] 국제협력 분야 정부 R&D 예산현황(2016∼2019)
|
구분 |
2016년 |
2017년 |
2018년 |
2019년 |
연평균 증가율 |
|
정부연구개발예산 |
190,942 |
194,615 |
196,681 |
205,328 |
1.8 |
|
국제협력 분야 (예산 비중) |
3,019 (1.6%) |
3,219 (1.7%) |
3,557 (1.8%) |
3,779 (1.8%) |
5.8 |
|
과학기술정보통신부 |
1,709 |
1,684 |
1,873 |
2,071 |
4.9 |
[표 2-40] 국가간협력기반조성사업 예산 현황(2019∼2021)
(단위: 백만 원, %)
|
구분 |
2019년 |
2020년 |
2021년 |
연평균증가율 |
|
국가간협력기반조성사업 |
15,510 |
20,824 |
22,520 |
20.5 |
(2) 국제협력 현황
한국과학기술기획평가원이 OECD 회원국을 대상으로 매년 시행하는 국가 과학기술혁신역량평가에 따르면 2020년 한국의 과학기술혁신역량지수(COSTII: Composite Science and Technology Innovation Index)는 1만 2,246점으로 OECD 35개국 중 8위를 차지했으나, 3위 네덜란드와의 지수 차이가 1점 미만으로 이 구간의 경쟁은 치열한 것으로 나타났다.11)
기업 간 협력과 국제협력 항목 및 하위 지표들의 최근 5년간 순위는 하락한 것으로 나타났다. 특히 국제협력은 지난 10년간 순위가 하위권에 고착된 상태이다. 국제협력 항목순위는 전년 대비 2단계 상승했으나 최근 5년간 추이에서 내림세를 보였고, 하위항목인 GDP 대비 ‘해외투자+외국인투자’ 비중 순위 또한 최근 5년간 다소 큰 폭으로 하락하여 OECD 평가대상국 중 최저 수준에 이르렀다.
반면, 전년도와 비교할 때 한국의 국제협력 항목순위는 2단계 하락한 16위며, 조직(7위, ↓1), 지식창출(23위, ↓1)도 소폭 순위 하락하였고 조직은 하위의 2개 세부지표는 모두 값이 상승하며 순위가 유지되었으나, 7위였던 호주가 5위로 상승함에 따라 항목순위는 7위로 1단계 하락하였다. 지식창출은 특허 건수와 논문 수의 상승에도 불구하고 연간 R&D 투자 대비 특허 건수와 연구원 1인당 SCI 논문 수가 감소하여 항목 순위가 1단계 하락하였고 전반적 국제협력의 순위하락은 GDP 대비(해외투자+외국인투자) 비중의 감소가 주요 원인으로 알려졌다.
이러한 점은 여전히 국제협력 및 국제공동연구를 수행하기 위한 인프라 및 제도개선이 필요하다는 점을 시사하고 있으며 향후 우수한 해외 연구진과의 공동연구를 지원할 방안이 검토되어야 할 것이다.

자료: 2020년 국가 과학기술혁신역량평가, 과학기술정보통신부, KISTEP, 2021.
[그림 2-9] 2020년 국가별 과학기술혁신역량지수(COSTII)

자료: 저자 작성.
[그림 2-10] 한국의 네트워킹 부문 항목별 순위(2019∼2020)
(3) 생명공학 분야의 국제협력 현황
국제협력 및 국제공동연구의 성과는 논문의 질적 수준과의 상관도를 통해 파악할 수 있다. 가장 보편적으로 활용되는 논문 피인용도의 경우 피인용도가 높은 논문은 국제협력활동이 상대적으로 높은 것으로 조사되고 있다.
실질적으로 Scopus 논문 데이터를 통해 최근 5년(2016∼2021)간 선진국들의 논문 발간 현황을 살펴보면 논문 발간 수가 높은 국가들이 논문의 질적 수준이 우수한 것으로 조사된다. 피인용도(FWCI값 기준12))는 상대적으로 높게 나타나고 있다.
[표 2-41] 기준 국가별 논문 발표현황(2016∼2020)
|
연번 |
국가 |
논문 수 |
논문성장률 (16년 대비 20년) |
인용 수 |
Citations/ Publication |
Field-Weighted Citation Impact |
|
1 |
미국 |
3,494,586 |
3.2 |
34,979,767 |
10 |
1.39 |
|
2 |
중국 |
3,124,468 |
53.9 |
26,165,093 |
8.4 |
1.06 |
|
3 |
영국 |
1,097,087 |
5.8 |
11,794,357 |
10.8 |
1.56 |
|
4 |
독일 |
932,748 |
5.1 |
9,308,065 |
10 |
1.35 |
|
5 |
인도 |
901,377 |
35.7 |
4,996,141 |
5.5 |
0.87 |
|
6 |
일본 |
678,775 |
4 |
4,848,589 |
7.1 |
0.94 |
|
7 |
이태리 |
633,691 |
23.9 |
6,309,974 |
10 |
1.46 |
|
8 |
프랑스 |
620,741 |
-0.3 |
6,137,795 |
9.9 |
1.3 |
|
9 |
캐나다 |
573,199 |
11.1 |
6,114,417 |
10.7 |
1.48 |
|
10 |
호주 |
542,990 |
15.1 |
6,263,665 |
11.5 |
1.6 |
|
11 |
러시아 |
524,619 |
50.8 |
2,032,024 |
3.9 |
0.77 |
|
12 |
스페인 |
504,302 |
21.5 |
4,823,158 |
9.6 |
1.29 |
|
13 |
한국 |
441,674 |
14.3 |
3,795,385 |
8.6 |
1.06 |
|
14 |
브라질 |
422,459 |
25.7 |
2,745,954 |
6.5 |
0.91 |
|
15 |
네덜란드 |
322,250 |
11.2 |
4,226,866 |
13.1 |
1.75 |
|
16 |
이란 |
306,782 |
36.6 |
2,436,475 |
7.9 |
1.08 |
|
17 |
폴란드 |
256,783 |
17.4 |
1,780,009 |
6.9 |
1.01 |
|
18 |
스위스 |
249,803 |
11.6 |
3,430,137 |
13.7 |
1.78 |
|
19 |
터키 |
244,500 |
19.3 |
1,484,363 |
6.1 |
0.94 |
|
20 |
스웨덴 |
222,495 |
9.6 |
2,741,938 |
12.3 |
1.65 |
|
21 |
대만 |
193,153 |
8.9 |
1,538,897 |
8 |
1.09 |
대표적 선진국인 미국, 영국, 독일, 프랑스, 이태리, 캐나다 등은 논문 발간 수와 더불어 상대적 피인용도가 높으며 주목할 점은 중국 또한 논문 발간 수와 피인용도 모두 높은 것으로 나타난다는 점이다. 논문 발간 수는 미국 다음으로 2위이며 인용도의 경우 한국과 동일한 수준임을 확인할 할 수 있다.
국제협력지수 측면에서 네덜란드, 스위스, 영국, 스웨덴, 호주, 싱가포르, 프랑스 독일, 스페인이 상위 국가이며 한국의 경우 중국, 일본보다 낮은 것으로 조사되었다.
반면 일본의 경우 논문 발간 수는 6위이지만 인용도 측면에서 상대적으로 낮아 발간되는 논문 수 대비 논문의 질적 수준은 다소 낮은 것으로 나타난다. 우리나라의 경우 13위 정도이며 논문의 질적 수준도 6% 정도 피인용 되는 경향이 높은 것으로 조사되며 논문의 성장률도 14.3%로 꾸준히 증가하고 있는 모습을 보인다.
[표 2-42] 농업 및 생명과학분야 국제공동 논문 발간 현황(2016∼2020)
|
국가 |
Field-Weighted Citation Impact |
국제협력비율 (%) |
국제협력 논문 수 (건) |
|
호주 |
1.51 |
60.2 |
32,258 |
|
브라질 |
0.84 |
30.2 |
24,278 |
|
캐나다 |
1.37 |
58.7 |
28,192 |
|
중국 |
1.03 |
25.0 |
56,230 |
|
프랑스 |
1.45 |
69.1 |
31,106 |
|
독일 |
1.43 |
64.7 |
42,523 |
|
인도 |
0.75 |
18.4 |
12,142 |
|
이란 |
1.02 |
30.1 |
7,813 |
|
네덜란드 |
1.68 |
72.6 |
17,379 |
|
러시아 |
0.65 |
33.4 |
9,182 |
|
싱가포르 |
1.47 |
76.2 |
3,263 |
|
한국 |
0.87 |
29.9 |
8,685 |
|
스페인 |
1.38 |
58.8 |
29,465 |
|
스웨덴 |
1.53 |
75.6 |
13,598 |
|
스위스 |
1.66 |
76.7 |
14,208 |
|
미국 |
1.28 |
46.4 |
111,949 |
생명공학 분야의 경우, 주요 국가의 논문 수는 꾸준히 증가하고 있으나 국내 국제협력 지수는 상대국에 비해 낮은 것으로 조사되고 있다. 아래 표의 경우 농업 및 생명과학분야 국제협력 비율 또한 30% 이하로 최하위 수준이며 논문의 질적 수준도 높지 않은 것으로 나타나고 있다.
이러한 추세는 국내 연구자의 연구역량 및 연구환경이 상대적으로 비교우위에 있지 않고 무엇보다 생명과학 분야의 연구생태계가 국내 연구자 중심으로 운영되는 현실을 반영한 것으로 판단된다.
[표 2-43] 생화학, 분자생물학 분야 국제공동 논문 발간 현황(2016∼2020)
|
국가 |
Field-Weighted Citation Impact |
국제협력비율 (%) |
국제협력논문 수 (건) |
|
호주 |
1.59 |
63.4 |
36,324 |
|
브라질 |
0.99 |
41.1 |
18,844 |
|
캐나다 |
1.45 |
58.2 |
39,852 |
|
중국 |
1.16 |
23.2 |
91,220 |
|
프랑스 |
1.45 |
61.8 |
45,305 |
|
독일 |
1.49 |
59.6 |
70,195 |
|
인도 |
0.83 |
21.9 |
19,312 |
|
이란 |
1.02 |
26.4 |
8,573 |
|
네덜란드 |
1.72 |
67.6 |
28,323 |
|
러시아 |
0.76 |
32.1 |
11,410 |
|
싱가포르 |
1.86 |
71.9 |
9,340 |
|
한국 |
1.09 |
29.2 |
17,572 |
|
스페인 |
1.44 |
57.1 |
32,549 |
|
스웨덴 |
1.67 |
73.8 |
21,636 |
|
스위스 |
1.79 |
74.8 |
25,532 |
|
미국 |
1.44 |
43.0 |
196,775 |
(4) 국가간 협력 현황
한국연구재단은 2021년 7월 현재 51개국 80개 기관과 협력 관계를 유지하고 있으며, 한-미국, 한-영국, 한-독일, 한-스위스, 한-스웨덴, 한-프랑스, 한-중국 등과 같은 양자 간 과학기술 협력사업뿐만 아니라 한-ASEAN, 한-중-일, 한국-EU, 한-V4(헝가리, 체코, 폴란드, 슬로바키아) 등과 같은 다자간 과학기술 협력사업을 추진하고 있다. 본 백서에서는 한국연구재단이 지원하는 양자 및 다자간 과학기술 협력사업의 현황과 주요 성과, 특히 생명공학 분야의 우수성과를 소개하고자 한다.
(가) 한국-미국
한국과 미국 사이의 과학기술 협력을 활성화하기 위한 사업은 크게 4가지를 들 수 있다. 과학기술 교육․교류 사업으로 미국국립과학재단(NSF)과 협력사업으로 추진하는 미국 우수대학원생 방문연구사업(GROW13))과 미국 선진 기술사업화사업 및 국제협력 정책을 학습하기 위한 연구관리․국제협력 전문가 교육과정, 그리고 한국 이공계 여성 대학원생 미국 연수 프로그램이 있다. 이 3가지 사업에 2021년도 지원예산은 2억 3,000만 원이다.
또한, 미국과의 국제협력 네트워크를 강화하고 효율적으로 미래핵심기술을 확보하기 위해 양자물질 분야에서 미국 공군연구실과 협력사업을 추진하고 있으며, 2021년 지원예산은 3억 3,000만 원이다. 올해는 특별히 미국국토안보부과 사이버안보 관련 신규과제를 1억 1,000만 원 규모로 지원할 계획이다.
(나) 한국-독일
한국과 독일 사이의 과학기술 협력을 활성화하기 위해 한-독 산학연 공동연구사업을 운영하고 있다. 산학연 공동연구사업은 매 3년 동안 한국-독일 대학/출연연 및 기업체 연구자 간 연구활동을 지원하였다. 2017년 한-독 산학연 공동연구사업을 통해 다양한 분야에서 장기적으로 국제협력을 추진할 수 있는 기반을 마련하였으며, 과제당 연간 1억 5,000만 원씩 총 3개 과제를 선정․지원하였고 2020년에는 연간 3억 원씩 1개 과제를 선정․지원하였다.
2017년 한-독 산학연 공동연구사업 중 생명공학 분야에서 선정된 연구자 중에서 연세대학교 윤미진 교수는 전립선암 조기진단용 방사성의약품으로 사용 가능한 물질의 개발과 상업화를 목표로 한 과제를 수행하였다. 독일에서 제공한 전구물질을 바탕으로 방사성물질을 합성하고 제조공정을 확립하였으며 전임상 시험을 시행하여 안전성과 유효성 자료를 확보한 성과를 거두었다.
(다) 한국-프랑스
한국과 프랑스 사이의 과학기술 협력을 활성화하기 위해 한-프랑스 협력기반조성사업을 운영하고 있다. 과제당 연간 지원예산은 1,500만 원이며 2년 동안 지원한다. 2002년 제1차 한-프랑스 과학기술공동위원회에서 사업개시에 합의하여 2003년 신규과제를 선정하였고 매년 15개 과제 내외를 선정한다.
2018~2020년에 한-프랑스 협력기반조성사업을 수행한 연구자 중 한국과학기술원 조병관 교수는 미생물 기반 C1 가스 리파이너리 기술 관련 연구협력 및 연구자/대학원생 교환 프로그램 등 교류활동을 수행하였고, 이를 바탕으로 SCI 논문을 게재하는 성과를 거두었다.14)
(라) 한국-영국
한국과 영국 사이의 과학기술 협력을 활성화하기 위해 한-영 과학기술협력창구(Focal Point)사업을 운영하고 있다. 과제당 연 6,000만 원을 2년 이내로 지원하며, 2019년에는 의료 빅데이터를 위한 인공지능, 수소 에너지, 인공지능 기반연구 분야에 3개 과제를 선정․지원하였다. 2021년에는 감염병, 수소 에너지, 인공지능 응용연구 분야에서 신규과제를 모집하고 3개 이내를 선정하여 지원할 예정이다.
2019년 선정 한-영국 Focal Point 사업을 수행 중인 연세대학교 정재호 교수는 인공지능 기반 난치성 종양 신규 치료 표적 발굴을 위해 영국 케임브리지대학 Milner Institute와 협력하고 있으며, 난치성 위암에 대한 임상 데이터와 유전체 데이터, 약물반응 데이터에 관한 연구교류를 수행하고 있다.
(마) 한국-스위스
한국과 스위스 사이의 과학기술 협력을 활성화하기 위해 한-스위스 협력기반조성사업을 운영하고 있다. 과제당 연간 지원예산은 9,000만 원이며 3년 동안 지원한다. 2015년에는 신규 12개 과제를 지원에 이어 2019년 사업에서도 12개 과제를 지원하고 있다. 그뿐만 아니라, 2016년에는 양국 간 신진과학도(박사, 박사후과정생)의 상호 방문연구를 지원하기 위해 한-스위스 박사과정생 연수사업을 추진하여 2016∼2020년간 총 40명의 한국 연구자와 19명의 스위스 연구자를 선정하여 상호간 방문을 지원하였다. 2021년에는 연수사업을 통해 9명의 국내 신진연구자와 9명의 스위스 신진연구자를 모집․지원할 계획이다.
한-스위스 협력기반조성사업을 수행한 연구자 중에서 서울대학교병원 최홍윤 교수는 스위스 연구팀과 신경퇴행성질환의 바이오마커 개발을 위한 인공지능 기반 통합적 다중추적자 양전자 단층촬영(PET) 영상 분석이라는 주제로 공동연구를 수행했으며, PET의 딥러닝 기반 복원 기술 초기개발을 위한 데이터 확보 및 알츠하이머 PET의 딥러닝 기반 임상 활용 정량화 기술개발을 달성하는 등의 성과를 거두었다.
(바) 한국-스웨덴
한국과 스웨덴 사이의 과학기술 협력을 활성화하기 위해 한-스웨덴 과학기술 공동연구사업을 운영하고 있으며, 과제당 5,000만 원을 2년 동안 지원한다. 상대 기관인 스웨덴 연구협의회(VR: Vetenskapsrådet)와 2019년에는 ‘한-스웨덴 연구자원 공동 활용’을 주제로 5개 과제를 지원하기로 합의하고, 양국의 연구기반시설 공유를 통한 과학기술 공동연구 5개 과제를 선정하였다. 또한 2020년에는 VR에서 코로나19 팬데믹 상황을 고려하여 연내 감염병 분야 신규과제 모집을 제안하였고, 이를 바탕으로 코로나19 진단․치료․감염 확산 예측 관련 4개 과제를 선정하여 지원하고 있다.
2019년 선정 한-스웨덴 과학기술 공동연구사업을 수행한 연세대학교 서영준 교수는 한국인 골도 청력 데이터 표준화를 위한 인공 skull simulator 개발을 위해 스웨덴 Cochlear사와 협력하였고, 이를 바탕으로 한국인의 두개골 특성을 반영하고 국내 참조 표준에 부합하는 skull simulator 개발 및 유효성을 검증하고자 한 정성적 성과와 함께 SCI 논문을 4건 게재하는 정량적 성과를 거두었다.
(사) 한국-러시아
과학기술정보통신부와 한국연구재단은 한국과 러시아간의 과학기술협력을 위해 2007년 3월에 한-러시아 과학기술협력센터를 설립하여 현재까지 운영하고 있다. 한-러 센터는 현지 과학기술정보의 수집․제공, 과학기술자 국내유치, 상호 방문 알선, 기술사업화 등의 업무를 추진하고 있다.
한-러 센터는 한-러시아 과학기술자 간 상호 이해와 협력 네트워크 제고를 위해 ‘제4회 한-러 과학의 날’(2020.12., 온라인)을 개최하였고, COVID-19 확산 사태를 고려하여 면역학 및 역학, 신경과학 분야에서 양국 간 실질적 협력 방안을 모색하였다.
또한, 한국과 러시아 간 협력 네트워크 강화를 위해 2014년부터 한-러시아 과학기술 공동연구사업을 운영하고 있다. 생명공학 분야에 대하여 2014년 2개 과제, 2017년에는 1개 과제를 지원하였다. 2021년에는 생명공학 분야 1개 과제를 선정할 예정이며, 해당 과제는 연간 1억 5,000만 원 이내로 21개월간 지원할 예정이다.
(아) 한국-중국
한국과 중국 사이의 과학기술 협력을 활성화하기 위해 한-중핵심공동연구지원사업을 운영하고 있다. 본 사업은 한-중 간 대형 공동연구 추진을 통해 양국의 공통 문제 해결에 이바지할 수 있는 실질적인 연구 성과를 도출하기 위해 양국에서 전략분야를 지정․지원함으로써 연구 성과를 제고하고 있다.
한국연구재단과 중국 국가자연과학기금위원회(NSFC) 간에 체결한 양해각서에 의거, 양 기관이 공동으로 승인한 과제를 지원하고 있다. 2016년도에는 IoT(Internet of Things), Big Data 분야에 3개 과제를 선정하였으며, 2017년도에는 ‘Mechanistic Approach on Photocatalysis’ 분야에 2개 과제를 선정할 예정이며, 해당 과제는 연간 6,000만 원 이내로 3년간 지원할 예정이다.
한-중신진과학자교류사업으로는 2016년도에 7명의 중국인 과학자를 초청하고, 5명의 국내 연구자를 파견하였고, 2017년도에는 10명을 초청, 8명을 파견하여 연구교류를 확대해 나갈 예정이다.
과학기술정보통신부의 국가간 협력기반조성사업으로 추진되고 있는 한-중 협력사업을 통해 2019년도에는 신규 6개 과제를 선정하였으며, 2021년도에도 6개 과제를 선정할 예정이다. 연간 6,000만 원씩 총 3년을 지원하며, 2021년도 지원 대상 분야로는 BT, ICT, 신재생에너지, 의료과학, 항공우주 분야에 기후변화(적응)가 추가되었다. 또한, 과학기술정보통신부의 전략형 공동연구 사업에서 한-중 산학연 대형공동연구 사업도 추진하고 있으며, 연간 5억 원씩 총 15억을 3년간 지원한다. 2019년 BT와 ICT 분야에서 각 1개 과제씩 총 2개 과제를 지원하였으며, 2021년에도 동일한 분야에서 신규과제를 선정할 예정이다. 주요 성과 중 하나로써 2016년부터 2019년까지 한-중 산학연 대형공동연구사업을 수행한 한국생명공학연구원의 김장환 연구원은 ‘세포 리프로그래밍 조성물 및 이를 이용한 유도만능줄기세포의 제조방법’으로 특허를 등록하였으며, SCI급 논문 4편의 성과도 거두었다.
중국과 초기 협력 네트워크 구축을 위해 1992년부터 추진된 한-중 기술조사단의 경우, 2019년 제14차 한-중 과학기술 공동위에서 ‘한-중 과학기술교류 단기 연수프로그램’으로 개편하기로 하였으나 코로나19로 인해 양국간 협의가 잠정적으로 중단되어 있다.
한-중 과학기술협력센터는 중국과의 과학기술협력 종합창구 및 인력․정보 네트워크를 구축하고 있다. 2019년에는 산시성과 한-중 바이오의약 과기협력 세미나를 개최(2019.10.14.∼18., 시안)하였으며, 톈진에서 제9최 중국 줄기세포학회에도 참석하는 등 중국 내 여러 지방성과 과학기술 교류를 추진하는 등 협력 범위를 확대해 가고 있다.
(자) 한국-유럽연합(EU)
한국연구재단은 2014년도부터 추진되고 있는 Horizon 2020 프로그램 및 2021년부터 출범한 Horizon Europe에 참여 기회를 늘리기 위한 노력을 기울이고 있다. 새롭게 출범하는 Horizon Europe 프로그램은 글로벌 사회과제(SDGs등) 해결을 위한 수준 높은 지식, 기술 및 솔루션 개발과 EU의 혁신역량 강화를 위해 과학적 탁월성, 글로벌 도전과 산업 경쟁력, 유럽의 혁신을 3대 중점 추진과제로 삼고 있다.
2021∼2027년간 총예산은 약 955억 유로(한화 약 129조 4,000억 원)인데, 이는 8차 Framework Program에서 투입된 약 786억 유로보다 약 17.7% 증가한 규모이다. 특히 디지털, 우주, 기후변화 등을 글로벌 도전 부분에 전체 투입 금액의 31%(약 304억 7,000만 유로)라는 최대 예산을 배정하였다.
또한, 한국연구재단은 한-EU 과기협력을 심화․확대하기 위한 협력 인프라를 구축하고 미래 협력분야를 발굴함으로써 국내 연구자의 참여 기회를 늘리기 위한 ‘한-EU 과학기술혁신 협력사업(KONNECT)’을 2013년부터 2017년 3월까지 성공적으로 수행했다. 한국(NRF, KIAT, KISTEP), 독일(DLR, KIST_Europe), 네덜란드(RVO), 스페인(CDTi), 터키(TUBITAK) 등 5개국 8개 기관간 컨소시엄 형태로 진행된 이 프로젝트에서 한국연구재단이 연구책임자로 활동하여 EU 측으로부터 3년간 사업비 20억 원을 수주하고 한-EU 과기혁신 정책분석, 수요 맞춤형 네트워킹 구축, 신규 프로그램 론칭, 국제공동연구 평가모형 개발 등 많은 성과를 거두었다. 이 프로젝트의 결과를 기반으로 네트워크 확장 및 지속가능성을 확보하기 위하여 Post-KONNECT를 추진한 바 있다. 특히 생명공학 분야에서는 2014년부터 감염병 연구기관 간 컨소시엄(GloPID-R, Global Research Collaboration for Infectious Disease Preparedness)에 참여하여 공동연구가 진행된 바 있다.
한국연구재단은 유럽연합과의 협력을 강화하고 핵심 원천기술을 확보하며 다자간 국제협력 네트워크를 구축하기 위해 Horizon2020 및 Horizon Europe에 선정이 확정된 연구자들의 공동연구를 지원하고 있다. ‘한-EU 공동연구지원사업’은 ‘인력교류’ 분야에는 연간 5,000만 원 이내, ‘공동연구’ 분야에는 연간 1억 5,000만 원 이내의 연구비를 2∼4년간 지원하여 유럽연합 내 선도적인 연구집단 사이의 지속적인 연구교류와 협력을 촉진하고 있다. 2021년도 신규과제 지원예산은 약 1억 7,500만 원이며, 6월 공모를 통해 총 4개 과제 내외를 선정․지원할 계획이다.
(차) 한국-캐나다
한국과 캐나다간의 과학기술 협력을 활성화하기 위해 한-캐나다 공동연구사업을 운영하고 있다. 한-캐나다 공동연구사업의 지원예산은 과제당 연간 1억 원으로, 2년 동안 한국 연구자를 대상으로 캐나다 연구자와의 공동연구 활동을 지원하였다. 2018년 6개 과제, 2019년 3개 과제, 2020년 2개 과제를 다양한 분야에서 선정․지원하였다.
2018년 선정된 연구자 중에서 세종대학교 곽진태 교수는 전립선암 탐지 및 진단기술의 향상을 위해 초음파 영상의 진단과 디지털 병리 영상의 분석 관련 인공지능 기술개발을 목표로 과제를 수행하였다. 시계열 데이터 분석을 통한 시각화, 영상 분할, 다중 스케일 영상 처리 및 영상 정합 기술을 개발함으로써 전립선암 진단 및 판독 분야의 기술을 향상시켰으며, SCI급 논문 4편 게재, 특허 출원 2건 등의 성과를 거두었다.
(카) 한국-헝가리
한국과 헝가리 사이의 과학기술 협력을 활성화하기 위해 한-헝가리 협력기반조성사업을 운영하고 있다. 과제당 연간 지원예산은 6,500만 원이며 2년 동안 지원한다.
2018년 제9차 한-헝가리 과학기술공동위원회에서 사업개시에 합의하여 2019년 신규로 5개 과제를 선정하였다. 부경대학교 배승철 교수는 헝가리 연구팀과 사료내 감마아미노뷰티릭산(GABA=γ-aminobutyric acid)이 담수어(헝가리) 및 해산어(대한민국)의 고밀도 사육 스트레스 저감에 미치는 영향에 관해 연구하였으며, 이를 통해 양식 물고기의 스트레스 저감 및 질병저항성 증진을 통해 양식어류의 생산성 및 품질 등을 향상시켜 경제적 효과를 볼 수 있는 등의 성과를 거두었다.
(타) 한국-크로아티아
한국과 크로아티아 사이의 과학기술 협력을 활성화하기 위해 한-크로아티아 협력기반조성사업을 운영하고 있다. 제1차 한-크로아티아 과기공동위 후속 조치로 시작된 공동연구 사업은 과제당 연간 지원예산은 5,000만 원이며 2년 동안 지원한다.
2020년 신규과제를 4개 과제 선정하였고, 삼육대학교 김현희 교수는 결명자 유전체 활용 육종 신기술 확립을 위한 분자세포 유전학적 연구를 수행하고 있으며, 성균관대학교 조슈아 잭맨 교수는 ‘항균성 지질의 차세대 약물전달 전략: 지질막의 생명공학기술을 통한 융합의학 응용연구’를 수행하고 있다.
(파) 한국-호주
한국과 호주는 제4차 한-호주 과학기술공동위원회(2019.11.)의 합의사항에 따라 ‘감염병 퇴치를 위한 인공지능의 활용(Application of Artificial Intelligence to Counter Infectious Disease)’이라는 주제로 양국 연구자 간의 교류를 활성화하기 위한 ‘한-호주 Tech-Bridge’ 세미나(2021.7.28.∼29.)를 개최할 예정이다. 감염병 감시를 위한 수리모델링(Mathematical modeling for surveillance of emerging/re-emerging infectious disease)과 인공지능 기반 코로나 진단 도구(AI-based Covid-19 diagnosis tools)라는 세부주제로 개최되는 2개 세션의 세미나를 통해 양국 연구자 간 네트워크 구축을 지원하고, ‘한-호주 Tech-Bridge’ 세미나 참여자 간 매치 메이킹을 통해 각 세부주제에 대한 한-호주 협력기반조성사업 과제를 선정․지원할 예정이다. 해당 과제는 연간 5,000만 원 이내로 총 3년간 지원 예정이다.
또한, 2021년 전략형 국제공동연구사업(한-호주 공동연구)에서 ‘인공지능 기반 가축질병 진단 IoT 통합형 독립구동 센서모듈 개발’이라는 신규과제를 선정․지원하고 있다. 과제기간은 총 2년이며, 연간 5억 원이 지원될 예정이다. 총괄과제 책임자인 아주대학교 김종현 교수팀은 이번 연구를 통해 가축의 건강상태를 실시간으로 모니터링하여 발병을 사전에 진단․예찰하는 독립구동형 IoT 센서모듈 개발과 건강상태 데이터 마이닝 분석 및 가축 질병 솔루션을 제안할 계획이다.
(하) 한국-벨라루스
한국과 벨라루스 사이의 과학기술 협력을 활성화하기 위해 한-벨라루스 협력기반조성사업을 운영하고 있으며, 과제당 4,500만 원을 2년 동안 지원한다. 2020년에는 과학기술 분야의 총 4개 과제를 지원하기로 합의하고, 양국의 전략분야인 소재 분야와 나노․바이오 분야의 공동연구 총 4개 과제를 선정하였다.
또한, 지난 2019년 4월 제6차 한-벨라루스 과학기술포럼을 개최하여 나노․바이오 분야의 연구 성과를 공유하고 해당 분야의 연구 동향을 파악하는 등 양국 연구자 간 교류의 장을 마련하였다.
(거) 한국 정부의 개발협력
2015년 UN에서 지속가능개발목표(SDGs: Sustainable Development Goals)가 채택된 이후 국제사회의 최대 공동 목표를 달성하기 위한 수단으로 과학기술의 중요성이 점차 높아짐에 따라 과학기술정보통신부에서는 한국의 국제적 위상에 부합하는 역할 수행을 위해 개도국의 과학기술 역량을 제고시키는 일에 적극적으로 참여하고 있다.
과학기술정보통신부와 한국연구재단이 시행하는 ‘개도국 과학기술지원사업’은 국내 연구기관과 개도국 연구기관과의 협력 활동을 통해 개도국의 과학기술 역량을 향상시키고, 이공계 전문인력의 양성을 지원하는 것뿐만 아니라 현지 주민의 삶의 질 제고에도 앞장서고 있다. 특히 글로벌 문제 해결 거점(적정과학기술거점센터) 사업의 경우 물, 에너지, 농업 등 생존의 문제에 직접적인 영향을 줄 수 있는 분야를 대상으로 현지에 적합한 적정기술 개발을 통해 현지 문제를 해결하고 있다. 과학기술정보통신부는 2020년에 개도국 과학기술 지원사업 예산 34억으로 18개 과제를 지원하여 네팔, 탄자니아, 에티오피아, 베트남 등 개도국의 과학기술 발전에 이바지하고 있다.
생명공학 분야와 관련해서는 탄자니아 거점을 통해 이동형 백신 냉장고를 개발․보급하여 현지 보건 역량을 강화한 바 있다. 백신의 성능을 보장하기 위해서는 적절한 온도를 유지한 상태로 이동할 수 있는 운송시스템이 필수적인데, 아프리카의 오지에서는 이러한 시스템이 운용되기 어려운 환경이다. 이에, 탄자니아 거점에서는 현지의 운용 환경에 적합한 이동형 백신 냉장고를 개발하였고, 오토바이 등의 현지 교통수단의 전원장치를 이용해 작동하는 효과적인 냉각장치와 함께 현지에서 운용 가능한 통신시스템을 기반으로 GPS를 장착하여 백신 온도와 위치 등 중요 정보를 모니터링 할 수 있는 백신냉장고 시스템을 개발하여 탄자니아뿐만 아니라 에티오피아, 우간다 등에 보급 확산 활동을 펼치고 있다.
아울러 현지의 열악한 전력 사정을 고려하여 에너지 분야 문제 해결도 추진하고 있는데, 특히 에너지 인프라가 부족하고 유지 관리가 어려운 농촌 지역의 에너지 빈곤 문제를 해결하기 위해 총 3개의 발전소를 설립하여 약 750명의 마을 주민들에게 전기와 조명을 공급하고 있다. 발전소에서 공급되는 전기는 유치원을 비롯하여 마을 가로등 및 일반 가정집에 공급되어, 에너지 빈곤에 따른 치안 문제를 완화하고, 교육의 기회를 확대하며, 지역 주민의 생활 여건을 개선해 주고 있다. 작년 코로나19 확산 시에는 이 발전소를 통해 마스크를 생산하여 현지 주민들의 보건 역량을 향상시킨 바 있다. 코로나19 확산에 따른 마스크 부족 문제 해결에 이바지하기 위해 탄자니아 아루샤 지방정부와 협력하여 아루샤주 메루(Meru) 지역 병원과 응고로도토(Ngurdoto) 및 음칼라마(Mkalama) 지역 마을 태양광 발전소들에 재봉틀과 현지에서 구할 수 있는 부직포를 이용하여 현지 주민들이 직접 마스크를 생산할 수 있도록 하였다. 이를 통해 지난 약 3만 8,000여 개의 마스크를 생산하여 지역 내 병원, 보건소, 진료소 등 의료기관과 지역사회에 마스크를 공급하였다.
(5) 제언
최근 진행되고 있는 국제협력사업의 특징은 다음과 같이 3가지로 요약될 수 있다.
첫째, 국제공동연구의 목적 자체가 실질적 공동연구를 직접 수행하기보다는 해외 연구자와의 네트워킹을 구축하고자 하는 경향이 높다. 국내 연구자의 연구목적 자체가 해외 연구진과의 암묵적 네트워크를 구축하기 위해 상대측의 연구수준, 분야, 관심사, 장비 시설 등을 확인 후 실질적인 공동연구로 진화하는 경향이 높다. 이에 따라 국가간 협력기반 조성사업의 연구비 규모 또한 대부분 5,000만 원 이하로서 연구비의 사용은 대부분 항공료, 체재비, 학생 연구진 파견비용, 상대측 연구진 초청비용 등으로 소진되는 경향이 높다. 이러한 특성으로 인해 국내 연구자를 대상으로 연구자 간담회에서 확인된 내용은 국가간 사업 대상자의 일반적 만족도는 높고 특히 네트워킹 사업 후 실질적인 공동연구로 진화되는 경향이 높은 것으로 확인되었다.
둘째, 국가간 협력기반 조성사업의 공모 분야는 특정 분야로 한정되기보다 전 학문 분야 대상으로 자유 공모제(bottom up) 방식으로 진행되는 경향이 높다. 물론 최근 COVID-19로 인해 호주, 스웨덴, 캐나다, 중국 등 바이오 분야를 중심으로 한국과 공동연구를 진행하고자 하는 수요가 높아진 것은 사실이다. 하지만 중국과 같은 국가의 경우 자국의 수요를 반영하여 해양과학, 바이오 의료 등 특정 분야를 중심으로 공모를 희망하는 국가도 발생하고 있다.
셋째, 선진국의 경우 국제공동연구의 명확한 구분이 사라지고 있다. 국제공동연구라는 명칭으로 사업을 공모 및 진행하는 경향이 줄어들며 전체 연구비를 연구책임자에게 부여한 뒤 연구책임자 판단으로 해외 연구진과 공동연구가 필요한 경우 연구비 일부를 해외 출장 경비, 해외 연구자 지원비용 항목으로 배정하여 연구과제를 운영하는 경향이 높다. 이러한 경향은 우리나라의 국제화 사업에도 적용 가능할 수 있다고 판단된다. 예컨대 국제공동연구 사업항목에 속한 인력교류사업의 연구비는 국가와 관계없이 3,000만 원으로 하며, 공동연구의 경우 1억 원으로 확정하여 운영하는 것이 바람직할 것으로 생각한다.
마지막으로 현재 일본과는 이명박정부 이후로 국가간 협력기반조성사업을 운영하지 못한 상태이다. 2019년 12월 양국 과학기술부 장관회담이 극적으로 성사되어 2020년부터 청년과학자 포럼 및 공식적인 네트워킹 활동을 정부 수준에서 지원할 계획이었으나 COVID-19로 인해 중단된 상태이다. 하지만 국제공동연구 사업은 정치 및 외교로서 풀기 어려운 문제들을 원만히 해결할 수 있는 시발점으로 활용될 수 있다고 판단된다.
나. OECD BNCT 활동 현황
(1) 개요
OECD의 바이오나노융합기술작업반(BNCT: Working Party on Biotechnology, Nanotechnology and Converging Technologies)은 생명공학, 나노기술 및 융합기술의 책임 있는 개발과 관련 정책 이슈를 논의 및 대응하고자 2014년부터 운영 중이다. 한국은 부의장 국가(생명연 김승준 부원장, 2019∼2022)로 BNCT 활동을 통해 바이오 분야 국제협력 이슈를 발굴하고 글로벌 바이오 이슈 및 정보를 국내에 전파하고 이를 국내 생명공학 정책에 활용하고 있다.
여기에서는 2019년 하반기부터 2021년 상반기까지의 BNCT 활동을 중심으로 글로벌 바이오 정책 이슈와 국내 대응을 살펴보고자 한다.
(2) 추진 경과
(가) 의제별 국내 전문가 소그룹 운영
OECD는 매 2년 주기로 PWB(Programme of Work and Budget)란 이름으로 예산(안)을 책정하여 수행하고 있으며, 이에 따른 3∼4개의 프로젝트를 운영하고 있다. 한국은 핵심 프로젝트별 산․학․연 국내 전문가 소그룹 구성하여 OECD 글로벌 이슈를 토론․논의하는 플랫폼을 상시적으로 운영하고 있다. 주제별 소그룹을 중심으로 OECD 권고문의 모니터링, 정책보고서 및 정책워크숍에 활발하게 참여하고 있다. 특히, 매년 2회 열리는 BNCT 정기총회 전후로 국내 전문가 회의를 통해 총회 주요의제 및 회의결과를 공유하여 OECD 의제에 대한 의견을 수렴하고 한국의 대응방안을 마련하고 있다. 또한, 기술영향평가 그리고 신경기술의 경우 BNCT 작업반 기획위원회(Steering Group) 참여 및 자발적 기여금(VC: Voluntary Contribution) 제공을 통해 프로젝트 초기부터 OECD와의 공동연구에 주도적․적극적으로 참여하고 있다.
(나) OECD 권고문 모니터링
BNCT 작업반 책임으로 주어진 바이오 관련 OECD 권고문은 다섯 가지이며, 각 권고문의 이행과 확산에 관한 모니터링과 개정 필요성에 대한 의견 조회를 위해 회원국들을 대상으로 설문조사를 진행하고 있다.
첫째, 인체자원은행과 유전학연구 데이터베이스에 관한 권고문(OECD Guidelines on Human Biobanks and Genetic Research Database)은 2009년 10월에 채택되었으며, HBGRD(Human Biobanks and Genetic Research Database)의 구축, 거버넌스, 관리, 운영, 접근, 이용 및 중단에 관한 지침을 제공하는 것을 목적으로 한다. HBGRD에는 유전자 연구 목적으로 사용될 수 있는 구조화된 자원, 인체 유래물 및 / 또는 그 분석에서 생성된 정보와 광범위한 관련 정보들이 해당한다. 2019년 해당 권고안의 보급과 인식, 인체자원은행과 유전학연구 데이터베이스의 구축 현황, 그리고 법, 규제, 정책 및 정책 파급효과와 타당성에 대한 설문조사를 진행하였고, 한국도 참여하였다.
둘째, OECD에서는 유전자 발명에 대한 접근성 제한이 가져올 수 있는 문제점을 인식하여 발명의 접근성과 기술혁신을 향상하시키고자 ‘유전자 발명15)의 라이선싱에 관한 가이드라인(Recommendation of the Council on the Licensing of Genetic Inventions)’을 2006년에 수립하였다. 본 권고문은 5대 분야16)로 구분하여 라이선싱 원칙과 수범사례(best practices)를 제시하고 있으며, 특히, 유전자의 ‘특허 적격성’과 ‘발명의 실시허락’을 분리해서 접근하고, 해당 권고문에서는 실시허락에 대해서만 다루고 있다.
이후 유전체 염기서열분석과 유전자 편집기술 등 이머징 기술출연에 적절하게 대응하지 못한다는 이슈가 발생하여 2019년 OECD는 표준 정비 사업의 일환으로 해당 권고안 개정 착수를 결정하였다. 한국은 2020년 권고안 개정과 관련한 국내 전문가 의견을 취합하여 OECD 전문가 작업반 회의에 전달하였다. 권고안 정의에서의 산업디자인권 포함 필요, 라이선스 계약서 샘플 첨부 필요, 유전자 특허와 독점은 연구 개발활동에 방해가 될 수 있다는 한국의 의견이 OECD 권고안 개정안(초안)에 반영된 상태이다.
셋째, 2012년 OECD는 바이오 기반 제품의 지속가능성 평가에 대한 권고문(Recommendation of the Council on Assessing the Sustainability of Bio-Based Products)을 채택하여 5년 후인 2020년, 해당 권고문의 모니터링 결과를 바탕으로 캐나다, 중국, 일본 등 바이오경제 이행 사례집인 바이오경제 혁신생태계 보고서를 발간하였다.
넷째, 분자진단검사의 품질 보증에 관한 권고사항(Recommendation of the Council on Quality Assurance in Molecular Genetic Testing)이 2007년에 채택되었다. OECD는 분자진단검사 수행에 관련된 일반적으로 준수해야 할 사항과 테스트 수행 기관의 품질 보증을 위한 시스템의 적립, 수련도 및 품질 모니터링, 검사 수행 종사자의 의무교육/훈련, 결과 보고의 품질 등에 대한 권고 사항 및 최적화된 업무 사례를 제시하고 있다. 또한 개인 유전정보 보호 및 처리 방법, 수집된 환자 샘플의 사용, 유전자 검사에 대한 과대 홍보 및 광고 금지, 유전자 검사 결과 관련 상담의 필요성 등도 해당 권고문에 담겨있다.
마지막으로 PWB 2019-20 프로젝트의 결과로 신경기술 분야 책임 있는 혁신 9가지 원칙17)을 공표한 신경기술의 책임 있는 혁신에 대한 권고문(Recommendation of the Council on Responsible Innovation in Neurotechnology)이 OECD 의회로부터 2019년 12월 채택되었다. 해당 권고문은 브레인 해킹 등 신경기술이 야기할 수 있는 사회 윤리적이고 부정적인 영향을 최소화하고 책임 있는 신경기술 연구의 방향성을 제시한 최초의 국제기준인 만큼 의미가 크다. 한국은 권고문의 개발 초기부터 기획위원회(Steering Group) 및 수차례의 워크숍과 논의과정 등에 참여하여 한국의 입장을 전달하였다.
OECD 권고문은 법적 구속력은 없는 일종의 연성법(soft law)으로 신경기술 등과 같은 이머징기술 분야에서는 민첩한(agile) 접근법으로 생각되며, 지지하는 국가들(adherents)의 동의와 신뢰를 바탕으로 작성된 만큼 권고문에서 제시하는 방향으로 국제사회가 노력할 것으로 예상된다.
(다) OECD 정책보고서 및 워크숍
PWB 2019-20 프로젝트 1. 융합기술의 협력 플랫폼은 개인맞춤형 의료, 합성생물학, 신소재 3가지 파트로 구성되어 진행되었으며, 주제별 3개의 정책워크숍과 더불어 해당 프로젝트에 대한 교차논의(cross-cutting)를 제11차 총회(2020.4.27.∼28.)에서 가졌다. 교차논의 결과, 3가지 분야 모두 데이터 및 지식재산권(IP) 공유가 공통된 도전이고, 플랫폼 운영에 맞는 거버넌스의 모델이 성공의 요소이며, 플랫폼이 발전할수록 생태계가 확충되는 경향이 있다는 것에 의견을 모았다. 이를 바탕으로 세 가지 분야별 플랫폼의 종류와 특징을 비교․분석하여 융합/지속가능성/책임 있는 혁신/거버넌스 네 가지 교차이슈를 담고 있는 ‘Collaborative platforms for emerging technology: Building the convergence space’ 란 제목의 synthesis report를 해당 프로젝트의 결과물로 발간하였다.
최근 유전체연구 이니셔티브가 늘어나면서 대량의 고품질 데이터에 대한 접근의 필요성에 의해 플랫폼이 성장하였으며, 민관협력(PPP: Public Private Partnership)의 구현, 지속가능한 모델 개발과 더불어 개인정보보호, 데이터의 상호운용성 및 표준과 관련된 이슈가 제기되고 있다.
디지털 기술의 발전은 유전체와 바이오뱅크 협력 플랫폼에 중요한 기회를 제공하였으며, 데이터는 이 플랫폼의 주요 가치통화로서 거버넌스에 대한 주요 시사점을 전달하고 있다. 협력 플랫폼의 지속가능성은 참가자, 공공, 연구기관, 연구자 간의 상호 책임과 신뢰를 수반하는 ‘사회적 계약(social contract)’에 달려 있다고 할 수 있다. 한국은 정부 주도의 국가 이니셔티브의 하나로 국가 바이오 빅데이터 사업을 OECD 정책페이퍼인 ‘Building and sustaining collaborative platforms in genomics and biobanks for health innovation’에 소개하였다.
synthesis report에 따르면, 임무지향적 접근(mission-oriented approach)과 공동가치창출(co-creation)과 같은 개방적이고 참여적인 지식 확산에 따라 다양한 종류의 협력 플랫폼이 생겨나고 있으며, 이 같은 플랫폼은 기술개발과 확산을 위한 공유 자원(재료, 디지털 또는 둘 다)에 대한 조직적 배치라고 할 수 있다. 협력 플랫폼은 신기술의 개발에 필수적인 자원의 구축과 관리를 위한 정책에 관한 기술 특정(technology-specific) 및 일반화된(generalized) 통찰력을 제공할 수 있으며, ‘융합공간(convergence space)’으로서 작동할 때 가장 높은 가치를 발휘할 수 있다.
한편, 2020년 9월 23∼24일 양일간 서울에서 ‘Building Capacity to Implement the OECD Recommendation on Responsible Innovation in Neurotechnology’란 제목으로 한-OECD 공동 워크숍이 온라인으로 개최되었다. 신경기술의 책임 있는 혁신에 대한 권고문이 채택된 이후 처음 열린 포럼으로 해당 권고문의 확산과 이행 방안을 모색하고자 한국 정부와 BNCT 대표단을 비롯해 14개국의 정책전문가, 뇌연구자 및 민간 기업 등 다양한 분야의 전문가들이 참여했다.
워크숍에서 OECD 권고문의 확산과 이행을 촉진하기 위해 각국의 사례들을 공유했으며, 뇌 신경기술과 같은 이머징 분야의 윤리적, 법적, 사회적 이슈들을 해결하려는 방법에 대해 심도 있는 논의가 이루어졌다. 프랑스는 OECD 권고문 실행을 위한 국가 태스크포스(TF)를 창설하고 생명윤리법 개정에 신경기술에 관한 사항을 포함했으며, 개정과정에 프랑스 국민을 대표하는 시민 위원회가 구성․운영되었다. 스위스는 과학 박람회, 공개 토론회, 미디어 활용 등을 통해 인식제고 및 참여 역량 구축에 힘쓰고 있다. 한국은 본 워크숍의 공동 주최자로서 행사 구성과 진행 등을 함께 했으며, 뇌연구촉진법 등 뇌연구 관련 지원정책과 국내 사례를 공유하고, 관련 분야 국내 전문가들의 적극적인 참여를 독려하였다.
(3) 주요 정책
OECD는 고령화, 식량부족, 지구온난화 등과 같은 글로벌 도전과제(grand challenges) 해결을 임무로 지정하고 이를 달성하기 위한 임무지향적 혁신정책(MOIP: Mission-oriented Innovation Policy)을 전개하고 있다. 이는 기존의 거버넌스 시스템이 ‘지속 가능한 목표(SDGs: Sustainable Development Goals)’와 같은 사회적 목표에 맞춰 혁신 시스템을 조정하지 못했다는 인식에서 비롯되었다. 따라서 기술개발과 사회적 요구를 적절히 조화시킬 수 있는 기술 거버넌스를 추구하고자 한다. 광의의 기술 거버넌스는 기술영향평가 및 예측, R&D 의제 설정 및 공공 책임, 대중 참여 및 과학 커뮤니케이션, 기술 및 디자인 표준, 규제 및 연성법 그리고 민간부분 거버넌스 및 자율 규제 등 기술개발을 주도하는 여러 메커니즘을 포함하고 있다.
최근 OECD는 신경기술의 책임 있는 혁신에 대한 권고문 등 기술거버넌스에 대한 업스트림 접근방식(upstream approach)을 취하고 있다. BNCT 작업반은 ‘사회를 위한, 사회 속의 기술- 책임 있는 혁신 접근법(Technology in and for Society – a Responsible Innovation Approach)’에 집중하고 있다. 책임 있는 혁신은 목표 지향성(goal-orientation), 포용력(inclusivity) 및 예측(anticipation) 3가지 핵심 요소를 가지고 있어 기술거버넌스를 검토하기 위한 도구(렌즈)로 사용되고 있다. 이를 통해 BNCT 작업반은 책임 있는 연구개발을 장려하면서 공유가치를 재확인하고자 한다.
또한, 코로나19 팬데믹으로 인한 미래의 불확실성이 증가함에 따라 미래예측(foresight)의 중요성이 더욱 강조되고 있다. 위기상황에서의 복원력(resilience)을 강화하는 동시에 향후 지속가능한 사회로 전환(sustainability transition)하기 위해 전략적 예측(strategic foresight)을 적극적으로 활용할 계획이다. 미래예측은 미래에 대한 비전을 함께 공유하고 집단적인 행동을 촉진함으로써 간접적으로 미래의 불확실성을 축소시킬 수 있다.
(4) 주요 사업
(가) 기술영향평가 및 미래 예측
기술영향평가(TA: Technology Assessment)와 기술예측(TF: Technology Foresight)은 기술거버넌스의 본질과 프로세스에 필수적인 것으로서 기술개발이 현재와 미래에 어떤 영향을 미치는지 탐구함으로써 정책결정을 위한 전략적 지식을 제공하는 수단이다. 최근 기술영향평가 프로세스가 기술정책 수요를 예측하고 의제를 설정하며 기술개발을 지원할 수 있는 사회역량 구축의 일부가 되어야 한다는 인식이 증가하고 있다. 게다가 글로벌 팬데믹, 기후변화나 생물 다양성 감소 등 지속가능성에 대한 사회적 과제가 증대됨에 따라 전통적인 형태의 기술영향평가는 도전에 직면하였다.
이에 BNCT 작업반은 기술영향평가 방법에 대한 연구진행 및 근거 변화로 인해 미래지향적 기술영향평가 및 임무지향적․도전지향적 기술영향평가를 위한 도구 개발 및 역량을 구축하는 방향으로 전환하고자 한다. 이를 통해 단순한 예상(prediction)이 아니라 기술의 혜택을 극대화하고 부작용과 위험을 최소화하는 미래지향적 시나리오를 제공함으로써 증거기반의 정책 설정에 도움을 주고자 한다. 한국은 일본, 포르투갈 및 미국으로 구성된 Steering Group에 참여하여 생명공학육성법 개정(2020.5.)에 따른 기술영향평가 내용18)을 공유하였다.
(나) 팬데믹 대응 및 건강회복력 증진을 위한 협력 플랫폼
코로나19 팬데믹 위기 상황의 정책수요를 충족하기 위해 BNCT 작업반은 2020년 Ad-hoc 연구를 진행하였으며, PWB 2021-22 ‘지속가능한 개발을 위한 융합기술 플랫폼’의 일부로서 ‘팬데믹 대응 및 건강회복력 증진을 위한 협력 플랫폼’이란 제목의 프로젝트를 진행 중이다. PWB 2019-20은 특정기술(technology-push)의 관점에서 협력 플랫폼을 바라봤다면 이번 프로젝트는 사회적 요구(demand-pull) 관점에서 살펴보고, 감염병 등 사회적 요구에 대한 대응력을 높이고자 한다. 팬데믹으로 인한 혁신정책, 건강회복력, 지식재산권과 사회적 요구의 관리를 위한 프레임워크 사이의 접점에서 문제가 제기되고 있으며, 인공지능 알고리즘, 스마트 소재 등 이머징 기술이 글로벌 공중보건 비상사태에 더욱 직접 연계해 지속가능한 목표(SDGs)를 지원하는 중요한 도구로 부상하였다.
건강회복력을 강화하기 위한 국가적 조치 외에도, 새로운 물질, 약물, 백신 및 감염병 대비를 위한 진단 공급품의 가용성에 대한 예측 가능성, 확실성 및 신뢰도를 제공하기 위한 국제협력이 강조되고 있다. BNCT 작업반은 코로나19 대응을 통한 협력 플랫폼의 실제 적용사례, 지식재산권 및 데이터 공유, 경제 사회적 가치를 창출할 수 있는 지속가능한 비즈니스 모델에 관해 토론하고자 두 번의 OECD 정책워크숍을 개최하였다. 한국은 감염병 민관협력 모델인 RIGHT Fund19)의 사례를 통해 데이터와 지식재산권의 공유 원칙, 기술에 대한 소유권 그리고 오픈사이언스와 개방형 혁신에 따른 재정적 지속가능성 유지 전략 등을 OECD에 전달하였다.
(5) 향후 계획
포용적으로 사회기술적 전환을 이루어내기 위한 기술 거버넌스를 구축하기 위한 예견적 접근을 모색하고자 BNCT 작업반은 상위기구인 과학기술정책위원회(CSTP: Committee for Scientific and Technology Policy)와 공동으로 ‘포용적 전환을 위한 기술 거버넌스Technology Governance for Inclusive Transitions)’란 주제의 콘퍼런스를 개최할 예정이다. 이를 통해, 다양한 사회문제에 대응하기 위해 에너지, 농식품, 모빌리티, 산업 등에서의 시스템 전환이 요구되는 상황에서, 이를 해결하기 위한 이머징 기술의 사회기술적(sociotechnical) 변화의 경로를 모색하는 한편 잠재된 부정적 효과를 방지 혹은 최소화하고자 한다. 그리고 현실적인 아이디어, 경험, 지식의 원천 등의 풀(pool)을 구성함으로써 예견적 거버넌스 접근법의 이행가능성을 높일 수 있는 제도적, 사회적 역량을 강화하고자 한다.

1. 투자 현황
가. 정부 연구개발예산 중 미래유망 신기술(6T) 분야별 투자
2019년도 정부 연구개발 투자액은 20조 6,254억 원으로 총 827개 사업, 7만 327개 과제에 투자되었다. 이는 일반회계, 특별회계, 기금을 모두 포함한 금액으로 2017년 19조 3,927억 원 대비 1조 2,327억 원(6.4%) 증가하였다.
최근 5년간(2015∼2019) 정부 연구개발 투자는 연평균 2.2% 증가하였으며, 대학과 중견기업 및 지방 R&D에 대한 투자가 증가 추세인 것으로 나타났다.
2019년도 미래유망 신기술(6T) 6개 분야 투자액은 전년 대비 5,607억 원 증가한 총 12조 2,277억 원으로 국가연구개발사업 총 집행액의 63.5%를 차지하였다.20) 생명공학기술(BT) 분야 투자액은 총 3조 6,717억 원으로 전년 대비 1,222억 원(3.4%) 증가하였으며, 최근 5년간 연평균 증가율은 2.7%로 나타났다.

자료: 2019년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP).
[그림 2-11] 국가연구개발사업 투자 추이(2015∼2019)

자료: 2019년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP).
[그림 2-12] 6T 분야별 투자 추이(2015∼2019)
생명공학기술(BT) 분야는 2017년 이후 미래유망 신기술(6T) 6개 분야 중 가장 높은 비중으로 투자되고 있으며 2019년도 투자 비중은 19.1%이다. 정보기술(IT) 분야는 18.0%의 비중으로 뒤를 이었다.
생명공학기술(BT) 분야에서 2017년도 총 122개 사업, 2만 1,844개 과제가 수행되었고, 2019년도 총 179개 사업, 2만 4,798개 과제가 수행되어 사업과 과제 수가 모두 증가하였다.

|
6T |
사업 수 |
과제 수 |
정부연구비 |
|
|
억원 |
% |
|||
|
BT |
179 |
24,798 |
36,717 |
19.1% |
|
CT |
12 |
847 |
2,195 |
1.1% |
|
ET |
112 |
7,448 |
22,747 |
11.8% |
|
IT |
142 |
11,304 |
34,633 |
18.0% |
|
NT |
22 |
4,790 |
8,364 |
4.3% |
|
ST |
32 |
780 |
17,622 |
9.1% |
|
기타 |
272 |
11,734 |
70,320 |
36.5% |
|
합계 |
772 |
61,701 |
192,597 |
100.0% |
자료: 2019년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP).
[그림 2-13] 미래유망 신기술(6T) 분야별 투자현황(2019)
나. BT 분야 상세 투자현황 및 주요 특징
(1) 부처별 투자현황
2019년도 생명공학기술(BT) 분야 부처별 투자는 과학기술정보통신부(1조 5,054억 원, 41%)가 가장 높은 비중을 차지하고 있으며, 다음으로 농촌진흥청(5,224억 원, 14.2%), 보건복지부(4,506억 원, 12.3%), 교육부(2,874억 원, 7.8%), 산업통상자원부(2,740억 원, 7.5%) 순으로 이루어졌다. 2019년도 산업통상자원부 투자는 2017년(3,046억 원, 8.7%) 대비 금액과 비중 모두 감소한 것으로 나타났다.

자료: 2019년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP).
[그림 2-14] BT 분야 부처별 투자현황(2017 대비 2019)
(2) 연구개발 단계/연구수행 주체별 투자현황
생명공학기술(BT) 분야의 연구개발 단계별 투자는 기초연구(1조 4,947억 원, 40.7%), 개발연구(9,052억 원, 24.7%), 응용연구(6,340억 원, 17.3%) 순으로 이루어졌다. 전체 미래유망 신기술(6T) 분야에서는 개발연구에 가장 많은 투자가 이루어졌지만, 생명공학 기술(BT) 분야는 기초연구에 대한 투자 비중이 높았다. 2017년 투자와 비교하면 기초연구와 개발연구의 비중이 감소하였고, 응용연구의 투자 비중이 증가한 것으로 나타났다.
생명공학기술(BT) 분야의 연구수행 주체별 투자를 보면 대학(1조 6,346억 원, 44.5%), 출연연구소(6,941억 원, 18.9%), 국공립연구소(5,832억 원, 15.9%), 중소기업(5,244억 원, 14.3%), 중견기업(506억 원, 1.4%) 순으로 이루어졌다. 전체 미래유망 신기술(6T) 분야에서는 출연연구소가 차지하는 비중이 상대적으로 높았지만, 생명공학기술(BT) 분야에서는 대학의 연구수행 비중이 가장 높은 것으로 나타났다. 2017년 투자 대비 대학과 국공립연구소에 대한 지원은 증가했지만, 출연연구소 및 대․중견․중소기업에 대한 지원은 감소하였다.

자료: 2019년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP).
[그림 2-15] BT 분야 연구개발단계별(상)/연구수행 주체별(하) 투자현황(2017 대비 2019)
(3) 적용 분야별 투자현황
생명공학기술(BT) 분야의 투자는 공공분야(2조 1,621억 원, 58.9%), 산업분야(1조 5,095억 원, 41.1%)로 구성된 것으로 나타났다.
세부분야별로 공공분야에서는 건강(1조 4,380억 원, 39.2%), 지식의 진보(비목적 연구)(2,846억 원, 7.8%), 기타 공공목적(2,747억 원, 7.5%), 환경(736억 원, 2.0%) 순으로 투자되고 있으며, 산업 분야에서는 농업, 임업 및 어업(7,146억 원, 19.5%), 제조업(의료용 물질 및 의약품)(2,086억 원, 5.7%), 제조업(의료, 정밀, 광학기기 및 시계)(2,014억 원, 5.5%), 기타 산업(900억 원, 2.5%) 순으로 투자되고 있는 것으로 나타났다.

자료: 2019년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP).
[그림 2-16] BT 분야 적용 분야별 투자현황(2019)
(4) 기술분류별(유망기술․과학기술표준분류) 투자현황
생명공학기술(BT) 분야 투자액 3조 6,717억 중 상위 9개 유망기술 분야(투자액 기준)21)의 투자액은 1조 9,458억 원으로 53.0%의 비중을 차지하고 있다. 이 분야는 2015년부터 2019년까지 연평균 증가율 3.6%를 보이며, 생명공학기술(BT) 분야 연평균 증가율(2.7%)을 웃도는 것으로 나타났다.
2019년 투자규모는 생명현상 및 기능연구(3,177억 원, 16.3%), 의과학/의공학기술(2,898억 원, 14.9%), 난치성 질환치료기술(2,786억 원, 14.3%) 순이며, 최근 5년간 투자 규모의 연평균 증가율이 높은 분야는 뇌신경과학연구(9.4%), 난치성 질환치료기술(9.2%), 바이오신약개발기술(6.9%) 순이었다.

자료: 2019년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP).
[그림 2-17] BT 분야 유망기술 투자 추이(2015∼2019)
국가과학기술표준분류 대분류 기준 투자현황은 보건의료(1조 4,780억 원, 40.3%), 농림수산식품(8,974억 원, 24.4%), 생명과학(7,541억 원, 20.5%), 뇌과학(1,222억 원, 3.3%) 순이었다.

자료: 2019년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP).
[그림 2-18] BT 분야 국가과학기술표준분류별 투자현황(2017 대비 2019)
생명공학기술(BT) 분야에서 중점적으로 투자되고 있는 보건의료, 농림수산식품, 생명과학 분야를 국가과학기술표준분류 중분류를 기준으로 분석하였다. 보건의료 분야에서는 의약품/의약품개발(3,402억 원, 9.3%), 의생명과학(2,507억 원, 6.8%), 임상의학(2,410억 원, 6.6%) 순으로 투자되었으며, 농림수산식품 분야는 원예특용작물과학(1,697억 원, 4.6%), 동물자원과학(1,107억 원, 3.0%), 식량작물과학(1,028억 원,
[표 2-44] BT 분야 국가과학기술표준분류별(중분류) 중점투자 현황(2019)
|
보건의료 분야 |
농림수산식품 분야 |
생명과학 분야 |
||||||
|
|
억 원 |
비중 |
|
억 원 |
비중 |
|
억 원 |
비중 |
|
의약품/의약품개발기술 |
3,402 |
9.3% |
원예 특용작물과학 |
1,697 |
4.6% |
분자세포 생물학 |
1,318 |
3.6% |
|
의생명과학 |
2,507 |
6.8% |
동물자원과학 |
1,107 |
3.0% |
융합 바이오 |
984 |
2.7% |
|
임상의학 |
2,410 |
6.6% |
식량 작물과학 |
1,028 |
2.8% |
유전학/유전공학 |
960 |
2.6% |
|
치료/진단기기 |
2,136 |
5.8% |
기타 농림수산식품 |
961 |
2.6% |
산업 바이오 |
770 |
2.1% |
|
보건의료 전체 |
14,780 |
40.3% |
농림수산식품 전체 |
8,974 |
24.4% |
생명과학 전체 |
7,541 |
20.5% |
주) 비중은 BT 분야 정부연구비 36,717억 원 중 해당 분야가 차지하는 비중을 나타냄.
자료: 2019년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP).
2.8%) 순으로 투자된 것으로 나타났다. 생명과학 분야에서는 분자세포생물학(1,318억 원, 3.6%), 융합바이오(984억 원, 2.7%), 유전학/유전공학(960억 원, 2.6%) 순으로 투자가 이루어졌다.
(5) 기타 BT 분야 투자의 주요 특징
(가) 산학 공동연구 비중이 높음
생명공학기술(BT) 분야 투자에서 협력유형이 있는 비중(22.2%)이 협력유형이 없는 비중(73.1%)보다 낮은 것으로 나타났다. 협력유형별로는 산학 공동연구(2,432억 원, 29.8%), 학연 공동연구(2,165억 원, 26.6%), 산학연 공동연구(1,288억 원, 15.8%) 순으로 투자되었으며, 기업-대학의 협력 비중이 가장 높은 것으로 나타났다.
2017년도 유형별 투자 규모를 살펴보면 학연(2,998억 원, 31.2%) 산학(2,859억 원, 29.8%), 산학연(1,274억 원, 13.3%) 순이며, 특히 산학연의 경우 2019년 해당 유형의 투자가 증가했지만 산학, 학연의 경우 2017년 투자 대비 2019년 투자가 감소했다.
자료: 2019년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP).

[그림 2-19] BT 분야 협력유형별 공동연구 투자현황(2017 대비 2019)
(나) 수도권 투자비중이 높음
생명공학기술(BT) 분야의 17개 시․도별 투자 규모는 서울(1조 890억 원, 29.7%), 대전(4,484억 원, 12.2%), 경기(4,399억 원, 12.0%), 전북(4,090억 원, 12.0%) 순이었다. 2017년도 지역별 투자 규모는 서울(1조 40억 원, 28.7%), 전북(4,522억 원, 12.9%), 경기(4,504억 원, 12.9%), 대전(4,354억 원, 12.5%)의 순이며, 2019년에는 서울․대전의 투자는 증가했지만 경기․전북의 투자는 감소한 것으로 나타났다.
미래유망 신기술(6T) 분야 전체 투자 규모는 지방(6조 9,877억 원, 36.3%), 수도권(6조 3,322억 원, 32.9%), 대전(5조 7,827억 원, 30.0%) 순으로 분산 투자된 것에 반해, 생명공학기술(BT) 분야는 수도권(1조 5,885억 원, 43.3%)에 집중된 모습을 보였다.
(다) 여성 연구책임자 비중이 증가함
생명공학기술(BT) 분야 2019년도 연구책임자의 성별 비율은 남성(73.0%), 여성(27.0%)이었다. 2017년도 생명공학기술(BT) 분야 연구책임자 성별 비율은 남성(75.9%), 여성(24.0%)으로 2019년도 BT 분야 여성 연구책임자 비중이 다소 증가한 것으로 나타났다.

자료: 2019년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP).
[그림 2-20] BT 분야 지역별 투자현황(2017 대비 2019)

자료: 2019년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP).
[그림 2-21] BT 분야 연구책임자 성별 현황(2017 대비 2019)
(라) 생명공학 기술(BT) 분야 과제 평균 연구비는 가장 낮음

자료: 2019년도 국가연구개발사업 조사분석 보고서 재가공(과학기술정보통신부/KISTEP).
[그림 2-22] 6T분야별 과제당 평균 연구비 현황(2019)
미래유망 신기술(6T) 분야 2019년도 과제 평균 연구비는 3억 1,215만 원으로 나타났다. 생명공학기술(BT) 분야의 과제 수 비중은 2만 4,798개(40.2%)로 가장 높았지만 과제당 평균 연구비는 1억 4,806만 원으로 가장 낮게 나타났다. 우주항공기술(ST) 분야의 과제 수 비중은 780개(1.3%)로 가장 낮았지만, 과제당 평균 연구비는 22억 5,919만 원으로 가장 높은 것으로 나타났다.
2. 인력 현황
가. 학과별 배출인력
교육통계연구센터의 교육통계서비스에 따르면 2020년 기준 전문대학의 바이오 분야 학사 재적 현황에서 보건 분야의 학사 재적생 수(3만 9,764명)가 가장 많은 것으로 조사되었다.
학과별 학사 재적생 수의 성별 현황을 살펴보면, 농수산, 환경 및 의료장비 분야에서 남성 비중이 높게 나타났으며 특히 환경학과가 남성 비중이 81%로 가장 높았다.
여성 비중이 높게 나타난 보건학과와 자원학과로 보건학과 여성 비중은 58%, 자원학과는 52%로 남성보다 소폭 높은 비중을 차지하는 것으로 조사되었다.

주) 전문대학의 바이오 분야 학사 재적 현황.
자료: 교육통계서비스(http://kess.kedi.re.kr/index).
[그림 2-23] 바이오 분야 학과별 학사 재적 현황(2020)
[표 2-45] 바이오 분야 학과별 학사 재적생 수의 성별 현황(2020)
|
학과 |
학사 재적생(명) |
||
|
남자 |
여자 |
소계 |
|
|
농수산 |
1,906 |
495 |
2,401 |
|
생물 |
2,282 |
2,285 |
4,567 |
|
자원 |
138 |
148 |
286 |
|
환경 |
2,984 |
685 |
3,669 |
|
보건 |
16,585 |
23,179 |
39,764 |
|
재활 |
9,690 |
9,429 |
19,119 |
|
의료장비 |
3,924 |
2,064 |
5,988 |
주) 전문대학의 바이오 분야 학사 재적 현황.
자료: 교육통계서비스(http://kess.kedi.re.kr/index).
교육통계연구센터의 교육통계서비스에 따르면 2020년 기준 바이오 분야 학과 중 의학 석사(4,078명) 및 박사(4,296명) 졸업자가 가장 많은 것으로 조사되었다.
학과별 석․박사 졸업자의 성별 현황을 살펴보면 석사 졸업자에서는 보건학과 재활학의 여성 비중이 월등히 높았고 박사 졸업자에서는 재활학과, 보건학과를 제외한 모든 학과에서 남성 비중이 높은 것으로 나타났다.

자료: 교육통계서비스(http://kess.kedi.re.kr/index).
[그림 2-24] 바이오 분야 학과별 석[표 2-46] 바이오 분야 학과별 석․박사 졸업자의 성별 현황(2020)
|
학과 |
석사 졸업자(명) |
박사 졸업자(명) |
||||
|
남자 |
여자 |
소계 |
남자 |
여자 |
소계 |
|
|
농업학 |
395 |
249 |
644 |
179 |
91 |
270 |
|
동물·수의학 |
297 |
266 |
563 |
248 |
168 |
416 |
|
보건학 |
796 |
2,657 |
3,453 |
291 |
418 |
709 |
|
산림·원예학 |
300 |
294 |
594 |
160 |
98 |
258 |
|
생명과학 |
1,739 |
1,999 |
3,738 |
2,427 |
1,699 |
4,126 |
|
생물학 |
441 |
340 |
781 |
396 |
279 |
675 |
|
약학 |
519 |
745 |
1,264 |
453 |
439 |
892 |
|
의료공학 |
515 |
580 |
1,095 |
377 |
306 |
683 |
|
의학 |
2,483 |
1,595 |
4,078 |
2,447 |
1,849 |
4,296 |
|
재활학 |
1,220 |
3,462 |
4,682 |
232 |
431 |
663 |
|
치의학 |
753 |
698 |
1,451 |
454 |
342 |
796 |
|
한의학 |
432 |
345 |
777 |
224 |
202 |
426 |
자료: 교육통계서비스(http://kess.kedi.re.kr/index).
2019년과 2020년의 바이오 분야 학과별 학사 재적생 수 변화를 살펴보면 생물, 자원, 재활학과를 제외한 학과에서 전년 대비 재적생 수가 감소했고 이 중 농수산학과의 재적생 수가 가장 많이 감소(351명 감소)하였다. 반면, 생물학과는 전년 대비 806명 증가, 재활학과는 전년 대비 100명이 증가하였다.

자료: 교육통계서비스(http://kess.kedi.re.kr/index).
[그림 2-25] 바이오 분야 학과별 학사 재적생 수 비교(2019, 2020)
2019년과 2020년의 바이오 분야 학과별 석사 졸업자 변화를 살펴보면 농업학, 산림․원예학, 약학, 의료공학 의학, 치의학, 한의학에서 졸업생 수가 감소하였고 이 중 의학 졸업생이 가장 많이 감소(1,145명 감소)하였다.
나머지 학과에서는 졸업생이 증가하였으며 특히 재활학에서 가장 많이 증가(98명 증가)했다.

자료: 교육통계서비스(http://kess.kedi.re.kr/index).
[그림 2-26] 바이오 분야 학과별 석사 졸업자 비교(2019, 2020)
2019년과 2020년의 바이오 분야 학과별 박사 졸업자 변화를 살펴보면 의료공학, 치의학, 한의학에서 졸업생 수가 감소하였고 의료공학 졸업생이 가장 많이 감소(61명 감소)하였다.

자료: 교육통계서비스(http://kess.kedi.re.kr/index).
[그림 2-27] 바이오 분야 학과별 박사 졸업자 비교(2019, 2020)
이들 학과를 제외한 나머지 학과에서는 졸업생이 증가하였으며 특히 재활학 졸업생이 89명으로 가장 많이 증가하였다.
나. 바이오산업 인력 현황
산업통상자원부와 한국바이오협회가 조사하여 발표한 ‘국내 바이오산업 실태조사’에 따르면, 국내 966개 바이오기업에 종사하는 인력 수는 4만 9,113명으로 2018년 대비 2,066명(5.6%) 증가하였고 1개 업체당 평균 51명이 근무하고 있는 것으로 조사되었으며, 2017년 이후 2019년까지 최근 3년간 연평균 4.6%의 증가율을 보인 것으로 나타냈다.
[표 2-47] 바이오산업 연도별 인력 변화 추이(2017∼2019)
(단위: 명)

자료: 2019년 기준 국내 바이오산업 실태조사(산업통상자원부/한국바이오협회).
(1) 분야 및 직종별 인력 현황
국내 바이오산업 인력을 직종별로 보면 연구인력이 1만 5,463명(31.5%), 생산인력 1만 6,971명(34.6%), 기타인력 1만 6,679명(34.0%)으로 구성되어 있다
[표 2-48] 바이오산업 분야별 인력 분포(2019)
(단위: 명)
|
구분 |
업체 수 |
연구인력 |
생산인력 |
기타인력 |
계 |
산업별 구성비 |
|
|
전체 |
인력 |
966 |
15,463 |
16,971 |
16,679 |
49,113 |
100.0% |
|
비율 |
100.0% |
31.5% |
34.6% |
34.0% |
100.0% |
||
|
바이오의약산업 |
291 |
7,060 |
6,854 |
6,980 |
20,894 |
42.5% |
|
|
바이오화학․에너지산업 |
187 |
2,117 |
2,328 |
2,272 |
6,717 |
13.7% |
|
|
바이오식품산업 |
174 |
1,583 |
2,740 |
1,979 |
6,302 |
12.8% |
|
|
바이오환경산업 |
64 |
370 |
297 |
404 |
1,071 |
2.2% |
|
|
바이오․의료기기산업 |
95 |
1,276 |
2,053 |
2,053 |
5,382 |
11.0% |
|
|
바이오장비 및 기기산업 |
52 |
364 |
398 |
790 |
1,552 |
3.2% |
|
|
바이오자원산업 |
18 |
265 |
177 |
615 |
1,057 |
2.2% |
|
|
바이오서비스산업 |
85 |
2,428 |
2,124 |
1,586 |
6,138 |
12.5% |
|
자료: 2019년 기준 국내 바이오산업 실태조사(산업통상자원부/한국바이오협회).
(2) 학위별 인력 분포
2019년 기준 바이오산업 인력 중 학사 졸업자는 2만 4,013명(48.9%)으로 가장 많았으며, 석사 9,501명(19.3%), 박사 2,807명(5.7%)의 순으로 나타났다.
[표 2-49] 바이오산업 학위별 인력 분포(2019)
(단위: 명)
|
구분 |
박사 |
석사 |
학사 |
기타 |
계 |
산업별 구성비 |
|
|
전체 |
인력 |
2,807 |
9,501 |
24,013 |
12,792 |
49,113 |
100.0% |
|
비율 |
5.7% |
19.3% |
48.9% |
26.0% |
100.0% |
||
|
바이오의약산업 |
1,483 |
4,736 |
9,970 |
4,705 |
20,894 |
42.5% |
|
|
바이오 화학․에너지산업 |
342 |
1,237 |
3,117 |
2,021 |
6,717 |
13.7% |
|
|
바이오식품산업 |
324 |
930 |
2,834 |
2,214 |
6,302 |
12.8% |
|
|
바이오 환경산업 |
42 |
150 |
712 |
167 |
1,071 |
2.2% |
|
|
바이오․의료기기산업 |
218 |
926 |
2,356 |
1,882 |
5,382 |
11.0% |
|
|
바이오 장비 및 기기산업 |
54 |
170 |
917 |
411 |
1,552 |
3.2% |
|
|
바이오 자원산업 |
34 |
144 |
711 |
168 |
1,057 |
2.2% |
|
|
바이오 서비스산업 |
310 |
1,208 |
3,396 |
1,224 |
6,138 |
12.5% |
|
자료: 2019년 기준 국내 바이오산업 실태조사(산업통상자원부/한국바이오협회).
2017년부터 2019년까지 바이오산업 분야 종사자의 학위 변화를 살펴보면 학사 출신 인력은 연평균 8.4%로 가장 높은 증가율을 보였으며, 석사와 박사학위를 소지한 인력은 각각 3.4%와 3.5%가 증가한 것으로 나타났다.
[표 2-50] 바이오산업 종사자 학위별 인력 변화 추이(2017∼2019)
(단위: 명)
|
구분 |
2017년 |
2018년 |
2019년 |
전년 대비 증감 |
연평균 증감률 |
||||
|
인원 |
구성비 |
인원 |
구성비 |
인원 |
구성비 |
인원 |
증감률 |
||
|
전체 |
44,895 |
100.0 |
46,488 |
100.0 |
49,113 |
100.0 |
2,625 |
5.6 |
4.6 |
|
박사 |
2,622 |
5.8 |
2,854 |
5.8 |
2,807 |
5.7 |
-47 |
-1.6 |
3.5 |
|
석사 |
8,885 |
19.8 |
9,208 |
18.7 |
9,501 |
19.3 |
293 |
3.2 |
3.4 |
|
학사 |
20,431 |
45.5 |
22,335 |
45.5 |
24,013 |
48.9 |
1,678 |
7.5 |
8.4 |
|
기타 |
12,957 |
28.9 |
12,091 |
24.6 |
12,792 |
26.0 |
701 |
5.8 |
-0.6 |
자료: 2019년 기준 국내 바이오산업 실태조사(산업통상자원부/한국바이오협회).
다. 바이오 분야 인력수급 현황
산업통상자원부와 한국산업기술진흥원의 2020년도 산업기술인력 수급실태조사 결과에 따르면 12대 주력산업 중 바이오․헬스 분야 인력 부족률은 3.2%로 소프트웨어․화학 분야와 함께 부족률이 가장 높은 산업으로 조사되었으며, 2016년부터 3%대의 높은 부족률이 지속되고 있는 것으로 나타났다.
[표 2-51] 12대 주력산업의 산업기술인력 부족률 변화(2016∼2019)
(단위: %)
|
구분 |
12대 주력산업 전체 |
기계 |
디스 플레이 |
반도체 |
바이오 헬스 |
섬유 |
자동차 |
전자 |
조선 |
철강 |
화학 |
소프트 웨어 |
IT 비즈니스 |
|
2016 |
2.4 |
2.7 |
0.5 |
1.5 |
3.5 |
2.3 |
1.9 |
2.2 |
0.9 |
1.7 |
3.5 |
4.0 |
1.3 |
|
2017 |
2.4 |
2.7 |
0.6 |
1.5 |
3.5 |
2.4 |
1.9 |
2.3 |
0.8 |
1.6 |
3.5 |
4.1 |
1.3 |
|
2018 |
2.5 |
2.6 |
0.5 |
1.6 |
3.3 |
2.5 |
2.0 |
2.6 |
1.1 |
1.9 |
3.3 |
4.3 |
1.7 |
|
2019 |
2.5 |
2.7 |
0.6 |
1.6 |
3.2 |
2.6 |
2.0 |
2.6 |
1.0 |
1.9 |
3.3 |
4.0 |
1.6 |
|
증감 |
0.0 |
0.1 |
0.1 |
0.0 |
△0.1 |
0.1 |
0.0 |
0.0 |
△0.1 |
0.0 |
0.0 |
△0.3 |
△0.1 |
자료: 2020년도 산업기술인력 수급 실태조사(산업통상자원부/한국산업기술진흥원).
(단위: %)
|
|
자료: 2020년도 산업기술인력 수급 실태조사(산업통상자원부/한국산업기술진흥원).
[그림 2-28] 12대 주력산업의 산업기술인력 부족률(2019년 말 기준)
한국바이오협회에서 발간한 바이오산업 인력수요 및 공급조사 결과 분석보고서에 따르면 2021년 바이오산업의 부족 인원은 1,234명으로 전망되며, 직종별로는 연구인력 669명, 생산인력 277명, 영업․관리 등 기타인력은 287명이 부족할 것으로 전망되었다.
|
구분 |
연구인력 |
생산인력 |
영업․관리 등 기타인력 |
합계 |
|
바이오의약 |
304 |
143 |
168 |
614 |
|
바이오 화학․에너지 |
52 |
14 |
14 |
80 |
|
바이오 식품 |
45 |
13 |
10 |
68 |
|
바이오 환경 |
43 |
74 |
24 |
141 |
|
바이오 의료기기 |
29 |
32 |
9 |
70 |
|
바이오 장비 및 기기 |
16 |
2 |
4 |
22 |
|
바이오 자원 |
47 |
0 |
25 |
72 |
|
바이오 서비스 |
133 |
0 |
33 |
167 |
|
합계 |
669 |
277 |
287 |
1,234 |
자료: 한국바이오협회, 2019년 기준 국내 바이오산업 인력수요 및 공급조사 결과 분석.
3. 특허 현황
가. 생명공학 특허 개요
생명공학기술은 의약품, 식량, 환경 등 다양한 분야에 활용될 수 있는 중요한 기술 분야이다. 생명공학기술의 산업화는 1982년 미국 FDA의 승인을 획득한 유전자 재조합 인슐린이 지식재산권으로 승인 허가가 내려진 이후로 생명공학 신제품들이 시장에 등장하면서 본격화되었다.
생명공학 산업화의 주도권은 원천기술을 바탕으로 하는 지식재산권 확보에 의존하므로 지식재산권보호의 중요성에 대한 국제적 인식은 나날이 증대되었으며, 이에 따라 관련 제도 구축 및 적정 보호를 위한 국제적인 노력이 끊임없이 계속되어 왔다. 한국 특허청도 1988년에 생명공학 분야 특허심사기준을 제정한 후, 급증하는 특허출원에 부응하여 유전자서열 전자출원제도를 도입하였고, 유전자서열 DB 및 생명공학 검색시스템을 구축, 심사 가이드를 마련하여 활용하고 있다.
특허는 과학기술 활동의 결과이며 특허정보는 연구개발 활동에 있어서 지적 투입요소로 판단할 수 있다. 또한 특허정보는 논문정보와는 달리 경제적 이익의 확보를 전제로 하고 있으므로 경제적 측면과 연결된 연구개발 활동 지표로 활용되고 있다.
특허정보에 기인한 특허통계는 국가별, 지역별, 기업별 발명활동의 성과를 반영하고, 혁신과정에서의 협력관계, 기술개발과정 등 연구개발과정의 역동성을 반영하고 있다.22) 따라서, 정량적 특허지표는 혁신시스템과 경제성장을 뒷받침하는 요인을 이해하는데 기여하고, 기술분야, 국가간, 기업간, 지역간 확산정도를 추적하는데 이용되고 있다. 또한 R&D의 성과, 특정기술 및 산업의 구조와 발전정도를 이해하는 데 사용되고 있다.
본 보고서에서는 한국과 미국에 출원 또는 등록된 생명공학분야 특허데이터를 추출하여 국가별, 기술별, 주요 출원인 분석을 통해 연구개발 성과를 측정하고 세부기술별 현황을 살펴보았다.
나. 분석 기준
생명공학분야의 기술분류는 2004년 8월 발행된 ‘생명공학 특허 동향’에서 사용된 것이다. 이는 OECD가 작성한 생명공학분야 특허 현황에 관한 보고서와 이를 기초로 작성된 OECD의 생명공학분야 분류체계(국제특허분류를 이용한 분류체계), 유럽특허청에서 정의한 생명공학관련 국제특허분류 및 국가과학기술기본계획상의 생명공학 분류체계를 참조하여 특허청과 외부기관의 생명공학 분야 전문가 그룹의 자문을 통해 결정된 것이다.
분석대상 국가로는 한국과 세계적 동향을 파악하기 위해 특허를 가장 강하게 보호하고 시장규모도 큰 미국특허를 대상으로 하였으며, 시간적 기준으로 한국은 출원시점으로 2010∼2019년까지23)를, 미국특허는 등록기준으로 2011∼2020년까지의 특허를 가지고 동향을 파악하였다.
주요 국가들의 기술집중도를 살펴보기 위해 현시기술우위지수(RTA: Revealed Technological Advantage)을 사용하여 분석을 수행해 보았다. RTA는 기술 특화(specialization) 현황의 파악을 위해 가장 많이 사용되는 지수 중 하나이다. 우리가 관심의 대상으로 삼는 특정 주체가 다른 주체와 비교하여 상대적으로 어떠한 기술분야에 기술혁신 활동을 집중하고 있는가를 분석할 때 활용되는 지표이다. RTA 지수의 산출방법은 아래와 같다. 아래의 수식에서 분자는 ![]() 의 특허에서 i분야가 차지하는 비율을 의미하며, 분모는 전 분야의 특허에서
의 특허에서 i분야가 차지하는 비율을 의미하며, 분모는 전 분야의 특허에서 ![]() 분야가 차지하는 비율을 의미한다.
분야가 차지하는 비율을 의미한다.
 (Pij는
(Pij는 ![]() 분야에 대한
분야에 대한 ![]() 의 특허 수)
의 특허 수)
RTA 지수 값이 1보다 크면 기술집중도가 높음을 의미하며 1보다 작으면 기술집중도가 낮음을 의미한다.
[표 2-53] 생명공학 분야 기술분류
|
산업 |
세부기술 |
국제특허분류 |
설명 |
|
기초 |
생물자원탐색기술 |
C12N 1/00-3/00 |
미생물 |
|
C12N 7/00-7/08 |
바이러스 |
||
|
동식물 세포배양기술 |
C12N 5/00-5/28 |
동식물 세포 |
|
|
효소 공학기술 |
C12N 9/00-13/00 |
효소 |
|
|
유전체기술 |
C12N 15/00-15/90 |
유전공학 |
|
|
C07H 19/00-21/04 |
당류기 함유 핵산 |
||
|
단백질체기술 |
C07K 1/00-14/825 |
펩티드 |
|
|
C07K 17/00-17/14 |
고정화 펩티드 |
||
|
C07K 19/00 |
하이브리드 펩티드 |
||
|
항체 이용기술 |
C07K 16/00-16/46 |
면역 글로불린 |
|
|
공정 |
생물공정기술 |
C12M 1/00-1/42 |
효소 미생물 관련 장치 |
|
C12M 3/00-3/10 |
동식물 세포 배양장치 |
||
|
C12P 1/00-41/00 |
생물학적 합성 |
||
|
C12S 1/00-13/00 |
분리 정제 |
||
|
측정진단기술 |
C12Q 1/00-3/00 |
측정 시험 |
|
|
G01N 33/50-33/98 |
조사 분석 |
||
|
의약 |
생물 의약개발기술 |
A61K 35/12-35/84, 7/26 |
신약 후보물질 |
|
A61K 38/00-38/58, 7/28 |
단백질 치료제 |
||
|
A61K 39/00-39/44 |
치료용 항체 |
||
|
A61K 48/00 |
유전자 치료 |
||
|
A61K 51/00-51/10 |
방사선 의약 |
||
|
농업 |
생물농약개발기술 |
A01N 63/00-65/02 |
생물 농약 |
|
형질전환동식물개발기술 |
A01H |
신규한 식물 |
|
|
A01K 67/00-67/04 |
신규한 동물 |
||
|
환경 |
발효식품개발기술 |
C12C - C12L |
알코올 발효 및 장치 |
|
환경생물공학기술 |
C02F 3/00-3/34 |
생물학적 수처리 |
|
|
C02F 11/02-11/04 |
슬러지 처리 |
다. 분석결과
(1) 한국에 출원된 생명공학 특허 동향
한국에 출원된 생명공학 분야 특허출원 건수는 매년 증가하여 연평균 증가율이 2.67%를 나타내고 있다. 내국인의 특허비율은 약 62%이며 이는 전체 특허에서 차지하는 내국인 비율 77%에 비하면 점유율이 낮은 것을 알 수 있다. 한국의 특허출원 건수는 매년 약 3,500여건을 상회하는 것으로 나타났으며, 미국이 약 1,000여 건의 특허를 출원하고 있는 것으로 조사되었다.
2010∼2018년까지의 연평균 증가율에서는 중국이 24.60%로 가장 높은 것으로 나타났고, 2019년 특허출원 건수 순위는 미국, 일본에 이어 4위를 차지하고 있는 것으로 조사되었다. 일본과 오스트레일리아는 상위 15개 국가 중에서 연평균 증가율이 마이너스인 것으로 나타났다.
[표 2-54] 한국특허출원의 국가별-연도별 현황(2010∼2019)
(단위: 건, %)
|
국가 |
2010∼2012년 |
2013∼2015년 |
2016년 |
2017년 |
2018년 |
2019년 |
연평균 증가율1) (’10∼’18년) |
|
한국 |
8,874 |
9,921 |
3,534 |
3,769 |
3,667 |
3,348 |
3.53% |
|
미국 |
2,491 |
2,565 |
920 |
974 |
1165 |
877 |
3.70% |
|
일본 |
848 |
654 |
227 |
275 |
221 |
155 |
-2.20% |
|
중국 |
118 |
169 |
89 |
105 |
122 |
128 |
24.60% |
|
독일 |
363 |
342 |
170 |
136 |
148 |
97 |
0.97% |
|
스위스 |
444 |
398 |
108 |
122 |
141 |
86 |
0.00% |
|
영국 |
180 |
206 |
112 |
112 |
104 |
90 |
8.79% |
|
프랑스 |
240 |
264 |
87 |
81 |
91 |
48 |
1.62% |
|
네덜란드 |
145 |
134 |
59 |
61 |
63 |
21 |
0.00% |
|
벨기에 |
97 |
87 |
36 |
39 |
39 |
26 |
1.73% |
|
덴마크 |
106 |
90 |
29 |
37 |
32 |
19 |
4.21% |
|
오스트레일리아 |
98 |
84 |
26 |
35 |
36 |
21 |
-1.00% |
|
스웨덴 |
55 |
67 |
37 |
28 |
31 |
24 |
15.19% |
|
캐나다 |
88 |
92 |
28 |
25 |
32 |
22 |
4.21% |
|
이스라엘 |
72 |
61 |
15 |
25 |
26 |
22 |
1.54% |
국내 다출원 상위 15개 국가의 RTA 지수를 살펴보기 위해 2010∼2018년까지의 기간을 3년 단위의 구간으로 구분하여 기술집중도의 변화를 살펴보았다. 상위 15개국의 RTA 산출결과, 한국과 일본을 제외하고는 모두 기술집중도가 1을 넘는 것으로 나타났다. 이는 각국이 한국에 특허를 출원함에 있어 다른 기술분야에 비해 생명공학 분야의 비중이 높음을 의미한다. 한국은 특허 출원 건수 측면에서는 많은 것으로 보이나, 다른 기술분야(예, ICT, 자동차 등)에 비해 기술집중도가 평균보다 낮은 것으로 조사되었다.

[그림 2-29] 한국특허출원의 주요국의 구간별 RTA 지수변화(2010∼2018)
연도별 기술별 특허출원 현황을 살펴보면, 공정분야의 측정진단기술 측정, 시험이 특허 건수가 꾸준히 가장 많이 나타나는 기술분류이다. 기초분야에서는 유전체기술의 유전공학, 단백질체의 펩티드의 특허 건수가 매년 500여 건 이상이 출원되고 있으며, 항체 이용의 면역 글로불린의 특허출원 건수는 지속적으로 증가하고 있는 것으로 나타났다.
의약 분야의 생물 의약기술에서는 단백질 치료제와 신약후보물질과 관련된 특허 출원이 조금씩 늘어나고 있는 것으로 나타났다.
[표 2-55] 한국에 출원한 생명공학 분야의 기술분류별-연도별 특허출원 현황(2010∼2019)
(단위: 건)
|
기술분류 |
2010∼2012년 |
2013∼2015년 |
2016년 |
2017년 |
2018년 |
2019년 |
||
|
공정 |
생물공정 |
분리정제 |
0 |
0 |
0 |
0 |
0 |
0 |
|
생물학적합성 |
537 |
547 |
152 |
166 |
165 |
131 |
||
|
동식물세포배양장치 |
238 |
224 |
42 |
29 |
26 |
23 |
||
|
효소,미생물관련장치 |
397 |
506 |
150 |
196 |
191 |
188 |
||
|
측정진단 |
조사, 분석 |
1,218 |
1,083 |
550 |
515 |
478 |
385 |
|
|
측정, 시험 |
1,292 |
1,942 |
762 |
885 |
858 |
711 |
||
|
기초 |
유전체 |
유전공학 |
2,006 |
1,885 |
568 |
555 |
588 |
498 |
|
당류기함유핵산 |
71 |
85 |
31 |
43 |
45 |
35 |
||
|
단백질체 |
펩티드 |
992 |
1,334 |
590 |
593 |
549 |
444 |
|
|
고정화펩티드 |
19 |
8 |
4 |
6 |
1 |
3 |
||
|
하이브리드펩티드 |
212 |
172 |
11 |
2 |
3 |
0 |
||
|
항체이용 |
면역글로불린 |
893 |
1,019 |
451 |
559 |
657 |
518 |
|
|
효소공학 |
효소 |
421 |
529 |
166 |
180 |
185 |
168 |
|
|
생물자원탐색 |
미생물 |
1,105 |
1,176 |
332 |
367 |
372 |
326 |
|
|
바이러스 |
123 |
164 |
64 |
92 |
67 |
79 |
||
|
동식물세포배양 |
동식물세포 |
640 |
811 |
315 |
356 |
367 |
362 |
|
|
농업 |
생물농약개발 |
생물농약 |
272 |
289 |
110 |
95 |
96 |
72 |
|
형질전환동식물개발 |
신규한동물 |
192 |
258 |
139 |
130 |
121 |
112 |
|
|
신규한식물 |
446 |
250 |
67 |
50 |
48 |
50 |
||
|
식품 |
발효식품개발 |
알코올발효및장치 |
596 |
513 |
184 |
221 |
188 |
141 |
|
의약 |
생물의약개발 |
방사선의약 |
51 |
44 |
12 |
21 |
23 |
15 |
|
유전자치료 |
130 |
267 |
90 |
87 |
112 |
79 |
||
|
치료용항체 |
674 |
627 |
207 |
183 |
207 |
150 |
||
|
단백질치료제 |
832 |
757 |
211 |
223 |
249 |
184 |
||
|
신약후보물질 |
471 |
491 |
227 |
262 |
307 |
241 |
||
|
환경 |
환경생물공학 |
슬러지처리 |
206 |
125 |
34 |
26 |
33 |
23 |
|
생물학적수처리 |
636 |
505 |
170 |
169 |
163 |
143 |
||
생명공학 분야의 국내 상위 10개 출원인을 살펴보면(출원인 명칭이 대한민국은 제외), 서울대학교와 연세대학교, 고려대학교 등 대학에서 생명공학 분야의 특허활동을 주도하고 있음을 알 수 있다. 2016∼2017년, 2018∼2019년 각각 구간에서 상위 10대 다출원인 중에서 대학이 7개, 연구원이 2개, 기업이 1개를 차지하고 있는 것으로 나타났다.
[표 2-56] 국내 상위 10대 다출원인 현황(2016∼2019)
(단위: 건)
|
2016∼2017년 |
건수 |
2018∼2019년 |
건수 |
|
서울대학교 |
224 |
서울대학교 |
196 |
|
연세대학교 |
174 |
고려대학교 |
189 |
|
고려대학교 |
172 |
연세대학교 |
165 |
|
경북대학교 |
120 |
한국생명공학연구원 |
108 |
|
한국과학기술연구원 |
115 |
씨제이제일제당 |
104 |
|
한국생명공학연구원 |
112 |
전남대학교 |
99 |
|
가톨릭대학교 |
109 |
한국과학기술연구원 |
98 |
|
전남대학교 |
108 |
충북대학교 |
97 |
|
건국대학교 |
108 |
경북대학교 |
93 |
|
엘지생활건강 |
101 |
가톨릭대학교 |
92 |
(2) 미국에 등록된 생명공학 특허 동향
미국에 출원된 생명공학 분야 특허등록 건수는 매년 증가하여 연평균 증가율이 4.01%를 나타내고 있다. 미국 자국인(US Origin)의 특허비율은 약 55%로 미국 전체 특허에서 차지하는 미국 자국인 특허비율 47%보다 높은 것으로 나타났다. 최근 10년간 미국의 연평균 증가율은 3.55%이며 특허등록 건수는 매년 증가하여 2019년부터는 7,000건이 넘는 특허 건수를 차지하고 있다.
연평균 증가율이 가장 높은 국가는 중국으로 24.93%로 나타났고, 한국도 10.58%의 높은 연평균 증가율을 보여주고 있는 것으로 조사되었다. 한국에 출원한 특허의 연평균 증가율과 마찬가지로 일본과 오스트레일리아만이 마이너스 증가율을 보여주고 있음을 알 수 있다.
특허등록 건수에서는 한국이 2011년 10위를 차지하였으나, 2020년에는 6위까지 건수 순위가 상승하고 있음을 보여주었다.
[표 2-57] 미국에 등록된 생명공학 특허의 국가별 특허등록 건수 현황(2011∼2020)
(단위: 건, %)
|
국가 |
2011∼ 2013년 |
2014∼ 2016년 |
2017년 |
2018년 |
2019년 |
2020년 |
연평균 증가율(10년) |
|
미국 |
17,354 |
19,615 |
5,924 |
6,781 |
7,329 |
7,309 |
3.55% |
|
일본 |
2,335 |
2,413 |
562 |
635 |
688 |
714 |
-1.55% |
|
독일 |
1,279 |
1,500 |
438 |
517 |
605 |
619 |
4.57% |
|
네덜란드 |
790 |
1,388 |
422 |
484 |
558 |
614 |
10.75% |
|
스위스 |
835 |
1,009 |
342 |
379 |
312 |
352 |
5.15% |
|
프랑스 |
741 |
957 |
305 |
324 |
348 |
383 |
8.04% |
|
대한민국 |
541 |
769 |
301 |
354 |
377 |
388 |
10.58% |
|
영국 |
672 |
815 |
216 |
285 |
350 |
389 |
8.35% |
|
덴마크 |
536 |
696 |
169 |
239 |
212 |
220 |
3.46% |
|
이스라엘 |
393 |
504 |
168 |
175 |
161 |
176 |
4.64% |
|
중국 |
208 |
410 |
164 |
231 |
282 |
341 |
24.93% |
|
캐나다 |
583 |
557 |
142 |
192 |
160 |
185 |
0.06% |
|
벨기에 |
318 |
397 |
137 |
159 |
158 |
153 |
2.27% |
|
대만 |
331 |
346 |
111 |
117 |
127 |
109 |
1.54% |
|
오스트레일리아 |
373 |
379 |
110 |
130 |
128 |
111 |
-0.68% |
미국내 다특허권 상위 15개 국가의 RTA 지수를 살펴보기 위해 2012∼2020년까지의 기간을 3년 단위의 구간으로 구분하여 기술집중도의 변화를 살펴보았다. 상위 15개국의 RTA 산출결과, 유럽국가(네덜란드, 스위스, 덴마크, 벨기에 등)들의 기술집중도가 평균보다 높게 나타났고, 아시아국가(한국, 일본, 중국, 대만)들의 기술집중도는 평균보다 낮은 것으로 나타났다. 아시아국가들은 전기․전자, 반도체, 정보통신 분야가 주력산업인 국가들로 생명공학 분야의 기술집중도는 이에 비해 낮은 것으로 판단된다. 한국은 2012∼2014년까지의 기술집중도 지수가 0.36에서 2019∼2020년의 기술집중도는 0.46으로 약간 높아지고 있는 것으로 나타났다.

[그림 2-30] 미국특허의 주요국의 구간별 RTA 지수변화(2012∼2020)
연도별 기술별 특허등록 현황을 살펴보면, 한국의 생명공학 특허출원 현황과 비슷한 현상을 보여주고 있다. 공정분야의 측정진단기술 조사, 분석과 측정, 시험이 특허 건수 많고, 기초분야에서는 유전체기술의 유전공학, 단백질체의 펩티드의 특허 건수가 꾸준히 증가하고 있는 것으로 나타났다. 항체 이용의 면역 글로불린의 특허 건수 역시 많은 것으로 나타났다. 한국 특허출원 동향과 다르게 나타나는 부분은 형질전환 동식물개발의 신규한 식물의 특허 건수가 많다는 것이다. 매년 2,000여 건 이상의 특허등록 건수를 보인다. 또한, 의약 분야의 생물 의약기술개발에서 치료용 항체와 단백질 치료제의 특허등록 건수가 매년 1,000여 건 이상으로 많이 발생하고 있음을 알 수 있다.
미국 특허의 한국국적 상위 10대 다특허권자를 살펴보면, 2017∼2018년 구간에서는 기업인 삼성전자와 CJ 제일제당의 특허 건수가 1, 2위를 차지하고 있으나, 2019∼2020년 구간에서는 CJ 제일제당이 1위, 서울대, 카이스트, 고려대 순으로 나타났다. 연구주체별로 살펴보면, 2017∼2018년 구간에서는 기업이 4개, 대학이 4개, 연구소가 2개였으나, 2019∼2020년 구간에서는 기업이 6개, 대학이 3개, 연구소가 1개로 기업의 숫자가 늘어났음을 알 수 있다.
[표 2-58] 미국에 등록된 생명공학 특허의 기술분류별-연도별 특허등록 건수 현황(2011∼2013)
(단위: 건)
|
기술분류 |
2011∼ 2013년 |
2014∼ 2016년 |
2017년 |
2018년 |
2019년 |
2020년 |
||
|
공정 |
생물공정 |
분리정제 |
5 |
2 |
0 |
1 |
0 |
0 |
|
생물학적합성 |
2,083 |
2,216 |
629 |
619 |
594 |
613 |
||
|
동식물세포배양장치 |
71 |
108 |
28 |
34 |
55 |
58 |
||
|
효소,미생물관련장치 |
722 |
760 |
238 |
218 |
229 |
207 |
||
|
측정진단 |
조사,분석 |
2,319 |
2,322 |
900 |
1,000 |
950 |
1,035 |
|
|
측정,시험 |
3,327 |
3,417 |
1,187 |
1,244 |
1,305 |
1,409 |
||
|
기초 |
유전체 |
유전공학 |
1,785 |
2,369 |
990 |
1,029 |
1,110 |
1,248 |
|
당류기함유핵산 |
1,672 |
1,257 |
344 |
306 |
306 |
287 |
||
|
단백질체 |
펩티드 |
1,206 |
1,839 |
685 |
673 |
852 |
785 |
|
|
고정화펩티드 |
33 |
44 |
13 |
4 |
1 |
12 |
||
|
하이브리드펩티드 |
21 |
44 |
16 |
11 |
9 |
13 |
||
|
항체이용 |
면역글로불린 |
749 |
1,221 |
655 |
707 |
693 |
886 |
|
|
효소공학 |
효소 |
907 |
1,259 |
402 |
465 |
572 |
562 |
|
|
생물자원탐색 |
미생물 |
555 |
659 |
180 |
196 |
152 |
162 |
|
|
바이러스 |
120 |
153 |
73 |
89 |
126 |
84 |
||
|
동식물세포배양 |
동식물세포 |
982 |
1,280 |
405 |
425 |
373 |
361 |
|
|
농업 |
생물농약개발 |
생물농약 |
709 |
748 |
226 |
146 |
121 |
125 |
|
형질전환동식물개발 |
신규한동물 |
122 |
171 |
70 |
84 |
85 |
91 |
|
|
신규한식물 |
5,534 |
6,921 |
2,407 |
2,194 |
2,472 |
2,466 |
||
|
식품 |
발효식품개발 |
알코올발효및장치 |
46 |
76 |
35 |
30 |
47 |
49 |
|
의약 |
생물의약개발 |
방사선의약 |
281 |
347 |
107 |
79 |
87 |
85 |
|
유전자치료 |
380 |
541 |
168 |
158 |
205 |
157 |
||
|
치료용항체 |
2,979 |
3,420 |
1,147 |
1,093 |
1,120 |
1,163 |
||
|
단백질치료제 |
3,137 |
3,465 |
1,128 |
1,067 |
1,036 |
999 |
||
|
신약후보물질 |
330 |
619 |
297 |
365 |
437 |
493 |
||
|
환경 |
환경생물공학 |
슬러지처리 |
6 |
9 |
15 |
7 |
13 |
5 |
|
생물학적수처리 |
323 |
268 |
89 |
84 |
101 |
100 |
||
주) 기술 분야별 특허 건수는 특허분류 개정, reissue 등의 사유로 인해 일부 차이가 발생할 수 있음.
[표 2-59] 미국에 등록된 생명공학 분야 특허의 한국국적 다등록권자 현황(2017∼2020)
(단위: 건)
|
2017∼2018년 |
건수 |
2019∼2020년 |
건수 |
|
삼성전자 |
72 |
CJ 제일제당 |
70 |
|
CJ 제일제당 |
48 |
서울대학교 |
26 |
|
고려대학교 |
31 |
한국과학기술원 |
21 |
|
서울대학교 |
22 |
고려대학교 |
19 |
|
한국생명공학연구원 |
20 |
한국과학기술연구원 |
19 |
|
한국과학기술원 |
20 |
삼성전자 |
18 |
|
한국과학기술연구원 |
18 |
삼성생명 |
15 |
|
연세대학교 |
18 |
케어젠 |
15 |
|
한미 |
14 |
인트론 바이오테크놀로지 |
14 |
|
젬벡스 & 카엘 가톨릭대학교 |
11 |
한미 |
15 |
4. 논문 현황
가. 개요
연구개발 결과는 논문을 통해 전파되고 이를 통해 학문이 발전하며 응용연구로 연결된다. 연구자는 논문발표를 통해 연구결과에 대한 객관적인 비판과 평가를 받으며, 자신의 축적된 연구역량을 확인해 주는 주요 수단이 되기도 한다. 이러한 논문의 현황분석은 우리나라 생명공학의 수준과 역량을 보다 객관적으로 진단하는 데 유용하다. 특히, 파괴적 혁신을 일으키는 R&D24)를 위해서는 논문의 양적 수준뿐 아니라 질적 수준에 대한 객관적인 분석이 필요하다.
논문분석을 수행하기 위해서는 논문 데이터베이스(DB)가 필요하다. Clarivate Analytics에서 발간하는 SCI(Science Citation Index) DB는 학계에 널리 알려진 DB로써 SCI등재 학술지 논문 수는 한 나라의 국제적인 연구개발 활동의 지표로서 널리 인식되고 있다. SCI DB는 30년 이상 엄정한 심사를 통과한 학술지에 대한 DB를 구축하여 제공함으로써 세계적인 권위를 인정받고 있다. 논문 현황 분석은 SCI DB의 일종인 InCites DB와 WoS(Web of Science), ESI(Essential Science Indicators, 2009∼2019)를 기반으로 하였다. 전체 과학기술 분야 중 생명공학 분야를 분석하기 위해 ESI 기준 SCI 과학기술 18개 분야 중 관련 6개 분야를 대상으로 하였다. 또한, 논문 타입은 article, review만으로 한정하였다.
나. 한국의 SCI 논문 현황
2019년 우리나라 SCI 논문 수는 7만 359편으로 세계 12위 수준이다. 세계 점유율도 2010년 대비 0.29% 증가하는 등 매년 양적으로 점진적인 증가 추세를 나타내고 있다.
[표 2-60] 연도별 한국의 SCI 논문 발표 현황(2010∼2019)
|
구분 |
2010 |
2011 |
2012 |
2013 |
2014 |
|
논문발표 수(편) |
42,003 |
46,290 |
50,374 |
52,835 |
55,838 |
|
세계 총 논문 수(편) |
1,350,341 |
1,443,887 |
1,496,096 |
1,574,834 |
1,627,375 |
|
세계 점유율(%) |
3.11 |
3.21 |
3.37 |
3.35 |
3.43 |
|
세계 순위 |
12위 |
12위 |
12위 |
12위 |
12위 |
|
구분 |
2015 |
2016 |
2017 |
2018 |
2019 |
|
논문발표 수(편) |
58,977 |
60,656 |
61,680 |
64,449 |
70,359 |
|
세계 총 논문 수(편) |
1,680,984 |
1,749,487 |
1,824,646 |
1,879,618 |
2,072,046 |
|
세계 점유율(%) |
3.51 |
3.47 |
3.38 |
3.43 |
3.40 |
|
세계 순위 |
12위 |
12위 |
12위 |
12위 |
12위 |
우리나라 SCI 논문의 최근 5년간(2015∼2019) 평균 피인용 횟수는 6.9회로, 세계 평균(6.38회)과 비교했을 때 질적 수준에서 약간 높은 수준을 보인다. 과거에는 세계 전체 평균에 비해 다소 낮은 편이었지만, 최근 상승하며 세계 평균을 넘어서게 되었다. SCI 논문의 양적 성장은 줄어들고 있지만, 질적으로는 점차 향상되고 있다는 것을 알 수 있다.
[표 2-61] 5년 주기별 한국의 SCI 논문 1편당 평균 피인용 현황(2010∼2019)
|
구분 |
2010∼2014 |
2011∼2015 |
2012∼2016 |
2013∼2017 |
2014∼2018 |
2015∼2019 |
|
한국 |
5.26 |
5.55 |
5.89 |
6.1 |
6.47 |
6.9 |
|
세계 평균 |
5.48 |
5.6 |
5.77 |
5.9 |
6.09 |
6.38 |
|
세계대비 |
96.0% |
99.1% |
102.1% |
103.4% |
106.2% |
108.2% |
다. 바이오 분야 SCI 논문 현황
우리나라 바이오 6개 분야의 최근 5년간(2015∼2019) SCI 논문 수는 다음 표와 같다. 미생물학과 약리학 분야가 논문 수로 세계 8위 수준이며, 점유율도 우리나라 평균(3.42%)보다 높은 것으로 나타났다. 국가별로는 미국이 6개 분야 모두 월등히 앞서 있으며, 중국, 영국, 독일, 일본, 프랑스 순으로 나타났다.
[표 2-62] 최근 5년간 한국의 바이오 분야 SCI 논문 현황(2015∼2019)
|
분야명 |
분야 논문 수 |
세계 순위 |
한국 대비 |
세계 대비 |
||
|
총 논문 수 |
점유율 |
세계분야 총 논문 수 |
점유율 |
|||
|
면역학 |
3,376 |
16위 |
311,649 |
1.08% |
137,450 |
2.46% |
|
미생물학 |
4,683 |
8위 |
311,649 |
1.50% |
111,235 |
4.21% |
|
분자생물학 & 유전학 |
9,038 |
10위 |
311,649 |
2.90% |
263,401 |
3.43% |
|
생물학 & 생화학 |
14,412 |
10위 |
311,649 |
4.62% |
389,658 |
3.70% |
|
신경과학 & 행동과학 |
7,509 |
13위 |
311,649 |
2.41% |
270,182 |
2.78% |
|
약리학 |
8,764 |
8위 |
311,649 |
2.81% |
225,570 |
3.89% |
|
생명공학 합계 |
47,782 |
12위 |
311,649 |
15.33% |
1,397,496 |
3.42% |
[그림 2-31] 최근 5년간 국가별 바이오 분야 SCI 논문 수(2015∼2019)
한국의 바이오 분야 SCI 논문을 연도별 살펴보면 분자생물학 및 유전학 분야의 SCI 논문 수가 최근 10년간 6.3%의 연평균 증가율을 보이며 대략 1.7배 정도 증가하였고, 면역학(5.4%), 신경과학 및 행동학(5.2%), 미생물학(3.9%), 생물학 및 생화학(3.7%), 약리학(2.6%) 순으로 SCI 논문이 증가하고 있는 것으로 나타났다.
[표 2-63] 한국의 생명공학 분야 SCI 논문 현황(2010∼2019)
|
분야명 |
구분 |
2010 |
2011 |
2012 |
2013 |
2014 |
||||||
|
면역학 |
논문 수 |
473 |
523 |
620 |
593 |
645 |
||||||
|
피인용 수 |
15,755 |
14,930 |
15,788 |
14,366 |
14,230 |
|||||||
|
평균 피인용 |
33.31 |
28.55 |
25.46 |
24.23 |
22.06 |
|||||||
|
미생물학 |
논문 수 |
667 |
757 |
921 |
807 |
847 |
||||||
|
피인용 수 |
16,787 |
15,169 |
18,844 |
11,315 |
13,024 |
|||||||
|
평균 피인용 |
25.17 |
20.04 |
20.46 |
14.02 |
15.38 |
|||||||
|
분자생물학&유전학 |
논문 수 |
990 |
1,198 |
1,328 |
1,344 |
1,534 |
||||||
|
피인용 수 |
44,477 |
38,128 |
53,920 |
42,215 |
48,716 |
|||||||
|
평균 피인용 |
44.93 |
31.83 |
40.60 |
31.41 |
31.76 |
|||||||
|
생물학 & 생화학 |
논문 수 |
2,175 |
2,278 |
2,467 |
2,750 |
2,855 |
||||||
|
피인용 수 |
65,483 |
67,536 |
68,200 |
65,386 |
62,194 |
|||||||
|
평균 피인용 |
30.11 |
29.65 |
27.64 |
23.78 |
21.78 |
|||||||
|
신경과학&행동과학 |
논문 수 |
1,006 |
1,037 |
1,223 |
1,289 |
1,292 |
||||||
|
피인용 수 |
29,635 |
29,539 |
30,694 |
31,874 |
28,174 |
|||||||
|
평균 피인용 |
29.46 |
28.49 |
25.10 |
24.73 |
21.81 |
|||||||
|
약리학 |
논문 수 |
1,477 |
1,598 |
1,657 |
1,653 |
1,625 |
||||||
|
피인용 수 |
40,020 |
36,431 |
37,005 |
35,774 |
30,101 |
|||||||
|
평균 피인용 |
27.10 |
22.80 |
22.33 |
21.64 |
18.52 |
|||||||
|
면역학 |
논문 수 |
659 |
633 |
640 |
686 |
758 |
||||||
|
피인용 수 |
12,187 |
11,044 |
9,481 |
7,657 |
5,128 |
|||||||
|
평균 피인용 |
18.49 |
17.45 |
14.81 |
11.16 |
6.77 |
|||||||
|
분야명 |
구분 |
2015 |
2016 |
2017 |
2018 |
2019 |
|
미생물학 |
논문 수 |
920 |
881 |
1,007 |
931 |
944 |
|
피인용 수 |
11,052 |
11,347 |
12,668 |
7,770 |
4,493 |
|
|
평균 피인용 |
12.01 |
12.88 |
12.58 |
8.35 |
4.76 |
|
|
분자생물학&유전학 |
논문 수 |
1,729 |
1,993 |
1,996 |
1,598 |
1,722 |
|
피인용 수 |
49,070 |
46,749 |
30,466 |
18,571 |
11,287 |
|
|
평균 피인용 |
28.38 |
23.46 |
15.26 |
11.62 |
6.55 |
|
|
생물학&생화학 |
논문 수 |
2,956 |
2,824 |
2,755 |
2,856 |
3,021 |
|
피인용 수 |
56,760 |
48,488 |
39,570 |
33,892 |
20,592 |
|
|
평균 피인용 |
19.20 |
17.17 |
14.36 |
11.87 |
6.82 |
|
|
신경과학&행동과학 |
논문 수 |
1,402 |
1,493 |
1,534 |
1,488 |
1,592 |
|
피인용 수 |
25,989 |
22,180 |
22,131 |
14,718 |
9,464 |
|
|
평균 피인용 |
18.54 |
14.86 |
14.43 |
9.89 |
5.94 |
|
|
약리학 |
논문 수 |
1,806 |
1,683 |
1,669 |
1,743 |
1,863 |
|
피인용 수 |
27,542 |
23,766 |
18,480 |
15,952 |
10,365 |
|
|
평균 피인용 |
15.25 |
14.12 |
11.07 |
9.15 |
5.56 |

[그림 2-32] 한국의 연도별 바이오 분야 SCI 논문 수 추이(2010∼2019)
최근 5년간 우리나라에서 발표한 바이오 6개 분야 SCI 논문 4만 7,782편 중 1회 이상 피인용된 논문은 4만 4,753편으로 논문의 피인용률은 93.7% 수준으로 나타났다. 대부분 분야에서 세계 평균과 비슷하게 나타났다.
[표 2-64] 최근 5년(2015∼2019) 한국의 바이오 분야 SCI 논문 피인용률
|
구분 |
한국 바이오 분야 논문 |
세계대비 |
|||
|
논문 수 |
피인용된 논문 수 |
피인용율 (a) |
세계피인용율(b) |
세계대비 (a/b) |
|
|
면역학 |
3,376 |
3,243 |
96.1% |
96.2% |
1.00 |
|
미생물학 |
4,683 |
4,317 |
92.2% |
96.0% |
0.96 |
|
분자생물학 & 유전학 |
9,038 |
8,416 |
93.1% |
95.7% |
0.97 |
|
생물학 & 생화학 |
14,412 |
13,509 |
93.7% |
94.7% |
0.99 |
|
신경과학 & 행동과학 |
7,509 |
6,999 |
93.2% |
95.7% |
0.97 |
|
약리학 |
8,764 |
8,269 |
94.4% |
94.1% |
1.00 |
|
생명공학 합계 |
47,782 |
44,753 |
93.7% |
95.3% |
0.98 |
최근 5년간 우리나라 SCI 논문의 바이오 6개 분야 평균 피인용 수는 13.9회로 세계 평균(15.42)대비 90% 수준으로 나타났다. 10년 전(2005∼2009) 69% 수준과 비교했을 때 질적으로 성장하고 있는 것으로 나타났다. 최근 5년간 6개 분야 중 생물학 & 생화학 분야와 약리학 분야의 평균 피인용 수가 세계 평균 대비 96% 수준으로 가장 높았다.
[표 2-65] 최근 15년 한국의 바이오 분야 SCI 논문 피인용율(2005∼2019)
|
분야명 |
2005∼2009 |
2010∼2014 |
2015∼2019 |
||||||
|
한국평균 (a) |
세계평균 (b) |
비율 (a/b) |
한국평균 (a) |
세계평균 (b) |
비율 (a/b) |
한국평균 (a) |
세계평균 (b) |
비율 (a/b) |
|
|
면역학 |
41.46 |
51.98 |
0.80 |
26.66 |
35.19 |
0.76 |
14.08 |
16.07 |
0.88 |
|
미생물학 |
24.29 |
44.36 |
0.55 |
19.05 |
29.62 |
0.64 |
10.57 |
14.36 |
0.74 |
|
분자생물학 & 유전학 |
46.09 |
71.38 |
0.65 |
36.02 |
46.74 |
0.77 |
17.88 |
19.65 |
0.91 |
|
생물학 & 생화학 |
35.49 |
47.86 |
0.74 |
26.59 |
33.18 |
0.80 |
14.38 |
14.97 |
0.96 |
|
신경과학 & 행동과학 |
37.67 |
51.85 |
0.73 |
25.98 |
34.90 |
0.74 |
13.11 |
15.03 |
0.87 |
|
약리학 |
31.78 |
36.23 |
0.88 |
22.67 |
24.89 |
0.91 |
11.40 |
11.86 |
0.96 |
|
생명공학 합계 |
35.43 |
51.15 |
0.69 |
26.47 |
34.56 |
0.77 |
13.90 |
15.42 |
0.90 |
주) InCites DB 특성상 과거 시점 5년 주기 평균피인용율을 구할 수 없어 현재 시점 피인용율을 사용함.
라. 바이오 분야 SCI 고피인용(상위 1%) 논문 현황
최근 11년간 우리나라의 바이오 6개 분야 피인용 상위 1% SCI 논문 수는 647편으로 세계 17위 수준이며, 피인용 상위 1% SCI 논문 비율은 0.69%로 세계 평균(1%)에 미치지 못하는 것으로 나타났다. 최근 5년간 분야별로는 면역학과 생물학&생화학 분야가 피인용 상위 1% SCI 논문 비율이 0.92%로 세계 평균(1%)에 가장 근접한 것으로 나타났다.
[표 2-66] 바이오 분야 피인용 상위 1% 논문(2009∼2019)
|
구분 |
한국 바이오 분야 논문 |
1% 세계 논문 수 |
|||
|
1% 논문 수 |
전체 논문 수 |
1% 논문 비중 |
1% 논문 세계 순위 |
||
|
면역학 |
48 |
6,567 |
0.73% |
24위 |
2,663 |
|
미생물학 |
49 |
9,326 |
0.53% |
17위 |
2,184 |
|
분자생물학 & 유전학 |
137 |
16,352 |
0.84% |
20위 |
5,042 |
|
생물학 & 생화학 |
210 |
28,773 |
0.73% |
15위 |
7,588 |
|
신경과학 & 행동과학 |
83 |
14,122 |
0.59% |
22위 |
5,475 |
|
약리학 |
120 |
18,072 |
0.66% |
16위 |
4,223 |
|
생명공학 합계 |
647 |
93,212 |
0.69% |
17위 |
27,175 |
[표 2-67] 세계 전체 대비 5년 주기별 한국의 피인용 상위 1% 논문 비중(2009∼2019)
|
구분 |
2009∼ 2013 |
2010∼ 2014 |
2011∼ 2015 |
2012∼ 2016 |
2013∼ 2017 |
2014∼ 2018 |
2015∼ 2019 |
|
면역학 |
0.58% |
0.49% |
0.53% |
0.64% |
0.66% |
0.77% |
0.92% |
|
미생물학 |
0.26% |
0.33% |
0.33% |
0.39% |
0.52% |
0.65% |
0.75% |
|
분자생물학 & 유전학 |
0.80% |
0.93% |
0.93% |
1.01% |
0.94% |
0.86% |
0.79% |
|
생물학 & 생화학 |
0.58% |
0.56% |
0.63% |
0.66% |
0.71% |
0.81% |
0.92% |
|
신경과학 & 행동과학 |
0.33% |
0.38% |
0.43% |
0.42% |
0.51% |
0.64% |
0.79% |
|
약리학 |
0.61% |
0.56% |
0.49% |
0.56% |
0.56% |
0.62% |
0.74% |
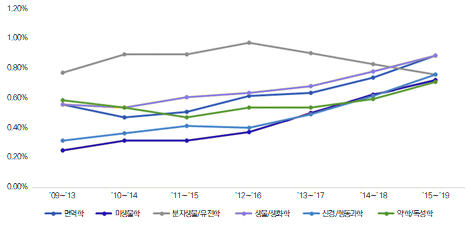
[그림 2-33] 연도별 한국의 피인용 상위 1% 논문 비율 추이(2009∼2019)
5. 산업 현황
산업통상자원부와 한국바이오협회가 국가표준 KS J 1009(바이오산업 분류체계)에 따라 국내 바이오기업 1,003개사를 대상으로 조사한 ‘2019년 기준 국내 바이오산업 실태조사(2020.12.)’ 결과, 국내 바이오산업 생산 규모가 12조 원대를 돌파한 것으로 나타났다.
가. 바이오기업 규모 및 매출 발생 현황
2019년 기준 국내 바이오기업은 총 1,003개 사로 기업 전체 종사자 규모를 기준으로 보면, ‘1∼50명 미만’ 기업이 598개(63.3%)로 가장 많고, 1,000명 이상의 기업은 31개(3.3%)인 것으로 나타났다.
매출 발생 현황을 살펴보면, 전체 1,003개 기업에서 미응답 기업 155개를 제외한 848개 기업 중 221개 기업(26.1%)이 2019년 현재 ‘매출 발생 이전’ 단계인 것으로 조사되었으며, 매출 발생이 있는 627개 기업 중 249개 기업(29.4%)은 ‘손익분기점 미만’인 것으로 조사되었다. 2019년 매출 발생이 있는 627개 기업 중 2019년 처음 매출이 발생한 기업은 18개(2.9%), 매출 발생이 10년 이상인 기업은 299개(47.7%)로 조사되었다.

[그림 2-34] 국내 바이오기업 규모 및 매출 발생 현황(2019년 기준)
나. 외부 협력 현황
전체 1,003개 기업 중 2019년 기준 타 기관과의 협력 관계가 있었던 기업은 344개로 34.3%의 비율을 보였다. 344개 협력실적이 있는 업체는 주로 국내 기관과 협력(96.1%)을 하고 있으며, 해외와는 36건(3.9%)이 있었다.
분야별로는 바이오의약이 376건으로 전체 924건 중 40.7%를 차지했으며, 바이오화학․에너지가 154건(16.7%), 바이오식품이 129건(14.0%)으로 이 3개 분야의 기업이 협력 건수의 71.4%를 차지하고 있다. 바이오의약과 바이오식품은 대학과의 협력이 많지만, 바이오화학․에너지는 상대적으로 연구기관과의 협력 건수가 많은 특징을 보였다.
협력 관계 형태는 공동연구 개발계약이 79.9%로 가장 많았으며, 다음으로 기술제휴-라이선싱(11.4%), 국내외 기술인력 교류(5.3%), 합작 투자(3.5%) 순으로 나타났다. 단계별로는 기초연구단계가 총 924건 중 300건으로 32.5%의 가장 큰 비중을 보였으며, 실험단계가 273건(29.5%)으로 그 다음으로 높았다. 전체 단계 중 마지막 단계인 사업화 단계는 59건으로 6.4%의 비율을 보여 사업 초기 단계에서 주로 타 기관과의 협력을 진행하는 것으로 나타났다.
분야별 및 단계별 협력 건수는 바이오의약산업, 바이오화학․에너지산업은 기초연구단계의 비중이 높지만, 바이오식품산업과 바이오․의료기기산업은 실험단계 비중이 더 높았다.
[표 2-68] 바이오산업 분야별 협력 단계별 협력 건수(2019)
(단위: 건)
|
구분 |
전체 업체 수 |
협력 관계 보유업체 |
협력 관계 단계 |
||||||
|
기초 연구단계 |
실험 단계 |
시작품 단계 |
제품화 단계 |
사업화 단계 |
합계 |
||||
|
전체 |
1,003 |
344 |
300 |
273 |
184 |
108 |
59 |
924 |
(100.0%) |
|
바이오의약산업 |
319 |
120 |
137 |
115 |
76 |
34 |
14 |
376 |
(40.7%) |
|
바이오화학․에너지산업 |
192 |
59 |
45 |
40 |
30 |
24 |
15 |
154 |
(16.7%) |
|
바이오식품산업 |
175 |
55 |
32 |
44 |
23 |
21 |
9 |
129 |
(14.0%) |
|
바이오환경산업 |
65 |
19 |
13 |
6 |
5 |
- |
3 |
27 |
(2.9%) |
|
바이오․의료기기산업 |
95 |
35 |
24 |
26 |
17 |
16 |
6 |
89 |
(9.6%) |
|
바이오장비 및 기기산업 |
53 |
15 |
24 |
10 |
8 |
5 |
7 |
54 |
(5.8%) |
|
바이오자원산업 |
19 |
7 |
2 |
16 |
2 |
3 |
- |
23 |
(2.5%) |
|
바이오서비스산업 |
85 |
34 |
23 |
16 |
23 |
5 |
5 |
72 |
(7.8%) |
다. 바이오산업 수급 현황
2019년 국내 바이오산업의 생산 규모는 12조 3,235억 원으로 국내판매 5조 6,111억 원(45.5%), 수출 6조 7,124억 원(54.5%)으로 나타났다. 국내판매와 수입에 따른 내수시장 규모는 6조 7,124억 원으로 조사되었다.
바이오산업의 생산규모에서 바이오의약 산업이 4조 2,389억 원으로 전체 산업의 34.4%를 차지하였고, 바이오식품산업이 3조 6,866억 원으로 29.9%의 비중을 보였다. 내수시장에서 가장 큰 비중을 차지하고 있는 산업은 바이오의약산업으로 전체 시장의 43.1%인 3조 2,679억 원 규모로 조사되었다.
2017∼2019년 바이오산업의 수급변화 추이를 보면 생산과 내수 규모는 지속적인 성장을 보였다. 2017년 이후 연평균 증감률은 수급 10,4%, 생산 10.2%, 내수 7.6%로 나타났다.
2019년의 생산 부문은 전년 대비하여 16.2%가 증가하였으며, 바이오장비 및 기기산업 성장률이 21.2%로 가장 높게 나타났다. 2019년의 내수 부문은 전년 대비하여 6.7% 증가하였으며, 바이오환경산업을 제외한 모든 산업 분야가 증가하였다.
[표 2-69] 바이오산업 생산 및 내수 변화 추이(2017∼2019)
(단위: 억 원, %)
|
구분 |
생산 |
내수 |
||||||||
|
2017년 |
2018년 |
2019년 |
전년대비 증감률 |
연평균 증감률 |
2017년 |
2018년 |
2019년 |
전년대비 증감률 |
연평균 증감률 |
|
|
전체 |
101,457 |
106,067 |
123,235 |
16.2 |
10.2 |
65,466 |
70,966 |
75,756 |
6.7 |
7.6 |
|
바이오의약산업 |
35,044 |
35,101 |
42,389 |
20.8 |
10.0 |
29,287 |
29,793 |
32,679 |
9.7 |
5.6 |
|
바이오 화학․에너지산업 |
15,945 |
17,916 |
18,551 |
3.5 |
7.9 |
15,644 |
18,083 |
18,396 |
1.7 |
8.4 |
|
바이오식품산업 |
31,241 |
31,015 |
36,866 |
18.9 |
8.6 |
12,659 |
12,947 |
13,355 |
3.1 |
2.7 |
|
바이오환경산업 |
462 |
576 |
557 |
-3.4 |
9.8 |
460 |
562 |
552 |
-1.8 |
9.5 |
|
바이오․의료기기산업 |
7,771 |
8,482 |
9,536 |
12.4 |
10.8 |
1,963 |
2,714 |
3,229 |
19.0 |
28.3 |
|
바이오장비 및 기기산업 |
1,130 |
889 |
1,078 |
21.2 |
-2.3 |
1,174 |
1,240 |
1,446 |
16.6 |
11.0 |
|
바이오자원산업 |
1,711 |
1,785 |
1,787 |
0.1 |
2.2 |
1,561 |
1,793 |
1,810 |
0.9 |
7.7 |
|
바이오서비스산업 |
8,153 |
10,302 |
12,472 |
21.1 |
23.7 |
2,718 |
3,834 |
4,288 |
11.9 |
25.6 |
라. 바이오산업 국내판매 현황
2019년 바이오제품의 국내판매 규모는 5조 6,111억 원이며 바이오화학․에너지산업이 1조 7,340억 원(30.9%)으로 국내판매 부분에서 가장 큰 비중을 차지하고 있었다. 다음으로는 바이오의약산업이 1조 6,236억 원(28.9%), 바이오식품산업 1조 2,788억 원(22.8%)으로 이들 세 개 분야는 전체 국내 판매액의 82.6%를 차지하는 것으로 나타났다.
국내판매 추이를 보면, 2019년은 전년 대비 2,427억 원(4.5%)이 증가하였다. 분야별로는 바이오화학․에너지산업이 전년 대비 3.1% 성장하였으며, 바이오장비 및 기기산업이 21.8%, 바이오․의료기기산업이 21.5%, 바이오서비스산업이 11.7% 성장해 성장세가 두드러졌다. 반면, 바이오환경산업과 바이오자원산업은 전년 대비 각각 1.7%, 0.4% 소폭 감소하였다.
2019년 기준 주요 바이오제품의 국내판매 현황을 보면, 바이오연료의 국내판매 규모가 1조 1,605억 원으로 전체 바이오제품 판매액 중 20.7%의 비중을 차지하였다. 다음으로는 사료첨가제(11.7%), 기타 바이오의약품(7.0%), 바이오화장품 및 생활화학제품(6.9%), 혈액제제(6.9%) 순으로 나타났다.
[표 2-70] 바이오산업 분야별 국내판매 추이(2017∼2019)
(단위: 백만 원, %)
|
구분 |
2017년 |
2018년 |
2019년 |
전년 대비 증감 |
연평균 증감률 |
||||
|
국내판매 |
비중 |
국내판매 |
비중 |
국내판매 |
비중 |
국내판매 |
증감률 |
||
|
전체 |
4,977,316 |
100.0 |
5,368,455 |
100.0 |
5,611,134 |
100.0 |
242,679 |
4.5 |
6.2 |
|
바이오의약산업 |
1,588,228 |
31.9 |
1,569,930 |
29.2 |
1,623,645 |
28.9 |
53,715 |
3.4 |
1.1 |
|
바이오화학․에너지산업 |
1,481,088 |
29.8 |
1,682,536 |
31.3 |
1,734,048 |
30.9 |
51,512 |
3.1 |
8.2 |
|
바이오식품산업 |
1,219,862 |
24.5 |
1,244,683 |
23.2 |
1,278,821 |
22.8 |
34,138 |
2.7 |
2.4 |
|
바이오환경산업 |
45,824 |
0.9 |
56,011 |
1.0 |
55,068 |
1.0 |
-943 |
-1.7 |
9.6 |
|
바이오․의료기기산업 |
164,090 |
3.3 |
221,062 |
4.1 |
268,614 |
4.8 |
47,552 |
21.5 |
27.9 |
|
바이오장비 및 기기산업 |
66,024 |
1.3 |
58,464 |
1.1 |
71,213 |
1.3 |
12,749 |
21.8 |
3.9 |
|
바이오자원산업 |
149,787 |
3.0 |
154,862 |
2.9 |
154,293 |
2.7 |
-569 |
-0.4 |
1.5 |
|
바이오서비스산업 |
262,413 |
5.3 |
380,907 |
7.1 |
425,432 |
7.6 |
44,525 |
11.7 |
27.3 |
마. 바이오산업 수출입 현황
2019년 기준 바이오산업의 수출규모는 6조 7,124억 원으로 조사되었다. 분야별 보면, 바이오의약산업이 2조 6,152억 원(39.0%)으로 가장 컸으며, 다음으로 바이오식품산업이 2조 4,078억 원(35.9%)을 수출하였다.
수출 제품별로 보면 사료첨가제가 1조 8,351억 원 수출되어 전체 수출액의 27.3%를 차지하였으며, 다음으로 치료용항체 및 사이토킨제제(25.7%), 바이오위탁생산․대행서비스(10.8%), 식품첨가물(7.9%), 체외진단(7.2%) 순이었다. 수출 상위 10개 제품 중 5개는 바이오의약제품이었으며, 바이오식품과 바이오․의료기가 각각 2개, 바이오서비스가 1개로, 이들 10개 제품이 전체 수출액의 93.2%를 차지하였다.
2019년 기준 바이오산업의 수입규모는 1조 9,644억 원으로 조사되었다. 분야별로 보면 바이오의약산업이 1조 6,442억 원으로 전체 수입액의 대부분(83.7%)을 차지하였다.
수입 제품별로 보면 치료용항체 및 사이토킨제제가 6,702억 원이 수입되어 전체 수입의 34.1%를 차지하였으며, 다음으로 백신 3,005억 원(15.3%), 호르몬제 2,963억 원(15.1%), 혈액제제 2,682억 원(13.7%) 순이었다. 수입 상위 10개 제품 중 5개가 바이오의약 제품이었으며, 바이오화학제품, 바이오식품, 바이오․의료기, 바이오장비 및 기기, 바이오자원이 각각 1개로, 이들 10개 제품이 전체 수입액의 93.8%를 차지하였다.
[표 2-71] 주요 바이오제품 수출입 현황(2019)
(단위: 백만 원, %)
<주요 수출 제품> <주요 수입 제품>
|
순위 |
제품명 |
수출액 |
구성비 |
|
1 |
사료첨가제 |
1,835,096 |
27.3 |
|
2 |
치료용항체 및 사이토킨제제 |
1,722,329 |
25.7 |
|
3 |
바이오위탁생산․대행서비스 |
728,144 |
10.8 |
|
4 |
식품첨가물 |
531,012 |
7.9 |
|
5 |
체외진단 |
480,173 |
7.2 |
|
6 |
백신 |
259,385 |
3.9 |
|
7 |
기타 바이오의약품 |
251,438 |
3.7 |
|
8 |
기타 바이오․의료기 |
204,746 |
3.1 |
|
9 |
혈액제제 |
140,042 |
2.1 |
|
10 |
바이오항생제 |
100,845 |
1.5 |
|
순위 |
제품명 |
수입액 |
구성비 |
|
1 |
치료용항체 및 사이토킨제제 |
670,218 |
34.1 |
|
2 |
백신 |
300,458 |
15.3 |
|
3 |
호르몬제 |
296,288 |
15.1 |
|
4 |
혈액제제 |
268,202 |
13.7 |
|
5 |
기타 바이오의약품 |
89,898 |
4.6 |
|
6 |
체외진단 |
52,324 |
2.7 |
|
7 |
다기능 및 기타 분석기기 |
49,137 |
2.5 |
|
8 |
연구․실험용 효소 및 시약류 |
46,392 |
2.4 |
|
9 |
건강기능식품 |
41,515 |
2.1 |
|
10 |
종자 및 묘목 |
26,215 |
1.3 |
바. 바이오기업 기술특례 상장현황
코스닥시장에서는 2005년부터 기술성과 성장성을 보유한 벤처기업의 상장 예비심사 시 일반기업과 차별화된 예비심사요건을 적용하는 ‘기술성장기업 상장 예비심사 특례’를 시행하고 있다. 즉, 현재 영업실적은 미미하지만, 기술력과 성장성을 갖춘 기업들이 전문평가기관의 기술평가 또는 상장주선인 추천을 통해 상장이 가능한 제도이다. 동 제도를 통해 2020년 10월 8일 기술특례상장기업 100개사가 상장하였으며 이 중 76개사가 바이오기업이다.
[표 2-72] 연도별․유형별 기술특례 신규상장기업 현황(2020.10.8.기준)
|
구분 |
2005∼2015 |
2016 |
2017 |
2018 |
2019 |
2020.10.8. |
합계 |
|
|
|
바이오 |
24 |
9 |
5 |
15 |
14 |
9 |
76 |
|
|
신약개발 |
13 |
7 |
2 |
8 |
6 |
4 |
40 |
|
|
체외진단 |
5 |
1 |
3 |
1 |
4 |
4 |
18 |
|
|
의료기기 |
4 |
- |
- |
3 |
2 |
1 |
10 |
|
|
기타* |
2 |
1 |
- |
3 |
2 |
- |
8 |
|
非바이오 |
3 |
1 |
2 |
6 |
8 |
4 |
24 |
|
|
합계 |
27 |
10 |
7 |
21 |
22 |
13 |
100 |
|
* 건강기능식품 판매, 유해동물 퇴치제 개발기업 등.
자료: 코스닥시장본부 보도자료, 2020년 10월 6일.
이들 100개사의 총 공모금액은 2조 4,000억 원으로 이 중 2조 원을 바이오기업이 조달하였으며 바이오기업의 평균 공모 규모는 269억 원으로 비바이오기업 평균 156조 원보다 많았다. 이들 기술특례상장 바이오기업의 기술이전 실적은 15개사 31건으로 총 규모는 12조 9,000억 원에 달했다.

|
주요 내용 요약 |
|
|
||
|
|
|
|
||
|
구분 |
유전체연구 |
단백질체 |
||
|
개요 |
유전체 연구는 유전체 해독, 정보 분석 및 이를 활용하는 실용화 등을 포함 |
단백질체학 (proteomics)은 세포, 조직, 체액 등에 존재하는 모든 단백질체에 대한 총체적인 연구로서 기초연구와 진단 및 신약개발 분야의 핵심 기술 |
||
|
해외동향 |
전 세계 여러 나라에서 10만 명 이상의 유전체를 분석하는 대규모 국가 유전체 프로젝트를 진행하고 있다. 한편으로 유전체 분야 산업 및 시장은 연평균 10% 이상 빠르게 성장하여 여러 분야로 파급중 |
단백질 분리분획, 질량분석, 정량기법, 번역후변화 분석, 동적 변화 분석기술 개발과 더불어 바이오마커 연구가 활발하게 진행되고 있으며 북미시장 위주로 바이오, 의료산업으로 빠르게 확산 추세 |
||
|
국내현황 |
유전체를 포함하는 바이오 빅데이터를 3대 주력산업으로 선포하고 투자를 확대하고 있으며, 규제 개혁 등을 통해 신산업을 창출하고자 노력 중 |
해외에 비해 국가 주도의 연구 지원이 다소 낮은 상태에서 다중오믹스 기반의 정밀의료기술개발 사업 등이 진행중이며 국내 단백체 관련 회사들의 약진이 진행 중 |
||
|
발전전망 |
유전체 빅데이터는 의학, 농학, 환경 등 다양한 분야에서 새로운 산업을 창출하며 혁신을 주도 |
중개연구 뿐만 아니라 진단, 신약개발 등 산업화에 적용될 수 있으며 이를 위해 정부, 의료기관, 산업계의 지속적인 관심과 헬스케어 관련 규제 완화가 필요 |
||
|
|
|
|
||
|
|
|
|
||
|
세포체 |
대사체 |
|||
|
세포치료제 출시 급증 오가노이드 기반 신약개발연구 활성화 |
AI 및 화학분석 기술의 발전으로 실제 대사 과정을 이해하는 데 집중하고 있으며 이를 위해 다른 omics 분야와의 결합으로 활용 분야가 증가 |
|||
|
각국의 전략적 투자 및 육성시스템 운영을 통한 경쟁력 확보 |
미국과 유럽뿐만 아니라 동아시아에서도 임상대사체학, 지질대사체학, 미생물대사체학, 식물 및 음식 대사체학 등의 성장세가 두드러지게 나타남 |
|||
|
제도개선을 통한 신속한 임상진입 및 상용화 촉진 진행중, 중소 벤쳐기업 중심에서 저대 제약사등의 참여가 확대 중 |
타 오믹스와의 연계연구가 본격적으로 시작되고 있으며 관련하여 대사체학 관련 연구논문들이 양산되고 있음 |
|||
|
혁신적 제도개선 진행 중 |
타 오믹스 분야와의 연계연구가 보편화할 것으로 판단되며 AI활용 및 초극미량분석기기를 활용한 대사산물 식별을 위해 광범위한 화합물 라이브러리 구축이 동반되리라 전망됨 |
|||
|
주요 내용 요약 |
|
|
||
|
|
|
|
||
|
구분 |
시스템생물 |
구조생물 |
||
|
개요 |
시스템생물학은 복잡한 생물 시스템을 네트워크 수준에서 통합적으로 이해하고 분석하기 위한 학문 |
초저온 전자현미경과 4세대 가속기 XFEL를 활용한 혁신적인 구조생물학 연구 변화가 이루어지고 있음 |
||
|
해외동향 |
Nature 저널은 2020-2021 향후 주목할 기술로 시스템생물학이 필수적으로 적용되어야 하는 분야들을 선정하였으며 이에 맞춰 전 세계적인 연구 및 산업은 빠르게 변화 중 |
초저온 전자현미경 기술을 활용한 막단백질과 거대 복합체 단백질 구조 분석에 집중된 연구 진행되고 있으며 구조생물학과 접목된 인공단백질이 최근 급부상하고 있음 |
||
|
국내현황 |
시스템생물학은 암, 바이러스 감염, 류마티스 관절염과 같은 질병 예방 및 신규치료제 개발 분야에 활발히 적용 |
초저온 전자현미경 환경 미흡, 여전히 3세대 가속기 시설에 의존적으로 구조생물학 연구가 진행. 세계 3번째로 구축한 4세대 가속기 XFEL 활용 연구 발전 기대 |
||
|
발전전망 |
빅데이터 생산 능력, 인공지능 발달으로 대용량 고차원의 생물학 분석이 가능해져 시스템생물학은 생물학 전반에 적용 및 필수적인 기술이 될 것으로 기대됨 |
초저온 전자현미경 기술 활용 주요 신약 타깃인 막단백질 및 생명 유지에 필수적인 거대 단백질 복합체 구조생물학 연구에 집중될 전망 |
||
|
|
|
|
||
|
|
|
|
||
|
뇌과학 |
노화과학 |
|||
|
뇌과학은 다학제 테마의 유기적 연결을 통한 융합연구의 핵심으로 기술의 혁신을 통해 아직 미개척 영역으로 남아있는 인간의 뇌기능 이해를 궁극적 목표로 함 |
전 세계적인 고령화로 인해 노화를 생물학적으로 치료하고자 하는 요구가 증가하고 있으며, 노화 치료 산업이 태동 중 |
|||
|
세계 주요 선진국들은 뇌연구를 미래유망 과학기술로 인식하고 국가차원의 뇌과학 프로젝트 착수하였으며 대부분의 국가 대형 프로젝트가 마지막 단계에 돌입 |
생물학적인 노화 속도를 측정할 수 있는 표지가 고도화되고 있으며, 여러 노화 치료 전략의 임상시험이 시작 되고 있음 |
|||
|
1998년 제정된 ‘뇌연구촉진법’을 기반으로 2018년 제3차 뇌연구촉진기본계획 하에 실천과제가 이행되고 있으며 우수한 논문․특허 성과와 함께 뇌질환 관련 기업들의 성과도 창출되고 있어 관련 산업시장이 태동하고 있음 |
정부의 노화 연구․개발투자가 증가하고 있지만, 아직 상당히 적은 수준이며, 노화 그 자체를 치료하고자 하는 관점의 연구는 시작 단계 |
|||
|
뇌연구는 고령화로 인한 뇌졸중․치매환자 증가와 COVID-19 팬데믹으로 인한 코로나 블루 등의 정신건강과 관련된 질환으로 발생하는 사회경제적 비용 최소화를 위한 필수 연구 분야임. 4차 산업혁명과 함께 뇌 원리 기반 활용 산업이 부상하고 있으며 혁신적 미래과학의 핵심기술로 새로운 성장동력과 일자리를 창출할 것으로 기대됨 |
WHO에서 노화에 질병 코드를 부여한 것에 발맞춰 노화 치료 산업 생태계를 구축할 수 있도록 산․학․연․병의 유기적 협력 체계 구축이 필요 |
|||
|
주요 내용 요약 |
|
|
||
|
|
|
|
||
|
구분 |
합성신약 |
바이오의약품 |
||
|
개요 |
국내 제약시장 규모는 최근 5년간(’14~’19) 연평균 7.1%의 성장률을 보이고 있으며, 바이오마커 기반 환자맞춤형 항암제, 희귀질환 치료제, 코로나19 치료제, 뇌질환 치료제 등이 향후 신약개발의 중요한 화두가 될 것 |
바이오의약품은 전체 의약품 매출의 29%를 차지함 |
||
|
해외동향 |
지난 4년간 미 FDA에 의해 승인된 합성의약품과 바이오의약품의 비율은 평균 3:1 정도를 유지 합성신약에서 항암제가 가장 높은 시장 점유율과 성장률을 보여주고 있으며 면역항암제와 표적함암제가 향후 항암제 의약품 시장의 성장을 주도할 전망 |
2019-2021년 32개 바이오신약이 승인됨. 항체치료제와 유전자치료제가 주종을 이룸 |
||
|
국내현황 |
순수 국내 제약기업이 개발한 신약은 2015년 5개 품목에서 이후 매년 1개 미만 개발로 저조하고, 개량신약 위주의 연구개발에 치중하는 경향임. 2020년 국내 제약사의 임상시험 승인은 256건이며 그 중 신약은 27.7%인 71건이며, 2020년 제약산업 매출 대비 연구개발비 투자비율은 9.73%로 역대 최고 수준 |
국내 바이오벤처사의 성장과 다수의 임상을 진행 |
||
|
발전전망 |
합성신약을 포함한 신약개발에서 항암제와 희귀질환 치료제가 가장 성장성이 높은 신약개발 분야가 될 것으로 예상 |
지속적인 항체신약의 성장과 신기술 활용의 증가 예상 |
||
|
|
|
|
||
|
|
|
|
||
|
바이오장기 |
진단 및 의료기기 |
|||
|
장기이식 수요의 폭발적 증가로 바이오장기 시장이 급속도로 성장하고 있음. 바이오장기 중에서도 유전자편집기술의 발전으로 이종장기가 가장 빠른 시간 내에 현실화될 것으로 예상됨 |
코로나19로 촉발된 뉴노멀 비대면 헬스케어 서비스의 중심으로 자리 잡은 디지털헬스케어는 의료전달체계의 효율성을 높이고 개인맞춤의료 구현을 목적으로 탄생한 건강관리시스템과 디지털기술의 융합산물 |
|||
|
최근 CISPR/Cas9 등 유전자편집기술의 발전으로 형질전환 돼지 생산기간이 획기적으로 단축되었음. 또한 이종장기 영장류 전임상 시험에서 우수한 성과들이 발표되고, 이종장기이식 전문회사가 설립되는 등 제2의 이종이식 전성기가 도래하였음 |
전 세계적인 고령화 추세에 따른 의료비 부담 증가, 만성중증질환 증가로 미국, 유럽 등은 정부차원의 디지털 정밀의료 중점지원정책 추진 |
|||
|
국내 연구진은 영장류 전임상시험에서 임상시험 진입조건을 충족하는 결과를 발표하는 등 이종장기이식에서 세계적 선도그룹으로 인정받고 있으며 2021년 이종 각막 및 췌도 연구자임상 시험 실시를 위한 식약처 IND 진행 중 |
디지털헬스케어 산업 생태계 활성화 및 기업 지원을 위해 다양한 정책을 추진 중 |
|||
|
국내 바이오이종장기 이식분야 연구는 꾸준한 투자와 연구로 경쟁력을 갖추었으며 그간의 성과와 기반시설의 지속적 유지․발전, 바이오장기 생산규제와 가이드라인 제정 등을 통해 국내 이종장기기술의 산업화 가능성 기대 |
범부처 차원의 의료제품 규제 합리화 정책을 통해 어느 정도의 시장 활성화는 기대하나, 우리나라는 여전히 전 세계 디지털헬스케어 시장의 핵심 사업모델인 원격의료와 소비자 의뢰 유전체분석(DTC) 등을 강력히 규제하고 있어 관련 글로벌 혁신기업의 활발한 시장 참여 및 투자에 큰 제약이 존재하는 실정 |
|||
|
주요 내용 요약 |
|
|
||
|
|
|
|
||
|
|
감염병 |
농림 |
||
|
개요 |
신변종 감염병에 대한 경고가 지속적으로 이루어졌으나 그에 대한 대비가 충분하게 이루어지지 않은 상태로 코로나19 팬데믹 상황을 맞게 됨 |
기후변화, 인구증가, 생명자원 보호 등을 배경으로 지속가능한 농업을 위한 분야별 연구개발 현환을 정리함. 신육종기술, 작물병해충 방제기술, 동물감염병 제어기술, 내재해성 산림육성, 생물농약개발, 농생명소재 활용 식의약소재개발, 스마트팜 활용 대량생산기술개발 등이 이루어지고 있음 |
||
|
해외동향 |
코로나19 대응을 위한 백신 및 치료제 연구에 대하여 지속적 투자를 진행하고 있으며 정책적 지원계획을 수립하고 있음 |
일본의 그린바이오전략, 식물기반 유용단백질 생산기술, 천연물 기반 식의약 소재 개발에 대한 연구 및 산업동향을 파악함 |
||
|
국내현황 |
감염병의 주기적 유행에 대비하기 위해 예방․대비, 대응, 복구 등 각 단계별로 R&D 현황을 점검하고 투자전략을 수립하고 있음 |
고부가가치 품종 육성, 동물감염병 감염통제 기술개발, 주요 작물의 병해충 방제 및 진단 기술개발, 빅데이터 생물정보 통합 및 활용체계 구축, 농생명자원 활용 소재개발, 산림 자생식물 활용 산업화 소재 발굴, 산림 소재의 활용도 다변화 연구를 진행 중임 |
||
|
발전전망 |
감염병에 대응하기 위한 바이오기술뿐 아니라 정보통신기술개발도 이루어지고 있으며 신변종 감염병에 대한 지속적인 대비가 필요할 것임 |
종자산업 육성 및 신품종개발, 품종보호제도 정비, 미생물소재 활용 생물농약개발, 포스트바이오틱스 농업활용 분야에 대한 전망과 과제를 정리함 |
||
|
|
|
|
||
|
|
|
|
||
|
축산 |
식품 |
|||
|
유전자 편집 기술을 활용한 유전자변형 가축 개발이 활발히 진행되며 식용 및 의료용으로의 활용 가능성이 확대되고 있음 |
식품 분야에서 사용되는 생명공학기술의 핵심기술은 크게 유전자재조합기술, 세포융합기술, 세포대량배양기술, 효소공학, 합성생물학 등으로 분류되며, 제품은 원료, 중간체 및 최종 제품을 모두 포함한다. |
|||
|
가축의 경제형질 개선 및 질병저항성 향상, 질환모델 동물 생산 등을 목적으로 다양한 유전자변형 가축 개발 지속 |
다양한 오믹스 기술들을 한 번에 분석할 수 있게 되면서 전 세계적으로 식품 파이토케미칼(phytochemical)과 인간유전체간 관련성, 영양관련 질병 제어 및 맞춤형 처방 분야로 응용하려는 연구가 핵심 연구 분야로 진행 특히 세계 배양육 시장이 급격히 증가하면서 시장 선점을 위해 투자를 확대하는 중 |
|||
|
유용물질 생산, 의료용 소재 개발, 질환 모델 등의 목적으로 다양한 유전자변형 가축 개발 연구와 경제형질 마커개발 연구가 진행되고 있음 |
식품의 영양, 품질, 안전성, 편의성, 생산성 및 수익성을 개선한 다양한 (건강)기능성 소재/식품 및 발효식품의 연구개발에 적용되고 있으며 최근에는 제3세대 유전자가위기술(CRISPR/Cas9)의 확산과 함께 식품소재 생산에도 이를 응용하려는 연구 시도 |
|||
|
전 세계적으로 유전자변형 가축의 규제에 관한 규정 방향에 따라 각국의 연구 방향이 결정될 것을 보임 |
핵심 원천 기술 및 산업화 연계를 위한 기반 기술 연구에 대한 정부 주도의 집중 투자가 필요 |
|||
|
주요 내용 요약 |
|
|
||
|
|
|
|
||
|
구분 |
환경생명공학 |
해양생명공학 |
||
|
개요 |
환경 생명공학기술은 생명공학기술을 이용하여 환경오염을 예방, 복원 및 정화하는 기술로서, 전 세계적으로 추구하고 있는 지속 가능한 발전의 핵심기술 |
해양바이오는 해양생물의 확보와 유용 물질의 신소재 개발을 통해, 산업화와 경제에 기여하는 기술 |
||
|
해외동향 |
이코지노믹스(생태유전체학)의 활용성이 강조되며, 해양 기름유출의 생물정화, 배가스 중 이산화탄소의 생물학적 저감, 식물-미생물 상호작용을 이용한 식물정화, 플라스틱의 생분해, 바이오센서 등이 활발히 진행 |
1950년대에 잠재력을 인정받은 태동기의 분야로서 다양성과 복잡성, 화학 및 유전적 차별성에 주목하여, 바이오 시대를 견인할 미래 산업분야로 육성 중 |
||
|
국내현황 |
제5차 국가환경종합계획(’20~’40)을 수립하여 탈석탄, 탈플라스틱, 탈내연기관화 등 경제․사회 전반의 녹색전환 방향을 제시하였으며, 그린뉴딜 계획(’20.7)을 통해 화석연료 기반의 경제사회시스템을 저탄소 기조로 전환해 탄소중립 사회로의 이행을 이끌어내는 것을 장기 목표 발표 |
기술력과 산업 역량이 선진국에 크게 뒤지고 있으며, 전체 해양바이오 소재의 대부분을 수입에 의존하는 열악한 상황 |
||
|
발전전망 |
오믹스 자료, AI를 이용한 빅데이터 분석, 마이크로바이옴 등을 활용한 생물정화 기술개발이 유망하며, 환경위성을 활용한 모니터링, 난분해성 물질의 생분해를 위한 GMO 기술개발, GMO 사용에 대비한 환경 안전성 평가, 법・제도 마련 등이 필요 |
신산업 개척이 어려운 현실에 대한 인식을 바탕으로 과감한 예산 투자와 기다림이 필요하며, 선진국들의 공공 인프라 지원 및 클러스터 전략 도입과 더불어 해양바이오 소재에 대한 접근성 강화를 통해 타 분야 기업들의 진출 유도 및 첨단 소재 산업 육성 필요 |
||
|
|
|
|
||
|
|
|
|
||
|
생물공정(산업바이오) |
BT + ICT |
|||
|
탄소중립 실현, ESG 경영 추구, 미세플라스틱 문제 대응 등 사회적, 산업적, 환경적 이슈에 대응할 수 있는 산업바이오의 중요성이 증가 |
고령화 사회, 첨단 ICT 및 바이오 기술 발전, 코로나19 확산 등 사회기술환경 등의 변화로 BT+ICT 의료 융합 서비스 개발이 가속화됨에 따라, 정밀의료, 디지털 치료제를 중심으로 국내외 정책, 기업 동향 및 시장전망을 살펴보고 의료 BT+ICT 융합산업의 지속적인 성장을 위한 발전 과제를 제시 |
|||
|
바이오매스 기반 산업바이오 제품에 대한 지속적인 투자와 상용화 확대 |
미국을 비롯한 해외 주요국은 의료 분야의 디지털 전환이 가속화 됨에 따라 인공지능, 빅데이터, 크라우드, 유전자 분석 기슬 등을 활용한 의료 융합 서비스에 대한 정책지원과 기업에서의 서비스 개발을 전개하고 있음 |
|||
|
정부의 산업바이오 육성정책 발표 및 민간기업의 상용화 계획 수립 시작 |
우리나라도 BT와 ICT 기술을 융합한 정밀의료, 디지털 치료제 산업 활성화를 위해 기술개발, 데이터 인프라 구축, 다양한 서비스 창출에 자원과 역량을 집중하고 있음 |
|||
|
산업바이오 전 주기 기술 확보를 위한 공공 인프라 구축 필요 산업바이오 제품 심사, 인증, 사용촉진 제도 마련 필요 |
BT와 ICT 융합 서비스인 정밀의료와 디지털 치료제가 고부가가치 산업으로 한층 도약하기 위한 전략 방향으로 통합적인 데이터 관리 인프라 구축, 기업 역량 강화, R&D 투자를 통한 기술경쟁력 확보, 이행관계자간 소통화 협력, 수익 창출 가능한 서비스/비즈니스 개발 등을 제시함 |
|||
|
주요 내용 요약 |
|
|
||
|
|
|
|
||
|
구분 |
바이오 소재 클러스터 |
바이오 데이터 |
||
|
개요 |
바이오 연구 및 산업 혁신을 뒷받침할 바이오 소재를 소재의 종류, 보존․유통 방식, 관련 규제 등을 기준으로 14대 분야의 소재 클러스터로 육성 |
바이오 데이터는 바이오경제의 핵심 자원으로서 바이오헬스, 신약개발 등의 다양한 분야에 활용됨에 따라 중요도는 시간이 갈수록 증가 |
||
|
해외동향 |
바이오 소재에 대한 자국 우선주의 기조가 확대되고 있으며, 주요국들은 소재자원은행을 중심으로 유용 바이오 소재 확보 중 |
대형 바이오 프로젝트 수행에 따라 데이터 생산량 급증하고 이를 활용한 다양한 연구가 진행 중이며, 미국, 유럽 중심으로 전 세계 데이터가 수집됨 |
||
|
국내현황 |
2020년 기준 237개 소재자원은행이 운영되고 있으며, 16,51만 6,055점의 소재가 보존․관리되고, 97만 9,643점이 분양됨 |
2020년 ‘제3차 국가생명연구자원 관리․활용 기본계획’ 발표에 따라 국내에서 생산되는 바이오 데이터의 체계적 수집․관리․활용 기반을 구축 |
||
|
발전전망 |
수요자 중심의 바이오 소재와 정보를 동시에 확보하여 제공하고 활용하는 방면으로 패러다임 전환을 추진 중 |
데이터 스테이션을 중심으로 범부처적 바이오 데이터의 수집․공유․활용을 총괄할 체계를 구축하여 국내 바이오 데이터 활용 생태계를 조성 필요 |
||
|
|
|
|
||
|
|
|
|
||
|
생명공학 인프라(장비 시설) |
|
|||
|
국내에는 정부지원을 토대로 기초-응용-개발-생산 연구 지원을 위해 단계별 지원 인프라를 기 구축․운영 중 |
|
|||
|
의약/산업/융합바이오 제품의 산업화 지원을 위한 인프라로는 국공립연구소와 더불어 29개 산업화지원센터, 23개 비임상GLP 및 198개 임상GLP가 대표적이며, 바이오빅데이터를 위한 인프라로는 PHR(개인건강정보) 기반 개인맞춤형 건강관리시스템 구축, CDM(질병정보 활용 공통데이터모델)기반 정밀의료 데이터 통합플랫폼 구축, AI기반 의료기기 영상분석 솔루션 구축 등이 있음 |
|
|||
|
글로벌 바이오헬스 시장이 재편되는 중요한 시기로 산업 정책의 근본적 혁신과 선제적 투자를 통해 우리나라와 같은 후발국이 선도주자로 급부상할 수 있는 좋은 기회임을 고려하여, 필요한 추가 인프라와 기존 인프라의 기능 고도화를 위한 다양한 정책 추진이 요구됨 |
|
|||

1. 유전체
가. 개요
유전체 연구는 생명체를 구성하고 있는 유전정보인 유전체 및 관련 정보를 분석하여 생명체를 이해하고 질병을 포함한 다양한 문제 해결에 그 정보를 활용하는 분야이다.
유전체 연구의 핵심기술은 ① NGS 장비를 이용한 유전체 해독 기술, ② 유전체 빅데이터 분석 소프트웨어 및 알고리즘 개발 기술, 이를 활용한 정보분석 및 데이터 관리 기술, ③ 유전체 정보 기반 정밀의료 개발 기술, ④ 유전체 정보 기반 유용 동식물 혹은 해양생물 유래 자원 확보와 같은 유전체 실용화 기술 등이 있다.
유전체 해독․분석 비용이 급격하게 감소하면서 인간, 동식물, 미생물 등 다양한 생물체에서 생산되는 유전체 빅데이터는 데이터마이닝, 인공지능 등 최신 IT 기술과 융합되어 개인 맞춤형 정밀의료 구현부터 새로운 생물 소재 개발 및 환경문제 해결에 이르기까지 다양한 분야에서 인류의 문제를 해결하고 새로운 산업과 시장을 창출하는 역할을 하고 있다.
나. 해외 동향
(1) 기술 및 연구 동향
유전체 분석기술이 발달하고 분석 비용이 급격하게 감소하면서 전 세계적으로 대규모 국가 유전체 프로젝트가 활발하게 진행되고 있다. 특히 지금까지의 유전체 프로젝트들이 주로 서구인 중심으로 진행되어 왔다면 최근에는 국가 및 민족 간 유전적인 다양성의 중요성을 인식하면서 각 국가가 전략적인 프로젝트로 유전체 프로젝트들을 진행하고 있다.
[표 3-1] 국가별 주요 유전체 연구 현황
|
국가 |
프로젝트/기관 |
주요 내용 |
|
미국 |
All of US program/NIH |
- 100만 명 미국인 정밀의료 코호트 구축 - 전장유전체, 생체시료, 환경정보, 의무기록 등 구축 - 2019년 유전체 분석 기관으로 3곳 지정 - 2020년 상반기에 40만 명 이상이 등록 참여 |
|
영국 |
10만 명 게놈프로젝트/지노믹스 잉글랜드 |
- 암 및 희귀질환 환자 10만 명의 전장유전체 분석 완료 - 50만 명 전장유전체 분석으로 프로젝트를 확대하여 진행 중 |
|
유럽 연합 |
Million European Genomes Alliance (MEGA) /European Alliance for Personalized Medicine(EAPM) |
- 2022년까지 유럽연합 국민 100만 명의 전장유전체, 전자의료 기록, 의료 영상 정보 등을 수집하고 분석 - EU Horizon 2020 및 Innovative Medicine Initiative 등 기관의 연구비 지원으로 수행 |
|
프랑스 |
프랑스 정밀의료 2025 |
-암, 희귀질환, 당뇨병 등 환자 20만 명 이상의 전장유전체 분석 진행 |
|
핀란드 |
FinnGen 프로젝트 |
-핀란드 국민의 10%인 50만 명의 유전체 분석을 2023년까지 완성 - 2019년 현재 15만 명 유전체 분석 완성 다양한 질환을 포함하며 환자기록과의 통합 분석 진행 |
|
중국 |
100만 명 게놈프로젝트 |
- 중국 내 다양한 지역 및 민족을 반영한 100만 명 게놈 분석 |
|
일본 |
질병 극복을 위한 게놈의료 실현 프로젝트(MED) |
- 난치성 아동 질환 등의 정밀의료 연구수행 - 기존에 구축한 40만 명의 바이오뱅크에 축적된 유전자 정보를 활용 |
|
호주 |
Genomics Health Future Mission(GHFM) |
- 2018년에 시작하였고 10년 동안 총 5억 달러를 투입하여 호주인 20만 명의 전장유전체 분석 - 암, 희귀질환 및 아동질환 등의 유전체 분석 진행 |
|
사우디아라비아 |
Saudi Human Genome Program |
- 2013년에 시작하였고 사우디 국민 10만 명의 유전체 분석 진행 - 사우디 국민의 유전적 변이 및 질병 연관성 연구 |
|
에스토니아 |
Estonian Personalized Medicine Programme |
- 에스토니아 국민 10만 명 이상의 유전체 분석 프로그램 |
|
두바이 |
Dubai Genomics |
- 두바이 시에 거주하는 모든 시민의 유전체 분석 프로젝트 |
|
터키 |
Turkish Genome Project |
- 1단계 3년 동안 터키인 10만 명의 전장유전체를 분석(2018∼2020) - 2단계에는 2023년까지 100만 명의 유전체 분석(2021∼2023) - 비만, 당뇨, 심혈관 질환, 신경계 질환 등 복합 질환 연구 |
|
카타르 |
Qatar Genome |
- 2015년에 1단계로 1만 명의 카타르인 전장유전체 분석으로 프로젝트 시작 -2단계에는 카타르 전체 인구의 10%, 3단계에는 대부분의 카타르인의 전장유전체 분석을 목표로 진행 |
|
홍콩 |
Hong Kong Genome Project |
-2만 명 홍콩인의 전장유전체 분석 프로젝트로 암 및 희귀질환을 포함한 여러 질환 연구 -2019년에 시작하여 6년 동안 진행하며 홍콩정부 소유 회사인 Hong Kong Genome Institute에서 진행 |
최근의 유전체 분야에서 중요한 분야로 부각되는 연구는 단일세포 분석 기반 인간세포지도 작성(Human Cell Atlas) 연구이다. 인간세포지도 컨소시엄은 인간의 신체를 이루고 있는 34조 개 이상 세포의 분자적 특성 및 공간적 특성을 규명하는 것을 목표로 출발한 프로젝트로 2021년 현재 전 세계 1,500명 이상의 연구자들이 참여하는 대규모 협업 프로젝트로 성장하면서 빠르게 발전하고 있다.
(2) 시장 및 산업 동향
유전체 분석 및 정밀의료 시장은 연평균 10% 이상 빠르게 성장하는 시장으로 분자진단, 동반진단, 디지털 헬스케어 등 여러 관련 분야의 성장도 견인하고 있다. 특히 최근에는 단일세포유전체 분석기술의 발달, 휴대성 높은 유전체 분석 장비, 나노포어(nanopore)와 같은 3세대 유전체 분석기술 등 새로운 기술들이 빠른 성장을 이끌고 있다.
유전체 시장 중 핵심분야인 NGS 장비 시장의 경우 지난 10년 이상 Illumina사가 독점적인 지위를 차지하였는데, 중국의 BGI社가 미국의 Complete Genomics사를 인수한 후 그 핵심 기술을 바탕으로 개발한 MGI 장비들이 가격 및 성능에서 Illumina사의 장비들과 비슷하여 새로운 경쟁사로 떠오르고 있다. 또한 나노포어 기술을 바탕으로 한 Oxford Nanopore의 장비들도 여러 가지 장점을 바탕으로 시장에서 영역을 넓혀가고 있다. 한편, 긴 염기서열 분석에 강점을 가지고 있는 PacBio사는 정확도가 높은 Hi-Fi 분석 기술을 제공하면서 de novo assembly를 비롯한 새로운 생물체의 유전체 분석 분야에서 널리 사용되고 있다. 한편으로 단일세포 분석기술의 발전 속에서 droplet 기술을 바탕으로 한 10X Genomics의 장비 및 실험 기술이 급속도로 보급되면서 단일세포 분야 시장의 주요 회사로 성장하고 있다.
[표 3-2] 해외 유전체 주요 기업 현황
|
회사명 |
주요 내용 |
|
Illumina |
-기존의 HiSeq 및 NextSeq 시리즈에 이어 NovaSeq 등 최신 유전체 분석 장비 개발 - 유전체 분석 기반 진단 시장 등 다양한 영역으로 사업을 확대 중 - 새로운 경쟁사인 BGI사와 특허 분쟁을 제기하며 경쟁사 진입을 차단하고자 함(미국, 덴마크, 독일, 스위스, 터키 등 여러 국가에서 소송 진행 중) |
|
Thermo Fisher Scientific |
- Ion torrent 기반의 NGS 장비 개발 및 판매 - 다양한 NGS 라이브러리, 시약 및 소프트웨어 개발 및 판매 |
|
BGI Genomics |
- 미국의 Complete Genomics 회사를 인수한 후 자체 NGS 장비들을 개발하여 2018년부터 판매 시작 - 최고 사양 장비인 DNBSEQ-T7 장비의 경우 하루에 6TB(60명의 인간 게놈) 정보를 한 명 당 600달러의 비용으로 생산 가능 - NGS 관련 특허 문제로 Illumina사와 여러 국가에서 특허 소송 진행 중 |
|
Agilent Technologies |
- NGS 기반 라이브러리 제작 시약, 기기 및 분석 소프트웨어 개발 및 판매 |
|
10x Genomics |
-단일 세포 분석 분야에서 새롭게 떠오른 회사로 단일세포 전사체, 후성유전체, 단백체, 공간 전사체 등 다양한 단일세포 분석을 위한 장비, 시약 및 소프트웨어의 개발 및 판매 |
|
QIAGEN |
- NGS 기반 라이브러리 제작 시약, 기기 및 분석 소프트웨어 개발 및 판매 |
|
GENEWIZ (Brooks Automation) |
- NGS 서비스, 유전자 합성, 올리고 합성, 임상유전체 분석 서비스 등 다양한 유전체 분석 서비스 제공 |
|
Pacific Biosciences of California(PacBio) |
- 3세대 염기서열 분석기술 기반의 장비 개발 및 판매 |
|
Oxford Nanopore Technologies |
- 나노포어 기술 기반의 3세대 염기서열 분석기술 기반 장비 개발: MinION, GridON, PromethION 등 판매 - 기존의 NGS와 달리 4Mb 길이 정도까지 길게 sequencing 가능 |
다. 국내 현황
(1) 기술 및 연구 동향
과기정통부, 복지부, 산업부, 질병청 등 4개 부처는 2020년 국가 바이오 빅데이터 시범 사업을 시작하여 2022년까지 희귀질환자 포함 총 2만 5,000명의 전장유전체 정보를 생산하고 국내 산학연 연구자들이 활용할 수 있도록 진행하고 있다. 동시에 2023년부터 2028년까지 6년 동안 1조 원 규모의 예산을 투입하여 총 100만 명의 유전체, 임상 정보 및 코호트를 구축하는 국가 바이오 빅데이터 사업을 발표하고 이를 위한 준비를 하고 있다. 또한, 다중오믹스 기반 정밀의료 기술개발 사업이 추진되어 대장암(2017년 선정, 40억/년), 폐암(2019년 선정, 20억/년) 등 한국인 호발암을 연구하는 정밀의료사업단이 선정되어 수행되고 있다.
특히 산업부는 유전체분석 기반 산업 경쟁력 강화를 위해 유전체분석시스템구축 사업(2019∼2022, 총 140억)을 추진하고 있다. 중소기업벤처부는 규제완화를 통한 산업 육성을 위하여 울산을 게놈서비스산업 규제자유특구로 지정하고 2020년부터 2022년까지 총 477억을 투입하여 3가지 유전체 관련 실증사업을 추진하고 있다.
2014년에서 시작한 ‘포스트게놈 다부처유전체사업’(2014∼2022)은 많은 성과를 만들면서 2022년 종료될 예정이고, 복지부의 정밀의료사업으로 진행한 ‘정밀의료 기반 암 진단 및 치료법 개발(K-MASTER) 사업단’과 ‘정밀의료 병원정보시스템(P-HIS) 개발 사업단’ 또한 2021년 종료를 앞두고 있다. 한편으로 최근 그 중요성이 부각되고 있는 단일세포 기반 오믹스 연구의 중요성을 반영한 단일세포 오믹스 기술개발 사업이 매년 10∼20억 규모로 신규 과제를 선정하면서 활발하게 진행되고 있다.
|
프로젝트명 |
주요 내용 |
|
국가 바이오 빅데이터 프로젝트 |
- 한국인 100만 명의 유전체 및 임상정보 통합 바이오 빅데이터 구축 및 정밀의료 구현 - 2020년 시범 사업을 시작하여 2022년까지 희귀질환자 1만 5,000명 포함 총 2만 5,000명의 유전체를 분석하고 산학연 연구자들이 활용할 수 있도록 제공 |
|
포스트 게놈 다부처 유전체 사업 |
- 인간․농생명자원․산림자원․수산생명자원 유전체 연구를 통한 성과 창출 및 유전체 기반 산업 발전 |
|
정밀의료 사업 |
- 정밀의료 기반 새로운 암 치료법 개발 및 ICT 기술 활용/클라우드 기반 병원정보시스템 구축 |
|
다중오믹스 기반 정밀의료 기술 개발사업 |
- 유전체, 단백체, 대사체 등 다중오믹스 분석을 통한 질환 바이오마커 개발 및 치료 기술 개발 사업 - 대장암, 폐암 등 한국인 호발 질환에 대한 정밀의료 기술 개발 진행 |
|
단일세포 오믹스 사업 |
- 단일세포 다중 오믹스 분석 기반 질환 바이오마커 개발 - 인간세포지도 작성 |
|
차세대한국인 유전체 분석시스템 구축사업 |
- 유전체 정보 생산 및 분석 기반 구축 - 대규모 유전체 분석을 통한 질환 바이오마커 개발 및 사업화 지원 |
[표 3-3] 국내 주요 유전체 연구 현황
(2) 시장 및 산업 동향
정부는 2019년 5월 ‘바이오․헬스 산업 혁신전략’을 발표하면서 유전체 기반 바이오 빅데이터를 차세대 3대 주력산업 중 하나로 선정하고 산업 육성을 위한 여러 전략을 발표하였다. 우선 2020년부터 향후 10년 동안 한국인 100만 명의 유전체 빅데이터 플랫폼을 구축하고 활용할 계획이다. 또한 바이오․헬스 산업의 발전을 가로막는 여러 규제를 개선하기 위한 제도도 도입하여 추진하고 있는데, 대표적으로 2020년 1월 데이터 3법(개인정보보호법, 정보통신망법, 신용정보법)을 통과시켜 가명 처리된 데이터를 활용할 수 있는 기반을 마련하였다.
유전체 분야의 핵심 사업 분야 중 하나인 개인 의뢰 유전자 검사(DTC: Direct-To-Consumer) 서비스 산업의 확대를 위해 DTC 유전자 검사 인증제 시범 사업을 추진하면서 여러 기업을 선정하여 최대 70여 개 항목에 대한 유전자 검사 시범 사업을 추진하고 있다. 또한 산업통상자원부의 규제샌드박스 사업을 통해 생명윤리법에서 DTC 서비스로 금지하는 각종 질병 대상 서비스도 개발 및 검증하고 있다.
[표 3-4] 국내 DTC 서비스 현황
|
회사명 |
브랜드 명 |
주요 내용 |
|
마크로젠 |
마이지놈스토리 블루 |
- 주요 암 15종, 일반질환 23종 등을 포함하는 질병예측 유전자 검사 서비스 |
|
마이지놈스토리 그린 |
- 다이어트 관련 17개 항목, 영양 관련 16개 항목을 포함하는 건강 생활습관 관련 유전자 검사 서비스 |
|
|
마이지놈스토리 골드 |
- 질병과 건강 생활습관을 포함하는 종합 유전자 검사 서비스 |
|
|
마이지놈스토리 더플러스 올인원 |
- 검사 항목은 영양소, 운동, 피부․모발, 식습관, 개인특성(알코올 홍조, 니코틴 의존성 등), 건강관리(비만, 혈당, 혈압 등) 등 총 73종의 유전자 검사 |
|
|
젠톡 |
- 건강 설문과 병원 EMR 데이터를 결합한 유전자 서비스로 주요 암, 심뇌혈관질환 등의 유전자 검사 서비스 |
|
|
테라젠이텍스 |
헬로진 |
- 암, 일반질환 등 질병 관련 유전자 검사 서비스 |
|
진스타일 |
- 체질량 지수, 혈압, 혈당 등 유전적 질병 예방 및 건강 관련 유전자 검사 서비스 - 진스타일 웰니스 70+의 경우 건강 및 생활습관 영역 78개 유전자 검사 서비스 제공 |
|
|
웰니스 뷰티 |
- 유전자 맞춤형 피부 관련 검사 서비스 |
|
|
메디젠휴먼케어 |
M-check |
- 유전적 질병 위험도 분석 서비스 |
|
Melthy |
- 운동, 피부미용, 건강관리 등 생활건강 유전체 서비스 |
|
|
DNA링크 |
DNAGPS |
- 생활 습관, 환경 관련 질환 및 약물감수성 관련 유전자 분석 서비스 |
|
랩지노믹스 |
WithGENE |
- 건강, 모발, 피부 관련 44개 유전자 검사 서비스 |
유전성 환자 진단 및 암 환자 치료를 위한 NGS 검사는 2017년 건강보험 항목에 포함된 이래 많은 의료기관에 도입되어 널리 사용되고 있는데 2021년 3월 기준으로 63개 기관이 승인되어 NGS 검사 서비스를 제공하고 있다. 일부 병원들은 병원 정보시스템에 임상 정보와 유전체 정보를 통합하여 분석할 수 있는 시스템들을 개발하며 정밀의료 구현을 위한 플랫폼으로 발전시키고 있다.
라. 발전 과제
21세기는 바이오의 시대로 바이오 및 관련 분야는 빠르게 성장하면서 새로운 시장을 창출하고 인류가 직면한 여러 가지 문제를 해결하는 주요 분야로 떠오르고 있다. 그 중에서도 NGS를 이용한 유전체 분석은 생명공학의 모든 분야에서 가장 기초적인 도구로 널리 활용되고 있으며, 정밀의료를 비롯하여 농수산학 및 환경생물학 등 다양한 분야에서 적용되고 있다.
세계의 많은 나라들은 자국민 유전체 정보의 중요성을 깨닫고는 스스로 자국민의 유전체 정보를 확보하고 각 나라에 맞는 정밀의료를 구현하기 위한 국가적인 프로젝트들을 활발하게 진행하고 있다. 유전체 정보와 더불어 최신 IT 기술을 접목한 의료 정보, 생활 습관 정보 등 다양한 정보를 체계적으로 수집하고 통합 분석하여 유전체, 환경 및 생활습관을 아우르는 데이터 기반 정밀의료 체계를 구축하기 위한 경쟁이 치열하게 이루어지고 있다. 이러한 환경에서 우리나라도 유전체 기반 정밀의료 체계 구축 및 국가경쟁력 확보를 위해 유전체 분야에 대한 투자를 지속적으로 늘리면서 해당 분야를 발전시키는 것이 중요할 것이다.
한편으로 개인 유전체 정보를 포함한 민감한 개인정보의 보호, 의료 현장에서의 유전자 분석의 유용성 여부 등 윤리적․법적․사회적 이슈들도 많이 존재하고 있어, 관련 규제들도 엄격하게 만들어지고 있다. 데이터 기반의 새로운 산업 창출이라는 긍정적인 측면과 개인 정보 보호 및 유전자 검사의 유효성과 안전성을 확보하기 위한 규제 등 서로 상충되는 면을 고려하여 올바른 방향을 찾기 위해서는 정부와 산․학․연․병 등 관련 기관, 그리고 국민들이 함께 논의하면서 합의점을 찾는 것이 중요할 것이다.
2. 단백질체
가. 개요
(1) 단백질체학이란?
단백질체학(proteomics)은 세포, 조직, 체액 등에 존재하는 모든 단백질체에 대한 총체적인 연구분야로서 단백질 동정 및 발현량 측정뿐 아니라 단백질의 생체․세포 내 위치와 변화, 상호작용, 기능과 구조 분석을 포함하며 생명활동과 직결되는 정보를 제공하기 때문에 다양한 형식의 진단 플랫폼 개발과 신약개발 분야에서 강력한 학문적 근거로 사용되고 있다.
(2) 단백질체학의 핵심기술
단백질체학 기술은 크게 단백질 분석기술, 단백질 기능 규명 기술, 단백질체 정보기술로 나뉘며, 핵심기술인 단백질 분석기술은 단백체 분리분획기술과 질량분석을 이용한 단백질 동정 및 정량기술이 주를 이룬다. 단백질 기능 규명 기술은 단백질 상호작용 및 경로 분석, 단백질 구조 규명 및 디자인, 세포 및 개체 기반 단백질 기능 검증기술 등으로 구분되며, 단백질체 정보기술은 단백질체학 전과정에 있어 자료 분석 및 결과 해석에 기반이 된다.
나. 해외 동향
(1) 기술개발 동향
(가) 분리분획기술
복잡한 단백질체 시료를 폭넓게 분석하기 위해 단백질과 펩티드 수준의 다양한 분획법이 사용되고 있다. 단백질체학의 태동에 큰 역할을 한 이차원 전기영동(2DE)은 단백질 수준에서 개별 단백질로 분리하는 방법으로 말디토프(MALDI-TOF: 항체, 생체조직에서부터 전자소재까지 다양한 종류의 시료를 분석할 수 있는 질량분석기) 질량분석기와 어울려 폭넓게 이용되었지만, 낮은 분석효율 및 재현성으로 사용빈도가 점점 낮아지고 있다.
이에 비해 펩티드 수준에서 주로 이용되는 액체크로마토그래피(LC) 기반의 분리분획 기술들이 활발히 개발되어, 역상액체크로마토그래피(RPLC) 기술은 단백질체 연구의 표준이 되었다. 또한 분해능(分解能)과1) 검출민감도를 높여 동일한 시료에서 더 많은 펩티드를 분석하기 위해 고정상 충진물 소형화, 컬럼 길이 증가, 컬럼 내경 소형화가 필요하게 되었고, 이를 뒷받침하기 위해 초고압액체크로마토그래피(UHPLC) 기술이 개발되었다.
한편 RPLC의 일차원 분해능을 극복하기 위해 RPLC와 분리직교성을 갖는 양이온교환 크로마토그래피(SCX), 음이온교환 크로마토그래피(SAX, WAX), 친수성 상호작용 크로마토그래피(HILIC), high-pH RPLC 등과 연계한 다차원크로마토그래피(MDLC) 기술을 통해 단백질체의 분석범위가 더욱 확장되고 있다. 이러한 다차원크로마토그래피는 오프라인(offline) 방식으로 연결하여 사용하기 시작하다가 시료의 손실을 최소화하고 편리성을 증대하기 위해 온라인(online) 방식의 연결방법이 개발되었다. 다차원단백질식별기술(MudPIT)은 SCX와 RPLC가 펩티드를 전혀 다른 성질에 따라 분리하는 원리를 활용하여 단일 컬럼 내에서 직접 연결하는 방법이며, high-pH RPLC와 low-pH RPLC를 온라인으로 연결하기 위해서는 복잡한 크로마토그래피 밸브시스템을 활용한다.
단백질 수준에서 복잡성을 낮추는 분획 방법으로 일반적인 폴리아크릴아마이드 겔 전기영동(SDS-PAGE)와 겔 내 소화(in-gel digestion)를 결합한 GeLC 방법이 오래전부터 개발되어 활용되고 있으며, 그 외에도 off-gel electrophoresis, PF2D, size-exclusion chromatography가 이용되지만 활용도는 GeLC에 비해 그리 높지 않다. SDS-PAGE의 원리를 이용하면서 분획된 단백질을 용액상태로 수득하는 GELFREE 분획법이 개발되어 top-down proteomics의 coverage를 높이는데 성공적으로 적용되고 있다.
최근 나노입자 화학을 이용하여 bead 표면에 차별적인 친화력을 가지는 잔기(residue)를 만들어 미량의 혈액 단백질들을 농축하는 proteograph라는 기법이 개발되어 바이오마커 개발 연구에 활용되고 있다.
(나) 질량분석기술
질량분석은 단백질․펩티드의 이온화(ion source), 질량-전하비(m/z)에 따른 이온의 분리(mass analyzer), 특정 질량 값에 해당하는 이온의 선택(ion optics), 기체상태에서 이온 파편화(fragmentation)를 복합적으로 활용하기 때문에 각 부문의 작동방식에 따라 실로 다양한 질량분석 기기가 개발되었다. 기존 삼중-사중극자(triple quad), 사중극자-TOF 결합(QTOF)을 필두로 하여 이온트랩과 사중극자(Q-TRAP), 이온트랩과 FT-ICR MS의 결합(LTQ-FT)에 이어, 이온트랩-오비트랩(LTQ-orbitrap), 사중극자-오비트랩(Q-exactive), 사중극자-오비트랩-이온트랩(fusion orbitrap) 등 질량 분석기의 성능을 향상시키기 위한 일반적인 전략으로 하이브리드 기기를 지속적으로 개발하였다.
이처럼 질량 분석기의 발전은 다양했지만 고해상도 및 고정확도 질량분석기를 도입하려는 뚜렷한 흐름에 따라 orbitrap과 TOF가 양대 산맥이 되어 꾸준히 개선되고 널리 활용되고 있다. 최근의 하이브리드 질량분석기 orbitrap fusion lumos tribrid는 사중극자, ion routing multipole, 선형이온트랩, 오비트랩 등 이온 분리․저장 장치를 5개나 포함하고 있어서 민감도와 분석속도가 획기적으로 향상되었다. 최근 개발된 orbitrap eclipse tribde는 ETD(Electron Transfer Dissociation), PTCR(Proton Transfer Charge Reduction) 등 추가적인 fragmentation 기술과 ionization 기술을 집적하여 single cell proteomics 분석이 가능한 수준으로 활용되고 있다.
최근의 두드러진 특징의 하나는 이온 이동도 분광계(ion mobility spectrometer) 장치를 질량분석기에 추가하는 것이다. 고압가스와 전기전압을 이용해 m/z 이외의 특징으로 이온을 분리하므로 질량분석기 앞에 결합하여 활용된다. orbitrap MS에 연계한 기술이 개발되었지만, 주로 TOF MS와 연계되어 사용된다. 더 나아가 TIMS(Trapped Ion Mobility Spectrometer)는 이온을 포집하는 기능을 더해 더 향상된 분해능을 제공한다. 그리하여 펩타이드 이온을 대량 선택적으로 방출하는 TIMS/PASEF(Parallel Accumulation Serial Fragmentation), 특정 m/z의 이온만 장치의 출구로 통과시키는 FAIMS(Field Asymmetric IMS), 모서리 주변에서 이온을 돌려서 매우 긴 경로로 이온을 분리하는 SLIMs(Structures for Lossless Ion Manipulations) 등이 개발되었다.
middle-down 혹은 top-down proteomics에서는 bottom-up 펩티드보다 훨씬 큰 폴리펩티드․단백질의 아미드 결합을 끊어내기 위해 더 강력한 절편화 방법이 필요하다. 전자 전달 해리법(ETD)과 자외선 광분해법(UVPD)의 개발은 top-down 단백질체 연구에 획기적으로 기여하였다. 진보된 컴퓨팅 알고리즘을 활용한 데이터 분석 기술의 발달로 DIA(Data Independent Analysis)나 HRM(Hyper Reaction Monitoring)과 같은 질량분석기술이 활용되고 있고 DDA(Data Dependent Analysis)나 MRM(Multiple Reaction Monitoring)과 같은 기술도 특정한 표지법 없이도 상대정량 분석에 있어 신뢰도 높은 결과를 얻을 수 있게 되었다.
DIA 기술은 Q-TOF와 만나서 m/z 전 구간을 구획하여 복합적인 스펙트럼을 얻어 분석하는 SWATH-MS(Sequential Window Acquisition of all Theoretical Mass Spectra)를 개발할 수 있게 하였으며, 이온 이동도 기술과 결합하여 DIA-TIMS를 가능케 함으로써 단백질체 분석범위를 획기적으로 증가시켰다. 사중극자-오비트랩 질량분석기의 등장으로 PRM(Parallel Reaction Monitoring) 기술이 개발되어 단백질체 프로파일링과 타깃 단백질의 정량분석이 동일 기기에서 가능해졌다.
한편, 질량분석 기반의 이미징 기술인 IMS(Imaging Mass Spectrometry)가 개발되어 in situ에서 단백질․펩티드의 공간 분포를 탐색하는 접근법으로 활용된다. 다른 생화학 영상 기술과 달리, IMS는 잠재적 표적 종에 대한 선험적 지식 없이 비표적으로 분석한다는 장점이 있다. MALDI 기반 IMS 외에도, ToF-SIMSimaging, DESI-IMS 등이 개발되었다. 금속을 측정하던 ICP MS기술과 세포계산(cytometry) 기법을 결합한 mass cytometry(cyTOF)는 세포간의 생물질 콘텐츠의 변이를 규명할 수 있어서 FACS(Fluorescence Activated Cell Sorter)를 대체하는 기술로 각광받고 있다. 질량분석기술의 민감도 향상, 멀티플렉싱을 통한 동일펩티드 이온증가, carrier를 이용하는 신호증폭, 시료처리의 간편화 전략을 이용해 single cell proteomics를 위한 기초연구도 활발히 진행되고 있다.
(다) Informatics 기술
질량분석에서 얻어진 방대한 데이터로부터 펩티드의 서열, 정량, 단백질 번역 후 변형(PTM: Post-Translational Modification) 정보를 해석하고, 생물학적 의미를 추출하는 정보학 기술은 미국의 Scripps, ISB와 PNNL 그리고 독일 MPI 등의 유수 연구기관을 중심으로 활발하게 개발되고 있다. 이들 기관에서는 분석의 자동화와 생산된 질량스펙트럼의 해석을 위한 소프트웨어(TPP, MSGF+, Skyline, MaxQuant, ProLuCID 등) 환경을 구축하였다. 또한 펩티드 서열로부터 단백질을 동정하고 정량적으로 해석하는 다양한 프로그램의 개발과 단백질의 PTM 분석을 위한 알고리즘(MODi, MSFragger, PeaksPTM 등)의 개발도 활발히 진행되고 있다. 스펙트럼을 해석할 때, 단백질 서열 DB를 사용하지 않고, 기존에 얻어진 스페트럼 라이브러리를 활용하는 알고리즘도 오래전부터 꾸준히 개발되었다. TPP 파이프라인의 SpectraST, GPM 프로젝트로 개발된 X1Hunter, 미국표준원의 MSPepSearch 등이 대표적이다. 그 외에도 단백질의 구조와 관련된 정보를 유추할 수 있게 하는 HDX-MS나 crosslinking에 의한 분석 등 다양한 질량분석 기반의 분석기술이 개발되면서 이를 해석할 수 있는 소프트웨어도 개발되고 있다.
최근에는 단백질체와 유전체 연구를 병행하여 종합적으로 해석하기 위한 단백유전체(proteogenomics) 연구가 활성화되면서, 질량분석을 통해 확인하고자 하는 단백질체를 DB 검색을 통해 동정 가능하도록 유전체 DB를 표현하고 구축하는 방법에 대한 연구가 진행되고 있다. 유전자 서열분석으로 얻어진 유전체 정보에 기반하여 질량분석 데이터를 해석하며, 서열 간의 중복을 최소화하기 위해 non-synonymous SNP나 alternative splice variant를 exon graph, splice graph 등으로 표현하여 해석하기도 한다. 또한 CPTAC과 같은 대규모 과제의 연구결과로 생산된 단백질체 데이터의 축적에 따라 PRIDE와 같은 데이터 저장소가 활성화되고, 대규모의 데이터분석이 가능해졌다.
(라) 단백질체 정량기술
초기 이차원전기영동에 기반을 둔 정량기술은 거의 사라져가고, LC와 질량분석기만 사용하여 정량하는 추세로, 안정 동위원소를 표지하는 방식(stable isotope labeling)과 비표지방식이 사용된다. 시료간의 상대적 양을 비교하는 상대정량기술에는 ICAT, iTRAQ, SILAC, IDBEST, TMT 등과 같은 표지식 방법이 있으며, 단백질체 분석 적합성을 크게 개선함으로써 그 적용 사례가 증가하고 있다.
TMT의 경우에는 최대 16개의 서로 다른 시료 분석이 가능한 16-plex TMT와, cysteine에 표지되어 산화 환원 반응에 주요한 단백질을 정량할 수 있는 iodo6plex TMT가 개발되어 적용되고 있다.
비표지 상대정량법은 펩티드들의 상이한 이온화 효율, 존재량과 peak 세기 간의 비선형 관계, 데이터 처리 부분에서 여러 가지 난제를 안고 있으나, spectral counting을 이용한 emPAI, NASF 등과 extracted ion chromatogram 기반의 MaxLFQ, iBAQ 등의 알고리즘이 개발되어 문제점을 개선해 다양한 정량분석에 활용되고 있다. 또한 재현성이 떨어지고 분석시간이 긴 MDLC 대신 한번의 RPLC로 최대한의 단백질체를 얻을 수 있는 50cm 이상의 칼럼이 활발히 적용되고 있다.
절대 정량기술에는 SISCAPA, QCAT proteotypic peptide, mTRAQ 기술 등이 사용되고 있으며, SIS(Stable Isotope Standard)를 사용한 삼중-사중극자 기반 MRM 기술 이용이 크게 증가하고 있다. 최근 MRM에 비해 transition 선정 소요 시간이 짧은 PRM과 재현성이 우수한 SWATH 방법이 개발되어 적용되고 있다. 이에 맞춰 Skyline, Spectronaut, DIA-Umpire, DIA-NN 같은 분석 소프트웨어가 개발되었다.
(마) PTM(Post-Translational Modification) 분석 기술
질량분석기를 이용한 PTM 분석에서의 낮은 stoichiometry 문제를 해결하기 위해, 각 PTM이 지닌 특이적인 물리화학적 성질을 이용하여 특정 PTM 단백질 혹은 펩티드를 농축하는 기술이 활발하게 개발되어 정착되고 있다.
인산화 펩티드 농축기술로는 IMAC, TiO2를 이용한 유연분리 기술이 있으며, SCX 또는 SAX 등과 복합하여 효율을 증가시킬 수 있다. 항체를 이용하여 phosphotyrosine을 갖는 단백질/펩티드를 농축하는 기술도 개발되었다. 당쇄화는 periodate 산화 후 hydrazide resin을 이용하는 화학적 농축법과 lectin을 이용한 affinity 기반 농축법이 활용되고 있으며 membrane filter와 lectin affinity 분리를 결합한 FACE 기법도 등장하였다. 라이신 잔기에 acetylation된 acetylome이나 ubiquitytlation된 ubiquitylome은 트립신을 이용하여 펩티드로 절편화한 후 각각에 맞는 항체를 이용하여 농축할 수 있게 되었다.
단백질의 N-말단 상태를 분석하기 위한 N-terminomics기술이 개발되어 N-terminal PTM과 alternative translational initiation site를 맵핑하거나, degradome을 관찰하는데 활용되고 있다. 대표적으로 COFRADIC, TAILS, Nrich 등이 있다. 하나의 단백질에 나타나는 복잡한 PTM의 조합을 규명하는데 top-down proteomics가 활용되고 있다. 질량분석 결과에서 PTM 정보를 해석하는 방법으로 일반적인 DB 서치 프로그램을 사용할 수 있지만, PTM의 조합이 무궁무진함에 따라 MODplus와 MSfragger같이 unrestrictive modification 알고리즘이나, 두 펩티드가 연결되어 있는 cross-link를 표적하여 발굴하는 알고리즘도 개발되었다.
(바) 단백질체 동적변화 분석 기술
단백질은 시공간적으로 변하고 복합체를 형성한다. 단백질 복합체 연구는 APMS(Affinity Pull-down Mass Spectrometry)가 가장 기본적이고 널리 활용되는 분석방법이다. 개별 단백질을 항체를 이용해 풀다운(pull-down)하면 복합체를 형성하는 다른 단백질도 따라 나와 복합체를 분석할 수 있다. 약하게 결합하여 복합체 얻기가 이려운 경우에는 cross-linking을 유도하여 분석한다. AP-MS는 한 종류의 복합체 연구에 적당하나 대규모 연구나 동적변화 연구에는 실용적이지 않다. 반면에, 질량분석 자체 기술의 발전으로 막단백질이나 단백질 복합체 분석이 훨씬 용이해졌다. surface-induced dissociation을 이용해 단백질 복합체에서 꺼풀을 벗기듯이 요소단백질을 분리할 수 있으며, top-down proteomics나 MS3 기술을 원용하고 UVPD와 HCD 파편화 방법을 결합하여 복합체 내 단백질의 proteoform을 결정할 수 있게 되었다.
PCP(Protein Correlation Profiling) 방법은 비변성 조건에서 단백질복합체가 서로 다른 크로마토그래피 조건에서 단백질이 동시에 용출된다면 전제하에 확률적으로 계산하는 방식이다. 이 전략은 질병이나 약물 치료와 같이 시스템에 교란이 있을 때 단백질 복합체의 역동성을 신속하게 측정할 수 있는 수단을 제공하며 대규모 연구에 효과적이다.
AP-MS의 변형법으로 APEX, BioID 방법이 개발되어 spacial proteomics로 자리 잡았다. 상호 작용하는 단백질간의 높은 친화성을 요구하지 않고 주변에 있는 단백질을 동정하는 방법이다. APEX는 ascorbate peroxidase라는 효소를 활용해 히드록실 라디칼로 비오틴을 주변 단백질을 표지하며, BioID은 biotin ligase 효소 BirA를 사용하여 주변 단백질에 비오틴을 표지한다. 비오틴이 붙은 단백질을 동정하여 소위 ‘공간적 복합체’를 규명한다.
단백질체의 생성과 분해에 따른 동적 정량변화를 보기 위해 pulsed SILAC를 활용하게 되었다. pulse-chase처럼 특정 시간동안만 stable isotope labeling을 하는 것이다. pulsed SILAC과 달리 일정한 시간동안 새로 합성된 단백질만 농축하는 BONCAT 기술도 등장하였다. 세포성장 시 메티오닌 대신 미국심장협회(AHA: American Heart Association)를 표지해 생물직교화학(bioorthogonal chemistry)으로 비오틴을 붙여 친화력 풀다운 할 수 있는 것이다. 최근에는 실락(SILAC)2)과 BONCAT3) 방법을 결합한 새로운 기법으로 HILAC 방법이 개발되어 농축과 정량을 동시에 수행하여 효율적인 분석이 가능해졌다.
(사) 바이오마커(bio-marker) 연구
질병의 조기진단, 예후, 약물치료에 대한 반응, 신약 후보물질에 대한 평가 등에 활용되는 오믹스 기반 바이오마커 중 단백질 마커는 표현형 바이오마커로서 생리 상태를 직접 반영하며, 체액에서 쉽게 분석이 가능한 이점이 있다. 초창기 미국 국립암연구소(NCI: National Cancer Institute)에서는 조기발견연구 네트워크(EDRN)을 조직하여 조기진단 바이오마커 연구를 시작하였다. 최근 유전체와 단백체 데이터를 통합하는 단백유전체 기술 기반의 바이오마커 개발 방법론이 본격적으로 태동되어 NCI의 CPTAC(Clinical Proteomic Tumor Analysis Consortium)은 TCGA 유전체와 단백질체 정보를 통합하는 단백유전체 이니셔티브 프로그램을 진행하였다.
2016년에 론칭된 미국의 암 문샷(Cancer Moonshot) 프로그램에서는 암 치료에 대한 보다 많은 치료제 및 기술 스펙트럼을 제공하기 위한 프로그램을 구성하고 있다. 그 중심에 단백질체학 기술이 있으며, 미국을 포함한 10개국이 참여하는 ICPC(International Proteogenome Consortium)는 CPTAC의 단백유전체 바이오마커 발굴 기술을 기반으로 종양의 단백질 유전체학 복잡성(proteogenomic complexity)에 대한 전반적인 연구협력, 종양 치료에 대한 반응연구 협력, NCI의 Proteogenomic Translational Research Centers 기술지원, 혁신적인 데이터 분석법을 개발하고 단백유전체 정보를 공유하며, 필요한 경우 분석에 들어가는 자원도 공유하려고 한다. 2019년부터 6년간 한국연구재단에서는 다중오믹스 기반의 정밀의학 연구가 폐암, 유방암, 당뇨 합병증 및 천식 질환에 대해 질량분석 기반의 단백체학이 포함되어 국내외 연구진들이 연구를 진행하고 있다.
또한 2017년 2월에 시작한 CPTAC 중심의 APOLLO(Applied Proteogenomics OrganizationaL Learning and Outcomes) 네트워크는 NCI, 미국 국방부, 재향군인회와의 협력을 통해 환자-병원-연구를 연결하는 네트워크를 구성하고 환자가 치료에 어떻게 반응할 것인지를 더 잘 예측하는 것을 목표로 종양의 단백유전체연구를 진행 중이다. 임상기관의 IHC 병리 연구에 오랫동안 이용되어 왔던 FFPE 조직시료에서 microdissection 후에도 다량의 펩티드를 추출하는 기술이 발달함에 따라, FFPE를 대상으로 항체없이 MRM 또는 SWATH 기법만으로 단백질들을 직접 검출하게 되었다. 이는 바이오마커 개발 연구에 활용되는 시료대상을 대폭 확정하는 효과를 가져왔다.
(2) 시장 동향 및 전망
(가) 시장 개요
전세계 단백질체 시장은 2019년 195억 달러에서 2024년 387억 달러로 연평균 14.7% 성장할 것으로 전망된다(MarketsAndMarkets, Proteomics Markets-Global Forecast to 2024). 이 시장의 성장은 맞춤의학 및 신약개발 분야연구 활동의 증가에 기인한다. 다른 시장 요인으로는 제약 및 생명공학 연구 개발비 증가, 단백질체에 대한 각국 정부의 자금지원 및 기술발전 등이 있다.
제품별 단백질체 시장은 계측장비기술 분야(instrument), 시약 분야(reagent), 서비스 및 소프트웨어 분야(service)로 구분할 수 있는데, 시약 분야가 2019년 시장점유율 1위를 차지할 것으로 예상되며, 이러한 추세는 2024년까지 계속 유지될 것이다. 시약 분야가 큰 비중을 차지하는 원인으로는 복잡한 혼합물 및 기타 단백질체 분석과정에서 단백질을 분리 정제하기 위한 다양한 시약의 사용증가로 볼 수 있다. 응용면으로 나누어 보면 신약개발, 임상진단 및 기타 응용으로 구분할 수 있으며, 신약개발이 가장 큰 시장 점유율을 차지하고 있다. 바이오의약 시장의 성장으로 정밀의학기술 개발의 기회가 창출되었고, 이는 단백질체를 이용한 신약개발 시장을 가속화시킬 것으로 기대된다. 특히 단백질체 기술의 발전으로 각종 화학 합성 및 약물의 생물학적 테스트의 비용, 시간 및 자원에 대한 필요부분이 최소화되고 있다.

[그림 3-1] 제품별 및 응용분야별 세계 단백질체 시장 규모
지역별로는 다양한 조직의 풍부한 자금지원을 받는 북미시장이 가장 크며, 그 다음으로 유럽, 아시아-태평양 순이다. 반면에 연평균 성장률로 보면 오히려 아시아 태평양 지역이 가장 높을 것으로 추정된다.

[그림 3-2] 지역별 단백질체 시장규모
(나) 시장 동향
세계 단백질체 분야 주요 기업으로는 Thermo Fisher Scientific(미국), Agilent Technologies(미국), GE Healthcare(미국), Danaher Corporation(미국), Merck KGaA(독일) 등이 있다. 2018년 Thermo Fisher Scientific사와 Symphogen사는 협약을 맺고, Symphogen이 개발한 치료용 단클론 항체를 분석하는 시스템을 Thermo사의 Q Exactive Plus Orbitrap을 이용하여 구축하기로 하였다. 또한 같은 해에 Agilent Technologies는 단백체 기술기반을 강화함과 동시에, 차세대염기서열분석을 포함한 단백체-유전체 포괄적인 서비스를 제공하기 위해 Advanced Analytical Technologies, Inc.를 인수하였다.
2017년 한국의 삼성바이오로직스는 독일의 Merck KGaA사와 생물 의약품 제조 및 생물학적 공정 개발에 관한 전략적 제휴를 위해 양해 각서(MOU)를 체결하였다. 이 협약에 따라 Merck는 Mobius 시스템, 세포주, 세포 배양배지 및 크로마토그래피 시스템 전반을 제공하여 삼성바이오로직스의 생물학적 약제의 개발을 가속화한다.
2021년 미국의 씨어(Seer)사는 나노입자 화학을 이용하여 혈액 내 미량의 단백질들을 리퀴드 핸들러 (liquid handler)로 자동화된 프로세서로 농축하고 단백체 분석을 할 수 있는 프로테오그래프라는 플랫폼으로 시총 5조원에 육박하는 회사로 성장하였다. 또한 노틸러스 바이오테크놀로지는 2020년 당시 아마존 CEO인 제프 베이조스와 마이크로소프트 공동 창업자인 폴 앨런 등이 투자에 참여하는 시리즈B 라운드에서 7,600만 달러 규모의 투자를 받는 등 단백체 분야에 대한 시장 전망은 매우 밝은 것으로 판단된다.
다. 국내 현황
(1) 연구개발 투자 현황
포스트게놈 다부처유전체 사업으로 다양한 단백질체 관련 연구사업이 계획되었으나, 2017년에 단백유전체 원천기술을 개발하는 다중 오믹스 신기술개발사업이 종료되었고 현재는 소규모의 유전단백체 융합정보기반 난치암 제어기술 개발사업(과기정통부, 수행기간 2017∼2022년, 연 10억 원, 주관기관 고려대학교)과 미국 NCI와 연계된 글로벌 바이오 연계기술 개발사업(과기정통부, 수행기간 2017∼2022년, 연 10억 원, 주관기관 한국과학기술연구원)이 진행되고 있다.
이러한 두 개의 사업은 모두 Cancer Moonshot의 일환으로 진행 중인 대규모 유전단백체 연구 이니셔티브인 ICPC를 통한 공동연구 및 활용에 참여하고 있으나, 다른 나라에 비해 국내 투자가 현저하게 미미한 편이다. 국내에서는 2019년 다중 오믹스 기반 정밀의료 사업이 새로 시작하였고 폐암, 유방암 등의 난치암 분야, 대사질환인 당뇨 합병증인 신증 분야, 천식 분야 총 3개 분야에 대해 단백질체 연구가 중심이 되어 6년간 진행되고 있다. 별개로 2023년부터 시작될 국가바이오빅데이터 구축 사업에 유전체 이외에 단백체가 어느 정도 포함될지는 미지수이다.
보건복지부에서는 Cancer Moonshot에 참여하기 위한 기획 작업의 일환으로 2018년 국립암센터 중심으로 단백유전체연구단을 꾸려 외부의 단백질체 연구그룹과 7개의 암종에 대해 컨소시엄 형태의 사업을 진행 중이다. 그 외에 대형 사업단인 글로벌프론티어연구개발사업 중 의약바이오컨버젼스연구단과 기초과학연구원 연구단(RNA 연구단)에서 단백질체 연구 인프라를 갖추고 연구에 활용하고 있으며, 이미 구축된 질량분석기기 등을 활용한 연구가 산발적으로 진행 중이다.
(2) 관련 산업 현황
[표 3-5] 국내 단백질체 관련 기업 현황
|
기업명 |
업종 |
설립연도 |
|
(주)영인프런티어 |
항체, 단백질, ELISA키트 생산 및 판매, 각종과학기기 판매, HUPO Antibody Initiative에 참여(www.younginfrontier.com) |
1994 |
|
(주)팹트론 |
주문형 펩타이드 제조 서비스, 기능성 및 약효 지속성의약품 제형 기술 개발, 펩타이드 개발 및 생산(www.peptron.co.kr) |
1997 |
|
(주)프로테옴텍 |
다중 알러지 진단키트 개발 및 판매, 프로테옴 분리 및질량분석, 단백질 동정 및 확인법 개발, 진단키트 개발(www.proteometech.com) |
2000 |
|
(주)노바셀테크놀로지 |
프로테오믹스 기술과 펩타이드 라이브러리 기술 기반으로 바이오 의약품과 바이오소재 개발(www.novacelltech.com) |
2000 |
|
다이아텍코리아(주) |
질량분석 기반 진단 제품 개발, 프로테오믹스 기술 이용 바이오마커 발굴, 면역항암제 액체생검 동반진단법 개발(www.diatech.co.kr) |
2000 |
|
(주)진메트릭스 |
MALDI-TOF를 이용한 바이러스 및 미생물 유전자 진단 기술 개발 및 서비스(www.genematrix.net) |
2000 |
|
(주)바이오인프라 |
빅데이터 기반 혈액 다중표지자 검사, 진단키트 개발, 바이오마커 발굴, 항암용 표적약물 전달 시스템 개발 등(www.bio-infra.com) |
2001 |
|
(주)프로탄바이오 |
인간용 암진단키드, 동물용 진단키트, 진단용 항원항체제작, 단백체 분석 서비스(www.protanbio.co.kr) |
2005 |
|
(주)아스타 |
병원성 미생물 신속 진단법 개발, MALDI-TOF 진단기기(로봇기술 활용 최초 국산화), MALDI plate 생산 판매, 시료전처리 기기 개발 생산 (www.astams.com) |
2006 |
|
프로테인웍스 |
단백질의약품 특성 분석 서비스, 천연물 분석 서비스, 프로테옴분석 (proteinworks.co.kr) |
2008 |
|
바이오앤시스템즈(주) |
단백질의약품 특성 분석 서비스(www.bionsystems.co.kr) |
2009 |
|
(주)라이프사이언스 래보러토리 |
단백질분석서비스, LC/MS/MS 분석 서비스, 각종 질량분석기술 교육 (www.proteinlab.co.kr) |
2013 |
|
(주)레티마크 |
단백체 기반 안질환 진단시스템 개발(www.retimark.com) |
2016 |
|
(주)베르티스 |
질량분석 기반의 단백체 플랫폼으로 유방암 진단 (http://www.bertis.com) |
2014 |
|
(주)솔브레인 바이오헬스 연구소 |
Seer사의 협력사로 프로테오그래프 플랫폼을 이용한 혈액 단백체 분석 서비스 제공 (http://www.soulbrain.co.kr/) |
2020 |
|
(주)프로메타바이오 |
단백체 기반의 헬스케어, 웰니스 플랫폼 분석 |
2020 |
라. 발전 과제
단백질체 연구는 기초학문 분야와 응용 산업 분야에서 다양하게 활용되고 있다. 노화 자체나 알츠하이머 및 퇴행성 뇌질환 같은 노화관련 질병연구, 화학단백질체학 및 신약개발 응용연구, 면역 및 감염성질환에 대한 연구, 시간과 공간에 따라 달라지는 단백질체 연구, 다양한 PTM 및 proteoform에 대한 연구, 유전체연구로 접근하기 어려운 세포외 소포체 및 막표면 단백질체 연구, 단백질 분해효소와 그 산물을 복합적으로 연구하는 degradomics 등은 단백질체학의 꾸준한 연구주제이다. 단백질체를 넘어서는 다양한 오믹스 정보를 융합하기 위한 정보과학, 세포신호전달 및 단백질 복합체를 해석하기 위한 생물정보학(bioinformatics)도 핵심 주제에 속한다.
또한 최근에 주목받는 단백질 의약품 개발 단계에서 항체의약품을 포함한 치료용 단백질 의약품 또는 peptide 의약품들의 분자량, 아미노산 조성, 당화여부, 이황화결합 부위 특정 등 특성 분석과 약물동력학 (PK: Pharmakokinetics) 분석에서 질량분석 기반의 단백체학은 매우 중요한 역할을 맡고 있다.
무엇보다도 최근에 주목받는 분야로서 임상단백질체학(clinical proteomics), metaproteomics, 단세포 단백질체학, 비변성조건 질량분석을 할용한 구조단백질체학이 있다. 임상단백질체학은 임상 중개 연구의 다양한 측면에 단백질체 기술을 응용하는데 중점을 둔 플랫폼으로 단백질 기반 임상시료 분석 및 임상화학 분석을 위한 단백질 처리기술 개발을 포함한다. 군집에 존재하는 다양한 미생물의 구성에 대한 정보는 metagenomics가 주이지만, 집단 내에서 발생하는 대사 활동에 대한 정보는 제공하지 않기에 metaproteomics를 이용해 생물의 대사활동 정보를 확보하고 미생물과 숙주의 생화학적 관계도 밝힐 수 있다. 단세포전사체학 기술이 세포의 분화과정이나 질병의 발생과정에서 세포 분포를 보여주고 있는 것처럼 단백질체학 기술은 단세포 수준까지 분석할 수 있는 기술적인 진보가 이루어지고 있으며 시료확보와 신호증폭 부분에서의 꾸준한 기술개발로 단세포단백질체학 (single cell proteomics)도 일상적 분석도구가 될 것으로 기대한다.
단백질체학의 가장 큰 응용분야로서는 정밀의료(precision medicine)가 있다. 약물을 적임자에게 적시에 제공하기 위해서는 사람의 질병상태를 먼저 파악하고 해당 치료법이 있는지 알아본 후 그 중 적절한 치료법을 찾을 수 있는 정확한 바이오마커(bio-marker)가 존재해야 한다. 따라서 단백질체 연구는 앞으로도 지속적으로 확장될 것이다. 다중오믹스, 특히, 유전체와 단백체를 통합적으로 바라보는 단백유전체는 Cancer Moonshot의 핵심부분이다. 정밀의료는 질병 유발 경로를 파악하고 결과를 모니터링하는 데 도움이 될 수 있을 것이며, 나아가 일상적 모니터링의 정밀건강(precision health)으로까지 확장될 것이다. 정밀의료의 진척을 위해서는 국제적 컨소시엄을 통한 단백질체 연구의 확대와 데이터 공유가 필요하다. 단백질체 연구는 정밀의료의 핵심기술로 정부, 의료기관, 산업계의 지속적인 관심이 필요하며 과감한 투자로 기술개발을 촉진해야 한다.
특히 2020년 보건복지부에서 건강과 웰니스에 관련된 유전자 패널에 대해서 소비자 직접 서비스 (DTC: Direct to Customer) 유전자 검사 가이드라인이 배부가 되면서 병원을 거치지 않고 소비자가 직접 신청하는 유전자 분석의 비대면 상업적 분석이 가능해졌다. 미국의 경우 미국 식품의약국(FDA)에서 허용하는 DTC 분석 서비스 범주에는 유전체 외에 대사체와 단백체 분석이 포함되어 있으나 한국의 경우 유전체 분석만 가능한 상태이다. 국내 단백체 기반의 헬스케어와 웰니스 산업의 발전을 위해서 유전체 일변도의 DTC 가이드라인에 대한 관련 분야의 규제 검토와 선제적 해소가 필수적이다.
3. 세포체(줄기세포 포함)
가. 개요
(1) 세포체 관련 재생의료 연구
(가) 재생의료 시장의 성장
재생의료는 손상된 조직과 장기의 재생 또는 이식을 통해 질병완치에 기여할 수 있는 신의료 분야의 연구이다. 궁극적으로 재생의료는 작용기전 등에 따라 질병의 한시적 완화를 뛰어넘어 완치를 기대할 수 있는 신의료기술로 개발 성공시 국민 의료복지의 향상과 더불어 관련 유관 산업의 발전을 창출할 수 있어 범세계적으로 정부와 민간영역에서 지속적인 투자와 규제완화 등의 잔입장벽 해소를 위한 노력이 진행되고 있다.
① 재생의료 분야의 지속적 수요증가와 제품상용화로 인한 시장확대
글로벌 재생의료 시장은 연평균 성장률이 평균 22.7%에 달하는 고성장 분야로 2017년 기준 약 226억 달러(약 25조 원) 규모에서 2028년 2,142억 달러(약 236조 원) 규모로 확대될 것으로 예상된다.4) 세계적으로 미국이 세계 시장의 약 52%를 차지하고 있어 절대적 우위를 점하고 있으며 유럽의 경우 영국 8%, 독일 7% 및 프랑스 4% 등이 그 뒤를 잇고 있고 아시아의 경우 일본이 7%와 한국이 4%를 점하고 있는 상황이다.5)
② 재생의료 제품 출시와 지속적인 임상시험 진행
재생의료 제품의 개발은 2000년부터 시작되었을 정도로 일천한 역사를 가짐에도 불구하고 2011년 (주)파미셀이 ‘하티셀그램-AM’을 세계 최초 세포치료제로 출시한 이래 현재까지 총 15개의 재생의료 치료제 개발이 성공적으로 출시되었고 이 중 5건이 국내에서 개발되어 상용화되었다.

자료: MDFS, EMA, MHLW 홈페이지, GSRAC 재가공(2017).
[그림 3-3] 세계 줄기세포 및 주요 재생의료 치료제 개발 현황
줄기세포에 대한 국가별 상업 임상 건수는 미국에 이어 한국이 15%(46건)로 정량적으로 2위를 위치하고 있으나 최근 3년간 현황을 살펴보면 임상승인 건수에 있어 중국에 역전되고 있다.

자료: 줄기세포 치료제 개발 및 규제 동향, 식품의약품안전처, 2016.3.
[그림 3-4] 국가별 재생의료 관련 세포치료제 임상연구 수행현황(1998∼2015, 누계)
[표 3-6] 인간 배아줄기세포 유래 세포치료제 임상시험 현황
|
Cell type |
Target Disease |
Clinical Phase |
Location |
Patient No. |
Year |
|
Retinal Pigment Epithelium(RPE) |
Stargadt’s Marcular Dystrophy(SMD) |
Phase I/IIa(NCT01469832) |
Astellas Pharma Inc., USA |
12 |
2011.11 |
|
RPE |
SMD |
Phase I(NCT01625559) |
ChaBiotech, Korea |
3 |
2012. 9 |
|
RPE |
Dry Age-related Marcular Degeneration(Dry-AMD) |
Phase I(NCT01674829) |
ChaBiotech, Korea |
12 |
2012. 9 |
|
RPE |
SMD |
Phase I/IIa(NCT02941991) |
Astellas Pharma Inc., USA |
11 |
2013. 1 |
|
CD15+Isl1+ Progenitor |
ISchemic Heart Disease |
Phase I (NCT02057900) |
Hospotaux de Paris, France |
10 |
2013. 5 |
|
CPCB-RPE1 |
Dry-AMD |
Phase I, II (NCT02590692) |
Regenerative Patch Technology, LLC., USA |
16 |
2015.10 |
|
RPE(SCNT-hESC) |
Dry-AMD |
Phase I (NCT03305029) |
CHA University, Korea |
3 |
2016. 5 |
|
RPE |
AMD |
Phase I (NCT03102138) |
Pfizer, UK |
2 |
2016. 9 |
|
Neural Precursor Cells |
Parkinson’s Disease |
Phase I, II (NCT03119636) |
Chinese Academy of Science, China |
50 |
2017. 5 |
|
RPE |
Dry-AMD |
Phase I, II (NCT03046497) |
Chinese Academy of Science, China |
10 |
2017. 9 |
|
RPE |
Marcular Degenerative Disease |
Phase I/IIa (NCT03167203) |
Astellas Pharma Inc., USA |
36 |
2018. 1 |
|
Astrocyte |
ALS (Amyotrophic Lateral Sclerosis) |
Phase I,II (NCT03482050) |
Kasmastem, Israel |
21 |
2018. 4 |
|
MMSC |
Interstitial cystitis |
Phase I, II NCT(04610359) |
Miraecellbop Inc, Korea |
28 |
2020. 5 |
출처: www.clinicaltrial.gov(편집).
③ 세포체(줄기세포 포함) 활용기술 확대 및 다양화 진행
줄기세포를 포함하는 세포체 연구는 치료적 목적을 위한 세포치료제 개발 외에도 최근 다양한 융복합 연구를 통해 특정 질환 모델링, 바이오 오가노이드, 신약개발 및 독성평가 등 치료외 분야로의 연구영역이 확대되고 있는 추세이다.
2016년 다국적 제약사인 GSK는 하버드대 연구팀과의 공동연구를 통해 기존 약물에 대한 적응증 확대연구를 통해 신규 루게릭병 치료제에 대한 임상시험 진입을 발표한 바 있고, 국제의약품규제조화위원회(ICH: International Conference on Harmonization)에서는 기존 신약개발시 임상과정에서 가장 큰 실패요인 중 하나인 심독성 평가 기술을 기존의 이온채널 에세이 기술에서 인간 전분화능 유래 심근세포를 활용하는 새로운 독성평가 시스템을 구축하고 표준화하고자 2016년부터 신규 프로젝트가 구성되어 추진되고 있다.6)
국내의 경우 줄기세포 유래 신경세포를 활용하여 희귀질환인 부신백질이영양증의 원인물질(VLCFA)규명을 통한 신규치료물질을 발굴7)하는 등 세포활용을 통한 신규 제약산업으로의 발전 가능성을 타진하고 있다.
조직장기는 다양한 세포로 구성되어 세포-세포 또는 세포-세포기질 간의 상호작용에 의해 기증이 작동되므로 최근 세포체(줄기세포 포함)를 활용하여 실제 인간 장기를 모사할 수 있는 바이오가노이드 연구가 활발히 연구되고 있다. 오가노이드 기술은 2015년 MIT에서 선정한 10대 미래유망기술로서 2013년 미니뇌가 제작된 이래 다양한 인체 장기를 모사할 수 있는 뇌, 안구, 간, 심장 등 각종 오가노이드 연구성과가 발표되어 향후 조직 및 장기 발생과정의 이해와 질병의 발병기전의 해석, 치료기술 개발 및 약물에 대한 독성평가, 궁극적으로 대체장기 개발 등의 바이오의료분야에 활용될 것으로 예측된다.
④ 오가노이드 활용기술 활성화
오가노이드는 줄기세포나 장기기반 세포로부터 분리한 세포를 3D 배양법으로 재가공하여 만든 세포집합체로, 자기 조직화 능력을 바탕으로 복잡한 생체의 장기를 모방 가능하다는 장점이 있다. 오가노이드 기술은 기초 생물학 연구와 관련하여 초기 장기의 발달, 조직의 상호작용, 질병의 발생을 이해하기 좋은 3차원 모델로 활용이 기대되고 있으나, 현재 기술로는 실제 장기의 복잡한 환경 구현에 한계가 있다. 현행 기술과 윤리적 한계가 숙제로 남아있지만, 혁신적인 기술이 개발되면 포유류 배아(embryo), 암 모델링(tumoroid), 칩(chip)기술 등 차세대 바이오․헬스 R&D 중심 역할을 수행할 것으로 예상된다.
최근 오가노이드는 줄기세포 기반의 정상 장기 모델링과 질환 모델링을 조직공학 및 유전자 편집 기술과 융합하여 생물학(R&D), 감염병 병리학, 재생의료, 약물 독성 및 효과 평가, 약물 탐색 및 맞춤 의약에 활용하는 연구개발이 확대되는 추세이다. 구체적으로 질환 모델링 연구는 미국을 중심으로 유럽연합, 일본 등의 추격, 중국의 약진으로 전 세계적인 경쟁이 심화되고 있다. 현재, 뇌, 간, 심장, 망막, 장, 신장 등 주요 장기의 맞춤형 질환 모델 개발 연구도 활발하게 진행 중이며, 2021년 3월 네덜란드 위트레흐트(Utrecht)대학 연구진은 눈물샘 오가노이드를 개발하여 임상질환 적용에 대한 기대감을 높이고 있다.

자료: Cell Stem Cell, 2021.3.
[그림 3-5] 눈물샘 오가노이드 개발
⑤ COVID-19 연구 분야에서의 오가노이드 활용성 제시
COVID-19 팬데믹 상황은 감염병 기전 등 생물학 연구와 신약개발에 오가노이드 활용을 촉진하며 새로운 기회로 작용하고 있다.
미국 웨일 코넬 대학교 등은 코로나19 바이러스에 취약한 인간 오가노이드(예: 신장, 폐 조직) 실험을 통하여 유용한 연구 플랫폼 가치를 확인하고 있으며, 오스트리아 등 유럽 연구진은 신장, 폐 등 코로나19로 영향 받는 신체 조직을 오가노이드로 구현하여 전임상시험 과정을 통하여 약물 효과성을 입증하여 기술적 가치를 입증하였다. 아시아에서는 일본 연구진(교토대학)이 코로나19 감염경로를 확인할 수 있는 기관지 오가노이드를 개발하여 약물 효과성 검증과정에 활용하였다.8)
한편, 국내의 경우 3D 생체조직 칩과 미세생체조직 시스템(오가노이드 포함)을 기반으로 하는 신약개발플랫폼구축사업이 추진 중이며, 줄기세포, 오가노이드, 유전자 등을 활용한 첨단재생의료기술 개발 사업(범부처 재생의료기술개발사업)이 2021년 8월부터 시행되고 있다. 현재, 장, 간, 심장 오가노이드의 경우 국외와 비교하여 선도그룹의 연구수준을 유지하고 있으며, 2020년 포항공대 연구팀이 미니 인공장기 수준의 방광오가노이드를 선보인 바 있다. 더불어 단일 장기가 아닌 다중 장기 오가노이드(multi-organoid)를 활용한 신약 스크리닝 연구에도 성과를 나타낼 것으로 보인다.

자료: 과학기술정보통신부, 2021.
[그림 3-6] (재)범부처재생의료기술개발사업단 사업 개요
산업적으로는 생명과학기업과 줄기세포기업들이 글로벌 오가노이드 시장에서 핵심적 역할을 하고 있다. 특히, 글로벌 오가노이드 산업 이해관계자(예, 바이오 회사)들은 시장에서의 지위를 높이기 위해 사업을 확장하고 전략적 협력, 파트너쉽 및 인수에 집중하고 있다.
국외의 경우, Merck KGgA, Corning 같은 생명과학기반 회사와 Thermo Fisher Scientific, STEMCELL Technologies, Inc, 3Dnamics, Inc, Organoid Therapeutics, PeproTech, Inc 등 줄기세포 관련 회사가 주류를 이루고 있다. 국내의 경우, 넥스트앤바이오, 넥셀, 오가노이드사이언스 등의 회사가 줄기세포와 오가노이드 상용화를 위한 시도를 하고 있다.
[표 3-7] 글로벌 줄기세포 관련 주요 기업 현황
|
회사명 |
활동년도 |
분류 |
활동내역 |
|
Thermo Fisher Scientific |
2019 |
제품출시 |
- Fisher Scientific은 오가노이드 세포주 개발을 위한 다양한 세포 배양 솔루션을 제공하기 위해 차세대 인큐베이터(Thermo Scientific Cytomat 2 C-LiN Series Automated Incubator)를 출시 - Cytomat 2 C-LiN 시리즈 자동 인큐베이터는 연구 과학자 및 세포 배양 생물학자에게 세포 기반 제약 응용 분야를 위한 강력하고 신뢰할 수 있는 배양 솔루션을 제공 |
|
Merck KGgAKEY |
2020 |
협력 |
- Merck와 BioMed X는 자가면역질환의 바이오마커를 식별하기 위해 기존의 고처리량 메타 유전체학, 뮤린 및 인간 피험자로부터 장 오가노이드 생성 연구 협력 |
|
Cellesce Ltd |
2019 |
파트너쉽 |
- 환자 유래 오가노이드 제조, 확장 및 재현성을 향상시킬 수 있는 완전 합성동물 없는 3차원(3D) 스캐폴드 개발을 위해 Manchester BIOGEL과 파트너십을 체결 |
|
3Dnamics Inc. |
2017 |
협력 |
- 3Dnamics Inc.와 Johns Hopkins University는 상용화를 위한 뇌 오가노이드 기술 개발을 위해 파트너십 체결 |
|
Corning Incorporated (Life Sciences) |
2019 |
제품출시 |
-스페로이드 및 오가노이드 배양 모델을 지원하는 새로운 솔루션을 제공 - 오가노이드 배양을 위한 새로운 Matrigel 매트릭스는 오가노이드 성장 및 분화를 지원 |
자료: The Insight Partners, Global Organoids Market Forecast To 2027, 생명공학정책연구센터 재가공, 2021.07.
오가노이드 적용 분야는 생물학(R&D), 감염병 병리학, 재생의료, 약물 독성 및 효능 평가, 약물 탐색 및 맞춤 의약으로 구분되며, 발달생물학 및 질환 등 생물학 연구분야에 가장 많이 활용될 것으로 예상한다. 생체재료, 조직공학 연구과 함께 혁신적인 기술개발이 이루어지면, 네덜란드 위트레흐트(Utrecht)대 연구팀이 보고한 눈물샘 오가노이드와 같이, 인공장기에 활용이 가능할 것으로 예상한다.
2019년 발달생물학(29%), 약물 탐색 및 맞춤의약(22.9%), 감염 병리학(16.6%), 재생의료(14.4%), 약물 독성 및 효능 평가(12.8%) 순의 시장 점유율은 2027년에는 발달생물학(30.4%), 약물 탐색 및 맞춤의약(25.3%), 감염 병리학(15.7%), 재생의료(13%), 약물 독성 및 효능 평가(12.3%) 순으로 시장 점유율을 예상하고 있다.

자료: The Insight Partners, 2021.
[그림 3-7] 오가노이드 활용 분야별 현황 및 전망 (2019∼2027)
오가노이드의 글로벌 시장 규모는 2019년 약 6억 9,000만 달러(약 7,775억 원)에서 연평균 22.1%로 증가하여 2027년 약 34억 2,000만 달러(약 3조 8,000억 원) 규모 전망하고 있다.
현재 글로벌 오가노이드 시장은 크게 미국과 유럽으로 양분되어 있지만 미국이 압도적으로 선도하고 있으며, 향후 특히 아시아 시장의 성장이 기대되고 있다. 오가노이드 시장 분석결과 긍정적인 요소로 정밀의료, 종양 모델링, 실험동물 대체 수요 등이 있으며, 부정적인 요소로 오가노이드 작업환경 인프라 구축과 인력 부족이 있다.
(단위: 백만 달러)

자료: The Insight Partners, 2021.
[그림 3-8] 글로벌 오가노이드 시장전망 (2019~2027)
(2) 첨단바이오의약품으로서 재생의료 제품 개발에 대한 혁신적 규제개선
(가) 재생의료 제품 관련 규제개선
주요 각국은 새로운 규제 시스템 정비를 통해 신의료기술을 통해 얻어지는 성과를 조기 상용화하기 위한 방안으로 재생의료 분야 연구의 체계적 지원을 위한 대대적인 제도 및 법률적 정비를 진행하고 있다.
세포치료제, 유전자치료제 및 조직공학 치료제로 대표되는 첨단바이오의약품은 크게 구분하여 신속심사와 조기승인을 통해 상용화되고 있으며 이러한 제도의 개선은 기존의 의약품의 심사기준과눈 부합되지 않는 인허가 절차를 획기적으로 개선하는 것이다.
미국의 경우 21st Century Cures Act 제정을 통해 재생의료 제품 개발 및 승인 관련 규제개혁을 포함하는 법률안을 발효(2016.12.)하여 시행하고 있으며, 유럽의 경우 희귀난치성 질환에 대한 미충족의학적 수요를 해결하고 신속한 첨단바이오의약품 개발 및 신속 승인을 촉진하기 위한 지원제도(PRIME: PRIority MEdicine)를 신설하여 운영하고 있다.
일본은 재생의료기술개발 및 상용화를 위해 여타 선진국에 앞서 가장 획기적인 제도 및 법률적 기반을 마련하여 시행하고 있는 상황이다. 재생의료 상업화 절차의 간소화와 연구개발 촉진을 위한 R&D 전담기관을 운영하고 있고, 특히 재생의료추진법 및 재생의료안전확보법의 입법을 통해 연구개발과 실용화를 전면적으로 지원할 수 있는 근거마련과 동시에 재생의료의 안전성을 담보하기 위한 실시계획의 승인 경로를 체계화하여 운영 중이다.
반면, 우리나라의 경우 2005년 제정된 생명윤리 및 안전에 관한 법률에 근거하여 세포치료제 개발 및 정부 지원의 당위성을 확보하고 있으나 급속히 발전하는 기술적 진보에 대응하는 데 한계를 가지고 있다. 최근 기존의 의약품 개발과는 별도의 규제를 통해 재생의료 제품개발 촉진을 위한 ‘첨단의료 및 첨단재생의료법률안’이 입법화되어 관련 기술의 탐색적 임상시험이 확대되어 환자에 더욱 많은 치료 기회의 제공이 가능하게 되었으며 동시에 관련 연구개발의 활성화가 가능하게 되었다.
(나) 재생의료 연구개발의 정부 및 민간투자
재생의료 연구개발은 과학적으로 급속한 발전을 하고 있으나 산업 분야로 연계되기 까지는 많은 장애요인을 가지고 있어 각국에서는 이러한 문제를 극복하기 위한 다양한 노력을 기울이고 있다. 특히 선진국의 경우 유망기술의 발굴과 지원 및 산업화를 위한 전문인력, IP 확보, 투자 등을 지원하는 기관을 국가가 선정하여 운영하고 있다. 대표적으로 산업화 촉진을 위해 캐나다의 CCRM, 영국의 Cell Therapy Catapult, 미국의 CIRM 등이 설립되어 연구개발에서 상용화에 이르는 전주기적 지원 시스템을 운영 중에 있다.
[표 3-8] 국가별 재생의료연구개발 촉진 기관 현황
|
국가 |
미국 |
영국 |
캐나다 |
|
기관명 |
CIRM 2.0 (California Institute for Regenerative Medicine) |
CGTC (The Cell and Gene Therapy Catapult) |
CCRM (Centre for Commercialization of Regenerative Medicine) |
|
목적 |
캘리포니아주 내 줄기세포 관련 연구기반시설에 대한 투자부터 최근 중개 임상연구까지 지원 |
영국을 세포치료제(cell therapy) 분야에 있어서 제조부터 상업화까지 총괄, 글로벌 리더로 육성 |
지식과 최첨단의 과학적 발견들을 시장 출시를 위한 상업화 제품으로 전환하기 위함 |
|
설립 |
2015년(2.0) |
2012년 |
2011년 |
|
지원 규모* |
2020년까지 $ 890million (약 1조 78억 원) |
2018년 3월까지 £ 70million (약 1,042억 원) 확보 |
2011년∼2017년 동안 $15million (약 169억 원) 투자 |
|
연구 및 산업화 추진 및 지원 |
-Accelerating Center, Translating Center 설립 예정 -기초연구 중심에서 임상연구에 대한 비중이 높아짐 |
공동 연구기관- UK stem cell initiative(UKSCI), MRC (Medical Research Council), BBSRC(Biotechnology and Biological Sciences Research Council) |
45개 회사와 산업 컨소시엄 구축 |
|
비고 |
-Alpha Stem Cell Clinic** : 2013년 시작되었으며, 환자에게 안전하고, 효과적으로 접근 가능한 치료 기회 제공 및 치료법을 확립하기 위한 통합 임상연구 인프라 및 지원 역할 수행 -총 예산에서 임상연구비중이 50%를 차지함 |
-연구자, 연구기관과 네트워크 -비임상/임상시험 지원 -투자연결 -제품개발 및 기업설립 -보건경제성․시장조사 -제품개발 및 기업설립 ※ (기업설립)CAR-T세포 치료제 개발 위한 신생기업 Chimeric Therapeutics Ltd 설립 |
-임상 지원 -기술 및 IP확보 플랫폼 구축 -GMP 시설 보유 및 운영 -기술 및 상업화 전략 수행 -투자자-스타트업 기업 연계 시스템 마련/창업 지원 -학-산 컨소시엄 구축 -투자네트워크 구축 -기술개발․평가/사업화 컨설팅 -제조 솔루션 개발 |
* 원화환산기준:1달러($)는 1,133원, 1파운드(£)는 1,489원으로 환산(2017.10.기준)
** http://stemcellstm.alphamedpress.org/site/misc/PerspectiveTrounson.xhtml
자료: 줄기세포 재생의료 분야 국내외 R&D 투자 동향, GSRAC report, 2016.12.
일본의 경우 2012년 신야 교수의 노벨상 수상을 기점으로 줄기세포 연구개발의 혁신과 실용화를 가속화하기 위해 부처간 협력강화, 연구프로젝트 및 예산 등의 연계 및 집중화를 도모하기 위해 2015년 일본의료연구개발기구(AMED)를 설립하여 적극 지원하고 있다. 의료분야 R&D 예산관리 및 기초연구에서 실용화 지원, 규제 혁신 등에 범정부적 집중을 위해 각 부처의 예산을 통합하여 연구와 기업에 분배하고 있다. 특히 역분화줄기세포 연구지원을 위한 예산을 약 10억 달러를 보유하고 있으며, 교토대를 중심으로 4대 거점 기관을 선정하여 총 439억 엔(약 4,900억 원)을 투자하는 등 기술개발에 필요한 거의 모든 지원을 진행하고 있다.
[표 3-9] 일본의 의료분야 연구개발 (2015)
(단위: 억 엔)
|
구분 |
주요 전략 |
예산 |
주요 사업 |
|
의약품/ 의료기기 개발 |
All-Japan 의약품창출 |
211 |
∙ 생명과학 연구지원 기반사업 ∙ 최첨단 기반개발연구 ∙ 임상응용기반연구 ∙ 희귀질환 치료제 개발지원 ∙ 혁신적 바이오의약품 개발기반기술개발 사업 |
|
All-Japan 의료기기 개발 |
145 |
∙ 첨단 계측 분석기술․기기개발 프로그램 ∙ 미래의료를 실현하는 의료기기․시스템 연구개발사업 ∙ 의공연계 사업화 추진 사업 ∙ 국산 의료기기 개발촉진 기반정비사업 ∙ 심사의 신속화․질의 향상 및 안전대책 강화 |
|
|
세계 최첨단 의료 실현 |
재생의료 실현화 고속도로 구상 |
143 |
∙ 재생의료 실현화 거점 네트워크 프로그램 ∙ 재생의료 실용화 연구사업 ∙ 재생의료 실용화 연구실시 거점 정비사업 |
|
질병 극복을 위한 유전체 의료 실현화 프로젝트 |
59 |
∙ 맞춤의료 실현 프로그램 ∙ 토호쿠 메디컬․메가뱅크 계획 ∙ 메디컬게놈 센터 |
|
|
임상연구 /임상시험 |
혁신적 의료기술 창출 거점 프로젝트 |
106 |
∙ 임상연구 가속화 네트워크 프로그램 ∙ 임상연구 중심병원 정비사업 |
|
질병 영역 |
Japan Cancer Research 프로젝트 |
162 |
∙ 차세대 암연구 우수성과 전략적 육성 프로그램 ∙ 혁신적 암 의료 실용화 연구사업 ∙ 암 조기진단․치료를 위한 의료기기 개발 |
|
뇌영역 건강대국 실현 프로젝트 |
68 |
∙ 분자 이미징 연구전략 추진 프로그램 ∙ 뇌영상․임상․IT 융합에 의한 알츠하이머 조기진단 실현 ∙ 인지증 연구개발 사업 ∙ 뇌과학 연구전략 추진 프로그램 ∙ 혁신적 기술에 의한 뇌기능 네트워크 전체해석 프로젝트 |
|
|
신흥 재생 감염병 제어 프로젝트 |
41 |
∙ 감염병 국제연구 네트워크 추진 프로그램 ∙ 신종 인플루엔자 등 감염병 연구사업 |
|
|
난치병 극복 프로젝트 |
96 |
∙ 난치병 극복 연구사업 ∙ 질환 특이적 iPS세포에서 분화 유도된 세포를 이용한 치료법 개발 연구 ∙ 질환 특이적 iPS세포를 활용한 난치병 연구 |
출처:http://scienceadvice.ca/uploads/eng/assessmentspublicationsnewsreleases/regenmed/regenmed_fullreport_en.pdf
http://www.asahi.com/articles/ASJDB2JH3JDBUBQU005.html
한편, 우리나라의 경우 2006년 줄기세포 종합추진계획 수립을 기점으로 본격적으로 체계적인 연구지원이 강화되어 왔으며 특히 2012년에 정부의 관련 예산 규모를 연간 1,004억 규모로 확대하면서 연구개발 촉진을 추진하고 있다. 정부 지원에 힘입어 4건의 세포치료제의 개발이 성공적으로 이루어져 관련 분야의 세계적 경쟁력을 확보할 수 있었으며 지속적인 세포치료제 개발을 통해 임상시험 건수도 지속해서 증가하는 상황이다. 그런데도 재생의료분야의 R&D 예산규모는 미국의 1/20, 일본의 1/3 수준으로 여전히 상대적으로 낮은 수준에 머무르는 상황이다.
나. 해외 동향
글로벌 첨단재생의료 시장은 예측기관에 따라 다소 상이하나 지속적으로 15% 이상의 연간 성장률을 나타내는 초고속 산업으로 발전할 것으로 예측된다. 2014년부터 2026년까지는 대부분 줄기세포 치료제가 주류를 차지할 것이나 조직공학치료제와 유전자 치료제의 경우는 연평균 성장률에서 더 높을 것으로 예상하고 있다.
뿐만 아니라 재생의료 산업은 관련 유관산업으로의 파급효과 커서 세포치료제 연구에서 요구되는 각종 배지를 포함한 기반 산업 역시 동시에 급속히 성장하는 추세이다. 전 세계적으로 줄기세포를 포함하는 세포체 배양시장 규모는 인간세포만 하더라도 2014년
[표 3-10] 세계 연도별 재생의료 시장현황 및 전망(2014∼2026)
(단위: 억 달러)
|
구분 (시장점유율) |
연도 |
연평균 성장률 |
||||||
|
’14년 |
’16년 |
’18년 |
’20년 |
’22년 |
’24년 |
’26년 |
||
|
줄기세포 치료제 |
36 (80%) |
45 |
63 |
85 (70.4%) |
114 |
155 |
194 (63%) |
15.0% |
|
조직공학치료제 |
9 (19.8%) |
12 |
18 |
27 (22.6%) |
41 |
61 |
93 (30.2%) |
21.5% |
|
유전자치료제 |
0.08 (0.2%) |
1 |
2 |
8 (7.1%) |
15 |
18 |
21 (6.8%) |
60.0% |
|
계 |
45 |
58 |
83 |
120 |
170 |
234 |
308 |
17.3% |
자료: Translational Regenerative Medicine: Market Prospects 2014~2026(Visiongain, 2016), GSRAC 재가공.

자료: Translational Regenerative Medicine: Market Prospects 2014-2026(Visiongain, 2016), GSRAC 재가공.
[그림 3-9] 세계 지역별 재생의료 시장현황 및 전망 (2014∼2026)
63억 달러에서 2020년 172억 달러로 연평균 18.7%의 고성장을 나타낼 것이며 특히 아시아 지역은 연평균 23.1%의 고성장을 나타낼 것으로 예측되고 있다.
이 밖에도 2015년 기준 소모성 물품(consumables)은 72억 달러, 장비 20억 달러 및 기기 5억 달러의 시장이 형성되어 있는 것으로 알려져 있다.9)
다. 국내 현황
(1) 국내 세포체 관련 시장전망
국내 재생의료를 포함하는 세포체 시장은 2014년 약 3,200만 달러로 세계 시장의 0.7%를 차지하나 이후 연평균 20.4%로 성장하여 2026년에는 약 3억 2,400만 달러(세계점유율 1.0%)에 이를 것으로 전망된다.
(단위: 백만 달러)

[그림 3-10] 연도별 국내 세포체 관련 시장규모 (2014~2026)
[표 3-11] 국내 세포체 시장예측
(단위: 백만 달러)
|
구분 |
2014년 |
2016년 |
2018년 |
2020년 |
2022년 |
2024년 |
2026년 |
연평균 성장률 |
|
세계 시장 |
4,556 |
5,847 |
8,373 |
12,091 |
17,046 |
23,470 |
30,862 |
17.3% (2014~2026) |
|
국내 시장 |
32 |
51 |
73 |
106 |
154 |
223 |
324 |
20.4% (2014~2026) |
|
점유율 |
0.7% |
0.9% |
0.9% |
0.9% |
0.9% |
1.0% |
1.0% |
|
자료 1: Translational Regenerative Medicine: Market Prospects 2014~2026(Visiongain, 2016).
자료 2: 금융감독원 & GSRAC 조사
(2) 국내 세포체 기술현황
국내 세포체 연구개발 기업은 대다수가 중소 벤처기업이며 기술 대부분이 연골 혹은 피부재생 치료제에 집중되고 있다. 최근 항암 면역세포치료제 개발 성과가 두드러지고 있는데 1세대 항암 면역세포치료제로 크레아젠사가 개발한 수지상세포치료제, 이노셀사가 개발한 간암 자가활성 T-림프구 치료제 등이 상업화에 성공하였으며 최근에는 NK 세포치료제, CAR-T 세포치료제 등이 개발 중이다.
(3) 국내 세포체 연구의 국가 경쟁력 수준
줄기세포/재생의료 기술경쟁력 및 연구자 네트워크 분석에 의하면 특허와 논문을 기준으로 재생의료 기술경쟁력을 분석한 결과 미국이 가장 경쟁력이 앞서고 있는 것으로 나타났으며 우리나라는 특허와 논문지수 모두 8위 정도의 기술경쟁력을 가진 것으로 조사되었다.

[그림 3-11] 세계 각국의 줄기세포/재생의료 논문지수

자료: 줄기세포/재생의료 기술경쟁력 및 연구자 네트워크 분석(GSRAC, 2016).
[그림 3-12] 세계 각국의 줄기세포/재생의료 특허지수
[표 3-12] 줄기세포/재생의료 분야의 특허 및 논문 기반 경쟁력 순위
|
구분 |
미국 |
영국 |
일본 |
독일 |
캐나다 |
프랑스 |
호주 |
한국 |
|||||||||
|
특허 |
논문 |
특허 |
논문 |
특허 |
논문 |
특허 |
논문 |
특허 |
논문 |
특허 |
논문 |
특허 |
논문 |
특허 |
논문 |
||
|
성체줄기 세포 |
점수 |
100 |
100 |
30 |
28 |
22 |
48 |
53 |
42 |
15 |
45 |
24 |
29 |
15 |
38 |
49 |
53 |
|
순위 |
1 |
1 |
4 |
8 |
6 |
3 |
2 |
5 |
7 |
4 |
5 |
7 |
7 |
6 |
3 |
2 |
|
|
배아줄기 세포 |
점수 |
100 |
100 |
50 |
80 |
30 |
54 |
42 |
24 |
17 |
41 |
13 |
25 |
13 |
49 |
15 |
7 |
|
순위 |
1 |
1 |
2 |
2 |
4 |
3 |
3 |
7 |
5 |
5 |
7 |
6 |
7 |
4 |
6 |
8 |
|
|
iPSc |
점수 |
85 |
100 |
10 |
35 |
100 |
95 |
74 |
43 |
0 |
10 |
22 |
0 |
0 |
23 |
26 |
22 |
|
순위 |
2 |
1 |
6 |
4 |
1 |
2 |
3 |
3 |
7 |
7 |
5 |
8 |
7 |
5 |
4 |
6 |
|
|
유전자+ 세포치료 |
점수 |
100 |
100 |
38 |
0 |
6 |
51 |
11 |
53 |
69 |
60 |
45 |
59 |
59 |
48 |
8 |
40 |
|
순위 |
1 |
1 |
5 |
8 |
8 |
5 |
6 |
4 |
2 |
2 |
4 |
3 |
3 |
6 |
7 |
7 |
|
|
내재성 줄기세포 |
점수 |
100 |
100 |
0 |
57 |
0 |
23 |
50 |
31 |
38 |
86 |
0 |
32 |
0 |
45 |
0 |
10 |
|
순위 |
1 |
1 |
4 |
3 |
4 |
7 |
2 |
6 |
3 |
2 |
4 |
5 |
4 |
4 |
4 |
8 |
|
|
조직공학 |
점수 |
100 |
100 |
48 |
45 |
33 |
61 |
37 |
39 |
18 |
48 |
60 |
21 |
89 |
38 |
19 |
45 |
|
순위 |
1 |
1 |
4 |
4 |
6 |
2 |
5 |
6 |
8 |
3 |
3 |
8 |
2 |
7 |
7 |
5 |
|
|
신약개발 |
점수 |
100 |
100 |
0 |
84 |
14 |
27 |
0 |
59 |
64 |
49 |
0 |
17 |
0 |
15 |
0 |
1 |
|
순위 |
1 |
1 |
4 |
2 |
3 |
5 |
4 |
3 |
2 |
4 |
4 |
6 |
4 |
7 |
4 |
8 |
|
|
실용화 공통기술 |
점수 |
100 |
100 |
34 |
50 |
20 |
5 |
27 |
51 |
62 |
50 |
59 |
58 |
50 |
55 |
- |
23 |
|
순위 |
1 |
1 |
5 |
6 |
7 |
8 |
6 |
4 |
2 |
5 |
3 |
2 |
4 |
3 |
8 |
7 |
|
|
질환 치료제 |
점수 |
100 |
100 |
32 |
60 |
38 |
29 |
72 |
56 |
67 |
58 |
65 |
52 |
37 |
36 |
22 |
0 |
|
순위 |
1 |
1 |
7 |
2 |
5 |
7 |
2 |
4 |
3 |
3 |
4 |
5 |
6 |
6 |
8 |
8 |
|
|
점수 평균 |
98.3 |
100 |
26.9 |
54.7 |
29.2 |
40.6 |
40.7 |
41.3 |
38.9 |
48.4 |
32 |
31.3 |
29.2 |
35.3 |
15.4 |
18 |
|
|
종합순위 |
1 |
1 |
7 |
2 |
5~6 |
5 |
2 |
4 |
3 |
3 |
4 |
7 |
5~6 |
6 |
8 |
8 |
|
자료: 줄기세포/재생의료 기술경쟁력 및 연구자 네트워크 분석(GSRAC, 2016).
(4) 세포체 연구개발을 위한 인프라 구축 및 운영
우리나라는 2015년 바이오․헬스 미래 신산업 육성전략을 통해 투자 생산성 및 실용화 촉진을 위한 인프라 구축을 제시하였고 그 결과 복지부는 2016년 질병관리본부 내에 줄기세포재생센터를 건립하였다. 줄기세포재생센터에는 세포치료제 의약품 생산시설(GMP) 및 품질평가 기반시설 등을 확보하고 있으며 국가줄기세포은행과 연계하여 첨단재생의료 중개연구의 임상연구 및 사업화 촉진을 위한 인프라를 제공하고 있다.
라. 발전 과제
줄기세포로 대별되는 세포체 연구는 단순히 학문적 연구에 그치는 것이 아니라 실제 난치 및 희귀질환으로 고통 받는 환자의 근원적 치료방법을 제시할 수 있을 것으로 기대되는 재생의료 분야의 핵심연구이다. 이미 2000년 초기부터 거의 모든 국가에서 중점연구개발 분야로 지정하여 다양한 형태의 연구투자와 지원을 해오고 있다.
우리나라 역시 줄기세포발전 종합계획 수립을 통해 체계적이고 종합적인 연구개발 촉진을 진행해오고 있으나 아직은 타 선진국에 비해 상대적으로 연구투자가 부족한 면이 있다. 그럼에도 불구하고 세계 최초의 세포치료제 개발을 포함하여 5건의 치료제 개발을 통해 나름대로 세계 선도적 위치를 점하고 있어 향후의 추가적인 발전 가능성을 높이고 있다고 할 수 있다. 다만 새로운 의약품으로서 세포치료제, 유전자치료제 및 조직공학치료제는 첨단학문연구 성과를 포함하고 있고 기존의 합성의약품 등과 같은 의약품개발 과정과는 다소 다른 점이 있어 실제 의약품으로 개발하는데 상당한 문제점을 내포하고 있고 이 중 가장 문제가 되는 것이 인허가 절차이다.
이를 위해 각국은 신속한 연구개발, 조기 임상진입 및 상용화 실현을 위한 혁신적인 제도개선을 위한 법률적 제도적 정비를 추진하는 상황이다. 우리나라 역시 이를 위한 적극적 노력이 필요할 것이다.
줄기세포를 포함하는 세포체 연구는 단순히 환자의 치료를 위한 세포치료제 또는 치료기술 개발에만 활용하는 것이 아니다. 최근 신약개발 과정에서 요구되는 독성평가 기술을 기본의 암세포 혹은 동물을 대상으로 하는 시스템을 인간 줄기세포 유래의 특정 세포를 이용하여 더욱 정교한 독성평가 시스템을 적용하려는 노력이 진행되고 있고 나아가 줄기세포를 활용한 약품의 적응증 확대 및 후보물질 개발 등의 연구에 적극적으로 활용하고 있는 상황이다. 또한 기존의 2D 상태의 세포연구에서 바이오프린팅 등의 기술을 접목한 3D, 4D 형태의 인공조직 및 장기 유사체라고 할 수 있는 다양한 오가노이드 연구가 활발히 진행되고 있고 실제 20여 종의 인간 조직 혹은 장기 유사체가 개발되고 있는 상황으로 이를 활용한 인간 발생기전의 이해, 약물의 대사연구 및 독성평가 등 매우 다양한 분야에서 활용될 것으로 예측되고 있다.
이처럼 줄기세포와 같은 세포체 연구는 그 연구영역의 다양성이 매우 확대될 것이며, 나아가 새로운 사업군으로 발전할 것으로 예측된다. 아직 국내 연구개발의 인력 및 인프라가 선진국에 비해 다소 부족하고 상용화를 위한 기업들의 영세성이 존재하지만, 여전히 세계적 경쟁력을 확보할 수 있는 충분한 역량을 갖추고 있다고 볼 수 있다. 도약기를 벗어나 성장기에 이를 것으로 예측되는 세포체 연구에 대한 정부 차원의 중장기적 육성방안의 구축과 다른 국가에서 성공적으로 추진하는 혁신적 제도 개혁 등에 더욱 노력을 기울여야 한다.
4. 대사체
가. 개요
대사체학은 genomics, transcriptomics 및 proteomics와 같은 다른 omics와 관련하여 발생하는 지식 분야이다. 이 학문은 대사산물의 성능을 이해하고, 이를 식별하고, 정량화하여 그 작용 메커니즘을 이해하려고 한다. 이 새로운 오믹스 분야는 비침습적 특성과 표현형과의 밀접한 관계로 인해 높은 잠재력을 보여준다.
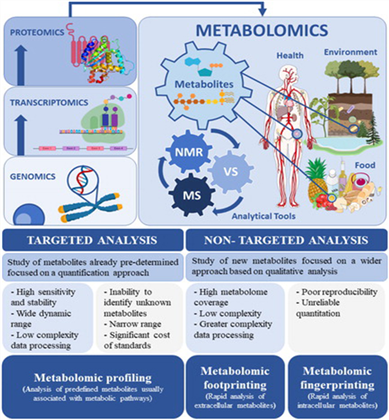
자료: Critical Reviews in Analytical Chemistry, 2020.
[그림 3-13] Metabolomics 방법에 속한 표적 분석과 비표적 분석의 장단점
근본적으로 핵자기 공명, 질량 분석법 및 진동 분석법 또는 여러 기술의 조합을 연구하기 위해 여러 기술이 개발되었다. 이러한 기술은 대사산물의 분리, 검출, 특성화 및 정량화와 관련 대사 경로에 대한 구조와 기능을 설명하는 데 중점을 둔다.
NMR은 새로운 화합물을 식별하고 구조를 밝히기 위해 주로 사용되며, MS는 다양성, 분리 기술과의 결합 용이성 및 높은 감도를 필요로 하는 방법에 주로 이용된다. 또한, VS는 비파괴적인 특성으로 인해 현장 연구에 널리 사용된다.
분석기술의 발전과 대사 과정의 이해도를 높일 수 있는 다른 omics와의 조합으로 인해 다양한 과학 분야에서 metabolomics 응용 분야가 매년 증가하고 있다. 대사체학의 모든 가능성을 계속 활용하려면 분석 도구의 추가 개발이 필요하다.
나. 해외 연구 동향
(1) Clinical metabolomics 분야
이탈리아의 Mario Aimetti 교수팀은 빠르고, 정확한 비침습적 샘플인 타액을 사용하여 치주염을 조기진단하고자 비표적 대사체학 과정을 사용하여 치주염 환자들의 대사경로 차이를 확인하고, 특히 valine, phenylalanine, isoleucine, tyrosine 과 butyrate가 환자군에서 상향조절되며, 이러한 대사경로의 차이는 염증, 산화적 스트레스와 면역 반응과 관련 있음을 확인했다.

자료: Metabolomics, 2021.
[그림 3-14] 치주염과 관련된 대사 바이오마커 분석
미국의 Roy W.A. Peake 교수팀은 untargeted metabolomics 플랫폼을 사용하여 유전 질환에 대한 임상 진단을 진행했다. untargeted metabolomics 플랫폼은 IEM(Inborn Errors of Metabolism)과 관련된 대부분의 진단 화합물을 성공적으로 감지하였고 이 방법을 사용하여 비특이적 표현형을 가진 환자의 유전자에서 사용할 수 있는 validation tool로의 가능성을 확인했다.


자료: Scientific Reports, 2020.
[그림 3-15] 임상 유용성 연구에서 비표적 대사체학의 진단 성능
스페인의 Coral Barbas 교수팀은 암의 새로운 치료 표적을 위한 personalized 의학 방법을 질량 분석학 기반의 단백질체학 및 대사체학을 통한 유전 정보로 완성하고자 했으며, 이는 종양 생물학에 대한 심층적인 이해가 필요하다. 특히, 단백질은 단백질-단백질 상호작용 때문에 변형될 수 있으며, 이는 신호 전달 또는 분자 수송을 포함한 여러 세포 과정에서 중요하다. 또한, 단백질의 변형은 특히 종양 질환에서 세포의 단백질 기능에 상당한 영향을 미칠 수 있다. 대사체는 우리의 생활 방식(식이 요법, 신체 활동 또는 약물)과 밀접한 관련이 있고, 대사산물은 전체 대사체의 측정을 어렵게 만드는 다양한 물리 화학적 특성이 있으므로, 완전한 대사체를 측정할 수 있는 단일 분석 도구의 필요성이 대두된다. 이 연구를 통해 질량분석학 기반 임상 proteomics 및 metabolomics의 기술적 측면을 확인했다.

자료: BBA-Molecular Basis of Disease, 2020.
[그림 3-16] 질량분석학 기반 임상 proteomics 및 metabolomics 연구의 과제
이란의 Masoud Yavarmanesh 교수팀은 인간의 신진대사에 영향을 미칠 수 있는 위장 장애인 과민성 대장 증후군에 대한 대사변화를 확인하고, 과민성 대장 증후군 환자의 혈청, 소변 및 대변 샘플에 대한 공생 생물 개입의 대사 효과를 조사했다. 과민성 대장 증후군 환자와 대조군 사이에 혈청 및 소변 대사산물 농도의 차이가 있음을 확인했고, 이는 환자군 그룹의 탄소 1대 대사의 변화로 설명된다.

주) 과민성 대장 증후군 환자 및 대조군의 혈청 homocystein 농도 및 과민성 대장 증후군 환자의 장내 미세 염증 가능성을 확인하고자, 대변내의 calprotectin 농도 비교.
자료: European Journal of Nutrition, 2019.
[그림 3-17] 과민성 대장 증후군에 대한 대사변화 확인
중국의 Haitao Lu 교수팀은 복잡하고 잠복적인 병인으로 인해 사망률이 높은 가장 공격적인 악성 종양 중 하나인 췌장암의 조기 진단 방법 및 향상된 치료 결과를 위하여 췌장암 환자의 혈장 샘플에서 대사산물 바이오마커를 식별하고 검증했다. 이러한 결과로, creatine, inosine, beta-sitosterol, sphinganine, glycocholic acid의 새로운 다섯 가지 대사산물 바이오마커를 확인했다. 더불어 췌장암의 진행 및 전이를 정확하고 민감하게 진단할 수 있는 대사산물 바이오마커를 식별했고, 이는 임상 사망률을 크게 낮춤으로써 췌장암 환자의 5년 생존율을 향상시킬 수 있음을 확인했다.

주) 5개의 잠재적 대사산물 바이오마커. 임상 환경에서 췌장암을 진단할 수 있는 능력을 갖추고 있으며, 췌장암 환자의 조직 및 혈장 샘플 모두에서 일치하는 변화 패턴을 보임.
PCT: 췌장암 조직
ANT: 인접한 비 암성 조직
자료: Pharmacological Research. 2020.
[그림 3-18] 췌장암 환자의 혈장샘플에서 대사산물 바이오마커 확인
(2) Lipidomics 분야
중국의 Jungang Xie 박사팀은 천식 환자에서 순환하는 글리세롤 인지질 대사산물을 특성화하고 지질 대사산물을 기반으로 조기 및 정확한 진단을 위한 신뢰할 수 있는 바이오마커를 개발했다.

자료: Clinica Chimica Acta, 2021.
[그림 3-19] 유의한 대사산물의 대사 경로 분석
호주의 Peter J. Meikle 교수팀은 성 관련 차이가 분명한 비만 및 관련 대사 질환에서 성별에 따라 나누어 지질 분석을 진행한 결과, 다양한 지질 차이가 있음을 검증하였고, 지질 대사에 대한 나이와 성별의 영향이 있음을 확인했다. 그 결과, 나이 및 성별에 따라 지질 대사의 차이가 있으며, 이는 질병 위험 관련 바이오마커 식별에서 중요함을 발견했다.

자료: Plos Biology, 2020.
[그림 3-20] 성별과 혈장 지질 등급 및 종 간의 연관성 검증
중국의 Wen Tan 교수팀은 비정상적인 지질 대사와 밀접한 관련이 있는 알츠하이머 질환에서의 초기 발달 및 변화하는 지질 바이오마커의 패널을 도출했다. 또한, 이 질병에서는 다양한 지질 종의 유의한 변화가 있는 것을 확인했으며 이는 초기 알츠하이머 진단을 위한 지질 바이오마커 개발의 가능성을 높이는 결과로 판단된다.

자료: Scientific Reports, 2020.
[그림 3-21] 생후 2,3,7개월의 초기 알츠하이머 마우스에서의 비정상 지질 대사 산물의 흐름
중국의 Yan-ming Wei 교수팀은 비표적 지질체학 전략을 사용하여 DHD(Dampness-Heat Diarrhea)의 작용 메커니즘을 확인했다. 한의학 제제인 PD(Pulsatilla Decoction)는 DHD의 임상 증상과 징후를 개선했으며, 총 42개의 지질 대사의 차별성을 다변량 통계 분석을 통해 검증했다. DHD는 glycerophospholipid metabolism, arachidonic acid metabolism, sphingolipid metabolism의 유의한 차이를 나타냈다. 또한, PD 치료 후 지질학적 프로파일은 정상인과 비교하여 회복되는 경향을 보였으며 glycerophospholipid 대사는 PD를 이용한 DHD 치료에 중요한 역할을 할 수 있음을 발견했다.

자료: Frontiers in Pharmacology, 2020.
[그림 3-22] PD 치료에 따른 DHD에서의 지질 바이오마커와 관련된 possible metabolic pathway maps
호주의 Michelle M. Hill 박사팀은 악성 형질 세포의 클론 확장을 특징으로 하는 혈액 악성 종양인 다발성 골수종(MM) 환자의 형질 세포에서 동시 지질체학 및 단백질체학 분석을 통해, 제한된 수의 환자 샘플에 적용했고, 재발성 MM 환자에서 phosphatidyl choline의 상당한 하향 조절을 확인했다.

자료: Plos One, 2020.
[그림 3-23] 다발성 골수종 환자에서의 관련된 지질 대사 경로 네트워크
(3) Microbial 분야
미국의 Erica M. Forsberg 교수팀은 비표적 질량 분석법 기반 대사체학 데이터를 사용하여 단순한 포도당 탄소원의 존재 하에서 자란 인간 공생 박테리아 Citrobacter Sedlakii에서 생성된 대사체 질량을 확인했다. 이 방법을 통해 더 정확한 대사 모델을 생성하기 위한 gap-filling algorithms을 개선하고, 대사산물을 식별할 수 있었다.

주) MS-FBA 프로그램을 사용한 3D 그래픽 출력. 이는 PyFBA 예측 대사 산물 목록간의 잠재적인 대사산물 일치도를 확인할 수 있다.
자료: Metabolites, 2020.
[그림 3-24] 비표적 질량 분석법 기반 대사체학 데이터 사용하여 대사체 질량 확인
말레이시아의 Ai Huey Tan 박사팀은 파킨슨병에서의 분변 미생물군 전체와 대사체 임상적 관련성을 확인했다. 특히, 추정 신경 보호 효과가 있는 생리 활성 분자(short chain fatty acids, ubiquinones, salicylate)의 유의한 차이를 발견했다. 장내 미생물 기능은 파킨슨병 환자에서 차이를 보이며, 이들의 임상적 관련성은 파킨슨병의 새로운 바이오마커 및 치료제 개발을 위한 잠재적인 표적으로서의 미생물 대사산물 역할을 뒷받침한다.

자료: Annals of Neurology, 2021.
[그림 3-25] 파킨슨병과 대조군 사이에 차별적으로 확인할 수 있는 미생물 및 대사체 기능
미국의 Santanu Banerjee 교수팀은 조기 발견이 쉽지 않은 췌관 선암에 대한 위험이 높은 환자에게 유용할 수 있는 도구 중 하나로 장내 미생물 군 전체와 그 대사 보완물을 확인했다. 췌관 선암의 초기 단계에서 장내 미생물총 중 proteobacterial 및 firmicutes 우세를 확인했고, 변경된 미생물 식물군 내에서 활성 대사 경로 재구성 시, 폴리아민 및 뉴클레오티드 생합성 경로가 증가했다. 종양 형성 초기 단계에서 미생물의 변화와 숙주 종양 형성을 촉진하는 대사산물의 방출 사이에 강한 상관관계가 있음을 확인했으며 이 연구를 통해 췌관 선암의 조기 발견을 위한 잠재적이고 정확한 비침습적 도구를 제공한다.
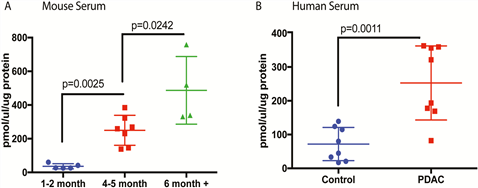
자료: Carcinogenesis, 2020.
[그림 3-26] 췌관 선암 환자 및 KPC 마우스 모델에서의 폴리아민 수치
중국의 Zhaoyu Lu 교수팀은 만성 신장 질환에서의 장내 미생물군에 대한 alpha-ketoacid의 영향을 확인하기 위하여 아데닌 유발 CKD(Chronic Kidney Disease) 쥐 모델에서의 alpha-ketoacid 처리에 대한 장내 미생물 총 및 대사 프로필의 변화를 조사했다. alpha-ketoacid 치료는 혈청 크레아티닌, 혈액 요소 질소 및 24시간 소변 단백질을 감소시켰으며, 아데닌 유발 CKD 쥐에서 세뇨관 위축, 사구체 경화증 및 간질 섬유증을 완화했다. 실험 결과로, alpha-ketoacid는 장내 미생물 군집에 영향을 주어 혈청 대사 프로파일의 조절을 매개할 수 있는 아데인 유발 CKD에 대한 reno-protective 효과를 보임을 확인했다.

자료: Frontiers in Pharmacology, 2021.
[그림 3-27] Alpha
(4) 식품과 식물 분야
독일의 Markus Fischer 교수팀은 비교적 일반적인 농도로 존재하고 외인성 영향을 거의 받지 않는 식물 기반 원료의 관리 대사산물 중 하나인 화이트 아스파라거스(asparagus officinalis)의 기원을 결정하기 위한 진위성 연구를 진행했다. 이 방법은 내부 표준이나 추가 참조 샘플의 측정이 필요하지 않으며, 다른 매트릭스 및 과학적 문제에도 적용할 수 있다.

자료: Journal of Agricultural and Food Chemistry, 2020.
[그림 3-28] Housekeeping 대사산물의 선택
일본의 Toru Takebayashi 교수팀은 식이 노출을 객관적으로 평가하는데 필요한 도구 중 하나인 음식 섭취 바이오마커 역학 및 임상 영양 연구를 진행했다. 습관적인 음식 섭취가 자유로운 일본 지역 인구에서 순환하는 혈장 대사체에 어떤 영향을 미치는지 명확히 하고 잠재적인 음식 섭취 바이오마커를 식별하고자 했다. 비표적 접근 방식으로 모세관 전기영동(capillary electrophoresis) 질량분석법을 사용하였으며, 총 21개의 혈장 대사산물이 9개 식품군의 장기 식품 섭취와 관련 있음을 발견했다.

자료: Plos One, 2021.
[그림 3-29] PLS-R 에 의해 평가된 식품 바이오마커 후보
미국의 Pieter C. Dorrestein 교수팀은 비표적 질량분석법과 분자 네트워킹을 사용하여 발효, 양조 및 숙성과 같은 일반적인 준비 과정에서의 식품 화학적 변화를 확인했다. 제시된 데이터 분석 work-flow는 화학 프로필의 전체적인 변화를 나타내며, 풍부도의 변화를 식별하고, 특정 화학 물질과 그 변형 제품을 식별할 수 있는 식품 화학의 변화를 연구하였고 나아가 요거트, 차, 소고기, 칠면조 및 토마토 샘플에서 시간 기반의 화학적 변화를 확인했다.

자료: Food Chemistry, 2020.
[그림 3-30] 분석된 모든 샘플 간의 분자 관계를 이해하기 위한 Global PCoA 분석
이탈리아의 Veronica M. T. Lattanzio 교수팀은 생물학적 시스템을 조사하기 위한 가장 강력한 대사체학 플랫폼 중 하나인 고분해능 질량분석기와 결합된 액체 크로마토그래피를 사용하여 식물 대사체학 연구를 위한 open-source work-flow를 진행했다. fusarium verticillioides 감염 후 질병 중증도와 관련하여 대조되는 표현형을 가진 두 옥수수 재조합 근친 교배 계통의 대사체학 변화 연구를 진행했으며, 그 결과로 2개의 아미노산(L-tryptophan, tyrosine), 5개의 flavonoids, 3개의 N-hydroxynnamic acid amide를 포함하여 서로 다른 대사 경로에 속하는 대사산물의 변화를 확인했다.

자료: Frontiers in Plant Science, 2020.
[그림 3-31] 각 샘플에서의 LC-HRMS 크로마토그램 사용 후 피크 목록에 대한 주성분 분석의 score scatter plot
다. 국내 연구 동향
한국기초과학지원연구원에서는 조기 면역 글로불린 A 신장 병증에 대한 진단적 또는 예후적 중요성이 있는 소변 대사산물 바이오마커의 식별을 위해 핵자기 공명 기반 대사체 프로파일링을 수행하고, 소변 샘플에서 26개의 대사산물을 확인했다. 그 결과, 요중 글리신 수치는 대조군보다 신장 병증을 가진 환자군에서 더 높았으며, 인간 신장 관 상피 세포에 글리신을 첨가하면 종양 괴사 인자-alpha에 의해 유도된 염증 신호가 개선됨을 확인했다. 이 연구를 통해 소변 글리신이 신장 병증에 대한 진단 및 예후 가치를 가질 수 있으며, 소변 글리신이 이 질병에 대한 보호 바이오마커가 식별됨을 입증하였다.

자료: Journal of Cellular and Molecular Medicine, 2021.
[그림 3-32] 크레아티닌으로 조정된 소변 대사산물 농도를 확인할 수 있는 box plots.
서울대학교에서는 국가간 대두(soybeans)의 무역이 증가함에 따라, 원산지에 대한 고의적인 오기가 전 세계적으로 심각한 문제가 되므로, 대두의 지리적 기원을 예측하기 위해 한국과 중국산 대두에 대한 대사 프로파일링을 핵자기공명분광법과 다변량 통계 분석을 통해 수행했다. 한국 및 중국 북동부, 중부, 남부 지역의 대두를 사용하여 진행하였으며, 이 연구에서 사용된 방법은 향후 연구에서 다양한 지리적 위치에서 대두의 샘플 인증을 위한 필수 정보를 얻는 데 사용될 수 있다.

자료: Foods, 2021.
[그림 3-33] 한국과 중국의 지리적 기원을 구별하기 위해 사용된 OPLS
건국대학교에서는 당뇨병 합병증의 병리 생리학적 특성을 조사하기 위해 당뇨병성 황반부종 및 질병 지속 기간이 15년 이상인 제2형 당뇨병 환자의 혈장 대사산물 차이를 확인했다. 이 결과에서 5가지의 아미노산(아스파라긴, 아스파르트산, 틀루탐산, 시스테인, 리신), 2가지의 유기화합물(시트르산, 요산), 4가지의 옥시립린이 다중비 후보로 확인되었고 이 연구를 통해 멀티 바이오마커가 더 오래된 2형 당뇨병 환자의 당뇨병성 황반부종을 예측하는데 유용할 수 있다는 것을 제안하였다.

주) 당뇨병성 황반부종 및 비-당뇨병성 황반부종 피험자를 포함한 실험 그룹의 대사산물 및 지질 프로파일링에서 파생된 혈장 대사산물을 사용하여 제안된 대사 경로.
자료: Scientific Reports, 2021.
[그림 3-34] 제2형 당뇨병 환자의 혈장 대사산물 차이 확인
연세대학교에서는 나노유동 초고성능 액체 크로마토그래피-전기 분무 이온화-텐덤 질량 분석법을 이용하여 분자량이 다른 스핑고미엘린과 포스파티딜콜린의 정량화 방법을 최적화한 후, 간암, 위암, 폐암 및 대장암 환자의 혈장 샘플을 분석하여 이전에 확인된 후보 지질 바이오마커의 성능을 진행하였다. 그 결과, 보고된 표지자 후보 중 약 73%를 최적화된 방법으로 배정할 수 있어 높은 처리량의 지질 분석을 뒷받침할 수 있음을 확인하였다.

자료: Journal of Chromatography B, 2021.
[그림 3-35] 현재의 방법 및 이전의 방법 간에 얻은 주성분 분석 비교
라. 발전 전망
대사체학 연구는 향후 몇 가지 적용 분야로 크게 발전될 가능성이 있다고 생각한다.
1)시료 수집 시에 적합한 시료 채취 절차 및 시료분석 단계에서의 표준화(standardization)에 대한 정립이 이루어짐
2) 향상된 chemometric analysis를 통해 대용량의 데이터를 단순화하고 상관성을 찾을 수 있는 data mining 기술과 통계기법의 발전이 기대됨
3) 단세포 대사체학(single cell metabolomics)의 확장 및 적용이 관련 하드웨어 및 소프트웨어의 도움으로 달성됨
4) isotopomer metabolomics 활용 metabolic flux 연구는 환경 분야에서의 노출 정도 평가 및 식품 분야에서의 원산지 판별 및 GMO 식품의 위해도 평가 연구 등에 적용 가능성이 커지게 됨
5) 다중도 혼합(multi-omics)연구 관련 기술의 발전이 활발히 이루어질 것으로 판단됨
6)단순히 biomarker를 도출하는 목적이 아닌 생물학적 과정(biological process)을 해결할 수 있는 activity metabolomics의 발전도 기대됨
이렇듯 다양한 대사체학 연구의 발전을 통해 기존의 생물학, 생화학적인 이론에 적용함으로써 질병의 원인 및 기전을 규명함으로써 맞춤의학 발전이 활발해질 전망이고 식품 분야에서 원산지 판별 및 GMO 식품의 위해도 평가 연구 및 미량의 환경유해물질 노출에 의한 질환 연구 등에 적용 가능성이 있다. 또한, metabolic flux 연구는 질병의 원인 규명을 더욱 명확히 설명할 수 있을 것이며, 또한 환경에 노출되었을 경우 유해인자 추적 연구에 활용될 것이다.
5. 시스템생물
가. 개요

자료: Science, 2002, 298, 5594, 763~764.
[그림 3-36] 생물학적 복잡성을 나타내는 피라미드
시스템생물학은 분자 수준에서 유기체 규모에 이르는 생명현상의 메커니즘을 이해하기 위해 실험적 접근과 긴밀하게 상호 연결된 수학적 모델링을 사용하는 연구 분야이다. 이를 위해, 유전체, 전사체, 번역체, 단백질체, 대사체 등의 오믹스 데이터를 바탕으로, 세포 내 구성성분 간의 상호작용을 규명함으로써 생명현상을 개별 구성성분이 아닌 전체 시스템 차원에서 통합적으로 분석하여 전체적인 생명현상을 밝힌다.
시스템생물학 분야는 그 접근방식으로 인해 유망기술을 넘어선 필수 기술로 성장하여 최근에는 미생물, 식물, 환경, 질병 연구, 바이러스, 의학 등 그 적용 범위가 확대되었으며, 앞으로도 필수적인 기술로 자리 잡을 전망이다. 특히 차세대 염기서열분석(next-generation sequencing) 기술의 발달로 천문학적 규모의 빅데이터 생산이 가능해지고 구글의 딥마인드 등과 같은 인공지능-기계학습 기반의 빅데이터 분석이 적용됨에 따라 시스템생물학을 통한 생명연구는 전에 없던 규모와 속도로 세대가 전환되는 순간을 맞이하게 되었다.
나. 해외 동향
Nature 저널은 향후 주목할 기술로 (1) 단일 세포 생물학의 확장(expand single-cell biology), (2) 전사체 분석의 향상(Improve RNA analysis), (3) 인공지능과 딥러닝의 활용(apply AI and deep learning), (4) 마이크로비옴 분석(Decoding the microbiome), (5) 합성유전체와 합성생물학의 진보(advance synthetic genomes) 등의 분야를 선정하였다. 이는 생명연구의 패러다임이 단일 유전자 혹은 단백질 연구에서 벗어나 생명현상 전체를 다양한 오믹스 연구 기법을 통해 통합적으로 이해하는 것으로 변화한 것을 시사하고, 해외 연구 및 산업은 이미 이에 맞추어 빠르게 변화, 진행되고 있다.
(1) 단일 세포 생물학
지난 10년간, 생물학적 분석 기법의 발달로 생명체에 존재하는 단일 세포를 분석하고자 하는 시도는 많이 있었다. 생명체에 존재하는 세포들의 집합(population)을 분석하던 지난 시스템생물학과는 달리 단일 세포 분석은 기능과 특성이 다른 다양한 세포들이 생명체 내에서 어떻게 상호작용하고 어떠한 다양성을 가지고 생명현상에 기여 하는지에 대한 정보를 제공하는 전혀 새로운 패러다임으로 2019년부터 2021년까지 Nature 저널이 선정한 주요 연구 주제로 3년 연속 선정되었다. 특히 단일 세포 생물학은 최근 2년간 단일 세포 분리, 바코드를 이용한 세포 표지, 차세대 염기서열분석 기술의 발전으로 폭발적으로 적용 분야가 확장되어 현재 암생물학, COVID-19, 인간 뇌의 발달 등을 이해하는데 필수적인 기술이 되었다.
2019년 주간 200~300개의 단일 세포를 분석할 수 있던 기술은 10X Genomics 사의 미세유체기기(microfluidic device) 개발을 통해 하루에 수 천 개 수준의 속도로 단일 세포 분석이 가능해졌다. 더불어 단일 세포에서 유전자 발현과 유전체를 관측하기 위하여 scNMT-Seq, CITE-Seq, ASAP-Seq G&T-Seq, CUT&Tag, SHARE-Seq, scRNA-Seq 등의 실험 기술들이 개발되었다. 워싱턴 대학의 Cole Trapnell과 Jay Shendure 연구진은 인간 태아의 500만 개 세포를 각각 분석한 인간 게놈 아틀라스를 발표, 15개 장기를 이루는 세포를 분류, 장기간 다양한 분화과정과 유전자 발현을 분석하였다. 같은 그룹에서 지난 6월에는 실험쥐의 수정란이 발달하는 10일간 140만 개 세포를 분석하여 다양한 세포(혈액, 장기 등)의 분화과정을 규명하고 주요한 역할을 하는 500개의 전사 인자를 발굴하였다.

주) 수천 개 내외의 세포 분석에서 수백만 개의 단일 세포 분석을 통한 종합적 분석으로의 변화를 통한 미세하고 복잡한 상호작용, 생명체 전반에 이르는 현상 규명, 다양성.
자료: Nature 2019, 576, 487~491; Nature Neuroscience 2021, 24, 584~594.
[그림 3-37] 15개 장기를 이루는 세포를 분류하고, 장기간 다양한 분화과정과 유전자 발현 분석
이러한 단일 세포 분석은 전사체, 염색질 메틸체(chromatin methylome), 염색질 열린 정도(chromatin openness), 단일염기다형성(single nucleotide polymorphism) 등의 복잡한 오믹스 빅데이터를 수반하는데, 이를 분석하기 위한 기법 및 소프트웨어에도 큰 진전이 있었다.
2만 개 이상의 유전자로 구성된 멀티오믹스 정보는 인간이 이해할 수 없는 차원의 데이터이기 때문에 일반적으로 차원 축소 기법이라는 기법을 통해 단순화하고, UMAP(Uniform Manifold Approximation and Projection) 기법을 통해 모식화하여 분석하는데, New York Genome Center의 Rahul Satija 교수 연구진은 서로 다른 오믹스 데이터를 통해 제작한 UMAP 지도를 통합 분석하는 소프트웨어인 Seurat10)11)를 개발하였다. 더불어 Harvard Medical School의 Soumya Raychaudhuri 교수 연구진은 서로 다른 오믹스 데이터의 주성분통합 분석 기법인 Harmony를 개발하여 빠른 속도로 축적되는 빅데이터 분석이 가능하게 하였다.12)13)
스탠포드 대학의 Caleb Lareau 교수가 “새로운 분석법과 실험 기법의 도입으로 인해 단일 세포 생물학이 놀라운 속도로 발전하고 있으며, 향후 싱크대 이외의 모든 것을 분석할 것이다.”라고 소개한 것처럼,14) 단일 세포에 대한 시스템생물학 연구로 생명현상 이해의 가속화가 기대되고 있다.

자료: Cell 2021, 184, 3573~3587.e29; Nature Methods 2019, 16, 1289∼1296.
[그림 3-38] 단일 세포 분석을 위한 Seurat(좌측), Harmony(우측) 소프트웨어 분석 알고리즘
(2) 인공지능 및 딥러닝을 통한 전사체 분석의 향상
차세대 염기서열 분석기술의 등장으로 대량의 염기서열 정보가 생산되고 있는데 가장 대규모의 염기서열 데이터 아카이브인 NIH SRA(Sequence Read Archive)에 의하면 지난 10년간 서열 정보는 지수적(exponential)으로 증가하여 2023년 43 PB에 달할 것으로 예상한다고 한다.

자료: NCBI Insights, 2020.7.17.
[그림 3-39] 지난 약 10년간 NIH 산하 Sequence Read Archive(SRA)에 보고된 염기서열 정보 누적량
이렇듯 전사체 해독 결과는 실험의 목적에 따라 연구자에 의해서 분석되고 있지만, 이 과정은 고난도의 생물정보학 분석과 전문가 인력이 요구되어 병목으로 작용하는 한계점이 존재한다. 최근에는 인공지능 및 딥러닝의 발전으로 수많은 RNA-Seq 데이터 분석 연구에 큰 발전이 있었다. 예를 들어, UCSD의 Bernhard Palsson 교수 연구팀은 기존에 존재하는 수백 개 이상의 전사체 해독 결과를 독립 인자 분석(independent component analysis) 기반의 딥러닝 기술을 통해 고차원적으로 분석하고 생명체 내 유전자 조절 단위인 레귤론(regulon)을 분석하는 기법을 개발하였다.15) 생명체 내에서 유전자 발현은 전사 인자(transcription factor)에 의해 조절되는데, 하나의 전사인자에 의해 조절되는 유전자들의 집합인 레귤론은 변화가 동일한 패턴으로 나타난다. 연구진은 이에 착안하여, 수많은 조건에서 반복 수행된 전사체 데이터에서 동일한 패턴으로 변화하는 집합을 인지하는 기계학습(machine learning)을 개발하였으며, 인간의 인지 능력으로는 분석할 수 없었던 조절 단위를 규명하였다.

[그림 3-40] 독립 인자 분석을 통한 92개 대장균 전사 조절 단위 규명 연구
이는 인공지능 기반의 딥러닝 기술이 시스템생물학 분석에 유용할 것이라는 예측에서 나아가 실질적으로 적용 가능함을 증명한 것에 의의가 있다. 이 연구는 지난 10년간 누적된 전사체 해석 정보를 바탕으로 수행되었는데, 단시간에 지난 10년간 밝혀내지 못했던 새로운 사실들을 도출하는 성과로 미루어 보아 미래에는 인공지능 및 빅데이터가 주도하는 연구가 생물학 연구의 주류가 될 수 있음을 시사한다. 이미 고초균(bacillus subtilis), 포도상구균(staphylococcus aureus) 등의 미생물뿐만 아니라 다양한 고등생물에 적용되어 유전자 조절 네트워크 분석에 새로운 돌파구가 될 것으로 촉망받고 있다.16)17)
(3) 마이크로비옴
마이크로바이옴이란 미생물(microbe)과 생태계(biome) 혹은 미생물(microbiota)과 게놈(genome)의 합성어로 한정된 공간(예: 인체) 내 존재하는 미생물을 총칭하는 말이다. 특히 인체 마이크로바이옴은 손가락 지문처럼 각기 다른 마이크로바이옴을 가지고 있으며, 이러한 차이로 의해 알레르기, 아토피, 비만부터 장염, 심장질환에 이르기까지 각종 질환의 발병률이 좌우될 수 있다.

주) 진단(diagnosis): 무세포 종양 DNA(ctDNA)과 함께 암 특이적 미생물 DNA를 바탕으로 진단 시 사용, 예후(prognosis): 장 및 종양 내 마이크로바이옴은 암 환자의 진행도 예측 시 사용(NR, 무반응자, R, 반응자, TME, 종양 미세환경), 치료(therapy): CD47 나노바디(CD47nb)를 생성하는 대장균의 종양 내 주사는 수지상 세포(DC) 식세포 작용, 림프절(LN) 항원(Ag) 제시 및 세포독성 T 림프구(CTL) 활성을 증대시켜 전신 항종양 면역을 생성.
출처: Science, 2021, 371, 1331.
[그림 3-41] 마이크로바이옴이 암 치료에 미치는 영향
최근 10년 동안 차세대 서열분석 기술을 이용하여 전체 마이크로바이옴을 분석하는 기술이 개발되어 마이크로바이옴 연구는 큰 진전을 이루고 있다. 메타게놈(meta-genome) 시퀀싱을 통해 각 시료에 존재하는 종과 그 풍부함을 식별하고, 시료내 대사산물의 프로필을 결합함으로써 특정 대사산물의 수준을 어떤 미생물이 결정하는지 이해할 수 있다. 그뿐만 아니라, 마이크로바이옴과 대사체 데이터를 연결하고 이러한 특징과 복잡한 패턴을 이해하기 위해 기계학습 접근방식 등을 도입하여 간단한 질병-마이크로바이옴 상관관계 분석뿐만 아니라 새로운 미생물 군집에서 대사체를 예측하거나 미생물-대사체 관계를 복구할 수 있는 전략 등을 제시할 수 있다. 이러한 기술적 발전을 토대로, 최근 마이크로바이옴 분석은 암 발생 및 암 치료에서 마이크로바이옴의 중요한 기능들이 새롭게 밝혀지고 있다. 이러한 연구 동향은 미생물의 암 발생/억제 메커니즘, 진단 및 암 발생 조절 전략을 포함한 암에 대한 마이크로바이옴이 중요한 역할을 함을 강조한다.
미국 Rob Knight 교수팀은 33종 1만 481명의 암환자 유전체 데이터를 분석하고 혈액 내 미생물 DNA와 암 연관성을 확인함으로써 혈액 내 미생물을 이용한 암 진단 방법을 제시하였다. 암 환자 시료에서 분석한 마이크로바이옴 DNA 패턴을 기반으로 특정한 암과 미생물종을 연관시키기 위해 기계학습 알고리즘을 적용하였고, 그 결과 미생물 DNA 패턴에 따라 정상인과 암 환자들의 구별뿐만 아니라, 암의 종류(전립선암, 폐암, 피부암)를 구별하였다. 이러한 연구 결과는 마이크로바이옴 정보가 암 진단에 활용될 수 있음을 시사한다.

주) a. 암 종류에 따른 전체 시퀀싱 데이터에 따른 마이크로바이옴 데이터 비율. b. 전체 데이터 처리 과정.
자료: Nature, 2020, 579, 567~574.
[그림 3-42] Cancer Genome Atlas의 암 마이크로바이옴 정보 분석
미국 Ravid Straussman 교수팀은 암 방사선 치료 과정과 같은 방사선 노출에서 살아남은 생쥐는 장내 미생물군에서 독특한 마이크로바이옴 패턴을 발견하였다. 이러한 결과는 소수의 인간 피험자에게서도 유사한 상관관계가 관찰되었는데, 쥐를 대상으로 한 추가 실험에서 일부 박테리아 균주가 높은 수준의 단쇄 지방산(propionate)을 생성하여 염증 반응을 약화시키고 방사선에 의해 방출된 활성 산소 종으로 인한 손상을 완화하는 것을 발견하였다. 추가적인 대사체학 분석은 방사선 생존에서 트립토판 대사 경로(1H-indole-3-carboxaldehyde, kynurenic acid)의 역할을 암시하였다.

주) 프로피온산(Propionate)을 생산하는 장내 미생물(Lachnospiraceae 및 Enterococcaceae)과 트립토판 생산 회로는 조혈 및 장 회복 작용을 통하여 방사선 치료로부터 위장장애를 억제할 수 있다.
자료: Science, 2020, 370, 6516, eaay9097.
[그림 3-43] 마이크로바이옴 및 마이크로바이옴 대사물질을 통한 방사선 차폐
캐나다 Kathy McCoy 교수팀은 어떤 장내 박테리아가 암과 싸우는 우리의 면역체계에 도움을 주는지, 그리고 관련 기작을 증명하였다. 연구팀은 먼저 대장암을 면역요법으로 치료할 때 대장 종양과 관련된 박테리아 종을 식별해 냈다. 이어 무균 실험용 쥐에게 이 특정 박테리아와 함께 면역항암제의 일종인 면역 관문 억제제(immune checkpoint blockade)를 투여한 결과, 특정 박테리아는 면역요법이 작동하는 데 필수 요소임이 밝혀졌다. 특정 박테리아와 면역 관문 억제제를 함께 투여하자 종양이 급격히 줄어든 것으로 나타났으며 이 유익균을 투여하지 않은 실험 쥐에게서는 면역요법이 아무런 효과가 없는 것으로 밝혀졌다. 이 박테리아는 이노신(inosine)이라는 소분자를 생성한다는 사실을 발견하였으며, 이노신은 T세포와 직접 상호작용하고, 면역치료제와 함께 치료 효과를 향상시키며, 경우에 따라 모든 대장암 세포를 파괴함을 확인하였다.
이러한 발견은 방광암과 흑색종에서도 효과가 있음이 입증되었으며, 앞으로 면역 반응을 증폭시키는 데 도움이 되는 면역 항암요법(immunotherapy)이 어떤 경우에는 효과가 있는지 또 어떤 경우에는 효과가 없는지에 대한 새로운 이해를 제시하였다.

주) A: 실험 모식도. 동물들은 anti-CTLA-4, anti-PD-L1, 혹은 대조군을 처리하였다. B-E: 면역 관문 억제제 처리에 따른 암 개수(B), 암 무게(C), EpCAM+ LGR5+ 세포 % (D), 암 세포 내 종양침윤 T세포(TIL:Tumor infiltrating Lymphocyte)(E). F: 16s 분석을 통한 면역 관문 억제제 처리후 장내 미생물 분포 증감 분석. (G) 혐기성 조건 내 암세포 내 존재하는 박테리아 배양 결과.
출처: Science, 2020. 369, 1481~1489.
[그림 3-44] 면역 관문 억제제(Immune checkpoint blockade, ICB) 반응을 촉진시키는 마이크로바이옴 발굴
이스라엘 Gal Markel 및 Ben Boursi 교수팀은 장내 마이크로바이옴의 구성이 암 환자의 면역 치료에 어떠한 영향을 미치는지 확인하기 위해 임상시험 결과를 보고하였다. 본 연구팀들은 악성 흑색종 환자들의 면역 관문 억제제 기반의 면역 치료과정에서 분변미생물군이식(FMT: Fecal Microbiota Transplantation)의 영향을 확인하였다. 그 결과, 장내 미생물의 다양성 분포는 anti PD-1 치료와 CD8+ T세포 활성화, 인터루킨-8 분비하는 골수 유래 면역억제 세포의 감소와 높은 관련성이 있음을 보고하였다. 이러한 연구결과는 FMT가 항암 면역 치료에 적극적으로 활용될 수 있음을 시사한다.

주) A: 임상시험 프로토콜 모식도. FMT 수여자들은 72시간 이전 항생제를 복용하여 기존에 존재하는 마이크로바이옴을 제거하였다. FMT는 캡슐화된 분변을 구강 복용하였다. FMT 유지(mFMT) 및 anti-PD-1은 14일간 6번을 반복하였다. B: 10 명의 수여자에 대한 종양 크기 변화. 공여자 그룹에 따른 수여자들의 색상 표현하였다.
출처: Science, 2021, 371, 602~609.
[그림 3-45] 임상시험 프로토콜 및 FMT와 면역 치료에 따른 환자 암세포 크기 변화
(4) 합성유전체와 합성생물학
차세대 염기서열분석 기술의 발달 이후로 생물학 연구는 전에 없던 속도와 규모로 생명현상을 이해하는 수준에 도달하였다. 이제 생물학 연구는 생명현상의 이해에서 나아가 새로운 생명체를 설계하고 제작하는 합성생물학과 포스트게놈 개념에 도달하였다. 인간게놈 프로젝트를 통해 서열을 해독하고 구성하는 유전자들을 이해하였다면 최근에는 유전체 설계 및 합성 분야에서도 많은 진전이 있었다.
영국 Cambridge 대학의 Jason Chin 교수 연구팀은 화학적으로 합성한 대장균 유전체 조각을 연결하여 인공 대장균을 제작하였다.18) 지난 2016년 J. Craig Venter 연구소의 J. Craig Venter 교수 연구팀에서 배양 가능한 미생물 중 가장 작은 크기의 유전체를 가지는 mycoplasma genitalium 병원균의 유전체(JCVI-syn3.0)를 합성한 바 있지만, 이보다 약 7배 이상 거대한 대장균 유전체를 비교적 빠른 시간안에 합성할 수 있는 기술이 개발되었다는데 의의가 있다.

자료: Nature 2019, 569, 514~518.
[그림 3-46] DNA 조립을 통한 대장균 인공유전체 합성
이러한 DNA 합성 및 유전체 합성 기술을 발전을 바탕으로 이제 human-genome write project라고 불리는 인간의 전장 유전체 합성을 시도하고 있고19) 미래에는 자유롭게 유전체를 합성하는 수준에 도달할 것으로 예상한다.
더불어 Venter 연구소의 J. Craig Venter 교수 연구팀에서는 기존에 제작하였던 최소유전체 미생물인 JCVI-syn3.0의 성장 속도 저해를 보완하기 위하여 19개의 유전자를 복원하여 일반 미생물처럼 빠르게 성장할 수 있는 최적 유전체를 개발하였다.20) 단순히 인공유전체를 합성하는 것이 아니라 합성한 유전체의 단점을 보완하고 여러 가지 유전조작이 가능한 연구로서 의의가 있다.

[그림 3-47] mycoplasma genitalium 인공유전체 JCVI-syn3.0과 이를 보완한 최적 유전체 JCVI
다. 국내 동향
서울대학교와 기초과학연구원(IBS) RNA 연구단에서는 감염상태에서 SARS-CoV-2 RNA에 특이적으로 결합하는 단백질을 찾기 위해 특정 RNA에 결합하는 단백질만을 분리․동정하는 기술을 개발하였다. 그 결과 SARS-CoV-2 RNA에 결합하는 단백질 109개를 모두 찾아냈으며, 다른 코로나바이러스(HCoV-OC43)도 같은 실험 방법을 수행하고 분석한 결과 COVID-19에서 특이적으로 바이러스 증식을 돕는 단백질 8종과 항바이러스 단백질 17종을 발견했다. 예를 들어 숙주세포의 LARP1, SHIFTLESS 단백질은 바이러스의 단백질 생성을 방해하여 바이러스 증식을 막는다. 이 결과는 코로나바이러스 증식에 대한 이해를 확대함과 동시에 COVID-19 특이적인 항바이러스제 개발 가능성을 제공하였음을 시사한다.

자료: Molecular Cell, 2021, 81, 2838-2850.
[그림 3-48] SARS-CoV-2 RNA에 결합하는 단백질 분석결과 및 바이러스 증식 및 항바이러스 단백질 발굴
DGIST와 포항공과대학교에서는 흉선에서 형성되는 3가지 선천성 T세포(자연살해 T세포, 감마델타 T세포, MAIT)들이 어떻게 각 성숙과정을 거치는지 단일 세포 RNA 시퀀싱을 통하여 분석하였다. 선천성 T세포는 병원균을 만나기 전부터 활성화되어 다양한 병원균과 바이러스에 대처할 수 있으며, 특히 자연살해 T세포가 항암과 항바이러스에 뛰어난 효과를 보이지만, 쥐와 달리 사람에게는 자연살해 T세포가 없어 사람으로 확장하는 연구에 어려움이 많았다. 단일 세포 RNA 시퀀싱과 TCR 클로노타이핑 분석은 세 가지 유형 모두 흉선에서 사람에게 풍부한 MAIT세포와 감마델타 T세포가 자연살해 T세포와 같은 발달과정을 거쳐, 같은 역할을 하는 것으로 확인했다. 이 결과는 사람 몸에서 인터페론 감마를 분비하는 MAIT세포와 감마델타 T세포를 이용하면 생쥐에게서 자연살해 T세포를 이용해 항암과 항바이러스에 큰 효과를 본 것처럼 비슷한 효과를 낼 수 있음을 시사한다.

주) a. 단일 세포 RNA 시퀀싱의 실험 모식도, b. UMAP 그래프로 나타낸 각 세포 타입에 따른 분포, c. UMAP 그래프로 나타낸 각 세포 타입의 바이오 마커 유전자 발현 패턴, d. 선천성 T 세포를 여러 세포 클러스터링 한 결과.
출처: Nature Communications, 2020, 11, 4367.
[그림 3-49] 단일세포 RNA시퀀싱은 선천성 T 세포의 숙성과정을 판단할 수 있다
경희대학교에서는 57마리의 성장하는 송아지에서 수집된 450개의 대변 표본을 다중 오믹스 분석하였고, 장내 미생물 총의 분변미생물군 이식(porphyromonadaceae 계통의 증가) 및 대사체 프로필(배변 아미노산 농도의 감소)이 설사 완화와 강한 상관관계가 있음을 밝혔다. 24개월에 걸친 지속적인 추적 연구에서 분변미생물군 이식이 소의 성장 성능을 향상시킨다는 것을 발견하였다. 반추동물에 대한 이 첫 번째 분변미생물군 이식 시험은 이유 전의 송아지의 장내 미생물을 변화시켜 설사를 개선할 수 있으며 분변미생물군이식이 성장 성능 개선에 잠재적인 역할을 할 수 있음을 시사한다.

주) a-c. FMT 여부에 따른 각 성장단계에 따른 소의 체중, d. FMT 여부에 따른 도축 후 무게, e. 12개월 된 소의 장내 미생물 군집 프로파일, f. 12개월 된 소의 각 그룹에서 강화 미생물 분류군. FMT 여부에 따른 주요 장내 미생물 상대 분포.
출처: Nature Communications, 2021, 12, 161.
[그림 3-50] FMT에 의한 장내 미생물 군집 변화 및 성장 속도 변화
한양대학교 류마티스병원, 경희대학교와 국립보건연구원에서는 82명의 류마티스 환자와 40명의 정상인을 대상으로 유전체 수준의 유전자 돌연변이 데이터, 전사체 데이터, 그리고 DNA methylation 데이터의 오믹스 분석을 수행하였다. 그 결과 류마티스 관절염 환자의 유전자 발현 패턴은 CD4 T세포의 활성과 분화에 연관된 특징이 정상군에 비해 큰 차이가 있었으며, 많은 유전자가 DNA 염기의 메틸화에 의해서 조절됨을 규명했다. 또한 DNA 염기 메틸화는 류마티스 관절염의 원인 유전변이에 의해 메틸화 정도가 결정된다는 것도 밝혀냈다. 이로써 유전변이로 인한 후성유전학적 차이로 유전자 발현이 조절되어 나타난다는 일련의 발병 메커니즘을 총체적으로 증명했다. 한국인의 CD4 T세포 내 유전변이들이 DNA 염기 메틸화를 통해 연관 유전자를 조절한다는 것을 다차원 오믹스 연구를 통해 밝혔고, 이는 향후 한국인 류마티스 관절염 환자를 위한 발병예측과 약물 반응성 예측, 나아가 질병 예방이나 정밀의학을 한층 더 발전시킬 수 있음을 시사한다.

주) A. 통계적으로 유의한 류마티스 환자 CD4+ T 세포 내의 유전자 발현 변화, B. 류마티스 환자 CD4+ T 세포 내 특이적으로 유전자 발현변화가 나타나는 유전자들의 기능. C. T 세포 분화에 연관성이 높은 유전자.
출처: Annals of the Rheumatic Diseases, 2021, 0, 1-8.
[그림 3-51] 류마티스 환자 CD4+ T세포 내의 유전자 발현 변화
KAIST와 한국파스퇴르연구소에서는 FDA 승인 약물 또는 임상 진행 중인 6,218종의 약물 가상 라이브러리를 구축하고, 구조 유사도 분석 모듈과 상호작용 유사도 분석 모듈을 도킹 전후에 도입한 컴퓨터 기반 가상 스크리닝을 통하여 바이러스 치료제로 가능성이 있는 약물만 신속하게 선별하였다. 사스-코로나바이러스-2(SARS-CoV-2)의 복제와 증식에 필수적인 역할을 하는 단백질 가수분해 효소(3CL hydrolase, Mpro)와 RNA 중합효소(RNA-dependent RNA polymerase, RdRp)를 저해할 수 있는 후보 화합물을 15종과 23종으로 각각 선정하였으며, 세포 이미지 기반 항바이러스 활성 분석 플랫폼을 활용해 약효를 일차적으로 검증하고, 사스-코로나바이러스-2가 감염된 원숭이 신장 세포를 이용한 시험관 내 실험을 통해 추가로 7종의 약물에서 항바이러스 활성을 확인하였다. 이러한 연구는 예측 성능이 우수한 약물 가상 스크리닝 플랫폼을 통하여 바이러스 감염 치료제로 유망한 후보물질을 단기간에 발견할 수 있음을 시사한다.

주) A. SARS-CoV-2 복제 주기 내 약물 타겟 선별. 가장 중요하면서도 변이가 적은 Mpro 및 RdRp 단백질을 약물 타겟으로 선정. B. 물질 도킹 기반 가상 스크리닝을 통하여 SARS-CoV-2에 적합한 새로운 물질을 찾을 수 있다. 컴퓨터 분석을 통해 빠르고 안전하게 SARS-CoV-2 주요 타겟에 적합한 약물들의 선별 가능하다.
출처: Proceedings Of The National Academy Of Sciences, 2021, 118, 30, e2024302118.
[그림 3-52] SARS-CoV-2의 약물 타겟 및 컴퓨터 시뮬레이션을 통한 SARS-CoV-2 치료제 발굴
KAIST에서는 인공유전체 구축에서 나아가 인공유전체의 문제점을 해결하고 엔지니어링하여 여러 가지 바이오화합물을 생산하는 대장균 최소유전체 세포공장을 개발하였다.21) 기존 인공유전체 연구는 인공유전체의 타당성을 검증하고, 구축한 인공유전체의 특성을 보고하는 방향으로 진행되었다. 합성생물학 기술을 통해 불필요한 유전자를 모두 제거하고 최소한의 유전자만 남긴 인공유전체인 최소유전체가 제작되었으나 이후 폭넓고 깊은 분석과 후속연구가 이루어지지 않아, 최소유전체가 안고 있던 여러 가지 문제점에 의해 한계가 발생해 활용 가치가 크지 않았다.
이러한 문제점들을 해결하기 위해 연구진은 우선 자연계에서 수십∼수백만 년에 걸쳐 진행되는 진화 과정을 실험실에서 가속화한 적응진화기법을 통해 최소유전체 대장균의 성장속도를 획기적으로 증가시켰다. 이후 다중오믹스 분석 기술을 기반으로 정밀한 분석을 진행하여 문제점의 원인이 최소유전체에 적합하지 않은 대사에 의해 발생한다는 것을 규명하였고, 최소유전체에 맞게 최적화된 새로운 대사 원리를 도출하였다.
이렇게 최적화된 인공유전체는 당 대사 과정에서 타 대장균보다 4.5배 높은 환원력을 생산하였고 이로 인해 뛰어난 항산화 효과와 항암효과를 가진 유용 물질인 리코펜 및 비올라세인의 생산량을 일반 대장균 대비 80% 증가시켰다. 이 연구는 향후 지속가능한 바이오 기반 산업에서 큰 역할을 할 것으로 기대된다.

자료: Nature Communications 2019, 10, 935.
[그림 3-53] 바이오 화합물 고생산을 위한 최소유전체 대장균 세포공장
라. 발전 전망
차세대 염기서열 분석기술의 발전과 로보틱스 기반의 자동화가 생물학 연구에 적용되면서 천문학적인 양의 실험 데이터가 생산되는 시대에 접어들었다. 따라서 이러한 빅데이터를 분석하기 위한 생물정보학과 시스템생물학 분야는 생물학 연구에서 필수적인 요소가 되었고, 향후 더 많은 분야로 적용될 뿐만 아니라 그 자체로도 무궁무진한 발전이 기대된다.
우선 대용량 고차원의 데이터들을 계산하고, 이들로부터 새로운 생물학적 통찰을 얻기 위한 컴퓨터 기반 시뮬레이션, 신경망 기반의 인공지능과 딥러닝 기술, 생명체 모델링, 통계기법을 위한 소프트웨어 기술의 발전이 기대된다. 특히 앞서 살펴본 바와 같이 다양한 세포 종류와 환경, 그리고 상호작용의 복잡성으로 인해 발생하는 실험 오차를 극복할 수 있는 단일 세포 다중오믹스 연구와 관련된 적용기술도 많은 주목을 받을 전망이다.
또한 단순히 기존에 존재하는 생명체를 이해하거나, 일부를 조작하여 공학적으로 이용하던 생물학이 DNA 합성 등의 기술 발전에 힘입어 새로운 대사 회로를 구축하고 생명현상을 조절하는 수준에 이르렀다는 사실이 고무적이다. 이를 통해 개발된 인공유전체, 최소유전체 및 세포공장 등은 석유자원을 대체하기 위한 바이오화합물 생산, 의약품-백신 제조, 치료용 미생물 등 차세대 연구 분야에 적용되어 많은 발전이 예상된다.
추가적인 노력이 필요한 분야로는 대사 네트워크의 동역학 모델링 및 시뮬레이션 연구 분야가 있다. 현재 생명체 내의 대사과정을 이해하기 위하여 각종 오믹스 정보와 생화학 데이터를 이용한 다중스케일 모델링이 이용되고 있는데, 가장 단순한 미생물의 대사과정조차 매우 복잡하여 정확히 예측하기 힘든 수준이다. 이는 여러 가지 대사 조절 네트워크와 이를 담당하는 효소에 대한 정확한 생화학적 정보가 부족하기 때문인데 다중오믹스 분석을 통한 조절 네트워크의 발견 및 이해, 미세유체 및 자동화 기술을 이용한 효소 대량 분석 등의 기술이 가능해짐에 따라 예측 정확도가 비약적으로 향상될 수 있다. 많은 연구를 통해 in silico 모델 예측 정확도를 높여 시스템생물학의 궁극적인 목표인 세포 내에서 발생하는 생명현상의 전체적인 이해가 가능해질 것으로 기대된다. 이러한 발전된 시스템생물학을 적용한다면 미생물, 식물, 환경, 질병 연구, 마이크로바이옴 등 다양한 주요 연구 분야에 대한 새로운 통찰력을 제공할 수 있을 것이다.
6. 구조생물
가. 개요
구조생물학은 세포를 구성하고 다양한 생명현상을 직접 담당하고 있는 생체 분자기계(molecular machine)의 삼차 구조를 규명하고 이를 기반으로 그 작용 기작(mechanism)과 이에 기반을 둔 생명현상의 작동 원리를 이해하려는 학문이다. 생체 분자기계는 일반적으로 단백질로 구성되어 있으며, 따라서 단독 혹은 복합체 형태의 단백질이 구조생물학의 주 표적이 되지만, 단백질과 결합하여 생체 분자기계의 부품이 되는 핵산 및 다양한 생체 내 소분자 물질들 역시 구조생물학의 중요한 표적이 된다.
구조생물학은 생명현상을 원자 수준에서 이해하는 데 크게 이바지했을 뿐만 아니라, 그러한 정보를 바탕으로 생명현상을 필요에 따라 제어하는 물질을 찾아내는 신약개발 과정에서도 핵심적인 역할을 하고 있다. 구조생물학은 주로 세 가지 실험적 방법에 기반을 두는데, X-선 결정학(X-ray crystallography), 핵자기공명법(NMR: Nuclear Magnetic Resonance), 극저온 전자현미경(cryo-EM: cryo-Eelectron Microscopy)이 그것이다.
이러한 방법들은 각각 장단점을 가지고 있으며 연구 목적 및 필요에 따라 상호보완적으로 활용 가능하다. 예를 들어 X-선 결정학은 작용기작 분석과 신약개발에 중요한 초고해상도 구조 규명이 가능하며, NMR은 단백질의 동역학적 분석에 가장 적합한 방법이다. 이러한 기존 방법에 더하여, 기존 방법으로는 삼차 구조 분석이 힘들었던 초거대복합체 삼차 구조를 분석할 수 있게 하는 cryo-EM 기술의 급격한 발전, 4세대 가속기(XFEL: X-ray Free Electron Laser)를 이용하여 단백질 삼차 구조의 실시간 변환 과정을 분석하는 시분해 결정학(time-resolved crystallography)의 발전 등 혁신적인 기술 개발과 함께 구조생물학의 기존 한계를 뛰어넘은 혁명적 연구 변화가 이어지고 있다.

[그림 3-54] 생물 시료에 따른 구조 분석 기술분류와 해상도 분포
나. 해외 동향
2021년 7월 기준으로 단백질 데이터 뱅크(PDB: Protein Data Bank)에 등록된 전체 구조는 약 18만 개이다. 그 중 X-선 결정학에 의해 15만 8,300여 개(88%), NMR에 의해 1만 3,400여 개(7%), cryo-EM에 의해 8,100여 개(5%)의 구조가 분석되었는데, 수치를 보면 알 수 있듯이 지금까지 가장 보편적이고 많이 사용되어 온 단백질 구조 분석법은 X-선 결정학이다.
그런데도 주목해야 할 사실은 cryo-EM 기술력에 일대 혁신이 일어났던 2013년, 이른바 ‘해상도 혁명(resolution revolution)’ 이후 cryo-EM으로 규명한 구조의 수가 급격히 증가하고 있다는 것이다. 즉 cryo-EM에 의하여 규명된 전체 8,100여 개의 구조 중 무려 94%에 달하는 7,600여 개의 구조가 2013년 이후에 규명된 것이며, 이러한 수치는 이 방법이 최근 10년 사이에 급격하게 성장하였음을 잘 보여준다. 또한, 규명된 삼차 구조의 절대적 수치로 보아도, 2019년 이후 최근 3년 사이 cryo-EM을 이용한 구조는 5,200여 개로 이미 NMR(2019년 이후 1,000여 개)을 훨씬 넘어섰으며, X-선 결정학(2019년 이후 2만 6,000여 개)의 20% 수준까지 올라왔음을 알 수 있다.
이러한 경향성은 특히 거대 복합체 구조와 세포막 단백질의 경우 더욱 두드러진다. 2015년 이후 규명된 20megadalton 이상 거대 복합체 구조 923종 중 81%에 달하는 752종이, 그 중 단백질 생산 공장인 리보솜을 제외하면 나머지 290종 중 무려 93%에 달하는 271종이 cryo-EM을 이용하여 규명된 구조이다. 또한, 전체 단백질 중 30%를 차지하며 중요한 약물 표적으로 알려진 세포막 단백질의 경우 생산 및 결정화의 어려움 때문에 그동안 삼차 구조 규명에 어려움을 겪어왔다. 하지만 cryo-EM은 상대적으로 적은 양의 단백질이 필요하며 결정화 과정이 필요 없다는 장점이 있다. 실제로 신약개발 표적의 30%를 차지하는 핵심 단백질로 잘 알려진 G protein-coupled receptor, 이른바 GPCR 단백질들의 경우, 2019년까지는 X-선 결정학을 통하여 규명된 구조(877건)가 cryo-EM으로 규명된 구조(35건)의 25배에 달했으나, 2020년 이후로는 각각 X-선 결정학 138건과 cryo-EM 148건으로 오히려 수치상으로 역전된 상황이다.
이상에서 설명한 바와 같이 cryo-EM은 구조생물학의 핵심 기술로서 완전히 자리를 잡았으며, 특히 기존 기술로는 분석하기 어려웠던 거대 복합체 단백질 및 세포막 단백질 구조 규명을 가능하게 함으로써 구조생물학, 더 나아가 생물학 전체의 혁신을 불러일으키고 있음을 알려준다.

[그림 3-56] 거대 복합체 구조 규명이 가능한 cryo
한편, 이와는 별도로 구조생물학과 접목된 새로운 분야가 최근 급격히 부상하고 있는데, 바로 인공 단백질 디자인(de novo protein design)이 그것이다. 인공 단백질 디자인은 자연에 존재하는 단백질의 삼차 구조 및 기능을 분석하는 것이 아니라, 역으로 의학적, 산업적으로 필요한 기능을 갖출 수 있는 단백질의 삼차 구조를 의도적으로 디자인하는 것이다. 이러한 인공 단백질은 디자인 과정에서 구조생물학적 배경지식이 필수적으로 필요할 뿐만 아니라, 만들어진 인공 단백질의 성능을 확인하기 위하여 주로 X-선 결정학 또는 NMR에 기반을 둔 구조생물학적 분석이 필수적이다. 이 분야는 미국 워싱턴 대학의 단백질 디자인 연구소가 주도하고 있으며, 해당 연구소를 이끄는 데이비드 베이커 교수는 2021년 브레이크스루(Breakthrough) 상을 받기도 하였다.


[그림 3-57] 단백질 디자인 전략(좌측) 및 결과물(우측
다. 국내 현황
국내 구조생물학 연구진은 약 100여 명에 달하며, 세계적 수준의 경쟁력을 갖춘 것으로 평가된다. 먼저 X-선 결정학 연구에는 전용 X-선 빔 라인이 필수적인데, 국내에는 1994년 포항가속기연구소(PAL: Pohang Accelerator Laboratory)가 완공되면서 3세대 방사광가속기인 포항 방사광가속기(PLS: Pohang Light Source)가 운영되고 있다. PLS는 2012년 PLS-II로 전면 개조되어 지금까지 국내 기초연구 및 산업적 측면에서 다방면으로 중요한 역할을 맡고 있으며, 특히 X-선 결정학 전용 빔 라인 3기(5C, 7A, 11C)를 운영하면서 국내 구조생물학 연구진에 안정적으로 X-선 빔을 제공하고 있다.
지금까지 국내 구조생물학 연구진이 포항가속기연구소를 이용하여 얻은 주요 성과로는 ‘비아그라 작용원리 규명(2003, 네이처)’, ‘B-Z DNA 결합 분석(2005, 네이처)’, ‘코로나 바이러스 검출용 신규 단백질 센서 개발(2021, 네이처)’ 외 다수가 있다.
또한, 포항가속기연구소는 지난 2016년부터 기존 3세대 가속기보다 수억 배 더 강한 빛을 만들어내는 4세대 가속기 XFEL 시설, 즉 PAL-XFEL을 미국과 일본에 이어 세계 3번째로 설치하여 운영 중이다. XFEL은 펨토초(10∼15초)의 짧은 시간 동안 X-선 펄스를 이용하여 분자 세계에서 일어나는 반응을 분석할 수 있으며, 기존 3세대 가속기보다 훨씬 더 작은 나노 사이즈의 결정을 이용하여 삼차 구조 규명이 가능하다. 또한, XFEL은 마이크로에서 밀리 초(ms, millisecond) 단위에서 이루어지는 단백질 삼차 구조의 실시간 변환 과정을 분석하는 시분해동역학 연구를 가능하게 한다. 최근 국내 연구진에 의한 ‘XFEL을 통한 세포막 단백질 로돕신의 동역학적 분석(2021.3., PNAS)’이 발표되는 등, XFEL은 국내 구조생물학 연구를 보다 확장시킬 것으로 기대된다.
여기에 더하여, 2020년 5월 4세대 방사광가속기인 오창가속기연구소(OASIS: Ochang Advanced Synchrotron for Industry and Science) 건립이 확정되었다. 2028년 완공을 목표로 하는 최첨단 시설인 오창가속기연구소는 기존의 가속기보다 향상된 세계 최고 수준의 성능으로 향후 다양한 분야에서 중요한 역할을 할 것으로 기대되며, 특히 X-선 결정학을 이용한 국내 구조생물학 연구에도 크게 이바지할 것으로 기대된다.



(좌) 3세대 PLS-II. (중) 4세대 PAL-XFEL, (우) 4세대 오창가속기연구소(예상 조감도)
[그림 3-58] 국내 가속기연구소 시설
반면, cryo-EM을 활용한 구조생물학 연구는 지금까지 많은 어려움이 있었는데, 이는 근본적으로 cryo-EM 장비 부족에서 기인한다. 미국과 유럽연합이 각각 100기 이상, 중국이 40기 이상의 cryo-EM 장비를 갖추고 해당 분야를 선도하고 있지만, 국내에는 고성능 cryo-EM 장비가 기초과학지원연구원(KBSI: Korea Basic Science Institute)의 300kV 수준의 Titan Krios 1기에 불과하였으며, 초기 스크리닝부터 복합체 삼차 구조 데이터 수집 및 분석까지 모두 이 1기의 기기에 의존하여야 하는 상황이 오랫동안 지속되어 왔다.
다행스러운 것은, 최근 이러한 cryo-EM 장비 부족 문제가 어느 정도 해결되고 있다는 점이다. 2021년 7월 기준으로 기초과학지원연구원에 300kV 수준 Titan Krios 1기 및 200kV 수준 Talos Arctica 1기, 기초과학연구원에 300kV 수준 Titan Krios 1기 및 200kV 수준 Talos Glacios 1기, 서울대학교, 한국과학기술원(KAIST), 포항공과대학교(POSTECH)에 200kV 수준 Talos Glacios 각각 1기 등, 모두 7기의 고성능 cryo-EM 장비가 가동 중이다. 여기에 더하여 카이스트, 포스텍, 부산대학교(이상 300kV 수준), 한국생명공학연구원(KRIBB, 200kV 수준), 그리고 국내 민간기업 중 최초로 (주)바오밥에이바이오(300kV 및 200kV 수준 각 1대) 등에서 추가적인 cryo-EM 장비 구축이 진행되고 있다.
지금까지 cryo-EM 장비 부족에도 불구하고 국내 구조생물학 연구진은 KBSI 장비 혹은 해외 장비를 이용하는 방법을 통하여 ‘RNA polymerase 거대 복합체 구조(2020, Nature Communications)’, ‘세포 사이를 연결하는 커넥신 반쪽채널 구조(2020, Science Advances)’, ‘판코니 빈혈 연관 복합체 구조(2020, Nucleic Acid Research)’, ‘뉴클레오좀 복합체 구조(2019, Nature Communications)’ 등 다수의 우수한 연구결과를 창출하였다. 향후 국내에 기 구축된, 그리고 가까운 시일 내에 구축될 고성능 cryo-EM 장비가 본격적으로 가동되면 더 많은 우수한 연구성과들이 창출될 것으로 기대된다.


[그림 3-59] 기초과학지원연구원(KBSI)에 구축된 300kV 수준 Titan Krios cryo
라. 전망
최근 구조생물학 연구는 기존의 X-선 결정학 및 NMR 기술과 더불어 거대 복합체 구조와 세포막 단백질 삼차 구조 분석의 장벽을 무너트린 cryo-EM 기술, 단백질의 동적인 움직임을 관찰하는 XFEL 기술 등의 급속한 성장과 보급으로 인해 큰 변화가 이루어지고 있다.
이러한 방법들은 배타적인 것이 아니라 상호보완적으로 작용하며, 생체 분자기계에 의한 생명 현상의 비밀을 보다 더 정확하게 밝혀내는 생물학적 기초과학분야에서부터 이를 조절하는 의과학적 신약 개발 과정에 이르기까지 커다란 발전과 혁신을 가져올 것으로 기대되고 있다. 여기에 더하여, 기존 자연에 존재하던 단백질을 분석하는 데에서 그치지 않고 필요에 따라 구조생물학적 배경에 근거하여 인공 단백질을 만들어내는 인공 단백질 디자인이 새로운 기술영역으로 급부상하고 있다. 이러한 점들을 종합해 볼 때 구조생물학 분야는 급격한 변화와 발전의 시기를 맞이하고 있으므로, 국내 구조생물학 연구 역시 여기에 뒤처지지 않도록 자체적인 혁신과 정부 차원의 적극적인 지원이 필요하다고 생각된다.
|
참고자료 |
-Wyatt WY, D SF, Paul EB. The role of protein structural analysis in the next generation sequencing era. Top Curr Chem. 336:67-98, 2014.
-Procko E, Berguig GY, Shen BW, Song Y, Frayo S, Convertine AJ, Margineantu D, Booth G, Correia BE, Cheng Y, Schief WR, Hockenbery DM, Press OW, Stoddard BL, Stayton PS, Baker D. A computationally designed inhibitor of an Epstein-Barr viral Bcl-2 protein induces apoptosis in infected cells. Cell. 157(7):1644-1656, 2014.
-Nygaard R, Kim J, Mancia F. Cryo-electron microscopy analysis of small membrane proteins. Curr Opin Struct Biol.64:26-33, 2020.
-Wang J, Hua T, Liu ZJ. Structural features of activated GPCR signaling complexes. Curr Opin Struct Biol. 63:82-89, 2020.
-Zhu L, Chen X, Abola EE, Jing L, Liu W, Serial Crystallography for Structure-Based Drug Discovery. Trends Pharmacol Sci. 41(11):830-839, 2020.
-Leman JK, Weitzner BD, Lewis SM, Adolf-Bryfogle J, Alam N, Alford RF, Aprahamian M, Baker D, Barlow KA, Barth P, Basanta B, Bender BJ, Blacklock K, Bonet J, Boyken SE, Bradley P, Bystroff C, Conway P, Cooper S, Correia BE, Coventry B, Das R, De Jong RM, DiMaio F, Dsilva L, Dunbrack R, Ford AS, Frenz B, Fu DY, Geniesse C, Goldschmidt L, Gowthaman R, Gray JJ, Gront D, Guffy S, Horowitz S, Huang PS, Huber T, Jacobs TM, Jeliazkov JR, Johnson DK, Kappel K, Karanicolas J, Khakzad H, Khar KR, Khare SD, Khatib F, Khramushin A, King IC, Kleffner R, Koepnick B, Kortemme T, Kuenze G, Kuhlman B, Kuroda D, Labonte JW, Lai JK, Lapidoth G, Leaver-Fay A, Lindert S, Linsky T, London N, Lubin JH, Lyskov S, Maguire J, Malmström L, Marcos E, Marcu O, Marze NA, Meiler J, Moretti R, Mulligan VK, Nerli S, Norn C, Ó'Conchúir S, Ollikainen N, Ovchinnikov S, Pacella MS, Pan X, Park H, Pavlovicz RE, Pethe M, Pierce BG, Pilla KB, Raveh B, Renfrew PD, Burman SSR, Rubenstein A, Sauer MF, Scheck A, Schief W, Schueler-Furman O, Sedan Y, Sevy AM, Sgourakis NG, Shi L, Siegel JB, Silva DA, Smith S, Song Y, Stein A, Szegedy M, Teets FD, Thyme SB, Wang RY, Watkins A, Zimmerman L, Bonneau R. Macromolecular modeling and design in Rosetta: recent methods and frameworks. Nat Methods. 17(7):665-680, 2020.
7. 뇌과학
가. 개요
뇌는 약 1,000억 개의 신경세포로 구성되어 있다. 이런 신경세포 하나당 평균 1,000개의 시냅스를 통해 다른 세포들과 연결되어 있으며 뇌 전체를 기준으로 100조 개 이상의 시냅스가 형성되어 있다. 이렇게 뇌는 수억 개의 세포들이 서로 복잡하게 연결되어 있으며 지금까지 우리가 우주에서 발견한 것 중에서 가장 복잡한 기관이다.
뇌연구는 뇌신경생물학과 인지․과학적 이해를 바탕으로 뇌 작동의 근본 원리를 파악하여 뇌질환 극복 및 공학적 응용에 활용하는 분야이다. 뇌는 외부 세계와 몸속의 환경을 인지하고 이에 반응해 정보를 분석․처리하여 행동을 선택․조절하는 중요한 기관이다. 인간의 뇌는 현대의학과 과학기술의 발전에도 불구하고 아직까지도 많은 부분 미개척 영역이며 한국이 미래 선진국으로 도약할 기회를 제공할 수 있는 도전적 영역이다. 또한 뇌연구는 감정, 인지, 사고능력으로 대표되는 인간의 본질을 탐구하는 영역이기도 하며 의생명과학, 화학, 물리, 전기, 전자, 기계 등의 타 기술 분야를 아우르는 중요한 분야이다.
뇌과학은 생체나 생체유래물질 또는 생물학적 시스템과 관련된 바이오기술(BT), 분자와 세포 수준의 접근이 가능한 나노기술(NT)과 컴퓨터를 활용한 정보기술(IT)의 유기적 연결을 통한 융합연구가 핵심이다. 또한, 정서와 감정을 이용한 감성형 문화콘텐츠기술(CT)까지 추가되어 뇌과학은 그야말로 초융합 학문의 정점이라 할 수 있다.
최근에는 다면적, 다차원적, 초정밀 연구 방법과 AI 기반 빅데이터 분석기술 등의 발달로 뇌질환을 더 정밀하고 맞춤형으로 예방-진단-치료할 수 있는 기술을 개발하고 있어 뇌과학에서도 빅데이터를 활용할 수 있는 시대가 도래하였다. 이러한 기술의 혁신은 뇌과학의 기초분야뿐만 아니라 진단 및 치료 등과 같은 응용 분야, 그리고 아직은 태동기인 뇌 산업을 촉진하고, 궁극적으로는 뇌 연구를 통해 인류의 평생 건강한 삶을 가시화 할 수 있을 것이라 기대하고 있다.
나. 해외 동향
미국, EU 등 주요 선진국들은 인구 고령화에 따른 사회경제적 문제를 해결하기 위해 일찍부터 뇌연구의 중요성을 인식하고 국가 차원의 R&D 예산과 정책을 수립하였다. 뇌연구 기술과 산업적 파급효과를 고려하여 뇌연구를 국가경쟁력과 직결된 유망 과학기술로 인식하고 21세기 첨단과학기술을 기반으로 한 범국가적 대형 프로젝트를 추진하고 있다.
세계 최고 뇌과학 강국인 미국은 오바마 대통령이 ‘뇌 작동 원리의 미스터리 해결이 최우선 과제’임을 강조(BRAIN Initiative 연설문 중에서, 2013)하면서 뇌의 근원적 이해에 도전하는 대규모 프로젝트를 시작하였다. 미국은 2013년 인간 뇌지도 작성을 목표로 하는 BRAIN Initiative(2013∼2025년간 5조 2,000억 원)를 중심으로 국가 대형 사업을 추진하고 있다. 2019년에는 BRAIN Initiative에 대한 중간 점검을 통해 그간의 성과 및 향후 과제를 제시한 BRAIN Initiative 2.0을 발표하였다. BRAIN Initiative 2.0에서는 1.0에서 개발된 기술 및 데이터 공유, 인력양성, 기술보급 및 확산과 대중과의 소통, 기초연구의 질병 모델과의 연결 등을 주요 이슈로 하고 있다.
NIH가 지원하는 뇌과학 관련 연구비는 2020년 80억 달러에서 2021년 85억 1,000만 달러로 5억 달러 정도 증가하였으며 2021년 NIH 전체 예산 429억 달러 중 20% 정도를 차지하고 있다. 상세하게는 뇌질환 25억 1,000만 달러, 노화 39억 달러, 정신건강 21억 달러 규모로 지원되고 있다. NIH 산하 국립정신건강연구소, 국가알코올남용및중독연구소, 미국 국립약물남용연구소를 중심으로 정신건강 연구가 수행되고 있으며 효과적인 치매 예방과 치료를 위해서 국가 치매 계획을 2019년에 수립하고 약 4억 2,500만 달러를 지원하고 있다.
유럽연합은 2013년부터 인간의 뇌를 슈퍼컴퓨터에서 그대로 구현해 시뮬레이션하는 것을 목표로 하는 HBP(Human Brain Project)를 착수하였으며 현재는 HBP의 마지막 단계(2020∼2023)로 2023년까지 혁신적인 EBRAIN(의료 정보학 플랫폼) 인프라 확장과 뇌 네트워크와 의식에서의 역할, 인공신경망 등 3가지 핵심 과학 분야를 발전시키는 데 초점을 맞춰 추진 중이다.
[표 3-13] 미국 BRAIN Initiative 2.0 주요 내용(2019.10.)
|
우선 영역 구분 |
성과 |
향후 과제 |
|
1. 다양한 뇌신경세포 종류의 역할규명 (Discovering Diversity) |
분석 방법 개발 및 정보처리 속도 증대 |
세포 유형 데이터 분석 확장, 생성단백질 기반 이해, 세포 유형에 대한 (비)유전적 접근, 세포 기반 회로 기능 모델 개발 |
|
2. 다양한 스케일의 뇌신경회로 연결 (Maps at Multiple Scales) |
고해상도의 이미지화 |
뇌 전체로 분석영역 확대, 비뉴런 세포 유형과 시냅스의 지도화, 동일한 뇌에서 구조와 기능 매핑 통합, 종간 비교 |
|
3. 작동 중인 뇌기능 이해 (Brain in Action) |
신경활동 기록 및 분석을 위한 기술개발 |
신경 조절 기능의 이해 증대, 전체 뇌를 연구하는 도구 개발 등 |
|
4. 신경활동과 행동의 인과관계 입증 (Demonstrating Causality) |
신경활동을 조절하는 기술개발(광학, 전기, 자기 등을 활용) 등 |
단일세포 광유전학 제어, 중독 및 사회적인지 장애, 공격성 및 강박적 행동과 같은 선택된 부적응 행동 장애에 관한 연구, 동물모델을 활용한 기계학습 알고리즘 연구 등 |
|
5. 인지․사고과정의 생물학적 원리 규명 (Identifying Fundamental Principles) |
뇌 회로 수준에서의 메커니즘의 기초 이론과 모델 연구 등 |
실험 데이터에서 정보를 추출하는데 필수적인 통계 및 모델링 도구 개발 등 |
|
6. 인간 뇌이해와 진단․예방치료를 위한 기술혁신 (Human Neuroscience) |
비침습적 이미징 기술개발, 뇌에서 기록된 신호 해석 연구 등 |
(비)침습적 장치 개발, 공유를 위한 지원, 게놈 데이터 활용 연구, 데이터 보급, 기초연구와 중개연구 간 협력 연구, 교육 및 임상/수술연구자, 임상연구자 과학자 및 의사과학자 교육 등 지원 |
|
7. BRAIN 결과의 뇌 적용 (From BRAIN to Brain) |
회로기능에 대한 최첨단 접근방식 통합 및 적용을 위한 연구 |
1∼6 우선 영역에 대한 통합적 접근 |
|
8. 과학 체계화 (Organization of Science) |
데이터 관리 및 공유, 인력, 기술보급 등 |
기술 인큐베이터의 역할 및 공유, 교육, BRAIN 2.0은 중개 역할을 통해 초기 투자를 활용하여 SBIR(중소기업혁신연구) 펀딩 생태계 내에서 학계 과학자와 기존 기업 간의 추가 협력을 촉진, 커뮤니티 소집 및 지식 공유 촉진 |
자료:https://braininitiative.nih.gov/strategic-planning/acd-working-groups/brain-initiative%C2%AE-20-cells-circuits-toward-cures
일본은 2014년부터 영장류 뇌연구와 뇌 매핑 기술개발 등을 통해 인간의 뇌를 이해하고 뇌질환을 극복하기 위한 Brain/MINDS가 시작되었으며 2014년부터 2023년까지 4,000억 원 이상의 예산이 투자된다. RIKEN 뇌과학센터를 중심으로 퇴행성 뇌질환 연구를 위한 마모셋 모델 연구, 임상연구 및 기술개발 등을 위한 연구가 지원되고 있다. 일본의료연구개발기구(AMED)는 뇌와 정신건강 강국 실현 프로젝트를 통해 국내외 연계 및 코호트를 활용하여 정신․신경질환 극복에 이바지하는 연구개발을 추진하고 있으며 2019년 AMED 총 예산 1,515억 엔 중 뇌와 정신건강 강국 실현 프로젝트에 116억 엔이 지원되었다.
[표 3-14] 일본 AMED의 뇌와 정신건강 강국 실현 프로젝트 구성 사업
|
주요 사업명 |
개요 |
|
∙ 뇌과학 연구전략 추진 프로그램 ∙ Brian/MINDS ∙ 전략적 국제 뇌과학 연구 추진 프로그램 |
사회에 공헌하는 뇌과학의 실현을 목표로 신경회로 형성, 정보처리, 뇌기능 네트워크 분석, 치매 및 우울증, 발달 장애를 비롯한 정신․신경 질환의 극복으로 이어질 인간의 고차원 뇌 기능의 해명을 위한 기반구축 |
|
∙ 치매 연구 개발 사업 |
초고령사회 대비를 위한 치매 시책 추진 종합 전략(신 오렌지 플랜)에 근거하여 진단, 예방, 치료 등에 대한 연구 추진 |
|
∙ 장애인 대책 종합 연구개발 사업 |
신체․지적 장애, 감각 기관 장애, 정신장애, 신경․근육 질환 분야 연구개발 및 질병 등의 병인․병태의 해명, 예방, 진단, 치료 등의 선진․실천적인 연구 추진 |
|
∙ 치매 대책 민관 혁신 실증 기반 정비사업 |
기업․지자체 등과 연계하여 양질의 서비스․기기개발을 위한 연구 추진 |
자료: AMED 홈페이지(https://www.amed.go.jp/pr/pamphlet.html)
2016년 착수된 국제협력 기반의 글로벌 뇌연구 이니셔티브(IBI: International Brain Initiative)에는 미국, 한국, EU, 일본, 캐나다, 호주, 중국 등이 참여하고 있으며 글로벌 뇌과학 연합을 결성하여 향후 뇌과학 기술의 공유와 발전을 위해 협력하고 있다. 2019년에는 뇌신경과학 분야의 최대 학술대회인 ‘국제 뇌신경과학총회(IBRO: International Brain Research Organization)’가 한국에서 개최되었다.
다. 국내 현황
한국 뇌연구는 1998년 제정된 ‘뇌연구 촉진법’ 및 ‘뇌연구 촉진법 시행령’ 등 법적 기반을 바탕으로 과기정통부, 산업부, 복지부 및 교육부 등 부처가 공동으로 뇌연구촉진 기본계획을 수립하여 추진하고 있다. 이와 같은 범정부적 뇌연구 지원 사업이 추진되면서 국내 뇌과학 수준과 경쟁력이 향상되었다.
제1차 뇌연구촉진 기본계획(1998∼2007)이 수립된 이후 기초연구기반을 조성하고 뇌연구 주체별 기술 역량을 강화하는 방향으로 기본목표가 설정되었으며, 이에 따른 다양한 시책들이 국내 뇌과학 육성을 위해 추진되었다.
이어 수립된 제2차 뇌연구촉진 기본계획(2008∼2017)에는 ‘창조적 뇌연구’를 통한 삶의 질 향상과 ‘미래 신사업 창출’이라는 비전 아래 ‘R&D 핵심역량 강화’, ‘연구개발 시스템 혁신’, ‘산학연 협력 및 인프라 기반구축’ 등 3대 추진전략이 강조되었다.
2018년부터 시작된 제3차 뇌연구촉진 기본계획(2018∼2027)은 ‘뇌이해 고도화와 뇌활용의 시대 진입’을 위한 비전 아래 ‘인간의 이해에 다가가는 뇌과학’, ‘사회문제를 해결하는 뇌과학’, ‘미래사회를 대비하는 뇌과학’의 추진 방향으로 향후 10년 동안 뇌과학을 발전시켜 나아갈 청사진을 완성하였다.

자료: 제3차 뇌연구촉진 기본계획 및 2021년 뇌연구촉진 시행계획, 과기정통부.
[그림 3-60] 국내 범정부 뇌연구 지원 추진 경과 및 추진 방향
3차 뇌연구촉진 기본계획을 확정하고 지속적인 투자로 미래 신시장 선점을 위한 연구개발사업을 추진하였으며 2006년부터 시작된 뇌과학원천기술개발사업은 2023년 종료를 앞두고 있다. 4차 산업혁명에 대응하기 위하여 핵심 기술 요소인 초융합, 초연결기술과 뇌과학간 융합을 위한 미래 뇌융합기술개발사업과 국민 치매 부담의 실질적 경감 도모를 위해 과기정통부와 복지부가 함께 추진하는 치매극복연구개발사업이 2020년부터 신규로 추진되고 있다. 또한, 주요 뇌질환의 임상적 현안에 대한 과학적 해결책 제시를 위한 뇌질환극복연구사업도 함께 시작되었다.
정부의 뇌연구 투자를 살펴보면, 연평균 12%씩 증가하여 2007년 411억 원에서 2020년 1,822억 원으로 증가하여 총 1조 5,204억 원이 투자되었다. 2019년 뇌연구 총 투자액은 1,802억 원이며 부처별 투자 비중을 살펴보면 과기정통부(출연연 포함)가 87%(1,875억 9,000만 원), 복지부 8.6%(186억 3,000만 원), 교육부 2.6%(55억 3,000만 원), 산자부 1.8%(38억 8,000만 원) 순으로 투자되었다.
2020년 뇌연구 총 투자액은 1,821억 7,000만 원이며 부처별 투자 비중을 살펴보면 과기정통부(출연연 포함)가 83.9%(1,529억 1,000만 원), 복지부 9.6%(174억 8,000만 원), 다부처(과기정통부/복지부) 3.2%(59억 원), 교육부 1.8%(33억 1,000만 원), 산자부 1.4%(25억 8,000만 원) 순으로 투자되었다.
2020년부터 2028년까지 9년간 치매 예방․진단․치료 분야에 1,987억 원이 투자되는 치매극복연구개발사업은 과기정통부와 복지부가 공동으로 추진하고 있다.
[표 3-15] 국내 뇌연구 부처별 투자비중(2020)

자료: 2021년 뇌연구촉진 시행계획.
국내 뇌연구를 통한 SCI 논문 수는 2019년 1,505건, 2020년 1,181건이며, IF 10 이상의 우수논문 게재 건수는 2019년 92건, 2020년 105건으로 2007년 16편 대비 약 6∼7배 증가되는 등 뇌연구의 질적 성장이 이루어지고 있다.
국내외 특허등록은 2008년 총 55건에서 2019년 154건, 2020년 158건이며 기술이전은 2008년 2건에서 2019년 13건, 2020년 9건으로 지속적인 성과가 도출되고 있다.
뇌연구 과제 참여인력은 2008년 2,911명에서 2020년 5,628명으로 약 2배 증가하였으며, 석박사 인력도 지속해서 배출하였다. 뇌연구 분야 석박사 배출은 2009년부터 2020년까지 총 3,219명 이상을 배출하였으며 우수인력은 연평균 293명씩 배출되었다.
KISTEP에서 발표하는 기술수준 평가에 의하면, 미국 대비 한국의 뇌연구 관련 기술격차는 2.5∼4년 차이이며, 기술수준은 선진국 대비 70∼75% 수준으로 평가되어 추격그룹에 속하는 것으로 조사되었다.
[표 3-16] 뇌연구 분야 기술수준(2018년 대비 2020년)
|
기술 분야 |
최고 기술국 |
한국의 기술수준 |
||||
|
기술수준(%) |
기술격차(년) |
그룹 |
||||
|
2018 |
2020 |
2018 |
2020 |
|||
|
뇌신경계 질환 원인 규명 및 치료․예방기술 |
미국 |
70.0 |
75.0 |
4.3 |
2.5 |
추격 |
|
뇌신호 관측 및 조절 기술 |
미국 |
65.0 |
70.0 |
4.0 |
4.0 |
추격 |
자료: 2018, 2020년 기술수준 평가, KISTEP.
뇌연구 데이터 관리․활용과 관련해서는 2021년부터 한국뇌연구원을 중심으로 뇌자원 데이터의 통합 데이터시스템인 ‘Brain Data Station’이 추진 중이다. MRI, PET 등의 뇌 영상 데이터와 유전체, 단백체, 대사체, 지질체 등 뇌 자원 멀티오믹스, 뇌파 등 뇌생체신호와 같은 뇌연구 자원을 수집, 저장, 분석, 활용을 목적으로 한다.
2019년에는 뇌신경과학 분야의 최대 학술대회인 ‘국제 뇌신경과학총회(IBRO: International Brain Research Organization)’가 대구에서 개최되어 한국의 글로벌 리더십 강화 및 산업계의 기술정보 교류 활성화를 위한 기회가 마련되었다. 2019년 9월 21일부터 5일간 진행된 ‘IBRO 2019’에는 총 88개 국가에서 4,385명이 참석하여 역대 IBRO 중 최대 참가국과 인원을 기록하였으며, 성공적 개최를 통해 국제적 뇌연구 위상을 제고할 수 있었다.
뇌연구 법률과 관련하여 2021년 ‘시체해부 및 보존에 관한 법률(시체해부법)’의 개정을 통해 제한적이던 시체 일부의 외부 제공을 보건복지부가 허가한 기관에 한해서 일부를 연구자에게 제공할 수 있게 되었다. 개정안 주요 내용을 살펴보면 연구를 위한 시체의 일부 제공기관에 대한 허가 및 변경허가에 대한 절차 및 기준 등을 마련했다. 이와 같은 법률 개정으로 인해 치매 등 뇌질환 치료를 위해 시급했던 뇌조직 연구가 더욱더 활성화될 것으로 기대한다.
라. 산업 현황
뇌산업은 뇌연구에 의학, 전자통신, 공학을 적용하여 치료, 개발, 제조, 생산하거나 이에 관련한 서비스를 제공하는 모든 산업으로 정의할 수 있다. 뇌산업 시장은 뇌의약품, 뇌질환 진단 및 치료용 장비를 비롯하여 연구용 장비, 응용 및 인공지능 활용 디지털 헬스케어를 중심으로 성장하고 있다. 뇌작동원리 이해와 활용이 기반이 되는 뇌산업은 전 세계적으로 급격한 성장이 예상된다.
2020년 기준 전체 뇌산업 규모는 1,944억 달러에서 연평균 37%로 성장하여 2028년 2조 4,101억 달러 규모로 성장할 것으로 예측되고 있다. CNS Therapeutics Market Analysis 보고서(2020)에 따르면 중추신경계 치료제 시장 규모는 연평균 성장률 7%로 꾸준히 성장하고 있으며 2020년 1,061억 3,000억 달러에서 2028년 1,796억 6,000억 달러로 다양한 파이프라인으로 인해 향후 빠른 속도로 성장할 것으로 예상되고 있다.
최근 미국 FDA가 18년 만에 처음으로 알츠하이머 치료제(아두카누맙) 사용을 신속허가하였다. 2003년 메만틴(Memantine) 이후 18년 동안 알츠하이머 치료제가 나오지 못한 상황에서 아두카누맙(미국 내 상품명 : Aduhelm)은 단순히 증상 완화가 아닌 질환의 진행을 억제하는 치료제라는 점에서 의미가 있다.
진단/치료장비와 연구장비도 각각 연 8%와 5%로 꾸준히 증가할 것으로 예측된다. 응용 및 인공지능 활용 디지털 헬스케어는 BMI(Brain Machine Interface) 및 인공지능 헬스케어 산업의 연평균 성장률은 약 56%의 연평균 성장률이 전망되고 있어 뇌의약품 다음으로 큰 시장규모를 차지하고 있다.
[표 3-17] 뇌산업 4대 분야별 글로벌 시장 규모
(단위: 억 달러)
|
구분 |
2020 |
2028 |
|
뇌의약품 |
1,061.3 |
1,796.6 |
|
진단/치료장비 |
107.3 |
198.3 |
|
연구장비 |
136.7 |
210.0 |
|
응용 및 인공지능 활용 디지털 헬스케어 |
638.5 |
21,895.6 |
|
총합 |
1,943.8 |
24,100.5 |
자료: CNS Therapeutics Market Analysis And Segment Forecasts to 2028(GrandView research, 2020), The neurotechnology industry 2016~2017 report를 참고하여 전망.
4차 산업혁명 기술(AI, 데이터, IoT 등)과 관련하여 뇌와 기계, 뇌와 컴퓨터를 연결하는 기술과 인공지능 분석을 결합한 소통기술개발이 활발하다. 글로벌 BMI와 BCI 시장의 확대에 대한 기대가 높아지고 있으며 일본 조사기관 AQU Technology Research Institute(2019)에 의하면 BMI 및 BCI 시장 규모가 2019년 13억 1,000만 달러에서 2025년 25억 달러로 약 2배 가량의 성장을 예측하고 있다. BMI 활용 분야로 구분해보면 의료․헬스케어 분야(57%), 커뮤니케이션(17%), 게임․엔터테인먼트(15%), 훈련․스포츠(6%), 기타(6%) 순으로 시장이 형성될 것으로 기대되고 있다.
일론 머스크가 설립한 뇌신경과학 스타트업 뉴럴링크는 뇌에 컴퓨터칩을 이식한 돼지(2020)와 원숭이 뇌에 무선 컴퓨터 칩을 이식하여 생각만으로 게임하는 원숭이(2021)를 공개하는 등 혁신적 기업들이 앞다투어 뇌과학 기술 개발에 뛰어들면서 향후 뇌과학 분야는 산업화의 방향과 속도를 예측하기 어려울 만큼 변화해 가고 있다.
뇌산업 시장의 성장과 함께 자본의 유입도 활발하다. 미국의 중추신경계 관련 바이오벤처 투자는 2006∼2011년 대비 2012∼2016년 사이에 약 10억 달러 증가하였으며, 이는 같은 시기 전체 벤처 펀딩 증가율인 33% 보다 더 높은 42%의 펀딩 증가율을 기록하였다.
국내 뇌산업 시장은 태동기 수준으로 산업연관분석을 통해 예측된 국내 시장 규모는 2018년 4조 2,460억 원에서 연평균 7%씩 성장하여 2023년 5조 9,564억 원으로 성장이 전망되고 있다.
국내 주요 기업의 괄목할 만한 성과로는 SK바이오팜의 ‘엑스코프리’ FDA 승인(2019), 와이브레인사의 우울증 전자약 ‘마인드(MINDD)’ 시판허가(2021), 뷰노사의 ‘뷰노메드 딥브레인’ 유럽 인증(2020), 아스트로젠의 자폐스펙트럼 장애 국내 임상 2상 승인(2020), 뉴로핏사의 뇌영상 분석 소프트웨어인 ‘AQUA’ 유럽CE 인증(2021) 등이 있다.
[표 3-18] 주요 뇌질환 기업의 우수성과
|
기업명 |
주요 내용 |
|
SK바이오팜 |
∙ 뇌전증 치료제인 세노바메이트(미국제품명 엑스코프리) FDA 승인(2019) |
|
아스트로젠 |
∙ 자폐스펙트럼 장애 국내 임상 2상 승인(2020) |
|
와이브레인 |
∙ 마인드(MINDD)의 국내 식약처 1호 우울증 치료보조기기 허가(’17) 및 유럽의료기기 국제규격(CE MDD)인증(2017) ∙ 우울증 치료제 전자약 국내 시판허가(2021) |
|
뷰노 |
∙ AI 진단 솔루션인 뷰노메드 딥브레인 유럽 인증(2020) ∙ 뷰노메드 딥브레인ADTM 식약처 3등급 허가(2021) ∙ 코스닥 상장(2021) |
|
뉴로핏 |
∙ 국내 1호 뇌영상 치료계획 소프트웨어 tES LAB인증(2021) ∙ 뇌 전기자극 치료설계 소프트웨어(뉴로핏 TMS lab) 인증(2021) ∙ 뇌영상 분석 소프트웨어인 ‘AQUA’ 유럽CE 인증(2021) |
자료: 각 기업 IR 자료.
NeuroTech 전망 보고서(2020)에 의하면 글로벌 뉴로텍 200개 기업 중에는 뉴로핏과 와이브레인이 포함되어 있으며 글로벌 지배기업이 없는 인공지능 진단기기 관련 융복합 의료기기 분야에서 벤처기업을 중심으로 세계 시장 진출이 시작되고 있다. 최근에는 대기업 LG가 인간 뇌를 닮은 천재급 초거대 AI 개발(2021)을 통해 AI 패러다임 선도 계획을 발표하였다. 이처럼 4차 산업혁명과 함께 뇌 원리 기반 활용 산업이 부상하고 있다.
마. 발전 과제
고령화 사회 및 포스트 코로나 시대 진입 등으로 세계 주요 선진국들은 뇌연구를 우주산업과 함께 미래산업의 새로운 패러다임을 제시할 수 있는 가장 강력한 블루오션으로 보고 있다.
한국의 고령인구는 2020년 813만 명(15.6%)에서 2025년 초고령화 사회에 진입하여 1,296만 명(24.5%)이 될 것이라 예측하고 있다. 이로 인한 퇴행성 뇌질환 유병률과 사회적 비용 증가가 사회문제로 대두되고 있다. 중앙치매센터의 2020년 보고서에 따르면 치매 환자는 2020년 84만 명에서 2030년 136만 명으로 증가하고 이에 따른 관리 비용은 18조 원에서 34조 원으로 증가할 것으로 예측한다. 치매, 조현병, 기분장애 등 정신행동장애 관련 사회경제적 비용은 2015년 11조 원에서 2025년 34조 원 이상으로 증가가 예상된다. 2019년 12월 발생한 COVID-19로 인해 국민의 41%가 우울감이 높아지고 디지털 중독으로 이어지는 ‘코로나 블루’를 경험했다고 한다.
2021년 미국 뉴스위크지가 선정한 세계 최고 뇌신경병원 100위 중에 국내 8개 병원이 포함되어 있다.22) 이처럼 한국은 세계 최고 수준의 신경과학 임상역량을 보유하고 있으며 이를 우수한 뇌연구 기초성과와 연결할 수 있는 가교적 중개연구 확장을 통해 국민이 체감할 수 있는 뇌질환 극복 성과 창출이 필요하다.
뇌연구는 고령화로 인한 뇌졸중․치매 환자의 증가와 COVID-19 팬데믹으로 인한 코로나 블루 등 뇌질환으로 인한 사회경제적 비용 최소화를 위한 필수 연구 분야이다.
뇌연구는 4차 산업혁명의 핵심인 AI 기술을 기반으로 하여 다학제적 연구를 통한 미래형 신산업 창출이 가능한 분야이다. 뇌 원리 활용 산업은 조기 선점을 통해 글로벌 주도권 확보 기회가 남아 있는 분야로 이때까지 지속적으로 창출된 양적․질적 연구성과를 산업화로 연결시킬 수 있는 전략의 확대가 필요하다. 정부의 지속적인 뇌연구 R&D 예산 지원으로 논문과 특허 성과는 지속적으로 성장하고 있으며 이를 바탕으로 실용화와 산업화를 고려한 전략이 마련된다면 뇌 활용 시대 진입을 가속화할 수 있을 것이다.
2023년 국내 뇌 산업의 규모가 5조 9,564억 원일 때 고용유발인원은 5만 8,622명으로 추정되며 뇌산업의 고용유발계수(9.842)는 일반산업 평균 7.301보다 높아 뇌산업 육성은 일자리 창출에도 기여할 수 있을 것으로 기대된다.
4차 산업혁명을 넘어 뇌질환 정복과 뇌 원리 활용․응용 산업 시장을 선점하기 위한 산학연병의 연계와 협력이 필요한 골든타임이 지금이라 하겠다. 한국의 뇌산업은 괄목한 성과가 조금씩 나오고 있고 이를 마중물 삼아 노력한다면 향후 국가 산업동력으로 확고하게 자리매김 할 수 있을 것으로 기대된다.
8. 노화과학
가. 개요
통계청 발표에 따르면 우리나라는 2025년 고령 인구가 전체 인구의 20%를 넘어서는 초고령사회로 진입하게 될 것이며, 이 추세를 따르면 40년 뒤에는 인구의 절반이 노인 인구가 될 것으로 예상하고 있다. 우리나라의 고령화 속도는 세계 최고 수준이며, 이로 인해 생산연령인구(15∼64세) 100명당 65명 이상 인구를 의미하는 ‘노년 부양비’가 급속하게 증가하고 있다.
검진 기술과 보건의료의 발전으로 우리나라의 기대수명은 점점 증가하고 있지만, 노인 인구 중 자신이 실제로 건강하다고 인식하는 비율은 32% 수준으로 이는 OECD 평균인 67.9%의 절반 수준에 불과하다. 이러한 기대수명과 건강수명의 격차는 노인 의료비의 부담을 증대시키고 있으며, 우리나라가 초고령사회로 진입하는 2025년에는 65세 이상 노인진료비가 60조 원에 육박할 것으로 추산된다.
고령화는 우리나라를 포함한 전 세계적인 흐름이며, 노년 부양비의 증가와 노인 의료비 부담의 증가는 세대간 갈등을 비롯한 사회문제와 정부재정 부담 증가를 초래할 것으로 전망되며, 이를 해결하기 위한 정책적, 과학적 방안 마련이 시급하다.

자료: 통계청, 2020.
[그림 3-61] 노인 인구 의료비 부담 증가
노화는 시간에 따라 생체 기능이 점진적으로 나빠지는 현상이며, 되돌릴 수 없는 시간의 흐름이 유발하는 문제를 회복하거나 역전시키는 방법은 없다고 생각되어 왔다. 오랫동안 노화는 진지한 과학적 탐구의 대상으로 여겨지지 않았으며, 그로 인해 노화 속도를 늦추거나 되돌리는 것은 SF 속에서만 가능했다.
그러나 최근 유전학, 세포 생물학의 빛나는 발전으로 에이즈, 암 등 해결 불가능할 것으로 여겨지던 질병도 생명체가 감당해야 할 기본 조건이 아니라는 사실이 밝혀지고 있으며, 심지어 각 생명체의 정해진 조건으로 여겨지던 수명도 단 몇 개의 유전자 조작으로 제어될 수 있다는 사실이 급속도로 밝혀지기 시작했다. 노화의 생물학적 이해가 심화되고 있고, 이를 제어할 수 있는 방법론이 활발히 개발되고 있으며 노화 치료 약물을 개발하기 위한 산업 생태계 또한 태동 하고 있다.
나. 해외 동향
(1) 노화 임상을 위한 제도 개선 및 표준지표 개발
현재 노화 과학은 노화의 기전을 밝히고자 하는 기초과학 연구에만 국한되지 않으며, 개별적인 노인성 질환 치료를 넘어서 노화 자체를 제어하고자 하는 다양한 시도가 이뤄지고 있다. 이에 발맞춰 세계보건기구(WHO)는 2018년 6월 국제 질병분류 11호에 ‘코드 MG2A(노화)’를 포함했다. 또한 미국은 2020년 ICD-10-CM에 노화와 연관된 신체 능력 저하를 진단할 수 있는 코드를 분류하였고, 영국 국민건강서비스(NHS)는 2017년 10월부터 1차 의료의사는 모든 노쇠 선별검사를 진행하도록 의무화하였다.
이러한 제도적 변화가 진행되고 있지만, 아직 미국식품의약국은 노화를 건강관리의 적정한 대상으로 여기지 않는 상황이다. 표준지표의 부재로 인해 노화 치료 약물의 임상적 평가지표 마련이 어려우므로, 노화 치료/관리의 과학적 인식과 제도적 인식의 격차가 발생하고 있다. 이를 극복하기 위해 노화의 전임상 표준화 지표 확립 및 임상 지표를 개발하기 위한 여러 시도가 이뤄지고 있다.
대표적으로 미국의 국립노화연구소에서는 2021년 대표적인 전임상 모델인 생쥐의 표준지표를 마련하기 위해, 생쥐의 전 생애주기에 걸친 변화를 추적, 분석하기 위한 SLAM(Study of Longitudinal Aging in Mice)을 시작하였다. 2,800마리의 양성 생쥐를 이용하여, 3년 동안 분석을 진행하여 생쥐의 노화 과정에서 나타나는 생물학적, 기능적 변화 양상을 추적하여, 딥러닝(deep learning) 기반으로 노화 제어 전임상 연구를 위한 표준지표를 마련하는 것을 목표로 하고 있다. 이러한 대규모 종단연구를 통해 노화의 표준지표가 마련된다면, 노화 제어 약물의 임상 파이프라인은 중요한 위치를 차지하게 될 것으로 예상된다.
[표 3-19] SLAM 연구의 분석 지표
|
측정값 |
측정 목적 |
빈도 |
|
몸무게 |
노화에 따른 몸무게 변화 양상 및 편차 추적 |
2주 |
|
식사량 |
노화에 따른 식사량 변화 및 편차 추적 |
2주 |
|
체온 |
노화에 따른 체온 변화 및 편차 추적 |
2주 |
|
공복 혈당량 |
노화로 인한 혈당의 변화 추적 및 대사 지표 마련 |
3개월 |
|
체성분 변화 |
노화로 인한 체성분(지방, 근육량)변화 추적 및 대사 지표 마련 |
3개월 |
|
혈액 검사 |
간, 신장 능력 변화 및 염증 변화 추적 |
3개월 |
|
다중오믹스 |
노화 지표 마련을 위한 전사체, 단백체, 대사체, 후성유전체 분석 |
3개월 |
|
걸음 속도 |
노화로 인한 걸음의 변화 측정. 인간에서 대표적으로 활용되는 지표 |
6개월 |
|
MRI |
노화로 인한 뇌경색 등 변화 양상 추적 |
6개월 |
|
운동능력 |
노화로 인한 운동 능력의 노쇠 패턴 분석 |
6개월 |
|
사망원인 |
사망한 개체의 사망원인을 분석하여 노인성 질환의 발병 비율 측정 |
사망시점 |
노화 제어를 실제 임상에 적용하기 위해서는 전임상 모델과 매칭할 수 있는 신뢰도 높은 임상 지표 마련이 필요하다. 종단적으로 약물의 효능을 평가하기 위해 비침습적 마커 발굴이 중요하며 대표적으로 텔로미어(telomere)23), DNA 메틸화, 염증 지표 등이 노화 속도를 측정할 수 있는 지표로 제안되었으며 현재 정확도의 고도화가 활발히 이뤄지고 있다.
2020년 952명의 인간 시퀀싱 데이터를 기반으로 나이에 따른 조직별 텔로미어 길이 감소를 측정한 결과 텔로미어 감소가 전체 조직에 걸쳐 일어나고 있음이 확인되었으며, 전체 혈액의 텔로미어 길이 감소가 노화와 상관관계가 높음이 확인되었다. 이는 최초로 인간에게서도 텔로미어가 노화 지표로 활용할 수 있음을 대규모 데이터로 보여준 사례로 노화 임상의 중요한 지표로 활용될 수 있을 것으로 예상된다.
현재까지 정확도 측면에서는 DNA 메틸화 정보를 기반으로 한 생체나이 방법론이 가장 앞서있다. 2013년 353개의 CpG 지역의 메틸화 정보를 기반으로 하는 인간 노화시계(오차범위 3.6년)가 처음 보고되었고, 이후 CpG 개수를 줄이고, 오차 범위를 줄이는 방식으로 노화 시계의 진보가 이뤄지고 있다. 2019년 노화로 인해 가장 빠르게 퇴화하는 기관인 흉선을 재생하는 처치를 수행했을 때 실제로 DNA 메틸화 시계가 역전될 수 있음이 보고되었다. 또한 2020년 역분화줄기세포를 유도하는 인자의 발현을 통해 시신경 세포를 역노화시켰을 때, DNA 메틸화 시계도 역전됨을 확인하였다. 따라서 노화 치료를 통해 역전됨이 검증되고 있는 DNA 메틸화 시계는 실제 노화 임상시험이 수행될 때 생물학적 나이를 되돌릴 수 있음을 보여줄 수 있는 직접적인 지표로 활용될 수 있을 것이다.
위에서 언급한 단일 표지 기반 노화 속도 예측 전략에 더하여 급속도로 발전하고 있는 다중 오믹스를 통해 노화를 측정하고자 하는 방법론이 등장하고 있다. 2019년 18∼95세의 4,263명 혈액 표본을 기반으로 노화와 관련된 14개의 바이오마커가 발굴되었으며, 노화 마커의 증가가 시간에 따라 연속적으로 일어나는 것이 아니라 일생에 거쳐 세 번의 변곡점(34세, 60세, 78세)을 거치는 방식으로 증가함이 확인되었다. 2020년에는 106명을 2년 동안 종단적으로 혈액에서 대사체, 단백체 변화를 추적하고, 대장과 코의 미생물을 추적하는 방식으로 사람의 노화 패턴을 4가지 유형으로 나눌 수 있음이 밝혀졌다.
이러한 결과는 비교적 간단한 혈액검사를 통해 개개인의 생물학적 나이를 정확히 진단할 수 있는 방법론을 제시하고 있으며, 노화 유형이 개인의 유전자와 생활방식에 따라 다르므로 개인맞춤형 정밀의학이 필요함을 시사하고 있다.
(2) 노화 치료제
다양한 모델생물에서 건강수명을 연장할 수 있음이 밝혀진 노화 제어 전략은 혈액에서 발굴한 역노화 물질, 식이 제한 모사 전략, 노화 세포 제거, 부분적인 세포 리포그래밍으로 크게 분류할 수 있다.
이러한 기술을 기반으로 많은 노화 스타트업이 등장하고 있으며, 투자 유치 금액의 규모가 큰 기업은 대부분 미국 회사이다. 이 회사들은 자신의 임상 파이프라인에 따라 임상시험을 진행하고 있으며, 이러한 흐름 하에서 2020년 MIT 테크놀로지리뷰가 발표한 2020년 10대 혁신 기술(10 Breakthrough Technologies 2020)에 ‘항노화 신약’이 포함되었다.
[표 3-20] 대표적 항노화 스타트업
|
회사명 |
국가 |
Funding (2020년) |
개발 전략 |
|
Samumed |
USA |
$658M |
소분자 기반 노화인자타겟 후보물질 발굴 및 퇴행성 질환 치료제 개발 |
|
Human Longevity |
USA |
$300M |
게놈, 표현형 및 임상 데이터에 대한 세계 최대 규모의 빅데이터 구축 |
|
Celularity |
USA |
$290M |
줄기세포 기반으로 치료제 개발 |
|
BlueRock Therapeutics |
Canada |
$225M |
유도만능줄기세포를 이용한 재생의학 세포치료제 개발 |
|
UNITY Biotechnology |
USA |
$208.3M |
노화세포제거 기술 개발 |
|
Juvenescence |
UK |
$162.3M |
AI 기반 노화 방지, 수명 연장과 관련된 신약 개발 |
|
resTORbio |
USA |
$65M |
노화인자(TOR) 기반 약물을 개발 |
|
Alkahest |
USA |
$50M |
혈액내 노화인자 기반 노화 질환 치료제 개발 |
|
Life Biosciences |
USA |
$50M |
자체 AI 플랫폼을 개발하여 노화 관련 증상에 대한 독자적인 치료법과 기술을 개발 |
|
Calico |
USA |
$1.5B |
노화의 비밀을 알아내 인간 수명연장을 목표로 R&D 추진 |
|
Neuraly |
USA |
$36M |
신경 퇴행성 장애 및 노화제어를 위한 치료제 개발 |
|
Elysium Health |
USA |
$28.2M |
건강수명 연장을 위한 건강 보조제 개발 |
|
Nuritas |
Ireland |
€23.9M |
인공 지능과 유전체학을 결합하여 건강수명을 위한 천연 생체 활성 펩타이드 개발 |
자료: https://www.medicalstartups.org/top/aging/
대표적으로 알카헤스트(Alkahest)는 알츠하이머 환자들을 대상으로 젊은 피를 투여하는 소규모 임상시험을 수행하여 일상생활 능력이 향상됨을 보고한 후 40명의 임상 2상 시험에서 6개월간 치매 증상 억제 효능이 나타남을 2019년 발표하였다.
또한 유니티 바이오테크놀로지(UNITY Biotechnology)와 메이오클리닉(Mayo Clinic)은 노화 세포의 제거 가능성에 대해 세포와 전임상 모델에서 검증된 약물을 이용하여 임상시험을 수행하고 있다. 메이오클리닉에서는 다사티닙(Dasatinib)과 쿼세틴(Quercetin)이라는 약물을 동시에 처리하는 방법으로 노인성 질환인 폐섬유화증과 당뇨성 신장질환 환자 대상 임상시험을 진행하고 있다. 또한 2021년 노화 세포 제거 약물을 통한 역노화 전략은 노화 생쥐의 SARS-CoV-2 감염을 억제할 수 있음이 보고되었으며, 이 약물 중 피세틴(Fisetin)을 이용하여 70명의 임상 2상 시험을 진행하고 있다.
그러나 현재 대부분의 노화 치료제는 노화 자체를 대상으로 하는 약물이 아니라 노화와 관련된 질환을 대상으로 임상시험이 진행되고 있다. 2020년 노인성 질환이 아닌 노화 자체를 대상으로 하는 임상시험 TAME(Targeting Aging with Metformin)이 시작되었다. TAME은 60년간 당뇨 치료제로 활용되면서 안정성이 입증된 메트포르민을 이용한 임상시험이며, 65∼85세의 노인 중 걸음 속도가 느리거나 노인성 질환이 있는 사람 3,000명을 14곳의 병원에서 6년 동안 추적 조사하여 다양한 노인성 질환과 사망률을 측정하는 방식으로 임상시험을 진행하고 있다. 53건의 메트포르민 임상시험을 메타분석(meta-analysis)한 연구 결과에 따르면 메트포르민을 투여하지 않은 정상인보다 투여한 당뇨환자의 사망률이 낮게 나오면서 노화 치료 임상시험에 대한 기대감을 높이고 있다.
다. 국내 현황
고령화가 주요 사회문제로 대두되면서, 경제, 복지 정책뿐만 아니라 과학적 해법에 대한 요구가 증가하고 있다. 2020년 제12회 국가과학기술자문회의 심의회의를 개최하여, ‘대한민국 과학기술 미래전략 2045’를 통해 ‘안전하고 건강한 사회’를 목표로 제시하였다. 8대 도전과제 중 바이오 분야에서 ‘생명과 노화의 원리’, 8대 응용과학 중 ‘질병, 질환으로부터 자유로운 장수시대’를 제시하였다.
고령화가 정부의 주요 의제로 자리 잡으면서 노화과학 연구․개발 투자가 더욱 확대될 것으로 예상된다. 노화 연구 및 치료에 투입된 정부 연구비는 2016년 97억 원에서 2020년 134억 원으로 연평균 8.4% 증가하였으며, 과제 수는 19.6% 증가하였다.
노화분야 부처별 연구․개발 투자현황을 살펴보면 총 8개의 부처에서 수행되고 있으며, 이 중 과기정통부가 282억 원(59.4%)으로 대부분을 투자하고 있으며, 교육부, 산업부, 중기부, 복지부 순으로 높게 나타나고 있다. 노화 연구 R&D에 대한 정부 연구비 투자가 증가하고 있지만 2020년 현재 국가 전체 R&D 투자금액(24조 4,532억 원)의 0.05%로 아직은 매우 적은 비중을 차지하고 있다.
[표 3-21] R&D 예산 투자 현황 및 과제 현황(2016~2020)
(단위: 백만 원, 건)
|
구분 |
2016 |
2017 |
2018 |
2019 |
2020 |
합계 |
|
정부 연구비 |
9,764 |
9,119 |
7,605 |
7,569 |
13,495 |
47,552 |
|
과제 수 |
42 |
50 |
52 |
66 |
86 |
296 |
아직 국내 노화 연구는 암, 혈관, 근육, 피부, 줄기세포 등 노화에 영향을 받는 질환이나 조직에 초점이 맞춰져 있으며, 연구개발의 성격을 살펴보면 대부분의 연구(61.4%)가 원천기술을 발굴하는 기초연구로 진행되고 있으며, 약물 개발과 치료에 중점을 둔 연구는 아직 큰 비중을 차지하지 않는 것으로 보인다.
[표 3-22] 연구개발 단계별 R&D 예산 투자 현황(2016~2020)
(단위: 백만 원, %)
|
구분 |
2016 |
2017 |
2018 |
2019 |
2020 |
합계 |
비중 |
|
기초연구 |
5,375 |
4,762 |
4,342 |
5,132 |
9,601 |
29,212 |
61.4 |
|
응용연구 |
2,158 |
1,512 |
1,934 |
1,738 |
1,959 |
9,301 |
19.6 |
|
개발연구 |
2,213 |
2,397 |
1,317 |
698 |
1,876 |
8,501 |
17.9 |
|
기타 |
17 |
448 |
11 |
0 |
62 |
538 |
1.1 |
|
합 계 |
9,763 |
9,119 |
7,604 |
7,568 |
13,498 |
47,552 |
100.0 |
자료: 국가과학기술지식정보서비스(NTIS).
국내에는 노화 연구만을 전문적으로 수행하는 기관이 존재하지 않기 때문에 대학, 출연연구소, 산업체, 병원 등 다양한 기관에서 노화 연구를 수행하고 있다. 서울대, KAIST, DGIST, GIST 등 여러 대학에서는 노화의 기초기전 연구를 중점으로 수행하고 있으며, 한국생명공학연구원, 한국식품연구원, 한국한의학연구원 등에서는 실용화를 목표로 노화 연구를 진행하고 있다. 또한 한국생명공학연구원과 한국기초과학지원연구원에서는 대표적인 노화 전임상 모델인 노화 마우스의 공급 시스템을 구축하고 있다.
라. 발전 과제
노화는 다양한 노인성 질환의 선행 질환이자 가장 큰 위험요인이기 때문에, 노화 자체를 치료했을 때 여러 노인성 질환의 발병률과 유병 기간을 효율적으로 한 번에 제어할 수 있다. 이처럼 현재 노화 과학은 기초과학 연구에만 국한되지 않으며, 개별적인 노인성 질환 치료를 넘어 노화 자체를 치료하고자 하는 약물의 임상시험이 수행되는 시대가 되었다.
노화는 과학적으로 제어 가능한 질병임을 뒷받침하는 연구 결과가 여러 모델 동물에서 나오고 있지만, 이를 받아들일 사회, 제도적 기반은 현재 미흡하다. 특히 노화 대상 임상시험 수행을 위한 표준 파이프라인이 확립되지 않은 상황이며, 몇 가지 약물이 제한적인 방법론에서 임상시험을 진행하고 있다. 노화가 예방 및 치료 가능한 질병으로 인식되기 위해선 산․학․연․병의 유기적인 시스템 구축을 비롯해 실제 노화의 제어가 근 미래에 가능할 수 있다는 인식 개선을 위한 정책적 노력이 필요하다.
현재 항노화 의약품의 임상시험 효능 등을 평가하기 위해 QALY(Quality-Adjusted Life Year) 및 HYE(Healthy-Years Equivalent) 등의 노화 관련 측정지표가 사용되고 있으나 이는 개인의 주관적 판단에 기반을 둔 것으로서 과학적인 검증이 필요한 의약품 개발을 위해서는 보다 객관적 노화 진단법의 도입이 시급하다. 이를 위해 전임상 모델과 인간 모두에 매칭될 수 있는 표지를 개발하는 것이 중요하다.
현재 국가마우스표현형분석사업단 산하의 분과에서 노화 마우스 마커를 발굴하고자 하는 시도가 이뤄지고 있지만, 생애주기에 걸친 종단 분석과 인간을 대상으로 하는 마커 발굴 작업은 부족하다. 이를 위해선 학․연․병의 유기적인 협력 체계를 구축하여 자연 노화 상황에서 나타나는 표현형, 유전체, 전사체, 단백체, 대사체 등 여러 지표를 측정하고, 이를 데이터베이스화하여 국내 노화 연구 및 치료제 개발 인프라 구축이 시급하다.
노화 연구․개발은 성장단계에 있고 아직 주도적으로 항노화 시장을 이끄는 기업이 없으므로 기존 인력과 장비를 효율적으로 활용한 연구성과 창출로 항노화 시장을 선점할 전략 마련이 필요하다. 현재 연구인력은 대학이 70.0%를 차지하고 있고, 출연연(10.1%), 산업체(8.8%) 순으로 항노화 시장 선점을 위해서는 출연연과 산업체의 연구인력을 균형적으로 양성할 필요가 있다. 정책적 지원으로 노화 분야 연구자를 육성하고, 해외 우수 연구자가 유입될 수 있는 생태계를 구축해야 하며, 노화 분야의 새로운 가능성 등에 대한 연구자와 정부 부처의 적극적인 홍보가 필요하다.
마지막으로 인류 모두가 겪는 질환인 노화 치료제를 빈부격차 없이 공정하게 공급하기 위해선 사회적 합의가 필요할 것이다. 현재 노화 그 자체를 대상으로 임상시험을 진행하고 있는 유일한 약물인 메트포르민의 경우 WHO에서 발표하는 기본적인 건강관리시스템을 유지하기 위해 꼭 필요한 약물의 목록에도 포함되어 있다. 그러나 저비용으로 공급할 수 있기 때문에 다수에게 처방할 수 있다는 장점이 분명히 존재하지만, 수익 창출을 고려하지 않을 수 없는 제약회사 입장에서는 매력이 떨어질 수밖에 없는 약물이기도 하다. 따라서 이러한 윤리적 문제를 고려한다면 노화 치료제는 개별 제약회사보다 정부 주도적인 방식의 개발이 적합할 것으로 예상된다.

1. 합성신약
가. 개요
글로벌 제약시장 규모는 2020년 1조 3,250억 달러 수준이며, 2014∼2019년까지 최근 5년간 연평균 4.7%의 성장률을 기록하고 있다. 국가별 시장규모는 전체 시장의 40% 정도를 차지하는 미국이 1위이며, 그 뒤를 이은 중국, 일본, 독일, 프랑스 등을 포함하여 10위권 국가들은 대부분 선진국으로 구성되어 있다. 국내 제약시장 규모는 2015∼2019년까지 최근 5년간 연평균 7.1%의 성장률을 보이며, 시장규모 12위를 기록하였다.
한편 지난 2년 동안 미국 FDA에 의해 승인된 합성신약(NME)은 2019년 38개, 2020년 40개로 전체 승인된 약물의 79%, 75%를 차지함으로써 여전히 합성신약이 신약개발에서 차지하는 비중이 상당히 높다는 것을 알 수 있다.
암과 희귀질환 치료제 비율이 높았으며 렘데시비르가 첫 코로나19 치료제로 미 FDA 승인을 받았다. 국내 합성신약의 경우 2019년에 SK바이오팜의 수면장애치료제 솔리암페톨, 뇌전증 치료제 세노바메이트가 미국 FDA 승인을 받았다. 바이오마커 기반 환자맞춤형 항암제, 희귀질환 치료제, 코로나19 치료제, 뇌질환 치료제 등이 향후 신약개발의 중요한 화두가 될 것으로 예상된다.
나. 해외동향
(1) 미국 FDA 신약 승인
지난 2년 동안 미 FDA에 의해 승인된 신약은 2019년 48개(합성 : 생물제제 = 79% : 21%), 2020년 53개(합성 : 생물제제 = 75% : 25%) 이며, 이 중에서 합성신약은 각각 38개, 40개였다. 2020년은 코로나19로 인한 어려운 상황임에도 불구하고 53개의 신약이 승인되었는데, 이는 2018년에 이어 역대 두 번째로 높은 수치로 기록되고 있다. 지난 4년간 미 FDA에 의해 승인된 합성의약품과 바이오의약품의 비율은 평균 3:1 정도를 유지하고 있다.

주) BLAs: biologics license applications, NMEs: new molecular entities
자료: Nature Reviews Drug Discovery 2020, FDA drug approvals.
[그림 3-62] 미국 FDA 신약 승인 수(1993∼2020)
2019∼2020년 제약시장에서 여전히 항암제 부분이 가장 높은 시장 점유율과 성장률을 지속하고 있다. 2019년에 승인된 주목할 만한 신약으로는 NTRK(Neurotrophic Tyrosine Receptor Kinase) 유전자 융합과 ROS1(c-ros oncogene 1) 유전자 변이를 바이오마커로 삼은 개인 맞춤형 항암제인 로슈의 엔트렉티닙(Entrectinib)이 있다. 엔트렉티닙은 암의 종류를 불문하고 NTRK 융합유전자 돌연변이를 가진 암 환자에 처방할 수 있는데 이러한 개인 맞춤형 유전자를 대상으로 하는 치료제의 등장은 약물의 처방기준이 이제 질환에서 유전자로 전환되는 시대에 접어들고 있음을 나타내고 있다.
그리고, 애브비의 JAK 억제제 린버크(성분명 우파다시티닙)가 류머티즘 관절염 치료제로 미 FDA 승인을 받았는데 이는 화이자 젤잔즈(성분명 토파시티닙), 릴리 올루미언트(성분명 바리시티닙)에 이은 세 번째 JAK 억제제이다. 현재 시장에서 우위를 점하고 있는 품목은 2016년 가장 먼저 승인을 받은 젤진즈인데 린버크의 가세로 경구용 JAK 억제제 시장의 경쟁이 더욱 치열해질 전망이다.
[표 3-23] 미국 FDA 승인 합성신약(38건) 리스트(2019)
|
일반명 (상품명) |
제약사 |
기전 |
적응증 |
심사형태 |
|
Triclabendazole (Egaten) |
Novartis |
항원충제 |
간 디스토마 |
P,O |
|
Brexanolone (Zulresso) |
Sage Therapeutics |
GABA |
산후 우울증 |
P,B |
|
Solriamfetol (Sunosi) |
Jazz |
GABAA 수용체의 알로스테릭 조절제 |
주간 졸림증 |
S,O |
|
Siponimod (Mayzent) |
Novartis |
S1P 수용제 조절제 |
다발성 경화증 |
S |
|
Erdafitinib (Balversa) |
Janssen/J&J |
FGFR 억제제 |
방광암 |
P,B,A |
|
Tafamidis (Vyndaqel) |
Pfizer/Foldrx |
불안정형 TTR 단백질 생성 억제제 |
트랜스티레틴 매개성 아밀로이드증 |
P,O,B |
|
Alpelisib (Piqray) |
Novartis |
PI3K 억제제 |
유방암 |
P |
|
Bremelanotide (Vyleesi) |
Amag |
멜라노코르틴 수용체 활성화 |
여성 성욕감퇴장애 |
S |
|
Selinexor (Xpovio) |
Karyopharm Therapeutics |
선택적 핵외수송단백질 저해제 |
다발성 골수종 |
P,O,A |
|
Cilastatin;imipenem;relebactam (Recarbrio) |
Merck&Co. |
베타-락타메이스 억제제 |
복잡성 요로감염증․복잡성 복강 내 감염증 |
P |
|
Ferric maltol (Accrufer) |
Shield Therapeutics |
비나트륨 기반 철분제 |
철 결핍성 빈혈 |
S |
|
Darolutamide (Nubeqa) |
Bayer |
안드로겐 수용체 길항제 |
전립선암 |
P |
|
Pexidartinib (Turalio) |
Daiichi Sankyo |
CSF1R 억제제 |
건활막 거대세포종 |
P,O,B |
|
Pitolisant (Wakix) |
Harmony |
히스타민 H3 수용체 길항제 |
주간 졸림증 |
P,O |
|
Pretomanid (Pretomanid) |
Pfizer/Mylan |
다제내성 치료제 |
내성 결핵 |
P,O |
|
Entrectinib (Rozlytrek) |
Roche |
TRK, ROS, ALK1 억제제 |
NTRK 융합 양성 고형암 및 ROS1 양성 비소세포폐암 |
P,O,B,A |
|
Upadacitinib (Rinvoq) |
AbbVie |
JAK-1 억제제 |
류머티스 관절염 |
S |
|
Fedratinib (Inrebic) |
Celgene/BMS |
JAK-2 억제제 |
골수섬유증 |
P,O |
|
Lefamulin (Xenleta) |
Nabriva |
펩티딜 트랜스퍼라아제 억제 |
지역사회 감염 세균성 폐렴 |
P |
|
Gallium dotatoc Ga-68 |
UIHCPET Imaging Center |
세포막 항원 진단 |
신경 내분비종양 진단제 |
S,O |
|
Istradefylline (Nourianz) |
KyowaKirin |
아데노신A2A 수용체 길항제 |
파킨슨병 |
S |
|
Tenapanor (Ibsrela) |
Ardelyx |
NHE3 억제제 |
변비 동반 과민성 대장증후군 |
S |
|
Trifarotene (Aklief) |
Galderma |
RAR-γ 활성화 |
여드름 |
S |
|
Afamelanotide (Scenesse) |
Clinuvel |
melanocortin-1 수용체 작용제 |
적혈구 조혈성 포르피린증 |
P,O |
|
Fluorodopa F-18 |
Feinstein Institutes |
도파민운반체 밀도 측정 |
파킨슨 증후군 진단제 |
S |
|
Lasmiditan (Reyvow) |
Eli Lilly |
세로토닌(5-HT) 1F 수용체 작용제 |
낭성섬유증 |
S |
|
Tezacaftor,elexacaftor,ivacaftor (Trikafta) |
Vertex |
CFTR 단백질 작용제 |
낭성섬유증 |
P,O,B |
|
Air polymer-typeA (ExEm Foam) |
Giskit |
난관 소통 검사제 |
불임 진단제 |
S |
|
Cefiderocol (Fetroja) |
Shionogi |
항생제 내성균 작용제 |
복잡성 요로감염증 |
P |
|
Zanubrutinib (Brukinsa) |
BeiGene |
BTK 억제제 |
외투세포 림프종 |
P,O,B,A |
|
Givosiran (Givlaari) |
Alnylam |
ALAS1 분해 유도제 |
급성 포르피린증 |
P,O,B |
|
Cenobamate (Xcopri) |
SK Life Science |
GABA-A 수용체 조절제 |
뇌전증 부분발작 |
S |
|
Voxelotor (Oxbryta) |
Global Blood Therapeutics |
헤모글로빈 중합 억제제 |
겸상 적혈구 빈혈 |
P,O,B,A |
|
Golodirsen (Vyondys 53) |
Sarepta |
디스트로핀 유전자 작용제 |
뒤센근이영양증 |
P,O,A |
|
Brilliant Blue G (Tissueblue) |
Dutch Ophthalmic Research |
내경계막 염색 |
안과수술용 염색제 |
P,O |
|
Lemborexant (Dayvigo) |
Eisai |
오렉신과 오렉신수용체 |
불면증 |
S |
|
Lumateperone (Caplyta) |
Intra-Cellular Therapies |
세로토닌, 도파민, 글루타메이트 수용체 저해 |
조현병 |
S |
|
Ubrogepant (Ubrelvy) |
Allergan |
CGRP 길항제 |
편두통 |
S |
주) A: Accelerated approval, B: Breakthrough designation, O: Orphan designation, P: Priority review, S: Standard review
자료: Nature Reviews Drug Discovery, 2019, FDA drug approvals.
2020년 신약허가 상황을 보면 항암질환이 여전히 강세를 보였으며 HIV, 에볼라 바이러스, 코로나19 등의 감염질환 치료제와 유전성 희귀질환 치료제가 FDA 승인을 많이 획득하였다. 다발성 경화증 및 관련 질환에 대한 신약이 승인되었으며, 신경계 퇴행성 뇌질환인 파킨슨병에 대한 신약이 등록되어 주목을 받았다. 이외에도 첫 담관암 표적 치료제 페미가티닙(Pemigatinib)을 Incyte사가 개발하여 미 FDA 허가 목록에 이름을 올렸다.
승인된 희귀질환 치료제 중에서 주목할 만한 약물로는 로슈의 자회사 제넨텍이 개발한 척수성 근위축증(SMA: Spinal Muscular Atrophy) 치료제 에브리스디(성분명 리스디플람)가 있다. 에브리스디는 RNA 스플라이싱(pre-mRNA splicing)을 조절하는 올리고핵산 기반 SMA 치료제로서 기존 노바티스와 바이오젠의 치료제가 이미 승인되었지만, 경구투여가 가능한 첫 번째 치료제라는 측면에서 기존 약물 대비 장점이 큰 것으로 평가되고 있다. 척수성 근위축증을 앓고 있는 2개월 이상의 어린이와 성인에게 투여 가능한 치료제로 2026년까지 약 14억 달러의 매출을 기록할 것으로 예상되고 있다.
[표 3-24] 미국 FDA 승인 합성신약(40건) 리스트(2020)
|
일반명 (상품명) |
제약사 |
기전 |
적응증 |
심사형태 |
|
Avapritinib (Ayvakit) |
Blueprint Medicines |
PDGFRA, PDGFRA 돌연변이, KIT 타깃 키나아제 저해제 |
절제불가 전이 위장관 기질종양 |
P,O,B |
|
Tazemetostat (Tazverik) |
Epizyme |
EZH2 저해제 |
상피육종 |
P,O,A |
|
Lactitol (Pizensy) |
Braintree Labs |
삼투성 완하제 |
만성 특발성 변비 |
S |
|
Bempedoic acid (Nexletol) |
Esperion Therapeutics |
ACL 저해제 |
이형접합 가족성 고콜레스테롤혈증 또는 동맥경화성 심혈관질환 |
S |
|
Amisulpride (Barhemsys) |
Acacia |
도파민 D2 수용체 길항제 |
수술 후 구역 및 구토 |
S |
|
Rimegepant (NurtecODT) |
Biohaven |
CGRP 수용체 길항제 |
편두통 |
S |
|
Osilodrostat (Isturisa) |
Recordati Rare Diseases |
코르티솔 합성 저해제 |
쿠싱증후군 |
S,O |
|
Ozanimod (Zeposia) |
Celgene/ Bristol Myers Squibb |
S1P 수용체 조절제 |
다발성 경화증 |
S |
|
Selumetinib (Koselugo) |
AstraZeneca |
MEK1/2 키나아제 저해제 |
1형 신경섬유종증 |
P,O,B |
|
Tucatinib (Tukysa) |
Seagen |
HER2 키나아제 저해제 |
HER2 양성 유방암 |
P,O,B |
|
Pemigatinib (Pemazyre) |
Incyte |
FGFR1-3 키나아제 저해제 |
담관암종 |
P,O,B,A |
|
Opicapone (Ongentys) |
Neurocrine |
COMT 저해제 |
파킨슨병 |
S |
|
Capmatinib (Tabrecta) |
Novartis |
MET 키나아제 저해제 |
비소세포 폐암 |
P,O,B,A |
|
Selpercatinib (Retevmo) |
Eli Lilly/ Loxo Oncology |
RET 키나아제 저해제 |
RET 변이 비소세포폐암 및 갑상선암 |
P,O,B,A |
|
Ripretinib (Qinlock) |
Deciphera |
KIT와 PDGFRA 키나아제 저해제 |
위장관 간질성 종양 |
P,O,B |
|
Fluoroestradiol F-18 |
Zionexa |
방사성동위원소 이용한 질병 진단 |
유방암 진단 조영제 |
S |
|
Artesunate (Artesunate) |
Amivas |
아르테미시닌의 항말라리아 작용 |
중증 말라리아 |
P,O,B |
|
Flortaucipir F-18 |
Eli Lilly |
방사성동위원소 이용한 질병 진단 |
알츠하이머 진단 |
P |
|
Lurbinectedin (Zepzelca) |
Jazz |
알킬화 약물 |
전이성 소세포폐암 |
P,O,A |
|
Triheptanoin (Dojolvi) |
Ultragenyx |
중쇄 중성지방 |
긴사슬 지방산 산화 장애 |
S,O |
|
Fostemsavir (Rukobia) |
ViiV Healthcare |
접착 억제제 |
HIV |
P,B |
|
Remimazolam (Byfavo) |
Acacia |
Benzodiazepine |
진정요법(진통유도) |
S |
|
Cedazuridine; decitabine (Inqovi) |
Otsuka |
Cytidine deaminase 저해제; nucleoside 대사 저해제 |
골수형성 이상증후군 |
P,O |
|
Abametapir (Xeglyze) |
Dr Reddy’s |
Metalloproteinase 저해제 |
머릿니 |
S |
|
Nifurtimox (Lampit) |
Bayer |
Nitrofuran의 항기생충 |
샤가스병 |
P,O,A |
|
Oliceridine (Olinvyk) |
Trevena |
아편 수용체 효능제 |
급성 통증 |
S |
|
Risdiplam (Evrysdi) |
Roche/Genentech |
SMN2 스플라이싱 조절제 |
척수성 근위축증 |
P,O |
|
Viltolarsen (Viltepso) |
Nippon Shinyaku |
Dystrophin 스플라이싱 조절제 |
뒤시엔느 근위축증 |
P,O,A |
|
Clascoterone (Winlevi) |
Cassiopea SpA |
안드로겐 수용체 저해제 |
여드름 |
S |
|
Copper dotatate Cu-64 |
Radiomedix |
방사성동위원소 이용한 질병 진단 |
신경내분비 종양진단 |
P,O |
|
Pralsetinib (Gavreto) |
Blueprint Medicines/ Roche |
RET 키나아제 저해제 |
RET 변이 비소세포폐암 |
P,O,B,A |
|
Remdesivir (Veklury) |
Gilead |
Nucleotide analogue RNA 폴리머레이즈 저해제 |
COVID-19 |
P |
|
Lonafarnib (Zokinvy) |
Eiger |
Farnesyltransferase 저해제 |
허치슨 길포드 조로 증후군 |
P,O,B |
|
Lumasiran (Oxlumo) |
Alnyam |
HAO1 표적으로 작용하는 siRNA |
1형 옥살산뇨증 |
P,O,B |
|
Setmelanotide (Imcivree) |
Rhythm |
MC 수용체 효능제 |
희귀 유전성 비만 질환 |
P,O,B |
|
PSMA-11 Ga-68 |
UCLA |
방사성동위원소 이용한 질병 진단 |
전립선암 진단 |
S |
|
Berotralstat (Orladeyo) |
Bio Cryst |
Plasma kallikrein 저해제 |
유전성 혈관부종 |
S,O |
|
Tirbanibulin (Klisyri) |
Athenex |
Microtubule 저해제 |
광선 각화증 |
S |
|
Relugolix (Orgovyx) |
Myovant Sciences |
GnRH 수용체 길항제 |
진행성 전립선암 |
P |
|
Vibegron (Gemtesa) |
Urovant Sciences |
β 아드레날린 수용체 효능제 |
과민성 방광 |
S |
(2) 블록버스터
(가) 2019∼2020년 개발된 블록버스터 예상 합성신약
동종계열 최초 약물인 혁신신약(first-in-class) 승인의 지속적인 감소가 예상되는 상황 속에서도 2019년과 2020년에 승인된 합성신약 중 10건이 향후 블록버스터 신약이 될 가능성이 높은 것으로 예상되었다.
2019년 승인된 약물 중 예상 매출액이 가장 높은 것은 버텍스(Vertex)사의 낭성섬유증 치료 복합제인 트리카프타(Trikafta)이며, 6년 후 4억 5,000만 달러의 매출이 예상되었다. 2020년도에 개발된 합성신약 중 셀젠/BMS의 다발성 경화증 치료제인 제포지아(Zeposia)는 6년 후 예상 매출액이 2억 5,000만 달러로 2020년에 승인된 약물 중 가장 높았다.
[표 3-25] 개발된 블록버스터 예상 합성신약(2019∼2020)
|
일반명 (상품명) |
제약사 |
작용기전 |
적응증 |
6년 후 예상 매출 (US$ billions) |
|
Tezacaftor,elexacaftor, ivacaftor(Trikafta) |
Vertex |
CFTR 단백질 작용제 |
낭성섬유증 |
4.5 |
|
Upadacitinib (Rinvoq) |
AbbVie |
JAK-1 억제제 |
류머티스 관절염 |
3.6 |
|
Tafamidis (Vyndaqel) |
Pfizer/Foldrx |
불안정형 TTR 단백질 생성 억제제 |
트랜스티레틴 매개성 아밀로이드증 |
1.7 |
|
Voxelotor (Oxbryta) |
Global Blood Therapeutics |
헤모글로빈 중합 억제제 |
겸상 적혈구 빈혈 |
1.5 |
|
Ozanimod (Zeposia) |
Celgene/Bristol Myers Squibb |
S1P 수용체 조절제 |
다발성 경화증 |
2.5 |
|
Rimegepant (NurtecODT) |
Biohaven |
CGRP 수용체 길항제 |
편두통 |
1.6 |
|
Risdiplam (Evrysdi) |
Roche/Genentech |
SMN2 스플라이싱 조절제 |
척수성 근위축증 |
2 |
|
Ripretinib (Qinlock) |
Deciphera |
KIT와 PDGFRA 키나아제 저해제 |
위장관 간질성 종양 |
1.6 |
|
Lurbinectedin (Zepzelca) |
Jazz |
알킬화 약물 |
전이성 소세포폐암 |
1.5 |
|
Tucatinib (Tukysa) |
Seagen |
HER2 키나아제 저해제 |
HER2 양성 유방암 |
1.2 |
자료: Nature Reviews Drug Discovery, 2019, 2020 FDA drug approvals.
(나) 2019∼2020년 매출액 상위 합성신약
2019년 기준으로 의약품 매출액 상위 10위권에서 합성신약은 두 가지 종류가 위치하였다. BMS와 화이자의 항응고제인 아픽사반(Apixaban)이 2019년 7억 9,000만 달러(6위)에서 2020년 9억 2,000만 달러(4위)로 16.1% 증가하였으며, 다발성 골수종 치료제인 레날리도마이드(Lenalidomid)가 9억 7,000만 달러(3위)에서 12억 2,000만 달러(3위)로 매출액이 25.3% 증가하였다. 만성림프구성백혈병 치료제인 이부루티닙(Ibrutinib)은 2020년 84억 달러의 매출을 기록하여 2019년 57억 달러 대비 47.9%나 증가하면서 2019년 14위였던 매출 순위가 2020년 5위로 뛰어올랐다. 안구질환관련 황반변성 치료제 애플리버셉트(Aflibercept), 에이즈 치료제 빅타비(성분명 Bictegravir/Emtricitabine/Tenofovir Alafenamide), 항응고제 리바록사(Rivaroxaban)가 매출이 크게 증가하며 상위권에 합류하였다.
[표 3-26] 매출액 상위 합성신약(2019∼2020)
|
제약사 |
제품명 |
효능․효과 |
2019년 매출액 (US$ billions) |
2020년 매출액 (US$ billions) |
전년대비 증감률 (%) |
|
BMS |
Revlimid(lenalidomide) |
다발골수종 치료제 |
9.7 |
12.2 |
25.3 |
|
BMS/Pfizer |
Eliquis(apixaban) |
항응고제 |
7.9 |
9.2 |
16.1 |
|
Abbvie/J&J |
Imbruvica(Ibrutinib) |
백혈병 치료제 |
5.7 |
8.4 |
47.9 |
|
Regeneron/ Bayer |
Eylea(aflibercept) |
황반변성 치료제 |
7.4 |
8.4 |
13.0 |
|
Gilead |
Biktavy (Bictegravir/Emtricitabine/ Tenofovir Alafenamide) |
HIV 치료제 |
4.7 |
7.3 |
54.5 |
|
J&J |
Xarelto(rivaroxaban) |
항응고제 |
6.8 |
6.9 |
1.9 |
자료: Nature Review Drug Discovery 2019, FDA drug approvals. Evaluate Pharma World Preview 2020.
(3) 질환별 연구개발
최근 5년간 FDA의 신약 허가 현황을 보면 항암제와 희귀질환 치료제가 꾸준히 증가하였다. 2019∼2020년도에도 암과 희귀질환을 대상으로 하는 신약들이 많이 승인되었으며, 이 밖에도 신경 및 정신장애, 감염병, 내분비질환, 자가면역질환 등 다양한 분야에서 새로운 신약들이 승인되었다. 항암제의 경우 면역항암제와 표적항암제가 향후 의약품 시장의 성장을 주도할 전망이다.
지난 5년간의 치료제 분야에 대한 추세를 보면 항암제에 대한 제약업계의 관심은 앞으로도 매우 높아질 것으로 예상된다. 특히 최근 5년 평균을 기준으로 항암제의 FDA 승인 비율은 20% 이상을 차지해 모든 질환군을 통틀어 가장 높은 비율을 차지하였다.
희귀의약품의 경우 과거에는 수익성이 없는 것으로 간주되어 대형 제약사에서 크게 주목받지 못했기 때문에 관련 연구개발 활동은 대부분 소규모 제약사에서 이루어졌다. 그러나 희귀의약품 개발을 독려하는 다양한 규제와 정책이 출현하면서 대형 제약회사들도 진입하기 유리한 환경이 만들어졌고 이들의 시장진입으로 최근 3년간 미 FDA에 의해 승인된 약물의 40% 이상이 희귀의약품으로 분류되고 있다. 글로벌데이터(GlobalData) 자료에 따르면 대형 제약회사는 자체개발보다는 주로 기업 인수합병을 통해 희귀질환 치료제 파이프라인을 확보하고 있으며 희귀질환 관련 혁신의약품은 주로 소규모 바이오텍에서 계속해서 탄생하고 있다.
또한 2020년에는 코로나19 팬데믹으로 인해 코로나19 치료제 개발이 활발히 진행되었으며 길리어드 사이언스의 베클루리주(성분명 렘데시비르)가 2020년 10월에 최초의 코로나19 치료제로 FDA 승인을 받았다. 렘데시비르 이외에도 경구용 항바이러스제 몰누피라비르가 MSD에 의해 개발되고 있다. 몰누피라비르는 리보뉴클레오사이드 유사체로 코로나19 바이러스의 복제를 억제하는 원리로 체내에서 코로나19 바이러스가 복제하는 과정을 차단하는 뉴클리오시드 유사체인 렘데시비르와 유사한 작용기전을 갖고 있다. MSD는 빠르면 2021년 하반기에 몰누피라비르의 긴급 사용승인을 FDA에 신청할 것으로 알려지고 있다.
(4) 산업 동향
코로나19 팬데믹 상황 속에서도 혁신적이고 효과적인 치료제에 대한 지속적인 요구로 글로벌 처방의약품 시장은 지속적으로 성장하고 있다. 합성신약에서 항암제가 가장 높은 시장 점유율과 성장률을 보여주고 있으며 면역항암제와 표적함암제가 향후 항암제 의약품 시장의 성장을 주도할 전망이다. 항암제 외에도 희귀질환 치료제가 주목받고 있으며 희귀질환 관련 정책적 지원과 더불어 FDA나 EMA 등 여러 규제기관에서는 희귀질환 치료제 개발을 촉진하기 위한 다양한 정책지원을 펼치고 있다. 2020년에 성사된 인수합병과 파트너십 내용을 분석해보면 상위 글로벌 제약사들의 항암제와 희귀질환 치료제 개발에 대한 관심이 고조되고 있음을 잘 알 수 있다.
2019년에는 로슈가 글로벌 처방 의약품 매출 1위를 차지하였다. 로슈는 2018년 매출 1, 2위를 차지했던 화이자와 노바티스를 제치고 전 세계 처방의약품 매출액 1위 기업으로 올라섰다. 다발성 경화증 치료제 ‘오크레부스’, 항암제 ‘티쎈트릭’, A형 혈우병 치료제 ‘헴리브라’, 유방암 치료제 ‘퍼제타’의 판매 증가로 앞으로도 견고한 성장세가 예상된다.
2020년 다국적 제약사의 매출은 코로나19의 영향력 속에서도 큰 변동없이 꾸준함을 유지하였다. 2019년 매출 1위였던 로슈 대신에 존슨앤존슨이 매출 규모 1위에 올랐으며 2위에는 로슈가 3위에는 노바티스, 4위에는 머크, 5위는 앨러간을 인수한 애브비가 올랐다.
다. 국내 현황
(1) 합성신약 승인 현황
순수 국내 제약기업이 개발한 신약은 2015년 5개 품목에서 이후 2016년 1개, 2017년 1개, 2018년 1개, 2019년 0개, 2020년 0개로 저조하다. 개발신약보다는 개량신약 위주의 연구개발에 치중하는 경향이 있으며, 연간 1조 매출을 상회하는 글로벌 혁신신약 개발에는 아직 성공에 이르지 못하고 있다. 다만, 유한양행의 비소세포폐암 신약 레이저티닙이 2021년 1월 식약처 허가를 획득하여 국내 31번째 신약이 되었으며 국내 폐암 환자들에게 좋은 치료 대안을 제공할 것으로 예상된다. 또한 레이저티닙은 다국적 제약사 얀센을 통해 글로벌 임상도 진행되고 있어서 세계시장에서도 주목받는 신약이 될 것으로 기대하고 있다.
지난 2년간 식약처 허가를 받은 신약은 개발되지 못했지만 SK바이오팜의 수면장애 치료제 수노시(성분명 솔리암페톨)와 뇌전증 치료제 엑스코프리(성분명 세노바메이트)가 2019년에 미 FDA 승인을 받았다. 이는 2014년 동아ST 시벡스트로(성분명 테디졸리드) 이후 5년 만의 미 FDA 승인 신약으로서 향후 국내 제약․바이오기업의 추가적인 혁신신약 개발이 기대되고 있다.
[표 3-27] 국내 합성신약 FDA 승인 현황(2019∼2020)
|
연번 |
제약사 |
제품명 |
효능․효과 |
허가일자 |
|
1 |
SK바이오팜 |
Sunosi(solriamfetol) |
수면장애 치료제 |
2019. 3. |
|
2 |
SK바이오팜 |
Xcopri(cenobamate) |
뇌전증 치료제 |
2019.11. |
자료: 제약사 및 언론자료 재구성.
(2) 합성신약 매출 현황
국내 개발 신약 중 100억 원 이상의 매출을 올리는 약물을 블록버스터급 신약으로 분류한다. 국산 블록버스터 신약 중 부동의 1위와 2위인 LG화학 제미글로군과 보령제약 카나브군의 2020년 매출액은 각각 890억 원 및 718억 원으로 전년 대비 약 12%씩 증가하였다. 또한, HK이노엔의 케이캡이 전년대비 106.1% 매출이 증가하여 639억 원의 매출을 달성하였다.
그 외 다른 국산 신약들은 상대적으로 저조한 매출을 보이고 있어서 국산 신약의 양극화 현상이 여전한 것으로 나타나고 있다. 다만, 동아ST 슈가논군이 전년대비 51.3%로 크게 매출액이 증가하며 5위로 뛰어올라 향후 매출 추이를 지켜볼 필요가 있다.
[표 3-28] 국내 합성신약 블록버스터 매출 현황(2019∼2020)
(단위: 백만 원)
|
연번 |
제약사 |
제품명 |
2019년 매출액 |
2020년 매출액 |
증감률 (%) |
허가일자 |
|
1 |
LG화학 |
제미글로군 |
79,512 |
89,063 |
12.0 |
2012. 6. |
|
2 |
보령제약 |
카나브군 |
64,102 |
71,828 |
12.1 |
2010. 9. |
|
3 |
HK이노엔 |
케이캡 |
31,026 |
63,945 |
106.1 |
2018. 7. |
|
4 |
일양약품 |
놀텍 |
20,891 |
24,473 |
17.1 |
2008.10. |
|
5 |
동아ST |
슈가논군 |
13,802 |
20,879 |
51.3 |
2015.10. |
|
6 |
대원제약 |
펠루비 |
22,898 |
20,437 |
△10.7 |
2007. 4. |
|
7 |
종근당 |
듀비에군 |
14,459 |
16,419 |
13.6 |
2013. 7. |
자료: 아이큐비아(IQVIA) 데이터 및 언론자료 재구성.
(3) 연구개발 동향
식품의약품안전처와 국가임상시험지원재단이 분석한 임상시험 승인현황에 따르면, 2020년 국내 제약사의 임상시험 승인은 256건이며 그 중 신약은 27.7%인 71건으로 나타났다. 국내 제약사 중에서는 종근당이 가장 많은 임상승인을 신청하였고 글로벌 제약사는 한국로슈였다.
신약에 대한 임상승인 71건 중 합성의약품이 47건(34개 제품)으로 가장 높은 비율을 나타내었고, 바이오의약품 21건(17개 제품), 한약(생약)제제 3건(2개 제품) 순으로 나타났다. 이러한 사실은 미 FDA 승인 의약품 비율에서 나타나는 것처럼 아직까지는 국내에서도 합성의약품 기반의 신약개발 연구 비율이 상대적으로 높은 것을 알 수 있다.
[표 3-29] 제약사(국내, 다국가) 및 연구자 임상 승인 현황(2018∼2020)
(단위: 건)
|
구분 |
제약사 임상 |
연구자 임상(%) |
전체 임상 |
||
|
계(%) |
국내(%) |
다국가(%) |
|||
|
2018년 |
505(74.4) |
223(44.2) |
282(55.8) |
174(25.6) |
679 |
|
2019년 |
538(75.4) |
250(46.5) |
288(53.5) |
176(24.6) |
714 |
|
2020년 |
611(76.5) |
256(41.9) |
355(58.1) |
188(23.5) |
799 |
합성신약 34개 제품을 질환별로 살펴보면 항암제 12개, 소화기계 4개, 중추신경계․근골격계 각 3개, 감염병치료제(항생제 등)․내분비계․비뇨기계 각 2개 제품 등으로 분석되어 국내에서도 항암제 신약개발이 가장 활발한 것으로 나타났다. 반면 바이오의약품 17개 제품의 경우 감염병치료제(항생제 등) 8개, 항암제 6개 제품 등으로 나타났다.
한미약품은 미 FDA 패스트트랙으로 지정된 HER2 Exon20 변이 비소세포폐암 치료제 포지오티닙(Poziotinib) 개발을 계속하고 있으며, 2020년 8월에는 MSD와 비알코올성지방간(NASH) 치료제 후보물질 에피노페그듀타이드(LAPS GLP/글로카곤 수용체 동시 작용제)에 대한 1조 규모의 기술수출 계약 체결에 성공했다. 에피노페그듀타이드는 지난 2015년 HM12525A라는 이름으로 다국적제약사 얀센에 비만․당뇨병 동시 치료제 후보물질로 기술수출 되었다가 반환된 물질이다.
유한양행도 미국 프로세사 파머수티컬(Processa Pharmaceuticals)사와 5,000억 규모의 기능성 위장관 질환 치료신약 YH12852 물질의 기술이전 계약을 체결했다. 오스코텍은 경구용 SYK 억제제 세비도플레닙(SKI-O-703)에 대한 개발을 계속하고 있으며 류머티즘 관절염 및 면역혈소판감소증에 대한 임상시험 외에도 루푸스, 건선, 다발성 혈관염에 대한 연구도 진행 중이다.
(4) 산업 동향
2020년 제약산업 매출 대비 연구개발비 투자비율은 9.73%로 역대 최고 수준이다. 매출 증가에 비해 연구개발 투자가 늘어나면서 최고 수준을 기록했다. 최근 5년 내 매출 대비 투자율은 2019년 8.88%, 2018년 8.82%, 2017년 8.58%, 2016년 8.37%, 2015년 8.66% 등이었다. 연간 매출 대비 연구개발 투자율이 9%를 넘은 적은 단 한 차례도 없었는데 2020년도에 9%를 넘어 글로벌 연구개발 기업의 기준선으로 불리는 10%에 육박하는 기록을 남겼다. 특히 코로나19라는 최악의 상황에서 이 같은 투자가 이뤄졌다는 점에서 의미가 크다고 할 수 있다.
이러한 연구개발 투자 열기는 연구개발 주도 업체들이 투자한 만큼의 성과를 내고 있다는 인식이 확산되면서 산업 전반의 투자 열기를 끌어올리며 실제 R&D 투자기업 저변을 확장시키고 있는 것으로 볼 수 있다. 하지만 여전히 미국, 유럽, 일본의 다국적 제약사와 비교할 때 연구개발 투자 규모 자체는 아직 상당한 격차를 보이고 있는 것이 현실이다.
라. 발전 전망
합성신약을 포함한 신약개발에서 항암제와 희귀질환 치료제가 가장 성장성이 높은 신약개발 분야가 될 것으로 예상된다. 면역항암제 및 표적항암제가 항암제의 시장 성장을 이끌 것으로 보이며 특히 환자유전체 빅데이터를 활용한 바이오마커 발굴 및 이를 활용한 환자맞춤형 신약개발이 점점 늘어날 것으로 예상된다.
한편 기존 합성신약과는 차별화된 표적단백질 분해 약물작용기작을 가진 프로탁(PROTAC), 분자글루(molecular glue) 등에 대한 연구도 활발히 진행되고 있으며, 관련 약물에 대한 임상 결과에 따라 합성신약개발 패러다임에 상당한 변화가 일어날 수 있어서 귀추가 주목되고 있다.
희귀질환의 경우에는 특히 미국을 중심으로 약가 및 개발비용에 대한 세제혜택 등 다양한 정책적 지원이 지속될 것으로 예상되어 전문성을 가진 바이오텍을 중심으로 희귀질환 치료제 개발이 도전적으로 이루어질 것으로 전망된다. 또한 코로나 팬데믹의 지속으로 코로나19 치료제를 포함하는 감염병 연구에 대한 관심이 크게 늘어날 것으로 예측된다.
2. 바이오의약품
가. 서론
바이오의약품은 혈액 제제와 백신을 포함하는 생물학적 제제, 인슐린이나 인간 성장호르몬 그리고 항체 등 유전자 조작기술을 활용한 유전자재조합의약품, 유전병과 암 치료를 위한 유전자치료제, 줄기세포치료제, 바이오시밀러, 그 외 식품의약품안전처장이 인정하는 제제를 포함한다. 의약품과 비교해 제조과정이 복잡하고, 인간 혹은 동물 유래의 세포 혹은 미생물 등의 생물 유래 물질을 응용하여 생산할 수 있다. 전체 의약품 시장에서 바이오의약품이 차지하는 비중은 2012년도에 20%에서 2019년도 29%로 성장했고, 2026년도에는 35%를 차지할 것으로 본다.
나. 해외 동향
(1) 미국 FDA 승인 바이오의약품 분석
미국 식품의약품청(FDA) 의약품평가연구센터(CDER)가 승인한 바이오신약은 2019년도에 총 48개 약물 중 10개, 2020년도에 총 53개 약물 중 13개였고, 2021년도 상반기에는 총 27개 약물 중 6개를 차지하고 있다. 그리고 생물의약품평가연구센터(CBER)는 2020년 1개의 CAR-T치료제를, 2021년에는 2개를 허가하였다.
바이오의약품 중 항체신약의 비중은 80∼90%로 매우 높은데 2019년에는 8개, 2020년에는 12개, 2021년도 상반기에는 5개를 차지하고 있다. 또한 바이오신약 중 항암제가 차지하는 비중이 30∼46%로 높고, 이외에 자가면역질환 등 다양한 분야에서 바이오신약이 승인되었다. 한편 희귀질환 약물의 승인 건수는 2019년도 전체 약물의 43%인 21건에서 2020년도에는 58%인 31건으로 늘어나는 경향이고, 희귀질환 바이오신약은 2019년도 4건에서 2020년도 9건으로 증가하였다. 승인된 바이오신약 중에서 미국 FDA의 신속심사 프로그램인 혁신신약지정(breakthrough therapy designation)을 받은 신약은 2019년도에 4건에서 2020년도에 9건으로 크게 증가하였고, 가속 승인(accelerated approval)된 과제 수는 3건에서 4건으로 비슷하였다. 최근 증가 추세인 항체-약물 결합체(ADC: Antibody-Drug Conjugate) 약물이 두 가지 프로그램에 모두 지정되었고, 암 치료제가 주종을 이루고 있다.
2019년도에는 단일 도메인 항체인 나노바디 약물 카블리비(Cablivi, caplacizumab)가 승인되었고, 3건의 항체-약물 결합체 약물과 IL-13을 표적으로 하는 자가면역증 건선치료제인 스카이리치(Skyrizi, risankizumab)가 허가되었다. 2025년도에 매출 10억 달러 이상의 블록버스터급 약물로 애비사의 스카이리치, 노바티스사의 황반변성 신약 비오뷰(Beovu, brolucizumab), 로슈사의 혈액암 치료제 폴리비(Polyvi, polatuzumab vedotin)를 예상하고 있다. 그리고 노바티스가 개발한 단회 투여 척수성 근위축증(SMA: Spinal Muscular Atrophy) 치료제 졸겐스마(Zolgensma, onasemnogene abeparvovec)가 유전자 치료제로 허가 받았고 이 또한 블록버스터급 약물로 예측하고 있다.
2020년도에는 ADC 약물인 이뮤노메딕스사의 트로델비(Trodelvy, sacituzumab govitecan)와 글락소스미스클라인(GSK)의 블렌렙(Blenrep, belantamab mafodotin)이 각각 삼중 음성 유방암 치료제와 다발성 골수종 치료제로 승인되었다. 또한 호라이즌 테라퓨틱스사의 갑상선안병증 치료제인 테페제(Tepezza, teprotumumab)도 승인되었는데 이 약물들이 블록버스터급 매출을 올릴 것으로 예측하고 있다. 테페제는 IGF-R1을 표적으로 하는 약물로 갑상선안병증의 첫 치료제로 승인되었다.
2021년도 상반기에 허가받은 5개의 항체 치료제 중 하나인 바이오젠사의 아두헬름(Aduhelm, aducanumab)은 베타 아밀로이드를 표적으로 하는 치매 치료제로 가속 승인과정을 통해 허가를 받았다. 그리고 이중항체(bi-specific antibody)로 세번째 약물인 리브레반트(Rybrevant, amivantamab)는 항 EGF-R와 c-Met을 표적으로 엑손 20 삽입변이 비소세포 폐암치료제다. 불일치 복구 결함(dMMR, mismatch repair-deficient) 재발성 및 진행성 자궁내막암 치료제인 젬퍼리(Jemperli, dostarlimab)는 PD-1을 표적으로 하는 항체 약물이고, 진론타(Zynlonta, loncastuximab tesirine)는 CD19을 표적으로 하는 ADC로 미만성 거대 B세포림프종(DLBCL: Diffuse Large B-Cell Lymphoma)의 3차 치료제로 승인받은 11번째 ADC 약물이다. CBER에서는 2종류의 CAR-T 치료제를 승인하였는데, BCMA를 표적으로 한 아베크마(ABECMA, idecabtagene vicleucel)와 CD19을 표적으로 하는 브레얀지(Breyanzi, lisocabtagene maraleucel)이다.
전 세계 의약품 시장에서 가장 많이 팔리는 바이오의약품은 휴미라로 2020년도 매출액이 20억 3,900만 달러이고 키투루다가 14억 3,800만 달러이다. 앞으로 키투루다와 같은 면역항암제와 스텔레라의 매출이 매우 늘어날 것으로 보이며, 특허 만료 오리지널 약물의 매출은 점점 위축되고 있다.
[표 3-30] 매출액 상위 바이오신약(2019∼2020)
|
순위 |
제품명 |
성분명 |
승인 |
개발기업 |
글로벌 매출액 (USBD) |
매출액증가율 (%) |
질환 |
|
|
2019 |
2020 |
|||||||
|
1 |
Humira® |
adalimumab |
2002 |
AbbVie |
19.73 |
20.39 |
3.3 |
류마티스 관절염 |
|
2 |
Keytruda® |
pembrolizumab |
2014 |
Merck |
11.12 |
14.38 |
29.3 |
흑색종, 비소세포폐암 등 |
|
3 |
Eylea® |
aflibercept |
2011 |
Regeneron |
7.99 |
8.36 |
4.6 |
황반변성 |
|
4 |
Stelara® |
ustekinumab |
2009 |
J&J |
6.62 |
7.94 |
19.9 |
크론병, 궤양성 대장염 |
|
5 |
Opdivo® |
nivolumab |
2014 |
BMS |
8.06 |
7.92 |
-1.7 |
비소세포폐암 |
|
6 |
Enbrel® |
etanercept |
1998 |
Amgen |
7.20 |
6.37 |
-11.5 |
류마티스 관절염 |
|
7 |
Prevnar13® |
pneumococcal conjugate vaccine |
2010 |
Pfizer |
5.95 |
5.95 |
0 |
폐렴구균 백신 |
|
8 |
Avastin® |
bevacizumab |
2004 |
Roche |
7.12 |
5.32 |
-25.3 |
전이성 직결장암 |
|
9 |
Ocrevus® |
ocrelizumab |
2017 |
Roche |
3.79 |
4.61 |
21.6 |
다발성 경화증 |
|
10 |
Rituxan® |
rituximab |
1997 |
Roche |
6.54 |
4.50 |
-31.2 |
비호지킨 림프종 |
|
11 |
Remicade® |
infliximab |
1998 |
J&J |
5.03 |
4.19 |
-16.6 |
류마티스 관절염 |
자료: Fierce Pharma.
(2) 항체치료제의 개발 동향
(가) 항체치료제의 성장
항체치료제는 1986년 첫 항체 치료제 OKT3 승인 이후 2021년 100번째 항체신약인 GSK의 젬퍼리가 승인되면서 바이오신약의 주력 제품으로 자리를 잡았고, 2020년도 상위 20위 중 8개 항체약물의 매출이 692억 달러에 달할 만큼 시장규모도 커졌다.
그러나 100개 항체 단백질을 분석해 보면 특정 표적 단백질에 많이 편중되어 있음을 알 수 있는데 10개의 표적 단백질에 42%로 집중되어 있다. 좀 더 살펴보면 PD-1/PD-L1이 7개, CD20가 6개로 많고, TNF, HER2, CGRP/CGRPR, VEGF/VEGFR, IL6/IL6R가 각각 4개씩, IL-23 p19, EGFR, CD19가 각각 3개씩 항체 약물이 허가된 상황이다.
한편 현재 870개 항체 약물이 임상 단계에 있고, 이 경우에도 특정 표적 단백질에 집중되어 있다. 즉 PD-1, PD-L1을 표적으로 하는 항체가 각각 42개, 38개이고, CD3가 71개, HER2가 34개, CTLA-4가 25개, SARS-CoV-2가 22개, 4-1 BB가 19개, EGFR가 17개, CD20가 15개, CD47이 15개 임상 중이다.
최근 들어 항체 개발이 암 치료제에 집중되고 있는데, 2020년도에 임상에 진입한 과제를 보면 106개 과제가 항암치료제이고 다른 질환 분야는 51과제에 머물렀다. 2020년도에는 COVID-19에 관련된 22개 항체 과제가 임상 개발 중이고, 일부는 긴급 사용승인을 받았으나 앞으로의 과제 수는 감염질환의 심각성에 달려 있을 것으로 보인다.
사노피사가 48억 달러에 인수한 아블링스(Ablynx)사는 낙타 항체인 나노바디를 이용하여 희귀 혈액질환 치료제 카블리비(Cablivi, caplacizumab)을 개발하여 2019년도에 승인받았고, 이외에도 여러 기관에서 인간항체의 변형체나 대체 물질을 다양하게 연구 중이다. 엘러간(Allergan, Abbive)사는 다핀(DARPin)이라는 항체 대체 물질을 기반으로 VEGF-A를 억제하는 노인황반변성 치료제 아비시파(Abicipar)를 개발하여 FDA에 제출하였으나 2020년에 거절되었다.
(나) 항체-약물 결합체(ADC: Antibody-Drug Conjugate)
항체-약물 결합체는 암세포에 결합할 수 있는 항체에 독성물질을 결합한 후 환자에 투여하여 암세포를 사멸시키는 새로운 방식의 약물이다. 현재 11개 약물이 미국 FDA의 승인을 받았고, 85개 약물이 임상 개발 중이다. 특히 2019년부터 6개 약물이 허가되었듯이 이 기술을 활용하여 항암제 개발이 최근 활발히 이루어지고 있다.
항체 이외에도 펩타이드, 항체 조각, 합성화합물 등에 독성물질을 결합한 다양한 형태의 약물이 연구개발 중이다. ADC테라퓨틱스사는 2021년도에 미만성 거대 B세포림프종(DLBCL)의 ADC치료제인 진론타를 FDA 승인받았다. 이 약물은 CD19에 대한 첫 ADC이고, 앞으로 CD19 CAR-T 치료제인 킴리아, 예스카타, 브렌얀지 등과의 경쟁이 예상된다.
아스텔라스사의 패드세브가 2019년도에 방광암에 대해 가속 승인을 받은 후 올해 정식 승인을 받았으며, 전이성요로상피암에 대해서도 적응증 추가 승인을 받았다.
한편 길리아드사는 삼중음성 유방암(TNBC) 치료제인 트로델비를 지닌 이뮤노메딕스사를 2020년 210억 달러에 인수하였고, 트로델비는 올해 정식 허가를 받았다. 아스트라제네카사는 다이이찌산쿄사의 기술을 활용한 Her2 양성유방암 ADC치료제에 70억 달러를 투자하여 2019년도에 엔허투 약물을 승인받았고, 이어서 삼중음성유방암 치료제에도 60억 달러를 투자하였다.
한편 머크사는 항 ROR-1 ADC인 VLS-101를 임상 개발 중인 벨로스바이오(VelosBio)사를 21억 5,000만 달러에 인수하였다. 베링거인겔하임도 임상단계의 ROR-1 ADC를 지닌 NBE테라퓨틱스사를 15억 달러에 인수하였고, 중국 씨스톤사는 국내 레고켐과 에이비엘바이오가 연구개발하고 있는 ROR-1를 표적으로 하는 LCB71을 3억 6,000만 달러에 기술이전 받아 임상 준비 중이다.
ADC의 안전성인 치료 범위가 중요하기 때문에 암종 별로, 항원 별로, 가장 최적화된 항체, 링커, 독성물질의 조합을 찾는 일과 고형암을 치료하기 위한 전략이 앞으로 ADC 약물 개발의 최대 관건으로 여겨진다.
[표 3-31] 미국 FDA 승인된 항체-약물 결합체 신약
|
순번 |
제품명 |
성분명 |
승인 |
개발기업 |
표적 |
질환 |
|
1 |
Mylotarg® |
Gemtuzumab ozogamicin |
2000 (2010 취하후 2017 재승인) |
Celltech/Wyeth/Pfizer |
CD33 |
CD33 단백질 양성 급성 골수성 백혈병(AML) |
|
2 |
Adcetris® |
Brentuximab vedotin |
2011 |
Seattle Genetics, Millennium/Takeda |
CD30 |
호지킨 림프종 환자(HL), CD30 양성 말초 T세포 림프종(PTCL) |
|
3 |
Kadcyla® |
Trastuzumab emtansine |
2013 |
Genentech, Roche |
HER2 |
HER2 양성 전이성 유방암(mBC) |
|
4 |
Besponsa® |
Inotuzumab ozogamicin |
2017 |
Celltech/Wyeth, Pfizer |
CD22 |
재발 또는 불응성 전구 B세포 급성 림프모구성 백혈병(ALL) |
|
5 |
Lumoxiti® |
Moxetumomab pasudotox |
2018 |
AstraZeneca |
CD22 |
재발 또는 불응성 털세포 백혈병(HCL) |
|
6 |
Polivy® |
Polatuzumab vedotin |
2019 |
Genentech, Roche |
CD79B |
재발성 또는 불응성 미만성 거대 B세포 림프종(DLBCL) |
|
7 |
Padcev® |
Enfortumab vedotin |
2019 |
Astellas/Seattle Genetics |
NECTIN-4 |
전이성/국소 진행성 방광암 |
|
8 |
Enhertu® |
Trastuzumab deruxtecan |
2019 |
AstraZeneca/Daiichi Sankyo |
HER2 |
HER2 양성 유방암, 위암 |
|
9 |
Trodelvy® |
Sacituzumab govitecan |
2020 |
Immunomedics, Gilead |
TROP2 |
삼중음성 유방암 |
|
10 |
Blenrep® |
Belantamab mafodotin |
2020 |
GlaxoSmithKline |
BCMA (CD269) |
다발성 골수종(MM) |
|
11 |
Zynlonta® |
Loncastuximab tesirine |
2021 |
ADC Therapeutics |
CD19 |
재발성 또는 불응성 거대 B세포 림프종(DLBCL) |
(나) 이중항체(Bi-specific antibody)
이중항체는 한 개의 항체에 두 개의 항원 결합 부위가 있는 항체다. 지금까지 미국 FDA에서 3건의 이중항체 신약을 승인하였고, 160개 물질이 임상 진행 중이다. 처음 승인된 암젠사의 블리나투모맙은 한 부위는 B세포계열 암세포 표면의 CD19에 붙고, 다른 부위는 T세포 표면의 CD3에 붙어 T세포를 끌고 와서 B암세포를 파괴시킨다.
이 기술을 바이트(BiTE: Bi-specific T-cell Engager)라 부르고, 현재 혈액 암에 대해 여러 B세포 항원을 이용한 다양한 BITE가 연구 중이다. B세포 비호지킨림프종(NHL: Non-Hodgkin Lymphoma)의 경우에는 CD19과 CD20를, 급성 골수성 백혈병(acute myeloid leukemia)에는 CD123, CD33, CLEC12A, WT1, FLT3를 표적으로 이용하고 있고, 다발성 골수증(mutiple myeloma)에는 BCMA, CD38, GPRC5D를 활용하고 있다.
CD3 활성화로 인한 부작용으로 사이토카인 방출 증후군(CRS: Cytokine Release Storm)이 생기는데, 스테로이드 약물인 덱사메타손이나 항 IL-6항체인 토시리주맙(Tocilizumab)으로 조절하고 있다. 리제네론사는 보조자극인자(co-stimulatory antigen)인 CD28을 인지하는 부위와 여러 암 표면단백질(전립선암의 PMSA, 자궁암의 MUC16, 고형암의 EGF-R)에 붙는 부위를 지닌 이중항체를 임상 중이다.
올해 승인된 얀센사의 아미반타맙은 암세포의 EGF-R와 c-MET을 동시에 인지하면서 엑손20 변이 비소세포 폐암(NSCLC)에 치료 효과가 좋다. 현재 이 회사는 TKI 계열의 합성의약인 유한양행의 레이저티닙과의 병용요법을 임상 중이다. 이중항체 기술은 암 이외의 질환 치료에도 활용되고 있다. 로슈사의 에미시주맙은 12세 이하 혈우병 치료제로서, 혈액응고인자인 IXa와 응고인자 X에 붙어 응고인자 VIII의 기능을 대신함으로써 출혈을 억제한다.
[표 3-32] 미국 FDA 승인된 이중항체 신약
|
순번 |
제품명 |
성분명 |
승인 |
개발기업 |
표적 |
질환 |
|
1 |
Blincyto® |
blinatumomab |
2014.12. |
Amgen |
CD19, CD3 |
급성 림프구성 백혈병(ALL) |
|
2 |
Hemlibra® |
emicizumab |
2017.11. |
Roche |
activated coagulation factor IXa, factor X |
A형 혈우병 |
|
3 |
Rybrevant® |
amivantamab |
2021. 5. |
Janssen |
EGF-R, c-MET |
엑손20 삽입변이 비소세포 폐암(NSCLC) |
(다) 면역관문억제제(Immune checkpoint inhibitor)
면역관문억제제인 키트루다는 피부암인 흑색종 치료제로 승인된 이래 적응증을 늘리기 위해 지속적으로 임상을 하고 있고, 다른 약물 또는 치료법과 병행하기 위해 다양한 임상을 시도하고 있다. GSK사는 51억 달러에 인수한 테사로(Tesaro)의 약물인 젬퍼리를 2021년도에 자궁내막암으로 FDA허가를 받았고, 대장암, 위암, 비소세포폐암, BRCA 변이가 없는 백금 내성 난소암의 임상 연구를 진행 중이다. T 세포의 또 다른 공동억제수용체(co-inhibitory receptor)인 LAG-3, TIM-3, TIGIT에 대한 연구가 진행되고 있고, 이를 억제하는 항체 약물들이 임상 중이다.
BMS사는 LAG-3 차단 항체인 렐라트리맙(Relatlimab)과 Opdivo와의 2/3상 임상시험 결과를 발표하였고, 이뮤텝(Immutep)의 에프틸라지모드 알파(Eftilagimod Alpha), 노바티스사의 레가미리맙(Ieramilimab), 베링거잉겔하임사의 에자벤리맙(Ezabenlimabe), 엠에스디(MSD)의 파베젤리맙(Favezelimab) 등 13개가 넘는 회사에서 임상 중이다. 또한 대부분 다국적 제약사들은 TIGIT항체의 임상연구도 진행 중이다. 면역관문억제제의 경우 자가면역과 관련된 면역관련 이상반응(immune-related adverse events)을 일으키는데 이를 해결할 필요가 있다.
[표 3-33] 미국 FDA 승인된 면역관문억제제
|
순번 |
제품명 |
성분명 |
승인 |
개발기업 |
표적 |
질환 |
|
1 |
Yervoy® |
ipilimumab |
2011.3. |
BMS |
CTLA-4 |
흑색종 |
|
2 |
Keytruda® |
pembrolizumab |
2014.9. |
MSD |
PD-1 |
흑색종, 비소세포폐암 |
|
3 |
Opdivo® |
nivolumab |
2014.12. |
BMS |
PD-1 |
흑색종, 비소세포폐암 |
|
4 |
Tecentriq® |
atezolizumab |
2016.5. |
Roche |
PD-L1 |
요로상피암, 비소세포폐암 |
|
5 |
Bavencio® |
avelumab |
2017.3. |
Merck KGaA |
PD-L1 |
메르켈세포암, 요로상피암, 신세포암 |
|
6 |
Imfinzi® |
durvalumab |
2017.5. |
AstraZeneca |
PD-L1 |
소세포페암, 비소세포폐암 |
|
7 |
Libtayo® |
cemiplimab |
2018.9. |
Regeneron |
PD-1 |
편평상피세포암, 기저세포암 |
|
8 |
Jemperli® |
dostarlimab |
2021.4. |
GSK |
PD-1 |
자궁내막암 |
(3) 유전자 치료제 개발 동향
(가) CAR-T/NK 치료제
2021년도에 FDA는 브리스톨마이어스스퀴브사(BMS사)에 의해 인수된 셀진(Celgene)사가 개발한 다발성 골수증 치료제인 아베크마를 승인하였다. 이 약물은 BCMA를 표적으로 하는 CAR-T 치료제로 최소한 4회에 걸쳐 다른 유형의 치료제들을 사용했으나 반응을 보이지 않았거나 치료 후 종양이 재발한 성인 다발성 골수종 환자들을 위한 세포 기반 유전자 치료제다.
최근 얀센사와 레전드바이오텍사가 개발하고 있는 또 다른 CAR-T치료제인 실타셀(Cilta-cel: Ciltacabtagene autoleucel)은 3회 이상의 치료를 받았으나 효과를 내지 못한 다발성 골수증 환자군에서 80%의 완전 관해를 보였고, FDA의 우선 심사에 진입했다. ROR-1이 항체-약물 결합체의 표적단백질로 활발히 임상 개발 중이듯이 CAR-T 치료제에서도 온터테라퓨틱스(Oncternal Therapeutics)사와 BMS사가 개발 중이다.
NK세포를 이용한 CAR-NK치료제 개발도 활발히 진행되고 있다. 2020년도에 얀센 파마슈티컬사와 31억 달러 규모의 파트너십을 맺은 페이트테라퓨틱스(Fate Therapeutics)사는 변형된 CD16를 발현하는 NK세포를 유도만능줄기세포(iPSC)에서 만들어 CD20, PD-L1을 표적으로 CAR-NK 치료제 FT516를 B세포 림프종에서 임상 1상 중이다.
[표 3-34] 미국 FDA 승인된 세포기반 유전자치료제 CAR
순번 제품명 성분명 승인 개발기업 표적 질환 1 Kymriah® tisagenlecleucel 2017 Norvatis CD19 급성 림프모구 백혈병
(Acute lymphoblastic, ALL) 2 Yescarta® axicabtagene
ciloleucel, 2017 Gilead CD19 미만성거대B세포림프종(diffuse
large B-cell lymphoma, DLBCL) 3 Tecartus® brexucabtagene
autoleucel, 2020 Gilead CD19 맨틀 세포 림프종
(mantle cell lymphoma) 4 Breyanzi® lisocabtagene
maraleucel, 2021 BMS CD19 미만성거대B세포림프종(DLBCL) 5 Abecma® idecabtagene
vicleucel, 2021 BMS BCMA 다발성 골수종(multiple myeloma)
사노피에서 인수한 키아디스 파마(Kiadis Pharma)는 건강한 공여자(供與者)에서 얻은 NK세포로 CAR-NK 치료제를 임상 2상 중이다. GC녹십자홀딩스와 GC녹십자랩셀이 투자하여 만든 아티바바이오테라퓨틱스(Artiva Biotherapeutics)사도 HER2와 CD19에 대한 CAR-NK 임상을 준비 중이다.
(나) 유전병치료제
미국 FDA는 유전자치료제가 2025년까지 매년 10∼20개 승인될 것으로 예상하였다. 그러나 장기 안전성에 대한 염려로 인해 FDA는 가이드라인을 만들어 유전자 내에 들어가는 벡터와 유전자 편집 기술은 15년간 모니터링을 하고, 아데노부속바이러스(AAV: Adeno-Associated Virus)인 경우 5년 이상 모니터링을 해야 한다고 하였다. 또한 미국 내 임상은 FDA의 허가를 받아야 하고, 연방정부 연구비를 받는 경우 NIH RAC에서 이를 검토한다. 따라서 새로운 모니터링 신기술과 데이터 공유 등을 통해 이 이슈를 풀어가야 할 것으로 보인다.
2021년 2월 블루버드(Bluebird)사는 겸형 적혈구 빈혈증(sickel cell anemia)과 베타 지중해빈혈(beta thalassemia) 유전자 치료제 렌티글로빈(LentiGlobin) 임상 환자에서 급성 골수성 백혈병(AML: Acute Myeloid Leukemia)이 발생하여 임상을 잠정적으로 중단하였다. 이후 분석 결과 VAMP4 유전자에 렌티바이러스 유전자가 삽입되었음을 밝혔고, 이는 AML과 관련성이 매우 낮다고 보았다. 같은 바이러스 벡터를 사용하여 헤모글로빈을 제공하는 유전자 치료제 진테그로(Zynteglo) 개발도 유보하였는데, 최근 관련성이 없는 것으로 보여 올해 미국 식약처에 허가신청 들어갈 것으로 예상된다.
아데노부속바이러스를 이용하여 유전자를 세포 내로 전달하고 있는데, 면역성 유발로 인해 바이러스의 캡시드(capsid) 단백질을 개량하고 있다. 또한 앨라일럼(Alnylam)사의 Si-RNA치료제인 온파트로(Onpattro)의 유전자 전달기술인 지질나노입자(lipid nanoparticle)는 mRNA 코로나 백신에 적용하면서 잘 알려졌고, 이 기술로 다양한 유전자를 생체 내 세포로 직접 전달하는 치료제 및 백신 연구개발을 많이 하고 있다.
(다) 유전자 편집기술(CRISPR)
크리스퍼(CRISPR) 유전자 편집기술은 현재 혈액질환, 암, 만성질환, 안질환, 단백질 폴딩문제 질환에 적용하여 활발히 연구 중이다. 유전자 편집기술을 가지고 겸상 적혈구(sickel cell anemia)로 인한 빈혈, 통증 치료를 위해 크리스퍼 테라퓨틱스(Crispr Therapeutics)사와 버텍스(Vertex)사에서는 돌연변이된 헤모글로빈을 고치기보다 태아 헤모글로빈을 만들 수 있게 체외에서 크리스퍼기술로 편집한 세포 CTX-001을 환자에 투여하였다. 투여 전에 환자의 기존 헤모글로빈을 만드는 줄기세포는 화학요법으로 모두 제거하였다. 그 결과 투여받은 환자에서 모두 일정 수준의 태아 헤모글로빈을 생성하였고, 일부 환자는 1년 뒤에도 유전자 편집이 된 세포를 갖고 있었으며 큰 부작용은 발견되지 않았다.
미국 캘리포니아대학 컨소시엄과 이노버티브제노믹스연구소(Innovative Genomics Institute)는 환자의 줄기세포를 꺼내서 전기천공법(electroporation)으로 크리스퍼 시스템을 넣고 다시 환자에 투여하는 방법으로 화학요법 없이 임상에 진입하였다. 암치료를 위해 PD-1 또는 T세포 수용체(TCR)가 발현되지 않게 유전자 편집을 하여 만든 T세포를 암환자에 투여하는 임상연구도 진행 중이다.
AAV벡터로 레버 선천성 흑암시(LCA: Leber Congenital Amaurosis) 유전병치료제 임상연구를 하고 있는 에디타스 메디슨(Editas Medicine)은 임상 1상을 완료하였고, 인텔리아(Intellia)사와 리제네론사는 트란스시레틴 아밀로이드증(ATTR: Transthyretin Amyloidosis) 치료 물질 NTLA-2001의 임상 1상을 완료하였다. 로커스바이오사언스(Locus Biosciences)사는 요로감염증 치료를 위해 Cas3를 갖고 있는 박테리오파아지를 이용하여 대장균을 제거하는 약물 LBP-EC01의 임상 2상을 준비 중이다. 앞으로 유전자를 편집하는 새로운 기술들(base 편집, prime 편집 등)의 응용도 눈여겨볼 만하다.
(4) 바이오시밀러 개발 동향
2015년 미국 FDA가 산도즈사의 작시오(Zarxio)를 허가한 이래 9개 오리지널 약물에 대해 29개의 바이오시밀러 제품을 승인하였고, 2020년 말까지 18개 제품이 출시되었다. 2019년도에는 10개 제품이 허가되었고, 2020년도에는 3개 제품이 승인되었으며, BLA신청에서 승인까지 12개월 정도 걸렸다.
이외에도 알보텍사(AVT02), 삼성바이오에피스(SB-11), 밀란(MYL-14020) 등이 미국 FDA에 허가 신청하여 승인을 기다리고 있다. 바이오시밀러 제품이 시장에서 차지하는 비중은 항암제의 경우 20%∼40%, 지지요법(supportive care)제의 경우 25%∼52%이다. 항염증제의 경우 Remicade 바이오시밀러가 20% 차지하지만 엔브렐과 휴미라는 특허 문제로 미국 내에서 아직 출시되지 못하고 있다.
[표 3-35] 미국 FDA 바이오시밀러 허가 현황(2019∼2020)
|
순번 |
바이오시밀러 제품명 |
승인시점 |
개발기업 |
오리지널제품 |
|
1 |
Ontruzant(trastuzumab-dttb) |
2019. 1. |
Samsung Bioepis/Merck |
Herceptin |
|
2 |
Trazimera(trastuzumab-qyyp) |
2019. 3. |
Pfizer |
Herceptin |
|
3 |
Eticovo(etanercept-ykro) |
2019. 4. |
Samsung Bioepis |
Enbrel |
|
4 |
Kanjinti(trastuzumab-anns) |
2019. 6. |
Amgen & Allergan |
Herceptin |
|
5 |
Zirabev(bevacizumab-bvzr) |
2019. 6. |
Pfizer |
Avastin |
|
6 |
Ruxience(rituximab-pvvr) |
2019. 7. |
Pfizer |
Rituxan |
|
7 |
Hadlima(adalimumab-bwwd) |
2019. 7. |
Samsung Bioepis |
Humira |
|
8 |
Ziextenzo(pegfilgrastim-bmez) |
2019. 11. |
Sandoz |
Neulasta |
|
9 |
Abrilada(adalimumab-afzb) |
2019. 11. |
Pfizer |
Humira |
|
10 |
Avsola(infliximab-axxq) |
2019. 12. |
Amgen |
Remicade |
|
11 |
Nyvepria(pegfilgrastim-apgf) |
2020. 6. |
Pfizer |
Neulasta |
|
12 |
Hulio(adalimumab-fkjp) |
2020. 7. |
Mylan |
Humira |
|
13 |
Riabni(rituximab-arrx) |
2020. 12. |
Amgen |
Rituxan |
[표 3-36] 미국 내 바이오시밀러 제품 시장 점유율(2020.7.)
|
질병분야 |
오리지널 제품 |
승인제품수 (출시제품수) |
최초 출시 시점 |
바이오시밀러 시장 점유율 |
|
항암제 |
Herceptin® (trastuzumab) |
5(5) |
2019. 7. |
40% |
|
Avastin® (bevacizumab) |
2(2) |
2019. 7. |
40% |
|
|
Rituxan® (rituximab) |
3(2) |
2019. 11. |
20% |
|
|
지지요법제 (supportive care) |
Neulasta® (pegfilgrastim) |
4(3) |
2018. 7. |
28% |
|
Neupogen® (filgrastim) |
2(2) |
2015. 9. |
52% |
|
|
Epogen®/Procrit® (epoetin alfa) |
1(1) |
2018. 11. |
25% |
|
|
염증치료제 |
Remicade® (infliximab) |
4(3) |
2016. 11. |
20% |
|
Humira® (adalimumab) |
6(0) |
- |
0% |
|
|
Enbrel® (etanercept) |
2(0) |
(2023년 예상) |
0% |
다. 국내 동향
(1) 바이오신약 허가 및 연구개발
국내 신약은 지금까지 총 33개가 허가되었고, 2019년도와 2020년도에는 허가된 신약이 없다. 2021년도 상반기에 승인된 신약 가운데 바이오신약으로 코로나바이러스 항체치료제인 셀트리온의 렉키로나와 한미약품의 롤론티스가 있다. 롤론티스는 G-CSF에 한미약품의 랩스커버리 기술을 적용하여 만든 국내에서 승인된 3번째 바이오신약이고, 미국 FDA의 승인을 앞두고 있다.
국가신약개발사업단이 국내 116개 기업을 분석한 자료를 보면 국내 바이오신약 253개 중 연구 단계에 78개, 비임상 단계에 87개, 임상 단계에 85개 그리고 허가준비 단계에 3개로 분류된다.
물질별로 보면 항체치료제가 70개로 전체의 28%를 차지하고, 이어서 단백질 의약이 52개, 유전자치료제가 31개, 세포치료제 30개, 핵산 치료제 25개, 펩타이드 치료제 22개, 항체-약물 접합체 12개 등으로 구성되어 있다.
그리고 질환별로는 암 치료제가 123개로 48%를 차지하고, 대사성질환 26개, 뇌질환 19개, 안질환 17개, 면역질환 15개, 소화기질환 11개, 피부질환 치료제 11개로 나뉜다. 국내 제약사의 임상단계별 해외임상을 보면 임상 0상에 24건, 1상에 14건, 1/2상에 2건, 2상에 16건, 3상에 6건으로 총 62건이다.
셀트리온사는 코로나바이러스 항체치료제 렉키로나의 임상 3상 결과를 발표하였고 유럽 EMA에서 심사 중이다. 파멥신사는 VEGF 수용체에 결합하는 항체인 올린베시맙을 아바스틴으로 치료한 후 재발한 뇌종양 환자를 대상으로 미국과 호주에서 임상 2a상 진행 중이고, 호주에서 전이성 삼중 유방암과 재발성 교모세포종 환자에 키트루다와 병용 투여로 임상 1b상 중이다. 에이비엘바이오사에는 VEGF와 DLL4에 붙는 이중항체 ABL-001의 국내 임상 1상을 완료하였다. 4-1 BB와 다양한 항원에 붙는 항암제 이중항체를 개발 중이며 PD-L1에 붙는 ABL-503과 Claudin18.2에 붙는 ABL-111은 미국에서 임상 1상 중이다. 면역항암제인 ABL-501과 레고켐과 공동개발하는 항체-약물 접합체 ABL-202도 임상을 앞두고 있다. 지아이이노베이션사는 CTLA-4에 붙는 CD80과 인터루킨 2의 변이체를 연결한 이중융합단백질 면역항암제 GI-101의 임상 1상을 미국과 국내에서 시작했고, 유한양행에 기술 이전한 알레르기 치료제 IgE 트랩 항체도 최근 임상 1상에 진입하였다.
유한양행에서 개발한 비알코올성지방간염치료제 YH25724는 GLP1과 FGF21에 붙는 이중융합단백질로서 베링거인겔하임에 기술이전 되었고 임상 준비 중이다. 종근당은 EGF 수용체와 c-MET에 붙는 이중항체를 폐암에서 임상 1상 중이다. 한미약품에서 이중항체 플랫폼 기술인 펜탐바디를 이용하여 PD1과 Her2에 붙는 이중항체를 고형암에서 임상 중이고, 이외에 다른 면역 표적 항암 이중항체를 연구 개발중이다. 한미약품의 랩스커버리를 이용한 삼중작용 바이오신약 HM15211을 비알코올성지방간염 치료제 개발로 임상 2상 중에 있고, 미국 FDA에서 패스트트랙과 희귀질환치료제로 지정을 받았다.
한올바이오파마가 개발한 자가면역질환 치료제 HL-161을 기술이전한 이뮤노반트사는 중증 근무력증과 갑상선 안질환에서 임상 2상 중 콜레스테롤 수치 상승으로 중단하였다가 최근 다시 재개 하였다. 안구건조증 치료제인 HL-036은 임상 3상 준비 중이다. 제넥신은 hyFc 기술로 체내 반감기를 늘린 다수의 유전자재조합 단백질을 임상 중인데, 특히 인터루킨 7과 연결한 GX-17은 다양한 암에서 단독 또는 병용요법으로 임상 1b/2 시험 중이다.
항체-약물 접합체(ADC)의 국내 연구를 보면 레고켐이 중국 푸싱(Fosun)사에 기술 이전한 HER2에 대한 ADC약물 LCB14가 임상 1상 중이고, 레고켐의 CD19, DLK1, ROR1 ADC를 기술 이전해 간 다수의 해외 기업이 임상 준비 중에 있다. 헬릭스미스는 유전자 치료 신약 물질인 엔젠시스(VM202-DPN)의 임상 3-1상 실패를 딛고 후속 임상 3-2상을 진행 중이다. 코오롱생명과학의 인보사는 국내 허가가 취소되었지만 미국 임상 3상을 재개 하였고, 신라젠의 펙사벡은 임상 3상 실패를 겪었다. 유틸렉스는 4-1 BB 항체 개발과 더불어 T세포를 활성화시켜 분리 후 투여하는 세포치료제 EBViNT도 임상 진행 중이다. 와이바이로직스사는 PD-1 항체를 임상 1상 중이고, 신규 면역관문 BTN1A1 항체를 개발 중인 에스티큐브도 임상 준비 중이다. 이뮨온시아사는 PD-L1 항체인 IMC-001을 임상 2상, CD47 항체를 임상 1상 중이다. 국내의 CD19 표적 CAR-T 치료제 개발은 큐로셀의 CRC01이 임상 1상 시험을 허가받았고, 앱클론의 AT101이 임상 신청에 들어갔다. GC녹십자셀은 메소텔린을 표적으로 CAR-T를 개발 중이다.
한편 국내 CAR-NK 치료제 개발도 녹십자랩셀, 앱클론, SL바이젠, 엔케이맥 등에서 연구 중이다. 수지상세포 또는 B세포로 항암 면역세포치료제를 개발하는 박셀바이오, JW크레아젠, 셀리드가 임상 중이다. 마이크로바이옴을 이용한 치료제 개발도 활발한데, 지놈앤컴퍼니의 항암치료제 GEN-001, 고바이오랩의 건선 치료제 등이 미국 임상 중이다. 알테오젠은 ADC 유방암치료제 ALT-P7의 임상 1상을 마무리했고, 바이오베터인 소아용 지속형 인성장호르몬(ALT-P1)의 글로벌 임상에 들어갔다. 또한 히알루로니다아제라고 하는 정맥주사를 피하주사로 바꿔주는 원천기술(ALT-B4)을 개발해 3개의 글로벌 제약사에 기술이전을 하였다.
[표 3-37] 국내기업의 연구개발 단계별 바이오신약 파이프라인
|
연구개발단계 |
파이프라인 수 |
비율(%) |
||
|
연구단계 |
78 |
31% |
||
|
전임상(비임상) |
87 |
34% |
||
|
임상 |
임상 0상 |
|
|
|
|
임상 1상 |
34 |
85 |
34% |
|
|
임상 1/2상 |
6 |
|||
|
임상 2상 |
33 |
|||
|
임상 3상 |
12 |
|||
|
BLA/MAA |
3 |
1% |
||
|
합계 |
253 |
100% |
||
자료: 국가신약개발사업단.
(2) 국내 바이오시밀러 개발 동향
국내에서는 셀트리온사의 렘시마가 바이오시밀러 첫 제품으로 2012년에 식약처의 허가를 받은 후 현재까지 25개 제품이 승인되었다. 2019년도와 2020년도에 국내에서 허가된 바이오시밀러 제품은 다음과 같다.
[표 3-38] 국내 바이오시밀러 허가 현황(2019∼2020)
|
순번 |
바이오시밀러 제품명 |
승인시점 |
개발기업 |
오리지널제품 |
|
1 |
에톨로체(에타너셉트) |
2019. 8. |
삼성바이오에피스(주) |
엔브렐 |
|
2 |
테로사(테리파라타이드) |
2019. 10. |
(주)대원제약 |
포스테오주 |
|
3 |
팬포틴 20000IU(에포에틴 알파) |
2019. 11. |
(주)펜젠 |
이프렉스 |
|
4 |
팬포틴 40000IU(에포에틴 알파) |
2019. 11. |
(주)펜젠 |
이프렉스 |
|
5 |
아달로체(아달리무맙) |
2020. 7. |
삼성바이오에피스(주) |
휴미라주 |
|
6 |
오기브리주(트라스투주맙) |
2020. 8. |
알보젠코리아(주) |
허셉틴주 |
|
7 |
삼페넷주(트라스투주맙) |
2020. 10. |
삼성바이오에피스(주) |
허셉틴주 |
|
8 |
벰폴라(폴리트로핀알파) |
2020. 10. |
(주)유영제약 |
고날-에프펜 |
라. 향후 전망
상위 100대 의약품을 분석해 보면, 2026년 바이오의약품 매출액이 100대 의약품의 55%에 달할 것으로 예상하고 있다.
바이오벤처의 성장이 돋보이고, 출시 후 5년 내 블록버스터급 약물을 출시할 만한 기업으로 다국적 제약사보다는 처음 신약을 출시하는 기업 숫자가 더 많아지고 있다. 전반적으로 약물개발을 지원하는 시스템이 잘 갖춰졌기 때문이라고 본다. 고형암 치료제 개발을 위한 노력이 지속될 것이고, 기존 치료제나 치료법과의 최적 병용 방법을 찾는 과정도 계속될 것이다.
올해 승인된 치매 항체의 승인으로 인해 치매 치료제 분야도 매우 활성화될 것으로 본다. CRISPR, CAR-T, mRNA 치료제 등 새로운 치료법을 도입하여 부작용을 낮추고 효과를 높이는 시도도 이루어질 것이다. 그러나 일부 치료제 가격이 매우 비싸지는 경향이 있어서 이를 해결할 수 있는 사회적 합의와 지혜 또한 필요할 것으로 보인다.
3. 바이오장기
가. 개요
(1) 바이오장기의 정의
바이오장기란 기능을 소실한 인간의 조직과 장기를 복원, 재생, 대체하기 위해 생명 공학적 기법을 이용하여 인간생체와 같은 기능의 장기를 인공적으로 만든 것을 말한다.
줄기세포, 조직공학, 바이오인공장기, 바이오이종장기연구 분야 등을 포함하며, 이를 위해서는 세포활용기술, 유전자편집기술, 이종장기생산기술, 면역조절기술, 장기이식 기술, 생체조직공학기술 등의 생명공학 핵심기술이 요구된다.
(2) 바이오장기의 필요성
인간 수명이 증가하여 고령화 인구가 증가함에 따라 장기부전환자의 수가 기하급수적으로 증가하고 있다. 이 환자들을 치료할 수 있는 유일한 방법이 손상된 장기를 교체해주는 장기이식이지만 타인으로부터 공급되는 장기의 절대수가 부족한 상황이다.
(가) 장기이식 수요 및 공급 현황
국내외적으로 장기이식 대기자 수는 매년 증가하고 있는데 반해 장기공급은 제한적이다. 국내에서 장기이식을 대기하고 있는 환자는 2000년 이후 계속적으로 증가하여 2019년에는 약 4만 253명24)에 이르고 있다. 이러한 장기의 수급 불균형으로 인해 이식 대기 중에 사망하는 환자 또한 증가하고 있는 실정이다.
이 같은 현상은 미국을 비롯하여 전 세계적으로 나타나고 있다. 특히 국내에서는 성인병의 증가, 고령화, 유교문화, 출산율 감소 등의 영향으로 외국보다 이식 장기의 수요와 공급의 불균형 현상이 더 심각하다. 이러한 결과로 불법 장기 매매가 성행하고 있으며, 최근에는 국내보다 의료기술 수준이 낮은 외국에서 장기이식을 받는 사례가 증가하여 심각한 사회문제를 일으키고 있다.
❐ 2019년도 이식대기자 40,253명:2018년 대비 8.2% 증가
∙ 신장 이식대기자 24,786명:2018년 대비 9.8% 증가, 전체 이식대기자의 61.6%
∙ 간장 이식대기자 5,804명:2018년 대비 2.7% 증가, 전체 이식대기자의 14.4%

자료: 국립장기이식관리센터(KONOS), 2019.
[그림 3-63] 연도별 국내 장기 이식대기자 추이(2010~2019)

자료: https://www.organdonor.gov/statistics-stories/statistics.html#glance
[그림 3-64] 미국 내 이식대기자(Waiting List)와 이식환자(Transplants) 수(2020)
(나) 대체장기로서 바이오장기
부족한 수의 대체장기를 확보하는 방법으로 줄기세포 분화, 생체조직공학을 이용한 조직재생, 바이오 이종장기 등이 있다. 줄기세포 분화 분야에 있어서는 조직이나 장기로의 분화 과정, 분화 조건 등에 대한 연구를 통해 뇌, 장관(intestine), 신장, 폐 등의 유사장기(organoids) 개발에 큰 진전이 있었다. 이를 이용하여 질환모델을 개발하거나, 신약 개발을 위한 스크리닝 방법으로 사용되고 있다. 그러나 아직 혈관 생성 등의 여러 가지 문제가 해결되어야 하고 완전한 장기의 형태를 갖추기까지는 더 많은 연구가 필요하므로 대체장기로서 상용화까지는 많은 시간이 걸릴 것으로 예상된다.
또한 세포를 잉크로 사용하는 3D 바이오프린팅과 같은 생체조직 공학적 방법을 이용해 사람의 심장조직(cardiac patch), 젖꼭지, 뼈 등을 생산하는 방법에 많은 진전이 있으나, 복잡한 기능을 수행하는 장기를 제작하는 데에는 아직 해결해야 할 문제들이 많이 있다. 바이오 이종장기는 사람이 아닌 다른 종의 동물(돼지)로부터 이식을 목적으로 생산된 장기를 사람에게 이식함으로써 부전된 기능을 빠르게 회복시킬 수 있기 때문에 시기적으로 볼 때 가장 빠른 시간 내에 대체장기로서의 역할을 수행할 것으로 기대한다.
여러 가지 장기대체 방법의 장단점과 특성을 다음 표에 비교하였다.
[표 3-39] 부족한 장기를 대체할 수 있는 방법
|
기술 |
공급 |
현재 적용 가능 여부 |
극복되어야 할 난관 |
비용 |
|
동종장기 |
제한 |
가능 |
공급/면역거부반응 |
중 |
|
배아줄기세포 |
무제한 |
불가능 |
장기형성/면역거부반응 |
중 혹은 고 |
|
역분화줄기세포 |
무제한 |
불가능 |
장기형성 |
고 |
|
시험관내 기관발생 |
? |
불가능 |
크기/성숙/기능 |
고 |
|
생체내 기관발생 |
? |
불가능 |
성숙/기능 |
? 중 |
|
기계장치 |
무제한 |
가능(심장, 신장) |
독성/내구성 |
고 |
|
바이오이종장기 |
무제한 |
가능(췌도, 각막) |
면역거부반응 |
저 |
자료: Curr Opin Organ Transplant. 2013 April ; 18(2): 179.185.
(다) 바이오이종장기 공급원
사람에게 제공될 장기를 제작하기 위해서는 장기 공급원(동물)이 사람과 생리적인 면에서 유사점이 많아야 하고, 또한 대량 공급을 위해 번식이 잘 되어야 한다. 그러나 사람과 가장 유사한 영장류는 번식에 오랜 시간이 걸리고, 사람에게 치명적인 바이러스를 전이할 위험이 있으며, 전 세계적으로 희귀동물로 지정되었기 때문에 이종장기 제공 대상에서 제외되었다.
미니돼지의 경우 인간과 비슷한 크기의 장기를 갖고 있으며, 생리적으로 유사점이 많기 때문에 현재 가장 많이 사용되고 있다. 또한 어미 1마리가 연간 20마리 이상의 새끼돼지를 생산할 수 있어, 이식용 장기의 대량공급이 가능하며 다른 장기대체기술에 비해 비용이 적게 든다. 또한 간염이나 AIDS 바이러스와 같은 치명적인 감염원의 회피가 가능하다는 장점이 있다.
(3) 바이오 이종장기 산업 발전을 위해 극복되어야 할 난관
(가) 장기이식 거부반응 및 복제 기술의 불안정성
이종장기 이식 후에 일어날 수 있는 주된 문제점으로는 조직의 이식거부반응이 있으며 이것은 동종이식보다 훨씬 빠르고 강하게 일어남이 임상시험을 통하여 밝혀졌다.
이식거부반응이란, 이식된 장기가 수혜자의 체내에서 초급성 거부반응, 급성혈관성 거부반응, 세포매개성 거부반응, 만성 거부반응을 일으켜 장기로서의 제 기능을 하지 못하고 괴사해버리는 것을 말한다. 활발한 연구를 통하여 이러한 이식거부반응의 기전은 비교적 많이 밝혀졌으며 이를 토대로 이식거부반응을 제어하기 위한 유전자 적중기술 및 형질전환돼지의 생산이 연구되어 왔다.
돼지 세포 표면에 존재하는 당(sugar) 성분인 알파-갈(1,3-α-Galactose)에 의해 혈청보체계와 혈액응고계가 활성화되어 이식 후 수 분 이내에 초급성 거부반응이 나타난다. 2002년 미국에서 알파-갈 전이효소가 제거된 형질전환돼지가 개발되었으며,25) 국내에서도 2009년 4월 알파-갈 합성효소 유전자 중 하나가 제거된 미니돼지가 개발되어 초급성거부반응을 극복할 수 있게 되었다.
현재는 CRISPR/Cas-9과 같은 유전자편집 기술의 발전으로 알파-갈 외에 N-glycolylneuraminic acid(Neu5Gc),β-1,4-N-acetyl-galactosamine와 같은 당을 만드는 전이효소가 모두 제거된 형질전환돼지가 개발되어 당 성분이 상이하여 발생하는 대부분의 면역반응을 조절할 수 있게 되었다.

자료: 2015 생명공학백서, 미래창조과학부, 2015.
[그림 3-65] 체세포복제에 의한 형질전환돼지 제조방법
급성혈관성 거부반응은 자연항체, 자연살해세포, 단핵구에 의해 혈관내피세포가 활성화됨에 따라 나타나는 반응이다. 이는 사람의 혈청보체 조절인자, 자연살해세포 억제인자가 발현되도록 형질전환된 돼지를 제작하여 혈관내피세포의 안정화, 내피세포유래 면역 매개물질 조절, 자연살해세포 활성화 억제 및 혈소판 기능조절을 통하여 극복하고 있다.
세포매개성 거부반응은 이종항원에 의해 면역세포가 활성화되어 나타나는 반응으로 동종이식에 사용되고 있는 면역억제방법과 면역관용유도 기술을 통하여 극복하려는 노력이 시도되고 있다.
이와 같이 초급성 거부반응, 급성혈관성 거부반응 및 세포매개성 거부반응을 제어하기 위해 관련 유전자들을 제거하거나 발현시키는 형질전환돼지의 개발이 활발히 이루어지고 있다. 또한, 복제된 동물들이 유산, 사산, 태어난 지 며칠 되지 않아 죽는 등의 문제를 극복하기 위해 형질전환 복제동물의 생산성 안정화 및 생산효율 증진을 위한 기술도 개발 중에 있다.
위와 같이 이종장기 이식에 적합한 형질전환 복제돼지의 생산은 관련 유전자의 발굴, 유전자편집기술, 핵이식 기술 등을 통하여 다양한 종류가 개발되어 있다. 앞으로는 생산된 돼지를 임상적용하기 위한 허가 및 산업화를 위한 연구가 필요할 것으로 전망된다.
(나) 안전성 문제
인수공통감염병원체는 돼지의 무균화를 통해 차단할 수 있다. 그러나 돼지의 내인성 레트로바이러스(PERV)의 경우 바이러스 유전자가 돼지세포의 염색체 내에 삽입되어 다음 세대로 유전되므로 무균화 작업을 통해서 제거되지 않는다. 이는 이종이식의 임상 적용에 있어서 해결해야 할 문제 중 하나로 대두되어 왔다.
그러나 현재까지 다수의 영장류 이식실험과 이종이식을 받은 환자(2005년 중국에서 시행)에서 돼지 내인성 레트로바이러스 감염이 확인되진 않았다. 또한 형질전환 돼지 생산 전문회사인 미국의 eGenesis사는 유전자 편집기술을 이용하여 돼지 내인성 레트로바이러스가 제거된 돼지를 성공적으로 개발하였다.
(다) 법적, 사회적, 생명윤리적 문제
아직까지는 이종이식이 초기 단계인 만큼 이종이식을 수여받은 자들에 대한 추적 관리가 요구될 것으로 전망된다. 이는 수여자들의 혈액이나 조직 기증에 제한되지 않고 성생활이나 출산에도 영향을 미칠 수 있다. 따라서 피험자의 인권 보호를 위하여 사회적, 생명윤리적 공감대를 논의하는 장이 필요할 것으로 생각된다.
미국은 FDA(식품의약청), 유럽은 EMA(European Medicines Agency)가 이종장기를 하나의 의약품으로 취급하여 임상적용에 대한 관리를 하고 있다. 일본은 2013년 11월에 ‘재생의료 등의 안전성 확보 등에 관한 법률’을 제정해 2014년 11월부터 이종이식의 임상적용을 관리하고 있다.
국내의 경우 2019년 8월 27일 ‘첨단재생의료 및 첨단바이오의 약품안전 및 지원에 관한 법률’이 제정되었다. 이 법에서는 첨단재생의료의 안전성 확보 체계 및 기술 혁신, 실용화 방안을 마련하고 첨단바이오의약품의 품질과 안전성확보 및 제품화 지원을 위하여 필요한 사항을 규정하고 있다. 제2조2항은 첨단재생의료의 대상인 ‘인체세포등’을 정의하고 있는데 “인체세포등이란 인체에서 유래한 줄기세포, 조혈모세포, 체세포, 면역세포, 이종세포등 대통령령으로 정하는 세포, 조직 및 장기를 말한다.”로 되어 있다. 2020년 9월 12일에 시행령이 마련되어 이 법의 시행령 하에서 이종이식의 임상적용이 관리될 예정이다.
나. 해외 기술 동향
(1) 형질전환 돼지의 개발
2002년 알파갈합성효소 유전자가 제거된 돼지가 생산된 이래 Revivicor, Avantea 등의 이종이식 관련회사들과 학계를 중심으로 다양한 종류의 형질전환돼지들이 개발되었으나, 기대했던 것만큼 영장류 전임상 결과가 개선되지 않았다. 현재까지 개발된 형질전환 돼지는 특이 당항원을 제거한 유전형질을 기반으로 보체활성 조절(CD39, CD55, CD59), 응고조절(thrombomodulin, EPCR: Endothelial Protein C Receptor), 염증반응조절(A20, TNFR Fc) 등 비특이적인 염증 반응을 제어할 수 있는 유전자를 적중하여 개발되었다.
최근 CRISPR/Cas9에 의한 다중 유전자 조작 돼지 개발 기술이 급속히 발전하면서 형질전환 돼지의 생산 기간이 기존 2∼3년에서 5개월로 획기적으로 단축되었고, 2015년 11월 네이처(Nature)지에서는 이종이식 제2의 전성기가 도래하고 있다고 보고하였다.26) 이러한 전성기를 맞아 United Therapeutics, eGenesis 등 이종이식 전문회사들이 다시 생겨나고 있다. 현재 미국, 호주, 독일, 이태리를 중심으로 다양한 종류의 형질전환돼지가 생산되고 있다.
[표 3-40] 해외에서 개발된 이종 장기이식을 위한 유전자 변형 돼지
|
돼지 내인성 레트로바이러스(PERV)의 제거 돼지 |
|
|
PERV 발현 억제(Knock down) |
(Miyagawa et al., 2005; Dieckhoff et al., 2008; Ramsoondar et al., 2009) |
|
PERV pol 유전자를 전체 유전체 수준에서(Genome-wide) 비활성화 |
(Niu et al., 2017) |
|
다중 유전자변형 돼지 |
|
|
GGTA1-KO / hCD55-tg / hCD59-tg / human fucosyltransferase(HT)-tg |
(Le Bas-Bernardet et al., 2011) |
|
GGTA1-KO / hCD55-tg / hCD59-tg |
(Hawthorne et al., 2014) |
|
GGTA1-KO / hCD46-tg / hCD39-tg |
(Bottino et al., 2014) |
|
GGTA1-KO / hCD46-tg / hTFPI-tg / pCTLA4-Ig-tg |
(Bottino et al., 2014) |
|
GGTA1-KO / hCD46-tg / hTFPI-tg / pCTL4-Ig-tg / hCD39-tg |
(Bottino et al., 2014) |
|
GGTA1-KO / hCD46-tg / hCD55-tg / hCD39-tg / hTBM-tg / hEPCR-tg |
(Iwase et al., 2015) |
|
GGTA1-KO / CMAH-KO / hCD46-tg / hCD55-tg / hCD59-tg / hA20-tg / hHO1-tg |
(Fischer et al., 2016) |
|
GGTA1-KO / CMAH-KO / shTNFRI-Fc-tg / hHO-1-tg |
(Kim et al., 2017) |
|
GGTA1-KO / hCD55-tg / hCD39-tg / hTFPI-tg / hC1-INH-tg / hTNFAIP3-tg |
(Kwon et al., 2017) |
|
GGTA1-KO / hCD46-tg / hCD55-tg / hCD47-tg / hTFPI-tg / hEPCR-tg |
(Iwase et al., 2017) |
|
GGTA1-KO / CMAH-KO / B4GalNT2-KO |
(Dai et al., 2018) |
|
GGTA1-KO / B4GalNT2-KO / hCD46-tg / hCD47-tg |
(Pan et al., 2019) |
|
GGTA1-KO / CMAH-KO / B4GalNT2-KO / hCD46-tg / hTBM |
(Park et al., 2019) |
|
GGTA1-KO / CMAH-KO / A3GALT2-KO |
(Shim et al., 2021) |
자료: Nature 2015;527;152.
(2) 이종이식 전임상 및 임상시험
이종이식 전임상시험 결과를 살펴보면, 이소성 심장의 경우 3년 이상, 동소성 심장의 경우 195일, 신장 1년 이상, 간 25일 이상, 췌도 2년 이상, 각막 2년 이상 등 우수한 성적들이 발표되면서 제2의 이종이식 전성기가 도래하고 있다.
미국 국립보건원은 형질전환돼지의 심장을 개코원숭이의 복부에 이식(heterotopic transplantation)하여 3년간 생존하였다고 보고하였다.27) 최근 독일의 Dr. Brenner 그룹은 형질전환돼지의 심장을 개코원숭이에게 이식하였는데 미국 국립보건원팀과는 달리 흉곽에 원숭이 심장을 제거하고 이식하여(orthotopic transplantation, life supporting) 6개월 이상 생존하였음을 보고하였다.28) 이는 이식된 돼지 심장이 원숭이의 심장을 대신하여 기능을 한 것으로 미국 국립보건원의 결과보다 더 진일보된 획기적인 결과라고 할 수 있다.
일본 오츠카 제약은 2014년에 인수한 LCT사(Living Cell Technologies)를 통하여 이종 췌도 이식 연구를 지속하여 왔으며, 2016년 3월 일본 재생의료학회에서 당뇨병환자에게 돼지의 췌도 세포를 이식한 임상 연구결과를 발표하였다.
(3) 포배 보상법을 이용한 장기생산
최근 포배 보상법(blastocyst complementation) 기술을 이용하여 두 종간 키메라(chimera) 생산이 가능해졌으며,29) 이는 이종면역반응을 근본적으로 동종면역반응과 비슷한 정도로 감소시키는 기술이기 때문에 키메라 돼지 생산은 향후 이종이식의 지향점이 되고 있다.
이런 키메라를 생산하기 위해서는 특정 장기가 결핍된 돼지의 생산이 필요하기 때문에 돼지 줄기세포를 이용한 targeting vector 개발, CRISPR/Cas9 시스템 개발, blastocyst injection 등의 기반기술 개발이 선행되어야 한다. 최근에는 사람의 줄기세포를 이용하여 돼지 배아에서 인간화 심장을 생성하는 기술이 보고되었다.30)
그러나 이런 포배 보상법으로 돼지에서 사람장기를 생산하는 것은 윤리적인 문제를 야기시키는데 사람 줄기세포가 원하는 특정장기로만으로 생성되는 것이 아니라 신경계나 생식기계로 분포되었을 경우에는 돼지 장기에서 사람의 신경이나 태아가 포함된 장기가 발생할 수 있기에 가장 큰 윤리적인 문제로 제기되고 있으므로,31) 향후 이러한 윤리적인 문제 또한 해결해야 할 장벽으로 여겨지고 있다.
다. 국내 기술 동향
(1) 형질전환 돼지의 개발
국내에서는 농촌진흥청에서 주관하는 ‘동물바이오신약장기개발사업단’과 민간기업으로 (주)옵티팜, (주)엠젠바이오, (주)제넨바이오 등의 회사가 형질전환돼지 생산 연구를 진행하고 있다. 국내에서 생산된 형질전환돼지의 현황은 다음과 같다.
[표 3-41] 국내에서 개발된 이종 장기이식을 위한 유전자 변형돼지
|
다중 유전자변형 돼지 |
|
|
hCD46-tg / hCD73-tg |
(축산과학기술연구소) |
|
GGTA1-KO / hCD55-tg |
(엠젠플러스) |
|
GGTA1-KO / hCD46-tg / hTBM-tg |
(축산과학기술연구소) |
|
GGTA1-KO / hCD46-tg / hCD73-tg / hTBM-tg |
(축산과학기술연구소) |
|
GGTA1-KO / hCD39-tg / hCD55-tg |
(옵티팜) |
|
GGTA1-KO / CMAH-KO |
(엠젠플러스) |
|
GGTA1-KO / CMAH-KO / hCD46-tg |
(엠젠플러스) |
|
GGTA1-KO / CMAH-KO / hTBM-tg |
(엠젠플러스) |
|
GGTA1-KO / CMAH-KO / hCD46-tg / hTBM-tg |
(엠젠플러스) |
|
GGTA1-KO / CMAH-KO / B4GalNT2 KO |
(옵티팜, 엠젠플러스) |
|
GGTA1-KO / CMAH-KO / B4GalNT2 KO / hCD46-tg / hTBM-tg |
(옵티팜) |
자료: 바이오이종장기개발사업단
(2) 이종이식 전임상 및 임상시험
‘바이오이종장기개발사업단’은 보건복지부의 지원을 받아 2004년 출범하여 2012년도까지 1단계에서 WHO(세계보건기구)의 장기이식원 권고기준을 만족시키는 미니돼지를 생산하였다. 2013년도부터 시작되는 2단계에는 이종장기용 돼지 생산을 계속하며, 면역거부반응 조절을 통한 이종장기의 전임상 및 임상적용에 대한 연구를 진행하였다.

자료: 바이오이종장기개발사업단 (www.xenokorea.org)
[그림 3-66] 바이오이종장기개발사업단 사업개요
특히 이 사업단은 2020년 8월 사업단을 종료할 때까지 이종장기이식분야에서 세계적 선도그룹으로 인정받았으며, 영장류 전임상시험에서 세계이종이식학회의 이종 췌도이식 임상시험 진입 조건을 충족한 결과를 발표하였다.
아울러 영장류 전임상실험에서 부분층 및 전층각막을 이식하여 2년 이상 각막 투명도를 유지한 결과를 발표하였다. 바이오이종장기개발사업단은 식품의약품안전처의 세포치료제 규제 하에 연구자주도 이종각막 및 이종췌도 임상시험계획서를 2020년 7월 및 8월에 제출하였다.
라. 발전 과제와 전망
(1) 발전 과제
이종장기이식은 인공장기 및 줄기세포 분화 기술을 이용한 장기이식에 비해 빠르게 임상에 적용할 수 있는 기술이다. 최근 영장류 실험에서 이식된 이종장기가 거부반응 없이 장시간 제 기능이 유지되는 것이 관찰되었으며 수혜 동물의 생존기간 또한 연장되었다. 이것은 이종장기이식의 가능성을 입증한 연구였다. 향후 안전하고 투명한 임상시험을 통해 많은 사람들이 혜택을 받을 수 있도록 유전자편집기술, 면역조절기법을 이용하여 위험요소를 낮춘다면 미래에 이종장기이식은 생명을 구하는 치료수단으로 자리 잡을 것이다.
과학기술의 개발과 이종장기이식의 안정성 확보와 더불어 윤리적 문제 역시도 반드시 고려해야 할 사항이다. 연구자들은 이종장기이식이 가져올 수 있는 위험성을 염두에 두고 세계이종이식학회나 WHO에서 제시하는 국제적인 가이드라인에 따라 이종장기의 임상시험을 수행해야만 한다. 뿐만 아니라 이종이식의 안전성을 확보하는 동시에 연구 대상자와 사회를 보호하기 위하여 연구대상자 선정, 임상시험 관리․감독, 공여동물 사육시설 관리 등에 대한 규제를 임상시험 실시 전에 반드시 마련하고 준수해야 할 것이다.
(2) 전망
장기이식 수요의 폭발적 증가에 따른 수급 불균형으로 인하여 바이오 이종장기 시장의 규모는 급속도로 커질 것으로 전망된다. 바이오 이종장기는 장기이식만을 기다리는 환자에게 고통을 덜어주고 희망을 줄 수 있을 뿐만 아니라, 우리나라를 미래 바이오의약품 선진국가로 도약하게 할 미래 산업이 될 것이다. 현재까지 이루어 온 바이오 이종장기 연구성과와 기반시설을 지속적으로 유지 및 발전시키고, 최근 마련된 바이오장기 생산 규제와 가이드라인을 잘 적용시킨다면 향후 학문, 산업, 경제발전에 크게 기여할 것으로 예상된다.
4. 진단 및 의료기기
가. 개요
디지털헬스케어는 건강수명 연장에 대한 관심과 의료비 절감의 필요성, 기술의 발전 등으로 인해 주목받기 시작했으며, 2020년 기준 우리나라 국민의 평균 기대수명은 82.7년으로 OECD 회원국(80.7년)보다 2년 높은 것으로 나타났다.32) 수명이 연장됨에 따라 기대수명에서 건강수명으로 관심 기준이 전환되고 있으며, 또한 조기진단, 치료기술의 발달 등으로 만성질환 의료비 부담이 당면 과제로 부상했으며, 고령화로 인해 의료비 부담 문제도 심화되고 있다.
코로나19로 촉발된 뉴노멀 비대면 헬스케어 서비스의 중심으로 자리 잡은 디지털헬스케어는 의료전달체계의 효율성을 높이고 개인맞춤의료 구현을 목적으로 탄생한 건강관리시스템과 디지털기술의 융합산물로서 코로나19 이전까지의 헬스케어 전달체계, 수요, 급여, 규제 등 전 과정에서 패러다임을 빠르게 전환시키고 있다. 의료현장 수요 중심의 의료기기 및 의료기술 개발과 사업화를 위해 병원과의 연계성과 정보통신기술을 활용한 중개임상 연구가 강화되고 있으며, 코로나19 등 감염병 대응 및 원격의료서비스 제공을 위한 맞춤형 의료서비스 시스템 구축도 추진되고 있다.
디지털헬스케어 분야는 고령화의 가속화와 만성질환자 수의 증가에 따른 공공 및 개인의 의료비 지출 부담을 헬스케어산업 전반의 효율성 개선을 통해 줄이도록 하는 시장의 요구에 따라 임상 적용이 확대되고 있으며, 과거의 치료․병원 중심에서 인공지능(AI: Artificial Intelligence), 빅데이터 분석, 사물인터넷(IoT: Internet of Things), 클라우드 컴퓨팅, 가상․증강현실, 메타버스, 웨어러블 기기, 로봇, 블록체인 등 다양한 첨단 융복합 의료기술의 발전으로 인해 진단․예방․예측․환자 중심으로 의료 패러다임이 급격하게 변화되고 있다. 이러한 변화에 따라 바이오․헬스 시장에서 새롭게 부각되는 제품/서비스 군으로는 기존 의료제품을 대체 또는 보조하여 진료에 활용되는 소프트웨어 의료기기(SaMD: Software as a Medical Device)가 있으며, 이 중에는 비대면으로 우울증, 중독, 외상 후 스트레스 장애와 같은 정신질환 등을 치료하는 치료용 소프트웨어인 디지털치료기기(Digital Therapeutics)도 포함되어 있다.
이와 함께 AI는 의료․헬스케어 영역에서 가용 의료 빅데이터 분석을 통해 환자의 질병 유무를 실시간으로 판단하고 적합한 치료법을 제시해 주는 AI기반 실시간 질병진단 소프트웨어 기술과 시간과 장소에 관계없이 환자의 의료데이터 변화 감시를 통해 환자상태 관리와 적절한 치료시기를 예측하고 질병의 발생과 위험률을 낮추는 환자 데이터 기반 질병상태 실시간 모니터링 기술에 활용되고 있다. 또한 의료 인력과 의료시설․장비 등 중요 의료자원의 효율적 분배 및 활용 지원 등에도 AI가 활용되고 있다.
질병에 대한 이해도 향상으로 유전체정보가 축적되면서 중증․난치성 질환의 발병원인이 유전자 수준에서 규명되고 있어 발병을 예측하고 건강을 관리할 수 있게 되었다. 또한 혁신적인 차세대 유전체 염기서열 분석(NGS: Next Generation Sequencing)기술과 디지털헬스케어 기술 등이 융합한 개인 맞춤형 정밀의료 헬스케어시스템이 떠오르고 있다. 정밀의료는 질병과 예후를 통합함으로써 환자에게 가장 적합한 헬스케어서비스를 제공하는 새로운 개념으로서 유전체 정보, 진료․임상정보, 생활습관 정보 등 의료 빅데이터를 통합 분석해 환자의 특성에 맞는 진료를 제공하게 될 것이며, 의료 빅데이터 분석에는 AI가 활용되어 최고 품질의 정밀의료 기반을 제공하게 될 것이다.
감염병 대응 관련하여 AI는 코로나19 등 시급한 대처가 필요한 감염병 발생 시 확산 추세 파악과 예방․진단․치료 등에 대한 방대한 데이터를 신속하고 정확하게 분석하여 감염병 확산 예측․조기경보를 가능케 한다. 또한, 병원체 구조 및 유전자 분석데이터 등 질병데이터를 활용한 백신․치료제 개발 등 질병 발생부터 치료까지 다양한 단계에서 효율적이고 신속한 대응이 가능하도록 활용되고 있다.
최근 들어 글로벌 의료서비스는 치료 결과를 중심으로 급여체계를 개편하는 가치기반 지불제도(Value-Based Payment System)로 전환되고 있으며, 이는 의료 품질을 높이고 의료비용을 절감하는 의사에게 인센티브를 제공한다는 것이 핵심이다.
IoT 기술이 의료분야에서 활용되기 시작함에 따라 병원은 원격임상 모니터링, 만성질환 관리, 건강상태 모니터링 측면에서 더욱 효율적인 시스템을 구축할 수 있게 되었다. 디지털 기술의 발달과 함께 환자가 생성하는 의료 빅데이터 축적이 중요해지고 있으며, 데이터의 복잡성 및 다양성으로 인해 클라우드 플랫폼 도입의 중요성 또한 부각되고 있다.
정밀의료는 유전체정보 이외에도 다양한 의료 빅데이터가 AI, 디지털헬스케어 기술과 만나 통합 분석된다는 점에서 기존의 맞춤의료와 차별화된다. 정밀의료는 초기 단계의 유망시장으로서, NGS 등 오믹스 분석기술과 빅데이터, AI기술의 발전이 정밀의료 시장의 성장을 견인할 것으로 예측되나, 개인 유전체정보 활용 등 규제 및 윤리적 문제, 표준화 미비, 정밀의료에 대한 고비용과 아직 훈련되지 않은 의사들은 정밀의료 산업 발전을 위해 시급히 개선되어야 하는 과제로 남아 있다.
간편하면서도 높은 정확도가 요구되는 현장진단시스템(POCT: Point of Care Testing)의 수요 또한 지속적으로 증가할 것으로 전망되며, 유전자 POCT와 암 POCT가 핵심 진단서비스 모델이 될 것으로 예측된다. 2020년 미국 FDA는 액체생검 기반의 NGS 동반진단검사법(CDx: Companion Diagnostics Test)을 승인했다. 이는 수십 가지 이상의 돌연변이 바이오마커를 한 번에 검사하며, 혈액을 채취하여 기존 개별검사들의 단점인 시간과 비용 낭비 및 환자의 부담을 줄여주고 빠른 치료 결정에 도움이 될 것으로 판단된다.
최근 들어 의료․헬스케어 분야에 블록체인 기술이 적용되어 의료데이터의 신뢰성 및 보안성이 확보되어, 의료정보 보호 및 환자 건강기록 변조 방지와 탈중앙성으로 인해 블록체인에 추가된 건강기록은 승인된 관련자인 경우 접근 가능한 상호운용성도 확보되어 개인의 의료정보 활용 촉진을 통한 의료정보의 교류 확대도 기대되고 있다.
해외 각국의 의료 관련 업체들은 정부기관, 병원 등과의 협력으로 블록체인 기술을 도입하여 안전하고 정확한 의료정보 활용을 함으로써 환자 중심 의료의 실현과 공공성 확대에 기여할 수 있을 것으로 기대하고 있다. 스마트폰, 웨어러블기기 등을 활용하여 건강이력, 생체정보, 생활습관 정보 등 환자가 자발적으로 생산한 건강데이터(PGHD: Patients Generated Health Data)를 블록체인에 담아 서비스하는 PGHD 데이터 비즈니스가 최근 들어 부각되고 있으며, 이에 따라 개인의 건강관리서비스 지원과 커뮤니티를 통해 난치병이나 희귀질환 환자들의 건강정보를 수집하고, 데이터를 가공해 제약․의료기기 업체나 관련 연구자 등 데이터를 필요로 하는 사람에게 제공하는 업체도 새롭게 등장하고 있다.
디지털헬스케어 분야의 발전을 위해서는 기반기술인 디지털헬스케어 플랫폼 활용을 통한 환자 중심의 의료서비스의 지속적 확대전략이 필수적이라고 판단된다. 아울러 2020년 5월 시행된 ‘의료기기산업 육성 및 혁신의료기기 지원법’의 법적 실효성을 높이려면 미국 FDA 의료기기방사선센터(CDRH) 산하의 ‘Digital Health Unit’과 ‘디지털헬스센터(DHCoE: The Digital Health Center of Excellence)’와 같은 디지털헬스 분야 전담부서를 식품의약품안전처에 신설하여 디지털헬스와 관련한 의료제품의 전문적인 허가 심사와 관리감독 체계를 구축해야 할 것이다.
또한 현행 치료중심의 보험수가(保險受價) 체계와는 별도로 예방과 관리 목적의 디지털헬스케어 제품 및 서비스에 대한 건강보험수가 적용 검토가 필요하다. 디지털헬스케어 혁신 의료기기나 의료기술의 경우 신속한 시장 진입을 위해서는 신의료기술 인증을 위한 임상적 유용성, 안전성, 경제성 등에 대한 입증을 전적으로 업계에만 지워서는 안 될 것이며, 규제기관의 허가를 받은 경우 선시장진입을 허용하고, 재심사 등 사후 모니터링 제도를 활용할 필요가 있다.
코로나19 대유행으로 세계 각국은 정부주도 하에 감염병 확산 저지를 위해 비대면 원격의료의 필요성을 인정하고 법․제도적 근거 마련을 통해 서비스를 권장하고 있다. 우리나라도 코로나19 확산으로 만성질환자, 가벼운 증세의 환자 등은 의료기관이 전화로 상담, 처방, 대리처방을 할 수 있도록 의사와 환자 간 비대면 원격의료 범위를 2020년 2월부터 한시적으로 허용하고는 있으나, 의료법에 따라 서비스 확대는 제한되고 있다.
의료 빅데이터 활용, 오진, 대형 병원 선호, 의료민영화 등 법제도 및 사회적 이슈로 인해 현재까지 원격의료의 활성화 및 산업화에는 한계가 존재하고는 있으나, 글로벌 디지털헬스케어 분야 성장의 메가트렌드에는 발맞춰야 할 것이다.
원격의료 중 원격모니터링은 의료인이 고혈압이나 당뇨 등 만성질환 환자의 질병 상태를 지속적으로 점검하고, 상담 및 교육 등을 통해 관리하는 서비스로서 최근 정부는 의료기관 내원을 통해 명확한 진료를 받아볼 것을 권유하는 행위는 의료 행위에 해당하지 아니한다고 해석하고 있다.
지금까지 우리나라에서는 원격의료 도입으로 기대되는 이익보다 우려가 더 컸지만 코로나19 상황에서는 원격의료 도입에 대해 논의할 시점이며, 현재 보유하고 있는 의료자원을 효율적으로 활용한다면 원격의료시스템을 정착시킬 수 있을 것이고, 의사들과 환자들의 의견 수렴을 통한 합리적인 원격의료시스템이 구축될 수 있을 것이다. 이를 위하여 원격진료는 대면진료를 비대면으로 대체하는 것이 아니고 기존 진료를 보완하고 시너지를 창출하는 역할로 이해될 필요가 있다. 비대면 진료가 오진 등 의료사고 가능성이 높다는 것은 사실이며, 그럼에도 감염 차단, 환자 편의 등을 위해 선택한 만큼 그에 따른 오진 등 의료사고에 대한 책임도 의료기관에만 지워서는 안 될 것이다.
코로나19로 한시적으로 허용되거나 규제 샌드박스 등으로 조건부 허가된 비대면 의료, 디지털헬스케어 기반 건강관리서비스 등에 대한 안전성․유효성, 환자 만족도 등을 검증할 수 있는 기회를 활용하여 관련 규제 개선 및 합리화가 시급한 현실이다. 검증할 수 있는 다양한 객관적 자료를 기반으로 이해관계자 간 의견대립을 조정․합의하는 공론의 장의 활성화를 통해 사회적, 국민적 의식 변화를 논의하고 혁신적인 제품/서비스에 대한 시장 조기 진입을 지원할 수 있는 선제적인 인․허가제도 도입을 통해 관련 제품/서비스 경쟁력 확보를 위한 실질적인 제도적 기반 마련도 필요하다.
정부는 디지털헬스케어 활성화 및 산업 성장을 위한 국가 비전과 목표 및 발전전략 등을 수립하고 민간 협력체계 구축을 기반으로 사업 발굴 및 투자를 확대할 필요가 있으며, 규제의 적용을 베네핏-리스크 기준(benefit-risk ratio)에 근간을 두고 민간과 함께 공동 인프라 구축, 제도개선, 서비스 모델 개발․검증 등을 통하여 시장경제 중심의 합리적이고 유연한 규제 정립이 필요할 것이다.
나. 디지털헬스케어 분야 해외 혁신동향
(1) 미국
① 미국 국립보건원(NIH)의 ‘올오브어스(All of Us)’프로그램
올오브어스 프로그램은 미국 정부의 정밀의료 연구프로젝트로서 전국 각지의 참여자들의 설문조사, 전자건강기록(EHR: Electronic Health Record) 등을 통해 시간이 지남에 따라 변하는 건강정보를 수집하고 연구자들에게 공유하는 것이다. 일부 참여자에게서는 혈액과 소변 샘플도 채취하며, 연구자들은 이 데이터를 활용하여 생물학과 행동양식, 환경이 건강과 질병에 어떻게 영향을 미치는지 연구하게 된다.
2018년 5월 공식적으로 참가자 모집을 시작했고, 2024년까지 100만 명을 모집하는 것을 목표로 한다. 미국의 의료보험체계는 사보험 중심으로 운영되고 있기 때문에 미국 정부는 규제 혁신을 통한 민간 중심의 디지털헬스케어 연구개발 및 활성화를 유도하는 동시에 의료데이터 통합처럼 정부 차원의 정책 추진이 불가피한 영역의 경우 정부 주도로 정책을 추진하는 병행 전략을 구축하고 있다.
일례로 2017년 미국 FDA에서 발표한 ‘디지털헬스 혁신전략 계획(Digital Health Innovation Action Plan)’에서 소프트웨어 의료기기에 특화된 사전인증 프로그램을 운영함으로써 ‘사전인증(pre-cert)’등을 통해 디지털헬스케어 관련 규제와 진입장벽을 완화하여 민간의 사업 참여와 투자를 유도하는 한편, 정밀의료계획(PMI: Precision Medicine Initiatives)의 핵심 요소로서 ‘올오브어스’와 같은 미국 국민의 각종 의료데이터를 수집․통합․분석하기 위한 프로그램은 정부의 과감한 투자를 통한 정책으로 추진하고 있다.
② 미국 식품의약국(FDA) ‘디지털헬스센터(DHCoE)’ 설립
미국 FDA는 2020년 디지털헬스 분야에 대한 제도정비로 규제와 감독을 동시에 할 수 있는 지원과 혁신을 통해 의료관계자는 물론 환자들에게 보다 나은 디지털헬스케어 환경을 제공하는 것을 목표로 의료기기․방사선 보건센터(CDRH: Center for Devices and Radiological Health) 내에 디지털헬스센터를 설립했다. 이번 설립으로 FDA는 의료용 모바일 헬스기기, 소프트웨어 의료기기(SaMD), 웨어러블 의료기기 등 디지털헬스 분야의 발전을 적극 추진하고 있다.
③ 미국 보험청(CMS: Centers for Medicare & Medicaid Services)의 신기술 추가지불 보상제도
2020년 신기술 추가지불 보상제도(NTAP: New Technology Add-on Payment)를 통해 Viz.ai의 AI 소프트웨어 의료기기인 뇌졸중 CT 플랫폼은 CMS로부터 신규성(newness), 진료비용(cost), 상당한 임상개선(substantial clinical improvement)의 3가지 기준 충족을 인정받아 AI가 탑재된 의료기기로는 최초로 메디케어 NTAP 보험급여를 받게 되었다. NTAP는 현저한 임상 개선을 입증한 최첨단 기술의 도입을 뒷받침하고 메디케어 환자에게 조기 이용 가능성을 보장하도록 마련된 제도이다.
(2) 독일
2019년 독일 의회는 디지털헬스케어법(DVG: Digitale-Versorgung-Gesetz) 채택을 통해 원격의료 이용을 장려하고 연구목적 의료데이터의 활용을 보장할 뿐만 아니라 아니라 법정 건강보험(Statutory Health Insurance)이 적용되는 모든 국민에게 디지털건강앱(DiGA)에 대한 혜택을 받을 수 있는 권한을 부여하고 있다.
주요 내용으로는 2021년 1월 1일부터 법정 보험회사는 고객에게 전자의무기록을 제공해야 하며, 의사나 병원 및 약국과 같은 의료서비스 제공자는 환자 요청 시 의료행위 및 약물 등에 관한 데이터를 제공할 의무를 규정하고 있다. DiGA의 처방 및 급여화를 통해 질병의 예측과 치료를 지원하고, 환자가 건강한 생활습관을 유지할 수 있도록 하고 있다.
DiGA는 위험도가 낮은 의료기기만 해당되며, EU가 정한 의료기기지침(MDD)에 따르면 Class I 및 Class IIa 의료기기(낮음에서 낮음/중간 위험, 측정기능 포함 또는 미포함)에 해당된다. 아울러 DiGA는 환자 또는 환자와 의료서비스 제공자가 함께 사용해야 한다.
(3) 영국
영국은 보건부 산하에 디지털헬스케어 추진을 위한 전문 조직인 ‘NHS(National Health Service)’를 운영하고 있다. NHS는 디지털 혁신기술을 활용해 영국의 공공 보건과 의료서비스 당면 과제를 해결하고자 다수의 글로벌 기업과 협력하여 ‘디지털헬스케어 테스트베드’ 사업을 진행하고 있다.
NHS의 주요 디지털헬스케어 사업은 의료데이터 분석을 통한 환자 모니터링 및 만성질환 예측, 웨어러블 기반 모바일 건강관리 등이다. 우선적으로 노인과 만성질환자, 정신질환자를 주요 대상으로 사업을 추진 중이며, 지속적인 테스트베드 사업을 통한 검증을 거쳐 향후 다른 영역으로 점차 확대해 나갈 계획이다.
(4) 핀란드
핀란드는 1950년대부터 세계 최초로 국가 차원으로 환자의무기록을 수집․관리해 왔으며, 암정보보관기록소도 설립․관리하고 있다. 정부 주도의 환자의무기록 통합관리시스템 구축으로 세계 최고 수준의 환자 전자의무기록 비율을 유지하고 있다.
2013년 인체 시료를 활용한 연구 지원을 위해 ‘바이오뱅크법(BioBank Act)’을 시행했으며, 이를 기반으로 국가 차원의 바이오뱅크 구축을 통해 의료기관뿐만 아니라 법규정에 따라 민간기업도 비식별화된 의료데이터를 활용할 수 있도록 허용하고 있다.
2018년에는 국민의 유전자정보를 관리하는 기구인 ‘국립유전자센터(National Genome Center)’를 개소했다. 아울러 정부 차원에서 국민의 보건의료데이터를 활용해 국가 주도의 디지털헬스케어 사업으로 원격의료 전문병원인 ‘가상병원(Virtual Hospital)’을 도입하고, 의료서비스의 접근성 향상과 디지털 기술을 활용한 의료서비스의 품질 제고를 추진하고 있다.
(5) 호주
호주는 정부 주도로 설립된 ADHA(Australian Digital Health Agency)를 통해 국가 차원의 디지털헬스케어 서비스 설계 및 정책의 발전방향을 수립하고 있다. 이를 통하여 디지털헬스케어 시스템의 효과성 및 효율성 제고와 수요자 관점과 만성질환 및 전염병 관리 등 질병중심의 설계, 정밀의료 및 신의료기술 육성을 지원하고 있다.
이러한 원칙 하에서 ADHA는 국가의료정보 통합플랫폼인 ‘마이 헬스 레코드(My Health Record)’를 운영하고 있으며, 국가에서 운영하는 디지털헬스케어 플랫폼을 통해 전 국민이 생애 주기에 걸쳐 자유롭고 안전하게 혁신적인 의료서비스를 받을 수 있도록 하였다.
다. 디지털헬스케어 분야 국내 혁신동향
AI 활용 진단보조소프트웨어, 모바일 의료용 앱, 가상․증강현실프로그램, 디지털치료기기 등 소프트웨어의료기기는 PC․모바일기기․웨어러블기기 등 범용 하드웨어에 설치해 사용하는 독립형 소프트웨어로서 전통적인 하드웨어 의료기기와는 달리 기존의 허가심사․인허가․사후관리 규제체계를 적용하는 것이 불가능하다. 이에 따라 미국 등 선도국가들은 소프트웨어의료기기 특성에 맞는 임상시험․허가심사․인허가․품질관리․사후관리 등에 대한 새로운 규제체계를 마련하고 전담조직을 신설하여 운영 중이다.
우리 정부에서도 디지털헬스케어 산업 생태계 활성화 및 기업 지원을 위해 다양한 정책을 추진 중에 있으며, 특히 4차 산업혁명위원회 산하 ‘헬스케어특별위원회’ 주도로 헬스케어산업 발전전략을 발표했고, 최근 한국판 뉴딜 종합 계획 내에 ‘스마트의료 인프라’ 정책을 통한 헬스케어시스템 구축 등 다양한 정책을 추진 중이다.
식품의약품안전처에서는 2020년 4월 식품의약품안전평가원 의료기기심사부 ‘디지털헬스기기TF’를 신설하여 질병의 예방․관리․치료에 대한 임상적 유효성 입증 등 소프트웨어 의료기기에 특화된 허가심사 규제와 가이드라인 마련을 위해 선제적으로 대응하고 있으나 정규 직제 조직이 아니라 전문 인력에 의한 합리적인 규제 마련에는 한계가 있는 현실이다.
소프트웨어 의료기기는 하드웨어에 종속되지 않고 의료기기의 사용 목적에 부합하는 기능을 갖는 독립적 형태의 소프트웨어만으로 이루어진 의료기기로서 약물중독이나 우울증 등 정신․신경계질환 등 다양한 질환 치료에 적용할 수 있다. 또한 인허가 시 비임상 단계가 없어 기존 신약개발에 비해 비용이나 시간이 적게 소요되는 장점이 있으나 인허가 이후 보험급여 여부가 제품 상용화에 직결되는 만큼 식품의약품안전처, 보건복지부, 한국보건산업진흥원, 건강보험심사평가원, 한국보건의료연구원 등 범부처 협의체 운영으로 인허가, 신의료기술, 보험급여 등 제품 개발부터 상용화까지 선제적 지원이 필요하다.
식품의약품안전처는 그간 국제의료기기규제당국자포럼(IMDRF) 인공지능 의료기기 실무그룹 결성 및 의장국 선출, 인공지능 제품화 지원을 위한 임상시험 작성 가이드라인 개발, 의료기기 분류에 디지털치료기기 등 소프트웨어 품목 90개 신설, 혁신의료기기소프트웨어 허가심사 특례 및 전주기 관리방안, 혁신의료기기소프트웨어 중대한 변경사항 가이드라인, 혁신의료기기 단계별 심사 가이드라인, 가상증강현실 적용 의료기기 허가심사 가이드라인, 의료기기 사이버보안 허가심사 가이드라인, 디지털치료기기 허가심사 가이드라인(영문본 포함) 등을 마련하여 소프트웨어 의료기기 분야에 대한 선제적 지원을 추진 중에 있다.
보건복지부에서는 AI 등을 이용한 의료기술이 기존 진단․치료를 뛰어넘는 새로운 가치를 입증한 경우 건강보험에서 별도 수가를 지급할 것으로 전망되며, 관련 법령 등에서 정한 혁신․첨단의료기기를 활용한 기술 등이 그 대상이다.
절차는 신의료기술 고시 뒤 요양급여 여부 결정을 신청한 경우 보건당국이 평가하게 되며, 현재 ‘혁신적 의료기술의 요양급여 여부 평가 가이드라인’(영상의학 분야의 인공지능 기술이 적용된 의료기술 급여 여부 평가 가이드라인)을 마련하여 건강보험등재 평가 과정에서 활용 중이다.
가이드라인의 급여보상 원칙은 환자에게 이익이 되는 요소가 클수록 별도 보상이 고려될 수 있다. 즉, 기존 의료 행위와 비교해서 환자에게 이익이 되거나 비용 절감 효과가 있다고 판별되는 경우에는 급여항목이 신설되거나 급여를 가산하는 등의 방식으로 보상하게 되며, 혁신적 의료기술이 기존 의료인이 제공하지 못하는 새로운 의학적 정보를 제공하거나, 기존 진단․치료의 효과를 유의미하게 향상시키는 등 편익이 있는 것으로 입증되면 진료항목을 신설하는 방식으로 보상하게 된다.
아울러 보건복지부는 의료분야 마이데이터 사업을 준비 중에 있다. 마이데이터 사업은 개인정보 자기결정권에 의해 자신의 의료데이터를 한곳에 모아 관리하고, 원하는 진료나 건강관리서비스에 활용하는 것으로서 가명 정보 활용 빅데이터와 달리 식별 가능한 본인의 정보로 스스로 개인 맞춤형 서비스를 제공받기 위해 활용할 수 있다. 정부는 의료데이터 제공 항목을 단계적으로 확대하여 마이데이터 활용 활성화를 위한 ‘마이헬스웨이 플랫폼’을 구축할 계획이다.
라. 발전 전망
범부처 차원의 의료제품 규제 합리화 정책을 통해 어느 정도의 시장 활성화는 기대할 수 있겠지만, 근본적으로 자생력을 갖춘 경쟁력 있는 생태계를 조성할 수 있을지에 대하여는 다소 회의적인 시각이 있다. 특히 다양한 산업과 기술이 융합되는 디지털헬스케어는 사업 참여자들이 자유롭게 시장에 참여하고 경쟁할 수 있는 개방형 생태계 조성과 이를 위한 법․제도적 기틀 마련이 핵심 요소이나, 우리나라는 여전히 전 세계 디지털헬스케어 시장의 핵심 사업모델인 원격의료와 소비자 의뢰 유전체분석(DTC) 등을 강력히 규제하고 있어 관련 글로벌 혁신기업의 활발한 시장 참여 및 투자에 큰 제약이 존재하는 실정이다. 또한 최근 AI 기반 의료기기가 식품의약품안전처로부터 허가를 받았으나 신의료기술로 인증받지 못해 수익모델 확보가 어려운 사례도 있다.
아울러 정부의 핵심 정책은 혁신․첨단 의료기기의 신속한 시장 진입 지원이나, 국민건강보험의 보장성 강화 정책에 따른 기존 비급여 항목의 급여화 정책 기조 하에서 혁신․첨단 의료기기/기술은 개발 후 급여에 편입되거나 그렇지 못한 경우는 시장 출시가 어려울 수 있다. 또한 우리나라는 공공 중심의 의료보험 체계로 저비용․고효율을 지향하는 시스템으로서 한정된 재원으로 다양한 의료서비스를 지원해야 하기 때문에 고비용 첨단 의료기기/기술에 대한 급여화는 어려울 수 있다. 이러한 측면에서 혁신․첨단 의료기기/기술의 경우 임상적 유용성, 안전성, 경제성 등에 대한 입증에 대해서는 정부 차원의 인프라 제공 등의 지원이 필요할 것으로 사료된다.
의료 분야의 혁신은 의료법 개정, 의료보험 수가체계 개선 등의 이슈로 결코 쉽지 않을 수 있으나 정부가 국가 차원의 의료혁신을 위한 명확한 전략의 방향성 제시와 개방형 플랫폼을 제공하고, 민간이 이를 달성하고 구현하기 위한 구체적인 기술과 사업모델을 개발하여 제공하는 협력 파트너링 구조가 실현된다면 혁신․첨단 의료기기/기술의 유의미한 가치가 우리 국민들에게 좀 더 가까이 다가올 수 있지 않을까 기대해 본다.
5. 감염병
가. 서론
(1) 감염병의 위협
감염병은 지난 수십 년 동안 계속 증가해 왔으며 국제 공중보건에 위협이 되고 있다. 감염병의 확산 요인으로는 인구 증가와 그에 따른 환경적 부담, 기후변화, 밀집된 도시화, 강제적 또는 자발적 국제 여행 및 이주의 기하급수적인 증가 등이 있다. 또한, 기본적인 의료시설, 위생적인 물, 기반시설 등의 부족으로 인해 감염병의 확산 및 통제의 어려움을 겪을 수 있다.
감염병의 발생으로 인명손실은 계속되고 있으며 특히 호흡기 감염병은 급성장하여 전세계적으로 호흡기 감염병으로 5,000만에서 8,000만 명의 인구가 사망하였을 것으로 추산되고 있다.
감염병은 사망자 발생 외에도 경제를 황폐화시킨다. 2014∼2016년 서아프리카 에볼라 발병으로 인한 경제적, 사회적 영향으로 530억 달러 손실, 2009년 H1N1 인플루엔자 대유행으로 인한 손실 비용은 450억∼550억 달러이다. 세계은행은 1918년의 규모와 병독성과 유사한 세계적 대유행 인플루엔자가 3조 달러 또는 국내 총생산(GDP)의 최대 4.8%의 경제손실을 입힐 것으로 추정하였다. 중간 정도의 치명적인 인플루엔자 대유행의 경우에도 비용은 GDP의 2.2%가 될 것으로 추정하였다.
세계보건기구(WHO)는 이와 같은 감염병 발생에 대비하여 잠재적인 감염병을 감지하고 통제하기 위한 시스템을 구축하기 위해 지속적인 노력을 하고 있다. 그 일환으로 GPMB(Global Preparedness Monitoring Board)는 2009년 H1N1 인플루엔자 대유행 및 2014∼2016년 에볼라 발병 이후 이전 고위급 패널과 위원회의 권장사항의 반영 여부를 검토하여 첫 번째 보고서를 발표하였다.
(단위: Villions($))

자료: Resolve to Save Lives(www.resolvetosavelives.org).
[그림 3-67] 감염병 발생으로 인한 손실(2001∼2017)
그 결과 검토된 많은 권장 사항이 제대로 구현되지 않았거나 전혀 구현되지 않았으며 심각한 격차가 지속되고 있었다. 오랫동안 감염병 발생과 관련하여 공황과 방치의 순환이 계속되고 있었으며, 심각한 위협이 있을 때만 노력하고 위협이 가라앉으면 빠르게 잊어버리는 상황이 반복되고 있었다.
GPMB는 백신 및 치료제 개발, 생산 능력 증대, 광범위한 항바이러스제에 대한 적절한 투자와 함께 모든 국가는 공중보건 목적으로 새로운 감염병의 게놈 염기서열을 즉시 공유하는 시스템과 제한된 의료 대책을 국가 간에 공유할 수 있는 수단의 개발 필요성을 제시하였다. 아울러 감염병 대유행에 대비하기 위해 정치적, 재정적 및 사회적인 지원이 정치적 의제에 우선하도록 최고 수준에서 옹호할 것이며 후속 조치에 대한 책임질 것도 약속했다.33)
WHO는 2011년과 2018년 사이에 172개국에서 발생한 1,483건의 전염병을 추적했다. 인플루엔자, 중증급성호흡기증후군(SARS), 중동호흡기증후군(MERS), 에볼라, 지카, 흑사병, 황열병 등과 같은 유행성 질병은 잠재적으로 빠르게 확산 될 수 있어 강한 영향을 미치는 새로운 시대의 선구자이다.
다음 그림은 자연적으로 발생한 병원체와 의도적으로 발생시킨 병원체를 포함하여 지난 50년 동안 세계적으로 발생한 병원체를 나타낸다.
WHO는 2014년 에볼라유행 경험을 계기로 신종 감염병에 의해 유발되는 새로운 위협에 신속하게 대응하기 위해 새로운 R&D 패러다임의 필요성을 인지하고, 2015년 감염병에 대한 R&D 청사진을 제시하였다. WHO는 감염병 우선순위 선정을 위한 요소로 인체 전파력, 치사율, 파급 가능성, 진화 가능성, 의학적 대응책 보유 여부, 감시 및 통제 난이도, 발생지역의 공중보건 상황, 국제사회로의 전파 위험성, 사회적 영향의 9가지 기준을 제시하였다. 이 9가지 기준으로 전문가 그룹은 가까운 미래에 공중보건위기를 초래할 수 있으나 현재 의학적 조치가 불충분하여 긴급 R&D 추진이 필요한 우선순위 감염병을 발표하고 정기적으로 모여 선정 방법론을 검증하고 목록의 재선정을 추진하고 있다.
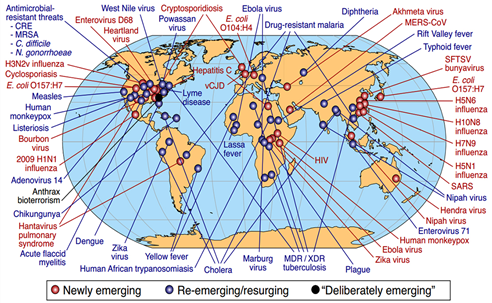
주) C. difficile: Clostridium difficile; CRE: carbapenem-resistant Enterobacteriaceae; E. coli: Escherichia coli; MDR: multidrugresistant [tuberculosis]; MERS-CoV: Middle East respiratory syndrome coronavirus; MRSA: meticillin-resistant Staphylococcus aureus; N. gonorrhoeae; Neisseria gonorrhoeae; SFTSV: severe fever with thrombocytopenia syndrome virus; XDR: extensively drug-resistant [tuberculosis].
자료: Source: United States National Institutes of Health, National Institute for Allergies and Infectious Diseases.
[그림 3-68] 신종 및 재출현 질병의 글로벌 사례
2018년 2월 최종 개정된 WHO 2018 R&D 청사진에서 8대 우선순위 감염병(▴Crimean-Congo haemorrhagic fever(CCHF), ▴Ebola virus disease and ▴Marburg virus disease, Lassa fever, ▴Middle East respiratory syndrome coronavirus(MERS-CoV) and ▴Severe Acute Respiratory syndrome(SARS), ▴Nipah and henipaviral diseases, ▴Rift Valley fever(RVF), ▴Zika)과 더불어 ‘Disease X’를 우선순위 감염병으로 선정하게 되었다. ‘Disease X’는 현재는 치료제나 백신이 개발되어 있지 않은, 신종 감염병 혹은 재출현의 위험성이 있는 감염병으로 발생 시 범세계적으로 위협이 될 수 있는 미지의 감염병을 의미한다.
GPMB는 2019년 발표한 ‘A World at Risk’라는 보고서에서 비말을 통해 빠르게 전파되는 치명적인 호흡기 RNA 바이러스 병원체의 출현에 대한 위험을 경고하였으며, 2019년 코로나19의 발생으로 전 세계는 첫 번째 Disease X의 발생을 목도하게 되었다.
(2) 코로나19의 발생과 팬데믹
코로나19는 2019년 말 중국 우환에서 최초로 발생한 이후 전 세계로 전파되었다. 코로나19가 114개국 12만 명의 감염자와 4,000여 명의 사망자를 발생시키며 확산세를 이어가자 2020년 3월 11일 WHO는 세계적 대유행, 팬데믹(pandemic)을 선언했다. 코로나19는 2021년 7월 31일 현재 전 세계 확진자 1억 9,700만 명, 사망자 420만 명에 이르며 21세기 인류 최악의 재앙으로 손꼽히고 있다.
최근 몇 년간 과학기술과 의학이 엄청나게 발전하였음에도 불구하고 코로나19는 감염병을 일으키는 미생물이 여전히 인류 역사에 치명적인 영향력을 행사할 수 있다는 사실을 상기시켜 주었다.
역사적으로 팬데믹을 일으켰던 질병들은 14세기 중국에서 발원해 실크로드를 거쳐 유럽에 도래한 흑사병이 있다. 흑사병으로 인해 당시 유럽 인구의 60%가 사망했다고 추정된다. 당시 흑사병은 yersinia pestis(페스트균)라는 세균에 의해 발생하였는데 이 세균은 동양쥐벼룩(xenopsylla cheopis)의 장에 침범하여 감염을 일으켰고 세균에 감염된 벼룩은 다시 인간을 감염시켜 질병을 전파할 수 있었다.34) 최근까지도 산발적인 감염이 발생하고 있으나 예방과 치료에 효과적인 항생제가 있어 향후 전 세계 대유행의 가능성은 낮은 것으로 알려져 있다.
이후 16세기 잉카제국을 멸망시켰다고 알려진 인류 역사에서 가장 오래된 감염병 중 하나인 천연두도 팬데믹 사례 중 하나이다. 고대 이집트 미이라에서 천연두 흔적이 발견되었으며 과거에는 사망률이 높은 무서운 질병이었지만 1980년에 WHO가 천연두의 근절을 선언함으로써 인류가 최초이자 유일하게 정복한 팬데믹 질병으로 남아 있다.
진정한 세계적 대유행이자 현대 의학 발전 단계에서 발생한 최초의 전염병은 20세기 초반에 발생한 스페인독감으로 역학과 같은 감염병 전문 분야가 발달하는 계기가 되었다. 1차 세계대전 중 군대의 이동과 인구의 과밀화가 대규모 확산에 원인이 되었던 유럽 외에도 이 바이러스는 미국, 아시아, 아프리카 및 태평양 제도로 전파되어 전 세계가 황폐해졌다. 당시 한국에서도 유행한 독감은 ‘무오년 감기’로 불렸으며 조선인의 약 1,700만 명 중 절반에 가까운 742만 명이 감염되어 14만 명이 사망했다고 기록되어 있다. 스페인독감의 사망률은 10%에서 20% 사이였으며 당시 전 세계 인구의 4분의 1 이상이 독감에 걸리면서 사망자 수는 불어났다. 이는 흑사병이 유행하였던 한 세기 동안 발생한 사망자 수보다 더 많은 사람들이 1년 만에 사망하였을 정도로 피해가 심각하였다.
1948년 세계보건기구 설립 이후 최초의 팬데믹이 선언된 사례는 1968년 홍콩독감으로 코로나19 팬데믹은 2009년 신종플루 팬데믹 이후 세 번째 팬데믹 사례이다.
|
순위 |
팬데믹명 |
질병명 |
사망자 수 |
전 세계 인구대비 사망자 비율 |
Date |
|
1 |
Black Death (흑사병, 페스트) |
Bubonic plague |
75∼200 million (7,500만∼2억 명) |
[1] |
1346∼1353 |
|
2 |
Spanish flu (스페인독감) |
Influenza A/H1N1 |
17∼100 million (1,700만∼1억 명) |
1∼5.4% |
1918∼1920 |
|
3 |
Plague of Justinian (유스티아누스 역병) |
Bubonic plague |
15∼100 million (1,500만∼1억 명) |
[1] |
541∼549 |
|
4 |
HIV/AIDS pandemic (에이즈) |
HIV/AIDS |
35 million+ (2018년 기준, 3,500만 명 이상) |
[1] |
1981∼present |
|
5 |
Third plague pandemic (3차 대역병) |
Bubonic Plague |
12∼15 million (1,200만∼1,500만 명) |
[1] |
1855∼1960 |
|
6 |
Cocoliztli Epidemic (코코리츨리 유행병) |
Cocoliztli |
5∼15 million (500만∼1,500만 명 이상) |
[1] |
1545∼1548 |
|
7 |
Antonine Plague (안토니우스 역병) |
Smallpox or measles |
5∼10 million (500만~1,000만명 이상) |
3∼6% |
165∼180 (possibly up to 190) |
|
8 |
COVID-19 pandemic (COVID-19) |
COVID-19 |
4.1∼8.5 million+ (2021.7.16. 기준, 400만∼800만 명 이상) |
0.05%∼0.1% |
2019 –present |
|
9 |
1520 Mexico smallpox epidemic (멕시코 천연두 유행병) |
Smallpox |
5∼8 million (500만~800만 명 이상) |
[1] |
1519∼1520 |
|
10 |
1918–1922 Russia typhus epidemic (러시아 티푸스 유행병) |
Typhus |
2∼3 million (200만∼300만 명) |
0.1∼0.16% |
1918∼1922 |
|
11 |
1957–1958 influenza pandemic (인플루엔자 대유행) |
Influenza A/H2N2 |
1∼4 million (100만∼400만 명) |
0.03∼0.1% |
1957∼1958 |
|
Hong Kong flu (홍콩독감) |
Influenza A/H3N2 |
1∼4 million (100만∼400만 명) |
0.03∼0.1% |
1968∼1969 |
[표 3-42] 최소 백만명 이상의 사망자가 발생한 에피데믹(유행병)과 팬데믹(범유행병)의 역사적 사례
주) [1] 당시 세계 인구 추정치가 매우 다양함(합의되지 않음).
자료: https://en.wikipedia.org/wiki/List_of_epidemics#cite_note-Worldp-8)
(3) 감염병에 대한 대응
감염병의 발생은 사망자 발생으로 인한 국민들의 불안과 공포를 극대화 하는 것 이외에도 경제 및 사회적 공황을 일으키며 국가 안보를 불안정하게 한다. 이는 일부 국가에 국한되는 것이 아니라 세계 경제와 보건안보에 심각한 영향을 미친다.
국가간 장기적이고 지속적인 소통은 발병을 조기에 감지하고, 감염병의 확산을 제어하고, 신뢰와 사회적 결속을 보장하고, 효과적인 대응을 촉진할 것이다. 감염병에 대한 대비는 성공적인 대응 및 통제를 가능하게 하고 축적된 역량과 지식으로 다음 위협을 대비하기 위한 기반이 된다.
국가마다 각국의 모범 사례를 공유하기 위한 환경과 메커니즘 활성화 및 감염병 관련 정책 수립을 통해 백신, 진단, 치료와 함께 감시 체계 마련, 신속한 정보전달 체계 확립과 같은 다양한 분야의 연구개발을 지원하고 있다.
나. 감염병 대응 해외 정책 동향
코로나19 발생 이후 전 세계는 코로나19 극복을 위한 R&D 투자에 집중하고 있다. 미국과 독일은 2020∼2021년간 코로나19 백신 개발의 투자를 강화하였으며 영국, 캐나다, 중국 등도 대규모 투자를 추진 중이다.

자료: Global health center, Lessons from COVID-19 Vaccine R&D.
[그림 3-69] 국가별 코로나19 백신 R&D 투자
(1) 세계보건기구(WHO)
세계보건기구는 전세계 각국의 감염병 대비․대응의 핵심 역할을 하는 국제기구로, 각국의 감염병 정책 기획 및 수립에 중요한 가이드 역할을 하고 있다. WHO는 주요 감염병에 대해 연구 의제, 로드맵, 실행계획 등 다양한 형태로 질환별 정책 전략과 글로벌 단위의 전략을 수립하고 있는데, 결핵, HIV, 백신 예방접종과 같이 개발도상국과 후진국에서 집중적으로 발생하는 질환에 대해서는 꾸준히 전략을 내고 있고, 기후변화 감염병, 신종 감염병, 인수공통감염병과 같이 최근에 이슈로 떠오르는 감염병에 대해서도 정책 전략을 수립하고 있다.
2014년 에볼라 유행을 통해, 감염병 R&D의 선제적 대응과 불필요한 중복낭비를 피하기 위한 조정 절차의 필요성이 제기되었다. 기존의 방식으로는 백신․치료제의 공급, 의료팀 구성 등이 시의적절하게 추진되지 않아, 새로운 R&D모델 개발 필요성이 제기되면서 2015년 ‘R&D Blueprint’ 작업이 추진되었다. WHO는 ‘R&D Blueprint’에서 R&D가 시급한 우선순위 병원체를 도출하고 그에 따른 진단기술, 치료제, 백신을 개발할 수 있는 연구개발 로드맵 마련, 연구개발을 뒷받침할 수 있는 규제 및 정책 장벽을 극복할 수 있는 새로운 표준을 개발하는 등의 과제를 제시하였다.35)
현재 인간 감염병의 60%가 동물매개로 발생하며, 에볼라, HIV, 인플루엔자와 같은 최근 쟁점이 되고 있는 감염병의 최소 75%가 동물 유래 감염병으로 알려짐에 따라 WHO, 세계동물보건기구(OIE), UN식량농업기구(FAO)에서는 ‘One Health’ 관점의 주요 인수공통감염병에 대한 감시 및 조기 경고 시스템 협력을 강화하고 있다.
2020년, WHO COVID-19 긴급위원회는 COVID-19 유행이 국제공중보건위기상황(PHEIC)임을 선포하고, ‘코로나19 전략적 대응대비 계획(Strategic Preparedness and Response Plan)’으로 6억 7,500만 달러를 마련하였다. 감염병 분야 글로벌 컨소시엄인 글로피드알(GloPID-R: Global Research Collaboration for Infectious Disease Preparedness)은 G7 국가를 중심으로 시작된 글로벌 감염병 연구 이니셔티브로, 한국연구재단을 포함한 28개 출연기관이 참여하고 있으며, WHO와 감염병 예방혁신연합(CEPI: Coalition for Epidemic Preparedness and Innovation)이 옵저버로 참여하고 있다.
(2) 감염병예방혁신연합
CEPI는 2017년, 노르웨이, 인도 정부, 게이츠재단, 영국 웰컴트러스트, 세계경제포럼 등이 함께 설립한 공공-민간 파트너십으로, 일본, 호주, 독일, 캐나다 등도 참여하게 되었으며 10억 달러 펀드 모집을 목표로 운영되고 있다.
항원 확인에서 임상시험 개시까지 소요되는 시간을 16주 내로 줄인다는 목표를 두고 다양한 백신연구 과제를 지원하고 있는데, 현재 메르스, 라싸, 치쿤군야, 니파, 리프트발리열, 말버그 외에 코로나19 백신 개발과제를 추진하고 있다.36)
(3) 미국
미국은 2001년 9․11 생물테러 직후 생화학, 화학물질, 방사능 등 테러의 위협과 인플루엔자 대유행에 대비하기 위한 방안으로 캐나다, 유럽연합(EU), 프랑스, 독일, 이탈리아, 일본, 멕시코, 영국이 참여한 비공식적 조직인 국제보건안보 이니셔티브(GHSI: Global Health Security Initiative)를 출범시켰다. 이 기구를 모태로 2014년, 28개 협력 국가와 WHO, 국제식량농업기구(FAO), 세계동물보건기구(OIE) 등의 국제기구들과 공동으로 ‘글로벌보건안보구상(Global Health Security Agenda)’을 출범하였다.
이후, 2014년 ‘CDC 국제보건전략 2012~2015(CDC Global HEalth Strategy 2012~2015)’와 ‘항생제내성정복 국가전략(National Strategy for Combating Antibiotic-Reistance Bacteria)’, 2015년 ‘국가안보전략(National Security Strategy)’과 ‘에이즈 2020 국가전략(National HIV/AIDS STrategy for the Unitied States : update to 2020)’ 등을 수립하였다.
미국 NIH 내 국립감염병․알러지연구소(NIAID)가 핵심기관으로 전 세계 감염병 연구를 주도하고 있으며, NIAID 내에 있는 백신연구센터(VRC: Vaccine Research Center)는 감염병 연구를 위한 임상 병원과 전임상 시험, 임상시험용 물질까지 생산 가능한 백신 파일럿 플랜트를 보유하고 있다. VRC는 1999년 설립되어 HIV백신, 인플루엔자 백신, 에볼라 백신 등 주요 감염병 백신 개발을 주도하였다.
미국의 보건의료분야 정책은 2012년 오바마 행정부의 ‘국가 바이오 경제 청사진’에 근간을 두고 보건의료분야를 핵심 동력 중 하나로 강조하였다. 2015년, 미국은 ‘새로운 미국혁신전략(New Strategy for American innovation)’ 발표를 통해, 보건의료 혁신 과제를 국가의 우선과제로 선정하였으며, Precision Medicine Initiative, BRAIN Initiative, Cancer Moonshot 등의 내용을 포함하여 혁신적인 이니셔티브의 추진을 강조하였다.
트럼프 전 대통령은 R&D 예산확대에 대해 회의적이고, 미래지향적 연구보다 미국 사회에 당면한 현안 과제 해결을 우선시하였는데, NIH에 대한 자금 지원은 비효율적인 것으로 인식하였고, 의료 연구에 대한 지원보다는 혁신을 촉진시킬 수 있는 우주 개발 프로그램 등 응용과학 분야의 R&D 투자 및 효율화를 강조하였다.37)
트럼프행정부는 2019회계연도의 과학기술투자 우선순위 중 하나로 공공보건을 제시하였고, 인구 고령화, 약물중독퇴치, 기타 공중보건 위기 해결 및 새로운 영역에 대한 투자 확대 등의 내용을 포함시켰다. 트럼프행정부에서 제시한 2020회계연도 예산안은 2018 회계연도 결산 대비 국방부 예산이 9.5%(58억 달러) 증가한 반면, 두 번째로 R&D 예산이 큰 보건복지부의 경우 8.8% 감소하였고, 특히, 미국의 보건의료 관련 예산의 90%를 수행하고 있는 NIH 예산은 7.5%가 감액되었다.
주된 감축 분야는 Cancer Moonshot, Precision Medicine Initiative, BRAIN Initiative이다. 2021회계연도 예산에서 NIH를 포함한 복지부 관련 기관은 긴급코로나 지출을 제외하고 대체로 감소하여 2019회계연도 결산 대비 7.2%가 감소하였다. 트럼프행정부 중반 이후, 전반적인 R&D 예산 감소와 과학기술 자문 기능의 축소, 코로나19 대응에 있어서의 과학적 논의 배제 등이 발생하게 되면서, 저명 학술지와 주요 과학기술 단체에서는 트럼프 대통령의 R&D 지원 정책 및 코로나19 대응을 비판하게 되었다.
2022회계연도 정부R&D 예산에는, 5대 우선 분야 중 하나로 공공보건 안보 및 혁신을 제시하였고, 주요 분야로는 신속진단․백신 및 치료제 개발 R&D, 감염병 예측, 바이오의약품 및 생명공학, 바이오 경제 강화 등을 포함하고 있다.38)
바이든행정부의 보건의료분야 정책은, 트럼프행정부에서 추락한 과학기술 위상을 복구하고, 코로나19 극복을 위한 역량 집중, 장기 전략으로써의 NIH 예산 증대 및 ARPA-H 설치, 저렴한 비용의 의료서비스를 위한 규제정책 등을 강조하고 있다. 특히, 코로나19 극복을 위해서는 ‘COVID-19: The Biden-Harris Plan to Beat COVID-19’ 공약을 내걸고, 총역량을 집중할 것을 선언하였는데, 이 계획에는 무상코로나 검사 실시, 개인보호장구의 공급, 과학적 근거에 기반을 둔 명확한 방역지침 제공, 백신 및 치료제의 공평한 분배, 고령층과 고위험군의 우선 보호, 팬데믹의 예측, 예방 및 치료체계의 복구, 연방차원에서의 마스크 의무화 등 총 7가지 계획이 포함되어 있다.
또한, 모든 국민들에게 저렴한 의료서비스를 제공하기 위해, 연구성과의 실시요구권 확대와 약가 통제 정책을 표명하는 등 보건의료분야의 공공성 강화를 주 내용으로 한다는 점이 이전 행정부 대비 큰 차이를 보이는 부분이다.
또한 바이든행정부는 과학기술 정책의 주요 이슈로 NICHE39)를 선정하였는데 그 중 하나로 포함된 ‘Next COVID-19’에서는 바이오 R&D 강화를 위한 NIH 자금을 지원하고, R&D 성과에 대한 정부의 권한을 강화하는 등 보건의료 분야의 공공성 강화에 초점을 맞추고 있다.40) 주요 내용은 보건복지부 산하의 생물의약품첨단연구개발국(BARDA: Biomedical Advanced Research and Development Authority)의 백신․치료제 개발 및 과학적 근거 기반 방역 대책 수립, 연방 자금을 지원받은 백신에 대한 정부의 특허 권한 강화 등이다. 또한 NIH에 대규모 예산을 배정함으로써 신속 진단키트와 백신, 치료제 개발, 임상시험 관련 인프라 증설 등 R&D 투자가 강화될 전망이다.
[표 3-43] 미국 행정부의 과학기술 정책 및 보건의료분야 지원 정책 변화
|
행정부 |
주요 과학기술 정책 및 보건의료 분야 지원 |
|
오바마 행정부 |
[과학기술 위상 증대] - 과학기술 거버넌스 및 자문기능 강화 [연구개발 지원체계 강화] - 연구개발 투자 확대 - NIH, DARPA 자금 지원 강화 통한 고위험 연구 지원 확대(대형 이니셔티브 추진) - 연구 및 실험 세금 영구적 공제 |
|
트럼프 행정부 |
[국방 R&D 강화] - 국방 분야 R&D 투자 확대 및 바이오 기술 투자 [보건혁신] - COVID-19 대응 관련 R&D 지원 - 아편류 약물의 오남용 방지 추진 - 퇴역 군인의 건강 문제 개선(2009년 대통령 요청에 따라 2015년 의회 가결사항) [과학기술 혁신] - 낭포성 섬유증 퇴치 및 에볼라 사망자 감소 ※ 임기 중반 이후, R&D 예산 감소, 과학기술정책국(OSTP) 권한 약화 및 과학기술 자문기능 축소, 규제 강화, COVID-19 대응 주요 의사결정 시 과학적 근거 배제 등의 문제 제기 |
|
바이든 행정부 |
[Next COVID-19] - NIH 대규모 예산 배정을 통한 감염병 관련 R&D 투자 확대 - 공공 R&D성과에 대한 정부권한 강화(Bayh-Dole법 제한) - 의약품 가격 규제를 통한 의약품 비용접근성 강화 - BARDA와 민간기업 간 파트너쉽 확대를 통한 공공 R&D 추진 - 과학적 근거 기반의 방역체계 구축 및 주요 의사결정 수행 |
자료: 한국과학기술기획평가원(2021), 바이든 행정부의 과학기술정책 니치(NICHE).
BARDA는 2021년 초까지 COVID-19 백신 3억회 분을 공급하는 것을 목표로 하여, ‘Operation Warp Speed’를 지휘하고, 모더나, 존슨앤존슨 등이 BARDA로부터 재정지원을 받아 COVID-19 백신을 개발하는데 큰 역할을 하였다.
(4) EU
유럽은 2005년 유럽연합 질병통제관리센터(ECDC: European Centre for Disease Prevention and Control)를 설립했다. 미국 CDC가 감염병을 포함하여 비감염병 등 타 질환도 관할하는 것과 달리 ECDC는 유럽연합 내 감염병 대비․대응을 핵심 업무로 추진하고 있다.
ECDC는 감염병을 7개 질환군(항생제내성․병원관련감염(HAIs), 신종감염병․매개질환(Emerging and Vector-borne Disease), 식품․식수 매개질환 및 인수공통감염병, 성매개감염병, 인플루엔자, 결핵, 백신으로 예방 가능한 질환)으로 분류하여 관리․감독하고 있다.
EU는 최대 연구개발 사업 지원프로그램인 FP(Framework Programme)41)를 통해 감염병 관련 연구를 지원하고 있다. FP 8차 프로그램인 EU Horizon 2020(2014∼2020)과 그 뒤를 잇는 Horizon Europe(2021∼2027)을 통해 백신, 신약, 진단기술 개발 등을 포함해 공공과 민간 협력의 R&D를 추진하고 있으며. 이 프로그램은 유럽의 연구․혁신 통합지원 정책으로, 선도적 기술개발 연구에서 상업적 응용단계까지 전 범위에 걸쳐 지원하고 있다.
Horizon Europe 프로그램은 식품, 천연자원 등을 포함한 바이오경제에 100억 유로를 지원하고 있으며, 이 중 보건의료에 직접적으로 지원되는 예산은 만성질환과 감염병 등의 질병연구, 신약과 백신개발 등의 특정과제, 희귀질환 및 개인맞춤의료, 원격의료 등의 기술개발 등에 7년간 약 75억 유로를 배분하였다.42)
Horizon Europe과는 별도로 EU는 세계 최대의 보건 분야 산․관․학 협력 플랫폼인 ‘혁신의약 이니셔티브(IMI: Innovative Medicines Initiative)’를 운영하고 있는데, EU와 유럽제약협회연맹에서 10억 유로씩 지원하고 있으며, 아스트라제네카, 바이엘, 존슨&존슨, 사노피 등 대형 제약사들이 참여하고 있다. IMI에서는 COVID-19의 신속한 대응을 위하여 진단제품과 치료제 개발 관련 제안서를 패스트트랙으로 지정하고, 민관협력 과제를 지원하고 있다.
EU집행위원회는 COVID-19 백신 개발을 위한 지원이 미국에 미치지 못했다는 비판에 따라, 미국의 BARDA를 모델로 하는 생명의학 연구를 위한 새로운 기관을 설립하겠다는 계획을 발표하였다.43)
(5) 중국
중국 정부는 R&D 전략과 함께 생산, 첨단기술, 중소기업 지원, 인력정책, 과학기술 거버넌스 등 광범위한 대책을 추진하고 있다. 범부처 코로나19 대응 공동연구팀 발족 후 중국과학원 및 국가중의약관리국 등을 통해 검사기술, 백신, 의약품 R&D 방향 설정 및 관련 연구 프로젝트 수행을 지원한다.
중국 정부는 코로나19 대응의 일환으로 기초연구 지원체계 최적화, 혁신주체 지원, 사업관리 개혁, 연구환경 조성, 지원 메커니즘 보완 등을 추진하고 있다.
(6) 일본
일본은 일본의료연구개발기구(AMED)에서 감염병 포함 보건의료분야 R&D 예산을 총괄, 조정하는 역할을 수행하고 있다.
2019년 감염병 연구혁신 이니셔티브, 감염병연구 국제전개전략프로젝트, 신종 및 재출현 감염병 혁신 의약품 개발추진 연구사업 등에 약 6,000억 원을 투자하여 추진하고 있다.
다. 감염병 대응 국내 정책 현황
우리나라는 코로나19 진단키트의 조기개발 및 적용, 스마트 방역기술의 적용 등을 통해 경제적 성과뿐 아니라 방역에서도 우수한 결과를 얻었으나 백신과 치료제 등의 개발속도는 주요국에 비해 늦은 편이다.
코로나19의 전세계적 확산과 장기화로 막대한 경제적․사회적 손실 발생, 국민 삶의 질 저하, 보건의료시스템의 과부화 등 사회적 재난 상황으로 대두되고 있어 이러한 문제해결을 위하여 다부처간의 융합적 노력이 필요하다. ‘R&D 투자시스템 혁신방안(과학기술관계장관회의, 2020.11.)’ 후속 조치로, 향후 감염병의 주기적 유행에 대비하기 위해 예방․대비, 대응, 복구 등 각 단계별로 R&D 현황을 점검하고 투자전략을 마련하였다.44)
(1) 추가경정예산 편성을 통한 재정 투자 확대
정부는 경제위기 조기 극복과 포스트 코로나 시대를 대비하고자 1∼3차의 추가경정예산을 편성해서 집행을 추진 중이다. 1차 추가경정예산은 총 11조 7,000억 원(지출 확대분 8조 5,000억 원 + 국세수입 감액경정분 3조 2,000억 원) 규모로 2020년 3월 17일 최종 확정되었다. 감염병 대응체계강화 등(2조 3,000억 원)과 중소기업․소상공인 회복 지원(2조 4,000억 원), 민생․고용안정 지원(3조 원), 지역경제 회복 지원(8,000억 원)의 네 가지 분야에 8조 5,000억 원을 지원하였으며, 연구개발 분야에도 1천억 원이 증액되어 편성되었다.
2차 추가경정예산(안)은 전국민에게 재난지원금을 지원하고자 12조 2,000억 원 규모로 2020년 4월 29일 최종 확정하였으며, 3차 추가경정예산은 정부안에서 2,000억 원이 감액된 35조 1,000억 원으로 2020년 7월 3일 역대 최대 규모로 확대되었다. 3차 추가경정예산은 경제 조기회복을 위한 경기대응과 ‘한국판 뉴딜’ 등을 통해 포스트 코로나19 시대 선도형 경제로 전환하는 데 역점을 두고 위기기업․일자리를 지키는 금융 지원(5조 원)과 고용․사회안전망 확충(10조 원)과 경기보강 패키지(10조 4,000억 원) 등으로 구성하였다. 경기보강 패키지에는 ‘K-방역 산업 육성 및 재난 대응시스템 고도화(2조 4,000억 원)’와 새로운 성장 발판을 위한 한국판 뉴딜인 ‘디지털 뉴딜+그린 뉴딜+고용안전망 강화’를 위해 4조 8,000억 원 등이 편성되었다.
특히, 한국판 뉴딜은 기존 전통적인 SOC 투자방식과 달리 코로나19 이후 디지털 가속과 비대면 강화 등의 변화된 사회적 흐름을 반영 초중고교 원격교육 인프라, 중소기업 원격근무시스템 등 비대면 산업 육성(7,500억 원)과 경제 생산성 제고를 위한 데이터 개방, 5G․AI 활용 가속화 및 디지털 인재양성 지원(1조 3,000억 원) 등으로 편성하였다.
[표 3-44] 제1회 추가경정예산안 주요 편성 내역(2020)
|
구분 |
주요내용 |
규모 |
|
감염병 대응체계 강화 등 (2.3조 원) |
∙ 감염병 대응체계 강화 |
0.1 |
|
∙ 의료기관 및 격리자 피해보전 |
2.2 |
|
|
중소기업․소상공인 회복 지원 (2.4조 원) |
∙ 경영자금 융자 등 확대 |
1.7 |
|
∙ 임금 보조 및 임대료 인하 유도 |
0.6 |
|
|
∙ 피해점포 회복 지원 및 전통시장 소비 진작 |
0.1 |
|
|
민생․고용안정 지원 (3.0조 원) |
∙ 각종 쿠폰․바우처 발급 등을 통한 민생안정 및 소비 여력 제고 |
2.4 |
|
∙ 고용시장 피해 최소화 |
0.6 |
|
|
지역경제 회복 지원 (0.8조 원) |
∙ 코로나19 피해지역 고용지원 |
0.1 |
|
∙ 지역사랑상품권 발행 확대 |
0.2 |
|
|
∙ 지방재정보강 |
0.5 |
|
|
|
총 규모 |
8.5 |
자료: 국회예산정책처(2020:10).
(2) 정부연구개발투자의 대응성 제고
정부는 당초 ‘2021년도 정부연구개발 투자방향 및 기준(2020.3.12.)’에 ‘포스트 코로나 시대의 위기 대응역량 강화’를 위한 중점 투자방향을 추가해 3대 분야 10대 중점 투자방향을 4대 분야 11대 중점 투자방향으로 수정하였다.
2021년도 정부 R&D 예산의 지출 한도는 최소 26조 원으로 올해 정부 R&D 예산(24조 2,000억 원)보다 1조 8,000억 원(7.4%) 증액되었다. 정부 R&D 예산의 지출 한도는 대부분 주요 R&D 사업 부문에서 증가를 보였다. 이는 코로나19로 인해 민간 R&D가 축소될 것으로 전망45)됨에 따라 민간 R&D를 보완하기 위한 정부 R&D 예산의 적극적 지원이며, 1997년 IMF와 2008년 글로벌 금융위기 상황에서도 정부 R&D 예산의 지출 규모는 축소되지 않고 확대된 바 있다.
자료: 국가과학기술자문회의 심의회의 운영위원회(2020:127).
[그림 3-70] 정부 R&D 예산의 중점 투자방향 변경내용(안)
(3) 감염병 관련 대응체계 강화
2020년 9월 기존 보건복지부 산하 질병관리본부를 감염병 총괄기구로서 감염병 감시, 조사, 분석, 위기대응, 예방을 담당하는 독립기관인 ‘질병관리청’으로 승격시켜 감염병 대응을 위한 종합적인 관리체계를 강화해 나가고 있다. 또한 2020년 하반기 보건복지부 국립보건연구원 산하에 국립바이러스감염병연구소를 설립하여 백신과 치료제 연구 등 감염병에 관한 포괄적 연구를 수행토록 할 예정이다. 과학기술정보통신부 산하에도 감염병에 국한하지 않고 바이러스에 대한 기초연구를 수행하는 (가칭)한국바이러스기초연구소 설립을 모색 중에 있다.
감염병 연구개발 투자에 있어서도 메르스 사태 이후, 2016년 4월 범부처감염병연구개발추진위원회는 제1차 국가감염병 위기 대응 기술개발 추진전략(2012∼2016)에 이어 2차 추진전략(2017∼2021)을 수립하여 기존 8대 중점분야(신종인플루엔자, 다제내성균(슈퍼박테리아), 결핵, 인수공통감염병, 만성감염질환, 기후변화, 관련 감염병, 생물테러, 원인불명 감염병) 외에 예방접종․백신과 재난대비․관리 분야를 추가하여 10대 중점분야를 선정하고 범부처 감염병연구포럼을 통해 감염병 분야 전문가들의 의견 수렴하였고, 7개 부처 합동 ‘방역연계 범부처 감염병 연구개발 사업(2018∼2022)’을 통해 감염병 유입차단, 현장대응, 확산방지에 활용될 7대 중점분야 30개 과제가 추진 중이다.
감염병 관련 연구개발사업에는 보건복지부와 과기정통부, 농식품부 등이 주도적으로 참여하고 있으며 보건복지부는 2020∼2029년까지 6,239억 원(정부 4,792억 원) 규모의 신규 ‘감염병 예방치료 기술개발 사업’을 추진 중이다. 2020년에는 감염병 예방치료 기술개발(246억 원), 질병관리본부 감염병관리 기술개발 연구(200억 원)을 포함하여 780억 원 규모로 사업이 진행되었다. 과학기술정보통신부도 미래 감염병 대응 기술(230억 원), 신종바이러스 융합연구단(105억 원) 등 2020년 510억 원 규모로 감염병 관련 기술개발 사업을 추진하였다.46)
라. 백신 기술 동향
백신은 병원체의 독성을 약화시킨 생백신과 병원체를 비활성화시킨 사백신 그리고 병원체의 표면단백질이나 독소 등을 항원으로 사용하는 톡소이드 백신, 다당류 백신, 정제단백질 백신, 유전자재조합 백신 등으로 분류된다.
이와 같은 다양한 백신개발을 기반으로 병원체에 따른 특정 항원이나 유전정보를 이용하여 새로운 병원체에 대해 백신을 개발할 수 있는 기반을 백신 플랫폼이라 한다.
최근에 잇따른 신종 전염병의 발생으로 인해 백신 플랫폼에 큰 변화를 가져왔다. 기존 방법으로 사용된 사백신, 생백신, 아백신 백신에서 차세대 백신 플랫폼인 mRNA/DNA/바이러스 벡터 백신 등의 개발이 이루어지고 있다.
mRNA 백신은 바이러스 표면의 단백질을 발현하는 mRNA를 체내에 직접 주입하여 바이러스 항원을 체내에서 발현시켜 항체를 생산하는 백신으로 빠른 확산으로 팬데믹의 공포를 몰고 오는 신종바이러스에 대응하여 신속한 백신개발과 생산이 가능하며, 저비용으로 소규모의 GMP 시설을 이용해 생산이 가능한 장점이 있다. 하지만, 불안정한 RNA의 특징으로 저온 유통체인망을 요구하며, 체내에 안전하게 전달해야 하는 전달 시스템의 개발이 필요하다.
[표 3-45] 코로나19대응 주요백신 플랫폼별 정의
|
구분 |
플랫폼 |
정의 |
|
1세대 |
생백신(약독화) |
∙ 질병을 일으키는 바이러스나 균의 활동을 둔화시켜 사람의 몸안에서 항체만을 만들 수 있도록 하여 제조되는 백신 |
|
사백신(불활성화) |
∙ 병원체를 배양한 후 화학물질, 열처리 등을 통해 체내에서 증식하지 못하도록 만든 백신 |
|
|
2세대 |
아단위 백신 |
∙ 병원체를 분쇄하거나 유전자 재조합을 통해 항원을 만드는데 필요한 부위만을 이용하는 백신 |
|
펩타이드 백신 |
∙ 감염체의 단백질 중 실제 면역반응에 관여하는 부분으로 한정하여 단백질 보다 짧은 아미노산 종합체(2∼50개)인 펩타이드를 합성하여 만든 백신 |
|
|
톡소이드 백신 |
∙ 병원체 자체가 아닌 병원체가 만들어내는 독소(톡신)에 대한 백신 ∙ 열 또는 화학물질로 처리하여 독성은 제거하고 면역원성을 유지 |
|
|
다당류 및 단백접합 백신 |
∙ 균의 세포막에 존재하는 다당류를 항원으로 사용하는 백신 ∙ 단백접합백신은 다당류 백신의 면역 유도 효과를 강화하기 위해 단백질과 캐리어 단백질을 결합시켜 만드는 백신 |
|
|
바이러스 유사입자 백신 |
∙ 유전물질 없이 바이러스 껍질을 구성하는 표면항원 단백질을 바이러스와 유사한 입자로 만들어 주입하는 백신 |
|
|
3세대 |
바이러스벡터 백신 |
∙ 항원 단백질의 염기서열을 가진 DNA를 아데노바이러스유사바이러스(AAV) 등 인체에 무해한 껍질로 감싸 주입하여 체내에서 항원 단백질을 생산하는 백신 |
|
mRNA 백신 |
∙ 항원을 만들 수 있는 염기서열을 가진 mRNA를 지질나노입자(LNP) 등 전달체와 함께 주입하여 우리 몸의 세포가 항원 단백질을 만들게 하는 백신 |
|
|
DNA 백신 |
∙항원을 만들 수 있는 염기서열을 가진 DNA를 체내 주입한 후 전기천공(electroporation) 등의 방법으로 세포 내로 보내고 이후 우리 몸의 세포가 항원 단백질을 생산하는 백신 |
자료: KISTEP 기술동향브리프 2021DNA 백신 역시 바이러스 항원을 발현하는 유전물질인 DNA를 체내에 직접 주입하여 특정 항체를 생산함으로써, 빠른 백신개발과 생산이 가능하고 mRNA에 비해 구조적으로 안정하여 운반과 보관도 용이하지만 mRNA백신에 비해 면역반응이 낮은 단점이 있다.

자료: IBS 코로나19 과학리포트(2021).
[그림 3-71] 백신 플랫폼의 종류
팬데믹 상황에서는 바이러스의 증식 기회가 매우 높아 변이주 발생 위험성이 함께 올라가며 백신 긴급사용 승인과 함께 백신접종이 빠르게 진행되고 있어 코로나바이러스가 유리한 형질로 증식을 재촉하게 되는 선택압으로 작용할 수 있다. 인도에서 처음 발생한 델타변이는 2021년 7월 기준 가장 강한 전파력을 갖고 있어 주도적인 변이주가 되고 있다.
영국의 경우 성인의 50% 이상이 백신 2차 접종을 완료하여 집단면역에 가까워지고 있으나 델타변이의 유행이 새로운 변수로 부상하였다.
국내의 경우 4차 대유행이 시작되어 신규확진자의 3분의 1에서 변이 바이러스가 검출되고 있다. 앞으로도 변이주의 지속적 출현은 당연하게 받아들여지며 신규 백신대응 전략 및 의료대응 역량을 준비해야 한다.
[표 3-46] 우려대상 코로나19 바이러스 변종
|
WHO label |
Pango lineages |
GISAID clade |
Nextstrain clade |
Additional amino acid changes monitored |
Earliest documented samples |
Date of designation |
|
Alpha |
B.1.1.7 |
GRY |
20I (V1) |
+S:484K +S:452R |
United Kingdom, Sep-2020 |
18-Dec-2020 |
|
Beta |
B.1.351 B.1.351.2 B.1.351.3 |
GH/501Y.V2 |
20H (V2) |
+S:L18F |
South Africa, May-2020 |
18-Dec-2020 |
|
Gamma |
P.1 P.1.1 P.1.2 |
GR/501Y.V3 |
20J (V3) |
+S:681H |
Brazil, Nov-2020 |
11-Jan-2021 |
|
Delta |
B.1.617.2 AY.1 AY.2 |
G/478K.V1 |
21A |
+S:417N |
India, Oct-2020 |
VOI: 4-Apr-2021 VOC:11-May-2021 |
자료: World Health Organization.
현재까지 COVID-19 백신과 관련하여 JCVI(Joint Committee on Vaccination and Immunization) 지침은 백신 접종을 받는 모든 사람이 두 가지 용량에 대해 동일한 백신을 맞아야 한다는 것이었으나 전 세계적으로 COVID-19 백신의 물량 부족을 겪으면서 공급문제를 해결하고 국가들이 백신 프로그램을 좀 더 유연하게 고안하기 위해 교차접종 전략이 제시되고 있다.
스페인 CombiVacS 연구팀에서 1차 AZ(ChAdOx1-S), 2차 화이자(BNT162b2) 교차접종의 면역원성 및 안전성 임상시험을 실시하여 향상된 중화항체 형성률을 확인하였다. 60세 이하 성인 676명의 참가자를 2:1 비율로 2차 화이자 접종군과 비교 관찰군(비접종)을 나누어 접종 2주 후 면역원성을 평가한 결과 향상된 항체생성능, 중화항체능, 세포성면역 활성능을 확인할 수 있었고 결정적으로 교차접종 그룹에서 경미한 주사부위 반응, 두통, 근육통, 무기력증 정도의 이상반응이 관찰되어 충분히 관리가 가능한 수준이었다.47)
에볼라 바이러스 백신(Ad26.ZEBOV & MVA-BN-Filo)의 경우 교차접종으로 임상 실험(유럽, 미국, 아프리카 2상, 시에라리온 3상) 중이며, 이를 통해 T세포 반응과 항체성 면역반응이 효과적으로 유도되는 것을 확인하였다.48) 이처럼 면역반응 측면에서 동일 백신을 연속 투여하는 것보다 교차접종이 더 효과적일 수 있다는 연구들을 통해 안전성 및 효능검증결과가 확보된다면 향상된 세포성, 체액성 면역을 바탕으로 높은 수준의 중화항체 생성능과 변이주 교차감염 대응력이 향상될 것으로 기대된다.
교차접종에 대한 연구 이외에도 체액의 면역반응을 매개로 한 백신들의 변이주에 대한 방어한계를 극복하기 위하여 세포독성 T세포에 의한 세포성면역반응에 주목하고 있다. 세포독성 T세포(killer T cell 또는 CD8+ T cell)는 바이러스에 감염된 세포를 직접 제거하는 세포성면역을 담당하며, 세포독성T세포는 세포표면의 MHC 1형 복합체를 통해 항원의 펩타이드를 인식하고 CD8 당단백질이 결합한다. 세포성 면역은 바이러스에 감염된 세포를 파괴하여 체내에서 바이러스가 증식억제하고 질병의 중증도를 낮출 수 있다.
최근 연구에 의하면, COVID-19에 작동하는 항체보다 CD8+ T cell의 항원결정인식부 분포가 더 넓은 범위를 갖는 것으로 확인되었다.49) 변이주들이 표면 spike 단백질에서 변이가 발생하는 점에 착안한다면, 체액성면역에 비해 세포성 면역의 T세포는 감염된 세포에서 발현되는 바이러스 단백질을 표적으로 인식해서 변이주들에 상대적으로 감염억제 효과가 높을 것으로 기대된다.
이러한 세포성면역을 효과적으로 유도하기 위해 어주번트(adjuvant) 기술이 도입되어 백신제제로 활용되고 있다. Matrix-MTM는 saponin, cholesterol, phospholipid로 구성된 40nm 크기의 나노입자로 면역증강 작용기전이 정확하게 분석되지는 않았지만, 항원과 함께 접종 시 항원 특이적 항체 생성능과 중화 항체능이 강화되고, 세포성 면역도 활성화되는 것으로 보고되어 있다. Novavax사는 재조합단백질 항원과 Matrix-MTM 어주번트 조합으로 여러 백신들을 개발 중이다.50)
마. 감염병 대응 기술 동향
우리나라는 정보통신기술 기반 스마트 검역정보시스템을 활용하여 코로나19 감시, 접촉 추적 및 엄격한 검역을 포함하여 정부가 조정하는 격리 및 완화 프로세스를 가동하였으며 이를 통해 감염병 조기 통제가 가능했다. 우리나라 외에도 다양한 나라에서 코로나19 대응을 위한 도구로서의 디지털 기술 활용이 이루어졌다.51)
(가) 한국
질병관리본부는 국민건강보험공단의 자격조회시스템, 건강보험심사평가원 의약품안전이용심의, 국제여행자정보시스템을 활용해 코로나19 모니터링 기간 동안 의료기관을 이용하는 내국인 및 외국인을 포함하여 한국에 입국하는 모든 개인의 출입국정보를 공유했다.
특별출입국절차에는 발열, 기침 등의 증상을 매일 신고해야 하는 휴대전화 자가진단 앱을 14일 동안 설치한 후 입국이 허용되는 절차가 포함됐다. 앱을 통해 증상이 등록되면 전담팀에 안내해 진료 및/또는 진료를 받을 수 있도록 안내했다. 이는 입국 당시(코로나19의 잠복기 때문에) 무증상이었던 코로나19 의심환자에 대한 신속한 진단과 격리 치료가 가능해 지역사회 감염병 관리 개선에 일조했다.
내국인에 대해서도 보안카메라 영상, 얼굴 인식기술, 은행카드 기록, 차량 및 휴대폰의 GPS(Global Positioning System) 데이터를 사용하여 사람들의 동선에 대한 실시간 데이터와 상세한 일정을 제공하는 공격적인 접촉 추적시스템을 구현하였다. 국내에서는 해당 지역의 새로운 코로나19 사례에 대한 긴급 문자 알림을 받고 감염자와 접촉했을 수 있는 사람들은 테스트 센터에 보고하고 자가격리 하도록 안내를 받았다.
(나) 대만
중국이 발병을 보고하자마자 대만은 중앙 집중식 실시간 국가 건강보험 데이터베이스와 이민기록의 데이터를 통합하여 우한에서 온 비행기 여행자들에 대한 건강 검진을 시작했다.
이 데이터를 통해 의료 시설은 환자의 여행 기록에 액세스하고 코로나19 테스트 및 추적을 위해 개인을 식별할 수 있었다. 대만은 중국 우한과 가까운 취약지역이었지만 빅데이터의 효율적인 사용으로 초기에 낮은 사례 및 사망자 수를 보였다.
(다) 중국
중국의 Alipay는 국가 통합 정부 서비스 플랫폼을 기반으로 전염병 예방 및 통제 건강 QR코드 시스템을 개발했다. QR코드는 개인의 최근 노출 가능성 및 위험에 대한 표준 설문지에 입력된 데이터에서 생성된다. 이 QR코드는 거주자 및 직장으로 복귀하는 사람들이 도시를 출입할 때 코로나19 건강 상태를 증명하는 도구로 사용되었다. 특히 녹색, 노란색 및 빨간색의 세 가지 색상을 사용하여 위험도 낮음, 중간 및 높음을 표시하는데, 위험도에 따라 활동반경이 제한되기도 한다. 예를 들어 녹색 코드가 있는 사용자는 대중교통 탑승이 가능하며 빨간색 코드가 있는 사용자는 14일 동안 집에서 자가격리된다.
(라) 싱가포르
싱가포르는 개인이 서로 가까이 있을 때 근거리 블루투스 신호를 교환하는 휴대폰 애플리케이션을 출시하였다.
이 애플리케이션은 사람들 간의 접촉을 기록하고 21일 동안 각자의 휴대폰에 저장하며 개인이 코로나19 감염자로 확진되면 싱가포르 보건부는 감염된 사람의 연락처를 식별하기 위해 데이터에 액세스하여 감염병 전파를 통제하였다.
(마) 독일
독일은 맥박, 체온, 수면 패턴 데이터를 수집하여 바이러스성 질병의 징후를 선별하는 스마트워치 애플리케이션을 출시하였다.
신청자의 데이터는 당국이 운영하는 코로나19 발병 가능성을 평가할 수 있는 온라인 대화형 지도에 표시되고 이에 따른 광범위한 검사와 디지털 의료 개입으로 독일은 높은 발병률에도 불구하고 다른 국가에 비해 낮은 1인당 사망률을 유지하였다.
(바) 아이슬란드
대부분의 다른 국가와 달리 아이슬란드는 무증상 개인에 대한 광범위한 테스트를 진행하였다. 아이슬란드는 모바일 기술을 사용하여 환자가 보고한 증상에 대한 데이터를 수집하고 이러한 데이터를 임상 및 게놈시퀀싱 데이터와 같은 다른 데이터 세트와 결합하여 바이러스의 병리 및 확산에 대한 정보를 공개하였다. 이러한 접근 방식을 통해 무증상 코로나19의 유행 및 전파에 대한 데이터들을 축적하였다. 이외에도 많은 국가들이 코로나19 확산을 방지하기 위하여 확진자 접촉 추적앱의 활용, 원격진료, 개인 건강정보 수집 등 다양한 디지털 도구를 활용하고 있으나 민감한 개인 건강 데이터의 수집이 개인정보 침해로 이어질 수 있어 활용된 정보가 상업적 목적으로 이용되지 않도록 정보 활용 이후의 데이터 처리에 대한 규제가 필요하다.
바. 전망
계속되는 코로나19의 확산 및 변이의 발생으로 전 세계는 감염의 공포에서 벗어나지 못하고 있으며 불황의 늪에 빠져 경제적 위기에 봉착해 있다. 전 세계는 이 난관을 해결하기 위하여 감염병을 직접 통제할 수 있는 백신과 치료제 개발에 많은 비용을 투자하고 있으며 정보통신기술을 적용하여 방역에 힘쓰고 있다. 경제협력개발기구(OECD)는 2022년 경제 수준이 코로나19 이전으로 회복될 것으로 전망하고 있으나 국가별 불균등이 심화될 것으로 예상하였다.
우리나라뿐만 아니라 전 세계는 여전히 기후변화와 인구이동, 무분별한 개발로 인해 감염병의 이동 및 인수공통감염병와 같은 신변종 감염병의 발생 위험에 직면해 있다. 바이오기술과 의료기술의 발달에도 감염병의 완벽한 정복은 불가능할 것이다. 발생 가능한 신변종 감염병에 대응하기 위하여 백신, 진단, 치료기술 뿐 아니라 감시/예측, 임상역학, 방역/방제 등과 같은 감염병 대응 연구 분야와 감염병 종료 이후 사회․경제적 회복을 위한 다양한 정책 및 인프라 확보 등 각 단계별 전방위적인 대응계획 및 투자가 이루어져야 한다.
또한 신변종 감염병 감시 및 확산방지를 위한 범국가적 정보공유, 디지털 협업 플랫폼과 같은 인프라 구축 및 감염병에 노출된 취약 국가에 기술적․재정적 지원을 수행할 수 있는 시스템의 구축 등 감염병 대응을 위하여 국제기구 및 외국과의 유기적 공조를 통한 글로벌 준비태세를 갖춰야 할 것이다.

1. 농림
가. 농업연구개발 개요
UN을 중심으로 각국은 인구 증가와 기후변화에 따른 식량 증진, 지속 가능한 농업, 생명자원의 보존에 대한 인류 공통의 목표를 위해 구체적인 실행계획을 정하고 이행하기 위해 노력하고 있다.
2050년까지 농작물에 대한 수요가 적어도 60% 이상 증가할 것으로 예상되며 바이오연료, 천연물질 생산의 원료로 활용되는 식물자원의 수요가 증가하고 있다. 인류 생존을 위한 안정적인 식량자원의 확보와 생태계 보호를 통한 지속 가능한 농업을 위해서는 그린바이오 분야의 연구개발 방향이 그 어느 때 보다도 중요한 이슈라고 할 수 있다. 이에 최근 농식품부, 농진청, 산림청 등 유관 부처의 그린바이오 연구개발 지원 동향과 연관 산업의 동향, 해외 동향을 파악하여 중장기적인 R&D 방향성 설정에 참고하고자 한다.
(1) 기후변화 대응 연구개발
(가) 신육종 기술개발
글로벌 종자강국 실현 및 종자산업 기반 구축을 위해 국가 전략형 수출 및 수입대체 신품종 20개 품목을 개발하였는데 씨적은 수박 품종인 ‘씨저근’, 동남아 시장 공략을 위한 양배추 ‘트로픽에이스’, 복합내병성 토마토 ‘찰스톤 TY’등을 예로 들 수 있다. 미래 대비를 위해 선진국 수준의 디지털 육종기술 확보를 위한 ‘디지털육종기반 종자산업 혁신기술개발사업’으로 신규 예타사업을 기획하여 대상사업으로 선정된 바 있다. 이 사업은 농식품부와 농진청의 골든시드프로젝트, 차세대바이오그린21사업과의 통합연계를 통하여 향후 한층 발전된 기술 수준으로 육종소재개발, 생산표준화, 내재해성 품종개발 등에 집중하여 정밀육종을 실현하고자 하는 것을 목표로 하고 있다.
유전체정보와 유전자 기반 기술을 활용한 동식물의 품종 개량을 위해 CRISPR/Cas9 유전자가위 원천기술을 개발, 성장 및 지방대사 관련 유전자를 제거한 가금류 세포주를 확보하여 생산 기술까지 연계한 성과를 발표하였다. 또한 다부처유전체사업, 차세대바이오그린 사업, 임업기술연구개발사업 등을 통하여 농업에 활용되고 있는 식물, 동물, 미생물의 유전체정보를 해독, 분석하여 2014년부터 축적된 데이터의 양은 약 15,500Gb52)에 달하고 있으며 이를 활용하기 위한 분석이 진행 중인데 정보의 활용이 가능한 수준까지는 보다 많은 분석기술 개발과 인력양성이 필요한 시점이다.
산림 분야의 생명공학 원천기술 개발은 내염성, 내건성 등의 환경 스트레스 내성 유전자를 교정한 현사시나무 개발과 유전체기술을 도입하여 난과식물 최초로 표준유전체 해독을 완료했으며 방사선 돌연변이 유도를 통한 고기능성 육종소재 43개체를 선발하였다. 또한 산림연구기술개발로 무병묘증식을 위한 재분화기술개발 및 신초(새순) 유도기술을 개발하였으며 곰솔 등 3개 수종의 유전체 빅데이터를 확보하였다.
(나) 고위험 병해충 및 질병 대응 기술개발
작물병해충 방제 및 진단 기술개발 분야에서는 경제적 피해가 큰 식물 유해선충 방제를 위한 미생물소재 개발, 작물바이러스 병 진단기술, 현장 검정용 휴대용 병 진단키트 개발 등이 이루어졌다. 농식품부와 농진청은 2020년 ‘작물바이러스 및 병해충대응기술개발’ 사업을 통하여 향후 3~5년간 현장적용 가능한 병 방제 기술개발을 지원 중이다.
동물 질병대응을 위해 예방에서 사후관리까지의 전 주기적 기술개발 지원을 위해 국가 재난형 동물감염병 대응 사업으로 아프리카 돼지열병(ASF) 분자진단법 효율성 향상, 반도체 센서 기반 진단시스템이 개발 중에 있다.
(2) 지속 가능한 농업을 위한 생물농약 연구
식량작물의 경제적 생산을 위해 오랜 기간 동안 상대적으로 비용이 저렴한 화학농약이 시장을 점유53)해오고 있었으나 안전한 먹거리와 농산물에 대한 관심이 높아지고 인체와 환경에 유해한 영향을 미치는 잔류농약, 농약내성 문제 등이 대두되면서 대체재에 대한 필요성이 부각되었다. 생물농약은 화학농약의 대체재로 각광을 받아 왔으나, 생산․유통․저장 비용이 높고 즉시 효과가 나오는 측면이 늦은 관계로 소비자의 외면을 당하는 상황이다. 생물농약은 천연물 기반의 생화학농약과 미생물 균주 자체를 활용하는 미생물농약으로 분류된다. 장점은 화학농약에서 문제가 되고 있는 잔류농약과 내성 문제가 없고 원제 개발비용이 낮으며 개발 기간이 상대적으로 약 3년 수준으로 짧은 것으로 조사되었다. 그러나 사용범위가 제한적이고 구입비용이 높으며 즉시 효과를 볼 수 없다는 단점을 가지고 있어서 살포 후 화학농약과 대비하여 처리 환경에 따라 50% 이하의 효과를 보이는 경우도 있어서 이러한 단점들을 보완할 수 있는 기술개발이 필요하다.
2020년 정부는 생물농약을 포함한 농업의 마이크로바이옴 연구개발 분야 등 그린바이오 5대 유망산업을 2030년까지 2배 이상 키우는 ‘그린바이오 융합형 신산업 육성방안’을 발표하였고 2021년 핵심농자재국산화기술개발사업 등을 통하여 지원을 시작하였다. 그러나 국가 R&D 사업 분석 결과, 시장규모나 성장 가능성에 비해 정부 R&D 지원이 미흡한 것으로 분석되었다.54)

(3) 농생명소재 개발 및 대량생산 기술
농생명소재는 ‘식물, 동물, 미생물, 곤충 등에서 유래한 유용하고 특수한 기능을 가지는 농생명 자원 그 자체, 또는 분리․정제 등 가공을 거친 물질’로 정의하고 있다.55)
(가) 고부가가치 농생명자원 활용 기능성 소재 개발
농진청에서는 농업의 부가가치 향상을 위해 기능성 농생명소재와 품종 개발에 지속적으로 예산을 투입 중이다. 대표성과로는 뽕나무, 누에, 곤충단백질 등의 소재를 개발하여 기술이전 11건을 달성했고 화장품소재, 질병치료 의약소재, 곤충자원 대상의 기능성 후보물질 발굴 등에 계속 지원하고 있으며 일부 성과를 달성하고 있다.
(나) 유용 산림자원 활용 소재 발굴 및 활용기술
산림청 지원의 기술개발사업을 통하여 산림약용자원을 활용한 천연물지도를 작성하였고 추출물 라이브러리를 제작하여 자원의 지역별 지표, 주요성분 등에 대한 정보를 구축하였다. 이 중 기능이 우수한 항염증 물질 탐색과 약리기전 구명 연구를 수행 중에 있다.
또한 산림자원 중 다양한 목적에 활용 가능한 기능성 소재 발굴을 위한 노력을 지속적으로 지원하고 있는데 참나무류로부터 유용 대사체를 분리하여 피부재생 효능을 검증한 성과를 이루었다.
(다) 스마트팜 활용 농산물 및 식의약소재 대량생산 기술개발
스마트팜은 미래 식량위기와 기후변화 대응 방안으로 농생명 소재의 생산성 극대화 및 고품질 생산을 가능하게 하였다. 스마트팜은 농축산 생산시설의 환경 및 생체정보 자료의 해석, 판단을 통하여 관행적이며 경험 위주의 농업기술에 대한 의존도를 낮추고 표준화된 제어 방법을 도입함으로써 최소의 노동력, 에너지, 자원투입을 통해 생산성을 극대화하고 고품질의 농산물을 생산할 수 있게 만들어 주고 있다.
현재 스마트팜을 활용한 농업은 대부분 온실작물 재배에 치중되어 있어서 파프리카, 토마토 등의 특정 과채류에 대한 대량생산으로 가격하락을 유발하고 있다. 따라서 투자 효율성을 높일 수 있는 고부가가치의 농생명 소재 개발이 절실히 필요한 시점이며 이러한 스마트팜 패러다임의 전환만이 차별화된 농산업으로 발전할 수 있는 기반을 마련할 수 있을 것으로 사료된다.
(라) 식물 기반 재조합단백질 생산기술개발
식물을 이용한 단백질 생산기술은 세포배양, 발현시스템, 형질전환시스템 등이 있다. 농식품부는 2010년 전후로 ‘분자농업(molecular farming)’개념의 도입과 신규과제 기획을 통하여 국내 연구팀에 의해 현재 산업화 단계에 접어든 개인연구 결과물들을 이끌어 냈다.
대표적으로 포스텍, (주)바이오앱은 돼지열병마커백신을 개발하여 해외 시장까지 개척 중에 있는데 보유하고 있는 기술이 식물체 내에서의 유용 단백질 발현에 대한 플랫폼 기술로서 향후 생산하고자 하는 단백질을 변경하여 적용한다면 다양한 식의약용 단백질 생산이 이루어질 수 있을 것으로 기대된다.
국내 기업인 (주)넥스젠은 산업화 진입단계에 들어선 식물 활용 진단용 항원 생산의 연구성과를 달성하였고 그 외 경희대, 국립농업과학원, 단국대, 전북대, (주)엔비엠 등이 다양한 의약소재를 대상으로 식물체 내 생산 연구개발과 산업화에 매진하고 있다.
(3) 유전체정보 분석 및 활용 기술개발
포스트게놈 다부처유전체사업(2014∼2021)을 통하여 농식품부는 농업 유용 미생물 유전체 해독 및 분석, 타 미생물 상호작용 연구, 유용 균주 발굴 및 소재 개발 등을 목표로 8년간 지원한 결과 고품질 김치 사업화 성과와 전통 누룩 유래의 우수 양조 미생물을 활용한 탁주를 생산하는 성과를 이루었다.
또한, 농진청을 중심으로 식물 유전체정보 해독하고 유용형질 연관 유전자 발굴 연구를 통하여 유용 자원의 해독률이 크게 향상되었다. 동물 유전체 분야에서는 유전정보를 활용한 유전체 선발 시스템을 활용하여 인공수정용 씨수소를 선발하여 장기적으로 유전자원 보급 체계를 구축하고자 하였으며 돼지 유전체선발 기술을 실용화하여 종돈 생산 시스템을 확립하였다.
나. 해외 동향
(1) 일본의 농림분야 연구개발 전략
일본 정부는 2020년 5월 ‘농림수산연구 혁신 전략 2020’을 발표하고 식량의 안정적 공급과 농업의 지속발전 등을 위한 기본계획을 수립하였다. 주요 분야로 스마트 농업, 환경, 바이오를 정하여 식품산업과 환경을 지키며 농림수산업의 국제 경쟁력을 강화한다고 공표하였다.
우리나라와 마찬가지로 일본에서도 농촌인력난 해소를 위한 스마트 농업의 실증과 이에 따른 새로운 플랫폼 창출, 서비스 비즈니스 모델의 확립, 농기계 완전 자동화 및 무인화시스템 구현, AI를 활용한 데이터 중심 농업 등을 주요 골자로 하고 있다. 아울러 환경과 관련된 분야로 온실가스 대폭 절감, 토양 미생물 기능을 활용한 생산방식 연구, 바이오매스 자원활용, 기후변화 적응기술 개발, 바이오 분야에서는 장내 미생물 대사산물 기능 연구, 데이터 기반 스마트 육종, 신소재, 동물의약품 등과 연계한 신산업 창출을 주요 분야로 담고 있다.
(2) 해외 식물기반 의약용 단백질 생산 연구개발 및 산업 동향
미국의 Dow AgroSciences사는 수의용 Newcastle 질병 백신을 개발하여 2006년 농무부(USDA)로부터 최초의 허가를 받았고 이스라엘의 Protalix사에서는 인간의 고셰병 치료제를 개발하여 미국 Pfizar사에 이전했으며 형질전환 당근세포를 이용한 단백질의약품으로 2012년 세계 최초로 미국 FDA 제품허가를 받은 바 있다.
현재까지 산업용 단백질 6개 제품이 개발되어 산업화를 이루었고 미국 Sigma사에 판매하고 있는 Advin 등은 연구용 시약으로 판매 중이다.
(3) 해외 식물유래 천연물 의약품 시장 동향
천연물 의약품 세계시장은 2022년 396억 달러로 성장을 전망하고 있으며 세계 상위 25개 의약품 25개 중 42%가 생물학제제 천연물 의약품 또는 천연물 유래 단일물질로 이루어졌으며 대표적인 식물유래 의약품은 타미플루(팔각회향나무, 항바이러스제)로 판매액은 30억 달러를 초과하고 있다.
대표적인 식물유래 천연물 의약품은 아스피린(버드나무, 해열진통제), 탁솔(주목나무, 항암제), 은행잎엑스(혈액순환), 차전자엑스(질경이, 정장제) 등이 있다. 미국 FDA에서는 ‘botanical drugs’이라는 의약품 분류를 새롭게 만들어 급격히 성장하고 있는 천연물 의약품 시장에 대한 가이드를 마련하고 산업의 성장과 가능성을 열어두고 있다.
미국뿐 아니라 영국, 독일, 일본 등에서도 다양한 식물유래 천연물 의약소재에 대한 라이브러리 구축 및 기능을 평가하고 있으며 이 중 뛰어난 치료효과가 있는 소재에 대한 의약품으로의 개발에 노력 중이다. 특히 중국은 세계 최대 천연화합물 기반을 구축하고 초대형 프로젝트를 적극 추진 중이다.
다. 국내 현황
골든시드프로젝트 사업을 통하여 채소종자사업단, 원예종자사업단 등을 지원하며 고부가가치 품종 육성을 통한 수입대체 및 해외수출을 지속적으로 추진 중이다. 또한 농식품부는 미생물 자원의 수집 및 활용 지원을 위해 바이오혁신 플랫폼인 유용미생물은행 구축을 위한 설계를 완료하였으며 동물감염병 유입방지와 감염통제 기술개발, 주요 작물의 병해충 방제 및 진단 기술개발이 이루어지고 있다.
농진청은 종자 빅데이터 생물정보 통합 및 활용체계 구축을 위해 농업생명공학정보센터(NABIC)의 빅데이터 관리를 강화하고 전산자원 확충을 추진 중이고 국내 농생명자원을 활용한 소재개발과 작용기전 및 효능평가 등의 연구를 수행하고 있다. 산림 분야는 자생식물을 활용하여 산업화하기 위한 소재 발굴과 신품종 육성에 힘쓰고 있으며 기존 산림 소재의 활용도를 다변화하고 재배와 개화조절 기술을 개발하여 활용가치를 높일 수 있는 우수개체 선발 연구를 진행하고 있다.
라. 발전 과제
(1) 품종보호제도 보완과 신규 종자개발 사업 추진 필요
세계 주요국의 종자시장은 지난 10여년간 1.5배의 성장을 이루었고 각국은 시장에서 우위를 점하기 위하여 UPOV 가입, 국가별 관련법을 만들어 신품종에 대한 지적재산권을 보호하고 있다.
이에 우리나라는 미비한 품종보호제도로 인해 막대한 로열티를 획득할 수 있는 기회를 상실한 일본의 사례를 거울삼아 품종보호체계를 재정비할 필요가 있다. 실제 농업 현장에서 자가채종하는 농업인과 품종보호권자 간의 분쟁발생의 가능성이 상존하고 있으므로 관련 규정을 보다 명확히 정의할 필요가 있을 것이다.
또한 종자의 해외 유출방지를 위한 식물 신품종 등록 시 국내 한정 등 재배지역이나 수출 목적지를 지정하는 방법을 검토해야 할 것으로 판단되며 골든시드프로젝트의 후속사업으로 디지털육종기반의 신규 사업을 추진할 필요성이 높다.
(2) 미생물 소재의 농업 적용에 대한 과제
식물은 화학적, 생물학적 토양환경에 따라 생육에 큰 영향을 받게 되는데 특히 농업을 위해 한정된 지역에서 동일한 작물을 연작할 경우 토양 내 영양분의 불균형을 초래하게 되고 생물학적인 환경 즉 토양 미생물의 생태계도 크게 변화하게 되는 것이 일반적이다.
이를 보완하기 위해 여러 가지 화학비료나 미생물 제재를 활용한 생물비료로 처리하게 되면 이것은 토양 내 환경에 변화를 일으키는 또 다른 차원의 순환적 연결고리를 가지게 된다.
이런 개념으로 최근에는 식물 또는 작물의 자체적인 면역력을 증강하여 생육을 향상시키고 나아가 농산물의 품질을 높이는 미생물 소재를 발굴하여 적용하는 사례가 증가하고 있다. 또한 미생물 균주 자체를 활용하여 작물이나 산림자원의 병해충 방제제 개발에도 일부 정부 예산이 지원되고 있다.
그러나 대부분은 미생물소재의 작용 메커니즘에 대한 이해를 바탕으로 하기보다는 실증적인 농업 현장 시험을 중심으로 효과성이 있는 경우 유기농자재로 등록하여 제품 생산에 돌입하고 바로 시장으로 진입하는 경우가 많은 것으로 파악이 된다.
따라서 우수한 미생물 소재를 활용한 제품으로 해외시장을 겨냥하기 위해서는 소재의 효과성에 대한 충분한 과학적 자료를 축적하는 것이 급선무이다. 다만 이러한 과정에는 많은 예산이 필요하므로 정부가 적극적으로 크고 작은 과제를 지원하여 발굴한 미생물 소재의 다양한 적용성과 효과성에 대한 과학적 데이터를 축적하고 시장에서의 경쟁력 확보와 시장 개척의 인프라를 구축할 필요가 있다.
(3) 포스트바이오틱스의 농업활용 연구 전망
농업 분야에서 포스트바이오틱스를 가축사료에 첨가 시 천연항생제 효과가 입증56)되고 있으므로 이에 대한 지원이 확대될 필요가 있다.
포스트바이오틱스 연구는 프로바이오틱스나 프리바이오틱스에 비하여 비교적 최근에 연구가 활발해지기 시작하였는데 2018년 PubMed에 발표된 논문 중 프리바이오틱스 및 프로바이오틱스 관련 논문은 3,000여 편이 넘는 반면 포스트바이오틱스 관련 논문은 25편에 불과하였다.
포스트바이오틱스 연구가 활발해짐과 동시에 전 세계 시장은 크게 확대(2024년 9억 4,200만 달러 → 2027년 17억 7,310만 달러)57)될 것으로 예상하고 있으며, 특히 농업 분야에서의 시장 확대 가능성이 높다. 이에 따라 한국형 바이오틱스 산업육성을 위해 농식품부는 연구개발 분야에 대한 투자를 2019년 1,601억 원에서 2024년까지 2,533억 원으로 확대 지원할 계획이며 고령화에 따라 관심이 높아지는 건강 증진 식품분야와 농업분야에서의 활용연구에 집중하고 있다.

자료: 프로바이오틱스, 프로바이오틱스 및 포스트바이오틱스 검색 PubMed 2019.01.
Int. J. Mol. Sci. 2019, 20, 4673; doi:10.3390/ijms20194673.
[그림 3-73] 바이오틱스 연구논문 발표 현황(1970~2018)
2. 축산
가. 축산연구의 개요
미국의 미네소타 주에 위치한 생명공학 기업 Recombinetics에서 2015년에 뿔 없는 홀스타인 젖소를 개발하였다. 그들은 2세대 유전자 편집 기술 TALEN(Transcription Activator-Like Effector Nuclease)을 적용하여 성공적으로 두 마리를 생산하였으며 스포티지(spotigy)와 부리(Buri)라고 명명하였다. 그 중 ‘부리’에서 17두의 자손을 증식한 후 ‘부리’의 정액을 브라질로 보내 대량 생산을 위한 준비를 하고 있었다. 그런데 미국의 식품의약국(Food and Drug Administration, FDA)에서 ‘부리’의 유전자를 면밀히 조사한 결과 ‘부리’는 수소의 유전자만 가진 것이 아니라고 판정하였다. ‘부리’에는 뿔의 형성을 조절하는 Polled 유전자 기능 제거(knock-out, KO)를 위해 벡터 제작에 사용했던 플라스미드와 형질전환 세포 선별을 위한 항생제 저항성 유전자가 삽입되어 있었던 것이다. Recombinetics는 이를 인정하고 3세대 유전자 편집 기술 CRISPR/Cas9(Cluster Regularly Interspaced Short Palindromic Repeats/CRISPR-associated protein 9)을 적용하여 뿔 형성 유전자 돌연변이 젖소를 개발할 것이라고 발표하였다.
위의 뉴스는 우리에게 두 가지 큰 의미를 전달하고 있다. 첫 번째는 유전자변형 생물체에 관한 법률이 없는 대표적인 유전자변형 생물 수출국인 미국과 브라질에서는 식품용으로 유전자변형 가축의 대량 생산을 준비하고 있다는 점이다. 두 번째는 일부 국가에서는 유전자 편집기술로 생산되었으나 외래유전자가 잔존하지 않은 가축의 경우 자연 상태에서 자연적으로 발생하는 돌연변이 개체와 크게 다르지 않다고 판단하며 이를 유전자변형 가축으로 인식하지 않는다는 점이다. 하지만 여전히 ‘외래유전자의 삽입이 없는 돌연변이 SDN-1(Site-Directed Nuclease-1) 산물이 LMO(Living Modified Organism)인가?’ 라는 논쟁이 국가별로 진행 중인 가운데 뿔 없는 홀스타인 종축 외에도 가축의 경제형질 개선 및 질병 저항성 향상, 인간의 질환 연구 등을 위한 다양한 유전자변형 가축이 개발되고 있다.
최근 2020년 12월에 세계 최초로 이종이식에 활용하기 위하여 개발된 알파갈(alpha-Gal) 항원을 제거한 복제돼지 ‘갈세이프(GalSafe)’를 소유권자 유나이티드 세라퓨틱스(United Therapeutics)의 산하기업 리비비코(Revivicor)에서 식품으로 활용을 신청하였고, FDA에서 승인하였다. 갈세이프는 세포 표면에 존재하는 알파갈 항원을 제거하였기 때문에, 이로부터 발생하는 적색육 알레르기가 발생하지 않아 적색육 알레르기 환자에게 제한적으로 식품으로 사용이 허용되었다. 이 돼지는 원래 세포, 장기, 혈액 성분 등의 이종이식 소재를 제공하기 위한 원료동물로 개발되었고 이종이식 연구에 활용되고 있는 가운데 식품의 영역으로 그 활용 범위가 확대되어 기존에 개발된 유전자변형 가축을 식품으로 활용하기 위한 시도가 있을 것으로 예상된다. 2019년 이탈리아의 생명공학 회사 Avantea는 alpha-Gal 항원을 제거한 소58)를 개발하였는데 어떻게 활용할 지 지켜볼 일이다. 2015년 유전자변형 연어에 이어 동물로서 갈세이프(GalSafe) 돼지의 FDA 승인은 두 번째이지만 가축으로서는 첫 번째 사례로 유전자변형 가축의 활용 가능성을 열었다고 평가된다.
나. 해외 동향
(1) 경제형질 개선을 위한 유전자변형 가축 개발 현황
유전자 편집 기술인 Zinc Finger Nuclease(ZFN), TALEN, CRISPR/Cas9은 유전자변형 가축의 생산을 가속화시켰으며 이는 다양한 연구 분야에 형질전환 기술의 접목이 가능하게 했다. 특히 생산성 향상을 위해 육질 및 근육량 관련 유전자(MSTN, FBXO40, fat-1 등), 유당 생성에 관여하는 유전자(BLG, LacS 등), 번식능력 관련 유전자(SOCS2, BMPR1B, GDF9 등)를 변형시킨 형질전환 가축이 다수 개발되었으며 해당 유전자의 기능이 검증되어 유전자변형을 통한 우수한 경제형질 보급 가능성이 열리고 있다.
유전자변형 가축 생산 연구는 기후 변화 같이 현안에 대응하여 가축의 생산성을 향상시키기 위한 연구로도 확대되고 있다. 여름철 폭염은 가축에 고온 스트레스를 유발하여 사료 효율 및 번식능력을 저하시키며 이는 생산성 감소로 이어진다. 소 품종 중 Senepol 종에서 발견되는 SLICK 유전자는 질과 직장의 온도를 낮추고 땀 분비를 증가시켜 여름철 산유량을 향상시키는 것으로 밝혀졌다. 2018년 브라질에서는 TALEN을 이용하여 Angus 종의 유전체 상에 존재하는 하나의 염기를 제거함으로써 Senipol 종과 동일한 SLICK 유전자를 가지는 소를 생산하였다고 보고되었다59).
2020년 미국 워싱턴주립대학, 유타주립대학, 메릴랜드대학과 영국 에든버러대학 로슬린 연구소의 공동연구진은 CRISPR/Cas9을 활용하여 수컷의 번식을 관장하는 NANOS2 유전자가 KO된 유전자변형 돼지, 염소, 소를 생산하였다고 보고하였다60). 대리부(Surrogate sires)라 불리는 NANOS2 KO 수컷 개체는 불임 상태로 출생되지만, 이들의 정소에 다른 수컷의 줄기세포(정원줄기세포, Spermatogonial Stem Cell)를 이식하여 이식된 줄기세포 유래의 정자를 생성할 수 있게 된다. 이는 동결 정자의 생존율이 낮은 돼지나 인공수정 효율이 낮은 염소, 인공수정 시 행동 통제가 어려운 육우에 활용하여 번식효율을 개선할 수 있을 것이라는 장점을 가진다. 또한 원하는 수컷 유래의 정자를 자연 교배 방식으로 전달할 수 있어 우수한 경제형질 보급을 통한 품종 개량이 손쉬워질 것이며 멸종위기종의 복원에도 활용할 수 있을 것으로 기대되고 있다. 게다가 그들로부터 생산된 자손에게는 외래유전자가 전달되지 않는다는 점에서 유전자변형 생물체의 안전성 논란에서 조금은 자유로울 수 있을 것으로 예상된다.
(2) 질병저항성 향상을 위한 유전자변형 가축 개발 현황
Caenorhabditis elegans(C. elegans) 유래의 Fat-1 유전자를 발현하는 가축은 육질이 개선되며 alpha-linolenic acid(ALA), docosahexaenoic acid(DHA) 등을 포함하는 n-3PUFAs의 수준이 증가하여 질병에 대한 저항성이 향상된다고 보고되었다. 2006년에 Fat-1을 발현하는 돼지, 2012년에는 Fat-1을 발현하는 소가 개발된 바 있으며, 2018년에는 CRISPR/Cas9을 이용하여 MSTN 위치에 fat-1 유전자를 도입하여 MSTN KO/ fat-1 Knock-in(KI) 염소를 생산하였다. Fat-1을 발현하는 유전자변형 동물은 관절염, 알레르기 반응, 심혈관계 질환, 암, 알츠하이머 등 질병 연구에도 활용되고 있는 것으로 보고되었다.
2019년 중국에서는 CRISPR/Cas9 기술을 통해 돼지 Rosa26 유전자 위치에 RSAD2가 Knock-in된 돼지는 농가의 경제적인 문제뿐만 아니라 인간의 건강과 동물의 복지 문제에도 직결되는 돼지열병바이러스(Classic swine fever virus, CSFV)와 가성광견병 바이러스(Pseudorabies virus, PRV)에 대해 저항성을 가진다고 알려졌다. 2020년에는 마찬가지로 Rosa26 유전자 위치에 porcine beta-defensin 2(PBD-2) 유전자가 돼지가 생산되었으며 이는 흉막폐렴의 원인균인 Actinobacillus pleuropneumoniae에 대해 저항성을 가진다는 연구결과가 보고되었다.
최근에는 유전자 편집 기술을 개발에 의해 다양한 유전자의 발현을 동시에 제어하는 것이 용이해졌으며, 2020년 중국에서는 CD163과 porcine Aminopeptidase N(pAPN) 유전자를 동시에 KO(CD163/pAPN double KO)한 돼지를 개발하였다. 각각의 유전자는 돼지생식기호흡기증후군 바이러스(Porcine Reproductive and Respiratory Syndrome Virus, PRRSV)와 Transmissible gastroenteritis virus(TGEV)에 대한 수용체 역할을 하는 단백질로 이들의 발현이 억제됨에 따라 CD163/pAPN double KO 돼지는 해당 감염병에 대해 저항성을 가지게 된다. 더불어 이는 신생자돈에서 설사병을 유발하는 Porcine deltacoronavirus (PDCoV)에도 저항성을 가진다고 밝혀지기도 하였다.
(3) 질환모델 가축 개발 현황
2018년 암 모델 동물로서 CRISPR/Cas9을 이용하여 TP53 유전자를 KO한 유전자변형 돼지가 생산되었다. 대동물을 활용한 질환모델 동물이 필요한 예로 마우스 암 모델에서 효과를 나타내었던 항암제의 단 5%만이 3상 임상시험에서 유효성을 가진다고 알려져 있다. 돼지의 경우 사람과의 면역 시스템이 80% 이상 유사한 반면 마우스의 경우 10% 이하인 것으로 조사된다. 이 외에도 돼지는 사람과 장기의 크기나 생리학적, 해부학적 특성이 유사하다는 점에서 사람의 질환 연구를 위한 질환모델 동물 개발에 주로 활용되고 있다.
퇴행성뇌질환(Neurodegenerative Disease, ND)인 파킨슨병(Parkinson’s disease) 모델로서는 2015년 CRISPR/Cas9을 이용한 DJ1 KO 돼지, TALEN을 이용한 PARK2/PINK1 double KO 돼지와 2016년 CRISPR/Cas9을 이용한 Parkin/DJ-1/PINK1 triple KO 돼지가 생산된 바 있다. 또한 alpha-Synuclein 단백질을 코딩하는 SNCA에 발생하는 특정 돌연변이가 파킨슨병을 유발한다고 알려져 있으며 2018년에는 이를 CRISPR/Cas9 시스템을 이용하여 KI 한 SNCA KI 파킨슨병 돼지 모델이 생산되기도 하였다.
2020년에는 우루과이에서는 청각신경병증(Auditory neuropathy spectrum disorder) 모델로서 Otoferlin(OTOF) 유전자를 변형시킨 양을 생산하였다. CRISPR/Cas9과 함께 single strand oligodeoxynucleotides(ssODN)을 도입하여 homology-directed repair(HDR)를 유도하였으며 OTOF 유전자의 exon 내에 도입된 ssODN에는 stop codon이 포함되어 있어 OTOF의 발현을 억제한다. 이는 대동물에서는 처음 생산된 OTOF KO 모델로 보고되고 있다.
다. 국내 현황
생명공학 기술을 활용하여 소, 돼지, 닭 등의 가축의 형질을 전환시키려는 연구 과제 정보를 확인하기 위해 국가 과학기술 지식 정보 서비스(www.ntis.go.kr)에서 키워드 ‘동물, 소 또는 돼지 또는 닭, 형질, 유전자, 개발’을 사용하여 검색해보면 소 관련 과제의 경우 2020년에는 11건, 2021년에는 8건 존재하는 것을 알 수 있다. 돼지의 경우 2020년에는 52건의 과제가 수행되었고 2021년에는 47건의 과제가 수행 중으로 확인된다. 닭의 연구 과제는 2020년에 18건, 2021년은 19건이 검색되었다. 연구과제는 국립축산과학원 같은 국립연구소와 한국생명공학원 같은 출연연구소, 대학, 기업, 민간 연구소 등 다양한 기관에서 수행하고 있었고 과제 관리기관도 농촌진흥청, 한국연구재단, 농림식품기술기획평가원, 한국보건산업진흥원, 교육부, 중소벤처기업부 등으로 다양하였는데, 특히 농촌진흥청에 관리하는 수가 가장 많았다. 국립축산과학원은 돼지, 한우, 닭 등의 가축을 보존하고 관리하는 연구 과제를 지속적으로 수행하며 국가기관으로서 우리나라의 유전자원 유지 및 공급 역할을 충실히 수행하고 있다. 닭 관련 연구과제의 주요 내용과 목표는 우수 경제 형질 유전자를 선발하기 위한 마커 개발이 대부분이었는데, 여기에는 조류인플루엔자 저항성 닭을 선발하기 위한 유전체 정보 해독 연구도 포함된다. 국립축산과학원은 닭의 원시생식세포와 정액 등의 생식세포를 동결 보존하는 기술 개발 연구를 수행하고 있다. 또한 달걀을 유용한 단백질을 생산할 수 있는 바이오리액터(bioreactor)로서 활용하기 위한 시스템 개발 연구를 수행하고 있는데, 이는 기존에 개발된 기술보다 생산성의 효율을 크게 증가시킬 수 있는 기술 개발이 연구목표이었다. 서울대학교는 기존의 유전자 변형 방법인 바이러스 벡터를 수정란에 도입하는 방식 이외에 웅성 닭에서 분리한 생식세포를 활용하여 유전자 변형 닭을 개발하려는 연구도 수행하고 있었다.
번식 기간이 길고 사업의 규모화가 필요한 소 개발 과제의 수는 상대적으로 적었는데, 신생 생명공학 기업인 ㈜리트바이오에서 비감염성 질환 예방과 치료를 위한 모델로서 근육의 발달을 억제시키는 기능의 myostatin(MSTN) 유전자 결손 소를 개발했다고 알려져 있다. 또한 우유 성분으로 사람의 세포 성장 인자 FGF와 EGF를 분비하는 소를 개발하여 이 성장인자를 화장품 개발에 활용하기 위한 과제를 수행하고 있었다. 서울대학교는 광우병 유발에 중요한 원인으로 알려진 프리온(Prion) 유전자 기능을 제거시킨 소 개발 연구를 수행하고 있다.
가축 중에서 돼지는 생리와 해부학적 관점에서 장기와 조직을 의료용 소재로서 활용이 가능한 품종이라고 오래전부터 인식되어 왔고, 면역학적으로 그 활용 가능성을 더욱 높이기 위하여 유전자 변형 돼지 개발이 지속되고 있다. 국립연구기관인 국립축산과학원과 더불어 기업들도 투자를 시작하여 돼지 개발에 참여하고 있다. 국립축산과학원은 기존에 개발하였던 alpha 1,3-galactosyltransferase 유전자 기능 제거(GTKO) 돼지에 기능을 강화하기 위하여 GTKO 돼지에서 분리한 세포에 보체조절단백질의 하나인 membrane cofactor protein(MCP)과 혈액이 응고되는 기전을 방해하는 thrombomodulin(TBM) 단백질을 발현하는 돼지를 개발하였다고 보고하였고(2020), 이종이식 거부반응의 증상 중에 하나인 염증 반응을 억제시키기 위하여 heme oxygenase 1(HO1)과 CD47을 발현하는 돼지 개발 과제를 수행 중에 있다. 또한 이미 개발한 이종이식용 돼지의 세포를 활용하여 의료용 소재 생산을 위한 기술 개발 연구도 진행하고 있다. 과학기술정보통신부의 지원으로 기업에서는 이종이식 거부반응의 원인 물질인 돼지 항원을 합성하는 유전자 GT, cytidine monophosphate-N-acetylneuraminic acid hydroxylase(CMAH), beta-1,4-N- acetyl-galactosaminyl transferase 2(B4GALNT2) 유전자에 추가로 isogloboside 3(iGb3) 유전자 기능 제거 돼지 개발이 진행 중이며, 이종이식에 활용하기 위하여 개발 또는 개발 중인 유전자 변형 형질전환 돼지의 임상 적용을 위한 무균 돼지 양산 시스템 구축 연구 과제 또한 진행 중이다.
농촌진흥청은 돼지의 장기 및 조직의 영장류 비임상 이종이식을 통한 장기이식 프로토콜 확립 및 모델 개발 연구를 지원하고 있으며 가톨릭대병원은 이종이식용 형질전환 돼지의 췌도를 분리하고 피막화 기술 개발 연구 과제를 수행하고 건국대병원은 돼지 각막의 비임상 이종이식 연구를 수행하는 등 우리나라에서 이종이식 임상 준비와 영장류 비임상 연구를 지속하여 임상 적용을 위한 기술개발 연구를 지속하고 있다. 농촌진흥청은 질환모델로서 돼지를 활용하기 위하여 흑색종 피부암 모델 돼지 개발을 목표로 Optogenetic fetal growth factor receptor를 발현하는 돼지 생산 과제를 지원하고 있고, 국립축산과학원은 신장 질환 모델 돼지를 개발하기 위하여 신장 질환 상염색체 우성 다낭신과 알포트 증후군 모델 돼지 개발 연구 과제를 기업과 대학연구팀과 공동으로 수행하고 있으며, 기존에 개발된 돼지를 모델 동물로 활용하기 위한 연구 과제를 수행 중에 있다.
라. 향후 전망
전 세계적으로 COVID-19에 의한 혼란이 지속되는 가운데 감염병 확산에 의한 팬데믹(Pandemic)은 비단 인간에게만 해당되는 것이 아니다. 가축 농가에서는 고병원성조류인플루엔자(Highly Pathogenic Avian Influenza, HPAI)나 아프리카돼지열병(African Swine Fever, ASF) 등 가축 감염병 확산에 대한 우려가 심각하다. 국내에서만 지난 10년간 가축 감염병 예방 목적으로 살처분 된 가축의 수가 7,000만 마리에 육박한다는 점에서 가축 감염병에 의한 경제․사회적 손실은 막대하다. 이러한 가축 감염병의 확산은 생산성에 대한 우려로 이어질 수밖에 없으며 이를 해결하기 위해 전 세계적으로 가축의 생산성과 질병저항성을 향상시킨 다양한 유전자변형 가축 개발 연구가 진행되고 있다. 우리나라는 최근 과학기술정보통신부, 농림축산식품부, 농촌진흥청의 지원으로 아프리카돼지열병 바이러스에 대한 수용체 유전자 발굴, 진단 및 백신 기술개발, 유전자편집 기술 구축 등의 연구 과제를 수행하고 있으며, 그 외 구제역 바이러스 등 다양한 바이러스성 질병을 회피할 수 있는 유전적 조절 방법 개발 연구도 진행되고 있다. 향후 국내에서 바이러스성 질병의 감염 및 저항하는 기전 연구를 목적으로 유전자변형 돼지 개발 연구가 시작될 것으로 예측된다.
최근 2021년 10월에는 미국 뉴욕대학교 랑곤헬스 메디컬센터의 로버트 몽고메리 박사팀에 의해 돼지의 신장을 신부전에 의한 뇌사 상태 환자에 이식하는 연구가 성공하였다는 기사가 뉴욕타임즈에 보도되었다. 식용 및 의료용으로 FDA 승인된 갈세이프(GalSafe) 돼지의 신장을 뇌사 환자의 허벅지 혈관에 연결한 후 3일간 관찰한 결과 초급성 면역거부반응이 발생하지 않았으며 돼지 신장이 정상적인 기능을 수행하는 것을 확인하였다. 이러한 결과는 장기이식을 기다리는 환자나 의료진의 기대감과 함께 동물복지에 대한 우려를 동시에 받으며 세간의 주목을 끌었다. 이처럼 유전자변형 돼지를 활용한 이종이식 임상 연구의 가능성은 점차 현실화 되어가고 있다. 또한 고도화된 유전자 편집 기술의 발달은 이종이식 분야뿐만 아니라 이 외의 다양한 분야에서도 유전자변형 가축이 활용될 수 있는 초석을 다지는 과정이라 생각된다.
[표 3-47] 경제형질 개선을 위한 유전자변형 가축 개발 현황
|
동물 |
유전자명 |
개발목적 |
형태 |
기법 |
발표년도 |
|
돼지 |
NANOS2 |
대리부(Surrogate sires)로 활용 가능 |
KO |
CRISPR/Cas9 |
2020 |
|
IRX3 |
지방량 감소 |
KO |
CRISPR/Cas9 |
2020 |
|
|
FBXO40 |
근육량 증가 |
KO |
CRISPR/Cas9 |
2018 |
|
|
IGF2 regulatory element |
육질 개선, 발육 속도 향상, 생산성 증대 |
KO |
CRISPR/Cas9 |
2018 |
|
|
소 |
NANOS2 |
대리부(Surrogate sires)로 활용 가능 |
KO |
CRISPR/Cas9 |
2020 |
|
Pc |
뿔 형성 억제 |
KI |
CRISPR/Cas12a |
2020 |
|
|
BLG |
유당분해효소결핍증 해결 |
KO |
TALEN |
2018 |
|
|
LacS |
유당 감소, 유당분해효소결핍증 해결 |
KI |
TALEN |
2018 |
|
|
양 |
SOCS2 |
번식 능력 향상 |
point mutation |
CRISPR/Cas9 BE |
2019 |
|
BMPR1B |
번식 능력 향상 |
point mutation |
CRISPR/Cas9 |
2018 |
|
|
염소 |
NANOS2 |
대리부(Surrogate sires)로 활용 가능 |
KO |
CRISPR/Cas9 |
2020 |
|
Tβ4 |
캐시미어(Cashmere) 생산 증대 |
CCR5-targeted KI |
CRISPR/Cas9 |
2019 |
|
|
FGF5 |
캐시미어(Cashmere) 생산 증대 |
point mutation |
CRISPR/Cas9 BE |
2019 |
|
|
MSTN |
근육량 증가 |
KO |
CRISPR/Cas9 |
2018 |
|
|
MSTN/Fat-1 |
근육량 증가, 육질 개선, 질병저항성 향상 |
MSTN KO/fat-1 KI |
CRISPR/Cas9 |
2018 |
|
|
EDAR |
캐시미어(Cashmere) 생산 증대 |
KO |
CRISPR/Cas9 |
2018 |
|
|
GDF9 |
번식 능력 향상 |
point mutation |
CRISPR/Cas9 |
2018 |
|
|
닭 |
G0S2 |
복부 지방 축적 감소 |
KO |
CRISPR/Cas9 |
2018 |
[표 3-48] 질병저항성 향상을 위한 유전자변형 가축 개발 현황
|
동물 |
유전자명 |
개발목적 |
형태 |
기법 |
발표 년도 |
|
돼지 |
CD163 pAPN |
Porcine Reproductive and Respiratory Syndrome (PRRS), Transmissible gastroenteritis virus (TGEV) 저항성 |
KO |
CRISPR/Cas9 |
2020 |
|
PBD-2 |
Actinobacillus pleuropneumoniae 저항성 |
KI |
CRISPR/Cas9 |
2020 |
|
|
RSAD2 |
Classic swine fever virus(CFCV), Peudorabies virus(PRV) 저항성 |
KI |
CRISPR/Cas9 |
2020 |
|
|
ANPEP |
Transmissible gastroenteritis virus(TGEV) 저항성 |
KO |
CRISPR/Cas9 |
2019 |
|
|
Ig-JH |
Hepatitis E virus 저항성 |
KO |
CRISPR/Cas9 |
2018 |
|
|
CSFV shRNA |
Classic swine fever virus(CFCV) 저항성 |
KI |
CRISPR/Cas9 |
2018 |
|
|
Fat-1 |
육질 개선, 질병저항성 향상 |
KI |
CRISPR/Cas9 |
2018 |
|
|
염소 |
Fat-1 |
육질 개선, 질병저항성 향상 |
KI |
CRISPR/Cas9 |
2018 |
|
닭 |
chNHE1 |
Avian leukosis 저항성 |
KO |
CRISPR/Cas9 |
2020 |
[표 3-49] 질환모델 가축 개발 현황
|
동물 |
유전자명 |
개발목적 |
형태 |
기법 |
발표년도 |
|
돼지 |
EDA |
폐 질환 모델 |
KO |
CRISPR/Cas9 |
2020 |
|
hF9 |
혈우병(hemophilia) 모델 |
KI |
CRISPR/Cas9 |
2020 |
|
|
SCD5 |
만성상악동염(Chronic Maxillary Sinusitis), 이골증(Dysostosis) 모델 |
KO |
CRISPR/Cas9 |
2019 |
|
|
hIAPP |
당뇨(Diabetes) 모델 |
KI |
CRISPR/Cas9 |
2019 |
|
|
MYH7 |
비대성심근증(Hypertropic Cardiomyopathy) 모델 |
Point mutation KI |
TALEN |
2018 |
|
|
Huntingtin |
헌팅턴병(Huntington’s Disease) 질환 모델 |
KI |
CRISPR/Cas9 |
2018 |
|
|
TP53 |
암 모델 |
KO |
CRISPR/Cas9 |
2018 |
|
|
ApoE |
죽상동맥경화증(Atherosclerosis) 모델 |
KO |
CRISPR/Cas9 |
2018 |
|
|
INS |
당뇨(Diabetes) 모델 |
KO |
CRISPR/Cas9 |
2018 |
|
|
SNCA |
파킨슨병(Parkinson's Disease) 모델 |
KI |
CRISPR/Cas9 |
2018 |
|
|
양 |
OTOF |
청각신경병증(Auditory neuropathy spectrum disorder) 모델 |
KI |
CRISPR/Cas9 |
2020 |
|
PPT1 |
유아 신경 세로이드 리포푸신증(Infantile Neuronal Ceroid Lipofuscinoses) 모델 |
KI |
CRISPR/Cas9 |
2019 |
|
|
CFTR |
낭포성섬유증(Cystic Fibrosis) 모델 |
KO |
CRISPR/Cas9 |
2018 |
|
|
ALPL |
저인산효소증(Hypophosphatasia) 모델 |
Point mutation |
CRISPR/Cas9 |
2018 |
3. 식품
가. 식품생명공학의 정의 및 범위
식품생명공학은 산업재 및 서비스 생산을 위해 살아있는 시스템(식물, 동물 또는 미생물) 또는 생물체에서 파생된 화합물을 사용하는 기술의 집합체로 정의되는 생명공학기술을 식품의 가공, 생산 및 산업적 활용에 응용하는 기술 분야이다. 대표적으로 (건강)기능성 식품 및 소재, 발효식품 분야 등을 포함한다.
식품 분야에서 사용되는 생명공학기술의 핵심기술은 크게 유전자재조합기술, 세포융합기술, 세포대량배양기술, 효소공학, 합성생물학 등으로 분류되며, 제품은 원료, 중간체 및 최종 제품을 모두 포함한다. 과학기술 표준 분류상의 범위는 F01 식량작물과학, F02 원예작물과학, F03 농생물학, F06 동물자원과학, F07 수의과학, F13 수산양식, F17 식품과학, F18 식품영양과학, 기타(F0401, F0506 등)를 포함한다.
본고에서는 식품생명공학 기술이 적용되는 분야에 초점을 맞추어 (건강)기능성 소재/식품(대체육 포함)과 발효식품으로 구분하여 국내외 기술동향, 산업동향 및 미래기술 전망을 기술하였다.
나. 국내외 기술(연구개발) 동향
(1) 국내 기술동향
국내에서 식품생명공학 기술은 식품의 영양, 품질, 안전성, 편의성, 생산성 및 수익성을 개선한 다양한 (건강)기능성 소재/식품 및 발효식품의 연구개발에 적용되고 있다.
전통적인 식품생명공학 기술인 효소반응이나 미생물배양 공정뿐만 아니라 형질전환(gene transformation) 및 과다발현(overexpression) 기술을 도입하여 미생물의 대사회로를 조절하거나 오믹스(omics) 기술을 적용하여 식품소재의 생산에 적용하고 있다. 특히 최근에는 제3세대 유전자가위기술(CRISPR/Cas9)의 확산과 함께 식품소재 생산에도 이를 응용하려는 연구가 시도되고 있다.
건강기능식품은 국내에서 식품생명공학기술이 적용되고 있는 대표적인 분야이다. 유전정보를 이용한 개인 맞춤형 건강기능식품에 대한 요구가 높아지고 있어 이에 관한 연구와 마이크로바이옴을 이용한 건강기능식품 연구가 가속화되고 있다. 또한, 건강기능식품의 제형 다양화 및 질환 예방 제품에 대한 수요 증가로 인해 관련 소재 및 기술이 개발되고 있다. 건강기능식품을 생산하는 데 있어서 효소반응이나 미생물배양공정을 이용하고 있는 예는 홍삼, 포스파티딜세린, 난소화성말토덱스트린, 코엔자임Q10, 폴리감마글루탐산, 글루코사민, 홍국, 뮤코다당(mucopolysaccharide), 헤마토코쿠스(haematococcus pluvialis) 추출물, 프로바이오틱스 등이다.
한국식품연구원에서는 새로운 기능성 소재나 공정연구뿐만 아니라 건강기능식품 플랫폼을 구축하여 산업체가 건강기능식품을 개발하도록 지원하고 있다. (재)유전자동의보감사업단에서도 천연물을 이용하여 의약품 및 건강기능식품 소재 개발을 위한 원천 및 융복합 기술을 개발하고 이를 활용한 소재 개발연구를 수행하고 있다.
다양한 기능성 식품소재 중 희소당(rare sugar), 당알콜, 올리고당과 같은 대체 감미료는 최근 국내외적으로 당류 저감화 분위기가 확산되면서 개발과 수요가 크게 증가하고 있다. 자연에 이미 존재하는 당원으로 그 함량이 극히 적어 희소당으로 구분되는 당류의 경우 최근 생명공학기술의 발전으로 대량생산이 가능해졌다. 국내에 생명공학기술 이용 희소당의 개발 및 상품화의 대표적인 사례는 알룰로스(D-allulose), 타가토스(D-tagatose) 등이다. 현재 알룰로스는 국내에서 한시적으로 인정된 식품원료이며, 화학적 방법으로도 생산이 가능하지만 미생물 유래 효소 자원으로 이성화 효소의 일종인 에피머라제(epimerase)를 이용하여 과당(D-fructose)으로부터 생산되고 있다. 알룰로스는 순도를 높이기 위한 정제에 많은 비용이 소요되고 있어 생산성을 높이기 위한 연구가 진행되고 있다.
충치 비유발성, 간 조직 내 글리코겐 합성 촉진, 소장 내 탄수화물 흡수 억제, 대장 내 유익균 증식 등 다양한 건강기능성이 보고되고 있는 타가토스는 현재 국내에서 개별인정형 건강기능 식품으로 인정되어 시장에서 판매되고 있다. 국내에서 타가토스 생산에 사용 승인된 유전자재조합 미생물은 corynebacterium glutamicum이다.
이외에도 미생물 및 미생물 유래 효소 자원을 이용하거나 단백질의 안정적인 고발현 시스템을 이용하는 등 생명공학적 방법으로 희소당을 생산하는 연구들이 시도되고 있다. 미생물 대사공학 기술을 이용하여 자일리톨이나 만니톨 등의 기능성 당류와 글루탐산(L-glutamate), 라이신(L-lysine), 세린(L-serine) 등 아미노산과 같은 식품소재를 생산하는 연구도 지속적으로 이루어지고 있다.
최근 장 건강에 대한 관심이 높아지면서 프로바이오틱스(probiotics) 균종과 프리바이오틱스(prebiotics)인 올리고당류가 기능성 식품의 소재로 다시 주목을 받고 있다. 최근에는 lactobacillus 이외에도 bifidobacterium, enterococcus 등 다양한 균주를 이용하거나 발효유뿐만 아니라 과립, 분말 등 다양한 형태로 개발되고 있는 것이 특징이다. 현재 국내 식품공전상에 사용이 허가된 프로바이오틱스 균종(species)은 lactobacillus 11종, lifidobacterium 4종, lactococcus 1종, enterococcus 2종, streptococcus 1종이다.
또한, 상품으로 개발된 프로바이오틱스도 맛과 향을 위해 다양한 형태의 첨가제를 포함하고 있기 때문에 프로바이오틱스의 활성 유지를 위해 식품 첨가제에 대한 내성과 식품 매트릭스 내에서의 안정성 확보에 대한 연구가 진행되고 있다.
올리고당은 프로바이오틱스의 영양분이면서 난소화성 특성으로 인해 설탕보다 칼로리가 낮은 기능성을 갖는 프리바이오틱스이다. 최근 들어 관심이 증가하고 있는 올리고당은 사람의 모유에 함유된 올리고당(HMO: Human Milk Oligosaccharides)이다. 모유 올리고당은 다른 포유류의 젖에 비해 상당히 높은 농도로 존재하며 그 종류도 200개 이상으로 복잡하고 다양하다. 모유 올리고당은 푸코실화 올리고당(fucosylated oligosaccharides), 시알릴화 올리고당(sialylated oligosaccharides) 및 기타 종류의 올리고당의 세 가지 범주로 크게 나눌 수 있다.
모유 올리고당의 건강기능성은 프리바이오틱 효과, 병원균 장내 부착 억제효과, 그리고 면역조절시스템 조절효과를 들 수 있다 이 가운데 2'-푸코실락토오스(2'-fucosyllactose, 2'-FL)는 가장 풍부한 HMO이며 인간 모유에서 발견되는 총 HMO의 거의 30%를 구성하지만, 우(牛)유에는 함유되어 있지 않다. 시험관 내 및 임상 테스트 결과, 2'-FL는 프로바이오틱 균의 성장을 유도할 뿐만 아니라 유아의 병원성 감염 위험을 낮추는 것으로 나타났다. 2021년 국내에서도 유전자변형 미생물 corynebacterium glutamicum APC199로 생산된 2'-FL가 한시적인 식품원료로 인정되었다.
육류는 오랜 세월 인류에게 단백질을 공급해 왔으나 동물복지 및 윤리성 문제, 자원과 환경의 지속가능성에 대한 관심의 증가로 인해 대체육 시장이 확대되고 있으며, 연구 및 투자가 활발하게 이뤄지고 있다.
이에 국내에서는 제3차 농림식품과학기술 육성 종합계획(2020~2024)과 제3차 혁신성장전략회의 안건에서 그린바이오 융합형 신산업 육성방안에서 대체육을 주요 유망 산업 중 하나로 선정하고 대체육 산업 활성화를 위한 정책을 잇달아 발표하고 있다.
대체육은 크게 식물성 대체육, 세포주를 이용한 배양육 혹은 곤충을 이용한 것으로 구분할 수 있으며, 일반육과 비교한 특징은 다음의 표와 같다.
[표 3-50] 일반 육류와 비교한 대체육의 특징
|
항목 |
일반 육류 |
식물성 대체육 |
배양육 |
식용곤충 |
|
|
정의 및 생산방법 |
|
전통적인 가축의 사육을 통한 식육 생산 |
식물성 단백질 또는 곰팡이를 이용하여 제조 |
조직의 배양을 이용한 식육 생산 |
식용이 가능한 모든 곤충 |
|
지속가능성 |
자원사용 |
많음 |
매우 적음 |
매우 적음 |
적음 |
|
온실가스 배출 |
높음 |
감소 |
감소 |
감소 |
|
|
영양가 |
|
변화 없음 |
높은 단백질 함량 |
지방산 조성 및 철분 함량 조절 가능 |
높은 단백질 및 무기질 함량 |
|
안전성 |
|
검증 |
검증 |
검증 필요 |
검증 진행중 |
|
시장적용 가능성 |
대량생산 |
가능 |
가능 |
현재 제한적임 (기술 개발 중) |
가능 |
|
가격 |
상승 중 |
낮음 |
매우 높음 |
보통 |
|
|
동물복지 문제 |
|
있음 |
없음 |
없음 |
없음 |
|
기존 육류 유사도 |
|
동일 |
다소 낮음 |
유사함 |
낮음 |
|
한계점 |
|
미래 식육 수요 충족 불가 |
맛과 조직감 부족 |
새로운 것에 대한 두려움 |
소비자 혐오감 |
자료: 세계농업(2019).
식물성 대체육의 경우, 그 원료가 되는 식물 소재 발굴이 지속적으로 이루어지고 있으며, 고기의 식감을 구현하기 위한 공정기술과 풍미를 구현하기 위한 원료 발굴을 위한 연구가 대학을 중심으로 진행되고 있다.
배양육의 경우 그 종류가 소, 닭, 돼지 등에서 다양하게 확대되고 있으며, 생산단가 절감 및 식감 증진을 위해 생산단계에 필요한 구성 요소별 연구가 주로 대학에서 이루어지고 있다.
식용 곤충은 중소기업(43%)과 국립연구소(23%)에서 곤충의 대상 확대를 위한 소재 발굴이 이루어지고 있으며, 부정적인 소비자 인식을 개선하고자 주요 성분만을 추출하여 새로운 식품을 만드는 연구를 진행하고 있다.
현재 식품의약품안전처에서는 배양육 제품에서 세포의 채취 과정, 세포주 및 배양액 성분 등의 안전성 검토, 세포주 은행 및 배양 시설 요건, 생산기술을 감시하는 방법 마련을 논의하고 있는 중이다. 그러나 배양육, 식물성 대체육, 식용 곤충 모두 대기업과 출연(연)의 참여가 거의 전무한 상황이다.
발효식품은 발효과정을 거쳐 부가가치를 높인 식품 및 소재로 한국의 전통식품은 발효식품이 대부분을 차지하고 있다. 발효식품 분야의 경우 발효미생물의 유전․단백질체 분석 및 대사체학을 활용한 전통발효식품의 과학적 해석, 품질 및 기능성 향상 등 기초, 응용 및 실용화에 관련된 일련의 연구가 진행되고 있다.
특히 전통식품은 국제시장에서 전통지식(traditional knowledge & culture)과 자원에 대한 종주권을 주장할 수 있는 중요한 분야이기 때문에 세계 각국에서 자국의 전통발효식품의 고부가 가치화 전략기술 개발에 박차를 가하고 있다.
국내의 경우, 김치 발효에 대한 과학적 연구를 통해 핵심기술을 개발하여 김치산업을 육성․발전시키고자 설립된 세계김치연구소에서 김치의 품질 향상(품질 유지기한 연장, 균일화)을 위한 종균을 개발하고 상용화시키는 연구를 수행하고 있다. 또한 주요 김치 유산균의 유전체를 분석하여 DB화하는 동시에 김치 발효에 따른 대사산물의 생성 경로와 유전자를 과학적으로 구명하고 있다. 특히 김치의 발효과정에서 면역조절 및 항균활성이 뛰어난 기능성 물질 ‘히카(HICA)’를 최초로 발견하였다.
한국생명공학연구원에서는 전통 식품산업에 적용할 수 있는 종균화 기술이나 기능성 미생물/효소를 스크리닝 및 제조하는 연구를 수행하고 있다.
(2) 국외 기술동향
게놈 프로젝트(genome project) 완성 이후 이들 유전자 정보를 활용하는 유전체학을 시작으로 전사체학, 단백체학, 대사체학까지 다양한 오믹스 기술들을 한 번에 분석할 수 있게 되면서 전 세계적으로 식품 파이토케미칼(phytochemical)과 인간유전체간 관련성, 영양관련 질병 제어 및 맞춤형 처방 분야로 응용하려는 연구가 핵심연구 분야로 진행되고 있다.
유럽의 경우 기능성 소재의 세부 작용기작에 대한 연구와 오믹스 기술을 접목한 첨단 연구를 진행하고 있다. 네덜란드의 TNO의 식품영양 연구그룹은 영양유전체학 뿐만 아니라 post-genomics 기술(전사체학, 단백체학, 대사체학 등) 및 생물정보학 기술을 통합적으로 접목시켜 학계의 기초연구와 산업계의 응용연구 간의 갭을 연결하는 역할을 수행함으로써 맞춤식품의 실용화를 위해 나아가고 있다.
한편, 마이크로바이옴을 이용한 건강기능식품 연구도 가속화되고 있다. 미국의 경우, 2016년에 미국 오바마 2기 정부의 마지막 대형 연구 프로젝트로 ‘국가 마이크로바이옴 이니셔티브(National Microbiome Initiative)’를 시작으로 마이크로바이옴 분야의 기술혁신을 위한 정책이 수립되고 관련 연구가 지속적으로 진행되고 있다.
유럽에서는 문화적으로 다양한 프리바이오틱스, 프로바이오틱스 및 기타 식품 보조제를 쉽게 수용하기 때문에 미생물 균형을 유지하기 위한 식품 및 음료 분야에 관한 연구가 활발하게 이루어지고 있다.
미국 FDA에서는 식품원료의 안전성을 증명하는 과정으로 GRAS(Generally Recognized As Safe) notification system을 운영하고 있으며, GRAS로 인증된 식품원료는 등재 및 공개하여, 급변하는 시장에 다양한 생명공학기술을 이용한 식품소재의 상용화에 활용될 수 있도록 조치를 취하고 있다. 비교적 최근에는 항균물질로써 박테리오파아지의 원료화, 모유 유용물질의 합성 및 유전자 변형을 통한 생산, 유전자 변형 미생물을 통한 특정효소 및 유용물질의 생산 등으로 특징되는 식품원료가 개발되어 등재되고 있다.
특히 국내에서도 새로운 원료로 인정된 모유 올리고당 2'-FL의 경우, 국내와는 달리 helicobacter plylori유래 fucosyltransferase 효소 유전자를 이용하여 생산한 원료가 개발되어 등재되었다. 또한 미국 임파서블푸드사에서는 식물 기반 대체육의 고기 풍미를 재현하기 위해 콩으로부터 레그헤모글로빈(leghemolglobin) 생산 유전자를 효모인 pichia pastoris에 도입시켜 발효를 통해 soy leghemoglobin을 생산하고 있다. bacillus licheniformis를 이용하여 생산된 menaquinone-7(비타민 K2) 또한 GRAS로 인증되었다.
국내에서는 상용화되지 못한 감미단백질인 브라제인(brazzein)의 경우 미국에서는 escherichia coli 등에 유전자 도입을 통한 단백질 고발현 시스템이 보고된 이후로, Natur Research Ingredients사가 크윗(Cweet™)이라는 제품으로 개발하였다.
유럽연합에서는 1997년 5월 15일 이전에 유럽공동체 내에서 인간의 섭취를 목적으로 유의적인 수준으로 사용된 적이 없는 식품을 노블푸드(novel food)로 관리하다가 2015년에 범위와 정의를 개정하였다. 이후 최근에는 식용 곤충, 신기술 및 생산 공정을 사용하여 생산된 식품, 새로 개발된 혁신적인 식품들의 노블푸드 신청이 대폭 증가하고 있다.
알룰로스는 영국의 Tate & Lyle사가 효소적 생물전환법으로 생산에 성공하였으며, 일본의 마쯔다니사도 카가와대학과 제휴하여 Astraea Allulose 제품을 개발하였다. 대체감미료로 잘 알려진 스테비아(stevia)의 경우, 감미 성분인 스테비올글리코사이드(steviol glycoside)와 레바우디오사이드A(rebaudiosides A)가 GRAS로 인정되어 미국 내에서 당류 대체재로 사용되고 있다. 그러나 천연추출법으로 생산되는 스테비올배당체는 쓴맛이 발생한다는 단점이 있어, 최근 스위스 Evova사와 미국 Cargill사는 유전자가 도입된 saccharomyces cerevisiae를 이용한 대량생산에 성공하였다.
전통 발효식품의 품질 향상을 위해 합성생물학을 기반으로 하여 인공적인 미생물 군집 생성을 활용하는 연구가 이루어지고 있다.
중국에서는 간장 생산을 위한 발효과정에서 국제암연구소(IARC)가 발암물질 2A군으로 분류한 에틸 카바메이트의 전구체인 시트룰린으로 전환되는 아르기닌을 소비하는 능력을 보유한 염저항성균주인 bacillus amyloliquefaciens JY06을 분리하였다. 이 균주를 간장 발효에 첨가하면 에틸 카바메이트 수치가 유의하게 감소하면서 양호한 관능적 특성을 보였다.
최근 중국의 소비자들은 연한 색의 간장 제품을 선호하는데, 간장의 갈색 착색은 주로 환원당과 아미노산 사이의 비효소적 Maillard reaction에 의한 멜라노이딘과 같은 고분자 갈색 이종중합체를 형성하기 때문으로 알려져 있다. 연한 색의 간장을 생산하기 위해 흡착 및 여과와 같은 솔루션이 제안되고 있으나, 이러한 접근방식은 맛과 영양을 손상시킬 수 있다. 또 다른 접근 방법인 멜라노이딘을 제거할 경우 간장이 탈색될 수 있다. 최근 간장 발효 조건에서 성장에 적합한 bacillus subtilis를 동정한 다음, 자일로스(Maillard reaction의 전구체) 또는 멜라노이딘을 분해하도록 조작하였다. 이를 간장에 처리했을 때 재조합 B. subtilis를 사용하지 않은 것과 비교하여 간장의 갈변 현상이 현저히 감소하였다.
중국에서 청주(rice wine)는 찹쌀로 만든 가장 오래된 술 중 하나로 4,000년 이상 소비되어 왔다. 중국 청주의 발효 과정은 곰팡이와 효모에 의해 수행되는데, 이 가운데 S. cerevisiae가 미생물 군집에서 주도적인 역할을 한다. 그러나 S. cerevisiae는 에틸 카바메이트와 같은 일부 유해한 부산물을 생성할 수 있으므로 S. cerevisiae의 요소 활용 능력을 높이는 전략이 적용되었다. S. cerevisiae에서 DUR1,2(요소를 암모니아로 분해할 수 있는 urea amidolyase를 인코딩함) 및 DUR3(urea permease를 인코딩함) 유전자를 과발현한 미생물 군집을 생성함으로써 원래 미생물 군집과 비교할 때 에틸 카바메이트 생산이 87% 및 15% 감소했다.

자료: Future Foods 3, 2021.
[그림 3-74] 전통 발효식품 생산을 위한 인공적 생성 미생물 군집의 활용 모식도.
다. 산업 현황
바이오산업은 2021년에는 약 28조 8,160억 원의 시장규모를 형성할 것으로 전망된다. 바이오산업 가운데, 전체 생산액에서 바이오식품이 차지하는 비중은 40.2%, 바이오의약 비중은 37.8%이며 바이오환경, 전자, 공정 및 기기 등 기타 분야 생산액은 미미한 수준이다. 바이오식품 중에서는 사료첨가제(25.0%)와 식품첨가물(7.1%)에 편중되어 있다.
세계 건강기능식품 시장규모는 2018년 1,456억 달러 규모에서 연평균 7.3% 성장하여 2024년에는 222억 700만 달러 규모에 이를 것으로 예상되고 있다. 국내의 경우 건강기능식품 시장규모는 2019년 4조 7,644억 원에서 평균 10.8% 성장하여, 2023년에는 7조 1,807억 원으로 성장할 것으로 전망되고 있다.
코로나19 팬데믹으로 인해 건강 및 면역에 대한 관심이 고조되고, 삶의 질 향상, 인구 고령화에 따른 만성질환 증가와 의료정책의 질병예방 개념의 도입 등으로 세계적으로 ‘자가관리(self care)’를 위한 건강기능식품의 사회적 필요성과 수요가 증가되고 있다.
농림식품축산부에서는 식품산업 활성화를 위해 2021년부터 일반식품의 기능성 표시 제도를 활성화할 예정이다. 건강기능식품의 제형 다양화 및 질환 예방 제품에 대한 수요 증가로 관련 소재 및 제품이 개발되고 있다. 전 세계적으로 주도하고 있는 기업은 네슬레 퓨리나사와 뉴트리카사이며 국내 주도 기업은 KGC인삼공사, CJ제일제당, 매일유업 등이다.
세계 감미료 시장규모는 2018년 기준 약 421억 달러(한화 약 49조 8,317억 원)로 추산되며, 2020년부터 2022년까지 강보합세(1.71%)를 보일 것으로 예상되고 있다.61) 대체 감미료의 경우 6.3%의 높은 시장 성장률이 전망되나(2018∼2022), 설탕 시장의 성장세가 1% 수준으로(2019∼2022) 저조하여 전체 감미료 시장의 성장률을 낮추고 있다. 국내의 대체 감미료 시장 규모는 2020년 약 3,300억에 달할 것으로 전망되고 있다. CJ제일제당과 삼양사는 2016년부터 신형감미료인 ‘알룰로스’제품 개발에 집중하고 있는데, CJ제일제당은 천연효소 대신에 인공효소를 사용하여 생산단가를 낮추고, 다양한 형태의 제품을 출시하고 있다. 삼양사는 미생물에서 발견한 천연효소를 원료로 사용하며, 2020년 미국 식품의약국(FDA)의 GRAS 인증을 취득하여 식품안전성과 수출 적합성을 증명하였다.
글로벌 컨설팅 업체 AT Kearney는 세계 육류 소비 시장의 전통 육류와 대체육 소비 비율이 2025년 9:1에서 2040년 4:6으로 변화할 것으로 전망하고 있다. 세계 배양육 시장은 2025년 2억 1,400만 달러에서 2032년 5억 9,300만 달러에 이르기까지 연평균 15.7% 증가할 것으로 예상되고 있다. 배양육 시장을 선점하기 위해 매년 더 많은 배양육 회사가 새로 생기고 있으며, 벤처캐피털(VC)도 배양육 산업에 대한 투자를 확대하고 있다.
전 세계적으로 배양육 회사가 설립되어 있으며, 미국에 가장 많고, 영국, 이스라엘, 독일, 네덜란드, 중국, 일본, 인도, 캐나다 등에 분포하고 있는 것으로 나타났다. 국내 배양육 산업은 아직 걸음마 단계로 배양육 관련 연구․개발을 진행 중인 회사가 극히 적고 초기 단계 투자를 유치하고 있다. 반면, 식물 기반 대체육 시장은 2019년 기준 121억 달러이며, 연평균 14.9% 증가하여 2025년 279억 달러에 이를 것으로 예상되고 있다. 식품공학 기술의 발전과 함께 식물 기반 대체육이 지속 가능한 미래 먹거리로 떠오르면서 스타트업을 비롯하여 기존 대형 식품회사들이 앞다퉈 식물 기반 대체육에 투자하고 있다. 세계 주요 대형 식품회사 PepsiCo, Tyson Foods, Nestle, JBS USA, Kraft Heinz는 식물성 대체육을 핵심 품목으로 설정하여 관련 제품을 연구 및 출시하고 있다.
전통 및 발효식품을 포함하는 웰빙식품은 대기업의 경우, CJ제일제당과 대상이 주도하고 있다. 이와 비교하여 중소기업은 틈새시장 공략과 제품차별화에 집중해 시장을 공략하고 있다.
전통식품 제조기업 중 발효식품 관련 제조업체 수는 1,814개이며, 업체의 약 90%는 매출액 1억 원 미만의 영세한 업체이다. 대표적인 웰빙 전통식품인 김치의 제조업체는 약 450여 개이며, 종업원 수 10명 이하가 61%로 영세한 규모이다. 장류 생산업체는 1,200여 개 수준으로 CJ, 대상, 샘표 등 대기업이 전체 장류 시장의 70% 이상을 차지하고 있다.

자료: Trend in Biotechnology, 38(6), 2020.
[그림 3-75] 전 세계 주요 배양육 생산 기업
라. 미래기술 전망
식품생명공학기술은 식품의 영양, 품질, 안전성 및 편의성을 개선할 뿐만 아니라 기존의 생산방법보다 효율적으로 대량생산이 가능하게 하여 생산성, 효율성 및 수익성을 개선할 수 있다는 장점 때문에 앞으로 그 영역은 더욱 넓어질 것으로 예상된다.
특히 COVID-19 위기 하에서, 식량안보나 식품생산의 지속가능성이 강조되면서 식품생명공학 기술의 중요성이 더욱 강조되고 있다. 기술적으로는 (건강)기능성 소재/식품(대체육 포함)과 발효식품 생산에 전통적인 식품생명공학 기술인 효소반응이나 (미)생물배양공정뿐만 아니라 형질전환(gene transformation) 및 과다발현(overexpression) 기술, 제3세대 유전자가위기술(CRISPR/Cas9), 합성 생물학 기술의 도입이 확대될 것으로 보인다. 그러나 기술적 측면에서 국내 식품을 포함한 생명공학기술은 유전자 재조합기술 등 기초기술 및 발효공정기술은 선진국 수준이나, 분리정제기술 및 신물질 창출 기술은 저위이며, 전반적인 기술경쟁력은 선진국의 60%에 불과하다.
이에 핵심 원천 기술 및 산업화 연계를 위한 기반 기술 연구에 대한 정부 주도의 집중 투자가 필요하다. 기술개발에 성공했다 하더라도 기업적 측면에서 산업 진출 시 몇 가지 주의할 사항이 존재한다. 즉, 추가적인 기술개발로 가격을 낮추고, 생명윤리 및 안전성 규제에 대한 대책 마련이 필요하며, 기술 우위 국가나 다국적 기업의 기술 독점에 대한 대응책을 준비해야 한다.
|
참고자료 |
-이현정, 조철훈 (2019), 세계 대체육류 개발 동향, 세계농업 3월호.
-농림축산식품부 (2019), 제3차 농림식품과학기술 육성 종합계획[2020∼2024].
-윤성용, 조해주, 이경본 (2021), 대체육(代替肉), KISTEP 기술동향브리프.
-박미성, 박시현, 이용선 (2020), 대체식품 현황과 대응과제, KREI.
-중소벤처기업부(2020): 중소기업 전략기술로드맵 2021~2023 식품.
-European Commision (2020), Farm to fork strategy for a fair, healthy and environmentally-friendly food system, European Union.
-Galanakis CM(2020) The food systems in the era of the coronavirus (COVID-19) pandemic crisis, Foods, 9, 523.
-한국농수산식품유통공사 (2020), 글로벌 감미료시장 트렌드 및 수출전망.
-한국농수산식품유통공사 (2020), 식품산업 시장 및 소비자 동향분석.
-유상호 (2019) 바이오기술을 이용한 식품소재 개발의 국내․외 현황 및 전망, 식품과학과 산업 6월호.
-Lv X, Wu T, Gong M, Deng J, Gu Y, Liu Y, Li J, Du G, Ledesma-Amaro R, Liu L, Chen J(2021) Synthetic biology for future food: Research progress and future directions. Future Foods 3, 100025.
-Choudhury D, Tseng T, Swartz E(2020) The business of cultured meat. Trend in Biotechnology, 38(6).

1. 환경 생명공학
가. 서론
(1) 개요
환경생명공학(environmental biotechnology)은 환경공학(environmental technology)과 생명공학(biotechnology)의 융합 분야로서 생명공학기술을 이용하여 환경오염을 사전에 예방하는 기술과 오염된 환경을 복원 및 정화하는 기술 또는 학문을 의미한다(생명공학정책연구센터, 2013). 환경생명공학기술은 미생물학, 식물학, 유전(체)학, 분자생물학, 생화학, 생리학, 생태학, 정보학 등의 다양한 첨단 과학기술을 기초로 하는 융․복합기술이다.
(2) 환경생명공학 기술분류
환경생명공학기술은 전세계적으로 추구하고 있는 지속가능한 개발(sustainable development)의 핵심기술이다. 환경생명공학의 기술군은 생물정화(bioremediation), 식물정화(phytoremediation), 생물예방(bioprevention), 생물모니터링(biomonitoring)의 4가지로 구분된다. 이들 기술군은 12개의 핵심기술로 세분되며, 환경생물산업을 주도할 핵심 제품을 도출하였다(기초기술연구회, 2003).
[표 3-51] 환경생명공학기술의 분류
|
기술군(Technology cluster) |
핵심기술(Key technology) |
제품(Products) |
|
생물정화 (Bioremediation) |
- 생물학적 폐수처리 기술 - 녹조, 적조 제어 기술 - 토양․지하수 생물정화 기술 - 생물학적 폐기물처리 기술 - 생물학적 배가스처리 기술 |
친환경 생물소재 미생물제재 생물정화 공정 생물정화 시스템 |
|
식물정화 (Phytoremediation) |
- 환경재해 내성유도 기술 - 식물정화 기술 |
생태복원용 식물 |
|
생물예방 (Bioprevention) |
- 청정 생물공정 기술 - 폐수 재활용 기술 |
청정 생물공정 |
|
생물모니터링 (Biomonitoring) |
- 오염물질 모니터링 기술 - 분자생태학적 모니터링 기술 - 환경위해성 평가 및 관리 기술 |
바이오센서 바이오칩 |
(3) 연구의 필요성
급속한 산업화와 인구증가에 따라, 다양한 환경오염 유발 물질의 생성 및 이로 인한 지구적 환경문제는 21세기 인류 생존을 위협하는 최대 현안으로 대두되고 있다.
기존의 환경복원 관련 기술의 한계가 나타나고 있으며, 최근 생명공학 분야에서 유전체 정보 등을 포함한 수많은 정보가 축적되고 있기 때문에 이를 이용한 기술의 고급화 및 적용분야의 확대가 필요하다.
최근에는 환경시료에서 전체 DNA를 추출하고, NGS(Next-Generation Sequencing) 기술을 이용하여 다량의 유전정보를 획득하며, 생물군집의 네트워크 분석 및 AI를 이용한 빅데이터 분석 등을 기반으로, 주요 미생물 및 생물 상호작용을 규명하며, 이를 활용하는 오믹스(omics) 기반 환경정화 및 모니터링 기술이 각광받고 있다.
나. 해외 동향
(1) 연구개발 동향
EU는 환경과 경제를 동시에 고려하는 지속가능한 환경관리체계 구축을 위한 생태유전체학(ecogenomics, ecological genomics)의 활용을 강조하면서 환경바이오기술 연구개발 플랫폼을 마련하였다(OECD, 2013). 생태유전체학은 유전체학을 생태와 환경과학에 적용하는 것으로 DNA, RNA, 그리고 단백질 수준에서 생물다양성을 정의하며, 기능적으로 다양한 환경에 존재하는 미생물의 신속한 동정과 이들의 상호작용 분석에 활용된다.
2020년 만료되는 교토의정서를 대체할 신기후체제로서, 제21차 유엔기후변화협약 당사국총회(COP21)는 2015년 12월 12일 파리협정(Paris Agreement)을 채택하였다. 파리협정은 장기 목표로 “산업화 이전 대비 지구 기온의 상승폭(2100년 기준)을 섭씨 2도보다 훨씬 낮게 유지하고, 더 나아가 온도 상승을 1.5℃ 이하로 제한하기 위하여 노력한다.”라고 합의했다. 당사국들은 2050년 이후에는 인간의 온실가스 배출량과 지구가 이를 흡수하는 능력이 균형을 이루어야 하며, 이를 위해 세계 주요 국가들은 탄소중립을 선언하고 저탄소 경제로 나아가기 위한 전략으로써 그린뉴딜을 추진하고 있다(환경부, 2020).
플라스틱 오염은 지구적 규모이고, 시급히 해결해야 할 환경문제이므로, GPOS( Global Plastic Pollution Observation System)의 설치 필요성이 제기되었다(Bank et al., 2021). 플라스틱은 대기, 육상, 수계를 통해 전 세계적으로 이동하는 특징으로 인하여, 통합적, 지구적 규모의 모니터링 시스템, 그리고 환경적, 사회적, 경제적 평가를 위한 포괄적 자료가 요구된다. GPOS 관찰시스템은 새로운 정보를 제공하고, 오염 집중지 파악, 모니터링 대상 확대 등의 효과가 있으며, 나아가 공공정책 수립을 돕고, UN의 SDGs(Sustainable Development Goals)에도 기여하게 될 것이다.
전 세계적으로 코로나19 감염병 확산이 인류 보건, 경제, 사회 등에 미치는 광범위한 악영향에 효과적으로 대처하기 위하여 폐수기반역학(WBE: WastewaterBased Epidemiology)이 제안되었다(Bivins et al., 2020). 코로나19 바이러스 RNA는 인체 배설물에 포함되므로 하수 중의 바이러스 RNA를 조사하여 코로나19의 역학 모니터링을 수행할 수 있다. 코로나 WBE와 관련된 국제적 협력연구의 활성화 그리고 감염병 학자, 수치모델러, 공중보건기관 등 다방면의 과학자, 공학자의 다학제적 협력이 필요하다.
(2) 환경생명공학 기술적용 사례
(가) 해양 기름유출의 생물정화
전 세계적으로 생물정화는 오염지 특이적이며, 생분해 속도가 느리고, 처리 공정률이 안정적이지 못하다는 점에서 오염지 정화기술 시장에서 약 10∼15%에 그치는 것으로 추정된다(OECD, 2013). 그러나 다른 복원기술에 비하여 생물정화의 장점은 지속가능성이고, 환경생명공학기술은 UN이 추진하는 새로운 글로벌 목표인 ‘지속가능한 발전 목표’를 달성하기 위해서도 필요한 분야로 평가된다.
해양 기름 유출의 대표적 사례로 1989년 Exxon-Valdez의 기름 유출사고가 있다. 25만 마리 이상의 바닷새가 희생되었고, 경제적 손실은 약 67조 원(610억 달러)으로 추정되었다. 세계적으로 에너지 수요가 증가하면서, 새로운 석유 탐사가 증가하므로 기름 유출 사고 발생 위험이 높아지고 있다. 기름의 주요 성분인 탄화수소는 미생물에 의하여 분해될 수 있으므로, 생물촉진(biostimulation)과 생물첨가(bioaugmentation)의 방법으로 기름 유출 지역을 정화할 수 있다.
(나) 토양과 해양의 플라스틱 생분해
미생물을 이용해 폴리에틴렌(PE)을 분해하려는 연구가 2010년 이후 진행되기 시작했다(이, 2019). 2014년 중국의 연구진은 벌집의 밀랍(wax)을 먹는 벌레인 왁스웜(waxworm)의 장내 미생물이 폴리에틸렌을 분해한다고 보고하였다. 2017년에는 영국과 스페인 연구진이 꿀벌부채명나방 애벌레가 폴리에틸렌을 빠른 속도로 분해할 수 있다고 보고하였다. 실제 이 애벌레는 12시간 이내에 92mg의 폴리에틸렌을 분해하였다. 폴리스티렌(PS)은 우리에게 스티로폼으로 잘 알려진 플라스틱이다.
자연의 진화보다 과학은 빠르게 발전하고 있다. 특히 엄청난 양의 DNA를 원하는 대로 설계하고 합성하여 새로운 기능을 갖는 미생물을 개발할 수 있는 바이오파운드리가 세계 곳곳에서 설립되고 있어 합성생물학 연구가 가속화되고 있다.
(다) 지구온난화 기체인 이산화탄소의 생물학적 저감
메탄자화능 효모인 pichia pastoris는 유기물을 탄소원으로 이용하여 생장하며, 산업적 효소나 의약품 생산에 널리 사용되고 있다. P. pastoris가 무기탄소인 CO2를 이용하여 독립영양적으로 생장할 수 있도록 개량하였다(Gassler et al., 2020). 8개의 새로운 유전자를 추가하고, 3개의 유전자 결손을 유도하여, 메탄올 합성경로를 변화시킴으로써 CO2 고정경로를 완성하였다. 즉, 개발된 형질전환 효모 P. pastoris는 CO2의 감축에 활용될 수 있다.
광합성 미생물인 미세조류를 이용한 생물학적 CO2 고정화 기술은 물리, 화학적 방법에 비하여 환경친화적이며, 생산된 미세조류 바이오매스로부터 바이오연료 또는 다양한 고부가 물질을 생산할 수 있는 장점이 있다. 향후 현장에서 scale-up 적용을 위한 미세조류주의 유전적 개량, 생물반응기 개발, 조류 바이오매스의 활용 등에 더 많은 노력이 필요하다.
(라) 식물-미생물 상호작용을 이용한 식물정화
식물정화는 식물을 식재하여 오염 환경을 정화하는 기술이며, 경제적이고, 비파괴적 방법으로 평가되고 있다. 식물정화는 phytostabilization, phytostimulation, phytotransformation, phytofiltration 그리고 phytoextraction이 있다. 식물을 이용한 독성 중금속 정화는 여전히 광범위하게 진행 중이며, 오염된 토양은 phytoextraction으로 정화될 수 있다.
대부분의 오염지대는 다수의 오염물질로 오염되었으므로 다양한 분해능을 갖는 미생물 확보가 필요하다. 이때 NGS 기법을 이용하여 미생물 군집분석을 수행하고, 오염지대 정화에 효과적인 미생물을 구분해 낼 수 있다. 미생물의 대사적 활성은 외부로부터 질소, 탄소 등의 영양을 추가하여 강화시킬 수도 있다.
(마) 바이오센서
2019년 말 코로나19가 전 세계적 감염병으로 확산되면서, 연구자들은 도시 하수 모니터링이 SARS, 코로나19 그리고 병원균에 대한 감시 시스템으로 활용될 수 있는지 관심을 갖게 되었다(Schmidt, 2020). 네덜란드에서 수행된 결과는 코로나19 발생 6일 전에 바이러스 양성 반응을 주목하였다. 즉, 하폐수 감시는 감염병 지역 확산의 조기 경보에 활용될 수 있음을 보였다.
cell-free 핵산 진단은 복잡계에서 특정 DNA 또는 RNA 염기서열을 검출하기 위하여 RNA 유전자 스위치 또는 CRISPR로 중재되는 상호작용을 활용하고, 목표 분자가 존재할 때는 형광 방출 또는 생화학적 반응으로 가시적 결과를 표출하게 된다(Jung et al., 2020). RNA 중합효소, allosteric 단백질전사인자 그리고 합성 DNA 전사주형의 조합은 형광을 활성화하는 RNA aptamer62)의 합성을 조절하였다. 개발된 cell—free 바이오센서는 다양한 항생제, 소규모 분자, 중금속 등 수중의 다양한 화합물과 원소를 검출할 수 있다.
다. 국내 현황
(1) 정책 방향
한국과학기술기획평가원(2021)은 제6회 과학기술예측조사를 실시하여 향후 25년이라는 중장기를 관점에 두고 산․학․연의 다양한 전문가가 참여하는 미래 이슈를 논의하고, 12개의 미래 이슈를 도출하였다. 이 중 ‘지구환경변화와 자원개척’ 분야는 환경보전을 우선으로 하는 인식 변화와 경제 활동으로 점차 바뀌고 탈탄소사회를 위한 에너지 전환과 자원의 선순환, 우주로 생활권을 확장하기 위한 도전이 예상된다. 특히 환경 분야의 세부 이슈는 온난화 심화에 따른 이상기후 현상, 미세먼지 등 대기오염, 일상생활 속 화학물질 증가 등 3가지가 선정되었다.
환경부는 2019년 제5차 국가환경종합계획(2020∼2040)을 수립하여 탈석탄, 탈플라스틱, 탈내연기관화 등 경제․사회 전반의 녹색전환 방향을 제시하였으며, 2020년 7월 14일 그린뉴딜 계획을 발표하였다(환경부, 2020). ‘그린뉴딜’은 기후변화 가속화, 저성장의 고착화, 경제환경 변화에 따른 구조적 실업 등 현재 우리나라가 처해 있는 상황에 적절한 처방으로 단기적으로는 그린 경제로의 전환을 위한 대규모 공공투자를 통해 경제 회복, 일자리 창출에 역점을 두고, 장기적으로는 화석연료 기반의 경제사회시스템을 저탄소 기조로 전환해 탄소중립 사회로의 이행을 이끌어내는 것을 목표로 한다.
생명공학정책센터는 ‘바이오 미래유망기술’ 발굴하고 있으며, 생명현상 연구(생명과학)를 기반으로 향후 5∼10년 이내에 기술적 또는 산업적 실현이 가능하고, 향후 기술적 혁신성, 산업적 혁신성 및 사회문제 해결가능성에 대한 파급효과가 높게 전망되는 기술을 선정하고 있다. 2020년 환경생명공학분야는 ‘탄소자원화 광합성 세포공장’이 선정되었으며, 이산화탄소 저감 및 탄소자원화 능력을 갖는 광합성 세포공장 시스템을 구축하고, 고부가가치 소재를 생산하는 기술이다.
2021년은 환경생명공학분야에서 2개가 선정되었다. 첫째는 ‘친환경 고분자 생산 미생물’로서, 일회용품 및 미세플라스틱 문제를 해결하기 위해 미생물로부터 완전 친환경 고분자 재료를 생산하는 기술이다. 둘째는 ‘빅데이터 기반 생태건강성 평가 기술’로서, 바이오 빅데이터(특히, 미생물 군집구조)를 포함한 환경, 생태 데이터를 통합하여 생태계의 건강성을 평가하는 기술이다.
(2) 환경생명공학 기술적용 사례
(가) 토양 미생물 간 상호작용 및 유용물질 생산
한국과학기술원과 한국기초과학지원연구원 연구팀이 방선균과 토양미생물인 점액세균(myxococcus xanthus)과의 상호작용을 이용, 방선균의 항생물질 생산 다양성을 높일 실마리를 찾아 국제 저명학술지 ISME Journal(2020)에 발표하였다(국가생명공학정책연구센터, 2021). 방선균의 이차대사산물 생산은 항생 효과로 주변 공생미생물의 접근을 제한함과 동시에, 철 이온 확보 능력을 증가시키려는 것으로 해석된다. 결론적으로 철이 부족한 방선균이 더 다양한 항생물질을 생산하였다.
(나) 녹조한국생명공학연구원 연구팀은 녹조 발생 남조류인 microcystis 속을 둘러싼 미생물의 상호작용 과정을 연구하여, 특히 여름철 녹조 사멸에는 vampirovibrionales 박테리아가, 가을철 녹조 사멸에는 skistodiaptomus라는 동물플랑크톤이 큰 역할을 하는 것으로 보고하였다(Chun et al., 2020). 즉 녹조 발생 과정에서 어떤 미생물들이 남조류와 상호작용하는지 최초로 밝혔으며 미생물을 이용한 친환경적인 녹조 제어 기술 개발에 기여할 것으로 보인다.
또한 동 연구팀이 수행한 ‘BIET 기반 유해 미세조류 발생/소멸기작 규명 및 생태공학적 제어기술 개발’은 기존의 일반적인 수질자료와 유해 미세조류 대발생의 관계 분석이라는 단순한 기법을 벗어나 생명공학(biotechnology), 정보(informatics), 환경(environment)의 통합적, 융합적 연구로 평가된다. 적조 발생 수역에서 지속적인 모니터링 자료를 축적하였으며 여름철 cochlodinium에 의한 적조 발생 시점에서의 수질, 환경 요인과 미생물 군집 분석 자료를 활용하여 상호작용 네트워크를 구축하였다(현대해양, 2020).
(다) 플라스틱의 생분해
한국생명공학연구원 연구팀은 세균 ideonella sakaiensis에서 유래한 효소를 이용해 페트병을 분해하는 식물플랑크톤 CC-124 PETase를 개발했다(김, 2021). I. sakaiensis는 2016년 일본 연구진이 처음 발견한 세균으로, 페트를 분해해 탄소원으로 활용하는 것으로 알려져 있다. 연구팀은 페트 분해 효소의 아미노산 서열을 이용, 미세조류 chlamydomonas reinhardtii에 적합하도록 유전자 형질을 전환해 새로운 플랑크톤을 개발했다. 개발한 플랑크톤을 시판 중인 음료수 페트병과 섞은 뒤 놔두면 시간이 지남에 따라 페트병이 인체에 무해한 테레프탈산, 에틸렌글라이콜 등의 물질로 분해되는 것이 관찰되었다.
(라) 이산화탄소의 생물학적 저감
한국과학기술원 연구팀이 개미산과 CO2만으로 상대적 고농도 배양이 가능한 대장균을 개발하여 Nature Microbiology(2020)에 보고하였다(국가생명공학정책연구센터, 2021). 대사 경로를 대장균에 도입하여 개미산과 CO2로부터 세포 성장에 필요한 탄소원을 합성하도록 개량하였다. 개발된 기술을 활용하면 대장균을 이용한 발효공정을 통해 바이오 연료, 고분자, 화학물질을 생산할 수 있으며 온실가스인 CO2 저감에 기여할 수 있다.
충북대학교 연구팀이 남극 해역 식물플랑크톤의 번성․소멸과 탄소 순환에 관여하는 미생물 군집의 종류를 밝히고 관련 기작을 Microbiome(2019)에 보고하였다(국가생명공학정책연구센터, 2020). 해양환경에서의 직접적인 미생물 대사활성을 분석하기 위하여 핵심 미생물의 유전체에 존재하는 유전자 발현 산물인 전사체를 해수에서 확보하여 분석하였는데 두 가지 대표적인 미생물 군이 식물플랑크톤이 고정한 탄소의 분해에 관여하였다.
(마) 바이오센서
바이오센서, 생체를 활용한 모니터링, 군집 수준의 특성을 이용한 모니터링 등 생물학적 모니터링에 대한 관심과 활용 노력이 확대되고 있다. 강원대학교 연구팀은 ‘지중환경 현장측정용 토양생태독성 측정 요소기술 개발’을 통해 미생물 기반 생태독성 평가키트 3종(황산화미생물, 혐기성 포자형성미생물, 조류)을 개발하였다. 3종의 독성 평가키트는 직접노출 평가법의 적용과 현장 중심의 독성 종말점 채택으로 높은 현장 적용성을 확보하였으며 독성평가 유효성 측면에서 높은 독성 측정 유효범위와 재현성(80%)을 보였다(한국환경산업기술원, 2019).
라. 발전 전망
(1) 유망 기술분야
정부 및 국책연구기관에서는 초미세먼지 제거, 친환경 녹조․적조 제거, 환경호르몬 제거, 생활폐기물 첨단 분류․재활용 시스템, 환경 변화 실시간 입체 관측, 미생물 활용 환경복원 등을 우선적 해결을 요하는 환경기술로 선정하였다. 또한, 오믹스 기술 발전에 따른 대량의 생물군집 및 네트워크 분석, AI를 이용한 대량의 생물 빅데이터 분석, 환경오염물질 분해 마이크로바이옴 등을 활용한 생물정화 기술개발이 유망하다. 전 세계적 환경 이슈인 기후변화, 플라스틱 폐기물, 하폐수 모니터링에 의한 감염병 사전 예측 등에 과학기술계의 역할이 기대된다.
(2) 분자기법 환경 모니터링 및 마이로바이옴 기반 수생태 건강성 평가
환경 마이크로바이옴(microbiome) 연구가 전 세계적으로 활발히 수행되고 있으며, 수생태계 건강성 평가에 적용할 경우에는 다음과 같은 장점을 갖는다(안, 2021). 미생물 샘플링을 위한 물시료 채취 공정이 간단하고, 이후의 DNA 또는 RNA 추출 프로토콜도 표준화되어 있어 수행 인력에 따른 편차가 거의 없다. 박테리아 군집도 계절 변화에 따라 안정적이고 일정한 순환 패턴을 유지함이 확인되면서, 기존의 장기반응에 기반한 수생태 건강성 평가지표를 대체할 수 있을 것으로 평가된다.
(3) 인공위성 활용 환경 모니터링
환경부 국립환경과학원은 동아시아 기후변화 유발물질 및 대기오염물질 배출․이동 상시 감시의 목적으로 정지궤도 환경위성(천리안위성 2B호의 탑재체)의 운영에 돌입하였다(환경부, 2020). 정지궤도 환경위성은 대기오염물질의 변화량이나 장거리 이동, 생성 및 소멸 관측이 가능한 장점이 있으나 관측자료 검증 등 정확도를 평가하고 보정해야 한다. 향후 녹조, 적조 등의 유해 미세조류 발생의 예측 및 관리에도 널리 활용될 수 있을 것으로 기대된다.
(4) GMO 활용에 대비한 법, 제도 마련
생물정화는 미생물 성장을 촉진할 수 있는 영양분 또는 공기 주입 등의 생물 촉진, 그리고 자연계에 서식하는 미생물을 추가하는 생물 첨가가 주로 적용되며, GMO(Genetically Modified Organisms)를 사용하는 경우는 드물다(OECD, 2013). 특별히 GMO를 필요로 하는 분야는 PCBs(Polychlorinated Biphenyls)와 같은 생분해가 어려운 난분해성 물질의 생분해이다.
오염지에서 오염물을 분해할 수 있는 미생물이 존재하지 않는 경우를 대비하여 GMO 또는 더 나아가 합성생물학 연구가 필요하다. 현대 생명공학은 인류 복지의 증진에 큰 역할을 하고 있으나, GMO가 환경, 생물다양성, 인류 건강 등에 미치는 다양한 영향을 간과할 수 없으므로(Madi et al., 2020) 향후 GMO의 원활한 사용, 환경 안전성 평가 등을 위한 법․제도 마련이 필요하다.
(5) 미래 산업에 대한 정책적 고려
환경생명공학기술은 에너지 절약형, 비공해형 기술로서 국제환경협약의 제약조건을 벗어날 수 있는 미래산업의 선도적 역할을 담당할 기술이다. 또한, 새로운 환경보전형 산업군을 유도하며 지속적 성장과 환경보전을 동시에 추구할 수 있는 이상적 미래 산업상을 창출할 것으로 기대된다. 따라서 환경생명공학기술의 확대 발전을 위해 연구개발 투자 증대 및 미래 산업으로 발전시키기 위한 정책적 고려가 필요하다.
|
참고자료 |
-국가생명공학정책연구센터, 2019 정부 BT 연구성과-보도자료 모음집(2020.3.).
-국가생명공학정책연구센터, 2020 정부 BT 연구성과-보도자료 모음집(2021.3.).
-기초기술연구회, 생명공학 TRM 및 전략분야 기획 연구-제3권 환경 생명공학 TRM(2003).
-김희식, 페트병 분해하는 식물플랑크톤 개발, KRIBB focus 9호(2021.7.).
-생명공학정책연구센터, BT기술동향 보고서: 환경생명공학(Bioremediation을 중심으로)(2013).
-안치용, BioINpro, 2021년도 바이오미래유망기술(상), 생명공학정책연구센터(2021.6.).
-이대희, 플라스틱 분해 미생물, 한국경제(2019.7.23.).
-한국과학기술기획평가원(KISTEP), 2045년을 향한 미래사회 전망과 핵심이슈 심층분석(2021.8.).
-한국환경산업기술원(KEITI), 환경 R&D 과제보고서(2019).
-환경부, 2020 환경백서(2020).
-현대해양, 특집 영원한 블루오션, 자원부국의 꿈 해양바이오산업(2020.5.).
-Bank, M.S. et al., Global Plastic Pollution Observation System to aid policy. Environ. Sci. Technol. 55: 7770-7775 (2021).
-Bivins, A. et al., Wastewater-Based Epidemiology: Global collaborative to maximize contributions in the fight against COVID-19. Environ. Sci. Technol. 54: 7754-7757 (2020).
-Chun, S.-J. et al., Network analysis reveals succession of Microcystis genotypes accompanying distinctive microbial modules with recurrent patterns. Water Res. 170: 115326 (2020).
-Gassler, T. et al., The industrial yeast Pichia pastoris is converted from a heterotroph into an autotroph capable of growth on CO2. Nature Biotechnol. 38: 210-216 (2020).
-Jung, J. et al., Cell-free biosensors for rapid detection of water contaminants. Nature Biotechnol. 38: 1451-1459 (2020).
-Madi, R. et al., Releasing GMOs into the environment or launching its products into markets: Regional and international legislations. Industrial Biotechnol. 16: 359-367 (2020).
-OECD, Biotechnology for the Environment in the Future: Science, Technology and Policy. OECD Science, Technology and Industry Policy Papers No. 3, OECD Publishing, Paris (2013).
-Schmidt, C. Watcher in the wastewater. Nature Biotechnol. 38: 917-920 (2020).
2. 해양 생명공학
가. 개요
(1) 해양바이오의 정의
해양생명공학 또는 해양바이오는 ‘해양수산 생명자원의 확보관리 및 이용 등에 관한 법률’에 따라 ‘해양수산생명자원을 이용하여 산업적으로 유용한 생산물을 만들거나 생산 공정을 개선할 목적으로 생물학적 시스템, 생체유전체 또는 그들로부터 유래되는 물질을 연구․활용하는 학문과 기술’로 정의할 수 있다.
(2) 해양바이오의 가치
지구 표면의 70%가 해양이며, 전체 지구 생물종 다양성의 약 90% 이상을 해양생물이 차지하고 있다. 해양생물은 고압, 고온, 저온, 저광량 등의 극한 환경에 최적화된 형태적, 생리적 기능을 갖고 있어서, 새로운 소재를 발굴해야 하는 바이오산업의 미래 자원으로 가능성이 높다.
국제 해양생물 유래 천연물 데이터베이스인 ‘Marine Life’에 등재된 해양바이오 생리활성 물질은 2018년 기준으로 2만 8,000개 이상이며, 매년 1,000개 이상의 물질이 보고되고 있다. 약 33만 종으로 추정되는 해양생물 중에 현재 인류에 의해 활용되는 종은 1% 미만으로 알려져 있으며, 경제협력개발기구(OECD)는 신의약품 이외에도 에너지, 환경 등 전 지구적 문제 해결과 경제성장의 원동력으로서 해양바이오 산업의 중요성이 크게 증가할 것으로 전망하고 있다.

[그림 3-76] 해양생물을 활용한 해양바이오 산업의 다양성
(4) 우리나라 해양생물의 높은 다양성
국내 육상생물 자원의 약 92%가 이미 확보되었으며(KOBIS, 2020), 연평균 종확보율은 2.4%로서 새롭게 발굴하는 종의 수는 점진적으로 감소하는 추세에 있으나, 해양생물자원의 연간 확보 자원 수는 3∼11%로 상대적으로 크게 증가하는 추세에 있다. 우리나라의 해양생물 종은 2018년 기준으로 총 1만 3,356종으로 파악되어 세계적인 수준의 종 다양성을 갖고 있다.
나. 해외 현황
(1) 해양바이오 기술개발
해양바이오는 1950년대에 들어서야 처음 잠재력을 인정받기 시작하였으며 아직은 태동기에 있다고 볼 수 있다.
[표 3-52] 해양바이오 기술개발의 주요 개발 연혁 및 내용
|
시기 |
주요 사항 |
내용 |
|
1955 |
해면동물 (Cryptotethia crypta) |
케리비안 해역에서 발견된 해면동물에서 측이한 당(arabinose)를 포함한 핵산물질 ara-A(vivarabine) 및 ara-C 등이 항암제 및 항바이러스제로 개발 |
|
1964 |
심해유인 잠수정 |
미국 우즈홀 해양연구소가 세계 최초로 심해 잠수정인 앨빈호를 운항하면서, 심해 해양생물자원 탐색 기술이 비약적으로 발전 |
|
1967 |
‘바다로부터 의약품 개발 (Drugs from the Sea)’심포지엄 |
미국 로드아일랜드 대학의 심포지엄을 통해 해양생명자원이 의약품 소재로 제안되면서 해양생물 유래 의약품 개발 연구가 활성화되기 시작하였으며, 해양바이오산업(MBT)이 하나의 독립된 산업 영역으로 인정받기 시작 |
|
1993 |
DNA중합효소(Taq polymerase) 및 PCR의 개발 |
해양심해저에 서식하는 미생물에서 중합효소를 발견하고 이를 PCR로 개발하여 노벨상 수상하고, 생명공학기술의 핵심기술로 보급되면서, 연 400개 이상의 신규 화합물을 발견하는 계기가 됨 |
|
2004 |
대규모 해양유전자원 탐사(Mega-genomic study) |
사가소 해역에서 1만 450억 쌍의 비반복성 유전자 서열 및 120만 개의 새로운 유전자 발견. 후에 인간게놈프로젝트의 발판이 됨 |
|
2008 |
형광단백질(GFP) 개발 |
해파리로부터 형광단백질을 발견하여 노벨상을 수상하였으며, 유전자 기능 연구 등의 표지 물질로 활용하면서 해양유래 유용물질의 개발과 관련 해양바이오 기업이 증가 |
|
2010 |
해양생물센서스 (Census fo for marine life) |
10년에 걸쳐, 80여 개국, 2,700명 이상의 해양생물학자가 참여하여 540회 이상의 탐사 실시, 6,000종 이상의 신종을 포함한 25만 종의 해양생물 존재를 확인하고, 해양에 약 100만 종 이상의 고등 생물과 수억 종 이상의 해양미생물의 존재 가능성을 시사 |
|
2010 |
인공세포 제작 |
Science에 바이오디젤 생산을 위해 특화된 해양생물 유래 최초의 인공 합성 세포 개발을 발표하여, ‘합성생물학(synthetic biology)’의 가능성 제시 |
(2) 해양바이오 산업
(가) 시장 규모
해양바이오 산업 시장 규모는 2019년 기준으로 4,362억 달러 규모인 전체 바이오 시장 대비 1.2% 정도에 해당하는 38억 달러 규모로 추정되고 있으나, 연평균 5.8%의 빠른 성장을 통해 2030년까지 80억 5,000만 달러 수준으로 확대될 것으로 예상된다.
전체 해양바이오 시장의 75%를 미국, 유럽, 일본이 차지하고 있으며, 한국의 시장 규모는 약 2% 수준에 머물고 있다.
(3) 해외 해양바이오 육성 전략
(가) 유럽
유럽은 해양성장전략(Blue Growth Strategy)을 통해서 ‘해양바이오는 생물다양성과 복잡성, 화학 및 유전적 차별성으로 다분야 원료화, 고부가가치화가 가능한 성장 잠재력이 높은 분야’로서 주목해 오고(Horizon 2020) 있다. 그래서 2017년 유럽의회(European Commission)는 결의를 통해 지속가능한 경제성장과 일자리 창출을 지원하는 수단으로서 해양바이오를 활용해야 한다는 점을 강조한 바 있다.
유럽해양위원회(European Marine Board)는 이를 실행하기 위해 배양바이오매스의 생산 및 차별화된 혁신적 해양바이오 제품의 개발을 주요 정책과제로 제시하고 있다. 유럽 9개국의 29개 기관이 참여하는 클러스터(EMBRIC: European Marine Biological Research Infrastructure Cluster) 구축을 통해 해양생물자원의 공동 활용 및 연구개발을 추진하고 있으며, 산업과 연구를 연결하기 위한 해양 클러스터 구축 전략을 적극 활용하고 있다. EMBRIC는 유럽해양생물자원센터(EMBRC: European Marine Biological Resource Center) 등을 통한 해양바이오 소재와 자원에 대한 접근성을 확보하는 것뿐만 아니라, 정보 처리와 분석을 담당하는 전문기관, 법제 및 인문사회 분야 전문기관을 함께 산업적 활용을 연계하는 종합적 해양바이오 인프라 체계를 갖추고 있다.
그 대표적인 곳이 프랑스, 노르웨이 등의 해양바이오 산업 클러스터로서, 기업 금융, 인력양성, 연구개발을 통합 지원하는 기업지원 시스템이 공통적으로 역할을 하고 있다.
프랑스의 해양클러스터(Pole-Mers)에는 약 380여 개의 기업과 4개의 연구기관, 2개의 대학을 비롯하여, 프랑스 해군, 지역청, 지역 의회 등이 참여하고 있으며, 약 3억 2,000만 유로의 공공 연구개발 기술을 포함해서 총 14억 유로의 R&D 자금을 조성하였다.
아이슬란드의 레이캬비크(Reykjavik) 해양클러스터(IOC: Iceland Ocean Cluster)는 대서양에서 주로 잡히는 대구 등 수산생물 기반의 복합 혁신 산업 단지를 조성하여 50개 이상의 기업들의 협력, 제품화와 수출까지를 총괄 지원하고 있다.
노르웨이는 NCE(Norwegian Centre of Expertise) 혁신클러스터 등 14개 분야 산업클러스터를 지정하여 식품, 제약, 바이오기업 뿐만 아니라, 금융기관, 정책 및 법제도 연구기관, 대학 등도 함께 참여하여 산업화, 연구개발, 교육의 전략적 연계를 유도하고 있다.
(나) 미국
미국은 가장 높은 수준의 연구역량과 해양바이오 시장을 갖고 있는 국가로서, 2013년 백악관 과학기술정책위원회(National Science and Technology Council) 산하 해양과학기술 소위원회에서 해양수산자원의 관리와 활용도 제고를 위한 연구 등을 높은 우선순위로 설정한 바 있으며, 해양대기청(NOAA), 국립보건원(NIH) 및 과학재단(NSF) 중심의 종합해양연구 지원을 통해 해양자원을 확보하고 해양생물자원은행 지원을 통해 민간의 해양바이오 산업화 활동을 지원하고 있다.
2015년 기준으로 약 1억 5,000만 달러 수준의 연구비를 해양바이오 소재 개발에 지원하고 있으며 해양바이오 에너지 개발에만 약 2억 2,400만 달러 이상을 투자하여, 해양바이오 산업소재 관련 특허를 1,000건 이상 생산해 왔다. 특히 2021년 출범한 바이든행정부는 ‘친환경 산업육성’을 주요 정책 방향으로 삼고 있어서 친환경 해양바이오 산업소재 선점을 위한 투자가 더욱 확대될 것으로 전망하고 있다.
(다) 중국
중국은 정부 주도로 2016년 청도에 100여 개 기업을 아우르는 국가 해양바이오산업단지를 조성하고 해양천연물, 한의학 융합 제품을 상품화하는 기업을 집중 육성하고 있다. 현재까지 약 1,000여 종의 해양생물로부터 약 100여건의 유용 추출물을 확보했으며 이 중 10여 종을 시장에 출시했다고 알려져 있다. 이때까지 정부 주도의 지원을 통해 중국의 해양바이오 산업 시장규모가 지속적으로 증가하여 해양바이오 의약의 경우 산업 성장률이 약 35%에 이르고 있다.
(라) 일본
일본은 2013년에 해양바이오 신산업 창출을 위해 해양생물의 특성과 다양성에 대한 DB구축 및 새로운 유용자원 활용을 위한 해양생물 연구 전략 방향을 수립하고, 해양생물종의 생리적 다양성 활용 가능성에 주목하여 심해 해양생물자원 확보 및 해양바이오 종 다양성 자료 종합 시스템 구축 사업을 적극 추진하고 있다. 최근 들어 ‘기능성식품 표시제도’의 도입으로 해양바이오를 포함한 식품산업의 확대 계기를 만들고 있다.
다. 국내 현황
(1) 해양바이오 기술개발
우리나라의 해양바이오 기술개발이 본격적으로 시작된 것은 2004년 국가가 주도하는 ‘마린바이오21 사업’의 착수부터라고 볼 수 있다. 3개 연구단을 중심으로 한, 2000년 초반의 해양바이오 연구개발은 기초 연구에 집중하여 우수한 논문을 생산해 왔다.
2010년대 후반에 이르러서는 산업화가 상대적으로 용이한 기능성 식품, 화장품, 의료용품 등 소재 개발 및 기업 수요 발굴에 중심을 둔 응용연구와 개발연구로 중심축을 변화시켜 왔으며 기업 중심의 사업화 연계 기술개발 사업(해양바이오 전략소재 개발 및 상용화 지원 사업)은 타 바이오 분야보다 상대적으로 늦어 2019년에 이르러서야 시작되었다. 이러한 관점에서 우리나라의 해양바이오는 이제 출발점에 서 있다고 볼 수 있다.
(2) 해양바이오 산업
국내의 해양바이오 시장은 2019년 기준으로 10조 5,000억 원에 이르는 국내 전체 바이오시장의 5∼6%인 약 5,000억 원 규모를 유지하고 있다.
해양바이오 관련 기업으로 분류할 수 있는 기업은 약 390개이며 해양바이오에 주력하는 업체는 약 118개, 전체 종사자의 수는 약 3,564명으로 전체 바이오산업 종사자의 7.6%에 불과하여, 바이오산업에 비해 사업 규모가 작고 영세한 기업들이 대부분을 차지하고 있다.
우리나라 해양바이오 기업의 대부분은 식품분야(45.1%)의 사업을 중심으로 하고 있으며, 그 다음이 화학 및 의약 분야 사업에 종사하고 있다. 해양바이오 기업의 대부분은 수도권(41.6%)에 위치하고 있어서 국내 연안 지역으로부터의 해양바이오 소재 공급과는 무관하다는 것을 알 수 있다. 이는 기능성 화장품 소재의 대부분을 수입에 의존하고 있으며 전체 해양바이오 소재의 수입 비중이 70%에 이른다는 현실과 연결되는 결과이다. 영세기업이 많으므로 국내 해양바이오 기업의 애로사항은 주로 소재의 대량 확보 어려움, 효능 정보의 부족, 전문 인력과 자금 부족 등이다.
(3) 해양바이오의 문제점
(가) 산업화 연계 부족
우리나라의 해양바이오 분야의 연구개발 투자는 2021년 약 1,040억 원으로 증가하였으나 아직까지 바이오 투자액 약 4조 원의 2.4% 수준에 불과하며, 국가연구개발사업 중에 사업화로 연결된 비율은 약 8.2%에 불과하여 타 분야에 비해 산업화 연계가 매우 미흡한 수준이다.
(나) 해양바이오 소재에 대한 국제 규제 강화
생물다양성협약(CBD: Convention on Biological Diversity)와 나고야의정서에 의한 영해 내 해양생물 다양성 보존과 활용 및 이익공유(ABS)에 대한 국제적 규제에 의한 국내 바이오산업 시장 피해 추정은 연간 4,000∼5,000억 원 규모에 이를 것으로 보인다.
이에 더하여, 2018년부터 정부간 회의가 진행되어 온 공해상 해양생물에 대한 접근과 개발이익을 제한하고자 하는 공해상 해양생물자원 다양성 협정(BBNJ: Biodiversity Beyond National Jurisdiction)이 향후 1∼2년 안에 타결될 가능성이 높다.
우리나라의 경우 해양생물자원에 대한 접근료, 이용 단계별 중도금, 상업적 이익에 대한 로열티가 연간 약 327억 원 가량의 비용으로 예상되는 등 향후에는 공해 심해저 해양생물자원에 대한 막대한 자본 투자가 필요한 것으로 보인다.
라. 발전 과제
(1) 신산업 개척의 어려움 인식 필요
최초의 해양유래 항암제인 Yondelis는 스페인 제약사인 Pharmamar사가 11년간 7,000억 원의 예산을 투입하여 개발한 성공사례이다. 이처럼 해양바이오 소재로부터 상용화 제품의 개발에는 많은 예산과 기간이 소요된다. 해양바이오산업은 아직까지 시장 형성의 초기에 있다고 볼 수 있으며, 정부와 민간의 과감한 투자와 인내는 초기 산업 시장개척에 매우 중요하다.
(2) 타 분야 기술력과 기업의 유입 필요
해외의 해양바이오 선도기업들은 기존의 바이오 인프라와 해양소재에 대한 접근 용이성을 바탕으로 해양 바이오 분야로의 전환을 통해 성과를 창출하고 있다.
세계 최대 화학회사인 듀퐁(DuPont)사는 60년간 주력사업이던 석유화학을 버리고 해양바이오를 한 축으로 하는 사업 포트폴리오를 기획하여 바이오 과학기업으로 탈바꿈하고 있으며, 로레알, 유니레버 등 글로벌 기업들이 식품, 의약품, 화장품 등 다양한 해양바이오 원료 시장을 점유하고 있다.
국내 해양바이오는 관련 기업의 수와 기업의 역량과 경험이 절대적으로 부족하기 때문에 효과적인 산업 육성을 위해 기술력을 보유한 바이오기업의 유입이 반드시 필요하며, 정부는 이를 지원하기 위한 인프라와 유망 소재의 발굴 및 대량생산을 지원할 필요가 있다.
최근 조사에 의하면 국내 바이오기업의 68.3%는 해양바이오 소재 확보가 가능하다면 해양바이오 분야에 진출할 의사가 있는 것으로 나타났다.
(3) 대량 생산과 공급 체계 구성을 통한 접근성 강화
고부가 해양바이오 산업 소재 확보의 어려움과 원료 소재를 수입에 의존하는 해양바이오 산업구조는 국내에서 해양바이오 산업이 발전하지 못하는 가장 큰 요인으로 지적되고 있다.
산업적으로 활용 가능한 충분한 양의 단일 성분 소재 확보를 위한 유전자재조합, 세포 및 조직 배양 등의 방법을 적용하기 위한 기술개발이 필요하다. 해양바이오 소재의 실용화를 위해 해양생물과 이들이 생합성하는 물질의 특성을 고려한 환경친화적 수집, 신속한 탐색과 분리 및 정제, 화학적 안정성 확보, 유전자 정보, 효능, 구조 및 독성 등의 자료와 더불어 합성생물학과 화학기반의 안정적 대량생산을 위한 다학제적 기술의 융합이 필요하다. 바이오 정보 플랫폼의 구축에 참여하여 해양바이오에 대한 접근성을 확대하는 것이 선결과제이다.
(4) 해양바이오 기술과 산업 연계 인프라 구축
해양바이오 산업의 육성을 위해 해양바이오 클러스터 등을 활용한 인프라의 지원, 관련 분야 인력 확보 및 양성체계의 구축도 필요하다.
최근 우리나라에서도 연안 지역의 주요 인프라를 연계하고 지역의 독창성을 강화하는 해역별 해양바이오 거점 조성을 계획하고 있다. 서천의 해양바이오 산업화 인큐베이터 건립, 완도의 해조류 기반 바이오소재 생산시설 조성, 인천항 배후부지 내 해양바이오 특화 단지 지정 추진 등이 그 예이다.
중앙정부, 지방정부 및 기업의 유치도 중요하지만, 기술 개발과 산업화의 연계, 정부와 민간의 연대, 국내외 시장 연결을 직접 이끌 수 있는 과학기술, 금융, 법률, 경제적 전문가 집단이 클러스터 내부에서 매개체로 활동하는 것이 무엇보다 중요하다.

1. 생물공정(산업바이오)
가. 산업바이오 환경 변화
바이오산업은 의약, 화학, 농식품 등 바이오기술이 응용되는 분야별로 구분하여 각각 레드(Red), 화이트(White), 그린(Green), 바이오로 분류되며, 기술 간 융합으로 신시장 창출을 주도하고 있다. 글로벌 바이오산업 시장규모는 2015년 3,325억 달러에서 연평균 7.9% 성장하여 2019년 4,502억 달러로 증가하였고, 향후 연평균 7.4%씩 성장하여 2024년 6,433억 달러로, 2019년 대비 42.9% 증가할 것으로 예상된다.63)
화이트바이오산업으로도 표현되는 산업바이오는 지구온난화, 자원고갈 등 환경변화에 대응하여 생물자원 및 생명공학 기술을 활용해 에너지와 소재 등을 생산하고 관련 산업과 서비스를 창출하는 바이오 분야64)로 정의된다. 최근, 기후변화 대응을 위한 주요국 탄소중립 선언, 이에 따른 다국적 기업의 ESG 경영 본격화, 코로나19 지속에 따른 플라스틱 사용 급증과 미세플라스틱 오염 등 다양한 산업적, 환경적 변화에 대응하고 지속가능한 사회를 구현하기 위해 산업바이오의 중요성이 날로 커지고 있다. 따라서, 산업바이오는 바이오매스를 포함한 다양한 탄소자원(온실가스, 유기성 폐자원 등)을 활용하여 탄소중립 구현 및 환경친화적인 에너지․산업소재의 안정적 생산과 고부가가치화를 통한
|
분야 |
금액(억$) |
점유율(%) |
|
Medical/Healthcare (의료․헬스케어) |
2,609 |
57.9 |
|
Food & Agriculture (농․식품) |
535 |
11.9 |
|
Environment & Industrial Processing (환경 및 산업공정) |
510 |
11.4 |
|
Service Provider (서비스 제공) |
451 |
10.0 |
|
Technology Service (기술서비스) |
397 |
8.8 |
|
합계 |
4,502 |
100 |
출처: 글로벌 바이오산업 시장현황 및 전망(생명공학정책연구센터(2020)
시장규모(단위: 억달러)

[그림 3-77] 글로벌 바이오산업 시장전망(2019∼2024년)
출처: 글로벌 바이오산업 시장현황 및 전망(생명공학정책연구센터(2020))
지속가능한 신산업 창출을 목적으로 하는 생물공학 기반의 바이오 에너지 및 화학 산업 분야로 범위가 확장되고 있다. 최근, 미국, 유럽 등 주요국은 바이오매스 유래 제품의 개발 및 상용화를 추진하고 있으며, 정부 차원의 바이오매스 기반 바이오경제를 적극적으로 확대하고 있다. 국내의 경우, 정부가 2050 탄소중립 추진전략 및 화이트바이오 산업 활성화 전략을 발표하고, 기업은 바이오매스 유래 친환경 제품 개발을 적극적으로 추진하는 등 산업바이오의 중요성이 더욱 커지고 있다.
나. 해외 동향
(1) 정책 동향
미국, 유럽, 일본, 중국 등 주요국은 2050 탄소중립 추진 및 지속가능한 발전을 위해 바이오매스 기반 바이오경제 활성화 정책을 적극적으로 추진하고 있다. 바이오매스 유래 제품 및 바이오연료 사용 확대, 일회용 플라스틱 제품 사용 금지 및 생분해성 플라스틱 사용 확대 등의 정책을 통해 산업바이오 분야를 육성하고 있다.
미국은 ‘Biopreferred Program’의 운영을 통해 공공기관 우선 구매 대상 바이오매스 유래 제품 품목 분야를 2005년 5개에서 2021년 현재 139개까지 확대하였다. 에너지부의 BETO(Bioenergy Technology Office)는 2019년-2021년간 바이오연료 및 바이오 기반 제품 기술 개발에 7.4억 달러를 투자하고 미국 8개 국립 연구소가 연합한 공공 바이오파운드리인 Agile Biofoundry를 지원하여 바이오 제품 개발 및 상용화 기간 50% 단축을 목표로 설정하였다. 플라스틱 문제를 해결하기 위해 플라스틱 혁신 로드맵(Plastic Innovation Draft Roadmap)을 마련하여 플라스틱 재활용, 고부가, 바이오플라스틱 개발 등을 추진하고 있다.
유럽은 탄소중립 실현 및 바이오경제 고도화를 위해 바이오매스 기반 산업바이오 육성정책을 가장 활발하게 추진하고 있다. EU는 2050년 탄소중립 실현을 목표로 에너지, 신산업, 운송, 건축, 식품 및 생태계 분야에 대한 다양한 정책을 추진하는 유럽그린딜 전략을 수립(2019년)하고, 2030년 탄소감축을 법제화한 유럽기후법을 통과(2021년)시켰다. ‘Horizon 2020’ 후속 프로그램으로 ‘Horizon Europe (2021-2027)’에 약 955억 유로를 투자를 확정하고 글로벌 도전과 산업 경쟁력 분야에서 식품, 바이오경제, 천연자원, 농업 및 환경 분야에 89.5억 유로를 투자할 예정이다. ‘Horizon 2020’ 프로그램 내 바이오기반산업연합(Bio-Based Industries Joint Undertaking) 사업을 통해 123개 과제를 지원하였으며, 2024년까지 바이오매스 유래 화합물 80개, 소재 180개, 제품 100개 이상을 확보할 것으로 예상하고 있다. 바이오기반산업연합 사업의 후속으로 순환형 바이오기반유럽연합(Circular Bio-based Europe Joint Undertaking)을 추진하여 ‘Horizon Europe’에서도 바이오매스 기반 바이오경제 고도화를 추진할 것으로 예상된다.
일본은 2021년 ‘바이오전략 2020’시장 분야 정책 확장판을 발표하여 고성능 바이오소재, 바이오플라스틱(53.3조엔) 등의 시장 분야별 규모 확대 목표를 제시하였으며, 경제산업성은 ‘2050년 탄소중립을 실현하기 위한 녹색성장전략’을 수립하고 바이오연료, 바이오매스 소재 등을 탄소순환을 위한 육성산업으로 선정하였다.
중국은 2020년 ’2060년 탄소중립(실질적 탄소배출량 제로)‘ 목표 달성을 위해 탄소배출권 거래시장을 개설하고 녹색기술 혁신체계 구축을 발표하였다. 또한, 2020년 국가발전개혁위원회와 생태환경부에서 공동으로 <플라스틱오염 관리강화제안> 발표하고 일회용 플라스틱 제품 사용 금지제도 시행에 따라 생분해성 바이오플라스틱 관련 산업이 급성장할 것으로 예상된다.
[표 3-54] 주요 국가의 산업바이오 관련 정책
|
국가 |
세부 정책 |
|
|
∙ 2017년 기준 바이오매스 유래 제품은 460만 고용창출, 4,700억 달러, 940만 배럴 석유 대체, 1,270만 톤 CO2 감소 효과 유발 ∙ Biopreferred Program은 공공기관 우선 구매 대상 바이오매스 유래 제품 품목 분야를 꾸준히 확대하여 2021년 현재 139 품목 분야 운영 중 ∙ BETO(Bioenergy Technology Office)는 바이오연료 및 바이오 기반 제품 기술 개발 사업에 7억 달러 이상 투자 (2019년-2021년) ∙ 플라스틱 혁신 로드맵(Plastic Innovation Draft Roadmap)을 마련하여 플라스틱 폐기물을 최소화를 위한 경제적인 플라스틱 및 화이트바이오 설계, 생산, 재사용 및 재활용 기술 개발 추진 (2021년) |
|
|
∙ 2050년 탄소중립 실현을 목표로 유럽그린딜 전략을 수립(2019년)하고, 2030년 탄소감축을 법제화한 유럽기후법을 통과 (2021년) ∙ 재활용이 불가능한 플라스틱에 대한 플라스틱세 도입 (2021년) ∙ Horizon 2020’ 후속 프로그램으로 ‘Horizon Europe (2021-2027)’에 약 955억 유로를 투자를 확정하고 식품, 바이오경제, 천연자원, 농업 및 환경 분야에 89.5억 유로 투자 예정 ∙‘Horizon 2020’ 프로그램 내 바이오기반산업연합(Bio-Based Industries Joint Undertaking) 사업의 후속으로 순환형 바이오기반유럽연합(Circular Bio-based Europe Joint Undertaking)을 추진 |
|
|
∙ 2021년 ‘바이오전략 2020’시장 분야 정책 확장판을 발표하여 고성능 바이오소재, 바이오플라스틱(53.3조엔) 등의 시장 분야별 규모 확대 목표를 제시 ∙ 경제산업성은 ‘2050년 탄소중립을 실현하기 위한 녹색성장전략’을 수립하고 바이오연료, 바이오매스 소재 등을 탄소순환을 위한 육성산업으로 선정 |
|
|
∙ 2020년 ’2060년 탄소중립(실질적 탄소배출량 제로)‘ 목표를 달성하기 위해 탄소배출권 거래시장*을 개설하고 녹색기술 혁신체계를 구축 추진 ∙ 2020년 <플라스틱오염 관리강화제안>에 따라 일회용 플라스틱 제품 사용을 금지함에 따라 생분해성 바이오플라스틱 제품 수요 급증 |
(2) 산업 동향
(가) 산업바이오 전반 동향
코로나19 팬데믹 이후 전 세계적으로 기후변화 대응 및 지속가능한 발전에 대한 필요성이 확산함에 따라, 산업바이오 관련 주요 다국적 기업은 바이오매스 기반 제품의 생산 규모를 확대하고 있으며, 지속적으로 신규 제품 개발을 추진하고 있다. 특히, 바이오플라스틱 및 플라스틱 순환 관련 산업의 꾸준히 성장하고 있다.
유럽은 2017년 기준 바이오매스 기반 산업바이오의 규모는 7,760억 유로며, 바이오매스 기반 화합물과 바이오플라스틱은 제품은 2008년 320억 유로에서 2018년 540억 유로 수준으로 약 68% 성장하였다.65)
미국은 농무부 BioProferred Program의 꾸준한 운영을 통해 2017년 기준 바이오매스 기반 산업바이오가 460만 고용창출, 4,700억 달러 경제 효과, 940만 배럴 석유 대체, 1,270만 톤 CO2 감소 효과 유발하였다고 발표하였다.66) 탄소중립 강화 및 합성생물학 기반 바이오파운드리 기술의 발전으로 미국의 산업바이오는 빠르게 성장할 것으로 예상된다.
|
(a) |
Turnover in the bio-based economy in the EU-27+UK, 2008-2018
|
|
(b) |
|
|
자료: Olaf Porc et al. (2021), European Bioeconomy in Figures 2008-2018, Daystar, J. et al. (2020), An Economic Impact Analysis of the U.S. Biobased Products Industry: 2019 Update. [그림 3-78] 유럽과 미국 산업바이오 규모 분석. (a) 2008년-2018년 기준 유럽 산업바이오 매출액 7,700억 유로 (b) 2013년-2017년 기준 미국 산업바이오 매출액 4,700억 달러
|
|
석유 기반 원료를 사용하는 용제, 계면활성제, 가소제 등 산업용 원료 제품 분야에서 바이오매스 기반 제품 규모가 점차 확대되고 있다. 전 세계시장 규모는 2020년 기준 바이오용제 74억 달러(BASF, Arkema, Cargil, Corbion, Dow Chemical, LyondellBasell 등)67), 바이오계면활성제 45억 달러(Evonik, Ecover, Soliance, Jeneil Biotec 등)68), 바이오가소제 24억 달러(Dow Chemical, Evnonik, Solvay, Danisco, Lanxess 등)69)의 시장을 형성하고 있다.
바이오플라스틱산업도 점진적으로 생산 규모가 확대되고 있으며, 유럽플라스틱협회는 세계 바이오플라스틱 생산 능력은 2020년 약 211만 톤에서 2025년 287만 톤으로 늘어날 것으로 예측하였다.70) 특히, 2018년 중국의 폐플라스틱 수입 금지와 미세플라스틱 오염 문제 등으로 인해 바이오매스 기반 바이오플라스틱 (Biomass-based bioplastics)보다 생분해성 바이오플라스틱(Biodegradable bioplastics)에 대한 시장수요가 빠르게 증가하고 있다. 2020년 211만톤 생산량의 41.9%(88.4만톤)는 바이오매스 기반 비분해성 바이오플라스틱이며, 58.1%(122만 톤)는 생분해성 바이오플라스틱이다. 2025년에는 생분해성 바이오플라스틱의 생산 규모가 62.7%(180만 톤)으로 더욱 성장할 것으로 예상된다.
BASF, NatureWorks, Novamont, Danimer Scientific, Braskem, LanzaTech, Genomatica, Carbios, Zymergen 등은 바이오플라스틱산업을 중심으로 자사의 산업바이오 제품 생산 규모를 확대하고 있다. 특히, 중국 정부의 <플라스틱오염 관리강화제안> 발표 이후, 중국기업은 BASF 등의 다국적 기업과 제휴를 통해 생분해성 바이오플라스틱산업 규모의 빠른 확대를 추진하고 있다.
BASF는 바이오납사(Bio-naptha) 또는 바이오가스 유래 바이오원료를 석유 유래 원료와 혼합하여 기존 자사의 석유화학제품을 생산하여 바이오매스 함량을 향상하는 질량균형 접근법(Biomass balance approach)을 개발하였다. 질량균형 접근법을 활용하여 BASF의 제품군(플라스틱, 건축 소재, 섬유, 자동차 소재, 페인트, 코팅) 전반에 바이오매스 함유 제품을 출시하고 있다. 생물공정을 활용한 기능성 소재(Beta-carotene, detergent cellulase and protease, scleroglucan polysaccharide, vitamin K2 등)와 범용소재(1,4-Butanediol, emollient 등) 제품군을 생산하고 있다.
NatureWorks는 생분해성 플라스틱소재 중 시장규모가 가장 큰 PLA(Polylactic acid)를 15만 톤/년 규모로 공급하고 있다. 빠르게 성장하는 PLA 시장에서 지배력을 유지하기 위해, 6억 달러를 투자하여 7.5만 톤/년 생산 규모의 신규 PLA 공장을 2024년 완공할 계획을 수립하였다.
|
(a) |
|
|
(b) |
|
자료: European Bioplastics, Bioplastic market data 2020.
[그림 3-79] 글로벌 바이오플라스틱 산업 규모 (a) 글로벌 바이오플라스틱 생산 규모 (b) 바이오플라스틱 소재별 생산 규모
Novamont는 바이오매스 기반 생분해성 소재를 활용하여 생분해성 바이오플라스틱(Mater-Bi), 바이오윤활유(Matro-Bi), 바이오화장품원료(Celus-Bi) 등과 같이 바이오제품군을 점차 확대하고 있다. 또한, 전분계 생분해성 바이오플라스틱 복합소재인 Mater-Bi의 시장경쟁력을 확대를 위해, 포장재 전문회사인 BioBag를 인수하였다.
Danimer Scientific은 2020년 기준 1만 톤/년 규모의 PHA(Polyhydroxyalkanoate) 생산공정을 완공하고, 2022년까지 7억 달러를 투입하여 2.25만 톤/년 생산 규모를 증설하여 최종적으로 3.25만 톤/년 규모의 PHA 생산공장을 확보할 계획이다.
Braskem은 바이오에탄올 기반 PE(Polyethylene)의 20만 톤/년 규모로 생산하고 있다. 6.1천만 달러를 투자하여 2022년 말까지 26만 톤/년까지 생산 규모를 증설할 계획을 수립하였으며, 태국의 화학회사인 SCG Chemical과 바이오 PE의 태국 내 생산을 논의하고 있다.
LanzaTech는 산업 부생가스를 활용하여 에탄올을 생산하는 생물공정의 상용화를 추진하고 있으며, BASF와 일산화탄소와 수소로부터 옥탄올(n-Octanol)을 생산하는 공동연구를 진행하고 있다.
Genomatica는 자사의 바이오매스 기반 소재 생산을 위한 미생물 개량 기술을 토대로 BDO(1,4-Butanediol), BrontideTM(1,3-Butanediol), BDE(Butadiene), GENO CPLTM(Hexamethylenediamine, caprolactam and adipic acid) 등과 같은 바이오플라스틱 또는 화장품 소재를 생산하는 생물공정을 개발하고, 화학기업과 협업을 통해 상용공정(Novamont, BDO 3만 톤/년)을 개발하고 있다.
Carbios는 PET를 고효율로 분해하는 효소를 개발하여 다양한 색과 혼합물로 이루어진 PET 폐기물을 단량체(Ethylene glycol, terephthalic acid)로 전환하여 다시 PET 플라스틱으로 재활용하는 공정을 개발하였다. PET 분해 효소는 Novozymes으로부터 공급을 받으며, 2025년까지 5만 톤/년 규모의 PET 재활용 공장을 건립할 계획이다.
Zymergen은 합성생물학 전문기업으로 Sumitomo와 협업을 통해 전자기기에 사용 가능한 고투명도 폴리이미드(Polyimide) Hyaline Z2를 개발하였다. 합성생물학 기반 바이오파운드리 기술이 신소재를 생산하는 미생물의 빠른 개량을 가능하게 하여, 바이오산업의 제조 혁신을 가속할 수 있음을 보였다.
중국 정부의 <플라스틱오염 관리강화제안> 발표 이후, 중국기업의 생분해성 바이오플라스틱산업 진출이 빠르게 진행되고 있다. Red Avenue New Materials는 BASF와의 협업을 통해 6만 톤/년 규모의 PBAT(Polybutylene adipate terephthalate) 생산공장을 2022년 건립계획을 수립하였다. 다수의 중국기업이 PBAT 생산공장 건립을 추진하고 있어, 중국은 수년 내 100만 톤/년 이상의 PBAT 생산 능력을 갖출 것으로 예상된다. BBCA는 5만 톤/년 생산 규모의 PLA 공장을 운영하고 있으며, 2023년까지 70만 톤/년 규모의 PLA 생산공장 신규 건립을 추진하고 있다.
[표 3-55] 산업바이오 관련 해외 선도 기업 현황
|
기업명 |
사업영역 및 주요 내용 |
|
|
∙ 바이오납사(Bio-naptha) 또는 바이오가스 유래 바이오원료를 석유 유래 원료와 혼합하여 기존 자사의 석유화학제품을 생산하는 질량균형 접근법(Biomass balance approach) 활용한 제품군 확대 ∙ 생물공정을 활용한 기능성 소재와 범용소재 제품군을 생산 |
|
|
∙ 6억 달러를 투자하여 7.5만 톤/년 생산 규모의 신규 PLA 공장을 2024년 완공할 계획을 수립 |
|
|
∙ 바이오매스 기반 생분해성 소재를 활용하여 생분해성 바이오플라스틱(Mater-Bi), 바이오윤활유(Matro-Bi), 바이오화장품원료(Celus-Bi) 등 바이오제품군 확대 |
|
|
∙ 2020년 기준 1만 톤/년 규모의 PHA(Polyhydroxyalkanoate) 생산공정을 완공하고 3.25만 톤까지 추가증설 계획 수립 |
|
|
∙ 6.1천만 달러를 투자하여 2022년 말까지 26만 톤/년까지 생산 규모 증설 계획 수립 |
|
|
∙ 산업 부생가스를 활용하여 에탄올을 생산하는 생물공정의 상용화를 추진 ∙ BASF와 일산화탄소와 수소로부터 옥탄올(n-Octanol)을 생산하는 공동연구를 진행 |
|
|
∙ BDO(1,4-Butanediol), BrontideTM(1,3-Butanediol), BDE(Butadiene), GENO CPLTM(Hexamethylenediamine, caprolactam, adipic acid)의 생물공정개발 및 화학기업과의 협업을 통한 상용화 추진 |
|
|
∙다양한 색과 혼합물로 이루어진 PET 폐기물을 분해하여 단량체(ethylene glycol, terephthalic acid)로 전환하는 효소공정을 개발하고 2025년까지 5만 톤/년 규모의 PET 재활용 공장 건립 계획을 수립 |
|
|
∙ Zymergen은 합성생물학, 로봇, 컴퓨팅 기반으로 하는 바이오파운드리 플랫폼 기술 보유 ∙Sumitomo와 협업을 통해 전자기기에 사용 가능한 고투명도 폴리이미드(Polyimide) Hyaline Z2를 개발 |
다. 국내 현황
(1) 정책 현황
탄소중립 추진, 플라스틱 문제 해결, 바이오산업 혁신 등 국가 현안의 해결방안으로 2050 탄소중립 추진전략, 생활폐기물 탈(脫)플라스틱 대책, 화이트바이오 산업 활성화 전략, 바이오산업 정책방향 및 핵심과제 등 주요 정책을 발표하였다. 특히 산업바이오는 각 정책의 주요 해결방안으로 제시되었다. 2050 탄소중립 추진전략에서는 3대 정책, 10대 과제 중 ’新유망 저탄소산업 생태계 조성‘정책의 ’新유망 산업 육성’과제에 해당한다. 생활폐기물 탈(脫)플라스틱 대책에서는 대체 플라스틱 사회로 전환을 위한 ’순수(100%) 바이오 플라스틱으로 대체’에 해당한다. 화이트바이오 산업 활성화 전략에서는 바이오플라스틱 개발․보급 확대, 화이트바이오 고부가가치 제품 중심으로 밸류체인 강화, 산업군을 형성하기 위한 기반 구축 등 산업바이오 전 분야 육성을 위한 전략을 마련하였다.
[표 3-56] 정부의 산업바이오 관련 주요 정책 및 세부 전략
|
정책 |
세부 전략 |
|
2050 탄소중립 추진전략 (2020년 12월) |
∙ 적응적(Adaptive) 감축”에서 “능동적(Proactive) 대응”을 통한 탄소중립, 경제성장, 삶의 질 향상 동시 달성을 목표 ∙ 3대(적응, 기회, 공정) 정책 및 10대 전략 제시 - “新유망 저탄소산업 생태계 조성” 정책의 “新유망 산업 육성” 과제에 해당 - 석유화학 대체 산업으로 화이트바이오 산업 육성 추진 |
|
생활폐기물 탈(脫)플라스틱 대책 (2020년 12월) |
∙ 생활폐기물 탈플라스틱 대책으로 단기적으로 플라스틱 발생 원천 저감, 플라스틱 재활용 확대하고 장기적으로 대체 플라스틱 사회로 전환하는 전략을 수립 ∙ 대체 플라스틱 사회 전환을 위해 순수(100%) 바이오플라스틱 기술 개발 추진 |
|
화이트바이오 산업 활성화 전략 (2020년 12월) |
∙ 미래 유망산업인 화이트바이오 산업의 경쟁력을 확보를 위한 전략 수립 ∙ 바이오플라스틱 개발․보급 확대, 화이트바이오 고부가가치 제품 중심으로 밸류체인 강화, 산업군을 형성하기 위한 기반 구축 등 주요 화이트바이오 산업 전반 발전 방안 마련 |
|
바이오산업 정책방향 및 핵심과제 (2020년 1월) |
∙ 바이오산업을 차세대 주력산업으로 육성하고, 바이오경제 선도국가로 도약하기 위한 정책 방안 마련 ∙ 5대 전략 분야 10대 핵심과제 추진 - “바이오기반 기술융합 사업화 지원” 분야의 “화이트바이오 초기시장 창출” 과제에 해당 - 화이트바이오 기술개발을 통한 기반조성과 시장성 확보를 위한 수요 창출 추진 |
바이오산업 정책방향 및 핵심과제에서는 ’화이트바이오 초기시장 창출’을 위한 사업화지원이 해당한다. 정부는 산업바이오 육성을 위한 다양한 정책을 발표하였으나, R&D 지원, 기반 구축, 기업체 지원 등 실제적인 지원 방안의 조속한 마련이 필요하다.
산업바이오와 관련성이 높은 기술 분야는 ‘친환경 바이오소재 기술‘과 ‘시스템생물학 및 합성생물학 분석 및 활용기술’은 최고기술국(미국) 대비 각 3.0년의 기술격차를 보였다. 특히, ‘시스템생물학 및 합성생물학 분석 및 활용기술’은 산업바이오의 핵심인 산업용 균주개발에 중요한 과학기술이나, 기초 및 응용연구에서 보통 수준에 그치고 있어, 정부의 대규모 R&D 투자를 통해 빠른 추격이 필요하다. ‘유용유전자 및 유전자원 개발 기술‘과 ‘바이오 및 폐자원 에너지화 기술’은 최고기술국(미국) 대비 각 4.3년 및 4.0년의 높은 기술격차를 보인다. 산업바이오의 원료인 바이오매스와 사용 후 제품의 순환과 관련된 기술로 개별기술의 개발보다는 바이오매스-소재-제품-재활용으로 이어지는 산업바이오 분야 전 주기적 요소기술의 통합적 개발이 진행되어야 해당 기술의 빠른 추격이 가능하다.
[표 3-57] 산업바이오 관련 분야 국내․외 기술 수준
|
11대 해당분야 |
120개 해당 번호 |
중점과학기술 |
기술수준(%) |
기술격차(년) |
기술 그룹 |
연구단계별 역량 |
연구개발 활동동향 |
|||||||||
|
한국 |
중국 |
일본 |
EU |
미국 |
한국 |
중국 |
일본 |
EU |
미국 |
기초 |
응용개발 |
|||||
|
소재․나노 |
40 |
친환경 바이오소재 기술 |
85.0 |
82.0 |
90.0 |
96.0 |
100.0 |
3.0 |
3.5 |
2.0 |
1.0 |
0.0 |
추격 |
우수 |
우수 |
상승 |
|
농림수산․ 식품 |
47 |
유용유전자 및 유전자원 개발 기술 |
80.0 |
94.0 |
84.5 |
94.5 |
100.0 |
4.3 |
1.0 |
3.0 |
1.0 |
0.0 |
추격 |
우수 |
우수 |
상승 |
|
생명․ 보건의료 |
71 |
시스템생물학 및 합성생물학 분석 및 활용기술 |
75.0 |
75.0 |
80.0 |
90.0 |
100.0 |
3.0 |
3.0 |
3.0 |
1.5 |
0.0 |
추격 |
보통 |
보통 |
상승 |
|
에너지․ 자원 |
79 |
바이오 및 폐자원 에너지화 기술 |
78.0 |
75.0 |
85.0 |
100.0 |
100.0 |
4.0 |
4.5 |
3.0 |
0.0 |
0.0 |
추격 |
우수 |
우수 |
유지 |
자료: KISTEP 2020년 기술수준평가
(2) 산업 현황
2019년 기준 국내 바이오산업 생산(국내판매+수출) 규모는 총 12조 3,235억 원으로 2018년 총 12, 3,348원 대비 15.8% 증가하였다.71) 2018년 대비 수출은 28.1% 증가한 6조 7,124억 원, 수입은 13.7% 증가한 1조 9,644억 원으로 4조 7,480억 원 무역수지 흑자를 냈다. 바이오산업의 국내 생산은 바이오의약산업(4조 2,389억 원, 34.4.%), 바이오화학․에너지산업(1조 8,551억 원, 15.1%), 바이오식품산업(3조 6,867억 원, 29.9%)이 대부분을 차지하였다. 산업바이오 관련 분야별 국내 생산의 경우, 바이오화학․에너지산업(1조 8,551억 원)은 바이오연료(62.9%, 1조 1,660억 원)와 바이오화장품 및 생활화학제품(24.6%, 4,562억 원)이 대부분을 차지하였고, 바이오식품산업은 사료첨가제(67.6%, 2조 4,903억 원)가 대부분을 차지하였다. 산업바이오 분야 수출 품목 1위인 사료첨가제는 전년 대비 31.2% 증가한 1조 8,351억 원 규모로 나타났다. 그러나, 산업바이오의 핵심 제품인 바이오플라스틱에 해당하는 바이오고분자는 국내 생산은 545억 규모에 머물러, 바이오플라스틱소재의 해외 의존도가 매우 높은 상황이 지속되고 있다.
[표 3-58] 2019년 바이오산업 분야별 생산 및 내수 현황
(단위: 백만 원, %)
|
구분 |
생산 |
내수 |
||||||
|
국내 판매 |
수출 |
계 |
비중 |
국내 판매 |
수입 |
계 |
비중 |
|
|
전체 |
5,611,134 |
6,712,371 |
12,323,505 |
100.0 |
5,611,134 |
1,964,445 |
7,575,579 |
100.0 |
|
바이오의약산업 (기타바이오의약품, 백신, 혈액제제 등) |
1,623,645 |
2,615,212 |
4,238,857 |
34.4 |
1,623,645 |
1,644,278 |
3,267,923 |
43.1 |
|
바이오화학․에너지산업 (바이오연료, 바이오화장품 및 생활화학제품, 바이오고분자제품 등) |
1,734,048 |
121,067 |
1,855,115 |
15.1 |
1,734,048 |
105,573 |
1,839,621 |
24.3 |
|
바이오식품산업 (사료첨가제, 건강기능식품, 식품첨가물 등) |
1,278,821 |
2,407,803 |
3,686,624 |
29.9 |
1,278,821 |
56,652 |
1,335,473 |
17.6 |
|
바이오환경산업 (환경처리용 생물제제 및 시스템 등) |
55,068 |
633 |
55,701 |
0.5 |
55,068 |
148 |
55,216 |
0.7 |
|
바이오의료기기산업 (체외진단 등) |
268,614 |
684,941 |
953,555 |
7.7 |
268,614 |
54,316 |
322,930 |
4.3 |
|
바이오장비 및 기기산업 (연구 및 생산장비 등) |
71,213 |
36,554 |
107,767 |
0.9 |
71,213 |
73,389 |
144,602 |
1.9 |
|
바이오자원산업 (종자 및 묘목 등) |
154,293 |
24,429 |
178,722 |
1.5 |
154,293 |
26,712 |
181,005 |
2.4 |
|
바이오서비스산업 (임상․비임상 연구개발 서비스 등) |
425,432 |
821,734 |
1,247,166 |
10.1 |
425,432 |
3,378 |
428,810 |
5.7 |
자료: 산업통상자원부
전 세계적인 바이오경제 확대로 인해 바이오매스 기반 제품 시장규모가 급격하게 성장하고 있다. 국내 기업도 ESG 경영을 강화하면서, E(환경) 부문에 관심이 높아지면서 온실가스 저감, 플라스틱 순환 등과 같은 산업바이오 관련 분야에 적극적인 투자를 하고 있다. 특히, 바이오플라스틱산업의 경우, 국내 기업의 수요가 폭발적으로 증가하고 있으나, 대부분의 소재를 수입에 의존하고 있어 국내 자립화가 어려운 상황이다. 최근, 대기업을 중심으로 바이오플라스틱 소재의 국산화를 위한 연구개발 및 상용화가 추진되고 있다.
CJ제일제당은 해양 생분해성이 우수한 바이오플라스틱소재인 폴리히드록시알카노에이트(PHA) 생산 라인(연산 5천 톤 규모)을 인도네시아에 건립하여 상용화 추진하고 있다. CJ제일제당은 SKC와의 협업을 통해, 자사가 생산한 PHA 소재와 PLA 소재를 활용하여 친환경 생분해성 포장재를 개발하여 자사 제품의 사용할 계획이다.
LG화학은 포도당과 폐글리세롤로부터 3-HP(Hydroxyproionic acid)를 생산하는 생물공정을 개발하였다. 3-HP와 젖산(Lactic acid)을 활용하여, 석유계 플라스틱인 PP(Polypropylene)와 동등한 기계적 강도를 가지면서 생분해가 가능한 바이오플라스틱 신소재 PLH(Poly lactate
hydracrylate)를 개발하고 상용화를 추진하고 있다. 또한, 생분해성 플라스틱 소재 PLA 생산을 위해 미국 곡물회사 ADM과 협력 연구를 진행하고 있으며, 연산 5만 톤 규모의 PBAT 공장 설립 계획을 수립하였다.
롯데케미칼은 사탕수수 유래 MEG(Mono ethylene glycol)를 이용하여 바이오매스 함량 30%인 바이오 PET를 생산하고 있다. 바이오 PET 생산량은 2017년 100t 규모에서 2020년 1만 톤 규모로 급속 성장하였고, 지속적으로 생산량을 확대할 것으로 예상된다.
대상은 아미노산 유래 바이오플라스틱 단량체(2-pyrrolidone, cadaverine)의 생산기술을 개발하였다. 또한, 자사의 전분당 사업 부문에서 축적된 전분당 처리 기술을 이용하여 전분계 생분해성 복합소재 기술 개발하고 있다.
삼양사는 군산에 연산 1만 톤 규모의 이소소르비드(Isosorbide) 공장 2021년 말 완공 예정이며, 이소소르비드를 활용한 생분해성 플라스틱 관련 다양한 응용 기술 및 적용 제품 개발 중이다.
SK케미칼은 바이오매스를 함유한 바이오플라스틱 ECOZEN과 ECOPROL을 판매하고 있다.
SKC는 바이오매스 기반 PET, PTT, PHA, PLA 필름 기술 개발하였고, 나노셀룰로오즈를 활용한 고강도 PBAT 개발하여 상용화를 추진하고 있다.
국내 기업은 바이오플라스틱 분야 이외에 미생물 기술을 이용하여 바이오소재를 개발하고 상용화를 추진하고 있다.
GS칼텍스 산업부 지원을 통해 개발한 2,3-BDO(2,3-Butanediol)를 그린다이올(GreenDiol) 상표권 등록 후 연산 300t 규모로 상용화하였다. 친환경 보습 원료로 국내외 화장품 기업에 공급하고 있다.
코스맥스는 마이크로바이옴 기술을 이용한 화장품 소재 기술 개발하였다. 피부 유익균 미생물 확보하여 마이크로바이옴 화장품 제품 출시하고 있다.
[표 3-59] 산업바이오 관련 국내 주요 기업 현황
|
기업명 |
사업영역 및 주요 내용 |
|
|
∙바이오플라스틱 폴리히드록시알카노에이트(PHA) 생산 라인(연산 5천 톤 규모)을 인도네시아에 건립하여 상용화 추진 |
|
|
∙3-HP(3-Hydroxypropionic acid)를 생산하는 생물공정을 개발하고, lactic acid와 3-HP의 공중합체인 신규 생분해성 바이오플라스틱 PLH를 개발 ∙ADM과 바이오플라스틱 PLA를 생산하기 위한 합작회사 건립 논의 중 |
|
|
∙바이오 MEG를 활용하여 바이오매스 함량이 30%인 PET를 생산 중 ∙생산 규모는 2017년 101 톤, 2018년 264 톤, 2020년 1만 톤으로 지속 확대 |
|
|
∙아미노산 유래 바이오플라스틱 단량체(2-Pyrrolidone, cadaverine) 생산 기술 개발 ∙자사의 전분당 기술을 활용한 전분계 생분해성 바이오플라스틱 복합소재 기술 개발 중 |
|
|
∙군산에 연산 1만 톤 규모의 이소소르비드 생산 공장 2021년 말 완공 예정 ∙이소소르비드를 활용한 생분해성 플라스틱 관련 다양한 응용 기술 및 적용 제품 개발 중 |
|
|
∙바이오매스 기반 바이오플라스틱 ECOZEN, ECOPROL 판매 |
|
|
∙바이오매스 기반 PET, PTT, PHA, PLA 필름 기술 개발 ∙나노셀룰로오즈를 활용한 고강도 PBAT 개발 및 상용화 추진 |
|
|
∙산업부 지원을 통해 개발한 2,3-BDO(2,3-Butanediol)을 그린다이올(GreenDiol) 상표권 등록 후 연산 300 톤 규모로 상용화 ∙화장품 보습 원료로 국내외 기업에 공급 |
|
|
∙마이크로바이옴 기술을 이용한 화장품 소재 기술 개발 ∙피부 유익균 미생물 확보하여 마이크로바이옴 화장품 제품 출시 |
기존 국내 바이오플라스틱산업은 가공 및 제품화 중심이며, 바이오플라스틱 제품에 대한 빠른 수요증가에도 불구하고 국내 소재 생산 기업의 부재로 바이오플라스틱 산업의 성장이 더딘 상황이다. 최근, 국내 석유화학기업과 발효기업을 중심으로 자사 제조 기술의 역량을 활용하여 생분해성 바이오플라스틱 소재를 개발하고 상용화를 추진하고 있다. 일부 기업이 소재 개발을 마치고 양산 공장 설립 계획을 검토하고 있어, 바이오플라스틱 소재의 국산화가 이루어질 경우, 바이오플라스틱 산업 전반이 빠르게 성장할 것으로 예상된다.
라. 발전 과제
최근 정부는 탄소중립 추진, 화이트바이오산업 육성, 탈플라스틱 대책 등과 같이 산업바이오 관련 육성정책을 발표하였다. 또한, 전 세계적인 바이오경제의 성장 추세와 연동하여 국내 산업바이오도 지속적으로 성장하고 있다. 그러나, 국내 산업바이오는 여전히 바이오연료와 사료첨가제 분야를 중심으로 빠르게 성장을 하였고, 바이오화장품 및 생활화학제품과 바이오플라스틱 분야의 성장이 더디게 진행되고 있다.
특히, 바이오플라스틱산업은 원료-단량체-소재-제품-인증-재활용으로 연결된 복잡한 가치사슬로 구성되어 있다. 민간 기업이 바이오플라스틱 상용화를 추진할 경우, 바이오플라스틱 소재 관련 전주기 기술을 확보하고 대규모 시설 투자를 해야 하는 부담이 있다. 또한, 단량체 생산을 위해 고효율 원천 미생물 균주의 설계 및 개량 기술도 필수적으로 보유해야 한다. 이러한 민간기업의 위험부담을 경감시키기 위해 유럽과 미국 등 주요국은 정부의 대규모 산학연 협력 R&D를 통해 기술성숙도에 따른 원천 및 상용화 기술을 개발하고 있다. 바이오 제조의 핵심인 산업용 미생물 개발의 경우, 미국, 유럽, 일본, 중국 등이 정부의 대규모 투자를 통해 공공 바이오파운드리 인프라를 구축하고, 산업 미생물 개발 과정을 디지털화하여 개발 속도를 비약적으로 향상시키고 있다. 개발된 신규 소재의 성능 평가 및 상용 소재의 제품다각화를 위한 파일럿 규모의 실증 인프라의 구축도 반드시 필요하다. 유럽은 바이오매스 기반 제품의 경쟁력 강화를 위해 제품군별로 바이오리파이너리 집적단지를 조성하고 있으며, 정부도 군산에 바이오콤비나트를 조성하였으나, 산업바이오 직접 단지의 추가조성과 지속적인 활용이 필요하다.
산업바이오의 빠른 상용화를 위해서는 정부의 심사 제도의 간소화, 인증제도의 다양화, 사용촉진제도의 도입 등이 정책적 지원도 필요하다. 기존 안정성이 확보된 산업미생물의 유전자변형생명체(Living Modified Organism) 심사나 바이오소재의 화학 물질등록 절차의 간소화가 필요하다. 또한, 생분해성 수지(EL724)와 바이오매스 합성수지(EL727)에 대한 환경마크 인증제도 이외에 바이오매스 함량에 따른 인증제도 다양화가 필요하며, 중소⋅중견 기업이 해외사업을 위해 별도의 해외기관에 인증을 받는 부담을 감소시키기 위해 국제 수준의 정부 공인 인증제도 마련도 필요하다. 미국의 Biopreferred Program과 같은 공공기관 우선 구매제도, 세제 혜택 등과 같은 산업바이오 제품 사용촉진제도의 도입도 시급하다.
"2. BT + ICT
가. 개요
고령화 사회로의 빠른 전환과 코로나19와 같은 전염병의 확산 등 사회․환경의 변화로 인해 건강에 관한 관심은 그 어느 때보다 높아지고 있다. 또한, 인공지능, 빅데이터, 클라우드, VR/XR(Virtual Reality/eXtended Reality), 유전체 분석 기술 등의 기술진화가 빠르게 전개되면서 질병의 진단, 치료 그리고 지속적인 건강관리를 가능하게 해줄 개인 맞춤형 의료서비스에 대한 기대가 커지고 있다. 특히, 인공지능의 비약적인 기술발전은 타 기술과의 융합 내지 결합을 통해 새로운 의료 융합 서비스의 등장을 촉진함에 따라 향후 의료 융합산업의 미래 핵심 성장동력으로 부각될 뿐만 아니라 건강한 삶을 실현하는 동인이 되고 있다.
이러한 기술의 고도화와 함께 의료 융합산업이 발전하기 위해서 필요한 것이 데이터 확보와 공유․활용이다. 개인의 의료기록, 진료정보, 라이프 로그 데이터, 유전자 등 다양한 데이터가 선행적으로 확보되어야 하며, 이들 데이터를 실제 서비스 제공을 위해 공유․활용할 수 있는 인프라 구축이 중요하다. 이를 위해 우리나라에서는 ‘케이-데이터댐’, ‘데이터 3법’ 및 ‘국가 바이오 빅데이터 구축(K-DNA)’ 등을 적극적으로 추진하고 있다.
BT+ICT 의료 융합 서비스로는 4차 산업혁명의 첨단기술(인공지능, 빅데이터, 클라우드, VR/XR 등)과 유전자 분석과 같은 바이오 기술이 결합된 정밀의료와 디지털 치료제가 대표적이다. 정밀의료 기술은 개인 맞춤형 특성에서 그 중요성을 알 수 있다. 기존에는 개인의 차이와 특성을 고려하지 않은 획일적이고 일률적인 의료서비스를 제공하였다면, 정밀의료는 개인의 유전․임상 정보, 생활습관 데이터를 분석하여 질병의 진단, 치료, 예측, 예방 및 관리를 위한 개인 맞춤형 의료․헬스케어 서비스를 제공한다.72) 이러한 정밀의료 기술은 각종 질병 진단서비스 뿐만 아니라 조상․뿌리 찾기, 운동․식단 관리, 음악 추천 등 다양한 개인 맞춤형 서비스로 확대․제공되고 있다. 또 다른 서비스인 디지털 치료제는 의료와 디지털 기술의 결합을 통해 의약품은 아니지만, 소프트웨어를 활용해 질병을 예방하고 치료하는 새로운 형태의 의료서비스다. 특히, 코로나19로 촉발된 의료서비스의 비대면화 추세에 맞춰 성장성이 기대되는 서비스다. 의료 소프트웨어 특성을 지닌 디지털 치료제는 불면증, 약물중독, 호흡기 질환, 우울증, 공황장애 등의 치료에서 점차 활용성이 증가하고 있다.
이에 본 장에서는 질병의 진단․예방․치료 및 상시 건강관리를 통해 삶의 만족도를 높여줄 수 있는 정밀의료, 디지털 치료제를 중심으로 국내외 정책, 기업 동향 및 시장전망을 살펴보고 의료 BT+ICT 융합산업의 지속적인 성장을 위한 발전과제를 제시하였다.
나. 해외 동향
(1) 정밀의료
미국은 2015년 국가 차원의 ‘정밀의료 이니셔티브’를 통해 국민 건강 및 헬스케어 전반에 정밀의료를 확대하는 것을 목표로 삼았다. 이러한 정밀의료를 실현하기 위해 약 22억 달러를 투자하여 새로운 의료 패러다임 선도에 집중하였다. 또한, 국립인간유전체 연구소와 조인트게놈연구소를 중심으로 질병을 진단하고 효과적인 치료를 위한 실용적인 연구를 추진해 오고 있다.
세계에서 정밀의료 기술 정책을 가장 먼저 추진한 영국은 ‘10만명 유전체 프로젝트’(2012)를 통해 희귀질환, 유전질환, 암 등 각종 유전학적 원인 규명을 통한 정밀의료 실현을 목표로 하고 있다. 이후 ‘보건의료 빅데이터 통합센터’(2013) 설립, ‘2020 개인 맞춤형 헬스케어 구상 프레임워크 보고서’(2014), ‘이노베이트 UK’(2015) 등을 통해 유전체 정보 분석 및 지원혁신센터 구축 등으로 정밀의료 실현을 위한 정책적 지원을 강화하고 있다.
한편, 유럽연합은 ‘제7차 유럽공동연구 개발 프로그램’의 ‘PedMed’프로그램을 추가하여 유럽에서 추진하고 있는 정밀의료 연구를 통합하고 실용화하는 작업을 확대하고 있다.
일본은 ‘의료혁신 5개년 전략’(2012)에 맞춤형 의료를 핵심 과제로 포함한 이후 일본 의료연구개발기구의 주요 연구 과제로 정밀의료 분야의 실용화 연구를 포함, 유전체 정보 분석 및 치료에 활용하는 연구를 지속적으로 추진해 오고 있다.
중국은 2015년 ‘정밀의료 5개년 발전계획’을 통해 2030년까지 정밀의학에 600억 위안(약 107조 원) 규모의 R&D 투자를 발표하였다.73) 주요 연구 내용으로는 100만 명 이상의 코호트 연구, 정밀의료 빅데이터 구축 및 차세대 생명공학 분야 핵심 기술 연구개발 등을 포함하고 있다.
개인의 유전체를 기반으로 한 다양한 솔루션 상품 시장이 빠르게 성장하고 있다. 유전자 분석 및 진단․예측 서비스업체로는 23앤드미, 파운데이션메디슨, 미리어드제네틱스 등이 대표적 기업이다.
유전자 분석의 대표적인 상품․서비스로는 개인 유전자 맞춤 건강관리, 질병 찾기 및 조상 찾기 등이 있다. 구글로부터 투자를 받아 2006년에 설립된 23앤드미(23andMe)가 대표적인 정밀의료 스타트업으로 질병을 진단할 수 있는 유전자 검사 키트 등을 핵심 사업으로 하고 있으며, 2021년 6월 나스닥에 상장하였다. 파운데이션메디슨은 차세대 염기서열 분석을 통해 개별 환자 한 명 당 약 400개 이상의 유전자를 분석할 수 있으며 암과 같은 질병의 유전자 변이 분석 정확도에서도 기술 역량을 보유한 기업이다. 유전자 분석 장비업체로는 일루미나가 대표적이다. 일루미나는 유전제 분석 장비 시장의 70% 이상의 점유율을 차지한 세계 1위의 유전체 분석 기업으로 유전자 검사 플랫폼 업체로 그 사업영역을 확장하고 있다.
개인의 건강관리뿐만 아니라 유전체 분석을 통한 질병 진단․치료 등에 대한 높은 관심으로 정밀의료 시장의 빠른 성장이 기대된다. 글로벌 정밀의료 시장규모는 2020년 약 662억 달러에서 약 13%의 연평균 성장을 통해 2023년 약 1,000억 달러의 규모로 확대될 것으로 전망된다.74)
(2) 디지털 치료제
미국을 비롯한 해외 주요국들은 디지털 치료제를 미래 디지털 헬스케어 산업의 핵심 산업으로 인식, 산업 활성화를 위한 다양한 정책을 추진하고 있다.
우선, 미국은 식품의약국(FDA)를 중심으로 디지털 치료제 분야의 기술혁신을 촉진하기 위한 규제체계를 선도적으로 마련하였다. 2017년에는 ‘Digital Health Innovation Action Plan’을 통해 SaMD 등 소프트웨어 기반 의료기기 특성을 반영한 이전보다 간소화된 규제의 틀을 마련하고 있다. 또한, 2019년에는 ‘Digital Health Software Pre-Cert 파일럿 프로그램’을 통해 제품이 아닌 기업 중심의 사전 승인 규제를 도입하였다.
유럽은 디지털헬스 혁신 의료기기의 등장에 따른 대응방안으로 의료기기지침법 및 체외진단의료기기법 등을 선제적으로 도입하여 산업 활성화를 모색하고 있다. 특히, 영국은 국립임상연구소(NICE)를 중심으로 국영건강보험제도에 디지털 치료제 도입과 실행을 위한 가이드라인을 제시하였으며, 제조 산업 현장의 정신질환 분야에 디지털 치료제의 활용방안을 마련하였다.
일본은 혁신 의료기기에 대한 조건부 승인제도 도입(2017)을 시작으로 치료용 스마트폰 애플리케이션에 대한 보험 적용을 승인(2020)하였다. 한편, 2019년에는 일본 디지털 치료제 컨소시엄을 설립하여 기업 중심의 디지털 치료제 도입을 추진함으로써 디지털 치료제 시장․산업 확산에 집중하고 있다.
중국은 디지털 헬스케어라는 새로운 의료 패러다임에 맞춰 혁신 의료기기의 개발과 허가를 장려하는 정책을 도입하고 글로벌 디지털 치료제 시장 진출을 위해 미국 기업과의 전략적 제휴 등의 글로벌 협업 전략을 추진하고 있다.
디지털 치료제 개발을 위한 주요 기업의 개발사례를 살펴보면, Pear Therapeutics사는 2017년 약물중독 환자 대상 인지치료 행동 앱인 ‘reSET’을 개발하여 FDA 승인을 받음으로써 최초의 디지털 치료제가 되었다. 이 외에도 수면장애 치료를 위한 Big Health의 ‘Sleepio’, 당뇨 치료용으로 WellDoc의 ‘BullStar’, 소아 ADHD 치료를 위한 Akili Interactive Lab의 ‘EndeavorRx’ 등 다양한 질환 치료를 위한 디지털 치료제 개발이 진행되고 있다.
한편 디지털 치료제 기업은 제약사와의 협력을 통해 노하우를 얻음으로써 새로운 서비스 개발에 역량을 강화하고 있다. Voluntis는 Sanofi, Roche, Novatis 등과의 협력을 통해 당뇨 및 각종 암 관련 치료제를 개발하고 있으며, Click Therapeutics와 Akili interactive는 각각 Sanofi, Shionogi로부터 R&D 투자 계약을 통해 공동으로 조현병, ADHD, 자폐증 등의 디지털 치료제 개발을 하고 있다.
세계 유수의 시장조사 기관인 그랜드 뷰 리서치(Grand View Research)에 의하면, 세계 디지털 치료제 세계 시장 규모는 2021년 35억 달러에서 연평균 23.1%의 빠른 성장을 통해 2028년 191억 달러를 형성할 것으로 전망된다.75)
다. 국내 동향
(1) 정밀의료
우리나라는 정밀의료에 활용 가능한 의료․바이오 데이터 구축 사업을 2001년부터 꾸준히 추진해 오고 있다. 정부는 정밀의료 실현을 위해 ‘국가 바이오 빅데이터 구축(K-DNA)’사업을 통해 2029년까지 100만 명의 유전체 정보를 확보할 예정이며, 1단계로 2021년까지 2만 명 규모의 데이터를 구축을 추진하고 있다. 2022년에는 개인이 병원이나 의료기관을 방문하지 않고 온라인 플랫폼상에서 자신의 건강정보 관리가 가능한 ‘마이 헬스웨어’를 구축할 예정이다.
정밀의료 구축을 위해 필요한 데이터는 국민건강보험공단, 건강보험심사평가원, 질병관리청 등 공공건강데이터에서 시작해 병원 의료 데이터, 라이프 로그, 유전정보 등 개인 건강데이터 범위까지 확대함으로써 개인 맞춤형 진단․치료가 가능해질 것으로 전망하고 있다. 정부는 정밀의료 기술개발에 대한 R&D 투자 또한 지속적으로 확대해 왔다. 이를 위해 복지부는 2017년 정밀의료기반 암 진단 치료법 개발 사업단을 출범하였으며, 2020년에는 500명 이상의 암 환자 유전자 데이터를 분석하였다.
특히, 과기정통부는 2021년 7월 복지부, 산업부, 식약처 등 관계부처와 함께 한국판 뉴딜 2.0 실현을 위한 정밀의료 소프트웨어 청사진을 발표했다. 국내 인공지능 의료 소프트웨어 기업의 안정적 시장 진입과 빠른 성장의 기반 인프라 조성을 목적으로 보건의료 빅데이터 및 국가 바이오 빅데이터 등 ‘케이-의료데이터댐’을 구축․개방, 닥터앤서 플랫폼 개방, 기업들의 인공지능 의료 소프트웨어 개발 및 의료기기 인허가 제도 개선을 통해 정밀의료 소프트웨어 생태계 조성을 추진하고 있다.
강원도는 삼성서울병원, 더존비즈온 등과 정밀의료 컨소시엄을 통해 국내 최초로 의료 데이터와 AI가 융합된 ‘정밀의료 빅데이터 서비스 플랫폼’을 구축할 예정이다. 이를 토대로 임상, 의료영상, 유전체 등 다양한 의료 자료와 데이터 분석을 위한 인공지능과 클라우드 기반의 혁신적인 의료서비스가 제공될 것으로 기대된다. 한국로슈는 한국보건산업진흥원과 정밀의료 생태계 구축을 위해 2020년 11월 향후 5년간 1,700억 원을 투자하는 협력을 체결하였다. 이를 통해 신약개발 연구, 디지털 솔루션 및 유전체 분석 서비스 국내 도입 등을 추진할 예정이다.
국내 대표적인 유전체 분석 기업인 마크로젠, 디엔에이링크, 테라젠바이오 등 3사는 2020년 10월 ‘국가 바이오 빅데이터 구축’(K-DNA)의 최종 사업자로 선정되었다.
마크로젠은 세계 5위 수준의 유전체 분석정보를 생성할 수 있는 기술을 보유하고 있으며 희귀 유전질환 스크리닝 검사 상용화 외에도 의료기관 기관용 서비스(암, 당뇨병 등)와 비의료 기관용 서비스(비만, 탈모 등)를 구분하여 예측하는 서비스를 제공하고 있다. 다엔에이링크는 유전체 바이오마커를 발굴하여 개인별 질병/약물 부작용을 예측하는 서비스를 제공하고 있다. 테라젠바이오는 국내에서 처음으로 세계에서는 4번째로 인간유전체 지도를 완성한 기업으로 잘 알려져 있다. 국내 최고의 유전체 분석 역량을 지닌 테라젠바이오는 전 세계 80여 개국의 유전체 연구자 및 기관과 협력하고 있으며 유전체 기반 신약개발, 바이오마카 발굴 등의 사업을 추진하고 있다. 이들 기업 외에 랩지노믹스는 체외진단 특히, 분자진단 검사에 특화된 기업으로 건강관련 진단검사 뿐만 아니라 암, 염색체 이상 등 유전자 검사와 관련한 기술 역량을 보유하고 있다.
(2) 디지털 치료제
우리나라는 디지털 치료제 산업 활성화를 위한 제도 마련 및 지원정책을 적극적으로 추진해 오고 있다. 정부는 ‘디지털 뉴딜(2020)’ 정책을 통해 코로나로 촉발된 비대면 산업 지원정책의 일환으로 디지털 치료제에 대한 R&D 투자를 확대하고 있다. 식약처는 디지털 치료제에 대한 시장진출 확산의 제도적 인프라 마련을 위해 디지털 치료기기 허가․심사 가이드라인을 발표(2020)하였다. 본 가이드라인의 핵심 내용으로는 혁신 의료기기로 지정된 의료기기소프트웨어 제조업체에 대한 인증/제조허가 또는 인증에 필요한 관련 자료의 일부를 면제하였으며, 디지털 의료기기(치료제)와 관련한 허가/심사 시 적용 범위와 판단기준 및 예시 등에 대해 안내하는 가이드라인을 제시하였다. 바이오․헬스 산업 혁신전략(2019)에서는 혁신적 디지털헬스기기에 대한 효과 검증 R&D를 지원하며 제12차 과학기술장관회의(2020)에서는 8개 영역별 30개 중점 유망기술 중 헬스케어 분야에 디지털 치료제를 포함하였다.
우리나라는 정부로부터 정식으로 승인받은 디지털 치료제가 없으나, 벤처기업과 스타트업을 중심으로 디지털 치료제 개발에 자원과 역량을 집중하고 있다. 대표적인 사례로서 뉴냅스의 2019년 시각장애 인지행동 치료를 위한 뉴냅비전이 국내 최초로 임상승인을 받아 임상이 진행 중이며, 호흡기질환 환자들의 재활을 돕는 ‘레드필숨튼’ 또한 임상이 진행되고 있다. 이외에 빅씽크테라퓨틱스는 강박장애 인지행동 치료용 디지털 치료제 오씨프리의 미국 임상승인을 받았다. 한독은 2021년 3월 온라인 근감소증 진단 및 관리 플랫폼을 개발하고 있는 디지털 치료제 개발업체 웰트에 30억 원 규모의 지분을 투자하고 알코올 중독과 불면증 디지털 치료제를 공동으로 개발할 예정이다.
국내 디지털 치료제 시장 규모는 2020년 1,586억 원에서 2023년 3,263억 원으로 약 2배 이상 성장할 것으로 전망된다.76)
라. 발전 과제 및 전망
고령화, 건강에 관한 관심 증대 및 인공지능, 빅데이터 등 첨단 ICT 기술과 유전자 분석 등 바이오 기술의 빠른 성장은 의료 BT와 ICT 융합산업을 활성화하고 새로운 혁신적인 서비스 시장 창출을 가속하고 있으며 국가의 핵심 성장산업으로 그 중요성이 날로 높아지고 있다. 이에 BT와 ICT 융합의 대표적인 핵심 산업 분야인 정밀의료와 디지털 치료제가 고부가가치 산업으로 한층 도약하기 위한 시장 활성화 전략 방향을 제언하면 다음과 같다.
첫째, 개인 의료 진단 및 치료의 기반이 되는 데이터의 통합적 관리 체계 마련이 필요하다. 진정한 의미의 정밀의료를 실현하기 위해서는 개인의 유전자 정보, 진료 기록, 라이프 로그 데이터 등의 연결 및 통합이 중요하다. 이를 위해서는 정부가 민간부문과의 유기적 협력체계를 통한 적극적인 정책 드라이브가 요구된다.
둘째, 기업 경쟁력 제고를 위한 전략적 사고의 전환이 필요하다. 자체 기술개발역량을 키우는 것도 중요하지만 자사가 취약한 부분의 기술력을 지닌 벤처/스타트업을 인수함으로써 사업 역량을 확대하는 것이 중요하다.
셋째, 지속적인 R&D 투자확대를 통해 기술 경쟁력을 높여야 한다. 유전체 분석을 위한 장비, 분석 소프트웨어 및 정밀의료 데이터 분석 분야에서 장기적인 안목을 가지고 원천기술 개발과 국산화를 이루는 것이 필요하다. 특히 디지털 치료제 관련 원천기술 확보 및 개방형 의료 데이터 플랫폼을 구축하여 디지털 치료제 신약개발을 촉진할 기술개발에 집중하는 것이 시급히 요구된다.
넷째, BT+ICT 의료 융합 콘텐츠 개발을 둘러싼 다양한 이해관계자와의 소통과 협력을 높이는 것이 필요하다. 특히, 정밀의료와 디지털 치료제 관련 다양한 이해관계자(제약사, 보험사, 의료기관, BT/ICT 기업, 정부 등)간 발생 가능한 다양한 이슈(개인정보보호, 의료수가 산정 및 반영, 데이터 공유 및 활용방안 등)를 해결하기 위해 이해관계자 상호 간 상생의 협력 생태계를 마련하는 것이 필요하다.
마지막으로, 의료 BT+ICT 융합의 새로운 서비스 및 비즈니스 모델 개발이 중요하다. 아울러 개인 맞춤형 치료를 실현하기 위한 혁신적인 서비스 개발과 사업화를 통해 수익 창출이 가능한 비즈니스 모델을 개발하는 것이 필요하다.

1. 바이오 소재 클러스터
가. 개요
코로나19에 대한 백신과 진단키트들이 빠르게 개발될 수 있었던 것은 코로나19 바이러스 및 유전체 정보가 바이오 연구 및 산업계에 제공되었기 때문이다. 이와 같이 바이오 연구 및 산업이 발전하기 위해서는 핵심 원료인 바이오 소재가 적시에 제공되는 것이 중요하다.
하지만 대부분의 바이오 소재는 그 자체가 상품이 되는 경우는 드물며, 바이오 연구의 원료로 사용되는 경우가 많아서 바이오 소재의 산업적 시장규모가 제시된 경우는 부족한 상황이다. 다만, 바이오 의약품 개발 및 생산에 활용되는 세포주의 글로벌 시장은 2015년 26억 2,000만 달러에서 2020년 48억 9,000만 달러 규모로 성장할 것으로 전망된 바가 있다.77)
바이오 연구 및 산업의 원료로서 바이오 소재의 중요성을 인식한 OECD는 2001년 세계 각국에 고품질의 바이오 소재와 정보를 관리 보급하는 생물자원센터(BRC: Biological Resource Centre)의 개념을 제시하였으며, 이를 생명공학 및 관련 산업의 성장을 견인하는 핵심 인프라 기관으로서 제시한 바 있다.
우리나라도 2007년 관계 부처 합동으로 ‘국가 생명자원 확보․관리 및 활용 마스터플랜’을 수립하였고, 관계 부처는 소관 분야의 바이오 소재를 확보․관리․활용하기 위한 제도를 정비하였다.
과기정통부는 2009년 5월 ‘생명연구 자원의 확보․관리 및 활용에 관한 법률’을 제정하였고, 바이오 소재와 데이터를 포함한 개념인 생명연구자원의 효율적인 확보와 체계적인 관리를 통해 지속가능한 활용을 도모하고, 생명공학의 발전 기반을 조성하기 위해 5년 단위의 기본계획과 연 단위의 시행계획을 수립하여 시행하고 있다. 그 결과, 2012년 기준으로 217만 5,802점이었던 바이오 소재는 2019년 1,184만 644점으로 약 5.4배가 증가하였고, 소재의 분양도 2012년 44만 5,831점에서 2019년 92만 413점으로 약 2배가 증가하였다.
OECD가 제시한 생물자원센터와 유사한 개념으로 바이오 소재를 확보하여 바이오 연구나 산업에 제공하는 국내 소재자원은행을 살펴보면, 정규직 인력이 5인 이하인 경우가 전체의 약 54%이며 약 58%가 1억 원 이하의 과제를 수행하여 소규모 실험실 수준으로 운영되고 있는 상황이다. 이로 인해 연구현장에서 필요로 하는 실물 소재와 효능, 유효물질 등의 소재 특성정보를 제공하지 못하고 있어서 양적 성장 대비 질적 성장이 부족하였다.
이러한 문제를 해결하기 위해 관계 부처는 2020년 ‘제3차 국가생명연구자원 관리․활용 기본계획’을 수립하였으며 부처별로 운영하던 소재자원은행을 14개 분야 클러스터로 재편하여 수요자 맞춤형으로 소재를 제공할 계획이다.
나. 국내외 소재자원은행 현황
유전자원의 이용을 통해 발생한 이익을 원산지국과 공유하도록 하는 나고야의정서의 발효, 코로나19 팬데믹 발생 등으로 세포주(細胞株, cell line), 천연물, 바이러스 등 실물 바이오 소재를 자국에서 먼저 확보․활용하려는 자국 우선주의 기조가 확대되고 있으며 주요국들은 소재자원은행을 중심으로 유용 바이오 소재 확보에 노력해오고 있다. 동물, 식물, 미생물, 인체유래물 등의 국내외 주요 소재자원은행 현황을 살펴보면 다음과 같다.
(1) 동물 분야
모델동물은 사람에게 직접 실험하기 어려운 질병 연구를 수행할 수 있는 재료로 활용되고 있으며 전임상시험, 작용기작 연구 등에 활용되어 바이오 및 보건의료 연구에 매우 유용하게 쓰이고 있다.
이에 주요국들은 마우스, 영장류, 제브라피쉬, 초파리 등 실험에 사용할 수 있는 동물의 확보에 힘쓸 뿐만 아니라 특정 질환이 유발된 형질전환 모델동물의 개발에도 힘쓰고 있다. 미국은 Jackson Laboratory, MMRRC(Mutant Mouse Resource & Research Center)와 같은 대표 마우스 인프라를 보유하고 있으며 7개의 영장류연구소를 통해 영장류를 국가 차원에서 관리하면서 연간 6∼8만 마리의 영장류를 과학자들에게 공급하고 있다.
EU는 연구 인프라 지원 프로젝트인 INFRAFRONTIER를 운영하고 있으며, 8개 회원국에서 영장류 공급 시설을 갖추고, 매년 수백∼수천 마리의 영장류를 공급하고 있다. 일본은 국가생물자원프로젝트(National BioResource Project)를 통해 마우스(RIKEN BRC), 렛트(교토의대), 영장류(교토대 영장류연구소)에 대해 국가 차원에서 모델동물을 전략적으로 관리․제공하고 있다.
국내는 정부출연연구소, 대학 등에서 모델동물을 확보․제공하는 인프라를 구축하고 있다. 한국생명공학연구원 실험동물자원센터는 2020년까지 1,578계통의 마우스를 확보․관리하고 있으며, 2020년에는 6,731마리를 분양하였다. (재)국가마우스표현형분석사업단은 261계통의 형질전환 마우스의 개발하고, 2020년 106마리를 분양하였다. 한국생명공학연구원 영장류자원지원센터는 2020년까지 979마리의 영장류를 확보하고 있으나, 아직까지는 100마리 이하로 분양되고 있다. 이외에도 질환모델링제브라피쉬연구소재은행(2만 5,000종류), 초파리연구자원은행(5,785종류), 제노푸스연구소재은행(3,300종류) 등이 운영되고 있어서 연구자들이 필요로 하는 모델동물들이 적시에 확보․제공될 수 있도록 노력하고 있다.
(2) 식물 분야
신종 인플루엔자 치료제로 유명한 타미플루(Tamiflu), 아스피린(Aspirin), 탁솔(Paclitaxel) 등은 식물 추출물에서 유래한 약물들이다. 이러한 식물 유래 추출물들은 전통적 임상적 경험과 지식을 가진 검증된 소재로 효능과 독성의 예측이 가능하여 신약 후보로 주목받아 왔다. 이에 주요국들은 식물 추출물을 확보․활용하기 위해 다양한 노력을 기울이고 있다.
미국 국립암연구소(NCI)는 천연물 기탁소를 운영하여 전 세계 25개국의 식물, 해양생물 등 천연물 자원을 수집하였으며, 식물 3,390종 및 11만 4,000종류의 추출물을 확보하였으며, 15만 개의 천연물 분획 라이브러리를 구축․제공하고 있다.
프랑스는 국립화합물라이브러리를 2003년 설립하여, 1만 1,000종류의 추출물과 4만 종류의 천연화합물을 확보․제공하고 있다. 호주 그리피스대학교 신약개발연구소는 AstraZeneca사의 투자로 1993년 NatureBank를 설립하였으며, 1993년부터 2007년까지 14년의 투자를 통해 4만 5,000종의 식물을 수집하였다.
국내에서는 한국생명공학연구원 천연물중앙은행 등을 통해 국내외 식물 추출물들을 확보․제공하고 있으며, 한국생명공학연구원은 2020년 기준으로 국내 식물 추출물 7,310점, 해외 식물 추출물 3만 5,613점을 확보하고 있으며, 약 3만 8,000종 12만 점을 확보하고, 제공하고 있다.
이 외에도, 인간의 주요 식량 자원 중 하나로 활용되는 식물이 전쟁, 기후변화 등으로 인해 멸종할 경우를 대비하여 노르웨이 스발바르 시드볼트(Svalbard Global Seed Vault)에는 100만여 개의 식물 씨앗을 장기적으로 저장하고 있으며, 국내에서는 농업유전자원센터와 백두대간수목원 시드볼트 등을 통해 다양한 씨앗들을 보존하고 있다.
(3) 미생물
김치, 유산균 등의 발효식품으로 우리 식탁에서 활발히 활용되는 미생물은 장내미생물, 합성생물학 등으로 범위가 점차 확대되어 다양한 분야에서 폭넓게 활용되고 있다.
미국은 1925년 ATCC(American Type Culture Collection)를 설립하여 전 세계의 미생물자원을 수집해왔으며, 세균 1만 8,000주, 곰팡이 4만 9,000주, 인간 및 동물 세포주 4,000주 등 세계에서 가장 큰 미생물 소재자원은행으로 운영되고 있다.
1969년 설립된 독일 DSMZ(Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH)는 유럽 최대 생물자원은행으로 세균 약 2만 주, 곰팡이 약 5,000주 등 다양한 미생물을 확보하여 분양하고 있다. 1979년 설립된 중국일반미생물자원센터(China General Microbiological Culture Collection Center)는 세균, 효모 등 4만 주 이상의 미생물을 확보하여 분양하고 있다. 국내에서는 한국생명공학연구원 생물자원센터(KCTC)에서, 농촌진흥청 국립농업과학원 미생물은행(KACC), 한국미생물보존센터(KCCM) 등 다수의 미생물 소재자원은행이 운영되고 있다. 2020년 기준으로 대표적인 미생물은행이 보유․분양한 일반세균 성과를 살펴보면, 확보는 KCTC 3만 6,224주, KACC 1만 1,686주이며, 분양은 KCTC 4,602주, KACC 1,989주가 제공되었다.
유산균과 같이 유익한 미생물도 존재하지만, 탄저균, 식중독균과 같이 병원성을 보유한 미생물도 존재한다. 이러한, 병원균에 대한 치료제 및 백신 개발을 위해서는 병원성 미생물의 확보 및 관리도 중요하다. 미국 국립알레르기․감염병연구소(NIAID)는 BEI Resource Center를 구축하였으며, ATCC에 자원의 보존 및 관리를 위탁하여 운영하고 있다. 우리나라는 2016년 ‘병원체자원의 수집․관리 및 활용에 관한 법률’을 제정하고, 국가병원체자원은행을 설립하여, 국민보건 증진과 보건의료산업 및 국민경제 발전에 기여하기 위한 병원체를 수집․제공하고 있다.
(4) 인체유래물
일반 바이오 연구자들의 경우 수술, 진단 등을 통해 인간에게서 채취한 암조직, 혈액 등은 확보․활용하는 것이 어렵다. 이에 인체에서 유래된 조직, 혈액, 혈장 등을 보존하여, 연구자에게 제공하는 인체자원은행들이 병원 또는 의학연구소를 중심으로 발전하였다.
미국 CHTN(Cooperatirve Human Tissue Network)은 국립암연구소의 암진단 프로그램에서 수집된 인체유래물을 연구자에게 제공하고 있으며 1987년 설립 이후 95만개 이상을 생체자원을 제공하고 있다. 영국은 2015년 NBC(National Biosample Centre)를 설립하여 생의학 및 임상연구 지원을 위해 고품질 생체시료 수집․관리 등을 지원하고 있다. 일본은 6개의 국립전문의료연구센터로 구성된 NCBN(National Center Biobank Network)를 통해 인체자원의 축적 및 활용 연구를 추진하고 있다. 우리나라는 국립인체자원은행을 중심으로 한국인체자원은행네트워크를 구축하여 운영하고 있으며 2021년 기준 74개 기관(주로 병원 단위)이 인체자원은행으로 허가받아 운영되고 있다.
치매, 뇌질환 등으로 연구에 필요한 뇌는 인체 중에서도 미지의 영역으로 남아있지만, 해당 조직을 확보하는 것이 어려워서 상대적으로 확보․제공이 부족한 편이다.
미국 국립보건원(NIH) 지원을 받아 2013년에 설립된 NBB(Neuro BioBank)는 산하에 6개의 뇌은행을 운영 중이며, 이 중 1978년 설립된 하버드 의과대학 뇌은행은 뇌연구를 위한 인간 뇌조직 표본 3,000례를 확보하여 분양하고 있다. 영국은 2008년 의학연구회(MRC)를 중심으로 10개 뇌은행이 뇌은행 네트워크(UKBBN) 형태로 운영 중이며, 3,000여 증례의 뇌조직을 확보하고 있다. 일본은 1967년 니이가타 의대 뇌은행을 시작하여 뇌․척수 및 전신장기 등 3,500례 확보 및 퇴행성질환의 원인규명 및 치료법 공동연구 및 교육 거점으로 운영되고 있으며, 2016년 의료연구개발기구(AMED) 중심으로 정신질환, 노화․치매, 신경질환을 중심으로 8개소의 뇌은행이 운영 중이다. 국내에서는 한국뇌연구원 한국뇌은행 중심으로 한국뇌은행네트워크를 구성하여 운영하고 있으며, 2만 3,440개의 뇌 조직, 혈액 등이 확보되어 있다. 이외에도 질병청에서는 치매뇌은행을 설립하여 치매 환자의 뇌를 수집하여 분양하고 있다.
(5) 기타(배양세포, 합성화합물)
전 세계적으로 연구에 사용되고 있는 약 1,500여종의 세포주는 대표적 배양세포 자원은행인 미국 ATCC, 독일 DSMZ, 영국 ECACC, 일본 JCRB, RCB, 한국 KCLB에서 주로 분양되고 있다. 배양세포 자원은행들은 확보, 개발, 보존 및 품질관리 서비스 등을 수행하고 있으며, 이외 유전자 조작기법을 이용한 이차적 세포주 개발 등을 수행 중이다. 세계 최대 배양세포 자원은행인 미국 ATCC는 차세대 3D 암세포 모델인 오가노이드 자원의 분양을 위해 HCMI(Human Caner Models Initiative)에서 보유 중인 오가노이드를 기탁받아 오가노이드 분양을 시작(2020년 말 기준 82종)하였다. 국내에서는 1987년 한국세포주은행이 설립되어 722주의 분양가능한 세포주를 확보하고 있으며 2021년 5월까지 12만 2,656주의 세포주를 전 세계에 분양하고 있다.
합성화합물의 확보와 관리는 신약개발의 핵심 경쟁력 중 하나로, 주요국들은 합성화합물의 확보에 큰 공을 들이고 있다. 미국은 2012년부터 국립보건원(NIH) 산하에 국립고등중개연구센터(NCATS)를 설립하여 운영하고 있으며 2019년 기준으로 인력 167명, 9,800억 원을 투자하여 60만 종류의 화합물을 보관하고 있으며 그 수를 지속해서 늘려나가고 있다. 중국은 CNCL이란 기관을 설립하여 운영하고 있으며, 2019년 기준으로 인력 1,000명, 약 1조 원의 예산을 투입하여 220만 종류의 합성화합물을 확보하고 있다. 우리나라는 한국화학연구원 한국화합물은행을 통해 합성화합물을 확보하고 있으며 약 65만 종류의 화합물을 확보하여 국내 연구자들에게 제공하고 있다.
다. 국내 바이오 소재 관리 및 성과
‘제3차 국가생명연구자원 관리․활용 기본계획’에 따라 기존 274개의 소재자원은행을 동물, 식물, 미생물 등의 소재의 종류, 보존 및 유통의 방식, 관련 법률 및 규제 등을 기준으로 14개 분야의 소재 클러스터로 조성․육성이 진행되고 있다. 각 소재 클러스터는 책임부처를 지정하고, 책임부처 중심으로 클러스터 내 중앙은행-거점은행-협력센터로 구성된 협력 네트워크가 구축․운영될 계획이다.
[표 3-60] 14대 소재 클러스터별 발전목표 및 책임부처
소재 클러스터 발전 목표 책임부처 (클러스터 중앙은행) 인체유래물 질환 중심의 인체유래물 확보 및 바이오 헬스 산업 활용 촉진 복지부/질병청 (국립중앙인체자원은행) 줄기세포 줄기세포 개발 연구기관들과 연계하여 줄기세포 신속 확보․제공 복지부/질병청 (국가줄기세포은행) 병원체 다양한 병원체자원 확보를 통한 활용 촉진 및 네트워크 체계화 복지부/질병청 (국가병원체자원은행) 배양세포 세포주에서 오가노이드까지 공급 범위 확대 및 맞춤 서비스 보강 과기정통부 (한국세포주은행) 모델동물 초파리, 제브라피쉬, 마우스 등 모델동물 이어달리기 제공 ※ 실험동물 사용 최소화를 위해 동물 대체시험법 개발도 병행 과기정통부 ((재)KMPC/ 생명연 실험동물자원센터) 뇌 규제 개선을 통한 뇌 연구뇌연구자원의 확보 및 연구 저변 확대 과기정통부 (한국뇌연구원 한국뇌은행) 미생물 규제 개선, 인력 양성, 안전중복보존 등에 대한 공동대응 체계 구축 과기정통부 (생명연 KCTC/
농진청 미생물은행) 천연물 천연물 자원 관리 특화 모델 마련 및 종자 클러스터와 협력 추진 과기정통부 (생명연 천연물중앙은행) 합성화합물 공공-대학-민간(국내 제약사 등) 및 해외 등 개방형 협력 확대 과기정통부 (한국화합물은행) 축산 가축생명자원을 활용한 축산업 미래 발전 영역확보 농식품부/농진청 (가축유전자원센터) 종자 종자산업 육성을 위한 농업유전자원의 전략적 확보 및 활용 확대 농식품부/농진청 (농업유전자원센터) 해양생물 해양생명자원 확보 및 해양바이오뱅크를 통한 산업적 활용 확대 해수부 (국립해양생물자원관) 수산생물 수산 현장 중심 수산생명자원 확보 및 활용 강화 해수부 (국립수산과학원) 야생생물 야생생물의 다양성 보전과 지속가능한 활용 확대 환경부 (야생생물소재은행)
자료: 제3차 국가생명연구자원 관리
2021년 기준으로 국내 소재자원은행을 살펴보면, 총 237개가 운영되고 있으며, 농림축산식품부 121개, 과학기술정보통신부 46개, 보건복지부 26개, 환경부 22개, 해양수산부 21개, 식품의약품안전처 1개의 소재자원은행을 운영하고 있다.
[표 3-61] 부처별, 소재 분야별 소재자원은행 현황(2021)
|
|
과기정통부 |
농식품부 (농진청/산림청) |
복지부/ 질병청 |
환경부 |
해수부 |
식약처 |
합계 |
|
인체유래물 |
6 |
|
18 |
|
|
|
24 |
|
병원체 |
2 |
1 |
4 |
|
|
|
7 |
|
줄기세포 |
|
|
1 |
|
|
|
1 |
|
배양세포 |
1 |
|
|
|
|
|
1 |
|
모델동물 |
12 |
|
|
|
|
1 |
13 |
|
합성생물학 |
1 |
|
|
|
|
|
1 |
|
뇌 |
8 |
|
3 |
|
|
|
11 |
|
천연물 |
4 |
2(산림청) |
|
|
|
|
6 |
|
미생물 |
10 |
6(농진청) |
|
|
|
|
16 |
|
축산 |
|
12(농진청) |
|
|
|
|
12 |
|
종자 |
1 |
69(농진청) 31(산림청) |
|
|
|
|
101 |
|
해양생물 |
|
|
|
|
16 |
|
16 |
|
수산생물 |
|
|
|
|
5 |
|
5 |
|
야생생물 |
|
|
|
22 |
|
|
22 |
|
기타 |
1 |
|
|
|
|
1 |
1 |
|
총계 |
237 |
||||||
자료: 2021년도 국가생명연구자원 관리
2021년 초에 수행한 실태조사를 보면, 2020년에 바이오 소재와 데이터 분야에 1,535억 원(전년도 대비 12.6% 증가)의 정부 투자가 투입되었다. 바이오 소재의 확보 및 활용은 2020년 132만 9,819점의 소재가 신규로 확보되어 1,651만 6,055점의 누적으로 관리되고 있으며, 2020년에는 97만 9,643점이 분양되었다. 국내 237개 소재자원은행에서 바이오 소재를 분양받아 활용한 성과는 2020년 2,111편의 논문이 발표되었고, 476건(국내 385건, 국제 91건)의 특허등록이 있었다. 추가적으로 소재자원은행들은 바이오 연구 및 산업의 소재 활용을 촉진하기 위해 5,137건의 기술지원을 산업계(21.2%), 학계(18.6%), 연구계(53%)에 제공하였다.
라. 발전 과제
바이오 연구자들은 믿을 수 있는 품질의 바이오 소재가 분양되기를 희망하며 나아가 사후관리(배양 기술 등) 할 수 있도록 교육의 필요성에 대해서도 제안하고 있다. 또한, 단순히 바이오 소재만 제공하는 것이 아니라 연구 현장에서 필요로 하는 소재별 특성정보(메타․성능․효능․성분 등)의 제공이 필요한데 실제 소재자원은행이 제공하는 정보는 이와 괴리가 있다고 이야기하고 있다. 일부 규모가 있는 소재자원은행들은 연구자들의 의견을 청취해오고 있으나 대다수 소재자원은행들은 소재의 확보와 분양에만 집중하고 있는 경우가 많다. 따라서, 산․학․연․병의 다양한 수요자들의 의견을 지속적으로 청취하고, 수요자가 원하는 바이오 소재와 정보를 적시에 제공할 수 있는 인프라 구축과 정책이 필요한 상황이다.
바이오 소재는 연구 과정을 통하여 산출된 결과물로써 최종 산출물이면서, 연구 및 제품생산을 위한 중간재적 성격도 존재하는 양면적 특성을 가진다. 이에 일방통행 방식의 정책은 한계가 있으며 이로 인해 정책의 효과가 반감될 수 있다. 실제로 기존 바이오 소재 분야의 정책은 양적 확보 중심으로 추진되어 왔으나 ‘제3차 국가생명연구자원 관리․활용 기본계획’과 이를 이행하기 위한 과제인 ‘다부처 국가생명연구자원 선진화 사업’의 시작을 계기로 수요자 중심의 바이오 소재와 정보를 동시에 확보하여 제공하고 활용하는 방면으로 패러다임 전환이 추진되고 있다.
향후 ‘제3차 국가생명연구자원 관리․활용 기본계획’을 바탕으로 수요자가 원하는 바이오 소재를 우선적으로 확보할 수 있도록 바이오 소재 제공 인프라를 구축하고, 실물 정보와 함께 특성정보, 약물반응성 정보 등 부가정보가 제공될 예정이다. 또한 바이오 소재의 보존․관리․분양 등의 절차를 표준화하며, 국제수준(ISO)의 품질관리를 도입하는 등의 노력이 진행될 예정이다.
|
참고자료 |
-제3차 국가생명연구자원 관리․활용 기본계획(2020∼2025) 2020, 관계부처 합동.
-2021년도 국가생명연구자원 관리․활용 시행계획, 2021, 관계부처 합동.
-2020 생명연구자원 통계, 2021, 과학기술정보통신부.
-BioINdustry(글로벌 세포뱅킹(Cell Banking) 시장 현황 및 전망, 2018, 한국생명공학연구원 생명공학정책센터.
-Bio-Resources Insight 제8호, 2021, 한국생명공학연구원 국가생명공학정책센터.
-국내 생명연구자원 관리 현황 및 개선방향, 2020, 환경정책 28(4):91-112.
-한국뇌은행 네트워크, https://kbbn.kbri.re.kr/portal/page/main/home.
2. 바이오 데이터
가. 바이오 데이터의 개요
본 백서에서 바이오 데이터는 ‘바이오 연구개발 수행 과정에서 실시하는 각종 실험, 관찰, 조사 및 분석 등을 통하여 산출된 사실 자료로서 연구 결과의 검증에 필수적인 연구데이터’로 정의하였다.
바이오 데이터는 바이오경제의 핵심 자원으로서 바이오․헬스, 정밀의료, 신약개발, 동식물 육종 등의 다양한 분야에 활용됨에 따라서 그 중요도는 시간이 갈수록 증가하고 있다. 특히 기술의 발달에 따라 유전체 정보의 활용 분야는 무궁무진하다.
2000년대 초 인간 DNA 염기서열 전체를 해독한 인간 유전체 지도 초안이 발표되는 당시 한 명의 유전체 해독을 위해 10년이라는 기간과 3조 원의 비용이 소요되었지만, 이후 새롭게 등장한 차세대 유전체 서열결정(NGS) 기술과 급속한 기술 발달로 인해 지금은 사람 1명의 유전체(3GB)를 50만 원과 1주일이라는 짧은 시간만으로도 데이터를 생산할 수 있게 되었다.
이는 반도체 기술의 압도적인 성능 향상을 상징하는 무어의 법칙(Moore’s Law)을 능가하는 속도이다. 이처럼 바이오 빅데이터로부터 새로운 지식과 분야가 열리게 되면서 실험과 이론 중심의 바이오가 데이터가 중심이 되는 과학으로 패러다임이 변화하게 되었다.
나. 해외 동향
바이오 데이터 생산을 위한 새로운 기술의 개발과 인공지능 등의 활용 신기술 발달에 따라 축적된 빅데이터를 활용한 혁신 연구 방식이 주목을 받고 있다. 주요 선진국은 2000년대 후반부터 대규모 국제 프로젝트를 통해 데이터의 대량 생산과 대규모화를 진행하고 있다. 암 정복을 위해 미국 중심의 TCGA(The Cancer Genome Atlas) 프로젝트는 33개의 암종에 대해서 1만 1,000명의 환자로부터 멀티오믹스 및 임상정보를 생산하여 암 연구에 필수적인 데이터를 제공하고 있다.
정밀의료 구현을 위해서 10만 명 이상의 인간 유전체 프로젝트를 수행하는 나라가 2018년도에 이미 10개국을 넘었다. 대표적인 인간 유전체 프로젝트로 암 환자 및 유전성 희귀질환 환자들을 위한 새로운 진단법 및 치료법 개발을 위한 영국의 10만 명 유전체 프로젝트(100K Genomes Project)가 있다. 이 프로젝트는 2018년 12월 10만 명의 임상․유전체 데이터 21PB를 최종적으로 확보하여 완료하였으며 향후 몇 년 내에 500만 명으로 그 규모를 확대해 나갈 예정이다.
미국 역시 ‘All-of-Us’ 프로젝트를 통해서 100만 명의 임상․유전체 데이터를 확보하여 정밀의료를 구현해 나갈 예정이다. 또한 대규모 국제 생물학 프로젝트 역시 계속해서 진행 중이다. 대표적인 것은 지구상 모든 생물체의 유전체 염기서열을 분석하는 지구생물 총 유전체 프로젝트(EBP: Earth BioGenome Project), 지구 곳곳에 서식하는 2만 7,000개 이상의 미생물군 표본을 수집, 분석해 최초로 박테리아 참조 데이터를 만들기 위한 지구 미생물군 유전체 프로젝트’(The Earth Microbiome Project) 등이 있다. 다음은 주요 선진국에서 운영하는 바이오 데이터 센터들에 관한 내용이다.
(1) 미국
미국은 전 세계에서 가장 많은 대형 바이오 데이터 프로젝트를 수행하고 있으며 동시에 대표적인 바이오 데이터센터인 NCBI(National Center for Biotechnology Information)를 운영하고 있다.
NCBI는 1988년 미국 메릴랜드주에 설립되었으며 생정보학(Bioinformatics) 전담부서로 컴퓨터를 활용하여 생물학 및 의학 분야의 방대한 데이터를 분석하기 위한 DB를 구축하고 분석 도구를 개발하는 것이 주요 임무이다. NCBI에는 문헌, 임상정보, 발현체, 단백체, 유전체, 구조, 변이, 화합물 정보, 질병, 바이러스 등 35종의 바이오 데이터베이스가 있으며, 현재 약 30억 건의 데이터를 보유하고 있다. NCBI의 대표적인 유전체 데이터인 SRA(Sequence Read Archive)의 2021년 7월 현재 정보의 총량은 약 55PB(petabytes)이며 매년 약 두 배씩 데이터양이 증가하고 있다. 이러한 모든 데이터는 ‘Entrez’라는 데이터 검색 시스템을 통하여 통합 검색할 수 있는 기능을 제공한다.
또한, 미국 국립보건원(NIH)과 국립 과학재단(NSF) 등 연방기관들은 데이터 정책․규정을 마련하여 시행 중이다. NIH/NSF는 연간 50만 달러 이상의 연구 과제에 대해 데이터관리계획(DMP: Data Management Plan) 제출을 의무화하고 있으며, 2022년부터 모든 과제로 확대 시행할 예정이다. 이에 따라서 NIH는 생산되는 모든 데이터를 지정된 데이터 저장소에 제출하는 것을 제도화하고 있다.
(2) 유럽
유럽의 대표적인 바이오 데이터센터는 영국에 있는 EBI(European Bioinformatics Institute)이다. EBI는 발현체, 단백체, 유전체, 대사체, 이미지, 구조, 화합물 정보, 상호작용 등 39종을 보유하고 있다. EBI는 생명과학 분야의 데이터 저장, 관리, 활용을 위한 하드웨어 인프라 구축 및 운영을 ELIXIR를 통하여 운영하고 있으며, EBI는 ELIXIR를 통하여 273PB의 저장 공간과 4만 CPU 코아 이상의 인프라를 구축하여 데이터 저장, 관리, 활용 인프라로 서비스 중이다.
(3) 중국
중국은 최근 바이오 분야에 엄청난 규모의 투자를 통해서 빠른 속도로 선진국을 추격하고 있다. 2015년 설립된 NGDC(National Genome Data Center)는 유전체, 발현체, 상호작용, 후성유전체, 유전변이, 마이크로바이옴 등 24종의 데이터를 보유하고 있다. 2021년 7월 기준으로 3,848개 프로젝트, 24만 9,392개 샘플과 NGS 기반 유전체 데이터 9,227TB를 보유하고 있다. 또한, 전산인프라로 1.6GB 네트워크 대역폭, 8,000 CPU 코어, 250 TFLOPS(Tiloating Point Operations Per Second), 18PB의 저장 공간을 보유하고 있다.
(4) 일본
일본의 대표적인 데이터센터인 DDBJ(DNA Data Bank of Japan)는 일본국립유전학연구소(NIG: National Institute of Genetics) 산하기관으로 2021년 6월 기준으로 약 28억 건의 바이오 데이터를 보유하고 있다.
현재 DDBJ의 전산인프라는 30PB의 저장 공간, 1만 1,840CPU 코어 규모이다. DDBJ는 유럽 EBI, 미국 NCBI와 함께 국제염기서열 데이터베이스연합(INSDC: International Nucleotide Sequence Database Collaboration)을 구축하여 데이터 공유 및 등록 양식을 정하고 있으며, 이는 전 세계 바이오 연구자 및 분석 프로그램 개발자들에게 절대적인 영향력을 끼친다.
다. 국내 동향
국내에서는 바이오․헬스 R&D 분야에 정부의 지속적인 투자(2020년 3조 8,000억 원) 및 바이오 기술혁신에 따라 다양한 바이오 데이터가 생산되고 있다. 생산된 데이터의 수집, 활용을 위해 정부는 연구성과물 관리제도(과기정통부, 2012)를 마련하였으며, 생산된 데이터 수집․관리․활용을 담당할 전담기관으로 한국생명공학연구원 국가생명연구자원정보센터(KOBIC)을 지정하였다.
또한, 각 부처는 자체적으로 생산된 데이터의 수집 및 관리를 위해서 데이터센터를 구축하여 운영하고 있다. 다음 표는 2021년 기준으로 부처 데이터센터가 보유하고 있는 전산 하드웨어 구성과 데이터의 양을 나타낸다.
[표 3-62] 부처 바이오 데이터센터의 전산 하드웨어 및 데이터 양(2021년 기준)
|
부처 유전체정보센터 |
하드웨어 |
데이터 |
||
|
CPU 코어 |
총 메모리(GB) |
저장공간(TB) |
||
|
KOBIC(과기정통부) |
3,132 |
20,480 |
12,595 |
482TB |
|
CODA(보건복지부) |
46 |
364 |
685 |
214TB |
|
MAGIC(해수부) |
408 |
10,957 |
330 |
47TB |
|
NABIC(농식품부/농립청/산림청) |
302 |
9,216 |
1,229 |
45TB |
|
INGIC(산업부) |
16 |
32 |
172 |
56TB |
이러한 제도 및 전담기관 지정에도 불구하고, 국가 R&D 사업에서 생산된 데이터의 수집은 연구자들의 인식 부족 등으로 미흡한 실정으로 대부분 바이오 데이터는 기관, 사업단, 개인 연구자가 보관하며, 사업 종료 후 생산 데이터는 유실․사장되고 있다.
하지만, 일부 사업의 경우, 체계적인 데이터 확보, 관리 및 활용체계를 자체적으로 구축하여 생산된 데이터의 활용도를 높이기도 한다. 대표적인 사업이 ‘포스트게놈 다부처 유전체사업’(2014∼2021)이다. 이 사업에 참여하는 7개 부처청의 과제에서 생산되는 유전체 데이터는 각 부처 유전체센터에 수집되고, 이후 수요자 중심으로 최대한 활용될 수 있도록 국가생명연구자원정보센터(KOBIC)에 공유되는 체계를 구축하였다. 이를 통해 2021년 7월 현재, 185개 과제에서 생산된 362TB 데이터를 수집하였으며, 이를 국내 유전체 연구자들에게 제공하고 있다.
바이오 R&D에서 생산되는 모든 데이터의 체계적인 확보와 활용을 위한 문제를 해결하고자 정부는 2020년 ‘제3차 국가생명연구자원 관리․활용 기본계획(생명연구자원 빅데이터 구축 전략)’을 발표하였다. 3차 기본계획은 기존의 1차, 2차 생명연구자원 기본계획과 비교해서 바이오 데이터에 관한 내용이 신규로 추가되었다.

자료: 제3차 국가생명연구자원 관리․활용 기본계획(생명연구자원 빅데이터 구축 전략).
[그림 3-80] 1차, 2차 기본계획 성과 및 3차 기본계획
3차 기본계획에서는 범부처가 협력하여 부처․사업․연구자별 흩어져 있는 데이터를 통합 수집․제공하는 ‘국가 바이오 데이터 스테이션’(이하, 데이터 스테이션)을 구축하기로 하였다.
데이터 스테이션은 효율․전문․안정적 운영을 위해 범부처 바이오 연구데이터 통합 관리기관인 국가생명연구자원정보센터(생명연구자원법 제11조)와 한국과학기술정보연구원(KISTI) 등의 협력 체제로 구축할 예정이다(2021.10. 시범오픈). 데이터 스테이션에서 수집하려는 데이터는 정부 바이오 R&D를 통해 생산․활용되는 생화학분석, 이미지(영상), 임상 및 전임상, 유전체, 분자구조, 표현형 정보, 화학반응 등이다.

자료: 제3차 국가생명연구자원 관리․활용 기본계획(생명연구자원 빅데이터 구축 전략).
[그림 3-81] 데이터 스테이션 구축 및 데이터 흐름
데이터 스테이션은 범부처 R&D 과제지원 통합 시스템(IRIS)과 연동한 데이터 등록 시스템을 구축하여 연구자들의 데이터 등록 편의성 제고하고, ‘국가생명연구자원수집․관리표준지침’을 제정해 R&D 사업을 관리하며 부처별 사업 공고․협약․평가 시, 준수해야 할 연구데이터 관리 기준을 제시할 예정이다. 또한 연구자들의 편의성을 제고하기 위해 개인 저장공간(마이 랩 데이터), 데이터 분석 플랫폼 등 개발․지원 및 데이터 활용 기반 R&D 지원 등을 확대할 예정이다. 이를 통해서 2025년까지 약 30PB 바이오 데이터와 40%의 데이터 활용률의 목표를 달성하고자 한다.
또한, 정부는 2020년에 바이오 데이터 공유를 위해서 바이오 데이터 표준 양식 51종을 마련하였다. 이를 위해서 생명공학육성 기본계획을 준용하여 바이오 연구를 바이오․헬스(Red Bio), 식량․자원(Green Bio), 환경․에너지(White Bio) 3대 분야의 15대 바이오 분야로 구분하였다.
그리고 분야별로 각 부처에서 추천받은 국내 전문가들로 작업반을 구성하였다. 작업반에 참가한 국내 바이오 전문가는 총 123명이며, 작업반을 통해서 분야 공통 7건 및 연구 분야별 44건을 포함해서 총 51건 표준 등록양식을 마련하였다. 이렇게 마련된 표준 등록양식은 데이터 스테이션에서 구현되어 연구자들이 생산한 데이터를 등록하는데 사용할 예정이다.
다음의 표는 2020년 마련된 바이오 데이터 표준 등록양식이며, 향후 바이오 기술 발달에 따라 신규 데이터를 발굴하거나 기존 데이터를 지속해서 갱신할 예정이다.
[표 3-63] 바이오 데이터 표준 등록양식
|
분야(51) |
최종 마련 등록 양식 |
|
|
데이터 종류 |
||
|
분야 공통(7) |
프로젝트 정보, 샘플 정보, NGS유전체, 마이크로어레이, 염기서열, 대사체, 단백체 |
|
|
Red |
신약(8) |
독성 시험 데이터, 항암약물의 임상 효능 데이터, 화합물 구조 정보 데이터, 화합물 약효 평가 데이터, 화합물 profiling 데이터, 기허가약제 repositioning 연구 정보 데이터, IND(신약임상시험신청) 데이터, 바이오마커 데이터 |
|
의료기기(8) |
의료기기 기본정보, 체외진단기기 데이터, 의료영상(MRI), 의료영상(PET), 의료영상(CT), 의료영상(초음파), 의료기기 생체재료 데이터, 생체신호 측정장치 데이터 |
|
|
뇌과학(8) |
뇌영상(MRI/fMRI), 뇌영상(PET), 뇌전도(EEG), 두 개강내, 뇌파(iEEG), 뇌자기도(MEG), 뇌 광학현미경 이미지, 뇌 전자현미경 이미지, 동물생체신호 |
|
|
혁신형 융복합(1) |
화합물 활성 데이터 |
|
|
보건(1) |
보건(질병 예방) 연구 분야 데이터(보건연구과제 정보 및 보건데이터 정보) |
|
|
Green |
종자/가축(4) |
가축 분야 특성정보, 수산 분야 특성정보, 작물 분야 특성정보, 수목(야생식물) 분야 특성정보 |
|
지능형 농업(2) |
시설원예 분야 데이터(환경데이터 및 작목별 생육/생산량 데이터), 축산 분야 데이터 (돼지 모돈사 환경/사양/생산성 데이터 및 젖소 생체/번식 데이터) |
|
|
해양수산(4) |
수산 양식 데이터, 수산 질병 데이터, 수산 먹이사료 데이터, 수산 사료 데이터 |
|
|
식품(4) |
식품 샘플, 식품 성분, 식품 기능성, 식품 가공 |
|
|
동식물 치료제(2) |
동물줄기세포, 농약 정보(생물농약 및 화학농약) |
|
|
White |
환경 바이오(2) |
DNA PCR 증폭을 위한 프라이머 염기서열 정보, 곤충 분포 정보 |
라. 발전 과제
우리나라는 바이오 데이터 인프라 및 연구․활용 분야에서는 후발 주자이다. 이러한 우리의 현실과 바이오 데이터 분야의 새로운 흐름에 국가적으로 어떤 준비를 해야 하는지 생각해 볼 필요가 있다.
우선 가장 시급한 것은 빅데이터를 저장하고 분석할 수 있는 전산인프라 구축과 해석 기술 개발이다. 일반적으로 사람 한 명의 유전체 정보량은 약 250GB이며, 1만 명이면 2.5PB라는 방대한 데이터가 생산된다. 이런 규모의 유전체 정보를 개인 연구자의 실험실에서 분석하는 것은 거의 불가능하다. 따라서 바이오 데이터의 효과적인 분석과 활용을 위해서는 국가 차원의 바이오 전용 전산 하드웨어 인프라를 구축하고 해석 기술을 개발하여 연구자들이 쉽게 사용할 수 있도록 제공하여야 한다.
또한 바이오 데이터 분야의 기술력과 심각한 전문 인력 부족을 개선하여야 한다. 바이오 데이터의 생산․공유, 분석, 인공지능을 이용한 응용, 정밀의료, 신약개발, 동식물 육종 등 분야별로 독자적인 기술력을 갖춰야 한다. 데이터 선진국의 기술을 따라가서는 우리는 영원히 바이오 분야의 선진국이 될 수 없기 때문이다. IT와 BT 기술을 가진 바이오 데이터 전문가 양성을 위해서 장기적인 대규모 투자가 꾸준히 이루어져야 한다.
바이오 데이터 특히 인체 유래 빅데이터 공유와 활용을 막고 있는 엄격한 개인정보 보호법 등의 국내 규제법들을 국제적인 표준에 따라 개방하여야 한다. 국내 바이오 빅데이터 활용에 대두된 문제점(제도 개선, 정보 공유 및 개방 등)들을 지혜롭게 풀기 위해서는 데이터 공유 주체인 정부․연구자․병원․기업․개인의 지속적인 논의를 통해 합의점을 찾아야 한다.
빅데이터 시대에 데이터가 병원, 연구소, 학교 등에 흩어져 있으면 활용에 한계가 있으므로, 한곳에 모이고 체계적으로 관리되어야 비로소 빅데이터로 능력을 발휘하게 된다. 그러기 위해서는 국내 연구자들이 자발적으로 자신의 데이터를 공유하는 문화가 확산하여야 하며, 국가적으로 이러한 데이터를 모으고 공유할 수 있는 기반 제공이 중요하다. 이를 위해서 데이터 스테이션을 중심으로 범부처적 바이오 데이터의 수집․공유․활용을 총괄할 체계를 구축하고 바이오 데이터 생태계를 조성하여 새로운 가치를 창출할 수 있어야 한다.
|
참고자료 |
-관계부처 합동(2017), 제3차 생명공학육성기본계획.
-관계부처 합동(2020), 제3차 국가생명연구자원 관리․활용 기본계획(’20∼’25).
-신수용 (2018) 유전체 데이터 국제 표준화 동향, 한국바이오협회, Bio Economy Report 8호.
-이세민 (2019) 국내외 바이오 빅데이터 현황 및 활용 방안, BioINpro Vol.59.
-이병욱 (2020) 바이오 연구데이터 현황과 활용방안, BioINpro 제74호.
-이병욱 (2019) 유전체 빅데이터 현황과 활용방안, BioINpro Vo.59.
-최명석 (2017) 국내 과학기술분야 연구기관의 과학데이터 관리 현황, 한국콘텐츠학회, 12호 117-126.
-황혜경 (2004) 오픈액세스기반 지식정보저장소 구축에 관한 연구, 한국비블리아, 15호 91-116.
-Stephens ZD, Lee SY, Faghri F, Campbell RH, Zhai C, Efron MJ, et al. (2015) Big Data: Astronomical or Genomical?, PLoS Biol, 13(7):e1002195.
-Eric W Sayers, Jeffrey Beck, Evan E Bolton, et al. (2021) Database resources of the National Center for Biotechnology Information, Nucleic Acids Research, Volume 49, Issue D1, Pages D10–D17.
-CNCB-NGDC Members and Partners (2021) Database Resources of the National Genomics Data Center, China National Center for Bioinformation in 2021, Nucleic Acids Research, Volume 49, Issue D1, Pages D18–D28.
-Gaia Cantelli, Guy Cochrane, Cath Brooksbank, Ellen McDonagh, Paul Flicek, et al. (2021) The European Bioinformatics Institute: empowering cooperation in response to a global health crisis, Nucleic Acids Research, Volume 49, Issue D1, Pages D29–D37.
-Asami Fukuda, Yuichi Kodama, Jun Mashima, Takatomo Fujisawa, Osamu Ogasawara (2021) DDBJ update: streamlining submission and access of human data, Nucleic Acids Research, Volume 49, Issue D1, Pages D71–D75.

가. 개요
바이오․헬스 산업은 고령화와 건강에 대한 관심 증대로 빠른 성장세를 보이는 미래 유망산업이며, 높은 성장에 대한 기대감으로 민간 투자도 활발히 진행되고 있는 분야이다.78) 따라서 정부는 바이오․헬스산업을 집중 육성하기 위해, 관계부처 합동 ‘바이오․헬스산업 혁신전략(2019.5.)’ 수립을 통해 BIG3 산업으로 지정하였다. 그리하여 2030년까지 혁신신약․의료기기 세계시장 점유율 3배 확대, 바이오․헬스 산업을 5대 수출 주력산업으로 육성, 신규 일자리 30만 명 창출 등을 위한 규제개선 등의 과제들을 시행 중에 있다.
바이오․헬스 산업의 근간이 되고 있는 생명공학 분야의 경쟁력을 강화하기 위해서는 핵심기술 개발뿐만 아니라 산업에 대한 경쟁력 확보에 징검다리 역할을 할 수 있는 다양한 분야의 생명공학 인프라 확충 및 내실화가 매우 중요하다. 특히 생명공학 제품의 고부가가치화, 안전성 확보, 인류의 건강 등에 대한 이슈가 더욱 중요해지면서, 생명공학 인프라는 실용화 기술개발 및 산업화에 필요한 강건한 뼈대 역할을 해주기 때문이다.
정부는 바이오․헬스산업 혁신전략 발표를 통해 기업의 투자가 성과로 연결되는 사업화․시장진출 정책 보완으로 민간 투자의 효과성 극대화, 개별 기업의 투자로 해소가 곤란한 분야에 정부 역량을 집중하여 ‘기업 투자 성공’- ‘산업 전체 성장’ 선순환 체계 구축 등을 기본 방향으로 설정하였다.
이후 ‘바이오․헬스산업 사업화 촉진전략(2020.11.)’을 통해 소부장 자급화, 제조․유통 프로세스 고도화로 생산 효율성 증대를 위한 바이오 소부장 생산 및 유통구조 고도화, 연구개발 → 인․허가 → 생산으로 이어지는 산업 가치사슬 단계별 전문 인력 공급으로 기업 성장 기반 강화를 위한 가치사슬 단계별 인력양성 지원, 첨단 기술을 이용한 신약 개발 리스크 완화와 공용 생산시설 구축으로 투자의 효율성 증대를 위한 사업화 리스크 완화 등을 중점 추진 과제로 설정하였다. 또한 전 세계 바이오․헬스 시장이 개인 맞춤형 치료기술 중심으로 발전해 가고 있음에 따라 의료기술 혁신의 핵심기반이 ‘데이터’라는 인식 아래, 바이오․헬스 빅데이터 플랫폼 구축, 데이터 중심병원 등을 매우 강조하고 있는 실정이다.
생명공학 분야 실용화기술개발 단계의 세부과정은 ① 순수연구 및 독창적․창의적 ‘기초연구(basic research)’ 과정, ② 개발가능성 확보 및 효능확인의 ‘응용연구(applied research)’ 과정, ③ prototype 및 시제품 제작의 ‘개발(development)’ 과정, ④ 대량생산의 가능성 확보 및 제품성능평가의 ‘시생산(pilot-plant)’ 과정, ⑤ 대량생산 및 품질관리의 ‘산업화(manufacturing)’ 과정 등으로 세분화할 수 있다. 바이오․헬스산업은개발과정 → 시생산과정 → 산업화과정 등을 수행하면서 개발될 제품(의약품 및 식품 등)을 최종적으로 인체에 적용하기 위하여 체내 안전성․유효성 등에 대한 신뢰성평가(비임상 GLP, 임상 GCP, 우수제조기준 GMP 등)를 필수적으로 수행하면서 객관적인 성능에 대한 검증을 받아야 한다는 특성이 있다.
또한 전체 연구과정에 필요한 데이터 플랫폼 활용(개인건강정보 및 환자질병정보 등 바이오빅데이터, 데이터중심병원, 신약후보물질 및 바이오특허 빅데이터 등)이 적절히 접목되어야 한다. 이러한 생물산업의 실용화기술개발 단계의 ‘R&D 기능’을 전-후, 좌-우, 상-하에서 적기에 지원해주는 기술하부구조인 ‘인프라구조’의 효율적인 체계 구축은 바이오․헬스산업의 지속가능한 성장을 촉진시키는 필수요인이 된다.
생명공학 인프라 분야와 관련하여 첫째, 실용화기술개발의 ‘응용연구’ 과정까지는 주로 한국생명공학연구원, 한국화학연구원, 한국식품연구원, 한국한의약연구원, 한국기초과학지원연구원, 한국표준과학연구원, 한국과학기술연구원, 한국전자통신연구원 등의 정부출연연구기관과 정부에서 지원하는 연구소재은행 및 한국세포주은행(과학기술정보통신부), 줄기세포․재생연구센터(보건복지부) 등을 중심으로 R&D 인프라가 구축․운영되고 있다.
둘째, ‘응용연구’ 과정 이후부터는 산업화에 특화된 지원을 위해 산업통상자원부를 중심으로 R&D 및 시제품 제작․생산에 필요한 고가의 시설․장비, 관련 기업의 창업∼성장 단계별 지원을 위한 인프라인 산학연공동연구기반구축센터, 바이오벤처기업지원센터(BVC: Bio Venture Center), 지역특화센터, 한국바이오협회 코리아바이오허브센터(Korea Bio-Hub Center) 등과 우수의약품 제조기준(cGMP)에 맞는 한국생산기술연구원의 생물산업기술실용화센터(KBCC) 등이 구축․운영되고 있고, 국제적 수준의 백신 GMP 제조시설로 동물세포실증지원센터(경북 안동), 미생물실증지원센터(전남 화순)를 통해 제품개발․생산 대행(CDMO: Contract Development & Manufacturing Organization)을 추진하고 있다.
셋째, 생물산업(의약품 등) 제품의 신뢰성 평가에 특화된 인프라는 안전성평가연구소(KIT)를 포함하여 식품의약품안전처에서 지정된 비임상시험(GLP) 기관과 임상시험(GLP) 기관이 구축․운영되고 있다. 또한 의약품 개발 R&D 비용 중 2/3 정도의 비용이 (비)임상시험 비용 등에 소요되고 있고, 그 중 30% 이상이 전문연구용역기관(CRO)에서 사용되는 것으로 추정되고 있다. 특히 CRO의 주요 성장기반이 되는 제약분야가 지속적으로 확대됨79)에 따라, 바이오산업 글로벌 진출을 위한 CRO 육성의 중요성이 어느 때 보다도 강조되고 있다. 이는 기업 입장에서는 의약품 개발 과정에서 소요되는 비용절감을, CRO 회사 입장에서는 수익창출로 서로에게 이익이 될 수 있기 때문이다.
넷째, 최근에는 바이오데이터 플랫폼의 중요성이 강조되면서 병원-기업-연구소가 연계되어 개인건강정보(PHR: Personal Health Record)를 활용한 데이터 플랫폼 구축 및 활용․실증, 환자의 질병정보를 활용한 CDM(Common Data Model) 기반 정밀의료데이터 통합플랫폼 구축 및 활용․실증, 환자의 영상진단 정보를 활용한 AI기반 의료기기 탑재용 영상분석 솔루션 개발에 대한 실증 연구체계를 빠르게 구축하고 있다.
[표 3-64] 실용화기술개발 단계별 생물산업 관련 주요 인프라 현황
|
인프라단계 |
세부구분 |
인프라기관 |
주요역할 |
|
Research
(기초연구 및 응용연구) |
의약바이오
|
한국한의약연구원 한국표준과학연구원 한국과학기술연구원 |
한의학표준화기반 연구 바이오분야 측정표준 연구 표적지향형 신규항암제 후보물질 연구 |
|
산업/그린/ 융합바이오
|
한국생명공학연구원 한국생명공학연구원 한국생명공학연구원 한국생명공학연구원 한국식품연구원 한국화학연구원 한국전자통신연구원 한국과학기술연구원 한국뇌연구원 |
바이오제품 안전성평가 및 정보관리 국가영장류센터 운영 바이오융합 연구 국가생물자원정보 관리 식품기능성 및 신소재․신공정 연구 화학기술분야 연구 및 성과 보급 유비쿼터스건강관리모듈/시스템개발 실시간분자영상 스마트센서기술 개발 뇌손상기전 등 다학제융합기술 기반 뇌연구 |
|
|
종합분야
|
한국기초과학지원연구원 한국세포주은행 한국생명공학연구원 한국생명공학연구원 |
고가의 바이오 연구기자재 활용 미생물 및 세포주은행(관리 및 공급) 해외생물소재(식물) 허브센터 국가생명공학정책연구 및 확산 |
|
|
Development Pilot-plant Manufacturing
(개발, 시생산 및 산업화)
|
산기반 공동장비/연구지원
|
경기바이오센터 등 5개 한국식품연구원 한국화학연구원 한국화학연구원 부산대학교 항노화센터 |
산학연공동연구기반구축 건강기능식품플랫폼 신약개발플랫폼, 바이오화학실용화 Drug Repositioning 연구지원 항노화산업 제품화 연구지원 |
|
벤처기업지원 |
한국생명공학연구원 등 9개 |
바이오벤처기업지원센터(TIC를 포함 BVC) 구축 |
|
|
지역 클러스터
|
대전테크노파크 등 22개 (지원기반정비 13개 별도)
|
지역특화산업 분야 혁신역량 제고 (시설․장비지원, 기술지원, 교육훈련, 시생산(Pilot plant, GMP 등) 및 공인검사지원 등 수행) |
|
|
종합분야
|
한국생산기술연구원 한국생명공학연구원 한국바이오협회 순창군 장류사업소 경북바이오산업연구원 전남생물산업진흥재단 |
생물산업기술실용화센터건립(cGMP) 바이오안전성정보센터(LMO관련) 코리아바이오허브구축(Networking) 발효미생물종합활용센터건립(전통식품) 동물세포실증지원센터(백신GMP, CDMO) 미생물실증지원센터(백신GMP, CDMO) |
|
|
GLP(비임상) GCP(임상)
(신뢰성평가) |
GLP(비임상)
|
식약처 지정 GLP 23개 (안전성평가연구소 등) |
비임상 시험항목별 허가기관(’21.6.)
|
|
GCP(임상) |
식약처 지정 GCP 198개 |
임상1상, 임상2상, 임상3상 허가기관(’21.6.) |
|
|
바이오빅데이터 (데이터플랫폼)
|
PHR (Personal Health Record)
|
서울대학교 병원(표준/가이드라인) 라이프시맨틱스(플랫폼) 디케이아이테크놀로지(플랫폼) |
* 실증체계 구축 : 유비플러스, 비트컴퓨터, 피플앤드테크놀러지, 하이디어솔루션즈, 두브레인, 헬스맥스, 휴레이포지티브, 미디어젠, 소프트넷, 브이티더블유 및 다수병원 |
|
CDM(EMR의 Common Data Model)
|
분당서울대병원, 서울아산병원, 아주대학교병원(통합데이터 구축 및 플랫폼 고도화) 서울삼성병원(표준/가이드라인) |
* 실증체계 구축 : 엠투아이티, 셀바스에이아이, 씨앤텍시스템즈, 파미니티, 휴레이포지티브 및 다수병원
|
|
|
AI기반 의료기기 탑재용 영상분석 솔루션
|
한국산업기술시험원(데이터셋), 경북대학교(영상진단), 서울대학교(영상분석), 대구테크노파크(온오프라인 플랫폼) |
* 솔루션 활용 : 길의료재단, 국립암센터, 삼성서울병원, 뷰웍스, 인피니트헬스케어, 제노레이 등 다수 병원 및 기업
|
* 의약바이오: 바이오신약, 바이오장기 등 바이오기술을 보건의료 분야에 응용한 것
* 산업/그린바이오: 건강기능식품, 바이오매스, 바이오플라스틱 등 바이오기술을 농축산, 식품, 바이오플라스틱, 바이오연료 등에 응용한 것
* 융합바이오: 바이오공정, 바이오환경, 바이오에너지 등 바이오기술을 산업공정/생산 및 환경 분야에 응용한 것
* BVC : 바이오벤처기업지원센터(Bio Venture Center), 전국 바이오벤처기업지원센터간 협력네트워크 및 전략적 연계운영시스템 구축을 통한 효율적 기업지원시스템 구축, 바이오산업의 지역별 균형발전을 도모하기 위해 설립․운영(지역대학 중심으로 지원한 TIC(Technology Innovation Center) 포함
* 지역클러스터(지역특화센터): 지역특화산업 분야의 혁신역량을 제고하기 위하여 지역 내 설치 운영되는 센터이며, 지역의 기획 및 기술개발역량의 중재자 기능을 수행
* 산기반 공동장비/연구지원: 산업부 산업기술기반조성/산업핵심기술개발 등으로 지원된 인프라
나. 현황
(1) 기초
기초․응용연구 단계 인프라는 기초이론 및 실험, 실용 목적의 아이디어 특허 등 개념 정립, 연구실 규모의 기본 성능 검증, 연구실 규모의 부품 및 시스템 핵심 성능 평가 등을 지원하는 인프라에 해당되며, 주로 국책연구원을 중심으로 인프라가 형성되어 기술개발을 지원하고 있다.
특히 기초․응용연구 단계에서 가장 큰 비중을 차지하는 한국생명공학연구원은 바이오제품 안전성평가 및 정보관리, 국가영장류센터 운영, 바이오융합 연구, 해외생물소재 허브센터 운영, 국가생명공학정책연구 및 확산 등의 기능을 담당하고 있고, 한국식품연구원은 식품 기능성 및 신소재․신공정 연구를 담당하고 있고, 한국화학연구원은 바이오분야를 포함한 화학기술분야 연구 및 성과보급을 담당하고 있고, 한국과학기술연구원은 표적지향형 신규 항암제 후보물질 연구, 실시간 분자영상 스마트센서 기술 연구 등의 기능을 담당하고 있으며, 한국뇌연구원은 뇌손상기전 등 다학제적인 융합기술기반의 뇌연구를 담당하고 있고, 기타 한국한의약연구원의 한의학표준화연구, 한국전자통신연구원의 유비쿼터스 건강관리시스템 연구 등도 중요한 인프라 기능을 담당하고 있다.
또한 기초․응용연구 환경에 종합적으로 필요한 2개의 추가 핵심 인프라는 분석 기능을 지원하고 있는 한국기초과학지원연구원과 연구개발 검증에 필요한 세포주를 지원하고 있는 한국세포주은행을 꼽을 수 있다. 한국기초과학연구원은 1988년 기초과학 진흥을 위한 연구지원 및 공동연구 수행을 목적으로 설립되어 국가적 대형 공동연구장비 개발․설치․운영, 첨단 연구장비 이용자 교육, 범국가적 연구장비 정보수집․분석 등의 기능을 담당하고 있다. 2021년 6월 현재 대전 본원 및 8개 센터(오창, 서울, 부산, 대구, 광주, 전주, 춘천, 서울서부)에 총 392명의 인력 및 632점의 지원 장비(BT, NT, ET 분야로 구분하여 분석포털시스템(USE-KBSI)을 통해 인프라 지원 중)를 보유하고 있다. 한국세포주은행은 1982년 전국의 연구기관에 필요한 세포주 개발․공급을 목적으로 설립되어 세포주 자원에 관련 정보 수집․보존․공급, 세포주 관련 각종 교육․연수․학술회의 실시, 특허출원 세포주의 기탁 및 보존 등의 기능을 담당하고 있다. 아울러 세포주 품질관리에 필요한 각종 실험기자재 및 실험 보조장치를 확보하고 있다. 1993년 UN 산하 세계지적재산권기구로부터 특허미생물의 국제기탁기관의 지위를 취득하였고, 세포주 분양업무 시작 이후 2015년까지 국내외 연구기관 3만 7,312여 연구과제에 7만 3,000여 바이알의 세포주를 분양해 왔다.
(2) 개발
개발․시생산 및 산업화 단계 인프라는 기초단계 이후의 효능검증 연구․확인, 확정된 부품․시스템의 시작품 제작․평가, pilot 규모의 시작품 제작 및 성능 평가 등을 지원하는 인프라에 해당되며, 대부분 산업통상자원부 지원 기관을 중심으로 인프라가 형성되어 의약바이오, 산업바이오, 융합바이오 분야의 산업화를 지원하고 있다.
산업화 지원 인프라는 기본적으로 기업성장 단계별 지원(창업보육 등), 시설․장비구축․활용, 교육훈련, 정보교류, 기술지도 등을 담당하고 있다. 인프라 구축 형태로 크게 구분하면, ① 생물산업실용화기반(cGMP, 발효미생물활용센터), 백신 GMP 제조시설(동물세포실증지원센터, 미생물실증지원센터), ② 바이오안전성정보 및 바이오분야국제협약운영기반(LMO), ③ 연계협력기반(Korea Bio-Hub), ④ 산업기술기반조성(BVC, 산학연공동연구기반, 플랫폼센터, DR센터), ⑤ 지역클러스터(지역특화센터) 등으로 구분될 수 있으며, 국내 생물산업의 여건 및 경쟁력을 고려하여 산업통상자원부 중심으로 전략적으로 구축되었다.
생물산업실용화기반 부분을 살펴보면, 1998년 국내 생물의약 분야의 성장에도 불구하고 미국 FDA의 인증을 받은 우수의약품제조 및 품질관리기준인 cGMP80)기준의 생산공장이 전무한 실정이다. 이를 감안하여 선진국 수출지원 등을 위해 미국 FDA와 유럽 EMA가 요구하는 기술적 사항을 종합적으로 반영하여 국제적으로 인정된 기준에 맞는 생물의약품 전문생산시설(생물산업기술실용화센터 KBCC(1998∼2007)81))가 구축되었으며, 2007년 국내 발효식품산업 육성을 위해 전통발효식품(고추장, 된장 등)의 안전성 확보 및 발효미생물자원의 허브 구축을 위하여 발효미생물종합활용센터(2007∼2010)82)이 구축되었다.
바이오안전성기반 부분을 살펴보면, 2002년 LMO(유전자변형생물체)를 중심으로 대두된 국제무역질서에 대응의 일환으로 의무사항․교육․홍보 등을 위하여 바이오안전성정보센터(2002∼ ), 바이오분야국제협약운영센터(2008∼ ), 바이오안전성평가관리사업(2008∼ ) 등이 구축되었다. 연계협력기반 강화 측면에서는, 국내외 바이오네트워크 구축․활성화 및 웹포털 구축․운영을 통한 각종 협업기관 지원을 위하여 코리아바이오허브센터(2004∼ )가 구축되었다.
또한, 산업기술기반조성 및 지역클러스터 부분을 살펴보면 수도권을 포함한 각 지역 소재 중소 바이오벤처기업 등의 특성화 지원 및 현장밀착형 지원을 위해 산업정책 차원에서의 바이오벤처기업지원센터(BVC, 1998∼2007)83)와 산학연공동연구기반구축(2004∼2011)84), 지역균형발전 차원에서의 지역 바이오클러스터(지역특화센터, 2002∼2012)85), 건강식품개발 및 신약개발을 위한 플랫폼구축(2009∼2014), Drug Repositioning 기술을 이용한 신약개발 활용 시스템 구축(2010∼2015), 바이오화학실용화센터 구축(2010∼2014)86), 지역산업 육성을 위한 융복합연구지원(2012∼2015) 및 항노화제품개발 인프라(2011∼2015)87) 등이 구축되었다.
(가) 산업화 지원 인프라 현황
산업화 지원 인프라는 국비지원 종료 후 대부분 운영 자립화 단계에 있으며, 지역 내외의 산학연 고객 수요, 정부/지자체 등 (비)R&D 자금 수주 등을 통해 전국적으로 생물산업 제품의 산업화를 직간접적으로 지원하고 있고, 2021년 현재까지 2017년 말의 규모로 큰 변동 없이 지속적으로 유지되고 있다. 2017년까지 지급한 국비지원금은 29개 기관, 60개 과제(2단계 13개 포함)에 총 6,279억 3,100만 원이며, 60개 과제는 cGMP 1개, LMO 3개, 산기반 3개, 네트워킹 1개, 발효산업 1개, BVC 9개, 지역특화센터 36개(2단계 13개 포함), 산업핵심 및 산기반 인프라 7개로 구성되어 있다.
광역경제권역별 정부 지원금액(지원과제 수 포함) 비중을 보면, 호남권 23%(1,441억 원, 14개), 충청권 22.7%(1,428억 원, 16개), 수도권 19.5%(1,226억 원, 4개), 대경권 10.07%(631억 원, 9개), 동남권 8.8%(555억 원, 9개), 강원권 8.1%(511억 원, 5개), 제주권 7.8%(487억 원, 3개) 순으로 지원되었다. 지원분야별 지원금액(지원과제 수 포함) 비중을 보면, 산업/그린바이오 분야 52.7%(3,310억 원, 36개), 의약바이오 분야 33.8%(2,121억 원, 15개), 복합지원(의약/산업/그린) 분야 8.8%(552억 원, 5개), 융합바이오 분야 4.7%(296억 원, 4개) 등이다.
60개 지원과제별 지원서비스 분야별 현황(2개 이상 지원 역할 포함)을 보면, pilot plant 지원이 70.0%(42개), GMP 지원이 56.7%(34개), 공인인증검사(식품위생검사 등 포함)가 45.0%(27개), 기타(연구지원, 정보제공 등)가 20.0%(12개) 등이다. 주로 생물산업 제품화 지원을 위한 시제품생산 및 공인시험 인증지원에 큰 비중을 두고 있음을 알 수 있다.

[그림 3-82] 광역경제권역별 산업화 인프라 지원 현황( ∼2020)

[그림 3-83] 지원분야별 산업화 인프라 지원 현황(∼2020)
나) 백신 특화 인프라 현황
백신 특화 인프라는 경북바이오산업연구원(안동), 전남생물산업진흥재단(화순)에 위치하고 있으며, 국제적 수준의 백신 GMP 제조시설 및 장비를 갖춘 개발․생산 대행기관(CDMO)을 구축․운영을 통해 국내 백신산업을 육성하고, 기업들의 세계시장 진출을 지원하고 있다.
동물세포실증지원센터는 경북 안동에 위치하고 있으며, 동물세포와 바이러스를 이용하여 제조하는 백신개발 생산시스템 구축을 위해(예로 독감백신, 수두백신 등), 총 1,029억 원(국비 695억 원, 지방비 334억 원)을 투자하여 4,200L, 1,000L 생산라인, BSL-3(Bio Safety Level-3) 생산라인, 완제생산라인 등을 구축하였다.
미생물실증지원센터는 전남 화순에 위치하고 있으며, 병원성 세균, 대장균, 효모 등 미생물을 이용하여 제조하는 백신개발 생산시스템 구축을 위해(예로 폐렴백신, 자궁경부암백신 등), 총 836억 원(국비 549억 원, 지방비 287억 원)을 투자하여 50L, 200L, 1,000L 생산라인, BSL-3 배양시설, 완제생산라인 등을 구축하였다.
동물세포실증지원센터는 2020년 10월부터, 미생물실증지원센터는 2020년 6월부터 파일럿 규모(50L) 비임상시료 생산 및 공정개발을 지원하고 있으며, 2020년 10월까지, COVID-19 백신개발 기업 4개사와 생산 MOU․계약 체결을 추진한 상태이다. 동물세포실증지원센터는 (주)스마젠과 임상용 시료 위탁생산 MOU 체결 및 바이러스전달체 백신 관련 업무 위․수탁기본계약을 체결하였고, (주)셀리드와는 바이러스전달체 백신 관련 공정개발, 제품생산 MOU를 체결하였다.
미생물실증지원센터는 (주)아이진과 비임상 및 임상시료 생산 계약을 체결하였고, (주)제넥신과는 DNA 백신 및 바이러스전달체 백신에 대한 MOU를 체결하였다. 향후 장비 구축 일정에 따라 2021년 하반기부터 임상시료 생산 등 본격 지원이 기대되고 있다.
[표 3-65] 동물세포실증지원센터 vs 미생물실증지원센터 인프라
|
구분 |
내용 |
용도 |
구분 |
내용 |
용도 |
||
|
동물 세포 실증 지원 센터 (안동) |
GMP 생산 시설 |
200L |
200L 부착세포 배양 및 정제 시스템 |
미생물 실증 지원 센터 (화순) |
GMP 생산 시설 |
50L |
50L 발효기 및 정제 시스템 |
|
200L |
50L, 200L 부유세포 배양 및 정제 시스템 |
200L |
50L, 200L 발효기 및 정제 시스템 |
||||
|
1,000L |
50L, 200L, 1,000L 부유세포 배양 및 정제 시스템 |
||||||
|
1,000L |
50L(x1대), 500L(x2대) 발효기 및 정제 시스템 |
||||||
|
BSL-3 (200L) |
50L, 200L 부유세포 배양 및 정제 시스템 |
||||||
|
BSL-3 (200L) |
50L, 200L 발효기 |
||||||
|
완제 (바이알) |
바이알 충전시스템 (12,000 바이알/hr)(동결건조 포함) |
||||||
|
완제 (바이알) |
5,000 바이알/hr (동결건조 포함) |
||||||
|
완제 (시린지) |
프리필드시린지 충전시스템 (10,000 시린지/hr) |
||||||
|
공정개발 시설 |
50L pilot scale |
공정개발 시설 |
50L pilot scale |
||||
[표 3-66] 생명공학분야 산업화 지원 인프라 현황(2021.6.말 현재, 지속적으로 유지 중)
|
광역 경제권 |
특화분야 |
사업구분 |
과제명(사업기간) / 지원기능 |
주관기관(URL) |
정부지원금 (~'17)(억원) |
|
수도권 |
복합지원 (의약/산업/그린) |
네트워킹 |
코리아바이오허브구축(’04-)/[기타-연구장비] |
한국바이오협회 www.koreabio.org |
237.8 |
|
의약바이오 |
cGMP |
생물산업기술실용화센터건립(’98~’07)/[GMP] |
(주)바이넥스 www.bi-nex.com |
898 |
|
|
의약바이오 |
산기반 |
바이오개량신약제제화공동연구기반구축(’06~’11)/[PP, GMP] |
경기과학기술진흥원 www.ggbc.or.kr |
50 |
|
|
산업/그린바이오 |
산업융합원천 |
건강기능식품플랫폼(’09~’14)/[기타-연구장비] |
한국식품연구원 www.kfri.re.kr |
40 |
|
|
충청권 |
의약바이오 산업/그린바이오 산업/그린바이오 산업/그린바이오 산업/그린바이오 |
BVC LMO LMO LMO 산기반 |
(BVC)생물의약TIC(’99~’04)/[PP, GMP] 바이오안전성정보기반구축(’02~계속)/[기타-안전성정보] 바이오국제협약운영(’08~계속)/[기타-안전성정보] 바이오안전성평가관리사업(’04~’07)/[기타-안전성정보] 단백질소재의산업적활용 극대화를위한기반구축(’05~’10)/[기타-연구장비] |
한국생명공학연구원 bvc.kribb.re.kr www.biosafety.or.kr biocat.or.kr |
50.3 86.37 181.86 118.28 45.25 |
|
의약바이오 의약바이오 산업/그린바이오 |
산업핵심 산업핵심 산업핵심 |
신약개발플랫폼(’09~’14)/[기타-연구장비] Drug Repositioning 기술을 이용한 신약개발 활용 시스템 구축 (’10~’15)/[기타-연구장비] 바이오화학실용화센터(’10~’14)/[PP] |
한국화학연구원 ddpt.krict.re.kr www.krict.re.kr ulsan.krict.re.kr |
89 104 71 |
|
|
의약바이오 의약바이오 |
지역클러스터 지역클러스터 |
바이오벤처타운조성(’02~’07)/[GMP] (2단계)바이오의약산업화허브구축사업(’08~’10)/[GMP] |
(재)대전테크노파크 www.daejeontp.or.kr |
260.66 49 |
|
|
복합지원 (의약/산업/그린) |
BVC |
(BVC)생물의약및식품TIC(’01~’06)/[PP, 공인검사] |
영동대학교 www.biotic.re.kr |
46.8 |
|
|
의약바이오 의약바이오 의약바이오 |
지역클러스터 지역클러스터 지역클러스터 |
보건의료산업종합지원센터건립(’04~’07)/[PP, GMP, 공인검사] 전통의약품개발지원센터건립(’03~’07)/[PP, 공인검사] (2단계)한방산업클러스터고도화사업(’08~’10)/[PP, 공인검사] |
(재)충북테크노파크 www.cbtp.or.kr/cbhic www.cbtp.or.kr/cbomc |
124.7 97.97 15.87 |
|
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
동물자원사업화지원센터건립(’03~’07)/[PP, GMP, 공인검사] (2단계)충남농축산바이오산업생산지원인프라구축사업(’08~’10)/[PP, GMP, 공인검사] |
(재)충남동물자원센터 www.cnasc.or.kr |
47.87 40 |
|
|
호남권 |
산업/그린바이오 산업/그린바이오 산업/그린바이오 |
BVC 지역클러스터 지역클러스터 |
(BVC) 생물벤처기업지원센터설립(’00-’04)/[PP, GMP, 공인검사] 바이오파크인프라구축(’05~’08)/[PP, GMP, 공인검사] (2단계)발효식품소재완제품화일괄지원시스템구축사업(’08~’10)/[PP, GMP, 공인검사] |
(재)전라북도생물산업진흥원 www.jjf.re.kr |
50.62 143.45 22.5 |
|
산업/그린바이오 |
산기반 |
기능성식품 임상시험지원센터설립(’04~’09)/[공인검사] |
전북대학교 www.ctcf2.com |
49.73 |
|
|
산업/그린바이오 |
발효산업 |
발효미생물종합활용센터건립(’07~’10)/[PP] |
순창군장류사업소 www.gochujang.go.kr |
234 |
|
|
산업/그린바이오 |
산기반 |
지역특화기술융복합연구지원(’12~’15)/[연구지원] |
(재)발효미생물산업진흥원 mifi.kr |
2.43 |
|
|
산업/그린바이오 |
BVC |
(BVC)생물산업산학연협동연구및실용화기반구축(’00~’04)/[PP] |
동신대학교 www.bic.re.kr |
50 |
|
|
산업/그린바이오 산업/그린바이오 의약바이오 의약바이오 의약바이오 산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 지역클러스터 지역클러스터 지역클러스터 지역클러스터 지역클러스터 |
전남생물식품사업화지원센터건립운영(’02~’07)/[PP, GMP] (2단계)건강기능식품소재산업지원기반구축사업(’08~’10)/[PP, GMP] 전남생물농업산학공동연구센터건립운영(’02~’07)/[PP, GMP] (2단계)생물의약품완제라인구축사업(’08~’10)/[PP, GMP] 독감백신원료생산기반구축(’05~’08)/[PP, GMP] 친환경생물산업클러스터구축(’07~’09)/[PP, 공인검사] 전남특산자원산업화기반구축(’07~’10)/[PP] |
(재)전라남도생물산업진흥재단 www.jbio.org www.jbrc.re.kr www.jbrc.re.kr www.jbrc.re.kr www.jbc.re.kr www.jinr.re.kr |
304 25 173.8 39.7 128.33 128.31 89.29 |
|
|
동남권 |
산업/그린바이오 |
BVC |
(BVC)마린바이오기능성물질연구기반구축(’02~’07)/[PP] |
신라대학교 mcbi.silla.ac.kr |
45.46 |
|
융합바이오 융합바이오 |
산업핵심 산기반 |
항노화 산업 제품화 기술개발(’11~’15)/[연구개발지원] 항노화 산업기반 구축(’12~’15)/[연구개발지원] |
부산대학교 anti-aging.re.kr |
37.56 112.87 |
|
|
융합바이오 융합바이오 |
지역클러스터 지역클러스터 |
차세대 의생명융합산업지원센터 구축사업(’05~’08)/[PP, 공인검사] 첨단 의생명테크노타운 건립 사업( ’09~’11)/[PP, GMP, 공인검사] |
(재)김해시차세대의생명융합산업지원센터 www.gbmc.or.kr |
58 88 |
|
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
해양생물산업육성센터(’04~’08)/[PP, GLP, 공인검사] (2단계)해양산업안전성확보기반구축사업(’09~’11)/[PP, GLP, 공인검사] |
(재)부산테크노파크 www.mbdc.or.kr |
113.89 20 |
|
|
산업/그린바이오 산업/그린바이오 |
BVC 지역클러스터 |
(BVC) 생물화학소재산업지원센터설립(’00~’04)/[PP] 바이오벤처프라자건립(’04~’08)/[PP] |
(재)바이오21센터 www.bio21.or.kr |
50 28,89 |
|
|
대경권 |
산업/그린바이오 산업/그린바이오 의약바이오 의약바이오 |
지역클러스터 지역클러스터 지역클러스터 지역클러스터 |
전통생물소재산업화센터(’04~’08)/[PP, GMP, 공인검사] (2단계)건강기능소재산업육성기반정비사업(’09~’12)/[PP, GMP, 공인검사] 한방산업지원센터기반구축(’04~’08)/[PP, GMP, 공인검사] (2단계)한방산업육성기반정비사업(’09~’11)/[PP, GMP, 공인검사] |
(재)대구테크노파크 www.dbic.or.kr www.omisc.or.kr
|
106.4 20.08 34.46 5.24 |
|
산업/그린바이오 |
BVC |
(BVC)생물농업및식품용생물소재TIC(’01~’06)/[PP, GMP] |
경북대학교 www.knu.ac.kr |
42.07 |
|
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
생물건강산업사업화지원센터건립(’02~’07)/[PP, GMP, 공인검사] (2단계)경북기능성바이오소재산업기반정비사업(’08~’12)/[PP, GMP, 공인검사] |
(재)경북바이오산업연구원 www.gib.re.kr |
137.48 135.52 |
|
|
산업/그린바이오 |
지역클러스터 |
해양생명환경산업지원센터건립(’04~’07)/[PP, GMP] |
(재)경북해양바이오산업연구원 www.gimb.or.kr |
80 |
|
|
산업/그린바이오 |
지역클러스터 |
포항테크노(바이오)정보지원센터건립(’07~’10)/[공인검사] |
(재)포항테크노파크 www.pohangtp.org |
69.61 |
|
|
강원권 |
복합지원 (의약/산업/그린) 복합지원 (의약/산업/그린) 복합지원 (의약/산업/그린) |
BVC 지역클러스터 지역클러스터 |
(BVC) 생물산업벤처기업지원기반조성(’98~’02)/[PP, GMP, 공인검사] 춘천바이오타운조성(’02~’07)/[PP, GMP, 공인검사] (2단계)생물의약소재시험생산지원기반정비(’08~’11)/[PP, GMP, 공인검사] |
(재)춘천바이오산업진흥원 www.cbf.or.kr |
58 172.3 37.2 |
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
강릉해양생물산업지원센터(’02~’07)/[PP, GMP, 공인검사] (2단계)해양의용식품사업화지원기반구축사업(’08~’11)/[PP, GMP, 공인검사] |
(재)강릉과학산업진흥원 www.gsif.or.kr |
225.87 17.9 |
|
|
제주권 |
산업/그린바이오 |
BVC |
(BVC)기능성바이오첨가제및생물자원TIC(’01~’06)/[PP, GMP, 공인검사] |
제주대학교 chejutic.cheju.ac.kr |
47.7 |
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
바이오사이언스파크(’02~’07)/[PP, GMP, 공인검사] (2단계)제주건강․뷰티생물산업기반정비사업(’08~’12)/[PP, GMP, 공인검사] |
(재)제주테크노파크 bio.jejutp.or.kr |
210.69 228.7 |
|
|
합계 |
6,279.31 |
||||
*(사)한국바이오특화센터협의회 및 각 기관자료를 참고로 필자 정리
(3) 신뢰성평가 단계 인프라
신뢰성평가 단계 인프라는 최종 개발제품의 산업화 전후 단계에서의 인체 적용을 통하여 체내 안전성․유효성 등에 대한 신뢰성(비임상, 임상 등) 확보를 지원하는 인프라에 해당되며, 대부분 보건복지부(식품의약품안전처)의 인허가를 득한 지원기관을 중심으로 인프라가 형성되어 지원되고 있다.
구체적으로 식품의약품안전처로부터 비임상시험관리기준(GLP: Good Laboratory Practice) 시험 기관으로 지정된 기관은 1988년부터 2019년 6월까지 31개 기관이었으나, 12개 기관의 지정 취하 및 신규 지정 4개로 인해 2021년 6월 현재 23개 기관이 운영 중에 있다. 임상시험관리기준(GCP: Good Clinical Practice) 기준에 맞는 자격기준을 갖추고 있고 식품의약품안전처에서 임상시험 실시기관으로 지정된 국내 기관은 2021년 6월 현재 198개 기관이다. 특히 GLP 기관은 전체의 61%에 해당하는 14개가 수도권에 위치하여 비임상을 지원 하고 있으며, 충청권에 4개, 호남권에 3개, 대경권에 1개, 강원권에 1개씩 위치하고 있다.
산업통상자원부에서는 2010년부터 대규모 투자가 이루어지고 있는 의약품에 관한 임상 수요를 국내 임상 전문연구용역기관(CRO:Contracted Research Organization)을 통해 충족시킴으로써 국내 개발사에 대한 전문 서비스를 신속하고 저비용으로 제공하고 있다. 동시에, 국내 임상 CRO 산업의 육성을 위해 (주)드림씨아이에스, (주)씨엔알리서치, (주)엘에스케이글로벌파마서비스 등 국내 대표적인 임상 CRO 회사를 중심으로 핵심 인프라 구축을 지원하였으며, 국내 CRO 관련 산업의 성장과 발전을 도모하고 국내 임상 CRO의 활성도를 제고하여 바이오의약품의 해외 진출을 지원하는 역할을 담당하고 있다.
주요 서비스 내용으로는 ① 글로벌 기준에 맞는 임상시험자료 관리시스템(CDM) 구축, ② 다국적 임상시험 진행시 원활한 진행을 위한 임상시험 관리시스템(PM) 구축, ③ 글로벌 수준의 임상시험 신뢰성보증시스템(QA)구축과 임상시험 모니터 요원(CRA) 교육, ④ 구축된 기반을 활용한 바이오시밀러 제품에 대한 임상시험 시범 수행 등이다.
[표 3-67] 국내 GLP 현황(2021.6.말 현재)
|
GLP기관 지정순서 |
1호 |
6호 |
8호 |
10호 |
11호 |
13호 |
15호 |
17호 |
18호 |
19호 |
20호 |
21호 |
22호 |
23호 |
25호 |
27호 |
28호 |
30호 |
31호 |
32호 |
33호 |
34호 |
35호 |
|
|
시험기관
시험항목 (세부시험항목) |
안전성 평가 연구소 (KIT) |
바이오 톡스텍 |
켐온 |
서울대 병원 |
한국화학 융합시험 연구원 (화순) |
인바이츠 바이오 코아 |
대구 카톨릭 대학교 |
넥시 오랩 |
한국건설 생활환경 시험 연구원 |
바이오 인프라 |
한국 원자력 의학원 |
한국 의약 연구소 |
호서 대학교 |
키프론 바이오 |
안전성평가 연구소 (전북 분소) |
인터네셔널 사이언스 티픽 스탠다드 |
크로엔 |
우정 바이오 |
제니아 |
디티앤 씨알오 |
싸토리우스 코리아 바이오텍 |
한약 비임상 시험센터 |
센트럴 바이오 |
|
|
단회 투여 독성 |
설치류 |
○ |
○ |
○ |
○ |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
○ |
- |
○ |
- |
|
비설치류 |
○ |
○ |
○ |
○ |
○ |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
- |
|
|
영장류 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
반복 투여 독성 |
설치류 |
○ |
○ |
○ |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
○ |
|
비설치류 |
○ |
○ |
○ |
○ |
○ |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
- |
|
|
영장류 |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
생식 발생 독성 |
수태능 및 초기배발생시험 |
○ |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
|
출생전후발생/모체기능시험 |
○ |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
|
|
배태자발생시험 |
○ |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
|
|
유전 독성 |
체외염색체이상 or 쥐림포마tk |
○ |
○ |
○ |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
○ |
○ |
- |
○ |
- |
- |
- |
|
체내소핵시험 |
○ |
○ |
○ |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
- |
|
|
항 원 성 독 성 |
아나필락시스 쇼크반응 |
○ |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
|
수동피부아나 필락시스반응 |
○ |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
|
|
피부감작성시험 |
○ |
○ |
○ |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
|
|
면역 독성 |
세포매개 및 체액성 |
○ |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
발암성 |
○ |
○ |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
국소 독성 |
피부자극시험 |
○ |
○ |
○ |
○ |
○ |
- |
- |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
|
안점막자극시험 |
○ |
○ |
○ |
○ |
○ |
- |
- |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
○ |
- |
- |
○ |
- |
- |
- |
|
|
기타 독성 |
광감작성시험 |
○ |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
|
광독성시험 |
○ |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
|
|
국소내성 |
- |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
설치류흡입독성(단회, 반복) |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
변이 원성 |
복귀돌연변이 |
○ |
○ |
○ |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
○ |
○ |
- |
○ |
- |
- |
- |
|
독성동태시험中 분석시험 |
- |
- |
- |
- |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
|
|
혈액조직병리 및 의존성(비GLP) |
- ○ |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
|
|
안전성약리 |
○ |
○ |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
|
|
기타 국제적으로 인증하는 시험 |
- |
○ |
○ |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
○ |
- |
- |
|
|
소재지 |
대전 |
충북 |
경기 |
서울 |
전남 |
서울 |
경북 |
서울 |
인천 |
경기 |
서울 |
경기 |
충남 |
충북 |
전북 |
강원 |
경기 |
경기 |
경기 |
경기 |
경기 |
전남 |
경기 |
|
|
지정일 |
1988. 7.22 |
2002. 12.13 |
2002. 8.12 |
2003. 1.9 |
2003. 5.30 |
2005. 5.24 |
2005. 7.26 |
2006. 7.21 |
2006. 11.6 |
2009. 1.15 |
2009. 3.2 |
2011. 5.23 |
2011. 7.12 |
2011. 7.12 |
2012. 12.12 |
2014. 10.1 |
2014. 10.10 |
2016. 6.1 |
2017. 4.17 |
2019. 9.2 |
2019. 12.20 |
2020. 9.14 |
2021. 5.7 |
|
* 식약처 임상정책과(∼2021.6.) 자료를 토대로 필자가 작성하였으며, 지정 취하 등 유한양행(2호), 동아제약(3호), LG생명과학(4호), CJ(5호), 산업안전보건연구원(7호), 태평양기술연구원(9호), 메드빌(12호), 아이바이오팜(14호), 동아대병원(16호), 동아에스티(24호), 호서의과학분석연구소(26호), 엘리드(29호)는 제외함.
[표 3-68] 국내 GCP 현황(2021.6.말 현재)
|
지정 번호 |
기관명 |
지정일자 |
지정 번호 |
기관명 |
지정일자 |
||||
|
임상1상 |
임상2상 |
임상3상 |
임상1상 |
임상2상 |
임상3상 |
||||
|
1 |
가톨릭대학교 서울성모병원 |
’97. 3.11 |
’97. 3.11 |
’97.3.11 |
41 |
충북대학교 병원 |
|
‘97. 3.11 |
’97. 3.11 |
|
2 |
가톨릭대학교 대전성모병원 |
|
’04. 4. 8 |
’97.3.11 |
42 |
한국원자력연구소 원자력병원 |
|
‘97. 3.11 |
’97. 3.11 |
|
3 |
가톨릭대학교 부천성모병원 |
|
’05. 3.28 |
’97.3.11 |
43 |
한전의료재단 한전병원 |
|
|
’97. 3.11 |
|
4 |
가톨릭대학교 여의도성모병원 |
’97. 3.11 |
’97. 3.11 |
’97.3.11 |
44 |
한림대학교 부속 강남성심병원 |
|
‘97. 3.11 |
’97. 3.11 |
|
5 |
가톨릭대학교 인천성모병원 |
|
’97. 3.11 |
’97.3.11 |
45 |
한림대학교 부속 춘천성심병원 |
|
‘97. 3.11 |
’97. 3.11 |
|
6 |
가톨릭대학교 성바오로병원 |
|
’04. 2. 9 |
’97.3.11 |
46 |
한림대학교 한강성심병원 |
|
‘97. 3.11 |
’97. 3.11 |
|
7 |
가톨릭대학교 의정부성모병원 |
’05.10.27 |
’05. 1.13 |
’97.3.11 |
47 |
한양대학교 구리병원 |
|
|
’97. 3.11 |
|
8 |
한림대학교 강동성심병원 |
|
’97. 3.11 |
’97.3.11 |
48 |
한양대학교 병원 |
‘05.12.13 |
’97. 4.29 |
’97. 3.11 |
|
9 |
경북대학교 병원 |
’05.12.19 |
’97. 3.11 |
’97.3.11 |
49 |
원광대학교 부속 치과병원 |
|
|
’97. 6.11 |
|
10 |
경희대학교 병원 |
|
’97. 3.11 |
’97.3.11 |
50 |
가톨릭대학교 성빈센트병원 |
|
’00. 1.25 |
’97. 6.11 |
|
11 |
차의과대학교 분당차병원 |
|
’97. 3.11 |
’97.3.11 |
51 |
서울특별시 보라매병원 |
|
|
’97. 6.23 |
|
12 |
계명대학교 동산병원 |
|
’99. 6.15 |
’97.3.11 |
52 |
인하대학교 의대 부속병원 |
’97. 8.12 |
’97. 8.12 |
’97. 8.12 |
|
13 |
고려대학교 의대 부속 구로병원 |
|
’99.11.26 |
’97.3.11 |
53 |
경희대학교 치과병원 |
|
|
’97.11. 7 |
|
14 |
학교법인 고려중앙학원 고려대학교 의대 부속 병원 |
’97.3.11 |
’97. 3.11 |
’97.3.11 |
54 |
경희대학교 한방병원 |
|
|
’97.11. 7 |
|
15 |
국립중앙의료원 |
|
|
’97.3.11 |
55 |
대구가톨릭대학교 병원 |
|
’03. 7.29 |
’98. 5.28 |
|
16 |
단국대학교 의대 부속병원 |
’97. 3.11 |
’97. 3.11 |
’97.3.11 |
56 |
제일의료재단 제일병원 |
|
’98. 5.28 |
’98. 5.28 |
|
17 |
동아대학교 병원 |
’03.11.10 |
’97. 3.11 |
’97.3.11 |
57 |
연세대학교 원주세브란스 기독병원 |
|
’05. 6.15 |
’98. 8.18 |
|
18 |
부산대학교 병원 |
’03.11.10 |
’97. 3.11 |
’97.3.11 |
58 |
고신대학교 복음병원 |
|
’06. 5.22 |
’99. 2 .6 |
|
19 |
삼성서울병원 |
’97. 3.11 |
’97. 3.11 |
’97.3.11 |
59 |
한림대학교 성심병원 |
|
’00. 7.22 |
’99. 7.19 |
|
20 |
서울대학교 병원 |
’97. 3.11 |
’97. 3.11 |
’97.3.11 |
60 |
경상대학교 병원 |
|
’02. 9.24 |
’99. 9.13 |
|
21 |
서울대학교 치과병원 |
’97. 3.11 |
’97. 3.11 |
’97.3.11 |
61 |
충남대학교 병원 |
|
’99. 9.20 |
’99. 9.20 |
|
22 |
순천향대학교 서울병원 |
’97. 3.11 |
’97. 3.11 |
’97.3.11 |
62 |
고려대학교 부속 안산병원 |
’06. 2.21 |
’00. 1.25 |
’00. 1.25 |
|
23 |
아산복지사업재단 서울아산병원 |
’97. 3.11 |
’97. 3.11 |
’97.3.11 |
63 |
국립마산병원 |
|
’00.10.23 |
’00.10.23 |
|
24 |
아주대학교 병원 |
’05. 2.19 |
’97. 3.11 |
’97.3.11 |
64 |
순천향대학교 부속 부천병원 |
’01. 5.22 |
’01. 5.22 |
’01. 5.22 |
|
25 |
연세대학교 세브란스병원 |
’97. 3.11 |
’97. 3.11 |
’97.3.11 |
65 |
단국대학교 치과대학 부속 치과병원 |
|
|
’01. 7.11 |
|
26 |
연세대학교 강남세브란스병원 |
’97. 3.11 |
’97. 3.11 |
’97.3.11 |
66 |
국립암센터 |
’02. 3.26 |
’01. 7.11 |
’01. 7.11 |
|
27 |
연세대학교 치과대학 치과병원 |
’97. 3.11 |
’97. 3.11 |
’97.3.11 |
67 |
인제대학교 일산백병원 |
|
|
’01.10.30 |
|
28 |
영남대학교 병원 |
’97. 3.11 |
’97. 3.11 |
’97.3.11 |
68 |
국민건강보험공단 일산병원 |
|
’01.11. 9 |
’01.11. 9 |
|
29 |
한국침례회의의료재단 왈레스기념침례병원 |
|
|
’97.3.11 |
69 |
의료법인영훈의료재단 대전선병원 |
|
’02. 5.31 |
’02. 5.31 |
|
30 |
원광대학교 의과대학병원 |
|
’97. 3.11 |
’97.3.11 |
70 |
학교법인 울산공업학원 울산대학교 병원 |
’06. 2.14 |
’02. 9.24 |
’02. 9.24 |
|
31 |
길병원 |
’99.12.29 |
’99.12.29 |
’97.3.11 |
71 |
노원을지대학교 병원 |
|
’02. 9.24 |
’02. 9.24 |
|
32 |
삼성의료재단 강북삼성병원 |
|
’97. 3.11 |
’97.3.11 |
72 |
파티마병원 |
|
’02. 9.24 |
’02. 9.24 |
|
33 |
이화여자대학교 부속 목동병원 |
’97. 3.11 |
’97. 3.11 |
’97.3.11 |
73 |
동국대학교 경주병원 |
|
’03. 3.31 |
’03. 3.31 |
|
34 |
인제대학교 부속 부산백병원 |
’97. 3.11 |
’97. 3.11 |
’97.3.11 |
74 |
조선대학교병원 |
|
’03. 7.29 |
’03. 7.29 |
|
35 |
인제대학교 상계백병원 |
|
’97. 3.11 |
’97.3.11 |
75 |
원광대학교 광주한방병원 |
|
’03. 9.25 |
’03. 9.25 |
|
36 |
인제대학교 서울백병원 |
|
’06.10.22 |
’97.3.11 |
76 |
분당서울대학교 병원 |
|
’03. 9.25 |
’03. 9.25 |
|
37 |
전남대학교 병원 |
’04.10. 4 |
’97. 3.11 |
’97.3.11 |
77 |
순천향대학교 부속 천안병원 |
’04. 2. 9 |
‘04. 2. 9 |
’04. 2. 9 |
|
38 |
전북대학교 병원 |
’06. 4.10 |
’97. 3.11 |
’97.3.11 |
78 |
국립서울병원 |
|
|
’04. 2. 9 |
|
39 |
중앙대학교 병원 |
|
’05. 4.15 |
’97.3.11 |
79 |
학교법인을지학원 대전을지대학교 병원 |
|
‘04. 4. 8 |
’04. 4. 8 |
|
40 |
서울특별시 서울의료원 |
|
|
’97.3.11 |
80 |
보훈복지의료공단 중앙보훈병원 |
|
‘05. 6.15 |
’04. 4. 8 |
|
지정번호 |
기관명 |
지정일자 |
지정 번호 |
기관명 |
지정일자 |
||||
|
임상1상 |
임상2상 |
임상3상 |
임상1상 |
임상2상 |
임상3상 |
||||
|
81 |
제주대학교 병원 |
|
’04. 5.13 |
’04. 5.13 |
120 |
광주보훈병원 |
|
’09. 1. 9 |
’09. 1. 9 |
|
82 |
동의대학교 부속한방병원 |
|
’04. 6. 3 |
’04. 6. 3 |
121 |
용인정신병원 |
|
’09. 3. 6 |
’09. 3. 6 |
|
83 |
건국대학교 충주병원 |
|
|
’04. 6.12 |
122 |
동국대학교 한의대 분당한방병원 |
|
’09. 6. 3 |
’09. 6. 3 |
|
84 |
화순 전남대학교 병원 |
|
’04.11.11 |
’04. 6.12 |
123 |
국립공주병원 |
|
’09. 7. 9 |
’09. 7. 9 |
|
85 |
천주교부산교구유지재단 메리놀병원 |
|
|
’04. 6.18 |
124 |
대전대학교 둔산한방병원 |
|
’09. 7.22 |
’09. 7.22 |
|
86 |
청주성모병원 |
|
’06. 5.19 |
’04. 9. 6 |
125 |
한국보훈복지의료공단 대구보훈병원 |
|
’09. 7.24 |
’09. 7.24 |
|
87 |
대동병원 |
|
|
’04.10.12 |
126 |
대항병원 |
|
’09. 7.30 |
’09. 7.30 |
|
88 |
제주한라병원 |
|
’04.11. 5 |
’04.11. 5 |
127 |
의료법인 동강의료재단 동강병원 |
|
’09. 8.19 |
’09. 8.19 |
|
89 |
건국대학교 병원 |
|
’06. 3.17 |
’04.11.26 |
128 |
서울특별시 은평병원 |
|
’09.11. 9 |
’09.11. 9 |
|
90 |
건양대학교 병원 |
|
’04.12. 1 |
’04.12. 1 |
129 |
한국보훈복지의료공단 부산보훈병원 |
|
’09.12.15 |
’09.12.15 |
|
91 |
차의과대학교 강남 차병원 |
|
’05. 1.13 |
’05. 1.13 |
130 |
글로리병원 |
|
’10. 3. 9 |
’10. 3. 9 |
|
92 |
명지의료재단 명지병원 |
|
’05. 1.19 |
’05. 1.19 |
131 |
대전대학교 부속 천안한방병원 |
|
’10. 3.23 |
’10. 3.23 |
|
93 |
강원대학교 병원 |
|
’05. 1.20 |
’05. 1.20 |
132 |
차의과대학교 부속 구미차병원 |
|
’10. 3.31 |
’10. 3.31 |
|
94 |
대구포교성베네딕도수녀회 창원파티마병원 |
|
|
’05. 5. 7 |
133 |
서울송도병원 |
|
’10. 5.28 |
’10. 5.28 |
|
95 |
강릉아산병원 |
|
|
’05. 8.11 |
134 |
의료법인혜원의료재단 세종병원 |
|
’10. 5.31 |
’10. 5.31 |
|
96 |
가천대학교부속 길한방병원 |
|
|
’05. 8.29 |
135 |
인제대학교 해운대백병원 |
|
’10. 6.14 |
’10. 6.14 |
|
97 |
동국대학교 일산불교병원 |
’05. 9.14 |
’05. 9.14. |
’05. 9.14 |
136 |
동남권원자력의학원 |
|
’11. 3. 8 |
’11. 3. 8 |
|
98 |
효산의료재단 안양샘병원 |
|
|
’05.10. 2 |
137 |
칠곡경북대학교병원 |
|
’11. 4. 4 |
’11. 4. 4 |
|
99 |
대진의료재단 분당제생병원 |
’05.11. 4 |
’05.11. 4. |
’05.11. 4 |
138 |
예수병원유지재단 예수병원 |
|
’11. 4.29 |
’11. 4.29 |
|
100 |
성균관대학교 삼성창원병원 |
|
|
’06. 5.23 |
139 |
부산대학교 한방병원 |
|
’11. 5.24 |
’11. 5.24 |
|
101 |
상지대학교 부속 한방병원 |
|
|
’06. 6. 2 |
140 |
성가롤로병원 |
|
’11. 7. 6 |
’11. 7. 6 |
|
102 |
광주기독병원 |
|
’06. 6. 5 |
’06. 6. 5 |
141 |
삼육서울병원 |
’11. 7.28 |
||
|
103 |
강동경희대학교의대 병원 |
’06. 8.17 |
’06. 8.17 |
’06. 8.17 |
142 |
동은학원 순천향대학병원 부속 구미병원 |
’11. 8.18 |
||
|
104 |
천주교부산교구유지재단 부산성모병원 |
|
’06.12.26 |
’06.12.26 |
143 |
예성이료재단 베데스다병원 |
’12. 1.10 |
||
|
105 |
경희대학교 강동한방병원 |
|
’07. 2. 9 |
’07. 2. 9 |
144 |
원광대학교 한방병원 |
’12. 1.11 |
||
|
106 |
동국대학교 일산불교 한방병원 |
|
’07. 2. 9 |
’07. 2. 9 |
145 |
국립경찰병원 |
’12. 1.26 |
||
|
107 |
국립부곡병원 |
|
’07. 8.23 |
’07. 8.23 |
146 |
미즈메디병원 |
’12. 3.19 |
||
|
108 |
정화의료재단 김원묵기념 봉생병원 |
|
’07.10.29 |
’07.10.29 |
147 |
인산의료재단 메트로병원 |
’12. 5.30 |
||
|
109 |
국립나주병원 |
|
’07.12. 4 |
’07.12. 4 |
148 |
연세대학교 용인세브란스병원 |
’12. 5.30 |
||
|
110 |
자생한방병원 |
|
’08. 2.27 |
’08. 2.27 |
149 |
연세사랑병원 |
’12. 8. 6 |
||
|
111 |
대구한의대학교 대구한방병원 |
|
’08. 3.28 |
’08. 3.28 |
150 |
성애병원 |
’12. 9.10 |
||
|
112 |
대원교육재단 세명대학교 부속 한방병원 |
|
’08. 3.28 |
’08. 3.28 |
151 |
모커리한방병원 |
’12.12. 3 |
||
|
113 |
세명대학교 충주한방병원 |
|
’08. 5.20 |
’08. 5.20 |
152 |
에이치플러스 양지병원 |
’13. 2. 4 |
||
|
114 |
동신대학교 광주한방병원 |
|
’08. 7. 3 |
’08. 7. 3 |
153 |
한림대학교 동탐성심병원 |
’13. 2. 4 |
||
|
115 |
김안과병원 |
|
’08. 7.30 |
’08. 7.30 |
154 |
비에이치에스한서병원 |
’13. 4. 2 |
||
|
116 |
베스티안재단 베스티안서울병원 |
|
’08. 8. 7 |
’08. 8. 7 |
155 |
씨엠병원 |
’13. 5. 8 |
||
|
117 |
누네안과병원 |
|
’08. 8.20 |
’08. 8.20 |
156 |
제일안과병원 |
’13. 7.10 |
||
|
118 |
우석대학교 전주부속 한방병원 |
|
’08.12.23 |
’08.12.23 |
157 |
나누리병원 |
’13.11. 1 |
||
|
119 |
양산부산대학교병원 |
|
’08.12.24 |
’08.12.24 |
158 |
효산의료재단 지샘병원 |
’13.12.31 |
||
|
지정 번호 |
기관명 |
지정일자 |
지정 번호 |
기관명 |
지정일자 |
||||
|
임상1상 |
임상2상 |
임상3상 |
임상1상 |
임상2상 |
임상3상 |
||||
|
159 |
국립재활원 |
’14. 1. 7 |
180 |
원광대학교 산본병원 |
’16. 7.26 |
||||
|
160 |
부산대학교 치과병원 |
’14. 3. 3 |
181 |
대전보훈병원 |
’16.11. 9 |
||||
|
161 |
원광대학교 한의과대학부속 전주한방병원 |
’14. 3.20 |
182 |
의료법인 안동병원 |
’16.12.26 |
||||
|
162 |
의료법인녹산의료재단 동수원병원 |
’14. 3.21 |
183 |
인천광역시의료원 |
’17. 8.10 |
||||
|
163 |
한길의료재단 한길안과병원 |
’14. 4. 9 |
184 |
의료법인인당의료재단해운대부민병원 |
’17.11.15 |
||||
|
164 |
학교법인 동의병원 |
’14. 5.27 |
185 |
분당제일여성병원 |
’17.12. 1 |
||||
|
165 |
가톨릭관동대학교 국제성모병원 |
’14. 6. 9 |
186 |
의료법인 우리의료재단 김포우리병원 |
’17.12.14 |
||||
|
166 |
동신대학교부속 목포한방병원 |
’14. 6.19 |
187 |
메디플렉스 세종병원 |
’18. 5.17 |
||||
|
167 |
의료법인 실로암안과병원 |
’14. 6.24 |
188 |
의료법인 루가의료재단 나은병원 |
’18.12. 6 |
||||
|
168 |
의료법인 광명성애병원 |
’14. 7.24 |
189 |
베스티안병원 |
’19. 1. 3 |
||||
|
169 |
의료법인인당의료재단 부민병원 |
’14.12.12 |
190 |
이화여자대학교 의과대학부속 서울병원 |
’19. 3.11 |
||||
|
170 |
의료법인세광의료재단 성모안과병원 |
’15. 3.27 |
191 |
의료법인 정선의료재단 온종합병원 |
’19. 4.29 |
||||
|
171 |
부민병원(서울) |
’15. 5.22 |
192 |
의료법인 해인의료재단 동신한방병원 |
’19. 7.29 |
||||
|
172 |
대구 누네안과병원 |
’15. 9.11 |
193 |
서울재활병원 |
’19. 9.20 |
||||
|
173 |
세경의료재단 새빛안과병원 |
’16. 3.16 |
194 |
의료법인한성재단 포항 세명기독병원 |
’19.10. 7 |
||||
|
174 |
청연한방병원 |
’16. 5.26 |
195 |
의료법인석경의료재단 센트럴병원 |
’19.12. 4 |
||||
|
175 |
창원 경상대학교병원 |
’16. 7. 1 |
196 |
부평세림병원 |
’20. 1.10 |
||||
|
176 |
자생의료재단 대전 자생한방병원 |
’16. 7. 4 |
197 |
의료법인은성의료재단 좋은강안병원 |
’20. 2.14 |
||||
|
177 |
자생의료재단 해운대 자생한방병원 |
’16. 6.17 |
198 |
현대병원 |
’20. 2.27 |
||||
|
178 |
자생의료재단 부천자생한방병원 |
’16. 7. 4 |
|
|
|
||||
|
179 |
밝은안과21병원 |
’16. 6.27 |
198개 |
||||||
주) 식약처 임상정책과(∼2021.6.) 자료를 토대로 필자가 작성함.
[표 3-69] 국내 대표적인 2개 비임상 CRO 회사 현황(2021.6.말 현재)
|
업 체 명 |
(주)바이오톡스텍 |
최근5년간 기업현황(단위: 천 원,명) |
||||||||||||
|
구분 |
2016년 |
2017년 |
2018년 |
2019년 |
2020년 |
|||||||||
|
총자산 |
48,007,296 |
59,770,502 |
63,135,803 |
60,175,524 |
63,654,913 |
|||||||||
|
설 립 년 월 일 |
2000년 08월 23일 |
총자본 |
25,562,365 |
31,240,721 |
35,749,343 |
31,195,005 |
34,281,583 |
|||||||
|
사업자등록번호 |
301-81-45781 |
총부채 |
22,444,931 |
28,529,781 |
27,386,460 |
28,980,519 |
29,373,330 |
|||||||
|
법 인 등록번호 |
150111-0048707 |
매출액 |
20,300,373 |
25,564,709 |
32,582,096 |
25,853,847 |
26,428,630 |
|||||||
|
대 표 자 성 명 |
강종구 |
총인원 |
179명 |
198명 |
196명 |
181명 |
195명 |
|||||||
|
주소 |
본 사 |
충북 청원군 오창읍 양청리 686-2 |
연락처 |
전화/팩스 |
043-210-7777 / 043-210-7778 |
|||||||||
|
홈페이지 |
www.biotoxtech.com |
|||||||||||||
|
주요생산품 (2020년 말 기준) |
산업분류 코드 |
시장규모(억 원) |
시장점유율(%) |
매출액(억 원) |
||||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
|||||||||
|
비임상시험대행업 |
M70113 (의학및약학연구개발업) |
1,200(추정) |
미확인 |
18.6 |
|
220 |
17 |
|||||||
|
비임상시험 과제수 (2021년 3월말 기준) |
주요 조직 |
네트워크 기관 |
||||||||||||
|
1,439건(국내 1,275, 해외 164) |
연구소(R&D컨설팅, 약효약리팀), 시험본부(QAxla, 시험관리팀, 독성1팀, 독성2팀, 병리팀, 조제팀), 영업본부(영업팀, 마케팅팀), 관리본부(경영관리팀), 공무팀 |
국내(한국과학기술연구원, 표준과학연구원, 한국생명공학연구원 등), 해외(일본 PPRC 등, 중국 Beijing Northland Biotech 등 |
||||||||||||
|
업 체 명 |
(주)켐온 |
최근5년간 기업현황(단위: 천 원,명) |
||||||||||||
|
구분 |
2016년 |
2017년 |
2018년 |
2019년 |
2020년 |
|||||||||
|
총자산 |
31,230,399 |
39,462,658,319 |
42,473,048,581 |
44,622,023 |
72,680,984 |
|||||||||
|
설 립 년 월 일 |
2000년 01월 11일 |
총자본 |
26,754,380 |
33,144,143,067 |
34,051,912,726 |
37,121,560 |
54,677,570 |
|||||||
|
사업자등록번호 |
108-81-19928 |
총부채 |
4,476,019 |
6,318,515,252 |
8,421,135,855 |
7,500,463 |
18,003,414 |
|||||||
|
법 인 등록번호 |
110111-1848542 |
매출액 |
15,416,764 |
15,549,165,712 |
19,450,820,403 |
20,914,334 |
24,767,180 |
|||||||
|
대 표 자 성 명 |
송시환 |
총인원 |
132명 |
177명 |
203명 |
199명 |
213명 |
|||||||
|
주소 |
본 사 |
경기 수원 영통 이의동 864-1 경기바이오센터 15층 |
연락처 |
전화/팩스 |
031-888-6634/031-888-6640 |
|||||||||
|
홈페이지 |
www.chemon.co.kr |
|||||||||||||
|
주요생산품 (2020년 말 기준) |
산업분류 코드 |
시장규모(억 원) |
시장점유율(%) |
매출액(억 원) |
||||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
|||||||||
|
비임상시험 |
M70113 (의학및약학 연구개발업 |
1,200(추정) |
미확인 |
12.8 |
- |
194 |
0 |
|||||||
|
비임상시험 과제수 (2021년 3월 말 기준) |
주요 조직 |
네트워크 기관 |
||||||||||||
|
358억원 수주(200억원 납품) |
경영지원본부, 사업개발본부, 비임상연구소(안정성평가센터, 독성병리센터, 연구지원센터, 시험물질평가센터, 효능평가센터, 춘천바이오센터) |
제약회사, 바이오벤처, 삼성서울병원, 한국생명공학연구원 등 |
||||||||||||
[표 3-70] 국내 대표적인 3개 임상 CRO 회사 현황(2021.6.말 현재)
|
업 체 명 |
(주)드림씨아이에스 |
최근 5년간 기업현황(단위: 천 원,명) |
|||||||||||||
|
구분 |
2016년 |
2017년 |
2018년 |
2019년 |
2020년 |
||||||||||
|
총자산 |
14,145,469 |
13,542,500 |
17,685,996 |
25,020,549 |
48,593,025 |
||||||||||
|
설 립 년 월 일 |
2000년 04월 27일 |
총자본 |
3,940,622 |
2,820,854 |
6,505,192 |
10,748,777 |
36,460,149 |
||||||||
|
사업자등록번호 |
101-81-57329 |
총부채 |
10,204,847 |
10,721,646 |
11,180,804 |
14,271,771 |
12,132,876 |
||||||||
|
법 인 등록번호 |
110111-1953953 |
매출액 |
15,482,007 |
15,957,711 |
19,199,521 |
22,108,907 |
23,489,321 |
||||||||
|
대 표 자 성 명 |
지아리우 |
총인원 |
261명 |
181명 |
181명 |
203명 |
206명 |
||||||||
|
주소 |
본 사 |
서울 종로 적선 80 적선현대빌딩 1010호 |
연락처 |
전화/팩스 |
02-2010-4504 / 02-720-5385 |
||||||||||
|
홈페이지 |
http://www.dreamcis.com |
||||||||||||||
|
주요생산품 (2020년말 기준) |
산업분류 코드 |
시장규모(억 원) |
시장점유율(%) |
매출액(억 원) |
|||||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
||||||||||
|
임상시험대행업 |
M70113 (의학및약학연구개발업 |
4,551 (2018년 기준) |
503,800 (2018년 기준) |
4.2% (2018년 기준) |
|
234 |
|
||||||||
|
임상시험 과제수(2021년 3월 말 기준) |
주요 조직 |
네트워크 기관 |
|||||||||||||
|
813억원 계약(432억원 납품) |
품질유닛, 사업개발유닛, R&D유닛, 임상시험유닛, 후기임상연구유닛, 바이오메트릭스유닛, IT유닛 |
지역임상시험센터 및 다수 해외CRO |
|||||||||||||
|
업 체 명 |
(주)씨엔알리서치 |
최근 5년간 기업현황(단위: 천 원,명) |
|||||||||||||
|
구분 |
2014년 |
2017년 |
2018년 |
2019년 |
2020년 |
||||||||||
|
총자산 |
5,822,485 |
28,456,219 |
35,048,749 |
39,274,034 |
43,941,813 |
||||||||||
|
설 립 년 월 일 |
2000년 03월 |
총자본 |
1,735,918 |
(654,142) |
4,754,517 |
(3,083,990) |
(138,184) |
||||||||
|
사업자등록번호 |
214-86-50573 |
총부채 |
4,086,567 |
29,110,361 |
30,294,231 |
42,358,024 |
44,079,997 |
||||||||
|
법 인 등록번호 |
110111-1895999 |
매출액 |
18,980,353 |
25,460,911 |
24,599,944 |
27,203,441 |
34,123,503 |
||||||||
|
대 표 자 성 명 |
박 관 수 |
총인원 |
202명 |
253명 |
253명 |
304명 |
304명 |
||||||||
|
주소 |
본 사 |
서울 강남구 역삼로 412 대치MS빌딩 6층 |
연락처 |
전화/팩스 |
02-6251-1500 / 02-6251-1504 |
||||||||||
|
홈페이지 |
http://www.cnrres.co.kr, http://www.cnracademy.org |
||||||||||||||
|
주요생산품 (2020년말 기준) |
산업분류 코드 |
시장규모(억 원) |
시장점유율(%) |
매출액(억 원) |
|||||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
||||||||||
|
임상시험대행업 |
N75999 (그외 기타 분류안된 사업지원 서비스업) |
4,551 (2018년 기준) |
503,800 (2018년 기준) |
5.4% (2018년 기준) |
|
341 |
|
||||||||
|
임상시험 과제수 (2021년 3월 말 기준) |
주요 조직 |
네트워크 기관 |
|||||||||||||
|
850건 |
Clinical Operation(PM, CR1, CR2, CR3, Oncology), Business development(Local, Global, Marketing, Sales Management), Regulatory Affairs(IND/IRB, Consulting), Medical(Biostatistics, Medical writing), Data management(IT), Training & Operatipon Practice, Management Support |
국내: 녹십자의료재단, 안전성평가연구소, 메디팁, CRScube, 병원(충북대, 중앙대, 인제대, 고려대구로, 경북대, 서울대) 등 해외: 일본 ACM, 대만 VCRO, 중국 RUNDO사 |
|||||||||||||
|
업 체 명 |
(주)엘에스케이글로벌파마서비스 |
최근 5년간 기업현황(단위: 천원,명) |
|||||||||||||
|
구분 |
2016년 |
2017년 |
2018년 |
2019년 |
2020년 |
||||||||||
|
총자산 |
11,883,859 |
13,765,228 |
15,927,458 |
15,774,876 |
15,162,898 |
||||||||||
|
설 립 년 월 일 |
2001년 10월 01일 |
총자본 |
-1,755,898 |
(3,223,719) |
(3,551,837) |
(5,041,925) |
(3,558,924) |
||||||||
|
사업자등록번호 |
211-87-01667 |
총부채 |
13,639,757 |
16,988,947 |
19,479,295 |
20,816,801 |
18,721,823 |
||||||||
|
법 인 등록번호 |
110111-2340646 |
매출액 |
19,492,374 |
21,390,769 |
25,098,530 |
26,822,660 |
29,858,807 |
||||||||
|
대 표 자 성 명 |
이영작 |
총인원 |
220명 |
310명 |
310명 |
318명 |
318명 |
||||||||
|
주소 |
본 사 |
서울시 중구 퇴계로 97 고려대연각타워 16층 |
연락처 |
전화/팩스 |
Tel. 02-546-1008 / Fax. 02-584-9008 |
||||||||||
|
홈페이지 |
www.lskglobal.co.kr |
||||||||||||||
|
주요생산품 (2020년 말 기준) |
산업분류 코드 |
시장규모(억 원) |
시장점유율(%) |
매출액(억 원) |
|||||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
||||||||||
|
임상시험대행업 |
M70113 (의학 및 약학 연구개발업) |
4,551 (2018년 기준) |
503,800 (2018년 기준) |
5.5% (2018년 기준) |
|
298억 |
|
||||||||
|
임상시험 과제수 (2021년 3월 말 기준) |
주요 조직 |
네트워크 기관 |
|||||||||||||
|
총 887개 프로젝트(해외 110) |
QM, Training, Corporate Communications, BD, SC, CM, MW&RES, CTM HQs, CDM HQs, PV, STAT/ER, F&A, 경영지원부 |
PRA International, MDS, Pharma Service, Covance, INC Research, Julius Clinica, Research, Cato Research, StatPlus, SLG, MPI, Target, Health, Medidata, LSK, Biopartners, George Clinical, Veras Research Japan, Semler, Research Center Pvt Ltd, Veras Research Sdn Bhd |
|||||||||||||
주) 기업 자료, 금감원 전자공시시스템 등 토대로 작성함.
(4) 바이오빅데이터 단계 인프라
산업화를 위한 바이오빅데이터 단계의 인프라는 개인건강정보, 병원질병정보, 영상의료정보 등 3가지로 구분한다.
산업부에서는 첫째, 개인건강정보 분야에 2015년부터 2021년까지 ‘PHR기반 개인맞춤형 건강관리시스템 개발사업’을 통해 약 216억 원을 투입하고 있다. 둘째, 병원질병정보 분야에는 2019년부터 2022년까지 ‘CDM기반 정밀의료 데이터통합플랫폼 기술개발’을 위해 약 202억 원을 투입하고 있다. 셋째, 영상의료정보 분야에는 2020년부터 2024년까지 ‘영상진단 의료기기 탑재용 AI기반 영상분석 솔루션 개발’을 통해 약 264억 원을 투입하고 있다.
(가) PHR기반 개인맞춤형 건강관리시스템 개발사업
개인이 스스로 자신의 개인건강기록(라이프로그, 유전체데이터, 진료데이터) 등 정밀 의료에 필요한 다양한 데이터를 통합 관리할 수 있는 개인주도형 플랫폼을 구축하고, 저전력 블루투스(BLE) 국제 표준 등을 적용해 IoT 헬스케어 기기(60여 종)와 연동하여 진료기록, 라이프로그, 투약정보 등 PHR 데이터(200여 개)를 측정하고, 개인동의를 통해 수집된 PHR 데이터를 개방형 오픈 API를 활용하여 건강관리 서비스를 개발하도록 지원하였다.
2018년부터는 국제 시장 경쟁력 향상을 위한 헬스케어 디바이스 연동 및 라이프로그 데이터 표준 가이드라인, 국내 및 국제 개인정보보호법에 위배되지 않는 보안 가이드라인, 국내 보건의료계의 실정을 고려한 국제 의료용어 표준을 따르는 의료용어 표준 가이드라인, PHR 사업자들의 글로벌 시장 진출 및 글로벌 헬스케어 기관․기업들과 협업을 위한 국제 의료정보 바탕 표준 및 가이드라인을 마련하고, 데이터 플랫폼을 활용한 다양한 기업형 서비스 실증사업 등을 추진하고 있다.
(나) CDM기반 정밀의료 데이터통합플랫폼 기술개발
병원에서 보유한 분산형 의료데이터(EMR: Electronic Medical Record)를 공통데이터모델(CDM: Common Data Model)로 표준화하고 분석하는 SW개발 등 플랫폼을 구축하였고, 아주대병원, 강동성심병원, 국민건강보험공단 일산병원, 경북대학교병원, 칠곡경북대학교병원, 강원대학교병원, 이대목동병원, 전북대병원, 부산대병원, 원광대학교병원, 강동경희대병원, 동국대일산병원 등 12개 병원 임상데이터를 CDM으로 변환하였다.
2018년부터 2019년 신규 참여기관까지 총 61개 병원이 참여하여(상급종합병원 28개, 종합병원 32개, 일반병원 1개), 총 환자 수 1,927만 3,669명, 총 임상데이터 수 68억 1,094만 5,880건에 대한 CDM 데이터 변환데이터 플랫폼을 활용한 다양한 기업형 서비스실증사업 등을 추진하고 있다.
(다) 영상진단 의료기기 탑재용 AI기반 영상분석 솔루션 개발
표준화한 의료영상 기반, 영상진단기기 특화 AI 기술 개발을 통해 (X-ray)폐질환(결절, 종괴, 기흉, 흉수 등), (MRI․CT)복부출혈, 근골격계 질환 등 연구를 지원하고 있고, AI기반 영상진단기기 개발 및 시험․평가 기술 개발을 통해 영상 촬영과 동시에 병변․질환을 검출․판독․진단(보조)할 수 있는 AI 탑재 영상진단기기 개발을 지원하고 있으며, 개발자 활용 확대를 위한 통합형 라이브러리, 툴킷 등 SW 개발 등을 지원하고 있다.
[표 3-71] 산업부 추진 PHR 추진과제 현황(2021.6. 현재)
|
구분 |
추진과제 |
주관기관 |
총개발기간 |
|
1 |
라이프로그-공공데이터를 활용한 PHR기반 생애 주기별 맞춤형 건강관리 시스템 개발 및 비즈니스 모델 실증 |
라이프시맨틱스 |
’15.6.1~’18.8.31 |
|
2 |
시장 경쟁력 향상을 위한 PHR 데이터 표준 및 가이드라인 개발 |
서울대학교병원 |
’18.11.1~’22.4.30 |
|
3 |
PHR기반 개인맞춤형 건강관리 서비스 플랫폼 기술 고도화 및 실증서비스 개발 연계지원 |
디케이아이테크놀로지 |
’18.11.1~’22.4.30 |
|
4 |
고령자 건강관리 서비스 개발 및 실증 |
유비플러스 |
’18.11.1~’21.3.31 |
|
5 |
PHR 플랫폼 기반의 근로자 맞춤형 건강관리 서비스 개발 및 사업화 |
비트컴퓨터 |
’18.11.1~’21.3.31 |
|
6 |
개방형 PHR기반 치매 보호자용 건강관리 서비스 개발 및 실증 |
피플앤드테크놀러지 |
’19.4.1~’21.12.31 |
|
7 |
퇴행성 근골격계 질환 1인가구 고령자의 자기주도적 재활의료 및 재가돌봄을 위한 상호운용 가능한 PHR 서비스플랫폼 개발 및 실증 |
하이디어솔루션즈 |
’19.4.1~’21.12.31 |
|
8 |
글로벌 PHR기반 소아발달장애 관리 및 치료용 모바일 인공지능 플랫폼 |
두브레인 |
’19.4.1~’22.6.30 |
|
9 |
개방형 PHR기반 IoMT 기기를 활용한 공동주택 주민 맞춤형 통합건강관리서비스 개발 및 실증 |
헬스맥스 |
’19.4.1~’21.12.31 |
|
10 |
개방형 PHR 플랫폼 환경에서 청진 IoMT를 활용한 심질환 진단지원서비스 고도화 모델 |
휴레이포지티브 |
’19.4.1~’21.12.31 |
|
11 |
맞춤형 개인건강관리 서비스를 위한 헬스케어 음성 UI 플랫폼 기술 개발 |
미디어젠 |
’19.4.1~’21.12.31 |
|
12 |
염증성장질환 개인주도형 라이프케어 맞춤형 건강관리서비스 플랫폼 개발 및 실증 |
소프트넷 |
’19.4.1~’21.12.31 |
|
13 |
개방형 PHR기반 만성질환자 응급실용 관리 시스템 개발 및 실증 |
브이티더블유 |
’19.4.1~’21.12.31 |
[표 3-72] 산업부 추진 CDM 추진과제 현황(2021.6. 현재)
|
구분 |
추진과제 |
주관기관 |
총개발기간 |
|
1 |
CDM기반 분산형 바이오․헬스데이터 플랫폼 고도화 및 기관확장 |
분당서울대학교병원 |
’19.5.1~’22.12.31 |
|
2 |
CDM기반 바이오․헬스데이터 통합 플랫폼 고도화 및 검증 기술개발 |
서울아산병원 |
’19.5.1~’22.12.31 |
|
3 |
CDM기반 바이오․헬스 통합 데이터망 기관확장 구축 기술개발 |
아주대학교산학협력단 |
’19.5.1~’22.12.31 |
|
4 |
공통데이터모델 기반 국내 표준화 및 익명화 가이드라인 수립 |
삼성서울병원 |
’19.5.1~’22.12.31 |
|
5 |
CDM기반 만성질환 데이터를 활용한 지능형 진단처방 조회 서비스 시스템 |
엠투아이티 |
’19.5.1~’21.12.31 |
|
6 |
사용자 편의성이 고도화된 CDM기반 스마트 임상시험 설계 지원 시스템 |
셀바스에이아이 |
’19.5.1~’21.12.31 |
|
7 |
CDM기반의 지능형 진료 가이드 알고리즘 개발과 확산을 위한 CDSS 플랫폼 개발 |
씨앤텍시스템즈 |
’19.5.1~’21.12.31 |
|
8 |
인공지능 딥러닝이 적용된 CDM 및 라이프로그 신규 디지털 바이오마커의 발굴 및 서비스 산업화 |
파미니티 |
’19.5.1~’21.12.31 |
|
9 |
CDM기반 디지털치료제 검증시스템 개발 및 실증 |
휴레이포지티브 |
’19.5.1~’21.12.31 |
|
10 |
CDM기반 알고리즘 진료 프로토콜 서비스 시스템 개발과 확산 |
씨앤텍시스템즈 |
’19.5.1~’21.12.31 |
[표 3-73] 산업부 추진 영상AI 추진과제 현황(2021.6. 현재)
|
구분 |
추진과제 |
주관기관 |
총개발기간 |
|
1 |
인공지능 탑재형 의료영상 진단기기 개발 |
한국산업기술시험원 |
’20.4.1~’24.12.31 |
|
2 |
인공지능 학습용 데이터셋 구축 |
한국산업기술시험원 |
’20.4.1~’24.12.31 |
|
3 |
영상진단 의료기기 탑재용 AI 진단 기술 개발 |
경북대학교 |
’20.4.1~’24.12.31 |
|
4 |
인공지능기반 영상분석 기술을 탑재한 영상진단 의료기기 개발 |
서울대학교 |
’20.4.1~’24.12.31 |
|
5 |
AI탑재 영상진단 의료기기 개발을 위한 개방형 온오프라인 플랫폼 기술 개발 |
대구테크노파크 |
’20.4.1~’24.12.31 |
다. 발전 과제
바이오․헬스산업은 연평균 세계시장 성장률이 조선, 자동차산업보다도 높은 산업이며, 정부의 효율적인 정책 수립, 산학연 모두의 몰입형 기술 개발 추진 등을 통해 경제적 효과로 가시화되는 대표적인 산업이다.
생명공학분야 국책연구소와 인프라 기관은 우리나라의 생물산업 발전을 위한 기술 및 제품화 지원의 하부구조를 구성하며 기초연구에서 사업화까지의 전 과정에 걸쳐 오랜 기간 동안 제 역할을 담당하고 있음을 부정할 수 없다. 그러나 지난 25년간 정부 지원을 통해 구축된 지역 중심의 인프라는 지속적인 운영 자립화 및 기업 지원 경쟁력 강화를 위해 효율성 강구가 필요하다.
또한 기초 단계(공공연구기관), 신뢰성평가 단계((비)임상GLP 등)를 연결해 주는 산업화 인프라에 대해서는 국가 단위의 성과를 창출할 수 있도록 중점분야별(의약, 식품 등), 단계별(후보물질∼시생산∼생산), 서비스별(백신, 바이오시밀러, 소재단백질 등) 인프라 연계 및 통합 서비스 체계 구축 지원을 지속적으로 고려할 필요가 있다. 이를 통해 중소․중견기업 등의 연구결과를 조기 제품화하고 지역별 기 구축된 산업화 인프라의 활용도와 전문성을 동시에 제고할 수 있을 것으로 판단된다. 인프라 활동도 시대가 요구하는 방향으로 뉴딜, 디지털전환, 탄소중립 등의 키워드와 함께 진화되어야 할 것이다.
현재는 4차 산업혁명과 인구고령화를 계기로 전 세계 바이오․헬스 시장이 재편되는 중요한 시기로 산업 정책의 근본적 혁신과 선제적 투자를 통해 우리나라와 같은 후발국이 선도주자로 급부상할 수 있는 좋은 기회이다. 이러한 시대적 기회를 통해 바이오의약품에 대해서는 바이오의약품 생산공정 고도화를 통한 기업의 생산성 제고, 바이오 신소재 개발로 고부가가치화 촉진, 해외 의존성 완화, 바이오의약품 관련 핵심 생산장비․원부자재 국산화, 고부가가치 유망 소재 연구개발 등 고도화 전략이 필요하다.
또한 대내외 이머징 이슈에 대한 R&D 지원 강화를 위해 COVID-19 등 감염성 질환 진단 및 백신 산업화, 백신 대량 생산공정 최적화, 마이크로바이옴 등 차세대 의약품 개발 추진, 탄소중립 시대 선도 및 미세플라스틱의 심각한 환경오염 문제 해결을 위한 바이오매스 기반 탄소중립형 생분해 플라스틱 개발 및 전주기 관리체계 해결 방안 마련도 필요하다. 이에 필요한 추가 인프라와 기존 인프라의 기능 고도화를 위한 다양한 정책 추진이 요구된다.


|
주요내용 요약 |
|
|
|||
|
|
|
|
|||
|
구분 |
바이오 안전성 |
생명윤리 |
지적재산권 |
||
|
개요 |
국제사회에서는 카르타헤나의정서를 중심으로, 우리나라는 유전자변형생물체법을 통해 유전자변형생물체 안전관리 및 바이오안전성 확보를 위해 노력 중 |
생명공학 연구개발의 윤리적, 법적, 사회적 의미를 탐구하는 생명윤리에 관해 국내외의 많은 변화 출현 |
코로나19발생으로 바이오헬스케어 산업은 글로벌 경쟁의 핵심분야로 부상하였으며, 바이오분야의 특성상 효율적인 정책적 지원을 바탕으로 한 지식재산 확보전략과 회피전략으로 강한 특허를 창출하고 특허분쟁에 대응하는 것이 중요 |
||
|
해외동향 |
카르타헤나의정서 주요 논의 및 미국, 캐나다, 중국, 일본 등 주요국 바이오안전성 법․제도 동향 |
COVID-19 백신 및 치료제 개발의 윤리적 고려 및 생명공학 신기술에 대한 새로운 규범이 제안됨 |
|
||
|
국내현황 |
유전자변형생물체법을 중심으로 한 법․제도 시행 현황 및 유전자가위기술 적용 산물 규제 개선 동향 |
첨단재생바이오법의 제정, 개인정보보호법의 개정, 생명윤리 기본정책의 수립 등의 변화가 있었음 |
|
||
|
발전과제 |
바이오기술의 발전 및 시대 환경 변화에 맞춘 적극적인 법․제도 개선 추진 필요 |
규제의 합리성 제고, 시민참여의 실질적 강화, 연구자-산업계-정부-시민사회의 소통 강화 등이 필요 |
|
||
|
|
|
|
||
|
|
|
|
||
|
제품 인허가 |
기업 현황과 지원제도 |
|||
|
코로나 시대에 첨단 바이오기술을 활용한 백신, 치료제, 진단시약 필요에 따른 허가체계 변화 및 포스트코로나를 대비한 인공지능 기반 의료기기 개발 등 발전 과제를 조명 |
국내외 상위 바이오기업의 현황과 동향을 분석하고, 코로나19 위기를 극복하고 국내 기업을 글로벌기업으로 성장시키기 위한 각종 지원제도 설명 |
|||
|
코로나19 백신 및 치료제, 희귀의약품 허가 급증 |
전 세계적으로 의약품 분야는 코로나19 치료제와 백신을 개발하는 기업의 가치가 높아졌으며, 의료기기 분야도 코로나19 영향으로 진단기기 및 디지털헬스 기업의 가치가 높은 상승률 시연 |
|||
|
코로나 진단시약의 국내 및 수출용 허가 급증, 인공지능 기반 의료기기 개발 강세 |
국내 바이오기업은 생산 및 수출 면에서 계속 증가하고 있으며, 우리 정부는 코로나19 치료제․백신 개발 지원을 비롯해 산업생태계 조성 등을 통해 기업 성장을 적극 지원 |
|||
|
국내개발 의료제품의 글로벌 임상시험 시스템 구축, 첨단융복합제품 중 조직 생체재료 개발 지원 필요 |
|
|||

가. 개요
생명공학육성법은 1983년에 ‘유전공학육성법’으로 최초 제정된 이후 생명공학 분야 육성을 위한 법률적 토대를 제공하였다. 법제정 이래로, 생명공학 육성정책 수립과 정부 연구개발 확대 및 산업적 응용촉진 등 우리나라 생명공학 연구개발 역량강화와 생태계 활성화에 기여하였다.
그간 축적한 연구개발 역량을 기반으로 바이오 분야의 국내 벤처 투자금이 정보통신기술을 넘어 1조 원을 상회하는 등 국내 바이오 생태계는 빠르게 성장하고 있다. 또한, 2005년 이후 기술특례상장기업1) 133개 중 81개 기업(61%)이 바이오 관련 업체이다. 시가총액 기준으로 (주)셀트리온헬스케어(19조 6,000억 원)가 국내 코스닥 1위 규모이며, 코스닥 상위 20개 기업 중 바이오․헬스 기업이 8개(셀트리온제약(5조 4,000억 원), 알테오젠(4조 4,000억 원), 씨젠(3조 4,000억 원), 제넥신(2조 4,000억 원) 등 2021.3.22. 기준)이다.
특히, 전례 없는 코로나19 팬데믹 위기 속에 국내 진단키트(기술)가 전 세계에 환영을 받아 106개국에 수출되는 등 ‘K-바이오’의 성장 가능성과 잠재력을 확인할 수 있었다. 이러한 변화 시점에서 생명공학육성법은 기술․사회 환경변화를 반영하고, 전주기적 연구지원과 사업화 역량강화 및 혁신적 연구 환경 조성 등의 정부 정책에 대한 실질적 지원 근거를 마련하는 내용을 담아 지난 2020년 5월 19일에 개정되었고, 6개월의 유예기간을 거쳐 2020년 11월 20일에 시행되었다.
나. 개정 필요성
(1) 생명공학육성법의 지위
생명공학육성법은 1983년에 ‘유전공학육성법’으로 최초 제정된 이후 국가 생명공학 분야 육성에 관한 일반법적 지위를 갖고 있다. 생명공학 분야에 관련된 법률로서 육성․진흥의 취지로 규정된 과학기술기본법, 산업기술혁신촉진법 및 생명연구자원의 확보․관리 및 활용에 관한 법률 등2)도 있으나 해당 법률들은 특정산업분야 또는 특정기술을 적용대상으로 규정하고 있는 것이 보통이다.3)
예컨대, 과학기술기본법은 ‘과학기술발전을 위한 기반을 조성’하고자 과학기술 전반을 대상으로 진흥하며, 산업기술혁신 촉진법은 ‘산업기술혁신을 촉진하고 산업기술혁신을 위한 기반을 조성’하고자 산업기술 전반을 대상으로 진흥하는 등 ‘생명공학(바이오)’ 분야보다는 과학기술, 산업기술 전반에 대한 육성취지를 가지고 있다. 생명연구자원의 확보․관리 및 활용에 관한 법률 역시, 생명연구자원이라는 특정한 적용대상을 중심으로 규정하고 있다는 점을 알 수 있다.
즉, 생명공학 전 분야를 포괄하여 육성․진흥의 취지로 규정하고 있는 법률로는 생명공학육성법이 유일하며, 생명공학연구의 기반을 조성하여 생명공학을 효율적으로 육성․발전하려는 목적으로 생명공학 분야에 일반적으로 적용되고 있다.
(2) 국내(생명공학육성법) 제도의 개정 경과
생명공학육성법의 시작은 1983년 12월 31일로 거슬러 올라간다. 유전공학육성법이라는 이름으로 처음 제정된 생명공학육성법은 지금까지 15번 개정되었는데, 이 중 10번 정도는 다른 법률의 개정에 따라 부차적으로 개정된 것이고 5번 정도는 실질적인 개정이 이루어졌다.
[표 4-1] 생명공학육성법 개정 주요경과(1983∼2017)
|
구분 |
개정일자 |
주요 개정내용 |
|
3차 개정 |
1995. 1. 5. |
- ‘유전공학육성법’을 ‘생명공학육성법’으로 제명을 변경 - 생명공학육성시책강구 규정상 관련부처의 역할 확대조정 - 생물다양성협약 가입에 대비하여 관련내용을 보완․정비 |
|
5차 개정 |
1997. 8.28. |
- 생명공학의 용어를 재정의 - 생명공학육성시책을 강구할 부처에 해양수산부 추가 및 관계부처의 역할을 조정 |
|
7차 개정 |
2003.12.30. |
- 생명공학 육성대상에 기초의과학 포함 - 생명공학실무추진위원회 폐지 - 생명공학의 산업적 응용촉진에 대한 정부의 지원시책 강구 - 기초의과학육성지원기구의 지정․운영규정 신설 |
|
11차 개정 |
2011. 7.21. |
- 생명공학종합정책심의회의 심의사항 추가 ※ 뇌연구촉진 기본계획의 수립 등에 관한 사항(뇌연구촉진법 상 폐지) |
|
12차 개정 |
2013. 3.23. |
- 정부조직법 개정에 따라 관련 부처 간 업무 분장 조정 ※ 생명공학육성기본계획 수립 및 종합 조정 등의 업무를 교육과학기술부에서 미래창조과학부로 이관 등 |
법 제정 이후 유전공학기술이 급속히 발전하고 단백질공학기술, 생물공정기술 등이 중요해지면서, 단순히 유전공학이라는 이름만으로 생명공학 기술 전반을 담을 수 없었다. 이러한 한계를 극복하기 위해 1995년에 제명을 ‘생명공학육성법’으로 변경하고, 생명공학 기술영역을 재정의하였다(3차 개정). 1997년에는 생명공학의 기초인 유전체를 생명공학의 기술영역에 포함하도록 재조정하고 생명공학육성시책을 강구할 관계부처에 해양수산부를 추가(5차 개정) 했는데 이는 당시 생명과학의 발전상을 반영한 조치이다.
이어 2003년에는 생명공학의 효율적 육성을 위해 기초의과학을 정책대상에 포함시켰으며, 이를 육성하고자 기초의과학육성기구를 지정 및 육성할 수 있는 근거를 마련했다(7차 개정). 2011년 개정에서는 정책 조정기구인 ‘생명공학종합정책심의회’의 심의 사항에 뇌연구촉진법상 폐지된 ‘뇌연구촉진기본계획’에 관한 사항을 추가했다(11차 개정). 마지막 중요한 개정은 2013년 개정으로, 과학기술과 정보통신부처를 통합하는 정부조직법 개정에 따라 생명공학육성기본계획 수립 및 종합 조정 등의 업무를 교육과학기술부에서 미래창조과학부로 이관하는 등 생명공학 육성에 관련한 부처간 업무를 재조정한 것이다.
(3) 생명공학육성법의 한계점
기존 생명공학육성법은 제한적 개정에 따른 일반법으로서의 위상 약화의 문제, 시대 흐름을 반영하지 못하는 생명공학에 대한 용어 정의, 생명공학 기반조성에 미흡한 규정 및 법률체계상 한계가 있었다.
먼저, 앞서 살펴본 바와 같이 1983년에 제정된 생명공학육성법은 그간 14차례 개정에도 불구하고 관계부처를 추가하거나 관계부처간의 업무를 조정하는 등 제한적인 범위에서 개정 하거나 기존의 규정을 다소 보완하는 등의 개정만이 이루어졌다.
이로 인해 2017년까지의 생명공학육성법은 여전히 연구개발 지원 중심의 법률체계와 더불어 제한적인 범위의 육성, 지원근거로 인해 바이오 전 분야를 포괄하는 일반법으로서의 위상을 가졌다고 평가하기 어려운 실정이었다.
생명공학에 대한 용어 정의 역시 시대 흐름을 반영하지 못하고 있었다고 평가할 수 있다. 제정 당시 ‘유전공학’을 ‘유전자재조립․세포융합․핵치환 등의 기술과 발효기술․세포배양기술 등을 사용하여 생명과학분야산업 발전을 도모하기 위한 학문과 기술’로 정의하고 있었으나, 2003년 개정시 ‘생명공학’을 정의하는 규정으로 변경하였다. 그러나 2003년 개정이후 ‘생명공학’에 대한 정의는 10여년을 지난 후까지도 변경된 적이 없어서 IT, NT 등과의 융합되어 새로운 가치 창출과 비즈니스를 정립하는 측면에서 한계가 있었다.
마지막으로, 생명공학 기반조성에 미흡한 규정 및 법률체계에 대한 한계점이 있었다. 기존 생명공학육성법은 생명공학연구의 기반을 조성하고 생명공학을 보다 효율적으로 육성 및 발전시키고 그 개발 기술의 산업화를 촉진하기 위해 제정된 입법목적을 가지고 있음에도 불구하고, 사업화 및 산업화, 기반조성을 촉진할 수 있는 근거 규정이 부족했다. 기존 법률에 사업화 및 산업화 촉진에 관한 규정은 있으나, 그 내용은 생명공학 관련 신기술제품 생산지원, 지역거점 구축 사항, 중소벤처 창업 지원 등 일반적이고 추상적인 내용만 규정되어 있을 뿐이었다.
또한 생명공학 분야를 활성화하기 위해서는 그 기초가 되는 연구개발이 활성화되어야 하는데 이를 체계적으로 지원할 수 있는 조항이 없어서, 과학기술기본법 등 타법을 인용하여 사용하는 등 그 체계가 미흡했다고 평가할 수 있다.
다. 개정의 주요 내용
최근 생명공학육성법 개정(2020.5.19.)을 통해, 생명공학육성 기반 강화 및 생명공학분야 연구개발과 사업화를 전주기적으로 지원하는 등 혁신적 바이오생태계 조성의 법적 근거를 마련하였고, 이어서 시행령을 개정하여 세부적인 기준과 절차를 규정하였다.
이번 생명공학육성법 개정은 연구개발부터 산업화에 이르는 전주기적 역량강화, 혁신적인 연구환경 조성을 목적으로 미래 신성장동력인 생명공학의 실질적인 성과를 창출하고 체계적으로 육성하기 위해 법적 근거를 정비하였다는 점에서 의의가 있다.
개정은 크게 4가지 측면에서 추진되었는데, 구체적으로는 생명공학 총괄 규범으로서의 위상을 확보하고, 데이터 증거기반의 시책을 신설하였으며, 생명공학 혁신을 유도하였다. 또한, 바이오 기술혁신과 신산업 창출에 지장을 초래하는 불필요한 규제를 개선할 수 있는 법적 근거를 마련하는 등 연구개발 측면에서의 규제과학을 추진하는 내용이 신설되었다.
(1) 생명공학 총괄 규범으로서 위상 확보
첫째, 생명공학 육성 및 산업발전의 주체로서 정부와 기업, 대학, 연구기관 등이 기술개발의 적극적인 수행과 그 성과가 산업적으로 유용하게 활용될 수 있도록 하는 책무를 신설하였다(법 제3조). 이와 같은 책무 규정은 법령으로 명확히 정하여 법령의 입법 목적을 효과적으로 달성하기 위함이며, 생명공학 육성과 발전에 관한 기본법 역할을 하는 생명공학육성법에 해당 규정을 두어 해당 법령이 달성하려는 정책의 수립과 집행의무를 명시적으로 부여하기 위함이다.4)
둘째, 생명공학육성기본계획에 중․장기 정책목표와 방향, 지식재산권 보호․활용 및 기술이전․사업화 촉진, 인력․정보․통계․시설 등 기반조성 및 지원에 대한 사항들도 추가로 포함하도록 규정하였다(법 제5조). 또한 동법 시행령에서 과학기술정보통신부장관은 기본계획을 수립하기 위하여 필요한 경우 관계중앙행정기관의 장, 지방자치단체의 장, 관련 교육․연구기관의 장 및 과학기술기본법 제11조에 따른 국가연구개발사업에 참여한 기업에 필요한 자료의 제출을 요청할 수 있는 근거를 마련하였다(영 제2조 제2항).
셋째, 생명공학종합정책심의회 운영 활성화를 도모하기 위해 심의사항을 사전에 검토하기 위한 실무위원회의 설치 근거를 마련하였다(법 제7조). 실무위원회는 생명공학분야 최고 의사결정 기구로서, 생명공학 분야 정책의 심도 있는 논의를 활성화할 수 있는 근거를 마련한 것이다. 실무위원회에 관한 규정은 2004년 6월 29일 개정시 삭제된 규정이었으나, 생명공학종합정책심의회 운영 활성화 측면에서 전문성 있는 생명공학 정책 심의를 위하여 실무위원회 및 분야별 소위원회를 추진할 수 있는 근거를 시행령에 다시 마련할 예정이다.
해당 규정들은 바이오 신기술의 체계적인 개발과 활용을 도모하기 위해 생명공학 육성 및 산업 발전 주체를 명확히 하고 보다 내실 있는 정책의 수립을 위해 정책 추진체계를 보완하였다는 점에 의의가 있다.
(2) 데이터 증거기반의 시책 신설
(가) 실태조사 추진 근거 마련(법 제9조)
정책수립을 위해 구체적인 정량․정성 정보들의 확보를 위한 실태조사(법 제9조)를 실시할 수 있는 근거를 마련하였다.
급변하는 바이오 기술발전과 생태계 혁신의 추세를 파악하기 위해서는 필요에 맞게 기존자료를 재가공, 취합하는 형태의 실태조사가 필요하다는 점을 기반으로 하였으며, 분류체계가 갖춰져서 주기적으로, 그리고 정형화된 형태로 이루어지는 통계조사와는 달리 변화하는 환경에 대한 다양한 요인을 빠르게 조사․분석할 수 있을 것으로 예상하고 있다.5)
[표 4-2] 실태조사, 정보 수집
구분 실태조사 생명공학정보 통계 법령 ◯법 제9조 ◯법 제19조 ◯법 제21조 조사 목적 ◦주기적으로 업데이트되는 통계 등의 정보 외에 정책수립을 위한 구체적인 정성․정량 정보 확보 ◦산․학․연․의료기관 등 혁신주체가 생성한 생명공학 관련 정보의 수집․관리 및 활용 ◦지속적․체계적으로 관리하여 그 추이를 관찰할 수 있는 정량화된 정보의 조사․분석 조사 항목 (예시) -정책 등에 대한 애로 및 건의 -신규채용 계획 여부 -창업경험 여부 -정부지원 만족도 -정책․기술동향 -연구참여인력(학력, 경력 등), 논문 및 특허정보 -우수성과정보 -바이오산업 시장규모 -업체당 평균 매출액 -기업 종사자 수 -바이오산업 투자비
출처: 생명공학정책연구센터 내부자료를 바탕으로 저자 작성.
해당 규정의 시행을 위해 시행령 개정 또한 추진하고 있는데, 실태조사의 실시 절차(사전통지) 및 방법(현장조사, 서면조사, 통계조사 또는 문헌조사 등)을 마련하고 있다. 시행령 개정을 통해 실태조사의 방법 등이 명시되면, 향후 생명공학기술개발 및 관련 인력․인프라 등 생명공학 관련 다양한 요인들의 실태조사 결과를 토대로 국내의 정확한 현황과 특성을 파악하여 보다 실효성있는 정책수립이 가능할 것으로 기대된다.
(나) 생명공학 관련 정보조사분석 추진 근거 마련(법 제19조)
산․학․연․의료기관 등 혁신주체가 생성한 생명공학 관련 정보의 수집․관리 및 활용을 위한 정보조사분석(법 제19조)을 추진할 수 있는 근거를 마련하였다.
국내 바이오산업 생태계에 대한 데이터 축적이 매우 미흡하였기 때문에 근거 기반의 정책 수립을 위해서는 무엇보다 데이터 확보와 관리가 필요했다. 특히, 연구현장에서는 분산된 생명공학 정보(투자, 기술수출, 장비시설 등)에 대한 통합적 서비스를 요구하여, 산․학․연․의료기관 등 혁신주체가 생성한 생명공학 관련 정보의 수집․관리 및 활용하고자 해당 규정이 마련되었다.
해당 규정 신설을 통해 여러 기관에 분산되어 있는 생명공학 분야의 정보를 수집하여 시스템을 통해 통합 관리함으로써 정책 수립 시 효율적으로 반영할 수 있다는 점에 의의가 있다.
(다) 생명공학 분류체계의 수립(법 제20조)
부처별로 목적과 기술범위에 따라 상이한 분류체계를 재정의(법 제20조)하였다. 기존에는 과학기술정보통신부, 산업통상자원부, 보건복지부별로 기술범위와 분류를 하고 있었다. 예컨대, 과학기술정보통신부에서는 ‘국가과학기술 표준분류체계’, 산업통상자원부에서는 ‘생명공학기술 분류체계’, 보건복지부에서는 ‘보건의료기술(HT) 표준기술분류체계’로 정의하여 각각 추진 중이었다. 이로 인해 부처별 분류체계를 독립적으로 활용할 수는 있으나 상호 연결․연계가 어려운 한계가 있었다. 이에 따라 생명공학 분야의 정보․인력․기술․제품․서비스 등의 효율적인 관리를 위하여 생명공학 분류체계를 수립할 수 있는 근거를 마련한 것이다.
해당 규정의 신설을 통해 생명공학 분류체계의 수립을 통해 정보․인력․기술․제품․서비스 등을 체계적으로 관리하고 정책 수립의 효율성을 제고할 수 있을 것으로 기대된다.
(라) 통계조사 근거 마련(법 제21조)
내실있는 생명공학 분야 정책 수립을 뒷받침할 수 있도록 바이오 분야 환경변화를 확인하는 다양한 조사를 추진할 수 있는 근거를 마련하였다.
먼저, 지속적․체계적으로 관리하여 그 추이를 관찰할 수 있는 정량화된 정보의 조사분석인 통계조사(법 제21조) 근거가 마련되었다. 기존에는 과학기술 전반적인 통계에서 생명공학 관련 통계를 참고하는 수준으로, 생명공학에 특화된 통계가 미흡했다. 또한, 다양한 기관에서 조사목적에 따라 작성된 통계들도 존재하여 통일된 관점에서 체계적으로 종합한 통계 역시 부재했다는 한계가 있었다.
이에 따라, 생명공학 기술개발 및 산업화 정책을 효율적으로 수립하기 위하여 관련 통계를 조사․분석․유지할 수 있는 법적 근거를 마련한 것이다. 해당 규정을 토대로 생명공학 통계를 체계적이고 일관되게 관리하여 효과적인 생명공학 정책수립 및 관련 R&D사업의 체계적 지원․육성을 도모할 수 있을 것으로 기대된다.
(3) 생명공학 지원 강화 및 연구 생태계 활성화
생명공학에 대한 정부연구개발을 추진할 수 있는 직접적인 근거조항(제11조)을 신설하였으며, 국가적으로 중요한 유망범용기술6)의 지원 및 이들의 기술이전과 사업화 촉진(제15조)을 강화하였다.
또한, 개방과 협력을 통한 연구자 주도의 공동․융복합 연구 생태계 활성화를 위해 공동․융복합 연구(제12조)를 강화하였다. 공동․융복합 연구는 2개 이상의 기관의 공동연구나 학제(學際)간 또는 기술․산업 간의 연계로 새로운 가치를 창출하는 연구를 의미하는데, 바이오와 화학이 융합한 생분해성플라스틱, 바이오와 IT가 융합한 바이오칩, 바이오와 의학이 융합한 재생의학 등의 융복합 사례로 들 수 있다.
해당 규정을 기반으로 하여 연구 주체․분야 간 활발한 공동․융복합 연구를 통해 신기술․신산업을 창출하고 4차 산업혁명을 주도할 수 있을 것으로 기대된다.
(4) 연구개발 측면에서의 규제과학 추진
(가) 기술영향평가 추진 근거 마련(법 제10조)
법률상 바이오 혁신기술에 대한 경제․사회․윤리 등에 미치는 영향을 사전에 평가하는 기술영향평가를 추진하는 내용이 신설되었다(법 제10조).
기술영향평가는 새로운 과학기술의 발전이 경제․사회․문화․윤리․환경 등에 미치는 영향을 사전에 평가하는 것으로서, 그간 과학기술기본법(제14조 제1항)에 근거하여 한국과학기술기획평가원(KISTEP)에서 기술영향평가를 수행 중이다. 하지만 정보통신기술(10건)에 비해 바이오분야의 기술영향평가는 절반수준(5건)에 불과하는 등 생명공학혁신기술에 대한 미래 대응태세가 부족하다는 한계점이 있었다.
이에 따라 생명공학육성법에 추진 근거를 명시하여 생명공학의 미래 혁신기술에 대한 사회 전반에 미치는 영향을 사전에 평가하고, 대응방안을 마련하기 위한 기술영향평가를 추진하고자 한 것이다. 해당 규정의 신설로 생명공학분야 신기술이 사회 전반에 미치는 파급효과 등을 미리 파악하여 정책 수립에 반영할 수 있다는 점에서 개정 의의가 있다.
(나) 규제 합동개선반 추진 근거 마련(법 제22조)
법률상 기술혁신과 신산업 창출에 지장을 초래하는 불필요한 규제를 발굴하고 이해관계자와 전문가 등의 의견을 수렴하여 개선방안을 마련하였다(법 제22조).
이를 위해 시행령 개정 시 관계중앙행정기관 소속 직원과 생명공학 규제 이해관계자․전문가로 구성되어 바이오규제 이슈를 종합적으로 분석․개선하는 민․관 협의체를 의미하는 ‘규제 합동개선반’ 개념을 도입하고자 하였다.
규제 합동개선반 운영을 통해 생명공학 분야의 기술혁신과 산업발전을 저해하는 규제들을 개선할 수 있도록 관계중앙행정기관들이 노력할 수 있는 계기를 마련할 수 있을 것이며, 범부처 차원의 적극적 규제개선활동을 통해 바이오 혁신성장을 촉진할 수 있을 것으로 기대된다.
라. 향후과제 및 결론
바이오기술은 고령화․감염병․식량안보 등 인류가 당면한 문제들을 해결해 줄 수 있는 유일한 대안으로 강조되고 있다. 더욱이 이번 신종 코로나 바이러스가 팬데믹으로까지 확대되어, 바이오가 ‘국민생명 및 국가안보’에 어느 때 보다 중요하게 대두되고 있다. 이에 정부는 바이오산업을 국가 3대 중점육성산업으로 육성하고 있고, 실제 코로나19 대응에서 보듯이 우리 기술은 이제 세계적인 주목을 받고 있다. 이 시점에서 생명공학육성법 개정을 통해 기술혁신과 산업화라는 두 개의 수레바퀴로 바이오산업에 보다 체계적이고 균형 잡힌 지원이 가능해졌다는 점에서 그 의의가 크다.
다만, 생명공학육성법이 향후 해결해야 할 과제는 여전히 남아 있다. 법 제14조의 실험지침 관련 조항은 현재 사문화된 규정으로 그 활용성이 낮은 상황이다. 그러나 이미 등장한, 그리고 앞으로 등장하게 될 새로운 혁신기술과 관련하여 실험지침을 수립하여 연구방향 및 윤리, 데이터 관리 등의 방향성을 제시할 필요가 있다. 따라서 혁신기술과 관련된 연구 분야에 대하여 실험지침의 효율적 수립 및 활용이 요구될 것이므로 향후 관련 조항의 개정이 필요할 것으로 보여진다.
생명공학육성법이 바이오 분야의 변화무쌍한 기술혁신과 변화속도에 지속적으로 대응하기 위해서는 기술의 혁신과 제도의 혁신이 함께 요구되는 기술과 제도의 공진화(coevolution)에 대해서도 지속적인 고민이 필요하다.
생명공학육성법은 최근 개정 당시 일부개정의 형태로 개정되었으나, 개정내용을 면밀히 살펴보면 전면개정에 가까운 구조변화7)가 있었다. 기존 생명공학육성법이 그간 14차례 개정에도 불구하고 여타 기술진흥법처럼 생명공학 분야 연구를 육성하고 진흥하기 위한 여러 근거 시책들을 마련해오지 못했기 때문에 4차 산업혁명, 바이오경제 등 최신의 패러다임을 변화에 대응8)하기 위한 대대적인 개정이 이루어진 것이다.
이번 개정을 통해 바이오 분야 기술혁신을 촉진함으로써 바이오경제 실현과 국민의 삶의 질 향상에 기여할 것으로 예상된다. 특히 바이오 분야에 대한 전주기적 지원을 강화함으로써 기술 확보부터 재투자에 이르는 바이오 생태계가 튼튼하게 조성되어, 궁극적으로 바이오산업이 국가 기간산업으로 성장하는 발판이 마련될 것으로 기대해 본다.

1. 개요
1990년대 중반 제초제내성 콩을 미국에서 최초로 상업화하여 유통한 이후 제초제내성, 해충저항성 등 경작에 도움을 주는 형질을 갖춘 콩, 옥수수, 목화, 카놀라 등 유전자변형작물을 재배하는 국가 및 재배면적은 2019년 말 기준 전 세계 29개국, 1억 9,040만 ha에 달하고 있다. 또한, 허가나 승인 등 자국의 법적 절차를 거쳐 유전자변형농산물을 식품 또는 사료 원료로 사용하는 국가는 재배국을 포함하여 총 72개국에 달한다. 콩, 옥수수 등 농산물 자급률이 매우 낮은 우리나라에서는 매년 1,000만 톤 이상 유전자변형농산물을 수입하고 있다.
이와 같이 유전자변형농산물이 국내외에서 많이 재배, 생산, 유통됨에 따라 국제사회에서는 2003년 9월 발효한 바이오안전성에 관한 카르타헤나의정서를 중심으로, 우리나라는 2008년 1월부터 시행하고 있는 유전자변형생물체의 국가간 이동 등에 관한 법률을 중심으로, 세계 각국은 자국의 환경과 여건에 적합한 법률과 제도를 갖추어 유전자변형생물체의 국가간 이동 및 국내 유통에 따른 안전관리를 추진하고 있다.
이에 따라 본 절에서는 2019년 하반기부터 2021년 상반기까지 유전자변형생물체를 둘러싼 국제사회 및 주요국, 우리나라의 법․제도 관련 최근 동향과 이슈를 중심으로 서술한다.
2. 해외 동향
가. 카르타헤나의정서 동향
제9차 카르타헤나의정서 당사국회의(2018.11, 이집트) 이후 제10차 당사국회의(2020.10, 중국 예정)를 준비하기 위한 다양한 전문가회의 및 위원회가 개최되었다. 하지만 코로나19 팬데믹으로 인하여 2020년 3월 이후에는 각종 회의가 연기되거나 온라인으로 개최되었다.
[표 4-3] 카르타헤나의정서 관련 주요 회의 일정(2019∼2021)
|
일시 |
회의명 |
장소 |
|
2019. 5.29.∼31. |
제16차 카르타헤나의정서 의무준수위원회 |
캐나다 몬트리올 |
|
2019. 6. 4.∼ 7. |
합성생물학 특별기술전문가그룹회의 |
캐나다 몬트리올 |
|
2019.10.22.∼25. |
제13차 카르타헤나의정서 리아종그룹회의 |
캐나다 몬트리올 |
|
2019.12.10.∼13. |
사회․경제적고려 특별기술전문가그룹회의 |
오스트리아 빈 |
|
2020. 2. 4.∼ 7. |
제6차 UNEP-KBCH 공동워크숍 |
인도 뉴델리 |
|
2020. 4.15.∼17. |
제17차 카르타헤나의정서 의무준수위원회 |
온라인 |
|
2020. 4.20.∼23. |
제14차 카르타헤나의정서 리아종그룹회의 |
온라인 |
|
2020.11.16.∼27. |
제1회 카르타헤나의정서 특별당사국회의 |
온라인 |
|
2020.12. 1.∼ 4. |
제11차 BCH 특별자문위원회 회의 |
온라인 |
|
2021. 5. 3.∼ 6.13. |
제24차 과학기술자문보조기구 회의& 제3차 이행보조기구 회의 |
온라인 |
|
2022. 4.(미정) |
제10차 카르타헤나의정서 당사국회의 |
중국 쿤밍 |
의무준수위원회는 카르타헤나의정서 제34조에 근거하여 설치되었고, 당사국에게 의무준수와 관련된 조언 및 지원을 하며, 국가별 보고서를 검토하고 역량강화 등 필요한 조치를 취하도록 권고하는 등의 역할을 수행한다. 2019년 5월에 열린 제16차 위원회에서는 국가보고서 미제출 국가에 대한 지원 및 권고 사항을 다루었고, 국제바이오안전성정보센터에 각국의 정보를 등록하고, 기등록한 정보의 결점 등에 대해서도 검토할 것을 독려하였다. 2020년 4월 온라인으로 개최한 제17차 위원회에서는 국가보고서 제출 비율이 저조함에 우려를 표하면서 미제출 국가들에 대해 취할 수 있는 조치를 논의하고 제10차 당사국회의에 제출할 의무준수위원회 권고안을 채택하였다.
카르타헤나의정서 리아종그룹회의는 카르타헤나의정서 전략계획(2011∼2020) 등을 효과적으로 이행하기 위해 설치되어 활동하였으나 최근에는 제9차 당사국회의 결정에 따라 2020년 이후 글로벌 생물다양성 프레임워크 구성 및 바이오안전성 전반적인 의제를 사전검토 하는 소규모 특별전문가그룹회의이다. 이 회의에 우리나라는 한국바이오안전성정보센터에서 참여하고 있다. 2019년 10월에 몬트리올에서 개최된 제13차 리아종그룹회의에서는 카르타헤나의정서 이행계획 및 역량강화 활동 계획(2021∼2030)을 검토하고, 2020년 이후 글로벌 생물다양성 프레임워크에 포함될 바이오안전성 분야 의제를 논의하였다. 2020년 4월 온라인으로 개최한 제14차 리아종그룹회의에서는 카르타헤나의정서 전략계획(2011∼2020), 카르타헤나의정서 이행 실효성 등을 평가하고 책임․구제 추가의정서 인식 제고 및 가입 지원 필요성을 강조하면서 제10차 당사국회의에 제출할 권고안을 채택하였다.
유엔환경계획(UNEP)과 한국바이오안전성정보센터(KBCH)는 2008년 이후 개도국 역량을 강화하고 지원하기 위한 워크숍을 정기적으로 개최하고 있다. 2020년 2월에 인도 뉴델리에서 개최한 제6차 워크숍에는 UNEP, KBCH 관계자와 아시아 11개국 등 총 34명이 참석하였다. 워크숍에서는 각국의 바이오안전성정보센터 운영 경험을 공유하고 국제바이오안전성정보센터에서 제공하는 교육프로그램을 진행하였다. 또한, 2021년 이후 아시아 바이오안전성 지역협력 강화를 위한 UNEP 프로젝트 시행계획을 공유하고, 각국의 협조를 요청하였다.
2020년 10월 개최 예정이었던 제10차 카르타헤나의정서 당사국회의가 2021년 10월로 잠정 연기되면서 2020년 11월에 온라인으로 진행한 특별당사국회의에서는 2021년 카르타헤나의정서 사무국 운영비용 및 각종 프로그램에 활용될 당사국 분담금 규모를 확정하였다. 또한, 2020년 12월에 온라인으로 개최한 제11차 BCH 특별자문위원회 회의에서는 새롭게 개발되고 있는 국제바이오안전성정보센터 홈페이지 개편과 관련한 문제를 집중적으로 논의하였다.
과학기술자문보조기구(SBSTTA: Subsidiary Body for Scientific, Technical and Technological Advice)는 생물다양성협약과 관련한 과학․기술의 정보와 자문을 제공하는 역할을 수행하는 자문기구로 1995년 제1차 회의를 시작으로 거의 매년 개최되고 있다. 이행보조기구(SBI: Subsidiary Body on Implementation)는 생물다양성협약과 부속의정서들의 효과적인 이행을 위한 전략 수립 및 진행상황 점검 등의 역할을 수행하는 자문기구로 2016년 제1차 회의를 시작으로 2년 또는 3년의 기간을 두고 개최되고 있다. 이 두 가지 기구는 당사국회의에서 의제 논의를 효과적으로 진행하기 위한 사전검토를 수행하는 핵심 기구라 할 수 있다.
코로나19 팬데믹이 계속됨에 따라, 생물다양성협약 및 카르타헤나의정서 사무국은 당사국 모두 참가 가능한 온라인 회의로 운영 방식을 변경하고 2021년 5월 3일부터 6월 13일까지 제24차 SBSTTA 및 제3차 SBI를 온라인으로 개최하였다. 이번 회의에서 카르타헤나의정서와 관련해서는 합성생물학과 유전자변형생물체의 위해성 평가 및 관리(SBSTTA), 카르타헤나의정서 실효성 평가 및 재검토(SBI) 의제가 논의되었다. 우리나라는 카르타헤나의정서 국가책임기관인 산업통상자원부를 비롯해 한국바이오안전성정보센터, 농촌진흥청, 국립생태원, 국립해양생물자원관 등이 중심이 되어 우리나라의 입장 발언 및 의제 대응, 모니터링을 진행하였다.
당사국들은 합성생물학과 관련해 최근 기술발전 및 긍정적, 부정적 영향에 대한 포괄적이고 정기적인 전수조사 및 모니터링, 평가 프로세스 수립에 합의하였으나, 전수조사의 시기 및 효과성 검토 시기 등 프로세스 이행에 관한 구체적인 합의에는 이르지 못하였다. 프로세스 이행을 위한 다분야 전문지식의 필요성 및 다분야 기술전문가 그룹의 설립 필요성에 대해서는 공감대를 형성하였으나, 다분야 기술전문가그룹의 기능 및 역할, 이행방안, 위임사항 등 구체적인 사항에 대해서는 합의하지 못하고 괄호(bracket) 처리하였다. 우리나라는 포괄적이고 정기적인 전수조사, 모니터링, 평가 프로세스 수립 및 다분야 기술전문가그룹의 설립을 지지한다는 입장을 밝혔다.
유전자변형생물체의 위해성평가 및 관리와 관련하여 대부분의 국가들이 유전자 드라이브(gene drive)를 포함한 유전자변형생물체에 대한 위해성평가 가이던스 개발에 대해 찬성했으나, 일본, 영국 등의 반대로 결정문에서는 괄호(bracket) 처리된 채 마무리 되었다. 우리나라를 비롯하여 말레이시아, 벨라루스 등은 유전자 드라이브를 포함한 유전자변형생물체 뿐만 아니라 유전자변형 어류의 위해성평가 가이던스도 만들어야 한다고 주장했으나 대다수의 국가들이 반대하였다. 그러나 절충안으로 유전자변형 어류와 관련된 국제협력 및 정보공유, 역량강화 등을 활발히 진행하도록 권장하자는 문구가 결정문에 삽입되었다. 카르타헤나의정서의 실효성 평가 및 재검토와 관련해 카르타헤나의정서의 이행과 관련한 12개 주제에 대해 당사국들의 발언이 진행되었다. 우리나라는 제4차 국가보고서 제출을 촉구하고 지난 코리아 바이오안전성 역량강화 이니셔티브(2015∼2020) 활동을 소개하면서 지역 내 협력 및 역량강화를 강조하였고, 관련 내용이 결정문에 반영되었다.
한편, 1년 정도 연기하여 2021년 10월 개최하기로 계획했던 제10차 카르타헤나의정서 당사국회의는 코로나19 펜데믹 등으로 사실상 개최가 불가능하게 되어, 2022년 4월 중국 쿤밍에서 개최하는 것으로 잠정 결정하였다.
나. 주요국 법·제도 동향
미국은 1986년에 발표한 ‘생명공학기술 규제를 위한 협력 체계’(Coordinated Framework for Regulation of Biotechnology, 이하 ‘협력 체계’)를 바탕으로 기본적인 유전자변형생물체 규제 방침 및 체계를 마련하였고, 유전자변형생물체의 특성에 따른 관계기관 및 역할 등을 규정하여 유전자변형생물체를 관리해 왔다. 그리고 2017년 4월에는 최신 과학에 근거한 인체 및 환경 보호 기준 마련, 협력 체계의 효율성 증진, 생명공학제품 감독에 대한 대중의 신뢰 향상을 목적으로 각 기관의 역할과 책임을 명확히 하는 협력 체계 개선안을 마련한 바 있다.
2019년 트럼프 대통령은 유전자변형작물 개발을 장려하기 위해 개발, 시험, 허가 절차를 간소화 하는 행정명령인 농업생명공학 제품에 대한 규제 프레임워크 현대화를 발표하였고, 농업부(USDA)는 협력체계개선(안)과 행정명령에 따라 2020년 5월 SECURE Rule(Sustainable, Ecological, Consistent, Uniform, Responsible, Efficient Rule) 최종안을 마련하였다. ‘SECURE Rule’의 목적은 투명하고 일관된 과학에 근거하여 위험에 비례하는 규제 시스템을 통해 생명공학기술의 개발과 가용성을 촉진하고, 오래되고 중복된 절차를 제거하여 농업부의 식물생명공학 규제 현대화를 도모하기 위함이다. 이에 따라 유전자가위 등 바이오신기술을 활용한 산물들의 재배와 관련한 규제가 대폭 완화되었다. 식약청(FDA)과 환경청(EPA) 등 협력기관들도 유전자가위 등 바이오신기술과 관련한 규제 개선 노력을 진행하고 있다.
캐나다는 과학을 기반으로 생명공학기술이 적용된 농업제품을 승인하고 있으며, 별도의 규제를 제정하지 않고 기존 법률에 따라 상황에 맞는 가이드라인을 마련하여 관리하고 있다. 식물은 규제 체계상 새로운 형질을 갖는 식물(PNT: Plants with Novel Traits), 신식품(novel food), 유전자변형식품, 신사료(novel feed)로 분류되어 관련 법과 가이드라인을 따르고 있으며, 규제 및 승인은 식품검사청(CFIA)과 보건부(HC)에서 관장하고 있다. 생명공학 유래 동물은 환경보호법에 따라 환경기후변화부(ECCC)와 보건부가 공동으로 평가와 승인을 담당하며, 어류에 관련해서는 해양수산부(FOC)가 관여하고 있다.
2020년 10월 식품검사청과 보건부는 규제에 대한 접근 절차를 용이하게 하고 투명성을 높이기 위하여 규제 절차에 필요한 정보를 미리 확인하고 준비할 수 있도록 하는 신식품, 신사료, 새로운 형질을 갖는 식물(PNTs)의 승인 절차 전 사전에 검토할 수 있는 절차 가이드라인(Pre-submission Consultation Procedures for Novel Foods, Novel Feeds and Plants with Novel Traits)을 마련하였다.
중국은 농업유전자변형생물체 안전관리조례, 농업유전자변형생물체 안전관리방법, 농업유전자변형생물체 수입안전관리방법, 농업유전자변형생물체 표시관리방법 등을 통해 유전자변형생물체 안전관리를 시행하고 있다. 2020년 10월 전국인민대표대회 상무위원회는 유전자변형생물체 안전관리를 총괄하는 생물안전법을 마련하였다(2021.4.15. 발효). 생물안전법에는 생명공학연구, 개발 및 응용 안전에 대한 내용이 포함되어 있으며, 농업유전자변형생물체의 안전 분류 및 관리, 평가 시스템을 도입하여 농업농촌부에서 관리하도록 하고 있다. 또한, 외국인 투자 접근을 위한 특별 행정조치에 따라 농축수산 유전자변형생물체 생산․재배 및 유전자변형종자 생산은 외국인 투자금지 분야가 되었다.9)
일본은 카르타헤나의정서 국내이행법인 카르타헤나법을 통해 유전자변형생물체를 제1종 사용(환경방출용)과 제2종 사용(폐쇄계이용)으로 구분하여 환경성, 농수산성, 후생노동성, 경제산업성 등 해당 부처에서 관리하며, 꾸준한 규제 검토를 통하여 관리 체계를 정비하고 있다. 일본은 2020년 상반기에 유전자가위산물 안전관리와 관련하여 카르타헤나법의 개정 없이 환경부, 농림수산성, 후생노동성 등의 고시를 통해 안전관리를 하도록 하였다. 외래 유전자의 도입이나 잔존이 없는 산물인 경우에는 사전상담 절차 등을 통해 해당 생물체의 명칭, 개요, 용도, 외래 유전자가 없다는 근거, 게놈편집 방법 등 기본적인 정보와 함께 생물다양성 영향 발생 가능성에 대한 정보를 제출하도록 하고 있다. 그 결과 최초로 2020년 12월에 GABA 함유량이 증가된 토마토(유전자가위적용 산물)에 대한 정보제공서가 제출되었으며, 일본 최초 유전자가위산물의 상업화가 이루어져 2021년 하반기부터 본격적인 유통을 준비하고 있다.
3. 국내 현황
가. 유전자변형생물체 안전관리
우리나라는 유전자변형생물체의 국가간 이동 등에 관한 법률(이하 유전자변형생물체법, 2008.1. 시행)을 기본으로 유전자변형생물체 안전관리를 하고 있다. 유전자변형생물체법은 유전자변형생물체의 연구개발, 위해성평가 및 심사, 수입, 생산, 수출, 보관, 유통, 환경영향조사 등에 따른 안전관리 내용을 규정하고 있으며, 유전자변형식품인 경우에는 식품위생법에 따른 안전성평가 및 심사, 표시 등의 규정을 따르도록 하고 있다.
유전자변경생물체법은 2018년 12월 생산공정이용 안전관리 대상을 미생물에서 생물체 전체로 확대하였으나 이후 추가적인 개선이 이루어진 바 없다. 다만, 외래 유전자 도입이 없거나 잔존하지 않은 바이오신기술(유전자가위 등) 산물 안전관리와 관련한 규제 개선 작업은 현재 추진 중이다. 유전자변형생물체법 시행령은 2020년 9월에 이미 심사를 완료한 유전자변형생물체를 다른 용도로 활용할 경우 위해성심사 절차를 간소화하는 내용을 담아 개정된 바 있다. 그 결과 2021년 5월에 식품용이나 사료용으로 이미 승인된 유전자변형옥수수 90건을 산업용으로 변경하여 승인하는 절차를 완료하였다.10)
나. 유전자가위 적용 산물 안전관리 규제 개선 추진
우리나라가 유전자가위 등 바이오신기술에 대한 논의를 정부 차원에서 본격적으로 시작한 것은 2015년 국가과학기술심의회 기술영향평가를 통해서였다. 당시에는 유전자변형생물체법, 식품위생법 등 국내 유전자변형생물체 안전관리제도에서 유전자가위기술 적용 산물들이 형태별로 어떻게 해석되고 있는지 불분명 했었다. 외래유전자 도입이 없는 유전자가위기술 적용 산물은 외래유전자 도입이 있는 유전자변형생물체에 비해 안전하고 돌연변이에 가까우므로 기존 유전자변형생물체 규제보다 완화된 규제를 적용하거나 규제 면제를 해야 한다는 의견이 있었던 반면, 유전자가위기술이 적용되어 상업화된 사례가 없고, 규제 대상에서 제외시킬 수 있을 만큼 해당 기술의 안전성에 대한 과학적 근거자료가 아직 불충분하여 면밀한 검증이 필요하다는 의견도 있었다.
이후 2016년 3월 국무조정실 신산업투자위원회 바이오헬스분과위원회에서는 유전자교정 동․식물 가이드라인 마련에 대한 건의 과제를 채택 및 심의하였다. 이에 산업통상자원부는 관계부처 실무자로 구성된 바이오안전성위원회 실무위원회를 통해 유전자가위기술 안전관리 및 상업화 방안에 대해 몇 차례 세미나 및 회의를 개최하였고, 추가적인 논의를 위해 2019년 1월에 산업부, 과기정통부, 농식품부, 환경부, 해수부, 복지부, 식약처 등 관계부처와 바이오안전성정보센터, 국립생태원, 국가연구안전관리본부 등 공공부문이 참여한 유전자가위 등 바이오신기술 규제 개선 TF를 구성, 발족하였다. TF는 6차례 회의를 통해 규제 개선 방향을 담은 최종보고서를 2019년 8월에 채택하였다.
[표 4-4] 유전자가위 등 바이오신기술 규제 개선 TF 활동 개요
|
회의명 |
활동개요 |
|
(2019년 3월 6일) 제1차 회의 |
- 유전자가위기술 적용 산출물이 유전자변형생물체에 해당하는지 논의 - 유전자가위기술 적용 범위(SDN1, 2, 3)와 안전관리 수준에 대한 논의 |
|
(2019년 4월 3일) 제2차 회의 |
- 일본 환경성 및 후생노동성의 유전자가위 규제 개선 발표 내용 분석 - 카르타헤나의정서 및 주요국 유전자변형생물체 정의 분석 -카르타헤나의정서 및 우리나라 유전자변형생물체법에 따르면 외래 유전자가 포함되지 않더라도 유전자변형생물체에 해당한다고 판단(유전자변형생물체법 안에서 관리 필요) -외래 유전자 도입이나 잔존 없는 경우 규제 완화 등 안전관리 방안에 대한 다양한 논의 |
|
(2019년 5월 8일) 제3차 회의 |
-병원미생물에 유전자가위기술을 적용할 경우에 대한 논의 (규제 완화 곤란) |
|
(2019년 6월 12일) 제4차 회의 |
- 유전자변형생물체법 개정안 여러 버전 마련 공유, 검토 |
|
(2019년 7월 4일) 제5차 회의 |
-한국육종학회 주관 유전자가위 심포지엄 특별세션 참석 / 다양한 의견 공유 |
|
(2019년 8월 12일) 제6차 회의 |
- 유전자가위 등 바이오신기술 규제 개선 TF 활동 보고서 검토 및 채택 |
여섯 차례의 TF 회의를 거쳐 유전자변형생물체법 개정 방향이 설정되었으며, TF 회의 제안에 따른 전문가회의 등을 통해 유전자변형생물체법 개정 방향에 대한 과학적, 법률적 자문을 받았다. 이후 개정안 초안을 마련하는 과정에서 과학계, 시민단체, 언론미디어 분야의 의견을 수렴하였고(언론미디어 대상 세미나(2019.6.27., HJ비즈니스센터 광화문), 유전자가위기술에 대한 시민사회 여론과 인식조사(2019.7.) 및 열린 토론회(2019.8.2., 서울 NPO 지원센터), 유전자교정 규제 관련 과학자 토론회(2019. 8.21., 미래식량자원포럼)), 2019년 12월 10일에는 서울 삼경교육센터에서 유전자가위 등 바이오신기술 적용 산물 규제개선 대토론회를 개최하였다. 대토론회에서는 과학자들이 바라본 유전자가위의 안전성, 유전자가위에 대한 국민의 수용도, 생명공학기술의 발전과 언론의 역할, 유전자가위기술 규제의 국제조화 필요성, 유전자가위기술 연구개발 규제 방향, 유전자가위기술 적용 병원체의 유전자변형생물체법 적용 여부에 대한 입장, 유전자가위 등 바이오신기술 규제 개선을 위한 유전자변형생물체법 개정 방향 등을 주제로 발표와 토론이 이루어졌다.
위와 같은 과정을 거친 후 2020년 1월부터 바이오안전성위원회 실무위원회는 유전자가위 등 바이오신기술 적용 산물 규제 개선을 위한 법안 마련 논의를 지속하였고, 2020년 6월 4일 유전자가위 규제 개선을 위한 관계부처회의를 통하여 사전검토제 도입을 주요 내용으로 하는 유전자변형생물체법 개정안 초안을 마련하였다. 해당 개정안 초안은 관계부처의 의견 수렴 과정과 바이오안전성위원회 실무위원회의 추가 검토 과정을 거쳐 2021년 2월 개정안 수립을 완료하고 정부입법을 추진하기로 결정하였다.
이에 따라 유전자변형생물체법의 소관부처인 산업통상자원부는 2021년 3월부터 부내 규제심사를 진행하였으며, 이후 국무조정실의 규제심사를 받아 2021년 5월 26일 유전자변형생물체법 개정안 입법예고를 하였다. 또한, 입법예고에 따른 국민 의견수렴 기간 중인 6월 29일 개정안 공청회를 서울상공회의소에서 개최하였다. 이후 2021년 7월 5일자로 국민의견수렴 기간이 종료되면서 산업계, 시민단체 등이 총 22건의 의견을 제출하였으며, 이메일 등을 통해 총 86건의 개정 반대의견이 제출되기도 하였다.
국가책임기관인 산업통상자원부와 유전자변형생물체 안전관리 관계부처는 제출된 의견을 종합, 반영 여부를 검토하고, 법제처 심사 등의 과정을 거쳐 유전자변형생물체법 개정안을 국회에 제출할 계획이다.
4. 발전 과제
과학기술, 특히 생명공학기술의 규제 정책은 국내 논의와 합의만으로 해결할 수 없는 측면이 있다. 이번 코로나19 팬데믹으로 위험(risk)이 발생할 때 국내에서 아무리 관리가 잘 된다고 하더라도 다른 나라에서 안전관리가 잘 이루어지지 않는다면 그 실효성이 감소할 수밖에 없다는 것을 모두 실감하였다.
따라서 생명공학기술 규제정책은 국제적 조화 및 공조가 필수적이기 때문에 국제적 조화와 발 맞추면서도 국내 이해당사자를 설득해야 하는 노력도 함께 기울여야 하는 이중적 구조를 갖고 있다. 유전자변형기술, 그리고 새롭게 등장한 유전자가위기술, 합성생물학과 같은 바이오신기술 역시 이러한 국제적 공조와 국내적 합의 절차, 그리고 다시 국제적 공조를 반복해야 하는 중층적 구조에 놓여 있다.
이런 여러 가지 상황 속에서 산업통상자원부 등 유전자변형생물체 안전관리 관계부처는 국제적 공조, 국내 여건 등을 고려하여 유전자가위기술 등 바이오신기술 적용 산물을 안전하게 관리하기 위해 몇 년 전부터 규제개선 검토 작업을 진행하였고, 그 결과 유전자변형생물체법 개정안 입법예고(2021.5.26.)와 공청회(2021.6.29.)를 개최하였다. 공청회에 참석한 반-유전자변형생물체 시민단체는 외래유전자 도입이나 잔존이 없더라도 유전자가위기술 적용 산물은 유전자변형생물체에 해당하기 때문에 일반 유전자변형생물체와 같은 안전관리가 필요하며, 사전검토제 신설과 같은 규제 완화 정책에 반대 입장을 피력하였다. 한편 과학계와 산업계는 유전자가위기술 적용 산물 중 일부는 전통적인 육종 산물과 같은 범주에 속하기 때문에 유전자변형생물체 규제 대상에 속하지 않는다고 주장하며 과학적 사실에 근거한 합리적 제도 개선을 강하게 요구하고 있다.
동일한 개정법안을 두고 한 쪽에서는 규제가 완화되었다고 주장하고, 또 한쪽에서는 규제가 오히려 강화되었다는 입장을 보이고 있다. 이는 어떠한 기술이든 이용에 따른 잠재적 위험과 예상되는 혜택이 그 적고 많음과 관계없이 공존하고, 그러한 위험과 혜택을 받아들이는 정도가 다양하기 때문이다. 따라서 이러한 기술을 개발하고 공급하는 연구계와 산업계는 바이오신기술이 어떤 이득과 잠재적 위험이 있는지 양면을 명확히, 능동적으로 알려 주어야 한다. 이를 소비하는 시민(단체)은 다양한 정보를 균형 잡힌 시각으로 접하면서 이득과 위험을 이해하여야 한다. 정부는 국민이 느낄 수 있는 불안감을 줄이면서, 위험과 이익의 균형 속에서 합리적․과학적으로 규제 개선을 적극 추진해야 한다.
향후 5∼10년 이내에 등장할 새로운 바이오산물은 현재의 규제 시스템 내에서는 처리할 수 없을 것이라는 예측을 다방면에서 제기하고 있다. 새롭게 등장하는 바이오기술을 통해 농업, 식품, 의약, 화학 등 각 분야 현안을 해결하고 신기술에 대한 혜택을 누리려면 올바른 정보 제공을 통해 국민이 균형적인 시각을 가질 수 있도록 노력해야 하며, 규제와 제도의 경우 정부를 중심으로 기술 및 시대 환경변화에 따른 능동적인 개선을 추진할 수 있는 법.제도 제.개정 프로세스의 적극적 변화도 필요하다.

가. 개요
생명윤리는 생명공학 연구개발에서 연구참여자의 권리를 보호하고 안전을 확보하며, 궁극적으로 사회적으로 수용 가능한 생명공학이 될 수 있도록 하는 것을 목표로 한다. 이를 위해 생명윤리는 생명공학 연구개발의 윤리적, 법적, 사회적 의미를 탐구하는 다학제적 방법론을 동원하게 된다. 2021년 생명공학백서의 생명윤리 동향도 이런 생명윤리에 대한 이해를 바탕으로 국내외에서 발표된 다양한 윤리적, 법적 규범들을 중심으로 살펴본다.
최근 중요한 생명윤리 동향은 생명공학 연구개발의 최신 동향과 밀접하게 관련되어 있다. 줄기세포, 유전자치료, 이종이식치료, 조직공학 등 재생의료 분야 및 개인정보와 빅데이터에 근간을 둔 정밀의료 분야에서 많은 변화가 있었다. 그리고 2020년부터 COVID-19 팬데믹 상황에서 백신, 치료제 개발 등에 관한 규범들도 여러 가지 제시되었다.
특히 국내에서는 ‘첨단재생의료 및 바이오의약품안전 및 지원에 관한 법률’(이하 첨단재생바이오법)이 제정되었고, ‘개인정보보호법’이 개정되었다. 그리고 ‘생명윤리 및 안전에 관한 법률’(이하 생명윤리법)에 따른 ‘생명윤리 및 안전에 관한 기본정책’이 제정되었다. 이 새로운 규범들은 국내 생명공학 연구개발에 직접적인 영향을 미치는 내용을 담고 있어서, 생명공학 연구자들이 이에 대해 충분한 이해할 수 있도록 상세한 설명자료와 교육이 제공될 필요가 있다.
나. 해외 동향
(1) COVID-19 관련 백신 및 치료제 개발의 윤리적 고려
(가) WHO
WHO에서는 COVID-19 관련 백신 및 치료제 개발에서 윤리적으로 고려해야 할 점을 담은 여러 문서를 발표하였다. 특히 2020년 5월 발표한 ‘Key Criteria for the Ethical Acceptability of COVID-19 Human Challenge Studies’에서는 감염병 연구(human infection studies)를 인간 시험연구(human challenge studies)의 관점으로 이해하면서, 건강한 연구참여자들의 건강과 안전의 보호를 강조하고 있다. 그리고 백신 개발을 촉진하는 것에 못지않게, 보다 효과 있는 백신이 될 수 있도록 시험연구를 설계하는 것이 중요하다는 점을 강조하고 있다. 이를 위해 과학적 정당성(scientific justification), 위험과 잠재 이득의 평가(assessment of risks and potential benefits), 협의와 참여(consultation and engagement), 조정(coordination), 장소 선정(site selection), 연구참여자 선정(participant selection), 전문가 심의(expert review), 충분한 정보에 의한 동의(informed consent) 등 인간 시험연구의 8가지 기준을 제시하였다.
나아가 WHO는 2020년 ‘Guidance for Research Ethics Committees for Rapid Review of Research during Public Health Emergencies’를 발표하여, 연구윤리위원회가 응급상황에서 신속 심의 시 주의해야 할 점에 대한 가이드라인을 제공하였다. 그리고 2021년 4월에는 ‘COVID-19 and Mandatory Vaccination: Ethical Considerations and Caveats’을 발표하여, 사실상 강제적인 백신 접종이 시행되지 않도록 관련된 윤리적 고려사항과 주의사항을 제시하였다. 필연성과 비례성(necessity and proportionality), 백신 안전(safety)에 대한 충분한 증거, 백신의 유효성과 효과성(efficacy and effectiveness)에 대한 충분한 증거, 충분한 공급, 대중의 신뢰, 의사결정의 윤리적 절차 등이 이에 해당한다.
(나) UNESCO와 EGE
UNESCO에서도 2020년 6월 COVID-19에 관하여 ‘Statement on COVID-19 : Ethical Considerations from a Global Perspective’라는 성명을 IBC(International Bioethics Committee)와 COMEST(World Commission on the Ethics of Scientific Knowledge and Technology)의 공동명의로 발표하였다.
주요 내용으로는 불확실성에 대처하기 위해 학제 간 대화가 필요하다는 점, 건전한 과학 지식에 근거한 정책이 있어야 된다는 점, 보건의료에 대한 접근의 불평등을 가로막는 보건의료 체계에 대한 고려와 취약한 개인에 대한 보호가 필요하다는 점, 책임있는 연구 활동(responsible research practice)이 필요하며, 백신 연구나 임상시험에서 국제적인 조정과 협력, 윤리심의 절차의 중요성에 대한 공동의 이해형성 등의 중요성을 제시하였다.
EGE(European Group on Ethics in Science and New Technology)에서도 2020년 4월 ‘Statement on European Solidarity and the Protection of Fundamental Rights in the COVID-19 Pandemic’이라는 성명서를 발표하였는데, 이 문서에서 가장 힘든 사람들과의 연대(solidarity with those who are hit hardest), 신뢰와 투명성, 가치의 강화와 더불어 COVID-19을 극복하기 위한 연구와 혁신(research and innovation)의 중요성을 강조하고 있다.
(2) 생명공학 신기술에 대한 생명윤리 규범의 변화
(가) 세계줄기세포학회 윤리 가이드라인 개정
세계줄기세포학회(ISSCR)는 2021년 기존의 줄기세포 연구와 임상적용에 관한 가이드라인(ISSCR Guidelines for Stem Cell Research and Clinical Translation)을 개정하였다.
이 개정안의 특징 중의 하나는 인간배아와 배아줄기세포 연구에 관하여 연구심의의 범주를 3가지로 나누어 제시하고 있다는 점이다. 이에 따르면 심의를 면제받을 수 있는 범주 1, 심의를 통해 연구수행 여부를 결정하는 범주 2, 그리고 연구수행이 허용되지 않는 범주 3으로 구별하게 된다. 과거 가이드라인은 범주 2를 중심으로 모든 연구가 심의를 받는 것을 원칙으로 구성되었으나, 새롭게 개정된 가이드라인은 위험도를 고려하여 범주를 구분하고 있는 것이다.
[표 4-5] ISSCR 인간배아와 배아줄기세포 연구에 관한 연구심의 3가지 범주
|
CATEGORY 1 |
CATEGORY 2 |
CATEGORY 3 |
|
1A Exempt from review by a specialized oversight process |
Reviewed by a specialized oversight process |
3A Not allowed; currently unsafe |
|
1B Reportable, but not typically reviewed by a specialized oversight process |
3B Not allowed: lacks compelling scientific rationale or is ethically concerning |
이에 따르면 인간 줄기세포 또는 이로부터 직접 분화한 세포를 동물의 중추신경계에 이식하는 연구는 범주 1에 해당한다. 특히 원시선 형성 혹은 14일이 지난 인간배아의 배양도 금지되는 것이 아니라 범주 2에 해당하여 심의를 통해 허용될 수 있도록 하고 있다. 그 전까지는 전 세계 생명윤리 규범들과 우리나라 생명윤리법 등이 원시선(??)이 나타나기 전까지만 배아 연구를 허용하고 있었다는 점을 고려하면 매우 놀라운 변화이고 향후 국내외에서 많은 논란이 있을 것으로 예상된다.
또한, 이 가이드라인에 따르면 인간-동물 키메라 배아 연구, 미토콘드리아 대체 기술 등도 범주 2에 해당하여 심의를 거쳐 연구할 수 있도록 분류되어 있다. 다만, 유전 가능성이 있는 유전자편집 기술은 범주 3의 3B에 해당하는 것으로 분류하여 현재로서는 허용하고 있지 않다.
(나) 공공 생명윤리와 시민 참여
2020년 12월 EU 집행위원회(European Commission)는 ‘Guide to Public Debate on Human Rights and Biomedicine’를 발표하였다. 이 문건은 공공 토론(public debate)이 보건의료와 생명과학에서 왜 필요한지를 설명하고 있으며, 효과적인 공공 토론을 위한 사항들을 준비단계에서부터 자세하게 제시하고 있다. 공공 생명윤리(public bioethics)를 강조하는 것으로서, 전문가와 정부 중심에서 시민과 공중의 참여 중심으로 생명윤리 규범이 변화하고 있다는 점을 잘 보여주고 있다. 이에 대해서는 UNESCO에서도 2019년 ‘Bioethics Committees and Public Engagement’라는 책자를 통해 시민 참여를 기반으로 한 생명윤리를 제시한 바가 있다.
EGE도 2021년 5월 ‘Values for the Future: The Role of Ethics in European and Global Governance’라는 문건을 발표하였다. 이에 따르면 기본권(fundamental rights), 민주주의, 법의 지배, 윤리와 가치 등이 강조되며, 특히 윤리를 민주적으로 이해하는 것을 강조하고 있는데 이 역시 공공 생명윤리를 강조하는 것이다.
이와 같이 생명윤리를 공공 생명윤리로 이해하는 경향은 생명공학 신기술의 사회적 수용 여부에 대해 윤리학자나 규제당국자의 판단에 전적으로 맡기기보다는 시민의 폭넓은 토론과 대화를 통해 결정하는 것이 바람직하다는 생각에 근거하고 있다. 향후 생명공학에 관한 규제에도 이런 경향이 지속적으로 반영될 것으로 생각된다.
다. 국내 현황
(1) 첨단재생의료 및 바이오의약품 안전 및 지원에 관한 법률 제정
지난 2019년 첨단재생의료와 첨단바이오의약품 분야를 규율하는 첨단재생바이오법이 제정되어, 2020년 8월 28일부터 시행되었다.
첨단재생바이오법에서 정의하는 첨단재생의료는 사람의 신체 구조 또는 기능을 재생, 회복 또는 형성하거나 질병을 치료 또는 예방하기 위하여 인체세포 등을 이용하여 실시하는 세포치료, 유전자치료, 조직공학치료 등을 의미한다. 그리고 그 중에서도 특히 첨단재생의료 임상연구를 규율하고 있다. 그리고 첨단재생바이오법에서 정의하는 첨단바이오의약품은 약사법의 의약품에 해당하는 세포치료제, 유전자치료제, 조직공학제제, 첨단바이오융복합제제 등을 말한다.
첨단재생바이오법의 제정으로 첨단재생의료 분야의 임상연구에 대해 새로운 규제체계가 성립하게 되었다. 새로운 규제체계는 위험도 평가에 기반한 것으로 위험도에 따라 임상연구 계획서 승인 및 연구진행 방식을 다르게 하는 것이 특징이다.
이를 위해 첨단재생의료 연구계획 승인 업무를 수행하는 ‘첨단재생의료 및 첨단바이오의약품 심의위원회’를 설치하고, 첨단재생의료 임상연구를 수행하는 첨단재생의료실시기관 제도를 두었다. 그리고 첨단재생의료 임상연구 수행에서 발생하는 안전 문제를 체계적으로 관리하기 위하여 질병관리청 산하에 첨단재생의료안전관리기관을 두고 안전성 모니터링, 이상반응 보고 및 장기추적조사 등의 업무를 담당하게 하였다. 그리고 첨단재생의료 임상연구에 사용하는 인체세포 등을 제공하는 첨단재생의료 세포처리시설 제도도 시행하고 있다.
첨단바이오의약품 분야에서도 허가․심사에 관한 신속처리 제도를 두고 첨단바이오의약품 규제과학센터 설립․지정에 관한 규정을 두었다. 신속처리 제도에는 개발자가 품목허가를 신청하기 전에 개발 과정별로 품목허가에 필요한 자료를 나누어 제출하고, 이를 미리 심사하여 줄 것을 요청하는 경우 협의한 심사계획에 따라 심사하는 ‘맞춤형 심사’, 개발자가 품목허가를 신청한 경우 신속처리 대상으로 지정되지 아니한 의약품에 대한 품목허가 신청보다 우선하여 심사하는 ‘우선 심사’, 그리고 시판 후 안전관리를 조건으로 품목허가를 하는 ‘조건부 허가’ 등이 포함되어 있다.
첨단재생바이오법의 제정으로 첨단재생의료 연구개발 전 과정을 체계적으로 관리할 수 있게 되었다. 그러나 연구참여자 보호, 국민의 접근성 보장 등에 관하여 아직 개선이 필요한 부분이 많으므로 향후 지속적으로 이를 보완하기 위한 노력이 필요할 것이다.
(2) 개인정보보호법 개정
최근의 생명공학 연구에서는 건강정보, 유전정보 등의 개인정보나 빅데이터 등의 이용이 거의 필수적인 것이 되었다. 이에 관한 사항을 규율하는 일반법이 개인정보보호법인데, 2020년 2월 개정되어 같은 해 8월 5일부터 시행되었다.
개인정보보호법 개정에서 가장 특징적인 부분은 ‘가명정보’와 ‘가명처리’ 방식을 도입한 것이다. 가명처리란 개인정보의 일부를 삭제하거나 일부 또는 전부를 대체하는 등의 방법으로 추가 정보가 없이는 특정 개인을 알아볼 수 없도록 처리하는 것을 말하며, 이렇게 가명처리 함으로써 원래의 상태로 복원하기 위한 추가 정보의 사용․결합 없이는 특정 개인을 알아볼 수 없는 정보를 가명정보라 한다.
개인정보보호법 개정에 따라 가명정보의 경우에도, 개인정보 처리자가 당초 수집 목적과 합리적으로 관련된 범위에서 정보주체에게 불이익이 발생하는지, 암호화 등 안전성 확보에 필요한 조치를 하였는지 등을 고려하여 대통령령으로 정하는 바에 따라 정보주체의 동의 없이 개인정보를 제공할 수 있게 되었다.
이런 개인정보보호법의 개정에 대해서는 EU의 GDPR과 같은 개인정보 보호에 관한 국제기준에 미달한다는 비판론과 4차 산업혁명이라는 트렌드에 적시에 참여하기 위해서는 불가피하다는 긍정론이 존재한다. 생명공학 분야에서 필요한 개인정보 중에는 개인정보보호법의 민감정보로 분류할 수 있는 것이 상당히 많다고 할 수 있는데, 이를 어떻게 규율하는 것이 적절한지에 대해서는 더 많은 논의가 필요할 것으로 생각된다.
(3) 생명윤리 및 안전에 관한 기본정책 수립
생명윤리법은 국가생명윤리심의위원회의 기능 중 하나로 ‘국가의 생명윤리 및 안전에 관한 기본 정책의 수립에 관한 사항’을 규정하고 있다. 그러나 그동안 이 기본정책이 수립되지 못하고 있다가, 2020년 12월 처음으로 ‘생명윤리 및 안전에 관한 기본정책’(이하 생명윤리 기본정책)을 수립하였다.
생명윤리 기본정책에서는 비전으로 ‘인간 존엄과 인권 등에 기반 한 공공생명윤리를 확립하고 실현하는 사회’를 제시하고, 비전을 확립하기 위한 전략으로 ‘생명윤리 의제와 정책에 대한 시민참여(engagement) 증진’, ‘시민-과학자-정부 사이의 소통(communication) 활성화’, ‘사회 구성원의 생명윤리 역량(capability) 강화’를 제시하고 있다.
이에 따라 ‘공공생명윤리 확립을 위한 제도적 기반 구축’, ‘새로운 생명윤리 의제에 대한 사회적 대응 체계 마련’, ‘생명윤리법에서 지향하는 생명윤리 가치와 규범의 실질적 구현’ 등의 핵심목표와 ① 공공생명윤리 허브로서 국가생명윤리위원회의 위상 재정립, ② 참여와 소통을 위한 공공 생명윤리 플랫폼 구축, ③ 체계적이고 실질적인 생명윤리 교육의 시행, ④ 생명 관련 신기술에 대한 위험 평가와 안전 관리를 위한 제도적 체계 구축, ⑤ 새로운 생명윤리 의제에 대한 사회적 수용성 평가 기능 체계화, ⑥ 생명윤리법 법제 개선 등 생명윤리법 중심의 국내․외 규범 재정립, ⑦ 생명윤리위원회의 역할과 기능의 실효성 제고, ⑧ 배아, 생식세포 및 인체유래물 관리의 공공성 강화, ⑨ 유전정보, 건강정보 등 개인정보의 보호와 책임 있는 활용을 위한 실효적 관리 등 9개의 추진방향으로 구성되어 있다.
이번에 수립된 생명윤리 기본정책은 세계적인 생명윤리 흐름이라고 할 수 있는 시민참여와 공공 대화 등 공공 생명윤리 경향에 부합하는 것으로 그 의의가 있다고 할 수 있다. 더구나 생명윤리 기본정책은 현 생명윤리법의 해석과 적용의 지침이 될 뿐 아니라 향후 생명윤리법 개정 방향도 제시하고 있다는 점을 고려할 때, 생명공학 분야의 규제체계의 변화를 예측하는 데 도움을 줄 수 있다.
라. 발전 과제
(1) 생명공학 규제의 합리성 제고
생명공학 규제에 대해서는 규제 완화 또는 규제 강화라는 양극단의 견해가 팽팽하게 맞서고 있다. 그러나 새로운 생명공학 기술에 대해서는 금지하거나 허용하거나 양자택일이 아닌 합리적인 규제 방안이 제시될 수 있다.
대표적인 것이 세계적으로 채택되고 있는 위험기반 규제 방안이다. 이에 따르면 현재 알려진 정보로 위험도가 높고 회피할 방법이 없다면 그 연구를 금지해야 하지만, 그렇지 않다면 적극적인 모니터링과 이상 반응 대처 체계를 기반으로 연구를 수행할 수 있는 길을 열어 줄 수 있다는 것이다. 물론 최소한의 위험이 예상된다면 이에 대해서는 규제를 대폭 완화할 수도 있을 것이다. 이런 생명공학 규제의 합리성 제고를 위해서는 다른 나라에서 시행하고 있는 규제 경향을 면밀히 검토하고 이를 국내 제도에 조화시킬 수 있도록 규제 체제를 운영할 필요가 있을 것이다. 나아가 이를 수행할 수 있는 규제전문가 및 생명윤리 전문가의 양성 또한 필요할 것이다.
(2) 시민참여와 민주적 심의의 실질적 강화
최근 국내외에서 시민참여와 민주적 심의를 기반으로 하는 생명윤리 체계가 중요한 흐름으로 자리 잡고 있다. 우리나라에서도 이에 관한 생명윤리 기본정책이 수립되기도 하였다. 그러나 아직 이를 현실적으로 시행할 수 있는 구체적인 모델이 아직 정립되어 있지 않고 있으며, 향후 법제도 개선이라는 과제도 여전히 남아있다. 특히 건강과 삶의 질에 직접 관련되는 생명공학 분야에 대해서는 시민적 관심이 매우 높으므로 이와 관련된 구체적인 모델 연구, 정책 개발 및 법제 수립에 많은 노력을 경주할 필요가 있다.
(3) 연구자생명윤리 및 생명공학 규제에 대해 지속적으로 제기되고 있는 것이 규제 당국인 정부와 관련 당사자인 연구자 및 산업계와의 소통 부족이다. 더구나 공공 생명윤리의 측면에서 볼 때 시민사회와 소통하는 것도 중요한데, 아직 이 부분도 만족할 만한 체계가 만들어지지 않은 것이 사실이다. 더구나 새로운 생명공학의 연구개발에 대해서는 위험에 관한 충분한 정보가 확보되지 않을 가능성이 높기 때문에, 그 연구개발의 사회적 수용성을 판단하기 위해서도 적절한 소통 체계가 반드시 필요할 것으로 생각된다. 향후 이에 관한 소통 플랫폼이 정립될 수 있도록 하는 정책적 노력이 요구된다.

가. 개요
2019년 12월 중국 후베이성에서 SARS-Cov-2의 감염이 처음 확인된 후 코로나19는 전 세계적으로 확산되었으며, 코로나 바이러스가 변이를 거듭하면서 현재까지도 세계적 대유행이 이어지고 있다. 전 세계적 비상대응상황이 2년 이상 지속되면서 보건 의료분야의 자국중심주의는 더욱 강화되고 있으며, 바이오․헬스케어 산업은 글로벌 경쟁의 핵심분야로 부상하고 있다.
바이오․헬스케어 산업은 현재까지 축적된 생명공학기술과 고도한 지식기반의 바이오 신기술 및 인공지능, 빅데이터, 사물인터넷, 지능형 네트워크 기술과 함께 융합되어 4차 산업혁명 시대의 혁신적 변화를 주도하며 글로벌 경제 시대의 조기 도래를 유도할 것으로 전망된다.
국가별 미래 산업의 경쟁력은 분야별 원천기술의 확보, 이를 위한 국가차원의 장기적 투자, 연구 성과물의 제도적 보호와 산업에서의 활용에 따라 좌우된다. 생명공학 분야는 성과물을 얻기까지 대규모의 자본과 장기간의 연구가 필요하지만 소수의 특허로 시장에 막대한 파급력을 미치고 고부가가치를 창출할 수 있다. 따라서 효율적인 정책적 지원을 바탕으로 한 지식재산 확보전략과 회피전략으로 강한 특허를 창출하고 특허분쟁에 대응하는 것이 중요하다.
4차 산업혁명기의 시대적 요구에 발맞추어, 특허청은 국내 과학기술 연구 성과물을 지식재산권으로 보호하고 활용하기 위한 산업육성 전략으로 ‘바이오산업 경쟁력 제고를 위한 지식재산 정책지원 추진방안’(혁신성장 BIG3 추진회의, 2021.5.26.)을 제안한 바 있다. 빅데이터를 활용한 바이오 특허 데이터댐 구축 및 R&D 연계, 심사기준 개정 및 신기술분야의 우선심사 확대로 신속하고 강력한 핵심특허를 창출하고, 맞춤형 기술보호․분쟁 전략 제공을 통한 기술보호 및 인력․제도 등의 인프라 확충으로 국내 바이오산업의 지식재산 경쟁력을 강화하기 위한 지원체계를 확립하는 것을 주요 내용으로 하고 있다. 이를 통해 우리나라가 포스트코로나 시대 바이오․헬스케어 시장을 선도하는 국가로 발돋움할 수 있기를 기원한다.
나. 생명공학 분야 특허심사제도
생명공학 분야의 특허출원은 무생물을 대상으로 하는 타 분야 기술과 달리 살아있는 생명체를 대상으로 하고 있고, 출원할 때 특허미생물기탁제도 및 서열목록제출제도 등 특수한 절차나 윤리적인 측면도 함께 고려해야 할 필요성이 있는 등의 특수성이 있어 특허심사에 있어서 일반 특허 심사기준 외에 별도의 기술 분야별 심사기준이 제정되어 운용되고 있다. 인간 유전자나 생물체 자체 등의 특허 대상 여부, 발명의 성립성 또는 산업상 이용 가능성에 대해 국가별로 독자적인 기준을 마련하여 판단하고 있다.
우리나라 생명공학 분야의 특허 심사기준은 1998년 3월 ‘생명공학 분야 산업부문별 심사기준’이 제정된 이후, 기술발전과 산업 환경의 변화에 따라 6차례의 개정작업으로 정비되었고, 2014년 7월 각 기술 분야별 심사 기준을 통합할 필요성에 따라 ‘특허․실용신안 심사기준’에 통합되어 운용되어 왔다. 2020년 12월에는 4차 산업혁명에 대응하여 바이오분야의 최근 비약적인 기술 발전 사항을 반영하고 바이오분야 신기술 및 융합기술의 판단기준을 확립하기 위하여 ‘바이오분야 심사실무가이드’(기술분야별 심사실무가이드 제3부, 2021.01. 배포)를 제정하였다.
(1) 심사 기준
기존의 생명공학 분야 심사실무가이드가 ‘특허․실용신안 심사기준’(제9부 제1장)으로 통폐합되면서 생명공학 분야의 전반에 대한 구체적 특허요건 판단 기준과 사례의 제시가 미흡하다는 대내․외의 요구를 반영하여, 2020년 12월에 심사기준과 심사사례 부문으로 구분하여 ‘바이오분야 심사실무가이드’를 새로이 제정하였다.
심사기준은 특허요건을 생명정보의 흐름의 단계별로 생명체의 주요 구성요소(핵산․단백질․세포)로 세분화하여 체계적으로 정비하고, 펩티드, 변이체 및 단일클론항체 등 심사 쟁점사항에 대한 청구범위 기재방법과 명세서 기재요건을 수록하여 구체적 판단기준을 확립하였다. 기재요건 및 특허요건은 판단기준을 구체적으로 설명하고, 기술별․대상별 기본예시와 판례를 제시하여 출원 명세서 작성에 대한 가이드로 활용하고, 출원인의 심사에 대한 예측 가능성을 높일 수 있도록 하였다.
특수한 분야의 발명으로는 바이오 빅데이터를 활용한 가상실험에서 신약 후보물질 확인방법이 컴퓨터나 소프트웨어 관련 발명임을 명시하고 관련 예시를 기재하였으며, 컴퓨터상에서 인공지능이나 기계학습 등의 컴퓨터 프로그램을 이용한 가상실험으로 개발된 의약에도 화학 분야의 물질발명과 동일하게 특정의 출발물질, 온도, 압력, 유입․유출량 등 그 물질발명을 제조하는 데에 필요한 구체적인 반응조건과 그 조건을 직접 적용하여 실시한 결과를 실시예로 기재하는 명세서 기재요건을 제시하여 차세대 바이오 분야의 신기술 및 융․복합 기술 발명이 선제적으로 보호될 수 있도록 하였다.
(2) 심사 사례
바이오 분야 기술은 21세기 초 인간 유전자지도 작성 사업의 완료를 기점으로 폭발적으로 성장하였고, 4차산업 혁명기에 진입하면서 융합기술의 발달로 바이오․헬스케어분야로 확장되며 고도성장하고 있다. 최근에는 빅데이터 분석, 인공지능, 기계학습 등을 적용한 질병예측 모델이나, 유전체 기반 맞춤형 신약개발, 또는 맞춤형 치료 등의 정밀의료 분야 및 ICT 기술과 융합된 스마트 헬스케어 분야 등이 눈부신 발전을 이루고 있다. 유전자가위, 합성생물학, 마이크로바이옴, 분자진단 등 바이오 분야 신기술 분야에서도 융합기술을 적용하여 데이터를 최적화하거나 검증하는 특허출원이 계속 증가하고 있는 추세이다.
2020년 12월에 제정된 바이오분야 심사실무가이드에는 바이오분야 융․복합기술 판단사례로 지능형 신약개발 관련 발명, 단백질 결정체 및 가상실험 분석방법을 수록하여 융․복합기술이 적용된 바이오 분야 발명의 명세서 기재요건 및 진보성 판단기준을 확립하였으며, 단백질 활성 단편에 관한 발명, 단백질의 활성이 향상된 변이체에 관한 발명, 새로운 의약용도를 발명한 경우의 청구범위 기재방법에 관한 구체적 심사사례를 기재하여 바이오 분야의 주요 심사 난제에 대한 가이드를 제시하였다. 그리고 유전자가위, 마이크로바이옴이나 다형성을 이용한 바이오마커 등의 발명에서 발명의 산업상 이용가능성이나 공서양속 위배에 대한 판단 및 발명의 단일성 기준에 대한 구체적 심사사례와 청구항 보정방향을 제시하여 바이오분야 신기술 발명에 대해 우수한 특허가 적정한 권리로 보호될 수 있도록 하였다.
이번 ‘바이오분야 심사실무가이드’ 제정을 통하여 출원인의 심사결과에 대한 예측가능성이 높아지고, 바이오분야의 특허가 제대로 보호되어 우리나라의 바이오․헬스케어 분야가 미래시대 산업을 선도할 수 있기를 기대한다.
다. 생명공학 분야의 주요 지식재산권 제도
(1) 미생물 기탁제도
미생물 기탁제도란 세균, 바이러스, 세포 등 미생물 발명을 포함하는 특허출원에 있어서 해당 특허출원 미생물을 공인기탁기관에 기탁하는 제도이다. 이는 특허출원하는 실제 미생물을 공인기탁기관에 기탁한 후, 출원 공개 후에 특허기탁 미생물을 제3자가 분양받아 실시할 수 있도록 함으로써 반복 재현이 곤란한 미생물 발명에 관한 명세서의 기재사항을 보완하기 위함이다.
특허법 시행령 제2조에서 미생물발명 관련 출원을 하고자 하는 자는 ‘출원 전’에 특허미생물을 기탁기관11) 중 1곳에 ‘특허기탁’ 하고, 출원할 때 특허출원서에 수탁증을 첨부하며, 특허출원서에 ‘미생물 기탁 정보(취지)’를 기재하도록 규정하고 있다(2015.1.1.시행). 한편, 특허법 개정(제58조 전문기관의 등록 등, 2017.6.3. 시행)에 따라 미생물기탁 관련 고시를 개정하여 미생물 기탁기관 등록의 근거를 마련하였고(특허청고시 제2017-16호, 2017.8.1. 개정), 관련 시행령과 시행규칙에 등록기준(시행령 제8조의4) 및 취소기준(시행규칙 제36조의3)도 함께 규정하였다.
특허미생물을 연구 또는 시험 목적으로 분양받고자 하는 자는 원기탁자의 허락을 받거나 특허청에 미생물 분양 자격증명을 신청한 후, 기탁기관에서 분양받을 수 있다. 특허청은 기탁기관으로부터 반기별로 수탁 및 분양 현황을 보고받고 있으며, 현재까지 기탁된 미생물은 1만 4,757건이며 분양된 미생물은 2,782건이다(2020.12.31. 기준).
특허미생물의 보호를 위하여 2013년 4월에 농촌진흥청 국립농업과학원을 ‘국가특허미생물 통합보존소’로 지정한 이후 4개 특허미생물 기탁기관에서 복제본 제작 및 통합보존을 완료하였으며 이에 대한 점검이 2017년 12월 완료되었다. 또한 2014년 5월, 특허미생물 훼손, 유출 등의 위기상황에서도 활용성 제고를 위해 특허미생물 기탁기관 공통의 안전관리규정 표준안을 마련하였으며, 이에 따라 민관합동 위기대응 훈련을 매년 실시하고 있다.12)
[표 4-6] 특허기탁기관 및 운영 현황(2020.12.31. 기준)
|
|
한국생명공학연구원 생물자원센터 |
한국미생물 보존센터 |
한국세포주 연구재단 |
농촌진흥청 미생물은행 |
||||
|
영문명칭 |
KCTC (Korean Collection for Type Cultures) |
KCCM (Korean Culture Center of Microorganisms) |
KCLRF (Korean Cell Line Research Foundation) |
KACC (Korean Agricul tural Culture Collection |
||||
|
설립 |
1985년 KIST 유전공학센터 특수사업부(유전자 은행) 설립 |
1967년 사단법인 한국종균협회 창립 |
1982년 세포주은행 업무 개시 |
1995년 설립 |
||||
|
기탁기관 등록 |
국내 |
국제 |
국내 |
국제 |
국내 |
국제 |
국내 |
국제 |
|
1981.08.25. |
1990.06.30. |
1981.08.25. |
1990.06.30. |
- |
1993.08.31. |
2002.01.01. |
2015.05.01. |
|
|
소재지 |
전북 정읍시 입신길 181 |
서울시 서대문구 홍제내2가길 45 유림빌딩 2층 |
서울시 종로구 대학로 101 서울의대 암연구소 |
전북 완주군 이서면 농생명로 166번지 |
||||
|
인터넷사이트 |
http://kctc.kribb.re.kr |
http://www.kccm.or.kr |
http://cellbank.snu.ac.kr |
http://www.genebank.go.kr |
||||
|
특허미생물 보유건수 (분양건수) |
7,304건 (963건) |
4,795 (680건) |
500건 (380건) |
2,158건 (759건) |
||||
|
담당자 |
김성건 센터장 이정숙 박사 |
박정민 박사 김유진 연구원 |
구자록 교수 신영경 교수 |
홍승범 연구관 한병학 연구사 |
||||
|
비고 |
조류, 종자 수탁․분양 가능 |
세균, 곰팡이 위주로 수탁․분양 |
동물세포 위주로 수탁․분양 |
종자 수탁․분양 가능 |
||||
[표 4-7] 기탁기관별 기탁가능 미생물(2020.12.31. 기준)
|
소재종류 |
기탁가능 미생물 종류 |
KCTC |
KCCM |
KCLRF |
KACC |
|
미생물소재 |
비병원성 세균(Non-Pathogenic Bacteria) |
○ |
○ |
|
○ |
|
방선균(Actinomycetes) |
○ |
○ |
|
○ |
|
|
비병원성 진균류(Non-Pathogenic Fungi) |
○ |
○ |
|
○ |
|
|
비병원성 효모(Non-Pathogenic Yeasts) |
○ |
○ |
|
○ |
|
|
점균류(Molds) |
○ |
|
|
|
|
|
동물 바이러스(Animal Virus) |
○ |
○ |
|
|
|
|
식물 바이러스(Plant Virus) |
○ |
○ |
|
○ |
|
|
조류(Algae) |
○ |
|
|
|
|
|
박테리오파지(Bacteriophages) |
○ |
○ |
|
○ |
|
|
동물소재 |
사람세포(Human Cell Cultures) |
○ |
|
○ |
|
|
융합세포(Hybridomas) |
○ |
|
○ |
|
|
|
동물세포(Animal Cell Cultures) |
○ |
|
○ |
|
|
|
수정란(Embryos) |
○ |
|
|
|
|
|
비기생성 원생동물(Non-Parasitic Protozoa) |
○ |
|
|
|
|
|
식물소재 |
식물세포(Plant Cell cultures) |
○ |
|
○ |
|
|
종자(Seeds) |
○ |
|
|
○ |
|
|
유전체소재 |
진핵생물 DNA(Eukaryotic DNA) |
○ |
|
○ |
○ |
|
RNA |
○ |
|
|
|
|
|
숙주 내 플라스미드(Plasmids in Hosts) |
○ |
○ |
○ |
○ |
|
|
숙주 외 플라스미드(Plasmids not in Hosts) |
○ |
○ |
○ |
|
(2) 서열목록 제출제도
서열목록 제출제도는 특허출원 시 컴퓨터 판독이 가능한 형태의 서열목록 전자파일을 제출하도록 하는 제도이다. 핵산염기서열 또는 아미노산서열을 포함한 특허 출원 증가에 대처하여 신속한 심사처리와 서열 데이터베이스 구축에 활용하기 위해 시행하고 있다. 관련 규정은 특허법시행규칙 제21조의 4(핵산염기서열 또는 아미노산서열을 포함한 출원 등, 2015.1.1. 시행) 및 핵산염기 서열목록 또는 아미노산 서열목록 작성기준(특허청 고시 제2016-5호, 2016.3.1. 시행)이 있다.
4개 이상의 아미노산 또는 10개 이상의 핵산염기를 포함하는 발명을 특허출원하는 자는 국내 및 국제 특허출원 시에 요구되는 서열목록 작성요건을 충족시키기 위해서 세계지적재산권기구(WIPO: World Intellectual Property Organization) 표준(ST.25)에 따라 작성된 서열목록을 제출하여야 하며, 서열정보의 효율적인 선행기술 검색을 위해 컴퓨터 판독이 가능한 전자파일 형태의 서열목록이 필요하다.
제출된 방대한 양의 특허서열정보를 국제적으로 공유하고 활용하기 위해 국제적 기준13)에 따라 작성된 서열목록의 데이터베이스화가 필요하고, 2016년 3월, WIPO 표준위원회는 서열목록 관련 현재 표준인 ST.25의 기능을 개선한 새로운 표준인 ST.26 제정안을 승인하였으며, 2022년 1월 1일 시행을 목표로 PCT 규정 개정안(PCT 시행세칙 개정안, PCT 서식 개정안)을 2021년 10월 PCT 총회에서 승인하기로 결정하였다. 이에 회원국들은 서열 작성 소프트웨어 개발을 빠른 시일 내에 완료하여 국내 및 국제 출원에 적용을 목표로 하고 있으며, 우리나라 특허청도 2022년 1월1일 서열목록 표준을 ST.25에서 ST.26으로 변경 및 실행하기 위해, 서열목록 작성 표준 전환 로드맵을 설정하여 특허법 시행규칙, 심사기준 및 서열목록 고시 개정을 추진하고 있다.
우리나라 특허청은 신속하고 효율적인 서열검색 및 서열목록 정보의 국제적 관리와 공유를 위해 세계 3대 서열목록 관리기관인 DDBJ(일본)14) GenBank(미국)15), EMBL(유럽)16)과 유기적인 협조관계를 구축하고 있다. 특허청은 KOBIC17)을 통해 DDBJ에 서열목록 정보를 제공키로 합의함에 따라(2006.6.), 서열목록을 2개월 주기로 CD 형태로 KOBIC에 제공하고, KOBIC은 연 2회 DDBJ 측에 서열목록 정보를 제공하고 있다(2007.8. 이후).
(3) 허가 등에 따른 특허권 존속기간 연장등록출원제도
의약품 및 농약은 특허발명을 실시하기 위해서 관련 기관의 허가나 등록(이하 ‘허가 등’)을 받아야 하고, 허가 등을 받기 위해서는 유효성 및 안전성 시험 등의 관련 절차를 수행해야 한다. 이를 수행하는 데에 상당한 기간이 소요되고 특허권자는 그 기간만큼 특허발명을 실시할 수 없게 된다. 이런 경우 특허권 존속기간은 ‘설정등록 후 출원일로부터 20년’으로 변함이 없기 때문에 타 특허권자와 비교하여 형평성에 문제가 발생할 수 있다.
이러한 문제점을 해결하기 위해 일정한 조건을 만족하는 의약품 및 농약에 대하여 5년 범위 내에서 그 특허권의 존속기간을 1회에 한하여 연장해주는 ‘허가 등에 따른 특허권 존속기간 연장등록출원제도(특허법 제89조)’를 마련하고 있다. 특허권 존속기간 연장등록출원은 주체, 대상 및 시기에 제한을 두고 있다(특허법 제91조). 연장등록 출원인은 특허권자이어야 하며, 특허권이 공유인 경우에는 공유자 전원이 공동으로 출원하여야 한다. 또한 그 발명을 실시하게 하기 위하여 다른 법령에 의하여 허가 등을 받을 필요가 있어야 하고, 그 허가 등을 위하여 필요한 유효성․안정성 등의 시험으로 인하여 장기간이 소요되는 발명이어야 한다. 그리고 특허권자 자신이 허가 등을 받았거나, 연장등록의 결정 전까지 전용실시권자 또는 등록된 통상실시권자가 허가 등을 받았음을 확인할 수 있어야 한다.
연장등록출원의 대상이 되는 특허는 물질, 제법, 용도 및 조성물 특허이고 중간체, 촉매 및 제조 장치에 관한 특허는 제외되며 약사법 및 농약관리법에 의하여 최초의 허가 등을 받은 유효성분이 특허청구 범위에 기재되어 있어야 한다. 연장의 대상이 되는 출원의 특허권은 특허청에 계속 중이어야 하고, 허가 등을 받은 날부터 3월 내, 존속기간 만료 전, 6월 내 연장등록출원을 해야 한다. 특허권 설정 후에도 허가기관에서 요구하는 임상시험 등에 시일이 소요되어 특허권을 실시하지 못했음을 입증하면 그 내용을 심사하여 연장등록 여부와 적정 연장기간을 결정하고, 그에 따라 특허권의 존속기간이 연장된다.
(4) 유전자원의 접근
생물다양성협약(CBD: Convention on Biological Diversity)은 생물다양성을 생태계, 종, 유전자 수준에서 파악하고 생물다양성의 보존, 생물자원의 지속 가능한 이용 및 유전자원의 이용으로 발생하는 이익의 공정하고 공평한 공유를 목적으로, 1992년 리우 정상 회의에서 채택된 국제협약이다.
가입국의 생물다양성 보전을 위한 의무와 더불어, 타국 보유 유전자원에 접근할 때에 해당국의 사전승인을 받도록 하는 제도(PIC: Prior Informed Consent)의 도입, 생명공학기술 등 생물다양성 보전기술을 다른 가입국에게 이전 촉진, 유전자변형생물체(LMOs: Living Modified Organisms)의 안전한 국가 간 이동․관리를 위한 의정서 채택 검토, 개도국의 협약이행을 위한 재정지원 조항 등 생물다양성 보전을 위한 가입국 간 협력을 주요 내용으로 하고 있다.
지식재산권과 연계한 유전자원 보호 방안에 대한 자원 제공국과 자원 이용국간의 다자간, 양자 간 국제 논의18)가 활발히 진행 중인 가운데 제12차 생물다양성협약 당사국총회 및 제1차 나고야의정서 당사국회의(강원도 평창, 2014.10.)에서 유전자원 이용 시 이용자는 유전자원 제공국으로부터 사전통보승인(PIC)을 받아야 하고, 해당 유전자원 이용으로 발생한 이익을 상호 합의한 조건(MAT: Mutually Agreed Term)에 따라 공유하기로 결정되었다. 이에 따라 ‘유전자원에 대한 접근 및 그 이용으로부터 발생하는 이익의 공정하고 공평한 공유에 관한 생물다양성협약과 나고야의정서’의 시행에 필요한 사항과 유전자원 및 이와 관련된 전통지식에 대한 접근․이용으로부터 발생하는 이익의 공정하고 공평한 공유를 위하여 필요한 사항을 정함으로써 생물다양성의 보전 및 지속가능한 이용에 기여하였다.
이어, 국민생활의 향상과 국제협력 증진을 목적으로 유전자원의 접근․이용 및 이익공유에 관한 법률이 2017년 1월 17일에 제정되었다(법률 제14533호, 2018.8.18. 시행).
한편, 나고야의정서 이행법률의 제정 및 시행은 유전자원의 이용에 따른 이익공유가 의무화되고, 자원 부국의 국내 조치 강화로 해외 생물유전자원 확보․이용에 있어 우리나라 생명공학 산업계의 부담이 증가될 것으로 예상된다. 또한 생물․유전자원 보호의 국제적인 움직임과 선진국의 기술이전 기피 현상은 이를 이용한 국내 생명공학 산업계의 기술개발에 부정적 영향을 미칠 수 있다.
이에 국내 고유 동․식물 자원과 유전자원의 보전 및 확보, 이를 이용한 생명공학 분야의 원천기술 개발의 계기로 삼아야 할 것이다. 정부는 국내 산업계의 피해를 최소화하기 위해 주요 자원제공국과의 자유무역협정(FTA: Free Trade Agreement) 지재권 분야 협상과정에 적극 대응하고, 바이오기업을 대상으로 유전자원 이용과 관련한 국제동향 홍보를 지속적으로 추진해야 한다.
라. 유전자가위 특허분쟁 사례
(1) 기술 및 산업 현황
유전자가위는 유전체에서 원하는 부위의 DNA를 정교하게 잘라내는 기술로서 원하는 DNA에 결합하는 물질과 목표 부위를 정확하게 자르는 물질로 구성된다. 1세대 징크핑거(2003), 2세대 탈렌(2011), 3세대 크리스퍼(2012)를 거쳐 최근 프라임에디터(2019) 기술로 발전되었다.
샤르팡티에(프랑스)․다우드나(미국) 그룹은 세균의 면역체계에서 침입 바이러스의 유전자를 자르는 구성을 원하는 유전자를 편집하기 위해 폭넓게 적용하는 3세대 유전자가위(CRISPR-Cas9) 시스템으로 확립하여 유전자가위 기술의 대중화를 이끈 공로로 2020년 10월에 노벨 화학상을 수상하였다.
유전자가위를 이용한 유전자 편집은 유전질환․난치병 치료, 식품․환경 분야의 분자진단, 동식물의 품종개량이나 복원 등 다양한 분야에 적용할 수 있으며, 최근에는 고가의 실험장비 없이 5분 안에 코로나19를 진단하는 기술에도 응용되고 있다.
전세계 유전자 편집 시장은 연평균 14.5% 성장하여 2023년 71억 2,000만 달러(약 8조 370억 원) 규모로 확대될 전망이며, 특히, 3세대 유전자가위는 유전자 편집 기술 중 가장 큰 시장을 형성(2018년 19억 5,000만 달러, 54% 점유)하여, 2023년 38억 7,000만 달러로 성장이 예상되고 있다.19)
유전자가위는 살아있는 생명체의 유전자를 변형하는 기술이므로, 인간배아 유전자 편집에 대한 윤리적 이슈가 야기되고 있으나, 생명체에 적용하는 허용 범위를 둘러싼 국내․외 가이드라인은 미비한 실정이며, 세계 과학자들이 대규모 국제회의20)를 통해 논의 중이다.
(2) 크리스퍼 특허현황
미국 다우드나 그룹(UC버클리)은 크리스퍼 유전자가위를 원핵세포에 적용한 2012년 5월 미국특허청에 제출한 최초의 가출원을 바탕으로 2013년 3월 미국특허청에 정식 특허를 출원하여 2019년 4월 등록되었다. 한국의 (주)툴젠은 인간 세포에 크리스퍼 기술을 최초로 적용하여 2012년 10월 미국특허청에 가출원 하였고 이를 기초로 2013년 10월 국제출원 후 한국․호주에서 2016년 9월 등록되었으며, 2020년 12월에는 분할출원이 미국에서 등록되었다.
미국 브로드 그룹은 크리스퍼 기술을 진핵세포에 적용하여 2012년 12월 미국특허청에 가출원 하였으며, 신속심사 신청을 통하여 원천특허 그룹 중 가장 빠른 2014년 4월 특허가 등록되었다. 크리스퍼 원천특허는 세계적으로 3개의 연구그룹이 유사한 시기에 특허를 출원하여, 현재 미국과 유럽에서 권리범위와 우선권 주장 쟁점으로 다수의 소송이 진행 중이다.
(3) 글로벌 특허분쟁
UC버클리의 특허가 미국특허청의 가출원일은 가장 빠르지만, 브로드연구소는 신속 심사를 신청하여 2014년 4월 15일에 원천특허 그룹 중에서 가장 먼저 특허권을 획득하였다. 이에, UC버클리는 미국 특허청에 저촉심사(interference)21)를 신청하여 ‘누가 선발명자인지에 대한 결정’을 요청하였다.
2015년 4월, UC버클리 측은 원천기술을 발명하고 처음 특허를 낸 것은 다우드나 그룹이므로, 브로드연구소의 특허는 무효라고 주장했다. 그러나 2017년 2월 15일, 미국특허청 특허심판항소위원회(PTAB)는 브로드연구소의 특허가 UC버클리 특허보다 후출원이기는 하지만 진핵세포 유도 등에 대해 신규성이 있고 진핵세포에서 크리스퍼의 작동을 입증한 브로드연구소의 특허는 기술적으로 진보한 면이 있으므로 특허를 인정한다는 결정을 내렸다. 이에 대해 UC버클리가 불복하여 제기한 항소심에서도 원심대로 브로드연구소 특허의 진보성이 인정되어, 2018년 9월 10일, 브로드연구소의 특허가 UC버클리 특허를 침해하지 않는 것으로 판결하였다. 2019년 4월 다우드나 그룹의 원천특허가 등록된 후, UC버클리측은 2019년 6월 24일 다시 제2차 저촉심사를 신청하여 현재 심리 중이다.

[그림 4-1] 크리스퍼 특허분쟁 관련 주요 사건
유럽특허청에서 2015년 2월 등록된 브로드연구소의 특허는 부적법한 우선권 주장22) 등을 이유로 이의신청이 제기되었으며, EPO는 해당 특허에 대해 주장된 우선권의 성립요건에 흠결이 있다고 판단하고, 이의신청인의 주장을 인용하여 2018년 1월 17일 해당 특허를 취소하였다. 이 사건의 경우, 브로드연구소 특허의 우선권 주장의 기초가 된 미국특허 일부의 출원인(승계인)이 해당 특허가 기반한 PCT 출원의 출원인과 일치하지 않음을 확인하여 우선권 주장에 흠결이 있음을 인정하였고, 이에 선출원과 해당 특허 출원일 사이에 공개된 발명으로 인해 신규성 또는 진보성이 결여되었다고 판단하여 해당 특허를 취소하였다.
김진수 그룹((주)툴젠)의 특허는 진핵세포에 적용한 크리스퍼 발명으로는 미국 가출원일이 가장 빠르다. 미국특허는 진보성을 이유로 거절되었으나, 미국특허청 특허심판항소위원회(PTAB)에서 승소하였으며, UC버클리와 브로드연구소를 상대로 2020년 12월 저촉심사에 진입하였다. (주)툴젠의 특허는 선출원주의 국가에서 유리한 위치(senior party23))에 있기는 하나 저촉심사 결과에 따른 권리 확정 예측은 아직 어려움이 있다. 가이드 RNA의 특징을 한정하여 기능을 향상한 분할출원은 2020년 12월 1일 등록되었다.
UC버클리, 브로드연구소와 (주)툴젠은 미국, 한국, 유럽, 호주, 중국 등에서 자신의 특허에 대한 출원․등록 경쟁뿐만 아니라 상대방의 특허를 취소 또는 무효화하려는 공방을 치열하게 벌이고 있다. 최종 결론이 나려면 앞으로 수 년 이상이 소요될 것이고, 특허독립의 원칙에 따라 국가별로 서로 다른 결과가 나올 수도 있다.

가. 서론
(1) 최근 코로나19 발생 환경 대처
(가) 코로나 진단시약 긴급사용 승인 및 허가
코로나19가 2019년 12월에 발생한 이후 코로나19의 감염여부를 확인하기 위한 진단시약이 가장 급히 필요했으며 이에 정부는 ‘긴급사용승인’이라는 허가특례제도를 도입하였다.
긴급사용승인제도란 감염병 대유행 시 감염병 대처에 필요한 허가된 의료기기가 없더라도 한시적으로 제조․판매․사용을 허용하는 제도로 2016년 사스, 메르스 사태를 거치면서 도입되었고, 미국 FDA와 유럽에서도 이 제도를 이번 코로나 방역을 위해 사용하였다.
코로나19 긴급사용승인 진단시약은 질병관리청과 진단검사학회에서 임상성능평가 자료를 제출하여 식약처 평가 후 승인하였는데, 최초 승인은 신청 후 7일 만인 2020년 2월 4일로 이루어졌으며, 허가 규정에 맞게 자료를 갖추어 최초 정식 허가는 2020년 8월 31일에 이루어졌다.
2021년 2월 4일부터는 긴급사용승인 받아 사용하였던 유전자 PCR 검사시약(7개 품목) 사용을 종료하고 정식 허가받은 유전자 PCR 검사시약 제품으로 코로나19 검사를 시행하고 있다.
(나) 코로나 치료제 및 백신 개발 및 허가
전세계적으로 코로나19의 감염 속도가 팬데믹 수준으로 판단되었으며 백신 개발만이 그 감염 속도를 조절할 수 있었으므로 개발에 막대한 투자가 이루어졌고 그 결과 신속한 허가가 이루어졌다(국내 최초 허가: 2021.2.10.) 국내에서도 정부 차원에서 코로나19 백신 개발과 치료제 개발을 지원하였고 2020년도부터 2021년도 상반기까지 백신과 치료제 개발 임상시험이 활발히 진행되었다.
허가를 받은 백신과 치료제들의 특성과 부작용 정보 등을 고려하여 향후 국내 개발 방향이 조정될 것으로 보인다.
(2) 첨단 바이오 및 신개념 의료기기 규제 패러다임 변화
(가) 첨단재생의료 및 첨단바이오의 약품안전 및 지원에 관한 법률(이하 ‘첨단재생바이오법’)
첨단재생바이오법이 2019년 8월 27일 제정되었고 2020년 8월 28일부터 시행되었다. 세포치료제, 유전자치료제, 조직공학제제, 첨단바이오융복합제제 등 살아있는 세포나 조직을 원료로 하고 체내에서 장기간 머물러 효과를 나타내는 첨단바이오의약품의 특성상, 원료 채취부터 안전성이 강화되고 시판 후 장기추적 보고가 의무사항이 되었다. 세포․유전자 치료제는 세포의 일관성을 검증할 수 있도록 유전학적 계통분석 결과와 검체의 세포은행을 반드시 밝히도록 하였다.24)
(나) 의료기기산업 육성 및 혁신의료기기 지원법
인공지능․로봇․3D프린팅 등 혁신 기술이 접목된 의료기기 개발․출현 등에 따른 대응 체계를 마련하고 새로운 의료기술에 대한 치료 기회를 제공하는 한편, 미래 성장동력인 의료기기 산업지원 등을 위하여 ‘의료기기산업육성 및 혁신의료기기지원법’이 제정(2019.4.30.공포, 2020.5.1.시행)되었다.
사용 목적 및 원리 등이 신개념 의료기기인 경우 혁신의료기기로 신청을 하면, 식약처에서는 보건복지부와 협의하여 혁신의료기기로 지정을 하고, 혁신의료기기로 지정이 되면 ▴(1단계) 제품설계 ▴(2단계) 성능시험 ▴(3단계) 임상시험계획 ▴(4단계) 기술문서․임상시험 등 단계심사와 우선심사가 가능해져서 정확하고 신속한 허가가 가능해진다. 혁신의료기기 소프트웨어 제조기업 인증을 받은 업체의 경우는 해당 소프트웨어 인․허가 시 특례(제조 및 품질관리기준에 관한 자료, 소프트웨어의 안정성 등에 관한 자료 등 일부 면제)가 적용된다.
(다) 체외진단의료기기법
사람으로부터 유래한 검체(조직, 혈액, 소변 등)를 이용한 체외진단의료기기의 특성에 맞는 허가․관리체계를 구축하여 체외진단의료기기의 개발 및 제품화를 지원하고자 ‘체외진단의료기기법’이 제정(2019.4.30. 공포, 2020.5.1. 시행)되어 미국, 유럽 등 선진 외국과의 국제조화를 이루게 되었다.
검체를 이용한 체외진단의료기기의 특성에 맞게 임상적 성능시험 실시기준을 만들고, 의약품과 함께 개발된 동반진단의료기기의 경우 허가 심사를 동시에 신청하여 심사받을 수 있게 되었다.
나. 바이오의약품 허가 현황 및 고찰
(1) 코로나19 백신
[표 4-8] 코로나19 백신 허가 현황(2021.7.1. 기준)
|
개발사 |
아스트라제네카 |
얀센 |
화이자 |
모더나 |
|
플랫폼 |
바이러스벡터 백신 |
바이러스벡터 백신 |
mRNA백신 |
mRNA백신 |
|
제품명 |
(한국)아스트라제네카 코비드-19백신주 |
코비드-19백신 얀센주 |
코미나티주(토지나메란) |
모더나코비드-19백신주 |
|
업체명 |
한국아스트라제네카(주) |
(주)한국얀센 |
한국화이자(주) |
(주)녹십자 |
|
개발국 |
영국 |
미국 |
미국/독일 |
미국 |
|
접종횟수 |
2회 |
1회 |
2회 |
2회 |
|
접종대상 |
18세 이상 |
18세 이상 |
12세이상 |
18세 이상 |
|
접종간격 |
4주∼8주 |
- |
21일 |
28일 |
|
보관조건 |
2∼8°C(6개월) |
-20°C(24개월) 2∼8°C(3개월) |
-75±15°C(6개월) -20±5°C(2주) 2∼8°C(1개월) |
-20°C(6개월) 2∼8°C(30일) |
|
국내허가 |
2021.2.10.(제조품목) 2021.5.21.(수입품목) |
2021.4.7. |
2021.3.5. |
2021.5.21. |
자료: 식품의약품안전처 및 저자 작성.
코로나19 감염 확산을 위해 백신의 필요성이 전 세계적으로 요청되었다. 미국 및 유럽에서는 많은 환자를 대상으로 임상시험을 신속하게 이루어내어 우리나라에서도 수입 백신이 2021년 2월에 허가되었다. 따라서 2020년 하반기부터 2021년 초까지 코로나19 백신 개발 임상시험 승인 신청은 활발하였으나(2021.7.1. 기준, 진행 중인 임상시험 8건), 수입 백신의 국내 공급이 큰 시대적 흐름이 된 이후 임상시험 대상자를 구하는 어려움이 있었고, 이미 허가받은 백신들의 유형에 따른 백신효과 및 부작용 정보를 고려하여야 할 상황에 당면하게 되었다.
(2) 코로나19 치료제
[표 4-9] 코로나19 치료제 허가 현황(2021.7.1. 기준)
|
|
업체명 |
제품명 |
허가일자 |
분류 |
비고 |
|
1 |
길리어드사이언스 코리아(유) |
베클루리주정맥주사용 동결건조분말(렘데시비르) |
2020. 7.24. |
항바이러스제 |
신물질 |
|
2 |
(주)셀트리온 |
렉키로나주960mg(레그단비맙) (단클론항체, 유전자재조합) |
2021. 2. 5. |
항바이러스제 (중화항체치료제) |
신물질 |
자료: 식품의약품안전처.
2021년 7월 12일 기준, 국내에서 코로나19 치료제로 허가된 품목은 2개 품목이다. 렉키로나주는 코로나19 완치자의 혈액에 존재하는 중화항체유전자를 선별하여 유전자 대량 생산이 가능한 숙주세포에 삽입하고, 세포배양을 통해 대량 생산한 국내개발 1호 코로나19 치료제이며 전 세계 세 번째로 규제당국의 검증을 받은 코로나19 항체치료제이다.
(3) 코로나19 치료제 및 백신 임상시험 현황 및 신속 허가 지원
코로나19 감염이 확산되면서 치료제와 백신 개발을 위한 임상시험 승인이 활발히 이루어졌다. 코로나19 백신이 첫 허가(2021.2.10.)된 2021년 상반기까지는 신물질 또는 약물재창출(국내에 다른 효과로 허가받은 의약품을 코로나치료에 사용)을 통한 임상 2․3상까지의 승인신청 건이 많았다. 2021년 3월 31일 기준 총 승인된 임상시험 계획은 연구자 임상을 포함하여 총 37건이었고, 그중 바이오의약품은 11건이었다.
2021년 7월 1일 현재 코로나19 치료제는 12건의 임상시험이, 코로나 백신은 8건의 임상시험이 진행 중이다. 치료제 임상 중 신물질 대상 임상은 7건(2․3상 2건, 2상 4건, 1b상 1건)이고, 약물재창출 품목이 5건(3상 2건, 2상 2건, 1상 1건)이다.
코로나19 백신은 2021년 7월 1일 현재, DNA백신 3건, 재조합백신 4건, 바이러스 벡터 백신 1건의 임상시험이 진행 중이다. 화이자/모더나 백신처럼 mRNA 백신은 국내 개발 중이긴 하나 기존 허가 품목과의 특허를 피하고 임상시험 대상자 모집에 어려움이 있어 아직 임상시험계획 승인은 이루어지지 못하고 있다.
2021년 2월 아스트라제네카 백신이 허가되기 전까지 식약처에서 제시한 코로나19 치료제와 백신 개발을 위한 가이드라인은 미국 FDA나 WHO 가이드라인과 유사하였다.25) 그러나 코로나19백신이 허가된 후, 백신을 긴급 확보하여 시급히 접종해야 되는 상황이 벌어지면서, 국내 백신 개발의 방향은 기허가받은 백신과의 유효성․안전성 비교시험을 제시하게 되었고, 식약처에서는 개발 상담과 임상시험계획 승인 사례집을 공개하여 임상시험 단계별, 항바이러스제/면역조절제 종류별로 임상시험 유효성평가변수도 공개하게 되었다.26)
(4) 바이오의약품 허가 현황
(가) 신약 및 희귀의약품
2018년 저조했던 신약 허가 건수가 2020년에는 40개 품목이 허가되어 꾸준히 늘고 있으며 그 중 수입 신약이 35개, 국내 제조 신약이 5개 품목이 허가되었다.27)
이 중 생물의약품은 6개 품목(모두 수입)이 허가되었으며, 발작성 야간 혈색소뇨증(PNH)치료제, 황반변성치료제 등이다. 또한 2020년에는 희귀질환 또는 생명을 위협하는 질환 치료 목적의 희귀의약품 중 바이오의약품이 50%를 차지하였다.
[표 4-10] 바이오신약 및 희귀의약품 허가 동향(2018∼2020)
|
구분 |
2018년 |
2019년 |
2020년 |
|
바이오신약/총 허가신약 |
4/15 |
7/35 |
4/40 |
|
바이오희귀/총 희귀의약품 |
3/21 |
3/11 |
14/28 |
자료: 식품의약품안전처 자료를 재구성.
(나) 바이오시밀러
국내개발 바이오시밀러 허가는 2018년부터 2020년까지 2개 성분 수준이었다.28)
[표 4-11] 바이오시밀러 허가 현황(2018∼2020)
|
연번 |
제품명 |
회사명 |
대조약 (성분명) |
효능효과 (일부요약) |
허가일자 |
제조/ 수입 |
|
1 |
에톨로체50밀리그램 프리필드펜주 |
삼성바이오에피스(주) |
엔브렐 (에타너셉트) |
류마티스관절염, 건선 등 |
2019. 8.19 |
수입 (국내 개발) |
|
2 |
테로사카트리지주 |
(주)대원제약 |
포스테오 (테리파라타이드) |
골다공증 |
2019.10.29 |
수입 |
|
3 |
팬포틴프리필드시린지주 2000IU |
(주)팬젠 |
이프렉스 (재조합인에리스로 포이에틴) |
만성신부전환자의 빈혈 |
2019.11.28 |
제조 |
|
4 |
팬포틴프리필드시린지주 4000IU |
제조 |
||||
|
5 |
아달로체프리필드펜주 40밀리그램 |
삼성바이오에피스(주) |
휴미라주40밀리그램 (아달리무맙) |
류마티스관절염, 건선성 관절염 등 |
2020. 7. 3 |
수입 (국내 개발) |
|
6 |
오기브리주150밀리그램 |
알보젠코리아(주) |
허셉틴주 (트라스투주맙) |
유방암, 위암 |
2020. 8.26 |
수입 |
|
7 |
삼페넷주440밀리그램 |
삼성바이오에피스(주) |
허셉틴주 (트라스투주맙) |
유방암, 위암 |
2020.10.14 |
수입 (국내 개발) |
|
8 |
벰폴라프리필드펜 |
(주)유영제약 |
고날-에프펜주 (폴리트로핀알파) |
난소과자극 , 무배란증 |
2020.10.29 |
수입 |
자료: 식품의약품안전처 자료를 재구성.
(5) 첨단바이오의약품
2001년 국내에서 개발한 ‘콘드론’이 국내 최초 세포치료제로 품목허가를 받은 이후 현재까지 총 16개의 제품이 허가되었으며, 2019년도 ‘카티라이프’ 허가 이후 2020년도에는 허가된 세포치료제가 없었다.
2020년 8월 28일부터 ‘첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률’(이하 첨단재생바이오법) 시행에 따라 기허가된 세포치료제는 2021년 8월 27일까지 첨단바이오의약품으로서 재허가를 받았다. 즉, 첨단바이오의약품 특성에 따라 세포 채취부터 판매 후 장기추적조사까지 전주기적 안전관리체계가 맞춤형으로 실시되었다.
[표 4-12] 세포치료제 허가현황(2019∼ )
|
연번 |
제조/수입 |
제품명 |
성분명 |
업체명 |
허가일자 |
효능효과 (일부 요약) |
비고 |
|
1 |
제조 |
카티라이프 |
바솔자가연골유래 연골세포 |
(주)바이오솔루션 |
2019.4.24. |
무릎 연골결손(ICRS grade III 또는 IV,결손면적 2내지10cm2)의 치료 |
|
자료: 식품의약품안전처 및 저자 작성.
첨단재생바이오법 시행(2020.8.) 이후 허가된 첨단바이오의약품은 2건이다. 첨단재생바이오법에 따라 각각의 제품은 15년간 안전성 추적 조사 보고를 매년 식약처에 해야 된다.
[표 4-13] 첨단바이오의약품 허가현황(2020.8.∼ )
|
제품명 |
업체명 |
허가일 |
적응증 |
특징 |
|
킴리아주 |
한국노바티스(주) |
2021.3.5. |
B세포 급성림프구성 백혈병 미만성 거대B세포 림프종 |
키메라 항원 수용체 T세포(CAR-T) 개인맞춤형 항암치료제 : 환자의 T세포를 받아 제조회사에서 암세포 표면의 특정 항원인식부위를 융합한 유전자를 넣어 다시 환자에 주입 |
|
졸겐스마주 |
한국노바티스(주) |
2021.5.30. |
SMN1유전자가 돌연변이 등으로 기능하지 못해 발생하는 퇴행성 척수성 근위축증 환자 중 제1형 임상적 진단이 있거나 SMN2 유전자 복제수가 3개 이하인 경우 |
유전자치료제: 사람생존운동뉴런(hSMN) 유전자가 도입된 재조합 전달체(벡터) |
자료: 식품의약품안전처 자료를 재구성.
다. 신개념 의료기기 허가현황 및 고찰
(1) 코로나19 진단시약
(가) 정식 허가 품목
2021년 7월 1일 기준 코로나19 진단시약 정식허가는 모두 48개 제품으로 유전자 PCR 검사 26개, 항원 검사 10개, 항체 검사 12개이다. 2020년 12월 31일 기준으로는 총 13품목(유전자 PCR검사 9품목, 항원검사 2개, 항체검사 2개 품목)이었던 것을 비교해 보면, 2021년에 허가된 품목은 유전자 PCR 검사 품목은 시간을 빠르게 하거나 독감바이러스까지 동시에 측정하는 품목들이 늘었고, 항원검사의 경우는 홈테스트(home test) 목적으로, 항체검사는 유전자 PCR검사로 음성이었던 사람의 자가격리 후 확인용 목적으로 개발 허가되었다.
(나) 수출 허가 품목
K-방역이라는 명칭으로 외국에서 좋은 평가를 받았던 이유 중 하나는 수출용 COVID-19 진단시약 허가를 신속히 하여 코로나19 발생 초기에 준비되어 있지 않은 상태의 외국에서 많이 활용되었기 때문이다.
[표 4-14] 코로나19 진단시약 허가현황(2020~2021)
(단위: 건수)
|
구분 |
정식허가 |
수출용허가 |
||||
|
PCR |
항원 |
항체 |
PCR |
항원 |
항체 |
|
|
2020.12.31. 기준 |
9 |
2 |
2 |
107 |
58 |
71 |
|
2021. 7.15. 기준 |
26 |
13 |
12 |
|
|
|
|
총계 |
51 |
236 |
||||
자료: 식품의약품안전처 자료를 재구성.
(2) 인공지능 기반 의료기기 개발 급증
인공지능 기술을 활용한 ‘인공지능 기반 의료기기’의 허가 건수는 2020년도 총 50건으로 2019년 10건 대비 5배 증가했다.29)
2020년 허가 제품은 국내 제조 45건, 수입 5건으로 대부분 국내 제조였으며, 주로 X-ray 등 의료영상을 분석하여 진단하는데 사용되는 AI 기반 소프트웨어 의료기기였다.
이와 같이 인공지능 기반 의료기기 개발이 급증한 데는 정부가 개발 요구가 있는 분야에 대한 가이드라인을 전문가협의체를 통해 선제적으로 제공한 역할이 컸다.30)
(3) 융복합 의료기기 증가
융복합 의료기기(복합․조합 품목)의 2020년 허가 건수는 23건으로 2018년도 이후 지속적으로 증가세에 있다.31)
대표적인 융복합 의료기기(복합․조합 품목)에는 조직수복용 생체재료, 스텐트, 비이식형 혈관접속용 기구 등이 있으며, 의료기기에 의약품의 효과(국소마취, 감염방지, 항균 등)를 추가하여 환자 치료에 도움을 주는 제품이 꾸준하게 개발되는 것으로 나타났다.
최근 생명공학, 로봇기술, 사물인터넷 등 첨단 융복합 기술을 접목한 의료기기 개발이 활발히 이루어지고 있어, 2015년부터 제품화 지원을 위해 운영하던 범부처 협의체 활동에 추가적으로 2019년 8월 27일에는 4개의 의료기기 전문학회(대한의용생체공학회, 한국생체재료학회, 대한의료인공지능학회, 대한의료정보학회)와 식약처가 연합하여 ‘의료기기 규제과학위원회’를 구성, 첨단의료기기 혁신의료기기 개발을 선제적으로 지원, 정보 공유하고 있다.
라. 발전 과제
(1) 국내개발 의료제품의 글로벌 임상시험 시스템 구축
코로나19 팬데믹을 겪으면서 긴급사용승인제도도 정착하고 임상시험 공동심사위원회도 가동하고 지정받지 않은 의료기관에서의 임상시험 참여 방법도 고안하여 시행하고 있다. 그러나 코로나 예방 백신과 같이 신속한 공급이 필요한 경우엔, 감염확산 방지를 위하여 세계적으로 먼저 허가 받은 제품을 먼저 공급하게 된다는 경험을 하게 되었다. 즉 개발 신속성이 절실히 요구되는 백신이나 의료제품 개발의 경우, 글로벌로 임상시험대상자를 포함시킬 수 있는 시스템이 작동되어야 할 것으로 보인다. 이를 위한 구체적인 실행계획이 필요한 시점이 되었다.
(2) 첨단융복합제품 중 조직 생체재료 개발 지원
최신 기술발전과 함께 생체재료가 복합된 첨단융복합의료제품 개발이 큰 관심사이다. 첨단재생바이오법과 혁신의료기기법의 동시 적용이 가능하고 정부차원의 융복합제품지원단도 가동되고 있다. 한편 첨단기술개발 분야가 학계․연구기관에서 시작되는 경우가 많아 의약품과 의료기기 전문가들의 공동 참여가 원활하지 못하고 제품화 소통에 어려움이 있을 수 있다. 허가단계뿐만 아니라 개발단계에서부터 의약품과 의료기기 공동 상담과 연구진도 공동 연구진으로 구성․진행함으로써 신속하고 효율적인 개발 성공이 확보될 수 있을 것이다.

1. 국내외 바이오기업 현황
가. 글로벌 상위 바이오
(1) 글로벌 시가총액 상위 바이오제약 기업
글로벌 의약품 시장조사기관인 EvaluatePharma에 따르면, 2020년 글로벌 600대 바이오제약기업의 시가총액은 코로나19에도 불구하고 전년에 비해 약 5,061억 달러가 증가했다고 밝혔다.
시가총액이 가장 높게 상승한 기업들은 코로나19 치료제와 백신을 개발하는 기업으로 일라이 릴리나 리제네론과 같은 기존 시가총액 상위 기업에서부터 백신 제조사인 바이오엔텍과 같은 시가총액이 작았던 기업에 이르기까지 다양했다.
상승 폭이 높은 기업을 보면 한국에서는 신풍제약과 셀트리온이 두드러졌으며, 가장 큰 폭으로 상승한 기업은 2020년 초 1억 달러에서 2020년 말 77억 달러로 76억 달러가 상승한 노바백스였다.
[표 4-15] 글로벌 시가총액 상승 바이오제약기업(2020)
(단위: %, 억 달러)
|
구분/기업명 |
시가 상승률 |
시가 상승액 |
시가총액 (2020.12.) |
|
다국적 제약사 |
|||
|
Lilly |
28% |
353 |
1,615 |
|
Abbvie |
21% |
582 |
1,892 |
|
Johnson & Johnson |
8% |
304 |
4,143 |
|
시가총액 대기업 |
|||
|
Lonza |
61% |
200 |
464 |
|
Merck KGaA |
33 |
209 |
713 |
|
Regeneron |
29% |
101 |
507 |
|
시가총액 중견기업 |
|||
|
Moderna |
434% |
348 |
413 |
|
Biontech |
126% |
120 |
196 |
|
Celltrion |
98% |
227 |
424 |
|
시가총액 소기업 |
|||
|
Shin Poong |
1,613% |
54 |
57 |
|
Cytodyn |
439% |
28 |
32 |
|
Denali |
381% |
84 |
100 |
|
시가총액 미소기업 |
|||
|
Novavax |
2,702% |
76 |
77 |
|
Seres Therpeutics |
661% |
20 |
22 |
|
Adaptimmune |
349% |
7 |
8 |
자료: Pharma, Biotech & Medtech 2020 in Review, Evaluate, 2021.2.
(2) 글로벌 시가총액 상위 의료기기 기업
바이오제약산업과 마찬가지로 글로벌 의료기기산업도 코로나19에 큰 영향을 받았으며 특히 진단기기 분야가 가장 큰 영향을 받았다. 미국 FDA는 300개에 달하는 코로나19 진단키트 및 검체수집키트에 대한 긴급사용승인(EUA)을 허가했다.
의료기기 주식 시장은 2020년 상반기에 코로나19 영향을 받았으나 하반기에 점차 회복되었다. 2020년 한해 다우존스 US의료기기 지수는 22% 상승하였고, 톰슨로이터 유럽헬스케어 지수는 6% 상승하였다.
시가총액 상위 대기업 중에서는 특히 Teladoc이 큰 폭의 시총 상승이 있었다. 2020년 봄부터 시작된 다양한 방역조치들로 Teladoc이 제공하는 원격헬스컨설팅에 대한 수요가 급증하였기 때문이다. 시가총액 중소 규모의 기업 중에는 코로나19 진단키트에 관련된 한국의 씨젠과 미국의 메리디언 바이오사이언스 등이 큰 폭의 시가총액 상승률을 기록했다.
[표 4-16] 글로벌 시가총액 상승 상위 의료기기 기업(2020)
(단위: %, 억 달러)
|
구분/기업명 |
시가 상승률 (12개월) |
시가 상승액 (12개월) |
시가총액 (2020.12.31. 기준) |
|
시가총액 대기업 |
|||
|
Teladoc Health |
139% |
230 |
290 |
|
Novocure |
105% |
92 |
176 |
|
Align Technology |
92% |
201 |
421 |
|
Abiomed |
90% |
69 |
147 |
|
West Pharmaceutical Services |
88% |
98 |
209 |
|
시가총액 중소기업 |
|||
|
Microport Scientific |
358% |
79 |
98 |
|
rhythm Technologies |
248% |
50 |
68 |
|
Seegene |
530% |
37 |
44 |
|
Sedana Medical |
153% |
6 |
9 |
|
Meridian BioScience |
106% |
4 |
8 |
자료: Pharma, Biotech & Medtech 2020 in Review, Evaluate, 2021.2.
나. 국내 바이오기업 현황
(1) 국내 바이오기업 현황
통계청 승인 국내 바이오산업 통계인 ‘국내 바이오산업 실태조사’에 따르면 2019년 기준 총 1,003개의 바이오기업이 있다. 이들 기업의 바이오산업 생산실적은 12조 3,235억 원으로 전년 대비 10.2% 증가하였다. 국내 판매와 수입에 따른 내수시장 규모는 6조 7,124억 원으로 전년 대비 6.7% 증가하였다.
산업통상자원부가 2021년 1월 발표한 2020년 국내 바이오․헬스(의약품+의료기기) 수출액은 140억 7,200만 달러로 전년도 91억 1,200만 달러에 비해 54.4% 급증하였다. 코로나19 상황에서도 주력 수출품목인 바이오의약품의 수출이 지속 증가하였고 코로나19 진단키트의 수출이 급증하였기 때문이다.
(2) 국내 의약품 기업 현황
식품의약품안전처 자료에 따르면 2019년 기준으로 의약품을 생산하는 기업은 558개 사로 이 회사들이 2만 8,363개 품목을 생산하고 있다. 원료의약품이나 완제의약품을 생산하는 기업이 424개, 한약재를 생산하는 기업이 134개가 있다. 2019년 기준 의약품 생산규모는 22조 3,000억 원에 달하며 전년에 비해 5.7% 증가하였다.
2019년 기준 국내 바이오의약품 제조기업(생산실적 보고 기준)은 총 59개사였다. 바이오의약품 생산실적은 2조 5,377억 원으로 최근 5년간 연평균 10.2% 증가 추세에 있다. 국내 바이오의약품 시장규모는 2조 6,002억 원으로 전년도 2조 2,309억 원 대비 16.6% 증가하였으며, 바이오의약품 중 가장 큰 비중을 차지하고 있는 유전자재조합의약품은 시장규모가 처음으로 1조 원을 돌파하였다.
(3) 국내 의료기기 기업 현황
식품의약품안전처 자료에 따르면 2019년 기준으로 의료기기를 생산하는 기업은 3,570개 사로 이 기업들이 1만 5,705개의 품목을 생산하고 있다. 2019년 기준 의료기기 생산규모는 7조 2,794억 원으로 전년에 비해 11.8% 증가하였다. 이 중 체외 진단용 시약의 생산액은 3,780억 원으로 5.2% 비중을 차지하고 있다.
2. 바이오기업 지원 제도
가. 코로나19 백신 및 치료제 개발 지원
정부는 2020년 4월부터 ‘코로나19 치료제․백신 개발 범정부지원위원회’를 설치하여 국산 코로나19 치료제 및 백신의 신속개발을 지원하고 있다. 실무적으로는 범정부 차원의 신속한 지원을 위해 ‘범부처 코로나19 치료제․백신 임상지원 TF’를 운영하여 개발기업 애로사항의 신속한 해결을 지원하고 있다. 치료제의 경우 정부의 적극적인 지원을 통해 2021년 2월 5일 국내 최초 항체치료제가 조건부 허가를 받았으며 40여 개 기업이 치료제를 개발하고 있는 상황이다.
2021년 6월 25일 현재 국내 5개 백신 개발기업이 임상시험을 실시하고 있으며, 정부에서는 개별 기업들이 신속하게 임상 3상에 진입할 수 있도록 임상 1/2상 종료 이전부터 개발기업과 1:1 맞춤 상담 및 사전검토를 지원하고 있다. 국가지정 중앙임상시험심사위원회(중앙 IRB)도 조기에 가동하여 기존에 각각 의료기관별로 받아야 하는 임상시험심사위원회(기관 IRB)의 승인에 대한 어려움도 해소하고 있다. 아울러, 대규모 임상시험 참여자 모집을 위해 국가임상시험지원재단을 중심으로 임상 참여자 모집을 지원하고 있으며, 임상비용도 지속적으로 확대하고 있다.
한편, 정부는 코로나19 상황에서 새로운 백신 플랫폼으로 떠오른 mRNA 백신에 대해 국내 기업들이 신속하게 개발할 수 있도록 부처별로 역할을 나누어 지원하고 있다. 과학기술정보통신부는 핵심원천기술개발, 질병관리청은 비임상 후보물질 발굴․효능검증, 보건복지부는 임상시험 지원, 산업통상자원부는 원자재․생산기술 기반 구축, 식품의약품안전처는 안전성 및 유효성 품질평가기술, 특허청은 특허분석 및 특허회피 전략 수립 등을 지원하고 있다.
나. 창업 및 초기 바이오기업 지원
정부는 분산된 부처별 창업지원 정보를 ‘K-Startup’으로 일원화하고, 창업기업 지원 정책을 성장단계에 따라 창업교육, 시설․공간․보육, 멘토링․컨설팅, 사업화, R&D, 행사․네트워크 등 6가지 범주로 분류하여 창업정보를 종합 제공하고 있다. 창업지원포털(www.k-startup.go.kr)을 통해 중앙부처의 개별 창업지원 사업공고를 통합해 안내해 왔으며 2021년 1월부터는 광역지자체 사업을 추가해 안내하고 있다. 2021년도 정부의 창업지원 통합공고 예산에 따르면 15개 부처 및 17개 광역지자체에서 194개 사업에 총 1조 5,179억 원 규모의 창업 지원을 할 계획이다.
특별히, 한국바이오협회는 정부의 창업지원사업 등을 참고하여 ‘바이오스타트업 지원 가이드북’을 발간하여 바이오기업들의 예비창업단계, 창업초기단계, 성장단계별 정책자금, 금융지원, 입주․시설․공간, 창업교육․멘토링․컨설팅, 인허가, 판로․해외진출 등에 대한 정부지원사업을 안내하고 있다.
한편, 최근 코로나19 확산 상황 속에서 바이오산업과 신약․백신 기술의 중요성이 커지면서 국내 바이오 창업기업이 빠르게 성장할 수 있는 인프라 구축 필요성에 따라, 중소벤처기업부는 ‘K-바이오 랩허브’ 구축을 추진하고 있다. ‘K-바이오 랩허브’는 미국 보스턴의 바이오 스타트업 지원기관인 ‘랩센트럴’을 벤치마킹한 모델이다. 여기서 감염병 진단, 신약개발 등 고기술을 요구하는 바이오 창업기업이 실험․연구부터 임상실험까지 활용할 수 있도록 실험․연구․임상․시제품 제작 등에 필요한 인프라, 창업지원프로그램, 산․학․연․병 협력 네트워크 등을 종합 지원하는 인프라 구축 프로젝트이다.
다. 기술개발 지원
정부는 바이오 분야에 대한 효율적․체계적 추진을 위해 8개 관계 부처 공동으로 매년 생명공학 육성 시행계획을 마련하고 생명과학, 의료, 농업, 환경, 융합신산업 등의 분야별 연구개발 투자를 시행하고 있다. 2020년에는 총 2조 8,322억 원의 연구개발 투자가 진행되었으며, 2021년에는 3조 3,400억 원의 투자를 계획하고 있다. 2019년 5월 발표된 ‘바이오․헬스 혁신전략’에 따라 정부는 R&D 투자를 2025년까지 4조 원 이상으로 확대 추진할 계획이다.
생명공학 육성 시행계획에 따라 2021년에는 창의적이고 도전적인 연구를 촉진하고, 신변종감염병 플랫폼 기술개발, 한국바이러스기초연구소 설립, 디지털치료제 개발 지원 등 미래 대비 R&D를 강화하며, 융합형 신의료기기 개발, 뇌 분야 핵심원천기술 개발, 해양 마이크로바이옴 연구 등 바이오 기반 융합연구를 확산할 계획이다.
라. 산업화 환경 조성
(1) 의약품
산업통상자원부는 바이오의약품에 사용되는 소재․부품․장비 16개 품목의 자립화를 위해 2020년부터 2024년까지 857억 원을 지원하고 있으며, 민간 주도의 연대협력 협의체를 지원하여 수요기업과 공급기업 간의 네트워킹을 활성화하고 있다. 아울러, 바이오의약품을 특별 보안검색 대상으로 항공보안법시행령에 명시하는 등 수출 절차를 간소화해 기업의 수출 유동성 확보를 지원하고 있다.
또한, 정부는 2020년부터 바이오공정 인력양성센터 구축 및 한국형 NIBRT 프로그램을 도입하여 2024년부터 연 2,000명 인력을 양성할 계획이며, 2021년부터 의약품 분야별 규제과학 전문교육을 도입하고, 4차 산업혁명과 재생․정밀의료로의 패러다임 변화에 대비해 재직자 대상 AI․빅데이터 활용 교육과 산학연계형 바이오 융합인력 양성을 지원하고 있다.
(2) 의료기기 및 디지털 헬스케어
병원․기업 공동 R&D 품목에 대한 발굴과 개발을 통해 내수시장 점유율을 확대할 수 있도록 지원하고 있으며, 병원의 의료기기 사용 현황을 기업에 유용한 형태로 가공․공개하여 기업의 사업화 전략 수립 시 활용할 수 있도록 지원할 계획이다. 또한, 기업 영문 디렉토리북, 국가별 의료기기 규제 누리집 발간, 의료기기 온라인 전시관 운영 등을 통해 중소기업들의 해외진출을 지원할 계획이다.
아울러, 개인 주도형 의료데이터 활용 플랫폼의 조속한 추진과 개방형 서비스플랫폼을 탑재한 100만 명 유전체 빅데이터 구축을 추진하고 있으며, EMR 보급률은 높으나 표준화 미비로 인해 기관간 상호호환이 어려운 상황을 고려해 EMR 인증제 도입을 통해 표준제품 개발을 유도하고 있다. 또한, 보건의료 데이터의 가명처리 표준화와 관련 기술개발 지원을 통해 가명화 처리부담 완화 및 데이터 활용 촉진을 추진하고 있다.
(3) 바이오플라스틱 등 바이오화학제품
정부는 플라스틱 쓰레기 문제 해결, 탄소 저감 등을 위한 산업적 대안으로 바이오플라스틱 등 화이트바이오산업을 육성하고 있다. 이를 위해 기존 플라스틱의 대체 소재로 주목받고 있는 생분해성 바이오플라스틱 개발을 지원하고 있으며, 인증 시험평가기관 구축부터 별도 쓰레기 처리체계 검토 등에 이르기까지 바이오플라스틱의 개발과 보급을 확대하고 있다.
아울러, 유전자가위 등 바이오신기술 적용 산물을 활용한 바이오화학 제품 개발 확대를 지원하고, 시간 및 비용 소모가 큰 위해성 심사를 대신하여 보다 간소화된 사전검토제를 통해 수입 및 생산 승인 등에 대한 면제를 추진하는 등 규제개선도 추진하고 있다. 또한, 바이오기술과 화학공정기술 교육을 통해 현장 연구 및 생산인력을 양성하고, 신시장 창출을 위해 특허 및 판로개척도 지원하고 있다.
마. 세제 및 관세 지원
바이오산업은 신약개발 등 연구개발에 투자하는 비용이 높아 연구개발 및 시설투자비 등에 관련된 기업 지원이 필요하며, 우리나라는 조세특례제한법 및 관세법에 따라 세제 및 관세 분야 혜택을 지원하고 있다.
조세특례제한법에서는 신성장․원천기술의 연구․인력개발비에 대한 세액 공제를 지원하고 있다(법 제10조). 바이오․헬스분야 신성장동력․원천기술에는 바이오․화합물의약, 의료기기․헬스케어, 바이오 농수산․식품, 바이오화장품소재가 포함되어 있다(시행령 별표7). 신성장․원천기술의 연구개발비 세액공제율은 대기업과 중견기업은 20∼30%, 중소기업 30∼40%이다. 또한, 신성장․원천기술의 사업화를 위한 시설에 투자하는 경우에도 세액 공제를 지원하고 있으며(법 제24조) 기업 규모별 세액공제율은 대기업은 3%, 중견기업은 5%, 중소기업은 12%이다.
특별히, 정부는 국가경제․안보에 중요한 반도체, 배터리, 백신 등 3대 분야를 국가전략기술로 지정해 기존 신성장․원천기술보다 R&D는 10%, 시설투자는 3∼4% 높게 세액공제율을 확대 지원할 계획이다.
한편, 관세법에서는 장애인보조기구에 대한 물품, 인공신장기 등 만성신부전증환자가 사용할 물품과, 고셔병, 후천성면역결핍증, 혈우병 등의 환자가 사용할 희귀병치료제 등 시행규칙 별표2에서 정한 물품에 대해 관세를 면제해 주고 있으며(법 제91조 제4호), 시행규칙 별표2의 4에서 정한 국내 제작이 곤란한 공장자동화 물품에 대해서도 수입할 때 관세를 감면하고 있다(법 제95조 제1항 제3호).
바. 바이오기업(제품) 인증
(1) 혁신형 제약기업 인증․지원
보건복지부는 국내 제약기업의 글로벌 경쟁력을 확보하고, 제약산업을 미래 신성장동력으로 육성하기 위해 혁신형 제약기업 인증 등을 지원하고 있다. 연구개발 투자 비중이 일정수준 이상이고 신약 연구개발 실적이 우수한 기업을 대상으로 선정되며 2020년 12월 기준 48개 사가 인증을 받았다.
인증받은 기업은 R&D 참여시 가점 부여, 세제 지원, 약가 결정시 우대, 정책자금 우선 융자, 해외 전문 인력 채용 지원, 연구시설 입지 규제 완화 등의 혜택을 받는다. 신규 인증 심사는 2년마다, 인증 연장 심사는 3년마다 실시하며 심사를 통과한 기업은 3년간 인증 지위를 유지하게 된다.
(2) 월드클래스 기업 인증·지원
산업통상자원부는 취약한 산업의 허리를 강화하고 성장동력을 지속적으로 확충하며 질 좋은 일자리를 창출하고자 2011년부터 10년간 성장 잠재력과 혁신성이 뛰어난 중소․중견기업 300개를 선정하여 지원하는 ‘월드클래스300’ 프로젝트를 추진하였다. 선정된 300개 기업 중에는 의약품, 의료기기, 식품, 유전체분석 기업 등이 포함되었다.
2021년부터 향후 10년간 추진될 ‘월드클래스 플러스’ 프로젝트에서는 일정 이상의 매출(중견기업 또는 700억 원 이상 후보중견) 및 수출․혁신 역량 등을 갖춘 200개 내외 기업을 선별하여 기업 주도의 R&D를 지원하고 유관기관과 함께 금융, 수출, 컨설팅 등을 지원할 계획이다.
(3) 세계일류상품 및 생산기업 인증·지원
산업통상자원부와 코트라는 수출 품목의 다양화․고급화 및 미래 수출동력 확충을 위해 세계일류상품 및 생산기업을 선정․지원하고 있다. 점유율에 따라 현재일류상품(점유율 5위 이내) 및 차세대일류상품(7년 이내 현재일류상품 진입 가능), 인증 대상에 따라 품목과 생산기업으로 나누어 선정하며, 업종별 추천위원회 및 세계일류상품 발전 심의위원회 심의를 거쳐 최종 선정된다. 바이오분야는 한국바이오협회가, 보건산업은 한국제약바이오협회․한국의료기기공업협동조합․한국의료기기산업협회․대한화장품협회․한국식품산업협회가 맡아 추천위원회를 구성한다.
선정된 기업에게는 해외시장 개척활동, 금융자금 조달, 컨설팅, 유공자 포상, 세계일류상품 로고 사용 등의 혜택이 주어진다.

![]()
세계 생명공학 연표
⋙ 기원전 8000년
◦인간이 농작물과 가축을 경작하고 사육하기 시작
◦최초로 감자를 식용으로 경작
⋙ 기원전 4000∼2000년
◦이집트에서 효모를 사용해 빵과 맥주의 발효 시작
◦수메리아, 중국, 이집트에서 치즈를 생산하고 포도주를 발효시킴
◦바빌로니아인들은 몇 그루 수술 나무의 꽃가루를 가지고 선별적으로 암술나무에 수정하여 대추야자를 생산
⋙ 기원전 500년
◦중국에서 항생물질을 가진 곰팡이가 핀 두부로 종기를 치료
⋙ 서기 100년
◦중국에서 최초로 살충제를 국화에 살포함
⋙ 1322년
◦아랍에서 우성 말을 생산하기 위해 최초로 인공수정을 사용
⋙ 1590년
◦Janssen, 현미경 발명
⋙ 1663년
◦Hooke, 세포의 존재 발견
⋙ 1675년
◦Leeuwenhoek, 박테리아를 발견
⋙ 1761년
◦Koelreuter, 다른 종의 농작물을 성공적으로 이종교배 하였음을 보고
⋙ 1797년
◦Jenner, 아이들에게 천연두를 막기 위한 바이러스성 백신을 접종
⋙ 1830∼1833년
◦1830년 단백질 발견
◦1833년 최초로 효소가 발견되고 분리됨
⋙ 1835∼1855년
◦Schleiden와 Schwann, 모든 유기체는 세포들로 구성되어 있다고 제안
◦Virchow, ʻʻ모든 세포는 세포에서 생겼다.ʼʼ고 선언
⋙ 1857년
◦Pasteur, 미생물들이 발효를 유발한다고 제안
⋙ 1859년
◦Charles Darwin, 자연 도태의 진화론을 발표(1800년대 후반 유전학의 무지에도 불구하고 선택된 부모와 도태된 다양한 자손에 대한 개념은 동식물 사육사들에게 매우 큰 영향을 줌)
⋙ 1865년
◦유전학 연구 시작
◦Gregor Mendel, 오스트리아인 수도사인 그는 완두를 연구하여 유전법칙에 의해 유전적 특징이 부모로부터 자손에게 물려진다는 점을 발견함
⋙ 1870∼1890년
◦Darwin의 이론을 이용하여 면화를 이종교배하고 수백 가지의 우성품종을 개발
◦최초로 농부들이 수확량을 늘리기 위해 농지에 질소고정 박테리아 미생물을 섞음
◦William James Beal, 최초로 실험실에서 실험용 옥수수 잡종 생산
⋙ 1877년
◦Koch, 박테리아를 염색하고 동정하기 위한 기술 개발
⋙ 1878년
◦Laval, 최초로 원심분리기 개발
⋙ 1879년
◦Fleming, 후에 염색체라 불려지는 세포핵 안쪽의 봉모양의 염색질을 발견
⋙ 1900년
◦초파리가 유전연구에 사용됨
⋙ 1902년
◦면역학이라는 용어가 처음으로 나타남
⋙ 1906년
◦유전학이라는 용어가 소개됨
⋙ 1911년
◦Rous, 최초로 암을 유발하는 바이러스 발견
⋙ 1914년
◦최초로 박테리아를 영국 맨체스터의 하수처리에 사용
⋙ 1915년
◦Phage(박테리아성 바이러스)발견
⋙ 1919년
◦최초로 생명공학(Biotechnology)이라는 단어가 출판물에 사용
⋙ 1920년
◦Evans&Long, 인간성장 호르몬 발견
⋙ 1928년
◦Alexander Fleming, 항생물질인 페니실린 발견
◦유럽에서 조명충 나방제어를 위한 소규모의 bacillus thuringiensis(Bt) 테스트 시작
◦1938년 프랑스에서 미생물 살충제의 상업적 생산 시작
◦Karpechenko, 무와 양배추를 교배하여 서로 다른 속(屬)의 식물 사이에서 번식력이 강한 자손을 만듦
◦Laibach, 최초로 오늘날 이종교배라 알려진 광범위한 교배로부터 잡종을 얻기 위해 배구제(embryo rescue)를 사용
⋙ 1930년
◦美의회에서 식물육종생산의 특허를 가능하게 하는 식물특허법(Plant Patent Act) 통과
⋙ 1933년
◦1920년대 Henry Wallace에 의해 개발된 잡종옥수수가 상업화 됨(1945년에는 엄청난 매출액은 증가된 연 종자구입비를 능가했고 잡종 옥수수는 미국 전체 옥수수 생산량의 78%를 차지)
⋙ 1938년
◦분자 생물학이란 용어가 생김
⋙ 1941년
◦유전공학이란 용어가 폴란드 Lwow의 기술연구소에서 효모복제에 관한 강의를 맡고 있는 덴마크의 미생물학자 A. Jost에 의해 최초로 사용
⋙ 1942년
◦박테리아를 감염시키는 박테리오파지를 구명하고 확인하기 위해 전자 현미경을 사용
◦페니실린을 미생물에서 생산함
⋙ 1944년
◦Avery와 그 외 다른 사람들에 의해 DNA가 유전정보를 운반한다는 점이 입증됨
◦Waksman, 결핵에 효과적인 항생제인 streptomycin을 분리(추출)
⋙ 1946년
◦새로운 타입의 바이러스를 형성하기 위해 서로 다른 바이러스로부터의 유전물질이 결합할 수 있다는 일종의 유전자 재조합이 발견
◦유전적 다양성의 상실로 인한 위협을 인식한 미의회는 식물수집과 보존 그리고 이러한 인식의 홍보에 막대한 자금을 제공함
⋙ 1947년
◦McClintock, 옥수수에서 소위 움직이는 유전자(jumping genes)라 불리는 전이요소를 발견
⋙ 1949년
◦Pauling, 겸상(鎌狀) 적혈구 빈혈증(흑인의 유전병)이 헤모글로빈 내 단백질분자의 돌연변이로 야기된 ʻ분자병ʼ임을 밝혀냄
⋙ 1951년
◦냉동정액을 사용한 가축의 인공수정이 성공적으로 수행됨
⋙ 1953년
◦과학저널 Nature는 현대 유전학의 출발을 상징하는 DNA의 이중나선 구조를 묘사한 James Watson과 Francis Crick의 원고를 출판
⋙ 1955년
◦핵산 합성에 관한 효소가 처음으로 추출됨
⋙ 1956년
◦Kornberg, DNA 복제에 필요한 효소 DNA 중합효소Ⅰ(DNA polymeraseⅠ) 발견
⋙ 1958년
◦겸상 적혈구 빈혈증이 단일 아미노산의 변화 때문에 발생한다고 밝혀짐
◦DNA가 처음으로 시험관에서 만들어짐
⋙ 1959년
◦조직 살균제가 개발됨
◦단백질 생합성의 첫 단계가 그려짐
⋙ 1950년대
◦바이러스 증식억제 물질(interferon) 발견
◦최초 합성 항생 물질 개발
⋙ 1960년
◦시냅시스(세포의 감수분열 초기에 있는 상동염색체의 병렬접착)를 이용해 DNA-RNA 잡종 분자가 만들어짐
◦메신저 리보 핵산(Messenger RNA) 발견
⋙ 1961년
◦美 농림부가 최초 미생물 살충제인 Bacillus Thuringiensis를 등록함
⋙ 1963년
◦Norman Borlaug에 의해 신품종 밀이 개발됨으로 인해 생산량이 70% 상승함
⋙ 1964년
◦필리핀의 국제 벼 연구소(The International Rice Research Institute)는 새로운 품종을 개발하여 충분한 비료를 주면 이전의 생산량보다 2배 많은 수확량을 얻을 수 있는 녹색 혁명을 일으킴
⋙ 1965년
◦Harris와 Watkins가 성공적으로 생쥐와 사람 세포를 융합시킴
⋙ 1966년
◦유전암호가 해독되고 일련의 3개의 뉴클리오티드가 하나의 아미노산을 결정한다는 사실이 밝혀짐
⋙ 1967년
◦최초로 자동 단백질 서열 분석기 완성
⋙ 1969년
◦처음으로 효소가 생체 외에서 합성됨
⋙ 1970년
◦노르만인 Borlaug, 노벨 평화상 수상(1963년 참조)
◦유전물질을 자르는 제한 효소(두 줄 사슬 DNA를 특정 부위에서 절단하는 효소)의 발견으로 유전자 복제의 장이 열림
⋙ 1971년
◦처음으로 유전자가 완벽하게 합성됨
⋙ 1972년
◦인간의 DNA 구성이 침팬지와 고릴라의 DNA와 99% 유사함이 발견됨
◦최초로 배이식(胚移植)이 시도됨
⋙ 1973년
◦Stanley Cohen와 Herbert Boyer, 제한효소와 리가제(ligases)를 사용해서 DNA를 자르고 붙이는 기술과 박테리아에서 새로운 DNA를 복제하는 기술을 완성함
⋙ 1974년
◦미국 NIH는 유전자 재조합 연구를 총괄하기 위해 재조합 DNA 자문위원회(Recombinant DNA Advisory Committee) 구성
⋙ 1975년
◦최초로 미국 정부가 캘리포니아 Asilomar 회의에서 유전자재조합실험을 규제하기 위한 가이드라인 개발을 주장함
◦단일클론항체가 생산됨
⋙ 1976년
◦유전자 재조합 기술이 유전 장애인에 최초로 적용
◦분자교배가 태아의 alpha thalassemia 진단에 사용됨
◦효모의 유전자가 대장균(E.coli)에서 발현됨
◦최초로 특정유전자의 염기쌍 순서가 결정됨(A, C, T, G)
◦美國재조합 DNA 자문위원회(NIH Recombinant DNA Advisory Committee)에 의해 유전자 재조합 실험에 대한 가이드라인이 처음으로 발표
⋙ 1977년
◦인간유전자를 박테리아에서 처음으로 발현시킴
◦전기영동을 이용해 DNA의 긴 마디를 빠르게 나열하기 위한 연구수행
⋙ 1978년
◦바이러스의 고방사선 구조가 최초로 확인됨
◦재조합 인간 인슐린이 최초로 생산됨
◦미국 노스캐롤라이나 과학자들이 DNA 분자상의 특정 위치에 특정 돌연변이를 일으키는 것이 가능하다는 것을 보여줌
⋙ 1979년
◦최초로 인간성장 호르몬이 합성됨
⋙ 1970년대
◦유전공학 제품을 개발하기 위해 최초의 상업적 회사가 설립
◦중합효소(polymerases)의 발견
◦뉴클리오티드(nucleotides)의 빠른 나열기술 완성
◦유전자 표적화
◦RNA splicing
⋙ 1980년
◦Diamond v. Chakrabarty 재판에서 미 연방법원은 유전자재조합생물형태에 대한 특허를 인정했으며, Exxon 석유회사가 기름 먹는 미생물에 대한 특허 취득
◦美國정부 유전자복제에 대한 권한을 Cohen과 Boyer에게 부여
◦최초의 유전자합성 기계 개발
◦인간인터페론유전자를 박테리아로 형질전환(Transformation) 시킴
◦노벨 화학상이 유전자 재조합분자를 개발한 Berg, Gilbert, Sanger에게 수여됨
⋙ 1981년
◦오하이오 대학의 과학자들이 다른 동물의 유전자를 쥐에 이식함으로써 최초로 유전자 이식동물을 생산함
◦중국의 과학자가 최초로 복제 물고기 금잉어를 만듦
⋙ 1982년
◦미국의 Applied Biosystems사는 단백질 서열분석에 필요한 샘플의 양을 획기적으로 줄일 수 있는 상업적 가스 상 단백질 서열분석기를 발표
◦가축을 위한 최초의 유전자 재조합 DNA 백신 개발
◦유전적 변이를 거친 박테리아에서 생산된 인간인슐린이 미국 FDA로부터 최초의 생명공학 기술에 의한 의약품으로 승인 받음
◦최초의 유전자 변형식물인 피튜니아 생산
⋙ 1983년
◦중합효소연쇄반응(PCR) 기술이 소개(유전자와 유전자 조각의 복제를 위해 열과 효소를 사용하는 PCR 기술은 이후 유전공학에서의 연구와 개발에 광범위하게 쓰이는 중요한 도구가 됨)
◦TI 플라스미드(plasmid: 염색체와는 따로 증식할 수 있는 유전인자)에 의한 식물 세포들의 유전학적인 변형이 수행됨
◦최초로 인공염색체 합성
◦특정유전병 유발인자 발견
◦생명공학기술을 이용해 피튜니아를 완전 성장시킴
◦피튜니아 식물을 통해 유전자변형식물의 새로운 특징이 자손에게 전달됨을 확인함
⋙ 1984년
◦DNA 지문검색 기술이 개발
◦HIV 바이러스의 전체 게놈이 복제되고 서열 결정됨
⋙ 1985년
◦신장병과 낭포성 섬유증을 유발하는 유전인자 발견
◦법적 증거로서 유전자 지문법이 도입
◦최초로 곤충과 박테리아, 바이러스에 저항력이 있는 유전자 변형식물이 시험됨
◦미국 NIH는 인간을 대상으로 하는 유전자 치료법 실험수행에 대한 가이드라인을 정함
⋙ 1986년
◦유전자 재조합 B형 간염 백신 최초 개발
◦최초의 유전공학 항암치료제 인터페론 생산
◦미국 정부는 유전자 재조합 유기체에 대해 전통적인 유전자재조합기술로 만들어진 제품에 적용된 규정보다 더 엄격한 ʻThe Coordinated Framework for Regulation of Biotechnologyʼ 규정 확립
◦California Berkeley 대학의 화학자가 신약을 개발하기 위해 항체와 효소를 결합하는 방법(abzymes) 제시
◦유전자 변형식물(담배)의 실제 실험이 수행됨
◦최초로 환경 보호국이 유전자변형 담배의 판매를 승인
⋙ 1987년
◦바이러스에 내성이 있는 토마토의 field test를 최초로 승인함
◦캘리포니아에서 농작물의 서리 형성을 억제하는 유전자 변형 박테리아인 frostban을 딸기와 감자를 통해 시험하였는데 이것이 처음으로 공식 승인된 유전자 재조합 박테리아 외부 실험임
⋙ 1988년
◦미국 정부는 하버드대학 분자유전학자에게 유전자 변형동물 즉, 유전자변형 쥐에 대한 특허권을 부여함
◦세제에 사용할 수 있는 표백제 내성을 지닌 단백질 분해효소를 만드는 공정에 대한 특허권이 부여됨
◦미국 의회가 다른 종의 게놈뿐만 아니라 인간유전자 암호를 해독하고 지도를 만드는 인간 게놈 프로젝트 연구비를 승인함
⋙ 1989년
◦최초로 유전자변형 해충방지 면화의 field test 승인
◦식물 게놈 프로젝트 시작
⋙ 1980년대
◦진화의 역사를 밝히기 위한 DNA 연구 시작
◦유럽에서 유전자 재조합 동물백신의 사용 승인
◦기름 청소에 미생물을 이용한 생물학적 정화기술 사용
⋙ 1990년
◦미국 최초로 유전자재조합 기술을 이용하여 치즈제조에 쓰이는 인공적으로 제조된 chymosin 효소인 Chy-MaxTM이 소개됨
◦인체의 모든 유전자 지도를 제작하려는 국제적인 노력인 인간 게놈 프로젝트가 시작됨
◦면역장애를 앓고 있는 4살 여자 어린이를 대상으로 실시한 유전자 치료가 성공적으로 수행됨
◦유아 조유용 우유 단백질을 만드는 유전자 변형 젖소 탄생
◦해충에 강한 옥수수인 Bt 옥수수 생산
◦영국 최초로 유전자변형 효모식품이 승인됨
◦유전자 변형 척추동물 송어의 실지실험이 수행됨
⋙ 1992년
◦미국과 영국의 과학자들이 시험관 내에서 배아에 낭포성 섬유증과 혈우병과 같은 유전적 기형을 테스트하는 기법을 밝힘
◦미국 FDA는 유전자 이식 음식이 유전적으로 위험하지도 않고 특별한 규정도 필요 없다고 선언함
⋙ 1993년
◦미국 FDA, 낙농가의 우유생산 촉진을 위해 BST(Borine Somatotropin)를 승인
⋙ 1994년
◦미국 FDA, 생명공학으로 만들어진 FLAVRSAVRTM tomato 승인
◦최초로 유방암 유전자 발견
◦CF 환자의 폐에 단백질이 쌓이지 않게 하는 재조합 인간 DNase 승인
◦소 성장호르몬(POSILAC)이 상용화됨
⋙ 1995년
◦에이즈 환자에게 최초로 비비의 골수가 이식됨
◦최초로 바이러스 이외의 살아있는 유기체(hemophilus influenzae)의 완벽한 유전자 배열이 완성됨
◦암정복을 위해 면역시스템 모듈, 유전자 재조합 항체형성과 같은 유전자 치료가 도입됨
⋙ 1996년
◦파킨슨병과 관련된 유전자의 발견으로 퇴행성 신경질환의 잠재 가능한 치료와 그 원인 연구의 중요한 이정표를 제시함
⋙ 1997년
◦스코틀랜드에서 어른세포로 복제된 최초의 복제양 Dolly 탄생
◦해충방지 농작물인 Roundup ReadyTM 콩과 BollgardTM 해충방지 면화와 같은 작물이 상업화됨
◦아르헨티나, 호주, 캐나다, 중국, 멕시코와 미국 등 전 세계적으로 500만 에이커 면적에서 유전자조작 작물이 재배됨
◦Oregon주 연구자들은 두 마리의 붉은 털 원숭이를 복제했다고 주장함
◦유전병 연구의 새로운 기술을 창조하기 위해 PCR, DNA 칩과 컴퓨터를 결합한 새로운 DNA기술 탄생
⋙ 1998년
◦하와이대학 연구진이 어른의 난소 적(cumulus)세포 핵으로부터 쥐를 복제함
◦인간 배아줄기세포주가 확립됨
◦일본 Kinki 대학 연구진은 한 마리 어른암소로부터 얻은 세포를 이용하여 8마리의 동일 송아지 복제함
◦최초로 C. elegans 벌레에 대한 동물 게놈 염기서열 해독 완료
◦3만 개 이상의 유전자 위치를 보여주는 인간 게놈지도의 초안 완성
◦동남아시아 다섯 나라가 병에 강한 파파야 나무를 개발하기 위해 컨소시엄을 구성
⋙ 1990년대
◦최초로 영국에서 유전자 지문법을 이용해 유죄를 판결함
◦규정 질량의 일반적 융기에 착상된 유전자 분리성공
◦유전성 대장암이 DNA 치료 유전자의 결핍으로 야기된다는 사실 발견
◦유전자 재조합 광견병 백신을 너구리에 실험
◦미국에서 농약을 기본으로 한 생명공학 제품판매 승인
◦특수이식 유전자를 가진 쥐에 관한 특허 허용
◦최초로 유럽에서 발암물질에 민감한 유전자변형 쥐에 관한 특허 제기
◦유방암 유전자 복제
⋙ 2000년
◦최초로 애기장대(학명 arabidopsis thaliana)의 게놈지도 개발
◦13개 나라에서 총 1억 89만 에이커 면적에서 생물공학 농작물이 재배됨
◦최초로 바이러스에 강한 고구마가 케냐에서 실질 시험됨
◦인간게놈 배열의 초안 발표
⋙ 2001년
◦최초로 벼 게놈지도 완성
◦오스트리아 연구진들은 barley yellow dwarf virus와 같은 바이러스 예방백신에 사용되는 hairpin RNA를 이용한 기술개발을 보고함
◦Chinese National Hybrid 연구진들은 일반 쌀 생산량보다 두 배 많은 super rice종 개발을 보고함
◦유럽위원회(The European Commission)가 모든 유전자 변형 식품에 라벨을 붙일 것을 제기함
◦농업적으로 중요한 시노라이조비움 멜리로티(sinorhizobium meliloti) 박테리아의 DNA배열 완성
◦염분이 있는 물과 땅에서 성장 가능한 최초의 농작물을 만들기 위해 애기장대로부터 추출된 유전자를 토마토에 이식함
◦농업에 중요한 식물병원균 Agrobacterium tumefaciens의 게놈서열이 공표됨
◦스트레스에 더 강한 농작물 개발의 실마리로서, 손상을 입거나 스트레스를 받았을 때 빛을 발하는 세일 크레스(thale cress)라 불리는 실험용 식물 재배
◦최초로 땅콩의 종합적 분자지도가 완성됨
⋙ 2002년
◦완성된 인간 게놈 배열을 과학전문지에 게재함
◦효모의 프로테옴(proteome: 단백질 간 상호작용과 네트워크의 총합)의 기능지도(functional map)의 초안 완성, 효모의 게놈지도는 1996년에 발표되었음
◦줄기세포의 분화에 관여하는 조절인자 연구에 큰 발전이 있었으며, 이에 관여하는 200여개의 유전자가 밝혀짐
◦생명공학 농작물이 16개국, 1억 4,500만 에이커에서 재배되고 있으며 이는 2001년보다 12% 증가한 것임
◦자궁경부암에 대한 백신 개발에 성공하였으며 이는 특정 암에 대한 예방백신이 가능함을 처음으로 보여준 성과임
⋙ 2003년
◦인간게놈 완전 해독(2003.4.)
◦정신분열증과 우울증 등 정신병의 발병 위험을 증가시키는 특정유전자 변형을 확인한 연구결과 발표
◦美최초의 GM 애완동물로 광고된 붉은 빛 형광물고기 GloFish 상업화
◦세계적으로 생명공학작물 이용의 활성화 증대
◦영국은 최초로 상업적인 생명공학작물인 제초제 저항옥수수를 인정
◦미국 환경 보호국은 최초로 형질전환 해충저항성 옥수수를 승인함
◦2003년 banteng 들소가 최초로 복제되었으며, 노새, 말, 사슴도 복제되었음
◦1997년 포유동물의 최초 복제양 돌리는 폐병연구 후에 안락사 됨
◦일본 연구팀은 자연적으로 카페인을 제거하는 생명공학 커피를 개발함
◦RNA 형태는 유전자 형식을 지시, 변형시키며 줄기세포와 배(胚)의 성장에 영향을 미침을 밝힘
◦쥐의 배 세포줄기가 정자나 난자 세포로 성장할 수 있음을 확인
◦남성을 결정짓는 Y염색체가 동일한 유전자를 함유하고 있음을 발견
◦종양으로 하여금 암의 전이에 필요한 혈관을 생성하지 못하도록 하는 약물의 개발
⋙ 2004년
◦미국 식품의약국(FDA)은 아바스틴이라는 최초의 신세대 항암제를 승인함
◦FDA는 다양한 종류의 약물치료와 질병을 위해 첫 DNA칩 및 유전자칩 개발
◦RNA 방해 제품으로, 임상 시험에 들어가는 첫 번째 RNAi 제품 생산
◦국제연합 식량농업기구(FAO)의 생명공학 작물 승인
◦국립과학연구원 산하 의학연구소에서는 ʻ생명공학작물이 건강에 해를 끼치지 않는다.ʼ라고 밝힘.
◦FDA는 식품안전성 검토 후 생명공학 밀의 안전성 밝힘
◦몬산토사는 지방산을 감소 삭제한 low-linolenic 콩을 소개함
◦닭 게놈 DNA 완전 해독
◦최초로 애완 새끼고양이 복제
◦ʻ쓸모없는 DNA(junk DNA)ʼ 구명
◦인간의 유전자 DNA 중 단백질을 합성하는 DNA는 전체 게놈의 10%에 불과하며 아무런 기능이 없는 DNA에 대한 구명 이루어짐
◦지난 3월 영국의 과학자들, 지난 20년간 나비 58종의 개체 수가 71% 줄었으며, 조류는 54% 감소했다고 보고
◦新의약품 개발 활발
◦유엔(UN), 대학, 민간자선단체, 제약업체 등 공공단체와 민간기업이 손을 잡고 미개발국의 환자를 위해 의약품을 개발하는 새로운 움직임이 일어남.
◦미생물게놈 추출성공, 인간게놈프로젝트 주역인 미국 크레이크 벤터 박사는 3월 사이언스에 바닷물에서 미생물 게놈을 추출해 10억 5,000만 염기쌍을 한꺼번에 분석하는 데 성공했다고 밝힘
⋙ 2005년
◦게놈지도와 야외 관찰로 진화가 일어나는 복잡한 과정을 밝힘
◦유럽 호이겐스 탐사선이 토성의 달 타이탄에 착륙하고, NASA의 Deep Impact가 혜성에 충돌한 실험 등
◦분자 생물학자들이 봄에 꽃이 다양한 색깔을 내게 하는 원리를 발견
◦위성과 지상망원경으로 도시 크기의 죽은 별들인 중성자별 관찰
◦정신분열증, 난독증, 안면경련증과 같은 뇌 신경질환 연구
◦외계에서 온 암석과 지구의 암석을 비교 분석한 결과 지구 생성에 대해 새로운 이론 설립
◦volage-gated potassium channel의 분자 구조 밝힘
◦인간 활동에 의한 지구 온난화의 증거 추가 발견
◦분자 생물학자들이 복잡한 시스템의 행태를 이해하기 위해 엔지니어 기술 이용
◦120억 달러 규모의 국제 핵융합 실험로(International Thermonuclear Ex-perimenta Reactor) 위치가 18개월의 논란 끝에 프랑스 Cadarache로 결정
◦Z 나선형 DNA와 B 나선형 DNA의 결합구조 구명, 네이처지 게재
⋙ 2006년
◦네안데르탈인 DNA 염기서열 분석
◦급진전되는 지구 온난화 전망 제기
◦땅위를 걸어다닌 물고기 화석 발견
◦시력감퇴 치료제 개발
◦생물 다양성의 재발견
◦최첨단 현미경 기술 개발
◦기억메커니즘 구명 단초 발견
◦마이크로 RNA와 siRNA보다 약간 긴 새로운 RNA를 발견
◦미연방정부 연구비 천만 달러를 받아 일리노이 대학 연구팀이 진행하고 있는 돼지 게놈 해독은 2년 안에 완성될 것으로 기대
◦미 부시 대통령이 상하원 합동연설에서 농업 페기물로부터 바이오에탄올 생산 지원
◦미 NIH가 유방암 재발을 예측하기 위해 10년간, 1만 명의 환자에 대해 유전자 검사를 실시하는 연구를 개시
◦미국 당뇨병 협회(ADA)가 농업 및 식량분야 생명공학에 대한 지원을 재확인
◦다우사가 최초의 식물 생산 백신에 대한 허가를 취득
◦Renessen사가 생명공학 기술을 이용하여 유용성이 추가된 작물에 대해 최초로 동물 사료로 판매할 수 있는 허가를 취득
◦USDA가 밀의 게놈연구를 위해 18개 대학 밀번식 컨소시엄에 연구비 500만 달러 지원
◦오메가-3 지방산을 생산하는 형질전환 돼지 개발
◦세계무역기구는 EU가 21가지의 농업 생명공학제품에 대해 통상약정을 위반 했다고 발표
◦프랑스 농무부가 생명공학 옥수수 및 담배 작물에 대해 17가지의 새로운 실지 시험을 허가
◦마이크로RNA의 초기프로세싱 기전 구명
◦암 발생 억제기능 SUSP4 유전자의 분리 및 작용 메커니즘 구명
◦저분자화합물을 이용한 세포노화의 가역적 재프로그래밍
⋙ 2007년
◦AMPK 효소 항암기능 최초 구명. AMPK 활성화를 통해 대장암 세포가 정상으로 변화
◦체내 면역반응 조절 ʻ브레이크 장치ʼ 물질 발견
◦ʻ스페인감기ʼ 바이러스를 이용해 조류독감을 치료할 수 있는 길이 열림
◦화성에 물 존재 증거 발견
◦자연계에 존재하지 않는 D-아미노산을 손쉽게 합성할 수 있는 신기술 개발
◦수명이 다하거나 손상을 입은 세포에 죽음의 신호를 보내는 메커니즘 구명
◦암 발병을 억제하는 유전자의 기능 구명
⋙ 2008년
◦조류독감 인체 간 감염 유발 경로 찾았다(Nature Biotechnology)
◦모유수유가 천식 등을 유발하는 항원에 대해 아이들을 어떻게 보호하는지에 대한 기전 구명(Nature Medicine)
◦장내 세균과의 공생 기제 밝혀냈다(Science)
◦인간배아줄기세포로 당뇨병 쥐 치료 성공(Nature Biotechnology)
◦탈모유발 유전자 발견, 새 탈모약 개발기대(Nature Genetics)
◦암 세포를 무제한 자라게 하는 ʻ효소단백질ʼ 확인(Nature)
◦비만 원인 ʻ유전자 네트워크 이상ʼ(Nature)
◦루게릭병 유발 ʻ유전자ʼ 찾았다(Nature Genetics)
◦운동신경세포 분화과정 구명(Developmental Cell)
◦알즈하이머치매 ʻ기억력ʼ 떨어뜨리는 핵심 단백질 구명(Nature Genetics)
◦배꼽시계 등 생체회로 조절원리 구명(Science)
◦예방법 없는 ʻ말라리아ʼ 백신 개발된다(Nature Medicine)
◦물체 인식과정 구명, 실명치료 도움(Nature)
◦항생제 ʻ페니실린ʼ 만드는 균 ʻ유전자서열ʼ 구명(Nature Biotechnology)
◦유전자 제어 마이크로RNA 조절․사멸 메커니즘 구명(Molecular Cell)
◦ʻ소리ʼ 잘 듣게 하는 귀 속 ʻ단백질ʼ 구명(Nature)
◦인체 세포 죽이는 단백질 구명, 새로운 항암제 개발(Nature)
◦日 연구팀 ʻ암세포ʼ 추적자 영상촬영물질 개발(Nature Medicine)
⋙ 2009년
◦파킨슨병 등 신경퇴행성질환 유발 기전 구명(Nature Medicine)
◦염색체 응축 ʻ단백질 복합체ʼ 분자구조 구명(Cell)
◦마이크로 RNA 메커니즘 구명(Cell)
◦ʻ고혈압ʼ 유발 유전자 변이 구명(Nature Genetics)
◦단백질과 패혈증의 원인 물질인 세균의 내독소가 결합된 복합체의 분자구조를 세계 최초로 구명(Nature)
◦당뇨 원인 인슐린 저항성 유발인자 발견(Cell Metabolism)
◦장(腸) 세포의 세균 제거 기전 구명(Developmental Cell)
◦소 유전자 지도 완성 ʻ축산혁명ʼ(Science)
◦미칠 듯한 가려움증 ʻ긁어주면 좋아지는 이유ʼ 구명(Nature Neurons)
◦다운증후군 ʻ암ʼ 잘 안 걸리는 이유 구명(Nature)
◦자도 자도 졸린 ʻ기면증ʼ 면역계 기능 부전이 원인(Nature Genetics)
◦체내 자연 발생 ʻ표백성분ʼ 상처회복 돕는다(Nature)
◦사람 줄기세포로 뇌졸중 쥐 치료성공(Gene Therapy)
◦한국 남성 ʻ유전자 서열ʼ 밝혔다(Nature)
◦NMR로 생체막 단백질 구조 구명(Science)
◦줄기세포 분화조절 단백질 발견(Cell)
◦ʻ새벽잠 없는 이유 있다ʼ, 적게 자게 하는 유전자 발견(Science)
⋙ 2010년
◦배아줄기세포 치매치료제 국내서 첫 임상 실시
◦혈관치료용 마이크로 로봇 개발(세계 최초로 살아있는 미니돼지의 혈관에 주입돼 이동하는 실험 성공)
◦0.3mm 핏줄까지 보이는 세계에서 가장 선명한 사람 뇌지도 7.0 Tesla MRI Brain Atlas 발간
◦나노 소재로 인공 광합성 성공
◦세계 최초 암 관련 신규 유전자 발굴
◦암 진행과 전이 매커니즘 구명
⋙ 2011년
◦인체면역결핍바이러스 예방 치료 네트워크(HPTN) 052
◦밝혀진 인간의 기원 : 현생 인류의 DNA 일부가 네안데르탈인 게놈과 연관되었다는 사실 발견
◦식물광합성 촉매 구조 구명 : 물 분해 촉매가 되는 막단백질 복합체의 구조 구명
◦말라리아 백신 : ʻRTS,Sʼ 말라리아 백신이 아프리카 영유아의 말라리아 감염률을 50% 이상 감소시킴
◦인간 장 속 미생물 : 인간의 장속 미생물이 혈액형과 같이 크게 3가지로 나뉨. 군집 종류에 따라 질병, 체질, 식습관이 달라짐
◦노화세포제거 : 실험쥐의 노화세포를 제거하자 백내장, 근육 손실 등의 현상이 사라지고 나이 들어도 운동능력 저하되지 않는다는 사실 발견
⋙ 2012년
◦한국 식약청서 동종(타가) 줄기세포 치료제 판매를 세계최초로 승인.
◦유럽의약청(EMA)이 서구 최초로 유전자치료제를 승인하고 희귀유전질환 지단백지질분해효소결핍증(LPLD) 치료제 글리베라(Glybera)를 판매를 허가
◦먹는 C형간염치료제, 미국 FDA 승인.
◦한국기업 셀트리온, 세계 최초의 항체 바이오시밀러인 ʻ램시마ʼ 출시
◦뇌신경세포 신호전달 원리 구명
◦체세포를 성체줄기세포로 직접교차분화를 유도하는데 성공
◦아시아인 당뇨-비만에 관계하는 새로운 유전변이 현상 및 요인 발견
◦자폐증에 관여하는 새로운 유전자 및 발병원인 발견
⋙ 2013년
◦인간 배아줄기세포 복제 성공. 태아의 피부세포를 핵을 제거한 난자에 융합시켜 인간 배아줄기세포를 만들고, 이후 심장세포로 자라게 하는 데 성공.
◦ʻDNA 백과사전ʼ 완성. 기능이 거의 없어 98%의 쓰레기 DNA(Junk DNA)의 기능이 거의 없고 정체가 불투명한 쓸모없는 유전자들로 ʻ쓰레기ʼ 가 인간 질병과 돌연변이에 관여한다는 사실 구명.
◦유도만능줄기세포(iPS) 임상 연구를 세계 최초로 승인. 삼출형가령황반변성(滲出型加齢黄斑変性)이라는 눈의 난치병의 환자로부터 만들어낸 iPS를 망막색소 상피세포로 변화시켜 손상된 부분에 이식하는 방식.
◦iPS 이용해 인간의 ʻ간ʼ 조직 배양 성공
◦대사공학 기술을 이용해 대장균으로 휘발유 및 벤젠의 인공합성에 성공
◦태아 중뇌에서 추출한 줄기세포로 만든 ʻ도파민 신경전구세포ʼ를 파킨슨병 환자의 뇌 피각부에 이식하는데 성공.
◦mRNA의 비정상적인 기능 인식과 제거에 관한 메커니즘 구명.
◦포유류 신경 재생 메커니즘 구명. 포유류의 말초신경 재생 메커니즘 구명. 중추신경에 적용할 경우 하반신 및 전신 마비환자 치료가능성 열려.
⋙ 2014년
◦N-말단 메티오닌, 세포내 단백질 분해 신호의 발견(Cell, 2014.1.16.)
◦고추 유전체서열 국내 독자 기술로 완성(Nature Genetics, 2014.1.19.)
◦혈액암의 한 유형인 악성림프종 돌연변이 유전자 구명(Nature Genetics, 2014.3.3.)
◦비만 조절하는 핵심 수용체 발견(Cell Metabolism, 2014.3.4.)
◦철 대사를 조절하여 병원성 세균의 증식을 억제하는 항균제제 후보물질 발견(Nature Medicine, 2014.3.23.)
◦성인체세포 이용한 줄기세포주 세계 최초 확립(Cell Stem Cell, 2014.4.18.)
◦빛으로 세포 내 단백질을 원격 조정한다(Nature Methods, 2014.5.4.)
◦C형간염바이러스의 면역회피 메커니즘 구명(Gastroenterology, 2014.5.19.)
◦면역억제제 부작용 유발하는 유전자 발견(Nature Genetics, 2014.8.11.)
◦초기 배아 단계의 마이크로RNA 조절 현상 구명(Molecular Cell, 2014.11.13.)
⋙ 2015년
◦표적유전자만 제거, ‘크리스퍼 유전자 가위’ 정확성 입증(Nature Methods, 2015.2.10.)
◦혈압 조절에 중요한 단백질 세포 속 분해과정(Science, 2015.3.13.)
◦한의학 처방 원리(군신좌사) 구명(Nature Biotechnology, 2015.3.6.)
◦피로물질 젖산, 세포신호물질로 새로운 기전 발견(Cell, 2015.4.16.)
◦유해 단백질의 분해 작용원리와 최종 변화과정 구명(Nature Cell Biology, 2015.6.15.)
◦암줄기세포 에너지 대사 구명(Gastroenterology, 2015.6.16.)
◦급성 골수성 백혈병의 새로운 신호 전달 경로 구명(Cell Stem Cell, 2015.7.23.)
◦항암 효과 뛰어난 GITR 항체의 작용기전 밝혀(Nature Medicine, 2015.8.17.)
◦뇌종양 재발위치에 따른 유전체 변이 패턴 세계최초 구명(Cancer Cell, 2015.9.14.)
◦빛으로 칼슘 농도 조절하고 기억력 높여(Nature Biotechnology, 2015.9.15.)
⋙ 2016년
◦microRNA(이하 miRNA) 생성에 결정적 역할을 하는 드로셔(DROSHA) 단백질의 3차원 구조를 세계 최초 구명(Cell, 2015.12.31.)
◦음식물에 든 항원(음식 유래 항원)들이 소장 내 면역 반응 억제에 큰 역할을 담당한다는 사실 구명(Science, 2016.1.29.)
◦가장 젊고 분화능력이 뛰어난 최상위 혈액-줄기세포의 선별 방법을 개발(Cell Stem Cell, 2016.3.18.)
◦세계 최대 규모의 유방암 환자 전장유전체(全長遺傳體, 전체 유전자 염기서열)를 분석(Nature, 2016.5.3.)
◦생존에 필수적인 오토파지(자가포식)작용을 조절하는 새로운 신호를 발견하여 오토파지의 작동 기전을 세계 최초 구명(Nature, 2016.6.15.)
◦뇌신경망을 형성․유지하는 새로운 기전을 세계 최초 발견(Cell, 2016.6.16.)
◦생체조직과 무기물의 결합으로 전기 없이 움직일 수 있는 바이오 하이브리드 로봇을 세계 최초 개발(Science, 2016.7.8.)
◦당뇨병 발병에 직접적으로 영향을 주는 혈당, 체내 대사조절관련 16개 신규 유전요인(부모로부터 물려받은 유전정보 중 질병 발생과 관련된 요인)을 발굴(Natrue, 2016년 7월호)
◦암과 치매 등 각종 질병을 유발시키는 것으로 알려진 단백질의 비정상적인 변형을 구현할 수 있는 맞춤형 단백질 변형기술을 세계 최초 개발(Science, 2016.9.29.)
◦우리 몸에서 병을 일으키는 감염원을 제거하는 초기 방어 시스템을 세계 최초 구명(Nature Microbiology, 2016.10.17.)
⋙ 2017년
◦조울증 일으키는 핵심 단백질의 작용 메커니즘 구명(Molecular Psychiatry, 2017.1.31.)
◦무독성 살모넬라균에 의한 암 치료 강화기술 개발(Science Translational Medicine, 2017.2.9.)
◦뇌종양 유전체의 시공간적 구조 분석을 통해 최적의 표적치료 전략 제시(Nature Genetics, 2017.4.1.)
◦홍합의 접착 단백질과 인체 조직에서 추출한 자연치유 성분을 결합하여, 상처 치료 기능과 흉터 방지 기능을 함께 갖춘 혁신적인 의료용 접착제를 개발(Biomaterials, 2017.4.26.)
◦문어 빨판의 독특한 돌기 원리를 밝히고, 이를 모사하여 습한 환경에서도 접착제 없이 탈부착할 수 있는 고점착 패치 소재를 세계 최초로 개발(Nature, 2017.6.15.)
◦빅데이터 분석을 통해 종양 주변의 면역세포가 종양의 진화 및 항암 치료에 미치는 영향을 구명(Cancer Cell, 2017.7.10.)
◦나노 일렉트로닉스라는 개념의 전자기화 된 금 나노입자를 활용한 신개념 ‘세포 직접교차분화 리프로그래밍’ 기술을 세계 최초 개발(Nature Nanotechnology, 2017.7.18.)
◦간경화 환자의 몸에서 간암이 유발되는 신규 신호경로 규명(Gastroenterology, 2017.7.20.)
◦인간배아에서 비후성 심근증의 원인이 되는 돌연변이 유전자를 크리스퍼 유전자 가위(CRISPR Cas9)로 교정하는데 성공(Nature, 2017.8.3.)
◦IT-BT 융합연구를 통한 간암 치료효과 제고 방법 발견(Hepatology, 2017.8.23.)
⋙ 2018년
◦액체방울 자유롭게 조종하는 나노 계면활성제 발명(Nature, 2018.1.11.)
◦간암치료를 목적으로 비수술적 치료법인 동맥화학색전술에 사용되는 미세구체의 개발(해외 PCT 특허 3건에 대해 6개국 등록 완료 2018.2.16.)
◦자연에 풍부한 탄화수소로 신약 원료 감마/락탐 합성 성공(Science, 2018.3.2.)
◦뇌에서 기억이 저장되는 장소 규명(Science, 2018.4.27.)
◦고지혈에 의한 루푸스 발병기전 규명(Nature Immunology, 2018.4.30.)
◦눈에서 47종의 시각 채널을 찾다(Cell, 2018.5.17.)
◦스스로 광합성하는 인공세포 제작(Nature Biotechnology, 2018.5.28.)
◦급성심장질환에 동반된 외상후증후군 치료를 통하여 심장질환 재발률을 획기적으로 감소(Journal of the American Medical Association, 2018.7.25.)
◦종양 스페로이드를 활용한 암 표적치료 혁신의 길 열려(Nature Genetics, 2018.9.27.)
◦병에 강한 식물에는 ‘보디가드 미생물’이 있다(Nature Biotechnology, 2018.10.8.)
◦YH25448(Lazertinib)의 글로벌제약사 기술수출(얀센 바이오텍, 2018.11.1.)
⋙ 2019년
◦40대 전후에 발생하는 조기발병위암 원인 규명(Cancer Cell, 2019.1.15.)
◦항생제 젠타마이신 B의 생합성 과정 규명(Nature chemical Biology, 2019.1.15.)
◦퇴행성관절염의 원인은 콜레스테롤(Nature, 2019.2.7.)
◦암세포의 림프절 전이, 지방산이 핵심 연료(Science, 2019.2.8.)
◦내 머리 속 공포기억, 시각자극으로 사라진다(Nature, 2019.2.14.)
◦간암세포 굶겨 죽이는 방법 제시(Cell Metabolism, 2019.4.5.)
◦의약품 수용체의 신호전달 과정 규명(Cell, 2019.5.10.)
◦서울대, 알츠하이머병 예방 및 치료 가능성 열어(Cell Metabolism, 2019.6.28.)
◦심장질환 발병원인 규명 및 새로운 치료 표적 제시(Nature, 2019.7.18.)
◦류마티스 관절염 발생과정의 수수께끼 풀어(Nature Immunology, 2019.8.13.)
◦생쥐모델을 활용한 알코올성 지방간 치료 표적 제시(Cell Metabolism, 2019.8.30.)
◦면역억제세포 리프로그래밍 약물전달체 개발(Advanced Materials, 2019.9.6.)
⋙ 2020년
1. 암세포 터뜨려 죽이는 나노버블로 면역물질 손상 막아(Advanced Materials, 2020.3.3.)
|
박재형 교수(성균관대학교 화학공학과) 연구팀이 초음파를 쬐면 기포가 나오는 나노버블로 암 세포막 파열을 유발, 네크롭토시스 유사 세포사멸을 유도했다. 과학기술정보통신부와 한국연구재단이 추진하는 기초연구사업(중견연구자, 선도연구센터)의 지원으로 수행된 이번 연구의 성과는 국제학술지 Advanced Materials 표지논문으로 3월 3일 온라인판에 게재되었다. |
2. 배양액 교체만으로 손상 없이 세포 시트 수확(Advanced Materials, 2020.3.11.)
|
임성갑 교수(KAIST 생명화학공학과), 조승우 교수(연세대학교 생명공학과) 연구팀이 온도 변화 없이 단시간 내 세포 시트를 배양기판으로부터 손상 없이 분리하는 방법을 개발했다. 과학기술정보통신부와 한국연구재단이 추진하는 기초연구사업(중견연구) 및 선도연구센터지원사업 등의 지원으로 수행된 이번 연구의 성과는 국제학술지 Advanced Materials에 3월 11일 게재되었다. |
3. 암세포를 굶겨 죽이는 대사 항암제의 원리 규명(Cell Metabolism, 2019.12.9.)
|
연세대학교 한정민 교수 연구팀이 암세포의 주 영양분인 글루타민을 세포 안의 미토콘드리아에 전달하는 수송체를 발견했다. 과학기술정보통신부의 글로벌프런티어사업, 교육부의 대학중점연구소지원사업 및 글로벌박사펠로십사업의 지원으로 수행된 이번 연구의 성과는 대사 분야 국제학술지 Cell Metabolism 온라인판에 12월 19일 게재되었다. |
4. 동아시아인 당뇨병 유전적 원인 규명, 세계의 주목받다!(Nature, 2020.5.6.)
|
국립보건연구원 유전체센터는 싱가포르 국립대학, 일본 이화학연구소 등과 함께 동아시아 3개국(한국, 중국, 일본)을 중심으로 약 43만 명의 유전체정보를 분석, 제2형 당뇨병 발병에 영향을 주는 61개 신규 유전요인을 발굴했다. 보건복지부가 추진하는 포스트게놈다부처유전체사업의 지원으로 수행된 이번 연구의 성과는 해당 분야 최고 학술지인 Nature에 2020년 5월 호에 게재되었다. |
5. 분자가 탄생하는 모든 순간(35펨토 초) 포착(Nature, 2020.6.25.)
|
기초과학연구원(IBS) 나노물질 및 화학반응 연구단 이효철 부연구단장(KAIST 화학과 교수) 연구팀은 원자가 결합하여 분자가 탄생하는 모든 과정을 실시간으로 관찰하는데 성공했다. 이번 성과는 세계 최고 권위의 학술지 Nature(IF 43.070) 온라인 판에 한국 시간으로 6월 25일에 게재되었다. |
6. 염기교정 유전자가위의 안전성 높일 실마리 찾아(Nature Biotechnology, 2020.7.7.)
|
연세대학교 약리학교실 김형범 교수 연구팀이 염기교정 유전자가위의 염기교정 효율과 교정결과를 예측할 수 있는 인공지능 프로그램을 개발했다. 과학기술정보통신부가 추진하는 중견연구지원사업, 바이오의료기술개발사업, 선도연구센터지원사업 등의 지원으로 수행된 이번 연구의 성과는 생명공학 분야 국제학술지 Nature Biotechnology에 7월 7일 게재되었다. |
7. 당뇨 치료제 효능을 억제하는 장내미생물 대사체의 작용기작 연구(Cell Metabolism, 2020.8.12.)
|
성균관대학교 의과대학 정밀의학교실 고아라 교수 연구팀과 스웨덴 예테보리대학교 프레드릭 백헤드 교수 연구팀이 장내미생물 대사체가 당뇨병 약인 메포민의 혈당조절 실패에 미치는 영향을 규명했다. 과학기술정보통신부가 추진하는 신진연구지원사업 등의 지원으로 수행된 이번 연구의 성과는 국제학술지 Cell Metabolism 온라인판에 8월 12일 게재되었다. |
8. 투명물질의 레이저 기반 초고속 가공법 개발(Nature Materials, 2020.8.17.)
|
서울대학교 고승환-전누리 교수 공동 연구팀이 바이오칩 쾌속 제작에 적용될 수 있는 초고속 레이저 직접 가공법을 개발했다. 과학기술정보통신부가 추진하는 중견연구자지원사업의 지원으로 수행된 이번 연구의 성과는 공학분야 국제학술지 Nature Materials에 8월 17일 게재되었다. |
9. 생체 내 나노 코딩 제어 시스템 개발(Advanced Materials, 2020.8.21.)
|
고려대학교 김영근, 강희민 교수 연구팀이 임플란트 소재 표면에서 세포의 부착과 분화를 조절할 수 있는 생체 내 나노 코딩 제어 시스템을 개발했다. 과학기술정보통신부가 추진하는 신진연구자지원사업 및 중견연구자지원사업의 지원으로 수행된 이번 연구는 국제학술지 Advanced Materials에 8월 21일 게재되었다. |
10. 면역항암치료 후 간암 급성진행 현상 규명(Journal of Hepatology, 2020.8.15.)
|
차의과학대학교 분당차병원 전홍재, 김찬 교수 연구팀이 세브란스병원, 삼성서울병원 연구팀과 함께 간암 면역항암치료 후 암이 급속도로 악화되는 급성 진행 현상을 규명했다. 과학기술정보통신부가 추진하는 기초연구지원사업(신진연구, 중견연구)의 지원으로 수행된 이번 연구의 성과는 유럽 간 학회지 Journal of Hepatology에 8월 15일 게재되었다. |
11. 세로토닌 수용체와 환각물질과의 결합구조 규명(Cell, 2020.9.17.)
|
한국연구재단은 교육부와 한국연구재단이 추진하는 박사후 국외연수지원사업의 지원을 받은 김국래 박사(공동 제1저자)가 소속된 브라이언 로스 교수 연구팀(미국 노스캐롤라이나 대학교)이 세로토닌 수용체와 환각물질(LSD, 25CN-NBOH)과의 결합구조를 규명했다고 밝혔다. 김국래 박사가 공동 제1저자로 참여한 이번 연구의 성과는 국제학술지 ‘셀(Cell)’에 9월 17일 게재되었다. |
⋙ 2021년
1. 늘었다 줄었다 하는 나노코일로 골세포 분화 조절 실마리(Advanced Materials, 2021.2.3.)
|
강희민, 김영근 교수(고려대학교 신소재공학부) 공동 연구팀이 임플란트 소재 표면에서 실시간 원격제어로 생체 내 세포의 부착과 분화를 조절할 수 있는 자성 나노코일 시스템을 개발했다고 과학기술정보통신부(장관 최기영)는 밝혔다. 과학기술정보통신부 개인기초연구(중견연구 및 신진연구 등)의 지원으로 수행된 이번 연구의 성과는 재료분야 국제학술지 어드밴스드 머티리얼스(Advanced Materials)에 2월 3일 00시(한국시간) 게재되었다. |
2. 새로운 뇌종양 면역반응 규명(Nature Immunology, 2021.2.11.)
|
이흥규 교수(KAIST) 연구팀이 악성 뇌종양 세포의 과도한 산소 소비로 인한 감마델타 T 세포의 면역반응 저하 과정을 규명했다고 밝혔다. 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업(차세대바이오 사업) 및 삼성미래기술육성재단의 지원으로 수행되었으며 면역학 분야 국제학술지 ‘네이처 이뮤놀로지(Nature Immunology)’ 2월 11일 자에 게재되었다. 한편 네이처 이뮤놀로지는 이 연구결과가 담긴 논문을 게재하는 외에 별도로 뉴스앤뷰즈(News & Views) 코너에서 이 논문에 대해 소개하였다. |
3. 나노-코로나를 이용한 면역 활성화 전략(Advanced Materials, 2021.3.1.)
|
강동우 교수(가천대학교) 연구팀이 혈액 내 면역반응 유발 단백질을 나노입자에 부착하면 단백질의 구조가 심하게 뒤틀리고 면역반응이 활성화가 된다는 것을 알아냈다고 밝혔다. 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발 및 중견연구지원사업으로 수행된 이번 연구의 성과는 국제학술지 ‘어드밴스드 사이언스(Advanced Science)’에 3월 1일 게재되었다. |
4. 녹내장 진단용 안압 모니터링 콘택트렌즈 개발(Nature Biomedical Engineering, 2021.5.3.)
|
박장웅 교수(연세대학교 신소재공학과) 및 김홍균 교수(경북대학교병원 안과), 김대우 교수(경북대학교병원 안과) 공동연구팀이 미세한 안압변화를 감지할 수 있는 고감도 안압 센서 및 무선 회로를 소프트 콘택트렌즈 내에 제작하여, 스마트폰과 무선 통신할 수 있도록 했다고 밝혔다. 과학기술정보통신부와 한국연구재단이 추진하는 중견연구지원사업 및 바이오․의료기술개발사업의 지원으로 수행된 이번 연구의 성과는 생명공학 분야 국제학술지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’에 5월 3일 게재됐다. |
5. 4D 프린팅으로 근육재생 및 척추유합 세포담체 개발(Applied Physics Reviews, 2021.5.12.)
|
김근형 교수(성균관대학교), 이상진 교수(Wake Forest Institute for Regenerative Medicine) 연구팀이 4D 프린팅 기술로 세포 배열을 조절할 수 있는 바이오잉크 기반 세포담체를 개발하고, 근육 손실 동물모델에서의 효과를 확인했다고 밝혔다. 과학기술정보통신부․한국연구재단이 추진하는 중견연구지원사업 및 자연모사혁신기술개발사업의 지원으로 수행된 이번 연구는 응용 물리학 분야 국제학술지 어플라이드 피직스 리뷰(Applied Physics Reviews)에 5월 4일(뼈조직 재생) 및 5월 12일(근육 재생)에 게재(featured article)되었다. |
6. 누르는 힘에 따라 밝기가 달라지는 전자피부 개발(Advanced Materials, 2021.6.2.)
|
강문성 교수(서강대학교 화공생명공학과) 연구팀과 김도환 교수(한양대학교 화학공학과) 연구팀이 누르거나 당기는 등 힘의 변화를 빛의 미세변화로 응답하는 ‘스마트 발광형 전자피부’를 개발했다고 과학기술정보통신부(장관 임혜숙)가 밝혔다 과학기술정보통신부와 한국연구재단이 추진하는 개인기초연구(중견연구) 사업의 지원으로 수행된 이번 연구의 성과는 재료과학 분야 국제학술지 ‘어드밴스드 머터리얼스(Advanced Materials)’에 6월 2일 0시(한국시간 기준) 온라인 게재되었다. |
7. 뇌 보호하는 혈액-뇌 장벽 모사한 인공 칩 개발(Nature Biomedical Engineering, 2021.6.15.)
|
한국연구재단(이사장 노정혜)은 조승우 교수(연세대학교 생명공학과), 반용선 교수(연세대학교 생명공학과) 연구팀이 혈뇌장벽의 구조와 기능적 특징을 모사한 인공 혈뇌장벽 칩을 설계했다고 밝혔다. 과학기술정보통신부의 기초연구지원사업, 뇌과학원천기술개발사업 등의 지원으로 수행된 이번 연구는 의생명공학 분야 국제학술지 네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)에 2021년 6월 15일 자로 게재되었다. |
8. 물방개 수중 점착컵 본뜬 무전원 체액포집 패치 개발(Advanced Materials, 2021.6.17.)
|
방창현 교수(성균관대학교), 조승우 교수(연세대학교) 연구팀은 수컷 물방개 앞발에 있는 점착컵의 구조․원리를 밝히고, 이를 본떠 무전원 방식의 신속 체액 포집 피부 모니터링 패치를 개발했다고 밝혔다. 과학기술정보통신부와 한국연구재단이 추진하는 신진연구사업 등의 지원으로 진행된 이번 연구의 성과는 국제학술지 ‘사이언스 어드밴시스(Science Advances)에 6월 17일(한국시간) 게재되었다. |
※ IF(Impact Factor) 20이상 우수 논문 중심으로 정리되었음.
![]()
생명공학 주요통계
1. 예산투자
투자액(단위: 억 원)

주1) 2007∼2012년의 투자실적에는 출연기관의 투자실적(932억 원, 1,046억 원, 913억 원, 1,218억 원, 1,542억 원, 1,676억 원)이 포함됨.
주2) 1994∼2020년 기간 동안의 정부투자는 총 34조 905억 원.
주3) 2021년도 수치는 실적치가 아닌 2021년도 생명공학 육성 시행계획 상의 계획치임.
자료: 연도별 생명공학 육성 시행계획 자료 가공.
[그림 부록 1] 정부 부문 생명공학 투자 실적(1994∼2021)
[표 부록 1] 국내 부처별 BT 투자실적 및 계획(2020∼2021)
(단위: 백만 원, %)
|
구분 |
’21년 투자계획 |
’20년 실적(B) |
증감율(%) ((A-B)/B) |
|||
|
연구개발 |
인프라 |
인력양성 |
합계(A) |
|||
|
과학기술정보통신부 |
1,403,938 |
122,212 |
3,750 |
1,529,900 |
1,349,502 |
13.4 |
|
교육부 |
231,195 |
- |
81,987 |
313,182 |
234,226 |
33.7 |
|
농림축산식품부 |
157,720 |
26,950 |
4,000 |
188,670 |
181,173 |
4.1 |
|
산업통상자원부 |
262,501 |
18,782 |
5,963 |
287,246 |
234,360 |
22.6 |
|
보건복지부 |
704,804 |
62,396 |
17,225 |
784,425 |
648,537 |
21.0 |
|
환경부 |
82,980 |
- |
- |
82,980 |
64,999 |
27.7 |
|
해양수산부 |
100,266 |
6,210 |
250 |
106,726 |
77,639 |
37.5 |
|
식품의약품안전처 |
46,012 |
553 |
265 |
46,830 |
41,774 |
12.1 |
|
총계 |
2,989,416 (89.5%) |
237,103 (7.1%) |
113,440 (3.4%) |
3,339,958 (100.0%) |
2,832,210 |
17.9 |
자료: 2021년도 생명공학 육성 시행계획, 2021.2.

출처: 2021년도 생명공학 육성 시행계획, 2021.2.
[그림 부록 2] 부처별 생명과학 분야 연구개발비 투자계획 비중(2021)
[표 부록 2] 부처별 생명과학 분야 연구개발 투자 비교(2020∼2021)
(단위: 백만 원)
|
구분 |
2020실적 |
2021계획 |
증감률(%) |
|
과학기술정보통신부 |
1,164,296 |
1,303,852 |
12 |
|
교육부 |
157,810 |
231,195 |
46.5 |
|
농림축산식품부 |
128,648 |
111,686 |
Δ13.2 |
|
산업통상자원부 |
98,182 |
148,690 |
51.4 |
|
보건복지부 |
26,602 |
34,509 |
29.7 |
|
환경부 |
19,577 |
20,042 |
2.4 |
|
해양수산부 |
18,712 |
30,717 |
64.2 |
|
식품의약품안전처 |
925 |
1,274 |
37.7 |
|
합계 |
1,614,752 |
1,881,965 |
16.5 |
자료: 2021년도 생명공학 육성 시행계획, 2021.2
[표 부록 3] 5대 분야별 연구개발 투자 비교(2020∼2021)
(단위: 백만 원)
|
구분 |
2020실적 |
2021계획 |
증감률(%) |
|
생명과학 분야 |
1,614,752 |
1,881,965 |
16.5 |
|
Red 분야 |
578,823 |
686,923 |
18.7 |
|
Green 분야 |
114,483 |
145,254 |
26.9 |
|
White 분야 |
70,372.20 |
83,070 |
18.0 |
|
융합신산업 분야 |
170,995 |
192,204 |
12.4 |
|
합계 |
2,549,425 |
2,989,416 |
17.3 |
자료: 2021년도 생명공학육성시행계획, 2021.2.
[표 부록 4] 정부 및 민간 BT 연구개발 투자(2015∼2021)
(단위: 백만 원)
|
구분 |
2015 |
2016 |
2017 |
2018 |
2019 |
|
정부 |
33,019 |
33,341 |
34,946 |
35,494 |
36,717 |
|
민간 |
26,927 |
22,796 |
27,165 |
30,907 |
39,545 |
|
합계 |
59,946 |
56,137 |
62,111 |
66,401 |
76,262 |
주1) 정부 BT 연구개발비는 NTIS 과학기술통계서비스 참고.
주2) 합계액은 ‘연구개발 활동 조사보고서’를 참고(민간 BT 연구개발비 = 합계액-정부 BT 연구개발비).
자료: 한국과학기술기획평가원, 연도별 연구개발 활동 조사보고서, NTIS 과학기술통계서비스, 생명공학정책연구센터 재가공.
(단위: 억 원)

자료: 한국과학기술기획평가원, 연도별 연구개발 활동 조사보고서, NTIS 과학기술통계서비스, 생명공학정책연구센터 재가공.
[그림 부록 3] 정부 및 민간 BT 연구개발 투자(2015∼2019)
2. 시설 및 기반구축(인프라)

자료: 2021년도 생명공학 육성 시행계획, 2021.2.
[그림 부록 4] 부처별 시설 및 기반구축(인프라) 투자계획 비중(2021)
[표 부록 5] 부처별 시설 및 기반구축(인프라) 투자실적 및 계획
(단위: 백만 원)
|
구분 |
과기정통부 |
농식품부 |
산업부 |
복지부 |
해수부 |
식약처 |
합계 |
|
2020실적 |
82,533 |
16,695 |
7,252 |
66,241 |
5,328 |
553 |
178,602 |
|
2021계획 |
122,212 |
26,950 |
18,782 |
62,396 |
6,210 |
553 |
237,103 |
|
증감률(%) |
48.1 |
61.4 |
159 |
Δ5.8 |
16.6 |
0 |
32.8 |
자료: 2021년도 생명공학 육성 시행계획, 2021.2.
3. 인력양성
[표 부록 6] 생명공학분야 인력양성 실적(2016∼2020)
(단위: 명, 건)
|
구분 |
2016 |
2017 |
2018 |
2019 |
2020 |
|
|
우수인력 배출 |
석사 |
4,374 |
6,958 |
5,611 |
4,244 |
3,864 |
|
박사 |
2,048 |
2,516 |
2,094 |
2,749 |
2,380 |
|
|
국제교류 인력 |
해외연구자유치 |
319 |
507 |
274 |
442 |
75 |
|
국내연구자 파견 |
230 |
209 |
316 |
428 |
173 |
|
|
참여연구 인력 |
104,088 |
89,964 |
104,896 |
85,454 |
98,276 |
|
|
국제 학술대회 개최(건) |
906 |
812 |
1,040 |
392 |
123 |
|
자료: 연도별 생명공학 육성 시행계획 자료 가공.

자료: 2021년도 생명공학 육성 시행계획, 2021.2.
[그림 부록 5] 부처별 인력양성 투자계획(2021)
[표 부록 7] 부처별 인력양성 투자실적 및 계획
(단위: 백만 원)
|
구분 |
과기정통부 |
교육부 |
농식품부 |
산업부 |
복지부 |
해수부 |
식약처 |
합계 |
|
2020실적 |
3,750 |
76,416 |
2,000 |
3,019 |
18,733 |
0 |
265 |
104,183 |
|
2021계획 |
3,750 |
81,987 |
4,000 |
5,963 |
17,225 |
250 |
265 |
113,440 |
|
증감률(%) |
0.0 |
7.3 |
100 |
97.5 |
Δ8.1 |
- |
0.0 |
8.9 |
자료: 2021년도 생명공학 육성 시행계획, 2021.2.

주) 생명공학분야 : 교육통계에 제시된 소계열 분류 중 12개 소계열이 해당(농업학, 동물․수의학, 보건학, 산림․원예학, 생명과학, 생물학, 약학, 의료공학, 재활학, 치의학, 한의학).
자료 : 교육통계서비스(https://kess.kedi.re.kr/) 자료, 생명공학정책연구센터 재가공.
[그림 부록 6] 국내 생명공학분야 졸업자 현황(2016∼2020)
[표 부록 8] 국내 생명공학분야 졸업자의 학위별 성별 현황(2016∼2020)
(단위: 명)
|
구분 |
2016 |
2017 |
2018 |
2019 |
2020 |
|
|
석사 |
남자 |
4,629 |
4,858 |
4,602 |
4,267 |
4,295 |
|
여자 |
5,271 |
5,430 |
5,328 |
5,204 |
5,107 |
|
|
소계 |
9,900 |
10,288 |
9,930 |
9,471 |
9,402 |
|
|
박사 |
남자 |
1,900 |
1,943 |
1,898 |
1,883 |
1,888 |
|
여자 |
1,316 |
1,384 |
1,301 |
1,400 |
1,417 |
|
|
소계 |
3,216 |
3,327 |
3,199 |
3,283 |
3,305 |
|
|
총계 |
13,116 |
13,615 |
13,129 |
12,754 |
12,707 |
|
자료: 교육통계서비스(https://kess.kedi.re.kr/) 자료, 생명공학정책연구센터 재가공.
(단위: 명)

자료: 산업통상자원부․한국바이오협회, 2019년 기준 국내 바이오산업 실태조사 결과 보고서, 2020.12.
[그림 부록 7] 국내 바이오산업 종사자 현황(2015∼2019)
[표 부록 9] 국내 바이오산업 업무별 종사자 인력 분포(2019)
(단위: 명, %)
|
구분 |
소계(명) |
비율(%) |
|
연구직 |
15,463 |
31.5 |
|
생산직 |
16,971 |
34.6 |
|
영업/관리직 |
16,679 |
34.0 |
|
전체 |
49,113 |
100.0 |
자료: 산업통상자원부[표 부록 10] 국내 바이오산업 학위별 종사자 인력 분포(2019)
(단위: 명, %)
|
구분 |
소계(명) |
비율(%) |
|
박사 |
2,807 |
5.7 |
|
석사 |
9,501 |
19.3 |
|
학사 |
24,013 |
48.9 |
|
기타 |
12,792 |
26.0 |
|
전체 |
49,113 |
100.0 |
자료: 산업통상자원부
[표 부록 11] 국내 바이오 중소․벤처기업의 총 근로자 및 평균 근로자 수(2018, 2020)
(단위: 명)
|
구분 |
총 근로자 수 |
기업당 평균 근로자 수 |
|
2020 |
65,387 |
29.6 |
|
2018 |
53,186 |
29.7 |
자료: 생명공학정책연구센터, 2019년 기준 국내 바이오 중소․벤처기업 현황통계, 2021.7; 2018년 국내 바이오 중소․벤처기업 현황통계, 2020.1.
[표 부록 12] 국내 바이오 중소․벤처기업의 분야별 평균 근로자 수(2018, 2020)
(단위: 명)
|
대분류 |
중분류 |
2018 |
2020 |
|
레드 |
의약품 |
43.0 |
39.0 |
|
진단의료기기 |
32.9 |
31.4 |
|
|
그린 |
농업 |
14.6 |
15.4 |
|
식품 |
26.6 |
27.0 |
|
|
화이트 |
화학 |
26.2 |
25.2 |
|
환경 |
22.6 |
21.9 |
|
|
에너지 |
27.1 |
23.7 |
|
|
플랫폼 |
지원서비스 |
29.1 |
34.3 |
|
기타 |
32.1 |
32.3 |
자료: 생명공학정책연구센터, 2019년 기준 국내 바이오 중소․벤처기업 현황통계, 2021.7; 2018년 국내 바이오 중소․벤처기업 현황통계, 2020.1.
[표 부록 13] 국내 바이오 벤처기업의 총 근로자 및 평균 근로자 수(2018, 2020)
(단위: 명)
|
구분 |
총 근로자 수 |
기업당 평균 근로자 수 |
|
2020 |
52,334 |
29.9 |
|
2018 |
42,269 |
30.4 |
자료: 생명공학정책연구센터, 2019년 기준 국내 바이오 중소․벤처기업 현황통계, 2021.7; 2018년 국내 바이오 중소․벤처기업 현황통계, 2020.1.
[표 부록 14] 국내 바이오 벤처기업의 분야별 평균 근로자 수(2018, 2020)
(단위: 명)
|
대분류 |
중분류 |
2018 |
2020 |
|
레드 |
의약품 |
43.3 |
38.2 |
|
진단의료기기 |
35.9 |
33.4 |
|
|
그린 |
농업 |
13.7 |
14.6 |
|
식품 |
26.1 |
26.1 |
|
|
화이트 |
화학 |
26.3 |
25.1 |
|
환경 |
22.2 |
22.5 |
|
|
에너지 |
37.4 |
32.4 |
|
|
플랫폼 |
지원서비스 |
30.2 |
33.3 |
|
기타 |
33.9 |
35.3 |
자료: 생명공학정책연구센터, 2019년 기준 국내 바이오 중소․벤처기업 현황통계, 2021.7; 2018년 국내 바이오 중소․벤처기업 현황통계, 2020.1.
4. 산업
광의의 개념(의약품, 의료기기 포함)*으로 바이오시장을 추산할 경우에, 2019년 글로벌 바이오시장 규모는 1,832조 원으로 추정
* 글로벌 보건산업의 ‘의약품’, ‘의료기기’ 시장과 글로벌 바이오시장 중 그린바이오(Food& Agriculture), 화이트바이오(Environment & Industrial processing) 시장을 합산함.
[표 부록 15] 글로벌 바이오 시장규모(2019)
|
구분 |
시장규모 |
비고 |
출처 |
|
|
글로벌 바이오시장 |
481조 원 (4,502억 달러) |
2019 환율 적용 환산 Medical/Healthcare, Food & Agriculture, Environment & Industrial Processing, Service Provider, Technology Service 시장으로 구성 |
MarketLine |
|
|
글로벌 보건 산업 |
의약품 |
1,247조 원 (1조 1,170억 달러) |
2019년 환율 적용 환산 |
Fitchsolutions |
|
의료 기기 |
473조 원 (4,090억 달러) |
2019년 환율 적용 환산 |
BMI Espicom |
|
|
의료 서비스 |
2,074조 원 (1조 9,416억 달러) |
2019 환율 적용 환산 Pharmaceuticals & Biotechnology, Medical Technologies, Medical Imaging, In-Vitro Diagnostics, Heathcare IT 시장으로 구성 국내 의료서비스 시장 규모와는 다른 기준 |
Frost&sullivan |
|
자료: MarketLine, Global Biotechnology, 2020.6.
한국보건산업진흥원, 보건산업통계(https://www.khiss.go.kr/). 통계지표(원출처: Fitchsolutions, BMI Espicom).
Frost&sullivan, Post-pandemic Global Healthcare Market Outlook 2020, 2020.7.
광의의 개념(의약품, 의료기기 포함)으로 바이오시장을 추산할 경우, 2019년 국내 바이오 시장규모는 36조 원으로 추정(글로벌 시장의 1.9% 규모)
* 보건산업통계의 ‘의약품’, ‘의료기기’ 생산규모와 바이오산업실태조사 보고서의 ‘바이오산업 분야별 생산 현황’ 중 ‘바이오의약’, ‘바이오의료기기’ 산업을 제외한 생산규모 합산함.
[표 부록 16] 국내 바이오 시장규모(2019)
|
구분 |
시장규모 |
비고 |
출처 |
|
|
국내 바이오시장 |
12조 원 |
바이오산업분야 유효표본 1,003개 기업, 2019년 국내 바이오산업 생산규모 바이오의약, 바이오화학․에너지, 바이오식품, 바이오환경, 바이오의료기기, 바이오장비 및 기기, 바이오자원, 바이오서비스산업으로 구성 |
바이오산업 실태조사 보고서 |
|
|
국내 보건 산업 |
의약품 |
24조 원 |
시장규모=생산-수출+수입 |
식품의약품 산업통계 |
|
의료기기 |
8조 원 |
시장규모=생산-수출+수입 |
||
|
의료 서비스 |
138조 원 |
2019년 환율 적용 환산 |
2019 글로벌 보건 산업 시장규모 |
|
자료: 산업통상자원부, 한국바이오협회, 2019년 기준 국내 바이오산업 실태조사 결과 보고서, 2020.12.
식품의약품안전처. 2020. 식품의약품 산업동향통계. 2020.11.
한국보건산업진흥원, 보건산업통계. 2019 글로벌 보건산업 시장규모(2012∼2023). 2019.4, 통계지표(원자료: Fitchsolutions).
(단위: 개)

주) 생존기업 대상.
자료: 생명공학정책연구센터, 2019년 기준 국내 바이오 중소․벤처기업 현황 통계, 2021.7.
[그림 부록 8] 바이오 중소
[표 부록 17] 바이오 중소․벤처기업의 분야별 분포
(단위: 개)
|
대분류 |
레드 |
그린 |
||||||
|
중분류 |
의약품 |
진단의료기기 |
소계 |
농업 |
식품 |
소계 |
||
|
기업 수 |
521 |
249 |
770 |
221 |
513 |
734 |
||
|
대분류 |
화이트 |
플랫폼 |
||||||
|
중분류 |
화학 |
환경 |
에너지 |
소계 |
지원서비스 |
기타 |
소계 |
|
|
기업 수 |
386 |
99 |
14 |
499 |
314 |
179 |
493 |
|
주) 생존기업 대상.
자료 : 생명공학정책연구센터, 2019년 기준 국내 바이오 중소․벤처기업 현황 통계, 2021.7.
(단위: 개)

주) 벤처인증 경험이 있는 기업 대상.
자료: 생명공학정책연구센터, 2019년 기준 국내 바이오 중소․벤처기업 현황 통계, 2021.7.
[그림 부록 9] 바이오 벤처기업의 분야별 분포
[표 부록 18] 바이오 중소․벤처기업의 분야별 분포
(단위: 개)
|
대분류 |
레드 |
그린 |
||||||
|
중분류 |
의약품 |
진단의료기기 |
소계 |
농업 |
식품 |
소계 |
||
|
기업 수 |
417 |
207 |
624 |
148 |
355 |
503 |
||
|
대분류 |
화이트 |
플랫폼 |
||||||
|
중분류 |
화학 |
환경 |
에너지 |
소계 |
지원서비스 |
기타 |
소계 |
|
|
기업 수 |
297 |
74 |
9 |
380 |
264 |
151 |
415 |
|
주) 생존기업 대상.
자료: 생명공학정책연구센터, 2019년 기준 국내 바이오 중소
![]()
생명공학 관련법령
1. 관련 법률
|
소관부처 |
법률(62개) |
QR코드 |
|
과기정통부 |
생명공학육성법(1983) |
|
|
기초연구진흥 및 기술개발지원에 관한 법률(1989) |
|
|
|
뇌연구촉진법(1998) |
|
|
|
과학기술기본법(2001) |
|
|
|
생명연구자원의 확보․관리 및 활용에 관한 법률(2009) |
|
|
|
농식품부 |
가축전염병 예방법(1961) |
|
|
동물보호법(1991) |
|
|
|
*시행령QR코드 |
||
|
종자산업법(1995) |
|
|
|
친환경농어업 육성 및 유기식품 등의 관리․지원에 관한 법률(1997) (농식품부/해수부) |
|
|
|
산림자원의 조성 및 관리에 관한 법률(2005)(산림청) |
|
|
|
농업생명자원의 보존․관리 및 이용에 관한 법률(2007) |
|
|
|
식품산업진흥법(2007)(농식품부/해수부) |
|
|
|
농림식품과학기술 육성법(2009) |
|
|
|
곤충산업의 육성 및 지원에 관한 법률(2010) |
|
|
|
해외농업․산림자원 개발협력법(2011) |
|
|
|
식물신품종 보호법(2012) |
|
|
|
산업부 |
신에너지 및 재생에너지 개발․이용․보급 촉진법(1987) |
|
|
산업기술혁신 촉진법(1994) |
|
|
|
화학무기․생물무기의 금지와 특정화학물질․생물작용제등의 제조․수출입규제 등에 관한 법률(1996) |
|
|
|
유전자변형생물체의 국가간 이동 등에 관한 법률(2001) |
|
|
|
에너지법(2006) |
|
|
|
산업융합 촉진법(2011) |
|
|
|
복지부 |
감염병의 예방 및 관리에 관한 법률(1954) |
|
|
시체 해부 및 보존 등에 관한 법률(1962) (복지부/질병관리청) |
|
|
|
보건의료기술 진흥법(1995) |
|
|
|
천연물신약 연구개발 촉진법(2000) |
|
|
|
한의약 육성법(2003) |
|
|
|
암관리법(2003) |
|
|
|
생명윤리 및 안전에 관한 법률(2004) |
|
|
|
저출산․고령사회기본법(2005) |
|
|
|
첨단의료복합단지 육성에 관한 특별법(2008) (복지부/산업부/과기정통부) |
|
|
|
제약산업 육성 및 지원에 관한 특별법(2011) |
|
|
|
희귀질환관리법(2015) |
|
|
|
의료기기산업 육성 및 혁신의료기기 지원법(2019) (복지부/식약처) |
|
|
|
첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률(2019) (복지부/식약처) |
|
|
|
환경부 |
환경기술 및 환경산업 지원법(1994) |
|
|
야생생물 보호 및 관리에 관한 법률(2004) |
|
|
|
가축분뇨의 관리 및 이용에 관한 법률(2006) |
|
|
|
생물다양성 보전 및 이용에 관한 법률(2012) |
|
|
|
유전자원의 접근․이용 및 이익공유에 관한 법률(2017) |
|
|
|
생활화학제품 및 살생물제의 안전관리에 관한 법률(2018) |
|
|
|
녹색융합클러스터의 조성 및 육성에 관한 법률(2021) |
|
|
|
해수부 |
해양수산발전 기본법(2002) |
|
|
해양생태계의 보전 및 관리에 관한 법률(2006) |
|
|
|
수산생물질병 관리법(2007) |
|
|
|
수산자원관리법(2009) |
|
|
|
수산과학기술진흥을 위한 시험연구 등에 관한 법률(2011) |
|
|
|
식물신품종 보호법(2012) |
|
|
|
수산종자산업육성법(2015) |
|
|
|
해양수산생명자원의 확보․관리 및 이용 등에 관한 법률(2012) |
|
|
|
해양수산과학기술 육성법(2016) |
|
|
|
식약처 |
약사법(1953) |
|
|
화장품법(1999) |
|
|
|
건강기능식품에 관한 법률(2002) |
|
|
|
의료기기법(2003) |
|
|
|
인체조직안전 및 관리 등에 관한 법률(2004) (식약처/복지부) |
|
|
|
실험동물에 관한 법률(2008) |
|
|
|
식품․의약품분야 시험․검사 등에 관한 법률(2013) |
|
|
|
식품․의약품 등의 안전기술 진흥법(2015) |
|
|
|
의료기기산업 육성 및 혁신의료기기 지원법(2019) |
|
|
|
체외진단의료기기법(2019) |
|
|
|
공중보건 위기대응 의료제품의 개발 촉진 및 긴급 공급을 위한 특별법(2021) |
|
주) 부처별 제정 연도순.
출처: 과학기술정보통신부(편), 제3차 생명공학육성기본계획, 2017을 참고하여 집필진 작성.
2. 관련 계획
|
소관부처 |
계획(50개) |
비고 |
|
과기정통부 |
제3차 생명공학 육성 기본계획(’17∼’26) |
|
|
제4차 기초연구 진흥 종합계획(’18∼’22) |
|
|
|
제3차 뇌연구 촉진 기본계획(1단계)(’18∼’27) |
|
|
|
제4차 과학기술 기본계획(’18∼’22) |
|
|
|
제3차 국가생명 연구자원 관리․활용 기본계획(’20∼’25) |
|
|
|
농식품부 |
동물 복지 종합계획(’20∼’24) |
|
|
제2차 종자산업 육성 5개년 계획(’18∼’22) |
|
|
|
제4차 친환경농업 육성 5개년 계획(’16∼’20) |
|
|
|
제3차 농업생명자원의 보존/관리 및 이용에 관한 기본계획(’19∼’23) |
|
|
|
제3차 식품산업 진흥 기본계획(’18∼’22) |
|
|
|
제3차 농림식품 과학기술 육성 종합계획(’20∼’24) |
|
|
|
제2차 곤충산업 육성 5개년계획(’16∼’20) |
|
|
|
제3차 해외농업자원 개발 5개년 종합계획(’18∼’22) |
|
|
|
제4차 농업생명공학 육성 중장기 기본계획(’18∼’27) |
|
|
|
제7차 농업과학기술 중장기 연구개발 계획(’18∼’27) |
|
|
|
제3차 곤충․양잠산업 육성 종합계획(’21∼’25) |
|
|
|
제8차 농업기계화 기본계획(’17∼’21) |
|
|
|
제3차 산림과학기술 기본계획(산림청)(’18∼’27) |
|
|
|
산업부 |
제4차 신․재생에너지 기본계획(’14∼’35) |
|
|
제7차 산업기술 혁신계획(’19∼’23) |
|
|
|
제3차 유전자변형생물체 안전관리계획(’18∼’22) |
|
|
|
제4차 에너지기술 개발계획(’19∼’28) |
|
|
|
제2차 산업융합발전 기본계획(’19∼’23) |
|
|
|
복지부 |
제2차 감염병의 예방관리 기본계획(’18∼’22) |
|
|
제2차 보건의료 기술육성 기본계획(’18∼22) |
|
|
|
제4차 천연물신약 연구개발 촉진계획(’20∼’24) |
|
|
|
제4차 한의약 육성 발전 종합계획(’21∼’25) |
|
|
|
제4차 암 관리 종합계획(’21∼’25) |
|
|
|
제4차 저출산․고령사회기본계획(’21∼’25) |
|
|
|
제4차 첨단의료복합단지 종합계획(’20∼’24) |
|
|
|
제2차 제약산업 육성․지원종합계획(’18∼’22) |
|
|
|
제1차 희귀질환 관리 종합계획(’17∼’21) |
|
|
|
제1차 첨단재생의료․첨단바이오의약품 기본계획(’21∼’25) |
|
|
|
제2차 국가 감염병 위기대응 기술개발 추진전략(’17∼’21) |
|
|
|
보건산업 종합 발전전략(’16∼’20) |
|
|
|
환경부 |
제4차 환경기술 및 환경산업 육성계획(’18∼’22) |
|
|
제4차 야생생물 보호 기본계획(’21∼’25) |
|
|
|
제4차 국가생물다양성전략(’19∼’23) |
|
|
|
제1차 생활화학제품 및 살생물제 관리에 관한 종합계획(’21∼’25) |
|
|
|
제2차 환경보건 종합계획(’21∼’30) |
|
|
|
해수부 |
제3차 해양수산 발전 기본계획(’21∼’30) |
|
|
제2차 해양생태계 보전․관리 기본계획(’19∼’28) |
|
|
|
제3차 수산생물 질병관리를 위한 기술개발 종합계획(’21∼’25) |
|
|
|
제3차 수산자원 관리 기본계획(’21∼’25) |
|
|
|
제1차 해양수산생명자원 관리 기본계획(’19∼’23) |
|
|
|
제1차 해양수산과학기술 육성 기본계획(’18∼’22) |
|
|
|
해양수산 R&D 중장기계획(’14∼’22) |
|
|
|
중기부 |
제4차 중소기업 기술혁신 촉진계획(’19∼’23) |
|
|
식약처 |
의약품 안전관리 제1차 종합계획(’20∼’24) |
|
|
제2차 식품․의약품 등의 안전기술 진흥 기본계획(’21∼’25) |
|
자료: 과학기술정보통신부(편), 제3차 생명공학육성기본계획, 2017을 참고하여 재구성.

출처: 2019년도 과학기술분야중장기계획 조사
● 집필진
|
[특집] 코로나19 대응 성과와 포스트 코로나 전략 |
|
|
|
특집-1 |
특집 1. 정부 정책 대응
|
고려대학교/송대섭 |
|
연세대학교/성백린 |
||
|
특집-3 |
특집 2. 진단기기 개발 및 성과 |
한국생명공학연구원/이규선 |
|
특집-2 |
특집 3. 치료제․백신 개발
|
국가마우스사업단/성제경 |
|
한국생명공학연구원/홍정주 |
||
|
특집-4 |
특집 4. 새로운 표준, K-방역 |
한국화학융합시험연구원/조진식 |
|
특집-5 |
특집 5. 국제협력 |
한국파스퇴르연구소/지영미 |
|
특집-6 |
특집 6. 바이오분야 포스트 코로나 전략
|
에쎄넴/전승민 셀트리온/이수영 |
|
제1장 : 생명공학의 변화와 도전 |
|
|
|
제1절 : 생명공학의 변곡점 |
||
|
1-1-1 |
1. 미국 |
한국생명공학연구원/김정석 |
|
1-1-2 |
2. EU |
영국캠브리지의과대학/한남식 |
|
1-1-3 |
3. 중국 |
한국연구재단/김준헌소장 |
|
1-1-4 |
4. 일본 |
前 KISTI/이상필 |
|
제2절 : 생명공학의 도전과 노력 |
||
|
|
1. 우리나라 바이오 육성을 위한 노력 |
|
|
1-2-1-1 |
1-1. 범부처 지원 민관협력(신약) |
국가신약개발재단/묵현상 |
|
1-2-1-2 |
1-2. 범부처 지원 민관협력(줄기세포) |
범부처재생의료기술개발사업단/조인호 |
|
1-2-1-3 |
1-3. 범부처 지원 민관협력(의료기기) |
범부처전주기의료기기사업단/김법민 |
|
1-2-2 |
2. 우리나라 바이오의 혁신성장과 향후과제 |
바이오디자이너스/신정섭 |
|
제2장 : 국가 생명공학 육성 정책 |
|||
|
제1절 : 생명공학 육성 정책 |
|||
|
2-1-1 |
1. 생명공학 연구개발 지원정책 |
과기정통부/생명기술과 |
|
|
2-1-2 |
2. 생명공학산업 육성정책 |
산업부/바이오융합산업과 |
|
|
2-1-3 |
3. 생명공학 기초과학진흥 정책 |
과기정통부/기초연구진흥과 |
|
|
2-1-4 |
4. 생명공학 인력양성 정책 |
교육부/학술진흥과 |
|
|
2-1-5 |
5. 농림축산식품분야 생명공학 육성정책 |
농식품부/종자생명산업과 |
|
|
2-1-6 |
6. 보건의료분야 생명공학 육성정책 |
복지부/보건의료기술개발과 |
|
|
2-1-7 |
7. 환경분야 생명공학 육성정책 |
환경부/환경연구개발과 |
|
|
2-1-8 |
8. 해양수산분야 생명공학 육성정책 |
해수부/해양수산과학기술정책과 |
|
|
2-1-9 |
9. 생명자원 분야의 육성 및 관리정책 |
|
|
|
2-1-9-1 |
9-1. 개요, 과기정통부 |
과기정통부/생명자원과 |
|
|
2-1-9-2 |
9-2. 농업 |
농식품부/종자생명산업과 |
|
|
2-1-9-3 |
9-3. 보건의료 |
복지부/보건의료기술개발과 |
|
|
2-1-9-4 |
9-4. 야생생물 |
환경부/환경연구개발과 |
|
|
2-1-9-5 |
9-5. 해양 |
해수부/해양수산생명자원과 |
|
|
2-1-10 |
10. 국제협력 |
|
|
|
2-1-10-1 |
10-1. 국제협력 R&D 및 국가간 협력(바이오분야) |
한국연구재단/최원근 |
|
|
2-1-10-2 |
10-2. OECD BNCT 등 활동 현황 |
과기정통부/다자협력과 |
|
|
제2절 : 생명공학 경쟁력 지표 현황 |
|||
|
2-2-1 |
1. 투자현황 |
한국과학기술기획평가원/홍미영 |
|
|
2-2-2 |
2. 인력현황 |
|
|
|
2-2-2-1 |
2-1. 인력현황(학과별 배출인력) |
한국생명공학연구원/정책센터 |
|
|
2-2-2-2 |
2-2. 인력현황(산업인력) |
한국바이오협회/손지호 |
|
|
2-2-3 |
3. 특허현황 |
특허정보진흥센터/김봉진 |
|
|
2-2-4 |
4. 논문현황(질적지표) |
한국연구재단/조석민 |
|
|
2-2-5 |
5. 산업현황 |
한국바이오협회/오기환 |
|
|
제3장 : 분야별 연구개발 및 관련 산업 현황 |
||
|
제1절 : 기초생명과학 |
||
|
3-1-1 |
1. 유전체 |
한국생명공학연구원/김선영 |
|
3-1-2 |
2. 단백질체 |
울산대학교/김경곤 |
|
3-1-3 |
3. 세포체(줄기세포 포함) |
건국대학교/정형민 |
|
3-1-4 |
4. 대사체 |
한국과학기술연구원/정봉철 |
|
3-1-5 |
5. 시스템생물 |
한국과학기술원/조병관 |
|
3-1-6 |
6. 구조생물 |
한국생명공학연구원/구본수 |
|
3-1-7 |
7. 뇌과학 |
한국뇌연구원/문지영 |
|
3-1-8 |
8. 노화과학 |
한국생명공학연구원/김천아 |
|
제2절 : 보건의료 |
||
|
3-2-1 |
1. 합성신약 |
한국화학연구원/최길돈 |
|
3-2-2 |
2. 바이오의약품 |
前 오송첨복재단/이태규 |
|
3-2-3 |
3. 바이오장기 |
바이오이종장기개발사업단/박정규 |
|
3-2-4 |
4. 진단 및 의료기기 |
성균관대학교/류규하 |
|
3-2-5 |
5. 감염병 |
고려대학교/송대섭 |
|
제3절 : 농림축산식품 |
||
|
3-3-1 |
1. 농림 |
숭실대학교/서정아 |
|
3-3-2 |
2. 축산 |
국립축산과학원/오건봉 |
|
3-3-3 |
3. 식품 |
중앙대학교/전향숙 |
|
제4절 : 환경․해양수산 |
||
|
3-4-1 |
1. 환경 생명공학 |
한국생명공학연구원/오희목 |
|
3-4-2 |
2. 해양 생명공학 |
해양수산과학기술진흥원/서경석 |
● 집필진
|
제5절 : 바이오 공정 및 융합 |
||
|
3-5-1 |
1. 생물공정(산업바이오) |
가톨릭대학교/주정찬 |
|
3-5-2 |
2. BT + ICT |
한국전자통신연구원/박종현 |
|
제6절 : 생물자원(생명연구자원) |
||
|
3-6-1 |
1. 바이오 소재 클러스터 |
한국생명공학연구원/진태은 |
|
3-6-2 |
2. 바이오 데이터 |
한국생명공학연구원/이병욱 |
|
제7절 : 생명공학 인프라(장비·시설) |
한국산업기술평가관리원/이강우 |
|
|
제4장 : 생명공학 관련 법제도 현황 |
||
|
제1절 : 생명공학육성법 개정의 의의 |
한국생명공학연구원/정책센터 |
|
|
제2절 : 바이오 안전성 동향 |
한국생명공학연구원/김기철 |
|
|
제3절 : 생명윤리 동향 |
이화여자대학교/김현철 |
|
|
제4절 : 생명공학 지적재산권 제도 동향 |
특허청/손영희 |
|
|
제5절 : 생명공학 제품 인허가 현황과 과제 |
이화여자대학교/이선희 |
|
|
제6절 : 생명공학 기업 현황과 지원제도 |
한국바이오협회/오기환 |
|
|
<부록> |
||
|
부록-1 세계 생명공학 연표 |
한국생명공학연구원/정책센터 |
|
|
부록-2 생명공학 주요통계 |
한국생명공학연구원/정책센터 |
|
|
부록-3 생명공학 관계법령 |
한국생명공학연구원/정책센터 |
|
● 편찬위원회
|
|
|
|
|
공동위원장 |
이창윤 |
과기정통부 기초원천연구정책관 |
|
|
최 선 |
국가과학기술자문회의 생명의료전문위원장 |
|
|
|
|
|
위 원 |
권석윤 |
한국생명공학연구원 부원장 |
|
|
김연수 |
충남대학교 교수 |
|
|
류충민 |
한국생명공학연구원 센터장 |
|
|
묵현상 |
국가신약개발재단 단장 |
|
|
박윤정 |
서울대학원 교수 |
|
|
이명화 |
과학기술정책연구원 단장 |
|
|
이승규 |
한국바이오협회 부회장 |
|
|
정영희 |
전남대학교 교수 |
|
|
홍미영 |
한국과학기술기획평가원 센터장 |
|
|
|
|
|
|
김상현 |
한국연구재단 신약단 단장 |
|
|
오민규 |
한국연구재단 차세대바이오단 단장 |
|
|
조은혜 |
한국연구재단 뇌․첨단의공학단 단장 |
|
|
|
|
|
간 사 |
김흥열 |
국가생명공학정책연구센터 센터장 |
|
|
|
|
|
실무팀 |
이선미 |
과기정통부 생명기술과 서기관 |
|
|
허예라 |
과기정통부 생명기술과 주무관 |
|
|
문성훈 |
국가생명공학정책연구센터 정책연구실장 |
|
|
이지현 |
국가생명공학정책연구센터 연구원 |
|
|
|
|

 2021 생명공학백서 바로가기
2021 생명공학백서 바로가기
 2021 생명공학백서 바로가기
2021 생명공학백서 바로가기





































































