2023 생명공학백서

- 발행일 2023-12-26
- 출처 과학기술정보통신부
- 담당자 이지현 ( 042-879-8366 / ljih@kribb.re.kr )
- 조회수 10382
-
키워드
#생명공학 #바이오 #동향 #인프라 #법제도
-
첨부파일
-
 2023 생명공학백서(PDF-책갈피).pdf
(다운로드 2334회)
바로보기
2023 생명공학백서(PDF-책갈피).pdf
(다운로드 2334회)
바로보기
-
-
차트+
개요
과학기술정보통신부가 열한 번째로 발간하는 이번 생명공학백서는 지난 2년간 우리나라의 변화와 도전과 더불어 세계 주요국의 동향, 관련 제도, 연구개발 성과 등 생명공학 분야의 현황과 향후 방향을 가늠할 수 있는 다양하고 유용한 정보를 담고 있습니다. 특별 주제로 「디지털 시대의 바이오 대전환」을 선정하여 디지털바이오 트렌드와 성공사례 및 발전 전망 등을 집중적으로 살펴보았습니다.
아무쪼록 이번 백서가 생명공학 분야 산학연 전문가들에게는 과거를 돌아보고 앞을 내다볼 수 있는 계기가 되고, 국민들께는 생명공학 기술의 중요성에 공감할 수 있는 좋은 참고서가 되기를 기대합니다.
제 4유형 : 출처표시 + 상업적 이용금지 + 변경금지
이용자는 이 공공저작물을 이용할 경우 저작물의 출처표시, 비영리 목적으로만 이용가능하며 저작물의 변경 혹은 2차 저작물 작성을 금지합니다.

<주요 목차>
특 집 : 디지털 시대의 바이오 대전환
제1장 : 생명공학의 변화와 도전
제2장 : 국가 생명공학 육성 정책 및 지표
제3장 : 분야별 연구개발 및 산업 현황
제4장 : 생명공학 관련 법·제도 현황
부록

발간사
| 과학기술이 국가의 안전과 번영을 담보하는 시대, 이른바 팍스 테크니카(Pax Technica) 시대가 도래하였습니다. 바이오는 기술발전, 경제성장 뿐 아니라, 기후변화, 고령화, 감염병, 자원고갈 등 글로벌 난제를 푸는 핵심 열쇠로서 전략적 중요성이 확대되고 있으며, 기술패권 경쟁 및 기술 블록화의 중심으로 대두되고 있습니다. 한편, 유전체 해독 기술이 급격하게 발전하고 유전체·임상 데이터 등이 축적됨에 따라, 바이오와 첨단 디지털 기술의 융합이 가속화되고 있습니다. 바이오에 인공지능, 빅데이터 등의 기술이 활용되면서 신약개발 등 연구와 사업화 과정에 소요되는 시간과 비용이 크게 절감되고 있으며, 과거에는 불가능했던 새로운 기술 개발, 이전에 없었던 산업의 창출이 가능해지고 있습니다. 이러한 바이오 대전환 시대에 어떻게 대응하는가에 따라 바이오 기술과 산업의 ‘새 판’이 조성될 수 있습니다. 2022년 9월, 미국 바이든 행정부가 「국가 생명공학 및 바이오제조 이니셔티브」 행정명령을 발동해 바이오 분야를 반도체, 배터리 수준으로 집중 관리하고 있는 것은 이러한 흐름과 무관하지 않습니다. 우리 정부도 바이오 대전환으로 나타난 새로운 기회를 놓치지 않고 글로벌 기술패권 경쟁에 대응하기 위하여 다양한 정책들을 추진하고 있습니다. 경제·외교·안보적 가치가 높은 12대 국가전략기술 중 하나로 첨단바이오를 선정하여 핵심기술 선점과 기술경쟁력 강화에 힘쓰고 있고, ‘디지털바이오 육성’을 국정과제에 포함하여 추진 중입니다. 바이오 산업을 넥스트 반도체로 육성하기 위한 전략을 마련하고 이를 뒷받침하는 바이오 규제혁신과 인력양성에도 집중적인 노력을 기울이고 있습니다. 바이오가 의료, 환경, 에너지, 농업 등 산업 전반에 적용됨에 따라 바이오경제는 빠르게 성장하고 있습니다. 글로벌 바이오 시장은 자동차, 석유화학, 반도체 산업을 합한 규모와 유사한 수준이며, 글로벌 기업들은 합성생물학 등을 활용한 신시장 창출을 적극적으로 추진하고 있습니다. 우리 바이오산업 규모는 연평균 약 10%의 증가율로 빠르게 성장하고 있으나, 아직은 글로벌 시장 대비 2% 수준의 영세한 규모입니다. 하지만, 최근 한국 바이오기업의 가치가 증가하고 국내 기술에 대한 세계적인 위상도 높아지고 있습니다. 또한, 2023년 식약처 허가를 받은 국내 디지털치료기기 1·2호가 나오는 등 우리의 세계적인 디지털 역량을 기반으로 한 바이오헬스 시장의 성장도 기대되는 상황입니다. 정부는 바이오 대전환, 바이오경제 성장의 흐름에 발맞춰, 집중적인 투자와 합리적인 전략을 통해 바이오가 차세대 성장동력으로서 국민이 기대하는 성과를 달성할 수 있도록 대학, 기업, 연구소 등 혁신주체들과 함께 지속적으로 노력해 나갈 것입니다. 열한 번째로 발간되는 이번 생명공학백서는 지난 2년간 우리나라의 변화와 도전과 더불어 세계 주요국의 동향, 관련 제도, 연구개발 성과 등 생명공학 분야의 현황과 향후 방향을 가늠할 수 있는 다양하고 유용한 정보를 담고 있습니다. 특별 주제로 「디지털 시대의 바이오 대전환」을 선정하여 디지털바이오 트렌드와 성공사례 및 발전 전망 등을 집중적으로 살펴보았습니다. 아무쪼록 이번 백서가 생명공학 분야 산학연 전문가들에게는 과거를 돌아보고 앞을 내다볼 수 있는 계기가 되고, 국민들께는 생명공학 기술의 중요성에 공감할 수 있는 좋은 참고서가 되기를 기대합니다. 끝으로 이번 백서 발간을 위해 수고해 주신 각 분야 전문가 및 관계자 여러분께 감사의 말씀을 드립니다. 2023년 12월 과학기술정보통신부 장관 ㅣ 이종호 | |||
편찬사
| 우리는 팬데믹을 겪으며 많은 일상생활의 변화와 함께 바이오 기술의 중요성도 함께 체감하였습니다. 현재 우리는 고령화, 감염병, 안전한 먹거리 확보 등 글로벌 도전 난제를 해결하고 급속한 디지털 전환에 적극 대응해야 하는 대전환의 시기에 있습니다. 세계 각국은 범용적으로 활용이 가능한 플랫폼 기술을 적극 도입하고, 단일세포 이미징 분석, 유전자 시퀀싱 등의 기반기술과 극저온 전자현미경, 가속기 등의 기반인프라를 구축하여 바이오연구의 질을 높이고, 디지털 기술과의 융합으로 바이오 연구개발 방식의 혁신을 통한 신연구 및 신산업 창출을 지원하고 있습니다. 또한 기술패권과 기술블록화의 본격화에 따라 바이오 기술이 안보의 관점에서 국가전략기술로 중요성을 재인식, 바이오 경제라는 패러다임의 전환을 넘어 지속가능성을 위해 능동적이고 적극적인 자세로 대응하고 있습니다. 우리나라는 선제적인 R&D 투자가 점진적으로 국내 바이오 생태계 전반의 기술력 향상과 기술수출・시장의 확대 등으로 연결되면서 양적・질적으로 성장하고 있으며, 다양한 환경변화 속에서 선택과 집중을 통해 바이오 선도국 진입을 위해 노력하고 있습니다. 또한 기술의 혁신뿐만 아니라 좀 더 장기적인 관점과 안목을 통해 바이오 기술이 사람에게 건강하고 올바르게 활용되어 우리 삶의 질을 높이고자 합니다. 생명공학백서에는 생명공학 분야의 이러한 주요 이슈, 정책추진 현황, 연구개발 및 산업 동향과 전망 등 방대한 생명공학 정보를 체계적으로 종합하여 수록하였습니다. 생명공학 분야의 종합 안내서인 이 백서를 통해 관련 분야 전문가는 물론 일반인들이 조금이나마 서로 소통할 수 있는 자료가 되기를 희망합니다. 다시 한번 2023 생명공학백서 발간을 축하하며, 그동안 수고해 주신 과학기술정보통신부 및 국가생명공학정책연구센터 관계자분들, 그리고 집필에 참여해 주신 모든 전문가분께 깊은 감사의 말씀을 드립니다. 감사합니다. 2023년 6월 2023 생명공학백서 편찬위원장 ㅣ 이혜숙 | |||
축하의 글
| 2023년 5월, 한국 정부는 2020년 초부터 시작된 기나긴 코로나19 팬데믹에 대한 사실상의 종식을 선언했습니다. 이 어려운 시기에 국내 바이오기업들은 신속하게 진단키트를 개발해 우리나라를 비롯해 전 세계에 공급해 팬데믹 대응에 크게 기여하였습니다. 코로나19 팬데믹은 엔데믹으로 전환되었지만 넥스트 팬데믹 대응을 위해 새로운 바이오기술을 이용한 진단기기, 백신 및 치료제 개발은 이미 시작되었습니다. 생명공학기술 또는 바이오기술은 코로나19를 계기로 보건안보 차원뿐만 아니라 지속가능한 경제활동을 위해서 필수적인 기술로 자리매김했고 거의 모든 나라들이 바이오기술과 바이오산업을 육성하기 위한 투자를 확대하고 있습니다. 최근 유전자 편집・분석기술 등 바이오기술 분야에서의 중요한 진전이 이루어지면서 헬스케어 분야뿐만 아니라, 경제 및 사회 영역에까지 활발한 변화를 주고 있습니다. 바이오기술과 이를 활용한 제품들이 일상생활과 산업 전반에 깊숙이 자리하는 바이오경제는 IT가 우리의 생활을 혁신적으로 바꿔놓았듯이 미래 생활에 폭넓고 다양하게 기여할 것으로 예상됩니다. 또한, 생명과 건강, 식량, 환경, 에너지 등 인류의 당면과제 해결은 물론이고 IT, NT 등과의 기술 융・복합을 통해 신산업 창출 및 고부가가치를 제공할 전망입니다. 세계적인 전략컨설팅기업들도 미래의 산업과 경제가 바이오기술 혁명으로 큰 변화를 맞이할 것으로 예측하고 있습니다. 맥킨지는 바이오 혁명으로 향후 10∼20년간 연 2조∼4조 달러 규모의 경제적 가치를, 보스톤컨설팅그룹은 2030년까지 합성생물학이 제조산업 글로벌 생산의 1/3에 영향을 미쳐 30조 달러에 달하는 경제적 가치를 창출할 것으로 전망했습니다. 최근 바이오기술 발전과 디지털기술과의 결합은 바이오경제 도래를 더욱 앞당길 것입니다. 이제 우리도 바이오경제 시대를 더욱 적극적으로 준비해야 합니다. 미국, 중국, 유럽, 일본은 우리보다 먼저 바이오경제를 대비한 종합적인 육성정책을 발표하고 추진하고 있습니다. 이번에 발간되는 생명공학백서에는 그간의 생명공학 발자취뿐만 아니라 주요국 및 국내 생명공학 정책을 세부적으로 정리하고 있어 그간의 성과를 평가하고 향후 바이오 육성 방향을 제시하는 종합 안내서로서 국내 바이오 관련 산업계, 연구계 및 정책입안자에게 모두 유용한 자료로 활용될 것으로 생각합니다. 2023 생명공학백서의 발간을 진심으로 축하드리며, 소중한 백서 발간을 위해 애쓰신 관계자 분들과 집필에 참여해 주신 전문가분께 감사드립니다. 2023년 6월 한국바이오협회 회장 ㅣ 고한승 | |||
축하의 글
| 최근 국제사회의 패러다임은 지정학(地政學)적 시대에서 기술 패권이 국제정치를 좌우하는 기정학(技政學, Techno-politics)적 시대로 바뀌고 있습니다. 이러한 흐름에 따라 전 세계는 기술 선도국이 되기 위해 첨단바이오, 6G, AI 반도체, 이차전지 등 ‘게임체인저’가 될 핵심 전략기술 중심으로 경쟁이 가속화되고 있습니다. 특히, 바이오 분야는 AI・빅데이터 등과 융합을 통해 연구・사업화 과정의 시간과 비용이 크게 절감되어 혁신기술 조기 확보가 가능한 ‘바이오 대전환 시대’가 도래하고 있습니다. 이에 따라 연구방식 및 신기술・신산업이 창출되고 있고, 바이오가 가진 한계를 벗어나 전 산업 분야에 전방위적으로 파급되어 혁신을 촉진하고 있습니다. 정부도 바이오헬스 산업을 ‘제2의 반도체 산업’으로 보고, 바이오 경제 시대의 글로벌 국가 경쟁력 확보를 위해 디지털바이오 혁신전략(2022.12), 바이오헬스 신시장 창출 전략(2023.2), 바이오헬스 신산업 규제혁신 방안(2023.3) 등의 정책을 적극 추진하고 있습니다. 이러한 시대적 흐름과 변화에 대응하여 한국생명공학연구원은 바이오 분야에 디지털 역량을 접목하여 연구・사업화 과정의 시간과 비용을 크게 절감하고, 나아가 국가 바이오산업 전반에 공헌할 수 있도록 다양한 역할을 수행하고 있습니다. 첨단・디지털 신약, 디지털 트윈 등 디지털 융・복합 연구를 통해 데이터 기반의 첨단 바이오 전략기술을 확보하고, 국가 R&D에서 생산되는 데이터를 수집・관리해 연구자들이 효율적으로 활용할 수 있도록 ‘국가바이오데이터스테이션(K-BDS)’ 플랫폼을 운영하여 연구데이터를 생산, 공유, 활용하는 선순환 체계를 운영하고 있습니다. 또한, 디지털바이오혁신센터를 설치하여 다양한 기존 연구방식을 데이터 기반으로 속도감 있게 전환하고 있으며, 대표적으로 질환 발생에 대한 빅데이터 기반의 전 주기적 대응을 위한 연구를 추진하고 있습니다. 앞으로 한국생명공학연구원은 국내 유일 바이오 전문 출연연으로서 바이오 분야의 디지털 혁신을 선도할 수 있도록 최선의 노력을 다하겠습니다. 과학기술정보통신부에서 11번째로 발간하는 2023 생명공학백서는 최근 이슈가 되고 있는 디지털바이오 등 주요 연구 분야에 대한 심층적인 내용과 국가 생명공학 육성 정책, 분야별 연구개발 및 산업 현황, 관련 법과 제도 등을 수록하고 있습니다. 앞으로 생명공학백서가 생명공학 분야 전문가들에게는 다양한 정보를 제공하는 안내서가 되고, 일반 국민들에게는 생명공학에 대한 이해의 폭을 넓히고 인식을 제고하기를 기대합니다. 2023 생명공학백서의 발간을 진심으로 축하드리며, 과학기술정보통신부와 집필에 참여하신 모든 생명공학 전문가분께 감사의 말씀을 전합니다. 감사합니다. 2023년 6월 한국생명공학연구원 원장 ㅣ 김장성 | |||


















2021년 주요연구성과(*수정~!) |
국가연구개발 우수성과 100의 ‘생명・해양’분야에 선정된 성과를 기준으로 소개 국가연구개발 우수성과 100의 ‘생명・해양’분야에 선정된 성과를 기준으로 소개 |
생명・해양 분야(26개) !!! | |||
성과명 | 연구자 | 소속기관 | 비고 |
인체장기 재현한 조립형 미니장기 ‘어셈블로이드’ 개발을 통한 조직재생 및 암발생 기작 규명 | 신근유 | 포항공과대학교 | 최우수 |
PCSK9이 LDL-Receptor를 분해하는 기전 규명 : 대사증후군 신치료제 개발 플랫폼 확립 | 김효수 | 서울대학교병원 | 최우수 |
장내 미생물 기반 알코올성 지방간 치료용 핵심 소재 개발 | 고광표 | 서울대학교 | |
고령화 대응 노인성 근감소증 제어 약물 개발 및 기술이전 | 권기선 | 한국생명공학연구원 | |
세계 최초 과수에만 농약 살포가 가능한 지능형 로봇 방제기 개발 | 김국환 | 국립농업과학원 | |
항생제 내성 특성 분석 및 제어기술 개발 | 김미경 | 식품의약품안전평가원 | |
물리적 포만감의 신경과학: 식욕을 조절하는 장-뇌 신호전달 연구 | 김성연 | 서울대학교 | |
국내 최초 개별인정형 여성 갱년기 증상 완화 프로바이오틱스 상용화 성공 | 김윤태 | 한국식품연구원 | |
해양 환경내 잔류성 독성물질의 잠재 독성 예측가능한 생-물리 연계 모델의 개발 | 김종성 | 서울대학교 | |
밀싹의 유용대사체 구명을 통한 건강기능식품 소재 원천기술 개발 | 김현영 | 국립식량과학원 | |
아프리카 토착 소의 유전체 진화 규명 | 김희발 | 서울대학교 | |
대장암 단일세포 분석을 통한 면역항암치료 기전 규명 | 박웅양 | 삼성서울병원 | |
ADC 항암제(DLK1-ADC), 미국 ‘픽시스’사에 글로벌 기술 이전 계약 | 박창식 | ㈜레고켐바이오사이언스 | |
선박운항 시뮬레이터 선박 운동성능 예측용 동역학 모델 개발 | 안성필 | ㈜세이프텍리서치 | |
URI-T, 국산 해저 케이블/파이프라인 매설 로봇 상용화 성공 및 해외시장 진출 쾌거 | 이계홍 | 한국로봇융합연구원 | |
중국 고추 시장 진출을 위한 성공적 R&D 체계 확립 및 해외 시장 확대 개발 | 이도현 | 대일국제종묘 | |
개미산과 이산화탄소만으로 잘 증식하는 대장균 개발 | 이상엽 | 한국과학기술원 | |
국내 자생 수국을 이용한 이너뷰티 건강기능식품의 글로벌 산업화 | 이선희 | 코스맥스바이오㈜ | |
국산 3D 홀로토모그래피・인공지능 기술로 질환 치료제 개발의 새로운 패러다임을 제시하다 | 이성수 | 한국기초과학지원연구원 | |
세계 최초, SUPER 항노화(抗老化) 식품자원의 발굴 및 산업화 | 이성현 | 국립농업과학원 | |
새로운 육종기술 지원을 통한 민간육종기반구축 및 사업화 | 임기병 | 경북대학교 | |
의료용 생분해성 폴리에스터 국산화를 위한 국제인증, 사업화 및 기술 수출 계약 | 전흥재 | 가톨릭대학교 | |
노화된 인간의 피부세포를 다시 젊은 세포로 되돌리는 역노화 원천기술 개발 | 조광현 | 한국과학기술원 | |
브랜드 쌀 원료곡 국산화를 위한 수요자 참여형 벼 품종개발 및 사업화 | 현웅조 | 국립식량과학원 | |
국내최초 선진국 수준의 코로나19 영장류 감염모델 개발 및 산학연 지원 | 홍정주 | 한국생명공학연구원 | |
휴대 가능한 디지털 X-ray 검출기 디자인 기술 개발 및 사업화 | 황강민 | 레이언스 | |
2022년 주요연구성과 |
국가연구개발 우수성과 100의 ‘생명・해양’분야에 선정된 성과를 기준으로 소개 |
생명・해양 분야(24개) | |||
성과명 | 연구자 | 소속기관 | 비고 |
티오레독신 단백질의 냉해 센서 기전규명 및 본 센서를 활용한 내한성 작물품종 개발 | 이상열 | 경상국립대학교 | 최우수 |
마이크로바이옴 대사체 규명을 통한 인체 면역시스템 조절 | 박승범 | 서울대학교 | 최우수 |
환자맞춤형 항혈소판제 용법 증명 | 구본권 | 서울대학교병원 | |
장을 통한 혈액내 포도당 체외 배출용 대사성 질환 신약 타깃 발굴 | 구철룡 | 연세대학교 | |
고콜레스테롤에 의한 대장암 악성화 기전 규명 및 암 전이/재발 진단 기술 개발 | 김남순 | 한국생명공학연구원 | |
신개념 뇌동맥류 수술 시스템 개발 및 동물 실험을 통한 성능 검증 (광섬유가 통합된 이중 내강 구조의 미세유체 장치 개발) | 김준원 | 포항공과대학교 | |
축산 시설에서 발생되는 복합악취 저감을 위한 전자선 기반의 기술 개발 및 기술 이전 | 김태훈 | 한국원자력연구원 | |
종양 후성유전학적 리프로그래밍 기술 개발 | 김필남 | 한국과학기술원 | |
국내 최대 규모의 한국인 장내미생물 빅데이터를 활용한 질환 예측・진단 기술 개발 | 남영도 | 한국식품연구원 | |
냉, 난방 효율이 증진된 시설원예용 하이브리드형 장기성 PO필름 개발 | 박광억 | 일신화학공업㈜ (현 일신하이폴리㈜) | |
CDM기반 바이오헬스 통합 데이터망 기관확장 구축 기술개발 | 박래웅 | 아주대학교 | |
저항성 벼 ‘참동진’ 개발・보급으로 병(病) 피해 확산에 선제 대응 | 박현수 | 국립식량과학원 | |
대변무리이식을 이용한 송아지 설사병 치료 및 생산성 향상 기술 개발 | 배진우 | 경희대학교 | |
예방접종 등록자료 및 건강보험청구자료 연계를 통한 백신 안전성 근거 생성 및 기반 마련 | 신주영 | 성균관대학교 | |
RNA 간섭 기작 기반 작물 감염 바이러스/균 방제 기술 개발 | 신찬석 | 서울대학교 | |
수면무호흡 질환의 유형에 따른 정밀의료를 위한 첫걸음 | 양형채 | 전남대학교 | |
멸종위기 용다시마의 복원 및 양식기술 개발 | 유현일 | 국립수산과학원 | |
세계 최초 “면역 증강용 구제역 백신 플랫폼” 개발하여 수입 구제역 백신 대체와 타 동물감염병 활용 | 이민자 | 농림축산검역본부 | |
식품산업의 반도체 ‘김’의 안정적 생산 기반 확보를 위한 질병 진단법 및 치료제 개발 | 이순정 | 국립수산물품질관리원 | |
심근허혈 정밀진단을 위한 차세대 심자도 시스템 기술 개발 및 기술이전 | 이용호 | 한국표준과학연구원 | |
암 환자의 생존율을 높일 수 있는 혁신적인 맞춤의료 플랫폼 개발 | 이주상 | 성균관대학교 | |
새로운 뇌종양 면역반응 기전 규명을 통한 면역항암 세포치료법 제시 | 이흥규 | 한국과학기술원 | |
차세대 면역세포치료 타깃 유도 자연살해세포 플랫폼 기술 개발 | 조이숙 | 한국생명공학연구원 | |
NK세포치료제 원천기술개발 및 기술이전 | 최인표 | 한국생명공학연구원 | |
바이오 미래유망기술 |
코로나19 팬데믹을 거치면서 생명과학 및 바이오기술은 인류 보편의 건강과 복지를 위한 중요성을 넘어 산업, 안보, 통상 및 공급망 관점에서 국가 생존 차원의 전략으로서의 중요성이 증가하였다. 이를 반영하듯 미국은 국가 바이오기술 및 바이오제조 이니셔티브(National Biotechnology and Biomanufacturing Initiative) 개시를 위한 행정명령 서명을 통해 자국의 이익 장벽을 높여가는 상황이다. 이는 미국이 바이오기술과 같은 필수 산업에 대해 외국의 재료와 생산에 너무 많이 의존해 왔다는 문제의식에서 출발하였다.
이렇듯 미국 등 주요국의 자국 우선주의가 팽배해지는 환경 속에서 만약 우리 고유의 바이오 혁신기술이 없다면 다른 나라의 정책과 전략에 좌지우지되는 상황이 발생할 수 있으며, 이에 대응하기 위해 바이오 혁신기술 확보가 그 어느 때보다 중요하다. 여기서 바이오 혁신기술이란 누구보다 먼저(원천, 파괴형) 개발하거나 다양하게 확장・응용(플랫폼, 통합형)할 수 있는 기술로, 혁신기술은 많은 경우에 원천성과 플랫폼 성격에 모두 해당한다.
따라서 선제적인 바이오 미래유망기술 발굴 연구를 통하여 자국의 기술 장벽을 높여가는 글로벌 환경에서 우리가 확보해야 할 혁신기술을 지속적으로 발굴하고자 한다.
바이오 미래유망기술은 생명현상 연구(생명과학)를 기반으로 향후 5∼10년 이내에 기술적 또는 산업적 실현이 가능하고, 향후 기술적 혁신성, 산업적 혁신성에 대한 파급효과가 높게 전망되는 기술(과학, 현상, 개념 포함)로 정의된다.
- (바이오) 생명현상 연구(생명과학)를 기반으로 과학적 지식의 발견을 촉진, 문제해결 또는 유용제품 생산에 활용할 수 있는,
- (미래) 향후 5∼10년 이내에 기술적 또는 산업적 실현이 가능하고,
- (유망기술) 기술적 혁신성, 산업적 혁신성에 대한 파급효과가 높은 기술
[표] 미래유망기술 파급효과 정의
구분 | 정의 |
기술적 혁신성 | 관련 분야의 기술발전을 혁신하거나 기술적 문제해결에 영향력 발휘 |
산업적 혁신성 | 관련 분야의 산업발전을 혁신하거나 광범위한 경제적 영향력 발휘 |
바이오 미래유망기술 발굴 연구결과는 일반인, 연구자, 정책입안자 관점에서 다양하게 활용 가능할 것으로 기대된다. 또한, 유튜브 동영상 제작 등을 통해 보다 이해하기 편안한 형태로 연구결과를 전달하고자 하며, 심도 있는 전문가 원고를 통해 연구계획서 작성 및 동향 파악에 도움이 될 수 있도록 할 예정이다. 더 나아가 정책적 관점에서는 바이오 R&D 방향 설정 및 전략 수립에 참고할 수 있는 형태로 보완해나갈 계획이다.
바이오 미래유망기술 발굴을 위한 추진 단계 모식도 |

2022년 10대 바이오미래유망기술!!! |

분야 | 이미지 | 주요 내용 | |
플랫폼 바이오 Platform Bio 기초・기반, 플랫폼 생명과학 |
|
• 역동적인 세포 내 현상을 3차원으로 정밀하게 관찰하는 동시에 특정 유전자의 서열을 분석하여 발현량과 위치를 파악하는 기술 • 세포 본연의 형태를 유지한 체 단일세포 수준의 시・공간적 생체분자정보를 제공하여 미지의 생명현상 규명에 활용 | |
|
• 생명체의 전체 게놈 또는 게놈 수준의 대형 DNA를 설계하고, 이를 정확하면서도 신속하게, 대량으로 합성하는 기술 • 의약물질이나 에너지, 소재 생산을 위한 고효율 균주 연구를 가속화 할 수 있고 나아가 건강, 환경, 우주 등의 분야에서 현재 인류가 직면한 기술적 한계를 극복하는 데에 기여 | ||
|
• 유전자편집 도구를 활용하여 후성유전학적 변이를 선택적으로 제어함 으로써 생물체의 기능을 연구하고, 분석하는 기술 • DNA의 절단이나 서열 변화를 일으키지 않아 후대 영향 없이 유전자 발현을 조절함으로써 보다 안전한 유전체 편집이 가능 | ||
레드 바이오 Red Bio 의약품 등 보건의료 |
|
• 의료용 대마 등 정신활성 물질의 유용성분을 기반으로 신경정신질환을 치료하는 의약품 개발과 관련된 기술 • 코로나19 팬데믹으로 사회적 부담이 더욱 가중되고 있는 우울증, 불안, 외상후스트레스장애, 중독, 뇌전증 등 만성・난치성 신경정신질환 극복에 기여 | |
|
• mRNA 기반의 칵테일 백신, 범용 백신, 신규 모달리티를 적용한 백신 등 다양한 병원체에 대한 감염을 방어하는 기술 • 다양한 병원체와 변이 바이러스에 신속하게 대응하여 효과적으로 감염병을 제어하고 더불어 항암과 희귀질환 예방에도 활용 | ||
|
• 세포 소기관인 소포체, 다양한 세포 유래 엑소좀을 활용하여 약물을 목적 세포까지 정확하고 효율적으로 전달하는 기술 • 기존의 리포좀 등 인공적 합성이 아닌 생체 유래 물질 특성상 면역원성이 낮아 안전하고, 세포 표적화가 용이하여 약물 전달체로서 유망 | ||
그린 바이오 Green Bio 식품, 종자 등 바이오농업 |
|
• 인간 줄기세포를 동물에 넣어 이식 및 치료 목적으로 인간의 조직이나 장기, 기관을 동물에서 생산하는 기술 • 면역거부 반응이 최소화된 범용 / 맞춤형 이식용 장기를 확보하여 환자에게 제공함으로써 장기수급 불균형 해소 및 난치질환 치료 가능성 제고 | |
|
• 식물의 광합성을 담당하는 기구의 기능을 개선하여 광합성 효율이 향상된 작물 등을 제작하는 기술 • 다양한 식물 종에 도입할 수 있는 범용성을 기반으로 식물이 확보할 수 있는 에너지의 총량을 증가시켜 식량 및 바이오소재 생산 효율을 크게 향상 | ||
화이트 바이오 White Bio 에너지, 소재 등 바이오화학 |
|
• 생분해성 키토산 등으로 이루어진 친환경 나노 입자로 미세 플라스틱, 섬유, 하이드로겔 등 자연에서 분해되지 않는 물질을 대체할 수 있는 중합체 합성 기술 • 지구상에 풍부하게 존재하는 바이오매스 기반의 친환경 소재를 활용하여 환경오염 및 인체 유해성 문제해결에 기여 | |
|
• 박테리아, 나방 등에서 분리해낸 환경오염물질 분해효소를 지닌 마이크로바이옴을 활용하여 플라스틱, 비닐 등 환경오염 물질을 분해하는 기술 • 유기체를 이용하여 플라스틱을 비롯한 난분해성 환경오염 물질을 분해하기 때문에 분해 과정에서 유해 물질이 발생하지 않아 친환경적이며, 안전한 환경 조성 가능 |
2023년 10대 바이오미래유망기술 |

분야 | 이미지 | 주요 내용 | |
플랫폼 바이오 Platform Bio 기초・기반, 플랫폼 생명과학 |
|
• 다양한 면역세포의 기능을 실시간으로 관찰하는 동시에 관련 유전자의 발현을 분석 • 복잡한 면역반응과 질환별 면역세포의 다양한 기능을 분석하여 인체 면역 원리에 대한 이해를 높이고, 이를 통해 효과적인 치료제 개발에 활용 | |
|
• AI 기술을 활용하여 자연계에는 존재하지 않지만 유용한 기능을 보유한 인공 단백질을 설계 • 실험적 접근 방식으로는 불가능했던 단백질을 인공적으로 설계하여 기존 단백질의 단점을 보완하고, 생산과 유통에 있어 획기적인 장점을 제공 | ||
|
• 세포 리프로그래밍 등을 통해 세포의 건강을 유지하고, 세포의 재생 능력을 복원 • 세포 노화에 의해 발생하는 각종 퇴행성 질환을 근본적으로 치료할 수 있을 뿐만 아니라 건강수명 연장 및 노년 삶의 질을 향상 | ||
레드 바이오 Red Bio 의약품 등 보건의료 |
|
• 암환자별 특이적 항원에 대한 데이터 분석을 통해 개발된 다양한 형태(DNA, RNA, 펩타이드 등)의 암백신 • 종양 항원에 대한 방대한 데이터로 암백신 라이브러리를 구축할 수 있으며, 이를 통해 치료용 암백신 및 예방용 암백신을 신속하게 개발하는 데 활용 | |
|
• 빠르게 진전되고 있는 유전자편집기술을 환자 치료 등 임상에 적용하기 위한 고도화 기술 • 높은 유전자 편집 효율성과 안전성을 기반으로 유전자 돌연변이 등 다양한 희귀, 난치질환에 대한 임상적인 치료 가능성을 제고 | ||
|
• 인지기능 저하 등 뇌기능 문제를 부작용과 거부감 없이 회복, 향상시키는 새로운 접근방법 • 비약물의 국소 신경망 자극을 통해 부작용과 거부감이 적고, 개인의 돌봄 접근성을 높임으로써 팬데믹 이후 증가 추세인 정신건강 문제해결에 기여 | ||
그린 바이오 Green Bio 식품, 종자 등 바이오농업 |
|
• 기후변화, 팬데믹 대응을 위해 동물세포 배양, 식물 유래 단백질 등을 통해 친환경, 고기능성 대체육류를 생산 • 축산업에 요구되는 자원과 공간, 온실가스 배출을 크게 감축하여 환경을 보호하며, 미래 식량 문제해결에 기여 | |
|
• 생물지각 내 마이크로바이옴을 파악하고, 개발하여 건강한 토양 생태계를 유지 • 탄소, 질소 등의 생물지구화학적 순환과 토양 내 영양수준을 유지하여 토양 안정성, 동식물 보존 등 건강한 토양 생태계 보존 및 복원에 기여 | ||
화이트 바이오 White Bio 에너지, 소재 등 바이오화학 |
|
• 합성생물학에 의해 재설계된 생합성 경로를 미생물에 구현 하여 천연물질, 화학합성 대체물질 및 유용 단백질을 생산 • 자연계에 존재하는 미생물에 비해 목표물질 생산 효율이 높으며, 다수의 대사반응 조합으로 복잡한 물질도 생산할 수 있어 바이오제조 역량 구축에 기여 | |
|
• 미세플라스틱이 생체에 미치는 영향을 모니터링하고, 장기별 독성, 유해성 검증을 통해 건강에 미치는 영향을 평가 • 환경 유해인자로 심각성이 새롭게 대두되고 있는 미세플라스틱의 체내 유입량과 잠재적인 영향에 대한 평가를 통해 환경 및 건강 관리방안 마련에 활용 |


특집 제1장 ‘디지털바이오’의 트렌드 변화 및 발전 전망 |
제1절 디지털바이오의 역사와 전망 |
가. 디지털 대전환의 시대
(1) ‘디지털바이오’의 정의
코로나 이후 전 세계는 사회, 경제, 문화 등 모든 분야에서 변혁을 겪고 있다. 특히 국내에서는 2020년 도입된 디지털 뉴딜 정책과 함께 디지털 대전환이 새로운 흐름으로 대두되었다. 바이오 분야에서도 ‘디지털바이오’가 주목받는 키워드로 급부상하였다. 2000년대 들어서면서 디지털바이오에 대한 다양한 논의가 시작되었으며, 넓은 의미에서 디지털바이오는 디지털 기술을 사용하여 생물학을 이해하고, 조작하고, 활용하는 광범위한 범위를 포함하고 있다. 최근 디지털 기술의 급격한 발전으로 인해 디지털바이오 역시 변혁을 겪고 있다.
[표 특집 1-1] 디지털바이오와 연관된 정의의 발전사
용어 | 정의 | 배경 |
Digital biology | Digital biology의 새로운 분야를 정의하는 세 가지 주요 영역은 과학 데이터 통합, 다중 규모 모델링, 네트워크 과학 | 2003년 NIH 심포지엄 |
Digital Bioconverter | 전자 디지털 정보를 DNA를 통해 생물학적 영역으로 전달 | 2005년 생명공학과 생물 의학 저널 |
Digital biology | 분자와 세포 단위의 과정을 정량화하는 실험적 기술과 데이터 통합 컴퓨팅 기술의 조합 통한 새로운 방식으로의 진보 | 2017년 유럽분자생물학 연구소 (EMBL) |
Biodigital Convergence | 디지털기술과 바이오 기술 및 생물학적 시스템의 상호작용적 결합의 조합 통한 새로운 방식으로의 진보 | 2019년 Policy Horizons Canada |
Bio- Convergence | 생명과학의 발전과 공학, 컴퓨팅, 자동화, 인공지능(AI)의 가속화된 발전을 통한 바이오융합 혁신 | 2020년 이스라엘 혁신청 |
출처: 국가생명공학정책연구센터
(2) 디지털바이오의 역사
바이오와 디지털의 만남은 사실 오래된 역사를 가지고 있다. 컴퓨팅 장치 및 소프트웨어의 발전은 생물학적 데이터를 생성, 처리 및 분석하는 데 중요한 역할을 해왔다. 이러한 디지털 기술은 유전자 코드의 복잡성을 밝혀내는 것부터 복잡한 생물학적 시스템을 모델링하는 것까지 생물학 연구에서 중요한 돌파구를 마련할 수 있게 해주었다. 그 결과로 계산적 방법을 사용해 생물학적 데이터 분석하는 생물정보학, 수학적 모델을 사용하여 생물학적 시스템을 이해하는 계산생물학, 생물학적 시스템 내의 복잡한 상호작용 연구하는 시스템생물학, 새로운 생물학적 시스템을 설계 및 구성하는 합성생물학 등 다양한 학문 분야를 낳았다. 이후 레드 바이오, 그린 바이오, 화이트 바이오 전 분야에서 디지털 기반 의약개발, 농업 및 축산업, 에너지 및 소재 등의 혁신을 촉발하였다.
또한 역으로 바이오 산업이 창출한 니즈는 디지털 기술의 혁신을 유도하였다. 생물학적 데이터의 복잡성과 방대한 규모 때문에 데이터 저장, 처리, 분석에 대한 새로운 접근 방식이 필요해졌고, 빅데이터 기술, 클라우드 컴퓨팅, 인공 지능, 머신러닝의 발전을 이끌었다. 이처럼 바이오와 디지털 기술의 상호 작용은 서로의 분야에서 상당한 발전을 가져왔으며, 기술이 계속 발전함에 따라 끊임없이 진화하고 있다. 이러한 흐름 속에서 대규모 바이오 빅데이터의 생산, 그리고 이를 바탕으로 바이오 모델 수립 및 시뮬레이션이라는 두 측면으로 나누어 ‘바이오의 디지털화’의 변천사를 살펴보고자 한다.
나. 디지털바이오의 역사
(1) 바이오 빅데이터 생산
생물정보학이라는 용어는 1970년대에 처음 만들어졌으며, 1980년대에 DNA 시퀀싱 방법이 개발되면서 구체화되기 시작했다. 이후 시퀀스 데이터를 관리하고 분석해야 할 필요성으로 인해 전문 생물정보학 데이터베이스와 소프트웨어가 만들어졌다. 그 당시 설립된 뉴클레오티드 서열을 저장하기 위한 GenBank, 대형 생체 분자의 3D 구조 데이터를 저장하기 위한 PDB(Protein Data Bank)는 지금까지도 활용되고 있다.
이후 1990년에 시작된 인간 게놈 프로젝트 HGP(Human Genome Project)는 바이오 빅데이터 시대의 진정한 시작을 알리는 획기적인 사건이었다. 전체 인간 게놈을 매핑하기 위한 이 프로젝트는 방대한 양의 데이터를 생성했으며, 데이터 관리 및 분석을 위한 새로운 알고리즘과 데이터베이스가 개발되었고, 바이오의 디지털화를 더욱 촉진했다. 2000년 이후 인간 중심의 데이터와 기술 두 가지 측면으로 나누어 발전사를 살펴보겠다.
[표 특집 1-2] 바이오의 디지털화 발전사(2000년 이후)
구분 | 연도 | 사건 | 설명 | 주관기관 및 국가 |
데이터 | 2000 | 인간 게놈 초안 공개 | 인간 게놈 프로젝트의 결과물로 그 초안이 발표됨 | 국제 인간 게놈 서열 컨소시엄 |
데이터 | 2001 | UCSC Genome 브라우저 출범 | 주석이 달린 게놈 서열의 시각적 탐색과 해석을 용이하게 할 수 있는 인터페이스를 제공함 | 미국 캘리포니아 산타크루즈 대학교 |
데이터 | 2002 | HGP (Human Genome Project) 완료 | 최초로 인간 게놈의 완전한 서열을 Nature 및 Science 저널에 발표. 이후 프로젝트가 공식적으로 완료되며 99.99%의 정확도로 인간 게놈의 99%를 시퀀싱함 | 국제 인간 게놈 서열 컨소시엄, 셀레라 지노믹스 |
데이터 | 2003 | ENCODE (Encyclopedia of DNA Elements) 프로젝트 출범 | 인간 게놈의 모든 기능적 요소를 식별하는 것을 목표로 포스트 게놈 프로젝트가 시작됨 | 미국 국립인간게놈연구소 |
데이터 | 2004 | 인간 마이크로바이옴 프로젝트 출범 | 인간의 건강과 질병에서 미생물의 역할을 이해하기 위해 휴먼 마이크로바이옴 프로젝트가 시작됨 | 미국 국립보건원 |
데이터 | 2005 | HPA (Human Protein Atlas) 공개 | 다양한 오믹스 기술을 통합하여 세포, 조직, 기관의 모든 인간 단백질을 체계적으로 매핑하는 것을 목표로 하는 프로젝트 첫 번째 버전이 공개됨 | 스웨덴 |
기술 | 2006 | 차세대 시퀀싱 기술 NGS (Next Generation Sequencing) 도입 | 대량의 병렬 데이터 생산으로 유전체의 염기서열을 고속으로 시퀀싱하는 기술을 통해 데이터 생산 규모가 크게 증가함 | - |
데이터 | 2007 | 1000 게놈 프로젝트 시작 | 인간 유전자 변이에 대한 가장 상세한 카탈로그를 구축하기 위해 많은 사람들의 게놈을 시퀀싱하여 인간 유전자 변이에 대한 상세한 자원을 만드는 것을 목표로 함 | 영국, 미국, 중국 |
데이터 | 2007 | Human Microbiome Project (HMP) 프로젝트 시작 | 인체의 여러 부위에서 발견되는 미생물 군집의 다양성을 밝히고, 질병과 마이크로바이옴 사이의 관계를 구축하는 것을 목표로 함 | 미국 국립보건원 |
기술 | 2008 | ChIP-Seq | 단백질과 DNA의 상호작용을 분석하는 방법인 ChIP-Seq이 개발되어 널리 활용됨 | - |
데이터 | 2010 | GTEx (Genotype-Tissue Expression) 프로젝트 출범 | 인간 조직별 유전자 발현과 조절을 연구하고, 유전자 변이와 유전자 발현의 관계를 분석할 수 있는 공공 리소스 구축을 목표로 시작됨 | 미국 국립보건원(NIH) |
데이터 | 2012 | ENCODE 프로젝트 주요 결과 발표 | 인간 게놈의 약 80%를 차지하는 400만 개의 유전자 조절 영역을 확인함 | 미국 스탠포드 대학교 |
데이터 | 2013 | The Cancer Genome Atlas (TCGA) 공개 | 33가지 유형의 암 환자에 대한 게놈, 후성유전체, 전사체 및 단백질체 데이터를 공개함 | 미국 국립암연구소, 국립인간게놈연구소 |
기술 | 2014 | 단일 세포 시퀀싱의 등장 | 연구자들이 개별 세포의 DNA 또는 RNA를 시퀀싱 할 수 있는 기술이 등장함 | - |
기술 | 2015 | 딥러닝 적용 | 의료 데이터에 딥러닝을 적용하여 생물학 및 의학 분야에서 AI의 잠재력을 보여줌 | - |
데이터 | 2016 | Human Cell Atlas Project 시작 | 단일 세포 시퀀싱 기술을 기반으로 모든 인간 세포에 대한 포괄적인 표준 지도를 만드는 것을 목표로 시작됨 | 다국적 조직위원회 |
기술 | 2017 | 3D 게놈 매핑 기술 | Hi-C와 같은 기술을 통해 게놈을 3D로 매핑하여 DNA가 핵 내에서 어떻게 접히는지 보여줄 수 있게됨 | - |
기술 | 2018 | 알파폴드 개발 | 아미노산 서열을 기반으로 단백질의 3D 구조를 예측하는 AI 시스템인 AlphaFold를 개발함 | 구글 딥마인드 |
기술 | 2019 | 고처리량 공간 전사체학의 등장 | 공간 해상도로 조직의 유전자 발현을 고처리량으로 측정할 수 있는 기술이 등장함 | - |
데이터 | 2020 | GTEx (Genotype-Tissue Expression) 프로젝트 완료 | 1,000명의 기증자로부터 54개의 조직 부위를 분석한다는 목표를 달성함 | 브로드연구소 |
기술 | 2021 | 알파폴드 2 개발 | 단백질 구조 예측에 대한 획기적인 발전 | 구글 딥마인드 |
출처: 저자 작성
(2) 바이오 모델 시뮬레이션
디지털 기술을 활용한 바이오 모델 연구는 컴퓨터의 등장과 함께 본격적으로 시작되었다. 1950년대와 60년대에는 초기 메인프레임 컴퓨터가 인구 유전학 및 생태 모델링에 필요한 계산을 수행하는 데 사용되었으며, 이것이 계산생물학의 시작이었다. 이후 생물학적 시스템의 물리적/화학적 특성을 고려하여 세포 및 분자 수준에서 바이오 모델을 수립하였고, 이에 관한 시뮬레이션 연구가 이루어졌다. 예를 들어, 뉴런에서 활동 전위를 생성하는 데 관여하는 전기적 과정, 세포 신호 경로의 복잡성, 심장 내 혈액 순환의 변동 등을 설명하기 위해 모델들이 개발되었다.
2000년대에는 복잡한 생물학적 시스템의 개별적인 부분만 따로 연구하는 것이 아니라, 전체 유기체 수준에서 모델링하는 것을 목표로 하는 시스템생물학이 등장했다. 이 분야에서는 유전자, 단백질, 세포, 조직, 장기, 유기체, 심지어 개체군까지 포함하는 생물학적 시스템을 통합하여 이해하기 위해 전체론적 접근 방식을 사용한다. 이를 위해 생물학적 시스템의 상호작용으로 인해 발생하는 동역학을 포착하여, 다양한 조건에서 시스템 동작을 예측할 수 있는 시뮬레이션을 수행하였다. 지금까지 디지털 기술을 활용해 바이오 모델을 구축한 대규모 프로젝트들을 살펴보겠다.
[표 특집 1-3] 디지털 기술을 활용하여 바이오 모델을 구축한 대규모 프로젝트
프로젝트 | 설명 |
Physiome Project | 1997년 IUPS(International Union of Physiological Sciences)에서 출발한 이 프로젝트는 온전한 유기체의 생리학적 동역학 및 기능적 행동을 설명해내기 위해 시작되었다. 컴퓨터 모델을 사용하여 분자 및 세포 수준에서 전체 유기체에 이르기까지 여러 규모의 시간과 공간에 걸쳐 있는 생물학적 시스템의 통합 모델을 개발하는 것이 목표다. CellML 및 FieldML과 같은 생물학적 모델링용 마크업 언어를 개발했으며, 개발된 모델을 공유하고 협업할 수 있는 온라인 데이터베이스인 PMR(Physiome Model Repository)을 구축했다. 또한 모델을 생성, 조작, 시뮬레이션하기 위한 OpenCell 등 소프트웨어 도구의 개발도 촉진했다. |
VPH (Virtual Physiological Human) 이니셔티브 | Physiome Project에서 영감을 받아 인간 생리학 및 병리학의 통합 모델 개발을 통한 가상 인간 구현에 중점을 두고 2007년에 시작되었다. 2009년에는 VPH 관련 프로젝트에 참여하는 연구자들을 위한 통합 커뮤니티를 제공하기 위해, 비영리조직인 연구소가 공식적으로 설립되었다. VPH는 가상 인간을 활용하여 예측 가능한 in silico 의학을 발전시키는 데 중점을 두고 있다. 질병 예방, 진단, 예후 평가, 치료 등 모든 측면에서 생리학 기반 개인화된 환자별 컴퓨터 모델의 시뮬레이션을 활용하는 것이 목표이다. |
Living Heart Project | 2014년에 시작된 Dassault Systèmes가 주도하는 연구 이니셔티브로, 개인화된 인간 심장의 3D 모델을 개발하는 것을 목표로 한다. 이를 위해 3D-EXPERIENCE 플랫폼과 SIMULIA 애플리케이션을 사용하여 인간 심장의 해부학적 구조와 생리학적 기능을 포괄적이고 정확하게 표현하고자 한다. 3D 모델은 심장의 전기 전도, 혈류, 심근 운동을 시뮬레이션하여 활동 중인 심장의 동역학을 나타낸다. 최종 목표는 동물 실험이나 임상 실험을 대체하는 디지털 심장을 개발하고, 환자별 모델 시뮬레이션으로 질병 진행 예측 및 최상의 치료 옵션 결정에 도움을 주는 것이다. |
Virtual Liver Project | 2010년부터 2019년까지 독일 연방 교육 연구부(BMBF)가 지원한 대규모 과학 이니셔티브였다. 이 프로젝트는 시스템생물학, 생물정보학, 이미징 기술, 분자 생물학, 임상 의학 등 여러 분야의 약 70개 연구 그룹을 모았다. 간과 관련된 수많은 데이터를 통합하고 새로운 계산 모델을 개발함으로써 대사, 재생, 약물에 대한 반응과 같은 간 기능의 다양한 측면을 시뮬레이션하고자 했다. 이를 위해 여러 간 기능에 대한 수학적 모델 개발, 데이터 통합을 위한 플랫폼 생성, 간 질환 분야에서 수많은 과학 논문 출판 등의 성과를 도출하였다. |
Blue Brain Project | 2005년 스위스의 EPFL의 Brain and Mind Institute에서 시작되었으며. 쥐의 뇌조직 연구에서 출발하여 궁극적으로는 인간 두뇌의 디지털 재구성 및 시뮬레이션을 목표로 한다. 뉴런 사이 신경 회로의 상세한 모델로부터 bottom-up 접근을 사용하며, 시냅스의 물리적 및 화학적 특성과 방대한 네트워크 연결망 데이터를 기반으로 구성되었다. 2015년 CELL 저널에 발표된 연구에서는 쥐 신피질 조각을 디지털 재구성하여, 밀리미터 단위에서 공각적으로 측정된 전기적 활동을 시뮬레이션했다. |
Human Brain Project | 2013년 유럽연합 집행위원회(European Commission)에서 시작한 대규모 프로젝트로, 슈퍼컴퓨터에서 완전한 인간 두뇌를 시뮬레이션하는 것을 목표로 한다. 크게 신경정보학, 뇌 시뮬레이션, 고성능 컴퓨팅, 의료 정보학, 신경모형 컴퓨팅, 신경 로보틱스 전용 정보 통신 기술 플랫폼, 이 6가지 분야로 구성되어 있다. 유전자에서 인지에 이르기까지, 그리고 생물학적 조직의 모든 수준에서 뇌에 대한 데이터와 지식을 통합하는 뇌의 멀티스케일 모델을 개발하는 것이다. 또한 모델 시뮬레이션에서 얻은 통찰력을 사용하여 의학 및 컴퓨팅과 같은 분야에서 새로운 기술과 솔루션을 개발하고자 한다. |
출처: 저자 작성
다. 디지털바이오의 변화
(1) 디지털 기술과 바이오의 다양한 만남
최근 디지털 기술의 급속한 발전은 바이오 분야를 변화시키며 전례 없는 기회를 창출하고 있다. 이러한 융합은 과거에 제약이 있었거나 현실화할 수 없었던 새로운 학제 간 분야를 탄생시키고 있다. 다음은 바이오 분야의 지형을 재편하고 있는 디지털 기술과의 새로운 교차점들이다.
① 바이오파운드리
합성생물학 분야에서 AI, 빅데이터, 로봇공학 등을 활용한 혁신적인 접근 방식으로, 바이오 제조공정의 설계-구축-테스트-학습 DBTL(Design-Build-Test-Learn) 사이클을 위한 자동화된 고 처리량 프로세스를 제공한다. 이러한 방법으로 바이오 설계의 속도를 가속화하고 치료제, 재료 과학, 농업, 바이오 연료 등 다양한 분야에 기여한다. DNA 조립, 변형, 스크리닝과 같은 다양한 작업을 수동으로 수행할 수 있는 것보다 훨씬 더 큰 규모와 빠른 속도로 수행하는 데 사용된다. 또한 연구자가 원격으로 실험을 설계하고 중앙 시설에서 로봇이 이를 수행하는 클라우드 랩이 등장하여, 고가의 자동화 장비를 활용하는 가상 실험실 환경을 광범위하게 이용할 수 있다.
② 디지털 치료제(DTx)
디지털 기술을 기반으로 하는 질병을 예방, 관리, 치료하는 새로운 범주의 의학이다. 소프트웨어 기반 솔루션을 통해 사용자의 건강 데이터를 확보하고, 개인화된 인지 행동 치료, 라이프스타일 개선, 심리적 상태 개입 등의 치료적 개입을 하게 된다. 이러한 플랫폼은 원격 환자 모니터링 및 관리, 정신 건강 지원을 가능하게 하였으며, 기존 치료법과 병용하여 환자 치료를 최적화하고 건강을 개선할 수 있다. 특히 우울증, 불안, 불면증과 같은 행동 건강 상태에 대한 디지털 치료법의 중요성이 점점 더 강조되고 있다. 또한 가상 현실(VR) 기술이 접목되어 대상 질환 및 가능한 치료 방법이 폭넓게 확대되고 있다.
③ 바이오닉스
생체 모방학이라고도 하는 바이오닉스는 생물학적 시스템에서 영감을 얻어 자연 기능을 복제하는 인공 시스템을 설계하고 엔지니어링하는 다학제적 분야다. 뇌-기계 인터페이스 BMI(Brain Machine Interface), 보철 및 신경계와 상호 작용하는 기기들에 디지털 기술을 접목해 이러한 장치와 생물학적 시스템 간의 복잡한 신호를 처리하고 해석하는 능력이 크게 향상되었다. 특히 인공 지능과 머신러닝 기술을 활용한 혁신을 통해 방대한 생물학적 데이터 세트를 분석하고, 뇌의 신경망과 같은 복잡한 시스템의 기능을 모방하는 알고리즘을 개발하는 데 적용되고 있다. 또한 바이오프린팅 기술이 발전하여, 디지털 설계와 컴퓨터 제어를 사용하여 세포 및 생물학적 물질을 층층이 쌓아 조직이나 장기와 같은 복잡한 3D 구조를 만들 수 있다.
④ 디지털 트윈
생물학적 시스템의 가상 모델인 디지털 트윈은 세포, 조직, 기관 수준에서부터 살아있는 개체 전체 시스템 또는 프로세스의 디지털 복제본으로, 생물학적 시스템의 물리적 및 화학적 동작을 실시간으로 모방하도록 설계된다. 이러한 모델을 만들려면 유전체학, 단백질체학, 대사체학을 포괄하는 멀티 오믹스 빅데이터와 수학적 모델 및 머신러닝 알고리즘이 복잡하게 결합되어야 한다. 이러한 정보와 기술의 융합을 통해 생물학적 시스템을 가상으로 모니터링하고, 변화나 이상을 감지하고, 실시간으로 최적화하는 데 사용할 수 있다. 예를 들어, 디지털 트윈을 사용하여 개별 세포, 조직 또는 기관의 동작을 시뮬레이션하고 다양한 약물이나 치료에 어떻게 반응할지 예측할 수 있다. 또한 질병의 진행을 모델링하고 환자 개개인의 유전적 구성 및 기타 요인에 따라 고유한 생물학적 반응에 맞춘 치료법을 제공할 수 있다.
⑤ 디지털 농업
농업의 전 과정에 걸쳐 첨단 디지털 신기술을 활용하는 그린 바이오 분야를 말한다. 적재적소에 물, 비료, 농약 등 필요한 요소를 필요한 만큼만 적시에 사용함으로써 생산성과 환경 부담을 줄이는 정밀농업, 첨단 ICT 기술과 인프라를 접목해 농작업의 생산성과 효율성을 높이는 스마트팜, 그리고 지능형 네트워크와 데이터 관리 도구가 결합된 스마트 농기계 기술이 활용된다. 또한 생산/유통/소비 단계별 농업 빅데이터를 수집 및 통합하는 정보시스템, 인공지능 기반 유망 작목 발굴 및 추천 시스템, 농생명분야 컴퓨팅 기술이 포함된다. 이를 통해 농식품의 생산성을 높이고, 농업 분야의 새로운 부가가치를 창출하고, 환경 부담을 줄이고 안전성을 확보하는 등 지속가능성을 확보할 수 있다.
(2) 바이오의 디지털화 향후 전망
앞으로 바이오의 디지털화는 빠른 속도로 변화할 것이다. 데이터 생산 측면에서 단일 세포 시퀀싱과 공간 전사체학 같은 새로운 기술로 인해 더욱 복잡하고 풍부한 정보가 축적되고 있다. 데이터 분석 측면에서 AI와 머신러닝의 발전으로 이러한 데이터를 해석하는 더욱 강력한 도구가 제공되고 있다. 시뮬레이션 측면에서 양자 컴퓨팅과 같은 기술의 발전으로 더욱 현실적인 표현이 가능해지고 있다. 조작 측면에서 실시간으로 개인의 상태를 모니터링하고 중재 방식을 전달하는 기술이 상용화되고 있다. 이러한 모습은 갈수록 진화하고 있으며, 바이오의 미래는 점점 더 디지털 중심이 될 것이다.
결론적으로 바이오의 디지털화는 역동적이고 지속적인 과정이다. 새로운 기술이 등장하고 생물학에 대한 이해가 깊어짐에 따라 생물학에서 디지털 기술의 역할은 계속 성장하고 서로 지대한 영향을 미치며 공동 진화할 것이다.
특집 제1장 ‘디지털바이오’의 트렌드 변화 및 발전 전망 |
제2절 디지털바이오의 주요 정책 동향 |
가. 디지털바이오의 개념
(1) 디지털바이오란
디지털바이오는 빅데이터, 인공지능(Artificial Intelligence, AI), 사물인터넷(Internet of Things, IoT), 클라우드 컴퓨팅 등 디지털 기술과 바이오기술이 융합된 새로운 바이오기술 및 산업 분야로, 디지털 기술을 사용하여 복잡한 생물학적 기능을 이해하고, 인류가 당면한 과제인 노화와 질병을 진단하고 치료하는 기회를 제공하는 바이오-ICT 융합 분야이다. 디지털바이오는 2000년대 초반 컴퓨터 기술, 통신 기술, 생명공학 기술의 융합을 통해 발전한 생명정보학 및 시스템생물학의 완성된 개념이라 할 수 있다. 정보통신(ICT)기술의 발전은 데이터의 수집, 분석, 관리 및 시각화 등을 효율적으로 향상시켰고, 바이오 난제 해결을 위한 데이터 기반 디지털바이오 데이터 공유와 협업을 가능하게 하였다. 특히 생명공학 기술의 발전과 함께 바이오산업의 디지털화가 진행되면서 향후 바이오산업의 생산성 향상, 신약 개발의 가속화, 맞춤형 의료의 실현 등 기존 산업의 혁신과 새로운 산업의 창출을 이끌 수 있을 것으로 기대되고 있다.
디지털바이오는 생명공학, 의약품, 의료기기, 농수산업, 식품, 환경 등의 다양한 분야에서 융합될 수 있으며, 최근 AI를 이용해 단백질 구조를 설계해 신약을 개발하거나, 실제 실험실 대신 디지털 공간에서 바이오기술을 개발하는 디지털 트윈(Digital Twin)이 디지털바이오의 대표적인 예시이다. 약물 개발 프로세스 또한 디지털 전환이 이루어지고 있으며, 디지털바이오마커를 활용한 분산형 임상 시험(Decentralized clinical trial, DCT)을 가능케 해 신약 개발의 성공률을 높이고 있다. 이와 함께 혁신성장 분야로 주목받고 있는 합성생물학은 AI 및 로봇 기술로 자동화되는 바이오파운드리를 통해 고도로 성장하는 추세이다. 바이오파운드리란 합성생물학의 설계, 제작, 검증 및 학습 과정을 자동화하는 플랫폼으로 생물학 실험이나 제조・공정을 고속화 및 자동화할 수 있는 기반이다. 선진국을 중심으로 정부 주도의 합성생물학 센터와 바이오파운드리 인프라를 구축하는 데에 집중하고 있으며, 관련 제도와 정책을 수립하고 있다. 정부 차원의 디지털 플랫폼 구축 및 확산을 위해서는 데이터에 근거한 증거 기반(evidence-based) 정책 수립이 필수적이며, 주요 과학기술혁신(Science, Technology and Innovation, STI) 데이터를 통합한 견고한 디지털바이오 데이터 기반 연구생태계를 구축함으로써 더욱 넓은 분야에서 패러다임을 제시할 것으로 전망된다. 바이오 대전환을 선도하는 디지털바이오를 구현하기 위해서는 합성생물학에 대한 중장기 R&D 투자, 국가 주도의 바이오파운드리 구축, 관련 스타트업 지원, 제도 및 규제에 대한 모니터링 등이 필수적인 선결 과제로 여겨지고 있다.
바이오 빅데이터와 인공지능 기술을 결합한 디지털바이오 플랫폼은 다양한 분야에 적용되며 기술 혁신과 산업의 고도화를 이끌고 있다. 최첨단 생명공학 기술의 발전은 유전체 분석 분야에서 차세대 시퀀싱(Next-generation sequencing, NGS)의 개발에 혁신적인 영향을 미쳤으며, 이 기술로 인간의 유전체를 비용 효율적이고 효과적이며 대량으로 분석할 수 있게 되었다. 유전체 데이터를 기반으로 유전체 정보를 해독・해석하는 것은 개인의 유전적 기반을 이해하는 것뿐 아니라 유전적인 질병 위험 요소를 예측하고 조기 진단을 가능하게 할 수 있다. 바이오헬스 관련 연구 및 산업, 농업 및 해양수산업 등에서 유전체 관련 바이오 빅데이터의 중요성이 증가함에 따라 해외 주요국들은 30∼40년 전부터 바이오 데이터를 수집하여 활용성을 높이기 위해 노력하고 있으며, 바이오산업을 포함한 다양한 산업 분야의 기술 개발에 있어서 해외 주요국 데이터에 의존하는 바이오산업의 기반을 혁신하고 국가 경쟁력을 강화하는 등 데이터의 국산화 및 자립화를 위해 국가 차원에서 데이터 공공 인프라 구축을 활발히 진행하고 있다.
이에 따라 방대한 양의 유전체 데이터가 공공 및 민간 연구기관에 축적되고 있으며, 생산된 데이터는 범국가적으로 동기화되어 생물학 및 의학 연구에 광범위하게 사용되고 있다. 고성능 컴퓨팅 기술의 발전으로 데이터를 대규모로 관리하는 데 경제성이 더욱 높아지고 있으며, 이는 기계 학습, 인공지능 및 생물정보학의 발전과 함께 고품질 바이오 데이터 붐을 더욱 강화시키고 있다. 바이오 빅데이터를 활용할 수 있게 되면서 이러한 데이터세트를 기반으로 머신러닝/딥러닝 기술을 적용하면 실험실에서 모델 생물을 대상으로 유전적 변이의 기능을 해석하는 것보다도 더 효율적일 것으로 보고 있다. 나아가 질병의 원인이 되는 변이를 발견하고 타깃 치료제의 스크리닝도 가능하게 되었다. NGS 기술의 발달과 더불어 정보통신기술(ICT)과 인공지능 기술도 진화를 거듭하고 있는데, 유전체 정보, 바이오마커 및 생체 신호 등 다양한 생물학적 데이터를 대량으로 수집하고 인공지능과 기계 학습 기술을 활용하여 패턴 인식・예측 모델 구축 기술을 통해 질병 예측, 개인 맞춤형 진료, 약물 개발 등을 통해 디지털 헬스케어를 실현할 수 있다. 디지털바이오가 접목된 정밀 의학은 개인의 생체 신호를 실시간으로 모니터링하고 분석하여 개인 맞춤형 진료를 가능케 하며, 웨어러블 장치, 센서 등을 통해 개인 건강의 조기 진단, 질병 예방 및 치료 효과 모니터링에 활용할 수 있다. 디지털바이오산업은 생명과학과 디지털 기술의 융합을 통해 혁신적인 솔루션을 제공하며, 맞춤형 의료, 질병 진단 및 신약 개발 등 다양한 분야에서 사회적 가치를 창출할 것으로 예상된다.

출처: Chui, M. et al, The Bio Revolution, McKinsey Global Institute, 2020.5
[그림 특집 1-1] 염기서열 해독 분석기술의 발전
(2) 생명공학 분야의 디지털바이오
오믹스(Omics)는 주로 세포 내 생물학적 분자를 매핑하고 그들의 상호작용을 이해하는 다양한 연구들을 포괄하는 개념이며, 이 중에서 유전체학(Genomics)은 기술적으로 가장 발전한 분야이다. 2003년 완료된 인간 게놈 프로젝트(Human Genome Project)의 염기서열 중 20년간 해결되지 못한 상태로 남아있던 8%(약 2억 개)의 유전체 영역이 2022년 완전히 해독되었으며, 현재는 지구 바이오게놈 프로젝트(Earth BioGenome Project)가 2018년부터 시작되어 지구상의 모든 생물체에 대한 유전체 데이터를 활용하여 의약품 개발, 농작물 개량, 환경 보전 등 다양한 분야에 응용할 것을 목표로 하고 있다. 대규모 유전체 데이터 프로젝트는 자율로봇 기술을 활용한 표본 수집, DNA 시퀀싱 기술, 생물정보학, 자동화 및 인공지능 등의 최신 디지털 기술을 활용하여 유전체 정보의 개방형 디지털 저장소를 구축하는 것을 목표로 하고 있다. 이제는 단일세포(Single cell) 염기서열 분석까지 가능해져 더욱 세부적인 수준으로 정밀한 시퀀싱이 가능해지고 있다. 진핵생물 종의 게놈 자원을 총망라한 완전한 디지털도서관이 완성된다면, 의학, 수의학, 재생에너지, 농업, 환경 등 여러 산업에 미칠 잠재적 영향력이 막대할 것으로 예상된다.
DNA 기반의 인공유기체를 제작하는 합성생물학이 디지털 첨단 기술과 융합함으로써 기존의 대사학, 미생물학, 기초생물학 연구의 프로세스 개발 속도와 규모가 크게 향상되고 있다. 3D 바이오 프린터는 세포나 조직, 장기 등의 바이오 시스템을 구축할 수 있고, 바이오 머신 인터페이스의 발전으로 신경 신호를 기계의 동작으로 변환 및 수정할 수 있다. 뇌-컴퓨터 인터페이스(Brain-Computer Interface, BCI)와 같은 기술에서 인공지능, 기계 학습 알고리즘이 활용되어 뇌파나 뇌세포 신경 신호와 기계와의 상호작용을 가능하게 한다. 그 외에도 AI 기반의 효소 유전자 설계 및 생산, 디지털 논리회로 기반의 유전자 회로(genetic circuit) 설계, 컴퓨터 모델링된 인공 미생물과 생물 시스템 등이 가능해졌다. 대표적인 예로 징코바이오웍스 社는 질소고정 미생물, 항생제, 백신 등의 맞춤형 균주 개량 표준화를 위해 바이엘 社, 로슈 社 등과의 공동연구로 바이오파운드리를 구축하여 연구의 고속화・대량화・저비용화를 실현하고 있다.

출처: Chui, M. et al, The Bio Revolution, McKinsey Global Institute, 2020.5
[그림 특집 1-2] 오믹스의 다양한 연구 분야

출처: Chui, M. et al, The Bio Revolution, McKinsey Global Institute, 2020.5
[그림 특집 1-3] 뇌-컴퓨터 인터페이스 기술
(3) 보건의료 분야의 디지털바이오
COVID-19 이후 바이오 분야 뿐만 아니라 보건의료 분야에도 비대면과 원격 문화가 확산되며 보건의료 분야의 디지털 전환도 본격화되었고, 디지털바이오기술을 이용한 원격 의료 진단, 개인 맞춤형 치료 및 예방, 의료 영상 이미지 자동 분석, 디지털바이오마커를 이용한 임상 연구 및 신약 개발 등이 새로운 의료 패러다임으로 대두되고 있다. 웰트(WELT) 社에서 개발한 불면증 관련 디지털 치료제는 생체 신호를 분석하는 웨어러블 센서를 기반으로 하여 디지털 생체 신호 처리 기술을 사용하였고 임상 시험을 진행하고 있다. 뷰노(VUNO) 社의 Vuno Med-PathLab은 인공지능 기반의 공간 분석 활용으로 간암 예후를 예측하고 연관 인자를 확인할 수 있으며, 루닛(Lunit) 社는 AI 바이오마커 플랫폼을 이용해 항암 치료 효과를 예측하는 ‘루닛 스코프’를 개발하였다. 구글 社의 Fitbit에서 개발한 기초대사 파라미터와 뇌파를 측정하여 수면을 돕는 웨어러블 기기, 얼라이브코어(AliveCor) 社의 AI 기반 모바일 심전도기 등 다양한 기업에서 디지털 의료 플랫폼을 상용화하기 위해 노력하고 있다. 이러한 AI 및 빅데이터 기술 개발은 신약 개발 연구 및 약물 발굴 단계에서 활용되어 시간과 비용을 단축시키고 있다.
그 외에도 바이오헬스 산업이 개인 맞춤형 의료에 관한 관심이 높아지면서 빠르게 성장하고 있는데, 개인의 유전체 데이터를 이용한 질병 진단, 유전적 위험 평가 및 약물 반응성 예측 등을 가능하게 하며, 생체 신호 모니터링을 통한 개인의 건강 상태 추적과 웨어러블 의료기기를 통한 신체 활동 추적 등 다양한 기술과 서비스를 포함한다. 인공지능, 빅데이터 분석, 기계 학습 기술을 활용한 유용 건강 데이터 도출, 의료서비스 관련 플랫폼과 헬스케어 프로그램의 개발 또한 디지털헬스 산업의 범주에 속해있다. 대표적인 디지털바이오헬스 산업 기업으로는 유전체 정보를 분석하여 질병 위험성, 유전적 특성, 가족력 등을 제공하는 23andme 社, 디지털 음압펌프를 통한 약물 투여를 관리하는 프로투스디지털헬스(Proteus Digital Health) 社, 암 환자의 임상 데이터를 수집, 분석, 예후 예측을 제공하는 템퍼스(Tempus) 社 등이 있다. 디지털바이오기술의 발전은 보건의료 분야에서 환자의 건강 증진과 의료비용 절감에 기여할 것으로 기대된다. 그러나 의료 빅데이터 활용은 각종 규제와 이해 상충으로 인한 제약이 존재하며, 의료 바이오 빅데이터의 생성은 꾸준히 증가한 반면 디지털 헬스케어 기업과 병원, 정부 기관 등이 연결된 통합 시스템이 부재하다는 문제점이 있다. 맞춤형 의료・건강정보 제공 및 활용을 위한 시스템 구축과 법・제도적 기반 마련이 확대된다면 보건의료 영역에서의 디지털바이오산업이 더욱 활성화될 것으로 보인다.
나. 국내 정책 동향
(1) 정부 부처별 동향
(가) 과학기술정보통신부
과학기술정보통신부는 지난 12월 정부 국정과제인 ‘바이오 대전환, 디지털바이오 육성’을 실현하기 위한 ‘디지털바이오 혁신전략’을 발표하였다. 데이터 기반 바이오 연구 확산과 디지털바이오 생태계를 조성하기 위해 바이오파운드리, DNA 암호화 화합물은행, 휴먼 디지털 트윈 등 5대 인프라와 전자약・디지털 치료제 등 3세대 치료제, 인공지능 기반의 신약개발, 인공장기 제작, 유전자 정밀 편집 등의 12대 핵심기술을 중점 육성할 분야로 선정하였다. 추진 전략별 세부 과제는 첨단뇌과학 분야에 10년간 4,000억 원 규모의 예산을 투입해 전자약, 디지털 치료제, 바이오칩, 전자인공장기 등 IT기술을 활용한 신개념 바이오 연구・산업을 육성하는 계획이 포함되었다. 또한 ‘디지털바이오 공통기반기술 확보’를 위해서는 유전자 편집・제어・복원 기술의 효율을 2배 이상 향상시키면서 줄기세포 유전체 지도와 데이터베이스를 구축하고, DNA 바코드 화합물 은행 핵심기술 확보와 공공은행 구축 등이 제시되었다. ‘데이터 중심 바이오 혁신생태계 조성’을 위해서는 바이오 연구데이터를 통합 수집・관리・공유하는 ‘국가 바이오데이터 스테이션(K-BDS)’에 총 1,780억 원의 예산을 투입할 예정이다.
2023년 6월 제39회 생명공학종합정책심의회에서 ‘제4차 생명공학육성 기본계획’을 심의・확정하였다. 이번 전략은 AI 기반 신약 개발, 디지털 치료기기, 디지털 육종, 합성생물학 등 디지털바이오 중점기술을 육성하고, 바이오파운드리나 스마트팜 등 디지털 기반의 인프라를 구축할 예정이다. 또한 휴먼 디지털 트윈, 오가노이드 등 동물실험을 대체할 수 있는 차세대 가상 연구・실험 플랫폼도 구축한다. 바이오기술을 통해 고령화나 기후 위기 등의 난제 해결에 기여하기 위해 노화 빅데이터를 활용한 한국인 노화 생체시계 개발, 치매・암 등의 난치질환 치료 기술 개발 등도 추진할 방침이며, 바이오 혁신기술이 산업으로 접목되도록 기술 고도화, 신생기업과 벤처 창업 지원, 글로벌 진출 지원 등을 수행할 예정이다.
(나) 보건복지부
보건복지부는 2023년 6월에 관계부처 합동으로 마련한 ‘첨단산업 글로벌 클러스터 전략회의’에서 ‘데이터 기반의 디지털 헬스케어 산업 고도화’를 보고하였다. 국가재정이 투입되었던 연구개발(R&D)과제에서 생성된 데이터에 대한 개방・공유를 의무화하고, 건강보험 데이터의 안전한 개방과 활용을 위한 지침 개정도 추진한다. ‘국가 통합 바이오 빅데이터’ 사업을 통해 100만 명 규모의 임상・유전체 정보를 수집・구축하여 정밀의료 관련 기술 개발을 촉진하는 것을 목표로 하고 있다. 또한 민간 의료기관으로부터의 자발적인 데이터 개방을 위해 전자의무기록(EMR) 데이터의 표준화를 촉진하고, 한국보건의료정보원이 디지털 헬스케어 연구 목적의 보건의료 데이터의 공유와 활용 활성화를 담당할 예정이다. 마지막으로 보건의료 데이터 활용을 위한 제도와 인프라 개선을 추진한다. 기존의 이중 심의 절차를 간소화하여 데이터 접근 편의성을 제고하고, 이를 활용하여 연구개발과 사업화를 고속화할 계획이다.
(다) 농림축산식품부
농림축산식품부는 2023년 농식품 분야 핵심 국정과제인 ‘농업의 미래성장산업화’를 위해 농업생명자원과 생명공학 기술을 융합한 ‘그린바이오 산업 육성 전략’을 수립하였다. 빅데이터와 인공지능 기술을 기존의 교배・품종 개발에 접목한 디지털 육종 기술을 개발하여 디지털 육종 기술 기반의 종자, 미생물 비료・농약・사료첨가제, 곤충 소재의 사료첨가제, 식물 백신, 배양육 및 바이오 디젤 등 광범위한 범위의 산물을 생산함으로써 농업 생산성을 향상시키고 신소재를 개발하는 것을 목표로 하고 있다. 종자업체가 최신의 디지털 육종 기술을 적용할 수 있도록 연구기관과 업체 간 데이터 공유 및 디지털 육종 컨설팅, 종자산업진흥센터 내 빅데이터 활용 분석 플랫폼 구축 등을 추진하고 있다. 최근 농식품산업 시스템에 전반적으로 생명공학과 IT기술의 융합, 대량생산 기술 개발, 신시장 창출을 위한 바이오파운드리 구축이 요구되고 있다.
(2) 기술 및 산업 동향
최근 의료의 디지털 전환은 디지털 헬스케어 제품의 시장 진입, 한시적 비대면 진료와 같은 새로운 형태의 디지털 기반 의료서비스 등으로 실현되고 있다. 특히 국내 제약바이오기업들은 디지털바이오기술을 활용한 신사업 진출에 적극적인 행보를 보이고 있다. 한미약품은 KT와 협업하여 디지털치료기기(Digital Therapeutics, DTx)와 전자약 전문기업 디지털팜에 합작 투자를 하고 본격적인 사업화를 시도하고 있다. 녹십자의 자회사 GC케어는 빅데이터, AI 기반의 개인 맞춤형 건강 관리 서비스를 제공하는 기업으로 국내 최초 전자의무기록(EMR)을 개발한 유비케어(UBcare) 社를 인수하여 국내 최대 규모의 의료 네트워크와 IT 융합 플랫폼을 구축하고 있다. 안국약품은 의료기기업체 뷰노(Vuno) 社와 협업하여 AI 기반 안구 내 안저 영상 진단 솔루션을 국내 최초로 개발하여 식품의약품안전처의 허가를 받고 국내 1호 혁신 의료기기로 지정되었다. 신약 개발 분야에서도 AI 신약 개발 벤처와 제약바이오기업의 연대는 확대되고 있는데, SK케미칼은 국내의 스탠다임(Strandigm) 社, 디어젠(Deargen) 社, 닥터노아(Dr.NOAH) 社 등 신약 개발 벤처 5곳과 신약 개발 연구에 착수하였고, 비알콜성지방간염(NASH) 치료제 후보물질을 발굴하였다. 대표적인 디지털 의료기술은 진료 데이터의 종별・기관별 통합 운영을 위한 AI 음성인식 및 클라우드 관련 기술이 있다. 네이버 헬스케어연구소 주력 기술인 ‘클로바’는 AI로 의료 용어를 학습한 음성녹음・텍스트 기록 앱 서비스로 예진, 진료 과정 텍스트화, 인수인계 텍스트 기록 등을 수행할 수 있으며 음성인식 의무기록(Voice EMR)을 작성하여 의료 현장에서의 디지털 진료를 실현할 수 있도록 개발되고 있다.
다. 국외 정책 동향
(1) 미국
(가) 정책 동향
지난 3월 미국 백악관 과학기술정책국(OSTP)은 바이든 행정부가 의회에 제출한 2024 회계연도 예산안 중 과학, 기술 및 혁신 분야의 주요 내용을 발표하였다. 예산안에서 과학, 기술, 혁신 분야 R&D에 역대 최대 규모인 약 2,100억 달러를 배정하였으며, 연방 R&D 기관인 국립과학재단(NSF)와 의료고등연구계획국(ARPA-H) 등에 각각 12억 달러, 25억 달러를 지원하였다. 또한 백악관은 미국 생명공학 및 바이오제조 분야의 발전을 위한 목표와 우선순위를 보고서로 발표하였고, 해당 보고서는 상기 기술한 ‘국가 생명공학 및 바이오 제조 이니셔티브’의 후속 조치로 추진되었다. 에너지부에서는 바이오매스와 토양의 탄소 순환 모니터링을 이용한 기후 변화 솔루션을 제시하였고, 농무부(USDA)는 질소와 메탄 불출량을 감축시킬 수 있는 작물을 개발하여 식량 및 농업 혁신을 제안하였다. 보건복지부는 정밀 다중오믹스 데이터 수집과 인공지능 기반 치료제 바이오 생산, 유전자 편집 기술 등을 추진한다.
(나) 기술 및 산업 동향
바이든 정부의 잇따른 자국 산업 육성 정책 발표로 관련 산업의 광범위한 영향이 예상되며, 이는 디지털바이오, 바이오제약 산업과 디지털 헬스케어 산업이 큰 주축을 이루고 있다. 특히 COVID-19 이후 바이오제약 산업에 대한 중요성과 관심이 더욱 증대되어 가상 임상 시험이나 원격 의료 등 디지털 전환이 가속화되는 추세이다. 디지털 헬스케어 산업에서 미국 자국 내 산학연의 협업이 이루어지고 있는데, NTT 리서치의 의학의료 정보연구소는 하버드 공대와 파트너십을 맺고 살아있는 심장 및 디지털 심장 모델을 개발하여 심혈관 바이오-디지털 트윈 모델에 적용할 예정이다. 에이번리(Avanlee) 社와 월마트(Walmart)도 협업하여 간병인을 지원하는 디지털 어플리케이션을 출시하여 미국의 노령 인구에 의료 관련 디지털 도구를 제공하는 사업을 진행하고 있다. 또한 미국 내 환자의 25%가 원격 의료를 활용하였으며 기술업체와 의료전문가의 합작 투자를 통해서 이후 계속 상승할 것으로 기대되며, 앞으로 가상 치료 및 디지털헬스 솔루션에 더 많은 자본이 유입될 전망이다.
(2) EU
(가) 정책 동향
EU의 대규모 연구 혁신 프로그램 ‘Horizon Europe(2021∼2027)’은 오픈 사이언스, 글로벌 과제 해결 및 산업경쟁력 강화, 오픈 이노베이션 등에 955억 유로를 투입하여, 건강, 문화, 디지털 산업, 에너지 및 바이오경제 등의 부문에 투자하고 있다. 바이오 R&D 프로그램으로는 만성질환과 감염병의 질병 연구, 의료시스템 효율화, 신약・백신 개발, 의료 공평화 등의 과제, 희귀질환 치료법, 맞춤의료, 원격의료 등의 기술 개발 등의 세부 주제를 지원하고 있다. 유럽 10개 회원국이 바이오경제 전용 전략을 개발하고 7개 회원국에서 전략 개발을 이미 진행하고 있다. 영국은 지속 가능한 바이오제조 연구개발과 상업화를 촉진하기 위해 ‘바이오기술 전략계획’을 수립하였고, 세계 최초로 정부 주도의 국가 합성생물학 로드맵을 구축하여 합성생물학센터와 바이오파운드리를 도입하였다.
(나) 기술 및 산업 동향
유럽은 높은 수준의 과학 기반을 보유하고 있으며 현재 디지털바이오 혁명의 선도적인 위치를 차지하기 위해 정책적 기반과 투자 유치를 다지고 있다. 아직은 디지털화 및 플랫폼 기반의 비즈니스 모델에서는 미국과 같은 다른 국가에 뒤처지고 있지만, 그럼에도 불구하고 디지털바이오 스타트업 생태계를 선도하고 있으며 청정기술, 생명과학, 농업기술, 대체육 분야에서 입지를 구축하고 있다. 영국의 휴마(Huma) 社는 최근 몇 년간 AI 및 웨어러블 기술 업체 바이오비츠(Biobeats) 社를 인수하고, 아이플라토(iPLATO) 社를 인수하는 등 디지털바이오마커 개발 분야를 개척하고 맞춤화된 환자 치료를 도모하려는 행보를 보이고 있다. 독일의 디지털 치료제 시장은 디지털 진료법이 통과되면서 활성화되고 있으며, 리해피(Rehappy) 社, 엠센스(M-sense) 社 등 많은 스타트업에서 뇌졸중 후유증, 우울증, 편두통, 근골격 장애 등에 대한 디지털 치료제가 상용화되고 있다.
(3) 중국
(가) 정책 동향
지난해부터 방역과 의료자원의 중요성이 커지면서 중국국가발전개혁위원회(NDRC)는 처음으로 ‘바이오’가 포함된 바이오경제 5개년 계획을 수립하였다. 이 5개년 계획에 따르면 중국은 국가 주도로 바이오의약(의료), 바이오농업(생산), 바이오매스(환경・생태), 바이오안전(방역) 등 4개 분야에서 바이오경제 혁신 기반 강화, 바이오 중점사업, 바이오자원 보호 활용, 바이오환경 정책환경 최적화 등 5개의 중점 과제를 추진할 계획이다. 특히 의약 분야 개요에서 약물, 백신, 의료 바이오소재, 정밀의료, 검사 분야의 선진국 수준으로의 혁신을 제시하며 고부가가치 바이오의약품의 생산・설비와 공급망 확보 등을 중점 방향으로 계획했다. 이를 위해서 임상의학・건강 관리・신약 개발 등의 국가 중대 과학기술 프로젝트를 추진하고, 베이징과 상하이를 비롯해 징진지, 창장 삼각주, 장수, 광둥, 청두-충칭 경제권을 바이오의약품 클러스터로 육성하겠다는 방안도 제시하였다. 이와 함께 의약품・의료기기 우선 승인 정책을 개선하고 국제규칙과 표준 제정에 적극 참여하여 선진형 의료기술을 주도할 예정이다.
(나) 기술 및 산업 동향
중국은 바이오 의약산업 후발주자로서 원천기술 기반이 취약해 로슈(Roche) 社나 노보노르디스크(NovoNordisk) 社 같은 외국계 기업이 중국 바이오 시장을 주도하고 있다. 그러나 내수 시장이 급격하게 성장하고 정부 차원의 지원 규모가 증대되고 있어 푸싱의약(复星医药), 이판제약(亿帆医药) 등의 대기업과 벤처기업을 중심으로 산업이 발전하고 있는 추세이다. 펀즈즈신(分子之心) 社는 완전한 기능을 갖춘 AI 단백질 예측 및 설계 플랫폼인 ‘MoleculeOS’를 개발하였고, 현재 단백질 설계・최적화, 단백질 및 복합체 구조 예측, 단백질-단백질 도킹, 단백질 기능 예측, 단백질 언어 모델 등 핵심 분야에서 10개 이상의 AI 알고리즘을 개발하는 성과를 거두었다. 중국 내 디지털 의료에 대한 관심도 커지면서 인터넷 병원을 포함한 디지털 치료기기, 디지털 치료제에 대한 플랫폼 회사도 등장하고 있다. 클라우드 기반 병원 입점 플랫폼인 ‘위닥터(Wee Doctor)’의 경우 진료 예약, 원격 진료 외에도 회원제로 가족 건강 관리, 만성질환 관리 등을 제공하며, 의료서비스의 디지털화를 주도하고 있다.
(4) 일본
(가) 정책 동향
일본 정부는 2030년 세계 최첨단 바이오경제 사회 실현을 위해 범부처 바이오전략인 ‘바이오 전략 2019’을 수립하였고, 2022년 6월 내각이 승인한 ‘경제 재정관리 및 개혁 기본방침 2022’를 통해 양자, AI 기술을 포함하여 바이오제조, 재생의료, 세포치료, 유전자치료 등 바이오기술과 의료 분야의 개혁 방안을 발표하였다. 국립연구개발법인 일본의료연구개발기구(Agency for Medical Research and Development, AMED)는 바이오・의료 분야의 연구개발사업을 관리부터 제품화까지를 지원하고 있으며, 2022년 바이오・의료 분야 프로젝트에 총 1,549억 엔을 지원하였다. ‘제2기 중장기 종합계획’을 통해 의약품, 의료기기・헬스케어, 재생・세포의료・유전자치료, 게놈 데이터 기반 연구, 질환 기초연구, 종자 개발 연구 등의 프로젝트에서 새로운 의료기술 개발을 집중 지원하기로 하였다. 또한 바이오를 포함한 10대 핵심기술을 확보하고 공급망 관리, R&D 투자 확대 등을 통해 글로벌 기술우위를 확보하고자 하는 ‘성장전략 2021’를 수립하였다.
(나) 기술 및 산업 동향
일본의 의료 빅데이터 분석 서비스 시장은 향후 약 360억 엔에 이를 것으로 전망되며, 현재까지 국가, 지자체, 대학, 연구기관으로 제한되었던 의료데이터를 전처리한 후 판매나 공유 서비스를 통해 제공하고자 계획하고 있으며, 데이터의 축적에 따라 시장 규모는 더욱 확대될 것으로 보인다. 일본 제약업체 아스텔라스(Astellas) 社는 AI와 로봇공학을 도입하여 납 화합물을 찾는 등 디지털 혁신을 통해 연구개발 비용을 절감하고 신약 개발 일정을 단축시키고 있다. 단백질 구조 분석 기술, 가상 라이브러리, 클라우드 컴퓨팅 등을 이용해 고품질의 저분자 발견을 고도화시키고 해당 데이터베이스의 구축에도 기여하고 있다. 일본의 대표 종합상사인 미쓰이물산은 이번 3월부터 미국 엔비디아(NVIDIA) 社와 협업하여 Tokyo-1 프로젝트를 추진하고 있으며, 고해상도 분자역학 시뮬레이션 및 신약 개발을 위한 생성형 AI 모델 등의 기술 개발을 추진할 예정이다. 미쓰이 자회사 제우레카(Xeureka) 社가 Tokyo-1의 온라인화를 담당하고 약물 발견 소프트웨어와 단백질, DNA, RNA 데이터에 대한 모델 등을 제공할 것이다. 신약 개발과 승인이 지연되는 드러그 랙(drug lag) 문제를 겪고 있던 일본 제약 환경에 최첨단 AI 도구의 도입은 제약산업 환경을 변화시킬 수 있는 혁신 허브가 될 것으로 주목받고 있다.
특집 제2장 디지털바이오의 성공사례 및 향후 발전 전망 |
제1절 AI 신약 플랫폼 |
가. 개요
AI를 활용한 가상화 및 모델링 기술은 현재 대부분의 제약회사에서 자체적으로 개발하거나, 전문 AI 기업들과의 협력을 통해 신약 개발과정에서 활용되고 있다. 이 기술은 인공지능 기반 신약 후보물질 발굴 플랫폼으로, 기존의 신약 개발에서의 많은 비용과 시간, 높은 실패율 등의 장벽을 극복하고 바이오 연구개발 속도를 높이며 성공 가능성을 크게 향상시키고 있다. 일반적으로 전통적인 방법으로 신약을 개발하는 경우, 10∼15년이라는 긴 기간과 2∼3조 원에 이르는 높은 개발 비용이 소요된다. 그러나 AI 신약 플랫폼 기술을 활용한 경우 개발 기간은 7년으로 단축되었고 개발 비용도 약 6,000억 원 정도로 감소되었다. 이는 후보물질 도출 단계에서 100만 건 이상의 논문을 빠르게 탐색하여 시간과 인건비를 최소화하고, 임상 단계에서도 최적의 임상 대상 환자군을 도출하여 개발 시간과 비용을 최적화했기 때문이다. AI 신약 플랫폼 기술은 앞으로 더욱 높은 예측력과 정확도로 더 많은 신약 후보물질을 발굴하고, 이를 신속하게 검증하여 개발 시간을 단축하고 성공 가능성을 높임으로써 앞으로 바이오산업의 발전과 인류의 건강 증진에 큰 기여를 할 것으로 기대된다.
(1) AI 신약 플랫폼 기술의 역사
AI 신약 플랫폼 기술을 활용하여 새로운 약물을 개발함에 있어 혁신적인 성과를 이룬 것을 “Pharma's AlphaGo Moment”라고 한다. 이러한 성과를 이룬 기업 중 하나인 인실리코 메디슨(Insilico Medicine)은 46일이라는 기존의 약물 개발 방법보다 15배나 빠른 시간 안에 새로운 약물 후보물질을 디자인, 합성, 검증하는 과정 성공을 발표하며1) AI 신약 플랫폼 기술의 적극적 활용의 중요함을 보여주었다. 1990년부터 Deep Learning(DL), Natural Language Processing(NLP) 같은 기본적인 AI 이론들이 구축되면서 2018∼2019년 바이오텍 기업들이 실제로 약물 개발 R&D에 AI 기술들을 적극적으로 활용하여 Pharma's AlphaGo Moment 성과가 나타났으며, 현재 R&D에 우선적으로 AI 기술을 도입하는 기업들이 빠르게 늘어나고 있다. 특히, 2021년 이후 본격적으로 양자역학 원리를 이용한 ‘양자컴퓨터(Quantum Computer)’가 AI 계산용 컴퓨터에도 도입되면서2) 개발속도가 비약적으로 가속화될 것으로 기대하고 있다.

주) DL(Deep learning), NLP(Natural Language Processing), GANs(Generative Adversarial Networks), NN(Neural Network), VR(Virtual Reality)
출처: Deep Pharma Intelligence. Landscape Overview Q1 2023 가공
[그림 특집 2-1] AI 신약 플랫폼 기술의 개발 및 변천사3)
1) Nature Biotechnology. 2019 37(9), p1038
2) Drug Discov Today. 2021 26(7), p1680
3) Chem. Rev. 2019 119, p10520
(2) AI 신약 플랫폼 기술의 적용 범위
신약개발은 다양한 자료를 분석하고 최적화하며 go/no-go의 신속한 결정을 요구하는 까다로운 과정을 거치게 되는데, 이러한 과정에서 대량의 데이터를 기반으로 하는 AI 기술이 유용하게 적용될 수 있다. AI 신약 플랫폼 기술은 다양한 자료의 지능적 탐색과 패턴 인식, 자동화를 통해 약물 개발의 효율성을 높일 수 있다. 또한, AI를 통해 자료로부터의 학습을 통해 표면적으로는 보이지 않는 내재된 현상과 패턴에 대한 통찰을 얻을 수 있어 신약개발의 모든 단계에서 유용하게 적용될 수 있다. 이러한 AI 기술의 적용 범위는 연구 논문, 특허 자료, 화합물의 구조와 효능 관련된 빅데이터, 의료 데이터, 임상 데이터 등 방대한 자료의 분석에서부터 화합물 활성화 및 효능 극대화, 독성 및 부작용 최소화, 약물 재창출, 전임상/임상 시험 설계 등 약물을 최적화하는 신약개발 과정 전반에 걸쳐 적용 가능하다.

출처: Deep Pharma Intelligence. Landscape Overview Q3 2022 참고
[그림 특집 2-2] AI 신약 플랫폼 기술의 적용 범위
나. 성공 사례
(1) 국내 사례
(가) 국내 주요 AI 기업 보유 기술
한국제약바이오협회 인공지능신약개발지원센터에 따르면 현재 국내 AI 신약개발 기업은 50여 개사로 추정되며, AI 기업과의 협업으로 신약개발을 하려는 중견 제약바이오 기업도 현재 약 30곳 이상이라고 한다. 또한 정보가 공개된 기업에 대한 누적 투자금이 약 6,000억 원에 이른다고 한다. 2022년 상반기 동안 ‘AI 활용 혁신신약 발굴’을 비롯한 27개 사업을 통해 14개 신약개발 AI 스타트업에 정부의 지원이 이뤄지고는 있으나, 현재 AI기술이 적극적으로 신약개발을 성공적인 단계로 이끌지는 못하고 있는 것으로 평가되고 있다. 50여 곳의 AI 신약 스타트업 기업들은 기업 창업이념에 따라 활성 화합물 탐색・예측, 타깃 발굴, 바이오마커 발굴 등의 플랫폼기술들을 구축하여 자체 개발 및 협업연구를 추진하고 있다. 현재 주요 AI 신약 스타트업 기업들이 보유하고 있는 AI 신약 플랫폼 기술들은 다음 표에 기술하였다.
[표 특집 2-1] 국내 AI 신약 스타트업 기업들이 보유하고 있는 AI 신약플랫폼 기술
기업명 | 인공지능 플랫폼 |
닥터노아바이오텍 | • ARK : 통합형 의약학 네트워크, 약물 유전체, 환자 유전체 DB를 이용하여 신규 타깃 발굴, 단일약물(복합제) 구조예측 플랫폼 |
디어젠 | • Dr.UG : 유전체 데이터 분석, 바이오마커 예측, 후보물질 발굴 및 최적화에 특화된 딥러닝 기술 기반 플랫폼 |
스탠다임 | • Standigm Best : Drug discovery space를 탐색하여 원하는 특성을 만족시키는 새로운 화합물 생성 • Standigm Insight : 잠재 목표 예측을 통해 hidden indication을 발견함으로써 복합제 발굴 |
신테카바이오 | • NEO-ARS™ : 암 유전체 분석과 AI 딥러닝 기술을 기반으로, 환자의 면역시스템을 활성화시켜 암을 치료할 수 있는 신생항원 펩타이드 예측 • GBL-ARS™ : 초기 단계 임상시험에서 확보된 유전체 데이터를 사용하여 약효예측 바이오마커 발굴 • DeepMatcher™ : AI 기반 유효물질 도출과 최적화를 통한 선도물질 발굴, 2차 타깃과 오프타깃 분석, 약물 저항 바이오마커의 개발 |
온코크로스 | • ONCO AI PArk : 약물 개발 예측을 위한 인공지능 기반의 다양한 플랫폼 |
에이조스바이오 | • iSTAs : 가상의 압축 공간에서 약리 활성 물질의 구조적 특징을 찾아 조합, 조합하는 과정에서 특정 효능을 가감할 수 있는 알고리즘 플랫폼 |
파로스아이바이오 | • Chemiverse : 약효정보 스크리닝용 화합물 데이터베이스로부터 필요한 화합물을 검색하고 분석/관리/구매할 수 있는 AI 플랫폼 |
출처: 표 순서대로
http://www.drnoahbiotech.com/sub/ark.php (닥터노아바이오텍)
https://deargen.me/ko/ (디어젠)
http://www.standigm.com/main (스탠다임)
http://www.syntekabio.com (신테카바이오)
https://www.oncocross.com/raptor (온코크로스)
http://www.azothbio.com (에이조스바이오)
https://pharosibio.com/m31.php (파로스아이바이오)
(나) 국내 주요 AI 기업 개발 중인 약물
국내 첫 AI를 활용한 신약 후보물질 임상시험에 해당하는 난치성 급성 골수성 백혈병(AML) 치료물질 ‘PHI-101’는 AI 기반 혁신 신약개발 전문 기업 파로스아이바이오가 자체 개발한 Chemiverse AI 신약 플랫폼 기술을 활용해 개발한 신약이다. 2022년 12월에 호주, 한국, 스페인 등 글로벌 임상시험 1상을 진행하고 있다고 밝혔다. AI 신약개발 벤처 온코크로스도 AI 신약개발 플랫폼 ‘랩터AI(RAPTOR AI)’를 통해 자체 개발된 파이프라인 OC514 복합체 약물을 2023년 글로벌 임상 2상을 목표로 호주 식품의약품안전청으로부터 2022년 2월 임상 1상 승인을 받았다. 닥터노아바이오텍은 자체 AI 플랫폼(ARK platform)을 이용해 개발한 국내 첫 인공지능 기반 복합신약 뇌졸중 치료제, ‘NDC-002’에 대해 국내 임상 1상 시험승인을 받았으며, 이는 세계 첫 ‘뇌졸중 후 치료’를 위한 의약품이 될 것으로 기대한다고 밝혔다.
[표 특집 2-2] 국내 개발된 AI 신약 플랫폼 기술을 활용한 약물 개발 현황
기업명 | 인공지능 플랫폼 | 약물이름(치료제) | 치료분야 | 임상단계 |
온코크로스 | ONCO AI PArk | OC514 | 근감소증 | 글로벌임상1상 (2022년) |
퍼스트바이오 | GeniFiNDTM 1ST-401 | FB-849 | 면역항암제 | 글로벌임상1/2상 (2022년) |
스탠다임 | Standigm Best Standigm Insight | NASH | 항암, 비알코올성지방간 | 임상 계획 (2022년) |
파로스아이바이오 | Chemiverse | PHI-101 | 항암 | 글로벌임상1B상 진행 (2022년) |
닥터노아바이오텍 | ARK platform | NDC-002 | 뇌졸증 | 국내 임상1상 (2022년) |
출처: 표 순서대로
https://www.oncocross.com/pipeline (OC514, 온코크로스)
https://www.1stbio.com/rd-pipeline/ (FB-101, 퍼스트바이오)
http://it.chosun.com/site/data/html_dir/2020/01/22/2020012202539.html (스탠다임)
https://pharosibio.com/m23.php (파로스아이바이오)
http://www.drnoahbiotech.com/ (닥터노아바이오텍)
(다) 국내 주요 AI 기업 협업사례
한국제약바이오협회 인공지능신약개발지원센터 조사에 따르면 AI 신약개발 기업의 총 파이프라인 수는 105건 정도로 파악됐다. 연도별로 2018년까지 누적 4건에 불과한 파이프라인이 2021년 89건, 2022년 105건으로 확대되었다고 한다. 신약개발에 AI 기술을 잘 활용하면 개발 기간과 비용을 획기적으로 개선할 수 있다는 인식이 확대되면서 제약사와 AI 신약개발 업체와의 협업은 지속적으로 늘어나고 있다. 2022년 이후 협업사례를 보면 유한양행-파로스아이바이오, 신풍제약-파로스아이바이오, 보령-온코크로스, JW중외제약-디어젠 등과 공동개발을 진행하는 사례가 대표적이다.
[표 특집 2-3] 국내 AI 기반 스타트업들과 국내 중견 제약사들과의 협업사례
기업명 | 협업 기업 | 후보물질 | 협업 내용 |
인세리브로 | 삼진제약 | - | 인세리브로-삼진제약, ‘양자역학 계산 기술’을 기반, 신약개발플랫폼(MIND) (2022년 9월) |
디어젠 | JW중외제약 | 신규적응증 확대 | 신약 후보물질의 새로운 적응증 발굴 AI 신약 플랫폼 공동연구 (2202년 10월) |
온코크로스 | 보령 | 고혈압 치료제 | 보령-온코크로스, AI 이용해 고혈압 치료제 ‘카나브’ 적응증 확대 (2023년 2월) |
알파몰 | 간경화 치료제 | 온코크로스, 스위스 알파몰과 간경화 치료제 공동연구 개발 계약 (2022년 11월) | |
에이조스 바이오 | 대웅제약 | 합성치사 항암제 | 대웅제약, 에이조스바이오와 AI 기반 항암 신약 공동연구 협약 (2022년 9월) |
파로스 아이바이오 | 신풍제약 | 급성 골수성 백혈병 치료제 | 파로스아이바이오, 신풍제약과 업무 협약 체결… 신약 조기 사업화 추진 (2022년 12월) |
유한양행 | 항암제 (폐암, 대장암, 췌장암) | 파로스아이바이오 & 유한양행, 신규 KRAS저해제 기술이전 및 공동개발 협약 체결 (2022년 4월) |
출처: 표 순서대로
https://www.samjinpharm.co.kr/front/kr/prcenter/news_view.asp?idx=425&page=1 (삼진-인세리브로)
https://www.jw-pharma.co.kr/pharma/ko/prcenter/all_view.jsp?contentsCd=2210061117312967ZQCL(디어젠-중외)
https://news.mt.co.kr/mtview.php?no=2023022409272224653 (온코크로스-보령)
https://www.biotimes.co.kr/news/articleView.html?idxno=9003 (온코크로스-알파몰)
http://www.bokuennews.com/news/article.html?no=221097 (에이조스바이오-대웅제약)
https://www.pharosibio.com/board/board.php?bo_table=news&PHPSESSID=6e862287cddc5600507d26ccca48096d&pg=1&idx=37 (파로스아이바이오-신풍제약)
https://www.pharosibio.com/board/board.php?bo_table=news&PHPSESSID=6e862287cddc5600507d26ccca48096d&pg=2&idx=24 (파로스아이바이오-유한양행)
(2) 해외 사례
(가) 해외 주요 AI 기업 보유 기술
전 세계 AI 기반 바이오텍은 800여 곳 이상이 알려져 있으며, 신약개발 초기 단계에서 임상에 이르기까지 다양한 분야의 AI 기반 기업들이 새로운 개념의 빠르고 정확한 AI 신약 플랫폼 기술들을 개발하고 있다. 생물학 분야의 50년 도전과제 중의 하나인, 아미노산 서열에서 단백질 3차원 구조를 성공적으로 예측하여 신약개발 타깃 발굴과 구조 활용에 큰 기대를 불러일으킨 Google 社의 DeepMind AlphaFold platform4) 기술과 생성적 적대 네트워크기반 시스템 GENTRL 플랫폼을 이용하여 21일 만에 키나아제 억제제를 개발한 인실리코 메디슨(Insilico Medicine) 社의 PHARMA.AI 플랫폼 기술5)은 놀라운 성과를 보여주고 있다. 최근 대표적인 AI 신약 플랫폼 기술 현황은 다음 표와 같다.

주) Disease Target identification, Generation of Novel molecules data과 Predicting Clinical trial 과정에 대한 AI기술을 도입하여 신약 탐색과 발굴과정을 가속화함
출처: https://insilico.com/platform
[그림 특집 2-3] Insilico Medicine사의 PHARM.AI 플랫폼 기술
[표 특집 2-4] 해외 AI 신약 스타트업들이 보유하고 있는 AI 신약 플랫폼 기술
기업명 | 인공지능 플랫폼 |
MindRank | • Molecule Pro™ , Molecule Dance™, PharmKG™: One stop, AI-driven drug discovery platform, molecule design, generation, MD simulation, Biomedical knowledge graph |
Peptilogics | • Nautilus™ platform: protein binding peptide prediction, a suite of predictive models to produce multiparameter-optimized leads for a broad range of targets and therapeutic areas. |
insilico Medicine | • PHARMA.AI: PandaOmics, Chemistry42, inClinico |
BenevolentAI | • Benevolent Platform™: driving a revolution in drug discovery – from target identification through to clinical development. |
Relay Therapeutics | • Dynamo Platform: Pioneering Motion-Based Drug Design, Understand How To Drug the Protein, Identify a Chemical Starting Point, Optimize Until development candidate selected |
Recursion | • MolE, The Recursion Data Universe, The Recursion Map |
출처: 표 순서대로
https://www.mindrank.ai/solutions https://peptilogics.com/ai-discovery-platform/ https://insilico.com/platform https://www.benevolent.com/what-we-do/ https://relaytx.com/dynamo-platform/ https://www.recursion.com/operating-system
(나) 해외 AI에 의해 개발된 후보약물개발 현황
최초의 AI 기반 기술로 개발된 키나아제 저해제 후보물질이 최근 전임상에서 임상으로 진입하여 AI 기반 약물의 성공 가능성을 입증하고 있다. 바로 특발성 폐섬유증 치료제인 인실리코 메디슨(Insilico Medicine) 社의 Pharma.AI drug discovery platform 기술로 개발된 ‘INS018-055’이 현재 임상 1상을 성공적으로 진행 중이며, 2023년 임상 2상에 진입할 것으로 기대하고 있다. 2022년 초까지 주요 20여 개 AI 기반 신약개발 회사는 협업을 포함 160여 개 신약 탐색 프로그램을 수행하고 있으며, 이 가운데 15개 정도가 임상 개발 중인 것으로 밝혀졌다.6)
[표 특집 2-5] 해외에서 AI 신약 플랫폼 기술을 활용하여 개발 중인 약물 현황
기업명 | 국적 | 약물 이름(치료제) | 치료 분야 | 임상 단계 | |
BenevolentAI | 영미 | 영국 | BEN2293 | 아토피 | 임상2상 (2023년) |
Baricitinib | COVID-19 | 임상4상 (2022년, 승인) | |||
Recursion | 미국 | REC-4881 | 가족성샘종폴립증 | 임상2상 (2022년) | |
BioXcel Therapeutics | 미국 | BXCL701 | 전립선암 | 임상2상 (2023년) | |
BXCL501 | 조울증 | 임상3상 (2022년) | |||
AbCellera | 캐나다 | Ly-CoV1404 | COVID-19 | 임상4상 (2022년, 승인) | |
Relay Therapeutics | 미국 | RLY4008 | 담도암 | 임상2상 (2021년) | |
Insilico Medicine | 아시아 | 홍콩 | INS018-055 | 폐섬유증 | 임상1상 (2021년) |
Adagene | 중국 | ADG116 | 고형암 | 임상2상 (2022년) | |
출처: 표 순서대로
https://www.benevolent.com/what-we-do/drug-programmes/atopic-dermatitis/ (BEN2293, BenevolentAI)
https://www.benevolent.com/news-and-media/blog-and-videos/fda-converts-emergency-approval-baricitinib-first-identified-covid-treatment-benevolentai-full-approval/ (Baricitinb, BenevolentAI)
https://clinicaltrials.gov/ct2/show/NCT05552755 (REC-4881, Recursion)
https://www.bioxceltherapeutics.com/our-pipeline/ (BXCL series, BioXcel Therapeutics)
https://investors.abcellera.com/news/news-releases/2022/AbCellera-Discovered-Antibody-Bebtelovimab-Receives-U.S.-FDA-Emergency-Use-Authorization-for-the-Treatment-of-Mild-to-Moderate-COVID-19/default.aspx (Ly-CoV1404, AbCellera)
https://ir.relaytx.com/news-releases/news-release-details/relay-therapeutics-announces-interim-clinical-data-support-rly(RLY4008, RELAY)
https://www.prnewswire.com/news-releases/insilico-medicine-initiates-first-in-human-study-of-ism001-055-a-novel-drug-discovered-using-insilicos-proprietary-end-to-end-artificial-intelligence-platform-301434226.html (ISM001-055, Insilico Medicine)
https://www.adagene.com/pipeline/pipeline-programs/ (ADG116, Adagene)
(다) 해외 주요 AI 기업 협업사례
AI 신약 플랫폼 기업에 쏟아지는 투자 자본의 양이 크게 증가하였고(2020년의 22억 8,000만 달러, 2022년의 1,264억 달러), AI 스타트업과 빅파마들의 연구 파트너십의 수도 꾸준히 증가하고 있다. 세계 굴지의 빅파마들인 일라이릴리(Lilly), 비엠에스(BMS) 등은 8∼12건, 사노피(Sanofi), 지에스케이(GSK) 등 13∼16건, 머크(Merck), 화이자(Pfizer) 등 17∼22건, 아스트라제네카(Astrazeneca) 27건 이상의 협업을 통해 AI 기술을 신약개발에 적극적으로 활용하고 있는 것으로 보고되고 있다. 대표적인 협업사례는 아래 표와 같다.
[표 특집 2-6] 해외 AI 기반 스타트업과 국내 중견 제약사들의 협업사례
기업명 | 협업 기업 | 후보물질 | 협업 내용 |
Exscientia | Sanofi | 15 novel small molecule candidates across oncology and immunology | AI-driven pipeline of precision-engineered medicines (2022년 1월) |
Insilico Medicine | Sanofi | 6 new targets in undisclosed indications | AI-driven pipeline of undisclosed indications (2022년 11월) |
Microsoft | Novo Nordisk | atherosclerosis, a cardiovascular disease | drug discovery and development using big data and artificial intelligence (2022년 9월) |
Tempus | Pfizer | cancer drugs | AI-enabled precision medicine solutions (2023년 2월) |
PathAI | Roche | pathologist access to innovative AI-powered technology | PathAI-developed research-use-only (RUO) algorithms (2021년 10월) |
Mila | Amgen | to develop advanced algorithms and models to support the discovery and optimization of biologics | Amgen’s future therapeutic developments (2023년 1월) |
Absci | Merck | Absci’s AI new drug platform | Absci’s Deep Learning-Enabled Drug Creation™ and Bionic Protein™ technologies (2022년 1월) |
Evotec SE | Lilly | Metabolic diseases | Evotec's AI Drug discovery Platforms (2022년 1월) |
Iterative Scopes | Janssen | inflammatory bowel disease (IBD) | Iterative's AI Drug discovery Platforms (2022년 1월) |
출처: 표 순서대로
https://www.sanofi.com/en/media-room https://pharmaphorum.com/news/(Insilico Medicine) https://www.novonordisk.com/news-and-media/ https://www.tempus.com/news/ https://diagnostics.roche.com/global/en/news-listing/ https://mila.quebec/en/amgen_mila/ https://www.absci.com/ https://www.evotec.com/ https://www.janssen.com/ko/janssen-rnd-data-science
다. 발전 전망
(1) 시장 및 산업 동향
2022년 전 세계 신약개발 인공지능 시장 규모는 11억 달러로 추산되었으며, 2023∼2030년까지 연평균 성장률 29.6%로 확장될 것으로 예상하고 있다. 2023년 3월 기준 AI 신약개발 관련 기업들의 누적 총 투자액은 약 602억 달러 정도로 예측되고 있으며, 2015년 이후 AI 기반 제약회사에 대한 투자 금액이 크게 증가한 것으로 조사되었다. 지난 9년 동안 800여개의 AI 신약 플랫폼 기업에 대한 연간 투자 금액은 27배 증가하였고(2022년 12월 기준 누적 총 539억 달러), 의약품 개발 회사의 AI에 대한 투자액은 136억 8,000만 달러였으며, 가장 빠른 성장은 2021년으로 파악된다. 시장 현황은 미국이 여전히 인공지능 기업의 점유율면에서는 선두에 있지만(58%, 2022년 기준), 아시아와 중동 지역에서 인공지능 기술 활용이 확대되고 있고, 특히 중국을 비롯한 아시아-태평양 지역에서는 약물 개발을 위한 인공지능 기업의 수가 증가하는 추세로 이러한 추세는 계속 유지될 것으로 예상된다. 신약개발 시장에서 AI 신약 플랫폼 기술은 산업현장에서 새로운 약물 발견 및 생산 비용을 줄이기 위한 자극이 되고 있으며 이런 자극이 증가하는 만큼 신약개발 시장을 주도할 것으로 보인다.

출처: Deep Pharma Intelligence. Landscape Overview Q1 2023 참고
[그림 특집 2-4] AI 신약개발 관련 기업들의 누적 총 투자액과 연간 투자액 추이(2014∼2023.3)
출처: Deep Pharma Intelligence
[그림 특집 2-5] 전 세계 지역별 800여 개 AI 신약 플랫폼 기업 분포 현황
(2) 국내 관련 정책 동향
국가적 차원에서는 산학연에서 기개발 중인 분석 모듈과 플랫폼을 고도화하고, 새로운 인공지능 기반 학습 모델도 추가 개발하는 투트랙 사업 추진을 계획하고 있다(인공지능 활용 혁신신약 발굴사업, 2022∼2026년, 후보물질 4개 이상 IND 신청을 목표로 하고 있다). 정부의 디지털바이오 5대 인프라 12대 핵심기술 육성 방향 중 연구 속도 성공확률 향상을 위하여 2026년까지 인공지능 모델을 활용한 신약 후보물질 4개 이상 발굴 및 IND 신청을 목표로 정하고 있다. 정책 적합성 측면에서는 디지털융합・플랫폼・기술경쟁 등의 패러다임 변화주도, 국가 R&D 공백 해소 등 정책적 중요도 및 시급성을 고려하여 최종 17개 중 한 개로 AI 신약 플랫폼 기술을 선정하였다. 또한 기술고도화 측면에서 시장 수요 및 사업화 연계 R&D 기획 및 학・연・벤처 교육・컨설팅, 전임상시험 지원 등 추가 R&D 사업을 확대 지원하기로 하고, 특히 2023년 3월 한국형 AI 신약개발 연구협력모델 구축사업의 필요성을 인식하여 19개 제약사가 참여하는 AI 신약개발 전문위원회를 출범시켰다.
(3) 국외 산업 동향
현재 AI 산업에서 주요 역할을 담당하고 있는 미국은 많은 기업들이 R&D, 연구센터 및 연구소에서 인공지능을 활용하고 본 기술에 투자하는 주요 참여자가 되고 있으며, 미국 식품의약국(FDA)은 규제 과학 분야에서 인공지능 활용을 탐구하기 위한 프로그램을 도입하고 있다. EU, 이스라엘, 영국, 호주 등에서도 AI 신약 플랫폼 기술을 국가 주요 전략기술로, MIT Technology Review, 세계경제포럼(WEF) 등에서도 국내 미래유망기술로 선정하였다. 뿐만 아니라, 아시아 국가도 AI 기술 주도권확보를 위해 발 빠르게 다양한 프로그램들을 개발하고 있다. 일본 경제산업성(Ministry of Economy)은 AI 기반의 약물 발견 기술 개발을 촉진하기 위한 프로그램을 설립하였고, 중국은 중국 최고의 경제 기획 기관인 국가개발개혁위원회에서 “Made in China 2025” 계획을 발표, 2025년까지 AI 기술의 세계적 선두 주자가 될 것을 선포하였다.
라. 발전 과제
(1) 도전 과제
(가) 데이터의 질과 유효성
AI 알고리즘은 대량의 고품질 데이터를 요구하며, 또한 제약산업 데이터는 접근과 통합의 어려움이 있다. 그러므로 데이터 기반의 바이오 R&D 혁신을 위해서는 고품질 데이터의 수집・공유・활용이 선순환되는 생태계 조성이 필요함이 계속 강조되어 오고 있다. 2022년 10월 기준으로 국내에서는 국가 바이오 데이터 스테이션 (K-BDS) 구축을 통해 약 146만 건(유전체 126만, 화합물 19만 7,000건 등)의 데이터가 확보되어 있다고 한다. 또한 국가는 바이오 연구데이터 활용 기반 조성 사업을 통해 FAIR 원칙(Findable(검색용이성), Accessible(접근성), Interoperable(상호호환성), Reusable(활용성))을 준수하는 국가 바이오 데이터 스테이션 구축을 위해 2026년까지 총사업비 1,780억 원을 투자할 계획이라고 밝혔다. 본 사업을 통해 고품질의 유효성 있는 대량의 데이터들이 수집・공유・활용되어 AI 신약 플랫폼 기술 개발에 잘 활용될 수 있기를 기대해 볼 수 있다.
(나) 규제(Regulation)와 윤리적 문제
초기 단계의 AI 신약개발 관련 활용 규제 가이드라인이 강력하게 요구되고 있으며, 사용하는 데이터와 알고리즘 편향 관련 문제도 발생할 수 있음을 고려한 윤리적 문제에 대한 가이드라인도 요구되고 있다. AI에 의한 인간 의사결정 대체 가능성에 대한 문제도 일각에서는 제기되고 있다. 이에 국제기구 활동을 통한 AI융합 바이오기술에 대한 표준 및 윤리적 가이드라인 마련에 참여, 국내 법・제도에도 반영하고자 국가적 차원에서 노력하고 있음은 고무적인 현상이다. 그리고 AI가 도입되는 연구 분야마다 분야별 특성을 고려한 가이드라인들이 제시되고 있다. 뇌연구 분야에서는 인간의 존엄성, 인간 증강 등을 마련하고 있으며(OECD-STEPI), 합성생물학 분야에서도 데이터 등에 대한 표준개발(KSBA-GBA) 마련에도 적극 참여하고 있다. 디지털바이오 육성을 위한 법적 기반을 마련하고 합성생물학 등 전략적 육성이 필요한 기술별로 법적 지원 근거 마련을 위해 관련 법령을 제・개정하고, 연구개발전략 수립부터 제품화까지 과정에서 규제를 극복할 수 있도록 민관합동 바이오 규제개선반도 본격 운영하여 AI 기술 활용이 신약연구 분야에 잘 정착하기를 희망한다.

출처: 저자 작성
[그림 특집 2-6] AI 신약플랫폼 기술 관련 3가지 큰 도전과제들
데이터 생산・축적・관리 선진화 | 데이터 활용 활성화 | |||
바이오데이터의 전략적 생산 및 제도개선을 통해 글로벌 수준으로 데이터 생산・축적・관리체계 구축 | + | 데이터를 분석・활용할 수 있는 환경조성을 통해 데이터 기반 바이오 연구개발로의 전환 촉진 | ||
⇕ | ||||
바이오데이터 허브 구축 | ||||
데이터 공유 기반 조성을 위한 국가적 허브 플랫폼 ‘국가 바이오데이터스테이션(K-BDS)’ 구축 | ||||
출처: 인공지능신문(https://www.aitimes.kr)
[그림 특집 2-7] AI 신약 플랫폼 기술 관련 도전과제 해결을 위한 정부의 노력방안과 정책
(2) 인력양성
바이오 분야의 융합형 인력양성 및 현장에서 필요한 인력에 대한 미스매치 문제 해결을 위한 다양한 고급인력 양성방안이 필요하다. 디지털바이오 융합형 인력양성을 위한 석・박사급 대상 교육 프로그램 활성화 및 산・학・연・병 간 융합 연구 촉진 방안이 요구되고 있다. 이에 교육프로그램은 교육・연구・산업 현장 간 유기적 연계가 가능토록 프로젝트 중심의 바이오+디지털 융합교육 프로그램으로 운영되어야 할 필요가 있다. 이러한 전문인력양성을 위해 정부에서는 디지털바이오 혁신인재 양성 프로그램(안)(2024년∼)을 발표하였다. 융합형 인력양성 프로그램을 활성화하기 위해 교육・연구・산업 현장 간 유기적 연계가 가능하도록 사업 중심의 융합교육 프로그램 신설을 추진하고, 바이오 데이터 분석・활용 전문역량을 갖춘 바이오데이터 조정자(코디네이터) 양성도 함께 추진될 전망이다. 아울러, 디지털 융복합 미래 의료 기술개발사업을 통해 융합형 의사과학자(MD-Ph.D.) 양성도 2023년부터 본격 착수할 계획임을 발표하였다. 정부는 AI・빅데이터 활용 신약개발 전문가 등 정보통신기술(IT)과 생명공학기술(BT)을 융합한 인재를 5년간(2023∼2027년) 4,000명 양성하겠다는 계획도 발표함으로써 AI를 이용한 신약개발 분야의 유능한 인재 개발을 위한 지원과 노력을 구체화하고 시행하고자 하는 의지를 정책에 반영하고 있는 것으로 보인다.
참고자료 |
∙ Nature Biotechnology. 2019 37(9), p1,038
∙ Drug Discov Today. 2021 26(7), p1,680
∙ Chem. Rev. 2019 119, p10,520
∙ Bioinformatics. 2019 35(22), p4,862
∙ Nature Reviews Drug Discovery 2022 21, p175
|
|
|
특집 제2장 디지털바이오의 성공사례 및 향후 발전 전망 |
|
제2절 휴먼 디지털 트윈 |
가. 개요
(1) 디지털 트윈 기술
디지털 트윈은 현실 세계를 3D 모델로 가상화하고 다양한 데이터를 연계・시각화하여 실시간 자동관제 및 시뮬레이션 기반 분석・예측・최적화를 구현하는 융합기술로 정의할 수 있다.7) 개별 요소기술이 아닌 다양한 ICT기술이 집적된 융복합 기술에 해당한다.

출처: 디지털 트윈 기술 K-로드맵, 정보통신기획평가원, 2021
[그림 특집 2-8] 디지털 트윈 개념도
디지털 트윈 기술 K-로드맵에 의하면 디지털 트윈 기술발전을 5단계로 정의하고 있다. ① 물리대상을 디지털 트윈으로 복제하는 모사 단계, ② 디지털 트윈 기반 물리대상 모니터링 및 관계분석을 통해 제어하는 관제 단계, ③ 디지털 트윈 모의결과를 적용한 물리대상을 최적화하는 모의 단계, ④ 최적화된 개별 물리대상들이 상호연계된 복합 디지털 트윈으로 재구성되고 물리대상 상호운영을 최적화하는 연합 단계, ⑤ 개별 및 복합 디지털 트윈에서 자율적으로 문제점을 인지하고 해결하여 물리대상을 최적화하는 자율 단계가 그것이다.6)
(2) 휴먼 디지털 트윈
휴먼 디지털 트윈은 메디컬 트윈(Medical Twin), 헬스 아바타(Health Avatar), 헬스케어 디지털 트윈(Healthcare Digital Twin) 등의 이름으로 기술되어 왔다. 이는 디지털 트윈의 적용 분야 특성을 반영한 정도의 차이만 있는 것으로 사람의 신체에 디지털 트윈을 적용한 기술적인 차이는 없다고 할 수 있다. 그리고 기계, 제조 등의 타 적용 분야와 비교하면 디지털 트윈의 요소 기술 중 시뮬레이션 기반 분석・예측・최적화에 있어 수치 방정식으로 표현이 가능한 기계・역학적 모델보다 딥러닝과 같은 데이터 기반의 통계 모델을 적용하는 경우가 휴먼 디지털 트윈에서는 더 많은 것이 특징이라고 할 수 있다. 이는 심장 혈류 시뮬레이션 등에서 유체역학 모델을 적용한 경우를 제외하면 외부 요인에 의한 신체의 변화가 기계・역학적으로 잘 정의된 것이 부재하기 때문일 것이다.
앞으로 휴먼 디지털 트윈에 대하여 인체 장기, 신체 일부, 건강관리와 같은 생체의학(biomedicine)적 관점에서 국내외 주요 사례들을 각각 기술한다. 마지막으로 휴먼 디지털 트윈의 발전 전망을 제시하는 것으로 마무리하고자 한다.
나. 인체 장기에 대한 휴먼 디지털 트윈 기술 사례
(1) 프랑스 Dassult System의 ‘The Living Heart Project’ 사례
Living Heart Project는 심혈관 연구자, 교육자, 의료 기기 개발자, 규제 기관 및 심장병 전문의들이 함께 맞춤형 디지털 인간 심장 모델을 개발하고 검증하는 데에 주력하고 있다. 디지털 인간 심장 모델은 심혈관 의학을 위한 통합 기반을 마련하고 교육, 의료 기기 설계, 테스트, 임상 진단 및 규제 과학을 위한 공통 기술 기반으로 활용할 수 있다. Living Heart Project는 상용화 가능한 심장 모델의 공동 개발과 신규 디지털 치료법을 활용하는 방법으로 개발되고 있다. 미국 FDA와의 협력으로 가상 환자를 대상으로 한 계산 모델링과 시뮬레이션을 통해 임상 시험 효율성을 향상시키고 있다. Living Heart의 3D 심장 모델을 활용한 프로젝트는 심혈관 의료기기 승인을 위한 디지털 임상 근거로 심장 시뮬레이션 결과를 사용할 예정이다.

출처: Dassault Systèmes’ Living Heart Project, Springer, 2022
[그림 특집 2-9] 심장 모델링 및 시뮬레이션 예시
(2) 대동맥에 대한 휴먼 디지털 트윈 사례
혈압 조절은 심혈관 시스템에서 가장 중요한 통제 메커니즘 중 하나이며, 혈압 조절 장애는 매우 유해한 결과로 이어질 수 있다. 따라서 혈압 조절을 시뮬레이션하고 분석하는 모델 개발은 매우 중요한 영역 중 하나이다. 덴마크의 올보르(Aalborg) 대학 연구팀에서는 혈압 조절기가 위치한 인간 대동맥 아치 관련 디지털 트윈 모델을 개발하였다. 이 모델은 박동 혈류 영역과 동맥벽 영역을 결합하면서 점탄성 특성까지 고려하도록 구성하여 혈압 조절에 대한 이해를 높이고 심혈관 시스템의 건강 상태까지 평가할 수 있다.

출처: Digital Human Modeling and Medicine, Elsevier, 2022
[그림 특집 2-10] 대동맥에 대한 모델링과 시뮬레이션 예시
(3) 신체 기도에 대한 휴먼 디지털 트윈 사례
에어로졸 요법은 천식 등 호흡기 질환을 치료하는 데 사용되는 일반적인 임상 기술이다. 에어로졸 요법의 효율성은 기관 내 약물이 어떻게 배포되는지에 따라 달라진다. 최근 몇 년간, 몇 가지 흡입기 장치가 설계되어 호흡기 내 에어로졸 약물의 배포를 개선하는 데 이용되고 있다. 기관 내 성형체가 염증, 조직 반응 및 기타 부작용을 유발하기도 하고 특정 영역에 에어로졸 과다 투여 등으로 부작용이 발생하는 경우도 있다. 스페인의 UPNA 대학 연구팀에서는 신체의 기도에 대한 디지털 트윈 모델링과 입자역학 기반 시뮬레이션을 개발하였다. 환자 기도 내의 입자 침착 운동에 대한 분석으로 호흡기 질환에 대한 환자 맞춤형 치료가 가능하여 환자 상태 개선이 가능하다.
(4) 중증 경동맥 협착 탐지를 위한 휴먼 디지털 트윈 사례
영국의 스완지(Swansea) 대학 연구팀에서는 중증 실어증을 감지하는 방법에 휴먼 디지털 트윈을 적용하였다. 혈류 및 머리 진동 모델을 함께 사용하여 서로 다른 폐쇄 정도에 대한 가상 머리 진동 데이터를 생성하고 실제 머리 진동은 가상 데이터와 비교하여 좁아진 혈관의 중증도를 결정하는 기술을 개발하였다.8) 머리 진동 데이터를 이용한 휴먼 디지털 트윈으로 정확성을 높일 수 있었으며 임상 실습에도 사용될 수 있도록 개발되었다. 본 연구는 실어증 또는 뇌졸중의 잠재력을 지속적으로 모니터링할 수 있는 휴먼 디지털 트윈의 형태로도 발전이 가능할 것으로 기대된다.
(5) 심장에 대한 휴먼 디지털 트윈 사례
독일의 뮌헨 공과대학교(Technische Universität München) 연구팀은 환자의 심장 기능을 시뮬레이션하는 수치 계산 기반 휴먼 디지털 트윈 모델을 개발하였다. 이 모델은 심장과 혈관 시스템의 전반적인 생리학적 데이터를 효율적으로 측정하고 심장 기능의 변화를 심근 조직 내의 국소적인 기계적 양에 대해서도 모델링 가능하다. 약리학적으로 유도된 돼지의 심장에 대한 in vivo 실험 데이터와 디지털 트윈 기반 모델의 예측 결과를 비교한 결과 매우 유사하게 일치하여 이 모델이 인간 신체 실험에서 측정할 수 없는 심근벽 스트레스와 변형의 변화를 모델링하고 시뮬레이션할 수 있음을 보여준 사례라고 할 수 있다.

출처: An in silico twin for epicardial augmentation of the failing heart, International Journal for Numerical Methods in Biomedical Engineering, 2019
[그림 특집 2-11] 3D 심장에 대한 시뮬레이션 모델
다. 신체 일부에 대한 휴먼 디지털 트윈 기술 사례
(1) 근골격계에 대한 휴먼 디지털 트윈 사례
한국전자통신연구원 연구팀은 근골격계에 대한 휴먼 디지털 트윈으로 관절염, 자세 이상 질환 등의 시뮬레이션 기반 변화 예측과 지능형 분석 및 3차원 정보 제공을 통한 진단 조력에 활용이 가능한 기술을 개발하였다. 관절 관성 센서, 신체 압력 분포, 생체 신호 등의 착용형 다중 센싱 기반 동작 데이터 획득으로 근골격 휴먼 디지털 트윈을 생성하고 다중 비전 센서 기반의 동작 분석을 위한 자세 인식 기술과, 가상 인체의 동작을 통해 질환이 빈번한 관절에 걸리는 비정상적인 힘을 해석하는 3차원 시뮬레이션 분석 모델 개발로 개인 맞춤형 디지털 트윈 융합 컨텐츠 서비스 제공이 가능한 기술을 개발하였다.
(2) 발에 대한 휴먼 디지털 트윈 사례
발과 발목은 신체의 균형을 유지하고 보행을 돕는 중요한 역할을 한다. 발과 발목은 복잡한 구조로 되어 있어 다양한 움직임을 할 수 있다. 발은 26개의 뼈로 구성되어 있으며, 하체의 긴 뼈와 함께 총 33개의 관절을 형성하고 있다. 이 뼈들은 100개가 넘는 인대의 복잡한 네트워크로 연결되어 있어, 발의 움직임 중에 엄청난 압축력과 전단력을 견디면서도 높은 안정성을 제공한다. 컴퓨터 모델링과 시뮬레이션은 발과 발목의 수술을 최적화하는 데 도움이 될 수 있다. 벨기에 브뤼셀 자유대학교(Libre de Bruxelles) 연구팀에서는 발의 해부학적 특성을 반영한 디지털 트윈을 만들고 유한 요소 모델로 환자 맞춤형 분석이 가능한 연구를 수행하였다. 현재까지 개발된 다양한 발 모델은 발과 발목의 생체역학적 지식을 증가시키는 데 유용했지만, 환자 특이적 발 모델을 생성하는 것은 오래 걸리고 지루한 수동 프로세스이며 임상 요구 사항을 충족하기에는 너무 많은 계산 부담을 초래하는 등 임상 현장에서 활용하기에는 아직 단점이 많은 상황이다.
(3) 턱에 대한 휴먼 디지털 트윈 사례
싱가포르 국립대학의 연구팀은 하악골 결손에 대한 재건으로 맞춤형 보철물 제작을 위하여 디지털 트윈 모델을 사용한 연구를 수행하였다. 하악골 결손은 외상, 종양 절제, 감염으로 인한 심각한 골 손실로 인해 발생할 수 있다. 하악골 결손은 근육의 당김으로 인한 나쁜 교합을 유발하는 잔여 연조직의 수축, 저작 및 비대칭을 유발하는 치아의 붕괴, 삶의 질에 영향을 미치는 연하 및 발음 문제를 일으킬 수 있다. 다양한 방법으로 하악골 재건을 시도하지만, 생체역학을 고려하지 않는 방법은 실패하는 경우가 많은 것으로 알려져 있다. 최근에 엔드프로시스 또는 맞춤형 보철물의 형태로의 알로플라스틱 교체 방법을 사용하고 있다. 본 연구팀은 먼저 임상에서 사용하기 전에 뼈이음(osteosynthesis) 플레이트 또는 맞춤형 보철물 형태의 임플란트를 설계하고 하악골의 스트레스와 변형에 대해서 유한 요소 분석의 시뮬레이션 방법으로 반복 확인이 가능한 기술을 개발하였다.
라. 생체의학(biomedicine)적 관점에서의 휴먼 디지털 트윈 기술 사례
(1) 노인 만성 피부 질환 관련 휴먼 디지털 트윈 사례
한국전자통신연구원에서는 노인 만성 피부 질환(압박궤양, 족부궤양)의 최적화된 예방・치료・관리를 위해 인체의 압력 분포와 족부의 수분함량・피부조직・혈관을 디지털 트윈화하고 인공지능으로 분석 진단이 가능한 개인 맞춤형 압박궤양・족부궤양 진단・예측・디지털 가이던스 제공 기술을 개발 및 디지털 치료제 서비스 형태로 실증까지 진행하는 연구 과제를 수행하고 있다. 본 기술 개발 과제를 통해서 확장 현실 플랫폼 기반의 협진, 원격 진단・치료 가이드 제공이 가능한 기술을 개발하고 있다. 본 기술로 환자를 트윈화 하여 플랫폼을 통해 공유함으로써 의사 간 협진이 가능하고 인공지능 기반 복합적 의료영상 분석으로 진단정확도를 향상하고 소요 시간은 단축될 것으로 기대되고 있다.
(2) 신경근골격계 질환 관련 휴먼 디지털 트윈 사례
한국전자통신연구원 연구팀에서는 의료 정보에 기반한 신경근골격계 휴먼 디지털 트윈 생성과 시뮬레이션을 통한 뇌손상 질환 원격 재활 관리 및 운동 가이드 생성이 가능한 최소 의료정보 기반 신경근골격계 디지털 트윈 기술을 개발하고 있다. 휴먼 디지털 트윈 시뮬레이션을 통해서 신경근골격계 질환 예측 평가가 가능하고 사용자의 움직임과 시뮬레이션 기반 예측 결과를 융합 제시하는 휴먼 디지털 트윈 가시화 기술까지 개발하고 있다. 본 기술 개발로 ICT 기술을 의료 분야에 적용하여 개인 맞춤형 트윈 생성, 시뮬레이션, 3차원 증강 가시화 기반 치료 훈련 등의 휴먼 디지털 트윈을 활용한 신의료융합형 시장 창출 및 글로벌 국가경쟁력 확보에 기여할 것으로 기대되고 있다.
(3) 당뇨 관리 관련 휴먼 디지털 트윈 사례
‘디지털 치료제 활성화를 위한 XR 트윈 핵심 기술 개발’ 사업의 일환으로 가톨릭대학교 연구팀에서는 1형 당뇨병 관리를 위한 인슐린 주입, 연속 혈당 및 라이프로깅 데이터 통합 플랫폼에 기반한 휴먼 디지털 트윈 기술을 개발하고 있다. 인공지능 기반 데이터 뱅크 분석을 통한 심층 디지털 표현형과 디지털 트윈 모델링 기술 그리고 트윈 기반 식이・활동량에 실시간 연동되는 혈당 변화 예측 AI 기술이 탑재된 환자용 모바일 앱 형태로 구현되고 있다. 본 연구로 개발한 기술을 통해 당뇨병에 의한 의료 및 사회비용을 절감할 수 있을 뿐만 아니라 의료서비스 불균형화의 심화를 막고 효율적인 의료서비스 제공 및 서비스 품질 향상이 가능할 것으로 기대된다.
(4) 감정노동자의 정신건강 관련 휴먼 디지털 트윈 사례
한국과학기술원 연구팀에서는 감정노동으로 인한 정신건강 관리를 위해 스트레스 위험요인들의 작동과정을 가상환경에서 휴먼 디지털 트윈으로 모델링하고 동기화・시뮬레이션하여 개인 맞춤 스트레스 위험관리 솔루션을 제공하는 기술을 개발하고 실증까지 진행할 계획이다. 본 연구개발 과제는 정신건강 영역에서 휴먼 디지털 트윈 기술을 적용한 사례이다. 휴먼 디지털 트윈을 통해 개인의 정서 반응, 신체 반응, 스트레스 유발요인 객체 기반 스트레스 위험 정밀 예측 모델링이 가능하고 통합 시뮬레이션 기반의 실시간 개인 스트레스 예측까지 가능하다. 감정노동이라는 스트레스와 정신건강 관리가 중요한 영역에서 ICT 기반의 사회문제 해결이 가능한 사례라고 할 수 있다.
(5) 고령자 건강관리를 위한 휴먼 디지털 트윈 사례
현재 클라우드 컴퓨팅, 사물인터넷 및 모바일 인터넷과 같은 기술들이 의료 분야에서 널리 사용되고 있으나 대부분의 연구는 플랫폼 집중화와 데이터 모니터링에 초점을 맞추고 있으며, 노인들을 위한 실시간 모니터링 또는 위기 경고에 대한 연구는 적은 편이다. 캐나다의 맥마스터(McMaster) 대학 연구팀이 디지털 트윈 기술을 의료 분야 특히 노인들을 위한 클라우드 기반 의료 서비스에 적용하는 기술을 개발하였다. 본 연구에서 휴먼 디지털 트윈은 의료 서비스에서 노인들의 실시간 모니터링과 위기 경고 등의 문제를 해결하기 위해 사용되었다. 휴먼 디지털 트윈이 클라우드 기반의 프레임워크에서 동작하도록 구현한 것이 특징이라 할 수 있다.

출처: A Novel Cloud-Based Framework for the Elderly Healthcare Services Using Digital Twin, IEEE Access, 2019
[그림 특집 2-12] 휴먼 디지털 트윈과 클라우드를 통한 고령자 건강관리 서비스 개념도
바. 발전 전망
이상으로 다양한 경우의 휴먼 디지털 트윈 연구개발 사례들을 살펴보았다. 현재까지 기술은 연구 시제품 정도의 수준이고 임상에 활용되는 경우는 극히 일부분으로 보인다. 하지만 비대면 의료 등과 같은 언택트 서비스에서는 휴먼 디지털 트윈이 매우 중요한 요소 기술로 자리를 잡아 임상에 활용이 가능한 수준으로 발전할 것으로 기대된다.
기술적 측면에서 휴먼 디지털 트윈은 사람의 인체 장기에서 세포 단위까지의 마이크로 방향을 하나의 축으로 하고 사람의 신체 일부에서 신체 전체와 유전체, 의료, 건강, 환경 정보 등까지 모델링하고 시뮬레이션이 가능한 매크로 방향을 또 하나의 축으로 발전할 것이다. 그리고 의료기기, 의료진, 환경적 요소 등이 추가적으로 디지털 트윈과 연동하고 연합하는 방향으로 발전할 것으로 예상된다.
향후 휴먼 디지털 트윈의 활용에 있어 중요성이 커질 시뮬레이션 부분은 물리법칙에 따른 수치 모델링 방법보다 딥러닝과 같은 데이터 기반의 통계적 모델이 더 많이 활용될 것으로 보인다. 현재는 모든 경우를 포함하는 데이터가 확보되지 않은 상황이라 통계적 방법에 오류가 클 수 있으나 대규모의 학습 데이터 구축과 인공지능 기술의 발전으로 이러한 오류는 매우 빠르게 줄어들 것으로 예상된다.
|
참고자료 |
∙ 디지털 트윈 기술 K-로드맵, 정보통신기획평가원, 2021
∙ Dassault Systèmes’ Living Heart Project, Springer, 2022
∙ Digital Human Modeling and Medicine, Elsevier, 2022
∙ A semi-active human digital twin model for detecting severity of carotid stenoses from head vibration-A coupled computational mechanics and computer vision method, International Journal for Numerical Methods in Biomedical Engineering, 2019
∙ An in silico twin for epicardial augmentation of the failing heart, International Journal for Numerical Methods in Biomedical Engineering, 2019
∙ A Novel Cloud-Based Framework for the Elderly Healthcare Services Using Digital Twin, IEEE Access, 2019
|
|
|
특집 제2장 디지털바이오의 성공사례 및 향후 발전 전망 |
|
제3절 디지털헬스케어 |
가. 디지털헬스케어 개요
의료서비스가 ‘처방’ 중심에서 ‘예방’ 중심으로 변화하고, 정보통신기술(ICT), 인공지능(AI), 빅데이터, 모바일 등 4차 산업혁명의 주요 키워드가 임상현장에 반영됨에 따라 ‘디지털 헬스케어’ 시대가 빠르게 다가오고 있다. 또한 코로나19의 팬데믹을 거치며 개인의 건강에 관해 관심이 크게 높아짐에 따라 인공지능기술 및 비대면 의료서비스 도입 등이 가속화되면서 병원 및 의료기기 산업의 디지털화는 더 이상 미래가 아닌 당장 경험할 수 있는 사회현상으로 자리잡았다.

출처: 한국과학기술한림원, 디지털 헬스케어-건강관리의 새로운 패러다임, 2020
[그림 특집 2-13] 디지털 헬스케어-건강관리의 새로운 패러다임
디지털 헬스에 대한 정의는 다양하게 제시되고 있으며, 과학기술정보통신부에서는 의료의 질 향상과 의료비 절감을 위한 행위에 ICT 기술이 융합된 개인 건강 및 질병 관리 산업・기술을 디지털 헬스로 정의하였다. 또한, 최근 발의된 ‘디지털헬스케어 진흥 및 보건의료데이터 활용 촉진에 관한 법률’에서는 ‘지능 정보기술과 보건의료데이터를 활용하여 질병의 예방・진단・치료 및 건강관리 등 국민의 건강증진에 기여하는 일련의 활동과 수단’으로 정의하고 있다. 이 외에도 디지털 헬스는 건강증진 목적이나 의료행위 포함 여부, 의료기기 및 관련 기술과의 연계성 여부 등에 따라 달리 정의되기도 한다. 일반적인 기술 분야로는 인공지능(AI) 의료기기, 디지털 치료기기, 웨어러블, 의료로봇, 3D 프린팅, 원격의료 등이 있지만 여기서는 소프트웨어 의료기기인 인공지능 의료기기, 디지털 치료기기 등 소프트웨어 의료기기에 한정해서 분석해 보고자 한다.
나. 디지털헬스케어 시장현황
(1) 글로벌시장 현황
GIA(Global Industry Analysts)에 따르면, 디지털헬스케어의 글로벌시장은 2020년 1,520억 달러에서 2027년 5,090억 달러 규모로 연평균 성장률이 18.8%로 전망되어 글로벌 제약시장의 평균 성장률인 3%보다 6배 이상 큰 것으로 평가된다. 기존의 의료기기 기업뿐만 아니라 ICT 기업 및 스타트업 등 다양한 기업들이 디지털헬스케어 글로벌시장에 진출함에 따라 시장의 성장이 가속화될 것으로 전망된다. 한 가지 주목할 점은 디지털 헬스 산업의 상당 부분을 차지하고 있는 원격의료 분야가 지금까지 우리나라에서 불법으로 분류되고 있고, 이는 OECD 국가 중 우리나라가 유일하여 가급적 이른 시일 내 개선될 필요가 있다.
(단위: 십억달러)

출처: 삼일PwC경영연구원, 디지털 헬스케어의 개화-원격의료의 현주소, 2022; 한국보건산업진흥원 재인용
[그림 특집 2-14] 디지털헬스케어의 글로벌시장(2020~2027)
(2) 국내시장 현황
올해 초 산업통상자원부와 한국디지털헬스산업협회에서 ‘2021년 디지털헬스케어산업 실태조사’를 발표하였다. 디지털헬스케어 시장의 급격한 성장에 따라 2020년부터 조사한 실태조사로, 2020년 1조 3,539억 원 대비 34.6% 성장한 1조 8,227억 원으로 조사되었으며, 이 중에서 의료기기 매출이 9,731억 원으로 가장 높은 매출이 발생하였다.

출처: 산업통상자원부, 2021년 디지털헬스케어산업 실태조사 발표, 2023
[그림 특집 2-15] 디지털헬스케어산업 매출 규모(2021)
하지만 디지털헬스 분야 국내시장은 아직 본격적인 형성 이전 단계로 평가되며 매출 등의 규모는 크지 않으나 2022년 이후 각종 규제 등의 측면에서 물꼬가 트여 가시적인 성과가 나오기 시작하고 있다. 예를 들어 대표적인 인공지능 의료기기 기업인 루닛에서는 올해 상반기 164억 원의 매출을 발생시켜 지난해 상반기 대비 200% 증가하였으며 뷰노도 올해 2분기 연결 기준 매출액이 30억 원을 넘어섰다고 보고되었다. 우리나라에서 2020년부터 혁신의료기기를 지정해 온 이래 올해 8월 31일 기준 총 44건이 지정되었고 이 중 70%가 소프트웨어 의료기기로 분류될 정도로 기술개발이 활발하게 이루어지고 있다.
다. 디지털헬스케어 의료기기의 기술동향
디지털헬스는 건강정보 기술, 데이터 및 정보 기반의 건강관리 등의 분야와 질병에 대한 진단 또는 치료 등을 위한 의료기기 분야 등 다양한 분야가 포함되어 있다. 디지털헬스에 포함되는 의료기기 분야는 소프트웨어 의료기기(Softwaer as Medical Device, SaMD)와 하드웨어가 접목된 디지털 의료기기 등으로 구분될 수 있는데 소프트웨어 의료기기로는 인공지능을 활용한 의료기기, 디지털치료기기가 대표적인 예시이다. 하지만 웨어러블 기기 포함 전통적인 하드웨어 기반 의료기기도 이와 같은 소프트웨어 의료기기와 융합하여 부가가치를 생성하는 방향으로 발전하고 있다는 차원에서 디지털헬스산업에 포함된다고 보는 것이 타당하다.

출처: 식약처 발표자료 재가공, 범부처전주기의료기기연구개발사업단 발표자료 활용
[그림 특집 2-16] 디지털헬스케어 의료기기 기술동향
(1) 인공지능(AI) 기반 의료기기
제한적이기는 하지만 보건의료 빅데이터들을 다양하게 활용하게 되면서 인공지능 기술의 수준이 한층 높아졌으며, 이를 통한 진단의 정확도도 향상되고 있다. 범부처전주기의료기기연구개발사업 등 다양한 국가 주도 R&D사업을 통하여 2020년부터 인공지능 기반 의료기기 개발을 위한 다양한 연구개발 과제를 지원하고 있다. 주요 개발 주제로 뇌질환, 폐질환 등에 대한 의료영상 기반의 진단보조 소프트웨어 의료기기, 생체신호 기반의 심혈관질환 예측 소프트웨어 의료기기, 기존 하드웨어 의료기기와 인공지능 소프트웨어 의료기기가 융합된 의료기기 개발 등이 진행되고 있다. 최근 짧은 시간 내에 촬영하여 잡음이 많은 MRI나 CT 영상을 기존의 촬영 시간 동안 찍은 영상과 동일한 수준으로 향상시켜주는 인공지능 소프트웨어 의료기기가 개발되어 FDA 인증까지 완료한 바 있다.
인공지능 기반 소프트웨어 의료기기는 2017년 11월 식약처에서 ‘빅데이터 및 인공지능(AI) 기술이 적용된 의료기기의 허가심사 가이드라인(민원인 안내서)’을 발간하여 의료기기로 인허가받을 수 있는 환경이 조성되었다. 2018년 5월 ㈜뷰노의 골연령측정 의료영상분석소프트웨어의 제1호 허가를 시작으로, 2022년 12월 31일 기준 총 149건의 인공지능(AI) 의료기기가 식품의약품안전처로부터 인허가(신고・인증 포함) 완료되었다.
그 결과 루닛, 뷰노, 딥노이드, 제이엘케이, 셀바스 AI, 마인즈랩 등 인공지능 기반 의료기기 기업이 시장에 상장되어, 투자유치와 제품개발을 진행하고 있다. 또한 네이버의 라인닥터, 카카오헬스케어 신규 설립과 카카오브레인의 인공지능 모델 연구, SK C&C의 AI 전문기업과의 얼라이언스 구축, KT의 맞춤형 인공지능 개발추진 등 대기업에서도 디지털헬스케어 진출을 본격화하고 있어 인공지능 기반 의료기기 시장에서 다양한 제품개발이 지속될 것으로 예상한다.
(2) 디지털치료기기(DTx)
디지털치료기기(Digital Therapeutics, DTx)는 질병의 예방 및 치료를 목적으로 한 소프트웨어 의료기기로, 다양한 적응증에 대하여 개발이 진행되고 있으며 이와 관련한 시장이 급성장하고 있다. 범부처전주기의료기기연구개발사업 등을 통해서도 2022년부터 임상 현장에서 사용할 수 있는 디지털치료기기 개발을 위한 다양한 지원을 추진하고 있다. 주요 개발 적응증으로 수면 장애, 공황장애, 아동 ADHD 치료기기, 호흡재활 치료 등이 있다. 또한 최근 사회문제로 나타나고 있는 마약과 관련하여 마약류 중독치료를 위한 디지털치료기기도 개발되고 있다.
국내에서는 2020년 5월 식약처의 ‘디지털치료기기 허가심사 가이드라인’ 발표 및 건강보험심사평가원의 DTx 수가(안) 발표 등으로 시장진출을 위한 다양한 제도적 기반이 구축되고 있다. 2023년 2월에는 에임메드사에서 불면증 인지행동 치료 관련한 ‘솜즈’가 제1호 디지털 치료기기로 인허가받았으며, 2023년 4월 웰트사 웰트아이의 2호 허가에 이어, 2023년 8월 현재 식약처 임상시험계획 승인하에 뉴냅스, 라이프시맨틱스 등의 기업에서 확증 임상 21건, 탐색 임상 26건 등 총 47건의 임상시험이 진행되고 있다.
[표 특집 2-7] 국내 디지털 치료기기 식약처 승인 대기 현황
|
개발 기업 |
확증 임상시험 승인일 |
제품명 |
개발 분야 |
|
뉴랩스 |
2019. 7 |
뉴냅비전 |
시야장애 |
|
2022. 8 |
비비드 브레인 |
시야장애 |
|
|
라이프시맨틱스 |
2021. 9 |
레드필 숨튼 |
호흡재활 |
|
웰트 |
2021. 9 |
필로우Rx |
불면증 |
|
2022. 5 |
필로우Rx(DCT 솔루션 적용) |
불면증 |
|
|
하이 |
2021. 12 |
영자이렉스 |
범불안장애 |
|
이모코크 |
2022. 9 |
코그테라 |
경도인지장애 |
|
메디마인드 |
2022. 10 |
알코테라 |
알코올 사용장애 |
|
SMDsolution |
2022. 10 |
SMD SleepDOC |
비기질성 불면장애 |
|
쉐어앤서비스 |
2022. 11 |
이지브리드 |
호흡재활 |
출처: 삼정KPMG, 3세대 신약 디지털 치료제의 투자방향과 미래 재인용; 메디컬타임즈, 국내 1호 디지털 치료기기 처방 임박 가이드라인 마련 시동, 2023.2.9
라. 디지털헬스케어 기업의 글로벌 진출전략
디지털헬스케어 제품의 시장진출전략은 기존의 의료기기와 유사한 부분이 많다. 다만 전통적인 의료기기의 시장진출 과정에서 무수히 겪어온 시행착오를 주목할 필요가 있으며 최근의 성장세와 기술동향 등을 고려하여, 다음과 같은 6대 전략을 제시하고자 한다.
(전략1) 미충족 의료수요(Unmet Needs)와 전주기 프로세스의 준수 및 이행
전통적인 의료기기와 마찬가지로 디지털헬스 제품군도 대부분 의료행위에 활용되기 때문에 임상 현장에서 사용자가 명확하게 정의되어 있다. 기술이 아무리 우수해도 미충족 의료수요에 따른 임상 현장의 요구사항을 충분히 충족시키지 못한다면, 제품개발 이후 시장진입에 어려움이 있을 수밖에 없다. 디지털헬스케어 분야는 다학제간 융합 분야이며 R&D의 비중이 매우 높다. 많은 초기 기업이 국가 R&D 수주에서 시작하여 제품개발을 통해 시장진출을 꾀한다. 또한 디지털헬스 기기를 포함한 의료기기 산업화는 개념 정립-개념검증-시작품 제작-시제품 제작-시험검사-비임상시험-임상시험 등 기존 공산품과 구별되는 추가적인 여러 단계를 거쳐야 하며, 개발하고자 하는 제품에 관하여 R&D 초기 단계에서부터 종합적으로 전주기 프로세스를 이해하고, 이를 고려한 R&D 진행과 기술의 차별성이 필요하다. R&D 수행 과제를 대상으로 이러한 전주기 지원을 수시로 제공할 수 있는 전문화된 지원체계가 필요하며 현재 진행되고 있는 범부처전주기의료기기연구개발사업단(2020~2025)의 예를 충분히 참고할 필요가 있다.
(전략2) 강점 집중과 개방 협력 전략
국내 의료 인공지능 기술수준의 조사 결과 100점 만점 평균 74점으로 최고기술 보유국(미국) 대비 2.7년이 뒤처진 것으로 나타났다.9) 시장에서의 경쟁력 강화를 위해서는 강점에 집중하는 전략이 필요하며, 일반화하거나 적응증을 늘리는 것보다는 잘할 수 있는 분야와 차별화된 가치를 만들 수 있는 분야에 집중하는 것이 필요하다. 또한 국내 인공지능 의료기기 기업들이 개발하고 있는 제품들을 보면 흉부 X-ray, 흉부 CT 및 안저카메라 영상 등을 활용한 기술개발이 상당수이므로, R&D 단계에서 서로의 강점을 유지하면서 다른 부분은 적극적인 개방 협력을 통해 새로운 시너지를 도출해 내야 할 것으로 본다. 이와 같은 개방 협력을 원활히 추진해 나가기 위해서는 신뢰기반 개발 협력 공유 플랫폼 구축 및 서비스 제공을 위한 정부의 주도적인 지원이 필요하다.
(전략3) 타겟마켓 정의 및 비즈니스모델 정립
전략1에서 언급하였던 미충족 의료수요를 기반으로 타깃 마켓의 정의와 해당 타깃 마켓별 비즈니스 모델 정립이 필요하다. 각 나라가 보유하는 의료서비스 구조에 따라 타깃 마켓은 다양하며, 이에 따라 사용자(의료기관)와 보험자(환자 및 일반 국민), 지불자(진료비 등 보상주체)별 속성을 반영한 비즈니스 모델을 고려하여 구축할 필요가 있다. 국내 시장에는 지불자가 국민건강보험으로 단일화되어 있으나, 재정 속성상 수가 부여가 매우 어려운 상황이다. 이를 타파하기 위하여 글로벌 시장에서 출발하여 국내로 확산시키는 모델 등 글로벌 우선 진출전략도 고려할 필요가 있다.
(전략4) 연계수출사업화 및 패키지화 전략
디지털헬스산업의 글로벌 시장진출을 위하여 연관 품목 간 연계, 진료과별 연계 등 상호 보완적인 요소를 통한 기업 간 사업화 협력 방안을 도출할 필요성이 있다. 루닛의 소프트웨어 제품과 GE Healthcare의 하드웨어 영상기기 간 결합이 그 한 예이다. 뷰노와 일본의 플랫폼 기업인 M3 AI와의 협력도 또 다른 예가 될 수 있다. 비즈에이아이(VIZ.ai)와 메드트로닉(Medtronic)간의 협력도 시너지를 기대할 수 있는 좋은 협력 사례가 된다. 또한 수술실에서 활용될 수 있는 제품군, POCT 형태로 활용될 수 있는 진단기기군, 이동형 응급시설에 활용될 수 있는 다양한 제품군 등을 토리텔링 형태의 패키지로 묶어 판매망을 넓히는 것도 하나의 전략이 될 수 있다.
(전략5) 규제 효율화를 통한 선제적 시장진출 촉진
디지털헬스로 분류되는 혁신적인 의료기기들은 신기술이면서 활용 사례가 적은 관계로 공보험 등을 통해 수가를 책정받기가 매우 어렵다. 이를 해결하기 위해 나라마다 나름의 방안을 만들고 시행 중이다. 미국 보험청(CMS)에서는 ‘신의료기술의 과도기적 보험급여 제도(Transitional Coverage for Emerging Technolgies, TCET)’ 발표를 통해 혁신적인 신기술에 대한 보험급여 결정 절차를 새롭게 마련하였다. 독일에서도 2019년 제정된 디지털헬스케어법에 따른 디지털헬스 어플리케이션 사례와 같이 처방형 지원모델을 기준으로 디지털 치료기기에 대해 안전성과 보안, 기능 등 일정 조건을 충족할 경우 1년간 임시수가를 지급하며, 해당 기간 내 임상결과를 평가하여 정식수가를 지급하고 있다. 우리나라에서도 지난해부터 ‘신의료기술평가 유예제도’가 도입되어 최장 3년간 비급여시장에 진입할 수 있게 되었으며, ‘혁신의료기기 통합심사 지정제도’를 통해 안전성은 확인되었지만, 잠재적 유효성만 판단되었던 조건부 신의료기술도 5년간 비급여시장에서 활용될 기회가 생겼다. 혁신적인 디지털헬스 제품이 시장에 선진입할 수 있는 루트로 환영받고 있지만 아직 세부적인 과정상 개선의 여지가 많이 남아있다. 올해 4월 의료기기산업 육성지원 종합계획에 명시된 바와 같이 혁신의료기기 혁신펀드 등을 현실화하는 것도 매우 큰 임팩트를 줄 것으로 기대된다.
(전략6) 글로벌 M&A 활성화 촉진
글로벌 의료기기 시장에서는 다양한 M&A가 진행되고 있으며 그 예로, 기존의 글로벌 의료기기 기업이 디지털헬스케어 기업을 M&A 하거나, IT 기업이 디지털헬스케어 기업을 M&A 하는 사례들이 나오고 있다. 또한 국내 의료기기 기업들도 글로벌 의료기기 기업에 M&A 되는 사례도 다수 나오고 있다. 이를 통해 국내 의료기기 기업의 기술력이 글로벌시장에 진출하여 인정받을 수 있는 계기가 만들어지고 있다. 이렇듯 M&A는 의료기기산업에서 기업의 새로운 출구전략으로 인식되고 있다. 올해 5월 글로벌 의료기기 1위 회사인 메드트로닉에서 총 1조 원 규모의 국내 이오플로우사 지분인수 및 국내 생산기지 확충을 위한 유상증자 추진 사례는 우리나라 의료기기 시장의 성장과 발전을 위한 새로운 모델을 제시한 예로 주목할 필요가 있다.
마. 결론
디지털헬스 분야는 전 세계적으로 많은 관심을 가지고 집중적으로 육성하고 있으며 시장도 빠르게 성장하고 있는 분야이다. 전통적인 의료기기 산업의 거의 모든 분야에 걸쳐 디지털 기술이 접목되면서 임상 의료 전반의 패러다임이 변하고 있고, 새롭게 확대되고 있는 시장인 만큼 지금까지 전 세계 시장을 장악하고 있는 빅테크 기업이 나오지 않았다고 볼 수 있다. 전주기적 R&D 지원, 적극적인 병원 참여, 효율적인 규제과학 등이 체계적으로 진행될 때 우리나라에서 그 주인공이 나올 수 있다.
|
|
|
특집 제2장 디지털바이오의 성공사례 및 향후 발전 전망 |
|
제4절 첨단뇌과학+바이오닉스 |
뇌 작동의 근본 원리를 파악하여 뇌질환 극복 및 공학적 응용에 활용하는 뇌연구 분야에서도 첨단 디지털 기술들을 접목해 기존 연구의 한계를 극복하는 혁신적인 기술들이 잇따라 등장하고 있다. 대표적으로 뇌와 컴퓨터 사이의 통신을 가능하게 하는 뇌-컴퓨터 인터페이스 기술의 핵심 요소인 뇌 신호 측정 및 해석에 신경 인터페이스 같은 첨단 공학기술과 인공지능 기반의 디지털 기술들이 적극적으로 활용되고 있다. 살아있는 신경세포들로 구성된 뇌 오가노이드를 활용하여 바이오컴퓨팅을 구현하는 바이오닉스 기술 개발도 활발히 진행되고 있다. 뇌과학과 첨단 디지털 기술의 융합이 시너지를 이루는 연구성과들과 미래 발전 전망을 살펴보자.
가. 뇌-컴퓨터 인터페이스
뇌-컴퓨터 인터페이스(Brain-Computer Interface, BCI) 연구는 인간의 뇌와 컴퓨터 간의 직접적인 통신을 가능하게 하는 기술 개발에 중점을 둔 연구 분야로 기계 장치의 제어, 인지 기능 향상, 상실된 기능 회복 등 환자 재활이나 가전제품에 적용해 삶의 질을 향상시키는 목적으로 1970년대부터 꾸준히 연구됐다. BCI 연구의 기본 과정은 뇌 신호의 측정과 신호의 해석으로 나눌 수 있는데 신호를 측정 방식에 따라 두피를 뚫고 직접 뇌에서 신호를 측정하는 침습적(invasive) BCI와 두피 밖에서 신호를 측정하는 비침습적(non-invasive) BCI로 구분할 수 있다. 침습적 BCI는 실용화를 고려하여 임상 적용의 안전성을 높이는 방향으로 기술 개발이 진행되고 있고, 비침습적 BCI는 뇌 신호 분석의 정확도를 높이는 방향으로 연구가 진행되고 있다. 뇌 안에 직접 측정 센서를 삽입하지 않고 두개골 아래 뇌막이나 뇌 속 혈관 표면에 삽입하는 최소 침습적 방식인 중재적(interventional) BCI는 침습적 기술의 장점을 취하면서 위험성을 줄일 수 있다. BCI로 인간의 모든 생각과 감정을 주고 받기에는 아직 기술적 한계가 존재하지만 첨단 공학기술과 인공지능이 융합하는 최근의 연구 성과들은 희망적인 전망을 가능하게 한다.
(1) Brain-to-text communication
컴퓨터를 통해 머릿속 생각이나 감정을 글로 옮기는 기술은 BCI 분야에서 오랫동안 연구되었다. 최근 인공지능 분석법의 도입으로 단어 수준이 아니라 하나의 문장으로 표현되는 소통을 위한 BCI 연구에 새로운 발전이 이뤄지고 있다. 생각을 글로 옮기는 BCI를 활용하면, 몸을 자유롭게 움직이지 못하는 사람들도 상상만으로 자신의 생각을 표현할 수 있게 된다.
미국 캘리포니아 대학(버클리) 연구팀은 브레인 임플란트(brain implant) 기술로 환자의 생각을 94% 정도의 정확도, 분당 약 7단어의 속도로 타이핑 하는 기술을 개발했다.10) 뇌파를 인식하는 장치를 통해 뇌파를 받아들인 후 딥 러닝 및 언어 모델링 기술을 사용해 문자 시퀀스를 디코딩하는 방식이다. 신체가 마비되고 말을 할 수 없는 사람의 뇌 활동에서 완전한 단어를 직접 해독하는데 성공한 첫 번째 시연이었다.
미국 스탠퍼드대학교 연구팀은 척추 장애로 수십 년간 거동이 어려웠던 환자의 운동 피질에 마이크로 전극을 삽입하고, 딥러닝 알고리즘을 활용하여 상상만으로도 빠르게 타이핑할 수 있는 시스템을 구현했다.11) 연구팀은 100∼500개의 문장을 단어로 분리해 재조합하여 수많은 문자를 만들어 내고, 이를 활용하여 딥러닝 알고리즘을 학습시켰다. 인공지능 알고리즘을 적용한 결과, 피실험자는 분당 18개의 단어를 타이핑하며 신기록을 세웠다.

출처: Nature, Stanford University ; Science, University of Pittsburgh
[그림 특집 2-17] Brain-to-Text BCI(좌)와 로봇팔-촉각 BCI(우)의 개념도
(2) Two-way neuronal communication
로봇 과학자들은 오랫동안 BCI를 로봇 팔이나 손에 적용하는 기술을 개발하고 있다. 정상적인 사람들은 자신이 가진 감각을 당연한 것으로 여기지만, 사고나 질병으로 감각을 잃은 사람들은 엄청난 고통과 불편을 겪게 된다. 특히 촉각의 경우 시각적으로 물체의 형태를 파악하고 동시에 촉각을 이용해 물체를 적절한 세기로 잡아야 할지 판단하므로 척수 손상에 따른 마비 환자들의 사지 기능을 복원하기 위해 촉각 회복이 중요하다. 감각을 인식하고 신경을 모사하는 기술을 BCI와 통합하는 양방향 BCI 기술의 발전으로, 생각만으로 다양한 물체를 잡을 수 있을 뿐 아니라 옷감과 같은 복잡한 물체도 인식할 수 있는 정교한 로봇 팔의 실용화 가능성이 커지고 있다.
미국 바텔연구소 연구팀은 BCI 시스템을 이용해 척수 손상이 심한 환자의 손 감각을 회복하는 기술을 개발했다.12) 이 기술은 인지할 수 없는 아주 작은 신경 신호를 인공 촉각 피드백을 통해 증폭시켜 연구 참가자에게 되돌려 보냄으로써 운동 기능을 크게 향상시켰다.
피츠버그대학교 연구팀은 사고로 팔을 사용할 수 없는 환자와 함께 BCI 기반의 로봇 팔 연구에서 뇌 운동피질에 전극을 꽂아 뇌 신호를 로봇 팔에 보내고, 로봇 손이 물체를 잡는 순간의 촉감을 다시 뇌 쪽으로 전달하는 기술을 개발했다.13) 뇌의 운동 피질뿐 아니라 감각피질에도 전극을 삽입하여 물체를 만질 때 느껴지는 촉감을 뇌에 전송하는 데 성공했다.
국내에서도 KAIST 바이오및뇌공학과 연구팀이 나노입자 기반의 복합 촉각 센서를 실제 신경 발화 패턴에 기반한 신호 변환 시스템과 연결하여 인간 피부-신경 모사형 인공 감각 인터페이스 시스템을 개발했다.14) 이 기술로 인간의 촉각 인식 프로세스를 모방하는 인공 감각 인터페이스 시스템을 최초로 구현하였다.
(3) 중재적 BCI 기술 : 뇌를 손상하지 않는 최소 침습적 BCI
미국 스타트업 싱크론(Synchron)은 뇌 수술 없이 혈관을 통해 센서를 이식하는 뇌 임플란트 기술을 개발하였다.15) 두개골에 구멍을 뚫거나 뇌 수술을 할 필요 없이, 심장에 스텐트를 삽입하는 것과 유사한 혈관 내 시술로 경정맥을 통해 전극 장치들을 뇌의 운동피질 내 혈관 벽에 삽입하고 가슴 부분에 연결된 안테나를 통해 뇌 신호를 외부 장치로 전송하는 중재적 방식으로 임상시험을 진행 중이다.
미국 스타트업 프리시즌 뉴로사이언스(Precision Neuroscience)는 사람의 두개골 안에 작은 전자 장치를 이식하는 BCI 시스템을 개발하고 있다.16) 사람의 두개골을 너비 약 2cm, 길이 400㎛의 슬릿 형태로 약간만 절개하고, 이를 통해 조직 손상 없이 뇌 표면에 맞도록 설계된 머리카락 두께 정도의 얇고 유연한 필름 소재된 스트립 형태의 전극 어레이를 뇌 조직 위에 있는 보호막인 경질막 아래에 삽입하는 뇌 임플란트 기술을 사용하고 있다.
서울대병원 신경외과를 주축으로 한 국내 연구팀은 최소 침습적 방식으로 사용자의 뇌신호를 분석해 무엇을 말하고자 하는지 파악할 수 있고, 역으로 사용자의 뇌에 전기자극을 가해 정보를 전달하는 방식으로 말없이 생각만으로 외부기기를 제어하거나 타인과 소통할 수 있는 인터페이스를 개발하고 있다.17)
(4) 인공지능 활용 뇌 신호 해석
비침습 BCI는 MRI 장비를 사용하거나 뇌 신호를 측정하는 헤드셋 형태의 장비를 사용하는 방식으로 침습적 시술이 필요 없어 간편하지만, 측정의 정확도는 침습적 방식에 비해 떨어진다. 비침습적 방식으로 뇌 신호를 측정하고 인공지능 기반으로 해석의 정확도를 향상하는 기술은 뇌손상, 뇌졸중, 전신 마비 등으로 혼수상태에 있는 환자와 의사소통에 도움이 될 수 있다.
미국 텍사스대 연구팀은 사람의 뇌 활동을 기능적 자기공명영상(fMRI) 측정과 OpenAI의 대규모 언어 모델인 ‘GPT-1’을 사용하여 생각하거나 상상하는 내용을 문장으로 재구성해 주는 인공지능 시스템을 개발했다.18) 연구팀은 사람이 듣거나 생각하는 것을 단어 단위로 낱낱이 해독하기보다는 인공지능 모델을 사용해 듣거나 생각한 것의 요지를 파악하는 방식을 사용하였다. 그 결과 이야기의 의미 파악에 필요한 단어들을 포착해 냈고, 일부는 이야기에서 사용된 정확한 단어와 구문까지 생성해 내는 데 성공했다.
일본 오사카대학 연구팀은 이미지 생성 인공지능 모델인 ‘Stable Diffusion’을 사용해 시각적 자극을 받은 뇌를 fMRI 스캔하여 사진 이미지로 바꾸는 기술을 개발하여 CVPR 2023 콘퍼런스에서 발표했다.19) 연구팀은 피실험자가 얼굴 이미지를 볼 때 fMRI를 이용해 시각을 담당하는 뇌 영역에서 뉴런의 활동을 스캔한 다음 Stable Diffusion 모델에 입력해 fMRI 스캔 정보를 기반으로 정확한 이미지를 생성할 수 있었다.
(5) 비임상 침습적 BCI
동물을 대상으로 하는 침습적 BCI 개발은 측정, 해석, 자극 영역에서 활발한 연구가 진행되고 있다. 상대적으로 안전성 이슈에서 제한이 덜해 인간 대상의 BCI의 정확도와 완성도를 향상시킬 수 있는 기반기술들이 적극적으로 개발되고 있다.
스위스 로잔 공과대학 연구팀은 쥐의 뇌 신호를 실시간으로 해석한 다음 쥐가 보고 있는 비디오를 재현할 수 있는 기술을 개발했다.20) 연구팀은 뇌의 시각 피질 영역에 삽입된 전극 탐침을 사용하여 쥐의 뇌 활동을 측정한 다음 어떤 뇌 신호가 보고 있는 영화의 어떤 프레임과 연관되어 있는지를 인공지능으로 학습시키는 방식으로 연구를 진행했다. 그 결과 쥐가 보고 있는 프레임을 실시간으로 예측하고 영상으로 변환할 수 있었다.
고려대학교 의대 연구팀은 쥐의 뇌 안에 약물을 정밀하게 투여해 행동을 제어하고, 이에 반응하는 뇌 신호를 실시간 모니터링할 수 있는 초소형 무선 뇌 이식 장치를 개발했다.21) 연구팀은 생쥐의 뇌에 다양한 약물을 투여해 실시간으로 반복 행동을 유도하거나 식욕 억제가 가능함을 보여주었으며, 이때 변화하는 뇌 신호를 성공적으로 관찰했다.
ETRI와 KIST 연구팀은 공동으로 뇌 신호를 실시간으로 감지하여 빛의 반짝임으로 나타내는 프로세서와 LED가 집적화된 실시간 무선 뇌파 측정, 분석시스템인 CBRAIN 시스템을 개발했다.22) 뇌 신호를 실시간으로 감지하여 반딧불이처럼 LED 불빛을 반짝이게 하고 이를 통하여 뇌 활동을 생중계하여 동물들의 감정과 생각을 눈으로 볼 수 있게 했다. 이 기술은 자유로운 상호 작용 사회성 연구와 군집 뇌연구에 활용되고 있다.
(6) BCI 실용화
몇 년 전부터 실리콘밸리를 중심으로 BCI 관련 산업의 열풍이 확산되고 있다. 특히 인간 대상의 침습적 BCI를 개발하는 뉴럴링크(Neuralink)와 싱크론(Synchron)이 미국 식품의약국(FDA)의 임상시험 승인을 받았고, 블랙락 뉴로테크(Blackrock Neurotech), 프리시전 뉴로사이언스(Precision Neuroscience), 파라드로믹스(Paradromics) 등이 임상시험 승인을 대기하고 있다. 더불어 콘트롤 랩스(Ctrl-labs), 뉴로시티(Neurosity), 커널(Kernel), 헤일로 뉴로사이언스(Halo Neuroscience) 등 BCI 관련 기업들도 큰 관심을 받고 있다.

출처: a. Blackrock Neurotech; b. Neuralink; c. Precision Neuroscience; d. Synchron
[그림 특집 2-18] 침습적 BCI를 위한 상용 뇌 임플란트 장치의 예
침습적 BCI 분야에서는 뇌 임플란트 기술의 상용화를 위한 임상시험에 관심이 집중되고 있다. 미국 기업 블랙락 뉴로테크가 개발한 뇌 신호 감지를 위한 소형 전극들로 구성된 유타 어레이(Utah Array) 임플란트 기술은 2004년부터 심각한 부작용 없이 환자에게 사용되고 있으며, 2021년에는 움직일 수 없는 환자에게 생각만으로 다양한 장치를 제어할 수 있는 기능을 제공하는 MoveAgain BCI 시스템을 발표하였다. 이 시스템은 뇌에 이식된 전극 배열로 뇌 신호를 측정하고 움직임을 해독하여 커서나 휠체어와 같은 외부 장치를 무선으로 제어하는 방식이다. 2021년 FDA로부터 획기적인 장치(Breakthrough device)로 지정23)받아 상용화가 빨라질 것으로 기대되고 있다.
미국 기업 파라드로믹스(Paradromics)는 신경 신호를 텍스트 또는 합성 음성으로 변환하는 시스템을 개발했다. 작은 전극 배열을 뇌 조직에 직접 이식하여 뇌 신호를 측정하고 해독하여 가슴 피부 아래에 있는 트랜시버를 통해 외부 장치로 보내는 시스템이다. 이 시스템은 2023년 FDA로부터 획기적인 장치로 지정받았다.
미국 기업 뉴럴링크(Neuralink)는 뇌 속에 전극들이 직접 삽입되는 소형장치를 무선으로 컴퓨터에 연결하는 침습적 BCI를 개발해 왔다. 2021년 초에 FDA에 신청한 임상시험 승인 요청이 2023년 초 거부되었으나, 2023년 3월에 재신청하여 2023년 5월 임상시험이 승인되어 2023년 9월부터 참가자 모집을 진행하고 있다.
비침습적 BCI 분야에서는 사용성을 높이기 위해 착용성이 좋은 새로운 웨어러블 뇌 신호 측정 장치들이 개발되고 있다. 미국 재활장치 전문기업 뉴롤루션스(Neurolutions)는 뇌졸중으로 손을 제대로 쓰지 못하는 환자들의 재활을 돕는 BCI 기반의 재활기기 입시핸드(IsiHand)를 개발하고, FDA로부터 De Novo 승인과 획기적인 장치 지정을 받았다. 미국 기업 뉴러블(Neurable)은 BCI를 지원하는 헤드폰 엔텐(Enten)을 개발했다. 비침습적 전극 센서로 뇌파의 패턴을 분석해 사람들이 집중력을 최대한 발휘할 수 있도록 시간 관리를 제안하고, 뇌의 피로도가 높아지면 적절한 휴식을 권유하고 뇌의 생산성을 높여주는 음악을 추천하는 기능의 제품이다.
국내에서는 와이브레인(Ybrain), 포엔(Poen), 룩시드랩스(looxidlabs) 등의 기업들이 비침습 BCI를 활용한 기술의 상용화를 진행 중이다. 와이브레인(Ybrain) 사는 인체에 안전한 미세 전류로 신경을 조절하는 기술인 경두개직류자극(tDCS)으로 재택치료가 가능한 우울증 전자약 기술을 개발하였고, 포엔(Poen) 사는 뇌파 측정 및 분석을 통한 빅데이터・인공지능 기반의 정신건강 진단보조시스템 서비스를 개발하고 있다. 룩시드랩스(looxidlabs) 사는 VR로 가상현실을 만들고 뇌 신호를 포함한 생체신호를 인공지능 기술로 분석하여 비즈니스에 활용하는 뉴로마케팅 솔루션을 개발하고 있다.
나. 뇌 바이오닉스
인공지능 시스템이 복잡한 작업을 수행하고 자연지능의 특정 측면을 따라 할 수 있지만 자연지능과 근본적으로 다른 원칙에 따라 작동한다. 연구자들은 적응성 및 정보 처리 기능과 같은 고유한 속성을 활용하기 위해 살아있는 세포를 컴퓨팅 시스템에 결합하는 방법을 찾고 있다. 특히 살아 있는 뇌 세포를 디지털 구성 요소와 통합하여 뇌 구조에서 영감을 얻은 방식으로 정보를 처리할 수 있는 하이브리드 시스템을 만드는 바이오컴퓨터에 대한 연구가 진행되고 있다. 바이오컴퓨터는 패턴 인식, 감각 처리 및 실시간 적응과 같은 새로운 컴퓨팅 기능을 제공할 수 있는 잠재력을 가지고 있다. 생명공학과 디지털 구성 요소의 통합으로 성능과 상호 작용을 향상시킬 수 있어 로봇, 인공기관 및 뇌-컴퓨터 인터페이스와 같은 첨단 분야와 밀접히 연관되어 있다.
(1) 인체 조직을 이용한 오가노이드
고령화와 더불어 사고로 인한 부상, 만성질환의 증가 등으로 인공장기나 조직과 같은 생체재료 개발이 활발하다. 오가노이드, 3D 프린터, 뉴럴 인터페이스 등의 첨단기술과 인공장기 분야의 융합 연구는 장기 이식 분야를 발전시키고 환자 치료를 개선할 수 있는 가능성을 가지고 있다.
최근 미국 생명공학 기업 유나이티드 테라퓨틱스(United Therapeutics)는 유전자 변형 돼지의 장기를 환자에게 이식하여 인체에서 제대로 작동하는지 관찰하는 실험을 진행했다.24) 2022년에는 3D프린터 전문기업 3D시스템즈(3DSystems)와 함께 4,000km의 폐 모세관과 2억 개의 폐포로 구성되는 인간의 폐 구조물을 3D프린터로 제작하여 Life Itself Conference에서 공개했다.25) 바이오폴리머(biopolymers) 재료를 사용하는 3D프린터로 인간의 세포로 구성된 장기 조직을 만들어 면역 시스템의 거부반응 없이 이식에 적합한 장기를 제작하는 기술을 개발하고 있다.
포항공과대학교를 주축으로 한 국내 연구팀은 유전자 가위 기술을 도입해 면역거부반응을 억제한 역분화줄기세포에서 혈관, 간, 췌도 세포로 분화한 세포를 3D프린터를 사용해 모세혈관을 포함하는 간과 췌장 모듈을 제작하고, 굵은 혈관과 함께 모듈을 쌓고 접착하여 이식할 수 있는 수준의 인공장기를 자동으로 조립하는 로봇시스템을 개발하고 있다.26)
특히, 인체 조직을 이용한 오가노이드는 동물실험의 단점인 인간-동물 간의 차이점을 극복할 수 있어 신약 개발을 위한 질환 모델링부터 표적발굴 및 표적의 유효성 평가, 유효물질 검색, 독성 평가 등 전임상 단계에 유용하게 활용할 수 있다.
(2) 뇌 오가노이드
미국 샌디에이고 캘리포니아대(UCSD) 의대 연구팀은 대뇌피질에서 신경망을 구성하는 줄기세포를 이용해 완두콩 크기의 뇌 오가노이드를 만들어 뇌파와 유사한 전기적인 활동을 관찰하였다.27) 연구팀은 수백 개의 뇌 오가노이드를 배양하면서 전극을 붙여 전기적인 활동을 관찰하여 뇌파 형태의 전기신호가 발생하는 것을 처음으로 포착했다.
미국 존스 홉킨스 대학 연구팀은 뇌 발달의 일부 측면을 모방한 인간 유래 줄기세포에서 뇌 오가노이드를 보다 효율적으로 연구하기 위해 마이크로 EEG 캡을 개발했다.28) 연구팀은 뇌 오가노이드에 완벽하게 맞는 소형화된 미세 전극 어레이 쉘을 만들어 뉴런 세포가 서로 통신하는 방법과 새로운 화학 물질에 노출되었을 때 반응을 추적하는 데 사용하고 있다.
국내에서는 기초과학연구원 나노의학연구단 연구팀은 신생아 뇌 수준에 가까운 미니 뇌를 개발했다.29) 연구팀은 하이드로젤을 이용해 뇌 오가노이드를 배양 한 결과, 대뇌 피질을 구성하는 신경상피가 발달해 뇌 주름이 다량 생성된 것을 확인했다. 고려대학교 의과대학 해부학교실 연구팀은 신경관 형성을 모사하는 척수 오가노이드 제작 방법을 확립하고, 조직학・전사체・전기생리학 분석을 통해 실제 척수 조직과 유사함을 검증했다.30) 줄기세포 배양 기술, 최신 3차원 이미징 기술 및 인공지능 기술의 융합을 통해 뇌 오가노이드 배양 플랫폼은 다양한 약물이 인간의 뇌에 어떤 영향을 미치는지 관찰할 수 있어 난치성 뇌질환 기전 규명 및 치료제 개발을 위한 효과적인 체외 모델로 활용할 수 있다.
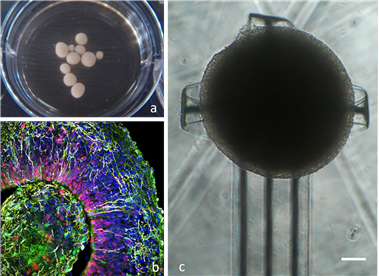
주) a. 완두콩 크기의 뇌 오가노이드, b. 뇌 오가노이드 단면 신경세포 이미지, c. 뇌 오가노이드를 감싸고 있는 마이크로 EEG 캡
출처: Cell Stem Cell, UCSD ; Science Advances, Johns Hopkins University
[그림 특집 2-19] 뇌 오가노이드 연구 사례
(3) Hybrid Brain : transplanting human neurons into animals
미국 스탠포드대 연구팀은 인간 줄기세포로 만든 뇌 오가노이드를 갓 태어난 쥐의 대뇌피질 부위에 삽입하고, 쥐의 뇌 신경계와 연결하는 연구 결과를 발표했다.31) 쥐에 이식한 뇌 오가노이드는 감각정보를 수용하는 부위인 대뇌의 체감각 피질에 통합돼 정상적으로 기능을 수행했고, 쥐에게 가해진 자극이 뇌 오가노이드로 전달될 수 있음을 관찰했다.
미국 캘리포니아대학교(샌디에이고) 연구팀은 인간 줄기세포를 이용해 제작한 뇌 오가노이드를 실험 쥐에 이식하는 실험에서 시각 자극에 대한 반응이 일어났다고 밝혔다.32) 시각적 자극이 뇌 오가노이드에 전기생리학적 변화를 일으키고, 쥐의 대뇌피질 반응과 동기화하는 것을 관찰했다. 뇌 오가노이드와 쥐의 대뇌피질은 이식 3주 만에 양쪽 시냅스가 모두 결합했고, 뇌에서 혈관이 늘어나 오가노이드에 영양을 공급함을 관찰했다.

주) a. 쥐 뇌에 이식된 인간 뇌 오가노이드, b. 뇌 오가노이드에 발생한 안배
출처: Nature, Stanford University; Cell Stem Cell, Universität Düsseldorf
[그림 특집 2-20] Hybrid Brain 연구 사례
독일 뒤셀도르프대학 연구팀은 실험실에서 배양한 미니 뇌에 안배(optic cups)라고 불리는 기관을 갖춘 원시적인 눈을 형성시키는 데 성공했다.33) 연구팀이 만든 뇌 오가노이드는 다양한 종류의 망막세포를 갖추고 있어 수정체나 각막과 같은 조직 외에 빛에 반응해 활동하는 신경세포의 네트워크도 확인됐다.
(4) 오가노이드 지능, 바이오컴퓨터
호주 바이오기업 코티컬랩스(Cortical Labs) 연구팀은 배양접시에 살아 있는 뇌 세포와 미세전극을 연결하여 외부와 피드백을 주고받게 하는 접시뇌(DishBrain) 기술을 개발하였다.34) 이 접시뇌로 컴퓨팅 시스템을 구성하여 기존 인공지능이 90분 걸려 습득한 컴퓨터 아케이드게임 ‘Pong’의 게임 방법을 10∼15회 정도 주고받는 경기로 5분 만에 알아냈다. 이는 접시뇌 속 뉴런들의 단일 레이어가 지능적인 행동을 스스로 조직하고 나타낼 수 있음을 의미한다.
미국 블루밍턴 인디애나대 연구팀은 뇌 오가노이드를 컴퓨터에 연결해 3D 생물학적 신경망의 계산능력을 활용하는 수학 방정식을 푸는 살아있는 인공지능 기기를 개발했다.35) 이 시스템은 다중 전극 배열을 통해 정보를 계산하는 뇌와 유사한 3D 체외 배양의 고유한 속성을 활용하여 신경망 내에서 정보를 수신하고 전송할 수 있다.
미국 존스 홉킨스 대학 중심의 국제공동연구팀이 뇌 오가노이드를 기반으로 한 바이오컴퓨터 개발 구상을 발표했다.36) 연구팀은 접시뇌와 같은 조직의 인지 능력을 오가노이드 지능(Organoid intelligence)이라고 명명하고, ‘실험실에서 배양한 인간 두뇌 모델에서 학습, 감각 처리 같은 인지 기능을 재현하는 것’으로 정의했다. 살아 있는 뇌세포가 실리콘 기반의 기존 컴퓨터보다 에너지를 적게 쓰면서도 빠르고 강력하고 효율적으로 일을 할 수 있다. 따라서 뇌의 기능을 컴퓨터에 끌어다 쓸 수만 있다면 데이터 처리 속도나 능력, 저장 능력, 에너지 효율 등을 크게 높일 수 있다. 공동연구팀은 오가노이드 지능은 아직 초기 단계로 바이오컴퓨터로 사용하려면 오가노이드를 구성하는 세포 수를 1,000만 개 수준으로 더 키워야 하고, 오가노이드에 정보를 보내고 받는 정밀한 장치가 필요하다고 제안하고 있다.

출처: Frontiers, John Hopkins University
[그림 특집 2-21] 바이오컴퓨팅을 위한 오가노이드 지능 시스템의 구성 예
다. 발전 전망
(1) 뇌-컴퓨터 인터페이스
앞서 살펴본 바와 같이 BCI는 하드웨어적, 소프트웨어적으로 많은 발전을 이루어 왔으며, 뉴럴링크를 비롯한 BCI 관련 기업들이 계속하여 진보된 시스템을 선보이고 있다. 하지만 근본적으로 BCI는 뇌에서 발생하는 신호를 측정하고 해석하는 기술이므로 뇌 작동 원리를 정확하게 이해하는 것이 중요하다. 사용자의 의도를 자연스럽게 처리하는 BCI의 개발은 뇌 작동 원리의 정확한 이해 없이는 한계가 있을 것이다.
BCI는 몸을 제어하기 어려운 장애인이나 사지마비 환자들에게 도움을 줄 수 있다는 긍정적인 측면이 있지만, 기술의 안전성에 대한 의심과 뇌 해킹 등의 부작용에 대한 우려도 있다. 신경 인터페이스가 신경 손상, 감염 같은 의도하지 않은 위험성과 뇌 가소성, 학습 및 적응에 미치는 장기적인 영향에 대한 연구와 함께 임상시험이 신중하게 진행되어 BCI 시스템의 사용이 잠재적인 부작용보다 이점이 더 큰지 확인해야 한다. 디지털 기술의 해킹에 의해 사용자의 생체정보가 노출되는 위험성에 관한 이슈들도 신중하게 다루어져야 한다.
최근 국내 연구 환경 및 연구의 수준이 점점 높아지고 있다. 한국뇌연구원, KIST, ETRI 등 연구기관과 국내 대학에서 디지털 기술을 기반으로 하는 BCI 연구가 활발히 진행되고 있다. 한국생명공학연구원 국가영장류센터에는 원숭이를 이용한 BCI 연구를 위한 높은 수준의 인프라가 구축되어 있다. BCI 분야의 국제적 기술 선도를 위해서 국내 여러 기관에 산재해 있는 역량을 하나로 모을 수 있는 대규모 통합 연구 프로젝트가 필요하다.
디지털 치료제, 전자약 같은 제3세대 치료제는 기존의 치료제와는 달리 만성 복용으로 인한 약물 부작용이 적고 실시간 모니터링과 피드백을 통한 개인 맞춤형 치료가 가능해 국민 건강 증진을 위해 꼭 필요한 기술이다. 앞서 소개된 BCI 기술들은 3세대 치료제의 개발과 검증에 필요한 핵심 기술들이다. 국제표준화기구(ISO)와 국제전기기술위원회(IEC)의 공동기술위원회인 JTC 1/SC 43은 뇌-컴퓨터 인터페이스의 국제 표준화 작업을 한국 주도로 진행 중이다. 뇌-컴퓨터 인터페이스의 기본 개념 및 분류, 하드웨어, BCI에서 사용되는 실험 설정 및 프로토콜, 뇌-컴퓨터 인터페이스 관련 코딩 및 디코딩 등 개별 요소의 표준 외에도 피드백 및 자극 등 외부 시스템이나 전자약 등과의 연계 방안까지 다루고 있다.
정부는 뇌-컴퓨터 인터페이스, 뇌기능 및 뇌질환 시각화, 뇌 신호 측정・해석 플랫폼 구축 등 뇌질환 극복 및 뇌기능 활용기술 개발과 사업화 지원할 계획이다. 특히, 첨단뇌과학을 기반으로 전자약 핵심 원천기술 개발을 통해 의료 패러다임 변화에 대비하고, 국민 체감형 차세대 치료 사례를 확보할 계획이다. 2022년부터 전자약기술개발사업을 통해 전자약 원천기술의 개발 및 성능 향상을 지원하고 있다. 이를 통해 전자약의 치료효능 증진, 전자약 기반기술을 확보하고자 한다.
(2) 뇌 바이오닉스
동물실험은 윤리문제뿐 아니라 질환 기전 연구나 신약 개발에는 명확한 한계가 존재하기 때문에 인간의 발생 과정 탐구, 질환의 원인 파악, 약물 개발과 부작용 예측 등 다양한 분야에서 적용 가능한 오가노이드가 대안으로 제시되고 있다. 반면, 인간 뇌 오가노이드가 의식이 있거나 고통을 느낄 수 있는지, 오가노이드 제작에 사용된 세포 기증자는 그 오가노이드에 어떤 권리를 가질 수 있는지 등 여러 가지 이슈가 제기될 수 있다. 바이오컴퓨터를 연구하고 있는 과학자들은 오가노이드 지능 커뮤니티를 결성하고 2022년 2월 제1차 오가노이드 지능 워크숍에서 ‘오가노이드 지능 탐사를 위한 볼티모어 선언’을 발표했다.37) 이 선언에서 오가노이드 지능 구축을 위한 기술적, 윤리적 문제 해결을 위한 다학제간 협력을 강조하고 있다.
정부는 장기, 조직 기능 향상을 위한 생체 조직과 전자부품이 결합한 광범위한 기능 장치 기술 개발 고도화 및 현장 적용 지원(바이오칩, 전자시스템 기반 인공장기 등)을 위한 신규사업을 기획 예정이다.

출처: Frontiers, John Hopkins University
[그림 특집 2-22] 뇌 건강과 질병 연구를 위한 뇌 오가노이드 활용 모델
라. 총론
뇌-컴퓨터 인터페이스와 뇌 오가노이드 분야의 특출한 연구성과를 통해 첨단뇌과학 분야의 최신 연구 동향을 살펴보았다. 최근 경제・정치적 패권 경쟁의 양상이 첨단기술 분야로 빠르게 확산되고 있으며, 단순히 기술 개발 경쟁뿐만 아니라 표준과 플랫폼 영역에서의 경쟁도 치열해지고 있다. 첨단뇌과학 분야도 역시 글로벌 첨단기술 패권 경쟁의 주요 대상이다. 인공지능, 정보통신기술, 로봇기술 등 디지털기술과 뇌과학 기술의 융합을 통해 첨단뇌과학 기술 혁신을 가속화하여 기술 주도 국가들을 추격하는 연구를 넘어 추월하는 연구를 위한 디지털 전환 전략이 필요하겠다. 정부는 뇌과학 분야의 초격차 선도융합기술 확보를 위해 2023년부터 ‘뇌과학 선도융합기술개발사업’ 추진하고 있다. 이 사업을 통해 그간 축적된 뇌연구 성과와 연구 환경을 활용하여 국민이 체감하는 실용기술을 확보하고자 한다. 궁극적으로 첨단뇌과학의 발전은 인간의 신체・두뇌・감성 능력의 저하를 예방, 회복, 향상함으로써 지속적으로 건강한 삶을 가능하게 하고, 인류의 보편적인 행복 증진에 기여할 수 있을 것이다.
|
|
|
특집 제2장 디지털바이오의 성공사례 및 향후 발전 전망 |
|
제5절 바이오파운드리 |
가. 바이오파운드리의 개요
바이오파운드리의 개념을 이해하기 위해서는 합성생물학의 개념과 작동 원리를 먼저 이해해야 한다. 합성생물학(Synthetic biology)은 인공적으로 생명시스템을 설계-제작하거나 기존 생명시스템을 재설계하여 활용하는 학문으로 유전체 기술의 발전과 데이터 분석 시스템의 고도화에 따라 혁신 성장 분야로 세계적인 주목을 받고 있다. 최근에는 인공지능과 로보틱스를 융합해 합성생물학의 기본 작동 원리인 설계-제작-시험-학습(Design-Build-Test-Learn, DBTL) 순환 과정을 자동화하여 바이오 연구의 규모와 속도의 한계를 극복한 바이오파운드리(Biofoundry)를 통해 혁신이 가속화되고 있다.
바이오파운드리란 합성생물학의 DBTL 순환 과정을 자동화하여 고속으로 인공 생명시스템을 경제적으로 제조할 수 있는 플랫폼 인프라 시설이다. 바이오는 생명체를 대상으로 연구하기 때문에 전통적으로 재현성이 낮고 불확실성이 높아 공학에서 활용되는 표준화 개념을 도입하기 어려웠다. 바이오가 국가의 성장동력이자 전략기술로 주목받아 왔음에도 괄목할 만한 성과를 보여주기 어려웠던 이유 중 하나다.
그러나 합성생물학은 생명과학에 공학의 작동 원리를 도입하기 위해 DNA 서열의 표준화와 부품화로부터 출발했다. 따라서 합성생물학과 바이오파운드리는 바이오 연구의 고질적인 문제를 극복할 수 있는 디지털바이오의 핵심 기술로 자리 잡고 있다. 특히 합성생물학은 바이오파운드리를 통해 바이오 연구의 고속화, 대량화, 저비용화를 실현하면서 의약, 에너지, 소재, 식량 등 다양한 미래 산업에 활용될 수 있고, 인류가 당면한 위협을 감소시켜 줄 수 있을 것으로 기대를 모으고 있다.
나. 디지털바이오 시대의 바이오파운드리
바이오파운드리는 혁신적인 합성생물학 기술에 빅데이터, 인공지능, 로봇기술 등과 같은 디지털 기술의 결합을 필요로 한다. 이러한 디지털 기술의 바이오와의 융합은 새로운 융합 학문 분야를 만들어 내고, 생명체의 본질적인 불확실성을 극복하며, 예측 가능한 인공 세포를 제작하고 활용하는 데 필수적이다.
인공지능은 대규모 유전자 데이터를 처리하고 이를 이해하도록 돕고 있다. 이를 통해, 우리는 DNA-RNA-단백질로 이어지는 생명체의 정보 흐름을 체계적이며 종합적으로 이해하고, 이를 활용할 수 있는 근간을 마련할 수 있다. 더불어 인공지능은 실험 설계 및 최적화에서도 중요한 역할을 하고 있다. 로보틱스 또한 바이오파운드리에 중요한 요소이다. 바이오파운드리의 자동화, 고속화, 저비용화 실현과 더불어 재현성 확보에 반드시 필요하기 때문이다. 끝으로 자동화 워크플로(Workflow)는 바이오파운드리의 DBTL 순환 과정을 반복적으로 수행하기 위해 필요한 디지털바이오 시대의 핵심 요소이다. 자동화 워크플로의 필요성은 다음과 같이 설명할 수 있다. 첫째, 자동화 워크플로는 수동 작업에 비해 훨씬 빠르게 처리할 수 있어 효율성을 확보할 수 있다. 이를 통해 더 많은 연구를 진행하고 더 빠르게 결과를 얻을 수 있다. 이는 대규모 실험을 가능하게 하며, 통계적으로 유의미한 결과를 도출하는 데 도움이 된다. 둘째, 자동화된 워크플로는 연구의 오류를 최소화하고 일관성을 유지할 수 있어 정확성을 확보할 수 있다. 이는 연구의 반복성을 보장하며, 데이터의 품질과 신뢰성을 향상시킬 수 있다. 셋째, 자동화 워크플로는 쉽게 확장될 수 있다. 즉, 프로세스의 규모를 증가시키거나 새로운 작업을 추가하는 것이 가능하다. 이는 연구 과정을 빠르게 확장하고, 더 복잡하고 다양한 연구를 수행할 수 있도록 한다. 넷째, 자동화 워크플로는 서로 다른 프로세스와 시스템을 통합하여, 다양한 데이터 형태와 프로토콜을 원활하게 관리할 수 있다. 이것은 한 연구그룹이 전체 실험 과정에서 보다 통합된 전략을 채택할 수 있도록 도와준다. 다섯째, 자동화 워크플로는 데이터의 접근성을 향상시키며, 이를 통해 연구원들이 더욱 쉽게 데이터를 분석하고 해석할 수 있다. 따라서 바이오파운드리에서의 DBTL 사이클은 능률적이고 정확한 결과를 도출하기 위해, 그리고 연구의 확장성과 통합성을 보장하기 위해 자동화 워크플로가 반드시 필요하다. 자동화 워크플로에 의해 구현되는 합성생물학의 DBTL 자동화는 신속한 반복적인 대규모의 실험, 데이터 수집 및 분석의 효율성, 그리고 결과의 정확성과 일관성을 보장할 수 있다.
다. 바이오파운드리 기반의 바이오제조
(1) Covid-19 글로벌 팬데믹 극복
바이오파운드리는 코로나19 극복 과정 중 모더나(Moderna)의 백신 개발을 통해 더욱 주목받게 된다. 2010년 설립된 모더나는 미국 국방부(Department of Defense) 산하 국방고등연구계획국(Defense Advanced Research Projects Agency, DARPA)의 혁신 기술 개발 프로젝트 중 하나였던 RNA 기반의 치료제 개발 과제를 2013년부터 수행하면서 2,500만 달러의 연구비를 지원받았다. 이는 당시 스타트업이었던 모더나가 본격적인 RNA 기반 치료제 연구를 수행할 수 있는 중요한 계기가 되었고, 2020년 말 코로나19가 대유행일 때 마침내 코로나19 백신 개발에 성공할 수 있었다.
그러나 설립한 지 불과 10년 갓 넘은 모더나가 코로나19 백신의 대량 생산과 공급이 가능했던 이유 중 하나는 바이오파운드리의 대표적인 회사인 깅코바이오웍스(Ginkgo Bioworks)의 지원이었다. 깅코바이오웍스는 모더나의 mRNA 백신 제조에 필요한 원료 물질 생산공정 최적화를 단시간에 수행했다. 그 결과 모더나의 mRNA 백신 개발 기술은 바로 산업화로 연결되어 코로나19 팬데믹을 극복할 수 있는 원동력이 되었다. 이 밖에 깅코바이오웍스는 빅데이터 기술을 이용해 코로나 바이러스 유전자 서열을 신속하게 분석하고, 인공지능을 이용해 백신으로 사용할 수 있는 mRNA를 빠르게 설계하여 12개월이라는 짧은 시간에 새로운 백신이 시장에 출시하도록 도왔다.
이를 계기로 바이오파운드리를 활용해 새로운 전염병을 신속하게 대응하기 위한 전략이 도출되었다. 즉, 새로운 변종 및 전염병이 발생했을 때 이에 대응하기 위해 백신 및 진단 후보물질을 신속하게 시제품으로 제작할 필요가 있으며, 이는 광범위한 분산 제조가 가능한 바이오파운드리를 통해 가능하다. 특히 전염병이 진행됨에 따라 변종의 전염성이 증가하거나, 백신의 효과가 감소하는 경우 등 변종의 진단과 모니터링이 매우 중요할 때 로봇 등을 이용하여 감염 테스트를 고속으로 많이 처리할 수 있는 바이오파운드리가 매우 중요하다.
(2) 미국의 바이오제조 이니셔티브 및 공급망 이슈
2022년 9월 미국의 바이든 대통령이 국가 바이오기술 및 바이오제조 이니셔티브 개시에 관한 행정명령에 서명했고, 이를 추진하기 위해 20억 달러 이상의 투자를 통해 관계부처가 주요한 업무를 진행하기로 하였다. 이에 따라 미국 과학기술자문위원회(President’s Council of Advisors on Science and Technology, PCAST)는 바이오제조에 관한 3대 주요 과제(생산능력, 규제, 전략)와 이를 해결하기 위한 방안을 제시하였다.
이중 생산능력(Capacity) 측면에서는 유망 바이오기술을 실험실 수준에서 제조 규모로 전환하기 위한 제조 기반과 숙련된 인력, 공유 인프라(바이오파운드리)의 필요성을 강조했다. 이는 현재 미국의 바이오제조 생산능력이 새로운 바이오제품의 대량 생산 수요를 충족시키는 못한 실정을 반영한 것으로, 실제 2011년 PCAST는 미국의 첨단제조 분야 권고를 통해 바이오제조 USA 프로그램(BioFab, BioMade, NIIMBL)의 기반을 마련하였으나, 다양한 바이오제품 지원 및 바이오제조 역량이 각 프로그램에 부재한 상황이다.
또한 미국 내 바이오제품 개발 업체 중 다수는 제한된 바이오제조 인프라와 높은 신제품 출시 비용 때문에 바이오제조 사업을 다른 국가로 이전한 상태다. 더욱이 바이오제조 분야는 바이오제품의 다양성, 복잡성, 정교함의 증가와 글로벌 경쟁 심화, 개발 파이프라인 수요의 폭발적 증가 등으로 점점 더 어려움이 가중될 것으로 예상되고 있다.
2023년 3월 국가 생명공학 및 바이오제조 이니셔티브 후속 조치로 국가 바이오기술 및 바이오제조를 위한 과감한 목표의 보고서를 발표했다. 해당 보고서에서 향후 20년간 미국 바이오경제 성장을 위한 실행 사항으로 바이오제조 인프라 확대를 통한 공급망 지원, 인공지능을 통한 데이터 활용과 생산성 향상, 인력양성, 규제개선, 바이오보안 강화, 국제적 공동연구를 통한 협력 등을 제시하였다. 따라서 미국은 바이오파운드리 기반의 바이오제조를 통해 바이오 공급망을 강화할 것으로 예상된다.
(3) 국내 바이오파운드리 활용 바이오제조 혁신 전략
국내에서는 바이오파운드리를 활용한 전문 서비스 기업이 탄생하고 기업 자체에 특화된 바이오파운드리를 구축하고 활용하고 있다. 또한 정부 주도로 기존 산업의 합성생물학 기반 제조공정으로 전환 지원을 위해 제조공정 시뮬레이션, 바이오소재 생산 최적화 기술, 대량생산 플랫폼 설계 및 시험생산 등을 수행하는 ‘(가칭)합성생물학 기반 바이오제조 실증사업’을 2027년까지 추진할 계획이다. 더불어 혁신 바이오 기업의 창업과 성장을 지원하기 위해 바이오파운드리를 활용하여 개발된 기술의 기술 이전, 실험실 창업 등 기술사업화를 범부처가 체계적으로 지원하는 ‘(가칭)합성생물학 이노베이터 지원 프로그램’을 추진하고 있다.
또한 합성생물학 기술 개발 및 산업화 등 혁신을 촉진시킬 수 있는 진흥법으로 ‘(가칭)합성생물학 연구진흥 및 지원에 관한 법률’을 입법 발의하기 위해 준비하고 있다. 이를 통해 합성생물학이 가져올 혁신을 가속화시키고 합성생물학에 대한 사회적 인식도 제고되기를 기대하고 있다.
무엇보다 국내 합성생물학 전문가와 관련 인력이 절대 부족한 상황으로 2030년까지 바이오, 인공지능, 공학이 융합된 교과과정을 개발하고, 타 분야 종사자의 재교육, 이론과 현장실습을 통한 균형 있는 교육 프로그램 등을 통해 핵심 인력 1,000명을 양성하고자 계획하고 있다.
국내 합성생물학과 바이오파운드리 혁신 거버넌스 구축을 위해 정부는 합성생물학 기술혁신 및 산업화 관련 부처의 역할을 명확히 하고 있으며, 민간에서는 한국합성생물학발전협의회가 2022년 7월 출범하여 기술과 산업, 네트워크 및 교육, 정책과 제도 분과로 나뉘어 운영 중에 있다.
세계적으로 바이오기술 패권경쟁이 심화됨에 따라 국가 차원의 합성생물학 기술 육성과 글로벌 경쟁에의 선제적 대응 및 주도권 확보를 위한 이니셔티브 수립하였다. 2022년 10월 대통령 주재 국가과학기술자문회의는 국가전략기술 육성방안의 12대 전략기술 중 하나인 ‘첨단바이오’의 중점기술로 합성생물학을 선정하여 그에 따른 정책을 추진하고 있다. 합성생물학 육성을 통한 국가 바이오제조 혁신 가속화를 비전으로 제시하였으며, 향후 10년 내 에너지・화학 등 기존 제조 산업의 바이오 전환율 30%를 목표로 설정하였다. 이에 따라 합성생물학 핵심기술 확보, 바이오파운드리 구축 및 활용, 지속가능한 생태계 조성 등을 핵심 전략으로 설정하여 추진할 계획이다.
구체적 전략 이행 중 하나로 바이오파운드리 구축 및 활용 예타사업을 추진하고자 하고 있다. 바이오파운드리 구축 및 활용 예타사업은 2024년부터 2028년까지 3,000억 원 규모로 투자하여 과기정통부가 주관하고 산업부가 참여하여 국가 주도의 공공 바이오파운드리를 구축할 예정이며, 합성생물학 연구개발 속도 5배 향상 및 인공세포 설계-제작이 가능한 세계 최고 수준의 인프라 구축을 목표로 하고 있다. 공공 바이오파운드리 구축을 시작으로 2027년 농식품・해양・첨단신약 등 산업별로 전문화된 인프라 및 서비스를 제공하는 권역별 공공 바이오파운드리 구축, 바이오파운드리 민간 확산을 촉진하여 2030년 공공-민간 연계 바이오제조 혁신 네트워크 구축 계획이 있다.
라. 바이오파운드리 기반 바이오제조 연구 동향
(1) 바이오의약
팬데믹 기간 발생한 공급망 문제는 의약품 공급에도 영향을 미쳐 암 치료가 중단되기도 하였는데, 2019∼2021년 항암제인 빈블라스틴(vinblastine)과 빈크리스틴(vincristine)의 부족으로 인해 대체 의약품이 없는 상황에서 많은 어린이와 성인의 암 치료가 중단된 바 있다.
최근 합성생물학에 의해 재설계된 효모에서 항암제인 빈블라스틴(vinblastine)을 제조한 연구결과가 발표되었다. 이 항암제는 마다가스카르 페리윙클(Madagascar periwinkle, Catharanthus roseus)라는 식물에서 추출한 모노테르펜 인돌 알칼로이드(monoterpene indole alkaloids)인 카타란틴(catharanthine)과 빈카 알칼로이드(vinca alkaloids)인 빈돌린(vindoline)을 화학적으로 결합하여 생산되고 있다. 모든 식물 유래 천연물질과 마찬가지로 빈카 알칼로이드의 공급은 식물 질병, 자연재해, 감염병 및 글로벌 물류 중단과 같은 요인에 취약하다. 그러나 천연물질의 구조적 복잡성은 기존의 화학합성 보다 미생물 합성으로 구현하기가 더 쉽다. 항말라리아제인 아르테미시닌(artemisinin), 오피오이드(opioid) 진통제, 의약용 대마성분(cannabinoids) 등 현재 식물에서 공급되는 필수 의약품이 유전적으로 재설계된 효모에 의해 생산될 수 있다는 중요한 연구 결과가 발표된 바 있으며, 유사한 접근 방식을 사용하여 C. roseus의 빈블라스틴 생합성 경로를 효모 안에 재설계하여 빈카 알칼로이드를 제조한 연구결과가 발표된 것이다. 빈블라스틴 생합성 경로는 31단계로 매우 복잡하므로 작업의 단순화를 위해 경로를 3개의 모듈로 나누어 효모를 만든 뒤, 3개 모듈을 모두 포함하는 최종 균주를 제작하였다. 최종 효모 균주는 식물 유래 34개 유전자를 포함하여 56개의 유전자를 편집하였고, 전구체 생산 성능을 개선하기 위해 효모 자체가 갖고 있는 10개의 유전자를 결실(knock-out), 저해(knock-down) 또는 과발현하도록 재설계하였다. 합성생물학에 의해 재설계된 생합성 경로는 식물에서의 자연적인 경로보다 더 높은 효능 또는 더 적은 부작용과 같은 개선된 약리학적 특성을 가질 수 있도록 보완할 수 있다. 하지만 연구팀은 효모 발효액에서 최종 산물의 농도를 높이고, 생산 속도를 높이기 위해서는 광범위한 최적화 연구와 더불어 대규모 발효 및 효율적인 정제 공정도 필요하다고 설명했다.38)

출처: Nature, A microbial supply chain for production of the anti-cancer drug vinblastine, 2022.8.31
[그림 특집 2-23] 빈블라스틴 생합성 경로를 효모 안에 재설계하여 빈카 알칼로이드를 제조한 연구
MIT 연구팀은 2022년 항생제 관련 위험을 줄이기 위한 잠재적인 전략으로 재설계된 박테리아를 사용해 장내 미생물을 보호하는 데 도움이 되는 방법을 개발했다. 인간이 섭취하기에 안전한 유산균인 락토코쿠스락티스(Lactococcus lactis) 박테리아를 사용하여 베타-락탐(β-lactam)이라고 불리는 일반적으로 사용되는 항생제를 분해하는 효소를 생성하도록 재설계하였다. 생쥐에게 항생제와 함께 투여했을 때 이 바이오치료제(Live Biotherapeutic Products, LBP)는 동물의 장내 미생물을 보호하는 동시에 혈류에서 순환하는 항생제 수준을 높게 유지시켰다. 항생제 분해 특성을 지닌 식품 관련 박테리아를 임상적으로 사용하기 위해 합성생물학 접근 방식을 사용하여 박테리아가 효소를 합성하는 방법론을 제시하였다. 베타-락타마제(β-lactamase) 유전자를 두 조각으로 분해해 각 조각에 효소 단편을 암호화하고, 베타-락타마제 단편은 재조립되는 세포 외부로 내보내져 효소 기능을 회복한다. 암피실린(ampicillin)을 주사할 때마다 조작된 박테리아를 생쥐에게 2회 경구 투여하자, 개발된 박테리아가 장에 도달하여 베타-락타마제를 방출하였다. 개발된 박테리아가 주어진 항생제 처리 생쥐에서 항생제만 투여한 대조군 생쥐와 비교할 때 훨씬 더 높은 수준의 장내 미생물 다양성을 유지했다. 항생제로 인한 장내 세균총 이상으로 인한 급성 질환 발병 위험이 큰 사람들을 대상으로 테스트할 수 있는 치료법을 개발해 궁극적으로 치료가 필요한 모든 사람을 보호하는 데 사용될 수 있을 것으로 기대를 모으고 있다.39)

출처: https://news.mit.edu/2022/bacteria-good-gut-microbes-antibiotics-0411
[그림 특집 2-24] 합성생물학 접근 방식을 사용하여 박테리아가 효소를 합성하는 방법론을 제시
(2) 기후 재난 대응
2021년 Science 저널에 효소 반응으로 구성된 무세포 인공 전분 합성회로(Artificial Starch Anabolic Pathway, ASAP) 개발을 통해 이산화탄소를 식량자원인 전분(starch)으로 합성할 수 있다는 연구결과가 발표되었다. 해당 기술은 탄소중립 및 식량고갈 문제를 동시에 해결할 수 있는 기술로 주목받고 있다. 인류의 주요 식량인 카사바, 고구마 등의 주성분은 전분이며 포도당이 연결된 중합체 탄수화물로 아밀로스(amylose) 20%와 아밀로펙틴(amylopectin) 80%로 구성된다. 식물은 광합성 시스템을 바탕으로 빛에너지를 활용하여 대기 중의 이산화탄소를 포도당을 합성하고, 이를 전분의 형태로 저장한다. 광합성을 수행하는 세포의 엔지니어링을 통해 이산화탄소에서 전분 생산량을 증가시킬 수 있으나, 전분이 세포 내 축적되면 세포의 성장 및 대사활동을 저해하기 때문에 지속가능한 고생산 시스템 구축이 어렵다. 이에 무세포 기반으로 이산화탄소와 수소로부터 전분의 주요 성분인 아밀로스, 아밀로펙틴을 합성할 수 있는 11개의 주요 효소로 인공 전분 합성 회로를 개발했다. 여러 생물학 데이터베이스(MetaCyc, ATLAS)의 6,568개 효소반응을 바탕으로, 탄소 1개로 구성된 탄소원으로부터 전분 합성이 가능한 대사경로를 컴퓨터 고속연산을 바탕으로 설계했다. 효소반응의 조합 및 에너지 분석, 탄소 흐름 최적화 등 수학적 모델링을 통해 9개의 주 효소반응을 선별하고, 이를 4개의 주요 모듈(C1, C3, C6, Cn module)로 구획화한 ASAP 1.0을 구축했다. 메탄올로부터 아밀로스를 합성하는 일련의 화학 반응 중 병목현상을 야기하는 몇몇 효소의 활성을 개선하여 ASAP 2.0을 구축했다. 이후 ZnO-ZrO2 화학 촉매를 이용하여 수소와 이산화탄소를 이용하여 메탄올을 합성할 수 있는 화학 촉매 전환 단계를 C1 모듈에 추가하여 ASAP 3.0을 구축했다.40) 끝으로 아밀로스로부터 아밀로펙틴을 합성할 수 있는 효소를 도입하여 이산화탄소와 수소로부터 아밀로펙틴을 합성할 수 있는 ASAP 3.1을 구축한다.41)42)

출처: https://www.sciencedirect.com/science/article/pii/S2451929421005891
[그림 특집 2-25] 효소 반응으로 구성된 무세포 인공 전분 합성회로(ASAP) 개발을 통해 이산화탄소를 전분(starch)으로 합성한 연구 사례
이번에 발표된 연구결과는 파운드리(foundry) 접근방식으로, 합성생물학 분야의 최신 트렌드를 잘 보여주는 사례로 ‘대용량 데이터의 고속연산을 통한 대사경로 설계’, ‘효소의 바이오부품화와 화학 반응의 모듈화’, ‘각 바이오부품, 모듈의 최적화와 조합을 통한 효율 극대화 파운드리식 접근방법’을 제시했다. 이번 연구결과와 기술을 인공광합성으로 발전시킬 경우의 빛-전분 전환효율은 약 7% 정도로 자연환경에서 식물의 빛-전분 전환효율 2%를 대비 3.5배 높은 이론적 수치를 기대할 수 있다. 인공지능, 로봇공학 등을 활용하여 각 모듈을 구성하는 효소의 고속 설계 및 합성, 대용량 스크리닝 기반의 최적화・안정화・고도화 달성 시 이산화탄소 전분 전환효율을 보다 극대화할 수 있을 것으로 기대되며, 기후 위기의 주범인 이산화탄소를 단순 고정 및 저장하는 기술이 아닌 탄소 순환시스템 구축을 통한 지속가능한 탄소중립 기술로도 의미가 있다. 해당 기술을 더 안정화, 고도화하여 전환효율을 보다 향상시킨다면 인류가 직면한 기후변화 위기 및 식량문제를 동시에 해결할 수 있을 것으로 기대할 수 있다.
합성생물학자들은 박테리아를 조작해 탄소 폐기물을 화학물질로 전환시켜, 탄소 네거티브 접근방식을 통한 순 제로(Net Zero) 배출 경제에 기여하기 위해 노력하고 있다. 노스웨스턴대학교(Northwestern University)와 란자테크(LanzaTech) 社 연구팀은 폐이산화탄소를 산업용 화학물질로 선택적 전환시킬 수 있는 클로스트리디움 오토에타노게눔(Clostridium autoethanogenum) 박테리아 균주를 최적화하는 데 성공했다. 새로운 가스 발효 공정은 대기에서 온실가스를 제거하고 일반적으로 아세톤과 이소프로판올을 생성하는 데 필요한 화석연료 사용을 방지할 수 있다. 식품산업에서 사용되는 미생물 발효는 비화석 연료공급원에서 다양한 화학물질을 제조하기 위한 유망한 접근 방식이지만, 고비용과 총 온실가스 배출량을 증가시키는 문제가 있다. 그러나 특정 박테리아는 이산화탄소와 같은 가스를 분자로 전환하는 가스 발효가 가능해 생활 및 산업폐기물에서 생성되는 가스를 유용한 제품으로 전환할 수 있으며, 새로운 합성생물학 접근 방식을 통해 기후 위기 자체를 해결할 수는 없지만 탄소 제거의 어려운 부분은 해결할 수 있을 것으로 전망하고 있다.43)

출처: https://news.northwestern.edu/stories/2022/02/bacteria-upcycle-carbon-waste-into-valuable-chemicals/
[그림 특집 2-26] 탄소 폐기물을 유용한 제품으로 업사이클 하는 박테리아
|
|
|
특집 제3장 융합형 인재양성과 산업 활성화 |
|
제1절 Bio-IT 전문가가 바라본 인력 양성 |
가. 디지털 인재 정책 동향
(1) 대한민국 디지털 전략과 100만 디지털 인재양성 종합방안
국가적 맥락 속에서 디지털바이오 인재양성을 살펴보면 윤석열정부 디지털 인재양성 정책은 2022년 9월 관계부처 합동으로 발표된 ‘대한민국 디지털 전략’이 기점이라 할 수 있다. 이는 디지털 전환시대에 대응하기 위한 범부처 종합계획으로, 디지털이 과학기술 혁신의 속도・범위・파급력을 높이는 원천으로서 과학기술 난제를 해결하고 신산업화를 촉진하는 기술패권의 핵심임을 강조하였다.
동 전략은 국가혁신역량(WIPO) 세계 1위 등 목표 달성을 위한 5대 전략 중 1순위 전략을 ‘세계 최고의 디지털 역량’으로 설정하였다. 추진 과제 중 하나가 국정과제 81번 ‘100만 디지털 인재양성’이다. 디지털로 핵심기술력을 확보한 사례로 바이오 분야를 다수 적시하였다. 디지털로 과학기술 난제를 해결한 사례로는 인공지능을 활용하여 3차원 단백질 구조 예측에 걸리는 시간이 10년에서 30분으로 축소된 사례를 들었다. 디지털로 신산업화가 촉진된 사례로는 뇌과학과 디지털이 융합된 뇌파 헤드셋과 AI・빅데이터 기반 mRNA백신 개발 사례를 뽑았다.
‘대한민국 디지털 전략’에 기반하여 디지털 대전환 시대가 요구하는 창의적 인재양성을 위해 수립한 범부처 정책이 ‘디지털 인재양성 종합방안’이다. 이 종합방안은 반도체 등 첨단 분야가 필요로 하는 ‘고도화된 디지털 전문 인재’ 양성뿐만 아니라 ‘도메인 분야에 디지털 기술을 적용하는 인재’ 양성 또한 핵심과제로 삼고 있다. 여러 추진 과제 중 ‘비전공 학습자들을 위한 AI 등 디지털+X 역량 향상 집중 교육과정 제공, AI 등 디지털+X 융합과정 활성화 등 추진 과제는 디지털바이오 인재양성 차원에서도 특히 주목할 필요가 있다.

출처: 관계부처 합동, 디지털 인재양성 종합방안, 2022.8.
[그림 특집 3-1] 100만 디지털 인재양성 종합방안
(2) 도메인별 디지털 인재 정책
(가) ICT 분야
2023년 4월 발표된 ‘소프트웨어 진흥 전략’은 ‘대한민국 디지털 전략’ 비전과 목표 아래 개별 전략으로 접근하기 어려운 디지털 인재양성, 기반기술 개발, 오픈소스 활성화, 제도 개선, 문화 확산 등을 집중적으로 추진하는 3대 전략 7대 과제로 구성되어 있다. 제1전략이 ‘전 국민 SW교육 및 고급・전문인재 양성을 위한 기반 마련’으로 누구나 누리는 SW・AI 보편교육 체계를 구축하고, 디지털 혁신을 선도할 고급 인재 양성을 추진하며, 기업-대학-정부 협력을 통한 전문・융합인재 양성을 본격화하고, 생성 AI 확산에 따른 디지털 교육 개선을 추진과제로 하였다. 이를 통하여 2027년까지 차질 없이 100만 디지털 인재를 양성하고, SW・AI 고급・전문 인재 20만 명을 양성하는 것이 목표이다.
전통 SW는 패키지 SW, IT 서비스, 인터넷 SW 등으로 분류되지만 인공지능, 빅데이터, 클라우드 등 新 SW의 등장으로 SW 영역이 확대됨에 따라 디지털바이오 인재양성 또한 직・간접적으로 ‘소프트웨어 진흥 전략’의 영향력 아래에 있다. 동 전략은 新 SW가 IT뿐 아니라 제조, 교육, 의료, 유통, 문화, 국방 등 주요 산업 영역으로 확대되어 물리적인 한계를 극복하는 등 새로운 가능성을 제시할 것으로 전망하였는데 바이오 분야 또한 밀접하게 연관된다. 진흥 전략 외 ‘AI 초일류 프로젝트 추진(안)(2023.1)’, ‘제1차 데이터 산업 진흥 기본계획(2023.1)’, ‘클라우드 3차 기본계획(2021.9)’, ‘블록체인 산업 진흥전략(2022.11)’ 등도 마찬가지이다.
(나) 바이오 분야
바이오 분야에서 제일 먼저 수립된 디지털 인재양성 관련 정책은 과학기술정보통신부가 2022년 12월 발표한 ‘디지털바이오 혁신전략’이다. 석・박사급 디지털바이오 융합형 인력 양성을 위해 프로젝트 중심의 바이오+디지털 융합교육 프로그램을 기획하고, 오믹스 빅데이터의 통합적 분석과 데이터 특성에 맞는 인공지능 활용 실습을 통해 현장 실무형 데이터 사이언티스트를 양성하며, 의료현장 미충족 의료수요 해결 지원 및 AI 3D프린팅 등 디지털 융복합 미래 의료기술 개발을 통해 융합형 의사과학자(MD.-Ph.D.)를 양성하는 것을 세부과제로 설정하였다.
2023년 3월에 발표된 보건복지부의 ‘제3차 제약바이오 산업・육성지원 종합계획(2023∼2027)’은 첨단기술 융복합 분야의 성장 가능성을 강조하고 BT-IT 융복합 전문인력의 수요 증대에 대응하는 실천과제를 제약바이오 생산공정 전문인력, 임상・규제과학 전문인력, 디지털-바이오 융복합 전문인력 등 3개 범주로 구분 제시하였다. 디지털-바이오 융복합 전문인력 양성을 위하여 AI 활용 신약개발 전문가 및 바이오데이터 전문가를 양성하고 융합형 교육과정 개발 및 재직자의 디지털 전환 교육방안 등 실천과제를 보다 구체화하였다.
2023년 4월에는 바이오헬스를 반도체 산업에 이은 차기 주력산업으로 도약시키기 위한 ‘바이오헬스 인재양성 방안’이 발표되었다. 바이오헬스 초격차 확보를 위한 핵심인재 11만 명 양성을 목표로 4대 분야 10개 추진 과제를 설정하였다. ‘NEXT 반도체 도약을 위한 핵심 연구인재’ 양성을 위해 인공지능, 데이터, 바이오-디지털헬스케어 등 첨단・융복합 교육을 확대하기로 하였다.
디지털바이오 분야에 집중한 구체적인 정책은 ‘디지털바이오 인프라 조성방안’으로 2023년 6월에 발표되었다. 디지털바이오 인재양성을 위해서 바이오 특화 AI 대학원을 신설하고, 의과대학 내 의료 AI 정규과정 개설 등을 통해 바이오 전문지식과 디지털 기술을 겸비한 양손잡이형 융합인재를 양성한다. 또한 MIT와 하버드의대의 HST 프로그램을 벤치마킹하여, 의과대학과 공과대학 등 의료계와 과학기술계 간 긴밀한 연계를 기반으로 세계적 수준의 의사과학자를 양성할 예정이다. 국내 우수 연구기관과 보스턴의 선도 연구기관 간 공동연구 프로젝트를 통해 디지털바이오 혁신기술을 개발하면서 동시에 핵심인력을 양성하는 ‘Boston-Korea 프로젝트’도 추진한다.
[표 특집 3-1] 윤석열정부 디지털 인재 정책(디지털바이오 유관)
정책방안 | 부처(총괄) | 발표 시기 |
대한민국 디지털 전략 | 관계부처 합동 | 2022. 9. |
디지털 인재양성 종합방안 | 관계부처 합동(교육부) | 2022. 8. |
소프트웨어 진흥전략 | 관계부처 합동(과기정통부) | 2023. 4. |
디지털바이오 혁신전략 | 과기정통부 | 2022. 12. |
제3차 제약바이오산업 육성・지원 종합계획(2023-2027) | 관계부처 합동(복지부) | 2023. 3. |
바이오헬스 인재양성 방안 | 관계부처 합동(복지부) | 2023. 4. |
디지털바이오 인프라 조성방안 | 과기정통부 | 2023. 6. |
출처: 저자 작성
(3) 해외 주요국 동향
세계 주요 국가들도 우리나라와 유사하게 기초, 실무, 고급 등 단계별로 디지털 역량을 함양하는 정책을 추진하고 있다. 기초단계에서는 초중등 및 고등교육 단계별 STEM(science, technology, engineering, and mathematics) 교육을 강화하고 디지털 소외계층을 포함한 전 국민을 대상으로 디지털 포용 정책을 펼치고 있다.
실무인력 확보를 위해서는 디지털+X 융합역량 확보 정책이 두드러진다. 개인의 직무・전공 분야에 디지털 기술을 활용하는 융합형 인재를 확보함과 더불어 기존의 산업인력을 대상으로 디지털 역량을 재교육하거나 향상시키는 방안이다. 독일은 ‘AI 육성전략’ 등을 통해 노동시장 변화에 따른 업무재교육 등을 지원하고, 영국은 ‘UK 디지털 전략 2022’ 등을 통해 디지털 분야 직업앱 개발 및 취업을 지원하고 있다.
고급인력 확보 정책으로는 디지털 기술을 포함한 첨단기술 우위 확보를 위해 높은 디지털 역량을 갖춘 국내외 석・박사급 인재양성・유치・보호에 집중하고 있다. 중국의 경우 해외 인재 유치를 위해 일회성 보조금 100만 위안을 지급하는 등 각종 혜택을 제공하기도 한다. 싱가포르는 신산업 우수인력 유치를 위해 ‘해외네트워크 전문지식(ONE)’ 비자를 신설하였다.
나. 디지털 인력현황 진단
(1) 디지털 분야 전반
한국직업능력연구원이 2022년 7월 발표한 향후 5년간(2022∼2026) 디지털 인재 수요 및 공급 전망에 따르면 산업계에서 디지털 신기술 개발・활용・운용에 필요로 하는 지식과 역량을 갖춘 인재는 약 73만 8,000명이다. 정부는 SW・AI 분야뿐 아니라 산업・사회 전반에 걸쳐 디지털 인력 수요 급증이 예상되므로 필요 인재는 약 100만 명 이상이고, 현재 인력양성 규모 유지시 약 49만 명의 격차가 있는 것으로 진단하였다.44) 최근 생성 AI, 초거대 AI 등장은 디지털 인력 부족으로 글로벌 경쟁에서 뒤처질 수 있다는 산업계의 우려를 더욱 증폭시키고 있다. 그나마 공급되는 인력이 초・중급에 그치거나 빅테크로 쏠리고 있어 현장에서 원하는 중급이상의 인재 부족은 더욱 심각하다.
특히 기술패권 경쟁에 대응하기 위해서는 단순 프로그래머보다 글로벌 수준의 뛰어난 연구자나 엔지니어 확보가 시급한데 우수한 디지털 인재의 경우는 더욱 심각한 형편이다. 2019년 기준 전 세계 인공지능 전문인력 2만 2,400명의 활동 국가별 비중을 보면 미국(10,295명, 46%), 중국(2,525명, 11.3%), 영국(1,475명, 6.6%)에 집중되어 있고, 한국은 405명(1.8%)에 불과하다.45) 수준 측면에서도 국내 AI 분야 고급인재(h-index 상위 10%)의 역량 수준은 25개국 중 19위로 하위권으로 1위인 미국에 비하면 76%에 불과하다.46)

출처: 이승환, 인공지능 두뇌지수(AI Brain Index):핵심인재 분석과 의미, SW정책연구소, 2019
[그림 특집 3-2] 국가별 인공지능 두뇌지수 분포(국가별 상위 100명)
정부는 디지털 전환의 전면화에 대응하기 위해 K-Digital Training(2020), 이노베이션 아카데미・스퀘어, AI 대학원(2019) 등을 신설하고 SW 인재양성 투자 규모를 지속 확대하였으나 양적 부족과 질적 미스매치가 존재한다. 이는 교육훈련을 거쳐 노동시장 진입까지의 시차(6개월∼4년)가 존재하고, 대학 학사 운영의 경직성, 디지털 전문인력을 양성할 수 있는 교・강사 부족, 적절한 교육환경의 부족 때문이라고 진단하였다.47)
또한 전 세계가 국경 없이 디지털 인재 확보 경쟁을 벌이고 있는 상황에서 숙련된 인재들에게 한국의 매력도가 하락하고 있다는 점도 간과할 수 없다. 2019년 보스턴컨설팅그룹(BCG) 조사에 의하면 세계 디지털 전문인력의 67%가 외국 진출을 희망하는데, 국가별 선호도는 미국이 40%, 독일 31%, 캐나다 27%, 호주와 영국이 24% 순이며 한국에 대한 선호도는 매우 낮은 수준이다.
한국 국적 이공계 인력의 외국 유출이 많고 박사학위 취득 후 국내로 복귀하는 비중이 매우 낮다는 것도 주목할 사안이다. 과학기술기획평가원 연구에 따르면 2019년 한국 국적 이공계 인력의 국가별 유출 비중은 미국(47.2%), 캐나다(14.3%), 일본(8.1%), 독일(7.7%) 순이다. 박사학위 취득 후 대부분은 미국에 체류하였고, 다음으로 중국, 캐나다, 호주, 영국 등에 체류하며, 우리나라 체류 비중은 약 6번째에 해당하여 복귀율이 매우 낮은 것으로 조사되었다.48) 국내 대비 미국 빅테크 기업의 연봉 수준과 업무 환경 등을 고려하면 SW・AI 분야 고급 인재의 국내 회귀 기대치는 이공계 분야 중에서도 특히 밝지 않다.
그나마 디지털에 대한 사회적 관심이 높아지면서 소프트웨어, 인공지능에 대한 학생들의 관심도 높아졌다는 점은 긍정적이다. 교육부의 ‘초중등 희망직업 조사’ 결과에 의하면 소프트웨어 분야 희망 학생의 비율이 중학생은 2017년 4.69%에서 2022년에는 5.42%로, 고등학생은 5.45%에서 8.19%로 증가하였다. 한국과학창의재단이 2022년 영재학교, 과학고 학생들을 대상으로 공동AP 교과목에 대한 수요를 조사한 결과 SW(프로그램과 문제해결) 수강을 희망하는 학생 비율이 63.1%로 미적분학Ⅰ에 이어 두 번째로 나타났다.
(2) 바이오헬스 분야
디지털바이오 분야로 세분된 인력 수급 전망은 아직 명확하게 제시되지 않아 바이오헬스 분야 전반으로부터 추정이 불가피하다. ‘바이오헬스 인재양성 방안’에 따르면 산업부(2022)는 우리나라 바이오헬스 산업 성숙도 증가와 융복합 기술 발전으로 바이오헬스 산업 전반의 인력 부족률은 12대 주력산업 부족율 2.5%보다 더 높은 3.4%로 진단하였다. 고용부가 밝힌 향후 5년간(2023∼2027) 발생할 신규인력 수요는 약 10만 8,700명이고, 신규 졸업자 중 바이오헬스 산업에 진출하는 인력은 약 3만 4,000명으로 예상되어 부족 인력 규모는 7만 4,700명으로 예측되고 있다.
‘제3차 제약바이오 산업・육성지원 종합계획(2023∼2027)’은 2021년 기준 3,582명인 제약바이오 융복합 인재양성 목표를 2027년까지 9,000명으로 설정하였다. 디지털-바이오 융복합 전문인력 양성을 위하여 향후 5년간 AI 활용 신약개발 전문가 1,650명을 비롯하여 바이오데이터 전문가 양성, 융합형 교육과정 개발 및 재직자의 디지털 전환 교육 등을 통한 전문인력을 양성하고자 하였다. ‘디지털 인재양성 종합방안’에 의하면 디지털 유관 분야는 기술혁신 속도가 급격하고 경기 변동 또한 클 뿐 아니라 일반산업의 디지털 전환 수요가 복합적으로 작용하여 디지털 인재 수요를 정밀하게 전망하기에는 여러 한계가 있음을 명시하였다. 정부가 가장 최근에 ‘첨단산업 글로벌 클러스터 육성 방안’을 통해 발표한 ‘디지털바이오 인프라 조성방안’에서도 디지털바이오 인력 수급에 대한 양적 전망은 알려지지 않았다.
다. 도메인별 디지털 인재상
(1) ICT 분야
챗GPT 등 AI 기반 코딩 지원 도구의 확산으로 단순 반복업무가 감소하고, 코딩 지식이 부족해도 소프트웨어를 활용할 수 있는 환경이 조성됨에 따라 소프트웨어 인재상도 변하고 있다. 코딩 역량이 중요했던 소프트웨어 분야의 인재에게 요구되는 핵심역량으로 기계적인 코딩 기술보다 창의적이고 혁신적인 아이디어가 더 높은 가치를 갖는 시대가 되었다. 또한 기술변화가 급격한 분야이므로 융합적 사고, 도전・성장의 경험, 동료와 협업하는 사회적 역량이 타 분야에 비해 더욱 중요한 역량으로 강조되고 있다.
[표 특집 3-2] 소프트웨어 영재 핵심역량 종합
지식기술역량 | 창의・융합역량 | 사회역량 | 인성역량 |
• 설계・분석 능력 • 구현 능력 • 컴퓨팅 사고력 • 데이터 기반사고 • 디지털스킬 | • 융합적 사고 • 창의성 • 문제해결능력 • 추론, 분석력, 혁신 • 기업가 정신 | • 리더쉽 • 의사소통 • 다양성 • 공유와 협업 • 사회적 기여 | • 자기주도성 • 동기 • 열정 및 진취성 • 자기확신 • 인내 |
출처: 한국과학창의재단, 소프트웨어 영재 교육연구(2018, 2021, 2022) 결과 종합
미국도 아이비리그 컴퓨터 관련 학과의 교육과정을 보면 개발 역량뿐 아니라 사업 기획・설계 역량을 요구하는 대학이 많다. 기업이 요구하는 디지털 인재 또한 마찬가지이다. 프로젝트 목표에 대하여 데이터 및 자동절차 추상화 관점에서 기획・설계 관련 비판적 사고를 수행할 수 있고, 기획・설계에 맞는 환경 구축 및 프로그래밍 진행을 통해 실제 시스템을 구현할 수 있는 태도, 지식, 기술 역량을 갖춘 인재를 선호하는 추세이다.
(2) 바이오 분야
앞서 살펴본 정책들은 디지털바이오 인재상을 명확히 정의하고 있지 않아 문제에 대한 인식에서 인재상을 추론해 볼 수 있다. ‘바이오헬스 인재양성 방안’ 등에 따르면 현재 디지털 관련 바이오헬스 인재양성의 문제점으로 직업계 고등 및 학・석・박사 졸업생이 적지는 않으나 교육과정이 기술혁신에 따른 산업환경 변화를 반영하지 못하고 있는 점, 인공지능・데이터・디지털 등 첨단 융복합 기술로의 변화를 선도할 핵심 연구인재 양성 미흡 등을 꼽고 있다.
이와 같은 문제를 해결하고 목표를 달성하는 방안으로 의료, 인공지능 등 첨단・융복합 특화교육을 강화하고, 연구개발 결과를 의료 등 현장으로 연계하는 경력・단계별 전주기 양성체계 마련을 위해 임상 연계, 기초연구 활성화, 산학협력을 강화하는 창의적・혁신적 연구지원 체계 마련을 강조하였다. 대체로 기초체력(펀더멘탈)을 강화하는 전략이다. 이로부터 추론할 수 있는 공통적인 핵심 문제 인식은 디지털 대전환으로 지칭되는 기술변화 속도와 방향이 예측하기 어렵다는 점이다. 바이오헬스, 디지털바이오 등 관련 인재 정책들이 제시한 추진 과제들이 목표 범위와 방안 측면에서 일관성이 있으나 구체적으로 열거된 추진 과제들로 미래 대비가 충분할 것인지가 관건이다.
라. 디지털바이오 융합인재 양성을 위한 과제
(1) 기술변화 속도를 고려한 인재상 정립
예상을 초월하는 급격한 기술변화에 대응한 교수학습 콘텐츠 및 교육체제 유연화 등 공교육 인프라가 부족하고 대학 교육의 유연화 또한 미흡하여 디지털 인재 수급의 미스매치는 향후 더욱 심화될 것으로 전망된다. ‘디지털 인재양성 종합방안’에서 디지털 인재는 ‘디지털 신기술을 개발・활용・운용하는데 필요한 지식과 역량을 갖춘 인재’라고 폭넓게 정의하였다. 나머지 정책방안들은 인재의 정의를 명확하게 제시하기보다는 추진 과제의 결과로 양성될 인재의 유형을 제시하고 있다. 정책들이 주로 과학기술계 또는 관련 산업계에 종사하며 기술패권 시대를 이끌 고도의 전문인력 확보에 중점을 둔다는 점에서 ‘디지털 대전환 시대’의 특성에 부합하는, 중장기적 안목의 열린 인재상을 우선 정립함으로써 목표를 선명하게 하되, 한계를 지양할 필요가 있다.
참고로 최근 소프트웨어 인재양성 추세는 급변하는 기술변화에 대응할 수 있도록 전문지식보다는 컴퓨팅 사고력과 창의적이고 혁신적인 문제해결 역량을 중요시하고 있다. 동일한 맥락에서 우리나라 과학・수학・정보 영재교육을 총괄하는 한국과학창의재단은 소프트웨어 영재의 정의를 “정보기술에 대한 재능을 바탕으로 현실의 문제를 디지털 환경에서 자기주도적으로 해결하는 역량이 뛰어난 자”로 포괄적으로 정리 중이다.
(2) 디지털 인재의 특성을 고려한 양성체계 도입
디지털바이오 인재 수급 방법은 바이오+디지털 융합방향과 디지털+X로서 인재 유입 방향을 모두 고려할 수 있다. 전자는 바이오 분야의 노력으로 주도할 수 있으나, 후자의 경우 SW・AI 분야에 유능한 인재가 바이오 분야로 유입되기를 기대하기는 어려울 것으로 전망된다. 이는 SW・AI 인재의 기본적인 성향과 더불어 SW・AI 분야 자체의 고급인재 수요가 폭증하고 있기 때문이다. 한편 바이오 분야 인재양성 정책은 대체로 바이오 도메인의 인재에게 디지털 융・복합 역량을 함양하는 방향으로 추진되고 있는 점도 한계점으로 보인다.
ICT 분야의 경우 세계적인 추세는 소프트웨어 재능을 조기에 발견하여 다양한 분야 또는 현실의 문제를 해결하는 역량을 키워주는 정책이 우세하다. 정부가 ‘100만 디지털 인재양성’을 국정과제(81번)로 채택하고 1순위 시행과제로 초중등 국가 교육과정 개편을 통해 정보 교과 시수를 2배 늘리고, 전 교과에 디지털 소양 함양을 교육목표로 삽입한 이유이다. 디지털 새싹 캠프에 많은 예산을 투입하여 초중등 단계부터 디지털 교육을 즐겁게 체험할 수 있는 기회를 제공하는 것 또한 같은 맥락이다.
바이오 분야 또한 초중등 조기 단계부터 바이오 데이터를 가지고 놀며, 학습하여 종국에 디지털 재능을 보유한 잠재 영재 등이 디지털바이오 분야로 진출하도록 친밀도를 높이는 전략 또한 고려할 필요가 있다. 초중등 단계 조기 인재양성은 국가 종합전략에서 다룰 부문이지만 바이오 친화적 교육환경 조성을 위해서는 바이오헬스 데이터 등을 활용하여 초중등 수준에 맞게 context가 추상화된 교수학습 자료 등이 교육 현장에 공급될 필요가 있는데, 이는 교육계의 노력만으로는 달성될 수 없다.
인재양성 체계는 학습자 관심 분야와 SW・AI 학습이 연계되어야 하며 이를 통해 해당 분야에 대한 도메인 지식을 바탕으로 데이터 및 절차 추상화 과정을 학습하는 것이 효과적이다. 관심 분야와 산업 영역이 연계되는 것이 효과적이므로 해당 연구・산업 분야 운영자 또는 사용자가 참여하는 커뮤니티를 구성하여 해당 분야 도메인 지식을 접할 수 있도록 하는 방법을 권장한다. 학습환경 또한 온라인 환경에서의 학습이 필수이다. 다만 일반적인 온라인 강의식 환경은 의미가 없으며 인터넷(google, stackoverflow 등 개발자 포럼) 검색에 모든 것이 있음을 잘 활용하여 디지털바이오의 특성이 가미된 온라인 학습 플랫폼이 제공되어야 한다. 한국생명공학연구원 등 기관의 플랫폼을 온라인 교육 플랫폼으로 오픈하여 활성화 할 필요가 있다.
|
|
|
특집 제3장 융합형 인재양성과 산업 활성화 |
|
제2절 데이터기반 바이오 빅데이터 사업화 |
가. 개요
디지털바이오는 디지털 기술과 생명과학의 융합으로 생명체 현상을 분석하고 활용할 수 있는 기술과 산업의 혁신을 의미하며, 글로벌 시장에서 빠르게 성장하고 있는 주요 분야이다. 지금과 같이 과학기술이 지배하는 기술패권 시대에서는 디지털바이오 시장의 빠른 성장은 주목할 일이다. 유전체 분석, 인공지능/빅데이터 분석, 휴먼 디지털 트윈 및 바이오파운드리 등 기술의 발전이 디지털바이오 분야의 혁신과 성장을 이끌고 있으며 이들 기술의 연속적인 발전은 의료 분야의 정확성, 효율성, 개인 맞춤형 의료 서비스의 품질 향상에 기여하게 될 것이다. 세계적으로 고령 인구의 증가와 만성 질환의 증가로 인해 개인 맞춤형 의료와 관리의 필요성이 증가하고 있다. 디지털바이오는 개인의 건강 상태를 모니터링하고 질병 예방, 관리, 치료에 필요한 정보를 제공하는 솔루션을 제공함으로써 이러한 요구를 충족시킬 수 있다. 이러한 인구 구조의 변화와 기술의 발전은 디지털바이오 시장의 성장을 견인하는 중요한 요인 중 하나이다. 디지털바이오는 의료 비용 절감과 효율성 향상을 위한 중요한 도구이며 특히 예방, 조기 진단, 개인 맞춤형 치료 등을 통해 질병의 예방과 치료 비용의 감소를 극대화할 것이다.
나. 본론
(1) 바이오와 디지털 기술의 융합으로 기술혁신 및 신산업 창출
바이오 데이터의 가치가 단순 연구 결과에 그치지 않고 R&D의 핵심 자원으로 인식되고 있다. 바이오 분야에서는 데이터가 신약 개발 및 기술혁신에 중요한 역할을 수행하고 있으며, 보유한 바이오 데이터의 양과 질이 연구 성과와 직결된다. 예를 들어, 유전체 정보, 헬스케어 정보 및 다양한 생체 데이터 등의 데이터를 활용하여 질병 예측, 약물 개발, 개인 맞춤형 치료 등의 연구개발이 이루어질 수 있다.
또한 바이오와 디지털 기술의 융합은 기술혁신을 가속화하고 신산업 창출에 기여하고 있으며, 디지털 기술인 인공지능(AI), 빅데이터 분석 등은 전통적인 바이오 R&D의 프로세스를 혁신하고 새로운 시장을 개척하는 데 활용되고 있다. 예를 들어, AI를 활용한 약물 스크리닝은 기존의 장기적이고 비용이 많이 드는 접근법을 대체하여 신약 개발 프로세스를 가속화하고 있다.
데이터 공유, R&D 협업, 가치 전달 등을 위한 디지털 플랫폼 중심의 생태계도 형성되고 있다. 바이오 분야에서는 산업체, 연구 기관, 정부 등 다양한 주체가 디지털 플랫폼을 활용하여 데이터를 공유하고 협업하고 있다. 이러한 플랫폼은 데이터 기술 연구 주체들을 연결하고, R&D 협업을 촉진하며, 가치 전달을 강화하는 역할을 하고 있으며 이를 통해 바이오 분야의 기술 발전과 산업화를 촉진하고 새로운 비즈니스 모델을 탄생시키고 있다.
(2) 바이오 데이터 공유, R&D 협업 및 디지털 플랫폼 중심 생태계 구축
개인 수준의 유전체 및 헬스케어 데이터의 생성은 의생명 연구에는 이전에 없던 속도와 규모로 이루어지고 있다. 그러나 전통적인 바이오 데이터 분석 모델은 각 연구자가 자체 계산 도구를 설치하고 유지 관리하는 데이터 센터를 중심으로 진행됐다. 이러한 모델은 연구자에게 유연성과 제어 기능을 제공하지만, 개별화되고 분리된(사일로화) 특성으로 인해 몇 가지 주요한 장벽과 비효율성이 발생했다. 이 모델은 각 기관이 중복된 데이터 센터를 구축하게 되어 중복된 인프라와 분석 도구를 배포하고 유지 관리해야 하는 비효율성을 초래하며 이로 인해 데이터의 저장, 공유, 분석에 대한 기술적, 물류적인 문제가 발생하며 협업을 어렵게 하고 비용 효율적이지 않다. 때문에 바이오 데이터 및 연결된 임상 데이터의 과학적 가치를 극대화하기 위해 새로운 컴퓨팅 및 스토리지 플랫폼의 개발이 필요하다. 앞으로의 디지털바이오 플랫폼은 전통적인 분석 모델의 장애와 비효율성을 극복하여 바이오 데이터를 빠르고 쉽게 분석할 수 있도록 지원해야 한다. 이를 위해 데이터 공유와 분석을 간소화하고 사용자 인증과 권한 부여 메커니즘을 개발해야 하며, 데이터의 중복성을 줄이면 분석 작업에 필요한 비용을 효율적으로 최적화할 수 있을 것이다.
또한 바이오 데이터 플랫폼은 효율적인 관리와 데이터 보안 강화를 위해 중앙 집중식 서비스, 데이터 암호화, 로깅, 감사 및 침입 탐지 기능을 제공한다. 이러한 플랫폼은 연구자들이 저비용으로 바이오 데이터 분석과 활용을 신속하게 수행할 수 있도록 도움으로써 데이터 공유, 협업, 디지털 플랫폼 생태계의 발전을 촉진하고 개인 맞춤형 의료, 질병 예방, 신약 개발 등에 대한 효율을 극대화할 수 있다. 이에 한국 정부도 기본 방향으로 국가 바이오 데이터 스테이션(K-BDS)을 구축하여 국내 연구 데이터를 체계적으로 관리하고 활용하는 플랫폼을 구축할 예정이며, 여기에 더 나아가 정부와 민간이 협력해 바이오 데이터의 산업적 활용도를 극대화하는 체계를 구축할 계획이다.
바이오 데이터 활용 플랫폼을 통한 연구 생태계를 구축하고 더 나아가 발 빠르게 다양한 산업화 효과를 기대하고 이를 준비하고 있는 영국(UK Biobank)과 미국(All of Us)의 사례를 소개하고자 한다.
(가) 영국의 연구 바이오 데이터 플랫폼인 UK Biobank 사례
UK Biobank는 영국 정부를 포함한 다양한 보건 자선단체, 학계 및 산업계로부터 투자 및 지원을 받고 있다. 특히 UK Biobank는 영국 정부로부터 핵심 자금으로 약 1억 8,000만 파운드(약 3,000억 원)를 받아 자발적 영국인 참여자 50만 명의 유전체/오믹스 데이터를 생산하고 약 2,000여 개에 해당하는 다양한 표현형을 수집했다. 데이터를 생산하고 모으는 것이 출발점이라고 할 수 있는데, 이에 대한 실제 가치는 후방 산업(다운스트림)적 측면에서 수요를 얼마나 잘 분석하느냐에 따라 엄청난 부가가치로 발생할 수 있다.
아직은 기초연구 수준이지만 이 프로젝트는 사람들을 더욱 건강하게 하고, 제약 바이오 기업들의 참여와 산업적 가치를 높이는 것을 목표로 하고 있다. 이 프로젝트는 공개 데이터 접근의 가치를 극대화하기 위해 진보된 유전학 기술과 원천 샘플 및 시료・자원을 적극적으로 자원화하고 언제든지 추가적인 데이터를 확보하고자 하였으며, 이를 후속 연구에 지속적으로 활용할 수 있도록 하는 개방형 인프라를 구축했다. 전 세계 연구자들은 이제 이런 개방형 데이터를 활용하여 많은 주요 연구 성과를 내고 있다.
이런 성과를 바탕으로 영국 정부는 바이오 데이터를 잘 보관하는 수준을 넘어 이를 국가적으로 활용하는 바이오 데이터 활용 플랫폼으로 나아가기 위해 적극적으로 노력하고 있다. 연구자들과 기업들이 참여해 데이터 활용을 위한 가이드라인을 개발하여 성과로 이어지도록 하고 있으며, 이러한 노력으로 전 세계 연구자들이 활용할 수 있는 디지털바이오 연구 데이터 플랫폼으로 발전하고 있다. 영국은 전 세계 연구자와 제약회사들이 원하는 기초연구 및 사업화에 다음과 같은 역할을 하고 있다.
① 질병 예방 및 치료: UK Biobank는 거대한 바이오 데이터 세트를 보유하고 이를 전 세계 기초연구자 바이오 및 제약회사 연구자들이 활용할 수 있게 함으로써 다양한 질병과 관련된 연구를 자유롭게 수행할 수 있도록 지원한다. 이러한 유례없는 50만 명의 대규모 인구집단을 통한 연구는 통계적 유의성을 높이고 연구 결과의 신뢰성과 일반화 가능성을 높인다. 또한 참여자들의 데이터와 샘플을 통해 질병의 원인과 발병 메커니즘을 이해하는데 큰 도움을 주어 바이오 및 제약회사들이 적절한 예방 및 치료제 개발 전략을 세울 수 있게 돕는다.
② 개인 맞춤형 의료: UK Biobank의 데이터는 기초연구자와 바이오/제약기업들은 개인의 유전체학적, 생체학적 특성과 건강 정보를 기반으로 개인 맞춤형 의료 접근 방식을 개발하는 데 활용될 수 있다. 이는 개인의 특성과 필요에 맞게 예방, 진단, 치료 등의 의료 서비스를 최적화할 수 있도록 한다. 또한 개인의 건강 상태를 모니터링하고 개인에게는 맞춤형 건강 관리 가이드를 제공함으로써 개인의 건강을 유지하고 개개인의 질병을 조기에 발견하여 치료 기술을 개발하는 데 크게 도움이 된다.
③ 공공 헬스케어 정책 수립: UK Biobank의 데이터는 공공 보건 정책의 근거를 제공하는 데 활용될 수 있다. 예를 들어, 유전체학적 요인이 건강에 미치는 영향을 평가하여 인구 전반에 걸친 국가 차원의 예방 전략을 구축하는 데 활용할 수 있다. 또한 UK Biobank의 데이터는 공공보건 차원에서의 질병 예방 및 관리 전략의 개발에 중요한 역할을 할 수 있으며, 영국 내 영국인들의 건강 상황을 파악하고 건강 격차를 감소시키는 데에도 크게 기여하고 있다.
(나) 미국 국립보건원(NIH)이 주도하는 정밀의료사업 플랫폼인 All of Us 사례
All of Us 프로젝트는 미국 국립보건원(NIH)이 주도하는 정밀의료 사업의 핵심적인 부분이며 이 프로젝트는 미국 내 100만 명의 자발적 참여자로부터 유전체 데이터, 생체 신호, 건강 정보 등 다양한 데이터를 수집하고 분석하여 개인 맞춤형 의료와 질병 예방에 기여하는 것을 목표로 한다. 미국 정부는 All of Us 프로젝트가 사업화 관점에서 큰 잠재력을 가지고 있다는 것을 인식하고 지속적으로 투자를 계획하였다. 특히 건강 데이터의 대규모 수집과 분석을 통해 질병 예방과 치료에 대한 새로운 통찰력을 제공하여 미국 내 바이오 및 제약 기업에게 새로운 약물 개발, 진단 방법의 개선, 인체에 미치는 유전체학적 영향 요소의 발견과 의생명 산업의 적용에 큰 도움을 줄 수 있을 것으로 예상하였다.
또한 All of Us는 데이터를 엄격히 보호하고 프라이버시를 유지하기 위한 철저한 보안 및 개인정보 보호 정책을 갖추고 있다. 이는 참여자의 신뢰를 얻어 연구자 그리고 더 나아가 산업체가 이 데이터를 활용할 수 있는 기반을 만들어 가기 위함이다. All of Us를 통해 산업체는 사업화 가능성을 확장할 수 있고, 데이터에 기반을 두고 있는 기술 및 서비스 제공 업체는 다양한 데이터를 활용하여 의료 분야에서 혁신적인 솔루션을 개발할 수 있다. 이는 개인 맞춤형 의료, 질병 예방, 생체 신호 모니터링 등 다양한 응용 분야에 대한 비즈니스 기회를 제공할 수 있다.
All of Us 프로젝트는 건강 데이터의 활용과 보호, 산업체와의 협력을 중심으로 전략을 구축하며 적절한 데이터 분석 기술과 개인정보 보호 방안을 개발하고, 산업체와의 파트너십을 구축하여 혁신적인 제품과 서비스를 개발하는 것에 집중하고 있으며, 이를 장기적으로 계획하여 추진 중이다.
궁극적으로 미국 정부는 All of Us를 통해 미국이 미래의 정밀 의료 분야와 함께 디지털바이오 플랫폼 시장에서도 경쟁력을 갖춰 선점하기를 기대하며 투자하고 있다. 이를 통해 미국 국민들에게는 개인화된 정밀의료 서비스가 개발되어 실생활에 활용되고, 공공 의료적인 측면에서는 국민들의 질병 예방을 통해 지속적으로 큰 부담으로 증가하는 의료비용의 감소를 목표로 하고 있다.
(3) 한국 정부의 디지털바이오 혁신 전략 및 방향
정부는 디지털바이오 분야에 매년 약 4,000억 원을 투자하여 2030년까지 기술 수준을 세계 최고 수준인 85%로 끌어올리고 선도국으로 진입할 계획이다. 2027년까지 DNA 암호화 화합물 은행을 포함한 디지털바이오 인프라 등의 연구환경을 구축하고 2028년까지 바이오파운드리를 구축하여 디지털바이오 분야의 연구개발을 지원하는 협업 네트워크를 강화하고자 한다. 또한 바이오 전 분야의 연구데이터를 통합 관리하는 국가 바이오데이터 스테이션을 조성하여 바이오 데이터의 활용과 공유를 원활하게 하며, 디지털바이오 인재를 양성하기 위해 교육과 연구 지원 프로그램을 확대한다고 발표했다. 이를 통해 개발된 선도적인 디지털바이오 기술들의 상용화를 적극적으로 추진하여 산업 경쟁력을 강화할 계획이다. 이러한 전략적 실행을 통해 정부는 세계적인 디지털 역량과 탄탄한 바이오 기본 역량을 접목시켜 글로벌 기술패권 경쟁에 대응하고, 바이오 분야의 기술혁신을 촉진하여 디지털바이오 시장에서 세계 최고 수준의 기술을 보유한 경쟁력 있는 선도국으로, 그리고 글로벌 바이오 강국으로 도약해 사회와 경제 발전에 크게 기여할 수 있을 것이라고 예상하고 있다.
(4) 디지털바이오 규제개선 및 혁신 생태계 조성
디지털바이오 분야는 높은 잠재력을 가지고 있지만 규제와 관련된 도전 과제가 존재한다. 기존의 규제로는 디지털바이오 분야 기술개발 및 사업화에 들어가는 시간과 비용이 많이 소요되는 문제가 있으며, 바이오 벤처기업과 중소기업들이 이러한 규제로 성장에 제약을 받고 있다. 또한 디지털바이오 분야의 앞선 선진국들의 정책과 보호주의로 인해 국내 기업들은 경쟁력이 약화되고 있다. 규제개선을 통한 혁신 생태계 조성과 더불어 의사과학자 등 융복합 인재양성과 바이오헬스 규제 샌드박스를 도입하여 혁신 생태계 조성을 위한 협력을 촉진해야 하며, 연구개발 투자, 제도개선, 정부-산업 협력 등을 통해 디지털바이오 사업화를 지원하는 등 디지털바이오 산업의 경쟁력을 향상시켜야 한다. 특히 국가 차원에서는 디지털바이오 분야에서의 기술개발 활성화를 위한 연구개발 예산을 대폭 확대하면서도 정보보호 등 개인정보 보호를 위한 법률의 강화와 정보보호 기술의 발전을 통해 개인의 헬스・의료 데이터가 안전하게 관리될 수 있는 환경을 조성해야 한다. 또한 관련 디지털바이오 산업의 육성과 성장을 위해 관련 기업들에 대한 지원사업과 정부의 구매력을 발휘할 수 있는 후방지원을 추진하여 국내 디지털바이오 기업들이 초기 산업 경쟁력을 강화하는 방향으로 추진할 필요가 있다.
다. 결론
현재 기술패권 시대 상황에서 가장 주목 받는 디지털바이오 분야는 국가 경제의 경쟁력과 안보에도 큰 영향을 미치는 중요한 요소가 되었다. 미국은 풍부한 연구 인프라와 기술 전문가를 보유하고 있으며, 중국은 대규모 시장과 투자를 통해 디지털바이오 분야를 선도하고 있다. 특히 미국, 중국, 유럽 등의 패권 국가들은 자국에서 생산된 디지털바이오 데이터를 국외로 반출하지 못하도록 하고, 전략적으로 데이터를 모아 활용하는 방법을 모색하고 있다. 한국도 데이터 주권에 대한 논의는 진행 중이지만, 데이터 활용에 대한 적절한 규제와 법적 근거 마련이 부족한 상황이다. 서둘러 규제개선과 법적 근거를 마련해 바이오 데이터 공유와 관련된 선도적인 규제 수립과 개선하는 등의 디지털바이오 혁신 생태계 조성을 위한 끊임없는 국가 차원의 전략적 의지가 요구된다.
|
참고자료 |
∙ 외교부, 미국의 바이오데이터 관련 행정명령(E.O,14081)에 대한 시사점, 외교부 MOFAST 리뷰 22호
∙ Schatz, Michael C., et al. “Inverting the model of genomics data sharing with the NHGRI Genomic Data Science Analysis, Visualization, and Informatics Lab-space.” Cell Genomics 2.1 (2022)
∙ All of Us Research Program Investigators. “The “All of Us” research program.” ‘New England Journal of Medicine’ 381.7 (2019): 668-676
∙ Sudlow C, Gallacher J, Allen N, et al. UK biobank: an open access resource for identifying the causes of a wide range of complex diseases of middle and old age. PLoS Med. 2015;12(3):e1001779. Published 2015 Mar 31. doi:10.1371/journal.pmed.1001779
|
|
|
특집 제3장 융합형 인재양성과 산업 활성화 |
|
제3절 디지털바이오의 법제도 고려사항 (데이터와 생명윤리) |
가. 개요
빅데이터 시대에 각종 디지털 기술의 등장과 발전, 그리고 융합은 바이오 분야를 향하여 확장되고 있다. 이를 기술의 관점에서 보면 디지털 시대의 바이오 대전환이라 볼 수 있을 것이다. 디지털 전환은 기술과 데이터를 활용한 사물인터넷(IoT), 인공지능(AI) 등으로 대표되는 4차 산업혁명의 흐름을 이끄는 대표적 개념이다. 이러한 기술의 발전과 그 기술의 발전을 뒷받침해 주는 데이터 활용에 대한 메커니즘이 곧 디지털 시대의 핵심 원리이자 동력이다.
특히 IoT 기술이나 AI 기술은 개발 당시 완성된 기술이 아니라, 사용되면서 동시에 지속적으로 공급받는 데이터와 알고리즘에 의해 진화하며 발전해야만 하는 특징이 있다. 이 때문에 더더욱 데이터가 활용되는 환경과 그 관련 기술이 중요하며, 그 혁신성과 새로운 가치 창출에 대한 가능성이 곧 관련 분야의 종합적인 성공 가능성으로 이어질 수 있는 핵심 요소가 된다.
이러한 맥락에서 ‘디지털 시대의 바이오 대전환’이라는 주제와 관련한 윤리적 문제와 그 동향을 살펴보려면 선행되어야 할 것이 있다. 바이오 분야의 데이터를 왜 디지털 전환하려는 것인가에 대한 궁극적인 목적과 방향에 대해 고민하고, 바람직하고 효율적인 추진을 위해 필요한 단계별 검토 사항과 과제를 찾는 것이 중요하다. 특히 바이오 분야의 디지털 전환을 통해 이루어야 할 목표와 그 목표를 위해 투자되어야 할 요소, 그리고 그에 따른 변화가 가져올 영향 등을 종합적으로 검토하고, 이를 바탕으로 기술을 개발하고 활용하는 주체 간의 상호작용과 협업을 통해 합리적으로 납득할 만한 가치를 창출할 수 있을 것인가를 검토해야 한다.
검토에 앞서 기억해야 할 것은, 어떤 기술의 발전이나 그 기술의 적용 범위와 방식 등에 대한 사회적 수용성과 관련된 윤리적인 문제들은 그 기술이 발전되어 적용되는 나라의 법률이나 제도적 환경 등에 영향을 많이 받는다는 점이다. 게다가 이러한 국가별 법률이나 제도에 의한 차이가 아니더라도 윤리적 문제가 그 특성상 기존의 법률이나 제도 내 또는 사회적 통념 등에 따라 해석이나 적용이 쉽지 않기 때문에 그 사회 구성원들이 가진 사고방식이나 문화, 인식 등에 의해 영향을 받을 수 있다는 것이다. 따라서 새롭게 발전 또는 융합하는 기술이나 그 적용 분야에 대한 윤리적 쟁점이나 동향 등을 살펴볼 때는, 먼저 그 사회가 갖는 법률, 제도 및 사회・문화적 특징과 함께 해당 기술의 발전 또는 적용의 단계 혹은 과정을 함께 확인하는 것이 중요하며, 그 특징과 현황에 따라 다른 검토가 필요하다. 따라서 본 절에서 살펴볼 생명윤리 문제는 각국에서 디지털 시대의 바이오 대전환과 관련하여 이미 가지고 있는 법・제도 현황 내에서의 윤리적 문제와 그 밖에 충분히 포섭되지 않는 영역의 윤리적 문제를 포함하고 있다.
나. 디지털 시대의 특징과 바이오 데이터 관련 동향
(1) 데이터 처리 기술과 데이터 과학
4차 산업으로의 전환을 위해 디지털 전환 및 디지털 과학은 필수이며 그 핵심에 데이터 처리 관련 컴퓨팅 기술이 있다. 컴퓨팅 기술은 꾸준하게 발전해 테라(Tera. 1012)에서 페타(Peta, 1015), 페타에서 다시 엑사(Exa, 1018) 스케일로 1,000배씩 빠르게 진화하고 있다. 그러나 수많은 데이터가 활용 가능한 지식(Knowledge)이 되려면 좀 더 체계적이고 정교한 데이터 과학(Data science)이 요구된다. 특히, 생의학에 기반한 소위 바이오 데이터에서는 더욱 그렇다. 미국 국립의료원(National Institutes of Health, NIH)은 데이터 과학을 “복잡하고 방대한 데이터 세트에서 지식과 통찰력을 추출하기 위한 정량적 및 분석적 접근 방식, 절차 및 시스템을 개발하고 사용하는 학제간 탐구 분야”로 정의하였다. 그리고 정부가 지원하여 수행된 수많은 의생명과학 연구에서 얻은 데이터를 지식화하기 위해 2014년 BD2K(Big Data to Knowledge) 프로젝트를 시작했는데, 여기에는 데이터 압축 형식, 알고리즘 모음, 웹 기반 소프트웨어, API, 공용 데이터베이스 및 접근 방식 등 다양하고 종합적이며 체계적인 개선을 위한 전략과 목표 등을 포함한다.
데이터 과학 및 그 발전을 위한 전략도 중요하지만, 실제 데이터 과학을 적용하려면 적용해야 할 분야의 복잡하고 방대한 데이터 세트를 충분히 파악하고 분석하여 효율적인 활용 및 정보 추출이 가능한 데이터 관리 시스템을 개발하는 것이 필요할 것이다. 데이터 보관, 통신 및 처리를 위한 각종 기술과 도구가 발전하고 인공지능, 딥러닝 등의 데이터 관련 혁신이 빠르게 발전하고는 있지만, 정작 미래의 고부가가치가 있는 데이터 자원을 확보하고 그 데이터를 유용한 지식으로 만들기 위해서는 결국 기술 집약적 연구와 기존 데이터 과학의 노력을 엮는 데이터 생태계로의 전환이 필수적이라는 것을 의미한다.
(2) 미국
미국은 이미 앞에서 설명하며 인용했듯이 정부가 그동안 지원하여 수행한 수많은 연구에서 얻은 데이터의 지식화를 위해 2014년 BD2K(Big Data to Knowledge) 프로젝트를 시작했다. 이에 따라 데이터 압축 형식, 알고리즘 모음, 웹 기반 소프트웨어, API, 공용 데이터베이스 및 접근 방식 등의 개선 분야와 전략 등을 발표한 바 있으며 이미 국가 주도로 상당히 적극적으로 추진되고 있다.
미국의 NIH는 생의학 연구 및 관련 정보 기술의 발전으로 수집된 다양한 바이오 관련 데이터 자원의 생태계를 먼저 검토하였다. 이를 통해 데이터 관리 비용의 증가와 연구자별 단위 분산과 다양한 형태로 생성되고 구축된 현재 데이터 생태계의 고립화(siloed), 낮은 유용성 등 현실적 문제들을 확인하였다. 특히, 임상 데이터를 포함한 대부분의 생의학 데이터는 다양하게 분산되어 있으며 주로 개별 과학자, 연구자 또는 소규모 연구진 또는 집단에 의해 생성되기 때문에 다양한 형식으로 존재하고 있었다. 때문에 임상 데이터를 적절하게 처리하고 안전하고 신뢰할 수 있는 데이터 사용 환경 즉, 환자 데이터에 대한 적절한 관리를 보장하고 데이터의 손상과 손실을 방지하기 위한 신뢰할 수 있는 데이터 관리, 보안 환경 조성 관련 법률의 준수 확인 등 데이터 품질과 무결성 확보 노력이 중요하다고 보았다.
NIH가 수립한 데이터 과학을 위한 전략에 따르면, 생물의학 데이터 자원의 생태계를 현대화하기 위한 목표 및 계획을 수립하고 생의학 연구데이터에 FAIR 원칙의 적용을 제안한다. 여기에서 데이터 FAIR 원칙이란, 데이터 자원의 수집 원칙으로 ‘검색 가능하고(Findable), 접근 가능하고(Accessible), 상호 운용 가능하며(Interoperable), 재사용 가능(Reusable)’해야 한다는 원칙이다. 이에 따라 NIH가 지원하여 수행된 모든 생의학 연구에서 데이터 수집 및 활용에는 이 원칙이 준수되어야 한다.
FAIR 원칙을 준수한다는 것이 어떤 것인지 좀 더 자세하게 살펴볼 필요가 있다. 먼저 ‘검색 가능’이란, 데이터 검색이 가능하도록 해당 데이터에 고유 식별자가 있어야 하며, 이에 따라 검색이 가능하도록 리소스 내에서 데이터에 효과적으로 레이블을 지정해야 한다는 것을 의미한다. 다음 ‘접근 가능’이란, 접근 가능하도록 개방형 시스템과 효과적이고 안전한 인증 및 권한 부여 절차를 통해 데이터를 쉽게 검색할 수 있어야 한다는 것이며, ‘상호 운용 가능’이란, 데이터가 표준화된 어휘 즉, 동일한 언어를 사용해야 한다는 것을 의미한다. 마지막으로 ‘재사용 가능’이란, 데이터를 수집한 사람이 아닌 새로운 사용자에게 해당 데이터를 적절하게 설명할 수 있고 데이터 사용 라이센스에 대한 명확한 정보가 있어야 한다는 것으로 추적 가능한 ‘소유자 매뉴얼’ 또는 출처가 명확해야 한다는 것이다. 더 나아가 NIH는 기 생성된 데이터의 가치를 극대화하기 위한 매우 효율적이고 효과적인 생물의학 연구데이터 인프라 지원, 데이터 자원 생태계의 현대화 및 고급 데이터 관리, 분석 및 시각화 도구의 개발 및 보급 지원, 생의학 데이터 과학 관련 전문인력의 발굴 및 역량 강화, 그리고 청지기로서의 관리 및 지속 가능성 촉진을 위한 적절한 정책 마련과 운영 등의 목표를 수립하고 각 목표별 시행계획을 수립하였다. 또한 규모의 경제와 시너지 효과 촉진 및 불필요한 중복 지원 방지 등을 위한 조정과 협력, 데이터 생태계의 유용성 극대화를 위한 최적의 과학적 투자와 수익 보장을 위한 전략적 목표 수립, 효율적 달성을 강조하고 있다.
(3) 영국
영국은 국민보건서비스(National Health Service, NHS)와 UK Biobank를 중심으로 국가 차원의 체계적인 연구와 개발을 지원해 온 대표적인 국가로 유전학 및 유전체학 분야의 글로벌 리더라고 볼 수 있다. 영국은 2017년 자발적인 참여자의 동의를 받아 UK Biobank에 수집된 50만 명의 영국인 전장유전체를 확보하여 유전자형 데이터를 공개하였다. 또한, 영국은 2020년부터 NHS를 중심으로 일상적 치료에서 전장유전체(WGS)를 제공하는 의료 서비스를 세계 최초의 국가 의료시템에 도입하는 국가가 되었다.
2020년 영국은 질병의 진단과 치료를 위한 최신 유전체학의 발전을 일상적인 의료 및 건강관리와 통합하는 계획을 수립하며 환자의 이익을 위해 유전 및 유전체학과 관련 기술의 발전을 활용하기 위한 다양한 협력을 제안하는 ‘Genomics UK’를 발표하였다. 여기서 영국은 핵심적 영역 진단 및 맞춤 의학, 예방, 연구라는 3가지 측면으로 나누어 각각 설득력 있는 비전을 제시한다. 먼저 진단 및 맞춤 의학의 영역에서는 질병의 진단과 치료의 개선을 위해 최신 유전체학의 발전을 일상적인 건강관리에 통합할 것이며, 이를 위해 NHS 시스템 내 의료 서비스에서 50만 건의 전장유전체 분석을 할 것과 표적치료제 등 유전형에 다른 치료적 효과가 다른 경우 적합한 치료를 위한 정보를 제공받을 수 있도록 약물유전체학에 기반한 효과적인 치료법을 제공할 계획, 그리고 암에 대한 다학제적 연구를 통한 개선에 집중할 계획을 밝혔다. 동시에 예방 영역에서는 공중 보건 및 건강 개선을 위한 예측 및 예방적 의료가 가능토록 할 것이라는 비전도 제시하였다. 이에 따라 선별검사를 통한 시퀀싱 정보와 질병 예측 관련 유전체학을 더 잘 사용할 수 있는 방안을 모색하고 있으며, 기초 및 중개연구를 지원하고 연구와 의료 간에 원활한 정보 공유 및 활성화가 가능한 공간을 보장함으로써 의료의 혁신을 지원하고 책임 있는 데이터의 사용 등을 강조하고 있다. 특히 환자의 이익을 위한 건강 데이터의 책임 있는 사용에 대한 모범을 유전체학에 적용하고자 하며, 이를 위해 중점을 두는 주제 중 하나가 ‘국가적 차원에서 조정된 데이터 분석 및 접근 방식의 제공’이다. 이를 통해 전문가와 승인된 연구원들이 유전체 데이터 세트에 쉽게 접근하고 해석할 수 있는 환경을 제공하겠다는 계획이다.
정부의 이러한 추진은 정책 수립 이전에 윤리적 문제에 대한 조사와 연구가 선행되었기에 가능했다. 영국의 너필드 생명윤리 위원회에서는 2015년 발표한 보고서 ‘생의학 연구 및 건강관리에서 데이터의 수집, 연결 및 사용 : 윤리적 문제’를 보면, 많은 인간 대상 연구에서 파생된 데이터가 다양하게 축적되고 있는 현실을 인정하고, 이런 데이터의 축적이 정보 기술 및 데이터 과학의 발전으로 데이터에 대한 통찰력과 수집 및 분석, 결합 및 관리 등에 대한 더 좋은 방법을 제공해 주며 그 결과로 데이터의 용도가 잠재적으로 무한하고 귀중한 자원이 된다는 것을 분명하게 인지하면서 이와 관련한 정책을 제안하였다. 대부분 데이터의 책임 있는 사용에만 관심이 있지만 개인의 사생활은 근본적으로 개인의 정체성이나 관계, 개인의 행복감과 그 유지가 중요하기 때문에 개인의 사생활 보호는 공공의 이익과도 직결된다고 강조하고 있다.
이렇게 공공과 민간의 이익은 복잡하게 얽혀 있기 때문에 데이터 이니셔티브에서는 데이터 사용에 대하여 합리적이고 도덕적으로 기대할 수 있는 것이 무엇이며, 그 기대가 충족될 것이라는 충분한 확신을 위해 필요한 조건이 무엇인가를 해결하는 것이 가장 중요한 선결과제라고 보았다. 이는 방대하게 축적된 데이터를 연결하고 재사용하는 것이 가치 있는 활용이므로 이를 위해 데이터 과학에 기반하여야 하고, 과학적, 정책적, 경제적 요인과 그에 관련된 여러 우려 또는 잠재적 위험을 조사하지만, 기존의 정보 거버넌스가 기술의 발전을 따라갈 수 없는 한계는 가지고 있다. 또한 법률을 준수한다는 것이 곧 데이터의 도덕적 사용을 의미하는 것은 아니므로 데이터 주체의 동의에 따라 데이터를 사용하는 것만으로 프라이버시 보호를 안정적으로 확보할 수는 없다는 것도 분명히 하여 법률 준수와 윤리적 사용이 다름을 명확하게 하였다.
그러나 궁극적으로 데이터는 연결되고 재사용됨으로써 그 활용의 가치를 도출할 수 있으므로 데이터 사용에 대한 효과적인 거버넌스가 반드시 필요하다. 이에 보고서는 데이터 주체의 동의에 따라 데이터에 대한 접근을 제한하는 것을 원칙으로 하되, 데이터의 장기 보관 및 광범위한 사용을 위해서는 동적 동의 형태로 지속적인 정보 주체의 참여가 필요하다고 요구한다. 정보 주체의 동의를 구하는 것이 개인의 이익에 영향 줄 수 있는 문제에 대한 결정권을 부여하는 것은 가능하지만, 데이터 사용으로 인한 잠재적인 문제로부터 개인을 보호할 수는 없으므로 단순히 동의만으로 데이터 주체에 대한 도덕적 의무를 면제할 수는 없다고 본다.
또한 이 보고서에서는 프라이버시 보호를 위한 법적 조치와 개인식별 방지를 위한 여러 가지 기술적 조치의 적용을 강조한다. 익명화 또는 비식별화 조치가 프라이버시 보호에 도움이 되긴 하지만 재식별이 가능한, 즉 잠재적인 재식별 위험을 정량화하기는 어렵기 때문에 데이터 주체의 프라이버시 보호를 위한 접근 제한과 관리가 중요하다는 것을 의미한다. 데이터 사용의 가치와 그로 인한 이익 사이에는 발생할 수 있는 긴장과 이해 상충 등은 데이터 사용에 관여하는 개인 또는 그룹, 기관은 물론 그 사회 구성원 수준에서 다양하게 발생할 수 있다. 특히, 민감한 프라이버시 영역에서 생성되고 관리되는 생의학 연구 및 건강관리에 대한 데이터 사용에서는 더욱 그렇다. 따라서 이러한 데이터의 사용은 공개적으로 확정할 수 있는 도덕적이고 합리적인 기대와 원칙을 정하고 그에 따라 철저하게 관리할 수 있는 적절한 거버넌스 하에서 주도되는 것이 중요하다.
그리고 너필드 위원회는 보고서에서 이러한 데이터 이니셔티브에 대한 윤리적 원칙으로 4가지 원칙을 제안하고 그 구현이 필요하다고 주장한다. 첫째, 데이터가 어떻게 사용될 것인지와 관련한 인간 존중의 원칙이다. 여기에는 데이터 기밀성 여부와 관계없이 자신과 관련한 정보에 대하여 타인의 접근 및 공개를 통제하는 데 있어 개인의 도덕적 관심을 인정하는 것이다. 둘째, 데이터가 사용되는 방식과 관련한 인권 및 사생활 보호의 원칙이다. 이는 타인의 이익을 보호하려는 것을 포함한 여러 가지 공익을 위해 개인의 사생활을 간섭할 수 있는 국가나 타인의 권한을 제한할 수 있다는 것이다. 셋째, 데이터의 사용 또는 재사용 방법과 관련한 절차적 정당성의 원칙이다. 데이터 이니셔티브가 데이터 사용과 관련한 다양한 이해관계를 가진 사람을 모두 참여하게 하거나 그렇지 못할 경우 적어도 모든 사람이 합리적으로 인정할 수 있는 형식으로 수립되고, 참여 및 공개 설명 등을 통해 관련된 이해관계를 가진 모든 사람들의 가치 등을 공정하게 담아야 한다는 것이다. 마지막으로 데이터 이니셔티브 그 자체가 도덕적으로 정당하고 효과적인 거버넌스와 책임 있는 시스템을 적용받을 수 있어야 한다. 이는 합법적인 사법 및 행정적 권한 하에서 발생할 수 있는 사회적 책임 구조를 포함하고, 효과적인 책임 유지와 그 영향이 더 광범위하게 전달되기 위해 좀 더 효과적인 조치를 포함해야 한다는 것이다.
다. 전망과 과제
바이오 분야의 데이터는 대부분 개별 의료기관 및 의료진 또는 과학자 등 소규모의 그룹이나 집단에 의해 생성 및 보관되고 있기 때문에 형식이나 내용이 매우 다양하게 존재한다. 따라서 생성 주체의 목적 및 관리 방식에 따라 매우 다양하고 주관적일 수 있다. 다시 말하면 표준화가 어렵고, 생성한 사람이 아닌 다른 사람이 그 데이터를 이용하기 위해서는 데이터에 대한 이해 및 정리 등이 필요하다는 것을 의미한다. 데이터에 대한 이해 및 분석, 정리 등을 위한 데이터 처리 기술이 꾸준하게 발전하고는 있지만, 실제 다른 사람이 생성한 데이터를 정리하려면 기술의 발전 전에 데이터 그 자체에 대한 충분한 이해와 표준화가 되어 있어야 분석 가능하며, 데이터 마이닝 등과 같은 상당히 전문적인 과정을 통해 디지털화 될 수 있다. 물론 기계학습이나 딥 러닝 등 AI 기술은 일단 많은 양의 데이터 입력과 노출을 통해 스스로 성장, 발전할 수 있다는 주장도 있지만, 최소한의 데이터 표준화 및 알고리즘에 의한 프로그래밍, 그리고 그 시스템으로 공급되는 데이터베이스들의 연계 등을 통한 생태계 조성은 필수적이다. 따라서 데이터 과학의 구현을 위한 전략과 목표, 그에 따른 구체적인 시행계획의 체계적 수행 및 관리가 필요하다.
생태계는 그 생태계 내 존재하는 유기체들이 서로 영향을 주고받으며 살아가는 체계뿐 아니라 그 주변 환경을 함께 부르는 통칭이므로, 모든 생태계에는 생물 및 비생물이 존재할 수 있으며 그 안에 생물 및 생물 집단 간 상호의존성과 독립된 체계로의 완결성, 그리고 그 생태계 안에는 먹이사슬 즉, 생태계의 생물집단 간에 연관성을 갖는다. 바이오 데이터 생태계를 어떻게 정의하고 그 생태계의 구성원 간 또는 환경 등의 상호 연관성을 어떻게 볼 것인가에 따라서 달라지겠으나, 바이오 분야의 데이터 생태계를 조성하려면 조성 목적과 대상, 조성의 주체와 전략 등을 구체적으로 검토하고 마련해야 할 것이다. 민간의 다양한 데이터베이스 또는 데이터 시스템 간에도 다양한 생태계 조성은 가능하겠으나, 바이오 데이터의 경우는 환자의 건강에 관한 민감한 정보를 포함하고, 그 정보의 대부분이 정보 주체인 환자의 부담(보험을 포함)으로 생성된다는 점, 정보 활용을 통한 정보 주체의 직접적 이익이나 서비스는 없다는 점 등은 해당 데이터의 활용에서 반드시 고려되어야 할 특징이다. 이에 대하여 우리 사회 구성원이 동의하고 합리적으로 받아들일 수 있는 수준의 안전한 활용과 보호의 기대치를 먼저 수립하고 그 범위 내에서 유용성을 극대화하려는 노력과 기밀성 및 보호 등을 위한 조치가 취해져야 할 것이다.
또한 데이터 생태계가 효율성을 가지려면, 데이터 및 데이터 시스템 간의 연계와 상호 운용 가능성의 확보가 중요하다. 그리고 궁극적 목적인 데이터 자원의 유용성을 높이고 이를 통한 종합적이고 통찰력 있는 지식의 도출이 가능하려면 연계 상호 운용 가능성의 확보를 위한 노력이 매우 치밀하고 계획적이어야 한다. 그리고 이때 민간 간의 협력은 물론 정부의 협력과 조화 및 조정 등이 절실하다.
미국은 이를 위해 국민의 건강을 보호하고 의료서비스를 제공할 책임이 있는 보건부에게 전자건강정보의 연결과 보건 관련 정보 기술의 상호 운용성 향상의 책임도 있다고 보고, 2015년 국민을 위한 의료정보 연계와 보건의료정보기술(Health IT) 인프라 구축 및 조정과 관리를 위한 10년 비전을 제시하고 보건의료정보기술조정국(Office of National Coordinator of Health IT, 이하 ONC)에게 미국 의료 분야의 디지털화 및 관리를 맡도록 하였다. ONC는 보건의료정보기술의 확립과 공통된 임상 데이터 세트의 구축을 통한 표준화 노력과 이미 존재하는 미국 보험청(Center for Medicare and Medicaid Services, 이하 CMS) 데이터베이스를 중심으로 데이터 분석 시스템, 데이터 활용을 위한 API, 각종 플랫폼 구축을 담당하고 있다. 이를 통해 개인과 의료제공자, 연구자는 물론 공동체에게 지속적으로 유용한 정보를 제공해 줄 수 있는 ‘학습하는 보건의료시스템(learning health system)’의 구축을 목표로 한다. 이러한 시스템을 통해 궁극적으로 국민 건강의 향상 및 보건의료비용의 절감과 소비자 권리 보호 등이 가능하며 신뢰할 수 있는 의료정보의 전송 및 수신, 검색 및 활용 등이 가능할 것이라고 주장한다.
그러나 상호 운용 가능한 보건의료정보기술 생태계를 구축하고 효율적으로 활용하기 위해서는 현재 보건의료정보기술 관련 시스템의 개선과 지원, 그 과정에서의 프라이버시 보호 및 보안 등의 관리 원칙 준수, 이미 개발 및 활용되고 있는 시장의 데이터 및 정보 기술을 적극적으로 활용할 수 있도록 지원하는 것, 건강관리를 위한 개인의 데이터 접근성 확대 등 권한 강화를 통한 활동성 보장, 의료비용 감소 등 공적 투자가치의 실현을 위한 고려도 수반되어야 할 것이다.
마지막으로 디지털 전환 또는 데이터 생태계 조성에서 흔히 디지털 리터러시(Digital literacy)의 강화 또는 데이터 연계 등의 중요성이 요구된다. 디지털 세상에서 디지털 리터러시가 그 어느 때보다 중요해졌다는 것을 부인할 사람은 없다. 유네스코(UNESCO)에서도 하고 있지만 디지털 리터러시의 강화가 구체적으로 누구에게 어떤 능력을 향상시키려는 것인지에 대해서는 고민이 필요하다. 전통적인 문해력(literacy)은 문자로 된 기록을 읽고 거기에 담긴 정보를 이해하는 능력으로 보았지만 디지털 리터러시는 디지털 세상에서 다양한 플랫폼 또는 형태로 생성된 정보를 찾고 평가하고 조합하는 ‘이용자의 능력’이라고 할 수 있어 전통적인 문해력과는 차이가 있다. 발전이 중요하지만 그 발전이 그리는 형상에 참여할 수 없거나 또는 그 형상으로 생긴 그림자 뒤에서 배제되는 사람이 없도록 정책적으로 그 방향성을 점검하고 관리하는 것도 중요하게 고려되어야 할 것이다.
데이터의 효율적이고 안전한 활용이 주는 가치와 이익도 있지만 위험이 없다고 할 수는 없다. 따라서 데이터 활용을 추진하고 관리하는 것에서 중요한 점은 데이터의 사용 또는 재사용이 가져다 줄 것으로 기대되는 이익은 물론 그 과정에서 정보 주체가 적절하게 보호받을 수 있을 것이라는 충분한 기대에 대한 신뢰를 얻는 것이 윤리적으로 매우 중요하다는 것이다. 영국도 미국도 이를 인지하고 있기에 정보 주체의 동의에 기반하되 충분한 동의가 불가한 것에 대하여 동적 동의를 활용한 보안과 동시에 데이터의 안전한 활용 및 공익 등의 가치를 강조한다. 그리고 그러한 관리를 위한 데이터 이니셔티브 수립을 위해 데이터 사용과 관련한 모든 이해관계자들의 참여 보장과 함께 합리적이고 도덕적으로 인정할 수 있는 범위와 공개적 설명 등을 강조한다. 결국 디지털 시대의 바이오 대전환에서 생명윤리 문제의 핵심은 정보 주체의 신뢰를 어떻게 확보할 것인가에 있다고 할 것이다.
|
참고자료 |
∙ NIH, NIH Strategic Plan for Data Science, 2018
∙ Nuffield Council on Bioethics, The Collection, linking and use of data in biomedical research and health care : ethical issues, 2015
∙ 한국보건의료정보원 번역(이재훈 감수), 미국 보건의료정보기술조정국(ONC) 상호운영성 개념 문서 및 실행전략서 한국어 번역본, 2020

|
|
|
|
|
주요 내용 요약 |
|
제1장 생명공학의 변화와 도전 |
|
|
|
구분 |
미국 |
EU |
|
사회적 이슈 |
코로나19 팬데믹을 경험하면서 바이오가 경제발전과 사회문제 해결에 그치지 않고, 국가방위, 국가안보에도 중요하다고 인식 |
러시아-우크라이나 전쟁, COVID-19 및 기후 변화에 대한 대응 |
|
정책 동향 |
팬데믹 대응 및 예방, 암 사망률 감소, 기후변화 대응, 국가안보 및 기술경쟁력 강화, 인력양성, 오픈 사이언스 촉진 중시 |
바이오경제 활성화 및 연구 및 혁신 향후 정책 지침 |
|
산업 동향 |
2021년 현재 바이오산업이 미국 경제에 약 2조 9,000억 달러를 기여하고 있고, 12만 7,000개 사업장에서 210만 명을 고용 중 |
유럽 체외 진단 산업 동향 및 순환 바이오 기반 유럽 공동 사업 계획 |
|
법제도 동향 |
미국혁신 및 경쟁법, 미국경쟁력강화법, 반도체칩 및 과학법 통과, 국가생명공학・바이오제조 행정명령 서명 등 |
유전자 변형 생물/신유전자 기술 법령 및 HERA/CBE JU 설립근거 |
|
|
|
|
|
|
|
|
|
|
|
중국 |
일본 |
|
중국은 제14차 5개년 계획(2021.3) 및 20차 당대회(2022.10)를 통해 생명공학, 바이오 분야 주요 정치 사회적 방향성 제시 |
2021년에 2번째 도쿄 올림픽이 개최되었고 아베, 스가 전 수상에 이어 기시다 수상이 취임. 지난 2년간 일본의 경제는 여전히 장기침체에 머물고 있으며, 한국과 대만이 일본의 1인당 GDP를 추월. 인구는 13년째 감소하고 있고, 도쿄를 비롯한 수도권 인구마저도 처음 감소세로 진입 |
|
14차 5개년 계획과 연계된 각 부처별 세부 실행계획 수립 및 추진(바이오경제 14・5 규획, 14차 5개년 국민건강계획 등) |
기시다 내각의 ‘새로운 자본주의의 실현’을 위한 계획에 근거하여 과학기술・이노베이션회의는 통합이노베이션 전략 2023의 방향성을 결정. 9개의 문샷형 연구개발과제가 진행, 경제산업성은 바이오모노즈쿠리 혁명 추진사업 연구개발계획을 확정하였고, 환경성은 10년 만에 생물다양성 국가전략을 개정. 2023년도 일본의 과학기술 관련 예산은 4조 3,318억 엔으로 전년 대비 397억 엔(0.9%) 증가 |
|
바이오의약 AI 도입 및 유전자 변형 바이오농업기술 확대 바이오경제, 바이오산업 분야 투자 규모 지속 확대 |
일본 후생노동성은 2022년 9월에 ‘통합이노베이션전략 2022’와 새로운 자본주의의 그랜드디자인 실행계획 등에 근거하여 전게놈 분석의 실행계획을 추진. 새로운 자본주의 실현 회의에서 일본의 스타트업 5개년 계획을 확정. 댕기열 백신, 알츠하이머 치료제, 배양육 등의 산업화에 성과를 이룸 |
|
생물다양성 보장을 위한 입법화 추진, 혁신치료제 개발 활성화를 위한 규제완화, 중국비교우위 기술 수출제한 등 추진 |
기시다 정부의 규제개혁실시계획을 각의에서 결정. 차세대의료기반법의 개정, 마이넘버법 개정, 의약품 긴급승인제도 창설, 윤리지침 및 유전자 변형 표시제도의 변경 |
|
|
|
제1장 생명공학의 변화와 도전 |
|
제1절 생명공학의 변곡점: 글로벌 트랜드 변화 |
1. 미국
가. 사회적 이슈
미국 정부는 향후 10년 내 바이오경제 시장이 약 30조 달러로 성장할 것으로 전망하고, 관련 산업을 선점하기 위한 기술 리더십 확보와 자국 내 제조역량 강화를 강조하고 있다.
바이든 대통령은 2021년 1월 취임 직후 바이오 혁신을 가속화하기 위해 관련 연방 부처 연구개발에 향후 4년간 3,000억 달러를 투자하겠다고 발표하였다. 이러한 행보는 포스트 코로나 시대에서 경제발전과 기술패권 경쟁 승리를 목표로 추진하고 있는 ‘메이드 인 아메리카(Made in America)’와 연결되어 있다.
특히, 코로나19 팬데믹을 경험하면서 바이오가 경제발전과 사회문제 해결을 위한 주요한 수단에 그치지 않고, 국민의 건강과 생존을 지키는 방패이며, 나아가 민(民)-군(軍) 겸용기술이기 때문에 국가방위, 국가안보 차원에서도 매우 중요하다고 인식하고 있다.
미국과학공학의학한림원(NASEM), 대통령과학기술자문회의(PCAST) 등 민간 싱크탱크와 정부 최고위급 자문기구에서 미국이 바이오경제를 선도하기 위한 정책을 제안하고, 의회에서 초당적으로 관련 지원 법률들을 승인하고, 대통령이 행정명령에 서명하는 것은 단순한 과학기술 경쟁력 확보를 위한 것이 아니라 미국이 세계의 바이오경제 패권을 차지하기 위한 것이라고 볼 수 있다.
나. 정책 동향
백악관 관리예산실(OMB)이 2022년 7월 각 부처에 배포한 대통령 메모(Memorandum)에 따르면, 2024년 연구개발 우선순위는 팬데믹 대응 및 예방, 암 사망률 50% 감소, 기후변화 대응, 국가안보 및 기술경쟁력 강화, 인력양성, 오픈 사이언스 촉진 등이다.
특히, 바이든 대통령은 2016년부터 본인이 주도해 온 ‘암 정복 이니셔티브(Cancer Moonshot Initiative)’의 목표를 2022년 3월에 수정하여 향후 25년간 암으로 인한 사망률을 현재의 절반 수준으로 낮추겠다는 야심 찬 목표를 제시하고 의회에 관련 사업의 지원 기간 연장과 예산 확대를 요청하였다.
이와 함께, 2022년 9월 국가 생명공학・바이오제조 이니셔티브(Executive Order on National Biotechnology and Biomanufacturing Initiative)에 대한 행정명령에 서명하였다. 이 행정명령은 바이오 혁신을 촉진하고 의료, 농업, 에너지 등 다양한 부문에서 경제성장을 가속화함으로써 다가올 바이오경제 시대를 선점하는 것을 목표로 하고 있으며, 핵심기술 리더십 유지, 자국 내 바이오제조 역량 강화, 인력양성에 중점을 두고 있다.
최근 미국 정부는 바이오를 국가 안전보장에 중요한 분야로 인식하고, 바이오제조 관련 전략 수립과 연구에 국방부가 깊이 관여하고 있다. 바이든 대통령은 2022년 10월 국가바이오방어전략・이행계획(National Biodefense Strategy and Implementation Plan)에 관한 행정명령에 서명하였다. 동 전략은 미래 팬데믹과 생물학적 위협으로부터 자국을 보호하기 위한 종합 대책으로, 백악관을 중심으로 20개 이상의 연방기관이 공동 대응하는 방안을 제시하고 있다.
다. 연방정부 동향
바이오 연구개발은 25개가 넘는 연방정부 부처와 기관이 지원하는 다원화 체제를 가지고 있다. 바이오헬스는 국립보건원(NIH), 기초 생명과학은 국립과학재단(NSF)이 주로 지원한다. 그 외에 에너지부(DOE), 국방부(DOD), 농림부(USDA) 등이 해당 분야의 연구개발을 지원하고 있다.
(1) 보건복지부(HHS)
보건복지부는 국립보건원, 식품의약품안전청(FDA), 질병통제센터(CDC) 등을 통해 연구개발을 지원한다. 2022년 9월 행정명령 이행을 위해 원료의약품, 항생제 등 핵심 바이오공급망 확충에 4,000만 달러를 투입하겠다고 발표했다.
(가) 국립보건원(NIH)
보건복지부 예산의 약 97%를 사용하는 바이오 분야 세계 최대 규모의 연구기관이며, 2021년 8월 발표한 전략계획(Wide Strategic Plan for Fiscal Years 2021–2025, NIH)에서 3대 목표1)와 5대 공통주제(cross-cutting themes)2)를 제시하였다.
연간 예산은 1996년 119억 달러에서 2008년 296억 달러, 2022년 462억 달러로 크게 증가하였다. 2023년 예산은 2022년 12월 통과된 통합세출법(H.R.2617)에서 2022년 대비 25억 달러 증가된 475억 달러로 결정되었다. 주요 내역으로는 국립암연구소(NCI) 예산 73억 달러3), 알츠하이머 및 관련 치매 연구에 37억 달러(2억 2,600만 달러 증), HIV/AIDS 연구에 33억 달러(1억 달러 증), 범용독감백신 연구에 2억 7,000만 달러(2,500만 달러 증) 등이다.
또한 2016년 제정된 21세기 치료법(21st Century Cures Act)에 근거하여 10년 동안 48억 달러가 지원되는 정밀의료(All of Us), 뇌 이해(BRAIN), 암 정복(Cancer Moonshot)4), 재생의료(RMIP)5) 등 4대 대형 이니셔티브를 주관하고 있다.
[표 1-1] 21세기 치료법에 따른 NIH 주관 주요 국가 이니셔티브
|
명칭 |
목표 |
기간 |
참여기관 |
예산 |
|
|
총액 |
2020년 |
||||
|
All of Us |
바이오 빅데이터 분석을 통해 정밀의료 구현. 100만 명 건강상태를 10년간 추적 관찰 |
2017∼26 (10년) |
5개 연방정부기관(NIH, FDA 등), 빌&멀린다게이츠재단, 브로드(연), 기업(화이자, 아마존, IBM, 인텔, MS), 병원 |
14.55억 달러 |
1.49억 달러 |
|
BRAIN |
뇌세포와 신경회로의 상호작용을 통해 뇌 기능을 규명하기 위한 신기술을 개발・응용 |
2017∼26 (10년) |
6개 연방정부기관(NIH, NSF, FDA 등)과 민간재단(시몬스재단 등), 대학(피츠버그대학), 기업(GE, 구글, GSK 등) |
15.11억 달러 |
1.4억 달러 |
|
Cancer Moonshot |
향후 25년 동안 암 사망률 최소 50% 감소 |
2017∼23 (7년) |
7개 연방정부기관(NIH, FDA, NCI, DOD 등), 빌&멀린다게이츠재단, 브로드(연), 기업(아마존, MS 등), 병원 등 |
18억 달러 |
1.95억 달러 |
출처: https://www.nih.gov/research-training/medical-research-initiatives/cures, 저자 수정
한편, 바이오헬스 분야에서 전통적인 방식의 연구개발로는 추진하기 어려운 고위험, 혁신적 아이디어를 지원하기 위해 국방부의 국방고등연구계획국(DARPA) 모델을 벤치마킹한 첨단보건연구기구(ARPA-H)를 설립하고 2022년 10억 달러, 2023년 15억 달러를 배정받았다.
(나) 식품의약품안전청(FDA)
식품의약품안전청은 희귀의약품, 중증 질병 치료제들의 개발을 촉진하기 위해 승인기간을 단축하는 가속승인, 신속심사, 혁신적 치료제, 우선심사 제도를 도입해 운영하고 있다. 2022년 6월에는 저분자의약품과 항체를 담당하는 약물평가연구센터(CBER)와 바이오의약품이나 세포・유전자치료제를 담당하는 생물학제제품평가연구센터(CBER) 간 협력을 증진하기 위해 ‘첨단 의약품 및 바이오의약품 제조센터(Center for Advancement of Manufacturing Pharmaceuticals and Biopharmaceuticals)’를 설립하였다.6) 2023년 정부 예산안에 21세기 치료법 예산 5,000만 달러, 암 정복(Cancer Moonshot) 예산 2,000만 달러 등이 포함되어 있다.
(2) 국립과학재단(NSF)
국립과학재단은 2022년 9월 행정명령 이행을 위해 3,200만 달러를 지원하겠다고 발표했다. 연구지원은 주로 생물과학국(BIO), 공학국(ENG), 수학물리과학국(MPS)을 통해 이루어진다.
생물과학국(BIO)은 의과학을 제외한 ① 분자・세포 기작, 기능 및 진화 이해, ② 유기체의 구조, 기능, 상호작용 및 행동 이해, ③ 생물다양성, ④ 감염병 생태 및 진화 등 기초 생명과학 연구를 지원한다. 주요 프로그램으로는 ‘10대 빅 아이디어 프로그램’의 하나로 유전자형으로부터 표현형을 예측하는 ‘생명법칙의 이해’(Understanding the Rules of Life) 사업과 NIH의 BRAIN 이니셔티브와 공동으로 추진하는 ‘뇌 이해’(UtB) 사업이 있다. 2023년 예산은 국립과학재단 총 예산(86억 달러)의 10%인 8억 2,000만 달러이며, 2023년도 정부 예산안에서는 바이오 인프라와 새로운 첨단기술 개발 분야 예산이 크게 증액된 9억 7,000만 달러를 요구하였다.
[표 1-2] 국립과학재단(NSF) 생물과학국(BIO) 예산 현황(2021∼2023)
(단위: 백만 달러)
|
항목 |
바이오 예산 |
|||
|
2021 |
2021 (긴급지원) |
2023(요구) |
2021 대비 증가율(%) |
|
|
Molecular & Cellular Biosciences(MCB) |
155.55 |
|
162.47 |
4.5 |
|
Integrative Organismal Systems(IOS) |
206.89 |
|
214.81 |
3.8 |
|
Environmental Biology(DEB) |
178.78 |
|
186.15 |
4.1 |
|
Biological Infrastructure(DBI) |
167.01 |
|
221.28 |
32 |
|
Emerging Frontiers(EF) |
109.51 |
9.18 |
185.52 |
69.4 |
|
계 |
817.74 |
|
970.23 |
18.6 |
출처: National Science Foundation FY 2023 Budget Request to Congress
공학국은 합성생물학, 생물공학, 환경융합, 재생가능 세포 및 오가노이드 등을 지원하고, 수학물리과학국은 생체재료(BMAT), 반도체합성생물학(SemiSynBio-II), 수학생물학을 지원하고 있으며, 국립과학재단과 국립보건원이 생물-수학인터페이스연구, NSF-Simons 복합생물시스템수학연구센터(MathBioSys), 스마트헬스 등을 공동으로 지원하고 있다.
(3) 에너지부(DOE)
에너지부는 주로 생물공학 분야의 기초과학 및 툴 개발, 바이오연료 및 바이오 제품 생산을 위한 미생물 및 식물 연구, 바이오에너지 작물 개발, 탄소고정 능력 향상 등을 지원한다. 2022년 9월 행정명령 이행을 위해 1억 7,800만 달러 지원하겠다고 발표했다.
에너지부에서 바이오 분야 연구지원을 담당하는 생물환경연구실(BER)의 2022년 총 예산은 7억 5,000만 달러이며, 이 중 순수 바이오 예산은 3억 8,700만 달러 규모이다. 2023년도 정부 예산안에서는 유전체 분야에 대한 예산이 30% 이상 증액된 4억 7,000만 달러를 요구하였다.
[표 1-3] 에너지부(DOE) 생명환경실(BER)의 바이오 부문 예산 현황(2021∼2023)
(단위: 천 달러)
|
항목 |
2021 |
2022 |
2023 |
|
|
예산액 |
전년대비 증가율(%) |
|||
|
유전체 과학 |
277,574 |
257,817 |
338,185 |
31 |
|
생물분자 동정 및 이미징 과학 |
45,000 |
45,000 |
45,000 |
- |
|
생물시스템 시설 및 인프라 |
80,000 |
84,500 |
85,000 |
0.6 |
|
합계 |
402,574 |
387,317 |
468,185 |
21 |
출처: DOE FY 2023 Congressional Budget Justification
이 외에도 기초에너지과학실(BES)은 식물과 미생물의 에너지 포집, 변환 및 저장, 생체모방 등의 연구를 지원하고, 첨단에너지사업청(ARPA-E)은 청정에너지 핵심 소재의 안정적 공급, 재생가능 수송연료 개발, 에너지 및 탄소 최적화를 위한 합성생물학 등을 지원하고 있다.
에너지부 산하의 핵심 연구 주체로는 공동 게놈연구소(Joint Genome Institute, JGI)와 4개의 바이오에너지연구센터(Bioenergy Research Centers, BRCs) 등이 있다.
(4) 농무부(USDA)
농무부는 2020년에 바이오경제를 2025년까지의 과학기술 분야 우선투자 분야로 선정하였다. 중점분야는 재생가능 농작물 유래 바이오 기반 제품 생산 기술개발 촉진, 연구개발 로드맵 수립, 공정 시스템 최적화, 데이터 생산・수집・통합 등이다. 2022년 9월 행정명령 이행을 위해 약 5억 달러를 투입하겠다고 발표했다.
농무부의 농업연구부(ARS)는 농물・작물의 보호 및 생산에서부터 사람의 영양, 식품 안전, 천연자원보호 등에 이르기까지 다양한 연구개발을 수행한다. 2023년도 정부 예산안에서 전년 대비 24%가 증액된 19억 달러를 요구하였고, 이 중 외래 신종 동물 감염병에 대응하기 위한 국립생물농업방어시설(National Bio and Agro-Defense Facility, NBAF) 운영비 4,800만 달러가 포함되어 있다.
국립식품농업연구소(NIFA)에서는 동・식물의 건강 및 생산성, 식품안전과 영양, 바이오에너지・자원・환경, 농업기술 등을 중점적으로 연구한다. 2023년도 정부 예산안에서 전년 대비 14% 증액된 21억 달러를 요구하였다. 또한 2021년 11월 바이든 대통령이 서명한 ‘인프라 투자 및 일자리 법’에 근거하여 2022년 신규로 착수한 바이오제품 파일럿 프로그램(Bioproduct Pilot Program)을 주관하고 있다. 동 사업은 재생가능 농업 소재를 이용하여 바이오 기반 저탄소 제품을 개발하는 대학, 민간부문 등에 1,000만 달러를 지원한다.
[표 1-4] 농무부(USDA) 바이오 관련 예산 현황(2021∼2023)
(단위: 백만 달러)
|
항목 |
2021 |
2022(추정) |
2023(요구) |
|
|
예산액 |
전년대비 증가율(%) |
|||
|
농업연구부(ARS) |
1,566 |
1,566 |
1,942 |
24.0 |
|
국립식품농업연구소(NIFA) |
1,592 |
1,828 |
2,080 |
13.8 |
출처: United States Department of Agriculture FY 2023 Budget Summary
(5) 국방부(DOD)
국방부는 바이오를 14대 핵심 기술 분야의 하나로 설정하고, 2022년 제정된 국방수권법(National Defense Authorization Act for Fiscal Year 2022)에 근거하여 바이오 기술의 진보가 국방부의 현재와 미래 활동에 미치는 영향을 점검하기 위한 국가바이오안보위원회(National Security Commission on Emerging Biotechnology)를 신설하는 한편, 국방고등연구계획국(Defense Advanced Research Projects Agency, DARPA)을 중심으로 관련 연구개발을 지원하고 있다.
[표 1-5] 국방부(DOD) 핵심기술 분야(Critical Technology Areas)의 분류 및 세부기술
|
분류 |
세부기술 |
|
|
시드 분야 (Seed Areas of Emerging Opportunity) |
생명공학(Biotechnology) |
양자기술 |
|
미래 세대 무선기술 |
첨단소재 |
|
|
효과적 적용 분야 (Effective Adoption Areas) |
신뢰할 수 있는 AI 및 자율 |
통합네트워크 Systems-of-Systems |
|
마이크로일렉트로닉스 |
우주기술 |
|
|
재생에너지 생산 및 저장 |
첨단 컴퓨팅 및 소프트웨어 |
|
|
인간-기계 인터페이스 |
|
|
|
군사목적 분야 (Defense-Specific Areas) |
지향성 에너지(Directed Energy) |
하이퍼소닉 |
|
통합 센싱 및 사이버 |
|
|
출처: https://www.cto.mil/usdre-strat-vision-critical-tech-areas/
국방부는 2022년 9월 행정명령 이행을 위해 미국 내 바이오제조 인프라 구축을 위한 민관협력 사업에 향후 5년간 10억 달러를 출연하고, 추가로 2억 달러를 바이오 및 사이버 안보 강화에 투입할 계획이라고 밝혔다. 2023년도 정부 예산안에서는 바이오 분야에 13억 달러를 요구하였는데, 주요 내용으로는 제조혁신연구소(BioMADE, BioFab) 계속 지원, 핵심 공급망 소재 확보를 위한 바이오제조 역량 개발 및 시험 운영(연료, 윤활유, 광학소재 등), 국내 바이오산업 제조역량 제고(국방소재 제조 스케일업 지원), 국방고등연구계획국(DARPA)의 혁신적 신기술 개발 등이 포함되어 있다.
[표 1-6] 국방부(DOD) 제조혁신연구소(바이오분야)7) 현황
|
명칭 |
첨단재생의료제조연구소 (Advanced Regenerative Manufacturing Institute, BioFabUSA) |
바이오산업 제조디자인 생태계 (Bioindustrial Manufacturing and Design Ecosystem, BioMADE) |
|
|
설립 |
2016. 12 |
2020. 10 |
|
|
소재지 |
맨체스터, 뉴햄프셔 |
세인트폴, 미네소타 (분소: CA 버클리, MA 캠브리지) |
|
|
미션 |
바이오기술을 통해 개발된 조직(조직 관련 기술)을 표준적, 일관적, 비용 효과적으로 생산 |
미국 내 바이오산업용 제품 제조, 기술개발, 관련 인프라 투자 위험제거(de-risk), 바이오제조 인력 양성 |
|
|
컨소시엄 주관 |
Advanced Regenerative Manufacturing Institute (ARMI) |
Engineering Biology Research Consortium |
|
|
회원수 |
172 |
80 |
|
|
펀딩 |
연방정부 |
8,000만 달러 |
8,750만 달러 |
|
민간 |
2억 1,400만 달러(비연방정부) |
1억 8,750만 달러 |
|
|
DoD 수탁과제 |
3,250만 달러 |
|
|
출처: NIST, MANUFACTURING USA, Highlights Report, October 2022
첨단방위사업청의 생물기술국(BTO)은 신경과학, 감염병, 휴먼-머신 인터페이스, 유전자교정, 합성생물학, 생물무기방어 등과 관련된 다양한 프로그램을 지원한다.
(6) 상무부(DoC)
상무부 산하 국립표준기술연구소(NIST)는 바이오 관련 새로운 측정 기술 개발, 데이터 검증 및 표준 개발을 지원한다. 2023년도 정부 예산안에서 생물공학, 정밀의료를 위한 바이오제조, 인공지능 및 바이오데이터 통합 치료 등 바이오경제 부문에 1,400만 달러를 추가 요구하였다.8) 표준기술연구소는 또한 제조 USA의 일환으로 2017년 3월 델라웨어 뉴와크에 국립바이오의약품제조혁신연구소(NIMBL)를 설립하여 지원하고 있다. 미션은 바이오의약품 제조혁신 가속화, 제조 효율화 및 기간 단축을 위한 표준 개발 지원, 바이오제조 인력 교육 및 양성 등이며, 델라웨어대학이 컨소시엄을 주관하고 회원 수는 186개 기관이다. 연방정부에서 7,000만 달러를, 민간에서 1억 2,900만 달러를 펀딩받아 10년 동안 운영된다.
(7) 보훈청(VA)
보훈청은 퇴역 군인이나 가족, 유족에 대한 보건서비스 측면에서 연구개발을 지원한다. 백만퇴역군인프로그램(Million Veteran Program)은 NIH의 정밀의료 프로그램(All of Us)과 연계되어 운영되며, NIH 국립암연구소(NCI)와 공동으로 대규모 코호트 데이터 분석연구를 수행하고 있다.
다. 산업 동향
미국과학공학의학한림원(NASEM)은 2016년을 기준으로 미국 바이오경제9)가 국민총생산(GDP)의 5%인 9,592억 달러 규모라고 추산하였다. 바이오산업협회(BIO)는 2021년 현재 바이오산업(bioscience industry)이 미국 경제에 약 2조 9,000억 달러를 기여하고 있고, 12만 7,000개 사업장에서 210만 명을 고용하고 있다고 발표했다.
Fitch Solutions(2022)에 따르면 미국은 세계 제약시장의 약 45%, 세계 생산량의 22%를 차지하고 있으며, 제약시장 규모는 2021년 3,973억 8,000만 달러이고, 2022년부터 2026년까지 연평균 3.01% 성장해 4,679억 9,000만 달러까지 확대될 것으로 전망된다.
농무부는 바이오 유래 제품의 시장확대를 촉진하기 위해 바이오제품 우선구매 제도(BioPreferred Program)10)를 운영하고 있다. 적용대상이 되는 제품의 분류와 각 분류별 필요한 최소한의 바이오매스 함량이 규정되어 있다. 현재 139개의 분류에 1만 4,000개의 제품이 등록되어 있다. 이 제품에 대해서는 미국 농무부 인증 라벨(USDA Certified Biobased Product Label)을 부착할 수 있다.
라. 법제도 동향
2021년 4월 상원 마키(Markey) 의원이 바이오경제 연구개발법안(Bioeconomy Research and Development Act of 2021)11)을 발의하였다. 동 법안은 이후 여러 법안에 포함되었다. 구체적으로는 2021년 6월 통과된 미국혁신및경쟁법(United States Innovation and Competition Act of 2021)12)에는 Section 2217에, 2022년 2월 통과된 미국경쟁력강화법13)(America COMPETES Act of 2022)에는 Division B(Title IV)에, 2022년 8월 바이든 대통령이 서명한 반도체칩및과학법(CHIPS and Science Act)14)에는 Division B(Title IV)에 포함되어 있다.
또한 2022년 9월 바이든 대통령은 국가 생명공학・바이오제조 이니셔티브 행정명령에 서명하였다. 2012년 발표된 국가바이오경제청사진(National Bioeconomy Blueprint)이 구체적인 실행방안이 부재하다는 한계를 가지고 있었다면, 동 행정명령은 구체적인 목표와 실행계획까지 제시하고 있다. 향후 5년간 바이오제조 연구개발과 인프라 구축에 20억 달러의 신규 투자 계획은 물론, 각 부처별 추진계획도 발표했다. 또한 백악관 안보보좌관에게 경제보좌관과 과학기술정책국장과 협의하여 개별 연방 부처의 활동을 총괄 조정하는 기능을 부여했다.
2022년 12월에는 바이든 대통령이 서명한 2023년 통합세출법(Consolidated Appropriations Act of 2023)에서 의약품을 허가받을 때 동물시험 자료가 없어도 된다고 규정함으로써 기존 식품의약품화장품법(Federal Food, Drug, and Cosmetic Act)이 개정되었다. 이에 따라 미국 FDA가 지난 80년 이상 진행해 온 의약품 안전성과 유효성 확인을 위해 필요로 했던 동물시험이 없이도 허가신청이 가능해졌다.
|
참고자료 |
∙ Congressional Justification of the NIH request for the fiscal year (FY) 2023 budget, https://officeofbudget.od.nih.gov/br.html
∙ Congressional Research Service, Federal Research and Development (R&D) Funding: FY2023(2022.6.10.)
∙ Congressional Research Service, National Institutes of Health (NIH) Funding: FY1996-FY2023(2022.5)
∙ Congressional Research Service, The Bioeconomy: A Primer (2022.9.19.)
∙ Congressional Research Service, White House Initiative to Advance the Bioeconomy, E.O. 14081: In Brief (2022.10.5.)
∙ Defense Budget Overview, UNITED STATES DEPARTMENT OF DEFENSE FISCAL YEAR 2023 BUDGET REQUEST(2022.4)
∙ Department of Energy FY 2023 Congressional Budget Request-Science(2022.4)
∙ EXECUTIVE OFFICE OF THE PRESIDENT, MEMORANDUM FOR THE HEADS OF EXECUTIVE DEPARTMENTS AND AGENCIES, Multi-Agency Research and Development Priorities for the FY 2024 Budget (2022.7.22.)
∙ NASEM, Safeguarding the Bioeconomy(2020)
∙ House Committee of Appropriations, Consolidated Appropriations Act, 2023 SUMMARY OF APPROPRIATIONS PROVISIONS BY SUBCOMMITTEE(2022.12)
∙ NATIONAL SCIENCE FOUNDATION, FY 2023 Budget Request to Congress(2022.3.28.)
∙ NIH-Wide Strategic Plan for Fiscal Years 2021–2025
∙ NIST, MANUFACTURING USA Highlights Report(2022.10)
∙ NSF DIRECTORATE FOR BIOLOGICAL SCIENCES (BIO) https://www.nsf.gov/about/budget/fy2023/pdf/69_fy2023.pdf
∙ TEConomy/BIO, The U.S. Bioscience Industry: Fostering Innovation and Driving America’s Economy Forward(2022)
∙ United States Department of Agriculture FY 2023 BUDGET SUMMARY(2022.4)
∙ 대한무역투자진흥공사(KOTRA), 미국의 바이오제약 산업 육성 정책과 시사점(2023.1)
∙ 보건산업진흥원, 2022 국가별 보건산업 현황 보고서-북미・중남미 4개국(2022.9)
∙ 한국과학기술기획평가원, 과학기술&ICT 정책・기술 동향 218호(2022.7.15.)
∙ 한국과학기술기획평가원, 과학기술&ICT 정책・기술 동향 229호(2022.12.30.)
2. EU
가. 사회적 이슈
(1) 러시아 – 우크라이나 전쟁
2022년 2월 24일, 러시아가 국경을 맞대고 있는 우크라이나 동부 지역(도네츠크, 루간스크)의 독립 승인 및 역내 평화 유지 명분으로 우크라이나를 전면 침공하면서 유럽에서 제2차 세계대전 이후 최대 규모의 무력 분쟁이 시작되었다. 이는 유럽이 러시아 및 우크라이나 지역으로부터 의존하던 천연가스, 원유, 밀, 각종 원자재 등의 공급망 붕괴를 가져왔으며 이 때문에 유래없는 고물가–저성장의 위기에 직면하고 있다. 또한, 800만 우크라이나 난민들이 유럽 전역에 흩어져 생활하고 있으며, 기존 아프리카 및 중동 지역에서 넘어온 난민들로 인한 추가적 부담이 유럽 각국에서의 사회적 혼란 및 긴장을 높이고 있다.
이 전쟁으로 초래된 식량 및 에너지 위기를 극복하기 위해서 유럽은 기존 가장 보수적인 입장을 견지했던 생명공학 기술(새로운 유전자 편집 기술, NGT)을 적용한 유전자 변형 작물(GMO)을 적극적으로 활용하는 자세로 대응하면서 새로운 시도들에 지원을 늘리고 있는 추세이다.
(2) COVID-19 대응과 전망
EU 연구자금을 지원받아 성장해 온 독일 바이온택(BioNTech)이 개발한 COVID-19 백신이 가장 처음 EU 내 사용승인을 받은 뒤 모더나, 아스트라제네카 백신들이 2021년 봄∼여름부터 일반 시민들에게 광범위하게 접종되었으며, 3∼6개월 간격으로 2차, 3차 백신 접종이 차례로 진행되었다. 다만, 같은 시기 동안 유럽 내 백신 접종 필수 정책에 반대하는 사람들의 집회가 유럽 주요 도시에서의 시위로 발전해 나가며 사회적 갈등을 유발했다.
2021년 연말부터 치명률이 낮은 오미크론 변이가 우세종이 되면서 2022년 연초까지 적용되던 확진자와 밀접 접촉자 격리 의무, 마스크 착용 의무 등의 규제는 2022년 봄∼여름을 기점으로 차츰 완화되기 시작하였으며 2023년 초 현재, 대부분의 나라 및 지역에서 더 이상의 코로나19 관련 규제는 찾아보기 힘들어졌다. 다만, 새로운 사회적 갈등 및 긴장 요소로 효율성이 확인된 비대면 업무가 가능한 노동자들과 대면 업무가 꼭 필요한 부문의 노동자 간 노동에 대한 인식 차이에 따른 사회적 긴장이 축적되고 있다.
코로나 팬데믹을 거치면서 갑자기 성장하게 된 체외진단의료기기 시장의 기업들은 최근 들어 그동안 확장했던 사업을 동결 및 감축하고 있다. 반면, 기존 우려를 빠르게 종식시키고 기술의 안정성을 확보하게 된 mRNA 기반 치료제 개발은 광범위한 암 및 염증 등 여러 질병 치료에 활발히 적용되고 있다.
(3) 기후변화
유럽의 시민들은 최근 몇 년간 겨울에 눈이 오는 날이 드물어졌으며 여름에는 40도 이상의 폭염이 잦아지는 것을 경험하면서 기후변화 위기에 대한 우려를 표명하고 있다. 그럼에도 불구하고, 최근 러시아-우크라이나 전쟁으로 인해 기존 가스 공급이 제한되면서 독일 정부는 어쩔 수 없이 일부 지역에서의 석탄채굴과 사용을 확대하는 정책을 허가하는 결정을 내렸다. 이는 기후 환경 운동가들의 거센 반대와 경찰력 투입이라는 심각한 갈등을 야기하기도 하였으나 일부 시민들은 이런 정부의 결정에 찬성하는 등 사회적 갈등이 심화되는 상황이다.
이런 어려운 시기에도 EU 집행위원회(European Commission)는 2050년까지 EU를 세계 최초 기후 중립 대륙으로 만들겠다는 목표로 2019년 연말에 공표한 유럽 그린 딜(European Green Deal)15)을 지속적으로 추진하면서 특별히 ‘생물다양성’, ‘농장에서 식탁까지’, ‘토양 보호’ 전략 등을 통해 생명공학을 활용한 지구 온난화 완화에 힘을 쏟고 있다.
나. 정책 동향
(1) 유럽 바이오경제 전략 강화
유럽 이사회(European Council)는 유럽 그린 딜을 구현하기 위한 주요 요소로서 바이오경제의 중요성을 인식하고 유럽 집행위원회에 2012년에 채택하고 2018년에 업데이트 한 유럽 바이오경제 전략(EU Bioeconomy Strategy)을 더 큰 목표인 그린 딜 정책에 맞도록 최신 업데이트 필요 및 평가를 요구하였다. 이에 집행위원회는 2022년 9월 6일 유럽 바이오경제 전략 진행 보고서 (European Bioeconomy policy: stocktaking and future developments)16)를 발표하였다.

출처: European Commission, EU Bioeconomy Strategy Progress Report, 2022.9.6
[그림 1-1] EU 바이오경제 전략의 발전상황
2022년 초 러시아의 우크라이나 침공에 따라 요구된 유럽의 에너지 독립과 식량 안보 강화 필요에 맞물려 기존 바이오경제 전략의 5가지 목표 – ‘식량 및 영양 안보 보장’, ‘천연자원의 지속 가능한 관리’, ‘재생 불가능하고 지속 불가능한 자원에 대한 의존도 감소’, ‘기후변화 완화 및 적응’, ‘유럽 경쟁력 강화 및 일자리 창출’ - 가 특별히 더욱 중요해졌으며 더 빠르게 달성해야만 하는 것들임을 재확인하였다.
이러한 목표를 달성하기 위해 추진해 오던 바이오경제 전략의 세 가지 주요 행동 계획 -‘바이오 기반 섹터의 강화와 규모 확장’, ‘지역 바이오경제를 빠르게 유럽 전역으로 확대 배치’, ‘바이오경제의 생태적 경계 이해’- 은 잘 진행하고 있으며, 그 중간 결과로 특별히 중부 및 동부 유럽에서의 바이오경제 구축 확대가 성공적으로 진행 중이며 민간 투자 및 연구 혁신이 눈에 띄게 이루어지고 있다고 평가하였다.
특별히 앞으로의 바이오경제 정책들이 세 가지 지속 가능성 – ‘생태적 경계 내에서의 토지 및 생물 자원 관리’, ‘지속가능한 가치 사슬과 소비’, ‘사회적 공정성과 정의로운 전환’ – 기반 위에서 수립되어야 함을 강조하였다. 이는 육지와 바다의 생물 자원 활용을 바이오 기술을 통해 최적화함으로써 바이오매스 생산, 기후변화 완화 및 생물다양성 증가를 유도하고, 이로 얻어진 산물을 지속 가능하고 공정하게 사용함으로써 유럽의 바이오경제 정책들이 더 큰 범위의 유럽 그린 딜 목표 달성에 기여할 수 있도록 유도하고 있다.
[표 1-7] 바이오경제 프로젝트 대표 사례
|
프로젝트명 |
대표 사례 |
|
호라이즌 2020 프로젝트 |
- Built-In-Wood: 지속 가능한 다층 목조 건물 - HEREWEAR: 현지에서 생산되는 바이오 기반 섬유 - FUSILLI: 새로운 도시 푸드 플랜 개발 |
|
바이오 기반 산업 공동 사업 |
- CIRCULAR BIOCARBON: 도시 폐기물을 부가가치 제품으로 전환 |
|
새로운 유러피안 바우하우스 수상 후보들 |
- TOCA Portugal: 종이 기반의 인터렉티브 및 친환경 표면 개발 - Xifré’s Rooftop Spain: 도시에 자연을 도입한 “플로팅” 야생 정원 |
|
유럽 해양수산 기금 지원 프로젝트 |
- FISH4FISH: 갑각류의 키틴과 리그닌 폐기물을 결합한 생선 포장 용기 개발 - BIOGEARS: 바다에서 분해되지 않고 퇴비로 변하는 플라스틱 개발 |
출처: European Commission, EU Bioeconomy Strategy Progress Report, 2022.9.6, SWD(2022) 162 final
(2) 호라이즌 유럽(2021-2027) 지원 정책 중 실행 프로그램(2023-2024) 목표
‘클러스터 1 건강’17)은 질병을 예방, 진단, 모니터링, 치료하고 건강 관리를 위한 기술개발, 건강 위험 완화, 일반 및 직장에서의 건강 및 복지 증진, 공중보건 시스템 향상, 빈곤 관련 질병을 예방 및 해결하며, 환자의 자가 관리를 활성화하기 위한 여러 프로젝트를 지원한다.
클러스터 6 식품, 바이오경제, 천연자원, 농업 및 환경18)은 관련 프로젝트 수행을 통해 환경 파괴를 줄이고 육지, 내륙, 바다의 생물 다양성 감소를 멈추거나 되돌리며 농업, 어업, 양식업, 식품 시스템 등에 대한 지식, 혁신, 디지털화를 통해 모든 사람의 식량과 영양 안보를 보장하고 임업을 포함한 저탄소, 자원의 효율적인 순환 경제 및 지속 가능한 바이오경제로의 전환을 촉진하고 가속할 것으로 기대한다. 클러스터 1과 6의 목표는 다음 표와 같다.
[표 1-8] 호라이즌 유럽(2021-2027) 실행 프로그램(2023-2024) 클러스터 1, 6의 목표
|
구분 |
목표 |
|
클러스터 1. 건강 (2년간 총 1억 유로 규모) |
- 급변하는 사회에서 건강하게 살기 - 건강을 증진하는 환경에서 생활하고 일하기 - 질병에 대처하고 질병 부담 줄이기 - 혁신적이고 지속 가능한 양질의 보건의료에 대한 접근성 보장 - 건강한 사회를 위한 새로운 도구 - 기술 및 디지털 솔루션의 잠재력 최대한 활용 - 혁신적이고 지속 가능하며 글로벌 경쟁력을 갖춘 보건 산업 유지 |
|
클러스터 6. 식품, 바이오경제, 천연자원, 농업 및 환경 (2년간 총 2억 유로 규모) |
- 1차 생산부터 소비까지 공정하고 건강하며 환경 친화적인 식품 시스템 - 순환 경제 및 바오경제 부문 - 청정 환경 및 오염 제로 - 기후 행동을 위한 토지, 해양 및 물 - 회복력 있고 포용적이며 건강하고 친환경적인 농촌 - 해안 및 도시 커뮤니티 - 그린 딜을 지원하는 혁신적인 거버넌스 - 환경 관측 및 디지털 솔루션 |
출처: European Commission, Horizon Europe work programmes 2023-2024, 2023.3.31
(3) 유럽 과학, 연구 및 혁신 성과 평가 및 향후 정책 지침
2022년 7월에 발간된 유럽 과학, 연구 및 혁신 성과 보고서(Science, Research and Innovation Performance of the EU, SRIP report)19)는 유럽의 연구와 혁신 시스템이 코로나 팬데믹이나 러시아-우크라이나 전쟁과 같은 전혀 예기치 않은 상황 속에서도 빠르게 대응할 수 있도록 이전보다 충분히 더 유연해져야 함을 강조하였다.
특별한 성과로 지목된 것으로 2007년부터 2019년까지 총 41억 유로가 지원된 감염병 연구 프로그램을 통해 mRNA 백신 개발(BioNTech)이 이루어졌으며 또한, COVID-19 염기서열 발표 직후 세계에서 가장 먼저 개발한 확진 진단 툴, 중화항체 발견, WHO 임상 지침 및 기타 지침 문서에 활용된 역할 연구 결과 등이 있다.
이 보고서는 지속적으로 추진해 오던 그린 딜 및 디지털 의제의 성공을 담보하고 위기에 대한 준비성, 대응성, 회복성을 강화하여 글로벌 경쟁에서의 지식 및 기술 주권을 지킬 수 있는 경쟁력을 갖추도록 요구하는 것으로 요약되며, 다음과 같이 6개 정책 지침 – ‘팬데믹 이후 더 나은 세상 준비’, ‘경쟁력 확보’, ‘상상할 수 없는 것을 생각하고 준비’, ‘사업, 기관, 인력의 연계 활용’, ‘활동가 연계 및 격차 해소’, ‘연구혁신 친화적 조건 보장’ - 을 제시하였다.
또한 향후 유럽의 기술 주권을 위한 핵심 기술 7가지(AI, 블록체인, 양자 컴퓨팅, 밧데리, 수소와 더불어)에 생명공학 분야 중 mRNA, oncology 두 가지 분야를 포함시키면서 이들을 향후 유럽이 투자해야 할 기술 개발 주력 분야로 선정하였다.

출처: European Commission, Science, Research and Innovation Performance of the EU 2022, 2022.7.
[그림 1-2] EU의 핵심 기술의 집중도(2015∼2020)
다. 기술 및 산업 동향
(1) 코로나19 이후 유럽 체외진단 산업(IVD)에 대한 관점20)
2021년 팬데믹에 의한 IVD 업계의 급격한 성장은 멈추고 2022년부터 팬데믹 이전 수준으로 돌아오고 있지만, 전문가와 연구자들은 2013년부터 팬데믹까지 정체되어 있던 IVD시장이 팬데믹 이후 연평균 4.5%의 성장을 예상하고 있으며, 그 이유로 정기 진단 검사에 대한 정부, 의료 보험사, 환자의 태도 변화를 꼽는다. 즉, 팬데믹으로 인해 더 많은 사람이 자가 테스트에 익숙해졌으며, 이는 감염성 질환과 만성 질환 모두에 대한 체외진단 검사의 증가로 이어질 수 있다고 보기 때문이다. 더욱이 독일, 프랑스, 영국, 이탈리아, 스페인의 상위 5개 EU IVD 시장 이외에 여러 국가에도 이미 검증된 검사 인프라가 잘 구축되어 있기 때문에 각국은 자국민의 여러 질환을 조기에 발견하고 대응하기 위해 체외진단을 늘려갈 수 있다고 전망한다.
팬데믹 기간 유럽에서 가장 빠르게 성장한 진단 회사로, 오스트리아 빈의 라이프브레인(Lifebrain) 社를 꼽을 수 있다. 이 회사는 기존 PCR 테스트의 10분의 1의 비용으로 거의 같은 정확도를 보이는 PCR 가글 테스트를 선보였으며 매일 80만 건의 테스트를 처리하고 새로운 바이러스 변종을 식별하기 위해 시퀀싱 역량을 확장해 왔다. 이 덕분에 오스트리아는 팬데믹 기간 1인당 17.5건으로 EU 내 최고 수준의 검사 건수를 보였으나, 팬데믹이 끝나가는 현재 이 회사의 규모는 적절한 수준을 찾아 작아지고 있다. 하지만 이들은 지속적인 기술개발로 향후 성장하는 개인 맞춤형 인간 유전자 검사 분야로 검사 기술 이전을 시도하며 정기적으로 건강을 모니터링하여 잠재적인 질병에 더 빨리 대처하고 더 오래 건강하게 살 수 있는 방법을 제시하는 회사로의 변모를 꾀하고 있다.
또한 IVD는 전염병뿐만 아니라 팬데믹 이후 암 예방 시장에서도 크게 성장할 것으로 기대받고 있다. 팬데믹 기간 유럽에서는 암 예방을 위한 약 1억 건의 선별 검사가 실시되지 않았고 약 100만 건의 암 사례가 진단되지 않은 채로 남아있었던 것으로 추산되어 이후 선별 및 예후 바이오마커 검사에 대한 엄청난 수요를 예상하고 있다. 더욱이 최근 유럽 내 암 발병의 40%가 조기 예방이 가능하다는 통계와 분자생물학 및 개인 맞춤형 mRNA 백신의 발전은 암을 훨씬 더 조기에 진단하여 장기적으로 전체 생존율을 향상시킬 수 있을 것으로 예상된다. 이는 IVD 및 시퀀스 또는 이미징 기반 종양 보드 개발자에게 중요한 비즈니스 기회가 될 것으로 보인다.
(2) 순환 바이오 기반 유럽 공동 사업(Circular Bio-based Europe Joint Undertaking, CBE JU)21)
CBE JU는 유럽에서 경쟁력 있는 순환 바이오 기반 산업을 발전시키는 프로젝트에 자금을 지원하는 유럽연합과 바이오 기반 산업 컨소시엄(Bio-based Industries Consortium, BIC22)) 간의 20억 유로 규모의 파트너십 프로젝트로서 2021∼2031년까지 10년간 EU의 연구 및 혁신 프로그램인 Horizon Europe의 규칙에 따라 운영된다. 이는 선행 프로젝트였던 BBI JU23) 에 이어지는 프로젝트로서 혁신적이고 지속 가능하며 순환적인 방식으로 폐기물과 바이오매스로부터 재생 가능한 바이오 기반 제품과 소재를 생산함으로써 2050년까지 기후 중립 목표에 크게 기여하는 동시에 유럽 전역의 지역에서 녹색 일자리와 지속 가능한 경제 성장을 창출하는데 목표를 둔다.

출처: https://biconsortium.eu
[그림 1-3] BBI JU와 CBE JU 프로젝트가 기여하는 분야
CBE JU 프로젝트는 농부부터 과학자에 이르기까지 바이오 기반 산업의 다양한 주체들을 한데 모아 해당 분야의 기술, 규제 및 시장 과제를 해결할 수 있도록 유도하며, 공공과 민간의 협력지원 제도를 통해 혁신과 시장 보급을 촉진하고 향후 투자를 위한 기반을 마련한다. CBE JU는 BBI JU의 성공을 기반으로 그 범위를 확대하고 유럽 바이오 기반 산업의 남은 과제를 해결해 나가고자 하며 ‘지속 가능한 바이오 기반 솔루션을 위한 연구 및 혁신 지원’, ‘혁신적인 순환형 바이오 기반 생산 공장에 대한 투자 위험 제거’, ‘바이오경제의 기술, 규제 및 시장 과제 해결’, ‘지속 가능성을 운영의 중심에 두기’, ‘모든 바이오경제 주체들의 협력 강화’, ‘가치 사슬을 따라 더 많은 이해관계자와 소통하기’ 등에 중점을 두고 프로젝트를 수행해 나가고 있다.
[표 1-9] 2023 CBE JU 프로젝트 대표 사례
|
• 고부가가치 바이오 기반 화학물질 및 중간재를 위한 바이오 정제소 확장 및/또는 개조 • 차단성, 식품 접촉성, 성형성, 인쇄성, 안전성, 재활용성/순환성 등 향상된 특성을 갖춘 바이오 기반 포장재 • 토양 건강 및 품질 개선을 위한 안전하고 지속 가능하며 효율적인 바이오 기반 비료 생산 • 바이오 기반 플라스틱 재활용을 통해 선별 및 재활용 함량 증가(업사이클링) • 지속 가능성 프로필을 개선한 확장 가능하고 안전한 바이오 기반 계면활성제 개발 • 식물 관리; 산업 작물로 토양을 치유하고, 오염된 땅과 염분이 있는 땅을 산업 작물 생산에 활용 • 견고하고 최적화된 산업 생명공학 및 화학/산업 생명공학 공정 |
출처: CBE JU
라. 법제도 동향
(1) 새로운 유전체 기술 규정(New Genomic Techniques, NGT)24) 연구 및 GMO 식물공개 자문25)
유전자 변형 식품(GMO)에 관한 EU 법률은 크게 다섯 가지 법률26)에 명시되어 있다.
유럽연합 이사회는 유럽사법재판소의 사건 C-528/16 판결에 비추어 앞서 서술한 유럽연합법에 따른 새로운 유전체 기술의 지위와 관련하여 이 연구를 요청했으며, 2021년 4월 29일 발표된 연구 내용에서 NGT는 유기체의 유전 물질을 변화시킬 수 있는 기술로 정의되며, 기존 GMO 법안이 채택된 2001년 이후 등장했거나 개발된 것으로 규정하였다. 이 연구에는 ‘NGT로 생산된 유기체의 법적 지위 명확화’, ‘유전자변형생물체와 관련된 GMO 법규의 이행 및 집행 현황’, ‘안전 및 위험 평가 고려 사항’, ‘NGT 및 해당 제품, 라벨링, 중소기업, 지식 재산권과 관련된 잠재적 혜택/기회 및 도전/우려에 대한 EU 국가 및 이해관계자의 견해’, ‘NGT 및 해당 제품의 윤리적 측면에 대한 정보’ 등과 같은 내용들이 기술되어 있다.
또한, 기존의 GMO 법령과 새롭게 연구된 NGT를 활용하여 새로운 특성(예: 질병, 해충 또는 가뭄에 대한 식물의 저항성, 제초제에 대한 식물의 내성, 식품의 품질 또는 영양가 개선, 수확량 증가)을 획득한 - 표적 돌연변이 유발(targeted mutagenesis) 및 시스제네시스(cisgenesis)로 얻은 - 식물 생산 이니셔티브에 대한 공개 자문이 2022년 4월 29일에 발표되었으며 약 1년여의 평가 기간을 거쳐 2023년 두 번째 분기에 그 결과 및 법적 제안이 이루어질 예정이다. 이러한 이니셔티브는 형질 개선된 식물 제품에 대한 적절한 규제 감독을 통해 인간과 동물의 건강과 환경을 높은 수준으로 보호하고, 유럽 그린 딜과 농장에서 식탁까지 전략의 목표에 안전한 새로운 게놈 기술의 혁신과 기여를 가능하게 하는 것을 목표로 하고 있다.
(2) 보건비상대응기구(EHRA) 설치27)
2021년 9월 16일 EU 집행위원회는 개별 국가 수준을 넘어선 EU 수준에서의 빠른 보건 위기 대응 전담 기구로서 보건비상대응기구(Health Emergency Preparedness and Response Authority, HERA)를 설립하였으며, 이는 기존의 독립 기관으로서 유럽 질병 예방 관리센터(European Centre for Disease Prevention and Control, ECDC), 감염병 조기경보대응시스템(Early Warning and Response System, EWRS) 등이 EU 회원국 간 이견을 조정할 권한이 없는 한계를 넘어서기 위해 EU 집행위원회에 내부 조직을 설치하였다. 따라서 향후 보건 위기 상황에서 회원국 간 보건・정치・경제 등을 감안한 종합적인 판단이 가능하도록 의사결정 체계를 개선하여 더 나은 위기 대응 능력을 보여줄 것으로 기대된다.
(3) CBE JU의 설립 근거28)
CBE JU는 2014년 5월 6일자 이사회 규정(EU) 560/2014에 따라 설립된 BBI JU의 법적 및 보편적 승계자로서 모든 계약, 보조금 계약 및 부채를 승계하며, 2021년 11월 19일의 이사회 규정(EU) 2021/2085에 따라 유럽위원회로 대표되는 유럽 연합과 바이오 기반 산업 컨소시엄(BIC) 간의 제도화된 유럽 파트너십으로 설립되었다.
3. 중국
가. 사회적 이슈
중국은 최근 20차 당대회(전국대표회의), 연간 양회(兩會・전국 인민대표대회와 정치협상회의) 등을 통해 ‘국민경제와 사회발전을 위한 14차 5개년 계획(2021)’ 등의 국가적 중장기 발전 계획을 발표하면서 생명공학 분야의 중요 이슈와 방향성에 대해서 제시한 바 있다. 또한 이러한 정치적 이벤트를 통해 짧게는 2025년까지, 그리고 궁극적으로는 2035년까지의 생명과학, 바이오산업, 생명공학을 포함한 중국의 사회・문화・경제・과학 등 전 분야의 중・장기 발전 전략을 확인할 수 있으며, 이를 구체적으로 살펴보면 다음과 같다.
(1) 국민경제와 사회발전을 위한 14차 5개년 계획
2021년 3월 13일 양회에서는 미중 분쟁이 강화되면서 ‘자립적 기술자강’을 전면적으로 부각하고, 전략적 과기역량 강화, 기업 기술혁신능력 향상, 인재혁신 향상, 과학기술 매커니즘 보완 등 8개 분야 사업 및 전략을 중점적으로 배치하는 내용을 중심으로 하는 ‘국민경제와 사회발전을 위한 14차 5개년 계획 및 2035년 원경 목표 강요’를 발표하였다. 중국은 해당 계획을 통해 장기적으로 과학기술 혁신 시스템을 구축하고, 특히 생명공학 분야에 대해서도 정부주도형 시스템 전환을 통해 다양한 혁신기구와 플랫폼을 확대하고자 하였다. 또한 중국의 차세대 발전모델로서 디지털 강국이 채택되면서 스마트의료 등 생명공학 디지털화를 가속화하고 있다.
[표 1-10] 중국 14차 5개년 계획 관련 생명공학 분야 정책
|
전략・사업 |
세부 과제 |
세부 내용 |
|
전략적 과기역량 강화 |
핵심기술 개발 |
❶ 뇌과학 및 뇌모방 연구 : 뇌인지 원리 해석, 뇌 메조스코픽 신경 연결 지도 제작, 뇌 중증질환 메커니즘 및 뇌・컴퓨터 인터페이스 기술 개발 ❷ 유전자 및 바이오 기술 : 유전체학 연구 응용, 유전세포와 유전육종, 합성생물, 바이오의약 등 기술 혁신, 혁신성 백신, 체외진단, 항체약물 등 연구개발, 농작물, 가축/수산, 농업 미생물 등 중대 신품종 개발 등 ❸ 임상의학 및 건강 : 암질환과 심뇌혈관, 호흡, 대사성 질환 등의 발병 메커니즘에 관한 기초연구, 능동적 건강간섭기술 연구개발, 재생의학, 마이크로바이옴, 신형 치료 등 첨단기술 개발, 중대 감염병과 중대 만성 비감염성 질환의 예방치료 핵심기술 연구 |
|
제조강국 건설 |
제조업의 고도화 발전 |
첨단의료장비와 혁신 약물 : ❶ 복강경 수술로봇, 체외막산소공급(ECMO) 설비 등 핵심기술 개발, 첨단영상, 방사선치료 등 대형 의료장비와 핵심부품의 연구개발 추진 ❷ 뇌 페이스메이커, 분해 가능한 혈관 스탠스 등 삽입제품 발전, 재활 보조 기구의 질적 업그레이드 추진, ❸ 중증 감염질환에 필요한 백신 개발, 악성 종양, 심뇌혈관 질환의 치료 특효약 개발, ❹ 중의약 핵심기술 장비의 연구개발 강화 |
|
전략적 신흥산업 육성 |
새로운 기간산업 육성 |
바이오기술과 정보기술의 융합혁신 촉진 및 바이오의약, 바이오육종, 바이오소재, 바이오에너지 등 산업의 발전 가속화, 바이오경제 규모 강화 |
|
디지털 중국 |
디지털 사회/정부 등 디지털 생태계 구축 |
스마트 의료: ❶ 전자건강기록과 병력・전자처방 등 데이터베이스를 보완하여 의료위생기관의 데이터 공유 가속화, ❷ 원격의료를 보급하고 의학영상보조판독 및 임상보조진단 등의 활용 추진, ❸ 빅데이터를 활용하여 의료기관과 의료행위에 대한 감독 관리능력 향상 |
출처: 국무원, 국민경제와 사회발전을 위한 14차 5개년 계획 및 2035년 원경목표 강요 내용 재구성
(2) 제20차 당대회(전국대표대회)
2022년 10월 16일 중국 20차 당대회(전국대표대회)가 개최되었으며, 5년마다 개최되는 당대회를 통해 중국은 공산당의 차기 지도자 결정 및 향후 5년간의 발전 비전을 제시하였다. 시진핑 총서기는 ‘중국식 사회주의 현대화 강국 발전’을 비전으로 제시하면서, 중국이 세계 제2위 대국으로 발전한 점을 강조하고, 2035년까지 경제발전, 과학기술 역량을 제고하여 세계 1등 국가를 건설하겠다고 발표한 바 있다. 특히, 시진핑 총서기는 과학기술, 인재양성 및 혁신의 중요성을 강조하면서 과학기술을 통한 국가 부흥, 인재강국, 혁신발전을 추진해야 한다고 역설하면서 지난 10년간의 우수한 과학기술 주요성과29)를 소개하고 15개 부문의 국가 전략을 제시하였다. 15개 전략 중 생명공학과 관련되는 전략은 ‘현대화 산업시스템 구축’, ‘생태계 다양성・안정성・지속성 향상’, ‘국가안보체계 능력 현대화 추진’ 등이 있으며, 또한 대부분의 전략은 2021년 3월에 발표된 ‘14차 5개년 계획’의 정당성을 다시 한번 확인하고, 이를 계속 유지・발전하겠다고 천명하였다.
나. 정책 동향
중국의 생명공학 관련 최근 정책 동향은 2021년 3월 발표된 ‘국민경제와 사회발전을 위한 14차 5개년 계획’과 연계되어 있으며, 해당 계획에서 제시한 방향성에 부합하는 정책을 국가발전개혁위원회, 공신부, 과기부 등 정부 주요 부처별로 마련하여 추진하고 있다. 생명공학과 연관한 주요 정책으로는 ‘바이오경제 14.5 규획’, ‘14차 5개년 국민건강계획’, ‘14차 5개년 의료장비산업 발전계획’ 등이 있으며 무엇보다도 앞서 소개한 14차 5개년 계획을 실현하기 위한 구체적인 방안이라고 할 수 있다.
(1) 바이오경제 14・5 규획
중국 국가발전개혁위원회는 2022년 5월 10일 생명과학, 바이오기술과 광범위한 산업 분야와의 융합을 강화하기 위해 ‘바이오경제 14・5 규획(“十四五”生物经济发展规划)’을 발표하였다. 해당 규획을 통해 2035년까지 바이오경제 역량을 선진국으로 향상시키고, 이를 위해 4대 중점분야, 5대 중점임무 및 7대 프로젝트를 선정하여 추진하고 있다.
* 4대 중점방향 : 바이오의약, 바이오농업, 바이오매스, 바이오안전, 5대 중점과제 : 바이오경제 혁신기반 강화, 바이오 중점산업, 바이오자원 보호활동, 바이오 분야 정책환경 최적화, 7대 프로젝트 : 바이오경제 혁신능력 제고, 생물의약기술 혜민(惠民), 종자산업 현대화, 바이오에너지 환경보호 산업 시범 프로젝트, 바이오기술 및 정보기술 융합응용, 바이오자원 보장 개발, 바이오경제 선도지역 구축
[표 1-11] 중국의 바이오경제 14・5 규획의 중점방향
|
분야 |
중점방향 |
내용 |
비고 |
|
바이오의약 |
질병치료 ▶ 건강관리 |
약물, 백신, 선진형 진료 기술과 장비, 의료용 바이오 소재, 정밀의료, 의학검사 분야 원천 혁신 능력 향상 |
|
|
바이오농업 |
먹거리 해결 ▶ 풍부한 영향 |
바이오 육성, 바이오 비료 및 바이오 농략 등 차세대 농업 바이오 제품 등 개발 |
|
|
바이오매스 |
생산성 ▶ 생태환경 |
바이오매스 소재, 신형 발효제품, 바이오매스 에너지 등 바이오매스 순환이용기술 시스템 구축 |
|
|
바이오안전 |
수동적 대처 ▶ 주도적 예방 |
신규 돌발성 감염병(동식물 감염병 포함)에 대한 예방제어 및 퇴치역량 강화 |
|
출처: “十四五”生物经济发展规划, https://www.ndrc.gov.cn/xxgk/zcfb/ghwb/202205/P020220510324220702505.pdf
(2) 14차 5개년 국민건강계획30)
중국 국무원은 2022년 5월 20일, 코로나19 시대 중국 인구 고령화, 출산율, 환경위생, 직업건강 등 문제해결을 위해 ‘14차 5개년 국민건강계획(“十四五”国民健康规划)’을 발표하였다. 해당 계획에서 2025년의 중국의 기대수명은 78.93세이며, 이에 대비하여 인구 고령화 대응전략을 수립하고 ‘건강중국(健康中国)’이라는 비전 아래 전 국민에 대한 전주기 건강서비스를 제공하고자 한다. 주요 전략으로는 중대 전염병 대응 역량 강화, 노인건강 관리 강화, 전통 중의약 발전 추진, 헬스케어 산업 육성이 있다.
(3) 14차 5개년 의료장비산업 발전계획31)
중국 공업정보화부, 국가발전개혁위원회 및 과기부 등 10개 부처는 2021년 12월 28일 의료장비 분야 자립화 수준을 향상시키기 위해 ‘14차 5개년 계획 의료장비산업 발전계획’을 수립하여 발표하였다. 중국은 해당 계획을 통해서 의료장비와 스마트제조, 차세대 정보기술, 신소재 바이오기술 등의 융합혁신을 통해 자국의 바이오 기술 수준 및 바이오기술 경쟁력을 강화하여 세계 수준의 의료장비 기업을 6∼8개를 배출하고자 한다. 이를 위해 의료장비산업 5대 목표, 7대 중점분야, 5대 프로젝트를 수립하여 추진하고 있다.
* 5대 목표 : 기술혁신능력 강화, 공급능력 강화, 국제경쟁력 강화, 서비스능력 강화, 지원능력 강화, 7대 중점분야 : 진단검사장비, 치료 장비, 모니터링 및 생명 연장 설비, 중의 진단설비, 유아/여성 전용 의료설비, 보건재활 장비, 생체이식 기기, 5대 프로젝트 : 산업기초능력, 스마트 의료장비, 클러스터화 발전, 비상 대응 의학구조, 의료장비 표준시스템
(4) 2022년 중국 생명과학 분야 10대 성과
중국과학기술협회 생명과학학회연합체는 2015년부터 매년 ‘중국 생명과학 분야 10대 성과’를 발표하고 있으며, 중국의 14차 5개년 계획, 바이오경제 14・5 규획 등 사회경제 및 과학기술 관련 정책의 효과라고 볼 수 있다. 2023년 1월 19일에 발표된 2022년 중국 생명과학 분야 10대 성과는 다음과 같다.
[표 1-12] 중국 생명과학 분야 10대 성과(2022)
|
연번 |
2022년 생명과학 10대 성과 |
기관명 |
|
1 |
코로나19 변이주 면역도피 메커니즘 |
베이징대학교(北京大学) 중국과학원 생명물리연구소 |
|
2 |
콜레스테롤 유출 새 경로 및 지질 저하 새 전략 |
우한대학교(武汉大学) |
|
3 |
포유류 염색체 공학 신기술 및 염색체 인공 전환 |
중국과학원 동물연구소 중국과학원 분자세포과학혁신센터 |
|
4 |
인류 초기 배아 번역체 지도 및 접합체 유전체(게놈) 활성화 인자 연구 |
칭화대학교(清华大学) 산동대학교(山东大学) |
|
5 |
고정밀 생명 파노라마 시간・공간 유전자 발현 지도 구축 |
화다생명과학연구원(华大生命科学研究院) |
|
6 |
메트포르민 표적 발견 및 노화 지연 메커니즘 논술 |
샤먼대학교(厦门大学) |
|
7 |
허혈성 뇌혈관 질환의 정밀 치료 방안 |
수도의과대학교 베이징천단병원 (首都医科大学附属北京天坛医院) |
|
8 |
파격적 유전자 디코딩 기술 연구개발 세계 최초 ‘교란도’ 구축 |
상하이과학기술대학교(上海科技大学) |
|
9 |
다세포 생물 자가포식 기원의 분자 메커니즘 |
중국과학원 생명물리연구소 |
|
10 |
벼의 고온 저항 유전자 발굴 및 조절 새로운 메커니즘 |
중국과학원 분자식물과학우수혁신센터 상하이교통대학교(上海交通大学) |
출처: http://www.stdaily.com/index/kejixinwen/202301/3d1ef34764c649138df658d90564569b.shtml
다. 기술 및 산업 동향
(1) 바이오기술 주요 동향
(가) 바이오의약 기술에 AI 도입
중국의 바이오의약 분야 연구개발 수준은 지속적으로 향상되고 있으며, 2021년 기준 바이오의약 R&D 지출비용은 298억 달러로서 전년 대비 21% 증가한 수치이다. 바이오의약 연구개발 인력이 100만 명 이상이고, 해외에서 유입된 인재가 30만 명에 달한다.32) 그 결과 약물 연구개발 품질이 크게 향상되었으며 이중항체, 항체융합 단백질, 항체결합 약물 등이 지속적으로 개발되고 있으며, 특히 바이오의약품 개발에 인공지능이 도입되었다. 펀즈즈신(分子之心)은 업계 최초로 완전한 기능을 갖춘 AI 단백질 예측 및 설계 플랫폼 ‘MoleculeOS’를 출시했으며, 세계 최고의 단백질 구조 및 특성 예측과 단백질 설계 능력을 갖추고 있다. 현재 단백질 설계, 단백질 최적화, 항체 중 설계, 단백질 및 복합체 구조 예측, 단백질-단백질 도킹, 단백질 측쇄(side chian, 곁사슬) 예측, 단백질 기능 예측, 단백질 언어 모델 등 핵심 분야에서 10개 이상의 세계 최고의 AI 알고리즘을 개발해 전 세계에서 인정받는 성과를 거두었다.
(나) 바이오농업 기술
중국은 세계 최대 유전자 변형 면화 생산국이며 현재 면화, 파파야의 2개 유전자 변형작물을 재배하여 수출용으로 생산하고 있지만, 기본적으로 유전자 변형 농작물의 국내 생산과 수입을 규제하고 있다. 유전자 변형 농작물과 관련된 연구개발은 하고 있으나 상업적으로 활발하지 않으며, 1997년부터 현재까지 토마토, 피망, 페튜니아, 포플러 등 4개의 유전자 변형 제품이 허가되었으나 상업적으로 재배되지는 않고 있다. 중국은 유전자 변형 작물을 식품안보 차원에서 강화하고 있으며 이에 따라 농촌농업부는 해당 분야 성과를 향상하기 위하여 재정적 지원을 강화하고 있다. 중국 정부는 신규 바이오종자 번식 지원을 위해 2008년부터 재정적 지원을 시작하여 총 240억 위안을 투입하였으며 곤충, 질병, 스트레스에 저항성이 있는 특성을 개발하기 위해 약 600여 개의 프로젝트를 지원하는 등 유전자 변형 종자 개발에 심혈을 기울이고 있다. 2023년 2월 16일에는 ‘2023년 농촌활성화 중점사업 추진에 관한 국무원 의견’을 발표하여 유전자 변형 육종 개발을 심화하고 유전자 변형 상업화의 가속화를 꾀하고 있다. 2022년에는 유전자 변형 종자 생산면적이 4,400만m²에서 2023년에는 약 51%가 증가한 6,600만m²로 확대할 예정이며 이를 통해 유전자 변형에 대한 핵심기술을 개발하고자 한다.
(2) 바이오산업 주요 동향
(가) 바이오의약 산업
중국은 12차 5개년 계획(2011∼2015) 이후부터 바이오의약을 전략산업으로 육성・지원하였고, 그 결과 세계에서 두 번째로 큰 시장을 구축하였다. 중국은 바이오의약 산업 후발국이지만 바이오의약 산업은 제도적으로 강력한 제조역량을 기반으로 다양한 국제 표준에 부합하고 규제를 완화하기 위해서 노력해 왔다. 중국정보망에 따르면, 중국 바이오의약 산업의 시장 규모는 2022년 4조 800억 위안으로 전년 대비 약 7% 증가하였다(2021년 3조 8,200억 위안). 또한 코로나19가 시작된 2022년부터 중국 바이오의약 분야 투자가 크게 늘어나서 2021년 기준 파이낸싱 건수는 전년 대비 57% 증가한 522건으로 금액은 1,114억 위안에 달하는 것으로 확인되었다. 특히, 중국은 총 211개의 바이오의약 산업단지가 있으며, 2021년 해당 단지의 매출액은 3조 5,000억 위안에 달하였고, 바이오의약 산업이 지역별 바이오 클러스터를 구성하여 발전하는 추세를 보이고 있다.33)
(나) 바이오경제
지난 10년간 중국의 바이오경제 규모는 7조 6,000억 위안에서 18조 4,000억 위안으로 증가했는데, 이는 연평균 증가율 측면에서 중국의 연간 GDP 성장률보다 약 10% 정도 높은 것으로 확인되었다. 이 중 바이오기술 산업은 다시 바이오의약, 바이오농업, 바이오제조, 바이오의학 공정, 바이오에너지, 바이오환경보호, 바이오서비스의 7대 산업으로 재구분 가능하고, 총 5조 3,000억 위안의 규모를 가지며, 이 중 가장 비중이 높은 분야는 바이오의약 분야이다. 2021년 말 기준 바이오경제 지역별 규모는 산동, 장쑤, 광동, 쓰촨, 허난 등 총 5곳의 규모가 1조 위안을 넘어섰으며, 산동성이 1조 6,265억 위안으로 1위를 차지한 것으로 나타났다.
|
중국 바이오경제 규모 및 성장율 |
중국 바이오경제 및 GDP 증가율 비교 |
|
|
|
출처: 中国电子信息产业发展研究院, 2022中国生物经济发展研究报告, 2022.12.7.
[그림 1-4] 중국 바이오경제 현황(2012∼2021)
라. 법제도 동향
(1) 생물안전법
2021년 4월 15일에 제정・시행된 생물안전법은 바이오기술 관리, 실험실 보안 등 중국의 생명공학, 바이오 안전관리 능력을 제고하기 위해서 만들어졌다. 이는 비교적 선진국에 비해 취약하였던 바이오기술 오남용, 생물테러 방지 등 8개 방면의 기준을 정립하여 글로벌 스탠다드에 부합하고자 제정하였다. 생물안전법은 총 8장 87개 조항으로 구성되어 있으며, 특히 바이오 분야의 안전을 위협하는 사항에 대해서 징벌적 조항을 명시하여 법의 실효성을 강화하고자 하였다. 즉, 국가가 금지하는 생명공학 연구・개발・응용하는 경우 최대 1,000만 위안, 국가안전관리규범 미준수 최대 200만 위안, 인적유전자원 미승인 사용 최대 500만 위안, 동물 등 외래종 미승인 수입 최대 25만 위안 등의 벌금을 부과할 수 있다. 또한 상기의 벌금 외에 관련된 모든 연구개발 활동은 중단, 연구비, 회사, 주요 연구기관 보직 해임 및 불법 이익의 10∼20배의 과태료를 부과하고 있다.
(2) 생물다양성 보장
중국과학원은 2008년부터 매년 ‘중국생물물종목록(Catalogue of Life China)’을 갱신 및 발표하여 중국의 생물다양성 보전 정책 및 계획 수립에 대한 과학적 근거를 제공하고, 관련 분야 연구를 보완하기 위한 데이터를 제공하고자 하였다. 연도별로 생물종 목록을 발표하는 국가는 중국이 유일하며, ‘중국생물물종목록 2022판’은 총 13만 8,293개(12만 5,034개 종, 하위단위 1만 3,259개 종)의 종자를 수록하고 있다. 해당 목록에는 6만 8,172개의 동물 종, 4만 6,725개 식물 종, 1만 7,173개 곰팡이 종을 포함하고 있으며, 이외에도 2,566개 원생동물 종, 2,383개 색소 종, 469개 세균 종, 805개 바이러스 종이 포함되었다. ‘중국생물물종목록 2022판’에 수록된 생물물종은 2021년 대비 1만 343개 종이 증가하였다.
중국은 1992년 생물다양성협약(CBD)에 가입한 이래 생물다양성 보호에 많은 관심을 가져왔으며, 2021년 10월 11∼24일까지 중국 쿤밍에서 개최된 제15차 생물다양성협약(COP15) 1차 회의를 통해서 중국은 15억 위안을 생물다양성을 위해 투자하겠다고 발표하였으며, 2022년 12월 7∼19일 동안 개최된 캐나다 몬트리올에서 개최된 제15차 생물다양성협약(COP15) 2차 회의에서 중국은 최초로 의장국으로서 국제 환경조약에 관여하였다.
한편, 2023년 3월 4일부터 개최된 2023년 양회를 통해 중국은 생물다양성 보장을 위한 시스템 강화에 대한 내용을 발표하였다. 즉, 중국은 생물다양성 보전 분야의 법적 수준이 낮고, 생물다양성 관리 시스템 조정력이 여전히 부족하다고 인식하여 기존에 부처의 관리 규정으로만 관리하던 생물다양성 관리에 대해서 입법 활동 추진, 생물다양성 전담 부서 신설 및 연구비 지원 확대 등이 2023년 안에 추진될 예정이다.
(3) 혁신치료제지정 제도 시행
중국 정부의 바이오의약품에 대한 규제 환경은 2016년 시판허가능제도(Marketing Authorization Holder, MAH) 도입에 따라 자체 제조소 없이도 외부 위탁생산을 통한 품목허가 신청 및 생산이 가능하도록 하였고, 2017년에 국제의약품규제조화위원회(ICH)에 가입함에 따라 의약품 허가와 관련된 규제를 국제기준에 맞춰 개선되었다. 2018년부터는 중국에서 임상을 하거나 중국에서 최초로 승인된 바이오의약품에 대한 자료독점권을 확대하였다. 이는 2018년 4월 이전에는 바이오의약품에 대해서 6년의 자료독점권을 부여하였으나, 그 이후에는 미국(12년)과 유럽(8년+2/3년)의 기준을 준용하여 12년의 자료독점권을 부여하였다. 최근에 중국은 심각한 질환에 대해 기존에 치료제가 없고, 특정 질환에 대해 가용한 치료 이점이 있다고 판단되는 경우 임상개발과 심사를 신속하게 하는 ‘혁신치료제지정(Breakthrough Therapy Desgnation, BTD)’제도를 2020년 7월 1일부터 시행하였다. 해당 규정이 제정된 이후부터 2022년 4월까지 약 78개의 신약(82개 적응증)이 평가를 받아서 혁신치료제로 지정되었다. 이렇듯 중국의 바이오의약품에 대한 규제환경은 국제기준에 부합하기 위해서 노력하면서도 코로나 상황 이후 신약 개발에 대해서는 규제를 완화하기 위해 제도를 개선하고 있다.
(4) 바이오의약 기술 수출제한 추진
중국과 미국의 기술 패권 경쟁이 심화되면서 바이오의약 분야에서도 첨예하게 견제와 갈등이 진행되고 있다. 미국 상무부는 일련의 중국에 대한 거래제한 조치34)를 취하고 있으며, 중국도 이에 대한 대응조치로서, 자국의 기술, 특허 등의 해외 이전을 금지하는 제도를 마련하고 있다. 특히, 바이오의약 기술의 수출제한을 추진하기 위해 중국 상무부는 2022년 12월 30일 ‘중국 수출제한 목록에 대한 통지’ 개정안을 발표하여 자율주행, 신에너지 바이오의약 등 최근 중국에서 급속히 발전된 기술에 대한 수출금지를 추진하였으며, 바이오의약 기술에는 세포클로닝, 유전자 편집 기술, 크리스퍼(Clustered Regularly Interspaced Short Palindromic Repeats, CRISPR), 합성생물학 기술 등이 포함되었다. 중국이 유전자 편집 기술, 합성생물학 기술 등의 바이오의약 관련 기술을 수출제한 기술로 지정하고자 하는 것은 중국이 이 기술 분야에서 미국과 대등한 수준에 근접했다고 판단하는 것으로, 미국이 취하고 있는 중국에 대한 일련의 수출・거래 규제를 통한 미국 내 역량 강화 움직임에 대한 중국의 대응적인 조치로 보는 것이 적절하다.
4. 일본
가. 사회적 이슈
지난 2년 사이, 일본에 가장 큰 영향을 미친 사건은 아베, 스가 전 수상에 이어 기시다 수상이 취임하고 새 내각이 2021년 10월에 출범한 것이라 볼 수 있다.35) 기시다 내각은 새로운 자본주의 실현, 신종코로나바이러스 대책 등의 5가지 주요 정책을 표방하였는데, 이 중에서 새로운 자본주의 실현이 가장 핵심 정책이라 볼 수 있다.36)
새로운 자본주의 실현은 성장, 규제개혁・구조개혁, 성장과 분배의 선순환, 디지털화 등의 사회개혁 새싹을 키워나가는 코로나 이후의 새로운 사회의 개척을 기본개념으로 한다. 대표적인 성장전략으로는 과학기술 입국(과학기술・이노베이션)을 내세우고 있는데, 대학 개혁・연구력 강화, 이노베이션 인재의 육성 강화, 지역 대학의 진흥, 스타트업 에코시스템의 구축, 기업의 해외 비즈니스 투자의 촉진 등을 핵심으로 하고 있다.
기시다 내각 출범 전인 2021년 7월 23일에 올림픽 역사상 처음으로 1년 연기된 하계올림픽이 1964년 이후, 두 번째로 도쿄에서 개최되었다.37) 8월 8일까지 17일간 개최되는 동안 참가자들은 매일 코로나19 진단검사를 받는 등의 감염대책을 실시하였으나, 올림픽 개막 6일 만에 감염자가 2.5배 폭증하였고, 일일 확진자가 1만 명을 넘어섰으며,38) 개막일인 23일(4,225명)에 비해 폐막일인 8일(14,472명)에 코로나19의 일일 확진자가 3.4배 늘어났다.39)
현재, 일본의 경제는 여전히 장기침체에 머물고 있고, 세계 최고의 저출산・고령화 추세가 계속되고 있다. 2022년 10월 기준으로 일본의 총인구는 약 1억 2,494만 명으로 13년째 감소하고 있으며, 도쿄를 비롯한 수도권 인구마저도 처음 감소세로 돌아섰다.40) 또한, 민간 연구기관인 일본경제연구센터는 엔 가치의 급락, 노동 생산성 저하 등으로 인해 작년 12월 일본의 1인당 GDP가 대만에 역전당했고, 한국에게도 추월당할 것으로 예상하였는데, 이 격차는 갈수록 심해질 것을 예측하였다.41) 지난 1월의 GDP마저도 전월 대비 0.6% 감소하는 등 코로나19 사태와 우크라이나 전쟁 발발 등으로 인한 전 세계 경제 혼란에서 벗어나지 못하고 있는 것으로 보인다.42)
일본 정부는 2023년 5월 8일부터 코로나19를 독감처럼 관리하고 마스크 착용은 개인의 판단에 맡기기로 했다.43) 수상 직속 위원회인 신종코로나바이러스 감염증 대책본부에서는 후속 조치로서 코로나19에 대한 기본방침과 마스크 착용에 대한 가이드라인을 수정하고, 이에 따른 의료제공체제 및 치료비 지원에 대한 기준도 변경하였다.44) 최근에는 약 2조 엔 넘게 투입하여 사전에 확보한 코로나19 백신의 유효기간이 만료되어 잉여 백신의 폐기 처리가 문제시되고 있다.45)
나. 정책 동향
(1) 과학기술・이노베이션 정책
(가) 통합이노베이션 전략
성장과 분배의 선순환과 코로나19 이후의 새로운 사회 개척을 기본개념으로 한 기시다 내각의 ‘새로운 자본주의의 실현을 위한 계획’46)에 근거하여, 과학기술・이노베이션회의(Council for Science, Technology and Innovation, CSTI)47)는 2023년 2월에 통합이노베이션 전략 2023의 방향성을 결정하였다.48)
통합이노베이션 전략 2023의 방향성은 과학기술・이노베이션을 국가 성장전략의 핵심으로 설정하고 첨단 과학기술의 전략적 추진, 지식기반(연구력)과 인재육성 강화, 이노베이션・에코시스템의 형성 등을 3가지 축으로 삼아, 일본의 미래를 견인할 기술을 양성하고 과학기술・이노베이션과 가치창조의 원천을 창출하여 과학기술・이노베이션의 혜택을 국민과 사회에 전달함으로써, 국가적 중요 기반을 유지하여 사회적 과제를 성장 엔진으로 전환하는 것으로 제시되었다.

출처: 향후의 과학기술・이노베이션 정책의 방향성, 내각부특명담당대신(과학기술정책), 2023.08., 그림 재구성
[그림 1-5] 일본 통합이노베이션 전략 2023의 개요
(나) SIP 및 PRISM의 연구과제
2023년부터 시작되는 전략적 이노베이션 창조 프로그램(Cross-ministerial Strategic Innovation Promotion Program, SIP)에서는 Society 5.049)을 백캐스팅하여 후보 과제를 선정한 후, 타당성을 분석하였고 기술뿐만 아니라 제도, 사업, 사회적 수용성, 인재 등의 5가지 관점50)에서 사회적 실현에 필요한 조치를 검토하여 과제를 선정하도록 방향성을 제시하였으며51), 이 기준에 따라 풍요로운 음식이 제공되는 지속 가능한 푸드체인의 구축, 통합형 헬스케어 시스템의 구축 등의 14개 과제가 선정되었다.52)
이 중에서 의료・헬스케어판 Society 5.0이라고 부르는 통합형 헬스케어 시스템 구축 사업은 과학기술・이노베이션회의 산하에 다부처 간의 상호 협조와 조정과 과제 검토를 위한 태스크포스를 설치하고, 2023년 1월에 사회적 실현을 위한 전략 및 연구개발계획을 확정하였다.53) 후생성은 재생의료 DX 비전을 마련하여 추진하고 있으며, AMED는 ‘게놈・데이터 기반 프로젝트’로 게놈・데이터 기반의 정비・활용에 관한 연구를 수행하고 있다.

출처: 통합형 헬스케어 시스템 구축 및 사회적 실현을 위한 전략 및 연구개발계획(안), 내각부 과학기술・이노베이션 추진사무국, 2023.03.16., 그림 재구성
[그림 1-6] 일본의 통합형 헬스케어 시스템의 구축
또한, 종래의 관민 연구개발 투자 확대 프로그램(Public/Private R&D Investment Strategic Expansion PrograM, PRISM)에서는 개별 기술 영역에서 각 부처가 연구개발을 주도하여 연구개발 단계를 특정하지 않아 사회적 과제 해결이나 신사업 창출로 바로 연결이 되지 않았다.54) 이를 해결하기 위해 개별 기술 영역을 설정할 뿐만 아니라 연구개발의 성과를 살려서 사회적 과제의 해결이나 신사업 창출의 가교가 되도록 중점과제를 설정하여 각 부처에서 추진하는 가교 프로그램(Programs for Bridging the gap between R&d and the IDeal society(society 5.0) and Generating Economic and social value, BRIDGE)을 실시하고 있다.55)
(다) 문샷형(Moonshot) 연구개발
인간의 행복(Human Well-being)을 지향하고 사회・환경・경제의 모든 과제를 해결하기 위한 목표로 설정한 문샷형 연구개발제도는 2021년 2월에 사람의 신체, 뇌, 공간, 시간의 제약으로부터 해방된 사회의 실현(2050년까지), 극히 조기에 질환의 예측・예방이 가능한 사회의 실현(2050년까지) 등의 7가지 연구과제를 범부처적으로 선정하였으며,56) 2021년 9월에 개최된 과학기술・이노베이션회의에서 지구 환경 재생을 위한 지속 가능한 자원 순환의 실현(목표 4), 미이용생물기능 등을 최대한 활용하여 글로벌 규모 지속적인 식료공급산업을 창출(목표 5) 등의 2개 과제가 확정되어 현재 총 9개 과제가 진행되고 있다.57)
문샷형 연구개발비 예산은 2018년 추경예산으로 1,000억 엔, 2019년 추경예산 150억 엔으로 기금을 조성한 후, 2021년 추경예산 800억 엔 추가하여 기금을 운용하고 있으며, 과제 당 최장 10년간 지원한다.58) 과제별로는 문부과학성의 과학기술진흥기구(JST)는 1∼3, 6, 8, 9번 목표, 경제산업성 신에너지・산업기술종합연구기구(NEDO)는 4번 목표, 농림수산성 농업・식품산업종합연구기구 생물계 특정 산업 기술연구지원센터(BRAIN)는 5번 목표, 후생노동성의 일본의료연구개발기구(AMED)는 7번 목표를 담당하고 있다.
(2) 바이오모노즈쿠리 혁명 추진사업
기시다 내각의 핵심 정책인 새로운 자본주의 그랜드디자인 및 실행계획(2022년 6월 7일 각의결정)59)에서 과학기술・이노베이션의 중점 투자 영역으로 양자기술(양자기술의 응용), AI(신약・농약 분야 응용 등), 재생・세포의료・유전자치료(iPS 세포 관련 연구 등)와 함께 바이오모노즈쿠리(합성생물학, 바이오모노즈쿠리 응용)가 선정되었다.
일본 경제산업성은 이를 근거로 2023년 3월, 바이오모노즈쿠리 혁명 추진 워킹그룹60)을 설치하여 바이오모노즈쿠리 혁명 추진사업의 연구개발・사회적 실현에 대한 방향성과 바이오모노즈쿠리의 전체상을 검토하고, 이를 바탕으로 바이오모노즈쿠리 혁명 추진사업 연구개발 계획을 확정하였다.61)
바이오모노즈쿠리 혁명 추진사업은 ① 미이용 자원의 수집・자원화를 위한 개발・실증 ② 산업용 미생물 등의 개발・육종 및 미생물 등의 변형 플랫폼 기술의 고도화 ③ 미생물 등에 의한 목적 물질의 제조 기술의 개발・실증 ④ 미생물 등에 의해 제조한 물질의 분리・정제・가공기술의 개발・실증 ⑤ 바이오 모노즈쿠리 제품의 사회적 실현을 평가 방법의 개발 등 5가지 과제로 구성되어 있다.

출처: 바이오모노즈쿠리 혁명 추진사업 연구개발 사회적 실현의 방향성, 바이오모노즈쿠리 혁명 추진 워킹그룹, 2023.3.23., 그림 재구성
[그림 1-7] 일본 바이오모노즈쿠리 혁명 추진사업의 목적
(3) 기타 정책
(가) 생물다양성 국가전략 2023-2030
일본 정부는 계속 훼손되고 있는 생태계를 2030년까지 회복시키는 것을 목표로 10년 만에 ‘생물다양성 국가전략’의 개정안을 각의에서 결정하였다.62) 이 전략은 2022년 12월에 생물다양성조약 15회 체결국 회의록(COP 15)에 채택된 ‘쿤밍・몬트리올 생물다양성 프레임’을 근거로 한 일본의 생물다양성 보전과 지속 가능한 이용에 관한 기본계획이다.
기본전략은 ① 생태계의 건전성 회복 ② 자연을 활용한 사회과제의 해결 ③ 네이처 포지티브 경제의 실현 ④ 생활・소비 활동에서 다양성의 가치 인식과 행동 ⑤ 생물다양성에 관련된 조치를 지원하는 기반 정비와 국제 제휴의 추진 등의 5가지 항목으로 구성되어 있다.

출처: 생물다양성 국가전략 2023-2030, 각의결정, 2023.3.31., 그림 재구성
[그림 1-8] 일본 생물다양성 국가전략 2023-2030의 개념
(나) 바이오트랜스포메이션(BX) 전략
일본경제단체연합회는 바이오테크놀로지의 진화가 환경파괴나 자원제약과 같은 사회적 과제의 해결과 지속 가능한 경제성장을 실현하여 사회의 본질이 크게 변할 가능성이 있는 것으로 예측하고, 바이오트랜스포메이션(BX) 전략을 제시하였다.63)
바이오테크놀로지의 적용 분야는 바이오소재나 바이오연료 등 공업・에너지 분야의 ‘화이트 바이오’, 수확이 높은 작물이나 삼림자원의 유효 활용 등의 ‘그린 바이오’, 재생・세포의료나 유전자치료 등과 같은 ‘레드 바이오’, 해양자원 보전과 CO2 흡수 조류 등의 ‘블루 바이오’, 폐기물 재이용과 환경정화 등의 ‘그레이 바이오’로 보고 있으며, 추진전략으로는 ① 바이오 가치를 창조하는 에코시스템의 구축 ② 바이오로 국민의 삶을 지키는 경제 안전보장의 확보 ③ 바이오로 세계에 진출하는 글로벌 룰 형성(rule-making) ④ 바이오를 국가의 중요과제로 삼아 사령탑 기능의 일원화 ⑤ 바이오를 사회 전체가 응원하는 국민 이해의 양성 등의 5가지 항목으로 구성되어 있다.
(4) 과학기술 관련 예산
일본 총무성에서 매년 조사하여 발표하는 과학기술 연구 조사 결과에 의하면, 2021년의 과학기술 연구비(민간 포함)는 전년 대비 2.6% 증가하여 사상 최고를 기록하면서 2020년 이전 수준을 회복한 것으로 나타났다.64) 연구비 주체별로 보면, 기업은 14조 2,214억 엔(2.6% 증가), 대학은 3조 7,839억 엔(2.9% 증가), 비영리단체・공공기관은 1조 7,324억 엔(1.9% 증가)이었다.
2023년도 일본의 과학기술 관련 예산은 4조 3,318억 엔으로 전년 대비 397억 엔(0.9%)으로 증가하였다. 연구개발 주요 부처별로 보면 문부과학성이 2조 579억 엔으로 가장 많고, 이어서 경제산업성 4,479억 엔, 후생노동성 2,345억 엔, 농림수산성 1,925억 엔, 환경성 1,591억 엔 등이다.
[표 1-13] 일본 과학기술 관련 예산(2023)
(단위: 억 엔)
|
항목 |
2023년 |
2022년 |
||||
|
예산액 |
전년도 비교 |
예산액 |
전년도 비교 |
|||
|
증액 |
증가율(%) |
증액 |
증가율(%) |
|||
|
일반회계 (과학기술진흥비) |
35,170 (13,942) |
289 (154) |
0.8% (1.1%) |
34,158 (13,788) |
740 (150) |
2.2% (1.1%) |
|
특별회계 |
8,148 |
108 |
1.3% |
8,040 |
264 |
3.4% |
|
계 |
43,318 |
397 |
0.9% |
42,198 |
1,004 |
2.4% |
주1) 과학기술 관련 예산이란, 과학기술 진흥비외, 국립대학의 운영비 교부금・사학 조성비 중 과학기술을 이용한 새로운 사업화의 대처, 신기술의 실사에서의 실증 시험, 기존 기술의 실사회에서의 보급 촉진의 대처 등에 필요한 경비로 하고 있다.
주2) 과학기술 진흥비란 일반회계 예산 중 주로 세출의 목적이 과학기술의 진흥에 있는 경비로 하고 있다. (예:연구개발법에 필요한 경비, 연구개발에 필요한 보조금・교부금)
출처 1: 2023년도 과학기술 관련 예산, 과학기술・이노베이션 사무국, 2023.02., 표 재구성
출처 2: 2022년도 과학기술 관련 예산, 과학기술・이노베이션 사무국, 2022.02., 표 재구성
다. 기술 및 산업 동향
(1) 연구개발 동향
(가) 전게놈 분석
일본 후생노동성은 2022년 9월에 ‘통합이노베이션전략 2022’와 새로운 자본주의의 그랜드디자인 실행계획 등에 근거하여 ‘전게놈 분석에 관한 실행계획 2022’를 확정하였다.65) 이 계획은 2022년부터 5년간 실행되는데, 암・난치병 신규환자의 게놈을 분석하여 임상 정보와 전체 게놈 해석 결과의 정보 기반을 구축할 예정이다. 10만 게놈 규모를 목표로 한 해석 결과 등을 활용하여 암・난치병에 관련된 신약 연구・개발을 지원하는 것을 목표로 삼고 있고, 현재 5만 명 이상의 환자 전게놈의 해석이 완료되었다.66) 일본 기업들은 개인을 대상으로 하는 전게놈 시퀀싱 유전자 검사키트 ‘GeneLife WGS’를 판매하고 있고, 게놈분석을 고속화하는 액셀러레이터를 개발 중인데 이 제품이 실용화되면 한 사람의 게놈분석에 걸리는 시간을 현재 50분에서 5분으로 줄일 수 있다고 한다.
(나) 바이오・의료 분야
최근, 오사카대학・규슈대학 연구팀이 세계 최초로 2마리의 수컷 마우스로부터 새끼 마우스를 탄생시키는 데 성공했다.67) 다양한 세포로 분화할 수 있는 iPS 세포를 이용하여 수컷의 체세포에서 난자를 만들었다는 것은 원리상으로는 사람의 남성들 사이에 아이가 생길 가능성이 있다는 것을 의미한다. 일반적으로 인간이나 마우스 등의 포유류는 수컷에서 XY, 암컷에서 XX의 2가지 성염색체를 가지는데 수컷 유래 iPS 세포의 XY를 XX로 바꿀 수 있으면, 이 세포가 성장하여 난자가 될 수 있다는 가정하에 ‘X 염색체의 복제’에 도전했다. Y 염색체는 X 염색체보다 짧고, 분열을 거듭하면 자연스럽게 소멸하는 일이 있다. 그래서 연구팀은 수컷 마우스의 꼬리 피부로 만든 iPS 세포를 장시간 배양하고, Y가 없어져 X가 1개만 남은 세포를 선택하였고, 이어서 X 염색체가 1개만 남은 세포가 2개로 분열하는 과정에서 2개로 복제된 X 염색체가 실수로 한쪽 세포에만 들어가 우연히 XX가 생기는 현상을 이용하여 정확히 같은 X 염색체를 2개 가진 수컷 유래의 난자로 키웠다. 즉, 사람의 남성으로부터도 난자를 만드는 길은 열린 것이고 향후, 불임 치료에 응용할 예정이다.
게이오대학 의학부 연구팀은 2022년 3월에 세계 최초로 사람의 iPS 세포로부터 신경의 기초가 되는 세포를 만들어 척수 손상의 환자에게 이식하였다고 발표했다.68) 교토대학이 제공한 타인의 iPS 세포로부터 신경의 기초가 되는 세포를 제작하여 약 200만 개 세포를 환자 척수의 손상 부위에 이식하였다. 이식받은 환자는 경과가 좋다고 하며, 18세 이상의 환자 대상으로 이식 효과가 있는 것으로 밝히고 있다.
동경대학교 정량생명과학연구소는 세계 최초로 게놈 DNA를 감싸고 있는 새로운 기본 단위 H3-H4 옥타솜(octasome)을 발견하였다.69) 진핵생물의 게놈 DNA는 디스크 형태의 뉴클레오솜(nucleosome) 구조에 감겨 세포핵 내에 들어있기 때문에 단백질의 설계도를 만드는 RNA 폴리머라제 II는 이 뉴클레오솜을 풀면서 게놈 정보를 읽어내야 한다. 즉, 뉴클레오솜을 기본 단위로 하는 게놈의 고차 구조(크로마틴)가 전사를 제어하고 있다고 할 수 있다. 지금까지 뉴클레오솜은 H2A, H2B, H3, H4의 4종류의 히스톤 2분자씩으로 이루어진 히스톤 8량체로 구성된 균일한 구조체라고 생각되어 왔지만, 히스톤 H3, H4의 2종류만으로도 뉴클레오솜 유사 구조체(H3-H4 옥타솜)가 형성되는 것을 세계에서 처음으로 규명하였다. 이 연구팀은 H3-H4 옥타솜(octasome)의 특이적인 구조를 출아 효모 내에서 검출하는 데 성공하였고, H3-H4 옥타솜이 생체 내에 존재한다는 것을 처음으로 입증하였다. 연구 성과는 향후 후성 제어의 이상이 원인이 되는 암 발생이나 생활습관병, 정신질환의 이해에서도 활용할 수 있다고 예측하였다.
(다) 환경・농업 분야
산업기술종합연구소(National Institute of Advanced Industrial Science and Technology, AIST)는 PET 관련 물질을 산소가 없는 환경에서 분해하는 미생물을 발견하였다.70) 페트병 등에 사용되는 폴리에틸렌테레프탈레이트(PET)의 단량체인 테레프탈산비스(2-히드록시에틸)나 PET 원료인 난분해성 물질 테레프탈산디메틸(DMT)이 혐기성 환경에서 분해되는 것을 발견하고, 이 미생물의 배양 특성과 게놈 정보에 기반하여 분해 메커니즘을 제시하였다. 이 연구 결과는 혐기성 생물에 의한 폐플라스틱류 제거 기술의 개발이나 플라스틱류로 오염된 자연환경의 정화에 이용될 수 있을 것으로 기대하고 후속 연구를 진행하고 있다.
이화학연구소(Institute of Physical and Chemical Research, RIKEN) 연구팀은 ‘세포 투과성 펩타이드(CPP)’를 기반으로 한 나노 크기의 담체를 이용하여 스프레이로 분무함으로써 핵산을 식물에 도입하는 데 성공했다.71) 이 방법을 사용하여 식물 세포 내 또는 엽록체 내에서, 도입한 외래 DNA로부터 일시적으로 단백질을 생산시키고, siRNA의 도입으로 식물 세포 내에서 목적 단백질의 발현을 억제하는 데에도 성공하였다. 연구 성과는 비유전자재조합으로 농작물의 일시적인 형질변환, 내병원성의 부여나 대사산물의 변형에 기여할 수 있을 것으로 기대되고 있다.
(2) 산업 동향
(가) 스타트업 육성
기시다 수상이 표방한 새로운 자본주의 실현을 위해 취임 초기에 내각부에 설치한 새로운 자본주의 실현 회의에서 일본의 스타트업 5개년 계획을 확정하였다.72) 2022년을 스타트업 창출 원년으로 삼아 스타트업 에코시스템 창출을 위해 스타트업에 대한 투자액을 2027년까지 10조 엔 규모로 확대하고, 스타트업을 10만 개(유니콘기업 100개) 창출하여 아시아 최대의 스타트업 허브를 구축할 계획이다.
이를 실현하기 위해 대기업이 스타트업에 투자했을 경우 세제의 확대, 스타트업에 투자한 투자자가 다른 스타트업에 재투자할 경우 비과세 조치 등을 실시하고 ① 스타트업 창출을 위한 인재・네트워크 구축(해외 창업가 육성거점 창설, 글로벌 스타트업 캠퍼스 구상 등) ② 스타트업을 위한 자금공급 강화 및 출구전략 다양화(신에너지・산업기술종합개발기구(NEDO)의 연구개발형 스타트업 지원방안 강화・보조 상한선 확대, 일본 의료연구개발기구의 신약 개발 벤처 지원 강화・향후 지원 대상을 감염병 관련 이외에 자금 조달이 어려운 신약 개발 분야로 확대하기로 하고 이를 위해 10년간 3,000억 엔의 기금 적립 등) ③ 오픈이노베이션 추진(오픈이노베이션을 촉진하기 위한 세제 조치 등) 등의 3가지 핵심 추진사항을 제시하고 있다.
(나) 뎅기열 백신
다케다약품공업은 지난해 8월에 유럽, 브라질에 이어 인도네시아에서도 뎅기열 백신 ‘큐뎅가’(Qdenga)를 승인받아 판매를 시작한다고 발표하였다.73) 다케다약품공업이 해외에 백신을 판매하는 첫 번째 사례이다. 최근, 미국의 존슨앤존슨 社 현재 개발 중인 뎅기열 백신 후보물질이 전임상에서 뎅기열에 대한 강력한 보호 효능을 보였다며 국제학술지에 발표하면서74) 뎅기열 백신 개발에서 치열한 경쟁을 벌이고 있다.
뎅기 바이러스에는 4가지 혈청형이 있는데, ‘큐뎅가’는 이 모두를 커버하는 4가 약독생백신으로 접종 대상은 6∼45세이고, 과거의 감염 이력에 상관없이 접종할 수 있어 접종 전의 혈청검사도 필요 없다. 최초의 뎅기열 백신인 사노피의 4가 약독생백신 ‘뎅바시아’(Dengvaxia)가 2015년에 멕시코에서 승인되어 중남미나 인도네시아에서도 사용이 인정되고 있으나, 6년간의 장기 임상 시험에서 감염력이 없는 사람이 백신 접종 후에 감염되면 중증화율이 높아질 가능성이 있는 것으로 확인되어 현재 사용이 제한되고 있다.
코로나19 발병 이후, 일본산 백신의 개발이 늦어지면서 미국산 백신에 의존했던 문제점을 개선하기 위해 일본 후생노동성은 2022년에 백신 개발의 사령탑 역할을 하는 ‘선진적 연구개발 전략센터(Strategic Center of Biomedical Advanced Vaccine Research and Development for Preparedness and Response, SCARDA)’를 발족시켰다.75) AMED 산하에 설치된 SCARDA는 백신 개발에 관한 광범위한 정보를 수집・분석하여 전략적 연구비의 투자로 연결하고 백신・신규 모달리티 연구개발 사업 및 백신 개발을 위한 세계 최고 수준의 연구거점 구축을 목표로 삼고 있다.
(다) 알츠하이머 치료제
올해 1월, 미국 FDA가 일본 에자이사와 미국 바이오젠사가 공동으로 개발한 알츠하이머병의 신약 레카네맙(lecanemab)을 신속 승인하였다.76) FDA는 약 850명을 대상으로 한 중간단계의 임상시험에서 이 약을 투여받은 환자의 뇌에서 비정상적인 단백질인 아밀로이드 베타를 감소시키는 효과가 나타났다고 평가하고 있다. 아밀로이드 베타에 작용하는 알츠하이머병의 치료제가 미국에서 승인되는 것은 이번이 두 번째이다. 한국 에자이사는 미국에서 신속 승인을 받은 알츠하이머병 치료제 레카네맙(상품명 레켐비)을 올해 중반에 국내 식품의약품안전처에 품목허가를 신청할 계획이고, 2024년 말 허가를 받는 것을 목표로 하고 있다고 발표했다.77) 하지만 최근에 알츠하이머 치료제 레카네맙이 오히려 뇌 수축을 유발할 수 있다는 학계 보고가 나와 관심을 끌고 있다.78) 에자이사 측은 주요 실험에서 레켐비를 복용한 환자들은 위약을 복용한 환자들보다 더 많은 부피의 뇌피질이 손실되었지만, 이는 뇌에서 아밀로이드 베타 단백질이 제거되고 염증이 발생하는 과정에서 발생할 수 있는 일이라는 의견을 제시하고 있다.
(라) 배양육
도쿄대학과 닛신식품은 2022년 3월에 일본 최초로 ‘먹을 수 있는 배양육’ 개발에 성공하였다.79) 배양육은 가축고기의 세포를 체외에서 조직 배양하여 만든 고기로, 가축을 사육하는 것에 비해 지구 환경에 주는 부하가 낮고, 축산과 같이 넓은 토지를 필요로 하지 않고 심지어 엄격한 위생관리가 가능하다는 등의 여러 가지 이점을 가지고 있어 육류의 새로운 선택지 중의 하나로 알려져 있다. 공동 연구팀은 독자적으로 개발한 식용 혈청과 식용 혈장 겔을 사용함으로써 식용 가능한 소재만으로 배양육을 제작할 수 있었고, 제작한 배양육을 연구 관계자들이 시식하는 절차도 포함되어 종래의 기기를 사용한 분석에 더하여, 사람에 의한 관능검사가 가능하게 됨으로써 맛, 향기, 식감 등에 관한 연구개발이 크게 진전된 것이다.
또한, 최근에 오사카대학・시마즈제작소・이토햄사・토판인쇄・시그막시스 등이 ‘배양육 미래 창조 컨소시엄’을 설립하였다.80) ‘3D 바이오 프린트에 의한 식용 배양육 제조 기술에 관한 사회적 실현의 구체적인 대처’를 목적으로 하고 있으며, 조직을 초월한 협업으로 3D 바이오 프린트 기술의 응용 개발, 생산・유통까지의 일관된 밸류체인의 확립, 부처나 민간 기업과의 제휴에 의한 법 규제 정비를 추진하며, 2025년 일본국제박람회(오사카・간사이)에 출품하여 일반 소비자들의 이해를 촉진함으로써 세계에 한발 앞선 배양육 식용화의 실현을 목표로 제시하고 있다.
라. 법제도 동향
(1) 규제개혁
일본 내각부는 성장과 분배의 선순환과 코로나 이후의 새로운 사회의 개척을 기본방향으로 새로운 자본주의 실현을 위해 규제・제도를 재검토하여 규제개혁 실시계획을 발표하였다.81) 규제개혁의 6대 중점분야로 ① 스타트업 혁신(스타트업 혁신을 위한 규제・제도 재검토 등) ② 디지털 기반(행정서비스 디지털 원칙적 전자화 등) ③ 인재에 대한 투자(디지털을 전제로 한 혁신을 키우는 학습 실현 등) ④ 의료・돌봄・감염증 대책(의료 DX 기반 정비 등을 통해 자택에서 진찰・건강관리, 의료인・간병인 등 전문인력 최대 활용, 첨단 의약품・의료기기 개발 촉진) ⑤ 지역산업 활성화(임업의 성장 산업화를 위한 개혁 등) ⑥ 환경(리튬이온전지 및 급속 충전기의 보급 확대를 위한 소방법 재검토 등)으로 설정하였다.
(2) 차세대의료기반법
일본의 차세대의료기반법(정식명칭:의료분야의 연구개발에 이바지하기 위한 익명의 가공 의료정보에 관한 법률)은 의료분야의 연구개발을 위한 익명의 가공 의료정보에 관하여, 익명의 가공 의료정보 작성자의 인정, 취급에 관한 규제 등을 정해 신약 개발, 미지의 부작용 발견, 효과적인 정책의 입안 등에 활용하여 신산업 창출을 촉진함으로써 건강 장수사회의 형성에 기여하는 것을 목적으로 2017년에 제정되었다.82)
건강・의료 데이터 활용 기반협의회 산하의 차세대의료기반법 검토 워킹그룹83)은 개선되어야 할 과제로서 익명의 의료정보 이용에 관한 시스템의 창설(의료정보의 연구 요구나 사회적 편익 관점에서 새로운 익명의 가공 의료정보의 작성・제공이 가능하게 하고, 개인정보 보호의 관점에서 익명의 가공 의료정보의 제공은 국가가 인정한 사업자로 한정한다), NDB(National Database) 등의 공적 데이터베이스와의 연결(차세대의료기반법에 근거한 익명의 가공 의료정보와 NDB나 간병 DB 등의 공적 데이터베이스와 연결 분석이 가능하게 한다), 의료정보의 이용 추진에 관한 시책에서의 협력(의료정보 사업자에 관해 인정 사업자에게 의료정보 제공하고, 사업자는 국가 시책의 협력에 노력할 것을 규정) 등의 3가지 재검토 항목을 제시하였다.84)
(3) 마이넘버법
일본 정부는 2023년 3월에 마이넘버법(행정 절차에서 특정 개인을 식별하기 위한 번호의 이용 등에 관한 법률)의 개정 법안과 그 관련 법안을 각의에서 결정하였다.85) 마이넘버 제도는 행정 업무를 원활하게 하는 것이 목적이지만, 코로나19 대책에서는 잘 활용되지 않았다. 지금까지 미진했던 마이넘버와 마이넘버 카드의 이용을 촉진하기 위해 마련된 것으로서 6가지의 주요 정책으로 구성되어 있다.
마이넘버의 이용 범위를 사회 보장이나 세금, 재해 대책으로 확대하고, 국가자격의 취득・갱신의 수속 등에서도 사용할 수 있도록 한다. 카드를 취득하지 않은 사람도 보험 진료를 받을 수 있는 ‘자격 확인서’ 발행도 포함되어 있으며, 현행 건강보험증을 2024년 가을에 폐지하고 ‘마이넘버카드’로 일원화한다. 이 밖에도 재외공관에서 마이넘버 카드의 교부나 갱신을 가능하게 하는 규정 등도 포함되었다.
(4) 의약품 긴급승인제도 창설
일본 정부는 작년 3월에 전염병 유행 시 백신과 치료약을 긴급 승인하는 제도가 신설된 의약품 의료기기법(약기법) 개정안을 각의 결정했다.86) 약이나 백신의 ‘긴급 승인’ 제도를 포함한 의약품 의료기기법(약기법)이 참의원 본회의에서 가결되고 2022년 5월 20일부터 시행되었다.
일본 후생노동성은 개정된 법안에 근거하여 2022년 11월, 시오노기제약의 코로나19 경구용 치료제인 조코바정을 최초로 긴급 승인하였다. 조코바정의 일반 유통이 올해 3월 말에 시작되었는데, 지금까지 일본 정부가 200만 명분을 매입하여 지정된 의료기관에 배분하고 있고, 1회 치료분(5일)의 가격은 약 5만 1,850엔이다.87)
(5) 게놈 편집 식품
일본 소비자청은 소비자가 자주적이고 합리적으로 식품을 선택할 수 있도록 관련 법을 개정하여, 2023년 4월부터 대두나 옥수수 등의 유전자 변형 식품에 대한 유전자 변형 표시제도가 변경된다고 발표하였다.88) 유전자 변형 표시제도는 ‘의무표시’와 ‘임의표시’의 2가지로 나누어져 있는데, 의무표시는 변함이 없고 임의표시에 관한 규정이 더 엄격하게 변경되었다.
최근 미국 듀폰사로부터 분사한 종자회사 코르테바 아그리사이언스(Corteva Agrisicience)사가 ‘왁시 콘’라고 불리는 게놈 편집 옥수수의 유통・판매를 신고하였는데89), 이는 게놈 편집 식품으로는 네 번째이고 해외 기업으로는 처음이다. 이 옥수수는 단맛은 약하지만 가열하면 쫄깃한 식감이 나오는 것이 특징으로 일반 옥수수를 게놈 편집하여 전분의 형성에 관련된 유전자를 절단함으로써 성분 구성을 변화시킨 것이다.
[표 1-14] 일본 후생성이 접수한 게놈 편집 식품
|
|
특징 |
접수일 |
|
토마토 |
혈압상승을 억제하는 성분의 양이 증가 |
2020년 12월 11일 |
|
참 돔 |
종래의 사료량으로 생선살을 두껍게 만듬 |
2021년 9월 17일 |
|
복 어 |
식욕이 왕성하게 되게 성장이 빨라짐 |
2021년 10월 29일 |
|
옥수수 |
쫄깃쫄깃한 식감을 높임 |
2023년 3월 20일 |
출처: 게놈 편집 식품, 요미우리신문, 2023.3.23., 표 재구성
|
|
|
제1장 생명공학의 변화와 도전 |
|
제2절 생명공학의 도전과 노력 |
1. 우리나라 바이오 육성을 위한 노력
가. 트렌드 변화 및 국내 주요 이슈
우리는 코로나19 팬데믹을 겪으며 디지털 트랜스포메이션의 영향으로 시간과 장소에 구애받지 않게 되면서 비대면, 원격문화의 확산 등 디지털 전환이 본격화되었다. 또한 감염병, 디지털헬스 등 바이오 기술에 대한 사람들의 인식을 제고시키면서 트렌드뿐만 아니라 패러다임의 변화를 일상 속에서 체감하고 있다.
이러한 많은 변화 속에 기술패권 경쟁 및 공급망 위기, 기후변화, 디지털 전환, 저출생・고령화, 재난・재해 복합화 등 국가적 도전과제가 산적한 가운데, 주요국은 기술 지도력을 유지・확보하고 국가적 현안에 대응하기 위해 과학기술 전략을 구체화하고 추진체계를 정비하고 있다. 미국은 자국 내 바이오 연구 및 생산능력을 강화하기 위한 행정명령을 발동(2022.9.)하고, 중국은 합성생물학, 유전자편집 등 핵심기술 수출 제한조치를 시행(2023.2.)하는 등 바이오기술을 안보로 인식한 주요국들은 첨단바이오에 대한 기술 주권을 확립하기 위한 패권경쟁을 심화하고 있다.
또한 현재 세계는 바이오와 디지털 융합 가속화 등 바이오 대전환기가 도래하였다고 평가하고 있다. AI를 활용한 신약 후보물질 발굴 시간이 300배 이상 단축, AI를 활용한 단백질 접힘문제 해결, 기존 메모리 대비 저장용량 1억 배 증가한 DNA 메모리 개발 등 바이오가 디지털과 융합되면서 기존의 한계를 극복하고 전자, 소재 공학 등 전 분야에 파급되는 바이오 대전환이 진행 중이다.
미국의 경우 10년 내 기존 제조산업의 30% 이상이 바이오 기반으로 대체될 것으로 전망90)하는 등 바이오가 전 분야에 파급되면서 감염병, 기후변화, 식량문제 등 글로벌 난제를 풀고 세계 경제를 견인하는 핵심기술로서 중요성이 증대되고 있다.
나. 정책적 변화 및 추진방향
우리나라는 그간 과학기술 발전을 통해 세계 10위의 경제대국으로 성장하였다. 국가연구개발 투자, 인구 대비 연구원 수 등 양적 지표는 세계적 수준이며, 논문・삼극특허 등 과학기술 성과도 우수한 편이다. 그러나 인구감소로 인한 연구인력・역량의 감소, 민간 연구개발 투자 둔화, 연구개발 인력・성과와 기업 수요 간 부조화 등에 대한 우려가 상존하며 저성장 극복을 위한 동력 확보 역시 필요한 시점이다.
이에 정부는 제5차 과학기술기본계획91)을 발표하였으며, 2022년 5월 새로 출범한 윤석열정부의 과학기술 관련 국정과제 29개를 반영하여 향후 5년간 40여 개 부・처・청・위원회와 함께 이행할 예정이다. 이번 제5차 기본계획은 ‘과학기술혁신이 선도하는 담대한 미래’를 비전으로 △국가 연구개발 전략성 강화, △민간 중심 과학기술 혁신생태계 조성, △과학기술 기반 국가적 현안 해결을 주요 방향으로 하고 있다.

출처: 과학기술정보통신부, 윤석열 정부 과학기술 정책 청사진, “과학기술혁신이 선도하는 담대한 미래”, 제5차 과학기술기본계획(2023~2027) 발표, 2022.12.14.
[그림 1-9] 제5차 과학기술기본계회의 주요 방향
2022년 10월 대통령 주재 국가과학기술자문회의에서 ‘국가전략기술 육성방안’을 발표하고, 12대 전략기술 중 하나로 ‘첨단바이오’92)를, 첨단바이오의 중점기술로 ‘합성생물학’을 선정하였다. 과기정통부는 2022년 11월 합성생물학 육성으로 바이오제조 혁신역량 강화를 위한 ‘국가 합성생물학 이니셔티브’를 발표하였다.
또한 2022년 12월 윤석열정부의 국정과제 중 하나였던 ‘디지털바이오 육성’을 위해 ‘디지털바이오 혁신 전략’을 수립하였다. 바이오 연구는 데이터를 핵심 연구자원(Key Currency)으로 하는 AI와 로봇 등 첨단 디지털 기술의 내재화를 특징으로 하는 ‘바이오 대전환’이 진행되면서 데이터와 소프트웨어로 연구하는 ‘디지털바이오 시대’로 진입하고 있다. 이 ‘디지털바이오 혁신전략’은 디지털과의 융합이 기존의 한계를 벗어나 전 산업 분야에 전방위적으로 파급되어 혁신을 촉진하고 있으며, 이런 대전환에 대응하여 기존 바이오 R&D 한계(고비용・고위험・장기간)를 극복하고 선택과 집중으로 바이오 선도국 진입을 촉진할 혁신 전략이다. 세부 추진전략으로 ① IT, Manufacturing, Health 등의 핵심기술과 결합하는 디지털바이오 신기술・신산업 창출, ② 연구혁신과 생산성 제고를 위한 디지털바이오 기반기술 확보 ③ 고품질 데이터의 생산부터 공유・활용까지 선순환되는 데이터 기반 바이오 연구 확산 ④ 폭발적인 R&D 및 산업 성장에 발맞춰 ‘연구-개발-사업화’ 간 연결을 촉진하는 디지털바이오 생태계 조성 등이 있다.93)
이런 전략을 토대로 과기정통부는 기술 안보 및 글로벌 기술 패권 경쟁에서 우위를 점하고자 하며, 넥스트 반도체로 주목받고 있는 바이오 분야의 기술경쟁력 확보를 위해 지속적인 노력을 기울일 전망이다.

출처: 과학기술정보통신부, 바이오 대전환 시대 디지털바이오 혁신전략, 2022.12.
[그림 1-10] 디지털바이오 혁신전략 비전과 추진전략
또한 과기정통부는 2023년 6월 생명공학육성법에 따라 과기정통부 주관 등 15개 부처・청94)이 공동으로 수립하는 생명공학 분야 최상위 법정계획인 ‘제4차 생명공학육성기본계획(2023∼2032)’을 수립하였다.
우리나라 바이오 분야의 경우 민관 투자 확대95) 등 양적인 성장은 달성하였으나, 기술 선도국과의 여전한 기술격차 등 바이오 선도국 도약은 지체96)되는 상황이며, 2021년 국내 바이오산업 규모는 48조 원으로 글로벌 시장(2,480조 원) 대비 1.9% 정도로 영세하고 의약품・의료기기 분야에 집중97)되는 한계를 가지고 있다.
이에 제4차 생명공학육성기본계획은 ‘융합’과 ‘연결’의 바이오 대전환을 통해 기존 한계를 극복하고 바이오가 전 분야에 파급되는 새로운 기회를 창출하고자 하며, 바이오경제 선도국으로 도약하기 위해 바이오 전 분야, 기술개발 전 단계에 걸친 종합적인 지원정책98)을 마련하였다.

출처: 과학기술정보통신부
[그림 1-11] 제4차 생명공학육성기본계획(2023∼2032)의 비전・목표 및 추진과제
다. 거버넌스의 변화
정부는 지난 2016년 범부처 바이오 정책 컨트롤타워 역할을 수행하기 위해 국가과학기술자문회의 심의회의 산하에 바이오특별위원회를 설치하여 운영하고 있으며, 2023년 3월 제4기 바이오특별위원회가 출범하였다.
새로 출범한 4기에서는 민간의 참여와 전문성 활용이 중요한 바이오 분야의 특성을 고려하여 정부・민간 공동위원장 체제를 도입하였으며, 관계 부처 등의 추천을 통해 학계・연구계・산업계・정책 분야 현장 전문가 14명을 위촉하였다. 이번 4기부터는 ‘12대 국가전략기술(2022.12. 자문회의 전원회의)99)’의 하나인 ‘첨단바이오’ 관련 분야에 대한 범부처 정책 조정 기능을 강화하며, 이 분야의 실무조정위원회 역할을 겸하여 첨단바이오 분야의 전략기술 로드맵 등을 검토할 예정이다.

주) 감염병특별위원회의 경우 팬데믹 상황에 따라 한시적으로 운영하였으며, 임기 종료(2021.6.11.∼2023.6.10.)됨
출처: 과학기술정보통신부
[그림 1-12] 국가과학기술자문회의 심의회의 체계도
라. 규제 개선
과기정통부는 바이오 연구활동을 저해하는 규제를 개선하기 위해 민간 전문가 중심의 ‘바이오 규제 선진화 TF(1기, 2017.10.)’를 시작으로 3기 바이오규제 TF(2020.7.∼2021.6.) 운영을 통해 연구・산업 현장 중심의 규제를 발굴하고 전문가 검토를 통한 개선 방안을 마련하여 관계부처에 제안해 왔었으며, 2022년에는 ‘범부처 경제 규제혁신 TF’ 내의 ‘보건의료 규제반’에 4건의 규제 개선안을 제안하였다.
또한, 바이오 규제에 대한 혁신과 미래를 상시적으로 논의하고, 합의에 기초한 정책의제 발굴 및 전략안 도출을 위해 산・학・연 연구자 및 법률 전문가 등 다양한 분야의 전문가들이 참여하는 ‘바이오규제 정책플랫폼’을 구성・운영하였으며, 이를 통해 바이오 규제에 대한 국내외 동향 및 트렌드, 현장 이슈 등에 대해 토론・토의하고, 핵심이슈를 발굴・정제하는 등 바이오 규제 혁신을 모색하기 위해 노력 중이다.
|
참고자료 |
∙ 과학기술정보통신부 보도자료, 새정부 과학기술 정책방향 간담회 개최, 2022.6.13.
∙ 과학기술정보통신부 보도자료, 제5차 과학기술기본계획(2023∼2027) 발표, 2022.12.14.
∙ 과학기술정보통신부, 제4차 생명공학육성기본계획(2023∼2032), 2023.6.
∙ 과학기술정보통신부, 바이오 대전환 시대의 디지털바이오 혁신전략, 2022.12
∙ 과학기술정보통신부 보도자료, 국가과학기술자문회의 제4기 바이오특위 출범, 2023.3.
2. 우리나라 바이오산업의 성장과 향후 과제
가. 우리나라 바이오산업의 성과: 글로벌 플레이어로 성장하고 있는 한국 바이오
시장 가치가 산업의 잠재력을 설명한다고 보기는 어렵겠으나, 시장 가치의 변화는 주요 사건의 발생을 대변하고, 그 영향력은 산업 전반에 미친다. 시장 가치 측면에서 우리나라 바이오산업은 세 번의 격변기를 맞았다고 평가된다. 첫 번째는 한미약품의 기술이전, 셀트리온의 미국 진출 등이 있었던 2014∼2015년, 두 번째는 삼성바이오로직스, 셀트리온 등의 매출 증가와 더불어 신라젠 및 코오롱 생명과학 등 국내 바이오텍들이 미국에서 임상을 추진하며 국내 기술력 상승에 대한 기대감이 커지던 2017년이다.
COVID-19가 본격적으로 발생한 2020년으로부터 지금까지 또한 바이오헬스케어 산업의 세 번째 격변기였다. COVID-19 팬데믹 사태 발생으로 많은 산업이 변화하였으며, 특히 바이오헬스케어 산업의 성장은 비약적이었다. COVID-19 진단키트와 백신 개발 등 첨단 기술에 대한 수요가 증가하며 정책 자금 및 민간 자금이 유입되었고, 기업 가치 증가, 인력 유입, 규제 개선 등 산업 성장에 긍정적인 영향을 미칠 수 있는 다양한 변화가 이루어졌다.
이와 같은 변화는 전 세계적으로 나타났으며, 한국에서도 바이오기업의 가치 증가와 더불어 자금 유입이 증가하며 많은 바이오기업이 성장하였다. 2021년 당시 국내 상장 바이오기업 가치를 대변하는 KRX 헬스케어 지수는 크게 증가하였다. 2021년에만 21곳의 제약바이오기업이 상장하였으며, 이 중 15곳이 기술특례 상장을 통해 상장했다. 2022년 시장이 반전되며 현재로서는 다른 국면이 형성되었으나, 그동안 국내 바이오 산업계는 많은 성과를 이루며 글로벌 수준의 플레이어로 부상하고 있다.
(1) 제약 분야 기술거래 활성화와 글로벌 신약 개발
한국 바이오기술에 대한 세계적 위상이 높아지고 있다. 2015년 이래 2021년까지 제약바이오 기술수출은 지속적으로 증가했다. 2020년 10조 원, 2021년 13조 원 수준으로 나타났다. 다만 2022년에는 총 16건의 기술수출이 이루어졌으며, 비공개인 곳을 제외하면 계약 규모는 총 6조 2,559억 원 수준으로 집계되었다. 2021년 34건, 13조 원 규모 대비 상당히 감소한 것으로 파악된다. 다만 전 세계적인 기술이전 계약 축소를 고려할 때 국내 바이오텍의 기술이전 규모 축소는 거시경제적 측면이 반영된 것으로 보인다. 여전히 ADC 등의 플랫폼 기술이 1조가 넘는 계약 규모에 기술이전이 되고있는 것은 긍정적으로 평가할 수 있다.
지속적인 기술이전과 더불어 주목할 만한 것은 국산 신약의 수가 이전보다 빠르게 증가하고 있을 뿐만 아니라, 그중에서도 큰 성과를 거둘 것으로 예측되는 약물이 등장하고 있다는 점이다. 식품의약품안전처에 따르면 2022년 12월 기준, 1999년 에스케이케미칼의 선플라주를 시작으로 지난 23년간 36개의 국산 신약이 허가받았다. 그중 1/6에 해당하는 6개가 지난 2021년부터 2년 사이에 신규 승인을 받은 약물이다.
과거 국산 신약은 승인에도 불구하고 성과에서 좋은 평가를 받기 어려웠던 반면, 최근에는 글로벌 블록버스터(매출 10억 달러 이상인 의약품)로 성장할 가능성으로 평가되는 약물 또한 등장하고 있다. 2019년 미국 FDA 승인을 획득한 SK바이오팜의 세노바메이트(시판명 엑스코프리)에 이어, 국내 승인을 취득하고 미국 FDA, 유럽 EMA 승인을 추진하고 있는 레이저티닙(시판명 렉라자, 유한양행), 테고프라잔(시판명 케이캡, HK이노엔) 등이 글로벌 분야에서 유의미한 매출을 달성할 것으로 평가된다.
[표 1-15] 제약바이오산업 2022년 기술수출 실적(2022.12.15기준)
|
개발사 |
계약상대(국가) |
제품명 |
적응증 |
계약규모(억원) |
|
지씨셀 |
리바라(인도) |
이뮨셀엘씨 |
면역항암제 |
비공개 |
|
에이비엘바이오 |
사노피(프랑스) |
ABL301 |
퇴행성뇌질환 |
12,720 |
|
종근당바이오 |
큐티아테라퓨틱스(중국) |
타임버스 |
보툴리눔 톡신 |
83 |
|
이수앱지스 |
NPO페트로박스팜(러시아) |
파바갈 |
파브리병 |
비공개 |
|
노벨티노블리티 |
발렌자바이오(미국) |
NN2802 |
자가면역질환 |
8,778 |
|
제넥신 |
KG바이오(인도네시아) |
GX-E4 |
지속성빈혈 |
159 |
|
코오롱 생명과학 |
주니퍼테라퓨틱스(싱가포르) |
TG-C |
골관절염 |
7,234 |
|
SK바이오팜 |
유로파마(브라질) |
세노바메이트 |
뇌전증 |
810 |
|
티움바이오 |
한소제약(중국) |
TU2670 |
자궁내막증 |
2,208 |
|
보로노이 |
메티스테라퓨틱스(미국) |
고형암 후보물질 |
고형암 |
6,680 |
|
동아에스티 |
뉴로보 파마슈티컬 (미국) |
DA1241, DA1726 |
당뇨 및 NASH |
4,715 |
|
올리패스 |
반다제약(미국) |
Olipass PNA 플랫폼 |
희귀질환/ 면역항암제 |
43 |
|
동아에스티 |
폴리파마(튀르키예) |
DA-3880 |
빈혈치료제 |
비공개 |
|
LG화학 |
이노벤트바이오로직스(중국) |
티굴릭소스타트 |
통풍치료제 |
1,240 |
|
레고켐바이오 |
암젠(미국) |
ADC 원천기술 |
5개 타겟 |
16,050 |
|
알테오젠 |
산도스(스위스) |
Hybrozyme |
- |
1,839 |
출처: 히트뉴스, 제약바이오, 올해 16건 기술수출 성사, 계약 규모 6조 원, 2022.12.30., http//www.hitnews.co.kr/news/articleView.html\?idxno=43064
(2) 바이오 의료 제품 수출 증가
COVID-19 팬데믹으로 인한 의료제품에 대한 수요 증가는 국내 제약바이오기업에게 큰 성장의 기회가 되었다. 진단기기에 대한 수요가 폭증하면서 한국 진단기기회사들은 해외에서 큰 매출을 올렸다. 에스디 바이오센서(SD Biosensor)는 글로벌기업 로슈(Roche)에 제품을 공급하며 2조 원이 넘는 매출을 올렸다.
진단기기뿐만 아니라 치과, 피부미용 등 다양한 분야에서 국내 제품의 실적이 증가하고 있다. 진단기기는 팬데믹 상황 변화에 따라 변동하나, 마스크 착용 조치 해제와 함께 치과와 미용기기는 더욱 성장할 전망으로 보인다. 치과재료 수출은 2020년 4억 3,300만 달러에서 2022년 7억 8,200만 달러까지 2배 가깝게 성장하였다. 또한 2022년 피부 미용기기 수출도 역대 최대를 달성했는데, 2020년 1억 6,800만 달러, 2021년 2억 6,100만 달러, 2022년 3억 5,300만 달러로 각각 전년 대비 54.9%, 35.2% 증가했다. 특히 레이저/고주파 치료기기 등 병원용 기기의 실적도 2022년 2억 6,400만 달러로 전년 대비 49.6% 증가했다.
바이오의약품 생산 수요 또한 연구개발 추세와 더불어 팬데믹의 영향으로 크게 증가해, 삼성바이오로직스, 셀트리온 등 바이오시밀러 생산 및 바이오의약품 CMO 업체가 크게 성장했다. 2022년 삼성바이오로직스는 3조, 셀트리온은 2조 2,840억 원에 달하는 매출을 달성하였다. 이로써 의료기기기업을 제외한 국내 제약바이오기업 중 처음으로 매출이 3조, 2조가 넘는 기업이 탄생했다. 두 기업의 바이오시밀러 포트폴리오가 계속해서 확장되고 있으며 유럽 및 미국에서 실적을 확보하고 있다. 또한 CMO 사업에서도 글로벌 빅파마와 지속적으로 위탁 수주를 확장하고 있어 향후에도 탄탄한 성장세가 기대된다.
(3) 글로벌 인수합병을 통한 성장동력 확보 증가
제약바이오 분야는 기술 및 연구개발 능력의 확보와 포트폴리오 확장을 위한 인수합병이 활발한 분야다. 금융적 투자와 달리 회사의 인력과 자산을 모두 확보하는 인수합병은 가장 적극적인 형태의 투자 방식이라고 할 수 있다. 제약 및 의료기기 회사들은 인수합병으로 동력을 확보해 큰 성장을 이루었다. 과거 그 주체는 미국, 유럽, 일본의 대규모 기업이 주가 되었으나 최근 한국에서도 바이오제약기업이 글로벌 인수합병 시장에 뛰어들었다.
에스디 바이오센서는 2조 원 규모로 2022년 미국의 체외진단 기업 메리디안 바이오사이언스(Meridian Bioscience)를 인수한다고 발표했다. 국내 제약바이오 업계의 2조 원대 첫 인수합병이다. 또한 국내 대기업에 의해 처음으로 FDA 승인받은 약물을 통해 미국 내 매출이 발생하는 업체를 인수한 사례도 있었다. LG화학은 2022년 12월, 8,000억 원을 투입해 미국 보스턴의 항암제 개발 기업 아베오 파마슈티컬스(AVEO Pharmaceuticals)에 대한 인수합병을 진행했다. 아베오는 나스닥 상장 업체로 미국 FDA로부터 승인받은 신장암 치료제 ‘포티브다(Fotivda)’ 등 항암 파이프라인을 확보하고 있는 기업이다. 롯데지주는 BMS의 미국 공장을 인수하였고, 의약품 CDMO 롯데바이오로직스를 설립했다. SK팜테코도 프랑스의 세포유전자치료제 CDMO기업 이포스케시(Yposkesi)를 인수했으며, 미국 세포유전자치료제 CDMO기업에 3억 5,000만 달러를 투자해 2대 주주가 되기도 했다.
이러한 경향성은 국내 기업들이 글로벌 인수합병이 가능한 수준으로 자금력이 확보되었음과 국내 대기업들 또한 바이오 분야에 대해 적극적인 투자를 추진하고 있음을 보여줌과 더불어, 해외 인허가, 판매 경험 등을 기반으로 해외 진출 가속화에 대한 기대감도 창출하고 있다.
나. 글로벌 바이오산업의 변화
(1) 바이오 분야 투자 감소
COVID-19가 여전히 기승을 부리고 있지만, 진단기기와 치료제의 발달로 사람들 사이에서는 어느 정도 대응이 가능한 질병으로 받아들여지고 있다. 산업과 경제는 포스트 팬데믹(Post pandemic) 국면으로 접어들었다고 보아도 무방할 것으로 보인다. 팬데믹 시기 급격한 감염 증가로 인해 발생할 수 있는 부작용을 최소화하기 위해 많은 국가지원사업으로 큰 자금이 시장에 수혈되었으나, 이제는 활성화된 경제의 연착륙을 위한 정책이 각국 정부로부터 나왔다.
이에 따라 시장 전반에서 현금 유동성이 감소하였으며, 벤처투자 또한 감소하였다. 블룸버그에 따르면 2021년 대비 2022년 벤처투자 감소율은 과거 닷컴 버블 직후의 투자 감소율 34%보다 큰 42%로 나타났다. 국내에서도 2012년 처음으로 2022년에 벤처투자 감소가 나타났다. 그간 벤처투자는 꾸준히 증가하여 2021년 무려 2012년 대비 6배나 증가한 7조 7,000억 원이 투자되었으나, 2022년에는 11.9% 감소한 6조 8,000억 원으로 나타났다. 특히 바이오의료 분야의 투자는 미국에서는 22.8%, 유럽에서도 53.5%, 아시아태평양에서도 12.3% 감소되었다. 국내 역시 2022년 1조 1,000억 원으로 전년 대비 34.1%나 감소하였다. 이는 상장 바이오기업의 주가 하락 및 기술특례상장 심사 강화 경향으로 인한 것으로 평가된다.
(2) 글로벌 제약/의료기기 회사의 신규 성장동력 확보 필요성 증가
글로벌 대규모 제약 및 의료기기 회사는 전 세계적인 판로를 확보하고 있을 뿐만 아니라 안정적인 매출을 발생시키고 있어 산업에 있어 늘 주요한 전략적 투자자로 활동해 왔으며, 이들은 내부 연구개발 조직과 더불어 인수합병과 라이선스, 공동개발을 통해 성장동력을 확보해 왔다. 특히 COVID-19 팬데믹 시기에 백신, 진단기기 등 의약품 수요의 증가로 인하여 많은 수의 글로벌 제약/의료기기 회사가 큰 매출을 올렸다. 매출을 통한 현금의 확보가 전략적 투자의 활성화로 연결될 수 있을 것이라는 시장의 기대감이 커지고 있다.
2023년을 기점으로 글로벌 바이오 신약의 특허 만료가 증가해, 2023년부터 2028년까지 특허 만료 의약품의 전년도 매출액은 2010∼2022년 평균 대비 높은 수준으로 예상된다. 특히 매출 기준 상위 30개 의약품 중 특허 만료, 만료 예정인 의약품이 22개로 파악된다. 애브비의 휴미라(Humira), 존슨앤존슨의 스텔라라(Stelara), BMS의 레블리미드(Revlimid), MSD의 키트루다(Keytruda) 등 각 제약사 매출의 10%를 상회하는 제품의 특허가 2023∼2028년 중 만료될 예정이다. 이에 각 제약사는 해당 의약품의 매출 감소에 대응하기 위한 신규 파이프라인 확보가 필요한 상황이다. 그런 반면 빅파마의 후기단계 파이프라인별 확보 비중을 보면, 내부 개발 비중은 2017년 65%에서 2020년 32%로 크게 감소하였으며, 인수, 공동개발, 라이선스 등으로 신규 파이프라인을 확보하는 것을 알 수 있다.
글로벌 의료기기 업체 또한 인수합병 등 적극적인 동력확보에 힘쓰고 있다. 2023년에는 연초부터 GE헬스케어, 애보트(Abbott) 등 거대 제약사에서 연이어 대규모 인수합병을 발표했다. 애보트는 말초/관상동맥 카테터 개발사 CSI를 8억 9,000만 달러에 인수한다고 발표하였고, GE헬스케어는 CT 내비게이션에 이어 초음파 영상진단 업체를 인수한다고 연이어 발표했다. 특히 GE헬스케어의 CEO 피트 아두이니(Peter Arduini)는 인수합병이 GE헬스케어의 중요한 전략이 될 것이라고 밝혔다.
출처: GlobalData, 하나증권
[그림 1-13] 특허 만료 의약품 매출액 추이 및 전망(2006∼2028F)
(3) 신기술 연구 동향: 최근 신규 모달리티 투자 경향성과 IT기술의 확장
바이오의약품 중 대부분은 항체를 비롯한 단백질의약품이 차지하고 있으나, CAR-T 등 세포, RNA, DNA, 엑소좀 등 새로운 모달리티에 대한 접근이 강화되고 있다. 여전히 글로벌 라이선스/파트너십 딜 규모를 보면 1, 2위를 소분자 의약품과 항체가 차지하고 있으나, 이들의 비중은 점차 감소하고 있으며 유전자 조작 세포치료제, 유전자치료제, ADC(Antibody-drug conjugation) 등 새로운 모달리티에 대한 투자가 증가하고 있다. 또한 항체에서도 이중항체, 유사항체 등 기존 항체의약품의 효과를 개선하기 위한 기술이 많이 개발되고 있다. 2022년에만 재즈 파마슈티컬(Jazz Pharmaceuticals), 길리어드(Gilead), 사노피(Sanofi), 화이자(Pfizer) 등에서 총 계약 규모 10억 달러가 넘는 이중항체 딜이 체결된 바 있다.
이러한 신기술의 도입은 접근 방식의 차이뿐만 아니라 연구개발 및 임상 환경에서도 나타나고 있는데, 디지털 기술의 활용도가 크게 증가했다는 점이다. 인공지능과 네트워크의 발전이 영향을 미치지 않은 산업은 없다. 바이오산업 역시 IT기술의 발전이 크게 작용하고 있다. 10년 전만 해도 시장 침투율이 현저하게 낮았던 인공지능 신약 개발, 디지털 분산형 임상 관리, 인공지능 영상진단, 디지털 헬스케어 등 디지털 기술은 이제 사용하지 않을 수 없는 수준이다. 전 세계적으로 가장 유명한 인공지능 신약 개발 소프트웨어를 개발하는 회사 슈뢰딩거의 매출은 2018년 6,000만 달러에서 2022년 1억 8,000만 달러까지 3배가량 증가하였다. 슈뢰딩거뿐만 아니라 많은 인공지능 신약 개발 소프트웨어 회사가 등장하는 가운데 시장은 훨씬 빠른 속도로 증가하고 있다.
또한 헬스케어 및 의료기기 분야에서도 디지털 기술의 도입은 빠른 속도로 이루어지고 있다. 글로벌 주요 의료기기 회사들은 인공지능 영상진단, 디지털 치료기기 및 헬스케어 등 각종 기술에 투자하고 있다. GE헬스케어는 인공지능 초음파 영상진단 업체 CSI를 인수하였으며, 메드트로닉 역시 인공지능 기반 심혈관 진단 업체 캐스웍스(Cathworks)에 7,500만 달러를 투자하며 파트너십을 체결하였다.

출처: GlobalData, 하나증권
[그림 1-14] 모달리티별 라이선스/파트너십 딜 규모 추이(2020∼2022)
다. 우리나라 바이오산업의 향후 과제
현재 국내에서는 그간의 정부지원과 투자를 바탕으로 많은 연구개발이 진행되고 있다. 우수한 인력과 풍부한 자금이 유입되었으며, 이를 바탕으로 많은 연구성과가 창출되고 있다. 그러나 팬데믹 상황에서 의료 수요가 증가하고, 해외 인허가 및 유통 사례를 겪어보았으며, 대기업의 바이오 투자가 활성화되었다고 하더라도 우리나라의 바이오 시장은 작고, 국내 전통 제약사와 대기업은 바이오 분야에서 글로벌 바이오의료기업의 규모에 달하지 못한다. 경색된 자금시장 상황에서 많은 연구개발 자금이 필요한 바이오기업은 결국 글로벌 바이오의료기업과의 협력이 필요하며, 국내기술의 활발한 라이선싱과 인수합병이 필요하다. 국내 바이오기술에 대한 관심도가 증가한 현재, 글로벌 수준의 연구개발과 더불어 국내기술의 확고한 입지 확보가 필요하다.
(1) 바이오 전문인력 확충
국내 바이오에 대한 투자와 창업이 증가한 현재, 바이오 인력에 대한 수요 대비 공급은 여전히 부족하다. 특히 연구개발(R&D), 사업개발(Business Development, BD) 등 각 분야에서 세부적인 역량을 확보한 전문인력의 수요가 여전히 높다. 2021년 바이오스펙테이터가 수행한 바이오기업 CEO 대상 설문 조사에 따르면 84%가 박사학위 이상의 인력수급이 어렵다고 답했으며, 특히 수급이 어려운 포지션은 글로벌 사업개발인력(35%)과 임상개발(26%), 연구개발(18%) 인력이라고 답했다. 향후 새로운 기술의 도입이 가속화될 경우, 새로운 분야에 대한 전문적인 지식을 갖춘 연구인력, 융합인력에 대한 수요도 계속해서 증가할 것으로 예상된다. 이와 같은 전문적인 인력은 단기적인 교육을 통해 확보할 수 있는 것이 아니라, 실제 경험을 통해 양성되기 때문에 더욱 어렵다. 따라서 단기적으로는 이러한 인력의 노하우를 활용할 수 있도록 지원하되 장기적으로 이러한 인력을 양성하고, 국내에 유치할 수 있는 전략이 필요하다.
(2) 글로벌 수준의 연구개발과 지적재산권의 확보
좋은 라이선싱을 위해서는 우선 당연히 적정 수요가 있는 분야에 대한 우수한 연구개발 성과가 필요하다. 이를 위하여 글로벌 바이오의료기업의 연구개발 및 라이선싱, 투자 동향 그리고 시장에 대한 연구를 통해 연구개발 전략의 확보가 필요하다.
그리고 더욱 강조되어야 하는 것은 지적재산권의 확보 전략이다. 연구개발을 자산으로 연결하는 것은 지적재산권이다. 아무리 좋은 기술은 연구개발을 했다고 하더라도 적절한 지식재산권을 확보하지 못한다면 활용도가 현저히 떨어지기 때문에, 시장에서의 적정가치를 인정받기 어렵다. 글로벌 바이오의료기업들이 어떤 지적재산권 확보를 추구하는지에 대한 확실한 이해와 이를 확보할 수 있는 역량이 필요한 시점이다. 어떤 제품에 대한 수요가 있는지, 해당 제품의 확보를 위해 권리보호가 필요한 핵심 부분은 어디인지, 기존 지적재산권을 회피할 수 있는지, 또한 나아가서는 해당 제품의 생존 기간을 확보하기 위한 추가적인 특허 창출이 가능한지에 대한 전략이 연구개발 단계부터 충분히 병행되어야 할 것이다.
(3) 투자와 인프라
경제 위축과 바이오 분야에서의 자금 회수 어려움으로 인해 바이오 분야에 대한 투자가 많이 감소한 현재, 많은 바이오기업들이 자금난을 겪게 될 것으로 보인다. 특히 제약기업의 경우 초기 연구개발에는 많은 자금이 소요되는 반면, 매출은 기술이전이 일어나는 시점까지 발생하기 어려워 주된 자금원인 투자에 의존하고 있으며, 연구개발 특성상 IT나 플랫폼 기업에 비해 피봇팅이 어려워 생존 수단을 확보하기 어렵다. 글로벌 기술이전이 초기보다는 임상 단계에서 많이 이루어짐을 고려할 때, 투자 유치가 적어지면 수억∼수백억에 달하는 임상 비용을 감당할 수 없으므로 기술이전 수준에 달하는 연구개발 단계에 올라설 수 없다. 특히 경제상황과 환율로 인해 글로벌 임상 비용은 더욱 불확실성이 커졌다. 바이오벤처의 ‘죽음의 계곡(Death Valley)’이 더욱 길고 깊어진 셈이다.
이러한 시점에서 바이오 분야의 기업공개(IPO) 심사기조 강화로 바이오벤처가 기업공개를 통해 자금을 유치하기 어려워졌고, 대부분의 기업들이 기업공개를 통해 자금을 회수하는 국내 시장의 특성상 자금 회수의 어려움으로 인해 비상장 단계에서도 투자를 위축되게 했다. 기업공개 심사는 시장 건전성 유지를 위해 꼭 필요한 관문으로 기업의 사업전략이 이에 의한 영향을 받는다. 지속적으로 예측 가능성을 높이고 전문성을 강화하여 바이오벤처가 건전한 사업전략을 구사하고, 시장참여자들이 이에 대해 호응할 수 있도록 만들어 나가야 할 것이다.
더불어 국내 대기업의 투자 증가와 해외 기업의 기술이전이 활성화되고 있는 현재 해당 분야의 민간투자가 활성화될 수 있도록 국내외 및 벤처-대기업 간의 거래를 활성화할 수 있는 네트워크 지원과 법, 제도의 정비가 필요하다.
국내 바이오산업은 계속해서 기대와 위기가 번갈아 찾아왔다. 그간 바이오산업은 위기에도 불구하고 기술수출 등 꾸준한 성과를 보여주며, 글로벌 수준의 플레이어로 성장해 왔다. 세 번째 격변이 지나고 ‘위기’가 오는 것으로 평가되는 현재, 그간 쌓아온 역량을 바탕으로 다시 한번 약진할 것이라고 기대한다.


|
|
|
|
|
주요 내용 요약 |
|
제2장 국가 생명공학 육성 정책 |
|
|
|
구분 |
생명공학 연구개발 지원 |
생명공학산업 육성 |
|
개 요 |
- 바이오 대전환(디지털화, 플랫폼화, 전략기술화)에 대응하여 국가 바이오 R&D를 혁신하고 디지털바이오를 집중 육성(국정 과제 75-3, 바이오 대전환 디지털 바이오 육성) |
생명공학산업은 생명공학기술 기반으로 고부가가치 제품 생산 및 사회문제 해결 제품 개발을 위한 중요한 산업임 |
|
추진 경과 |
- 국가전략기술 육성방안 발표(’22.10., 12대 국가전략 기술, 50대 중점기술 제시) * 국가 전략기술에 ‘첨단바이오’ 포함 - 국가 합성생물학 육성전략(’22.12.) - 디지털바이오 혁신전략 발표(’22.12.) - 국가전략기술육성특별법 국회 본회의 통과(’23.2.) - 제4차 생명공학육성기본계획(2023~2032) 수립(’23.6.) - 제4차 뇌연구촉진기본계획(2023~2027) 수립(’23.6.) |
산업부는바이오산업기술개발사업 중심으로 국내 바이오산업의 핵심원천기술 확보 및 글로벌 경쟁력확보를 위해 지원 중임 |
|
주요 정책 |
- 생명공학육성기본계획, 뇌연구촉진기본계획 등 바이오 분야 범부처 기본계획*을 수립하고 바이오 R&D 혁신전략** 및 핵심 기술분야별 로드맵 마련 * 제4차 생명공학육성기본계획, 제4차 뇌연구촉진기본계획 수립(’23.6.) ** 디지털바이오 혁신전략, 국가 합성생물학 육성전략(’22.12.) |
생명공학산업의 핵심원천기술 및 제품화, 바이오원부자재 및 장비 공급망 자립화, 디지털 기반 의약품 제조기술 확보, 바이오플라스틱 소재 및 제품화, 범부처 협력사업 추진 중임 |
|
주요 사업 |
- 바이오 분야 주요 전략기술에 대한 연구개발 강화를 위해 신약, 의료기기, 재생의료, 뇌연구 등 주요분야 기초・원천기술 개발을 추진하고, 유전자편집기술, 합성생물학 등 미래 유망 분야의 핵심기술 확보를 위해 선제적으로 지원 |
바이오산업기술개발사업, 바이오의약품 및 백신 원부자재 생산고도화, 탄소순환형 바이오플라스틱 제품화, 지능형 의약품 제조공정기술개발 사업 등 |
|
향후 계획 |
- 합성생물학과 CAR, 마이크로바이옴 등 디지털 바이오 핵심 기술 개발을 위한 대규모 예타사업 추진 및 전략마련 |
생명공학 산업의 글로벌 경쟁력 확보 및 수출 유도를 위한 바이오원부자재 및 장비 자립화, 첨단바이오 제품 개발, 석유계 대체 바이오 기반 산업소재 개발 지원 계획임 |
|
|
|
|
|
|
|
|
|
|
|
생명공학 기초과학진흥 |
생명공학 인력양성 |
|
디지털 기술의 발달로 디지털바이오 시대가 본격적으로 열리고 있으며 생명과학의 기초연구로부터 도출된 성과가 관련 산업으로 연계되면서 헬스케어 시장이 폭발적으로 성장 중 |
정부의 기초연구 확대 기조에 따라 교육부는 기초연구분야 저변 확대 및 우수연구인력 양성에 정책 역량을 집중하고 있음 |
|
기초연구진흥 및 기술개발지원에 관한 법률 제7조에 기초연구의 진흥을 위한 여건 조성을 위하여 기초연구에 관해 명시하고 있으며, 기초연구진흥종합계획 및 시행계획을 수립하여 국가의 기초연구진흥을 위한 정책적 노력 중 |
학문후속세대 지원, 풀뿌리 기초연구 지원, 4단계 두뇌한국21 사업, 의과학자 육성지원사업 등 추진 |
|
제4차 기초연구진흥종합계획(2018∼2022)을 수립하여 연구자의 창의적 아이디어를 지원하는 연구자 주도 기초연구지원 예산을 2017년 1조 2,600억 원의 2배가량인 2조 5,500억 원으로 2022년에 확대 |
초중등단계에서 융합인재교육을 통해 과학기술 선도 인재양성의 초석을 마련하고, 고등교육 단계에서는 고급인력 양성 중 |
|
과학기술정보통신부와 한국연구재단은 우리나라 과학기술 연구력의 근본이라 할 수 있는 기초연구를 중점 지원 중. |
개인기초연구, 이공학학술연구기반구축을 통해 이공학 분야 기초연구 활성화 도모, 4단계 BK21사업 등을 통해 고급인력 양성 추진 |
|
윤석열정부는 기초과학에 대해 연구자의 자율성 및 창의성 보장과 함께 국가 수요를 반영한 전략적 기초연구 투자 확대가 필요하다는 인식을 하고 있으며, 이러한 국가적 수요에 따라 기초연구도 전략적 기초연구 투자 확대를 지원할 예정 |
장래 성장가능성이 있으나 투자가 미흡하거나, 필요한 기반 분야 중 민간 투자가 소홀할 수 있는 부분을 적극 발굴하여 배려할 예정 |
|
구분 |
농림축산식품 |
보건의료 |
|
개 요 |
그린바이오 기술의 육성을 통해 기존 농업의 한계를 극복 |
보건의료기술이 국민의 생명과 건강뿐 아니라 국가 안보와 직결됨을 인식, 저성장 시기 경제 성장을 견인할 수 있는 핵심 분야로서 보건의료에 대한 관심도 고조 |
|
추진 경과 |
제3차 농림식품과학기술육성종합계획에 따라 정책 추진 중 |
보건의료 연구개발 지원정책의 최상위 계획은 ‘보건의료기술진흥법’에 근거한 범부처, 법정계획인 ‘보건의료기술육성기본계획’이며, 제3차 보건의료기술육성기본계획(2023∼2027) 수립 예정 |
|
주요 정책 |
그린바이오 융합형 신산업 육성방안(2020.9.), 그린바이오 산업 육성 전략(2023.2.)에 따라 정책 수립 및 계획 |
제2차 보건의료육성기본계획은 ‘보건의료기술 혁신으로 국민 모두가 건강한 내일’을 비전으로, 건강수명 연장, 보건산업 수출증대, 신규일자리 창출을 목표로 3대 추진전략, 9대 중점과제를 추진 |
|
주요 사업 |
3대 전략, 19개 사업에 따라 추진 |
2022년도 보건복지부 R&D 정책방향은 ‘국민 건강 중심의 투자 강화로 더욱 건강한 대한민국, 개방형 혁신을 통한 산・학・연・병 협력 강화’라는 목표로 4대 전략, 6대 중점 투자 방향을 설정 |
|
향후 계획 |
농림식품과학기술육성종합계획과 그린바이오 융합형 신산업 육성방안, 그린바이오 산업 육성 전략에 따라 유망산업 분야에 집중 투자 계획 |
보건의료 분야의 범정부 R&D 종합계획인 제3차 보건의료기술육성기본계획(2023∼2027)을 새로 수립・추진하여 보건의료 연구개발 지원에 박차를 가할 예정 |
|
환경 |
해양수산 |
|
환경생명공학기술의 개념 정의 |
해양수산생명자원의 전략적 가치의 중요성 및 이를 이용한 기술개발 및 산업화 육성정책 추진 |
|
법률 제정, 전략 수립 등 환경 분야 생명공학 육성을 위한 추진 사항 |
∙2019 제1차 해양수산생명자원 관리 기본계획(2019~2023) ∙2021 해양바이오 산업 활성화 기본계획(2021~2030) ∙2022 해양바이오 산업 신성장 전략(2022~2027) |
|
유전자원법, 기술개발, 생물산업 육성 등에 관한 정책 소개 |
해양바이오 산업 신성장 전략(2022.7.) 수립을 통한 해양생명공학 및 산업육성 정책 추진 |
|
관련 기술개발사업과 생물자원 발굴・분류에 관한 내용과 주요 성과 소개 |
기초소재 확보 및 고도화, 대량생산 및 표준화, 융복합 R&D 등 3대 핵심 분야 기술 집중투자 및 기업의 단계별 성장지원을 위한 인프라 구축 추진 |
|
나고야 의정서 발효에 따른 유전자원법 이행을 위한 노력, 기술개발사업 등 향후 추진 계획 |
국가관할권 이원지역의 해양유전자원에 대한 접근 및 이용(BBNJ) 협정 동향 및 해양바이오산업 육성정책 추진계획 |
|
|
|
제2장 국가 생명공학 육성 정책 |
|
제1절 생명공학 육성 정책 |
1. 생명공학 연구개발 지원
가. 개요
전 세계적으로 바이오・디지털의 융합의 강화, 바이오의 플랫폼화, 기술 패권 경쟁이 심화하고 있는 상황 속에 2022년 5월 윤석열정부가 새로 출범하였다. 과학기술정보통신부는 2023년도 국가과학기술 본경 육성 및 신기술 기반 미래산업 선점을 중점 업무로 추진하고자 한다.
과기정통부는 국가과학기술자문회의에서 글로벌 기술패권 경쟁 등에 대응하고자 ‘국가전략기술 육성방안’을 발표(2022.10.)하였으며, 이 육성 방안은 ‘국가전략기술 육성으로 미래 성장과 기술 주권 확보’를 비전으로 12대 국가전략기술1)과 50대 세부 중점기술을 제시하였다. 윤석열 대통령은 이 회의에서 과학기술은 국가경쟁력의 핵심 원천이고, 우리나라가 세계를 선도하기 위해서는 추격을 넘어 초격차를 만드는 국가 차원의 과학기술 전략이 필요함을 강조하였다. 이후 이런 국가적으로 중요성이 큰 국가전략기술의 신속・과감한 연구개발(R&D), 사업화, 인력 양성 등을 전주기 차원에서 체계적으로 육성하기 위한 ‘국가전략기술육성특별법’ 제정을 추진했고, 국회 본회의를 통과(2023.2.)하여 제도적 기반을 마련하였다.
세계 각국에서는 합성생물학2)을 국가 차원에서 육성해야 할 기술 분야로 지정하고 핵심 인프라인 바이오파운드리3)를 구축하는 등 기술주도권 확보를 위한 치열한 경쟁을 벌이고 있으며, 우리 정부도 ‘국가전략기술 육성 방안’의 후속조치로 ‘국가 합성생물학 육성전략’를 수립하고 본격적으로 합성생물학 육성을 위한 정책을 추진하겠다고 발표(2022.12.)하였다.
또한 디지털 시대의 본격적인 진입에 대응하여 바이오와 디지털의 융합을 촉진하고 공통 기반기술 및 인프라 혁신을 위한 ‘디지털바이오 혁신 전략’도 발표(2022.12)하였는데, 바이오 대전환에 대응하여 기존 바이오 R&D 한계(고비용・고위험・장기간)를 극복하고 선택과 집중으로 바이오 선도국 진입을 촉진하고자 한다.
또한 생명공학 분야 최상위 법정계획인 제4차 생명공학육성기본계획이 수립(2023.6)되어 바이오경제 선도국으로의 도약하기 위한 향후 10년간의 청사진을 제시하였으며, 제3차 뇌연구촉진 기본계획 또한 수립되어 지속적으로 성장하고 있는 국내 역량을 바탕으로 뇌연구 및 뇌산업 선도국가로 진입하기 위해 노력하고자 한다.
나. 주요 정책
(1) 제4차 생명공학육성기본계획(2023~2032) 수립
과기정통부는 2020년 생명공학육성법 전면 개정4) 후 부처합동으로 제4차 생명공학육성기본계획(2023∼2032)을 수립(2023.6.)하였다. 바이오 기술의 전략기술화와 디지털화 등의 경쟁이 심화되면서 기존의 한계를 극복하고 전자, 소재공학 등 전 분야에 파급되는 바이오 대전환 진행 중이다. 이에 대응하고자 ‘융합’과 ‘연결’의 바이오 대전환을 통해 기존 한계를 극복하고 바이오가 전 분야에 파급되는 새로운 기회가 창출을 위해 바이오 전 분야, 기술개발 전 단계에 걸친 종합적인 지원정책을 마련5)하여 바이오경제 선도국으로 도약하고자 한다.
동 계획은 ‘바이오 대전환시대, 디지털융합・전략적 R&D・스케일업을 통해 2030 바이오경제 선도국으로 도약’을 비전으로 2030년까지 바이오 분야 기술 수준은 85%, 연간 바이오 기술창업 1,000건, 바이오산업 생산규모 100조 원을 핵심 목표로 하고 있다.

출처: 과학기술정보통신부
[그림 2-1] 제4차 생명공학육성기본계획 비전 및 목표

출처: 과학기술정보통신부
[그림 2-2] 한눈에 보는 제3차 생명공학육성 기본계획의 성과
과기정통부는 2023년도 연구개발사업 종합시행계획을 통해 기초연구 투자를 지속 확대하고 그 중 전략기술의 초격차 확보를 위해 합성생물학, 마이크로바이옴 등 첨단바이오 분야 신기술・신산업 창출을 중점적으로 추진하고자 한다.
주력 분야인 범부처 전주기 R&D를 통해 신약・의료기기・재생의료 등을 지속 지원하고, 줄기세포 및 유전자 편집기술 개발 신규 착수할 예정이며, 마이크로바이옴 등 첨단바이오 핵심기술 개발을 신규 지원할 예정이다. 또한 바이오와 인공지능 등 디지털 기술 간 융합 R&D를 강화하며, 국민 건강과 직결되는 감염병 대응 및 뇌질환・치매 극복을 위한 원천기술 개발 및 뇌과학 선도융합연구 추진할 계획이다. 디지털 대전환에 발맞춰 생명연구자원의 효율적 확보・관리・활용을 위한 범부처 소재・데이터 인프라 선진화 등에도 지속적으로 지원할 계획이다.
범부처 차원의 신규사업으로 바이오・헬스 주력 분야(신약, 의료기기 및 재생의료)의 글로벌 경쟁력 강화를 위해 대형 프로젝트를 기획하여 기초원천 → 응용 → 사업화의 전주기 R&D 등을 지원한다.
[표 2-1] 바이오・헬스 주력 분야 범부처 차원 신규사업(2022~2023)
|
|
사업명 |
주요내용 |
기간/예산 |
관계부처 |
|
’22년 신규 |
전자약 기술개발 |
전자약 원천기술의 개발 및 성능향상 지원을 통한 전자약의 치료효능 증진, 전자약 기반기술 확보 지원 |
‘22~’26 총 458.5억원 |
과기부 복지부 |
|
’23년 신규 |
세포기반 인공혈액(적혈구및혈소판) 제조 및 실증 플랫폼 기술개발사업 |
혈액수급 안정화를 위한 수혈용 세포기반 인공혈액(적혈구 및 혈소판) 생산기술 확보 및 대량생산・제조기반 마련 |
’23∼’27/ 총471.2억원 |
과기부, 복지부, 산업부, 식약처, 질병청 |
|
한의 디지털 융합 기술개발사업 |
한의기술을 기반으로 디지털 등 첨단과학기술・지식 등을 융합하는 연구를 지원하여 고령화 등 현대의료 이슈 해결 기여 |
’23∼’27/ 총440억원 |
과기부, 복지부 |
출처: 과학기술정보통신부
(2) 제3차 뇌연구촉진 기본계획 수립
정부는 ‘뇌연구촉진법’ 제5조에 근거하여 과학기술정보통신부, 교육부, 보건복지부, 산업통상자원부, 질병관리청이 공동으로 디지털 대전환 등 뇌연구 기술 혁신 트렌드를 반영하고 방향성을 재정비하여 뇌과학 R&D 최상위 법정계획인 제4차 뇌연구촉진 기본계획(2023~2027)을 수립(2023.6.)하였다.
제4차 뇌연구촉진 기본계획은 혁신과 융합으로 뇌연구・뇌산업 선도국가 진입을 비전으로 뇌과학 기술수준 세계 최고 대비 85%, 선도그룹으로 도약, 자폐, 치매 등 주요 뇌질환 국산 치료제 2종 확보, 기업가치 1조 원 규모 뇌산업 전문기업 10개 창출을 목표로 한다.

출처: 과학기술정보통신부
[그림 2-3] 제4차 뇌연구촉진 기본계획 비전과 목표
그동안의 시행계획을 통한 성과를 살펴보면 2021년은 뇌질환극복연구사업(과기정통부), 치매극복 연구개발사업(과기정통부・복지부 공동) 등 신규사업과 뇌연구 고도화, 생애주기별 뇌 건강 실현 및 창의적 연구개발 등에 1,966억 원을 투자하였고, Tau 올리고머 형성 모니터링 플랫폼 기술이전(한국과학기술원), 뇌 영상을 통한 만성 통증 검사 가능성 제시(기초과학연구원) 등 뇌질환 극복을 위한 우수성과를 창출하였다.
2022년은 ‘뇌에 대한 근원적 이해 도전 및 뇌연구 기반 신기술 창출, 뇌질환 극복을 위한 국민 부담경감 및 삶의 질 제고’ 3대 목표와 글로벌 뇌과학 프로젝트 참여를 통한 국제공조 강화를 위해 뇌연구 중점 분야별 R&D에 1,821억 원을 투자한다.
[표 2-2] 뇌연구 촉진 기본계획 실천과제별 투자 계획(2022)
(단위: 백만 원)
|
실천과제 |
과기정통부 |
교육부 |
복지부 |
산업부 |
합계 |
비중(%) |
’21년 실적 |
증가율(%) |
|
인간 뇌 이해를 위한 뇌연구 고도화 |
55,344 |
512 |
- |
- |
55,856 |
30.7 |
67,786 |
△17.6 |
|
생애주기별 맞춤형 건강 뇌 실현 |
49,919 |
- |
16,267 |
- |
66,186 |
36.4 |
71,030 |
△6.8 |
|
4차 산업혁명 대응 창의적 연구개발 |
13,634 |
- |
- |
7,305 |
20,939 |
11.5 |
22,912 |
△8.6 |
|
혁신적 뇌연구 생태계 구축 |
10,645 |
1,178 |
850 |
- |
12,673 |
7.0 |
11,779 |
7.6 |
|
글로벌 협력 체계 구축 |
900 |
- |
- |
- |
900 |
0.5 |
- |
- |
|
뇌 산업 육성 |
100 |
- |
- |
- |
100 |
0.1 |
149 |
△32.9 |
|
기관운영 및 인프라 구축 |
24,913 |
- |
498 |
- |
25,411 |
14.0 |
22,957 |
10.7 |
|
합 계 |
155,455 |
1,690 |
17,615 |
7,305 |
182,065 |
100 |
196,613 |
△7.4 |
출처: 과학기술정보통신부, 2022년도 뇌연구촉진시행계획, 2022.4.
(3) 생명연구자원 기본계획에 따른 시행계획 수립
정부는 ‘생명연구자원법’ 제7조에 근거하여 과학기술정보통신부 등 11개 부처・청이 공동으로 바이오 강국 실현을 위한 생명연구자원 인프라 조성을 위해 ‘제3차 국가생명연구자원 관리・활용 기본계획(2020∼2025, 생명연구자원 빅데이터 구축 전략)’을 수립(2020.5.)하고, 기본계획에 포함된 각종 실천과제를 내실 있게 추진할 수 있도록 연도별 시행계획을 수립하여 이행하고 있다.
본 기본계획의 이행을 위해 과학기술정보통신부를 중심으로 환경부, 해양수산부, 농촌진흥청, 산림청, 질병관리청의 6개 부처는 2021년에 부처별로 추진되던 사업들을 구조 개편하여 다부처 국가 생명연구자원 선진화사업을 신규로 착수하였다. 이를 통해 바이오 연구소재 분야는 기존 200여 개의 소재자원은행을 14개 분야의 클러스터로 재편하여 육성하고 있다. 또한 바이오 연구데이터 분야는 범부처 연구데이터를 통합 수집・공유 환경을 조성하기 위해 2021년부터 국가 바이오 데이터 스테이션(K-BDS)를 구축하고 있으며, 2022년 12월에는 그동안 확보한 데이터를 공개하고, 데이터의 활용, 촉진을 위해 클라우드 기반의 데이터 분석 전산 환경의 지원에 착수하였다.
코로나19와 같은 바이오재난 발생 시, 진단기기・치료제・백신 등을 신속히 개발할 수 있도록 감염병 대유행 전에 연구개발에 필요한 바이러스, 검체 등을 신속하게 확보하여 공급하기 위한 인프라 등을 확대하고 있으며, 2021년부터 생명연구자원 인프라 지원 사업・정책의 범부처 공동 추진을 위한 민・관 협의체를 구성하여 운영하며 지속 가능한 민관 협력 기반을 조성해오고 있다.
2023년은 바이오 소재 정보의 접근성과 편의성 제고를 위해 뇌, 모델 동물, 야생생물 분야의 클러스터별 전문 포털을 구축하고, 클러스터별 전문 포털을 연계한 바이오 소재 정보 통합 포털 시스템을 구축하여 시범운영에 착수할 계획이다. 또한, 바이오 연구데이터 데이터 활용 기반 조성을 위한 법적 근거 마련을 위해 생명연구자원법 개정을 추진하고, 바이오 빅데이터를 활용한 우수 실증사례를 발굴하는 사업을 지원한다.
생명연구자원 기본계획의 이행을 위해 2023년에는 1,836억 원을 투자한다.
[표 2-3] 생명연구자원 분야별 투자 계획(2023)
(단위: 억 원)
|
|
확보 |
관리 |
활용 |
합계 |
비중(%) |
’22년 합계 |
|
바이오 연구소재 |
348 |
460 |
727 |
1,535 |
83.6 |
1,585 |
|
바이오 연구데이터 |
100 |
81 |
120 |
301 |
16.4 |
311 |
|
합 계 |
448 |
541 |
847 |
1,836 |
100 |
1,896 |
출처: 과학기술정보통신부, 2023년도 국가생명연구자원 관리・활용 시행계획, 2023.3.
(4) 디지털바이오 혁신 전략 수립(2022.12.7.)
과학기술의 발전이 국가의 안전 및 번영과 직결되는 팍스 테크니카(Pax-Technica) 시대 미국, 중국 등 글로벌 국가들이 기술패권 경쟁의 핵심으로 부상하고 있다. 미국은 2022년 9월 ‘생명공학・바이오제조 이니셔티브’ 행정명령을 통해 바이오기술로 에너지, 화학, 소재 등 기존 제조 산업을 혁신하는 의지를 표명하였고 이에 앞서 중국은 지난 5월, ‘바이오경제 5개년 계획’을 발표하여 바이오기술 기반의 경제발전을 본격 추진하였다.
또한 첨단 디지털 기술과 바이오의 융합을 통해 기존 바이오 연구개발이 가졌던 불확실성과 고비용 등의 한계가 극복되면서 바이오가 전 산업 분야에 영향을 미치게 되는 이른바 ’바이오 대전환‘의 시대를 맞이하였다.
이와 같이 새로운 도전과 기회가 공존하는 정책 환경 변화에 선제 대응을 위해 과기정통부는 ’디지털바이오 육성‘을 새 정부 국정과제로 설정하였고 2022년 12월 7일 한국 바이오파크 입주기업 현장에서 「디지털바이오 혁신전략」을 발표하였다.
본 전략은 2030 바이오 선진국 진입을 목표로 ① 5대 인프라-12대 핵심기술 확보, ② 세계 최고국 대비 기술 수준 85% 달성, ③ 디지털바이오 연구개발 집중 투자라는 목표를 설정하고, 이를 위한 4대 추진전략과 13대 세부 과제를 제시하였다.
디지털바이오 혁신전략을 토대로 과기정통부는 넥스트 반도체로 각광받고 있는 바이오 분야 기술경쟁력 확보를 위해 지속적인 노력을 기울일 전망이다.
(5) 국가 합성생물학 육성전략 수립(2022.12.6.)
생명과학에 공학적 기술개념을 도입하여 인공적으로 생명체의 구성요소・시스템을 설계・제작・합성하는 합성생물학은 바이오연구의 속도와 스케일, 불확실성의 한계를 극복할 수 있어, 제약・에너지・화학・농업 등 바이오 관련 다양한 산업에 막대한 파급력을 가지고 있다. 최근 심화되고 있는 바이오 분야 글로벌 기술패권 경쟁의 핵심기술로 부각되며, 미국, 영국, 일본, 중국 등 세계 각국에서는 합성생물학을 국가 차원에서 육성해야 할 기술 분야로 지정하고 핵심 인프라인 바이오파운드리를 구축하는 등 기술 주도권 확보를 위한 치열한 경쟁을 벌이고 있다. 이에, 우리 정부도 2022년 10월 대통령 주재 국가과학기술자문회의에서 「국가전략기술 육성방안」을 발표하고, 12대 전략기술 중 ‘첨단바이오’ 분야 중점기술로 합성생물학을 선정하였다.
과학기술정보통신부는 2022년 12월 합성생물학 육성으로 바이오제조 혁신역량 강화를 위한 국가 합성생물학 육성전략을 발표하였다. 이번 전략에는 ① 합성생물학 핵심기술 확보를 위한 6대 전략 분야 집중 육성, ② 합성생물학 혁신을 가속화하는 핵심 인프라인 바이오파운드리 구축・활용, ③ 합성생물학 발전을 위한 법・제도, 협력, 인력양성 등 지속가능한 생태계 조성 등의 내용을 담았으며, 구체적 전략 이행을 위해 바이오파운드리 구축 예타사업 추진, 합성생물학 육성을 위한 신규 법률(가칭, 합성생물학 연구 진행 및 지원에 관한 법률) 제정 계획 등을 발표하였다.
(6) 규제 개선
과기정통부는 바이오 연구활동을 저해하는 규제를 개선하기 위해 민간전문가 중심의 ‘바이오 규제 선진화 TF(1기, 2017.10.)’를 시작으로 ‘3기 바이오 규제 TF(2020.7.∼2021.6.)’ 운영을 통해 연구・산업 현장 중심의 규제를 발굴하고 전문가 검토를 통한 개선 방안을 마련하여 관계부처에 제안해 왔었으며, 2022년에는 ‘범부처 경제 규제혁신 TF’ 내의 ‘보건의료 규제반’에 4건의 규제 개선안을 제안하였다.
또한, 바이오 규제에 대한 혁신과 미래를 상시로 논의하고, 합의에 기초한 정책의제 발굴 및 전략안 도출을 위해 산・학・연 연구자 및 법률 전문가 등 다양한 분야의 전문가들이 참여하는 ‘바이오 규제 정책플랫폼’을 구성・운영하였으며, 이를 통해 바이오 규제에 대한 국내외 동향 및 트렌드, 현장 이슈 등에 대해 토론・토의하고, 핵심이슈를 발굴・정제하는 등 바이오 규제 혁신을 모색하기 위해 노력하였다.
다. 주요 사업
과학기술정보통신부는 신약, 의료기기, 재생의료 등 주력 분야에 대한 연구개발 강화를 통해 바이오 분야 글로벌 경쟁력을 강화하고, 뇌연구, 감염병 대응 등 국민건강과 직결되는 분야와 미생물, 합성생물학 등 미래 유망분야의 핵심기술 확보를 통한 미래시장창출을 위해 선제적으로 지원하고 있다.
(1) 신약개발 지원 분야
미래 경제성장을 견인하는 바이오헬스 핵심 산업인 신약개발을 위해 2021년부터 과기정통부는복지부・산업부공동으로국가신약개발사업(2021~2030년총 2조1,758억 원)을 추진하여 유효물질 도출부터 임상2상까지 혁신신약 전주기 R&D를 지원하고 있으며, 2022년에는 동 사업에서 발생하는 연구 공백 해소를 위해 새로운 타깃 발굴・검증 및 신약 파이프라인 공급을 확대하는 혁신신약기초기반기술개발사업을 신규로 착수하여 2026년까지 총 323억 원을 투자할 계획이다.
과기정통부는 또한 2021년 종료된 인공지능신약개발플랫폼구축사업 후속 사업인 인공지능활용 혁신신약발굴사업(2022~2026년, 총 279억 5,000만 원)을 통해 旣 구축된 인공지능플랫폼 고도화 및 후보물질 발굴에 활용하는 등 신약개발의 고질적 한계(고비용, 낮은 성공률) 극복을 위해 노력하고 있다. 이와 같은 노력의 연장선상에서 2023년에는 DEL(DNA encoded Library, 유전자암호화라이브러리) 기반 약물 스크리닝 플랫폼 구축 등 혁신적 신약개발을 위한 기반 기술도 지원할 계획이다.
(2) 뇌과학 연구 지원 분야
과기정통부는 국민건강을 증진하고 과학기술이 밝혀내지 못한 미래 유망분야로 원천기술 확보 및 미래시장 선점을 위해 뇌과학 및 뇌질환 분야를 지원하고 있다.
① 뇌과학 핵심 4대 분야(뇌신경생물, 뇌신경계 질환, 뇌인지, 뇌공학) 원천기술 개발을 지원하는 ‘뇌과학원천기술개발사업’(2006∼2023), ② 자연 신경망(뇌)을 이해하여 AI 개발의 혁신적인 전환점이 되는 원천 기술개발을 지원하는 ‘미래뇌융합기술개발사업’(2019∼2024), ③ 3대 핵심 뇌질환(뇌발달질환, 정신질환, 뇌손상)의 진단 및 치료기술 개발을 지원하는 ‘뇌질환극복연구사업’(2020∼2025), ④ 치매 조기 예측・진단 및 예방・치료 기술개발을 지원하는 ‘치매극복연구개발사업’(2020∼2028, 과기정통부・복지부 공동), ⑤ 뇌기능 기전 및 조절 기전 규명을 통한 뇌과학 지식 축적 및 조절기술 고도화를 위해 연구를 지원하는 ‘뇌기능규명・조절기술개발사업’(2022~2024), ⑥ 전자약의 원천기술 개발 및 성능향상 지원을 통해 치료효능 증진, 기반 기술 확보를 지원하는 ‘전자약 기술개발사업’(2022~2026, 과기정통부・복지부), ⑦ 뇌질환 극복 및 뇌기능 활용 분야에서 선도 융합기술 도출을 통해 원천기술 확보 및 기술사업화 연계 역량 강화를 지원하는 ‘뇌과학선도융합기술개발사업’(2023~2032)을 추진하고 있다.
(3) 감염병 대응 지원 분야
과기정통부는 국가 경제 및 국민건강에 위협이 되는 신・변종 감염병의 발생 빈도가 증가하고 감염병 확산으로 인한 사회적 비용이 사회문제로 대두되면서, 감염병 대응 지원을 위한 연구개발 투자를 확대하고 있다.
2021년부터는 코로나19 대응뿐만 아니라, 신・변종 감염병에 신속하게 대응할 수 있는 예측, 진단, 치료, 예방 분야에 대한 핵심 기술개발을 적극 지원하고 있으며, 바이러스 기초연구 역량 강화를 위하여 ‘한국바이러스기초연구소’를 설립(2021.7.)하였다.
2022년에는 산・학・연 전임상시험 원스톱 지원을 통한 국가재난형 감염병 대응 역량 제고를 위해 ‘국가전임상시험 지원센터’를 개소하였고(2022.6.), 감염병에 선제적으로 대응 가능한 차세대 백신 기반기술을 확보하기 위하여 ‘감염병 차세대 백신 기초원천 핵심기술개발 사업’(2022~2025년, 총 373억 원)을 신규로 추진하였다. 또한 기초연구 인프라 확대를 위해 국내 백신 전문연구인력 및 생물안전시설 활용 연구 서비스 인력을 확충하기 위한 감염병 전문인력 양성사업(2022~2027년, 총 165억 원)을 추진하고 있다.
(4) 의료기기 개발 지원 분야
의료기기 분야는 경제성장과 고령화 시대로의 진입, 건강에 관한 관심 증가에 따라 지속적인 고성장이 전망되는 고부가가치 산업으로 중요성이 증대됐으며, 이에 따라 과기정통부, 산업부, 복지부, 식약처가 공동으로 2020∼2025년까지 약 1조 2,000억 원을 투자하여 원천기술 R&D에서 임상・인허가・제품화 전주기를 지원하는 ‘범부처 전주기 의료기기 연구개발사업’을 추진했다.
과기정통부는 ‘범부처 전주기 의료기기 연구개발사업’을 통해 ① 의료현장에서 수요가 높은 의료기기를 대상으로 국내 기업의 역량을 강화하고, 관련 산업을 육성하기 위한 ‘시장 친화형 글로벌 경쟁력 확보 제품개발’, ② 미래 의료환경 및 수요를 예측하고 선제 대응으로 신규 의료기기 시장 창출 및 선점을 목표로 하는 ‘4차 산업혁명 및 미래 의료환경 선도’, ③ 신체기능 저하, 장애 및 만성질환, 고령화, 의료 소외지역 등의 문제 해결을 위한 의료기기 개발을 통해 의료서비스의 공공복지를 강화하기 위한 ‘의료 공공복지 구현 및 사회문제 해결’, ④ 시장 진입단계별 임상 및 인허가 지원을 위한 ‘의료기기 사업화 역량 강화’ 등 4개 내역사업에 대하여 의료기기 R&D를 지원하고 있다.
2022년에는 범부처 전주기 의료기기 연구개발사업을 통해 4개 내역사업을 대상으로 총 343개 과제 1,736억 원을 지원하였으며, 2023년에는 4개 내역사업에 대하여 248개 과제 1,978억 7,000만 원을 지원할 예정이다.
(5) 재생의료 연구지원 분야
손상된 인체 세포와 조직을 대체하거나 재생해 정상 기능으로 회복시키는 재생의료 치료제・치료기술 개발을 위해 2021년부터 10년간 총 5,955억 원 규모(국비 5,423억 원, 민자 532억 원)의 예타사업인 ‘범부처 재생의료 기술개발 사업’을 통해 재생의료 분야의 핵심 기초・원천기술부터 치료제・치료기술 임상 단계까지 전 주기를 지원하고 있다. 이에 따라, 2022년에는 ‘범부처 재생의료 기술개발 사업’을 통해 ① 재생의료 원천기술개발, ② 재생의료 연계기술개발, ③ 재생의료 치료제・치료기술개발 등 3개 분야에서 56개 신규과제 등 총 107개의 과제를 지원하였으며, 2023년에는 신규 과제 45개를 선정하여 지원한다.
아울러, 난치성 질환 치료제 개발에 응용 가능한 줄기세포 요소기술 개발을 위해 바이오의료기술개발사업 내의 ‘줄기세포/조직재생’ 사업을 통해 26개 과제를 지원하였다.
(6) 그린・화이트(GW) 바이오 연구 지원 분야
인구 고령화, 식량・환경・에너지 문제 등의 대안을 제시할 수 있는 차세대 바이오 성장동력 분야로서 그린・화이트 바이오 분야 원천기술의 중요성 확대되고 있다.
과기정통부는 생명 현상의 이해 및 생명 활동 기반으로 천연물, 장내미생물, 바이오에너지 등 다양한 분야로 활용 가능한 범용 원천기술 개발을 선제적으로 확보하기 위해, 천연물 분야에서는 식량 고갈 등의 문제를 해결할 미래 대체육(배양육 포함) 맞춤형 식품 신소재 원천기술개발, 장내미생물 분야에서는 구강 마이크로바이옴 평가플랫폼, 장뇌축 기전연구 등 마이크로바이옴 기반 신약의 원천기술 확보 및 바이오에너지 분야에서는 바이오매스 활용을 위한 e-biorefinery 사업을 지원하고 있다.
한편 인체 마이크로바이옴 분야에서도 기존 치료 방법의 한계와 문제점을 해결에 기여할 수 있도록 마이크로바이옴 기반 난치성 질환 및 항암 치료 등을 위한 원천기술 개발 사업을 시행 중이다.
(7) 차세대 바이오 분야 연구개발 지원
과기정통부는 신성장동력 확보를 위해 바이오 분야의 미래 파급력을 가진 다양한 도전적・핵심적 기술 분야와 IT・NT 등 타 분야와의 융합을 통해 4차 산업혁명을 주도할 수 있는 바이오 융・복합 핵심 원천기술 분야를 지원하고 있다. 2022년 말, 12대 국가전략기술 중 첨단바이오 분야를 지정한 바 있으며, 이중 세부 중점기술로서 합성생물학, 유전자・세포 치료 등을 차세대 바이오 분야에서 지원하고 있다.
특히 유전체 편집・제어・복원 기반 기술의 발전으로 유전체의 해독에서 합성으로 패러다임이 전환되고 있고, 또한 합성생물학 기술 확보를 위한 국가 바이오파운드리 인프라 구축 등을 통해 국가 간 경쟁이 치열해진 국제환경 속에서 미래 바이오산업 주도권을 선점하기 위해 육성전략을 수립 중이다. 또한 바이오 데이터를 활용한 실증사례를 발굴하여, 데이터 구축부터 활용까지 선순환 구조를 구축하도록 노력하고 있다. 특히 주요 질환 및 천연물 분야에서 바이오 빅데이터를 수집하고, 이를 바탕으로 AI 모델을 개발하여 진단・예측 기술 및 치료제 개발에 기여하도록 지원 중이다.
이러한 첨단바이오 분야 내 세부 중점기술 분야의 육성을 통해 향후 바이오 기술혁신을 촉진하고 다양한 산업 부문의 혁신을 가속화 할 수 있을 것으로 기대하고 있다.
(8) 바이오의료 창업・사업화 지원 분야
과기정통부는 바이오 기술이 창업, 성장, 재투자로 선순환이 될 수 있도록 바이오 발전 생태계를 조성하기 위해 다각적인 노력을 기울이고 있다. 예컨대 바이오 아이코어 ・코어퍼실리티 사업 지원을 통해 유망 바이오 기초・원천기술의 빠른 시장 진입을 촉진하고 있으며 혁신 기술의 규제 지체에 빠르게 대응하기 위해 규제과학지원 플랫폼을 구축하였다.
또 2023년에는 전국 6개 병원에 혁신형 미래 의료 연구센터를 구축하여 의사 과학자의 안정적인 연구환경 조성과 임상 현장에 적용할 수 있는 중개연구를 지원할 예정이다.
[표 2-4] 과기정통부 바이오 분야 연구개발사업 추진현황(2022~2023)
(단위: 백만 원)
|
지원 분야 |
세부 사업명 |
’22년 예산 |
’23년 예산 |
비고 |
|
신약 분야 |
바이오의료기술_신약개발 |
32,930 |
6,233 |
|
|
국가신약개발사업(다부처) |
46,118 |
37,085 |
|
|
|
인공지능 활용 혁신신약 발굴 |
1,653 |
6,800 |
‘22년 신규 |
|
|
혁신신약 기초기반 기술개발사업 |
3,000 |
7,050 |
‘22년 신규 |
|
|
뇌과학 분야 |
뇌과학 원천기술개발 |
13,611 |
4,881 |
|
|
미래 뇌융합 기술개발 |
11,289 |
10,724 |
|
|
|
치매 극복 연구개발 |
11,242 |
13,404 |
|
|
|
뇌질환 극복연구 |
9,500 |
9,667 |
|
|
|
뇌기능 규명・조절기술 개발 |
7,200 |
9,600 |
‘22년 신규 |
|
|
전자약 기술개발 |
2,400 |
4,100 |
‘22년 신규 |
|
|
뇌과학 선도융합 기술개발 |
- |
6,800 |
‘23년 신규 |
|
|
감염병 분야 |
미래 감염병 기술개발 |
33,070 |
33,162 |
|
|
신변종 감염병 대응 플랫폼 핵심기술개발 |
11,330 |
13,600 |
|
|
|
의료기기 분야 |
인공지능 바이오로봇 의료융합사업 |
2,140 |
- |
|
|
범부처 전주기 의료기기 연구개발(다부처) |
56,823 |
65,624 |
|
|
|
차세대 의료기술 개발 |
4,200 |
1,800 |
|
|
|
재생의료 분야 |
바이오의료기술_줄기세포/조직재생 |
14,195 |
10,580 |
|
|
범부처 재생의료 기술개발(다부처) |
19,051 |
29,150 |
|
|
|
바이오의료기술_줄기세포 ATLAS기반 난치성질환 치료기술개발 |
- |
4,500 |
’23년 신규 |
|
|
세포기반 인골혈액(적혈구및혈소판)제조 및 실증 플랫폼 기술개발사업 |
- |
1,925 |
’23년 신규 |
|
|
GW바이오 분야 |
전통 천연물 기반 유전자 동의보감 |
6,600 |
- |
|
|
첨단 그린・바이오(GW) |
24,166 |
21,883 |
|
|
|
창업・사업화 지원 분야 |
미래의료혁신 |
25,672 |
43,692 |
|
|
질병중심 중개연구 |
2,400 |
2,400 |
|
|
|
차세대 바이오 분야 |
차세대 바이오 기술개발 |
64,600 |
75,946 |
|
|
바이오융복합 기술개발 |
5,500 |
4,000 |
|
|
|
오믹스 기반 정밀의료 기술개발 |
6,000 |
6,000 |
|
|
|
바이오혁신 기반조성 |
13,604 |
7,033 |
|
|
|
한의디지털융합기술개발사업(다부처) |
- |
2,250 |
’23년 신규 |
|
|
마이크로바이옴 차세대치료 원천기술개발 |
- |
5,550 |
’23년 신규 |
|
|
연구자원 선진화 분야 |
포스트게놈 다부처유전체사업 |
2,206 |
- |
’22년 종료 |
|
데이터기반 디지털 바이오 선도사업 |
- |
3,700 |
’23년 신규 |
|
|
다부처 국가생명연구자원 선진화 사업 |
86,080 |
66,842 |
’21년 개편 |
|
|
합계 |
516,580 |
515,981 |
|
|
출처: 과학기술정보통신부
라. 향후 계획
과기정통부는 국가 생명공학 분야의 총괄부처로서 관련 핵심 원천기술을 확보하고 적극적인 R&D 투자와 정책 지원으로 바이오경제 시대를 준비하고 있다.
먼저 4차 생명공학육성 기본계획(2023∼2032) 및 ‘3차 뇌연구촉진 기본계획(2023∼2032)’ 수립에 따라 연도별 시행계획을 수립하여 이행실적과 세부 실행 계획을 점검할 계획이다. 국가전략기술인 첨단바이오 분야의 경우 생산성을 향상을 위한 디지털 융합형 인프라 구축(바이오파운드리, 바이오데이터 스테이션 등), 핵심기술(유전자 편집 및 제어, 줄기세포 등)의 확보, 의사과학자 양성(미래의료연구센터 선정) 및 신종 감염병 등을 선제적으로 대응하고자 한다.
디지털바이오 혁신전략 후속조치로 합성생물학과 CAR, 마이크로바이옴 등 디지털 바이오 핵심기술 개발을 위한 신규 예타 사업을 기획・추진하고 있다.
2. 생명공학산업 육성
가. 개요
(1) 정의와 분야
생명공학산업(바이오산업)은 생명공학 기술(Biotechnology)을 기반으로 생물체의 기능과 정보를 활용하여 제품 및 서비스 등 다양한 고부가가치를 생산하는 산업을 의미한다.
생물체의 기능을 이용하여 제품을 만들거나 유전적 구조를 변형시켜 새로운 특성을 나타내게 하는 생명공학기술은 제약 산업, 농업, 화학 산업 등에 직접 응용될 뿐만 아니라 IT・NT 등의 기술과 융합하면서 산업적 적용 범위가 확대되거나 새로운 산업으로 발전되고 있다. 특히, 최근 유전자진단・분석기술, 생체신호 측정기술 등 다양한 생물체 분석 및 진단기술 발전과 함께 빅데이터 저장・분석기술, 인공지능(AI) 등 디지털 기술의 급격한 발전으로 개인 맞춤형 치료・건강관리, 급성 감염병 질환 진단, 신약개발 예측 등 새로운 제품과 서비스를 제공하는 신산업이 빠르게 등장하고 있다. 또한 공급망 자립화, 탄소저감・순환 등의 사회문제 해결을 위한 생명공학기술 기반의 산업이 주목받고 있다.
생명공학산업은 일반적으로 분야에 따라 의약바이오(의약품 등), 산업바이오(바이오 화학제품 등), 그린바이오(유전자변형생물체 등), 융합바이오(디지털 헬스케어 등)로 분류하고 있다.
(2) 생명공학산업의 육성 필요성
생명공학산업은 의약, 환경, 식품, 에너지, 농업, 해양 등 산업 전반에 걸쳐 성장을 주도함과 동시에, 건강・식량・환경 문제 등 인류 난제를 해결함으로써 삶의 질을 향상시킬 수 있는 유망산업으로 성장하고 있다. 그러나 다른 산업과 달리 생명공학산업은 연구개발 중심의 기술집약적 산업으로 생명공학기술에 대한 기초연구에서부터 신제품을 출시하는 산업화에 성공하기까지는 소요 기간이 길고 개발비용도 큰 반면 성공 확률은 낮아 정부의 전략적 지원이 필요하다. 이러한 이유로 미국, 유럽, 일본, 중국 등 주요국들은 생명공학산업을 핵심 투자 분야로 선정하여 산업화를 위한 중장기 전략 및 계획을 수립하고 집중 지원하고 있다.
전 세계적인 인구 고령화와 건강에 대한 수요 증가를 고려하였을 때 생명공학 산업은 시장이 빠르게 확대되고 있으며, 특히 코로나19 팬데믹 상황에서는 국민 건강과 안전에 매우 중요한 산업으로 발전되고 있다. 이에 불확실한 미래와 성장 가능성 등을 고려하여 적극적인 투자와 연계된 고용 창출 효과가 매우 큰 미래 산업으로 각광받고 있다. 이에 우리 정부는 첨단바이오 분야를 경제・외교・안보적 가치가 높은 12대 국가전략 분야로 지정하고 적극 육성하고자 노력하고 있다. 특히 인공지능, 빅데이터 등 첨단디지털 기술과 연계하여 생명공학 분야 기술혁신을 가속화하는데 집중할 계획이다.
나. 추진 경과
산업통상자원부는 과거 중기거점기술개발사업, 성장동력기술개발사업, 차세대신기술개발사업, 전략기술개발사업 등으로 분산되어 있던 R&D 사업구조를 2008년부터 통합하였고, 생명공학산업 분야의 R&D도 바이오의료기기산업핵심기술개발사업으로 일원화하여 운영하였다. 바이오의료기기산업핵심기술개발사업은 산업통상자원부의 산업기술혁신계획(5개년), 산업기술 R&D 투자전략 로드맵 등에 기반한 하향식(Top-down) 방식과 함께 정기・상시 기술수요조사에 기반한 상향식(Bottom-up) 방식을 동시에 고려하여 추진하는 것이 큰 특징이다.
2016년부터는 바이오 분야와 의료기기 분야의 특성과 전문성을 고려하여 바이오의료기기산업핵심기술개발사업을 바이오산업핵심기술개발사업과 전자시스템산업핵심기술개발사업으로 분리하여 운영하였다. 2019년 바이오산업핵심기술개발사업은 일몰관리혁신 대상사업으로 지정되었고, 전자시스템산업핵심기술개발사업은 범부처의료기기기술개발사업 추진에 따라서 사업 일몰이 확정되었다. 2020년부터 창의산업미래성장동력사업과 통합하여 바이오산업기술개발사업을 운영 중이다.
또한 산업통상자원부는 생명공학산업에 대한 R&D 지원과 함께 생명공학기술의 산업화를 촉진하고 지속적인 산업 성장의 생태계를 구축하기 위해 2016년 유망바이오 사업화 촉진사업을 신설하여 바이오벤처 비즈니스 활성화에 필수요소인 창업 활성화, 투자 유치, 기술사업화, 글로벌 파트너십을 지원하기 시작하였다. 2020년부터는 바이오의약품 원부자재 및 장비 국산화를 위하여 바이오 생산 고도화사업을 통해서 바이오의약품 소재・부품・장비 수요・공급 기업 간의 연대협력을 활성화하는 등 바이오 소부장(소재, 부품, 장비)을 본격적으로 지원하였으며, 2022년부터는 백신원부자재생산고도화기술개발사업을 통해서 mRNA 백신 생산 및 공정 자립화를 위한 지원을 시작하였다. 2022년부터 면역계 질환, 고위험 감염질환, 신경 질환 등의 다양한 질병에 대해 분변미생물이식(Fecal Microbiota Transplantation, FMT) 관련 기술 혹은 FMT 기반 휴먼마이크로바이옴을 활용하여 (비)임상시험, 작용기전 등 치료제 개발 및 질병 간의 연계성 분석, 제조공정 등의 기술개발을 위해 휴먼마이크로바이옴 의약품 제품화사업을 지원하기 시작하였다. 2023년부터는 글로벌 수준에 부합된 의약품 제조 및 생산과 품질고도화 기술 확보를 위해 디지털, ICT 융복합 기술기반의 의약품 제조공정을 혁신하고 지능화 생산플랫폼을 구축하는 사업도 지원 중에 있다.
이 밖에도 기존 벤처캐피털(VC)과 정책 펀드가 창업 초기 바이오벤처에 대한 투자가 상대적으로 미미했다는 한계를 극복하고 우수 생명공학기술이 사업화로 이어지도록 지원하기 위한 초기 바이오기업 전문펀드를 2016년 말 조성하고 2017년부터 본격적인 투자에 착수했다. 그 뿐만 아니라 바이오기업들의 성장단계별 IR을 개최하여 투자 유치를 지원하고, 예비창업자 등을 대상으로 교육 및 멘토링프로그램 등을 운영하고 있다.
다. 주요 정책 및 사업
(1) 생명공학산업 분아별 사업화 촉진 R&D 지원
(가) 바이오산업 기술개발
산업통상자원부는 세계 최고 수준의 산업화 핵심기술을 개발하고 이를 기반으로 한 글로벌 사업화 제품 출시 등 국내 바이오산업 활성화를 위하여 선택과 집중을 통해 산업바이오, 융합바이오, 의약바이오 등 분야별 사업화 촉진을 위한 기술개발을 지원하고 있다. 바이오산업기술개발사업은 국가 성장전략 기반 바이오헬스 분야의 산업화 핵심・원천기술 개발을 집중 지원하여 미래 신산업 육성 및 주력 기간산업 경쟁력 제고를 목적으로 한다.
세부적으로 맞춤형 진단・치료제품 분야에서는 글로벌 선도 및 제품화를 위한 융복합 차세대 의약품 개발 및 제조・생산 혁신시스템 구축을 위해 차세대 의약품 제조 및 생산혁신 기술개발을 지원한다. 또한, 급성 감염병의 상시적, 선제적 대응을 위해 현장 맞춤형 다중 분석 및 진단, 모니터링 체계 구축을 지원한다. 이와 더불어, 글로벌 경쟁력 강화를 위한 맞춤형 진단치료제품 등 첨단바이오 분야의 산업적 활용 평가 및 분석 시스템 기술개발을 지원한다.
첨단바이오 신소재 분야에서는 탄소중립 실천을 위한 바이오매스 기반 고분자 소재 제품의 산업 활용 및 고부가가치화를 지원하며, 국민편익 증진 및 사회문제 해결을 위한 고품질, 고효능 생리활성소재의 산업적 생산기술 확보 및 제품화, 수요자 맞춤형 생체 친화적 의료소재 및 부품의 제품화를 위한 기술개발을 지원한다.
디지털 헬스케어 분야에서는 헬스케어 산업의 신성장 분야인 ‘디지털치료기기’의 경쟁력 강화를 위한 디지털치료기기 제품화 기술개발과 데이터 기반 디지털 헬스케어 기술 및 서비스 개발, 기존 기술을 활용한 BM 창출 중심의 실증화, 비대면 실시간 협진 시스템 및 디지털 병원 플랫폼 개발 등을 지원한다.
사람과 같이 서식하는 미생물과 미생물의 유전체 총체를 의미하는 휴먼마이크로바이옴은 다양한 질환 분야에 적용이 가능한 것으로 알려져 있어 다양한 연구 및 제품화가 진행 중으로, 현대 의학으로 치료가 어려운 면역계 질환, 감염성 질환 등 기존 의약품의 한계를 극복할 새로운 대안으로 각광받고 있다. 이에, 휴먼마이크로바이옴 의약품 제품화 분야에서는 휴먼마이크로바이옴 기반의 면역계 질환, 고위험 감염질환, 정신질환 등의 난치성 질환 중심 치료제 개발 및 이와 연계된 제조 기술개발을 지원한다.
(나) 백신원부자재 생산 고도화
코로나19 이후 mRNA의 기본 단위인 뉴클레오타이드(nucleotide)는 백신 생산량이 급증하면서 그 수요가 증가하고 있으며 코로나19 진단키트에도 활용되고 있다. 국내 뉴클레오타이드 합성 및 제조, 이를 활용한 치료제 개발 분야는 바이오의약 및 생명공학산업에서의 중요성이 확대되고 있어 국내 R&D 투자도 늘어날 전망이다.
코로나19 팬데믹 상황에서 mRNA 백신과 이와 연계된 제조공정 시스템 확보는 매우 중요하게 인식되었다. 따라서 포스트 코로나 시대를 맞이하여 mRNA 백신 개발과 생산을 위하여 핵심 원부자재 제조혁신을 통한 경쟁력 확보와 생산 공정 고도화가 필요하며, 관련 기술개발 지원을 통해 향후 또다른 팬데믹 발생, 글로벌 수급 불안정 등의 비상사태에서 안정적인 국내 의약품 확보의 기반이 될 것으로 기대된다.
이에 산업통상자원부는 cGMP급으로 mRNA 백신 원료용 핵심소재인 뉴클레오타이드, 캡핑소재, 필수 효소, 일회용 소재 및 정제용 레진, 백신 전달지질 등의 생산기술 개발을 지원한다. 또한 mRNA 백신 생산을 위한 핵심 공정인 지질나노입자 생산 공정 및 장비, 백신 제형 안정화, 제품 품질 및 효능 평가기술 등과 관련된 상용화 기술개발도 지원한다.
(다) 디지털전환 기반 의약품 제조공정 혁신
국내 제약바이오 분야에서 의약품 원료 및 제조의 대부분을 수입에 의존함에 따라 국내 원료의약품 자급률은 약 14% 정도의 낮은 수준을 차지하고 있다. 선진국은 의약품 제조혁신을 위해 NIIMBL(美), MMIC(英), SSPC(愛) 등의 제조혁신 기술센터를 신설하여 운영 중으로 제조혁신 중심의 생산 고도화에 집중하며 세계시장 선도 및 기술패권을 경쟁하고 있다. 이에 글로벌 의약품 시장 경쟁력의 핵심인 가격 및 품질 경쟁력 확보를 위해서는 제조기술의 혁신을 통해 제조비용 절감과 품질고도화를 동시에 만족시켜야 할 필요성이 있으나, 국내 제약바이오 생산 및 제조혁신 분야 기술개발을 위한 정부 지원은 미흡한 상황이다.
산업통상자원부는 신성장 산업으로 부상하는 디지털바이오 분야인 AI・빅데이터・디지털전환 등 ICT 기반 기술과 의약품 품질고도화 기술이 융합된 의약품 제조공정혁신 기술 구축을 위한 기술개발을 지원하고 있다. 의약품 연속공정 자동화 생산 장비 및 설비시스템을 개발, 이를 운용할 수 있는 실시간 품질 및 공정모니터링, 자동화 제어설계 기술, DB수집 및 예측 지능형 SW기술과 이를 활용한 제품 실증까지 집약된 의약품 제조혁신 지능형 연속생산 플랫폼 기술개발을 지원한다.
(라) 바이오매스 기반 탄소중립형 바이오플라스틱 제품화
온실가스 감축과 환경친화적 제품에 대한 기업의 책임이 커지고 인체에 무해한 친환경 소재에 대한 국민들의 관심이 급격히 커지면서 친환경 바이오화학 제품에 대한 중요성이 더욱 커지고 있다. 바이오화학 산업은 기존 석유화학 산업을 보완할 수 있어 높은 기술적 수요가 있으나, 바이오소재 개발, 공정 개발 등에 대한 투자 부담으로 인해 민간의 자발적인 투자는 여전히 미흡한 상황이다.
이에 산업통상자원부는 친환경적인 바이오화학 제품개발 및 공정 기술 확보, 실증 체계를 구축하여 화학공정 기반기술을 바이오공정 기반기술로의 전환을 유도하고 있다. 이에 기존의 석유화학 유래의 PBS, PGA, PBAT 등의 제품들을 바이오매스 유래 원천 생분해성 미생물 플라스틱 소재의 생산기술 및 응용 제품화 기술개발로 지원하여 석유계 플라스틱 대체 및 생분해성 바이오플라스틱 제조 플랫폼 기술 및 기능 고도화를 유도하고, 탄소중립형 바이오플라스틱 제조기술을 확보코자 한다.
(마) 다부처 협력 기술개발
생명공학 분야의 기술개발은 급변하는 외부 환경변화, 복잡・다양한 수요 증가에 대한 적절한 대응 및 부처별 연구개발 투자 효과의 최대화를 위해 복수의 부처가 참여하는 다부처 협력 R&D의 형태로 다수 지원되고 있다.
산업통상자원부는 국내 제약・바이오산업의 글로벌 경쟁력 강화와 국민건강의 필수조건인 의약주권 확보를 위해 제약기업과 학교・연구소・병원이 오픈 이노베이션 전략을 바탕으로 신약개발 전주기 단계를 지원하는 범부처 국가신약개발사업을 지원한다.
또한 국제적 동물 시험 규제 등 제약 산업의 패러다임 변화에 따라 3D 생체조직칩을 활용한 차세대 약물평가 플랫폼 구축 및 서비스 개발을 통해 신약개발 가속화, 임상시험 비용 절감 및 신산업 창출을 도모하고 있다. 이와 함께 위해성 평가심사의 진입장벽을 타파하고 유전자변형생물체(LMO) 제품화 인・허가에 능동적으로 대응할 수 있는 산업계 역량 강화를 위해 산업용 LMO 위해성 평가 및 생산 공정 이용시설 안전관리 고도화, 가이드라인 개발・배포 등을 효과적으로 지원하고 있다.
그리고 인구 고령화 추세로 현재의 헌혈기반 혈액공급 방식에 대한 지속가능성이 불투명함에 따라, 혈액수급 안정화를 위해 인공산소 운반체, 형질전환동물 기반 인공혈액, 수혈용 세포 기반 인공혈액 생산기술을 확보하고 대량생산 및 제조기반을 마련하기 위한 기술개발 지원도 준비하고 있다.
(2) 생명공학산업의 사회문제 해결을 통한 지속성장 생태계 구축
(가) K-바이오 소부장 국산화 노력
바이오의약품의 대부분은 동물세포 배양을 통해 생산되고 있으며, 세포 배양과정에서 배지가 영양분으로 사용되나 현재는 국내 배지 생산기업이 없어 전량 수입에 의존하고 있다.
산업통상자원부는 2020년 9월부터 ‘바이오 소부장 연대협력 협의체’를 구성하고 2020년부터 5년간 16개 바이오 소부장 핵심 품목 국산화를 위한 기술개발을 지원하고 있다. 동 협의체에 소속된 아미코젠 사는 국내 최초로 세포배양 배지 생산에 도전하는 기업으로 바이오의약품 배지 국산화 연구개발 지원을 받아 세포배양 배지 생산 공정 기술을 개발하고 있으며, 결과물을 적용하여 GMP 수준의 배지 생산 공장 건설에 적용하여 국내 세포배양 배지의 안정적인 수급 여건을 마련할 계획이다.
세포배양 배지 외에도 바이오 소부장 연구개발 지원을 받은 국내 기업들은 일회용 세포배양백, 바이오의약품 세균 진단도구 등의 품목에서도 국산화 성과를 거두고 있다. 이셀 사는 미국・독일 등 소수의 기업에 의존하고 있는 일회용 세포배양백 국산화에 성공하여 국내 제약사에 제품을 납품하고 있으며, 셀세이프 사는 첨단바이오의약품 생산과정에서 발생하는 오염원인 마이코플라즈마를 측정하는 진단도구를 개발하고 국내 수요기업과 납품 계약을 체결하였다.
(나) 백신 원부자재 국내 공급망 강화를 위한 민관 역량 결집
산업통상자원부는 2022년 1월에 보건복지부와 함께 백신 원부자재・장비 상생 협력 협의체를 개최하였다. 이는 코로나19와 같은 신종 감염병 대응을 위해 국내 백신 산업의 경쟁력을 강화하고 해외 의존도가 높은 원부자재와 장비에 대한 국내 기술력 확보 방안을 모색하기 위함이었다. 동 협의체는 삼성바이오로직스, 셀트리온 등의 백신 기업과 위아텍, 이셀 등의 원부자재・장비기업 등으로 구성되어 있으며 백신 기업과 원부자재・장비 기업이 제품개발 초기 단계부터 협력하여 수입 의존도가 높은 품목에 대한 국내 기술을 확보하고 국산 제품의 활용을 확대하는 것을 목적으로 한다. 그동안 민관이 합심하여 일본 수출규제에 대응했던 경험을 바탕으로 국내 바이오 공급 및 수요기업들과의 지속적인 소통 및 협력을 통해 백신 소부장 공급망을 강화하여 튼튼한 백신산업 생태계를 만들어 나갈 예정이다.
라. 향후 계획
산업통상자원부는 질병 문제, 기후위기, 식량・에너지난, 환경 문제 기반기술로써 생명공학기술 기반으로 국내 산업 전반의 혁신과 성장동력으로 본격 활용될 수 있는 “바이오경제”로의 전환을 위해 바이오헬스 산업을 중점으로 지원할 계획이다. 바이오의약품, 백신 소재, 마이크로바이옴 제품 등의 바이오 치료용 소재와 바이오공정 기반의 고부가가치 생리활성 소재 및 식용 소재 제품화, 석유화학 유래 대체 가능한 친환경적인 바이오플라스틱 및 고분자 소재 등의 개발을 지원하여 국내 바이오기업들의 산업화 기반 조성 및 글로벌 경쟁력 제고 확보를 위해 지속적으로 지원할 계획이다. 또한 혁신 바이오 소재용 제조 및 생산 장비 개발, 바이오 제품들의 디지털 제조공정 기술개발 등으로 바이오경제를 뒷받침할 첨단 제조기반을 구축할 예정이다.
그동안의 국내 바이오 소부장에 대한 정부의 노력에도 불구하고 여전히 수요기업과 공급기업 간의 공급망 형성 부족 등이 발생하는 고질적인 문제점 해결을 위해 국내 바이오의약품 및 첨단바이오의약품 제조에 필요한 핵심 원부자재의 자립화와 글로벌 진출 확대를 위한 기술개발을 지원할 예정이다.
코로나19 팬데믹 이후 상시화된 감염병 위기 대응의 필요성, 미-중 패권 경쟁의 확대, 미국 바이든 행정부의 의약품 공급망 행정명령 등 바이오산업의 글로벌 환경변화로 인해 첨단바이오의약품의 생산성 향상, 가격 및 품질 경쟁력 강화 필요성이 증가하고 있다. 따라서 국내 제약바이오기업들의 글로벌 수준의 의약품 제조 및 생산, 품질관리 및 제품화를 위한 제조혁신 기술개발과 신약개발의 효율성 증대 및 대체실험법 확산을 위한 평가 기기 및 장비 등의 첨단바이오제품 기술개발을 지원할 계획이다.
그뿐만 아니라, 탄소중립 2050 장기전략에 부합하고 환경 문제를 해결하기 위하여 바이오기술 기반의 친환경 생분해성 바이오플라스틱, 차세대 고부가가치 석유계 대체 산업소재 및 제품화 등을 개발하고 탄소순환 전주기 평가시스템(LCA) 구축을 지원할 계획이다.
3. 생명공학 기초과학진흥
가. 개요
디지털 기술의 발달로 생명공학 분야에서도 최근 인공지능, 빅데이터 기술을 포함한 첨단 ICT와의 접목을 통한 디지털바이오 시대가 본격적으로 열리고 있다. 인구 고령화 시대를 맞아 예방 중심의 건강관리에 관심이 높아지면서 생물학, 생화학, 생리학, 생물물리학, 분자생물학 등 관련 생명과학의 기초연구로부터 도출된 성과가 관련 산업으로 연계되어 헬스케어 시장이 폭발적으로 성장하고 있다.
유전체, 단백질체, 세포체, 대사체, 시스템 생물, 구조생물, 뇌과학, 노화 등 분야별 기초생명과학의 성과는 디지털바이오 시대를 맞아 줄기세포치료제, 차세대 면역치료, 신약개발 등에 소요되는 바이오 연구 개발의 기간과 비용을 획기적으로 줄일 수 있게 되었다.
따라서 미래 전략 분야에 대한 바이오 핵심 기초원천기술의 개발 확보 및 선진화 기반 확충을 위해 추진되고 있는 바이오・의료기술개발사업 및 첨단의료기반기술개발 등과 같은 정부 지원 연구개발사업도 기초생명과학으로의 투자가 선행되어야 글로벌 시대의 생명공학 변화에 부응하여 혁신 성장을 기대할 수 있을 것으로 보인다.
나. 추진 경과
정부는 기초연구의 진흥을 위한 여건 조성을 위하여 기초연구에 관하여 ①대학교수, 연구원 등 관계 전문가의 연수 및 연구비 지원, ②석사 및 박사 과정 학생의 연구・장학금 지원, ③연구교수(연구조교 포함) 제도, 교수의 연구휴가제도, 객원교수제도 및 객원연구원제도의 활용, ④대학의 연구시설 및 기자재 지원, ⑤대학부설연구소 및 우수연구집단 형성 지원, ⑥대학, 국공립 연구기관, 정부출연연구기관, 기업부설 연구소와의 공동연구, 인력교류, 연구 시설・장비 공동 활용 등 산업계・학계 및 연구소 간의 교류 촉진, ⑦기업 등의 대학 기초연구 지원 촉진, ⑧그 밖에 기초연구 환경 조성 및 기초연구 기반 구축에 필요한 사항 등을 의무적으로 마련하도록 기초연구진흥 및 기술개발지원에 관한 법률 제7조에 명시하고 있다. 또한 동 법에 따라, 기초연구진흥종합계획 및 시행계획을 수립하여 국가의 기초연구진흥을 위한 정책적 노력을 계속해 나가고 있다.
2008년 2월 교육인적자원부와 과학기술부의 통합으로 교육과학기술부가 출범하여 기초연구에 관한 다양한 정책이 일관성 있게 추진될 수 있는 기회를 제공하였다. 2013년 미래창조과학부(現 과학기술정보통신부)의 출범으로 창조적 기초연구 추진전략이 마련되어 상상력・창의력을 기반으로 한 과학기술과 ICT의 융합을 바탕으로 기초연구진흥을 추진하였다.
다. 주요 정책
제4차 기초연구진흥종합계획(2018∼2022)에 의거하여, 연구자의 창의적 아이디어를 지원하는 연구자 주도 기초연구지원 예산을 2017년 1조 2,600억 원의 2배가량인 2조 5,500억 원으로 2022년에 확대하였다.
제4차 기초연구진흥종합계획의 4대 전략 및 18대 중점 추진과제에 따라 다양한 사업 신설 및 제도 개선 등과 함께 기초연구 지원을 확대하고 있다. 연구자 맞춤형 지원 확대로 연구자가 보다 창의・도전적 연구에 매진할 수 있는 연구자 친화적 연구환경을 조성하고 있다.
특히, ‘연구자 수요를 반영한 기초연구사업 지원 개편’을 추진과제로 제시하며 ‘분야별 지원체계’로의 단계적 전환을 추진하여, 2020년 시범적용에서 2022년 전 분야 시행을 진행하였다. 이 과정에서 2021년부터 2022년도에 걸쳐 생명과학 분야의 기초연구 역량강화를 위한 고도화 기획과제를 운영하여 분야별 기초연구 현황, 연구역량 분석 등을 통해 특성에 맞는 역량강화를 위한 기초데이터를 분석하였다. 이를 토대로 생명과학 분야의 특성에 따른 과학 로드맵을 수립 및 보완이 이루어졌으며, 최근 연구계 수요 증가를 고려한 중장기 포트폴리오를 수립하여 생명과학 맞춤형 사업으로 연구 기간, 연구비, 과제 수 등을 사업별로 달리하는 맞춤형 지원체계를 운영하였다. 향후 생명공학 분야 전반을 고려한 예산의 효율적 배분을 위한 지속적인 노력을 통해 보다 체계화되고 고도화된 분야별 지원체계 운영을 통해 우수한 연구 성과 달성이 가능할 것으로 기대된다.
라. 주요 사업
과학기술정보통신부와 한국연구재단은 우리나라 과학기술 연구력의 근본이라 할 수 있는 기초연구를 중점 지원하고 있다. 기초연구지원은 개인 및 소규모 공동연구를 지원하는 ‘개인연구’, 우수 연구 인력을 조직화하여 지원하는 ‘집단연구’, 전문 연구정보 및 연구 인프라를 지원하는 ‘기반 구축’으로 구분하여 연구자 역량단계 및 참여연구원 규모에 따른 세부 프로그램을 통해 추진되고 있다.
생명공학 분야 기초연구는 한국연구재단 기초연구본부의 생명과학단, 의약학단, ICT・융합연구단에서 지원하고 있으며, 대단위 국책연구사업의 경우 한국연구재단 국책연구본부 신약단, 차세대바이오단, 뇌・첨단의공학단에서 지원하고 있다. 이 중에서도 생명공학 분야는 기초연구본부 생명과학단과 관련성이 높으며, ① 분자생물학, 신경생물학, 발생생물학, 유전자발현, 면역학 등의 분자생명분야, ② 세포생물학, 유전학, 생화학, 생리학, 식물학, 미생물학 등의 기초생명 분야, ③ 생물공학, 식량작물 및 원예작물, 동물 자원학, 수의학, 식품학 등의 기반생명 분야를 지원하고 있다. 이를 통해 생명과학의 메커니즘 연구를 집중 수행하는 생명 과학자를 양성하고, 노벨상 수상 수준으로 연구역량을 제고하며, 관련 연구 기반을 확충하여 미래 첨단 기초생명과학 연구를 선점하고자 한다.
(1) 기초연구지원 사업 현황
[표 2-5] 과학기술정보통신부 기초연구지원 사업내용(2022∼2023)
(단위: 백만 원)
|
사업 |
2022년 예산(A) |
2023년 예산(B) |
증감액(B-A) |
증감률 |
|||
|
합계 |
2,013,612 |
2,062,979 |
49,367 |
2.5% |
|||
|
【개인연구】 |
1,628,330 |
1,636,728 |
8,398 |
0.5% |
|||
|
우수 연구 |
• 리더연구 |
73,055 |
77,892 |
4,837 |
6.6% |
||
|
• 중견연구 |
972,404 |
996,319 |
23,915 |
2.5% |
|||
|
• 신진 연구 |
소계 |
310,902 |
310,111 |
△791 |
△0.3% |
||
|
- 우수신진 (최초혁신실험실 포함) |
239,798 |
216,383 |
△23,415 |
△9.8% |
|||
|
- 세종과학 펠로우십 |
일반트랙 |
71,104 |
87,053 |
15,949 |
22.4% |
||
|
국외연수트랙 |
- |
3,675 |
순증(신규사업 신설) |
||||
|
- 한우물파기 기초연구 |
- |
3,000 |
순증(신규사업 신설) |
||||
|
생애 기본연구 |
• 재도약연구 |
2,500 |
- |
기본연구사업으로 통합 운영 |
|||
|
• 기본연구 |
233,015 |
216,873 |
△16,142 |
△6.9% |
|||
|
• 생애첫연구 |
36,454 |
35,533 |
△921 |
△2.5% |
|||
|
【집단연구】 |
373,083 |
413,396 |
40,313 |
10.8% |
|||
|
• 선도연구센터 |
199,774 |
234,841 |
35,067 |
17.6% |
|||
|
-이학 분야(SRC) |
49,650 |
51,990 |
2,340 |
4.7% |
|||
|
-공학 분야(ERC) |
69,174 |
73,400 |
4,226 |
6.1% |
|||
|
-기초의과학 분야(MRC) |
49,450 |
52,951 |
3,501 |
7.1% |
|||
|
-융합 분야(CRC) |
9,000 |
14,500 |
5,500 |
61.1% |
|||
|
-지역특화 분야(RLRC) |
22,500 |
30,750 |
8,250 |
36.7% |
|||
|
-혁신연구센터(IRC) |
- |
11,250 |
순증(신규사업 신설) |
||||
|
• 기초연구실 |
173,309 |
178,555 |
5,246 |
3.0% |
|||
|
【기반구축】 |
12,199 |
12,855 |
656 |
5.4% |
|||
|
• 전문연구정보활용 |
2,400 |
1,950 |
△450 |
△18.8% |
|||
|
• 기초연구 실험데이터 글로벌허브구축 |
3,120 |
3,020 |
△100 |
△3.2% |
|||
|
• 유럽 핵입자 물리연구소(CERN)협력 |
5,888 |
7,094 |
1,206 |
20.5% |
|||
|
• 해외 대형 연구시설 활용연구지원 |
791 |
791 |
- |
- |
|||
출처: 과학기술정보통신부
과학기술정보통신부는 2016년부터 연구자 맞춤형 지원제도를 도입하여 연구자가 필요한 연구비, 연구 기간을 신청할 수 있도록 유연하게 개선하였다. 개선된 지원제도 내에서 연구자의 연구역량에 따른 성장단계별로 연구자 중심의 생애 전주기 체계 구축을 위한 기초연구를 지원하고 있다. 2019년부터는 개인기초연구사업을 우수연구와 생애 기본연구 유형으로 분류하여, 우수연구자 육성에서 글로벌 리더연구자 심화연구까지 지원하는 우수연구(신진연구 → 중견연구 → 리더연구)를 운영하고, 신규 임용 및 초기 임용된 전임교원 지원과 연구자 단절을 방지하기 위한 연구 안전망 구축을 위한 생애 기본연구(생애첫연구, 재도약연구, 기본연구)를 통해 연구자 중심의 균형적 연구 생태계 구축을 위해 노력하고 있다.
나아가 2021년에 세종과학펠로우십을 신설하여 상대적으로 연구환경이 열악한 비전임 연구자 대상으로 안정적으로 연구를 수행할 수 있는 환경을 조성하였다. 집단연구는 소규모 집단연구로 볼 수 있는 기초연구실사업(3∼4인)과 선도연구센터(10인 이내) 등 규모별로 지원하고 있으며, 기초연구기반구축 사업을 통해 연구자가 국내・외 주요 연구 정보에 접근 및 활용하도록 지원하고 있다.
2022년에는 제4차 진흥종합계획의 목표치였던 기초연구사업 예산 2조 5,500억 원 중 과학기술정보통신부에서 약 2조 100억 원을 지원함으로써, 약 78.5% 수준의 폭넓은 지원을 이어오고 있다.
(2) 생명공학 분야 사업 지원 현황
2021년 정부에서 이공 분야에 지원하는 총 R&D 투자액 중 생명공학 분야 범주에 속하는 생명과학, 농림수산, 보건의료 부문에 지원되는 총 투자 금액은 5조 595억 원으로 정부 R&D 투자액의 20.1%를 차지하고 있다.
2021년 정부 투자의 경우 2020년 투자 4조 4,037억 원 대비 14.9% 증가하였으며, 전 분야 평균 11.8%보다 약 3.1% 높은 증가율을 보이고 있다.
[표 2-6] 과학기술표준분류별 투자 추이(2020∼2021)
(단위: 억 원, %)
|
구분 |
2020 |
2021 |
증감 |
|||
|
금액(A) |
비중 |
금액(B) |
비중 |
금액(B-A) |
증감률 |
|
|
수학 |
1,072 |
0.5 |
1,229 |
0.5 |
157 |
14.6% |
|
물리학 |
6,723 |
3.0 |
5,341 |
2.1 |
△1,382 |
△20.6% |
|
화학 |
3,728 |
1.7 |
4,257 |
1.7 |
529 |
14.2% |
|
지구과학 |
5,087 |
2.3 |
5,810 |
2.3 |
723 |
14.2% |
|
생명과학 |
9,300 |
4.1 |
10,646 |
4.2 |
1,346 |
14.5% |
|
농림수산식품 |
13,743 |
6.1 |
15,851 |
6.3 |
2,108 |
15.3% |
|
보건의료 |
20,994 |
9.3 |
24,098 |
9.6 |
3,104 |
14.8% |
|
기계 |
41,865 |
18.6 |
43,597 |
17.4 |
1,732 |
4.1% |
|
재료 |
8,731 |
3.9 |
9,970 |
4 |
1,239 |
14.2% |
|
화공 |
5,039 |
2.2 |
5,452 |
2.2 |
413 |
8.2% |
|
전기 / 전자 |
22,142 |
9.9 |
25,384 |
10.1 |
3,242 |
14.6% |
|
정보 / 통신 |
23,880 |
10.6 |
28,074 |
11.2 |
4,194 |
17.6% |
|
에너지 / 자원 |
9,880 |
4.4 |
11,661 |
4.6 |
1,781 |
18.0% |
|
원자력 |
6,401 |
2.8 |
7,891 |
3.1 |
1,490 |
23.3% |
|
환경 |
6,062 |
2.7 |
6,853 |
2.7 |
791 |
13.0% |
|
건설 / 교통 |
8,426 |
3.8 |
9,501 |
3.8 |
1,075 |
12.8% |
|
과학기술과 인문사회 |
16,648 |
7.4 |
19,101 |
7.6 |
2,453 |
14.7% |
|
기타 |
14,960 |
6.7 |
16,555 |
6.6 |
1,595 |
10.7% |
|
합계 |
224,682 |
100 |
251,274 |
100 |
26,592 |
11.8% |
출처: KISTEP, 2021년도 국가연구개발사업 조사・분석 보고서
더불어 기초연구사업 내에서의 생명과학 분야 투자 추이를 살펴보면 앞서 언급한 분자생명, 기초생명, 기반생명 분야에 대한 투자가 2020년 3,260억 원에서 2021년 3,890억 원으로 약 18.0% 증가하였으며, 이 또한 전 분야 평균 16.4%보다 약 1.6% 높은 증가율을 보이고 있다.
|
구분 |
2020 |
2021 |
증감 |
||||
|
금액(A) |
비중 |
금액(B) |
비중 |
금액(B-A) |
증감률 |
||
|
자연과학 |
3,289 |
16.7% |
3,922 |
17.1% |
633 |
19.2% |
|
|
생명과학 |
분자생명 |
853 |
4.3% |
1,041 |
4.5% |
187 |
22.0% |
|
기초생명 |
1,258 |
6.4% |
1,512 |
6.6% |
255 |
20.3% |
|
|
기반생명 |
1,185 |
6.0% |
1,337 |
5.8% |
152 |
12.8% |
|
|
소계 |
3,296 |
16.7% |
3,890 |
17.0% |
594 |
18.0% |
|
|
의약학 |
5,002 |
25.4% |
5,556 |
24.2% |
554 |
11.1% |
|
|
공학 |
4,026 |
20.5% |
4,702 |
20.5% |
676 |
16.8% |
|
|
ICT융합분야 |
4,070 |
20.7% |
4,842 |
21.1% |
772 |
19.0% |
|
|
합계 |
19,684 |
100.0% |
22,912 |
100.0% |
3,228 |
16.4% |
|
출처: KISTEP, 2021년도 국가연구개발사업 조사・분석 보고서
2021년 중견연구 및 신진연구를 통해 신청 및 선정된 생명과학 분야별 과제 현황은 다음 표와 같다. 중견연구사업은 이공학 분야 교원(전임・비전임) 및 공공・민간연구소 연구원을 대상으로 최장 5년간 연평균 4억 원 이내를 지원하는 사업이며, 신진연구는 이공학 분야 교원 및 연구원 중 박사학위 취득 7년 이내 또는 만 39세 이하의 신진연구자를 대상으로 최장 5년간 연평균 1억 5,000만 원 이내를 지원하는 사업이다. 신진연구의 경우에는 초기 연구실 구축 등이 필요한 신진연구자 특성을 감안하여 최초혁신실험실 연구비를 별도 심사를 통해 1년간 5,000만 원∼1억 원을 추가 지원하는 사업이다.
[표 2-8] 중견연구 및 신진연구 중 생명과학 분야 중분야별 선정 현황(2021)
(단위: 건)
|
구분 |
신진연구 |
중견연구 |
|||
|
신청 과제 수 |
선정 과제 수 |
신청 과제 수 |
선정 과제 수 |
||
|
분자생명 |
감염생물학 |
9 |
3 |
16 |
10 |
|
구조생물/생물물리학 |
15 |
4 |
21 |
9 |
|
|
노화/암생물학 |
33 |
12 |
43 |
21 |
|
|
면역학 |
15 |
6 |
38 |
15 |
|
|
발생생물학 |
9 |
3 |
18 |
7 |
|
|
분자생물학 |
17 |
5 |
29 |
12 |
|
|
신경생물학 |
14 |
5 |
33 |
15 |
|
|
유전자발현 |
14 |
5 |
26 |
13 |
|
|
소계 |
126 |
43 |
224 |
102 |
|
|
기초생명 |
미생물학 |
16 |
6 |
26 |
14 |
|
분류/생태/환경생물학 |
17 |
6 |
34 |
15 |
|
|
생리학 |
23 |
9 |
30 |
15 |
|
|
생화학 |
13 |
6 |
26 |
12 |
|
|
세포생물학 |
12 |
2 |
20 |
11 |
|
|
식물학 |
12 |
3 |
23 |
12 |
|
|
유전학 |
21 |
7 |
30 |
13 |
|
|
소계 |
114 |
39 |
189 |
92 |
|
|
기반생명 |
농림생태환경 |
20 |
4 |
17 |
7 |
|
동물자원학 |
11 |
3 |
41 |
14 |
|
|
생물공학 |
24 |
5 |
36 |
12 |
|
|
수산학 |
20 |
4 |
28 |
9 |
|
|
수의학 |
25 |
6 |
31 |
11 |
|
|
식량작물/원예작물 |
30 |
7 |
57 |
18 |
|
|
식품학 |
29 |
7 |
69 |
19 |
|
|
영양학 |
12 |
3 |
23 |
9 |
|
|
응용생물화학 |
27 |
6 |
45 |
15 |
|
|
소계 |
198 |
45 |
347 |
114 |
|
|
총합계 |
438 |
127 |
760 |
308 |
|
출처: KISTEP, 2021년도 국가연구개발사업 조사・분석 보고서
마. 향후 계획
과학기술정보통신부는 연구자 수요를 반영한 기초연구사업 개편을 위한 기초연구사업 분야별 지원체계 전환을 진행하였으며, 2020년 수학 분야 시범적용을 시작으로, 2021년에는 기초・분자생명 분야적용을 시작하였다. 2022년에는 기반생명 분야까지 확대해 전 분야가 각 분야의 특성을 반영하여 기초연구사업을 운영하였다.
기초・분자생명 분야 특성을 고려한 지원체계의 원활한 시행 및 고도화를 위해 생명 분야 기획・자문위원회를 구성하고, 한국분자세포생물학회, 한국생물공학회, 한국미생물학회 등 학회 중심 연구자 의견 수렴을 지속적으로 진행하였다. 또한 ‘기초・분자생명 분야 분야별 지원체계 고도화 기획연구’를 통해 기초・분자생명 연구수행의 특성, 연구환경 및 연구인력 분석 등을 진행하였다.
분석 결과를 토대로, 기초・분자생명 분야의 평균 연구비 단가가 높은 특성을 반영하여 중견연구 유형2의 신규 과제 규모를 확대하여 지원하였으며, 기반생명 분야의 연구 인력구조에 대한 연구계의 의견을 수렴하여 우수연구 육성을 위해 리더연구 및 중견연구의 단가를 낮춰 우수연구 수혜자를 확대시키는 방향으로 지원하고 있다.
위와 같은 생명과학 분야에 대한 정부 R&D 및 기초연구사업의 투자 환경 변화와 연구인력 및 양적・질적 SCI 논문 실적 등의 분석을 진행하여, 2023년도에는 다음과 같이 기초연구사업 내 생명과학 분야 특성을 반영한 사업을 운영하고자 추진하였다.
|
사업구분 |
기초・분자생명 |
기반생명 |
수학(비교) |
||||
|
리더연구 |
연구비 |
- 연평균 직접비 6.4억 원 이내 ※ (연간 최대 6.4억 원) |
- 연평균 직접비 4억 원 이내 ※ (연간 최대 4억 원) |
- 연평균 직접비 3.2억 원 이내 ※ (연간 최대 3.2억 원) |
|||
|
연구기간 |
- 9년(3+3+3) |
- 5년(3+2) |
|||||
|
중견연구 |
연구비 |
- (유형1) 연평균 직접비 1.2억 원 이내 - (유형2) 연평균 직접비 1.2억 원 초과 2.4억 원 이내 ※ (연간 최대 2억 원) |
- (유형1) 연평균 직접비 1.2억 원 이내 - (유형2) 연평균 직접비 1.2억 원 초과 2억 원 이내 ※ (연간 최대 2억 원) |
||||
|
연구기간 |
- 1∼5년 |
- 1∼5년 |
|||||
|
우수신진연구 |
연구비 |
- 연평균 직접비 1.2억 원 이내 (연간 최대 1.2억 원 이내) (최초혁신실험실 0.5∼1억 원 추가 지원) |
- 연평균 직접비 0.8억 원 이내 (최초혁신실험실 0.5∼1억 원 추가 지원) |
||||
|
연구기간 |
- 1∼5년 |
- 1∼5년 |
|||||
출처: 2023년도 과학기술정보통신부 개인기초연구사업 신규과제 신청요강
연구계 의견 수렴 및 분야별 지원체계 운영을 위한 각종 위원회를 통한 특성화된 사업 운영뿐만 아니라, 연구계 중심으로 도출한 과학로드맵 등을 활용하여 국가 핵심전략 분야를 발굴하고, 생명 분야 특화 프로그램 지원 검토 등 생명 분야만의 특성을 반영한 기초연구를 지원할 예정이다. 또한 학회 및 연구자 설문 조사 등을 통해 지속적으로 의견을 수렴하고 수정・보완할 계획이다.
또한 윤석열정부는 기초과학에 대해 연구자의 자율성 및 창의성 보장과 함께 국가 수요를 반영한 전략적 기초연구 투자 확대가 필요하다는 인식을 하고 있으며, 이러한 국가적 수요에 따라 기초연구도 전략적 기초연구 투자 확대를 지원할 예정이다. 특히 국가과학기술자문회의에서 도출된 12개 국가전략기술에 대한 기초연구사업을 신설하여, ‘첨단바이오’ 분야에 대한 연구지원을 통해 기초연구에서의 생명공학 분야의 전략성을 강화하고자 한다.
4. 생명공학 인력양성
가. 개요
정부는 ‘기초연구진흥 및 기술개발지원에 관한 법률’에 따라 5년 주기로 기초연구 진흥에 관한 중장기 정책목표와 방향 설정을 위해 ‘기초연구진흥종합계획’을 수립하여 시행하고 있으며, 2022년까지 연구자 주도 기초연구 예산을 2조 5,000억 원을 목표로 매년 투자를 확대해 왔으며, 과학기술정보통신부에서는 2023년 3월 현재 제5차 계획을 수립 중이다.
정부의 기초연구 확대 기조 속에 교육부는 생명공학 분야의 경쟁력 확보를 위해서는 장기적 관점에서 연구의 지속가능성이 중요하다고 판단하고, 기초연구 분야에 대한 저변 확대와 우수 연구인력의 양성에 보다 정책 역량을 집중하고자 하였다.
특히 이러한 장기적 관점의 연구역량 제고에서는 무엇보다 생명공학 분야의 선진국과 같이 대학이 연구와 인력양성에 핵심적인 역할을 담당할 필요가 있기 때문에 대학의 연구역량을 강화하기 위해 노력하고 있다.
나. 추진 경과
교육부는 대학의 연구역량 강화를 위해 1982년부터 박사후연구자의 연구경험을 축적하고자 학문후속세대를 지원하고 있으며, 국가 연구역량 제고를 위한 연구 저변 확대를 위해 1989년부터 풀뿌리 기초연구를 지원해 오고 있다.
1999년부터는 미래 인재 양성을 위한 대학원의 교육・연구역량 강화 기반을 위한 BK21 사업을 시작으로 2020년부터는 4단계 두뇌한국21 사업을 통해 석・박사생 연구장학금 지원, 대학원혁신지원사업비 지원 등 대학원의 교육 및 연구역량 향상을 지원하고 있다.
아울러 2008년부터 2021년까지 의과학자 육성지원 사업을 통해 미래 성장 동력인 바이오산업 분야 경쟁력 확보를 위한 중개연구를 활성화하고, 이를 수행할 의과학자 양성을 추진한 바 있다.
다. 주요 정책
교육부는 인력양성 총괄 부처로서 초・중등에서 대학에 걸쳐 전 주기적 인재양성을 지원하고 있다. 특히 최근에는 생명공학 등 과학기술 분야에 대한 중요성이 높아짐에 따라 초・중등교육에서 융합인재교육(Science, Technology, Engineering, Arts and Mathematics, STEAM)을 통해 실생활 문제를 창의적으로 해결하는 방법으로 과학에 대한 흥미도를 제고하고 있고, 이는 과학기술 선도 인재양성의 초석이 되고 있으며, 이와 함께 고등교육 단계에서도 고급인력을 양성하기 위한 노력을 기울이고 있다.
교육부는 다양한 생명공학 분야에 대한 개인 및 대학 연구소 단위의 균형 잡힌 기초연구를 지원하여 연구 저변을 지속적으로 넓혀 나아감과 동시에 석・박사 연구인력에 대한 연수기회 부여, 연구경험 제공 및 장학금 지원을 통해 미래 한국을 책임질 학문후속세대를 육성해 나가고 있다.
라. 주요 사업
(1) 기초연구 지원사업
교육부는 2022년 개인기초연구사업에 284억 원, 이공학학술연구기반구축사업에 5,190억 원으로 총 5,474억 원을 투자하여 이공학 분야의 기초연구가 보다 활성화될 수 있도록 노력하였다.
[표 2-10] 기초연구 지원사업 예산(2021∼2022)
(단위: 백만 원, %)
|
사업명 |
2021년 예산(A) |
2022년 예산(B) |
증감 |
||
|
차액 (B-A) |
증감률 (%) |
||||
|
개인기초연구 |
67,376 |
28,357 |
△39,019 |
△57.9% |
|
|
|
기본연구 |
67,376 |
28,357 |
△39,019 |
△57.9% |
|
이공학학술연구기반구축 |
490,368 |
518,994 |
28,626 |
5.8% |
|
|
|
학문후속세대지원 |
72,825 |
65,395 |
△7,430 |
△10.2% |
|
대학연구기반구축 |
150,338 |
159,439 |
9,101 |
6.1% |
|
|
학문균형발전지원 |
267,205 |
294,160 |
26,955 |
10.1% |
|
|
계 |
557,744 |
547,351 |
△10,393 |
△1.9% |
|
출처: 교육부
(가) 개인기초연구지원
교육부는 개인기초연구지원을 통해 이공학 분야 개인연구자에게 5,000만 원 내외의 연구비를 폭넓게 지원하여 생명공학 분야 연구자가 창의적이고 혁신적인 연구에 전념할 수 있는 환경을 제공하고 있다.
[표 2-11] 개인기초연구사업 생명공학 분야 지원 현황(2021∼2022)
(단위: 개, 백만 원)
|
분야 |
2021년 |
2022년 |
||
|
지원과제 수 |
사업비 |
지원과제 수 |
사업비 |
|
|
분자세포생물학 |
91 |
2,297.5 |
28 |
987.4 |
|
유전학・유전공학 |
63 |
1,491.4 |
18 |
524.7 |
|
발생・신경생물학 |
14 |
308.3 |
3 |
37.5 |
|
면역학・생리학 |
15 |
320.8 |
3 |
37.5 |
|
분류・생태・환경생물학 |
24 |
699.1 |
10 |
370.0 |
|
생화학・구조생물학 |
14 |
516.5 |
7 |
237.5 |
|
융합바이오 |
2 |
25.0 |
- |
- |
|
생물공학 |
24 |
675.0 |
9 |
262.5 |
|
산업바이오 |
11 |
250.8 |
3 |
110.0 |
|
바이오공정・기기 |
3 |
75.0 |
1 |
12.5 |
|
생물유해성 |
2 |
45.8 |
- |
- |
|
기타생명과학 |
20 |
670.7 |
9 |
336.7 |
|
계 |
283 |
7,375.9 |
91 |
2,916.3 |
출처: 교육부
(나) 이공학학술연구기반구축
교육부는 이공학학술연구기반구축사업을 통해 생명공학 분야를 포함한 이공학 분야의 연구기반 확충을 지원하고 있다. 학문후속세대지원을 통해 박사과정생, 박사후연구원 등 생애주기별 지원을 통해 신진 연구자의 연구역량 강화를 도모하고 학술연구의 지속성을 유지하며, 대학연구기반구축을 통해 대학 부설연구소의 특성화・거점화를 통한 연구인력 양성과 연구장비의 집적화 등을 기반으로 공동연구 활성화를 지원하고 있다. 학문균형발전지원은 비전임교원, 보호 분야, 지역대학 연구자, 융합연구 등 상대적으로 연구비 지원이 부족한 연구자・학문 분야를 지원하여 학문의 균형적 발전을 목적으로 하고 있다.
[표 2-12] 이공학학술연구기반구축 생명공학 분야 지원 현황(2021∼2022)
(단위: 개, 백만 원)
|
분야 |
2021년 |
2022년 |
||
|
지원과제 수 |
사업비 |
지원과제 수 |
사업비 |
|
|
분자세포생물학 |
421 |
23,586.1 |
425 |
24,240.6 |
|
유전학・유전공학 |
216 |
11,845.8 |
234 |
12,827.0 |
|
발생・신경생물학 |
89 |
5,609.8 |
96 |
6,001.8 |
|
면역학・생리학 |
48 |
3,345.0 |
53 |
3,501.0 |
|
분류・생태・환경생물학 |
109 |
10,165.7 |
112 |
11,630.7 |
|
생화학・구조생물학 |
37 |
2,888.3 |
35 |
3,100.8 |
|
융합바이오 |
5 |
1,052.5 |
5 |
1,022.5 |
|
생물공학 |
96 |
6,165.1 |
105 |
7,418.6 |
|
산업바이오 |
44 |
3,621.3 |
45 |
3,879.0 |
|
바이오공정・기기 |
5 |
345.0 |
13 |
690.0 |
|
생물유해성 |
3 |
197.5 |
4 |
192.5 |
|
기타생명과학 |
71 |
4,920.0 |
71 |
5,115.9 |
|
계 |
1,144 |
73,742.1 |
1,198 |
79,620.4 |
출처: 교육부
(2) 고급인력 양성사업
2020년 9월부터 추진하고 있는 4단계 BK21 사업에서는 농생명 및 생명공학 분야 교육연구단(팀)에 약 856억 원을 투자하여, 약 6,700여 명의 대학원생에게 연구장학금, 국제화 경비 등을 지원하였다. 4단계 BK21 사업은 혁신인재양성사업 유형을 신설하여 생명공학 신산업 분야(맞춤형 헬스케어, 바이오헬스/혁신신약, 스마트팜 등) 석・박사급 연구인력 양성 기반을 마련하였으며, 이를 통해 신산업 분야의 고급인재 육성에 박차를 가하고 있다. 특히, 2023년부터 대학원생 연구장학금 단가를 일괄 30만 원6)씩 인상하여 대학원생이 연구와 학습에 집중할 수 있는 환경을 구축하였다.
[표 2-13] BK21 사업 생명공학 분야 지원 현황(2∼3단계, 2006∼2027)
(단위: 개, 백만 원)
|
분야 |
2단계 BK21(’06∼’13) |
BK21 플러스(’13∼’20) |
4단계 BK21(’20∼’27) |
|||
|
지원과제 수 |
사업비 |
지원과제 수 |
사업비 |
지원과제 수 |
사업비 |
|
|
농생명 분야 |
30 |
3,232 |
33 |
16,046 |
16 |
9,402 |
|
생물학 분야 |
15 |
12,317 |
23 |
13,800 |
17 |
14,957 |
|
약학 등 분야 |
22 |
2,862 |
15 |
9,631 |
30 |
21,592 |
|
응용생명 분야 |
17 |
14,972 |
15 |
3,602 |
18 |
9,687 |
|
의학, 맞춤형 헬스 등 분야 |
18 |
2,645 |
23 |
15,987 |
34 |
29,996 |
|
계 |
102 |
36,028 |
109 |
59,066 |
115 |
85,634 |
주) 2단계 BK21 사업은 2012년, BK21 플러스는 2019년, 4단계 BK21은 2023년 지원액 기준
출처: 교육부
특히, 디지털 시대에 적합한 바이오헬스 분야 인력양성을 위하여 교육연구단(팀)별로 다양한 교육과정 프로그램을 개설하여 운영하고 있다. 미래 약학기술을 선도할 전문인재 양성을 위해 동국대는 AI 기반 신약 개발, 스마트의약품 연구개발, AI 기반 약품화학특론 과정을 운영하고 학생들의 연구 수월성 증진을 위해 MPLC 사용법 및 3D printing 기술에 대한 이론과 실습 교육을 진행하였으며, 스마트팜 전문인재 양성을 위해 경북대-부산대 융합전공 과정에서 스마트팜정보화특론, 스마트팜 최신기술, 디지털식물병진단학 등 교과목을 개설하였다. 재난/응급현장 지능형 헬스케어 관련 전문가 육성을 위해 서강대는 참여 대학원생을 대상으로 미국 카네기멜론대학교 인공지능 단기연수 프로그램(6개월)을 운영하고, 재난구조로보틱스, 실시간응급모바일블록체인, 재난확률기계학습 등의 교과목을 운영하고 있다.
또한, 의약학 및 생명과학 분야에 특화한 의과학자 육성지원 사업도 추진하여, 의과학자 과정7)을 이수하는 총 153명(2008∼2015)을 선발하여 우수 전문대학원생에 등록금 전액과 연간 500만 원의 교육연구비를 최대 7년간 장기 지원한 바 있으며, 이중 39명(약 36%)이 박사후연구원, 교수, 기초의학 조교 등 의과학 분야로 진출하였다.
마. 향후 계획
교육부는 기초연구 진흥과 인력양성을 담당하는 부처로서 생명공학 분야의 연구와 인력양성을 위한 지원을 확충하기 위해 노력하고 있다. 기초연구와 인력양성 간 긴밀한 연계를 통해 시너지를 창출하기 위한 노력을 강구해야 하며, 특히 이러한 시너지가 가장 효과적으로 나타날 수 있는 현장이 대학이므로 대학에 대한 지원을 더욱 확대할 필요가 있다.
아울러, 교육부는 생명공학 분야 중 장래에 성장 가능성이 있으나 현재 투자가 미흡한 분야나 다른 분야의 성장을 위해 꼭 필요한 기반 분야 등 민간에서 투자가 소홀할 수 있는 부분을 적극적으로 발굴하고 정책적인 배려를 해 나갈 예정이다.
5. 농림축산식품 분야 생명공학 육성
가. 개요
농림축산식품 분야의 생명공학, 즉 그린바이오 기술은 농업의 부가가치와 생산성을 높이고 안전한 친환경 먹거리 생산에 기여하여 지속가능한 농업 기반 마련에 핵심적인 역할을 하고 있다. 육종기술, 분자생물학, ICT 융복합 기술 및 빅데이터 분석 등 다양한 기술이 농업 분야와 결합하여 새로운 기회를 창출하고 있으며 이러한 과학기술에 기반한 스마트 농업은 기존 농업의 한계를 극복하고 신성장 분야로 주목받고 있다.
농림축산식품부는 생명공학의 근간이 되는 농업생명자원의 체계적인 보존・관리 및 활용 기반 마련, 농생명 빅데이터 확충, 고부가가치 농생명 소재 개발 및 융복합 혁신 기술에 대한 R&D 지원과 관련 산업 인프라 구축 등 종합적인 정책 추진을 통해 농업생명공학 기술 및 산업 경쟁력을 강화할 계획이다.
나. 추진 경과
농림축산식품 분야의 과학기술 육성정책은 농촌진흥청의 1991년 ‘제1차 농업과학기술 중장기 연구개발 계획’을 시작으로 2009년 ‘농림식품과학기술 육성법’ 제정에 따라 ‘농림식품과학기술 육성 종합계획’ 수립과 함께 현 체계가 마련되었다. 현재 제3차 종합계획(2020∼2024)에 따라 매년 시행계획을 수립하여 연구개발 지원을 추진하고 있으며 미래 농업 수요를 반영한 효율적 농업 과학기술 육성정책을 수립・추진하고 있다.
다. 주요 정책
농식품부와 농진청・산림청에서는 2020년 9월 관계부처 합동으로 그린바이오 융합형 신산업 육성방안을 발표하여 기술개발, 빅데이터, 인프라, 사업화 지원, 산업생태계 구축 등 5대 전략, 마이크로바이옴, 대체식품・메디푸드, 종자, 동물용 의약품, 기타 생명소재를 5대 핵심산업으로 선정하여 집중 육성하고 핵심 유망기술 선정・로드맵을 마련하였으며 정책 역시 이를 반영하여 유망기술 분야에 선택과 집중을 추진하고 그린바이오 육성방안을 바탕으로 R&D・기업지원・제도 등 종합적 정책을 지원하고자 한다.
첫 번째로 R&D 부문에서는 육종과 유전자 분야에서는 유전자가위 기술, 표현체, 대사체 등 멀티오믹스 정보 분석기술, 디지털 육종기술, 미생물・동식물 유전체 정보분석 기술 등을 개발 및 지원하고 있으며 동물용 의약품 분야에서는 구제역, 조류인플루엔자, 아프리카돼지열병 등 동물 감염병의 예방, 검역, 진단, 방역 등을 위한 전주기적 기술개발 및 동물용 의약품, 진단키트 등을 개발하고 있고 식품과 소재 분야는 고령자용 영양식품・가공품, 기능성 간편・대체식품, 천연소재 활용 감미료, 생명자원을 이용한 기능성 소재 등의 산업화를 지원하고 있다.
인프라 부문에서는 식물백신 기업 지원시설, 융복합 전문인력 양성을 위해 수의방역 특수대학원 설립지원, 기능성식품 전문인력을 양성하는 계약학과, 데이터 분야에서는 농업생명공학정보센터(NABIC) 관리 강화 및 슈퍼컴퓨팅 센터와 같은 전산 자원 확충, 농축산용 미생물 산업 육성지원센터, 유용미생물은행 구축과 같은 마이크로바이옴 산업 인프라 구축, 산림 신품종 재배단지, 스마트 산림바이오 혁신성장 거점 등에 지원을 하고 있다.
마지막으로 기업지원과 산업생태계 구축을 위해 그린바이오 우수기업, 제품 등에 대한 인증제 도입 등을 검토하고, 그린바이오 전용 펀드 운영, 산업화 기술개발 등을 지원할 계획이며 산업생태계를 구축하기 위해 그린바이오 벤처캠퍼스 조성 및 창업보육 사업 지원, 신산업 분야 제도 개선 과제 발굴 등의 지원 정책을 수립 및 계획하고 있다.
또한, 2023년 2월 그린바이오 산업 육성 전략을 발표하고 6대 분야인 종자, 동물용 의약품, 미생물(마이크로바이옴), 식품소재, 곤충, 천연물 유래 소재를 선정하여 6대 거점을 집중 육성하고자 한다.
라. 주요 사업
농식품부, 농진청, 산림청은 유용농생명자원산업화기술개발, 바이오그린 연계 농생명혁신기술개발, 산림생명자원 이용 임업소득 증대 연구 등 생명공학 기술 분야에 2022년 기준 19개 사업에 총 1,567억 4,700만 원을 투자하였으며 생명공학 기본계획에 따라 R&D 혁신, 바이오경제 창출, 생태계 기반 구축의 3대 전략에 따라 추진하고 있다.
특히 2021년 시행계획부터는 농림 분야 생명공학 육성정책의 종합적 검토 및 부・청간 협력 강화를 위해 농림식품 과학기술위원회의 검토를 거쳐 계획을 수립하고 있으며, 향후 체계적 부・청 통합 생명공학 정책 수립・추진을 위해 ‘농림 분야 생명공학육성계획 중장기 방향(2021∼2025)’을 수립하였다(2020.12).
[표 2-14] 농림 분야 생명공학육성계획 중장기 방향(2021∼2025) 주요 내용
|
전략 분야 |
주요 내용 |
|
R&D 혁신 |
육종, 소재 개발, 유전체, 유전공학, 동식물 질병 R&D 등 추진 |
|
바이오경제 |
종자기업 수출 협의회, 해외 육종기지 및 시험・전시포 운영 등 |
|
생태계기반 |
농업생명공학 정보센터(NABIC) 시스템 고도화 및 유전체 빅데이터 구축 |
출처: 농림축산식품부
농림축산식품부・농진청・산림청의 주요 생명공학 육성사업은 다음과 같으며, 농식품부는 농정 이슈, 기술・산업 동향, 기존 사업 일몰 등에 대응하여 지속적으로 새로운 R&D 사업을 발굴해나갈 계획이다.
(1) 유용농생명자원산업화기술개발
2020년부터 2022년까지 농생명 자원의 고부가가치 기술 및 제품 개발과 원료 표준화, 안정적 공급까지 패키지화를 위한 R&D 사업으로 2022년에는 반려동물용 건강 보조사료, 곤충자원의 유용지질 고부가가치 사료 개발 등의 연구 성과가 있었다.
(2) 고부가가치식품기술개발
2010년부터 2025년까지 대체식품, 메디푸드, 고령친화식품, 포스트바이오틱스 등 스마트 식품 제조를 위해 추진하는 R&D 사업으로 2022년에는 쌀 발효기술을 활용한 저온유통 가정식 가공식품 개발, 바이오 생물전환 공정을 통한 당뇨병환자 맞춤형 발효식품 개발 등의 연구성과가 있었고, 2023년에는 푸드테크 10대 핵심기술 분야(세포배양식품, 식물기반식품 등)와 가루 쌀의 소재화 연구를 지원할 계획이다.
[표 2-15] 고부가가치식품기술개발 성과
|
<간 기능 개선 건강식품 ‘개똥쑥정’ > |
개똥쑥 추출분말을 활용한 건강기능식품 개발 |
|
농림축산식품부의 고부가가치식품기술개발사업의 지원을 받아 ‘간 건강’ 개선 기능을 갖는 개똥쑥 추출물을 통해 식약처 건강기능식품 개별인정형 원료로 인증을 획득하였으며, 개발된 기술로 건강기능식품 시장의 소재 다양화와 국민건강 증진에 기여할 것으로 사료됨 |
출처: 농림축산식품부
(3) 작물바이러스 및 병해충대응산업화기술개발
2020년부터 2024년까지 작물바이러스의 매개기작 규명, 유전적 변이 및 분포양상 분석 등 바이러스병 확산 방지를 위한 항바이러스제, 방제제 개발을 중점 지원하는 R&D 사업으로 2022년에는 작물바이러스 진단으로 현장에서 실시간 사용이 가능한 등온 PCR 장치 개발 성과가 있었고, 2023년에는 국내 토양 미생물 대사체 기반 내성 흰가루병 방제제 개발, 원예작물의 생산성 향상을 위한 잿빛곰팡이병 조기 진단기술 등의 연구를 지원할 예정이다.
[표 2-16] 작물바이러스 및 병해충대응산업화기술개발 성과
|
|
현장에서 사용 가능한 실시간 등온 PCR 장치 |
|
농림축산식품부의 작물바이러스 및 병해충대응산업화기술개발사업의 지원을 받아 현장에서 신속하고 정확하게 바이러스를 검사하기 위한 유전자 검사 기술로 유전자 추출부터 검사를 위한 시약과 장비를 개발하여, 시장에 출시함 |
출처: 농림축산식품부
(4) 농식품기술융합창의인재양성(특수대학원)
2020년부터 2023년까지 농생명 산업의 연구인력 수요와 농식품 산업의 새로운 기술 트렌드 변화에 대응하기 위해 농생명 분야 특수대학원 설립, 산업 연구인력 재교육 등을 통해 농식품 분야 연구 역량 제고를 위한 사업이다.
(5) 가축질병대응기술고도화지원
가축질병 방역과 축산농가의 현안을 해결하고자 가축질병대응기술개발사업의 후속 사업으로 2022년부터 2023년까지 2개년에 거쳐서 가축질병 R&D 고도화 사업을 추진하고 있다.
연구는 현장에 발생하는 질병에 대해 이미 개발된 기술성과의 보급과 국내 미유입 가축질병 바이러스에 대한 민간 연구 활성화를 위한 국제 공동연구의 기반을 다지고자 한다. 2023년도에는 소 바이러스성 설사병, 돼지 회장염, 돼지 부종병 등 다양한 가축질병 등의 연구를 지원할 예정이다.
(6) 디지털육종전환기술개발
농생명 산업의 근간이 되는 종자(seed)에 대한 주권을 확보하고, 글로벌 소비 트렌드 변화에 대응하여 종자산업의 국제 경쟁력 강화를 위해 2022년부터 2024년까지 추진하는 사업이다.
주요 연구내용은 데이터 기반 육종기술 개발을 지원하고, 육종 핵심기술 고도화를 통한 품종개발과 동시에, 디지털육종 전환을 위한 유전체・표현체 관련 데이터 모델링, 정밀검색 엔진, 상관분석 시스템 개발 등 복합형질 구현을 위해 적극 지원할 예정이다.
[표 2-17] 디지털육종전환기술개발사업 성과
|
<연관분석 파이프라인> |
유전체 및 표현체 정보 기반의 연관분석 파이프라인 개발 |
|
디지털육종 기반 구축을 통해서 효율적인 품종개발을 위한 유전형・표현형 데이터베이스 구축을 통한 관리 및 사용자 친화적 인터페이스를 통한 GWAS, GS 분석할 수 있는 파이프라인을 개발. 이를 통한 사용자 친화적 분석도구 제공을 기대할 수 있음 |
출처: 농림축산식품부
(7) 반려동물전주기산업화기술개발
반려동물 관련 사업의 양적 팽창에 따라 반려동물 먹거리(사료, 간식), 의약품, 의료서비스 등의 기술개발을 통해 산업 기반을 마련하고자 2022년부터 2026년까지 5년 동안 추진할 사업이다.
국산 사료의 경쟁력을 높이기 위해 2023년에는 질환 맞춤형 처방식 사료, 보충제 개발, 질병 진단 체계 구축과 치료제 개발 등 의료서비스의 품질을 높이기 위한 R&D를 추진할 예정이다.
(8) 디지털육종전환지원
2021년부터 추진하는 사업으로 종자업체가 최신의 디지털육종 기술을 적용할 수 있도록 생명연구기관과 종자기업 간 육종 초기부터 분석결과에 대한 디지털육종 컨설팅, 종자산업진흥센터 내 빅데이터 활용 분석 플랫폼, 첨단육종을 위한 유전자분석, 기능성 성분 분석지원 등 기업별 맞춤형 분석 서비스 등 비용 및 기술・서비스를 지원하는 사업이다.
(9) 동물용 그린바이오의약품 산업화 거점 조성
인수공통 감염병 및 반려동물용 그린바이오로직스8) 기술 기반 동물용 의약품 생산 지원시설 고도화를 위해 식물공장(GMP 시설) 및 동물용 의약품 제형별 생산장비 확충 등을 추진하는 사업이다.
(10) 농축산용미생물효능평가지원 등 미생물 산업 기반조성
농림축산식품부에서는 농축산용 미생물 산업의 진흥을 위하여 관련 산업계에 효능평가・배양・시제품・산업화 지원, 교육, 컨설팅을 제공하는 농축산용미생물효능평가지원사업을 추진하고, 전북 정읍에 GMP 기반 농축산용미생물산업화지원시설을 구축(2022∼2024)하여 수출기업의 GMP 인증을 지원하고, 농축산용미생물산업 공유인프라 구축(2023∼2025) 사업을 통해 미생물산업 벤처지원실, 공동기기실 및 장비 등 시설을 확충할 계획이다. 또한 전북 순창군에 유용미생물은행(2019∼2023)을 구축하여 농토 등에서 미생물 군집 등을 수집, 보존, 배양 등을 하여 DB를 구축・분석하여 관련 연구와 산업을 지원할 계획이다.
(11) 천연물소재 전주기 표준화 허브 구축
천연물 산업 표준화 산업 DB 구축과 전주기 표준화 지원을 통한 관련 산업 및 전・후방 산업의 경쟁력 제고를 위해 기업수요 원재료 생산 연계 및 국제규격 표준화를 지원하는 허브를 구축하는 사업(2023∼2027)이다.
(12) 바이오그린 연계 농생명 혁신기술 개발사업
차세대바이오그린21 사업은 2011년부터 2020년까지 고부가가치 신품종 및 글로벌 소재 개발을 통한 식량안보 등 국가전략 대응 기술의 확보와 생물자원 유전체 활용 및 합성생물체 개발 등을 통한 농업생명공학 원천기술의 확보로 농업기술의 한계를 극복하고자 추진되었다. 사업 분야(동물분자육종, 식물분자육종, 농생물게놈, 시스템합성, 식의약소재, 농생명공학)별로 유전체 육종체계 구축 및 육종기술 개발, 유전체 정보 활용 시스템 구축, 기후변화 대응, 농업형질 및 기능성 소재 확보, 글로벌 종자 개발로 국제 경쟁력 확보, 고부가가치 농작물 개발 등 다양한 성과를 산출하였으며, 이들 성과의 연계 및 확산을 위해 2021년부터 바이오그린 연계 농생명혁신기술 개발사업이 추진되어 기술의 실용화 촉진을 꾀하고 있다.

출처: 농림축산식품부
[그림 2-4] 차세대바이오그린21사업 및 2021년 바이오그린 연계 사업 체계도
(13) 차세대 농작물 신육종기술 개발사업
2020년부터 2026년까지 진행되는 R&D 사업으로 신육종기술개발 기반 구축과 육종소재의 개발을 통해 농작물 육종기술 경쟁력 향상 및 농생명산업 성장 기반 구축을 목표로 한다. 신육종 원천 기술개발을 통해 작물용 유전자교정 기반기술을 강화하고, 유전자교정 기반 돌연변이 집단을 구축하고 표현형 분석 플랫폼을 구축하며, 차세대 신육종 기반기술을 개발한다. 또한 벼, 브로콜리, 토마토 등을 대상으로 GM작물 대체 육종소재를 개발하고, 유전자교정 기반 내재해, 내병성, 생산성 효율 증대 및 고부가가치 증진 육종소재를 개발한다.

출처: 농림축산식품부
[그림 2-5] 차세대 농작물 신육종기술 개발사업 체계
(14) 국가생명연구자원 선진화 사업
제3차 국가생명연구자원 관리・활용 기본계획(2020)을 이행하기 위하여 국가생명연구자원 인프라(소재자원은행)를 클러스터 단위로 통합 관리하고 관련 사업을 통합・연계하기 위하여 2021년부터 다부처로 진행되는 R&D 사업이다. 농촌진흥청은 농생명 바이오산업의 발전을 견인하고 육성하기 위해 소재자원의 확보・보전 및 데이터의 수집・활용성 강화와 기반 구축을 목표로 사업을 추진하고 있다. 바이오 연구소재의 활용기반을 조성하기 위하여 종자 분야는 종자 소재은행의 종자 실물과 데이터 통합시스템을 구축하고, 축산 분야는 축산클러스터 통합시스템과 연구소재 안전보존 및 활용 체계를 구축한다. 또한 농생물 연구데이터의 효율적인 공유와 융합 활용을 위해 신규 범부처 표준에 맞추어 정보 수집・관리・연계 및 가공・활용을 위한 인프라(H/W)와 환경(S/W)을 구축한다.
(15) 공공성 확보를 위한 국가 기반 육종플랫폼 개발 사업
2023년부터 2027년까지 진행되는 R&D 사업으로 글로벌 선도기업과의 육종 기술격차를 해소하여 국내 종자산업의 경쟁력을 신속하게 확보하기 위한 사업으로, 공공성이 확보된 데이터를 확보・공유하고 AI・빅데이터 기반 디지털육종 선도모델 개발을 목표로 한다. 이를 위하여 표현체 중심 국가 표준 육종 빅데이터를 확보하여 딥데이터9)를 구축하고, 딥데이터 처리 및 연계 기술을 개발하며, AI 활용 유망계통 플랫폼 기술을 개발한다.
(16) 산림생명자원 이용 임업소득 증대 연구
산림 바이오 경제 견인을 목적으로 산림생명자원을 산업 소재로 활용할 수 있는 원천기술을 개발하여 산림 분야 신성장동력을 창출하고, 소득자원으로 이용할 수 있는 신품종 육성 및 재배 기술의 개발과 확산으로 소득증대에 기여할 수 있도록 하는 연구를 지속적으로 추진할 계획이다.
(17) 야생화 산업화 기반 구축
우리나라에 자생하는 야생화의 다양한 활용도를 개발하고 국민의 새로운 소득원을 창출하기 위하여 2018년부터 시작한 연구개발 사업이다. 야생화의 단점인 짧은 개화 기간, 도장, 표준화되지 않은 기준 등을 정비하여 국민께 우리나라 야생화의 우수성을 알리고 야생화의 산업화를 지원하기 위한 연구개발을 하고 있으며, 야생화를 활용한 신품종 개발 등과 같은 연구를 통해 우리나라 야생화의 우수한 품질을 부각하고, 단점은 보완하여 새로운 산업의 동력으로서 역할을 할 수 있도록 지속적인 연구를 수행할 것이다.
(18) 산림생물자원 빅데이터 구축 및 정보 대국민 서비스
국내 산림생물자원 통합정보 시스템의 부재로 인한 관련 산업의 성장 제약을 극복하기 위한 사업으로, 산림생물자원 활용시스템을 개발, 민간・산업계 연계를 통한 관련 산업 성장의 도모를 목표로 한다. 현재 산림생물자원 빅데이터를 지속적으로 구축하고 있으며, 이어 대국민 공개용 플랫폼 구축 및 대국민 서비스를 진행할 계획이다.
(19) 산림생물자원 활용 산업화 소재 및 기술 개발
기하급수적으로 성장하는 그린바이오 산업에 대한 국가경쟁력 확보를 위한 사업으로, 자생식물 기반 그린바이오 산업화 후보 소재 발굴 및 활용기술의 개발과 산업화 소재 관리 및 표준 생산을 위한 증식・재배기술 개발 사업으로 구성된다. 2023년에는 소재 특성 및 생리연구, 소재 발굴 연구, 기초 생리활성 분석과 유전자원 증식 등 연구를 활발히 추진할 계획이다.
(20) 스마트 산림 바이오 혁신성장거점 조성
나고야 의정서 등에 따른 각국의 생명자원에 대한 활발한 주권확보 움직임과 바이오산업 급성장에 따른 국내 바이오산업계의 원료물질 수요에 대응하기 위해 고부가가치 산림생명자원 원료물질을 안정적으로 공급하기 위한 플랫폼(거점)을 조성하는 사업이다. 구성 시설은 산림바이오센터, 종자 및 양묘기술센터, 생산단지 등으로 이루어져 있으며, 전국 4개소(충북 옥천, 전남 나주, 경남 진주, 강원 춘천)에 2022년부터 연차적으로 조성될 예정이다.
|
기관명 |
사업명 |
사업기간 |
’22년 실적 |
’23년 계획 |
|
농림축산 식품부 |
유용농생명자원 산업화 기술개발(R&D) |
’20∼’22 |
4,634 |
- |
|
고부가가치식품 기술개발(R&D) |
’10∼’25 |
33,816 |
38,035 |
|
|
작물 바이러스 및 병해충 대응 산업화 기술개발(R&D) |
’20∼’24 |
13,052 |
9,640 |
|
|
농식품기술 융합 창의 인재양성(특수대학원)(R&D) |
’20∼’23 |
9,670 |
7,320 |
|
|
(신규)가축질병 대응기술 고도화 지원(R&D) |
’22∼’23 |
11,180 |
15,071 |
|
|
(신규)디지털육종전환 기술개발(R&D) |
’22∼’24 |
10,050 |
13,395 |
|
|
디지털육종전환 지원 |
’21∼계속 |
1,615 |
1,615 |
|
|
농축산용 미생물 효능평가 지원 |
’17∼계속 |
435 |
435 |
|
|
유용미생물은행 구축 |
’19∼’23 |
3,825 |
1,000 |
|
|
(신규)GMP기반 농축산용 미생물 산업화 지원시설 구축 |
’22∼’24 |
250 |
2,500 |
|
|
(신규)천연물소재 전주기 표준화 허브 구축 |
’23∼’27 |
- |
400 |
|
|
(신규)농축산용 미생물산업 공유인프라 구축 |
’23∼’25 |
- |
200 |
|
|
(신규)동물용 그린바이오 의약품 산업화 거점 조성 |
’23∼’25 |
- |
300 |
|
|
동물용 의약품 효능 안전성평가센터 구축 |
’20∼’22 |
6,000 |
- |
|
|
소계 |
|
94,527 |
89,911 |
|
|
농진청 |
바이오그린 연계 농생명 혁신기술 개발사업(R&D) |
’21∼’22 |
21,270 |
- |
|
차세대 농작물 신육종기술 개발사업(R&D) |
’20∼’26 |
9,022 |
9,035 |
|
|
국가생명연구자원 선진화사업(R&D) |
’21∼계속 |
3,000 |
4,000 |
|
|
(신규)공공성 확보를 위한 국가 기반 육종플랫폼 개발사업(R&D) |
’23∼’27 |
- |
4,511 |
|
|
소계 |
|
33,292 |
17,546 |
|
|
산림청 |
산림생명자원 이용 임업소득 증대 연구(R&D) |
1949∼계속 |
9,810 |
10,888 |
|
야생화 산업화 기반 구축(R&D) |
’17∼’23 |
1,299 |
1,308 |
|
|
산림생물자원 빅데이터 구축 |
’21∼’25 |
767 |
767 |
|
|
산림생물자원 활용 산업화 소재 기술 개발(R&D) |
’21∼’25 |
2,833 |
2,833 |
|
|
스마트 산림바이오 혁신성장거점 조성 |
’19∼’25 |
3,000 |
14,325 |
|
|
소계 |
|
17,709 |
30,121 |
|
|
|
합계 |
145,528 |
137,578 |
|
출처: 농림축산식품부
마. 향후계획
향후 농식품부는 제3차 농림식품과학기술 육성 종합계획과 그린바이오 신산업 육성방안(2020.9.), 그린바이오 산업 육성 전략(2023.2.)10)에 따라 농업 분야의 중장기 R&D 비전 제시 및 유망기술 분야 특히 고부가가치 농생명소재, 첨단육종기술, 마이크로바이옴 등에 전략적 투자 확대를 추진할 계획이다.
이러한 첨단 기술육성을 통해 기존 농업 분야에 다양한 생명공학 기반기술을 결합한 융복합 신기술을 중점 육성하고 그에 따른 인프라, 제도 등을 정비하여 미래 선도기술과 현장 문제 해결을 위한 기술개발을 동시에 추진할 계획이다.
6. 보건의료 연구개발 지원정책
가. 개요
(1) 필요성
코로나19가 발생한 지 3년이 지나면서 일상 복귀에 대한 국민들의 기대가 증가하는 한편, 새로운 변이 바이러스가 지속적으로 발생하여 재확산 우려가 상존하고 있다. 이에 전 세계는 미래 감염병 위협 대응 역량 강화에 지원을 아끼지 않고 있으며 국가 안보에까지 그 개념이 확장되었다. 세계는 코로나19 대응 과정에서 백신・치료제 핵심기술 보유 여부가 국가 회복력과 글로벌 시장 선점 여부를 좌우한다는 것을 경험하였으며, 보건의료기술이 국민의 생명과 건강뿐 아니라 국가 안보와 직결됨을 인식했다. 이에 우리나라는 제3차 국가 감염병 위기대응 기술개발 추진전략(2022∼2026)을 마련하는 등 감염병 대응 역량과 의료안전망 강화를 위한 연구개발 지원체계를 확립했다. 또한 ‘2022 세계 바이오 서밋’을 개최하고 감염병 혁신 연합(CEPI)을 통한 협력을 강화하는 등 미래 감염병 위기 대비 글로벌 리더십 확보에 주력하고 있다. 앞으로도 국민의 건강과 생명을 보호하기 위한 국가 안보로서의 보건의료 연구개발 지원의 중요성이 더욱 커지고 있다.
한편 저성장 시기 경제 성장을 견인할 수 있는 핵심 분야로서 보건의료에 대한 관심도 고조되고 있다. 보건의료기술 혁신을 통해 팬데믹과 고령화에 따른 막대한 경제・사회적 비용 발생을 극복하고, 코로나19를 계기로 세계 수준으로 도약한 체외진단기기 등 보건의료산업 성장을 이어가기 위함이다. 실제 우리나라 보건산업 수출액은 2018년 149억 달러에서 2021년 257억 달러로 고속 성장했으며 코로나19 감염병 진단 기법이 국제표준화기구에 등록 및 국제 표준으로 제정되는 등 국제적 위상이 상승했다. 또한 인공지능・빅데이터 등 디지털 기술과의 융합을 통한 보건의료 분야 디지털 전환이 신산업 창출의 동력으로 부상하며 우리나라는 2021년 ‘보건의료 데이터・인공지능 혁신전략(2021∼2025)’을 수립하는 등 국가 차원의 지원 전략 마련을 통해 관련 산업을 적극 육성 중이며, 성장세를 이어 나가기 위한 지속적 지원이 필요하다.
(2) 보건복지부 연구개발 사업 추진체계
보건복지부에서는 매년 보건복지부 R&D사업 통합시행계획을 수립하여 보건의료기술정책심의위원회 심의를 통해 시행하고 있으며, 한국보건산업진흥원, 국립암센터, 국립재활원, 국립정신건강센터가 보건복지부 연구개발사업을 관리・수행하고 있다.

출처: 보건복지부
[그림 2-6] 보건복지부 연구개발 사업 추진체계
나. 추진경과
보건의료 연구개발 지원정책의 최상위 계획은 ‘보건의료기술진흥법’에 근거한 범부처, 법정계획인 ‘보건의료기술육성기본계획’이다. 제1차 보건의료기술육성기본계획(2013∼2017)은 보건의료의 개념을 환자에서 건강한 사람까지로 확장하고, 보건의료 연구개발의 양적 성장 및 이를 위한 인프라, 체계, 시스템 구축에 초점을 맞줬다. 제2차 보건의료기술육성기본계획(2018∼2022)은 연구개발을 통한 사회문제 해결 등 공공성 강화에 중점을 두었다. 고령화, 감염병 등 고비용 보건의료 문제에 국가적으로 대응하여 더 건강한 삶과 의료의 지속가능성 확보를 위한 대안을 창출하고자 했으며, 연구개발 성과 및 이행 관리를 위한 시스템을 구축하였다. 2022년 제2차 보건의료기술육성기본계획이 종료됨에 따라, 제3차 보건의료기술육성기본계획(2023∼2027)이 수립될 예정이다. 보건의료기술육성기본계획은 보건의료기술정책심의위원회 보고를 거쳐 국가과학기술자문회의 심의로 확정되며, 기본계획의 성실한 이행을 위해 매년 연도별 시행계획을 수립한다.

출처: 2021년 한국보건산업진흥원 보건의료기술 연구개발사업 연감
[그림 2-7] 제1차・제2차 보건의료기술육성기본계획 비교
다. 주요정책
(1) 제2차 보건의료기술육성기본계획(2018∼2022)
제2차 보건의료기술육성기본계획은 ‘보건의료기술진흥법’ 제4조에 근거한 정부 법정계획으로 10개 부처・청11)이 참여한 범부처 계획이다. 제2차 기본계획은 보건의료 문제를 해결하기 위한 공공성 강화에 중점을 두었다. 수립 단계부터 국민의 목소리를 반영하고 해결을 요구하는 문제에 전략적으로 투자하고자 했으며, 보건의료 정책・기술・인프라・규제의 종합적 접근을 통해 연구개발과 정책 간 연계성을 높였다. 제2차 기본계획은 다음의 3대 전략을 중심으로 9대 중점과제를 추진했다.
[표 2-19] 제2차 보건의료기술육성기본계획(2018∼2022) 비전 및 목표
|
비전 : 보건의료기술 혁신으로 국민 모두가 건강한 내일 |
|||
|
목표 |
현재 |
|
미래 |
|
1. 건강수명 연장 |
73.2세(’15) |
▶ |
76세(’22) |
|
2. 보건산업 수출 증대 |
117억 달러(’17) |
▶ |
210억 달러(’22) |
|
3. 신규 일자리 창출 |
17만 명(’16) |
▶ |
27만 명(’22) |
|
3대 전략 및 9대 중점과제 |
|
|
3대 전략 |
9대 중점과제 |
|
1. 공익적 가치 중심의 R&D 투자 강화 |
1. 고비용 보건의료문제 해결, 전략적 R&D 투자 |
|
2. 질환・계층・남북 주민 간 건강 형평성 강화 |
|
|
3. 예방・관리 중심의 미래의료 기반 확충 |
|
|
2. 개방・연결・융합을 통한 R&D 혁신 |
4. 보건의료 연구자원의 개방・공유 강화 |
|
5. 연구・정책협력 네트워크 강화 |
|
|
6. 혁신 뒷받침 R&D 지원시스템 |
|
|
3. 좋은 일자리 창출을 위한 미래신산업 육성 |
7. 혁신성장을 선도하는 미래형 신산업 육성 |
|
8. R&D 성과의 가치 성장 촉진 |
|
|
9. 신산업 육성을 지원하는 글로벌 수준의 규제 합리화 |
|
출처: 보건복지부
보건복지부는 제2차 보건의료기술육성기본계획과 정책의 연계성 강화를 위해 2022년도 시행계획을 수립하였으며, 2022년 보건의료 R&D 예산은 전년 예산액(2조 65억 원) 대비 1.7% 증가한 총 2조 404억 원 규모이다. 주요 내용으로는 고령사회에 대응한 다부처 치매 연구 확대와 코로나19를 계기로 향후 신종 감염병 상시화에 대비하기 위한 국가 방역체계 강화가 있다. 또한 난치병 극복을 위한 첨단재생의료 역량을 높이고 혁신 기술의 보건의료 분야 융・복합 가속화로 의료 효율성을 제고하고자 했다. 범부처 협업을 통해 바이오 빅데이터를 구축하고, 백신개발 플랫폼・생명연구자원 등 국가 인프라・자원을 산・학・연・병 연구자에 공유・개방하고자 하며 마지막으로 우리나라 제약・바이오산업 글로벌 경쟁력 강화를 통한 의약・의료기기 주권 확보 및 미래 신성장 동력으로서 신약・의료기기 개발을 집중 지원하고자 했다.
부처별로는 (주요 R&D 6,991억 원 및 일반 R&D 47억 원, 총 복지부 7,038억 원, 34.5%), 과기정통부(6,935억 원, 34.0%), 산업부(2,341억 원, 11.5%), 농식품부(1,246억 원, 6.1%) 순으로 투자가 이루어졌다. 전략별로는 감염병, 정신건강, 환경성 질환 등 사회적 문제로서의 질환 극복을 위해 국민건강・환경・안전 등 공익적 가치 중심 R&D에 43.5%, 신약, 의료기기, 첨단 융・복합 의료기술 개발 등 미래 신산업 육성에 32.5%, 의료데이터 활용 플랫폼 구축 및 전문인재양성 등 혁신적 연구 생태계 조성을 위한 R&D 혁신시스템 구축에 24.0% 순으로 투자가 이루어졌다.
[표 2-20] 3대 전략별 보건의료 R&D 사업 예산(2022)
(단위: 백만 원)
|
사업명 |
예산 |
|
|
공익적 가치 중심의 R&D 투자 강화 |
치매극복연구개발사업 등 |
888,525 |
|
개방・연결・융합을 통한 R&D 혁신 |
연구중심병원 육성 등 |
489,498 |
|
좋은 일자리 창출을 위한 미래신산업 육성 |
범부처 전주기 의료기기 연구개발사업 등 |
662,327 |
|
총계 |
2,040,350 |
|
출처: 제2차 보건의료기술육성기본계획 2022년도 시행계획 자료 재구성
[표 2-21] 시행 주체별 보건복지부 R&D 예산(2022)
(단위: 백만 원)
|
사업명 |
예산 |
|
|
한국보건산업진흥원 |
연구중심병원 육성 등 51개 사업 |
639,998 |
|
국립암센터 |
암 연구소 및 국가 암관리 사업본부 주요사업 |
43,015 |
|
국립재활원 |
재활연구개발용역사업, 지능형 재활운동체육 중개연구사업 |
11,367 |
|
국립정신건강센터 |
자폐혼합형디지털치료제개발, 국립정신건강센터 연구개발사업 |
4,702 |
|
총계(총 56개 사업) |
699,082 |
|
출처: 제2차 보건의료기술육성기본계획 2022년도 시행계획 자료 재구성
라. 주요 사업
코로나19를 계기로 감염병 위기 대응 역량의 중요성이 높아지고 있다. 세계는 감염병 대응을 위한 국제 공조를 강화하고 백신 주권 확보를 위한 연구역량 확보에 총력을 기울이고 있다. 또한 국가 미래 신산업으로 첨단 바이오헬스 분야에 대한 기대가 고조되고 있는데, 특히 기존 합성의약품이나 의료기기와는 다른 특성을 가진 재생의료가 주목받고 있다. D.N.A 기반 바이오헬스 융복합기술의 발전도 가속화되고 있다. 디지털치료제, 전자약 등 첨단 융복합기술 기반의 제품이 등장하고 있으며 국가 차원의 지원 전략(보건의료 AI・데이터 혁신 생태계 구축 5년 계획, 2021.6.)도 이어지고 있다. 치매, 정신건강 등 고비용・난치성 질병 부담 경감에 대한 이슈도 확산되었다. 특히 코로나19 이후 국민 정신건강 문제가 증가했다는 것이 결과로 보여지고 있다. 마지막으로 보건의료 산업 혁신을 뒷받침할 연구개발 생태계 구축 필요성이 강조되고 있다. 병원의 연구역량을 강화하고 산・학・연과의 연계 협력을 통해 혁신적인 성과를 창출할 필요가 있으며, 현장의 수요를 반영한 융복합 전문인력 양성 필요성도 대두되고 있다. 이러한 정책적 여건들을 반영하여 2022년도 보건복지부 R&D 정책방향은 ‘국민 건강 중심의 투자 강화로 더욱 건강한 대한민국, 개방형 혁신을 통한 산・학・연・병 협력 강화’라는 목표로 4대 전략, 6대 중점 투자 방향을 설정하였다.
6대 추진 방향별로는 먼저 감염병 신속 대응을 위한 연구 기반 조성에 1,945억 원을 지원하였다. 감염병 재난 및 원내감염 상황 시 환자・의료진 안전강화를 위한 구조・시스템・장비・인력 최적화 기술을 개발하는 ‘감염병 의료안전강화 기술개발사업’을 신규로 추진하고, 백신의 안정적 공급과 글로벌 백신 개발 경쟁력 확보를 위한 신속대응・범용 기반기술, 고부가가치 백신 등 핵심기술 개발을 위한 3개 사업도 신규로 추진했다. 질병청과 공동으로 신변종 감염병에 신속 대응 가능한 mRNA 백신의 임상시험도 새로 지원했다. 코로나19 치료제・백신 개발 또한 끝까지 지원하여 개발 성공 경험을 축적하고자 했다. 다음으로는 재생의료 분야로, 첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법에 따라 재생의료 혁신기술 발굴 및 연구개발 지원을 위한 ‘재생의료 임상연구 기반조성사업’을 신규 추진하는 등 재생의료 연구개발 전 주기 지원을 확대하고 있다. 또한 신약・의료기기・D.N.A 등 차세대 유망기술 부문에도 투자를 지속하고 있다. 기술(산업) 및 시장 등의 환경변화에 대응하는 선도형 의료 기반기술 확보를 위한 국가 의료연구개발 지원 기반을 고도화하는 ‘차세대 의료연구기반 육성사업’, 혁신형 기업 제품의 해외시장 진출을 위한 국제협력 연구와 해외 임상시험 지원, 국내 상용화를 지원하는 ‘혁신형 의료기기기업 기술상용화 지원사업’, 새로운 방식의 첨단 융복합 의료기기인 ‘전자약 기술개발사업’ 등을 신규로 지원하여 총 1,870억 원을 투자했다. 사회문제 해결을 위한 R&D에도 701억 원을 지원했다. 혈액 부족 사태를 대비하고 환자 중심의 안전한 혈액관리 정착을 위해 ‘포스트코로나시대 적정수혈을 위한 의료기술개발사업’을 신규로 추진하고, 희귀질환, 건강 격차 해소 등을 위한 공익적 의료기술 개발과 노인・장애인 보조기기 연구개발과 보급・확산에도 투자를 확대했다. 정신건강, 만성질환 등 고비용・난치성 질환 극복에도 876억 원을 지원했다. 코로나19 이후 사회문제로 떠오른 정신건강 증진을 위해 신규로 사업을 추진하고, 암, 치매 등 국민의 부담이 큰 질병 극복에도 투자를 강화했다. 마지막으로 의사 과학자와 융합 인재 양성, 병원 중심의 연구 플랫폼 구축 등 산・학・연・병 연구협력 생태계 조성에도 997억 원을 투자했다.
(1) 보건의료기술연구개발사업
(가) 개요
보건복지부는 21세기 지식기반경제의 핵심 산업으로 등장하는 보건의료 분야를 국민건강 증진과 국가 경제 발전에 이바지하는 고부가가치 국가전략산업으로 육성・발전시키기 위하여 ‘보건의료기술진흥법’(1995)을 제정하여 ʻ보건의료기술연구개발사업ʼ을 추진해 오고 있다. 보건복지부는 연도별 연구개발사업 시행계획을 수립하고, 전문기관인 한국보건산업진흥원을 통해 보건의료기술연구개발사업을 시행하고 있다.
[표 2-22] 보건의료연구개발사업 추진 경과(1995∼2022)
|
연도 |
주요 내용 |
|
1995년 |
보건의료기술연구기획평가단 설립, 보건의료기술연구개발사업(128억 원) 시행, 보건의료기술진흥법 제정(법률 제5017호) |
|
1998년 |
한의약선도기술개발사업(24억 원) 시행 |
|
2008년 |
임상연구인프라조성사업(350억 원) 시행 |
|
2009년 |
임상의과학자양성사업(12.5억 원) 시행 |
|
2010년 |
글로벌화장품 신소재 연구개발사업(60억 원) 시행 |
|
2011년 |
범부처 전주기 신약개발(50억 원), 시스템통합적 항암신약개발(50억 원) 시행, 의료기기기술개발사업(40억 원) 시행 |
|
2014년 |
연구중심병원 육성사업(100억 원) 시행 |
|
2015년 |
감염병위기대응 기술개발사업(70억 원, 추경) 확대 시행 |
|
2016년 |
국가전략프로젝트(정밀의료기술개발) (32억 원) 시행 |
|
2017년 |
연구자주도질병극복연구, 공익적 질병극복연구, 국가치매극복기술개발 등 6개 사업(322억 원) 시행 |
|
2018년 |
환자중심의료기술최적화연구, 스마트임상시험플랫폼기반구축, 바이오메디컬글로벌인재양성 등 10개 사업(389억 원) 시행 |
|
2019년 |
환자중심의료기술최적화연구, 스마트임상시험플랫폼기반구축, 바이오메디컬글로벌인재양성등 10개 사업(389억원) 시행 |
|
2020년 |
범부처전주기의료기기연구개발사업, 감염병예방치료기술개발사업, 치매극복연구개발사업등 11개 사업(969억원) 시행 |
|
2021년 |
국가신약개발사업, 범부처 재생의료기술개발사업 등 신규사업과 코로나19 관련 추경 사업 등 12개 사업(2,018억원) 시행 |
|
2022년 |
감염병 의료안전강화 기술개발사업, 백신 기반기술 개발사업과 재생의료 임상연구 기반조성사업 등 16개 사업(841억원) 시행 |
출처: 보건복지부
(나) 지원내용
한국보건산업진흥원에서 관리하는 2022년도 ‘보건의료기술연구개발사업’ 현황은 다음과 같다.
[표 2-23] 보건의료연구개발사업 세부 사업 및 지원내용(2022)
(단위: 백만 원)
|
세부사업명 |
지원 내용 |
예산 |
|
감염병방역기술개발사업 |
• 코로나19 및 신・변종 감염병 출현에 대비하여 의료현장에서 필요한 방역장비 핵심부품의 국산화 및 경쟁력 확보를 통한 국가방역체계 역량 강화 |
13,066 |
|
감염병예방・치료기술개발사업 |
• 국민건강을 위협하는 감염병의 예방・치료・확산방지를 위한 백신, 진단, 치료제 개발 지원 |
42,968 |
|
감염병위기대응기술개발사업 |
• 결핵, 대유행 인플루엔자 등 질병부담이 크거나 국가적 위기를 초래할 수 있는 감염병 대응을 위한 보건의료기술개발 및 백신의 국산화 사업 등 추진 |
2,900 |
|
공익적 의료기술연구사업 |
• 저출산, 희귀질환, 환자안전, 치매 등 공익적 의료수요 해결을 위한 실용화 기술개발 지원으로 개념검증, 임상적 근거 확보를 위한 연구 지원 |
11,925 |
|
국가신약개발사업 |
• 국내 제약・바이오 산업의 글로벌 경쟁력 강화와 국민건강의 필수조건인 의약주권 확보를 위해 제약기업과 학・연・병의 오픈이노베이션 전략을 바탕으로 신약개발 전주기 단계를 지원 |
42,013 |
|
국민건강 스마트관리 연구개발사업 |
• 국민의 건강증진을 위한 스마트 기술 기반의 이용자 중심 건강관리서비스 모델 개발 및 지역사회 기반의 건강관리 체계 구축 지원 |
8,358 |
|
노인・장애인 보조기기 연구개발사업 |
• 체계적인 보조기기 R&D 생태계 기반 구축을 통해 보조기기 국산화 및 산업육성, 국민 삶의 질 향상에 기여 |
10,078 |
|
노인천만시대 대비 고령친화서비스 연구개발 |
• 응급안전알림서비스 연계형 고령자 자립 생활 지원, 고령친화제품 및 서비스 개선을 위한 실생활기반 리빙랩 구축 및 운영, 정보통신기술 활용 비대면 사회서비스 개발 분야의 R&D 지원을 통해 건강하고 활기찬 노후 실현 및 고령자 삶의 질 향상 제고 |
5,147 |
|
돌봄로봇 중개연구 및 서비스모델 개발사업 |
• 돌봄 수혜자의 일상생활 지원 및 돌봄 제공자의 돌봄 부담 경감을 통해 삶의 질을 향상시키고, 돌봄기술 산업 육성 |
2,980 |
|
디지털 병리 기반의 암 전문 AI 분석 솔루션 개발사업 |
• 병리 진단이 필수적인 암에 대한 AI 병리 분석 솔루션 개발을 통해 진료 환자의 병리 판독 업무 효율화, 환자 진단 및 치료 효과성 제고 |
9,250 |
|
마이크로의료로봇실용화기술개발사업 |
• 마이크로 의료로봇 공통활용기술 기반구축 및 마이크로 의료로봇의 기술개발을 통해 고부가가치 의료기기 세계시장 선점 및 국가 의료복지 수준 향상 |
9,800 |
|
바이오헬스 투자인프라 연계형 R&D 사업 |
• 바이오헬스 분야 창업기업의 성공 잠재력이 있는 기술의 빠른 상용화 촉진을 위해 정부와 민간이 공동으로 자금 및 인프라 연계 지원 |
8,175 |
|
범부처재생의료기술개발사업 |
• 재생의료 핵심・기초 원천기술부터 치료제・치료기술 임상단계까지 전 주기 지원을 통한 희귀・난치 질환 극복 및 미래 바이오경제 시대의 글로벌 경쟁력 확보 |
19,051 |
|
범부처전주기의료기기연구개발사업 |
• 글로벌 제품 개발, 미래의료 선도 및 의료 복지 구현을 위해 범부처 차원의 의료기기 임상・인허가・제품화 전주기 지원 |
57,224 |
|
보건의료인재양성지원사업(기금) |
• 보건의료분야 전문인력 양성을 통한 신진 연구인력의 성장기반을 마련하고, 정기적인 인력교류 및 국제적 연구 네트워크 구축으로 국제 교류・협력 활성화, 국민의 건강증진과 4차 산업의 지속가능한 발전을 견인하기 위한 정밀의료 전문인재 양성 |
5,050 |
|
보건의료인재양성지원사업(일반회계) |
• 바이오메디컬 분야의 혁신을 이끌 융합형 글로벌 핵심인재 육성 |
13,163 |
|
스마트임상시험플랫폼기반구축사업 |
• 임상시험 효율성 및 품질 향상을 위한 차세대 임상시험 기반기술 개발을 통해 국내 임상시험산업의 글로벌 경쟁력 및 국내 신약개발 성공 가능성 제고 |
890 |
|
연구중심병원 육성 |
• 글로벌 수준의 연구역량 확보 및 사업화 성과 창출을 통해 보건의료산업 발전을 선도하며 국민 건강증진에 기여하는 세계적인 병원 육성 지원 |
52,875 |
|
의료기기기술 개발사업 |
• 의료기기 핵심기술 개발 빛 임상적 근거창출 지원 등을 통해 기술경쟁력 강화 및 사업화 촉진을 이루어 냄으로서, 의료기기산업을 육성하고 국민 보건 향상에 기여 |
3,829 |
|
의료기술상용화 지원센터 |
• 보건의료 기초연구 성과의 상용화 촉진을 위한 질환특화 유효성평가지원센터 및 의료기기 혁신지원센터 지원 |
13,500 |
|
의료데이터 보호활용 기술개발사업 |
• 의료 빅데이터를 활용한 공공적 목적 연구 지원 및 의료데이터 기반의 연구 활성화를 위한 개인정보 보호・보안기술 활용 연구 지원 |
6,000 |
|
인공지능바이오로봇의료융합기술개발 |
• 인공지능, 로봇기술 등 4차 산업혁명 핵심 기술을 의료산업에 융합한 신개념 의료융합기술을 부처협업(과기정통부, 산업부, 보건복지부)으로 전주기 지원 |
2,140 |
|
임상연구인프라조성사업 |
• 신약 및 의료기기 개발 활성화를 위한 선진국 수준의 임상시험 인프라 구축, 의료기술의 과학적 근거 확보를 위한 임상연구 지원을 통해 선진 의료산업 기반을 마련하고 임상시험 허브로의 도약 및 제약산업 국제경쟁력 강화 |
1,250 |
|
중환자 특화 빅데이터 구축 및 AI 기반 CDSS 개발사업 |
• 다기관 참여의 한국형 중환자 특화 데이터셋(K-MIMIC)을 구축하고, 이를 활용한 AI 기반 중환자 CDSS 개발 및 실증연구 |
9,100 |
|
질병중심중개연구사업 |
• 질환의 기초・기전 탐색 연구결과를 바탕으로 진단, 예방, 치료법 개발을 추구함으로써 기초연구 성과의 실용화연구 이행을 촉진 |
7,050 |
|
질환극복기술개발 |
• 21세기 대표적 고부가가치 미래 성장산업인 보건의료 산업을 육성・발전시켜 국민의 생명・건강을 증진시키고 사람이 살기 편안한 건강・안전 사회 구현 |
300 |
|
첨단의료기술개발 |
• 보건의료 산업의 첨단의료 수요 증가를 반영하고 산업 경쟁력 확보를 위하여 재생의료, 신약개발 등 미래 유망 신기술 개발 지원 |
39,851 |
|
치매극복연구개발사업 |
• 치매의 예방부터 진단, 치료, 돌봄 분야에서 실용화 성과창출을 위한 단기 기술개발 지원 |
11,243 |
|
치의학의료기술연구개발사업 |
• 치과질환의 진단・치료・예후의 통합적 기술 및 ICT 기반 첨단기술개발 |
4,200 |
|
코로나19 백신 임상지원사업 |
• 국내 유망 백신 개발 기업 대상으로 개발에 필요한 임상시험 비용을 지원하여 국내 자체 코로나19 백신 개발 촉진 |
41,800 |
|
코로나19 치료제 백신 비임상지원사업 |
• 코로나19 종식에 필수적인 우수한 치료제・백신개발 및 첨단동물을 활용한 감염병 의료제품 평가지원체계 구축 지원 |
8,000 |
|
코로나19 치료제 임상지원사업 |
• 국내 유망 치료제 개발 기업 대상으로 개발에 필요한 임상시험 비용을 지원하여 국내 자체 코로나19 치료제 개발 촉진 |
47,500 |
|
포스트게놈 다부처 유전체사업 |
• 유전체 기술이 가져올 미래사회 변화에 적극적으로 대비하고 글로벌 경쟁력을 높이기 위해 범정부적 차원의 사업 지원(보건복지부는 개인별 맞춤 의료를 실현하기 위한 질병 예방・진단・치료기술 개발 집중지원) |
347 |
|
피부과학 응용소재 선도기술 개발사업 |
• 소재 국산화, 기술 경쟁력 강화, 시장 다변화를 통해 화장품산업을 지속가능한 미래 성장동력으로 육성하기 위한 연구개발 지원 |
10,280 |
|
한의기반융합기술개발사업 |
• 한의약을 바탕으로 IT, BT, NT 등 현대과학기술을 응용하여 한의약의 외연을 확장하고, 질병을 예방・치료하는 실증적인 지식과 기술을 개발 지원 |
6,830 |
|
한의약혁신기술개발사업 |
• 근거 중심의 한의약 의료서비스 표준화・과학화로 한의 의료서비스 품질 제고 및 산업화 기반 마련 |
14,213 |
|
환자중심 의료기술 최적화 연구사업 |
• 임상현장의 다양한 의료기술을 대상으로, 최적의 의료서비스를 환자에게 제공하고, 보건의료체계의 지속가능성을 확보하기 위한 근거창출 |
18,262 |
|
K-Medi융합인재양성지원사업 |
• 바이오 메디컬 혁신인재 및 신진 의사과학자 양성(Career Path) 지원 등 보건의료 분야 특화 융합 인재 양성 |
5,875 |
|
감염병의료안전강화기술개발사업 |
• 장기화된 코로나19 대응과정에서 발생한 의료현장의 긴급수요를 반영하고, 차기 감염병 위협 및 의료 관련 감염에 대비하기 위해 필수적인 4개 분야(구조・시스템・장비・인력)에 대한 최적화 기술개발 추진 |
10,800 |
|
미래성장 고부가가치 백신 개발사업 |
• 미충족 수요 백신, 프리미엄 백신, 치료용 백신 등 글로벌 백신 산업의 미래성장 가능성이 높은 고부가가치 백신에 대한 개발 지원 |
4,756 |
|
백신 기반기술 개발사업 |
• 백신개발 및 생산에 기반이 되는 연관기술 국산화 개발 지원 |
6,525 |
|
보건의료 빅데이터 큐레이션 기술개발 사업 |
• 보건의료 빅데이터 큐레이션 기술개발을 통하여 고품질의 의료데이터를 확보하고 데이터 분석 연구 및 의료 인공지능 개발 등 활용성 제고 |
2,695 |
|
신변종 감염병대응 mRNA백신 임상지원사업 |
• 신・변종 감염병에 신속 대응 가능한 국내 자체의 mRNA백신 개발 |
10,500 |
|
신속 범용백신 기술개발 사업 |
• 신ᐧ변종 감염병 신속대응 백신 플랫폼 구축 및 범용 백신, 미래 팬데믹 타깃 백신 개발 지원 |
5,639 |
|
실사용데이터(RWD) 기반의 임상연구 지원 사업 |
• 실사용데이터(RWD)에 근거한 다기관 임상시험 효과성・안전성 연구 지원을 통해 임상연구와 실제 임상현장 간 증거 격차를 해소하고 실사용 데이터 기반의 임상연구 체계 구축 |
5,000 |
|
재생의료 임상연구 기반조성사업 |
• 첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법에 따른 재생의료 혁신기술 발굴 및 연구개발 지원 |
6,825 |
|
전자약기술개발사업 |
• 전자약 시장생태계 조성으로 희귀・난치질환 극복, 만성질환 등의 치료편의 증진을 위한 국산화 연구개발 및 제품화 지원 |
2,775 |
|
정신건강연구개발사업 |
• 코로나19, 사회적 불안 요소 증가에 따른 국민 정신건강 증진 및 정신질환자의 안전한 치료환경조성을 통한 정신건강 서비스 기반 강화 |
6,200 |
|
차세대의료연구기반육성사업 |
• 의료제품 R&D지원 기반 고도화를 통한 기술선도형 생태계 구축 및 의료연구개발 문제해결 중점지원 |
5,000 |
|
포스트코로나시대 적정수혈을 위한 의료기술개발사업 |
• 포스트코로나시대, 혈액 부족 사태에 대비하고 환자 중심의 안전한 환자혈액관리(PBM, Patient Blood Management) 정착을 위한 의료기술 개발 연구 지원 |
2,000 |
|
혁신형 의료기기기업 기술상용화 지원사업 |
• 글로벌 연구기관과 국제협력연구 추진 및 해외 임상데이터 축적을 통해 보험등재가 용이한 해외시장을 우선 개척 후 국내시장을 진입하는 역방향 기술 상용화 중점 지원 |
4,800 |
|
합계 |
639,998 |
|
출처: 보건복지부
(2) 암 연구사업
(가) 개요
보건복지부는 국민보건 향상을 목적으로 암에 관한 전문적인 연구와 암환자의 진료 등을 위해 2000년 ‘국립암센터법’을 제정하여 국립암센터를 설립・운영하고 있으며, 암의 발생・예방・진단・치료 및 관리 등에 관한 연구 활동을 지원하는 국립암센터 ‘기관고유연구사업’과 국내 학・연・산・의료계 소속 암 연구자의 연구 활동을 지원하는 ‘암정복추진연구개발사업’ 관리업무를 각각 수행하고 있다.
[표 2-24] 제4차 암관리종합계획(2021∼2025) 비전 및 목표
|
비전 : 어디서나 암 걱정 없는 건강한 나라 |
|
|
목표 |
1. 고품질 암데이터 구축 및 확산 2. 예방 가능한 암 발생 감소 3. 암 치료・돌봄 격차 완화 |
|
추진과제 |
1. 암 빅데이터 활성화 2. 암 예방・검진 고도화 3. 암 치료・대응 내실화 4. 균등한 암관리 기반 구축 |
출처: 보건복지부
국민 사망원인 1위인 암질환을 국가 차원에서 장기적・종합적으로 관리하기 위해 ‘제1차 국가암관리종합계획(1996∼2005)’ 시행으로 국립암센터설립(2001), 암관리법 제정(2003) 등 국가암관리체계를 구축하고 암등록통계사업, 5대 암검진사업 등 기틀을 마련하였다. ‘제2차 국가암관리종합계획(2006∼2015)’에서는 고령화와 생활습관의 서구화에 따른 질병 구조 변화에 대응하기 위해 사전예방을 강조해 암예방・검진사업 등을 강화하였다. ‘제3차 국가암관리종합계획(2016∼2000)’에서는 암 검진 수검률을 상승시켜 조기 발견을 확대하였고, 조기 발견과 치료기술 향상으로 암 생존률을 향상시켰다. 또한 암 관련 건강보험 보장률을 향상시키고 호스피스 이용률도 증가하였다. 2021년부터는 ‘제4차 암관리종합계획(2021∼2025)’를 수립・시행 중이다.
(나) 지원 내용
국립암센터는 국가 암관리정책 개발 및 각종 국가암관리사업의 기획・관리・평가 등을 적극 지원함으로써 국민의 암 부담을 획기적으로 감소시키고, 삶의 질 향상에 기여하고 있다. 또한 내부 연구자의 연구 활동을 지원하는 ‘기관고유연구사업(Intramural Program)’과 산・학・연・의료계 소속 암연구자의 연구 활동을 지원하는 ‘암정복추진연구개발사업(Extramural Program)’ 관리업무를 수행하며, 주요 암 발생률 및 사망률을 낮추고 암 치료율을 제고시킬 수 있는 이행성 연구 등 실용화 연구를 중점으로 추진하고 있다. 2022년 기관고유연구사업은 공익적 핵심 암 융합연구, 공익적 암 기반연구, 전주기적 암관리・정책 연구, 공공 개방형 암 연구 인프라 운영에 281억 원을 지원하였고, 암정복추진연구개발사업을 통해 암관리 근거창출 연구, 공익적 암 임상연구, 차세대 정밀의료 선도연구, 지역암센터 연구사업 지원 등에 117억 원을 지원하였다. 더불어 국가항암신약개발사업의 후속으로 항암신약개발 성과확산사업에 30억 원을 지원하였다.
[표 2-25] 국립암센터 세부사업 및 지원내용(2022)
(단위: 백만 원)
|
세부사업명 |
지원 내용 |
예산 |
|
암 연구소 및 국가 암관리사업본부 주요사업비 |
<기관고유연구사업> • 공익적 핵심 암 융합연구, 공익적 암 기반연구, 전주기적 암관리・정책 연구, 공공 개방형 암 연구 인프라 운영 |
28,138 |
|
<암정복추진연구개발사업> • 연구자 주도 다기관 암 임상연구, 차세대 정밀의료 선도연구, 암 정책・관리연구, 암 공중보건 연구 |
11,692 |
|
|
<항암신약개발 성과확산사업> • 항암신약개발사업 우수과제 후속 지원 |
3,000 |
|
|
<기획평가비> |
185 |
|
|
합계 |
43,015 |
|
출처: 보건복지부
(3) 재활연구개발사업
(가) 개요
보건복지부는 국내 유일의 재활 전문 국립중앙기관인 국립재활원을 통해 재활연구개발용역사업(재활연구개발지원사업, 재활로봇중개연구사업), 지능형 재활운동체육 중개연구사업을 수행하고 있다.
(나) 지원 내용
국립재활원 재활연구개발용역사업은 2개의 내역사업(재활연구개발지원사업, 재활로봇중개연구사업)으로 구성되어 있으며, 각 내역사업별로 사업목적 및 특성에 맞춰 다양한 재활 관련 연구를 지원하고 있다.
재활연구개발지원사업에서는 COVID-19 등 팬데믹 발생에 따른 장애인 등 건강 취약계층의 치료 및 재활 여건 어려움 증가 및 변화에 따른 선제적 대응을 위해 장애인 비대면 건강프로그램 개발 및 임상적용 연구와 다양한 장애・상황을 고려한 맞춤형 임상 재활 데이터 기술 활용 모델 개발 연구 등에 약 20억 원을 지원하였다.
재활로봇중개연구사업에서는 재활로봇의 임상 진입 가속화를 위해 로봇기술에 대한 ① 기술개선, ② 안전성 시험검사, ③ 인허가, ④ 임상의 4단계를 중심으로 측정・평가・분석 및 피드백이 가능한 재활로봇, 소아용 재활로봇, 가정 내 사용이 가능한(In-home) 재활로봇, 착용형 재활로봇, 재활로봇의 임상근거 확보를 위한 중개연구와, 뇌이미징 등 첨단기술 융복합 재활로봇, 운동학습이론/자극피드백/생체신호 등을 활용한 재활로봇 등 다양하고 고도화된 기술이 접목된 재활로봇의 중개연구 등에 약 45억 원을 지원하였다.
지능형 재활운동체육 중개연구사업을 통해서는 복지부, 과기부, 문체부, 산림청 공동으로 지역사회로 복귀하는 장애인의 건강증진을 위한 재활운동 및 체육에 관한 스마트 운동・치료기기 개발 및 융복합 프로그램・서비스 연구개발에 49억 원을 지원했다.
[표 2-26] 국립재활원 세부사업 및 지원내용(2022)
(단위: 백만 원)
|
세부 사업명 |
지원 내용 |
예산 |
|
국립재활원 재활연구개발용역사업 |
• 장애인・노인의 삶의 질 향상, 신체・인지・심리적 기능 개선 및 사회복귀 등을 목적으로 한 다원적 맞춤형 연구 추진, 기술연구와 임상연구 간의 연계 촉진을 통한 재활로봇 등 재활보조기술산업 육성 |
6,462 |
|
지능형 재활운동체육 중개연구사업 |
• 지역사회로 복귀하는 장애인의 건강증진을 위해 지속적으로 제공되는 재활운동 및 체육에 관한 스마트 운동・치료기기 개발 및 융복합 프로그램・서비스 연구개발 |
4,905 |
|
합계 |
11,367 |
|
출처: 보건복지부
(4) 정신건강연구개발사업
(가) 개요
보건복지부 국립정신건강센터는 2022년부터 기관고유연구개발사업을 확보하여 공공 정신건강 영역에서 국가 주도의 공공정신건강 서비스 개발 및 보급을 지원하고 있다. 또한, 혁신도전프로젝트 다부처 사업을 통해 디지털치료제 개발을 지원하고 있다.
(나) 지원 내용
국립정신건강센터 연구개발사업을 통해 정신건강 코호트 연계・확산, 정신건강교육 거버넌스 등 개발에 16억 원을 지원하며, 자폐혼합형 디지털치료제 개발을 통해 자폐성 장애를 위한 혼합형(HW・SW) 디지털 치료제 상용화 기반 마련, 코호트 기반 기초연구자료와 디지털치료제 통합 연계 데이터를 포괄하는 데이터 플랫폼 및 DB 구축, 이를 활용한 AI 기반 자폐성 장애 고위험군 진단・예측 SW 개발에 31억 원을 지원했다.
[표 2-27] 국립정신건강센터 세부 사업 및 지원내용(2022)
(단위: 백만 원)
|
세부 사업명 |
지원 내용 |
예산 |
|
국립정신건강센터 연구개발사업 |
• 공공정신건강서비스 강화를 위한 사회문제 대응형 공공서비스 개발, 연구성과 현장실증, 공공연구자원 기반구축 |
1,625 |
|
(혁신도전) 자폐혼합형디지털치료제개발 |
• 자폐성 장애의 다차원적 모니터링・분석을 위한 디지털 표현형 기반 통합 데이터 플랫폼 및 코호트 DB 구축 |
3,077 |
|
합계 |
4,702 |
|
출처: 보건복지부
마. 추진 방향
2023년도 보건복지부는 보건의료 분야의 범정부 R&D 종합계획인 제3차 보건의료기술육성기본계획(2023∼2027)을 새로 수립・추진하여 보건의료 연구개발 지원에 박차를 가할 예정이다.
2023년에는 디지털 헬스케어, 보건의료데이터, 첨단재생의료와 같은 차세대 유망기술 분야의 신규사업이 대폭 확충되는 등 바이오헬스 경쟁력 강화를 목표로 감염병 위기대응 역량 강화, 바이오헬스 분야 첨단유망기술 육성, 질환 극복 등 공익적 연구개발 투자 확대, 의료현장 연계 연구개발 지원의 4대 분야를 중심으로 적극적인 투자를 지속할 예정이다. 미래 감염병으로부터 국민들의 생명・건강을 보호하기 위하여 백신・치료제 핵심기술 역량 확보 등 미래 감염병 대응 기술과 방역 전주기 연구개발 지원을 통하여 국가 방역체계 고도화, 감염병 위기대응 역량 강화를 위한 연구개발을 지원하고자 한다. 바이오헬스 디지털 전환 촉진을 위한 데이터・인공지능 기반의 보건의료기술, 의료의 질을 제고할 수 있는 개인별 맞춤 서비스 보건의료기술, 미개척 영역・첨단의료기기 등 핵심기술 자급화를 통하여 산업 경쟁력을 제고할 수 있는 기술 및 이종장기 등 첨단 재생의료기술을 대상으로 연구개발을 지원하여 바이오헬스 차세대 유망 분야를 발굴・육성하고자 한다. 뇌질환, 정신건강, 암 등 국민들의 의료부담이 높은 질환 및 고령화, 저출산 등 사회변화로 인해 공익적 수요 급증이 예상되는 영역의 보건의료기술을 선제적으로 연구・개발하는 공익적 연구개발 투자를 강화하고자 한다. 마지막으로 신진 의사과학자 연구지원 확대, 규제과학 전문가 양성 지속 등 바이오헬스 혁신을 주도할 수 있는 전문인력 양성 투자를 통하여 의료현장 연계 연구개발을 지원하고자 한다.
7. 환경 분야 생명공학 육성
가. 개요
환경생명공학기술(Environmental Biotechnology, EBT)이란 생명공학기술(Biotechnology, BT)을 환경기술(Environmental Technology, ET)에 접목하거나 융합하는 기술이다. 즉, 생물학적・분자생물학적 기법이나 생물학적 처리공정을 이용하여 환경오염을 예방(prevention)하거나 감시(monitoring)하는 기술, 오염된 환경을 복원(restoration)하고 정화(remediation)하는 기술을 의미한다.
환경생명공학기술은 청정기술, 환경오염제어 및 관리기술, 바이오에너지 기술을 포함한다. 그 밖에도 생물학적 방법을 이용한 환경오염물질의 검출(detection), 친환경 소재・제품 개발, 생태계 건전성 및 생물다양성 유지, 토양・지하수 복원, 온실가스 감축, 기후변화 적응 등에 필요한 기술까지로 그 범위가 확대되고 있다. 환경생명공학기술은 근래 각 분야에서 개발되고 있는 첨단기술과 융합하며 기존의 환경기술로는 극복하기 어려운 한계를 해결할 수 있다는 점에서 그 중요성이 부각되고 있다.
세계 발전과 인류 공영을 위해 2015년 9월에 유엔 총회에서 채택한 지속가능발전목표(SDGs) 17개 중 8개가 환경과 밀접히 관련되어 있고, 세계경제포럼(WEF)에서 발간한 글로벌 리스크 보고서(The Global Risks Report 2020)에서는 가장 영향력 있는 위기 중 3건이 환경문제(기후변화 대응 실패, 생물종다양성 소실, 극심한 기후현상 등)로 선정되었다.
나. 추진 경과
환경부는 생물다양성의 보전과 그 구성요소의 지속가능한 이용을 위해 1997년부터 범부처 ‘국가생물다양성전략’을 수립하고 있다. 이후 2012년에는 ‘생물다양성 보전 및 이용에 관한 법률’이 제정되어 생물다양성의 종합적・체계적인 보전, 생물자원의 지속가능한 이용, 생물다양성협약 이행을 위한 기틀이 마련되었다.
환경부는 국가생물자원 확보・소장・전시・연구를 체계적으로 수행하여 생물산업의 육성・지원 기반을 마련하고 국가경쟁력을 강화하고자 2007년 ‘국립생물자원관’을 설립하였다. 이후 2013년에는 환경부 산하 ‘국립생태원’이 출범하여 자연생태계와 생물다양성 보전, 야생생물 관리를 위한 다양한 활동과 함께 국토환경 보전 기본정책 수립을 지원・협력하고 있으며, 2020년에는 환경부 소속 ‘국립야생동물질병관리원’이 개원하여 야생동물 질병 관리 분야에서 중심 역할을 수행하고 야생동물 질병 예방과 확산 방지를 위해 총력을 기울이고 있다.
아울러 환경부는 2012년 ‘환경기술 중장기 로드맵(2013∼2022)’, 2018년 ‘환경 R&D 중장기 추진 전략(2019∼2028)’, 2021년 ‘환경기술개발 추진 전략(2021∼2030)’에 기초하여 생물자원의 지속 가능한 이용・보전과 생물다양성 가치 제고를 위한 R&D 사업을 추진 중이다.
[표 2-28] 주요 추진 경과(1994∼2021)
|
년 도 |
내 용 |
주관 |
|
1994 |
• 환경기술 및 환경산업 지원법 제정 |
환경부 |
|
1997 |
• 제1차 국가생물다양성전략 수립 |
환경부 (자연생태정책과) |
|
2007 |
• 환경부 소속 국립생물자원관 설립 |
환경부 |
|
2009 |
• 제2차 국가생물다양성전략 수립 |
환경부 (자연생태정책과) |
|
2012 |
• 생물다양성 보전 및 이용에 관한 법률 제정 |
|
|
2012 |
• 환경기술로드맵(2013∼2022) 수립 |
환경부 (녹색기술개발과) |
|
2013 |
• 제3차 국가생물다양성전략(2013∼2018) 수립 |
환경부 (자연생태정책과) |
|
2013 |
• 환경부 산하 국립생태원 설립 |
환경부 |
|
2015 |
• 제1차 야생동물 질병관리 기본계획 수립(2016∼2020) |
환경부 (생물다양성과) |
|
2017 |
• 유전자원의 접근・이용 및 이익 공유에 관한 법률 제정 |
|
|
2018 |
• 환경 R&D 중장기 추진전략(2019∼2028) 수립 |
환경부 (녹색기술개발과) |
|
2019 |
• 제4차 국가생물다양성전략(2019∼2023) 수립 |
환경부 (자연생태정책과) |
|
2020 |
• 환경부 소속 국립야생동물질병관리원 설립 |
환경부 |
|
2020 |
• 제2차 야생동물 질병관리 기본계획 수립(2021∼ 2025) |
환경부 (생물다양성과) |
|
2021 |
• 환경기술개발 추진 전략(2021∼2030) 수립 |
환경부 (녹색기술개발과) |
출처: 환경부
다. 주요 정책
(1) 유전자원의 접근・이용 및 이익 공유에 관한 법률 제정
2010년 제10차 생물다양성에 관한 협약(Convention on Biological Diversity, CBD) 당사국 총회에서 ‘유전자원에 대한 접근 및 유전자원의 이용으로부터 발생하는 이익의 공정하고 공평한 공유에 관한 나고야 의정서’가 채택되고 2014년 10월 12일에 발효되었다.
이에 따라 자국의 생물자원에 대한 주권을 강화하려는 국제적 추세에 대응하기 위하여 유전자원 등에 대한 접근과 이용을 위한 지원시책의 수립, 국내 유전자원 등에 대한 접근 신고 및 유전자원 등의 이용으로부터 발생한 이익의 공유 등에 관한 제도적 기반 마련을 내용으로 하는 ‘유전자원의 접근・이용 및 이익 공유에 관한 법률(유전자원법)’이 제정되어 2017년 8월 17일부터 시행 중이다.
(2) 환경 분야 생명공학 기술개발 추진
환경부는 환경생명공학기술 유망 분야 중 생물학적・분자생물학적 기법이나 생물학적 처리공법을 활용한 환경오염 예방・감시・복원・정화기술 개발에 투자하고 있다.
이 외에 탄소중립을 위한 유기성폐자원의 바이오가스화 실증, 야생 미생물을 활용한 수소 생산 기술개발을 추진하였고, 바이오 연구에 필요한 실물 소재와 연구 데이터를 체계적으로 확보하여 바이오 연구・산업 혁신을 촉진하기 위한 다부처 국가생명연구자원 선진화 사업에 참여하여 담수・섬 야생생물 소재를 중심으로 유용정보를 확보하고 분류군별・특성별 표준화된 보존・관리 체계를 마련하고 있다.
또한, 국내 야생생물자원을 활용한 소재와 공정 기술개발 사업에 착수하여 야생 미생물을 활용한 천연색소 생산, 야생식물을 활용한 친환경 필터, 야생생물 유래 유용물질을 활용한 유해조류 제어기술 연구 등을 진행하였다.
[표 2-29] 환경생명공학 주요 핵심기술 분야
|
기술 분야 |
주요 내용 |
|
융합기반 청정기술 |
환경오염물질의 발생을 사전에 예방하는 사전 오염 예방기술과 사업장 등 생산・소비단계의 오염물질 배출을 억제하는 기술 |
|
환경오염제어 및 관리기술 |
미량함유 물질 등 유해 물질들의 모니터링을 통한 관리기술 |
|
폐자원에너지화 및 고부가가치 자원화 기술 |
유기성 폐기물 등을 열화학적 또는 생물학적 방법으로 에너지화하는 기술 |
|
환경복원 및 정화기술 |
생물자원을 활용한 생태계 복원 및 정화, 유용생물자원의 기능별 실증화 기술 |
출처: 환경부
(3) 생물산업 육성
생물산업은 생물자원의 보전과 지속가능한 이용을 추진하고, 생물주권을 강화하기 위한 산업분야이다. 환경부는 지속가능한 생물자원의 확보를 위해 국내외 생물다양성을 조사하고 신규종을 발굴하는 한편, 생물소재 확보와 대량증식, 유용성 탐색연구를 통해 생물산업을 지원하는 정책을 추진하고 있다.
2006년부터 생물자원 발굴・분류 연구, 야생동물 첨단 연구 등 국가 생물자원의 조사・보전・관리를 위한 기본연구를 수행하고 있고, 국가야생생물소재은행을 구축하여 생물소재를 확보하고, 대량증식연구를 수행 중이다. 국가생물다양성센터와 유전자원정보관리센터를 통해 범부처별로 각자 운영하고 있는 다양한 생물 관련 정보를 통합하여 빅데이터를 구축・운영하고 있으며, 나고야 의정서 대응을 위한 생물산업지원플랫폼을 운영하고 있다.
(4) 야생동물 질병연구 추진
환경부는 야생동물 질병으로부터 생태계와 국민 건강을 보호하고 사회・경제적 피해를 최소화하고자 야생동물 질병 조사・연구를 통한 방역시스템 구축, 인수공통감염병에 대한 진단・대응 기법 연구를 추진하고 있다.
야생멧돼지 아프리카돼지열병(ASF) 표적 단백질 선정, 바이러스 배양기법 개발 등의 기초연구와 더불어 백신 효능평가 및 동물 대상 임상실험 등을 추진하고 있고, 주요 관리대상 질병에 대한 진단기법 개발 연구를 수행하고 있어서, 2025년까지 주요 법정 질병 40종에 대한 진단기법 개발을 목표로 표준화된 질병 진단 체계를 구축할 계획이다.
[표 2-30] 연도별 진단법 개발 수(누적, 2020∼2025)
|
연도 |
|
’20 |
|
’21 |
|
’23 |
|
’25 |
|
진단법 개발 수(누적) |
6종 |
10종 |
30종 |
40종 |
주) 2022년까지 개발된 진단법(20종): AI N형, AI H형, SFTS, 코로나, 살모넬라, 광견병, 웨스트나일열, 보툴리즘, 큐열, 구제역, 뉴캣슬병, 결핵, 브루셀라, 야토병, 토끼바이러스성출혈열, 개홍역, 랩토소피라, 개선충, 톡소플라즈마증, 항아리곰팡이병
출처: 환경부
이 외에도 야생멧돼지 아프리카돼지열병(ASF), 야생조류인플루엔자(AI) 등 사회・경제적 피해를 유발하는 현안 질병과 중증열성혈소판감소증후군(SFTS) 등 관리가 필요한 야생동물 질병에 대해 집중적으로 조사하고, 진단・대응기술을 개발하기 위한 연구를 중점적으로 추진하고 있다.
[표 2-31] 야생동물 질병연구 분야
|
추진 목표 |
주요 내용 |
|
야생동물 질병 감시체계 강화 |
• 야생조류 감염병 감시연구(감시기술 개발, 서식지 정밀모니터링) • 야생포유류 감염병 감시연구(시공간적 분포 특성 및 역학조사) • 주요 인수공통감염병 매개동물(멧돼지, 박쥐, 고라니 등) 시료분석 |
|
야생동물 질병 진단 및 관리 선진화 |
• 야생동물 질병 진단법 표준화 및 현장진단키트 개발 • 신변종 감염병 대응을 위한 진단기법 및 백신개발 연구 • 야생동물 질병관리정보시스템 구축・운영 |
출처: 환경부
[표 2-32] 야생동물 질병연구 주요 성과
|
|
야생멧돼지 ASF 유전자 분석(2022.12.) |
|
국내 야생멧돼지 ASF 전체 유전자를 분석하여 2007년 조지아에서 발생한 ASF와의 유전적 유사점과 IGR 유전형 Ⅱ형을 확인하여 백신 개발의 기초자료로 활용 ※ (관련 논문) Complete genome analysis of the African swine fever virus isolated from a wild boar responsible for the first viral outbreak in Korea, 2022.12.19 |
|
|
|
ASF 바이러스의 병원성 발현 신호체계 규명(2022.7.) |
|
ASF 바이러스 감염시 일부 유전자(EP364R, C129R) 부위로 인해 숙주의 인터페론 발현을 차단하여 면역력을 약화시킨다는 것을 확인, 병원성과 관련 있는 유전자 연구로 인위적 조작으로 인한 백신후보주 개발에 활용 ※ (관련 논문) African Swine Fever Virus EP364R and C129R Target Cyclic GMPAMP To Inhibit the cGAS-STING Signaling Pathway 2022.7.21 |
출처: 환경부
라. 주요 사업
(1) 환경 분야 생명공학기술개발사업
환경부는 생명공학 관련 기술개발을 위해 2011년부터 환경산업선진화기술개발사업, 생활공감 환경보건기술개발사업 등 다양한 사업을 추진해왔다. 이를 통해 보건 분야, 환경오염물질 사전예방, 생태계 복원 및 관리 등 다양한 분야에서 성과를 도출하였으며, 최근에는 탄소중립과 유용 생물자원의 구축・활용, 환경오염물질 저감을 위한 사업을 중점적으로 추진하고 있다.
[표 2-33] 환경 분야 생명공학기술 주요성과
|
|
생물 구조색을 모방한 휘발성유기화합물(VOCs) 측정용 색변화 센서 개발(2022.10.) |
|
나비 날개의 구조색을 모사하여 4종의 휘발성유기화합물(BTX, IPA, 아세톤, 폼알데하이드)을 동시에 무전원으로 민감하게(자일렌 최대 1ppm) 반복 검출할 수 있는 센서를 개발함 |
|
|
|
도시생태계 구조 및 기능 관리 기술 개발(2022.12.) |
|
위성영상과 차량용 센서(라이다, IR 등)를 융합한 시스템을 확보하여 도시 식생 모니터링 시스템을 구축함. 또한, 식생의 건강성에 영향을 끼치는 도시 토양의 유기탄소 변동양상을 분석하여 산림 파편화와 유기탄소 축적량과의 인과관계를 파악함 |
|
|
|
원헬스(One-Health)의 관점에서 본 항생제 내성체: 항생제 내성 전파의 이해 및 제어(2020.12.) |
|
한강 수계에 존재하는 항생제 내성균(병원균, 장내 세균 등)의 유래 메커니즘을 규명하고, 검출된 내성 유전자가 어느 세균으로부터 유래되었는지 추적하여 4개의 세균 분류군을 찾아내는 등 기반 성과를 도출하였음. 본 연구를 통해 국내 주요 지역(4대강, 도시 하수처리장 등)의 항생제 내성 지도를 구축함 |
|
|
|
흡입독성물질을 선별할 수 있는 독성예측 프레임워크 개발 (2020.12.) |
|
흡입독성 화학물질의 분자 수준에서 단계별 주요 현상을 거쳐 최종 악영향이 나타나는 전 과정을 분석하여 최종 독성을 예측하는 독성발현경로(AOP)개념을 적용한 기술, 폐섬유화에 대한 독성 기전을 미국 환경보호청(EPA)에서 구축한 실험실 독성테스트(ToxCast) 데이터베이스와 딥러닝 모델을 사용하여 독성발현경로(AOP)를 개발함 |
|
|
|
환경유해인자 노출에 의한 환경성 질환 영향 규명을 위한 연구 방법론 개발(2021.12.) |
|
임신 중 산모의 유해인자 노출에 따른 태아의 발달과 생후 건강에 대한 노출 위해성을 평가하는 어린이 노출환경인자(exposome) 연구 중 하나로 유해인자의 독성이 체내에서 어떤 기전(mechanism)으로 건강에 영향을 주는지 분자생물학 수준에서 평가하고 유해인자 노출 여부를 예측하여 조기 대응이 가능하게 함. 또한, 중합효소연쇄반응(PCR) 기술을 활용하여 환경유해인자에 대한 모니터링이 가능함 |
|
|
|
빛 먹는 식물 모사 친환경 광촉매를 사용한 공기청정기 개발 (2021.11.) |
|
자연 잎 표피조직을 모방한 다공성 구조 촉매, 미생물에 의한 오염물 분해를 모방한 산화・환원 반응을 통한 대기오염물 분해, 식물의 광합성 반응을 모방한 선택적 반응을 위한 이종금속 광촉매를 활용한 자연모사 공기오염 저감 광촉매 시스템을 개발함 |
출처: 환경부
(2) 생물자원 발굴 및 분류
환경부는 ‘나고야 의정서’ 발효에 대응하여 생물자원을 발굴・확보하고 생물자원 보유국・주권국의 입지를 구축하며 해외 유용생물자원을 선점하고, 한반도 자생생물의 주권 강화를 위한 과학적・객관적 증거 확보 및 정보화를 추진하여 생물산업을 지원하고자 2006년부터 2022년까지 총 1,774억 원을 생물자원 발굴 및 분류 사업에 투자하였다.
최근 3년간(2020∼2022) 곤충, 무척추동물, 균류, 조류를 중심으로 신종/미기록종 후보 3,832종을 발굴하여 사업 초기에 3만 종에 불과한 자생생물 자원을 5만 8,000여 종(2022년 12월 기준)으로 늘려서 자생생물자원 증가에 크게 기여하였다. 또한, 발굴된 생물종의 종 특성 연구를 통해 수입 효모를 대체할 국산 효모를 발굴하여 지역 특산 막걸리를 개발하는 등 국내 자생생물 자원을 활용할 수 있는 가능성도 확인하였다.
발굴종의 국제적 공인을 위한 학술논문도 최근 3년간 661편 발표하였다. 2022년까지 자생생물의 종속지적 연구를 수행하고, 국・영문 생물지 원고 1만 7,702종 작성을 완료하였으며 국・영문으로 총 444권을 발간하였다. 또한 한반도 주요 생물자원(한반도 고유종, 국외반출승인대상종, 법적보호종, 고부가가치종 등)의 종간/종내 유전적 다양성 정보, 유전자(체) 정보를 총 868건 분석하고, 학술지 논문 219편 출판을 완료하였다.
환경부는 다양한 생물다양성 정보를 공유하고 활용 기반을 구축하기 위해 정부와 민간에서 보유 중인 생물다양성 정보 약 1,800만 건을 연계하여 대국민 서비스를 제공하고 있다.
2009년부터 생물다양성이 위협받고 있는 개도국 핫스폿 지역(생물지리학적으로 매우 가치가 높지만 현재 극심하게 훼손되었거나 장차 사라질 위기에 처한 지역)의 지구 생물권 보전을 통한 국제 네트워크 강화를 위해 캄보디아, 미얀마, 라오스, 베트남과 공동연구를 추진하여 2022년까지 해외생물자원 1만 6,000여 종을 확보하고, 생물다양성 도감을 39권 발간하여 기증하였다. 또한, 중복표본을 기증하고 표본실 5개 지역 설치를 지원하였으며, 알러지, 아토피, 미백, 주름개선 등에 대한 특허 출원 39건, 특허 등록 28건, 기술이전 6건을 완료하였다.
[표 2-34] 생물자원 발굴 및 분류 분야의 주요 성과
|
|
한-캄보디아 생물다양성 공동연구에서 확보한 중복표본 1만 7,000여 점 기증 및 생물표본실 설치, 개소식 행사 추진(2022.7.) |
|
한-캄보디아 생물다양성 공동연구 15주년 기념 국제심포지엄 및 생물표본실 개소, 현지어 및 영어 생물도감 3종 1,200부 제작・기증. 생물다양성 핫스폿 지역에서의 생물다양성 보전을 위한 시설과 과학기술 관리 노하우 전수를 통해 지구 생물다양성 보전에 기여, 캄보디아 생물도감 기증 및 현지 생물표본 반환 사업을 통해 비금전적 이익공유를 통한 나고야 의정서 이행의 모범적 사례임 |
|
|
|
최근 3년간(2020∼2022) 자생생물 3,832종 신종/미기록종 후보 발굴 (2022.12.) |
|
자생생물조사발굴 사업을 통해 3년간 3,832종 신종/미기록종 후보를 발굴하고, 발굴종에 대한 국제적 공인을 위해 학술논문 661편을 발표함. 연평균 1,277종 발굴로 세계 최고 수준의 성과를 달성함. 우리나라에서 처음 발굴한 종에 대해서는 국가명 또는 지명을 이름으로 부여함으로써 우리의 고유성을 확보함 |
|
|
|
국산 효모로 지역 특산 막걸리 개발(2022.2.) |
|
대부분의 전통주 업체에서 수입 효모를 사용하여 수입 의존도가 매우 높아 이를 대체할 자생효모를 확보・발굴하고, 자생효모 자원의 주류 발효 적합성 연구를 통해 최적 효모를 선정하였음. 지자체・기업과 협업을 추진하여 각 기관별(자원관, 주류면허지원센터, 전문기업, 지자체) 전문성을 살려 효모 발굴부터 품질관리까지 안정적인 공급체계를 구축함으로써 지역 특산 프리미엄 제품을 개발하고 시제품을 출시함 |
|
|
|
멸종위기 야생생물II급 식물 선제비꽃 자생 집단의 유전적 구조 및 다양도 평가 |
|
동북아시아 지역 특산식물 선제비꽃은 멸종위기 야생생물II급으로 국내 2개 지역(양산, 연천)에 한정적으로 분포함. 국내 2개 집단과 일본 6개 집단을 대상으로 유전자 다양성을 분석하여 자생 집단의 유전적 특성 분석 및 보전 전략에 필요한 정보를 확보. 유전자 분석(엽록체 SNP, microsatellite)을 통해 국내 자생 집단 사이의 유전적 구조 변이를 확인하였으며, 일본 집단과 구별되는 고유한 유전적 특성이 파악되어 각 집단별 보전 전략 마련 필요성 등을 제안함 |
출처: 환경부
마. 향후 계획
생물산업은 석유화학산업을 대체할 수 있는 신성장동력으로서 그 가치가 증대되고 있고, 생물자원에 대한 패러다임도 ‘보전’에서 ‘지속가능한 이용’으로 변화하고 있으며, 생명공학 기술의 발달과 더불어 관련 산업의 세계 시장규모도 지속적으로 성장할 것으로 전망되고 있다.
그러나 ‘생물다양성 협약’, ‘나고야 의정서’ 비준에 따른 각국의 생물자원 확보와 이익 극대화를 위한 주권 확보 경쟁도 가속화될 것으로 예상되어, 생물다양성이 풍부한 개도국과의 협력 확대가 필요한 상황이다. 또한 기후위기와 환경 변화에 따라 생물다양성이 위협받고 감소하고 있으며, 사스(2007), 메르스(2013), 코로나19(2019) 등 인수공통감염병이 지속적으로 발생하고 있어 이에 대한 대응도 시급한 실정이다.
환경부는 야생생물 모니터링, 자생생물 대량증식・보급을 위한 생물소재 클러스터 조성, 유전 정보 확보, 생물다양성 평가와 변화 예측, 감염병 매개 동물 연구를 통해 탄소중립・환경오염 저감・환경복원 등 환경현안을 생물자원 기반으로 해결하고, 새로운 부가가치를 창출하기 위한 정책사업을 추진할 것이다.
나고야 의정서 발효 이후 관계부처 합동으로 제정・공포된 유전자원의 접근・이용 및 이익 공유에 관한 법률(유전자원법)의 안정적인 시행을 위해 노력하고, 국제 동향과 국내 현황을 폭넓게 반영한 제5차 국가생물다양성전략(2024∼2029)을 수립할 계획이며, 이를 기반으로 자연・생태 기반의 기후위기 대응과 생태계 보전을 위한 정책을 지속적으로 추진할 예정이다.
한편, 생물자원의 지속가능한 이용・보전과 생물다양성 가치 제고를 위한 환경기술개발사업을 계속 추진하는 가운데, 환경유해인자로 인한 환경성 질환 규명・예방・관리 강화 기반을 마련하기 위한 ‘환경보건 생체데이터 구축 및 활용 기술개발사업’, 기후변화에 따른 밀원수(蜜源樹)종 쇠퇴에 대응하고 꿀벌생태계를 보전하기 위한 다부처 협력사업인 ‘기상이변대응 새로운 밀원수종 개발로 꿀벌 보호 및 생태계 보전 사업’을 새롭게 준비하고 있다.
8. 해양수산 분야 생명공학 육성
가. 개요
해양수산생명공학(해양바이오)는 해양수산생명자원을 이용하여 산업적으로 유용한 생산물을 만들거나 생산공정을 개선할 목적으로 생물학적 시스템, 생체유전체 또는 그들로부터 유래하는 물질을 연구・활용하는 학문과 기술을 말한다. 현재 육상자원 탐색이 상당 부분 완료됨에 따라 고압, 고염 등 극한 환경에 적응하고 특이물질을 보유하고 있는 해양생물에 대한 글로벌 바이오기업들의 관심이 많으며, 해양생물의 효능을 활용한 바이오 신소재 개발이 활발히 진행되고 있다. 해양바이오는 국내 기업들의 기술 수준 및 주력 품목 등에 따라 기초연구부터 제품화 지원까지 정책 수요가 다양하다. 해양수산부는 해양바이오 핵심기술 개발, 산업생태계 조성, 기업 지원체계 구축을 주요 내용으로 하는 해양바이오 산업 신성장 전략(2022.7.)을 발표하고 육성정책을 추진 중이다.
나. 추진 경과
해양수산부는 2004년 ‘마린바이오21 사업(2004∼2013)’을 시작으로 해양생명공학 분야를 꾸준히 육성하고 있다. 2008년 ‘해양생명공학육성기본계획(2008∼2016)’, 2009년에는 ‘해양바이오 연구개발 활성화 대책(2010∼2014)’, 2018년 ‘해양바이오 산업육성 전략’을 수립하였다. 뿐만 아니라 해양생명자원의 보존・관리 및 이용 등에 관한 법률을 제정(2012.7.)하여 해양생명자원의 확보와 체계적이고 효율적인 관리 및 이용을 위한 제도를 마련하였다. 특히, ‘국립해양생물자원관의 설립 및 운영에 관한 법률(2014.10.)’을 제정하고, 해양생물자원의 수집・보존・전시 및 연구 등을 체계적으로 수행하기 위한 국립해양생물자원관을 설립(2015.4.)하여 해양생명자원을 활용한 해양생명공학의 체계적 육성을 추진하고 있다. 또한, 해양바이오 산업 활성화 기본계획(2021∼2030)으로 ‘글로벌 해양바이오 선점전략(2021.1.)’을 수립하고, 동 기본계획의 실행력 확보를 위한 추진전략과 이행방안을 보다 구체화한 ‘해양바이오 산업 신성장 전략(2022.7.)’을 마련하였다.
[표 2-35] 해양생명공학 분야 육성 추진 경과(2003~2022)
|
연도 |
내 용 |
주관 |
|
2003 |
∙ 해양바이오21 사업 기획연구 실시 |
해양수산부 (해양생태과) |
|
2004 |
∙ 마린바이오21 사업 3개 연구단 연구 착수 |
해양수산부 (해양생태과) |
|
2006 |
∙ 한국해양과학기술진흥원으로 관리업무 이관 |
해양수산부 |
|
2007 |
∙ 해양생명자원 종합관리 마스터플랜 수립 |
해양수산부 (해양생태과) |
|
2008 |
∙ 해양생명공학육성 기본계획(Blue-Bio 2016) 수립 |
국토해양부 (해양생태과) |
|
2009 |
∙ 해양바이오 산업 활성화를 위한 간담회 - 해양바이오 R&D 투자 확대 후속 조치 지시 |
국토해양부 (해양생태과) |
|
2014 |
∙ 해양수산 R&D 중장기 계획(2014∼2020) - 국가과학기술위원회 의결 |
해양수산부 |
|
2015 |
∙ 국립해양생물자원관 설립 |
해양수산부 (해양수산생명자원과) |
|
2017 |
∙ 해양수산 생명자원의 확보・관리 및 이용 등에 관한 법률 |
해양수산부 (해양수산생명자원과) |
|
2018 |
∙ 해양바이오 산업 육성 전략 마련 |
해양수산부 (해양수산생명자원과) |
|
2019 |
∙ 제1차 해양수산생명자원 관리 기본계획(2019∼2023) 수립 |
해양수산부 (해양수산생명자원과) |
|
2021 |
∙ 글로벌 해양바이오 선점전략 마련 - 해양바이오 산업 활성화 기본계획(2021∼2030) |
해양수산부 (해양수산생명자원과) |
|
2022 |
∙ 해양바이오 산업 신성장 전략(2022∼2027) - 국정현안조정점검회의 의결 |
해양수산부 (해양수산생명자원과) |
출처: 해양수산부
다. 주요 정책
해양수산부는 2027년까지 해양바이오 시장 규모 1조 2,000억 원 달성, 해양바이오를 통한 고용규모 1만 3,000명을 달성하는 것을 목표로 ‘해양바이오 산업 신성장 전략(2022.7.)’을 수립하였다. 이 전략은 ① 해양바이오 핵심기술 개발, ② 선순환 산업생태계 조성, ③ 기업의 자율적 성장 지원체계 구축 등 3대 중점과제로 구성되어 있다.
(1) 해양바이오 핵심기술 개발
기술 중요도 및 산업의 성장 가능성 등을 토대로 기초소재 개발 및 고도화, 대량생산 및 표준화, 그리고 융・복합 연구개발(R&D) 등 분야별 핵심기술을 선정하고, 투자에 집중한다. ① 해양바이오 소재 강국으로 도약하기 위해 심해저・공해 등의 해양생명자원으로부터 기초소재 확보를 강화하고, 나노기술 등 첨단기술과 융합하여 고부가가치 제품 개발에 활용될 수 있도록 한다. 이를 위해 해양생명자원 4,000여 종에 대해 항암・항균 등 유용소재를 확보하고 해양바이오 뱅크를 통해 기업에 바이오 소재를 제공함과 동시에 공동연구를 지원할 계획이다. 또한 유전체 분석을 확대해 2027년까지 산업적 가치가 높은 해양생물 500여 종의 유전체 정보를 확보할 계획이다. ② 해양바이오 소재의 대량생산, 표준화 등 산업화 촉진을 위해 합성생물학 기반 연구를 확대하고, 미세조류 등 대량배양 기술을 개발하는 한편, 기업과 공동으로 바이오 파운드리 도입을 추진한다. 특히, 폐기물로 버려지는 수산부산물의 해양바이오 자원화를 실현함으로써 어촌경제 활성화 및 환경문제 개선에 기여토록 할 것이다. ③ 해양바이오 소재를 환경, 에너지, 의약 등의 분야까지 활용이 확대될 수 있도록 첨단기술과 융복합 연구개발(R&D)을 확대할 계획이다. 적조 생물의 성장을 억제하는 유용 미생물을 개발하고, 양식장 등에서 질병을 유발하는 유해 바이러스에 대한 진단・치료 기술을 개발한다. 괭생이모자반 등 버려지는 해조류를 원료로 바이오플라스틱 소재를 개발하고, 심해저 고세균의 대량생산을 통해 바이오수소 상용화를 추진한다. 홍합 단백질을 이용한 생체조직 접합제, 해조류에서 추출한 관절치료제, 미세조류 독소를 활용한 진통제 등 의약제품 소재 개발을 적극 지원한다.
(2) 해양바이오 산업의 선순환 생태계 조성
해양바이오 산업의 선순환 생태계 조성을 위해 투자를 확대하고 관련 펀드를 조성하는 한편, 지역경제 활성화와 연계한 거점별 산업 클러스터를 조성한다. 핵심기술 연구개발(R&D) 투자를 확대하여 해양바이오 분야의 연구개발(R&D) 투자 규모를 현재 630억 원 규모에서 2027년까지 1,000억 원 수준으로 확대하고, 정부와 민간 공동펀드를 조성하여 우수한 기술을 보유한 기업에 지원할 계획이다. 또한, 해양바이오 뱅크를 확대하고 해양바이오 데이터센터를 구축해 해양바이오 소재에 대한 산업계의 접근과 이용이 확대되도록 할 계획이다. 또한, 해양바이오 소재 발굴을 위한 전용 조사선 건조를 추진하고 이를 통해 2027년까지 자원확보 규모를 2만 3,000종으로 확대한다. 아울러, 지역별 해양수산업 및 바이오 관련 시설 등 특성을 고려하여 권역별 해양바이오 거점을 조성해 나간다. 중부권, 서남해권, 동해권, 남해권 등 4개 권역을 기초소재, 기능성 제품, 의료・헬스 및 융복합 연구 등의 분야에 특성화하여 관련 인프라를 지원한다.
(3) 기업의 자율적 성장 지원체계 구축
해양바이오 산업에 대한 기업의 투자 확대와 사업화 성공을 위해 산업계, 연구기관 및 정부가 참여하는 해양바이오 규제개선 TF를 운영하여 소재개발, 대량생산 및 표준화, 인증・제품화 등 산업 전 단계에 걸쳐 규제를 발굴하고 정비한다. 아울러 기업의 전문인력 부족 문제를 해소하기 위해 해양바이오 전문인력 육성 전담기관 설립을 추진하고, 해양바이오 산업의 체계적 육성과 기업 지원확대 등을 위해 해양생명자원법을 개정할 계획이다.
라. 주요 사업
(1) 해양생명공학 연구개발사업
(가) 해양바이오 전략소재 개발 및 상용화
해양바이오 전략소재 개발 및 상용화 지원 사업에 착수하여 해양수산생물자원 유래 기능성 식품, 기능성 화장품, 의료기기 활용 소재의 식약처 허가를 통한 실용화 기술개발을 추진하고 있다. 본 사업은 해양수산생명공학 기술개발사업의 일몰 후속사업으로 대학 및 연구소 중심의 R&D 지원으로 확보된 원천기술을 활용하여 기업 중심의 상용화 연구를 지원한다. 해양생물자원을 활용한 기능 성분 확보 기술, 대량생산 및 표준화 기술, 효능검증 기술개발을 통해 단기 실용화 성과 창출에 박차를 가하고 있다.
(나) 빅데이터 기반 해양 바이러스 제어 및 마린바이오틱스 개발 사업
숙주와 숙주 내 서식하는 미생물군집(마이크로바이옴)과 상호작용 연구를 통해 인류의 난제인 질병 극복 및 가축 생산성 증대 문제 등을 해소하기 위한 연구가 다수 진행 중이나, 해양생물에 대한 국내 마이크로바이옴 연구는 체계적으로 진행되지 못하고 있다. 최근 COVID-19, SARS, MERS 등 인체감염 바이러스와 구제역, 조류독감, 아프리카돼지열병 등 가축 및 가금류를 감염시키는 바이러스성 질병 확산으로 막대한 경제적 손실과 사회적 혼란을 야기함에 따라 감염성 바이러스 연구 수요가 증대되고 있다. 해양에 다양하게 존재하고 잠재 위험성이 있는 해양바이러스에 대한 제어 및 관리 기술을 선제적으로 확보하여 해양 바이러스로부터 사람, 육상 및 수산생물 건강을 보호하기 위한 선제적 대응이 필요하다. 이에 따라 빅데이터 기반 해양 바이러스 제어 및 마린바이오틱스 개발 사업을 통해 해양생물 마이크로바이옴을 연구하여 생산성 조절 소재(해양생물 성장률 향상)를 개발하고, 해양환경 내 감염성 바이러스를 조사하여 진단법, 치료 소재 발굴을 추진하고 있다.
(다) 해양바이오수소 생산 상용화 기술개발
해양수산생명공학기술개발(2009∼2020) 사업을 통해 해양미생물을 활용한 수소 생산원리 규명(2010, Nature지 게재), 미생물 생산성 개량(야생종 대비 100배 향상), 실험실 규모(6kg/일) 실증, 데모플랜트(1톤/일 용량) 단기운전(10일) 실증을 완료하여 TRL 7단계 수준의 기술개발을 완료하였다. 서부발전(충남 태안)에 이미 구축된 해양바이오 수소 실증플랜트를 기반으로 운영 최적화 시스템 및 고효율 바이오수소 정제시스템을 개발하고 고순도 수소 품질검증, 신기술 인증 등 상용화 기술개발 목표로 연구개발을 추진하고 있다. 해양바이오 수소 생산기술은 바이오 분야 수소생산 기술 중 선도적 기술 수준으로 수소 경제 활성화에 대응한 수소 생산방식 다변화에 기여할 것으로 기대된다.
(라) 해양바이오 산업소재 국산화 기술개발
해양바이오 소재의 국내 수급 어려움에 따라 해양바이오 산업소재 중 85%가 수입 중인 만큼 해외의존도도 높다. 국내기업은 해양바이오 R&D 역량 한계로 고부가가치의 다양한 원료 개발 및 사업화에 이르는 전 주기에서 해외 대비 기술격차가 크다. 국내 기업이 국내산 소재를 이용하여 산업시장을 창출할 수 있도록 바이오 소재 생산 기술개발 지원을 통한 기업 경쟁력을 제고하고 국・내외 시장점유를 높일 수 있도록 지원이 필요하다. 이에 따라 수입의존도가 높은 해양바이오 산업소재의 국산화 대체를 위한 타깃 소재(베타-글루칸, 알긴산, 피코시아닌, 포르피린, 콜라겐, 잔토필) 대량생산 및 공정 표준화 기술을 개발하고, 해조류를 이용하여 석유화학 대체 바이오플라스틱 단량체 생산공정기술 확립 및 소재 상용화를 위한 성능, 안전성, 유효성, 위해성 관련 원료 소재 표준화 기술을 개발하고 있다.
(마) 해양수산부산물의 바이오 소재화
수산부산물 발생량은 연평균 약 85∼131만 톤 수준(2020, 해조류 제외)이고, 발생한 부산물 중 단백질원 유실비용은 처리비용 포함 총 324억 원(KIOST, 2020)으로 추정된다. 어업 또는 일부 양식업에서 발생하는 비상품어 및 부산물의 경우 해양에 투기되어 오염을 야기하고, 양식 또는 가공 과정에서 대량 발생하는 부산물은 폐기물 처리비용 등 부수적 비용을 유발한다. 해양수산부산물은 가공 과정을 거쳐, 일정 장소에 대량 집적되는 특징이 있어 양질의 해양바이오 산업소재로 활용이 가능하다. 이에 해양수산부산물의 바이오 소재화 사업을 통해 해양수산부산물 원료 표준화 및 유용물질 확보, 해양수산부산물 유래 바이오 소재 안정성 평가 및 시제품 제작, 해양수산부산물 유래 유용물질 대량생산 및 건강기능식품 원료 인정, 수요기업 기술이전을 통한 해양수산부산물의 순환시스템 구축을 추진하고 있다.
(2) 해양바이오 산업 지원사업
(가) 해양바이오 전문인력 양성
영세한 해양바이오 기업은 자체적인 인력교육 프로그램 운영이 어렵고 해양바이오 분야에 특화된 전문인력 확보에 한계가 있다. 실무 능력을 갖춘 전문인력 부족으로 어려움을 겪는 기업 지원을 위해 재직자 대상 현장 맞춤형 인력양성 프로그램이 2021년부터 운영하고 있다. 교육에 필요한 시설과 장비를 보유한 교육기관을 공모로 선정하고, 해양바이오 제품화 등 산업화 경험을 지닌 인력으로 강사진을 구성하였다. 교육과정은 해양생물 유래 소재 분리・정제, 기능 성분 분석, 장비(소재 배양, 탈염・중금속 제거 등) 실습, 국내・외 허가 인증 제도 등 실무역량을 강화할 수 있는 내용으로 진행하였으며, 교육과정을 이수한 인원은 2021년 34명에서 2022년 50명으로 확대되었다.
(나) 권역별 산업지원 인프라 구축
심해저 등 극한 서식환경에 있는 해양생물은 채집을 위해 조사선 등 인프라가 필요하여 민간차원에서 접근하기 어려우며, 효능연구부터 시제품 제작 등 식약처 허가 과정에 평균 6.5년의 오랜 기간과 많은 비용이 소요되어 기업의 투자만으로는 성과 창출에 한계가 있다. 또한, 기존의 해양바이오 관련 정책은 R&D 중심으로 추진되어 산업화 성과 창출이 미흡하였고, 업계 수요 맞춤형 인프라 지원이 미비하였다. 이에 해양바이오 소재의 시험・분석・인증부터 제품의 특허・제품화・마케팅까지 해양바이오에 특화하여 기업 수요 중심으로 산업화 전주기를 전담 지원할 기관으로 ‘해양바이오 산업화 지원센터’ 건립을 추진하였다. 동 센터는 2021년부터 2024년까지 총사업비 347억 원을 투입하여 충청남도 서천군 장항생태산업단지 내에 건립될 예정이다.
해조류는 후코이단, 알긴산 등 활성 소재가 풍부하나, 국내 생산의 99%가 원물 및 1차 가공으로 유통되며, 영세한 해양바이오 기업 여건상 투자 여력이 부족하고 안정적인 원료 소재 확보 문제로 사업화에 어려움을 겪고 있다. 해조류의 전처리에서부터 활성 소재를 추출・대량생산하고, 산업현장에서 즉시 활용 가능한 중간소재 및 품질 인증까지 받을 수 있는 소재를 대량으로 생산할 수 있는 시설의 필요성이 제기되어, ‘해조류 활성소재 인증생산시설’ 건립을 추진하였다. 동 시설은 2021년부터 2024년까지 총사업비 250억 원을 투입하여 전라남도 완도군 해양생물특화 농공단지 내에 건립될 예정이다.
기능성 식품 및 의약품 제품화를 위한 인허가를 받기 위해서는 안전성 증명, 독성・효능 분석 등 수행에 고비용이 소요되고 실패 가능성이 높아 영세 기업은 자체적인 데이터 확보에 어려움이 있다. 이에 식약처 기준에 따른 시험 설계・실시로 신뢰성 있는 평가자료를 생산하고 인허가를 지원하는 해양소재 특화 인증지원기관 설립 필요성이 제기되었다. 해양생명자원 활용 의약품・기능성 식품 관련 원료 표준화, 안전성, 유효성 평가 등 인증지원을 통해 해양바이오 기업의 사업화를 촉진하기 위해 ‘해양바이오 인증지원센터’ 건립을 추진하였다. 동 시설은 2023년부터 2026년까지 총사업비 250억 원을 투입하여 충청남도 서천군 장항생태산업단지 내에 건립될 예정이다.
충분한 연구역량을 보유한 연구기관이나 연구기업도 임상 기초정보 및 경험 부족, 메디컬 특화 인프라 미비 등으로 의료 분야 진입에는 어려움을 겪고 있다. 해양바이오 산업 고도화 및 고부가가치 창출을 위해 의료 분야 진출을 지원하는 인프라 설립 필요성이 제기되었다. 이에 동해권에 메디컬・헬스케어 분야에 특화된 연구개발 및 기술사업화 거점을 조성하여 해양바이오 기업의 고부가 의료시장 진출을 촉진하고자 ‘해양바이오 메디컬 실증연구센터’ 건립을 추진하였다. 동 시설은 2023년부터 2027년까지 총사업비 300억 원을 투입하여 경상북도 포항시 포항융합기술산업지구 내에 건립될 예정이다.
마. 향후 계획
(1) 국가관할권 이원지역 해양생물다양성 보전 및 지속가능이용(BBNJ) 협정안 타결
공해 및 심해저 등 국가관할권 이원지역의 해양생물다양성(Biodiversity Beyond National Jurisdiction, BBNJ) 보전 및 지속가능이용을 위한 협정안이 2023년 3월 마련되었다. 동 협정은 1982년 유엔 해양법협약의 세 번째 이행협정으로서 1994년 심해저협정, 1995년 공해어업협정에 이어 약 30년 만에 마련된 것이다. 바다 표면적의 약 2/3를 차지하는 공해 지역에 대한 환경 및 해양생물다양성 보호를 목적으로 하는 최초의 지구적 다자조약으로, 주요 내용은 다음과 같다.
① 공해 및 심해저에 해양보호구역(Marine Protected Area, MPA) 등 구역기반 관리수단을 설정하는 기준과 절차를 마련하고, 공해 및 심해저에 영향을 미칠 수 있는 활동에 대한 환경영향평가의 실시요건 및 상세 절차 규정
② 공해 및 심해저에서 채집한 해양유전자원 및 그로부터 획득한 디지털염기서열정보(Digital Sequence Information, DSI)에 대한 접근과 이용 내역을 투명하게 공유하고, 상업적 이용으로부터 발생하는 이익을 공유하기 위한 다자적 메커니즘 수립
③ 개발도상국을 위한 관련 역량 강화 및 해양기술이전에 관한 조건 및 형태를 규정하고, 전문성을 보유한 인사들로 구성된 과학기술기구를 포함한 협정 기구 설치
개도국들은 선진국 중심의 해양유전자원 상업화에 따른 이익공유를 주장하면서 공해 질서에 대한 국제적 규제를 보다 강화하고자 하였다. 이에 비하여 선진국들은 가급적 기존 유엔 해양법협약의 틀을 유지하면서 상대적으로 이행이 용이한 내용을 담아내고자 하였다. 윤석열정부는 협정 체결이 해양유전자원 연구개발의 동력 저하로 이어지지 않도록 유사 입장국들과 긴밀하게 협력하여 대응하는 한편, 환경 보전 및 개도국 지원 관련 의제에 대해서는 총체적 국익 달성 및 국제규범 형성 과정에서의 긍정적 역할 수행을 염두에 두고 적극적이고 유연한 자세로 협상에 참여하였다. 협정안 성안은 2004년 개방형 실무작업반 설치를 시작으로 약 20년 동안 이어져 온 BBNJ 보전 및 지속가능한 이용을 위한 다자적 논의의 결실로서, 정식 채택 및 발효 시 공해 및 심해저에 대한 관리규범이 미흡한 상태를 보완하고, 지구적 환경 위기에 선제적으로 대응할 수 있는 규범적 기틀이 될 수 있을 것으로 보인다.
(2) 해양생명자원의 확보에서 제품화에 이르기까지의 전 주기 지원 정책 추진
세계 각국은 무한한 바다의 잠재력을 끌어내기 위해 해양바이오 육성을 위해 노력하고 있다. 현재 약 7조 원 규모에 달하는 세계 해양바이오 시장이 5년 후에는 약 11조 원 규모를 넘어설 것으로 전망되며, 우리나라 해양바이오 시장도 1조 이상으로 커질 것으로 예상된다. 해양수산부는 ‘해양바이오 산업 육성’을 국정과제로 선정하고, 해양바이오 핵심기술 개발, 산업생태계 조성, 기업지원체계 구축을 주요 내용으로 하는 ‘해양바이오 산업 신성장 전략’을 수립하였다. 해양수산부는 바이오경제 시대를 대비하여 미래가 유망한 해양바이오 산업이 새로운 국가 성장동력원으로 자리매김할 수 있도록 해양바이오 정책을 추진할 계획이다. 이를 위해 해양바이오 산업의 뿌리가 되는 해양생명자원 확보와 핵심기술 개발에 대한 투자를 확대할 예정이다. 우선, 자원조사 전용 선박을 도입하고, 고부가가치 소재의 대량생산, 표준화 및 국산화 등을 위한 핵심전략 기술을 개발한다. 둘째, 해양바이오 산업 기반 조성을 위한 인프라 투자를 확대한다. 지역별로 형성 과정에 있는 산업생태계 특성을 고려하여, 동, 서, 남해 권역별 해양바이오 특성화 거점을 조성한다. 셋째, 해양바이오 기업 지원체계를 확립한다. 해양바이오 산업의 선순환 생태계 조성을 위해 투자・경영 그리고 첨단기술을 지원하는 ‘스마트 해양바이오 플랫폼’을 구축하고, 자율과 창의에 기반한 기업활동 지원을 위해 규제혁신 등 제도개선을 추진한다. 해양수산부는 현재 태동기 단계에 머물고 있는 국내 해양바이오 산업이 성장기를 거쳐 성숙기로 진입할 수 있도록 투자확대, 정책개발 등을 수행할 예정이다.
9. 생명연구자원 분야의 육성 및 관리
가. 생명연구자원 및 통합관리(과기정통부)
(1) 개요
생명공학 연구의 기반이 되는 생명연구자원은 인체유래물, 동물, 식물, 미생물 등 연구에 활용되는 실물 소재와 이로부터 산출된 유전체, 단백체, 구조, 건강 등의 정보를 포함한다.
코로나19와 같은 팬데믹 위기, 기후변화, 식량부족 등 인류가 직면한 난제를 해결하는 생명공학의 핵심소재인 생명연구자원은 의약품, 건강기능식품, 농업 등 산업의 고부가가치를 창출할 수 있는 잠재적 가치를 가지고 있다. 이로 인해 전 세계적으로 생명연구자원에서 확보와 활용의 중요성이 증대되고 있으며, 미국, 독일, 일본, 우리나라 등 주요국들은 국내외 유용 생명연구자원을 확보하고 연구자 및 산업계에 제공하여 생명공학 연구와 산업화를 지원하고 있다.
(2) 추진 경과
과학기술정보통신부는 2009년 제정된 ‘생명연구자원의 확보・관리 활용에 관한 법률’에 근거하여 관계부처와 함께 생명연구자원의 효율적인 확보와 체계적인 관리를 통한 지속가능한 활용을 도모하며, 생명공학의 발전 기반을 조성하기 위해 국가 생명연구자원 관리・활용 기본계획을 수립하고 이행을 주도해 오고 있다.
2010년 수립된 ‘제1차 생명연구자원관리 기본계획(2011∼2020)’에서는 바이오 연구 소재의 확보 중심의 정책이 추진되었으며, ‘제2차 생명연구자원관리 기본계획(2016∼2020)’이 수립되면서 세포주, 마우스 등 국가 차원에서 중요한 국가전략생명연구자원을 중심으로 바이오 소재의 관리가 추진되었다. 최근 바이오기술의 급속한 발전으로 생명의 실체와 그 기능에 관한 데이터가 폭발적으로 증가함에 따라, 인공지능(AI) 기술 등을 이용한 빅데이터 분석과 활용이 바이오 연구개발 및 산업 발전의 필수 요소가 되고 있다. 이러한 시대적 흐름에 맞추어 기존 소재 중심의 계획에서 바이오 소재와 데이터를 아우르는 ‘제3차 국가생명연구자원 관리・활용 기본계획(2020~2025)’을 수립하였다.
(3) 주요 정책
‘제3차 국가생명연구자원 관리・활용 기본계획’은 2020년부터 2025년까지 6년간의 정책 방향을 제시하는 계획으로 ‘바이오 강국 실현을 위한 생명연구자원 인프라 조성’이라는 비전을 제시하였다. 이를 달성하기 위해 데이터 기반 바이오 연구 환경 구축, 수요자 맞춤형 바이오 소재 활용 촉진, 바이오 재난 대응을 위한 인프라 비상 운영 체계 정립 및 지속가능한 민관 협력 기반 조성을 주요 전략으로 수립하였다.
(가) 데이터 기반 바이오 연구 환경 구축
과기정통부는 2020년 기본계획을 수립 후 관계부처와 함께 부처・사업・연구자별로 흩어져 있는 바이오 연구데이터를 통합 수집・공유 환경을 조성하기 위해 국제 표준 및 국내 활용 수요를 기반으로 주요 분야에 대한 ‘바이오 연구데이터 표준 등록 양식’을 마련하고 매년 수요를 반영해 제・개정 해오고 있다. 2021년에는 국가 바이오 데이터 스테이션(K-BDS)의 구축에 착수하여 같은 해 10월 국가 바이오 데이터 스테이션(K-BDS)에 데이터 등록을 위한 시범운영에 착수하였으며, 2022년 12월에는 그동안 확보한 데이터를 공개하고 클라우드 기반의 데이터 분석 전산환경의 지원에 착수하였다.
또한, 2022년 7월 선정한 단백체, 대사체, 화합물 및 바이오이미징 4개 분야의 분야별 데이터 품질선도센터들은 유전체 및 기타 분야 데이터의 품질관리를 수행하는 국가생명연구자원정보센터(KOBIC)와 함께 데이터 품질관리 기준을 마련하고, 그 기준에 따라 국가 바이오 데이터 스테이션(K-BDS)에 등록하는 데이터의 품질을 관리할 계획이다. 그리고 빅데이터 활용 연구를 촉진하기 위해 다양한 데이터 분석 툴의 개발을 지원하고 있으며, 개발된 분석 툴은 국가 바이오 데이터 스테이션(K-BDS)에 탑재되어 2024년에는 서비스될 예정이다. 특히, 2023년에는 바이오 연구 데이터 활용 기반 조성을 위한 법적 근거 마련을 위해 생명연구자원법의 개정을 추진하였다. 이를 통해 바이오 빅데이터를 활용한 우수 실증사례 발굴을 지원하여 데이터 수집・구축의 성과를 창출하고 데이터의 구축부터 활용의 선순환 구조를 마련하기 위해 노력하고 있다. ‘데이터 기반 디지털바이오 선도사업’을 통해서는 주요 질환(범 난치암, 대사질환, 치매) 및 천연물 분야의 바이오 빅데이터를 수집하고, 이를 바탕으로 진단・예측 기술 및 치료제 개발에 기여하는 AI 모델을 개발하도록 지원할 예정이다.
(나) 수요자 맞춤형 바이오 소재 활용 촉진
기본계획의 수립 후 부처별로 운영하던 기존 200여 개의 소재자원은행을 소재 종류, 보존・유통 방식, 관련 규제 등을 기준으로 재편하여, 배양세포, 모델 동물, 뇌, 미생물 등 14개 분야의 소재 클러스터로 조성하였다. 클러스터별로 책임부처를 지정하고, 책임부처 중심으로 클러스터 내 소재자원은행 간 협력 및 융합을 촉진하기 위해 중앙은행-거점은행-협력센터로 구성된 협력 네트워크를 구축하였다. 2022년에는 ‘바이오 연구 소재 활용기반 조성 사업’에 대한 사업 적정성 재검토 조사를 통해 소재 클러스터별 추진내용을 보완하여, 수요자가 원하는 바이오 소재 및 서비스가 적시에 제공될 수 있도록 노력하고 있다.
또한 소재자원은행의 운영 및 이들이 분양하는 바이오 소재에 대한 신뢰도 향상을 위해 2023년 2월까지 5개의 소재자원은행이 ‘소재자원은행 운영에 대한 국제표준 KS J ISO 20387’을 인정 취득하였다. 이뿐만 아니라, 기존 실물 소재 확보 중심에서 수요자가 가장 필요로 하는 소재 특성정보(약리, 병리, 효능 등)의 정보를 분석・제공할 수 있도록 소재 클러스터별 전문포털과 바이오 소재 정보 통합포털 시스템을 구축하고 있으며, 이를 통해 수요자가 원하는 소재를 쉽게 검색하여 분양받을 수 있도록 추진하고 있다.
(다) 바이오 재난 대응을 위한 인프라 비상 운영 체계 정립
코로나19와 같은 바이오 재난 발생 시, 진단기기・치료제・백신 등을 신속히 개발할 수 있도록 감염병 대유행 전에 연구개발에 필요한 바이러스, 검체 등을 신속하게 확보하여 공급하기 위한 인프라 등을 확대하고 있다.
2021년까지 코로나 관련 연구데이터, 논문 등의 정보 제공에 주력하였으며, 2022년에는 ‘감염병 예방법’의 제1급 감염병 중 메르스를 추가, 2023년에는 제1급 감염병 중 원숭이 두창과 중증급성호흡기증후군(SARS)를 추가하여 국가 생명연구자원 인프라로 구축・서비스되는 DB를 추가하며 계속 관리할 계획이다. 또한 마우스의 전임상 실험 지원 등을 통해 확보한 전임상 데이터를 제공할 계획이다.
이외에도 약물재창출 화합물, 세포주, 마우스, 영장류 등을 공급하여 ‘국가 전임상 지원체계’ 구축을 통한 백신・치료제의 상용화를 지원하고 있다.
(라) 지속가능한 민관 협력 기반 조성
각 부처가 개별적으로 추진해 온 사업들의 구조를 개편하여 관계부처가 협력・운영하는 ‘다부처 국가생명연구자원 선진화 사업’을 수행하여, 생명연구자원 인프라 지원사업과 정책의 범부처 공동 추진을 위한 민・관 협의체 운영, 범부처 바이오 소재 중앙은행협의회 운영 등을 통해 범부처 정책 협력 체계를 공고히 하고 있다.
또한, 산・학・연・병의 바이오 연구데이터 활용 인력을 양성하기 위해 온・오프라인으로 다양한 바이오 데이터 교육 프로그램을 운영하고, 미생물, 배양세포 등 소재 분야별 실무자 교육을 제공하고 있다. 이외에도 산업계 대상 바이오 소재 설명회, 인터비즈 바이오 파트너링 및 투자포럼 등을 통해 바이오 소재 및 소재자원은행 홍보를 강화하고 있으며, 해외와의 생물소재자원의 협력 확대 등을 통해 과학기술 협력 강화, 생물다양성 및 바이오경제 협력을 추진하고 있다.
(4) 주요 사업
(가) 다부처 국가생명연구자원 선진화 사업
과학기술정보통신부는 관계부처와 협력하여 바이오 연구・산업 활동에 필요한 생명연구자원의 활용 인프라를 선진화시키기 위해 2021년 부처별로 추진해 온 사업을 개편하여 ‘다부처 국가생명연구자원 선진화 사업’에 착수하였다. 이를 위해 ‘다부처 국가생명연구자원 선진화사업 운영관리규정(2021)’을 마련하고, 본 사업의 주요 사항을 논의하고 심의하는 사업 추진위원회 성격의 선진화위원회를 운영하고 있다. 이를 통해 바이오 연구 활동에 사용되는 실물 소재 자원과 국가 바이오 R&D를 통해 생산되는 연구데이터를 체계적으로 확보하고 관리하여 산・학・연・병에 제공함으로써 바이오 연구・산업 혁신을 촉진하기 위해 노력하고 있다.
과학기술정보통신부는 관계부처와 함께 ‘다부처 국가생명연구자원 선진화 사업’에 2022년 1,521억 원을 투자하였으며, 2023년에는 총 1,354억 원을 투자할 계획이다.
[표 2-36] 다부처 국가생명연구자원 선진화 사업의 내역 사업 및 주요 내용(2023)
(단위: 백만 원)
|
내역 사업 |
주요 내용 |
예산 |
비고 |
|
바이오 연구소재 활용기반조성 |
관계부처가 협력하여 바이오 연구에 필요한 실물 소재 자원(배양세포, 모델동물, 뇌, 미생물, 천연물, 합성화합물 등)을 체계적으로 확보・지원하기 위한 국가생명연구자원(소재) 인프라 조성 |
94,596 |
|
|
바이오 연구데이터 활용기반조성 |
관계부처가 협력하여 국가 바이오 R&D를 통해 생산되는 데이터(생화학분석, 이미지(영상), 임상 및 전임상, 유전체, 분자구조, 표현형 정보, 화학반응 등)의 통합 수집・제공 및 활용 기반을 조성하기 위한 ‘국가 바이오 데이터 스테이션’ 구축・운영 |
26,439 |
|
|
국가마우스 표현형 분석 사업 |
국내 바이오 의료 연구에 필수적인 유전자변형마우스(GEM) 자원의 생산・관리 및 이를 활용한 질환 분석 |
14,400 |
’23.11월 종료 |
|
합계 |
135,435 |
|
|
출처: 과학기술정보통신부
(5) 향후 계획
과학기술정보통신부는 디지털 대전환에 신속하게 대응할 수 있도록 첨단바이오 자원(소재, 데이터)의 확보・관리・활용 기반을 선진화하고, 바이오와 디지털 기술의 융합을 통해 연구개발을 혁신하고 신산업 창출의 원동력이 될 데이터 기반의 첨단바이오 기술개발을 지원할 계획이다.
바이오 연구데이터 분야는 국가 바이오 데이터 스테이션(K-BDS)을 중심으로 바이오 연구데이터의 생산・수집・관리・활용을 위한 데이터 공유 생태계를 조성하고, 이를 통해 바이오 데이터 기반의 바이오 연구 빅데이터 활용 및 연구성과 증진을 추진할 계획이다.
그리고 바이오 소재 분야는 수요자 맞춤형 소재의 확보・관리・활용 촉진을 위해 14대 소재 클러스터 육성 및 바이오 소재 특성정보 빅데이터를 구축할 계획이다. 소재 클러스터 내 또는 클러스터 간 협력을 통한 시너지를 창출하여, 소재 공급 및 소재 활용 지원 서비스의 질을 향상시켜 연구자가 원하는 바이오 소재를 신속 확보・제공하고, 양질의 바이오 소재 활용지원 서비스의 이용이 가능하도록 추진할 계획이다.
또한, 바이오 재난 발생 시 신속히 대응할 수 있도록 감염병 대유행 전에 연구개발에 필요한 바이러스, 검체 등을 신속하게 확보하여 공급하기 위한 인프라를 지속적으로 확대할 계획이다.
나. 농업 분야(농식품부)
농림축산식품 분야는 1987년 농촌진흥청에 종자은행을 설립하는 등 일찍부터 생명자원의 중요성을 인식하고 선도적으로 자원 보존 및 관리를 시작해 왔으며 이후 2007년 ‘농업유전자원의 보존・관리 및 이용에 관한 법률’을 제정하여 종합적인 농업생명자원 관리의 제도적 기반을 마련하게 되었다. 이후 정부조직 개편 등에 따라 몇 차례 개정을 거쳐 현재의 ‘농업생명자원의 보존, 관리 및 이용에 관한 법률’로 개정(2019.8.)되었으며, 본 법령에 따라 산림생명자원은 산림청, 수의생명자원은 농림축산검역본부, 그 외 농업생명자원은 농촌진흥청에서 각각 전문적으로 관리하고 있으며 농림축산식품부에서는 제도 및 정책을 총괄하고 있다. 또한 민간 연구소, 대학, 지자체 농업기술센터 등의 역량을 활용하기 위해 140개의 농업생명자원 관리기관을 지정하여 농업생명자원의 수집, 보존, 분석 및 연구를 지원하고 있다.
|
구분 |
계 |
종자 |
영양체 |
미생물 |
가축 |
곤충 |
|
합계 |
140 |
27 |
85 |
14 |
11 |
3 |
|
지자체 |
70 |
6 |
53 |
- |
8 |
3 |
|
대학・민간 |
70 |
21 |
32 |
14 |
3 |
- |
출처: 농림축산식품부
또한 상기 법령에 따른 법정 종합계획인 ‘농업생명자원 보존, 관리 및 이용활성화를 위한 기본계획’에 따라 자원 관리 정책을 추진하고 있다. 2014∼2018년까지 추진한 제2차 기본계획을 통해 자원 보유 점수가 128만 점에서 294만 점으로 두 배 이상 증가하는 등 대폭 확충되었으며 2019년에 새로 수립된 제3차 기본계획은 이러한 자원을 이용한 육종, 소재 개발 등 ‘농업생명자원의 고부가가치 산업화 촉진’을 목표로 2023년까지 5년간 추진될 계획이다. 아울러 제4차 기본계획(2024∼2028)을 수립하고 그에 따라 세부 추진 전략을 마련하여 추진할 계획이다.
|
비전 |
|
농업생명자원 활용 강국으로 도약 |
|
목표 |
|
농업생명자원의 고부가가치 산업화 촉진 |
|
추진 전략 |
|
?? 양질의 자원 확보 |
|
?? 자원보존・관리 강화 |
|
① 자원다양성 증대 ② 특성평가 내실화 |
|
① 증식・보존 강화 ② 관리기관・체계 정비 |
||
|
|
|
|
||
|
?? 수요자 중심 정보제공 |
|
?? 자원이용 활성화 |
||
|
① 정보서비스 개선 ② 나고야 의정서 관련 정보제공, 대응 지원 |
|
① 분양 확대 및 사후관리 ② R&D, 인력양성 지원 |
출처: 농림축산식품부
[그림 2-8] 제3차 농생명자원 보존・관리 및 이용활성화를 위한 기본계획의 4대 추진전략
제3차 기본계획은 ① 양질의 자원 확보, ② 자원 보존・관리 강화, ③ 수요자 중심의 정보 제공 ④ 자원 이용 활성화의 4대 전략으로 구성되어 있다. 유용・토종자원의 집중 수집 및 특성평가를 통한 우수자원을 확보하고 자원 보존・증식기술의 고도화, 국외반출, 자원관리 등의 규정을 개정하여 자원 관리 강화를 하는 한편 생명자원 정보시스템 및 관련 컨텐츠 확충 및 유전자원 이익 공유에 관련된 국내외 쟁점 분석, 협력을 추진하고 유용미생물은행 등 자원 활용 인프라 구축, 분양 활성화, 자원 활용 기술개발 등을 추진할 계획이다.
한편 농식품부는 기관별로 분산 관리되고 있는 생명자원 DB를 통합해 수요자 중심의 정보 제공을 위한 생명자원정보서비스(BRIS.go.kr)를 구축・운영하고 있다. 농식품부는 생명자원 DB 및 관련 특허, 전통지식 등 정보와 카드뉴스, 교육 컨텐츠 등을 지속적으로 확충할 계획이며, 특히 2018년 8월부터 본격적으로 국내에도 관련 법령이 시행된 나고야 의정서 관련 정보제공을 강화할 계획이다. 2022년에는 연계기관의 데이터를 오픈 API 방식으로 연계하여 주 1회 실시간으로 업데이트 하고 있으며, 2023년에는 특허정보를 정비하고, 대구통합전산센터로 서버를 이전할 계획이다. 마지막으로 자원 이용활성화를 위해 농업생명자원의 분양 및 사후관리를 강화하고 관련 연구 및 인력양성에 대한 지원을 확대할 계획이다.
2022년 말 기준 농식품부 및 관계 기관에서 보유한 자원은 농진청 81만 6,003점, 산림청 242만 6,602점, 검역본부 1만 322점 등 총 325만 2,927점으로 세부 분류별 보유현황은 아래와 같다.
|
기관 |
분야 |
종수 |
보존점수 |
|
농진청 |
종자 |
1,599 |
249,863 |
|
영양체 |
1476 |
25,859 |
|
|
미생물 |
9215 |
25,697 |
|
|
가축 |
17 |
514,197 |
|
|
곤충 |
23 |
387 |
|
|
계 |
12,330 |
816,003 |
|
|
산림청
|
종자 |
5,605 |
59,693 |
|
영양체 |
5,680 |
930,882 |
|
|
미생물 |
525 |
8,113 |
|
|
DNA |
196 |
164,952 |
|
|
현지내보존집단 |
21 |
(3,405ha) |
|
|
표본 |
23,021 |
1,262,962 |
|
|
계 |
35,048 |
2,426,602 (3,405ha) |
|
|
검역본부 |
병원균 |
499 |
9,106 |
|
항혈청 |
20 |
317 |
|
|
세포주 |
68 |
112 |
|
|
기타 |
203 |
787 |
|
|
계 |
790 |
10,322 |
|
|
합계 |
48,168 |
3,252,927 (3,405ha) |
|
주) 농업생명자원 종수는 단순합산으로 일부 중복이 있을 수 있음
출처: 농림축산식품부
다. 보건의료 분야(복지부)
미래 보건의료연구의 핵심 인프라인 인체자원의 국가적 종합관리를 위해 한국인체자원은행사업(Korea Biobank Project, KBP)을 추진하고 있으며, 보건의료연구 및 관련 기술개발에 있어 산・학・연 전반에 걸친 적극적인 지원을 목표로 KBP 4기(2021∼2025)를 추진하고 있다.
(1) 추진 배경
① 개인별 유전체 연구의 급속한 발전에 따라 보건의료연구 및 산업계의 대량 인체자원 수요 증가
② 그간 성과를 바탕으로 보다 강화된 고품질 특성화 자원의 수집체계 마련, 분양 확대 등을 통해 구체적 성과창출 필요
(2) 추진 전략
① 인체자원은행 특성화 지원 : 기존 단위은행 체제(2008∼2020) 개편 후 특성화 전문 거점은행 구축을 통해 Top down 방식의 질환군 선정 및 선택적 수집, 영상정보, 오믹스정보, 2차 자원 등 심층자원 확보
② 성과창출형 바이오뱅크 컨소시엄 지원 : 혁신형 바이오뱅킹 컨소시엄 지원사업 운영을 통해 뱅킹 기반 전주기 R&D 지원 및 진단치료제, 신약개발 등 목적형 성과창출
③ 바이오뱅킹 서비스 플랫폼 구축・운영 : 인체유래물은행으로부터 자원정보, 임상정보 등 관련 정보를 통합 관리하여 공유개방 코디네이팅 수행, 인체자원분양지원센터 운영을 통한 KBN 연계분양 체계 지원

출처: 국립보건연구원 국립중앙인체자원은행
[그림 2-9] 한국인체자원은행사업(KBP) 2030 추진전략
(3) 추진 현황 및 성과
①국립중앙인체자원은행과 민간 인체자원은행12), 연구기관 및 산업계가 참여하는 한국인체자원은행네트워크(KBN)를 통하여, 다양한 코호트 및 질환군 인체자원 수집・관리・분양
②수요중심의 인체자원 수집체계로 개편, KBN 미확보 자원에 대해서는 ‘주문형 뱅킹’ 도입으로 연구자-KBN 소속 인체자원은행과의 협의를 통해 연구자 맞춤형 인체자원 수집 및 분양 서비스 지원
③특성화 질환별 KBN 임상정보 공통데이터모델(CDM), ETL 프로그램 개발, HuBIS_ClinDB를 이용한 정보관리 등 효율적인 임상정보 연계체계 및 표준화된 정보관리 체계 구축
④ 2022년 12월 기준, 111만여 명분 인체자원 확보하여 4,562여 개 과제에 분양하고 논문 1,721편 및 특허 156건의 성과 창출

출처: 국립보건연구원 국립중앙인체자원은행
[그림 2-10] 한국인체자원은행네트워크 운영 현황
|
|
|
|
출처: 국립보건연구원 국립중앙인체자원은행
[그림 2-11] 중앙은행 및 인체자원단위은행 수집・활용성과(2001~2022)
(4) 향후 추진계획
① 심층자원 수집 고도화 등 인체자원 특성화 서브 네트워크의 안정적 운영 지속
② 타 과제 연계, 해당 질환 연구 컨소시엄 운영 등 활용 확대
③KBN CDM v3.0 개발, 비정형 데이터 처리기술 시범 운영 등 KBN 바이오뱅킹 활용 플랫폼 기능 고도화
④ KBN 코디네이팅 기능 강화(교육, 홍보)
⑤ 산업체 분양 확대 등 다양한 연구・개발 분야의 효율적 지원
라. 야생생물자원 분야(환경부)
(1) 야생생물자원 분야
(가) 자생생물자원 관리 정책
환경부는 ‘생물다양성협약(Convention on Biological Diversity, CBD)’13)에 따른 생물다양성 보전과 지속가능한 이용을 위한 체계적인 정책 지원 및 생물 주권 강화를 위한 국제적 대응을 위하여 ‘생물다양성 보전 및 이용에 관한 법률’을 제정(2012.2.1.)하였다. 이에 따라 정부는 동 법 제7조에 따라 생물다양성의 보전과 그 구성요소의 지속가능한 이용을 위한 범부처 법정전략으로 국가생물다양성전략을 5년마다 수립하고 있으며, 제4차 국가생물다양성전략(2019∼2023)에 따라 매년 시행계획을 수립・시행하고 있다. 또한, ‘생물자원관의 설립 및 운영에 관한 법률’ 제4조에 따라 제1차 생물자원관 기본계획(2021∼2025)을 수립(2020.12.)하여 생물자원의 전략적 조사・발굴을 통한 생물 주권 강화와 생물자원을 활용한 바이오 신산업 육성 등 생물자원 활용을 위한 지원체계를 구축하고 있다.
(나) 자생생물자원의 확보・관리・활용 연구현황
환경부는 국가생물자원의 조사, 보전, 관리와 현명한 이용을 위한 정책을 추진하고 있다. 현재까지 지속적인 투자와 연구를 통해 5만 8,000여 종의 국가생물종목록(2022.12.기준)을 구축하고 320만 점의 생물자원(표본, 생물소재)을 확보하여 관리하고 있다. 자생생물 1만 7,702종의 종속지적 연구를 수행하여 2022년까지 한국 생물지를 국문과 영문으로 총 444권 발간하여 배포하였다. 기후변화로 야기되는 환경문제 생물종 대응을 위해 1만 1,104종에 대한 생물종 바코드 정보를 구축하였으며, 이를 통해 오・혼용 약용소재 등 슈퍼바코드로 종 판별법 개발 100종, 전국 지자체 수돗물에서 발견된 생물(깔따구 등)의 종 동정 정보(총 157건, 454시료)를 제공하였다. 아프리카돼지열병(ASF), 조류독감(AI) 등 방역관리를 위해 철새 분포・이동 모니터링 정보 제공(2021.11∼2022.4, 총 126회), 멧돼지 등의 서식밀도 조사(2,550개소), 야생생물 수출입 정보화 사업 등을 수행하고 있다. 또한, 유전자원 정보, 유용성 정보 등 각 부처별로 관리되는 생물다양성 정보를 통합하여 표준화한 약 1,800만 건(2022.12.기준)의 정보를 ‘국가생물다양성 정보공유체계(www.kbr.go.kr)’를 통해 필요한 부처에 제공하고 있다.
‘나고야 의정서’ 비준(2017.5.19.) 이후, 국가책임・점검기관 같은 주요 기관의 지정, 유전자원정보관리센터 설치・운영, 국내 유전자원 접근 신고, 내국인이 해외 유전자원을 이용하는 경우의 절차준수 신고, ABS 정보공유체계 운영 등을 담은 ‘유전자원의 접근・이용 및 이익 공유에 관한 법률’을 제정(2017.1.17.)하는 등 구체적인 국내 이행・지원 체계를 구축해 나가고 있다. 나고야 의정서 이행 법률 제정을 통해 국내 유전자원에 대한 주권을 강화하고, 유전자원정보관리센터 설치(2018.3.30.) 및 부처 합동 통합신고시스템(2018.8.18.)을 구축하여 운영하는 등 산업계 지원 정책을 단계적으로 추진하고 있다.
국립생물자원관에서는 생물자원의 보전과 지속가능한 이용을 위해 생물다양성 우수지역 등에서 전해져 내려오거나, 의서, 농서 등 주요 고문헌 50여 권에 기술된 전통지식 총 12만여 건을 수집하고, 전통지식 대상종 등 자생생물의 유용성 분석 및 유전체 분석을 수행하여 환경생물산업을 지원하고 있다. 2022년까지 국내 자생생물 1,082종에 대한 항산화, 항염 등을 연구하여 유용성 결과를 확보하였으며, 최근에는 저탄소 녹색기술의 원천소재로 온실가스를 유용물질로 전환하는 자생생물을 확보하여 우리나라 생물자원을 이용한 탄소중립 이행 기반을 마련하고 있다.
다양한 자생생물 생물소재의 안정적 보존과 지속가능한 이용을 위해 국가야생생물소재은행(유전자원, 종자, 천연물, 배양체)을 운영하고 있다. 고품질 및 수요자 맞춤형 생물소재를 확보하고 관리하여 다양한 생물소재를 산업계, 학계, 연구소에 맞춤형 분양서비스로 제공하고 있다. 현재까지 기원이 정확한 다양한 생물소재 24만 8,814점을 확보・관리하고 있으며 고품질 생물소재 1만 7,252점을 분양하였다. 잠재적 활용가치가 높은 해외 생물자원 조사・발굴을 위해 베트남, 라오스, 탄자니아 등 10개국 이상의 해외 협력 국가와 MOU/MOA를 체결하여 지속적 네트워크 구축 등 국제협력을 강화하고 있다. 특히, 지금까지 이들 국가와 공동연구를 통해 자국 생물다양성 도감 39권을 발간하여 일부를 기증하였고 39건의 특허를 출원하여 국가 간 신뢰도를 높이고 있다. 캄보디아와 공동연구로 현지 식물의 미백 효능을 확인하고 국내 기업에 기술을 이전하여 화장품을 개발한 것은 해외생물자원 활용의 좋은 방향성을 제시해 주고 있다.
(다) 향후 계획
향후 기후변화・생물종 감소 등 인류가 당면한 전 지구적 위기를 해결해 나가기 위해 기후변화 대응 등 생물다양성 평가 및 변화 예측, 마이크로바이옴 및 유전체 정보 확보, 환경문제 생물종의 선제적 대응체계 마련을 위한 대발생 생물의 분류・생태・특성 등을 활용한 종 판별 체계 구축, 야생생물로 야기될 수 있는 질병에 대응하기 위한 야생생물 전주기 관리 기반 등을 마련하고자 한다.
앞으로 자생생물종의 신규 발굴 난이도는 점차 증가할 것으로 예상되고, 이를 뒷받침해 줄 국내 전문인력도 부족한 실정이다. 이를 극복하기 위해, 곤충, 무척추동물, 균류 등 발굴 가능성이 높지만 전문가가 부족한 분야를 중심으로 생물다양성 전문인력 양성사업을 통해 부족한 생물분류군 전문가를 양성하고, 생물다양성협약 대응 생물학, 국제학, 법학 등 다학제적 전문인력 인프라를 구축해 나갈 예정이다. 또한, 분류 전문가가 국내에 적거나 없는 분류군에 대해서는 해외 공동연구를 통한 지속적인 발굴 노력을 통해 2025년까지 국가생물종목록 6만 2,600종 구축 목표에 기여하고자 노력하고 있다.
이러한 생물종 정보를 기반으로 지금까지 알려지지 않았던 생물자원의 가치를 발굴하는 유용성 연구 결과는 식품, 의약품, 향장품 등으로의 활용을 통한 생물 주권 확보의 기반이 되고, 환경 현안 대응 자생 유용생물 활용한 한반도 환경에 적합한 환경영향평가 기준 마련 등 다양한 분야에서 새로운 생물자원 활용 가능성을 열어줄 수 있을 것으로 기대된다. 동시에 부족한 국내 생물자원을 대체할 해외생물자원 확보를 강화하기 위해 협력국을 동남아시아에서 남미, 아프리카까지 확대하고 국내 생물산업 지원을 위한 영역을 넓혀가고자 한다.
나고야 의정서 대응 및 유전자원법 이행을 위한 관계부처 협력 강화 및 법제도 정비, 수요자 맞춤형 ABS 컨설팅을 통한 산업계 인식 제고 사업을 지속적으로 추진하고자 하며, 국내・외 유관기관 및 민간이 보유하고 있는 생물다양성 및 생물자원 정보를 종합 관리하여 국가 차원의 정보 연계・구축・운영 등 수요자 맞춤 정보 제공 체계를 마련하고자 한다.
국가생물다양성센터 운영으로 국가생물다양성전략의 수립과 이행점검을 위한 기반을 마련하고 부처별 분산된 생물다양성 통계자료의 수집 및 통합관리 체계 구축을 위한 국가생물다양성 정보 컨트롤타워로서의 역할을 수행하고자 한다.
마. 해양수산 분야(해수부)
(1) 추진 배경
해양수산생명자원은 ‘고부가가치를 창출하는 해양바이오산업의 원천소재로서 생명공학연구 또는 산업을 위하여 실제적이거나 잠재적인 가치가 있는 자원’을 의미하며, 해양동식물, 해양미생물 등 해양생물체의 실물과 그 실물을 이용하여 파악된 정보, 유전물질 등을 포함한다.
나고야 의정서가 발효(2014.10.)됨에 따라 각국은 자원 주권화를 위해 생명자원의 확보・관리 및 정보 구축과 활용기반을 구축하고 운영하고 있다. 이러한 국제사회의 환경변화에 대응하기 위해 해양수산부는 해양생명자원의 확보・관리 및 이용 등에 관한 법률을 2012년에 제정하였고, 2016년 12월에 법률의 전부 개정을 통해 그동안 이원적으로 관리되었던 해양생명자원과 수산생명자원을 통합・정비하고 나고야 의정서 이행에 필요한 사항을 신설하여 해양수산생명자원의 지속 가능한 이용체계를 바탕으로 해양바이오산업을 국가 미래 신성장동력으로 육성하기 위한 제도적 기반을 마련하였다. 이에 해양수산부는 같은 법 제8조에 따라 해양수산생명자원의 보존과 지속가능한 이용을 위하여 2019년에 제1차 해양수산생명자원관리기본계획(2019∼2023)을 수립하였고, 매년 시행계획을 수립・시행하고 있다.
또한 해양수산생명자원 책임기관으로 해양생명자원 분야에 국립해양생물자원관, 수산생명자원 분야는 국립수산과학원을 지정하여 운영하며, 이외에도 대학, 연구소 등을 대상으로 27개의 해양수산생명자원 기탁등록보존기관을 지정하여 해양수산생명자원의 수집, 보존, 관리 및 활용을 위한 운영을 지원하고 있다.
(2) 추진 전략 및 정책
해양수산부는 5년 단위 법정 계획인 제1차 기본계획(2019∼2023)에서 4대 전략과 12개 추진과제를 수립하고, 국내외 자원의 효율적 확보・관리 및 활용가치가 높은 자원의 체계적 개발을 통한 해양바이오 산업 육성 기반을 마련하기 위해 노력하고 있다.14)
특히 해양수산부는 해양바이오 산업을 활성화하기 위해 2030년까지 추진할 주요 과제를 담은 ‘글로벌 해양바이오 시장 선점 전략(2021.1.)’을 마련하고 자원확보 범위를 연안 중심에서 근해, 공해, 심해저까지 확대, 모든 해양생명소재의 연구・분양 거래 플랫폼으로서 해양바이오뱅크 고도화, 해역별 특성에 맞춰 해양바이오 특성화 거점 구축 등 중점 추진과제를 발표하였다.
이와 함께, 2022년 7월에는 윤석열정부 국정과제 중 하나인 해양바이오 등 신산업 육성 등 정책환경 변화에 따라 해양바이오 산업이 2027년까지 1조 2,000억 원 규모의 시장으로 성장할 수 있도록 지원하는 ‘해양바이오 신성장 전략(2022∼2027)’을 발표하였다. 이를 달성하기 위해 해양바이오 핵심기술 개발, 선순환 산업생태계 조성, 기업의 자율적 성장 지원체계 구축을 주요 전략으로 수립하였다.
(3) 추진 현황 및 성과
해양수산부는 해양생명자원법 제7조에 따라 5년마다 전국을 대상으로 해양생명자원의 현황 및 서식지 등 기초조사를 실시하고 있다. 2017년 동해 중부를 시작으로 매년 동해 남부, 남해 동부, 남해 서부, 서해까지 순차적으로 1단계 전국조사를 실시하였고, 2021년에 1단계 조사 성과를 분석하여 2단계(2022∼2026) 조사 계획을 수립하였다. 1단계 조사결과, 미확보자원 238종을 포함하여 총 2,917종 1만 1,637점의 확증표본을 확보하였고, 2022년 동해 자원조사에서는 2017년 대비 160% 상향된 950종을 확보하였다.
해양수산부는 국가 해양수산생물에 대한 체계적인 관리를 위해 2022년 12월 기준으로 1만 5,010종에 대한 종 목록을 구축하고 9,339종을 자원(표본, 소재)으로 확보하여 관리하고 있다. 이와 관련된 정보는 해양생명자원통합정보시스템(www.mbris.kr)을 통해 확인할 수 있다.
|
구분 |
기록종수(종) |
실물표본 확보종수(종) |
확보율(%) |
||||||
|
2021년 |
2022년 |
2023년 |
2021년 |
2022년 |
2023년 |
2021년 |
2022년 |
2023년 |
|
|
해양척추동물 |
1,458 |
1,474 |
1,483 |
894 |
925 |
913 |
61.3 |
62.7 |
61.6 |
|
해양무척추동물 |
5,815 |
5,926 |
6,024 |
3,503 |
3,571 |
3,951 |
60.2 |
64.1 |
65.6 |
|
해양식물 |
1,071 |
1,079 |
1,082 |
784 |
830 |
841 |
73.2 |
76.9 |
77.7 |
|
해양원생생물 |
2,990 |
4,165 |
3,110 |
904 |
911 |
946 |
30.2 |
21.8 |
30.4 |
|
해양미생물 |
3,005 |
3,104 |
3,311 |
2,443 |
2,451 |
2,688 |
81.3 |
78.9 |
81.2 |
|
합계 |
14,339 |
14,669 |
15,010 |
8,528 |
8,688 |
9,339 |
59.5 |
59.2 |
62.2 |
출처: 2023 국가 해양수산생물종 목록집, 해양수산부
국립해양생물자원관은 해양생명자원 기탁등록보존기관 운영 사업과 해외 해양생명자원 확보거점 구축 및 운영 사업 등을 통해 국내 8,823종, 해외 3,264종을 확보하였고, 기탁등록보존기관 20개소, 해외 거점15)을 5개소로 확대하는 등 유용자원 확보를 위한 체계를 강화하고 있다. 또한, 국제옵서버16), 공해상 자원확보 및 기초효능 탐색 사업 등을 통해 공해(심해)자원 확보 및 유용소재 발굴을 위해 지속적으로 노력하고 있다.
국립해양생물자원관은 해양생물자원으로부터 유용소재를 발굴하고 무료로 제공하는 5개의 뱅크(추출물, 유전자원, 미생물, 미세조류, 화장품)를 구축・운영하고 있으며 추출물에 대해서는 소재의 선택이 용이하도록 효능(항산화, 항염증, 항균 등)의 활성도에 따라 등급화(A∼C등급)하여 제공하고 있다. 2022년 기준 총 1만 3,399건의 해양생명소재가 등록되었고, 이 중 1,051건의 소재를 분양하는 등 해양바이오 산업화에 기여하고 있다. 추출물과 유전자원 바이오뱅크는 2021년에 국제표준화기구(ISO) 인증을 받았고, 2022년에는 미생물, 미세조류 등 소재 전 분야에 걸쳐 ‘ISO 품질경영시스템 인증’을 획득함으로써 해양바이오뱅크의 모든 자원이 국제 표준에 부합되게 품질관리가 되고 있음을 인정받았다.
(4) 향후 계획
해양수산부는 제1차 해양수산생명자원관리기본계획 수립 이후 주요 목표(자원확보율, 해양바이오뱅크 등) 대비 추진 성과를 점검하고 2차 기본계획을 수립할 계획이다. 먼저 자원조사 범위를 연안에서 연근해, 심해 등으로 점차 확대하고 자원부국, 종 다양성이 높은 지역을 협력거점으로 하는 국제협력과 해양바이오소재 발굴을 위한 전용조사선 건조 등을 추진하여 2027년까지 자원확보 규모를 2만 3,000종으로 확대할 계획이다.
해양바이오 소재 강국으로 육성하기 위해 심해저・공해 등의 해양생명자원으로부터 기초소재 확보를 강화하고, 해양생명자원 4,000여 종에 대해 항암・항균 등 유용소재를 확보하는 한편 2023년에는 산업 활용도가 높은 항생제 분야 뱅크를 추가해 기업 제품개발 수요에 기반한 소재 공급을 확대할 계획이다.
또한 유전체 분석을 확대해 2027년까지 산업적 가치가 높은 해양생물 500여 종의 유전체 정보를 확보하고, 해양바이오 데이터센터를 구축하여 해양바이오 소재에 대한 산업계의 접근과 이용이 확대되도록 할 계획이다.
국립해양생물자원관은 해양바이오 산업 강화를 위한 전략자원 확보를 위해 산업계 요구를 반영한 수요자원을 확보하고, 블루카본 해양생물 발굴, 미개척 지역인 극지 및 심해로부터 자원확보 등의 역량을 강화할 계획이다.
10. 국제협력
가. 국제협력 R&D
(1) 개요
인류는 최근 발생한 팬데믹으로 인해 앞으로 바이러스를 포함한 미지의 영역에 대해 국경을 초월하여 전 세계가 협력 및 공조를 하여 대비해야 할 필요가 있다는 교훈을 얻었다. 나아가 백신, 치료법 및 진단 도구 또한 신속하게 연구 및 개발되어야 한다는 점이 강조되었다.
국제협력을 통해 연구자와 기업은 전문 지식 및 자원을 공유할 수 있으므로 연구 개발을 가속화하여 보다 혁신적이고 효과적으로 제품을 만들 수 있다. 그리고 기업과 연구소는 국제적으로 다양한 배경과 기술을 가진 과학자, 엔지니어, 기술자를 포함하여 더 많은 인재 풀에 접근할 수 있어 창의적이고 효과적인 솔루션을 도출할 수 있다.
바이오 및 제약 회사에게는 자사 제품의 성공을 위해 글로벌 시장에 접근하는 것이 중요한데, 이때 국제협력은 복잡하고 각기 다른 규제 프로세스로 인해 발생되는 문제들을 보다 효과적으로 해결할 수 있게 도와준다.
전염병 같은 국제보건위기에는 국제 공조 시스템이 필수적이며 연구자, 기업 및 정부 간 협력은 질병을 예방하고 치료하는 데 도움이 되는 새로운 백신, 치료법 및 진단법의 개발에 기여한다.
그리고 연구 개발 비용을 분담하는 데 도움이 되고 임상 시험 과정에서 요구되는 표준화된 연구윤리의 제정이 가능하며 참가자의 권리를 보호하는 규제에 대해 표준화 기반을 마련할 수 있다. 즉, 바이오 연구 분야에서 중요한 획일화된 국제화 지침 및 규정의 필요성을 충족할 수 있다. 이렇듯 전반적으로 생명과학 분야의 국제협력은 다양한 국제적 난제를 해결하고 책임감 있고 지속 가능한 방식으로 바이오 연구를 발전시키는 것이 중요하다고 인식되고 있다.
(2) 일반적 사항
생물학적 연구에서 제기되는 도전과 기회는 국경을 초월하며, 이를 효과적으로 해결하기 위해 국제협력이 필수적이다. 위에서 언급했듯 국가 간 협력을 통해 과학자들은 지식, 전문성, 그리고 자원을 공유할 수 있게 된다. 이러한 정보와 리소스 공유는 문제 해결 속도를 향상시키고, 연구자들이 복잡한 문제를 더 효율적으로 해결할 수 있도록 한다. 특히 생물학 분야의 국제협력은 다양한 문화적, 교육적 배경을 가진 연구자들을 모아 더 광범위한 관점과 아이디어를 수용할 수 있게 된다. 이러한 다양성은 혁신적인 솔루션 및 복잡한 생물학적 시스템에 대한 보다 포괄적인 이해로 이어질 수 있다.
또한, 기후 변화, 전염병, 식량 안보, 항생제 내성과 같은 생명과학 분야가 해결하고자 하는 다수의 문제는 본질적으로 국제적인 성격을 가지고 있다. 이러한 글로벌 이슈는 국제협력을 통해 해결할 수 있고, 개발된 솔루션 또한 전 세계적으로 적용할 수 있게 된다.
국제협력을 통해 표준화된 연구 방법론, 데이터 공유 프로토콜 및 윤리적 지침을 확립하여 연구의 일관성, 비교 가능성, 그리고 투명성을 높일 수 있다. 공동연구 프로젝트와 파트너십은 개발도상국의 과학자와 기관의 역량을 강화하는 데에도 도움이 된다. 과학적 협력은 외교 관계를 촉진하고 국가 간의 신뢰를 구축할 수 있으며, 이는 국제 관계의 다른 영역에서 더 나은 의사소통, 이해 및 협력에 기여할 수 있다. 결국, 이러한 협력은 경제적 이익으로까지 연결될 수 있다.
(3) 학술적 사항
OECD 기준, 자연과학 및 공학, 기술과학 분야의 18개 소주제 분야 기준으로 양과 질을 분석하면, Biological sciences 분야 논문이 17만 2,341편으로 가장 많고, 다음으로 Physical sciences(148,797편), Chemical sciences(146,195편) 순으로 나타났다.
질적 평가지표인 FWCI(상대적인 피인용지수) 기준으로 분석하면 Biological sciences가 1.46으로 가장 높은 것으로 확인되며, Earth and related environmental sciences(1.43), Industrial biotechnology(1.41) 순서로 높은 영향력을 가진 것으로 확인되며 18개 주제 분야 모두가 FWCI 1 이상인 것으로 나타나며, 상대적으로 FWCI가 낮은 분야는 Materials engineering(1.09), Civil engineering(1.10), Chemical sciences(1.14) 등으로 확인된다. 특히 생명과학의 경우 국제 공저자 형식으로 출간되는 논문도 많고 질적 수준도 동시에 우수하다는 것을 확인할 수 있다.

출처: 저자 작성
[그림 2-12] 한-독 과학기술 주요 분야 양・질적 수준 분석
(4) 새로운 국제협력의 사례 등장
독일의 소도시 마인츠(Mainz)는 예전에는 재정자립도가 낮은 어려운 도시였지만, 백신 제조업체인 BioNTech(비온텍)이 개발한 코로나 백신 덕분에 이제 부채가 없는 도시로 변모하였다. 지금까지 마인츠는 주로 카니발의 거점이자 구텐베르크의 도시로 지역 밖에서 거의 알려지지 않았다. 마인츠 시장은 "비온텍의 백신 개발과 생산은 요하네스 구텐베르크가 인쇄술을 발명한 것만큼이나 마인츠에 큰 의미가 있다."라고 열광적으로 말했다. 1450년경 마인츠는 미디어 혁명의 중심지였지만 그 후로 재정 적자에 시달렸다. 그러나 BioNTech의 경제적 성공으로 인해 마인츠시 정부의 예산은 10억 유로의 흑자를 달성했다.
2021년 독일 전체 경제 성장의 20%를 단일 기업인 비온텍이 차지할 것이라는 전망이 나왔는데 이런 비온텍 효과는 전후 독일 역사상 한 번도 없었던 일이다. 비온텍은 독일 국내총생산(GDP) 성장에 약 0.5% 포인트 기여하였고 독일 경제는 2021년에 2.7% 성장했으나 비온텍의 성공이 없다면 2.2% 성장에 그쳤을 것이라고 한다.
비온텍의 성공으로 마인츠시는 세계적으로 인정받는 바이오테크 도시로 탈바꿈하려는 계획을 세우고 있다. 백신 제조업체인 비온텍은 이미 마인츠에서 약 1,500명의 직원을 고용하고 있으며, 시 당국은 앞으로 10년간 약 5,000개의 새로운 일자리가 창출될 것으로 예상하고 있다. 대학 병원 및 대학과 연결된 30헥타르 규모의 생명공학 캠퍼스가 계획되어 있으며, 이곳에서는 암과 노화 연구를 할 것이라고 한다. 결국, 신약 개발의 성공은 도시의 재정 상태를 개선하는 것뿐만 아니라 국가 내 산업 경쟁력을 향상시키며 전 세계적 협력관계를 구축할 수 있는 기회를 제공한다는 것에 큰 의미가 있다.
(5) 생명과학 분야의 국제협력 수행
(가) 국제협력 촉진을 위한 도전
생명과학 분야의 국제협력 또는 공동 프로젝트를 수행하는 과정에서 다음과 같은 다양한 도전과 어려움에 직면하고 있다. 연구를 지속가능하게 수행할 수 있는 연구비 투자는 국제협력에 필수적 요인이다. 재정적 제약, 상충되는 우선순위 및 상이한 자금 조달 주기로 인해 공동 프로젝트에 사용할 수 있는 리소스가 제한될 수 있다. 특히 국가마다 지식재산권에 대한 규정과 관점이 다를 수 있으므로 지식재산권 소유권 및 관리에 대한 명확한 계약을 체결하는 것이 어렵다. 이러한 국가마다 다른 규제 및 승인 프로세스로 인해 공동 프로젝트를 수행하는 데 문제가 발생할 수 있으며 규정 요구 사항을 조정하고 규정 준수를 보장하는 작업에 시간과 비용이 많이 소요될 수 있다.
또한 언어, 문화, 커뮤니케이션의 차이는 효과적인 협업을 방해하고 오해를 불러일으켜 잠재적으로 프로젝트 진행을 지연시킬 수 있다. 샘플 배송, 장비 공유 및 데이터 전송과 같은 국경 간 물류 조정은 복잡하고 비용이 많이 들며 독일의 경우 EU 회원국에 비해 실험군의 이동을 엄격히 제한하고 있다. 국가 간 연구데이터를 공유하는 것은 다양한 데이터 보호법 및 개인 정보 보호 문제로 인해 어려우며 데이터 공유 계약을 체결하고 법적 요구 사항을 탐색하는 것은 복잡하고 시간이 많이 소요될 수 있다. 협력 당사자 간 신뢰 구축은 성공적인 협력을 위해 매우 중요하지만 신뢰를 유지하고 생산적인 협업을 보장하려면 프로젝트 목표, 기대치 및 진행 상황이 투명한 상황에서 진행되어야 하며 장기간 운영되어야 한다는 점에서 어려움을 가지고 있다.
(나) 유럽연합(EU)의 국제협력 방안
유럽연합은 EU Horizon 2020(H2020) 연구 및 혁신 프로그램에 따라 생명과학 분야의 국제협력을 지원하고 있다. 전염병, 기후 변화, 식량 안보와 같은 생명과학 분야의 과제들은 본질적으로 국제 문제를 해결하며 국제협력을 통해 EU는 자원, 전문성 및 지식을 다른 국가와 공유하여 이러한 시급한 문제에 대한 혁신적인 솔루션을 개발하고자 한다. 국제 파트너와의 협력을 통해 유럽 연구자들은 다양한 관점과 첨단 기술을 접하고 과학적 우수성과 혁신을 주도할 수 있고 또한 건전한 경쟁을 촉진하고 생명과학 분야의 새로운 아이디어, 방법론 및 기술 개발을 장려할 수 있다. 또한 유럽 국가 및 그 외 지역 간의 협력과 시너지 효과를 촉진하는 통합된 연구 공간을 만들어 유럽 연구지역(ERA) 구성을 촉진한다. 연구원의 이동성, 지식 교환 및 연구 인프라에 대한 접근성을 촉진하여 유럽 연구 지역의 실현에 기여한다. 이곳에서 새로운 사업 기회와 일자리를 창출하며 외국인 투자를 유치할 수 있다. 글로벌 연구 네트워크에 참여함으로써 유럽 기업은 새로운 시장에 접근하고 고객 기반을 확장하며 경쟁력 강화에 기여한다. 또한 인간의 건강과 식량 안보를 보장하며 지속가능한 농업 및 바이오 기반 산업을 개발할 수 있는 잠재력을 통해 사회적 문제를 해결한다.
이렇듯 EU는 H2020에 따라 우수한 과학기술과 유럽 연구 분야를 진흥시키고, 경제 성장과 경쟁력을 키우며, 국제 문제와 사회 문제를 해결하고 외교 관계를 개선하기 위해 생명과학 분야에 투자 및 지원한다.
(다) 한국의 국제협력 강화정책
우리 정부는 바이오산업의 중요성을 인식하고 있으며 R&D 투자 확대, 효율성 강화, 산학연 협력, 국제공동연구 수행 등을 지원하고 있다. 이러한 투자를 토대로 국내 다수의 대학들과 연구 기관들이 생명공학 관련 프로그램을 수행하며, 줄기세포 연구, 암 치료, 유전자 검사와 같은 분야에서는 세계적인 성과를 도출한 바 있다. 우수한 교육 시스템 및 전문가 양성으로 인해 대학 및 연구기관과 긴밀한 협력이 발생하며 정부의 세금 혜택 및 바이오테크 성장지원 정책은 한국과의 국제협력 추진 과정에서 긍정적인 평가를 받는다.
반면 한국의 바이오산업은 미국, 유럽 등 타 국가에 비해 상대적으로 작은 산업 규모를 가지고 있으며 글로벌 시장에서의 경쟁, 투자 유치 시의 어려움 가능성 있다. 특히 주변 국가인 중국, 일본과 치열한 경쟁을 해야 하며 창업 초기 자금 조달 접근 제한성이 있고 민간 부문의 투자가 다소 부족한 것으로 평가된다.
특히 국내 인력 구조의 다양성은 부족하며 소수 상위권 대학 출신을 채용하는 경향이 높아 산업 내 관점, 아이디어의 제한으로 혁신이 저해되며 규제 환경, 특히 신약 및 의료기기 승인 프로세스에 대한 우려 등으로 장기간 지연과 불확실성으로 업계의 혁신과 성장을 저해한다.
(라) 한국의 바이오연구 국제협력 및 국제공동연구 강화방안
우리 정부는 생명과학 분야에서 국제협력을 지원하는 정책 기조를 일관되게 유지하고 있다. 생명공학 및 생명과학 산업은 21세기 경제 성장의 핵심 동인으로 인정되었고 타 국가와 협력함으로써 글로벌 전문성, 자원, 기술을 활용하여 생명공학 부문을 강화하고 혁신을 촉진하며 일자리를 창출할 수 있다. 전염병, 기후 변화 및 식량 안보와 같은 글로벌 문제를 해결하기 위해 효과적 솔루션 개발이 필요하며 다른 국가들과의 협력을 통해 다양한 도전 과제를 해결하고 공유된 지식과 자원을 활용할 수 있다.
생명공학 분야의 국제협력은 연구원과 기관 간 지식 교환을 촉진할 수 있는 아이디어, 전문 지식 및 자원을 교환하며 기타 참여 국가의 연구 개발을 발전시키는 데 도움을 줄 수 있다. 지속적인 협력 관계의 유지는 국내 생명공학 분야에 대한 투자와 인재를 유치할 수 있는데 기여하며 의료 및 기술의 발전으로 이어져 국내 및 전 세계적으로 공중 보건을 개선하는 데 도움이 될 수 있다.
(6) 정책적 제언
COVID-19는 글로벌 문제를 해결하려면 글로벌 솔루션이 필요하다는 것을 보여준 대표적 사례로서 공중 보건 비상사태를 해결하고 자원을 공유하며 백신과 치료법을 개발하려면 국제 협력과 조정이 필수적이라는 사실을 확인하게 해주었다. 정부와 정책 입안자는 공중 보건 조치 및 개입과 관련하여 정보에 입각한 결정을 내리기 위해 과학적 증거에 의존해야 하므로 일반적인 사항보다 과학 및 증거 기반 의사 결정 시스템의 중요성을 확인할 수 있었다.
그러므로 이러한 생명과학 분야의 국제협력의 중요성과 효과를 고려할 때, 정부, 연구 기관, 학계 및 산업계는 다음과 같은 방안을 고려하여 지속적인 국제협력을 추진하고 발전시킬 수 있다. 생명과학 분야의 국제협력은 연구, 개발 과정에서 몇 가지 중요한 의미가 있다. 도출되는 의견은 긍정적일 수도 있고 부정적일 수도 있으므로 다양한 측면을 포함한 의사 결정 및 정책수행이 필요할 것이다.
바이오 분야의 국제협력은 국가 간 공동 노력을 통해 다양한 국가의 연구자들이 지식, 자원 및 전문성을 공유할 수 있어 생물학적 과정을 이해하고 새로운 기술 및 치료법을 개발하는 데 있어 더 빠른 발전을 이끌어낼 것이다. 국제협력은 적절한 자원이 부족한 국가에서 연구 인프라와 인적 자원 개발을 촉진하여 첨단 연구 수행을 위한 전반적인 역량을 높일 수 있다. 국제적 협력을 통해 모범 사례, 데이터 및 리소스의 공유를 촉진하여 전염병 및 만성 질환과 같은 글로벌 보건 문제를 해결함으로써 전 세계적으로 더 나은 공중 보건 결과를 얻을 수 있을 것이며 생명과학 분야의 협력은 혁신적인 솔루션 개발을 촉진하여 기후 변화, 식량 안보, 생물 다양성 손실과 같은 시급한 글로벌 문제를 해결하는 데 기여할 것이다.
국제협력은 공통의 윤리 및 규제 기준을 수립하여 국경을 넘어 보다 효율적이고 책임 있는 연구 관행을 가능하게 하며 공동연구 노력이 종종 새로운 제품, 서비스 및 산업으로 이어지기 때문에 협력은 경제 성장과 일자리 창출로 이어질 수 있다. 특히 연구 노력의 중복을 최소화하고 연구자들이 서로의 연구를 기반으로 할 수 있도록 함으로써 시간과 자원을 절약할 수 있다. 또한 국가마다 특허법 및 규정이 다르기 때문에 국제협력은 복잡한 지적 재산 문제로 이어질 수 있으므로 사전에 이에 대해 충분히 협의하는 것이 필요하며, 숙련된 연구자와 과학자는 더 나은 연구 기회가 있는 선진국으로 가는 경향이 높으므로 두뇌 유출이 발생하고 현지 역량에 영향을 미칠 수 있다. 생명과학 분야의 국제협력으로 인한 이익은 공평하게 분배되지 않을 수 있으며, 공동연구 프로젝트에서 잠재적으로 부유한 국가가 대부분의 보상을 얻을 수 있는 한계가 존재한다.
이러한 측면에서 과기정통부에서 수행하고 있는 국가간협력조성사업의 경우 소규모 연구비를 투입하여 연구 네트워크를 심도 있게 장기간 운영할 수 있다는 점에서 의미가 있다. 국내 연구수준은 상당히 높아 해외 연구자들이 국제공동연구를 수행하고자 하는 대표적인 국가로 알려져 있다. 또한 국가간협력기반조성사업은 박사생들이 파트너 기관에서 방학 기간을 이용하여 장기간 연구 경험을 확보할 수 있고 연구자들로부터 사업 만족도가 높다는 점에서 의미가 있다.
나. OECD BNCT 등 활동 현황
(1) 개요
OECD의 바이오나노융합기술작업반(Working Party on Biotechnology, Nanotechnology and Converging Technologies, BNCT)은 생명공학, 나노기술 및 융합기술의 책임 있는 개발과 관련 정책 이슈를 논의 및 대응하고자 2014년부터 운영 중이다. 한국은 부의장 국가로 BNCT 활동을 통해 바이오 분야 국제협력 이슈를 발굴하고 글로벌 바이오 이슈 및 정보를 국내에 전파하고 이를 국내 생명공학 정책에 적극 활용하고 있다. 여기에서는 2021년 하반기부터 2023년 상반기까지의 BNCT 활동을 중심으로 글로벌 바이오 정책 이슈와 국내 대응을 살펴보고자 한다.
(2) 추진 경과
(가) 의제별 국내 전문가 소그룹 운영
OECD는 매 2년 주기로 PWB(Programme of Work and Budget)이란 이름으로 예산(안)을 개발하고 수행하고 있으며, 이에 따른 2∼3개의 프로젝트를 운영하고 있다. 한국은 BNCT 핵심 프로젝트별 산・학・연 국내 전문가 소그룹 구성하여 OECD 글로벌 이슈를 토론・논의하는 플랫폼을 상시적으로 운영하고 있다. 주제별 소그룹을 중심으로 OECD 권고문의 모니터링, 정책보고서 및 정책워크숍에 활발하게 참여하고 있다. 또한 매년 2차례 열리는 BNCT 정기총회 전후로 국내 전문가 회의를 통해 총회 주요의제 및 회의결과를 공유하여 OECD 의제에 대한 의견을 수렴하고 한국의 대응방안을 마련하고 있다. 특히, 기술영향평가 팬데믹 준비와 건강 회복력을 위한 협력 플랫폼 그리고 합성생물학 워크숍의 경우 BNCT 작업반 기획위원회(Steering group) 참여 및 자발적 기여금(Voluntary Contribution, VC) 제공을 통해 프로젝트 초기부터 OECD와의 공동연구에 주도적으로 참여하고 있다.
(나) OECD 한국 워크숍 개최 (Policy directions for critical health technology innovation and access)
BNCT는 2021년부터 추진하고 있는 ‘팬데믹 준비와 건강 회복력’ 프로젝트의 일환으로, 건강기술에 대한 시장과 사회의 요구를 동시에 충족하는 혁신 생태계 구축방안을 논의하기 위해 ‘Policy directions for critical health technology innovation and access’ 주제의 한국 워크숍을 개최하였다. 해당 워크숍은 2022년 9월 28일과 29일 양일간 서울에서 열렸으며, 항생제 내성, 필수 의약품의 불충분한 공급 등 시장 실패 영역의 건강기술 혁신을 위한 정책과 전략에 대해 다각도로 논의하였다.
과기정통부 과학기술혁신본부장은 개회식에서 “항생제, 백신과 같은 우리 사회 필수 건강기술의 시장 실패를 조정하기 위해 정부의 역할이 중요하다.”고 말하며, “한국 정부도 국가가 지향할 임무와 기술개발 목표를 명확히 설정하여 임무 지향적 관점에서 종합적인 기술전략 로드맵을 수립할 예정으로, 그 과정에서 민간의 우수한 역량 결집을 중점에 두고, 실제 적용 가능한 실질적 성과 창출에 집중할 것”이라고 강조하였다.
첫째 날, 기조연설을 맡은 국제보건기술연구기금(RIGHT Foundation)의 김한이 대표는 ‘공공재(Global public goods)’로서의 핵심 건강 전략기술의 지속가능성을 위한 현지 상황(local context) 분석과 예상적(anticipatory) 접근을 강조하였다. 이를 위해 미충족 의료수요를 파악하고, 현재(치료제, 백신, 진단 등) 연구개발 현황과 미충족 수요와의 간극을 확인할 필요가 있다고 말했다. 사례로 RIGHT Foundation은 글로벌 형평성 개선을 미션으로 5년간 4,500만 US달러를 중저소득 국가(Lwo and Midell Income Country, LMIC)의 감염병 대응에 집중 지원 중이라고 덧붙였다. 이어진 토론에서 참석자들은 파트너쉽 구축의 중요성에 동의하며, 치료제와 다르게 진단과 백신 분야는 명확한 조정 메커니즘(coordinating mechanism)의 부재 그리고 후보물질 발굴의 어려움으로 파트너십 형성이 쉽지 않다고 이야기했다.
둘째 날, 유럽 개인맞춤형 치료연합(European Alliance for Personalised Medicine) 데니스 호간(Denis Horgan) 박사는 핵심 건강 관련 핵심 기술의 우선순위 선정을 위한 정확하고 일관성 있으며 과학적인 정보가 요구된다고 기조연설을 시작했다. 호간 박사는 사회 경제적 기회를 극대화할 수 있는 보건의료기술을 육성하기 위한 새로운 접근 모델이 필요하다고 말했다. 이후 토론자들은 연구개발 초기단계부터 비용을 줄일 수 있고, silo를 벗어나 학제 간 장벽을 허물고, 지식을 공유하고 연구결과의 상용화를 위한 중개를 효율화할 수 있는 모델 개발이 절실하다고 한목소리를 내었다. 또한 항생제 및 살충제 내성, 희귀난치질환 치료제 등 시장과 투자 수익이 제한적인 영역에 대한 다양한 종류의 인센티브(multiple forms of incentives)에 대한 전문가 패널 토의가 이어졌다.
마지막으로, 워크숍의 핵심 주제인 EDI(Equity/형평성, Diversity/다양성 and Inclusivity/포용성) 강화를 위한 글로벌 협력에 대한 토론의 장이 열렸다. 한국생명공학연구원 감염병연구센터의 류충민센터장은 GloPID-R(Global Research Collaboration for Infectious Disease Preparedness) 한국 참여기관으로서 아시아태평양 지역의 중저소득 국가에서의 신변종 감염병에 대한 대응과 대비 강화를 위한 APIS(Asia-Pacific Infectious disease Shield) 프로젝트를 소개했다. 해당 프로젝트는 중저소득 국가의 목소리를 경청하고, 연구 우선순위와 펀딩 및 인프라와의 괴리를 파악하여 아시아태평양 지역의 감염병 돌발상황에 대한 실행 가능한 해결방안을 도출하는 것에 목표를 두고 있다. 이어서 전문가들은 보건의료 기술의 혁신뿐만 아니라 분배, 배치 그리고 흡수(uptake)를 촉진할 수 있는 협력 방안과 생태계 수립이 필요하다는데 뜻을 모으고, 기술의 디자인, 상용화와 분배에 대한 모든 과정에 있어 시민 중심의 접근법을 위해 집중적인 지식교류와 명확한 공유 목표 확립을 통한 신뢰 구축을 제안했다.
[표 2-40] 2022년 OECD 한국 워크숍 주요내용
|
구성 |
주요 내용 |
발표자 |
|
개회식 |
축사 |
과기정통부 혁신본부장 |
|
OECD 과학기술혁신국장 |
||
|
기조연설 |
공공재로서의 보건의료 핵심기술의 개발 |
김한이 대표 (RIGHT FUND) |
|
세션1. 전략기술관련 정책 |
건강 회복력, 사회・경제적 핵심 기술 분야의 혁신과 포용적 접근을 위한 전략 및 거버넌스 |
[좌장] Dr. Richard Gold (Virus Interruption Medicines Initiative) [패널] Dr. Andrew Rintoul Dr. Simone Boekelaar (Innovate UK), Dr. Rosario Rizzuto (Univ. Padova) |
|
세션2. 핵산기술 잠재력 실현 |
건강 우선순위를 위한 mRNA와 핵산 기술의 잠재력 실현 |
[좌장] Dr. Denis Horgan (European Alliance for Personalised Medicine) [패널] Dr. Roy van der Meel (Eindhoven Univ.), 성백린 단장 (백신실용화사업단) 차현주 센터장 (KRIBB) |
|
기조연설 |
보건의료 핵심기술과 접근에 대한 정책 방향 |
Denis Horgan (EAPM) |
|
세션3. 혁신의 초기단계 강화 |
기술 이전, 인큐베이터, 액셀러레이터 및 의료 기술 혁신 및 상업화의 촉진자로서의 활동 |
[좌장] Dr. Kevin Outterson (Boston University) [패널] Dr. Anand Anandkumar (Bugworks, India) Dr. Anton Ussi (European Research Infrastructure Consortium) 이재훈 교수 (성신여자대학교) 최병현 교수 (인하대학교) |
|
세션4. 의료시스템 회복력 구축 |
시장 실패, 투자, 인프라 및 인력 부족 등으로 인한 팬데믹 이후의 회복력 지연에 대한 논의 |
[좌장] Dr. Susan Sparkes (WHO) [패널] Dr. Sarah Norris (Univ. Sydney) 강민아 교수 (이화여자대학교) 김한이 대표 (RIGHT Fund) |
|
세션5. 국제협력 및 공유자원 |
보건의료 기술의 혁신과 접근을 위한 협업 프레임워크 논의 |
[좌장] Dr. David Winickoff (OECD) [패널] Dr. Antoine Andremont (MESRO) Dr. Helen Yu (Univ. Copenhagen) Dr. Federica Angeli (Univ. York) 송완호 파견관(OECD) 류충민 센터장 (KRIBB) |
출처: 과학기술정보통신부
(3) 주요 정책
OECD는 팬데믹, 기후변화 등 글로벌 도전과제(Grand challenges) 해결과 미래 위기 대응 및 불확실성에 대비하기 위한 과학기술혁신(STI)을 강조하고 있다. 특히, 이머징 기술의 양면성을 미리 예측하고 내재된 위험에 대응(responsive)하기 위한 전략적 인텔리전스(strategic intelligence)를 제안하였다. 이는 코로나19를 겪으면서 백신 개발과 같이 목표 달성에 기여 가능하도록 임무 지향적 혁신정책(MOIP)의 설계 활용이 필요하다는 것을 깊게 깨달았기 때문이다. 지속가능한 사회기술적 전환(sociotechnical transition)을 위한 ‘좋은 기술 거버넌스(good tehchnology governance)’를 구축하기 위한 예견적 접근(anticipatory approach)을 모색하고자 BNCT 작업반은 상위기구인 과학기술정책위원회(Committee for Scientific and Technology Policy, CSTP)와 공동으로 ‘포용적 전환을 위한 기술 거버넌스(Technology Governance for Inclusive Transitions)’란 주제의 콘퍼런스(2021.12.6.∼7, 온라인)를 개최하였다. 해당 콘퍼런스에서 전문가들은 이머징 기술의 사회기술적 변화의 경로를 모색하고, 잠재적인 부정적 효과를 방지 혹은 최소화하는 방향의 책임 있는 기술혁신(responsible innovation)을 강조하였다. 나아가 사회적 수요에 잘 대응할 수 있도록(responsive) 가치를 새롭게 정립하여 좋은 기술 거버넌스를 구축할 필요가 있다고 뜻을 모았다. 같은 맥락으로, 최근 Tech For Good Summit 2020에서 프랑스의 Technology for Good 이니셔티브와 2021년 G7에서 영국 주도의 미래기술포럼(Future Tech Forum)에서 기술 거버넌스 이슈들이 논의되었다. 이러한 국제적 논의를 통해 기술혁신의 초기과정에서부터 사회적 가치 반영과 기술의 사회적 유용성을 고려하고자 예측적 프레임워크(anticipatory framework)가 제시되었다. 이는 기술의 위험을 배타적으로 관리하는 것이 아니라, 혁신과정 그 자체를 개방적이고 포용적으로 전환함으로써 혁신이 일어나는 경로(innovation trajectory)를 사회적 목표 및 가치와 연계하고 일치시키고자 하는 것이다. 이를 위해서는 연구자, 시민 등 다양한 이해관계자들이 새로운 신기술 거버넌스 구축 과정에 참여해야 한다.
OECD는 STI outlook 202317)에서 이머징 기술 거버넌스를 위해 설계조건(design criteria)으로 예측(anticipation), 포용성과 연계(inclusivity and alignment) 그리고 적응성(adaptivity)을 꼽았다. 각각의 설계조건 요소들을 살펴보면, 혁신의 우연성을 보장하면서도 기술 예측, 통계, 평가 등 전략적 인텔리전스를 적용한 예측을 강화해야 한다. 또한 다양한 가치와 사회적 수요를 고려할 수 있도록 여러 이해관계자들을 폭넓게 참여시키고, 연구개발 과정에 다양한 학제 및 접근법을 고려해야 한다. 그리고 이머징 기술의 효과를 미리 예측하여 적응성을 높이고 거버넌스 시스템의 회복력을 갖추어야 한다. 한편, OECD는 각 설계조건에 맞추어 미래지향적 기술영향평가(forward-looking technology assessment), 사회적 참여(societal engagement), 연성법(soft law) 그리고 국제협력(international collaboration on anticipatory governance)을 정책적 도구로 제안하였다. 특히, OECD 권고문과 같이 법적 구속력은 없으나 도덕적 및 정치적 강제성을 가진 연성법은 기존의 규제, 규칙, 표준과 같은 전통적 접근에 대한 대안적 접근이 될 수 있고, 가치와 목적성이 있는 기술개발을 유도할 수 있을 것으로 기대된다.

출처: OECD STI outlook 2023 Enabling transitions through science, technology and innovation
[그림 2-13] 이머징기술 거버넌스 프레임워크 구성 요소
(4) 주요 사업
(가) 기술영향평가 및 미래 예측
최근 기술 변화의 빠른 속도, 건강과 환경 분야의 증가하는 요구, 이미징 기술에 대한 잠재적 위험과 부정적 결과를 완화해야 할 필요성을 고려할 때, 신흥기술에 대한 전략적 정보에 대한 의사결정자들의 요구가 증가하고 있다. 또한 팬데믹, 생물다양성 감소 등 지속가능성에 대한 사회적 과제가 증대됨에 따라 전통적인 기술영향평가는 도전에 직면하였고, 미래지향적 그리고 임무 지향적 방향으로 전환하기 위해 OECD 기술영향평가 프로젝트가 시작되었다. 기술영향평가는 기술정책을 알리는 예측 능력(Anticipatory capacities)을 개발하는 수단으로써 좋은 기술 거버넌스를 위한 전략적 인텔리전스 제공할 수 있다. BNCT 작업반은 한국을 포함한 9개의 사례연구와 비엔나 워크숍(2022.6.28.∼29)을 통해 임무 지향과 문제해결책 중심의 프레임을 포함한 강력하고 미래지향적인 기술영향평가(forward-looking Technology Assessment)에 대한 지침으로 고려할 수 있는 8가지 핵심 차원(dimensions)을 도출하였다.
[표 2-41] 나라별 기술영향평가 연구 사례
|
사례 |
기관 |
국가 |
|
NANOTRUST |
Institute of Technology Assessment (ITA) / Austrian Academy of Science (ÖAW) |
오스트리아 |
|
STOA genome editing in crops |
Science and Technology Options Assessment (STOA) / European Parliament |
유럽 |
|
DNA dialogue |
Rathenau Instituut |
네덜란드 |
|
Value-directed AI |
Rathenau Instituut |
네덜란드 |
|
Industry & Manufacturing Agenda 2030 |
Instituto Superior Técnico (IST) |
포르투갈 |
|
Biotechnology Assessment in Korea |
Korea Research Institute of Bioscience and Biotechnology (KRIBB) Science and Technology Policy Institute (STEPI) |
한국 |
|
Novel and Exceptional Technology and Research Advisory Committee (NExTRAC) |
National Institutes of Health (NIH) |
미국 |
|
GAO’s Assessment of Vaccine Development Technologies |
Government Accountability Office (GAO)/Science, Technology Assessment, and Analytics (GAO-STAA) |
미국 |
|
The National Nanotechnology Initiative’s Strategic Planning Process |
National Nanotechnology Initiative (NNI) / National Nanotechnology Coordination Office (NNCO) |
미국 |
출처: OECD Technology Assessment for Emerging technology- Meeting new demands for strategic intelligence, 2023
[표 2-42] 강력한 기술영향평가를 위한 8가지 핵심 차원의 주요 내용
|
설계 차원 |
주요 내용 |
고려사항 |
|
목적 부합성 |
TA 프로세스는 다음과 같은 주요 목표와 일치해야 함 • 의견을 심의 및 측정 • 주요 동향에 대한 정보 제공 • 의제 구축 • 거버넌스 형성 및 운영 |
전반적인 목표 달성에 가장 적합한 방법과 도구를 결정하기 위해 TA의 주요 목표를 달성할 다양한 단계와 활동을 식별해야 함 (1) TA가 시작된 이유와 (2) TA 활동의 예상 결과를 명확히 하는 것을 고려해야 함 |
|
합법성과 신뢰 |
TA 프로세스와 그 결과는 다양한 공동체에 합법적이고 신뢰할 수 있어야 함. TA 기관이 정치적 영향력과 무관하고 프로세스와 결론에 대해 투명하게 “정직한 중개인”으로 간주되어야 함 |
• 특히 논란의 여지가 있거나 불편한 증거에 직면했을 때 신뢰할 수 있는 TA를 수행하려면 독립성과 투명성을 유지 • 불확실성, 기술의 잠재적 진화 및 관련 유익성 및 위해성에 대해 알려진 것과 알려지지 않은 것에 대한 투명성은 사용자(예: 정책 입안자)와 TA 활동에 참여하는(예: 시민 사회) 모두에게 신뢰할 수 있는 TA를 수행하는 데 핵심 |
|
명확한 세분화 및 TA 초점의 범위 |
강력한 TA는 다음과 같은 세분성과 조사 수준에 대한 명확성을 요구함 • 기술 중심(예: 양자 컴퓨팅) • 가치 사슬 초점 • 사회 기술 시스템 관점 • 하이브리드 분석 수준 |
• TA의 범위와 세분성은 TA 연습의 목표와 밀접하게 연결되어 있으며, 이는 TA에 의해 생성된 지능의 최종 사용자와 관련이 있음 • 관점의 각 형태(기술 중심, 가치 사슬, 시스템 관점 등)는 서로 다른 범위의 전문 지식, 증거 도구 및 프로세스를 필요로 함 |
|
현명하고 포괄적인 참여 |
다음과 같은 여러 제약 조건에 따라 어떤 이해관계자가 포함되고 어떤 이해관계자가 포함되는지를 고려해야 함 • 사용 가능한 리소스(비용, 자금 조달) • 범위(TA의 주제 및 범위를 기반으로 관련 사회 집단 식별) • 사용 가능한 시간 |
• 기업 및 산업 협회, 연구 공동체, 시민 사회, 규제 기관 등과 같은 다양한 이해관계자를 식별하기 위한 수단으로 STEPED 접근법과 같은 프로세스를 고려 • 이머징 기술의 1차, 2차 영향도 고려 • 참여에 대한 장벽을 인식하고 낮추어야 함 • 편견을 식별하는 데 도움이 되도록 다양한 이해관계자들을 TA 프로세스 자체에 대한 자문 그룹으로 간주해야 함 • 가상 및 물리적 포함 간의 균형을 고려 |
|
학제간 융합 |
이머징 및 융합 기술의 결과는 광범위한 통찰력과 학문적 지식을 필요로 함 |
• 사회과학자를 TA의 구성과 실행에 동원하는 것을 고려 • 자연과학자 및 사회과학자를 TA팀에 통합하는 것을 고려 |
|
가치, 프레임 및 편향에 대한 명시 |
TA 실무자는 자신의 편견을 인식할 뿐만 아니라 참가자의 가치와 프레임을 진단함으로써 투명하고 독립적이며 유용한 전략적 인텔리전스를 생산 |
• 장단점을 고려하고 프레임 편향을 피하기 위해 TA 및 예측 핸드북과 지침의 사용을 고려 |
|
(적절한 시기에) 예측과 불확실성의 관리 |
새로운 기술을 위한 TA는 여러 기간에 걸쳐 불확실성을 관리해야 함 • 단기(5년) • 중기(10년) • 장기(15년+) |
• 호라이즌 스캐닝, 데이터 마이닝, 시나리오 개발, 공동 설계 등 적절한 시기에 기술 미래를 탐색하기 위한 다른 예측 도구와 접근 방식을 동원하는 것을 고려 • TA 활동을 수행하기에 적절한 시기인지 고려해야 하는데, 너무 이른 경우 불확실성이 큰 주제에 대한 대중의 우려를 촉발시킬 수 있으며, 너무 늦은 경우 결과를 실행 불가능하거나 중복시킬 수 있음 |
|
유용한 인텔리전스 생산 |
의사 결정을 위한 TA 출력의 유용성에 대한 주요 문제는 다음과 같음 • 명확한 메시지를 가지고 있음 • 소화하기 쉬운 재료를 생산 • 적시에 정책에 통보 • 의사 결정 프로세스와 명확하게 연결되어 있음 |
• TA 활동에서 생성되는 인텔리전스의 대상 고객을 고려 • TA 활동과 의사 결정 사이의 관계를 명확히(주요 행위자와 의사 결정 시기 측면 모두) 설명해야 함 |
출처: OECD Technology Assessment for Emerging technology- Meeting new demands for strategic intelligence, 2023
(나) 팬데믹 준비와 건강회복력을 위한 협력 플랫폼
팬데믹 위기 상황의 정책 수요를 충족하기 위해 BNCT 작업반은 PWB 2021-22 ‘지속가능한 개발을 위한 융합기술 플랫폼’의 일부로서 팬데믹 준비와 건강 회복력을 위한 협력 플랫폼이란 제목의 프로젝트를 진행했다. OECD는 코로나19를 통해 모든 유형의 병원체(세균, 곰팡이, 기생충 및 바이러스)에 걸쳐 혁신 격차(innovation gap)를 전염병 발생, 인간의 고통 및 부정적인 경제적 결과의 원천으로 노출되었다는 것을 인지하였다. 따라서 긍정적인 장기적 사회 기술적 전환에 주요 핵심 보건의료기술(critical health technologies)의 기여를 위해 정부와 기업 모두 사회적 요구를 연결하는 혁신 생태계를 구축할 필요가 있다. 한편, 개방형 혁신, 공유, 소유권 및 보호 사이의 근본적인 긴장을 겪으면서 OECD는 지속 가능한 연구, 제품 개발 및 공평한 접근을 실현하는 방법에 대한 정책적 질문을 제기하였다. 이에 대한 해결책으로 협력적 비즈니스 모델이 부각되었는데, 이를 위해 다양한 관계자의 참여, 가치 교환을 조직하고 촉진하며 지식재산권(IP) 라이선스에 대한 보다 개방적인 접근법을 제안하였다.
(5) 향후 계획
OECD는 이머징 기술의 혜택과 위험이라는 양면적 속성으로 인해 긍정적인 면을 극대화하고 위해를 최소화할 수 있는 ‘좋은 기술 거버넌스’ 구축을 지속할 예정이다. 일반적인 프레임워크 개발뿐만 아니라 기술영향평가를 위한 전략적 인텔리전스 제공을 위한 정책적 도구(tool)를 개발하고자 한다. 이머징 기술 사례를 통해 근본적인 가치를 포함하여 혁신을 사회적 요구에 보다 책임감 있고 대응력 있게 만들 수 있는 방법에 대한 지침과 합의를 모색하고자 한다. 구체적인 기술의 예시로 합성생물학은 녹색 전환 달성 및 식량 안보 문제 해결과 같은 주요 사회적 과제를 해결할 것을 기대되면서도 mRNA 백신과 같이 이미 혁신적인 솔루션을 제공하고 있다. 이에 따라 OECD는 미래 제조혁신의 핵심으로 합성생물학에 대한 생명안보, 안전성, 사회적 수용성 등 거버넌스와 윤리적 문제에 대해 논의하고자 정책 워크숍(2023.5.10., 파리)을 계획 중이다.
|
|
|
제2장 국가 생명공학 육성 정책 |
|
제2절 생명공학 경쟁력 지표 |
1. 투자 현황
가. 정부 연구개발예산 중 미래유망 신기술(6T) 분야별 투자
2021년도 정부 R&D 예산은 집행액 기준 26조 5,791억 원이다. 이는 전년도인 2020년의 23조 8,803억 원 대비 11.3% 증가한 금액이다. 최근 5년간(2017∼2021) 국가연구개발사업의 집행액은 연평균 8.2% 증가하였다. 2021년 국가연구개발사업의 사업 수는 1,181개 사업이고 과제 수는 7만 4,745개로 각각 전년도의 1,022개 사업, 7만 3,501개 과제 대비 증가하였다.

출처: 2021년도 국가연구개발사업 조사분석 보고서, 과학기술정보통신부/KISTEP, 2022
[그림 2-14] 국가연구개발사업 투자 추이(2017∼2021)
연구단계 중에서는 개발연구가 9조 4,566억 원(48.9%)으로, 전년도의 46.8%(7조 8,754억 원) 대비 높아졌고 다음은 기초연구가 5조 3,068억 원(27.5%), 응용연구 4조 5,620억 원(23.6%) 순이다.
기술분류 중 미래유망 신기술(6T)별 집행현황 분석은 2021년도 전체 7만 4,745개 세부과제 중 인문사회 분야를 제외한 과학기술 분야와 국방(비밀 세부과제 포함) 분야의 6만 7,833개 세부과제(25조 1,274억 원)를 분석대상으로 한다. 이 중 미래유망 신기술(6T) 해당 분야 집행액은 16조 7,019억 원으로 분석대상 국가연구개발사업 총 집행액의 66.5%를 차지하였다. 이는 전년도 미래유망 신기술(6T) 집행액 대비 2조 30억 원(13.6%) 증가한 것이다.
미래유망 신기술(6T) 중 생명공학기술(BT) 분야의 집행액은 4조 7,766억 원으로 분석대상 전체(25조 1,274억 원) 중 19.0%를 차지한다. 이는 IT 분야(4조 9,004억 원, 19.5%)에 이어 두 번째로 높은 비중이다. 과제 수로는 생명공학기술(BT) 분야에서 2019년에 2만 4,798개 과제가 수행된 데 이어 2021년에는 2만 6,632개로 7.4% 증가하였다. 전년 대비 증감액은 생명공학기술(BT) 분야가 6,513억 원으로 가장 높았고 그 다음은 ET 분야(6,255억 원), IT 분야(5,836억 원), NT 분야(1,614억 원), CT 분야(776억 원), ST 분야(△963억 원) 순이다.
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
출처: 2021년도 국가연구개발사업 조사분석 보고서, 과학기술정보통신부/KISTEP, 2022
[그림 2-15] 미래유망 신기술(6T) 분야별 투자현황(2021)
최근 5년간 추이에서도 BT 분야는 IT 분야와 함께 최상단에 위치하고 있고, 2020년과 2021년에 큰 폭으로 정부연구개발 투자가 증가하였다.

출처: 2021년도 국가연구개발사업 조사분석 보고서, 과학기술정보통신부/KISTEP, 2022
[그림 2-16] 6T 분야별 투자 추이(2017∼2021)
나. BT 분야 상세 투자현황 및 주요 특징
(1) 부처별 투자현황
2021년도 생명공학기술(BT) 분야 부처별 투자는 과학기술정보통신부(1조 8,581억 원, 38.9%)가 가장 높은 비중을 차지하고, 다음으로 농촌진흥청(6,295억 원, 13.2%), 보건복지부(4,723억 원, 9.9%), 다부처(3,624억 원, 7.6%), 교육부(3,192억 원, 6.7%), 산업통상자원부(3,061억 원, 6.4%) 순으로 이루어졌다. 이 중 다부처의 경우 2019년(946억 원, 2.6%) 대비 금액과 비중 모두 크게 증가한 것이 특징이다. 또한 질병관리청(2020.9.12. 출범)을 포함하고 있는 기타 부처는 2021년 금액과 비중(1,046억 원, 2.2%)이 2019년(74억 원, 0.2%) 대비 크게 증가했다.

출처: 2021년도 국가연구개발사업 조사분석 보고서, 과학기술정보통신부/KISTEP, 2022 재구성
[그림 2-17] BT 분야 부처별 투자현황(2019 대비 2021)
(2) 연구개발 단계/연구수행 주체별 투자현황
생명공학기술(BT) 분야의 연구개발 단계별 투자는 기초연구(1조 8,251억 원, 38.2%), 개발연구(1조 3,565억 원, 28.4%), 응용연구(8,834억 원, 18.5%), 기타(7,116억 원, 14.9%) 순이다. 전체 미래유망 신기술(6T) 합계 중에서 개발연구의 비중이 기초연구와 응용연구를 합한 비중과 유사한 것을 감안하면, 생명공학기술(BT) 분야는 기초연구 비중이 상당히 높은 것을 알 수 있다. 다만, 2019년에 기초연구(1조 4,947억 원, 40.7%), 개발연구(9,052억 원, 24.7%), 응용연구(6,340억 원, 17.3%) 순이었던 점을 고려할 때 개발연구 비중은 다소 증가하고 기초연구 비중은 감소하였다.

출처: 2021년도 국가연구개발사업 조사분석 보고서, 과학기술정보통신부/KISTEP, 2022 재구성
[그림 2-18] BT 분야 연구개발 단계별 투자현황(2019 대비 2021)
생명공학기술(BT) 분야의 연구수행 주체별 투자는 대학(2조 365억 원, 42.6%), 중소기업(7,905억 원, 16.5%), 출연연구소(7,817억 원, 16.4%), 국공립연구소(7,292억 원, 15.3%), 중견기업(729억 원, 1.5%), 대기업(455억 원, 1.0%), 정부부처(39억 원, 0.1%) 순이다. 전체 미래유망 신기술(6T) 중에서는 출연연구소 비중이 가장 높으나, 생명공학기술(BT) 분야는 대학의 비중이 가장 높았다. 2019년 투자에서 대학(1조 6,346억 원, 44.5%), 출연연구소(6,941억 원, 18.9%), 국공립연구소(5,832억 원, 15.9%), 중소기업(5,244억 원, 14.3%), 중견기업(506억 원, 1.4%), 정부부처(135억 원, 0.4%), 대기업(109억 원, 0.3%) 순이었는데, 이에 비해 대학과 정부출연연구소, 국공립연구소, 정부부처의 비중은 감소하고 대・중견・중소기업의 비중은 증가한 것이 특징이다.

출처: 2021년도 국가연구개발사업 조사분석 보고서, 과학기술정보통신부/KISTEP, 2022 재구성
[그림 2-19] BT 분야 연구수행 주체별 투자현황(2019 대비 2021)
(3) 적용 분야별 투자현황
생명공학기술(BT) 분야의 투자는 공공 분야(2조 8,319억 원, 59.3%), 산업 분야(1조 9,447억 원, 40.7%)로 구성된 것으로 나타났다.
세부 분야별로 공공분야에서 건강(1조 9,259억 원, 40.3%), 지식의 진보(비목적 연구)(3,786억 원, 7.9%), 기타 공공목적(2,982억 원, 6.2%), 환경(1,188억 원, 2.5%) 순으로 투자되고 있고, 산업 분야에서는 농업, 임업 및 어업(8,220억 원, 17.2%), 제조업(의료, 정밀, 광학기기 및 시계)(4,097억 원, 8.6%), 제조업(의료용 물질 및 의약품)(2,831억 원, 5.9%), 보건업 및 사회복지 서비스업(1,069억 원, 2.2%) 순으로 투자되고 있다.

출처: 2021년도 국가연구개발사업 조사분석 보고서, 과학기술정보통신부/KISTEP, 2022 재구성
[그림 2-20] BT 분야 적용 분야별 투자현황(2021)
(4) 기술분류별(유망기술・과학기술표준분류) 투자현황
생명공학기술(BT) 분야 투자액 4조 7,766억 중 미래유망 신기술(6T)의 소분류 기준으로 투자액 상위 9개 유망기술 분야18)를 선정한 결과 해당 투자액은 3조 5,648억 원으로 74.6%의 비중을 차지하고 있다. 이 분야는 2017년부터 2021년까지 연평균 증가율은 9.8%로, 생명공학기술(BT) 분야 연평균 증가율(8.1%)을 웃도는 것으로 나타났다.
상위 9개 유망기술 분야 중 2021년 투자 규모는 의과학/의공학기술(5,377억 원)이 가장 높았고 다음은 생명현상 및 기능연구(4,081억 원), 바이오신약개발기술(3,822억 원) 순이었다. 최근 5년간 투자 규모의 연평균 증가율이 높은 분야는 의과학/의공학기술(19.3%), 바이오신약개발기술(10.6%), 뇌신경과학연구(9.8%) 순이었다.

출처: 2021년도 국가연구개발사업 조사분석 보고서, 과학기술정보통신부/KISTEP, 2022 재구성
[그림 2-21] BT 분야 유망기술 투자 추이(2017∼2021)
국가과학기술표준분류 대분류 기준 투자현황은 보건의료(2조 984억 원, 43.9%), 농림수산식품 1조 1,265억 원, 23.6%), 생명과학(9,370억 원, 19.6%), 뇌과학 1,417억 원, 3.0%) 순이었다.

출처: 2021년도 국가연구개발사업 조사분석 보고서, 과학기술정보통신부/KISTEP, 2022 재구성
[그림 2-22] BT 분야 국가과학기술표준분류별 투자현황(2019 대비 2021)
생명공학기술(BT) 분야에서 중점적으로 투자되고 있는 대분류인 보건의료, 농림수산식품, 생명과학 분야에 대해 국가과학기술표준분류 중분류를 기준으로 분석하여, 상위 4개 분야를 보여주는 결과는 다음과 같다. 보건의료 분야에서는 의약품/의약품개발(4,675억 원, 9.8%), 치료/진단기기(3,667억 원, 7.7%), 임상의학(3,129억 원, 6.6%) 순으로 투자되었고, 농림수산식품 분야는 원예특용작물과학(2,252억 원, 4.7%), 동물자원과학(1,283억 원, 2.7%), 식량작물과학(1,261억 원, 2.6%) 순으로 투자된 것으로 나타났다. 생명과학 분야에서는 분자세포생물학(1,583억 원, 3.3%), 융합바이오(1,326억 원, 2.8%), 산업바이오(1,103억 원, 2.3%) 순으로 투자가 이루어졌다.
[표 2-43] BT 분야 국가과학기술표준분류별(중분류) 중점투자 현황(2021)
|
보건의료 분야 |
농림수산식품 분야 |
생명과학 분야 |
||||||
|
|
억 원 |
비중 |
|
억 원 |
비중 |
|
억 원 |
비중 |
|
의약품/의약품개발기술 |
4,675 |
9.8% |
원예특용작물과학 |
2,252 |
4.7% |
분자세포생물학 |
1,583 |
3.3% |
|
치료/진단기기 |
3,667 |
7.7% |
동물자원과학 |
1,283 |
2.7% |
융합바이오 |
1,326 |
2.8% |
|
임상의학 |
3,129 |
6.6% |
식량작물과학 |
1,261 |
2.6% |
산업바이오 |
1,103 |
2.3% |
|
의생명과학 |
3,064 |
6.4% |
수의과학 |
929 |
1.9% |
유전학/유전공학 |
1,002 |
2.1% |
|
보건의료 전체 |
20,984 |
43.9% |
농림수산식품 전체 |
11,265 |
23.6% |
생명과학 전체 |
9,370 |
19.6% |
주) 생명과학 분야 중분류 중 “기타생명과학”을 제외했고, 비중은 BT 분야 정부연구비 4조 7,766억 원 중 해당 분야가 차지하는 비중을 나타냄
출처: 2021년도 국가연구개발사업 조사분석 보고서, 과학기술정보통신부/KISTEP, 2022
(5) 기타 BT 분야 투자의 주요 특징
(가) 지역별 투자 비중
생명공학기술(BT) 분야의 17개 시・도별 투자 규모는 서울(1조 3,631억 원, 28.5%), 대전(5,616억 원, 11.8%), 전북(4,899억 원, 10.3%), 경기(4,787억 원, 10.0%) 순이었다. 2017년 지역별 투자 규모가 서울(1조 890억 원, 29.7%), 대전(4,484억 원, 12.2%), 경기(4,399억 원, 12.0%), 전북(4,090억 원, 12.0%) 순이었던 데 비해 투자 금액은 증가했으나 연구비가 많이 투자되던 주요 지역들의 전국 내 비중은 다소 감소하였다.
2019년 대비 전국 내 비중이 증가한 지역은 기타(4.7% 증가), 인천광역시(0.7% 증가) 강원도(0.2% 증가), 세종특별자치시(0.2% 증가) 순이었다.

출처: 2021년도 국가연구개발사업 조사분석 보고서, 과학기술정보통신부/KISTEP, 2022 재구성
[그림 2-23] BT 분야 시・도별 투자현황(2019 대비 2021)
(나) 공동연구 협력유형별 비중
2021년도에 생명공학기술(BT) 분야 투자에서 협력유형이 있는 과제의 연구비 비중(9.6%)은 협력유형이 없는 과제의 비중(83.7%)보다 크게 낮았다. 이는 2019년 협력유형이 있는 비중(22.2%)과 협력유형이 없는 비중(73.1%)과 비교할 때 협력유형이 없는 과제가 크게 늘어난 것으로 파악된다.
2021년도에 협력유형이 있는 과제의 경우 산학 공동연구(1,756억 원, 38.3%), 산학연 공동연구(716억 원, 15.6%), 산산 공동연구(539억 원, 11.8%) 순으로 투자되었다. 2019년도의 협력유형별 투자는 산학(2,432억 원, 29.8%), 학연(2,165억 원, 26.6%), 산학연 공동연구(1,288억 원, 15.8%) 순이었던 점을 감안하면 전반적으로 공동연구 비중이 감소한 것이다. 특히 학연과 학학, 학기타 등 학계가 참여한 공동연구가 전반적으로 크게 감소하였다. 다만, 산연, 산산, 연연 및 연기타 등 일부 유형에서는 공동연구 금액이 다소 높아졌다.

출처: 201년도 국가연구개발사업 조사분석 보고서, 과학기술정보통신부/KISTEP, 2022 재구성
[그림 2-24] BT 분야 협력유형별 공동연구 투자현황(2019 대비 2021)
2. 인력 현황
가. 학과별 배출 인력
교육통계연구센터의 교육통계서비스에 따르면 2022년 기준 전문대학19)의 바이오 분야 학과 중 보건 분야의 학사 재적생 수(3만 7,209명)가 가장 많은 것으로 조사되었다.
전문대학의 학과별 학사 재적생 수의 성별 현황을 살펴보면, 농수산, 환경 및 의료장비 분야에서 남성 비중이 월등히 높으며, 특히 환경학과가 남성 비중이 80%로 가장 높았다.
여성 비중이 높은 학과는 보건학과(58%)와 생물학과(57%)로 남성보다 소폭 높은 비중을 차지하는 것으로 조사되었다.

출처: 교육통계서비스, http://kess.kedi.re.kr
[그림 2-25] 전문대학의 바이오 분야 학과별 학사 재적 현황(2022)
[표 2-44] 전문대학의 바이오 분야 학과별 학사 재적생 수의 성별 현황(2022)
|
학과 |
학사 재적생((명/비율) |
||||
|
남자 |
여자 |
소계 |
|||
|
농수산 |
2,053 |
77% |
627 |
23% |
2,680 |
|
생물 |
2,355 |
43% |
3,138 |
57% |
5,493 |
|
자원 |
120 |
51% |
114 |
49% |
234 |
|
환경 |
2,075 |
80% |
518 |
20% |
2,593 |
|
보건 |
15,618 |
42% |
21,591 |
58% |
37,209 |
|
재활 |
10,429 |
56% |
8,148 |
44% |
18,577 |
|
의료장비 |
3,083 |
64% |
1,768 |
36% |
4,851 |
출처: 교육통계서비스, http://kess.kedi.re.kr
교육통계연구센터의 교육통계서비스에 따르면 2022년 기준 대학20)의 바이오 분야 학사 재적 현황은 생명과학 분야가 4만 8,867명으로 가장 많은 것으로 조사되었다.
대학의 학과별 학사 재적생 수의 성별 현황을 살펴보면 의학, 농업학, 한의학, 의료공학, 생물학, 산림・원예학, 생명과학 순으로 남성 비중이 높게 나타났으며 특히 의학과의 남성 비중이 65%로 가장 높았다.
여성 비중이 소폭 높게 나타난 학과는 치의학과, 보건학과, 약학과로 특히 치의학과의 여성 비중은 72%, 보건학과는 60%로 나타났다.

출처: 교육통계서비스, http://kess.kedi.re.kr
[그림 2-26] 대학의 바이오 분야 학과별 학사 재적 현황(2022)
[표 2-45] 대학의 바이오 분야 학과별 학사 재적생 수의 성별 현황(2022)
|
학과 |
학사 재적생(명/비율) |
||||
|
남자 |
여자 |
소계 |
|||
|
농업학 |
7,070 |
59% |
4,990 |
41% |
12,060 |
|
동물・수의학 |
2,667 |
49% |
2,742 |
51% |
5,409 |
|
보건학 |
8,877 |
40% |
13,584 |
60% |
22,461 |
|
산림・원예학 |
4,654 |
58% |
3,388 |
42% |
8,042 |
|
생명과학 |
26,026 |
53% |
22,841 |
47% |
48,867 |
|
생물학 |
5,372 |
57% |
3,982 |
43% |
9,354 |
|
약학 |
4,366 |
43% |
5,835 |
57% |
10,201 |
|
의료공학 |
6,288 |
57% |
4,836 |
43% |
11,124 |
|
의학 |
12,062 |
65% |
6,548 |
35% |
18,610 |
|
재활학 |
11,420 |
49% |
12,026 |
51% |
23,446 |
|
치의학 |
2,328 |
28% |
5,951 |
72% |
8,279 |
|
한의학 |
2,704 |
59% |
1,910 |
41% |
4,614 |
출처: 교육통계서비스, http://kess.kedi.re.kr
교육통계연구센터의 교육통계서비스에 따르면 2022년 기준 바이오 분야 석・박사 졸업자는 의학과가 가장 많으며(2,382명), 학위과정별로는 생명과학 석사(1,732명) 및 의학 박사(1,112명) 졸업자가 가장 많은 것으로 조사되었다.
학과별 석・박사 졸업자의 성별 현황을 살펴보면 석사 졸업자에서는 보건학과 재활학의 여성 비중이 월등히 높고 박사 졸업자에서는 재활학과, 보건학과를 제외한 모든 학과에서 남성 비중이 높은 것으로 나타났다.

출처: 교육통계서비스, http://kess.kedi.re.kr
[그림 2-27] 바이오 분야 학과별 석・박사 졸업자 현황(2022)
[표 2-46] 바이오 분야 학과별 석・박사 졸업자의 성별 현황(2022)
|
학과 |
석사 졸업자(명/비율) |
박사 졸업자(명/비율) |
||||||||
|
남자 |
여자 |
소계 |
남자 |
여자 |
소계 |
|||||
|
농업학 |
195 |
57% |
145 |
43% |
340 |
37 |
56% |
29 |
44% |
66 |
|
동물・수의학 |
113 |
46% |
135 |
54% |
248 |
59 |
59% |
41 |
41% |
100 |
|
보건학 |
281 |
24% |
888 |
76% |
1,169 |
81 |
42% |
112 |
58% |
193 |
|
산림・원예학 |
84 |
47% |
94 |
53% |
178 |
39 |
57% |
29 |
43% |
68 |
|
생명과학 |
783 |
45% |
949 |
55% |
1,732 |
569 |
58% |
407 |
42% |
976 |
|
생물학 |
134 |
50% |
132 |
50% |
266 |
93 |
60% |
62 |
40% |
155 |
|
약학 |
210 |
37% |
363 |
63% |
573 |
144 |
54% |
121 |
46% |
265 |
|
의료공학 |
188 |
46% |
222 |
54% |
410 |
89 |
54% |
77 |
46% |
166 |
|
의학 |
740 |
58% |
530 |
42% |
1,270 |
625 |
56% |
487 |
44% |
1,112 |
|
재활학 |
318 |
23% |
1,065 |
77% |
1,383 |
40 |
35% |
73 |
65% |
113 |
|
치의학 |
196 |
51% |
192 |
49% |
388 |
107 |
55% |
88 |
45% |
195 |
|
한의학 |
113 |
49% |
118 |
51% |
231 |
72 |
51% |
69 |
49% |
141 |
출처: 교육통계서비스, http://kess.kedi.re.kr
2021년과 2022년의 바이오 분야 학과별 전문대학 재적생 수 변화는 농수산, 생물학과를 제외한 학과에서 전년 대비 재적생 수가 감소했고 이 중 보건학과의 재적생 수가 가장 많이 감소(1,174명 감소)하였다. 반면, 생물학과는 전년 대비 657명 증가, 농수산학과는 전년 대비 148명이 증가하였다.

출처: 교육통계서비스, http://kess.kedi.re.kr
[그림 2-28] 바이오 분야 학과별 전문대학 재적생 수 비교(2021, 2022)
2021년과 2022년의 바이오 분야 학과별 대학 재적생 수 변화를 살펴보면 농업학, 동물・수의학, 보건학, 약학, 의학, 재활학을 제외한 학과에서 전년 대비 재적생 수가 감소했고 이 중 생물학과의 재적생 수가 가장 많이 감소(1,018명 감소)하였다. 반면, 약학과는 재적생 수가 가장 많이 증가(1,915명 증가)하였다.

출처: 교육통계서비스, http://kess.kedi.re.kr
[그림 2-29] 바이오 분야 학과별 대학 재적생 수 비교(2021, 2022)
2021년과 2022년의 바이오 분야 학과별 석사 졸업자 변화를 살펴보면 보건학, 산림・원예학, 생물학, 의료공학, 의학, 치의학에서 졸업생 수가 감소하였고 이 중 의학과에서 졸업생이 가장 많이 감소(86명 감소)하였다.
나머지 학과에서는 졸업생이 증가하였으며 특히 생명과학과에서 가장 많이 증가(109명 증가)하였다.

출처: 교육통계서비스, http://kess.kedi.re.kr
[그림 2-30] 바이오 분야 학과별 석사 졸업자 비교(2021, 2022)
2021년과 2022년의 바이오 분야 학과별 박사 졸업자 변화를 살펴보면 보건학, 산림・원예학, 생물학, 의료공학, 치의학에서 졸업생 수가 감소하였고 이 중 생물학과 졸업생이 가장 많이 감소(33명 감소)하였다.
나머지 학과에서는 졸업생이 증가하였으며 특히 약학과 졸업생이 가장 많이 증가(43명 증가)하였다.

출처: 교육통계서비스, http://kess.kedi.re.kr
[그림 2-31] 바이오 분야 학과별 박사 졸업자 비교(2021, 2022)
나. 산업인력
(1) 산업인력 규모 및 증감
산업통상자원부와 한국바이오협회가 조사하여 발표한 국내 바이오산업 실태조사에 따르면, 국내 1,037개 바이오기업에 종사하는 인력 수는 5만 5,618명으로 2020년 대비 3,321명(6.4%) 증가하였고 1개 업체당 평균 54명이 근무하고 있는 것으로 조사되었으며, 2019년 이후 2021년까지 최근 3년간 연평균 6.9%의 증가율을 보인 것으로 나타냈다.
(단위: 명)

출처: 산업통상자원부ㆍ한국바이오협회, 2021년 기준 국내 바이오산업 실태조사, 2022
[그림 2-32] 바이오산업 연도별 인력 변화 추이(2019~2021)
(2) 분야 및 직종별 인력 현황
국내 바이오산업 인력을 직종별로 구분해 보면 연구인력이 1만 7,908명(32.2%), 생산인력 1만 7,867명(32.1%), 기타인력 1만 9,843명(35.7%)으로 구성되어 있는 것으로 조사되었다.
[표 2-47] 바이오산업 분야별 인력 분포(2021)
(단위: 명)
|
구 분 |
업체수 |
연구인력 |
생산인력 |
기타인력 |
계 |
산업별 구성비 |
|
|
전 체 |
인력 |
1,037 |
17,908 |
17,867 |
19,843 |
55,618 |
100% |
|
비율 |
100% |
32.2% |
32.1% |
35.7% |
100% |
||
|
바이오의약산업 |
333 |
7,879 |
6,395 |
7,570 |
21,844 |
39.3% |
|
|
바이오화학・에너지산업 |
201 |
2,289 |
2,423 |
2,244 |
6,956 |
12.5% |
|
|
바이오식품산업 |
175 |
1,748 |
3,232 |
2,305 |
7,285 |
13.1% |
|
|
바이오환경산업 |
62 |
356 |
329 |
244 |
929 |
1.7% |
|
|
바이오의료기기산업 |
109 |
1,898 |
2,473 |
3,975 |
8,346 |
15.0% |
|
|
바이오장비 및 기기산업 |
55 |
443 |
567 |
866 |
1,876 |
3.4% |
|
|
바이오자원산업 |
15 |
265 |
292 |
493 |
1,050 |
1.9% |
|
|
바이오서비스산업 |
105 |
3,030 |
2,156 |
2,146 |
7,332 |
13.2% |
|
출처: 산업통상자원부ㆍ한국바이오협회, 2021년 기준 국내 바이오산업 실태조사, 2022
(3) 학위별 인력 분포
2021년 기준 바이오산업 인력 중 학사 졸업자는 2만 7,030명(48.6%)으로 가장 많았으며, 다음으로는 기타 1만 5,015명(27.0%), 석사 1만 339명(18.6%), 박사 3,234명(5.8%)의 순으로 나타났다.
[표 2-48] 바이오산업 학위별 인력 분포(2021)
(단위: 명)
|
구 분 |
박사 |
석사 |
학사 |
기타 |
계 |
산업별 구성비 |
|
|
전 체 |
인력 |
3,234 |
10,339 |
27,030 |
15,015 |
55,618 |
100% |
|
비율 |
5.8% |
18.6% |
48.6% |
27.0% |
100% |
||
|
바이오의약산업 |
1,585 |
4,955 |
10,751 |
4,553 |
21,844 |
39.3% |
|
|
바이오화학・에너지산업 |
378 |
1,259 |
3,236 |
2,083 |
6,956 |
12.5% |
|
|
바이오식품산업 |
322 |
1,006 |
3,330 |
2,627 |
7,285 |
13.1% |
|
|
바이오환경산업 |
33 |
127 |
594 |
175 |
929 |
1.7% |
|
|
바이오의료기기산업 |
380 |
1,188 |
3,573 |
3,205 |
8,346 |
15.0% |
|
|
바이오장비 및 기기산업 |
56 |
181 |
1,058 |
581 |
1,876 |
3.4% |
|
|
바이오자원산업 |
48 |
156 |
493 |
353 |
1,050 |
1.9% |
|
|
바이오서비스산업 |
432 |
1,467 |
3,995 |
1,438 |
7,332 |
13.2% |
|
출처: 산업통상자원부ㆍ한국바이오협회, 2021년 기준 국내 바이오산업 실태조사, 2022
2019년부터 2021년까지 3년간 바이오산업 분야 종사자의 학위별 연평균 증감률을 보면 주로 생산직종에 종사하는 기타(고졸∼전문학사) 인력의 연평균 증감률이 8.7%로 가장 높은 증가율을 보였으며, 다음으로 박사 학위를 소지한 인력이 7.6% 증가한 것으로 나타났다.
[표 2-49] 바이오산업 종사자 학위별 인력 변화 추이(2019~2021)
(단위: 명)
|
구 분 |
2019 |
2020 |
2021 |
전년 대비 증감 |
연평균 증감률 |
||||
|
인원 |
구성비 |
인원 |
구성비 |
인원 |
구성비 |
인원 |
증감률 |
||
|
전 체 |
48,683 |
100% |
52,297 |
100% |
55,618 |
100% |
3,321 |
6.4% |
6.9% |
|
박 사 |
2,793 |
5.7% |
2,941 |
5.6% |
3,234 |
5.8% |
293 |
10.0% |
7.6% |
|
석 사 |
9,395 |
19.3% |
9,703 |
18.6% |
10,339 |
18.6% |
636 |
6.6% |
4.9% |
|
학 사 |
23,798 |
48.9% |
25,666 |
49.1% |
27,030 |
48.6% |
1,364 |
5.3% |
6.6% |
|
기 타 |
12,697 |
26.1% |
13,987 |
26.7% |
15,015 |
27.0% |
1,028 |
7.3% |
8.7% |
출처: 산업통상자원부ㆍ한국바이오협회, 2021년 기준 국내 바이오산업 실태조사, 2022
(4) 지역별 인력 현황
2021년 기준 시도별 바이오산업 인력은 경기 지역이 1만 7,996명으로 32.4%의 비율을 보여 가장 많은 바이오 인력을 보유한 것으로 나타났으며, 다음으로는 충북(8,603명), 서울(8,852명), 인천(5,931명) 순으로 바이오 인력 수가 많은 것으로 조사되었다.
[표 2-50] 바이오산업 시도별 인력 분포(2021)
(단위: 명, %)
|
구 분 |
박사 |
석사 |
학사 |
기타 |
계 |
구성비 |
|
|
전 체 |
인력 |
3,234 |
10,339 |
27,030 |
15,015 |
55,618 |
100% |
|
비율 |
5.8% |
18.6% |
48.6% |
27.0% |
100% |
||
|
서울 |
663 |
1,995 |
5,027 |
1,167 |
8,852 |
15.9% |
|
|
부산 |
15 |
32 |
156 |
41 |
244 |
0.4% |
|
|
인천 |
331 |
1,168 |
3,002 |
1,430 |
5,931 |
10.7% |
|
|
대구 |
16 |
48 |
711 |
641 |
1,416 |
2.5% |
|
|
광주 |
7 |
20 |
37 |
4 |
68 |
0.1% |
|
|
대전 |
248 |
611 |
1,397 |
384 |
2,640 |
4.7% |
|
|
울산 |
48 |
195 |
711 |
340 |
1,294 |
2.3% |
|
|
세종 |
8 |
73 |
160 |
87 |
328 |
0.6% |
|
|
경기 |
1,145 |
3,613 |
7,981 |
5,257 |
17,996 |
32.4% |
|
|
강원 |
164 |
481 |
1,290 |
1,151 |
3,086 |
5.5% |
|
|
충북 |
389 |
1,438 |
4,111 |
2,665 |
8,603 |
15.5% |
|
|
충남 |
87 |
300 |
797 |
785 |
1,969 |
3.5% |
|
|
전북 |
34 |
115 |
501 |
459 |
1,109 |
2.0% |
|
|
전남 |
25 |
91 |
477 |
191 |
784 |
1.4% |
|
|
경북 |
18 |
37 |
229 |
179 |
463 |
0.8% |
|
|
경남 |
27 |
100 |
338 |
148 |
613 |
1.1% |
|
|
제주 |
9 |
22 |
105 |
86 |
222 |
0.4% |
|
출처: 산업통상자원부ㆍ한국바이오협회, 2021년 기준 국내 바이오산업 실태조사, 2022
(5) 고용형태 및 퇴직・채용 현황
한국바이오협회에서 400개 바이오기업을 대상으로 진행한 국내 바이오산업 인력수요 및 공급조사 결과에 따르면 인력의 고용형태는 조사 대상 기업의 인력 1만 9,491명 중 정규직이 1만 9,410명으로 정규직 비중이 99.6%를 차지하고 있으며, 성별로는 남성이 1만 2,629명(64.8%)으로 여성 6,862명(35.2%)에 비해 많은 것으로 나타났다. 이 중 남성은 영업 및 관리직에서 4,177명(33.1%)에 종사하는 비중이 가장 높았으며, 여성은 연구직(2,112명)과 생산직(2,010명)에 종사하는 비중이 각각 30.8%와 29.3%로 높았다.
전체 인력 중 3∼5년 미만의 경력을 가진 인력이 5,450명(28.0%)으로 가장 많은 비중을 차지하였으며, 다음으로 5∼10년 미만 5,128명(26.3%), 1∼3년 미만 4,152명(21.3%)의 순으로 나타났으며, 경력 1년 미만의 신입은 1,818명(9.3%)이었다. 또한 외국인 근로자는 438명으로 주로 생산직(165명)과 연구직(148명)으로 근무 중이었다.
|
구분 |
연구직 |
개발직 |
생산 및 시설직 |
품질관리직 (QA, QC 등) |
영업 및 관리직 |
총원 |
|
|
전체 |
5,051 |
752 |
5,654 |
1,321 |
6,713 |
19,491 |
|
|
성별 |
남 |
2,939 |
506 |
3,644 |
763 |
4,777 |
12,629 |
|
여 |
2,112 |
246 |
2,010 |
558 |
1,936 |
6,862 |
|
|
계 |
5,051 |
752 |
5,654 |
1,321 |
6,713 |
19,491 |
|
|
고용 형태 |
정규직 |
5,039 |
749 |
5,649 |
1,319 |
6,654 |
19,410 |
|
비정규직 |
12 |
3 |
5 |
2 |
59 |
81 |
|
|
계 |
5,051 |
752 |
5,654 |
1,321 |
6,713 |
19,491 |
|
|
경력 |
1년 미만(신입) |
299 |
10 |
709 |
105 |
695 |
1,818 |
|
1∼3년 미만 |
977 |
139 |
1,283 |
317 |
1,436 |
4,152 |
|
|
3∼5년 미만 |
1,470 |
246 |
1,551 |
365 |
1,818 |
5,450 |
|
|
5∼10년 미만 |
1,448 |
244 |
1,345 |
329 |
1,762 |
5,128 |
|
|
10년 이상 |
857 |
113 |
766 |
205 |
1,002 |
2,943 |
|
|
계 |
5,051 |
752 |
5,654 |
1,321 |
6,713 |
19,491 |
|
|
외국인 근로자 |
148 |
29 |
165 |
46 |
50 |
438 |
|
출처: 한국바이오협회, 국내 바이오산업 인력수요 및 공급조사, 2022
2021년도에 400개 조사대상 기업에서 퇴사한 인력은 총 2,474명이었으며, 생산직이 1,089명, 영업 및 관리직 702명, 연구직 560명 등의 순으로 조사되었다.
2021년도에 구인활동을 진행한 263개의 기업에서 총 3,129명을 채용하였으며, 이중 생산직 채용이 1,250명으로 가장 높은 비중을 보였고 다음으로는 연구직 875명, 영업 및 관리직 797명 등의 순으로 조사되었다. 또한, 채용인원 3,129명 중 경력 1년 미만의 신입직원 채용은 1,275명(40.7%)이었고 경력직 채용은 1,854(59.3%)명으로 경력직의 채용 비율이 더 높은 것으로 나타났으며, 채용인력 중 업무에 즉시 투입 가능한 인력은 경력직이 1,765명(95.2%)으로 신입(경력 1년 미만) 680명(53.3%)에 비해 훨씬 더 높은 비중을 차지하는 것으로 조사되었다.
[표 2-52] 바이오기업 채용 및 퇴사 인력(2021)
(단위: 명)
|
구분 |
기업수 |
연구직 |
개발직 |
생산 및 시설직 |
품질 관리직 |
영업 및 관리직 |
합계 |
|
퇴사인력 |
400 |
560 |
53 |
1,089 |
70 |
702 |
2,474 |
|
채용인력 |
263 |
875 |
70 |
1,250 |
137 |
797 |
3,129 |
출처: 한국바이오협회, 국내 바이오산업 인력수요 및 공급조사, 2022
나. 바이오 분야 인력수급 현황
산업통상자원부 및 한국산업기술진흥원의 2022년도 산업기술인력 수급실태조사 결과에 따르면 12대 주력산업 중 바이오헬스 분야 인력 부족률은 4.1%로 반도체산업(4.8%)에 이어 두 번째로 부족률이 높은 산업으로 조사되었으며, 2017년부터 3∼5%대의 높은 부족률이 지속되고 있는 것으로 나타났다.
[표 2-53] 12대 주력산업의 산업기술인력 부족률 변화(2017~2021)
(단위: %)
|
구분 |
12대 주력 산업전체 |
기계 |
디스 플레이 |
반도체 |
바이오 헬스 |
섬유 |
자동차 |
전자 |
조선 |
철강 |
화학 |
소프트 웨어 |
IT 비즈니스 |
|
2017년 |
1,094,314 |
153,261 |
50,562 |
90,501 |
30,039 |
36,012 |
116,331 |
201,472 |
63,436 |
66,784 |
127,291 |
135,872 |
22,752 |
|
증가율 |
1.8 |
1.3 |
△1.3 |
4.6 |
5.7 |
△1.2 |
△2.0 |
5.5 |
△2.6 |
△2.4 |
1.9 |
4.3 |
2.9 |
|
2018년 |
1,101,105 |
153,681 |
50,100 |
92,873 |
31,572 |
36,197 |
118,524 |
203,988 |
60,301 |
65,289 |
126,006 |
139,454 |
23,120 |
|
증가율 |
0.6 |
0.3 |
△0.9 |
2.6 |
5.1 |
0.5 |
1.9 |
1.2 |
△4.9 |
△2.2 |
△1.0 |
2.6 |
1.6 |
|
2019년 |
1,102,119 |
152,599 |
50,007 |
95,429 |
32,557 |
35,291 |
118,199 |
204,141 |
59,621 |
64,412 |
123,546 |
142,914 |
23,403 |
|
증가율 |
0.1 |
△0.7 |
△0.2 |
2.8 |
3.1 |
△2.5 |
△0.3 |
0.1 |
△1.1 |
△1.3 |
△2.0 |
2.5 |
1.2 |
|
2020년 |
1,098,921 |
150,122 |
48,795 |
99,285 |
34,140 |
34,000 |
116,498 |
202,889 |
58,622 |
63,531 |
120,533 |
146,714 |
23,793 |
|
증가율 |
△0.3 |
△1.6 |
△2.4 |
4.0 |
4.9 |
△3.7 |
△1.4 |
△0.6 |
△1.7 |
△1.4 |
△2.4 |
2.7 |
1.7 |
|
2021년 |
1,115,526 |
151,337 |
48,864 |
104,004 |
35,528 |
33,494 |
119,818 |
205,024 |
58,225 |
64,381 |
122,307 |
148,270 |
24,273 |
|
증가율 |
1.5 |
0.8 |
0.1 |
4.8 |
4.1 |
△1.5 |
2.8 |
1.1 |
△0.7 |
1.3 |
1.5 |
1.1 |
2.0 |
|
증가 인원 |
16,605 |
1,215 |
69 |
4,719 |
1,388 |
△506 |
3,320 |
2,135 |
△397 |
850 |
1,774 |
1,556 |
480 |
출처: 산업통상자원부ㆍ한국산업기술진흥원, 2022년 산업기술인력 수급 실태조사, 2022
한국바이오협회에서 발간한 바이오산업 인력수요 및 공급조사 결과 분석보고서에 따르면 2023년 인력 수요 규모는 총 1만 827명에 이를 것으로 전망되며, 세부 산업별로는 바이오의약산업이 5,342명으로 총수요 중 가장 높은 49.3%를 차지할 것으로 전망되었고 다음으로는 바이오의료기기산업 1,794명(16.6%), 바이오화학・에너지산업 1,227명(11.3%) 등의 순으로 예상되었다.
[표 2-54] 바이오산업 분야별・직종별 인력 수요 규모 전망(2023년 기준)
(단위: 명)
|
구분 |
연구직 |
개발직 |
생산 및 시설 |
품질관리 |
영업 및 관리직 |
합계 |
|
바이오의약산업 |
1,266 |
196 |
1,903 |
323 |
1,654 |
5,342 |
|
바이오화학・에너지산업 |
367 |
30 |
495 |
35 |
300 |
1,227 |
|
바이오식품산업 |
174 |
14 |
412 |
66 |
221 |
887 |
|
바이오환경산업 |
26 |
2 |
161 |
△1 |
54 |
242 |
|
바이오의료기기산업 |
431 |
75 |
749 |
94 |
445 |
1,794 |
|
바이오장비 및 기기산업 |
39 |
4 |
74 |
12 |
107 |
236 |
|
바이오자원산업 |
25 |
7 |
11 |
△4 |
△29 |
10 |
|
바이오서비스산업 |
564 |
65 |
152 |
37 |
271 |
1,089 |
|
합계 |
2,892 |
393 |
3,957 |
562 |
3,023 |
10,827 |
출처: 한국바이오협회, 국내 바이오산업 인력수요 및 공급조사, 2022
2023년 기준으로 바이오산업 분야에서 필요한 인력수요 대비 인력공급이 부족(수급차)한 인원은 7,416명으로 전망되며, 직종별로는 생산직 3,207명(43.2%), 연구직 1,618명(21.8%), 영업・관리직은 2,013명(27.1%)이 부족할 것으로 전망되었다.
[표 2-55] 2023년 기준 바이오산업 분야별 직종별 인력 수급차 전망
(단위: 명)
|
구분 |
연구직 |
개발직 |
생산 및 시설 |
품질관리 |
영업 및 관리직 |
합계 |
|
바이오의약산업 |
891 |
149 |
1,682 |
259 |
1,356 |
4,337 |
|
바이오화학・에너지산업 |
174 |
6 |
382 |
2 |
147 |
711 |
|
바이오식품산업 |
14 |
△6 |
318 |
39 |
94 |
459 |
|
바이오환경산업 |
△94 |
△14 |
90 |
△21 |
△41 |
△80 |
|
바이오의료기기산업 |
386 |
70 |
722 |
86 |
409 |
1,673 |
|
바이오장비 및 기기산업 |
△17 |
△4 |
41 |
3 |
63 |
86 |
|
바이오자원산업 |
△221 |
△24 |
△134 |
△46 |
△224 |
△649 |
|
바이오서비스산업 |
485 |
55 |
106 |
24 |
209 |
879 |
|
전체 |
1,618 |
232 |
3,207 |
346 |
2,013 |
7,416 |
출처: 한국바이오협회, 국내 바이오산업 인력수요 및 공급조사, 2022
3. 특허 현황
가. 특허 현황 분석개요
특허는 연구개발 활동의 산물이며 이러한 특허정보에 기인한 특허통계는 국가별, 지역별, 기업별 성과를 나타낸다.
생명공학 분야의 특허성과를 살펴보기 위해 최근 10년간의 한국등록 특허와 미국등록 특허의 시계열 데이터를 추출하여 국가별, 기술별, 주요 특허권자별 분석을 실시하였다. 미국특허를 선정한 이유는 미국은 특허권의 보호가 시스템적으로 잘 갖춰져 있을 뿐만 아니라 가장 큰 시장으로 전 세계 모든 기업들이 특허권 확보에 나서고 있어 국가별 기술경쟁력을 상대적으로 비교할 수 있는 이점을 가지고 있기 때문이다.
생명공학 분야의 기술분류는 OECD의 생명공학 분야 분류체계(국제특허분류를 이용한 분류체계), 유럽 특허청에서 정의한 생명공학 관련 국제특허분류 및 국가과학기술 기본계획상의 생명공학 분류체계를 기준으로 작성되었다.
[표 2-56] 생명공학 분야 기술분류
|
산업 |
세부기술 |
국제특허분류 |
설명 |
|
기초 |
생물자원탐색기술 |
C12N 1/00-3/00 |
미생물 |
|
C12N 7/00-7/08 |
바이러스 |
||
|
동식물세포배양기술 |
C12N 5/00-5/28 |
동식물 세포 |
|
|
효소공학기술 |
C12N 9/00-13/00 |
효소 |
|
|
유전체기술 |
C12N 15/00-15/90 |
유전공학 |
|
|
C07H 19/00-21/04 |
당류기 함유 핵산 |
||
|
단백질체기술 |
C07K 1/00-14/825 |
펩티드 |
|
|
C07K 17/00-17/14 |
고정화 펩티드 |
||
|
C07K 19/00 |
하이브리드 펩티드 |
||
|
항체이용기술 |
C07K 16/00-16/46 |
면역글로불린 |
|
|
공정 |
생물공정기술 |
C12M 1/00-1/42 |
효소 미생물 관련 장치 |
|
C12M 3/00-3/10 |
동식물 세포 배양장치 |
||
|
C12P 1/00-41/00 |
생물학적 합성 |
||
|
C12S 1/00-13/00 |
분리 정제 |
||
|
측정진단기술 |
C12Q 1/00-3/00 |
측정 시험 |
|
|
G01N 33/50-33/98 |
조사 분석 |
||
|
의약 |
생물의약개발기술 |
A61K 35/12-35/84, 7/26 |
신약 후보물질 |
|
A61K 38/00-38/58, 7/28 |
단백질 치료제 |
||
|
A61K 39/00-39/44 |
치료용 항체 |
||
|
A61K 48/00 |
유전자 치료 |
||
|
A61K 51/00-51/10 |
방사선 의약 |
||
|
농업 |
생물농약개발기술 |
A01N 63/00-65/02 |
생물 농약 |
|
형질전환동식물개발기술 |
A01H |
신규한 식물 |
|
|
A01K 67/00-67/04 |
신규한 동물 |
||
|
환경 |
발효식품개발기술 |
C12C - C12L |
알코올 발효 및 장치 |
|
환경생물공학기술 |
C02F 3/00-3/34 |
생물학적 수처리 |
|
|
C02F 11/02-11/04 |
슬러지 처리 |
출처: 저자 재구성
나. 특허 분석 결과 현황
(1) 한국에 등록된 생명공학 특허 현황
최근 10년간 한국에 등록된 특허 건수는 증가 추세이나 2021년을 기점으로 감소하는 경향을 보이며 연평균 증가율은 0.50%이다. 내국인의 특허 비율은 71.8%로 전체 특허에서 차지하는 내국인 비율 77%보다는 조금 낮게 나타났다. 한국 국적의 특허등록 건수는 2020년을 기점으로 감소하고 있고, 스위스와 덴마크 역시 연평균 증가율이 마이너스를 보여주고 있다. 상위 10개국 중 나머지 7개국은 특허등록 건수가 꾸준하게 늘어나고 있음을 알 수 있다.
[표 2-57] 한국 등록 특허 상위 10개 국가별-연도별 현황(2013~2022)
(단위: 건, %)
|
국가 |
2013 |
2014 |
2015 |
2016 |
2017 |
2018 |
2019 |
2020 |
2021 |
2022 |
Total |
CAGR |
|
한국 |
2,620 |
2,759 |
2,165 |
2,323 |
3,102 |
2,869 |
2,946 |
3,264 |
3,121 |
2,200 |
27,369 |
△1.92% |
|
미국 |
335 |
303 |
297 |
323 |
411 |
417 |
446 |
524 |
620 |
707 |
4,383 |
8.65% |
|
일본 |
204 |
196 |
159 |
184 |
167 |
180 |
165 |
146 |
206 |
209 |
1,816 |
0.27% |
|
독일 |
76 |
57 |
48 |
49 |
55 |
78 |
77 |
80 |
84 |
102 |
706 |
3.32% |
|
스위스 |
72 |
63 |
77 |
73 |
52 |
57 |
59 |
74 |
70 |
71 |
668 |
△0.16% |
|
프랑스 |
37 |
28 |
38 |
46 |
49 |
40 |
43 |
54 |
49 |
59 |
443 |
5.32% |
|
중국 |
10 |
12 |
22 |
26 |
35 |
33 |
52 |
63 |
73 |
57 |
383 |
21.34% |
|
영국 |
20 |
24 |
22 |
22 |
37 |
30 |
37 |
35 |
56 |
57 |
340 |
12.34% |
|
네덜란드 |
33 |
24 |
27 |
14 |
37 |
20 |
31 |
34 |
35 |
44 |
299 |
3.25% |
|
덴마크 |
27 |
12 |
8 |
10 |
24 |
18 |
23 |
15 |
20 |
26 |
183 |
△0.42% |
|
합계 |
3,565 |
3,620 |
2,977 |
3,189 |
4,111 |
3,892 |
4,069 |
4,475 |
4,515 |
3,730 |
38,143 |
0.50% |
출처: 특허청
연도별 기술별 특허등록 현황을 살펴보면, 공정 분야의 측정진단기술의 측정, 시험이 특허 건수가 꾸준히 가장 많은 등록 건수를 보여주고 있고, 기초 분야에서는 유전체기술의 유전공학, 생물자원탐색의 미생물 분야가 그다음으로 많은 특허등록 건수를 차지하고 있다.
연평균 증가율에서는 항체이용의 면역글로불린 분야가 11.02%로 가장 높고, 그다음으로 생물공정의 효소, 미생물관련 장치 분야, 측정진단의 측정, 시험 분야의 연평균 증가율이 높은 것으로 나타났다.
[표 2-58] 한국 등록 특허의 기술분류별-연도별 현황(2013~2022)
(단위: 건, %)
|
기술분류 |
2013 |
2014 |
2015 |
2016 |
2017 |
2018 |
2019 |
2020 |
2021 |
2022 |
Total |
CAGR |
||
|
공정 |
생물공정 |
분리정제 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
생물학적합성 |
130 |
142 |
121 |
69 |
153 |
95 |
156 |
129 |
79 |
80 |
1,154 |
△5.25% |
||
|
동식물세포배양장치 |
49 |
88 |
44 |
55 |
59 |
23 |
29 |
18 |
24 |
43 |
432 |
△1.44% |
||
|
효소, 미생물관련장치 |
77 |
138 |
82 |
96 |
134 |
158 |
130 |
111 |
132 |
166 |
1,224 |
8.91% |
||
|
측정진단 |
조사, 분석 |
307 |
241 |
147 |
159 |
261 |
393 |
400 |
431 |
461 |
390 |
3,190 |
2.69% |
|
|
측정, 시험 |
287 |
386 |
416 |
418 |
768 |
643 |
626 |
721 |
694 |
564 |
5,523 |
7.80% |
||
|
기초 |
유전체 |
유전공학 |
505 |
602 |
464 |
451 |
423 |
397 |
410 |
460 |
465 |
323 |
4,500 |
△4.84% |
|
당류기함유핵산 |
22 |
17 |
15 |
18 |
14 |
19 |
20 |
21 |
29 |
15 |
190 |
△4.17% |
||
|
단백질체 |
펩티드 |
240 |
234 |
237 |
281 |
292 |
370 |
410 |
353 |
401 |
352 |
3,170 |
4.35% |
|
|
고정화펩티드 |
4 |
5 |
2 |
9 |
2 |
1 |
4 |
4 |
1 |
2 |
34 |
△7.41% |
||
|
하이브리드펩티드 |
42 |
31 |
41 |
65 |
36 |
21 |
35 |
20 |
16 |
9 |
316 |
△15.73% |
||
|
항체이용 |
면역글로불린 |
128 |
168 |
184 |
192 |
208 |
222 |
243 |
268 |
320 |
328 |
2,261 |
11.02% |
|
|
효소공학 |
효소 |
120 |
114 |
91 |
70 |
152 |
135 |
132 |
168 |
193 |
108 |
1,283 |
△1.16% |
|
|
생물자원탐색 |
미생물 |
340 |
318 |
337 |
300 |
352 |
305 |
322 |
356 |
347 |
243 |
3,220 |
△3.66% |
|
|
바이러스 |
28 |
41 |
30 |
53 |
47 |
53 |
50 |
61 |
54 |
46 |
463 |
5.67% |
||
|
동식물세포배양 |
동식물세포 |
147 |
139 |
157 |
175 |
216 |
201 |
216 |
332 |
315 |
218 |
2,116 |
4.48% |
|
|
농업 |
생물농약개발 |
생물농약 |
81 |
56 |
43 |
58 |
75 |
74 |
63 |
95 |
73 |
66 |
684 |
△2.25% |
|
형질전환동 식물개발 |
신규한동물 |
36 |
50 |
30 |
36 |
67 |
66 |
79 |
97 |
112 |
89 |
662 |
10.58% |
|
|
신규한식물 |
156 |
150 |
63 |
67 |
35 |
56 |
41 |
34 |
46 |
39 |
687 |
△14.28% |
||
|
식품 |
발효식품개발 |
알코올발효및장치 |
179 |
168 |
46 |
58 |
154 |
108 |
95 |
105 |
111 |
119 |
1,143 |
△4.43% |
|
의약 |
생물의약개발 |
방사선의약 |
8 |
8 |
13 |
3 |
4 |
12 |
11 |
6 |
13 |
16 |
94 |
8.01% |
|
유전자치료 |
10 |
44 |
47 |
81 |
67 |
60 |
48 |
67 |
57 |
29 |
510 |
12.56% |
||
|
치료용항체 |
153 |
87 |
102 |
99 |
141 |
83 |
108 |
137 |
125 |
121 |
1,156 |
△2.57% |
||
|
단백질치료제 |
139 |
148 |
110 |
176 |
185 |
135 |
180 |
166 |
138 |
121 |
1,498 |
△1.53% |
||
|
신약후보물질 |
102 |
99 |
58 |
104 |
140 |
129 |
115 |
187 |
176 |
168 |
1,278 |
5.70% |
||
|
환경 |
환경생물공학 |
슬러지처리 |
66 |
28 |
15 |
29 |
38 |
24 |
23 |
22 |
26 |
5 |
276 |
△24.93% |
|
생물학적수처리 |
209 |
118 |
82 |
67 |
88 |
109 |
123 |
106 |
107 |
70 |
1,079 |
△11.44% |
||
출처: 특허청
국내 등록 특허 중에서 한국 국적의 특허만을 추출하여 연도별 기술분류별 현황을 살펴보면, 전체 특허등록 현황과 유사하게 공정 분야의 측정진단기술의 측정, 시험 분야, 기초 분야에서는 유전체기술의 유전공학, 생물자원탐색의 미생물 분야가 그다음으로 많은 특허등록 건수를 차지하고 있다. 그러나 유전체의 유전공학 분야는 연평균 증가율이 –10.90%로 2020년 이후 감소폭이 점차 커지고 있는 것으로 나타났다.
[표 2-59] 한국 등록 특허 중 한국 국적 특허의 기술분류별-연도별 현황(2013~2022)
(단위: 건, %)
|
기술분류 |
2013 |
2014 |
2015 |
2016 |
2017 |
2018 |
2019 |
2020 |
2021 |
2022 |
Total |
CAGR |
||
|
공정 |
생물공정 |
분리정제 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
생물학적합성 |
95 |
107 |
93 |
46 |
116 |
70 |
107 |
73 |
55 |
55 |
817 |
△5.89% |
||
|
동식물세포배양장치 |
44 |
73 |
35 |
51 |
48 |
21 |
21 |
11 |
17 |
28 |
349 |
△4.90% |
||
|
효소, 미생물관련장치 |
61 |
118 |
65 |
84 |
111 |
120 |
96 |
97 |
109 |
110 |
971 |
6.77% |
||
|
측정진단 |
조사, 분석 |
241 |
189 |
120 |
106 |
224 |
288 |
299 |
326 |
326 |
243 |
2,362 |
0.09% |
|
|
측정, 시험 |
234 |
319 |
344 |
361 |
708 |
568 |
560 |
631 |
586 |
427 |
4,738 |
6.91% |
||
|
기초 |
유전체 |
유전공학 |
387 |
506 |
374 |
350 |
304 |
274 |
269 |
293 |
256 |
137 |
3,150 |
△10.90% |
|
당류기함유핵산 |
6 |
1 |
5 |
3 |
3 |
3 |
4 |
6 |
6 |
2 |
39 |
△11.49% |
||
|
단백질체 |
펩티드 |
101 |
133 |
131 |
161 |
168 |
241 |
270 |
200 |
242 |
157 |
1,804 |
5.02% |
|
|
고정화펩티드 |
2 |
2 |
0 |
5 |
1 |
1 |
4 |
3 |
1 |
1 |
20 |
△7.41% |
||
|
하이브리드펩티드 |
32 |
19 |
26 |
48 |
13 |
8 |
11 |
3 |
1 |
4 |
165 |
△20.63% |
||
|
항체이용 |
면역글로불린 |
26 |
25 |
41 |
40 |
55 |
61 |
76 |
85 |
101 |
48 |
558 |
7.05% |
|
|
효소공학 |
효소 |
80 |
92 |
62 |
53 |
120 |
112 |
99 |
122 |
129 |
59 |
928 |
△3.33% |
|
|
생물자원탐색 |
미생물 |
305 |
287 |
308 |
270 |
308 |
274 |
281 |
330 |
316 |
231 |
2,910 |
△3.04% |
|
|
바이러스 |
20 |
32 |
21 |
47 |
30 |
45 |
40 |
45 |
36 |
27 |
343 |
3.39% |
||
|
동식물세포배양 |
동식물세포 |
117 |
105 |
108 |
127 |
166 |
131 |
159 |
255 |
202 |
108 |
1,478 |
△0.89% |
|
|
농업 |
생물농약개발 |
생물농약 |
78 |
54 |
40 |
54 |
71 |
67 |
57 |
87 |
69 |
58 |
635 |
△3.24% |
|
형질전환동 식물개발 |
신규한동물 |
34 |
44 |
25 |
34 |
59 |
59 |
67 |
76 |
80 |
58 |
536 |
6.11% |
|
|
신규한식물 |
147 |
131 |
56 |
59 |
24 |
46 |
33 |
23 |
41 |
36 |
596 |
△14.47% |
||
|
식품 |
발효식품개발 |
알코올발효및장치 |
177 |
159 |
43 |
55 |
148 |
101 |
92 |
101 |
107 |
112 |
1,095 |
△4.96% |
|
의약 |
생물의약개발 |
방사선의약 |
1 |
7 |
3 |
2 |
0 |
6 |
5 |
4 |
5 |
3 |
36 |
12.98% |
|
유전자치료 |
4 |
35 |
39 |
70 |
56 |
52 |
36 |
55 |
45 |
18 |
410 |
18.19% |
||
|
치료용항체 |
32 |
22 |
29 |
30 |
37 |
22 |
31 |
48 |
43 |
39 |
333 |
2.22% |
||
|
단백질치료제 |
70 |
93 |
63 |
94 |
106 |
85 |
102 |
113 |
88 |
59 |
873 |
△1.88% |
||
|
신약후보물질 |
78 |
76 |
42 |
83 |
106 |
85 |
90 |
158 |
132 |
112 |
962 |
4.10% |
||
|
환경 |
환경생물공학 |
슬러지처리 |
64 |
28 |
13 |
27 |
36 |
22 |
22 |
20 |
26 |
5 |
263 |
△24.67% |
|
생물학적수처리 |
184 |
102 |
79 |
63 |
84 |
107 |
115 |
99 |
102 |
63 |
998 |
△11.23% |
||
출처: 특허청
생명공학 분야의 국내 상위 10개 특허권자를 살펴보면(특허권자 명이 대한민국은 제외)21), 주로 대학들의 특허등록 건수가 많음을 보여주고 있다. 10년 전체 기간에서는 서울대학교가 896건으로 가장 많고, 한국생명공학연구원, 고려대학교, 연세대학교 순으로 나타나고 있다. 상위 10개 특허권자 중에는 대학이 7개, 출연연 2개, 기업이 1개를 차지하고 있다.
5년 주기별로 구분하여 살펴보면, 한국생명공학연구원은 2013∼2017년 구간에서는 504건으로 가장 많은 특허등록 건수를 보여주고 있으나, 2018∼2022년 구간에서는 237건으로 6위로 떨어졌고, CJ 제일제당은 2013∼2017년에는 상위 10위안에 포함되어 있지 않았으나 2018∼2022년에는 273건으로 4위를 차지하고 있는 것으로 나타났다. 대부분의 특허권자들의 특허등록 건수가 최근 구간에서 감소하고 있으나, 연세대학교는 반대로 특허등록 건수가 증가한 것으로 나타났다.
[표 2-60] 국내 상위 10대 특허권자 현황(2013~2022)
(단위: 건)
|
전체 구간(2013∼2022) |
2013∼2017 |
2018∼2022 |
|||
|
특허권자 명 |
특허수 |
특허권자명 |
특허수 |
특허권자명 |
특허수 |
|
서울대학교 |
896 |
한국생명공학연구원 |
504 |
서울대학교 |
415 |
|
한국생명공학연구원 |
741 |
서울대학교 |
481 |
연세대학교 |
363 |
|
고려대학교 |
712 |
고려대학교 |
363 |
고려대학교 |
349 |
|
연세대학교 |
662 |
연세대학교 |
299 |
CJ 제일제당 |
273 |
|
건국대학교 |
476 |
건국대학교 |
283 |
전남대학교 |
238 |
|
경북대학교 |
467 |
경북대학교 |
250 |
한국생명공학연구원 |
237 |
|
한국과학기술연구원 |
440 |
한국과학기술원 |
230 |
가톨릭대학교 |
218 |
|
가톨릭대학교 |
422 |
한국과학기술연구원 |
230 |
경북대학교 |
217 |
|
전남대학교 |
418 |
가톨릭대학교 |
204 |
한국과학기술연구원 |
210 |
|
CJ 제일제당 |
417 |
이화여자대학교 |
181 |
건국대학교 |
193 |
출처: 특허청
(2) 미국에 등록된 생명공학 특허 현황
최근 10년간 미국에 등록된 특허 건수는 꾸준하게 증가하였으나 2020년 이후부터 점차 감소하고 있는 것으로 나타났다. 연평균 증가율은 0.98%이며 미국 자국인(US Origin)의 특허 비율은 약 54%로 미국 전체특허에서 차지하는 미국 자국인 특허 비율 47%보다 높은 것으로 나타났다.
상위 10개 국가 중 중국과 네덜란드의 연평균 증가율이 상대적으로 높은 것으로 나타났고, 한국은 2022년 등록 건수가 6위를 차지하고 있는 것으로 조사되었다.
[표 2-61] 미국에 등록된 생명공학 특허의 국가별 특허등록 건수 현황(2013~2022)
(단위: 건, %)
|
|
2013 |
2014 |
2015 |
2016 |
2017 |
2018 |
2019 |
2020 |
2021 |
2022 |
Total |
CAGR |
|
미국 |
6,267 |
6,663 |
6,482 |
6,470 |
5,924 |
6,781 |
7,329 |
7,309 |
6,935 |
6,157 |
66,317 |
△0.20% |
|
일본 |
781 |
843 |
793 |
777 |
562 |
635 |
688 |
714 |
608 |
632 |
7,033 |
△2.32% |
|
독일 |
417 |
485 |
525 |
490 |
438 |
517 |
605 |
619 |
547 |
467 |
5,110 |
1.27% |
|
네덜란드 |
271 |
428 |
476 |
484 |
422 |
484 |
558 |
614 |
518 |
501 |
4,756 |
7.07% |
|
스위스 |
337 |
328 |
343 |
338 |
342 |
379 |
312 |
352 |
296 |
276 |
3,303 |
△2.19% |
|
프랑스 |
305 |
280 |
326 |
351 |
305 |
324 |
348 |
383 |
300 |
298 |
3,220 |
△0.26% |
|
한국 |
218 |
248 |
255 |
266 |
301 |
354 |
377 |
388 |
324 |
370 |
3,101 |
6.05% |
|
영국 |
250 |
282 |
287 |
246 |
216 |
285 |
350 |
389 |
290 |
310 |
2,905 |
2.42% |
|
중국 |
95 |
111 |
129 |
170 |
164 |
231 |
282 |
341 |
412 |
540 |
2,475 |
21.30% |
|
덴마크 |
203 |
260 |
206 |
230 |
169 |
239 |
212 |
220 |
222 |
187 |
2,148 |
△0.91% |
|
전체 |
10,884 |
11,877 |
11,746 |
11,912 |
12,434 |
12,328 |
13,051 |
13,455 |
12,607 |
11,887 |
122,181 |
0.98% |
출처: 특허청
연도별 기술별 특허등록 현황을 살펴보면, 형질전환동식물 분야의 신규한 식물 분야의 특허등록 건수가 가장 많은 것으로 조사되었고, 그다음으로 측정진단 분야의 측정, 시험 분야의 특허가 많았다. 한국등록 특허와는 달리 미국등록 특허에서는 생물의약개발 분야의 치료용항체와 단백질 치료제 분야의 특허 건수가 많은 것으로 조사되었다.
[표 2-62] 미국에 등록된 생명공학 특허의 기술분류별-연도별 특허등록 건수 현황(2013~2022)
(단위: 건, %)
|
기술분류 |
2013 |
2014 |
2015 |
2016 |
2017 |
2018 |
2019 |
2020 |
2021 |
2022 |
Total |
CAGR |
||
|
공정 |
생물공정 |
분리정제 |
3 |
1 |
- |
1 |
- |
1 |
- |
- |
- |
- |
6 |
△100.00% |
|
생물학적합성 |
711 |
782 |
741 |
693 |
629 |
619 |
594 |
613 |
548 |
468 |
6,398 |
△4.54% |
||
|
동식물세포배양장치 |
14 |
30 |
47 |
31 |
28 |
34 |
55 |
58 |
57 |
88 |
442 |
22.66% |
||
|
효소, 미생물관련장치 |
222 |
269 |
266 |
225 |
238 |
218 |
229 |
207 |
204 |
203 |
2,281 |
△0.99% |
||
|
측정진단 |
조사, 분석 |
755 |
749 |
784 |
789 |
900 |
1000 |
950 |
1035 |
936 |
871 |
8,769 |
1.60% |
|
|
측정, 시험 |
1,135 |
1,142 |
1,129 |
1,146 |
1,187 |
1,244 |
1,305 |
1,409 |
1,332 |
1,190 |
12,219 |
0.53% |
||
|
기초 |
유전체 |
유전공학 |
605 |
715 |
827 |
827 |
990 |
1,029 |
1,110 |
1,248 |
1,173 |
1,250 |
9,774 |
8.40% |
|
당류기함유핵산 |
512 |
453 |
413 |
391 |
344 |
306 |
306 |
287 |
239 |
260 |
3,511 |
△7.25% |
||
|
단백질체 |
펩티드 |
405 |
484 |
626 |
729 |
685 |
673 |
852 |
785 |
912 |
801 |
6,952 |
7.87% |
|
|
고정화펩티드 |
10 |
15 |
11 |
18 |
13 |
4 |
1 |
12 |
6 |
2 |
92 |
△16.37% |
||
|
하이브리드펩티드 |
10 |
9 |
19 |
16 |
16 |
11 |
9 |
13 |
8 |
10 |
121 |
0.00% |
||
|
항체이용 |
면역글로불린 |
289 |
270 |
422 |
529 |
655 |
707 |
693 |
886 |
979 |
973 |
6,403 |
14.44% |
|
|
효소공학 |
효소 |
340 |
398 |
401 |
460 |
402 |
465 |
572 |
562 |
503 |
470 |
4,573 |
3.66% |
|
|
생물자원탐색 |
미생물 |
230 |
271 |
196 |
192 |
180 |
196 |
152 |
162 |
145 |
140 |
1,864 |
△5.37% |
|
|
바이러스 |
48 |
42 |
41 |
70 |
73 |
89 |
126 |
84 |
71 |
51 |
695 |
0.68% |
||
|
동식물세포 배양 |
동식물세포 |
365 |
457 |
418 |
405 |
405 |
425 |
373 |
361 |
369 |
308 |
3,886 |
△1.87% |
|
|
농업 |
생물농약개발 |
생물농약 |
271 |
280 |
235 |
233 |
226 |
146 |
121 |
125 |
117 |
108 |
1,862 |
△9.72% |
|
형질전환 동식물개발 |
신규한동물 |
48 |
47 |
56 |
68 |
70 |
84 |
85 |
91 |
86 |
79 |
714 |
5.69% |
|
|
신규한식물 |
2,040 |
2,366 |
2,211 |
2,344 |
2,407 |
2,194 |
2,472 |
2,466 |
2,017 |
1,989 |
22,506 |
△0.28% |
||
|
식품 |
발효식품개발 |
알코올발효및장치 |
17 |
18 |
18 |
40 |
35 |
30 |
47 |
49 |
67 |
68 |
389 |
16.65% |
|
의약 |
생물의약개발 |
방사선의약 |
127 |
129 |
114 |
104 |
107 |
79 |
87 |
85 |
106 |
79 |
1,017 |
△5.14% |
|
유전자치료 |
132 |
178 |
192 |
171 |
168 |
158 |
205 |
157 |
178 |
111 |
1,650 |
△1.91% |
||
|
치료용항체 |
1,137 |
1,234 |
1,114 |
1,072 |
1,147 |
1,093 |
1,120 |
1,163 |
1,031 |
920 |
11,031 |
△2.33% |
||
|
단백질치료제 |
1,221 |
1,274 |
1,151 |
1,040 |
1,128 |
1,067 |
1,036 |
999 |
838 |
769 |
10,523 |
△5.01% |
||
|
신약후보물질 |
141 |
154 |
224 |
241 |
297 |
365 |
437 |
493 |
578 |
570 |
3,500 |
16.79% |
||
|
환경 |
환경생물공학 |
슬러지처리 |
3 |
1 |
5 |
3 |
15 |
7 |
13 |
5 |
7 |
8 |
67 |
11.51% |
|
생물학적수처리 |
93 |
109 |
85 |
74 |
89 |
84 |
101 |
100 |
100 |
101 |
936 |
0.92% |
||
출처: 특허청
미국등록 특허 중에서 한국국적의 특허만을 추출하여 연도별 기술분류별 현황을 살펴보면, 특허 건수가 많지는 않지만, 생물의약개발 분야의 단백질치료제 분야에 대한 미국특허 등록 건수가 가장 많은 것으로 나타났다. 그다음으로 측정진단의 측정, 시험 분야, 유전체 분야의 유전공학 분야와 단백질체 분야의 펩티브 분야에 대한 특허 건수가 많은 것으로 나타났다.
[표 2-63] 미국등록 특허 중 한국 국적의 기술분류별-연도별 특허등록 건수 현황(2013~2022)
(단위: 건, %)
|
기술분류 |
2013 |
2014 |
2015 |
2016 |
2017 |
2018 |
2019 |
2020 |
2021 |
2022 |
Total |
CAGR |
||
|
공정 |
생물공정 |
분리정제 |
1 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
1 |
△100.00% |
|
생물학적합성 |
27 |
38 |
34 |
32 |
36 |
39 |
31 |
38 |
31 |
30 |
336 |
1.18% |
||
|
동식물세포배양장치 |
- |
1 |
3 |
3 |
- |
- |
1 |
- |
2 |
4 |
14 |
- |
||
|
효소, 미생물관련장치 |
8 |
16 |
15 |
4 |
8 |
12 |
12 |
6 |
7 |
7 |
95 |
△1.47% |
||
|
측정진단 |
조사, 분석 |
17 |
20 |
21 |
14 |
15 |
29 |
29 |
31 |
19 |
23 |
218 |
3.42% |
|
|
측정, 시험 |
17 |
25 |
32 |
29 |
34 |
34 |
36 |
33 |
23 |
37 |
300 |
9.03% |
||
|
기초 |
유전체 |
유전공학 |
28 |
15 |
16 |
26 |
26 |
28 |
33 |
39 |
26 |
27 |
264 |
△0.40% |
|
당류기함유핵산 |
12 |
12 |
12 |
7 |
6 |
7 |
9 |
7 |
3 |
4 |
79 |
△11.49% |
||
|
단백질체 |
펩티드 |
10 |
18 |
19 |
15 |
24 |
26 |
35 |
40 |
29 |
41 |
257 |
16.97% |
|
|
고정화펩티드 |
- |
- |
1 |
- |
2 |
- |
- |
- |
- |
- |
3 |
- |
||
|
하이브리드펩티드 |
- |
1 |
- |
- |
3 |
- |
1 |
- |
2 |
1 |
8 |
- |
||
|
항체이용 |
면역글로불린 |
8 |
6 |
4 |
14 |
17 |
22 |
14 |
20 |
17 |
24 |
146 |
12.98% |
|
|
효소공학 |
효소 |
7 |
7 |
12 |
13 |
15 |
17 |
25 |
19 |
15 |
28 |
158 |
16.65% |
|
|
생물자원탐색 |
미생물 |
12 |
13 |
6 |
10 |
10 |
19 |
12 |
10 |
10 |
9 |
111 |
△3.15% |
|
|
바이러스 |
- |
1 |
1 |
6 |
3 |
5 |
7 |
3 |
1 |
3 |
30 |
- |
||
|
동식물세포 배양 |
동식물세포 |
6 |
15 |
12 |
10 |
20 |
18 |
30 |
27 |
7 |
8 |
153 |
3.25% |
|
|
농업 |
생물농약개발 |
생물농약 |
13 |
9 |
10 |
12 |
2 |
4 |
3 |
2 |
2 |
3 |
60 |
△15.03% |
|
형질전환 동식물개발 |
신규한동물 |
2 |
2 |
2 |
2 |
3 |
1 |
1 |
3 |
2 |
2 |
20 |
0.00% |
|
|
신규한식물 |
1 |
3 |
1 |
- |
4 |
5 |
2 |
4 |
2 |
- |
22 |
- |
||
|
식품 |
발효식품개발 |
알코올발효및장치 |
1 |
- |
- |
- |
- |
- |
1 |
1 |
14 |
10 |
27 |
29.15% |
|
의약 |
생물의약개발 |
방사선의약 |
- |
1 |
1 |
3 |
3 |
- |
2 |
1 |
3 |
5 |
19 |
19.58% |
|
유전자치료 |
1 |
4 |
8 |
6 |
5 |
6 |
7 |
10 |
9 |
7 |
63 |
24.14% |
||
|
치료용항체 |
14 |
13 |
11 |
19 |
15 |
23 |
16 |
16 |
22 |
17 |
166 |
2.18% |
||
|
단백질치료제 |
25 |
26 |
27 |
33 |
39 |
42 |
53 |
57 |
49 |
36 |
387 |
4.13% |
||
|
신약후보물질 |
2 |
1 |
4 |
8 |
11 |
16 |
15 |
18 |
26 |
42 |
143 |
40.25% |
||
|
환경 |
환경생물공학 |
슬러지처리 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
1 |
1 |
- |
|
생물학적수처리 |
6 |
1 |
3 |
- |
- |
1 |
2 |
3 |
3 |
1 |
20 |
△18.05% |
||
출처: 특허청
미국등록 특허의 상위 10대 한국특허권자를 살펴보면, 10년 전체 구간에서는 기업인 CJ 제일제당과 삼성전자가 가장 많은 특허 건수를 보여주고 있다. 구간별로 살펴보면 2013∼2017년 구간에서는 삼성전자가 164건으로 압도적으로 많은 특허 건수를 보여주었으나 2018∼2022년에는 52건으로 감소한 것을 알 수 있다. CJ 제일제당은 2018∼2022년 구간에서 전 구간에 비해 2배 이상 많은 특허등록 건수를 나타내고 있으며, 그다음으로 서울대학교와 고려대학교의 특허등록 건수가 크게 증가하고 있는 것으로 나타났다.
최근 5년 구간에서의 연구 주체별로 보면 기업이 6개, 대학이 3개, 출연연이 1개로 한국등록 특허와 달리 미국등록 특허는 기업이 많은 부분을 차지하고 있음을 알 수 있다.
[표 2-64] 미국등록 특허의 상위 10대 한국 특허권자 현황(2013~2022)
(단위: 건)
|
전체구간(2013∼2022) |
2013∼2017 |
2018∼2022 |
|||
|
출원기관명 |
특허수 |
출원기관명 |
특허수 |
출원기관명 |
특허수 |
|
CJ 제일제당 |
242 |
삼성전자 |
164 |
CJ 제일제당 |
162 |
|
삼성전자 |
216 |
CJ 제일제당 |
80 |
서울대학교 |
66 |
|
서울대학교 |
113 |
한국생명공학연구원 |
63 |
고려대학교 |
63 |
|
고려대학교 |
98 |
서울대학교 |
47 |
삼성전자 |
52 |
|
KAIST |
85 |
KAIST |
45 |
한국과학기술연구원 |
43 |
|
한국생명공학연구원 |
81 |
포항공과대학교 |
38 |
KAIST |
40 |
|
한국과학기술연구원 |
78 |
한국과학기술연구원 |
35 |
한미 |
39 |
|
한미 |
67 |
고려대학교 |
35 |
㈜케어젠 |
31 |
|
포항공과대학교 |
44 |
한미 |
28 |
LG 전자 |
29 |
|
연세대학교 |
44 |
연세대학교 |
18 |
인트론바이오테크놀로지 |
27 |
출처: 특허청
4. 논문 현황
가. 개요
기초 과학 및 연구의 결과는 대부분 논문의 형태로 발표되어 전파되고, 이를 통해 학문이 발전하며 응용연구로 연결된다. 따라서 한 국가 또는 분야에서 발표한 논문을 분석하는 것은 해당 조직의 연구 역량을 판단하는 데 중요한 수단이 된다. 이러한 논문의 현황 분석은 우리나라 생명공학의 수준과 역량을 보다 객관적으로 진단하는 데 유용하다. 특히, 꾸준히 양적 성장을 이뤄온 우리나라 논문 성과의 질적 수준에 대한 객관적인 분석이 더욱 중요해졌다.
논문 분석을 수행하기 위해서는 논문 데이터베이스(DB)가 필요하다. Clarivate Analytics에서 발간하는 SCI(Science Citation Index) DB는 학계에 널리 알려진 DB로써 SCI 등재 학술지 논문수는 한 나라의 국제적인 연구개발 활동의 지표로서 널리 인식되고 있다. SCI DB는 50년 이상 엄정한 심사를 통과한 학술지에 대한 DB를 구축하여 제공함으로써 세계적인 권위를 인정받고 있다. 논문 현황 분석은 SCI DB의 일종인 InCites DB와 WoS(Web of Science), ESI(Essential Science Indicators, 2011∼2021)를 기반으로 하였다. 전체 과학기술 분야 중 생명공학 분야를 분석하기 위해 ESI 기준 22개 분야 중 관련 6개 분야를 대상으로 하였다. 또한 논문 타입은 Article, Review만으로 한정하였다.
나. 한국의 SCI 논문 현황
2021년 우리나라 SCI 논문수는 8만 4,070편으로 세계 12위 수준이다. 최근 10년간 논문수의 연평균 증가율은 6%로 양적으로 점진적인 증가 추세를 나타내고 있으나, 세계 대비 점유율은 3.4% 수준에서 유지하고 있다.
[표 2-65] 최근 10년간 한국의 SCI 논문 발표 현황(2012~2021)
|
구분 |
2012 |
2013 |
2014 |
2015 |
2016 |
|
논문발표수(편) |
50,343 |
52,816 |
55,839 |
58,981 |
60,684 |
|
세계 총 논문수(편) |
1,496,317 |
1,575,208 |
1,627,612 |
1,683,117 |
1,756,163 |
|
세계 점유율(%) |
3.36 |
3.35 |
3.43 |
3.50 |
3.46 |
|
세계 순위 |
12위 |
12위 |
12위 |
12위 |
12위 |
|
구분 |
2017 |
2018 |
2019 |
2020 |
2021 |
|
논문발표수(편) |
61,671 |
64,481 |
70,738 |
76,874 |
84,070 |
|
세계 총 논문수(편) |
1,831,113 |
1,896,207 |
2,116,115 |
2,266,586 |
2,423,861 |
|
세계 점유율(%) |
3.37 |
3.40 |
3.34 |
3.39 |
3.47 |
|
세계 순위 |
12위 |
12위 |
12위 |
12위 |
12위 |
출처: InCites DB, WoS(Web of Science), ESI(Essential Science Indicators, 2011∼2021), 저자 재구성
우리나라 SCI 논문의 최근 5년간(2017∼2021) 평균 피인용 횟수는 8.53회로, 세계 평균(7.73회)과 비교했을 때 질적 수준에서 약간 높은 수준을 보인다. 과거에는 세계 전체 평균에 비해 다소 낮은 편이었지만, 최근 상승하며 세계 평균을 넘어서게 되었다. 세계 대비 SCI 논문의 양적 성장은 둔화되고 있지만 질적으로는 점차 향상되고 있다는 것을 알 수 있다.
[표 2-66] 5년 주기별 한국의 SCI 논문 1편당 평균 피인용 현황(2012~2021)
|
구분 |
2012∼2016 |
2013∼2017 |
2014∼2018 |
2015∼2019 |
2016∼2020 |
2017∼2021 |
|
한국 |
5.90 |
6.12 |
6.51 |
7.02 |
7.62 |
8.53 |
|
세계평균 |
5.78 |
5.92 |
6.11 |
6.44 |
6.93 |
7.73 |
|
세계대비 |
102.1% |
103.4% |
106.5% |
109.0% |
110.0% |
110.3% |
출처: 과학기술 논문성과 분석연구(2012-2021), 한국과학기술기획평가원, 2022
다. 바이오 분야 SCI 논문 현황
우리나라 바이오 6개 분야의 최근 5년간(2017∼2021년) SCI 논문수는 다음 표와 같다. 약리학 분야가 논문수로 세계 9위 수준으로 가장 높고, 세계 대비 점유율로는 미생물학(3.92%)이 6개 분야 중 가장 우수한 것으로 나타났다. 국가별로는 미국이 약리학을 제외한 5개 분야에서 가장 앞서 있으며, 중국이 약리학 분야에서 1위이며 다른 분야에서는 2위이다. 다음으로는 영국, 독일, 일본, 이탈리아 순으로 나타났다.
[표 2-67] 최근 5년간 한국의 바이오 분야 SCI 논문 현황(2017∼2021)
|
분야명 |
분야 논문수 |
세계 순위 |
한국 대비 |
세계 대비 |
||
|
총 논문수 |
점유율 |
세계분야 총 논문수 |
점유율 |
|||
|
면역학 |
3,718 |
17위 |
353,595 |
1.05% |
156,020 |
2.38% |
|
미생물학 |
5,097 |
11위 |
1.44% |
129,959 |
3.92% |
|
|
분자생물학 & 유전학 |
8,434 |
11위 |
2.39% |
272,977 |
3.09% |
|
|
생물학 & 생화학 |
15,466 |
10위 |
4.37% |
432,637 |
3.57% |
|
|
신경과학 & 행동과학 |
8,096 |
13위 |
2.29% |
294,008 |
2.75% |
|
|
약리학 |
9,235 |
9위 |
2.61% |
261,236 |
3.54% |
|
|
생명공학 합계 |
50,046 |
12위 |
353,595 |
14.15% |
1,546,837 |
3.24% |
출처: InCites DB, WoS(Web of Science), ESI(Essential Science Indicators, 2011∼2021), 저자 재구성

출처: InCites DB, WoS(Web of Science), ESI(Essential Science Indicators, 2011∼2021), 저자 재구성
[그림 2-33] 최근 5년간 국가별 바이오 분야 SCI 논문수(2017∼2021)
한국의 바이오 분야 SCI 논문을 연도별로 살펴보면 신경과학 및 행동과학 분야의 SCI 논문수가 최근 10년간 4.3%의 연평균 증가율을 보이며 대략 1.5배 정도 증가하였고, 생물학 및 생화학(3.8%), 면역학(3.8%), 약리학(2.4%), 미생물학(2.2%), 분자생물학 및 유전학(1.8%) 순으로 SCI 논문이 증가하고 있는 것으로 나타났다.
[표 2-68] 최근 10년간 한국의 생명공학 분야 SCI 논문 현황(2012~2022)
|
분야명 |
구분 |
2012 |
2013 |
2014 |
2015 |
2016 |
||||||
|
면역학 |
논문수 |
620 |
593 |
645 |
658 |
631 |
||||||
|
피인용수 |
18,743 |
17,565 |
17,931 |
16,033 |
15,584 |
|||||||
|
평균피인용 |
30.23 |
29.62 |
27.80 |
24.37 |
24.70 |
|||||||
|
미생물학 |
논문수 |
920 |
807 |
847 |
921 |
881 |
||||||
|
피인용수 |
21,910 |
13,638 |
16,505 |
14,979 |
16,637 |
|||||||
|
평균피인용 |
23.82 |
16.90 |
19.49 |
16.26 |
18.88 |
|||||||
|
분자생물학&유전학 |
논문수 |
1,326 |
1,344 |
1,531 |
1,718 |
1,987 |
||||||
|
피인용수 |
62,357 |
50,825 |
60,633 |
63,681 |
63,886 |
|||||||
|
평균피인용 |
47.03 |
37.82 |
39.60 |
37.07 |
32.15 |
|||||||
|
생물학&생화학 |
논문수 |
2,469 |
2,750 |
2,857 |
2,971 |
2,828 |
||||||
|
피인용수 |
81,454 |
79,717 |
78,585 |
76,898 |
70,811 |
|||||||
|
평균피인용 |
32.99 |
28.99 |
27.51 |
25.88 |
25.04 |
|||||||
|
신경과학&행동과학 |
논문수 |
1,223 |
1,289 |
1,292 |
1,402 |
1,493 |
||||||
|
피인용수 |
36,454 |
38,925 |
36,155 |
34,753 |
32,291 |
|||||||
|
평균피인용 |
29.81 |
30.20 |
27.98 |
24.79 |
21.63 |
|||||||
|
약리학 |
논문수 |
1,657 |
1,653 |
1,625 |
1,805 |
1,683 |
||||||
|
피인용수 |
44,035 |
43,629 |
37,774 |
36,376 |
33,363 |
|||||||
|
평균피인용 |
26.58 |
26.39 |
23.25 |
20.15 |
19.82 |
|||||||
|
분야명 |
구분 |
2017 |
2018 |
2019 |
2020 |
2021 |
|
면역학 |
논문수 |
640 |
683 |
743 |
788 |
864 |
|
피인용수 |
14,554 |
14,181 |
11,857 |
11,204 |
4,998 |
|
|
평균피인용 |
22.74 |
20.76 |
15.96 |
14.22 |
5.78 |
|
|
미생물학 |
논문수 |
1,007 |
935 |
945 |
1,087 |
1,123 |
|
피인용수 |
20,824 |
14,596 |
11,583 |
10,139 |
4,180 |
|
|
평균피인용 |
20.68 |
15.61 |
12.26 |
9.33 |
3.72 |
|
|
분자생물학&유전학 |
논문수 |
1,991 |
1,586 |
1,716 |
1,589 |
1,552 |
|
피인용수 |
48,155 |
35,238 |
27,731 |
21,017 |
9,779 |
|
|
평균피인용 |
24.19 |
22.22 |
16.16 |
13.23 |
6.30 |
|
|
생물학&생화학 |
논문수 |
2,756 |
2,863 |
3,028 |
3,378 |
3,441 |
|
피인용수 |
62,592 |
64,513 |
51,259 |
41,592 |
25,439 |
|
|
평균피인용 |
22.71 |
22.53 |
16.93 |
12.31 |
7.39 |
|
|
신경과학&행동과학 |
논문수 |
1,532 |
1,489 |
1,591 |
1,702 |
1,782 |
|
피인용수 |
35,760 |
28,931 |
23,311 |
14,720 |
8,734 |
|
|
평균피인용 |
23.34 |
19.43 |
14.65 |
8.65 |
4.90 |
|
|
약리학 |
논문수 |
1,671 |
1,748 |
1,870 |
1,887 |
2,059 |
|
피인용수 |
29,006 |
29,629 |
24,802 |
17,434 |
13,642 |
|
|
평균피인용 |
17.36 |
16.95 |
13.26 |
9.24 |
6.63 |
출처: InCites DB, WoS(Web of Science), ESI(Essential Science Indicators, 2011∼2021), 저자 재구성
(단위: 개)

출처: InCites DB, WoS(Web of Science), ESI(Essential Science Indicators, 2011∼2021)
[그림 2-34] 한국의 연도별 바이오 분야 SCI 논문수 추이(2012~2021)
최근 5년간 우리나라에서 발표한 바이오 6개 분야 SCI 논문 50,046편 중 1회 이상 피인용된 논문은 4만 6,623편으로 논문의 피인용율은 93.2% 수준으로 나타났다. 대부분의 분야에서 세계 평균과 비슷하게 나타났다.
[표 2-69] 최근 5년 한국의 바이오 분야 SCI 논문 피인용율(2017∼2021)
|
구분 |
한국 바이오 분야 논문 |
세계대비 |
|||
|
논문수 |
피인용된 논문수 |
피인용율 (a) |
세계 피인용율(b) |
세계대비 (a/b) |
|
|
면역학 |
3,718 |
3,508 |
94.4% |
93.5% |
1.01 |
|
미생물학 |
5,097 |
4,687 |
92.0% |
93.9% |
0.98 |
|
분자생물학&유전학 |
8,434 |
7,781 |
92.3% |
93.8% |
0.98 |
|
생물학&생화학 |
15,466 |
14,560 |
94.1% |
92.1% |
1.02 |
|
신경과학&행동과학 |
8,096 |
7,442 |
91.9% |
92.7% |
0.99 |
|
약리학 |
9,235 |
8,647 |
93.6% |
91.4% |
1.02 |
|
생명공학 합계 |
50,046 |
46,623 |
93.2% |
92.7% |
1.01 |
출처: InCites DB, WoS(Web of Science), ESI(Essential Science Indicators, 2011∼2021), 저자 재구성
최근 5년간 우리나라 SCI 논문의 바이오 6개 분야 평균 피인용수는 14.61회로 세계 평균(15.24) 대비 96% 수준으로 나타났다. 10년 전(2007년∼2011년) 72% 수준과 비교했을 때 질적으로 성장하고 있는 것으로 나타났다. 10년 전과 5년 전에는 모든 분야에서 평균 피인용수가 세계 평균보다 낮은 수준이었으나, 생물학 및 생화학 분야와 약리학 분야의 최근 5년 평균 피인용수는 세계 평균보다 높아졌다.
[표 2-70] 최근 15년 한국의 바이오 분야 SCI 논문 평균 피인용수(2007∼2021)
|
분야명 |
2007∼2011 |
2012∼2016 |
2017∼2021 |
||||||
|
한국 평균(a) |
세계 평균(b) |
비율 (a/b) |
한국 평균(a) |
세계 평균(b) |
비율 (a/b) |
한국 평균(a) |
세계 평균(b) |
비율 (a/b) |
|
|
면역학 |
38.77 |
48.69 |
0.80 |
27.28 |
34.63 |
0.79 |
15.28 |
16.61 |
0.92 |
|
미생물학 |
25.95 |
41.11 |
0.63 |
19.12 |
30.35 |
0.63 |
12.03 |
14.81 |
0.81 |
|
분자생물학&유전학 |
45.11 |
66.75 |
0.68 |
38.12 |
43.63 |
0.87 |
16.83 |
19.49 |
0.86 |
|
생물학&생화학 |
35.59 |
46.19 |
0.77 |
27.93 |
33.05 |
0.85 |
15.87 |
14.91 |
1.06 |
|
신경과학&행동과학 |
34.83 |
49.44 |
0.70 |
26.66 |
34.01 |
0.78 |
13.77 |
14.09 |
0.98 |
|
약리학 |
30.88 |
34.26 |
0.90 |
23.17 |
24.88 |
0.93 |
12.40 |
12.07 |
1.03 |
|
생명공학 합계 |
35.08 |
48.46 |
0.72 |
27.73 |
33.87 |
0.82 |
14.61 |
15.24 |
0.96 |
주) InCites DB 특성상 과거 시점 5년 주기 평균 피인용율을 구할 수 없어 현재 시점 피인용율을 나타냄
출처: InCites DB, WoS(Web of Science), ESI(Essential Science Indicators, 2011∼2021), 저자 재구성
라. 바이오 분야 SCI 고피인용(상위 1%) 논문 현황
최근 11년간 우리나라의 바이오 6개 분야 피인용 상위 1% SCI 논문수는 813편으로 세계 17위 수준이며, 전체 논문 대비 피인용 상위 1% SCI 논문 비중은 0.80%로 세계 평균(1%)에 미치지 못하는 것으로 나타났다. 최근 5년간 분야별로는 생물학 및 생화학 분야가 전체 논문 대비 피인용 상위 1% SCI 논문 비중이 1.12%로 가장 높고 세계 평균(1%)을 상회하는 것으로 나타났다.
[표 2-71] 최근 11년간 바이오 분야 피인용 상위 1% 논문(2011∼2021)
|
구분 |
한국 바이오 분야 논문 |
1% 세계 논문수 |
|||
|
1% 논문수 |
전체 논문수 |
1% 논문 비중 |
1% 논문 세계 순위 |
||
|
면역학 |
56 |
7,337 |
0.76% |
23위 |
3,047 |
|
미생물학 |
58 |
10,158 |
0.57% |
18위 |
2,512 |
|
분자생물학&유전학 |
163 |
17,551 |
0.93% |
18위 |
5,484 |
|
생물학&생화학 |
285 |
31,352 |
0.91% |
16위 |
8,522 |
|
신경과학&행동과학 |
104 |
15,768 |
0.66% |
21위 |
5,924 |
|
약리학 |
147 |
19,167 |
0.77% |
14위 |
4,900 |
|
생명공학 합계 |
813 |
101,333 |
0.80% |
17위 |
30,389 |
출처: InCites DB, WoS(Web of Science), ESI(Essential Science Indicators, 2011∼2021), 저자 재구성
[표 2-72] 5년 주기별 한국의 전체 논문 대비 피인용 상위 1% 논문 비중(2011∼2021)
|
구분 |
2011∼2015 |
2012∼2016 |
2013∼2017 |
2014∼2018 |
2015∼2019 |
2016∼2020 |
2017∼2021 |
|
면역학 |
0.49% |
0.64% |
0.63% |
0.71% |
0.87% |
0.95% |
0.95% |
|
미생물학 |
0.38% |
0.46% |
0.63% |
0.76% |
0.79% |
0.76% |
0.66% |
|
분자생물학&유전학 |
0.94% |
1.02% |
0.90% |
0.89% |
0.81% |
0.89% |
0.94% |
|
생물학&생화학 |
0.65% |
0.66% |
0.74% |
0.88% |
1.03% |
1.13% |
1.12% |
|
신경과학&행동과학 |
0.46% |
0.40% |
0.51% |
0.64% |
0.73% |
0.73% |
0.88% |
|
약리학 |
0.50% |
0.58% |
0.59% |
0.66% |
0.80% |
0.89% |
0.99% |
출처: InCites DB, WoS(Web of Science), ESI(Essential Science Indicators, 2011∼2021)

출처: InCites DB, WoS(Web of Science), ESI(Essential Science Indicators, 2011∼2021), 저자 재구성
[그림 2-35] 5년 주기별 한국의 전체 논문 대비 피인용 상위 1% 논문 비중 추이
5. 산업 현황
산업통상자원부와 한국바이오협회가 국가표준 KS J 1009(바이오산업 분류체계)에 따라 국내 바이오기업 1,055개사를 대상으로 조사한 2021년 기준 국내 바이오산업 실태조사 결과(2022.12.), 국내 바이오산업 생산 규모가 25조 원대를 돌파한 것으로 나타났다.
가. 바이오기업 규모 및 매출 발생 현황
2021년 기준 국내 바이오기업은 총 1,055개사로 기업 전체 종사자 규모를 기준으로 보면, ‘1∼50명 미만’ 기업이 667개(63.5%)로 가장 많고, ‘1,000명 이상’의 기업은 33개(3.1%)인 것으로 나타났다.
매출 발생 현황을 살펴보면, 전체 1,055개 기업에서 미응답 기업 89개를 제외한 966개 기업 중 258개 기업(26.7%)이 2021년 현재 ‘매출 발생 이전’ 단계인 것으로 조사되었으며, 매출 발생이 있는 708개 기업 중 247개 기업(25.6%)은 ‘손익분기점 미만’인 것으로 조사되었다. 2021년 매출 발생이 있는 708개 기업 중 2021년 처음 매출이 발생한 기업은 28개(4.0%), 매출 발생이 10년 이상인 기업은 344개(48.6%)로 조사되었다.
|
기업 규모 |
매출 발생 현황 |
|
|
|
출처: 산업통상자원부・한국바이오협회, 2021년 기준 국내 바이오산업실태 조사, 2022
[그림 2-36] 2021년 기준 국내 바이오기업 규모 및 매출 발생 현황
나. 외부 협력 현황
전체 1,055개 기업 중 2021년 기준 타 기관과의 협력관계가 있었던 기업은 400개로 37.9%의 비율을 보였다. 400개 협력실적이 있는 업체는 주로 국내 기관과의 협력을 하고 있으며 국내가 993건(95.0%), 해외는 52건(5.0%)이 있었다.
분야별로는 바이오의약이 384건으로 전체 980건 중 36.7%를 차지했으며, 바이오서비스가 168건(16.1%), 바이오화학・에너지가 159건(15.2%)으로 이 3개 분야의 산업이 전체 협력 건수의 68.7%를 차지하고 있다. 바이오의약, 바이오서비스, 바이오화학・에너지산업 분야 모두 연구기관과의 협력 건수가 많은 특징을 보이고 있었다.
협력관계 형태는 공동연구 개발계약이 92.8%로 가장 많았으며, 다음으로 기술제휴-라이센싱(11.1%), 합작 투자(3.0%), 국내외 기술인력 교류(2.0%) 순으로 나타났다. 단계별로는 실험단계가 총 1,045건 중 351건으로 33.9%의 가장 큰 비중을 보였으며, 그다음으로 기초연구단계가 351건으로 33.6%를 차지했다. 전체 단계 중 마지막 단계인 사업화 단계는 54건으로 5.2%의 비율을 보여 사업 초기 단계에서 주로 타 기관과의 협력을 진행하는 것으로 나타났다.
분야별 및 단계별 협력 건수는 바이오의약산업, 바이오서비스산업, 바이오환경산업은 기초연구단계에서 협력 비중이 높은 반면, 바이오화학에너지산업과 바이오의료기기산업은 실험단계에서 협력 비중이 높았다.
[표 2-73] 바이오산업 분야별 협력 단계별 협력 건수(2021년 기준)
(단위: 건, %)
|
구 분 |
전체 기업 수 |
협력 관계 보유 업체 |
협력관계 단계 |
||||||
|
기초연구단계 |
실험 단계 |
시작품 단계 |
제품화 단계 |
사업화 단계 |
합계 |
||||
|
전 체 |
1,055 |
400 |
351 |
354 |
186 |
100 |
54 |
1,045 |
100.0 |
|
바이오의약산업 |
333 |
145 |
162 |
131 |
66 |
21 |
4 |
384 |
36.7 |
|
바이오화학・에너지산업 |
201 |
57 |
44 |
46 |
31 |
20 |
18 |
159 |
15.2 |
|
바이오식품산업 |
175 |
57 |
32 |
59 |
18 |
14 |
7 |
130 |
12.4 |
|
바이오환경산업 |
62 |
19 |
10 |
7 |
8 |
- |
3 |
28 |
2.7 |
|
바이오의료기기산업 |
109 |
45 |
30 |
36 |
19 |
14 |
8 |
107 |
10.2 |
|
바이오장비 및 기기산업 |
55 |
16 |
9 |
13 |
18 |
5 |
- |
45 |
4.3 |
|
바이오자원산업 |
15 |
6 |
3 |
18 |
- |
3 |
- |
24 |
2.3 |
|
바이오서비스산업 |
105 |
55 |
61 |
44 |
26 |
23 |
14 |
168 |
16.1 |
출처: 산업통상자원부・한국바이오협회, 2021년 기준 국내 바이오산업실태 조사, 2022
다. 바이오산업 수급 현황
2021년 국내 바이오산업의 생산 규모는 20조 9,983억 원으로 국내판매 9조 1,385억 원(43.5%), 수출 11조 8,598억 원(56.5%)으로 나타났다. 국내판매와 수입에 따른 내수시장 규모는 13조 9,077억 원으로 조사되었다.
바이오산업의 생산 규모에서 바이오의약산업이 5조 8,385억 원으로 전체 산업의 27.8%를 차지하였고, 바이오식품산업이 4조 1,937억 원으로 20.0%의 비중을 보였다. 내수시장에서 가장 큰 비중을 차지하고 있는 산업은 바이오의약산업으로 전체 시장의 46.0%인 6조 3,979억 원 규모로 조사되었다.
2019∼2021년 바이오산업의 수급변화 추이를 보면 생산과 내수규모는 지속적인 성장을 보이고 있었다. 2019년 이후 연평균 증감률은 수급 32.3%, 생산 28.8%, 내수 30.4%로 나타났다.
2021년의 생산 부문은 전년 대비하여 22.1%가 증가하였으며, 바이오서비스산업 성장률이 43.1%로 가장 높게 나타났다. 2021년의 내수 부문은 전년 대비하여 45.2% 증가하였으며, 바이오자원산업을 제외한 모든 산업 분야가 증가하였다.
[표 2-74] 바이오산업 생산 및 내수 변화 추이(2019∼2021)
(단위: 억 원, %)
|
구 분 |
생산 |
내수 |
||||||||
|
2019 |
2020 |
2021 |
전년 대비 증감률 |
연평균 증감률 |
2019 |
2020 |
2021 |
전년 대비 증감률 |
연평균 증감률 |
|
|
전 체 |
126,586 |
171,983 |
209,983 |
22.1 |
28.8 |
81,836 |
95,776 |
139,077 |
45.2 |
30.4 |
|
바이오의약산업 |
42,246 |
49,174 |
58,385 |
18.7 |
17.6 |
32,623 |
35,158 |
63,979 |
82.0 |
40.0 |
|
바이오화학・에너지산업 |
18,561 |
21,253 |
27,509 |
29.4 |
21.7 |
18,412 |
20,036 |
26,801 |
33.8 |
20.6 |
|
바이오식품산업 |
39,903 |
40,925 |
41,937 |
2.5 |
2.5 |
16,385 |
17,824 |
19,463 |
9.2 |
9.0 |
|
바이오환경산업 |
557 |
663 |
691 |
4.2 |
11.4 |
552 |
664 |
692 |
4.2 |
12.0 |
|
바이오의료기기산업 |
10,438 |
38,976 |
52,793 |
35.5 |
124.9 |
3,638 |
9,074 |
11,164 |
23.0 |
75.2 |
|
바이오장비및기기산업 |
1,105 |
1,721 |
1,910 |
11.0 |
31.5 |
2,455 |
3,334 |
3,685 |
10.5 |
22.5 |
|
바이오자원산업 |
1,257 |
1,211 |
922 |
△23.9 |
△14.4 |
1,308 |
1,292 |
1,002 |
△22.4 |
△12.5 |
|
바이오서비스산업 |
12,519 |
18,058 |
25,838 |
43.1 |
43.7 |
6,464 |
8,395 |
12,291 |
46.4 |
37.9 |
출처: 산업통상자원부・한국바이오협회, 2021년 기준 국내 바이오산업실태 조사, 2022
라. 바이오산업 국내판매 현황
2021년 바이오산업의 국내판매 규모는 9조 1,385억 원으로 바이오화학・에너지산업이 2조 3,906억 원(26.2%)으로 국내판매 부분에서 가장 큰 비중을 차지하고 있었다. 다음으로는 바이오의약산업이 2조 3,320억 원(25.5%), 바이오식품산업 1조 8,408억 원(20.1%)으로 이들 세 개 분야는 전체 국내 판매액의 71.8%를 차지하는 것으로 나타났다.
국내판매 추이를 보면, 2021년은 전년 대비 1조 9,913억 원(27.9%)이 증가하였다. 분야별로는 바이오서비스산업이 전년 대비 46.5% 성장하였으며, 바이오의약산업이 39.6%, 바이오화학・에너지산업이 32.7%, 바이오의료기기산업이 23.0%, 바이오장비 및 기기산업이 12.7%, 바이오식품산업이 9.7%, 바이오환경산업이 4.2%로 성장해 성장세가 두드러졌다. 반면, 바이오자원산업은 전년 대비 26.0% 감소한 것으로 나타났다.
2021년 기준 주요 바이오 제품 및 서비스의 국내판매 현황을 보면, 바이오연료의 국내판매 규모가 1조 6,611억 원으로 전체 바이오 제품 및 서비스 판매액 중 18.2%의 비중을 차지하였다. 다음으로는 사료첨가제(10.9%), 체외진단(9.8%), 백신(7.8%), 바이오위탁생산・대행서비스(7.3%) 순으로 나타났다.
[표 2-75] 바이오산업 분야별 국내판매 변화 추이(2019∼2021)
(단위: 억 원, %)
|
구 분 |
2019 |
2020 |
2021 |
전년 대비 증감 |
연평균 증감률 |
||||
|
국내 판매 |
비중 |
국내 판매 |
비중 |
국내 판매 |
비중 |
국내 판매 |
증감률 |
||
|
전 체 |
61,172 |
100.0 |
71,471 |
100.0 |
91,385 |
100.0 |
19,914 |
27.9 |
22.2 |
|
바이오의약산업 |
16,180 |
26.5 |
16,703 |
23.4 |
23,320 |
25.5 |
6,617 |
39.6 |
20.1 |
|
바이오화학・에너지산업 |
17,356 |
28.4 |
18,013 |
25.2 |
23,906 |
26.2 |
5,893 |
32.7 |
17.4 |
|
바이오식품산업 |
15,818 |
25.9 |
16,782 |
23.5 |
18,408 |
20.1 |
1,626 |
9.7 |
7.9 |
|
바이오환경산업 |
551 |
0.9 |
662 |
0.9 |
690 |
0.8 |
28 |
4.2 |
11.9 |
|
바이오의료기기산업 |
3,095 |
5.1 |
8,603 |
12.0 |
10,583 |
11.6 |
1,980 |
23.0 |
84.9 |
|
바이오장비 및 기기산업 |
701 |
1.1 |
1,245 |
1.7 |
1,403 |
1.5 |
158 |
12.7 |
41.5 |
|
바이오자원산업 |
1,041 |
1.7 |
1,093 |
1.5 |
809 |
0.9 |
△284 |
△26.0 |
△11.8 |
|
바이오서비스산업 |
6,430 |
10.5 |
8,371 |
11.7 |
12,265 |
13.4 |
3,894 |
46.5 |
38.1 |
출처: 산업통상자원부・한국바이오협회, 2021년 기준 국내 바이오산업실태 조사, 2022
마. 바이오산업 수출입 현황
2021년 기준 바이오산업의 수출 규모는 11조 8,598억 원으로 조사되었다. 분야별 보면, 바이오의료기기산업이 4조 2,209억 원(35.6%)으로 가장 컸으며, 다음으로 바이오의약산업이 3조 5,065억 원으로 29.6%를 차지하였다.
수출 제품별로 보면 체외진단이 3조 9,942억 원 수출되어 전체 수출액의 33.7%를 차지하였으며, 다음으로 치료용항체 및 사이토카인제제(20.1%), 사료첨가제(15.0%), 바이오위탁생산・대행서비스(10.5%), 식품첨가물(4.3%) 순이었다. 수출 상위 5개 제품 중 2개는 바이오식품산업 제품이었으며, 바이오의약품, 바이오의료기기, 바이오서비스가 각각 1개로, 이들 5개 제품이 전체 수출액의 83.6%를 차지하였다.
2021년 기준 바이오산업의 수입규모는 4조 7,692억 원으로 조사되었다. 분야별로 보면 바이오의약산업이 4조 659억 원으로 전체 수입액의 대부분(85.3%)을 차지하였다.
수입 제품별로 보면 유전자의약품이 2조 1,590억 원 수입되어 전체 수입의 45.3%를 차지하였으며, 다음으로 치료용항체 및 사이토카인제제는 9,274억 원(19.4%), 백신 3,256억 원(6.8%), 호르몬제 3,208억 원(6.7%), 바이오연료 1,968억 원(4.1%) 순이었다. 수입 상위 5개 제품 중 4개가 바이오의약산업 제품이었으며, 바이오화학에너지산업 제품이 1개로, 이들 5개 제품이 전체 수입액의 82.6%를 차지하고 있었다.
[표 2-76] 주요 바이오제품 수출입 현황(2021년 기준)
(단위: 억 원, %)
|
주요 수출 제품 |
주요 수입 제품 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
출처: 산업통상자원부・한국바이오협회, 2021년 기준 국내 바이오산업실태 조사, 2022
바. 바이오기업 기술특례상장 현황
코스닥시장에서는 2005년부터 기술성과 성장성을 보유한 벤처기업의 상장예비심사 시 일반기업과 차별화된 예비심사 요건을 적용하는 기술성장기업 상장 예비심사 특례를 시행하고 있다. 즉, 현재 영업실적은 미미하지만 기술력과 성장성을 갖춘 기업들이 전문 평가기관의 기술평가 또는 상장 주선인 추천을 통해 상장이 가능한 제도이다. 동 제도를 통해 2021년 기술특례상장기업 143개 사를 기록하였으며 이 중 93개 사가 바이오기업이다.
[표 2-77] 유형별 기술특례 신규 상장기업 현황(2005~2022)
(단위: 개)
|
구 분 |
2005∼2015 |
2016 |
2017 |
2018 |
2019 |
2020 |
2021 |
2022 |
합계 |
|
|
|
바이오 |
24 |
9 |
5 |
15 |
14 |
17 |
9 |
8 |
101 |
|
|
신약개발 |
13 |
7 |
2 |
8 |
6 |
6 |
6 |
4 |
52 |
|
|
체외진단 |
5 |
1 |
3 |
1 |
4 |
8 |
2 |
1 |
25 |
|
|
의료기기 |
4 |
- |
- |
3 |
2 |
1 |
- |
1 |
10 |
|
|
기타 |
2 |
1 |
- |
3 |
2 |
2 |
1 |
2 |
13 |
|
非바이오 |
3 |
1 |
2 |
6 |
8 |
8 |
22 |
20 |
70 |
|
|
합계 |
27 |
10 |
7 |
21 |
22 |
25 |
31 |
28 |
171 |
|
주) 기타: 건강기능식품 판매, 유해동물 퇴치제 개발기업 등
출처: 한국거래소 코스닥 신규상장 기업 현황


|
|
|
|
|
주요 내용 요약 |
|
제3장 분야별 연구개발 및 관련 산업 현황 |
|
|
|
구분 |
유전체 |
단백질체 |
|
개 요 |
유전체 연구는 유전체 해독, 정보 분석 및 이를 활용하는 실용화 등을 포함 |
단백질체학(proteomics)은 세포, 조직, 체액 등에 존재하는 총체적 단백질체에 대한 정성 및 정량 분석을 기반으로 하는 연구로서 기초연구와 진단 바이오마커 개발 및 신약 표적 개발 분야의 핵심기술임 |
|
해외 동향 |
유전체 분석 기술의 발달로 100달러에 인간 게놈을 해독할 수 있는 시대가 되었고, 다양한 유전체 분석 기술들이 개발되어 기업 간의 경쟁이 치열해짐 |
단백질 분리분획, 질량분석, 정량기법, 번역 후 변화 분석, 동적 변화 분석기술 개발과 더불어 바이오마커 연구가 활발하게 진행되고 있으며 북미시장 위주로 바이오, 의료산업으로 빠르게 확산 추세이다. 또한 단일 세포 단백체 분석과 함께 nanopore 기반의 단일 분자 단백질 시쿼싱(Single molecule protein sequencing, SMPS) 기술이 개발되고 있음 |
|
국내 현황 |
국가 통합 바이오 빅데이터 사업을 통해 100만 명 규모의 유전체 빅데이터와 임상 정보를 확보하는 계획을 수립하고 준비하고 있음 |
국가 주도의 연구 지원을 통해 다중 오믹스 기반의 정밀의료기술개발 사업 및 암유전단백체 연구개발 사업 등이 진행 중이며 국내 단백체 관련 회사들의 성장이 진행 중임 |
|
발전 과제 |
유전체 빅데이터는 의학, 농학, 환경 등 다양한 분야에서 새로운 산업을 창출하며 혁신을 이루고 있음 |
중개연구와 더불어 진단, 신약 개발과 원격 헬스케어 등 산업화에 적용될 수 있으며 이를 위해 정부, 의료기관, 산업계의 지속적인 지원과 규제 완화가 필요함 |
|
|
|
|
|
|
|
|
|
|
|
세포체 |
대사체 |
|
재생의료기술은 기존의 치료제나 의료기술의 치료 한계성을 근본적으로 극복하기 위한 혁신형 신의료기술임 |
대사체학(metabolomics)은 유전체학(genomics), 전사체학(transcriptomics), 단백체학(proteomics)과 같은 오믹스 분야 중 하나로 다양한 종류의 생체 시료로부터 생체 내 1,500Da 이하의 저분자량을 가진 대사체군(metabolome)에 대한 정보를 총체적으로 분석하는 연구 분야임 |
|
선진국은 재생의료의 특성을 고려하여 기존 합성의약품과 다른 새로운 영역으로 분류하고 관련 법률을 제정 운영하고 있음 |
대사체 분석기술은 임상 대사체학, 약물 대사체학, 지질체학, 미생물 대사체학, 식물/식품 대사체학 등의 분야에 적용되어 질환의 발병원인 규명, 치료제 개발, 식물/식품의 효능물질 발굴, 품질평가 등을 위한 연구에 활발히 활용되고 있음 |
|
정부는 혁신성장 도약을 위한 유망분야 중 하나로서 제약・바이오를 지정하고, 첨단의료(재생의료 포함) 바이오 디지털 분야를 중점 지원하고 있음 |
국내의 대사체학 연구는 한국기초과학지원연구원, 한국과학기술연구원, 서울대학교, 건국대학교, 중앙대학교 등 다양한 기관이 질환의 기전연구, 치료타깃 발굴, 식품/식물 대사기전 연구 등 활발히 수행하고 있음 |
|
재생의료기술의 디지털화와 융・복합화를 위해 오픈 이노베이션(개방형 혁신)을 해야 하고 활발하게 협력해야함 |
최근 대사체학에서 관심받고 있는 유망 기술로 대사흐름(metabolif flux) 분석기술, 4D 지질체학(lipidomics), 공간 대사체학(spatial metabolomics) 기술이 개발되어 활용되고 있음 |
|
구분 |
시스템생물 |
구조생물 |
|
개 요 |
빅데이터 및 인공지능 기반의 시스템생물학 접근법은 생명현상을 이해하는데 필수 불가결한 접근법으로 성장 |
구조생물학은 생체 분자기계의 삼차구조 및 그 작용기작을 밝혀내려는 학문 기존 실험적 방법에 더하여 AI 기반 단백질 삼차구조 모델링이 급부상 |
|
해외 동향 |
다양한 NGS 기술들의 발전으로부터 생산된 빅데이터들이 인공지능 및 합성생물학과 접목되고 있음 |
극저온 전자현미경(cryo-EM)에 의한 삼차구조 분석의 급격한 발전이 두드러짐 AI 기반 단백질 삼차구조 모델링과 신규 단백질 디자인 기술이 급발전
|
|
국내 현황 |
인공지능 및 합성생물학 기반 연구들이 점차 국내에서도 활발하게 연구가 진행되기 시작함 |
실험적 방법 기반 구조생물학 분야에서 세계적인 수준의 경쟁력 유지 AI 기반 모델링/디자인 기술 분야에 대한 본격적인 진입 시작 |
|
발전 과제 |
빅데이터, 인공지능 등의 시스템생물학과 활용기술인 합성생물학 및 바이오파운드리 기술의 접목으로 생명공학 기술의 비약적 발전이 예상됨 |
실험적 기술 기반에 AI 기술이 더해지면서 폭발적인 발전 중 향후 생물학 전 분야에 구조생물학적 분석이 필수로 자리 잡을 것으로 전망 |
|
뇌과학 |
노화과학 |
|
뇌연구는 뇌에 대한 신경생물학적 인지과학적 이해를 바탕으로 뇌 작동의 근본원리를 파악하여 뇌질환 극복 및 공학적 응용에 활용하는 연구임 뇌연구는 다층적이며 융합적이고 파급력과 무한 활용 가능성이 있어 기술 패권 경쟁이 심화하고 있는 글로벌 시장에서의 선점이 필요한 시점임 |
한국을 포함한 선진국에서는 초고령 사회 대응을 위한 노화 과학의 역할을 정책적으로 강조하고 있으며, 노화 과학에 근거를 둔 노화 진단 및 치료 기술을 개발하고자 하는 기업들이 새롭게 탄생함 |
|
바이오 분야 글로벌 기술 패권의 경쟁이 심화하면서, 미국, 유럽 등 주요국들은 대형 뇌연구 프로젝트를 통해 정부 주도로 장기적인 투자를 하고 있음 세계 각국의 프로젝트가 중반에 접어들면서, 지원 전략을 강화하고, 글로벌 협력 및 타 분야 융합을 통한 혁신적 뇌연구 기술개발을 추진하고 있음 |
DNA 메틸화 시계와 다양한 임상 지표의 통합으로 생물학적 나이 측정 기술의 고도화가 이뤄지고 있으며, 노인성 질환 대상 노화 치료제의 임상 시험에서 나아가 노화를 되돌리겠다는 역노화 전략도 등장함 |
|
한국 뇌연구는 뇌연구촉진 기본계획을 수립하여 추진하고 있으며, 기본계획에서는 뇌과학 분야를 육성・발전시키기 위한 국가 차원의 비전과 정책 방향을 제시하고 있음 현재 4차 뇌연구촉진 기본계획이 진행 중임 |
초고령 사회 대응을 위한 노화 과학의 역할이 어느 때보다 강조되고 있지만, 여전히 국내 노화 산업 생태계는 개인 기초연구와 건강보조제 등에 머물고 있음 |
|
우리나라는 뇌연구의 혁신과 융합을 통해 핵심 원천 전략기술 개발과 기술의 실용화, 상용화로 기술 패권 경쟁이 심화하고 있는 글로벌 시장에서 뇌연구・산업의 선도국가로 나아가야 함 미래 블루오션인 뇌연구 및 뇌산업을 강력한 국가 산업 동력으로 확고하게 자리매김하기 위해서 정부와 산학연병의 협력이 절실히 필요함 |
노화 치료제 임상시험 실패를 최소화하기 위한 노화 과학 근거의 노화 치료제 평가 플랫폼 개발이 필요하며, 노화 과학의 성과와 기업을 연결하여 노화 치료제 신시장을 이끌 수 있는 컨트롤타워가 필요함 |
|
구분 |
화합물신약 |
바이오의약 |
|
개 요 |
화합물 신약은 새로운 약물로서의 독창성과 기술 진보 측면에서의 우월성을 지녀야 하며, 비임상시험, 임상시험, 시판 후 조사의 개발 과정을 거침 |
바이오의약품 분야에서 최근 주목받는 특징은 신속한 개발과 다양한 치료제로 사용될 수 있는 mRNA 기반의 의약품 플랫폼, 융합항체의약품, 면역치료제, 환자 맞춤형 치료제 개발임 |
|
해외 동향 |
2022년 미국 FDA 승인 신약을 모달리티(modality) 별로 살펴보면 화합물의약품인 저분자신약(small molecules)이 21건 (57%)로서 가장 큰 비중을 차지하고 있음 |
바이오의약품의 FDA 승인과 개발 동향을 보면, 항체, 이중항체, ADC와 같은 항체 기반의 의약품이 주류를 이루고 있으며, 기존의 세포치료제에서 유전자 및 세포유전자치료제 개발이 증가하고 있음 |
|
국내 현황 |
2019년부터 대한민국 정부의 3대 중점산업으로서 바이오메디컬(신약: 화합물 신약, 바이오신약)-디지털헬스(신의료기기)의 두 제품군을 묶어서 바이오헬스 신산업으로 선정하여 미래 주력산업으로 육성하고 있음 |
식약처 승인과 KDDF의 파이프라인 개발 지원 현황을 보면, 항체, 재조합단백질의약품 개발이 주류를 이루고, 백신 분야에서는 2021년 핵산 기반에서 2022년 단백질 기반으로 이동하였다는 특징을 보임 |
|
발전 과제 |
바이오경제와 Life Care, 기술 융복합의 시대를 맞아서 글로벌 성장 모델 구축을 통해서 화합물의약품은 가장 큰 세계시장 점유율과 지속적인 성장세를 이어 나갈 것임 |
바이오의약품은 항체, 융합항체, 면역조절 기반의 항암제 개발이 성장을 지속하고, 신경, 대사, 면역질환 등으로 치료 영역이 확대될 전망임 또한 인공지능 기술은 개인 생체 정보 분석을 기반으로 한 환자 맞춤형 정밀 의료뿐만 아니라 신약개발 전반에 걸쳐 활용될 것으로 보임 |
|
바이오장기 |
진단 및 의료기기 |
|
장기이식 수요의 폭발적 증가로 바이오장기 시장이 급속도로 성장하고 있음. 바이오장기 중에서도 유전자편집기술의 발전으로 이종장기가 가장 빠른 시간 내에 현실화될 것으로 예상됨 |
의료기기는 개발과 허가 이후 의료현장 사용을 위해 안전성・유효성 평가와 의료현장 실증이 요구되나 기업의 전문 인력 부족으로 국가 차원의 지원이 필요한 분야 |
|
최근 CISPR/Cas9 등 유전자편집기술의 발전으로 형질전환 돼지 생산기간이 획기적으로 단축되었음 또한 이종장기 영장류 전임상 시험에서 우수한 성과들이 발표되고, 형질전환돼지를 이용한 심장이식 임상시험이 미국 FDA 긴급승인으로 시행되었으며 면역학적 거부반응 없이 60일 생존함 |
미국, 유럽 등 선진국들은 융・복합 혁신의료기기 상용화 지원, 신속승인제도 마련 등 정부 차원의 중점 지원정책을 추진 |
|
국내 연구진은 영장류 전임상시험에서 임상시험 진입조건을 충족하는 결과를 발표하는 등 이종장기이식에서 세계적 선도그룹으로 인정받고 있으며 2022년 12월 식약처로부터 이종췌도이식 의뢰자 주도 임상시험계획 승인 획득하여 2023년 임상시험 실시 예정 |
정부는 2023∼2027년까지 의료기기산업 육성・지원 혁신전략 실현을 위한 의료기기산업 육성・지원 종합계획 발표하고, 전략적 R&D 투자 확대, 국내외 임상 실증을 통한 국산 의료기기 사용 활성화, 지역별 맞춤형 지원을 통한 시장진출 확대, 혁신기술 시장진입 규제 합리화 및 생태계 조성 추진 |
|
국내 바이오 이종장기 이식 분야 연구는 꾸준한 투자와 연구로 경쟁력을 갖추었으며 그간의 성과와 기반 시설의 지속적 유지・발전, 바이오장기 생산 규제와 가이드라인 제정 등을 통해 국내 이종장기기술의 산업화 가능성을 기대 |
혁신・첨단 의료기기/기술의 안전성・유효성, 경제성 등 입증에 대한 정부 차원의 인프라 제공 및 규제 합리화 등 관련 규정 개정과 의료혁신을 위한 전략의 방향성 제시와 개방형 플랫폼 제공 필요 |
|
구분 |
감염병 |
농림 |
|
개 요 |
코로나19 이후에도 새로운 신종 감염병의 위협은 계속되고 있음 |
농림 분야는 기후변화 대응과 탄소중립, 디지털 농업으로의 전환, 그린바이오산업 육성 등을 위한 전략을 수립하고 추진 중임 |
|
해외 동향 |
감염병 대응을 위한 예측과 국제 협력을 지원할 수 있는 사업이 강화됨 |
해외 주요국은 친환경 농림업을 통한 탄소중립 실현, 지속가능한 농업을 위한 디지털 농업 정책과 전략을 수립하여 실행중 |
|
국내 현황 |
진단, 백신, 치료제의 플랫폼 기술개발 및 임상시험을 지원할 수 있는 사업과 글로벌 네트워크 구축사업이 강화됨 |
농림 분야 탄소농업, 디지털 농업으로의 전환, 농생명소재의 산업화를 위한 ‘그린바이오산업 육성전략’을 발표하는 등 적극적인 정책과 기술개발 전략을 수립하고 실행 중임 |
|
발전 과제 |
신종 감염병에 대응하기 위해서는 빠른 진단법의 확립 및 백신, 치료제 개발과 같은 약물적 접근도 중요하지만, 사전 예찰을 통한 감시체계 구축과 더불어, 보건위생 강화와 사회적 거리두기와 같은 비약물적 대응이 함께 이루어져야 함 |
심각한 기후변화 대응, 탄소저감, 데이터 기반의 디지털 농업 실행, 그린바이오산업 육성을 위하여 농림 분야 R&D 투자의 확대 및 중장기적 지원이 필요함 |
|
축산 |
식품 |
|
최근 유전자 편집 기술을 활용한 유전자변형 가축 개발의 진행과 함께 식용 및 의료용 활용 가능성이 확대되고 있음 |
코로나19 팬데믹, 기후변화 및 생명공학기술의 발달에 따른 주력 식품산업과 식품연구개발 기술에 대해 소개 |
|
유전자변형 가축 개발에 유전자 편집 기술의 활용 빈도가 높아지고 있으며, 동물 복지와 주요 전염병에 대한 대응 분야가 부각되고 있음 |
식품연구 주요 개발기술로서, ① 기능성 식품소재 개발 및 맞춤형 식품연구 ② 기후 위기 시대 지속가능한 식품기술 개발에 관한 해외 연구 동향을 기술 |
|
가축의 번식기술 증진과 경제형질 마커 개발 연구와 더불어, 질병 저항성 제고, 이종이식용, 질환모델 및 가축 유래 소재 개발 연구 활발 |
생명공학과 푸드테크의 기술 발전에 따른 ① 마이크로바이옴 식품소재 기술, ② 맞춤형 건강기능식품 제안과 식단연구, ③ 메디푸드・고령친화식품, ④ 대체식품 분야에 대한 주요 핵심기술의 국내 연구현황, 연구개발 지원 동향과 산업 현황을 기술 |
|
가축 질병 저항성, 이종이식용 원료 동물 생산, 동물복지와 기후변화, 식품안전성 등 현안에 대응한 연구 지속 추진 전망 |
핵심 원천 기술 및 산업화 연계를 위한 기반기술 연구에 대한 정부 주도의 집중 투자가 필요하며 규제 완화 정책이 필요함 |
|
구분 |
환경 |
해양 |
|
개 요 |
환경생명공학은 미생물 군집이 보유한 다양한 기능을 이용해 오염물질 분해, 재생에너지 생산, 유용물질 생산, 병원성 미생물의 확산방지와 같은 공공 서비스를 제공하는 학문 분야임 |
해양생명공학 분야는 각국에서 주요한 신산업 분야로 인식되어 정부 차원의 연구개발 투자가 진행되고 있음 |
|
해외 동향 |
자연자원의 고갈 및 온실가스 배출 증가로 인한 기후변화는 환경생명공학의 연구개발 및 관련 산업을 지속가능성을 높이는 방향으로 유도하고 있음 |
미국에서는 선도적인 연구기관이나 기업을 중심으로, 유럽은 유럽연합 차원의 협력을 통한 인프라 구축을 통하여 연구개발 혁신과 관련 산업 성장을 견인 중임 |
|
국내 현황 |
산업적 중요성이 큰 오염물질 분해에 관한 분야는 세계적인 수준에 도달하였지만, 아직까지 여러 환경생명공학 기술은 선진국을 추격하는 수준에 머물러 있음 |
정부 투자의 생명자원 관리와 원천기술 개발을 통하여 산업 혁신을 도모하고 있음 |
|
발전 과제 |
미생물 군집 형성을 과학적으로 이해할 수 있는 생태학적 접근과 군집구조와 대사를 분석할 수 있는 분자미생물학의 발전으로 조만간 특정 미생물군의 유지와 농화를 위한 마이크로바이옴 엔지니어링이 현실화될 것으로 전망함 |
체계적인 정부 투자를 통한 산업 성장으로 글로벌 해양생명공학 산업의 성장 추이에 부응할 것으로 기대됨 |
|
생물공정(산업바이오) |
BT + ICT |
|
전 세계적인 탈탄소 정책 추진에 따라 저탄소 친환경 산업 확대를 위해 산업바이오 분야 집중 육성 |
노인 인구 증가로 의료비용 증대, 주기적인 감염병 팬데믹 발생 및 인공지능, 바이오 기술 발전과 융합이 활성화되면서 혁신적인 의료/헬스케어 서비스 창출을 촉진시키고 있음. 이에 정밀의료와 디지털 치료제를 중심으로 국내외 정책동향, 기업 동향 및 시장 전망을 살펴보고 BT+IT 기술 융합산업의 새로운 성장 도약을 위한 발전 방향을 제시 |
|
주요국은 자국의 바이오제조 경쟁력 확보를 위한 정책 및 연구개발을 우선 지원하며, 다국적 기업은 바이오 기반 제품군을 확대 |
미국을 비롯한 해외 주요국들은 BT+IT 기술간 융합이 가속됨에 따라 이러한 융합기술을 활용한 다양한 기술개발 및 제품/서비스를 제공하고 있으며, 각 국의 상황에 맞는 적극적인 정책지원을 하고 있음 |
|
2050 탄소중립 추진전략 및 바이오 제조・디지털 혁신 전략 등 바이오제조 경쟁력 고도화를 위한 산업바이오 육성 전략을 발표하고 기업은 바이오플라스틱을 중심으로 상용화 시작 |
우리나라도 높은 성장이 전망되는 정밀의료와 디지털 치료제 산업 기반 활성화를 위해 정부주도로 정책을 개발/지원하고 있으며, 기업들 또한 다양한 제품/서비스를 개발한 결과 2023년 디지털 치료제를 정식으로 승인 받은 기업을 배출하는 등 본격적인 시장 진출을 시작하고 있음 |
|
산업바이오 육성을 위해 마련된 정책이 실제 지원으로 연계되어야 하며, 바이오플라스틱산업 육성을 위해 인증제도 등 관련 제도의 현실화가 필요 |
BT와 IT 융합 서비스/산업의 성장을 견인할 전략적 방향을 제언하면, 우선 데이터 보유기업과 기술보유 기업간 전략적 동반적 관계 강화, 둘째, 개발된 기술의 상용화를 촉진할 제도적 기반 마련 셋째, 정밀의료 및 디지털 치료제 분야 국내 스타트업의 지속적 성장을 위한 핵심 애로사항 파악과 지원정책 마련, 마지막으로 혁신적인 비즈니스 모델 개발 등이 요구됨 |
|
구분 |
BT + NT |
바이오 소재 클러스터 |
|
개 요 |
신기술의 등장과 예방 중심으로의 의료 트렌드 변화 속에 BT・NT 융합 바이오헬스 산업 분야에서는 바이오의약품과 체외진단기기가 많은 주목받고 있음 |
바이오 연구 및 산업 혁신을 뒷받침할 바이오 소재를 소재의 종류, 보존・유통 방식, 관련 규제 등을 기준으로 14대 분야의 소재 클러스터로 재편하고, 수요자 의견을 반영하는 등 분야 특성에 맞게 수립된 발전 전략을 지속적으로 이행하고 있음 |
|
해외 동향 |
바이오의약품 분야의 경우 각국 정부의 적극적인 지원 아래 기업・대학・연구기관 간의 협력을 통해 mRNA 백신 전달 플랫폼과 같은 괄목할 만한 발전을 이루었으며, 체외진단 기기의 경우 체외진단 산업을 체계적으로 발전시키기 위해 규제 완화 및 안전성 확보를 위한 정책을 시행하고 있음 |
주요국들은 자국의 이익에 우선하여, 바이오 소재를 확보・활용하고 있으며, 이로 인해 바이오 소재의 자국 우선주의 기조가 확대되고 있음 |
|
국내 현황 |
바이오의약품 시장 전체는 2020년 대비 2021년 112.3%의 성장률로 최근 5년 중 가장 높은 성장세를 보였으며, 국내 체외진단기기 기업은 2019년 기준 506개 기업으로 5년간 약 100개 기업이 증가, 2020년 수출액은 약 21억 7,000만 달러(약 2조 6,200억 원)로 2018년 약 4.2억 달러(약 9,400억 원)에 대해 연평균 126.5%의 성장률을 달성 |
2020년 ‘제3차 국가생명연구자원 관리・활용 기본계획’이 수립되었으며, 매년 연차별 시행계획을 수립하여 전년도 성과와 차년도 계획을 점검・이행 중임 2022년 말 기준으로 226개 소재자원은행이 운영되고 있으며, 1,943만 5,441점의 소재가 보존・관리되고, 2022년에는 178만 1,026점이 분양됨 특히 2022년에는 2,000만 원 이상 규모의 기술이전이 15건(전년도 3건)이 있었음 |
|
발전 과제 |
바이오의약품 및 체외진단기기가 국가 핵심 고부가가치 산업으로 자리잡는 데에는 중장기 R&D 확대 지원, 전주기 R&D 거버넌스 정립, 수요 중심의 R&D 전문인력을 양성, 오픈 이노베이션을 확대, 혁신 제품의 시장 진입 및 안착을 위한 정책적 지원이 필요 |
기존에는 공급자가 확보한 바이오 소재를 일방적으로 제공하는 측면에서 진행되어 왔으나 향후에는 수요자가 원하는 맞춤형 바이오 소재를 확보・제공하고, 소재를 분석한 효능과 같은 부가 정보들을 제공하여 연구자나 산업계가 요청하던 바이오 소재+관련 정보가 제공될 수 있도록 발전할 계획임 |
|
바이오 데이터 |
생명공학 인프라(장비 시설) |
|
바이오 데이터는 바이오경제의 핵심 자원으로서 바이오헬스, 신약개발 등의 다양한 분야에 활용됨에 따라 중요도는 시간이 갈수록 증가하고 있음 |
우리나라는 정부지원을 토대로 기초-응용-개발-생산 연구 지원을 위해 단계별 지원 인프라를 구축・운영 중 |
|
선진국 중심으로 국가 차원의 초대형 바이오 프로젝트 수행에 따라 데이터 생산량이 급증하고 이를 활용한 다양한 활용 연구가 진행 중임 |
|
|
부처・사업・연구자별 흩어져 있는 바이오 데이터를 통합 수집・제공하는 ‘국가 바이오 데이터 스테이션’이 2022년 본격 운영에 따라 체계적 공유체계 구축 |
의약/산업/융합바이오 제품의 산업화 지원을 위한 인프라로는 국공립연구소와 더불어 29개 산업화지원센터, 백신글로벌기반구축사업단, 24개 비임상 GLP 및 208개 임상 GLP가 대표적이며, 바이오빅데이터를 위한 인프라로는 PHR(개인건강정보) 기반 개인맞춤형 건강관리시스템 구축, CDM(질병정보 활용 공통 데이터모델)기반 정밀의료 데이터 통합플랫폼 구축, AI 기반 의료기기 영상분석 솔루션 구축 등이 있음 |
|
데이터 스테이션을 중심으로 범부처적 바이오 데이터의 수집ㆍ공유ㆍ활용을 총괄할 체계를 구축하여 국내 바이오 데이터 활용 생태계를 조성 필요 |
글로벌 바이오헬스 시장이 재편되는 중요한 시기로 산업 정책의 근본적 혁신과 선제적 투자를 통해 우리나라와 같은 후발국이 선도주자로 급부상할 수 있는 좋은 기회로 바이오헬스 산업 수출 활성화를 위해 생명공학 인프라의 지원 역할 강화 또한 요구됨 |
|
|
|
제3장 분야별 연구개발 및 산업현황 |
|
제1절 기초생명과학 |
1. 유전체
가. 유전체 연구의 개요
유전체 연구는 생명체를 구성하고 있는 유전정보인 유전체 및 관련 정보를 분석하여 생명체를 이해하고 질병을 포함한 다양한 문제 해결에 그 정보를 활용하는 분야이다.
유전체 연구의 핵심기술은 ① 차세대염기서열분석(Next Generation Sequencing, NGS) 장비를 이용한 유전체 해독 기술, ② 유전체 빅데이터 분석 소프트웨어 및 알고리즘 개발 기술, 이를 활용한 정보 분석 및 데이터 관리 기술, ③ 유전체 정보 기반 정밀의료 개발 기술, ④ 유전체 정보 기반 유용 동식물 혹은 해양생물 유래 자원 확보와 같은 유전체 실용화 기술 등이 있다.
유전체 해독・분석 비용이 급격하게 감소하면서 인간, 동식물, 미생물 등 다양한 생물체에서 생산되는 유전체 빅데이터는 데이터마이닝, 인공지능 등 최신 IT 기술과 융합되어 개인 맞춤형 정밀의료 구현부터 새로운 생물 소재 개발 및 환경 문제 해결에 이르기까지 다양한 분야에서 인류의 문제를 해결하고 새로운 산업과 시장을 창출하는 역할을 하고 있다.
나. 해외 동향
(1) 기술 및 연구 동향
유전체 분석 기술이 발달하고 분석 비용이 급격하게 감소하면서 전 세계적으로 대규모 국가 유전체 프로젝트가 활발하게 진행되고 있다. 특히 최근에는 50만 명에서 100만 명에 이르는 대규모 국가 유전체 프로젝트가 여러 국가에서 활발하게 진행되고 있다. 이 중 영국의 UK Biobank 코호트는 전 세계 연구자가 가장 활발하게 활용하고 있는 데이터들을 제공하면서 유전체와 결합된 코호트 연구의 중요성과 효용성을 입증하고 있다.
[표 3-1] 국가별 주요 유전체 연구 현황
|
국가 |
프로젝트/기관 |
수집 기간 |
수집 규모 |
사업 목적 |
|
미국 |
All of US/ NIH |
2017∼2026 |
100만 명 |
대규모 코호트 및 데이터 플랫폼 구축을 통한 개인 맞춤 의료서비스 구현 |
|
Million Veteran Program |
2011∼계속 |
100만 명 |
재향 군인과 일반인으로 구성된 사업으로 유전-환경-질병 요인 분석 |
|
|
영국 |
Genomics England |
2006∼계속 |
500만 명 |
암 및 희귀질환 환자 10만 명의 전장유전체 분석을 성공적으로 완료하고 이후 500만 명 전장유전체 분석으로 프로젝트를 확대하여 진행 중임 |
|
UK Biobank |
2006∼2010 |
50만 명 |
50만 명의 생체시료에 대해 SNP, WES, WGS 순으로 유전체 정보를 생산하고 전 세계 연구자들이 사용할 수 있도록 공개함 |
|
|
유럽 연합 |
1+Million Genomes (EU) |
2020∼2022 |
100만 명 |
2022년까지 유럽연합 국민들 100만 명의 전장유전체, 전자의료 기록, 의료 영상 정보 등을 수집하고 분석함. EU Horizon 2020 및 Innovative Medicine Initiative 등 기관의 연구비 지원으로 수행 |
|
핀란드 |
FinnGen 프로젝트 |
2017∼2023 |
50만 명 |
유전-건강정보 분석 인프라 기반으로 제약 분야 산학연과 공공협력체를 형성하여 프로젝트를 진행함 |
|
중국 |
100만 명 게놈프로젝트 |
2016∼2030 |
100만 명 |
중국 내 다양한 지역 및 민족을 반영한 100만 명 게놈 분석 |
출처: 저자 작성
2022년에는 PacBio 社나 Oxford Nanopore 社에서 개발한 롱 리드 시퀀싱(long read sequencing) 기술의 발전으로 처음으로 염색체 시작부터 끝부분까지 완벽하게 해독한 표준유전체가 T2T-CHM13이라는 이름으로 발표되었다. 이와 더불어 de novo assembly를 통해 개인의 유전체를 해독한 후 다양한 인류 집단의 유전적인 차이를 잘 대표할 수 있는 표준서열들을 확보하는 인간 범유전체 참조 컨소시엄(Human Pangenome Reference Consortium, HPRC)이 결성되어 3,000명 이상의 인간 게놈을 확보하는 대규모 연구가 미국, 영국을 중심으로 진행되고 있다.
한편으로 미국과 중국 간의 기술 패권 경쟁이 심화되면서 유전체 분야도 국가 안보와 직결되는 핵심 분야로 지정되어 서로 간의 견제가 심해지고 있다. 미국은 중국의 BGI사가 미국 국민의 유전체 정보를 불법으로 유출하는 회사로 간주하고 무역 거래를 금지하는 블랙리스트에 포함시키는 등 유전체 분야에서의 기술 유출 방지 및 보호가 강화되는 추세이다.
(2) 시장 및 산업 동향
유전체 분석 및 정밀의료 시장은 연평균 10% 이상 빠르게 성장하는 시장으로 분자진단, 동반진단, 디지털 헬스케어 등 여러 관련 분야의 성장도 견인하고 있다. 특히 2022년에는 100달러에 인간 게놈을 해독할 수 있는 기술 및 장비들이 발표되면서 그동안 Illumina 사가 거의 독점하다시피 한 유전체 분석 시장에 큰 변화를 예고하고 있다. 한 예로 Ultima Genomics 사는 시퀀싱 시약을 개선하여 인간게놈 해독 비용을 100달러로 낮추었다고 발표하였고, 중국의 MGI 사도 2023년 새롭게 선보이는 DNBSEQ-T20이라는 장비를 사용하여 하루에 220명의 인간게놈 정보를 생산하고 또 인간게놈 해독 비용도 100달러까지 낮추었다고 발표하였다. 한편 기존에 NGS 장비 및 시약을 독점해온 Illumina 사는 2022년 하반기에 Novaseq-X라는 최신 장비를 소개하면서 한 번에 160명의 인간게놈 정보를 생산하고 해독 비용은 200달러까지 낮추었다고 발표하였다. 또 다른 기술로는 다양한 용도 및 규모로 유전체 분석을 진행할 수 있는 중간 규모의 장비들이 있는데, Element Biosciences 사의 AVITI 장비나 Singular Genomics 사의 G4 장비 등이 3∼4억 원 정도의 장비 비용에 저렴한 비용으로 유전체 정보를 생산할 수 있어 연구자들에게 유용한 장비로 도입되고 있다.
[표 3-2] 새로운 유전체 분석 기술 및 장비
|
회사명 |
주요 내용 |
|
Element Biosciences |
AVITI라는 소형 장비를 도입하면서 인간 게놈 해독 비용을 200달러까지 낮추고 다양한 활용 기술을 개발함 |
|
Illumina |
2022년 하반기에 최신 기종인 Novaseq-X를 소개하였는데 한 번에 160명의 전장유전체에 해당하는 16TB의 데이터를 만들 수 있고, 인간 게놈 해독 비용을 200달러까지 낮춤 |
|
MGI |
2023년에 소개한 DNBSEQ-T20 장비는 하루에 220명의 전장유전체에 해당하는 22TB의 데이터를 만들 수 있고, 1년에 5만 명 정도의 전장유전체 정보를 생산할 수 있는데, 인간 게놈 해독 비용도 100달러로 낮춤 |
|
Oxford Nanopore Technologies |
나노포어 기술 기반의 3세대 염기서열 분석기술 기반 장비를 개발하고 MinION, GridON, PromethION 등의 장비를 판매함. 기존의 NGS와 달리 4Mb 길이 정도까지 긴 길이의 염기서열 분석이 가능하여 de novo assembly 등 다양한 연구에 사용됨. DNA 염기서열과 함께 DNA 메틸화와 같은 후성 유전적 변이도 동시에 측정 가능하여 유전체 및 후성유전체 연구에 널리 사용되고 있음 |
|
Pacific Biosciences of California (PacBio) |
3세대 염기서열 분석 기술 기반의 장비 개발 및 판매함. 특히 염기서열 해독의 정확도를 높인 Sequel HiFi 장비는 긴 길이 기반의 인간유전체 분석에 널리 사용되고 있음 |
|
Singular Genomics |
기존의 소형 NGS 장비보다 3∼4배 성능은 향상되고 염기서열 분석 비용은 절감한 G4라는 장비를 소개하며 다양한 분야의 유전체 연구에 사용될 수 있음을 보여줌 |
|
Ultima Genomics |
Ultima Genomics에서 새롭게 소개한 UG 100 장비와 시약은 인간 게놈 해독 비용을 100달러까지 낮춤 |
출처: 저자 작성
다. 국내 현황
(1) 기술 및 연구 동향
과기부, 복지부, 산업부, 질병청 등 네 부처・청은 2020년에 국가 바이오 빅데이터 시범 사업을 시작하여 2022년까지 희귀질환자 포함 총 2만 5,000명의 전장유전체 정보를 확보하였고 국내 산학연 연구자들이 활용할 수 있도록 제공하고 있다. 시범 사업 기간 동안 1만 5,000명의 희귀질환 환자 시료, 5,000명의 역학 코호트 시료에 대해 전장유전체 정보를 생산하였고 기존에 다른 사업을 통해 생산된 유전체 정보들을 5,000명 이상 확보하였는데, 여기에는 자폐증, 치매, 대장암, 폐암 등 다양한 중증질환자와 울산 1만 명 게놈프로젝트에 참여한 일반인의 유전체 및 임상정보가 포함되었다. 동시에 2024년부터 2032년까지 9년 동안 1조 규모의 예산을 투입하여 총 100만 명의 유전체, 임상 정보 및 코호트를 구축하는 국가 바이오 빅데이터 사업을 발표하고 이를 위한 예비타당성 심사를 진행하고 있다.
2014년에 시작되어 2022년까지 진행되었던 포스트게놈다부처사업은 여러 성과를 창출하며 성공적으로 마무리되었다. 또, 다중오믹스 기반 정밀의료 기술개발 사업이 추진되어 대장암(2017년 선정, 40억/년), 폐암(2019년 선정, 20억/년) 등 한국인 호발암을 연구하는 연구단과 만성호흡기질환 및 당뇨질환(2019년 선정, 20억/년)을 연구하는 사업단이 선정되어 다중오믹스 기반 유전체 연구를 수행하고 있다.
산업부는 유전체 분석 기반 산업 경쟁력 강화를 위해 유전체분석시스템 구축 사업(2019∼2022, 총 140억)을 추진하였고, 중소기업벤처부는 규제완화를 통한 산업 육성을 위하여 울산을 게놈서비스산업 규제자유특구로 지정하고 2020년부터 2022년까지 총 477억을 투입하여 3가지 유전체 관련 실증사업을 추진하였다. 한편, 제주도는 2022년에 메타버스 기반 유전체 프로젝트를 추진하면서 제주도민의 유전체, 임상정보 및 생활 데이터 등을 수집하고 분석하여 헬스케어 산업을 발전시키는 프로젝트를 시작하고 향후 4년 동안 3만 명 규모로 유전체 분석을 진행할 예정이다.
[표 3-3] 국내 주요 유전체 연구 현황
|
프로젝트명 |
주요 내용 |
|
국가 바이오 빅데이터 시범사업 |
2020년 시범 사업을 시작하여 2022년까지 희귀질환자 1만 5,000명 포함 총 2만 5,000명의 유전체를 분석하고 산학연 연구자들이 활용할 수 있도록 제공 |
|
다중오믹스 기반 정밀의료 기술 개발사업 |
유전체, 단백체, 대사체 등 다중오믹스 분석을 통한 질환 바이오마커 개발 및 치료 기술 개발 사업임. 대장암, 폐암, 천식, 당뇨 등 한국인 호발 질환에 대한 정밀의료 기술을 개발함 |
|
차세대한국인 유전체 분석시스템 구축사업 |
유전체 정보 생산 및 분석 기반 구축과 대규모 유전체 분석을 통한 질환 바이오마커 개발 및 사업화 지원 |
|
울산 게놈서비스산업 규제자유특구 |
게놈 기반 바이오헬스 산업 활성화를 위하여 2020년 8월부터 2024년 7월까지 48개월 동안 지정됨. 바이오 데이터팜 구축 및 운영, 질환별 맞춤형 진단마커 개발, 감염병 발생 대비 신속한 지원체계 마련 등 세 가지 중점 사업을 추진함 |
|
제주 지놈프로젝트 |
2022년부터 2025년까지 제주대학교병원과 ㈜인바이츠지노믹스가 협력하여 제주도민 3만 명의 유전체 분석 진행 |
출처: 저자 작성
(2) 시장 및 산업 동향
정부는 2022년 7월 ‘바이오헬스 산업 혁신방안’을 발표하면서 바이오헬스 산업 육성을 위한 투자, 융복합 산업에 맞는 규제혁신 및 보건의료 빅데이터 축적의 필요성 등을 강조하였다. 특히 보건의료데이터 활용 촉진을 위한 제도를 마련하여 의료데이터의 제3자 제공을 가능하게 하는 의료데이터 공유 및 활용 생태계 조성을 발표하였고, 정밀의료 연구개발의 핵심인프라인 ‘국가 통합 바이오 빅데이터’ 구축을 추진하여 100만 명 규모의 유전체 및 임상정보 빅데이터를 구축하기 위한 사업을 추진하고 있다.
유전체 분야의 핵심 사업 분야 중 하나인 개인 의뢰 유전자 검사(direct-to-consumer, DTC) 서비스 산업의 확대를 위해 2022년 7월 유전자검사역량 인증제를 도입하여, 2022년 12월 ㈜랩지노믹스, ㈜마크로젠, ㈜엔젠바이오, 제노플랜코리아㈜, ㈜클리노믹스 및 ㈜테라젠바이오 등 6개의 기관을 처음으로 인증하였다. DTC 인증제는 DTC 유전자검사기관의 정확도, 광고 및 검사결과 전달, 개인정보 보호 등을 평가하여 인증하는 제도로 기존에 유전자 검사가 가능한 항목을 열거하여 제한하던 방식에서 벗어나 검사기관이 먼저 검사항목을 신청하고 인증을 받으면 검사가 가능한 제도이다. 이를 통해 DTC 기관들의 자율성을 높임으로써 DTC 유전자 검사 서비스 시장을 확대하면서도 안전한 유전자 검사 환경을 조성할 수 있도록 하였다. 인증받은 6개 기관에서 현재 제공하는 DTC 서비스는 아래 표와 같다. 특히 최근에는 사람의 건강과 연관성이 높은 마이크로바이옴에 대한 관심이 높아지면서 개인의 마이크로바이옴을 분석하는 서비스도 출시되어 판매되고 있다.
[표 3-4] 2022년 인증받은 국내 6개 회사의 DTC 서비스 현황
|
회사명 |
제품명 |
주요 내용 |
|
랩지노믹스 |
WithGENE |
건강, 모발, 피부 관련 63가지 유전자 검사 서비스 |
|
마크로젠 |
마이지놈스토리 블루 |
주요 암 15종, 일반질환 23종 등을 포함하는 질병 예측 유전자 검사 서비스 |
|
마이지놈스토리 그린 |
다이어트 관련 17개 항목, 영양 관련 16개 항목을 포함하는 건강 생활습관 관련 유전자 검사 서비스 |
|
|
마이지놈스토리 더플러스 올인원 |
영양소, 운동, 피부・모발, 식습관, 개인특성(알코올 홍조, 니코틴 의존성 등), 건강관리(비만, 혈당, 혈압 등) 등 총 73종의 유전자 검사 |
|
|
마이크로브앤미 |
장내 미생물 분석을 통해 질병을 예측하고, 프로바이오틱스의 분포를 알려주는 검사 |
|
|
엔젠바이오 |
지노리듬 |
탈모 가능성, 비만, 피부 등과 건강과 아름다움에 관련된 11가지 항목에 대한 유전자 검사 |
|
지노리듬 Plus |
영양/운동/뷰티 등 총 45개 항목의 유전자 분석 서비스 제공 건강 관련 유전자 정보 분석 후 개인별 건강관리 프로그램을 통한 맞춤형 피드백 제공 |
|
|
제노플랜코리아 |
개인유전체분석서비스 |
건강관리, 운동, 식습관, 수면습관, 개인특성, 피부/모발, 영양소 및 혈통분석 서비스 제공 |
|
클리노믹스 |
Geno-P |
11가지 신체적 특징에 대해 유전자 분석정보 제공 |
|
Geno-D |
암질환 10종, 주요 일반질환 10종 등 한국인 주요 질환 발병가능성 예측서비스 |
|
|
Geno-Dx |
남성질환 65종, 여성질환 70종에 대한 발병 가능성(위험도) 분석 |
|
|
테라젠이텍스 |
헬로진 |
암, 일반질환 등 질병 관련 유전자 검사 서비스 |
|
진스타일 |
체질량 지수, 혈압, 혈당 등 유전적 질병 예방 및 건강 관련 유전자 검사 서비스임. 진스타일 웰니스 70의 경우 건강 및 생활습관 영역 관련 70개 유전자 검사 서비스를 제공함 |
|
|
테라바이옴 |
장내 미생물 분석 서비스 |
출처: 저자 작성
유전성 환자 진단 및 암 환자 치료를 위한 NGS 검사는 2017년 건강보험 항목에 포함된 이래 많은 의료기관에 도입되어 널리 사용되고 있는데 2023년 3월 기준으로 69개 기관이 승인되어 NGS 검사 서비스를 제공하고 있다. 일부 병원들은 병원 정보시스템에 임상정보와 유전체 정보를 통합하여 분석할 수 있는 시스템들을 개발하며 정밀의료 구현을 위한 플랫폼으로 발전시키고 있다
라. 발전 과제와 전망
차세대염기서열분석을 이용한 유전체 분석 기술이 발전하면서 드디어 100달러에 인간유전체를 해독하는 시대가 다가왔고 생명공학 연구의 모든 분야에서 유전체 분석은 더욱 보편적으로 사용될 것으로 기대된다. 특히 임상 의료 현장에서 질병의 진단부터 치료에 이르기까지 유전체 분석을 적용하는 사례가 더욱 증가할 것으로 예상된다. 세계의 많은 나라들은 자국민 유전체 정보의 중요성을 깨닫고는 스스로 자국민의 유전체 정보를 확보하고 각 나라에 맞는 정밀의료를 구현하기 위한 국가적인 프로젝트들을 활발하게 진행하고 있다. 또한 유전체 분석 기술을 국가 안보와 직결되는 중요 분야로 지정하고 다른 국가에 정보가 유출되는 것을 방지하는 정책을 수립하는 국가들이 늘고 있다.
유전체 정보와 더불어 최신 IT 기술을 접목한 의료 정보, 생활 습관 정보 등 다양한 정보를 체계적으로 수집하고 통합 분석하여 유전체, 환경 및 생활 습관을 아우르는 데이터 기반 정밀의료 체계를 구축하기 위한 경쟁이 치열하게 이루어지고 있다. 이러한 환경에서 우리나라도 유전체 기반 정밀의료 체계 구축 및 국가 경쟁력 확보를 위해 유전체 분야에 대한 투자를 지속적으로 늘리면서 해당 분야를 발전시키는 것이 중요할 것이다.
한편으로 개인 유전체 정보를 포함한 민감한 개인정보의 보호, 의료 현장에서의 유전자 분석의 유용성 여부 등 윤리적・법적・사회적 이슈들도 많이 존재하고 있으며, 관련 규제들도 엄격하게 만들어지고 있다. 데이터 기반의 새로운 산업 창출이라는 긍정적인 측면과 개인 정보 보호 및 유전자 검사의 유효성과 안전성을 확보하기 위한 규제 등 서로 상충하는 면을 고려하여 올바른 방향을 찾기 위해서는 정부와 산・학・연・병 등 관련 기관, 그리고 국민들이 함께 논의하면서 합의점을 찾는 것이 중요할 것이다.
2. 단백질체
가. 개요
(1) 단백질체학이란?
단백질체학(proteomics)은 세포, 조직, 체액 등에 존재하는 모든 단백질체에 대한 총체적인 연구로서 단백질 동정 및 발현량 측정뿐 아니라 단백질의 생체・세포 내 위치와 변화, 상호작용, 기능과 구조 분석을 포함하며 생명활동과 직결되는 정보를 제공하기 때문에 기초 연구뿐만 아니라 다양한 형식의 진단 플랫폼 개발과 신약개발 분야에서 강력한 학문적 근거로 사용되고 있다.
(2) 단백질체학의 핵심기술
단백질체학 기술은 크게 단백질 분석기술, 단백질기능 규명기술, 단백질체 정보기술로 나뉘며, 핵심기술인 단백질 분석기술은 단백체 분리분획기술과 질량분석을 이용한 단백질 동정 및 정량기술이 주를 이룬다. 단백질기능 규명기술은 단백질 상호작용 및 경로 분석, 단백질 구조 규명 및 디자인, 세포 및 개체 기반 단백질 기능 검증기술 등으로 구분되며, 단백질체 정보기술은 단백질체학 전 과정에 있어 자료 분석 및 결과 해석에 기반이 된다.
나. 해외 동향
(1) 기술개발 동향
(가) 분리분획기술
복잡한 단백질체 시료를 폭넓게 분석하기 위해 단백질과 펩티드 수준의 다양한 분획법이 사용되고 있다. 단백질체학 태동에 큰 역할을 한 이차원 전기영동(2 Dimensional Electrophoresis, 2DE)은 단백질 수준에서 개별 단백질로 분리하는 방법으로 MALDI-TOF MS(항체, 생체조직에서부터 전자소재까지 다양한 종류의 시료를 분석할 수 있는 질량분석기)와 어울려 폭넓게 이용되었지만, 낮은 분석효율 및 재현성으로 사용빈도가 점점 낮아지고 있다.
이에 비해 펩티드 수준에서 주로 이용되는 액체크로마토그래피(Liquid Chromatography) 기반의 분리분획기술들이 활발히 개발되어, 역상액체크로마토그래피(Reverse Phase LC) 기술이 단백질체 연구의 표준이 되었다. 또한 분해능과 검출 민감도를 높여 동일한 시료에서 더 많은 펩티드를 분석하기 위해 고정상 충진물 소형화, 컬럼 길이 증가, 컬럼 내경 소형화가 필요하게 되었고, 이를 뒷받침하기 위해 초고압액체크로마토그래피(Utra High Pressure LC) 기술이 개발되었다.
한편 RPLC(reversed phase liquid chromatographic)의 일차원 분해능을 극복하기 위해 RPLC와 분리직교성을 갖는 양이온교환 크로마토그래피(SCX), 음이온교환 크로마토그래피(SAX, WAX), 친수성 상호작용 크로마토그래피(HILIC), high-pH RPLC 등과 연계한 다차원크로마토그래피(MDLC) 기술을 통해 단백질체의 분석범위가 더욱 확장되고 있다. 이러한 다차원크로마토그래피는 오프라인 방식으로 연결하여 사용하기 시작하다가 시료의 손실을 최소화하고 편리성을 증대하기 위해 온라인 방식의 연결방법이 개발되었다. 다차원단백질식별기술(MudPIT)은 SCX와 RPLC가 펩티드를 전혀 다른 성질에 따라 분리하는 원리를 활용하여 단일 컬럼 내에서 직접 연결하는 방법이며, high-pH RPLC와 low-pH RPLC를 온라인으로 연결하기 위해서는 복잡한 크로마토그래피 밸브시스템이 적용되었다.
단백질 수준에서 복잡성을 낮추는 분획 방법으로 일반적인 폴리아크릴아마이드 겔 전기영동(SDS-PAGE)와 겔 내 소화(in-gel digestion)를 결합한 GeLC 방법이 오래전부터 개발되어 활용되고 있으며, 그 외에도 off-gel electrophoresis, PF2D, size-exclusion chromatography가 이용되지만 활용도는 GeLC에 비해 그리 높지 않다. SDS-PAGE의 원리를 이용하면서 분획된 단백질을 용액상태로 수득하는 GELFREE 분획법이 개발되어 top-down proteomics의 범위(coverage)를 높이는데 성공적으로 적용되고 있다.
최근 나노입자 화학을 이용하여 방울(bead) 표면에 차별적인 친화력을 가지는 잔기를 만들어 미량의 혈액 단백질들을 농축하는 프로테오그래프(proteograph)라는 기법이 개발되어 바이오마커 개발 연구에 활용되고 있다.
(나) 질량분석기술
질량분석은 단백질・펩티드의 이온화(ion source), 질량-전하비(m/z)에 따른 이온의 분리(mass analyzer), 특정 질량 값에 해당하는 이온의 선택(ion optics), 기체상태에서 이온 파편화(fragmentation)를 복합적으로 활용하기 때문에 각 부문의 작동방식에 따라 실로 다양한 질량분석 기기가 개발되었다. 기존 삼중-사중극자(Triple Quad), 사중극자-TOF 결합(QTOF)을 필두로 하여 이온트랩과 사중극자(Q-TRAP), 이온트랩과 FT-ICR MS의 결합(LTQ-FT)에 이어, 이온트랩-오비트랩(LTQ-Orbitrap), 사중극자-오비트랩(Q-Exactive), 사중극자-오비트랩-이온트랩(Fusion Orbitrap) 등 질량분석기의 성능을 향상시키기 위한 일반적인 전략으로 하이브리드 기기가 지속적으로 개발되었다.
이처럼 질량분석기의 발전은 다양했지만 고해상도 및 고정확도 질량분석기를 도입하려는 뚜렷한 흐름에 따라 Orbitrap과 TOF가 양대 산맥이 되어 꾸준히 개선되고 널리 활용되고 있다. 최근의 하이브리드 질량분석기 Orbitrap Fusion Elite Tribrid는 사중극자, ion routing multipole, 선형이온트랩, 오비트랩 등 이온 분리・저장 장치를 5개를 포함하고 있어서 민감도와 분석속도가 획기적으로 향상되었으며 Electron Transfer Dissociation(ETD), Proton Transfer Charge Reduction(PTCR) 등 추가적인 분할(fragmentation) 기술과 이온화(ionization) 기술을 집적하여 단일세포 단백체(single cell proteomics) 분석이 가능한 수준으로 활용되고 있다.
최근 질량분석기술의 두드러진 특징 중 하나는 이온 이동도 분광계(ion mobility spectrometer) 장치를 질량분석기에 추가하는 것이다. 고압가스와 전기전압을 이용해 m/z 이외의 특징으로 이온을 분리하므로 질량분석기 앞에 결합하여 활용된다. Orbitrap MS에 연계한 기술이 개발되었지만, 주로 TOF MS와 연계되어 사용된다. 더 나아가 trapped ion mobility spectrometer(TIMS)는 이온을 포집하는 기능을 더해 더 향상된 분해능을 제공한다. 그리하여 펩타이드 이온을 대량 선택적으로 방출하는 TIMS/PASEF(parallel accumulation serial fragmentation), 특정 m/z의 이온만 장치의 출구로 통과시키는 FAIMS(field asymmetric IMS), 모서리 주변에서 이온을 돌려서 매우 긴 경로로 이온을 분리하는 SLIMs(structures for lossless ion manipula-tions) 등이 개발되었다.
Middle-down 혹은 top-down proteomics에서는 bottom-up 펩티드보다 훨씬 큰 폴리펩티드・단백질의 아미드 결합을 끊어내기 위해 더 강력한 절편화 방법이 필요하다. 전자 전달 해리법(ETD)과 자외선 광분해법(UVPD)의 개발은 하향식(top-down) 단백질체 연구에 획기적으로 기여하였다. 진보된 컴퓨팅 알고리즘을 활용한 데이터 분석 기술의 발달로 DIA(data independent analysis)나 HRM(hyper reaction monitoring)과 같은 질량분석 기술이 활용되고 있고 DDA(data dependent analysis)나 MRM(multiple reaction monitoring)과 같은 기술도 특정한 표지법 없이도 상대정량 분석에 있어 신뢰도 높은 결과를 얻을 수 있게 되었다.
DIA 기술은 Q-TOF와 만나서 m/z 전 구간을 구획하여 복합적인 스펙트럼을 얻어 분석하는 Sequential Window Acquisition of all Theoretical Mass Spectra (SWATH-MS)를 개발할 수 있게 하였으며, 이온 이동도 기술과 결합하여 DIA-TIMS를 가능케 함으로써 단백질체 분석범위를 획기적으로 증가시켰다. 사중극자-오비트랩 질량분석기의 등장으로 PRM(parallel reaction monitoring) 기술이 개발돼 단백질체 프로파일링과 타깃 단백질의 정량분석이 동일 기기에서 가능해졌다.
한편, 질량분석 기반의 이미징 기술인 IMS(imaging mass spectrometry)가 개발되어 제자리(in situ)에서 단백질・펩티드의 공간 분포를 탐색하는 접근법으로 활용된다. 다른 생화학 영상 기술과 달리, IMS는 잠재적 표적 종에 대한 선험적 지식 없이 비표적으로 분석한다는 장점이 있다. MALDI 기반 IMS 외에도, ToF-SIMSimaging, DESI-IMS 등이 개발되었다. 금속을 측정하던 ICP MS기술과 세포계산(cytometry) 기법을 결합한 mass cytometry(cyTOF)는 세포 간의 생물질 콘텐츠의 변이를 규명할 수 있어서 FACS(Fluorescence activated cell sorter)를 대체하는 기술로 각광받고 있다. 질량분석 기술의 민감도 향상, 멀티플렉싱을 통한 동일 펩티드 이온증가, 매개체(carrier)를 이용하는 신호 증폭, 시료처리의 간편화 전략을 이용해 단일세포 단백체(single cell proteomics)를 위한 기초연구도 활발히 진행되고 있다.
(다) Informatics 기술
질량분석에서 얻어진 방대한 데이터로부터 펩티드의 서열, 정량, 단백질 번역 후 변형(Post- Translational Modification, PTM) 정보를 해석하고, 생물학적 의미를 추출하는 정보학 기술은 미국의 스크립스연구소(Scripps), ISB, 퍼시픽 노스웨스트 국립연구소(Pacific Northwest National Laboratory, PNNL) 그리고 독일 막스플랑크 연구소 등의 유수 연구기관을 중심으로 활발하게 개발되고 있다. 이들 기관에서는 분석의 자동화와 생산된 질량스펙트럼의 해석을 위한 소프트웨어(TPP, MSGF+, Skyline, MaxQuant, ProLuCID 등) 환경을 구축하였다. 또한 펩티드 서열로부터 단백질을 동정하고 정량적으로 해석하는 다양한 프로그램의 개발과 단백질의 단백질 번역 후 변형 분석을 위한 알고리즘(MODi, MSFragger, PeaksPTM 등)의 개발도 활발히 진행되고 있다. 스펙트럼을 해석할 때, 단백질 서열 DB를 사용하지 않고, 기존에 얻어진 스펙트럼 라이브러리를 활용하는 알고리즘도 오래전부터 꾸준히 개발되었다. TPP 파이프라인의 SpectraST, GPM 프로젝트로 개발된 X1Hunter, 미표준원의 MSPepSearch 등이 대표적이다. 그 외에도 단백질의 구조와 관련된 정보를 유추할 수 있게 하는 HDX-MS나 교차결합(crosslinking)에 의한 분석 등 다양한 질량분석 기반의 분석기술이 개발되면서 이를 해석할 수 있는 소프트웨어도 개발되고 있다.
최근에는 단백질체와 유전체 연구를 병행하여 종합적으로 해석하기 위한 단백유전체(proteogenomics) 연구가 활성화되면서, 질량분석을 통해 확인하고자 하는 단백질체를 DB 검색을 통해 동정 가능하도록 유전체 DB를 표현하고 구축하는 방법에 대한 연구가 진행되고 있다. 유전자 서열분석으로 얻어진 유전체 정보에 기반하여 질량분석 데이터를 해석하며, 서열 간의 중복을 최소화하기 위해 비동의(non-synonymous) SNP나 alternative splice variant를 exon graph, splice graph 등으로 표현하여 해석하기도 한다. 또한 Clinical Proteomic Tumor Analysis Consortium(CPTAC), cHPP와 같은 대규모 과제의 연구결과로 생산된 단백질체 데이터의 축적에 따라 PRIDE와 같은 데이터 저장소가 활성화되고, 대규모의 데이터 분석이 가능해졌다.
(라) 단백질체 정량기술
초기 이차원전기영동에 기반을 둔 정량기술은 거의 사라져가고, LC와 질량분석기만 사용하여 정량하는 추세로, 안정 동위원소를 표지하는 방식(stable isotope labeling)과 비표지방식이 사용된다. 시료 간의 상대적 양을 비교하는 상대정량기술에는 ICAT, iTRAQ, SILAC, IDBEST, TMT 등과 같은 표지식 방법이 있으며, 단백질체 분석 적합성을 크게 개선함으로써 그 적용 사례가 증가하고 있다. TMT의 경우에는 최대 16개의 서로 다른 시료 분석이 가능한 16-plex TMT와, 시스테인(cysteine)에 표지되어 산화 환원 반응에 주요한 단백질을 정량할 수 있는 iodo6plex TMT가 개발되어 적용되고 있다. 비표지 상대정량법은 펩티드들의 상이한 이온화 효율, 존재량과 최고(peak) 세기 간의 비선형 관계, 데이터 처리 부분에서 여러 가지 난제를 안고 있으나, spectral counting을 이용한 emPAI, NASF 등과 extracted ion chromatogram 기반의 MaxLFQ, iBAQ 등의 알고리즘이 개발되어 문제점을 개선해 다양한 정량 분석에 활용되고 있다. 또한 재현성이 떨어지고 분석시간이 긴 MDLC 대신 한 번의 RPLC로 최대한의 단백질체를 얻을 수 있는 50cm 이상의 칼럼이 활발히 적용되고 있다.
절대 정량기술에는 SISCAPA, QCAT proteotypic peptide, mTRAQ 기술 등이 사용되고 있으며, SIS(stable isotope standard)를 사용한 삼중-사중극자 기반 MRM 기술 이용이 크게 증가하고 있다. 최근 MRM에 비해 transition 선정 소요 시간이 짧은 PRM과 재현성이 우수한 SWATH 방법이 개발되어 적용되고 있다. 이에 맞춰 Skyline, Spectronaut, DIA-Umpire, DIA-NN 같은 분석 소프트웨어가 개발되었다.
(마) 단백질 번역 후 변화(Post-translational modification, PTM) 분석 기술
질량분석기를 이용한 PTM 분석에서의 낮은 화학량론(stoichiometry) 문제를 해결하기 위해, 각 PTM이 지닌 특이적인 물리화학적 성질을 이용하여 특정 PTM 단백질 혹은 펩티드를 농축하는 기술이 활발하게 개발되어 정착되고 있다. 인산화 펩티드 농축기술로는 IMAC, TiO2를 이용한 유연분리 기술이 있으며, SCX 또는 SAX 등과 복합하여 효율을 증가시킬 수 있다. 항체를 이용하여 포스포티로신(phosphotyrosine)을 갖는 단백질/펩티드를 농축하는 기술도 개발되었다. 당쇄화는 과요오드산(periodate)산화 후 hydrazide resin을 이용하는 화학적 농축법과 렉틴(lectin)을 이용한 친화력(affinity) 기반 농축법이 활용되고 있으며 막여과기(멤브레인 필터, membrane filter)와 렉틴 친화력(lectin affinity) 분리를 결합한 FACE 기법도 등장하였다. 라이신 잔기에 아세틸화(acetylation)된 acetylome이나 유비퀴틴화(ubiquitytlation)된 ubiquitylome은 트립신을 이용하여 펩티드로 절편화한 후 각각에 맞는 항체를 이용하여 농축할 수 있게 되었다.
단백질의 N-말단 상태를 분석하기 위한 N-terminomics기술이 개발되어 N-terminal PTM과 alternative translational initiation site를 맵핑하거나, 단백질 분해 효소체(degradome)을 관찰하는데 활용되고 있다. 대표적으로 COFRADIC, TAILS, Nrich 등이 있다. 하나의 단백질에 나타나는 복잡한 PTM의 조합을 규명하는데 top-down proteomics가 활용되고 있다. 질량분석 결과에서 PTM 정보를 해석하는 방법으로 일반적인 DB 서치 프로그램을 사용할 수 있지만, PTM의 조합이 무궁무진함에 따라 MODplus와 MSfragger같이 unrestrictive modification 알고리즘이나, 두 펩티드가 연결되어 있는 교차 결합(cross-link)을 표적하여 발굴하는 알고리즘도 개발되었다.
(바) 단백질체 동적변화 분석 기술
단백질은 시공간적으로 변하고 복합체를 형성한다. 단백질 복합체 연구는 APMS(affinity pull-down mass spectrometry)가 가장 기본적이고 널리 활용되는 분석방법이다. 개별 단백질을 항체를 이용해 풀다운(pull-downs)하면 복합체를 형성하는 다른 단백질도 따라 나와 복합체를 분석할 수 있다. 약하게 결합하여 복합체를 얻기가 어려운 경우에는 교차 결합(cross-link)을 유도하여 분석한다. AP-MS는 한 종류의 복합체 연구에 적당하나 대규모 연구나 동적변화 연구에는 실용적이지 않다. 반면에, 질량분석 자체 기술의 발전으로 막단백질이나 단백질 복합체 분석이 훨씬 용이해졌다. 표면 유도 해리(Surface-induced dissociation)를 이용해 단백질 복합체에서 꺼풀을 벗기듯이 요소단백질을 분리할 수 있으며, top-down proteomics나 MS3 기술을 원용하고 UVPD와 HCD 파편화 방법을 결합하여 복합체 내 단백질의 proteoform을 결정할 수 있게 되었다.
protein correlation profiling(PCP) 방법은 비변성 조건에서 단백질 복합체가 서로 다른 크로마토그래피 조건에서 단백질이 동시에 용출된다는 전제하에 확률적으로 계산하는 방식이다. 이 전략은 질병이나 약물치료와 같이 시스템에 교란이 있을 때 단백질 복합체의 역동성을 신속하게 측정할 수 있는 수단을 제공하며 대규모 연구에 효과적이다. AP-MS의 변형법으로 APEX, BioID 방법이 개발되어 spacial proteomics로 자리 잡았다. 상호 작용하는 단백질 간의 높은 친화성을 요구하지 않고 주변에 있는 단백질을 동정하는 방법이다. APEX는 ascorbate peroxidase라는 효소를 활용해 히드록실 라디칼로 비오틴을 주변 단백질을 표지하며, BioID은 biotin ligase 효소 BirA를 사용하여 주변 단백질에 비오틴을 표지한다. 비오틴이 붙은 단백질을 동정하여 소위 ‘공간적 복합체’를 규명한다.
단백질체의 생성과 분해에 따른 동적 정량변화를 보기 위해 pulsed SILAC을 활용하게 되었다. 펄스-체이스(pulse-chase)처럼 특정 시간 동안만 안정 동위원소 표지(stable isotope labeling)를 하는 것이다. pulsed SILAC과 달리 일정한 시간 동안 새로 합성된 단백질만 농축하는 BONCAT 기술도 등장하였다. 세포 성장 시 메티오닌 대신 미국심장협회(American Heart Association, AHA)를 표지해 생물직교화학(bioorthogonal chemistry)으로 비오틴을 붙여 친화력 풀다운 할 수 있는 것이다. 최근에는 실락(SILAC)1)과 BONCAT2) 방법을 결합한 새로운 기법으로 HILAC 방법이 개발되어 농축과 정량을 동시에 수행하여 효율적인 분석이 가능해졌다.
(사) 바이오마커(bio-marker) 연구
질병의 조기진단, 예후, 약물치료에 대한 반응, 신약 후보물질에 대한 평가 등에 활용되는 오믹스 기반 바이오마커 중 단백질 마커는 표현형 바이오마커로서 생리 상태를 직접 반영하며, 체액에서 쉽게 분석이 가능한 이점이 있다. 초창기 미국 국립암연구소(National Cancer Institute, NCI)에서는 조기발견연구 네트워크(EDRN)를 조직하여 조기진단 바이오마커 연구를 시작하였다. 최근 유전체와 단백체 데이터를 통합하는 단백유전체 기술 기반의 바이오마커 개발 방법론이 본격적으로 태동되어 NCI의 암단백체분석컨소시엄(Clinical Proteomic Tumor Analysis Consortium, CPTAC)은 TCGA 유전체와 단백질체 정보를 통합하는 단백유전체 이니셔티브 프로그램을 진행하였다.
2016년에 개시된 미국의 캔서 문샷(Cancer Moonshot) 프로그램에서는 암 치료에 대한 보다 많은 치료제 및 기술 스펙트럼을 제공하기 위한 프로그램을 구성하고 있다. 그 중심에 단백질체학 기술이 있으며, 미국을 포함한 10개국이 참여하는 국제암유전단백체컨소시엄(International Cancer Proteogenome Consortium, ICPC)은 CPTAC의 단백유전체 바이오마커 발굴 기술을 기반으로 종양의 단백질 유전체학 복잡성(proteogenomic complexity)에 대한 전반적인 연구협력, 종양 치료에 대한 반응 연구 협력, NCI의 Proteogenomic Translational Research Center들의 기술지원, 혁신적인 데이터 분석법을 개발하고 단백유전체 정보를 공유하며, 필요한 경우 분석에 들어가는 자원도 공유하려고 한다. 2019년부터 6년간 한국연구재단에서는 다중 오믹스 기반의 정밀의학 연구가 폐암, 유방암, 당뇨 합병증 및 천식 질환에 대해 질량분석 기반의 단백체학이 포함되어 국내외 연구진들이 연구를 진행하고 있다.
또한 2017년 2월에 시작한 CPTAC 중심의 아폴로(Applied Proteogenomics OrganizationaL Learning and Outcomes, APOLLO) 네트워크는 NCI, 미 국방부, 재향군인회와의 협력을 통해 환자-병원-연구를 연결하는 네트워크를 구성하고 환자가 치료에 어떻게 반응할 것인지를 더 잘 예측하는 것을 목표로 종양의 단백유전체 연구를 진행 중이다. 임상기관의 IHC 병리 연구에 오랫동안 이용되어 왔던 FFPE 조직시료에서 현미해부(microdissection) 후에도 다량의 펩티드를 추출하는 기술이 발달함에 따라, FFPE를 대상으로 항체없이 MRM 또는 SWATH 기법만으로 단백질들을 직접 검출하게 되었다. 이는 바이오마커 개발 연구에 활용되는 시료 대상을 대폭 확정하는 효과를 가져왔다.
최근 중국은 국가 주도 형식의 단백체 프로젝트 중 하나인 Phi 프로젝트(Proteome Identification and Quantification Project)를 본격적으로 시작했다. 대규모 단백질 연구 프로젝트인 이 연구는 2014년에 시작되었으며, 중국 정부의 대규모 연구 프로그램 중 하나인 ‘863 계획’의 일환으로 지원받고 있다. Phi 프로젝트는 인간, 쥐, 삼투압 등 다양한 종의 조직 및 세포에서 발현되는 단백질들의 광범위한 아미노산 서열 정보를 수집하고, 이를 기반으로 단백질-단백질 상호작용, 신호전달 경로 등의 생물학적 기능을 연구한다. 이를 위해 다양한 단백질 분석 기술을 활용하며, 대량의 단백질 데이터를 생성하여 단백질의 구조, 기능, 발현, 조절 등을 연구하고 있다. Phi 프로젝트는 다양한 연구 그룹과 협력하여 단백질 연구 분야에서의 중국의 역할을 확대하고, 국제적인 경쟁력을 강화하기 위한 목적으로 시작되었으며 국제적인 단백질 연구 프로젝트인 HUPO(Human Proteome Project)와도 연계되어 있고 최근 아시아-오세아니아 단백체학회 학술대회(Asia-Oceania Human Proteome Organization, AOHUPO)와 전략적 협약을 진행 중이다.
(2) 시장 동향 및 전망
(가) 시장 개요
글로벌 단백체 시장 규모는 2021년에 236억 5,434만 달러로 평가되었으며, 2022년부터 2031년까지 연평균 성장률 15.2%로 980억 5,183만 달러까지 성장할 것으로 예상된다.3) 이 시장의 성장은 맞춤의학 및 신약개발 분야연구 활동의 증가가 주요 원인이며 제약 및 생명공학 연구 개발비 증가, 단백질체에 대한 각국 정부의 자금지원 및 기술발전 등이 시장 확대에 기여하고 있다.
제품별로 봤을 때, 단백질체 시장은 계측장비 기술 분야(instrument), 시약 분야(reagent), 서비스 및 소프트웨어 분야(service)로 구분할 수 있는데, 시약 분야가 2022년 시장점유율 1위를 차지하고 있으며, 이러한 추세는 2024년까지 계속 유지될 것으로 예상한다. 시약 분야가 큰 비중을 차지하는 원인으로는 복잡한 혼합물 및 기타 단백질체 분석과정에서 단백질을 분리 정제하기 위한 다양한 시약의 사용증가로 볼 수 있다. 응용 면으로 나누어 보면 신약개발, 임상진단 및 기타 응용으로 구분할 수 있으며, 신약개발이 가장 큰 시장점유율을 차지하고 있다. 바이오의약 시장의 성장으로 정밀의학기술 개발의 기회가 창출되었고, 이는 단백질체를 이용한 신약개발 시장을 가속화시킬 것으로 기대된다. 특히 단백질체 기술의 발전으로 각종 화학 합성 및 약물의 생물학적 테스트의 비용, 시간 및 자원에 대한 필요 부분이 최소화되고 있다.

출처: Proteomics Markets-Global Forecast, MarketsAndMarkets
[그림 3-1] 제품별 및 응용 분야별 세계 단백질체 시장 규모(2019 대비 2024)
지역별로 북미(미국, 캐나다)가 2021년 기준으로 108억 300만 달러이며 2022년부터 2031년까지 연평균 성장률 13.9%을 예상한다. 유럽(영국, 독일, 프랑스, 이탈리아, 스페인 등)은 북미보다는 규모가 작은 69억 5,700만 달러이지만 2022년부터 2031년까지 연평균 성장률 14.6%로 예상된다. 아시아 태평양 지역(중국, 일본, 인도 등)은 49억 9,900만 달러이지만 2022년부터 2031년까지 연평균 성장률은 17.5%로 가장 높은 성장률을 보일 것으로 예상된다. 중동 및 아프리카 지역은 14억 1,000만 달러이며 연평균 성장률 16.3%을, 남미 지역(브라질, 멕시코 등)은 14억 8,500만 달러로 15.8%의 연평균 성장률을 보일 것으로 예상한다.

출처: Proteomics Markets-Global Forecast, MarketsAndMarkets
[그림 3-2] 지역별 단백질체 시장규모(2017~2024)
(나) 시장 동향
세계 단백질체 분야 주요 기업으로는 Thermo Fisher Scientific(미국), Agilent Technologies(미국), GE Healthcare(미국), Danaher Corporation(미국), Merck KGaA(독일) 등이 있다. 2018년 Thermo Fisher Scientific 사와 Symphogen 사는 협약을 맺고, Shymphogen 사가 개발한 치료용 단클론 항체를 분석하는 시스템을 Thermo 사의 Q Exactive Plus Orbitrap을 이용하여 구축하기로 하였다. 또한 같은 해에 Agilent Technologies 사는 단백체 기술기반을 강화함과 동시에, 차세대염기서열분석을 포함한 단백체-유전체 포괄적인 서비스를 제공하기 위해 Advanced Analytical Technologies, Inc.를 인수하였다. 2017년 한국의 삼성바이오로직스는 독일의 Merck KGaA 사와 생물 의약품 제조 및 생물학적 공정 개발에 관한 전략적 제휴를 위해 양해 각서(MOU)를 체결하였다. 이 협약에 따라 Merck 사는 Mobius 시스템, 세포주, 세포 배양배지 및 크로마토그래피 시스템 전반을 제공하여 삼성바이오로직스의 생물학적 약제의 개발을 가속한다. 2021년 미국의 Seer 사는 나노입자 화학을 이용하여 혈액 내 미량의 단백질들을 리퀴드 핸들러(Liquid handler)로 자동화된 프로세서로 농축하고 단백체 분석을 할 수 있는 프로테오그래프라는 플랫폼으로 시총 5조 원에 육박하는 회사로 성장하였다. 또한 단일 분자 단백질 시퀀싱을 표방하는 노틸러스 바이오테크놀로지 사는 2020년 당시 아마존 CEO인 제프 베이조스와 마이크로소프트 공동 창업자인 폴 앨런 등이 투자에 참여하는 시리즈B 라운드에서 7,600만 달러 규모의 투자를 받는 등 단백체 분야에 대한 시장 전망은 매우 밝다.
다. 국내 현황
(1) 연구개발 투자 현황
포스트게놈 다부처유전체 사업으로 다양한 단백질체 관련 연구사업이 계획되었으나, 2017년에 단백유전체 원천기술을 개발하는 다중 오믹스 신기술개발사업이 종료되었고 현재는 소규모의 유전단백체 융합정보기반 난치암 제어기술 개발사업(과기정통부, 수행 기간 2017∼2022, 연 10억 원, 주관기관 고려대학교)과 미국 NCI와 연계된 글로벌 바이오 연계기술 개발사업(과기정통부, 수행 기간 2017∼2022, 연 10억 원, 주관기관 한국과학기술연구원)이 진행되고 있다. 이러한 두 개의 사업은 모두 캔서 문샷(Cancer Moonshot)의 일환으로 진행 중인 대규모 유전단백체 연구 이니셔티브인 ICPC를 통한 공동연구 및 활용에 참여하고 있으나, 다른 나라에 비해 국내 정부투자가 현저하게 적은 편이다. 국내에서는 2019년 다중 오믹스 기반 정밀의료 사업이 새로 시작하였고 폐암, 유방암 등의 난치암 분야, 대사질환인 당뇨 합병증인 신증 분야, 천식 분야 총 3분야에 대해 단백질체 연구가 중심이 되어 6년간 진행되고 있다. 2024년부터 시작될 국가 바이오 빅데이터 구축 사업은 유전체와 더불어 단백체와 대사체 연구가 포함되어 예산 타당성 검토가 진행 중이다 보건복지부에서는 캔서 문샷에 참여하기 위한 기획 작업의 일환으로 2018년 국립암센터 중심으로 암유전단백체연구단을 꾸려 외부의 단백질체 연구그룹과 7개의 암종에 대해 컨소시엄 형태의 사업을 진행 중이다. 그 외에 대형 사업단인 글로벌프론티어연구개발사업 중 의약바이오컨버젼스연구단과 기초과학연구원 연구단(RNA 연구단)에서 단백질체 연구 인프라를 갖추고 연구에 활용하고 있으며, 이미 구축된 질량분석기기 등을 활용한 연구가 산발적으로 진행 중이다. 국내 대형병원에서도 단백체 연구 설비 구축에 힘을 쏟고 있다. 서울대병원은 CMI(Center for Medical Innovation)에 단백체 분석 Core를 구축하여 중개연구에 활용하고 있으며 서울아산병원은 융합연구지원센터 내에 2015년부터 임상단백질체 Core 연구실을 운영 중이다.
2022년부터 과기정통부는 관계부처와 함께 국가연구개발사업을 통해 생산되는, 생화학분석, 이미지(영상), 임상 및 전임상, 오믹스, 분자구조, 표현형 정보 등 연구 데이터를 표준화 기반으로 통합 수집하여 품질 관리된 데이터가 연구현장에서 활용될 수 있는 환경을 조성하기 위해 범부처 바이오 연구데이터 공유 플랫폼인 국가 바이오 데이터 스테이션(Korea-BioData Station, K-BDS)를 운영 중이며 국가 바이오 데이터 스테이션에 등록되는 연구데이터의 품질관리와 큐레이션을 위해 주요 바이오 빅데이터 분야로 대사체, 화합물, 바이오이미징을 비롯한 단백체 분야의 산학연 전문가 집단으로 구성된 4개의 데이터 품질선도센터를 운영하고 있다. 바이오 분야별 데이터 품질관리센터들은 대표적인 국제 데이터 저장소의 품질관리 기준에 부합하도록 품질관리 기준 등을 수립하고, 이에 따라 품질을 관리하고 큐레이션 함으로써 국가 바이오 데이터 스테이션이 해외 저널의 데이터 저장소 기능을 수행하고 있다. 국제적인 기준에 따라 데이터 품질관리가 수행되고 있는 유전체 분야와 달리, 단백체 분야에서는 국제적인 데이터 품질관리의 기준과 체계가 미비하고 지금 점차적으로 확립해가는 상황으로 단백체 데이터 품질선도센터가 국제적 수준의 품질 표준 마련 등에 적극 기여할 수 있을 것으로 기대된다. 또한, 데이터의 생산, 분석 및 해석까지 문제 해결을 위한 자문을 지원하고, 데이터 생산 시 참고할 수 있는 데이터 품질관리 지침을 제시하며 고품질 연구데이터가 생산되어 공유되는데 일조할 전망이다.
(2) 관련 산업 현황
[표 3-5] 국내 단백질체 관련 기업 현황
|
기업명 |
업종 |
설립연도 |
|
㈜영인프런티어 |
항체, 단백질, ELISA키트 생산 및 판매, 각종과학기기 판매, HUPO Antibody Initiative에 참여(www.younginfrontier.com) |
1994 |
|
㈜펩트론 |
주문형 펩타이드 제조 서비스, 기능성 및 약효 지속성의약품 제형 기술 개발, 펩타이드 개발 및 생산(www.peptron.co.kr) |
1997 |
|
㈜프로테옴텍 |
다중 알러지 진단키트 개발 및 판매, 프로테옴 분리 및질량분석, 단백질 동정 및 확인법 개발, 진단키트 개발(www.proteometech.com) |
2000 |
|
㈜노바셀테크놀로지 |
프로테오믹스 기술과 펩타이드 라이브러리 기술 기반으로 바이오 의약품과 바이오소재 개발(www.novacelltech.com) |
2000 |
|
㈜진메트릭스 |
MALDI-TOF를 이용한 바이러스 및 미생물 유전자 진단 기술 개발 및 서비스(www.genematrix.net) |
2000 |
|
㈜바이오인프라 |
빅데이터 기반 혈액 다중표지자 검사, 진단키트 개발, 바이오마커 발굴, 항암용 표적약물 전달 시스템 개발 등(www.bio-infra.com) |
2001 |
|
㈜프로탄바이오 |
인간용 암진단키드, 동물용 진단키트, 진단용 항원・항체제작, 단백체 분석 서비스(www.protanbio.co.kr) |
2005 |
|
㈜아스타 |
병원성 미생물 신속 진단법 개발, MALDI-TOF 진단기기(로봇기술 활용 최초 국산화), MALDI plate 생산 판매, 시료전처리 기기 개발 생산(www.astams.com) |
2006 |
|
프로테인웍스 |
단백질의약품 특성 분석 서비스, 천연물 분석 서비스, 프로테옴분석 (proteinworks.co.kr) |
2008 |
|
㈜바이오앤시스템즈 |
단백질의약품 특성 분석 서비스(www.bionsystems.co.kr) |
2009 |
|
㈜라이프사이언스 래보러토리 |
단백질분석서비스, LC/MS/MS 분석 서비스, 각종 질량분석기술 교육 (www.proteinlab.co.kr) |
2013 |
|
㈜레티마크 |
단백체 기반 안질환 진단시스템 개발(www.retimark.com) |
2016 |
|
㈜베르티스 |
질량분석 기반의 단백체 플랫폼으로 유방암 진단(http://www.bertis.com) |
2014 |
|
㈜바질바이오텍 |
질량분석 기반의 단백체 분석 서비스 회사(http://www.basilbiotech.com/) |
2017 |
|
㈜솔브레인 바이오헬스 연구소 |
Seer사의 협력사로 프로테오그래프 플랫폼을 이용한 혈액 단백체 분석 서비스 제공 (http://www.soulbrain.co.kr/) |
2020 |
|
㈜프로메타바이오 |
단백체 기반의 헬스케어, 웰니스 플랫폼 분석(https://www.prometabio.com/) |
2020 |
출처: 저자 작성
라. 발전 과제
단백질체 연구는 기초학문 분야와 응용 산업 분야에서 폭넓고 다양하게 활용되고 있다. 노화 자체나 알츠하이머 및 퇴행성 뇌질환 같은 노화 관련 질병연구, 화학 단백질체학 및 신약개발 응용연구, 면역 및 감염성 질환에 대한 연구, 시간과 공간에 따라 달라지는 단백질체 연구, 다양한 PTM 및 proteoform에 대한 연구, 유전체연구로 접근하기 어려운 세포 외 소포체 및 막표면 단백질체 연구, 단백질 분해효소와 그 산물을 복합적으로 연구하는 분해학(degradomics) 등은 단백질체학의 꾸준한 연구주제이다. 단백질체를 넘어서는 다양한 오믹스 정보를 융합하기 위한 정보과학, 세포 신호전달 및 단백질 복합체를 해석하기 위한 생물정보학(Bioinfrmatics)도 핵심 주제에 속한다.
또한 최근에 주목받는 단백질의약품 개발 단계에서 항체의약품을 포함한 치료용 단백질의약품 또는 펩타이드 의약품들의 분자량, 아미노산 조성, 당화여부, 이황화결합 부위 특정 등 특성 분석과 약물동력학(Pharmakokinetics, PK) 분석에서 질량분석 기반의 단백체학은 매우 중요한 역할을 맡고 있다.
무엇보다도 최근에 주목받는 분야로서 임상단백질체학(clinical proteomics), 메타단백체학(metaproteomics), 단세포 단백질체학, 비변성조건 질량분석을 할용한 구조단백질체학이 있다. 임상단백질체학은 임상 중개연구의 다양한 측면에 단백질체 기술을 응용하는데 중점을 둔 플랫폼으로 단백질 기반 임상시료 분석 및 임상화학 분석을 위한 단백질 처리기술 개발을 포함한다. 군집에 존재하는 다양한 미생물의 구성에 대한 정보는 균유전체학(metagenomics)가 주이지만, 집단 내에서 발생하는 대사 활동에 대한 정보는 제공하지 않기에 메타단백체학(metaproteomics)를 이용해 생물의 대사 활동 정보를 확보하고 미생물과 숙주의 생화학적 관계도 밝힐 수 있다. 단세포전사체학 기술이 세포의 분화과정이나 질병의 발생과정에서 세포 분포를 보여주고 있는 것처럼 단백질체학 기술은 단세포 수준까지 분석할 수 있는 기술적인 진보가 이루어지고 있으며 시료확보와 신호 증폭 부분에서의 꾸준한 기술개발로 단세포단백질체학(Single cell proteomics)도 일상적 분석 도구가 될 것으로 기대한다. 현재 기술로는 1개의 세포로부터 평균 250pg의 단백질을 추출할 수 있으며 이를 TMT 기술과 Orbitrap 또는 비표지 기술과 DIA 기반의 분석법을 통해 약 1,500여 개의 단백질들을 정량분석할 수 있는 수준으로 개발이 진행되고 있다.
단백질체학의 가장 큰 응용분 야로서는 정밀의료(precision medicine)가 있다. 약물을 적임자에게 적시에 제공하기 위해서는 사람의 질병 상태를 먼저 파악하고 해당 치료법이 있는지 알아본 후 그 중 적절한 치료법을 찾을 수 있는 정확한 바이오마커(bio-marker)가 존재해야 한다. 따라서 단백질체 연구는 앞으로도 지속적으로 확장될 것이다. 다중 오믹스, 특히, 유전체와 단백체를 통합적으로 바라보는 단백유전체는 캔서 문샷(Cancer Moonshot)의 핵심 부분이다. 정밀의료는 질병 유발 경로를 파악하고 결과를 모니터링하는 데 도움이 될 수 있을 것이며, 나아가 일상적 모니터링의 정밀건강(precision health)으로까지 확장될 것이다.
정밀의료의 진척을 위해서는 국제적 컨소시엄을 통한 단백질체 연구의 확대와 데이터 공유가 필요하다. 단백질체 연구는 정밀의료의 핵심기술로 정부, 의료기관, 산업계의 지속적인 관심이 필요하며 과감한 투자로 기술개발을 촉진해야 한다. 현재 단백체 및 질량분석 기술을 기반으로 하는 진단법 5가지가 신의료기술인증(NECA)를 획득하였으나 그 이후에 추가되는 신의료기술인증을 받은 기술은 아직은 없는 상태이다.
특히 2020년 보건복지부에서 건강과 웰니스에 관련된 유전자 패널에 대해서 소비자 직접 서비스(Direct to Customer, DTC) 유전자 검사 가이드라인이 마련 되면서 병원을 거치지 않고 소비자가 직접 신청하는 유전자 분석의 비대면 상업적 분석이 가능해졌다. 미국의 경우 미국 식품의약국(FDA)에서 허용하는 DTC 분석 서비스 범주에는 유전체 외에 대사체와 단백체 분석이 포함되어 있으나 한국의 경우 유전체 분석만 가능한 상태이다. 국내 단백체 기반의 헬스케어와 웰니스 산업 및 진단에서의 발전을 위해서 유전체 일변도의 DTC 가이드라인에 대한 관련 분야의 규제 완화 검토와 선제적 해소가 필수적이다.
또한 국내 연구자들에 의해 생산되는 단백체 데이터들을 효율적으로 관리, 축적하고 데이터 댐으로써 활용하기 위한 제도적인 준비를 국가생명연구자원정보센터(KOBIC)에서 진행 중이다. 그전까지는 생산된 단백체 테이터를 논문으로 발표하기 위해서 미국, 일본, 중국, 유럽에 있는 데이터베이스에 원본 데이터(raw data)를 업로드하고 접수번호(accession number)를 받아야 하는 상황에서 데이터의 주권을 확보하기 어려운 상황이었다. 해당 데이터 댐이 잘 활용되어 단백체를 비롯한 바이오 빅데이터가 일반 연구자들에게 적극적으로 선순환되어 활용됨으로써 진단 및 신약개발에 마중물이 될 수 있기를 기대한다.
3. 세포체
가. 개요
(1) 세포체 관련 재생의료 연구
재생의료는 손상된 인체의 구조 또는 기능을 재생, 회복시킴으로써 질병을 치료 예방하는 의료기술이다. 기존의 치료제나 의료기술의 치료 한계성을 근본적으로 극복하기 위한 혁신형 신의료기술로써 현대 의학의 치료 대안으로 그 중요성이 점차 확대되고 있다. 재생의료의 정의는 국가별로 상이한 측면이 있으나 국내의 경우 의약품 중에서도 바이오의약품(생물의약품)의 하위분류로 구분되며, 첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률(이하 첨단재생바이오법) 및 그 하위규정에 따라 첨단바이오의약품으로 정의하고 있다. 첨단재생바이오법 제2조 및 약사법 제2조 제4호에 따르면 재생의료의 범위는 인간 세포 등을 이용하여 실시하는 세포치료, 유전자치료, 조직공학치료와 이를 조작, 변형한 치료제와 이들 치료제에 의료기기가 물리적, 화학적으로 결합한 융복합제제까지 포함하고 있다.

출처: 범부처재생의료기술개발사업단, 국내외 재생의료 동향 조사・분석 연구, 2022.12.
[그림 3-3] 첨단바이오의약품 범주 구분
우리 정부는 재생의료의 특수성 및 중요성을 인식하고 2019년 첨단재생바이오법을 제정했다. 동법은 2020년 9월 시행되었으며, 정책심의위원회를 거쳐 2021년 1월 제1차 첨단재생의료・첨단바이오의약품 5개년 기본계획(2021∼2025)을 수립했다. 법 시행과 함께 새로운 치료법이 절실한 희귀・난치환자들에게 안전한 관리체계 아래에서 합법적인 치료기회를 임상연구를 통해 제공받을 수 있는 시스템이 마련되었다. 임상연구 계획의 심의를 위해 보건복지부와 식품의약품안전처 공동으로 첨단재생의료 및 첨단바이오의약품 심의위원회를 설치했다. 2021년 3월에는 재생의료기술개발사업 추진을 위하여 과학기술정보통신부와 보건복지부가 공동으로 연구지원관리 전담기관으로 범부처재생의료기술개발사업단을 설립했다.
글로벌 재생의료 시장은 적용기술에 따라 세포치료제, 유전자치료제, 조직공학치료제, 엑소좀치료제로 크게 구분할 수 있다. 이들 중 세포치료제는 시장 규모가 가장 클 뿐만 아니라, 연평균 성장률 또한 가장 높을 것으로 전망되고 있다. 그러나 유전자조작기술 발전과 함께 유전자치료제 시장도 크게 성장할 것으로 보인다. 글로벌 재생의료 시장 규모는 2019년 229억 달러에서 2030년 1,277억 달러 규모로 연평균 17.45%로 성장할 것으로 전망되고 있다. 기술별로 시장점유율을 보면 세포치료제가 약 52%를 차지하고 있고 다음이 조직공학치료제이다.

|
구분 |
2019 |
2020 |
2021 |
2022 |
2023 |
2024 |
2025 |
2026 |
2027 |
2028 |
2029 |
2030 |
CAGR (’21-’30) |
|
세포치료제 |
11.80 |
13.49 |
15.50 |
17.89 |
20.76 |
24.18 |
28.31 |
33.29 |
39.33 |
46.68 |
55.68 |
66.72 |
17.61% |
|
유전자치료제 |
3.05 |
3.47 |
3.97 |
4.57 |
5.28 |
6.12 |
7.14 |
8.36 |
9.83 |
11.62 |
13.80 |
16.47 |
17.12% |
|
조직공학 |
6.27 |
7.16 |
8.22 |
9.48 |
10.99 |
12.79 |
14.96 |
17.57 |
20.75 |
24.60 |
29.32 |
35.11 |
15.51% |
|
엑소좀치료제 |
1.80 |
2.05 |
2.33 |
2.67 |
3.08 |
3.56 |
4.13 |
4.82 |
5.65 |
6.66 |
7.88 |
9.37 |
16.71% |
|
합계 |
22.92 |
26.17 |
30.02 |
34.61 |
40.09 |
46.65 |
54.53 |
64.04 |
75.56 |
89.57 |
106.68 |
127.68 |
17.45% |
|
주) 시장 규모 값은 2019∼2020년은 실측치, 2021∼2030년은 예측치임 출처: Global Regenerative Medicine Market-Analysis of Market Size, Share & Trends and Forecast-2030, SPER, 2022; 범부처재생의료기술개발사업단, 국내외 재생의료 동향 조사・분석 연구, 2022.12. |
|||||||||||||
[그림 3-4] 연도별, 기술별 재생의료 시장 규모(2019~2030)

출처: Global Regenerative Medicine Market-Analysis of Market Size, Share & Trends and Forecast-2030, SPER, 2022; 범부처재생의료기술개발사업단, 국내외 재생의료 동향 조사・분석 연구, 2022.12.
[그림 3-5] 치료제별 재생의료 시장 점유율 비교(2020 대비 2030)
(2) 세포체 핵심기술
(가) 세포치료제
세포치료제는 세포를 체외에서 증식하거나 특성을 변화시키는 방법을 통해 조제하는 의약품이다. 활성세포를 주입하여 기능장애를 겪는 세포를 대체하는 기술로써 분화능을 갖는 줄기세포가 주로 활용되며, 재생의료 기술 분야 중에서 시장 규모의 절반 이상을 차지하고 있다. 세포치료제는 생물학적 제제에 대한 수요 증가, 줄기세포 치료제의 기술 발전, 개인 맞춤형 의약품 개발에 대한 관심 증가로 인해 지속적인 성장이 전망된다. 세포치료제는 세포은행, 세포 조작 장비, 대량 세포 배양 장치 및 시설, 배지공급, 세포치료 서비스 등 고도의 플랫폼화된 형태의 산업으로 발전하는 추세이다.
(나) 유전자치료제
유전자치료제는 유전자 조작을 이용, 치료 유전자를 환자의 몸(궁극적으로는 환자의 세포) 안으로 주입해 유전자 결함을 치료하는 의약품이다. 유전자 복원・억제・대체 기술은 유전・선천성 질병과 암, 감염병 대응에 용이하고 바이오마커 발굴로 신약 효능검증 등에 적용되고 있다. 현재 유전자 변형 세포치료제를 포함한 유전자치료제는 전 세계적으로 20개가 승인되었다. 이 중 미국 FDA가 10개(유전자변형 세포치료제 6개, 유전자변형 항암바이러스 1개, 유전자치료제 3개)를 승인했다. 다국적 제약사 노바티스는 CAR-T 세포치료제인 킴리아를 개발했다. 이외에도 길리어드의 예스카타 등 5종의 CAR-T 치료제가 미국 FDA 승인을 받았다. 유전자치료제의 경우 현재 블루버드바이오의 진테글로 등 6개의 치료제가 상용화되었는데, 진테글로는 1회 치료에 280만 달러(약 36억)의 높은 가격이 책정되었다. 고액의 약가로 실제 임상현장에 사용되는 데는 어려움이 따르지만 유전자치료제 시장 선점을 위해 국내외 제약 바이오 기업들이 신약개발, 인수합병(M&A), 설비투자 확대 등 치열한 경쟁을 하고 있다. 특히 새로운 유전자치료제 개발을 위한 CRISPR/Cas9 등 유전자 편집 기술 고도화로 유전자치료제 개발이 가속화될 전망이다.
(다) 조직공학치료제
조직공학치료제는 세포・스캐폴드・성장인자를 활용하여 만든 인공조직을 퇴행 또는 손상조직에 이식하여 재생하는 조직공학기술을 기반으로 한 치료제이다. 세포는 줄기세포 등이 많이 이용되며 다양한 조직 및 장기를 모사하게 된다. 조직공학기술로 재생할 수 있는 조직으로는 크게 피부, 뼈, 연골, 신경 등이다. 현재 근골격계, 피부계 질환을 중심으로 치료제 개발이 활발하게 진행되고 있다. 특히 당뇨병성 족부질환, 화상 등 폭넓은 치료에 적용되어 재생의료 치료제 개발 중에 두 번째로 큰 규모를 차지하고 있다. 또한 미니장기를 뜻하는 오가노이드 연구와 3D프린팅 기술을 활용해 조직과 유사한 주형에 세포와 세포외기질을 주입하여 원하는 모양을 자유롭게 제작하는 방법이 개발되고 있다. 오가노이드는 인체 모사도가 높기 때문에 안전 및 윤리적인 문제로 인해 인체를 대상으로 직접 실험이 불가능할 경우, 동물모델 대신 오가노이드를 활용해 질환 모델링을 구축할 수 있다는 점에서 주목받고 있다. 손상조직을 치료할 수 있는 대체제로서 조직공학치료제 시장은 3D 프린터를 사용한 조직공학 기술 발전으로 성장을 가속화 할 것으로 예상된다. 그러나 여기서 기술하는 조직공학치료제는 2019년 제정된 첨단재생바이오법에 의한 첨단바이오의약품의 품목분류로 정의된 조직공학제제와는 좀 다른 개념으로 파악되고 있음을 주의해야 한다.
(라) 엑소좀치료제
엑소좀은 세포에서 뿜어내는 50∼200nm의 엔도솜으로 구성된 나노 입자 세포외 소포체이다. mRNA, miRNA, DNA 등을 포함하며 소포체의 크기, 함량 등 특성과 배출기전, 그리고 결합하는 수용세포에 따라 다양한 생리학적 기능을 수행한다. 엑소좀에 약물을 탑재하면 원하는 세포안으로 전달할 수 있어 차세대 약물 전달체로 주목받고 있다. 최근 엑소좀 관련 기술이 빠르게 발전하고 있으며, 액체생검, 표적치료제, 유전자치료제 등의 영역으로 확대되고 있어 엑소좀 시장 규모는 크게 성장할 것으로 예상된다. 엑소좀치료제 개발은 세계적으로 임상 1/2상 수준의 개발 초기 단계이다. 최근 1∼2년 사이 국내 중소기업 및 대형제약사들도 많은 관심을 두고 개발을 진행 중이며, 국내 엑소좀 기업의 수준은 글로벌 수준과 차이가 많이 나지 않는다. 전 세계적으로 엑소좀치료제의 임상이 진행되고 있으며, 국내 기업도 호주와 미국에 임상승인을 받았다. 식약처가 2018년 세포외소포체 치료제 개발에 관한 가이드라인을 만들었으나 이질성이 높은 엑소좀을 치료제로 개발하는데 많은 어려움이 있다. 식약처는 혁신기술 적용 바이오의약품에 관한 정의를 신설하고 새로운 분류기준을 마련하고자 노력 중이다.
나. 해외 동향
(1) 주요국 정책 및 연구 동향
(가) 미국
미국은 새로운 치료법 개발과 첨단의약품 및 의료기기 개발 촉진을 위한 신속한 허가를 지원하기 위해 21세기 치료법(21st Century Cures Act)을 2016년 제정하였다. 동법을 통해 첨단재생의료치료제(Regenerative Medicine Advanced Therapy, RMAT)에 대한 정의와 범주를 신설하고 불필요한 규제들을 정비하였다. 또한 재생의료 첨단의약품에 해당하는 의약품은 FDA의 신속심사제도를 이용할 수 있도록 재생의료치료제지정제도(Regenerative Advanced Therapy Designation, RATD)를 신설하였다. 법 제정 이후 RMAT으로 지정받기 위해 미 FDA에 신청된 건수는 2022년 기준 총 195건이며 그 중 지정 승인된 건수는 77건이다.4) NIH는 21세기 치료법에 의거하여 FDA와 협력하여 줄기세포 기반 치료법 개발을 목표로 첨단재생의학혁신프로젝트(Regenerative Medicine Innovation Project, RMIP)를 통해 4년간 3,000만 달러의 연구비를 지원하였다. 2023년에는 동 프로젝트를 통해 연구자 주도 임상시험 최대 3건, 전임상연구 최대 10건, 임상시험계획 최대 10건에 대해 280만 달러의 자금을 투입할 예정이다.
(나) EU
EU는 첨단의료제품(Advanced Therapy Medical Product, ATMP)의 개발과 시판허가를 촉진하기 위하여 2007년 특별법을 제정했다. 동법을 통해 EU 회원국 간의 제품의 안전성과 사후 추적관리를 효율적으로 관리하고 첨단의약품 분야의 전문성을 공유하기 위해 중앙허가제를 도입했다. ATMP의 개발을 위한 임상시험 신청서는 국가 관할 당국에 개별적으로 제출되나, 판매 승인의 경우 유럽 의약품청(European Medicines Agency, EMA)에 의해 EU 전역에 적용 가능한 중앙집중식 승인 및 허가를 받고 있다. 또한 ATMP는 비일상적인 조건(non-routine basis) 하에서 EMA의 통합승인 대상에서 제외되어 병원에서 의사의 책임하에 치료목적으로 환자 개인 맞춤형 처방・사용이 가능하도록 병원 면제제도를 허가했다. 2021년 9월 기준 EU에서는 총 19개의 ATMP가 승인되었고, 치료제별로는 유전자치료제가 12개로 가장 많으며, 그 외 조직공학제제 4개, 세포치료제 3개이다.
(다) 일본
일본은 국민들에게 신속하고 안전하게 재생의료를 제공하고, 보급을 촉진 하기위해 2013년 재생의료안전법을 제정했다. 동법에서 임상연구를 통해 안전성과 유효성이 입증된 중위험 및 저위험으로 분류된 치료기술 중 지역재생의료위원회의 심의, 승인을 받은 경우 지정 의료기관에서 자유 진료를 허용하고 있다. 2015년에는 혁신적인 치료방법이 필요한 질환을 대상으로 하는 의약품과 세계 최초로 일본에서 조기 개발, 신청된 의약품을 우선적으로 상담 및 심사하는 사키가케 지정(Sakigake Designation)제도를 도입했다. 사키가케 지정을 받은 경우 일반적으로 임상 종료 후 12개월이 걸리는 승인 표준심사 대신 6개월간의 우선심사(priority review) 과정을 거치게 된다. 2021년 기준 일본 내에 14개 재생의료 제품이 승인되었다.
(2) 산업 동향
전 세계 재생의료치료제 개발업체는 2022년 기준으로 총 1,369개로 파악되며 북아메리카의 기업 수가 651개로 가장 많다. 주요국의 개발 기업 수, 임상 수 및 투자 규모를 볼 때 미국은 단연 재생의료 강국이다. 특히 미국과 유럽은 기업주도 임상시험의 수가 학계 및 정부지원 임상시험 수에 비해 많으나 아시아・태평양의 경우 연구자 임상의 수가 더 많다.
|
|
[그림 3-6] 전 세계 재생의료 개발 기업 수 현황(2022)
|
구분 |
미국 |
유럽 |
아시아・태평양 |
|
개발 기업 수 |
651 |
230 |
453 |
|
기업주도 임상시험 수 (Industry-Sponsored Trials) |
472 |
178 |
294 |
|
학계 및 정부지원 임상시험 수 (Academic, Government & Other Trials) |
336 |
151 |
346 |
출처: Regenerative Medicine: The Pipeline Momentum Builds ARM, 2022
2021년 기준 세계적으로 진행 중인 임상시험은 2,406건으로 이 중 1,171건이 기업주도 임상시험(Industry-Sponsored Trials)이며, 학계 및 정부지원 임상시험(Academic, Government & Other Trials) 수는 1,235건이다. 기업 임상시험의 경우 약 12%(총 142건)가 임상 3상에 해당하는 반면, 학계 및 정부지원 임상시험은 약 7%(총 80건)로 일반적으로 개발 초기 단계를 수행하고 있다.
|
치료제별 기업주도 임상시험 현황 |
치료제별 학계 및 정부지원 임상시험 현황 |
|
|
|
출처: Regenerative Medicine: Disrupting the status quo, ARM, 2021, 범부처재생의료기술개발사업단 재편집
[그림 3-7] 전 세계 치료제별 임상시험 현황(2021)
다. 국내 현황
(1) 정책 현황
2022년, 윤석열정부는 국내 혁신성장 도약을 위한 유망 분야 중 하나로서 제약・바이오를 지정하고, 바이오헬스 분야 국가 지원 예산을 현재 2조 8,000억 원에서 5조 6,000억 원 규모로 확대키로 발표했다. 또한 바이오헬스 관련 정책 입안 및 수행을 위한 통합기구로써 제약바이오혁신위원회(가칭)를 설치하고, 첨단의료(재생의료・정밀의료・뇌과학・노화・유전자편집・합성생물학 등) 바이오 디지털 분야를 중점 지원할 예정이다.
2021년 3월에 과학기술정보통신부와 보건복지부가 공동 설립한 범부처재생의료기술개발사업단을 통해 2023년 3월 기준 152개 과제에 1,361억 원을 지원했다. 재생의료 원천기술개발과제에 44개 과제, 비임상 연구지원이 포함된 연계기술개발과제에 100개 과제, 허가용 임상시험에 해당되는 치료제치료기술개발과제에 8개를 각각 지원했다. 한편 첨단재생바이오법에 따라 시행된 임상연구는 지난 2021년 5월부터 2022년 11월까지 총 57건의 임상연구과제가 신청됐고, 13건의 임상연구가 심의를 거쳐 적합 의결됐다5). 임상연구를 실시할 수 있는 첨단재생의료 실시기관은 2022년 12월 기준 56개 병원이 지정되었고 이중 상급 종합병원이 33개, 종합병원이 20개, 일반병원이 3개를 각각 차지하고 있다.
(2) 연구 및 투자 현황
재생의료 분야에 최근 6년간(2016∼2021) 국가 R&D 연구비로 지원된 과제 수를 국가과학기술지식정보서비스(NTIS)에서 재생의료 한글 키워드 및 영문 키워드 검색을 통해 분석한 결과 5,826개으로 나타났다. 세부 분야별 과제수 및 투자는 모든 분야에서 꾸준히 증가하고 있으며 연구가 가장 활발한 분야는 세포치료제 분야이다. 6년간 세포치료제 분야는 2,165개 과제에 3,698억원이 지원되었다. 지원 과제를 연구개발 단계로 보면 기초연구가 3,679개 과제인 63%로 가장 활발히 연구되고 있으며 그 외 개발연구가 1,157개 과제인 20%, 응용연구가 909개 과제인 16%의 순서를 보인다. 재생의료 관련 임상진입 과제는 총 286개 과제로 이중 임상 단계별로 볼 때 1상 단계가 129개 과제인 45%로 가장 높은 비중을 차지한다.
|
재생의료 연구과제 분야별 과제 수 |
연도별 과제 수 및 정부투자 규모 |
|
|
|
출처: 범부처재생의료기술개발사업단, 국내외 재생의료 동향 조사・분석 연구, 2022.12
[그림 3-8] 재생의료 국가 R&D 투자 현황(2016~2021)
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
구분 |
2016 |
2017 |
2018 |
2019 |
2020 |
2021 |
합계 |
|||||||||||||||
|
세포치료 |
593 |
624 |
608 |
557 |
643 |
672 |
3,698 |
|||||||||||||||
|
유전자치료 |
404 |
424 |
320 |
439 |
411 |
373 |
2,371 |
|||||||||||||||
|
조직공학 |
131 |
148 |
201 |
267 |
345 |
417 |
1,508 |
|||||||||||||||
|
융복합제제 |
10 |
13 |
5 |
5 |
4 |
4 |
41 |
|||||||||||||||
|
기타 재생의료 |
78 |
69 |
69 |
8 |
72 |
84 |
456 |
|||||||||||||||
|
기반연구 |
377 |
374 |
423 |
419 |
493 |
528 |
2,613 |
|||||||||||||||
|
합계 |
1,593 |
1,653 |
1,627 |
1,770 |
1,967 |
2,077 |
10,687 |
|||||||||||||||
출처: 범부처재생의료기술개발사업단, 국내외 재생의료 동향 조사・분석 연구, 2022.12
[그림 3-9] 분야별 연도별 재생의료 연구과제 정부투자 동향(2016~2021)
라. 발전 과제
첨단재생바이오법이 제정되어 해외 주요국과 같이 재생의료 특성에 맞는 안전관리체계 아래 의약품과 구분되는 별도의 임상연구를 지원하고 있다. 그러나 기존과 다른 제도와의 조화, 제한된 치료 접근성 등 제도개선 과제가 여전히 존재하고 있다. 첨단재생의료 임상연구는 상용화의 첫 단추로써 중요한 역할을 하기 때문에 활성화가 필요하다. 빠르게 변화하는 첨단재생의료 분야에 적합한 규제 및 지원체계를 조속히 갖출 필요가 있으며, 혁신기술개발을 장려하는 범정부 차원의 지원이 필요할 것이다.
미래의 재생의료기술은 연구영역의 다양성, 세포 기반의 엄청난 양의 데이터 분석, 표준화 방법 부재, 수동 검사의 오류 등을 감안할 때 융복합기술, 특히 AI, 빅데이터 등 디지털 기술과의 접목이 필요하다. 재생의료기술개발의 진행 속도는 상상을 초월할 것이고 우리는 기존 제품 개발이나 치료와는 전혀 다른 대전환의 변곡점에 서 있다. 현재 글로벌 시장에서는 재생의료기술의 한계를 극복하기 위해 새로운 혁신 융・복합기술 확보를 위한 치열한 경쟁과 동시에 다양한 협력이 전개되고 있다. 국내 산・학・연 연구자들도 디지털화와 융・복합화를 위해 오픈 이노베이션(개방형 혁신)을 해야 하고 활발하게 협력해야 한다. 기업은 유망 혁신기술로 파이프라인을 다양화해야 하며, 정부는 글로벌 선진 기술 동향을 분석해 재생의료 선도형 R&D를 지원하여 글로벌 핵심 원천기술을 도출해야 한다.
재생의료기술의 특성상 국민의 이해 제고를 위해 기술개발 초기 단계부터 환자, 환자의 보호자, 연구자 및 정부 간의 다방향 소통 시스템을 운용하는 것이 중요하다. 임상적 유효성과 안전성 확보를 위해 규제기관과 긴밀히 연계해야 하며, 재생의료 연구성과에 대한 대국민 소통과 홍보를 위한 다양한 노력을 해야 한다. 또한 재생의료 시장에서의 경쟁력을 확보하기 위해 세포은행(cell bank), 생산・제조 공정기술, CRO, CMO, CDMO 등 제조・서비스산업 육성 전략 마련도 필요하다.
4. 대사체
가. 개요
대사체학(metabolomics)은 유전체학(genomics), 전사체학(transcriptomics), 단백체학(proteomics)과 같은 오믹스 분야 중 하나로 다양한 종류의 생체 시료로부터 생체 내 1,500Da 이하의 저분자량을 가진 대사체군(metabolome)에 대한 정보를 총체적으로 분석하는 연구 분야이다. 이 학문은 지난 20여 년간 수천 편의 논문들이 발표되면서 발전해왔고, 식물, 미생물 시료뿐만 아니라 인간 및 동물의 생체 시료를 활용한 연구도 활발히 수행되었다. 그러나 대사체가 가지고 있는 화학적 구조와 농도에서의 다양성 때문에 다른 오믹스에 비해 대사체군의 분석 범위가 제한되고 표준화가 어려운 문제가 있다. 이러한 한계점을 극복하기 위해 크로마토그래피 및 질량분석법 등에서의 고도화된 분석 기술들이 지속적으로 개발되고 있다.

출처: Nature Methods, 2021
[그림 3-10] 질량분석기 기반 대사체학의 연구흐름
최신 분석기기들의 발달에 따라 대사체학의 활용 범위는 매우 확장되었으며, 특히 가장 많이 활용되고 있는 분야 중 하나는 질환 진단을 위한 임상 대사체학 (clinical metabolomics) 분야이다. 또한 약물 치료에 의한 대사 반응을 연구하는 약물 대사체학(pharmacometabolomics) 분야, 지질에 대해 분석하는 지질체학(lipidomics) 분야, 최근 더 주목받고 있는 미생물 분야에 적용된 미생물 대사체학(microbial metabolomics) 분야, 식물 및 식품에 적용된 식물/식품 대사체학(plant/food metabolomics) 등이 있다.
나. 해외 연구 동향
(1) 임상 대사체학(Clinical Metabolomics) 분야
독일의 Jonel Trebicka 연구팀은 각각 83명과 851명의 혈액 샘플에서의 비표적 혈청 대사체 분석을 통해 급성 비대상성 간경화의 단기 사망과 연관된 예후 예측 바이오마커를 이용한 예측 모델을 개발하고 검증하고자 하였다. 단기 사망 예측 바이오마커로 4-hydroxy-3-methoxyphenylglycol sulfate, galacturonic acid, hexanoylcarnitine를 포함하는 3개의 대사체가 선택되었고, 이러한 대사체들은 전신 염증 및 미토콘드리아 이상과 연관되어 있음을 밝혔다. 선별된 대사체들을 이용하여 개발된 예측 모델들은 기존의 장기 기능 장애만을 이용한 점수보다 높은 단기 사망 예측력을 보여 실제 임상에서의 급성 비대상성 간경화 환자의 위험도 분류 및 간 이식을 위한 우선순위 판단 등에 활용 가능성을 제시하였다.

주) 높은 C-index를 가지는 29개의 대사체(왼쪽)와 개발된 예측 모델의 단기 사망 예측력(오른쪽)
출처: Gut, 2023
[그림 3-11] 급성 비대상성 간경화의 단기사망 예측 바이오마커 관련 연구 사례
독일의 Roland Eils 연구팀은 UK biobank로부터 얻어진 11만 7,981명으로부터 분석한 168개 혈액 대사체 프로파일을 이용하여 24개의 통상 질환 발생에 대한 위험도를 예측하고자 하였다. 10년 이상의 결과(outcome) 발생에 대한 추적관찰(follow-up)을 통해 대사체 프로파일에서의 총체적인 정보를 활용하여 동시에 여러 질환을 예측하기 위한 통합된 metabolomic states를 유도하였고, metabolomic states가 여러 질환에 대해 예측 가능함을 확인 및 검증하였다. 이를 통해 혈액 NMR 기반 대사체 프로파일이 동시에 여러 질환을 예측하는 데 활용될 수 있음을 보였다.

출처: Nature Medicine, 2022
[그림 3-12] 질환 위험도와 연관된 metabolite profiles을 제시하는 metabolomic state 분석
(2) 약물 대사체학(Pharmacometabolomics) 분야
미국의 Jeannine S. McCune 연구팀은 busulfan 투여 직전이나 투여 2주 전에 수집된 조혈세포이식 환자 혈장 샘플에서의 대사체학 분석을 통해 각각 13개의 대사체가 busulfan clearance와 연관되었음을 발견하고, 이러한 대사체들을 busulfan clearance 예측 모델에 사용하였다. 또한, lysine degradation, steroid hormone, glutathione pathway와 busulfan clearance 관련성을 확인하였다. 개인의 busulfan clearance를 이용하여 개인 맞춤화된 busulfan 정맥 주사량을 결정하는 데 종종 사용되어 오던 기존의 임상 약학(clinical pharmacology) 또는 translational science 대신에 이러한 약물대사체학 방법을 사용하여 busulfan 주사량 결정에 활용 가능성을 제시하였다.

출처: Clinical Pharmacology & Therapeutics, 2023
[그림 3-13] Busulfan clearance와 연관된 대사기전의 working hypothesis
스웨덴의 Johan Jendle 연구팀은 제2형 당뇨병 치료제 GLP-1 RAs의 당뇨병 개선 효과뿐만 아니라 심혈관 및 지방간 질환 위험도를 낮추는 효과 메커니즘을 규명하기 위해 GLP-1 RAs 계열 약물인 리라글루티드(liraglutide) 또는 글리메피리드(glimepiride)가 각각 투여된 제2형 당뇨병 환자 62명의 치료 후 18주의 혈장 샘플에서 지질과 극성 대사체 변화를 관찰하였다. 리라글루티드 치료 그룹이 글리메피리드 치료 그룹보다 cholesterol esters hexocyl-ceramides, lysophosphatidylcholines, sphingolipids, phosphatidylcholines 레벨이 감소하였고, 지질 레벨이 치료 전에 비해 15% 정도, 글리메피리드 치료 그룹보다는 10% 감소하였다. 이처럼 리라글루티드 치료 그룹은 세라마이드(ceramides)와 관련된 지질대사에서 더 큰 변화를 나타내었고, 세라마이드의 증가된 축적이 심혈관 및 지방간 질환과 높은 연관성이 있음을 보여주었다.

출처: Cardiovascular Diabetology, 2021
[그림 3-14] Glimepiride와 liraglutide 치료 그룹 사이에 변화된 대사체들
(3) 지질체학(Lipidomics) 분야
덴마크의 Aleksander Krag 연구팀은 알코올성 지방간 환자 315명의 혈장 및 간 조직 샘플에서 알코올성 지방간에서의 지질 기능 장애 역할을 규명하기 위해 질량분석기 기반 지질체학(lipidomics) 분석을 진행하였다. 대부분의 sphingolipids인 sphingomyelins(SMs)과 ceramides, 및 phosphocholines가 간 조직과 혈장에서 모두 감소하였음을 확인하였다. 특히 SMs가 섬유증(fibrosis)과 염증이 진행됨에 따라 감소하였고 감소한 SMs이 간과 관련된 질환 발생과 연관됨을 보임으로써 알코올성 지방간의 pro-fibrotic과 pro-inflammatory 메커니즘에서 SMs의 중요 역할을 제시하였다.

출처: Gastroenterology, 2023
[그림 3-15] 관찰된 지질과 알코올성 지방간/비알콜성 지방간 index 사이의 연관성
프랑스의 Soazig Le Lay 연구팀은 비만과 관련된 대사 기능 이상에 참여하는 지질 전달 역할을 하는 adipose extracelluar vesicles(AdEVs)에서의 비만 상태에서의 지질 변화를 확인하고자 마른 또는 비만 마우스 모두에서 타깃 지질체(targeted lipidomics) 분석을 수행하였다. AdEVs에서의 지질 변화는 혈장이나 내장지방에서의 지질 변화와 비교되었고, ceramides, sphingomyelins, phosphatidylglycerols의 레벨이 내장지방에서보다 AdEVs에서 증가하며 비만 상태가 AdEV lipidome을 변화시킴을 확인하였다. 본 연구를 통해 이러한 AdEV lipidome 결과가 비만 조직의 대사 상태를 이해하는데 매우 유용함을 제시하였다.

출처: Cell Reports, 2023
[그림 3-16] 마른 또는 비만 마우스의 AdEVs에서의 지질 변화
(4) 미생물 대사체학(Microbial and Microbiome Metabolomics) 분야
영국의 the BreathDx Consortium 연구진들은 기계적으로 인공호흡 하는 환자들의 체외 호흡에 포함된 미생물 유래 휘발성 유기 화합물(mVOC)을 활용하여 비침습적 감염의 임상 진단을 위한 바이오마커 발굴 연구를 수행하였다. 환자에서 S. aureus, Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli가 주요한 병원균으로 확인되었다. 기체 크로마토그래피 질량분석법을 활용하여 체외 호흡에서 총 19종의 mVOC를 확인하였고 이 중 3-methylbutanal과 3-methylbutanoic acid가 S. aureus의 감염 유무를 진단할 수 있는 주요 바이오마커로 확인되었다.

출처: Clinical Infectious Disease, 2022
[그림 3-17] 인공호흡 환자의 감염 여부 진단을 위한 미생물 유래 휘발성 유기 화합물(mVOC) 2종의 농도 및 ROC 커브의 산포도
최근 인체의 장내 미생물과 그로부터 유도된 대사물질이 암, 비만, 심혈관질환, 뇌질환 등 주요 질환과 강력한 연관성이 있으며 인체의 면역기전 조절에 관여함이 제시되고 있다. 그 일환으로 미국의 Anthony M. Haag 연구팀은 gut-brain axis로 알려진 위장과 중추 신경계 사이의 커뮤니케이션 연구를 위한 미생물 및 숙주 유래 신호의 질량분석기 기반 정량적 분석 플랫폼과 프로토콜을 개발하였다. 이 플랫폼과 프로토콜을 활용하여 미생물, 미생물 유래 대사물질, 장/뇌의 신경 전달물질 사이의 연관성에 대한 연구뿐만 아니라 시험관 내(organoids) 또는 생체 내 마우스 모델 시스템에서 장내 미생물 대사산물의 포괄적인 연구 가능성을 제시하였다.

출처: Nature Protocols, 2022
[그림 3-18] 다양한 유형의 미생물군 유전체 모델 제작의 워크플로우
(5) 식물/식품 대사체학(Plant/Food Metabolomics) 분야
중국의 Wenzhi Yang 연구팀은 질량분석기 기반 pseudo-targeted metabolomics를 활용하여 인삼의 정확한 인증과 복합 제형 제품 분류를 위한 진세노사이드 마커 발굴 연구를 수행하였다. 262개 진세노사이드 타깃 분석법을 구축하고 14개의 진세노사이드 마커를 동시에 검출하여 12개 인삼 잎 및 꽃 샘플 판별의 가능성을 제시하였다.

출처: Journal of Agricultural and Food Chemistry, 2023
[그림 3-19] 다양한 인삼의 잎 및 꽃의 분류와 주요 진세노사이드 함량 차이
식품 대사체 연구에서 식품 내 존재하는 수많은 대사체를 동정하는 것이 가장 시간이 오래 걸리고 어려운 과정이다. 이를 극복하기 위해 최근 미국의 Pieter C. Dorrestein 연구팀은 우리가 섭취하는 음식과 음료에 존재하는 복잡하고 다양한 대사체에 대한 정보와 데이터 제공을 위한 MS/MS 스펙트럼 검색 엔진인 foodMASST 플랫폼을 개발하였다. foodMASST를 활용하면 GNPS/MassIVE에 저장된, 알려져 있거나 알려지지 않은 모든 MS/MS 스펙트럼의 라이브러리 검색이 가능하여 많은 수의 식품 대사체 동정을 가능하게 하였다. 이를 통해 foodMASST를 활용한 식품 연구와 특정 식품 및 품질 평가를 위한 식이 바이오마커 발굴 활용성을 제시하였다.

출처: npj Science of Food, 2022
[그림 3-20] foodMASST 활용 워크플로우
다. 국내 연구 동향
한국기초과학지원연구원에서는 phospholipase A2 Receptor(PLA2R) 관련 막성 사구체신염 환자 소변 시료에서의 대사체 프로파일링 분석을 통해 막성 사구체신염 환자에서 정상인과 차이 나는 14개의 대사체를 확인하였고, 이 중에서 소변 내 fumarate 농도가 질병 대조군인 미세변화 신증후군 환자와 정상인보다 막성 사구체신염 환자에서 높음을 확인하였다. 또한, 막성 사구체신염을 가진 환자 중 치료에 반응하지 않은 환자에서 fumarate의 농도가 높음을 확인함으로써 치료 반응 모니터링 마커로서의 적용 가능성을 검증하였다. 또한 fumarate의 농도가 예후와 관련되어 있으며 In vitro 실험과 더불어 fumarate가 막성 사구체신염의 잠재적 치료 표적임을 제시하였다.

출처: Kidney International, 2021
[그림 3-21] 막성 사구체신염 환자의 치료 전후의 fumarate 농도 비교
서울대학교에서는 5-fluorouracil(5-FU)는 dihydropyrimidine dehydrogenase(DPD) 효소에 의해 대사되는 화학 요법 치료제로 DPD 효소 활성 부족이 중증도와 관련되었다는 기존 결과들을 바탕으로 DPD의 활성을 확인하기 위해 건강한 한국 남성 혈장에서 계산된 uracil(U)/dihydrouracil(DHU) 비율을 이용하여 DPD 활성 정도에 따른 2개 그룹을 비교하고자 하였다. 비표적 대사체학 분석을 통해 6개의 대사체가 DPD 활성이 높은 그룹과 낮은 그룹에서 유의적으로 차이를 확인하고, pyrimidine 대사에서 uracil의 전구체인 uridine의 레벨은 DPD 활성이 높은 그룹이 낮은 그룹보다 높았다. 이로써 DPD 부족이 혈장에서의 uridine 레벨에 영향을 줄 수 있으며, DPD 부족 환자를 확인하는 새로운 바이오마커로 활용될 수 있음을 보였다.

출처: Clinical and Translational Science, 2022
[그림 3-22] Dihydropyrimidine dehydrogenase(DPD) 활성 정도에 따른 대사체 변화
중앙대학교에서는 기체크로마토그래피-질량분석기를 활용한 대사체 프로파일링을 통해 멜라토닌의 농도별 Spirodela polyrhiza의 성장에 미치는 영향과 관련된 유용 대사산물에 대한 규명을 수행하였다. 멜라토닌은 Spirodela polyrhiza의 성장을 증가시킬 뿐 아니라 유용 대사체인 GABA, ascorbic acid, dopamine, serotonin, campesterol, β-sitosterol, stigmasterol의 생성을 증가시켰다. 이를 통해, 화장품, 식품/사료 및 제약 산업에서 Spirodela polyrhiza의 대량 배양동안 멜라토닌은 바이오매스와 유용 대사산물의 생산에 중요한 역할을 제시하였다.

출처: Agricultural and Food Chemistry, 2022
[그림 3-23] 멜라토닌 처리 Spirodela polyrhiza의 유용 대사산물의 농도 변화
라. 대사체학에서의 유망 기술
기존의 대사체 분석에 비해 안정 동위원소표지 추적자를 활용한 대사흐름(metabolic flux) 분석기술은 ‘동적’ 대사조절에 대한 정보 확보가 가능하여 최근 질환 메커니즘 규명 연구에서 주목받고 있는 기술이다. 특히, 다중경로와 여러 상호작용에 영향을 받아 변화하는 대사산물의 농도에 대한 정확한 정보를 확보할 수 있게 하며, 대사흐름에 대한 측정이 가능하여 생체대사의 조절 메커니즘을 이해할 수 있는 가장 효과적인 방법으로 활용할 수 있다.

출처: Trends in Analytical Chemistry, 2023
[그림 3-24] 안정동위원소표지 추적자를 이용한 대사체 라벨링 및 시료 전처리 방법
지질은 생리학적 변화 과정에서 중요한 역할을 담당하기 때문에 지질 대사의 조절 장애는 만성 대사질환, 퇴행성 신경질환 및 종양 발생과 연관성이 높다. 최근 지질체학(lipidomics) 연구가 활발히 진행되고 있지만, 구조적 특성상 다양한 이성질체가 존재하기 때문에 지질 확인의 정확성을 향상시키는 기술의 필요성이 제시되고 있다. 이와 같은 한계점 극복을 위해 독일의 Laura Bindila 연구팀은 이온 이동성(ion mobility) 분리가 가능한 액체크로마토그래피-질량분석기를 활용하여 m/z, 머무름 시간, 충돌단면적(collision cross section, CCS), 질량 조각 이온 정보를 포함한 4D lipidomics 플랫폼을 개발하고 표준 혈장 샘플에서 370개의 지질과 혈청 샘플에서 364개의 지질에 대해 높은 재현성과 정확성이 획기적으로 향상된 대량신속처리(high throughput) 프로파일링이 가능한 4D lipidomics 유용성을 제시하였다.

출처: Nature Communications, 2023
[그림 3-25] 4D lipidomics 기반 ion mobility 분리와 lipid isomer 분리 분석 예시
생체 기관 및 조직은 혈관, 다양한 세포 등 이질적인 미세환경을 가지며 이들의 상호작용에 따라 대사변화가 일어난다. 이러한 미세환경 내 대사변화를 연구하기 위해 matrix-assisted laser desorption /ionization–mass spectrometry(MALDI-MS), desorption electrospray ionization–mass spectrometry(DESI-MS), laser ablation–inductively coupled–plasma–mass spectrometry, secondary ion mass spectrometry(SIMS)와 같이 고도화된 이미징 질량 분석법 기반 공간 대사체학(spatial metabolomics) 기술이 개발되었다. 대사체를 공간 및 시간적으로 프로파일링하여 다각도의 대사 변화에 대한 멀티 스케일에서의 더 심도깊고 체계적인 생물학적 과정 이해를 위한 정보를 제공할 수 있게 되었다.
중국의 Michael Q. Zhang 연구진들은 in situ 단일 세포 수준에서 대사체 프로파일과 조직 미세환경에 대한 포괄적 정보를 제시함에 따라 이전의 세포 대사체 프로파일에서 소실되었던 정보 제공이 가능한 SIMS 기반 spatial single nuclear metabolomics(SEAM) 플랫폼을 개발하였다. 이를 활용하여 복잡한 간 조직 내 다양한 간세포, 표피세포, 쿠퍼 세포의 서로 다른 대사 패턴을 제시하여 공간적인 대사체 정보제공이 가능함을 보여주었다.

출처: Nature Methods, 2021
[그림 3-26] SEAM 활용 간조직의 대사 패턴과 간조직 내 공간 정보 데이터
5. 시스템생물
가. 시스템생물학 개요
지구상의 수많은 생명체는 지질막 내부에 수많은 거대분자 간의 상호작용으로 생명 활동을 유지한다. 따라서 다양한 생명현상을 이해하기 위해서는 단일 유전자, 단일 단백질 등의 움직임뿐만 아니라 복합적인 유전자들의 움직임과 단백질들의 상호작용 분석이 필요하다. 시스템생물학은 이러한 관점에서 생물학적 시스템의 복잡성을 해석하는 전체적인 접근 방식으로, 생명체 내부의 다양한 생명현상을 시스템 수준에서 이해하고 모델링하는 것을 목표로 한다. 이를 위해 생물학적 지식뿐만 아니라, 전산학, 공학, 생물 정보학, 물리학 등 여러 학제간 융합에 기반하여 접근함으로써 생명체 내 시스템이 다양한 환경조건에서 시공간적으로 어떻게 변화하는지 분석하고, 이해할 수 있으며, 이를 넘어 예측하고자 한다.
차세대염기서열분석(Next-Generation Sequencing, NGS) 기술의의 개발 이후, 생명활동에 필요한 다양한 분자생물학적 움직임을 다양한 차원에서 대량・고속 분석이 가능케 되었다. 이렇게 생성된 막대한 양의 데이터들을 처리할 수 있는 딥러닝 및 인공지능 기술들이 개발되면서 시스템생물학 접근법은 더 이상 유망기술이 아닌 생명 활동을 이해하기 위한 필수적인 접근법으로 자리매김하고 있다.
특히 인공지능의 폭발적인 발전으로 시스템생물학 접근법은 적은 비용과 빠른 속도로 질병에 대한 새로운 바이오마커를 대량으로 발견하는 것이 가능하게 했고, 독특한 유전자 프로필에 따라 환자를 분류하며, 개별 환자 맞춤형 약물 투여 및 예후 관측을 가능케 하고 있다. 나아가 빅데이터 시대에서 사람의 직관으로는 이해할 수 없는 다차원적 데이터를 식별가능한 형태로 분류 및 분석하여 새로운 결론을 도출해내는 ‘데이터 기반(Data-driven) 연구’를 가능하게 한다. 이렇게 생성된 빅데이터들은 다시 인공지능에 의해 분석되면서 연구 흐름을 더욱 가속화하고 주도하게 될 것이다.
나. 해외 동향
최근 시스템생물학 연구의 주요 연구 주제는 ① 단일 세포 생물학의 확장(expansion of single-cell biology), ② 마이크로비옴 분석(decoding the microbiome), ③ 인공지능과 딥러닝의 활용(application of AI and deep learning), ④ 합성생물학의 진보(advancement of synthetic biology)로, 이들 모두는 Nature 저널지가 주목한 향후 기술로 소개된 바 있다. 특히, 2000년대에 개발된 NGS 기술로 생성된 막대한 양의 생체 빅데이터들이 인공지능과 융합되기 시작하면서, 데이터의 생산・분석 및 해석을 이전과는 비교할 수 없는 정도로 고속・융합・대량으로 처리할 수 있게 되었다. 이러한 시스템생물학의 비약적인 기술의 진보가 유전자가위 및 합성생물학과 결합되면서 생명공학 전반에 걸쳐 매우 활발히 연구되고 있으며, 전 세계 바이오벤처에 붐을 일으키고 있다고 해도 과언이 아니다.
(1) 차세대염기서열시퀀싱 기술의 진보
(가) 단일 세포 생물학
NGS 기술을 응용한 다양한 염기서열분석 기술들이 등장하면서 생명체 내 다양한 생체정보를 이해할 수 있게 되었다. 이러한 염기서열 분석 기술들이 형광유세포분석기(Fluorescence-activated cell sorting, FACS), 미세유체기기(microfluidic device) 등과 접목되면서 생명체 혹은 조직 수준의 염기서열분석 해상도가 단일세포(single cell) 수준까지 활용할 수 있게 되었다. 이러한 단일세포 염기서열 분석 기술은 다음 그림과 같이 기존 생명체 혹은 조직을 구성하는 전체 세포 내의 DNA, RNA 정보의 평균화된 신호를 측정할 수밖에 없던 한계를 넘어 각각의 세포 단위로 변화하는 신호를 분리하여 세포들의 이질성(heterogeneity)을 측정할 수 있게 되었다. 해당 단일 세포 시퀀싱을 통해 유전체(Genomics), 전사체(transcriptomics)와 같은 영역의 대량의 생체정보를 축적할 수 있게 되어, 신경학, 면역학, 조직학, 줄기세포 등 다양한 분야에 걸쳐 연구의 규모가 급속도로 증가 중이며 국제 학술지에도 관련 연구 논문이 많이 발표되는 추세이다.

출처: Patel, A.P., et al, Science, 2014
[그림 3-27] scRNA-seq을 이용한 종양 내 교모세포종 간 이질성(heterogeneity) 정량 결과
이러한 단일세포 시퀀싱 분석 기술은 크게 ① scRNA-seq(Single cell RNA-sequencing)을 이용한 전사체 분석기술, ② 단일 세포 분석을 이용한 DNA methylation, histone modification 등의 후성유전체(epigenome) 분석기술, ③ 단일 세포 분석을 이용한 단백체(proteome) 분석기술, ④ 단일세포 공간 전사체 분석기술(spatial transcriptomics)로 크게 나눌 수 있으며, 나아가 다양한 NGS 기술들이 단일세포 수준에 적용되고 있다.
[표 3-7] 단일세포 다중오믹스 분석기술
|
기술 |
대상 |
세포 분리 방법 |
시퀀싱 속도 |
자동화 여부 |
|
DR-seq [8] |
유전체, 전사체 |
Mouth pipette |
느림 |
아니오 |
|
G&T-seq [10] |
유전체, 전사체 |
FACS |
중간 |
예 |
|
scTrio-seq [5] |
CNV, DNA CpG methylation, 전사체 |
Mouth pipette |
느림 |
아니오 |
|
scMT-seq [6] |
SNPs, scRNA-seq, DNA CpG methyl- ation, 전사체 |
Microcapillary pi- pette |
느림 |
부분적 |
|
scM&T-seq [7] |
DNA CpG methylation, 전사체 |
FACS |
중간 |
예 |
|
scNOMe-seq [21] |
Chromatin accessibility, DNA CpG methylation |
FACS |
중간 |
아니오 |
|
scCOOL-seq [16] |
CNV, Chromatin accessibility, DNA CpG methylation |
Micromanipulator |
느림 |
아니오 |
|
scNMT-seq [17] |
Chromatin accessibility, DNA CpG methylation, 전사체 |
FACS |
중간 |
부분적 |
최근에는 AI를 기반으로 하는 빅데이터 전산처리 기술들이 발전하면서 이러한 정보들을 융합한 다중 오믹스(multi-omics) 분석을 통해 생명 활동을 다각도에서 이해하고자 하는 움직임이 주를 이루고 있다.

출처: 배서경 et al , 단일 세포 다중 오믹스 분석 (Single cell multi-omics analysis), 생화학분자생물학회
[그림 3-28] 다양한 단일 세포 시퀀싱 기술과 다중 오믹스 분석 방법의 예시
글로벌 단일세포 시퀀싱 분석시장 규모는 2025년 약 56억 달러 규모를 형성할 것으로 예측된다.6) 세계 시장 전망 기간 중 특히 아시아-태평양 시장은 예측기간 동안 가장 높은 성장세를 보일 것으로 예상된다. 이는 많은 환자 인구의 분포와 정부의 R&D 투자 증가, 아시아 CRO(Contract Research Organization, 임상시험 대행 기관)에 대한 약물 발견 서비스 등의 시장이 단일 세포 분석 수요를 주도하는 주요 요인이라 할 수 있다. 줄기세포 연구 분야의 단일세포 분석 응용은 정부의 지원 증가와 함께 암 연구의 접목이 단일세포 시퀀싱 분석시장의 성장을 이끄는 주요 요인으로 작용할 것으로 예측된다.7)

출처: MarketandMarket ‘Single-cell-analysis-market’-Global Forecasts to 2026
[그림 3-29] 단일세포 분석 응용 분야 시장 전망(2017~2025)
단일세포 시퀀싱 분야의 가장 큰 시장인 미국의 경우, 10X지노믹스(10X Genomics) 사는 Chromium system을 통해 단일세포 시퀀싱 분야에 연구 접목 시장을 개척한 후 보다 정확성이 개선된 단일세포 시퀀싱을 희귀질환 치료에 접목하려는 움직임을 보이고 있고, 서모피셔 사이언티픽(ThermoFisher Scientific) 사는 ‘Cells-to-CT kit’이라는 표준화된 플랫폼을 통해 유전자 발현 분석용 워크플로우를 서비스 중이다. 나아가 학계에선 샌디에이고 의과 대학 연구팀 마일스 윌킨슨(Miles F. Wilkinson) 교수는 단일세포 유전자 발현 분석기법을 기반으로 사람의 정원줄기세포(Spermatogonial Stem Cells, SSC)를 시험관에서 배양하는 방법을 밝혔다.8) 텍사스 MD 엔더슨 대학 연구팀 코이치 타카하시(Koichi Takahashi) 교수는 단일세포 DNA 시퀀싱 방법을 통해 123명의 급성골수성백혈병(Acute Myeloid Leukemia, AML) 환자의 clonal 구성과 돌연변이 내력을 보고하였다.9) 카롤린스카 연구소 마틴 엔지(Martin Enge) 교수는 단일세포 수준의 전염기시퀀싱과 유전자 발현의 조인트 분석 방법(Direct Nuclear Tagmentation and RNA sequencing, DNTR-seq)을 개발하여 단일세포 내에서 스케일업 가능한 mRNA와 전장유전체분석(whole-genome sequencing) 플랫폼을 확립하였다.10)
(나) 염색체의 3D 구조 분석
앞서 소개한 차세대 염기서열 분석기술(Next generation sequencing, NGS)은 매우 다양한 형식으로 생명체에 적용되었는데, 최근에는 3C(chromosome conformation capture), Hi-C 및 이의 파생기술인 GAM(genome architecture mapping), SPRITE(Split-Pool Recognition of Interactions by Tag Extension) 등의 기술들이 개발되면서 세포 염색체의 3차원 구조에 대한 해석이 나오면서, 유전체 2차원 평면상에 수 Mbp 떨어진 영역들이 염색체의 3차원 구조에서는 매우 근접하게 되면서 주요 유전자의 전사 발현에 매우 중요한 역할을 한다는 것이 증명되고 있다.11) 2021년에 루스템 F. 이스마길로프(Rustem F. Ismagilov) 그룹과 미첼 구트만(Mitchell Guttman) 그룹은 단일 세포 수준에서의 유전체 구조를 해석하였고,12) 일본의 유이치 타니쿠치(Yuichi Taniguchi) 그룹은 염색체를 구성하는 기본 단위인 뉴클레오솜(nucleosome)의 위치와 방향을 규명하였다.13) 2022년에 마친 이멜리스키(Marcin Imieliński) 그룹은 nanopore long read 시퀀싱 기법을 도입한 Pore-C를 개발하면서 보다 다양한 영역에서의 상호작용을 규명하였고,14) 인디타 라자팍세(Indika Rajapakse) 그룹은 이러한 Pore-C를 전사인자 결합 부위와 통합 분석하여 세포 특이적 3차원 전사 영역에 대한 연구를 수행하였다.15)

출처: Stevens, T., et al, Nature, 2017
[그림 3-30] 단일 세포 수준에서의 유전체 구조 연구
(2) 마이크로비움
마이크로비옴(Microbiome)은 특정 환경에 서식하고 있는 미생물 군집(마이크로바이오타, Microbiota)과 이들의 유전정보 전체를 뜻하는데, 이러한 마이크로비움이 사람을 포함한 동물, 나아가 식물의 성장 및 질병 등에 영향을 미친다는 사실이 밝혀지면서 마이크로비움에 대한 연구는 새로운 미생물학의 지평을 열었다. 특히 NGS기술로 마이크로비움을 이해하기 위한 다양한 연구들이 수행된 바 있다.
[표 3-8] 마이크로비옴의 분류
|
분류 |
설명 |
관련 산업 |
|
인간 마이크로비옴 (Human Microbiome) |
인체 내, 외부의 여러 서식처에서 다양한 생태학적 지위를 획득하여 인간과 공생관계를 유지하는 미생물군의 집합체 |
식품발효 및 유가공 산업 화장품, 피부치료제 |
|
장내 마이크로비옴 (Gut Microbiome) |
주로 위장관 내에 존재하며 미생물과 미생물, 숙주와 미생물 간의 복잡한 상호관계를 이루는 미생물군으로 인간(동물) 마이크로비옴의 일부 |
건강기능식품 질병치료제 축산(생장, 사료, 예방) |
|
식물 마이크로비옴 (Phytobiome) |
식물과 토양, 공기, 물, 기후 등의 환경, 그리고 식물과 연고나되어 있는 미생물, 동물, 기생식물 등으이 모든 생물 군집의 총합 |
농업(육종, 비료, 영양제) |
|
항생제 내성관리 (Resistome) |
항생제에 대한 저항성을 가진 미생물과 관련된 모든 유전자들의 집합 |
농, 축, 수, 산물 생산업 식의약품 제조 |
(가) 인간 마이크로비옴
인체 내 마이크로비옴은 인간의 세컨드 게놈(Second Genome)으로 불릴 만큼 인체에 미치는 영향력이 매우 크다고 알려져 있다. 인체 곳곳에 존재하는 미생물 총 수는 인간 세포의 2배 이상이며, 이들의 유전자 총합은 인간 유전자 개수의 100배 이상으로 알려져 있다. 인체 마이크로비옴은 서식하는 신체 부위에 따라 미생물 종류와 수가 다르며, 이에 따라 각 군집마다 서로 다른 특성을 나타낸다.

출처: 미국국립보건원(National Institute of Health) 주관 인체 마이크로비옴 프로젝트 자료
[그림 3-31] 신체 다양한 부위에 따라 존재하는 미생물 군집의 종류
[표 3-9] 인체 마이크로비옴의 주요 기능
|
기능 |
설명 |
|
영양분 흡수 |
동일한 영양분을 섭취하더라도 개개인의 마이크로비옴 구성에 따라 영양분 흡수 양상에 차이가 존재 |
|
약물대사 조절 |
체내에 유입된 약물 및 발암 물질로부터 인체를 보호 |
|
면역작용 조절 |
인체 면역체계와 상호작용을 통해 외부의 병원성 미생물로부터 인체를 보호 |
|
발달 조절 |
마이크로비옴 생성물질은 뇌 발달 및 신경 조절을 통한 행동 발달에 영향 미침 |
사람 마이크로비옴의 95%는 장을 포함한 소화기관에 존재하며 나머지는 피부, 구강, 생식기, 호흡기 등에 널리 퍼져 있다. 이들의 주요 기능은 영양분 흡수, 약물대사 조절, 면역 작용 및 발달 조절 등으로 인간 건강에 지대한 영향을 미치고 있다. 다양한 인체 부위 중에서도 장(張) 내에는 가장 많은 미생물이 서식하고 있으며 매우 다양한 종류의 미생물들로 구성되어 있다. 장내 마이크로비옴(Gut Microbiome)은 주로 위장관 내에 서식하며, 미생물끼리의 상호작용과 더불어 숙주와 미생물 간의 복잡한 상호작용을 통해 인간 건강에 큰 영향을 미친다고 알려져 있다. 장내 마이크로비옴과 관련된 인간 질병과 건강 분야는 매우 광범위하며, 비만이나 당뇨병과 같은 대사질환, 아토피 등의 피부질환, 그리고 우울증 등의 정신 질환 및 노화까지 영향을 미친다고 보고되어 있다.
(나) 차세대염기서열분석기반 마이크로비옴 연구
NGS의 급격한 발달로 인해 염기서열 분석 속도가 매우 빨라졌으며 그 비용도 크게 절감되었다. 이러한 초고속 대용량 염기서열 분석은 인간 게놈보다 수백 배 이상의 유전자를 포함하는 마이크로비옴의 초고속 분석을 이끌어 냈다. 이러한 게놈 분석과 더불어 유전자, 전사체, 단백질, 대사체 등의 각 부분들의 관련성으로부터 새로운 지식을 창출하는 오믹스(Omics) 분석을 결합하여 마이크로비옴의 특성 및 인체 내에서의 작동 기전 연구까지 진행되고 있다. 이 때문에 인간 마이크로비옴의 존재 및 활용에 대한 연구는 식품과 제약 기업에도 큰 바람을 일으키고 있다.
[표 3-10] 마이크로비옴의 활용
|
활용 분야 |
설명 |
|
진단 분야 |
질병을 가진 환자와 건강한 사람의 장내 마이크로비옴을 비교하였을 경우, 환자의 마이크로비옴의 불균형이 발견되었으며, 질환별 마이크로비옴의 구성에 차이가 있음을 확인함. 이에 착안하여 장내 마이크로비옴을 다양한 바이오마커로 사용하는 연구가 진행되고 있음 |
|
치료제 개발 |
장내 미생물을 이용한 치료제 연구개발이 가장 활발히 이루어 지고 있으며, 피부질환, 여성 생식기 질환에서도 활발히 진행되고 있음 |
|
식품산업 |
미생물 활효를 통해 생산되는 전통 발효 식품인 김치와 치즈, 요구르트 등에서부터 분리한 미생물로부터 프리바이오틱스 및 프로바이오틱스 소재 건강기능식품까지 확대됨 |
|
축산업 |
사람의 경우와 유사하게 동물도 특정 마이크로비옴을 고농도로 장기간 투여시, 동물의 장 건강뿐만 아니라 고품질의 축산물 생산과 축사환경 개선이 가능할 것으로 연구됨 |
이러한 마이크로비옴의 중요성을 일찍 인식한 미국, 유럽 등의 글로벌 과학기술 강국에서는 약 10년 전부터 휴먼 마이크로비옴의 중요성을 인지하고, 막대한 자금과 연구 인력을 투입하여 범국가적인 대규모 프로젝트를 진행하고 있다.

출처: HMP(www.hmpdacc.org), MetaHIT(www.metahit.eu)
[그림 3-32] 대표적인 인체 마이크로비옴 대형 국제 프로젝트
특히 미국의 경우, 인간 마이크로비옴 프로젝트(Human Microbiome Project, HMP)가 2007년부터 10년간 미국 국립보건원을 주관으로 진행된 해당 프로젝트는 전 세계적으로 가장 큰 금액(10억 달러 이상)이 투자된 프로젝트로 알려져 있다. 해당 프로젝트의 목표는 첫 번째, 다양한 인체 부위 각각의 미생물 구조 및 유전체 서열 분석을 통해 인간 마이크로비옴 참조 유전체(Reference Genome)를 구축하는 것이며, 두 번째는 마이크로비옴 연구 기술 및 분석 방법 개발 및 공개를 통한 세계 연구자들의 지원이다. 마지막으로는 인체 마이크로비옴 변화에 따른 인간 질병과의 연관성을 발견하는 것이다. 위 세 가지 목표를 통해 인간 질병과 장내미생물 간의 상관관계를 이해하고 질병에 대한 인간의 숙제를 푸는 것이 HMP의 최종 목표이다.

출처: Nature, 미국국립보건원 (NIH) Human Microbiome Portfolio Analysis Team, 2019
[그림 3-33] 미국 NIH 인간 마이크로비옴 투자 현황(2007~2016)
이러한 대규모 프로젝트를 1기, 2기로 나눠 수행한 결과 인간의 구강, 비강, 질, 소화기, 피부 등 다양한 신체 부위에 서식하는 미생물 군집의 구조 분석 및 유전체 서열결정을 통해 ‘참조 유전체 서열 데이터 베이스’ 구축에 성공하였다. 이렇게 확보한 대량의 유전체 데이터를 다양한 멀티오믹스(Multi-omics) 분석으로 미생물과 숙주 간의 상호작용과 관련된 통합적 분석을 진행하여 대표적으로 임신 및 조산, 염증성 장질환, 2형 당뇨병과 마이크로비옴의 상관관계를 밝혔다.
유럽의 경우 2008년부터 2012년까지 네덜란드, 독일, 덴마크, 이탈리아, 영국, 스페인, 중국, 프랑스 등이 참여한 ‘MetaHIT’이라는 프로젝트에 약 250억 원 이상의 연구비를 투자하였다. 이 프로젝트로 질병과 장내 마이크로비옴 비교 분석을 통한 마이크로비옴과 인간 건강의 연관성을 밝힌 바 있다.
이 외 세계 각국은 다양한 대규모 투자를 통해 인간 마이크로비움의 연구를 수행하였고, 이에 따른 엄청난 양의 메타지노믹스(Metagenomics) 빅데이터를 구축한 바 있다.
최근 앞서 언급한 단일 세포 시퀀싱 기술이 크게 발전하면서 마이크로비움의 연구 역시 단일 세포 수준의 해상도를 가진 데이터들이 생산되고 있어 질병에 연관이 있는 마이크로비움의 변화를 종 수준에서 해석할 수 있을 것이라 기대한다.
출처: Zheng et al., Science, 2022
[그림 3-34] 단일 세포 수준 장내 마이크로비옴 분석 기술
(3) 인공지능과 딥러닝
현재 전 세계는 바야흐로 인공지능의 시대라 할 수 있다. 이러한 인공지능 기술은 사회 각 분야에서 활용하지 않는 분야가 없으며, 생명공학 분야에서도 매우 다양한 방법으로 활용되고 있다. 특히 NGS 기술로 생산된 엄청난 생체데이터들의 융합분석에 있어 인공지능은 매우 강력한 힘을 발휘하고 있다. 이러한 인공지능이 합성생물학을 만나면서, 비로소 생명공학의 비약적인 발전을 눈 앞에 두고 있다고 할 수 있다.

출처: Zeeshan Ahmed, Human Genomics, 2020
[그림 3-35] 다양한 오믹스 빅데이터의 AI 기반 융합 분석 모델
이러한 인공지능이 가장 크게 빛을 발휘하는 분야는 신약개발 분야이다. 전통적인 신약개발 과정은 막대한 시간과 비용, 노동력을 투입하는 과정이었다. 하나의 신약개발에 약 15년 이상, 수천억 원에서 2조 원 정도의 비용이 소요되며, 5,000∼1만여 개 중 1개만이 신약개발에 성공하며 시판된다.16) 실제로 연구원들이 5년 이상의 기간에 걸쳐 전임상에 들어가는 신약후보물질을 발굴하는 데 비해 AI를 활용하면 신약후보물질 발굴 기간을 1년 이하로 줄일 수 있다.

출처: KKIDI Brife report, 2020, vol.314, 신약 디자인에서 AI 기반의 약물 생성 예측 모델을 이용한 강화 학습과 화학정보학, 강수임, 2023
[그림 3-36] 전통적인 신약개발 과정과 인공지능 기반 신약개발 비교

출처: Jumper et al., Nature, 2021
[그림 3-37] 구글 DeepMind의 AlphaFold2 단백질 구조예측 개요
이러한 AI 기반 신약, 항체 등의 개발은 2021년 구글 DeepMind의 AlphaFold2와 David Baker 그룹의 RoseTTAFold의 등장에 힘입어 급격하게 가속화되고 있다. 이러한 구조예측 알고리즘은 기존에 실험적 의존성이 높던 단백질 구조예측과정의 속도와 정확도를 비약적으로 개선했고, 단백질 구조에 대한 빅데이터 역시 급격하게 축적되고 있다.
나아가 해외의 많은 연구 그룹들은 단순히 단백질의 구조만을 예측하는 것을 넘어, mutation screening, chemicals 혹은 ligand 기질들과의 docking 시뮬레이션 등의 알고리즘을 적용하여 컴퓨터 시뮬레이션을 통해 단백질-기질의 결합과정을 다양하게 연구할 수 있게 되었다. 이러한 과정이 AI에 의해 고속・대량으로 생산・분석되고, 나아가 연구자의 영역이었던 해석 단계에도 적용되기 시작하면서 신약개발에 소요되는 시간과 비용, 노동력을 비약적으로 감축시키고 있으며, 누적되는 데이터의 양이 많아질수록 AI 기반의 신약개발 과정은 더욱 가속화될 전망이다. 이러한 AI 기반의 신약개발은 단순히 표적과의 결합을 예측하는 것을 넘어, 임상시험에서의 독성 여부를 검증하는 단계까지 다양하게 적용되고 있다.

출처: Clent et al., Journal of Chemical Education, 2021
[그림 3-38] 단백질 구조예측 및 docking 시뮬레이션을 통한 신약 설계과정
2019년 홍콩 인실리코 메디슨과 캐나다 토론토대학교는 단 46일 만에 인공지능 플랫폼을 이용하여 섬유증 치료제 후보물질을 발굴하였고, 3만 개의 섬유증 단백질 타깃을 21일 만에 스크리닝 해내는 놀라운 성과를 보여주었다. 2022년 7월 최종 약물 후보물질(INS018_055)을 임상 1상 지원자에게 투여하였다고 발표했으며, 이는 AI가 발견하고 설계해 임상 단계까지 진입한 최초의 약물이다. 이러한 AI에 의한 신약개발이 가속화되는 흐름에서 세계 굴지의 제약회사 아스트라제네카(AstraZeneca), 화이자(Pfizer) 등의 업체들이 구글이나 마이크로소프트 등의 AI 등의 업체들과 협업 하는 등의 사례가 늘어나고 있다.
이러한 기업들의 신약개발 흐름과 발맞춰, 세계 최고 수준의 대학 및 연구소에서도 AI를 활용한 타깃 단백질-타깃 기질 간의 결합을 예측하고 설계하는 연구들이 많이 수행되고 있다. 대표적으로 미국 캠브리지(Cambridge)의 제임스 콜린스(James J. Collins) 그룹은 2020년 AI를 기반으로 새로운 항생제를 고속・대량으로 시뮬레이션함으로써 새로운 항생제를 개발하는 프로토콜을 통해 수억 개의 화학물질 중에서 십만 개 단위로 타깃을 빠르게 줄였고, 최종적으로 새로운 항생제를 찾는 데 성공하였다.17) 이러한 연구는 2021년 알파폴드(AlphaFold) 구조예측 알고리즘과 결합하여 더욱 빠르고 정확한 항생제 및 타깃 단백질을 선별하는 방법을 소개하였다.18)
[표 3-11] AI 기반 신약 개발에 뛰어든 주요 기업들의 발표내용
|
Companies |
Date |
Headline |
|
BenevolentAI, AstraZeneca |
April 2019 |
AstraZeneca partners with BenevolentAI to identify new drug candidates for chronic kidney disease and idiopathic pulmonary fibrosis. |
|
Insitro, Gilead |
April 2019 |
Gilead becomes first big pharma company to sign 3-year deal with Insitro to apply its Insitro Human platform to identify new drug targets for non-alcoholic steatohepatitis by creating experimental models of the disease. Insitro will be paid $15 million upfront in a deal potentially worth $1 billion. |
|
Exscientia, Rallybio |
July 2019 |
Exscientia brings its AI drug discovery platform Centaur Chemist to a partnership with Rallybio to discover small- molecule drugs for rare diseases. |
|
Microsoft, Novartis |
October 2019 |
Novartis announces strategic alliance with Microsoft to apply their Al algorithms to its large datasets to identify and develop therapeutics. |
|
ZebiAI Therapeutics, Google Accelerated Science |
January 2020 |
ZebiAl Therapeutics collaborates with Google Accelerated Science to discover small-molecule drug candidates using its machine learning and DNA-encoded library technologies. |
|
Exscientia, Bayer |
January 2020 |
Bayer collaborates with Exscientia to discover cardiovascular and oncology drug candidates using their artificial intelligence drug discovery platform Centaur Chemist. |
|
BioSymetrics, Sema4 Johnson&Johnson |
August 2020 |
J&J's Janssen partners with BioSymetrics and Sema4 in a collaboration that aims to apply machine learning to predict onset and severity of COVID-19 among different populations, with a goal of developing new treatments and vaccines. |
|
Recursion Pharmaceuticals, Bayer |
September 2020 |
In addition to its Series D financing round, Bayer partners with Recursion Pharmaceuticals in drug development deal for new small-molecule therapies to treat fibrotic diseases using Recursion's Al-guided drug discovery platform. |
|
Insitro, Bristol Myer Squibb |
October 2020 |
Insitro will use its machine-learning technology Insitro Human platform to identify potential drug targets by developing predictive models of amyotrophic lateral sclerosis and frontotemporal dementia. Bristol Myers Squibb will then choose candidates to develop further. |
|
Genesis Therapeutics, Genentech |
October 2020 |
Genesis Therapeutics partners with Genentech in multi-target drug development deal using Genesis' graph machine learning capabilities to identify drug candidates for a range of disorders |
|
Roivant, Silicon Therapeutics |
February 2021 |
Roivant buys Silicon for $450 million, including its physics-based platform for in silico small-molecule drug design, to be integrated with Roivant's machine learning approaches. |
|
Exscientia, University of Oxford |
February 2021 |
Exscientia and the University of Oxford collaborate to develop treatments for Alzheimer disease |
|
Iktos, Pfizer |
March 2021 |
Iktos will apply its AI-driven de novo design software to a number of Pfizer's small-molecule programs. |
|
ZebiAI Therapeutics, Relay Therapeutics |
April 2021 |
Relay buys ZebiAI for $85 million upfront and a further $185 million in potential milestone payments. |
출처: Neil Savage, Nature biopharmdeal, 2021

출처: Stokes et al., Cell, 2020
[그림 3-39] AI 기반 새로운 항생제 스크리닝 프로토콜

출처: Wong et al., Molecular Systems biology, 2021
[그림 3-40] AlphaFold2 기반 타깃단백질-기질 결합 시뮬레이션을 통해 새로운 항생제 개발
(4) 합성생물학의 진보
최근 인공지능과 데이터를 기반으로 하는 시스템생물학과 함께, 로봇 등 첨단 디지털 기술과 융합된 기술들의 발전으로 합성생물학 역시 크게 발전하고 있는 분야이다. 합성생물학은 개별적인 부품들을 조립하여 자동차를 제조하듯 생명과학에 공학적 개념을 도입했다. 분산된 바이오부품의 표준화를 통해 유전자로 대표되는 생물의 기본단위인 게놈의 구성요소를 합성, 새로운 바이오 시스템을 제작한다. 생물의 기초요소의 조작을 통해 기존 생명체를 모방 혹은 변형하거나 새로운 생명 구성요소 및 시스템을 설계 및 구축하는 등 디지털 기술에 기반한 접근방식으로, 합성생물학은 화학, 의료, 생명에서부터 환경 문제까지 다양한 분야가 직면한 문제에 대한 새로운 해결책을 제공할 수 있는 바이오경제의 핵심 기술로 대두되고 있다. 최근 비교적 단순한 미생물의 인공적 제작이 가능한 기술 단계까지 도달한 합성생물학은 바이오파운드리의 도입으로 생명분야의 고질적 문제인 속도, 규모, 불확실성 한계의 극복을 통해 견인과 혁신으로 바이오 제조 혁명을 가속화 할 전망이다.
(가) 바이오파운드리
바이오파운드리는 합성생물학에 로봇 및 인공지능을 도입하여 새로운 바이오 시스템 제작을 위한 설계(Design)-제작(Build)-시험(Test)-학습(Learn) (DBTL)의 각 단계를 자동화 및 고속・고병렬적으로 구동하는 시스템이다. 바이오파운드리는 최종 바이오 시스템을 실물화하기 위한 포괄적이고 고도화된 바이오 인프라 시설로, 정밀한 바이오 시스템 설계기술과 도출된 설계 논리에 따라 DNA 합성・조립에서부터 제작된 바이오 시스템의 성능을 고속・대용량으로 테스트하는 장비를 연결・구동하는 자동화 소프트웨어, 인력 및 바이오데이터 관리 시스템 등을 지칭한다.

출처: 과학기술정보통신부
[그림 3-41] 바이오분야의 복잡성/다양성 문제를 극복하기 위한 DBTL 전략
바이오파운드리 기술의 근간이 되는 합성생물학은 기존 생명체를 모방하거나 자연에 존재하지 않는 인공생명체를 제작하는 것을 목표로 하는 학문이다. 합성생물학은 생물학 분야의 패러다임 전환을 이끌고 미래 바이오산업 경쟁력을 제고하는 미래지향적 기술로서 주목받고 있다. 유전체 기반기술의 발전과 데이터 축적은 유전체 해독(Read/학습)에서 합성(write/창작)으로 생명과학의 패러다임 전환을 유발하였다. 일례로, 인간게놈프로젝트(1990∼2003) 이후 인간게놈합성프로젝트(2016∼2025) 추진으로 생명현상 이해에서 진일보한 유용한 기능을 설계하는 단계에 진입하였다.19) 2021년 자가 번식이 가능한 492개의 유전자를 갖는 인공생명체 JCVI-syn3A를 합성하였고,20) 이를 통해 합성생물학의 설계・제작을 통하여 단순한 인공적 생명체 제작이 가능한 기술 단계로 진입하였다.

출처: 과학기술정보통신부
[그림 3-42] 바이오파운드리, 근간기술 및 파급효과 개요
바이오파운드리 인프라는 바이오 연구개발에 고질적인 문제인 불확실성과 낮은 생산성 등의 합성생물학의 한계를 극복하고, 바이오 제조공정의 속도와 규모, 그리고 생산효율의 향상시킨다. 더 나아가 반복 노동업무를 자동화하고 처리량을 극대화해 기존 기술로는 불가능한 규모의 바이오 R&D를 현실화한다. 현재는 운영 주체에 따라 공공과 민간 바이오파운드리로 구분하고 있으며, 미국의 깅코 바이오웍스(Ginkgo Bioworks) 등 소수의 민간 바이오파운드리를 제외하면 대부분의 국가에서 공공 바이오파운드리의 형태로 구축 및 운영하고 있다.

출처: Dixon et al. Nature Communications, 2022
[그림 3-43] 바이오파운드리의 구성요소 개요
이러한 합성생물학은 DNA 부품의 미검증, 유전자 회로의 낮은 예측가능성, 부품 간 낮은 호환성, 생물의 복잡성, 부품 반응의 불확실성, 그리고 장시간의 연구개발-제품 판매 기간과 같은 한계가 존재한다.21) 바이오파운드리는 바이오산업의 오랜 난제인 불확실성과 낮은 생산성 등의 합성생물학의 한계를 극복하고, 첨단 기술(빅데이터, AI, 자동화 로봇 등)과의 융합으로 기존 바이오 프로세스 개발의 속도와 규모를 크게 향상하며 4차 산업혁명의 첨병 역할을 할 것으로 주목받고 있다.

출처: 과학기술정보통신부
[그림 3-44] 바이오의 취약점인 기술개발 불확실성, 소요기간, 비용 극복에 합성생물학 전략 필요
바이오파운드리 기반 합성생물학 적용사례로, 합성생물학과 로봇기술을 융합하여 반복성과 재현성 향상을 위한 표준화를 획득한 맞춤형 균주 개량 기업인 깅코 바이오웍스(Ginkgo Bioworks)는 바이엘(Bayer), 로슈(Roche), 모더나(Moderna) 등과 공동연구로 기존보다 약 5∼20배 빠르게 연구를 추진하였으며, 생산된 빅데이터는 AI에 의해서 분석되어 생물학적 복합성 문제를 해결하고 있다.22) 더 나아가 AI와 로봇기술의 융합은 복잡하고 불확실한 생물학적 문제 해결과 연구개발에서 판매까지의 기간 단축을 제공한다. 일례로 말라리아 치료제 아르테미시닌 개발사 아미리스(Amyris)는 해당 제품을 개발하고 상용화하는데 약 1,500만 달러 비용과 연구개발에서 판매까지 약 10년의 기간이 걸렸으나 로봇과 AI 기술 융합을 통해 약 2.5분마다 새로운 균주 제작 및 성능을 시험하는 고속 기술을 보유하고 있다. 이를 통해 기존 기술 대비 20배 이상의 빠른 속도로 7년간 15개 제품 상용화에 성공하였으며 바이오산업 전반에 영향력을 확장하고 있다.
(나) DNA 합성기술
합성생물학은 기본적으로 생명공학과 정보공학이 융합된 학문이기에 생명체의 정보를 공학적으로 활용하는 것을 기본 목표로 한다. 원하는 인공생명체를 구축하기 위해 다양한 공학적 방법을 통해 생명체를 설계하고, 이를 기본적으로 DNA 서열을 바탕으로 구현한다. 따라서 생명체의 기본 단위인 DNA를 합성하고 응용하는 기술이 합성생물학에 있어 매우 중요한 기술로 급부상하고 있다.
기존 DNA 합성 기술은 포스포아미티드(Phosphoramidite) 기반의 화학적 핵산 합성 방법이다. 이는 합성 안정성을 높이고자 변형된 핵산을 사용해 고체 지지체에 연속적인 중합반응을 일으키고, 화학반응을 통해 핵산의 부착을 제어하며 목표하는 서열 및 길이를 가진 단일가닥 DNA를 합성한다.23) 하지만 해당 방법은 합성 사이클이 길어질수록 최종 수율이 감소하고, 유기반응으로 인해 독성 물질이 발생하는 등의 한계가 존재하기 때문에 목적 DNA를 합성하기 위한 차세대 기술이 요구된다.
이러한 화학합성의 한계로 인해 최근 많은 연구자들은 효소 기반의 차세대 DNA 합성 기술에 주목하고 있다. 특히, 말단데옥시뉴클레오티드 전달효소(Terminal deoxynucleotidyl Transferase, TdT)를 활용한 DNA 합성기술을 개발하고자 하는데, 천연 TdT는 새로운 DNA 염기를 무작위로 첨가한다는 한계가 있어, 이를 제어하기 위한 연구들이 진행 중이다. 전 세계적 DNA 합성시장의 규모는 2021년 기준 24억 2,000만 달러로 평가되었으며, 임상 진단 분야의 발전으로 인해 2022년부터 2030년까지 복리 연간 성장률(CAGR) 19.63%로 성장할 것으로 예상된다. 특히 코로나19 팬데믹 이후 치료제 및 백신 개발 수요가 전 세계적으로 증가함에 따라 북미 지역은 2022년도 기준 전 세계 DNA 합성 시장에서 40% 이상의 매출 점유율로 선도적인 지위를 차지했다.

출처: Manufacturing CHEMIST, Towards the enzymatic synthesis of oligonucleotides: part I, 2021
[그림 3-45] 포스포아미디트 기반의 무주형 DNA 합성 과정
(단위: 달러)

출처: POLARIS Market Research Report, DNA Synthesis Market Share, Size, Trends, Industry Analysis Report, By Application (Research and Development, Academic, Industrial, Diagnosis, Therapeutics); By Region; Segment Forecast, 2022~2030, 2022
[그림 3-46] 글로벌 DNA 합성 시장 규모 현황 및 예측(2018~2030)

출처: GRAND VIEW RESEARCH, Share & Trends Analysis Report By Service Type (Gene Synthesis, Oligonucleotide Synthesis), By Application (Research And Development, Therapeutics), By End-use, By Region, And Segment Forecasts, 2023∼2030
[그림 3-47] 2022년 글로벌 DNA 합성 시장 규모
이에 따라 많은 DNA 합성 벤처들이 나타나고 있다. 대표적인 DNA 합성 벤처기업으로 등장한 미국의 트위스트 바이오사이언스(Twist Bioscience)는 화학적 기법을 사용하여 낮은 단가로 소비자별 맞춤형 DNA 제작 서비스를 제공하고 있으며, 최근에는 많은 기업들이 TdT 효소 기반 합성 기법을 사용하고자 하는 움직임도 있다.
[표 3-12] 효소 기반 DNA 합성 기술 보유 업체 현황
|
업체명 (국가) |
창립연도 |
창립자 |
플랫폼 |
|
DNA Script (프랑스) |
2014 |
Thomas Ybert, Sylvain Gariel and Xavier Godron |
TdT 기반 비천연 핵산 합성 |
|
Molecular Assemblies (미국) |
2013 |
J. William Efcavitch and Curt Becker |
TdT 기반 비천연 핵산 합성 |
|
Nuclera (영국) |
2013 |
Michael Chen, Jiahao Huang and Gordon McInroy |
TdT 기반 비천연 핵산 합성 |
|
Ansa Biotechnologies (미국) |
2018 |
Daniel Arlow and Sebastian Palluk |
가역적 TdT-핵산 복합체 사용 |
|
Camena Bioscience (영국) |
2016 |
Steve Harvey, Derek Stemple and Scott Fraser |
효소 조합을 통한 트리뉴클레오타이드 (Trinucleotide) 합성 |
|
Kern Systems (미국) |
2019 |
Henry Lee and George Church |
TdT/Apyrase 간 경쟁 반응 촉진 |
출처: Nature Biotechnology. Enzymatic DNA synthesis enters new phase, 2020
학계에서도 미국 UC 버클리(UC Berkeley)의 제이 키슬링(Jay D. Keasling) 그룹에서 각 TdT에 한 개의 dNTP 분자를 결합한 TdT–dNTP 복합체를 사용하여 하나의 뉴클레오티드만을 결합할 수 있는 기술을 개발하였다. 해당 기술은 뉴클레오타이드 한 개가 연장되는 데 10∼20초만이 소요되며, 합성 사이클의 반복을 통해 원하는 서열의 DNA를 97.7%의 정확도로 합성할 수 있었다. 일본 고베 대학에 설립된 공학생물학연구센터(Engineering Biology Research Center, EBRC)는 6개 학과가 혁신 허브(Innovation Hub)를 결정하여 100kb 이상의 거대 DNA 합성 기술을 구축하는 등 활발한 연구를 진행 중이다.24)
다. 국내 현황
(1) 차세대염기서열시퀀싱 기술의 진보
(가) 단일 세포 생물학
국내에서도 단일 세포 생물학을 기반으로 하는 다양한 연구들이 수행되고 있다. 삼성서울병원 조용범-박웅양 교수팀은 단일세포 수준의 유전자 분석 기술을 응용하여 대장암의 성장과 전이 과정에 영향을 미치는 암의 미세환경을 조사하였다. 해당 연구로부터 대장암 조직 내 근섬유아세포와 골수성 세포가 면역 억제 기능을 하는 것과 해당 세포들이 면역 억제 유도체인 TGF-beta의 과다발현을 유도함을 밝혔다.25) 또한 단일세포 시퀀싱을 통해 바이오마커를 찾는 연구도 활발히 진행되었다. 삼성서울병원-성균관대학 안명주-이혜옥 교수팀은 전이 및 재발 가능성이 높은 호발암성 질환 임상 시료로부터 단일세포 수준의 전사체(transcriptomics) 분석을 진행하여, 치료반응과의 상관관계를 분석하여 바이오마커를 발굴했고, 분자적 수준의 기전을 규명하여 해당 바이오마커의 유효성을 검증하였다.26)
(나) 염색체의 3D 구조 분석
2020년 11월 카이스트 정인경 교수 연구팀과 한국생명공학연구원 국가생명연구자원정보센터 이병욱 박사 연구팀은 인체 정상 조직과 암 조직, 그리고 다양한 세포주 대상 3차원 유전체 지도를 분석하여 전 세계 최대 규모인 약 400여 종 이상의 3차원 인간 유전체 지도를 구축했으며 대규모 구조 변이와 3차원 유전체 지도를 연결할 수 있는 분석 도구들을 개발했다. 이를 통해 암세포에서 빈번하게 발생하는 대규모 유전체 구조 변이(structural variation)의 기능을 해독할 수 있는 신규 전략을 제시한 바 있다.27)
(2) 마이크로비움
인체 마이크로비옴은 인체의 면역체계와 꾸준한 상호작용을 통해 인간의 건강과 질병에 큰 영향을 미치고 있다. 이 때문에 인체 내 서식하는 마이크로비옴의 구조 및 특성에 대한 연구는 꾸준히 진행되고 있다. 2021년 12월 카이스트 조병관 교수 연구팀과 한국생명공학연구원 실험동물자원센터 이철호 박사 연구팀은 노화 관련 질병과 장내 마이크로비옴과의 상관관계 연구를 통해 아카먼시아(Akkermansia)를 비롯한 노화와 관련된 주요 마이크로비옴과 펙틴 분해 및 뷰티레이트, GABA 합성 회로의 중요성을 밝혔다.28) 더 나아가 노령 마우스에 아카먼시아를 구강투여해 노령쥐의 장내 건강, 인지능력, 근골격, 면역 노화 복원을 보여줌으로써 건강한 노화의 가능성을 제시하였다. 이외에도 마이크로비옴을 활용하여 인체 질병을 진단하고 치료하는 스마트 미생물 개발에 대한 연구도 활발히 진행되고 있다. 2020년 11월 한국생명공학연구원 합성생물학연구소 이대희 박사 연구팀은 장내 염증 발생을 형광신호로 알려주는 프로바이오틱스 개발에 성공하였으며, 이를 통해 미생물을 활용한 새로운 형태의 질병 진단 및 치료제 개발 가능성을 제시하였다.29)
(3) 인공지능과 딥러닝
KAIST에서도 이상엽, 김현욱 교수 연구팀들은 2018년 AI를 활용하여 약물-약물간의 상호작용을 예측하거나,30) 2019년 AI를 활용하여 효소기능을 예측하고 분류할 수 있는 툴을 개발한 바 있다.31) 해당 연구그룹은 2021년에 빅데이터와 AI를 기반으로 천연추출물의 영향을 예측하는 등의 연구를 수행한 바 있다.32)

출처: Jeon et al., Natural Product Reports 2021
[그림 3-48] AI 및 빅데이터 기반 천연추출물의 효과 검증 연구
KAIST의 조광현 교수 연구팀은 빅데이터 및 AI를 통한 다양한 질병 치료와 관련된 연구를 수행 중이다. 2017년 컴퓨터 시뮬레이션을 통해 암세포 유형별 약물 반응 예측 모델을 개발한 바 있고,33) 2021년 빅데이터를 활용하여 세계 최초 알츠하이머성 치매 환자 맞춤형 치료 효능 예측 기술을 개발한 바 있다.34) 해당 그룹은 2023년 다양한 컴퓨터 시뮬레이션과정을 통해 폐암세포를 불안정한 암세포 상태에서 치료가 가능한 상피세포로의 역전과정을 수학적으로 계산 가능한 모델을 구축하였고, 이를 바탕으로 약물 타깃을 선별하여 적용하는데 성공하였다.35)

출처: Kim et al., Cancer Research, 2023
[그림 3-49] 컴퓨터 시뮬레이션 기반 암세포 전이 과정(epithelial-to-mesenchymal transition, EMT) 모델 제시 및 치료 타깃 발굴
(4) 합성생물학의 진보
(가) 바이오파운드리
국내에는 아직 합성생물학 전반을 제공하는 글로벌 역량을 갖춘 바이오파운드리 전문기업은 없으나 최근 CJ제일제당이 바이오파운드리를 도입하고 바이오기업의 활용을 공개한 바 있다. 최근 바이오니아(DNA 분석・합성 분야), 툴젠(유전체 편집 분야), 제노포커스(효소 개발) 등 다수의 바이오기업들이 합성생물학 활용 기술을 도입하기 위한 노력을 하고 있다. 초고속 DNA 설계 및 합성에 필요한 바이오파운드리, 공정개발 지원 및 시험시설은 개별 기관 및 기업 차원에서 소규모로 운영 중이다.
학계에서는 보다 심층적으로 바이오파운드리 기술을 연구 및 도입하기 위한 노력 중이다. 한국생명공학연구원은 한국과학기술원과 공동으로 K-바이오파운드리(K-biofoundry)를 구축하며 GBA에 회원가입 하였고(2019년), 합성생물학 전문연구센터를 신설하여 합성생물학 분야에서 세계 수준의 연구성과를 창출하고 있다.36) KAIST 또한 기존 바이오파트의 단점을 보완한 고품질 신규 바이오파트의 발굴 및 표준화와 같은 합성생물학 원천기술개발 연구를 활발히 진행이다.37) 과기정통부를 중심으로 ‘바이오파운드리 구축 개발사업’을 기획하는 중이며 인프라 구축과 핵심 장비, 소프트웨어 및 바이오 부품 뱅크 구축 등을 중심으로 초기 인프라를 조성하고 바이오 설계・제작・시험・학습의 각 단계를 구성하는 핵심 기반기술개발에 나설 계획이다.
(나) DNA 합성기술
DNA 합성 기술을 보유한 국내 기업체는 모두 포스포아미다이트 기반 화학합성법을 활용하며 주로 국내 연구시설을 대상으로 의뢰받은 특정 서열의 DNA를 공급하고 있으며, 짧은 올리고(oligo)의 경우 중합효소 연쇄반응(PCR)에 사용되는 프라이머를 비롯해 목적에 맞게 다양하게 활용된다. 이외 대부분의 국내 DNA 합성 전문 기업체들은 올리고(oligo) 합성 기술을 기반으로 합성생물학 및 시스템생물학 분야에서 필요로 하는 다양한 형태의 추가 서비스를 제공한다. 예를 들어 바이오니아, 마크로젠, 제노텍은 DNA 합성과 더불어 고성능 DNA 분석 서비스를 제공하며, 툴젠의 경우 유전체 편집, 제노포커스는 고성능 단백질 효소 개발과 관련된 기술을 보유하고 있다.38) 하지만 아직 합성생물학 관련 응용 기술 전반을 제공하는 합성생물학 전문기업은 없는 실정이다.
TdT를 이용한 생물학적 합성법의 경우 국내에서는 아직 연구실 수준에서 연구들이 이뤄지고 있는데, 고려대학교 백승필 교수 연구팀은 주형가닥 없이 DNA를 합성하는 효소(Terminal deoxynucleotidyl transferase, TdT)를 보다 효과적으로 활용하는 방안을 고안하여 국제 학술지에 게재한 바 있다.39)
라. 발전 과제
(1) 시스템생물학 기반의 빅데이터 생산 및 분석
2000년대 이후 생명체를 이해하기 위한 다양한 오믹스 기술이 개발 및 적용되어왔고, 최근 고해상도 단일세포(single cell) 수준의 오믹스 기술들의 등장으로 엄청난 양의 빅데이터들이 누적되고 있다. 이러한 데이터 사이즈들은 이미 한 명의 연구자가 소화하기 힘든 수준에 이르렀기에 점차 AI를 기반으로 빅데이터를 분석하고 해석하는 다양한 연구 방법들이 등장하고 있다. 아직 생명공학 전반에 걸쳐서는 딥러닝이나 기계학습 수준의 분석이 주가 되고 있지만 점차 AI의 도입이 주가 될 것으로 보인다. 이러한 기술들은 대량의 다중오믹스 단일 세포 분석, 마이크로비움, 맞춤형 미생물 개량 등 생명공학 전반에 걸쳐 응용되고 있다. 특히 앞서 언급한 것과 같이 신약개발에 있어서 AI는 엄청난 활약을 하고 있으며 실제 결과로까지 이어지는 중이다.
이러한 흐름에 발맞춰 우리나라의 과학기술정보통신부는 인공지능 신약개발플랫폼(KAIDD) 연구사업단을 출범시키면서 국내 다양한 산학이 참여한 빅데이터와 AI를 기반으로 하는 신약개발 연구에 박차를 가하고 있다.

출처: KAIDD 홈페이지(https://www.kaidd.re.kr/)
[그림 3-50] 빅데이터 및 AI 기반 KAIDD 인공지능 신약개발 플랫폼 연구개요
(2) 합성생물학 바이오파운드리 허브 구축
과기정통부를 중심으로 국가차원의 합성생물학 육성전략이 활발히 세워지고 있으며 동시에 합성생물학육성법 제정, 바이오파운드리 인프라 구축, 전문인력 양성, 기업지원 등이 추진되고 있다. 작년 2022년 7월 한국생명공학연구원 및 KAIST를 주축으로 합성생물학발전협의회가 발족하여 국내 합성생물학의 중장기적 발전 로드맵을 제시하였고, 국회에서도 국가 차원에서 합성생물학 기술의 체계적 육성을 위한 ‘합성생물학육성법안’이 2022년 발의되어 향후 바이오경제 시대를 준비하기 위한 초석을 차근차근 다지고 있다. 이와 더불어 전략적 국제협력 활성화의 일환으로 한국-미국 합성생물학 공동 콘퍼런스가 2022년 12월 부산에서 개최되어 주요 연구기관간 MOU를 통해 국내 합성생물학 역량에 더욱 힘을 실을 전망이다. 또한, 합성생물학 핵심기술 확보를 통한 연구역량 강화 및 조기 성과 창출을 가속화 하기 위해 산업통상부 주관으로 KAIST에 인공지능중심 메타융합 교육시설 및 mRNA/DNA 의약품 생산지원센터인 ‘메타융합관 1’이 건립되어 2023년 완공 예정이며, 바이오파운드리 생태계 종사 전문인력의 체계적인 양성을 위해 관련 학과가 2023년 가을에 신설될 예정이다.

출처: 과학기술정보통신부
[그림 3-51] 합성생물학 분야 발전을 위한 국가적 임무
바이오파운드리는 합성생물학 분야에서 빠른 속도로 발전하는 핵심 인프라이며 합성생물학 DBTL 사이클 자동화에 초점을 맞추면서, 바이오화학, 의약, 바이오플라스틱, 환경 등의 난제를 해결할 게임 체인저로 주목받고 있다. 바이오파운드리 구축은 DNA 합성 및 조립기술, 전문장비, IT 기술과 전문인력의 융합이 필요한 복잡한 과정이며 초기 운용비용은 표준 실험실 보다 더 높을 수 있다. 하지만 모듈화, 자동화를 통한 처리량, 결과 도출 속도, 재현성 및 신뢰성을 극대화 할 수 있는 잠재력을 가지고 있어 연구개발에 투입되는 최종 소요 비용은 감소하고 성공 가능성은 극대화할 수 있다. 구축된 시설은 화이트바이오, 레드바이오, 그린바이오 등 바이오 전 분야에 걸친 다양한 프로젝트에 빠르고 신뢰할 수 있을 만한 데이터를 제공해 줄 것이며 새로운 바이오경제 개발의 기초를 형성하여 합성생물학 프로그램의 핵심이 될 수 있다.
이러한 성공사례는 정부와 민간의 투자를 계속 유치하는 선순환 구조를 만들고 정부-산학 간의 유기적인 협업을 가능케 한다. 바이오파운드리는 합성생물학 R&D를 더욱 진전시킬 국가 인프라의 기능을 수행하며, 바이오제조 산업 성장의 가속화에 기여할 전망이다. 이에 광범위한 국가혁신 전략 내에서 적절한 바이오파운드리 모델을 계획하고 추진해야 할 것이다.
NGS 기술의 발전으로 인해 생성된 막대한 양의 빅데이터들이 딥러닝 혹은 인공지능과 만나면서 생명체 내 다양한 생명 활동을 다차원 고속 분석이 가능케 되고, 이러한 분석 비용과 시간, 연구 노동력들은 급속도로 줄어들고 있는 반면, 신약개발 및 바이오헬스 등의 다양한 생명공학 기술개발의 규모와 투자는 나날이 커지고 있다. COVID-19 팬데믹 사태 이후 우리는 바이오 기술이 차세대 먹거리 기술임을 분명히 인지하였고, 이러한 국가 기술 경쟁 시대에 뒤처지지 않기 위해서는 정부와 기업, 사회 각 계층의 지속적인 관심과 투자가 필요하며, 보다 장기적인 계획이 필요한 시점이다.
6. 구조생물
가. 개요
구조생물학은 세포 내외부를 조직, 구성하고 다양한 생명현상을 조절하는 생체 분자기계의 삼차구조를 규명하고 이를 기반으로 생체 분자기계의 작용기작과 이와 연관된 생명현상의 작동 원리를 밝혀내려는 학문이다. 이러한 생체 분자기계는 주로 단독 혹은 복합체 형태의 단백질들로 구성되어 있으나, 그 외에도 핵산, 지질, 기타 다양한 소분자 물질 또한 분자기계의 구성 및 작동 과정에서 중요한 역할을 수행하고 있다. 1959년 막스 페루츠와 존 켄드류에 의해 혈액 내 산소 수송을 담당하는 미오글로빈과 헤모글로빈의 삼차구조가 최초로 규명된 이후, 구조생물학은 원자 수준에서 생명현상을 이해하고 질병 원인을 규명하는 데 큰 기여를 해왔을 뿐만 아니라, 질병 원인 단백질을 표적하는 약물 개발 과정에서도 핵심적인 역할을 하고 있다.
지금까지 구조생물학은 주로 세 가지 실험적 방법을 기반으로 이루어졌으며 X-선 결정학(X-ray crystallography), 핵자기공명법(nuclear magnetic resonance, NMR), 극저온 전자현미경(cryo- electron microscopy, cryo-EM)이다. 이러한 방법들은 각각 장단점을 가지고 있으며 연구 목적 및 필요에 따라 상호보완적으로 활용 가능하다. 예를 들어 X-선 결정학은 생체 분자기계 작용기작 분석과 신약 개발에 중요한 초 고해상도 데이터를 제공할 수 있으며, NMR은 X-선 결정학으로는 분석이 어려운 수용체 내 단백질 삼차구조 규명 및 단백질 동역학(protein dynamics) 분석에 매우 유용한 방법이다. 여기에 cryo-EM 기술의 급격한 발전을 통해 기존 방법으로는 분석이 힘들었던 초거대복합체의 삼차 구조 분석이 가능해졌으며, 4세대 가속기의 X-선 자유전자레이저(X-ray free electron laser, XFEL)를 이용한 시분해 결정학(time-resolved crystallography)을 통해 단백질 삼차구조의 실시간 변환 과정 분석이 가능해지는 등 구조생물학의 기존 한계를 뛰어넘은 혁신적 연구 변화가 이어지고 있다.

주) 좌측부터 각각 X-ray 결정학, NMR, cryo-EM, 삼차구조 모델링
출처: Wyatt WY et al., The role of protein structural analysis in the next generation sequencing era, Top Curr Chem, 336:67-98, 2014
[그림 3-52] 구조생물학적 분석 기법
이외에도 최근에는 아래 그림과 같이 혁신적 인공지능(artificial intelligence, AI)에 기반한 단백질 삼차구조 모델링 프로그램이 나오면서 구조생물학에 일대 혁명이 일어나고 있다. 가장 대표적인 것이 바로 구글 딥마인드(Google DeepMind)에서 개발한 알파폴드(AlphaFold)이며, 이로써 이론적으로 아미노산 서열이 밝혀진 모든 단백질은 적어도 단독 상태의 삼차구조를 높은 정확도로 모델링하는 것이 가능해졌다. 이러한 인공지능 삼차구조 모델링 프로그램의 발달은 구조생물학적 분석 및 적용 가능 범위를 생물학 전 분야로 극적으로 확장시켰을 뿐만 아니라, 생체 분자기계의 작용기작 규명 과정에 있어서도 기존의 실험적 방법과 시너지를 내면서 구조생물학 분야의 발전을 가속화시키고 있다.


출처: Callaway E, ‘It will change everything’: DeepMind's AI makes gigantic leap in solving protein structures, Nature, 2020, 588(7837), 203-204 https://twitter.com/RichardDawkins/status/1333690411223707653
[그림 3-53] 알파폴드를 소개하는 네이처 기사
나. 해외 동향
2023년 3월 기준으로 단백질 정보 은행(Protein Data Bank, PDB)에 등록된 전체 구조는 약 20만 2,000여 개이며, 최근 5년(2018∼2022)간 연 평균 1만 2,700여 개의 삼차구조가 다음 그림과 같이 신규 등록되고 있다. 실험 방법적으로 보면 X-선 결정학에 의해 17만 3,300여 개(86%), 전자현미경에 의해 1만 4,400여 개(7%), NMR에 의해 1만 3,900여 개(7%)의 구조가 등록되었다. 특히 2년 전과 비교하면 전자현미경에 의하여 규명된 구조가 6,300여 개가 증가하며 같은 기간 동안 500여 개의 구조가 등록된 NMR을 제치고 X-선 결정학에 이은 2위로 올라선 것을 알 수 있다. 동 기간 1만 5,000여 개 구조가 신규 등록된 X-선 결정학이 가장 보편적이고 많이 사용되어 온 단백질 구조 분석법인 것은 여전하나, 2013년 이른바 ‘해상도 혁명(resolution revolution)’ 이후 이어지고 있는 전자현미경, 특히 극저온 전자현미경(cryo-EM) 기법에 의한 삼차구조 분석법의 급격한 발전 및 확산 또한 여전히 지속되고 있음을 알 수 있다. 이는 전자현미경에 의해 규명된 전체 1만 4,400여 개의 삼차구조 중 97%가 2013년 이후에, 86%가 2018년 이후에 규명된 것만 보아도 분명한 사실이다. 또한 전자현미경을 이용한 구조 규명은 2017년(564개)에서 2022년(4,113개)까지 5년 만에 7.3배 증가한 반면, 동 기간 X-선 결정학 및 NMR을 통한 삼차구조 규명은 각각 1만 72개에서 9,846개(X-선 결정학), 412개에서 304개(NMR)로 오히려 감소하였다.
특히 이러한 경향성은 거대 복합체 구조와 세포막 단백질의 경우 더욱 두드러진다. 2020년 이후 규명된 2MDa(2,000 kDa) 이상 거대 복합체 구조 778종 중 94%에 달하는 728종이 cryo-EM을 이용하여 규명된 구조이며, 여기에는 리보솜(399종) 또는 바이러스 파티클(60종) 이외에도 300종 이상의 광합성 센터, ATP 합성 복합체, 미세소관 복합체 등의 다양한 생체 거대분자기계들이 포함되어 있었다. 반면 X-선 결정학으로 규명된 구조는 49종이었으며, 대부분이 단백질 생산 공장인 리보솜(39종) 또는 바이러스 파티클(7종)로 한정되었다. 또한 중요한 약물 표적으로 알려졌지만 생산 및 결정화의 어려움 때문에 그동안 어려움을 겪어온 세포막 단백질의 삼차구조 연구에서도 cryo-EM 기술의 발달로 인해 획기적인 전기가 마련되었다. 실제로 신약 개발 표적의 30%를 차지하는 핵심 단백질인 G protein-coupled receptor, 이른바 GPCR 단백질들의 경우 2022년 1년 동안 전자현미경으로 규명된 구조는 274종인 반면, X-선 결정학으로 규명된 구조는 22종에 그쳤다. 이러한 결과는 전자현미경, 특히 cryo-EM이 구조생물학의 핵심 기술로서 완전히 자리를 잡았으며, 특히 기존 기술로는 분석하기 어려웠던 거대 복합체 단백질 및 세포막 단백질 구조 규명을 가능하게 함으로써 구조생물학, 더 나아가 생물학 전체의 혁신을 불러일으키고 있음을 다시 한번 확인시켜 준다.

출처: https://www.rcsb.org/stats
[그림 3-54] PDB에 등록된 삼차구조 개수(2014~2022)
한편, 최근 급속히 발달 중인 인공지능(artificial intelligence, AI) 기술이 구조생물학과 접목하면서 두 가지 새로운 흐름이 큰 주목을 받고 있다. 그 중 첫 번째는 AI에 기반한 단백질 삼차구조 모델링 프로그램이다. 가장 대표적인 것이 바둑에서 이세돌 9단을 꺾은 인공지능 프로그램 알파고(AlphaGo)로 유명해진 구글 딥마인드(Goolge Deepmind)에서 개발한 알파폴드(AlphaFold)이다. 알파폴드는 인간의 뉴런 구조, 특히 시각 및 청각 피질을 본떠 만든 인공신경망(artificial neural network)에 기반을 둔 인공지능 프로그램으로, 기계학습법(machine learning)을 통해 고도로 훈련받은 후 크게 두 가지 방법을 통하여 단백질 삼차구조를 모델링한다. 첫 번째, 다중서열정렬법(multiple sequence alignment)을 통해 서열상 멀리 떨어진 아미노산들이 삼차구조 상 같은 지점으로 모이는 과정인 단백질 접힘 기작을 계산하고 학습하였다. 두 번째, 경사하강법(gradient descent)이라는 최적화 방법(optimization method)을 이용해 물리적으로 가능한 모든 단백질 접힙 중 실제 존재할 가능성이 높은 ‘세련된’ 단백질 삼차구조가 되는 최선의 방법을 다음 그림처럼 학습하였다.

출처: Senior AW, et al., Improved protein structure prediction using potentials from deep learning, Nature, 2020, 577, 706-710
[그림 3-55] 알파폴드의 단백질 삼차구조 모델링 기작
2018년 12월 개최된 제13회 단백질 구조예측 학술대회(Critical Assessment of protein Structure Prediction, CASP)에 등장하여 전체 104개 표적 단백질에 대하여 128점의 Z-score를 획득, 108점의 2등, 99점의 3등 그룹을 제치고 99개 팀 중 1위를 차지한 바 있었다. 그리고 기존 알파폴드의 학습법에 작은 조각들을 맞춘 후 조합하여 더 큰 형태를 만드는 텐션 알고리즘(tension algorithm)을 결합하여 성능을 개선한 알파폴드 2가 2020년 12월 개최된 제14회 CASP에 참가, 전체 92개 표적 단백질에 대하여 무려 244점의 Z-score로 92점의 2등, 91점의 3등 그룹을 압도하며 그림과 같이 1위를 차지하였다.

출처: https://www.predictioncenter.org/casp13/zscores_final.cgi https://www.predictioncenter.org/casp14/zscores_final.cgi
[그림 3-56] 제13회, 제14회 CASP 대회 단백질 구조예측 순위표
2023년 3월 현재, 알파폴드는 연구자들에게 무료 공개되어 아미노산 서열이 알려진 모든 단백질은 단백질 삼차구조 모델링이 가능해졌다.40) 또한 알파폴드 외에도 메타에서 개발한 ESM폴드, 미국 워싱턴대학 단백질디자인 연구소가 개발한 로제타폴드 등 새로운 AI 기반 단백질 모델링 프로그램이 속속 공개되고 있다. 이러한 흐름은 구조생물학적 연구 범위를 삼차구조 규명에 성공한 20여만 개에서 자연계에 존재하는 아미노산 서열이 공개된 2억 개에 달하는 모든 단백질로 극적으로 확장시키고 있다.
AI 기술이 구조생물학과 접목하면서 생긴 새로운 흐름 중 두 번째는 바로 인공 단백질 디자인(de novo protein design)이다. 인공 단백질 디자인은 자연에 이미 존재하는 단백질의 삼차구조를 분석하고 활용 가능성을 타진하는 대신, 역으로 의학적, 산업적으로 인류에게 필요한 기능을 갖춘 단백질의 삼차구조를 의도적으로 디자인하는 것이다.

출처: Xingjie Pan and Tanja Kortemme, Recent advances in de novo protein design: Principles, methods, and applications, J Biol Chem, 2021
[그림 3-57] 인공 단백질 디자인의 개념 모식도
이 분야는 지금까지 규명된 20여만 개의 단백질 삼차구조 정보 및 기존 컴퓨터 기술에 기반하여 천천히 성장했으나, 최근 급격히 발달된 AI 기술과 접목되면서 급격히 발전하고 있다. 특히 해당 분야는 2021년 브레이크스루(Breakthrough)상을 받은 데이비드 베이커 교수가 이끄는 미국 워싱턴대학의 단백질 디자인 연구소가 주도하고 있다. 해당 연구팀은 인공 인터루킨-2 면역강화 항암단백질 개발(2019년 1월 Nature 게재), 고감도 인공 단백질 센서 시스템 개발 (2021년 2월 Nature 게재, 다음 그림 참고), 최초의 인공 맥주통 모양 단백질 개발(2021년 2월 Science 게재), 최초의 인공 효소 단백질 개발(2023년 2월 Nature 게재) 등의 성과를 내고 있다. 단백질은 자연이 만들어낸 가장 정교한 분자 기계 중 하나이며, 백신 개발, 항암제, 질병 진단용 센서 등의 의료용 목적, 또는 각종 화학반응을 매개하는 촉매효소로서 산업적 목적으로 이미 널리 활용되고 있다. 향후 해당 분야의 발달을 통해 단백질의 활용 가능성이 더욱 높아질 것으로 보이며, 이 과정에서 특정 기능을 가진 단백질 디자인 및 제작이 필수인 만큼 해당 연구를 수행할 수 있는 구조생물학의 중요성은 더욱 강조될 것으로 보인다.

출처: Alfredo Quijano-Rubio et al., De novo design of lmodular and tunable protein biosensors, Nature, 2021
[그림 3-58] 단백질 디자인을 통한 고감도 인공 단백질 센서 시스템 개발
다. 국내 동향
국내 구조생물학 연구진은 약 100여 명에 달하는 등 세계적 수준의 경쟁력을 갖춘 것으로 평가된다. 그동안 구조생물학의 주축을 이루어왔던 X-선 결정학 연구에는 전용 X-선 빔라인이 필수적인데, 국내에는 1994년 3세대 방사광 가속기인 포항 가속기 연구소(Pohang Accelerator Laboratory, PAL)가 완공, 현재까지 운영되고 있다. 2012년 포항 가속기 연구소의 방사광(Pohang Light Source, PLS)이 PLS-II로 전면 개조된 이후 지금까지 국내 기초연구 및 산업적 측면에서 다방면으로 중요한 역할을 맡고 있다. 특히 X-선 결정학 전용 빔라인 3기(5C, 7A, 11C)를 운영하면서 국내 구조생물학 연구진에 안정적으로 X-선 빔을 제공하고 있다. 지금까지 국내 구조생물학 연구진이 포항 가속기 연구소를 이용하여 얻은 주요 성과로는 비아그라 작용원리 규명(2003, Nature), B-Z DNA 결합 분석(2005,Nature), 세포 내 물질수송 조절 복합체 삼차구조 규명(2006, Cell), 인간 면역 핵심 TLR 수용체 복합체 구조 규명(2007, Cell / 2009, Nature), DNA 응축 단백질 복합체 삼차구조 규명(2009, Cell), RNA 절단효소 Drosha 삼차구조 규명(2016, Cell) 외 다수가 있다. 또한 포항 가속기 연구소는 지난 2016년부터 기존 3세대 가속기보다 수억 배 더 강한 빛을 만들어 내는 4세대 가속기인 PAL-XFEL을 미국과 일본에 이어 3번째로 설치하여 운영 중이다. XFEL은 펨토초(10∼15초)의 짧은 시간 동안 X-선 펄스를 이용하여 분자 세계에서 일어나는 반응을 분석할 수 있으며, 기존 3세대 가속기에 비하여 훨씬 더 작은 나노 사이즈의 결정을 이용하여 삼차구조 규명이 가능하다. 또한 XFEL은 마이크로에서 밀리초 단위에서 이루어지는 단백질 삼차구조의 실시간 변환 과정을 분석하는 시분해 동역학 연구를 가능하게 한다. 앞으로 XFEL은 국내 구조생물학 연구를 보다 확장시킬 것으로 기대된다.
2020년 5월, 4세대 방사광 가속기인 오창 가속기 연구소(Ochang Advanced Synchrotron for Industry and Science, OASIS) 건립이 확정되었다. 2021년 10월 오창 방사광가속기구축사업단이 출범되었으며 2023년 12월 부지 조성을 마치는 것을 목표로 현재 공사가 진행 중이다. 2027년 준공과 2028년 운영 시작이 목표인 오창 가속기 연구소는 기존의 가속기보다 향상된 세계 최고 수준의 성능으로 향후 다양한 분야에서 중요한 역할을 할 것으로 기대되며, 특히 X-선 결정학을 이용한 국내 구조생물학 연구에도 큰 기여를 할 것으로 기대된다.

주) (좌측) 3세대 PLS-II, 가운데-4세대 PAL-XFEL (우측) 4세대 오창 가속기 연구소(예상 조감도)
출처: 저자 작성
[그림 3-59] 국내 가속기 연구소 시설
국내 cryo-EM 장비 부족으로 인해 어려움을 겪었던 전자현미경을 이용한 구조생물학 연구는 최근 장비 부족 문제가 해결되면서 큰 힘을 받고 있다. 국내에는 고성능 cryo-EM 장비가 기초과학지원연구원(KBSI)의 Titan Krios(300 kV) 1기에 불과하였으며, 초기 조건 탐색부터 복합체 삼차구조 데이터 수집 및 분석까지 모두 이 1기의 기기에 의존하여야 하는 상황이 오랫동안 지속되어 왔다. 하지만 2023년 2월 현재 대학교, 연구소, 기업 등에 10여기 이상의 고성능 cryo-EM 장비가 가동되면서 장비 부족 문제는 어느 정도 벗어난 상태이다.
[표 3-13] 국내 고성능 cryo-EM 장비 현황(2023.2월 현재)
|
보유 기관 |
보유 수 |
|
부산대학교 |
300kV 1기 |
|
서울대학교 |
200kV 2기 |
|
포항공과대학교(POSTECH) 세포막연구소 |
300kV 1기, 200kV 2기 |
|
기초과학연구원(IBS) |
300kV 1기, 200kV 1기 |
|
한국과학기술원(KAIST) |
300kV 1기, 200kV 1기 |
|
한국기초과학지원연구원(KBSI) |
300kV 1기, 200kV 1기 |
|
한국생명공학연구원(KRIBB) |
200kV 1기 |
|
㈜바오밥에이바이오 |
300kV 1기, 200kV 1기 |
출처: 저작 작성

주) 좌측부터 각각 부산대학교, IBS, 기초과학지원연구원 설치
출처:
[그림 3-60] 국내 구축된 300kV 수준 cryo-EM 기기
2022년 이후에만 찾아보아도 국내 구조생물학 연구진은 B형 간염 바이러스 침입 경로 규명(2022, Nature), RNA에 의한 전사조절기작 규명(Nature Communications, 2022), Y1 수용체를 통한 신경활성 조절 기작 규명(Nature Communications, 2022), RNA 절단효소 Drosha 활성상태 삼차구조 규명(Nature, 2023), 세포연결 채널 단백질 구조 규명(Nature Communications, 2023) 등 다수의 우수한 연구결과를 창출하였다. 향후 국내에 구축된 고성능 cryo-EM 장비가 본격적으로 가동되면서 더 많은 우수한 연구성과들이 창출될 것으로 기대된다.
지금까지 국내 구조생물학 분야는 주로 전통적 실험적 기법을 통한 삼차구조 규명에 초점을 맞추어 왔다. 전 세계적으로 보아도 AI 기반 단백질 모델링 방법 또는 인공 단백질 디자인 개발은 세계적 대기업(구글, 메타 등)의 전폭적 지원을 받은 기업 연구소나 워싱턴 대학교 단백질 디자인 연구소 등 소수의 선도그룹을 중심으로 이루어지고 있다. 하지만 최근 이들 선도그룹에서 연구한 AI 기반 단백질 모델링/디자인 관련 연구자들이 국내에 속속 자리 잡고 있어, 이들 선도그룹과 국내 연구진 간의 협력을 통하여 고감도 인공 단백질 센서 시스템이 개발(Nature, 2021)되는 등 결과물도 나오고 있다. 앞으로 AI 기술 활용은 구조생물학의 선택이 아니라 필수가 될 것이며, 국내에서도 관련 연구가 활발히 이루어질 것으로 기대된다.
라. 전망
최근 구조생물학 연구는 기존의 X-선 결정학 및 NMR 기술과 더불어 거대 복합체 구조와 세포막 단백질 삼차구조 분석의 장벽을 무너트린 cryo-EM 기술, 단백질의 동적인 움직임을 관찰하는 XFEL 기술 등의 급속한 성장과 보급으로 인해 기술적 분야에서 큰 변화가 이루어지고 있다. 거기에 더하여 고성능 AI 기술이 구조생물학에 접목되면서 단백질 모델링, 인공 단백질 디자인 등의 새로운 분야가 급속하게 성장하였고, 이에 구조생물학 분야는 혁명적 변화를 맞이하고 있다. 이러한 방법들은 배타적인 것이 아니라 상호 보완적으로 작용하며, 생체 분자기계에 의한 생명 현상의 비밀을 보다 더 정확하게 밝혀내는 생물학적 기초과학분야에서부터 궁극적으로 이를 조절하고 인류의 목적에 맞게 활용하는 의과학적 신약 개발 과정에 있어서 커다란 발전과 혁신을 가져올 것으로 기대되고 있다. 따라서 앞으로 유전자, 혹은 단백질의 역할 및 작용기작에 대한 분자생물학적 연구에서 구조생물학적 분석은 선택이 아니라 필수가 될 것으로 보인다. 특히 중요한 약물 표적이지만 지금까지 삼차구조가 규명되지 않아 연구가 힘들었던 단백질에 대한 연구가 획기적 전환을 맞이할 것으로 예측된다. 그리고 지금까지의 구조생물학이 알려지지 않은 구조를 새롭게 규명하는 실험적, 기술적 요소에 치중해 있었다면, 이제 구조생물학은 인공지능 프로그램이 제공하는 무한에 가까운 단백질 삼차구조를 분석하고 그 생물학적 의미와 활용 가능성을 해석하고 이해하는 보다 고차원적 연구에 집중할 것으로 보인다. 이러한 점들을 종합해 볼 때 구조생물학 분야는 혁명적인 변화와 발전의 시기를 맞이하고 있으며, 국내 구조생물학 연구 역시 여기에 뒤처지지 않도록 자체적인 혁신과 정부 차원의 적극적인 지원이 필요할 것이다.
7. 뇌과학
가. 개요
뇌연구는 뇌에 대한 신경생물학적, 인지과학적 이해를 바탕으로 뇌 작동의 근본원리를 파악하여 뇌질환 극복 및 공학적 응용에 활용하는 연구이다. 뇌연구는 뇌신경계, 뇌질환, 뇌공학의 연구 분야로 나눌 수 있다. 뇌기능 연구는 뇌신경계의 형성과 기능에 대한 신경생물학적 원리를 규명하고 고등인지기능에 관해 탐구하며, 뇌질환 연구는 뇌의 기능적 결함과 노화 등으로 인한 질환의 원인을 밝히고 진단・치료・예방에 관해 연구한다. 뇌공학은 뇌의 정보처리 구조와 작동 원리를 이해하고 공학적 접근법으로 뇌기능을 측정하거나, 뇌신경계의 기능을 조절하는 연구 분야이다.
뇌연구는 인간의 장기 중 가장 복잡한 뇌의 구조와 기능 이해를 위해 세포부터 인지・판단 등의 고위 뇌기능까지 다양한 단계에 대한 연구결과를 통합・분석하는 다층적 연구이다. 또한, 최근 뇌연구 분야는 정보통신기술・나노기술 등 타 분야와 융・복합 연구가 가장 활발히 일어나는 융합적 연구 분야이다. 뇌과학 기술은 현대사회의 급속한 고령화와 급변하는 사회변화로 인해 많이 발생하는 치매, 우울증 등 뇌질환 예방・치료(생명과학, 의학) 뿐 아니라 공학, 국방, 운송, 마케팅, 엔터테인먼트 등 다양한 산업 분야에 무한한 활용 가능성과 파급력을 가지고 있다.
코로나 시대를 지나면서, 헬스케어 영역의 디지털 대전환이 도래하였다. ICT, 인공지능, 빅데이터 등 융합 기반기술 혁신이 뇌과학에 접목되어 전자약, 디지털 치료기기, BMI/BCI 등을 활용하여 뇌와 관련된 산업(뇌산업)이 빠른 속도로 성장하고 있다. 부상하는 글로벌 뇌산업에 대응하기 위한 핵심 원천 기술 개발과 기술의 실용화, 상용화로 기술 패권 경쟁이 심화하고 있는 글로벌 시장의 선점이 필요한 시점이다.
나. 해외 동향
바이오 분야 글로벌 기술 패권의 경쟁이 심화하면서, 미국, 유럽 등 주요국들은 대형 뇌연구 프로젝트를 통해 정부 주도로 장기적 투자를 하고 있다. 세계 각국의 프로젝트가 중반에 접어들면서, 지원 전략을 강화하고, 글로벌 협력 및 타 분야 융합을 통한 혁신적 뇌연구 기술개발을 추진하고 있다. 미국은 BRAIN Initiative 1.0(2013∼2026, 약 6조 8,000억 원)에서 개발된 기술을 활용하기 위한 BRAIN Initiative 2.0에 착수(2019)했으며, 유럽은 슈퍼컴퓨터를 이용한 인간 뇌 시뮬레이션 및 ICT 융합 플랫폼을 개발하는 Human Brain Project(2013∼2024, 약 1조 5,000억 원)를 2027년까지 연장 추진하였다. 중국은 바이오경제 7대 과학기술에 뇌과학을 선정하고 China Brain Project를 추진 중이며 향후 미국 수준으로의 예산 확대 계획을 발표하였다. 각국은 다양한 뇌연구 분야의 글로벌 협력 연구 프로그램41)을 개발하여 뇌연구를 단독 연구 중심에서 글로벌 협업 연구로의 국제 협력을 강화하고 있다.
|
국가 |
주요 내용 |
|
|
(미국) |
정책 |
• 미국은 하등동물부터 인간까지 뇌신경회로망 작성 및 혁신기술개발을 위한 대형 프로젝트인 BRAIN(Brain Research through Advancing Innovative Neurotechnologies) Initiative 추진(2014∼2025, 6.8조 원 투자) • BRAIN Initiative 2.0(2019.6.) 계획 발표 : 1.0에서 개발된 기술, 성과 및 데이터 공유, 기술보급 및 확산, 기초연구의 질병 모델과의 연결 등과 같은 이슈를 바탕으로 향후 우선순위 영역 발표 |
|
R&D |
• 인간 커넥톰, 통증, 신경계 질환 치료제 등을 중점 분야로 선정하여 인간 행동 관련 신경회로 지도 작성 및 신경 활동을 이해하기 위한 연구 지원, 2014∼2025년까지 46.4억 달러(약5.5조 원)를 투자 |
|
|
(EU) |
정책 |
•슈퍼컴퓨터를 이용하여 사람의 뇌를 시뮬레이션하는 동시에 ICT 융합 플랫폼 기술 개발을 통한 Human Brain Project 추진(2013∼2023, 1.5조 원 투자) • Horizon Europe에서 2027년까지 지원을 결정하면서 뇌연구 혁신을 포함한 생애주기 건강 전반 및 헬스케어 시스템을 포함한 건강 분야에 10조 원 투자 |
|
R&D |
• Human Brain Project(HBP)를 통해 인간 뇌 시뮬레이션 및 ICT 융합 플랫폼 기술개발 • HBP는 2023년까지 EBRAINS(의료정보학 플랫폼) 인프라 확장, 뇌 네트워크와 의식에서의 역할, 인공신경망 등 3가지 핵심 과학 분야 발전에 초점 - 1단계 통합적 연구시스템 구축, 2단계 브레인 네트워크, 고위 뇌기능에서의 네트워크 역할 규명, 인공신경망 및 뉴로로보틱스 중점 - 개발된 혁신적 뉴로 툴, 3D 아틀라스(해마 시냅스 정보 등), 뇌세포의 전기신경학적 정보예측이 가능한 시뮬레이션 플랫폼 개발 등 |
|
|
(중국) |
정책 |
• 뇌과학 및 인지 연구를 꾸준히 수행해왔으며, 최근 뇌연구와 인공지능 기술 발전을 위한 연구 프로젝트 착수 |
|
R&D |
• China Brain Project(2016∼2030)를 통해 대뇌의 감지능력 탐구, 감정 형성과정 연구 및 지능기술 개발에 관한 연구 등을 수행 |
|
|
(일본) |
정책 |
• 영장류 뇌 이해를 통한 인간 뇌 이해 증진 및 뇌질환 극복연구를 지원하는 Brain/MINDS 프로젝트 추진(2014∼2023, 4,000억 원 이상) • 일본 의료연구개발기구는 뇌와 정신건강 강국 실현 프로젝트를 통해 국내외 연계 및 코호트를 활용하여 정신・신경질환 극복연구개발을 추진(2019, 116억 엔) |
|
R&D |
• 영장류 뇌 연구와 뇌 매핑 기술개발 등을 통해 인간의 뇌를 이해하고 뇌질환을 극복하기 위한 연구개발 추진 • Brain Mapping by Integrated Neurotechnologies for Disease Studies |
|
출처: 한국뇌연구원, 2021 뇌연구 통계연감, 2021
다. 국내 현황
한국 뇌연구는 1998년 제정된 ‘뇌연구촉진법’ 및 ‘뇌연구 촉진법 시행령’ 등 법적 기반을 바탕으로 과학기술정보통신부, 교육부, 보건복지부, 산업통상자원부, 질병관리청의 부처가 공동으로 뇌연구촉진 기본계획을 수립하여 추진하고 있다. 기본계획에서는 주무부처인 과학기술정보통신부 총괄 아래 관계부처의 세부 계획을 종합・체계화하여 뇌과학 분야를 육성・발전시키기 위한 국가 차원의 비전과 정책 방향을 제시한다.
[표 3-15] 제1차∼제3차 뇌연구촉진 기본계획의 주요 내용
|
뇌연구촉진 기본계획 |
주요내용 |
|
제1차 (1998∼2007) |
• 국가발전을 위한 뇌연구 핵심기반기술 확립으로 기초연구기반을 조성하고 뇌연구 주체별 기술 역량을 강화하는 방향으로 목표가 설정되어 다양한 뇌과학 육성 시책들이 추진 |
|
제2차 (2008∼2017) |
• 창조적 뇌연구를 통한 삶의 질 향상과 新미래 산업 창출을 통한 뇌연구 분야 세계 7위 기술 강국 진입을 목표로 R&D 핵심역량 강화, 산학연 협력 및 인프라 기반구축, 사회문제 해결형 연구강화의 3대 추진전략이 강조 |
|
제3차 (2018∼2027) |
• 뇌이해 고도화와 뇌활용의 시대 진입의 비전 아래 미래대비를 위한 창의적 뇌연구 강화, 융합형 기반 마련 및 활용 촉진, 미래지향적 뇌산업 육성 등의 추진전략으로 뇌과학의 나아갈 방향을 제시 |
출처: 과학기술정보통신부, 뇌연구촉진 기본계획
제3차 기본계획 1단계(2018∼2022) 종료 이후 디지털 대전환 등 新기술・新산업의 등장으로 뇌연구 기술의 혁신 트렌드를 반영하여 뇌연구 촉진 방향성 재정비가 필요하여, 차기 기본계획인 4차 뇌연구촉진 기본계획(2023∼2027) 수립을 추진 중이며, 향후 5년 주기로 단계별 수정/보완 계획을 발표할 예정이다.

출처: 과학기술정보통신부, 제3차 뇌연구촉진 기본계획, 2023
[그림 3-61] 국내 뇌연구 관련 주요 정책 및 사업 흐름
(1) 투자현황
2022년 뇌연구 총 투자액은 1,820억 7,000만 원으로 2021년 정부 투자 실적 1,966억 1,000만 원 대비 145억 4,000만 원(7.4%) 감소하였다. 부처별로 과학기술정보통신부 79.2%(1,442억 1,000만 원), 산업통상자원부 4.0%(73억 1,200만 원), 보건복지부 3.5%(63억 7,000만 원), 교육부 0.9%(16억 9,000만 원), 다부처 사업 12.4%(224억 9,000만 원) 순이며, 과학기술정보통신부는 총괄부처로 가장 많은 투자를 하였다.
뇌연구의 연구개발 단계별 R&D 투자 현황은 대부분 기초연구단계에 집중하여 투자되고 있으나, 응용 및 개발연구단계의 비중이 점진적으로 증가하고 있다.
|
|
|
과학기술정보통신부 |
1,442.1억 원(79.2%) |
|
*출연(연) |
810.5억 원(44.5%) |
||
|
|
보건복지부 |
63.7억 원(3.5%) |
|
|
|
교육부 |
16.9억 원(0.9%) |
|
|
|
산업통상자원부 |
73.1억 원(4.0%) |
|
|
|
다부처 사업 (과학기술정보통신부/보건복지부) |
224.9억 원(12.4%) |
출처: 과학기술정보통신부, 2022 뇌연구촉진 시행계획
[그림 3-62] 2022년도 뇌연구의 부처별 투자 비중
[표 3-16] 뇌연구 분야 연구개발 단계별 투자 현황(2017∼2020)
(단위: 억 원)
|
연구개발단계 |
2017 |
2018 |
2019 |
2020 |
연평균성장률 |
|
기초연구 |
1,567.1 |
1,715.7 |
1,969.6 |
2,065.1 |
10% |
|
비중(%) |
74.1% |
73.0% |
72.3% |
69.7% |
|
|
응용연구 |
211.5 |
228.3 |
224.8 |
240.4 |
3% |
|
비중(%) |
9.7% |
8.3% |
8.1% |
8.7% |
|
|
개발연구 |
162.5 |
225.2 |
271.1 |
379.5 |
30% |
|
비중(%) |
9.6% |
10.0% |
12.8% |
10.8% |
|
|
기타 |
173.1 |
181.9 |
258.6 |
277.2 |
23% |
|
비중(%) |
7.7% |
9.5% |
9.4% |
8.9% |
|
|
총합계 |
2,114.2 |
2,351.1 |
2,724.1 |
2,962.2 |
12% |
|
비중(%) |
100.0% |
100.0% |
100.0% |
100.0% |
출처: 한국뇌연구원, 2021 뇌연구 통계연감, 2022
과학기술정보통신부의 ‘뇌과학 선도융합 기술개발사업(K-Brain Project)’이 예비타당성조사를 통과하여 2023년부터 본격적으로 추진될 예정이다. 이 사업은 뇌질환 극복 및 뇌기능 활용 분야에서 응용의 교두보를 확보함으로써 국가 사회에 직접적 혜택을 주는 ‘국민 체감 뇌과학 기술’로 도약하려는 실천 방안으로 기술사업화를 견인하는 선도융합기술 개발을 목적으로 한다. 본 사업은 뇌과학 분야의 기초연구역량을 토대로 산업계, 의료계 등에서 즉시 활용이 가능한 선도융합기술을 확보하기 위한 사업으로 2023년부터 2032년까지 10년간 약 4,500억 원이 투입될 예정이다. 선도융합기술이란 기술사업화의 관문 통과에 필수적인 우수성, 파급효과, 신뢰성의 요건을 모두 만족하는 완성도 높은 기술을 말한다.
|
|
|
|
출처: 과학기술정보통신부, 뇌과학 선도융합 기술개발사업 보도자료 인용, 2022
[그림 3-63] 뇌과학 선도융합 기술개발사업의 목적과 기대효과
(2) 기술 수준
국내 뇌과학 기술 수준은 미국(최고기술 보유국) 대비 기술 수준 72.5%, 기술격차 3.3년으로 추격그룹에 해당한다(2020년 기준). 국내 기술 수준은 EU, 일본 대비 빠른 속도로 향상되고 있으나, 최근 한-중 기술 수준의 역전이 발생하였다.
[표 3-17] 주요국 뇌연구 기술 수준 추이(2018년 대비 2020년)
|
구분 |
2018 |
2020 |
||||
|
기술 수준(%) |
기술 격차(년) |
그룹 구분 |
기술 수준(%) |
기술 격차(년) |
그룹 구분 |
|
|
미국 |
100.0(1) |
0.0 |
최고 |
100.0(1) |
0.0 |
최고 |
|
EU |
90.0(2) |
1.2 |
선도 |
90.0(2) |
1.0 |
선도 |
|
일본 |
81.3(3) |
2.4 |
선도 |
81.5(3) |
2.3 |
선도 |
|
한국 |
67.5(4) |
4.2 |
추격 |
72.5(5) |
3.3 |
추격 |
|
중국 |
61.8(5) |
4.5 |
추격 |
76.5(4) |
3.3 |
추격 |
출처: 한국과학기술평가원(KISTEP), 기술수준평가보고서, 2020
(3) 논문, 특허, 인력 현황
국내 뇌연구 분야 SCI급 게재 논문 수는 2021년 총 1,163건으로 과학기술정보통신부 1,038건(출연(연) 301건 포함), 교육부 29건, 보건복지부 48건, 산업통상자원부 10건이다. 뇌연구 분야 상위 10% 이내 게재 논문 수는 총 263건으로, 과학기술정보통신부가 250건(출연(연) 118건 포함)으로 가장 많은 부분을 차지하였으며, 보건복지부 2건, 교육부 2건이다. IF10 이상 우수논문 게재 건수는 총 149건으로 2019년 92건, 2020년 105건에 이어 양적, 질적으로 꾸준한 성장을 하고 있다.
2021년 국내외 특허등록은 국내 출원 194건, 국내등록 100건으로 국내 출원 대비 등록률은 52% 수준이며, 국외 출원 76건, 국외 등록 14건으로 국외 출원 대비 등록률은 18% 수준으로 집계되었다.
2021년 뇌연구 총 과제 참여 연구인력은 5,482명으로 2013년 참여 연구인력 2,306명에 비해 2배 이상 증가하였다. 우수인력 양성에서도, 박사 108명, 석사 127명을 배출하였고, 국제 인력 교류 면에서도 해외연구자 유치는 3명, 국내연구자 해외파견은 3명으로 집계되었다. 뇌연구 분야 국제학술회의 개최 건수도 2021년 25건으로 집계되었다.
(4) 뇌연구 자원 현황
과학기술정보통신부는 뇌연구 자원 활용을 위한 뇌은행 지정・운영 기준을 뇌연구촉진법 시행령으로 규정하고(2023.1.), 4개 뇌은행(한국뇌은행, 서울아산병원 뇌은행, 인제대학교 뇌은행, 가톨릭대학교 뇌은행)을 지정하였다. 국내 뇌자원 관리기관은 한국뇌연구원(뇌은행)과 질병관리청(치매 뇌은행)으로, 총 12개소 뇌은행 네트워크를 구축하여 운영 중이다. 연간 사후 뇌 구득 건수가 2015년 5례에서 2022년 80례로 15배 이상 증가하여, 2015년부터 2022년까지 누적 구득 건수는 총 403례이다. 뇌기능 희망자는 2015년 24명에서 2022년 540명으로 20배 이상 증가하여 총 3,642명이 등록되어 있다.
(5) 뇌산업 현황
뇌산업 국내 시장은 2020년 약 4조 1,000억 원으로 연평균 6.7% 성장하고 있으며, 글로벌 시장의 약 2.2%를 차지한다. 뇌산업 분야 신규창업 수는 2019년까지 빠른 속도로 성장하였으나, 최근 창업 수는 연간 10∼20개 기업 내외로 감소 추세이다.42) 국내 535개 기업이 뇌질환치료제, 진단 키트 개발 등 뇌산업에 참여하고 있으며, 이중 의약품이 335개(62%), 진단/치료장비 91개(17%), 뇌작동 원리 활용 제품 77개(14%), 연구장비 26개(5%) 순으로 비중을 차지하고 있다. 538개 기업 중 상장사는 88개이며, 이 중 60개(68%)가 뇌질환치료제 개발사이다. 최근 주요 뇌산업 기업들이 활발한 해외시장 진출 및 국내 시판 허가 등을 통해 매출로 성과가 연결되고 있다.43)
[표 3-18] 국내 뇌산업 분야 기업 현황(2020년 기준)
|
주요 제품 |
기업 수 |
주요 기업 |
|
의약품 |
335개 |
• 중견제약사: SK바이오팜(뇌전증), 대웅제약(알츠하이머), 동아ST(알츠하이머) 등 • 바이오벤처: 소바젠(RNA 기반 뇌전증 치료제), 지놈앤컴퍼니(마이크로바이옴 기반 자폐증 치료제) 등 |
|
진단/치료기기 |
91개 |
와이브레인(우울증), 뉴라이브(퇴행성 뇌질환), 뷰노(치매), 뉴냅스(시야장애) 등 |
|
뇌작동 원리 활용제품 |
77개 |
앞썬아이에퓨쳐캠(파킨슨병), 리드브레인(뇌경색), 뉴로젠(치매) 등 |
|
연구장비 |
26개 |
휴레브(뇌 전도 전극), 바이나리(바이오이미징 솔루션) 등 |
주) 기타 기업 9개 : 뇌질환 관련 파이프라인, 비임상시험기관 등
출처: 한국뇌연구원, 2021년 국내 뇌산업 기업 주요 성과 및 투자분석 보고서, 2021
라. 발전 과제
글로벌 뇌연구 동향은 원리에서 실증으로, 가설에서 정보 중심으로 변화하고 있다. ICT, 인공지능, 빅데이터 등 융합기반 기술 혁신이 뇌과학에 접목되어 원리 중심의 연구에서 벗어나 본격적인 실증 연구로 도약하고 있고, 정밀 뇌연구의 본격화로 가설 중심에서 벗어나 빅데이터 기반의 정보 중심의 뇌과학으로 발전하고 있다. 연구발전의 빠른 속도만큼 뇌 관련 산업시장도 눈부신 발전을 하고 있다. 코로나 팬데믹 이후 의료와 헬스케어 분야의 디지털 대전환에 맞춰, 뇌산업 시장도 맞춤형 뇌질환 치료기기부터 집중력 향상 뇌파 자극기까지 다양한 디지털 기반 뇌융합 신산업 제품들이 뇌질환의 진단, 치료 예방 및 뇌기능 향상 분야에 걸쳐 엄청나게 발전하고 있다. 또한, 뇌기능 이해를 기반으로 한 뉴로모픽 칩 등 혁신적인 제품부터 뇌 작동 원리에 기반한 Brain-inspired AI를 활용하여 교통, 통신, 교육과 문화, 건축, 감성, 디자인 등 다양한 산업 분야에 뇌과학이 활용되어 신시장이 창출되고 있다.
우리나라는 이러한 시대에 발맞춰 뇌연구의 혁신과 융합을 통해 핵심 원천 전략기술 개발과 기술의 실용화, 상용화로 기술 패권 경쟁이 심화하고 있는 글로벌 시장에서 뇌연구・산업의 선도국가로 나아가야 한다.
R&D 분야에서는 디지털 기반 뇌융합 기술 확보를 통한 뇌연구 활성화를 위해 뇌연구 분야에 전략적 투자가 필요하며, 新 연구 패러다임 기반 뇌연구 초격차 전략기술을 개발해야 한다.
뇌연구 분야 투자에서는 투자 체계를 정비하여 기초연구부터 전 주기적 R&D 지원, 사회・경제적 상황에 따른 전략적 지원으로 글로벌 뇌연구 선진국의 투자 변화에 발맞춰 나가야 한다. 新 연구 패러다임 기반 뇌연구 활성화를 위해서는 첨단 연구 방법론 적용 확대로 뇌연구 발전의 가속화와 국내 독자 기술개발을 추진해야 하며 글로벌 최초 원천연구를 통해 뇌연구의 미지영역을 탐구해야 한다. 또한, 디지털 기술 기반 뇌융합 기술 고도화로 전자약, 디지털 치료기기, 뇌영상, 신경망 모델 개발 등에서 초격차 전략기술 개발이 필요하다.
뇌연구・산업의 선도국가로 나아가기 위해서는 공유와 융합을 통해 뇌연구 생태계를 강화하여야 하고, 시장 연계형 미래 뇌산업 육성을 통해 국민 체감형 뇌산업의 활성화를 이끌어 가야 한다.
공유・융합의 뇌연구 생태계 강화를 위해서 미래 뇌연구를 이끌어갈 핵심 인력 양성을 체계화하여 디지털바이오 융합 등의 뇌연구 전문인력을 양성하고, 임상현장 중심의 의사과학자를 양성하여 기초과학과 임상의 활발한 교류를 통한 선순환 중개 연구가 활성화되어야 한다. 뇌은행 운영 체계의 재정비를 통해 뇌연구자원의 효과적인 활용과 함께, 뇌 관련 연구 데이터 수집부터 활용까지 체계 개선을 통해 뇌 관련 데이터 표준화와 공동 활용 편의성을 강화하고, 임상 정보 데이터 수집 및 공유 강화를 통해 활용성을 제공해야 한다. 뇌연구의 글로벌 리더십 강화를 위해 한국 주도형 국제협력 및 뇌연구 교류를 확대해야 하며, 국제 공동연구 프로그램을 통해 국제 감각을 갖춘 인재를 육성해야 한다. BMI 등 뇌 분야 기술의 발전으로 발생할 수 있는 윤리・사회 문제에 선제 대응을 위해 IRB 심의사항을 뇌연구에 맞게 구체화한 가이드라인을 마련하고 다양한 분야 전문가가 참여하는 민간 자문단 등을 구성하여 국제신경윤리학회 등에서 제기하는 뇌신경 윤리에 관한 글로벌 이슈에 대해 대응할 수 있어야 한다. 뇌 연구 전문기관 역량 강화 및 협의체 활성화를 통한 공동연구 체계화와 최신 뇌연구장비 공유체계의 효율화도 필요하다.
글로벌 뇌연구 시장 선점을 위해 뇌연구・산업 선도 기술 분야를 선정하여 국민 체감형 성과 창출을 해야 하며, 주요 연구 거점을 중심으로 공동연구 및 기술활용을 지원하는 코어퍼실리티 구축을 통해 뇌연구 실용화・사업화 지원 조직을 육성하여 기술거래 및 사업화, 창업 생태계를 활성화하여 시장 연계형 뇌산업을 육성해야 한다.
현재 위의 계획을 중심으로 4차 뇌연구촉진 기본계획이 진행 중이며, 미래 블루오션인 뇌연구 및 뇌산업을 강력한 국가 산업 동력으로 확고하게 자리매김하기 위해서 정부와 산학연병의 협력이 절실히 필요한 때이다.
8. 노화 과학
가. 개요
세계는 빠르게 늙어가고 있다. 20세기의 시작과 함께 태어난 아이의 평균 기대수명은 불과 30세에 불과했다. 하지만 의료기술의 발전과 위생 상태의 개선으로 현재 기대수명은 그 2배를 훌쩍 넘어 평균 80세에 육박하게 되었다. 저출산과 고령화로 인해 전 세계의 노인 인구 비율은 가파르게 증가하고 있고, 우리나라의 고령화 속도는 그중 최고 수준으로 2025년에는 65세 이상 인구가 20퍼센트 이상인 초고령화 사회로 진입할 것으로 예상된다. 오래 사는 것이 축복이 되려면 늘어난 기대수명만큼 건강수명(기대수명에서 유병 기간을 뺀 수명)도 함께 늘어야 하지만 아직 건강수명의 증가 속도가 기대수명의 증가 속도를 따라가지 못하고 있다.
이제 고령화는 피할 수 없이 직면한 미래이며, 노화의 근본적인 이해를 토대로 노화를 되돌릴 수 있는 전략을 마련하는 노화 과학의 중요성이 어느 때보다 커지고 있다. UN에서는 ‘2021-2030 건강 노화 10년 정책’을 마련하였고, 건강한 노년을 위한 전 세계적 협력을 강조하고 있다. 이에 발맞춰 윤석열정부에서는 인구 구조변화에 대한 적응과 예견되는 위기에 따른 대응이 필요함을 역설하고 있다. 또한 최근 영국 정부는 코로나19로 발생한 보건 문제와 현재 직면한 의료 문제를 해결하기 위해 생명과학이 추구해야 할 7가지 목표(UK Life Sciences Vision) 중 하나로 ‘노화의 근본적인 생물학적 이해’를 내세웠다. 여러 선진국에서는 건강보조식품, 화장품 등에 머물던 제한적인 항노화 기업 생태계에서 벗어나 노화 과학에 근거를 두고 노화를 진단 및 치료하고자 하는 기업들의 성장으로 새로운 생태계가 형성되고 있다.
세계보건기구의 정의에 따르면 생물학적으로 노화는 시간이 지남에 따라 다양한 분자 및 세포 손상 축적의 영향으로 인해 발생하는 현상이다. 노화로 인해 신체적, 정신적 능력이 점진적으로 감소하여, 질병 및 궁극적으로 사망위험을 높이는데 같은 나이일지라도 유전인자와 생활 습관의 영향으로 개인 간 큰 편차가 발생한다. 노화 과학에서는 개별 노인성 질환에 초점을 맞추는 전략을 넘어, 이를 한꺼번에 제어할 수 있는 노화를 치료하는 방식의 대전환을 요구하고 있다. 구체적으로 현재의 항노화 연구는 연령 그 자체가 아닌 신체적, 정신적 능력의 감소를 초래하는 생물학적 노화를 정확히 정의 및 측정하고, 이를 치료하는 방향으로 급속히 전환되고 있다.
나. 해외 동향
(1) 노화 질병 코드 논쟁과 노화 진단
세계보건기구는 2015년 알렉스 자보론코프(Alex Zhavoronkov) 박사의 “노화에 질병 코드를 부여하자”는 제안을 시작으로 노화의 생물학적 치료법 개발의 근거 마련을 위해, 임상 진단의 국제 표준 시스템(11th revision of International Classification of Diseases, ICD-11)에서 노령(old age) 자체를 병리 증상 코드 MG2A를 부여를 예고하였다. 그러나 노화 그 자체가 질병이 될 수 없다는 반발에서부터 노인차별(Ageism)을 우려하는 목소리까지 다양한 전문가 및 단체들의 찬반 논란을 불러일으켰다. 이러한 논란 속에서 결국 2022년 발표된 ICD-11에 MG2A 코드가 빠지게 되었지만, 병리의 원인 분류 항목의 확장 코드 XT9T로 노화와 연관된 병리학적 과정을 추가하였는데, 이는 노령 그 자체를 치료의 대상으로 삼는 논란을 피하고, 노화 과학에 근거를 둔 생물학적 노화를 표적 할 수 있는 치료제 개발의 기회는 여전히 제공하는 결정으로 해석된다.
이러한 노화 질병 코드 논쟁이 불러일으킨 가장 큰 교훈은 생물학적 노화를 측정할 수 있는 정확한 방법론의 필요성이며, 현재 가장 앞서있는 전략은 DNA 메틸화를 활용한 후성유전체 시계를 활용한 노화 속도 측정 전략이다. 2013년 일루미나(Illumina) 사의 메틸화 측정 플랫폼 450K와 27K를 활용하여, 353개의 DNA 메틸화 지역을 측정한 시계가 발명된 이후 DNA 메틸화 지역의 해상도를 높이거나 인종 맞춤형 방식으로 해당 시계의 정확도를 개선할 수 있는 방법론이 제시되고 있다. 종단연구형 임상 코호트 데이터베이스 구축을 토대로 딥러닝 모델을 활용한 DNA 메틸화 지역을 최소화하는 전략 등이 마련되고 있으며, 저비용으로 정밀하게 DNA 메틸화 신호를 측정하는 방법도 다양하게 제안되고 있다. 코로나 팬데믹으로 인해 자가진단키트 시장이 커졌을 뿐만 아니라 개인들의 사용 경험이 증가하면서 노화를 진단하는 시장도 함께 성장하고 있다. 대표적으로 2023년 노화 과학의 대표적 연구자인 MIT의 데이비드 싱클레어 교수는 탤리 헬스(Tally Health)라는 회사를 창업하여, DNA 메틸화 시계를 활용한 생체 나이 측정 및 항노화 생활 습관 및 건강보조제를 추천하는 서비스를 시작하였다.
그러나 여전히 DNA 메틸화 시계는 노화의 모든 요소를 측정할 수 없다는 반론 또한 많이 제시되고 있다. 실제로 2022년 메틸화 시계의 가속은 대표적인 노화의 원인인 세포 노화, 텔로미어 마모 및 유전체 불안정성과는 무관하며 미토콘드리아 활성 및 영양분 감지 시스템의 변화와 같은 대사적 요인과의 관련성이 보고되었다. 또한 혈액을 활용한 현재의 검진 방식은 간편히 검체를 채취할 수 있다는 큰 장점이 있지만 감염, 생활 습관 등 혈액 내 면역 세포의 비율을 바꿀 수 있는 요소에 의해 큰 영향을 받는다는 단점 또한 존재한다. 이러한 생체 시계의 문제를 보완하기 위해 다양한 임상 지표에 의해 생체 시계가 받는 영향을 보정할 수 있는 정밀한 모델이 제시되고 있으며, 기존의 선형 모델이 아닌 딥러닝 기반의 모델로 생체 시계의 정확도를 높이는 전략 또한 함께 제시되고 있다. 그리고 텔로미어, 전사체, 대사체, 단백체 분석을 통해 생체 시계에 영향을 미칠 수 있는 요인을 정량적으로 평가하여 생체 시계 평가의 정확도를 높이는 방법도 시도되고 있다.
(2) 노화 치료 전략
P&S 인텔리전스의 보고서에 따르면 전 세계 항노화 시장은 1,915억 달러에서 2030년에는 무려 4,214억 달러로 급증할 것으로 예상되며, 아마존, 페이팔 등 글로벌 기업의 창업자들과 사우디 왕실 등에서는 천문학적인 금액으로 노화 치료를 목표로 삼은 기업을 지원하고 있다. 현재 노화 과학을 근거로 임상시험까지 진행되고 있는 대표적인 노화 치료 전략은 혈액에서 발굴한 역노화 물질, 식이 제한 모사 전략, 노화 세포 제거, 세포 역노화이다. 세포 역노화 기술은 국가생명공학정책연구센터에서 선정한 ‘2023년 바이오 미래유망기술’의 플랫폼 바이오 기술로 선정되었으며, 세포 역노화를 통한 노화 치료를 목표로 2022년 설립된 알토스랩(Altos lab)은 4조 원의 초기 투자금을 끌어모아 화제가 되었다. 노화 학자 데이비드 싱클레어가 집필한 ‘노화의 종말’이 베스트셀러에 오르는 등 노화 치료에 대한 대중적 관심도 증가하고 있다.
노화 치료 방식으로 가장 오랫동안 제안된 방식은 식이 제한(Dietary restriction) 방식이었다. 그러나 동물 시험에서 시행된 40%가량의 과도한 식이 제한은 현실적으로 인간에게 적용하기는 어려우므로 실제 적용이 가능한 수준인 10% 내외의 식이 제한을 수행하거나 특정 영양소를 제어하는 방식의 연구가 시도되고 있다. 최근 장기간 식이 제한의 효과를 확인하기 위한 임상시험 ‘에너지 섭취 감소의 장기적 영향에 대한 종합적 평가(Comprehensive Assessment of Long term Effects of Reducing Intake of Energy, CARERIE)’에서 2년간 14% 식이 제한 중재 시 알츠하이머병과 파킨슨병과 같은 노인성 질환의 발병을 억제할 뿐만 아니라 염증 감소와 면역 능력 개선을 이룰 수 있음이 보고되었다.
젊은 혈액에서 역노화 물질을 발굴하는 연구에서는 적은 양의 혈액에서도 높은 해상도로 많은 물질을 찾아낼 수 있는 방법론들의 등장으로 종단연구형 임상 코호트를 활용하여 새로운 인자를 도출해내기 위한 방향으로 나아가고 있다. 또한 엑소좀, 마이크로RNA, 세포 외 DNA, 세포 외 RNA 등 노화로 인해 증가하는 신규 인자의 기능을 규명하고, 이를 항체 신약 및 나노 기술 등으로 검진 및 제어하려는 시도들도 새롭게 등장하고 있다. 혈액 내 역노화 인자를 상용화한 대표적인 기업인 알카헤스트(Alkahest)에서는 알츠하이머병, 파킨슨병 등의 임상시험에서 긍정적 효과를 보고하고 있다. 최근 늙은 피의 혈장 성분을 희석하는 것으로도 노화 속도를 늦출 수 있음이 보고되었는데, 이는 노화로 인해 축적된 노화 세포의 분비물을 희석하는 효과와 연관될 수 있음 또한 보고되었다.
최근 노화 치료 전략으로 가장 주목받고 있는 전략은 노화 세포 제거 약물 개발이다. 노화 세포는 나이가 듦에 따라 축적될 뿐만 아니라 노화 세포 특이적 분비물을 통해 주변 세포를 노화 세포로 감염시키고, 앞서 언급한 것처럼 노화된 혈액에서 악영향을 미치는 주된 인자로 지목되고 있다. 노화 세포의 특이적 세포 사멸을 유도하는 것으로 세포 및 모델에서 밝혀진 합성 화합물인 다사티닙, 퀘르세틴, 피세틴 등은 만성 신장 질환, 폐섬유화증부터 운동 능력 개선, COVID-19로 인한 사망위험 감소까지 노화로 인한 다양한 문제를 표적으로 하기 위한 임상시험이 수행되고 있다. 또한 면역 세포를 통한 노화 세포의 생체 내 감지 효능을 높이기 위해 항암 연구를 통해 상당한 진보를 이룬 세포유전자 치료제의 적극적 활용이 시도되고 있다. 더불어 노화 세포의 특이적 특성을 활용한 전구약물(Pro-drug)이나 노화 세포의 특정 단백질을 E3 접합 효소를 통해 제거하는 프로탁(PROTAC) 전략 또한 노화 세포에 도입되는 등 노화 세포 약물 개발 분야는 신규 치료제 개발 전략이 다양하게 평가되는 시험대로 활용되고 있다.
[표 3-19] 대표적 항노화 임상시험
|
중재 방법 |
중재 대상 |
결과지표 |
|
메트포르민 |
노화 |
노화로 인한 노인성 질환 및 사망률 증가 정도, 노화로 인한 인체 내 지표 변화 |
|
식이제한 |
노화로 인한 대사 악화 |
혈당, 혈압, 혈액 내 인슐린, 콜레스테롤, DNA 메틸화 시계 |
|
NR 복용 |
노화로 인한 대사 악화 |
혈액 내 NAD 양, 근육 NAD 양, 염증인자(IL-2, IL-5, IL-6, TNF-a) 레벨 |
|
다사티닙 + 퀘르세틴 |
노화 세포 축적 |
걸음 속도, 노화 세포 마커(p16, p21) 레벨, 노화 세포 유도 염증 인자(IL-1a, IL-2, IL-6, IL-9, MMP-2, MMP-9, MMP-12) 레벨 |
|
피세틴 |
노화 세포 축적 |
COVID-19 치료 효능(염증인자 레벨), 노화 세포 마커 레벨 |
|
라파마이신 |
노화로 인한 대사 악화, 노화 세포 축적 |
노화 세포 마커(p16, p21) 레벨, 면역 기능 개선 |
|
운동 |
혈액 내 역노화 물질 |
노화 관련 염증 인자 IL8 레벨 |
|
운동 + 식이 제한 |
혈액 내 역노화 물질 |
DNA 메틸화 시계 |
|
운동 + 식이 제한 + 수면 + 피토케미컬 |
혈액 내 역노화 물질 |
DNA 메틸화 시계 |
출처: 저자 작성
아직 임상시험 단계까진 도달하진 못했지만, 노화를 가속하는 핵심적인 변화인 줄기세포와 면역세포를 젊은 상태로 재부팅 하려는 시도 또한 진지하게 시도되고 있다. 실제로 줄기세포의 빠른 노화나 면역세포의 빠른 노화를 유도하면 개체의 노화 속도가 가속화된다는 연구결과가 많이 쌓여가고 있으며, 젊은 면역세포나 줄기세포를 이식하는 방식으로 노화 속도를 늦출 수 있다는 전임상 수준의 연구결과도 등장하고 있다. 그러나 자신의 줄기세포나 면역세포를 노화 처치를 위해 이식하기 위한 임상적 적용은 아직 요원하기 때문에 줄기세포나 면역세포의 기능을 개선하는 방식의 연구가 더 큰 부가가치를 창출할 것으로 기대된다.
앞서 언급한 노화 치료 전략, 즉 노화 과정에 발생하는 악영향을 제거하거나 늦추는 방식이 아니라 근본적으로 노화 자체를 되돌리는 역노화 전략도 최근 많은 주목을 받고 있다. 대표적으로 만능 분화 줄기세포를 유도하는 데 사용된 전사인자(OCT4, SOX2, KLF4, MYC) 중 암 유발과 가장 깊은 관련이 있는 MYC을 제외한 인자를 활용하여 시신경을 회복시킬 수 있음이 2022년 Nature에 게재되었으며, DNA 메틸화 시계 또한 역전할 수 있다는 보고가 2023년 Cell에 게재되는 등 노화 치료를 위한 다양한 방법론이 급속도로 등장하고 있다.
다. 국내 현황
우리나라는 세계에서 전례 없는 속도로 초고령화 사회로 진입하면서 노인 인구의 삶의 질 개선과 의료비 급증이 사회적 문제로 대두되고 있다. 윤석열정부는 공약으로 노화를 포함한 첨단의료 분야에 대한 국가 연구・개발 확대를 약속하였으며, 2023년 3월 7일 최초로 법제화된 중장기 투자전략 ‘제1차 국가연구개발 중장기 투자전략(2023∼2027)’의 23대 과제 중 하나로 국민건강 증진을 위한 노화 대응을 제시하였다. 노화 분야는 직면한 고령화의 시급한 문제를 해결하기 위해 선택과 집중으로 혁신역량을 강화하는 전략으로 정책적으로 투자되어야 함을 역설하였다.
노화 분야 정부 연구비는 최근 5년간 2018년 308억 원에서 2022년 430억 원으로 30%가량 증가하였으며, 이에 발맞춰 과제 수도 30%가량 증가하였다. 실제로 과제당 평균 연구비 규모는 연간 1억 5,000만 원가량으로 80% 이상의 연구비가 기초연구에 투자되었다. 이는 노화 치료 기술의 개발 및 중개연구에 집중적으로 투자하는 방식이 아니라 노화 과학의 저변을 넓히는 방식으로 투자되었음을 의미한다. 노화 분야 연구는 여러 연구 중심대학, 거점 국립대학 및 정부 출연연구원에서 수행되었으며, 대표적인 과제 수행 기관은 서울대학교(56개 과제), 한국생명공학연구원(28개 과제) 순이었다.
[표 3-20] 노화 과학 R&D 예산 투자 현황 및 과제 현황(2018∼2022)
(단위: 억 원, 건)
|
구분 |
2022 |
2021 |
2020 |
2019 |
2018 |
합 계 |
|
정부 연구비 |
430 |
387 |
361 |
336 |
308 |
2,209 |
|
과제 수 |
241 |
236 |
212 |
192 |
153 |
1,034 |
|
기초연구 |
195 |
195 |
179 |
170 |
126 |
865 |
|
개발연구 |
29 |
21 |
18 |
11 |
20 |
99 |
|
응용연구 |
17 |
20 |
15 |
11 |
7 |
70 |
주) 검색연산자 - “노화” “aging” (“동물”|“세포”), 과제 금액 1억 원 이상
출처: 국가과학기술지식정보서비스(NTIS)
노화 과학 기초연구에 대한 투자로 노화의 기전 및 노인성 질환의 발병 기전에 관해 연구하는 기초 연구자는 양적으로 성장하였으며, 질적으로도 우수한 논문 성과를 창출하고 있다. 그러나 최근 선진국에서 활발히 노화 과학을 기반으로 노화 진단 기술 및 치료제 개발을 위한 중개연구가 시작되고 있는 것과는 달리 국내에서는 노화를 집중적으로 연구하는 집단인 한국생명공학연구원을 제외하고는 소그룹의 개인 기초연구 과제로 노화 연구가 수행되고 있다. 또한 노화 과학 연구를 위한 인프라도 한국생명공학연구원, 한국기초과학지원연구원의 고령 동물 분양 인프라에 그치고 있다.
노화 과학 분야의 박사급 인력은 주로 대학에서 배출되고 있으며, 해당 인력을 소화할 산업 생태계가 부족한 실정이다. 최근 선진국의 노화 산업 생태계의 성장에는 건강한 노년을 맞이하고자 하는 욕망을 가진 대부호들의 투자가 큰 영향을 미쳤다. 그러나 국내 대기업에서는 노화 치료제 분야 파이프라인이 마련되지 않고 있으며, 관련 분야 투자도 미흡한 실정이다. 이러한 상황 속에서 국내 노화 산업 생태계는 주로 건강보조식품 및 화장품 등을 만드는 중소기업으로 구성되어 있으며, 일부 신생 벤처기업에서 노화 진단, 혹은 아직 치료제가 없는 노인성 질환인 근감소증, 섬유화증을 표적으로 연구를 수행하고 있다.
라. 발전 과제
시간에 따른 엔트로피의 증가로 인한 노화를 인간이 되돌릴 수 없다고 여기던 인류의 긴 역사를 통과해 노화를 과학적으로 제어할 수 있다는 생각으로 연구를 수행한 시간은 30년 가량의 짧은 세월에 불과했다. 그러나 예쁜꼬마선충, 초파리, 생쥐 모델 동물 덕분에 노화의 생물학적 원인에 대한 이해가 높아졌고, 유전적・환경적 방법을 활용한 노화 제어 전략이 탄생할 수 있었다. 그러나 미국 국립보건연구원에서 수명 증진 약물 42종에 대해 양성(兩性) 생쥐와 다양한 유전체 조합의 생쥐 대상 검증 프로그램 ITP(Intervention testing program)를 수행한 결과 단 4가지 약물만 모든 조건에서 생쥐의 평균 및 최대 수명을 늘릴 수 있었다. 이렇듯 지금까지 노화 과학 분야를 견인한 평균 수명 연장 전략은 해당 모델생물의 특이적인 사망원인을 조절할 가능성이 크고, 인간과 같이 다양한 유전체 조합을 가진 상황에서는 수명 연장 효과가 나타나지 않을 가능성이 크다. 따라서 생물 종에 무관하게 노화 속도를 조절할 수 있는 범용적인 생체 노화 시계를 활용하여, 특정 생명체 특이적인 수명 연장이 아닌 생물학적 노화 속도를 늦출 수 있는 기전 발굴의 중요성이 커질 것이다. 해당 과제를 성공적으로 수행하기 위해서는 노화 평가 방법론의 표준화가 시급하며, 노화 약물의 임상시험 실패를 최소화하기 위한 전임상 노화 평가 플랫폼이 구축되어야 할 것이다.
생체 노화 시계의 정밀화를 위해서는 성별, 인종 특이적인 DNA 메틸화 정보를 수집하고 개인차를 배제한 정밀한 모델을 만드는 것이 필수적이다. 또한 생체 노화 시계에 영향을 미칠 수 있는 개인의 질병 및 생체 지표의 영향을 엄밀히 평가해야 하며 이를 위해선 국민들의 의료정보와 생체 시계를 통합적으로 분석할 수 있는 플랫폼 개발이 필요하다. 이를 위해선 노화 과학의 최신 성과 및 다가올 미래사회의 모습을 홍보하고, ‘노화는 치료 가능하다’는 아젠다를 적극적으로 설파하여 노화 진단을 위한 생체 정보 수집에 대한 국민적 공감대를 넓혀야 할 것이다. 특히 노화 치료에 대한 이해를 높이기 위해 개인 차원에서 노화 속도 지연을 위해 시도해볼 수 있는 영양 전략이나 생활 습관을 알리는 것도 좋은 전략이 될 수 있을 것이다.

출처: 저자 작성
[그림 3-64] 노화 진단 및 치료가 가능할 미래사회
마지막으로 돌봄 및 건강보조제 산업에 국한된 국내 노화 산업 생태계에서 혁신 노화 신약을 개발하는 생태계로 나아가기 위해선 노화 과학 성과를 상용화할 수 있는 중개연구 전담 조직 혹은 컨트롤타워의 마련이 필요할 것이다. 이러한 목표로 한국생명공학연구원에서 수행하고 있는 국가과학기술연구회 융합연구단 사업(노화 진단, 치료 및 지연 기술 개발)이 노화 신약 생태계의 시발점이 될 수 있을 것이다. 또한 선진국과의 기술 경쟁에서 뒤처지지 않기 위해선 대학 및 출연연에서 양성된 박사급 우수 인력을 흡수할 수 있는 노화 전담 연구조직의 신설이 필요하며, 노화 치료제 개발 경험을 지닌 해외 우수 인력의 확보가 이어져야 국내 노화 과학의 성장이 이어질 수 있을 것이다.
|
|
|
제3장 분야별 연구개발 및 산업 현황 |
|
제2절 보건의료 |
1. 화합물 신약
가. 화합물 신약개발 개요
일반적으로 혁신적인 기술이 도입된 화합물 신약(New chemical Entities, NCE)44)은 기존 약물의 문제점을 근본적으로 해결하고 새로운 기전에 의거한 새로운 약물로서의 독창성을 지녀야 하며, 약효 및 안정성 면에서 기존 약제보다 현저하게 개선된 약물로서 우월성을 지녀야 한다.
점증적인 혁신기술이 도입된 개량신약(Incrementally Modified Drug, IMD)은 기존 제품 대비 안전성, 유효성, 유용성(복약순응도, 편리성 등)이 개량되었거나 의약 기술에 있어 진보성이 있어야 한다.
신약의 특허 기간이 만료된 이후 생산되는 제네릭 의약품(generic drug)은 의약품동등성시험을 통해서 원개발 의약품과 동등함을 인정받아 허가된 의약품을 말한다. 허가 이후에도 주기적으로 제조 시설을 점검하여 의약품 제조 및 품질을 엄격하게 관리하고 있을 뿐만 아니라 신약과 동등한 품질로서 의약품의 안정적인 공급에 기여하는 등 큰 역할을 하고 있다.
의약품 개발 과정은 크게 비임상시험(동물시험), 임상시험, 시판 후 조사(post marketing surveillance, PMS) 등 3가지로 나눠서 볼 수 있다. 임상시험은 또다시 제1상, 제2상, 제3상으로 구분할 수 있다. 비임상과 임상을 성공적으로 마무리하면 시판 허가를 받게 된다. 임상시험의 경우 설계 단계에서부터 안전성과 유효성에 대한 통계학적 유의성 범위를 설정한다. 임상 1상에서 안전성이 충족되면 소규모 인원을 대상으로 하는 임상 2상과 대규모 인원을 대상으로 하는 임상 3상을 거친 뒤 유효성을 평가한다. 임상시험 통계는 과학적으로 신뢰성 데이터를 근거로 의약품으로 시판해도 될지를 증명하는 과정에서 절대 필요하며 임상시험 설계 단계에서 설정한 통계학적 유의성이 임상 단계에서 증명이 되면 안전성과 유효성이 담보된 것으로 볼 수 있다. 특히 안전성의 경우 이상 반응 등 부작용이 임상시험 중에 발생하지 않을 수도 있으므로 긴 기간 동안 해당 의약품을 관찰하고 평가하는 PMS 과정이 필요하다. PMS에서 나아가 약물의 시판 전 및 시판 후 약물 감시(Pharmacovigilance, PV) 과정에서 수집된 자료를 통해 무시할 수 없는 이상 사례가 있는지를 점검한다.
나. 화합물 신약의 시장 동향
의약품은 환자의 건강과 직결되어 공공재의 성격을 띠고 있고, 연구개발 과정상 고위험, 고비용의 장기투자 사업으로써 기초과학 연구가 산업화 성과로 연결되어 세계 각국은 국가적인 차원에서 체계적인 지원책을 선제적으로 추진하고 있다. 최근에는 4차 산업 혁명을 대표하는 디지털기술, 나노기술, 바이오기술 등의 주요 융복합기술의 접목을 통해서 고위험・고비용 구조의 산업적 한계 극복 및 R&D 효율성 향상을 추진하고 있다.
인구 고령화와 의료 개혁에 대한 다양한 환자군의 신약개발 요구 등으로 인해서 항암제, 희귀의약품 등의 임상시험 증가와 시장 규모가 확장되고 있으며 연평균 6.4%로 지속적으로 성장해 2026년에는 1조 4,080억 달러 규모로 다음 그림과 같이 전망되고 있다.
|
|
출처: EvaluatePharma, WORLD PREVIEW 2021 Outlook to 2026, 2021.7.
[그림 3-65] 2026년 10대 질환별 의약품 시장 점유율 및 매출 전망
우리나라의 신약개발은 1980년대 후반에 다국적 제약회사를 대상으로 기술수출이 본격적으로 시작된 이래로 화합물 신약을 중심으로 신약개발 성과가 나오고 있다. 1999년 식품의약품안전청에서 최초로 국산 신약으로 허가받은 SK케미칼의 항암제 선플라주(Sunpla Injection), 2003년 우리나라 기업으로서 최초로 미국 FDA에서 허가받은 LG생명과학의 퀴놀론계 항균제 팩티브정(Factive Tab.)이 탄생한 이래로 진보하고 있다.
화합물 신약과 개량신약, 천연물 유래 합성신약을 꾸준하게 연구개발하고 있고, 희귀의약품을 중심으로 바이오의약품에 투자하고 있다. 융복합기술을 바탕으로 한 디지털 치료제, ADC(Antibody-Drug Conjugate) 치료제 등 차세대 의약품 개발도 시작하였다.
화합물 신약은 대표적인 융복합기술 대상 분야로서 규제가 성장에 절대적인 영향을 미치고 있지만 궁극적으로는 화합물 신약의 가치사슬은 전임상시험부터 임상시험까지 단계별 부가가치 창출로서 연구개발(R&D) 성과는 의료 시장을 통해서 나타나고 있다.
2019년부터 대한민국 정부의 3대 중점산업으로서 바이오메디컬(신약: 화합물 신약, 바이오신약)-디지털헬스(신의료기기)의 두 제품군을 묶어서 바이오헬스 신산업으로 선정하여 미래 주력산업으로 육성하고 있다.
다. 미국 FDA 화합물 신약 인허가 동향
미국 FDA의 의약품평가연구센터(Center for Drug Evaluation and Research, CDER)는 사람에게 사용하는 의약품의 인허가를 담당하는 주무 기관이고, 생물의약품평가연구센터(Center for Biologics Evaluation and Research, CBER)는 바이오의약품 인허가를 담당하는 주무 기관이다.
많은 화합물의약품과 바이오의약품의 적응증이 서로 비슷하고, 또한 비슷한 적응증을 가진 의약품들에 대한 임상시험들은 일관성을 갖고 심사하는 것이 더 효율적이라는 판단 아래 많은 바이오의약품들이 2003년도에 CBER에서 CDER로 이전되었다. 현재 CBER에서 인허가를 담당하는 의약품은 세포치료제, 유전자치료제, 백신, 혈액제제, 혈액성분제제, 혈장 유래 치료제 등이다.
CDER와 CBER는 서로 소통하며 과학적이면서도 진보와 규제 사이의 평형을 맞추기 위한 합리적인 심사를 위해서 노력하고 있다. 대부분의 CBER 심사관들은 연구실에서 관련 연구도 수행하고 있는데 규제보다 진보에 방점을 두고 있다.
2022년도에 미국 FDA가 승인한 신약은 CDER 승인기준으로 다음 표와 같이 총 37개이며(백신과 유전자/세포치료제 미포함) 이 중에서 CBER 승인 신약은 8개이다. 질환별로는 항암제가 주를 이뤘고 세포유전자 치료제를 비롯한 새로운 모달리티(modality)의 약물(이중항체, ADC, 방사성동위원소결합체 등)이 승인되었다.
[표 3-21] 미국 FDA CDER 승인 내역
|
연번 |
성분명 |
제품명 |
제약사 |
작용기전 |
적응증 |
|
1 |
Daridorexant |
Quviviq |
Idorsia |
Orexin receptor antagonist |
불면증 |
|
2 |
Abrocitinib |
Cibinqo |
Pfizer |
JAK inhibitor |
아토피 피부염 |
|
3 |
Tebentafusp |
Kimmtrak |
Immunocore |
gp100 peptide-HLAxCD3 bispecific T cell engager |
포도막 흑색종 |
|
4 |
Faricimab |
Vabysmo |
Roche/ Genentech |
VEGFxANG2 bispecific antibody |
노인성 황반변성, 당뇨병성 황반부종 |
|
5 |
Sutimlimab |
Enjaymo |
Vioverativ |
C1s-targeted mAb |
한랭응집소증 |
|
6 |
Mitapivat |
Pyrukynd |
Agios |
Pyruvate kinase activator |
용혈성 빈혈 |
|
7 |
Pacritinib |
Vonjo |
CTI Biopharma |
JAK2 inhibitor |
골수 섬유화증 |
|
8 |
Ganaxolone |
Ztalmy |
Marinus |
GABAA receptor positive allosteric modulator |
CDKL5 결핍장애로 인한 발작 |
|
9 |
Relatlimab+nivolumab |
Opdualag |
BMS |
LAG3-targeted mAb+PD1-targeted mAb |
흑색종 |
|
10 |
Lutetium Lu-177 vipivotide tetraxetan |
Pluvicto |
Novatis |
PSMA-binding radioligand therapeutic agent |
PSMA 양성 전립선암 |
|
11 |
Oteseconazole |
Vivjoa |
Novatis |
Azole antifungal |
외음부 칸디다증 |
|
12 |
Mavacamten |
Camzyos |
BMS |
Cardiac myosin inhibitor |
폐쇄성 비후성 심근병증 |
|
13 |
Vonoprazan +amoxicillin +clarith romycin |
Voquezna triple pak |
Phathom |
Potassium-competitive acid blocker +penicillin class antilbacterial +macrolide antimicrobial |
헬리코박터 파일로리 |
|
14 |
Tirzepatide |
Mounjaro |
Eli Lilly |
GIP receptor and GLP1 receptor agonist |
제2형 당뇨병 |
|
15 |
Tapinarof |
Vtama |
Dermavant |
Aryl hydrocarbon receptor agonist |
건선 |
|
16 |
Vutrisiran |
Amvuttra |
Alnylam |
TTR-targeted siRNA |
아밀로이드 트랜스티레틴 아밀로이드증 다발신경병증 |
|
17 |
Olipudase alfa |
Xenpozyme |
Sanofi/ Genzyme |
Acid sphingomyelinase ERT |
산성 스핑고미엘린분해효소결핍증(ASMD) |
|
18 |
Spesolimab |
Spevigo |
Boehringer Ingelheim |
IL-36R-targeted mAb |
전신 농포성 건선 |
|
19 |
Dazibotulinumtoxina |
Daxxify |
Revance |
Cotulinum toxin |
미간 주름 개선 |
|
20 |
Deucravacitinib |
Sotyktu |
BMS |
TYK2 inhibitor |
건선 |
|
21 |
Eflapegrastim |
Rolvedon |
Spectrum |
Leukocyte growth factor |
골수억제성 항암제를 투여받는 비골수성 악성종양의 호중구감소증 |
|
22 |
Terlipressin |
Terlivaz |
Mallinckrodt |
Vasopressin receptor agonist |
말린크로트 간신증후군 |
|
23 |
Gadopiclenol |
Elucirem |
Guerbet |
Gadolinium-based contrast agent |
비정상적 혈관 병변 |
|
24 |
Omidenepag isopropyl |
Omlonti |
Santen |
Prostaglandin E2 receptor agonist |
개방각 녹내장, 고안압증의 안압강화 |
|
25 |
Sodium phenylbutyrate+taurursodiol |
Relyvrio |
Amylyx |
Mechanism unknown |
근위축성 측색경화증 |
|
26 |
Futibatinib |
Lytgobi |
Taiho Oncology |
FGFR kinase inhibitor |
FGFR2 유전자 융합 또는 재배열을 보이는 간내담관암 |
|
27 |
Tremelimumab |
Imjudo |
AstraZeneca |
CTLA4-targeted mAb |
간세포암 |
|
28 |
Teclistamab |
Tecvayli |
J&J |
BCMAxCD3 bispecific antibody |
다발성 골수종 |
|
29 |
Mirvetuximab soravtansine |
Elahere |
Immunogen |
FRα-targeted ADC |
난소암 |
|
30 |
Teplizumab |
Tzield |
Provention Bio |
CD3-targeted antibody |
제1형 당뇨병 발병 지연제 |
|
31 |
Olutasidenib |
Rezlidhia |
Rigel/Forma |
IDH1 inhibitor |
IDH1 변이 급성 골수성 백혈병 |
|
32 |
Adagrasib |
Krazati |
Mirati |
KRAS-G12C inhibitor |
KRASG12C 변이 비소세포폐암 |
|
33 |
Lenacapavir |
Sunlenca |
Gilead |
HIV-1 capsid inhibitor |
HIV-1 |
|
34 |
Mosunetuzumab |
Lunsumio |
Roche/ Genentech |
CD20xCD3 biospecific antibody |
여포성 림프종 |
|
35 |
Xe 129 hyperpolarized |
Xenoview |
Polarean |
Hyperpolarized contrast agent |
폐 환기능력 평가 |
|
36 |
Ublituximab |
Briumvi |
TG Therapeutics |
CD20-targeted mAb |
재발성 다발성 경화증 |
|
37 |
Anacaulase |
Nexobrid |
Mediwound |
Proteolytic enzymes from pineapple plants |
중증 열화상 가피제거 |
출처: A Mullard, 2022 FDA approvals, Nature reviews drug discovery, 2023
다음 그림과 같이 지난 5년간(2017∼2021) 미국 FDA는 평균적으로 51건이 승인되었으나 2022년에는 37건의 신약이 승인된 것으로 나타났다.
|
|
주1) 백신 및 유전자 요법과 CBER 승인 제품 미포함
주2) BLAs: Biological License Applications(생물의약품 품목허가)
주3) NMEs: New Molecular Entities(신규물질 품목허가)
출처: A Mullard, 2022 FDA approvals, Nature reviews drug discovery, 2023
[그림 3-66] 미국 FDA의 연도별 승인 신약 건수(1993∼2022)
한편, 미국 FDA는 21세기 치료법 제정을 통해서 새로운 치료법의 연구, 개발 등을 포괄적으로 점검하고 관련 규제를 정비하고 있다. 미충족 의료수요(unmet medical needs) 해결 가능성이 있다고 판단되는 약물은 신약개발 촉진을 위한 프로그램(FDA/CDER Expedited program)인 Fast Track(신속심사), Breakthrough Therapy(혁신치료제), Priority Review(우선심사), Accelerated Approval(신속승인) 등을 통해서 허가 승인 과정을 다음 그림과 같이 거친다. 이는 FDA와 기업 간의 소통과 협업이 증가함으로 개발 기간과 허가 기간이 단축되고, 기업이 신약 승인(NDA나 BLA) 자료를 단계적으로 제출할 수 있는 이점이 있다. 비임상 자료만으로 가능하기에 임상 초기 지정을 받으면 미국 FDA로부터 신약개발에 대한 많은 조언을 들을 수 있다.
|
|
출처: 미국 FDA
[그림 3-67] 미국 FDA CDER Drug Designation
실제로 중대하거나 생명을 위협하는 질환의 치료제로 Breakthrough Therapy로 지정되면 기존 치료제에 비해서 괄목할 만한 유효성이 보이는 약물의 개발과 심사를 신속히 처리하기 위해 지정, 임상시험 디자인, 바이오마커의 이용 등과 관련하여 FDA와 소통할 수 있는 기회의 확대, 적절 기준 만족 시 신속심사와 우선심사 자격을 갖게 된다. 우선심사를 받으면 신약 허가 신청서 및 생물의약품 허가 신청서의 심사가 8개월 이내에 이루어진다. 우선심사가 아닌 보통 심사 기간은 12개월이나 신속심사는 생명을 위협하는 또는 중대한 질병을 치료하는 약물을 개발하고 승인하는데 임상적 평가변수(surrogate endpoint)를 사용할 수 있게 한다. 단, 신속심사 승인 신약은 임상 3상을 통해 치료 유효성을 증명해야 한다.45)
2022년 미국 FDA 승인 신약을 모달리티(modality)별로 살펴보면 화합물의약품인 저분자 신약(small molecules)이 21건(57%)으로 가장 큰 비중을 차지하고 있고, 바이오신약(proteins)이 15건으로 상승세를 유지하였다. 단클론항체(mAb), 이중특이(Bispecific) 및 항체-약물 결합체(ADC)를 포함한 항체 기반 치료제는 다음 그림과 같이 전체 승인 신약의 30%를 차지하였다.
|
|
주1) 복수의 적응증에 해당하는 질병 영역은 하나로 분류함
주2) 2017∼2021년 5년간의 평균임
출처: A Mullard, 2022 FDA approvals, Nature reviews drug discovery, 2023
[그림 3-68] 2022년 미국 FDA 승인 신약의 유형별 비중
한편, Pharma Annual Review(2022)에 의하면 합성 유래 화합물의약품의 파이프라인이 다른 의약품의 파이프라인보다 월등히 많음을 확인할 수 있다.
[표 3-22] Origins of pipeline drugs(2021~2022)
|
No. |
Target |
제품수 |
|
|
2021 |
2022 |
||
|
1 |
Chemical, synthetic |
9,007 |
9,565 |
|
2 |
Biological, protein, antibody |
2,484 |
2,681 |
|
3 |
Biological, protein, recombinant |
771 |
865 |
|
4 |
Biological cellular, autologous |
758 |
776 |
|
5 |
Biological nucleic acid, viral vector |
563 |
680 |
|
6 |
Biological cellular, heterologous |
448 |
587 |
|
7 |
Biological, cellular |
459 |
558 |
|
8 |
Biological, protein |
562 |
541 |
|
9 |
Biological, virus particles |
458 |
493 |
|
10 |
Chemical, synthetic, nucleic acid |
437 |
489 |
|
11 |
Biological, nucleic acid |
296 |
471 |
|
12 |
Chemical, synthetic, peptide |
475 |
453 |
|
13 |
Biological, bacterial cells |
251 |
283 |
|
14 |
Biological, peptide |
259 |
272 |
|
15 |
Biological, other |
155 |
237 |
|
16 |
Natural product, plant |
260 |
215 |
|
17 |
Biological |
224 |
187 |
|
18 |
Biological, nucleic acid, non-viral vector |
136 |
184 |
|
19 |
Biological, peptide, recombinant |
141 |
171 |
|
20 |
Natural product, bacterial |
54 |
55 |
|
21 |
Chemical, semisynthetic |
57 |
53 |
|
22 |
Natural product, fungal |
39 |
46 |
|
23 |
Natural product |
39 |
41 |
|
24 |
Chemical, synthetic, isomeric |
21 |
24 |
|
25 |
Natural product, animal |
31 |
23 |
출처: Pharma Annual Review, 2022
라. 발전 전망과 과제
2022년 말까지 축적되어 온 다국적 제약기업들의 재정 여력은 역대 최고 수준이고, 우리나라 대기업 및 중견 제약기업들의 현금성 자산 또한 증가 추세다. 지금 2022년 말까지 축적되어 온 다국적 제약기업들의 재정 여력은 역대 최고 수준이고, 우리나라 대기업 및 중견 제약기업들의 현금성 자산 또한 증가하고 있다.
벤처기업들에 대한 투자 감소와 가치 평가의 하락은 오히려 대기업, 중견 제약기업들과의 투자, 기술이전, M&A 등 다양한 의약품 연구개발 비즈니스 협력이 확장되는 계기가 되고 있다.
그동안 우리나라 신약개발 분야의 오픈 이노베이션 활동은 주로 대학, 연구기관, 벤처 등 개별 혁신 주체와의 공동연구, 기술이전 및 라이센싱, 제한된 범위 내에서의 투자가 중심이었다. 최근에는 원천기술과 플랫폼을 기반으로 특정 기술 및 질환 분야에 특화된 바이오 스타트업의 창업이 연평균 300건 이상에 이르게 되면서 포스트 오픈 이노베이션의 새로운 모델로 스타트업과 기존 국내 제약・바이오기업, 벤처 투자자본 간 역할 분담을 통한 글로벌 성장 모델이 필요하게 되었다.
이를 위해서는 첫째, 시장 경험이 상대적으로 부족한 공급자 중심형 바이오 스타트업 모델이 지니고 있는 리스크를 최소화하고 신약개발 기업의 혁신수요에 실질적으로 부합시켜야 한다. 둘째, 현재의 역량으로 수용하기 어려운 영역이지만 신약개발 기업이 미래유망 기술 분야 혁신 트렌드를 선도할 수 있도록 기존 산업과 스타트업 간의 역할 분담형 상생 협력모델을 구축해야 하는 당면 과제가 있다.
향후, 바이오경제와 Life Care, 기술융복합의 시대를 맞아서 화합물의약품은 바이오의약품의 고속 성장세와 함께 의약품 분야를 통틀어 가장 큰 세계시장 점유율을 기록하면서 지속적인 성장세를 이어 나갈 것으로 전망한다.
|
참고자료 |
∙ A Mullard, 2022 FDA approvals, Nature reviews drug discovery, 2023
∙ FDA, Center for Drug Evaluation and Research, Advancing Health Through Innovation, 2018 New Drug Therapy Approvals
∙ FDA, Center for Drug Evaluation and Research, Advancing Health Through Innovation, 2017 New Drug Therapy Approvals
∙ FDA, Novel Drugs Summary 2016
∙ FDA, Novel Drugs Summary 2015
∙ EvaluatePharma, WORLD PREVIEW 2021 Outlook to 2026, 2021.7.
∙ Pharma Annual Review 2022
2. 바이오의약품
가. 개요
바이오의약품은 생물체에서 유래하거나 생물체를 통해 생산되는 의약품으로, 백신, 항체, 재조합단백질, 세포치료제, 유전자치료제 등이 포함된다. 최근 바이오의약품 분야에서 가장 주목할 만한 특징은 mRNA 백신 및 치료제의 개발이었다. COVID-19 대유행이 지속되면서 화이자(Pfizer)-바이오엔테크(BioNTech), 모더나(Moderna)가 개발한 mRNA 백신은 신속한 개발과 다양한 치료제로 적용이 가능하다는 장점으로 인해 단시간에 새로운 바이오의약품 플랫폼으로 자리 잡았다.
항체의약품은 높은 특이성과 낮은 부작용으로 다양한 질환에서 사용되고 있으며, 신규 바이오의약품 개발의 75% 이상을 차지하였다. 그 중 이중항체(Bispecific Antibody)와 항체-약물 접합체(Antibody-Drug Conjugate, ADC) 개발은 전체 항체의약품의 10%를 차지하였다.
면역치료제(Immunotherapy) 개발은 CAR(Chimeric Antigen Receptor)-T 세포유전자치료제와 면역관문억제제(Immune Checkpoint Inhibitor)를 중심으로 꾸준히 증가했다. 특히 면역관문억제제는 다양한 종류의 암에 적용할 수 있어 반응률과 효과를 높이기 위한 병용요법이 늘어나고 있다.
또한 고감도 생체정보 분석기술과 인공지능 기반의 빅데이터 분석기술을 활용한 환자 맞춤형 치료제는 고가의 의약품을 적합한 환자에게만 선별적으로 적용하여 정밀의료 시대를 앞당기고, 고령화 사회에서 의료 서비스를 개선할 것으로 예상된다.
나. 해외 동향
(1) 바이오의약품 승인 및 개발 동향
미국 식품의약국(FDA)에서 승인된 바이오의약품은 가속 승인의 감소에도 불구하고 최근 몇 년간 비교적 일정한 수준을 유지하였다.

출처: U.S.Food and Drug Administration; RSM US LLP
[그림 3-69] 미국 FDA 의약품 승인 동향(2002~2022)
지금까지 FDA에서 승인된 COVID-19 백신은 화이자-바이오엔테크(Pfizer-BioNTech), 모더나(Moderna), 얀센(Janssen), 노바백스(Novavax)가 개발한 총 4건이었다. 이 중 2건은 mRNA 백신이었다. 새로운 mRNA 백신은 가장 빠르게 FDA 승인을 받아 사용되었을 뿐만 아니라, 환자의 생존율을 크게 향상시키는데 기여하였다. 이러한 성공을 토대로 mRNA 치료제는 다양한 질환 분야로 확대되고 있으며, mRNA 치료제 시장은 2030년까지 13.03%의 높은 연평균 성장률(CAGR)을 기록할 것으로 전망되고 있다.46)

출처: Precedence Research
[그림 3-70] mRNA 치료제 시장 규모 전망(2021∼2030)
COVID-19에 대한 mRNA 백신은 1년도 걸리지 않고 개발되었다. 이러한 신속한 개발은 감염병 대유행 상황에서 매우 중요한 성공 요소로 인식되었다. 그러나 건강한 사람을 대상으로 하는 예방용 백신은 단기간 내에 개발된 mRNA 백신이 안전성을 보장하는 유일한 해결책이 될 수 없다. 따라서 COVID-19 백신은 연령대별로 다양한 형태로 사용되었다. 성인은 mRNA 또는 바이러스 벡터 형태의 백신, 청소년은 재조합단백질 형태의 백신, 영유아는 감염 차단 항체를 투여받았다.
COVID-19 치료를 위해 백신 외에도 다양한 항체의약품이 개발되었다. 임상 3상까지 완료된 항체의약품은 총 12건이었다. Bamlanivimab(Spike)과 Etesevimab(Spike)은 바이러스 표적항원에 결합하여 감염을 차단하는 항체였고, Siltuximab(IL-6), Olokizumab(IL-6), Tocilizumab(IL-6R), Sarilumab(IL-6R), Canakinumab(IL-1b)은 바이러스 감염으로 인한 염증 반응을 억제하는 항체였다. 이러한 사례는 항체의약품이 항암제와 자가면역질환치료제 중심에서 중증 감염질환을 포함한 다양한 질환의 치료제로 확대되고 있음을 보여 준다.
최근 2년 동안 미국 FDA를 통해 승인된 바이오의약품은 총 22건으로, 전체 의약품의 25%를 차지하였다. 이 중 항체의약품은 18건으로 바이오의약품의 81.8%를 차지하였으며, 그 중 이중항체와 ADC가 각각 4건과 2건으로 전체 항체의약품의 33.3%를 차지하였다. 특히 이중항체의 수는 2021년 1건에서 2022년 3건으로 증가하였다. 나머지는 재조합단백질 효소가 3건(13.6%), 사이토카인(cytokine)이 1건(4.6%)이었다.47)
[표 3-23] 미국 FDA 바이오의약품 승인 현황(2021∼2022)
|
구분 |
의약품 |
바이오의약품 |
항체 |
이중항체 |
ADC |
효소 |
Cytokine |
|
2021 |
51 |
11 |
6 |
1 |
1 |
2 |
1 |
|
2022 |
37 |
11 |
6 |
3 |
1 |
1 |
- |
|
합계 |
88 |
22 |
12 |
4 |
2 |
3 |
1 |
출처: FDA, Novel Drug Approvals

출처: FDA, Novel Drug Approvals
[그림 3-71] 미국 FDA 바이오의약품 승인 현황(2021∼2022)
최근 2년 동안 세포 및 유전자치료제는 미국 FDA로부터 총 9건의 승인을 받았다. 그중 세포치료제가 22.2%(2건)를 차지하였고, 유전자 및 세포유전자치료제가 77.8%(7건)를 차지하였다. 2021년에는 세포치료제와 세포유전자치료제(CAR-T)가 각각 2건이었는데, 2022년에는 유전자치료제가 2건, 세포유전자치료제(CAR-T, 1건)가 3건으로 증가하였다. 2020년 이전까지는 세포치료제가 유전자치료제의 2배로 많았지만, 최근 2년간은 유전자치료제가 세포치료제의 3.5배로 증가하는 경향을 보였다. 이러한 경향은 유전자치료제가 세포치료제에 비해 효능이 더 명확한 질환을 대상으로 하기 때문일 수도 있으며, 또한 이전에는 치료가 어려웠던 희귀질환에 대한 초고가 치료제 시장의 가능성을 보여주었기 때문으로 보인다.
[표 3-24] 세포 및 유전자치료제 개발 동향(2010∼2022)
|
구분 |
전체 |
세포 치료제 |
유전자 치료제 |
세포유전자 치료제 |
(CAR-T)주) |
|
2010∼2020 |
18 |
12 |
3 |
3 |
(3) |
|
2021 |
4 |
2 |
- |
2 |
(2) |
|
2022 |
5 |
- |
2 |
3 |
(1) |
|
합계(2021∼2022) |
9 |
2 |
2 |
5 |
(3) |
주) 세포유전자치료제 중 CAR-T 치료제의 수
출처: FDA, Novel Drug Approvals
희귀유전질환에 대한 유전자치료제와 마찬가지로 고가인 세포유전자치료제의 수요가 증가하고 있다. 이는 유전자치료제와 세포유전자치료제가 기존에 치료제가 없던 희귀질환과 난치성 질환을 대상으로 하기 때문이다. 이러한 의약품은 시장이 작고 개발 비용이 높은 초고가 제품이기 때문에 시사하는 바가 크다. 희귀질환치료제는 제약사에게 개발 전략적으로 유리한 측면이 있지만 시장 규모가 작다는 단점도 있다. 최근에는 개인 유전체 정보를 이용하여 정밀의료 기술이 발전되어 다양한 생체 정보를 통합적으로 분석할 수 있게 되었다. 이러한 정보를 기반으로 소수의 환자를 대상으로 고가의 맞춤형 치료제를 개발하는 전략적 변화가 의미있게 이루어지고 있다. 글로벌 시장에서 고가의 치료비용을 감당할 수 있는 환자 수가 증가하면서 제약사에게는 수익성 면에서 매력적인 시장이 되고 있다는 것을 의미한다.
(2) 항체치료제 개발 동향
항체치료제는 단클론항체, 이중항체, ADC, 면역관문억제제, 바이오시밀러로 구분할 수 있다. 이 중 단클론항체가 가장 큰 비중을 차지하며, 미국 FDA의 생물의약품허가신청(Biologics license Application, BLA) 기준으로 알아보고자 한다.
(가) 단클론 항체치료제
단클론 항체치료제는 암, 자가면역질환, 유전질환, 대사질환 치료 등에 사용된다. 2021년에는 EGFR, CD38, CD20을 표적으로 하는 항암제와 TNFa, BAFF, IL-6R, IL-23A, IL-17A, IL-4Ra, IgE, IL-5를 표적으로 하는 자가면역질환치료제, 그리고 보체 C5를 표적으로 하는 유전질환치료제와 proprotein convertase subtilisin/kexin type 9를 표적으로 하는 대사질환치료제가 개발되었다. 특히, 2022년에는 암과 자가면역질환치료제 외에도 CD4를 표적으로 하는 HIV 감염질환치료제, 노바티스(Novartis) 사의 VEGFA를 표적으로 하는 신생혈관 황반변성치료제, 암젠(Amgen)사의 CGRPR을 표적으로 하는 편두통치료제가 개발되었다. 이로써 항체치료제가 더욱 다양한 질환에 적용되어 확대되고 있음을 보여 주었다.
[표 3-25] 단클론 항체 치료제 개발 현황(2021∼2022)
|
연도 |
제품명 (성분명) |
표적/적응증 |
제조사 |
|
2022 |
DARZALEX (DARATUMUMAB) |
CD38, 다발성골수종 |
JANSSEN BIOTECH |
|
GAZYVA (OBINUTUZUMAB) |
CD20, 만성림프구성 백혈병 |
GENENTECH |
|
|
SKYRIZI (RISANKIZUMAB-RZAA) |
IL-23A, 건선, 크론병, 자가면역질환 |
ABBVIE |
|
|
BENLYSTA (BELIMUMAB) |
BAFF, 전신성 홍반성 루푸스 |
GSK |
|
|
STELARA (USTEKINUMAB) |
IL-12/IL-23, 크론병, 건선 |
JANSSEN BIOTECH |
|
|
DUPIXENT (DUPILUMAB) |
IL-4Ra 항체, 알러지, 천식 |
REGENERON |
|
|
ILUMYA (TILDRAKIZUMAB-ASMN) |
IL-23, 염증성질환 |
SUN PHARMA |
|
|
ULTOMIRIS (RAVULIZUMAB-CWVZ) |
Complement C5, 발작성 야간혈색소뇨증 |
ALEXION |
|
|
TROGARZO (IBALIZUMAB-UIYK) |
CD4, HIV |
THERATECHNOLOGIES |
|
|
BEOVU (BROLUCIZUMAB-DBLL) |
VEGFA, 신생혈관 황반변성 |
NOVARTIS |
|
|
AIMOVIG (ERENUMAB-AOOE) |
CGRPR, 편두통 |
AMGEN |
|
|
2021 |
ERBITUX (CETUXIMAB) |
EGFR, 전이성 직장암 등 |
ELI LILLY |
|
SARCLISA (ISATUXIMAB-IRFC) |
CD38, 다발성 골수종 |
SANOFI-AVENTIS |
|
|
RITUXAN (RITUXIMAB) |
CD20, 백혈병, 자가면역질환 |
GENENTECH |
|
|
CYLTEZO (ADALIMUMAB-ADBM) |
TNFa, 류마티스관절염, 자가면역염증질환 |
BOEHRINGER INGELHEIM |
|
|
HUMIRA (ADALIMUMAB) |
TNFa, 류마티스관절염, 자가면역염증질환 |
ABBVIE |
|
|
SIMPONI ARIA (GOLIMUMAB) |
TNFa, 류마티스관절염, 자가면역염증질환 |
JANSSEN BIOTECH |
|
|
ACTEMRA (TOCILIZUMAB) |
IL-6R, 류마티스관절염 |
GENENTECH |
|
|
SKYRIZI (RISANKIZUMAB-RZAA) |
IL-23A, 건선, 크론병, 자가면역질환 |
ABBVIE |
|
|
COSENTYX (SECUKINUMAB) |
IL-17A, 건선, 관절염 |
NOVARTIS |
|
|
DUPIXENT (DUPILUMAB) |
IL-4Ra, 알러지, 천식 |
REGENERON |
|
|
XOLAIR (OMALIZUMAB) |
IgE, 천식 |
GENENTECH |
|
|
NUCALA (MEPOLIZUMAB) |
IL-5, 호산구성 천식 |
GSK |
|
|
ULTOMIRIS (RAVULIZUMAB-CWVZ) |
Complement C5, 발작성 야간혈색소뇨증 |
ALEXION |
|
|
REPATHA (EVOLOCUMAB) |
Proprotein convertase subtilisin/kexin type 9, 과지질혈증 |
AMGEN |
|
|
PRALUENT (ALIROCUMAB) |
Proprotein convertase subtilisin/kexin type 9, 고콜레스테롤증 |
AMGEN |
|
|
BLINCYTO (BLINATUMOMAB) |
CD19/CD3, 급성림프구성 백혈병 |
AMGEN |
출처: FDA, Novel Drug Approvals
(나) 이중항체치료제
이중항체치료제는 모두 항암제로 개발되었다. 2021년에 암젠(Amgen) 사에서 개발한 블리나투모맙(Blinatumomab)은 CD19/CD3을 표적으로 하는 BiTE(bispecific T cell engager)로, CD19를 통해 B세포를 인식하고 CD3을 통해 CD8+ T세포를 활성화시켜 치료 효과를 높이는 급성 림프구성 백혈병 치료제이다. 블리나투모맙의 연간 치료비용은 17만 8,000딜러로 가장 비싼 항암 치료제 중 하나이며, 혁신적인 바이오의약품의 개발, 제조 및 공급의 복잡성을 반영하고 있다. 2022년에 얀센 바이오텍(Janssen Biotech) 사에서 개발한 아미반타맙(Amivantamab)은 EGFR/MET를 표적으로 하는 이중항체로, EGFR 엑손 20 삽입 돌연변이를 가진 진행성 비소세포폐암 환자를 위한 표적 치료제이다.
(다) 항체-약물 접합체(Antibody-Drug Conjugate, ADC)
ADC는 최근 2년 동안 항암제로 총 6개가 개발되었다. 2021년에는 4개가 개발되었는데, 아스텔라스제약(Astellas pharma) 사의 Nectin-4항체와 미세소관(microtubule) 저해제인 Vedotin을 결합시킨 엔포투맙(Enfortumab Vedotin)은 요로상피암 치료에 사용되고, 다이이찌산쿄(Daiichi Sankyo) 사의 HER2 항체와 Topoisomerase I 저해제인 Deruxtecan을 결합시킨 ‘Fam-Trastuzumab Deruxtecan’은 유방암 및 위암 치료에 사용된다. 또한, 이뮤노메딕스(Immunomedics)사의 Trop2 항체와 Topoisomerase 저해제인 Govitecan을 결합시킨 사시투주맙(Sacituzumab Govitecan)은 전이성 3중 음성 유방암 치료제로 개발되었으며, 얀센 바이오텍(Janssen Biotech)사의 CD38 항체와 히알루로니다아제(Hyaluronidase)를 결합시킨 다라튜뮤맙 히알루로니다제(Daratumumab Hyaluronidase)가 재발성 다발성 골수종 치료제로 개발되었다. 개발된 이 6개의 제품은 모두 우선 심사로 진행되었다. ADC의 경우에도 단클론 항체치료제와 마찬가지로 주로 새로운 적응증 추가를 위해 개발이 이루어졌다.
(라) 면역관문억제제(Immune Checkpoint Inhibitor, ICI)
면역관문억제제의 약물 표적은 CTLA-4, PD-1, PD-L1로 한정되었으며, 이 분야는 최근 항암제 중 가장 활발하게 개발되고 있다. 2021년에 비엠에스(BMS) 사에서는 CTLA-4를 표적으로 하는 여보이주(Yervoy, Ipilimumab)의 표시 변경을 위해, PD-1을 표적으로 하는 옵디보(Opdivo, Nivolumab)는 흑색종과 폐암 등의 적응증을 확대하기 위해 개발되었다. PD-1을 표적으로 하는 머크앤드컴퍼니(Merck Sharp&Dohme)사의 키트루다(Keytruda)와 리네제론 파마슈티컬스(Regeneron pharmaceuticals)사의 리브타요(Libtayo)는 각각 흑색종과 폐암, 편평세포 피부암에 대한 신규 적응증을 추가하였다. 또한 PD-L1을 표적으로 하는 아스트라제네타(Astrazeneca)사의 임핀지(Imfinzi)와 제넨텍(Genentech)사의 티센트릭(Tecentriq)은 요로상피암과 비소세포폐암 치료제로 개발이 진행되었다. 2022년에는 EMD세로노(EMD Serono)사의 바벤치오(Bavencio, Avelumab)가 PD-L1을 표적으로 메르켈세포암, 요로상피암, 신장세포암 치료제로 개발되었다.
[표 3-26] 면역관문억제제 개발 현황(2021∼2022)
|
연도 |
제품명 (성분명) |
표적/적응증 |
제조사 |
|
2022 |
YERVOY (IPILIMUMAB) |
CTLA-4, 흑색종, 비소세포상피암 |
BMS |
|
KEYTRUDA (PEMBROLIZUMAB) |
PD-1, 흑색종, 폐암 등 |
MERCK SHARP & DOHME |
|
|
OPDIVO (NIVOLUMAB) |
PD-1, 흑색종, 폐암 등 |
BMS |
|
|
LIBTAYO (CEMIPLIMAB-RWLC) |
PD-1, 편평세포 피부암 |
REGENERON PHARMACEUTICALS |
|
|
TECENTRIQ (ATEZOLIZUMAB) |
PD-L1, 요로상피암, 비소세포폐암 |
GENENTECH |
|
|
IMFINZI (DURVALUMAB) |
PD-L1, 요로상피암, 비소세포폐암 |
ASTRAZENECA |
|
|
BAVENCIO (AVELUMAB) |
PD-L1, 메르켈세포암, 요로상피암, 신장세포암 |
EMD SERONO |
|
|
2021 |
YERVOY (IPILIMUMAB) |
CTLA-4, 흑색종, 비소세포상피암 |
BMS |
|
OPDIVO (NIVOLUMAB) |
PD-1, 흑색종, 폐암 등 |
BMS |
|
|
KEYTRUDA (PEMBROLIZUMAB) |
PD-1, 흑색종, 폐암 등 |
MERCK SHARP & DOHME |
|
|
LIBTAYO (CEMIPLIMAB-RWLC) |
PD-1, 편평세포 피부암 |
REGENERON PHARMACEUTICALS |
|
|
IMFINZI (DURVALUMAB) |
PD-L1, 요로상피암, 비소세포폐암 |
ASTRAZENECA |
|
|
TECENTRIQ (ATEZOLIZUMAB) |
PD-L1, 요로상피암, 비소세포폐암 |
GENENTECH |
출처: FDA, Novel Drug Approvals
(마) 바이오시밀러(Biosimilar)
바이오시밀러는 블록버스터급 바이오의약품의 특허 만료와 관련하여 개발이 증가하고 있다. 2021년에는 VEGF-A를 표적으로 하는 암젠(Amgen)사의 베바시주맙(Bevacizumab)은 항암제와 안과질환치료제로 개발되었고, CD20를 표적으로 하는 화이자(Pfizer)사의 리툭시맙(Rituximab)은 백혈병과 자가면역질환치료제로 개발되었다. 특히, 2022년에는 애브비(AbbVie)사의 블록버스터급 바이오의약품인 휴미라(Humira, Adalimumab)가 2023년에 미국 내에서 특허 만료를 앞두고 있어 TNFa를 표적으로 하는 아달리무맙(Adalimumab) 바이오시밀러의 개발이 암젠(Amgen), 마일란 파마슈티컬스(Mylan pharmaceuticals), 화이자(Pfizer), Sandoz(산도즈), UCB, 삼성바이오에피스를 중심으로 활발히 진행되었다. 또한 암젠(Amgen)사에서는 CD20을 표적으로 하는 리툭시맙(Rituximab) 바이로시밀러의 개발도 진행되었다. 블록버스터급 오리지널 의약품의 특허 만료를 기점으로 바이오시밀러가 출시될 것으로 예상된다. 휴미라 이외에도 존슨앤존슨(J&J)의 건선치료제인 스텔라라(Stelara, Ustekinumab)도 IL-12와 IL-23를 표적으로 하는 바이오시밀러가 2023년에 출시될 것으로 예상하고 있다.
[표 3-27] 바이오시밀러 개발 현황(2021∼2022)
|
연도 |
제품명 (성분명) |
표적/적응증 |
제조사 |
|
2022 |
ERELZI (ETANERCEPT-SZZS) |
TNFa 저해제, 자가면역질환 |
SANDOZ |
|
AMJEVITA (ADALIMUMAB-ATTO) |
TNFa, 류마티스관절염, 자가면역염증질환 |
AMGEN |
|
|
HULIO (ADALIMUMAB-FKJP) |
TNFa, 류마티스관절염, 자가면역염증질환 |
MYLAN PHARMACEUTICALS |
|
|
ABRILADA (ADALIMUMAB-AFZB) |
TNFa, 류마티스관절염, 자가면역염증질환 |
PFIZER |
|
|
HADLIMA (ADALIMUMAB-BWWD) |
TNFa, 류마티스관절염, 자가면역염증질환 |
SAMSUNG BIOEPIS |
|
|
HYRIMOZ (ADALIMUMAB-ADAZ) |
TNFa, 류마티스관절염, 자가면역염증질환 |
SANDOZ |
|
|
CIMZIA (CERTOLIZUMAB PEGOL) |
TNFa, 류마티스관절염, 자가면역염증질환 |
UCB |
|
|
RIABNI (RITUXIMAB-ARRX) |
CD20, 자가면역질환, 암 |
AMGEN |
|
|
2021 |
MVASI (BEVACIZUMAB-AWWB) |
VEGF-A, 암, 안과질환 |
AMGEN |
|
ZIRABEV (BEVACIZUMAB-BVZR) |
VEGF-A, 암, 안과질환 |
AMGEN |
|
|
RUXIENCE (RITUXIMAB-PVVR) |
CD20, 백혈병, 자가면역질환 |
PFIZER IRELAND PHARMACEUTICALS |
출처: FDA, Novel Drug Approvals
(3) 세포 및 유전자치료제 개발 동향
2010년부터 현재까지 개발된 세포 및 유전자치료제의 최근 2년 동안의 성과를 살펴보면, 세포치료제는 14.3%, 유전자치료제는 40%, 그리고 세포유전자치료제는 62.5%의 성과를 이뤄냈다. 특히 CAR-T 치료제는 50%의 비중을 차지하였다. 2016년 이전까지는 주로 세포치료제에 중점을 두고 개발되었으나, 2017년에 CAR-T 치료제인 킴리아(Kymriah)와 예스카르타(Yescarta)가 출시되면서, 세포유전자 및 유전자치료제에 대한 개발이 활발히 진행되고 있다.
(가) 세포치료제
2021년에 엔지반트 테라퓨틱스(Enzyvant therapeutics)사가 선천성 무흉선 환자의 면역기능 개선을 위해 레티믹(Rethymic)이라는 타가 흉선조직 세포치료제를 개발하였다. 또한 스트라타텍(Stratatech)사에서 열화상 환자 치료를 위해 스트라타그래프트(Stratagraft)라는 타가 각질세포와 진피 섬유아세포의 세포화된 스캐폴드 치료제를 개발하였다.
(나) CAR-T/NK 치료제
2021년에는 주노 테라퓨틱스(Juno therapeutics)사의 브레얀지(Breyanz)와 셀진(Celgene)사의 아베크마(Abecma)가 B세포 림프종 및 B 세포 종양 치료제로 개발되었다. 브레얀지는 CD19를 표적으로 하고, 아베크마는 BCMA를 표적으로 한다. 2022년에는 얀센 바이오텍(Janssen Biotech)사가 BCMA를 표적으로 하는 재발성, 불응성 다발성 골수종 치료제인 카빅티(Carvykti)를 개발하였다.
(다) 유전자치료제
2022년에는 유전자 및 세포 유전자치료제의 개발이 2021년보다 활발히 이루어졌다. 페링제약(Ferring pharmaceuticals)사의 애드스틸라드린(Adstiladrin)은 아데노바이이러스 기반의 IFNa-2b 발현 유전자치료제로 방광암 치료제로 개발되었고, CSL베링(CSL Behring)사의 헴제닉스(Hemgenix)는 AAV5 기반의 F9 발현 유전자치료제로 B형 혈우병 치료제로 개발되었다. 또한 블루버드 바이오(Bluebird bio)사는 렌티바이러스 기반으로 ABCD1을 조혈 줄기세포(Hematopoietic Stem Cell, HSC)에 도입한 스카이소마(Skysoma)를 대뇌 부신백질이영양증 치료제로, HBB를 HSC에 도입한 진테그롤(Zynteglo)를 ß-지중해 빈혈 치료제로 개발하였다.
[표 3-28] (세포)유전자치료제 개발 현황(2021~2022)
|
연도 |
제품명 |
유형 |
제조사 |
설명 |
|
2022 |
ADSTILADRIN |
Adenovirus |
Ferring Pharmaceuticals |
재조합 아데노바이러스(rAd-IFNa/Syn3)(인간 인터페론 알파-2b), 특정 방광암 |
|
HEMGENIX |
AAV5 |
CSL Behring |
재조합 AAV5(F9), 특정 B형 혈우병 |
|
|
SKYSONA |
Cell (autologous) |
bluebird bio |
Lenti-D 벡터(ABCD1) 도입 조혈줄기세포, 대뇌 부신백질이영양증 |
|
|
ZYNTEGLO |
Cell (autologous) |
bluebird bio |
LentiGlobin BB305(HBB) 도입 조혈줄기세포. 특정 ß-지중해 빈혈 |
|
|
CARVYKTI |
CAR-T (Autologous) |
Janssen Biotech |
렌티바이러스 도입 CAR-T 세포, 재발성 또는 불응성 다발성 골수종(BCMA-발현) |
|
|
2021 |
ABECMA |
Cell (autologous) |
Celgene |
렌티바이러스 도입 CAR-T 세포, B 세포 성숙 항원(BCMA) 발현 종양 |
|
BREYANZI |
Cell (autologous) |
Juno Therapeutics |
렌티바이러스 도입 CAR-T 세포, B 세포 림프종(CD19 발현) |
|
|
RETHYMIC |
Cell (allogeneic) |
Enzyvant Therapeutics |
흉선 조직, 특정 선천성 무흉선 환자 면역 기능 개선 |
|
|
STRATAGRAFT |
Cell (allogeneic) |
Stratatech |
마우스 콜라겐 각질세포 및 진피 섬유아세포의 세포화된 스캐폴드, 일부 열 화상 |
출처: FDA, Novel Drug Approvals
다. 국내 현황
(1) 신약 승인
최근 2년 동안 식품의약품안전처(식약처)를 통해 승인된 바이오의약품은 전체 의약품의 34.92%를 차지하였다. 바이오의약품 중에는 백신이 가장 높은 비율인 36.36%를 차지하였으며, 이는 코로나 대유행 상황을 반영한 결과이다. 항체(31.82%), 재조합단백질(22.73%), 유전자치료제(9.1%)가 그 뒤를 이었다.
백신의 경우 2021년에는 mRNA와 바이러스벡터 백신이 각각 2건, 단백질 백신이 1건 승인되었으나, 2022년에는 단백질 백신만 3건이 승인되었다. 이러한 백신 개발 동향은 코로나 대유행 초기에는 신속하고 효과적인 개발이 우선되었으나, 이후에는 오랫동안 안전성이 검증된 단백질 형태의 백신이 주로 개발되었음을 보여 주었다. 또한, 새로운 mRNA 백신 플랫폼에 대한 특허 장벽도 추가적인 개발에 영향을 미쳤을 것으로 보인다.
[표 3-29] 식약처 바이오신약 승인 현황(2021∼2022)
|
구분 |
전체 의약품 |
바이오 의약품 |
백신 (mRNA) |
백신 (바이러스벡터) |
백신 (단백질) |
항체 |
재조합 단백질 |
유전자치료제 (CAR-T) |
유전자 치료제 |
|
2021 |
35 |
12 |
2 |
2 |
1 |
4 |
1 |
1 |
1 |
|
2022 |
28 |
10 |
- |
- |
3 |
3 |
4 |
- |
- |
|
합계 |
63 |
22 |
2 |
2 |
4 |
7 |
5 |
1 |
1 |
|
비중(%) |
100 (34.92)주) |
36.36 |
31.82 |
22.73 |
4.55 |
4.55 |
|||
주) 전체 의약품 중 바이오의약품 비중
출처: 식품의약품안전처
최근 식약처의 바이오신약 지정 현황을 살펴보면, 2021년에는 항체의약품이 총 4건으로 지정되었는데, 그중 1건은 코로나 감염 차단을 위한 항체였고, 나머지는 유전성 혈관부종 발작과 편두통을 예방하기 위한 항체였다. 2021년은 항체의약품이 다양한 질환 치료제로 확대되는 경향을 보였다. 한편 2022년에 지정된 3건은 모두 항암제였다.
재조합단백질 의약품은 2021년에는 1건이었지만, 2022년에는 4건으로 증가했는데, 이 중 3건은 희귀질환 치료제였다. 희귀질환 치료제에서 특이한 점은 2021년에는 유전성 질환과 한정된 수의 환자를 대상으로 하는 고가 치료제였지만, 2022년에는 유전성이나 소수의 질환자에게 반복 치료가 필요한 형태의 치료제였다. 다케다제약의 세프로틴주는 단백질 C 결핍으로 인한 정맥혈전증 치료제였고, BMS의 레블로질주는 성인 빈혈 치료제로 개발되었다.
유전자치료제는 2021년에 재발 또는 불응성 급성 림프성 백혈병과 림프종을 치료하는 CAR-T 치료제인 킴리아주(Kymriah)와 SMN1 유전자 변이로 인한 척수성 근위축증을 치료하는 유전자치료제인 졸겐스마주(Zolgensma)가 승인된 이후 추가적인 승인은 이루어지지 않았다. 추가적인 CAR-T 치료제 개발이 이루어지기 위해서는 정상 세포와 명확히 구분되는 특이적인 표적의 발굴과 고형암에 대한 적용 가능성이 중요한 요소로 보인다. 또한, mRNA 백신을 통해 효율적인 유전자 전달체로 입증된 지질나노입자(LNP)는 유전자치료제 개발 확대를 이끌어갈 것으로 보인다.
최근 2년 동안 국내 제약사가 개발한 신약은 식약처가 지정한 신약 총 22건 중 4건에 불과했다. 이 중에서 셀트리온의 SARS-CoV-2 항체치료제인 렉키로나주(Regkirona), 한미약품의 중증 호중구 감소증 재조합단백질 치료제인 롤론티스프리필드시린지주(Rolontis), SK 바이오사이언스의 SARS-CoV-2 단백질 백신인 스카이코비원멀티주(Skycovione)와 뉴백소비드프리필드시린지(Nuvaxovid)가 있다. 롤론티스는 한미약품이 개발한 약효를 늘려주는 독자 플랫폼 기술인 ‘랩스커버리’를 적용하여 허가를 받은 첫 제품이다. 이 약은 항암화학요법 치료 부작용으로 나타나는 중증호중구감소증의 치료 또는 예방에 사용되는 항암 신약으로, 한국에서는 33번째 신약이자 미국 FDA에서 승인된 첫 번째 항암제이다. 롤론티스의 성공은 한미약품의 랩스커버리 기술에서 중요한 의미를 가진다. 상용화 가능성을 입증함으로써 앞으로 다양한 의약품에 적용될 수 있는 가능성을 열었다.
[표 3-30] 식약처 지정 바이오신약(2021∼2022)
|
구분 |
제품명(주성분) |
업체명 |
중분류 |
소분류 |
대상질환 |
비고 |
|
2021 |
코미나티주(토지나메란) |
화이자 |
백신 |
mRNA |
SARS-CoV-2 |
|
|
모더나스파이크박스주 |
녹십자 |
백신 |
mRNA |
SARS-CoV-2 |
|
|
|
한국아스트라제네카백스제브리아주 |
아스트라제네카 |
백신 |
바이러스벡터 |
SARS-CoV-2 |
|
|
|
코비드-19백신얀센주 |
얀센 |
백신 |
바이러스벡터 |
SARS-CoV-2 |
|
|
|
싱그릭스주 |
GSK |
백신 |
단백질 |
대상포진 |
|
|
|
렉키로나주960mg(레그단비맙) |
셀트리온 |
항체 |
- |
SARS-CoV-2 |
RBD 결합 |
|
|
탁자이로주(라나델루맙) |
다케다 |
항체 |
- |
유전성혈관부종 발작 예방 |
희귀 |
|
|
아조비오토인젝터주(프레마네주맙) |
한독테바 |
항체 |
- |
편두통 예방 |
|
|
|
아조비프리필드시린지주(프레마네주맙) |
한독테바 |
항체 |
- |
편두통 예방 |
|
|
|
롤론티스프리필드시린지주 (에플라페그라스팀) |
한미약품 |
재조합 단백질 |
- |
중증호중구감소증 |
GCSF 유사체 |
|
|
킴리아주(티사젠렉류셀) |
노바티스 |
세포 유전자 치료제 |
CAR-T |
재발, 불응성 B세포 급성 림프성 백혈병, 미만성 거대 B세포 림프종 등 |
희귀 |
|
|
졸겐스마주(오나셈노진아베파르보벡) |
노바티스 |
유전자 치료제 |
AAV |
SMN1 변이 척수성근위축증 |
희귀 |
|
|
2022 |
스카이코비원멀티주 |
SK바이오사이언스 |
백신 |
단백질 |
SARS-CoV-2 |
|
|
뉴백소비드프리필드시린지 |
SK바이오사이언스 |
백신 |
단백질 |
SARS-CoV-2 |
|
|
|
벡세로프리필드시린지 |
GSK |
백신 |
단백질 |
수막구균B군 |
|
|
|
포텔리지오주20밀리그램(모가물리주맙) |
쿄와기린 |
항체 |
- |
균상식육종, 시자리증후군 |
희귀 |
|
|
젬퍼리주(도스탈리맙) |
GSK |
항체 |
- |
자궁내막암 |
|
|
|
엔허투주100mg(트라스투주맙데룩스테칸) |
다이이찌산쿄 |
항체 |
- |
유방암, 위암 |
|
|
|
세프로틴주(사람단백질씨) |
다케다 |
재조합 단백질 |
- |
단백질C결핍 정맥혈전증, 전격자색반병 |
희귀 |
|
|
레블로질주25mg(루스파터셉트) |
BMS |
재조합 단백질 |
- |
성인 빈혈 |
희귀 |
|
|
레블로질주75mg(루스파터셉트) |
BMS |
재조합 단백질 |
- |
성인 빈혈 |
희귀 |
|
|
오젬픽프리필드펜(세마글루티드) |
노보노디스크 |
재조합 단백질 |
- |
제2형 당뇨병 |
|
출처: 식품의약품안전처
(2) 개발 동향
국가신약개발사업단(KDDF)은 2022년 총 111건의 파이프라인 개발을 지원하였다. 이 중에서 바이오의약품이 62건으로 절반 이상을 차지하였다. 바이오의약품 중에서는 항체의약품이 45.16%로 가장 많았다. 질환별로는 항암제가 58.04%로 가장 많았다. 항암제 중에서는 이중항체와 ADC가 단클론항체보다 많았다. 항체치료제 중에서는 대사질환이 2건, 중추신경계 질환이 1건으로 다양한 질환에 적용되었다.
항체 이외의 바이오의약품인 재조합단백질, 펩타이드, 유전자치료제, 엑소좀(exosome)은 전체 바이오의약품의 46.77%를 차지하였다. 또한, 이러한 바이오의약품은 암과 면역질환에 13건이 적용되었으며, 심혈관계, 중추신경계, 대사질환, 안과질환 등 다양한 질환에 사용되었다.
[표 3-31] 국가신약개발사업단 지원 파이프라인 현황(2022.3.)
|
구분 |
전체의약품 |
바이오의약품 |
항체 |
이중항체 |
ADC |
CAR-T/NK |
기타주4) |
|
암 |
53 |
36 |
10 |
7 |
5 |
4 |
10 |
|
심혈관계 |
5 |
3 |
- |
- |
- |
- |
3 |
|
소화기계 |
2 |
- |
- |
- |
- |
- |
- |
|
호흡기계 |
3 |
1 |
- |
- |
- |
- |
- |
|
중추신경계 |
9 |
5 |
1 |
- |
- |
- |
4 |
|
대사질환 |
14 |
6 |
2 |
- |
- |
- |
4 |
|
면역질환 |
12 |
3 |
- |
- |
- |
- |
3 |
|
안과질환 |
4 |
1 |
- |
- |
- |
- |
1 |
|
기타 |
9 |
7 |
2 |
1 |
- |
- |
4 |
|
합계 |
111 |
62 |
15 |
8 |
5 |
4 |
29 |
|
비율(%) |
- |
55.86주1) (58.04주2)) |
24.19 |
12.90 |
8.06 (45.16주3)) |
6.45 |
46.77 |
주1) 전체 의약품 중 바이오의약품 비율, 주2) 바이오의약품 중 항암제 비율, 주3) 바이오의약품 중 항체의약품 비율, 주4) 재조합단백질, 펩티드, 유전자치료제(miRNA, viral vector, CRISPR), 엑소좀(exosome) 등
출처: 국가신약개발사업단
KDDF가 지원한 파이프라인을 개발 단계별로 살펴보면, 초기 발굴(discovery) 단계는 70.49%이었고, 비임상 단계 이상은 29.51% 였다. 임상 1상 지원 과제는 총 5건으로, 와이바이오로직스(Y-biologics) 사의 PD-1 표적 항체 항암제, 에이비엘바이오(ABL Bio) 사의 PD-L1/LAG-3 표적 이중항체 항암제, 종근당의 c-MET/EGFR 이중항체 항암제, 큐로셀(CuroCell) 사의 CD19 표적 CAR-T 항암 치료제, 노바셀테크놀로지(Novacell technology) 사의 FPR2 표적 아토피 피부염 펩타이드 치료제였다. 임상 2상 지원 과제는 총 2건으로, 퓨처캠(FutureChem) 사의 전립선 특이표적 막항원에 방사선물질을 결합시킨 항암제와 한미약품의 선천성 고인슐린증 글로카곤(glucagon)을 표적으로 한 대사질환 항체치료제였다.
[표 3-32] 국가신약개발사업단 지원 파이프라인 개발 단계별 현황(2022.3.)
|
|
Discovery |
Preclinical |
Phase I |
Phase II |
|
암 |
25 |
6 |
4 |
1 |
|
심혈관계 |
2 |
1 |
- |
- |
|
소화기계 |
- |
- |
- |
- |
|
호흡기계 |
1 |
- |
- |
- |
|
중추신경계 |
4 |
1 |
- |
- |
|
대사질환 |
5 |
- |
- |
1 |
|
면역질환 |
1 |
1 |
1 |
- |
|
안과질환 |
1 |
- |
- |
- |
|
기타 |
4 |
2 |
- |
- |
|
합계 (61) |
43 |
11 |
5 |
2 |
|
비율(%) |
70.49 |
18.03 |
8.20 |
3.28 |
출처: 국가신약개발사업단
라. 발전 전망
항체치료제(Antibody therapeutics)의 승인은 계속해서 늘어날 것으로 예상된다. 항체치료제는 현재까지 유방암, 폐암, 대장암 등 다양한 종류의 암과 자가면역질환에 주로 사용되었으며, 항체 전달 기술의 발전으로 인해 뇌종양과 같이 기존에 치료가 어려웠던 암종 및 중증 감염병 등 다양한 질환 분야에서도 적용될 것으로 예상된다.
면역관문억제제(Immune checkpoint inhibitors)를 비롯한 면역항암제의 승인도 지속적으로 늘어날 것으로 예상된다. 면역항암제는 면역계를 활성화시켜 암을 공격하는 치료법으로, 암 치료 분야에서 가장 성공적인 치료법 중 하나이다. 면역치료제는 다양한 암 치료에 적용될 수 있어 암종의 범위가 확대되는 한편, 승인된 면역항암제 외에도 새로운 면역 조절 표적에 대한 치료제 개발이 활발히 이루어질 것으로 예상된다.
또한 단클론항체 칵테일(Monoclonal antibody cocktails) 요법도 증가할 것으로 전망된다. 특히 면역관문억제제는 다양한 종류의 암에 대한 반응률과 치료 효과를 높이기 위해 항체의약품 간의 칵테일 요법뿐만 아니라 방사선치료제나 합성의약품과의 병용요법도 증가할 것으로 전망된다.
유전자치료제(Gene therapies) 개발도 더욱 늘어날 것으로 예상된다. 유전자 편집 기술의 정확성이 향상되고, 더 안전한 유전자 전달방법이 개발됨에 따라 이전에는 치료가 어려웠던 유전성 희귀질환의 치료가 가능해질 것으로 예상된다.
mRNA 기반 치료제(RNA-based therapies)는 빠른 개발과 일반적인 적용 가능성으로 인해 다양한 분야에서 확대될 것으로 예상된다, 특히, 암 유전체 정보를 기반으로 한 맞춤형 항암 백신 분야에서 다양하게 활용될 것으로 예상된다.
또한 새로운 플랫폼의 바이오의약품 개발도 활발해질 것으로 예상된다. mRNA 백신의 성공을 통해 빠르고 안전한 플랫폼 기술의 가능성이 입증되었으므로 혁신적인 바이오의약품 플랫폼 기술 개발에 대한 도전이 계속될 것으로 예상된다.
인공지능 기술은 바이오의약품 개발의 다양한 분야에서 활용될 것으로 예상된다. 생체 정보 빅데이터 분석을 통해 개인에게 맞춤형으로 개발된 치료제를 만들어 내는 것은 물론, 바이오의약품 개발 전 과정에서 효율성을 극대화하는데도 적극적으로 활용될 것으로 보인다.
바이오시밀러의 경쟁 역시 치열해질 전망이며, 주요 바이오의약품의 특허 만료, 개발 비용 증가, 고령화로 인한 환자와 보건의료 재정 부담의 증가는 생산성 향상 기술과 바이오시밀러 개발 경쟁을 촉진할 것으로 예상된다.
이에 따라 바이오의약품 시장은 계속해서 성장할 것이며, 다양한 의약품 플랫폼 개발 경쟁은 환자에게 더 나은 치료 옵션을 제공할 것으로 예상된다.
3. 바이오장기
가. 개요
(1) 바이오장기의 정의
바이오장기란 기능을 소실한 인간의 조직과 장기를 복원, 재생, 대체하기 위해 생명공학적 기법을 이용하여 인간 생체와 같은 기능의 장기를 인공적으로 만든 것을 말한다. 줄기세포, 조직공학, 바이오인공장기, 바이오 이종장기 연구 분야 등을 포함하며, 이를 위해서는 세포활용기술, 유전자편집기술, 이종장기생산기술, 면역조절기술, 장기이식기술, 생체조직공학기술 등의 생명공학 핵심기술이 요구된다.
(2) 바이오장기의 필요성
인간 수명이 증가하여 고령화 인구가 증가함에 따라 장기부전 환자의 수가 기하급수적으로 증가하고 있다. 이 환자들을 치료할 수 있는 유일한 방법이 손상된 장기를 교체해 주는 장기이식이지만 타인으로부터 공급되는 장기의 절대 수가 부족한 상황이다.
(가) 장기이식 수요 및 공급 현황
국내외적으로 장기이식 대기자 수는 매년 증가하고 있는데 반해 장기공급은 제한적이다. 국내에서 장기이식을 대기하고 있는 환자는 2000년 이후 계속 증가하여 2020년에는 약 4만 4,459명48)에 이르고 있다. 이러한 장기의 수급 불균형으로 인해 이식 대기 중에 사망하는 환자 또한 증가하고 있다. 이 같은 현상은 미국을 비롯하여 전 세계적으로 나타나고 있으며, 특히 국내에서는 성인병의 증가, 고령화, 유교문화, 출산율 감소 등의 영향으로 외국보다 이식 장기의 수요와 공급의 불균형 현상이 더 심각하다. 이러한 결과로 불법 장기 매매가 성행하고 있으며, 최근에는 국내보다 의료기술 수준이 낮은 외국에서 장기이식을 받는 사례가 증가하여 심각한 사회문제를 일으키고 있다.
(단위: 명)

|
구분 |
2011 |
2012 |
2013 |
2014 |
2015 |
2016 |
2017 |
2018 |
2019 |
2020 |
전년대비 증감율 |
|
■신장 |
10,964 |
12,463 |
14,181 |
14,477 |
16,011 |
17,959 |
20,283 |
22,620 |
24,786 |
27,096 |
9.3 |
|
■간장 |
4,895 |
5,671 |
6,334 |
4,422 |
4,774 |
4,969 |
5,411 |
5,649 |
5,804 |
6,102 |
5.1 |
|
■췌장 |
532 |
603 |
715 |
766 |
890 |
1,082 |
1,210 |
1,334 |
1,365 |
1,510 |
10.6 |
|
■심장 |
257 |
343 |
433 |
342 |
400 |
431 |
577 |
642 |
694 |
770 |
11.0 |
|
■폐 |
88 |
123 |
194 |
99 |
120 |
119 |
168 |
245 |
282 |
321 |
13.8 |
|
■췌도 |
18 |
23 |
23 |
25 |
28 |
32 |
33 |
34 |
35 |
36 |
2.9 |
|
■소장 |
10 |
17 |
21 |
20 |
18 |
19 |
19 |
20 |
24 |
22 |
△8.3 |
|
■골수 |
3,746 |
1,941 |
2,448 |
2,761 |
3,323 |
3,702 |
4,364 |
4,497 |
4,996 |
6,436 |
28.8 |
|
■안구 |
1,351 |
1,511 |
1,687 |
1,695 |
1,880 |
1,973 |
2,122 |
2,176 |
2,267 |
2,286 |
0.8 |
|
계 |
21,861 |
22,695 |
26,036 |
24,607 |
27,444 |
30,286 |
34,187 |
37,217 |
40,253 |
44,579 |
10.7 |
주) 2020년도 이식대기자 44,579명(전년 대비 10.77% 증가), 신장 이식대기자 27,096명(전년대비 9.3% 증가, 전체 대기자의 60.8%), 간장 이식대기자 6,102명(전년대비 5.1% 증가, 전체 대기자의 13.7%)
출처: 국립장기이식관리센터(KONOS), 2020
[그림 3-72] 연도별 국내 장기이식대기자(장기별) 추이(2011∼2020)
(단위: 명)

주) Other includes allograft transplants like face, hands and abdomninal wall
출처: https://www.organdonor.gov/statistics-stories/statistics.html#glance
[그림 3-73] 미국 내 이식대기자(Waiting List)와 이식환자(Transplants) 수(2021)
(나) 대체 장기로서 바이오장기
부족한 수의 대체 장기를 확보하는 방법으로 줄기세포 분화, 생체조직공학을 이용한 조직재생, 바이오 이종장기 등이 있다. 줄기세포 분화 분야에 있어서는 조직이나 장기로의 분화 과정, 분화 조건 등에 대한 연구를 통해 뇌, 장관(intestine), 신장, 폐 등의 유사장기(organoids) 개발에 큰 진전이 있었다. 이를 이용하여 질환 모델을 개발하거나 신약개발을 위한 스크리닝 방법으로 사용되고 있다. 이식을 위한 유사장기의 최근의 결과로는 사람 유래 장 유사장기(intestinal organoids)를 장염 모델 유발 면역결핍마우스에 이식하여 장 유사장기의 장 상피세포의 치유 효능을 보여주고 있다.49) 또한, 당뇨 유발 면역결핍마우스에 사람 유래 췌도 유사장기(췌도세포, 내피세포, 양막상피세포를 혼합배양하여 만듦)를 신장피막 하에 이식하여 당뇨를 조절하는 효능을 검증하고 있고,50) 이식을 위한 뇌, 신장, 간 등의 유사장기의 개발이 연구 중이다. 그러나 아직 혈관 생성 등의 여러 가지 문제가 해결되어야 하고 완전한 장기의 형태를 갖추기까지는 더 많은 연구가 필요하므로 대체 장기로서 상용화까지는 많은 시간이 걸릴 것으로 예상된다. 또한 세포를 잉크로 사용하는 3D 바이오프린팅과 같은 생체조직 공학적 방법을 이용해 사람의 심장조직(cardiac patch), 젖꼭지, 뼈 등을 생산하는 방법에 많은 진전이 있으나, 복잡한 기능을 수행하는 장기를 제작하는 데에는 아직 해결해야 할 문제들이 많이 있다. 바이오 이종장기는 사람이 아닌 다른 종의 동물(돼지)로부터 이식을 목적으로 생산된 장기를 사람에게 이식함으로써 부전된 기능을 빠르게 회복시킬 수 있기 때문에 시기적으로 볼 때 가장 빠른 시간 내에 대체 장기로서의 역할을 수행할 것으로 기대한다. 여러 가지 장기 대체 방법의 장단점과 특성을 다음 표에 비교하였다.
[표 3-33] 부족한 장기를 대체할 수 있는 방법
|
기술 |
공급 |
현재 적용 가능 여부 |
극복되어야 할 난관 |
비용 |
|
동종장기 |
제한 |
가능 |
공급/면역거부반응 |
중 |
|
배아줄기세포 |
무제한 |
불가능 |
장기형성/면역거부반응 |
중 혹은 고 |
|
역분화줄기세포 |
무제한 |
불가능 |
장기형성 |
고 |
|
시험관 내 기관발생 |
? |
불가능 |
크기/성숙/기능 |
고 |
|
생체 내 기관발생 |
? |
불가능 |
성숙/기능 |
? 중 |
|
기계장치 |
무제한 |
가능(심장, 신장) |
독성/내구성 |
고 |
|
바이오 이종장기 |
무제한 |
가능(췌도, 각막) |
면역거부반응 |
저 |
출처: Curr Opin Organ Transplant. 2013
(다) 바이오 이종장기 공급원
사람에게 제공될 장기를 제작하기 위해서는 장기 공급원(동물)이 사람과 생리적인 면에서 유사점이 많아야 하고, 또한 대량 공급을 위해 번식이 잘 되어야 한다. 그러나 사람과 가장 유사한 영장류는 번식에 오랜 시간이 걸리고, 사람에게 치명적인 바이러스를 보유할 위험이 있으며, 전 세계적으로 희귀동물로 지정되었기 때문에 이종장기 제공 대상에서 제외되었다.
미니돼지의 경우 인간과 비슷한 크기의 장기를 갖고 있으며, 생리적으로 유사점이 많아 현재 가장 많이 사용되고 있다. 또한 어미 1마리가 연간 20마리 이상의 새끼돼지를 생산할 수 있어, 이식용 장기의 대량 공급이 가능하며 다른 장기대체 기술에 비해 비용이 적게 든다. 또한 간염이나 AIDS 바이러스와 같은 치명적인 감염원의 회피가 가능하다는 장점이 있다.
(3) 바이오이종장기 산업 발전을 위해 극복되어야 할 난관
(가) 장기이식 거부반응 및 복제 기술의 불안정성
이종장기 이식 후에 일어날 수 있는 주된 문제점으로는 조직의 이식거부반응이 있으며 이것은 동종이식보다 훨씬 빠르고 강하게 일어남이 임상시험을 통하여 밝혀졌다. 이식거부반응이란, 이식된 장기가 수혜자의 체내에서 초급성 거부반응, 급성혈관성 거부반응, 세포매개성 거부반응, 만성 거부반응을 일으켜 장기로서의 제 기능을 하지 못하고 괴사해 버리는 것을 말한다. 활발한 연구를 통하여 이러한 이식거부반응의 기전은 비교적 많이 밝혀졌으며, 이를 토대로 이식거부반응을 제어하기 위한 유전자 적중기술 및 형질전환 돼지의 생산이 연구되고 있다.
돼지 세포 표면에 존재하는 당(sugar) 성분인 알파-갈(1,3-α-Galactose)에 의해 혈청보체계와 혈액응고계가 활성화되어 이식 후 수 분 이내에 초급성 거부반응이 나타난다. 2002년 미국에서 알파-갈 전이효소가 제거된 형질전환 돼지가 개발되었으며51), 국내에서도 2009년 4월 알파-갈 합성효소 유전자 중 하나가 제거된 미니돼지가 개발되어 초급성 거부반응을 극복할 수 있게 되었다. 현재는 CRISPR-Cas9과 같은 유전자편집기술의 발전으로 알파-갈 외에 N-glycolylneuraminic acid (Neu5Gc), β-1,4-N-acetyl-galactosamine와 같은 당을 만드는 전이효소가 모두 제거된 형질전환 돼지가 개발되어 당 성분이 상이하여 발생하는 대부분의 면역반응을 조절할 수 있게 되었다.

출처: 저자 작성
[그림 3-74] 체세포복제에 의한 형질전환 돼지 제조방법
급성혈관성 거부반응은 자연항체, 자연살해세포, 단핵구에 의해 혈관내피세포가 활성화됨에 따라 나타나는 반응이다. 이는 사람의 혈청보체 조절인자, 자연살해세포 억제인자가 발현되도록 형질 전환된 돼지를 제작하여 혈관내피세포의 안정화, 내피세포 유래 면역 매개물질 조절, 자연살해세포 활성화 억제 및 혈소판 기능조절을 통하여 극복하고 있다.
세포매개성 거부반응은 이종항원에 의해 면역세포가 활성화되어 나타나는 반응으로 동종이식에 사용되고 있는 면역억제 방법과 면역관용 유도 기술을 통하여 극복하려는 노력이 시도되고 있다.
이처럼 초급성 거부반응, 급성혈관성 거부반응 및 세포매개성 거부반응을 제어하기 위해 관련 유전자들을 제거하거나 발현시키는 형질전환 돼지의 개발이 활발히 이루어지고 있다. 또한 복제된 동물들이 유산, 사산, 태어난 지 며칠 되지 않아 죽는 등의 문제를 극복하기 위해 형질전환 복제동물의 생산성 안정화 및 생산효율 증진을 위한 기술도 개발 중이다.
위와 같이 이종장기 이식에 적합한 형질전환 복제돼지의 생산은 관련 유전자의 발굴, 유전자편집기술, 핵이식 기술 등을 통하여 다양한 종류가 개발되어 있다. 앞으로는 생산된 돼지를 임상 적용하기 위한 허가 및 산업화를 위한 연구가 필요할 것으로 전망된다.
(나) 안전성 문제
인수공통감염병원체는 돼지의 무균화를 통해 차단할 수 있다. 그러나 돼지의 내인성 레트로바이러스(PERV)의 경우 바이러스 유전자가 돼지 세포의 염색체 내에 삽입되어 다음 세대로 유전되므로 무균화 작업을 통해서 제거되지 않는다. 이는 이종이식의 임상 적용에 있어서 해결해야 할 문제 중 하나로 대두되어 왔다. 그러나 현재까지 다수의 영장류 이식실험과 이종이식을 받은 환자(2005년 중국에서 시행)에서 돼지 내인성 레트로바이러스 감염이 확인되진 않았다. 또한 형질전환 돼지 생산 전문회사인 미국의 이제네시스(eGenesis)사는 유전자편집기술을 이용하여 돼지 내인성 레트로바이러스가 제거된 돼지를 성공적으로 개발하였다.
(다) 법적, 사회적, 생명윤리적 문제
아직까지는 이종이식이 초기 단계인 만큼 이종이식을 받은 수여자들에 대한 추적 관리가 요구될 것으로 전망된다. 이는 수여자들의 혈액이나 조직 기증에 제한되지 않고 성생활이나 출산에도 영향을 미칠 수 있다. 따라서 피험자의 인권 보호를 위하여 사회적, 생명윤리적 공감대를 논의하는 장이 필요할 것으로 생각된다.
미국은 FDA(식품의약청), 유럽은 EMA(European Medicines Agency)가 이종장기를 하나의 의약품으로 취급하여 임상 적용에 대한 관리를 하고 있다. 일본은 2013년 11월에 ‘재생의료 등의 안전성 확보 등에 관한 법률’을 제정해 2014년 11월부터 이종이식의 임상 적용을 관리하고 있다. 국내의 경우 2020년 9월 12일 ‘첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률’이 시행되었다. 이 법에서는 첨단재생의료의 안전성 확보 체계 및 기술 혁신, 실용화 방안을 마련하고 첨단바이오의약품의 품질과 안전성 확보 및 제품화 지원을 위하여 필요한 사항을 규정하고 있다. 제2조2항은 첨단재생의료의 대상인 ‘인체세포등’을 정의하고 있는데 ‘인체세포등이란 인체에서 유래한 줄기세포, 조혈모세포, 체세포, 면역세포, 이종세포 등 대통령령으로 정하는 세포, 조직 및 장기를 말한다.’로 되어있다. 2022년 12월 20일에 위 법률의 시행령이 발효되어 이종이식의 임상 적용이 관리될 예정이다.
나. 해외 기술 동향
(1) 형질전환 돼지의 개발
2002년 알파갈합성효소 유전자가 제거된 돼지가 생산된 이래 리비비코(Revivicor), 아반티(Avantea)등의 이종이식 관련 회사들과 학계를 중심으로 다양한 종류의 형질전환 돼지들이 개발되었으나, 기대했던 것만큼 영장류 전임상 결과가 개선되지 않았다. 현재까지 개발된 형질전환 돼지는 돼지 특이 당항원을 제거한 유전형질을 기반으로 보체활성 조절(CD39, CD55, CD59), 응고조절(thrombomodulin, EPCR), 염증반응조절(A20, TNFR Fc) 등 비특이적인 염증 반응을 제어할 수 있는 유전자를 타깃으로 개발되었다. 최근 CRISPR-Cas9에 의한 다중 유전자 조작 돼지 개발 기술이 급속히 발전하면서 형질전환 돼지의 생산기간이 기존 2∼3년에서 5개월로 획기적으로 단축되었고, 2015년 11월 네이처(Nature) 지에서는 이종이식 제2의 전성기가 도래하고 있다고 보고하였다.52) 이러한 전성기를 맞아 유나이티드테라퓨직스(United Therapeutics)사, 이제네시스(eGenesis)사 등 이종이식 전문 회사들이 다시 생겨나고 있다. 현재 미국, 호주, 독일, 이태리를 중심으로 다양한 종류의 형질전환 돼지가 생산되고 있다.
[표 3-34] 해외에서 개발된 이종장기이식을 위한 유전자 변형 돼지
|
돼지 내인성 레트로바이러스 (PERV)의 제거 돼지 |
|
|
PERV 발현 억제 (Knock down) |
Miyagawa et al., 2005; Dieckhoff et al., 2008; Ramsoondar et al., 2009 |
|
PERV pol 유전자를 전체 유전체 수준에서 (Genome-wide) 비활성화 |
Niu et al., 2017 |
|
다중 유전자변형 돼지 |
|
|
GGTA1-KO / hCD55-tg / hCD59-tg / human fucosyltransferase(HT)-tg |
Le Bas-Bernardet et al., 2011 |
|
GGTA1-KO / hCD55-tg / hCD59-tg |
Hawthorne et al., 2014 |
|
GGTA1-KO / hCD46-tg / hCD39-tg |
Bottino et al., 2014 |
|
GGTA1-KO / hCD46-tg / hTFPI-tg / pCTLA4-Ig-tg |
Bottino et al., 2014 |
|
GGTA1-KO / hCD46-tg / hTFPI-tg / pCTL4-Ig-tg / hCD39-tg |
Bottino et al., 2014 |
|
GGTA1-KO / hCD46-tg / hCD55-tg / hCD39-tg / hTBM-tg / hEPCR-tg |
Iwase et al., 2015 |
|
GGTA1-KO / CMAH-KO / hCD46-tg / hCD55-tg / hCD59-tg / hA20-tg / hHO1-tg |
Fischer et al., 2016 |
|
GGTA1-KO / CMAH-KO / shTNFRI-Fc-tg / hHO-1-tg |
Kim et al., 2017 |
|
GGTA1-KO / hCD55-tg / hCD39-tg / hTFPI-tg / hC1-INH-tg / hTNFAIP3-tg |
Kwon et al., 2017 |
|
GGTA1-KO / hCD46-tg / hCD55-tg / hCD47-tg / hTFPI-tg / hEPCR-tg |
Iwase et al., 2017 |
|
GGTA1-KO / CMAH-KO / B4GalNT2-KO |
Dai et al., 2018 |
|
GGTA1-KO / B4GalNT2-KO / hCD46-tg / hCD47-tg |
Pan et al., 2019 |
|
GGTA1-KO / CMAH-KO / B4GalNT2-KO / hCD46-tg / hTBM -tg |
Park et al., 2019 |
|
GGTA1-KO / CMAH-KO / B4GalNT2-KO / GHRKO-KO / hCD46-tg / hCD55-tg / hEPCR-tg / hTBM-tg / hHO-1-tg / hCD47-tg |
Griffith et al., 2022 |
출처: 저자 작성
(2) 이종이식 전임상 및 임상시험
이종이식 전임상시험 결과를 살펴보면, 이소성 심장의 경우 3년 이상, 동소성 심장의 경우 195일, 신장 1년 이상, 간 25일 이상, 췌도 2년 이상, 각막 2년 이상 등 우수한 성과들이 발표되면서 제2의 이종이식 전성기가 도래하고 있다.
미국 국립보건원은 형질전환 돼지의 심장을 개코원숭이의 복부에 이식(heterotopic transplantation)하여 3년간 생존하였다고 보고하였다.53) 독일의 브레너 박사(Dr. Brenner) 그룹은 형질전환 돼지의 심장을 개코원숭이에게 이식하였는데 미국 국립보건원팀과는 달리 흉곽에 원숭이 심장을 제거하고 이식하여(orthotopic transplantation, life supporting) 6개월 이상 생존하였음을 보고하였다.54) 이는 이식된 돼지 심장이 원숭이의 심장을 대신하여 기능을 한 것으로 미국 국립보건원의 결과보다 더 진일보된 획기적인 결과라고 할 수 있다.
일본 오츠카 제약은 2014년에 인수한 LCT(Living Cell Technologies) 사를 통하여 이종 췌도 이식 연구를 지속하여 왔으며, 2016년 3월 일본 재생의료학회에서 당뇨병 환자에게 돼지의 캡슐화췌도를 이식한 임상 연구결과를 발표하였다. 2021년 9월과 11월에 미국 몽고메리 박사팀은 GGTA1 유전자 결핍 돼지에서 신장 적출 두달 전 돼지 흉선세포를 신장의 피막하에 이식한 thymokidney를 준비하여 그 신장을 두 명의 뇌사자 환자의 대퇴 동정맥에 문합하고 thymokidney를 체외에서 54시간 동안 관찰하면서 소변 생성 능력 등의 이식신의 기능을 평가하는 임상시험을 진행하였다. 이 임상시험에서 돼지의 이식신은 54시간 동안 신기능을 잘 유지하면서, 초급성 거부반응은 보이지 않는 고무적인 결과를 도출하였다.55)
또한, 미국의 모후히딘 박사팀은 이소성 심장이식 전임상시험에서 3년 이상의 생존을 보인 결과를 이용하여 미국 FDA에 임상시험 승인을 받아, 57세 심장질환 환자에 10개의 유전자가 변형된 형질전환 돼지를 이용하여 심장이식을 진행하고 60일의 생존을 보였다.56) 이는 미국 FDA의 긴급승인을 통하여 시행된 최초의 형질전환 돼지 심장을 사람에게 이식한 예로서 이식 후 60일째 심부전 소견을 보여 생존이 중단되었지만 적어도 면역학적 거부반응은 관찰되지 않음을 확인함으로써 형질전환 돼지를 이용한 장기이식의 임상실현을 한 걸음 더 앞당긴 쾌거라고 볼 수 있다.
(3) 포배 보상법을 이용한 장기생산
최근 포배 보상법(blastocyst complementation) 기술을 이용하여 두 종간 키메라(chimera) 생산이 가능해졌으며,57) 이는 이종면역반응을 근본적으로 동종면역반응과 비슷한 정도로 감소시키는 기술이기 때문에 키메라 돼지 생산은 향후 이종이식의 지향점이 되고 있다. 이런 키메라를 생산하기 위해서는 특정 장기가 결핍된 돼지의 생산이 필요하기 때문에 돼지 줄기세포를 이용한 타깃 벡터(targeting vector) 개발, CRISPR-Cas9 시스템 개발, 배반포 주입(blastocyst injection) 등의 기반기술 개발이 선행되어야 한다.
최근에는 사람 줄기세포를 이용하여 돼지 배아에서 인간화 심장을 생성하는 기술이 보고되었다.58) 그러나 이런 포배 보상법으로 돼지에서 사람 장기를 생산하는 것은 윤리적인 문제를 야기시키는데 사람 줄기세포가 원하는 특정 장기로만으로 생성되는 것이 아니라 신경계나 생식기계로 분포되었을 경우에는 돼지 장기에서 사람의 신경이나 태아가 포함된 장기가 발생할 수 있기에 가장 큰 윤리적인 문제로 제기되고 있으므로,59) 향후 이러한 윤리적인 문제 또한 해결해야 할 장벽으로 여겨지고 있다.
다. 국내 기술 동향
(1) 형질전환 돼지의 개발
국내에서는 농촌진흥청 국립축산과학원과 민간기업으로 ㈜옵티팜, ㈜BNGT, ㈜제넨바이오, ㈜아퓨어스 등의 회사가 형질전환 돼지 생산 연구를 진행하고 있다. 국내에서 생산된 형질전환 돼지의 현황은 다음 표와 같다.
[표 3-35] 국내에서 개발된 이종장기이식을 위한 유전자변형 돼지
|
다중 유전자변형 돼지 |
|
|
hCD46-tg / hCD73-tg |
국립축산과학원 |
|
GGTA1-KO / hCD46-tg / hCD73-tg / hTBM-tg |
|
|
GGTA1-KO / hCD46-tg / hTBM-tg |
BNGT |
|
GGTA1-KO / hCD55-tg |
|
|
GGTA1-KO / CMAH-KO |
|
|
GGTA1-KO / CMAH-KO / hCD46-tg |
|
|
GGTA1-KO / CMAH-KO / hTBM-tg |
옵티팜 |
|
GGTA1-KO / CMAH-KO / hCD46-tg / hTBM-tg |
|
|
GGTA1-KO / CMAH-KO / B4GalNT2-KO |
|
|
GGTA1-KO / CMAH-KO / B4GalNT2-KO |
|
|
GGTA1-KO / hCD39-tg / hCD55-tg |
|
|
GGTA1-KO / CMAH-KO / B4GalNT2-KO / iGb3s-KO / hCD39-tg / hCD55-tg |
|
|
GGTA1-KO / CMAH-KO / B4GalNT2-KO / hCD46-tg / hTBM-tg |
|
|
GGTA1-KO / CMAH-KO / B4GalNT2-KO / iGb3s-KO |
|
|
GGTA1-KO / CMAH-KO / B4GalNT2-KO / iGb3s-KO / B2M-KO |
|
|
GGTA1-KO / CMAH-KO / B4GalNT2-KO / iGb3s-KO / hCD39-tg / hCD55-tg / hCD46-tg / hTBM-tg |
|
출처: 저자 작성
(2) 이종이식 전임상 및 임상시험
‘바이오이종장기개발사업단’은 보건복지부의 지원을 받아 2004년 출범하여 2012년도까지 1단계에서 WHO(세계보건기구)의 장기이식원 권고기준을 만족시키는 미니돼지를 생산하였다. 2013년도부터 시작되는 2단계에는 이종장기용 돼지 생산을 계속하며, 면역거부반응 조절을 통한 이종장기의 전임상 및 임상 적용에 대한 연구를 진행하였다.

출처: 바이오이종장기개발사업단 www.xenokorea.org
[그림 3-75] 바이오이종장기개발사업단(2004~2020) 사업개요
특히 이 사업단은 2020년 8월 사업단을 종료할 때까지 이종장기이식 분야에서 세계적 선도그룹으로 인정받았으며, 영장류 전임상시험에서 세계이종이식학회의 이종 췌도이식 임상시험 진입조건을 충족한 결과를 발표하였다. 아울러 영장류 전임상실험에서 부분층 및 전층각막을 이식하여 2년 이상 각막 투명도를 유지한 결과를 발표하였다. 바이오이종장기개발사업단은 식품의약품안전처에 연구자주도 이종췌도 임상시험계획승인 신청을 2020년 8월에 제출하였다. 이후 식품의약품안전처와 오랜 기간 논의 및 수정을 거쳐 2022년 12월에 ㈜제넨바이오의 의뢰자 주도 임상시험으로 이종췌도이식 임상시험 계획승인을 획득하여 조만간 국내에서 이종췌도이식의 임상시험을 진행할 계획이다.
라. 발전 과제와 전망
(1) 발전 과제
이종장기이식은 인공장기 및 줄기세포 분화 기술을 이용한 장기이식에 비해 빠르게 임상에 적용할 수 있는 기술이다. 최근 영장류 실험에서 이식된 이종장기가 거부반응 없이 장시간 제 기능이 유지되는 것이 관찰되었으며 수혜 동물의 생존 기간 또한 연장되었다. 이것은 이종장기이식의 가능성을 입증한 연구였다. 향후 안전하고 투명한 임상시험을 통해 많은 사람들이 혜택을 받을 수 있도록 유전자편집기술, 면역조절기법을 이용하여 위험요소를 낮춘다면 미래에 이종장기이식은 생명을 구하는 치료 수단으로 자리 잡을 것이다.
과학기술의 개발과 이종장기이식의 안정성 확보와 더불어 윤리적 문제 역시도 반드시 고려해야 할 사항이다. 연구자들은 이종장기이식이 가져올 수 있는 위험성을 염두에 두고 세계이종이식학회나 WHO에서 제시하는 국제적인 가이드라인에 따라 이종장기의 임상시험을 수행해야만 한다. 그뿐만 아니라 이종이식의 안전성을 확보하는 동시에 연구대상자와 사회를 보호하기 위하여 연구대상자 선정, 임상시험 관리・감독, 공여 동물 사육시설 관리 등에 대한 규제를 임상시험 실시 전에 반드시 마련하고 준수해야 할 것이다.
(2) 전망
최근 미국에서 진행된 2건의 이종신장이식 임상시험과 1건의 이종심장이식 임상시험, 그리고 국내에서 이종췌도이식 임상시험계획승인 획득으로 인해 바이오 이종장기의 임상적용 가능성은 한층 높아지고 있는 추세에 있다. 미국 NIH에서는 ‘부족한 장기 문제를 해결할 수 있는 방법에 관한 워크숍60)’ 을 개최하였는데 ‘이종장기이식’과 ‘순환정지 후 장기기증(Donation after Circulatory Determination of Death)’이 주 과제로 다루어질 정도로 바이오 이종장기이식의 임상실현이 가까워지고 있다.
장기이식 수요의 폭발적 증가에 따른 수급 불균형으로 인하여 바이오 이종장기 시장의 규모는 급속도로 커질 것으로 전망된다. 바이오 이종장기는 장기이식만을 기다리는 환자에게 고통을 덜어주고 희망을 줄 수 있을 뿐만 아니라, 우리나라를 미래 바이오의약품 선진국가로 도약하게 할 미래 산업이 될 것이다. 현재까지 이루어 온 바이오 이종장기 연구 성과와 기반 시설을 지속적으로 유지 및 발전시키고, 최근 마련된 바이오장기 생산 규제와 가이드라인을 잘 적용시킨다면 향후 학문, 산업, 경제발전에 큰 기여를 할 것으로 예상된다.
4. 진단 및 의료기기
가. 개요
의료기기산업은 전 세계적으로 고령화와 건강에 대한 관심 증가 및 경제성장에 따라 연평균 7.9%로 지속적인 고성장이 전망되는 미래 유망산업으로 부각되고 있으며, 관련 산업과의 연계성과 다품종 소량생산, 지속적인 사용자 교육과 사후 서비스 필요성 등의 특성에 따라 일자리 창출 효과도 큰 산업으로 판단된다.
코로나19 이후 글로벌 체외진단의료기기 산업은 급격하게 성장했다. 2021년도 글로벌 체외진단의료기기 시장 규모는 2019년 대비 약 32% 성장했으며, 글로벌 전체 의료기기 시장에서 체외진단 의료기기는 약 20%의 비중을 차지하고 있다.61) 특히 코로나19 이후 의료기관보다는 현장진단(Point Of Care Testing, POCT) 분야에서 큰 폭의 성장세가 나타나고 있다. 미국 등 글로벌 체외진단의료기기 시장에서는 선진화된 의료 인프라와 차세대염기서열분석(Next Generation Sequencing, NGS) 등 혁신적인 체외진단 기술 수요가 증가하고 있으며, 노령화 및 만성질환의 증가와 새로운 감염병 예방과 정밀의료・조기진단 등이 중요해짐에 따라 새로운 시장 창출이 예상되고 있다.
체외진단 분야는 코로나19 이후 산업적・기술적 측면에서 급격하게 발전되었으며, 디지털 분자진단 기술, 차세대염기서열분석 기술, 디지털 병리와 같은 혁신기술들의 등장으로 코로나19 등 감염병 진단 이외에도 각종 암, 심혈관질환, 알츠하이머병 등과 같은 중증・만성질환과 기타 진단 분야와 조기진단 및 동반진단을 포함한 맞춤 진단과 예후・예측 진단 측면에서 중요한 역할을 하고 있다. 그러나 국내 체외진단 시장에서는 아직도 제품의 의료현장 진입에 커다란 규제 장벽이 존재한다는 것이 전문가들의 시각이다.
글로벌 혁신 체외진단기술 지원전략에서 보듯이 추상적인 제품화 지원전략이 아닌 실질적이고 구체적인 전략 실행만이 합리적인 규제를 바탕으로 안전성과 유효성이 확보된 신뢰성 있는 제품화를 가능케 하여 글로벌 시장 진출의 발판이 될 것이다.
치료 중심에서 질병의 예방・진단・관리 중심으로의 의료 패러다임 변화와 코로나19로 촉발된 뉴노멀 비대면 헬스케어서비스의 중심으로 자리 잡은 디지털헬스케어 산업은 인공지능(AI)・빅데이터 기술 도입으로 의료전달체계의 효율성을 높이고 개인 맞춤의료 구현을 목적으로 탄생한 건강관리시스템과 디지털기술의 융합 산물로서 코로나19 이전까지의 헬스케어 전달체계, 수요, 급여, 규제 등 전 과정에서 패러다임을 빠르게 전환시키며 급부상하고 있다.
(1) 체외진단 분야별 개요
체외진단 분야의 유망기술로는 정밀 종양진단(Precision Oncology)을 비롯하여 알츠하이머 치매진단을 위한 바이오마커 발굴을 통해 차세대염기서열분석에 기반한 액체생검 기술을 들 수 있다.62)
(가) 면역화학적 진단(Immunochemistry)
면역화학적 진단(Immunochemistry)은 항원・항체 면역반응 원리에 근간을 두고 있으며, 기존 면역분석과 임상화학 플랫폼의 통합된 형태이다. 면역화학적 진단 분야에서 암 진단은 유망한 분야로 평가되며, 특히, 심혈관 질환 위험도 평가검사 분야에서는 구체적인 검사지표들을 활용하여 질환 평가의 유효성을 제공하고 있다.
분자 진단(Molecular Diagnostics, MDx)은 인체나 바이러스 등의 유전자 정보를 담고 있는 핵산(DNA, RNA)을 검사하는 방법으로서 암 등 만성・중증질환과 감염병 진단이 목적이며, 진단시약과 키트뿐만 아니라 측정기기, 서비스와 분석 소프트웨어 등 조합된 체외진단의료기기 형태로 활용되고 있다.
(나) 액체생검(Liquid Biopsy)
최근 암 조기진단과 예후・예측을 위한 액체생검(Liquid Biopsy)은 환자의 유전체정보를 차세대 염기서열 분석으로 임상정보 모니터링까지 가능하게 하여 차세대 진단기술로 평가되고 있다. 액체생검은 기존의 암 진단의 표준으로 활용되는 조직생검(Tissue Biopsy)이 침습적이고 환자의 고통과 비용, 시간이 많이 소요되는 불편함을 초래하는 데 비해 혈액, 침, 소변 등의 액상검체로 대체하여 순환 종양 DNA(Circulating tumor DNA) 또는 순환 종양세포(Circulating tumor cells, CTCs), 엑소좀(Exosomes) 등을 분리하여 진단정보를 분석하는 기술이다. 현재 미국 등 글로벌 국가들은 액체생검 패널을 활용한 임상진단기법에 대한 신속승인을 통해 글로벌 시장을 주도하고 있다.
(다) 현장진단(POCT)
현장진단(POCT)은 별도 검사실에서 검사를 진행하지 않고, 환자가 있는 장소에서 진단하는 현장 검사방법으로서 미세유체(Microfluidic) 및 바이오센서 기술이 포함된 랩온어칩(Lab on a chip) 장치를 활용한 플랫폼 기술이다. 현장진단 기술은 비용이 저렴하고 휴대성이 높다는 장점이 있어 감염성 질환 진단 등에 활용되고 있다. 휴대용 분자진단(Portable MDx) 장치 또한 기존의 미생물 진단기법에 비해 신속 진단을 가능케 하여 감염병 진단에 활용되고 있다.
나. 시장 동향
(1) 글로벌
글로벌 디지털헬스케어 시장은 전체 헬스케어 시장의 8.9% 규모이며, 디지털헬스케어산업 매출 비중은 2021년 기준으로 전년 대비 34.6% 성장한 것으로 나타났으며, SiMD(Software in Medical Device), 전자약 등 의료용기기 매출이 53.4%로 가장 높았으며, 웨어러블 기기, 생체데이터 수집 센서 등 건강관리 기기(13.9%), 웰니스플랫폼 등 디지털 건강관리 플랫폼(12.3%)이 그 뒤를 이었다.63)
2021년 디지털헬스케어산업 투자유치 주요 품목은 SiMD, 전자약 등 의료용 기기(36.7%), 원격의료, O2O 플랫폼, 메타버스 등 의료인-환자 간 매칭 플랫폼(21.7%), 디지털치료기기, SaMD(Software as a Medical Device) 등 의료용 소프트웨어(19.3%), EMR, EHR, PHR, 병원운영시스템, 마이헬스웨이 등 디지털의료 및 건강관리 지원 시스템 및 인프라(10.6%) 등이 뒤를 이었다.64) 디지털헬스케어 시장은 아직까지는 모바일 헬스케어 시장이 큰 규모를 차지하고 있으나, 향후 원격의료 분야의 높은 성장률이 예상된다.
디지털헬스케어는 디지털 기술의 융합으로 진단・치료부터 예방・관리 영역까지 포함하고 있으며, 환자 또는 소비자의 의료데이터 정보 수집과 분석을 통해 그 결과를 의료기관 및 건강관리 기업에 제공하고, 이는 의료진의 의사결정 지원과 의료데이터 관련 제품 개발과 의료서비스 제공에 활용될 수 있다.
혁신기술의 발전에 따라 의료로봇이 의료현장에서 다양하게 활용되기 시작했으며, 이에 따라 의료패러다임도 함께 변화하고 있다. 의료로봇 시장은 2020년 59억 달러에서 연평균 16.5%의 성장률로 2025년 127억 달러로 성장할 것으로 전망된다.65)
수술용 로봇은 최소침습 수술, 뇌, 척추 수술 등 고도의 정밀도와 정확도가 요구되는 수술에서 중요성이 부각되고 있다. 글로벌 수술로봇 시장은 글로벌 주요기업들을 중심으로 새로운 수요를 충족시킬 수 있는 제품들이 개발되고 있으며, 기존 로봇수술 시스템의 한계를 극복할 수 있는 AI 융합 수술로봇, 3D 시각화, 고정밀 모션제어 등 다양한 기술이 연구되고 있다.
(2) 국내
국내 의료기기산업은 글로벌 기업이 선점한 국내외 시장에서 인공지능, 의료로봇 등 혁신기술이 적용된 융복합 의료기기 개발실적을 만들어 내고 있다. 아울러 코로나19 기간에는 체외진단기술과 시장이 급격하게 성장했으며, 코로나19 이후 감염병 진단 시약 조기 상용화 기술뿐만 아니라 암・만성질환 조기진단 분야로의 기술개발 등 신사업 모델 확장을 위한 기술개발 등을 통한 신시장 진출 준비가 필요한 시점이다. 초기・중소기업의 경우 연구・임상・인허가・마케팅 등 전주기 역량과 전문 인력은 여전히 부족한 상황이며, 고부가가치 창출이 가능한 고위험도 3, 4등급 의료기기 개발과 투자에는 한계를 보이고 있다.
의료기기는 개발과 허가 이후 실제 의료현장에서의 사용을 위해서는 성능 및 임상시험 등 안전성・유효성 평가와 의료현장의 실증과정이 요구되나 기업의 자본력 부족, 임상시험 설계에 대한 지식 부족, 관련 전문 인력의 부족 등으로 기업 자체적으로 평가와 실증을 하기에는 어려움이 존재하여 국가 차원의 지원이 필요한 분야이다.
우리나라 정부는 부처 및 지자체별로 의료기기산업 육성과 지원을 위해 의료기기 중개임상시험센터, 혁신의료기기 실증지원센터, 연구중심병원 사업, 의료기기 사용 적합성센터 등 개발부터 인허가 및 제품 상용화까지 전주기 인프라 구축과 지원체계를 운영해 오고 있다.
의료현장의 수요를 반영한 제품 개발과 시판 전후 임상데이터 근거 마련과 교육・훈련 지원센터, 국제인증센터 등 지자체 연계 국산 의료기기 사용 활성화 및 해외시장 진출 지원을 위한 지원 인프라 구축 프로그램도 다양화하고 있다.
하지만 통합적 지원이 아닌 기업, 병원, 지역 단위의 분절적 지원으로 산학연병 협력을 통한 산업생태계 구성은 어려운 상황이다. 특히, 기업과 의료기관 간 협력시스템 구축은 효율적인 성과 창출을 위해 매우 시급하다고 할 수 있다.
첨단 혁신기술이 적용된 의료기기의 경우 식품의약품안전처(식약처) 허가 후 건강보험심사평가원(심평원)의 요양급여・비급여 대상 확인, 한국보건의료연구원의 신의료기술 평가와 심평원의 보험등재 등 최대 490일이 소요되는 절차를 거쳐 의료현장에 도입된다. 품목 허가 후 신의료기술 여부를 판단하고 보험등재를 신청하는 일련의 과정에는 상당히 많은 기간이 소요되며, 이 기간을 단축하기 위해 ‘허가-평가 통합 운영 제도’가 운영되고 있다.
‘허가-평가 통합 운영 제도’는 식약처 품목 허가신청 시 통합 운영하겠다고 신청하면 식약처, 보건의료연구원, 심평원에 신청자료가 동시에 접수되며, 허가심사 중인 상황에서 심평원은 요양급여・비급여 여부를 확인하고 보건의료연구원에서도 평가를 진행한다. 각 기관 간에 자료를 공유하고 결과를 통지하여 급여등재까지의 기간을 단축하고자 노력하고 있다.
이처럼 범정부 차원에서 혁신기술이 안전하고 신속하게 의료현장에 도입될 수 있도록 의료기기 허가-신의료기술 평가 통합운영제도, 신의료기술 평가유예 도입, 대상 확대 및 기간 연장, 혁신의료기술평가 도입 등 허가단계부터 신의료기술 평가까지 규제 절차를 합리화하려는 노력은 하고 있으나, 아직까지 혁신기술 활용 의료기기의 의료현장 도입은 어렵고 기술에 대한 경제적 가치를 인정받기가 어려운 현실이다. 일례로 인공지능, 의료로봇 등 새로운 기술을 활용한 의료기기가 건강보험 급여 적용 시 대부분 기존기술로 분류되어 건강보험의 추가 급여 반영 또는 별도 보상이 어려워 의료기관에서의 사용 수요가 없게 된다. 새로운 기술이 신속하게 의료현장에 도입되고 기술의 가치가 반영될 수 있는 제도 마련이 시급한 사유이다.
다. 주요 국가별 혁신 의료기기 정책 동향
주요 선진국들은 융・복합 혁신의료기기 상용화 지원, 신속승인 제도 마련 및 검토 기간 단축, 임상적 근거 창출 지원을 위한 방안을 시행 중이다.
(1) 미국
2017년부터 혁신의료기기 허가 기간을 단축하고, 환자 등 의료데이터의 공유와 분석 등을 지원하고, 혁신제품의 신속 및 우선 검토 절차 마련을 위해 혁신적 의료기기 프로그램 가이드라인을 발표했다. 2021년 기준으로 약 320여 개의 혁신의료기기가 지정되어 있다.
바이든 대통령은 2022년 9월 12일 생명공학 및 바이오산업의 제조 역량 강화 등을 통해 타국의 의존도를 낮추고 글로벌 리더십 제고와 미국 내 바이오헬스산업 보호를 위해 ‘국가 생명공학 및 바이오 제조 이니셔티브 행정명령’에 서명했다. 국가 생명공학 및 바이오제조 이니셔티브를 통해 미국 내 일자리 창출, 강력한 공급망 구축, 가격을 낮추는 안정화 효과를 기대하고 있으며, 미국 내 중요기관이 참석한 국가 생명공학 및 바이오제조 회의에서 9가지 내용이 논의됐다.
[표 3-36] 미국 ‘국가 생명공학 및 바이오제조 이니셔티브’ 관련 회의의 9가지 주요 논의 내용
|
• 강화된 공급망을 위한 생명공학 활용 • 미국 내 바이오제조 확장 • 미국 전역에서 혁신 촉진 • 바이오 제품의 시장 출시 • 차세대 생명공학자 양성 |
• 생명공학 제품에 대한 접근성 향상을 위한 규제 혁신 • 바이오경제를 위한 측정과 표준의 발전 • 바이오 보안에 대한 투자를 통해 위험감소 • 바이오경제 발전을 위한 데이터 공유 촉진 |
출처: 미국 백악관
(2) 독일
2019년 독일 의회는 디지털헬스케어법(Digital Healthcare Act ; Digitale-Versorgung-Gesetz, DVG) 시행을 통해 원격의료 이용을 장려하고 연구목적 의료데이터의 활용 보장뿐만 아니라 법정건강보험(Gesetzliche Krankenversicherung, GKV)이 적용되는 모든 국민에게 디지털건강앱(DiGA)에 대한 혜택을 받을 수 있는 권한을 부여하고 임상적 근거창출을 지원하고 있다. 주요 내용으로는 2021년 1월 1일부터 법정 보험회사는 고객에게 전자의무기록을 제공해야 하며, 의사나 병원 및 약국과 같은 의료서비스 제공자는 환자 요청 시 의료행위 및 약물 등에 관한 데이터를 제공할 의무를 규정하고 있다.
DiGA의 처방 및 급여화를 통해 질병의 예측과 치료를 지원하고, 환자가 건강한 생활습관을 유지할 수 있도록 하고 있다. DiGA는 위험도가 낮은 의료기기에만 해당되는데, EU가 정한 의료기기지침(MDD)에 따르면 Class I 및 Class IIa 의료기기(낮음에서 낮음/중간 위험, 측정기능 포함 또는 미포함)에 해당된다. DiGA는 환자와 함께 의료서비스 제공자에게 질병이나 부상, 장애의 인식, 치료, 완화를 지원하는 것을 목적으로 하고, 이런 목적이 주요 디지털 기능을 통해서 달성되는 기기에 해당하며 일반인이나 의사만 활용하는 앱은 해당되지 않는다. DiGA는 독일 식약처(Bundesinstitut für Arzneimittel und Medizinprodukte, BfArM)의 절차를 완료한 디지털치료기기의 특징과 성능에 대한 포괄적인 정보를 제공하는 웹 포털(web portal)이며, 크게 디지털치료기기 사용자, 의료서비스 제공자, 제조업체를 위한 정보를 제공하고 있다.
DiGA에 디지털치료기기를 등재하기 위해서는 독일 사회보장법(Sozialgesetzbuch) 139e조에 의거하여 BfArM에 신청해야 한다. 이후 BfArM은 업체가 제출한 신청서(175개 요구사항 및 치료효과)를 3개월 동안 평가하여 등재 여부를 결정한다. BfArM의 평가 기준을 충족한 제품은 DiGA에 등재되며, 등재는 영구등재(Final listing)와 임시등재(Provisional listing)로 구분된다. 영구등재는 BfArM이 수립한 요구사항과 긍정적 치료효과를 모두 입증한 제품의 등재를 의미하며, 임시등재는 기기에 대한 요구사항은 입증하였으나 긍정적 치료효과를 입증하지 못한 경우로서 긍정적 치료효과 입증을 위해 12개월간 임시등재를 신청할 수 있다. 임시등재의 기간 연장이 필요한 경우에는 기간 종료 3개월 전에 연장 사유를 제출해야 하며, 효과성 입증을 위한 연장이라는 사유가 인정되는 경우 최초 신청일 기준 24개월까지 연장이 가능하다. 등재 유형과 관계없이 DiGA에 등재된 제품은 법정건강보험(GKV)에서 비용을 보상받을 수 있다.
(3) 영국
영국은 보건부 산하에 디지털헬스케어 추진을 위한 전문 조직인 국민보건서비스(National Health Service, NHS)를 운영하고 있다. NHS는 디지털 혁신기술을 활용해 영국의 공공 보건과 의료서비스 당면 과제를 해결하고자 다수의 글로벌 기업과 협력하여 ‘디지털헬스케어 테스트베드’ 사업을 진행하고 있다. NHS의 주요 디지털헬스케어 사업은 의료데이터 분석을 통한 환자 모니터링 및 만성질환 예측, 웨어러블 기반 모바일 건강관리 등이며, 우선적으로 노인과 만성질환자, 정신질환자를 주요 대상으로 사업을 추진 중이다. 지속적인 테스트베드 사업을 통한 검증을 거쳐 향후 다른 영역으로 점차 확대해 나갈 계획이다.
2022년 4월 영국 정부는 보건의료법(Health and Care Act 2022)을 통과시켰다. 이 법은 지역 서비스를 개선하고 공적 자금을 최대한 활용하기 위해 병원, 일차의료의사(GP), 사회복지사 및 기타 기관 간의 협력이 필요하다는 인식에 기반을 두고 있다. 이 법의 핵심은 통합의료시스템(Integrated Care Systems, ICSs)이 국민의 건강을 개선하고 불평등을 줄이기 위해 지역 서비스 계획을 담당하는 것이다. 이와 같은 변화로 통합의료시스템(ICSs)은 법적 권한과 책임이 있는 법인으로 공식화되면서 2022년 7월 1일부터 임상커미셔닝그룹(Clinical Commissioning Groups, CCGs)을 대체하게 됐다.
통합의료시스템(ICSs)은 지자체 및 지역 내 기타 조직과 함께 NHS 서비스 제공자와 기타 기관을 통합하여 보건의료서비스 계획, 건강 개선 및 지역 내 불평등 해소 등에 대한 공동 책임을 지는 지역 기반 조직이다. 통합의료시스템(ICSs)의 핵심 목표는 모든 국민의 건강을 향상시키고 복합 및 만성 질환을 앓고 있는 사람들을 지원하는 것이며, 진료 변화에 대응하여 비용 대비 최대한의 가치를 실현하고 원활한 서비스를 제공하는 것이다. 2022년 9월 현재 영국 전역에 42개의 통합의료시스템(ICSs)이 있다.
영국 국립보건연구원(National Institute for Health Research, NIHR)은 의료 인공지능의 임상연구 활성화를 위해 AI in Health and Care Award를 통해 의료 인공지능의 개발, 인허가 획득, 의료기간 적용을 위한 임상연구를 지원하고 있다.
(4) 유럽
유럽 의료기기 인증 기준이 2021년 5월부터 MDD(Medical Device Directive)는 MDR(Medical Device Regulation)로 IVDD(In Vitro Diagnostic Directive)는 IVDR(In Vitro Diagnostic Regulation)로 개정됨에 따라 임상자료, 시판 후 책임 요건 등 요구사항이 강화됐다. 현재 MDR 및 IVDR 적용 국가는 2023년 3월 기준으로 독일, 이탈리아, 프랑스 등 유럽연합 27개 회원국이다.
개정 배경으로는 MDD 인증된 의료기기 제품의 인체 내 안전성과 품질관리 이슈로 유럽연합 차원에서 의료기기에 관한 규제체계를 전면적으로 재검토하게 됐다.
주요 내용으로는 제조자의 법적 지위, 임상자료 제출, 시판 후 책임 요건, 의료기기 품질관리 투명성, 심사기관(Notified Body, NB) 자격 등 전반적인 안전성 요구수준 강화됐다. 또한 기존 유럽 의료기기 인증(MDD/IVDD)의 무효화 시점 고위험장비(2027.12.), 중저위험장비(2028.12.) 이후 미인증 의료기기는 EU 회원국 시장에서 판매가 불가능하다.
글로벌 의료기기 시장은 초대형기업이 시장을 대부분 점유하고 있어 자체 경쟁력만으로는 높은 성장을 기대하기 어려워 새로운 의료기기 분야로 진입하기 위해서는 기존 기업과의 적극적인 인수합병(M&A)을 통해 시장 지배력을 강화하고, 지속 성장의 동력으로 활용하는 것이 필요할 수 있다.
특히, 코로나19 이후 체외진단의료기기 수요의 급증과 AI 기술 접목에 따른 디지털 전환 시대의 도래로 체외진단 및 디지털헬스케어 기업 인수합병이 활발하게 이루어지고 있다.
(5) 일본
일본 유망제품 우선심사제도(SAKIGAKE Designation, 사키가케 지정)는 현장 수요 기반 제품화 촉진 제도로서 2015년부터 질병 치료에 효과가 높다고 기대되는 대상 품목에 대해 보험 우대 가격을 적용하는 프로그램이다. ‘사키가케 지정’은 의약품, 재생의약품 및 의료기기를 포함하는 혁신 의료제품에 대한 허가절차 가속화를 위해 마련되었으며, 미국의 ‘혁신의료기기 지정(Breakthrough designation)’과 유럽의 ‘우선심사 지정(Priority Medicine(PRIME) designation)’과 같은 가속경로(Accelerated pathways)와 동등한 제도라고 볼 수 있다.
사키가케 지정의 주요 혜택은 일본 ‘의약품 및 의료기기청(Pharmaceutical and Medical Devices Agency, PMDA)’과의 우선 협의(Prioritized consultation)를 받고 PMDA 지정 컨시어지 그룹(Concierge group)의 컨시어지가 업체가 사전신청 상담(Pre-application consultation)을 통해 제품의 규제시스템을 신속히 통과할 수 있도록 명시적으로 도움을 주는 프로그램에 배정된다. 사키가케 지정으로 판매허가 신청을 우선 검토(Priority review)하여 6개월 목표로 검토를 완료한다는 가정을 하고 있어 신속한 제품 출시를 도와주고 있다. 우선 조건부 허가가 주어지면, PMDA는 신청자와 재심사(Re-examination) 기간을 논의하고 적절한 재심사 기간을 선택한다. 사키가케 제품은 일본 가격 시스템에서 지정되지 않은 제품 대비 추가 프리미엄 가격(Additional premium pricing)을 적용받을 수 있다. 사키가케 지정을 받으려면 신제품은 다음 기준을 충족시켜야 한다.
[표 3-37] 사키가케 지정을 위한 충족요건
|
① 신제품은 혁신적이어야 하며, 혁신적 치료 또는 진단이 꼭 필요한 질병 치료에 해당해야 한다. 새로운 적응증이나 질병에 대한 제품은 기존 의약품의 개선된 전달 시스템과 마찬가지로 적합해야 한다. ② 기존 치료법과 비교 시 혁신적 개선이 기대되는 탁월한 효과성이 있어야 한다. 탁월한 효과성에 대한 근거는 비임상 데이터 또는 초기 임상데이터를 기반으로 제시할 수 있다. ③ 만성 쇠약 상태인 삶이나 질환에 중대한 영향을 미치는 심각한 질환을 치료하기 위한 것이어야 한다. ④ 의학적 미충족 수요(Medical unmet needs)를 해결해야 한다. ⑤ 해당 질환에 대해 허가된 의약품이 없거나 신제품이 기존 의약품보다 우수해야 한다. ⑥ 또한 일본 시장 또는 최소한 다른 시장과 동시에 제품을 도입할 의도가 있어야 한다. 일본에서 개발이 꾸준히 진행되고 있거나 일본에서 최초(First-in-human) 또는 개념입증(Proof-of-concept) 연구가 진행되고 있다는 증거가 있어야 한다. |
출처: 저자 재작성
일본 정부는 도시에 집중된 의사 인력과 지방의 의사 부족 문제를 해결하기 위해 원격의료에 관한 법을 개정해 왔으며, 이번 코로나19로 관련 규제 및 시스템들이 더욱 주목받고 있다. 일본 후생노동성은 코로나19 여파로 2020년 2월 이후부터 원격의료 중 온라인 진료의 규제를 대폭 완화했고, 특례로 4월 13일부터는 원칙적으로 금지됐던 원격진료가 초진이어도 온라인 진료가 가능하도록 하고, 진료 기한은 코로나19가 진정될 때까지라고 발표했다. 이는 병원 내에서의 집단 감염을 막고, 중증환자 급증에 따른 의료체계의 붕괴를 막기 위함이다.
(6) 중국
중국은 2014년 3월 의료기기의 연구와 혁신을 장려하고 새로운 의료기술의 적용을 촉진하여 자국 제조업 활성화와 혁신의료기기 조기 출시 및 개발 장려의 일환으로 혁신의료기기 특별승인절차 시행을 추진하였으며, 심사 허가제도의 개혁 심화와 의약품・의료기기의 혁신 이행을 위해 2018년 12월 개정된 혁신의료기기 특별승인절차를 발표했다. 새롭게 개정된 절차는 2014년 시행된 프로세스를 대체하며, 적용사항을 보완하여 신청 절차를 세분화하고, 혁신심사의 실효성을 제고하며, 심사방식과 통지형식을 보완하고 혁신의료기기의 허가사항 변경에 대한 우선순위를 명확히 했다.
2021년 10월까지 중국 국가의약품감독관리국(NMPA)을 통해 혁신의료기기 특별승인절차에 지정된 제품은 총 350여 건으로서 이후 연간 50건 내외의 제품이 신규로 지정되고 있다. 이 가운데 국가의약품감독관리국(NMPA) 승인을 받은 제품은 2021년 6월 기준 총 98건이다. 중국 혁신의료기기 특별승인절차에 지정된 제품 중에서는 심혈관 분야가 가장 높은 비중을 차지하고 있으며, 진단검사의학, 외과학 등에 활용되는 제품 비중도 각각 10% 이상을 차지한다.
중국 정부는 2021년 2월 국무원령 제739호에 서명하고, 개정된 의료기기 감독관리조례를 확정했으며, 6월 1일부터 정식 시행되고 있다. 이는 의료기기에 대한 최초인증, 심사로부터 최종 판매, 시판 후 감독까지 전체 주기를 다루고 있으며, 중국 의료기기 시장의 질서를 유지하는 중요한 법규이다. 이 법으로 희귀질환과 생명을 중대하게 위협하는 질병에 대한 효과적인 치료수단이 없고, 공중보건사고 및 기타 긴급히 필요한 대응에 사용되는 의료기기가 없을 경우, 등록신청을 수락한 의약품 규제당국은 조건부로 승인을 내릴 수 있고 의료기기등록증에 관련 사항을 기재할 수 있다.
특히 중대한 공중위생 비상사태 또는 공중건강을 심각하게 위협하는 기타 비상사태가 발생하는 경우 국무원 보건당국은 사고 예방 및 통제의 필요성에 따라 의료기기의 비상사용을 권고해야 한다. 이는 국무원 약물규제 기관에 의해 일정 범위와 기한 내에서 긴급 사용하도록 하고 있다.
라. 디지털헬스케어 분야 국내 혁신 동향
정부는 2023년부터 2027년까지 관계부처 합동으로 의료기기산업 육성・지원 혁신전략 실현을 위한 의료기기산업 육성・지원 종합계획을 발표했다.
주요 중점 추진과제로는 포스트 코로나 대비 새로운 패러다임 대응을 위한 전략적 R&D 투자 확대, 국내외 임상 실증을 통한 국산 의료기기 사용 활성화, 국가・지역별 맞춤형 지원을 통한 시장진출 확대, 혁신기술 시장진입 규제 합리화 및 생태계 조성 등이며, 이를 위한 실천과제는 다음과 같다.
(1) 포스트 코로나 대비 새로운 패러다임 대응을 위한 전략적 R&D 투자 확대
① 향후 5년간 민・관 R&D 투자 규모 대폭 확대를 통한 체외진단의료기기 분야 성공사례 확산과 영상진단 기술 프리미엄화로 글로벌 수출경쟁력 강화 등 선택과 집중을 통한 R&D 투자 확대로 기술의 초격차를 확보한다.
② 환자 중심 예방・맞춤형 치료로의 패러다임 전환에 맞춰 AI・빅데이터 등 혁신기술, 융복합 의료로봇, 생체친화형 인공장기, 인공망막 등 차세대 이식형 의료기기 및 의료 난제 해결을 위한 고위험・고수익 의료기기의 선제적 개발 등 유망분야 신기술 투자로 글로벌 신시장을 선점한다.
③ 초고령화에 대응해 노인과 장애인의 삶의 질 향상을 위한 보조・재활기기 및 맞춤형 돌봄 로봇, 치매・만성질환 치료 전자약 등 진단・치료 의료기기 개발, 의료격차 해소, 희귀・난치질환 극복 등 의료 사각지대 해결, 신・변종 감염병 대응역량 강화 및 방역체계 마련 등 공익적 투자로 초고령화 대응과 보건안보를 확립한다.
(2) 국내외 임상 실증을 통한 국산 의료기기 사용 활성화
① 혁신의료기술 의료현장 임상 실증센터 구축 및 국산 의료기기 트레이닝 센터 등 국산제품 사용 활성화를 위해 시판 전후에 사용자인 의료인의 평가를 통해 인허가, 신의료기술 평가, 보험등재를 위한 안전성・유효성 평가, 동등성 또는 우월성 검증 등을 지원한다.
② 디지털헬스 의료기기 시범보급 및 임상 근거 축적 지원과 새로운 기술의 의료현장 진입・확산을 통한 디지털헬스 신기술 실증데이터 구축과 디지털헬스 의료기기를 활용한 의사-의료인 원격 협진, 원격모니터링, 비대면 진료 등 비대면 의료서비스 활성화를 집중 지원한다.
③ 검체 정보 매칭 및 국내외 검체 보유기관과 협업체계 구축 등 검체의 효율적 제공과 활용을 통한 체외진단 분야 임상 성능평가 지원과 품질경쟁력 강화를 위한 성능평가센터 구축 등 체외진단의료기기의 품질향상 기반을 마련한다.
(3) 국가・지역별 맞춤형 지원을 통한 시장진출 확대
① 주요 국가별 인허가・보험・유통 등 시장진출 요소와 인공지능・디지털・이식형 의료기기 등 새로운 시장을 분석하여 맞춤형 전략로드맵 수립을 통한 수출 유망 권역별 수출 특화전략 확대와 MDR, IVDR 등 선진국 규제강화와 WHO 품질인증(PQ) 대응체계 구축과 집중 지원을 통한 글로벌 시장 진출 역량을 강화한다.
② 의료기기산업 종합지원으로 국내 중소 의료기기 유니콘 기업을 발굴하고, 통합 정보제공 플랫폼 구축과 같은 전주기 종합정보 제공으로 의료기기산업 시장진출 지원을 고도화한다.
③ 기업・병원・연구자・투자자 등의 정보공유와 혁신아이디어 창출을 위한 오픈 이노베이션 플랫폼 구축과 의료기기 개발 데스밸리 극복을 위한 펀드 조성을 통한 투자유치와 사업화 역량을 강화한다.
(4) 혁신기술 시장진입 규제 합리화 및 생태계 조성
① 허가・임상시험 등 새로운 기술의 의료현장 진입을 위한 규제 합리화, 혁신의료기기 통합심사 등 혁신기술 시장진입 확대, 신의료기술 한시적 비급여 등재를 통한 선진입 후평가 체계 정착, 우선 급여 적용 후 사후 정식급여로 등재하는 체계 마련 등 혁신기술의 원활한 시장진입을 촉진한다.
② 혁신형 의료기기 기업의 연구개발, 실증 등의 집중 지원과 새로운 의료기술 발굴 및 개발을 통한 혁신 가속화를 위해 보건의료 빅데이터 활용 인프라 조성으로 도전적 산업생태계를 조성한다.
③ 글로벌 규제 변화 및 의료패러다임의 빠른 변화에 따른 현장 수요 맞춤형 바이오헬스 인재양성 프로그램 시행, 임상연구인력 역량 및 전문성 강화, 의료기기산업 특성화대학원 지원확대 및 교육과정 고도화를 통해 의료기기산업 전문 인력을 양성한다.
마. 발전 전망
범부처 차원의 의료제품 규제 합리화 정책만으로는 근본적으로 자생력을 갖춘 경쟁력 있는 시장 생태계 형성은 어려워 보이며, 다양한 산업과 기술이 융합되는 의료기기산업 참여자들이 자유롭게 시장에 참여하고 경쟁할 수 있는 개방형 생태계 조성과 이를 위한 법・제도적 기틀 마련이 핵심 요소일 것이다.
하지만 우리나라는 여전히 글로벌 융복합 혁신의료기기의 활성화 정책과는 조화되어 있지 않으며, 일례로 국내 첫 디지털치료기기가 식약처로부터 시판허가를 받았으나 아직 건강보험 수가 기준이 마련되지 않아 의료현장 도입이 지연되고 있다. 특히 식약처 허가 기준의 문턱을 넘지 못하는 첨단기술도 적지 않지만, 조직검사 대신 혈액검사만으로 여러 개의 암 돌연변이를 확인하는 차세대염기서열분석(NGS) 기반 액체생검 제품이 대표적이다.
NGS 기반 액체생검 기술은 혈액검사만으로 빠르게 항암치료 표적을 찾아낼 수 있어 진행 속도가 빠르고 조직검사가 힘든 암 치료에 유용하게 활용될 수 있는 신기술이다. 이런 액체생검 기술은 차세대 암 진단법으로 주목받아 미국에서는 2014년 미국 FDA 승인 후 이미 산업으로 자리 잡았으나, 국내에서 허가받은 제품은 아직 없을뿐만 아니라 이 검사가 아직까지 진단 보조 수준에 머물고 있다. 국내외 기업들이 식약처 시판 허가에 도전하고는 있으나 식약처 허가심사 기준이 높아 중도 포기하는 사례도 나오고 있다.
이러한 측면에서 혁신・첨단 의료기기 및 기술의 경우 임상적 유용성, 안전성・유효성, 경제성 등에 대한 입증에 대해서는 정부 차원의 인프라 제공 등의 지원이 필요할 것으로 사료된다. 민간 주도 혁신이 활성화될 수 있도록 하는 의료 분야의 혁신은 규제 합리화, 인허가 절차를 지원하는 합리적인 허가기준 마련을 위한 관련 규정 개정, 의료법 개정, 의료보험 수가체계 개선 등의 이슈로 인해 결코 쉽지 않을 수 있으나, 정부가 국가 차원의 의료혁신을 위한 명확한 전략적 방향 제시와 개방형 플랫폼을 제공하고, 민간이 이를 달성하고 구현한다면 혁신・첨단 의료기기 및 기술의 유의미한 가치가 우리 국민들에게 좀 더 가까이 다가올 수 있을 것으로 기대된다.
5. 감염병
가. 서론
(1) 코로나19, 단계적 일상회복으로의 전환
7억 5,800만 명, 680만 명. 코로나19로 인해 발생한 전 세계 확진자 수와 사망자 수이다(2023년 3월 기준).66) 전 세계 80억 명 인구의 10% 가량을 감염시킨 코로나19는 현재까지 종식 여부는 불투명하지만, 미국, 독일, 오스트리아 등 선진국을 중심으로 방역 해제를 선언하고 있으며, 우리나라 역시 올해 3월부터 코로나19 위기경보 단계 하향 및 마스크 착용 전면 해제, 격리 의무 조정 등 코로나19 발생 후 행해졌던 수많은 방역 규제의 전면 해제를 공식적으로 논의하고 있다.
2019년 12월 중국 후베이성 우한시에서 코로나19가 최초로 발생하고 전 세계를 휩쓴 뒤 다시금 일상으로 돌아오기까지 만 3년의 시간이 소요되었다. 코로나19 팬데믹 사태는 인수공통감염병이 인류의 삶에 끼치는 파괴적 영향을 실감하게 하였다. 2000년대 이후 사스, 신종플루, 에볼라, 메르스, 지카 그리고 이번 코로나19까지 신종 감염병의 발생 주기는 갈수록 짧아지고 있다. 코로나19 이후 새로운 ‘Disease X’는 그리 멀지 않은 시기에 다시금 인류를 위협해 올 것이다.
지난 3년 동안 전 세계가 중지를 모아 감염병의 선제적 감시체계 확립, 나노 기술 등을 활용한 백신 플랫폼의 구축, 신약 후보물질의 적극적인 발굴 등 새로운 ‘Disease X’에 대응하기 위해 총체적인 노력을 기울여 왔다. 역사적으로 위기는 새로운 기회를 불러왔다. 지난 코로나19로 인한 3년의 위기는 앞으로 다가올 신종 감염병에 대응할 수 있는 준비를 갖추게 된 귀중한 기회의 시간이 될 것이다.
나. 코로나19 이후의 감염병 발생 현황
(1) 원숭이두창(Mpox)
원숭이두창은 1958년 덴마크의 실험실 사육 원숭이에서 처음 발견되었으며, 1970년 콩고민주공화국에서 인체감염의 첫 사례가 보고되었다. 본래 중앙아프리카 및 서아프리카 지역의 농촌 열대우림 지역에서 주로 발생하는 풍토병이었지만, 2022년 5월 스페인, 포르투갈, 영국을 중심으로 유럽의 다수 국가에서 원숭이두창의 발병 사례가 보고되며 이후 북미 지역까지 급속도로 전파되었다. 이 사례는 중서부 아프리카 외의 여러 개의 국가에서 원숭이두창이 유행한 최초의 사례이며, 현재까지 전 세계적으로 110개국, 8만 6,231명이 확진되었다(2023.3. 기준).67) 미국이 3만여 명으로 가장 많은 수를 차지하였고 브라질 1만여 명, 스페인 7,000여 명, 프랑스 4,000여 명으로 뒤를 이었다. 우리나라도 2022년 6월 최초 확진자가 보고되었고 이후 총 4명이 확진되었다. 이에 같은 해 7월 세계보건기구(World Health Organization, WHO)는 원숭이두창 유행을 국제적 공중보건 비상상태로 선언하였다.

출처: WHO
[그림 3-76] 전세계 원숭이두창 발병 지도(2023.3월 기준)

출처: WHO
[그림 3-77] 전 세계 원숭이두창 발병 현황(2023.2.26)
원숭이두창은 중앙아프리카형과 서아프리카형의 2가지 유전형을 가진다. 이 중 2022년 유행한 바이러스는 서아프리카형으로 확인되었으며, 2018∼2019년에 영국에서 보고되었던 바이러스에서 유래되었을 것으로 추정된다. 국제학술지의 발표에 의하면 2018년 유행주에 비해 47개의 변이가 발견되었으며 이 중 42개는 숙주 방어 인자로 불리는 ‘Apobec3’ 효소에 집중되었다. 연구진은 2018년 이후 이 효소에 변이가 쌓이며 원숭이두창 바이러스 인체감염이 촉진되었을 수 있다고 주장하였다. 또한 코로나19의 사례와 마찬가지로 국가 간 이동 및 교역의 증가로 인해 삽시간에 전 세계로 퍼질 수 있음이 원숭이두창의 사례에서도 증명되었다.
하지만 원숭이두창은 코로나19와는 달리 공기 전파가 이루어지지 않고 밀접한 접촉을 통해서 전파되기 때문에 확진자에 대한 적극적인 격리와 신속한 감시로 유행 2개월 후인 2022년 8월에 정점을 찍은 후 확산세가 잦아들었으며, 2023년 현재에는 일부 지역에서 국지적으로만 발생하고 있다.
(2) 조류인플루엔자(H5N1)
![]() H5N1 고병원성 조류인플루엔자 바이러스는 1996년 중국 남부지방에서 처음 보고된 후 1997년 홍콩에서 18건의 인체 감염을 시작으로 2003년부터 현재까지 WHO 공식 집계된 감염자 수는 22개국에서 총 868명이며 그중 사망자 수는 457명으로 약 53%의 치명률을 보이고 있다. 또한 최근 세계동물보건기구(World Organisation for Animal Health, WOAH)에 따르면 2021년 10월 시작되어 현재까지 지난 15개월 동안 전 세계 79개국에서 4,200만 마리의 가금류와 야생조류의 감염이 확인되었으며, 2억여 마리가 살처분되었다. 보건기구는 그 어느 때보다도 많은 야생조류와 가금류가 희생되었으며 총 약 80종의 조류가 바이러스에 감염되었다고 보도하였다. 2021년 10월 이후 H5N1 바이러스의 인체감염 사례는 미국, 영국, 중국, 에콰도르, 인도, 캄보디아 등 총 6건이 확인되었으며 인간을 제외한 포유류 감염 사례는 2023년 1월 기준 119건이 보고되었다.
H5N1 고병원성 조류인플루엔자 바이러스는 1996년 중국 남부지방에서 처음 보고된 후 1997년 홍콩에서 18건의 인체 감염을 시작으로 2003년부터 현재까지 WHO 공식 집계된 감염자 수는 22개국에서 총 868명이며 그중 사망자 수는 457명으로 약 53%의 치명률을 보이고 있다. 또한 최근 세계동물보건기구(World Organisation for Animal Health, WOAH)에 따르면 2021년 10월 시작되어 현재까지 지난 15개월 동안 전 세계 79개국에서 4,200만 마리의 가금류와 야생조류의 감염이 확인되었으며, 2억여 마리가 살처분되었다. 보건기구는 그 어느 때보다도 많은 야생조류와 가금류가 희생되었으며 총 약 80종의 조류가 바이러스에 감염되었다고 보도하였다. 2021년 10월 이후 H5N1 바이러스의 인체감염 사례는 미국, 영국, 중국, 에콰도르, 인도, 캄보디아 등 총 6건이 확인되었으며 인간을 제외한 포유류 감염 사례는 2023년 1월 기준 119건이 보고되었다.

출처: Michelle Wille, Ian G. Barr. Science, 2022
[그림 3-78] H5 고병원성 조류인플루엔자바이러스의 전파
2020년 이후의 H5N1 고병원성 인플루엔자는 기존의 H5N8 바이러스가 야생조류의 N1 유전자와 재조합되어 2020년 10월 유럽에서 최초로 보고되었다. 2021년 9∼10월부터 상대적으로 안정적인 유전자형을 가진 H5N1 clade 2.3.4.4b가 우세종으로 자리매김하였고 야생 철새의 이동에 따라 전 세계적으로 확산되었다. 이후 2021년 12월까지 아시아와 북미지역에 전파되었고 2022년 중반 중미지역, 그리고 2022년 말 남미 지역의 야생조류와 가금류 모두에서 바이러스가 발견되었다. 이번 H5N1 유행이 과거의 사례와 구별되는 점은 야생 포유류에서의 대규모 감염이 발생했다는 것이다. 많은 수의 감염이 발생한 밍크와 바다표범 외에도 유럽과 미주 지역에서 확인된 포유류 감염 목록에는 오소리, 흑곰, 살쾡이, 코요테, 돌고래, 돼지, 족제비 등 총 30여 종이 확인되었다.68) 이와 같은 포유류에서의 대규모 확산은 바이러스의 포유류 숙주에 대한 추가적인 적응을 야기할 수 있어 동물과 인간 모두에게 더욱 치명적인 변종의 출현으로 이어질 수 있다. 이번 유행이 과거의 대규모 인체감염 사태로 이어지지 않기 위해서는 지속적인 역학 조사를 통해 종간 전파의 위험성에 대한 선제적인 감시가 필수적이다.
(3) 신종 인수공통감염병-랑야 헤니파바이러스
중국 베이징 미생물 및 유행병 연구소와 싱가포르-듀크 의학전문대학원이 2022년 4월에 발표한 논문에 따르면 2018년 12월부터 2021년 8월까지 중국 산둥성과 허난성에서 일명 랑야 헤니파바이러스(The Langya henipavirus, LayV)에 의한 감염사례가 38건 발생하였다. 랑야 헤니파바이러스의 사람 간 감염 사례는 아직 확인되지 않았고 감염지 주변 25종의 야생동물 혈청 검사 결과 27%의 뾰족뒤쥐에서 바이러스가 검출되어 해당 동물에 의한 인수공통 바이러스로 추정된다. 현재까지 보고된 사례를 기준으로 살펴볼 때 다른 헤니파바이러스에 비해 증상이 심하지 않아 아직까진 사람에게 심각한 위협이 되지 않는 것으로 판단된다.
(4) 마버그, 라싸열, 크리미안 콩고열
마버그, 라사열, 크리미안-콩고 출혈열, 그리고 에볼라, 이들 바이러스는 모두 아프리카 지역에서 유래되었으며 해당 지역의 풍토병으로 자리 잡아 과거부터 오늘날까지 지속적으로 인류 공중보건에 큰 위협을 끼치고 있다. 2022년 WHO는 아프리카에서의 인수공통감염병의 발병 건수가 10년 전에 비해 63% 증가했다고 밝혔다. 그 요인으로는 높은 인구 성장률, 도로・철도・항공 등 교통 인프라의 발달, 축산물 소비량의 증가 등을 꼽았다. 아프리카는 2021년 합계 출산율이 4.31명으로 세계 평균의 2배에 이르며, 2040년에는 현재 인구의 1.5배인 20억 명에 달할 것으로 예측된다.69) 또한 천문학적인 인프라 개발 투자 및 경제 발전을 통해 아프리카인의 생활 및 건강 수준은 높아지는 한편, 역설적으로 인수공통감염병 발병 및 확산의 위험성은 점점 더 증가하고 있다.
출처: John N. Nkengasong, Sofonias K. Tessema, Cell, 2020
[그림 3-79] 아프리카 지역의 감염병 발병 지도(2020)
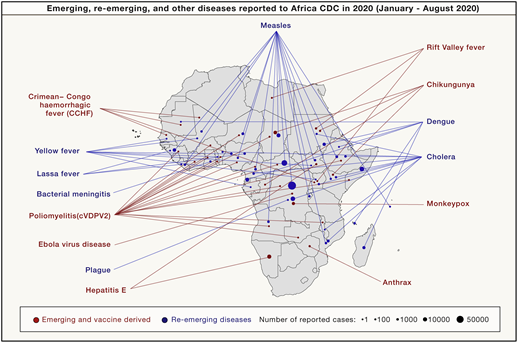
마버그의 경우 2021년 기니에서 1건의 감염 및 사망사례가 발생하였는데 이는 서아프리카에서의 첫 마버그 발병 사례이다. 이후 2022년 7월 가나에서 4명이 감염되어 3명이 사망하였고, 2023년 1월 적도기니에서도 마버그가 처음으로 보고되었으며 당시 9명이 사망하고 16명이 의심증세를 보였다. 이는 2012년 우간다에서 18명이 감염된 사례 이후 가장 강하게 확산된 사례로 보고되었다.70)
라사열과 크리미안-콩고 출혈열의 경우에는 아프리카 이외의 국가로 전파되었다. 2022년 2월 영국인 3명이 라사열로 확진되어 1명이 사망하였고, 이들은 모두 서아프리카 지역의 방문과 관련되어 있었다. 크리미안-콩고 출혈열은 2022년 초부터 아시아, 유럽 등지에서 다수 발생하였는데 그 중 이라크에서 299명이 확진되어 55명이 사망하였고, 조지아에서는 45명이 감염되어 3명이 사망하였다. 해당 감염병의 경우 진드기 매개 질병으로 전 세계 9종의 진드기에서 해당 바이러스 유전자가 검출되었고 국내에 서식하는 뿔참진드기도 9종의 진드기 중 하나이다.
출처: GOV.UK
[그림 3-80] 라사열, 에볼라, 마버그의 아프리카 지역 발병 지도
다. 코로나19 발생 이후 국내 감염병 대응 사업 현황
코로나19 대유행 동안 전 세계는 각국의 상황에 맞는 다양한 방역모델을 내세워 감염병을 진압하고자 노력하였다. 우리나라는 정부가 시행하는 적극적인 방역 정책과 탄탄한 보건의료 체계, 그리고 국민들의 자발적인 참여 덕분에 백신 접종, 마스크 착용, 사회적 거리두기 등을 철저히 준수한 결과 0.13%의 세계 최저 수준의 코로나19 사망률을 기록하였다.71) 특히 유례없는 대유행 동안 감염 파동을 수차례 겪는 와중에도 세계적인 수준의 정보통신 기술과 의료체계를 바탕으로 대규모 봉쇄 조치 없이 민첩하고 효율적으로 감염병을 통제함으로써 한국형 방역모델의 우수성을 전 세계적으로 증명하였다. 진단과 방역 체계에 있어서 이제 우리나라는 세계적인 롤모델 국가로 손꼽히고 있지만 새로운 미지의 감염병인 ‘disease X’를 예방하기 위해서는 진단과 방역뿐만 아니라 백신과 치료제 기술도 선제적으로 개발하려는 노력이 필요하다. 또한 국가 간 상호 교류가 증가하면서 감염병 대응을 위한 국가적 연대와 협력이 중요해진 만큼 감염병 대응 체계를 더욱 견고하게 하기 위해서는 글로벌 공동연구를 위한 네트워크 강화가 필수적이다. 결론적으로 포스트 코로나 시대를 대비하기 위하여 최근 정부에서 제시하는 감염병 대응정책은 진단, 방역, 백신, 치료 영역에서 세계적 수준의 경쟁력을 확보하고 감염병 공동연구를 위한 글로벌 네트워크 강화에 초점을 맞추고 있다.72)73)
[표 3-38] 2023년 질병관리청 주요업무계획
|
현안 과제 |
(국내) 코로나19 안정적 관리로 국민의 일상회복 지원 |
1. 코로나19 관리 및 고위험군 보호 집중 |
|
2. 중국發 코로나19 리스크 관리 철저 |
||
|
3. 근거 기반 대응을 위한 임무 중심 연구 강화 |
||
|
(국제) 글로벌 보건의료협력 선도 |
1. 글로벌 보건의료 선도기관으로 위상 확립 |
|
|
2. 국제 네트워크 확대로 보건의료 협력 선도 |
||
|
핵심 과제 |
미래 팬데믹에 대비한 국가 감염병 대응체계 고도화 |
1. 신종감염병 조기 인지를 위한 감시・분석 |
|
2. Disease X 대응 진단・역학 역량 강화 |
||
|
3. 대응체계 개편 및 접종 역량 강화 |
||
|
4. Disease X 대응, Big data 활용을 위한 정보시스템 구축 등 제도 정비 |
||
|
상시 감염병 예방관리 강화로 일상 속 감염 위험 최소화 |
1. 국가 예방접종 확대 |
|
|
2. 상시감염병 관리 및 퇴치 전략 마련 |
||
|
3. 잠재적 위험요인 관리 강화 |
||
|
4. 안전한 의료환경 조성으로 의료 감염 감소 |
||
|
고령화 및 미래 건강위협 대비 국민 건강보호 체계 마련 |
1. 만성질환 예방관리 체계 강화 |
|
|
2. 희귀질환자 지원 확대 및 인프라 강화 |
||
|
3. 건강위해 예방・관리를 위한 안전망 구축 |
||
|
보건의료 선도국가 도약을 위한 R&D 주도 |
1. 백신・치료제 핵심 기술 확보 |
|
|
2. 미래의료 기술 선점을 위한 인프라 강화 |
||
|
3. 보건의료 R&D 지원체계 강화 |
출처: 질병관리청
그동안 국내 제약산업은 기업 중심의 응용/개발 연구에 집중하였지만 이제는 미국, 유럽과 같이 산・학・연 협력을 기반으로 한 기초과학 연구의 필요성이 부각되고 있고 포스트 코로나 시대에 대비한 백신 주권 확보가 필요하기에 정부에서는 아래와 같은 다양한 백신 개발 사업들을 지원하고 있다.
|
분야 |
부처 |
세부사업명(내역사업명) |
예산 |
||
|
2022 |
2023 |
||||
|
감 염 병 위기대응 |
복지부 |
RNA바이러스 감염병(Disease X) 대비 항바이러스 치료제 개발
|
- |
38 |
|
|
범부처 감염병 방역체계 고도화 R&D사업
|
- |
16 |
|||
|
감염병 예방・치료기술개발사업 |
430 |
450 |
|||
|
미래성장 고부가가치 백신 개발사업 |
48 |
90 |
|||
|
백신 기반기술 개발사업 |
65 |
104 |
|||
|
신변종 감염병 대응 mRNA백신 임상지원사업 |
105 |
105 |
|||
|
신속 범용백신 기술개발 사업 |
56 |
84 |
|||
|
감염병 방역기술개발사업 |
131 |
19 |
|||
|
감염병 의료안전 강화기술개발사업 |
108 |
144 |
|||
|
감염병 위기대응 기술개발사업 |
29 |
- |
|||
|
코로나19 백신 임상지원사업 |
418 |
- |
|||
|
코로나19 치료제 백신 비임상지원사업 |
80 |
- |
|||
|
코로나19 치료제 임상지원사업 |
475 |
- |
|||
|
과기부 |
바이오・의료기술개발 (미래감염병) |
331 |
332 |
||
|
바이오・의료기술개발 (백신허브기반구축) |
193 |
81 |
|||
|
신변종감염병대응플랫폼핵심기술개발 |
113 |
136 |
|||
|
감염병차세대백신기초원전핵심기술개발 |
100 |
91 |
|||
|
바이오・의료기술개발 (국가 전임상 지원체계 구축)
|
- |
133 |
|||
|
산업부 |
범부처감염병 방역체계 고도화 R&D
|
- |
7 |
||
|
방역연계 범부처 감염병 R&D |
10 |
- |
|||
|
백신원부자재생산고도화기술개발 |
69 |
84 |
|||
|
식약처 |
감염병 대응 혁신기술 지원 및 활용연구 |
95 |
95 |
||
|
질병청 |
감염병 관리기술 개발연구(R&D) |
203 |
163 |
||
|
신기술 기반 백신플랫폼 개발 지원사업(R&D) |
122 |
113 |
|||
|
신변종 감염병 대응 mRNA백신 임상지원(R&D)_출연금 |
67 |
60 |
|||
|
공공백신개발지원사업(R&D) |
50 |
101 |
|||
|
국가위기초래 바이러스 감염병 극복 기술개발(R&D) |
140 |
142 |
|||
|
코로나19후유증조사연구사업(R&D)_출연금 |
55 |
73 |
|||
|
범부처감염병 방역체계 고도화(R&D)_출연금
|
- |
13 |
|||
|
병원기반 인간마이크로바이옴 연구개발사업(R&D)
|
- |
24 |
|||
|
공공백신개발・지원센터 건립 및 운영(R&D)(종료) |
85 |
- |
|||
|
국가 보건의료 연구인프라 구축(R&D) - 기후변화 급만성 질병연구, 국립감염병연구소 연구장비 구축 |
58 |
43 |
|||
|
합계 |
3,636 |
2,740 |
|||
출처: 보건복지부
(1) 백신실용화기술개발 사업단(VITAL-Korea)
백신실용화기술개발 사업단(단장 연세대학교 의과대학 성백린 교수)은 보건복지부의 지원을 받아 ‘백신 주권 확보 및 글로벌 시장진출’을 비전으로 백신 자급화, 신규 후보 발굴과 임상 진입 가속화를 위해 2020년 4월에 출범하였다. 정부 지원 하에 다양한 학술 및 연구 기관이 협력하고 있으며 2029년까지 필수예방접종 3종을 포함한 7종 후보물질의 임상 2상을 완료하는 것을 목표로 하고 있다. 사업단은 코로나19뿐만 아니라 DTaP(디프테리아, 파상풍, 백일해), SFTS(중증열성혈소판감소증후군), RSV(호흡기 세포융합바이러스) 등 필수적으로 예방이 필요한 감염병 백신의 안정적인 수급을 위하여 한국형 신규 백신 플랫폼을 개발하고 공공성과 경제성을 모두 고려한 백신 타깃 발굴, 국가 접종이 필요한 백신 자급화와 향후 국내외 확산이 우려되는 신종 감염성질환의 미래대응형 백신 개발에 선도적 역할을 수행하는 것을 목표로 한다.74)

주1) DTaP: 디프테리아, 파상풍, 백일해(Diphtheria, Tetanus, Pertussis)
주2) SFTS: 중증열성혈소판감소증후군(Severe Fever with Thrombocytopenia Syndrome)
주3) RSV: 호흡기 세포융합 바이러스(Respiratory Syncytial Virus)
출처: 백신실용화기술개발사업단, https://www.vitalkorea.kr/kr/company/overviewSystem
[그림 3-81] 백신실용화기술개발사업단 추진체계 및 사업개요
(2) 신변종 감염병 대응 mRNA 백신 사업단(KmVAC)
신변종 감염병 대응 mRNA 백신 사업단(단장 가천대 의과대학 홍기종 교수)은 주기적으로 도래할 신변종 감염병의 위협에 신속하게 대응할 수 있는 백신 기술을 확보하고 국가의 보건 안보를 공고히 하고자, 보건복지부와 질병관리청의 지원사업으로 가천대학교가 총괄사업단을 유치, 출범하였다. 사업에는 에스티팜, 아이진, 큐라티스 등 비임상 및 임상지원 분야 9개 과제가 선정되어 국제백신연구소를 포함한 총 26개 기관 참여하에 국산 mRNA백신개발사업을 수행한다. 사업단은 2025년까지 정부출연금 688억 원을 포함한 총 900억 원 규모의 연구비를 투입해 신・변종 감염병에 대한 신속 대응이 가능한 mRNA백신 플랫폼을 확보하고, 위기 시 긴급생산이 가능한 생태계 구축을 추진할 계획이다.75)
(3) 글로벌백신기술선도사업단(GVL)
글로벌백신기술선도사업단(단장 경희대 의과대학 우정택)은 국내 백신 기술 주권을 확보하기 위해 2022년 1월 출범하였다. 향후 발생할 수 있는 신변종 전염병을 대비하는 목적으로 준비된 이 사업에서는 국내 우수한 감염병 전문가들을 발굴하고 지원하여 실질적인 백신 임상시험에 근접할 수 있도록 하는 것이 목적을 둔다. 글로벌백신기술선도사업단은 오는 2026년까지 신속・범용백신기술개발사업, 미래성장고부가가치 백신개발사업, 백신기반기술 개발사업 등 3개 사업을 수행하며 단기간 내 상용화 목표 달성과 효율적 연구수행 및 지원을 위해 세부 사업들을 총괄하는 1개 사업단 형태로 추진하고 있다.76)77)
[표 3-40] 글로벌백신기술선도산업단 사업 개요
|
비고 |
사업범위 |
사업목표 |
|
|
글로벌 백신 선도기술 사업단 |
신속・범용백신 기술개발사업 |
- 나노 파티클(NP), 합성항원 백신 신속제작 플랫폼 등 다양한 형태의 대유행 신속대응 백신 플랫폼 기술개발 - 다가형 백신, 이형백신(인플루엔자, 코로나) 등 범용적 사용이 가능한 백신 - 향후 팬더믹 가능성이 높은 감염성 질환*에 대한 백신 library구축 등 * WHO Blueprint Priority Disease 포함 |
- 임상1상 완료 3건 - 비임상 완료 5건 |
|
미래성장고부가가치 백신개발 |
- AIDS, C형간염, 말라리아, 뎅기열 등 글로벌 수요가 높지만 아직까지 개발되지 않은 미충족 백신 개발 - 고령자, 만성질환자, 면역억제 치료환자 등 성인 고위험군 대상 백신 개발 - 감염 이후 중증질환으로의 이행을 차단하는 치료용 백신개발 등 |
- 임상2상 완료 1건 - 임상1상 완료 2건 - 비임상 완료 7건 |
|
|
백신기반기술개발 |
- 다양한 백신에 공통적으로 적용 가능한 면역증강제 - 경피, 점막, 비강스프레이, 경구약, 마이크로니들 등 주사제 대체 가능한 접종기술 - 백신 보관・유통기술 개발 - 부작용 위험군과 증상을 예측하는 기술 등 |
- 임상2상 완료 1건 - 임상1상 완료 2건 - 비임상 완료 6건 |
|
출처: 글로벌백신기술선도사업단
(4) 신・변종 감염병 대응 플랫폼 핵심기술개발사업
신・변종 감염병 대응 플랫폼 핵심기술개발사업은 향후 발생할 수 있는 다양한 신・변종 감염병에 선제적으로 대비하기 위한 핵심기술 개발을 목적으로 한다. 구체적으로는 감염병의 확산 예측・진단・치료・예방(백신)까지 감염병 대응 전주기에 대한 차세대 원천기술 개발을 목표로 2024년까지 12개 과제에 대해 지원하는 사업이다. 예측 분야는 개별 연구 중인 예측 모델을 연계・종합하여 신뢰도가 높은 빅데이터・AI 기반의 총괄 예측 플랫폼 개발하는 것을 목적으로 하며, 진단 분야는 기존 기술보다 신속성・정확성・간편성 등이 고도화된 진단기술을 개발하고, 항원・항체 라이브러리 등 인프라 구축 및 제조 원료물질 국산화 원천기술 개발을 목적으로 한다. 치료제 분야는 최근 코로나19 연구를 통해 새롭게 밝혀진 바이러스 감염 및 증식 기전을 타깃으로 하는 차세대 치료제 플랫폼 개발을 목적으로, 백신 분야는 mRNA 백신, 범용 백신 등 신・변종 감염병 백신 후보 도출 및 유효성 검증을 포함한 한국형 신규 백신 플랫폼 기술개발을 목적으로 한다.78)

출처: http://www.btnews.or.kr/bbs/board.php?bo_table=bt_news&wr_id=483
[그림 3-82] 신・변종 감염병 대응 플랫폼 핵심기술개발사업 개요
백신 주권을 확보하고 감염병에 효과적인 대응을 하기 위하여 현재 다양한 사업과제가 진행되고 있으나 백신 개발을 더욱 신속화하기 위해서는 규제의 변화도 필요하다. 특히 임상시험 대상 환자 모집 및 관련 비용 지원, 심사 기간 단축 등 전방위적인 정부 지원이 필수적이다. 또한 감염병의 대상 원인체와 전파양상, 환자의 특성에 따라 적합한 백신 플랫폼이 다를 수 있기 때문에 정부는 기초원천 분야에 장기적으로 투자하여 국가 주도하에 다양한 플랫폼 기술을 확보하고 관련 인력을 양성하는 역할을 적극적으로 수행해야 한다.
라. 코로나19 발생 이후 국외 감염병 대응 사업 현황
(1) 미국
(가) Pandemic Preparedness Plan
미국 국립보건원(National Institutes of Health, NIH)의 감염병 및 알레르기 연구기관인 NIAID는 2021년 12월에 새로운 팬데믹 대비 계획을 발표하였다. 이 계획은 병원체의 특성화 및 연구 감시 강화를 통해 대유행 위험을 미리 파악하여, 치료제와 백신 승인 시간을 단축시켜 미래 팬데믹에 대한 대응 능력을 강화하는 것을 목표로 하고 있다.79)
(나) NIH Community Engagement Alliance(CEAL)
COVID-19 대유행으로 가장 취약한 공동체와 연결을 유지하고, 공동체 내의 감염병 관련 지식 및 교육 연구를 구축하고 강화하기 위한 NIH의 계획이다. 이를 통해 COVID-19 대응에 대한 지역 사회 참여 지원 확대 및 네트워크 구축, 그리고 예방, 진단, 치료, 백신 연구에 대한 지원과 가속화를 목표로 하고 있다.80)
(다) NIH RECOVER Initiative
RECOVER Initiative는 COVID-19 대유행 후 이전 수준으로 환자의 건강을 되찾게 하는 데 초점을 맞춘 연구 프로그램이다. ‘RECOVER’는 ‘Researching COVID to Enhance Recovery’의 약자이다. 이 프로그램은 선진적인 기술과 대규모 데이터 분석을 결합하여 COVID-19가 인체에 미치는 영향을 연구하고, 건강을 되찾을 수 있는 최적의 방법을 찾는 데 중점을 둔다.81)82)
(라) Center for Forecasting and Outbreak Analytics(CFA)
CDC의 새로운 기관인 전염병 예측 및 발병 분석 센터(Center for Forecasting and Outbreak Analytics, CFA)는 데이터, 모델링, 분석을 사용하여 광범위한 공중보건에 대한 의사 결정을 지원하는 역할을 목표로 2021년 1월에 처음 설립이 제안되었으며, 2022년 4월에 공식적으로 출범되었다. 기존 CDC에서는 공중보건 데이터를 통합적으로 수집할 수 있는 시스템이 구축되어 있지 않았기 때문에 해당 기관이 신설되었다. CFA는 출범 이전이었던 2021년 겨울부터 오미크론 변이의 심각성과 미국 내 확산 시기 및 영향을 추정하는 데 기여했으며, 학교에서의 검사 후 체류 정책(school test-to-stay policies), 여행, 백신 관련 정책에 대한 분석에도 도움을 주었다.83)
(2) 유럽
(가) European Health Union
2020년 11월 유럽위원회는 유럽보건연합(European Health Union)을 발족했다. 유럽보건연합은 유럽 국가 간의 보건 안전에 대한 협력을 강화하고, 다양한 위기 상황에 대비하기 위한 방안을 제시하고 있다. 이는 COVID-19 대응을 비롯한 전염병 대비를 위한 연구, 의료 인프라 구축 및 협력체계의 구축 등 다양한 분야에서 이루어지고 있다.84)
(나) European Virus Archive GLOBAL(EVA-GLOBAL)
2020년부터 2023년까지 기획된 해당 프로젝트는 유럽연합의 지원을 받으며, 바이러스학 분야를 대표하는 27개의 EU 및 19개의 비 EU 연구센터로 총 46개의 실험실로 구성된 국제적인 그룹이 참여하고 있다. 이 프로젝트는 세계적인 네트워크의 구축을 통해 현재 발생하고 또 재출현하는 바이러스에 대한 대응 능력 개선을 목표로 하고 있다. 이를 위해 바이러스 샘플의 수집, 보존 및 분류, 바이러스의 특성화 및 진단 개발 등의 연구를 진행하고 있다.85)
(다) Beyond COVID(BY-COVID)
BY-COVID는 SARS-CoV-2 및 다른 감염병에 대해서 실험실의 과학자뿐만 아니라 병원의 의료진이나 공무원을 포함한 모든 사람들이 COVID-19 데이터에 액세스할 수 있도록 하는 것을 목표로 한다. 이 프로젝트는 생물의학 분야, 병원, 공중보건, 사회과학 및 인문학 분야의 이해 관계자들을 하나로 모아 세계적인 대유행 상황에서 유용한 데이터를 제공한다. BY-COVID 프로젝트는 데이터를 수집하고 연결하며 표준화하고 분석하는 방법을 제공하여 새로운 지식과 의학 분야의 발전에 기여할 것이다.86)
(라) REACTing: 감염병 대응을 위한 연구 네트워크
REACTing은 프랑스 보건부와 프랑스 국립보건원(National Institute of Health and Medical Research)에서 지원하는 감염병 대응을 위한 연구 네트워크이다. 이 프로젝트는 다양한 연구자와 협력하여 감염병 예방, 진단 및 치료를 위한 다양한 연구를 수행하고 있다. 프랑스의 생명과학 및 건강 연합(Aviesan)은 Inserm(Institut National de la santé et de la recherche médicale)이 조정한 컨소시엄인 REACTing을 통해 바이러스 및 COVID-19 질병에 대한 연구를 가속화하기 위해 동원 하고 있다. 연대 보건부와 고등 교육 연구 혁신부의 지원으로 REACTing의 과학 자문 위원회는 수학적 모델링에서 질병 예방 및 치료에 이르기까지 다양한 분야를 다루는 20개의 과학적 이니셔티브를 선택했다.87)
(마) European Research and Preparedness Network for Pandemics and Emerging Infectious Diseases (EU-RESPONSE)
EU-RESPONSE는 EU에서 자금 지원을 받아 5년 동안 진행되는 사업으로, 다국적이고 적용 가능한 유럽 COVID-19 및 신진 감염성 질환 임상시험 네트워크를 구축하는 것이 목표이다. 이 사업을 통해 약물 재창출 또는 재창출된 약물의 허가에 필요한 데이터가 제공될 것이며, 이를 통해 유럽연합 및 관련 국가 내의 병원들의 참여 및 연구 네트워크를 구축을 위해 노력하고 있다. 또한 다른 유럽 플랫폼과 협력하여 적응적 플랫폼 시험이 구축될 수 있도록 하고, 세계적인 임상시험 능력과 전염병 통제에 기여할 수 있을 것으로 기대되고 있다.88)89)
(바) The human genetic and immunological determinants of the clinical manifestations of SARS-CoV-2 infection: Towards personalised medicine (Project UNDINE)
유럽연합(EU)의 UNDINE 프로젝트는 COVID-19의 다양한 임상증상에 영향을 미치는 유전적 및 면역학적 요인을 연구하고자 한다. 나이와 동반 질환은 질병 결과에 영향을 미칠 수 있지만, 모든 변이를 설명하지는 않는다. 최근 연구결과에 따르면 면역 결함 및 자가항체도 역할을 할 수 있다. 이 프로젝트는 환자 집단에서 데이터를 수집하고 자가항체 진단 검사를 개발하여 COVID-19 부작용을 예측하는 것을 목표로 한다. 최종 목표는 SARS-CoV-2 감염의 병인에 기반한 맞춤형 예방 및 치료 접근법을 개발하는 것이다.90)
(사) Pandemic literacy and viral zoonotic spillover risk at the frontline of disease emergence in Southeast Asia to improve pandemic preparedness (PANDASIA)
PANDASIA 사업은 새로운 전염병 가능성 바이러스의 생물학 및 인간, 동물, 환경과의 상호작용을 이해하기 위한 프레임 워크를 개발한다. 이를 활용하여 질병 발생을 예측하고 예방하는 건강 및 팬데믹 교육 개입 전략을 개발한다. 이 프로젝트는 동남아시아 지역의 지역사회 및 당국과 협력하여 미래 스피루버 이벤트와 건강 위협에 대한 대비책을 강화하고, 유럽연합(EU)의 대비 및 긴급 대응 능력을 개선하는 데 도움을 줄 것이다.91)
(3) 일본의 선진적 연구개발 전략센터(SCARDA)
2022년 3월 선진적 연구개발 전략센터(SCARDA)가 신설되었다. SCARDA는 100일 안에 신종 바이러스에 대한 백신의 개발을 가능하게 하는 것을 목표로 하고 있으며, 1조 1,000억 엔(약 85억 달러)이 투입될 예정이다. SCARDA는 코로나바이러스, 인플루엔자, 지카, 뎅기열, 니파, 천연두 등의 백신 연구개발에 초점을 맞추고 있으며, mRNA 기술, 바이러스 벡터 및 재조합 단백질 등 다양한 기술을 활용할 예정이다.92)93)
마. 새로운 기술 도입을 통한 감염병 대응
코로나19 발생 1년 후 2021년 12월 영국을 시작으로 전 세계는 코로나19 백신 접종을 시작하였다. 코로나19 백신은 현재까지 전 세계 132억 2,916만 6,046회 백신이 접종되었으며(2023.3. 기준), 우리나라는 2차 접종 완료자가 4,441만 3,770명(2023.3. 기준, 86.8%)으로 접종률이 매우 높다. 질병관리청의 보고에 따르면 2차 접종자 대상으로 효과를 분석한 결과 코로나19 백신은 64∼84%의 중증화 예방효과, 72∼100%의 추가 사망 예방효과, 27∼42%의 추가 감염 예방효과가 있다고 한다.94) 새로운 백신이 임상시험 진입을 위해 통상 10년에서 20년 이상의 시간이 소요되는 것에 비하면 mRNA 백신의 승인은 과히 획기적이라고 할 수 있다. 그러나 이 혁신적인 백신도 1980년대 말 이후 30년이 넘는 연구를 통해 이뤄낸 성과이며 지금도 존재하는 한계를 극복하기 위한 노력들이 계속되고 있다.
예측할 수 없는 신종 감염병을 통제하기 위해서는 진단기술, 치료제, 백신과 같은 기술이 확보되어야 한다. 현재까지 개발되어 사용되는 기술들도 백신과 치료제의 경우 안전성과 유효성, 냉장・냉동 보관의 어려움과 같은 문제점들이 개선되어야 하며 진단기술의 경우도 낮은 민감도와 현장 적용을 위한 기술적 문제의 개선이 필요하다. 이들을 극복하기 위해 다양한 백신기술(자가조립-나노백신, 차세대 항원전달체 등)을 개발하고 있으며, 진단영역에서는 나노포어와 크리스퍼 유전자 가위를 활용한 신속 정확한 분자진단 및 현장형 진단기술개발을 시도하고 있다.
(1) 항원의 자가조립을 통한 나노백신 개발 연구
감염병 대응을 위한 면역 항원으로 안전성과 생산성을 확보하기 위해 바이러스의 특정 항원결정부를 포함하는 서브유닛 단백질 백신 연구도 많이 진행되었다. 자가조립 나노백신은 서브유닛 단백질이 면역체계에 다양한 각도로 인식될 수 있게 나노입자화 되어 있다. 나노입자화된 자가조립-나노백신은 면역원성을 확보하는 과정이 면역체계가 바이러스를 인식하는 과정과 동일하며, 실제 바이러스와 달리 항원결정부의 단백질만 인식시켜 안전성이 확보되어 백신으로 활용이 가능하다. 해당 기술은 플랫폼 기술로 다양한 감염체에 적용 가능하며, 여러 연구팀에서 자가조립-나노백신 시술을 다양한 감염병(코로나19 변이종, 인플루엔자 바이러스, 에볼라 바이러스, RSV 등)에 적용 중이다. 95)96)
(2) 신규 항원 전달체 기술
mRNA백신의 전달체로 지질 나노입자가 사용된 이후, mRNA항원, 서브유닛 단백질 항원, 불활화 항원들을 체내로 전달하기 위해 지질, 프로타민, 덴드리머, 고분자, 펩타이드 등 다양한 물질들이 신규 전달체 연구에 활용되고 있다. 프로타민은 양이온성 핵단백질로 여러 감염성 질환(인플루엔자, 광견병, 흑색종, 코로나19)의 mRNA 백신 전달체로 개발되어 전임상, 임상에 적용 중이다.97) 프로타민은 강한 양이온성을 갖고 있어 음이온성 mRNA와 정전기적 인력으로 즉각적인 혼합체를 형성하여 mRNA의 가수분해를 보호해주는 역할을 한다. 뿐만 아니라 프로타민은 면역증강 효과를 갖고 있어 TLR7/8을 자극하는 경로로 강한 면역반응을 유도해 낼 수 있다. 다만, 프로타민은 강한 친수성 성질로 인해 세포투과 및 엔도좀 탈출이 원활하지 못하여 mRNA항원의 전달 및 발현이 낮아지는 문제점이 있어 PEG나 지질나노입자와 함께 사용하는 등 개선점이 존재한다.98)
덴드리머는 에볼라, 인플루엔자, 지카 등 다양한 바이러스에 백신 항원전달체 기술로 연구되고 있다.99) 인조 고분자인 덴드리머는 3차원 구조적 특성으로 외부표면에 기능성을 부여할 수 있어 면역항원을 다가로 제시할 수 있다. 이를 활용한 다가백신(multivalent vaccine)은 면역반응 효과, 비용, 반복 접종 등 여러 이점을 갖지만 생분해성이 낮아 독성 문제를 개선하기 위한 노력이 필요하다.

주) Low generation multiple antigenic peptide (MAP) system as an asymmetric dendrimer (e.g., 4*arginine) exhibit minimal toxicity and effectively complex DNA for gene delivery applications compared with symmetrical dendrimers (e.g., G1 PAMAM)
출처: Biomaterials Volume 280, January 2022
[그림 3-83] 항원전달체 덴드리머 구성
(3) 나노포어를 활용한 감염병 진단, 분석 기술
나노포어(nanopores)란 나노미터(nm, 10-9m) 크기의 기공(pore)을 지칭하는 용어이다.100) 나노포어는 단일 분자 수준에서 생체 분자의 미묘한 형태 변화를 감지할 수 있는 새로운 고정밀 바이오 센서이다. 나노미터 크기의 포어에 전위가 가해지면 나노포어를 가로지르는 이온 플럭스(flux)가 전기적 신호를 생성하고 나노포어를 통과하는 분석물은 이온 전류의 일시적인 차단을 유도하여 전류 세기(current amplitude) 등으로 측정된다. 나노포어 바이오 센서는 게놈 시퀀싱, 다양한 개별 생체 분자의 검출 및 생체 분자 상호작용을 감지하는 데 사용된다.101)
2014년 Oxford Nanopore Technologies(ONT)는 MinION 플랫폼을 개발했다. MinION을 이용하여 서아프리카에서 에볼라 전염 기간 현장에서 바이러스의 게놈 시퀀싱을 통해 감염병의 발병을 실시간으로 감시할 수 있었다. 자원이 부족하고 바이러스가 빠르게 진화하는 상황에서 나노포어 시퀀싱을 활용하면 병원체 식별과 백신 및 치료를 위한 모니터링에 큰 도움이 된다.102)

출처: BRIC VIEW 2021-T25
[그림 3-84] 생물학적 나노포어의 원리
이외에도 나노포어 기술은 현장형 인플루엔자 바이러스 진단을 위해 연구되고 있다. 인플루엔자 A 바이러스(IAV) 감염 예방을 위해 단일 분자 수준에서 고도로 보존된 IAV RNA 프로모터를 식별하기 위해 단백질 나노포어 기술을 이용하였다. 특정 DNA probe가 IAV RNA 프로모터에 결합함으로써 단일 또는 이중 전류 차단 스파이크의 두 가지 유형의 나노포어 흐름의 특징이 생성되었으며, 체류 시간을 증가시켜 IAV 프로모터와 비특이적 거대 분자와 구별을 용이하게 한다. 또한 α-Hemolysin(αHL)은 정교한 기하학적 구조로 인해 진단 센서 연구에 주로 사용되는데, αHL을 이용한 나노포어 기술을 통해 실시간으로 현장에서 고병원성 바이러스 질병 검출이 가능하며, 맞춤형 DNA probe를 사용하여 다양한 바이러스 변이체에 쉽게 적용할 수 있다.103)

출처: ACS Sensors, 2019, 4, 11, 2849-2853
[그림 3-85] IAV RNA 프로모터에 대한 특이적 DNA probe의 결합
(4) 진단영역에서의 크리스퍼(CRISPR) 유전자 가위
2020년 노벨 화학상을 수상한 크리스퍼(CRISPR, Clustered Regularly Interspaced Short Palindromic Repeats) 유전자 가위는 바이러스로부터 자신을 보호하기 위한 세균의 면역시스템으로부터 발견되었다. 바이러스를 식별하는 유전정보를 저장하여 바이러스 DNA를 잘라 방어하는 메커니즘이다.

출처: Journal of Biomedical Engineering Research 42: 125-142, 2021
[그림 3-86] 크리스퍼(CRISPR) 유전자 가위: 이중 가닥 DNA를 인식하는 리보핵단백질
CRISPR-Cas 시스템은 특정 핵산 서열과 상보적 결합을 이루면 효소적 절단 특성이 나타나고, 시료 내 검출 probe를 절단하여 형광을 발색하는 바이오 센서로 활용된다.104) CRISPR 시스템을 이용한 진단법은 감염자로부터 채취한 검체에서 바이러스를 추출하고 정제 과정을 거친 뒤 혼합하는 것으로 신호를 얻어낼 수 있어 감염병 진단 분야에서 현장용 센서 기술로 충분한 잠재력을 갖춘 기술이다.105)106) 또한, 형광 신호를 활용하는 경우, 단순히 양성 또는 음성의 결과가 아닌 형광 세기를 바탕으로 정량화가 가능하며, 시간에 따른 형광 변화를 분석할 수 있는 휴대 장치를 활용하면 현장에서 100분 이내에 바이러스를 ∼30copy/μL 수준으로 검출할 수 있다.107) 이처럼 CRISPR 시스템은 뛰어난 현장성과 민감도를 가졌지만, 비용, 바이러스 정제 기술, 휴대용 장치 및 전문 인력의 필요성과 같은 개선사항이 여전히 남아있다.

주) CRISPR-Cas13a와 FRET기반 형광probe가 결합된 바이러스 검출 시스템 및 휴대용 형광 측정 장비이용한 SARS-CoV-2 검출 모식도
출처: Cell volume 184, Issue 2, January 2021
[그림 3-87] CRISPR 시스템을 이용한 진단법
바. 감염병 대응을 위한 비약물적 접근
치료제도 약물도 존재하지 않은 신종 감염병인 코로나19가 급속히 전 세계로 확산되던 시점에 각 국가는 감염을 통제하기 위해 비약물적 대응방식(Non Pharmaceutical Intervention, NPI)을 도입했다. 비약물적 대응방식은 손 씻기, 마스크 착용하기, 기침 예절 지키기와 같은 개인위생 강화와 이동제한, 모임 금지, 재택근무, 재택수업과 같은 사회적 거리두기가 해당된다.

출처: European Centre for Disease Prevention and Control
[그림 3-88] 다양한 비약물적 대응 방식들
1980년대 영국의 유명한 역학자인 토마스 매큐언(Thomas Mckeown)이 저서인 ‘질병의 기원‘을 통해 발표한 통계를 보면 홍역, 성홍열, 장티푸스, 결핵과 같은 감염병의 역사에서 사망률이 획기적으로 낮아진 이유는 항생제나 백신의 개발 이전에 상・하수도 시설의 보급과 같은 공중위생의 개선이 있었기 때문이라고 한다. 영국의 의학전문지인 BMJ(British Medical Journal)에서 2007년 실시한 “1840년 이후 의학 역사상 가장 중요한 이정표는 무엇인가?”에 대한 설문에서 1위를 차지한 것도 바로 백신이나 치료제가 아닌 ‘깨끗한 물과 하수처리 시설의 도입’이었다. 그 뒤를 이어 항생제와 마취제가 2위와 3위를 차지했다.108) 코로나19 사태를 맞으며 우리는 이전의 사례에서 경험했던 것처럼 비약물적 대응 방식이 약물적 대응방식만큼이나 위력적으로 감염병을 통제할 수 있음을 체험하게 되었다.
(1) 마스크, 손소독제, 개인위생 강화
많은 연구진들이 비약물적 대응방식의 실효성을 정량화하기 위해 다양한 연구 및 분석을 실시하고 있다. 마스크는 호흡기 질병을 방어하기 위해 가장 손쉽게 사용될 수 있는 비약물적 대응방법 중 하나로 공기 중의 미세먼지와 바이러스 등을 필터를 통해 직접 걸러주는 제품이다. 미국 연구팀에 따르면 마스크를 착용한 사람의 수와 마스크의 성능에 따라 다양한 범위의 감염방지 효과를 보일 수 있음을 모델링을 통해 보여주었다.109)

출처: https://www.pnas.org/doi/10.1073/pnas.2014564118
[그림 3-89] 마스크의 성능과 마스크 착용자 수에 따른 코로나19 확산 방지 시나리오
또한 손소독제 사용과 같은 개인위생의 강화는 코로나19 예방 효과뿐 아니라 인플루엔자와 수족구병, 유행성 각결막염 환자 수의 감소를 가져왔다.110)111)112)
(2) 환기
밀폐된 공간 및 빌딩, 차량 내부 등 사람들이 밀집된 장소를 자주 환기한다면, 코로나19 바이러스나 유해물질들이 공기를 타고 나갈 확률이 높아진다. 환기는 공기의 질을 유지하거나 개선하기 위해 신선한 외부 공기를 실내로 들여오고 실내 공기를 외부로 내보내는 과정이다. 호흡기 질환의 감염 위험은 혼잡하고 환기가 잘 안되는 환경에서 증가한다. 갇힌 공기 중에서 바이러스는 비말과 에어로졸 형태로 사람들 사이에 긴 시간 부유하거나 공간 사이를 이동할 수 있다. 세계보건기구는 코로나19 예방을 위해 차량 안 또는 실내에서 에어컨이나 공기청정기를 사용할 때 적합한 효과적인 환기법을 권장하였다.113)

출처: WHO
[그림 3-90] 세계보건기구에서 권장한 COVID-19 관련 환기 방법들
(3) 사회적 거리두기
적극적인 사회적 거리두기와 개인위생 강화 접촉 추적 및 격리를 시행했던 우리나라는 K-방역이라는 찬사를 받으며 코로나19 전파의 초기대응에 성공했다. K-방역과 사회적 거리두기 실효성에 대한 논란도 있었지만 중국의 NPI 도입 시기가 코로나19 전파에 미치는 영향에 대한 시뮬레이션 연구의 결과에 따르면 연구 당시 실제 308개 도시에서 감염사례가 발생하였으나 3주 일찍 비약물적 대응방식이 개입되었다면 초기 코로나19 영향 지역을 61개 도시로 줄일 수 있었을 것이라는 예측도 있었다.114) 비약물적 대응방식 중 이동제한과 같은 극단적 제한 조치는 사회적 경제적 활동에 제약을 준다는 측면에서 감염병 예방을 위해 단독으로 장기적인 적용은 어려워 신종 감염병 발생 시 초기 대응을 위해 고려될 수 있으나 백신, 치료제 개발이 후행되면 점차 완화되어야 한다.

출처: Lai, S., et al, Effect of non-pharmaceutical interventions to contain COVID-19 in China, Nature 585, 410–413, 2020
[그림 3-91] 비약물적 대응 방식 개입 시점에 따른 코로나19의 영향 예측
사. 전망
코로나19 발생으로 전 세계는 감염병이 초래하는 경제적, 사회적, 보건적 위협을 경험하게 되었다. 기존에는 전쟁이나 테러에 의한 위협이 국가 안보에 영향을 미치는 중대한 사항이었으나 예측 불가능한 신종 감염병의 발생 또한 질병의 초기 통제가 어렵기 때문에 국민의 생명, 경제, 사회, 문화 등 국가 전반에 걸쳐 중대한 위해를 가져오는 국가 위기상황을 초래할 수 있어 안전관리 측면이 아닌 보건안보 측면에서의 접근이 필요하다. 감염병 문제는 어느 한 국가만의 문제가 아니라 인류의 안보와 직결되는 문제이다. 신종 감염병 통제를 위해서는 빠른 진단법, 백신, 치료제 개발을 가능하게 하는 플랫폼 형태의 기술개발과 더불어 이동제한, 격리와 같은 제도적 개입, 손소독, 마스크 착용과 같은 개인위생 강화, 아플 때 외출 자제하기와 같은 감염병에 대한 개인의 인식 변화 등 비약물적 접근이 함께 이루어져야 한다. 또한, 국제 협력을 통한 정보 교류와 개발도상국의 감염병 관리를 위한 노력도 필요할 것이다.
|
|
|
제3장 분야별 연구개발 및 산업 현황 |
|
제3절 농림축산식품 |
1. 농림
가. 서론
(1) 탄소저감을 위한 농림 분야 동향
전 세계적인 지구 온난화, 기후변화에 의한 식량안보 위협은 심각한 식량부족과 농산물 가격 폭등에 대한 우려를 커지게 하고 있으며 더욱이 70% 이상의 곡물을 수입하고 있는 우리나라는 상당히 큰 영향을 받을 가능성이 높다. 기후변화에 의한 강수량 변화, 가뭄, 홍수 등은 농작물의 생산량을 감소시킬 뿐 아니라 지하수 부족 및 토양의 황폐화 등 장기적인 환경문제를 가중시킴으로써 식량과 농업 생산 시스템에 큰 영향을 줄 것으로 예측된다. 또한 탄소농업보고서에 따르면, 농업은 온실가스 배출의 주요 부문 중 하나로 지난 50여 년간 농업, 임업, 기타 토지 사용으로 인한 온실가스 배출량은 거의 두 배가량이 증가하였으며 2050년까지 지속적으로 증가할 것으로 예상된다. 이에 향후 농업 부문의 온실가스 배출량 감축은 필수적으로 이행해야 하는 의무가 되었으며 이를 위한 농업 분야의 대응과 준비가 필요한 시점이다.
탄소농업은 온실가스 저감 농법개발, 저메탄 사료개발, 탄소흡수원인 토양・과수・산림 관련 저감기술, 농축산물의 가공・유통・소비에 따른 탄소저감 등 다양한 농림 분야에 걸쳐있으며 공통적으로 탄소 배출량을 저감하여 제로화하기 위한 범위로 정의한다. 농업 분야의 온실가스 배출원인은 다음 표와 같이 정리할 수 있는데 이중 축산 분야를 제외하고 벼재배, 농경지토양에 사용된 화학비료에 의한 온실가스배출 등이 주요 원인으로 분석되고 있다.
[표 3-41] 농업 분야 온실가스 배출원
|
CRF 코드 |
배출원 |
온실가스 |
주요 내용 |
|
|
4A |
축산 |
장내발효 |
CH4 |
가축의 소화기관 내 발효에 의한 CH4 배출량 |
|
4B |
가축분뇨처리 |
CH4, N2O |
가축 분뇨의 혐기적 분해에 의한 CH4, N2O 배출량 |
|
|
4C |
경종 |
벼재배 |
CH4 |
논에 사용된 유기물의 혐기적 분해에 의한 CH4 배출량 |
|
4D |
농경지토양 |
N2O |
농경지에 사용된 화학비료, 가축 분뇨, 작물 잔사에서 배출되는 N2O 배출량 |
|
|
4F |
작물잔사소각 |
CH4, N2O |
농작물 잔사 소각 과정에서 발생하는 CH4, N2O 배출량 |
|
출처: 온실가스종합정보센터(2020)의 내용을 재구성
국내 온실가스 배출량은 1990년 대비 2018년도 기준으로 약 149%가 증가하였고 전체 배출량 중 농업 분야의 배출은 2.9%를 차지한다고 알려져 있으며, 국내 온실가스의 주요 흡수원인 임업 분야 산림에 의한 온실가스 흡수량은 2000년에 비하여 2018년도에 25.7% 감소하였는데 원인은 국내 산림 면적이 1990년 대비 3.7% 감소하였기 때문으로 산림의 노령화가 주요 원인이라는 견해가 있다. 또한 농업 분야에서의 온실가스 발생에 가장 큰 원인으로 파악된 벼재배 분야는 재배 면적의 지속적인 감소로 인하여 온실가스 배출량도 감소하고 있는 추세이다(탄소농업보고서). 이것은 국내 1인당 양곡 소비량의 감소와 연관이 되며 그중 쌀 소비량은 2000년에 전년 대비 36% 이상 감소한 반면, 육류의 소비는 급격히 증가하고 있는 추세이다.

출처: 2020년도 농림축산식품부 주요 통계
[그림 3-92] 국내 농축산물 1인당 소비량(1970∼2018)
(2) ‘디지털 농업’의 배경과 범위
우리나라를 비롯하여 세계 각국은 2020년 COVID-19의 팬데믹 이후 포스트 코로나 뉴노멀 시대의 개막에 따라 각국의 보호무역주의가 강화되고 농산물 가격 등락, 그에 의한 사회경제적 파급효과 등으로 어느 때보다도 농림산업과 연관된 변화의 물결이 큰 시점이다. 더불어 농림 분야는 세계 인구의 증가로 인한 농산물 소비 증가, 웰빙 문화의 확산에 따른 고품질 농산물에 대한 수요 증가 등 농산물 생산의 효율성과 생산성을 증대하여 안정된 식량안보 확보와 고품질의 안전한 먹거리를 제공하는 고유의 역할을 함과 동시에 기후변화에 대응하고 탄소저감을 위한 노력도 수반해야 하는 임무를 부여받고 있다. 국내적으로는 농경지와 농가의 감소로 인한 식량 자급률의 개선이 어려운 상황에 직면해 있어 안정된 식량안보를 위해서는 농림업의 생산성을 높일 수 있는 기술의 혁신이 요구되고 있다.

출처: 2020년도 농림축산식품부 양곡 자급률 현황
[그림 3-93] 국내 양곡 자급률 변화(1990∼2019)
이러한 배경으로 등장한 ‘디지털 농업’의 개념은 농업 가치사슬 전반에서 식량 공급 시스템을 최적화하여 효율성을 높이고자 하는 농업의 방향성을 대변하고 있으며 ‘스마트팜’이나 ‘정밀농업’과 같은 용어들과 혼용되어 사용되고 있으나 각각의 정의나 범위에 있어서는 차이가 확연히 있다고 볼 수 있다. 그러나 공통적인 점은 식량 시스템의 최적화를 위하여 디지털 기술의 역할을 강조하고 가치사슬 전반에서 데이터 또는 정보를 수집, 저장, 분석, 공유하고자 하는 도구나 활동을 포함하고 있다는 것이다.

출처: 농식품 2030 미래이슈 ① 디지털 농업
[그림 3-94] 디지털 농업의 주요동인
(3) 그린바이오 신산업 육성을 통한 농림업의 부가가치 증대
그린바이오산업은 농생명자원에 생명공학 기술을 적용하여 농업과 전후방산업에 대한 부가가치를 창출하는 신산업으로 정의하며 종자, 미생물비료・농약, 동물용의약품, 곤충소재, 디지털육종 기술 등의 농자재, 고품질・고기능성 농산물, 천연물 기반 화장품 원료, 향미제, 바이오플라스틱 등의 제품이나 결과물을 포함한다.115) 그린바이오산업의 구조는 세계시장에서 식품산업이 약 72%를 차지하고 있고 그 외 농림산업 분야로 바이오사료, 종자・묘목, 바이오 기반 농산물, 기타 분야가 나머지를 차지한다. 국내 시장의 구조는 바이오사료 시장이 약 57%로 가장 크며 식품 시장은 약 18%, 기타 시장 약 25%를 차지하고 있다. 그린바이오산업 육성을 위해서는 농식품산업 전반에 바이오기술 기반의 전환이 필요한 시점이며 생명공학 기술을 적용하여 농생명소재와 농산물의 소재화 및 제품화를 달성해야 하는 목표가 있다. 최근 우리 정부는 ‘그린바이오산업 육성전략’을 발표(2023.2.)하고 그린바이오산업의 주요 분야와 육성전략의 세부 이행계획을 수립하였으며 이를 통하여 농림산물의 소재화, 대량생산체계 구축 등 산업화 지원, 사업화 생태계 조성 등이 이루어질 것으로 기대되고 있다.
(4) 농림 분야의 전환기
농림업은 전통적인 식량 생산을 위한 1차 산업으로서의 역할을 꾸준히 해왔던 분야이지만 최근 다양한 사회적, 경제적 요구에 따라 농업 생산성과 효율성 증대, 고품질 농식품 공급, 고부가가치 농생명소재 발굴 및 생산, 농식품 전반의 가공・유통 디지털 밸류체인의 안정된 구축 등 과학기술을 기반으로 한층 업그레이드되어야 하는 전환기를 지나고 있다. 사회적으로는 농촌인구의 고령화와 급격한 감소에도 불구하고 전 국민의 안정된 먹거리 공급을 위한 가장 기본적인 임무를 소홀히 할 수 없으며 세계적으로 심각한 기후변화에 대응하기 위해 온실가스 저감 의무와 온실가스 흡수의 역할까지도 담당해야 하는 분야이다. 이에 국내 역량을 결집하여 가장 우선순위의 필수적이며 당면한 탄소농업과 디지털 농업 관련 기술개발에 대한 선택과 집중의 투자와 함께 농림산업을 한층 업그레이드된 과학기술 기반 분야로 발돋움할 수 있도록 노력해야 할 것이다. 본 집필에서는 지난 2년간 국내 농림 분야의 탄소농업과 디지털 농업 관련 기술 및 산업 분야 동향과 해외 동향을 파악하고 향후 농림 분야의 발전을 위한 전망을 기술하고자 한다.
나. 해외 동향
(1) 해외 주요국의 기후변화 대응과 탄소중립을 위한 농림 분야 현황
2021년 11월 제26차 유엔기후변화회의(COP26)에서 미국, 한국을 포함한 30여 개국은 기후를 위한 ‘농업혁신임무(AIM for Climate)’를 공식 출범하였으며 지속가능한 농업의 혁신 가속화를 위한 노력으로 ‘기후 스마트 농업 및 식품 시스템 혁신’을 위해 40억 달러를 확보하였다. ‘농업혁신임무’는 농업 생산성을 높이는 동시에 기후변화에 적응하고 회복력을 추구하며 온실가스 배출을 줄이거나 제거하는 것을 목표로 하고 있다.
(가) 미국
미국에서는 CCPO(Climate Change Program Office)가 OEEP(Office of Energy and Environmental Policy) 내에서 운영되어 농무부(USDA) 전역의 농업, 농촌, 임업 관련 기후변화 프로그램과 정책 문제를 조정하고 있으며 미국 정부는 2021년도부터 5년간 10억 달러를 ‘기후 스마트 농업 및 식품 시스템 혁신’에 투자한다는 계획을 발표하였다.
미국 농무부(USDA)는 기후변화에 대응하고 온실가스 감축, 탄소저장 능력 향상, 친환경적 재생에너지 창출 등을 목적으로 세부적인 실행계획들을 발표(USDA, 2016)하였는데, 그 내용은 토양재생력과 생산성을 높이기 위한 토양 체질 강화, 알맞은 영양공급으로 질소 관련 온실가스를 줄이기 위한 질소관리, 민감한 토지보존, 공유림 관리, 방목지관리, 도시 숲 조성 등을 내용으로 하고 있다 한다. 이와 관련하여 ‘농업혁신 아젠다(Agricultural Innovation Agenda, AIA)’를 발표(USDA, 2020), 주요 내용은 농업의 환경 발자국을 2050년까지 절반으로 줄이는 동시에 농업 생산량은 40% 늘리며 적극적인 산림관리 및 복원에 투자하여 경관 복원력을 구축하며 식량 손실 및 폐기물의 50% 저감 등을 담고 있다. 또한 2021년 1월 바이든 대통령은 국내외 기후 위기에 대처하는 행정명령에 서명하였고 농업과 임업 분야에서의 기후변화 완화 및 회복력을 위한 전략 수립을 지시하였다(USDA, 2021).
(나) EU
유럽의 기후변화 적응정책은 정책 틀, 프로그램, 적응수단으로 구성되어있으며 목표와 내용들이 현실에서 적용되고 이행될 수 있도록 지원하는 체계를 구축하고 있다.
EU의 농업 부문 기후변화 적응 주요 정책 틀로는 ‘기후변화 적응전략(The EU Strategy on adaptation to climate change)’과 ‘공동농업정책(Common Agricultural Policy, CPA)’을 들 수 있고 2021년 EU집행위원회는 기후변화적응 관련 새로운 ‘EU적응전략’을 채택하였다.
최근 유럽의회는 새로운 CAP 개혁에 동의하였으며 농업, 농촌의 사회, 환경, 경제적 지속가능성에 대한 공통 목표와 연결하여 2023∼2027년간의 CAP 주요 목표를 재설정하였다(European Commission, 2021).

출처: ECA, 2021
[그림 3-95] 2020년 발행된 기후변화 및 농업에 관한 EU 전략, 제안 및 협정
(다) 일본
일본은 기후정상회담(2021)에서 2050년 탄소중립의 목표로 2030년 온실가스를 2013년 대비 46% 저감을 선언함과 동시에 50% 저감까지 도전한다고 발표하였다(농림수산성, 2021a).
일본 정부는 최근 ‘농림수산성 지구 온난화 대책 계획(2021)’, ‘농림수산성 기후변동 적응계획(2021)’을 최종 개정, 공표하였는데 내용은 바이오매스 활용, 재생에너지 도입, 삼림, 농지, 해양 등 흡수원 보전 등이며 농업 분야의 주요 대책 등을 담고 있다. 또한 기후변동 적응계획에는 기후변화 영향에 의한 농업, 산림임업 분야의 대응을 정확하고 효과적으로 실시하기 위한 계획 등을 포함하고 있다(농림수산성, 2021b).
(2) 해외 주요국의 스마트・디지털 농업 정책 현황 및 글로벌 산업 동향
(가) 해외 주요국의 디지털 농업 정책
① 미국 농무부(USDA)
미국 농무부(USDA)는 산하 농업연구청(ARS), 국립식량농업원(NIFA)을 중심으로 농업정책을 수립, 실행하고 있는데 최근 아젠다와 혁신전략에서 디지털 농업의 중요성을 강조하고 있다. 2020년부터 2025년까지의 농업과학기술 로드맵을 발표하였으며 이 로드맵에는 지속가능한 농업강화, 농업기후적응, 식품과 영양전환, 고부가가치 혁신, 농업과학기술 정책 등으로 구성되어있으며 특히 정밀농업기술의 활용, 데이터 수집 활동의 개선, 자동화와 딥러닝 등 최신 기술을 강조하고 있다.
농무부의 농업혁신어젠다(AIA)의 첫 번째 실행계획으로 마련된 관련 보고서(2021년 발표)에 따르면, 농업생산성과 환경에 큰 영향을 미칠 것으로 예상되는 4대 혁신 분야로 유전체디자인, 데이터과학 기반 농식품 시스템관리, 디지털과 자동화, 시스템 기반 농장관리 등을 지목하였다.
② 유럽연합(EU)
유럽연합(EU)은 2016년 이후 농업, 농촌 사회가 직면한 문제 해결을 위해 농업 분야에서의 디지털 기술 활용이 중요하다고 강조해 왔다. EU의 농업 분야 재정지원은 연구개발 재정지원 프로그램인 ‘Horizon Europe’을 통하여 이루어지고 있는데 2021년부터 2027년까지 운영되며 디지털 농업 주요 프로그램은 Sweeper(피망 수확 로봇개발), 4D4F(데이터 기반 낙농업 의사결정 시스템개발), IoF2020(농식품 IoT기술개발), Flourish(농업 생산성 향상, 지속가능성 확보 로봇개발) 등이 있다.
③ 일본
일본 정부는 스마트농업에 대한 정책 패키지를 2019년 10월에 수립하고 2021년 2월에 개정하였는데 이 패키지는 스마트농업의 실증・분석・보급, 새로운 농업지원서비스의 육성・보급, 농업데이터 활용 촉진, 스마트농업 교육의 충실 등의 구체적인 내용을 포함하고 있다.
(나) 세계 디지털 농업 시장 및 투자 규모
스마트농업 세계 시장은 2020년 137억 달러에서 2025년 220억 달러로 연평균 9.8% 성장할 것으로 전망되고 있다(유거송・여창민, 2021). 시설농업 시장은 연평균 9.2%, 노지농업 시장은 연평균 12.7% 증가할 것으로 예상되며 노지농업 시장은 자율주행 트랙터와 농업용 드론 시장이 각 연평균 24%, 35.9% 성장하며 스마트농업의 큰 축을 이룰 것으로 보인다.
2020년 농업기술 스타트업에 대한 글로벌 투자액은 50억 달러로 2019년 대비 두 배 수준으로 증가하였으며 총 투자액 중 정밀농업 6%, 항공 모니터링 6%, 센서와 스마트팜 장비 8%, 유통 및 금융 9%, 시설농업 24% 등 디지털 농업 관련 분야가 53%를 차지하였다(Finistere Ventures, 2021).

출처: Finistere Ventures. 2020 Agrifood Tech Investment Review. 2021
[그림 3-96] 2020년 농업 기술 스타트업에 대한 섹터별 글로벌 투자 비율
(다) 해외 주요국의 디지털 농업 기술 적용 현황
① 미국
미국은 디지털 농업을 선도하고 있는 국가로 적합한 대규모 농경지와 첨단기술을 바탕으로 디지털 농업 기술을 적극 적용하고 있으며 농업용 드론과 위성 기술에서는 선도적 위치를 차지하고 있다(김수경 등, 2019). 디지털 농업은 대규모 농경지일수록 적용 가능성이 커지는데 미국의 옥수수 농장의 사례를 보면 매핑 기술, 주행유도 기술, 변량투입 기술 등이 적용되어 대규모 농장에서 디지털 농업 기술이 적극 활용되고 있는 것으로 나타나고 있다. 미국에서 정밀농업 기술 중 가장 많이 적용되고 있는 기술은 농기계 주행유도 기술로서 옥수수, 땅콩, 쌀, 대두 면적의 45∼65%에 주행 유도기술이 적용되고 있고 디지털 농업 기술의 적용비율은 계속 증가하고 있는 추세다(Hellerstein, 2019).

출처: Hellerstein, D., Vilorio, D., & Ribaudo, M., Agricultural Resources and Environmental Indicators, USDA, 2019
[그림 3-97] 미국의 주행 유도 기술 적용 현황(2001~2016)
② 유럽
유럽의 경우 디지털 농업이나 정밀농업 기술이 적용된 현황을 전체에 걸쳐 거시적이며 체계적으로 파악한 연구나 통계자료는 찾아보기 힘든 상황이나 2020년 연구 자료들을 정리한 결과를 보면 유럽에서 정밀농업 기술을 선도하고 있는 나라는 독일, 프랑스, 영국이라고 한다. 특히 독일은 농가의 30%가 정밀농업 기술을 활용하고 있으며 영국은 스코틀랜드 지역에서 83%, 아일랜드 지역에서 63% 농가가 정밀농업을 적용하고 있다고 분석되었다.
③ 일본
일본에서는 디지털 농업 또는 정밀농업 기술이 적용된 전반적인 현황을 조사한 자료가 거의 없는데, 다만 일본 농림수산성의 농업용 드론 보급 계획에 따르면 드론에 의한 농약살포 면적을 100만 ha로 확대하는 것을 목표로 설정하고 있다. 2020년 정부 자료에 의하면 농약 살포용 드론 판매 대수가 2018년 약 1,400대에서 2019년 2,100대로 증가한 것으로 조사되었다(농림수산성, 2020a).
일본 정부는 2019년부터 스마트농업 실증프로젝트를 실시하고 있으며 2021년 4월 기준으로 179개 지구에서 프로젝트를 실시 중으로 발표되었다(농림수산성, 2021). 자료에 따르면 드론에 의한 농약살포가 관행방제 대비 작업시간이 평균 81% 감소하였고 자동물관리 시스템 도입으로 작업시간이 평균 87% 감소하였으며 인공지능과 자동 조향기능 등을 활용하여 양배추 수확기에 작업시간이 20% 감소된 것으로 조사되었다(농림수산성, 2021b).
[표 3-42] 스마트 농업에 의한 노동시간의 변화율
|
논농사 |
밭농사 |
노지야채 |
시설원예 |
과수 |
지역작물 |
|||
|
대규모 |
중산간 |
수출 |
밀 |
양배추 |
수박 |
피망 |
귤 |
차 |
|
△13% |
△12% |
△4% |
△1% |
△20% |
△41% |
+7% |
△20% |
△16% |
출처: 農林水産省, スマート農業の展開について, 2021c
(3) 해외 그린바이오산업 동향
글로벌 그린바이오 시장은 연평균 6.7% 성장세를 보이며 2020년 약 1조 2,000억 달러 규모로 바이오사료 분야와 식품・식품첨가물 시장이 큰 비중을 차지하고 있다(Orion Market Research, 2021).
(가) 미국
미국은 생명공학 기반, 디지털기술의 융합에 의한 제품, 서비스 개발과 바이오 제품의 대량생산을 위한 바이오 파운드리 구축 등을 지원하여 바이오 제품 우선구매와 바이오경제 가치를 측정하기 위한 통계 데이터를 축적하고 있다. 또한 유용 마이크로바이옴 제품 개발, 디지털 육종 활용 기능성 종자개발 등 연구개발의 투자를 확대하는 추세이다(Engineering Biology Research Consortium, EBRC, 2019∼2022).
(나) 유럽연합(EU)
유럽연합(EU)은 바이오 기반 자원・에너지 순환, 탄소저감, 생태보전을 강조하는 정책기조를 지속하고 있으며 농식품자원의 타 분야 활용을 통한 순환경제 활성화를 위한 바이오 기반기술과 제품 개발에 투자를 확대하고 있다. Horizon Europe(2021∼2027) 프로그램을 통하여 약 10%의 예산을 ‘식품・바이오・자연자원・농업・환경’에 투자할 계획이다.
(다) 일본
일본은 바이오 기반 제품・서비스 개발 등 바이오기술 관련 규제를 일부 완화하고 있고 농업 관련 지속가능한 생산시스템의 개발과 실증을 위한 민관 공동 거점을 육성 중이며 농림 분야 인력 양성, 바이오소재 수요 확대를 위한 환경부하 저감 바이오 유래 제품 표시제 등을 검토 중이다.
다. 국내 현황
(1) 기후변화 대응과 탄소중립 실현을 위한 농림기술 연구개발 현황
우리나라는 ‘2050 Net-Zero 선언’을 기점으로 탄소중립이 국가적 과제로 부상하였으며 농업 분야에서도 2050 탄소중립을 위해 농축산 부분 온실가스 배출원별 감축 기술개발 및 기술의 현장 실용화를 위해 노력하고 있다. 이를 위해 ‘기후변화 완화 및 저탄소 농업기술 개발을 위한 중장기 연구개발 계획’을 발표하였다(농진청, 2020).
[표 3-43] 국내 기후변화 완화 및 저탄소 농업기술 연구개발 추진 계획
|
신기후체제 대응 농축산 부문 온실가스 계측 및 관리기술 개발 |
|
• 논에서 질소투입에 따른 아산화질소 배출량 평가 • 밭에서 아산화질소 배출 관련 인자 변화에 따른 배출량 조사 • 가축의 장내 발효 온실가스 배출계수 개발 및 산정 고도화 - 한우, 젖소, 돼지, 염소의 연령 및 성장단계별 메탄 배출량 측정법 확립 • 신규 IPCC 가이드라인 적용 기계 종류별(건조기, 트랙터) 배출계수 개발 • 재배부문 2030 온실가스 감축 로드맵 이행 평가 : 기술 적용성, 감축 잠재량 |
|
농축산 부문 탄소 흡수량 평가 및 온실가스 감축기술 현장 실용화 |
|
• 영농관리(유기물 투입, 경운, 작부체계)에 따른 토양 탄소 변화량 조사분석 • 국내 토양 층위별 탄소 함량 예측을 위한 적정 모델 평가 - 국제 적용 모델(Cubist, Fuzzy 등)의 국내 적용성 평가 및 환경요인 적용 • 영년생 혼파초지의 이용 형태별 토양 탄소 흡수량 정량화 방법 개발 • 유기농업 형태에 따른 토양 탄소 격리 및 온실가스 저감 효과 분석 - 농지 형태(전답)・재배작물별 토양 탄소 축적 및 온실가스 발생량 평가 • 반추가축 메탄 배출 저감을 위한 장내 발효 조절 기술 개발 - 한우 사료 내 첨가 급여 시 저감 제원별 메탄 저감 효과 구명 및 선발 • 저탄소 농축산물 인증제 기술요소 등록 및 전과정평가(LCI) 목록 구축 - 축산분야 LCI DB 구축을 위한 방법론 개발, 농자재 LCI 목록 구축 |
|
신재생에너지의 농업적 생산 활용 및 에너지 효율화 기술 개발 |
|
• 신재생에너지 이용 복합열원 자원조사 및 히트펌프 냉난방 시스템 설계 - 농업시설(온실, 축사, 버섯사 포함)의 유형(작목, 축종 등)별 환경관리 현황 분석 • 농업 기계의 에너지 효율화를 통한 온실가스 감축 기술 개발 - 자동변속 농업용 트랙터 에너지 사용량 및 온실가스 배출량 비교 분석 • 에너지 저감형 다요인 복합시스템 적용 시설 환경 제어 시스템 개발 - 국내 시설원예 정수 시스템 현황 조사 및 생육단계별 양액 급배액량 산정 |
출처: 농식품 2030 미래 이슈 ② 탄소농업
산림청은 관련 연구 분야의 예산을 2020년 1,289억 원에서 2021년 1,493억 원으로 편성하여 연구개발 투자를 확대하고 있는 추세이며, 2021년도 투자 분야에는 4차 산업혁명 기술과 산림임업 접목, 스마트 헬스케어 기술개발, 산림재해예방 대응 기술개발, 산림바이오매스 활용사업 등이 포함되어 있다.
국내외 탄소농업 분야 관련 논문 1만 1,000건 이상을 분석한 결과 가장 많이 출현한 키워드는 바이오매스, 토지활용, 지속가능 등의 단어들이었으며 최근 다루어진 연구주제는 바이오연료, 바이오에너지, 토양비료, 탄소흡수저장, 기후환경 등의 주제로 토양미생물, 유기질토양, 미생물 다양성, 마이크로바이옴, 탄소발자국, 탄소제거, 혼농임업 등이 관련 내용으로 분석되었다.
(2) 국내 디지털 농업 기술 적용 현황
(가) 스마트팜, 노지 농업, 시설 농업 분야
우리나라의 스마트팜 기술 수준은 유럽 대비 70% 수준으로 약 4년의 기술격차가 있는 것으로 평가되고 있다(한국과학기술평가원, 2020). 국내 노지 농업 분야는 협소한 면적, 다품종, 영세농 중심의 구조로 디지털 농업 기술개발과 적용이 느리게 진행되고 있는 편이다. 시설농업 분야에서도 핵심부품과 장비는 수입에 의존하고 있는 현실이며 디지털 농업 실현을 위한 데이터의 표준화와 데이터 축적이 체계적으로 구축되고 있지 않은 것이 현실이다(유거송・여창민, 2021).
국내에서는 정부 주도로 개발된 스마트팜 기술이 시설원예 위주로 보급되고 있으며 농식품부는 ICT 융복합사업 등 보조금 지급을 통해 보급하고 있다. 정부지원에 의한 스마트팜 보급은 2020년 5,948ha로 확대되었고 전국 4곳에 스마트팜 혁신밸리를 조성 중이다(농림축산식품부, 2021).
노지농업 분야에서는 디지털기술 도입 초기 단계로 국내 산업계는 형성되기 전이며 국내 농기계 기업을 중심으로 농기계 공급이 주요 관련 현황이며 자율주행과 자동작업 등 디지털 노지농업 관련 기계와 설비는 대부분 연구 단계에 머무르고 있다.
(나) 국내 농업기술 기업 투자
국내 농업기술 스타트업이나 어그테크(Agtech) 관련 기업에 대한 투자는 사모펀드 운용사를 중심으로 이루어지고 있으며 국내 투자자들은 내수 시장에 기반을 두면서 해외 진출을 통한 성장 여력을 갖춘 국내 농업법인을 주요 투자처로 물색 중이라고 알려져 있다(김수경 등, 2020).
[표 3-44] 국내 농업・어그테크 관련 주요 투자 현황
|
투자자 |
투자 대상 |
시기 |
내용 |
|
카카오인베스트먼트 |
만나CEA |
2015 |
카카오 산하의 투자전문회사 카카오인베스트먼트(구케이벤처그룹)는 아쿠아포닉스 농법을 활용한 스마트팜 솔루션과 제어 시스템을 공급하는 만나CEA에 100억 원(지분약33%)을 투자 |
|
IMM인베스트먼트 국순당 |
팜에이트 |
2014 2015 2016 |
IMM인베스트먼트는 2014년 농업펀드를 조성해 특수채소를 재배하는 팜에이트에 투자. 팜에이트는 수직농법의 식물공장 시스템으로 잎채소를 생산. 국순당 또한 팜에이트 지분의 37%를 인수 |
|
LG화학 |
동부팜한농 |
2016 |
LG화학은 작물보호제・비료제조, 종자개발・공급 관련 높은 기술력과 시장 점유율을 갖춘 동부팜한농을 인수 |
|
앵커에쿼티파트너스 |
대흥농산 |
2016 2017 |
앵커에쿼티파트너스는 2016년 대흥농산 지분을 77.8% 매입 후, 2017년 대흥농산 지분 전량을 매입 |
|
DSC인베스트먼트 |
만나CEA |
2015 2017 |
만나CEA에 2015년(10억 원), 2017년(보통주 80억 원) 두 차례에 걸쳐 90억 원을 투자, 총 7.36%의 지분 보유 |
|
DSC인베스트먼트 DS자산운용 |
더파머스 |
2015 |
2014년 12월 농산물 도소매업, 이커머스(E-commerce) 사업을 영위하는 스타트업으로 설립됨. 온라인 식품 플랫폼 마켓컬리를 운영 중인 더파머스가 창업했을 당시, 50억 원을 투자 |
|
마이다스에셋자산운용 AJ캐피탈파트너스 |
그린플러스 |
2016 |
AJ캐피탈파트너스 및 마이다스에셋자산운용은 그린플러스 투자를 위해 62억 원 규모의 프로젝트 펀드 마이다스AJ신기술사업투자조합을 결성. 그린플러스는 첨단 유리온실의 설계・시공 및 식물공장 시스템 설치 관련 사업을 영위 |
|
유큐아이파트너스 외 |
엔씽 |
2018 |
유큐아이파트너스 및 티비티 등 벤처캐피털은 사물인터넷을 활용한 컨테이너 형태의 모듈형 스마트팜 솔루션 제조 업체에 25.5억 원을 투자. 엔씽은 스마트팜 단지 구축에 대부분 자금을 활용하며 향후 재배 농작물 수출을 위한 기반을 마련 |
|
KDB산업은행 |
엔씽 |
2018 |
KDB산업은행은 엔씽에 20억 원을 투자. 엔씽은 중국엠파워인베스트먼트로부터 받은 50만 달러, KDB산업은행의 투자금을 기반으로 모듈형 수경재배키트(Kit) 플랜티스퀘어를 개발 |
|
스톤브릿지벤처스 외 |
더플랜잇 |
2019 |
순식물성 대체 식품 관련 플랫폼 및 제품 개발 업체 더플랜잇은 스톤브릿지벤처스, 롯데엑셀러레이터, 퓨처플레이-KDB캐피탈로부터 15억 원의 투자 유치 |
출처: 김수경 등, 2020
(3) 국내 그린바이오산업 동향
정부는 관계부처 합동으로 ‘그린바이오 융합형 신산업 육성방안’(2020.9.)을 마련하고 산업기반조성, 기업지원 생태계 조성 및 5대 분야로 마이크로바이옴, 대체식품・메디푸드, 신육종, 동물용의약품, 기타생명소재(곤충 등)를 선정하여 육성한다는 전략을 수립하였다. 2024년 2,027억 원 규모로 그린바이오 분야 연구개발 투자를 확대한다는 계획을 수립(제3차 농림식품과학기술육성종합계획, 2020∼2024)하고 이행 중이다. 5대 분야의 기술로드맵 수립을 추진하고 있는데 예타 규모의 연구개발 사업의 추진은 미흡한 것으로 진단되었으며, 디지털 육종, 대체식품, 합성생물학 분야 등 혁신기술 분야에서는 기술격차가 커질 가능성이 제기되어 우려되는 상황이다. 산업의 기반이 되는 농생명자원 수집, 농생명 데이터 축적 및 활용에 있어서는 농촌진흥청 산하의 농업생명공학정보센터(NABIC), 생명자원정보시스템(BRIS) 등 빅데이터 플랫폼을 구축하여 운영 중이다. 그 외 그린바이오 지원기관인 ‘발효미생물산업지원센터’를 통한 종균 보급, 시설 장비 보급으로 대량생산 시스템 구축을 지원하고 있으나 여전히 산업을 뒷받침하기에는 필요한 융합인력의 공급이나 산업화 시설이 부족한 것으로 조사되었다(농림축산식품부, 2023).
농림축산식품부가 발표(2023.2.)한 ‘그린바이오산업 육성전략’에 따르면 국내 그린바이오 시장은 약 5조 4,000억 원 규모로 세계시장의 0.3% 수준에 머무르고 있다. 국내 시장에서 가장 큰 비중을 차지하는 것은 바이오사료(56.5%) 분야이며 수출품목으로는 사료첨가제가 67.8%로 가장 큰 비중을 차지하고 있다. 새롭게 떠오르는 식물성대체육(197억 원, 0.3%), 곤충식품(414억 원, 0.8%) 분야는 비중은 낮으나 관심도는 높아서 관련 기술개발에 대한 투자 또한 활성화되고 있는 추세이다. 대기업인 CJ는 친환경 발효공법을 이용한 천연조미소재(식품첨가제)나 사료용 아미노산(사료첨가제) 등에 투자하고 있으며 LG 팜한농은 생명공학기술을 활용한 천연작물보호제, 종자, 비료 개발에 중점 투자하고 있는 추세이다.
라. 발전 과제
국내외적으로 농림 분야는 날로 심각해지고 있는 기후변화에 대응하고 적응하며 탄소중립 선언에 따른 온실가스 감축 목표를 달성하기 위한 기술개발에 노력 중이다. 또한 ICT 기술을 도입, 융합하여 데이터 기반의 디지털 농업 실현을 위한 실천 등으로 일대 전환기를 맞이하고 있다고 해도 과언이 아니다. 이러한 변화의 물결 속에서 반드시 기억해야 할 점은 농림산업의 발전은 항상 생명공학 기술을 기반으로 하는, 과학적으로 증명된 사실을 바탕으로 만들어 낸 결과물 또는 제품들이 국내외에서 경쟁력을 확보할 수 있다는 사실이다. 따라서 농림 분야 경쟁력 확보에 가장 중요한 연구개발, 기술개발에 대한 투자는 지속적으로 이루어져야 하며 육성하고자 하는 산업 분야와 연관된 기술개발의 수준을 끌어올릴 수 있도록 기획되어 중장기적 관점에서 지원해야 할 것이다. 최근 농림축산식품부의 R&D 사업 예산 규모가 축소되고 있고 생명공학 기술 기반의 사업이 축소되어 그린바이오산업 육성의 근간이 되는 분야에 대한 투자가 축소된 것은 매우 우려되는 상황이다. 이에 농림 분야 전문가들과 정책입안자들이 힘을 모아 그린바이오산업 육성을 위한 5대 분야 기술개발을 위한 예비타당성조사 대상 규모의 대형 R&D 사업을 기획하고 농생명자원을 활용한 기술개발사업에 대한 예산 확보에 관심을 기울이는 노력이 필요할 것으로 생각된다.
|
참고자료 |
∙ 김수경, 이효정, 김주희, 스마트 농업, 다시 그리는 농업의 가치사슬, 2019, 삼정KPMG, Issue Monitor, 119
∙ 김수경, 이효정, 김주희, 스마트 농업과 변화하는 비즈니스 생태계, 2020, 삼정KPMG, Issue Monitor, 125
∙ 농림식품기술기획평가원, 농식품 2030 미래 이슈 ① 디지털 농업, 2022
∙ 농림식품기술기획평가원. 농식품 2030 미래 이슈 ② 탄소 농업, 2022
∙ 농림축산식품부, 2020년도 농림축산식품 주요통계, 2020a
∙ 농림축산식품부, 양곡자급률 현황(2020.1.), 2020b, 접속일: 2021-06-10, https://www.mafra.go.kr/bbs/mafra/131/322523/artclView.do.
∙ 농림축산식품부, 2021년 농림축산식품부 주요업무 추진계획, 2021
∙ 농림축산식품부, 그린바이오산업 육성 전략, 2023
∙ 농촌진흥청, 제7차 농업과학기술 중장기 연구개발 계획 2020년도 시행계획(안), 2020
∙ 온실가스종합정보센터, 2020 국가 온실가스 인벤토리 보고서, 2020
∙ 유거송・여창민, 스마트농업. KISTEP 기술동향브리프 2021–03호. 한국과학기술기획평가원, 2021
∙ 한국과학기술기획평가원, 2020년 기술수준평가: 농림수산・식품, 2020
∙ ECA, Common Agricultural Policy and climate: Half of Eu climate spending but farm emissions are not decreasing. https://www.eca.europa.eu/Lists/ECADocuments/SR21_16/SR_CAP-and-Climate_EN.pdf, 2021
∙ Engineering Biology Research Consortium, EBRC, 2019∼2022
∙ Finistere Ventures, 2020 Agrifood Tech Investment Review, 2021
∙ Hellerstein, D., Vilorio, D., & Ribaudo, M. (2019). Agricultural Resources and Environmental Indicators, 2019, USDA
∙ Orion Market Research, 2021
∙ USDA, USDA’s Building Blocks for Climate Smart Agriculture & Forestry, 2016
∙ USDA, USDA Agriculture Innovation Agenda, 2020
∙ USDA, Climate-Smart Agriculture and Forestry Strategy: 90-Day Progress Report, 2021a
∙ 農林水産省, 農業分野におけるドローンの活用状況, 2020
∙ 農林水産省, 地球地球温暖化対策計画. 접속일: 2021-12-22, https://www.maff.go.jp/j/kanbo/kankyo/seisaku/climate/taisaku/attach/pdf/top-17.pdf, 2021a
∙ 農林水産省, 農業分野における気候変動・地球温暖化対策について. 접속일: 2021-12-22. https://www.maff.go.jp/j/seisan/kankyo/ondanka/attach/pdf/index-72.pdf, 2021b
∙ 農林水産省, スマート農業の展開について, 2021c
2. 축산
가. 축산연구의 개요
2022년 미국 농무부의 축산 분야 농업 전망은 사료생산과 분뇨처리 분야에서 메탄 저감 등 환경발자국을 줄이려는 노력과 더불어, 항생제의 적정한 사용 등을 통해 축산 분야에서 동물 건강과 복지를 증진하려는 노력을 강조하였다. 2022년 3월 미국 식품의약국(FDA) 산하 수의학센터(Center for Veterinary Medicine)는 미네소타 소재 생명공학 회사인 리콤비네틱스(Recombinetics) 사가 3세대 유전자 편집 기술인 CRISPR/Cas9(Cluster Regularly Interspaced Short Palindromic Repeats/CRISPR-associated protein 9) 기술로 개발한 유전자 편집 육우(PRLR-SLICK 소)를 식용으로 판매할 수 있도록 허용한다고 발표했다. PRLR-SLICK 소는 매끄러운 털을 가지고 있어 잠재적으로 더운 기후에 잘 적응할 수 있을 것으로 보인다.
앞서 2020년 12월 FDA는 이종이식용으로 리비비코(Rivivicor) 사가 개발한 유전자 편집 형질전환돼지(GalSafe, 갈세이프)의 식용 및 의료용 사용을 동시에 승인하였다. 갈세이프는 세포 표면에 존재하는 면역거부반응을 일으키는 세포 표면의 알파갈(alpha-Gal) 항원이 제거된 돼지로, 적색육 알레르기 환자의 식품으로 사용이 제한적으로 허용된 바 있다. 갈세이프(GalSafe) 돼지는 원래 이종이식 소재 원료 동물로 개발되었고 이종이식 연구에 활용되고 있는데 식품의 영역으로 그 활용 범위가 확대되었으며, PRLR-SLICK 소 또한 식용으로 영역이 확대된 사례로 볼 수 있다.
현재까지 FDA가 식용 또는 의료용으로 승인한 유전자변형 가축은 연어(2015)116)를 포함, 염소(Atryn, 2009), 닭(Kanuma, 2015), 토끼(Ruconest, 2014; Sevenfact, 2020), 돼지(Galsafe, 2020)에 이어 소(PRLR-SLICK, 2022)까지 모두 6종으로 늘어났다. 앞서 벡터 일부 및 항생제 저항성 유전자의 존재로 인해 FDA 승인과정에서 거부되었던 리콤비네틱스(Recombinetics) 사의 뿔 없는 홀스타인 젖소(TALEN 기술, 2015)는 CRISPR 기술을 적용한 신규 개발을 추진 중인 것으로 알려져 있다. 이는 자연적으로 발생하는 돌연변이 개체와 외래유전자가 남아있지 않은 유전자 편집 가축이 크게 다르지 않다고 판단하는 미국의 기조로 볼 때, 식품용 유전자변형 가축의 대량 생산을 준비하고 있다는 사실을 엿볼 수 있다.
점점 심각해지는 지구온난화 우려로 탄소중립 노력과 세계화와 발맞추어 급속히 확산하고 있는 가축 질병에 대한 대응, 동물권에 대한 인식변화로 인한 육류 소비 패턴의 전환 요구 등 다양한 이유로 가축의 경제형질 개선 및 질병 저항성 향상, 인간의 질환 연구 등을 위한 축산 분야 생명공학 기술의 개발과 적용이 요구되고 있다.
나. 해외 동향
(1) 경제형질 개선을 위한 유전자변형 가축 개발
가축의 유전적 개량은 오랫동안 자연적 변이에 의존한 선택적 번식과 육종에 의존하였고 대부분의 상업적인 품종들이 이렇게 만들어졌다. 하지만 근래에는 외부의 특정 유전변이 또는 형질을 도입하기 위해 유전자 편집 기술이 활용되고 있으며 지난 10년간 다양한 유전자변형 가축 생산이 가속되었다. 특히 3세대 유전자가위 기술로도 불리는 CRISPR 기술은 주로 미세주입을 통해 Cas9/gRNA 복합체를 배아에 전달함으로써 부위별 돌연변이를 지닌 유전자 편집 동물을 생산하는 데 가장 많이 사용되고 있다. 여러 경제형질 중 생산성 향상을 위해서는 육질 및 근육량 관련 유전자(MSTN, FBXO40, fat-1 등), 유당 생성에 관여하는 유전자(BLG, LacS 등), 번식능력 관련 유전자(SOCS2, BMPR1B, GDF9, DAZL, SRY 등)를 변형시킨 형질전환 가축이 다수 개발되었으며, 해당 유전자의 기능이 검증되어 유전자변형을 통한 우수한 경제형질 보급 가능성이 열리고 있다.
최근에는 번식 기술의 개발과 연계하여 동물 복지와 관련하여 희생되는 개체 수를 줄이기 위한 노력의 하나로 성 결정과 관련된 유전자의 편집이 늘어나고 있다. 2022년 영국의 로슬린연구소에서는 DAZL 유전자 좌위에 CRISPR/Cas9 기술로 iCaspase 유전자를 도입하여 조건부 불임 수컷과 암컷 대리 숙주 닭을 개발하였다. 이를 통해 원하는 유전자가 편집된 계통이나 희귀계통의 닭 라인을 빠르게 만들 수 있는 방법이 마련되었으며, 상업용과 연구용 닭 계통의 유전적 다양성을 보존할 수 있는 능력이 향상되었다. 또한 가축에서 성별의 결정은 경제적으로 여러 가지 문제를 일으킬 수 있는데 이를 조절하는 연구도 활발히 진행되고 있다. 2021년에는 중국농업대학 연구진이 소 Y 염색체에 있는 Sry 유전자의 성 결정 기능을 확인하기 위해 TALEN 기술을 활용하여 Sry 유전자에 넉인(Knock-in, KI)과 체세포 핵이식을 통해 성전환 소를 개발하였다. 개발된 소는 난소를 가진 불임 개체로서 Sry 유전자가 소에서 중요한 성 결정 인자임을 확인하였다.
(2) 질병 저항성 향상을 위한 유전자변형 가축 개발
유전자 편집 기술로 인해 동시에 다양한 유전자의 발현을 제어하는 것이 좀 더 수월해졌고, 이는 치명적인 질병에 대한 저항력이 있는 가축의 개발에도 활용되고 있다. 특정 질병, 특히 바이러스에 대한 저항성을 갖도록 유전자를 편집하는 시도도 이어지고 있다.
2022년 미국에서는 돼지의 수포성 질병의 원인이 되는 senecavirus A(SVA)의 수용체인 ANTXR1의 넉아웃(Knock-out, KO) 돼지를 개발하였다. 특발성 수포병(idiopathic vescular disease, IVD)으로 불리는 해당 질병은 미국 양돈장에서 성장기 비육돈은 43%, 모돈에서 76%의 유병률을 보이고 신생자돈의 폐사율 증가와도 관련이 있다고 보고되었는데, ANTXR1 넉아웃 돼지가 SVA 감염에 저항성을 보인다는 사실을 밝혔다.
최근 전 세계적으로 돼지 생산을 위협하는 치명적 출혈성 질병인 아프리카돼지열병(African Swine Fever, ASF)에 대한 내성 부여를 위한 시도도 이루어지고 있다. 2020년에는 McCleary 등이 ASF 감염 시 면역반응 조절에 중요한 역할을 하는 NF-KB 전사인자의 하위단위인 RELA 단백질의 아미노산 서열을 내성을 가진 흑멧돼지의 것으로 대체한 돼지에서 발병이 지연된다고 보고하였다.
2020년 중국에서는 CD163과 porcine Aminopeptidase N(pAPN) 유전자를 동시에 넉아웃 한 CD163/pAPN 더블 넉아웃(double KO) 돼지를 개발하였는데, CD163의 넉아웃은 PRRS 바이러스에 대한 저항성을 유도한다는 점은 널리 인정되는 추세이며, CD163 전체 또는 일부 엑손의 결실을 통한 CD163 넉아웃 돼지의 상업화를 위한 연구와 논의가 현재까지 활발하게 진행되고 있다.
(3) 이종이식용 및 질환모델 가축 개발
돼지는 유전학적, 해부학적 구조 및 생리학적 측면에서 인간과 매우 유사하므로 이종이식을 위한 원료 동물로서 제일 나은 선택으로 여겨지고 있다. 다만 인간과 돼지 간의 계통발생학적 거리로 인한 면역체계 문제를 해결하기 위해 여러 가지 유전자를 넉아웃(KO)하거나 넉인(KI)하여 다중유전자 제어 형질전환 돼지를 개발하려는 시도가 이루어지고 있다. 최근에는 초급성 면역거부반응의 원인이 되는 알파갈(αGal)의 넉아웃(GGTA1 KO, GTKO)에 더해 CMAH, B4GALNT2, 또는 A3GALT2 유전자의 3중 넉아웃(triple KO)을 기반으로 다양한 유전자의 넉아웃 또는 넉인을 수행하는 경향이 계속되고 있다. 특히 2021년 10월 미국 뉴욕대 연구팀은 갈세이프(GalSafe) 돼지의 신장을, 2022년 1월에는 미국 메릴랜드대 연구팀이 살아있는 환자에 돼지의 심장을 이식하여 초급성 면역거부반응이 일어나지 않는 것을 확인하였으나 환자는 최대 2달간 생존 후 사망하였다. 현재까지도 사망의 이유는 명확하지 않다. 이식에 사용된 돼지는 거부반응을 일으키는 유전자 3개와 성장 촉진 유전자 1개를 제거하고 염증반응과 면역반응을 제어하는 6개 유전자를 삽입하는 등 10개의 유전자가 편집된 돼지로 리비비코 사에서 개발했다. 각 장기에 맞는 유전자 제어 연구는 여전히 활발히 진행되고 있다.
돼지는 사람과 장기의 크기나 생리학적, 해부학적 특성이 유사하다는 점에서 사람의 질환 연구를 위한 모델동물 개발에도 주로 활용되고 있다. 전 세계적으로 사회 경제적 충격을 안겨주었으며 현재까지도 영향을 미치고 있는 COVID-19에 관한 동물모델 연구가 활발하게 진행되었다. 2021년 중국 연구진은 CRISPR/Cas9 기술로 사람의 COVID-19 감수성 유전자인 ACE2 유전자를 돼지에 넉인한 돼지모델을 개발했다고 보고하였다. 돼지는 사람과 달리 COVID-19에 감수성을 보이지 않으며, 사람의 ACE2 유전자가 도입된 돼지는 질병 메커니즘, 바이오마커 및 치료 방법의 연구에 많은 도움을 줄 수 있을 것으로 기대된다.
유전질환과 더불어 치매, 당뇨 등 만성질환 연구를 위한 질환모델동물로 중소가축을 활용하려는 시도도 계속되고 있다. 2022년 덴마크 연구진은 알츠하이머 질환의 유병 원인 중 하나로 의심되는 SORL1 유전자 일부를 유전자 편집을 통해 제어한 유전자변형 미니돼지 모델을 개발하였다. 이를 통해 알츠하이머 비임상 연구에 바이오마커의 조사에도 활용될 수 있을 것으로 보인다.
간암의 발병률을 높이는 유전성 난치성 질환인 티로신혈증(Hereditary Tyrosinemia type I, HT1)의 돼지모델도 보고되고 있다. 티로신 대사의 마지막 단계를 촉매하는 효소인 fumarylacetoacetate hydrolase(FAH)의 결핍은 HT1을 유발한다고 알려져 있다. 2022년 중국 연구진은 FAH 넉아웃 돼지에 CRISP/Cas9 기술로 RAG1 또는 RAG1과 IL2RG 유전자를 동시에 넉아웃하여 돼지 자체의 면역 결핍을 유도한 유전자변형 돼지를 만들고, 사람의 간세포를 이식하여 돼지에서 사람의 알부민이 생산되는 것을 확인하였다. 이는 사람의 간 조직을 구성할 수 있는 중증 면역결핍 돼지모델로 간세포 재생 및 치료를 위한 정밀 연구 소재로 활용이 기대된다. 이에 앞서 2021년 다른 중국 연구진은 FAH 넉아웃 돼지에 CRISPR/Cas9 기술로 추가적으로 4-hydroxyphenylpyruvate acid dioxygenase(HPD) 유전자를 넉아웃하여 이중 돌연변이에 의한 티로신 분해경로의 대사 교정 효과를 보여주었다. 이 결과는 HT1의 새로운 치료전략의 개발에 활용될 수 있을 것으로 기대된다.
다. 국내 현황
축산 분야의 생명공학 기술은 소, 돼지, 닭 등의 가축의 형질을 직접 전환하여 번식능력을 향상시키거나, 유용 단백질을 생산하는 생물반응기 및 이종이식용 장기의 공급원이나 인체 질환모델로 이용, 또는 유전정보를 토대로 원하는 형질을 가진 가축의 육종과 선발 기간을 단축하는 데 주로 활용되고 있다. 최근에는 가축의 질병 저항성을 높이거나 동물실험의 대체 또는 세포 활용 대체 단백질 생산 등 다양한 목적으로도 활용되고 있다.
국내에서 수행되는 축산 분야 생명공학 국가 R&D 과제 정보를 확인하기 위해 국가 과학기술 지식 정보 서비스(www.ntis.go.kr)에서 키워드 ‘동물, 소(또는 돼지, 닭), 형질, 유전자, 개발’을 사용하여 검색해보았다. 소 관련 과제의 경우 2021년에는 9건, 2022년에는 7건이 검색되지만, 여러 축종에 공통된 과제나 직접적인 관련이 없는 과제를 제외하면 실제로 소와 관련된 과제 수는 2021년 4건, 2022년 3건에 불과하였다. 마찬가지로 돼지의 경우에는 2021년 37과제, 2022년 36과제가 실제로 수행되었다. 닭 연구과제는 2021년에 15건, 2022년은 14건이었다.117)
[표 3-45] 국내에서 수행되는 축산 분야 국가 R&D 과제수(2021∼2022)
|
구분(연도/건) |
소 관련 |
돼지 관련 |
닭 관련 |
|
2021 |
4 |
37 |
15 |
|
2022 |
3 |
36 |
14 |
출처: NTIS, 저자 작성, ‘동물, 소(또는 돼지, 닭), 형질, 유전자, 개발’ 키워드 검색
(1) 가축의 경제형질 개선 및 유용 물질 생산을 위한 생명공학 활용
소는 긴 번식 기간과 비용 때문에 관련된 생명공학 과제가 상대적으로 적었다. ㈜라트바이오와 ㈜제넨바이오가 비감염성 질환 예방과 치료를 위한 질환모델과 생물반응기로서 근육의 발달을 억제시키는 기능의 myostatin(MSTN) 유전자 결손 소를 개발했다고 보고하였다. 또한 ㈜라트바이오는 우유 성분으로 사람의 세포 성장 인자 FGF와 EGF를 분비하는 소를 개발하였으며, 이 성장 인자를 화장품 개발에 활용하기 위하여 전기천공법, AAV 시스템을 활용한 간단하고 효율적인 넉인 소 배아 생산방법을 개발하고 있었다. 분자 육종 분야에서는 충남대가 소의 근육세포를 이용한 한우 도체형질과 관련한 신규 SNP를 분석하여 그 기능과 조절 기전을 규명하는 연구를 수행하였다. 국립축산과학원은 번식기술 확보를 위해 희소한우의 유전특성을 분석하고 수정란을 대량증식하는 생명공학 기술을 이용한 축군 증식 연구를 수행하였다.
돼지의 경우, 보조생식술을 이용한 인공번식 분야에서는 강원대에서 cyclic AMP modulator를 이용한 돼지 미성숙 난자의 체외발육-체외성숙 시스템의 개발을 보고하였으며, 초기발육난포 유래 미성숙난자의 활용을 위한 3차원 생체모방형 체외발육 시스템 개발 연구를 수행하였다. 돼지 정원 줄기세포주의 체외 배양 체계를 확립하기 위하여 건국대는 돼지 정원 줄기세포막 표지 단백질 CD14의 역할 및 초기 meiosis 조절 기전 규명 연구를, 연세대는 번식기술 증진을 위해 돼지 착상과정에서 Conceptus 유래 인터페론의 모체 면역조절 및 면역관용 유도 기전 연구를 수행하였다. 유전체를 활용한 육종 분야에서는, 육질형질과 관련하여 공주대가 요크셔 돼지에서 유전자 기반 정밀 저밀도 DNA 칩 개발을 위한 후보 원인변이 동정연구와, 디지털 정밀육종을 위한 멀티오믹스정보 기반 돼지 전장유전체 미세지도 작성 연구를 수행하였다. 전북대는 유전체 정보를 활용한 돼지의 저밀도 SNP칩 개발 연구를 수행하였으며, 경남과기대는 융합 유전체 마커를 활용한 버크셔 돼지의 등지방 두께 조절 기술 개발을 수행하였다. 축산과학원은 건국대와 공동으로 우리흑돈의 유전적 조성 파악 및 오믹스 기반 형질 예측 기술 개발 연구를 수행하였고, 경제형질 활용을 위해 난축맛돈 및 미니돼지 표준유전체 해독과 형질 연관 유전자 발굴 과제를 수행하고 있다. 유전체 정보를 이용한 종돈의 강건성(지제) 형질 개량을 위하여 축산과학원과 전북대가 공동으로 유전적 특성 분석연구를 수행하였다. 축산과학원은 재래돼지를 활용한 성장 및 산자수를 개선한 신품종의 생산 기술을 개발 중이며, 중앙대와 공동으로 재래돼지 경제형질 관련 유전정보에 기반한 돼지 관리체계 마련 및 육질개량 기술 개발, 돼지 생애 강건성(지제) 개량체계 구축 연구를 수행하였다. 또한 빅데이터 기반 종축 선발 체계 및 ICT 융합 개량 정보 활용 기술 개발과 함께 계통별 다산 요크셔와 우리흑돈을 활용한 축진종돈의 경제형질 개량 및 산업 활성화 연구를 수행하고 있다. 고려대는 육종에 활용하기 위한 PCR-free, 유전체 선발용 SNPs 다중 탐지 시스템 개발 및 성능 검증 연구를 수행하였다. 축산현장의 현안인 웅취 문제 해결을 위해 농진청의 지원으로 정피엔씨연구소는 유전자형에 따른 참여 종돈장 참조돈군 검정체계 확립 및 차별화 종돈 개발을 수행하고 있다.
닭 관련 연구과제의 주요 내용과 목표는 다루기 어려운 닭의 생식세포 배양 및 유전자 편집 연구와 우수 경제 형질 유전자를 선발하기 위한 마커 개발이 대부분이었다. 번식기술 개발 분야에서 축산과학원은 닭의 원시생식세포와 정액 등의 생식세포를 장기 배양하고 동결 보존하는 기술 개발 연구를 수행하고 있다. 이와 관련하여 축산과학원은 닭을 이용한 유용재조합단백질 생산 시스템 개발을 위한 닭의 원시생식세포의 장기배양 기술 개발 연구를 수행하였다. 또한, 가축생명자원의 관리 측면에서 가축생명자원 보존 및 관리 고도화 기술 개발과 가축유전자원 생태계 관리 역할 및 효율적 보존 방법 개발에 관한 연구를 수행하였다. 서울대는 기존의 유전자변형 방법인 바이러스 벡터를 수정란에 도입하는 방식 이외에 수탉에서 분리한 생식세포를 활용한 유전자변형 닭 개발 연구와 더불어, Busulfan 저항성 원시생식세포의 정소 내 이식을 통한 효율적인 형질전환 닭 생산기법 개발, 유용물질 생산용 닭 생물반응기 시스템 최적화를 위한 난관 상피 세포 특이적 유전자 편집 닭 개발 및 난관 상피 세포주 구축 연구를 수행하였다. 유전체 활용 분자육종 분야에서 전북대는 한국 오계와 토착 코니시종 닭에서 성장 관련 유전체 발굴과 활용연구를, 축산과학원과 충남대는 공동으로 오계와 백색레그혼 교배집단 표현형 정보 활용 육질 관련 소재 발굴 연구와 우리맛닭의 육질 향상을 위한 유전체 선발 기술 개발 연구를 수행하였다. 충남대는 한국형 닭 유전체 선발용 맞춤형 SNP 칩 개발 연구를 수행하였다.
[표 3-46] 경제형질 개선, 질병저항성 및 동물 복지 향상을 위한 유전자변형 가축 개발 현황(2021∼2022)
|
동물 |
유전자명 |
개발 목적 |
형태 |
기법 |
발표년도 |
|
돼지 |
ANTXR1 |
Senecavirus A(SVA) 저항성 |
KO |
CRISPR/Cas9 |
2022 |
|
소 |
MSTN |
MSTN 변이 한우 개발 |
KO |
CRISPR/Cas9 |
2021 |
|
Sry |
성전환 소 개발 |
KI |
TALEN |
2021 |
|
|
닭 |
MLPH, MSTN |
PGC 매개 없는 유전자 편집 |
KO |
CRISPR/Cas9 |
2022 |
|
DAZL iCaspase9 |
불임대리숙주(Sire Dam Surrogate, SDS) 짝짓기를 통한 희귀품종 생산 |
KO, HDR |
CRISPR/Cas9 |
2022 |
|
|
PLIN1 |
닭 지방 조직 성장 및 발달 조절 |
KO |
CRISPR/Cas9 |
2022 |
출처: NTIS, 저자 재구성
(2) 가축의 질병 저항성 향상과 면역 증진을 위한 생명공학 활용
가축 감염병의 제어와 관련하여 국내에서는 주로 범용성을 갖는 면역증진기술의 개발과 특정 바이러스를 목표로 하는 저항성 연구가 진행되었다. 축산과학원은 성우와 송아지에서 ASF 및 구제역 바이러스 감염저항성인자 탐색을 통한 면역증진기술 개발 연구를, 서울대는 양돈 전염성 질병 예방을 위한 효과적인 TLR2 표적형 점막면역백신 체계 개발 연구를 수행하였다. 안전성평가연구소는 유전자 편집 기술을 활용, OASL1 유전자 적중 형질전환돼지에서 다양한 바이러스의 감염 저항성 기전 연구를 수행 중이다. 녹림축산검역본부는 유전자 교정 기술 기반 PRRS 바이러스의 효율적 생산을 위한 세포주 개발 연구를 수행하였다. 서울대는 PRRS 바이러스 고역가 배양을 위한 유전자 교정 세포주 확립 연구를, 중앙대는 통합 멀티오믹스 기반 돼지 PRRS 바이러스 병원성에 따른 차등 감염 면역기전 구명 연구를 수행하였다. 전북대는 현장검사 및 실험실 검사기법 구축과 평가 및 진단 결과 관리시스템 구축과제를 통해 현장에서 채취된 검체에서 유전물질을 신속하고 간편하게 추출하고 검사할 수 있는 시스템의 개발을 보고하였다. 닭의 질병과 관련해서는 서울대가 단일 세포 전사체 분석 기반 CRISPR 스크리닝을 활용한 닭의 조류 인플루엔자 바이러스 저항성 기전 규명 연구와 효율적인 유전자 편집 조류 생산을 위한 생식세포 결핍 모델 개발을, 충남대는 닭의 면역 및 질병 저항성 관련 MHC 유전자형 분석을 위한 MS 및 SNP 마커의 개발과 반수체 분석 연구를 수행하였다.
(3) 이종이식용 및 질환모델 가축 개발
이종이식용 돼지 개발 및 생산 분야에서 축산과학원은 기존에 개발하였던 알파갈 유전자 제어(GTKO) 돼지를 기반으로, 이종이식 거부반응 조절 유전자 프로모터 개발, HO1 유전자 도입 형질전환 돼지 개발 및 돼지 항원 합성 유전자 좌위에 사람 핵산 분해 효소 유전자가 넉인된 돼지 개발 연구를 수행 중이다. ㈜옵티팜은 이종이식 면역조절 기술 개발을 위한 비단백 항원 결핍 형질전환돼지 개발 연구 및 비임상 확대에 따른 동물 공급을 위해 이종 장기이식용 장기 친화적 형질전환 돼지 생산 연구와 함께, 이미 개발한 이종이식용 돼지의 세포를 활용하여 의료용 소재 생산을 위한 기술 개발을 진행하고 있다. ㈜옵티팜은 이종이식 거부반응의 원인 물질인 돼지 항원을 합성하는 유전자 GT, CMAH, B4GALNT2 유전자에 추가로 isogloboside 3(iGb3) 유전자 기능을 제거한 돼지를 개발 중이며, 한국생명공학연구원은 미니돼지자원 거점은행 구축 연구를 수행 중이다. 삼성서울병원은 비단백 항원 제거 돼지를 이용한 영장류 이종 혈관 이식 모델에서의 유효성 평가를 수행하고 있다. 농진청은 돼지 장기 및 조직의 영장류 비임상 이종이식을 통한 장기이식 프로토콜 확립 및 모델 개발 연구를 지원, 단국대는 PDX1 유전자 결손 돼지의 이종간 키메라 형성에 의한 돼지 체내 인간 췌장 생산 연구를, 건국대병원과 안전성평가연구소는 전임상 및 면역억제 유효성 검증을 위한 형질전환 돼지 각막 이종이식 기술 고도화 연구를 수행하였다. 서울대는 영장류 비임상시험을 통한 이종 장기이식 프로토콜 정립 연구 수행 등 국내 이종이식 임상 준비와 영장류 비임상 연구를 지속하여 임상 적용을 위한 기술 개발 연구를 지속하고 있다. 질환모델동물 개발 측면에서 축산과학원은 사람에서 질환을 유발하는 유전자의 생체 내 기능 검증을 위한 Cas9 발현 돼지 개발을 추진하고 있으며, 서울대와 함께 유전성 신장질환 형질전환 돼지모델의 표현형 및 발현중증도 검증 연구를 수행하였다. 이와 관련하여 단국대와 ㈜비엔지티는 공동으로 유전성 신장질환 형질전환 미니돼지 생산 연구를 수행하였다. 충북대는 전임상을 위한 흑색종의 인체 질환모델 중대동물을 개발 중이며, ㈜크로넥스는 전임상 연구를 위한 흑색종 모델 중대동물 SPF생산 라인 및 상용화 기반 구축 연구를 수행하였다. 한국생명공학연구원은 인간 질환 형질전환 중대형 모델을 활용한 신규 유전자가위 기반 유전자치료 원천기술을 개발 중이며, 충북대는 난세포질 응집기술을 이용한 키메라 흑색종 질환모델 돼지 생산 연구를 수행하였다. (재)아부다비생명공학연구원은 유전자 재조합 기법을 활용한 형질전환 흑색종 질환 모델견 개발 연구를 수행하였다. 코로나19 팬데믹과 관련하여 ㈜옵티팜은 미니돼지 동물모델을 이용한 코로나19 백신 전임상 후보물질 유효성 평가과제를 수행하기도 하였다.
[표 3-47] 이종이식용 및 질환모델 가축 개발 현황(2021∼2022)
|
동물 |
유전자명 |
개발 목적 |
형태 |
기법 |
발표년도 |
|
돼지 |
SORL1 |
알츠하이머(Alzheimer’s Disease, AD) 모델 |
haplo KO |
CRISPR/Cas9 |
2022 |
|
FAH/RAG1 및 FAH/RAG/IL2RG |
중증 티로신혈증 I형(Tyrosinemia type I, HT1) 모델 및 인간 간 조직을 구성할 수 있는 중증면역결핍 돼지 모델 |
KO |
CRISPR/Cas9 |
2022 |
|
|
ACE2 |
COVID-19 감수성 모델 |
KI |
CRISPR/Cas9 |
2021 |
|
|
FAH, HPD |
유전성 티로신혈증 I형(Hereditary tyrosinemia type I, HT1) 모델 |
KO |
CRISPR/Cas9 |
2021 |
|
|
ASGR1 |
고콜레스테롤혈증(Hypercholesterolemia) 및 죽상동맥경화증(Atherosclerosis) 모델 |
KO |
CRISPR/Cas9 |
2021 |
|
|
GIPRdn, hIAPP, PNPLA3I148M |
비만 관련 2형 당뇨(Type 2 Diabetes mellitus) 및 비알콜성 지방간(non-alcoholic fatty liver disease, NAFLD) 모델 |
KI |
CRISPR/Cas9 |
2021 |
출처: NTIS, 저자 재구성
(4) 생명공학을 활용한 가축 유래 소재 활용 연구
여러 축종의 가축 줄기세포를 활용한 소재 개발 분야의 관심이 증가하고 있다. 특히 배양육과 오가노이드의 활용 분야가 동물복지 및 식품 안전성 이슈와 관련되어 가축 유래 세포의 새로운 활용방안으로 대두되고 있다. 농식품부, 과기정통부, 산자부, 중기부, 교육부, 농진청 등 다양한 부처가 공동으로 또는 독자적으로 지원하는 연구가 최근부터 다방면에서 추진되고 있다.
배양육 분야에서는 영남대가 가장 많은 과제를 수행하는 것으로 검색되었다. 영남대는 주요 축종별 근육줄기세포 특성 분석 및 식품 안정성이 보장된 최적의 기본배지 개발을 통한 대량 배양시스템 확립 연구, 세포배양육 생산을 위한 근육줄기세포 성장 및 분화 제어기술 연구, 세포외기질이 근육의 형성 및 발달에 미치는 효과 연구, 배양육 생산을 위한 닭 근육줄기세포의 순수분리 및 배양조건 확립 연구, 닭 근육 위성세포 배양육을 이용한 인공 소고기 제조기술 개발 연구 등을 수행하였다. 다음은 전북대로 한우 배양육에 적합한 줄기세포주 확립 및 배양육 생산, 한우 유전체 빅데이터와 integration-free 줄기세포를 이용한 배양육 생산성 관련 기초 기술 개발, 소의 근육줄기세포를 이용한 3차원 조직배양법 및 배양장치 개발, 배양육 생산을 위한 돼지 근육 줄기세포의 분화 및 조직화 기술 개발 연구 등을 수행하였다. 축산과학원에서는 인공근육(Bioartifical muscle) 구축을 위한 골격근 줄기세포(Skeletal muscle stem cell) 증식 기술 개발, 닭 유래 백색육 세포 소재 발굴기술 개발과제를 수행하였고, 서울대는 배양육 생산기반 기술 구축 및 산업화 연구, 돼지와 닭의 체외 3차원 근육 분화 및 발달 기전 연구를 수행하였다. 연세대는 세포 기반 배양육 개발을 위한 대량생산 요소 신기술의 확립 및 신산업 창출 연구를, 중앙대는 배양육 산업화를 위한 천연물 기반 축종별 무혈청 배지 개발 및 안전성 검증 연구를, 건국대는 가축 유래의 다양한 줄기세포로부터 근육 및 지방조직 배양/분화기법 개발 연구를 수행하고 있다.
가축 오가노이드의 개발은 생체 내 실험에 사용되는 동물의 수를 효율적으로 줄일 좋은 기회를 제공할 것으로 기대된다.118) 국내에서 가축 오가노이드 연구를 수행하는 주체는 사람이나 설치류 오가노이드 연구에 비해 많지 않은 실정이다. 축산과학원에서는 돼지 소장 오가노이드 개발 연구와 독성물질의 체외 평가용 돼지 간 오가노이드 개발 연구를 수행하고 있다. 부산대는 돼지와 닭의 장관 오가노이드를 활용하여 단위 가축의 장 건강 향상을 위한 면역물질 발굴 및 효과 구명 연구를, 단국대에서는 유전성 신장질환 체외 모델 신장 오가노이드를 개발하는 연구를 수행하였다.
라. 향후 전망
축산 분야는 여전히 고병원성 조류인플루엔자(HPAI)나 아프리카돼지열병(ASF) 등 가축 감염병의 확산으로 고통받고 있다. 전 세계적으로 가축의 생산성과 질병저항성을 향상시키는 다양한 유전자변형 가축의 개발이 진행되고 있고, 우리나라도 범정부 차원의 가축 감염병 저항성 및 면역 증진을 위한 연구과제를 수행하고 있다. 향후 국내에서도 바이러스성 질병의 감염 기전 및 저항성 확보를 위한 유전자 편집 가축 개발 연구가 늘어날 것으로 예측된다. 또한 여러 가지 대사질환 등 사람 질환에 대한 돼지모델의 개발과 함께 이종이식용 돼지 개발 요구도 지속될 것으로 보인다. 2022년 12월 식약처는 2009년 국제이종이식학회 합의를 기반으로 국내 실정에 맞는 146개 검사 및 모니터링 항목을 설정하고 영장류에 대한 비임상 결과를 근거로 돼지의 췌도를 이용한 이종췌도 이식의 임상시험을 처음으로 승인하였고, 국내 연구진은 23년 내 임상 1상을 추진할 것으로 알려져 있다. 이종이식 임상 연구 가능성이 점차 현실화 되고 있는 가운데, 유전자변형 돼지의 안정적인 공급은 반드시 선결되어야 할 문제로 보인다. 이종이식에 필요한 기술을 차치하고라도 원료용 돼지의 생산, 증식, 관리 및 공급에 축산 분야의 전문성이 요구된다.
고도화된 유전자 편집 기술의 발달은 이종이식 분야뿐만 아니라 다양한 분야에서 유전자변형 가축이 활용될 수 있는 계기를 제공할 것이다. 미국은 국립형질전환돼지자원센터(NSRRC)에서 유전자변형 중소가축의 관리를 수행하고 있다. 우리나라에서도 생명연구자원법에 따라 대부분의 형질전환 동물이 지정된 관리 주체에 의해 관리되고 있으나, 유전자변형 중소가축이나 대가축에 대한 국가관리시스템은 아쉬운 형편이다. 질환모델 및 이종이식용으로 주로 사용되는 형질전환 돼지의 개발에 사용되는 돼지는 주로 미니돼지 계통으로, 유카탄(멕시코), 괴팅겐(독일, 베트남), WZS(중국 하이난성), 바마(중국 광시성) 계통이 주로 보고되고 있다. 국내에서도 일부 기업이나 연구소가 국내 재래돼지 품종을 기반으로 미니돼지 계통을 활용하고 있으나 미래 경쟁력 제고를 위해서는 품종의 확립이 필요할 것으로 보인다.
복제 소가 미국에서 식용으로 승인된 지 15년이 지났고 이제는 유전자 편집 소의 식용이 승인되었다. 우리나라에서도 다양한 유전자 편집 가축의 개발이 추진되고 있으나 이를 계기로 더욱 활발한 연구가 추진될 것으로 예상된다. 또한 동물복지와 기후변화, 식품 안전성 등 현안에 대응한 연구도 지속해서 추진될 것으로 보인다. 특정 성별 가축의 비선호로 인한 조기 도태 문제의 해결, 메탄가스 등 온실가스 배출의 저감, 배양육과 동물대체시험법 등 다양한 분야에서 축산 분야의 생명공학 수요는 앞으로도 지속될 것으로 판단된다.
3. 식품
가. 식품연구개발의 개요
코로나19 팬데믹, 기후변화 및 글로벌 저성장 기조의 지속 등 급변하는 대외환경 변화 흐름 속에서 주력 식품산업과 식품연구개발 기술이 다변화하고 있다. 인구 고령화, 1인 가구 증가 등 인구구조와 라이프 스타일의 변화는 건강 기능성과 편의성을 강화한 제품개발과 식품산업에 영향을 미치고 있으며, 기후변화에 대응하기 위한 탄소중립과 친환경성을 강조한 식품산업이 조성되고, 생명공학 기술 및 IT 기술 진보의 영향으로 건강과 직결되는 식품에 대한 연구기술 개발이 가속화되고 있다.
이에 본고에서는 농림식품과학기술 분야 최상위 계획인 제3차 농림식품과학기술 육성 종합계획의 차세대식품 핵심기술과 식품산업진흥정책119)에서 제시한 유망식품 분야와 그린바이오 유망산업을 기반으로, 생명공학 기술과 최신 푸드테크기술이 반영되어 활발하게 연구개발이 진행되고 있는 기능성 식품(맞춤형 식품, 마이크로바이옴 포함), 메디푸드・고령친화식품, 대체식품 등 분야별 핵심기술의 동향, 농식품부 등 유관 부처의 연구개발 지원 동향과 산업 현황을 기술하고자 한다.
나. 해외 동향
(1) 기능성 식품소재 개발 및 맞춤형 식품 연구
인구 고령화, 건강 관심도 증가로 꾸준한 시장 성장이 기대되는 기능성 식품소재 개발 및 제품을 위한 해외 R&D 투자는 기업 중심으로 활발히 진행되고 있다. 글로벌 기업인 네슬레 퓨리나(스위스)는 우유 단백질 알레르기를 가진 태아의 소화를 돕고 건강 증진 및 면역기능을 위한 프락토올리고당 및 모유 유래 성분의 기능성 식품을 개발하였고, 임상시험에서 태아의 분유 섭취 후 설사 및 구토 완화에 유의적 효과가 있음을 입증하였다. 이에 마이크로바이옴 생명공학 기업과 제휴하여 경구용 미생물 군집 치료제 개발을 진행 중이다. 네슬레 헬스 사이언스는 비타민, 미네랄 및 허브 보충제 공급업체인 바인티풀 컴퍼니의 핵심 브랜드를 인수하여 건강 및 영양 포트폴리오를 보완하고 있다. 프랑스의 뉴트리시아는 암 환자의 근육 손실 문제를 해결하기 위한 다양한 솔루션과 전문지식을 제공하기 위한 ‘Food4Health’의 프로젝트를 수행하는 등 소재개발뿐만 아니라 맞춤형 식품시장으로 분야를 확대하고 있다.
개인 맞춤형 식이 관리 서비스는 미국과 유럽 중심으로 대규모 임상연구를 통하여 검증된 데이터 기반으로 공중보건에 활용되거나 기업에서 이미 일반 소비자에게 서비스화되고 많은 데이터를 축적하는 단계에 있다. EU의 7차 프레임워크 프로그램의 지원을 받은 대규모 개인 맞춤형식품 ‘Food4Me’ 프로젝트에서는 6개월간 7개 유럽국가의 1,600명 성인 대상 연구에서 기존 식사분석을 기반으로 개인 맞춤형 식이를 제안하였고, 일반적인 식이 제안을 받은 소비자보다 더 건강한 식단을 먹고 더 건강한 라이프 스타일을 따르게 하는 동기를 부여하는 긍정적인 효과를 관찰하였다.120) 이 연구는 인터넷 기반 자료수집과 맞춤 식사 정보를 제공하는 접근방식에 대한 모델을 제공하였고, 공중보건에서 규모를 확장하고, 비용 효율적으로 대중의 건강개선 효과를 발휘할 수 있음을 보여준 정책적 지원이다.
미국 국립보건원(NIH)은 ‘All of US(2020-2030)’ 프로젝트를 통하여 100만 명 건강정보와 생체시료 수집계획을 진행 중이며, 정밀영양(precision nutrition)121)에 초점을 맞춰 국민 건강과 삶의 질 향상, 질병 예방 및 감소에 있어 인체 영양의 근원적 역할을 규명하는 영양과학 연구를 추진하고 있다. 이는 건강과 건강 불균형, 여성과 아동 건강, 과학연구의 엄격성과 재현성, 데이터과학, 시스템과학 및 인공지능, 영양과학 연구인력 교육훈련 등 연구영역으로 진행된다.
기업에서는 맞춤형 식사 서비스 사업을 확장하고 있다. 미국 실리콘밸리의 스타트업 기업인 조이(ZOE)는 재택 검사(at-home test)를 통해 식사 후 고유한 장내 미생물과 염증을 프로파일링하고 AI를 사용하여 개인화된 식사 계획을 제공하는 서비스를 도입하였다. 대규모 임상 영양 연구 PREDICT 1차 프로젝트122)에서, 유전 요인보다는 개인이 섭취하는 식이의 중요성을 강조하고 맞춤형 식사 서비스 사업으로 확장하였다.
이스라엘 와이즈만연구소 연구팀123)은 같은 음식에 대하여 개인마다 혈당반응이 다르게 반응할 수 있음을 데이터화하여 개인 맞춤 예측모델을 개발하고, 기계학습에 의한 개인 맞춤 식단제공이 효율적으로 작동하였음을 검증하였다.124) 이후 식후 혈당반응 예측에 따른 개인 맞춤 영양 솔루션을 제공하는 스타트업 기업 DayTwo(이스라엘/미국)을 설립하여 시장에서 소비자에게 서비스하고 있다.
2003년 인간유전체 해독 프로젝트가 완성된 이후 개인의 유전정보에 대한 윤리적인 이슈에도 불구하고 개인 선택에 의한 소비자 의뢰(Direct-To-Consumer, DTC) 유전자 검사가 가능하게 규제를 푼 미국과 유럽의 경우는 유전자 맞춤형 영양제와 건강기능식품 서비스가 산업적으로 자리를 잡고 있다. 뉴트리지노믹스(Nutrigenomix, 캐나다)의 유전자 분석 서비스와 식단 제안, 네슬레(스위스)의 식이 처방 서비스, 뉴트리라이트(미국)의 식이보충제 처방, DNAfit(영국)의 민감성 식품 서비스 등이 그것이다. 초창기부터 서비스를 시작한 뉴트리지노믹스 社는 채식 항목에 해당하는 각 항목당 70여 개의 유전자를 DTC 기반으로 검사하여 채식 또는 비건 식단을 따르는 개인에게 적합한 DNA 기반 채식 맞춤형 식단 권장 서비스를 제공하고 있다. 이러한 맞춤형 영양제와 식단 서비스 시장은 발전하는 AI 기술과 결합하여 대규모 임상시험과 같은 데이터 기반 검증연구와 피드백 데이터가 축적되고 있으며 헬스케어서비스 관련 내용이 점점 더 확대되고 있다.
(2) 기후 위기 시대 지속가능한 식품기술 개발
글로벌 이슈인 기후 위기에 따른 지속 가능한 식생활을 추구하고 기후 위기 극복의 필요성과 대응에 대한 공감대가 형성되며 친환경 식품인 식물성 대체육・유제품과 업사이클 식품, 프로바이오틱스가 첨가된 식품개발이 증가하고 있다. 여기에 미국・EU 등 주요국은 IT・BT 기술이 결합한 푸드테크에 대한 대규모 정책 지원을 통해 자체 소재 기술을 확보하고 있으며 세계적 신성장 산업으로 부상하고 있다.
식물성 대체육의 경우, 미국의 임파서블 푸드 社는 고농도 식품성 헴(heme) 단백질 생산이 가능한 기술과 특허를 보유하고, 산업화 단계에 있다. 대두단백, 감자 단백질을 혼합하여 제품을 생산하고 있으며, 코코넛과 해바리기 오일을 통해 지방의 식감과 맛을 이미 구현하였고 콩 뿌리혹에서 발견되는 레그헤모글로빈(leghemoglobin)의 효모를 배양하여 식물성 유기철분 헴(heme)을 추출하여 동물성 식육의 향, 맛, 육즙까지 구현하여 품질 고급화, 비용 절감 효과를 만들었고 GMO 대두를 사용하여 가격 경쟁력을 갖추고 있다. 이 외에도 잇저스트 社의 녹두로 만든 달걀, 푸드테크를 활용하여 쌀로 만든 고기 같은 식물성 단백질도 개발하였다.
미국・EU에서는 동물・식물・미생물 등 다양한 세포배양연구가 진행 중이다. 미국 스타트업 ‘업사이드푸드’는 미생물을 활용하여 무혈청 배지 개발, 2022년 11월 FDA로부터 닭고기 세포배양기술의 안전성을 승인받았다. 핀란드 ‘VTT 기술연구센터’는 아라비카 커피 잎에서 세포를 추출 배양하여 세포주를 만든 후 이를 증식시키는 식물세포 배양 과정 등을 통해 커피를 생산하였다. 미국 기업 퍼펙트데이는 미생물 정밀발효기술을 활용하여 유청단백질 DNA 염기서열을 효모에 삽입, 우유 등 유제품의 영양성분과 동일한 단백질을 생산하는 기술을 가지고 있다.
각국은 미래유망식품 분야인 대체육에 관한 대응전략을 수립하고, 다양한 R&D 사업을 정책적으로 추진하고 있다. 미국은 ‘2020 국가 인공지능 이니셔티브 법’ 제정으로 푸드테크 R&D 지원 강화, 배양육 관리를 위한 FDA와 USDA 정부 역할 정립 등 범부처 협업체계를 구축하고 있다. EU는 2020년 ‘Farm to Fork Strategy’를 통해 지속가능한 식량 시스템을 위한 방안을 제시하면서, 식물성 단백질 및 육류 대체물을 포함한 대체 단백질의 가용성과 공급원을 확대하는 데 초점을 두고 식물, 조류, 곤충 등의 대체 단백질 분야의 연구개발을 지원하고 있다(Horizon Europe(2021∼2027)).125) 네슬레 같은 글로벌 식품기업은 푸드테크 기업, 식물성 식품기업을 인수하고 브랜드를 런칭하였다. 일본에서는 식료・농업・농촌 정책 기본계획(2020∼2024)에 따라 산학연 협력을 바탕으로 농식품 기술혁신, 대체식품 기술개발 등에 집중 지원하고 있으며, 2020년 160개 이상의 식품기업, 스타트업, 정부, 연구기관 참여의 푸드테크 연구단을 발족하였다. 호주연방 과학산업 연구기구인 CSIRO는 ‘2030 Future Protein Mission’을 통해 식물성 단백질 생산을 위한 3개의 연구과제에 1억 5,000만 달러를 투입하여 연구개발 지원하고 있으며, 중국에서는 보건당국, 지구온난화 등 환경문제 해결을 위한 규정식 권고안(2016)을 발표하고 2030년까지 육류 소비량 50% 저감 목표, 단백질 섭취량 증대를 위한 식물성 고기 중심의 대체육 개발 지원 및 보급확산을 추진하고 있다.
다. 국내 현황
(1) 마이크로바이옴 식품소재 기술
그린바이오테크놀로지의 5대 핵심 분야로 선정된 마이크로바이옴 연구 분야 지원에 힘입어 기능성 식품소재뿐만 아니라 맞춤형 식품 설계기술로서 활발한 연구가 진행되고 있다. 마이크로바이옴(microbiome; microbiota+genome)은 특정 환경에 존재하는 미생물의 집합 전체를 의미하는 용어로, 신진대사・질병관리체계・면역・노화 등 인간의 건강과 질병에 상당한 영향을 미치는 것으로 밝혀지고 있으며, 차세대염기서열분석(Next Generation Sequencing, NGS)과 메타 유전체(metagenome) 연구기술을 적용한 개발연구가 가속화되고 있다. 마이크로바이옴 기술의 핵심은 장내 마이크로바이옴의 선택적 조절에 있고, 주요 영향 인자로는 기능성 식품소재를 활용한 프리바이오틱스, 유익균인 프로바이오틱스, 이들의 대사산물과 사균체를 포함하는 포스트바이오틱스 소재를 들 수 있다.
프리바이오틱스(prebiotics)는 소화효소로 분해되지 않아 흡수되지 않고 장까지 도달하는 저분자 섬유소로서 장내 미생물의 먹이원이 되어 장내균총을 개선시키는 것으로 보고되었다. 프리바이오틱스는 영양소가 풍부한 식물성 식품에 주로 함유되어 있으며, 대표 성분으로 이눌린(inulin)과 프럭토올리고당(fructo- oligosaccharides, FOS)을 포함한 프럭탄(fructan), 갈락토올리고당(galacto-oligosaccharides, GOS), 올리고 프럭토오스(oligofructose) 및 저항성 전분(resistant starch)을 포함하는 난소화성 당류가 알려져 있으나, 최근에는 폴리페놀과 파이토케미컬과 같은 비 탄수화물 성분도 이에 포함된다. 폴리페놀은 화학・생물학적 활성을 지닌 식물의 2차 대사산물로 락토바실러스균의 성장을 촉진시키거나 병원균에 대한 항균 활성을 나타내고, 비피도박테리아의 성장을 선택적으로 촉진하는 인간 모유 유래 펩타이드의 분자구조가 밝혀졌다. 또한, 비피도박테리아 롱검(Bifidobacteria longum) 균주에 의해 생산된 카제인(casein) 가수분해물의 항산화능이 보고되었다. 이처럼 다양한 기능성 식품소재로서 프리바이오틱스의 정의 및 응용 범위가 점차 확대되고 있으며 프리바이오틱스 성분 자체로 기능성을 보유하고 있는지에 대한 임상시험이 다양하게 이루어지고 있다.
프로바이오틱스(probiotics)는 장내 미생물에 이로운 기능을 줄 수 있는 유익균으로, 제품 내 균 구성 정도에 따라 장내 미생물 군집의 균형을 유지하는 데 크게 영향을 미친다. 건강기능식품의 장 면역 및 장 건강 개선 이외에도 고혈압, 피부 건강, 인지력, 갱년기 및 질 건강, 체지방 개선 등 최근 3년간 10여 건이 개별인정형 원료로 등재되었다. 노화에 따른 뇌질환, 면역기능뿐만 아니라 모발 건강, 호흡기 건강, 구취 감소, 청력 유지 등 새로운 기능성으로 확대 추진되고 있다.126) 한편, 최근 프로바이오틱스 소재 개발이 증가하면서, 식약처에서는 안전성 평가를 위하여 WHO/FAO 가이드라인에 따른 항생제 내성, 용혈활성, 독성 생성여부, 대사적 독성시험자료 등 안전성 검사를 강화하였다(식품의약품안전처, 2022).
포스트바이오틱스는 건강에 도움을 주는 프로바이오틱스와 먹이원인 프리바이오틱스를 통해 미생물의 대사과정 또는 식품의 발효과정 중에 생성되어 다양한 기능성・풍미・생체이용률을 갖는 새로운 기능성 식품소재이며, 장내 마이크로바이옴의 조절제로서 건강 증진에 유용한 소재이다. 단독 사용은 물론 기존 소재들과의 혼합 사용이 가능하며, 기존의 프로바이오틱스의 장 정착률이 낮은 단점과 한계를 보완하는 포스트바이오틱스로 진화하면서 건강기능식품 산업뿐만 아니라 치료제 범위까지 지속 성장할 것으로 전망된다. 프로바이오틱스 대사산물인 단쇄지방산(short-chain fatty acids), 항균 펩타이드(antimicrobial peptide), 비타민 B, 비타민 K, 복합아미노산, 펩타이드, 신경전달물질, 효소, 미네랄, 테이코익산, 다당류, 세포표면 단백질, 세포파쇄물 등이 연구되어 있다.127) 포스트바이오틱스를 식품소재로 활용하기 위해서는 사균화 처리공정, 대사산물의 분리, 정제, 분석에 대한 표준화, 효능 검증, 제품 품질관리 등이 확립되어야 한다. 향후 기능성 포스트바이오틱스의 발굴과 원료 표준화, 대량 생산, 임상시험에 대한 정부지원과 기업의 활발한 투자가 이루어져야 하며 포스트바이오틱스 소재와 제품에 대한 건강기능식품 인허가 가이드라인도 마련되어야 할 것이다.
(2) 맞춤형 건강기능식품 제안과 식단연구
정부의 샌드박스 규제 특례 시범사업으로 2019년부터 가능해진 소비자 의뢰 유전자 분석 서비스(DTC)는 개인 맞춤형 영양제와 건강기능식품 산업화가 가능해졌고 범위가 확대되어 영양소, 식습관 등 정부가 고시한 70개 항목의 범위 안에서 식이, 영양, 신체 기능 및 운동 등을 제안하고 맞춤형 건강기능식품을 판매하는 사업이 기업에서 이루어지고 있다. 최근에는 일부 기업 대상이기는 하나, 개인 맞춤형 건강기능식품 소분 판매가 가능해져(식품의약품안전처, 2022.12) 건강기능식품의 판매가 다양해지고 있다. 이는 생명공학 기술의 발전과 정부 규제 완화에 따라 가능해진 산업이다. 글로벌 시장에서는 이미 DTC 허용 유전자의 범위가 질병까지 다양하게 가능하고 시장도 커짐에 따라 국내 서비스에 대한 기대치도 크다. 기술적으로는 국내 유전자 분석기술은 성숙되어 있어 충분히 가능한 기술이나, 데이터의 정확도를 높이기 위하여 한국인 특이 유전체 정보 기반 데이터 확보와 근거 중심 유전자 기능에 관한 연구는 좀 더 축적될 필요성이 있다. 유전정보와 연계한 응용기술인 맞춤형 솔루션에 관한 정밀도를 높이고 정부의 정책적 지원도 필요할 것이다.
개인 맞춤형 건강기능식품 서비스 산업의 발전은 맞춤형 식이 제공을 위한 플랫폼 기술로 연계되어 연구가 진행되고 있다. 농식품부가 지원하는 ‘맞춤형 식이설계 플랫폼 개발’ 사업에서는, 식이설계 알고리즘 개발과 실증연구를 서울대와 기업에서 수행 중이고, 농진청의 ‘빅데이터 기반 건강 식단 추천 시스템 연구’ 사업이 진행되고 있다. 이러한 플랫폼은 연동되는 건강, 식품 DB가 중요하여 데이터 산업과도 연계되고 있다. AI 기술이 접목되면서 개인의 건강을 대표할 수 있는 다양한 요소들 즉, 개인의 유전자, 장내 미생물 군집, 대사체, 생활패턴/습관, 건강/식이/영양상태, 건강 목표, 기호도/선호도 등은 따로 또는 같이 계산되어 다양한 형태의 개인 맞춤 식품으로 서비스가 가능하므로 다양한 DB가 필요하다. 한국식품연구원에서는 ‘맞춤 식품 건강관리 AI 융합솔루션 개발’ DB와 비질환/질환 한국인 대상자 6,400명의 장내 미생물 정보분석을 목표로, 공공 데이터 제공을 위한 DB 작업을 진행하고 있다. CJ 제일제당은 국내 최대 규모의 마이크로바이옴 DB, 실물 균주(5,600여 개)와 활용 플랫폼을 보유한 기업 천랩을 인수하여 마이크로바이옴 기반 맞춤형 의약 및 식품 시대를 준비하고 있다. 이화여대 연구팀은 한국인 대상 나이, BMI, 식사의 질, 혈액 지표 등과 같은 16가지 변수를 종합적으로 고려해 산화스트레스 위험 정도를 정량화할 수 있는 예측 기계학습 모델을 개발하였다.128) 산화스트레스 위험도를 계층화, 예측하는 모델로 활용하여 데이터 기반 기능성식품과 식단제공을 위한 기술 상용화를 계획하고 있다.
(3) 메디푸드・고령친화식품
식품에 건강기능을 더한 케어푸드(care food)에서 맞춤형 영양 처방의 개념을 더해 질병의 예방 및 관리가 가능한 건강기능 맞춤형 식품 개념을 포함하는 메디푸드는 특정 질병이 있는 환자의 질환 치료 용도 또는 질환 치료를 위한 영양학적 상태의 유지를 위한 치료 보조 용도로 의학적 검증을 통해 질병 치료의 효과가 인정되었거나 의사의 처방에 따라 이용할 수 있는 특수의료용도식품이다. 식품의약품안전처에서는 특수의료용도식품(메디푸드)을 독립된 식품군으로 분류하고 표준형, 맞춤형, 식단형 제품으로 재분류하였으며, 영양성분 함량에 민감한 만성질환자를 위한 ‘식단형 식사관리 식품’ 유형을 신설하고, 환자용 식품의 유형을 질환별(당뇨・신장질환・장질환 등)로 세분화하는 내용 등으로 식품의 기준 및 규격을 개정・시행하였다.129) 여기에는 고령친화식품 중 액상 식품에 대해서는 무리 없이 삼킬 수 있도록 적절한 점도규격(1,500 mpa・s 이상)의 신설을 포함하고 있다. 또한 고령자용 영양 조제식품의 유형과 기준・규격을 신설하여 단백질 등 영양소 19종을 고령자의 영양 요구량 기준으로 설정(2021.11.30.) 하였다. 최근 제형을 액상・겔・분말・과립형태로 지정했던 식품 유형 제한을 삭제하여 다양한 형태로 제조할 수 있도록 영양 조제식품의 정의를 개정하였다.130) 초기 치매 환자용과 당뇨용 영양식 위주의 제품, 액상 음료 중심에서 고령자용 물성 조절식, 영양강화 및 메디푸드로 확대되고 있다.
노인용 건강관리 식품인 고령친화식품은 쉽게 섭취할 수 있는 액상이나 타 먹는 분말 형태로 단백질・탄수화물・지방 등 필수 영양소가 균형 있게 배합되어 있다. 수술 전후나 만성질환자를 위한 영양보충제, 전분이나 덱스트린 같은 점도 증진제를 활용한 환자용 식품이 가능하다. 영양강화식품 분야에서는 기존 영양성분 강화기술에서 의약품에 사용하던 DDS(drug delivery system) 기술원리를 활용하여 효율적으로 생체 내 흡수율을 높이려는 NDS(nutrition delivery system) 연구가 진행되고 있다. 영양강화 액상제형의 매트릭스화를 통해 수용성 물질의 경우 하이드로콜로이드(hydrocolloid) 등의 겔화 반응을 유도하거나, 지용성 물질의 경우 고체 지질을 활용하는 기술이 가능하다. 영양성분, 비타민 K 강화 제형 연구에서는 DLLME(disperse liquid microextraction) 추출법을 개발하고 추출조건 최적화를 위한 반응표면분석을 하여 수율을 측정함으로써, 영양성분을 강화할 수 있는 제형을 개발하였다.
(4) 대체식품
주요 대체식품131)은 식물성 대체육, 배양육, 식용곤충으로 구분할 수 있다. 시장에 나와 있는 식물성 단백질은 식물성 대체육 특유의 향을 제거하기 위하여 효소처리, 콩 품종개량, 캡슐화 압축 등의 연구 기술이 개발되고 있으며, 동물성 식육 고유의 맛과 냄새 구현, 적색육의 헴(heme) 성분을 대체할 수 있는 식물성 소재 탐색, 갈변반응 구현 등이 중요한 요소이다. 또한, 원육과 같은 조직감(texured vegetable protein, TVP)을 확보하기 위한 핵심적인 소재개발과 공정기술 개발이 진행 중이다. 이를 위해서 저수분(low moisture meat analogue, LMMA)과 고수분(high meat analogue, HMMA)으로 구분되는 핵심적인 기술을 적용하고 있으며, 압출성형기술(extrusion)을 통한 용도별 조직단백(TVP)을 제조할 수 있다. 압출기의 가열 압착을 통해 단백질 구조 재배열을 시켜 얻어지는 조직단백(TVP)은 일정 부분 건조된 상태로 유통 보관하며 다양한 형태의 완제품 제조에 기본 원료로 사용된다. 최근에는 기존의 저수분 방식 제품의 조직감을 높이기 위하여 압출시 냉각과정에서 60% 함유된 고수분 함유 섬유상 조직 형성기술로 변형 발전되고 있다.
단백질 원료는 대표적으로 콩, 밀, 완두로부터 추출하고 있으며, 쌀, 콩류에서부터 곤충, 해조류, 미생물 등 다양한 원료 이용을 시도하고 있다. 현재 전 세계 식물성 대체육 사용 원료는 콩류를 기반으로 하는 제품의 비중이 57%로 가장 높으며 곡류(grain) 19.5%와 함께 원료의 77%를 차지하고 있다. 기존 밀과 대두가 갖는 글루텐 성분과 GMO 문제를 극복하기 위한 완두, 녹두 등 대안 소재의 접근과 같이 식물성 원료별로 장단점이 극명하여 이를 극복하기 위한 소재 간 조합 및 식물성 첨가물의 연구개발이 필요하다. 조직감을 높이기 위한 달걀, 우유와의 조합이나 관능적 품질을 위한 기존 육제품을 추가하거나 곡류 기반 귀리브랜, 쌀브랜 등을 추가하는 연구가 이루어지고 있다. 공주대 연구팀은 전지콩(full fat soy) 기반 발효 고수분 대체육 연구도 시도하고 있다.
[표 3-48] 식물성 단백질 원료별 장단점 비교
|
식물성 단백질 원료 |
장점 |
단점 |
|
밀 |
식감이 실제 고기와 제일 유사 |
글루텐 |
|
대두 |
가장 일반화된 원료 |
GMO |
|
완두 |
GMO, 글루텐 문제로부터 자유로움 |
식감의 부족 |
|
버섯(균류) |
단백질 함량이 높고 저지방 |
생산과정 및 조건이 까다로움 |
|
조류 |
영양성분 우수 |
냄새와 맛이 좋지 않음 |
출처: 한국과학기술기획평가원, KISTEP 기술동향브리프-대체육, 2021
배양육(세포배양식품)의 경우, 요소기술로는 활용 세포와 이를 배양하기 위한 배지 및 생물반응기 그리고 배양육의 형태와 질감 및 풍미에 영향을 주는 지지체 기술로 구분된다. 대량 생산을 위한 세포배양 등 다양한 원천기술과 경제성이 충분히 확보되지 않아 완성도가 낮은 편이나 미래유망식품으로서 지정되고 관리기준규격에 대한 정부 지원책이 발표되었다.132) 국내에서는 고수율의 줄기세포 개발과 소태아혈청이 아닌 무혈청배지 개발 등 대량 생산을 위한 연구가 엑셀세라퓨틱스, 다나그린, 씨위드, 셀미트 등 스타트업을 중심으로 활발하다. 씨위드 사는 무혈청배지를 개발하여 해조류를 한우 배양육을 생산하는 기술력을 보유하고 있다. 그러나 배양육 판매가 이루어지기까지 규제 불확실성과 산업화 단계에 있는 해외 기술과의 기술격차도 따라잡아야 하는 등 고려해야 할 요소들이 많이 존재한다.
라. 발전 전망
미래 사회에 대한 주요 예측조사133)에 의하면, 위험의 일상화, 인구구조 변화, 디지털전환, 기후위기 등이 지속될 것으로 보인다. 국내에서는 고령화, 인구구조와 라이프 스타일 변화, 식생활 변화로 건강기능식품, 간편식, 특수용도식품, 대체육, 반려동물 식품/기능성 사료 등의 식품시장 성장과 다양화가 이루어질 것으로 전망되었다.134) 국제사회는 기후위기에 본격적으로 대응을 시작하며 친환경 식품시장인 유기농, 재생농업, 식물기반 식품시장이 성장할 것으로 전망135)되고 있으며 우크라이나 사태, 인플레이션으로 원자재 가격이 상승하며 식품 가격이 상승할 것으로 전망되었다. 사회변화와 기술의 발전으로 부상한 푸드테크에 대한 투자와 개발이 확대되어 푸드테크를 기반으로 한 다양한 맞춤형 식품 서비스가 일상으로 들어올 것으로 전망되고 있다. 이에 핵심 원천 기술 및 산업화 연계를 위한 기반기술 연구에 대한 정부 주도의 집중 투자가 필요하며 DTC 가능 유전자의 확대, GMO 식품소재의 활용에 관한 정부의 정책적 판단과 규제혁신 정책이 필요하다. 또한, 지속적인 기술개발과 신사업 개척 및 해외 진출 노력으로 빠르게 성장하고 있는 대기업에 비해 영세한 대부분의 식품기업은 중소기업이며 자체 연구개발 능력이 낮은 수준이어서 혁신성장에 한계를 지니고 있으므로 적극적인 기술개발 및 정책지원이 필요하다.
|
참고자료 |
∙ 농림축산식품부, 제3차 농림식품과학기술 육성 종합계획(2020-2024) 2021년 식품산업진흥 시행계획
∙ Celis-Morales C, Livingstone KM, Marsaux CF, et al., Food4Me Study, Effect of personalized nutrition on health-related behaviour change: evidence from the Food4Me European randomized controlled trial. Int J Epidemiol 2017;46:578-88
∙ Francesco Asnicar 등, Microbiome connections with host metabolism and habitual diet from 1,098 deeply phenotyped individuals. Nature Medicine 27: 321-332, 2021
∙ Zeevi D, Korem T, Zmora N, et al., Personalized nutrition by prediction of glycemic responses, Cell, 2015; 163:1079-1094
∙ Mendes-Soares H, Raveh-Sadka T, Azulay S, et al, Model of personalized postprandial glycemic response to food developed for an Israeli cohort predicts responses in Midwestern American individuals. Am J Clin Nutr. 110: 63-75, 2019
∙ 관계부처 합동, 농식품산업의 혁신성장을 위한 푸드테크 산업발전방안, 2022.12
∙ KISTEP, 국가 마이크로바이옴 이니셔티브 사업, 2022.8
∙ Curr. Top. Lact, Acid Bact, Probiotics 7(1): 14-22, 2021
∙ Kim 등. A Machine Learning Algorithm for Quantitatively Diagnosing Oxidative Stress Risks in Healthy Adult Individuals Based on Health Space Methodology: A Proof-of-Concept Study Using Korean Cross-Sectional Cohort Data. Antioxidants 2021, 10(7), 1132
∙ 한국과학기술기획평가원, KISTEP 기술동향브리프-대체육, 2021
∙ 농식품산업의 혁신성장을 위한 푸드테크 산업 발전방안, 2022.12
∙ 과기정통부, 대한민국 과학기술 미래전략 2045, 2020.10; 과기정통부, 제6회 과학기술 예측조사, 2022.6
∙ 중소벤처기업부, 중소기업 전략기술로드맵 2022-2024; 중소기업 전략기술로드맵 2023-2025; 중소기업 전략기술로드맵 2021-2023
∙ 한국농수산식품유통공사 수출정보분석부, 글로벌 식품시장 2022년 분석 및 2023년 전망, 2022.11
|
|
|
제3장 분야별 연구개발 및 산업 현황 |
|
제4절 환경・해양수산 |
1. 환경생명공학
가. 개요
(1) 환경생명공학의 개념 및 발전 방향
넓은 의미에서 환경생명공학(Environmental biotechnology)은 자연환경을 연구하는 생명공학 그리고 상업적 혹은 공공적 목적을 달성하기 위한 생물공정이라고 정의할 수 있다. 그렇지만 많은 연구자에게 받아들여지는 환경생명공학은 미생물 군집(Microbial community)이 보유한 다양한 기능을 이용해 오염물질 분해, 재생에너지 생산, 유용물질 생산, 병원성 미생물의 확산 방지와 같은 공공 서비스를 제공하는 학문 분야라고 할 수 있다.136) 예를 들면 유기성 폐기물을 분해하여 재생에너지인 바이오 메탄을 합성하는 혐기성 소화 공정은 가수분해, 산생성, 아세트산생성, 메탄생성으로 이어지는 일련의 과정을 거치는데, 각 과정에 관여하는 여러 미생물군(Microbial populations)의 경쟁과 협동으로 이루어지는 생화학 반응이라고 할 수 있다. 따라서 환경생명공학이 목적으로 하는 공공 서비스를 달성하기 위해서는 특정 미생물군이 반응기에 우점화하거나 미생물군의 비율이 적정하게 유지되어야 한다.
그렇다면 어떻게 원하는 미생물 군집을 반응기에 우점하게 할 수 있을까? 일반적인 방법은 특정 미생물군이 경쟁 미생물군보다 선택적 우위에 놓일 수 있도록 반응기의 내부 환경을 조절하는 것이다. 혐기성 소화는 반응기 내부에 산소를 포함한 공기를 차단함으로써 호기성 산화 미생물군의 생존을 억제하고, 중성의 pH 조건에서 일정 기간의 체류 시간을 제공함으로써 혐기성 소화를 담당하는 가수분해, 산생성, 아세트산생성, 메탄생성 미생물군이 적정한 비율로 유지될 수 있도록 하는 것이다. 전통적으로 적정한 환경조건을 유지해 특정한 미생물군을 우점시키기 위한 방법은 주로 경험에 의존하였다. 20세기 초에 개발된 활성슬러지(Activated sludge) 하수처리 공정이 그 좋은 예라고 할 수 있다. 영국의 하수 공학자인 Ardern과 Lockett은 하수를 포함하는 반응기에 공기를 주입하였더니 우연히 하수에 포함된 오염물질을 분해할 수 있는 미생물군(즉, 활성슬러지)을 발견함으로써 활성슬러지 공정이 개발되었다.
앞으로도 환경생명공학은 이러한 우연한 경험에만 의존할 것인가? 그렇지 않다는 것이 최근 환경생명공학자들의 전망이다. 우선 미생물 군집을 보다 빠르고 정밀하게 분석할 수 있는 분자미생물학적 기술이 개발되었다는 것이다. 특히 짧은 시간에 대용량 염기서열분석이 가능한 차세대염기서열분석법 보급은 이 분야의 발전을 가속화시키고 있다. 차세대염기서열분석법의 도움으로 환경조건을 변화시켜가면서 특정 미생물군의 변화를 보다 객관적으로 모니터링하고 분석할 수 있게 된 것이다. 아울러 미생물군 간의 경쟁과 협조를 이론적으로 설명할 수 있는 미생물생태학의 발전은 환경생명공학 시스템과 공정을 과학적 측면에서 이해할 수 있는 발판을 제공하였다. 이러한 분자생물학적 기술의 진보와 미생물생태학적 이론에 기반한 접근은 앞으로 환경생명공학이 효율의 향상을 넘어 보다 다양한 공공적 서비스를 제공할 수 있는 학문으로 거듭날 것으로 기대한다.
(2) 환경생명공학의 범위
오염물질의 분해 혹은 처리는 가장 흔하게 접하는 공공적 가치가 있는 환경생명공학의 분야라고 할 수 있다. 특히 하수처리 공정은 환경생명공학을 이용한 가장 큰 규모의 산업적 응용이다. 서울시 중랑구에 있는 하수처리장(현재는 중랑 물재생센터로 명명됨)은 하루에 처리할 수 있는 하수가 159만 톤에 이르고 있다. 의약품을 생산하거나 맥주를 발효하는 바이오리엑터(Bioreactor)의 크기와 비교하면 하수처리장의 생물반응조(즉, 바이오리엑터)가 얼마나 클지 상상하는 것은 어렵지 않을 것이다. 현대의 하수처리 공정은 활성슬러지 공정에 기반을 두고 있다. 하지만 지금의 하수처리 공정은 개발된 지 100년이 넘은 초기의 공정을 그대로 사용하는 것은 아니다. 방류수 수질기준에 질소, 인과 같은 영양염류가 포함되면서 질소와 인을 대사할 수 있는 미생물군을 농화(Enrichment)시키기 위한 다양한 공정이 추가적으로 개발되었다. 하수처리 이외의 오염물질의 분해를 위한 환경생명공학적 응용사례에는 오염 토양의 정화, 오염 지하수의 처리, 오염 배기가스의 처리 등이 포함된다.
환경생명공학의 두 번째 분야는 재생에너지의 생산이라고 할 수 있다. 앞서 언급하였듯이 혐기성 소화는 다양한 미생물군의 경쟁과 협동의 과정을 거쳐 바이오가스를 생산하는 공정이다. 바이오가스의 주성분은 메탄이므로, 생산된 바이오가스를 정제하여 보일러와 가스엔진을 포함한 다양한 기기의 연료로 사용할 수 있으며, 천연가스 공급망에 연결하여 지역사회에 에너지원으로 제공할 수 있다. 아직 본격적으로 상용화가 이루어지지는 않았지만, 특정 미생물군을 이용한 수소(즉, 바이오 수소)의 생산도 가능하다. 바이오 수소는 광합성 미생물군의 도움으로 빛에너지를 이용해 유기물 혹은 물을 분해하여 수소를 생산하거나 빛이 없는 조건에서 발효 미생물군이 중심이 되어 유기물을 산화하여 수소와 유기산과 같은 부산물을 생산하는 공정으로 나뉜다. 더불어 전도체에 전자를 전달하는 미생물군에 기반한 미생물 연료전지는 오염물을 분해하면서 전기에너지를 생산하는 공정도 최근 많은 주목을 받고 있다.
미생물 군집을 이용해 유용물질을 생산 혹은 회수하는 것은 환경생명공학의 세 번째 분야이다. 아직 상업적 생산은 더디게 진행되고 있지만, 재생 가능한 원료 혹은 하수로부터 생분해성 고분자인 Polyhydroxyalkanoate(PHA)와 Polylactic acid(PLA)를 생산하는 연구가 활발히 진행되고 있다. 또한, 특정 미생물군이 물속에 존재하는 백금과 희토류를 생체 내에 축적하거나 비용해성 형태로 환원시켜 용출시키는 특성을 응용한 생물공정이 학계에 보고되고 있다.
환경생명공학의 네 번째 분야는 병원성 미생물의 확산 방지를 위한 다양한 응용이다. 조류인플루엔자 그리고 중증급성호흡기증후군과 같이 생물테러에 우려가 있는 바이러스 혹은 결핵을 일으키는 세균은 공기를 매개로 전파된다. 이러한 감염성 미생물을 DNA 마이크로어레이를 통해 식별할 수 있는 시스템이 대표적인 예이다. 이와 함께, 하수에 포함된 다양한 병원성 미생물을 신속히 감지하여 지역사회에 유행성 전염병 확산을 방지하는 하수 기반 역학(Wastewater-based epidemiology)도 이 범위에 포함된다.

출처: 저자 작성
[그림 3-98] 미생물 군집을 이용한 환경생명공학의 4개 범위
나. 해외 동향
(1) 오염물 처리 공정의 개발 동향
자연자원의 고갈 및 온실가스 배출 증가로 초래된 기후변화는 오염물 처리 공정개발의 지속가능성을 높이는 방향으로 유도하고 있다. 북유럽과 북미의 경우 하수처리에 소모되는 에너지는 국가 전력생산량의 3%에 달한다. 호기성 미생물군의 서식을 촉진하기 위해 생물반응조에 공기를 공급하는 과정은 하수처리 전체 에너지 소모량의 50%를 상회하므로, 하수처리 기술개발은 공기공급 에너지를 줄이는 데 집중되고 있다. 생물반응조에 공급되는 공기의 70% 이상은 호기성 미생물에 이용되지 못하고 대기(大氣) 중으로 확산되기 때문에, 기술개발의 방향은 공급된 공기의 대부분이 호기성 미생물군이 이용할 수 있도록 하는 것이다. 최근 많은 주목을 받는 기술은 중공사(Hollow fiber) 형태의 가스 분리막 안쪽에 공기를 공급하고 바깥쪽으로 확산하게 함으로써, 공급된 공기가 대부분 중공사 표면에 생물막 형태로 형성된 호기성 미생물군에 의해 이용하게 하는 것이다. 이 기술은 MABR(Membrane aerated biofilm reactor)로 불리고 있으며, Dupont Oxymem, Suez, Fluence 등에서 상용화하였다.
한편 하수처리에서 호기성 질산화 미생물은 오염물 중 하나인 질소를 제거하는 데 중요한 역할을 하는 독립영양 미생물이다. 하지만 이 미생물군을 서식시키기 위해서는 공기공급을 위한 많은 에너지가 소모되므로, 공기공급이 없는 혐기성 조건에서 암모니아를 산화하는 미생물인 아나목스(Anammox) 세균을 이용한 질소 제거 공정이 유럽을 중심으로 확산되고 있다. 아나목스 세균은 암모늄(NH4+)을 전자공여체로 아질산염(NO2-)을 전자수용체로 사용하기 때문에 질소대사 과정에서 산소를 소모하지 않는다. 호기성 질산화 미생물을 이용한 질소제거 공정에 비해, 아나목스 세균을 이용한 질소제거는 산소 소모량이 38%밖에 되지 않는다. 아나목스 세균을 이용해 상업적 질소제거 공정을 이룬 회사는 네덜란드의 Paques와 Triqua International, 미국의 Gradiant Cooperation 그리고 중국의 Qingdao Headwaters Environmental Technology 등이 있다.
유럽연합은 하수처리장의 에너지를 절약하고 유입 하수를 이용해 에너지를 생산할 수 있는 요소기술과 운전 방법 등을 조합해, 에너지를 소비하는 하수처리장이 아닌 에너지를 생산하는 시설개발을 위해 노력하고 있다. POWERSTEP137)으로 명명된 개발 프로젝트는 2015년부터 3년간 진행된 실 규모 연구로 독일의 비영리 물 연구기관인 KWB가 주관이 되어 프랑스 환경기업인 Veolia 그리고 오스트리아의 Wien공대를 비롯해 15개 기관이 공동으로 참여하였다. 이 프로젝트는 아나목스 공정과 같이 실험실에서 구현된 기술들을 유럽의 4개국 6개 실 규모 하수처리시설에서 평가함으로써 상용화를 궁극적인 목적으로 하였다. 프로젝트 수행 결과 하수처리장에서 에너지 순생산은 환상이 아니라 실제로 구현가능 하다는 것을 증명하였다.
(2) 재생에너지 생산의 개발 동향
혐기성 소화를 통해 하수슬러지와 같은 유기성 바이오매스를 분해하여 바이오메탄을 생산하는 공정은 이미 반세기 전에 확립되었다. 그렇지만 바이오메탄 전환효율은 낮은 편이어서 이를 극복하고자 하는 노력이 유럽 국가들을 중심으로 진행되고 있다. 상업적으로 가장 주목받고 있는 방법은 150℃ 정도의 고온과 6bar의 고압 조건에서 유입 바이오매스를 가수분해함으로써 혐기성 소화 효율을 높이는 것이다. 이 기술을 상용화한 노르웨이 Cambi 社138)에 의하면 바이오메탄의 생산이 50%가량 증가하며, 이로 인해 소화슬러지의 탈수성 향상과 소화조의 고부하 운전, 그리고 탄소발자국을 줄일 수 있는 긍정적 효과가 있다는 연구결과가 보고된 바 있다. 또 다른 유입 바이오매스 전처리 방법은 호기성 조건에서 단백질, 지질, 다당의 분해효소를 생산하는 미생물을 활성화시키는 것이다. 이를 통해 유입 바이오매스가 쉽게 소화되어 메탄생성 효율이 증가한다. 글로벌 생명공학기업인 Novozymes 社139)는 바이오매스 전처리에 도움을 주는 여러 미생물을 혼합한 제품을 도축폐수 혐기성 소화에 적용하였을 때 바이오가스 생산수율이 29%까지 증가하였다고 보고한 바 있다.
아직 연구실 수준에 머물러 있지만, 활성탄과 같은 전도성 물질을 통한 종간 직접 전달을 이용한 메탄 생산 기술도 주목할 필요가 있다. 매사추세츠 대학의 Lovley교수 연구팀은 세포 바깥으로 전자를 방출하는 세균(Exoelectrogen)이 전도성 물질에 전자를 내어놓게 되면 전도성 물질에 함께 부착된 메탄생성균(Methanogen)이 전자를 받아 이산화탄소를 환원시켜 메탄을 생산한다는 것이다.140) 이 기작은 메탄생성 속도를 향상시킬 수 있을 뿐만 아니라 메탄 수율도 증가시켜 향후 상용화가 기대되는 기술로 여겨지고 있다.
수소는 그린에너지원으로 각광받고 있지만, 아직 정유공장 혹은 제철소로부터 얻어지는 부생수소와 화석연료를 수증기로 개질하여 생산되는 추출수소가 대부분을 차지한다. 이러한 측면에서 탄소를 배출하지 않는 바이오수소는 많은 주목을 받고 있다. 그렇지만 안정적으로 수소를 고수율로 얻기 어려워 상용화 단계로 진입한 예를 찾기 어렵다. 광합성미생물에 기반해 광분해와 광발효 과정에서 수소가 생산되기도 하지만, 스케일업을 통해 연속적으로 수소를 생산할 수 있는 암 발효가 현재 기술개발의 주류를 이루고 있다. 연속적으로 수소를 안정적으로 생산하기 위해서는 유입기질과 접종원을 포함해 반응기의 구조와 활성 미생물군을 반응기에 고농도로 보유하는 방법이 중요하다고 알려져 있다. 따라서 연구개발 역시 이러한 요인을 최적화하는 방향으로 진행되고 있다.
(3) 유용물질 생산의 개발 동향
단일 미생물을 이용하여 생분해성 고분자를 생산할 수도 있지만, 상대적으로 생산비용이 낮은 미생물 군집에 기반한 방법도 주목받고 있다. 하수처리 과정에 관여하는 Accumulibacter phosphatis와 같은 인(Phosphorus) 제거 미생물군은 혐기와 호기를 교대하는 조건에서 선택적으로 증식하게 된다. 이 미생물군은 혐기 조건에서 휘발성 지방산을 흡수하면서 세포 내에 PHA를 축적하고, 호기 조건에서는 세포 내 PHA를 산화하면서 세포 바깥의 인을 과잉으로 흡수하는 특성을 가진다. PHA를 얻기 위해서는, 혐기 조건에서 PHA를 축적한 미생물을 회수해 PHA를 추출하는 것이다. PHA를 세포 내에 많은 양을 가지게 하도록 다양한 생물공정과 반응기가 제안되었다. 이 방법은 화석연료 유래 고분자의 수요를 대체할 수 있는 대안으로 부상하면서 꾸준한 연구개발과 상용화가 시도되고 있다.
젖산(Lactic acid)은 발효과정을 거치게 되면 L-형태, D-형태, 그리고 L과 R 라세믹 혼합체의 형태로 만들어진다. PLA는 주로 L-형태 젖산의 중합반응으로 생성되므로, 발효과정에서 L-형태의 젖산을 고수율로 확보하는 것이 PLA의 생산성에 영향을 미친다. 염분농도가 높은 음식물 폐수나 하수슬러지를 기질로 사용하여 발효를 진행하게 되면, 기질에 포함된 미생물의 다양성을 떨어뜨리며 미생물 군집의 변화를 일으켜 L-형태의 젖산을 생산하는 미생물이 우점하는 것으로 알려졌다.141) 이러한 접근을 바탕으로 앞으로 상용화 시도가 예상된다.
(4) 병원성 미생물의 확산 방지
지역주민이 생활하면서 배출하는 하수에는 인간을 숙주로 하는 병원성 미생물(특히, 바이러스)의 종류와 농도 정보를 포함하고 있다. 하수를 이용하게 되면 개인정보의 동의를 구할 필요가 없고 저렴한 비용으로 신속하게 병원성 미생물의 모니터링이 가능하다. 특히, 감염병이 확산하기 전에 신속히 감지할 수 있으며 변이종이 발생하는지 추적할 수 있다는 장점도 있다. 지난 수년간 전 세계적 코로나19 팬데믹으로 이 바이러스가 어떻게 지역사회로 확산하는지 그리고 확산을 어떻게 낮출 수 있는지에 대한 국가적 관심이 고조되고 있는 상황에서, 하수 기반 역학이 주목받는 것은 당연할 수 있겠다. 코로나19 바이러스의 경우, 하수로부터 바이러스를 회수하고 농축하는 방법이 아직 최적화되어 있지 않았으며, 표준 시료 채취 방법, 감염인구 표준화, 도덕적 가이드라인도 확립되지 않았지만, 하수 기반 역학의 효용성은 여러 연구자에 의해 잠재력이 증명되고 있다.142)
출처: Polo, D. et al., Making waves: wastewater-based epidemiology for COVID-19 - approaches and challenges for surveillance and prediction., Water Research 186(1): 116404, 2020
[그림 3-99] 지역사회 코로나19 감시에 사용되는 하수 기반 역학의 접근방식
다. 국내 현황
환경생명공학의 분야 중 우리나라는 오염물 분해 및 처리와 관련하여 연구 및 산업적 적용 측면에서 선진국과 비교해 역량과 기술의 수준 차이는 크지 않다는 것이 중론이다. 지난 20여 년간 과기정통부와 환경부를 중심으로 상용화를 위한 대규모 연구사업이 진행되면서 생물학적 하수처리 기술은 크게 발전하였다. 이러한 연구사업은 그동안 뒤처졌던 공학적 설계 및 운영 기술을 선진국 수준으로 끌어올리고, 이미 해외에서 개발되었던 공정을 국내 현실에 적합하도록 최적화하는 방향으로 진행되었다. 이러한 연구개발 성과를 바탕으로 국내의 엔지니어링 및 건설사는 개발도상국의 환경문제를 해결하는 공공 프로젝트에 참여하는 수준에 이르렀다. 이러한 성공모델을 기반으로 미생물 군집을 이용한 재생에너지의 생산, 유용물질 생산, 그리고 병원성 미생물 확산 방지 분야에도 정부 주도로 많은 연구비가 투입되고 있다.
아나목스(Anammox) 미생물을 이용한 저에너지 질소제거 공정은 삼성엔지니어링, GS건설, 부강테크, 삼진정밀 등이 대학과 공동으로 연구개발을 수행하고 있다. 특히, 중소기업인 부강테크는 아질산염의 생산과 아나목스 반응을 분리한 2단 탈암모니아 공정을 개발하여 부산시 녹산 하수처리장의 반류수를 처리하는데 응용하였다. 한편, SK에코플랜트와 퓨어엔비텍은 MABR 기술을 상용화하기 위해 전략적 제휴를 맺고, 기술개발의 성능을 입증하기 위해 안산 하수처리장에서 파일럿 테스트를 실시하고 있다. 바이오메탄 생산을 극대화하기 위해 슬러지를 전처리하는 기술에 대해서도 국내 여러 기업과 대학에서 연구개발에 매진하고 있다. 잠재력이 큰 바이오수소 생산은 아직 상업화되지는 않았지만, 연구재단을 통해 2022년 연구 컨소시엄이 형성되어 상용화를 위한 가능성을 타진하고 있다. 미생물 군집이 아닌 단일 미생물을 이용한 바이오수소 생산은 산업화 상용화 플랜트 수준에 근접하였다. 이 기술은 한국해양과학기술원에서 발굴한 심해 열수구 미생물인 써모코서스(Thermococcus)를 이용해 대기오염물질인 일산화탄소를 대사하면서 바이오수소를 생산하는 공정이다. 하수 기반 역학을 이용해 병원성 미생물의 감시에 관한 연구도 활발히 진행되고 있는데, 고려대와 수원대 연구진이 코로나19 바이러스를 비롯해 다양한 병원성 세균의 지역사회 확산에 대한 감시체계를 구축하는 연구를 진행하고 있다.
타 산업 분야와 마찬가지로 국내의 환경생명공학 분야도 북미와 유럽의 기술을 빠르게 추격하는 것을 넘어 새로운 지식을 창출하고 이를 바탕으로 새로운 생물공정을 개발하는 수준에는 도달하지 못하고 있다. 환경생명공학 분야의 선도국가로 부상하기 위해서는 미래사회를 견인할 원천기술의 확보와 개발이 필요한 상황이다.
라. 발전 전망
(1) 미생물생태학의 역할
미생물생태학은 미생물 군집의 조성과 미생물 군집이 환경과 어떠한 상호작용을 수행하는지 이해하는 과학의 한 분야이다. Rittmann 등143)에 의하면 미생물생태학은 어떠한 미생물이 군집을 구성하며, 군집을 조성하는 각각의 미생물은 어떠한 대사기능을 보유하고 있는지, 그리고 환경을 변화시키는데 어느 미생물이 중요한 역할을 하는지 연구하는 학문으로 정의한다. 아울러 미생물생태학은 미생물 군집을 구성하는 미생물 간의 상호작용 그리고 미생물과 환경의 상관관계를 규명하는 것을 목적으로 한다. 이러한 미생물생태학의 연구를 위해서는 환경의 변화에 따라 미생물 군집의 조성과 기능의 변화를 조사하는 과정이 필요하다. 이를 위해 전통적으로 배양에 의존한 방법을 사용했지만, 부정확하며 시간도 오래 소요되는 매우 지루한 과정이었다. 그렇지만 최근의 차세대염기서열분석법의 비약적 발전과 더불어 컴퓨팅 파워의 증가 및 바이오인포메틱스의 도움으로 미생물 군집의 조성과 기능을 단시간에 더욱 객관적으로 분석할 수 있게 되었다. 이러한 분위기에서 미생물생태학은 매우 급속하게 발전하게 되었다.
환경과 미생물 군집의 상호작용을 연구하는 미생물생태학의 발전은 환경생명공학이 다루는 다양한 분야를 보다 과학적으로 해석하고 성능을 향상하는데 밑거름을 제공하고 있다. 최근에 개발된 질소제거를 위한 아나목스 공정이 좋은 예가 될 수 있다. 아나목스 반응에 관여하는 미생물은 유입 하수에 포함된 암모늄(NH4+)과 암모늄산화 미생물이 제공하는 아질산염(NO2-)을 이용하여 서식하는데, 아질산염을 질산염(NO3-)으로 산화하는 아질산염 산화 미생물의 성장이 저해되어야만 아나목스 미생물이 성장할 수 있다. 이러한 미생물 간의 경쟁과 협동은 비(非)배양 조건에서 특정 미생물을 확인하고 정량하는 분석방법과 메타게놈 분석방법 등으로 해석할 수 있었다.
(2) 마이크로바이옴 엔지니어링의 부상
환경을 변화시켜가면서 특정 미생물군을 반응기에 우점시키는 방법을 넘어, 적극적으로 마이크로바이옴을 조작하여 원하는 기능을 가지는 시스템을 구현할 수 있는 마이크로바이옴 엔지니어링 개념이 최근 주목을 받고 있다. 환경변화를 이루어 특정 미생물군이 선택적 우위를 갖게 하는 전통적인 접근법은 많은 경우 의도와는 다르게 작동할 수 있어서 최적화시키기에 어려움이 있으며, 목적에 맞는 정밀한 조작과 제어를 하기에는 제한적인 측면이 있다. 최근에 개발된 대용량 염기서열 분석법, 바이오인포매틱스, 유전자 조작기술 등의 다양한 분자 미생물적 기법을 생물공정에 활용하여 마이크로바이옴의 구성원 간의 상호작용을 설계하고 이를 조작함으로써, 원하는 대사경로를 가진 합성 마이크로바이옴 생물공정 개발이 시도되고 있다. Lawson 등144)은 마이크로바이옴 엔지니어링을 위해 설계(Design)-구축(Build)-평가(Test)-학습(Learn) 순환법을 제안하였다. 예를 들어, 셀룰로오스로부터 유용물질 생산을 위해 상향식 접근에 기반한 설계-구축-평가-학습 순환법을 설명해 보자. 설계단계에서는 우선 유용물질을 생산하기 위한 미생물 파트너를 정의하기 위해 대사모델링을 이용해 상호작용하는 미생물을 발굴한다. 이때 메타게놈으로부터 얻은 유전자와 이를 자동으로 수행할 수 있는 기술이 접목된다. 아울러 반응기 해석모델의 도움으로 성장과 활성이 우수한 미생물 파트너의 조합을 정의할 수 있다. 구축단계에서는 설계단계에서 정의한 미생물의 여러 조합을 구성하고 조합을 이룬 군집을 농축하고 분리한다. 미세유체장치(Microfluidic device)나 로봇을 이용한다면 대량으로 조합을 구성할 수 있다. 평가단계에서는 조합의 기능과 안정성을 확인한다. 신속히 유용물질을 생산하는 미생물 조합을 찾기 위해서는 오믹스(Omics) 기술과 결합한 고속표현형선별법(High- throughput phenotypic screening)이 사용된다. 학습단계에서는 유용산물을 생산하는데 기능하는 미생물 상호관계를 확인한다. 대사흐름분석(Metabolic flux analysis)을 이용해 조합조건에서 자라는 미생물의 대사를 분석함으로써 유용물질 생산의 기작과 미생물 간의 상호작용을 이해할 수 있다. 이를 통해 선별된 마이크로바이옴의 환경조건을 최적화할 수 있다. 앞으로는 인위적으로 대사경로를 변경한 미생물을 조합하여 적응진화(Adaptive evolution)를 거치게 한 후 원하는 기능을 극대화하는, 마이크로바이옴 엔지니어링 접근법도 제안될 것으로 전망한다.

출처: Lawson, C. E. et al. Common principles and best practices for engineering microbiomes, Nature Revies Microbiology, 17: 725, 2019
[그림 3-100] Lawson 등이 제안한 마이크로바이옴 엔지니어링을 위한 설계-구축-평가-학습 주기 접근법
2. 해양생명공학
가. 개요
(1) 해양생명공학의 정의
경제협력개발기구(OECD)가 발표한 생명공학의 정의는 지식, 재화 및 서비스의 생산을 목적으로 생물 또는 소재를 변형시키는 과정에서 생물체, 생체 유래 물질 및 생물학적 모델에 과학과 기술을 적용하는 활동을 말하며, 이에 따라 해양생명공학은 상기의 과정에서 해양 유래 생명자원을 근원으로 하거나 적용 대상으로 하는 시도로 정의된다.145) 해양생명공학 분야의 연구개발이 UN에서 수립한 지속가능한 발전 계획146)의 17개 항목 중 SDG 4, 5와 16을 제외한 14개 항목의 달성에 기여할 수 있다고 평가되며,147) 경제협력개발기구는 해양생명공학 산업을 질병, 자원, 환경 등 글로벌 문제를 해결하고 혁신 성장 및 일자리를 창출할 수 있는 미래 산업으로 평가하였다. 해양생물 유래의 기능성 물질 연구를 통해 질환 효능 천연물이나 기능성 효소나 항체 등의 개발이 가능하고, 생물자원 증식 기술을 통해 식량 자원의 확보에 기여할 수 있으며, 일차 대사산물에 대한 연구를 통해 대체 에너지 및 플라스틱 소재 개발의 토대를 제공할 뿐만 아니라 해양생물의 유전체나 생태 분석을 통해 연안이나 대양의 환경을 관측하거나 개선하는 데에 핵심적인 자료들을 제공할 수 있다. 이 때문에 해양생명공학은 소위 블루바이오로도 일컬어지며 유럽연합에서 제시한 블루이코노미의 핵심적인 산업 영역으로 포함되기도 하였다. 그럼에도 불구하고 해양생명공학 연구개발은 아직 태동기에 있는 것으로 평가되면서 세계적인 수준에서도 연구개발 인프라에 대한 재정적 투자가 충분치 않은 점이 극복되어야 할 현안으로 분석되어 정부 차원의 투자나 공공-민간 파트너십 구축의 중요성이 강조되고 있다.148)
(2) 해양생명공학 연구개발 분야
해양생명공학이 포괄하는 범위와 관련된 연구개발 현황을 정확하기 이해하기 위하여 개발 혹은 산업 분야에 대한 분류를 명확히 할 필요가 있다. 빠르게 발전하는 연구개발과 기술 수준을 반영할 수 있는 통일적인 분류 체계는 존재하지 않지만, 산업동향 보고서나 국제기구, 연구기관들의 보고서를 참조하면 주로 관련 연구개발 분야를 근원 생물이나 개발을 목적으로 하는 제품 중심으로 개발 영역을 분류하여 현황을 분석하는 사례들을 흔히 접할 수 있다. 근원 생물의 경우 해조류와 세균에서 유래하는 물질이나 유전자 염기서열 정보를 활용한 기술과 제품 개발이 절대적으로 우세하며 그 외 불가사리나 성게 등 극피동물(echinoderm), 어류, 진균을 활용한 개발이 그 뒤를 따른다. 개발을 목적으로 하는 제품이나 서비스의 범위를 살펴보면 식품, 의약, 에너지와 효소나 센서 등을 포함하는 기타 소재 등이 포함된다.149)
국내에서는 효율적인 연구개발 지원을 위한 정책 수립의 일환으로 해양생명공학 기술 분류 체계를 확립하려는 시도가 있었다. 최초로 그 예가 보고된 것은 ‘제2차 생명공학육성 기본계획(2007∼2016)’으로 확인된다. 여기서 ‘해양수산생명공학’은 해양수산생명체의 기능과 정보의 이용으로 고기능・고부가가치 신소재를 개발하며 생물종 다양성을 보존하는 분야로 정의되었으며, 포괄하는 범위는 해양수산생물 분자 유전체 규명/조절 기능, 초기능 해양수산 신품종 개발 및 대량생산 기술, 해양수산 신기능성 소재 개발 및 활용 기술, 해양수산생물 환경보전 기술로 정리되어 있다. 2008년에 발표된 해양생명공학 육성 기본계획(Blue-bio 2016)에서는 좀 더 세부적인 내용들이 포함되었는데, 해양생명공학의 기술 분야를 해양생물 기반 기술, 해양생물 생산기술, 해양신소재 개발기술 및 해양생태환경 보전기술로 구분하여 각 항목의 주요 내용과 주요한 예들이 제시되었다.
해양 신산업으로서의 해양생명공학 산업의 중요성이 부각되고 이에 대한 정부의 투자 필요성이 강조되면서 중점투자 분야 도출을 위한 산업 분류 체계 도출의 필요성이 인지되었는데, 2017년에 발표된 보고서에서 상기의 정부 계획과 함께 바이오산업 분류(산업통상자원부), 생명공학기술 분류체계(생명공학정책연구센터), 해양바이오 산업 분류체계(KMI) 등에 기반하여 제시한 해양바이오 산업 분류 체계는 다음 표와 같다.150) 제1차 해양수산과학기술 육성 기본계획에 따라 국내 해양바이오 산업 현황에 대한 정확한 진단을 위해 2016년부터 해양바이오산업 실태조사가 정기적으로 진행되고 있는데, 기술 개발과 산업 육성이 필요한 분야를 정확히 도출하기 위하여 2021년까지 진행된 4차 조사까지 다음 표의 산업 분류 체계가 활용되고 있다.
[표 3-49] 해양바이오 산업 분류(2017)
|
산업군 |
정 의 |
|
해양바이오 자원 |
해양생물자원 또는 해양생명공학기술을 이용하여 새로운 기능을 위한 해양생명자원을 발굴, 제작하여 재배 또는 사육하는 산업 활동 |
|
해양바이오 식품 |
해양생명자원으로부터 분리 정제기술 혹은 해양생명공학기술을 연구개발 또는 생산과정에 이용하여 각종 음식료품 및 동물사료, 동식물성 유지 등을 제조 및 수입, 연구・개발하는 산업 활동 |
|
해양바이오 화장품 |
해양생명자원으로부터 분리 정제기술 혹은 해양생명공학기술을 연구개발 또는 생산과정에 이용하여 유용한 기능성(미백, 주름개선, 자외선 차단 등)을 보유한 화장품을 제조 및 수입, 연구・개발하는 산업 활동 |
|
해양바이오 의약 |
해양생명자원으로부터 분리 정제기술 혹은 해양생명공학기술을 연구개발 또는 생산과정에 이용하여 인간 또는 동물의 각종 질병을 진단, 예방, 치료하는데 사용되는 의약품 및 의료용품을 제조 및 수입, 연구・개발하는 산업 활동 |
|
해양바이오 화학 |
해양생명공학기술 혹은 분리정제기술을 연구개발 또는 생산과정에 이용하여 해양생물체로부터 화합물을 제조 및 수입, 연구・개발하는 산업 활동 |
|
해양바이오 에너지 |
해양생명공학기술 혹은 분리정제기술을 연구개발 또는 생산과정에 이용하여 신재생 에너지를 획득하는 산업 활동 |
|
해양바이오 환경 |
해양 생물체 또는 해양 생물체에서 유래된 물질, 혹은 해양바이오 기술을 연구・개발 또는 생산 과정에 이용하여 환경정화, 환경복원, 환경오염 저감 및 방지 목적의 물질, 시스템을 제조 및 수입, 연구・개발하거나 이를 이용한 오염진단 및 측정서비스, 시설을 건설하는 활동 |
|
해양바이오 기기장비 |
해양 생물체에서 유래된 물질이나 해양바이오 기술이 포함된 연구・개발 및 산업적 응용을 목적으로 활용되는 장비 및 기기, 공정용 부품을 제조 및 수입, 연구・개발하는 산업 활동 |
|
해양바이오 연구개발 및 서비스 |
해양바이오 기술을 이용하여 연구・개발을 대행하거나 분석평가 관련 컨설팅 및 생물정보를 제공하는 산업 활동 (타 기업으로부터 수탁받아 해양바이오 제품을 제조하는 활동 제외 |
|
산업소재 제공산업 |
해양생명자원에 해양생명공학기술을 이용하여, 제품 생산활동에 필요한 표준화 및 대량생산공정을 개발하며, 연구 및 제품생산 기업에 판매・제공하는 산업 |
출처: 장덕희 외, 최종보고서-‘해양바이오 전략소재 개발 및 상용화 사업’ 기획연구(해양수산과학기술진흥원), 2017
나. 해외 동향
(1) 해양생명공학산업 글로벌 시장 규모와 선도 기업
2019년 발표된 산업 동향 보고서에 의하면 2018년 기준 해양생명공학산업 시장 규모는 40억 1,200만 달러에 달하며 2025년까지 연평균 8.1%씩 성장하여 69억 1,300만 달러 규모에 달할 것으로 예측된다. 이 중 눈에 띄는 것은 단일 분야 중 의약이 차지하고 있는 비중이다. 전체 해양생명공학 산업 중 의약 부문이 차지하는 비중은 이미 29% 이상에 달하며 시장 규모의 증가율도 전체 산업의 평균치 8.1%를 넘어서는 수준이다.151)
[표 3-50] 해양바이오 산업군별 시장 규모 추정(2018 대비 2025)
(단위: 백 만 달러, %)
|
산업군 |
2018 |
2025 |
2018 비중(%) |
2025 비중(%) |
연평균 증가율(%) |
|
식품 |
650.9 |
1,124.8 |
16.2% |
16.3% |
8.1% |
|
의약 |
1,172.9 |
2,055.0 |
29.2% |
29.7% |
8.3% |
|
화장품 |
314.3 |
544.4 |
7.8% |
7.9% |
8.2% |
|
화학 |
241.2 |
429.0 |
6.0% |
6.2% |
8.6% |
|
에너지 |
322.6 |
552.5 |
8.0% |
8.0% |
8.0% |
|
기타 |
1,310.1 |
2,207.7 |
32.7% |
31.9% |
7.7% |
|
합계 |
4,012.0 |
6,913.4 |
100% |
100% |
8.1% |
출처: Energias Market Research, Global Marine Biotechnology Market, 2019
현재 글로벌 해양생명공학 산업은 몇 개의 선도 기업에 의해서 그 시장이 점유되고 있다. 2021년 기준 전체 해양생명공학 산업 시장에서 가장 높은 시장 점유율을 나타내는 회사는 파마마(PharmarMar, 4.9%) 社이다.152)
파마마 社는 이름에서 유추할 수 있듯이 해양소재 기반의 신약개발 전문 기업으로 해양 천연물 유래 항암제 개발을 진행하고 있다. 스페인에 본사를 두고 있으며 1986년 설립 이후 지속적으로 해면이나 멍게 등 해양 무척추동물 유래 천연물을 활용한 신약개발 영역에 대한 특화된 기술을 보유하고 있는데, 피낭동물(Ecteinasida trubinata)로부터 유래한 트라벡테딘(trabectedin) 화합물의 난소암 등 치료제로서의 승인을 획득하였고(상품명: 욘델리스(Yondelis)), 2020년 유사 골격을 가지는 유도체 루비텍테딘(lubinectedin, 상품명: 젭젤카(Zepzelca))이 폐암 치료제로서 미국 식품의약국(FDA) 승인을 획득하였다. 다른 종의 피낭동물(Aplidium albican)로부터 분리된 다이뎀닌(didemnin)계 화합물의 경우, 이들 유도체 중 하나인 플리티뎁신(plitidepsin, 상품명: 아플리딘(aplidin))의 다발성 골수종에 대한 임상실험이 진행되고 있었다. 이 물질은 약물재창출 연구를 통해 렘데시비르(remdsivir)를 능가하는 코로나19 치료 효능이 있음이 발표되면서 많은 관심을 끌었지만 이후의 개발 현황에 대해서는 확인된 바가 없다.
파마마 사에 필적하는 높은 시장 점유율인 4.8%를 나타내는 회사가 네델란드의 에이커바이오마린(Aker Biomaine AS) 社인데, 크릴 오일과 이로부터 유래하는 아스타잔틴, 오메가-3 지방산, 단백질 등 개발하고 있으며, 주력 영역인 최근 크릴 오일 제품 관련 할랄 승인으로 시장 점유율이 가파르게 성장한 것으로 분석된다.
이외 해양생물 유래 영양이나 기능성 성분 비타민, 스테롤, 오메가-3 지방산 등을 개발 중인 바스프(BASF) 社, 해조류 유래 다당체 캐라지난(carrageenan)을 활용한 식품, 의약 소재를 개발 중인 씨피켈코(CP Kelco) 社, 오메가-3 지방산 관련 제품 개발의 디에스엠(Royal DSM N. V.) 社, 미세조류 바이오매스나 이로부터 정제되는 아스타잔틴 등의 화합물을 주성분으로 하는 기능성 식품 소재 개발의 시아노테크(Cyanotech corporation) 社 등의 회사에서 해양생명소재를 기반으로 하는 식품, 의약, 의료기기 소재 등을 개발, 생산하고 있으며, 일본 제약사 에이사이(Eisai) 社에서는 해양천연물을 기반으로 하는 신약개발 파이프라인을 지속적으로 관리하고 있다.
특히 해양천연물 기반 신약개발과 관련한 현재의 추이를 보면 관련 산업 내에서 의약 분야의 산업 성장세를 좀 더 명확하게 확인할 수 있다. 해면으로부터 유래한 뉴클레오사이드(nucleoside)계 화합물로부터 개발된 시타라빈(cytarabine)이 해양천연물 신약으로서는 최초로 미국 식품의약국의 승인을 획득한 이후 2020년까지 해양천연물 신약이 각국에서 승인을 받은 현황을 10년 단위로 나누어 살펴보면 다음 그림과 같다. 1960∼1990년까지는 각 10년 당 한 개의 해양천연물이 승인되었고, 1991∼2000년에는 2개, 2001∼2010년에는 4개가 승인을 받았는데, 가장 최근의 10년 동안에는 10개의 신약이 승인된 것으로 확인된다. 이러한 최근의 급격한 성장세는 해양천연물 개발과 관련한 다양한 기술들의 진보가 이를 견인했다고 볼 수 있는데, 구체적으로는 해양천연물의 분리, 정제 및 화학적 변환을 통한 가공 기술의 발달과 높은 세포독성을 항암제 개발로 연결시킬 수 있는 항체-약물 접합 기술의 발달이다. 전자는 글락소스미스클라인(GlaxoSmithKlein) 社에서 개발, 판매한 고지질혈증 치료제 로바자(lovaza) 이후에 오메가-3 지방산의 다양한 유도체들의 개발로 이어졌던 사례에서 확인할 수 있다. 최근 각각 다른 화학 구조와 제형의 오메가-3 지방산 유도체 배세파(vascepa), 에파노바(epanova), 오메가벤(omegaven) 등이 미국 식품의약국 승인을 획득하였다. 후자의 경우는 해양 무척추동물 군소로부터 분리된 천연물 오리스타틴(auristatin)의 유도체를 암세포에 선택적으로 전달시키는 기술로서 항체-약물 접합 기술에 관한 것이다. 2011년 림프종 치료제로 승인을 획득한 최초의 항체-약물 접합 신약 애드세트리스(adcetris) 이후 지속적인 개발이 진행되어 2019년에서 2020년 사이 폴리비(polivy), 파드세브(padcev), 블렌렙(blenrep) 등 다양한 해양천연물 유도체-항체 결합체가 항암제로서의 신약 승인을 획득하였다.

출처: Energias Market Research, Global Marine Biotechnology Market, 2019
[그림 3-101] 해양 유래 신약 승인 추세(1961∼2020)
2021년 기준 미국에서 임상 단계에 진입한 해양천연물 기반 신약은 36개 정도로 추산되며 이 중 5종이 임상 3상에 진입한 것으로 확인된다.153) 높은 세포독성, 신경독성을 나타내는 해양천연물의 특성을 고려하여 주로 암과 신경계 질환 치료제에 대한 임상이 주를 이루고 있다.
(3) 각국의 해양생명공학 연구개발 정부 투자 현황
북미와 유럽의 경우 몇 개의 선도적인 기업들이 기술 개발을 이끌고 시장을 점유하고 있지만, 전술한 바와 같이 전반적인 산업 기반을 확고하게 구축하기 위한 각국 정부의 투자가 활발하다.
(가) 미국
미국은 국가과학재단(National Science Foundation, NSF)과 국립해양대기국(National Oceanic and Atmospheric Administration, NOAA)에서 해양생명공학 분야 연구에 대한 투자를 진행하고 있다. 국가과학재단에서는 특히 미생물/마이크로바이옴 관련한 연구개발(MO(microbiology observation), MIP(microbial interactions and processes)) 등 상당 부분이 해양생물과 관련한 프로젝트에 투입되고 있는 것으로 알려져 있으며, 국립해양대기국은 심해를 아우르는 생명자원 탐사 프로젝트를 수행, 지원하여 자원을 확보하고 민간에 분양하는 역할을 담당하고 있다.
또한 자국 내 다양한 해양생명공학 특화 연구기관의 설립과 운영을 지원하고 있다. 대표적으로는 스크립스 해양연구소(Scripps Institution of Oceanography) 내 해양생명공학연구센터 (Center for Marine Biotechnology and Biomedicine, CMBB)가 있는데, 생물과 환경에 작용하는 천연물의 발굴과 작용 기전 연구, 미생물, 미세조류와 (메타)게놈 등의 연구 영역에서 세계적인 선도 기관이다. 여러 다국적 제약 기업과의 협업으로 신약 선도, 후보물질 개발을 진행하고 있으며 관련 기술이전 실적을 내고 있다. 플로리다 하버 브랜치 연구소(the Harbor Branch Institute, HBOI) 역시 특화된 연구조직(the Center for marine Biomedical and Biotechnology Research, CMBBR)을 설치하여 대체 에너지와 신약개발 연구를 수행하고 있으며, 국립해양대기국과 주 정부 등이 협력하여 설립한 해양 분야 특화 연구기관(the National Institute for Undersea Science and Technology, NIUST)는 생명공학 분야 특화 연구 조직(Ocean Biotechnology Center and Repository, OBCR)을 설립하여 해양 유래 생리활성 추출물 라이브러리를 구축하고 있는데 의약이나 기능성 소재로 개발될 수 있는 화합물들에 대한 분석과 규명 연구가 진행되고 있다. 듀크대(Duke University)를 비롯한 5개 대학과 주 정부 기관의 출자로 운영되는 생명공학 연구기관(the North Carolina Biotechnology Center, NCBC)의 해양 분야 특화 연구 조직(Marine Biotechnology Center of Innovation, MBCOI)은 의약 및 진단 소재, 대체 에너지, 식품 개발 연구를 진행하고 있다.
(나) 유럽연합
유럽 각국은 주로 유럽연합을 통해 공동의 예산을 조성하고 장기적인 발전 방향을 수립하여 연구개발 투자를 진행하고 있는데, 연합 내외 국가 간 협력이나 연구 시설이나 연구선(research vessel) 등 공동의 인프라 구축이 지속적으로 진행되고 있다. 유럽연합의 연구 지원 협력체(ERA-NET)는 7차 프로그램에서 해양생명공학 분야 독자 프로그램(ERA-MBT)을 구축하였는데, 이는 2012년에 수립되고 2018년에 개정된 유럽연합의 바이오경제 전략(Eruopean Bioeconomoy Strategy)을 반영하여 해양자원 탐사, 바이오매스 생산과 처리, 개발 제품의 혁신과 차별화 등을 목표로 해양생명공학 기술 개발과 관련한 단기(2016∼2020)와 장기(2020∼2030) 계획을 제시하였다. 이에 따른 다양한 연구개발 지원이 다양한 형태 (MarBEF, MARFISH, AMPERA, MarineEra, JPI Oceans 등)로 진행되고 있다.
상기의 지원 등을 통해 구축된 대표적인 연구 인프라가 ‘유럽 해양생물연구 인프라 클러스터(European Marine Biological Research Infrastructure Cluster, EMBRIC)’인데, 해양 동물과 균류 등에 특성화된 데이터베이스 및 연구 인프라(European Marine Biological Resource Centre, EMBRC)를 구축하여 공유하고 있으며 다른 연구개발 컨소시엄(European aquaculture(AQUAEXCEL), bioinformatics(ELIXIR), microbial resources(MIRRI), research and innovation policy studies(RISIS))과 협력하여 그 활용성을 확장하고 있다.
(다) 중국과 일본
중국 정부는 ‘전국과학기술흥해계획(2016∼2020)’에서 해양바이오 의약품, 첨단 장비, 신소재, 환경보호 관련 해양 산업 육성을 위해 해양과학기술 성과의 산업 전환율 55%, 해양 경제 기여도 60%를 구체적인 목표로 설정하였다. 2012년 시작한 해양천연물 산업화 혁신 협동 프로그램은 과학기술부, 농림부, 정책연구소 등 범부처 사업으로 다양한 연구기관과 기업이 참여하고 있으며, 해양천연물의 발굴과 효능 분석을 통한 한의학 융합 제품 개발 지원을 위해 국가 해양바이오 산업단지를 조성하여 기업 육성을 지원하고 있다.
일본은 제3차 해양기본계획(2018)에서 해양 신산업 창출을 위한 심해 해양생물자원 확보와 관련 인프라 구축이 필요함을 강조하였고, 2019년 바이오전략(Bio-strategy)에서 생명공학 기반의 바이오경제 실현을 목표로 환경문제, 식량 공급, 의약품과 에너지 소재 개발을 위한 지속 가능한 해양생물자원의 이용 계획을 발표하였다. 이에 국가연구기관 일본해양연구개발기구(JASTEC)는 심해 생물자원 확보 및 종합 시스템 운영을 위해 전문 기관(Research Center for Bioscience and Nanoscience)을 설립하여 운영하고 있고, 국제해양탐사프로그램(Integrated Ocean Drilling Program, IODP)을 통해 심해 미생물 자원 확보와 생물다양성이 높은 지역(Biodiversity hot-spot) 국가 연안에서의 생물자원 확보를 위해 연간 최소 150만 달러 규모의 투자를 진행하고 있다.
다. 국내 현황
(1) 해양바이오 산업 현황
국내 산업 현황은 ‘제1차 해양수산과학기술 육성 기본계획’에 따라 해양바이오 산업 관련 정책의 지속적인 정책 마련과 시행을 위해 진행되고 있는 ‘해양바이오산업 실태조사’를 통해 체계적인 정리와 분석이 진행되고 있다. 2017년 시범 조사 이후 2021년까지 3차의 정례 조사가 진행되었으며, 2020년의 현황을 분석한 마지막 조사에서는 407개 기업을 모집단으로 169개 기업에 대한 조사가 완료되었다. 4차 조사가 진행되는 동안의 변화 추이를 살펴보면 업체 수 기준 의약과 화학 분야 기업이 늘어난 데 반해 2018년 조사에서 가장 많은 비중(45%)을 차지했던 식품 분야의 비중이 줄어든 것으로 관련 산업의 구조가 고부가가치 산업으로 재편되고 있음을 확인할 수 있다.
2019년에 대하여 2020년에 발표된 2차 조사 결과는 당시의 해양바이오 산업의 열악한 현황을 시사하였는데, 해양바이오 분야를 차지하는 대부분의 기업이 영세기업으로 소재 확보 곤란, 해양소재에 대한 임상 정보 부족, 관련 전문인력과 자금 부족 등의 문제를 겪고 있는 것이 확인되었다. 이에 정부에서는 2021년에 ‘해양바이오산업 활성화 기본계획(2021∼2030)’을 수립하여 발표하였는데, 산업 기반 조성과 해양바이오 연구개발 혁신을 해양바이오 산업 육성을 위한 2대 전략으로 설정하고, 이에 따른 중점 추진 과제를 도출하였다.
[표 3-51] 해양바이오 기업 현황 중 분야별 현황(2020년 기준)
(단위 : 백만 원, %)
|
분 야 |
사업체 수(비율) |
해양바이오 매출액(비율) |
||
|
2019 |
2020 |
2019 |
2020 |
|
|
사업체 전체 |
403 (100.0) |
407 (100.0) |
615,317 (100.0) |
640,583 (100.0) |
|
자원 |
12 (3.0) |
13 (3.2) |
9,799 (1.6) |
6,738 (1.1) |
|
식품 |
173 (42.9) |
145 (35.6) |
388,749 (63.2) |
358,784 (56.0) |
|
의약 |
84 (20.8) |
106 (26.0) |
55,581 (9.0) |
113,476 (17.7) |
|
화학 |
112 (27.8) |
126 (31.0) |
151,701 (24.7) |
150,699 (23.5) |
|
에너지/환경 |
8 (2.0) |
5 (1.2) |
2,034 (0.3) |
1,010 (0.2) |
|
기기장비 |
8 (2.0) |
7 (1.7) |
5,844 (0.9) |
7,872 (1.2) |
|
연구개발 및 서비스 |
6 (1.5) |
5 (1.2) |
1,609 (0.3) |
2,005 (0.3) |
출처: 해양수산부, 보도자료, 국내 해양바이오 시장 규모 6,405억원으로 추산, 2022.1.

출처: 해양수산부
[그림 3-102] 해양바이오산업 활성화 기본계획의 목표와 추진전략
(2) 연구개발 현황
‘해양바이오산업 활성화 기본계획’을 추진하기 위해 해양수산부는 2027년까지의 세부적인 추진 전략인 ‘해양바이오산업 신성장 전략’을 발표(2022)하였다. 해양바이오 핵심기술 개발과 산업 생태계 조성, 기업 지원체계 구축을 위한 세부 추진 전략이 제시되었으며, 이에 따라 다양한 연구개발 및 일반 사업을 지원하고 있다. 특히 해양바이오 핵심기술 개발은 크게 기초소재 개발 및 고도화, 대량생산 및 표준화 기술개발, 상용화 기반 조성을 위한 융・복합 연구개발 확대로 구성되는데 이에 따라 다양한 국가연구개발사업을 체계적으로 추진, 지원하고 있다.
(가) 기초소재 개발 및 고도화
기술 중요도 및 산업 성장 가능성 등을 토대로 기초소재를 개발하고 관련 기초・원천 기술과 인프라를 구축하는 계획을 제출하였다. 현재 추진되고 있는 ‘국가생명연구자원선진화 사업(2021∼2026)’은 연근해와 심해 해양자원 4,000여 종에 대한 확보와 분석을 목표로 한다. 해양 동물, 식물, 미소생물과 공해상 생물과 유전체, 추출물을 확보하고 추출물의 기초 효능(항암, 항균, 항산화, 항염증, 항바이러스)을 분석하여 유망 소재를 도출하는 사업으로, 관련 실물이나 정보(효능, 유전자 염기서열 등)가 해양바이오뱅크(국립해양생물자원관)에서 생물, 추출물 라이브러리와 데이터베이스 형태로 구축된다. 확보된 실물과 정보는 신청을 통해 연구기관이나 기업에 분양하는 체계가 구축되고 있고 향후 항생제, 화장품 등 특화된 제품 개발에 적합한 생물소재 뱅크가 추가적으로 구축될 예정으로 이러한 개발 인프라 구축은 산업생태계 조성을 위한 지원 플랫폼으로서의 역할을 할 수 있을 것으로 기대한다.
2022년에 시작된 ‘해양바이오 산업소재 국산화 기술 개발 사업(2022∼2026)’은 콜라겐 등 해외 수입에 의존하는 해양소재의 국산화를 위한 연구개발 사업으로 현재 베타글루칸, 알긴산, 키토시아닌, 포르피란, 잔토필, 콜라겐의 국산화와 관련된 과제들이 진행되고 있다.
(나) 대량생산 및 표준화 기술 개발
해양생물자원의 상용화 촉진을 위해 합성생물학, 미세조류 대량 배양 등 소재 생산기술을 연구하고 ‘수산 부산물 재활용법’의 시행(2022.7.)에 따라 어패류의 가공 과정에서 발생하는 부산물을 활용하여 소재를 개발하는 기술을 확립하고자 계획하였다. 특히 미세조류 파운드리 기술과 인프라를 구축하기 위한 연구개발 사업에 대한 기획연구가 진행되고 있으며, ‘해양수산 부산물 바이오 소재화 기술 개발 사업(2022∼2027)’으로 매년 약 150만 톤 규모로 발생하는 매립, 소각, 배출되고 있는 수산 부산물에 대한 위생관리 기준과 저온 유통 체계를 수립하고 기능성 식품이나 화장품, 의료기기 소재로 개발하는 연구가 진행되고 있다.
(다) 상용화 기반 조성을 위한 융복합 연구개발 확대
기술 영역을 바이오 기술 분류에서 흔히 활용되는 체계인 그린바이오, 화이트바이오, 레드바이오로 분류하여 개발을 지원하고 있다.
그린바이오 영역의 경우 ‘빅데이터 기반 해양 바이러스 제어 및 마린바이오틱스 개발(2021∼2026)’에서 ‘해양환경 내 감염성 바이러스 빅데이터 기반 진단, 치료 및 제어기술 개발’ 과제를 통해 해양 동식물 질병 바이러스 분석과 대응기술 개발을 진행하고 있으며, ‘해양생물 마이크로바이옴 분석, 확보, 검증 및 활용기술 개발’ 과제를 통해 어류 양식에 적용 가능한 유용 미생물 활용기술을 개발하고 있다. ‘유용 해양 와편모조류 증식 및 병원성 기생충 제어 기반기술 개발(2016∼2021)’ 과제는 미세조류 중 와편모조류의 배양기술을 고도화하고 이를 활용하여 패류 양식에 적용할 수 있는 기생충 제어기술 개발을 진행하였다.
화이트바이오 영역에서는 화학이나 의료 산업용 고분자 소재를 개발하는 ‘해양 섬유복합소재 및 바이오플라스틱 기술 개발 사업(2010∼2019)’이 완료되었다. 이 사업을 통해 해양생물이나 관련 물질 정보로부터 지혈제 개발, 차폐막 개발, 골 이식재나 바이오플라스틱을 생산하는 원천기술이 확보되었다. 심해 열수구 해양 고세균의 배양을 통한 수소 생산기술 확보, 실증 플랜트 고도화를 위한 ‘고효율 바이오 수소 정제 시스템 개발(2021∼2022)’, ‘바이오플랜트 운영 최적화 시스템 개발(2021∼2023)’ 과제를 통해 산업 부생가스 활용 수소 생산의 파일럿 수준 검증을 완료하였고, 고순도 수소 생산이나 유기성 폐자원 활용의 수소 생산으로 기술 개발 영역 확대가 도모되고 있다.
레드바이오 영역에서는 ‘극지 유전자원 활용기술 개발’의 ‘극지 유래 생물자원을 활용한 항생제 후보물질 개발(2020∼2023)’에서 해양천연물과 이들의 합성 유도체로부터 항생제 후보물질을 도출하고 이들의 생산기술을 개발하는 연구를 진행하고 있다. 2017년에 시작된 ‘해양단백질 기반 바이오 메디컬소재 개발’에서는 고래 유전체 중 섬유아세포성장인자(FGF) 관련 서열을 발굴하여 단백질을 생산하고 이들 단백질의 의약학적 효능과 활용을 검증하는 연구를 2022년에 마무리하였다. 상처 치유나 항바이러스, 비알콜성 지방간염에 대한 치료 효능을 가진 단백질을 발굴하고 열이나 효소에 대한 단백질의 안정성을 개선하는 원천기술을 개발한 것이 주요성과로 평가된다.
라. 발전 전망
앞에서 살펴보았듯이 해양바이오 산업 내 의약 분야의 높은 시장 비율과 성장세는 ‘해양바이오산업 활성화 기본계획’에도 반영되어 해양 신산업 창출을 위한 해양생명자원의 고부가가치화 기술 개발을 여러 차례 강조하고 있다. 해양생명공학 분야 중 특히 신약개발 분야의 비중은 전체 규모에 큰 영향을 끼칠 것으로 전망되었는데, 특히 관련 기술-심해저나 대양 등에서의 자원 탐사와 생물 시료 확보 기술, 화합물 구조 규명을 위한 나노 수준의 핵자기공명분광분석 기술, 해양천연물의 전합성 및 합성생물학 기술, ICT 기술 접목의 해양생물 양식 혹은 배양기술-의 발전으로 가속화될 것으로 예상된다. ‘해양바이오산업 신성장 전략’에서도 의약과 의료기기 소재 개발의 추진 방향을 포함하여 부처 협력 사업의 형태로의 추진 계획이 제시되었다.
‘해양바이오산업 신성장 전략’에서 해양생명공학 관련 산업 생태계 조성을 위해 정부 투자를 확대하고 권역별 클러스터 및 산업 지원 인프라 구축 계획이 제시되어 있는데, 특히 권역별 특성화 거점 마련에 있어서는 중부권, 서남해권, 동해권과 남해권으로 나누어 권역별로 연구기관과 연구개발 인프라, 관련 기업들 중심의 클러스터 구축이 진행될 전망이다.
해양바이오 정책 수립 지원과 산업계 네트워크 구축을 위한 민간 협회 설립 추진 계획 또한 제시되었는데, 관련하여 2022년 말에 해양수산부는 의료, 식품, 화학・에너지 등 해양바이오 분야 20개 기업이 참여한 사단법인 ‘한국해양바이오산업협회’의 설립을 허가하였다. 현재 이 협회는 해양바이오 산업에 관한 조사・연구, 산・학・연 교류 및 협력, 해양바이오산업 종사자 대상 교육・훈련, 홍보 등을 계획하고 있다.
해양생명공학 분야에서는 공해와 심해 자원 확보와 이들의 지속적인 개발 기반 구축을 위한 국제 협력에 대한 대응도 중요하게 고려된다. ‘유엔 국가관할권 이원 지역의 생물다양성 협약(Biodiversity Beyond National Jurisdiction, BBNJ)’과 나고야 협정(Nagoya protocol) 등 국제 규제 강화 대응을 위한 자원 확보와 관리의 경우 현재 주로 ‘국가생명연구자원선진화 사업’에서 진행되고 있는데, 연구개발 기반과 국제적인 경쟁력 구축 차원에서 지속적으로 진행될 필요가 있다.
|
|
|
제3장 분야별 연구개발 및 산업 현황 |
|
제5절 바이오 공정 및 융합 |
1. 생물공정(산업바이오)
가. 산업바이오 환경 변화
글로벌 바이오산업은 코로나19 영향으로 시장규모가 코로나19 이전 예측보다 더욱 확대될 것으로 예상된다. 코로나19 이전에 예측한 2021년부터 2026년까지 5년간 연평균 성장률 6.5%는 코로나19 이후 7.6%까지 상승하여 2021년 5,837억 달러에서 2027년 약 9,113억 달러의 시장을 형성할 것으로 전망된다.154)
산업바이오(또는 화이트바이오)는 2050 탄소중립 추진, 플라스틱 사용 규제 등 전 세계적인 탈탄소 정책 추진과 이에 따른 저탄소 친환경 산업의 중요성이 부각되면서 국내외 기업의 산업바이오 확대 또는 진출이 본격화되고 있다. 따라서, 주요국은 바이오제조 기술의 혁신과 첨단기술 확보를 통해 기존 화학 제조 방식을 산업바이오 방식으로 점차적으로 대체 또는 전환하는 전략을 수립하고 있다. 이를 위해 바이오경제 육성정책을 마련하여 바이오산업에서 지속가능성 및 경제성 확보, 공급망 안정을 통한 자국 산업 보호 및 육성을 적극적으로 추진하고 있다.
|
분 야 |
금액(억$) |
점유율(%) |
|
Healthcare(헬스케어) |
3,606 |
62 |
|
Crop Production & Agriculture(작물생산 및 농업) |
1,377 |
23 |
|
Industrial Processing(산업공정) |
537 |
9 |
|
Nautural Resources & Environment(천연자원 및 환경) |
236 |
4 |
|
Others(기타) |
397 |
2 |
|
합계 |
5,837 |
100 |
출처: 국가생명공학정책연구센터, 글로벌 바이오산업 시장현황 및 전망(2021~2027), 2021
|
|
|
출처: 국가생명공학정책연구센터, 글로벌 바이오산업 시장현황 및 전망(2021~2027), 2021
[그림 3-103] 글로벌 바이오산업 시장 현황 및 전망(2021∼2027)
나. 해외 현황
(1) 정책 현황
미국, 유럽, 일본, 중국 등 주요국은 바이오경제 활성화를 위해 바이오제조 경쟁력 고도화 및 공급망 확대를 위한 정책을 적극적으로 추진하고 있다. 미・중 경쟁이 무역 분쟁을 넘어 첨단기술 패권 경쟁으로 심화함에 따라, 미국 정부는 자국 공급망 강화 및 글로벌 가치사슬 재편을 진하고 있으며 중국 또한 과학기술 자립자강 정책을 통해 핵심 기술을 국산화하고 있다. 유럽, 일본 등 주요국은 미・중 관계에서 협력과 경쟁을 유지하며 기술적 자주성 및 제조경쟁력 확보를 위해 노력하고 있다. 특히, 각국은 지속 가능한 성장을 위해 다양한 바이오경제 활성화 정책을 펼치고 있으며 탈탄소 경제 생태계 구축을 위해 산업바이오 분야에 많은 투자를 하고 있다. 특히 바이오제조 기술 경쟁력 확보를 위해 미국과 중국은 선제적으로 공공 바이오파운드리를 도입하였고 유럽, 일본, 호주 등은 후발 주자로 추격하는 형국이며 우리 정부도 공공 바이오파운드리 설립을 위한 예타를 추진하고 있다.
미국은 Biopreferred Program의 지속적인 운영을 통해 미국 50개 주에서 3,000개 이상 기업이 참여하고 있다. 2023년 현재 4,500개 이상 제품이 바이오매스 함량 25% 이상 인증을 받았으며 전체 264개 품목 중 171개 품목 1,400개 이상 제품이 연방정부 우선구매 대상으로 등록되어 있다.155) 또한 바이든 행정부는 2022년 국가 바이오기술 및 바이오제조 이니셔티브 추진156)을 위한 행정명령을 발표하고 바이오제조 역량 강화, 바이오 기반 제품 시장 확대, 국제협력 강화 등을 추진하며 약 20억 달러 이상 투자를 계획하고 있다. 이와 연계하여 바이오제조 연구 역량 강화를 위해 민간 바이오파운드리와 별도로 공공 바이오파운드리인 Agile Biofoundry 등에 대해 지속적인 투자를 하고 있다. 또한 미국 정부는 경쟁국 대비 제조경쟁력 및 공급망 확대를 위해 상무부(DOC), 국방부(DOD), 에너지부(DOE)가 지원한 16개 제조혁신연구소(Institutes for Manufacturing Innovation, IMI)의 네트워크인 Manufacturing USA를 운영하고 있으며, 바이오제조 경쟁력 강화를 위해 BioMADE 제조혁신연구소를 2021년 개설하였다.157) BioMADE는 의약품, 연료, 소재, 식품 등 수많은 분야에서 개발되는 바이오 제품들이 실험실 단계에서 대규모 상업화 단계로 넘어갈 수 있도록 자금, 연구개발, 인프라 구축, 인력 육성 등의 지원을 목표로 하고 있으며 미국 정부는 2021년 초기 투자액 8,700만 달러를 2023년 5억 달러로 상향 조정하여 본격적으로 미국 내 바이오제조 역량 강화를 추진하고 있다. 2022년 미국 상원은 미국판 탄소국경조정제도인 청정경쟁 법안(Clean Competition Act, CCA)을 발의하여 2024년부터 미국으로 수입되는 석유화학제품에 대해 온실가스 배출 1톤당 55달러의 관세를 부과할 예정이다. 2023년 에너지부는 2023년까지 90% 이상 플라스틱 재활용 및 50% 이상 에너지 감소를 목표하는 플라스틱 혁신전략(Strategy for Plastic Innovation)을 발표하고 플라스틱 문제 해결을 위해 4대 분야(플라스틱 분해, 업사이클링, 재활용, 기술확산)에 집중 투자를 시작했다.

출처: NIST, Manufacturing USA Highlights Report, 2021.11.5.
[그림 3-104] Manufacturing USA의 제조혁신연구소(Institutes for Manufacturing Innovation, IMI) 현황
유럽은 바이오경제 확대를 위한 바이오제조 경쟁력 확대를 위한 정책 및 투자를 지속하고 있다. 2021년부터 2027년까지 지속되는 EU의 과학 연구 이니셔티브인 Horizon Europe 프로그램에서 EU 민관이 20억 유로 규모로 합작 투자한 바이오매스 기반 제품 기술개발 프로젝트인 CBU・JU(Circular Bio-based Europe Join Undertaking)를 2022년부터 본격적으로 가동하여 바이오매스 및 폐기물로부터 지속가능한 제품을 생산하는 바이오제조공정의 개발 및 확산을 추진하고 있다. 2023년 유럽의회는 2030 기후목표 계획 달성을 위한 입법안(Fit for 55)에 탄소국경조정제도(Carbon Border Adjustment Mechanism, CBAM)를 포함하고 2026년부터 시행하여 유럽으로 수입되는 6대 품목(시멘트, 전기, 비료, 철강, 알루미늄, 수소)에 대해 온실가스 배출량 보고서 제출을 의무화였으며, 유기화학품 및 플라스틱이 향후 포함될 가능성도 있다. 2023년 EU 집행위원회는 2050년 탄소중립 목표 달성을 위해 그린딜 산업계획(Green Deal Industrial Plan)을 제안하고 청정기술 시장 선점, 주요 무역대상국의 친환경 산업 육성정책 대응, 에너지 위기 대응 등을 추진하고 있다. 또한 그린딜 산업계획의 후속 정책으로 기후중립산업법(Net-Zero Industry Act)을 발표하여 8개 기후중립 전략기술(strategic net-zero technologies)을 지정하여 해당 기술의 EU 역내 제조역량을 2030년까지 연간 수요 40% 증대를 목표로 하고 있으며, 지속가능한 바이오가스/바이오메탄 기술과 탄소 포집 사용 및 저장(CCUS) 기술이 포함되어 있다.
일본 기시다정부는 제6기 과학기술・혁신기본계획의 지속적인 추진을 위해 2022년 새로운 자본주의 실행계획(안)을 발표하고 바이오제조, 재생・세포 의료・유전자 치료에 집중 투자를 추진하고 있다. 특히 2022년 4월부터 플라스틱 자원순환 촉진법이 시행되어 플라스틱제품에 대한 ‘3R(Reduce, Reuse, Recycle)+Renewable’ 정책이 추진됨에 따라 기업체는 바이오매스 또는 생분해성 플라스틱 제품의 도입 추진하고 있다. 2021년 공표된 바이오플라스틱 도입 로드맵에 따라 2030년까지 200만 톤의 바이오매스 플라스틱 도입 추진하고 있다. 2023년 발표된 통합혁신전략 2023에서 첨단 과학기술을 전략적 추진을 최우선 순위 정책으로 지정하여 첨단기술 육성 추진하고 있다.
중국은 2022년 첫 바이오경제 5개년 계획인 ‘14차 5개년 바이오경제 발전 계획’을 발표하고, 바이오의약, 바이오농업, 바이오제조, 바이오에너지, 바이오환경보호 등 주요 제품과 서비스 개발 경쟁력 확보 추진하고 있다. 특히 중국은 선전(Shenzhen) 지역에 7,200억 원을 투자하여 9개 기관과 그 밖의 수많은 연구소 시설로 구성된 대규모 바이오파운드리 건설하고 사업화-상업화-대량생산이 가능한 복합 클러스터를 구축하여 미국과의 바이오기술 경쟁에서 우위 확보를 위해 노력하고 있다. 또한 2020년 플라스틱 오염 관리강화제안에 따라 일회용 플라스틱제품 사용을 금지에 따라 플라스틱 기업의 PLA, PBAT 등 생분해성 플라스틱 생산 공장 증설을 추진하고 있다.
[표 3-53] 주요 국가의 산업바이오 관련 정책
|
국가 |
세부 정책 |
|
|
• 농무부는 BioPreferred Program의 지속적 운영, 미국 50개 주에서 3,000개 이상 기업이 참여 • 바이든 행정부는 2022년 국가 바이오기술 및 바이오제조 이니셔티브(National Biotechnology and Biomanufacturing Initiative) 추진을 위한 행정명령을 발표, 약 20억 달러 이상 투자 계획 • 2022년 청정경쟁 법안 CCA(Clean Competition Act) 발의되어 2024년부터 석유화학제품에 대해 온실가스 배출 1톤당 55달러를 관세로 부과 • 민간 바이오파운드리와 별도로 Agile Biofoundry 등 공공 바이오파운드리 투자를 통해 바이오제조 관련 연구역량 강화 및 기업과의 협력 추진 • 바이오제조 및 공급망 확보에서 비교 우위를 점하기 위해 제조혁신연구소인 BioMADE를 설립하고, 2023년 투자액을 5억 달러로 상향 조정 • 2023년 에너지부는 ‘플라스틱 혁신 전략’(Strategy for Plastic Innovation)을 발표하고 플라스틱 문제 해결 기술개발에 집중 투자 |
|
|
• ‘Horizon Europe’ 프로그램에서 바이오매스 기반 제품 기술개발 프로젝트인 CBE JU(Circular Bio-based Europe Joint Undertaking)에 20억 유로 투자 예정 • 2023년 탄소국경조정제도(Carbon Border Adjustment Mechanism, CBAM)를 발표하고 2026년부터 시행되어 유럽으로 수입되는 6대 품목(시멘트, 전기, 비료, 철강, 알루미늄, 수소)에 대해 온실가스 배출량 보고서 제출을 의무화 • 2050년 탄소중립 목표 달성을 위해 2023년 그린딜 산업계획(Green Deal Industrial Plan)을 제안 • 그린딜 산업계획의 후속정책으로 기후중립산업법(Net-Zero Industry Act)을 발표하여 8개 기후중립 전략기술(strategic net-zero technologies)을 지정 |
|
|
• 제6기 과학기술・혁신기본계획의 지속적인 추진을 위해 기시다 정부는 2022년 새로운 자본주의 실행계획(안)을 발표하고 바이오제조, 재생・세포 의료・유전자 치료에 집중 투자 • 2022년 4월부터 플라스틱 자원순환 촉진법이 시행되고 플라스틱제품에 대한 ‘3R(Reduce, Reuse, Recycle)+ Renewable’ 정책을 추진하며, 기업체는 바이오매스 또는 생분해성 플라스틱 제품의 도입 추진 • 2021년부터 바이오플라스틱 도입 로드맵을 공표하고 2030년까지 200만톤의 바이오매스 플라스틱 도입 추진 중 • 통합혁신전략 2023에서 첨단 과학기술 추진을 최우선 순위 정책으로 지정 |
|
|
• 2022년 중국의 첫 바이오경제 5개년 계획인 ‘14차 5개년 바이오경제 발전 계획’을 발표하고, 바이오의약, 바이오농업, 바이오제조, 바이오에너지, 바이오환경보호 등 주요 제품과 서비스 개발 경쟁력 확보 추진 • 2020년 <플라스틱오염 관리강화제안>에 따라 일회용 플라스틱 제품 사용을 금지에 따라 PLA, PBAT 등 기업의 생분해성 플라스틱 생산 공장 증설 추진 |
출처: 저자 작성
(2) 산업 현황
글로벌 탄소중립 추진, ESG 경영 압박, 탈탄소 무역장벽 확산에 따라 주요 다국적 기업들은 탈탄소전략 로드맵 구축 및 지속가능한 제품 포트폴리오 확대를 위해 노력하고 있다. 석유화학 및 바이오 관련 기업들은 바이오매스 기반 제품군의 생산 규모를 확대하고 있으며, 이를 통해 미국 및 유럽 등의 주요 지역의 바이오경제 규모가 지속적으로 성장하고 있다.
미국의 바이오산업 규모는 2017년 기준 약 3,880억 달러(GDP 2% 수준)이며, 의약바이오(35%, 1,370억 달러), 농업바이오(27%, 1,040억 달러), 산업바이오(38%, 1,470억 달러) 분야로 구성된다.158) 2021년 기준 바이오산업의 규모는 약 5,520억 달러(GDP 2.4% 수준)로 성장하였으며, 의약바이오(41%, 2,250억 달러), 농업바이오(26%, 1,470억 달러), 산업바이오(33%, 1,800억 달러) 분야별 규모도 확대되었다.159) 바이든 정부는 자국 내 공급망 안전과 글로벌 기술 선도를 위해 바이오제조 분야 투자를 지속적으로 확대하고 있어, 미국의 국내외 바이오산업의 시장규모는 꾸준히 성장할 것으로 예상된다.

주) (a) 2021년 기준 미국 산업바이오 매출액 1,800억 달러 (b) 40년간 미국 바이오산업 분야별(농업바이오, 의약바이오, 산업바이오) 성장 추이
출처: Robert Carlson, Bioeconomy Capital, BIOECONOMY DASHBOARD: ECONOMIC METRICS, 2023
[그림 3-105] 미국의 바이오산업 규모 분석(2021)
유럽은 바이오경제 활성화를 위해 전 세계에서 가장 활발하게 정책 지원과 투자를 하고 있으며, 유럽의 바이오산업 규모는 2018년 기준(영국 포함 28개국) 약 2조 4,300억 유로 수준이며 산업바이오는 7,760억 유로이며, 2019년 기준(영국 제외 27개국) 약 2조 4,300억 유로 수준이며 산업바이오는 8,140억 유로 수준이다. 2020년 EU에서 탈퇴한 영국의 바이오산업 규모를 2019년 EU의 바이오산업 규모 산정에서 제외하더라도 바이오산업의 지속적인 성장 추세를 확인할 수 있다. 특히 바이오매스 기반 화합물과 바이오플라스틱은 제품은 2008년 320억 유로에서 2019년 510억 유로 수준으로 2018년 540억 유로 대비 약 59% 성장하였다.160)

주) (a) 2008~2019년 기준 바이오산업 분야별 변화 추이 (b) 2019년 기준 유럽 산업바이오 규모(농업, 임업, 어업, 식품, 음료 및 담배산업 제외) 8,140억 유로
출처: Olaf Porc et al., European Bioeconomy in Figures 2008~2019, 2022
[그림 3-106] 유럽의 바이오산업 규모 분석(2022)
산업바이오의 대표적인 분야인 바이오플라스틱산업은 플라스틱 사용 규제 및 화학산업의 탈탄소추진 등의 이유로 급격한 성장이 예상되며, 유럽플라스틱협회는 세계 바이오플라스틱 생산 능력을 2022년 약 222만 톤에서 2027년 629만 톤으로 연평균 성장률 23.2%로 매우 빠르게 확대될 것으로 예측하였다.161) 특히 바이오플라스틱산업의 성장은 한국, 중국, 브라질, 태국 등 주요 국가의 화학 및 바이오기업이 바이오플라스틱 분야에 집중 투자한 결과이다. 2022년 222만 톤 생산량의 48.5%(107만 7,000톤)는 바이오매스 기반 비분해성 바이오플라스틱이며, 51.5%(114만 3,000톤)는 생분해성 바이오플라스틱이다. 2027년에는 생분해성 바이오플라스틱의 생산 규모가 56.5%(355만 6,000톤)으로 더욱 성장할 것으로 예상된다. 2022년 대비 2027년에는 바이오매스 기반 비분해성 바이오플라스틱에서는 PE(polyethylene)와 PA(polyamide)가 주로 생산되며, 생분해성 플라스틱은 PLA(polylactic acid)와 PHA(polyhydroxyalkanoate) 시장의 확대가 예상된다.


주1) PEF is currently in development and predicted to be available at commercial scale in 2023
주2) Regenerated cellulose films
주3) (a) 글로벌 바이오플라스틱 생산 규모 예측 (b) 2022년 바이오플라스틱 소재별 생산 규모 (c) 2027년 바이오플라스틱 소재별 생산 규모
출처: European Bioplastics, Bioplastic market data 2022, 2023
[그림 3-107] 글로벌 바이오플라스틱 생산 규모(2022)
BASF, NatureWorks, Novamont, Danimer Scientific, Braskem, LanzaTech, Genomatica, Carbios, Ginko Bioworks, Amyris 등 바이오매스 또는 온실가스를 활용하여 주로 바이오플라스틱, 기능성 소재를 생산하고 있으며 자사의 산업바이오 제품 생산 규모 확대하고 제품군을 다각화하고 있다.
BASF는 생분해 바이오플라스틱 PBAT를 연산 7만 4,000톤 규모의 생산 공장을 가동하고 있으며, 2023년 중국의 Red Avenue New Materials와 협력을 통해 연산 10만 톤 규모 공장을 Shanghai에 건립하고 시생산 완료하였다. 생물공정 또는 바이오매스를 활용하여 기능성 소재(비타민, 화장품 첨가제, 식품 첨가제, 세제용 효소 등)와 화학 제품군(바이오플라스틱, 비건가죽, 비이온성 계면활성제, 코팅제 등)을 생산 확대 또는 신제품 개발을 하고 있다. BASF가 보유한 화학제품에 대한 지속가능한 원료 기반 친환경 소재 인증 RedCert2 또는 ISCC+ 획득 및 확대 추진하고 있다.
NatureWorks는 lactic acid, lactide, PLA의 통합 생산이 가능한 연산 7만 5,000톤 규모의 신규 PLA 공장을 태국에 건설 중이며 2024년 완공 예정이다. Ingeo™ PLA(NatureWorks)와 PHACT® PHA(CJ제일제당)를 활용한 첨단 소재 솔루션 개발을 위한 포괄적 협력 계약(Master Collaboration Agreement) 체결하여, NatureWorks는 CJ제일제당과 협력을 통해 퇴비화 가능한 식품 포장, 식기류 및 개인 위생용품에 이르기까지 다양한 응용 분야에서 화석 연료 기반 플라스틱을 대체할 고성능 바이오플라스틱을 개발하고 있다.
Novamont의 경우, 이탈리아의 Eni 그룹의 화학부문 계열사인 Versalis가 Novamont의 보유주식 36%에서 100%로 확대하여 바이오플라스틱 부문 강화하여 친환경 소재 분야 글로벌 경쟁력 확보를 추진하고 있다. Novamont는 자사 바이오플라스틱 Mater-Bi를 활용한 의약품・식품 포장재, 농업용 필름 등 다양한 제품 확대 생산하고 있으며, Versalis와 Novamnot가 50:50으로 합작한 바이오원료 생산 기업인 Matrica는 페인트 및 잉크, 바이오플라스틱, 바이오 윤활유 등 고부가가치 응용 분야에 적용되는 재생 가능한 바이오원료인 마트리록스(Matrilox)를 생산하고 있다. Matrical의 마트리록스는 Lanxess에 공급되어 친환경 작물보호제 리벤톨(Preventol®)의 원료로 사용되고 있다.
Danimer Scientific은 2022년 말 기준 연산 3억 2,500만 파운드 규모의 PHA 생산 공장을 Kentucky에 완공하여 생산하고 있으며, 자사 PHA를 활용한 완제품 생분해성 수지는 약 연간 6,000만 파운드 공급이 가능하며 이는 약 1억 9,000만 달러 상당의 매출액에 해당한다.
Braskem은 2023년 7월 브라질 바이오 PE 생산 규모를 연산 20만 톤에서 26만 톤으로 30% 증설 완료하였으며, 2030년까지 연산 100만 톤 바이오 PE 규모 확장을 목표로 하고 있다. 또한 태국의 SCG Chemicals과 합작기업인 Braskem Siam을 설립하고 태국에 바이오 PE 공장 설립을 추진하고 있다.
LanzaTech은 CO를 다량 포함하는 산업 부생가스를 탄소원으로 활용 가능한 미생물 기술을 확보하여, 부생가스로부터 에탄올, isopropanol, acetone, monoethylene glycol 등 주요 화합물의 데모 규모 생산이 가능하고 100개 이상 화합물 생산을 검증하고 있다. 특히, 중국의 제철소에서 약 연산 15만 톤 규모의 에탄올을 연속, 상용 생산하고 있으며, 일본, 캐나다, 벨기에, 인도 등에서 데모 규모 생산을 검증하고 있다. 산업 부생가스로부터 PET(polyethylene terephthalate), 항공연료 생산 등을 추진하여 자사가 보유한 제품군 확대를 적극적으로 추진하고 있다.
Genomatica는 BDO(1,4-butanediol) 생산 기술을 Cargill과 HELM의 합작기업인 Qore에 이전하여 2024년까지 미국 Iowa에 연산 6만 5,000톤 규모의 BDO 공장을 건립하고, 생산된 BDO는 Lycra의 바이오매스 함량 70% 이상 스판덱스 제조에 활용 예정이다. 바이오 nylon 6, 66 제조를 위한 바이오매스 유래 caprolactam, hexamethylenediamine, adipic acid 생산 기술 고도화 지속 추진하고 있다.
Carbios는 세계 최대의 PET 재활용 생산기업인 Indorama Ventures와 2025년까지 연산 5만 톤 규모의 PET 생물학적 재활용 공장 건립 계획을 수립하였고, 세계 최대 효소 생산 기업인 Novzymes와 PET 분해 효소의 산업적 생산 및 공급을 위한 상호 협력 연장하였다.
Ginkgo Bioworks는 2022년 합성생물학, 로봇, 컴퓨팅 기반으로 하는 바이오파운드리 플랫폼 기술 보유 기업인 Zymergen을 3억 달러에 인수・합병하였다. Ginkgo Bioworks는 합성생물학을 활용한 바이오제조 연구개발 분야 세계 최고 기업으로 다양한 글로벌 기업과 의약바이오(Merck, Lilly, Moderna, GSK, Roche, Novo Nordisk 등), 산업바이오(Sumitomo Chemical, Givaudan, Solvay, Bolt Threads, Robertet, CAMBIUM 등), 농업바이오(Cargill, Syngenta, ADM, BAYER, Corteva 등) 분야에서 연구개발 계약을 체결하였다.
Amyris는 효모 개량 전문성을 확보하고 효모로부터 다양한 바이오화학, 화장품, 기능성소재 등 다양한 바이오 제품을 상용화하였다. 특히 효모 전용 바이오파운드리 플랫폼을 구축하고 세계 최고 수준의 효모 개량 및 스케일-업 기술을 보유하고 있어 다양한 산업 분야로 제품군을 확대할 것으로 예상된다.
[표 3-54] 산업바이오 관련 해외 선도 기업 현황
|
기업명 |
사업영역 및 주요 내용 |
|
|
• BASF는 생분해 바이오플라스틱 PBAT 연산 74,000톤 규모 생산, 중국의 Red Avenue New Materials와 연산 100,000톤 규모 공장을 Shanghai에 건립 • 생물공정 또는 바이오매스를 활용하여 기능성 소재와 화학 제품군의 생산 확대 또는 신제품 개발 • BASF가 보유한 화학제품에 대한 RedCert2 또는 ISCC+ 인증 확대 |
|
|
• 2024년까지 lactic acid, lactide, PLA의 통합 생산이 가능한 연산 7만 5,000톤 규모의 신규 PLA 공장을 태국에 건설 예정 • CJ제일제당과 첨단 소재 솔루션 개발을 위한 포괄적 협력 계약(Master Collaboration Agreement) 체결 |
|
|
• 이탈리아의 Eni 그룹의 화학부문 계열사인 Versalis가 Novamont 합병을 추진 중이며, 친환경 소재 분야 글로벌 경쟁력 확보 위해 노력 • 자사 바이오플라스틱 Mater-Bi를 활용한 의약품・식품 포장재, 농업용 필름 등 다양한 제품 확대 생산 • Versalis와 합작기업인 Matrica는 페인트 및 잉크, 바이오플라스틱, 바이오 윤활유 등에 활용 가능한 바이오 원료 마트리록스(Matrilox)생산 |
|
|
• 2022년 말 기준 연산 3,250만 파운드 규모의 PHA 생산 공장을 Kentucky에 완공, 완제품 수지를 약 연간 6,000만 파운드 공급 가능 |
|
|
• 2023년 7월 브라질 바이오 PE 생산 규모를 연산 20만 톤에서 26만 톤으로 30% 증설 완료 • 2030년까지 연산 1백만 톤 바이오 PE 규모 확장을 목표 • 태국의 SCG Chemicals과 합작기업인 Braskem Siam을 설립하고 태국에 바이오 PE 공장 설립을 추진 |
|
|
• 산업 부생가스를 활용 가능한 플랫폼 미생물 시스템을 확보하여 에탄올, isopropanol, acetone, monoethylene glycol 등 데모 규모 생산이 가능하며, 100개 이상 화합물 생산을 검증 • 중국 제철소에서 약 연산 15만 톤 규모의 에탄올을 연속 상용 생산 • 일본, 캐나다, 벨기에, 인도 등에서 데모 규모 생산 검증 실시 • 산업 부생가스로부터 PET, 항공연료 생산 등을 추진 |
|
|
• BDO(1,4-butanediol) 생산 기술을 Cargill과 HELM의 합작기업인 Qore에 이전하여 미국 Iowa에 연산 6만 5,000톤 규모의 BDO 공장을 2024년까지 건립 예정 • 생산된 BDO는 Lycra의 바이오매스 함량 70% 이상 스판덱스 제조에 활용 예정 • 바이오 nylon 6, 66 제조를 위한 바이오매스 유래 caprolactam, hexamethylenediamine, adipic acid 생산 기술 고도화 지속 추진 |
|
|
• 세계 최대의 PET 재활용 생산기업인 Indorama Ventures와 2025년까지 연산 5만 톤 규모의 PET 생물학적 재활용 공장 건립 계획을 수립 • 세계 최대 효소 생산 기업인 Novzymes와 PET 분해 효소의 산업적 생산 및 공급을 위한 상호 협력 연장 |
|
|
• Ginkgo Bioworks는 합성생물학, 로봇, 컴퓨팅 기반으로 하는 바이오파운드리 플랫폼 기술 보유 기업 Zymergen을 3억 달러에 인수합병 • 합성생물학을 활용한 바이오제조 연구개발 분야 세계 최고 기업으로 다양한 글로벌 기업 연구개발 계약 체결 |
|
|
• 효모를 활용하여 바이오화학, 화장품, 기능성소재 등 다양한 산업 분야의 제품을 상용화 • 효모 전용 바이오파운드리 플랫폼을 구축하고 세계 최고 수준의 효모 개량 및 스케일-업 기술 보유 |
출처: 저자 작성
다. 국내 현황
(1) 정책 현황
글로벌 탈탄소 무역장벽 확산, 플라스틱 사용 규제, 공급망 확보, 바이오제조 패권 다툼 등 국가 간 경쟁 심화에 대응하기 위해 정부는 전 주기 탈(脫)플라스틱 대책, 바이오제조・디지털 혁신 투자방향, 신성장 4.0 전략 추진계획, 2050 탄소중립 추진전략 등 주력산업 및 첨단기술 육성을 위한 정책을 발표하였다. 미국, EU, 중국, 일본 등 주요국이 바이오제조경쟁력 확보를 핵심 정책으로 추진함에 따라 산업바이오 육성 전략 또한 정부가 발표한 주요 정책에 포함되었다.
플라스틱 사용 규제에 대응하기 위해 2022년 12월에 발표된 전 주기 탈(脫)플라스틱 대책은 2020년 12월에 발표된 생활폐기물 탈(脫)플라스틱 대책의 후속 정책으로 2024년 이후 본격화될 Post-플라스틱 시대 준비를 위해, 2025년까지 폐플라스틱 발생 20%를 감축을 목표로 하고 있다. 대체 서비스 기반의 일회용품 감량, 온전한 재활용, 재생원료・대체재 산업 및 시장 육성, 국제사회 책무 이행과제를 발표하였다. 또한, 소각형 재활용에서 고품질 물질・화학적 재활용으로 유도하며, 재활용품 사용 촉진하고, 바이오플라스틱(생분해성 플라스틱, 바이오매스 플라스틱)의 활용 유도 및 인증 기준 세부화 추진을 담고 있다.
바이오제조 패권 다툼 및 공급망 확보에 대응하기 위해 2022년 12월에 발표된 바이오제조・디지털 혁신 투자 방향은 바이오제조・디지털 혁신을 통한 글로벌 경쟁력 강화 및 차세대 시장 선점을 위한 핵심기술개발 지원, 디지털 전환 투자 강화, 제조혁신 생태계 구축, R&D 투자체계 고도화 전략을 담고 있다. 특히 핵심기술개발 지원을 위해 공공 바이오파운드리 구축하고 바이오 소부장 기술 확보 등 추진하여 산업바이오 분야 제조경쟁력 강화를 추진하고 있다. 또한 디지털 전환 투자 강화를 위해 디지털 바이오 기반 구축, 바이오 특화 IT 전문기업 육성 등을 추진하고, 제조혁신 생태계 구축을 위해 바이오제조 혁신 인재 양성, 선제적 규제개선 등을 추진한다. 연이어 발표된 新성장 4.0 전략 추진계획은 초일류국가 도약을 위해 미래기술 확보, 디지털 전환, 전략산업 초격차 확대 등 도전과제 해결 추진을 위한 신성장 4.0 전략 추진계획을 수립하고 3대 분야 15대 핵심 프로젝트를 발굴・추진한다. 특히 바이오 분야 新시장 창출 및 초격차 확보를 위해 바이오 R&D 및 제조공정을 표준화・고속화・자동화하여 바이오제조의 혁신경쟁력을 강화하는 국가 바이오파운드리 구축을 추진한다.
2050 탄소중립 이행 및 글로벌 탈탄소 무역장벽 확산에 대응하기 위해 2023년 3월에 발표된 2050 탄소중립 추진전략은 2022년 3월 시행된 ‘탄소중립 기본법’에 따라 최초의 제1차 국가 탄소중립・녹색성장 기본계획(2023~2042) 정부 안을 포함하고 있다. 중장기 국가 온실가스 감축 목표치인 40%를 유지하지만 각 부문의 감축분 및 흡수・제거량을 조정하여, 산업 부문 감축률은 다소 완화(14.5% → 11.4%)되고 전환 부문(44.4% → 45.9%)과 국제감축 부문(3,350만 → 3,750만 이산화탄소 상당량 톤)의 기여도를 확대하였다. 또한 핵심 녹색기술 개발 및 녹색 신산업 발굴・육성, 한국형 탄소중립 100대 핵심기술 선정하고 친환경 바이오매스를 활용한 기초 및 고부가 화학원료 생산기술과 바이오・생분해성 플라스틱기술 등을 포함하였다.
[표 3-55] 정부의 산업바이오 관련 주요 정책 및 세부 전략
|
정책 |
세부 전략 |
|
전 주기 탈(脫)플라스틱 대책 (2022년 12월) |
• 2025년까지 폐플라스틱 발생 20%를 감축을 목표 • 바이오플라스틱(생분해성 플라스틱, 바이오매스 플라스틱)의 활용 유도 및 인증 기준 세분화 추진 |
|
바이오 제조・디지털 혁신 투자방향 (2022년 12월) |
• 바이오제조・디지털 혁신을 통한 글로벌 경쟁력 강화 및 차세대 시장 선점을 위한 핵심기술개발 지원을 목표 • 공공 바이오파운드리 구축, 바이오 소부장 기술 확보 등 추진 예정 |
|
신성장 4.0 전략 추진계획 (2022년 12월) |
• 초일류국가 도약을 위해 미래기술 확보, 디지털 전환, 전략산업 초격차 확대 등 도전과제 해결 추진을 위한 3대 분야 15대 핵심 프로젝트를 발굴・추진 • 바이오제조의 혁신경쟁력을 강화를 위해 공공 바이오파운드리 구축 추진 강조 |
|
2050 탄소중립 추진전략 (2023년 3월) |
• 2023년 3월, 최초의 제1차 국가 탄소중립・ 녹색성장 기본계획(2023~2042) 정부 안을 발표 • 중장기 국가 온실가스 감축 목표 40% 유지하고 산업 부문 감축률이 다소 완화(14.5% → 11.4%), 핵심 녹색기술 개발 및 녹색 신산업 발굴・육성, 한국형 탄소중립 100대 핵심기술 선정 |
출처: 저자 작성
(2) 산업 현황
2021년 기준 국내 바이오산업 생산(국내판매+수출) 규모는 총 20조 9,983억 원으로 2020년 총 17조 1,983억 원 대비 22.1% 증가하였다.162) 2020년 대비 수출은 18.0% 증가한 11조 8,598억 원, 수입은 96.2% 증가한 4조 7,692억 원으로 7조 906억 원 무역수지 흑자를 냈다. 바이오산업의 국내 생산은 바이오의약산업(5조 8,385억 원, 27.8.%), 바이오의료기기산업(5조 2,793억 원, 25.1%), 바이오식품산업(4조 1,937억 원, 20.0%), 바이오화학・에너지산업(2조 7,509억 원, 13.1%)이 대부분을 차지하였다. 코로나19로 인해 바이오의료기기산업의 생산규모가 2020년 3조 8,976억 원에서 35.5% 증가하였고, 바이오화학・에너지산업의 생산규모도 2020년 2조 1,253억 원에서 29.4% 증가하였다. 산업바이오 관련 분야별 국내 생산의 경우, 바이오화학・에너지산업(2조 7,509억 원)은 바이오연료(67.4%, 1조 8,533억 원)와 바이오화장품 및 생활화학제품(20.4%, 5,328억 원)이 대부분을 차지하였고, 바이오식품산업은 사료첨가제(66.3%, 2조 7,802억 원)가 대부분을 차지하였다. 산업바이오 분야 수출 품목 1위인 사료첨가제는 전년 대비 2.9% 감소한 1조 7,806억 원 규모로 나타났다. 그러나 산업바이오의 핵심 제품인 바이오플라스틱에 해당하는 바이오고분자는 국내 생산은 699억 규모에 머물러 있다. 전량 해외 수입에 의존하는 바이오플라스틱소재의 경우, 국내 기업이 대규모 투자를 통해 PBAT, PHA 등의 생분해성 플라스틱 소재의 국산화를 추진하고 있어 수년 내 바이오화학・에너지산업의 생산규모가 급속하게 성장할 것으로 예상된다.
[표 3-56] 바이오산업 분야별 생산 및 내수 현황(2021)
(단위 : 백만 원, %)
|
구 분 |
생산 |
내수 |
||||||
|
국내 판매 |
수출 |
계 |
비중 |
국내 판매 |
수입 |
계 |
비중 |
|
|
전 체 |
9,138,461 |
11,859,846 |
20,998,307 |
100.0 |
9,138,461 |
4,769,249 |
13,907,710 |
100.0 |
|
바이오의약산업 (기타바이오의약품, 백신, 혈액제제 등) |
2,331,985 |
3,506,493 |
5,838,478 |
27.8 |
2,331,985 |
4,065,908 |
6,397,893 |
46.0 |
|
바이오화학・에너지산업 (바이오연료, 바이오화장품 및 생활화학제품, 바이오고분자제품 등) |
2,390,566 |
360,302 |
2,750,868 |
13.1 |
2,390,566 |
289,582 |
2,680,148 |
19.3 |
|
바이오식품산업 (사료첨가제, 건강기능식품, 식품첨가물 등) |
1,840,776 |
2,352,874 |
4,193,650 |
20.0 |
1,840,776 |
105,495 |
1,946,271 |
14.0 |
|
바이오환경산업 (환경처리용 생물제제 및 시스템 등) |
69,026 |
66 |
69,092 |
0.3 |
69,026 |
149 |
69,175 |
0.5 |
|
바이오의료기기산업 (체외진단 등) |
1,058,324 |
4,220,932 |
5,279,256 |
25.1 |
1,058,324 |
58,034 |
1,116,358 |
8.0 |
|
바이오장비 및 기기산업 (연구 및 생산장비 등) |
140,327 |
50,631 |
190,958 |
0.9 |
140,327 |
228,178 |
368,505 |
2.6 |
|
바이오자원산업 (종자 및 묘목 등) |
80,913 |
11,324 |
92,237 |
0.4 |
80,913 |
19,306 |
100,219 |
0.7 |
|
바이오서비스산업 (임상・비임상 연구개발 서비스 등) |
1,226,544 |
1,357,224 |
2,583,768 |
12.3 |
1,226,544 |
2,598 |
1,229,142 |
8.8 |
출처: 산업통상자원부・한국바이오협회, 2021년 국내바이오산업실태조사, 2022; 바이오산업 상세 분류체계는 2021년 국내바이오산업실태조사 보고서 참고
국내 기업들은 바이오매스를 활용하거나 생분해가 되는 친환경소재 및 제품을 개발하여 바이오경제 및 탄소순환경제 구축을 추진하고 있다. 가치사슬체계가 복잡한 산업바이오의 경우, 가치사슬 단계별 역량을 보유한 화학 또는 바이오기업 간 협력을 통해 합작기업을 설립하고 다양한 바이오화학소재의 상용화를 추진하고 있다.
CJ제일제당은 해양 생분해성 플라스틱 PHACT 브랜드를 론칭하고, 현재 연산 5,000톤 규모의 인도네시아 공장을 2025년까지 연산 6만 5,000톤 규모로 증설 계획 수립하였다. 생분해성 플라스틱 소재 다각화를 위해 HDC현대EP와 바이오 컴파운딩 합작기업인 CJ HDC 비오솔을 설립하여 연산 1만 1,000톤 규모 생분해성 컴파운딩 소재 생산하고 있으며, NatureWorks, SKC, 유한킴벌리, BGF에코바이오 등 국내외 기업들과의 협력을 통해 PHA 소재 응용 분야 확대를 추진 중이다. 자사가 보유한 아미노산 중 lysine을 활용한 cadaverine 생물제조공정을 개발하고 LG화학과 바이오 nylon 5X 개발을 위한 협력을 진행하고 있다.
LG화학은 glucose, glycerol로부터 3-HP(3-hydroxypropionic acid)를 생산하는 생물공정을 개발하고, GS칼텍스와 3HP 실증플랜트 구축하여 시제품 생산을 추진하고 있다. ADM과 바이오플라스틱 PLA 소재 생산을 위해 합작기업 설립 계약을 체결하며, 젖산 생산 법인은 ADM 발효기술을 이용한 연산 15만 톤 규모의 그린와이즈 락틱(GreenWise Lactic)을 설립하고, PLA 생산 법인은 LG화학 바이오플라스틱기술을 이용한 연산 7만 5,000톤 규모의 LG화학 일리노이 바이오켐(LG Chem Illinois Biochem)을 설립하고 2023년 착공하여 2025년 상용 생산을 목표로 하고 있다. 생분해성 소재인 PBAT(polybutylene adipate-co-terephthalate)의 연산 5만 톤 규모 생산 공장을 서산에 건설하여 2024년 상용 생산이 예정되어 있다.
롯데케미칼은 여수에서 생산 중인 바이오 PET의 판매량을 1만 4,000톤에서 2030년 7만 톤까지 확대 추진하고, 생물공정이 아닌 화학공정을 이용한 PHA 생산 기술 연구 진행하여 생물공정 대비 경제성 확보를 위해 노력하고 있다.
대상은 lysine을 활용한 cadaverine 생물제조공정의 실증을 마치고 화학기업과 협력을 통해 바이오나일론, 바이오폴리우레탄 소재 및 시제품 개발 추진 중이다. Genomatica의 1,4-BDO 특허를 회피할 수 있는 glutamate를 활용한 1,4-butanediol 생산기술을 개발 중이며 이를 통해 PBAT의 바이오매스 함량을 향상시킬 예정이다. 또한, 자사의 전분당 기술을 활용한 열가소성 전분계 플라스틱 기술 개발하고 있으며, 저열량 감미료 알루로스 생산기술을 개발하여 2023년 군산에 상용 공장 건립하였다.
삼양사는 2022년 군산에 연산 1만 5,000톤 규모의 이소소르비드 생산 공장을 건립하여 세계에서 두 번째로 상용화 성공하였고, 향후 3~4만 톤 규모까지 확대할 예정이다. 이소소르비드를 활용한 에폭시, 코팅제, 접착제, 페인트 등 친환경 바이오화학제품 개발을 추진하고 있다. 또한, 아스팔담, 수크랄로스 등 인공감미료를 대체하는 저열량 감미료 알루로스를 상용화하고, 천연 고감미료 연구개발 중이다.
SKC는 고강도 PBAT 중합기술을 확보하고 협력 연구를 통한 친환경 제품 개발 중이며, 대상, LX 인터내셔날과 합작기업 에코밴스를 설립하고 연산 7만 톤 규모의 PBAT 공장 설립을 추진 중이다. SK Innovation은 lactic acid 내산성 플랫폼 균주를 확보하고 상용화를 위한 스케일-업 연구 진행하고 있다.
GS칼텍스는 바이오 2,3-BDO(2,3-butanediol)의 상용화를 토대로 글로벌 화장품 기업인 로레알 등과 협력을 통해 바이오 기반 친환경 원료 공급 및 화장품 적용을 진행하고 있다. 바이오 기반 1,3-PDO (1,3-propanediol) 생산기술을 개발하고 상용화 추진 중이며, LG화학과 3-HP 생산 실증 플랜트를 구축하여 시제품을 생산할 계획이다.
대기업을 중심으로 PBAT, PHA, PLA 등 핵심 생분해성 플라스틱 소재의 상용화가 우선적으로 추진되고 있으며, 바이오매스 고함량 PA 및 PUR(polyurethane) 소재의 실증도 추진되고 있다. 바이오플라스틱 소재의 국산화가 추진됨에 따라, 바이오플라스틱 소재의 가공 및 제품화 관련 기업 또한 소재의 해외 의존도를 낮출 수 있다. 또한 바이오플라스틱 소재의 국산화가 성공적으로 달성될 경우, 바이오매스 유래 소재의 다각화를 통해 국내 산업 전반에 확산될 것으로 예상된다.
[표 3-57] 산업바이오 관련 국내 주요 기업 현황
|
기업명 |
사업 영역 및 주요 내용 |
|
|
• 해양 생분해성 플라스틱 PHACT 브랜드 출시, 연산 5,000톤 규모의 인도네시아 공장을 2025년까지 연산 6만 5,000톤 규모로 증설 계획 수립 • HDC현대EP와 바이오 컴파운딩 합작기업인 CJ HDC 비오솔을 설립하여 연산 1만 1,000톤 규모 생분해성 컴파운딩 소재 생산 • Lysine을 활용한 cadaverine 생물제조공정 개발, LG화학과 바이오 nylon 5X 개발을 위한 협력 추진 |
|
|
• GS칼텍스와 3HP 실증 플랜트를 구축하여 시제품 생산 추진 • ADM과 바이오플라스틱 PLA 소재 생산 합작기업 설립, 젖산 생산 법인은 ADM 발효기술을 이용한 연산 15만 톤 규모의 그린와이즈 락틱(GreenWise Lactic), PLA 생산 법인은 LG화학 바이오플라스틱기술을 이용한 연산 7만 5,000톤 규모의 LG화학 일리노이 바이오켐(LG Chem Illinois Biochem), 2023년 착공하여 2025년 상용생산을 목표 • 연산 5만 톤 규모 PBAT 공장을 서산에 건설하여 2024년 상용 생산을 목표 |
|
|
• 여수에서 생산 중인 바이오 PET의 판매량을 1만 4,000톤에서 2030년 7만 톤까지 확대 추진 • 생물공정이 아닌 화학공정을 이용한 PHA 생산 기술 연구 진행하여 생물공정 대비 경제성 확보 노력 |
|
|
• Lysine을 활용한 cadaverine 생물제조공정의 실증을 마치고 바이오나일론, 바이오폴리우레탄 소재 개발 추진 • Genomatica의 1,4-BDO 특허를 회피할 수 있는 glutamate를 활용한 1,4-butanediol 생산 기술 개발 중 • 저열량 감미료 알루로스 생산기술을 개발하고 군산에 상용 공장 건립 |
|
|
• 2022년 연산 1만 5,000톤 규모의 이소소르비드 공장 건립, 세계 두 번째 상용화 • 아스팔담, 수크랄로스 등 인공감미료를 대체할 저열량 감미료 알루로스를 상용화하고, 천연 고감미료 연구 개발 중 |
|
|
• Lactic acid 내산성 플랫폼 균주를 확보하고 스케일-업 연구 진행 |
|
|
• 고강도 PBAT 개발 및 협력 연구를 통한 친환경 제품 개발 • 대상, LX 인터내셔날과 합작기업 에코밴스를 설립하고 연산 7만 톤 규모의 PBAT 공장 건설 추진 |
|
|
• 로레알 등 글로벌 화장품 기업에 바이오 2,3-BDO(2,3-butanedio)l을 친환경 원료 공급 추진 • 바이오 기반 1,3-PDO(1,3-propanediol) 생산기술을 개발하고 상용화 추진 • LG화학과 3-HP 생산 실증 플랜트 구축을 통해 상용화 추진 |
출처: 저자 작성
라. 발전 과제
주요국의 공급망 안정 및 바이오제조 역량 강화, 다국적 거대 기업의 친환경 바이오제품 확대 등에 따라 전 세계적으로 바이오경제의 중요성이 확대되고 있어 정부의 산업바이오 육성 전략 마련이 매우 중요하다. 기존 화학산업과 비교하여 산업바이오는 원료-단량체-소재-제품-인증-순환의 가치사슬 전 과정에서 바이오와 화학기술이 복잡하게 융합되어 있기 때문에 산업바이오를 육성하기 위해서는 가치사슬 각 단계에서 기술 경쟁력을 확보하는 것이 매우 중요하다. 기존 바이오연료와 사료첨가제 분야에 한정되었던 산업바이오도 대기업을 중심으로 바이오플라스틱소재 및 제품으로 포트폴리오 확대를 추진하고 있다. 그러나 바이오플라스틱산업은 석유계 플라스틱 대비 경제성 확보, 바이오플라스틱 인증 획득, 안정적인 국내외 시장 창출 등으로 인해 상용화에 어려움이 있으며 이를 해결하기 위한 정부의 정책지원도 필요한 상황이다.
미국, 유럽, 중국, 일본 등 주요국은 자국의 바이오제조 역량 강화를 위해 바이오설계 및 공정 실증 고도화를 위한 연구개발 및 투자를 지원하고 있다. 특히 미・중 바이오 분야 패권경쟁이 격화됨에 따라 미국과 중국은 막대한 투자를 통해 자국 바이오연구의 자동화 및 디지털화를 추진하고, 이를 통해 얻은 성과를 산업적 실증까지 연계하고 있다. 미국은 Agile Biofoundry와 같은 공공 바이오파운드리를 구축하고, BioMADE를 통해 상용화를 위한 실증 연구를 지원하고 있다. 중국 또한 선전(Shenzhen) 지역에 합성생물학 관련 대규모 투자를 통해 SIAT Biofoundry를 구축하고 기초연구에서 산업화연구가 가능한 바이오연구 복합 클러스터를 구축하였다. 미국과 중국뿐만 아니라 캐나다, 영국, 덴마크, 독일, 핀란드, 호주, 싱가포르, 일본, 인도 등 주요국은 공공 바이오파운드리 구축을 통해 합성생물학 분야 연구개발 가속화를 추진하고 있으나, 우리나라는 아직 공공 바이오파운드리 구축을 위한 예비타당성 조사가 진행 중이다. 주요 경쟁국과 비교하여 우리나라의 공공 바이오파운드리 구축이 지연되는 상황에서 미국은 바이오소재 원천기술의 전 주기 실증 및 빠른 상용화를 위한 바이오 분야 제조혁신연구소인 BioMADE의 지원 금액을 2023년 5억 달러로 상향 조정하였다. 따라서 정부도 민간기업의 위험부담을 경감시키고 원천기술의 빠른 상용화를 위한 공공 바이오파운드리 구축 및 실증 기반 마련이 시급하다.
|
구분 |
바이오파운드리 |
국가, 소속 |
특징 |
|
공공 |
Agile Biofoundry |
미국, 국립연구소 연합 |
• 민간부문이 바이오프로세싱 상용화 일정과 비용을 줄일 수 있도록 미국 7개 국립연구소의 역량과 전문지식을 결합한 공공 인프라 투자 |
|
Concordia Genome Foundry |
캐나다, 콘코디아 대학교 |
• 합성생물학자들이 상당한 규모와 속도로 작업을 수행할 수 있는 최첨단 로봇 장비를 보유한 선도적 기관 |
|
|
London BioFoundry |
영국, 임페리얼 칼리지 |
• SynbiCITE의 핵심 기관으로, 자동화된 설계(처음부터 끝까지), 제작, 다량의 유전자 제작물의 평가를 위한 최첨단 로봇 장비 제공. SynbiCITE 파트너가 새로운 바이오 화학물질, 의약품, 소재의 초기제품화를 통한 상업화를 지원하도록 설계 |
|
|
SYNBIOCHEM |
영국, 멘체스터 대학교 |
• 의약품, 농화학, 지속 가능 바이오제조를 위한 신소재를 포함하는 고품질 특수 화학물질 생산 특화 합성생물학 센터 |
|
|
DTU Biosustain BioFoundry |
덴마크, 덴마크공대(DTU) |
• 미생물 세포공장을 활용한 바이오화학물질 생산을 위한 새로운 지식과 기술을 개발하는 학제 간 연구 수행 |
|
|
Lara, Laboratory Automation Robotic Assistant Biochemistry Greifswald |
독일, University of Greifswald |
• 완전 자동화된 고처리량 단백질 스크리닝을 핵심과제로 하는 연구 플랫폼 |
|
|
VTT Technical Research Centre |
핀란드, VTT 연구소 |
• 기술혁신을 통해 사회와 기업이 성장할 수 있도록 지원 |
|
|
CSIRO-UQ BioFoundry (CUB) |
호주, 퀸즈랜드 대학교 |
• 대용량 로봇 합성생물학을 활용, DBTL Cycle의 합성단계에 초점을 맞추며, 역량에 따라 단계통합도 진행. 호주의 연구개발 커뮤니티가 공개적으로 접근할 수 있는 국제 네트워크 시설을 제공 |
|
|
SynCTI, Singapore BioFoundry |
싱가포르, 싱가포르국립대 |
• 임상 및 기술혁신 중심. 유명 국제기관 및 민간 산업과의 연구 협업을 통해, 합성생물학의 새로운 지식 창출, 기초과학 및 활용연구 능력을 갖춘 고도로 숙련된 연구자의 미래세대 양성 |
|
|
SIAT Biofoundry, Shenzhen |
중국, 중국과학원(CAS) |
• 7,200억 원을 투자하여 9개 기관과 그 밖의 수많은 연구소와 시설로 구성된 대규모 바이오파운드리 구축 완료 • 사업화-상업화-대량생산이 가능한 복합 클러스터의 역할 |
|
|
Kobe Biofoundry |
일본, 고베대학교 |
• ‘스마트 셀 프로젝트’ 내에서 개발된 요소기술을 활용하여 단기간에 스마트 셀을 개발하는 플랫폼 구축 |
|
|
Biofoundry India |
인도, Jawaharlal Nehru University |
• 생물공학 및 바이오제조의 속도 향상을 위한 교육, 기술지원, 계산 및 실험 지원을 제공하는 비영리 이니셔티브 |
|
|
K-Biofoundry |
한국, KAIST, KRIBB |
• 바이오제조의 발전을 위해 생물공학, 데이터 분석 및 스케일업 프로세스의 도구 통합 목표 |
|
|
SKy Biofoundry |
한국, 성균관대학교 |
• 각 분야 기초 기술의 수월성 제고 및 융합 기술의 학문적 성과 도출 목표 |
|
|
민간 |
Amyris |
미국 |
• 7년간 15개 물질 상용화(NASDAQ상장) |
|
Twist Bioscience |
• 합성DNA 최대 공급 기업, Nasdaq(2018) |
||
|
Ginkgo Bioworks |
• DNA 부품 기반 프로세스에 자동화 로봇/자동화 시스템 도입 |
||
|
Moderna |
• RNA 기반 코로나19 백신 개발 |
||
|
Labman |
영국 |
• custom laboratory automation 공급 |
|
|
Astechproject |
• robotics and automation system 공급 |
||
|
Robotic Biology Consortium |
일본 |
• robot facilities, data management 제공 |
[표 3-58] 주요 글로벌 공공 및 민간 바이오파운드리 현황
출처: 저자 작성
국내 바이오플라스틱산업의 육성을 위해서는 글로벌 수준의 바이오플라스틱 제품 인증 제도 마련이 필요하다. 환경부 산하 기관인 한국환경산업기술원은 바이오플라스틱 제품의 물성 인증을 위한 환경표지인증 EL724(생분해성수지제품)와 EL727(바이오매스 유래 합성수지 제품)이 운영 중이다. 하지만 2022년 12월 기준 EL724 인증은 통상적으로 회수가 곤란한 제품에 대해서만 발급이 가능하며, 기존 일회용 생분해성 플라스틱 제품에 대한 신규 인증 발급이 중지되었다. 또한 EL727 인증도 통상적 재활용이 가능한 PE, PP(polypropylene), PS(polystyrene), PET 등 소재로 한정하고 바이오매스 함량도 기존 20%에서 40%로 상향하였다. 바이오플라스틱 제품 관련 환경표지인증 EL724와 EL727의 수정에 따라 많은 기업은 신규 바이오플라스틱 제품에 대한 환경표지인증 획득에 어려움을 겪고 있다. 산업통상자원부의 지원을 통해 한국건설생활환경시험연구원이 2023년 1월 독일 DIN CERTCO 인증기관으로부터 퇴비화조건 인증조건 시험기관으로 지정을 받아 국제 수준의 인증시험 서비스를 개시하였다. 따라서 바이오플라스틱 제품의 인증 기준을 세분화하고 국제 수준의 인증제도를 마련하기 위해서는 정부의 정책적인 지원이 필수적이다.
2. BT + ICT
가. 개요
인구 고령화로 인한 노인 인구의 증가로 의료 비용 증대, 사스, 코로나 등 주기적인 감염병 팬데믹의 창궐, 건강한 삶과 의료 서비스에 대한 기대 수준 향상 등으로 의료 환경을 둘러싼 환경 변화에 따라 저비용의 최적화된 건강관리 및 의료서비스에 대한 니즈가 커지고 있다. 한편, 인공지능, 빅데이터, 바이오 기술 등의 발전과 이러한 이종기술간 융합이 활성화되면서 헬스케어, 의료에 적용하려는 노력이 꾸준히 전개되고 있으며 이를 토대로 혁신적인 의료 융합서비스의 창출을 촉진하고 있다.
개인의 의료정보, 유전체 정보, 라이프로그 등을 BT, IT 기술을 활용해 개인에 최적화된 맞춤형 의료 서비스 제공 역량이 한층 성장함에 따라 주요국에서는 R&D 투자 및 산업활성화 정책을 적극적으로 추진하고 있다. 이러한 BT와 IT의 대표적 기술로 정밀의료와 디지털 치료제가 부각되어 왔으며, 더욱 고도화된 인공지능 기술과 유전체 분석 기술을 통해 미래 성장 산업으로서의 중요성이 증대하고 있다.
정밀의료는 다수를 대상으로 하는 치료에서 개인을 중심으로 다양한 데이터를 인공지능으로 분석해 건강관리, 질병 진단・예측 및 최적의 맞춤형 치료를 제공함으로써 비용을 줄이는 동시에, 치료 효과는 늘리는 것으로 개인에 특화된 의료서비스 실현을 추구한다. 디지털 치료제는 전통적인 의사와 환자의 대면진료를 바탕으로한 의료시스템을 넘어 디지털 기기를 활용한 의료서비스의 패러다임을 전환하는 성장 잠재력이 매우 큰 산업으로 확대・확산 될 것으로 기대된다.
한편, 세계 최초로 디지털 치료제를 개발한 미국의 페어 테라퓨틱스가 파산보호 신청을 함에 따라 현시점에서 산업의 성장 저해 요인 파악과 적극적인 수익 창출 모델 개발에 대한 고민이 필요한 시기다.
이에 본장에서는 정밀의료와 디지털 치료제를 중심으로 국내외 정책동향, 기업 동향 및 시장 전망을 살펴보고 BT+IT 기술 융합산업의 새로운 성장 도약을 위한 발전 방향에 제언하였다.
나. 해외동향
(1) 정밀의료
미국을 비롯한 주요국들은 정밀의료를 미래 핵심전략산업 분야의 하나로 선정해 R&D 투자 및 정책적 지원을 강화해 최근 가시적인 성과로 연결되고 있다.
미국은 ‘정밀의료 이니셔티브(2015)’를 통해 미국 국민의 건강관리 전반에 정밀의료를 적용하는 것을 핵심 목표로 정책을 추진해 왔다. 국립보건원(NIH) 중심으로 최소 100만 명 이상의 사람 데이터를 취합하는 ‘All of Us Research Program’을 통해 개인 건강・질병 관련 과학적 데이터에 기반한 개인 특성화에 적합한 치료법 등의 적용과 궁극적으로는 연구용 코호트 구축에 역량을 집중하고 있다. 2023년 5월 기준으로 약 96만 명의 사람들이 ‘All of Us Research Program’에 등록함으로써 초기 단계의 데이터 구축이 진행 중이다.163)
영국은 보건부 산하에 ‘Genomics England’ 국영 기업을 설립하여 암・희귀 질환 유전체 연구를 토대로 세계 최초로 유전체 분석인 ‘10만 게놈(100K Genome)프로젝트’를 시작해 2018년 10만 명에 대한 유전체 해독・분석의 성과를 달성하였다. 이러한 유전체 분석 기반 정밀의료 경험을 기반으로 전국민 대상의 전장 유전체 분석(Whole-genome sequencing, WGS)을 2023년까지 진행하고 있다. 영국 정부는 정밀의료 실현을 위해 관련 의료제도에 최대 2억 6,000만 파운드를 지원하고, 생명과학 비전 확장을 위하여 6,000만 파운드를 지원할 예정이다.
중국은 ‘정밀의료 5개년 발전계획(2015)’을 토대로 국민에게 맞춤형 의료지원을 위해 R&D 투자를 강화하고, ‘14차 5개년 규획: 2021∼2025(2020)’을 통해 7대 과학기술 첨단 분야 과제 중 하나로 ‘유전자 및 바이오테크’를 선정하였으며, ‘제14차 5개년 바이오 경제 발전 규획(2022)’으로 바이오 산업 발전 전략 방향 등을 제시함으로써 적극적인 정밀의료 정책 지원에 자원과 역량을 집중하고 있다.
개인의 유전체 데이터를 인공지능, 빅데이터 등 기술과 결합을 통해 유전자 분석 기반 개인의 건강관리 및 질병의 진단・치료에 특화된 다양한 의료 솔루션 상품 개발이 확산되고 있다. GSK는 2018년부터 인간 유전체 데이터를 바탕으로 면역시스템을 조절하는 의약품 개발이라는 새로운 방향을 설정하고 4년간 3억 달러를 투자해 23andMe의 방대한 인간 유전체 데이터를 활용해 신약을 개발하고 있다. UK Biobank는 대규모의 유전체 정보를 모아 화이자, 바이오젠 등 글로벌 제약사에 유전체 데이터를 제공하고 이를 통해 신약개발을 하는 계약을 체결하였다. 한편, 아마존은 머크, 화이자, 아스트라제네카 등 글로벌 제약사와 협력해 AION Labs를 설립했다. AION Labs는 인공지능과 컴퓨터 과학을 활용해 치료제 연구개발에 투자하는 혁신 연구소다.164) 써모 피셔는 유전자 분석 장비 및 솔루션 등을 제공하는 글로벌 생명공학 기업으로 유전자 분야 전 과정에 맟춤형의 솔루션 제공을 통해 질병의 조기 예측 및 정밀의료 실현에 기여하고 있다. 로슈의 파운데이션 메디슨(FMI)은 환자 유전체 맞춤형 치료 제공, 수집된 정보를 통합・분석해 임상 유전체 데이터베이스 구축 및 신약개발 등을 가능하게 하는 종합유전체 검사 플랫폼을 제공하고 있으며, NGS 분석을 통해 300개 이상 유전자에서 유전자 돌연변이를 확인, 환자 개인에게 최적의 치료 옵션을 제공한다.
정밀의료 기술의 발달로 조기진단, 개인 맞춤형 건강・질병관리 서비스의 일상화를 앞당겨 의료 시장의 새로운 패러다임 변화를 가속함으로써 핵심 성장 산업으로 빠르게 발전할 것으로 기대된다. 세계 정밀의료 시장 규모는 2022년 735억 달러에서 연평균 11.5%의 성장을 통해 2030년 1,756억 달러의 규모로 확대될 것으로 전망된다.165)
(2) 디지털 치료제
미국, 유럽, 일본, 중국 등 해외 주요국들은 디지털 치료제 서비스 조기 활성화를 촉진하기 위한 정책에 역량을 강화하고 있다.
미국은 ‘Digital Health Innovation Action(2017)’과 ‘Digital Healteh Software Pre-Cert(2019)’를 통해 디지털 치료제 분야에 적합한 규제체계를 개선하였으며, FDA 인허가 단계에서 소프트웨어 의료기기 사업자에게 간편인증제도를 도입해 빠른 시장 진입 환경을 마련했다. 또한 보험청(Centers for Medical and Medicaid Services)은 2021년 일반의약품과 유사한 처방과 조제 시스템의 권한을 주기 위해 이에 합당한 새로운 코드를 부여했다.
독일은 2020년 디지털 치료제를 3개월 내 임시 승인할 수 있는 DiGA(Digital Health Apps program, 디지털 건강 앱) 패스트 트랙 제도를 도입함으로써 디지털 치료제 수가 체계를 신설해 다수의 제품이 상용화되고 있다. 독일 건강보험 재원으로 운영되는 혁신기금은 주로 디지털 치료제 개발자금으로 사용되며 이 기금을 통해 선정된 디지털 치료제 프로젝트는 6개월 동안 최대 7만 5,000 유로를 지원받을 수 있다. 프랑스와 벨기에는 독일의 DiGA 정책을 2022년 도입해 디지털 치료제를 포함한 디지털 헬스케어 수가를 적용할 것을 발표했다. 영국은 디지털 치료제의 신속한 시장 적용을 촉진하기 위해 등재 절차를 간소화하거나 도입 인센티브를 지급하고 있으며, 디지털 치료제를 포함한 디지털 헬스의 임상실험 자금지원을 위한 프로그램을 운영하고 있다.
일본은 디지털 치료제 시장 기반 조성을 통해 디지털 헬스 산업의 성장 촉진을 위한 규제를 정비하였다. 혁신 의료기기에 대한 조건부 승인제도 도입(2017), 프로그램 의료기기 실용화 촉진 패키지 전략(2020), 프로그램 의료기기의 실용화 촉진을 위한 체제 강화(2021) 등을 추진해 왔다. 이러한 규제개혁은 디지털 치료제 실용화를 위한 상담창구를 일원화하고 프로그램의 특성을 반영한 심사제도를 개선, 조기 실용화를 위한 체계 마련 등의 내용을 포함하고 있다.
중국은 공식적인 디지털 치료제 관리지침이 없지만, 유사 제품의 감독 및 등록은 의료기기 소프트웨어 관련 정책 및 절차에 따라 승인하고 있으며 글로벌 디지털 치료제 시장 진입을 위해 선도국인 미국과의 협업 전략을 적극 활용하고 있다.
최초의 디지털 치료제가 미국에서 개발・승인된 후 미국과 유럽 등의 개발사가 만든 디지털 치료제가 후속 승인을 통해 활발하게 시장에 진출하고 있다. 또한, 제약회사를 중심으로 디지털 치료제 개발사와의 전략적 협력을 통해 디지털 치료제 시장 확보를 위한 경쟁이 가속화 되고 있다. 대표적으로 미국의 Highmark Health 보험사는 reSET(약물 사용 장애), NIghtwave(외상 후 스트레스성 악몽), Somryst(만성 불면증) 등과의 협력으로 치료비의 실비보장을 제공하고 있으며, SelectHealth는 PDT(Pear의 혁신적 처방 디지털 치료), reSET-O(오피오이드(아편) 중독 장애 치료) 등에 보험을 적용하고 있다.
이러한 글로벌 디지털 치료제 시장은 미국이 시장을 리딩하는 가운데 유럽과 한국, 캐나다가 추격하는 형국이다. 미국은 2017년부터 5년간 전체 특허 출원 건수의 42%를 차지할 정도로 디지털 치료제 시장을 이끌어가고 있으며, 유럽 9%, 한국과 캐나다가 7%를 차지하고 있다.166)
한편, 디지털 치료제의 성장과 한계가 동시에 공존하는 상황을 확연하게 보여주는 사례가 발생했다. 세계 최초로 디지털 치료제를 개발한 페어 테라퓨틱스가 2023년 4월 파산보호를 신청했다. 이번 페어 테라퓨틱스의 파산보호 신청의 근본 원인 중 하나로 보험급여 미적용을 들 수 있다. 디지털 치료제에 대한 FDA 허가를 받은 지 5년이 넘었어도 여전히 일부 공공・민간 보험에서만 제한적 적용으로 사업자의 수익확보에 대한 한계를 보여준 것이다.167) 이는 디지털 치료제 사업자가 안정적이고 지속적인 사업을 운영하기 위해 보험 적용과 함께 새로운 수익 모델을 개발하는 것이 필요함을 시사한다.
Strategic Mareket에 의하면, 글로벌 디지털 치료제 시장은 2021년 30억 2,000만 달러에서 연평균 31.4%의 고성장을 통해 2030년 357억 8,000만 달러의 시장 규모가 형성될 것으로 전망된다.168)
다. 국내동향
(1) 정밀의료
우리나라는 국민건강보험공단, 건강보험심사원, 국립암센터, 국립보건연구원 등에 건강검진 데이터베이스, 진료・투약 내역, 100만 명 표본 코호트, 각종 암 발생 통계 데이터, 약 93만 명분의 인체자원 정보, 그리고 민간의료기관에 EMR(전자화된 의무기록) 등 방대한 양의 대규모 보건의료 데이터를 통해 일찍이 정밀의료가 가능한 의료환경을 갖추고 있다.169)
복지부는 2017년 정밀의료기반 암 진단 치료법 개발 사업단 출범을 통해 500명 이상의 암 환자 유전자 데이터 분석을 2020년 시행하였으며, 과기정통부는 2021년 한국판 뉴딜 2.0 실현을 목적으로 정밀의료 소프트웨어 선도계획을 발표함으로써, 세계적인 정밀의료 소프트웨어 생태계 조성을 강조하였다.
한국형 정밀의료 ‘KOSMOS2’는 개인 맞춤형 치료를 현실화할 수 있는 프로젝트로, 차세대염기서열분석(NGS)을 통해 1,000명의 환자를 모집해 300명 약제를 제공하고 축적된 유전체 DB를 활용해 신약개발을 목표로 한다. 이를 위해 국가 차원의 공공 임상 유전체 데이터베이스(Clinico-Genomic Database, CGDB)를 구축하고 ‘KOSMOS2’ 플랫폼이 다양한 약제와 진단법, 소프트웨어 기술 등을 더 발전시켜 집단지성으로 최적의 맞춤형 치료 전략을 제시함으로써 정밀의료를 앞당기는데 기여할 것이다.170)
보건복지부, 과기정통부, 산업통상자원부, 질병관리청 등을 중심으로 대규모 범부처 주도의 ‘100만명 바이오 빅데이터 구축사업’의 예비타당성조사가 2023년 6월 통과되었다. 이로써 100만 명 규모의 임상정보, 유전체 등 오믹스 데이터, 공공데이터, 개인보유건강정보를 통합하여 구축・개방하는 ‘국가 통합 바이오 빅데이터 구축사업’이 2024년부터 본격 추진될 예정이다. ‘국가 통합 바이오 빅데이터 구축사업’은 뱅킹시스템(Banking system)을 특징으로 한다. 참여자는 병원, 건강검진센터 등 참여자 모집기관을 통해 자신의 혈액, 소변 등 검체와 임상정보 등 바이오 데이터를 본 사업의 바이오뱅크와 데이터뱅크에 기탁하게 된다. 의료계・산업계・학계 등에서는 정밀의료 기술, 혁신 신약, 디지털 헬스 신제품 및 서비스 개발 등 연구 목적에 맞는 한국형 바이오 빅데이터를 필요한 양과 종류만큼 데이터뱅크로부터 제공받을 수 있다. 1단계 사업은 2024년부터 5년간 총 6,065억 8,000만 원 투자해 77만 2,000명(질환자 18만 7,000명, 일반인 58만 5,000명)의 바이오 데이터 구축 및 개방을 목표로 한다.

출처: 보건복지부, ‘100만 명 바이오 빅데이터 구축사업’ 예비타당성 조사 통과, 2023.6
[그림 3-108] 국가 통합 바이오 빅데이터 구축사업
국립보건연구원은 2022년 11월 세계적 학술지인 Nature Communications에 한국인 포함 동아시안 29만 명 대상 유전체 분석 연구 결과를 실었다. 당뇨, 고지혈증 등에 영향을 주는 200개 이상의 신규 유전 요인을 발굴하였다. 이번 연구를 통해서 발굴한 모든 유전 요인들을 통합 분석하면 저위험군 대비 10배 이상 높은 유전적인 고위험군을 당뇨 발병 이전에 미리 선별하여 예방할 수 있다는 것이 가장 큰 특징이다.
국내의 대표적인 정밀의료 관련 사업자 및 의료기관에서의 정밀의료 추진 현황을 살펴보면 다음과 같다. 마크로젠은 국내 1위의 유전체 분석 전문 기업으로 2022년 12월 복지부로부터 국내 최초로 DTC(Direct to Customer) 공식 유전자 검사 기관 인증을 획득했다.171) 지니너스는 삼성서울병원 삼성유전체연구소에서 2018년 스핀오프(Spin-off)한 유전체분석 전문기업이다. 2023년 3월에는 글로벌 바이오텍 기업인 ‘10x Genomics’와 차세대 정밀의료 파트너십을 통해 싱글셀 분석과 신약개발 등을 아우르는 협력체계를 구축하였으며, 오믹스데이터를 활용한 신약개발 플랫폼 ‘Drugs GPS’를 발표했다.172) 지아이비타는 2018년 설립되었으며 건강데이터 인공지능 기술과 의료전문가의 가이드로 건강관리 및 질병 예방 솔루션을 제공하는 디지털 헬스케어 기업이다. 2022년 출시된 디지털 헬스케어 서비스 ‘로디(ROTHY)’는 스마트폰・워치 등과 연결해 사용하는 개인 맞춤형 헬스케어 애플리케이션으로 인공지능 기술을 기반으로 맞춤형 걸음 수 제공 및 기간별 걸음수를 데이터화 해 볼 수 있게 함으로써 궁극적으로 개인의 건강한 생활습관을 유지하는데 기여한다.173) 현대건설은 2023년 6월 글로벌 생명공학 분야 1위 기업인 미국의 써모 피셔 사이언픽 및 국내 유전자 분석・검사 전문 서비스기업 마크로젠 등과 생명공학・정밀의료의 기술융합을 통해 신개념의 미래형 건강주택 개발을 위한 전략적 업무협약을 체결했다.
용인세브란스병원은 2022년 7월 개인 맞춤형 정밀의료 구현을 위해 유전체분석 전문기업 지니너스와 협력해 유전체 연구실을 개소하였다. 유전체 연구실은 개인 맞춤형 디지털 헬스케어와 융합한 환자 유전체 분석 및 관리 시스템을 구축해 정밀의료 구현을 위한 기초 환경을 조성하고 이와 연계한 연구 역량을 확보하고자 한다. 또한 유전자, 환경, 생활 습관 등 개개인의 특성을 반영된 데이터의 축적활용을 통해 질병을 예방진단하고 유전적 특성에 따른 맞춤형 치료를 제공하고자 한다.174)
(2) 디지털 치료제
우리나라는 높은 성장이 전망되는 디지털 치료제 산업기반 활성화를 위해 적극적인 정책 개선과 연구개발을 지원하고 있다. 식약처는 2020년 5월 ‘디지털치료기기 허가/심사 가이드라인’을 발표하였으며, 디지털 치료제를 ‘소프트웨어 의료기기(Software as a Medical Device, SaMD)’175)로 정의함으로써 본격적으로 디지털 치료에 대한 정책 방향을 설정하였다. 제12차 과학기술관계장관회의(2020.8.)에서는 포스트 코로나 시대 30개 중점 유망기술에 헬스케어 영역에서 디지털 치료제가 포함되었다. 정부는 2020년 발표한 ’디지털 뉴딜‘ 정책을 기반으로 디지털 치료제 산업생태계 활성화를 위해 R&D 투자를 확대하고 있다. 과기정통부는 2026년까지 XR(확장현실) 핵심 기술 개발 사업에 350억 원을 투입할 계획이며 2023년 예산으로 약 100억 원을 편성하였다. 산업통상자원부는 디지털 치료제의 개발방법론・시험평가 기술 개발 등에 2022년에 이어 2023년에도 45억 원을 편성하였다. 과기부는 2022년 ’디지털바이오 혁신전략‘을 통해 매년 4,000억 원을 투입해 디지털 치료제를 비롯한 신개념 치료제 시제품 개발 지원을 발표했으며, 범부처적 혁신의료기기 규제개선 방안 마련을 통해 임상현장에 디지털기술 적용을 강화하는 노력을 하고 있다. 또한 디지털 치료에 연구개발 지원의 하나로 과기부는 만성질환 건강관리를 위한 맞춤형 메디컬 트윈 기반 디지털 치료제를 개발 중이며, 복지부와의 협업을 통해 소아자폐 환자와 보호자가 함께 사용할 수 있는 디지털 치료제도 공동 개발 중이다. 이를 통해 국민이 체감할 수 있는 디지털 치료제의 개발과 활용에 적극적인 R&D 투자와 정책적 지원을 강화하고 있다.
우리나라에서도 2023년 디지털 치료제를 정식으로 승인받은 기업이 탄생했다. 불면증 개선 분야의 에임메드와 웰트다. 에임메드의 불면증 증상 개선 소프트웨어 ‘솜즈176)’가 2023년 2월 복지부로부터 국내 1호 디지털 치료제로 허가를 받았다. 솜즈는 6∼9주간 실시간 피드백, 행동 중재, 교육훈련 프로그램으로 환자 맞춤형의 불면증 치료를 제공하며 수면제한요법, 자극조절법, 수면습관교육, 스트레스 관리요법 등 환자가 불안함을 느끼지 않도록 다양한 프로그램을 제공하고 있다.

출처: 에임메드 홈페이지
[그림 3-109] 에임메드의 불면증 치료제 ‘솜즈’의 치료 솔루션
에임메드의 ‘솜즈’에 이어 2023년 4월 국내 두 번째 디지털치료기기로 불면증 인지치료소프트웨어 웰트의 ‘WELT-I’가 선정되었다. WELT-I는 ‘불면증 인지행동치료법’을 모바일 앱으로 구현한 소프트웨어 의료기기로 수면 효율을 높여 불면증 환자의 증상을 개선하는 데 사용하도록 허가받았다. 웰트는 2016년 삼성전자에서 스핀오프 된 디지털 헬스케어 스타트업으로 삼성, 한독, 스마일게이트 등으로부터 누적 140억 원의 투자금을 유치했다.
2023년 5월 기준으로 식약처의 임상시험계획(IND) 승인을 받아 최종단계인 확증 임상에 진입한 디지털치료제 바이오벤처 개발사로는 뉴냅스, 라이프시맨틱스, 하이, 메디마인드, 이모코그 등이며 향후 디지털치료제에 대한 정부의 승인이 기대된다.
[표 3-59] 디지털치료제 확증임상 진행 현황(2023.5)
|
의뢰회사 |
확증임상승인일 |
제품명 |
치료 분야 |
|
뉴냅스 |
2019년 6월 13일 |
뉴냅비전 |
뇌손상 시야장애 개선 |
|
라이프시맨틱스 |
2021년 9월 3일 |
레드필 숨튼 |
호흡 재활 |
|
하이 |
2021년 12월 30일 |
엥자렉스 |
범불안장애 |
|
뉴냅스 |
2022년 8월 1일 |
비비드 브레인 |
뇌질환 시야장애 개선 |
|
이모코그 |
2022년 10월 20일 |
코그테라 |
경도인지장애 치료 |
|
메디마인드 |
2022년 10월 28일 |
알코테라 |
알코올 사용장애 개선 |
출처: 식약처
전통적인 제약사와 대기업 바이오회사도 향후 디지털 치료제의 성장 가능성을 높게 보고 디지털치료제 바이오 벤처기업에 대한 투자를 강화하고 있다. SK바이오팜은 칼라헬스, 동화약품은 하이, 한미약품은 디지털팜, 한독은 웰트 등이 대표적인 투자 사례이다.
한편, 경희의료원은 환자가 아플 때 의사가 약을 처방하는 것처럼 디지털 치료제를 처방할 수 있는 플랫폼을 국내 최초로 개발했다. 의료정보시스템과 데이터 연계를 통해 디지털 치료제 처방 플랫폼을 활용할 경우 환자 밀착형 관리가 가능할 것으로 기대된다.177)
국내 디지털 치료제 시장은 2019년 1,247억 원에서 연평균 27.2%의 성장률을 보이며 2025년 5,288억 원에 이를 것으로 예측된다.178)
라. 발전 과제 및 전망
고령인구의 증가와 함께 건강한 삶에 대한 높은 사회적 관심의 증대라는 새로운 라이프 패러다임의 변화가 바이오, IT기술의 발전으로 빠르게 성장하고 있는 디지털 기반 치료 및 정밀의료 기술과의 만남을 통해 개인에 최적화된 맞춤형 의료・헬스케어 서비스・산업의 성장을 촉진하고 있다.
이에 BT와 IT 융합 서비스・산업의 성장을 견인할 전략적 방향을 제언하면 다음과 같다.
우선, 데이터 보유기업과 기술보유 기업 간 전략적 동반적 관계를 강화해야 할 것이다. 소비자에게 최적의 맞춤형 서비스를 제공하기 위해서는 개인의 유전자, 의료, 라이프로그 등 데이터와 인공지능, 빅데이터, 바이오 기술 등의 결합을 통한 솔루션 개발이 중요함에 따라 데이터, 기술에 특화된 기업 간 협력의 시너지를 발휘, 새로운 고부가가치 상품 개발이 필요하다.
둘째, 개발된 기술의 상용화를 촉진할 제도적 기반 마련이 요구된다. 디지털 치료제의 경우 적정한 건강보험 수가 체계가 마련되지 못해 실제 소비자가 이용하는데 장애요인으로 작용하고 있다. 건강한 삶을 추구하는 수요자 관점을 고려하여 실효성 있는 보험수가 체계 확립을 위한 이해당사자 간 협의를 통해 제도적 기반을 확충해야 할 것이다.
셋째, 정밀의료 및 디지털 치료제 분야 국내 스타트업의 지속적 성장을 위한 핵심 애로사항 파악과 지원정책 마련이 요구된다. 스타트업의 가장 큰 애로사항인 자금조달 부족은 대표적인 요인 중 하나이며, 스타트업의 성장 단계별 자금조달을 쉽게 하기 위해서는 다양한 수요기업을 위한 맞춤형 정책금융 지원을 강화해야 할 것이다.
마지막으로, 혁신적인 비즈니스 모델 개발이 필요하다. 정밀의료와 디지털 치료제는 정부에서 시행하고 있는 마이 데이터(My Data)와의 결합을 통해 개인 맞춤 서비스로 발전할 것으로 전망된다. 개인의 유전체 정보뿐만 아니라 헬스케어 데이터, 식습관, 금융데이터 등을 인공지능, 빅데이터와 같은 첨단 IT기술에 접목할 경우 더욱 정밀하고 다양한 혁신적인 개인 맞춤형의 솔루션 개발이 기대된다.
3. BT + NT
가. 개요
고령화, 만성질환의 증가, 의료기술의 고도화에 따른 의료비 급증 등에 의해 의료서비스의 개념은 4P(Preventive, Prediction, Personalized, Participatory) 의학으로 변화하고 있다. 4P 의학은 예측, 예방, 맞춤, 참여 의학으로 이 중에서도 예방으로의 의료시스템 변화가 부각되어 왔다. 더불어, 우리의 바이오헬스 산업의 패러다임은 전환기를 맞이하였다. 인공지능, 빅데이터 등 정보지능 기술이 이끄는 4차 산업혁명과 유전자가위, 유전자시퀀싱, 줄기세포와 같은 첨단 생명공학 기술의 출현은 바이오헬스 분야 생태계 전반을 변화시켰다. 특히, 나노입자 전달체, MEMS와 같은 나노 기술의 융합은 바이오헬스 기술의 고도화와 원천・신개념 플랫폼 개발을 견인하며, 바이오헬스 분야의 핵심 성장동력으로 작용하였다. 이는 환자 맞춤형・정밀 의료의 확립 및 신종감염병에 대한 신속 대응을 촉진하며, 건강 사회 구현에 기여하였다.
이러한 융합 바이오헬스 산업의 비약적인 발전에 오픈 이노베이션(Open innovation)이 중추적인 역할을 하였다. 기업・대학・연구기관 등 연구개발 주체 간의 자발적 협력을 통해 분산된 기술, 인력, 인프라를 집중함으로써 절대적 R&D 규모, 역량, 속도의 한계를 극복하고 R&D, 사업화, 투자로 이어지는 선순환적 R&D 생태계를 구축하였다. 또한 코로나19 사태를 계기로 규제에 대한 인식 변화 및 관련 제도 개선이 바이오헬스 산업 발전에 물꼬를 틔웠다. 최근 백신・치료제, 진단키트 제품 인허가, 배아 유전자편집 및 줄기세포 연구, 보건의료 빅데이터 활용 등에 대한 일부 핵심 규제가 완화되었다. 보건의료 빅데이터 활용의 걸림돌이었던 가명처리 등이 ‘개인정보보호법’ 개정(2020)에 포함되었으며, 분야의 특성을 고려한 ‘첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률’이 제정되었다(2019).
혁신 기술의 등장과 예방 중심으로의 의료 트렌드 변화 속에 BT・NT 융합 바이오헬스 산업 분야에서는 바이오의약품과 체외진단기기가 많은 주목을 받아왔다. 바이오의약품은 생체 유래 원료를 사용해 만든 의약품으로, 질병의 증상 개선에 국한된 합성의약품과 달리 질병의 발병 원인에 직접적인 효능을 발휘하여 근본적인 치료가 가능한 데 의의가 있다. 백신, 항체의약품, 세포・유전자 치료제로 범주화되며, 암, 류마티스 관절염 등 희귀・난치성 질환에 대해 표적 치료를 기반으로 한 혁신적 개발 성과가 보고되었다.179) 특히 mRNA 코로나19 백신은 대표적인 차세대 바이오 나노 융합 백신으로서 조속한 코로나19 위기 대처에 중요한 역할을 하였다. 체외진단기기는 사람・동물 유래 검체를 체외에서 검사하기 위해 사용하는 시약, 장치, 소프트웨어를 포함하며, 나노・바이오 소재 개발, 미세유체 제어, 진단칩의 고집적화, 인공지능, 프로세스 자동화 등 플랫폼 기술이 고도화됨에 따라 활용 범위가 확대됐다. 이는 신종감염병에 대한 효과적인 대응을 가능하게 하고, 풍부한 직・간접적 진단정보 확보를 통한 ‘환자 맞춤형 치료’ 및 치료 효과 예측을 통한 ‘정밀의료’ 확립을 앞당겨 줄 것으로 기대된다.
이에 본 장에서는 질병의 예방부터 근본적인 치료까지, 헬스케어 전반을 아우를 수 있는 바이오의약품, 체외진단기기를 중심으로 국내・외 정책, 기업 및 연구개발 동향, 시장 전망을 살펴보고 BT・NT 융합 바이오헬스 산업의 지속적인 성장을 위한 발전 과제를 제시하였다.
나. 해외 동향
(1) 바이오의약품
코로나19 팬데믹 선언 후 미국은 민・관 협력 계획 ‘ACTIV(2020)’ 및 ‘Operation Warp Speed (2020)’를 통해 백신・치료제 개발 및 생산을 가속화하고 2021년 1월까지 3억 회 분의 백신 공급을 목표로 제시하였다. FDA는 특별 비상 프로그램, ‘CTAP’를 구성하여 규제를 완화함으로써 백신・치료제 개발을 촉진하였다.
유럽은 EU 최대 감염병 백신 연구혁신 프로그램, ‘Horizon 2020’의 일환으로 제약업계 민・관 파트너십, ‘혁신 의약품 이니셔티브(IMI)’에 7,200만 유로(약 1,000억 원)를 투입하며, 코로나19 백신 개발을 지원하였다. 한편, 영국은 ‘COVID-19 Genomics UK Consortium(2020)’을 조직하여 대학의 백신 연구개발에 8,400만 파운드(약 1,300억 원)를 지원하였으며, 범정부 백신 테스크포스 출범을 통해 백신 7종 3억 6,700만 회 분의 계약 등 60억 파운드(약 9조 4,700억 원) 이상을 투자하였다.
일본은 ‘의약품 산업 강화 종합전략(2015)’을 통해 의약품 산업경쟁력을 강화해왔으며, 1,261억 엔(약 1조 3,085억 원)의 예산이 편성된 의료 연구개발 기구(AMED) 2기(2021)에서 코로나19 의약품 개발에 높은 비중을 두었다. 또한 신종감염병 전반에 대응하는 의약품 연구개발을 위해 ‘신종・재출현 감염병 관리 프로젝트’를 추진하였다.
중국은 ‘바이오산업 발전규획(2016∼2020)’을 통해 바이오산업 육성을 추진하였다. 특히, ‘바이오의약 비중 확대’ 및 ‘신약・바이오시밀러(Biosimilar) 개발’에 초점을 두었다. 즉, ‘원료 중심에서 완제품 수출 중심’으로 산업을 개편하였다. 또한 시스템 개선을 위해 제조설비를 첨단화하고, 품질・안전 검사과정을 감축하였다. 2021년 발표한 제14차 5개년 규획에서는 2025년까지 관련 R&D 투자를 연간 7% 이상 늘릴 계획을 발표하였다.
각국 정부의 적극적인 지원 아래, 기업・대학・연구기관 간의 협력을 통해 바이오의약품 분야는 괄목할 만한 발전을 이루었다. 특히, mRNA 백신 전달 플랫폼으로 지질나노입자를 도입한 mRNA/지질나노입자 기반 코로나19 백신은 비약적인 발전을 이루었으며 신속한 팬데믹 위기 대응에 이바지하였다. 대표적으로 화이자-바이오엔텍, 모더나 및 아스트라제네카가 코로나19 백신 시장을 주도하였으며 이노비오, 사노피 등은 타 연구기관과 공동으로 개발 중이다.
바이오엔텍은 암 치료용 백신 개발에 활용 중인 mRNA 플랫폼 기술을 바탕으로 화이자에 공동개발을 제안하였고, 화이자는 임상시험, 승인, 유통 등을 추진하였다. 이를 통해, 코로나19 백신 코미나티를 개발하였으며, 2020년 12월 최초로 FDA 승인을 받았다. 2021년 한 해에만 30억 회 분량의 백신을 생산하였으며, 426억 달러(약 51조 1,200억 원)의 수익을 냈다. 뒤이어 모더나는 미 정부의 지원을 받아 NIH NIAID 산하 백신 연구센터와 공동연구를 수행하여 mRNA 백신 스파이크백스를 개발하였다. 아스트라제네카는 제조 및 유통에 참여해 옥스퍼드대학교 제너연구소, 옥스퍼드 백신 그룹과 함께 코비실드를 개발하였다.180)
전방위적인 재정적, 제도적 지원 및 글로벌 백신 수요의 증가 등으로 많은 글로벌 제약 바이오 기업이 RNA 백신 R&D에 참여함에 따라 백신 시장 규모는 당분간 성장할 것으로 예상된다. mRNA 백신・치료제 시장 규모는 2020년 11억 7,000만 달러(약 1조 3,300억 원)에서 2026년까지 연평균 8.7% 이상 성장해 21억 2,000만 달러(약 2조 5,440억 원)에 이를 것으로 전망된다.181) 한편, 코로나19 백신 연구개발 과정에서 mRNA 플랫폼의 기술적・임상적 안정성 및 치료제로서의 가능성이 확인되며 mRNA 기반 세포・유전자 치료제 개발이 가속화됨에 따라 세포・유전자 치료제 시장 또한 2024년까지 높은 성장률을 보일 것으로 기대된다. 이외에도 항체의약품은 이중표적 항체, 항체-약물 결합체와 같은 새로운 플랫폼 개발과 함께 연평균 9.5%의 성장률을 보일 것으로 전망되며 특히, 항체-약물 결합체 시장은 2019년 26억 5,000만 달러(약 3조 1,800억 원)에서 2024년 135억 달러(약 16조 2,000억 원)로 급성장할 것으로 전망된다. 이러한 추세에 힘입어 바이오의약품 시장 전체는 향후 7년간(2019∼2026) 9.6%의 고성장 및 5,050억 달러(약 606억 원)의 규모를 달성할 것으로 예상된다.182)
(2) 체외진단기기
세계 각국은 체외진단 산업을 체계적으로 발전시키기 위해 규제 완화 및 안전성 확보를 위한 정책을 시행해 왔으며 세계국가보건기구 WHO는 2014년 에볼라 유행을 계기로 긴급사용평가(WHO EUAL)에 대한 평가 기준과 지침을 수립하였다.
미국은 신속한 코로나19 위기대응을 위해 2020년 2월 FDA를 통해 진단기기의 긴급사용승인(EUA) 절차를 진행하였고 다양한 정책을 통해 진단 기술의 고도화를 추진하였다. 보건부 산하의 생물의약품 첨단연구개발국(BARDA)은 민간과의 파트너십을 통해 코로나19 진단 기술 연구개발 및 상용화를 지원하였다. 미국 질병통제청(CDC)은 ‘COVID-19에 대한 글로벌 대응을 위한 CDC 전략(2020∼2023)’을 제시하며, 진단 부문의 첨단 분자진단 기술, 차세대 시퀀싱 등 핵심기술 R&D 지원을 발표하였다. 또한, 산하의 인수공통감염병질병센터(NCEZID)는 신종감염병 및 인수공통감염병 대응을 위한 ‘전략계획(2018∼2023)’을 발표하며 진단 기술의 신속화 및 고도화를 추진하였다. 국립보건원(NIH)은 ‘RADx Initiative’를 통해 15억 5,000만 달러(약 1조 8,600억 원)를 투입하여 신개념 바이러스 진단 기술 개발, 검증, 임상시험을 통한 상용화 가속화 등 코로나19 진단 기술 개발 관련 다양한 프로그램을 추진하였다. 한편, 미 특허청은 2020년 5월 코로나19 관련 FDA 승인이 필요한 소규모 기업의 발명에 대해 ‘우선심사 프로그램’을 무료로 지원하며 민간의 R&D 참여를 장려하였다.
대표적인 글로벌 체외진단기기 기업으로는 애보트, 로슈, 지멘스, BioMerieux, 레인댄스 테크놀로지, 바이오-라드 등이 있다. 해당 기업들은 PCR 및 면역진단 방식의 신속진단키트 외에도 생명공학 기술과 나노 기술을 융합함으로써 새로운 플랫폼 및 관련 제품을 개발하였다. 디지털 PCR, 유전자가위, 반도체 칩, 전자 코와 같은 신개념 플랫폼을 중심으로 활발한 연구개발이 이루어졌으며, 특히 디지털 PCR은 암, 알츠하이머 등 난치성 질환의 정밀진단에 활용됨에 따라 환자맞춤형 의료・정밀의학 분야의 발전에 이바지하였다. 디지털 PCR은 2016년 미국 전체 PCR 시장의 20% 이상을 차지하였고, 2023년까지 연평균 20% 이상 성장하며 7억 5,000만 달러(약 9,000억 원)의 시장 규모를 확보할 것으로 전망된다.183)
글로벌 체외진단 시장 규모는 2018년 612억 달러(약 73조 4,400억 원)였으며, 연평균 4.5%의 성장률로 성장해 2026년에는 880억 달러(약 105조 6,000억 원)에 이를 것으로 전망된다. 기술별 규모는 분자진단, 면역진단, 현장진단 순으로, 분자진단 및 면역진단은 각각 2015년 150억 달러(약 18조 원) 및 100억 달러(약 12조 원)에서 2023년 220억 달러(약 26조 4,000억 원) 및 150억 달러(약 18조 원)로, 두 분야 모두 연평균 4.7%로 성장할 것으로 예상된다.184)
[표 3-60] 글로벌 BT・NT 융합 체외진단 기술 개발 동향
|
기술 |
진단 원리 |
진단 분야 |
기업명 |
|
디지털 PCR |
1,000만여 개의 pL 수준의 액적 내에서 병원체 유전자에 특이적인 검출반응에 의한 신호 유무를 파악. 단일 병원체 유전자가 각각의 액적에 국부화되어 있으므로, 디지털 측정을 통해 병원체 유전자의 절대적 정량이 가능함 |
분자진단 |
플루다임 |
|
바이오-라드 |
|||
|
레인댄스 테크놀로지 |
|||
|
라이프 테크놀로지 |
|||
|
유전자가위 |
병원체 유전자를 특이적으로 인식하는 유전자가위 시스템에 기인한 반응산물을 종이검사지 상에서 비색신호를 통해 확인 |
분자진단 |
셜록 바이오사이언스 |
|
맘모스 바이오사이언스 |
|||
|
반도체칩 |
소음 제거, 신호 증폭 등을 담당하는 아날로그 신호처리 모듈인 센서 ASIC를 기반으로, 칩에 고정된 유전자와 병원체 유전자의 결합에 의한 반도체의 전기적 저항 차를 고감도로 감지 |
분자진단 |
팔로젠 |
|
나노리본 구조체를 기반으로 병원체 바이오마커에 의한 전도도 변화를 증폭 |
면역진단 |
NanoDiagnosiX |
|
|
전자 코 |
피검사자의 날숨에 포함된 질환 특이적인 휘발 성분을 인식하고, 기계학습을 통해 진단 |
면역진단 |
나노센트랩 |
|
근접 유도 신장 (Proximity Extension Assay) |
한 쌍의 DNA-항체가 병원체 바이오마커에 특이적으로 결합함에 따라, 항체의 DNA 간 거리가 가까워지고 DNA 간 신장반응이 일어남. 시퀀싱 또는 실시간 PCR 증폭을 통해 신장반응산물을 분석 (1회에 최대 96종 동시 분석 가능) |
면역진단 |
오링크 |
|
단분자 어레이 (Single Molecule Array) |
병원체에 의해 특이적으로 형성되는 면역복합체에 의한 신호 유무를 파악. 단일 병원체 (또는 면역복합체)가 각각의 마이크로 웰에 국부화되므로, 농축 효과에 의한 신호증폭 및 디지털 측정을 통한 병원체의 절대적 정량이 가능함 |
면역진단 |
Quanterix |
출처: 저자 작성
다. 국내 현황
(1) 바이오의약품
우리나라는 2019년 과학기술 분야 최상위 계획인 ‘제4차 과학기술 기본계획’을 통해 미래 신산업 투자 분야의 신약개발에 대한 중장기 투자계획을 발표하였으며, 혁신 바이오의약품 및 환자 맞춤형 신약 연구개발에 대한 지속적인 지원이 골자를 이루었다. 또한 범부처 차원의 ‘바이오헬스 산업 혁신전략(2019)’을 수립하였다. 이 전략은 2030년까지 혁신 신약 및 의료기기 분야 글로벌 시장 점유율 6% 확보를 목표로 하였고, 면역세포 기반 표적항암제, 세포・유전자 치료제 등 바이오의약품 R&D 및 전문인력 양성에 대한 지원과 인・허가 단축, 우선・신속 심사 지원 등 제도 구축에 주안점을 두었다.
한편, 코로나19 창궐을 계기로 우리 정부는 신종감염병 대응을 위한 백신・치료제 개발에 정책역량을 집중하였다. 과학기술정보통신부의 ‘미래 감염병 기술 개발 사업(2021)’을 통해 신종감염병 대응 백신・치료제 플랫폼 기술 개발, 바이러스 기초 연구역량 강화 및 인프라 구축을 주요 목표로 제시하였다. 코로나19 백신・치료제 개발에 연 100억 원, 한국 바이러스 기초연구소 설립 및 바이러스 연구자원센터 구축에 연 109억 원을 투자하였다. 같은 해 보건복지부는 ‘국가신약개발재단’을 출범하여 신약개발의 전주기 R&D를 지원하였다. 또한 우수 후보물질 지속가능 공급망 구축, 오픈 이노베이션 구축, 병목구간 집중 지원, 글로벌 진출을 중점적으로 지원하였다. 이외에도 2020년에 조직한 ‘백신실용화기술개발사업단’을 통해 ‘백신 주권 확보 및 글로벌 시장 진출’을 비전으로 내세우며 백신 관련 14가지 중점 분야를 지원하였으며, 백신 자급화, 유망 후보물질 발굴, 임상 진입 가속화를 적극 추진하였다.
국내 대표기업으로는 에스티팜, GC녹십자, 한미약품, 알엔에이진, 삼성바이오로직스, SK바이오사이언스, 큐라티스 등이 코로나19 백신 개발 및 위탁생산에 참여하였다. 에스티팜은 자체 mRNA 기술력을 제네반트의 지질나노입자 기술과 접목해 mRNA 백신 개발에 나섰으며, 우수한 원료・완제품 생산설비를 갖춘 GC녹십자 및 한미약품과 ‘차세대 mRNA 백신 플랫폼 기술 컨소시엄’을 결성하였다. 알엔에이진은 항암제 개발 과정에서 축적한 mRNA 플랫폼 기술을 기반으로 코로나19 백신을 개발하였으며 임상시험에 진입하였다. 삼성바이오로직스, SK바이오사이언스 및 큐라티스는 미국의 글로벌 제약・생명공학 기업(모더나, 노바백스, HDT바이오 등)의 위탁생산을 담당하며 한・미 글로벌 백신 파트너십 강화에 일조하였다.185)
2015∼2019년 연평균 3.2%의 성장률을 보이던 국내 백신 시장은 2019년 대비 2020년 30.3%, 2020년 대비 2021년 322.3%의 비약적인 성장을 기록하였으며, 2021년에는 시장 규모 3조 8,050억 원을 달성하며 유전자재조합의약품을 제치고 바이오의약품 시장에서 가장 큰 비중(약 54%)을 차지하였다. 코로나19 백신 치료제 실적 호황에 힘입어, 바이오의약품 시장 전체는 2020년 대비 2021년 112.3%의 성장률로 최근 5년 중 가장 높은 성장세를 보였다.186)
(2) 체외진단
정부는 국내 체외진단기기의 기술 경쟁력 확보 및 해외시장 진출을 위해 R&D 투자와 제도 개선에 집중하였으며, 분야 육성을 위한 법적 기반을 마련하였다. ‘의료기기 산업 중장기 발전계획(2014)’을 통해 ‘세계 7대 의료기기 강국 진입’을 비전으로 제시하며 수출액 13조 5,000억 원, 세계 시장 점유율 3.8% 달성을 목표로 설정하였다. 이를 위해 중소기업 육성, 규제 완화, 산업인프라 조성 등 국내 의료기기 산업의 경쟁력 강화에 집중하였다. 이듬해 ‘바이오헬스 미래 신산업 육성전략’을 수립하여 첨단기술과 융합된 새로운 진단 플랫폼 개발에 대한 투자를 제고하였다. 2016년 이후, 사업 신규과제의 30% 이상을 융합 진단・치료기기, 생체 대체 소재 등 미래 유망 분야에 투자하며 2020년까지 국내 의료기기 점유율 45% 및 의료기기 수출 기업 수 1,000개 달성을 목표로 제시하였다. 또한, ‘제2차 국가 감염병위기대응기술개발 추진전략(2017∼2021)’을 통해 현장진단용 감염병 진단기법 개발, 감염병 정보・자원 확보 등 R&D 인프라 강화와 검체 분석 확대를 추진하였다.
신규 진단기기의 시장 진입을 원활히 하기 위해 ‘혁신성장 확산을 위한 의료기기 분야 규제혁신 및 산업육성 방안(2018)’을 발표하였으며, 이는 허가 절차 간소화, 체외진단기기 평가제도의 선 진입・후 평가 전환을 포함하였다. ‘바이오헬스 산업 혁신전략(2020∼2025)’을 통해 혁신 의료기기 분야에 대한 정부 R&D를 확대하였다. 전략 품목으로 ‘수출 주력 및 차세대 융・복합 의료기기’를 지정하여 기술 고도화를 지원하였다. 또한, ‘의료기기산업 육성 및 혁신의료기기 지원법(2020)’을 제정하여, R&D에 적극 투자하는 기업에 대해 국가 연구개발 사업 우대, 각종 부담금 면제 등의 혜택을 제공함으로써 기업의 R&D 참여를 독려하였다.187)
체외진단기기의 수출 및 국제화 방안을 모색하기 위해 관계부처 합동의 ‘제4차 비상경제회의’를 개최하였다(2020). 질병관리청은 긴급사용승인 계획을 통해 통상 1년 6개월의 허가 소요 기간을 2주 이내로 단축하며 민간의 진단키트 개발을 촉진하였다. 복지부는 ‘코로나19 진단키트 생산기업을 위한 미국 FDA 긴급사용승인(EUA) 취득에 관한 설명회’를 개최하여 미국 진출 활성화를 도모하였다. 산업부, 식약처 및 특허청은 협력을 통해 우리나라의 감염병 진단기법의 국제표준화를 추진하였고 국제표준화기구(ISO)의 국제표준을 선점하였다.188)
국내 체외진단기기 기업은 2019년 기준 506개 기업으로 5년간 약 100개 기업이 증가하였고, 대표적인 기업으로 SD바이오센서, 씨젠, KH메디컬, 바디텍메드, 미코바이오메드, 수젠텍 등 호흡기, 소화기 관련 다양한 병원체에 대한 분자・면역진단 제품을 개발・생산하고 있다. 국내 체외진단기기 시장 규모는 2015년 5억 7,400만 달러(약 6,900억 원)에서 2025년 7억 6,200만 달러(약 9,200억 원)로 연평균 약 2.9% 성장이 예상되며 2020년 수출액은 약 21억 7,000만 달러(약 2조 6,200억 원)로 2018년 약 4억 2,000만 달러(약 9,400억 원)에 대해 연평균 126.5%의 성장률을 달성하였다.189) 또한, 기관과 학교를 중심으로 BT, NT 및 MEMS 기술을 융합한 첨단 체외진단 기술 개발이 활발히 이루어지고 있으며 와해성이 큰 혁신 기술 개발 및 정립190)은 향후 해당 분야 선도에 핵심 동력이 되어줄 것으로 기대된다.
[표 3-61] 국내 대표 체외진단 기업 및 기술 개발 현황
|
기업 |
분야 |
내용 |
|
SD바이오센서 |
면역진단, 분자진단 |
- 신종감염병에 대한 신속 면역진단 STANDARD Q 제품군 개발 - 면역진단, 분자진단, 효소진단에 대해 각각 STANDARD F, STANDARD M, STANDARD E 제품 라인업을 보유 |
|
씨젠 |
분자진단 |
- 일반 PCR 방식의 Seeplex® 제품과 및 실시간 PCR 방식의 Anyplex™ II, Allplex™ 제품 - 질병 바이오마커 다중 분석용 진단 시약에 관한 원천기술 보유 (DPO™, TOCE™, MuDT™) |
|
바디텍메드 |
면역진단 |
- 현장진단에 필요한 진단기기 및 진단 카트리지를 전문 제조 및 판매 - 측방유동 면역형광 기술을 기반으로 감염성, 당뇨, 심혈관 등 70여종 이상의 질환 진단 제품군을 보유 |
|
수젠텍 |
면역진단, 현장진단 |
- BT/NT/IT 융합 기술을 기반으로 상용화한 다중면역블롯, 현장진단, 퍼스널케어 등 세 개의 플랫폼을 상호보완적으로 활용하여 시스템을 구현 |
|
젠큐릭스 |
분자진단 |
- 액체생검 및 바이오마커 발굴 핵심기술을 기반으로 분자진단 기술 개발 - 암 환자를 위한 분자진단검사 개발을 통해 아시아 최초 유방암 예후진단 검사 ‘진스 웰 BCT’와 차세대 분석기술인 Digital PCR 기반의 동반진단 검사 ‘드롭플렉스(Droplex)’를 출시함 |
|
진매트릭스 |
분자진단 |
- HPV(인유두종) 유전자형 진단키트 Omni Plex HPV, 성감염병 분자진단제 NeoPlex STI, 호흡기/소화기 감염 병원체 다중 진단제 개발 |
출처: 한국바이오협회 한국바이오경제연구센터, Bio economy brief, 2022
[표 3-62] 국내 BT・NT 융합 진단 기술 연구개발 동향
|
기술 |
기술내용 |
특징 및 기대효과 |
기관명 |
|
수용체 단백질 기반 인공 후각 센서 |
세포막에서 발현시키기 어려운 후각수용체를 대장균을 통해 안정적으로 생산하여, 센서의 표적인식 모듈에 적용 |
인간의 후각수용체를 활용하여, 인간의 민감한 신경신호 전달을 가장 유사하게 모방하므로, 높은 검출 민감도 및 특이도 확보 |
서울대학교 |
|
생체-비생체 융합 기반 3차원 바이오 센서 |
바이러스 및 박테리아 유래 단백질 나노입자를 유전공학적으로 재설계해 3차원 나노구조체와 접목함으로써 고감도, 다중 검출용 센서를 개발 |
범용 플랫폼 기술로서, 다양한 진단 기술 개발에 활용 |
고려대학교 |
|
압타머-질량분석 시스템 융합 질병 진단칩 |
‘핵산 항체’라 불리는 압타머의 대량 생산 기술을 개발하고, 이를 항체 대신 질량분석 시스템에 적용함으로써, 낮은 노이즈의 진단칩을 개발 |
기존 대비 1,000배 이상의 민감도 향상을 보이며, 압타머의 질병 진단 마커로서의 가능성 제시 |
동국대학교 |
|
3차원 나노구조체 기반 광전기화학 세포 칩 |
3차원 나노구조체를 기반으로 전기화학 신호와 광학 신호를 동시에 측정할 수 있는 플랫폼으로서, 세포의 생화학적 구조 및 활성을 동시에 분석 |
암세포 진단, 항암제 스크리닝, 유해물질 탐지, 세포독성 평가 등 다양한 활용 가능 |
서강대학교 |
|
플라스모닉 나노입자 복합체 기반 표면증강 라만산란 센서 |
나노입자 복합체 형성을 통해, 표적에 대해 증폭된 라만산란 신호 확보 및 고감도 센서 개발 |
나노입자 복합체의 표면 코팅을 통해 항체 고정화 효율 및 센서의 안정성 향상 |
중앙대학교 |
|
자성-금나노입자 기반 초고속 플라스모닉 PCR 시스템 |
빛과 자성-금나노입자의 공명현상에 기인한 급속 플라즈모닉 가열 시스템 확립 및 통합형 현장진단 장치 개발 |
PCR 검출시간을 2시간에서 17분 이내로 단축. 표적 유전자에 특이적인 탐침용 유전자를 도입함으로써 다양한 병원체 진단 가능 |
기초과학연구원 나노의학연구단 |
|
그래핀 기반 전계효과 트랜지스터 (Field- effect Transistor) |
트랜지스터 표면에 항원에 특이적인 항체를 고정화하여, 항원-항체 반응에 고감도의 전기적 신호를 보이는 트랜지스터 센서 개발 |
범용 플랫폼 기술로서, 표적 항원에 대한 실시간, 고감도 검출이 가능 |
한국기초과학 지원연구원 |
출처: KIST 융합연구정책센터
라. 발전 과제
유전자기술, 나노기술, 신소재, 3D 프린팅, 웨어러블 기기 등 4차 산업혁명 기술의 발전은 BT・NT 융합 기반 바이오헬스 산업의 가파른 성장을 주도하며, 혁신 기술 및 제품의 개발을 촉진해왔다. 고령화, 의료비 증가, 건강에 대한 관심 제고 등 의료 분야의 분위기 변화와 신종감염병과 같은 공중보건 이슈의 등장에 따라 바이오헬스 시장에 대한 수요는 지속적으로 증가해왔으며, 국가의 핵심 성장동력 산업으로 주목받고 있다. 이에 대표적인 BT・NT 융합 바이오헬스 산업 분야인 바이오의약품 및 체외진단기기가 국가 핵심 고부가가치 산업으로 자리잡는 데 필요한 지원 방향을 다음과 같이 제언하였다.
첫째, 미래지향적인 관점으로 중장기 R&D 지원을 지속・확대해 나가야 한다. 연구개발부터 사업화까지, 전 주기에 대한 체계적인 지원을 통해 연구개발의 매듭을 지음으로써 신규 기술・제품을 선점, 국산화하여야 한다. 일례로, mRNA 백신 플랫폼 기술의 실질적 결과물은 기초 기술이 개발된 지 20여 년이 지난 후에야 코로나19 백신으로 완성되었고 기술 경쟁력이 경제적 가치를 넘어 안보와 직결됨을 상기하였다.
둘째, 바이오헬스 분야의 전 주기 지원에 필요한 R&D 거버넌스 체계를 정립해 나가야 한다. 이상적으로는 미국의 NIH와 같이 한 기관이 연구개발, 임상, 사업화 모두를 관장하는 것이다. 한편, 사업 목적 및 내용에 유사성이 있는 부처별 사업들을 다부처 공동 사업화한다면 좋은 출발점이 될 것이다. 이를 통해 기획 단계부터 각 부처의 역량을 집중함으로써 사업의 효율성을 향상해 나가야 한다. 장기적으로는 전체 바이오헬스 분야 R&D 관리를 일원화한 범부처 차원의 컨트롤타워를 구축해나가야 한다.
셋째, 수요 중심의 R&D 전문인력을 양성해 나가야 한다. 다수의 R&D 지원 정책에서 인력 양성을 중요하게 다루고 있지만, 실제 현장과의 연계 부족으로 실제 투입할 수 있는 인력은 부족한 실정이다. 이러한 스킬 미스매치(Skill mismatch) 문제를 해결하기 위해 기초연구를 수행하는 바이오・나노공학 전문가, 임상연구 전문가, 데이터 과학자, 규제과학 전문가 등 기술 발전 전망에 따른 인력 수요 분석을 토대로 R&D 밸류체인(Value chain)별 전문인력을 양성해야 한다.
넷째, 오픈 이노베이션을 확대해 나가야 한다. 기술이 고도화 됨에 따라 새로운 기술・제품의 수명주기는 점차 줄어드는 반면, R&D 효율성 감소, 관련 비용 증가 등 R&D에 수반되는 위험도는 커지고 있다. 특히, 소규모 주체의 경우 개발 전 과정을 자력으로 진행하기에 무리가 따른다. 이러한 위험요소들을 상쇄함과 동시에 R&D 효율을 극대화하고 성장동력을 조기에 확보하기 위해 국내・외 공동연구 네트워크 구축, 유망 기술 보유 기업 M&A, 아웃소싱(Outsourcing) 등 R&D 주체 간 긴밀한 협력이 필요하다.
마지막으로 혁신 제품의 시장 진입 및 안착을 위한 정책적 지원이 필요하다. 전 주기적 관점에서 바이오헬스 산업 생태계의 정점은 판로 확보에 있다. 하지만 바이오헬스 제품에 대한 신뢰는 임상에서 얼마나 오랫동안 안전하게 사용되었는지를 반영한 실증자료에 기반하므로 혁신 제품이 시장에 정착하는데 오랜 시간이 걸리고 많은 위험이 따른다. 이러한 특수성을 고려해 정부 차원에서 국산 보호정책 신청기준 완화, 공공기관 판로 확보, 국산화 인식 개선 프로그램 등 민간・공공 시장으로의 초기 진입에 대한 지원이 요구된다.
|
|
|
제3장 분야별 연구개발 및 산업 현황 |
|
제6절 생명연구자원 |
1. 바이오 소재 클러스터
가. 개요
코로나19에 대한 백신과 진단키트들이 빠르게 개발될 수 있었던 것은 코로나19 검체, 바이러스, 유전체 정보가 빠르게 제공되었기 때문이다. 이 사례에서 보는 바와 같이 바이오 연구 및 산업이 발전하기 위해서는 시작점인 바이오 소재가 적시에 제공되는 것이 중요하다.
바이오 연구 및 산업의 원료로서 바이오 소재의 중요성을 인식한 OECD는 2001년 세계 각국에 고품질의 바이오 소재와 정보를 관리 보급하는 생물자원센터(Biological Resource Centre, BRC)의 개념을 제시하였으며, 이를 생명공학 및 관련 산업의 성장을 견인하는 핵심 인프라 기관으로서 제시한 바 있다. 우리나라도 2007년 관계부처 합동으로 ‘국가 생명자원 확보・관리 및 활용 마스터플랜’을 수립하였고, 관계부처는 소관 분야의 바이오 소재를 확보・관리・활용하기 위한 제도를 정비하였다. 과기정통부는 2009년 5월 생명연구자원의 확보・관리 및 활용에 관한 법률을 제정하였고, 바이오 소재와 데이터를 포함한 개념인 생명연구자원의 효율적인 확보와 체계적인 관리를 통해 지속가능한 활용을 지원하고 있다.
생명연구자원의 체계적 확보・관리・활용을 위해 과기정통부는 관계부처와 함께 5년 단위의 기본계획과 연 단위의 시행계획을 수립하여 이행하고 있으며, 2020년에는 ‘제3차 국가생명연구자원 관리・활용 기본계획’을 수립하여 이행하고 있다. ‘제3차 국가생명연구자원 관리・활용 기본계획’에서는 소규모 또는 단기과제로 운영되는 경우가 과반수였던 274개의 소재자원은행을 14개의 분야로 클러스터화하여 체계적・지속적으로 육성하는 전략을 제시하였다. 그 결과 2012년 기준으로 217만 5,802점이었던 바이오 소재는 2022년 1,943만 5,441점으로 약 8.9배가 증가하였고, 소재의 분양도 2012년 44만 5,831점에서 2022년 178만 1,026점으로 약 4배가 증가하였다. 또한, 2022년에는 2,000만 원 이상의 기술이전도 15건이 보고되어, 바이오 소재의 확보뿐만 아니라 활용도 성과가 점차 증가하고 있다.
나. 국내 바이오 소재 관리 및 성과
‘제3차 국가생명연구자원 관리・활용 기본계획’에 따라 기존 274개의 소재자원은행을 동물, 식물, 미생물 등의 소재의 종류, 보존 및 유통의 방식, 관련 법률 및 규제 등을 기준으로 14개 분야의 소재 클러스터로 조성・육성이 진행되고 있다. 각 소재 클러스터는 책임부처를 지정하고, 책임부처 중심으로 클러스터 내 중앙은행-거점은행-협력센터로 구성된 협력 네트워크가 구축・운영 중이다.
[표 3-63] 14대 소재 클러스터별 발전 목표 및 책임 부처・중앙은행
|
소재 클러스터 |
발전 목표 |
책임부처 (클러스터 중앙은행) |
|
인체유래물 |
- 질환 중심의 인체유래물 확보 및 바이오 헬스 산업 활용 촉진 |
복지부/질병청 (국립중앙인체자원은행) |
|
줄기세포 |
- 줄기세포 개발 연구기관들과 연계하여 줄기세포 신속 확보・제공 |
복지부/질병청 (국가줄기세포은행) |
|
병원체 |
- 다양한 병원체자원 확보를 통한 활용 촉진 및 네트워크 체계화 |
복지부/질병청 (국가병원체자원은행) |
|
배양세포 |
- 세포주에서 오가노이드까지 공급 범위 확대 및 맞춤 서비스 보강 |
과기정통부 (한국세포주은행) |
|
모델동물 |
- 초파리, 제브라피쉬, 마우스 등 모델동물 이어달리기 제공 ※ 실험동물 사용 최소화를 위해 동물 대체시험법 개발도 병행 |
과기정통부 ((재)KMPC/생명연 실험동물자원센터) |
|
뇌 |
- 규제 개선을 통한 뇌 연구자원의 확보 및 연구 저변 확대 |
과기정통부 (한국뇌연구원 한국뇌은행) |
|
미생물 |
- 규제 개선, 인력 양성, 안전중복보존 등에 대한 공동대응 체계 구축 |
과기정통부 (생명연 KCTC/농진청 미생물은행) |
|
천연물 |
- 천연물 자원 관리 특화 모델 마련 및 종자 클러스터와 협력 추진 |
과기정통부 (생명연 천연물중앙은행) |
|
합성화합물 |
- 공공-대학-민간(국내 제약사 등) 및 해외 등 개방형 협력 확대 |
과기정통부 (한국화합물은행) |
|
축산 |
- 가축생명자원을 활용한 축산업 미래 발전 영역확보 |
농식품부/농진청 (가축유전자원센터) |
|
종자 |
- 종자산업 육성을 위한 농업유전자 원의 전략적 확보 및 활용 확대 |
농식품부/농진청 (농업유전자원센터) |
|
해양생물 |
- 해양생명자원 확보 및 해양바이오뱅크를 통한 산업적 활용 확대 |
해수부 (국립해양생물자원관) |
|
수산생물 |
- 수산 현장 중심 수산생명자원 확보 및 활용 강화 |
해수부 (국립수산과학원) |
|
야생생물 |
- 야생생물의 다양성 보전과 지속가능한 활용 확대 |
환경부 (야생생물소재은행) |
출처: ‘제3차 국가생명연구자원 관리・활용 기본계획’, ‘2021년도 국가생명연구자원 관리・활용 시행계획’을 재가공
2022년 말 기준으로 국내 소재자원은행은 총 226개가 운영되고 있다. 부처별로 살펴보면 농림축산식품부 115개, 과학기술정보통신부 36개, 보건복지부 26개, 환경부 19개, 해양수산부 27개, 식품의약품안전처 2개의 소재자원은행을 운영하고 있다.
[표 3-64] 부처별・소재 분야별 소재자원은행 현황(2022)
|
|
과기정통부 |
농식품부 (농진청/산림청) |
복지부/ 질병청 |
환경부 |
해수부 |
식약처 |
합계 |
|
인체유래물 |
4 |
- |
11 |
- |
- |
- |
15 |
|
병원체 |
1 |
1 |
10 |
- |
- |
- |
12 |
|
줄기세포 |
- |
- |
1 |
- |
- |
- |
1 |
|
배양세포 |
2 |
- |
- |
- |
- |
- |
2 |
|
모델동물 |
14 |
- |
- |
- |
- |
2 |
16 |
|
합성생물학 |
1 |
- |
- |
- |
- |
- |
1 |
|
뇌 |
8 |
- |
4 |
- |
- |
- |
12 |
|
천연물 |
4 |
2(산림청) |
- |
- |
- |
- |
6 |
|
미생물 |
2 |
11(농진청) |
- |
- |
- |
- |
13 |
|
축산 |
- |
12(농진청) |
- |
- |
- |
- |
12 |
|
종자 |
- |
67(농진청) 23(산림청) |
- |
- |
- |
- |
90 |
|
해양생물 |
- |
- |
- |
- |
20 |
- |
20 |
|
수산생물 |
- |
- |
- |
- |
7 |
- |
7 |
|
야생생물 |
- |
- |
- |
19 |
- |
- |
19 |
|
총계 |
226 |
||||||
출처: 과학기술정보통신부, 2023년도 국가생명연구자원 관리・활용 시행계획 재가공
2023년 초에 수행한 실태조사를 기준으로 보면, 정부 투자는 2022년에는 바이오 소재 분야에 1,585억 원(전년도 대비 7.7% 증가)이 투자되었다. 바이오 소재의 확보 및 활용은 2022년까지 1,943만 5,441점이 확보되어 관리되고 있으며. 2022년에는 178만 1,026점이 분양되었다. 국내 226개 소재자원은행에서 바이오 소재를 분양받아 활용한 성과는 2022년 3,211편의 논문이 발표되었고, 307건(국내 285건, 국제 22건)의 특허등록이 있었다. 추가적으로 소재자원은행들은 바이오 연구 및 산업의 소재 활용을 촉진하기 위해 2,561건의 기술지원을 산업계(44.4%), 연구계(28.9%), 학계(21.6%)에 제공하였다.
다. 국내외 소재자원은행 현황
유전자원의 이용을 통해 발생한 이익을 원산지국과 공유하도록 하는 나고야 의정서의 발효, 코로나19 팬데믹 발생 등으로 세포주, 천연물, 바이러스 등 실물 바이오 소재를 자국에서 먼저 확보・활용하려는 자국 우선주의 기조가 확대되고 있으며 주요국들은 소재자원은행을 중심으로 유용 바이오 소재 확보에 노력해 오고 있다. 동물, 식물, 미생물, 인체유래물 등의 국내외 주요 소재자원은행 현황을 살펴보면 다음과 같다.
(1) 동물 분야
모델동물은 사람에게 직접 실험하기 어려운 질병의 기초 또는 기작 연구를 수행할 수 있는 재료로 활용되고 있으며 전임상시험에도 활용되어 바이오 및 보건의료 연구에 매우 유용하게 쓰이고 있다. 이에, 주요국들은 마우스, 영장류, 제브라피쉬, 초파리 등 실험에 사용할 수 있는 동물의 확보에 힘쓸 뿐만 아니라, 특정 질환이 유발된 형질전환 모델동물의 개발에도 힘쓰고 있다. 미국은 Jackson Laboratory, MMTTC(Mutant mouse resource & research center)와 같은 대표 마우스 인프라를 보유하고 있으며, 7개의 영장류연구소를 통해 영장류를 국가 차원에서 관리하면서 영장류를 과학자들에게 공급하고 있다. EU는 연구 인프라 지원 프로젝트인 인프라프론티어(INFRAFRONTIER)를 운영하고 있으며, 8개 회원국에서 영장류 공급 시설을 갖추고 매년 수백∼수천 마리의 영장류를 공급하고 있다. 일본은 국가생물자원프로젝트(National BioResource Project)를 통해 마우스(RIKEN BRC), 렛트(교토의대), 영장류(교토대 영장류연구소)에 대해 국가 차원에서 모델동물을 전략적으로 관리・제공하고 있다.
국내는 정부출연연구소, 대학 등에서 모델동물을 확보・제공하는 인프라를 구축하고 있다. 한국생명공학연구원 실험동물자원센터는 2020년까지 1,578 계통의 마우스를 확보・관리하고 있으며 2020년에는 6,731마리를 분양하였다. (재)국가마우스표현형분석사업단은 261 계통의 형질전환 마우스를 개발하고 2020년 106마리를 분양하였다. 한국생명공학연구원 영장류자원지원센터는 2022년까지 1,001마리의 영장류를 확보하고 있으나 아직까지는 100마리 이하로 분양되고 있다. 이외에도 질환모델링 제브라피쉬연구소재은행(2만 5,000종류), 초파리연구자원은행(5,785종류), 제노푸스연구소재은행(3,300종류) 등이 운영되고 있어서 연구자들이 필요로 하는 모델동물들이 적시에 확보・제공될 수 있도록 노력하고 있다. 또한, 기존의 소재 중심에서 모델동물 정보들이 연계・협력하는 모델동물 클러스터를 구축하여 특정 질환 연구에 필요한 초파리부터 영장류까지 모델동물이 이어달리기로 제공될 수 있도록 노력하고 있다.
(2) 식물 분야
신종 인플루엔자 치료제로 유명한 타미플루(Tamiflu), 아스피린(Aspirin), 탁솔(Paclitaxel) 등은 식물 추출물에서 유래한 약물들이다. 이러한 식물유래 추출물들은 전통적 임상적 경험과 지식을 가진 검증된 소재로서 효능과 독성의 예측이 가능하여 신약 후보로 주목받아 왔다. 이에 주요국들은 식물 추출물을 확보・활용하기 위해 다양한 노력을 기울이고 있다.
미국 국립암연구소(NCI)는 천연물 기탁소를 운영하여 전 세계 25개국의 식물, 해양생물 등 천연물 자원을 수집하였으며 식물 3,390종 및 11만 4,000종류의 추출물을 확보하여 15만 개의 천연물 분획 라이브러리를 구축・제공하고 있다. 프랑스는 국립화합물라이브러리를 2003년 설립하여 1만 1,000종류의 추출물과 4만 종류의 천연화합물을 확보・제공하고 있다. 호주 그리피스대학교 신약개발연구소는 AstraZeneca 사의 투자로 1993년 NatureBank가 설립되었으며 1993년부터 2007년까지 14년의 투자를 통해 4만 5,000종의 식물을 수집하였다.
국내에서는 한국생명공학연구원 천연물중앙은행 등을 통해 국내외 식물 추출물들이 확보・제공되고 있으며, 한국생명공학연구원은 2022년 기준으로 국내 식물 추출물 7,310점, 해외 식물 추출물 3만 5,613점을 확보하고 있으며, 약 3만 8,000종 12만 점을 확보하여 제공하고 있다.
이 외에도 인간의 주요 식량 자원 중 하나로 활용되는 식물이 전쟁, 기후변화 등으로 인해 멸종할 경우를 대비하여 노르웨이 스발바르 시드볼트(Svalbard Global Seed Vault)에는 100만여 개의 식물 씨앗을 장기적으로 저장하고 있으며, 국내에서는 농업유전자원센터와 백두대간수목원 시드볼트 등을 통해 다양한 씨앗들을 보존하고 있다.
(3) 미생물
김치, 유산균 등의 발효식품으로 우리 식탁에서 활발히 활용되는 미생물은 장내 미생물로 범위가 확대되면서 다양한 분야에서 폭넓게 활용되고 있다.
미국은 1925년 ATCC(American Type Culture Collection)를 설립하여 전 세계의 미생물자원을 수집해왔으며, 세균 1만 8,000주, 곰팡이 4만 9,000주, 인간 및 동물 세포주 4,000주 등 세계에서 가장 큰 미생물 소재자원은행으로 운영되고 있다. 1969년 설립된 독일 DSMZ(Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH)는 유럽 최대 생물자원은행으로 세균 약 2만주, 곰팡이 약 5,000주 등 다양한 미생물을 확보하여 분양하고 있다. 1979년 설립된 중국 일반미생물자원센터(China General Microbiological Culture Collection Center)는 세균, 효모 등 4만주 이상의 미생물을 확보하여 분양하고 있다.
국내에서는 한국생명공학연구원 생물자원센터(KCTC)에서 농촌진흥청 국립농업과학원 미생물은행(KACC), 한국미생물보존센터(KCCM) 등 다수의 미생물 소재자원은행이 운영되고 있다. 2022년 기준으로 대표적인 미생물은행이 보유・분양한 일반세균 성과를 살펴보면, 확보는 KCTC 3만 6,224주, KACC 1만 1,686주이며, 분양은 KCTC 4,602주, KACC 1,989주가 제공되었다.
유산균과 같이 유익한 미생물도 존재하지만 탄저균, 식중독균과 같이 병원성을 보유한 미생물도 존재한다. 이러한 병원균에 대한 치료제 및 백신 개발을 위해서는 병원성 미생물의 확보 및 관리도 중요하다. 미국 국립알레르기・감염병연구소(NIAID)는 BEI Resource Center를 구축하고 ATCC에 자원의 보존 및 관리를 위탁하여 운영하고 있다. 우리나라는 2016년 ‘병원체자원의 수집・관리 및 활용에 관한 법률’을 제정하고 국가병원체자원은행을 설립하여 국민보건 증진과 보건의료산업 및 국민경제 발전에 기여하기 위한 병원체를 수집・제공하고 있다.
(4) 인체유래물
수술, 진단 등을 통해 인간에서 채취한 암 조직, 혈액 등은 일반 바이오 연구자들이 확보・활용하는 것이 어렵다. 이에 인체에서 유래된 조직, 혈액, 결장 등을 보존하여 연구자에게 제공하는 인체자원은행들이 병원 또는 의학연구소를 중심으로 발전하였다.
미국 CHTN(Cooperatirve Human Tissue Network)은 국립암연구소의 암 진단 프로그램에서 수집된 인체유래물을 연구자에게 제공하고 있으며 1987년 설립 이후 95만 개 이상을 생체자원을 제공하고 있다. 영국은 2015년 NBC(National Biosample Centre)를 설립하여 생의학 및 임상연구 지원을 위해 고품질 생체시료 수집・관리 등을 지원하고 있다. 일본은 6개의 국립전문의료연구센터로 구성된 NCBN(National Center Biobank Network)을 통해 인체자원의 축적 및 활용 연구를 추진하고 있다. 우리나라는 국립인체자원은행을 중심으로 한국인체자원은행네트워크를 구축하여 운영하고 있으며, 2022년 기준 74개 기관(주로 병원 단위) 인체자원은행으로 허가받아 운영되고 있다.
치매, 뇌질환 등으로 연구에 필요한 뇌는 인체 중에서도 미지의 영역으로 남아있지만 해당 조직을 확보하는 것이 어려워서 상대적으로 확보・제공이 부족한 편이다. 미국 국립보건원(NIH) 지원을 받아 Neuro BioBank(NBB)가 2013년에 설립되어 산하에 6개의 뇌은행을 운영 중이며, 이 중 1978년 설립된 하버드 의대 뇌은행은 뇌 연구를 위한 인간 뇌 조직 표본 3,000례를 확보하여 분양하고 있다. 영국은 2008년 의학연구회(MRC)를 중심으로 10개 뇌은행이 뇌은행 네트워크(UKBBN) 형태로 운영 중이며, 3,000여 증례의 뇌 조직을 확보하고 있다. 일본은 1967년 니이가타 의대 뇌은행을 시작하여 뇌・척수 및 전신 장기 등 3,500례 확보 및 퇴행성질환의 원인 규명 및 치료법 공동연구 및 교육 거점으로 운영되고 있으며, 2016년 의료연구개발기구(AMED) 중심으로 정신질환, 노화・치매, 신경질환을 중심으로 8개소의 뇌은행이 운영 중이다. 국내에서는 한국뇌연구원 한국뇌은행을 중심으로 한국뇌은행네트워크를 구성하여 운영하고 있으며, 2만 3,440개의 뇌 조직, 혈액 등이 확보되어 있다. 이외에도 질병청에서는 치매 뇌은행을 설립하여 치매 환자의 뇌를 수집하여 분양하고 있다.
(5) 기타(배양세포, 합성화합물)
전 세계적으로 연구에 사용되고 있는 약 1,500여 종의 세포주는 대표적 배양세포 자원은행인 미국 ATCC, 독일 DSMZ, 영국 ECACC, 일본 JCRB, RCB, 한국 KCLB에서 주로 분양되고 있다. 배양세포 자원은행들은 확보, 개발, 보존 및 품질관리 서비스 등을 수행하고 있으며 이외 유전자 조작기법을 이용한 이차적 세포주 개발 등을 수행 중이다. 세계 최대 배양세포 자원은행인 미국 ATCC는 차세대 3D 암세포 모델인 오가노이드 자원의 분양을 위해 HCMI(Human Caner Models Initiative)에서 보유 중인 오가노이드를 기탁받아 오가노이드 분양을 시작(2022년 말 기준 150종)하였다. 국내에서는 1987년 한국세포주은행이 설립되어 운영되고 있으며, 864주의 분양 가능한 세포주를 확보하고 2022년 말까지 14만 2,742주의 세포주를 전 세계에 분양하고 있다.
주요국들은 합성화합물의 확보와 관리를 신약개발의 핵심 경쟁력 중 하나로 인식하여 합성화합물의 확보에 큰 공을 들이고 있다. 미국은 2012년부터 국립보건원(NIH) 산하에 국립고등중개연구센터(NCATS)를 설립하여 운영하고 있다. 2019년 기준으로 인력 167명, 9,800억 원을 투자하여 60만 종류의 화합물을 보관하고 있으며 그 수를 지속해서 늘려나가고 있다. 중국은 CNCL이란 기관을 설립하여 운영하고 있으며, 2019년 기준으로 인력 1,000명, 약 1조 원의 예산을 투입하여 220만 종류의 합성화합물을 확보하고 있다. 우리나라는 한국화학연구원 한국화합물은행을 통해 합성화합물을 확보하고 있으며 약 65만 종류의 화합물을 확보하여 국내 연구자들에게 제공하고 있다.
라. 발전 과제
바이오 연구자들은 믿을 수 있는 품질의 바이오 소재가 분양되기를 희망하며 나아가 사후 관리(배양 기술 등)할 수 있도록 교육의 필요성에 대해서도 제안하고 있다. 또한 단순히 바이오 소재만 제공하는 것이 아니라 연구 현장에서 필요로 하는 소재별 특성정보(메타・성능・효능・성분 등)의 제공이 필요한데 실제 소재자원은행이 제공하는 정보는 이와 괴리가 있다고 이야기하고 있다. 일부 규모가 있는 소재자원은행들은 연구자들의 의견을 청취해오고 있으나 대다수 소재자원은행들은 소재의 확보와 분양에만 집중하고 있는 경우가 많다. 따라서 산・학・연・병의 다양한 수요자들의 의견을 지속적으로 청취하고 수요자가 원하는 바이오 소재와 정보를 적시에 제공할 수 있는 인프라 구축과 정책이 필요한 상황이다.
바이오 소재는 연구 과정을 통하여 산출된 결과물로써 최종 산출물이면서 연구 및 제품생산을 위한 중간재적 성격도 존재하는 양면적 특성을 가진다. 이에 일방통행 방식의 정책은 한계가 있으며 이로 인해 정책의 효과가 반감될 수 있다. 실제로 기존 바이오 소재 분야의 정책은 양적 확보 중심으로 추진되어 왔으나 ‘제3차 국가생명연구자원 관리・활용 기본계획’과 이를 이행하기 위한 과제인 ‘다부처 국가생명연구자원 선진화 사업’의 시작을 계기로 수요자 중심의 바이오 소재와 정보를 동시에 확보하여 제공하고 활용하는 방면으로 패러다임 전환이 추진되고 있다.
향후 ‘제3차 국가생명연구자원 관리・활용 기본계획’을 바탕으로 수요자가 원하는 바이오 소재를 우선적으로 확보할 수 있도록 바이오 소재 제공 인프라를 구축하고, 실물 정보와 함께 특성정보, 약물 반응성 정보 등 부가정보의 제공이 추진될 예정이다. 또한 바이오 소재의 보존・관리・분양 등의 절차를 표준화하며 국제수준의 품질관리(ISO)를 도입하는 등의 노력이 진행될 예정이다.
|
참고자료 |
∙ 관계부처 합동, 제3차 국가생명연구자원 관리・활용 기본계획(2020∼2025), 2020
∙ 관계부처 합동, 2023년도 국가생명연구자원 관리・활용 시행계획, 2023
∙ 과학기술정보통신부, 2022 생명연구자원 통계, 2023
∙ 국내 생명연구자원 관리 현황 및 개선방향, 환경정책 28(4):91-112., 2020
∙ 한국뇌은행 네트워크, https://kbbn.kbri.re.kr/portal/page/main/home
2. 바이오 데이터
가. 바이오 데이터의 개요
본 백서에서는 ‘바이오 데이터’를 바이오 연구개발(R&D) 수행 과정에서 실시하는 각종 실험, 관찰, 조사 및 분석 등을 통하여 산출된 사실 자료로서 연구 결과의 검증에 필수적인 연구데이터로 정의한다. 현재 바이오 데이터의 생산 및 활용을 선도하는 대표적인 분야는 유전체 연구 분야로, 특히 DNA 서열 해독기술의 발전은 바이오 데이터의 획기적인 기술 발전을 잘 설명하고 있다.
인간 DNA 염기서열 전체를 해독한 인간 유전체 지도 초안이 2000년대 초에 발표되었다. 당시 한 명의 유전체 해독을 위해 10년이라는 기간과 3조 원의 비용이 소요되었다. 하지만 2005년경에 새롭게 등장한 차세대 유전체 서열 결정(NGS) 기술과 이후 급속한 기술 발달로 인해 지금은 사람 1명의 유전체(3GB)를 50만 원과 며칠의 시간으로 같은 양의 데이터를 생산할 수 있게 되었다. 이는 반도체 기술의 압도적인 성능 향상을 상징하는 무어의 법칙(Moore’s Law)을 능가하는 속도이다. 또한 단백체 분야에서는 최근 초저온 전자현미경(Cryo-EM)이 등장하였으며, 극소량의 샘플에서 막단백질과 거대 복합체의 고해상도 입체구조를 한눈에 파악하는 기술로 2017년 노벨화학상을 받았다. Cryo-EM에서 생산되는 데이터를 활용하면 암, 바이러스 등의 질병을 진단하거나 치료제 개발 및 백신 연구에 폭넓게 사용될 수 있다. 이처럼 바이오 빅데이터로부터 새로운 지식과 분야가 열리게 되면서 실험과 이론 중심의 바이오가 데이터가 중심이 되는 과학으로 패러다임이 변화하게 되었다. 바이오 데이터는 바이오경제의 핵심 자원으로서 바이오헬스, 정밀의료, 신약개발, 동식물 육종 등의 다양한 분야에 활용됨에 따라서 그 중요도는 시간이 갈수록 증가하고 있다.
나. 해외 동향
바이오 데이터 생산을 위한 새로운 기술의 개발과 인공지능 등의 활용 신기술 발달에 따라, 축적된 빅데이터를 활용한 혁신 연구 방식이 주목 받고 있다. 주요 선진국은 2000년대 후반부터 대규모 국제 유전체 프로젝트를 통해 데이터의 대량 생산과 규모화를 진행하고 있다. 2023년 현재 유럽, 미국, 싱가포르 등 선진국에서는 100만 명 유전체 프로젝트를 진행하거나 계획하고 있다. 대표적인 인간 유전체 프로젝트로 암 환자 및 유전성 희귀질환 환자들의 새로운 진단법 및 치료법 개발을 위한 유럽의 여러 나라들과 협력한 ‘1+ million Genomes(B1MG)’ 이니셔티브가 있다. 미국 역시 ‘All of Us’ 프로젝트를 통해서 100만 명의 임상・유전체 데이터를 확보하여 정밀의료를 구현해 나갈 예정이다. 또한 싱가포르도 최근 Nature지에 2029년을 목표로 싱가포르인의 약 1/6인 100만 명의 유전체 프로젝트를 진행한다고 발표하였다. 대규모 국제 생물학 프로젝트 역시 계속해서 진행 중이다. 대표적인 것은 지구상 모든 생물체의 유전체 염기서열을 분석하는 ‘지구 생물 총 유전체 프로젝트(Earth BioGenome Project, EBP)’, 지구 곳곳에 서식하는 2만 7,000개 이상의 미생물군 표본을 수집, 분석해 처음으로 박테리아 참조 데이터를 만들기 위한 ‘지구 미생물군 유전체 프로젝트(The Earth Microbiome Project)’ 등이 있다. 이러한 대규모의 유전체 데이터는 인간 윤리 및 개인정보 보호와 같은 윤리적인 문제에서 생명연구자원 보유국과 자원을 활용하는 선진국 간의 이익공유를 위한 나고야 의정서의 이슈까지 다양한 문제를 야기하고 있다. 다음은 주요 선진국에서 운영하는 바이오 데이터센터들에 관한 최신 내용이다.
(1) 미국
미국은 전 세계에서 가장 많은 대형 바이오 데이터 프로젝트를 수행하는 나라이면서 동시에 대표적인 바이오 데이터센터인 NCBI(National Center for Biotechnology Information)를 운영하고 있다. NCBI는 1988년 미국 메릴랜드주에 설립되었으며 생명정보학 전담 부서로 컴퓨터를 활용하여 생물학 및 의학 분야의 방대한 데이터를 분석하기 위한 DB를 구축하고 분석 도구를 개발하는 것이 주요 임무이다. NCBI에는 2022년 말 기준으로 문헌, 임상정보, 발현체, 단백체, 유전체, 구조, 변이, 화합물 정보, 질병, 바이러스 등 35종의 바이오 데이터베이스가 있으며, 현재 약 38억 건의 데이터를 보유하고 있다. 이러한 모든 데이터는 ‘Entrez’라는 데이터 검색시스템을 통하여 통합 검색할 수 있는 기능을 제공한다.
또한 미국 국립보건원(NIH)과 국립과학재단(NSF) 등 연방기관들은 데이터 정책・규정을 마련하여 시행 중이며, NIH/NSF는 연간 50만 달러 이상의 연구 과제에 대해 데이터관리계획(Data Management Plan, DMP) 제출을 의무화하고 있으며 2023년부터 모든 과제로 확대 시행할 예정이다. 이에 따라서 NIH는 생산되는 모든 데이터를 지정된 데이터 저장소에 제출하는 것을 제도화하고 있다.
(2) 유럽
유럽의 대표적인 바이오 데이터센터는 영국에 소재하고 있는 EBI(European Bioinformatics Institute)이다. EBI는 발현체, 단백체, 유전체, 대사체, 이미지, 구조, 화합물 정보, 상호작용 등 39종을 보유하고 있다. EBI는 생명과학 분야의 데이터 저장, 관리, 활용을 위한 하드웨어 인프라 구축 및 운영을 ELIXIR를 통하여 운영하고 있다.
(3) 중국
중국은 최근 바이오 분야에 엄청난 규모의 투자를 통해서 빠른 속도로 선진국을 추격하고 있다. 2015년 설립된 NGDC(National Genome Data Center)는 유전체, 발현체, 상호작용, 후성유전체, 유전변이, 마이크로바이옴 등 24종의 데이터를 보유하고 있다. 2023년 3월 기준으로 1만 840개 프로젝트, 62만 6,544개 샘플과 NGS 기반 유전체 데이터 22PB를 보유하고 있다. 또한 전산 인프라로 1.6GB 네트워크 대역폭, 8,300 CPU코어, 266 TFLOPS, 39PB의 저장공간을 보유하고 있다.
(4) 일본
일본의 대표적인 데이터센터인 DDBJ(DNA Data Bank of Japan)는 일본국립유전학연구소(National Institute of Genetics, NIG) 산하기관으로 등록된 데이터는 2022년 기준으로 매년 128% 증가하고 있다. DDBJ는 유럽 EBI, 미국 NCBI와 함께 국제염기서열데이터베이스연합(International Nucleotide Sequence Database Collaboration, INSDC)을 구축하여 데이터 공유 및 등록 양식을 정하고 있으며, 이는 전 세계 바이오 연구자 및 분석 프로그램 개발자들에게 절대적인 영향력을 끼치고 있다.
다. 국내 동향
국내에서도 4차 산업혁명 시대로 진입함에 따라 바이오 빅데이터는 R&D 혁신을 견인・촉진하는 핵심요소로 각광받고 있으며, 바이오헬스 R&D 분야에 지속적인 투자가 이루어지고 바이오 기술 혁신이 빠르게 일어나고 있다. 바이오 데이터의 제도적인 측면에서 정부는 국가 바이오 R&D에서 생산된 데이터의 수집과 활용을 위해서 연구성과물 관리제도(과기정통부, 2012)를 마련하였으며, 생산된 데이터 수집・관리・활용을 담당할 전담 기관으로 한국생명공학연구원 국가생명연구자원정보센터(KOBIC)을 지정하였다.
또한, ‘제3차 국가생명연구자원 관리・활용 기본계획(2020∼2025)’을 마련하였으며, 범부처가 협력하여 부처・사업・연구자별 흩어져 있는 데이터를 통합 수집・제공하는 ‘국가 바이오 데이터 스테이션’(이하, 데이터 스테이션, K-BDS)을 구축하여 2022년 본격 운영하고 있다. 아래는 대표적인 국가 바이오 데이터 인프라 사업 소개이다.
(1) 국가 바이오 데이터 스테이션 구축 및 운영
국내에서는 연구데이터 수집 관련 법・제도적 기반은 기(旣)마련되었으나 바이오 R&D 사업에서 생산되는 데이터는 수집 및 공유 관리체계의 미흡으로 사장되고 있는 것이 현실이다. 국내 연구자들은 논문을 목적으로 미국 NCBI, 유럽 EBI 등의 해외 데이터센터에 데이터를 등록하고 있다. 따라서 범정부 차원에서 부처・사업・연구자별 흩어져 있는 바이오 연구데이터를 범부처가 협력하여 통합 수집・제공하기로 협의하고, ‘국가 바이오 데이터 스테이션’을 구축하여 운영하고 있다.
데이터 스테이션은 효율・전문・안정적 운영을 위해 범부처 바이오 연구데이터 통합 관리기관인 국가생명연구자원정보센터(생명연구자원법 제11조)와 한국과학기술정보연구원(KISTI) 등의 협력 체제로 운영 중이다. 데이터 스테이션에서 수집하려는 데이터는 정부 바이오 R&D를 통해 생산・활용되는 생화학분석, 이미지(영상), 임상 및 전임상, 유전체, 분자구조, 표현형 정보, 화학반응 등의 모든 데이터를 대상으로 하고 있다.

출처: 과학기술정보통신부
[그림 3-110] 국가 바이오 연구데이터 스테이션(K-BDS) 개념도
데이터 스테이션은 범부처 R&D 과제지원 통합 시스템(IRIS)과 연동한 데이터 등록 시스템을 구축하여 연구자들의 데이터 등록 편의성을 제고하고, ‘국가생명연구자원 수집・관리 표준지침’을 제정해 R&D 사업을 관리하며 부처별 사업 공고・협약・평가 시 준수해야 할 연구데이터 관리 기준을 제시할 예정이다. 연구자들의 편의성을 제고하기 위해 개인 저장공간, 데이터 분석 플랫폼 등 개발・지원 및 데이터 활용 기반 R&D 지원 등을 확대할 예정이며, 이를 통해서 2025년까지 약 30PB 바이오 데이터와 40%의 데이터 활용률의 목표를 달성하고자 한다.
또한, 정부는 2022년에 바이오 데이터 공유를 위해서 바이오 데이터 표준 양식 57종을 마련하였다. 이를 위해서 바이오 연구데이터를 프로젝트, 샘플, 유전체, 단백체, 대사체, 화합물, 이미지, 전임상, 기타로 대분류하였다. 이렇게 마련된 표준 등록양식은 데이터 스테이션에서 구현되어 연구자들이 생산한 데이터를 등록할 수 있도록 할 예정이다. 아래의 표는 2022년 마련된 바이오 데이터 표준 등록양식이며, 향후 바이오 기술 발달에 따라 신규 데이터를 발굴하거나 기존 데이터를 지속해서 갱신할 예정이다.
[표 3-65] 바이오 연구데이터 표준 등록양식 목록(2022)
|
대분류 |
중분류 |
건수 |
등록양식 |
|
프로젝트 |
프로젝트 정보 |
1 |
① 프로젝트 정보 |
|
샘플 |
기본 샘플 정보 |
1 |
① 기본 샘플 정보 |
|
부가 샘플정보 |
5 |
① 가축 분야 특성정보 ② 수산 분야 특성정보 ③ 작물 분야 특성정보 ④ 수목(야생식물) 분야 특성정보 ⑤ 동물줄기세포주 정보 |
|
|
유전체 |
NGS |
1 |
① NGS유전체 |
|
마이크로어레이 |
1 |
① 마이크로어레이 |
|
|
염기서열 |
2 |
① 염기서열 ② PCR 프라이머 데이터 |
|
|
단백체 |
단백체 프로파일 |
1 |
① 단백체 데이터 |
|
대사체 |
대사체 프로파일 |
1 |
① 대사체 데이터 |
|
화합물 |
화합물 |
4 |
① 화합물 활성 데이터 ② 화합물 구조 정보 데이터 ③ 화합물 약효 평가 데이터 ④ 화합물 profiling 데이터 |
|
이미지 |
일반 |
2 |
① Cryo-EM ② 광학영상 |
|
뇌과학 |
7 |
① 뇌영상(MRI/fMRI) ② 뇌영상(PET) ③ 뇌전도(EEG) ④ 두 개강내뇌파(iEEG) ⑤ 뇌자기도(MEG) ⑥ 뇌 광학현미경 이미지 ⑦ 뇌 전자현미경 이미지 |
|
|
의료기기 |
5 |
① 의료영상(MRI) ② 의료영상(PET) ③ 의료영상(CT) ④ 의료영상(초음파) ⑤ 의료영상(X-ray) |
|
|
전임상 |
감염병 전임상 |
2 |
① 감염병 전임상 진단 데이터 ② 감염병 전임상 백신/치료제 데이터 |
|
기타 |
기타 |
1 |
① 기타 데이터 |
|
의료기기 |
4 |
① 의료기기 연구 기본정보 ② 체외진단기기 데이터 ③ 의료기기 생체재료 데이터 ④ 생체신호 측정장치 데이터 |
|
|
뇌과학 |
1 |
① 동물생체신호 |
|
|
신약 |
5 |
① 독성 시험 데이터 ② 항암약물의 임상 효능 데이터 ③ 기허가약제 repositioning 연구 정보 데이터 ④ IND(신약임상시험신청) 데이터 ⑤ 바이오마커 데이터 |
|
|
농약 |
1 |
① 생물농약 및 화학농약 |
|
|
식품 |
4 |
① 식품 샘플 ② 식품 성분 ③ 식품 소재 ④ 식품 가공 |
|
|
수산 |
4 |
① 수산 양식 데이터 ② 수산 질병 데이터 ③ 수산 먹이사료 데이터 ④ 수산 사료 데이터 |
|
|
환경 |
1 |
① 곤충 분포 정보 |
|
|
임상 |
2 |
① 보건연구과제 정보 ② 보건데이터 정보 |
|
|
지능형 농업 |
1 |
① 시설원예 분야 환경/작목별 데이터 및 축산 분야 돼지(모돈)/젖소 데이터 |
|
|
계 |
57 |
|
|
출처: 과학기술정보통신부
또한 논문 등 연구성과 발표 전 비공개인 데이터의 공유를 매개, 연구데이터와 소재정보를 연계 제공 등 활용성 제고, 논문 투고용 데이터 저장소 역할을 수행하고 있다.
KISTI는 데이터 기반 바이오 연구 활성화를 위한 국가 바이오 연구데이터 플랫폼 구축 및 부처 데이터센터 연계 활용 체계 구축 및 운영을 목표로 하고 있다. 이를 위해서 국가 R&D 과제의 연구데이터 활용을 위한 데이터 스테이션 플랫폼을 개발하고, 부처 데이터센터와의 데이터 연계 체계 및 이송 체계를 확립하며, 이를 위한 전용 네트워크망을 구축을 담당하고 있다. 확보된 바이오 연구데이터를 연구자들이 손쉽게 활용할 수 있는 연구 환경을 구축하여 연구 지원 업무를 수행하고 있다.
(2) 국가 바이오 빅데이터 구축 시범사업
본 사업은 전 세계적으로 정밀의료 바탕이 되는 바이오 빅데이터가 사후적 치료 중심에서 개인 맞춤형 치료・예방 의료로 전환됨에 따라, 국내에서 한국인 유전체 기반의 바이오 빅데이터를 구축하는 시범사업이다. 시범사업은 2020∼2022년까지 진행되었으며, 한국인 전체 2만 5,000명을 대상으로 하였다. 이는 희귀질환자 및 가족 1만 5,000명 샘플, 한국인유전체역학조사사업(KOGES) 샘플 5,000명, 기존의 유전체 사업에서 생산된 데이터 5,000명의 샘플이 포함되어 있다. 생산된 데이터는 희귀질환 임상정보・유전체 데이터를 분석하여 희귀질환자 진단참고용 보고서를 생산하고, 희귀질환 협력기관은 이를 환자 상담・진단 등에 활용한다. 한국과학기술정보연구원(KISTI)은 연구자들에게는 데이터 연구를 지원하기 위해서 민감정보인 데이터의 정보보호를 위해 폐쇄망 구축하고, 임상분석연구네트워크(CIRN)을 통해 연구 활용을 지원하고 있다. 정부는 100만 명의 한국인 임상유전체 생산을 위한 예비타당성 사업도 현재 진행하고 있다.
(3) 국가 바이오 R&D에서 생산되는 데이터 현황
KOBIC이 매년 마련하는 국가생명공학연구자원 관리・활용 시행계획에 따르면 국내 바이오 R&D에서 생산되어 주요 데이터 관련 기관에 확보된 데이터는 2022년까지 부처별 정보센터 데이터를 포함하여 약 16.56PB이다. 이러한 데이터는 향후 국가 바이오 데이터 스테이션에 통합 또는 연계되어 제공될 예정이다.
[표 3-66] 각 기관별 연구 데이터 보유 내역
|
부처 및 기관 |
데이터 유형별 용량 (GB) |
합계(GB) |
||||||
|
부처 |
기관 |
유전체 |
단백체 |
대사체 |
화합물 |
바이오 이미지 |
기타 |
|
|
과기정통부 |
KOBIC |
9,500,191 |
4,352 |
3,103 |
- |
92 |
1,677,322 |
11,185,060 |
|
복지부 질병청 |
CODA |
754,688 |
- |
- |
- |
- |
- |
754,688 |
|
농식품부・농진청 |
NABIC |
55,209 |
- |
166 |
- |
- |
- |
55,375 |
|
해수부 |
MAGIC |
64,410 |
- |
- |
- |
- |
- |
64,410 |
|
산업부 |
INGIC |
67,319 |
- |
- |
- |
- |
- |
67,319 |
|
과기정통부 |
한국화합물은행 |
- |
- |
- |
3,101 |
- |
- |
3,101 |
|
한국뇌연구원 |
150,608 |
1,472 |
- |
- |
123,206 |
7,288 |
282,574 |
|
|
정밀의료기술개발사업단 |
4,103,644 |
- |
- |
- |
- |
- |
4,103,644 |
|
|
유전자동의보감사업단 |
- |
- |
- |
10,000 |
- |
- |
10,000 |
|
|
복지부 |
K-MASTER사업단 |
- |
22,000 |
- |
- |
- |
- |
22,000 |
|
환경부 |
국립생물자원관 |
15,360 |
- |
- |
- |
- |
- |
15.360 |
|
합계 |
14,711,429 |
27,824 |
3,269 |
13,101 |
123,298 |
1,684,610 |
16,563,531 |
|
주1) 과기정통부 기타: 데이터 유형 분류가 되지 않은 해외 DB, 개인 연구자 등 데이터 포함
주2) 운영 종료: INGIC(2022.12. 종료), 유전자동의보감사업단(2022.9. 종료), K-MASTER사업단(2021.12. 종료)
출처: 과학기술정보통신부
라. 발전 과제
우리나라는 바이오 데이터 인프라 및 연구・활용 분야에서는 후발 주자이다. 이러한 우리의 현실과 바이오 데이터 분야의 새로운 흐름에 국가적으로 어떤 준비를 해야 하는지 생각해 볼 필요가 있다.
우선 가장 시급한 것은 빅데이터를 저장하고 분석할 수 있는 전산 인프라 구축과 해석 기술의 개발이다. 방대한 바이오 데이터의 효과적인 분석과 활용을 위해서는 국가 차원의 바이오 전용 전산 하드웨어 인프라를 구축하고 해석 기술을 개발하여 연구자들이 쉽게 사용할 수 있도록 제공하여야 한다. 또한 바이오 데이터 분야의 기술력과 심각한 전문 인력 부족을 개선하여야 한다. 바이오 데이터의 생산・공유, 분석, 인공지능을 이용한 응용, 정밀의료, 신약개발, 동식물 육종 등 분야별로 독자적인 기술력을 갖춰야 한다. IT와 BT 기술을 가진 바이오 데이터 전문가 양성을 위해서 장기적으로 대규모 투자가 꾸준히 이루어져야 한다.
바이오 데이터 특히 인체 유래 빅데이터 공유와 활용을 막고 있는 엄격한 개인정보 보호법 등의 국내 규제법들을 국제적인 표준에 따라 개방하여야 한다. 국내 바이오 빅데이터 활용에 대두된 문제점(제도 개선, 정보 공유 및 개방 등)들을 지혜롭게 풀기 위해서는 데이터 공유 주체인 정부・연구자・병원・기업・개인의 지속적인 논의를 통해 합의점을 찾아야 한다. 또한 국내 연구자들이 자발적으로 자신의 데이터를 공유하는 문화가 확산되어야 하며, 국가적으로 이러한 데이터를 모으고 공유할 수 있는 기반 제공이 중요하다. 이를 위해서 데이터 스테이션을 중심으로 범부처적 바이오 데이터의 수집・공유・활용을 총괄할 체계를 구축하고 바이오 데이터 생태계를 조성하여 새로운 가치를 창출할 수 있어야 한다.
|
참고자료 |
∙ 관계부처 합동, 제3차 생명공학육성기본계획, 2017
∙ 관계부처 합동, 제3차 국가생명연구자원 관리・활용 기본계획(’20∼’25), 2020
∙ 신수용, 유전체 데이터 국제 표준화 동향, 한국바이오협회, Bio Economy Report 8호, 2018
∙ 이세민, 국내외 바이오 빅데이터 현황 및 활용 방안, BioINpro Vol.59, 2019
∙ 이병욱, 바이오 연구데이터 현황과 활용방안, BioINpro 제74호, 2020
∙ 이병욱, 유전체 빅데이터 현황과 활용방안, BioINpro Vo.59, 2019
∙ 최명석, 국내 과학기술분야 연구기관의 과학데이터 관리 현황, 한국콘텐츠학회, 12호 117-126, 2017
∙ Stephens ZD, Lee SY, Faghri F, Campbell RH, Zhai C, Efron MJ, et al. Big Data: Astronomical or Genomical?, PLoS Biol ,13(7):e1002195, 2015
∙ Eric W Sayers, Jeffrey Beck, Evan E Bolton, et al. Database resources of the National Center for Biotechnology Information, Nucleic Acids Research, Volume 49, Issue D1, Pages D10–D17, 2021
∙ CNCB-NGDC Members and Partners, Database Resources of the National Genomics Data Center, China National Center for Bioinformation in 2021, Nucleic Acids Research, Volume 49, Issue D1, Pages D18–D28, 2021
∙ Gaia Cantelli, Guy Cochrane, Cath Brooksbank, Ellen McDonagh, Paul Flicek, et al. The European Bioinformatics Institute: empowering cooperation in response to a global health crisis, Nucleic Acids Research, Volume 49, Issue D1, Pages D29–D37, 2021
∙ Asami Fukuda, Yuichi Kodama, Jun Mashima, Takatomo Fujisawa, Osamu Ogasawara, DDBJ update: streamlining submission and access of human data, Nucleic Acids Research, Volume 49, Issue D1, Pages D71–D75, 2021
|
|
|
제3장 분야별 연구개발 및 산업 현황 |
|
제7절 생명공학 인프라(장비・시설) |
가. 개요
바이오헬스 산업은 미래 성장 가능성과 고용 효과가 크고 국민건강에도 이바지하는 유망 신산업이며 높은 성장에 대한 기대감으로 민간 투자도 활발히 진행되고 있는 분야이다.191) 그간 정부는 바이오헬스 산업을 집중 육성하기 위해 관계부처 합동 ‘바이오헬스 산업 혁신전략(2019.5.)’ 수립을 통해 Big3 산업으로 지정하여 2030년까지 혁신신약・의료기기 세계시장 점유율 3배 확대, 바이오헬스 산업을 5대 수출 주력산업으로 육성, 신규 일자리 30만 명 창출 등을 위한 규제 개선 등 추진 과제를 발표하였다. ‘바이오산업 산업화 촉진 및 지역 기반 고도화 전략(2020.11.)’ 수립을 통해 기업의 투자가 성과로 연결되는 사업화・시장진출 정책 보완으로 민간 투자의 효과성 극대화, 기업투자 성공-산업 전체 성장의 선순환체계 구축의 기본방향을 제시하였으며, ‘디지털헬스케어 서비스산업 육성전략(2022.2.)’ 수립을 통해 디지털헬스케어 서비스 유효성 입증, 디지털헬스케어 서비스 확산을 위한 기반 조성을 목표로 설정, 10대 중점 추진 과제를 설정하였다. 최근에는 ‘바이오헬스 신시장 창출 전략(2023.2.)’ 발표를 통해 디지털 신시장 창출, 바이오헬스 수출 활성화를 목표로 설정, 5대 핵심과제를 설정하여 미래 의료・건강・돌봄 디지털전환으로 국민건강 향상과 디지털・바이오헬스 글로벌 중심국가 도약이라는 비전을 제시하였다.
아무리 강조해도 그 중요성이 큰 바이오헬스 산업의 근간이 되는 생명공학 분야의 경쟁력을 강화하기 위해서는 핵심기술 개발뿐만 아니라 산업에 대한 경쟁력 확보에 징검다리 역할을 할 수 있는 다양한 분야의 생명공학 인프라 확충 및 내실화가 매우 중요하다. 특히 생명공학 인프라는 생명공학 제품의 고부가가치화, 안전성 확보, 인류의 건강 등에 대한 이슈가 더욱 중요해지면서 실용화 기술개발 및 산업화에 필요한 강건한 뼈대 역할을 해주기 때문이다. 정부는 바이오헬스 산업 혁신전략, 바이오헬스 신시장 창출 전략 등을 발표하여 기업의 투자가 성과로 연결되는 사업화・시장진출 정책을 보완하고, 민간 투자의 효과성 극대화, 개별 기업의 투자로 해소가 곤란한 분야에 대한 정부 역량 집중, 소부장 자급화, 제조・유통 프로세스 고도화로 생산 효율성 증대를 위한 바이오소부장 생산 및 유통구조 고도화, 연구개발 → 인・허가 → 생산으로 이어지는 산업 가치사슬 단계별 전문인력 공급으로 기업 성장 기반 강화를 위한 가치사슬 단계별 인력 양성 지원, 첨단 기술을 이용한 신약개발 리스크 완화와 공용 생산시설 구축으로 투자의 효율성 증대를 위한 사업화 리스크 완화 등을 차질 없이 이행 중이다. 또한 전 세계 바이오헬스 시장이 개인맞춤형 치료기술 중심으로 발전해 가고 있음에 따라 의료기술 혁신의 핵심기반이 ‘데이터’ 라는 인식 아래 바이오헬스 빅데이터 플랫폼 구축, 데이터 중심병원 등을 매우 강조하고 있다.
생명공학 분야 실용화기술개발 단계의 세부과정은 ① 순수연구 및 독창적・창의적 ‘기초연구(Basic research)’ 과정, ② 개발 가능성 확보 및 효능확인의 ‘응용연구(Applied research)’ 과정, ③ Prototype 및 시제품 제작의 ‘개발(Development)’ 과정, ④ 대량 생산의 가능성 확보 및 제품성능평가의 ‘시생산(Pilot-plant)’ 과정, ⑤ 대량 생산 및 품질관리의 ‘산업화(Manufacturing)’ 과정 등으로 세분화할 수 있다. 그러나 바이오헬스 산업의 경우에는 타 산업 분야와 달리 차별성 및 특이성이 존재하게 되는데, 이는 개발 과정 → 시생산 과정 → 산업화 과정 등을 수행하면서 개발될 제품(의약품 및 식품 등)을 최종적으로 인체에 적용하기 위하여 체내 안전성・유효성 등에 대한 신뢰성 평가(비임상 GLP, 임상 GCP, 우수제조기준 GMP 등)를 필수적으로 수행하면서 객관적인 성능에 대한 검증을 받아야 한다는 것이다. 또한 전체 연구과정에 필요한 데이터 플랫폼의 활용(개인건강정보 및 환자 질병정보 등 바이오빅데이터, 데이터중심병원, 신약후보물질 및 바이오특허 빅데이터 등)이 적절히 접목되어야 하는 특징이 있다. 이러한 생명공학 분야의 실용화기술개발 단계의 ‘R&D 기능’을 전-후, 좌-우, 상-하에서 적기에 지원해주는 기술 하부구조인 ‘인프라구조(Infra-structure)’의 효율적인 체계 구축은 바이오헬스 산업의 지속가능한 성장을 촉진시키는 필수 요인이 된다.
생명공학 인프라 분야와 관련하여, ① 실용화 기술개발의 ‘응용연구’ 과정까지는 주로 한국생명공학연구원, 한국화학연구원, 한국식품연구원, 한국한의약연구원, 한국기초과학지원연구원, 한국표준과학연구원, 한국과학기술연구원, 한국전자통신연구원 등의 정부출연기관과 정부에서 지원하는 연구소재은행 및 한국세포주은행(과학기술정보통신부), 줄기세포・재생연구센터(보건복지부) 등을 중심으로 R&D 인프라가 구축・운영되고 있고, ② ‘응용연구’ 과정 이후부터는 산업화에 특화된 지원을 위해 산업통상자원부를 중심으로 R&D 및 시제품 제작・생산에 필요한 고가의 시설・장비, 관련 기업의 창업∼성장 단계별 지원을 위한 인프라인 산학연공동연구기반구축센터, 바이오벤처기업지원센터(Bio Venture Center, BVC), 지역특화센터, 한국바이오협회 코리아바이오허브센터(Korea Bio-Hub Center) 등과 우수의약품 제조기준(cGMP)에 맞는 한국생산기술연구원의 생물산업기술실용화센터(KBCC) 등이 구축・운영되고 있다. 또한 국제적 수준의 백신 GMP 제조시설로 동물세포실증지원센터(경북 안동), 미생물실증지원센터(전남 화순)를 통해 제품개발・생산 대행(Contract Development & Manufacturing Organization, CDMO)을 운영 중이다. ③ 특히, 생물산업(의약품 등) 제품의 신뢰성 평가에 특화된 인프라는 안전성평가연구소(KIT)를 포함하여 식품의약품안전처에서 지정된 비임상시험(GLP) 기관과 임상시험(GLP) 기관이 구축・운영되고 있다.
또한 의약품 개발 R&D 비용 중 2/3 정도의 비용이 (비)임상시험 비용 등에 소요되고 있고, 그중 30% 이상이 전문연구용역기관(CRO)에서 사용되는 것으로 추정되고 있다. CRO의 주요 성장 기반이 되는 제약 분야가 지속적으로 확대됨192)에 따라 바이오산업 글로벌 진출을 위한 CRO 육성의 중요성이 어느 때보다도 강조되고 있다. 이는 기업 입장에서는 의약품 개발 과정에서 소요되는 비용 절감을, CRO 회사 입장에서는 수익창출로 서로에게 이익이 될 수 있다. 최근에는 ④ 바이오데이터 플랫폼의 중요성이 강조되면서 병원-기업-연구소가 연계되어 개인건강정보(Personal Health Record, PHR)를 활용한 데이터 플랫폼 구축 및 활용・실증, 환자의 질병정보를 활용한 CDM(Common Data Model) 기반 정밀의료데이터 통합플랫폼 구축 및 활용・실증, 환자의 영상진단 정보를 활용한 AI 기반 의료기기 탑재용 영상분석 솔루션 개발에 대한 실증 연구체계를 빠르게 구축하고 있다.
[표 3-67] 실용화기술개발 단계별 생물산업 관련 주요 인프라 현황
|
인프라 단계 |
세부 구분 |
인프라 기관 |
주요 역할 |
|
Research
(기초연구 및 응용연구)
|
의약바이오
|
한국한의약연구원 한국표준과학연구원 한국과학기술연구원 |
한의학표준화기반 연구 바이오 분야 측정표준 연구 표적지향형 신규항암제 후보물질 연구 |
|
산업/그린/융합바이오
|
한국생명공학연구원 한국생명공학연구원 한국생명공학연구원 한국생명공학연구원 한국식품연구원 한국화학연구원 한국전자통신연구원 한국과학기술연구원 한국뇌연구원 |
바이오제품 안전성평가 및 정보관리 국가영장류센터 운영 바이오융합 연구 국가생물자원정보 관리 식품기능성 및 신소재・신공정 연구 화학기술 분야 연구 및 성과 보급 유비쿼터스건강관리모듈/시스템개발 실시간분자영상 스마트센서기술 개발 뇌손상기전 등 다학제융합기술 기반 뇌연구 |
|
|
종합분야
|
한국기초과학지원연구원 한국세포주은행 한국생명공학연구원 한국생명공학연구원 |
고가의 바이오 연구기자재 활용 미생물 및 세포주은행(관리 및 공급) 해외생물소재(식물) 허브센터 국가생명공학정책연구 및 확산 |
|
|
Development Pilot-plant Manufacturing
(개발, 시생산 및 산업화)
|
산기반 공동장비/연구지원
|
경기바이오센터 등 5개 한국식품연구원 한국화학연구원 한국화학연구원 부산대학교 항노화센터 |
산학연공동연구기반구축 건강기능식품플랫폼 신약개발플랫폼, 바이오화학실용화 Drug Repositioning 연구지원 항노화산업 제품화 연구지원 |
|
벤처기업지원 |
한국생명공학연구원 등 9개 |
바이오벤처기업지원센터(TIC를 포함 BVC) 구축 |
|
|
지역 클러스터
|
대전테크노파크 등 22개 (지원기반정비 13개 별도)
|
지역특화산업 분야 혁신역량 제고 (시설・장비지원, 기술지원, 교육훈련, 시생산 (Pilot plant, GMP 등) 및 공인검사지원 등 수행) |
|
|
종합분야
|
한국생산기술연구원 한국생명공학연구원 한국바이오협회 순창군 장류사업소 백신글로벌산업화기반구축사업단 백신글로벌산업화기반구축사업단 |
생물산업기술실용화센터건립(cGMP) 바이오안전성정보센터(LMO관련) 코리아바이오허브구축(Networking) 발효미생물종합활용센터건립(전통식품) 동물세포실증지원센터(백신GMP, CDMO) 미생물실증지원센터(백신GMP, CDMO) |
|
|
GLP(비임상) GCP(임상)
(신뢰성평가) |
GLP(비임상)
|
식약처 지정 GLP 24개 (안전성평가연구소 등) |
비임상시험실시기관 시험항목별 허가(’23.2월 기준)
|
|
GCP(임상) |
식약처 지정 GCP 208개 |
임상시험실시기관(임상1상, 2상, 3상) 허가(’23.2) |
|
|
바이오빅데이터
(데이터플랫폼)
|
PHR (Personal Health Record)
|
서울대학교 병원(표준/가이드라인) 라이프시맨틱스(플랫폼) 디케이아이테크놀로지(플랫폼)
|
* 실증체계 구축 : 유비플러스, 비트컴퓨터, 피플앤드테크놀러지, 하이디어솔루션즈, 두브레인, 헬스맥스, 휴레이포지티브, 미디어젠, 소프트넷, 브이티더블유 및 다수병원 |
|
CDM(EMR의 Common Data Model)
|
분당서울대병원, 서울아산병원, 아주대학교병원(통합데이터 구축 및 플랫폼 고도화) 서울삼성병원(표준/가이드라인) |
* 실증체계 구축 : 엠투아이티, 셀바스에이아이, 씨앤텍시스템즈, 파미니티, 휴레이포지티브 및 다수병원
|
|
|
AI기반 의료기기 탑재용 영상분석 솔루션
|
한국산업기술시험원(데이터셋), 경북대학교(영상진단), 서울대학교 (영상분석), 대구테크노파크 (온오프라인 플랫폼) |
* 솔루션 활용 : 길의료재단, 국립암센터, 삼성서울병원, 뷰웍스, 인피니트헬스케어, 제노레이 등 다수 병원 및 기업
|
주1) 의약바이오: 바이오신약, 바이오장기 등 바이오기술을 보건의료 분야에 응용한 것
주2) 산업/그린바이오: 건강기능식품, 바이오매스, 바이오플라스틱 등 바이오기술을 농축산, 식품, 바이오플라스틱, 바이오연료 등에 응용한 것
주3) 융합바이오: 바이오공정, 바이오환경, 바이오에너지 등 바이오기술을 산업공정/생산 및 환경 분야에 응용한 것
주4) BVC : 바이오벤처기업지원센터(Bio Venture Center), 전국 바이오벤처기업지원센터간 협력네트워크 및 전략적 연계운영시스템 구축을 통한 효율적 기업지원시스템 구축, 바이오산업의 지역별 균형발전을 도모하기 위해 설립・운영(지역대학 중심으로 지원한 TIC(Technology Innovation Center)) 포함
주5) 지역클러스터(지역특화센터): 지역특화산업 분야의 혁신역량을 제고하기 위하여 지역내 설치 운영되는 센터이며, 지역의 기획 및 기술개발역량의 중재자 기능을 수행
주6) 산기반 공동장비/연구지원: 산업부 산업기술기반조성/산업핵심기술개발 등으로 지원된 인프라
출처: 저자 작성
나. 현황
(1) 기초・응용연구 단계 인프라
기초・응용연구 단계 인프라는 기초이론 및 실험, 실용 목적의 아이디어 특허 등 개념 정립, 연구실 규모의 기본성능 검증, 연구실 규모의 부품 및 시스템 핵심성능 평가 등을 지원하는 인프라에 해당되며, 주로 국책연구원을 중심으로 인프라가 형성되어 기술개발을 지원하고 있다.
특히 기초・응용연구 단계에서 가장 큰 비중을 차지하는 한국생명공학연구원은 바이오제품 안전성평가 및 정보관리, 국가영장류센터 운영, 바이오융합 연구, 해외생물소재 허브센터 운영, 국가생명공학정책연구 및 확산 등의 기능을 담당하고 있다. 한국식품연구원은 식품기능성 및 신소재・신공정 연구를 담당하고 있고, 한국화학연구원은 바이오 분야를 포함한 화학기술 분야 연구 및 성과 보급을 담당하고 있다. 한국과학기술연구원은 표적지향형 신규 항암제 후보물질 연구, 실시간 분자영상 스마트센서기술 연구 등의 기능을 담당하고 있으며, 한국뇌연구원은 뇌손상기전 등 다학제적인 융합기술 기반의 뇌연구를 담당하고 있고, 기타 한국한의약연구원의 한의학표준화연구, 한국전자통신연구원의 유비쿼터스 건강관리시스템 연구 등도 중요한 인프라 기능을 담당하고 있다.
또한 기초・응용연구 환경에 종합적으로 필요한 2개의 추가 핵심 인프라는 분석기능을 지원하는 한국기초과학지원연구원과 연구개발 검증에 필요한 세포주를 지원하는 한국세포주은행을 꼽을 수 있다. 한국기초과학지원연구원은 1988년 기초과학 진흥을 위한 연구지원 및 공동연구 수행을 목적으로 설립되어 국가적 대형 공동연구장비 개발・설치・운영, 첨단 연구장비 이용자 교육, 범국가적 연구장비 정보수집・분석 등의 기능을 담당하고 있다. 2022년 12월 말 현재, 대전 본원 및 8개 센터(오창, 서울, 부산, 대구, 광주, 전주, 춘천, 서울서부)에 총 397명의 인력 및 578점의 지원 장비193)를 보유하고 있다. 한국세포주은행은 1982년 전국의 연구기관에 필요한 세포주 개발・공급을 목적으로 설립되어 세포주 자원에 관련 정보 수집・보존・공급, 세포주 관련 각종 교육・연수・학술회의 실시, 특허출원 세포주의 기탁 및 보존 등의 기능을 담당하고 있다. 세포주 품질관리에 필요한 각종 실험기자재 및 실험 보조장치를 확보하고 있으며, 1993년 UN 산하 세계지적재산권기구로부터 특허 미생물의 국제기탁기관의 지위를 취득하였다. 세포주 분양업무 시작 이후 2015년까지 국내외 연구기관 3만 7,312여 개의 연구과제에 7만 3,000여 바이알의 세포주를 분양해 왔다.
(2) 개발・시생산 및 산업화 단계 인프라
개발・시생산 및 산업화 단계 인프라는 기초단계 이후의 효능검증 연구・확인, 확정된 부품・시스템의 시작품 제작・평가, Pilot 규모의 시작품 제작 및 성능 평가 등을 지원하는 인프라에 해당하며, 대부분 산업통상자원부 지원 기관을 중심으로 인프라가 형성되어 의약바이오, 산업바이오, 융합바이오 분야의 산업화를 지원하고 있다.
산업화 지원 인프라는 기본적으로 기업 성장 단계별 지원(창업보육 등), 시설・장비구축・활용, 교육훈련, 정보교류, 기술지도 등을 담당하고 있고, 인프라 구축 형태로 크게 구분하면, ① 생물산업실용화기반(cGMP, 발효미생물활용센터), 백신 GMP 제조시설(백신글로벌산업화기반구축사업단; 동물세포실증지원센터, 미생물실증지원센터), ② 바이오안전성정보 및 바이오분야국제협약운영기반(LMO), ③ 연계협력기반(Korea Bio-Hub), ④ 산업기술기반조성(BVC, 산학연공동연구기반, 플랫폼센터, DR센터), ⑤ 지역클러스터(지역특화센터) 등으로 구분될 수 있으며, 국내 생물산업의 여건 및 경쟁력을 고려하여 산업통상자원부 중심으로 전략적으로 구축되었다.
생물산업실용화기반 부분을 살펴보면, 1998년 국내 생물의약 분야의 성장에도 불구하고 미국 FDA의 인증을 받은 우수의약품 제조 및 품질관리기준인 cGMP194)기준의 생산공장이 전무한 실정이다. 이를 감안하여 선진국 수출지원 등을 위해 미국 FDA와 유럽 EMA가 요구하는 기술적 사항을 종합적으로 반영하여 국제적으로 인정된 기준에 맞는 생물의약품 전문생산시설(생물산업기술실용화센터 KBCC, 1998∼2007)195)가 구축되었으며, 2007년 국내 발효식품산업 육성을 위해 전통발효식품(고추장, 된장 등)의 안전성 확보 및 발효미생물자원의 허브 구축을 위하여 발효미생물종합활용센터(2007∼2010)196)가 구축되었다.
바이오안전성 기반 부분을 살펴보면, 2002년 LMO(유전자변형생물체)를 중심으로 대두된 국제무역질서에 대응하기 위한 의무사항・교육・홍보 등을 위하여 바이오안전성정보센터(2002∼), 바이오 분야 국제협약운영센터(2008∼), 바이오안전성평가관리사업(2008∼) 등이 구축되었으며, 연계협력 기반 부분을 살펴보면 국내외 바이오네트워크 구축・활성화 및 웹포털 구축・운영을 통한 각종 협업기관 지원을 위하여 코리아바이오허브센터(2004∼)가 구축되었다.
또한, 산업기술 기반 조성 및 지역 클러스터 부분을 살펴보면 수도권을 포함한 각 지역 소재 중소 바이오벤처기업 등의 특성화 지원 및 현장 밀착형 지원을 위해 산업 정책 차원에서의 바이오벤처기업지원센터(BVC, 1998∼2007)197)와 산학연공동연구 기반 구축(2004∼2011)198), 지역균형발전 차원에서의 지역 바이오클러스터(지역특화센터, 2002∼2012)199), 건강식품개발 및 신약개발을 위한 플랫폼 구축(2009∼2014), Drug Repositioning 기술을 이용한 신약개발 활용 시스템 구축(2010∼2015), 바이오화학 실용화 센터 구축(2010∼2014)200), 지역산업 육성을 위한 융복합 연구지원(2012∼2015) 및 항노화 제품개발 인프라(2011∼2015)201) 등이 구축되었다. 이후, GMP급 백신 제조 인프라 구축, 산・학・연・관의 백신 개발 및 생산 지원을 통해 백신산업의 글로벌 진출과 육성・진흥에 기여하고자 (재)백신글로벌산업화기반구축사업단을 설립(2017∼)202)하였다.
(가) 산업화 지원 인프라 현황
산업화 지원 인프라는 국비 지원 종료 후 대부분 운영 자립화 단계에 있으며, 지역 내외의 산학연 고객 수요, 정부/지자체 등 (비)R&D 자금 수주 등을 통해 전국적으로 생물산업 제품의 산업화를 직・간접적으로 지원하고 있고, 2023년 현재까지 2017년 말의 규모로 큰 변동 없이 지속적으로 유지되고 있다. 2017년까지 지급한 국비지원금은 29개 기관, 60개 과제(2단계 13개 포함)에 총 6,279억 3,100만 원이 지원되었으며, 60개 과제는 cGMP 1개, LMO 3개, 산기반 3개, 네트워킹 1개, 발효산업 1개, BVC 9개, 지역특화센터 36개(2단계 13개 포함), 산업핵심 및 산기반 인프라 7개로 구성되어 있다.
광역경제권역별 정부 지원 금액(지원 과제수 포함) 비중을 보면, 호남권 23%(1,441억 원, 14개) 지원되었으며, 충청권 22.7%(1,428억 원, 16개), 수도권 19.5%(1,226억 원, 4개), 대경권 10.07%(631억 원, 9개), 동남권 8.8%(555억 원, 9개), 강원권 8.1%(511억 원, 5개), 제주권 7.8%(487억 원, 3개) 순으로 지원되었다. 지원 분야별 지원금액(지원 과제수 포함) 비중을 보면, 각각 산업/그린바이오 분야 52.7%(3,310억 원, 36개), 의약바이오 분야 33.8%(2,121억 원, 15개), 복합지원(의약/산업/그린) 분야 8.8%(552억 원, 5개), 융합바이오 분야 4.7%(296억 원, 4개) 등의 비중을 차지하고 있다.
60개 지원과제별 지원 서비스 분야별 현황(2개 이상 지원 역할 포함)을 보면, Pilot Plant 지원이 70.0%(42개), GMP 지원이 56.7%(34개), 공인인증검사(식품위생검사 등 포함)가 45.0%(27개), 기타(연구지원, 정보제공 등)가 20.0%(12개) 등으로 주요 역할이 생물산업 제품화 지원을 위한 시제품 생산 및 공인시험 인증지원에 큰 비중을 두고 있다.

주) 2023년 현재 지속 유지 중
출처: 저자 작성
[그림 3-111] 광역경제권역별 산업화 인프라 지원 현황(∼2020)

주) 2023년 현재 지속 유지 중
출처: 저자 작성
[그림 3-112] 지원분야별 산업화 인프라 지원 현황(2020)
(나) 백신 특화 인프라 현황
백신 특화 인프라인 (재)백신글로벌산업화기반구축사업단(동물세포실증지원센터, 미생물실증지원센터)은 국제적 수준의 백신 GMP 제조시설 및 장비를 갖춘 개발・생산 대행기관(CDMO)을 구축・운영하여 국내 백신산업을 육성하고, 기업들의 세계시장 진출을 지원하고 있다.
동물세포실증지원센터는 경북 안동에 위치하고 있으며, 동물세포와 바이러스를 이용하여 제조하는 백신개발 생산시스템 구축을 위해(예로 독감백신, 수두백신 등), 총 1,029억 원(국비 695억 원, 지방비 334억 원)을 투자하여 4,200L, 1,000L 생산라인, BSL-3(Bio Safety Level-3) 생산라인, 완제생산라인 등을 구축하였다. 미생물실증지원센터는 전남 화순에 위치하고 있으며, 병원성 세균, 대장균, 효모 등 미생물을 이용하여 제조하는 백신개발 생산시스템 구축을 위해(예로 폐렴백신, 자궁경부암백신 등), 총 836억 원(국비 549억 원, 지방비 287억 원)을 투자하여 50L, 200L, 1,000L 생산라인, BSL-3(Bio Safety Level-3) 배양시설, 완제생산라인 등을 구축하였다.
동물세포실증지원센터는 2020년 10월부터, 미생물실증지원센터는 2020년 6월부터 파일럿 규모(50L) 비임상시료 생산 및 공정개발을 지원하고 있으며, 2020년 COVID-19 백신개발 기업 4개 사와 생산 MOU・계약 체결하였다.
동물세포실증지원센터는 ㈜스마젠과 임상용 시료 위탁생산 MOU 체결 및 바이러스전달체 백신 관련 업무 위・수탁 기본계약을 체결하였고, ㈜셀리드와는 바이러스전달체 백신 관련 공정 개발, 제품 생산 MOU를 체결하였다. 미생물실증지원센터는 ㈜아이진과는 비임상 및 임상시료 생산 계약 체결을 하였고, ㈜제넥신과는 DNA 백신 및 바이러스전달체 백신에 대한 MOU를 체결하였다.
[표 3-68] (재)백신글로벌산업화기반구축사업단 동물세포실증지원센터 vs 미생물실증지원센터 인프라
|
구분 |
내용 |
용도 |
구분 |
내용 |
용도 |
||
|
동물 세포 실증 지원 센터 (안동) |
GMP 생산 시설 |
200L |
200L 부착세포 배양 및 정제 시스템 |
미생물 실증 지원 센터 (화순) |
GMP 생산 시설 |
50L |
50L 발효기 및 정제 시스템 |
|
200L |
50L, 200L 부유세포 배양 및 정제 시스템 |
200L |
50L, 200L 발효기 및 정제 시스템 |
||||
|
1,000L |
50L, 200L, 1,000L 부유세포 배양 및 정제 시스템 |
1,000L |
50L(x1대), 500L(x2대) 발효기 및 정제 시스템 |
||||
|
BSL-3 (200L) |
50L, 200L 부유세포 배양 및 정제 시스템 |
BSL-3 (200L) |
50L, 200L 발효기 |
||||
|
완제 (바이알) |
바이알 충전시스템 (12,000 바이알/hr) (동결건조 포함) |
완제 (바이알) |
5,000 바이알/hr (동결건조 포함) |
||||
|
완제 (시린지) |
프리필드시린지 충전시스템 (10,000 시린지/hr) |
||||||
|
공정개발 시설 |
50L pilot scale |
공정개발 시설 |
50L pilot scale |
||||
출처: (재)백신글로벌산업화구축사업단, https://www.ipogiv.or.kr/facility/facility
[표 3-69] 생명공학 분야 산업화 지원 인프라 현황 (2023년 2월말 현재, 지속적으로 유지 중)
|
광역 경제권 |
특화 분야 |
사업 구분 |
과제명(사업기간) / 지원기능 |
주관기관(URL) |
정부지원금 (∼’17) (억원) |
|
수도권 |
복합지원(의약/ 산업/그린) |
네트워킹 |
코리아바이오허브구축(’04-)/[기타-연구장비] |
한국바이오협회 www.koreabio.org |
237.8 |
|
의약바이오 |
cGMP |
생물산업기술실용화센터건립(’98-’07)/[GMP] |
㈜바이넥스 www.bi-nex.com |
898 |
|
|
의약바이오 |
산기반 |
바이오개량신약제제화공동연구기반구축(’06-’11)/[PP, GMP] |
경기과학기술진흥원 www.ggbc.or.kr |
50 |
|
|
산업/그린바이오 |
산업융합원천 |
건강기능식품플랫폼(’09-’14/[기타-연구장비] |
한국식품연구원 www.kfri.re.kr |
40 |
|
|
충청권 |
의약바이오 산업/그린바이오 산업/그린바이오 산업/그린바이오 산업/그린바이오 |
BVC LMO LMO LMO 산기반 |
(BVC)생물의약TIC(’99-’04)/[PP, GMP] 바이오안전성정보기반구축(’02-계속)/[기타-안전성정보] 바이오국제협약운영(’08-계속)/[기타-안전성정보] 바이오안전성평가관리사업(’04-’07)/[기타-안전성정보] 단백질소재의산업적활용 극대화를위한기반구축(’05-’10)/[기타-연구장비] |
한국생명공학연구원 bvc.kribb.re.kr www.biosafety.or.kr biocat.or.kr |
50.3 86.37 181.86 118.28 45.25 |
|
의약바이오 의약바이오 산업/그린바이오 |
산업핵심 산업핵심 산업핵심 |
신약개발플랫폼(’09-’14)/[기타-연구장비] Drug Repositioning 기술을 이용한 신약개발 활용 시스템 구축(’10-’15)/[기타-연구장비] 바이오화학실용화센터(’10-’14)/[PP] |
한국화학연구원 ddpt.krict.re.kr www.krict.re.kr ulsan.krict.re.kr |
89 104 71 |
|
|
의약바이오 의약바이오 |
지역클러스터 지역클러스터 |
바이오벤처타운조성(’02-’07)/[GMP] (2단계)바이오의약산업화허브구축사업(’08-’10)/[GMP] |
(재)대전테크노파크 www.daejeontp.or.kr |
260.66 49 |
|
|
복합지원(의약/ 산업/그린) |
BVC |
(BVC)생물의약및식품TIC(’01-’06)/[PP, 공인검사] |
영동대학교 www.biotic.re.kr |
46.8 |
|
|
의약바이오 의약바이오 의약바이오 |
지역클러스터 지역클러스터 지역클러스터 |
보건의료산업종합지원센터건립(’04-’07)/[PP, GMP, 공인검사] 전통의약품개발지원센터건립(’03-’07)/[PP, 공인검사] (2단계)한방산업클러스터고도화사업(’08-’10)/[PP, 공인검사] |
(재)충북테크노파크 www.cbtp.or.kr/cbhic www.cbtp.or.kr/cbomc |
124.7 97.97 15.87 |
|
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
동물자원사업화지원센터건립(’03-’07)/[PP, GMP, 공인검사] (2단계)충남농축산바이오산업생산지원인프라구축사업(’08-’10)/ [PP, GMP, 공인검사] |
(재)충남동물자원센터 www.cnasc.or.kr |
47.87 40 |
|
|
호남권 |
산업/그린바이오 산업/그린바이오 산업/그린바이오 |
BVC 지역클러스터 지역클러스터 |
(BVC) 생물벤처기업지원센터설립(’00-’04)/[PP, GMP, 공인검사] 바이오파크인프라구축(’05-’08)/[PP, GMP, 공인검사] (2단계)발효식품소재완제품화일괄지원시스템구축사업(’08-’10)/ [PP, GMP, 공인검사] |
(재)전라북도생물산업진흥원 www.jjf.re.kr |
50.62 143.45 22.5 |
|
산업/그린바이오 |
산기반 |
기능성식품 임상시험지원센터설립(’04-’09)/[공인검사] |
전북대학교 www.ctcf2.com |
49.73 |
|
|
산업/그린바이오 |
발효산업 |
발효미생물종합활용센터건립(’07-’10)/[PP] |
순창군장류사업소 www.gochujang.go.kr |
234 |
|
|
산업/그린바이오 |
산기반 |
지역특화기술융복합연구지원(’12-’15)/[연구지원] |
(재)발효미생물산업진흥원 mifi.kr |
2.43 |
|
|
산업/그린바이오 |
BVC |
(BVC)생물산업산학연협동연구및실용화기반구축(’00-’04)/[PP] |
동신대학교 www.bic.re.kr |
50 |
|
|
산업/그린바이오 산업/그린바이오 의약바이오 의약바이오 의약바이오 산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 지역클러스터 지역클러스터 지역클러스터 지역클러스터 지역클러스터 |
전남생물식품사업화지원센터건립운영(’02-’07)/[PP, GMP] (2단계)건강기능식품소재산업지원기반구축사업(’08-’10)/[PP, GMP] 전남생물농업산학공동연구센터건립운영(’02-’07)/[PP, GMP] (2단계)생물의약품완제라인구축사업(’08-’10)/[PP, GMP] 독감백신원료생산기반구축(’05-’08)/[PP, GMP] 친환경생물산업클러스터구축(’07-’09)/[PP, 공인검사] 전남특산자원산업화기반구축(’07-’10)/[PP] |
(재)전라남도생물산업진흥재단 www.jbio.org www.jbrc.re.kr www.jbrc.re.kr www.jbrc.re.kr www.jbc.re.kr www.jinr.re.kr |
304 25 173.8 39.7 128.33 128.31 89.29 |
|
|
동남권 |
산업/그린바이오 |
BVC |
(BVC)마린바이오기능성물질연구기반구축(’02-’07)/[PP] |
신라대학교 mcbi.silla.ac.kr |
45.46 |
|
융합바이오 융합바이오 |
산업핵심 산기반 |
항노화 산업 제품화 기술개발(’11-’15)/[연구개발지원] 항노화 산업기반 구축(’12-’15)/[연구개발지원] |
부산대학교 anti-aging.re.kr |
37.56 112.87 |
|
|
융합바이오 융합바이오 |
지역클러스터 지역클러스터 |
차세대 의생명융합산업지원센터 구축사업(’05-’08)/[PP, 공인검사] 첨단 의생명테크노타운 건립 사업(’09-’11)/[PP, GMP, 공인검사] |
(재)김해시차세대의생명 융합산업지원센터 www.gbmc.or.kr |
58 88 |
|
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
해양생물산업육성센터(’04-’08)/[PP, GLP, 공인검사] (2단계)해양산업안전성확보기반구축사업(’09-’11)/[PP, GLP, 공인검사] |
(재)부산테크노파크 www.mbdc.or.kr |
113.89 20 |
|
|
산업/그린바이오 산업/그린바이오 |
BVC 지역클러스터 |
(BVC) 생물화학소재산업지원센터설립(’00-’04)/[PP] 바이오벤처프라자건립(’04-’08)/[PP] |
(재)바이오21센터 www.bio21.or.kr |
50 28,89 |
|
|
대경권 |
산업/그린바이오 산업/그린바이오 의약바이오 의약바이오 |
지역클러스터 지역클러스터 지역클러스터 지역클러스터 |
전통생물소재산업화센터(’04-’08)/[PP, GMP, 공인검사] (2단계)건강기능소재산업육성기반정비사업(’09-’12)/ [PP, GMP, 공인검사] 한방산업지원센터기반구축(’04-’08)/[PP, GMP, 공인검사] (2단계)한방산업육성기반정비사업(’09-’11)/[PP, GMP, 공인검사] |
(재)대구테크노파크 www.dbic.or.kr www.omisc.or.kr
|
106.4 20.08 34.46 5.24 |
|
산업/그린바이오 |
BVC |
(BVC)생물농업및식품용생물소재TIC(’01-’06)/[PP, GMP] |
경북대학교 www.knu.ac.kr |
42.07 |
|
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
생물건강산업사업화지원센터건립(’02-’07)/[PP, GMP, 공인검사] (2단계)경북기능성바이오소재산업기반정비사업(’08-’12)/ [PP, GMP, 공인검사] |
(재)경북바이오산업연구원 www.gib.re.kr |
137.48 135.52 |
|
|
산업/그린바이오 |
지역클러스터 |
해양생명환경산업지원센터건립(’04-’07)/[PP, GMP] |
(재)경북해양바이오산업 연구원 www.gimb.or.kr |
80 |
|
|
산업/그린바이오 |
지역클러스터 |
포항테크노(바이오)정보지원센터건립(’07-’10)/[공인검사] |
(재)포항테크노파크 www.pohangtp.org |
69.61 |
|
|
강원권 |
복합지원(의약/ 산업/그린) 복합지원(의약/ 산업/그린) 복합지원(의약/ 산업/그린) |
BVC 지역클러스터 지역클러스터 |
(BVC) 생물산업벤처기업지원기반조성(’98-’02)/[PP, GMP, 공인 검사] 춘천바이오타운조성(’02-’07)/[PP, GMP, 공인검사] (2단계)생물의약소재시험생산지원기반정비(’08-’11)/[PP, GMP, 공인검사] |
(재)춘천바이오산업진흥원 www.cbf.or.kr |
58 172.3 37.2 |
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
강릉해양생물산업지원센터(’02-’07)/[PP, GMP, 공인검사] (2단계)해양의용식품사업화지원기반구축사업(’08-’11)/[PP, GMP, 공인검사] |
(재)강릉과학산업진흥원 www.gsif.or.kr |
225.87 17.9 |
|
|
제주권 |
산업/그린바이오 |
BVC |
(BVC)기능성바이오첨가제및생물자원TIC(’01-’06)/[PP, GMP, 공인검사] |
제주대학교 chejutic.cheju.ac.kr |
47.7 |
|
산업/그린바이오 산업/그린바이오 |
지역클러스터 지역클러스터 |
바이오사이언스파크(’02-’07)/[PP, GMP, 공인검사] (2단계)제주건강・뷰티생물산업기반정비사업(’08-’12)/[PP, GMP, 공인검사] |
(재)제주테크노파크 bio.jejutp.or.kr |
210.69 228.7 |
|
|
합계 |
6,279.31 |
||||
출처: ㈔한국바이오특화센터협의회 및 각 기관자료를 참고로 필자 정리
(3) 신뢰성평가 단계 인프라
신뢰성평가 단계 인프라는 최종 개발제품의 산업화 전후 단계에서의 인체 적용을 통하여 체내 안전성・유효성 등에 대한 신뢰성(비임상, 임상 등) 확보를 지원하는 인프라에 해당되며, 대부분 보건복지부(식품의약품안전처)의 인허가를 득한 지원기관을 중심으로 인프라가 형성되어 지원하고 있다. 구체적으로 식품의약품안전처로부터 비임상시험관리기준(Good Laboratory Practice, GLP) 시험기관으로 지정된 기관은 1988년부터 2019년 6월까지 31개 기관이었으나, 12개 기관의 지정취하 및 신규 지정 5개 등으로 2023년 2월 말 현재는 24개 기관이 운영 중이다. 임상시험관리기준(Good Clinical Practice, GCP) 기준에 맞는 자격 기준을 갖추고 있고 식품의약품안전처에서 임상시험실시기관으로 지정된 국내기관은 1997년부터 2020년 6월까지 198개 기관이었으나, 3개 기관의 지정 취하 및 신규 지정 13개 등으로 2023년 2월 말 현재는 208개 기관이 운영 중이다. 특히 GLP 기관은 전체의 58%에 해당하는 14개가 수도권에 위치하여 비임상 지원을 하고 있으며, 충청권에 4개, 호남권에 4개, 대경권에 1개, 강원권에 1개씩 위치하고 있다.
산업통상자원부에서는 2010년부터 대규모 투자가 이루어지고 있는 의약품에 관한 임상 수요를 국내 임상 전문연구용역기관(Contracted Research Organization, CRO)를 통해 충족시킴으로써 국내 개발사에 대한 전문 서비스를 신속하고 저비용으로 제공하는 동시에, 국내 임상 CRO 산업의 육성을 위해 ㈜드림씨아이에스, ㈜씨엔알리서치, ㈜엘에스케이글로벌파마서비스 등 국내 대표적인 임상 CRO 회사를 중심으로 핵심 인프라 구축을 지원하였으며, 국내 CRO 관련 산업의 성장과 발전을 도모하고 국내 임상 CRO의 활성도를 제고하여 바이오의약품의 해외 진출을 지원하는 역할을 담당하고 있다. 주요 서비스 내용으로는 ① 글로벌 기준에 맞는 임상시험자료 관리시스템(CDM) 구축, ② 다국적 임상시험 진행 시 원활한 진행을 위한 임상시험 관리시스템(PM) 구축, ③ 글로벌수준의 임상시험 신뢰성보증시스템(QA) 구축과 임상시험 모니터요원(CRA) 교육, ④ 구축된 기반을 활용한 바이오시밀러 제1품에 대한 임상시험 수행 등이다.
(4) 바이오빅데이터 단계 인프라
산업화를 위한 바이오빅데이터 단계 인프라는 개인 건강정보, 병원 질병정보, 영상 의료정보 등 3가지로 구분해 보았으며, 이를 위해 산업부에서는 개인 건강정보에 대해서 2015년부터 2022년까지 ‘PHR 기반 개인맞춤형 건강관리시스템 개발사업’을 통해 약 216억 원을, 병원 질병정보에 대해서 2019년부터 2022년까지 ‘CDM 기반 정밀의료 데이터통합플랫폼 기술개발’을 통해 약 202억 원을 투입하였고, 영상 의료정보에 대해서 2020년부터 2024년까지 ‘영상진단 의료기기 탑재용 AI 기반 영상분석 솔루션 개발’을 통해 약 260억 원을 투입하고 있다.
PHR을 통해 개인이 스스로 자신의 개인 건강기록(라이프로그, 유전체데이터, 진료데이터) 등 정밀 의료에 필요한 다양한 데이터를 통합 관리할 수 있는 개인 주도형 플랫폼을 구축하고, 저전력 블루투스(BLE) 국제 표준 등을 적용해 IoT 헬스케어 기기(60여 종)와 연동하여 진료기록, 라이프로그, 투약정보 등 PHR 데이터(200여 개)를 측정하며, 개인 동의를 통해 수집된 PHR 데이터를 개방형 오픈 API를 활용하여 건강관리서비스를 개발하도록 지원하였다. 2018년부터는 국제 시장 경쟁력 향상을 위한 헬스케어 디바이스 연동 및 라이프로그 데이터 표준 가이드라인, 국내 및 국제 개인정보보호법에 위배되지 않는 보안 가이드라인, 국내 보건의료계의 실정을 고려한 국제 의료용어 표준을 따르는 의료용어 표준 가이드라인, PHR 사업자들의 글로벌 시장 진출 및 글로벌 헬스케어 기관・기업들과 협업을 위한 국제 의료정보 바탕 표준 및 가이드라인을 마련, 데이터 플랫폼을 활용한 다양한 기업형 서비스 실증사업 등을 추진하고 있다.
CDM을 통해서는 병원에서 보유한 분산형 의료데이터(Electronic Medical Record, EMR)를 공통데이터모델(Common Data Model, CDM)로 표준화하고 분석하는 SW 개발 등 플랫폼을 구축하였고, 아주대병원 등의 임상데이터를 CDM으로 변환하였다. 2018년부터 2022년까지 총 54개 병원이 참여하여(상급 종합병원 32개, 종합병원 22개), 총환자 수 7,456만 825명에 대한 CDM 데이터 변환데이터 플랫폼을 활용한 다양한 기업형 서비스 실증사업 등을 추진하고 있다.
영상 의료정보를 통해서는 표준화한 의료영상 기반, 영상진단기기 특화 AI 기술개발을 통해 X-ray-폐질환(결절, 종괴, 기흉, 흉수 등), MRI・CT-복부출혈, 근골격계 질환 등 연구를 지원하고 있고, AI 기반 영상진단기기 개발 및 시험・평가 기술개발을 통해 영상 촬영과 동시에 병변・질환을 검출・판독・진단(보조)할 수 있는 AI 탑재 영상진단기기 개발을 지원하고 있으며, 개발자 활용 확대를 위한 통합형 라이브러리, 툴킷 등 SW 개발 등을 지원하고 있다.
[표 3-70] 산업부 추진 PHR 추진과제 현황 (2023년 2월 현재)
|
구분 |
추진 과제 |
주관 기관 |
총 개발기간 |
|
1 |
라이프로그-공공데이터를 활용한 PHR 기반 생애 주기별 맞춤형 건강관리 시스템 개발 및 비즈니스 모델 실증 |
라이프시맨틱스 |
’15.6.1∼’18.11.30 |
|
2 |
시장 경쟁력 향상을 위한 PHR 데이터 표준 및 가이드라인 개발 |
서울대학교병원 |
’18.11.1∼’22.4.30 |
|
3 |
PHR 기반 개인맞춤형 건강관리 서비스 플랫폼 기술 고도화 및 실증서비스 개발 연계지원 |
디케이아이테크놀로지 |
’18.11.1∼’22.4.30 |
|
4 |
고령자 건강관리 서비스 개발 및 실증 |
유비플러스 |
’18.11.1∼’21.3.31 |
|
5 |
PHR 플랫폼 기반의 근로자 맞춤형 건강관리 서비스 개발 및 사업화 |
비트컴퓨터 |
’18.11.1∼’21.3.31 |
|
6 |
개방형 PHR기반 치매 보호자용 건강관리 서비스 개발 및 실증 |
피플앤드테크놀러지 |
’19.4.1∼’21.12.31 |
|
7 |
퇴행성 근골격계 질환 1인가구 고령자의 자기주도적 재활의료 및 재가돌봄을 위한 상호운용 가능한 PHR 서비스플랫폼 개발 및 실증 |
하이디어솔루션즈 |
’19.4.1∼’21.12.31 |
|
8 |
글로벌 PHR기반 소아발달장애 관리 및 치료용 모바일 인공지능 플랫폼 |
두브레인 |
’19.4.1∼’22.12.31 |
|
9 |
개방형 PHR 기반 IoMT 기기를 활용한 공동주택 주민 맞춤형 통합건강관리서비스 개발 및 실증 |
헬스맥스 |
’19.4.1∼’21.12.31 |
|
10 |
개방형 PHR 플랫폼 환경에서 청진 IoMT를 활용한 심질환 진단지원서비스 고도화 모델 |
휴레이포지티브 |
’19.4.1∼’21.12.31 |
|
11 |
맞춤형 개인건강관리 서비스를 위한 헬스케어 음성 UI 플랫폼 기술 개발 |
미디어젠 |
’19.4.1∼’21.12.31 |
|
12 |
염증성장질환 개인주도형 라이프케어 맞춤형 건강관리서비스 플랫폼 개발 및 실증 |
소프트넷 |
’19.4.1∼’21.12.31 |
|
13 |
개방형 PHR기반 만성질환자 응급실용 관리 시스템 개발 및 실증 |
브이티더블유 |
’19.4.1∼’21.12.31 |
출처: 산업통상자원부
[표 3-71] 산업부 추진 CDM 추진과제 현황 (2023년 2월 현재)
|
구분 |
추진 과제 |
주관 기관 |
총 개발기간 |
|
1 |
CDM 기반 분산형 바이오헬스데이터 플랫폼 고도화 및 기관확장 |
분당서울대학교병원 |
’19.5.1∼’22.12.31 |
|
2 |
CDM기반 바이오헬스데이터 통합 플랫폼 고도화 및 검증 기술개발 |
서울아산병원 |
’19.5.1∼’22.12.31 |
|
3 |
CDM기반 바이오헬스 통합 데이터망 기관확장 구축 기술개발 |
아주대학교산학협력단 |
’19.5.1∼’22.12.31 |
|
4 |
공통데이터모델 기반 국내 표준화 및 익명화 가이드라인 수립 |
삼성서울병원 |
’19.5.1∼’22.12.31 |
|
5 |
CDM기반 만성질환 데이터를 활용한 지능형 진단처방 조회 서비스 시스템 |
엠투아이티 |
’19.5.1∼’21.12.31 |
|
6 |
사용자 편의성이 고도화된 CDM 기반 스마트 임상시험 설계 지원 시스템 |
셀바스에이아이 |
’19.5.1∼’21.12.31 |
|
7 |
CDM 기반의 지능형 진료 가이드 알고리즘 개발과 확산을 위한 CDSS 플랫폼 개발 |
씨앤텍시스템즈 |
’19.5.1∼’21.12.31 |
|
8 |
인공지능 딥러닝이 적용된 CDM 및 라이프로그 신규 디지털바이오마커의 발굴 및 서비스 산업화 |
파미니티 |
’19.5.1∼’22.6.30 |
|
9 |
CDM 기반 디지털치료제 검증시스템 개발 및 실증 |
휴레이포지티브 |
‘20.4.1∼’23.6.30 |
|
10 |
CDM 기반 알고리즘 진료 프로토콜 서비스 시스템 개발과 확산 |
씨앤텍시스템즈 |
‘20.4.1∼’22.12.31 |
출처: 산업통상자원부
[표 3-72] 산업부 추진 영상 AI 추진과제 현황 (2023년 2월 현재)
|
구분 |
추진 과제 |
주관 기관 |
총 개발기간 |
|
1 |
인공지능 탑재형 의료영상 진단기기 개발 |
한국산업기술시험원 |
‘20.4.1∼’24.12.31 |
|
2 |
인공지능 학습용 데이터셋 구축 |
한국산업기술시험원 |
‘20.4.1∼’24.12.31 |
|
3 |
영상진단 의료기기 탑재용 AI 진단 기술 개발 |
경북대학교 |
‘20.4.1∼’24.12.31 |
|
4 |
인공지능기반 영상분석 기술을 탑재한 영상진단 의료기기 개발 |
서울대학교 |
‘20.4.1∼’24.12.31 |
|
5 |
AI탑재 영상진단 의료기기 개발을 위한 개방형 온오프라인 플랫폼 기술 개발 |
대구테크노파크 |
‘20.4.1∼’24.12.31 |
출처: 산업통상자원부
다. 발전 과제
바이오헬스 산업은 연평균 세계시장 성장률이 조선, 자동차산업보다 높은 산업이며, 정부의 효율적인 정책 수립, 산학연 모두의 몰입형 기술개발 추진 등을 통해 경제적 효과로 가시화되는 대표적인 산업이다. 생명공학 분야 국책연구소와 인프라 기관은 우리나라의 생물산업 발전을 위한 기술 및 제품화 지원의 하부구조를 구성하며 기초연구에서 사업화까지의 전 과정에 걸쳐 오랜 기간 제 역할을 담당하고 있음을 부정할 수는 없다. 그러나 지난 25년간 정부지원을 통해 구축된 지역 중심의 인프라는 지속적인 운영 자립화 및 기업지원 경쟁력 강화를 위해 효율성의 강구가 필요하다. 또한 기초단계(공공연구기관), 신뢰성 평가단계((비)임상GLP 등)를 연결해 주는 산업화 인프라에 대해서는 국가 단위의 성과를 창출할 수 있도록 중점 분야별(의약, 식품 등), 단계별(후보물질∼시생산∼생산), 서비스별(백신, 바이오시밀러, 소재단백질 등) 인프라 연계 및 통합 서비스 체계 구축 지원을 지속적으로 고려할 필요가 있으며, 이를 통해 중소・중견기업 등의 연구결과를 조기 제품화하고 지역별 기 구축된 산업화 인프라의 활용도와 전문성을 동시에 제고할 수 있을 것으로 판단된다. 인프라 활동도 시대가 요구하는 방향으로 제조혁신 및 공급망, 디지털전환, 탄소중립 등의 키워드와 함께 진화되어야 할 것이다.
현재는 4차 산업혁명과 인구고령화를 계기로 전 세계 바이오헬스 시장이 재편되는 중요한 시기로 산업 정책의 근본적 혁신과 선제적 투자를 통해 우리나라와 같은 후발국이 선도주자로 급부상할 수 있는 좋은 기회이다. 이러한 시대적 기회를 통해 바이오의약품에 대해서는 바이오의약품 생산공정 고도화를 통한 기업의 생산성 제고, 바이오신소재 개발로 고부가가치화 촉진, 해외 의존성 완화, 바이오의약품 관련 핵심 생산장비・원부자재 국산화, 고부가가치 유망소재 연구개발 등 고도화 전략이 필요하다고 판단된다. 또한, COVID-19 팬데믹을 경험하며, 감염성 질환 진단, 백신 산업화, 의약품 생산공정 최적화와 마이크로바이옴 등 차세대 의약품 개발의 추진, 탄소중립 시대 선도 및 미세플라스틱의 심각한 환경오염 문제해결을 위한 바이오매스 기반 탄소중립형 생분해 플라스틱 개발 및 전주기 관리체계 마련 등도 필요하다. 아울러 정부에서 발표했듯이 바이오헬스 산업 수출 활성화를 위해 생명공학 인프라의 지원 강화가 요구된다.
[표 3-73] 국내 GLP 현황(2023년 2월 말 기준)
|
GLP기관 지정순서 |
1호 |
6호 |
8호 |
10호 |
11호 |
13호 |
15호 |
17호 |
18호 |
19호 |
20호 |
21호 |
22호 |
23호 |
25호 |
27호 |
28호 |
30호 |
31호 |
32호 |
33호 |
34호 |
35호 |
36호 |
|
|
시험기관
시험항목 (세부시험항목) |
안전성 평가 연구소 (KIT) |
바이오 톡스텍 |
켐온 |
서울대 병원 |
한국 화학 융합 시험 연구원 (화순) |
인바이츠 바이오 코아 |
대구 카톨릭 대학교 |
넥시 오랩 |
한국 건설 생활 환경 시험 연구원 |
바이오 인프라 |
한국 원자력 의학원 |
한국 의약 연구소 |
에이치엔 에이치 ㈜ |
키프론 바이오 |
안전성 평가 연구소 (전북 분소) |
인터 네셔널 사이언스 티픽 스탠다드 |
크로엔 |
우정 바이오 |
오리앤트제니아 |
디티앤 씨알오 |
싸토 리우스 코리아 바이오텍 |
한약 비임 상시험 센터 |
센트럴 바이오 |
한국식품산업 클러스터진흥원 |
|
|
단회투여독성 |
설치류 |
○ |
○ |
○ |
○ |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
○ |
- |
○ |
○ |
○ |
|
비설치류 |
○ |
○ |
○ |
○ |
○ |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
○ |
- |
|
|
영장류 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
|
|
반복투여독성 |
설치류 |
○ |
○ |
○ |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
- |
- |
○ |
- |
○ |
- |
○ |
○ |
- |
- |
○ |
- |
|
비설치류 |
○ |
○ |
○ |
○ |
○ |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
○ |
- |
|
|
영장류 |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
|
|
생식발생독성 |
수태능 및 초기배발생시험 |
○ |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
출생전후발생/모체기능시험 |
○ |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
|
배태자발생시험 |
○ |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
|
유전독성 |
체외염색체이상 or 쥐림포마tk |
○ |
○ |
○ |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
○ |
○ |
○ |
○ |
- |
- |
○ |
- |
|
체내소핵시험 |
○ |
○ |
○ |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
- |
- |
○ |
- |
○ |
- |
○ |
○ |
- |
- |
- |
- |
|
|
항원성 독성 |
아나필락시스 쇼크반응 |
○ |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
수동피부아나 필락시스반응 |
○ |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
|
피부감작성시험 |
○ |
○ |
○ |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
|
면역독성 |
세포매개 및 체액성 |
○ |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
발암성 |
○ |
○ |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
국소독성 |
피부자극시험 |
○ |
○ |
○ |
○ |
○ |
- |
- |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
○ |
- |
|
안점막자극시험 |
○ |
○ |
○ |
○ |
○ |
- |
- |
- |
○ |
- |
- |
- |
○ |
- |
○ |
- |
○ |
- |
- |
○ |
- |
- |
○ |
- |
|
|
기타독성 |
광감작성시험 |
○ |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
광독성시험 |
○ |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
|
국소내성 |
- |
○ |
○ |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
설치류흡입독성(단회, 반복) |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
변이원성 |
복귀돌연변이 |
○ |
○ |
○ |
○ |
○ |
- |
○ |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
○ |
○ |
○ |
○ |
- |
- |
○ |
- |
|
독성동태시험中 분석시험 |
- |
- |
○ |
- |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
○ |
- |
- |
○ |
○ |
- |
- |
○ |
- |
|
|
혈액조직병리 및 의존성(비GLP) |
- ○ |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
- - |
|
|
안전성약리 |
○ |
○ |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
- |
- |
- |
- |
|
|
기타 국제적으로 인증하는 시험 |
- |
○ |
○ |
- |
○ |
- |
- |
- |
○ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
○ |
○ |
- |
- |
- |
|
|
소재지 |
대전 |
충북 |
경기 |
서울 |
전남 |
서울 |
경북 |
서울 |
인천 |
경기 |
서울 |
경기 |
충남 |
충북 |
전북 |
강원 |
경기 |
경기 |
경기 |
경기 |
경기 |
전남 |
경기 |
전북 |
|
|
지정일 |
1988. 7.22 |
2002. 12.13 |
2002. 8.12 |
2003. 1.9 |
2003. 5.30 |
2005. 5.24 |
2005. 7.26 |
2006. 7.21 |
2006. 11.6 |
2009. 1.15 |
2009. 3.2 |
2011. 5.23 |
2011. 7.12 |
2011. 7.12 |
2012. 12.12 |
2014. 10.1 |
2014. 10.10 |
2016. 6.1 |
2017. 4.17 |
2019. 9.2 |
2019. 12.20 |
2020. 9.14 |
2021. 5.7 |
2022. 12.1 |
|
주) 식약처 임상정책과(∼2023년 2월) 자료를 토대로 필자 작성하였으며, 지정 취하 등 유한양행(2호), 동아제약(3호), LG생명과학(4호), CJ(5호), 산업안전보건연구원(7호), 태평양기술연구원(9호), 메드빌(12호), 아이바이오팜(14호), 동아대병원(16호), 동아에스티(24호), 호서의과학분석연구소(26호), 엘리드(29호)는 제외함
[표 3-74] 국내 GCP 현황(2023년 2월 말 현재)
|
지정번호 |
기관명 |
지정 일자 |
지정번호 |
기관명 |
지정일자 |
||||||||||||
|
임상1상 |
임상2상 |
임상3상 |
임상1상 |
임상2상 |
임상3상 |
||||||||||||
|
1 |
가톨릭대학교 서울성모병원 |
‘97.3.11 |
‘97.3.11 |
‘97.3.11 |
41 |
충북대학교 병원 |
- |
‘97.3.11 |
‘97.3.11 |
||||||||
|
2 |
가톨릭대학교 대전성모병원 |
- |
’04.4.8 |
‘97.3.11 |
42 |
한국원자력연구소 원자력병원 |
- |
‘97.3.11 |
‘97.3.11 |
||||||||
|
3 |
가톨릭대학교 부천성모병원 |
- |
’05.3.28 |
‘97.3.11 |
43 |
한전의료재단 한전병원 |
- |
- |
‘97.3.11 |
||||||||
|
4 |
가톨릭대학교 여의도성모병원 |
‘97.3.11 |
‘97.3.11 |
‘97.3.11 |
44 |
한림대학교 부속 강남성심병원 |
- |
‘97.3.11 |
‘97.3.11 |
||||||||
|
5 |
가톨릭대학교 인천성모병원 |
- |
‘97.3.11 |
‘97.3.11 |
45 |
한림대학교 부속 춘천성심병원 |
- |
‘97.3.11 |
‘97.3.11 |
||||||||
|
6 |
가톨릭대학교 은평성모병원 |
- |
’04.2.9 |
‘97.3.11 |
46 |
한림대학교 한강성심병원 |
- |
‘97.3.11 |
‘97.3.11 |
||||||||
|
7 |
가톨릭대학교 의정부성모병원 |
’05.10.27 |
’05.1.13 |
‘97.3.11 |
47 |
한양대학교 구리병원 |
- |
- |
‘97.3.11 |
||||||||
|
8 |
한림대학교 강동성심병원 |
- |
‘97.3.11 |
‘97.3.11 |
48 |
한양대학교 병원 |
’05.12.13 |
‘97.4.29 |
‘97.3.11 |
||||||||
|
9 |
경북대학교 병원 |
’05.12.19 |
‘97.3.11 |
‘97.3.11 |
49 |
원광대학교 부속 치과병원 |
- |
- |
‘97.6.11 |
||||||||
|
10 |
경희대학교 병원 |
- |
‘97.3.11 |
‘97.3.11 |
50 |
가톨릭대학교 성빈센트병원 |
- |
’00.1.25 |
‘97.6.11 |
||||||||
|
11 |
차의과대학교 분당차병원 |
- |
‘97.3.11 |
‘97.3.11 |
51 |
서울특별시 보라매병원 |
- |
- |
‘97.6.23 |
||||||||
|
12 |
계명대학교 동산병원 |
- |
‘99.6.15 |
‘97.3.11 |
52 |
인하대학교 의대 부속병원 |
‘97.8.12 |
‘97.8.12 |
‘97.8.12 |
||||||||
|
13 |
고려대학교 의대 부속 구로병원 |
- |
‘99.11.26 |
‘97.3.11 |
53 |
경희대학교 치과병원 |
- |
- |
‘97.11.7 |
||||||||
|
14 |
학교법인 고려중앙학원 고려대학교 의대 부속 병원 |
‘97.3.11 |
‘97.3.11 |
‘97.3.11 |
54 |
경희대학교 한방병원 |
- |
- |
‘97.11.7 |
||||||||
|
15 |
국립중앙의료원 |
- |
- |
‘97.3.11 |
55 |
대구가톨릭대학교 병원 |
- |
’03.7.29 |
‘98.5.28 |
||||||||
|
16 |
단국대학교 의대 부속병원 |
‘97.3.11 |
‘97.3.11 |
‘97.3.11 |
56 |
제일의료재단 제일병원 |
- |
‘98.5.28 |
‘98.5.28 |
||||||||
|
17 |
동아대학교 병원 |
’03.11.10 |
‘97.3.11 |
‘97.3.11 |
57 |
연세대학교 원주세브란스 기독병원 |
- |
’05.6.15 |
‘98.8.18 |
||||||||
|
18 |
부산대학교 병원 |
’03.11.10 |
‘97.3.11 |
‘97.3.11 |
58 |
고신대학교 복음병원 |
- |
’06.5.22 |
‘99.2.6 |
||||||||
|
19 |
삼성서울병원 |
‘97.3.11 |
‘97.3.11 |
‘97.3.11 |
59 |
한림대학교 성심병원 |
- |
’00.7.22 |
‘99.7.19 |
||||||||
|
20 |
서울대학교 병원 |
‘97.3.11 |
‘97.3.11 |
‘97.3.11 |
60 |
경상대학교 병원 |
- |
’02.9.24 |
‘99.9.13 |
||||||||
|
21 |
서울대학교 치과병원 |
‘97.3.11 |
‘97.3.11 |
‘97.3.11 |
61 |
충남대학교 병원 |
- |
‘99.9.20 |
‘99.9.20 |
||||||||
|
22 |
순천향대학교 서울병원 |
‘97.3.11 |
‘97.3.11 |
‘97.3.11 |
62 |
고려대학교 부속 안산병원 |
’06.2.21 |
’00.1.25 |
’00.1.25 |
||||||||
|
23 |
아산복지사업재단 서울아산병원 |
‘97.3.11 |
‘97.3.11 |
‘97.3.11 |
63 |
국립마산병원 |
- |
’00.10.23 |
’00.10.23 |
||||||||
|
24 |
아주대학교 병원 |
’05.2.19 |
‘97.3.11 |
‘97.3.11 |
64 |
순천향대학교 부속 부천병원 |
’01.5.22 |
’01.5.22 |
’01.5.22 |
||||||||
|
25 |
연세대학교 세브란스병원 |
‘97.3.11 |
‘97.3.11 |
‘97.3.11 |
65 |
단국대학교 치과대학 부속 치과병원 |
- |
- |
’01.7.11 |
||||||||
|
26 |
연세대학교 강남세브란스병원 |
‘97.3.11 |
‘97.3.11 |
‘97.3.11 |
66 |
국립암센터 |
’02.3.26 |
’01.7.11 |
’01.7.11 |
||||||||
|
27 |
연세대학교 치과대학 치과병원 |
‘97.3.11 |
‘97.3.11 |
‘97.3.11 |
67 |
인제대학교 일산백병원 |
- |
- |
’01.10.30 |
||||||||
|
28 |
영남대학교 병원 |
‘97.3.11 |
‘97.3.11 |
‘97.3.11 |
68 |
국민건강보험공단 일산병원 |
- |
’01.11.9 |
’01.11.9 |
||||||||
|
29 |
한국침례회의의료재단 왈레스기념침례병원 |
- |
- |
‘97.3.11 |
69 |
의료법인영훈의료재단 대전선병원 |
- |
'02.5.31 |
'02.5.31 |
||||||||
|
30 |
원광대학교 의과대학병원 |
- |
‘97.3.11 |
‘97.3.11 |
70 |
학교법인 울산공업학원 울산대학교 병원 |
’06.2.14 |
’02.9.24 |
’02.9.24 |
||||||||
|
31 |
길병원 |
‘99.12.29 |
‘99.12.29 |
‘97.3.11 |
71 |
노원을지대학교 병원 |
- |
’02.9.24 |
’02.9.24 |
||||||||
|
32 |
삼성의료재단 강북삼성병원 |
- |
‘97.3.11 |
‘97.3.11 |
72 |
파티마병원 |
- |
’02.9.24 |
’02.9.24 |
||||||||
|
33 |
이화여자대학교 부속 목동병원 |
‘97.3.11 |
‘97.3.11 |
‘97.3.11 |
73 |
동국대학교 경주병원 |
- |
’03.3.31 |
’03.3.31 |
||||||||
|
34 |
인제대학교 부속 부산백병원 |
‘97.3.11 |
‘97.3.11 |
‘97.3.11 |
74 |
조선대학교병원 |
- |
’03.7.29 |
’03.7.29 |
||||||||
|
35 |
인제대학교 상계백병원 |
- |
‘97.3.11 |
‘97.3.11 |
75 |
원광대학교 광주한방병원 |
- |
’03.9.25 |
’03.9.25 |
||||||||
|
36 |
인제대학교 서울백병원 |
- |
’06.10.22 |
‘97.3.11 |
76 |
분당서울대학교 병원 |
- |
’03.9.25 |
’03.9.25 |
||||||||
|
37 |
전남대학교 병원 |
’04.10.4 |
‘97.3.11 |
‘97.3.11 |
77 |
순천향대학교 부속 천안병원 |
’04.2.9 |
’04.2.9 |
’04.2.9 |
||||||||
|
38 |
전북대학교 병원 |
’06.4.10 |
‘97.3.11 |
‘97.3.11 |
78 |
국립서울병원 |
- |
- |
’04.2.9 |
||||||||
|
39 |
중앙대학교 병원 |
- |
’05.4.15 |
‘97.3.11 |
79 |
학교법인을지학원 대전을지대학교 병원 |
- |
’04.4.8 |
’04.4.8 |
||||||||
|
40 |
서울특별시 서울의료원 |
- |
- |
‘97.3.11 |
80 |
보훈복지의료공단 중앙보훈병원 |
- |
’05.6.15 |
’04.4.8 |
||||||||
(계속)
(이어서)
|
지정번호 |
기관명 |
지정 일자 |
지정번호 |
기관명 |
지정일자저 |
||||||||
|
임상1상 |
임상2상 |
임상3상 |
임상1상 |
임상2상 |
임상3상 |
||||||||
|
81 |
제주대학교 병원 |
- |
’04.5.13 |
’04.5.13 |
120 |
광주보훈병원 |
- |
’09.1.9 |
’09.1.9 |
||||
|
82 |
동의대학교 부속한방병원 |
- |
’04.6.3 |
’04.6.3 |
|||||||||
|
121 |
용인정신병원 |
- |
’09.3.6 |
’09.3.6 |
|||||||||
|
83 |
건국대학교 충주병원 |
- |
- |
’04.6.12 |
|||||||||
|
122 |
동국대학교 한의대 분당한방병원 |
- |
’09.6.3 |
’09.6.3 |
|||||||||
|
84 |
화순 전남대학교 병원 |
- |
’04.11.11 |
’04.6.12 |
|||||||||
|
123 |
국립공주병원 |
- |
’09.7.9 |
’09.7.9 |
|||||||||
|
85 |
천주교부산교구유지재단 메리놀병원 |
- |
- |
’04.6.18 |
|||||||||
|
124 |
대전대학교 둔산한방병원 |
- |
’09.7.22 |
’09.7.22 |
|||||||||
|
86 |
청주성모병원 |
- |
’06.5.19 |
’04.9.6 |
|||||||||
|
125 |
한국보훈복지의료공단 대구보훈병원 |
- |
’09.7.24 |
’09.7.24 |
|||||||||
|
87 |
대동병원 |
- |
- |
’04.10.12 |
|||||||||
|
126 |
대항병원 |
- |
’09.7.30 |
’09.7.30 |
|||||||||
|
88 |
제주한라병원 |
- |
’04.11.5 |
’04.11.5 |
|||||||||
|
127 |
의료법인 동강의료재단 동강병원 |
- |
’09.8.19 |
’09.8.19 |
|||||||||
|
89 |
건국대학교 병원 |
- |
’06.3.17 |
’04.11.26 |
|||||||||
|
128 |
서울특별시 은평병원 |
- |
’09.11.9 |
’09.11.9 |
|||||||||
|
90 |
건양대학교 병원 |
- |
’04.12.1 |
’04.12.1 |
|||||||||
|
129 |
한국보훈복지의료공단 부산보훈병원 |
- |
’09.12.15 |
’09.12.15 |
|||||||||
|
91 |
차의과대학교 강남 차병원 |
- |
’05.1.13 |
’05.1.13 |
|||||||||
|
130 |
대전대학교 부속 천안한방병원 |
- |
’10.3.23 |
’10.3.23 |
|||||||||
|
92 |
명지의료재단 명지병원 |
- |
’05.1.19 |
’05.1.19 |
|||||||||
|
131 |
차의과대학교 부속 구미차병원 |
- |
’10.3.31 |
’10.3.31 |
|||||||||
|
93 |
강원대학교 병원 |
- |
’05.1.20 |
’05.1.20 |
|||||||||
|
132 |
서울송도병원 |
- |
’10.5.28 |
’10.5.28 |
|||||||||
|
94 |
대구포교성베네딕도수녀회 창원파티마병원 |
- |
- |
’05.5.7 |
|||||||||
|
133 |
의료법인혜원의료재단 세종병원 |
- |
’10.5.31 |
’10.5.31 |
|||||||||
|
95 |
강릉아산병원 |
- |
- |
'05.8.11 |
|||||||||
|
134 |
인제대학교 해운대백병원 |
- |
’10.6.14 |
’10.6.14 |
|||||||||
|
96 |
가천대학교부속 길한방병원 |
- |
- |
’05.8.29 |
|||||||||
|
135 |
동남권원자력의학원 |
- |
’11.3.8 |
’11.3.8 |
|||||||||
|
97 |
동국대학교 일산불교병원 |
’05.9.14 |
’05.9.14. |
’05.9.14. |
|||||||||
|
136 |
칠곡경북대학교병원 |
- |
’11.4.4 |
’11.4.4 |
|||||||||
|
98 |
효산의료재단 안양샘병원 |
- |
- |
’05.10.24 |
|||||||||
|
137 |
예수병원유지재단 예수병원 |
- |
’11.4.29 |
’11.4.29 |
|||||||||
|
99 |
대진의료재단 분당제생병원 |
’05.11.04 |
’05.11.4. |
’05.11.4. |
|||||||||
|
138 |
부산대학교 한방병원 |
- |
’11.5.24 |
’11.5.24 |
|||||||||
|
100 |
성균관대학교 삼성창원병원 |
- |
- |
’06.5.23. |
|||||||||
|
139 |
성가롤로병원 |
- |
’11.7.6 |
’11.7.6 |
|||||||||
|
101 |
상지대학교 부속 한방병원 |
- |
- |
’06.6.2. |
|||||||||
|
140 |
삼육서울병원 |
’11.7.28 |
|||||||||||
|
102 |
광주기독병원 |
- |
’06.6.5 |
’06.6.5 |
|||||||||
|
141 |
동은학원 순천향대학병원 부속 구미병원 |
’11.8.18 |
|||||||||||
|
103 |
강동경희대학교의대 병원 |
’06.8.17 |
’06.8.17 |
’06.8.17 |
|||||||||
|
142 |
예성이료재단 베데스다병원 |
’12.1.10 |
|||||||||||
|
104 |
천주교부산교구유지재단 부산성모병원 |
- |
’06.12.26 |
’06.12.26 |
|||||||||
|
143 |
원광대학교 한방병원 |
’12.1.11 |
|||||||||||
|
105 |
경희대학교 강동한방병원 |
- |
’07.2.9 |
’07.2.9 |
|||||||||
|
144 |
국립경찰병원 |
’12.1.26 |
|||||||||||
|
106 |
동국대학교 일산불교 한방병원 |
- |
’07.2.9 |
’07.2.9 |
|||||||||
|
145 |
미즈메디병원 |
’12.3.19 |
|||||||||||
|
107 |
국립부곡병원 |
- |
’07.8.23 |
’07.8.23 |
|||||||||
|
146 |
인산의료재단 메트로병원 |
’12.5.30 |
|||||||||||
|
108 |
정화의료재단 김원묵기념 봉생병원 |
- |
’07.10.29 |
’07.10.29 |
|||||||||
|
147 |
연세대학교 용인세브란스병원 |
’12.5.30 |
|||||||||||
|
109 |
국립나주병원 |
- |
’07.12.4 |
’07.12.4 |
|||||||||
|
148 |
연세사랑병원 |
’12.8.6 |
|||||||||||
|
110 |
자생한방병원 |
- |
’08.2.27 |
’08.2.27 |
|||||||||
|
149 |
성애병원 |
’12.9.10 |
|||||||||||
|
111 |
대구한의대학교 대구한방병원 |
- |
’08.3.28 |
’08.3.28 |
|||||||||
|
150 |
모커리한방병원 |
’12.12.3 |
|||||||||||
|
112 |
대원교육재단 세명대학교 부속 한방병원 |
- |
’08.3.28 |
’08.3.28 |
|||||||||
|
151 |
에이치플러스 양지병원 |
’13.2.4 |
|||||||||||
|
113 |
세명대학교 충주한방병원 |
- |
’08.5.20 |
’08.5.20 |
|||||||||
|
152 |
한림대학교 동탐성심병원 |
’13.2.4 |
|||||||||||
|
114 |
동신대학교 광주한방병원 |
- |
’08.7.3 |
’08.7.3 |
|||||||||
|
153 |
비에이치에스한서병원 |
’13.4.2 |
|||||||||||
|
115 |
김안과병원 |
- |
’08.7.30 |
’08.7.30 |
|||||||||
|
154 |
씨엠병원 |
’13.5.8 |
|||||||||||
|
116 |
베스티안재단 베스티안서울병원 |
- |
’08.8.7 |
’08.8.7 |
|||||||||
|
155 |
제일안과병원 |
’13.7.10 |
|||||||||||
|
117 |
누네안과병원 |
- |
’08.8.20 |
’08.8.20 |
|||||||||
|
156 |
나누리병원 |
’13.11.1 |
|||||||||||
|
118 |
우석대학교 전주부속 한방병원 |
- |
’08.12.23 |
’08.12.23 |
|||||||||
|
157 |
효산의료재단 지샘병원 |
’13.12.31 |
|||||||||||
|
119 |
양산부산대학교병원 |
- |
’08.12.24 |
’08.12.24 |
|||||||||
(계속)
(이어서)
|
지정번호 |
기관명 |
지정 일자 |
지정번호 |
기관명 |
지정일자 |
||||
|
임상1상 |
임상2상 |
임상3상 |
임상1상 |
임상2상 |
임상3상 |
||||
|
158 |
국립재활원 |
’14.1.7 |
184 |
의료법인 우리의료재단 김포우리병원 |
’17.12.14 |
||||
|
159 |
부산대학교 치과병원 |
’14.3.3 |
185 |
인천세종병원 |
’18.5.17 |
||||
|
160 |
원광대학교 한의과대학부속 전주한방병원 |
’14.3.20 |
186 |
의료법인 루가의료재단 나은병원 |
’18.12.6 |
||||
|
161 |
의료법인녹산의료재단 동수원병원 |
’14.3.21 |
187 |
베스티안병원 |
’19.1.3 |
||||
|
162 |
한길의료재단 한길안과병원 |
’14.4.9 |
188 |
이화여자대학교 의과대학부속 서울병원 |
’19.3.11 |
||||
|
163 |
학교법인 동의병원 |
’14.5.27 |
189 |
의료법인 정선의료재단 온종합병원 |
’19.4.29 |
||||
|
164 |
가톨릭관동대학교 국제성모병원 |
’14.6.9 |
190 |
서울재활병원 |
’19.9.20 |
||||
|
165 |
동신대학교부속 목포한방병원 |
’14.6.19 |
191 |
의료법인한성재단 포항 세명기독병원 |
’19.10.7 |
||||
|
166 |
의료법인 실로암안과병원 |
’14.6.24 |
192 |
의료법인석경의료재단 센트럴병원 |
’19.12.4 |
||||
|
167 |
의료법인 광명성애병원 |
’14.7.24 |
193 |
부평세림병원 |
‘20.1.10 |
||||
|
168 |
의료법인인당의료재단 부민병원 |
’14.12.12 |
194 |
의료법인은성의료재단 좋은강안병원 |
‘20.2.14 |
||||
|
169 |
의료법인세광의료재단 성모안과병원 |
’15.3.27 |
195 |
현대병원 |
‘20.2.27 |
||||
|
170 |
부민병원(서울) |
’15.5.22 |
196 |
세종 충남대학교병원 |
‘20.8.10 |
||||
|
171 |
대구 누네안과병원 |
’15.9.11 |
197 |
성광의료재단 일산차병원 |
‘20.9.4 |
||||
|
172 |
세경의료재단 새빛안과병원 |
’16.3.16 |
198 |
에스포항병원 |
‘20.12.21 |
||||
|
173 |
창원 경상국립대학교병원 |
’16.7.1 |
199 |
계명대학교 대구동산병원 |
‘20.12.23 |
||||
|
174 |
대전자생한방병원 |
’16.7.4 |
200 |
빛고을전남대학교병원 |
‘21.4.8 |
||||
|
175 |
해운대자생한방병원 |
’16.6.17 |
201 |
영훈의료재단 유성선병원 |
‘21.8.17 |
||||
|
176 |
부천자생한방병원 |
’16.7.4 |
202 |
성남시의료원 |
‘21.8.24 |
||||
|
177 |
밝은안과21병원 |
’16.6.27 |
203 |
을지학원 의정부을지대학교병원 |
‘21.8.26 |
||||
|
178 |
원광대학교 산본병원 |
’16.7.26 |
204 |
나주 동신대학교한방병원 |
‘21.11.3 |
||||
|
179 |
대전보훈병원 |
’16.11.09 |
205 |
남양주 한양병원 |
‘21.12.16 |
||||
|
180 |
의료법인 안동병원 |
’16.12.26 |
206 |
국립교통재활병원 |
‘22.5.10 |
||||
|
181 |
인천광역시의료원 |
’17.8.10 |
207 |
중앙대학교 광명병원 |
‘22.6.2 |
||||
|
182 |
의료법인인당의료재단해운대부민병원 |
’17.11.15 |
208 |
경상북도 김천의료원 |
‘22.11.15 |
||||
|
183 |
분당제일여성병원 |
’17.12.1 |
208개 |
||||||
출처: 식약처 임상정책과(∼2023년 2월) 자료를 토대로 필자 작성함
[표 3-75] 국내 대표적인 2개 비임상 CRO 회사 현황(2021년 말 기준)
|
업 체 명 |
㈜바이오톡스텍 |
최근 5년간 기업현황(단위: 천원,명) |
|||||||||||
|
구분 |
2017년 |
2018년 |
2019년 |
2020년 |
2021년 |
||||||||
|
총자산 |
59,770,502 |
63,135,803 |
60,175,524 |
63,654,913 |
90,740,895 |
||||||||
|
설 립 년 월 일 |
2000년 08월 23일 |
총자본 |
31,240,721 |
35,749,343 |
31,195,005 |
34,281,583 |
41,849,361 |
||||||
|
사업자등록번호 |
301-81-45781 |
총부채 |
28,529,781 |
27,386,460 |
28,980,519 |
29,373,330 |
48,891,533 |
||||||
|
법 인 등록번호 |
150111-0048707 |
매출액 |
25,564,709 |
32,582,096 |
25,853,847 |
26,428,630 |
34,086,706 |
||||||
|
대 표 자 성 명 |
강종구 |
총인원 |
198명 |
196명 |
181명 |
195명 |
243명 |
||||||
|
주소 |
본 사 |
충북 청원군 오창읍 양청리 686-2 |
연락처 |
전화/팩스 |
043-210-7777 / 043-210-7778 |
||||||||
|
홈페이지 |
www.biotoxtech.com |
||||||||||||
|
주요생산품 (2021년말 기준) |
산업분류 코드 |
시장규모(억원, 억불) |
시장점유율(%) |
매출액(억원) |
|||||||||
|
국내 |
국외1) |
국내 |
국외 |
국내 |
국외 |
||||||||
|
비임상시험 |
M70113 (의학및약학연구 개발업) |
1,633(추정) (국내 주요 비임상업체 매출 합산값) |
167.4 |
24.6 |
- |
308 |
14 |
||||||
|
비임상시험 과제수(2021년말 기준) |
주요 조직 |
네트워크 기관 |
|||||||||||
|
2,802건(국내 2,377건, 해외 425건) 수주총액 653억원 |
연구소(R&D컨설팅, 약효약리팀), 시험본부(QAxla, 시험관리팀, 독성1팀, 독성2팀, 병리팀, 조제팀), 영업본부(영업팀, 마케팅팀), 관리본부(경영관리팀), 공무팀 |
국내(한국과학기술연구원, 표준과학연구원, 한국생명공학연구원 등), 해외(일본 PPRC 등, 중국 Beijing Northland Biotech 등 |
|||||||||||
|
업 체 명 |
㈜켐온 |
최근 5년간 기업현황(단위: 천원,명) |
|||||||||||
|
구분 |
2017년 |
2018년 |
2019년 |
2020년 |
2021년 |
||||||||
|
총자산 |
39,462,658,319 |
42,473,048,581 |
44,622,023 |
72,680,984 |
80,322,140 |
||||||||
|
설 립 년 월 일 |
2000년 01월 11일 |
총자본 |
33,144,143,067 |
34,051,912,726 |
37,121,560 |
54,677,570 |
58,952,296 |
||||||
|
사업자등록번호 |
333-86-00035 |
총부채 |
6,318,515,252 |
8,421,135,855 |
7,500,463 |
18,003,414 |
21,369,843 |
||||||
|
법 인 등록번호 |
110111-567884 |
매출액 |
15,549,165,712 |
19,450,820,403 |
20,914,334 |
24,767,180 |
29,139,837 |
||||||
|
대 표 자 성 명 |
송시환 |
총인원 |
177명 |
203명 |
199명 |
213명 |
240명 |
||||||
|
주소 |
본 사 |
경기도 용인시 처인구 양지면 남평로 240 |
연락처 |
전화/팩스 |
031-329-9900/031-888-6640 |
||||||||
|
홈페이지 |
www.chemon.co.kr |
||||||||||||
|
주요생산품 (2021년말 기준) |
산업분류 코드 |
시장규모(억원, 억불) |
시장점유율(%) |
매출액(억원) |
|||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
||||||||
|
비임상시험 |
M70113 (의학및약학연구 개발업) |
1,633(추정) (국내 주요 비임상업체 매출 합산값) |
167.4 |
21.9 |
- |
291 |
- |
||||||
|
비임상시험 과제수(2021년말 기준) |
주요 조직 |
네트워크 기관 |
|||||||||||
|
수주총액 547억원 |
경영지원본부, 사업개발본부, 비임상연구소(안정성평가센터, 독성병리센터, 연구지원센터, 시험물질평가센터, 효능평가센터, 춘천바이오센터) |
제약회사, 바이오벤처, 삼성서울병원, 한국생명공학연구원 등 |
|||||||||||
[표 3-76] 국내 대표적인 3개 임상 CRO 회사 현황(2021년 말 기준)
|
업 체 명 |
㈜드림씨아이에스 |
최근 5년간 기업현황(단위: 천원,명) |
||||||||||||
|
구분 |
2017년 |
2018년 |
2019년 |
2020년 |
2021년 |
|||||||||
|
총자산 |
13,542,500 |
17,685,996 |
25,020,549 |
48,593,025 |
56,705,488 |
|||||||||
|
설 립 년 월 일 |
2000년 04월 27일 |
총자본 |
2,820,854 |
6,505,192 |
10,748,777 |
36,460,149 |
37,979,896 |
|||||||
|
사업자등록번호 |
101-81-57329 |
총부채 |
10,721,646 |
11,180,804 |
14,271,771 |
12,132,876 |
18,725,591 |
|||||||
|
법 인 등록번호 |
110111-1953953 |
매출액 |
15,957,711 |
19,199,521 |
22,108,907 |
23,489,321 |
26,153,499 |
|||||||
|
대 표 자 성 명 |
지아리우 |
총인원 |
181명 |
181명 |
203명 |
206명 |
246명 |
|||||||
|
주소 |
본 사 |
서울 종로 적선 80 적선현대빌딩 1010호 |
연락처 |
전화/팩스 |
02-2010-4504 / 02-720-5385 |
|||||||||
|
홈페이지 |
http://www.dreamcis.com |
|||||||||||||
|
주요생산품 (2021년말 기준) |
산업분류 코드 |
시장규모(억원, 억불) |
시장점유율(%) |
매출액(억원) |
||||||||||
|
국내2) |
국외 |
국내 |
국외 |
국내 |
국외 |
|||||||||
|
임상시험대행업 |
M70113 (의학및약학연구 개발업) |
5,542 (2020년 기준) |
426.5 |
4.2% (2020년 기준) |
- |
232 |
29 |
|||||||
|
임상시험 과제수(2021년말 기준) |
주요 조직 |
네트워크 기관 |
||||||||||||
|
수주총액 388억원 |
품질유닛, 사업개발유닛, R&D유닛, 임상시험유닛, 후기임상연구유닛, 바이오메트릭스유닛, IT유닛 |
지역임상시험센터 및 다수 해외CRO |
||||||||||||
|
업 체 명 |
㈜씨엔알리서치 |
최근 5년간 기업현황(단위: 천원,명) |
||||||||||||
|
구분 |
2017년 |
2018년 |
2019년 |
2020년 |
2021년 |
|||||||||
|
총자산 |
28,456,219 |
35,048,749 |
39,274,034 |
43,941,813 |
71,271,780 |
|||||||||
|
설 립 년 월 일 |
2020년 6월 |
총자본 |
(654,142) |
4,754,517 |
(3,083,990) |
(138,184) |
30,470,710 |
|||||||
|
사업자등록번호 |
829-87-01755 |
총부채 |
29,110,361 |
30,294,231 |
42,358,024 |
44,079,997 |
40,801,070 |
|||||||
|
법 인 등록번호 |
110111-7525110 |
매출액 |
25,460,911 |
24,599,944 |
27,203,441 |
34,123,503 |
43,171,233 |
|||||||
|
대 표 자 성 명 |
윤 문 태 |
총인원 |
253명 |
253명 |
304명 |
304명 |
417명 |
|||||||
|
주소 |
본 사 |
서울 강남구 역삼로 412 대치 씨엔알빌딩 |
연락처 |
전화/팩스 |
02-6251-1500 / 02-6251-1504 |
|||||||||
|
홈페이지 |
http://www.cnrres.co.kr, http://www.cnracademy.org |
|||||||||||||
|
주요생산품 (2021년말 기준) |
산업분류 코드 |
시장규모(억원, 억불) |
시장점유율(%) |
매출액(억원) |
||||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
|||||||||
|
임상시험대행업 |
M70113 (의학 및 약학 연구개발업) |
5,542 (2020년 기준) |
426.5 |
6.1% (2020년 기준) |
- |
431 |
- |
|||||||
|
임상시험 과제수(2021년말 기준) |
주요 조직 |
네트워크 기관 |
||||||||||||
|
수주총액 1,999억원 |
Clinical Operation(PM, CR1, CR2, CR3, Oncology), Business development(Local, Global, Marketing, Sales Management), Regulatory Affairs(IND/IRB, Consulting), Medical(Biostatistics, Medical writing), Data management(IT), Training & Operatipon Practice, Management Support |
국내: 녹십자의료재단, 안전성평가연구소, 메디팁, CRScube, 병원(충북대, 중앙대, 인제대, 고려대구로, 경북대, 서울대) 등 해외: 일본 ACM, 대만 VCRO, 중국 RUNDO사 |
||||||||||||
|
업 체 명 |
㈜엘에스케이글로벌파마서비스 |
최근 5년간 기업현황(단위: 천원,명) |
|||||||||||
|
구분 |
2017년 |
2018년 |
2019년 |
2020년 |
2021년 |
||||||||
|
총자산 |
13,765,228 |
15,927,458 |
15,774,876 |
15,162,898 |
18,229,044 |
||||||||
|
설 립 년 월 일 |
2001년 10월 01일 |
총자본 |
(3,223,719) |
(3,551,837) |
(5,041,925) |
(3,558,924) |
(1,193,781) |
||||||
|
사업자등록번호 |
211-87-01667 |
총부채 |
16,988,947 |
19,479,295 |
20,816,801 |
18,721,823 |
19,422,826 |
||||||
|
법 인 등록번호 |
110111-2340646 |
매출액 |
21,390,769 |
25,098,530 |
26,822,660 |
29,858,807 |
35,533,355 |
||||||
|
대 표 자 성 명 |
이영작 |
총인원 |
310명 |
310명 |
318명 |
318명 |
310명 |
||||||
|
주소 |
본 사 |
서울시 중구 퇴계로 97 고려대연각타워 16층 |
연락처 |
전화/팩스 |
Tel. 02-546-1008 / Fax. 02-584-9008 |
||||||||
|
홈페이지 |
www.lskglobal.co.kr |
||||||||||||
|
주요생산품 (2021년말 기준) |
산업분류 코드 |
시장규모(억원, 억불) |
시장점유율(%) |
매출액(억원) |
|||||||||
|
국내 |
국외 |
국내 |
국외 |
국내 |
국외 |
||||||||
|
임상시험대행업 |
M70113 (의학 및 약학 연구개발업) |
5,542 (2020년 기준) |
426.5 |
5.4% (2020년 기준) |
- |
355 |
- |
||||||
|
임상시험 과제수(2021년말 기준) |
주요 조직 |
네트워크 기관 |
|||||||||||
|
총 887개 프로젝트(해외 110개) |
QM, Training, Corporate Communications, BD, SC, CM, MW&RES, CTM HQs, CDM HQs, PV, STAT/ER, F&A, 경영지원부 |
PRA International, MDS, Pharma Service, Covance, INC Research, Julius Clinica, Research, Cato Research, StatPlus, SLG, MPI, Target, Health, Medidata, LSK, Biopartners, George Clinical, Veras Research Japan, Semler, Research Center Pvt Ltd, Veras Research Sdn Bhd |
|||||||||||
출처: 기업 자료, 금감원 전자공시시스템 등 토대로 필자 작성함


|
|
|
|
|
주요 내용 요약 |
|
제4장 생명공학 관련 법제도 현황 |
|
|
|
구분 |
바이오안정성 |
생명윤리 |
|
개 요 |
국제사회에서는 카르타헤나 의정서를 중심으로, 우리나라는 유전자변형생물체법을 통해 유전자변형생물체 안전관리 및 바이오안전성 확보를 위해 노력하고 있음 |
유전자치료 연구에 관한 생명윤리의 지속적 관심. 생명윤리 중심의 과학기술 젠더혁신 태동 |
|
해외 동향 |
카르타헤나 의정서 주요 논의 및 유럽연합, 미국, 캐나다, 일본, 중국 등 주요국 바이오안전성 법・제도 동향 |
(유전자치료 연구) 미국은 NIH의 RAC자문위원회 운영하며 유전자치료 연구 안전성 확보를 구체적으로 판단 (젠더혁신) NIH은 2014년 척추동물과 인간에 대한 연구에서 성별을 중요한 생물학적 변수로 고려하는 정책 발표 |
|
국내 현황 |
유전자변형생물체법을 중심으로 한 법・제도 시행 현황 및 유전자가위기술 산물 안전관리 제도 개선 동향 |
(유전자치료 연구) 유전자치료에 관한 연구 허용 기준 완화 및 생명윤리 확보를 위한 생명윤리법 일부 개정 (젠더혁신) 과학기술기본법 및 연구성과평가법 일부 개정 |
|
발전 과제 |
유전자변형생물체 안전관리 최근 주요 이슈 및 우리나라 안전관리 체계・제도 개선 추진 전망 |
(유전자치료 연구) 유전자치료 연구의 허용기준을 완화하면서 심의 절차의 강화를 통해 연구의 안전성을 확보하려는 방향은 상당히 타당한 흐름이나 지속적인 관심 필요 (젠더혁신) 성별 등의 특성에 기초하여 여성 및 남성에 대한 연구개발 결과의 수용성을 더욱 높일 수 있는 생명윤리적 관점 접근 필요 |
|
|
|
|
|
|
|
|
|
|
|
지식재산권 |
제품 인허가 |
|
효율적인 정책적 지원을 바탕으로 하는 지식재산 확보전략과 회피전략으로 강한 특허를 창출하고 특허분쟁에 대응하는 것이 무엇보다 중요 |
코로나 시대에 첨단 바이오기술을 활용한 백신, 치료제, 진단시약 필요에 따른 허가체계 변화 및 포스트코로나를 대비한 인공지능 기반 의료기기 개발 등 발전 과제를 조명함 |
|
생명공학 분야의 특허출원은 살아있는 생명체를 대상으로 하므로 특수한 절차나 윤리적인 측면도 함께 고려해야 할 필요성이 있는 등의 특수성이 있어 특허 심사에 있어서 별도의 기술 분야별 심사기준이 제정되어 운용되고 있음 인간 유전자나 생물체 자체 등의 특허 대상 여부, 발명의 성립성 또는 산업상 이용 가능성에 대해 국가별로 독자적인 기준을 마련하여 판단하고 있음 합성생물학 분야의 특허분쟁 사례로 유전자가위 특허분쟁 및 NGS 분야 일루미나-BGI 특허분쟁 사례를 소개
|
코로나19 백신 및 치료제, 희귀의약품 허가 급증 |
|
코로나 진단시약의 국내 및 수출용 허가 급증. 인공지능 기반 의료기기 개발 강세 |
|
|
|
|
구분 |
기업 현황 및 지원 제도 |
|
개 요 |
해외 상장 바이오기업과 국내 바이오기업의 현황과 동향을 분석하고, 국내 기업을 글로벌기업으로 성장시키기 위한 각종 지원제도를 설명 |
|
해외 동향 |
글로벌 경기 하락 및 투자 침체로 코로나19로 시가총액이 크게 상승했던 의약품 및 의료기기 기업들의 가치가 하락하고 있으며 특히 의료기기 및 디지털헬스 분야 기업들이 더 큰 영향을 받고 있음 |
|
국내 현황 |
국내 바이오기업은 생산 및 수출 면에서 계속 증가하고 있으며, 우리 정부는 창업, 제품화, 규제개선, 수출 및 인증 지원 등을 통해 기업 성장을 적극 지원하고 있음 |
|
발전 과제 |
|
|
|
|
제4장 생명공학 관련 법제도 현황 |
|
제1절 바이오분야 육성을 위한 법제도 개선 노력 |
1. 들어가며
생명공학육성법이 1983년에 ‘유전공학육성법’으로 최초 제정된 이후 40년이 지났다. 법 제정을 통해 생명공학 육성정책 수립과 정부 연구개발의 확대, 산업적 응용촉진 등 생명공학 연구개발 역량 강화와 생태계 활성화 등 우리나라 바이오 분야의 육성과 진흥에 기여하였다. 2021년 기준으로, 국가연구개발사업 중 바이오 예산은 4조 7,000억 원으로 IT 분야(4조 9,000억 원)에 이어 두 번째로 높은 비중을 차지하고 있으며, 최선도국(미국)과의 기술 격차도 꾸준히 감소하고 있다. 2018년과 대비하여 2%p(75.5% →77.6%) 증가하였다. 또한 국내 바이오산업은 코로나19 팬데믹을 겪으면서 그 잠재성을 인정받고 성장한 것은 사실이다. 국내 진단키트(기술)가 전 세계로부터 환영받아 106개국에 수출되기도 하고, 삼성바이오로직스 등 국내 의약품 위탁생산이 주요 거점과 허브가 되어 국내 기업이 이 분야에서 대세가 되는 등 주목 받기도 하였다.
그렇다고 국내 바이오산업 생태계가 글로벌 수준이 되었다고 판단하기는 어렵다. 국내 바이오산업의 규모(생산)는 48조 원으로 양적 성장은 이루었으나 글로벌 시장 대비 1.9%에 지나지 않는다. 또한 AI(인공지능), 빅데이터 등 4차 산업혁명이 본격 진행되면서 디지털화 등 바이오를 둘러싼 패러다임 변화가 이루어지고 있다. 기술혁신과 경제발전은 반짝이는 아이디어와 이들의 축적에서 출발한다. 패러다임이 변화하는 상황 속에서 선도국으로 도약하기 위해서는 기술혁신과 더불어 여러 이해관계자가 포함된 사회시스템의 변화도 동반되어야 한다. 즉, 기술과 제도의 공진화(Co-evolution)가 필요하며 절실하다. 기술혁신이 법・제도적 변화를 가져오고, 다시 법・제도가 기술발전을 촉진하는 선순환이 이루어져야 한다. 좋은 제도의 지원으로 인적자본과 혁신역량은 생산성 증가, 자본 축적, 경제성장으로 연결된다. 이러한 관점에서 바이오를 둘러싼 최신 트렌드가 무엇이며, 국내 관련 법령 현황과 진단, 그리고 개선방향에 대해 살펴보고자 한다.
2. 바이오 패러다임 변화
바이오와 디지털 간 융합이 가속화되는 등 바이오 대전환기가 도래하고 있다. 기술 발전과 유전정보 등 데이터의 급속한 증가로 인해 생명공학 연구에 디지털 기술 접목은 이제 자연스러운 연구 방향이며 이를 통해 혁신적인 연구성과가 창출된다. 인공지능을 활용하여 신약후보물질 발굴시간은 300배 이상 단축되기도 하고, 단백질 접힘문제(protein folding problem)도 해결하는가 하면, 인공지능 기반 유전자가위 활성 예측으로 제작비용까지 단축할 수 있다. 이를 통해 바이오의 한계(복잡성 → 낮은 재현성, 극도의 다양성 → 예측효율 저하, 실험방법 복잡성 → 표준화 어려움)까지 극복할 수 있어 보인다.
전례 없는 감염병 대유행을 겪으면서 정부의 역할 변화와 바이오기술의 사회적 역할이 강조되고 있다. 미국은 자국 내 바이오 연구 및 생산역량을 강화하고, 자국 내 바이오제조 역량 강화, 인력양성 등을 위한 행정명령을 발동(2022.9.)하는 등 주요국들은 바이오를 통해 사회문제를 해결하고, 자국 내 바이오 공급망을 확보하는 등 기술 주권 확립을 위한 최선의 지원을 하고 있다. 더욱이 합성생물학, 뇌・기계 인터페이스 등 핵심신흥기술(Critical and Emerging Technology)을 선정하여 해당 기술에 대한 수출 통제・제한을 가하는 등 기술 블록화가 진행되고 있다.
최근에 우리나라도 개발도상국에서 선진국 그룹으로 그 위치가 변경되었다.1) 이제 과학기술에서도 ‘추격자(fast follower)’를 벗어나 ‘선도자(first mover)’로 도약할 수 있는 준비가 필요하다. 산・학・연・병 등 혁신 주체의 혁신 활동을 위해서는 제도적 뒷받침이 중요하다. 제도로부터 혁신 방향이 제시되고 이를 통해 기술적 학습이 일어나 기술변화를 가져오고 반대로, 혁신 및 기술로부터 변화를 인지하고 이를 통한 제도적 학습이 제도의 구성을 변화시키는 등의 상호작용을 한다. 이러한 측면에서 국내에는 바이오와 관련된 법령들이 어떤 것이 있고 그 한계는 무엇인지 짚어보기로 한다.
3. 바이오 관련 법령 및 주요내용
가. 바이오 법령 주요내용
제4차 생명공학육성기본계획에서 제시되어 있는 법률들은 총 41개이다. 과기정통부에서는 생명공학육성법, 생명연구자원의 확보・관리 및 활용에 관한 법률을 중심으로 5개의 법률이 있다. 농식품부는 농림식품과학기술육성법, 식품산업진흥법을 중심으로 6개의 법률이 존재하고, 산업부는 유전자변형생물체의 국가 간 이동 등에 관한 법률을 중심으로 5개의 법률이 있다. 복지부는 보건의료기술진흥법, 생명윤리 및 안전에 관한 법률 등을 중심으로 6개 법률, 환경부에서는 생물다양성 보전 및 이용에 관한 법률, 유전자원의 접근・이용 및 이익 공유에 관한 법률 등을 중심으로 5개 법률이 있다. 해수부는 해양수산과학기술육성법 등 5개 법률, 식약처는 약사법, 의료기기법 등 6개 법률, 질병청은 병원체자원법 등 2개 법률이 각 부처별의 업무 역할과 방향에 따라 각각 시행되고 있다.
[표 4-1] 바이오 관련 주요 법률리스트
|
부처 |
법률 |
|
과학기술정보통신부 |
생명공학육성법(1983) 기초연구진흥 및 기술개발지원에 관한 법률(1989) 뇌연구촉진법(1998) 과학기술기본법(2001) 생명연구자원의 확보・관리 및 활용에 관한 법률(2009) |
|
농림축산식품부 |
가축전염병 예방법(1961) 종자산업법(1995) 친환경농어업 육성 및 유기식품 등의 관리・지원에 관한 법률(1997)(농식품부/해수부) 농업생명자원의 보존・관리 및 이용에 관한 법률(2007) 식품산업진흥법(2007)(농식품부/해수부) 농림식품과학기술 육성법(2009) |
|
산업통상자원부 |
신에너지 및 재생에너지 개발・이용・보급 촉진법(1987) 산업기술혁신 촉진법(1994) 화학무기・생물무기의 금지와 특정 화학물질・생물작용제 등의 제조・수출입 규제 등에 관한 법률(1996) 유전자변형생물체의 국가 간 이동 등에 관한 법률(2001) 산업융합 촉진법(2011) |
|
보건복지부 |
보건의료기술 진흥법(1995) 생명윤리 및 안전에 관한 법률(2004) 첨단의료복합단지 육성에 관한 특별법(2008)(복지부/산업부/과기정통부) 제약산업 육성 및 지원에 관한 특별법(2011) 의료기기산업 육성 및 혁신의료기기 지원법(2019)(복지부/식약처) 첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률(2019)(복지부/식약처) |
|
환경부 |
환경기술 및 환경산업 지원법(1994) 생물다양성 보전 및 이용에 관한 법률(2012) 유전자원의 접근・이용 및 이익 공유에 관한 법률(2017) 해양수산발전 기본법(2002) 해양생태계의 보전 및 관리에 관한 법률(2006) |
|
해양수산부 |
수산자원관리법(2009) 수산과학기술진흥을 위한 시험연구 등에 관한 법률(2011) 수산종자산업육성법(2015) 해양수산생명자원의 확보・관리 및 이용 등에 관한 법률(2012) 해양수산과학기술 육성법(2016) |
|
식약처 |
약사법(1953) 의료기기법(2003) 인체조직안전 및 관리 등에 관한 법률(2004)(식약처/복지부) 실험동물에 관한 법률(2008) 의료기기산업 육성 및 혁신의료기기 지원법(2019) 체외진단의료기기법(2019) |
|
질병관리청 |
감염병의 예방 및 관리에 관한 법률(1954) 병원체자원법(2016) |
출처: 과학기술정보통신부, 제4차 생명공학육성 기본계획 참고
나. 법률의 주요 의미와 한계
이러한 법률은 크게 ‘육성・진흥’과 ‘규제・관리’로 구분할 수 있다. 하지만 ‘육성・진흥’에 관한 법률들을 살펴보아도 앞서 언급된 바이오 패러다임을 직접적으로 대응할 수 있는 적합한 법률은 없는 것으로 보인다. 물론 바이오 분야의 기본법 역할을 하고 있는 생명공학육성법을 통해 대응이 가능하다고 할 수 있으나, 첨단바이오라고 일컫는 바이오 생태계를 둘러싼 최신 이슈와 트렌드를 대응하기에는 턱없이 부족하다.
첨단바이오는 4가지 특징이 있다. 첫째, 그간은 연구를 통한 개발과정에서 가치가 창출되었다면, 합성생물학 등 첨단바이오에서는 연구단계에서부터 가치 창출이 가능하다(R&D → R&I). 둘째, 생산되는 데이터는 혁신과정에서의 핵심으로 선형 관계보다는 네트워크 관계를 통한 효과 발생이 주목된다(Value chain → Value net). 여기서 데이터는 가설에 대한 검증이 아니라, 새로운 방법과 지식을 얻고 결합을 통한 혁신의 엔진으로 부상하고 있다. 셋째, 생산 산물에 대한 불확실성과 이중 용도 등의 위험성이 존재한다. 그렇기 때문에 위험을 차단하는 것이 아니라 위험을 관리하는 방안이 필요하다(Risk block → Risk management). 넷째, 감염병, 기후변화 등 새로운 도전에 다학제적 접근과 새로운 지원방식이 필요하다(Industry in Science → Social Problem in Science). 그간 포트폴리오 구축 등 경제발전에 바이오기술이 집중되었다면, 앞으로는 디지털전환 촉진, 탄소중립 실현, 공급망 변화 등 경제사회 현안 및 미래 이슈에 대해서도 문제해결 관점의 접근이 필요하다.
4. 시사점
가. 법 개정 시 고려사항
법률의 제정 또는 개정은 어떤 의미를 주는 것일까. 사실 법제도는 혁신을 지배하는 원리이자 사회적으로 인정한, 이행을 위한 합의된 절차이다. 다시 말해 법률의 제정(또는 개정)은 기술혁신과 산업생태계 성장의 숨겨진 핵심 열쇠라고 할 수 있다. 그렇다면 어떠한 법률과 내용들이 바뀌어야 하는가. 법률을 직접적으로 언급하기 전에 우리가 생각해봐야 할 관점들이 있다. 법률 제・개정에 염두해야 할 키워드는 바로 ‘기술혁신’과 ‘경제안보’이다.
기술혁신 측면을 살펴보면 다음과 같다. 바이오는 과학기술이 안전과 번영을 담보하는 ‘팍스 테크니카(Pax Technica)’ 시대의 대표 분야로, 기술혁신이 곧 신산업으로 직결된다. 기술・산업 간 경계가 사라지고 과학과 기술의 융합은 바이오 혁신을 촉발시켜 경제・사회・문화 등 모든 생활영역에 영향을 미치는 바이오경제 시대가 본격적으로 이루어지고 있다. 저성장, 기후변화 대응, 감염병 및 고령화 등 인류가 당면한 난제 대응을 위해 문제해결 및 임무 지향적 융합연구에 대한 필요성이 증대된다. 다음으로는 경제안보이다. 최근 미・중 기술패권 경쟁 및 기술 블록화의 본격화에 따라 공급망, 통상, 안보 관점에서 국가전략기술로서 바이오의 중요성이 재인식되고 있다. 선진국과 공유할 첨단기술을 갖지 못한 국가는 철저히 소외될 수 있는 상황으로 기술적 우위가 국가경쟁력을 좌우한다. 무엇보다 주요국은 경제-산업-기술을 안보의 관점에서 일체화시키는 정책을 강화하고 있다. 결국 우리는 기술혁신과 국가경쟁력 제고를 위해 제도의 경쟁력 확보가 절실하며 국가 차원의 기술 입법을 위한 다방면의 입법전략 마련이 필요하다. 임무 기반의 전략목표 달성을 위한 선제적 입법전략을 제시하고, 관련 법적 근거를 확보하여 혁신 활동을 촉발하는 입법정책의 마중물이 필요하다. 무엇보다 ‘기술-산업-경제-안보’를 일체화시키는 기술주권의 기조 강화가 검토되어야 한다. 과학기술의 입법 영역의 변화도 조금씩 변화하고 있다. 사회경제 발전에 초점을 두었다면 이제는 사회문제 해결, 좀 더 나아가서 국가안보까지 그 영역이 확장되고 있다.

출처: 국가생명공학정책연구센터
[그림 4-1] 바이오기술의 역할 확대 방안
나. 주요 법률 개정 방향 및 시사점
이제부터는 법률을 좀 더 개별적으로 접근하여 이슈를 제안한다. 앞서 언급된 바이오 관련 법률 대부분은 지금의 현안과 대응, 관리적 측면 중심으로 시행되고 있다. 물론 제도가 제・개정이 되기에는 많은 시간과 노력이 필요하기에 미래를 예측하고 대응하기에는 어려운 점이 많다. 그렇다 하더라도 패러다임 변화에 손 놓고 있을 수는 없는 상황이다. 바이오를 중심으로 하는 패러다임 변화에 미래 선도적 역할을 할 수 있는 기반 마련을 위한 법률 제・개정이 필요하다. 그 관점을 ‘수평적×수직적’으로 제시하고자 한다.
우선 ‘수평적’ 관점이다. 횡적 역할을 할 수 있는 그리고 기본법 역할을 하는 생명공학육성법의 개정이다. 동법은 최근인 2020년 5월에 개정되었다. 이때에는 정책 이행을 위한 시책인 실태조사, 통계, 정보 등을 중심으로 개정되었고 연구개발 혁신에 필요한 시책과 그 관련 내용은 다루지 않았었다. 최근 바이오와 정보통신기술 간 융합과 결합, 연결이 당연시 되는 상황에서 이러한 개념들이 생명공학육성법에 반영될 필요가 있다. 만약 생명공학육성법에 반영하는 것이 어렵다면 별도의 입법을 통해 대응할 필요가 있다. 가장 필요하고 시급한 디지털바이오를 육성하기 위한 법률이 있을 것이다. 양자기술의 경우에도 정보통신융합법 개정을 통해 관련 시책을 우선 마련하여 입법안이 발의되었으나 현재는 국회 계류 중에 있으며, 내용과 성질이 달라 하나의 법률에서 규정하면 오히려 내용이 복잡해지고 이해하기 어려운 상황이 발생하기도 한다. 디지털바이오 육성에 관한 주요 시책으로는 디지털 융합연구 활성화, 연구데이터 공유 및 활용 체계 구축, 성과의 산업 확산, 기반 조성이 주요 골자를 이룰 것이다.
다음으로는 ‘수직적’ 관점이다. 즉 종적 역할을 할 수 있는 분야에 대한 신규 입법이 필요하다. 그 첫 번째가 합성생물학이다. 합성생물학은 기술주도권 경쟁이 시급한 상황에서 국가적 역량 결집에 필요한 직접적인 법적 근거가 부재한 상황이다. 생명공학육성법을 통해 관련 예산은 확보할 수 있으나 해당 기술에 대한 구체적이고 세부적인 시책 마련은 사실 어렵다. 합성생물학에 대한 핵심 공통 기반기술의 발전을 도모하고, 디지털 전환과 이에 따른 데이터 활용, 기술패권에 대응하는 국산화와 표준화 선도, 불확실성과 미지의 신기술에 대비하는 위험관리와 사회적 수용성 노력 등이 반영되어 임무 지향적인 혁신정책(Mission Priented Innovation Policy, MOIP)을 펼칠 수 있는 입법안이 필요하다. 즉 새로운 혁신기술에 대한 지원과 육성을 위한 ‘완벽한 동조’에 가까운 입법안이 필요하다는 것이다.
다음으로는 생명연구자원법 개정이다. 바이오데이터가 이제는 모든 연구에 핵심 자원으로 활용되고 있다. 그러한 상황에서 바이오데이터에 대한 정의와 범주는 그 어느 법률에서 다루고 있지 않아 연구현장에서는 혼란이 가중되고 있다. 따라서 바이오데이터에 대한 정의와 범위가 신설될 필요가 있다. 또한 바이오데이터의 국외 반출에 대한 규제도 미흡하다. 미국이나 중국에서는 자국 내의 바이오데이터 관리에 만전을 기하고 있다. 이에 우리도 그 중요성을 충분히 인지하여 생명연구자원법 개정이 필요하다.
이처럼 바이오 패러다임에 민첩한 대응과 혁신 주체의 창의력 발휘를 고양시킬 수 있는 입법과 체계가 필요하다. 데이터를 중심으로 하는 바이오, 기술패권 다툼 속에서 핵심 기술 선정과 이를 위한 적극적인 지원 등 사회변화에 부응하는 법・제도적 정비과제를 사전에 검토하여 사회변화에 따른 충격을 완화하고 역기능을 선제적으로 제어할 수 있는 입법역량이 필요하다. 혁신의 가치와 안전성을 동시에 보장하기 위한 제도화 노력이 그 어느 때보다 절실한 상황이다.
|
|
|
제4장 생명공학 관련 법제도 현황 |
|
제2절 바이오안전성 동향 |
가. 개요
1990년대 중반 제초제내성 콩을 미국에서 최초로 상업화하여 유통한 이후 제초제내성, 해충저항성 등 경작에 도움을 주는 형질을 갖춘 콩, 옥수수, 목화, 카놀라 등 유전자변형작물을 재배하는 국가 및 재배면적은 2019년 말 기준 전 세계 29개국, 1억 9,040만 ha에 달하고 있다.2) 또한, 허가나 승인 등 자국의 법적 절차를 거쳐 유전자변형농산물을 식품 또는 사료 원료로 사용하는 국가는 재배국을 포함하여 70개국을 넘고 있다. 콩, 옥수수 등 농산물 자급률이 매우 낮은 우리나라에서는 매년 1,000만 톤 이상 유전자변형농산물을 수입하고 있다.3)
이처럼 유전자변형농산물이 국내외에서 많이 재배, 생산, 유통됨에 따라 국제사회에서는 2003년 9월 발효한 바이오안전성에 관한 카르타헤나 의정서를 중심으로, 우리나라는 2008년 1월부터 시행하고 있는 유전자변형생물체의 국가 간 이동 등에 관한 법률을 중심으로, 세계 각국은 자국의 환경과 여건에 적합한 법률과 제도를 갖추어 유전자변형생물체의 국가 간 이동 및 국내 개발・생산, 유통에 따른 안전관리를 추진하고 있다.
이에 따라 본 절에서는 2021년 하반기부터 2023년 상반기까지 유전자변형생물체를 둘러싼 국제사회 및 주요국, 우리나라의 법・제도 관련 최근 동향과 이슈를 중심으로 서술한다.
나. 해외 동향
(1) 카르타헤나 의정서 동향
2018년 11월 이집트에서 개최된 제9차 카르타헤나 의정서 당사국회의 이후 2020년 10월 중국에서 개최 예정이었던 제10차 당사국회의는 코로나19 펜데믹 영향으로 인하여 대면회의가 계속 연기되다가 장소와 일정을 변경하여 2022년 12월 캐나다 몬트리올에서 개최되었으며, 의제별 주요 논의 내용은 아래와 같다.
모니터링 및 보고와 관련해서는 유전자변형생물체 안전관리에 대한 제4차 국가보고서 제출국가 수가 적은 것에 대한 우려가 제기되었으며, 제5차 국가보고서 제출과 관련하여 개도국 및 저개발국에 대한 예산지원의 중요성, 작성 가이던스 개발, 의정서 이행 역량강화 관련 지표에 국가보고서 제출 사항이 포함될 것 등이 논의되었다.
재정 메커니즘 및 재원 관련해서는 의정서 이행에 필요한 국제환경기금(GEF)의 중요성이 강조되었으며, 재정 메커니즘의 효율성 확보 및 접근성 확대가 필요함이 제기되었다.
바이오안전성정보센터(BCH) 운영 및 활동에 대해서는 새로운 ‘central BCH portal’로 데이터 이관이 성공적으로 완료된 것을 환영하고, 지속적인 정보 업데이트 및 역량강화가 강조되었다.
검출・식별 의제에 대해서는 관련 역량강화 및 정보 공유가 강조되었으며, 관리 대상을 환경에 부정적인 영향을 줄 수 있는 유전자변형생물체로 명확히 하고, 합성생물학 용어는 이번 결정문에서 일단 삭제하기로 결정하였다.
사회・경제적 고려 가이드라인의 자발적인 적용이 강조되었고, 향후 각국 경험 및 정보 수집과 역량강화 필요성이 추가되었으며, 책임・구제 추가의정서 발효를 축하하면서 각국이 책임・구제 추가의정서에 가입할 것을 촉구하였다.
의정서 이행계획 및 역량강화 실행계획과 관련해서는 기술 이전뿐만 아니라 접근을 강조하고, ‘재정 메커니즘 및 재원’ 의제 논의 결과를 반영하여 의정서 이행을 위한 별도의 ‘재정기회(funding window)’ 마련 검토 및 제11차 당사국회의에서 이행 실효성 분석 필요성이 제기되었다.
위해성평가 가이던스 마련을 위한 소규모 전문가그룹 구성 여부를 논의하였으나, 기존 특별기술전문가그룹(AHTEG)을 계속 운영하는 것으로 합의하였으며, 유전자변형어류에 대한 위해성평가 가이던스 작성 여부에 대해서는 차기 당사국회의에서 논의를 고려하는 것으로 결정하고, 유전자드라이브 산물 및 유전자변형어류 위해성평가 온라인포럼 및 AHTEG 회의를 제11차 당사국회의 이전에 개최할 것을 결정하였다.
합성생물학 의제의 주요 쟁점은 신규의제(New and emerging issues) 여부에 대한 지속적인 검토 필요성, 조기이슈탐색(Horizon scanning), 모니터링, 평가를 위한 다학제 특별기술전문가그룹(Multidisciplinary AHTEG, 이하 MTEG) 설립 여부, MTEG 임무 및 조기이슈탐색의 세부절차 확립 등이었다. 논의 결과, 합성생물학이 생물다양성협약의 결정문(IX/29)에서 정한 기준들에 부합하는 신규의제인지 여부에 대한 추가적인 분석이 필요 없다고 결정하였으며, 초기이슈탐색을 차기 당사국회의 전에 한 차례 실시하는 것으로 결정하고, 이를 위해 MTEG을 설립하여 광범위하고 다학제적인 평가를 수행하기로 결정하였다.
(2) 주요국 법・제도 동향
유전자가위, 합성생물학 등 기존 유전자변형기술을 넘어서는 바이오신기술을 활용한 다양한 산물 개발 및 상업화가 지속적으로 증가할 것으로 전망됨에 따라 세계 주요국은 바이오신기술 산물 안전관리를 중심으로 법・제도 개선 작업을 추진하고 있다.
① 유럽연합(EU)
유럽연합(EU)은 생명공학기술의 발달을 고려하여 유전자가위 등 새로운 식물육종기술의 GMO 규제 범주(GMO 지침 2001/18/EC) 포함 여부를 평가하는 작업반을 10여 년 전부터 구성하여 지속적으로 논의해 왔다. 2018년 7월 유럽사법재판소는 원칙상 돌연변이 유도기술(mutagenesis)로 만들어진 생물체는 GMO 지침의 규제 대상이라고 밝혀 유전자가위기술 산물도 GMO 규제 대상이라고 발표하였다.4) 유럽사법재판소 판결 이후 EU 집행위원회는 2021년 4월 신육종기술(NGTs)에 대한 보고서를 발간하고 일부 NGTs와 그 제품에 한하여 현재의 GMO 규제가 “목적에 맞지 않는다(not fit for purpose)”라고 서술하였다. 2021년 9월 집행위원회는 유전자가위기술로 개발된 작물에 대한 법적 이니셔티브를 마련하기 위한 로드맵을 작성하였으며, 표적 돌연변이(targeted mutagenesis) 및 동종기원(cisgenesis)으로 만들어진 작물과 이로부터 유래한 식품 및 사료에 대한 법적 프레임워크를 새롭게 제안할 계획임을 천명하였다. 이러한 유럽연합의 법적 프레임워크는 2023년 6월 이후 확정, 발표될 것으로 전망된다.
② 미국
2018년 3월 미국 농업부(USDA)는 유전자가위기술을 포함한 신육종기술에 대하여 식물 해충(plant pest)이 아니거나 식물 해충을 이용하여 개발된 경우가 아니라면 규제할 계획이 없다는 입장을 발표한 후, 2020년 5월 생명공학기술 규제에 대한 개정안(SECURE RULE)을 발표하고 2021년부터 단계적으로 시행하고 있다. 이에 따라 2022년 12월 말까지 총 27건이 규제 면제 확인 요청을 하였으며 심사를 담당하고 있는 동식물검역국(USDA-APHIS)에서는 모든 요청 건에 대하여 면제 대상임을 확인한 바 있다. 미국은 이른바 ‘생명공학기술 규제를 위한 협력 체계(Coordinated Framework for Regulation of Biotechnology)’를 바탕으로 기본적인 유전자변형생물체 규제 방침 및 체계를 마련하고 시행하는데 USDA와 함께 유전자변형생물체 안전관리를 담당하고 있는 식약청(FDA)과 환경청(EPA) 등 협력기관들도 유전자가위 등 바이오신기술과 관련한 규제 개선 노력을 진행하고 있다.
③ 캐나다
캐나다는 생명공학기술이 적용된 농업제품은 과학을 기반으로 하여 승인하고 있으며, 별도의 규제를 제정하지 않고 기존 법률에 따라 상황에 맞는 가이드라인을 마련하여 관리하고 있다. 식물은 규제 체계상 새로운 형질을 갖는 식물(Plants with Novel Traits, PNTs), 새로운 식품(Novel Food), 유전자변형식품, 새로운 사료(Novel Feed)로 분류되어 관련법과 가이드라인을 따르고 있으며, 규제 및 승인은 식품검사청과 보건부에서 관장하고 있다. 2022년 5월 보건부가 발표한 새로운 지침에 따르면, ‘새로운 식품(novel food)’으로 간주되지 않는 식품 기준을 충족하는 유전자가위 적용 작물은 기존 작물처럼 취급되며 시판 전 안전성 평가를 거치지 않아도 된다. 또한 보건부는 ‘새로운 식품’에 해당하지 않는 식품용 유전자가위 작물에 대해 자발적인 투명성 이니셔티브(transparency initiative) 절차를 마련하여 개발사에게 제품에 대한 간결한 정보를 제공하도록 요구하고 보건부는 그 정보를 온라인에 게시하여 공개하고 있다.
④ 일본
일본은 유전자가위기술 등 새로운 육종 기술로 만들어진 생물체에 외래유전자가 존재하지 않으면 ‘카르타헤나법’의 규제 대상이 아니라는 방침을 정하고 적용 중이다. 환경성은 2019년 2월 ‘유전자가위기술 유래 생물로 카르타헤나법에서 규정하는 유전자변형생물 등에 해당하지 않는 생물 취급’을 발표하고 외부핵산 잔존 여부에 따라 카르타헤나법 상 규제 대상 여부를 판단하겠다는 기본 방침을 마련하였다. 후생노동성은 2019년 9월 ‘유전자가위기술 응용 식품 및 첨가물의 식품위생 상의 취급요령’을 발표하고 유전자가위기술로 개발한 일부 식품은 기존의 품종 개량과 동일한 것으로 간주하여 후생노동성의 안전성 심사를 받지 않고 신고 후 유통을 허가하고 있다. 농림수산성은 2019년 10월 ‘농림수산 분야 유전자가위기술 이용으로 얻어진 생물다양성 영향에 관한 정보제공 등의 구체적 절차’를 발표하고, 제1종사용(환경방출용)의 경우 사전 상담을 통해 정보를 제공하고 확인 후 사용 가능, 제2종사용(폐쇄계)의 경우 확산방지조치와 그 유효성을 확인받은 후 이용 가능, 사료 및 사료첨가물의 경우 외래유전자가 남아있지 않은 경우는 신고 후 사용 가능하다고 규정하였다. 그 이후 일본에서는 가바 함유 방울토마토, 생선살 부위가 증가한 복어와 넙치 등이 유전자가위기술로 개발되어 정부에서 제시한 절차를 거쳐 2022년 이후 본격적으로 상업화된 바 있다.
⑤ 중국
중국은 농업유전자변형생물체 안전관리조례, 농업유전자변형생물체 안전관리방법, 농업유전자변형생물체 수입안전관리방법, 농업유전자변형생물체 표시관리방법 등을 통해 유전자변형생물체 안전관리를 시행하고 있다. 2022년 1월 농업농촌부는 ‘농업용 유전자가위 식물의 안전성 평가를 위한 지침(시험)’을 발표하고 유전자가위 식물은 환경 위해성, 식품안전 위험성과 관련한 안전성 평가 절차를 그 정도에 따라 차등 적용한다고 규정하였다. 이 지침에 따르면 환경 위해성 또는 식품안전 위험이 없는 것으로 간주되는 유전자가위 작물에 대해서는 개발자가 실험실 데이터를 제공하고 소규모 현장 시험만 시행한 후 생산응용 안전인증서를 신청할 수 있는 비교적 간소화된 절차를 규정하고 있다. 그에 따라 중국에서는 2023년 5월 초 유전자가위기술 산물로는 자국 최초로 고올레인산 대두에 대한 상업화 승인을 결정한 바 있다.
다. 국내 현황
(1) 유전자변형생물체 안전관리
우리나라는 유전자변형생물체의 국가 간 이동 등에 관한 법률(이하 유전자변형생물체법, 2008년 1월 시행)을 기본으로 유전자변형생물체 안전관리를 하고 있다. 유전자변형생물체법은 유전자변형생물체의 연구개발, 위해성평가 및 심사, 수입, 생산, 수출, 보관, 유통, 환경영향조사 등에 따른 안전관리 내용을 규정하고 있으며, 유전자변형식품인 경우에는 식품위생법에 따른 안전성 평가 및 심사, 표시 등의 규정을 따르도록 하고 있다. 그에 따라 바이오안전성위원회를 중심으로 국가책임기관, 국가연락기관, 바이오안전성정보센터 및 7개 관계 중앙행정기관으로 유전자변형생물체 안전관리를 시행하고 있다.
|
|
|
|
|
|
바이오안전성위원회 (위원장: 산업부장관) |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
국가책임기관(산업부) (의정서 이행, LMO법 총괄) |
|
|
|
|
|
|
|
국가연락기관(외교부) (의정서 이행 연락 담당) |
|||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
바이오안전성정보센터 (정보 수집, 관리, 제공 등) |
|
|
|
|
|
바이오안전성위원회 실무위원회 |
|
|
|||||||||||||||
|
|
|
||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
과학기술 정보통신부 |
|
농림축산 식품부 |
|
산업통상 자원부 |
|
보건 복지부 |
|
환경부 |
|
해양 수산부 |
|
식품의약품 안전처 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
시험・연구용 LMO의 수출입등에 관한 업무 + 연구시설 (신고 위주) |
|
농업용・ 임업용・ 축산업용 LMO의 수출입등에 관한 업무 |
|
산업용 LMO의 수출입등에 관한 업무
|
|
보건의료용 LMO의 수출입등에 관한 업무 + 연구시설 (허가 위주) |
|
환경정화용 LMO의 수출입등에 관한 업무 |
|
해양수산용 LMO의 수출입등에 관한 업무
|
|
식품・ 의료기기용 LMO의 수출입등에 관한 업무
|
|||||||||||
출처: 한국바이오안전성정보센터
[그림 4-2] 우리나라 유전자변형생물체 안전관리 체계
(2) 유전자가위 적용 산물 안전관리 규제 개선 등 추진
정부는 유전자변형생물체 안전관리 개선을 위하여 2022년 7월 외래유전자가 없거나 잔존하지 않는 경우 위해성심사 면제, 시험・연구용 유전자변형생물체 수입승인 대상 축소 및 개발・실험 신고제 도입, 환경방출실험 승인 및 격리실험구역 신고 등 안전관리체계 일원화 등을 골자로 하는 유전자변형생물체법 개정안을 국회에 제출하였다.
그 내용을 구체적으로 살펴보면 시험・연구용 유전자변형생물체에 대해 의도적으로 도입된 약제 내성 유전자를 가진 생물체(동물, 식물, 미생물) 중 실제로 위험성이 증가하는 미생물만 수입승인 대상으로 함으로써 그 범위를 축소하고, 유전자변형생물체 개발・실험시 위해 가능성의 수준을 구분하여 상대적으로 위해 가능성이 적은 유전자변형생물체의 개발・실험은 신고제로 완화하려는 것이다. 그에 따라 연구 현장의 부담이 감소되고 불필요한 행정력이 상당 부분 줄어들 것으로 기대된다.
또한, 환경방출실험의 승인기관과 환경방출실험이 이루어지는 장소인 격리실험구역의 신고기관을 일원화하고, 기존 시행령에 따라 환경방출실험을 하는 자는 용도에 따라 관계 중앙행정기관의 장에게 승인받도록 하는 규정을 법률로 상향하려 한다. 현행 법령에 따르면, 연구시설 신고는 과학기술정보통신부에 하고 실험승인은 용도에 따라 타 부처의 승인을 받아야 하는 이중 구조로 인해 번거로움과 현장의 혼란이 발생하고 있는바, 개정안은 격리실험구역 설치운영 및 환경방출실험 승인에 관한 조항을 신설하여 분산된 관리체계를 해당하는 관계 중앙행정기관의 장으로 일원화하려는 것이다.
우리나라가 유전자가위 등 바이오신기술에 대한 논의를 정부 차원에서 본격적으로 시작한 것은 2015년 국가과학기술심의회 기술영향평가를 통해서였다. 당시에는 유전자변형생물체법, 식품위생법 등 국내 유전자변형생물체 안전관리제도에서 유전자가위기술 적용 산물들이 형태별로 어떻게 해석되고 있는지 불분명했었다. 외래유전자 도입이 없는 유전자가위기술 적용 산물은 외래유전자 도입이 있는 유전자변형생물체에 비해 안전하고 돌연변이에 가까우므로 기존 유전자변형생물체 규제보다 완화된 규제를 적용하거나 규제 면제를 해야 한다는 의견이 있었던 반면, 유전자가위기술이 적용되어 상업화된 사례가 없고, 규제 대상에서 제외시킬 수 있을 만큼 해당 기술의 안전성에 대한 과학적 근거자료가 아직 불충분하여 면밀한 검증이 필요하다는 의견도 있었다. 이후 2016년 3월 국무조정실 신산업투자위원회 바이오헬스 분과위원회에서는 유전자교정 동・식물 가이드라인 마련에 대한 건의 과제를 채택 및 심의하였다. 이에 산업통상자원부는 관계부처 실무자로 구성된 바이오안전성위원회 실무위원회를 통해 유전자가위기술 안전관리 및 상업화 방안에 대해 몇 차례 세미나 및 회의를 개최하였고, 추가적인 논의를 위해 2019년 1월에 산업부, 과기정통부, 농식품부, 환경부, 해수부, 복지부, 식약처 등 관계부처와 바이오안전성 정보센터, 국립생태원, 국가연구안전관리본부 등 공공부문이 참여한 유전자가위 등 바이오신기술 규제 개선 TF를 구성, 발족하였다. TF는 6차례 회의를 통해 규제 개선 방향을 담은 최종보고서를 2019년 8월에 채택하였다.
TF 최종보고서 제안에 따른 전문가회의 등을 통해 유전자변형생물체법 개정 방향에 대한 과학적, 법률적 자문을 받았다. 이후 개정안 초안을 마련하는 과정에서 과학계, 시민단체, 언론 미디어 분야의 의견을 수렴하였고, 2019년 12월에는 유전자가위 등 바이오신기술 적용 산물 규제 개선 대토론회를 개최하였다. 대토론회에서는 과학자들이 바라본 유전자가위의 안전성, 유전자가위에 대한 국민의 수용도, 생명공학기술의 발전과 언론의 역할, 유전자가위기술 규제의 국제 조화 필요성, 유전자가위기술 연구개발 규제 방향, 유전자가위기술 적용 병원체의 유전자변형생물체법 적용 여부에 대한 입장, 유전자가위 등 바이오신기술 규제 개선을 위한 유전자변형생물체법 개정 방향 등을 주제로 발표와 토론이 이루어졌다. 이와 같은 과정을 거친 후 2020년 1월부터 바이오안전성위원회 실무위원회는 유전자가위 등 바이오신기술 적용 산물 규제 개선을 위한 법안 마련 논의를 지속하였고, 2020년 6월 유전자가위 규제 개선을 위한 관계부처 회의를 통하여 사전검토제 도입을 주요 내용으로 하는 유전자변형생물체법 개정안 초안을 마련하였다. 해당 개정안 초안은 관계부처의 의견수렴 과정과 바이오안전성위원회 실무위원회의 추가 검토 과정을 거쳐 2021년 2월 개정안 수립을 완료하고, 규제심사 등 절차를 거쳐 2021년 5월 말 유전자변형생물체법 개정안 입법예고를 하였다. 또한, 입법예고에 따른 국민 의견수렴 기간 중인 6월 말 개정안 공청회를 개최하였다. 국가책임기관인 산업통상자원부와 유전자변형생물체 안전관리 관계부처는 입법예고 기간에 제출된 의견 검토, LMO법 개정 반대 시민단체 토론회(2021.9.), LMO법 개정안 산업계 토론회(2021.12.), 법제처 심사 등의 과정을 거쳐 2022년 7월 유전자변형생물체법 개정안을 국회에 제출한 것이다. 유전자변형생물체법 개정안에는 외래유전자 도입이 없거나 잔존하지 않은 경우 사전검토 절차를 통해 자연적 돌연변이 수준의 안전성을 확보하였다고 인정할 수 있는 경우 위해성심사 및 승인 절차를 면제할 수 있도록 규정하고 있다.
라. 발전 과제
(1) 유전자변형생물체 안전관리 주요 이슈
유전자변형생물체의 용도 다양화 및 복잡성에 따른 안전관리 체계 개선 필요성이 대두되고 있다. 유전자변형생물체가 식품 또는 사료로 제한적으로 사용되던 기존과 달리 산업소재, 보건의료소재 등 다양한 목적으로 사용됨으로 인하여 이에 따른 안전관리 소관 부처 명확화의 필요성이 제기되고 있다. 또한 카르타헤나 의정서에 따른 유전자변형생물체 용도 구분(식품・사료・가공, 환경방출, 밀폐이용)에 적합한 국내 유전자변형생물체 안전관리 소관 부처의 조화가 필요하다. 이어 국내에서도 유전자변형생물체의 환경방출(재배, 사육 등)이 등장할 것으로 예상됨에 따라 유전자변형생물체의 특성과 환경방출의 형태에 따른 안전관리가 필요하다. 특히, 유전자변형농작물(또는 식물)의 온실재배와 노지재배 시 안전관리 기준 마련이 필요하며, 유전자변형 모기, 유전자변형 농약미생물 등 작물 이외 형태의 유전자변형생물체를 환경에 방출할 경우 안전관리 기준 마련도 필요하다. 유전자변형식물을 스마트팜 등 밀폐된 시설 안에서 직접 재배하여 출하하는 경우를 대비하여 용도 구분의 명확화와 안전관리 기준 마련도 필요하다.
비의도적 환경방출(환경유출)에 대한 모니터링 강화 문제도 주요 검토 대상이다. 환경방출로 승인받지 아니한 식품・사료・가공용 또는 밀폐이용 유전자변형식물을 국내 자연환경에서 불법적으로 재배할 가능성, 그리고 국내 자연환경에 유출되어 자생할 가능성 및 유출된 유전자변형생물체가 확산되어 국내 자연환경에 위해를 미칠 가능성에 대하여 상시 모니터링 시스템의 구축과 운영을 지속할 필요가 있다.
유전자변형생물체 안전관리 정책에 대한 공공의 관심 및 참여 요구가 증가하고 있다. 특히, 유전자변형생물체 위해성심사 결과에 대한 국민 의견수렴 확대가 필요하다. 현재 식품의약품안전처에서만 위해성심사에 대한 공개 의견수렴 절차를 도입하고 있으나, 이를 타 부처 위해성심사에 대해서도 확대할 필요성이 제기되고 있다. 또한, 유전자변형생물체 환경방출실험이 이루어지는 지역의 지자체를 중심으로 실험승인 과정 중 지역주민 의견 수렴 절차 도입도 필요하다.5)
미승인 유전자변형생물체 불법 유통에 따른 사후조치 제도화 필요성과 함께 유전자변형생물체로 인한 피해의 책임 및 구제 관련 문제가 대두되고 있다. 2023년 3월 26일 정부는 소비자・유통업체가 보유한 주키니호박을 전량 수거・매입하여 폐기 조치하겠다는 보도자료를 배포, 국내에서 승인받지 않은 유전자변형 호박(주키니호박)이 재배되어 유통되고 있었음이 밝혀져 큰 이슈가 된 바 있다.6) 카르타헤나 의정서의 부속 의정서인 책임・구제 추가의정서가 이미 국제적으로 발효되었으나 우리나라는 아직 미가입국이며 관련 법・제도가 없는 실정이다. 우리나라는 한 해에 유전자변형농산물을 1,000만 톤 이상 수입하여 유전자변형생물체로 인한 피해로부터 자유롭지 못한 국가임에도 불구하고 이에 대한 대책이 미비하다. 책임・구제 추가의정서 가입과 실효적인 제도 마련을 위한 사회적 공론화가 필요하다.
(2) 유전자변형생물체 안전관리 추진 전망
우리나라 정부는 유전자변형생물체법에 근거하여 5년마다 안전관리계획을 수립, 시행하고 있다. 이에 따라 ‘제4차 유전자변형생물체 안전관리계획(2023∼2027)’을 수립 중이다. 해당 계획은 공청회(2023.6월 예정) 및 바이오안전성위원회 심의 절차를 거쳐 2023년 상반기 중 확정・시행될 예정인데, 그 중점 추진 과제는 다음과 같다.
첫째, 유전자변형생물체 안전관리 실효성 제고를 위한 과제를 추진한다. 카르타헤나 의정서의 용도 구분과 유전자변형생물체법의 용도 구분이 일치하지 않아 발생하는 문제점을 분석하고 밀폐이용 구분 및 소관 부처 명확화, 위해성심사 목적과 안전관리 용도 구분 명확화 등을 통해 유전자변형생물체의 용도 구분 및 소관 부처 명확화를 추진한다. 또한 유전자변형생물체 생산승인 관련 세부 시행 방안 마련(시행령・규칙, 통합고시 개선), 유전자가위・합성생물학 등 바이오신기술에 대응한 유전자변형생물체 안전관리 실효성 제고를 위한 법・제도 개선 등을 추진 할 예정이다.
둘째, 국내 개발 유전자변형생물체 상업화에 따른 실질적 관리 방안 마련을 추진한다. 산업용, 보건의료용, 수산동물의약품용 등으로 활용되는 유전자변형미생물 상업화 증가에 따른 위해성평가기술, 시설운영 기준 마련 등이 필요하다. 미세조류, 스마트팜 등 새로운 형태의 유전자변형생물체 상업화 가능성 대두에 따른 시설 관리체계 및 평가 가이드라인 마련, 수산환경 및 해양생태계 위해성평가기술 개발, 환경방출실험구역 운영기준 마련, 농림축산업용 LMO 재배 및 사육시설 기준 정비, 환경정화용 LMO 격리 포장 안전관리체계 마련 등을 계획하고 있다.
셋째, 유전자변형생물체 안전관리 기술 개발 및 원활한 정보 공유를 추진한다. 바이오신기술 산물을 포함한 유전자변형생물체 위해성평가 및 심사기술 개발, 검역 및 검출기법 개발, 비의도적・불법적 유전자변형생물체 위해방지 및 비상대응 지침 마련, 부처 및 관계기관 간 정보 공유 마련 등을 추진한다.
넷째, 체계적이고 투명한 유전자변형생물체 정보관리 과제를 추진한다. 안전관리 소관 부처 간 논의를 통한 유전자변형생물체 정보공개 가이드라인 마련, 유전자변형생물체 안전성 관련 정보 투명성 제고를 위한 위해성심사 관련 세부정보 공개, 안전관리 소관 부처 주관 회의 및 행사 등의 자료와 결과보고서 공개, 환경방출 및 격리실험구역 관련 정보공개 등 세부과제를 추진한다.
다섯째, 바이오안전성에 대한 소통강화를 위해 노력한다. 유전자변형생물체법에 따른 승인 절차 중 공공참여 보장, 유전자변형생물체 안전관리 신뢰도 제고를 위한 시민단체 및 관련 단체와 협력 확대, 대국민 커뮤니케이션 활성화를 위한 다양한 소통 채널 구축 및 활용, 중・고등학교 대상 유전자변형생물체 취급 안전관리 방안 마련, 다양한 이해당사자별 교육 및 세미나 개최 등을 추진한다.
마지막으로 최근 주키니호박 사건을 계기로 유전자변형종자의 불법 수입・유통 방지를 위한 대책을 농식품부를 중심으로 수립하여 추진 중이다. 수입단계에서는 검역증명서 첨부 의무화, 검역미신고에 따른 제재 강화 등을 추진한다. 국내 생산・유통 단계에서는 기존 등록된 종자에 대한 LMO 여부 전수검사, 유통 전・후 종자의 LMO 검사 품목 확대, 발견지・재배지에 대한 철저한 사후관리를 추진한다. 역량강화 및 피해지원과 관련해서는 LMO 검사 조직・인력 정비, 국경 X-ray 장비 확충 및 역량강화, 미승인 LMO 폐기에 따른 피해지원 근거 마련 등을 추진한다. 이에 따라 정부는 책임・구제 추가의정서 가입 및 피해 보상에 대한 절차 마련을 위한 국내 법・제도 정비를 추진할 계획이다.
|
|
|
제4장 생명공학 관련 법제도 현황 |
|
제3절 생명윤리 동향 |
가. 개요
(1) 유전자치료 연구에 관한 생명윤리의 지속적 관심
2015년 4월 중국에서 인간배아를 대상으로 연구가 시작되면서 본격적으로 윤리적 문제가 국제사회에서 논의되었다. 이 연구를 기점으로 과학자들은 저명한 학술지를 통해 배아 및 생식계열 세포의 유전자교정 연구의 잠정적 금지를 선언하였으나 이러한 노력에도 불구하고 연구결과가 학술지에 게재되기도 하였다.
2018년 8월 미국 NIH(National Institute of Health)와 FDA(Food and Drug Administration)는 유전자치료에 대해 중복되는 관리・감독을 효율적으로 하기 위한 노력을 진행하겠다고 발표하였다. 그 목적으로 대중의 의견을 수렴해 2019년 4월 개정된 NIH의 재조합 및 합성 핵산 분자 포함 연구 가이드라인이 제정되었고, 유전자치료 연구를 활성화하되 생명윤리적인 관점에서의 관리가 이루어지도록 방향을 정했다. 즉, 모든 인간 유전자치료 임상시험은 규제 감독하는 FDA에서 이루어지며, NIH가 지원하는 인간 유전자치료 연구는 NIH가 지원하는 모든 연구에 적용하는, 일반적인 NIH 감독뿐만 아니라 기관 검토위원회 및 기관 생물안전위원회와 같은 지역 당국의 생명윤리적 관점의 감독을 받게 된다.
해당 가이드라인이 국내에 바로 적용되는 조약 등의 법률적 성격이 있는 것은 아니지만 국내 유전자치료 연구 관련 제도 간소화 및 생명윤리 관점에서 시사하는 바는 상당하다. 이에 국내도 생명윤리 및 안전에 관한 법률(이하 ‘생명윤리법’)에서 해당 사항을 다루고 있으며, 유전자치료에 관한 연구의 허용요건을 일부 완화하는 동시에 생명윤리에 관한 감독을 강화하는 측면으로 입법이 이루어져 시행 중이다.
(2) 생명윤리 중심의 과학기술 젠더혁신 태동
젠더혁신(Gendered Innovations)은 연구개발의 전 과정에서 성차 및 젠더 차이를 반영한 요소를 분석할 수 있는 도구를 제공하고 이를 활용해 새로운 발상을 함으로써 연구개발의 질(quality)을 향상시키고 지식창출과 기술 및 디자인 등 과학기술 전반에 혁신적 변화를 이루는 것을 의미한다. 구체적으로는 연구의 우선순위 결정부터 연구문제 도출, 연구방법 선정, 연구결과 발표 등 연구개발의 모든 과정에서 필요한 성/젠더 특성을 반영 또는 통합하는 것으로 본다.
오랫동안 생명공학 연구개발에서 남성을 기준・표준으로 하여 창출된 지식에 젠더 편견이 있었다는 것이 확인되었고, 이는 일정 집단에게 생명의 위협을 초래하는 경우도 있고, 모르는 사이에 불이익을 당하게 되는 경우도 있다. 최근 10년간 특정 학술지에 출판된 동물을 활용한 임상 연구의 79% 이상은 수컷만을 대상으로 했으며, 수컷과 암컷 모두를 대상으로 한 임상시험 중에서도 겨우 4%만이 성별 등에 따른 연구결과의 차이를 연구하였다.
이와 같이 연구개발 과정에서 성별 등의 특성을 제대로 고려하지 않을 경우 결국 차후 해당 연구개발 결과의 활용에서 부정적 결과를 초래할 가능성이 커진다. 1997년과 2001년 사이에 미국 시장에서 철회된 10가지 처방약 중 8개가 남성보다 여성에게 더 큰 피해를 입혔다는 결과도 있다. 이에 최근 미국 FDA에서는 졸피뎀(Zolpidem) 제품 출시 이후 다양한 피해 결과를 바탕으로 남성들에 비해 부작용이 더 큰 여성들의 기존 복용 권고량을 절반으로 변경하기도 하였다.
생명공학 연구개발 과정에서부터 생명윤리 관점에서의 성별 등의 특성을 제대로 반영하여 분석하였다면, 해당 제품 승인 전에 남성과 여성의 약물 부작용 가능성과 투여량에 필요한 충분한 정보가 마련되었을 수 있었을 것이다.
따라서 생명공학 연구개발 전 과정에 생물학적인 성과 사회적인 성인 젠더 차이와 특성을 반영하여 남녀 모두를 위한 연구와 기술개발을 해야 한다는 공감대가 폭넓게 일어나고 있다.
나. 해외 동향
(1) 유전자치료 연구에 관한 해외 생명윤리 사전적 검토 제도 동향
(가) 미국
관할기관(NIH, FDA)에서 생명윤리 측면의 안전성 등을 사전에 검토하여 유전자치료 연구가 진행될 수 있도록 허용하고 있다. 유전자치료 연구 허용조건에 대한 별도 규정을 두고 있지 않은데, 미국은 NIH의 RAC(Recombinant DNA Advisory Committee) 자문위원회를 운영하며 유전자치료 연구 안전성 확보를 구체적으로 판단하고 있다. 즉, 유전자치료 연구 시 연구계획에 대해 IRB 외에 국가 차원의 전문위원회에서 심의・자문을 의무화하고 있다는 특징이 있다.
(나) 일본
기존의 치료법보다 치료 효과가 우수하고, 연구 대상으로서의 피험자 이익이 불이익보다 클 경우를 판단하여 유전자치료 연구를 허용하고 있으며, 유전자치료 임상연구에 관한 지침을 별도로 운영하여 규정하고 있다.
[표 4-2] 해외 주요국 유전자치료 연구 관련 생명윤리에 관한 규정
|
국가 |
주요 내용 |
|
미국 |
• 대상 질환 제한하지 않음 • 유전자치료제 임상시험 대상 질환 제한을 하지 않고 있으며, FDA에서 임상시험 참여자의 안전성을 검토한 후 허용 |
|
일본 |
• 가이드라인(유전자치료 임상연구에 관한 지침)으로 제한 • 임상연구 대상은 다음 각호 요건 모두 충족 시 허용 ① 유전자치료 임상연구에서 치료 효과가 다른 치료법에 비해 우수함이 예측 ② 피험자에게 유전자치료 임상연구에서 얻는 이익이 불이익을 상회할 것으로 예측되는 질환 |
|
EU |
• 연구범위 제한하지 않음 • 첨단치료제의 연구・개발범위에 대해 구체적 범위 정하지 않음 • 첨단치료제 관련 법률에 근거하여 유럽 의약청(European Medicines Agency, EMA)의 첨단치료제 위원회(Committee for Advanced Therapies)의 심의를 통해 신약 허가가 이뤄지며 Directive 2001/20/EC에 따라 개별 회원국의 관할기관이 임상시험 허가를 담당 |
출처: 저자 작성
|
국가 |
IRB이외 국가 차원 검토위원회 |
설치기관(국가기관) |
|
미국 |
RAC(Recombinant DNA Advisory Committee), CTGTAC(Cellular Tissue and Gene Therapies Adivisory Committee) |
NIH, FDA |
|
일본 |
유전자치료 임상연구에 관한 심사위원회 등 |
후생노동성 |
|
영국 |
유전자치료 자문위원회(Gene Therapy Advisory Committee, GTAC) |
Department of Health and Social Care |
|
유럽 |
선진치료위원회(Committee for Advanced Therapies, CAT) |
European Medical Agency(EMA) |
출처: 저자 작성
(2) 생명윤리 관점에서의 젠더혁신 관련 해외 법・제도 동향
(가) EU
EU법은 회원국 법질서의 불가결한 일부이며 회원국 법에 의하여 적용되는 것인바, 젠더 관련 내용은 EC 지침 제29조와 제20조에 반영되어 있다. 2006/54/EC 지침 제29조에는 “회원국은 본 지침과 관련되어 있는 법령, 행정지침, 정책 및 조치를 마련하고 집행할 때 여성과 남성 간의 평등 실현의 목적을 적극적으로 고려해야 한다.”라고 규정하고 있으며, 동일 지침 제20조에는 젠더 평등을 위한 EU 기관으로 유럽 성평등연구소(European Institute for Gender Equality, EIGE) 설립을 위한 내용이 규정되어 있다.
현재 ‘Horizon 2020’으로 명명되어 진행 중인 EU 혁신 프로그램에서 연구개발에서의 젠더 이슈는 중요한 의제로 채택되었고 젠더 평등 신장과 젠더 요소를 고려한 혁신 과제 및 연구를 장려한다는 내용이 포함되었다.
[표 4-4] 유럽연합 Horizon 2020의 젠더 관련 규정
|
규정 |
조항 |
내용 요지 |
|
종합계획 규칙 |
제14조 |
• Cross-cutting 이슈: 젠더를 포함한 책임 있는 연구와 혁신에 특별히 주목한다. |
|
제16조 |
• 성평등: HORIZON 2020은 성평등과 연구와 혁신의 내용에 성별분석을 효과적으로 증진할 것을 보장해야 한다. 평가 패널과 전문가 그룹 구성 등 연구와 혁신 관련해서 성 균형을 보장하기 위해서 특별한 주의를 기울여야 한다. 연구와 혁신의 내용, 전략, 프로그램, 프로젝트 연구의 전 주기에 성별 분석을 포함한 젠더 차원이 적절하게 통합되어야 한다. |
|
|
참여규칙 |
제14조 |
• 규정: Article. 13 “Proposal” …연구 프로그램이나 계획에서 성별 분석이 고려되어야 하는 경우에, 제안서에 연구문제, 방법론, 확산에 이르는 전 단계에 필요한 젠더 분석 계획을 명시할 것을 요구하고 제안서 양식에 성별 분석의 방법과 범위를 제시해야 한다. |
출처: 저자 작성
(나) 미국
미국국립보건원(NIH)은 2014년 척추동물과 인간에 대한 연구에서 성별을 중요한 생물학적 변수로 고려하는 정책을 발표하였다. 이 정책에 따라 2016년 1월부터 척추동물 이상을 대상으로 NIH에 연구비를 신청할 때 성별을 생물학적 변수로 고려한 연구제안서를 작성하는 것이 의무 조항이 되었다.
다. 국내 현황
(1) 유전자치료에 관한 연구 허용기준 완화 및 생명윤리 확보를 위한 생명윤리법 일부 개정
우리나라 생명윤리법상 유전자치료란 ‘① 질병의 예방 또는 치료를 목적으로 인체 내에서 유전적 변이를 일으키거나, ② 유전물질 또는 유전물질이 도입된 세포를 인체로 전달하는 일련의 행위’를 의미한다.
기존 생명윤리법 제47조에 따르면, 유전자치료에 관한 연구 중 ① ‘인체 내에서 유전적 변이를 일으키는 유전자치료에 관한 연구’는 ㉠ 유전질환, 암, 후천성 면역결핍증과 같은 특정 질환을 대상으로 하고(AND), ㉡ 현재 이용 가능한 치료법이 없거나 유전자치료의 효과가 현저히 우수할 것으로 예측되는 경우에 허용되며, ② ‘유전물질 또는 유전물질이 도입된 세포를 인체로 전달하는 유전자치료에 관한 연구’는 ㉠ 유전질환, 암, 후천성 면역결핍증과 같은 특정 질환을 대상으로 하거나(OR), ㉡ 현재 이용 가능한 치료법이 없거나 유전자치료의 효과가 현저히 우수할 것으로 예측되는 경우에 허용하고 있었다. 이는 ‘인체 내에서 유전적 변이를 일으키는 유전자치료’에 관한 연구는 질병에 따라 제한적으로 허용되고 있는데 이에 따라 유전자치료의 기회가 특정 질병에 한정되는 문제가 있었다.
이에 ‘인체 내에서 유전적 변이를 일으키는 유전자치료’에 관한 연구도 ‘유전물질 또는 유전물질이 도입된 세포를 인체로 전달하는 유전자치료’에 관한 연구와 마찬가지로 한 가지 조건만 충족하면 허용하도록 함으로써, 국내에서보다 다양한 유전자치료에 관한 연구가 가능하도록 하였다.
|
|
구분 |
비고 (요건) |
|
|
인체 내에서 유전적 변이를 일으키는 유전자치료 |
유전물질 또는 유전물질이 도입된 세포를 인체로 전달되는 유전자치료 |
||
|
기존법 |
㉠, ㉡ 모두 충족 |
㉠, ㉡ 중 하나만 충족 |
㉠ 유전질환, 암, 후천성 면역결핍증, 그 밖에 생명을 위협하거나 심각한 장애를 불러일으키는 질병의 치료를 위한 연구 ㉡ 현재 이용 가능한 치료법이 없거나 유전자치료의 효과가 다른 치료법과 비교하여 현저히 우수할 것으로 예측되는 치료를 위한 연구 |
|
▼ |
|||
|
현행법 |
㉠, ㉡ 중 하나만 충족 |
||
출처: 저자 작성
다만, 허용기준 완화에 따라 발생할 수 있는 위험성 등을 기관위원회 심의제도로 보완할 수 있도록 규정을 마련하였다. 유전자치료에 관한 연구를 하는 자가 연구계획서를 기관생명윤리위원회(Institutional Review Board, IRB)에 제출하여 사전에 심의를 받도록 하고, 위험도와 신규성이 높은 연구 등에 대해서는 국가생명윤리심의위원회의 자문을 받도록 함으로써 연구의 윤리성과 안전성을 확보하였다. 이는 생명윤리법을 개정하여 2021년 12월 30일부터 시행하고 있다.
또한 해당 개정사항에는 유전자검사기관에 대한 숙련도 평가를 의무화하고, 소비자를 대상으로 직접 유전자검사를 수행하는 유전자검사기관에 대한 인증 제도를 도입하는 내용이 포함되었다. 이를 통해 유전자치료기관을 감독 대상기관에 추가하는 등 유전자검사기관 및 유전자치료기관에 대한 체계적인 관리・감독이 가능할 수 있도록 제도를 신설하고 관련 규정을 정비하였다.
한편, 폐기 및 개선 명령, 등록 등의 취소와 업무 정지 명령, 업무 정지 명령에 갈음하여 부과하는 과징금의 대상을 확대하였다. 이에 신고하지 않고 유전자치료 및 유전자검사를 실시하는 자에 대하여 그 시설을 폐쇄할 수 있도록 시설 폐쇄 명령 규정을 신설함으로써 유전자치료 및 유전자검사 관련 규정 위반 시 실효성 있는 제재조치가 가능하게 되었다.
그 밖에 유전자치료기관 및 유전자검사기관의 신고 또는 변경 신고의 수리를 요하는 신고임을 명시적으로 규정함으로써 관련 민원의 투명하고 신속한 처리와 일선 행정기관의 적극 행정을 유도할 수 있도록 하였다.
(2) 연구윤리 관점에서의 젠더혁신에 관한 국내 법・제도 현황
(가) 과학기술기본법 개정을 통한 연구윤리 관점의 젠더혁신 요소 반영
과학기술기본법은 과학기술발전을 위한 기반을 조성하여 과학기술을 혁신하고 국가경쟁력을 강화함으로써 국민경제의 발전을 도모하며 나아가 국민의 삶의 질을 높이고 인류사회의 발전에 이바지함을 목적으로 한다. 과학기술기본법에 근거하여 과학기술정보통신부 장관이 5년마다 과학기술발전에 관한 중・장기 정책목표와 방향을 반영한 과학기술 기본계획을 세우도록 하고 있고, 정부는 국내외 과학기술 활동 및 연구개발성과 등의 과학기술 통계와 지표를 조사・분석하도록 하고 있다.
최근 선진국을 중심으로 연구개발 전 과정에 걸쳐 다양한 연령과 성별・젠더 요소를 반영하는 젠더혁신을 통하여 새로운 시장을 창출하고 지식재산 및 산업기술의 새로운 부가가치를 개발하여야 한다는 필요성이 제기되었고, 특히 연구개발 과정에서 특정 성별을 중심으로 실험이 진행될 경우 해당 연구 효과가 특정 성별에만 효능을 보이는 등 불완전한 지식 및 기술이 창출되는 경우가 발생하므로, 이에 제5차 과학기술 기본계획의 주요 사항에 성별 등 특성을 고려하고 사회적 가치를 증진하기 위한 과학기술의 구현을 추가하였다.
이 뿐만 아니라 정부가 과학기술 통계와 지표를 조사・분석하는 경우에 성별 등 특성이 반영되도록 함으로써 젠더혁신을 통한 과학기술 혁신을 도모하고자 노력 중이다.
(나) 국가연구개발사업 등의 성과평가 및 성과관리에 관한 법률 개정
국가연구개발사업 등의 성과평가 및 성과관리에 관한 법률(이하 ‘연구성과평가법’)은 정부가 추진하는 과학기술 분야의 연구개발 활동을 성과 중심으로 평가하고 평가결과를 환류하며 연구성과를 효율적으로 관리・활용함으로써 연구개발 투자의 효과성 및 책임성을 향상시키는 것을 목적으로 한다.
과학기술 분야에서 연구개발사업을 추진할 때 성별 특성을 고려하지 아니하거나 남성적 특성이 편향적으로 반영된 불완전한 지식・기술이 창출되고 있고, 이를 활용한 제품・서비스가 시장에서 부작용을 일으켜 연구개발의 투자손실로 이어지는 부분을 최소화하기 위하여, 유럽과 북미의 주요 국가들은 연구개발 정책 및 활동에서 젠더분석(Gender Analysis)을 활용하여 새로운 지식을 창출하고 혁신기술을 개발하는 등 젠더혁신을 활성화하고 있다.
이에 우리나라도 국가연구개발사업의 성과평가를 실시할 때 연구개발사업의 성격을 감안하여 성별 특성이 연구결과에 미치는 영향을 분석・반영하였는지 여부를 고려하도록 함으로써, 연구개발사업의 추진 과정에서 젠더혁신의 활성화를 도모하고자 노력 중이다.
라. 발전 과제
(1) 유전자치료에 관한 연구에 관한 생명윤리 확보
유전자가위 기술 등 급격한 생명과학 기술의 발전에 따라 기존의 생명윤리 확보를 위한 심의 방식에 변화가 필요하다는 학계 등의 요청을 수용하고, 미국・일본・유럽 등 선진국의 사례를 살펴봐도 유전자치료에 관한 연구의 대상 질환을 제한하는 경우는 없다는 점 등을 고려할 때, 유전자치료 연구의 허용기준을 완화하면서 연구계획서의 심의 절차 강화를 통해 연구의 안전성을 확보하려는 방향은 상당히 타당한 흐름으로 보인다. 다만, 생명윤리법상 생명윤리사항을 발전 과제로서 고려해야 할 필요가 있는 점은 다음과 같이 정리해 볼 수 있다.
첫째, 유전자치료에 관한 연구가 개인의 유전형질을 변경하는 데 악용될 수 있으며, 유전자치료의 부작용으로 인해 환자가 사망하거나 암과 같은 다른 질환을 얻게 되는 등의 사례가 보고되기도 하는 점 등을 고려할 때 유전자치료 연구의 허용범위 확대에 대해서는 충분한 논의를 거칠 필요가 있다.
둘째, 유전자치료에 관한 연구를 하는 자가 연구계획서를 기관 생명윤리위원회에 제출하여 심의를 받고, 일부 위험성이 높은 연구의 경우 기관 생명윤리위원회는 국가생명윤리심의위원회에 자문을 요청하여 연구계획서를 심의하여야 한다고 규정하고 있을 뿐 국가생명윤리심의위원회의 자문 결과에 따른 조치사항 등은 별도 제도로 마련되어 있지 않다. 유전자치료 연구 허용기준을 완화하는 대신 생명윤리에 관한 심도 있고 구체적인 심의를 받도록 함으로써 기준 완화에 따라 발생할 수 있는 위험성 등을 심의제도로 보완하고자 하는 것인바, 심의제도에 대한 실효성을 담보하기 위해서는 제도 운용 절차에 대한 보완이 필요할 수 있다.
(2) 생명윤리 관점에서의 생명공학 젠더혁신
실제로 과학기술 젠더혁신은 성별 등의 특성에 기초하여 여성뿐만 아니라 남성에 대한 연구개발 결과의 수용성을 더욱 높일 수 있다. 특히 성별 특성을 반영할 수 있는 연구개발 분야의 예시로, 의・생명공학 분야에서는 약물 개발, 심혈관질환 및 대사질환의 혈액 바이오마커 개발, 백신 접종에 따른 면역반응 연구 등 세포와 동물연구, 사람을 대상으로 하는 연구 등이 있다.
한편, 이와 같은 생명윤리 관점에서의 젠더혁신은 단순히 생물학적인 특성을 기준으로 한 적극적 평등 실현조치와 구별하여 이해하여야 한다. ‘적극적 평등 실현조치’란 현존하거나 계속되고 있는 차별을 제거 또는 과거에 행해진 고질적인 차별을 구제, 그리고 미래에 발생 가능성이 있는 차별을 방지하기 위한 제도나 절차의 마련을 위한 일련의 조치(Affirmative Action)로서, 생명윤리 관점에서의 성별특성분석 반영과 구별되는 개념이다. 다시 말하면 공적・사적 기관이 차별지표로 사용된 속성을 역사적으로 불이익을 받아온 집단에게 정치적・경제적・사회적・문화적 영역에서의 기회 제공에 이를 고려함으로써 차별의 결과를 구제하고, 실질적인 평등을 실현하기 위하여 계획된 우선적・잠정적・보상적인 평등실현정책ᆞᆞ이라 할 것이다. 해당 사항의 중요성과 별개로 생명윤리 관점에서의 생명공학 젠더혁신에 관한 법・제도 개선 사항에 대해서는 면밀히 그 추이를 지켜볼 필요가 있다.
|
|
|
제4장 생명공학 관련 법제도 현황 |
|
제4절 생명공학 지식재산권 제도 동향 |
1. 개요
2019년 12월 중국 후베이성에서 SARS-Cov-2의 감염이 처음 확인된 후 COVID-19는 3년여의 전 세계적 대유행(pandemic)을 거쳐 2023년 5월 5일 WHO는 코로나19에 대한 종식을 선언하였다. 코로나의 대유행은 바이오기술 분야의 혁신을 한발 앞당기는 기폭제가 되었다. 보건 의료 분야의 자국중심주의는 더욱 강화되고 있으며, 바이오헬스케어 산업은 글로벌 기술 패권경쟁의 핵심분야로 부상하고 있다.
코로나의 대유행은 그동안 축적된 바이오 분야 기술과 IT, 컴퓨터, 인공지능, 로봇 등의 분야가 융합되어 어떻게 실질적으로 활용될 수 있는지를 보여주는 계기가 되었다. 초고속 분자진단법을 적용한 질병의 진단과 원격진료 등으로 감염병을 관리하였고, 합성생물학과 바이오파운드리의 결합으로 바이오 분야 연구의 오랜 난제인 속도, 스케일과 불확실성의 한계를 극복하여 역사상 최단기간에 백신을 제조하여 코로나 확산을 저지하였다.
이에 따라 합성생물학 분야는 디지털 기술과의 융합을 통하여 바이오기술의 디지털 전환을 가속화하며 디지털바이오 시대의 핵심으로 떠오르고 있다. 합성생물학 기술은 AI・로봇・빅데이터 기술이 융합된 바이오파운드리 분야와의 결합으로 바이오산물 제조에서 고비용의 장벽을 극복할 수 있어 에너지, 화학, 의료, 환경, 농업, 국가 안보 및 나노 기술까지 다양한 산업 분야에 광범위하게 적용이 가능하며, 특히 탄소중립을 지원하는 에너지 및 화학 분야에서도 바이오산물이 규모의 경제를 실현 가능하게 한다.
전 세계 바이오기술 패권 경쟁의 일환으로 미국의 바이든 대통령은 2022년 9월 ‘국가 생명공학 및 바이오제조 이니셔티브’ 행정명령에 서명함으로써 바이오기술의 블록화 및 바이오산업의 자국 제조를 위한 전략을 주도하며 중국의 바이오굴기에 대응하고 있다. 한국 정부도 미・중 바이오기술 패권 경쟁에서 타격을 최소화하기 위한 전략을 마련하고 있으며, 윤석열정부 출범 이후 제4차 비상 경제민생회의를 통한 ‘바이오헬스 산업 혁신 방안(2022.7.27.)’, 미래성장과 기술주권 확보를 위한 ‘국가전략기술 육성방안(2022.10.28.)’등을 마련하고, 첨단바이오 분야로 합성생물학, 유전자・세포 치료, 감염병 백신・치료, 디지털헬스 데이터 분석・활용 등의 세부 기술을 지정하여 제도 및 지원방안을 수립하고 있다.
국가별 미래 산업의 경쟁력은 분야별 원천기술의 확보, 이를 위한 국가 차원의 장기적 투자, 연구 성과물의 제도적 보호와 산업에서의 활용에 따라 좌우된다. 생명공학 분야는 성과물을 얻기까지 대규모의 자본과 장기간의 연구가 필요하지만 소수의 특허로 시장에 막대한 파급력을 미치고 고부가가치를 창출할 수 있다. 따라서 효율적인 정책적 지원을 바탕으로 하는 지식재산 확보전략과 회피전략으로 강한 특허를 창출하고 특허분쟁에 대응하는 것이 무엇보다 중요하다.
2. 생명공학 분야 특허심사제도
생명공학 분야의 특허출원은 무생물을 대상으로 하는 타 분야 기술과 달리 살아있는 생명체를 대상으로 하고 있고, 출원할 때 특허미생물 기탁제도 및 서열목록 제출제도 등 특수한 절차나 윤리적인 측면도 함께 고려해야 할 필요성이 있는 등의 특수성이 있어 특허 심사에 있어서 일반 특허 심사기준 외에 별도의 기술 분야별 심사기준이 제정되어 운용되고 있다. 인간 유전자나 생물체 자체 등의 특허 대상 여부, 발명의 성립성 또는 산업상 이용 가능성에 대해 국가별로 독자적인 기준을 마련하여 판단하고 있다.
우리나라 생명공학 분야의 특허 심사기준은 1998년 3월 ‘생명공학 분야 산업부문별 심사기준’이 제정된 이후, 기술발전과 산업 환경의 변화에 따라 6차례의 개정작업으로 정비되었고, 2014년 7월 각 기술 분야별 심사기준을 통합할 필요성에 따라 ‘특허・실용신안 심사기준’에 통합되어 운용되어 왔다. 2020년 12월에는 4차 산업혁명에 대응하여 바이오 분야의 비약적인 기술발전 사항을 반영하고 바이오 분야 신기술 및 융합기술의 판단 기준을 확립하기 위하여 ‘바이오 분야 심사실무가이드(‘기술 분야별 심사실무가이드’ 제3부, 2021.1. 배포)’를 새로이 제정하였으며, 2021년 1월에는 세부 바이오기술 분야별 사례를 구체화하여 심사실무가이드를 개정하였다.
가. 심사기준
새로이 제・개정된 ‘바이오 분야 심사실무가이드’는 기존의 생명공학 분야 심사실무가이드가 ‘특허・실용신안 심사기준(제9부 제1장)’으로 통폐합되면서 생명공학 분야의 전반에 대한 구체적 특허요건 판단 기준과 사례의 제시가 미흡하다는 대내・외의 요구를 반영하였으며, 특허요건을 생명정보의 흐름의 단계별로 생명체의 주요 구성요소(핵산・단백질・세포)로 세분화하여 체계적으로 정비하고, 펩티드, 변이체 및 단일클론항체 등 심사 쟁점 사항에 대한 청구범위 기재방법과 명세서 기재요건을 수록하여 구체적 판단 기준을 확립하였다. 기재요건 및 특허요건은 판단 기준을 구체적으로 설명하고, 기술별・대상별 기본예시와 판례를 제시하여 출원 명세서 작성에 대한 가이드로 활용하고, 출원인의 심사에 대한 예측 가능성을 높일 수 있도록 하였다.
특수한 분야의 발명으로는 바이오 빅데이터를 활용한 가상실험에서 신약 후보물질 확인방법이 컴퓨터나 소프트웨어 관련 발명임을 명시하고 관련 예시를 기재하였으며, 컴퓨터상에서 인공지능이나 기계학습 등의 컴퓨터 프로그램을 이용한 가상실험으로 개발된 의약에도 화학 분야의 물질발명과 동일하게 특정의 출발 물질, 온도, 압력, 유입・유출량 등 그 물질발명을 제조하는 데에 필요한 구체적인 반응조건과 그 조건을 직접 적용하여 실시한 결과를 실시 예로 기재하는 명세서 기재요건을 제시하여 차세대 바이오 분야의 신기술 및 융・복합 기술 발명이 선제적으로 보호될 수 있도록 하였다.
나. 심사사례
바이오 분야 기술은 21세기 초 인간 유전자 지도 작성사업의 완료를 기점으로 폭발적으로 성장하였고, 4차산업 혁명기를 거치면서 융합기술의 발달로 바이오헬스케어 분야로 확장되며 고도성장하고 있다. 최근에는 빅데이터 분석, 인공지능, 기계학습 등을 적용한 질병 예측 모델이나, 유전체 기반 맞춤형 신약개발, 또는 맞춤형 치료 등의 정밀의료 분야 및 ICT 기술과 융합된 스마트 헬스케어 분야 등이 눈부신 발전을 이루고 있다. 유전자가위, 합성생물학, 마이크로바이옴, 분자진단 등 바이오 분야 신기술 분야에서도 융합기술을 적용하여 데이터를 최적화하거나 검증하는 특허출원이 계속 증가하고 있는 추세이다.
바이오 분야 심사실무가이드에는 바이오 분야 융・복합기술 판단사례로 지능형 신약개발 관련 발명, 단백질 결정체 및 가상실험 분석방법을 수록하여 융・복합기술이 적용된 바이오 분야 발명의 명세서 기재요건 및 진보성 판단 기준을 확립하였으며, 단백질 활성 단편에 관한 발명, 단백질의 활성이 향상된 변이체에 관한 발명, 새로운 의약 용도를 발명한 경우의 청구범위 기재방법에 관한 구체적 심사사례를 기재하여 바이오 분야의 주요 심사 난제에 대한 가이드를 제시하였다. 그리고 유전자가위, 마이크로바이옴이나 다형성을 이용한 바이오마커 등의 발명에서 발명의 산업상 이용 가능성이나 공서양속 위배에 대한 판단 및 발명의 단일성 기준에 대한 구체적 심사사례와 청구항 보정방향을 제시하여 바이오 분야 신기술 발명에 대해 우수한 특허가 적정한 권리로 보호될 수 있도록 하였다. 2021년 1월에는 세부 바이오기술 분야별로 구체적 사례를 더욱 추가하여 심사실무가이드를 개정하였다.
이러한 ‘바이오 분야 심사실무가이드’ 제・개정을 통하여 출원인의 심사결과에 대한 예측 가능성이 높아지고, 바이오 분야의 특허가 제대로 보호되어 우리나라의 바이오헬스케어 분야가 미래시대 산업을 선도할 수 있기를 기대한다.
3. 생명공학 분야의 주요 지식재산권 제도
가. 미생물 기탁제도
미생물 기탁제도란 유전자, 세균, 종자, 세포 등 미생물 발명을 포함하는 특허출원에 있어서 해당 특허출원 미생물을 공인 기탁기관에 기탁하는 제도이다. 이는 특허출원하는 실제 미생물을 공인 기탁기관에 기탁한 후, 출원 공개 후에 특허기탁 미생물을 제3자가 분양받아 실시할 수 있도록 함으로써 반복 재현이 곤란한 미생물 발명에 관한 명세서의 기재사항을 보완하기 위함이다. 우리나라는 특허청이 지정한 4개의 기탁기관7)이 운영되고 있다.
특허법 시행령 제2조에서 미생물 발명 관련 출원을 하고자 하는 자는 ‘출원 전’에 특허미생물을 기탁기관 중 1곳에 ‘특허기탁’ 하고, 출원할 때 특허출원서에 수탁증을 첨부하며, 특허출원서에 ‘미생물 기탁 정보(취지)’를 기재하도록 규정하고 있다. 특허법 시행령 제4조는 특허미생물을 연구 또는 시험 목적으로 분양받고자 하는 자가 원기탁자의 허락을 받거나 특허청에 미생물 분양 자격증명을 신청한 후, 기탁기관에서 분양받을 수 있도록 규정하고 있다. 한편, 특허법 제58조(전문기관의 등록 등)에 따라 미생물 기탁기관의 등록 및 운영에 관한 고시가 마련되어 미생물 기탁기관 등록의 근거를 규정하고(특허청 고시 제2022-28호), 관련 시행령과 시행규칙에 등록기준(시행령 제8조의4) 및 취소기준(시행규칙 제36조의3)도 함께 규정하여 운영되고 있다.
최근 특허청은 특허출원 및 심사과정에서 국민 불편을 해소하는 규제 개혁의 일환으로 미생물 발명과 관련된 특허출원 시 필요한 미생물 기탁・분양 절차와 서식을 대폭 간소화하였다(2022.4.19.일부 개정). 이번 미생물 기탁제도의 개선 및 특허미생물 정보 통합관리 체계의 구축으로, 특허청과 4개 미생물 기탁기관은 특허미생물의 기탁 및 분양 정보를 실시간으로 공유할 수 있게 되었다.
특허미생물 정보 통합관리 체계의 구축으로 인한 실시간 기탁 정보의 공유를 통해 국내 기탁기관에 미생물을 기탁한 출원인은 별도의 미생물 기탁증 사본을 제출하지 않고 바로 출원할 수 있고, 기탁 미생물을 분양받고 싶은 사람도 별도의 서면증명서 없이 기탁기관에 바로 분양신청을 하면 된다. 아울러, 출원 시 기탁증 제출을 생략하고 온라인으로 미생물 분양자격 증명신청이 가능하도록 특허출원 체계인 ‘특허로’8)를 개편하였으며, 특허검색체계인 ‘키프리스(KIPRIS)’9)를 통해 특허미생물 관련 정보를 일괄해서 검색과 조회를 할 수 있도록 기능을 개선했다.
[표 4-6] 미생물 기탁제도의 주요 개선사항
|
구 분 |
개 선 전 |
개 선 후 |
|
법령 개정 |
✓특허법시행령 제2조 제2항 * 수탁증 사본 제출 규정 ✓특허법시행규칙 제23조 * 분양신청서 등 서류 제출 규정 |
✓개정(삭제)
|
|
정보 공유 |
✓특허청 – 기탁기관 간 기탁 및 분양 정보 미공유 |
✓실시간 기탁 및 분양 정보 공유 |
|
절차 개선 |
✓미생물 수탁증 사본 - 특허청 제출 ✓특허청에 각종 서류(4종) 제출 * 기탁기관 분양신청서, 시험・연구 증명서류, 특허공보, 의견제출통지서 등 |
✓수탁증 사본 제출 불필요 ✓각종 서류 제출 불필요 ✓분양신청이유, 특허번호만 기재 |
|
[기탁] ① 기탁기관에 미생물 기탁 후 (1 Step) ② 수탁증 첨부하여 특허청에 출원 (2 Step) [분양] ① 특허청에 증명서 신청 후 (1 Step) ② 증명서 첨부, 기탁기관에 분양신청(2 Step) |
✓[기탁] 기탁과 출원을 기탁기관과 특허청에 각각 신청 가능 (1 Step) ✓[분양] 증명신청과 분양신청을 기탁기관과 특허청에 각각 신청 가능 (1 Step) |
|
|
DB 구축 |
✓(국내기탁미생물) 특허청 및 4개의 기탁기관에 특허미 생물 관련 정보가 산재 |
✓특허미생물 통합정보 DB구축으로 국내특허 미생물 기탁-출원-분양 정보 종합관리 |
|
정보공개 |
✓기탁-IP-분양 연계정보 등 미공개 |
✓특허미생물 통합관리시스템에 실시간 공개 |
출처: 저자 작성
특허청은 기탁기관으로부터 반기별로 수탁 및 분양현황을 보고받고 있으며, 현재까지 기탁된 미생물은 1만 6,099건, 분양된 미생물은 3,091건이다(2022.8.15.기준). 특허미생물의 보호를 위하여 2013년 4월에 농촌진흥청 국립농업과학원을 ‘국가특허미생물통합보존소’로 지정한 이후 4개 특허미생물 기탁기관에서 복제본 제작 및 통합보존을 완료하였으며 이에 대한 점검이 2017년 12월 완료되었다. 또한 2014년 5월, 특허미생물 훼손, 유출 등의 위기상황에서도 활용성 제고를 위해 특허미생물 기탁기관 공통의 안전관리규정 표준안을 마련하였으며, 이에 따라 민관합동 위기대응 훈련을 매년 시행하고 있다(제7차 훈련 실시, 2022.8)
[표 4-7] 특허 기탁기관 및 운영 현황(2022.8.31.기준)
|
|
한국생명공학연구원 생물자원센터 |
한국미생물 보존센터 |
한국세포주 연구재단 |
국립농업과학원 미생물은행 |
||||
|
영문명칭 |
KCTC (Korean Collection for Type Cultures) |
KCCM (Korean Culture Center of Microorganisms) |
KCLRF (Korean Cell Line Research Foundation) |
KACC (Korean Agricultural Culture Collection |
||||
|
설립 |
1985년 KIST 유전공학센터 특수사업부(유전자 은행) 설립 |
1967년 사단법인 한국종균협회 창립 |
1982년 세포주은행 업무 개시 |
1995년 설립 |
||||
|
기탁기관 등록 |
국내 |
국제 |
국내 |
국제 |
국내 |
국제 |
국내 |
국제 |
|
1981.8.25. |
1990.6.30. |
1981.8.25. |
1990.6.30. |
- |
1993.8.31. |
2002.1.1. |
2015.5.1. |
|
|
소재지 |
전북 정읍시 입신길 181 |
서울시 서대문구 홍제내2가길 45 유림빌딩 2층 |
서울시 종로구 대학로 101 서울의대 암연구소 |
전북 완주군 이서면 농생명로 166번지 |
||||
|
인터넷 사이트 |
http://kctc.kribb.re.kr |
http://www.kccm.or.kr |
http://cellbank.snu.ac.kr |
http://www.genebank.go.kr |
||||
|
특허미생물 보유건수 (분양건수) |
8,074건 (1,045건) |
5,128건 (787건) |
513건 (403건) |
2,384건 (856건) |
||||
|
담당자 |
김성건 센터장 이정숙 박사 |
박정민 박사 김유진 연구원 |
구자록 교수 신영경 교수 |
홍승범 연구관 한병학 연구사 |
||||
|
비고 |
조류, 종자 수탁・분양 가능 |
세균, 곰팡이 위주로 수탁・분양 |
동물세포 위주로 수탁・분양 |
종자 수탁・분양 가능 |
||||
출처: 특허청
[표 4-8] 기탁기관별 기탁가능 미생물(2022.8.31.기준)
|
소재종류 |
기탁가능 미생물 종류 |
KCTC |
KCCM |
KCLRF |
KACC |
|
미생물소재 |
비병원성 세균 (Non-Pathogenic Bacteria) |
○ |
○ |
- |
○ |
|
방선균(Actinomycetes) |
○ |
○ |
- |
○ |
|
|
비병원성 진균류 (Non-Pathogenic Fungi) |
○ |
○ |
- |
○ |
|
|
비병원성 효모 (Non-Pathogenic Yeasts) |
○ |
○ |
- |
○ |
|
|
점균류(Molds) |
○ |
- |
- |
- |
|
|
동물 바이러스(Animal Virus) |
○ |
○ |
- |
- |
|
|
식물 바이러스(Plant Virus) |
○ |
○ |
- |
○ |
|
|
조류(Algae) |
○ |
- |
- |
- |
|
|
박테리오파지(Bacteriophages) |
○ |
○ |
- |
○ |
|
|
동물소재 |
사람세포(Human Cell Cultures) |
○ |
- |
○ |
- |
|
융합세포(Hybridomas) |
○ |
- |
○ |
- |
|
|
동물세포(Animal Cell Cultures) |
○ |
- |
○ |
- |
|
|
수정란(Embryos) |
○ |
- |
- |
- |
|
|
비기생성 원생동물 (Non-Parasitic Protozoa) |
○ |
- |
- |
- |
|
|
식물소재 |
식물세포(Plant Cell cultures) |
○ |
- |
○ |
- |
|
종자(Seeds) |
○ |
- |
- |
○ |
|
|
유전체소재 |
진핵생물 DNA (Eukaryotic DNA) |
○ |
- |
○ |
○ |
|
RNA |
○ |
- |
- |
- |
|
|
숙주 내 플라스미드 (Plasmids in Hosts) |
○ |
○ |
○ |
○ |
|
|
숙주 외 플라스미드 (Plasmids not in Hosts) |
○ |
○ |
○ |
- |
출처: 특허청
나. 서열목록 제출제도
서열목록 제출제도는 핵산염기 또는 아미노산 서열을 포함한 특허출원은 해당 서열이 포함된 서열목록을 수록한 전자파일을 특허출원서에 첨부하여 제출하도록 하는 제도이다. 핵산염기 서열 또는 아미노산 서열을 포함한 특허출원 증가에 대처하여 신속한 심사처리와 서열 데이터베이스 구축에 활용하기 위해 시행하고 있다. 서열목록의 작성은 특허청 고시에서 작성법 규정, 특허청 특허로 홈페이지 또는 WIPO에서 제공하는 WIPO Sequence를 이용하여 작성하는데 최근 세계지적재산권기구(World Intellectual Property Organization, WIPO)의 서열목록 작성요건의 표준이 ST.26으로 변경됨에 따라, 우리나라의 관련 규정인 특허법 시행규칙 제21조의 4(핵산염기 서열 또는 아미노산 서열을 포함한 출원 등, 2022.7.1.시행) 및 핵산염기 서열목록 또는 아미노산 서열목록 작성기준(특허청 고시 제2022-11호, 2022.7.1.시행)도 개정되었다.
4개 이상의 아미노산 또는 10개 이상의 핵산염기를 포함하는 2022년 7월 1일 이후의 출원10)은 서열목록을 세계지식재산기구 또는 특허청 홈페이지에 게시된 세계지식재산기구 표준 ST.26 XML을 사용한 핵산염기 및 아미노산 서열목록 제시를 위한 권장 표준에 따라 작성하거나 세계지식재산기구에서 제공하는 서열목록 작성 소프트웨어(WIPO Sequence)를 이용하여 작성한 서열목록전자파일11)을 첨부하여야 하며, 특허출원서에 서열목록전자파일이 첨부된 경우에는 명세서의 발명의 설명에 서열목록전자파일에 수록된 서열목록을 기재한 것으로 본다. 10개 미만의 핵산염기 서열이나 4개 미만의 아미노산 서열은 그 서열에 부여된 서열식별번호만을 서열목록전자파일에 포함시키고, 서열의 구체적인 내용은 명세서 또는 도면에 기재하여야 하는 것으로 변경되었다.
우리나라 특허청은 신속하고 효율적인 서열검색 및 서열목록 정보의 국제적 관리와 공유를 위해 세계 3대 서열목록 관리기관인 DDBJ(일본)12), GenBank(미국)13), EMBL(유럽)14)과 유기적인 협조 관계를 구축하고 있다. 특허청은 KOBIC15)을 통해 DDBJ에 서열목록 정보를 제공키로 합의함에 따라(2006.6월), 서열목록을 2개월 주기로 CD 형태로 KOBIC에 제공하고, KOBIC은 연 2회 DDBJ 측에 서열목록 정보를 제공하고 있다(2007.8월 이후).
다. 허가 등에 따른 특허권 존속기간 연장등록출원제도
의약품 및 농약은 특허발명을 실시하기 위해서 관련 기관의 허가나 등록(이하 ‘허가 등’)을 받아야 하고, 허가 등을 받기 위해서는 유효성 및 안전성 시험 등 관련 절차를 수행해야 한다. 이를 수행하는 데에 상당한 기간이 소요되고 특허권자는 그 기간만큼 특허발명을 실시할 수 없게 된다. 이런 경우 특허권 존속기간은 ‘설정등록 후 출원일로부터 20년’으로 변함이 없으므로 타 특허권자와 비교하여 형평성에 문제가 발생할 수 있다.
이러한 문제점을 해결하기 위해 일정한 조건을 만족하는 의약품 및 농약에 대하여 5년 범위에서 그 특허권의 존속기간을 1회에 한하여 연장해 주는 ‘허가 등에 따른 특허권 존속기간 연장등록출원제도(특허법 제89조)’를 마련하고 있다. 특허권 존속기간 연장등록출원은 주체, 대상 및 시기에 제한을 두고 있다(특허법 제91조). 연장등록 출원인은 특허권자이어야 하며, 특허권이 공유인 경우에는 공유자 전원이 공동으로 출원하여야 한다. 또한 그 발명을 실시하게 하기 위하여 다른 법령에 의하여 허가 등을 받을 필요가 있어야 하고, 그 허가 등을 위하여 필요한 유효성・안정성 등의 시험으로 인하여 장기간이 소요되는 발명이어야 한다. 그리고 특허권자 자신이 허가 등을 받았거나, 연장등록의 결정 전까지 전용 실시권자 또는 등록된 통상실시권자가 허가 등을 받았음을 확인할 수 있어야 한다.
연장등록출원의 대상이 되는 특허는 물질, 제법, 용도 및 조성물 특허이고 중간체, 촉매 및 제조 장치에 관한 특허는 제외되며 약사법 및 농약관리법에 따라 최초의 허가 등을 받은 유효성분이 특허청구 범위에 기재되어 있어야 한다. 연장의 대상이 되는 출원의 특허권은 특허청에 계속 중이어야 하고, 허가 등을 받은 날부터 3월 내, 존속기간 만료 전, 6월 내 연장등록출원을 해야 한다. 특허권 설정 후에도 허가기관에서 요구하는 임상시험 등에 시일이 소요되어 특허권을 실시하지 못했음을 입증하면 그 내용을 심사하여 연장등록 여부와 적정 연장 기간을 결정하고, 그에 따라 특허권의 존속기간이 연장된다.
현행 허가 등에 따른 특허권 존속기간 연장등록출원제도는 허가등록 후 연장 기간을 포함한 특허권 존속기간(유효 특허권 존속기간)의 상한(캡) 및 연장 가능한 특허권 수의 제한이 없어 제네릭 출시가 지연되는 경우가 발생하고, 이에 반하여 미국・유럽 등 주요국의 경우에는 유효 특허권 존속기간의 상한(캡) 및 연장 가능한 특허권 수를 제한하는 규정이 마련되어 있어 허가 등에 따른 특허권 존속기간 연장등록출원제도의 국제적인 조화가 필요한 상황이다. 특허청은 국민의 의약품 조기 접근성을 높이려는 차원에서 허가 등에 따른 특허권 존속기간 연장등록출원제도의 개정(안)을 마련하고 있다.
라. 유전자원의 접근・이용 및 이익공유에 관한 법률
생물다양성협약(Convention on Biological Diversity, CBD)은 생물다양성을 생태계, 종, 유전자 수준에서 파악하고 생물다양성의 보존, 생물자원의 지속가능한 이용 및 유전자원의 이용으로 발생하는 이익의 공정하고 공평한 공유를 목적으로, 1992년 리우 정상 회의에서 채택된 국제협약이다. 가입국의 생물다양성 보전을 위한 의무와 더불어, 타국 보유 유전자원에 접근할 때 해당국의 사전승인을 받도록 하는 제도(Prior Informed Consent, PIC)의 도입, 생명공학 기술 등 생물다양성 보전기술을 다른 가입국에게 이전 촉진, 유전자변형 생물체(living modified organisms, LMOs)의 안전한 국가 간 이동・관리를 위한 의정서 채택 검토, 개도국의 협약이행을 위한 재정지원 조항 등 생물다양성 보전을 위한 가입국 간 협력을 주요 내용으로 삼고 있다.
지식재산권과 연계한 유전자원 보호 방안에 대한 자원 제공국과 자원 이용국 간의 다자간, 양자 간 국제 논의16)가 활발히 진행 중인 가운데 제12차 생물다양성협약 당사국총회 및 제1차 나고야 의정서 당사국 회의(강원도 평창, 2014.10.)에서 유전자원 이용 시 이용자는 유전자원 제공국으로부터 사전통보승인(PIC)을 받아야 하고, 해당 유전자원 이용으로 발생한 이익을 상호 합의한 조건(Mutually Agreed Term, MAT)에 따라 공유하기로 결정되었다. 이에 따라 ‘유전자원에 대한 접근 및 그 이용으로부터 발생하는 이익의 공정하고 공평한 공유에 관한 생물다양성협약과 나고야 의정서’의 시행에 필요한 사항과 유전자원 및 이와 관련된 전통지식에 대한 접근・이용으로부터 발생하는 이익의 공정하고 공평한 공유를 위하여 필요한 사항을 정함으로써 생물다양성의 보전 및 지속가능한 이용에 기여하였다.
이어, 국민 생활의 향상과 국제협력 증진을 목적으로 유전자원의 접근・이용 및 이익공유에 관한 법률이 2017년 1월 17일에 제정되었다(법률 제14533호, 2018.8.18.시행).
한편, 나고야 의정서 이행법률의 제정 및 시행은 유전자원의 이용에 따른 이익공유가 의무화되고, 자원 부국의 국내 조치 강화로 해외 생물유전자원 확보・이용에 있어 우리나라 생명공학 산업계의 부담이 증가될 것으로 예상된다. 또한, 생물・유전자원 보호의 국제적인 움직임과 선진국의 기술이전 기피 현상은 이를 이용한 국내 생명공학 산업계의 기술개발에 부정적 영향을 미칠 수 있다. 이에 국내 고유 동・식물 자원과 유전자원의 보존 및 확보, 이를 이용한 생명공학 분야의 원천기술 개발의 계기로 삼아야 할 것이다. 정부는 국내 산업계의 피해를 최소화하기 위해 주요 자원 제공국과의 자유무역협정(Free Trade Agreement, FTA) 지재권 분야 협상 과정에 적극 대응하고, 바이오기업을 대상으로 유전자원 이용과 관련한 국제동향 홍보를 지속적으로 추진해야 한다.
최근 NGS와 같은 DNA 염기서열 분석기술이 개발되면서 유전자원의 디지털염기서열정보는 빠르게 데이터베이스에 축적되고 있고, 다양한 연구 및 산업 분야에서 활용되고 있다. 생명과학 분야 연구가 컴퓨터 프로그램을 활용한 대량의 유전자 염기서열 정보의 이용을 기반으로 발전하고 있어, 유전자원 디지털염기서열정보(DSI)를 이용할 때에 생물다양성협약과 나고야 의정서 상의 접근 및 이익공유 절차를 준수해야 하는지가 중요한 쟁점 중의 하나로 주목받고 있다. 따라서 지금까지 자유롭게 이용되던 유전자원 디지털염기서열정보가 나고야 의정서의 적용대상이 될 경우, 바이오 분야의 연구개발에 걸림돌로 작용할 수도 있다. 이러한 이유로 유전자원 디지털염기서열정보의 나고야 의정서 접근 및 이익공유 대상 여부가 선진국과 개도국 간에 첨예하게 대립 중이다.
4. 합성생물학 분야 특허분쟁 사례
가. 유전자가위 특허분쟁 사례
유전자가위는 유전체에서 원하는 부위의 DNA를 정교하게 잘라내는 기술로서 원하는 DNA에 결합하는 물질과 목표 부위를 정확하게 자르는 물질로 구성된다. 1세대 징크핑거(2003), 2세대 탈렌(2011), 3세대 크리스퍼(2012)를 거쳐 최근 프라임에디터(2019) 기술로 발전되었다. 샤르팡티에(佛)・다우드나(美) 그룹은 세균의 면역체계에서 침입 바이러스의 유전자를 자르는 구성을 원하는 유전자를 편집하기 위해 폭넓게 적용하는 3세대 유전자가위(CRISPR-Cas9) 시스템으로 확립하여 유전자가위 기술의 대중화를 이끈 공로로 2020년 10월에 노벨화학상을 수상하였다.
유전자가위를 이용한 유전자 편집은 유전질환・난치병 치료, 식품・환경 분야의 분자진단, 동식물의 품종개량이나 복원 등 다양한 분야에 적용할 수 있으며, 최근에는 고가의 실험장비 없이 5분 안에 코로나19를 진단하는 기술에도 응용되고 있으며 다양한 분자진단 분야에서 특이성과 민감도가 향상된 기술로 다수의 특허가 출원 중이다. 전 세계 유전자 편집 시장은 2022년 63억 5,000만 달러에서 2023년에는 74억 4,000만 달러에 이르고, 연평균 성장률(CAGR) 17.3%로 확대될 전망이다. 또한 2027년까지 연평균 성장률(CAGR) 17.7%로 성장하여 142억 8,000만 달러에 달할 것으로 예상된다.17) 최근 크리스퍼 테라퓨틱스(CRISPR Therapeutics)와 버텍스 파마슈티컬스(Vertex Pharmaceuticals)가 공동 개발 중인 유전자편집 치료제인 엑사셀(exa-cel)이 2023년 4월 미국 식품의약국(FDA)에 품목허가신청(BLA)을 완료할 것으로 전망되어 유전자가위 기술을 적용한 바이오의약품 시장이 본격적으로 열릴 것으로 기대되고 있다.
유전자가위는 살아있는 생명체의 유전자를 변형하는 기술이므로, 인간배아 유전자 편집에 대한 윤리적 이슈가 야기되고 있으나 생명체에 적용하는 허용 범위를 둘러싼 국내・외 가이드라인은 미비한 실정이며, 세계 과학자들이 대규모 국제회의18)를 통해 논의 중이다.
미국 다우드나 그룹(UC버클리)은 크리스퍼 유전자가위를 원핵세포에 적용한 2012년 5월 미국 특허청에 제출한 최초의 가출원을 바탕으로 2013년 3월 미국 특허청에 정식 특허를 출원하였으며 2019년 4월 등록되었다. 한국의 ㈜툴젠은 인간 세포에 크리스퍼 기술을 최초로 적용하여 2012년 10월 미국 특허청에 가출원하였고 이를 기초로 2013년 10월 국제출원 후 한국・호주에서 2016년 9월 등록되었으며, 2020년 12월에는 분할출원이 미국에서 등록되었다. 미국 브로드 그룹은 크리스퍼 기술을 진핵세포에 적용하여 2012년 12월 미국 특허청에 가출원하였으며, 신속심사 신청을 통하여 원천특허 그룹 중 가장 빠른 2014년 4월 특허가 등록되었다. 크리스퍼 원천특허는 세계적으로 3개의 연구그룹이 유사한 시기에 특허를 출원하여, 현재 미국과 유럽에서 권리범위와 우선권 주장 쟁점으로 다수의 소송이 진행 중이다.
UC버클리의 특허가 미국 특허청의 가출원일은 가장 빠르지만, 브로드연구소는 신속심사를 신청하여 2014년 4월 15일에 원천특허 그룹 중에서 가장 먼저 특허권을 획득하였다. 이에, UC버클리는 미국 특허청에 저촉심사(Interference)19)를 신청하여 ‘누가 선발명자인지에 대한 결정’을 요청하였다.
2015년 4월, UC버클리측은 원천기술을 발명하고 처음 특허를 낸 것은 다우드나 그룹이므로, 브로드연구소의 특허는 무효라고 주장했다. 그러나 2017년 2월 15일, 미국 특허청 특허심판 항소위원회(PTAB)는 브로드연구소의 특허가 UC버클리 특허보다 후출원이기는 하지만 진핵세포 유도 등에 대해 신규성이 있고 진핵세포에서 크리스퍼의 작동을 입증한 브로드연구소의 특허는 기술적으로 진보한 면이 있으므로 특허를 인정한다는 결정을 내렸다. 이에 대해 UC버클리가 불복하여 제기한 항소심에서도 원심대로 브로드연구소 특허의 진보성이 인정되어, 2018년 9월 10일, 브로드연구소의 특허가 UC버클리 특허를 침해하지 않는 것으로 판결하였다. 2019년 4월 다우드나 그룹의 원천특허가 등록된 후, UC버클리측은 2019년 6월 24일 다시 제2차 저촉심사를 신청하여 현재 심리 중이다.

출처: 저자 작성
[그림 4-3] 크리스퍼 특허분쟁 관련 주요 사건
유럽특허청(EPO)에서 2015년 2월 등록된 브로드연구소의 특허는 부적법한 우선권 주장20) 등을 이유로 이의신청이 제기되었으며, EPO는 해당 특허에 대해 주장된 우선권의 성립요건에 흠결이 있다고 판단하고, 이의신청인의 주장을 인용하여 2018년 1월 17일 해당 특허를 취소하였다. 이 사건의 경우, 브로드연구소 특허의 우선권을 주장의 기초가 된 미국 특허 일부의 출원인(승계인)이 해당 특허가 기반한 PCT 출원의 출원인과 일치하지 않음을 확인하여 우선권 주장에 흠결이 있음을 인정하였고, 이에 선출원과 해당 특허 출원일 사이에 공개된 발명으로 인해 신규성 또는 진보성이 결여된다고 판단하여 해당 특허를 취소하였다.
㈜툴젠의 특허는 진핵세포에 적용한 크리스퍼 발명으로는 미국 가출원일이 가장 빠르다. 미국 특허는 진보성을 이유로 거절되었으나, 미국 특허청 특허심판 항소위원회(PTAB)에서 승소하였으며, UC버클리와 브로드연구소를 상대로 2020년 12월 저촉심사에 진입하였다. ㈜툴젠의 특허는 미국의 저촉심사에서 유리한 위치(senior party21))을 점하였고, 가이드 RNA의 특징을 한정하여 기능을 향상한 분할출원은 2020년 12월 1일 등록되었다.
UC버클리, 브로드연구소와 ㈜툴젠은 미국, 한국, 유럽, 호주, 중국 등에서 자신의 특허에 대한 출원・ 등록 경쟁뿐만 아니라 상대방의 특허를 취소 또는 무효화하려는 공방을 치열하게 벌이고 있다. 최종 결론이 나려면 앞으로 수년 이상이 소요될 것이고, 특허 독립의 원칙에 따라 국가별로 서로 다른 결과가 나올 수도 있다.
나. NGS 분야 일루미나-BGI 특허분쟁 사례
2022년 7월, 미국 일루미나사와 중국 BGI(Beijing Genome Institute)간의 10여 년에 걸친 특허분쟁이 종료되었다. 양사는 전 세계 차세대 게놈 시퀀싱(NGS) 시장에서 경쟁을 벌이고 있는 선두 주자들로서, 2010년부터 차세대 유전체 해독 플랫폼 기술에 대해서 특허분쟁을 벌여왔다. 일루미나사는 2010년 NGS 장비의 세계 첫 상용화에 성공한 기업으로, 글로벌 유전체 분석 분야의 1위 업체이고 BGI는 산전 태아진단 분야의 세계 1위 기업이다. 소송의 결과로 일루미나사는 BGI 그룹에 3억 2,500만 달러를 지불하기로 합의하였다.
일루미나사와 BGI 그룹의 특허분쟁이 눈길을 끄는 이유는 NGS가 차세대 바이오패권의 중심기술 분야인 합성생물학 분야의 핵심기술로서, 분석된 게놈 데이터가 미-중 바이오데이터 패권전쟁으로 격화될 수 있다는 점이다. 바이오 빅데이터는 미래산업인 개인맞춤형 정밀의학 플랫폼 구축의 기반이 되며, 유전체 기술 및 데이터 블록화를 통한 바이오 빅데이터의 수집 및 처리의 결과가 새로운 산업장벽을 구축하고 있다. 미국은 BGI가 유전체 분석 서비스를 통해 60여 개국의 바이오 데이터를 중국이 수집하고 있다고 우려를 나타내고 있으며, 코로나19 팬데믹 중 6개 주의 중국 BGI 미국인 검체 확보를 불허한 바 있다. 중국은 2022년 9월 시행된 데이터보안법으로 자국의 바이오 데이터 반출을 원칙적으로 금지하고 있어 바이오 빅데이터에 대한 양국의 패권 다툼은 이미 진행 중이다.
최근 호주전략정책연구소(ASI)는 차세대 첨단기술에서 미국에 비하여 중국이 다수의 분야에서 우위를 점하고 있다는 결과를 발표하였다.22) 특히 바이오기술 분야 중 합성생물학 및 바이오제조에 있어 중국이 우위를 점하고 백신 및 의료 대응기술에 있어서는 미국이 우위를 점하고 있다는 분석을 내놓았다. 우리나라는 바이오제조 분야에만 세계 5위의 순위를 점하고 있어 합성생물학 등 차세대 바이오 선도 분야에 대한 정부의 지원과 인프라 구축이 절실한 상황이다.
|
|
|
제4장 생명공학 관련 법제도 현황 |
|
제5절 생명공학 제품 인허가 현황과 과제 |
가. 서론
(1) 최근 코로나19 발생 환경 대처
(가) 코로나 진단시약 긴급사용 승인 및 허가23)
2019년 12월 코로나19 발병 이후 코로나19의 감염 여부를 확인하기 위한 진단시약을 2020년 2월 식품의약품안전처(이하 식약처)와 질병관리청(이하 질병청)에서는 의료기기법 시행령 제13조2(감염병 대유행 등의 경우 의료기기 허가 등 면제 요청 절차)에 따라 ‘긴급사용승인’이라는 허가특례제도를 도입하였고, 2021년 2월 긴급사용을 종료하고 정식 허가 제품만 코로나19 확진 검사에 사용하게 하였다.
‘긴급사용’은 의료기기법 제46조의2(감염병 대유행 등의 경우 의료기기에 관한 특례)에 따라 감염병 대유행이 우려되어 긴급히 진단시약이 필요하나 국내에 허가제품이 없는 경우, 중앙행정기관의 장(질병관리청 포함)이 요청한 제품을 한시적으로 제조(수입) 및 판매 사용할 수 있게 한 특례 제도이다.
식약처와 질병청은 코로나19 발생 초기 진단시약 긴급사용을 신속 추진하여 확진용 7개 제품을 긴급사용승인 했으며, 이는 국내 코로나19 대규모 검사역량을 확보하는 기반이 되었다.
코로나19 긴급사용승인 진단시약은 질병청과 진단검사학회에서 임상 성능평가 자료를 제출하여 식약처 평가 후 승인하였는데, 최초 승인은 신청 후 7일 만에 2020년 2월 4일 이루어졌으며, 허가 규정에 맞게 자료를 갖추어 최초 정식 허가는 2020년 8월 31일에 이루어진 이래 2021년 2월 4일부터는 긴급사용승인받아 사용했던 유전자 PCR 검사시약(7개 품목) 사용을 종료하고 정식 허가받은 유전자 PCR 검사시약 제품으로 코로나19 검사를 시행하고 있다.
(나) 코로나 치료제 및 백신 개발 및 허가
전 세계적인 코로나19 팬데믹 공표 이후 백신 개발에 막대한 투자가 이루어졌고 그 결과 국내외 코로나19 예방 백신의 신속한 허가가 이루어졌다(국내 최초 허가 2021.2.10.). 특히 식약처에서는 ‘우리 백신 프로젝트’ 등과 같이 코로나19와 같은 신종 감염병 위기에 대비하기 위해 국산 백신의 연구개발에서부터 허가까지 백신 개발의 전 과정을 적극 지원하였다. 이를 바탕으로 2020년 이래로 백신과 치료제 개발 임상시험이 활발히 진행되었다.24)
식약처는 코로나19 백신 및 치료제 허가전담심사팀을 구성 운영(2020)하였고, 제조(수입)사가 제출한 자료에 대해 분야별 전문가의 심사결과와, 필요시 중앙약사심의위원회 등 외부 전문가의 의견을 종합하여 최종 허가하고 있는데, 식약처는 신속한 허가 심사를 통해 기존 처리 기간(180일 이상)을 단축하여 40일 이내에 처리하는 것을 목표로 하였다.25)
(2) 첨단 바이오 및 신개념 의료기기 규제 패러다임 변화
(가) 첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률(이하 첨단재생바이오법)26)
첨단재생바이오법이 2019년 8월 27일 제정되었고 2020년 8월 28일부터 시행되었다.
생명공학 기술의 발달로 최근 개발되고 있는 첨단바이오의약품은 살아있는 세포・조직 등을 원료로 하고 체내에 장기간 머무는 등 합성의약품과는 다른 특성을 가지므로, 안전성 및 유효성 검증, 채취 및 생산 등 과정, 사후관리 등에서 차별화된 평가 및 관리 방식이 필요하였다.
이에 원료 채취부터 시판 후 장기추적조사까지 전주기 안전관리체계를 구축하고, 기술 발전에 신속하게 대응하기 위해 약사법에서 분리해 별도 법률로 제정하게 되었다.
이 법 시행으로 첨단바이오의약품 원료 채취부터 최종 사용 단계까지 정부 책임하에 관리하게 되었고, 제제 특성을 반영한 허가 심사를 통해 안전성 및 유효성이 확보된 첨단바이오의약품이 공급되어 환자 안전 제고를 기대하게 되었다.
(나) 의료기기산업 육성 및 혁신의료기기 지원법27)
국내 의료기기 산업을 더 체계적으로 육성하고, 국민에게 새로운 치료 기회를 적기에 제공하기 위해 의료기기산업 육성 및 혁신의료기기 지원법을 제정(2019.4.30. 공포, 2020.5.1. 시행)하였다.
혁신의료기기란 혁신 기술의 적용이나 사용방법 등의 개선을 통해 기존의 의료기기나 치료법보다 안전성 및 유효성이 개선 또는 개선될 것으로 예상되는 의료기기를 말한다.
혁신의료기기에 포함되는 의료기기의 경우 식약처에 혁신의료기기 지정을 신청할 수 있으며, 혁신의료기기로 지정된 의료기기는 개발 단계별 심사 및 우선심사 등의 인허가 특례를 받을 수 있다.
사용 목적 및 원리 등이 신개념 의료기기인 경우 혁신의료기기로 신청을 하면 식약처에서는 보건복지부와 협의하여 혁신의료기기로 지정을 하고 혁신의료기기로 지정이 되면, (1단계) 제품설계, (2단계) 성능시험, (3단계) 임상시험계획, (4단계) 기술문서・임상시험 등 단계심사와 우선심사가 가능해져서 정확하고 신속한 허가가 가능해진다. 혁신의료기기 소프트웨어 제조기업 인증을 받은 업체의 경우는 해당 소프트웨어 인・허가 시 특례28)가 적용된다.
(다) 체외진단의료기기법29)
체외진단의료기기는 일반 의료기기와 달리 검체를 사용하여 체외에서 질병진단의 민감도 및 특이도 등을 검증하는 제품으로 특성에 맞는 허가 심사 및 관리체계가 필요하였다. EU 등 주요국에서도 체외진단의료기기의 별도 관리체계를 마련 운영하고 있어 우리나라에서도 질병 조기 발견과 맞춤형 치료를 통해 국민 의료비 지출 증가를 막고 환자의 치료 기회를 확대하기 위해 ‘체외진단의료기기법’을 제정(2019.4.30. 공포, 2020.5.1. 시행)하였다.
‘체외진단의료기기법’은 체외진단의료기기에 한정하여 적용이 필요한 규정을 정하고, 그 외의 사항은 ‘의료기기법’을 따른다.
체외진단의료기기의 GMP 품목군은 총 8개로 분류하는데, 검체 전처리 기기(Device for Sample Preparation), 임상화학 검사기기(Devices for Clinical Chemistry), 면역 검사기기(Devices for Clinical Immunology), 수혈의학 검사기기(Devices for Blood Transfusion), 임상미생물 검사기기(Devices for Clinical Microbiology), 분자진단기기(Devices for Molecular Diagnostics), 조직병리 검사기기(Devices for Immuno Cyto/Histo Chemistry), 체외진단 소프트웨어(IVD software) 등이다.
나. 바이오의약품 허가 현황 및 고찰
(1) 코로나19 백신
[표 4-9] 코로나19 백신 허가 현황(2023.2.22.기준)
|
개발사 |
아스트라제네카 |
얀센 |
화이자 |
모더나 |
노바백스 |
에스케이 바이오사이언스 |
|
플랫폼 |
바이러스벡터 백신 |
바이러스벡터 백신 |
mRNA백신 |
mRNA백신 |
합성항원백신 |
재조합백신 |
|
제품명 |
한국아스트라제네카 백스제브리아주 |
코비드-19백신 얀센주 |
코미나티주 (토지나메란) |
모더나코비드-19백신주 |
뉴백소비드 프리필드시린지 |
스카이코비원 멀티주 |
|
업체명 |
한국아스트라제네카㈜ |
㈜한국얀센 |
한국화이자㈜ |
㈜녹십자 |
에스케이바이오사이언스㈜ (위탁생산) |
에스케이바이오사이언스㈜ |
|
개발국 |
영국 |
미국 |
미국/독일 |
미국 |
미국 |
한국 |
|
접종 횟수 |
2회 |
1회 |
2회 |
2회 |
2회 |
2회 |
|
접종 대상 |
18세 이상 |
18세 이상 |
12세 이상 |
18세 이상 |
12세 이상 |
18세 이상 |
|
접종 간격 |
4주∼8주 |
- |
21일 |
28일 |
3주 |
4주 |
|
보관조건 |
2∼8°C(6개월) |
-20°C(24개월) 2∼8°C(3개월) |
-75±15°C(6개월) -20±5°C(2주) 2∼8°C(1개월) |
-20°C(6개월) 2∼8°C(30일) |
2∼8°C(12개월) |
2∼8°C(12개월) |
|
국내허가 |
2021.2.10. (제조품목) 2021.5.21. (수입품목) |
2021.4.7 |
2021.3.5 |
2021.5.21 |
2022.1.12 |
2022.06.29 2022.06.29. |
출처: 1) 식품의약품안전처, 식약처 코로나19 백신 치료제 정보, https://www.mfds.go.kr/vaccine_covid19.jsp(확인일: 2023.02.22.) 2) 식품의약품안전처, 의약품안전나라 > 의약품 등 정보 > 의약품 등 정보검색, https://nedrug.mfds.go.kr/searchDrug
미국 및 유럽에서는 많은 환자를 대상으로 임상시험을 신속하게 이루어냈고 우리나라도 수입 백신이 2021년 2월에 허가, 국내 개발 백신이 2022년 6월에 허가되었다.
2021년 코로나19 치료제・백신 임상시험은 32건으로, 코로나19 상황이 지속됨에 따라 관련 임상시험도 전년도 37건과 유사한 수준으로 수행되었다.30)
식약처는 생물학적 제제 중 국가 필수예방접종에 사용되는 백신의 안정적 공급을 지원하기 위해 질병청과 업무 협의체를 구성 운영하며, 필요 수요 대비 공급 가능한 수량을 모니터링하고 원활한 공급을 위해 대한의사협회, 대한병원협회 등 관련 단체 등을 대상으로 공급 가능한 생물학적 제제의 정보, 허가사항 등을 제공하거나 관련 제조 수입사로 하여금 공급 중단 사유 및 공급 재개 계획 등을 알리도록 요청할 수 있게 하였다.31)
(2) 코로나19 치료제
[표 4-10] 코로나19 치료제 허가 현황(2023.2.22.기준)
|
|
업체명 |
제품명 |
허가일자 |
분류 |
비고 |
|
1 |
길리어드사이언스 코리아(유) |
베클루리주정맥주사용 동결건조분말(렘데시비르) |
2020.7.24. |
항바이러스제 |
신물질 |
|
2 |
㈜셀트리온 |
렉키로나주960mg(레그단비맙) (단클론항체, 유전자재조합) |
2021.2.5. |
항바이러스제 (중화항체치료제) |
신물질 |
출처: 식품의약품안전처, 식약처 코로나19 백신 치료제 정보, https://www.mfds.go.kr/vaccine_covid19.jsp(확인일: 2023.02.22.)
2023년 2월 22일 기준, 국내에서 코로나19 치료제로 허가된 품목은 2개 품목이다. 렉키로나주는 코로나19 완치자의 혈액에 존재하는 중화항체 유전자를 선별하여 유전자 대량 생산이 가능한 숙주세포에 삽입(재조합)하고, 세포배양을 통해 대량 생산한 유전자재조합 중화항체 치료제이다. 렉키로나주는 국내 개발 의약품으로는 최초로 허가받은 코로나19 치료제 및 전 세계에서 세 번째로 규제 당국의 검증을 받은 코로나19 항체치료제이며, 식약처는 3상 임상시험 결과 제출을 조건으로 품목 허가를 결정하였다.32)
(3) 코로나19 치료제 및 백신 임상시험 현황 및 신속 허가 지원
코로나19 감염이 확산되면서 치료제와 백신 개발을 위한 임상시험 승인이 활발히 이루어졌다. 코로나19 백신은 첫 허가(한국아스트라제네카코비드-19백신주)가 2021년 상반기였고, 치료제의 경우 신물질 또는 약물 재창출(국내에 다른 효과로 허가받은 의약품을 코로나19 치료에 사용)을 통한 임상 2・3상까지 승인 신청한 건이 많았다. 2020년 이후 2022년 4월 27일 기준 코로나19 치료제의 제약사 주도 임상시험 현황은 총 29개 품목(진행 중 10개 품목), 코로나19 백신의 경우 총 12개 품목이 수행(진행 중 7개 품목) 되었다.33)34)
2021년 2월 아스트라제네카 백신이 허가되기 전까지 식약처에서 제시한 코로나19 치료제와 백신 개발을 위한 가이드라인은 미국 FDA나 WHO 가이드라인과 유사하였다.35)
식약처에서는 코로나19 치료제 및 백신 개발 시 시행착오를 줄이고 신속한 제품화에 도움을 주기 위해 연구개발, 임상시험 등에 대한 상담사례를 담은 ‘코로나19 치료제 백신 개발 상담사례집’을 발간 배포(2022.7.) 하였고, 코로나19 치료제 백신의 주요 상담사례를 품질, 비임상, 임상 분야별 질의응답 형식으로 추가하였다.36)37)
(4) 바이오의약품 허가 현황
(가) 신약 및 희귀의약품
2018년 저조했던 신약 허가 건수가 2021년에는 37개 품목이 허가돼 증가 추세를 유지하고 있으며, 그 중 수입 신약은 29개, 국내 제조 신약은 8개 품목이 허가되었다.38)
그중 생물의약품은 11개 품목(제조 3개 품목, 수입 8개 품목), 첨단바이오의약품 2개 품목(수입 2개 품목)이 허가되었으며, 코로나19 치료제 또는 백신, 항악성종양제 등이다. 또한 2021년에는 희귀질환 또는 생명을 위협하는 질환 치료 목적의 희귀 의약품이 22개 품목 허가받았고, 그중 생물의약품은 4개 품목이었다.
[표 4-11] 바이오신약 및 희귀의약품 허가 동향
|
구분 |
2018 |
2019 |
2020 |
2021 |
|
바이오신약/총 허가신약 |
4/15 |
7/35 |
4/40 |
11/37 |
|
바이오희귀/총 희귀의약품 |
3/21 |
3/11 |
14/28 |
4/22 |
출처: 식품의약품안전처, 2021년 의약품 허가보고서, 2022.04
(나) 바이오시밀러
국내 개발 바이오시밀러 허가는 2018년부터 2021년까지 2∼3개 성분 수준이었다.39)
[표 4-12] 바이오시밀러 허가 현황(2018∼2021)
|
연번 |
제품명 |
회사명 |
대조약 (성분명) |
효능 효과 (일부요약) |
허가 일자 |
제조/수입 |
|
1 |
에톨로체50밀리그램 프리필드펜주 |
삼성바이오에피스㈜ |
엔브렐 (에타너셉트) |
류마티스관절염, 건선 등 |
2019-08-19 |
수입 (국내 개발) |
|
2 |
테로사카트리지주 |
㈜대원제약 |
포스테오 (테리파라타이드) |
골다공증 |
2019-10-29 |
수입 |
|
3 |
팬포틴프리필드시린지주 2000IU |
㈜팬젠 |
이프렉스 (재조합인에리스로 포이에틴) |
만성신부전환자의 빈혈 |
2019-11-28 |
제조 |
|
4 |
팬포틴프리필드시린지주 4000IU |
제조 |
||||
|
5 |
아달로체프리필드펜주 40밀리그램 |
삼성바이오에피스㈜ |
휴미라주40밀리그램 (아달리무맙) |
류마티스관절염, 건선성 관절염 등 |
2020-07-03 |
수입 (국내 개발) |
|
6 |
오기브리주150밀리그램 |
알보젠코리아㈜ |
허셉틴주 (트라스투주맙) |
유방암, 위암 |
2020-08-26 |
수입 |
|
7 |
삼페넷주440밀리그램 |
삼성바이오에피스㈜ |
허셉틴주 (트라스투주맙) |
유방암, 위암 |
2020-10-14 |
수입 (국내 개발) |
|
8 |
벰폴라프리필드펜 |
㈜유영제약 |
고날-에프펜주 (폴리트로핀알파) |
난소과자극 , 무배란증 |
2020-10-29 |
수입 |
|
9 |
온베브지주 |
삼성바이오에피스㈜ |
아바스틴 (베바시주맙) |
전이성직결장암 등 |
2021-03-11 |
수입 (국내 개발) |
|
10 |
자이라베브주 |
한국화이자제약㈜ |
아바스틴 (베바시주맙) |
전이성직결장암 등 |
2021-05-17 |
수입 |
|
11 |
싸이트로핀에이카트리지주 15mg |
싸이젠코리아㈜ |
지노트로핀 (소마트로핀) |
소아의 성장부진 등 |
2021-07-09 |
수입 |
|
12 |
유플라이마프리필드시린지주 40mg/0.4ml |
㈜셀트리온 |
휴미라40mg/0.4ml (아달리무맙) |
류마티스관절염, 건선성 관절염 등 |
2021-10-15 |
수입 (국내 개발) |
|
13 |
유플라이마펜주 40mg/0.4ml |
수입 (국내 개발) |
||||
|
14 |
본시티펜주 |
㈜한국팜비오 |
포스테어 (테리파라타이드) |
골다공증 |
2021-11-16 |
수입 |
출처: 식품의약품안전처, 2021년 의약품 허가보고서, 2022.4.
(5) 첨단바이오의약품
2001년 국내에서 개발한 ‘콘드론’이 국내 최초 세포치료제로 품목 허가를 받은 이후 현재까지 총 16개의 제품이 허가되었고, 2020년 8월 28일부터 첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률 시행에 따라 자진취하한 1개 품목을 제외한 기허가된 세포치료제 전체 품목(15개)이 첨단바이오의약품으로서 재허가를 받았다. 즉, 첨단바이오의약품 특성에 따라 세포 채취부터 판매 후 장기추적조사까지 전 주기적 안전관리체계가 맞춤형으로 실시되었다.
[표 4-13] 세포치료제 및 유전자치료제 허가현황(2001~2021)
|
연번 |
제조/수입 |
제품명 |
성분명 |
업체명 |
허가 일자 |
효능 효과 (일부 요약) |
비고 |
|
■ 세포치료제 |
|||||||
|
1 |
제조 |
콘드론 |
자기유래 연골세포 |
셀론텍 |
2001-01-30 (재허가 2021-08-26) |
무릎관절의 부분적 연골결손 환자(결손 부위 크기: 단독병변의 경우 15㎠이하, 다발성의 병변의 경우 20㎠이하)의 치료 |
|
|
2 |
제조 |
홀로덤 |
자가유래 피부각질세포 |
테고사이언스 |
2002-12-10 (재허가 2021-08-27) |
1. 심한 이도화상이 체표면적의 30% 이상을 차지하는 화상, 2. 삼도화상이 체표면적의 10% 이상을 차지하는 화상에 이식하여 기능적인 표피층이 생성되도록 한다. |
|
|
3 |
제조 |
칼로덤 |
사람유래 피부각질세포 |
테고사이언스 |
2005-03-21 (재허가 2021-08-27) |
1. 심부 이도화상의 재상피화 촉진, 2. 혈액공급이 원활하고 감염증 소견이 없는 당뇨성 족부궤양의 상처 치유 촉진 |
|
|
4 |
제조 |
케라힐 |
자가유래 피부각질세포 |
바이오솔루션 |
2006-05-03 (재허가 2021-08-25) |
1. 심한 이도화상으로 체표면적의 30% 이상을 차지하는 화상, 2. 삼도화상이 체표면적의 10% 이상을 차지하는 화상에 이식하여 기능적인 표피층이 생성되도록 한다. |
|
|
5 |
제조 |
크레아박스- 알씨씨주 |
자가유래 수지상세포 |
제이더블유 크레아젠 |
2007-05-15 (취하 2021-08-27) |
신적출술이 가능한 전이성 신세포암 |
수출용 |
|
6 |
제조 |
이뮨셀엘씨주 |
활성화 티림프구 |
지씨셀 |
2007-08-06 (재허가 2021-08-27) |
간세포암 제거술(수술, 고주파 정제술, 경피적 에탄올 주입술) 후 종양 제거가 확인된 환자에서 보조요법 |
|
|
7 |
제조 |
알엠에스 오스론 |
자기유래 뼈세포 |
셀론텍 |
2009-08-26 (재허가 2021-08-06) |
국소 골형성 촉진 |
|
|
8 |
제조 |
퀸셀 |
자가지방조직유래 최소조작 지방세포 |
안트로젠 |
2010-03-26 (재허가 2021-06-09) |
피하지방 결손 부위의 개선 |
|
|
9 |
제조 |
큐어스킨 |
자가유래피부 섬유아세포 |
에스바이오 메딕스 |
2010-05-11 (재허가 2021-07-29) |
피하지방 결손 부위의 개선 |
|
|
10 |
제조 |
하티셀그램- 에이엠아이 |
자가골수유래 중간엽줄기세포 |
파미셀 |
2011-07-01 (재허가 2021-08-26) |
흉통 발현 후 72시간 이내에 관상동맥성형술을 시행하여 재관류된 급성 심근경색 환자에서의 좌심실구혈률의 개선 |
|
|
11 |
제조 |
카티스템 |
동종제대혈유래 중간엽줄기세포 |
메디포스트 |
2012-01-18 (재허가 2021-08-19) |
퇴행성 또는 반복적 외상으로 인한 골관절염 환자(ICRS grade IV)의 무릎 연골결손 치료 |
|
|
12 |
제조 |
큐피스템 |
자가지방유래 중간엽줄기세포 |
안트로젠 |
2012-01-18 (재허가 2021-08-24) |
크론병으로 인한 누공 치료 |
희귀 |
|
13 |
제조 |
뉴로나타-알주 |
자가골수유래 중간엽줄기세포 |
코아스템 |
2014-07-30 (재허가 2021-08-27) |
리루졸과 병용하여 근위축성 측삭경화증의 질환 진행 속도 완화 |
희귀 |
|
14 |
제조 |
케라힐-알로 |
동종피부유래 각질세포 |
바이오솔루션 |
2015-10-16 (재허가 2021-08-25) |
심부 2도 화상의 재상피화 촉진 |
|
|
15 |
제조 |
로스미르 |
테고자가피부유래섬유아세포 |
테고사이언스 |
2017-12-27 (재허가 2021-08-24) |
중등도 이상의 비협골 고랑의 개선 |
|
|
16 |
제조 |
카티라이프 |
바솔자가연골유래 연골세포 |
바이오솔루션 |
2019-04-24 (재허가 2021-07-22) |
무릎 연골결손 (ICRS grade Ⅲ 또는 Ⅳ, 결손면적 2 내지 10 cm2) 의 치료 |
|
|
■ 유전자치료제 |
|||||||
|
1 |
수입 |
킴리아주 |
티사젠렉류셀 |
한국노바티스 |
2021-03-05 |
1. 25세 이하의 소아 및 젊은 성인 환자에서의 이식 후 재발 또는 2차 재발 및 이후의 재발 또는 불응성 B세포 급성 림프성 백혈병의 치료 2. 두 가지 이상의 전신 치료 후 재발성 또는 불응성 미만성 거대 B세포 림프종 성인 환자의 치료 |
희귀 신약 |
|
2 |
수입 |
졸겐스마주 |
오나셈노진 아베파르보벡 |
한국노바티스 |
2021-05-28 |
Survival Motor Neuron 1(SMN1) 유전자에 이중대립형질 돌연변이가 있는 척수성 근위축증 환자에서 다음 중 어느 하나에 해당하는 경우 : - 제1형의 임상적 진단이 있는 경우 - Survival Motor Neuron 2(SMN2) 유전자의 복제수가 3개 이하인 경우 |
희귀 신약 |
|
3 |
수입 |
럭스터나주 |
보레티진 네파보벡 |
한국노바티스 |
2021-09-09 |
이중대립유전자성(biallelic) RPE65 돌연변이에 의한 유전성 망막디스 트로피로 시력을 손실하였으며, 충분한 생존 망막 세포를 가지고 있는 성인 및 소아의 치료 |
희귀 |
출처: 식품의약품안전처, 2021년 의약품 허가보고서, 2022.4.
다. 신개념 의료기기 허가현황 및 고찰
(1) 코로나19 진단시약40)
2023년 2월 17일 기준 코로나19 진단시약 정식 허가는 모두 137개 제품으로 PCR 검사 52개, 항원 검사 61개, 항체 검사 24개이다.
코로나19 진단시약은 검체 내의 바이러스 유무를 확인하는 ‘유전자 진단시약(RT-PCR)’, ‘항원 진단시약’과 검체 내의 바이러스에 대한 항체 유무를 확인하는 ‘항체 진단시약’ 등 3종류가 있다.
‘유전자 진단 시약’은 환자 검체 내의 바이러스 유전자를 증폭하는 ‘분자진단(RT-PCR) 방식’으로, 바이러스 유무를 확인, 감염 여부를 진단한다. 이 방식은 과학적으로 가장 정확도가 높아 코로나19 확진용으로 사용하고 있다. ‘RT-PCR 방식’은 비인두와 구인두 가검물 등 환자 검체에 포함된 미량의 바이러스 유전자를 분리, 이를 증폭해 바이러스 유무를 확인하는 방법이다.
‘항원 진단시약’은 바이러스의 특정 단백질을 인식, 검체 내의 바이러스 유무로 감염 여부를 확인하며, 바이러스 감염에 대한 면역반응으로 만들어진 항체의 생성 여부를 확인하는 제품이다. 항체가 생성되기 이전 초기 감염단계일 땐 음성으로 진단될 수 있으며 검사 당시의 검체 내 바이러스 유무를 직접 확인하기엔 어려움이 있다.
[표 4-14] 내수용 및 수출용 코로나19 진단시약 허가현황(2021)
(단위: 건수)
|
구분 |
정식 허가(내수용) |
수출용 허가 |
||||
|
PCR |
항원 |
항체 |
PCR |
항원 |
항체 |
|
|
2021년 |
24 |
20 |
13 |
62 |
45 |
49 |
|
총계 |
57 |
186 |
||||
출처: 식품의약품안전처, 2021년 의료기기 허가 보고서 발간 보도자료, 2022.5.
(2) 인공지능(AI)기반 의료기기 개발 급증
인공지능 기술을 활용한 ‘인공지능(AI) 기반 의료기기’ 수는 2017년 이후 꾸준히 허가되고 있었다.41)42) 2021년 인공지능 의료기기 허가 37건 중 91.9%(34건)을 국내 제조업체가 차지하여 해당 분야에서의 국내 업체가 강세다.
이와 같이 인공지능 기반 의료기기 개발이 급증한 데는 정부가 전문가 협의체를 통해 개발 요구가 있는 분야에 대한 가이드라인을 선제적으로 제공한 역할이 컸다.43)
(3) 융복합 의료기기 증가
융복합 의료기기(복합・조합 품목)의 2021년 허가 건수는 20건으로, 제조 13건(65%), 수입 7건(35%)이었다.44) 대표적인 융복합 의료기기(복합・조합 품목)에는 조직수복용 생체재료, 스텐트, 비이식형 혈관접속용 기구 등이 있으며, 의료기기에 의약품의 효과(국소 마취, 감염방지, 항균 등)를 추가하여 환자 치료에 도움을 주는 제품이 꾸준하게 개발되는 것으로 나타났다.
최근 생명공학, 로봇 기술, 사물인터넷 등 첨단 융복합 기술을 접목한 의료기기 개발이 활발히 이루어지고 있고, 2015년부터 제품화 지원을 위해 운영하던 범부처 협의체 활동에 추가적으로 4개의 의료기기 전문학회(대한의용생체공학회, 한국생체재료학회, 대한의료인공지능학회, 대한의료정보학회)와 식약처가 연합하여 ‘의료기기 규제과학위원회’를 구성(2019.8.27.), 첨단의료기기 및 혁신의료기기 개발을 선제적으로 지원, 정보를 공유하고 있다.
|
|
|
제4장 생명공학 관련 법제도 현황 |
|
제6절 생명공학기업 현황과 지원제도 |
1. 국내외 바이오기업 현황
가. 글로벌 상장 바이오헬스케어기업 현황
(1) 글로벌 시가총액 상위 바이오제약 기업
글로벌 바이오헬스 시장조사기관인 EvaluatePharma에 따르면, 2022년 전 세계 상장 700개 바이오제약기업 중 시가총액 2억 5,000만 달러 이상인 기업들의 시가총액은 2021년 5조 6,360억 달러보다 2,480억 달러가 감소한 5조 3,880억 달러로 나타났다.
대기업 중에는 미국 Merck의 경우 면역항암제 키트루다로 인해 가장 큰 상승폭을 보였다. 미국 Lilly 및 Abbvie, 일본 Daiichi Sankyo도 보유 신약의 잠재성으로 상승했고, 일본 Takeda와 미국 Vertex는 시가가 회복세에 있다.
중견기업의 경우 Sarepta는 개발 중인 유전자치료제의 FDA 허가 기대감에 상승했고, Halozyme의 경우도 블록버스터 항암 항체치료제로, 핀란드의 Orion사도 전립선암 치료제 후보물질에 대한 기대감에 상승했다.
중소기업의 경우 Verona는 COPD 임상데이터로, Madrigal은 NASH 치료제로, Rhythm은 희귀질환치료제의 미국 및 유럽 승인에 따라 시가총액이 상승했다.
이와는 반대로 2021년 코로나19 백신으로 시가총액이 급상승했던 Biontech, Moderna, Novavax, Curevac 등은 급격히 하락했다. 다국적 기업에서는 Roche가 알츠하이머 치료제에 대한 실패로, GSK는 잔탁(Zantac) 소송 등으로 시가총액이 각각 23%, 11% 하락했다.
[표 4-15] 기준 글로벌 시가총액 상승 바이오제약기업(2022)
(단위: %, 억 달러)
|
구분/기업명 |
시가 상승률 (2022년 1월-12월) |
시가 상승액 (2022년 1월-12월) |
시가총액 (2022년 12월 30일) |
|
다국적 제약사 |
|||
|
Merck & Co |
45% |
877 |
2,810 |
|
Lily |
32% |
834 |
3,480 |
|
Abbvie |
19% |
464 |
2,860 |
|
시가총액 대기업 |
|||
|
Daiichi Sankyo |
45% |
155 |
655 |
|
Vertex |
32% |
183 |
741 |
|
Takeda |
31% |
79.5 |
515 |
|
시가총액 중견기업 |
|||
|
Sarepta |
44% |
35.3 |
114 |
|
Halozyme |
42% |
20.3 |
76.9 |
|
Orion |
42% |
19.3 |
78.1 |
|
시가총액 소기업 |
|||
|
Verona Pharma |
289% |
15.7 |
19.8 |
|
Madrigal |
243% |
35.2 |
49.6 |
|
Rhythm |
192% |
11.4 |
16.4 |
출처: Evaluate, Biopharma and Medtech Review 2022, 2023.2.
2022년 글로벌 바이오제약기업에 대한 벤처 투자는 전년에 비해 큰 폭으로 하락했다. 글로벌 벤처투자는 2018년 182억 달러, 2018년 157억 달러, 2020년 226억 달러, 2021년 285억 달러로 지속 증가 추세에 있었으나 2022년에는 217억 달러로 전년에 비해 68억 달러 감소했다.
(2) 글로벌 시가총액 상위 의료기기 기업
가장 큰 폭으로 시가총액이 상승한 의료기기 기업에는 인슐린펌프 Omnipod5를 보유한 Insulet이 11% 상승했고, 매출이 확대된 Boston Scientific이 9%, Johnson and Johnson에 인수된 Abiomed가 6% 증가했다.
중견기업 중에 시가총액이 상승한 기업에는 Haemonetics, Welgao, Convatec이 각각 48%, 32%, 15% 증가했고, 중소기업 중에 시가총액이 상승한 기업에는 EDAP, Bonesupport, Meridian Bioscience가 각각 88%, 83%, 63% 증가했다.
[표 4-16] 2022년 기준 글로벌 시가총액 상승 상위 의료기기 기업
(단위: %, 억 달러)
|
구분/기업명 |
시가 상승률 (2022년 1월-12월) |
시가 상승액 (2022년 1월-12월) |
시가총액 (2022년 12월 30일) |
|
시가총액 대기업 |
|||
|
Insulet |
11% |
21 |
204 |
|
Boston Scientific |
9% |
57 |
663 |
|
Abiomed |
6% |
8 |
172 |
|
시가총액 중견기업 |
|||
|
Haemonetics |
48% |
13 |
40 |
|
Weigao Group |
32% |
17 |
74 |
|
Convatec |
15% |
9 |
61 |
|
시가총액 중소기업 |
|||
|
EDAP TMS |
88% |
1.8 |
3.8 |
|
Bonesupport |
83% |
2.2 |
5.4 |
|
Meridian Bioscience |
63% |
5.6 |
14.5 |
출처: Evaluate, Biopharma and Medtech Review 2022, 2023.2.
이와는 반대로 시가총액이 급락했던 기업도 많았다. 대기업 중에는 Align Technology, Phillips, Sysmex가 각각 68%, 57%, 49% 감소했고, 중견기업에서는 원격의료로 큰 주목을 받았던 Teledoc Health가 Livongo 인수에 실패하면서, 액체생검 기업인 Guardant Health가 결장암에 대한 실망스러운 임상결과로 각각 74%, 73%라는 큰 폭의 하락세를 보였다. 의약품 및 의료기기 모두 시가총액이 하락했지만 의료기기 분야 기업들의 하락폭이 컸다.
나. 국내 바이오기업 현황
(1) 국내 바이오기업 현황
통계청 승인 국내 바이오산업 통계인 ‘국내 바이오산업 실태조사’를 보면 2021년 기준 총 1,055개의 바이오기업이 있다. 이들 기업의 바이오산업 생산실적은 20조 9,983억 원으로 전년 대비 22.1% 증가하였다. 국내 판매와 수입을 합한 내수시장 규모는 13조 9,077억 원으로 전년 대비 45.2% 증가하였다.
산업통상자원부가 2023년 1월 발표한 2022년 국내 바이오헬스(의약품+의료기기) 수출액은 163억 달러로 전년도 162억 달러에 비해 소폭 증가했다. 코로나19 엔데믹에 따라 진단키트 및 백신 수출이 하락했으나 바이오시밀러 등 바이오의약품과 영상진단기기의 수출 호조로 전년수준으로 수출이 유지되었다.
(2) 국내 의약품 기업 현황
식품의약품안전처 자료에 따르면 2021년 기준으로 의약품을 생산하는 기업은 609개 사로 이 회사들이 2만 7,395개의 품목을 생산하고 있다. 원료의약품이나 완제의약품을 생산하는 기업이 478개소, 한약재를 생산하는 기업이 131개소가 있다. 2021년 기준 의약품 생산 규모는 25조 4,906억 원에 달하며 전년에 비해 3.8% 증가하였다.
국내 바이오의약품 제조기업(생산실적 보고 기준)은 총 67개 사였다. 바이오의약품 생산실적은 4조 7,398억 원으로 전년 대비 20.6% 증가하였고 최근 5년간 연평균 16.2% 증가 추세에 있다. 2021년 기준 국내 바이오의약품 시장 규모는 7조 111억 원으로 전년도 3조 3,029억 원 대비 112.3% 증가하였다. 이는 코로나19 백신 및 치료제(항체의약품)의 신규 생산 및 수입실적이 급증한 데에 기인한 것으로 분석된다. 바이오의약품 중 가장 큰 비중을 차지하고 있는 유전자재조합의약품 시장 규모는 1조 8,845억 원으로 전년 대비 39.8%라는 큰 폭의 증가를 보였다.
(3) 국내 의료기기 기업 현황
식품의약품안전처 자료에 따르면 2021년 기준으로 의료기기를 생산하는 기업은 4,085개 사로 이 기업들이 1만 7,433개의 품목을 생산하고 있다. 2021년 기준 의료기기 생산 규모는 12조 8,831억 원으로 전년에 비해 27.1% 증가하였다. 이중 체외진단의료기기 생산액은 33.8% 비중을 차지하고 있다.
2. 바이오기업 지원 제도
가. 바이오헬스 신시장 창출 지원
2023년 2월 대통령 주재 범부처 바이오헬스 신시장 창출 전략회의가 개최되었다. 바이오헬스 및 디지털 헬스케어 육성방안을 마련하라는 대통령의 지시에 따라 정부는 디지털 신시장 창출, 바이오헬스 수출 활성화라는 목표 달성을 위해 5대 핵심과제로 구성된 바이오헬스 신시장 창출 전략을 수립하였다.
5대 핵심과제로는 데이터 기반 의료・건강・돌봄 통합서비스 제공, 바이오헬스 수출 활성화, 첨단 융복합 기술 연구개발 강화, 바이오헬스 첨단 전문인력 양성, 창업 지원 강화, 법제도 및 인프라 구축이 제시되었다. 바이오헬스 수출 활성화의 목표로는 향후 5년 내 연 매출 1조 원 이상의 블록버스터급 신약 2개 창출과 의료기기 수출 약 2배 달성을 통해 글로벌 바이오헬스 강국 도약이 제시되었으며, 이를 위해 연구개발 투자 확대, 개방형 혁신, 제도 개선, 해외 현지 거점 확대, 규제 협력 등이 지원될 계획이다.
나. 코로나19 백신 및 치료제 개발 지원
정부는 2020년 4월부터 ‘코로나19 치료제・백신 개발 범정부지원위원회’를 설치하여 국산 코로나19 치료제 및 백신의 신속개발을 지원하고 있다. 정부는 코로나19 상황에서 새로운 백신 플랫폼으로 떠오른 mRNA 백신에 대해 국내 기업들이 신속하게 개발할 수 있도록 부처별로 역할을 나누어 지원하고 있다. 과학기술정보통신부는 핵심 원천기술 개발, 질병관리청은 비임상 후보물질 발굴・효능검증, 보건복지부는 임상시험 지원, 산업통상자원부는 원자재・생산기술 기반 구축, 식품의약품안전처는 안전성 및 유효성 품질평가 기술, 특허청은 특허분석 및 특허 회피 전략 수립 등을 지원하고 있다.
한편, 기업 간 생산 및 기술 협력, 원부자재 공동 활용 등 협력체계 구축을 위해 2021년 6월부터 백신기업 협의체가 구성・운영되고 있다. 글로벌 백신 허브화 추진단에서는 기업애로 지원센터를 운영하고 있으며, 가이드북 발간을 통해 백신・치료제 개발 현장에 필요한 정부 지원제도를 안내하고 있다. 2022년 12월에 발간된 가이드북에 담긴 백신・치료제 지원 부분은 백신・치료제 개발, 생산역량 확충, 투자유치 및 글로벌 진출, 백신 산업 생태계 조성 등 기업 경영활동에 따라 구분되어 있다.
[표 4-17] 백신・치료제 주요 지원 제도
|
구분 |
주요 제도(사업) |
|
백신・치료제 개발 |
• 감염병 예방・치료 기술개발사업, 바이오・의료기술개발사업 • 신・변종 감염병 대응 mRNA백신 임상지원사업, 공공백신 개발 지원 • 신속범용백신기술개발 사업, 차세대 의료연구기반 육성사업 • 신기술 기반 백신 플랫폼 개발지원사업, 백신 기반 기술개발사업 • 미래성장 고부가가치 백신개발사업, 지재권 연계 연구개발 전략지원사업 • RNA바이러스감염병(Disease X) 대비 항바이러스 치료제 개발사업 • 백신 실증지원센터 활용 지원, K-바이오 백신 펀드 등 |
|
생산역량 확충 |
• 백신 실증지원센터 활용 지원 • 의약품 업종 특화 스마트공장 구축 지원사업 • 제약 스마트공장 기반이 되는 QbD 인재양성 및 컨설팅 • 백신・원부자재・장비 성능시험 지원사업 등 |
|
투자유치 및 글로벌 진출 |
• 첨단투자지구, ADB 민간금융 지원제도 활용 지원 • 제약산업 전주기 글로벌 진출 강화지원 사업 • 바이오・의료 해외 진출 지원사업, 글로벌 바이오파마 플라자 • 국제 지재권 분쟁 대응전략 지원사업(특허) 등 |
|
백신 산업 생태계 조성 |
• K-medi 융합인재양성사업, 한국형 NIBRT 바이오 공정인력 양성 • K-바이오 헬스 지역센터, BL3 등 인프라 확충 • 중소기업 정책자금, 기술보증 지원, K-바이오 우대 지원 • 신산업 혁신 분야 창업패키지, 창업기업 기술사업화 등 |
출처: 보건복지부, 2023년도 백신・치료제 지원 가이드북 발간, 2022.12.6
다. 창업 및 초기 바이오기업 지원
정부는 분산된 부처별 창업지원 정보를 ‘K-Startup’으로 일원화하고, 창업기업 지원 정책을 성장단계에 따라 ▴창업교육, ▴시설・공간・보육, ▴멘토링・컨설팅, ▴사업화, ▴R&D, ▴행사・네트워크 등 6가지 범주로 분류하여 창업 정보를 종합 제공하고 있다. 창업지원포털(www.k-startup.go.kr)을 통해 중앙부처의 개별 창업지원 사업공고를 통합해 안내해 왔으며 2022년부터는 중앙부처와 지역자치단체에서 운영하는 모든 창업 지원사업을 대상으로 안내하고 있다. 2023년도 정부의 창업지원 통합공고 예산에 따르면 14개 부처 및 17개 광역・지자체에서 426개 사업에 총 3조 6,607억 원 규모의 창업지원을 할 계획이다.
특별히 한국바이오협회는 정부의 창업 지원사업 등을 참고하여 바이오 분야에 특화된 ‘바이오스타트업 지원 가이드북’을 발간하여 바이오기업들의 예비창업단계, 창업 초기단계, 성장단계별 정책자금, 금융지원, 입주・시설・공간, 창업교육・멘토링・컨설팅, 인허가, 판로・해외진출 등에 대한 정부 지원사업을 안내하고 있다.
한편, 중소벤처기업부는 바이오의약 분야 혁신 스타트업을 육성하기 위한 ‘K-바이오 랩허브’ 구축을 추진하고 있다. 바이오의약 분야는 우리 경제의 미래를 견인할 동력이지만 분야의 특성상 연구개발에 많은 시간과 비용이 필요하고 실험을 위한 연구시설과 장비 마련에도 높은 비용이 소요되어 창업에 어려움이 있었다. ‘K-바이오 랩허브’는 미국 보스턴의 바이오 스타트업 지원기관인 ‘랩센트럴’을 벤치마킹한 모델로 초기 연구개발을 위한 시설과 장비, 보육 공간은 물론 사업기획과 연구개발, 투자, 그리고 기업・대학・연구소・병원・투자자 등 관련 기관과의 네트워킹까지 전주기 지원을 위한 인프라 구축 프로젝트다.
‘K-바이오 랩허브’ 구축사업은 공모를 통해 인천 송도를 후보지로 선정한 후, 2021년 12월부터 약 9개월간의 예비타당성조사를 거쳐 2022년 8월 최종 통과되었다. 사업 기간은 9년, 총예산은 국비 1,095억 원, 지방비 1,550억 원, 민간 81억 원 등 총 2,726억 원의 대규모 중장기 사업으로 2023년 3월 30여 개 기관과 ‘K-바이오 랩허브’의 성공적인 구축과 운영을 위한 업무협약을 체결하는 등 본격적으로 구축을 추진하고 있다. 2025년까지 구축을 완료하고 2026년부터 본격적으로 운영될 예정이다.
라. 디지털바이오 지원
과학기술정보통신부는 인공지능, 빅데이터 등 첨단디지털 기술을 도입하여 바이오 분야 기술 혁신을 가속화하는 ‘디지털바이오 혁신전략’을 2022년 12월 발표했다. 2030년 바이오 선진국 진입을 목표로 한 이 혁신전략의 주요 내용은 디지털바이오 신기술・신산업 창출, 디지털바이오 기반기술 확보, 데이터 기반 바이오 연구 확산, 디지털바이오 육성 생태계 조성이다.
특히, 2022년 9월 미국 바이오 행정명령에서 중요기술로 언급한 합성생물학의 핵심 기반이면서 인공지능・빅데이터・로봇 기술을 활용하여 바이오 연구와 제조공정을 자동화・고속화할 수 있는 바이오파운드리(바이오조립생산) 기반 구축을 본격 추진하고 있다. 이를 위해 과학기술정보통신부와 산업통상자원부 공동 기획을 통해 3,000억 원 규모 사업에 대한 예비타당성조사를 신청했다. 아울러, 최근 각광받고 있는 마이크로바이옴을 이용한 유효물질 발굴 및 식물을 활용한 유효물질 대량 생산 기술개발도 지원할 계획이다.
마. 제품화 지원
식품의약품안전처는 국내 개발 바이오시밀러의 제품 개발 성공률을 높이고, 제품 출시를 앞당겨 수출을 지원하기 위해 2023년 바이오시밀러 제품화 지원단을 운영하고 있다. 지원단은 비임상, 임상, 허가 등 전주기에 걸쳐 국내 바이오시밀러 개발 업체가 겪는 어려움과 문제점에 대해 맞춤형으로 상담을 제공하고 있다. 유전자재조합의약품과로 신청하면 내부 평가를 거쳐 최종 선정된 업체에 전담 상담팀을 구성해 맞춤형 상담을 제공한다.
또한 식품의약품안전처는 글로벌 혁신 의료제품이 신속하게 제품화될 수 있도록 임상 초기부터 지원하고자 2022년 9월부터 글로벌 혁신제품 신속심사 지원(GIFT) 프로그램을 운영하고 있다. GIFT 대상으로 지정되면 심사 기간 최소 25% 단축, 수시 동반심사(Rolling review), 규제 관련 전문 상담 및 컨설팅을 지원받게 된다. 한편, 식품의약품안전처는 공중보건 위기대응 의약품, 신개념/신기술 의약품 등의 신속한 시장 진입을 지원하고 제약바이오헬스산업을 육성하기 위해 2022년 4월 25일 ‘제품화 전략지원단’을 출범했다.
바. 규제 혁신
보건복지부 등 관련부처는 2023년 2월 발표한 ‘바이오헬스 신시장 창출전략’의 후속대책으로 디지털・바이오헬스 글로벌 중심국가 도약 기반을 마련하기 위한 바이오헬스 규제 혁신을 추진하고 있다. 기존 기술로 분류된 혁신의료기기에 대해 별도 가치보상을 받을 수 있도록 하고, 새롭게 개발된 의료기기의 품목 분류와 등급 결정에 장시간 소요될 경우 ‘한시품목’으로 분류해 허가 신청할 수 있도록 추진하고 있다. 또한, 암・희귀질환 치료제로 대체 약제가 없으나 개선효과가 충분한 약제는 의약품 품목허가(식약처)-급여평가(심평원)-약가협상(건보공단) 과정을 동시에 진행될 수 있도록 추진하고 있다. 아울러, 환자가 동의할 경우에 의료기관이 안전관리기준을 충족하는 제3자에게 개인 의료데이터를 직접 전송할 수 있도록 개인정보보호법 개정을 추진하고, 의료정보의 특수성을 반영하기 위한 디지털헬스케어법 제정도 추진하고 있다.
식품의약품안전처에서도 2022년 8월부터 식의약 규제 혁신 100대 과제를 선정해 규제 개선을 추진하고 있다. 신산업지원 19개, 민생불편・부담 해소 45개, 국제조화 13개, 절차적 규제 해소 23개 등 100대 과제를 개선하기 위해 법령 정비, 행정조치 등을 추진하고 있으며, 2023년부터는 업계 등 정책 수요자가 직접 규제 혁신 과제를 제안할 수 있도록 하고 업무방식의 디지털전환, 수출 규제지원 분야의 과제를 추가로 발굴하고 있다.
사. 세제 및 관세 지원
바이오산업은 신약개발 등 연구개발에 투자하는 비용이 높아 연구개발 및 시설투자비 등에 관련한 기업 지원이 필요하며, 우리나라는 조세특례제한법 및 관세법에 따라 세제 및 관세 분야 혜택을 지원하고 있다.
조세특례제한법에서는 국가전략기술, 신성장・원천기술의 연구・인력개발비에 대한 세액 공제를 지원하고 있다(법 제10조). 국가전략기술은 2022년 신설된 규정으로 국가 안보 및 국민경제에 미치는 기술로서 바이오 분야에서는 유일하게 백신이 포함되었다. 바이오헬스 분야 신성장동력・원천기술에는 바이오・화합물의약, 의료기기・헬스케어, 바이오 농수산・식품, 바이오화장품소재가 포함되어 있다(시행령 별표7). 국가전략기술의 연구개발비 세액공제율은 대기업과 중견기업은 30%, 중소기업은 40%이며, 신성장・원천기술의 연구개발비 세액공제율은 대기업과 중견기업은 20%, 중소기업 30%이다. 또한, 국가전략기술 및 신성장・원천기술의 사업화를 위한 시설에 투자하는 경우에도 세액 공제를 지원하고 있다(법 제24조). 기업 규모별 세액공제율을 보면, 국가전략기술의 사업화 시설투자의 경우 대기업과 중견기업은 15%, 중소기업은 25%이며, 신성장・원천기술의 사업화 시설투자는 대기업 3%, 중견기업 6%, 중소기업 12%이며 2023년 한시적으로 대기업 6%, 중견기업 10%, 중소기업 18%로 상향되었다.
한편, 관세법에서는 장애인 보조기구에 대한 물품, 인공신장기 등 만성 신부전증 환자가 사용할 물품과, 고쉐병, 후천성면역결핍증, 혈우병 등의 환자가 사용할 희귀병 치료제 등 시행규칙 별표2에서 정한 물품에 대해 관세를 면제해 주고 있으며(법 제91조제4호), 시행규칙 별표2의4에서 정한 국내제작이 곤란한 공장자동화 물품에 대해서도 수입 시 관세를 감면하고 있다(법 제95조 제1항 제3호).
아. 바이오기업(제품) 인증・지원
(1) 혁신형 제약기업 및 의료기기기업 인증・지원
보건복지부는 국내 제약기업의 글로벌 경쟁력을 확보하고, 제약산업을 미래 신성장동력으로 육성하기 위해 혁신형 제약기업 인증 등을 지원하고 있다. 연구개발 투자 비중이 일정 수준 이상이고 신약 연구개발 실적이 우수한 기업을 대상으로 선정되며 2023년 1월 기준 47개 사가 인증을 받았다. 인증받은 기업은 R&D 참여 시 가점 부여, 세제 지원, 약가 결정 시 우대, 정책자금 우선 융자, 해외 전문인력 채용 지원, 연구시설 입지 규제 완화 등의 혜택을 받고 있다.
아울러, 의료기기산업 육성 및 혁신의료기기 지원법에 근거해 일정 수준 이상의 연구개발 역량과 실적을 갖춘 의료기기 기업에 대한 인증 등을 지원하고 있다. 2023년 3월 현재까지 총 41개 기업이 인증을 받았으며, 인증받은 기업들은 R&D 및 해외 진출 등의 지원을 받게 된다.
(2) 월드클래스 기업 인증・지원
산업통상자원부는 취약한 산업의 허리를 강화하고 성장동력을 지속적으로 확충하며 질 좋은 일자리를 창출하고자 2011년부터 10년간 성장 잠재력과 혁신성이 뛰어난 중소・중견기업 300개를 선정하여 지원하는 ‘월드클래스 300’ 프로젝트를 추진하였다. 선정된 300개 기업 중에는 의약품, 의료기기, 식품, 유전체분석 기업 등이 포함되었다.
2021년부터 향후 10년간 추진될 ‘월드클래스 플러스’ 프로젝트에서는 일정 이상의 매출(중견기업 또는 700억 원 이상 후보 중견) 및 수출・혁신 역량 등을 갖춘 200개 내외 기업을 선별하여 기업 주도의 R&D를 지원하고 유관기관과 함께 금융, 수출, 컨설팅 등을 지원하고 있다.
(3) 세계일류상품 및 생산기업 인증・지원
산업통상자원부와 코트라는 수출 품목의 다양화・고급화 및 미래 수출동력 확충을 위해 세계일류상품 및 생산기업을 선정・지원하고 있다. 점유율에 따라 현재일류상품(점유율 5위 이내) 및 차세대일류상품(7년 이내 현재일류상품 진입 가능), 인증대상에 따라 품목과 생산기업으로 나누어 선정하며, 업종별 추천위원회 및 세계일류상품 발전심의위원회 심의를 거쳐 최종 선정된다. 바이오 분야는 한국바이오협회가, 보건산업은 한국제약바이오협회・한국의료기기공업협동조합・한국의료기기산업협회・대한화장품협회・한국식품산업협회가 맡아 추천위원회를 구성한다.
선정된 기업에게는 해외시장 개척 활동, 금융자금 조달, 컨설팅, 유공자 포상, 세계일류상품 로고 사용 등의 혜택이 주어진다.


|
|
|
|
|
부록1 생명공학 연표 |
▶ 기원전 8000년
∙ 인간이 농작물과 가축을 경작하고 사육하기 시작
∙ 최초로 감자를 식용으로 경작
▶ 기원전 4000∼2000년
∙ 이집트에서 효모를 사용해 빵과 맥주의 발효 시작
∙ 수메리아, 중국, 이집트에서 치즈를 생산하고 포도주를 발효시킴
∙ 바빌로니아인들은 몇 그루 수술 나무의 꽃가루를 가지고 선별적으로 암술나무에 수정하여 대추야자를 생산
▶ 기원전 500년
∙ 중국에서 항생물질을 가진 곰팡이가 핀 두부로 종기를 치료
▶ 서기 100년
∙ 중국에서 최초로 살충제를 국화에 살포함
▶ 1322년
∙ 아랍에서 우성 말을 생산하기 위해 최초로 인공수정을 사용
▶ 1590년
∙ Janssen, 현미경 발명
▶ 1663년
∙ Hooke, 세포의 존재 발견
▶ 1675년
∙ Leeuwenhoek, 박테리아를 발견
▶ 1761년
∙ Koelreuter, 다른 종의 농작물을 성공적으로 이종교배 하였음을 보고
▶ 1797년
∙ Jenner, 아이들에게 천연두를 막기 위한 바이러스성 백신을 접종
▶ 1830∼1833년
∙ 1830년 단백질 발견
∙ 1833년 최초로 효소가 발견되고 분리됨
▶ 1835∼1855년
∙ Schleiden와 Schwann, 모든 유기체는 세포들로 구성되어 있다고 제안
∙ Virchow, ʻʻ모든 세포는 세포에서 생겼다.ʼʼ고 선언
▶ 1857년
∙ Pasteur, 미생물들이 발효를 유발한다고 제안
▶ 1859년
∙ Charles Darwin, 자연 도태의 진화론을 발표(1800년대 후반 유전학의 무지에도 불구하고 선택된 부모와 도태된 다양한 자손에 대한 개념은 동식물 사육사들에게 매우 큰 영향을 줌)
▶ 1865년
∙ 유전학 연구 시작
∙ Gregor Mendel, 오스트리아인 수도사인 그는 완두를 연구하여 유전법칙에 의해 유전적 특징이 부모로부터 자손에게 물려진다는 점을 발견함
▶ 1870∼1890년
∙ Darwin의 이론을 이용하여 면화를 이종교배하고 수백 가지의 우성품종을 개발
∙ 최초로 농부들이 수확량을 늘리기 위해 농지에 질소고정 박테리아 미생물을 섞음
∙ William James Beal, 최초로 실험실에서 실험용 옥수수 잡종 생산
▶ 1877년
∙ Koch, 박테리아를 염색하고 동정하기 위한 기술 개발
▶ 1878년
∙ Laval, 최초로 원심분리기 개발
▶ 1879년
∙ Fleming, 후에 염색체라 불려지는 세포핵 안쪽의 봉모양의 염색질을 발견
▶ 1900년
∙ 초파리가 유전연구에 사용됨
▶ 1902년
∙ 면역학이라는 용어가 처음으로 나타남
▶ 1906년
∙ 유전학이라는 용어가 소개됨
▶ 1911년
∙ Rous, 최초로 암을 유발하는 바이러스 발견
▶ 1914년
∙ 최초로 박테리아를 영국 맨체스터의 하수처리에 사용
▶ 1915년
∙ Phage(박테리아성 바이러스) 발견
▶ 1919년
∙ 최초로 생명공학(Biotechnology)이라는 단어가 출판물에 사용
▶ 1920년
∙ Evans&Long, 인간성장 호르몬 발견
▶ 1928년
∙ Alexander Fleming, 항생물질인 페니실린 발견
∙ 유럽에서 조명충 나방제어를 위한 소규모의 Bt(Bacillus thuringiensis) 테스트 시작
∙ Karpechenko, 무와 양배추를 교배하여 서로 다른 속(屬)의 식물 사이에서 번식력이 강한 자손을 만듦
∙ Laibach, 최초로 오늘날 이종교배라 알려진 광범위한 교배로부터 잡종을 얻기 위해 배구제(embryo rescue)를 사용
▶ 1930년
∙ 美의회에서 식물육종생산의 특허를 가능하게 하는 식물특허법(Plant Patent Act) 통과
▶ 1933년
∙ 1920년대 Henry Wallace에 의해 개발된 잡종옥수수가 상업화 됨(1945년에는 엄청난 매출액은 증가된 연 종자구입비를 능가했고 잡종 옥수수는 미국 전체 옥수수 생산량의 78%를 차지)
▶ 1938년
∙ 분자 생물학이란 용어가 생김
∙ 1938년 프랑스에서 미생물 살충제의 상업적 생산 시작
▶ 1941년
∙ 유전공학이란 용어가 폴란드 Lwow의 기술연구소에서 효모복제에 관한 강의를 맡고 있는 덴마크의 미생물학자 A. Jost에 의해 최초로 사용
▶ 1942년
∙ 박테리아를 감염시키는 박테리오파지를 구명하고 확인하기 위해 전자 현미경을 사용
∙ 페니실린을 미생물에서 생산함
▶ 1944년
∙ Avery와 그 외 다른 사람들에 의해 DNA가 유전정보를 운반한다는 점이 입증됨
∙ Waksman, 결핵에 효과적인 항생제인 streptomycin을 분리(추출)
▶ 1946년
∙ 새로운 타입의 바이러스를 형성하기 위해 서로 다른 바이러스로부터의 유전물질이 결합할 수 있다는 일종의 유전자 재조합이 발견
∙ 유전적 다양성의 상실로 인한 위협을 인식한 미의회는 식물수집과 보존 그리고 이러한 인식의 홍보에 막대한 자금을 제공함
▶ 1947년
∙ McClintock, 옥수수에서 소위 움직이는 유전자(jumping genes)라 불리는 전이요소를 발견
▶ 1949년
∙ Pauling, 겸상(鎌狀) 적혈구 빈혈증(흑인의 유전병)이 헤모글로빈 내 단백질분자의 돌연변이로 야기된 ʻ분자병ʼ임을 밝혀냄
▶ 1951년
∙ 냉동정액을 사용한 가축의 인공수정이 성공적으로 수행됨
▶ 1953년
∙ 과학저널 Nature는 현대 유전학의 출발을 상징하는 DNA의 이중나선 구조를 묘사한 James Watson과 Francis Crick의 원고를 출판
▶ 1955년
∙ 핵산 합성에 관한 효소가 처음으로 추출됨
▶ 1956년
∙ Kornberg, DNA 복제에 필요한 효소 DNA 중합효소Ⅰ(DNA polymeraseⅠ) 발견
▶ 1958년
∙ 겸상 적혈구 빈혈증이 단일 아미노산의 변화 때문에 발생한다고 밝혀짐
∙ DNA가 처음으로 시험관에서 만들어짐
▶ 1959년
∙ 조직 살균제가 개발됨
∙ 단백질 생합성의 첫 단계가 그려짐
▶ 1950년대
∙ 바이러스 증식억제 물질(interferon) 발견
∙ 최초 합성 항생 물질 개발
▶ 1960년
∙ 시냅시스(세포의 감수분열 초기에 있는 상동염색체의 병렬접착)를 이용해 DNA-RNA 잡종 분자가 만들어짐
∙ 메신저 리보 핵산(Messenger RNA) 발견
▶ 1961년
∙ 美 농림부가 최초 미생물 살충제인 Bacillus Thuringiensis를 등록함
▶ 1963년
∙ Norman Borlaug에 의해 신품종 밀이 개발됨으로 인해 생산량이 70% 상승함
▶ 1964년
∙ 필리핀의 국제 벼 연구소(The International Rice Research Institute)는 새로운 품종을 개발하여 충분한 비료를 주면 이전의 생산량보다 2배 많은 수확량을 얻을 수 있는 녹색 혁명을 일으킴
▶ 1965년
∙ Harris와 Watkins가 성공적으로 생쥐와 사람 세포를 융합시킴
▶ 1966년
∙ 유전암호가 해독되고 일련의 3개의 뉴클리오티드가 하나의 아미노산을 결정한다는 사실이 밝혀짐
▶ 1967년
∙ 최초로 자동 단백질 서열 분석기 완성
▶ 1969년
∙ 처음으로 효소가 생체 외에서 합성됨
▶ 1970년
∙ 노르만인 Borlaug, 노벨 평화상 수상(1963년 참조)
∙ 유전물질을 자르는 제한 효소(두 줄 사슬 DNA를 특정 부위에서 절단하는 효소)의 발견으로 유전자 복제의 장이 열림
▶ 1971년
∙ 처음으로 유전자가 완벽하게 합성됨
▶ 1972년
∙ 인간의 DNA 구성이 침팬지와 고릴라의 DNA와 99% 유사함이 발견됨
∙ 최초로 배이식(胚移植)이 시도됨
▶ 1973년
∙ Stanley Cohen와 Herbert Boyer, 제한효소와 리가제(ligases)를 사용해서 DNA를 자르고 붙이는 기술과 박테리아에서 새로운 DNA를 복제하는 기술을 완성함
▶ 1974년
∙ 미국 NIH는 유전자 재조합 연구를 총괄하기 위해 재조합 DNA 자문위원회(Recombinant DNA Advisory Committee) 구성
▶ 1975년
∙ 최초로 미국 정부가 캘리포니아 Asilomar 회의에서 유전자재조합실험을 규제하기 위한 가이드라인 개발을 주장함
∙ 단일클론항체가 생산됨
▶ 1976년
∙ 유전자 재조합 기술이 유전 장애인에 최초로 적용
∙ 분자교배가 태아의 alpha thalassemia 진단에 사용됨
∙ 효모의 유전자가 대장균(E.coli)에서 발현됨
∙ 최초로 특정유전자의 염기쌍 순서가 결정됨(A, C, T, G)
∙ 美國재조합 DNA 자문위원회(NIH Recombinant DNA Advisory Committee)에 의해 유전자 재조합 실험에 대한 가이드라인이 처음으로 발표
▶ 1977년
∙ 인간유전자를 박테리아에서 처음으로 발현시킴
∙ 전기영동을 이용해 DNA의 긴 마디를 빠르게 나열하기 위한 연구수행
▶ 1978년
∙ 바이러스의 고방사선 구조가 최초로 확인됨
∙ 재조합 인간 인슐린이 최초로 생산됨
∙ 미국 노스캐롤라이나 과학자들이 DNA 분자상의 특정 위치에 특정 돌연변이를 일으키는 것이 가능하다는 것을 보여줌
▶ 1979년
∙ 최초로 인간성장 호르몬이 합성됨
▶ 1970년대
∙ 유전공학 제품을 개발하기 위해 최초의 상업적 회사가 설립
∙ 중합효소(polymerases)의 발견
∙ 뉴클리오티드(nucleotides)의 빠른 나열기술 완성
∙ 유전자 표적화
∙ RNA splicing
▶ 1980년
∙ Diamond v. Chakrabarty 재판에서 미 연방법원은 유전자재조합생물형태에 대한 특허를 인정했으며, Exxon 석유회사가 기름 먹는 미생물에 대한 특허 취득
∙ 美國정부 유전자복제에 대한 권한을 Cohen과 Boyer에게 부여
∙ 최초의 유전자합성 기계 개발
∙ 인간인터페론유전자를 박테리아로 형질전환(Transformation) 시킴
∙ 노벨 화학상이 유전자 재조합분자를 개발한 Berg, Gilbert, Sanger에게 수여됨
▶ 1981년
∙ 오하이오 대학의 과학자들이 다른 동물의 유전자를 쥐에 이식함으로써 최초로 유전자 이식동물을 생산함
∙ 중국의 과학자가 최초로 복제 물고기 금잉어를 만듦
▶ 1982년
∙ 미국의 Applied Biosystems사는 단백질 서열분석에 필요한 샘플의 양을 획기적으로 줄일 수 있는 상업적 가스 상 단백질 서열분석기를 발표
∙ 가축을 위한 최초의 유전자 재조합 DNA 백신 개발
∙ 유전적 변이를 거친 박테리아에서 생산된 인간인슐린이 미국 FDA로부터 최초의 생명공학 기술에 의한 의약품으로 승인 받음
∙ 최초의 유전자 변형식물인 피튜니아 생산
▶ 1983년
∙ 중합효소연쇄반응(PCR) 기술이 소개(유전자와 유전자 조각의 복제를 위해 열과 효소를 사용하는 PCR 기술은 이후 유전공학에서의 연구와 개발에 광범위하게 쓰이는 중요한 도구가 됨)
∙ TI 플라스미드(plasmid: 염색체와는 따로 증식할 수 있는 유전인자)에 의한 식물 세포들의 유전학적인 변형이 수행됨
∙ 최초로 인공염색체 합성
∙ 특정유전병 유발인자 발견
∙ 생명공학기술을 이용해 피튜니아를 완전 성장시킴
∙ 피튜니아 식물을 통해 유전자변형식물의 새로운 특징이 자손에게 전달됨을 확인함
▶ 1984년
∙ DNA 지문검색 기술이 개발
∙ HIV 바이러스의 전체 게놈이 복제되고 서열 결정됨
▶ 1985년
∙ 신장병과 낭포성 섬유증을 유발하는 유전인자 발견
∙ 법적 증거로서 유전자 지문법이 도입
∙ 최초로 곤충과 박테리아, 바이러스에 저항력이 있는 유전자 변형식물이 시험됨
∙ 미국 NIH는 인간을 대상으로 하는 유전자 치료법 실험수행에 대한 가이드라인을 정함
▶ 1986년
∙ 유전자 재조합 B형 간염 백신 최초 개발
∙ 최초의 유전공학 항암치료제 인터페론 생산
∙ 미국 정부는 유전자 재조합 유기체에 대해 전통적인 유전자재조합기술로 만들어진 제품에 적용된 규정보다 더 엄격한 ʻThe Coordinated Framework for Regulation of Biotechnologyʼ 규정 확립
∙ California Berkeley 대학의 화학자가 신약을 개발하기 위해 항체와 효소를 결합하는 방법(abzymes) 제시
∙ 유전자 변형식물(담배)의 실제 실험이 수행됨
∙ 최초로 환경 보호국이 유전자변형 담배의 판매를 승인
▶ 1987년
∙ 바이러스에 내성이 있는 토마토의 field test를 최초로 승인함
∙ 캘리포니아에서 농작물의 서리 형성을 억제하는 유전자 변형 박테리아인 frostban을 딸기와 감자를 통해 시험하였는데 이것이 처음으로 공식 승인된 유전자 재조합 박테리아 외부 실험임
▶ 1988년
∙ 미국 정부는 하버드대학 분자유전학자에게 유전자 변형동물 즉, 유전자변형 쥐에 대한 특허권을 부여함
∙ 세제에 사용할 수 있는 표백제 내성을 지닌 단백질 분해효소를 만드는 공정에 대한 특허권이 부여됨
∙ 미국 의회가 다른 종의 게놈뿐만 아니라 인간유전자 암호를 해독하고 지도를 만드는 인간 게놈 프로젝트 연구비를 승인함
▶ 1989년
∙ 최초로 유전자변형 해충방지 면화의 field test 승인
∙ 식물 게놈 프로젝트 시작
▶ 1980년대
∙ 진화의 역사를 밝히기 위한 DNA 연구 시작
∙ 유럽에서 유전자 재조합 동물백신의 사용 승인
∙ 기름 청소에 미생물을 이용한 생물학적 정화기술 사용
▶ 1990년
∙ 미국 최초로 유전자재조합 기술을 이용하여 치즈제조에 쓰이는 인공적으로 제조된 chymosin 효소인 Chy-MaxTM이 소개됨
∙ 인체의 모든 유전자 지도를 제작하려는 국제적인 노력인 인간 게놈 프로젝트가 시작됨
∙ 면역장애를 앓고 있는 4살 여자 어린이를 대상으로 실시한 유전자 치료가 성공적으로 수행됨
∙ 유아 조유용 우유 단백질을 만드는 유전자 변형 젖소 탄생
∙ 해충에 강한 옥수수인 Bt 옥수수 생산
∙ 영국 최초로 유전자변형 효모식품이 승인됨
∙ 유전자 변형 척추동물 송어의 실지실험이 수행됨
▶ 1992년
∙ 미국과 영국의 과학자들이 시험관 내에서 배아에 낭포성 섬유증과 혈우병과 같은 유전적 기형을 테스트하는 기법을 밝힘
∙ 미국 FDA는 유전자 이식 음식이 유전적으로 위험하지도 않고 특별한 규정도 필요 없다고 선언함
▶ 1993년
∙ 미국 FDA, 낙농가의 우유생산 촉진을 위해 BST(Borine Somatotropin)를 승인
▶ 1994년
∙ 미국 FDA, 생명공학으로 만들어진 FLAVRSAVRTM tomato 승인
∙ 최초로 유방암 유전자 발견
∙ CF 환자의 폐에 단백질이 쌓이지 않게 하는 재조합 인간 DNase 승인
∙ 소 성장호르몬(POSILAC)이 상용화됨
▶ 1995년
∙ 에이즈 환자에게 최초로 비비의 골수가 이식됨
∙ 최초로 바이러스 이외의 살아있는 유기체(hemophilus influenzae)의 완벽한 유전자 배열이 완성됨
∙ 암정복을 위해 면역시스템 모듈, 유전자 재조합 항체형성과 같은 유전자 치료가 도입됨
▶ 1996년
∙ 파킨슨병과 관련된 유전자의 발견으로 퇴행성 신경질환의 잠재 가능한 치료와 그 원인 연구의 중요한 이정표를 제시함
▶ 1997년
∙ 스코틀랜드에서 어른세포로 복제된 최초의 복제양 Dolly 탄생
∙ 해충방지 농작물인 Roundup ReadyTM 콩과 BollgardTM 해충방지 면화와 같은 작물이 상업화됨
∙ 아르헨티나, 호주, 캐나다, 중국, 멕시코와 미국 등 전 세계적으로 500만 에이커 면적에서 유전자조작 작물이 재배됨
∙ Oregon주 연구자들은 두 마리의 붉은 털 원숭이를 복제했다고 주장함
∙ 유전병 연구의 새로운 기술을 창조하기 위해 PCR, DNA 칩과 컴퓨터를 결합한 새로운 DNA기술 탄생
▶ 1998년
∙ 하와이대학 연구진이 어른의 난소 적(cumulus)세포 핵으로부터 쥐를 복제함
∙ 인간 배아줄기세포주가 확립됨
∙ 일본 Kinki 대학 연구진은 한 마리 어른암소로부터 얻은 세포를 이용하여 8마리의 동일 송아지 복제함
∙ 최초로 C. elegans 벌레에 대한 동물 게놈 염기서열 해독 완료
∙ 3만 개 이상의 유전자 위치를 보여주는 인간 게놈지도의 초안 완성
∙ 동남아시아 다섯 나라가 병에 강한 파파야 나무를 개발하기 위해 컨소시엄을 구성
▶ 1990년대
∙ 최초로 영국에서 유전자 지문법을 이용해 유죄를 판결함
∙ 규정 질량의 일반적 융기에 착상된 유전자 분리성공
∙ 유전성 대장암이 DNA 치료 유전자의 결핍으로 야기된다는 사실 발견
∙ 유전자 재조합 광견병 백신을 너구리에 실험
∙ 미국에서 농약을 기본으로 한 생명공학 제품판매 승인
∙ 특수이식 유전자를 가진 쥐에 관한 특허 허용
∙ 최초로 유럽에서 발암물질에 민감한 유전자변형 쥐에 관한 특허 제기
∙ 유방암 유전자 복제
▶ 2000년
∙ 최초로 애기장대(학명 arabidopsis thaliana)의 게놈지도 개발
∙ 13개 나라에서 총 1억 89만 에이커 면적에서 생물공학 농작물이 재배됨
∙ 최초로 바이러스에 강한 고구마가 케냐에서 실질 시험됨
∙ 인간게놈 배열의 초안 발표
▶ 2001년
∙ 최초로 벼 게놈지도 완성
∙ 오스트리아 연구진들은 barley yellow dwarf virus와 같은 바이러스 예방백신에 사용되는 hairpin RNA를 이용한 기술개발을 보고함
∙ Chinese National Hybrid 연구진들은 일반 쌀 생산량보다 두 배 많은 super rice종 개발을 보고함
∙ 유럽위원회(The European Commission)가 모든 유전자 변형 식품에 라벨을 붙일 것을 제기함
∙ 농업적으로 중요한 시노라이조비움 멜리로티(sinorhizobium meliloti) 박테리아의 DNA배열 완성
∙ 염분이 있는 물과 땅에서 성장 가능한 최초의 농작물을 만들기 위해 애기장대로부터 추출된 유전자를 토마토에 이식함
∙ 농업에 중요한 식물병원균 Agrobacterium tumefaciens의 게놈서열이 공표됨
∙ 스트레스에 더 강한 농작물 개발의 실마리로서, 손상을 입거나 스트레스를 받았을 때 빛을 발하는 세일 크레스(thale cress)라 불리는 실험용 식물 재배
∙ 최초로 땅콩의 종합적 분자지도가 완성됨
▶ 2002년
∙ 완성된 인간 게놈 배열을 과학전문지에 게재함
∙ 효모의 프로테옴(proteome: 단백질 간 상호작용과 네트워크의 총합)의 기능지도(functional map)의 초안 완성, 효모의 게놈지도는 1996년에 발표되었음
∙ 줄기세포의 분화에 관여하는 조절인자 연구에 큰 발전이 있었으며, 이에 관여하는 200여개의 유전자가 밝혀짐
∙ 생명공학 농작물이 16개국, 1억 4,500만 에이커에서 재배되고 있으며 이는 2001년보다 12% 증가한 것임
∙ 자궁경부암에 대한 백신 개발에 성공하였으며 이는 특정 암에 대한 예방백신이 가능함을 처음으로 보여준 성과임
▶ 2003년
∙ 인간게놈 완전 해독(2003.4.)
∙ 정신분열증과 우울증 등 정신병의 발병 위험을 증가시키는 특정유전자 변형을 확인한 연구결과 발표
∙ 美최초의 GM 애완동물로 광고된 붉은 빛 형광물고기 GloFish 상업화
∙ 세계적으로 생명공학작물 이용의 활성화 증대
∙ 영국은 최초로 상업적인 생명공학작물인 제초제 저항옥수수를 인정
∙ 미국 환경 보호국은 최초로 형질전환 해충저항성 옥수수를 승인함
∙ 2003년 banteng 들소가 최초로 복제되었으며, 노새, 말, 사슴도 복제되었음
∙ 1997년 포유동물의 최초 복제양 돌리는 폐병연구 후에 안락사 됨
∙ 일본 연구팀은 자연적으로 카페인을 제거하는 생명공학 커피를 개발함
∙ RNA 형태는 유전자 형식을 지시, 변형시키며 줄기세포와 배(胚)의 성장에 영향을 미침을 밝힘
∙ 쥐의 배 세포줄기가 정자나 난자 세포로 성장할 수 있음을 확인
∙ 남성을 결정짓는 Y염색체가 동일한 유전자를 함유하고 있음을 발견
∙ 종양으로 하여금 암의 전이에 필요한 혈관을 생성하지 못하도록 하는 약물의 개발
▶ 2004년
∙ 미국 식품의약국(FDA)은 아바스틴이라는 최초의 신세대 항암제를 승인함
∙ FDA는 다양한 종류의 약물치료와 질병을 위해 첫 DNA칩 및 유전자칩 개발
∙ RNA 방해 제품으로, 임상 시험에 들어가는 첫 번째 RNAi 제품 생산
∙ 국제연합 식량농업기구(FAO)의 생명공학 작물 승인
∙ 국립과학연구원 산하 의학연구소에서는 ʻ생명공학작물이 건강에 해를 끼치지 않는다ʼ라고 밝힘
∙ FDA는 식품안전성 검토 후 생명공학 밀의 안전성 밝힘
∙ 몬산토사는 지방산을 감소 삭제한 low-linolenic 콩을 소개함
∙ 닭 게놈 DNA 완전 해독
∙ 최초로 애완 새끼고양이 복제
∙ ʻ쓸모없는 DNA(junk DNA)ʼ 구명
∙ 인간의 유전자 DNA 중 단백질을 합성하는 DNA는 전체 게놈의 10%에 불과하며 아무런 기능이 없는 DNA에 대한 구명 이루어짐
∙ 지난 3월 영국의 과학자들, 지난 20년간 나비 58종의 개체 수가 71% 줄었으며, 조류는 54% 감소했다고 보고
∙ 新의약품 개발 활발
∙ 유엔(UN), 대학, 민간자선단체, 제약업체 등 공공단체와 민간기업이 손을 잡고 미개발국의 환자를 위해 의약품을 개발하는 새로운 움직임이 일어남
∙ 미생물게놈 추출성공, 인간게놈프로젝트 주역인 미국 크레이크 벤터 박사는 3월 사이언스에 바닷물에서 미생물 게놈을 추출해 10억 5,000만 염기쌍을 한꺼번에 분석하는 데 성공했다고 밝힘
▶ 2005년
∙ 게놈지도와 야외 관찰로 진화가 일어나는 복잡한 과정을 밝힘
∙ 유럽 호이겐스 탐사선이 토성의 달 타이탄에 착륙하고, NASA의 Deep Impact가 혜성에 충돌한 실험 등
∙ 분자 생물학자들이 봄에 꽃이 다양한 색깔을 내게 하는 원리를 발견
∙ 위성과 지상망원경으로 도시 크기의 죽은 별들인 중성자별 관찰
∙ 정신분열증, 난독증, 안면경련증과 같은 뇌 신경질환 연구
∙ 외계에서 온 암석과 지구의 암석을 비교 분석한 결과 지구 생성에 대해 새로운 이론 설립
∙ volage-gated potassium channel의 분자 구조 밝힘
∙ 인간 활동에 의한 지구 온난화의 증거 추가 발견
∙ 분자 생물학자들이 복잡한 시스템의 행태를 이해하기 위해 엔지니어 기술 이용
∙ 120억 달러 규모의 국제 핵융합 실험로(International Thermonuclear Ex-perimenta Reactor) 위치가 18개월의 논란 끝에 프랑스 Cadarache로 결정
∙ Z 나선형 DNA와 B 나선형 DNA의 결합구조 구명, 네이처지 게재
▶ 2006년
∙ 네안데르탈인 DNA 염기서열 분석
∙ 급진전되는 지구 온난화 전망 제기
∙ 땅위를 걸어다닌 물고기 화석 발견
∙ 시력감퇴 치료제 개발
∙ 생물 다양성의 재발견
∙ 최첨단 현미경 기술 개발
∙ 기억메커니즘 구명 단초 발견
∙ 마이크로 RNA와 siRNA보다 약간 긴 새로운 RNA를 발견
∙ 미연방정부 연구비 1,000만 달러를 받아 일리노이 대학 연구팀이 진행하고 있는 돼지 게놈 해독은 2년 안에 완성될 것으로 기대
∙ 미 부시 대통령이 상하원 합동연설에서 농업 페기물로부터 바이오에탄올 생산 지원
∙ 미 NIH가 유방암 재발을 예측하기 위해 10년간, 1만 명의 환자에 대해 유전자 검사를 실시하는 연구를 개시
∙ 미국 당뇨병 협회(ADA)가 농업 및 식량분야 생명공학에 대한 지원을 재확인
∙ 다우사가 최초의 식물 생산 백신에 대한 허가를 취득
∙ Renessen사가 생명공학 기술을 이용하여 유용성이 추가된 작물에 대해 최초로 동물 사료로 판매할 수 있는 허가를 취득
∙ USDA가 밀의 게놈연구를 위해 18개 대학 밀번식 컨소시엄에 연구비 500만 달러 지원
∙ 오메가-3 지방산을 생산하는 형질전환 돼지 개발
∙ 세계무역기구는 EU가 21가지의 농업 생명공학제품에 대해 통상약정을 위반 했다고 발표
∙ 프랑스 농무부가 생명공학 옥수수 및 담배 작물에 대해 17가지의 새로운 실지 시험을 허가
∙ 마이크로RNA의 초기프로세싱 기전 구명
∙ 암 발생 억제기능 SUSP4 유전자의 분리 및 작용 메커니즘 구명
∙ 저분자화합물을 이용한 세포노화의 가역적 재프로그래밍
▶ 2007년
∙ AMPK 효소 항암기능 최초 구명. AMPK 활성화를 통해 대장암 세포가 정상으로 변화
∙ 체내 면역반응 조절 ʻ브레이크 장치ʼ 물질 발견
∙ ʻ스페인감기ʼ 바이러스를 이용해 조류독감을 치료할 수 있는 길이 열림
∙ 화성에 물 존재 증거 발견
∙ 자연계에 존재하지 않는 D-아미노산을 손쉽게 합성할 수 있는 신기술 개발
∙ 수명이 다하거나 손상을 입은 세포에 죽음의 신호를 보내는 메커니즘 구명
∙ 암 발병을 억제하는 유전자의 기능 구명
▶ 2008년
∙ 조류독감 인체 간 감염 유발 경로 찾음(Nature Biotechnology)
∙ 모유수유가 천식 등을 유발하는 항원에 대해 아이들을 어떻게 보호하는지에 대한 기전 구명(Nature Medicine)
∙ 장내 세균과의 공생 기제 밝혀냄(Science)
∙ 인간배아줄기세포로 당뇨병 쥐 치료 성공(Nature Biotechnology)
∙ 탈모유발 유전자 발견, 새 탈모약 개발기대(Nature Genetics)
∙ 암 세포를 무제한 자라게 하는 ʻ효소단백질ʼ 확인(Nature)
∙ 비만 원인 ʻ유전자 네트워크 이상ʼ(Nature)
∙ 루게릭병 유발 ʻ유전자ʼ 찾음(Nature Genetics)
∙ 운동신경세포 분화과정 구명(Developmental Cell)
∙ 알즈하이머치매 ʻ기억력ʼ 떨어뜨리는 핵심 단백질 구명(Nature Genetics)
∙ 배꼽시계 등 생체회로 조절원리 구명(Science)
∙ 예방법 없는 ʻ말라리아ʼ 백신 개발됨(Nature Medicine)
∙ 물체 인식과정 구명, 실명치료 도움(Nature)
∙ 항생제 ʻ페니실린ʼ 만드는 균 ʻ유전자서열ʼ 구명(Nature Biotechnology)
∙ 유전자 제어 마이크로RNA 조절・사멸 메커니즘 구명(Molecular Cell)
∙ ʻ소리ʼ 잘 듣게 하는 귀 속 ʻ단백질ʼ 구명(Nature)
∙ 인체 세포 죽이는 단백질 구명, 새로운 항암제 개발(Nature)
∙ 日 연구팀 ʻ암세포ʼ 추적자 영상촬영물질 개발(Nature Medicine)
▶ 2009년
∙ 파킨슨병 등 신경퇴행성질환 유발 기전 구명(Nature Medicine)
∙ 염색체 응축 ʻ단백질 복합체ʼ 분자구조 구명(Cell)
∙ 마이크로 RNA 메커니즘 구명(Cell)
∙ ʻ고혈압ʼ 유발 유전자 변이 구명(Nature Genetics)
∙ 단백질과 패혈증의 원인 물질인 세균의 내독소가 결합된 복합체의 분자구조를 세계 최초로 구명(Nature)
∙ 당뇨 원인 인슐린 저항성 유발인자 발견(Cell Metabolism)
∙ 장(腸) 세포의 세균 제거 기전 구명(Developmental Cell)
∙ 소 유전자 지도 완성 ʻ축산혁명ʼ(Science)
∙ 미칠 듯한 가려움증 ʻ긁어주면 좋아지는 이유ʼ 구명(Nature Neurons)
∙ 다운증후군 ʻ암ʼ 잘 안 걸리는 이유 구명(Nature)
∙ 자도 자도 졸린 ʻ기면증ʼ 면역계 기능 부전이 원인(Nature Genetics)
∙ 체내 자연 발생 ʻ표백성분ʼ 상처회복 돕는다(Nature)
∙ 사람 줄기세포로 뇌졸중 쥐 치료성공(Gene Therapy)
∙ 한국 남성 ʻ유전자 서열ʼ 밝혔다(Nature)
∙ NMR로 생체막 단백질 구조 구명(Science)
∙ 줄기세포 분화조절 단백질 발견(Cell)
∙ ʻ새벽잠 없는 이유 있다ʼ, 적게 자게 하는 유전자 발견(Science)
▶ 2010년
∙ 배아줄기세포 치매치료제 국내서 첫 임상 실시
∙ 혈관치료용 마이크로 로봇 개발(세계 최초로 살아있는 미니돼지의 혈관에 주입돼 이동하는 실험 성공)
∙ 0.3mm 핏줄까지 보이는 세계에서 가장 선명한 사람 뇌지도 ??7.0 Tesla MRI Brain Atlas?? 발간
∙ 나노 소재로 인공 광합성 성공
∙ 세계 최초 암 관련 신규 유전자 발굴
∙ 암 진행과 전이 매커니즘 구명
▶ 2011년
∙ 인체면역결핍바이러스 예방 치료 네트워크(HPTN) 052
∙ 밝혀진 인간의 기원 : 현생 인류의 DNA 일부가 네안데르탈인 게놈과 연관되었다는 사실 발견
∙ 식물광합성 촉매 구조 구명 : 물 분해 촉매가 되는 막단백질 복합체의 구조 구명
∙ 말라리아 백신 : ʻRTS,Sʼ 말라리아 백신이 아프리카 영유아의 말라리아 감염률을 50% 이상 감소시킴
∙ 인간 장 속 미생물 : 인간의 장속 미생물이 혈액형과 같이 크게 3가지로 나뉨. 군집 종류에 따라 질병, 체질, 식습관이 달라짐
∙ 노화세포제거 : 실험쥐의 노화세포를 제거하자 백내장, 근육 손실 등의 현상이 사라지고 나이 들어도 운동능력 저하되지 않는다는 사실 발견
▶ 2012년
∙ 한국 식약청서 동종(타가) 줄기세포 치료제 판매를 세계최초로 승인
∙ 유럽의약청(EMA)이 서구 최초로 유전자치료제를 승인하고 희귀유전질환 지단백지질분해효소결핍증(LPLD) 치료제 글리베라(Glybera)를 판매를 허가
∙ 먹는 C형간염치료제, 미국 FDA 승인
∙ 한국기업 셀트리온, 세계 최초의 항체 바이오시밀러인 ʻ램시마ʼ 출시
∙ 뇌신경세포 신호전달 원리 구명
∙ 체세포를 성체줄기세포로 직접교차분화를 유도하는데 성공
∙ 아시아인 당뇨-비만에 관계하는 새로운 유전변이 현상 및 요인 발견
∙ 자폐증에 관여하는 새로운 유전자 및 발병원인 발견
▶ 2013년
∙ 인간 배아줄기세포 복제 성공. 태아의 피부세포를 핵을 제거한 난자에 융합시켜 인간 배아줄기세포를 만들고, 이후 심장세포로 자라게 하는 데 성공
∙ ʻDNA 백과사전ʼ 완성. 기능이 거의 없어 98%의 쓰레기 DNA(Junk DNA)의 기능이 거의 없고 정체가 불투명한 쓸모없는 유전자들로 ʻ쓰레기ʼ 가 인간 질병과 돌연변이에 관여한다는 사실 구명
∙ 유도만능줄기세포(iPS) 임상 연구를 세계 최초로 승인. 삼출형가령황반변성(滲出型加齢黄斑変性)이라는 눈의 난치병의 환자로부터 만들어낸 iPS를 망막색소 상피세포로 변화시켜 손상된 부분에 이식하는 방식
∙ iPS 이용해 인간의 ʻ간ʼ 조직 배양 성공
∙ 대사공학 기술을 이용해 대장균으로 휘발유 및 벤젠의 인공합성에 성공
∙ 태아 중뇌에서 추출한 줄기세포로 만든 ʻ도파민 신경전구세포ʼ를 파킨슨병 환자의 뇌 피각부에 이식하는데 성공
∙ mRNA의 비정상적인 기능 인식과 제거에 관한 메커니즘 구명
∙ 포유류 신경 재생 메커니즘 구명. 포유류의 말초신경 재생 메커니즘 구명. 중추신경에 적용할 경우 하반신 및 전신 마비환자 치료가능성 열려
▶ 2014년
∙ N-말단 메티오닌, 세포내 단백질 분해 신호의 발견(Cell, 2014.1.16.)
∙ 고추 유전체서열 국내 독자 기술로 완성(Nature Genetics, 2014.1.19.)
∙ 혈액암의 한 유형인 악성림프종 돌연변이 유전자 구명(Nature Genetics, 2014.3.3.)
∙ 비만 조절하는 핵심 수용체 발견(Cell Metabolism, 2014.3.4.)
∙ 철 대사를 조절하여 병원성 세균의 증식을 억제하는 항균제제 후보물질 발견(Nature Medicine, 2014.3.23.)
∙ 성인체세포 이용한 줄기세포주 세계 최초 확립(Cell Stem Cell, 2014.4.18.)
∙ 빛으로 세포 내 단백질을 원격 조정한다(Nature Methods, 2014.5.4.)
∙ C형간염바이러스의 면역회피 메커니즘 구명(Gastroenterology, 2014.5.19.)
∙ 면역억제제 부작용 유발하는 유전자 발견(Nature Genetics, 2014.8.11.)
∙ 초기 배아 단계의 마이크로RNA 조절 현상 구명(Molecular Cell, 2014.11.13.)
▶ 2015년
∙ 표적유전자만 제거, ‘크리스퍼 유전자 가위’ 정확성 입증(Nature Methods, 2015.2.10.)
∙ 혈압 조절에 중요한 단백질 세포 속 분해과정(Science, 2015.3.13.)
∙ 한의학 처방 원리(군신좌사) 구명(Nature Biotechnology, 2015.3.6.)
∙ 피로물질 젖산, 세포신호물질로 새로운 기전 발견(Cell, 2015.4.16.)
∙ 유해 단백질의 분해 작용원리와 최종 변화과정 구명(Nature Cell Biology, 2015.6.15.)
∙ 암줄기세포 에너지 대사 구명(Gastroenterology, 2015.6.16.)
∙ 급성 골수성 백혈병의 새로운 신호 전달 경로 구명(Cell Stem Cell, 2015.7.23.)
∙ 항암 효과 뛰어난 GITR 항체의 작용기전 밝혀(Nature Medicine, 2015.8.17.)
∙ 뇌종양 재발위치에 따른 유전체 변이 패턴 세계최초 구명(Cancer Cell, 2015.9.14.)
∙ 빛으로 칼슘 농도 조절하고 기억력 높여(Nature Biotechnology, 2015.9.15.)
▶ 2016년
∙ microRNA(이하 miRNA) 생성에 결정적 역할을 하는 드로셔(DROSHA) 단백질의 3차원 구조를 세계 최초 구명(Cell, 2015.12.31.)
∙ 음식물에 든 항원(음식 유래 항원)들이 소장 내 면역 반응 억제에 큰 역할을 담당한다는 사실 구명 (Science, 2016.1.29.)
∙ 가장 젊고 분화능력이 뛰어난 최상위 혈액-줄기세포의 선별 방법을 개발(Cell Stem Cell, 2016.3.18.)
∙ 세계 최대 규모의 유방암 환자 전장유전체(全長遺傳體, 전체 유전자 염기서열)를 분석(Nature, 2016.5.3.)
∙ 생존에 필수적인 오토파지(자가포식)작용을 조절하는 새로운 신호를 발견하여 오토파지의 작동 기전을 세계 최초 구명(Nature, 2016.6.15.)
∙ 뇌신경망을 형성・유지하는 새로운 기전을 세계 최초 발견(Cell, 2016.6.16.)
∙ 생체조직과 무기물의 결합으로 전기 없이 움직일 수 있는 바이오 하이브리드 로봇을 세계 최초 개발(Science, 2016.7.8.)
∙ 당뇨병 발병에 직접적으로 영향을 주는 혈당, 체내 대사조절관련 16개 신규 유전요인(부모로부터 물려받은 유전정보 중 질병 발생과 관련된 요인)을 발굴(Nature, 2016.7.)
∙ 암과 치매 등 각종 질병을 유발시키는 것으로 알려진 단백질의 비정상적인 변형을 구현할 수 있는 맞춤형 단백질 변형기술을 세계 최초 개발(Science, 2016.9.29.)
∙ 우리 몸에서 병을 일으키는 감염원을 제거하는 초기 방어 시스템을 세계 최초 구명(Nature Microbiology, 2016.10.17.)
▶ 2017년
∙ 조울증 일으키는 핵심 단백질의 작용 메커니즘 구명(Molecular Psychiatry, 2017.1.31.)
∙ 무독성 살모넬라균에 의한 암 치료 강화기술 개발(Science Translational Medicine, 2017.2.9.)
∙ 뇌종양 유전체의 시공간적 구조 분석을 통해 최적의 표적치료 전략 제시(Nature Genetics, 2017.4.1.)
∙ 홍합의 접착 단백질과 인체 조직에서 추출한 자연치유 성분을 결합하여, 상처 치료 기능과 흉터 방지 기능을 함께 갖춘 혁신적인 의료용 접착제를 개발(Biomaterials, 2017.4.26.)
∙ 문어 빨판의 독특한 돌기 원리를 밝히고, 이를 모사하여 습한 환경에서도 접착제 없이 탈부착할 수 있는 고점착 패치 소재를 세계 최초로 개발(Nature, 2017.6.15.)
∙ 빅데이터 분석을 통해 종양 주변의 면역세포가 종양의 진화 및 항암 치료에 미치는 영향을 구명(Cancer Cell, 2017.7.10.)
∙ 나노 일렉트로닉스라는 개념의 전자기화 된 금 나노입자를 활용한 신개념 ‘세포 직접교차분화 리프로그래밍’ 기술을 세계 최초 개발(Nature Nanotechnology, 2017.7.18.)
∙ 간경화 환자의 몸에서 간암이 유발되는 신규 신호경로 규명(Gastroenterology, 2017.7.20.)
∙ 인간배아에서 비후성 심근증의 원인이 되는 돌연변이 유전자를 크리스퍼 유전자 가위(CRISPR Cas9)로 교정하는데 성공(Nature, 2017.8.3.)
∙ IT-BT 융합연구를 통한 간암 치료효과 제고 방법 발견(Hepatology, 2017.8.23.)
▶ 2018년
∙ 액체방울 자유롭게 조종하는 나노 계면활성제 발명(Nature, 2018.1.11.)
∙ 간암치료를 목적으로 비수술적 치료법인 동맥화학색전술에 사용되는 미세구체의 개발(해외 PCT 특허 3건에 대해 6개국 등록 완료, 2018.2.16.)
∙ 자연에 풍부한 탄화수소로 신약 원료 감마/락탐 합성 성공(Science, 2018.3.2.)
∙ 뇌에서 기억이 저장되는 장소 규명(Science, 2018.4.27.)
∙ 고지혈에 의한 루푸스 발병기전 규명(Nature Immunology, 2018.4.30.)
∙ 눈에서 47종의 시각 채널을 찾다(Cell, 2018.5.17.)
∙ 스스로 광합성하는 인공세포 제작(Nature Biotechnology, 2018.5.28.)
∙ 급성심장질환에 동반된 외상후증후군 치료를 통하여 심장질환 재발률을 획기적으로 감소(Journal of the American Medical Association, 2018.7.25.)
∙ 종양 스페로이드를 활용한 암 표적치료 혁신의 길 열려(Nature Genetics, 2018.9.27.)
∙ 병에 강한 식물에는 ‘보디가드 미생물’이 있다(Nature Biotechnology, 2018.10.8.)
∙ YH25448(Lazertinib)의 글로벌제약사 기술수출(얀센 바이오텍, 2018.11.1.)
▶ 2019년
∙ 40대 전후에 발생하는 조기발병위암 원인 규명(Cancer Cell, 2019.1.15.)
∙ 항생제 젠타마이신 B의 생합성 과정 규명(Nature chemical Biology, 2019.1.15.)
∙ 퇴행성관절염의 원인은 콜레스테롤(Nature, 2019.2.7.)
∙ 암세포의 림프절 전이, 지방산이 핵심 연료(Science, 2019.2.8.)
∙ 내 머리 속 공포기억, 시각자극으로 사라진다(Nature, 2019.2.14.)
∙ 간암세포 굶겨 죽이는 방법 제시(Cell Metabolism, 2019.4.5.)
∙ 의약품 수용체의 신호전달 과정 규명(Cell, 2019.5.10.)
∙ 서울대, 알츠하이머병 예방 및 치료 가능성 열어(Cell Metabolism, 2019.6.28.)
∙ 심장질환 발병원인 규명 및 새로운 치료 표적 제시(Nature, 2019.7.18.)
∙ 류마티스 관절염 발생과정의 수수께끼 풀어(Nature Immunology, 2019.8.13.)
∙ 생쥐모델을 활용한 알코올성 지방간 치료 표적 제시(Cell Metabolism, 2019.8.30.)
∙ 면역억제세포 리프로그래밍 약물전달체 개발(Advanced Materials, 2019.9.6.)
∙ 암세포를 굶겨 죽이는 대사 항암제의 원리 규명(Cell Metabolism, 2019.12.9.)
▶ 2020년
1. 암세포 터뜨려 죽이는 나노버블로 면역물질 손상 막아(Advanced Materials, 2020.3.3.)
|
박재형 교수(성균관대학교 화학공학과) 연구팀이 초음파를 쬐면 기포가 나오는 나노버블로 암 세포막 파열을 유발, 네크롭토시스 유사 세포사멸을 유도했다. 과학기술정보통신부와 한국연구재단이 추진하는 기초연구사업(중견연구자, 선도연구센터)의 지원으로 수행된 이번 연구의 성과는 국제학술지 Advanced Materials 표지논문으로 3월 3일 온라인판에 게재되었다. |
2. 배양액 교체만으로 손상 없이 세포 시트 수확(Advanced Materials, 2020.3.11.)
|
임성갑 교수(KAIST 생명화학공학과), 조승우 교수(연세대학교 생명공학과) 연구팀이 온도 변화 없이 단시간 내 세포 시트를 배양기판으로부터 손상 없이 분리하는 방법을 개발했다. 과학기술정보통신부와 한국연구재단이 추진하는 기초연구사업(중견연구) 및 선도연구센터지원사업 등의 지원으로 수행된 이번 연구의 성과는 국제학술지 Advanced Materials에 3월 11일 게재되었다. |
3. 동아시아인 당뇨병 유전적 원인 규명, 세계의 주목받다!(Nature, 2020.5.6.)
|
국립보건연구원 유전체센터는 싱가포르 국립대학, 일본 이화학연구소 등과 함께 동아시아 3개국(한국, 중국, 일본)을 중심으로 약 43만 명의 유전체정보를 분석, 제2형 당뇨병 발병에 영향을 주는 61개 신규 유전요인을 발굴했다. 보건복지부가 추진하는 포스트게놈다부처유전체사업의 지원으로 수행된 이번 연구의 성과는 해당 분야 최고 학술지인 Nature에 2020년 5월 호에 게재되었다. |
4. 분자가 탄생하는 모든 순간(35펨토 초) 포착(Nature, 2020.6.25.)
|
기초과학연구원(IBS) 나노물질 및 화학반응 연구단 이효철 부연구단장(KAIST 화학과 교수) 연구팀은 원자가 결합하여 분자가 탄생하는 모든 과정을 실시간으로 관찰하는데 성공했다. 이번 성과는 세계 최고 권위의 학술지 Nature(IF 43.070) 온라인 판에 한국 시간으로 6월 25일에 게재되었다. |
5. 염기교정 유전자가위의 안전성 높일 실마리 찾아(Nature Biotechnology, 2020.7.7.)
|
연세대학교 약리학교실 김형범 교수 연구팀이 염기교정 유전자가위의 염기교정 효율과 교정결과를 예측할 수 있는 인공지능 프로그램을 개발했다. 과학기술정보통신부가 추진하는 중견연구지원사업, 바이오의료기술개발사업, 선도연구센터지원사업 등의 지원으로 수행된 이번 연구의 성과는 생명공학 분야 국제학술지 Nature Biotechnology에 7월 7일 게재되었다. |
6. 당뇨 치료제 효능을 억제하는 장내미생물 대사체의 작용기작 연구(Cell Metabolism, 2020.8.12.)
|
성균관대학교 의과대학 정밀의학교실 고아라 교수 연구팀과 스웨덴 예테보리대학교 프레드릭 백헤드 교수 연구팀이 장내미생물 대사체가 당뇨병 약인 메포민의 혈당조절 실패에 미치는 영향을 규명했다. 과학기술정보통신부가 추진하는 신진연구지원사업 등의 지원으로 수행된 이번 연구의 성과는 국제학술지 Cell Metabolism 온라인판에 8월 12일 게재되었다. |
7. 투명물질의 레이저 기반 초고속 가공법 개발(Nature Materials, 2020.8.17.)
|
서울대학교 고승환-전누리 교수 공동 연구팀이 바이오칩 쾌속 제작에 적용될 수 있는 초고속 레이저 직접 가공법을 개발했다. 과학기술정보통신부가 추진하는 중견연구자지원사업의 지원으로 수행된 이번 연구의 성과는 공학분야 국제학술지 Nature Materials에 8월 17일 게재되었다. |
8. 신경활성 조절하는 뇌 화학물질 발굴(iScience, 2020.3.23.)
|
한국연구재단(이사장 노정혜)은 정지혜 교수(건국대)와 김세윤 교수(KAIST) 연구팀이 뇌에서 합성되는 화학물질 이노시톨 파이로인산(5-IP7)의 신경활성 조절 기능을 규명했다고 밝혔다. 과학기술정보통신부와 한국연구재단이 추진하는 중견연구지원사업, 뇌과학원천기술사업, 선도연구센터사업의 지원으로 수행되었으며 국제학술지 셀(Cell)의 자매지 ‘아이사이언스(iScience)’에 3월 23일 게재되었다. |
9. 생체 내 나노 코딩 제어 시스템 개발(Advanced Materials, 2020.8.21.)
|
고려대학교 김영근, 강희민 교수 연구팀이 임플란트 소재 표면에서 세포의 부착과 분화를 조절할 수 있는 생체 내 나노 코딩 제어 시스템을 개발했다. 과학기술정보통신부가 추진하는 신진연구자지원사업 및 중견연구자지원사업의 지원으로 수행된 이번 연구는 국제학술지 Advanced Materials에 8월 21일 게재되었다. |
10. 면역항암치료 후 간암 급성진행 현상 규명(Journal of Hepatology, 2020.8.15.)
|
차의과학대학교 분당차병원 전홍재, 김찬 교수 연구팀이 세브란스병원, 삼성서울병원 연구팀과 함께 간암 면역항암치료 후 암이 급속도로 악화되는 급성 진행 현상을 규명했다. 과학기술정보통신부가 추진하는 기초연구지원사업(신진연구, 중견연구)의 지원으로 수행된 이번 연구의 성과는 유럽 간 학회지 Journal of Hepatology에 8월 15일 게재되었다. |
11. 세로토닌 수용체와 환각물질과의 결합구조 규명(Cell, 2020.9.17.)
|
한국연구재단은 교육부와 한국연구재단이 추진하는 박사후 국외연수지원사업의 지원을 받은 김국래 박사(공동 제1저자)가 소속된 브라이언 로스 교수 연구팀(미국 노스캐롤라이나 대학교)이 세로토닌 수용체와 환각물질(LSD, 25CN-NBOH)과의 결합구조를 규명했다고 밝혔다. 김국래 박사가 공동 제1저자로 참여한 이번 연구의 성과는 국제학술지 ‘셀(Cell)’에 9월 17일 게재되었다. |
▶ 2021년
1. 늘었다 줄었다 하는 나노코일로 골세포 분화 조절 실마리(Advanced Materials, 2021.2.3.)
|
강희민, 김영근 교수(고려대학교 신소재공학부) 공동 연구팀이 임플란트 소재 표면에서 실시간 원격제어로 생체 내 세포의 부착과 분화를 조절할 수 있는 자성 나노코일 시스템을 개발했다고 과학기술정보통신부(장관 최기영)는 밝혔다. 과학기술정보통신부 개인기초연구(중견연구 및 신진연구 등)의 지원으로 수행된 이번 연구의 성과는 재료분야 국제학술지 어드밴스드 머티리얼스(Advanced Materials)에 2월 3일 00시(한국시간) 게재되었다. |
2. 새로운 뇌종양 면역반응 규명(Nature Immunology, 2021.2.11.)
|
이흥규 교수(KAIST) 연구팀이 악성 뇌종양 세포의 과도한 산소 소비로 인한 감마델타 T 세포의 면역반응 저하 과정을 규명했다고 밝혔다. 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업(차세대바이오 사업) 및 삼성미래기술육성재단의 지원으로 수행되었으며 면역학 분야 국제학술지 ‘네이처 이뮤놀로지(Nature Immunology)’ 2월 11일 자에 게재되었다. 한편 네이처 이뮤놀로지는 이 연구결과가 담긴 논문을 게재하는 외에 별도로 뉴스앤뷰즈(News & Views) 코너에서 이 논문에 대해 소개하였다. |
3. 나노-코로나를 이용한 면역 활성화 전략(Advanced Materials, 2021.3.1.)
|
강동우 교수(가천대학교) 연구팀이 혈액 내 면역반응 유발 단백질을 나노입자에 부착하면 단백질의 구조가 심하게 뒤틀리고 면역반응이 활성화가 된다는 것을 알아냈다고 밝혔다. 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발 및 중견연구지원사업으로 수행된 이번 연구의 성과는 국제학술지 ‘어드밴스드 사이언스(Advanced Science)’에 3월 1일 게재되었다. |
4. 녹내장 진단용 안압 모니터링 콘택트렌즈 개발(Nature Biomedical Engineering, 2021.5.3.)
|
박장웅 교수(연세대학교 신소재공학과) 및 김홍균 교수(경북대학교병원 안과), 김대우 교수(경북대학교병원 안과) 공동연구팀이 미세한 안압변화를 감지할 수 있는 고감도 안압 센서 및 무선 회로를 소프트 콘택트렌즈 내에 제작하여, 스마트폰과 무선 통신할 수 있도록 했다고 밝혔다. 과학기술정보통신부와 한국연구재단이 추진하는 중견연구지원사업 및 바이오・의료기술개발사업의 지원으로 수행된 이번 연구의 성과는 생명공학 분야 국제학술지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’에 5월 3일 게재됐다. |
5. 4D 프린팅으로 근육재생 및 척추유합 세포담체 개발(Applied Physics Reviews, 2021.5.12.)
|
김근형 교수(성균관대학교), 이상진 교수(Wake Forest Institute for Regenerative Medicine) 연구팀이 4D 프린팅 기술로 세포 배열을 조절할 수 있는 바이오잉크 기반 세포담체를 개발하고, 근육 손실 동물모델에서의 효과를 확인했다고 밝혔다. 과학기술정보통신부・한국연구재단이 추진하는 중견연구지원사업 및 자연모사혁신기술개발사업의 지원으로 수행된 이번 연구는 응용 물리학 분야 국제학술지 어플라이드 피직스 리뷰(Applied Physics Reviews)에 5월 4일(뼈조직 재생) 및 5월 12일(근육 재생)에 게재(featured article)되었다. |
6. 누르는 힘에 따라 밝기가 달라지는 전자피부 개발(Advanced Materials, 2021.6.2.)
|
강문성 교수(서강대학교 화공생명공학과) 연구팀과 김도환 교수(한양대학교 화학공학과) 연구팀이 누르거나 당기는 등 힘의 변화를 빛의 미세변화로 응답하는 ‘스마트 발광형 전자피부’를 개발했다고 과학기술정보통신부(장관 임혜숙)가 밝혔다 과학기술정보통신부와 한국연구재단이 추진하는 개인기초연구(중견연구) 사업의 지원으로 수행된 이번 연구의 성과는 재료과학 분야 국제학술지 ‘어드밴스드 머터리얼스(Advanced Materials)’에 6월 2일 0시(한국시간 기준) 온라인 게재되었다. |
7. 뇌 보호하는 혈액-뇌 장벽 모사한 인공 칩 개발(Nature Biomedical Engineering, 2021.6.15.)
|
한국연구재단(이사장 노정혜)은 조승우 교수(연세대학교 생명공학과), 반용선 교수(연세대학교 생명공학과) 연구팀이 혈뇌장벽의 구조와 기능적 특징을 모사한 인공 혈뇌장벽 칩을 설계했다고 밝혔다. 과학기술정보통신부의 기초연구지원사업, 뇌과학원천기술개발사업 등의 지원으로 수행된 이번 연구는 의생명공학 분야 국제학술지 네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)에 2021년 6월 15일 자로 게재되었다. |
8. 물방개 수중 점착컵 본뜬 무전원 체액포집 패치 개발(Advanced Materials, 2021.6.17.)
|
방창현 교수(성균관대학교), 조승우 교수(연세대학교) 연구팀은 수컷 물방개 앞발에 있는 점착컵의 구조・원리를 밝히고, 이를 본떠 무전원 방식의 신속 체액 포집 피부 모니터링 패치를 개발했다고 밝혔다. 과학기술정보통신부와 한국연구재단이 추진하는 신진연구사업 등의 지원으로 진행된 이번 연구의 성과는 국제학술지 ‘사이언스 어드밴시스(Science Advances)에 6월 17일(한국시간) 게재되었다. |
9. 헬리코박터만 위 질환을 유발하는 것이 아니다(Gut, 2021.8.13.)
|
한국연구재단은 이용찬, 남기택, 김지현 교수(연세대학교) 연구팀이 경상국립대학교 권순경 교수와의 공동연구를 통해 위 질환 환자의 위강내 미생물에 의한 마우스에서의 위 질환 유도에 성공했다고 밝혔다. 위암화 과정을 동물모델에서 직접 구현한 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오・의료기술개발사업 등의 지원으로 수행되었으며 연구결과는 소화기 연구 분야 최고 권위 학술지 거트(Gut)에 8월 13일(온라인) 발표되었다. |
10. 바이러스 사용한 높은 효율의 태양전지 박막 구현(Advanced Energy Materials, 2021.9.2.)
|
한국연구재단은 “전일(성균관대학교), 오진우(부산대학교) 교수 연구팀과 김형도 교수(교토대학교) 연구팀이 바이러스를 첨가해 페로브스카이트 결정의 질을 높이고 페로브스카이트 태양전지 소자가 태양광을 전기에너지로 전환하는 광전효율을 높였다.”고 밝혔다. 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구(신진연구)사업, 미래소재디스커버리사업 등의 지원으로 수행된 이번 연구 성과는 재료과학 분야 국제학술지 ‘어드밴스드 에너지 머터리얼스(Advanced Energy Materials)’에 9월 2일 게재(온라인)되었다. |
11. 생명체와 상호 교감이 가능한 초소형 소프트 로봇 개발(Science Robotics, 2021.10.14.)
|
과학기술정보통신부(장관 임혜숙)는 한승용・강대식・고제성 교수(아주대학교 자연모사연구실) 연구팀이 사람 손 형상을 닮은 초소형 소프트 로봇(그리퍼)을 개발했다고 밝혔다. 과학기술정보통신부 개인기초연구(신진연구) 사업의 지원으로 수행된 본 연구 성과는 로봇 분야 세계 최고 권위 학술지인 국제학술지 사이언스 로보틱스(Science Robotics)에 10월 14일 04시(한국시간) 게재되었다. |
12. 개구리 발바닥 모사한 생체 삽입형 전자패치 개발(Advanced Materials, 2021.11.15.)
|
한국연구재단(이사장 이광복)은 성균관대학교 방창현 교수팀, 손동희 교수팀(제1저자 성균관대 김다완 박사, 대구경북첨단의료산업진흥재단 송강일 박사)이 공동연구를 통해 화학 점착제 없이 생체 내 역동적인 움직임 및 수분환경 등에서도 고접착 상태를 유지할 수 있는 생체친화성 전자 패치를 개발했다고 밝혔다. 과학기술정보통신부와 한국연구재단이 추진하는 신진연구사업 등의 지원으로 진행된 이번 연구의 성과는 국제학술지 ‘어드밴스드 머티리얼즈(Advanced Materials)’에 2021년 11월 15일 온라인 게재(출간본 표지 논문 선정)되었다. |
13. 돌연사 주범 심부전 원인 규명(European Heart Journal, 2021.11.15.)
|
한국연구재단(이사장 이광복)은 한진, 김형규 교수(인제대학교 심혈관대사질환센터) 연구팀이 심장의 전기활동과 수축력을 조절하는 세레블론(Cereblon) 단백질의 새로운 기능을 규명했다고 밝혔다. 과학기술정보통신부와 한국연구재단이 추진하는 집단연구사업(기초연구실) 등의 지원으로 수행된 이번 연구의 성과는 심혈관 질환 분야 국제학술지 ‘유럽 심장 저널(European Heart Journal)’에 2월 22일 온라인 게재되었다. |
▶ 2022년
1. 인간 미토콘드리아 DNA의 아데닌 염기교정 기술 최초 개발(Cell, 2022.4.26.)
|
기초과학연구원(IBS, 원장 노도영) 유전체 교정 연구단(前단장 김진수)은 세계 최초로 미토콘드리아 DNA의 아데닌(A) 염기 교정 도구인 ‘TALED(Transcription Activator-Like Effector-linked Deaminase)’를 개발하여 Cell에 발표하였다. 이번 연구결과는 생물학 분야의 권위 있는 학술지인 셀(Cell, IF 41.582)에 4월 26일 게재되었다. |
2. 피 한 방울로 암 진단 가능한 바이오센서 개발(Advanced Materials, 2022.5.17.)
|
기초과학연구원(IBS, 원장 노도영) 첨단연성물질 연구단(단장 스티브 그래닉) 조윤경 그룹리더(UNIST 바이오메디컬 공학과 교수) 연구진은 혈액・소변을 이용해 암과 같은 질병을 현장에서 바로 진단할 수 있는 다공성 금 나노전극 기반 바이오센서를 개발했다. 이번 연구결과는 세계적인 권위지인 어드밴스드 머티리얼즈(Advanced Materials, IF 30.849) 誌에 5월 17일 온라인 게재됐고 표지 논문 (frontispiece)으로 선정되었다. |
3. 뇌 속 반응성 별세포의 ‘요소회로’, 치매의 새 원인(Cell Metabolism, 2022.6.23.)
|
기초과학연구원(IBS, 원장 노도영) 인지 및 사회성 연구단 이창준 단장 및 주연하 박사 연구팀은 한국과학기술연구원(KIST, 원장 윤석진) 뇌과학 연구소 류훈 단장 연구팀과 함께 별세포 내 요소회로의 존재를 확인하고, 활성화된 요소회로가 치매를 촉진함을 규명했다. 이 연구는 세계적 학술지 ‘셀 메타볼리즘(Cell Metabolism, IF 27)’에 6월 23일 0시(한국시간) 온라인 게재됐다. |
4. 감염으로부터 폐를 보호하는 면역세포 발견(Blood, 2022.6.9.)
|
한국연구재단(이사장 이광복)은 배외식 교수(성균관대학교) 연구팀이 폐 호중구가 감염이나 염증 환경에서 폐를 보호하는 역할을 담당하고 있음을 발견했다고 밝혔다. 과학기술정보통신부와 한국연구재단이 추진하는 기초연구사업(중견연구 및 선도연구센터사업) 등의 지원으로 수행된 이번 연구의 성과는 혈액학 분야 국제학술지 ‘블러드(Blood)’에 6월 9일 온라인 게재되었다. |
5. 항생제를 활용한 고효율 디스플레이 소자 개발(Advanced Materials, 2022.7.12.)
|
한국연구재단(이사장 이광복)은 류승윤 교수(고려대학교, 제1저자 김동현, 이창민 박사과정) 연구팀이 항생제 기반 미세구조 합성을 통해 유기전계 발광소자의 효율을 높일 수 있는 원천기술을 확보했다고 밝혔다. 과학기술정보통신부와 한국연구재단이 추진하는 중견연구사업 및 교육부와 한국연구재단이 추진하는 중점 연구소지원사업으로 수행된 이번 연구의 성과는 재료과학 분야 국제학술지 ‘어드밴스드 머티리얼스(Advanced Materials)’에 7월 12일 온라인 게재되었고, 정식출간본 표지 논문으로 선정되었다. |
6. 생합성 필수대사체로 세포사멸 조절 기전 찾아내(Nature Cell Biology, 2022.8.8.)
|
한국연구재단(이사장 이광복)은 황철상, 이윤태 교수(포항공과대학교, 제1저자 응우옌 테 카 박사) 연구팀이 마치에프6 단백질이 생합성에 꼭 필요한 대사체인 NADPH를 직접 감지하고 주요 페롭토시스 유도 인자들의 분해를 조절함으로써 세포사멸을 제어한다는 사실을 규명했다고 밝혔다. 과학기술정보통신부와 한국연구재단이 추진하는 리더연구, 중견연구, 선도연구센터지원사업 등으로 수행된 이번 연구의 성과는 세포생물학 분야 국제학술지인‘네이처 셀 바이올로지(Nature Cell Biology)’에 8월 8일 게재되었다. |
7. 로봇, 바이오 등 다양한 영역에 적용 가능한 고성능 하이드로젤 전극/작동장치 개발(Science Robotics, 2022.10.27.)
|
과학기술정보통신부(장관 이종호, 이하 ‘과기정통부’)는 조진한 교수 연구팀(고려대)과 고제성 교수(아주대) 연구팀이 고전도・고신축성 하이드로젤 전극을 제작할 수 있는 기술을 확보하여 고성능・저전력 연성 구동기와 초소형 수상 로봇 개발에 성공했다고 밝혔다. 과기정통부 개인기초연구사업(중견연구 및 신진연구) 등의 지원으로 수행한 이번 연구의 성과는 국제학술지인 사이언스 로보틱스(Science Robotics)에 10월 27일(현지시간 10.26.(수) 14시, 미국 동부) 게재되었다. |
8. 동고동락하던 쌍둥이 분자, 소리로 격리시킨다(Chem, 2022.11.16.)
|
기초과학연구원(IBS, 원장 노도영) 복잡계 자기조립 연구단 김기문 단장(POSTECH 화학과 교수) 연구팀은 소리만을 이용하여 한 용액 안에서 서로 다른 키랄성을 가지는 분자들을 공간적으로 분리하는 데 성공했다. 연구 결과는 11월 16일(한국시간) 화학 분야 저명 국제학술지인 ‘켐(Chem, IF 25.832)’에 실렸다. |
9. 간암 치료제의 조기 내성 규명(JAMA Oncology, 2022.10.20.)
|
한국연구재단(이사장 이광복)은 전홍재・김찬 교수(차의과학대학교) 연구팀이 아테졸리주맙 성분의 약물을 투여한 간암 환자의 면역항암치료 조기 내성에 항약물항체가 관련되어 있음을 규명했다고 밝혔다. 과학기술정보통신부와 한국연구재단이 추진하는 기초연구사업(신진연구 및 중견연구)의 지원으로 수행된 이번 연구의 성과는 종양 분야 국제학술지 ‘자마 온콜로지(JAMA Oncology)’에 10월 20일 게재되었다. |
10. 암 전이 억제 할 수 있는 새로운 조성물 개발(Cellular & Molecular Immunology, 2022.10.14.)
|
한국연구재단(이사장 이광복)은 이화여자대학교 이지희 교수 연구팀이 사멸된 암세포가 암 관련 섬유아세포(Cancer-Associated Fibroblasts, 이하 CAF)를 타깃하여 Notch1 시그널-의존적 WISP-1 생성을 유도하고, 측분비교신(paracrine communication) 작용을 통해 암 전이를 억제할 수 있다는 사실을 새롭게 규명했다고 밝혔다. 과학기술정보통신부와 한국연구재단이 추진하는 선도연구센터(MRC) 및 중견연구사업의 지원으로 수행된 이번 연구의 성과는 국제학술지 ‘세포&분자 면역학(Cellular & Molecular Immunology)’에 10월 14일 온라인 게재되었다. |
▶ 2023년
1. 나노기술로 암・알츠하이머 일으키는 단백질 형성 원리 규명(Nature Cell Biology, 2023.1.10.)
|
천진우 단장(연세대 화학과・고등과학원 교수) 연구팀은 나노기술과 세포공학 기술을 이용해 조직발달에 중요한 역할을 하는 노치(Notch) 수용체 신호 활성화 과정과 알츠하이머의 주원인으로 알려진 아밀로이드 베타(amyloid-beta, Aβ) 형성 메커니즘을 규명했다. 이번 연구결과는 국제학술지 ‘네이처 셀 바이올로지(Nature Cell Biology, IF 28.82)’에 2022년 12월 2일 온라인 게재됐다. |
2. RNA 유전자 치료제 개발 새 가능성 열었다(Nature, 2023.2.23.)
|
김빛내리 단장(서울대 생명과학부 석좌교수) 연구팀은 마이크로RNA(이하 miRNA) 생성과 RNA 치료제에 중요한 ‘다이서(DICER) 단백질’의 핵심 작동 원리를 밝혀냈다. 뿐만 아니라, 노성훈 서울대 교수 연구팀과 함께 지난 20여 년간 베일에 싸여 있던 다이서의 3차원 구조를 초저온전자현미경(cryo-EM) 기술을 활용해 세계 최초로 규명했다. 암을 비롯한 질병들의 원인을 밝히고 RNA 치료제 개발하는 데 크게 기여할 것으로 기대되는 두 연구결과는 세계 최고 권위지 네이처(Nature, IF 69.5)에 2월 23일(한국시간) 동시 게재됨으로써 그 학술적 가치를 인정받았다. |
3. 코 속 혈관과 림프관의 3차원 정밀지도 최초 완성(Nature Cardiovascular Research, 2023.3.21.)
|
고규영 단장(KAIST 의과학대학원 특훈교수)과 홍선표 연구위원 연구팀은 코 속 혈관과 림프관의 3차원 정밀지도를 최초로 완성했다. 코로나19 증상 원인 파악, 비염 치료 개선 등 비강면역 연구의 새로운 이정표가 될 이번 연구는 국제학술지 ‘네이처 심혈관 연구(Nature Cardiovascular Research)’의 표지 논문으로 선정되었으며, 3월 21일(한국시간) 온라인 게재됐다. |
주) IF(Impact Factor) 20이상 우수 논문 중심으로 정리되었음
|
|
|
|
|
부록2 생명공학 주요 통계 |
1. 예산투자
|
그림 부록 1 |
|
정부 부문 생명공학 투자 실적(1994∼2021) |
(단위: 억 원)

주1) 2007∼2012년의 투자실적에는 출연기관의 투자실적(932억 원, 1,046억 원, 913억 원, 1,218억 원, 1,542억 원, 1,676억 원)이 포함됨
주2) 1994∼2020년 기간의 정부투자는 총 34조 905억 원
주3) 2021년도 수치는 실적치가 아닌 2021년도 생명공학육성시행계획 상의 계획치임
출처: 과학기술정보통신부, 연도별 생명공학육성시행계획 자료 재구성
|
표 부록 1 |
|
국내 부처별 BT 투자실적 및 계획(2020∼2021) |
(단위: 백만 원, %)
|
구 분 |
2021년 투자계획 |
2020년 실적(B) |
증감율 (%) ((A-B)/B) |
|||
|
연구개발 |
인프라 |
인력양성 |
합계(A) |
|||
|
과학기술 정보통신부 |
1,403,938 |
122,212 |
3,750 |
1,529,900 |
1,349,502 |
13.4 |
|
교육부 |
231,195 |
- |
81,987 |
313,182 |
234,226 |
33.7 |
|
농림축산 식품부 |
157,720 |
26,950 |
4,000 |
188,670 |
181,173 |
4.1 |
|
산업통상 자원부 |
262,501 |
18,782 |
5,963 |
287,246 |
234,360 |
22.6 |
|
보건복지부 |
704,804 |
62,396 |
17,225 |
784,425 |
648,537 |
21.0 |
|
환경부 |
82,980 |
- |
- |
82,980 |
64,999 |
27.7 |
|
해양수산부 |
100,266 |
6,210 |
250 |
106,726 |
77,639 |
37.5 |
|
식품의약품 안전처 |
46,012 |
553 |
265 |
46,830 |
41,774 |
12.1 |
|
총계 |
2,989,416 (89.5%) |
237,103 (7.1%) |
113,440 (3.4%) |
3,339,958 (100.0%) |
2,832,210 |
17.9 |
출처: 과학기술정보통신부, 2021년도 생명공학육성시행계획, 2021.2
|
그림 부록 2 |
|
부처별 생명과학 분야 연구개발비 투자계획 비중(2021) |

출처: 과학기술정보통신부, 2021년도 생명공학육성시행계획, 2021.2
|
표 부록 2 |
|
부처별 생명과학 분야 연구개발 투자 비교(2020∼2021) |
(단위: 백만 원)
|
구 분 |
2020 실적 |
2021 계획 |
증감률(%) |
|
과학기술정보통신부 |
1,164,296 |
1,303,852 |
12 |
|
교육부 |
157,810 |
231,195 |
46.5 |
|
농림축산식품부 |
128,648 |
111,686 |
Δ13.2 |
|
산업통상자원부 |
98,182 |
148,690 |
51.4 |
|
보건복지부 |
26,602 |
34,509 |
29.7 |
|
환경부 |
19,577 |
20,042 |
2.4 |
|
해양수산부 |
18,712 |
30,717 |
64.2 |
|
식품의약품안전처 |
925 |
1,274 |
37.7 |
|
합계 |
1,614,752 |
1,881,965 |
16.5 |
출처: 과학기술정보통신부, 2021년도 생명공학육성시행계획, 2021.2
|
표 부록 3 |
|
5대 분야별 연구개발 투자 비교(2020∼2021) |
(단위: 백만 원)
|
구 분 |
2020 실적 |
2021 계획 |
증감률(%) |
|
생명과학 분야 |
1,614,752 |
1,881,965 |
16.5 |
|
Red 분야 |
578,823 |
686,923 |
18.7 |
|
Green 분야 |
114,483 |
145,254 |
26.9 |
|
White 분야 |
70,372.20 |
83,070 |
18.0 |
|
융합신산업 분야 |
170,995 |
192,204 |
12.4 |
|
합계 |
2,549,425 |
2,989,416 |
17.3 |
출처: 과학기술정보통신부, 2021년도 생명공학육성시행계획, 2021.2
|
표 부록 4 |
|
정부 및 민간 BT 연구개발 투자(2017∼2021) |
(단위: 백만 원)
|
구분 |
2017 |
2018 |
2019 |
2020 |
2021 |
|
정부 |
34,946 |
35,494 |
36,717 |
41,253 |
47,766 |
|
민간 |
27,165 |
30,907 |
39,545 |
47,909 |
55,988 |
|
합계 |
62,111 |
66,401 |
76,262 |
89,162 |
103,754 |
주1) 정부 BT 연구개발비는 NTIS 과학기술통계서비스 참고
주2) 합계액은 ‘연구개발활동조사보고서’를 참고(민간 BT 연구개발비 = 합계액-정부 BT 연구개발비)
출처: 한국과학기술기획평가원, 연도별 연구개발활동조사보고서, NTIS 과학기술통계서비스, 생명공학정책연구센터 재가공
|
그림 부록 3 |
|
정부 및 민간 BT 연구개발 투자(2017∼2021) |
(단위: 억 원)

출처: 한국과학기술기획평가원, 연도별 연구개발활동조사보고서, NTIS 과학기술통계서비스, 생명공학정책연구센터 재가공
2. 시설 및 기반구축(인프라)
|
그림 부록 4 |
|
부처별 시설 및 기반구축(인프라) 투자계획 비중(2021) |

출처: 과학기술정보통신부, 2021년도 생명공학육성시행계획, 2021.2
|
표 부록 5 |
|
부처별 시설 및 기반구축(인프라) 투자실적 및 계획 |
(단위: 백만 원)
|
구 분 |
과기정통부 |
농식품부 |
산업부 |
복지부 |
해수부 |
식약처 |
합계 |
|
2020 실적 |
82,533 |
16,695 |
7,252 |
66,241 |
5,328 |
553 |
178,602 |
|
2021 계획 |
122,212 |
26,950 |
18,782 |
62,396 |
6,210 |
553 |
237,103 |
|
증감률(%) |
48.1 |
61.4 |
159 |
△5.8 |
16.6 |
- |
32.8 |
출처: 과학기술정보통신부, 2021년도 생명공학육성시행계획, 2021.2
3. 인력양성
|
표 부록 6 |
|
생명공학 분야 인력양성 실적(2016∼2020) |
(단위: 명, 건)
|
구분 |
2016 |
2017 |
2018 |
2019 |
2020 |
|
|
우수인력 배출 |
석사 |
4,374 |
6,958 |
5,611 |
4,244 |
3,864 |
|
박사 |
2,048 |
2,516 |
2,094 |
2,749 |
2,380 |
|
|
국제교류 인력 |
해외연구자유치 |
319 |
507 |
274 |
442 |
75 |
|
국내연구자 파견 |
230 |
209 |
316 |
428 |
173 |
|
|
참여연구 인력 |
104,088 |
89,964 |
104,896 |
85,454 |
98,276 |
|
|
국제 학술대회 개최(건) |
906 |
812 |
1,040 |
392 |
123 |
|
출처: 과학기술정보통신부, 연도별 생명공학육성시행계획 자료 재구성
|
그림 부록 5 |
|
부처별 인력양성 투자계획(2021) |

출처: 과학기술정보통신부, 2021년도 생명공학육성시행계획, 2021.2.
|
표 부록 7 |
|
부처별 인력양성 투자실적 및 계획 |
(단위: 백만 원)
|
구 분 |
과기정통부 |
교육부 |
농식품부 |
산업부 |
복지부 |
해수부 |
식약처 |
합계 |
|
2020 실적 |
3,750 |
76,416 |
2,000 |
3,019 |
18,733 |
0 |
265 |
104,183 |
|
2021 계획 |
3,750 |
81,987 |
4,000 |
5,963 |
17,225 |
250 |
265 |
113,440 |
|
증감률(%) |
0.0 |
7.3 |
100 |
97.5 |
Δ8.1 |
- |
0.0 |
8.9 |
출처: 과학기술정보통신부, 2021년도 생명공학육성시행계획, 2021.2.
|
그림 부록 6 |
|
국내 생명공학 분야 졸업자 현황(2018∼2022) |
(단위: 명)

주) 생명공학 분야 : 교육통계에 제시된 소계열 분류 중 12개 소계열이 해당(농업학, 동물・수의학, 보건학, 산림・원예학, 생명과학, 생물학, 약학, 의료공학, 재활학, 치의학, 한의학)
출처: 교육통계서비스(https://kess.kedi.re.kr/) 자료, 생명공학정책 연구센터 재구성
|
표 부록 8 |
|
국내 생명공학 분야 졸업자의 학위별 성별 현황(2018∼2022) |
(단위: 명)
|
구분 |
2018 |
2019 |
2020 |
2021 |
2022 |
|
|
석사 |
남자 |
4,602 |
4,267 |
4,295 |
3,452 |
3,355 |
|
여자 |
5,328 |
5,204 |
5,107 |
4,640 |
4,833 |
|
|
소계 |
9,930 |
9,471 |
9,402 |
8,092 |
8,188 |
|
|
박사 |
남자 |
1,898 |
1,883 |
1,888 |
1,963 |
1,955 |
|
여자 |
1,301 |
1,400 |
1,417 |
1,550 |
1,595 |
|
|
소계 |
3,199 |
3,283 |
3,305 |
3,513 |
3,550 |
|
|
총계 |
13,129 |
12,754 |
12,707 |
11,605 |
11,738 |
|
출처: 교육통계서비스(https://kess.kedi.re.kr/) 자료, 생명공학정책 연구센터 재구성
|
그림 부록 7 |
|
국내 바이오산업 종사자 현황(2017∼2021) |
(단위: 명)

출처: 산업통상자원부・한국바이오협회, 2021년 기준 국내 바이오산업 실태조사 결과보고서, 2022.12.
|
표 부록 9 |
|
국내 바이오산업 업무별 종사자 인력 분포(2021) |
(단위: 명, %)
|
구분 |
소계(명) |
비율(%) |
|
연구직 |
17,908 |
32.2 |
|
생산직 |
17,867 |
32.1 |
|
영업/관리직 |
19,843 |
35.7 |
|
전체 |
55,618 |
100.0 |
출처: 산업통상자원부・한국바이오협회, 2021년 기준 국내 바이오산업 실태조사 결과보고서, 2022.12.
|
표 부록 10 |
|
국내 바이오산업 학위별 종사자 인력 분포(2021) |
(단위: 명, %)
|
구분 |
소계(명) |
비율(%) |
|
박사 |
3,234 |
5.8 |
|
석사 |
10,339 |
18.6 |
|
학사 |
27,030 |
48.6 |
|
기타 |
15,015 |
27.0 |
|
전체 |
55,618 |
100.0 |
출처: 산업통상자원부・한국바이오협회, 2021년 기준 국내 바이오산업 실태조사 결과보고서, 2022.12.
|
표 부록 11 |
|
국내 바이오 중소・벤처기업의 총 근로자 및 평균 근로자 수(2019, 2020) |
(단위: 명)
|
구분 |
총 근로자 수 |
기업당 평균 근로자 수 |
|
2020 |
64,338 |
30.0 |
|
2019 |
58,905 |
29.8 |
출처: 산업통상자원부・한국바이오협회, 2021년 기준 국내 바이오산업 실태조사 결과보고서, 2022.12.
|
표 부록 12 |
|
국내 바이오 중소・벤처기업의 분야별 평균 근로자 수(2019, 2020) |
(단위: 명)
|
대분류 |
중분류 |
2019 |
2020 |
|
레드 |
의약품 |
37.0 |
35.5 |
|
진단의료기기 |
33.0 |
34.7 |
|
|
그린 |
농업 |
14.9 |
16.0 |
|
식품 |
27.8 |
26.5 |
|
|
화이트 |
화학 |
25.6 |
26.6 |
|
환경 |
24.1 |
23.2 |
|
|
에너지 |
20.4 |
19.2 |
|
|
플랫폼 |
지원서비스 |
31.3 |
33.9 |
|
기타 |
34.9 |
32.2 |
출처: 산업통상자원부・한국바이오협회, 2021년 기준 국내 바이오산업 실태조사 결과보고서, 2022.12.
|
표 부록 13 |
|
국내 바이오 벤처기업의 총 근로자 및 평균 근로자 수(2019, 2020) |
(단위: 명)
|
구분 |
총 근로자 수 |
기업당 평균 근로자 수 |
|
2020 |
54,134 |
30.3 |
|
2019 |
49,039 |
30.7 |
출처: 생명공학정책연구센터, 2020년 기준 국내 바이오 중소・벤처기업 현황통계, 2022.12; 2019년 국내 바이오 중소・벤처기업 현황통계, 2021.8.
|
표 부록 14 |
|
국내 바이오 벤처기업의 분야별 평균 근로자 수(2019, 2020) |
(단위: 명)
|
대분류 |
중분류 |
2019 |
2020 |
|
레드 |
의약품 |
36.4 |
33.5 |
|
진단의료기기 |
33.6 |
36.4 |
|
|
그린 |
농업 |
14.5 |
16.6 |
|
식품 |
25.6 |
26.3 |
|
|
화이트 |
화학 |
23.2 |
27.1 |
|
환경 |
22.5 |
23.8 |
|
|
에너지 |
32.4 |
24.3 |
|
|
플랫폼 |
지원서비스 |
31.2 |
33.9 |
|
기타 |
35.3 |
34.8 |
출처: 생명공학정책연구센터, 2020년 기준 국내 바이오 중소・벤처기업 현황통계, 2022.12; 2019년 국내 바이오 중소・벤처기업 현황통계, 2021.8.
4. 산업
광의의 개념(의약품, 의료기기 포함)*으로 바이오시장을 추정할 경우에, 2021년 글로벌 바이오시장 규모는 2,480조 원으로 추정
*글로벌 보건산업의 ‘의약품’, ‘의료기기’ 시장과 글로벌 바이오 시장 중 헬스케어 분야를 제외한 시장을 합산
|
표 부록 15 |
|
글로벌 바이오 시장 규모(2021) |
|
구분 |
시장 규모 |
비고 |
출처 |
|
|
글로벌 바이오시장 |
264조 원 (2,230억 달러) |
2021 환율 적용 환산 Healthcare, Crop Production and Agriculture, Industrial Processing, Natural Resources & Environment, Others 시장으로 구성 ※헬스케어 제외 |
Orion Market Research |
|
|
글로벌 보건 산업 |
의약품 |
1,688조 원 (1조 4,240억 달러) |
2021 환율 적용 환산 |
IQVIA Institute |
|
의료 기기 |
528조 원 (4,450억 달러) |
2021 환율 적용 환산 |
Fitch Solutions |
|
|
의료 서비스 |
2,571조 (2조 1,690억 달러)** |
2021 환율 적용 환산 Pharmaceuticals, Medical Devices, Digital Health, Next-Generation Diagnositics, Medical Imaging and Informatics 시장의 합 국내 의료서비스 시장 규모와는 다른 기준 |
Frost & Sulivan |
|
**Frost & Sullivan, Global Pharmaceuticals Outlook, 2022; Frost & Sullivan, Global Medical Devices Outlook, 2022; Frost & Sullivan, Global Digital Health Outlook, 2022; Frost & Sullivan, Next-generation Diagnostics Outlook, 2022; Frost & Sullivan, Global Medical Imaging and Informatics Outlook, 2022의 개별 보고서에서 추정한 시장 규모의 합
출처: Orion Market Research, Global Biotechnology Market 2021-2027, 2021 IQVIA Institute, The Global Use of Medicines 2022, 2021.12. Fitch Solutions, Worldwide Medical Market FactBook, 2020을 통해 추정
광의의 개념(의약품, 의료기기 포함)으로 바이오시장을 추산할 경우, 2021년 국내 바이오 시장 규모는 48조 원으로 추정(글로벌 시장의 1.9% 규모)
*보건산업통계의 ‘의약품’, ‘의료기기’ 생산 규모와 바이오산업 실태조사 보고서의 ‘바이오산업 분야별 생산 현황’ 중 ‘바이오의약’, ‘바이오의료기기’ 산업을 제외한 생산 규모를 합산
|
표 부록 16 |
|
국내 바이오 시장 규모(2021) |
|
구분 |
시장 규모 |
비고 |
출처 |
|
|
국내 바이오시장 |
10조 원 |
바이오산업 분야 유효표본 1,055개 기업, 2021년 국내 바이오산업 생산 규모 바이오의약, 바이오화학・에너지, 바이오식품, 바이오환경, 바이오의료기기, 바이오장비 및 기기, 바이오자원, 바이오서비스산업으로 구성 |
바이오산업 실태조사 보고서 |
|
|
국내 보건 산업 |
의약품 |
25조 원 |
시장규모=생산-수출+수입 |
식품의약품 산업통계 |
|
의료기기 |
13조 원 |
시장규모=생산-수출+수입 |
||
|
의료 서비스 |
182조 원 |
2021년 환율 적용 환산 |
2019 글로벌 보건 산업 시장규모 |
|
출처: 산업통상자원부, 한국바이오협회, 2021년 기준 국내 바이오산업 실태조사 결과 보고서, 2022.12. 식품의약품안전처. 2022 식품의약품 산업동향통계. 2022.12. 한국보건산업진흥원, 보건산업통계. 2019 글로벌 보건산업 시장규모(2012∼2023). 2019.4, 통계지표(원출처: Fitchsolutions)
|
그림 부록 8 |
|
국내 바이오 중소・벤처기업의 분야별 분포 |
(단위: 개)

주) 생존기업 대상
출처: 생명공학정책연구센터, 2020년 기준 국내 바이오 중소・벤처기업 현황통계, 2022.12
|
표 부록 17 |
|
국내 바이오 중소・벤처기업의 분야별 분포 |
(단위: 개)
|
대분류 |
레드 |
그린 |
||||||
|
중분류 |
의약품 |
진단의료기기 |
소계 |
농업 |
식품 |
소계 |
||
|
기업 수 |
613 |
280 |
893 |
248 |
557 |
805 |
||
|
대분류 |
화이트 |
플랫폼 |
||||||
|
중분류 |
화학 |
환경 |
에너지 |
소계 |
지원서비스 |
기타 |
소계 |
|
|
기업 수 |
418 |
105 |
15 |
538 |
339 |
206 |
545 |
|
주) 생존기업 대상
출처: 생명공학정책연구센터, 2020년 기준 국내 바이오 중소・벤처기업 현황통계, 2022.12.
|
그림 부록 9 |
|
국내 바이오 벤처기업의 분야별 분포 |
(단위: 개)

주) 벤처인증 경험이 있는 기업 대상
출처: 생명공학정책연구센터, 2020년 기준 국내 바이오 중소・벤처기업 현황통계, 2022.12.
|
표 부록 18 |
|
국내 바이오 벤처기업의 분야별 분포 |
(단위: 개)
|
대분류 |
레드 |
그린 |
||||||
|
중분류 |
의약품 |
진단의료기기 |
소계 |
농업 |
식품 |
소계 |
||
|
기업 수 |
497 |
247 |
744 |
168 |
385 |
553 |
||
|
대분류 |
화이트 |
플랫폼 |
||||||
|
중분류 |
화학 |
환경 |
에너지 |
소계 |
지원서비스 |
기타 |
소계 |
|
|
기업 수 |
334 |
78 |
10 |
422 |
290 |
173 |
463 |
|
주) 생존기업 대상
출처: 생명공학정책연구센터, 2020년 기준 국내 바이오 중소・벤처기업 현황통계, 2022.12
|
|
|
|
|
부록3 생명공학 관련 법령 |
|
소관부처 |
법률(71개) |
QR코드 |
|
과기정통부 |
생명공학육성법(1983) |
|
|
기초연구진흥 및 기술개발지원에 관한 법률(1989) |
|
|
|
뇌연구촉진법(1998) |
|
|
|
과학기술기본법(2001) |
|
|
|
생명연구자원의 확보・관리 및 활용에 관한 법률(2009) |
|
|
|
기후변화대응 기술개발 촉진법(2022) |
|
|
|
농식품부 |
가축전염병 예방법(1961) |
|
|
동물보호법(1991) |
|
|
|
*시행령QR코드 |
||
|
종자산업법(1995) |
|
|
|
농식품부 |
친환경농어업 육성 및 유기식품 등의 관리・지원에 관한 법률(1997) (농식품부/해수부) |
|
|
산림자원의 조성 및 관리에 관한 법률(2005)(산림청) |
|
|
|
농업생명자원의 보존・관리 및 이용에 관한 법률(2007) |
|
|
|
식품산업진흥법(2007)(농식품부/해수부) |
|
|
|
농림식품과학기술 육성법(2009) |
|
|
|
곤충산업의 육성 및 지원에 관한 법률(2010) |
|
|
|
해외농업・산림자원 개발협력법(2011) |
|
|
|
식물신품종 보호법(2012) (농식품부/해수부) |
|
|
|
산업부 |
신에너지 및 재생에너지 개발・이용・보급 촉진법(1987) |
|
|
산업기술혁신 촉진법(1994) |
|
|
|
화학무기・생물무기의 금지와 특정화학물질・생물작용제 등의 제조・수출입 규제 등에 관한 법률(1996) |
|
|
|
유전자변형생물체의 국가간 이동 등에 관한 법률(2001) |
|
|
|
에너지법(2006) |
|
|
|
산업융합 촉진법(2011) |
|
|
|
국가첨단전략산업 경쟁력 강화 및 보호에 관한 특별조치법(2022) |
|
|
|
복지부 |
감염병의 예방 및 관리에 관한 법률(1954) |
|
|
시체 해부 및 보존 등에 관한 법률(1962) (복지부/질병관리청) |
|
|
|
보건의료기술 진흥법(1995) |
|
|
|
천연물신약 연구개발 촉진법(2000) |
|
|
|
한의약 육성법(2003) |
|
|
|
암관리법(2003) |
|
|
|
생명윤리 및 안전에 관한 법률(2004) |
|
|
|
저출산・고령사회기본법(2005) |
|
|
|
첨단의료복합단지 육성에 관한 특별법(2008) (복지부/산업부/과기정통부) |
|
|
|
제약산업 육성 및 지원에 관한 특별법(2011) |
|
|
|
희귀질환관리법(2015) |
|
|
|
의료기기산업 육성 및 혁신의료기기 지원법(2019) (복지부/식약처) |
|
|
|
첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률(2019) (복지부/식약처) |
|
|
|
환경부 |
환경기술 및 환경산업 지원법(1994) |
|
|
야생생물 보호 및 관리에 관한 법률(2004) |
|
|
|
환경부 |
가축분뇨의 관리 및 이용에 관한 법률(2006) |
|
|
환경보건법(2008) |
|
|
|
생물다양성 보전 및 이용에 관한 법률(2012) |
|
|
|
유전자원의 접근・이용 및 이익 공유에 관한 법률(2017) |
|
|
|
생활화학제품 및 살생물제의 안전관리에 관한 법률(2018) |
|
|
|
기후위기 대응을 위한 탄소중립·녹색성장 기본법(2021) |
|
|
|
녹색융합클러스터의 조성 및 육성에 관한 법률(2021) |
|
|
|
해수부 |
해양수산발전 기본법(2002) |
|
|
해양생태계의 보전 및 관리에 관한 법률(2006) |
|
|
|
수산생물질병 관리법(2007) |
|
|
|
수산자원관리법(2009) |
|
|
|
수산과학기술진흥을 위한 시험연구 등에 관한 법률(2011) |
|
|
|
수산종자산업육성법(2015) |
|
|
|
해양수산생명자원의 확보・관리 및 이용 등에 관한 법률(2012) |
|
|
|
해양수산과학기술 육성법(2016) |
|
|
|
식약처 |
약사법(1953) |
|
|
화장품법(1999) |
|
|
|
건강기능식품에 관한 법률(2002) |
|
|
|
의료기기법(2003) |
|
|
|
인체조직안전 및 관리 등에 관한 법률(2004) (식약처/복지부) |
|
|
|
실험동물에 관한 법률(2008) |
|
|
|
식품・의약품분야 시험・검사 등에 관한 법률(2013) |
|
|
|
식품・의약품 등의 안전기술 진흥법(2015) |
|
|
|
체외진단의료기기법(2019) |
|
|
|
공중보건 위기대응 의료제품의 개발 촉진 및 긴급 공급을 위한 특별법(2021) |
|
1. 관련 법률
주) 부처별 제정 연도순
출처: 과학기술정보통신부(편), 제4차 생명공학육성기본계획, 2023을 참고하여 집필진 작성
2. 관련 계획
|
소관부처 |
계획(51개) |
비고 |
|
과기정통부 |
제4차 생명공학육성 기본계획(’23~’32) |
|
|
제5차 기초연구진흥 종합계획(’23~’27) |
|
|
|
제4차 뇌연구촉진 기본계획(’23~’27) |
|
|
|
제5차 과학기술 기본계획(’23~’27) |
|
|
|
제3차 국가생명연구자원 관리·활용 기본계획(’20~’25) |
|
|
|
제1차 기후변화대응 기술개발 기본계획(’23~’32) |
|
|
|
농식품부 |
동물복지종합계획(’20~’24) |
|
|
제3차 종자산업 육성 5개년 계획(’23~’27) |
|
|
|
제5차 친환경농업 육성 5개년 계획(’21~’25) |
|
|
|
제3차 농업생명자원의 보존/관리 및 이용에 관한 기본계획(’19~’23) |
|
|
|
제4차 식품산업진흥 기본계획(’23~’27) |
|
|
|
제3차 농림식품과학기술 육성 종합계획(’20~’24) |
|
|
|
제2차 곤충산업육성 5개년계획(’16~’20) |
|
|
|
제4차 해외농업자원개발 5개년 종합계획(’23~’27) |
|
|
|
제4차 농업생명공학 육성 중장기 기본계획(’18~’27) |
|
|
|
제7차 농업과학기술 중장기 연구개발 계획(’18~’27) |
|
|
|
제3차 곤충·양잠산업 육성 종합계획(’21~’25) |
|
|
|
제9차 농업기계화 기본계획(’22~’26) |
|
|
|
제3차 산림과학기술 기본계획(산림청)(’18~’27) |
|
|
|
산업부 |
제5차 신・재생에너지 기본계획(’20~’34) |
|
|
제7차 산업기술혁신계획(’19~’23) |
|
|
|
제4차 유전자변형생물체 안전관리계획(’23~’27) |
|
|
|
제4차 에너지기술 개발계획(’19~’28) |
|
|
|
제2차 산업융합발전 기본계획(’19~’23) |
|
|
|
복지부 |
제3차 감염병 예방관리 기본계획(’23~’27) |
|
|
제3차 보건의료기술육성 기본계획(’23~’27) |
|
|
|
제4차 천연물신약 연구개발 촉진계획(’20~’24) |
|
|
|
제4차 한의약 육성발전 종합계획(’21~’25) |
|
|
|
제4차 암관리 종합계획(’21~’25) |
|
|
|
제4차 저출산·고령사회기본계획(’21~’25) |
|
|
|
제4차 첨단의료복합단지 종합계획(’20~’24) |
|
|
|
제3차 제약바이오산업 육성·지원 종합계획(’23~’27) |
|
|
|
제2차 희귀질환관리 종합계획(’22~’26) |
|
|
|
제1차 첨단재생의료·첨단바이오의약품 기본계획(’21~’25) |
|
|
|
환경부 |
제5차 환경기술·환경산업·환경기술인력 육성계획(’23~’27) |
|
|
제4차 야생생물 보호 기본계획(’21~’25) |
|
|
|
제4차 국가생물다양성전략(’19~’23) |
|
|
|
제1차 생활화학제품 및 살생물제 관리에 관한 종합계획(’21~’25) |
|
|
|
제2차 환경보건종합계획(’21~’30) |
|
|
|
해수부 |
제3차 해양수산발전기본계획(’21~’30) |
|
|
제2차 해양생태계 보전·관리 기본계획(’19~’28) |
|
|
|
제3차 수산생물질병관리를 위한 기술개발 종합계획(’21~’25) |
|
|
|
제3차 수산자원 관리기본계획(’21~’25) |
|
|
|
제1차 해양수산생명자원 관리기본계획(’19~’23) |
|
|
|
제2차 해양수산과학기술 육성 기본계획(’23~’27) |
|
|
|
해양수산 R&D 중장기계획(’14~’22) |
|
|
|
중기부 |
제4차 중소기업 기술혁신 촉진계획(’19~’23) |
|
|
식약처 |
의약품 안전관리 제1차 종합계획(’20~’24) |
|
|
제2차 식품・의약품 등의 안전기술 진흥 기본계획(’21~’25) |
|
|
|
질병관리청 |
제3차 국가 감염병 위기대응 기술개발 추진전략(’22~’26) |
|
|
제1차 병원체자원관리종합계획(’21~’25) |
|
출처: 과학기술정보통신부(편), 제4차 생명공학육성기본계획, 2023을 참고하여 집필진 작성

 2023 생명공학백서 바로가기
2023 생명공학백서 바로가기
 2023 생명공학백서 바로가기
2023 생명공학백서 바로가기