BioINwatch
(BioIN + Issue + watch) : 바이오 이슈를 빠르게 포착하여 정보 제공글로벌 희귀의약품 시장 현황 및 전망
- 등록일2016-03-22
- 조회수14348
- 분류레드바이오 > 의약기술, 제품 > 바이오의약
-
발간일
2016-03-22
-
키워드
#글로벌#희귀의약품#시장#희귀질환
- 첨부파일
-
차트+
?
차트+ 도움말
BioINwatch(BioIN+Issue+Watch): 16-20
글로벌 희귀의약품 시장 현황 및 전망
◇ 글로벌 제약산업 분석기업인 미국 이벨류에이트 파마(EvaluatePharma)가 ‘2015 희귀의약품 보고서(Orphan Drug Report 2015)’를 발표함에 따라 희귀의약품 시장 전망에 관한 내용 정리
■ 희귀의약품(Orphan Drug) 이란?
○ 희귀질환(Rare Disease)의 진단, 치료, 예방을 위해 지정된 의약품
- 희귀질환에 대한 정의는 국가마다 상이하나, 유병율을 사용하며 수익성 또는 삶의 질과 관련된 부가적인 규정들을 대체로 함께 적용
※ 미국에서는 유병율이 20만명 이하인 질환으로 정의하나, 미국 FDA에서는 자국 내 환자수가 20만명 이상일지라도 개발비용이 판매를 통해 회수하기 어려운 경우이거나 기허가 제품의 적응증이 희귀질환 치료에 새로 추가된 품목도 포함
※ 한국은 유병율이 2만명 이하로 적절한 치료방법과 치료 의약품이 개발되지 않은 질환으로 정의
○ 희귀의약품은 환자의 수가 적음에도 불구하고 각 국가에서는 정부 차원의 지원정책으로 연구개발을 장려하는 추세
- 미국은 1983년 ‘희귀의약품법(Orphan Drug Act)*’을 통해 희귀의약품 개발에 대한 특혜 부여
* 공익을 위해 희귀의약품을 개발하는 제약회사에 대해 희귀의약품 개발과정에 소요된 비용에 대한 세금공제, 특허수수료 면제, 최초 의약품에 대한 7년간의 마케팅 독점권 부여, 신속심사 대상지정 등의 특혜 부여
- 한국은 현 정부의 공약사항이었던 4대 중증질환(암, 심장질환, 뇌혈관질환, 희귀·난치질환)에 대한 보장성 강화로 희귀질환에 대한 정책 강화
※ 복지부는 2008년 ‘희귀질환진단치료기술 연구사업단’을 출범하였고, 2012년부터 ‘희귀질환중개연구센터’ 지원
※ 식약처는 2011년부터 희귀의약품 허가신청시 일부 자료를 면제하고 우선·신속심사로 다른 의약품에 비해 비교적 빨리 허가될 수 있도록 희귀의약품 지정기준 확대
○ 제한된 환자 수로 시장성이 낮게 평가되었던 희귀의약품에 대해서 국가 차원의 강력한 지원정책, 희귀의약품으로 허가받은 후 적응증을 확대해나가는 제약업체들의 전략 등에 힘입어 관련시장이 유망*할 것으로 전망
* 2015년 IMS Health 보고서에서는 1996∼2020년 사이 새롭게 승인되거나 승인될 신약 중 희귀의약품이 24%(반면에 암 13%)의 가장 큰 비중으로 높은 시장성 예측
■ 글로벌 희귀의약품 시장 현황 및 전망
○ 희귀의약품 세계시장은 2015년 1,030억달러에서 연평균 11.7%로 성장하여 2020년 1,780억달러 규모 전망
- 희귀의약품의 시장 성장 추세는 전체 처방 의약품 시장 성장률(5.9%) 보다 2배 정도 높은 것으로,
- 전체 처방 의약품 시장에서 희귀의약품이 차지하는 비중은 2015년 15.5% → 2020년 20.2%로 상승 예측
<글로벌 희귀의약품 시장 규모/점유율 현황 및 전망(2000~2020년, 단위: 십억달러)>

구분 | 2010년 | 2015년 | 2020년 | CAGR (2015~2020년) |
희귀의약품 시장 | 70 | 102 | 178 | 11.7% |
전년대비 성장율 | 10.7% | 5.6% | 10.3% |
|
점유율 | 11.2% | 15.5 | 20.2% |
|
전체 처방 의약품 시장 | 628 | 661 | 879 | 5.9% |
전년대비 성장율 | 2.5% | -1.7% | 6.3% |
|
출처 : EvaluatePharma, Orphan Drug Report 2015, 2015. 10
○ 미국, 유럽, 일본에서 허가한 희귀의약품은 2003년 이후 강한 증가세를 보이는 것으로 조사
- 미국은 2014년 한 해에 291건의 희귀의약품 허가 수를 보이면서 전년대비 12%의 증가를, 유럽은 201건을 허가하면서 62%의 증가를, 일본은 32건을 허가하면서 7% 증가
<미국, 유럽, 일본의 연도별 희귀의약품 허가 수(1983∼2014년)>
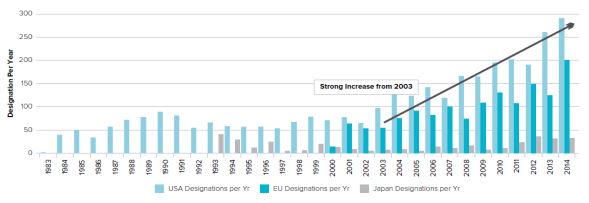
출처 : EvaluatePharma, Orphan Drug Report 2015, 2015. 10
○ 2020년 희귀의약품 관련 주요 업체로는 셀젠(Celgene), 노바티스(Novartis), BMS(Bristol-Myers Squibb), 로슈(Roche)가 희귀의약품 매출액 125~127억달러 사이에서 선두 경쟁
- 알렉시온(Alexion Pharmaceuticals), 버텍스(Vertex Pharmaceuticals), 애브비(AbbVie)도 희귀의약품 매출액이 각각 68억달러, 60억달러, 58억달러로 추산돼 톱 10에 오를 것으로 예상
...................(계속)
본 내용은 연구자의 개인적인 의견이 반영되어 있으며, 생명공학정책연구센터의 공식 견해는 아닙니다.
본 자료는 생명공학 정책연구센터 홈페이지(http://www.bioin.or.kr)에서 PDF 파일로 다운로드가 가능하며,
자료의 내용을 인용할 경우 출처를 명시하여 주시기 바랍니다.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
☎ 해당 사이트 링크가 열리지 않을시 Bioin 담당자(042-879-8377, bioin@kribb.re.kr)에게로 연락주시기 바랍니다.
지식
동향


 BioINwatch16-20(3.22)●글로벌 희귀의약품 시장 전망.pdf
BioINwatch16-20(3.22)●글로벌 희귀의약품 시장 전망.pdf
 글로벌 희귀의약품 시장 규모/점유율 현황 및 전망(2000~2020년, 단위: 십억달러)
글로벌 희귀의약품 시장 규모/점유율 현황 및 전망(2000~2020년, 단위: 십억달러)
 희귀의약품과 비-희귀의약품의 임상비용 비교(단위: 명, 백만달러)
희귀의약품과 비-희귀의약품의 임상비용 비교(단위: 명, 백만달러)