BioINwatch
(BioIN + Issue + watch) : 바이오 이슈를 빠르게 포착하여 정보 제공EU, 2번째 유전자치료제 ‘스트림벨리스’ 승인
- 등록일2016-09-05
- 조회수9595
- 분류레드바이오 > 의약기술, 제품 > 바이오의약
-
발간일
2016-09-01
-
키워드
#EU#유전자치료제#승인
- 첨부파일
-
차트+
?
차트+ 도움말
BioINwatch(BioIN+Issue+Watch): 16-60
EU, 2번째 유전자치료제 ‘스트림벨리스’ 승인
◇ 영국의 제약회사 GSK에서 개발한 줄기세포·유전자치료제 ‘스트림벨리스’를 EU에서 2번째 유전자치료제이자 세계 최초 소아용 유전자치료제로 승인함에 따라 관련 내용 정리
■ EU, 2번째 유전자치료제이자 세계 최초 소아용 유전자치료제 승인
○ 유럽의약품청(European Medicines Agency, EMA)은 글리베라(Glybera)*에 이어 2번째로 유전자치료제 ‘스트림벨리스(Strimvelis)’의 시판을 승인(2016.6)
* 네덜란드의 생명공학 기업인 유니큐어(UniQure)사가 개발한 세계 최초의 희귀질환(지질분해 효소결핍증) 유전자치료제로, 글리베라 가격은 110만유로(약 15.2억원)로 고가의 약가가 책정되는 신기록 기록. 유니큐어는 미국 FDA에서도 글리베라의 승인을 신청해 2018년까지 판매허가를 받을 수 있을 것으로 기대
○ 스트림벨리스는 희귀질환인 아데노신 디아미나아제 결핍증(ADA-SCID)*을 대상으로 한 유전자치료제로 소아 환자에게 사용할 수 있도록 승인
* 중증합병면역결핍증(Severe combined immunodeficiency, SCID)은 면역계통 구성 요소의 기능장애에 의하여 발생하는 질환으로, 상염색체 열성으로 유전되는 SCID 중 50%가 아데노신 디아미나아제(Adenosine Deaminase, ADA) 결핍이 요인
■ 스트림벨리스 기술개발 내용
○ 환자 본인의 줄기세포를 일부 분리한 후, 바이러스 벡터를 이용해 결함이 있는 아데노신 디아미나아제(ADA) 유전자에 건강한 유전자를 줄기세포에 삽입하는 기술 이용
- 치료 목표는 교정된 줄기세포들이 환자의 면역체계를 바로 잡고 감염에 대항하는 기능을 회복시키는 것
- ADA-SCID 소아 환자 18명을 대상으로 임상시험을 수행한 결과 3년차인 현재까지 100% 생존율 기록
※ ADA-SCID 소아는 면역 체계가 충분히 기능하지 않아 일상적인 감염에 대항할 능력 부족, 즉각적인 치료를 하지 않을 경우 생후 1년 내에 사망
○ GSK는 스트림벨리스 가격을 글리베라(110만유로, 약 15.2억원) 보다 상당히 낮은 수준에서 책정할 계획
- 스트림벨리스는 개별 환자의 세포를 채취해 발병 원인에 따라 대응할 수 있는 특성 보유
스트림벨리스 승인으로 유전자치료제 개발 활성화 전망
○ 유전자치료제는 한 번의 치료만으로 효과를 볼 수 있다는 장점이 있어 그동안의 여러 실패에도 불구하고 치료제 개발이 이어지는 중
- 현재 스트림벨리스에 이어 유전자치료제 후보의 2∼3상 시험이 활발하게 진행 중, 세 번째로 등장할 유전자치료제는 스파크 테라퓨틱스(Spark Therapeutics)*사의 SPK-RPE65 유력
* 유전적 안질환인 레베르 선천성 흑암시에 대한 유전자치료제로 올 연말 미국 FDA 승인 신청이 예상되며, 승인을 취득하면 미국에서의 첫 번째 유전자치료제가 되며 5억달러(약 5,400억원) 이상의 매출도 가능할 것으로 전망
<승인 취득 및 취득이 임박한 주요 유전자치료제>
제품 | 제약업체 | 적응증 | 현황 |
젠다이신 | 센젠 시비오노 | 두경부암 | 2003, 중국 승인 획득 |
온코린 | 상하이 선웨이 | 두경부암 | 2005, 중국 승인 획득 |
글리베라 | 유니큐어 | 지질분해 효소결핍증 | 2012, EU 승인 획득 |
스트림벨리스 | GSK | ADA-SCID | 2016, EU 승인 획득 2017, 미국 승인 신청 예정 |
SPK-RPE65 | 스파크 테라퓨틱스 | 레베르 선천성 흑암시 | 2017, 승인 신청 예정 (EU,미국) |
렌타-D | 블루버드 바이오 | 소아기 대뇌 부신 백질 영양장애 치료제 | 임상 3상 진행중 |
Ad-RTS-hIL-12 | 지오팜 온콜로지 | 유방암, 흑색종 | 임상 2상 진행중 |
GSK2696275 | GSK | 비스코트-올드리치증후군 | 임상 2상 진행중 |
LentiGlobin BB305 | 블루버드 바이오 | 베타 지중해 빈혈, 겸상 적혈구 빈혈 치료제 | 임상 2상 진행중 |
SPK-CHM | 스파크 테라퓨틱스 | 맥락막결손 | 임상 2상 진행중 |
BAX 335 | 박스텔라 | 혈우병 B | 임상 2상 진행중 |
출처 : EP Vantage, Strimvelis approval could rejuvenate gene therapy arena, 2016.6, 일부 업데이트
○ 임상단계의 유전자치료제는 종양과 단일유전질환 치료영역에 다수 분포
- 종양에 대한 유전자치료제는 임상 단계로 많이 진입한 상태인 반면에 단일유전질환 관련 유전자치료제는 비임상 단계에서 개발이 활발히 추진 중
- 심혈관질환에 대한 유전자치료제 또한 임상시험 단계에 비교적 활발하게 진입한 상황
<질환별/단계별 주요 유전자치료제 개발 현황>
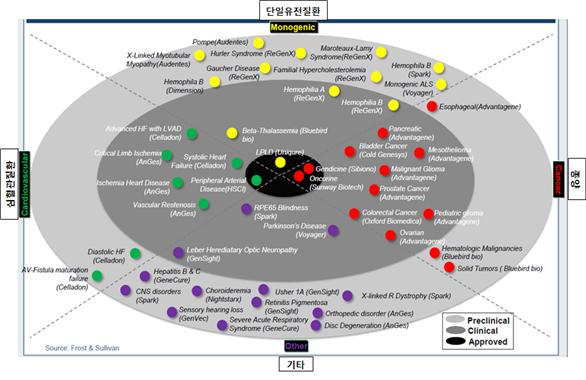
출처 : Frost&Sullivan, Advances in Gene Therapy, 2015.9; 생명공학정책연구센터 BioINdustry 105호, 유전자치료제 산업 전망, 2016.6
본 내용은 연구자의 개인적인 의견이 반영되어 있으며, 생명공학정책연구센터의 공식 견해는 아닙니다.
본 자료는 생명공학정책연구센터 홈페이지(http://www.bioin.or.kr)에서 PDF 파일로 다운로드가 가능하며,
자료의 내용을 인용할 경우 출처를 명시하여 주시기 바랍니다.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
☎ 해당 사이트 링크가 열리지 않을시 Bioin 담당자(042-879-8377, bioin@kribb.re.kr)에게로 연락주시기 바랍니다.
지식
동향


 BioINwatch16-60(9.1)●EU 2번째 유전자치료제 ‘스트림벨리스’ 승...
BioINwatch16-60(9.1)●EU 2번째 유전자치료제 ‘스트림벨리스’ 승...
 승인 취득 및 취득이 임박한 주요 유전자치료제
승인 취득 및 취득이 임박한 주요 유전자치료제
 질환별/단계별 주요 유전자치료제 개발 현황
질환별/단계별 주요 유전자치료제 개발 현황