BioINpro
(BioIN + Professional) : 전문가의 시각에서 집필한 보고서 제공[KRIBB 워킹그룹] 신약 전달기술 연구동향
- 등록일2024-08-02
- 조회수4661
- 분류레드바이오 > 의약기술, 플랫폼바이오 > 바이오기반기술
-
저자/소속
윤성진 외 13명/한국생명공학연구원 환경질환연구센터
-
발간일
2024-08-02
-
키워드
#신약 전달기술#세포 기반 전달기술#항체 기반 전달기술#지질나노입자 기반 전달기술
- 첨부파일
-
차트+
?
차트+ 도움말
[KRIBB 워킹그룹] 신약 전달기술 연구동향
2024년도 KRIBB 워킹그룹이슈페이퍼 제2호
◈ 목차
개요
주요 동향 및 이슈
세포 기반 전달 기술
항체 기반 전달 기술
지질나노입자 기반 전달 기술
결론 및 시사점
◈본문
1. 개요
■ 전달 기술의 정의
-전달 기술이라 함은 저분자 화합물, 유전자, 펩타이드, 단백질 그리고 세포를 표적 생체 조직 또는 세포에 전달하는 기술들을 의미함
-전달 기술은 일반적으로 약물을 생체 내 전달 시 약물의 효과를 높이고 부작용을 줄여 안정성을 높이기 위하여 개발되는 기술로 신약 모달리티 특성에 따라 다양한 형태와 접근 방식이 개발되고 있음
-표적 약물 전달 기술은 최소한의 부작용으로 최대의 치료 효과를 구현하기 위해 종양, 심혈관, 신경, 호흡기 질환을 포함한 다양한 질병 적응증에 대한 약물의 전달 메커니즘을 최적화는 기술임
■ 신약 모달리티 시장 성장에 따른 전달 기술의 중요성
○ 신약 모달리티 확장
-전통적으로 신약 개발은 저분자 및 생물학적 제제를 중심으로 개발이 되어 왔지만, 최근 항체, 펩타이드, 유전자 및 세포 치료제 등 다양한 형태의 신약이 개발되고 있음
-질병의 예방 및 예측, 그리고 개인별 맞춤의학을 실현하는 첨단바이오의학의 패러다임 변화에 따라서 안정성 및 유효성이 검증된 혁신 신약 개발이 요구되고 있으며, 이러한 추세에 따라 기존의 신약과 차별화된 형태의 신약들이 개발되고 있음
-신약 모달리티별 특징에 따라 혈중 안정성(단백질과 펩타이드), 세포내 전달력(핵산 기반 유전자 치료제), 생존력 및 유효성(세포치료제)을 효과적으로 개선시킬 수 있는 새로운 전달 기술 및 전략이 필수적임
○ 신규 모달리티별 약물 전달 기술의 차별화 전략
-저분자 화합물 기반 약물의 경우 약물의 용해도, 효능 및 약동학, 그리고 안전성에 중점을 두고 개발이 되고 복용 및 주사제를 통해서 약물이 전신에 전달되는 것에 집중되어 전달 방법이 개발되어 왔음
-새로운 특성과 치료 전략을 가지는 신규 모달리티의 경우 기존의 약물 전달 방식으로는 효능 및 안전성을 평가 및 확보하기 어려움
-이에 따라, 세포 기반 전달기술, 항체 기반 표적화, 지질나노입자의 최적화 기술들이 개발되고 있음
-최근 in vitro 실험에서 세포의 특정 유전자를 편집할 수 있는 기술이 주목받고 있음. 세포 내로 Cas9과 같은 유전자 편집 효소를 효율적으로 전달하거나 실제 인체에 표적 조직에 in vivo 유전자 편집 기술을 적용하기 위한 전달 기술 및 전략 개발이 필요함
|
출처 : Nat Biomed Eng. (2021) |
[그림 1] 신약 모달리티에 따른 전달 기술 다양화 |
[표 1] 신약 모달리티에 따른 전달 기술 다양화
신약 모달리티 | 전달 시스템 | 사례 |
저분자 화합물 | 서방형 캡슐 | 메디키넷리타드 (Concerta),펙소페나딘, 슈도에페드린 (Allegra D) |
서방형 임플란트 | 에토노게스트렐 임플란트(Nexplanon), 플루오시놀론 (Retisert) | |
흡입식 장치 | 알부테롤 (Proventil HFA), 부데소니드/포르모테롤 (Symbicort) | |
경피 흡수형 패치 | 펜타닐 경피 시스템 (Duragesic), 경피 니코틴 (NicoDerm CQ) | |
자극 감지 약물 방출 | 주사용 버테포핀 (Visudyne) | |
마이크로입자 | 리스페리돈 (Risperdal Consta) | |
나노입자 | 독소루비신(Doxil), 단백질 결합 파클리탁셀 (Abraxane) | |
표적 전달 | 아도-트라스투주맘 엠탄신 (Kadycla) | |
펩타이드 및 단백질 | 제어 방출 미세 입자 저장소 | 류프로라이드 아세테이트 (Lupron Depot) |
현장 성형 폴리머 매트릭스 | 류프로라이드 아세테이트 (Eligard) | |
임플란트 | 류프로라이드 아세테이트 임플란트 (Viadur) | |
비침습적 전달 시스템 | 인슐린 흡입 분말 (Afrezza), 세마글루타이드(Rybelsus) | |
항체 | 항체-약물 접합체 (ADC) | Brentuximab vedotin (Adecetris), ado-trastuzumab emtansine (Kadcyla) |
인간화 항체/분산 촉진제 결합을 통하 최소 침습 피하 주사제 | Trastuzumab and hyaluronidase-oysk (Herceptin Hylecta) | |
비침습적 전달 시스템 | Inhalation powder of anti-IL-13 antigen-binding fragment | |
핵산 치료제 | 지질 기반 나노 입자 | 패티시란 (Onpattro), COVID-19 mRNA 백신 |
바이러스 기반 전달체 | 재조합 P53(Gendicine, 미국에선 미 승인됨), 얀센 Covid-19 백신 | |
폴리머 접합체 | 페갑타닙 (Macugen) | |
표적/리간드 접합체 | 기보시란 (Givlaari) | |
세포 치료제 | 세포 유지를 위한 지지체 | 기질 유도 자가 연골세포 임플란트 (Matrix-induced autologous chondrocyte implantation, MACI) |
미세입자 및 임플란트 | SIG-001 (NCT04541628) | |
약물 분비 치료 박테리아 | AG019 (NCT03751007) | |
세포 하이재킹 (Cellular hitchhiking) | PRIMEIL-15/RPTR-147 (NCT03815682) |
출처: Nat Biomed Eng. (2021)
2. 주요 동향 및 이슈
2.1 세포 기반 전달 기술
■ 세포 기반 약물 전달 기술
-세포 기반 약물 표적화 기술은 개발 초기 단계에 있지만, 전통적인 약물 전달 시스템에 비교해 표적에 대한 특이성과 다양한 응용성에 대한 장점을 가지고 있음
-세포 기반 약물 전달 기술은 치료법의 특성과 사용 목적에 따라 세포 표면에 단백질 기반 약물 페이로드를 결합하거나 세포 내부로 단백질 및 핵산 기반 약물 캡슐화가 가능함
-혈액을 순환 및 이동성을 가지는 세포에 약물을 결합하는 방식으로 조직 및 병변 부위에 약물을 특이적으로 전달할 수 있는 장점을 지니고 있음
[표 2] 세포 기반 약물 전달 기술
약물 이름/회사 | 전달 세포 | 페이로드 (Payloads) | 표적 | 임상 진행 상황 |
RTX-134 (Rubius Therapeutics) | 적혈구 | AvPAL (anabaena variabilis phenylalanine ammonia lyase) | 페닐케톤뇨증 | NCT04110496 (phase I) |
Eryaspase (ERYtech Pharma) | 아스파라기나제 (asparaginase) | 췌장암 | NCT03665441 (phase III) | |
Eryaspase (ERYtech Pharma) | 아스파라기나제 (asparaginase) | 급성 림프구성 백혈병 | NCT03267030 (phase II) | |
Eryaspase (ERYtech Pharma) | 아스파라기나제 (asparaginase) | 삼중음성 유방암 | NCT03674242 (phase II/III) | |
Erydel | dexamethasone sodium phosphate | 혈관확장성 운동실조증 (ataxia telangiectasia) | NCT03563053 (phase III) | |
Orphan Technologies | thymidine phosphorylase | mitochondrial neurogastrointestinal encephalomyopathy (TEETPIM) | NCT03866954 (phase I/II) | |
| 단핵구/ 대식세포 | indinavir nanoparticles (NPs), nanozyme (catalase), doxorubicin-silica nanoparticles, cellular backpack, paclitaxel-liposome | HIV 치료, 파킨슨병, 피부 및 폐 염증 질환, 신경교종 | 전임상 단계 진행 중 |
| 호중구 | pyropheophorbide-a-BSA NPs, TPCA-1 BSA NPs, ER-loaded cRGD liposome | 흑색종, 폐 염증 질환, 뇌경색 | 전임상 단계 진행 중 |
Bluebird Bio | 줄기세포 | LentiGlobin BB305 | 베타지중해빈혈 | NCT02906202 (phase III) |
MSCTRAIL (University College London) | MSCs expressing TRAIL | 비소세포폐암 | NCT03298763 (phase II/III) |
출처: Cell (2020)
○ 약물 전달을 위한 세포 히치하이킹(Cellular hitchhiking) 개념
-세포 히치하이킹을 통한 약물 전달 전략은 생체 내 약물을 전달하기 위하여 세포를 약물 수송체로 이용하는 기술로, mRNA, 단백질 복합체, 세포 소기관 및 세포막에 약물을 부착시켜 전달하는 전략임
-이는 암 치료에서 혈액을 순환하는 세포와 박테리아가 종양에 특이적으로 이동하는 특성을 이용하여 약물을 전달하는 방식으로 종양 특이적 약물 전달 기술뿐만 아니라 다양한 질환에 적용 가능한 잠재력을 가지고 있어 약물 전달 기술에 새로운 가능성을 제시
-적혈구 히치하이킹 전략은 약물이 탑재된 나노 입자를 적혈구에 흡착 시켜 표적 장기의 약물 농도를 지속적으로 높이는 방식으로 폐색전증 및 암 전이에 대한 전임상 연구가 진행되고 있으며, 뇌를 포함한 다양한 장기에 약물을 전달할 수 있는 기술임
○ 호중구 기반 약물 전달 시스템
-호중구 (Neutrophil)는 선천성 면역세포로 골수에서 생성되어 혈류를 순환하다 감염 및 조직 손상 시 표적 조직에 침윤되어 염증 반응을 조절하는 기능을 함
-염증 질환 외에 심혈관 질환, 암, 자가 면역질환 및 알츠하이머에서도 호중구의 유형 및 기능에 따라 질환의 발병 및 진행이 조절된다고 보고되어 있음
-호중구는 생체 내 조직의 감염 및 손상에 따른 염증 반응시 표적 조직으로 이동이 자유로운 호중구의 이동하는 특성과 포식작용을 통하여 약물 함유 지질 나노입자를 세포 내로 저장할 수 있어 약물의 표적 전달이 가능한 세포로 주목받음
-골수/혈관 장벽을 자유롭게 통과할 수 있는 호중구의 특성을 활용하여 골수로 전달해야 하는 약물 나노 입자를 호중구에 유입시키고 이를 활용한 골 전이 암을 치료하는 기술이 보고되었으며, 관련 치료 전략을 통하여 골 전이 암 뿐만 아니라 골다공증을 완화시킬 수 있음이 동물 모델에서 확인 됨
○ 적혈구 기반 약물 전달 시스템
-적혈구는 대표적인 조직 특이적 약물 표적 세포임. 혈액 내에서 가장 풍부한 세포이며 조직 특이적으로 약물 표적 기술을 적용하는데 대표적인 세포로서, CD47 마커를 가지고 있어 대식세포에 의해 제거되지 않고 오래 순환되어 치료 약물의 지속적인 방출 및 유지가 가능하다는 장점을 가짐
-염증성 질환, 암 및 효소 결핍 관련 질환 등 다양한 질병을 치료하기 위하여 저분자 화합물을 적혈구 표면에 부착시켜 지속적인 약물 방출을 유도할 수 있음
-적혈구 기반 서방성 약물 전달 원천기술이 개발되었고, 관련하여 현재 5건의 임상 시험이 진행 중임
|
출처 : Nat Nanotechnol. (2023) |
[그림 2] 호중구 기반 약물 전달 기술 |
|
출처 : ACS NANO (2023) |
[그림 3] 적혈구 기반 약물 전달 기술 |
○ 박테리아 기반 약물 전달 시스템
-박테리아가 종양 조직으로 침윤되어 종양의 성장 및 억제를 유도하는 특성을 기반으로 저분자 화합물의 종양 선택적 전달체로 개발되어 왔음
-암 미세 환경은 혐기성 박테리아가 성장 가능한 저산소 환경을 제공하기 때문에 다양한 종류의 혐기성 박테리아를 이용하여 종양의 면역 시스템을 활성화 또는 약물을 전달할 수 있는 연구들이 진행됨
-특히 약물 전달을 위해 박테리아를 사용하는 개념은 암 치료 전략에서 치료 효능 및 특이성을 향상시킬 수 있는 잠재력과 더불어 최근에는 합성생물학을 기반으로 박테리아 엔지니어링 기술의 발달로 인하여 암 치료를 위한 약물 전달 운반체로 가능성이 주목받고 있음
-박테리아의 대사 경로를 활용하여 산소 농도, pH, 온도 및 다양한 대사 산물에 의한 자극에 의해 조절되는 프로모터를 통하여 박테리아가 종양 환경 특이적으로 이동 및 약물을 전달할 수 있는 기술들이 개발되고 있음
|
출처 : Nat Rev Cancer (2018) |
[그림 4] 박테리아 기반 약물 전달 기술 |
○ 박테리아 주사기를 이용한 약물 전달 시스템
-내공생 박테리아(endosymbiotic bacteria)는 숙주 세포를 조절할 수 있는 인자를 분비하여 유리한 공생 환경을 유지 하고자 함. 많은 인자들이 세포막을 쉽게 통과할 수 없기 때문에 없기에 유효 단백질을 숙주세포 내로 능동적으로 전달하는 시스템 존재
-박테리오파지와 유사한 형태인 세포외 수축 주입 시스템(extracellular contractile injection system)은 스파이크 형태의 구조체를 통하여 표적 세포의 세포막을 통과하여 유효 성분 (단백질)을 전달할 수 있으며, 이러한 특성을 응용하여 단백질 기반 약물을 박테리아 주사기를 통하여 전달이 가능함
-표적 세포의 세포막에 특이적인 결합을 유도하기 위하여 스파이크 형태의 구조체에 에피토프 특이 서열 발현을 통해 항체 및 세포 특이적 전달을 유도하여 단백질 기반 페이로드의 전달 효율을 향상시킬 수 있음
|
출처 : Nature (2023) |
[그림 5] 박테리아 주사기를 이용한 단백질 기반 약물 뇌 전달 |
2.2 항체 기반 전달 기술
■ 항체-약물 결합 기술 (Antibody-drug conjugates, ADCs)
-항체를 활용한 대표적인 약물 전달체인 항체-약물 결합체(ADC)는 표적세포에 특이적으로 발현되는 항원에 결합하는 단일클론항체에 세포사멸 약물을 결합시켜 표적세포를 선택적으로 제거함
-항체-약물 결합체(ADC)는 암세포에 특이적으로 발현되는 항원에 결합하는 단일 클론 항체에 페이로드를 결합시켜 혈액에 방출되지 않고 표적 암 세포에 전달되어 세포사멸을 유도하는 기술임
-항체-약물 결합체는 암 세포 특이적 항원에 결합하여 세포 내재화(cellular internalization)를 통하여 세포 내부로 유입되면 리조솜 분해 기전을 이용하여 페이로드가 방출되고 암 세포의 표적과 결합하여 세포 사멸을 유도하는 기작으로 작용함
-기존의 항체-약물 결합체의 안전성 문제를 해결하기 위하여 이중특이적 항체-약물 결합체, Probody-drug 결합체, 면역 자극 항체-약물 결합체, 단밸질 분해 항체-약물 결합체(PROTAC ADC), 이중 약물 항체-약물 결합체 등 다양한 형태로 개발되고 있음
-항체, 링커, 페이로드 및 접합 기술 등 다양한 항체-약물 결합체의 구성 요소들은 약물의 효능과 안전성을 개선하는데 핵심적이며, 각 요소 기술들에 대한 고도화 연구가 수행되고 있음
|
출처 : Nat Rev Drug Discov.(2023) |
[그림 6] 항체-약물 결합기술(ADC)의 구성 요소 및 작용 기전 |
○ 표적항체
-다양한 항체 중에서 일반적으로 인간화 및 인간 IgG가 항체-약물 결합 기술의 기본 골격으로 사용되고 있으며, 특히 면역원성을 감소시킴으로써 면역 과민 반응을 억제하고 안정성을 확보할 수 있는 인간 IgG1이 주로 사용하고 있음
-현재 항체-약물 결합 기술은 페이로드의 효능, 내구성 및 생체 분포와 같은 항체-약물 결합 기술의 약동학적 특성에 따라 간독성 및 염증 반응을 최소화 할 수 있는 항체 선별이 중요함
-최소한의 면역원성을 가진 인간 IgG1 항체를 경우 약물의 비특이적인 전달에 따른 간독성 및 염증반응을 최소화함
-항암 표적치료제 개발 분야에서 ADC는 암세포 표면에 특이적으로 발현되고 있는 항원을 인식할 수 있는 항체를 선별하고 암세포 고특이 결합 및 세포 내 이입 효능 최적화에 중점을 두고 개발되고 있음
-최근에는 두 개의 서로 다른 항원을 동시에 인식하여 암 치료 효능을 높이기 위한 인간 IgG1 기반 이중항체 ADC가 개발되고 있음
○ 페이로드 (Payload)
-항체-약물 결합 기술에 사용되는 페이로드(약물)는 2019년 전까지는 튜블린 결합제(tubulin binding agents)와 DNA 표적 약물(DNA targeting agents)이 대표적이며, 현재 많은 약물들이 잠재적인 페이로드로 주목받고 있는 상황임
-항체-약물 결합 기술에 사용되는 대부분의 페이로드는 매우 강력한 세포 독성을 가지고 있지만, 항체에 대한 결합 지표인 DAR(drug to antibody ratios) 값이 2~4에서 안정적으로 결합하게 되면 충분한 표적 세포 제거 효능을 나타냄.
-최근 약 8의 DAR값을 가지는 T-DXd와 사시투주맙 고비데칸(sacituzumab govitecan)의 경우 약동학적 특성에 영향을 주지 않으면서 더 많은 수의 독성 페이로드를 항체에 결합하여 효능을 보일 수 있다는 것이 확인되기도 함
-모든 암세포가 특정 형태의 페이로드에 민감하게 반응하지 않을 수도 있으므로, 페이로드의 다양화 및 개발은 ADC의 적응증 확대를 위한 연구가 활발히 진행 중임
|
출처 : Nat Rev Drug Discov.(2023) |
[그림 7] 항체-약물 결합기술(ADC)에서 페이로드의 다양성 |
○ 항체-약물 결합을 위한 링커 (linkers)
-화학적 링커 (chemical linkers)는 독성이 강한 페이로드가 항체에 안정적으로 결합되어 표적 암 세포에 전달되는데 핵심적임
-링커는 절단이 가능한 형태와 불가능한 형태로 개발되고 있으며, 절단 불가능한 링커 (non-cleavable linker)는 혈액 내 순환에서 약물이 방출되지 않게 하여 탁월한 안정성을 제공할 수 있지만, 표적 세포 내에서 충분한 활성을 나타내지 못하는 단점을 가지고 있음
-절단 가능한 페이로드(Cleavable linker)의 경우 암 미세 환경에 특이적으로 반응하여 분해되도록 설계가 되어 암 세포에 내재화 과정에서 활성 페이로드가 효율적으로 방출되도록 유도하여 암 세포의 표적 제어를 통한 세포 사멸을 유발함
-항체와 페이로드의 결합을 위한 링커는 안정성과 효능을 효율적으로 조절할 수 있도록 설계가 되어야 함으로 다양한 형태의 링커들이 발굴 및 개발되고 있는 상황임
○ 단백질 분해-항체 결합체 (Protein degrader-antibody conjugates, DACs)
-DAC는 기존의 독성 페이로드를 전달하는 것과는 다르게 단백질 분해 표적 키메라(PROTAC, proteolysis targeting chimera)를 전달하는 새로운 기술로 PROTAC 기술에서도 두 개의 리간드를 연결하기 위하여 링커를 사용하는 것을 응용하여 단일 클론 항체에 단백질 분해제를 결합시켜 표적 세포에서 표적 단백질 분해가 가능한 방법으로 큰 주목을 받고 있음
-DAC는 표적 단백질을 제거하도록 설계되어 기존의 항체-약물 결합체에 비해 독성이 적고, 항체의 정교한 표적화를 통하여 치료 효능을 높인 기술임
|
출처 : Nat Rev Clin Oncol (2024) |
[그림 8] 단백질 분해제-항체 결합을 이용한 전달 기술 |
2.3 지질나노입자 기반 전달 기술
■ 지질나노입자 기반 약물 시스템
○ 핵산 치료제 개발에서 지질나노입자
-지질나노입자는 간에 siRNA 전달 및 mRNA 백신 전달을 위해 FDA에서 승인된 전달 기술로 코로나19 펜더믹 당시 mRNA/지질나노입자 기반 백신이 감염 예방 및 차단에 큰 효과를 보이면서 지질나노입자 기반 전달 기술이 주목을 받음
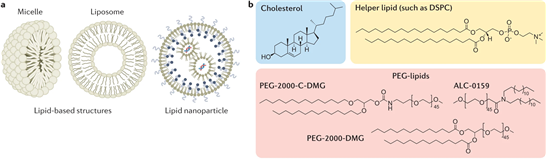
-FDA에 승인된 지질나노입자는 보편적으로 이온화지질(Ionizable lipid), 도움지질(Helper lipid), 콜레스테롤(Cholesterol), PEG-지질(PEGlated lipid)로 구성됨
-이온화 지질은 약산성 환경에서 양전하를 띄는 성질을 가지고 있어 세포 내 RNA 기반 약물 방출에 유도함하며, 현재 이온화지질의 신규 구조를 개발하기 위한 연구가 활발히 진행되고 있는 상황임
|
출처 : Nat Rev Genet (2022) |
[그림 9] FDA 승인된 지질 구조 |
○ mRNA 백신에서 신규 지질나노입자 연구 동향
-mRNA 백신의 경우 전달하고자 하는 항원에 대한 최적의 면역 반응을 유도하는 것이 중요하며, 최근 연구에서는 면역 반응을 강화하는 것이 B세포의 클론 변이를 활성화하고 더 다양한 바이러스 변이체에 대응할 수 있는 항체가 형성되는 것이 보고됨
-이러한 면역반응 강화 또는 최적화는 변이 바이러스에 대한 치료 효능을 높일 수 있음을 시사하며, 최근 연구들은 Toll like 수용체에 대한 agonist (TLR7/8 또는 TLR2/6)를 지질에 합성하여 지질나노입자의 일부로 포함을 시키고 있으며, 이러한 전략은 기존 지질나노입자 제형에 비해 향상된 항원 특이적 T세포 세포성 면역 및 B세포 체액성 면역 반응을 유도할 수 있음
-Toll like 수용체 외에도 STING agonist와 마이크로바이옴 대사물이 결합된 지질 성분이 지질나노입자에 포함되었을 때도 유사한 면역 반응 향상 효능을 보이는 것으로 보고됨
○ mRNA 치료제에서 신규 지질나노입자 연구 동향
-mRNA 치료제의 경우 면역반응 향상이 필수적인 백신과는 다른 특성을 갖는 지질 나노입자 개발이 필요하며, 표적 장기 및 세포로 정밀하게 전달하기 위한 기술이 중요
-지질나노입자의 표적 전달을 위하여 표적 리간드를 지질나노입자 표면에 결합시키거나, 표면 전하의 변화를 유도하여 특정 세포 및 조직에 선택적으로 약물을 전달시키는 기술로 이용되고 있음
-최근에는 이온화지질의 구조를 이용한 지질나노입자 기반 표적 전달이 시도되고 있으며, 대표적으로 파이페라진 구조를 가지는 지질의 경우 면역 세포로 mRNA 전달 효율이 크게 향상된 것으로 보고됨
-구조가 유사한 두 지질에서 질소 원자 또는 산소 원자가 포함되어 있는지에 따라 폐 또는 간으로 mRNA 전달이 가능하다는 연구도 보고됨에 따라 단일 원자에 의한 지질나노입자 표면에 달라붙는 혈중 단백질의 차이를 유발시켜 전달의 효율을 조절할 수 있는 가능성이 확인됨
-이온화지질의 구조에 따라 대표적인 면역세포인 대식세포의 세포막 표면에 과발현하는 Cd11b 유형의 세포에 mRNA의 전달이 가능한 연구 결과를 바탕으로 지질 구조 특이적으로 세포별 표적 전달 가능성이 제시됨
-뇌혈관벽을 투과할 수 있는 지질나노입자, 간세포에 향상된 mRNA 전달 효율을 가지는 신규 지질나노입자 등이 개발되고 있음
■ 효율적인 약물 전달을 위한 나노 입자의 표면 구조 설계
-나노 입자를 이용하여 표적 세포 및 조직에 약물을 효율적으로 전달하는 과정에서 점막 표면, 상피 접합부 (epithelial junctions), 세포막과 같은 생물학적 장벽은 구조적인 특징으로 인하여 약물을 효과적으로 전달하는데 방해물로 작용하기 때문에 다양한 모달리티 약물을 효과적으로 전달할 수 있는 나노전달체 개발 연구에 있어 표적 세포 및 조직에 약물을 효과적으로 전달시키고자 하는 노력은 꾸준히 이어져 옴
-약물을 전달 기술에서 표적 세포의 구조적 특성을 고려하여 효과적으로 약물을 방출할 수 있도록 나노 입자의 표면을 설계하는 것은 약물 전달 효율을 개선할 수 있을 것으로 기대되고 있음
-자연계 존재하는 생명체의 구조적 특성을 응용한 약물 전달 기술이 주목받고 있으며, 바이러스의 스파이크 입자 구조와 유사한 나노 전달체의 경우 표적 세포에 약물 전달 효율을 향상시킬 수 있음
-조직 및 세포내 공간적 특징을 활용한 나노입자의 표면 설계를 통하여 약물 전달체의 표적 조직에 접착, 세포 흡수 및 효율적인 약물 방출을 유도하는 기술들이 개발되고 있음
|
출처 : Nat Rev Bioengineering (2023) |
[그림 9] 나노 입자의 표면 구조 변화를 통한 약물 전달 효율 |
3 결론 및 시사점
■ 종양, 심혈관, 신경, 호흡기 질환을 포함한 다양한 질병 적응증에 대한 전달 메커니즘을 최적화하여, 최소한의 부작용으로 최대의 치료 효과를 내기 위해서 신약 모달리티별 다양한 약물 전달 기술을 확립해야 함
■ 개인별 맞춤의학을 실현하는 첨단 바이오의학의 패러다임 변화에 따라서 치료제의 안전성 및 유효성이 검증된 혁신 신약 개발이 요구되고 있지만, 약물의 효율적인 전달 기술 부재 시 약물의 효능과 안전성을 보장할 수 없음
■ 최근 주목받고 있는 mRNA 치료제 및 유전자 편집 기술의 경우, in vitro 실험에서 세포의 유전자를 편집할 수 있는 기술들이 개발되어 왔으나, in vivo 상에서 표적세포 특이적으로 치료제를 전달하기 위한 기술을 개발하기 위해 경쟁이 치열함. 또한 mRNA 치료제 및 유전자 편집 기술의 잠재적인 가치를 고려하였을 때, 표적 질환 및 표적세포 특이적 치료제 전달 기술을 확립하는 것은 유전자 치료제 개발에 있어서 필수적임
■ 약물 전달 기술은 평균 10년 이상의 기간과 막대한 비용이 필요한 신약개발 과정과 비교할 때, 상대적으로 짧은 시간과 적은 비용으로 약물의 효능을 향상시킬 수 있는 잠재력이 상당한 기술임
■ 또한, 약물 전달 기술은 최근 코로나19 팬데믹 상황에서 등장한 mRNA 백신에 효과적으로 활용된 사례처럼, 최근 신약 개발 과정에 광범위하게 적용되고 있으며 그 발전 가능성이 매우 높을 것으로 전망됨
■ 이에 따라 표적 조직 및 세포에 효율적으로 저분자 화합물, 단백질, 유전자 등을 효율적으로 전달하기 위해서 적혈구, 면역세포, 박테리아 그리고 박테리아 주사기 같은 새로운 개념의 전달 기술 개발이 시도되고 있음
■ 현재의 약물 전달 기술은 아직 개발 초기 단계이기 때문에 국가 전략적 사업으로 효율적인 전달 기술 개발을 위한 관심 및 투자가 필요하며 이를 기반으로 한 선도적인 연구와 수월성 있는 성과들은 국가 경제적·산업적으로 큰 가치를 지닐 수 있을 것으로 전망됨
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 2024_WG_이슈페이퍼_제2호_전달기술 고도화.pdf
2024_WG_이슈페이퍼_제2호_전달기술 고도화.pdf
 신약 모달리티에 따른 전달 기술 다양화
신약 모달리티에 따른 전달 기술 다양화
 신약 모달리티에 따른 전달 기술 다양화
신약 모달리티에 따른 전달 기술 다양화