기술동향
염증반응 시 caspase-11 비고전적 염증복합체와 NLRP3 고전적 염증복합체 간 기능적 상호작용 연구 동향
- 등록일2019-10-16
- 조회수5293
- 분류기술동향 > 레드바이오 > 의약기술
-
자료발간일
2019-10-08
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#caspase-11# inflammation#NLRP3#canonical#non-canonical
- 첨부파일
염증반응 시 caspase-11 비고전적 염증복합체와 NLRP3 고전적 염증복합체
간 기능적 상호작용 연구 동향
< 목 차 >
1. 서론
2. 본론
2.1. Caspase-11 비고전적 염증복합체
2.2. NLRP3 고전적 및 비고전적 염증복합체
2.3. 염증반응 중 Caspase-11 비고전적 및 NLRP3 고전적 염증복합체 간 기능적 상호작용
2.3.1. Caspase-11 및 NLRP3 염증복합체 간 기능적 상호작용
2.3.2. Caspase-11 비고전적 염증복합체 활성화 인자들
2.3.3. Caspase-11 및 NLRP3 염증복합체 간 기능적 상호작용의 분자세포학적 기전
3. 결론
4. 참고문헌
----------------------------------------------------------------------------
1. 서론
선천성 면역반응인 염증은 병원균 침입 및 세포 내 이상 신호로부터 신체를 보호하는 일련의 복잡한 생물학적 과정으로, 다섯 가지의 대표적 특징들-발적, 열, 통증, 부종 및 조직기능상실-을 나타낸다 [1, 2]. 염증반응은 병원균으로부터 유래한 병원균 일부 분자인 병원균-연관 분자패턴(pathogen-associated molecular patterns; PAMPs) 또는 세포D 내 이상 신호인 위험-연관 분자패턴(danger associated molecular patterns; DAMPs)를 염증세포 내/외부에 존재하는 PRRs가 인식함으로써 개시된다 [1, 2]. 염증반응은 크게 priming과 triggering이라는 두 과정으로 진행되는데, priming은염증성 물질들의 발현을 증가시켜 염증반응을 준비하는 과정이다. 반면, triggering은 실질적인 염증반응이 진행되는 과정으로, 이 triggering 과정의 가장 중요한 특징이 염증복합체의 활성화이다 [3,4]. Priming은 주로 세포 표면에 발현된 PRRs인 Toll-like receptors (TLRs)가 PAMPs 및 DAMPs를 인식한 후, nuclear factor-kappa B (NF-κB), activator protein-1 (AP-1), and interferon-regulatory factors(IRFs)와 같은 염증성 신호 경로(inflammatory signaling pathways)들의 활성화를 통해 염증성 유전자의 발현 및 염증성 물질들의 생성을 촉진시킨다 [5-7]. 반면, triggering은 nucleotidebinding oligomerization domain (NOD)-like receptors (NLRs), RIG-I-like receptors (RLRs), absent in melanoma 2(AIM2)-like receptors (ALRs), and caspase-11와 같은 세포 내 PRRs가 PAMPs 및 DAMPs를 인식 후, 염증복합체(inflammasomes)를 형성하면서 개시된다. 염증복합체는 세포 내 PRRs와 염증성 분자들이 결합한 형태의 단백질 복합체로, 크게 NLRP1, NLRP3, NLRP6, NLRP13, NLRC4 및 AIM2와 같은 고전적 염증복합체와 마우스 caspase-11 및 인간 동종(homologs)인 caspase-4, caspase-5와 같은 비고전적 염증복합체로 구성되어 있다 [3, 4, 8-11]. 이러한 염증복합체들은 염증질환 및 감염질환의 발병요인인 염증반응 중 활성화되는데, 염증복합체의 활성화는 순차적으로 gasdermin D (GSDMD)의 가수분해 및 GSDMD에 의한 세포막 천공(cell membrane pores) 형성과 염증성 세포사인 pyroptosis를유도하고, 동시에 capsase-1의 가수분해를 통한 활성화 및 caspase-1에 의한 염증성 싸이토카인(cytokines)들-IL-1β, IL-18-의 성숙 및 분비를 촉진한다 [4, 12]. 현재까지, 염증반응 및 염증질환 그리고 감염질환 등에서 고전적 염증복합체 기능에 관련한 매우 다양하고 많은 연구들이 진행되어 왔다[13-16]. 그러나, 최근 발견된 마우스 caspase-11 및 인간 caspase-4, caspase-5와 같은 비고전적 염증복합체들은 고전적 염증복합체 대비 상대적으로 적은 수의 연구가 진행된 상황이나, 최근 다양한 연구들은 염증반응 중 비고전적 염증복합체, 특히 caspase-11 비고전적 염증복합체의 활성화는 고전적 염증복합체 활성화와는 독립적으로 GSDMD 매개 pyroptosis 및 caspase-1 매개 IL-1β, IL-18의 분비를 촉진함을 규명하였다 [17-21]. 고전적 그리고 비고전적 염증복합체들은 각각 다른 PRRs로 구성되어 있고 서로 다른 리간드에 의해 활성화되기 때문에, 대부분의 앞선 연구들은 특정 염증복합체에초점을 맞춰 연구를 진행해 왔다. 그러나, 염증복합체 활성화 결과 유도되는 염증반응의 기전은 염증복합체 종류와는 상관없이 동일하며, 이는 염증복합체들 간, 특히 고전적-비고전적 염증복합체 간기능적 상호작용이 일어날 수 있음을 의미한다. 실제로, 최근 연구들은 염증복합체 간 기능적 상호작용을 보고하고 있다.
따라서, 이 연구 동향 보고서에서는 최근 보고된 염증반응 시 caspase-11 비고전적 염증복합체와 고전적 염증복합체 중 가장 많은 연구가 진행된 NLRP3 고전적 염증복합체 간 기능적 상호작용에 대한 연구들에 대해 논의하고자 한다. 더불어, 이러한 논의를 통해 염증반응 시 고전적-비고전적 염증복합체 간 기능적 상호작용에 대한 학술적 이해를 증진시키고, 더 나아가 고전적-비고전적 염증복합체 간 기능적 상호작용의 선택적 타겟팅 및 효율적인 제어 전략을 활용한 새롭고 효과적인 염증질환 및 감염질환 치료제 개발에 통찰을 제시할 수 있을 것으로 기대한다.
2. 본론
2.1. Caspase-11 비고전적 염증복합체
Caspase-11의 구조는 N-terminal caspase recruit domain (CARD), p20 및 C-terminal p10의 주요 세 도메인으로 구성되어있다 (그림 1A) [10]. Caspase-11 비고전적 염증복합체는 그람 음성균 세포벽에 존재하는 주요 PAMPs 중 하나인 lipopolysaccharide (LPS)를 인식 후, 직접적인 결합을 통해 활성화된다. 세포 내 존재하는 caspase-11에 의해 LPS가 인식되기 위해서는, 세포 외부에 존재하는 그람 음성균으로부터 LPS가 세포 내로 내재화되어야 하는데, 현재까지 LPS의 내재화 기전은 대략 세 가지로 규명되었다. 첫 번째 기전은, 세포 외부의 LPS가 세포 표면에 발현된 TLR4/MD2/CD14 수용체 복합체 매개 엔도시토시스(endocytosis)를 통해 세포 내부로 내재화되는 방식이다 (그림 1B, 왼쪽) [22]. 두 번째 기전은, 박테리아로부터 생성된 outer membrane vesicles (OMVs)를 통해 세포 내로 내재화되는 방식이다 (그림 1B, 중간) [22]. 마지막 세 번째 기전은, 최근 규명된 기전으로 세포표면에 발현된 advanced glycation end-product (RAGE) 수용체에 의해 내재화되는 방식이다. 세포외부 LPS는 hepatocyte-related high mobility group box 1 (HMGB1)와 결합하여 LPS-HMGB1 복합체를 형성 후, 이 복합체가 세포 표면에 발현된 RAGE 수용체와 결합하여 엔도시토시스를 통해 세포내로 내재화되는 방식이다 (그림 1B, 오른쪽) [23].
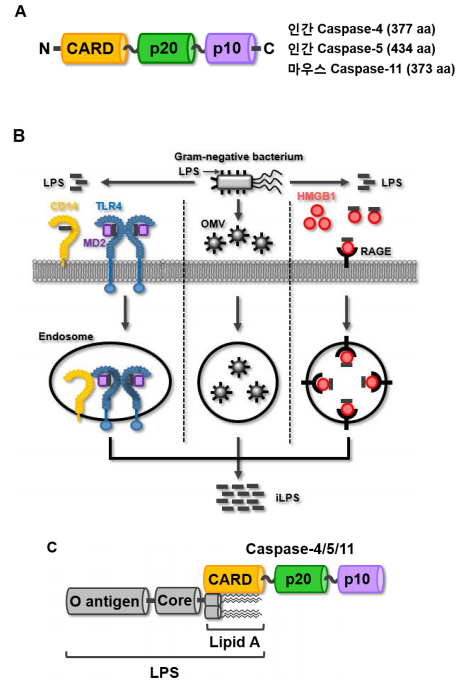
그림 1. Caspase-11 비고전적 염증복합체 구조 및 활성화
(A) 마우스 caspase-11 및 인간 caspase-4/5의 도메인 구조. Caspase-4/5/11은 동일하게 N-terminal CARD, p20 및 C-terminal p10의 세 도메인으로 구성되어 있으며, 아미노산 길이는 각각 337, 434 및 373이다. (B) 세포 외부에 존재하는 LPS가 세포 내로 내재화 되는 기전. 그람 음성균 세포벽으로부터 유래 된 LPS는 CD14과 MD2의 도움을 받아 TLR4와 결합 후, TLR4-MD2-LPS 복합체가 엔도시토시스를 통해 세포 내로 내재화 된다(왼쪽). 또한, 세포 외부에 존재하는 그람 음성균은 LPS를 포함하는 OMVs를 생성한 후, 이 OMVs가 엔도시토시스를 통해 세포 내로 내재화 된다(중간). 마지막으로, 세포 외부의 LPS는 HMGB1과 결합 후, LPS-HMGB1 복합체가 RAGE 수용체와 결합한다. 이 RAGE-HMGB1-LPS 복합체는 엔도시토시스를 통해 세포 내로 내재화 된다(오른쪽). (C) Caspase-11 비고전적 염증복합체 구조. Caspase-11은 세포 내로 내재화 된 iLPS를 인식 후, caspase-11의 CARD와 LPS의 lipid A 부분 간 직접적인 결합을 통해 caspase-11 비고전적 염증복합체를 형성한다.
세포 내로 내재화된 LPS (intracellular LPS; iLPS)는 앞선 연구 결과, caspase-11과 결합하여 caspase-11 비고전적 염증복합체를 형성 및 활성화시키는 유일한 리간드로 규명되었다. iLPS와 caspase-11은 LPS의 lipid A 부분과 caspase-11의 CARD 도메인 간 직접적인 결합을 통해 iLPScaspase-11 복합체가 형성되고 (그림 1C), 그 결과 iLPS-caspase-11 복합체들 간 올리고머화(oligomerization)를 통해 caspase-11 비고전적 염증복합체가 형성된다. 이후, caspase-11 285번 아스파르트산(Asp285) 부위가 가수분해되어 caspase-11 비고전적 염증복합체가 활성화되는데, 이러한 가수분해 작용에 caspase-11 254번 시스테인(Cys254) 부위가 효소 활성에 매우 중요한 부위임이 최근 연구를 통해 규명되었다 [24]. iLPS에 의해 caspase-11 비고전적 염증복합체가 활성화될 경우 순차적인 염증반응이 일어나는데, 먼저 caspase-11 비고전적 염증복합체에 의해 GSDMD가 276번 아스파르트산(Asp276) 부위가 가수분해되고, 가수분해된 N-terminal GSDMD 단편들(fragments)이 세포막으로 이동해 세포막에 천공을 형성 후 염증성 세포사인 pyroptosis를 유도한다 [11,25]. 또한, caspase11 비고전적 염증복합체는 caspase-1을 가수분해를 통해 활성화시키며, 그 결과 염증성 싸이토카인인 IL-1β와 IL-18의 성숙화(maturation) 후 GSDMD 천공을 통해 세포 외부로 분비된다 [11, 25].
앞서 언급했듯이, caspase-11은 마우스 단백질로 caspase-11에 대한 인간 동종을 규명하려는 연구가 진행되었는데, Shi et al. 인간 caspase-4 및 caspase-5가 마우스 caspase-11과 유사하게 iLPS를 인식 후, 직접 결합하여 pyroptosis를 유도함을 밝혀 caspase-11의 인간 동종임을 규명하였다[18]. 다수의 다른 연구들 또한, 인간 caspase-4/5가 iLPS와의 직접적인 결합을 통해 caspase-4/5 비고전적 염증복합체를 형성 후, GSDMD 가수분해에 의한 GSDMD 매개 pyroptosis와 caspase-1 활성화에 의한 caspase-1 매개 IL-1β, IL-18의 성숙 및 분비를 촉진함을 규명하였다 [18, 24, 26-30]. 이러한 연구 결과들은 caspase-4/5가 마우스 caspase-11의 인간 동종이라는 강력한 증거들이며, 염증반응 시 마우스 caspase-11과 동일하게 인간 caspase-4/5가 iLPS와의 직접적인 결합을 통해 caspase4/5 비고전적 염증복합체를 형성하고, 그 결과 GSDMD 매개 pyroptosis 및 caspase-1 매개 IL-1β, IL-18의 성숙 및 분비를 유도한다는 점을 의미한다.
2.2. NLRP3 고전적 및 비고전적 염증복합체
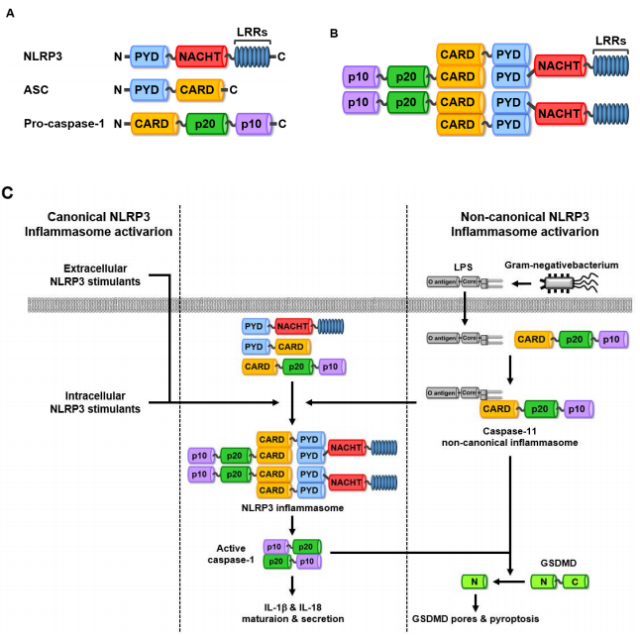
NLR family PRRs 종류 중 하나인 NLRP3의 구조는 N-terminal pyrin domain (PYD), nucleotide-binding and oligomerization domain (NACHT) 및 C-terminal leucine-rich repeats (LRRs)의 주요세 도메인으로 구성되어 있다 (그림 2A). NLRP3는 ATP, cholesterol, K+ efflux, Ca2+ influx, monosodium urate, silica, crystals, alum, asbestos, hyaluronan, β-amyloids, oxidized mitochondrial DNA, mitochondrial reactive oxygen species, phagosomal rupture, bacterial pore-generating toxins, and pathogen-originated nucleic acid hybrids 등과 같은 매우 다양한 종류의 세포 내/외의 리간드들과 결합 및 반응하는 것으로 알려져 있으며, 이러한 리간드들과의 결합 및 반응 후, pro-caspase-1 및 중간 어답터(adaptor) 분자인 ASC (그림 2A)와의 결합을 통해 NLRP3 염증복합체를 형성한다 [3, 4, 8, 9, 31-33]. NLRP3 염증복합체는 NLRP3와 ASC의 PYD를 통한 결합 후, 이 NLRP3-ASC 복합체에 procaspase-1이 CARD를 통해 결합함으로써 형성된다 (그림 2B) [4, 8, 9]. 이러한 NLRP3 염증복합체 형성 및 활성화 과정에는 caspase-11이 전혀 관여하지 않으며, 따라서 이러한 과정을 ‘고전적’ NLRP3 그림 2. NLRP3 염증복합체 구조 및 활성화 (A) NLRP3, ASC 및 pro-caspase-1의 도메인 구조. NLRP3는 N-terminal PYD, NACHT 및 C-terminal LRRs의 세 도메인으로, ASC는 N-terminal PYD 및 C-terminal CARD의 두 도메인으로, pro-caspase는 N-terminal CARD, p20 및 C-terminal p10의 세 도메인으로 구성되어 있다. (B) NLRP3 염증복합체의 구조. NLRP3는 ASC와 PYD를 통해 결합한 후, 순차적으로 pro-caspase-1과 CARD를 통해 결합한다. 이렇게 형성된 NLRP3-ASC-pro-caspase1 복합체는 동종 이합체(homodimer)를 형성한 후, NLRP3 염증복합체로 활성화된다. (C) 고전적 및 비고전적 NLRP3 염증복합체 활성화. 고전적 NLRP3 염증복합체의 활성화의 경우, 세포 내/외부의 리간드에 의해 NLRP3 염증복합체가 형성된 후, caspase-1 활성화를 통한 IL-1β, IL-18의 성숙 및 분비를 유도한다(왼쪽). 반면, 비고전적 NLRP3 염증복합체의 활성화의 경우, 세포 내부로 내재화된 LPS에 의해 활성화된 caspase-11 비고전적 염증복합체에 의해 NLRP3 염증복합체가 형성된 후, GSDMD에 의한 세포막 천공 형성 및 pyroptosis를 유도한다(오른쪽).
염증복합체 활성화라 명명되었다 [4, 8, 9, 34]. 반면, H. influenzae, K. pneumoniae, N. gonorrhea, S.flexneri, E. cloacae 및 P. mirabilis 등과 같은 그람 음성균으로부터 유래한 iLPS가 caspase-11과 결합한 결과 활성화된 caspase-11 비고전적 염증복합체는 NLRP3 염증복합체를 형성 및 활성화시키는 것으로 밝혀졌는데 [35], 이러한 NLRP3 염증복합체 활성화를 고전적 NLRP3 염증복합체 활성화와는 구분지어 caspase-11이 관여하여 활성화되는 ‘비고전적’ NLRP3 염증복합체 활성화로 명명하였다 [9, 34].
비록 고전적 및 비고전적 NLRP3 염증복합체는 다른 방식으로 활성화되지만, 흥미롭게도 두 종류의 NLRP3 염증복합체 활성화 결과 유도되는 염증반응의 분자 기전은 동일한 것으로 규명되었다. 고전적 NLRP3 염증복합체 활성화는 caspase-1을 가수분해를 통해 활성화시킨다. 그 결과 활성화 된 caspase-1은 GSDMD의 가수분해를 유도해 GSDMD 매개 세포막 천공 형성을 유도하고, 그 결과 pyroptosis를 유도한다. 더불어, IL-1β, IL-18의 성숙 및 분비를 촉진한다 (그림 2C). 이와 유사하게, 비고전적 NLRP3 염증복합체의 활성화 또한, 고전적 NLRP3 염증복합체와 동일한 방식으로 caspase-1의 가수분해를 통한 활성화 및 caspase-1 매개 IL-1β, IL-18의 성숙 및 분비를 촉진한다. 이와 더불어, iLPS에 의해 활성화된 caspase-11 비고전적 염증복합체는 GSDMD를 가수분해를 통해 활성화시키고, 그 결과 GSDMD 매개 세포막 천공 형성 및 pyroptosis를 유도한다 (그림 2C) [4, 8, 9, 34]. 비고전적 NLRP3 염증복합체의 활성화는 염증반응 중 고전적 NLRP3 염증복합체와 caspase-11 비고전적 염증 복합체 간 기능적 상호작용이 유도됨을 강력하게 시사하는 것으로, 다음 장(chapter)에서, 염증반응 시 이 두 종류의 염증복합체 간 기능적 상호작용에 대하여 더욱 구체적으로 논의하고자 한다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
동향
- 기술동향 염증반응 시 caspase-11 비고전적 염증복합체와 NLRP3 고전적 염증복합체 간 기능적 상호작용 연구 동향 2019-10-22
- 기술동향 급성, 만성 염증에서의 마크로파지 분극화(Macrophage polarization in acute and chronic inflammation) 2017-05-25
- 기술동향 Imaging inflammation in the living brain 2011-10-05
- 기술동향 Japanese genomes inform on gut inflammation culprits 2010-03-08


 pdf_0003325.pdf
pdf_0003325.pdf