기술동향
얼음결합단백질의 최신연구동향
- 등록일2020-03-17
- 조회수5746
- 분류기술동향
-
자료발간일
2020-03-10
-
출처
한국분자 · 세포생물학회
- 원문링크
-
키워드
#얼음결합단백
얼음결합단백질의 최신연구동향
이정은 극지연구소(실용화연구사업단)
얼음결합단백질(Ice-binding protein: IBP)은 얼음의 표면에 결합하여 얼음의 성장을 억제하거나 혹은 촉진시키는 단백질군을 의미한다. 얼음결합단백질은 1960년대 후반 Dr. DeVries가 남극대구의 혈액에서 antifreeze glycoprotein (AFGP)을 분리하며 세상에 알려졌기 때문에 흔히 결빙방지단백질이라고도 불린다[1,2]. 하지만 이후 다양한 형태의 IBP가 다양한 생물군에서 발견되었는데, 이들은 얼음에 결합한다는 공통점을 공유하지만 구조적으로 다양한 형태를 가지고 있음이 확인되었다[3,4]. 이들이 가지는 활성의 특성에 따라 AFP/THP (Antifreezing/Thermal hysteresis protein), IRIP (Ice-recrystalization inhibition protein) 및 INP (Ice nucleating protein)으로 분류하는데, AFP/THP, IRIP는 얼음의 성장을 억제하는 효과를 갖는 반면, INP는 얼음핵 형성을 유도하여 얼음의 성장을 촉진하는 효과를 가진다[3,5].
얼음결합단백질의 대표적 활성은 온도이력(TH : thermal hysteresis) 활성과 얼음재결정억제(IRI: ice-recrystalization inhibition) 활성으로
나뉜다[3,4]. 온도이력활성은 어는점을 녹는점 아래로 떨어뜨려 결빙을 억제하는 것을 의미하는데 주로 어류 및 곤충의 얼음결합단백질에서 관찰된다[3,4,5]. 한편 식물과 호냉성박테리아,
빙하미세조류 등에서 발견된 얼음결합단백질은 온도이력활성은 낮지만 얼음의 재결정화를 억제함으로써 결빙환경에서 개체의 생존을 돕거나 host가 얼음에 결합하는 것을 도와준다고
알려져있다[6,7,8].
얼음결합단백질 중, 결빙방지단백질 (AFP)로 분류되는 단백질들은 어는점을 녹는점 아래로 떨어뜨려 FH (freezing hysteresis)를 유도한다[3.4.5].
일차 얼음핵의 경우, 얼음핵이 과냉각된 액체로부터 새롭게 형성되지만 이차얼음핵은 기존에 존재하는 결정으로부터 생성되는 특징을 가지는데, AFP들은 어는점을 떨어뜨려 이차얼음핵의 형성을 방지한다[3].
얼음결합단백질의 이차얼음핵 생성 억제 기능은 냉동음식산업에 활용되는 얼음결합단백질의 주요 특성이다[9]. 한편 녹는점 역시 살짝 올라가게 되는데 이는 MH (melting hysteresis)라
일컬으며 온도이력은 MH와 TH사이의 차이 (TH=MH-FH)로 표현된다[3,4,10,11,12].
동결회피(Freeze avoidance)생물은 중간 및 높은 수준의 TH 활성을 이용하여 subzero 혹은 그 이하의 온도에서 체액이 어는 것을 방지하는 능력을 가지는 생물을 말한다[3].
어류의 경우 체액내 삼투농도에 의해 체액의 어는점이 -0.6℃에서 -0.9℃정도에 형성되어 있다. 대략 -1.9℃의 온도를 가지는 남북극 해역에 서식하는 어류의 경우, 이들의 혈장에서
발현되는 AFP 단백질의 FH활성에 의해 체액의 어는점이 좀더 내려가게 되며, 이로 인해 subzero 환경의 바닷물에서도 얼지않은 상태로 생체활동을 유지할 수 있다[13]. 어류 AFP의 TH
활성은 중간수준으로 ~1℃/mM 수준으로 알려져 있다[3]. 한편 극지역 및 고산지역에서 발견되는 곤충과 절지동물의 AFP의 경우 이들은 -20도 이하에서도 생존하는 것으로 알려져 있는데 이들의 hemolymph는 체액의 어는점을 2℃~13℃까지 낮추는 것으로 알려져 있어 hyperactive AFP로 알려져 있다[14.15,16].
TH 활성의 차이는 얼음결합단백질이 얼음평면에 결합하는 패턴의 차이에서 유래하는 것으로 알려졌다. 그림 1에서 볼 수 있듯이, 순수한 물이 어는 과정에는 얼음은 기저평면만 존재하는 디스크 모양을
가지는데 얼음결합단백질이 첨가되게 되면 얼음결정은 다양한 모양의 육각형태를 띄게 된다[3,4,5]. 이때 TH활성이 높은 곤충의 hyperactive AFP의 경우 얼음의 기저평면 및
프리즘평면에 결합하여 a- c- direction(a- : 수평방향, c- : 수직방향)의 생장을 모두 억제하는 반면, 중간활성의 어류 AFP의 경우 프리즘평면에만 결합하여 a- direction의
생장만 억제하는 것으로 보아 얼음에
접합하는 면의 차이와 얼음생장억제의 방향이 TH 활성을 결정한다고 알려져왔다[3,17]. 그러나 최근 Bayer-Giraldi의 연구결과에 의하면 해빙미세조류 (Fragilariopsis
cylindrus)의 fcIBP의 경우 중간활성의 얼음결합단백질이지만, 이 경우 기저평면과 프리즘평면에 모두 결합하여 a- c- direction의 얼음생장을
억제하는 현상이 관찰되어,
얼음생장억제 방향이 얼음결합단백질의 hyperactivity를 결정하는 요인이라고 단정할 수 없게 되었다 [18].
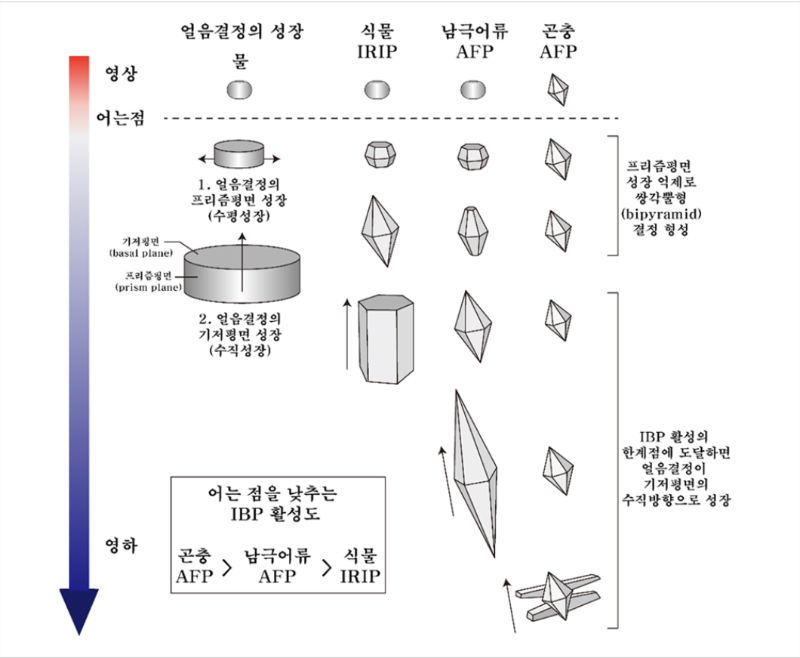
그림 1. 얼음결합단백질의 종류에 따른 얼음성장억제 양상 및 TH (Thermal hysteresis)의 차이
식물과 빙하미세조류의 얼음결합단백질은 온도이력활성은 낮은 반면, IRI 즉, 얼음재결정화 억제 활성이 높다. 식물 세포내 체액이 어는점에 도달하면 다수의 작은 얼음결정들이 extracellular 영역인 아포플라스트에 생기게 된다. 시간이 지남에 따라 작은 얼음결정은 녹게 되지만, 큰 얼음결정은 크기가 점점 커져 세포에 물리적 손상을 일으키게 되는데 이를 얼음재결정화(Ice Recrystalization, IR) 과정이라 한다. 이 때 얼음결합단백질은 얼음의 표면에 결합하여 결정의 생장을 억제하게 되는데 이를 IRI (Ice Recrystalization Inhibition) 활성이라 부른다[3,4,21]. 한편 해빙과 빙하에 서식하는 미세조류의 얼음결합단백질 역시 높은 수준의 IRI 활성을 가지고 있다고 알려져 있다. 이들은 세포 외부로 분비되어 미세조류를 둘러싼 얼음 사이에 브라인포켓(brine pocket)이라는 액체층을 형성하는데, 해빙생태계에서 브라인포켓은 박테리아 및 플랑크톤의 서식처 역할을 한다[3,4,19,25,26,27].
해빙박테리안인 Marinomonas primoryensis 에서 분리된 거대결빙방지단백질인 MpAFP (1.5-Mda)의 경우, 전체 단백질의 2%에 해당하는 RTX
adhesin
domain에서만 얼음결합능이 관찰되었고 나머지 부분은 세포외 분비 및 외막결합 등에 관여하는 것으로 보이며, 박테리아가 해빙의 얼음의 표면에 결합하게 함으로써 phototrophic zone의
영양분과 산소를 획득가능하게 하는 것으로 보인다[7,8].

그림 2. 극지 및 호냉성 생물에서 발견되는 얼음결합단백질의 생태학적 기능
한편 얼음핵형성단백질 (Ice-Nucleating Proteins, INP) 도 IBP의 서브그룹으로 분류되며, 이들은 막결합단백질로서 subzero 온도에서 얼음핵 형성을 촉진하는 효과를 가진다. INP는 식물, 곤충 및 박테리아에서 보고되었는데, 특히 병원성균인 Pseudomonas sp.의 경우 식물의 잎의 표면에서 얼음핵을 유도하여 식물에 물리적 손상을 준다고 알려져 있다[22,23,24].
얼음결합단백질은 얼음에 결합한다는 특성을 공유하고 있지만, 놀랍도록 다양한 구조를 가지고 있다. 현재까지 밝혀진 크리스탈 결정 구조에 의하면 얼음결합단백질은 소형 구형단백질에서부터, 단일 α-helices, 단일 β-solenoids, four helix bundles, polyproline type II helix bundles 등, 다양한 구조를 가지고 있다. 이러한 점은 이들이 지구에 polar ice-cap이 형성되고 빙하가 발달했던 신생대 마이오세~플라이스토세를 거쳐 독립적으로 발생했을 것이라는 가설을 지지한다[3,4]. 한편 이들 단백질 사이의 서열유연관계는 매우 흥미로운 점을 보이는데, 'IBP는 다수의 독립적 기원을 가지지만, IBP의 기능도메인은 유전자 수평이동(horizontal gene transfer)에 의해 획득되었다' 라는 가설이 지지를 받고 있다[3,25,26,27]. 특히 β-solenoid 형태IBP의 특정 도메인(DUF3494)은 박테리아, 규조류, 조류, 곰팡이 및 효모 등 다양한 분류군에서 함께 발견되는 점은 이러한 가설을 지지한다[3,4,25,26,27]. 얼음결합단백질 중 일부는 -TXT- 반복서열이 특정간격의 정렬 형태로 나타나며 이것이 얼음결합모티프로서 작용한다고 알려져 있다. 이들은 서열상의 유연관계는 나타나지 않기 때문에, 이 경우 역시, 독립적 단백질이 구조적 유사성을 가지게 되어 비슷한 기능을 하게 되는 수렴진화의 대표적 예라 할 수 있을 것이다[3]. 최근 필자의 연구팀에서 보고한 빙하미세조류인 Chloromonas sp.의 CmIBP 그룹 단백질도 다른 미세조류나 규조류에서 발견되는 DUF3494 domain 이 나타나지 않는 대신 -TXT- 반복서열이 규칙적으로 나타나는 단백질임을 보고하였다. 이들 단백질의 경우 이들과 서열유사성이 있는 단백질들은 데이터베이스에서 확인되지 않았으나, 메탄고세균의 adhesion A domain에서 '얼음결합모티프의 -TXT- 반복서열'이 비슷한 간격으로 나타난다는 점을 찾을 수 있었고 이들 도메인 역시 얼음결합활성이 있다는 것을 확인할 수 있었다[28]. 이러한 점은 새로운 형태의 얼음결합단백질은 서열유사도가 아닌 단백질의 구조 및 형태에 기반하여 찾아야 한다는 점을 시사한다.
한편 얼음결합단백질의 TH 활성을 높이기 위한 연구들이 활발하게 진행되고 있다. 일반적으로 얼음결합단백질의 사이즈가 커질수록 TH 활성이 높다고 알려져 있다 [29-32]. 초기연구에서
얼음결합단백질을 항체와 함께 넣어준 경우나 혹은 epitope을 달아준 경우에 TH 활성이 크게 증가한 사례가 보고되었다[31]. 자연에서 얼음결합단백질은 유전체 내에 다수의 isoform
유전자로 존재하는 경우가 많은데, 많은 경우에서 길이가 긴 isoform이 더 나은 TH 활성을 가진다고 알려져 있으며, 이경우 얼음결합면 (Ice binding site)의 표면적이 넓어질수록
TH가 훨씬 커진다는 것이 확인되었다[32]. 딱정벌레목에 속하는 Tenebrio molitor의 β-helical TmAFP의 경우 얼음결합면에 해당하는 7개의 coil 중 그
개수를
증가시키면 TH의 활성이 드라마틱하게 증가하는 반면 coil의 수를 감소시키는 경우 활성이 매우 낮아지는 것을 관찰되었다[30].
한편, IRI 활성 역시 단백질의 세부적인 구조에 의해 조절될 수 있다. Chloromonas IBP인 CmIBP의 경우 유전체내 6개이상의 isoform 유전자를 가지고 있는
것으로
확인되었는데, 이들은 모두 평행한 β-sheet로 구성된 β-solenoid 형태를 하고있으며 얼음결합면에 5개 이상의 TXT motif를 일렬로 가지고 있다. 재미있게도 TXT 잔기가 친수성
잔기로 치환된 CmIBP1에서 in vitro 및 과발현 형질전환체식물의 IRI 활성이 가장 높게 나타났는데, 이는 얼음결합모티프의 서열변이 역시 IRI 활성에 영향을 줄 수
있음을
시사한다[28]. 자연형태에 존재하는 얼음결합단백질 들 중 활성이 높은 단백질들을 대상으로, 이들 단백질의 형태 및 활성부위의 서열변이가 얼음결합단백질과 얼음표면사이의 결합형태에 어떤 방식으로
영향을 미치는지 규명한다면 얼음결합단백질의 활성을 보다 정교하게 조절할 수 있을 것이다.

그림 3. 극지미세조류(Chloromonas sp.) 유래 얼음결합단백질을 발현하는 형질전환식물의 IRI 활성 및 결빙내성 향상
1. DeVries AL, Komatsu SK, Feeney RE. 1970. Purification and characterization of a freezing-pointdepressant glycoprotein from Antarctic fish. J. Biol. Chem. 245:2901-8
2. DeVries AL, Wohlschlag DE. 1969. Freezing resistance in some Antarctic fishes. Science 163:1073-753. Bar Dolev M., Braslavsky, I. and Davies PL 2016 Ice-Binding Proteins and Their Function. Annu Rev Biochem 85: 515-542
4. Davies, PL. 2014 Ice-binding proteins: a remarkable diversity of structures for stopping and starting ice growth. Trends Biochem Sci 39: 548-555
5. Voets IK. From ice-binding proteins to bio-inspired antifreeze materials. Soft Matter. 2017 Jul 19;13(28):4808-4823
6. Urrutia ME, Duman JG, Knight CA. 1992. Plant thermal hysteresis proteins. Biochim. Biophys. Acta 1121:199-206 6. Meyer K, Keil M, Naldrett MJ. 1999. A leucine-rich repeat protein of carrot that exhibits antifreeze activity. FEBS Lett. 447:171-78
7. Guo S, Stevens CA, Vance TDR, et al. Structure of a 1.5-MDa adhesin that binds its Antarctic bacterium to diatoms and ice. Sci Adv. 2017;3(8):e1701440.
8. Guo S, Garnham CP, Whitney JC, Graham LA, Davies PL. Re-evaluation of a bacterial antifreeze protein as an adhesin with ice-binding activity. PLoS One. 2012;7(11):e48805. doi:10.1371/journal.pone.0048805
9. Kiani H, Sun DW. 2011. Water crystallization and its importance to freezing of foods: a review. Trends Food Sci. Technol. 22:407-26
10. Celik Y, Graham LA, Mok YF, Bar M, Davies PL, Braslavsky I. 2010. Superheating of ice crystals in antifreeze protein solutions. Proc. Natl. Acad. Sci. U.S.A.107:5423-28
11. Knight CA, DeVries AL. 1989. Melting inhibition and superheating of ice by an antifreeze glycopeptide. Science 245:505-7
12. Cziko PA, DeVries AL, Evans CW, Cheng C-HC. 2014. Antifreeze protein-induced superheating of ice inside Antarctic notothenioid fishes inhibits melting during summer warming. Proc. Natl. Acad. Sci. U.S.A. 111:14583-88
13. Scholander PF, van Dam L, Kanwisher JW, Hammel HT, Gordon MS. 1957. Supercooling and osmoregulation in arctic fish. J. Cell. Comp. Physiol. 49:5-24
14. Duman JG, Bennett V, Sformo T, Hochstrasser R, Barnes BM. 2004. Antifreeze proteins in Alaskan insects and spiders. J. Insect Physiol. 50:259-66
15. Graham LA, Liou YC, Walker VK, Davies PL. 1997. Hyperactive antifreeze protein from beetles. Nature 388:727-28 32. Tyshenko MG, Doucet D, Davies PL,Walker VK. 1997. The antifreeze potential of the spruce budworm thermal hysteresis protein. Nat. Biotechnol. 15:887-9
16. Graham LA, Davies PL. 2005. Glycine-rich antifreeze proteins from snow fleas. Science 310:461
17. Knight CA. 2000. Structural biology: adding to the antifreeze agenda. Nature 406:249-51
18. Bayer-Giraldi M et al. Growth suppression of ice crystal basal face in the presence of a moderate ice-binding protein does not confer hyperactivity. 2018 Proc. Natl. Acad. Sci. U.S.A. 115(29): 7479-84.
19. Bayer-Giraldi M, Uhlig C, John U, Mock T, Valentin K 2010 Antifreeze proteins in polar sea ice diatoms: diversity and gene expression in the genus Fragilariopsis Environmental microbiology 12: 1041-1052
20. Bredow M, Vanderbeld B, Walker VK 2017 Ice-binding proteins confer freezing tolerance in transgenic Arabidopsis thaliana Plant Biotechnol J 15: 68-81
21. Bredow M and Walker VK 2017 Ice-Binding Proteins in Plants Front Plant Sci 8:2153
22. Green RL, Warren GJ. 1985. Physical and functional repetition in a bacterial ice nucleation gene. Nature 317:645-48
23. Garnham CP, Campbell RL, Walker VK, Davies PL. 2011. Novel dimeric β-helical model of an ice nucleation protein with bridged active sites. BMC Struct. Biol. 11:36
24. Graether SP, Jia ZC. 2001. Modeling Pseudomonas syringae ice-nucleation protein as a β-helical protein. Biophys. J. 80:1169-73
25. Raymond JA and Kim HJ 2012 Possible role of horizontal gene transfer in the colonization of sea ice by algae. PLoS One 7: e35968
26. Raymond JA 2014 The ice-binding proteins of a snow alga Chloromonas brevispina: probable acquisition by horizontal gene transfer. Extremophiles 18: 987-994
27. Raymond JA and Morgan-Kiss R 2017 Multiple ice-binding proteins of probable prokaryotic origin in an Antarctic lake alga Chlamydomonas sp ICE-MDV Chlorophyceae. J Phycol 53: 848-854
28. Cho SM, Kim S, Lee H, Lee JH, Lee H, G Choi and Lee J 2019 Type II Ice-Binding Proteins Isolated from an Arctic Microalga Are Similar to Adhesin-Like Proteins and Increase Freezing Tolerance in Transgenic Plants. Plant and Cell Physiol 60 12: 2744-57
29. Leinala EK, Davies PL, Doucet D, Tyshenko MG, Walker VK, Jia ZC. 2002. A β-helical antifreeze protein isoform with increased activity: structural and functional insights. J. Biol. Chem. 277:33349-52
30. Mok YF, Lin FH, Graham LA, Celik Y, Braslavsky I, Davies PL. 2010. Structural basis for the superior activity of the large isoform of snow flea antifreeze protein. Biochemistry 49:2593-603
31. Wu DW, Duman JG, Xu L. 1991. Enhancement of insect antifreeze protein activity by antibodies. Biochim. Biophys. Acta 1076:416-20
32. Chao H, Hodges RS, Kay CM, Gauthier SY, Davies PL. 1996. A natural variant of type I antifreeze protein with four ice-binding repeats is a particularly potent antifreeze. Protein Sci. 5:1150-56
저자약력
2002-2008 서울대학교 자연과학대학, 생명과학부 박사
2009-2011 University of California, Berkeley, Dept. of Plant and Microbial Biology,
박사후 연수연구원
2011-2014 극지연구소, 극지생명과학연구부, 박사후 연수연구원2014-현재 극지연구소, 극지기능생물학, 책임연구원
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.

