기술동향
단백질 삼차원 구조에 기반한 신약 디자인 동향
- 등록일2021-01-28
- 조회수6569
- 분류기술동향
-
자료발간일
2021-01-26
-
출처
생물학연구정보센터(BRIC)
- 원문링크
-
키워드
#단백질 구조#SBDD#도킹#조각#신약 디자인
- 첨부파일
단백질 삼차원 구조에 기반한 신약 디자인 동향
요약문
생명과학의 가장 큰 목표 중 하나는 인간의 생명 현상에 대해 잘 이해하고 건강한 삶에 기여하는 것이다. 이를 위해 역사적으로 신약 개발에 상당한 비용이 투입되었으며, 개발에 성공할 경우 대부분 인류의 복지에 크게 기여한다. 그러나, 신약 개발 프로젝트는 투입되는 비용 대비 성공률이 낮기 때문에 쉽게 접근하기 힘든 것도 사실이다. 더 좋은 효과를 내는 신약을 찾고, 그 과정에서 실패 확률을 낮추려는 노력은 지속적으로 존재했다. 본 글에서는 특정한 타겟(주로 단백질)의 구조에 대한 정보를 출발점으로 하여 신약을 디자인하는 방법론에 대해 소개한다.
구조를 기반으로 신약을 개발하려는 노력은 역사가 오래되었는데, 최신의 방법론이라고 할 수 있는 ‘조각’ 기반의 방법론에 초점을 맞추었다. 조각은 작은 크기로 인해 기존의 큰 분자 위주의 리간드에 비해 많은 장점을 가지며, 스크리닝 과정의 비용이 낮기 때문에 신약 디자인 프로젝트에 대한 진입 장벽 또한 낮다. 그리고 컴퓨터를 이용한 시뮬레이션이 타겟과 리간드의 결합을 예측하고 평가하는 능력이 발전하면서 신약 개발 과정에서 필수적으로 사용되고 있다. 본 글에서는 이러한 방법론들의 특징과 장점 그리고 남아있는 도전 과제 및 앞으로의 발전 방향에 대해서 소개한다.
목 차
1. 서론
2. 본론
2.1 구조 기반의 신약 디자인(structure-based drug design, SBDD)
2.2 조각 기반의 리드 발견(fragment-based lead discovery, FBLD)
2.3 도킹 방법론
3. 결론
4. 참고 문헌
1. 서론
잠재적인 신약을 시장에 출시하는 것은 엄청난 시간과 돈의 투자를 필요로 한다. 한 연구 기관에서는 이 과정의 평균적인 비용이 26억 달러라고 추산했으며 최근에는 더 증가하고 있는 추세이다. 개발에 소요되는 기간은 평균적으로 10년에서 15년 정도가 필요하다고 한다 [1]. 그러나 이런 노력에도 불구하고 약효가 충분하지 않거나 부작용이 발견되는 등의 이유로 신약 개발 프로세스의 90%는 임상시험 중 실패한다 [2]. 기술의 개발을 통해 높은 처리량으로 수많은 약물을 스크리닝할 수 있게 되었지만, 엄청난 비용이 드는 것은 여전하다. 따라서 어떤 방향이든 비용은 줄이고 성공률을 높일 수 있는 방법론이 중요하다. 신약 개발 분야에서 이는 크게 두 갈래의 방향으로 이루어지고 있는데, 하나는 wet lab 기반의 실험적인 방법론이고, 다른 하나는 컴퓨터 기반의 접근법이다.
사실 이 두 가지 방향은 따로 존재한다기보다는 서로 상보적으로 같은 목표를 위해 나아간다고 할 수 있다. 수많은 생물학적 분자들의 삼차 구조가 밝혀지고 데이터 베이스화되고 있으며 이를 기반으로 신약을 디자인하려는 노력이 일정 부분 성공을 거두었다. 이 과정에서 실험적으로 해결할 수 없는 부분에서는 컴퓨터를 이용한 예측이 필요하며, 그러한 예측에 대한 검증 과정에 실제 실험이 도입되는 것이 이상적이다. 본 글에서는 우선 구조 기반의 신약 디자인(structure-based drug design, SBDD)의 개념에 대해 설명하고, 그 구체적인 형태를 조각 기반의 리드 발견(fragment-based lead discovery, FBLD) 과정을 기반으로 소개하고자 한다. 그리고 컴퓨터 기반의 신약 개발 과정에 대해 도킹 방법론을 중심으로 서술한다. 이러한 구분은 편의적인 목적을 위해서이며, 실제로는 두 방향의 조화가 중요하다는 것을 다시 강조해두고 싶다. 구조 기반의 신약 디자인 과정의 기본적인 흐름과 사례, 각 단계에서의 한계점, 앞으로의 방향에 대해 소개하며 최신의 신약 개발 프로세스에 대한 이해를 돕고자 한다.
2. 본론
2.1 구조 기반의 신약 디자인(structure-based drug design, SBDD)
신약을 찾는다는 것은 대개 높은 품질의 화학적 리드(lead)를 찾는 것을 의미한다. “리드"란 특정한 생물학적 타겟에 대해 원하는 활성을 가지는 물질을 말하며, 생화학적인 테스트를 통해 그 활성을 측정할 수 있어야 한다. 그리고 임상적인 적용을 위한 후보로 고려되기 위해서는 화학적, 생물학적, 물리적 특성에 대한 최적화 과정을 거쳐야만 하는 상태의 물질을 말한다. 리드는 다양한 곳에서 발견 가능하다. 예를 들면, 자연적인 산물이나 이미 존재하던 화학적 리드 또는 허가받은 신약이 리드로 사용될 수 있고, 스크리닝을 통해 직접 히트(hit: 사용된 테스트에서 양성 결과를 내는 물질)를 찾고자 시도할 수도 있다. 지난 약 20여 년간 리드를 찾기 위해 가장 널리 사용되던 방식은 높은 처리량의 스크리닝(high-throughput screening, HTS)이었다. HTS는 수백만 개 이상의 물질로부터 출발해서 히트를 찾고 최적화하여 리드로 발전시키고자 한다.
약간 거슬러 올라가 보면, 1950년대와 1960년대에 X-선 결정학(X-ray crystallography)으로 첫 번째 단백질 구조가 발견된 이후 특정한 타겟의 삼차 구조에 대한 지식으로 신약을 개발하려는 노력이 꾸준히 존재했다 [2]. 흔히 이러한 방법론을 구조 기반의 신약 디자인(structure-based drug design, SBDD)으로 부르는데, 컴퓨터, 구조 생물학에 기반하여 다양한 분야를 포괄하며 학계와 산업계에서 관심을 모았다. John Kendrew와 Max Perutz에 의해 만들어진 SBDD의 초기 성과는 상당히 유명한 편이다. 미오글로빈과 헤모글로빈의 구조가 풀렸으며 이 단백질들이 산소를 어떻게 저장, 수송할 수 있는지 뿐만 아니라 sickle cell anaemia의 기전에 대한 분자적인 기반을 제공하고 치료 방향도 제시했다 [3]. 또한 Fred Sanger가 인슐린의 아미노산 서열을 결정하고 Dorothy Hodgkin이 삼차 구조를 결정함으로써 당뇨병을 처치하기 위해 합성 인슐린을 제작하는 기반이 되었다 [4]. 이러한 연구는 단백질의 구조 및 기능에 대한 이해가 어떻게 치료에 영향을 미쳤는지를 단적으로 보여준다. 단백질 접힘에 대한 지식, 구조-기능의 관계, 분자 진화, 치료에 연관 있는 삼차 구조의 이용 가능성 등이 합쳐져 SBDD의 기반을 닦았다.
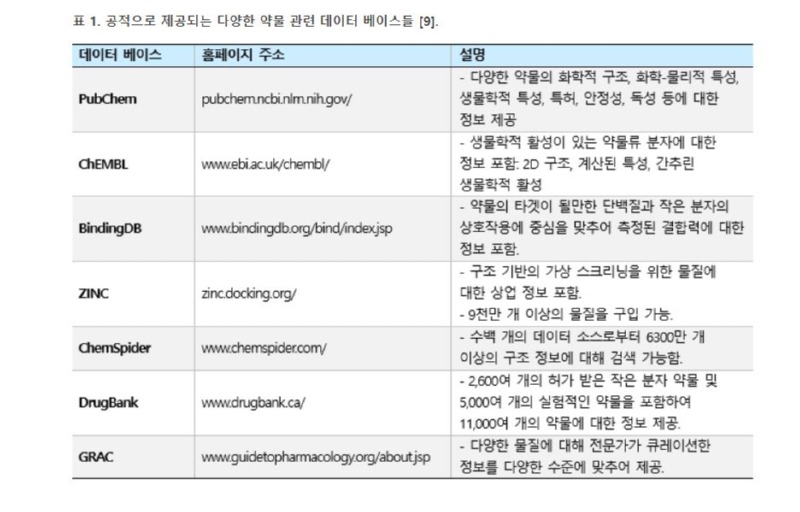
1980년대에는 다양한 바이오 기업들이 성장하여 구조 기반의 신약 찾기에 나섰는데 암을 타겟팅하는 곳도 있었고, 인플루엔자 바이러스를 억제하기 위한 시도도 있었다. 대표적인 성공 사례는 HIV/AIDS에 대한 처치로 HIV protease의 구조를 사용하여 FDA를 승인을 받은 saquinavir, nelfinavir, indinavir, ritonavir 등이 있다 [5, 6]. 이처럼 신약 개발 분야 이외에도 Protein Data Bank (PDB) 같은 데이터 베이스에 단백질 구조 정보가 대량으로 모이자, 이를 컴퓨터로 분석하여 특정 타겟에 대한 저해제 등을 개발하기 위한 소프트웨어 개발도 활성화되었다.
1990년대에는 SBDD가 발전하여 “조각 기반의 리드 발견(fragment-based lead discovery, FBLD)”이라는 형태가 되었다 [7]. 이는 컴퓨터와 구조 생물학 양쪽 분야의 큰 발전에 힘입은 결과이다. FBLD는 30개 이상의 신약 후보를 제시했고, 암 분야에서 FDA의 승인을 받은 세 가지 성공 사례를 만들었다. BRAF의 저해제인 vemurafenib, BCL-2의 저해제인 venetoclax, CDK4의 저해제인 ribociclib이다 [8]. 이런 성공을 바탕으로 FBLD는 더욱 다양한 방법론을 포용하며 발전하고 있다. 라이브러리 크기가 작고 초기 진입 비용이 낮은 점 때문에 학계와 작은 회사에서도 널리 쓰이고 있고, 특히 중견 이상의 제약 회사들에서는 핵심적인 도구로 이미 사용되고 있다.
구조 기반의 디자인은 임상에서 쓰일 신약을 개발하는 것뿐만 아니라 일반적인 생물학 분야에서 분자적인 기전을 연구하는데 사용될 화학적인 탐침을 발견하는 데도 중요하다. RNA 간섭이나 CRISPR 같은 유전적인 접근에 더해서 높은 선택성과 다양한 기능을 가지는 화학적 탐침을 사용하는 것이 기전 이해에 큰 도움이 될 수 있다.
2.2 조각 기반의 리드 발견(fragment-based lead discovery, FBLD)
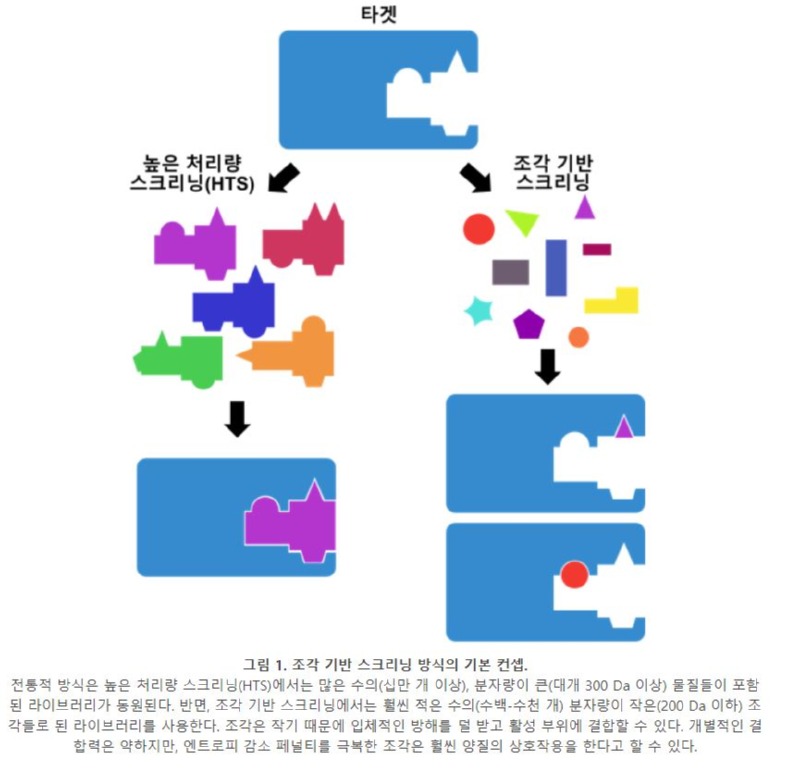
조각(fragment) 방법론은 관심 있는 생물학적 분자에 결합하는 200 Da 이하의 화합물 또는 조각을 찾는 것으로부터 시작한다 [10-12]. 수백에서 수천 개 정도의 적은 수의 물질로 스크리닝을 시작해서 타겟(대다수의 조각 방법론은 단백질을 타겟으로 한다)에 대한 한 두개의 좋은 상호작용을 보이는 물질을 찾는 것을 목표로 한다. HTS에서 타겟 단백질과 수많은 상호작용을 하는 물질을 찾는 것과는 대조적이다. 조각은 작기 때문에 결합을 방해하는 부분을 포함하고 있을 가능성이 낮고, 타겟에 적절히 결합할 조건을 갖추고 있을 확률이 높다. 결과적으로 높은 분자량과 더 복잡한 분자들을 포함하는 비슷한 크기의 라이브러리보다 히트를 얻을 확률이 높다. 이를 다른 방식으로 표현하면 조각은 큰 분자보다 더욱 효율적으로 화학적 공간(chemical space)을 샘플링할 수 있다.
조각 스크리닝은 히트를 찾을 확률은 높지만, 찾아진 조각의 타겟에 대한 친화력은 상대적으로 낮은 편이다. 그러나 이것이 ‘타겟과 상호작용을 제대로 하지 못한다’는 의미는 아니라는 것을 분명히 해야 한다. 오히려 리간드가 단백질에 결합할 때 잃게 되는 엔트로피를 고려하면, 조각은 일반적인 크기의 리간드보다 뛰어난 상호작용을 한다. 엔트로피의 감소는 용액 내에 있던 분자가 특정한 결합을 이루게 되며 회전 운동이나 병진 운동이 감소하기 때문에 발생한다 [13, 14]. 대개 이러한 엔트로피 페널티는 분자량에 무관하다. 분자가 타겟에 결합하기 위해서는 이러한 엔트로피 페널티를 극복해야 하는데, 수많은 상호작용을 하는 큰 분자량의 신약 후보에게 이는 별다른 문제가 되지 않는다. 반대로 말하면, 한 두개의 상호작용만을 만드는 조각의 경우에는 타겟과 강력한 상호작용을 해야만 엔트로피 페널티를 극복할 수 있다. 이런 강력한 상호작용을 기반으로 조각을 리드로 최적화하기 쉬운 것도 FBLD의 장점이다.
타겟과 결합하는 조각이 발견되면 이후에 최적화 과정을 거치는데 리드로 발전시키는 것 이외에도 관심 있는 타겟을 탐지하는데 사용되는 더 높은 친화성의 화합물로 발전시킬 수도 있다. 대부분의 조각은 타겟 사이트에 매우 약한 정도로 결합하기 때문에 그러한 약한 결합을 탐지할 수 있는 특별한 방법론을 필요로 하게 되고, 조각 라이브러리를 만드는 과정에서 높은 용해도를 유지할 수 있게 하는 것이 중요하다.
조각 방법론이 1996년에 최초로 도입된 후 많은 회사들이 원하는 기능을 가지는 조각을 찾는 성과를 보였다. 중요한 점은 1,000개 정도의 작은 조각 라이브러리로 시작해서 유의미한 발견을 할 수 있었다는 점이고 점차 높은 처리량의 방법론이 동원되어 후보 물질의 수를 늘려갔다. 리드가 최적화되어감에 따라서 신약의 개발이 이루어지기 때문에 리드 조각을 찾는 것이 매우 중요하다. 더 중요한 것은 실제로 효과가 있느냐, 즉 조각이 타겟에 결합했을 때 질병이나 상황에 원하는 효과를 줄 수 있느냐라고 할 수 있다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
-
다음글
- 다음글이 없습니다.
-
이전글
- 이전글이 없습니다.
관련정보
지식


 pdf_0003701.pdf
pdf_0003701.pdf