오가노이드
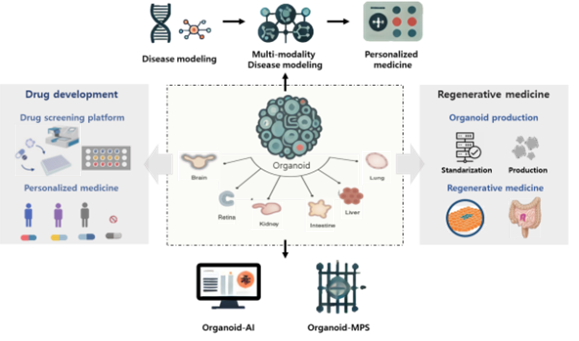
장기유사체 또는 미니 장기로도 불리는 오가노이드는 줄기세포나 장기 기원세포로부터 분리한 세포를 3차원 배양법으로 다시 응집·재조합하여 만든 장기 특이적 세포 집합체이며, 오가노이드는 자가 조직화(Self-organization)가 가능해 일반적인 배양 세포보다 복잡한 생체의 장기를 모방할 수 있어 신약 개발, 인공 장기 및 질병 치료 등으로 활용되고 있습니다.Collection
오가노이드
개념
오가노이드 연구는 2009년 Hans Clevers 연구팀의 연구성과 발표 이후 급격히 발전하여 암 연구를 위한 암 오가노이드 및 장, 간, 폐, 위, 신장, 뇌, 심장에 이르는 다양한 장기의 오가노이드 개발에 성공하였다. 하지만 현재의 오가노이드 기술로는 실제 장기의 복잡한 환경을 반영하지 못하며, 재현성 및 고비용 등 해결과제가 있어 이를 극복하기 위한 다양한 연구개발이 진행되고 있다.
여기에서는 바이오인에서 담고 있는 오가노이드에 관련된 다양한 자료들을 종합적으로 살펴볼 수 있다.
|
오가노이드 연구 동향
|
|
|||||||||||||||||||||||||||
|
오가노이드 활용 분야
|
|
|||||||||||||||||||||||||||
|
글로벌 시장 동향
|
|
|||||||||||||||||||||||||||
|
내용 출처 |
|
지식
더보기-
BioINwatch오가노이드의 복합체, 어셈블로이드(assembloid)
오가노이드의 복합체, 어셈블로이드(assembloid) BioINwatch(BioIN+Issue+Watch): 25-56 ◇ 단일 오가노이드로는 서로 다른 뇌 영역 간의 상호작용이나 장거리 축삭 (axon) 연결을 연구하는 데 한계가 있는데, 이를 극복하기 위해 여러 개의 오가노이드를 조합하여 조직 간 상호작용을 모델링하는 '어셈블로이드(assembloid)'를 개발. 향후 동물모델 중심의 연구 패러다임을 벗어나 어셈블로이드와 같은 인간모델이 점차 중심적 역할을 할 것으로 전망 ▸주요 출처 : Science, Midline assembloids reveal regulators of human axon guidance, 2025.7.17 ◆︎ 인체 줄기세포를 이용한 어셈블로이드(assembloids)로 인간 특이적 신경생물학과 질병 연구가 가능할 것으로 기대 ○ 인간의 뇌가 어떻게 발달하고 복잡한 신경회로를 형성하는지에 대한 이해는 신경과학의 핵심 과제 중 하나 - 특히
2025-08-27

-
BioINwatch맞춤형 ASO 치료제 개발에 유연성과 확장성을 제공하는 오가노이드 플랫폼
맞춤형 ASO 치료제 개발에 유연성과 확장성을 제공하는 오가노이드 플랫폼 BioINwatch(BioIN+Issue+Watch): 25-9 ◇︎안티센스 올리고뉴클레오타이드(ASO, antisense oligonucleotides) 치료제는 유전자 수준에서 특정 질병을 치료할 수 있는 혁신적인 치료법으로, 희귀 유전질환, 암, 감염질환 등에 대한 새로운 치료 가능성을 주목. 최근 연구에서 환자 유래 오가노이드를 사용하여 맞춤형 ASO 치료제 개발을 가속화할 수 있는 방법론을 제시. 신속하면서도 확장 가능한 오가노이드 기반 ASO 스크리닝 플랫폼은 개인 맞춤형 치료제 개발에 기여할 것으로 기대 ▸주요 출처 : Nature News, A scalable system using mini-organs to test personalized RNA therapy, 2025.1.22. Nature, Rapid and scalable personalized ASO screening in p
2025-02-06

-
BioINpro[KRIBB 워킹그룹] 첨단의약품 개발을 위한 오가노이드 기술
첨단의약품 개발을 위한 오가노이드 기술 2024년도 KRIBB 워킹그룹 이슈페이퍼 제8호 ◈ 목차 1.개요 2.주요 동향 및 이슈 2.1 오가노이드 활용 기술 동향 2.2 '23-24 생명(연) 오가노이드 최신 기술개발 성과 2.3 글로벌 오가노이드 기술 동향 2.4 오가노이드 특허 최신 동향 3.결론 및 시사점 참고문헌 ◈본문 1.개요 ■동물실험 대체 ‘오가노이드’ 기술 ○오가노이드 기반 신약 평가 기술 -︎오가노이드(organoid, 유사장기)는 인체 발달과정과 질환기전을 이해하기 위한 가장 진보된 장기 모사 생체모델로, 약물의 독성 평가, 효능 평가, 대체시험법 개발, 조직 재생치료제 개발에 활용될 수 있음 -︎인간-동물 간 불일치는 임상시험 실패 주요 요인으로, 오가노이드를 이용한 고효율, 저비용으로 신약의 효능 및 독성 평가가 가능함 -︎“Quick win, Fast fail" 전략을 통해, 신약 후보물질의 임상시험 진입을 빠르게 검증할 수 있으며, 이는 신약
2024-11-07

-
BioINwatch양수(amniotic fluids) 유래 오가노이드의 가능성
양수(amniotic fluids) 유래 오가노이드의 가능성 BioINwatch(BioIN+Issue+Watch): 24-17 ◇ 엄마의 양수에서 분리한 태아의 상피 줄기세포로부터 신장, 소장, 폐 오가노이드 배양에 최초로 성공한 연구결과가 발표. 양수 유래 줄기세포는 만능/유도만능 줄기세포와 달리, 이미 특정 장기의 특성을 가져 별도의 조작 없이 4∼6주 만에 오가노이드 형성이 가능. 향후 태아 발달, 선천성 질환에 대한 조기진단 및 맞춤치료를 위한 체외모델로 유용할 것으로 기대 ▸주요 출처 : Nature News, Organoids grown from amniotic fluid could shed light on rare diseases, 2024.3.4 ■ 엄마의 양수로부터 태아의 상피 줄기세포를 분리해 신장, 소장, 폐 오가노이드 배양에 최초로 성공한 연구결과가 발표 ○ 영국의 유니버시티 칼리지 런던(UCL) 연구팀은 양수(AF, amniotic fluids)*에 3
2024-03-14

-
BioINwatch바이오컴퓨터, ‘오가노이드 지능(OI)’ 시대 도래
바이오컴퓨터, ‘오가노이드 지능(OI)’ 시대 도래 BioINwatch(BioIN+Issue+Watch): 23-86 ◇ 최근 실험실에서 배양한 인간 두뇌 모델에서 학습, 감각 처리 같은 인지 기능을 재현하는 이른바 ‘바이오컴퓨터’를 개발하려는 움직임이 포착되면서 생물과 사물, 아날로그와 디지털 융합의 새로운 사례로 주목 ▸주요 출처: Neuron, In vitro neurons learn and exhibit sentience when embodied in a simulated game-world, 2022.12.7, Nature electronics, Brain organoid reservoir computing for artificial intelligence, 2023.10.13, Frontiers in Science, The Baltimore declaration toward the exploration of organoid intelligence, 2023.2.28
2023-12-28

-
BioINpro[KRIBB 워킹그룹] 한국생명공학연구원 오가노이드 기술 현황
한국생명공학연구원 오가노이드 기술 현황 2023년도 KRIBB 워킹그룹 이슈페이퍼 제7호 ◈ 목차 1. 서론 2. 국내외 연구개발 동향 2.1 국내외 연구현황 및 전망 2.2 국내외 특허동향 2.3 국내외 정책 동향 3. 결론 및 시사점 3.1 생명(연) 역량 3.2 생명(연) 오가노이드 기술 발전방안 제안 ◈본문 1. 서론 □ 개요 ○동물실험을 대체할 시험법으로 오가노이드 기반 평가 플랫폼 기술 ╶︎지난해 조 바이든 미국 대통령이 식품의약국 현대화법 2.0(FDA Modernization Act 2.0)에 서명함에 따라 비임상 단계에서 동물실험 결과 없이도 의약품 허가 신청을 할 수 있도록 의무 조항이 완화되면서 동물실험을 대체할 시험법으로 오가노이드 기반 약물 평가 플랫폼이 각광을 받고 있음 ╶︎스위스 다국적 제약회사인 로슈(Roche)는 2023년 5월 4일 오가노이드를 이용한 인간 모델 시스템 분야 연구 발전을 위해 ‘인체생물학 연구소(In
2023-10-18

-
BioIN4P오가노이드 분야 4P분석
오가노이드 분야 4P분석 - Paper(논문), Patent(특허), Product(산업), Portfolio(투자) - Paper(논문) 글로벌 국내 연도별 발표현황 연도별 발표현황 주요 국가 주요 국가(공동연구 현황) 주요 연구기관 주요 연구기관 ...................(계속) ☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
2022-06-20

-
BioINpro오가노이드 재생치료제 산업 현황 및 전망
오가노이드 재생치료제 산업 현황 및 전망 오가노이드사이언스 주식회사(CEO)/차의과학대학교(교수) 유종만 1. 개요와 현황 가. 오가노이드(Organoid)의 개념 오가노이드(Organoid)는 ‘장기’를 뜻하는 ‘Organ’과 ‘유사함’을 뜻하는 접미사 ‘-oid’가 합쳐진 ‘기관을 닮은 유기체’를 의미한다. 기존 생물학 영역에서의 오가노이드는 3차원 세포 응집체를 의미하는 용어로 사용되었으며, 이는 실제 장기를 모사한다는 개념을 포함하지는 않는다. 하지만 지난 수십 년간 발생 생물학 및 줄기세포 생물학 분야의 발전을 통해 장기 특이적 줄기세포의 생성 및 분화에 대한 분자생물학적 기전을 규명할 수 있게 되었고, 이에 조직 공학 기술의 발전이 더해져 줄기세포의 자가 조직화를 통한 조직 또는 장기 유사체를 만들어낼 수 있게 되었다. 최근 이와 같은 방법으로 제작된 장기 유사체를 오가노이드로 규정하고 있으며, 좀 더 엄격한 의미의 오가노이드가 되기 위해서는 다음의 3
2021-08-31

발간
더보기-
 이슈 보고서2019 바이오미래유망기술의 이야기 - 제6화 “암 오가노이드 연계 면역세포 치료기술” 편
이슈 보고서2019 바이오미래유망기술의 이야기 - 제6화 “암 오가노이드 연계 면역세포 치료기술” 편
[바이오로 열어가는 2035 미래사회 – “암 오가노이드 연계 면역세포 치료기술”편] 제6화 “험난한 여름휴가 일정” 생명공학정책연구센터에서 지난 1월에 발표한 '2019 10대 바이오 미래유망기술(클릭)' 에 대해서 10화의 소설을 연재하고자 합니다. 바이오가 열어가는 행복하고 희망찬 미래상 제시를 통해 바이오 미래유망기술을 공감하고 이해하는 데에 도움이 되기를 기대합니다. 여름 휴가철을 맞아 강현과 권하선, 두 사람은 고민 끝에 나란히 휴가원을 내기로 작심했다. 업무가 과중하다 보니 같은 연구실에서 일하는 두 사람이 동시에 휴가를 내는 건 동료 연구자들의 질책을 한몸에 받을 만한 일이었다. 하지만 얼마 전 ‘1000일 기념일’마저(2019 바이오미래유망기술의 이야기 1화 참조) 야근으로 보내야 했던 두 사람은 일만 계속하다간 몸보다 정신이 먼저 망가질 것 같다는 불안감이
2019-07-29
동향
더보기-
제도동향
오가노이드 기반 조직공학제제 품질시험법 시험정보집2025.10.27
식품의약품안전평가원
-
기술동향
FDA, 동물실험 대체 계획 발표 ‘오가노이드·AI’ 전환 공식화2025.07.22
한국바이오의약품협회
-
기술동향
-
기술동향
오가노이드 감염모델 개발 동향2024.06.24
BRIC
-
제도동향
[생물의약품] 오가노이드 재생치료제 국내외 기술 개발 및 규제 동향2024.05.09
식품의약품안전평가원
-
기술동향
오가노이드를 이용한 감염질환연구동향2024.04.08
BRIC
-
기술동향
[이슈 브리핑] 임신부 양수에서 유래된 오가노이드 배양 성공2024.03.13
한국바이오협회
-
제도동향
[첨단바이오포커스 제33호] - Key Issue 오가노이드 개발 동향2023.09.26
첨단바이오의약품 규제과학센터
-
기술동향
췌장암 환자 유래 오가노이드 기반 항암제 감수성 검사2023.09.18
NECA 신의료기술평가사업본부
-
산업동향
로슈, 오가노이드 연구소(인체생물학연구소) 설립2023.06.09
한국바이오협회
-
산업동향
식의약 R&D 이슈보고서(오가노이드)2023.04.20
식품의약품안전평가원
-
기술동향
환자 맞춤형 오가노이드 기반 정밀 의료 플랫폼2023.01.03
생물학연구정보센터(BRIC)
-
기술동향
뇌 오가노이드 연구동향과 비즈니스 전망2022.11.07
생물학연구정보센터
-
기술동향
[독성] 장기 유형별 오가노이드 구축 및 활용 사례집2022.05.30
식품의약품안전평가원
-
정책동향
줄기세포 및 오가노이드_기초연구본부 선정 R&D 이슈 연구동향2021.11.22
한국연구재단
-
기술동향
신약개발 과정에서의 오가노이드 활용 현황 및 전망2020.05.20
생물학연구정보센터(BRIC)
-
기술동향
환자 유래 대장암 오가노이드의 특성 분석 정보집2020.01.06
식품의약품안전처 식품의약품안전평가원
-
산업동향
오가노이드(Organoids) 시장현황2019.12.10
한국바이오협회 한국바이오경제연구센터
-
기술동향
암 연구를 위한 오가노이드(Organoids) 모델2018.10.30
생물학연구정보센터(BRIC)
-
기술동향
오가노이드를 활용한 치료제 개발 동향2018.02.19
생물학연구정보센터(BRIC)
차트+
더보기뉴스
더보기-
R&D
강석연 "표준 선점 시 오가노이드 연구데이터 해외서 통용…시간·비용 절감”2025.11.05
서울경제
-
R&D
인간 골수 오가노이드→방사선 노출 세포 손상·회복 정밀 재현2025.10.22
아이뉴스24
-
R&D
조현병·조울병, 뇌 신호가 뒤죽박죽…‘미니 뇌’ 오가노이드로 입증2025.09.23
조선비즈
-
R&D
오가노이드 성장 동력 되려면 국제 표준 선점·특허 회피가 관건2025.08.27
서울경제
-
R&D
그래디언트 바이오컨버전스, 알츠하이머병 오가노이드 모델 글로벌 협력 체결2025.08.14
한국경제
-
R&D
K-오가노이드 컨소시엄 출범…27개 기업·18개 기관 뭉쳤다2025.08.14
연합뉴스
-
R&D
美 동물실험 금지...오가노이드·오간온어칩 등 대체기술 뜬다2025.08.14
매일경제
-
R&D
두경부암, 오가노이드로 맞춤 치료 길 열린다…치료 내성 유전자 규명2025.08.13
뉴스1
-
R&D
셀인셀즈 "오가노이드 신기술 개발…재생의료 글로벌 리더 되겠다"2025.08.05
한국경제
-
R&D
바이오 분야 대세 ‘오가노이드'…한국은 고가 설비·인력난·규제 공백 '삼중고'2025.07.24
동아사이언스
-
R&D
미니 장기 오가노이드, 혈관 생겼다…동물실험 대체, 세포 치료도 기대2025.07.17
조선비즈
-
R&D
생명연, 여러 오가노이드 연결 기술 구현...'나노코리아'서 공개한다2025.07.02
전자신문
-
R&D
유한양행·JW중외도…'오가노이드' 활용 신약 개발 박차2025.06.27
연합뉴스
-
R&D
삼성바이오도 뛰어든 '오가노이드' 신약개발 게임체인저 부상2025.06.18
파이낸셜뉴스
-
R&D
식약처, 오가노이드 시험법 국제표준화 추진위원회 발족2025.06.17
헬스조선
-
R&D
‘아바타 피부’로 약물 효능·부작용 예측…오가노이드 기술이 가져다줄 놀라운 미래2025.06.16
경향신문
-
R&D
생명연, 미니 장기 '휴먼 오가노이드' 활용 신약개발 논의2025.06.05
뉴스1
-
R&D
“동물실험 완벽대체” 휴먼 오가노이드…‘감염병 치료제’ 개발 도전2025.06.04
헤럴드경제
-
R&D
팬데믹 막는다…韓연구팀, 대규모 박쥐 인공장기 '오가노이드' 구축2025.05.16
연합뉴스
-
R&D
줄기세포·유전자치료·오가노이드… 재생의료로 승부수 던진 K-바이오, 글로벌 도약 견인2025.05.09
바이오타임즈
부처보도자료
더보기-
식약처, K-오가노이드 규제혁신 실현을 위한 첫걸음 기대
식품의약품안전처
2025-08-14
-
농촌진흥청, 돼지 오가노이드 기술로 산업체 협력 연구 착수
농촌진흥청
2025-07-17
-
농촌진흥청, 돼지 오가노이드 기술로 산업체 협력 연구 착수
농촌진흥청
2025-07-17
-
식약처, 오가노이드 시험법 국제표준화 위한 추진위원회 발족
식품의약품안전처
2025-06-17
-
‘박쥐 유사장기(오가노이드)’로 미래 감염병 세계적 대유행(팬데믹) 막는다
과학기술정보통신부
2025-05-16
-
농촌진흥청, 오가노이드 활용 가축 질병 연구 민관 협력 논의
농촌진흥청
2025-02-27
-
농촌진흥청, 오가노이드 활용 가축 질병 연구 민관 협력 논의
농촌진흥청
2025-02-27
-
오가노이드 활용 곰팡이 분석… 유산균 배양액 처리로 독성 저감 확인
농촌진흥청
2025-02-19
-
오가노이드 활용 곰팡이 분석… 유산균 배양액 처리로 독성 저감 확인
농촌진흥청
2025-02-19
-
동물 실험 대체 오가노이드 기술 확대 ‘연구 협력 강화’
농촌진흥청
2025-02-14
-
동물 실험 대체 오가노이드 기술 확대 ‘연구 협력 강화’
농촌진흥청
2025-02-14
-
돼지 소장 오가노이드(미니장기) 개발, 영양분 흡수 실험 쉬워질 듯
농촌진흥청
2024-11-18
-
돼지 소장 오가노이드(미니장기) 개발, 영양분 흡수 실험 쉬워질 듯
농촌진흥청
2024-11-18
-
국가기술표준원·식품의약품안전처, 오가노이드 국제표준 선점을 위해 함께 뛰다
산업통상부
2024-09-25
-
식품의약품안전평가원, 국가기술표준원과 함께 오가노이드 국제 표준화 선도
식품의약품안전처
2024-09-23
-
식약처, OECD와 함께 세계 최초 간(肝) 오가노이드 활용 독성시험법 개발
식품의약품안전처
2024-05-10
-
식약처, 오가노이드 활용 독성평가 표준화에 앞장
식품의약품안전처
2023-04-20
-
식약처, 오가노이드 활용 독성평가법 연구 진행
식품의약품안전처
2022-02-17
성과
더보기-
‘박쥐 유사장기(오가노이드)’로 미래 팬데믹 막는다
2025-05-20
-
고품질 오가노이드의 대량 생산 기반 기술 확보
2024-11-21
-
심장 미세환경까지 구현한 미니 장기 ‘오가노이드’ 나왔다
2024-04-25
-
오가노이드가 상처 재생을 돕는다
2024-04-17
-
오가노이드에서 고순도 줄기세포를 대량 배양하는 기술 개발
2024-03-07
연계정보BICS는 바이오 R&D에서 산업화까지 다양한 정보 자료를 수집하여
이용자들이 쉽게 접근하고 활용할 수 있는 플랫폼입니다.
더보기
-
기술혁신암 오가노이드 연계 면역세포 치료기술
암환자 세포 유래 암 오가노이드를 이용하여 환자 맞춤형 면역세포치료제를 생산하고, 이를 항암치료에 활용하는 기술
2024-11-25
-
기술혁신오가노이드 기반 생체모사기술
줄기세포, 3D 프린팅기술 융합 등을 통해 제작된 오가노이드를 이용하여 복잡한 생체시스템(순환계, 신경계, 소화계, 개체 전체 등)을 모사하는 기술
2024-11-25
연계정보
-
연구보고서
더보기
-
ntis인간 유도만능줄기세포 유래 오가노이드 기반의 유전성 망막질환 치료제 개발
닫기
연계정보(NTIS)
연구보고서인간 유도만능줄기세포 유래 오가노이드 기반의 유전성 망막질환 치료제 개발/
사업 : 2023 보건복지부 질병중심 중개연구사업과제 : 1465038481 순천향대학교 망막질환 치료용 오가노이드의 확립 및 치료 효과 규명등록번호,발행년월,발행기관명, 발행국가/사용언어,키워드 등록번호 발행년월 202312 발행기관명 순천향대학교 발행국가 대한민국 초록 1 연구개발 목표 및 내용1 최종목표 및 내용 인간 유도만능줄기세포 유래 오가노이드 기반의 유전성 망막질환 치료제 개발 최종 목표인간 유도만능줄기세포 유래 오가노이드 기반의 유전성 망막질환 치료제 개발 정상군 및 유전성 망막질환 환자의 iPCS 유래 오가노이드 확립 망막 오가노이드 분화 단계별 분비 분자 프로파일링 엑소좀 miRNA 단백질 및 망막질환 치료 후보 분자 발굴 유효 분자의 치료 기전 탐색 망막질환 오가노이드에 대한 유효 분자를 분비하는 오가노이드의 치료 효과 규명 전체 내용1 분화 단계별 정상군과 유전성 망막질환 환자 유래 오가노이드의 제작 정상군 3명 망막색소변성증 3명 망막층간분리증 3명등 총 9명의 iPSC 유래 오가노이드 제작 초기 90일 배양 중기 120일 후기 150일 이상 iPCS 유래 망막오가노이드 각 27개씩 총 81개 구축 분화 단계별 정상질환 오가노이드의 분화 특성 확인 배양자의 현미경 관찰에 따른 오가노이드 형태 기반의 성숙화 및 완전성 정도 평가 면역형광염색을 통한 오가노이드 성숙화 및 광수용체 발현 평가2 질환별분화 단계별 오가노이드 배양 상층액에서 치료효과를 보이는 후보 분비분자 도출 LCMS와 small RNAseq을 이용한 분화 시기별 오가노이드 배양 상층액의 분비 단백체 및 exosomal miRNA 프로파일링 망막질환 오가노이드보다 정상군 오가노이드에서 발현이 증가된 단백질 및 miRNA 중 치료효과가 기대되는 후보 분자 발굴 각 10종3 최적의 치료효과를 보이는 오가노이드 획득 시기 확립 치료 후보 분비분자의 함량이 가장 높은 최적의 배양 시기 선정 및 새로운 치료용 오가노이드 획득 총 100 및 검증 신규로 제작된 정상 오가노이드의 배양상층액에서 유효 분비 분자 함량 확인4 망막질환 오가노이드와 치료효과를 보이는 정상 오가노이드의 공배양을 통한 망막질환 치료효과 확인 분화 초기 질환 오가노이드 총 90개 제작 RP 및 XLRS 각 45개 치료용 정상 오가노이드와의 공배양 공배양 시기별 질환 오가노이드 형태분석 면역형광염색 분자 프로파일링을 통해 질환 표현형 개선 효과 확인5 유효 분자의 치료기전 도출 및 확립 유효한 치료제 후보 분자의 치료 기전 도출 정상 오가노이드 분비 단백질 및 엑소좀 miRNA의 조절 타겟 유전자의 gene ontology biologycal process 및 KEGG pathway gene network 분석 질환 망막 오가노이드 모델에 유효 분자 처리 후 분자 특성 및 표현형의 변화 확인 유효한 치료제 후보 분자 처리 후 광수용체 세포 및 망막 신경세포 분화 관련 기전의 규명6 유전자 도입을 통한 유전성 망막질환 치료용 오가노이드의 기능 개선 AAV를 이용한 질환 오가노이드에 유효 치료 후보 유전자 도입 iPSC 2종 제작 CRISPR 유전자 가위를 이용한 유전성 망막질환 유발 돌연변이의 정상화 질환 오가노이드 총 2종 제작 분화 시기별 정상화 질환 오가노이드 형태분석 면역형광염색 분자 프로파일링을 통해 질환 표현형 개선 효과 확인7 기능개선 치료용 오가노이드와 질환 오가노이드의 공배양을 통한 망막질환 치료효과 확인 획득한 치료용 유전자 도입편집 오가노이드와 질환 오가노이드의 공배양 60건 공배양 시기별 질환 오가노이드 형태분석 면역형광염색 분자 프로파일링을 통해 질환 표현형 개선 효과 확인8 유전자 도입편집된 치료용 오가노이드와 공배양한 질환 오가노이드의 유전자 발현 변화 확인 치료용 오가노이드와 공배양된 질환 오가노이드에 대해 total RNAseq 및 realtime PCR을 수행하여 광수용체세포 및 시신경세포 분화와 기능관련 유전자 변화를 확인 및 검증 단독배양과 비교하여 발현이 변화한 유전자의 GO 및 network 분석과 망막 분화 및 기능 관련 유전자의 발현 확인 연구개발과제 1 망막질환 치료용 오가노이드의 확립 및 치료 효과 규명 최종 목표유효 분자를 분비하는 망막질환 치료용 오가노이드의 확립 및 치료 효과 규명 정상군과 유전성 망막질환 환자의 iPSC 유래 오가노이드 확립 및 배양 상층액 획득 최적의 망막질환 치료 후보 오가노이드 획득 및 질환 오가노이드와의 공배양을 통한 치료효과 검증 유전성 망막질환 치료용 오가노이드의 기능 개선 및 확립 전체 내용연구개발 내용 1 분화 단계별 정상군과 유전성 망막질환 환자 유래 오가노이드의 제작 및 배양 상층액 수집 초기 iPCS 유래 망막오가노이드 27개 구축 85〜95일 배양 오가노이드 3 organoid인3인group3 groups 정상 RP XLRS 중기 iPCS 유래 망막오가노이드 27개 구축 115〜125일 배양 오가노이드 3 organoid인3인group3 groups 정상 RP XLRS 27개 후기 iPCS 유래 망막오가노이드 27개 구축 150일 이상 배양 오가노이드 3 organoid인3인group3 groups 정상 RP XLRS 27개연구개발 내용 2 분화 단계별 정상질환 오가노이드의 분화 특성 확인 배양자의 현미경 관찰에 따른 오가노이드 형태 기반의 성숙화 및 완전성 정도 평가 면역형광염색을 통한 오가노이드 성숙화 및 광수용체 발현 평가 HuCD Brn3b CHX10 Hoechst 33342연구개발 내용 3 최적의 치료효과를 보이는 오가노이드 획득 시기 확립 분비 분자 프로파일링으로 도출된 정상오가노이드 특이적 분비 분자의 함량이 가장 높은 최적의 배양 시기 선정 및 새로운 오가노이드 획득 총 100개 2개 배양 조건 x 50개조건 면역형광염색 및 형태학적 분석을 통한 신규 제작된 치료용 정상오가노이드의 10개의 분화정도 및 기능확인 배양 조건별 각 5개 x 2개 배양조건 신규로 제작된 정상 오가노이드의 배양상층액 수집 총 100건연구개발 내용 4 망막질환 오가노이드와 치료효과를 보이는 정상 오가노이드의 공배양을 통한 망막질환 치료효과 확인 분화 초기 질환 오가노이드 총 90개 제작 RP 및 XLRS 각 45개 연구개발 내용 3에서 획득한 치료용 정상 오가노이드와의 공배양 RP 45개 단독배양 15개 후보 1 정상오가노이드와 공배양 15개 후보 2 정상오가노이드 공배양 15개 XLRS 45개 단독배양 15개 후보 1 정상오가노이드와 공배양 15개 후보 2 정상오가노이드 공배양 15개 공배양 시기별 질환 오가노이드 형태분석 면역형광염색 분자 프로파일링을 통해 질환 표현형 개선 효과 확인연구개발 내용 5 유전자 도입을 통한 유전성 망막질환 치료용 오가노이드의 기능 개선 AAV를 이용한 질환 오가노이드에 유효 치료 후보 유전자 도입 iPSC 2종 제작 치료용 유전자도입 XLRS 오가노이드 1종 치료용 유전자도입 RP 오가노이드 1종 CRISPR 유전자 가위를 이용한 유전성 망막질환 유발 돌연변이의 정상화 질환 오가노이드 총 2종 제작 치료용 유전자 편집 XLRS 오가노이드 1종 치료용 유전자 편집 RP 오가노이드 1종 분화 시기별 정상화 질환 오가노이드 형태분석 면역형광염색 분자 프로파일링을 통해 질환 표현형 개선 효과 확인연구개발 내용 6 유전자 도입편집된 치료용 오가노이드와 질환 오가노이드의 공배양을 통한 망막질환 치료효과 확인 획득한 치료용 유전자 도입편집 오가노이드와 질환 오가노이드의 공배양 60건 RP 30개 단독배양 10개 유전자 도입 오가노이드와 공배양 10개 유전자 편집 오가노이드와 공배양 10개 XLRS 30개 단독배양 10개 유전자 도입 오가노이드와 공배양 10개 유전자 편집 오가노이드와 공배양 10개 공배양 시기별 질환 오가노이드 형태분석 면역형광염색 분자 프로파일링을 통해 질환 표현형 개선 효과 확인 연구개발과제 2 망막질환 치료 후보 분자 발굴 및 유효 분자의 치료 기전 탐색 최종 목표망막 오가노이드 분화 단계별 분비 분자 프로파일링 엑소좀 miRNA 단백질을 통한 망막질환 치료 후보 분자 발굴 및 유효 분자의 치료 기전 탐색 1차년도 정상군과 유전성 망막질환 오가노이드 확립 및 분비 단백질과 exosomal miRNA의 프로파일링 2차년도 망막질환 환자유래 오가노이드를 이용한 치료제 후보 분비분자의 치료 기전 탐색 3차년도 유전성 망막질환 치료용 오가노이드의 치료 기전 확립 전체 내용단백체 분석 기법을 이용한 질환별분화 단계별 오가노이드 배양 상층액에서 분비된 단백질의 프로파일링 LCMS를 이용한 분화 시기별 오가노이드 배양 상층액의 분비 단백체 profiling 초기 오가노이드 27개 9건 정상군 XLRS RP 각각 9개 오가노이드를 3개씩 pooling 중기 오가노이드 27개 9건 상동 후기 오가노이드 27개 9건 상동 형태학적 면역형광염색으로 확인된 오가노이드 분화 평가 결과와 단백체 프로파일링 결과의 비교분석 망막질환 오가노이드보다 정상군 오가노이드에서 발현이 증가된 단백질 발굴 10종Small RNAseq을 이용한 질환별분화 단계별 오가노이드 배양 상층액에서 분비된 엑소좀 miRNA의 프로파일링 NGS를 이용한 분화 시기별 오가노이드 배양 상층액의 exosome 및 오가노이드 자체의 RNA profiling 초기 오가노이드 27개 9건 정상군 XLRS RP 각각 9개 오가노이드를 3개씩 pooling 중기 오가노이드 27개 9건 상동 후기 오가노이드 27개 9건 상동 형태학적 면역형광염색으로 확인된 오가노이드 분화 평가 결과와 miRNA 프로파일링 결과의 비교분석 망막질환 오가노이드보다 정상군 오가노이드에서 발현이 증가된 exosomal miRNA 발굴 10 종치료용 정상오가노이드 배양 상층액에서 유효 분비 분자 함량 확인 1세부 과제에서 제작된 치료용 정상오가노이드 배양상층액 100건에서 유효 치료제 후보 분자의 정량 Exosomal miRNA 10종 Realtime PCR로 확인 protein 10종 ELISA로 확인 유효 후보 분자의 최대 농도를 분비하는 정상 오가노이드 60개 선별 공배양을 통한 치료효과 탐색에 이용유효 분자의 치료기전 도출 및 확립 유효한 치료제 후보 분자의 치료 기전 도출 정상 오가노이드 분비 단백질 및 엑소좀 miRNA의 조절 타겟 유전자의 gene ontology biologycal process 및 KEGG pathway gene network 분석을 통한 망막 분화 및 기능 관련 기전의 도출 12차년도에 확보된 오가노이드 조직절편에서 면역형광염색 및 in situ hybribization을 이용한 해당 기전 관련 유전자의 발현 양상 확인 유효한 치료제 후보 분자의 분자 기전 확립 질환 망막 오가노이드 모델에 유효 분자 처리 후 분자 특성 및 표현형의 변화 확인 유효 miRNA가 포함된 최적 exosome의 분리 및 농도별 처리 후 광수용체 세포 및 망막 신경세포의 분화 정도의 확인 및 추적 관찰 유효 단백질의 recombinant의 농도별 처리 후 광수용체 세포 및 망막신경세포의 분화 정도의 확인 및 추적 관찰 유효한 치료제 후보 분자 처리 후 광수용체 세포 및 망막 신경세포 분화 관련 기전의 규명 Western blot IHC realtime PCR in situ hybridization유전자 도입편집된 치료용 오가노이드와 공배양한 질환 오가노이드의 유전자 발현 변화 확인 치료용 오가노이드와 공배양된 질환 오가노이드에 대해 total RNAseq 및 realtimePCR을 수행하여 광수용체세포 및 시신경세포 분화와 기능관련 유전자 변화를 확인 및 검증 RP 9건 단독배양 3건 유전자 도입 오가노이드와 공배양 3건 유전자 편집 오가노이드와 공배양 3건 XLRS 9건 단독배양 3건 유전자 도입 오가노이드와 공배양 3건 유전자 편집 오가노이드와 공배양 3건 단독배양과 비교하여 발현이 변화한 유전자의 GO 및 network 분석과 망막 분화 및 기능 관련 유전자의 발현 확인출처 요약문 2p -
ntis유전성 유방암 오가노이드 확보 및 임계전이 핵심네트워크 인자의 임상적용성 검증
닫기
연계정보(NTIS)
연구보고서유전성 유방암 오가노이드 확보 및 임계전이 핵심네트워크 인자의 임상적용성 검증/
사업 : 2023 보건복지부 질병중심 중개연구사업과제 : 1465038930 아산사회복지재단 유전성 유방암 오가노이드 확보 및 임계전이 핵심네트워크 인자의 임상적용성 검증등록번호,발행년월,발행기관명, 발행국가/사용언어,키워드 등록번호 발행년월 202401 발행기관명 서울아산병원 발행국가 대한민국 초록 1 연구개발 목표 및 내용1 최종목표 및 내용 환자유래 단일세포 전사체 데이터 기반 유전성 암 임계전이 규명 및 이를 활용한 고위험군의 암 예방 후보물질 발굴 최종 목표유전성 유방암이나 대장암등과 같이 잘 알려진 암 억제 유전자의 돌연변이를 물려받은 고위험군의 경우 예방적 절제수술 혹은 주기적 검진 외에 언젠가는 발생할 암을 막을 수 있는 효과적인 방법은 없음본 연구는 유전성 암 고위험군의 돌연변이를 가진 세포가 암화 되는 과정에서의 임계전이 변화를 분자적으로 규명하고 이를 제어할 수 있는 물질을 발굴 함으로써 유전성 암의 예방법을 제시하고자 함 전체 내용본 연구는 유전성 암 중 가장 빈번한 것중 하나인 BRCA1 결손에 의한 유방암을 모델로 함1 BRCA1 돌연변이 고위험군 오가노이드 및 환자유래 세포의 확보 단일세포 분석을 위한 오가노이드 배양조건 확립 BRCA1돌연변이 고위험군의 정상 및 암 오가노이드 pair 5케이스 이상 확보2 BRCA1의 Loss of heterozygosity 구현을 위한 유전자 가위 디자인 및 오가노이드에서의 최적화 BRCA1의 wild type copy를 선택적으로 타겟하는 유전자 가위의 제작 및 검증 오가노이드에서 유전자 가위 도입시 시간에 따른 BRCA1의 결손 확인 및 단일세포 분석시료 확보3 단일세포 전사체 분석을 통한 BRCA1의 LOH과정에서의 암 임계전이 모델링 유전성 유방암 오가노이드 pair에 대한 단일세포 전사체 분석 및 임계전이 모델링 임계전이 과정에서의 핵심 분자네트워크 발굴 및 타겟 유전자 선별4 BRCA1의 결핍에 의한 암 임계전이에서의 핵심 분자네트워크 기능검증 핵심 분자네트워크를 저해시 나타나는 LOH과정에서의 변화 규명 BRCA1이 결손된 암세포에서의 핵심 분자네트워크의 기능 규명5 약물 유전체 데이터를 활용한 insilico drug repositioning 으로 임계전이 제어물질 발굴 LINCS 약물유전체 database를 이용하여 핵심 분자네트워크가 유도하는 발현패턴의 변화를 저해하는 물질 발굴 BRCA1 손실에 의한 암 임계전이 모델에서 제어물질을 도입할 경우 나타나는 발현변화의 파급성 검증6 BRCA1 결핍 오가노이드 및 환자유래 이종이식모델에서 임계전이 제어 약물후보의 유효성 평가 오가노이드 및 환자유래 세포에서 임계전이 제어 후보물질이 BRCA1 결핍시 나타나는 암화 과정을 막는지 검증 최종 선별된 물질의 임상적 유용성 검증 및 환자유래 이종이식모델에서유효성 평가 연구개발과제1 유전성 유방암 LOH 모델 구축 및 약물유전체 데이터 베이스를 이용한 임계전이 제어 후보물질 발굴 최종 목표1세부과제의 목표는 2세부에서 수행할 BRCA1의 결손 시기에 나타나는 암 임계전이의 수학적 모델링 결과를 실험적으로 검증하여 어떤 세포들이 어떤 유전자들의 변화로 살아남아서 암화 되는지 규명하는 것임 또한 이 과정에서 나타나는 핵심 네트워크 유전자들의 변화를 바탕으로 약물유전체 데이터 베이스를 검색 이 과정을 제어하는 물질을 발굴하고 그 유효성을 평가하는 것을 목표로 함 전체 내용연구목표 달성을 위해 1세부는 아래와 같은 실험들을 수행하고자 함1 BRCA1의 Loss of heterozygosity 구현을 위한 유전자 가위 디자인 및 오가노이드에서의 최적화BRCA1의 wild type copy를 선택적으로 타겟하는 유전자 가위의 제작 및 검증오가노이드에서 유전자 가위 도입시 시간에 따른 BRCA1의 결손 확인 및 단일세포 분석시료 확보2 BRCA1 유전성 유방암 모델의 LOH과정에서의 기능적 변화 분석HR DNA repair reporter를 통한 BRCA1의 기능 모니터링세포주기 변화 및 암화의 기준이 되는 colony forming assay기법 최적화3 BRCA1의 결핍에 의한 암 임계전이에서의 핵심 분자네트워크 기능검증핵심 분자네트워크를 저해시 나타나는 암화 지연 효과 규명BRCA1이 결손된 암세포에서의 핵심 분자네트워크의 필요성 규명4 암 임계전이 조절인자 중 신규성이 있는 약물타겟 유전자 도출 cBioportal을 활용 BRCA1의 LOH과정에서 나타나는 임계전이 조절인자 중 암에서 비정상적 발현을 보이는 유전자 발굴 후보 유전자 중 약물로서 제어가 가능한 효소활성 조절 유전자 혹은 단백질의 구조가 알려진 유전자들을 선정5 약물 유전체 데이터를 활용한 insilico drug repositioning 으로 임계전이 제어물질 발굴 단일세포 전사체 데이터를 통하여 임계전이를 넘은 세포와 그렇지 않은 세포간에 발현 차이가 큰 유전자들을 선별 이 유전자들을 입력데이터로 사용하여 약물유전체 탐색엔진인 L1000CDS tool에 적용함으로써 임계전이 제어 후보물질을 발굴6 암 임계전이 제어물질의 유효성 평가 오가노이드에서 후보물질을 처리시 위에서 확립된 암화 관련 기능분석을 통해 세포의 암화를 제어할 수 있는지 검증 환자유래 BRCA1 돌연변이 PDX모델 혹은 유방암 마우스 모델에서 후보물질의 암 억제 기능을 평가 연구개발과제2 단일세포 전사체 데이터 기반 유전성 암 임계전이의 수학적 모델링 및 핵심 분자네트워크 발굴 최종 목표최근 인구의 고령화에 따라 의료 산업은 질병 치료를 넘어서 건강 수명의 시대로 초점이 맞춰지고 있다 단순히 오래 사는 것이 아니라 건강하게 오래 사는 건강수명을 연장하기 위해 치료의 범위가 확장되고 있으며 특히 유전성 암환자의 경우 암 발생을 미리 억제하여 의료비 지출을 경감하고 건강수명을 연장하고자 하는 미충족 의료 수요가 증가하고 있는 실정이다본 연구팀은 정상세포에서 암세포가 발생하는 시점의 암 임계전이 상태tumor transition state를 수학적으로 모델링하고 동역학 분석을 통하여 암을 억제하기 위한 핵심 제어 타겟을 발굴할 수 있는 기술을 보유하고 있다이러한 기술을 BRAC1 돌연변이 고위험군 환자의 오가노이드 및 환자유래 이종이식모델의 LOH 과정에서 확보한 단일세포 데이터1 3세부과제에 적용하여 유전성 암 발생과정의 임계전이를 저해할 수 있는 핵심 저해 타겟 유전자를 발굴하고자 한다또한 발굴한 타겟 유전자에 대한 가상 약물 처리 시뮬레이션 결과 데이터를 1세부와 공유하여 약물 유전체 데이터베이스를 활용한 임계전이 제어 물질 후보 발굴에 기여하고 제어 물질의 작용기전을 암 임계전이 수학 모델을 통하여 밝히고자 한다 본 연구팀이 개발할 유전성 암 임계전이 제어 물질 발굴 기술은 추후 유방암 뿐만 아니라 대장암 등의 여타 유전성 암에 적용하여 예방 약물을 발굴하는 데에 범용적으로 활용될 수 있을 것이다 전체 내용 공개데이터 기반 BRCA1 발현 변화에 대한 전사변화 추적 및 암 임계전이 상태의 수학적 모델링 유전성 유방암 관련 단일세포 전사체 공개데이터 수집 BRCA1 발현 변화에 따른 단일세포 전사변화 추적 암 임계전이 상태의 동정 및 분자 네트워크 모델 구축 암 임계전이 상태의 동역학 특성 분석 및 제어 타겟 유전자 후보 발굴 암 임계전이 네트워크 모델의 동역학 특성 분석 유전자 섭동 분석을 통한 제어 타겟 유전자 후보 발굴 BRCA1 손실에 따른 제어 타겟 유전자의 효과 분석 BRCA1 결핍 오가노이드 모델의 단일세포 분석을 통한 유전성 유방암 임계전이 상태의 수학적 모델링 BRCA1 결핍 오가노이드 모델에 대한 암화 과정의 단일세포 데이터를 이용한 단일세포 전사변화 추적 유전성 유방암 발달 궤적 추적 및 임계전이 상태 동정 암 임계전이 상태의 분자 네트워크의 수학 모델 구축 암 임계전이 상태의 동역학 분석을 통한 핵심 분자네트워크 발굴 및 제어 타겟 유전자 선별 암 임계전이 네트워크 모델의 끌개 분석을 통한 핵심 분자네트워크 발굴 핵심 분자네트워크 제어를 위한 최적 제어 타겟 유전자 선별 타겟 유전자 제어에 따른 임계전이 모델의 표현형 변화 분석 약물 데이터베이스를 활용한 암 임계전이 제어 타겟 유전자의 약물 후보 탐색 표현형 변화 분석을 통해 최적의 단일조합 제어 타겟 발굴 약물타겟 데이터베이스를 통한 최적 약물 후보 선별 암 예방 제어물질의 효과 시뮬레이션을 통한 최적 저해 물질의 작용기전 분석 제어 타겟 유전자의 단일조합 섭동 시뮬레이션을 통한 유전자 발현 변화 데이터 생성 및 1세부 제공 암 예방을 위한 제어 물질의 효과 시뮬레이션을 통한 표현형 변화 분석과 암 예방 작용기전 분석 연구개발과제3 유전성 유방암 오가노이드 확보 및 임계전이 핵심네트워크 인자의 임상적용성 검증 최종 목표1 최종 목표 유전성 유방암 환자 유래의 정상암 오가노이드 및 이종이식모델을 이용한 암 임계전이 발현 기전 규명 및 약물 타켓으로서의 임상적 유용성 검증2 단계별 목표1 1단계 목표 BRCA1 돌연변이 고위험군 오가노이드 및 환자유래 세포의 확보 단일세포 분석을 위한 배양조건 확립 BRCA1돌연변이 고위험군의 정상 및 암 오가노이드 pair 5케이스 이상 확보2 2단계 목표 BRCA1 돌연변이 고위험군 환자유래 이종이식모델의 확보 및 분자적 분석 BRCA1 돌연변이 고위험군 환자유래 이종이식모델의 5 케이스 이상 확보3 3단계 목표 Tissue microarray를 통한 암 임계전이 핵심 분자들의 발현추적 및 약물타겟으로서의 임상적 유용성 평가 Tissue microarray를 통한 암 임계전이 핵심 분자들의 발현추적 최종 선별된 물질의 임상적 유용성 및 환자유래 이종이식모델에서 유효성 평가 유방암 오가노이드 단독 및 각 정상조직들과의 Coculture 플랫폼에서 약물반응성 평가 전체 내용1 대상자 선정기준 및 제외기준선정기준 유방의 정상 조직 확보가 가능한 환자1 유방암으로 수술 및 보조전신치료 등의 표준치료 시행한 환자2 Normal fresh tissue를 얻을 수 있을 것으로 판단된 환자3 기저질환 임상병리학적 정보 재발전이 여부 확보가 가능제외기준1 샘플채취에 취약한 장애인 임산부 노인2 20세 미만 환자2 연구설계 및 방법1 확보할 조직1 유방 정상조직 유방암 조직2 Caner등의 surgery로 인해 정상 조직의 확보가 가능한 환자를 수술검체에서 fresh tissue를 확보2 환자 유래 오가노이드 수립 유방암 및 매칭되는 유방 정상조직 오가노이드 pair 각 5례씩 수립 Organoid culture 1 Tissue wash2 tissue chopping3 15ml tube에 dissociation buffer 5ml tissue 넣음 37 12h shaking4 100um filter로 tissue 걸러줌5 4 80g 3min centrifuge6 Sup 제거 HF 10ml 넣어줌7 1200rpm 5min centrifuge8 Sup 제거 후 red blood cell 있으면 red blood cell lysis buffer 2ml 넣음 RT 5min medium 추가후 centrifuge9 Sup 제거 medium 1ml 넣어줌10 Counting11 1000cellsul로 맞춤12 ex120ul에 120k 12ul로 10개 seeding13 1200rpm 5min centrifuge14 Sup 제거 BME 130ul 10개 기준 넣고 12ul씩 seeding 24well15 37 510min16 Organoid Growth Medium 500ul 넣어줌17 4일에 한번씩 media change3 유방암 오가노이드 정상 장기들과의 coculture system에서의 약물반응성 평가 유방암 전신치료의 근간을 이루고 있는 항호르몬치료제제 및 cytotoxic agents들을 유방암오가노이드 5례에 개별적으로 평가 각 약물 별 반응성 분석 유방암 오가노이드 5례와 각 정상 장기를 coculture 하면서 약물처리 tumor formation의 영향을 control과 비교하여 원격전이 발병 억제 즉 보조요법으로의 치료반응성을 평가4 BRCA1 돌연변이 고위험군 환자유래 이종이식모델의 5 케이스 이상 확보 PDX patientderived xenografts 또는 PDTX patientderived tumor xenografts는 환자 유래 암조직 이종 이식 기반 전임상 모델로 환자로부터 얻어진 primary tumor를 면역이 억제된mouse에 직접 이식하는 동물모델임 BRCA1 돌연변이 고위험군 환자유래 이종이식모델의 5 케이스 구축5 Tissue microarray를 통한 암 임계전이 핵심 분자들의 발현추적 및 약물타겟으로서의 임상적 유용성 평가 Tissue microarray를 통한 암 임계전이 핵심 분자들의 발현을 추적하여 임상적 유용성 검증 최종 선별된 물질의 환자유래 이종이식모델에서 유효성을 평가하여 임상적 실효성 검증3 평가항목1 기본정보유방암 진단 유무검진 대상 유무 연령 유방암 진단 시점 혹은 검진 시점 신장체중cmkg 유방질환 조직 검사 병력 암 병력 초경 나이 폐경 유무 폐경 시 폐경 나이 호르몬치료 유무 및 시기 결혼 유무 자녀 유무 첫 분만 나이 모유수유 유무기간 마지막 유방 검진 시점 및 방법2 가족력유방암 및 난소암에 대한 가족력 Number of affected relatives Degree of affected relatives Age at diagnosis BRCA tested 유무결과3 유방암수술일 수술 방법 환측 선행항암유무 크기림프절 개수 ERPRHER2Ki67 방사사선 치료항호르몬치료항암치료 재발사망출처 요약문 3p -
ntis고정밀 치료 반응 예측 모델 개발을 위한 폐암 환자 유래 오가노이드 기반 면역항암제 평가 플랫폼 구축
닫기
연계정보(NTIS)
연구보고서고정밀 치료 반응 예측 모델 개발을 위한 폐암 환자 유래 오가노이드 기반 면역항암제 평가 플랫폼 구축/
사업 : 2023 보건복지부 질병중심 중개연구사업과제 : 1465038538 오가노이드사이언스(주) 고정밀 치료 반응 예측 모델 개발을 위한 폐암 환자 유래 오가노이드 기반 면역항암제 평가 플랫폼 구축등록번호,발행년월,발행기관명, 발행국가/사용언어,키워드 등록번호 발행년월 202312 발행기관명 오가노이드사이언스 발행국가 대한민국 초록 1 연구개발 목표 및 내용1 최종목표 및 내용 고정밀 폐암 치료 반응 예측 모델 개발을 위한 폐암 환자 유래 오가노이드기반 면역항암제 효능 평가 플랫폼 구축 최종 목표 고정밀 폐암 치료 반응 예측 모델 개발을 위한 폐암 환자 유래 오가노이드기반 면역항암제 효능 평가 플랫폼 구축 폐암은 우리나라 암 환자 사망률 1위를 차지하는 암종으로 12기에는 치료후 완치율이 높지만 34기 환자들의 치료법이 부재한 상황임 1세대 항암제 및 2세대 항암제의 한계점을 극복한 3세대 면역항암제는 독성이 적다는 면에서 고령 암환자에서 시도해 볼 수 있는 치료법이긴 하지만 효과를 기대할 수 있는 종양이 제한적이라는 점과 어떤 환자 어떤 종양에서 반응을 보일 것인지 또한 불분명함 따라서 본 과제에서는 폐암 환자 유래 오가노이드기반 면역항암제 효능 평가 플랫폼 구축을 통해 치료반응을 미리 예측하고 새로운 치료법을 찾아 미충족 의료 수요를 해결하고자함 전체 내용 폐암 오가노이드와 면역세포 공배양 조건 최적화 T세포 억제에 관여하는 면역체크포인트 단백질immune checkpoint protein의 활성을 차단하여 암세포를 공격하는 면역관문억제제의 효능을 평가하기 위해서는 종양과 면역세포의 상호작용이 반영된 시스템이 필요함 따라서 선행연구에서 확립된 PBMC로부터 T세포 분리 공정 최적화를 바탕으로 인체와 유사한 면역환경을 구성하기위해 폐암 환자 유래 오가노이드와 T세포의 공배양 조건을 최적화 하고자함 면역항암제 효능 평가 플랫폼 Validation 본 연구에서 구축하고자하는 면역항암제 효능 평가 플랫폼은 동일 환자 유래 종양과 혈액으로부터 제작된 시스템으로 2가지 조건에서 면역항암제 효능 평가 플랫폼을 validation하고 자함 폐암 12기로 수술받은 환자 조직이외에 폐암 34기로 기관지내시경 및 침 생검을 통한 조직확보 및 폐암 4기로 악성흉수로부터 유래된 종양세포를 이용한 암 오가노이드 연구를 위해 기관윤리위원회IRB 변경계획서 신청 및 승인하고자함 기관지내시경 및 침 생검 조직 악성흉수로부터 유래된 종양세포를 통한 오가노이드 배양 방법 확립을 위해 선행연구에서 수행되었던 오가노이드 배양 공정 최적화 프로토콜을 활용하 고자함 다양한 폐암환자 유래 면역항암제 효능 평가 플랫폼을 활용한 약물평가 수행 다양한 폐암 오가이드 라인에서 약물의 효능 평가를 수행하기 위해 면역세포와 오가노이드를 공배양 한 후 효능을 평가하고자하는 시험 약물 및 표준 약물을 다양한 농도로 처리하여 다양한 시간에서 종양 오가노이드 사멸 효과를 관찰하고자함 다양한 폐암 오가노이드 라인에서 수행한 면역항암제 효능 평가 결과와 환자로부터 수집된 데이터베이스성별 나이 흡연력 조직학적 분류 항암치료에 대한 치료 반응 재발 여부 무진행생존기간 전체생존기간 등등을 바탕으로 치료반응 및 예후인자 탐색 및 규명함으로써 플랫폼의 임상적 유용성을 검증하고자함 면역항암제 플랫폼의 상용화를 위한 표준화 및 최적화 진행 임상적으로 유의함을 입증하기 위해서는 충분한 표본 크기에서 약물 평가를 수행해야함 따라서 100개 이상의 오가노이드 라인을 활용하여 면역항암제 효능 평가를 수행함으로써 플랫폼의 유효성을 입증하고자함 면역항암제 효능 평가 플랫폼 구축에 필요한 폐암 환자 유래 오가노이드 배양 T세포 분리 공정 오가노이드와 T새포 공배양에 관련된 실험 방법 및 조건들을 구체적으로 문서화 하여 표준화된 protocol을 확보하고자함 오가노이드 배양을 위한 조성물 및 방법 배양 시 필수로 사용되는 성분인 R스폰딘 Rspondin을 대체할 수 있는 특정 화합물을 적용함으로써 플랫폼 구축을 위한 오가노이드 배양 시 기존 배양가의 약 13 단가로 생산이 가능하게 하여 전체적인 플랫폼 활용 서비스의 단가를 낮출 수 있음 다양한 폐암 내성 환자 유래 오가노이드를 활용한 면역항암제 효능 평가 플랫폼 확장 폐암 환자 유래 오가노이드를 이용하여 구축하였던 면역항암제 효능 평가 플랫폼 기술을 활용하여 폐암 내성 환자 유래 면역항암제 플랫폼을 구축하고자함 연구개발과제 1 고정밀 치료 반응 예측 모델 개발을 위한 폐암 환자 유래 오가노이드 기반 면역항암제 평가 플랫폼 구축 최종 목표 폐암 오가노이드 기반 개인 맞춤형 면역항암제 치료 예측 플랫폼 개발 폐암은 우리나라 암 환자 사망률 1위를 차지하는 암종으로 12기에는 치료후 완치율이 높지만 34기 환자들의 치료법이 부재한 상황임 1세대 항암제 및 2세대 항암제의 한계점을 극복한 3세대 면역항암제는 독성이 적다는 면에서 고령 암환자에서 시도해 볼 수 있는 치료법이긴 하지만 효과를 기대할 수 있는 종양이 제한적이라는 점과 어떤 환자 어떤 종양에서 반응을 보일 것인지 또한 불분명함 따라서 본 과제에서는 폐암 환자 유래 오가노이드기반 면역항암제 효능 평가 플랫폼 구축을 통해 치료반응을 미리 예측하고 새로운 치료법을 찾아 미충족 의료 수요를 해결하고자함 전체 내용 연구개발 내용 1 침생검 및 기관지 내시경을 검체를 이용한 오가노이드 배양 공정 최적화 수술을 이용하여 조직을 절제할 수 없는 폐암 3b 4기 환자들을 대상으로 침생검 및 기관지 내시경을 통해 검체를 획득하고자함 연구개발 내용 2 폐암 오가노이드와 면역세포 공배양 조건 최적화 T세포 억제에 관여하는 면역체크포인트 단백질immune checkpoint protein의 활성을 차단하여 암세포를 공격하는 면역관문억제제의 효능을 평가하기 위해서는 종양과 면역세포의 상호작용이 반영된 시스템이 필요함 따라서 선행연구에서 확립된 PBMC로부터 T세포 분리 공정 최적화를 바탕으로 인체와 유사한 면역환경을 구성하기위해 폐암 환자 유래 오가노이드와 T세포의 공배양 조건을 최적화 하고자함 연구개발 내용 3 면역항암제 효능 평가 플랫폼 Validation 본 연구에서 구축하고자하는 면역항암제 효능 평가 플랫폼은 동일 환자 유래 종양과 혈액으로부터 제작된 시스템으로 2가지 조건에서 면역항암제 효능 평가 플랫폼을 validation하고자함 1T세포가 없는 종양 오가노이드가 있는 조건에서 음성대조군과 양성대조군을 이용하여 종양 오가노이드의 사멸을 관찰하고자함 2 T세포에 의한 비특이적인 종양 오가노이드 사멸 효과를 분석하기 위해 서로 다른 공여 자로부터 유래된 오가노이드와 T세포를 공배양 한 후 암 세포 사멸 효과를 평가하고자함 연구개발 내용 4 다양한 폐암환자 유래 면역항암제 효능 평가 플랫폼을 활용한 PD1 면역항암제 효능평가 수행 환자 유래 폐암 오가노이드라인 특성을 분석하기 위해 유세포 분석기Flow cytometer를 이용해 면역관문에 관여하는 대표적인 표면 항원 인자 PDL1의 발현율과 각 환자의 혈액으로부터 증식된 면역세포는 T세포 표지 인자인 CD4 CD8의 발현과 T세포연관 면역관문 PD1의 발현을 관찰하고자함 15개 이상의 폐암 오가노이드 라인에서 PD1 면역항암제의 효능 평가를 수행하기 위해 면역세포와 오가노이드를 공배양 한 후 효능을 평가하고자하는 시험 약물 및 표준 약물을 다양한 농도로 처리하여 다양한 시간에서 종양 오가노이드 사멸 효과를 관찰하고자함 연구개발 내용 5 면역항암제 플랫폼의 상용화를 위한 표준화 및 최적화 진행 임상적으로 유의함을 입증하기 위해서는 충분한 표본 크기에서 약물 평가를 수행해야함따라서 100개 이상의 오가노이드 라인을 활용하여 면역항암제 효능 평가를 수행함으로써 플랫폼의 유효성을 입증하고자함 연구개발 내용 6 병용치료법다양한 면역항암제를 활용하여 플랫폼 확장 암 치료제 개발 방향이 면역항암제 단독요법에서 병용요법 중심으로 변화하고 있음 본 연구를 통해 개발할 면역항암제 플랫폼에 병용 치료법을 적용하여 치료반응 및 독성 발생율을 예측하고자함 또한 PD1이외의 새로운 면역관문인자를 표적으로 하는 면역항암제를 활용한 면역항암제 효능 평가 플랫폼 확장 연구개발 내용 7 폐암 내성 환자 오가노이드를 활용한 플랫폼 확장 표적항암제 투여로 약물에 대한 저항성 및 내성이 나타나는 환자들을 대상으로 폐암 오가노이드 기반 플랫폼을 구축하여 내성을 극복할 수 있는 약물을 탐색하고 선별하고자함출처 요약문 2p -
ntis고 투과성 나노섬유 마이크로웰 기반 균일하고 높은 재현성을 가지는 오가노이드 배양 자동화 시스템 개발
닫기
연계정보(NTIS)
연구보고서고 투과성 나노섬유 마이크로웰 기반 균일하고 높은 재현성을 가지는 오가노이드 배양 자동화 시스템 개발/Development of an automated organoid culture system with uniform and high reproducibility based on highly permeable nanofibrous microwell
사업 : 2024 중소벤처기업부 TIPS과제과제 : 2420011187 셀로이드(주) 고 투과성 나노섬유 마이크로웰 기반 균일하고 높은 재현성을 가지는 오가노이드 배양 자동화 시스템 개발등록번호,발행년월,발행기관명, 발행국가/사용언어,키워드 등록번호 발행년월 202406 발행기관명 셀로이드(주) 발행국가 대한민국 초록
-
ntis인간 유도만능줄기세포 유래 오가노이드 기반의 유전성 망막질환 치료제 개발
-
과제
더보기
-
ntis뇌신경 및 심장 오가노이드 분석을 위한 48채널 MEA 시스템 및 세포칩 개발
닫기
연계정보(NTIS)
과제뇌신경 및 심장 오가노이드 분석을 위한 48채널 MEA 시스템 및 세포칩 개발
주식회사 셀라메스 정부투자연구비 66,500,000원 총연구비 88,750,000원 생명과학 산업바이오 바이오기기- 본 과제에 참여한 연구자
- 연구책임자조상준
- 참여연구자김민성;박진수;설창기;김철웅;김명주;이상현;ABARRO CHESKA
연구목표연계정보 과제고유번호 2420024287 기준년도 2025 연구책임자 조상준 과제수행기관 주식회사 셀라메스 정부투자연구비 66,500,000 총연구비 88,750,000 - NAMs (New Approach Methodologies, 동물 대체 시험법)의 일환으로, In vitro 시험법을 적용하여, 세포 또는 오가노이드를 활용한 신경세포 전기생리 반응 분석 및 심장 약물 독성 평가를 위한 48채널 MEA (Micro Electrode Array) 시스템과 세포칩을 개발 하고자 함
- - 브레인 및 심장 오가노이드 분석을 위한 48채널 MEA 시스템 개발- 생체적합 전도성 재료 기반 전극 표면개질 개선 48채널 세포칩 개발- 48채널 MEA 시스템 (HW, SW) 검증- 표면개질 개선 세포칩 검증- 오가노이드(2D 세포 포함)를 이용한 MEA 시스템 세포 실험
- 1. 기술적 측면 - NAMs(New Approach Methodologies, 동물대체 시험법) In Vitro 시험에 적용 가능한 MEA 시스템으로, 브레인 오가노이드 및 심장 오가노이드를 활용한 신경 분석 및 약물 독성 평가를 위한 전기 생리학적 분석 시스템의 핵심 기술 확보. 동물 대체 시험법 확대에 기여 2. 사회적 측면 - 화학물질 안...
- 6T관련효과
- 뇌신경과학 연구
-
ntis생체모사를 위한 돼지 장 오가노이드 개발 및 기능 검증
닫기
연계정보(NTIS)
과제생체모사를 위한 돼지 장 오가노이드 개발 및 기능 검증
국립축산과학원 정부투자연구비 350,000,000원 총연구비 350,000,000원 생명과학 발생/신경생물학 줄기세포생물학- 본 과제에 참여한 연구자
- 연구책임자옥선아
- 참여연구자이풍연;정진영;이보람;이해선;정선근;박수민;이민국
연구목표연계정보 과제고유번호 2390002081 기준년도 2025 연구책임자 옥선아 과제수행기관 국립축산과학원 정부투자연구비 350,000,000 총연구비 350,000,000 - ○ 돼지 장 유래 줄기세포 추출 및 3차원 세포 배양을 통한 오가노이드 형성 유도○ 돼지 장 오가노이드의 특성 분석 및 물리적·세포투과성 기능 검증○ 돼지 장 오가노이드 활용 영양소 흡수능 및 독성물질의 세포단위 기능적 모사체계 구축
- 1년차(2022)○ 돼지 장 유래 부위별 줄기세포 분리 및 오가노이드 형성을 위한 최적의 조직선별○ 돼지 장 유래 줄기세포의 3차원 배양 최적화 및 장 오가노이드 형성2년차(2023)○ 돼지 장 오가노이드의 핵심 유전자 및 단백질 발현 분석○ 돼지 장 오가노이드의 물리적·세포투과성 기능 검증 3년차(2024)○ 부위별 돼지 장 오가노이드 활용 주요 영양소...
- ○ 가축 유래 생체 모사체 개발로 동물실험 대체시험법 개발에 기여 ○ 실험동물의 개체수 감축을 통한 탄소중립에 기여 ○ 가축의 생산성 향상 및 생체 면역반응 연구 등 질병모델링이 가능 ○ 동물복지 증진 및 동물대체 시험법 연관 산업의 활성화
- 6T관련효과
- 기타기초·기반기술
-
ntis간암 오가노이드 유래 엑소좀 기반 면역관문억제제 유효성 평가를 위한 다가결합형 나노리셉터 수식 고감도 광화학센싱 플랫폼 개발
닫기
연계정보(NTIS)
과제간암 오가노이드 유래 엑소좀 기반 면역관문억제제 유효성 평가를 위한 다가결합형 나노리셉터 수식 고감도 광화학센싱 플랫폼 개발
인하대학교 정부투자연구비 95,070,000원 총연구비 95,070,000원 생명과학 융합바이오 바이오센서- 본 과제에 참여한 연구자
- 연구책임자부지윤
- 참여연구자신동준;손채연;정은아;이호수;문가영;박현성;이효리;신동휘;조정빈
연구목표연계정보 과제고유번호 2710090806 기준년도 2025 연구책임자 부지윤 과제수행기관 인하대학교 정부투자연구비 95,070,000 총연구비 95,070,000 - 1. 연구의 필요성(1) 연구의 시급성: 간세포암은 국내 6대 암 중 5년 생존률이 가장 낮으며, 주로 40~60대의 경제활동 인구에서 발생률과 치사율이 높아 사회경제적 부담이 큼. 특히 간경변이나 만성 간염 등의 기저질환을 동반하는 경우가 많아 항암 치료에 대한 내약성이 낮고, 효과적인 치료 반응 예측도 어려움. 면역관문억제제가 간암 치료에 새로운 가능성...
- 연구내용 1. 면역관문억제제 유효성 평가를 위한 간암 오가노이드-면역세포 공배양 모델 구축간세포암 치료에 있어 면역관문억제제의 반응성을 정밀하게 평가하기 위해, 종양 미세환경을 모사한 오가노이드?면역세포 공배양 시스템을 개발함. 본 연구에서는 간암 세포주 및 환자 유래 간암 조직으로부터 유도된 오가노이드를 기반으로 3차원 종양 모델을 형성하고, 여기에 면역...
- 1. 연구개발성과의 활용계획(1) 면역관문억제제 유효성 평가를 위한 오가노이드 기반 분석 기술- 간암 환자 유래 오가노이드와 면역세포 간 공배양을 통해 종양 미세환경을 정밀 모사함으로써, 기존 전임상 모델의 한계를 극복한 정밀 면역항암제 반응성 평가 플랫폼으로 활용 가능함.- 환자 맞춤형 면역반응 분석에 기반하여 신약의 유효성 검증뿐 아니라 병용투여 전략 ...
- 6T관련효과
- 바이오칩 개발기술
-
ntis후각 오가노이드 고도화를 통한 후각 질환의 병태생리 규명 및 새로운 치료법 개발
닫기
연계정보(NTIS)
과제후각 오가노이드 고도화를 통한 후각 질환의 병태생리 규명 및 새로운 치료법 개발
연세대학교 정부투자연구비 247,180,000원 총연구비 247,180,000원 생명과학 발생/신경생물학 신경질환생물학- 본 과제에 참여한 연구자
- 연구책임자김창훈
- 참여연구자김진선;김수인
연구목표연계정보 과제고유번호 2710084261 기준년도 2025 연구책임자 김창훈 과제수행기관 연세대학교 정부투자연구비 247,180,000 총연구비 247,180,000 - 후각 오가노이드 모델을 기반으로 하여 후각 장애 기전 규명을 위한 연구 시스템을 마련하고, 이를 활용하여 유효성이 검증된 후각 장애 치료법 개발
- 1. 기구축한 마우스 후각 오가노이드 모델의 고도화2. 사람 유래 후각 오가노이드 모델 구축3. 후각 오가노이드 모델에서의 후각 감각 세포 생성 기전 연구4. 퇴행성 뇌질환 및 바이러스 감염 질환 모사 오가노이드 모델 제작 및 질병 모사 오가노이드 모델에서의 후각 장애 병인 기전 규명5. 퇴행성 뇌질환 및 바이러스 감염 질환 마우스 모델에서의 후각 장애 병...
- 1. 오가노이드 모델 통한 임상 연구 기반을 마련함으로써, 환자 기전 연구의 한계성을 극복하고, 이로써 임상 분야에서 후각 질환 관련한 활발한 연구 활동2. 다양한 후각 질환 모델을 통해 규명한 후각 장애 병인 기전 연구들에서 기인한 훌륭한 논문 성과3. 새로운 후각 장애 치료법의 임상연구 및 상용화 진행 후 병원부터 일상생활로의 후각 치료 확대
- 6T관련효과
- 난치성 질환 치료기술
-
ntis뇌신경 및 심장 오가노이드 분석을 위한 48채널 MEA 시스템 및 세포칩 개발
- 논문 더보기
- 특허 더보기


 개념
개념 지식
지식 발간
발간 동향
동향 차트 +
차트 + 뉴스
뉴스 부처보도자료
부처보도자료 성과
성과 연계정보
연계정보 연계정보
연계정보 영상 +
영상 +
















![[과학1열] 위암 유발 헬리코박터균…오가노이드 모델로 정복 한 발짝! / YTN 사이언스](/InnoDS/data/upload/bt_youtube/E3E9F300-1338-5E9E-AC76-FADB7452C1ED.jpg)