부처보도자료
K-제네릭, 신뢰와 경쟁력으로 도약하겠습니다!
- 등록일2020-07-16
- 조회수2226
-
발간일
2020-07-16
-
출처
식품의약품안전처
- 원문링크
-
키워드
#제네릭
- 첨부파일
K-제네릭, 신뢰와 경쟁력으로 도약하겠습니다!
제네릭의약품 민관협의체 운영 결과 21개 과제 도출
김영주 사무관(의약품안전국 의약품정책과)
□ 식품의약품안전처(이의경 처장)는 우리나라 제네릭의약품의 경쟁력 강화를 위해 지난 5월부터 구성·운영해온 ‘제네릭의약품 국제경쟁력 강화를 위한 민관협의체’(이하 민관협의체) 운영 결과를 발표하였습니다.
|
< 제네릭의약품 국제경쟁력 강화를 위한 민관협의체 >
제네릭의약품 경쟁력 강화 및 안심사용 확대를 위해제약업계, 의약사 단체,학계, 환자단체 및 소비자단체 전문가와 식약처 관련자로 구성한 협의체 |
○ 민관협의체에서는 제네릭의약품의 품질, 안전관리 및 국제경쟁력 강화 방안에 대하여 집중 논의하였으며,
- 제네릭의약품의 품질신뢰성 제고, 정보제공 확대, 제품개발촉진, K-제네릭 해외진출 지원 등 4개 분야 21개 세부과제별 향후 추진 계획(붙임 참조)을 마련하였습니다.
□ 이 민관협의체에서 향후 추진하기로 협의한 주요 과제들은 아래와 같습니다.
< ①-1 제네릭의약품 품질신뢰성 제고 >
○ 우리나라에서 허가·유통 중인 제네릭의약품의 품질을 확보하고 해외에서도 그 품질을 인정받도록 아래 과제들을 추진합니다.
○ 품질이 확보된 제네릭의약품이 유통될 수 있도록, 전 공정을 위탁하여 제조하는 때도 GMP 적격성 여부를 사전에 확인하고 허가하는 등,
- GMP 자료 요건을 강화하여 위탁자의 품질책임성을 높여 나갈 예정입니다.
|
현행 |
▪위탁제조품목 GMP 자료 미제출 *실제 제조하는 수탁자 품목만 GMP 자료 제출
|
|
개선 |
▪위탁제조품목 GMP 자료 제출 * 위탁자 품목도 허가 시 3개 제조번호실제 생산 후 GMP 자료 제출 (다만, 수탁사 품목과 제조단위 규모, 설비 등 동일하면 1개 제조번호 제출) |
○ 또한, 의약품 제조업체의 관리·운영 정도를 국민이 알 수 있도록 현장 실태조사 결과를 식약처 홈페이지에 공개하겠습니다.
< ①-2 제네릭의약품 제조방법 변경 등 사전 안전관리 강화 >
○ 제네릭의약품의 허가 이후 품질 및 약효에 영향을 미칠 수 있는 세부공정 변경, 원료의 입자크기 변경 등 업체 자율적으로 관리하던 ‘제조방법’에 대한 변경을 품질·약효 영향에 따라 변경 정도를 차등화하여 사전 변경허가 하는 체계로 강화하겠습니다.
○ 제네릭의약품의 동등성 유지를 위해 주성분과 제형이 동일하고 함량이 다른 의약품(△△정 10mg, 20mg)의 경우,
- 함량이 다른 제품 간의 첨가제의 종류·배합비율이 다를 경우에는 ‘비교용출시험’이 아닌 ‘생물학적동등성시험’으로 동등성을 입증토록 기준을 강화할 예정입니다.
○ 아울러, 원료의약품(주성분) 등록 이후 완제의약품의 품질심사를 진행하던 것을 완제의약품 심사 시 원료의약품에 관한 품질심사를 병행함으로써 허가심사의 효율성을 높이는 한편,
- 완제의약품 심사단계에서 원료의약품 관련 불순물(NDMA 등)과 같은 위험요인을 사전에 파악하는 등 의약품의 품질 사각지대를 해소하겠습니다.
< ②-1 제네릭의약품 묶음정보 개발·제공 >
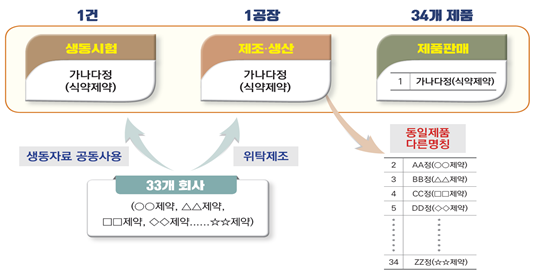
○ 제네릭의약품임을 쉽게 알 수 있도록 ‘제네릭의약품 묶음정보’*를 개발하여 식약처 홈페이지, 모바일웹 등 다양한 방법을 통해 누구든지 사용할 수 있도록 제공합니다.
|
< 제네릭의약품 묶음정보 > ▪ 동일 제조소에서 제조되고, 동일 동등성시험 자료로 허가된 제네릭의약품의 목록 ▪ 묶음정보 목록에는 동일제조소에서 제조되는 동일 제네릭의약품들의 |
* (위탁제조 제네릭의약품 비율) 위탁 생동시험 허용한 ‘12년 기준으로, 위탁제조품목 비율이 49%(‘12년 이전) ⇒ 85%(‘12년 이후)로 상승
|
구분 |
’12년 이전 |
’12년 1월∼’20년 5월 |
계 |
|
자사 제조 |
2,235 |
1,423 |
3,658 |
|
위탁 제조 |
2,127 |
7,814 |
9,941 |
|
계 |
4,362 |
9,237 |
13,599 |
|
위탁제조 비율 |
49% |
85% |
73% |
오리지널의약품 : 신약, 국내 최초 품목 등으로 공고하고 있는 대조약
제네릭의약품 : 의약품동등성시험(생동성시험, 이화학적동등성시험, 비교용출시험 등)을 실시하여 공고 대조약과 동등성을 입증한 품목
○ ’제네릭의약품 묶음정보‘는 국내 모든 의약품의 안전관리(제품개발, 허가심사, 품질관리, 회수·폐기 등) 및 안전사용을 위해 활용될 것입니다.
< ②-2 의약품 정보 제공 확대 >
○ 현재 단일성분의 의약품만 제품명에 유효성분을 기재하고 있으나, 앞으로는 제품을 쉽게 구분할 수 있도록 복합성분 의약품도 제품명에 유효성분을 함께 기재합니다.
|
현행 |
▪ 제품명(성분명 미기재)
|
|
개선 |
▪제품명(성분명 기재)
|
○ 많은 제네릭의약품이 제조 위·수탁을 통해 1개 회사에서 동일하게 생산되는 제품을 다른 제품으로 인식하는 상황입니다.
|
위탁제조, 생동자료 공동사용에 대한 허가사례 |
|
|
- 이와 같은 상황을 개선하고, 의약품 정보를 올바르게 인식할 수 있도록 제품 외부포장에 제조소·동등성 등에 대한 정보를 표시하는 방안 등을 추진할 계획입니다.
|
현행 |
|
|
개선 |
|
< ②-3 제네릭의약품 선택·사용 관련 홍보 강화 >
○ 인식 개선을 통한 제네릭의약품 사용 활성화를 추진합니다.
○ 의사·약사의 신뢰도 향상 및 사용 활성화를 위해 의사·약사 연수교육 과정에 의약품 허가관리 제도, 생동시험 결과 통계자료 등을 교육자료로 제공하겠습니다.
○ 또한, 소비자 인식 개선과 정보제공 확대를 위해 소비자단체 교육 프로그램 참여, 유튜브 등 SNS 홍보, 리플릿 배포 등 정보를 지속적으로 제공할 예정입니다.
< ③ 제품 개발 촉진 및 사용 활성화 >
○ 오리지널의약품의 특허에 도전하는 등 연구개발을 통해 제네릭의약품 출시를 준비하는 업체를 지원함으로써 제네릭의약품 개발을 촉진하여 사용을 활성화하겠습니다.
- 현재 오리지널의약품의 특허가 만료되었음에도 국내 제네릭의약품이 없는 경우가 다수 발생*하고 있어 특허정보 제공을 통한 개발 지원이 필요합니다.
* 특허만료 463품목 중 제네릭 미허가는 239품목(‘19.12월 기준)
○ 이를 위해 제품 개발을 위한 맞춤형 허가 가이드라인을 마련하고 등재된 특허가 없거나 제네릭의약품이 출시되지 않은 제품의 개발을 위한 특허-허가 연계 종합정보를 지속적으로 분석·공개를 추진하고자 합니다.
○ 중소제약기업을 대상으로 제품개발 및 출시에 필요한 특허 도전 컨설팅을 지속 제공할 예정입니다.
○ 오리지널의약품의 등재특허 도전에 성공하여 시장 진입을 앞당긴 최초의 제네릭의약품 개발업체에게 9개월간 다른 제품에 우선하여 판매할 수 있는 기회(다른 제네릭 의약품 판매금지)를 보장하는 ‘우선판매품목허가’ 제도의 실효성을 높이고자, 실제 최초 제네릭의약품 개발 업체가 혜택을 받을 수 있도록 위탁으로 품목허가를 받은 품목은 우선판매품목허가 대상에서 제외하는 것을 추진할 예정입니다.
< ④ K-제네릭 경쟁력 강화 및 해외 진출 지원 >
○ 우리나라 제네릭의약품이 국제경쟁력을 가지고 해외 진출 할 수 있도록 지원하겠습니다.
○ 제네릭의약품의 부가가치를 향상하기 위한 국산 원료 사용 제네릭의약품 개발 촉진을 위해 국산 원료의약품 사용 시 완제의약품을 신속히 심사하는 인센티브 제공 방안을 마련할 예정입니다.
○ 또한, 국산 의약품의 해외 진출을 위해 해외 주요국과 상호 인정 협정(MRA)을 지속 추진하고자 합니다.
○ 제약사 등 해외 의약품 구매자의 편의를 위해 의약품 성분별 국내 제약사 현황을 확인할 수 있도록 영문 Index 데이터베이스를 마련하여 정보를 제공하겠습니다.
□ 식품의약품안전처는 이번 민관협의체에서 도출된 각종 추진방안을 실효성·현장감 있게 추진해 나갈 예정입니다.
○ ‘제네릭 묶음정보’는 8월 말부터 단계적으로 식약처 홈페이지 등을 통해 공개하고자 합니다.
○ 품질평가 분야에 전문심사관 26명을 채용하여 품질심사 및 묶음정보 데이터베이스를 마련할 예정입니다.
○ 도출된 추진과제들의 추진과정에서 의사·약사·소비자 단체 및 제약업계 등 전문가와 긴밀히 소통하여 정책들이 원활히 추진될 수 있도록 할 것입니다.
○ 이를 통해 우리나라 제네릭의약품의 품질과 약효가 오리지널의약품과 같은 수준으로서, 안심사용 체계를 확립하고 경쟁력 강화를 위해 지원해 나가겠습니다.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 7.16+의약품정책과+등.hwp
7.16+의약품정책과+등.hwp