부처보도자료
국내 개발 코로나19 백신(1상).치료제(2상) 임상 승인
- 등록일2020-11-24
- 조회수2379
-
발간일
2020-11-24
-
출처
식품의약품안전처
- 원문링크
-
키워드
#코로나#백신#임상#승인
- 첨부파일
국내 개발 코로나19 백신(1상)·치료제(2상) 임상 승인
코로나19 치료제·백신 국내 임상시험 총 22건 진행 중
□ 식품의약품안전처(김강립 처장)는 국내 개발 코로나19 백신 ‘NBP2001(에스케이바이오사이언스(주))’ 및 치료제 ‘DW2008S(동화약품(주))’에 대한 임상시험을 11월 23일 각각 승인하였습니다.
○ 이로써 현재 국내에서 코로나19 관련하여 승인한 임상시험은 총 30건이며, 이 중 22건(치료제 19건, 백신 3건)이 임상시험 진행 중에 있습니다.
|
구분 |
승인 |
진행 |
종료 |
||
|
제품분류 |
치료제 |
27 |
19 |
8 |
|
|
백신 |
3 |
3 |
- |
||
|
합계 |
30 |
22 |
8 |
||
|
임상주체 |
제약 업체 (22) |
1상 |
치료제 5, 백신 3 |
7 |
1 |
|
2상 |
치료제 10 |
10 |
- |
||
|
3상 |
치료제 4 |
2 |
2 |
||
|
연구자(8) |
치료제 8 |
3 |
5 |
||
|
합계 |
30 |
22 |
8 |
||
* 세부 현황 ‘붙임 1’ 표 참조
|
임상시험 단계 |
|
|
(임상 1상)최초로 사람에게 투여하여 안전성, 약동학등을 평가 (임상 2상)1상 종료 후, 대상 환자들에게 투여하여 치료효과를 탐색 (임상 3상)2상 종료 후, 많은 환자들에게 투여하여 안전성 및치료효과를확증 ※ ‘1상과 2상’(1/2상) 또는 ‘2상과 3상’(2/3상)을 동시 승인하는 경우도 있음 |
|
<< NBP2001 (에스케이바이오사이언스(주)) >>
□ 이번 임상시험은 건강한 성인을 대상으로 ‘NBP2001’의 안전성 및 면역원성을 평가하기 위한 1상 임상시험입니다.
* 면역원성 : 바이러스 감염성을 없애거나 낮추는 ‘중화항체’ 증가 비율
○ 해당 백신은 코로나19 바이러스의 ‘표면항원 단백질’을 유전자재조합 기술을 이용하여 제조한 ‘재조합 백신’입니다.
- 예방원리는 백신의 표면항원 단백질이 면역세포를 자극하여 면역반응을 유도하며, 코로나19 바이러스가 침입하는 경우 항체가 코로나19 바이러스를 제거하게 됩니다.
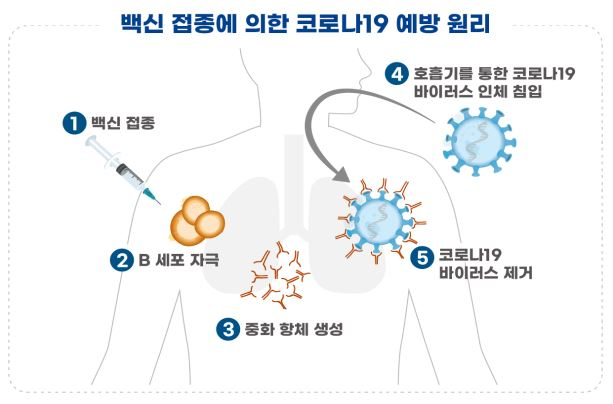
○ 참고로, 국외에서도 유전자재조합 기술을 이용한 코로나19 백신의 임상시험이 진행되고 있습니다. (미국 N社 3상, 중국 A社 2상)
<< DW2008S (동화약품(주)) >>
□ 이번 임상시험은 중등증 코로나19 환자를 대상으로 ‘DW2008S’의 유효성, 안전성을 평가하기 위한 2상 임상시험입니다.
○ 해당 의약품은 천식치료제 신약으로 개발 중인 천연물의약품으로, 이번 임상시험에서는 새로운 항바이러스 효과 탐색을 통해 코로나19 치료제로서의 가능성을 확인할 예정입니다.
- 천식치료제 개발 당시 건강한 사람을 대상으로 한 임상시험에서 안전성과 내약성에 대해 평가하였으며, 현재 천식치료제에 대해서도 2상 임상을 진행하고 있습니다.
* 내약성 : 임상시험 대상자가 부작용이나 불편감을 견뎌낼 수 있는 정도.
□ 식약처는 앞으로도 코로나19 치료제·백신 개발*에 대한 국민적 관심이 높은 점 등을 고려하여 개발 제품의 임상시험 현황에 대한 정보를 신속하게 전달하겠습니다.
* 개발단계 : ① 임상시험 승인 → ② 임상시험 → ③ 품목허가 신청 및 승인 → ④ 유통·판매
○ 또한, 안전하고 효과 있는 코로나19 치료제·백신이 신속히 개발될 수 있도록 필요한 사항을 지원하여 우리 국민이 치료 기회를 보장받을 수 있도록 최선을 다할 계획입니다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 11.23+임상정책과+등 (1).hwp
11.23+임상정책과+등 (1).hwp
 11.23+임상정책과+등.pdf
11.23+임상정책과+등.pdf