부처보도자료
모더나 코로나19 백신 검증 자문단 회의결과 발표
- 등록일2021-05-10
- 조회수2187
-
발간일
2021-05-10
-
출처
식품의약품안전처
- 원문링크
-
키워드
#모더나 #코로나 19#코로나 백신#코로나 대응#백신 검증
- 첨부파일
모더나 코로나19 백신 검증 자문단 회의결과 발표
□ 식품의약품안전처(처장 김강립)는 ㈜녹십자社가 수입품목허가 신청한 ‘모더나 코비드-19백신주’ 품목허가 진행 상황에 대해 다음과 같이 설명합니다.
1 코로나19 백신 허가·심사 진행 상황
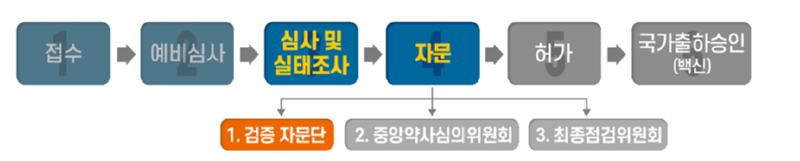
□ 식약처는 ㈜녹십자의 ‘모더나 코비드-19백신주’의 임상시험 결과에 대하여 ‘코로나19 백신 안전성·효과성 검증 자문단’(이하 검증 자문단) 회의를 5월 9일(일) 개최했습니다.
○ 검증 자문단은 중앙약사심의위원회 자문에 앞서 식약처가 임상·비임상·품질 등 다양한 분야의 전문가들에게 자문 의견을 수렴하는 절차로서,
- 이번 검증 자문단 회의에는 감염내과 전문의, 백신 전문가 및 임상 통계 전문가 등 7명이 참석했습니다.
2 임상시험 결과 및 자문결과
<< 개요 >>
□ 제출된 임상시험자료는 미국에서 진행중인 임상 1, 2, 3상(각 1건)의 중간결과로 안전성과 효과성은 주로 미국에서 수행된 3상 임상시험을 통해 평가했습니다.
○ 3상 임상시험에서 백신 또는 대조약물을 투여받은 사람은 3만 351명으로 평균연령은 52세이며, ▲여성 47.3%(1만 4,366명) ▲비만·폐질환·당뇨 등 기저질환이 있는 사람 22.5%(6,817명) ▲65세 이상 24.8%(7,520명)가 포함됐습니다.
<< 효과성 >>
□ (예방 효과) 백신 또는 대조약물(생리식염수 0.9%) 투여 전 코로나19에 감염되지 않고, 2차 투여를 완료한 대상자 2만 8,207명(백신군 1만 4,134명, 대조군 1만 4,073명)을 대상으로 예방 효과를 평가했습니다.
○ 예방 효과는 백신 또는 대조약물을 28일 간격으로 2회 투여한 후 14일 이후 각 군에서 발생한 코로나19 감염 환자의 비율을 비교·분석한 것으로, 코로나19 임상증상이 있고 코로나19 바이러스 검사* 결과 양성이 확인된 경우 감염이 확진된 것으로 정의했습니다.
* RT-PCR(역전사 중합효소 연쇄반응 분자진단법, Reverse Transcription Polymerase Chain Reaction)
○ 백신 2차 투여 14일 이후 코로나19로 확진 받은 사람은 백신군 11명, 대조군 185명으로 약 94.1%의 예방효과*가 나타났으며, 연령1), 기저질환 유무2)에 관계없이 86%이상의 예방효과가 있었습니다.
* 예방율(%) = 100 x (1 - (백신접종군 중 확진자율) / (위약접종군 중 확진자율))
|
구분 |
예방율(%) |
|
|
2차 투여 후 14일 이후 |
||
|
연령1) |
18∼64세 |
95.6 |
|
65세 이상 |
86.4 |
|
|
기저질환2) |
유(有) |
90.9 |
|
무(無) |
95.1 |
|
* WHO 등 코로나19 백신 효과평가와 관련된 국내외 기준(예방효과 50% 이상)
○ 또한, 중증 환자가 발생하거나 코로나19로 인한 사망사례는 대조군에서는 31명(중증확진 30명, 사망 1명)이었으며, 백신군에서는 없었습니다.
□ (면역원성 평가) 백신효과를 예측할 수 있는 간접 지표로써 백신 투여 후 몸 안에 생성되는 중화항체의 종류와 양 등 면역반응을 평가했습니다.
* 미국 임상1상(1건), 2상(1건) 총 2건의 임상시험을 통해 면역원성 평가함
○ 코로나19 바이러스 입자표면에 결합하여 바이러스의 감염성을 중화시킴으로써 예방효과를 유도할 수 있는 ‘중화항체’의 경우, 투여 전과 비교했을 때 백신 2차 투여 4주 후부터 ‘항체가’*가 4배 이상 증가하는 대상자 비율 등을 의미하는 ‘혈청전환율’은 100%이었습니다.
* 항체가 : 어떤 항원에 대하여 대응하는 항체의 역가(측정값)
** 혈청전환율 : 백신 접종 전 대비 항체가가 4배 이상 증가하는 등인 사람의 비율
□ (자문결과) 백신의 예방 효과에 대해서 검증 자문단은 제출된 자료에서 18세 이상 2차 투여 14일 후 효과가 확인되어, 허가를 위한 예방 효과는 인정 가능하다고 판단했습니다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 5.10+바이오의약품정책과+등.hwp
5.10+바이오의약품정책과+등.hwp