부처보도자료
국내 개발 코로나19 백신 3상 임상시험 승인
- 등록일2021-08-10
- 조회수2787
-
발간일
2021-08-10
-
출처
식품의약품안전처
- 원문링크
-
키워드
#코로나 19 백신#3상 임상시험
- 첨부파일
국내 개발 코로나19 백신 3상 임상시험 승인
- 최초 3상 진입 국산 백신, 세계 2번째 비교임상 적용 코로나19 백신 -
□ 식품의약품안전처(처장 김강립)는 국내 개발 코로나19 백신 ‘GBP510(㈜에스케이바이오사이언스)’의 3상 임상시험 계획에 대해 안전성과 과학적 타당성을 철저히 검증한 결과, 국내 최초로 국산 코로나19 백신의 3상 임상시험 계획을 8월 10일(화)승인했습니다.
○ 이번승인으로 국내 업체가 개발한 코로나19 백신이 최초로3상에 진입하게 됐으며, 기 허가된 백신과의 비교로 효과를 입증하는 비교임상 방식으로는 세계에서2번째**로 3상을 진행하게 됩니다.
* 면역원성 : 바이러스 감염성을 없애거나 낮추는 ‘중화항체’ 증가 비율
** ’21.4. 프랑스 발네바社가 개발한 코로나19 백신이 아스트라제네카 백신을대조군으로 하는 비교임상(3상)을 승인받아 영국에서 임상을 시작했음
1. 제품개요
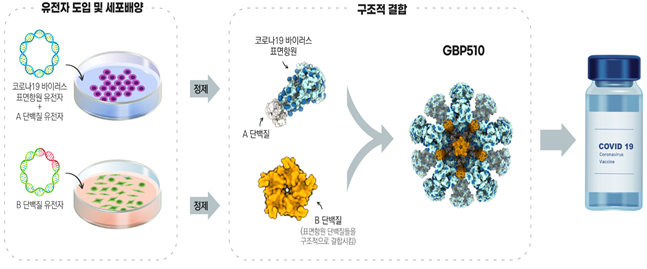
□ GBP510은 유전자 재조합기술을 이용해 만든 코로나19 바이러스의 표면항원 단백질을 주입해 면역반응을 유도하는‘재조합 백신’입니다.
○ 표면항원 단백질을 투여하면 체내에서 면역세포를 자극해중화항체생성을 유도하며, 인체에 코로나19 바이러스가 침입했을 때바이러스를 중화해 제거하게 됩니다.
* 중화항체 : 특정 바이러스를 중화할 수 있는 항체
○ 이 백신은 특히 항원 노출을 증가시키는 기술을 활용하여 항체를 많이생성함으로써 면역효과를 높일 수 있도록 개발됐습니다.
< GBP510 제조과정 개요 >
|
|
2. 임상시험 개요
□ 이번에 승인한 3상 임상시험은 18세 이상의 성인을 대상으로 GBP510의면역원성과 안전성을 평가하기 위한 임상시험입니다.
○ 3상 임상시험은 국내에서 허가되어 예방접종에 사용하고 있는‘아스트라제네카코비드-19백신주’를 대조백신으로 사용해 시험백신의 효과를 확인하는 비교임상 방식으로 진행됩니다.
- 대조백신은 허가된 코로나19 재조합 백신이 없는 상황을 고려해바이러스벡터 방식인 아스트라제네카코비드-19백신주를 선정했고,중화항체가의 우월성·혈청반응률의 비열등성을 확인하는 것으로 설계됐습니다.
* 중화항체가 : 특정 바이러스를 중화할 수 있는 항체의 양
* 혈청반응률 : 백신 접종 전 대비 항체가가 4배 이상 증가하는 시험대상자의 비율
○ 전체 시험대상자는 총 3,990명이며 시험백신은 3,000명, 대조백신은990명에게 0.5㎖씩 4주 간격으로 2회 접종하게 되고, 안전성과 면역원성을 평가합니다.
- 이번 3상 임상시험은 국내뿐만 아니라 동남아시아, 동유럽 등 여러 나라에서 동시에 진행될 예정입니다.
* 임상시험 정보 : 의약품안전나라(nedrug.mfds.go.kr)→임상시험정보→제품명검색→확인
3. 임상시험 심사 진행 경과
□ 식약처는 시험대상자의 안전을 최우선으로 과학적 근거에 기반하여 GBP510에 대한 임상시험계획을 면밀하게 심사했습니다.
○ 3상 임상시험은 의약품의 안전성과 유효성을 확증하기 위한 시험으로, 선행 임상시험 결과와 임상약의 품질, 비임상 자료 등을 토대로 그 타당성을 검토합니다.
- GBP510의 경우 현재 임상 2상이 진행 중이나 1상에서 안전성과 면역원성이 충분히 나타나 임상 3상 진입 가능성을 보여주었습니다.
|
임상시험 단계 |
|
|
(임상 1상)최초로 사람에게 투여하여 안전성, 약동학등을 평가 (임상 2상)1상 종료 후, 대상 환자들에게 투여하여 치료효과를 탐색 (임상 3상)2상 종료 후, 많은 환자들에게 투여하여 안전성 및치료효과를확증 ※ ‘1상과 2상’(1/2상) 또는 ‘2상과 3상’(2/3상)을 동시 승인하는 경우도 있음 |
|
○ 지난 1월 26일 임상 1·2상 승인 후 건강한 성인(만19세~55세 이하) 80명을 대상으로 1상 임상시험이 진행됐으며, 240명 대상으로 2상 임상시험이 진행 중입니다.
- 1상 중간분석결과, 유효성측면에서는 모든 백신 접종자에게서중화항체가 생성되었으며, 국제표준혈청(완치자혈청)*패널 대비 5배 이상의 높은 수치를 나타냈습니다.
* 국립바이오의약품연구소(NIBSC, 영국)에서 제조
- 안전성측면에서는 백신 접종 시 일반적으로 나타나는 이상사례(주사부위 통증, 피로, 근육통, 두통 등)외 특별한 부작용은보고되지 않았습니다.
○ 이 외에 생식발생 독성*및 동물모델 공격시험**등 비임상시험자료, 3상 시료의 특성 및 배치분석 결과 등 품질에 대한 자료를검토했습니다.
* 생식·발생 독성 : 시험물질이 포유류의 생식·발생에 미치는 영향을 규명하는 시험
** 동물모델 공격시험 : 코로나19 바이러스에 감수성이 있는 동물에 백신을 접종한 후 코로나19 바이러스에 노출시켜 백신의 방어효과를 확인하는 시험
4. 전문가 자문 및 검토 결과
□식약처는 코로나19 백신의 심사 과정에서 전문성과 객관성을 확보하기위해 임상승인 전 전문가 자문회의를 거치고 있습니다.
○ 8월 9일 코로나19 백신 외부 임상전문가들과 자문회의를 개최하고3상 임상시험 진입을 위한 근거자료의 적절성 및 임상시험계획의타당성에 대하여 자문을 받았습니다.
- 자문회의 결과 3상 비교임상 진입이가능한 것으로 결론을 내렸으며, 대조백신의 부작용으로 알려진 ‘혈전증이나 면역혈소판감소증 등 자가면역질환자’는 임상시험에서 제외해야 한다는 의견이 제시됐습니다.
5. 임상시험 승인의 의의
□이번 임상시험 승인은 코로나19 유행이 이어지는 상황 속에서 최초로국산 코로나19 백신이 3상 임상에 돌입함에 따라, 국내 백신제품화를 위한 첫걸음을 내딛었다는 데 의의가 있습니다.
○ 특히 ➊글로벌 백신 선도 기업이 없는 국가임에도 국내 개발코로나19 백신에 대한 임상 3상을 승인했고, ➋면역대리지표(ICP)*가정립되기 전이지만 전통적인 위약임상으로 국제적인 임상 3상을 하기가 쉽지 않은 상황에서 적극적이고 면밀한 심사로 비교임상 방식을추진했으며, ➌코로나19 변이 바이러스 대응을 위해 필수불가결할것으로 전망되는 비교임상 방식을 선제적으로 도입해 향후국제 표준을 주도할 수 있을 것으로 기대됩니다.
* 면역대리지표(ICP) : 접종한 백신에 의한 면역원성(항체가, 지속기간 등)과 방어효과 간 상관관계를 나타날 수 있는 대리지표
□식약처는 비교임상의 필요성에 대해 세계보건기구(WHO), 감염병예방혁신연합(CEPI)*, 해외 규제기관들과의회의, 워크숍 등에서지속적으로소통하여
* CEPI : 2017년 설립된 공공, 민간, 자선단체 및 시민단체의 기부를 받아 새로운 전염병에 대한 백신을 개발하기 위한 독립적인 연구 프로젝트 지원하는 국제비영리협의체
○ 백신 접종률이 높아지고 있는 상황 속에서기존의 위약대조 방식으로 3상 임상을 진행하는 것이 현실적으로어려워 비교임상이 필요하다는 공감대를 국제사회에 확산시키고 있습니다.
□한편식약처는 코로나19 등 신종 감염병 위기에 대응하기 위해 국내개발백신으로 백신 주권을 확보할 수 있도록 연구개발부터 허가까지 백신 개발 전(全) 과정을 지원하는 ‘우리 백신 프로젝트’를 추진하고있습니다.
○ 그간 코로나19 임상시험계획서 표준안 마련(‘21.5.31.)을 시작으로 면역원성 비교 3상 임상시험 설계 시 고려사항 발간, 코로나19 변이주 백신 개발 시 고려사항 발간, 코로나19 백신 국가출하승인가이드라인 제정(‘21.6.30.), 중앙임상시험심사위원회 출범(‘21.7.30.) 등을 진행했습니다.
□이에 식약처는 내부 심사결과 및 자문의견을 종합적으로 검토해 GBP510에 대한 3상 임상시험을 승인하기로 결정했습니다.
○ GBP510의 비임상, 1상 중간분석 결과안전성과 면역원성측면에서 3상 임상시험 진입이 가능하고, 시험백신의 효과를 입증할 수 있는 디자인으로 임상시험이 설계됐다고 판단했습니다.
- 다만, 전문가 자문결과에 따라 ‘혈전증이나면역혈소판감소증 등 자가면역질환자’는 제외하도록 임상시험계획을 시정승인했습니다.
6. 향후 계획
□식약처는 이 제품의 임상승인 이후에도 임상 현장과 지속적으로 소통하면서 임상시험이 원활하게 진행될 수 있도록 지원하고, 이 외에 국내에서 임상을 진행하고 있는 다른 제품도 신속하게 3상 임상시험에 진입할 수 있도록 지속적으로 지원하겠습니다.
○ 또한, 임상시험 참여자의 예상하지 못한 중대한 이상반응 등 안전에 관한 사항이나 임상시험 실시에 영향을 미치는 의약품 정보 등을 철저히 모니터링하면서 임상시험이 안전하게 진행될 수있도록 관리에 만전을 다하겠습니다.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 8.10+임상정책과.hwp
8.10+임상정책과.hwp