부처보도자료
규제과학 기반의 첨단재생의료 임상연구 발전방안 논의
- 등록일2021-09-27
- 조회수2349
-
발간일
2021-09-24
-
출처
식품의약품안전처
- 원문링크
-
키워드
# 규제과학#첨단재생의료 # 임상연구
- 첨부파일
규제과학 기반의 첨단재생의료 임상연구 발전방안 논의
- 제3차 첨단재생의료 및 첨단바이오의약품 정책심의위원회 개최(9.24.) -
□ 정부는 식품의약품안전처 김강립 처장 주재로 ‘제3차 첨단재생의료 및 첨단바이오의약품 정책심의위원회’(이하 정책위원회) 회의를 9월 24일 개최하였습니다.
○ 정책위원회는 위원장(복지부 장관)·부위원장(식약처장)*을 포함한 부처 관계자와 민간전문가 20인으로 구성되며 재생의료 관련 범정부 지원정책과 임상연구 관련 주요 사항을 심의하는 기구입니다.
* 1년 4회(분기별) 정기 회의 중 1회(3회차)를 식약처장이 의장으로 회의 주재
□ 이번 정책위원회에서는 첨단재생의료 임상연구 심의·승인 현황과 다부처 공동사업으로 추진하는 연구사업의 내용 진행 현황 등을 공유하고, 규제과학* 기반의 첨단재생의료 임상연구 제도에 대한 발전방안을 논의했습니다.
* (규제과학) 정부의 규제가 필요한 제품의 안전성, 유효성, 품질, 성능 등의 평가부터 허가·사용까지 규제적 의사결정에 활용되는 모든 도구, 기준 및 접근방법 등을 개발하는 과학
○ 지난해 첨단재생의료 임상연구의 법적 기반과 근거를 마련*한 이후 현재까지 심의·승인된 임상연구의 위험도에 대해 분류별 현황을 확인했습니다.
* 「첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률」(’19.8 제정, ’20.9 시행)
○ 또한 안전성을 확보하면서 희귀질환자의 치료받을 기회를 확대하기 위해, 관계부처가 서로 협력해 첨단재생의료 임상연구 제도를 조화롭게 운영할 수 있는 방안에 대해 토론했습니다.
<첨단재생의료 임상연구 위험도 분류체계 및 심의/승인 절차 등>
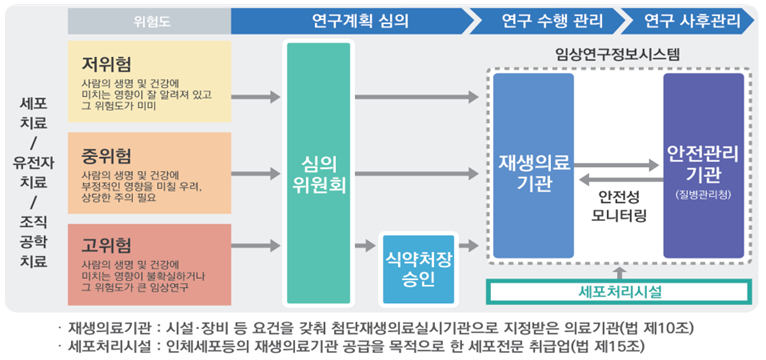
□ 이 자리에서 김강립 처장은 “부처 간 협력으로 규제과학에 기반한 전문적이고 안전한 첨단재생의료 임상연구 체계를 구축하고 운영할 것”이라면서 “희귀난치병 환자의 치료 기회를 확대하는 것은 반드시 필요하고 이는 국가의 의무라고 생각한다”고 강조했습니다.
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 9.24+(부처합동)+첨단바이오의약품TF.hwp
9.24+(부처합동)+첨단바이오의약품TF.hwp