부처보도자료
식약처, 예방용 mRNA 백신 평가 가이드라인 마련
- 등록일2022-01-27
- 조회수1809
-
발간일
2022-01-27
-
출처
식품의약품안전처
- 원문링크
-
키워드
#식품의약품안전처#식약처#mRNA 백신#가이드라인
- 첨부파일
식약처, 예방용 mRNA 백신 평가 가이드라인 마련
□ 식품의약품안전처(처장 김강립)는 국산 mRNA 코로나19 백신 개발을 지원하기 위해 품질관리, 비임상·임상 시험에 대한 고려사항을 안내하는 ‘예방용 mRNA 백신 평가 가이드라인‘을 1월 27일 마련·배포했습니다.
○ 이번 가이드라인의 주요 내용은 ▲mRNA 백신에 대한 특이적 고려사항 ▲품질관리 ▲비임상 평가 ▲임상 평가 등입니다.
- (고려사항) mRNA 안정성(지질나노입자 결합 등) 확보 등 mRNA 백신에서 특이적으로 고려해야 하는 점, (품질관리) 중요한 품질관리 기준, 시험법 예시 등 원료의약품과 완제의약품 품질관리 방법, (비임상 평가) 동물을 이용한 mRNA 백신의 안전성·효력 평가 시 고려할 점, (임상 평가) 임상시험 수행 시 주의사항 등을 안내합니다.
■용어설명
▸ mRNA 백신: 코로나19 바이러스 항원 유전자를 mRNA(messenger RNA, 세포에서 단백질로 번역되는 RNA) 형태로 주입하여 체내에서 항원 단백질을 합성하고, 이 단백질이 중화항체의 생성을 유도하여 코로나19 바이러스 감염을 예방
▸ RNA(Ribonucleic acid): 유전자 정보를 매개, 유전자 발현 조절 등의 역할을 하는 세포의 핵 속에 있는 두 종류의 핵산 중 하나
□ 이번 안내서는 코로나19와 같은 신종 감염병 위기를 대비하기 위해 국내에서 국산 백신을 개발할 수 있도록 식약처가 연구개발부터 허가까지 백신 개발 전(全) 과정을 적극 지원하는 ‘우리 백신 프로젝트’의 일환으로 마련됐습니다.
○ mRNA 백신 플랫폼은 재조합 단백질 플랫폼 등 전통적 방식과 비교하여 신속하게 백신을 생산할 수 있는 장점이 있어 코로나19와 같은 감염병 위기 상황에서 빠른 대응이 가능합니다.
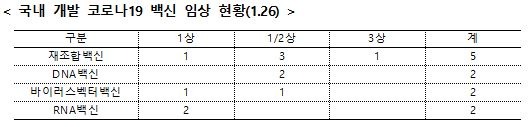
- 국내에서 임상이 진행 중인 코로나19 mRNA 백신은 현재 2개 품목으로 모두 임상 1상을 진행하고 있습니다.
□ 식약처는 이번 안내서 발간이 국내 개발사들의 시행착오를 줄이고 코로나19 백신을 신속하게 개발하는 데 도움을 줄 것으로 기대하며, 앞으로도 전문성과 규제과학을 기반으로 새로운 플랫폼 백신이 개발될 수 있도록 지원하겠습니다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.


 1.27+(보도참고)+생물제제과.hwp
1.27+(보도참고)+생물제제과.hwp