산업동향
광우병(mad cow disease)연구관련동향
- 등록일2004-09-01
- 조회수10578
- 분류산업동향 > 제품 > 바이오의약
-
자료발간일
2004-09-01
-
출처
보스톤총영사관
-
원문링크
-
키워드
#광우병
광우병(mad cow disease)연구관련동향
1986년 영국에서 처음으로 소에서 발견된 이래 1996년 11명의 청소년이 광우병으로 사망함에 따라 동질병의 인간에 대한 전염가능성이 제기되었고 작년에 미국내에서는 처음으로 워싱톤주에서 광우병에 감염된 소들이 발견됨으로써 전 인류에게 공포심을 자아내고 있는 광우병(mad cow disease)은 비정상적인 형태의 프리온(prion) 단백질에 의해 뇌, 특히 피질(cortex) 및 소뇌(cerebellum)부위가 스폰지와 같은 형태로 변형됨으로 소해면상뇌증(BSE, bovine spongiform encephalopathy)로도 알려있는 만성신경성 질병임. 광우병은 특정한 증상이 나타나지 않는 2~5년의 긴 잠복기간을 거쳐 발병하여 불안, 보행장애, 전신마비등의 임상적인 증상을 보이다가 결국은 사망에 이르는 치명적인 결과를 가져옴으로써 동 질병의 조기발견방법 및 치료방법개발이 현재 과학자들에게 있어서 주요관심대상인 바, 그 동안 이루어진 광우병에 대한 연구내용, 최근연구동향 및 미래연구과제등에 대해 아래와 같이 보고함.
1. 광우병 관련연구내용
지금까지 영국내에서만 약 18만마리의 소에서 발병되었고 현재 약 190만마리의 소가 감염되어 있는 것으로 알려진 광우병(BSE)은 양, 사슴, 밍크에서 각각 발병하는 scrapie, CWD(chronic wasting disease), TME(transmissible mink encephalopathy)등과 마찬가지로 비정상적인 구조를 가진 prion단백질에 의해 발생하는 prion계 질병중의 하나임. 일반적으로 Prion계 질병은 동종뿐만 아니라 다른종사이에서도 전염가능하며 그 증상으로 스폰지형태의 뇌조직을 가지고 있음으로써 TSE(transmissible spongiform encephalopathies)로도 알려져 있으며 특히 인간에게 발생되는 prion계 질병에는 자연적으로 발병하는 크로이츠펠트-야콥증(sporadic CJD, creutzfeldt-Jacob disease) 및 유전성인 GSS(gerstmann-straussler-scheinker syndrome), FFI(fetal familial insomnia)등과 감염(infection)등을 통해 후천적으로 발병하는 Kuru, vCJD(Variant of creutzfeldt-Jacob disease)등이 있는 것으로 확인됨.
Table 1. The prion diseases (www.sciencemag.org/feature/data/prusiner/245.shl)
Disease Mechanism of pathogenesis
Animal diseases
ㅇ BSE, Bovine spongiform encephalopathy (cattle): Infection with prion-contaminated
ㅇ Scrapie (sheep): Infection in genetically susceptible sheep
ㅇ CWD, Chronic wasting disease (mule deer, elk): Unknown
ㅇ TMB, Transmissible mink encephalopathy (mink): Infection with prions from sheep or
cattle
Human diseases
ㅇ GSS, Gerstmann-Straussler-Scheinker disease: Germline mutations in PrP gene
ㅇ FFI, Fatal familial insomnia: Germline mutation in PrP gene (D178N and M129)
ㅇ Familial Creutzfeldt-Jakob disease: Germline mutations in PrP gene
ㅇ Sporadic Creutzfeldt-Jakob disease: Somatic mutation or spontaneous conversion of
PrPC into PrPSc
ㅇ Kuru: New Guinea의 종교의식인 cannibalism(식인)에 의해 발생한 prion계 질병
ㅇ vCJD, Variant Creutzfeldt-Jakob disease Infection from bovine prion
가. 광우병 원인병원체 단백질 prion 규명
1984년 미국 UCSF의대 신경생화학과 교수(노벨수상자)인 Dr. Stanley Prusiner에 의해 처음으로 prion이 소의 BSE, 양의 scrapie, 인간의 크로이츠펠트-야콥증(CJD)등의 질병원인단백질인 사실이 밝혀짐으로써 DNA나 RNA가 아닌 단백질(protein)자체가 감염성질환을 야기시키는 능력을 가질수 있다는 사실을 입증하였음(science, 2004(July) 305 :673-676). 일반적으로 prion은 크게 두가지 형태로 존재하는데 그중 하나인 정상적인 형태의 prion PrPc(c for cellular)는 GIP(glycoinositol phospholipid)가 anchor된 막단백질로서 신경세포(neuron)표면에 존재하며 synaptic function에 관련되는 것으로 알려져 있고 또 다른 형태의 질병원인형 prion PrPsc(Sc for scrapie)은 아직 규명되지 않은 mechanism에 의해 PrPc이 PrPsc로 구조적변형(conformational )된 것으로써 변형된 PrPsc가 지속적으로 PrPc을 자신과 같은 병변(pathogenic)단백질로 전환 및 뇌에 축척된 결과로 뇌세포가 파열되여 뇌가 스폰지와 같은 형태를 갖게됨.
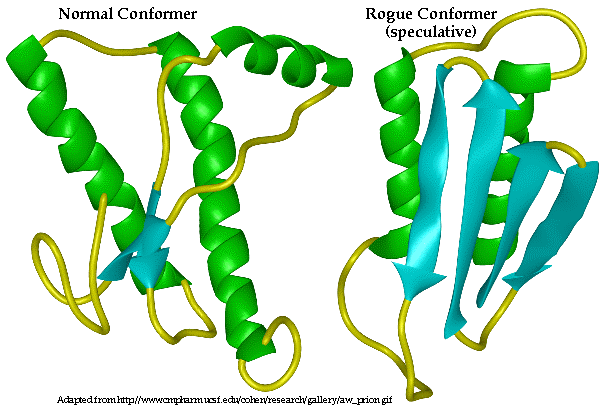
Fig 1. a normal prion protein (PrpC, left) and a disease-causing form (PrpSc, right) (www.mad-cow.org/prion_structure_folder/normal_rogue.gif)
The two structures exhibit two different, classic protein motifs, called alpha helices, and beta sheets. Alpha helices, seen here in the normal prion (left), consist of linked amino-acid building blocks that spiral around like a coiled spring. Beta sheets form when amino acid chains line up in a flat plane within the protein, as in the disease-causing protein shown here. The propagation of infectious prions arises from a rearrangement of a normal prion protein into a disease-causing form, a process that can be spurred by the initial presence of the infectious protein. The infectious form of the prion protein (right) arises when alpha-helical regions in the normal protein unfold and beta sheets form within the protein. When the protein converts to the form exhibiting more sheet-like regions, it is able to clump together and react in ways that contribute to disease in some as-yet undefined manner.
나. 인간광우병 vCJD규명
1996년 영국에서 11명의 청소년들이 백만명중 한명꼴로 대부분 노년층에서 발병하는 것으로 알려진 크로이츠펠트-야콥증(CJD)과는 달리 변형된 크로이츠펠트-야콥증인 vCJD(Variant of creutzfeldt-Jacob disease, www.cdc.gov/ncidod/diseases/cjd/cjd_fact_sheet.htm) 에 의해 사망한 것이 보도된 이래 이에 따른 원인규명연구를 통하여 광우병의 인간에로 전염가능성을 밝힘으로써 광우병에 대한 경각심과 함께 그와 관련연구가 진행되고 있음. 긴잠복기간으로 인해 정확한 추정은 불가능하나 2004년 현재, 영국(146명)을 비롯하여 전세계적으로 약157명의 vCJD환자가 있는 것으로 밝혀져 있음. 인간광우병 vCJD에서는 원인병원체단백질 PrPsc이 뇌뿐만 아니라 편도선(tonsil), 충수(appendix)와 같은 임파계(lymphoid system)에도 축척됨으로써 혈관을 통한 감염가능성이 있으며 현재 수혈을 통한 감염사례가 보도됨. (news.bbc.co.uk/1/hi/health/3916285.stm)
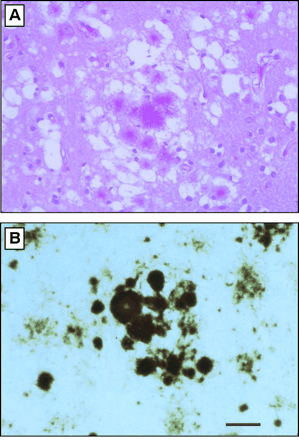
Fig 2. Histopathology of vCJD in Great Britain. (A) Section from frontal cortex stained by the periodic acid-Schiff (PAS) method, showing a field with aggregates of plaques surrounded by spongiform degeneration. (B) Multiple plaques and amorphous deposits are PrP-immunopositive (www.sciencemag.org/feature/data/prusiner/245.shl)
2. 최근연구동향
현재 MIT whitehead연구소의 Dr. Susan Lindquist(www.wi.mit.edu/far/far_lindquist_bio.html), UCSF의대 신경생화학과 교수 Dr. Stanley Prusiner(www.ucsf.edu/neurosc/faculty/neuro_prusiner.html), 미국 국립 알레르기·전염병 연구소(National Institute of Allergy and Infectious Diseases ; NIAID)의 Dr. Byron Caughey (www.niaid.nih.gov/dir/labs/lpvd/caughey.htm), 일본 큐슈대학의 Dr. Katsumi Doh-ura(www.med.tohoku.ac.jp/room/075/english.html)등의 연구팀이 병원체 Prion단백질 증식 및 억제 mechanism규명연구 및 Thorazine(기존의 정신분열증치료약), Quinacrine(기존의 항말라리아치료약)등의 광우병 치료제로의 가능성여부를 확인하기 위한 임상실험단계에 있음.
또한, 정상적인 PrPc과는 달리 PrPsc는 단백질분해효소(protease)로 분해되지 않고 박테리아, 바이러스, 곰팡이등을 박멸시킬수 있는 열, 방사선, 화학약품등에 의한 살균작용에도 저항력이 강함으로써 prion계 질병에 걸린 가축육골의 섭취에 따른 감염예방이 어려움. 이에 가축뇌조직에 존재하는 병원체단백질 PrPsc을 조기 발견하여 인간이 섭취하지 않도록 예방하는 것이 급선무이며 이에 현재 과학자들은 이상적인 진단방법개발에 중점을 두고 있음. 현재 쓰이고 있는 광우병진단방법으로는 bioassay*, immunohistochemistry*, immunoassay*, CDI(conformation-dependent immunoassay)*가 있으며 현재 소량의 PrPsc도 인식하는 방법인 CDI가 주목받고 있으며 동 CDI을 이용하여 살아있는 가축으로부터의 조직을 통해 병의 존재여부를 밝히는 진단방법이 실험중에 있음.
*bioassay :소의 뇌에서 조직을 분리하여 쥐에 주입한후 쥐의 발병여부를 확인하는 방법으로 약 36개월이 걸림
* immunohistochemistry: 소의 뇌 조직절편(section)을 가지고 병원체 prion단백질 PrPsc을 인식하는 항체(antibody)를 이용하여 stain한 후 현미경을 통해 관찰함으로써 병의 존재여부를 판단하는 방법인데 이 과정은 약 일주일이 걸리며 다량감정(mass screening)시 비효율적임
* immunoassay: 소의 뇌에서 분리된 조직을 단백질분해효소(protease)를 이용하여 protease에 분해되지 않고 남은 PrPsc을 그 특정 항체로 인식하는 방법으로 동 과정은 약 8시간이 걸리며 현재 상업적으로 보편화되어 있으나 이 방법은 PrPsc이 대량으로 존재하는 경우에 한정된다는 단점이 있음
*CDI(conformation-dependent immunoassay): 화학물질(chemical)을 이용하여 서로 다른 두가지 형태의 prion을 분리한후 형광물질(fluorescence)이 tag된 PrPsc항체를 이용하여 병의존재여부를 판단하는 방법으로 소량의 PrPsc도 인식한다는 장점이 있음
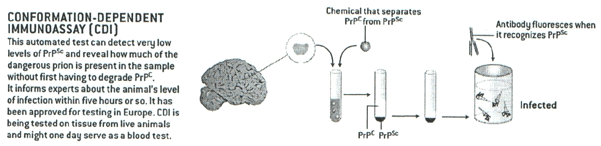
Fig 3. CDI method (Scientific American, 2004. 7)
3. 미래의 연구과제
현재 인간 광우병 치료제로 개발된 약물들은 주로 병의 치료보다는 병의 진전속도(progression)를 완화(slow down)시키는 역할을 하는 것으로 알려져 있으므로 병원체Prion단백질 PrPsc의 증식 및 억제 mechanism을 target으로 하여 보다 효과적인 치료약개발이 급선무이며 동 치료약개발은 인간광우병(vCJD)뿐만이 아닌 치매(Alzheimer's), 파킨슨씨병(Parkinson's)등의 신경퇴행성질병치료에도 효과적일 것으로 생각되며 또한 혈액 또는 뇨를 통해 광우병을 조기진단할 수 있는 인간광우병 예방차원의 연구도 미래의 중요한 과제임.
4. 참고자료
ㅇ Detecting mad cow disease(Scientific American, 2004. 7, www.sciam.com)
ㅇ Mad cow disease(organicconsumers.org/madcow.htm)
ㅇ 한국 포항공대website,bric의 광우병(소해면상뇌증:BSE)관련 자료 (bric.postech.ac.kr/trend/issue/2004/bse.html)
ㅇ Carsten Korth (hdlighthouse.org/see/research/prionhope.htm)
ㅇ Prion disease(users.rcn.com/jkimball.ma.ultranet/BiologyPages/P/Prions.html#scrapie), (www-micro.msb.le.ac.uk/3035/prions.html)
ㅇ Improved conformation-dependent immunoassay: suitability for human prion detection with enhanced sensitivity (J of Genetic Virology. 2003. 84:1921-5, vir.sgmjournals.org/cgi/content/full/84/7/1921)
ㅇSynthetic mamalian prions(science, 2004, 7, sciencemag.org)
ㅇPrion finding offers insight spontaneous protein diseases (Bio. 2004. 7. 29. www.bio.com)
-
이전글
- 바이오벤처협회 김완주회장
-
다음글
- 암(Cancer)연구관련동향

