산업동향
2021년 멕시코 의료기기 산업 정보
- 등록일2022-01-12
- 조회수4127
- 분류산업동향 > 제품 > 바이오의약
-
자료발간일
2022-01-07
-
출처
KOTRA
- 원문링크
-
키워드
#의료기기#멕시코
2021년 멕시코 의료기기 산업 정보
◈목차
첨단기술의 의료기기 수요 아직 미미, 의료용품류(거즈, 밴드, 수액, 카테터) 소비 두드러져
글로벌 의료기기 유치 위해 인증 획득에 소요기간 축소되는 추세, 사전 준비 철저해야
◈본문
가. 산업 특성
정책 및 규제
멕시코 보건의료 부문은 공공 분야와 민간 분야로 구분되며, 공공의료는 전액 무료로 지원된다. 멕시코 국가 전체 의료진의 70~80%가 공공의료부문에 배치되어 있으며, 25~30% 정도가 민간부문에서 근무하고 있다. 멕시코 공공의료부문은 크게 6개의 기관을 통해 국민들에게 의료서비스를 제공하고 있다.
1. IMSS(INstituto Mexicano del SeguroSocial, 사회보장보험청): 한국의 국민건강보험공단이라고 볼 수 있으며, 멕시코 전체인구의 80%가 동 제도를 통해 의료서비스를 받는다.
2. ISSSTE(Instituto de Seguridad y Servicios de los Trabajadores del Estado, 공무원보험청)
3. PEMEX(Petróleos Mexicanos): 석유공사 산하에 별도 사회보험청이 존재한다.
4. 국가방위군(SEDENA; Secretaría de Defensa Nacional)
5. 해군(SEMAR; Secretaría de Marina)
6. 보건부(SSA; Secretaría de Salud)
멕시코 민간의료부분의 주요 기관은 앙헬레스 그룹(Grupo Empresarial Ángeles), 스타 메디카(Star Medica), 메디카 수르(Medica Sur), 산 호세 병원(Hospital San Jose), 에이비시 의료 센터(Centro Medico ABC), 에스파뇰라 병원(Hospital Español), 아메리메드 병원(Amerimed Hospitales), 산 앙헬 인 병원(Hospitales San Angel Inn), 크리스투스 무게르사 그룹(Grupo Christus Muguerza)이 있다.
의료기기 수출 및 유통을 위한 필수 제품인증(위생등록): 코페프리스(COFEPRIS)
멕시코 식약청, 일명 코페프리스(COFEPRIS; Comisión Federal para la Protección contra Riesgos Sanitarios)는 멕시코 보건부 산하 기관으로 한국의 식약청에 준한다. 해당 기관에서는 시장에 판매되는 인체에 영향을 끼치는 모든 제품(의료기기, 제약, 특정 기능성 화장품 등)에 대한 안전을 보장하고 위생등록을 통해서 멕시코에서 해당 제품이 판매될 수 있도록 권한을 부여한다.
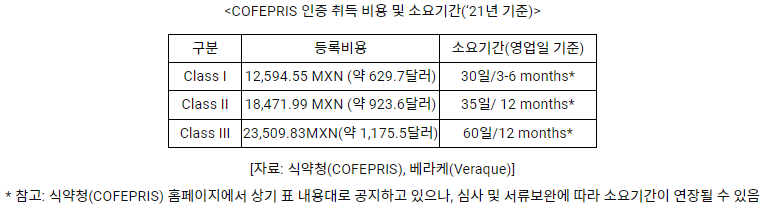
멕시코에서 의료기기는 사용 위험도에 따라 3가지로 분류된다.
- Class I: 안전성이 완전히 보장되며 인체 접촉이 없는 의료기기
- Class II: 인체 접촉이 있고 그 접촉 기간이 30일 미만인 의료기기
- Class III: 인체 접촉이 있고 그 접촉 기간이 30일 이상인 의료기기
의료 기기 인증 취득방법은 1) 식약청(COFEPRIS)에 직접 접수하는 방법, 2) 타국 (미국, 캐나다, 일본) 인증제도 활용, 3) 공식 인증대행업체를 통한 제3자 접수가 있으며, 직접 접수하는 경우 최소 8개월, 제3자 인증업체를 이용하는 경우 최소 6개월이 소요된다.
식약청(COFEPRIS) 위생 등록 신청 자격은 멕시코 정부에서 인증 받은 멕시코 현지의 법적 기관으로, 제품의 법적 책임을 지고 현지 연락 담당자의 역할을 할 수 있는 유자격 인원을 보유해야 한다. 신청 서류는 모두 스페인어로 작성되어야 하며, 서류 준비는 제3자 인증기관에서 대행하지 않는다. 직접 준비하는 것에 애로가 다대할 경우 별도 컨설팅업체가 있으니 대행서비스를 받는 것도 좋은 방법이다. 실제로 보완 및 수정 등 식약청 요구 사항이 많으므로 현지에 에이전시를 두는 것을 권하는 편이다. 식약청(COFEPRIS) 위생 등록은 인증취득 후 5년 동안 유효하며, 갱신 서류는 인증만료 전 150일 이내에 제출하여야 한다. 등록자 주소지, 제조지 변경 등 제품에 대한 기타 변경사항이 발생할 경우 등록사항을 변경(Modification)해야 하며, 역시 변경 비용이 발생한다.
인증 신청을 위한 신청 서류는 1) 신청자(현지 법인 또는 에이전트)의 사업자 등록증, 2) 의료기기 제조업체의 수입∙유통∙판매 동의서, 3) 제품의 원자재 및 부품 구성 분석표, 4) 제품 사용설명서(스페인어 작성), 5) 제품 제조공정 설명서, 6) 제품 부분별 기능, 구조에 대한 설명서, 7) 제조국이 발행한 ‘우수의약품 제조 및 품질관리 기준증명서, 8) 제품 제조를 위해 사용되는 원료 분석표(Certificate of Analysis), 9) NOM(멕시코 공식표준규격제도)* 검사 취득 증명서이다. 단, 제품별로 요구 서류에 차이가 있을 수 있다.
*멕시코 공식표준규격제도(NOM): 일부 전자 의료기기는 NOM(규격, 안전 및 라벨링 규격, 품질테스트 및 포장방법 등을 규정)에 의한 안정성 증명서 취득이 필요하다.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
관련정보
지식
동향

