BioINwatch
(BioIN + Issue + watch) : 바이오 이슈를 빠르게 포착하여 정보 제공2017년 美 FDA 신약 승인 21년 만에 최고치
- 등록일2018-01-15
- 조회수8183
- 분류제품 > 바이오의약
- 원문링크
-
발간일
2018-01-09
-
키워드
#FDA#신약
- 첨부파일
-
차트+
?
차트+ 도움말
BioINwatch(BioIN+Issue+Watch): 18-3
2017년 美 FDA 신약 승인 21년 만에 최고치
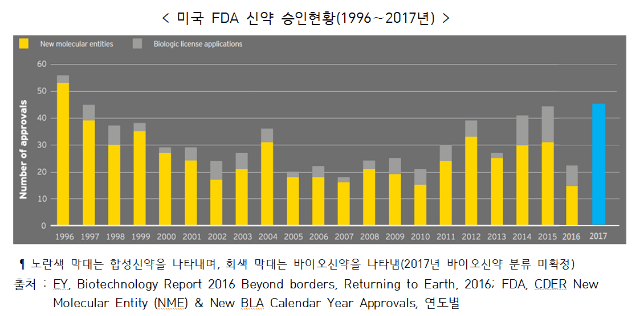
◇ 2017년 미국 FDA가 전년대비 2배가 넘는 46개의 신약을 승인하며 21년만 (1996년 53개)에 최고치를 기록. 최근 FDA는 신속심사(Fast Track), 우선심사(Priority Review), 획기적 치료제(Breakthrough Designation), 가속승인(Accelerated Approval) 등 신약 승인 프로세스를 단축시키기 위해 정책을 시행 중
▸주요 출처 : FDA 홈페이지(www.fda.gov/Drugs/DevelopmentApprovalProcess/DrugInnovation/ ucm537040.htm); Reuters, New drug approvals hit 21-year high in 2017, 2018.1.2
■ 2017년 미국 FDA가 지난해의 2배가 넘는 46개의 신약을 승인하여 21년 만에 최고치를 기록
○ 1996년 50건 이상의 신약 승인 건수에서 감소하기 시작하여 2010년까지 연간 20건 정도로 부진한 실적으로 보이다가 2011년 이후 증가 추세로 전환
- 2016년 신약 승인 건수가 22건으로 크게 감소하였으나, 2017년 2배 이상인 46개의 신약을 승인
※ 신약 승인 건수: 1996년 53개 → 2005∼12년 18∼39개 → 2013년 27개 → 2014년 41개 → 2015년 45개 → 2016년 22개 → 2017년 46개
- 승인된 신약 중 바이오신약에 대한 비중이 증가하는 추세
※ 바이오신약 비중(건수) : 2013년 15%(4개) → 2014년 27%(11개) → 2015년 27%(12개) → 2016년 32%(7개)
○ 2017년 승인받은 신약 중 많은 신약이 환자 수는 매우 적지만 약가는 수십만 달러가 될 수 있는 희귀질환 치료제가 다수 승인
- 또한 신속심사(Fast Track) 등 신속허가 트랙을 통해 승인되는 신약의 수가 증가하는 추세
※ 신속허가 승인된 신약 비중(건수) : 2015년 60%(27개) → 2016년 73%(16개)
- 46개 신약에는 CAR-T 치료제 등 별도의 항목(바이오의약품)에서 승인받은 노바티스(Norvatis), 길리어드 사이언스(Gilead Science), 스파크 테라퓨틱스 (Spark Therapeutics)의 최초 세포 및 유전자치료제는 불포함
※ 미국 FDA 청장인 스코트 고틀리에브(Scott Gottlieb)는 이들 제품이 “중증질환 치료를 위한 전혀 새로운 과학적 패러다임”이라고 반겼지만 자금난을 겪고 있는 헬스케어 시스템이 어떻게 약가를 보상해줄 수 있을지에 대한 논란 존재
■신약 승인 건수의 증가 원인은 신약개발 관련기술의 발전과 신속승인 등의 규제 효율화가 주요 요인
○ 생명현상과 질환에 대한 이해가 높아지고, 강력한 신약 발굴 툴과 기술 개발로 인해 신약개발 혁신을 일으켰고, 특히 바이오의약품 개발에 큰 영향을 미친 것으로 판단
- 지난 10여 년간 추진해온 ‘omics’ 연구의 결과를 기반으로 생명공학 회사들은 암을 파괴하는 면역시스템 연구와 희귀질환을 치료할 수 있는 유전자 편집기술을 개발 중
○ 획기적 치료제(Breakthrough Designation)와 같은 규제 효율화도 신약 심사시간을 단축시킴으로써 신약 승인 건수 증가에 한 몫을 한 것으로 평가
- 2012년 도입 이후 60개 가까운 신약이 Breakthrough Designation* 트랙으로 승인되었고, 그간 주목받지 못한 질환에 대한 치료제 개발 촉진
* 중대한 질병의 치료를 목적으로 초기 임상에서 기존 치료법 대비 우월한 임상 효과를 나타낸 의약품에 대하여 우선심사, Rolling Review 등을 통하여 개발 가속화 및 심사 단축
○ 바이오 연구와 Big science에 대한 바이오의약품 개발회사에 대한 대규모 R&D 투자 또한 신약개발 생산성 향상에 기여
- 최근 산업화 이전 단계의 바이오텍 회사에 대한 R&D 투자가 많아지면서, 초기 단계이지만 생명과학 분야의 혁신적 아이디어*에 대한 벤처캐피털의 투자 또한 증가
* 노화 질환(diseases of ageing), 신경퇴화(neurodegeneration), 항암백신(cancer vaccine) 등
*참고1 : 2017년 미국 FDA 승인 신약(46개)
순번 | 의약품명 | 활성 성분 | 승인일 | FDA 승인 용도 |
46. | angiotensin II | 12/21/2017 | To increase blood pressure in adults with septic or other distributive shock | |
45. | macimorelin acetate | 12/20/2017 | For the diagnosis of adult growth hormone deficiency | |
44. | ertugliflozin | 12/19/2017 | To improve glycemic control in adults with type 2 diabetes mellitus | |
43. | netarsudil | 12/18/2017 | To treat glaucoma or ocular hypertension | |
42. | ozenoxacin | 12/11/2017 | To treat impetigo | |
41. | semaglutide | 12/5/2017 | To improve glycemic control in adults with type 2 diabetes mellitus | |
40. | emicizumab | 11/16/2017 | To prevent or reduce the frequency of bleeding episodes in adult and pediatric patients with hemophilia A who have developed antibodies called Factor VIII (FVIII) inhibitors. | |
39. | vestronidase alfa-vjbk | 11/15/2017 | To treat pediatric and adult patients with an inherited metabolic condition called mucopolysaccharidosis type VII (MPS VII), also known as Sly syndrome. | |
38. | benralizumab | 11/14/2017 | For add-on maintenance treatment of patients with severe asthma aged 12 years and older, and with an eosinophilic phenotype | |
37. | letermovir | 11/8/2017 | To prevent infection after bone marrow transplant | |
36. | latanoprostene bunod ophthalmic solution | 11/2/2017 | To treat intraocular pressure in patients with open-angle glaucoma or ocular hypertension. | |
35. | acalabrutinib | 10/31/2017 | To treat adults with mantle cell lymphoma | |
34. | abemaciclib | 9/28/2017 | To treat certain advanced or metastatic breast cancers | |
33. | secnidazole | 9/15/2017 | To treat bacterial vaginosis | |
32. | copanlisib | 9/14/2017 | To treat adults with relapsed follicular lymphoma | |
31. | benznidazole | 8/29/2017 | To treat children ages 2 to 12 years old with Chagas disease | |
30. | meropenem and vaborbactam | 8/29/2017 | To treat adults with complicated urinary tract infections | |
29. | inotuzumab ozogamicin | 8/17/2017 | To treat adults with relapsed or refractory acute lymphoblastic leukemia | |
28. | glecaprevir and pibrentasvir | 8/3/2017 | To treat adults with chronic hepatitis C virus | |
27. | enasidenib | 8/1/2017 | To treat relapsed or refractory acute myeloid leukemia | |
26. | sofosbuvir, velpatasvir and voxilaprevir | 7/18/2017 | To treat adults with chronic hepatitis C virus | |
25. | neratinib maleate | 7/17/2017 | To reduce the risk of breast cancer returning | |
24. | guselkumab | 7/13/2017 | For the treatment of adult patients with moderate-to-severe plaque psoriasis | |
23. | betrixaban | 6/23/2017 | For the prophylaxis of venous thromboembolism (VTE) in adult patients hospitalized for an acute medical illness | |
22. | delafloxacin | 6/19/2017 | To treat patients with acute bacterial skin infections | |
21. | sarilumab | 5/22/2017 | To treat adult rheumatoid arthritis | |
20. | edaravone | 5/5/2017 | To treat patients with amyotrophic lateral sclerosis (ALS) | |
19. | durvalumab | 5/1/2017 | To treat patients with locally advanced or metastatic urothelial carcinoma | |
18. | abaloparatide | 4/28/2017 | To treat osteoporosis in postmenopausal women at high risk of fracture or those who have failed other therapies | |
17. | midostaurin | 4/28/2017 | To treat acute myeloid leukemia | |
16. | brigatinib | 4/28/2017 | To treat patients with anaplastic lymphoma kinase (ALK)-positive metastatic non-small cell lung cancer (NSCLC) who have progressed on or are intolerant to crizotinib | |
15. | cerliponase alfa | 4/27/2017 | To treat a specific form of Batten disease | |
14. | valbenazine | 4/11/2017 | To treat adults with tardive dyskinesia | |
13. | deutetrabenazine | 4/3/2017 | For the treatment of chorea associated with Huntington’s disease | |
12. | ocrelizumab | 3/28/2017 | To treat patients with relapsing and primary progressive forms of multiple sclerosis | |
11. | dupilumab | 3/28/2017 | To treat adults with moderate-to-severe eczema (atopic dermatitis) | |
10. | niraparib | 3/27/2017 | For the maintenance treatment for recurrent epithelial ovarian, fallopian tube or primary peritoneal cancers | |
9. | naldemedine | 3/23/2017 | For the treatment of opioid-induced constipation | |
8. | avelumab | 3/23/2017 | To treat metastatic Merkel cell carcinoma | |
7. | safinamide | 3/21/2017 | To treat Parkinson’s disease | |
6. | ribociclib | 3/13/2017 | To treat postmenopausal women with a type of advanced breast cancer | |
5. | telotristat ethyl | 2/28/2017 | To treat carcinoid syndrome diarrhea | |
4. | brodalumab | 2/15/2017 | To treat adults with moderate-to-severe plaque psoriasis | |
3. | deflazacort | 2/9/2017 | To treat patients age 5 years and older with Duchenne muscular dystrophy (DMD) | |
2. | etelcalcetide | 2/7/2017 | To treat secondary hyperparathyroidism in adult patients with chronic kidney disease undergoing dialysis | |
1. | plecanatide | 1/19/2017 | To treat Chronic Idiopathic Constipation (CIC) in adult patients. |
*참고2 : 선진국(미국, 일본, 유럽)의 신약 신속허가 관련 제도
○ 미국
- (Breakthrough Designation) 중대한 질병의 치료를 목적으로 초기 임상에서 기존 치료법 대비 우월한 임상 효과를 나타낸 의약품에 대하여 우선심사, Rolling Review 등을 통하여 개발 가속화 및 심사 단축
- (Fast Track Designation) 중대한 질병을 치료하고 미충족된 의료적 수요를 해결할 잠재적 가능성이 있는 신약 또는 지정 감염병 치료제로 지정된 의약품에 대하여 우선심사, Rolling Review 등을 통하여 개발 가속화 및 심시 단축
* 지정 감염병 치료제 : 공중 보건에 심각한 위협을 줄 가능성이 있는 병인에 대응하기 위한 의약품
- (Accelerated Approval) 질병의 경과가 오래 걸리거나 신약의 임상적 유익성 측정에 오랜 시간이 소요되는 의약품에 대하여 대리결과변수 등을 바탕으로 품목 허가, 단 허가 후 임상적 유익성 확인을 위한 자료를 제출토록 함
- (Rolling Review) 의약품 품목허가 신청 전 제출 자료의 일부를 단계적으로 제출하여 FDA의 심사를 받도록 하여 심사 절차를 가속화
○ 일본
- (의약품, 세포치료등 제품의 특례승인) 중대한 질병 등 보건상 위해 확대 방지를 위해 긴급한 사용이 필요한 의약품에 대하여 약사심의회의 의견을 들어 특례 승인
- (개발 선구자 패키지 전략 – SAKIGAKE) 유효한 치료법이 없고 생명을 위협하는 질환을 대상으로 한 의약품 등의 일본 최초 실용화를 위하여 기초연구부터 국제전개까지 일괄 지원
○ 유럽(EMA)
- (PRIME - Priority Medicines제도) 현재 치료대안이 존재하지 않는 질환을 대상으로 한 것으로 기존 치료제 대비 약효의 우월성이 있는 의약품에 대하여 우선 심사, 지속적이고 능동적인 자문, 전문가 지원 등을 통하여 개발 가속화
출처 : 식약처 보도자료, 「의약품의 개발지원 및 허가특례에 관한 법률」제정안 입법예고, 2016.5.26
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.
☎ 해당 사이트 링크가 열리지 않을시 Bioin 담당자(042-879-8377, bioin@kribb.re.kr)에게로 연락주시기 바랍니다.
지식
동향


 BioINwatch18-3(1.9)●2017년 美 FDA 신약 승인 21년 만에 최고치....
BioINwatch18-3(1.9)●2017년 美 FDA 신약 승인 21년 만에 최고치....
 미국 FDA 신약 승인현황(1996∼2017년)
미국 FDA 신약 승인현황(1996∼2017년)
 2017년 미국 FDA 승인 신약(46개)
2017년 미국 FDA 승인 신약(46개)