BioINwatch
(BioIN + Issue + watch) : 바이오 이슈를 빠르게 포착하여 정보 제공美 FDA, 인공지능 기반 안 질환 진단기기 승인
- 등록일2018-05-31
- 조회수7021
- 분류레드바이오 > 의료기기기술, 제품 > 바이오의료기기
-
발간일
2018-05-29
-
키워드
#인공지능#당뇨병성 막망병증
- 첨부파일
-
차트+
?
차트+ 도움말
BioINwatch(BioIN+Issue+Watch): 18-39
美 FDA, 인공지능 기반 안 질환 진단기기 승인
◇ 미국 식품의약국은 당뇨병 환자의 실명 원인인 당뇨병성 막망병증(Diabetic retinopathy)을 인공지능 소프트웨어를 이용해 진단하는 의료기기 ‘IDx-DR’를 허가. 인공지능을 이용한 당뇨병성 막망병증 진단 의료기기에 대한 FDA의 최초 승인으로, 이번 승인을 계기로 건강관리에 대한 환자의 접근성 향상 및 디지털 의료기기 사용이 촉진될 것으로 기대
▸주요 출처 : U.S. Food and Drug Administration, FDA permits marketing of artificial intelligence-based device to detect certain diabetes-related eye problems, 2018.4.11
■ 인공지능(AI) 기반 당뇨병성 망막병증 진단 의료기기, 미국 FDA 승인
○ 미국 FDA는 성인 당뇨병 환자의 실명 원인인 당뇨병성 망막병증(Diabetic retinopathy)을 AI 소프트웨어를 이용해 진단하는 의료기기 ‘IDx-DR’를 허가(2018.4.11)
- 당뇨병성 망막병증*은 미국 내 3,000만 명 이상의 당뇨병 환자의 시력상실의 가장 흔한 원인이며, 생산가능 연령 성인의 시력손상 및 시력상실의 주요 원인
* 높은 혈당 수치가 안구 뒤쪽의 망막혈관 손상을 유발하여 발생하는 질환
- 미국 의료기기업체 IDx가 개발한 IDx-DR는 Topcon NW400이라는 망막 카메라를 통해 찍은 눈 영상을 분석하는 AI 알고리즘이 이용되는 소프트웨어 프로그램으로, 의사나 간호사는 환자 망막에 대한 디지털 영상을 클라우드 서버에 업로드
○ 업로드된 이미지 품질이 충분한 경우 이 기기는 AI 알고리즘으로 영상을 분석해 당뇨병성 망막병증을 진단하고, 두 가지 결과 중 하나를 제공
- ① 경증 이상의 당뇨병성 망막병증이 발견(양성). 안과 전문의의 진찰이 필요합니다 또는 ② 경증 당뇨병성 망막병증 음성으로 12개월 이내 재검사가 필요하다는 결과를 제시
※ FDA는 양성 결과가 나올 경우 가능한 빨리 안과 전문의의 진찰을 받아 치료를 진행해야 한다고 설명
○ 900명의 당뇨병 환자로부터 얻은 망막 이미지를 테스트한 임상시험 결과, IDx-DR는 경증 당뇨병성 망막병증의 존재를 정확히 파악
- 경증 이상의 당뇨병성 망막병증에 대한 IDx-DR의 진단 성공률은 87% 이며, 경증 이상의 당뇨병성 망막병증이 없는 환자를 정확하게 가려낸 비율은 90%로 조사
< IDx-DR의 당뇨병성 망막병증 진단 프로세스 >
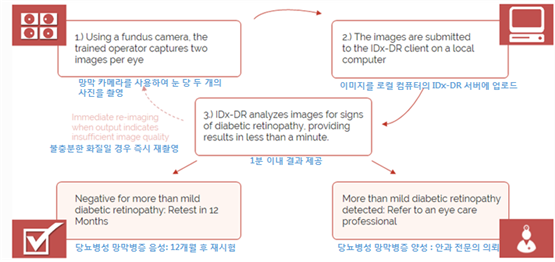
출처 : IDx 홈페이지(www.eyediagnosis.net/idx-dr)
○ IDx-DR은 임상의사가 이미지나 결과를 해석할 필요 없이 선별결과를 제공하는 최초의 의료장치로, 안과진료를 수행할 수 없는 의료제공자들(안과전문의가 아닌 의사, 간호사)도 사용 가능
- FDA 의료기기·방사선보건센터 눈·귀·코·목 장치 담당부서의 책임자인 Malvina Eydelman은 “당뇨병성 망막병증의 조기 발견은 당뇨병을 관리하는데 있어 중요한 부분이지만 환자 중 절반 가량이 안과진단을 매년 받지 않기 때문에 충분한 검사가 이뤄지지 않고 있다”고 설명
※ “이번 승인 결정은 일차 진료의사의 진료실에서 사용할 수 있는 새로운 AI 기술의 판매를 허가한 것으로, 앞으로 건강관리에 대한 환자 접근성을 향상시킬 수 있는 안전하고 효과적인 디지털 의료기기의 가용성을 계속 촉진할 것이다”라고 말함
- 다만 레이저 치료, 눈 수술 및 눈 주사를 받은 병력이 있거나 특정 안과질환을 앓는 환자, 임신 중인 당뇨병 환자에게는 IDx-DR을 사용할 수 없으며, 급속 진행성 당뇨병성 망막병증 평가 용도로는 사용 불가
○ IDx-DR은 FDA의 De Novo premarket review pathway*로 검토되었으며, 혁신적인 기기(Breakthrough Device)**로 지정받아 승인 절차를 거침
* 합법적으로 판매중인 기존의 장치가 없는 중・저위험 기기에 대한 새로운 규제 경로
** 효과적인 의료기기 개발을 위한 우선 검토 프로그램으로 혁신적인 기기로 지정받기 위해서는 다음의 기준 중 하나 이상 충족 필요. ① 해당 기기는 혁신적인 기술을 나타내야 함 ② 승인되거나 분명한 대안이나 없어야 함 ③ 기존 승인 또는 대체된 대안보다 상당한 이점을 제공해야 함 ④ 기기의 유용성은 환자의 최대 이익에 있음
지식


 BioINwatch18-39(5.29)●美 FDA 인공지능 기반 안 질환 진단기기 ...
BioINwatch18-39(5.29)●美 FDA 인공지능 기반 안 질환 진단기기 ...
 IDx-DR의 당뇨병성 망막병증 진단 프로세스
IDx-DR의 당뇨병성 망막병증 진단 프로세스