BioINwatch
(BioIN + Issue + watch) : 바이오 이슈를 빠르게 포착하여 정보 제공2020년 미국 FDA 승인 신약, 총 53개
- 등록일2021-06-08
- 조회수5110
- 분류레드바이오 > 의약기술
-
발간일
2021-06-08
-
키워드
# FDA#신약#New drug
- 첨부파일
-
차트+
?
차트+ 도움말
BioINwatch(BioIN+Issue+Watch): 21-38
2020년 미국 FDA 승인 신약, 총 53개
◇ 지난해 코로나19 상황에서도 미국 FDA는 53개 신약을 승인하며 역대 두 번째로 많은 신약을 허가. 희귀의약품 및 획기적치료제 지정 등 신속심사 허가제도를 적극적으로 활용하여 신약개발 및 승인 촉진
▸주요 출처: Nature Reviews Drug Discovery, 2020 FDA drug approvals, 2021, FDA(https://www.fda.gov/).
▣ 코로나19 팬데믹에도 불구하고, 지난해 미국 FDA의 신약 승인건수는 총 53건으로 역대 두 번째로 높은 수치를 기록
○ 지난해 FDA 의약품평가센터(CDER)는 2019년 48건에서 10.4%(5건) 증가한 53건의 신약을 승인했으며, 2018년 59건 다음으로 높은 기록
- 2020년 허가된 신약의 58%(31건)는 희귀의약품(Orphan designation) 지정, 42%(22건)는 획기적치료제(Breakthrough designation)로 지정
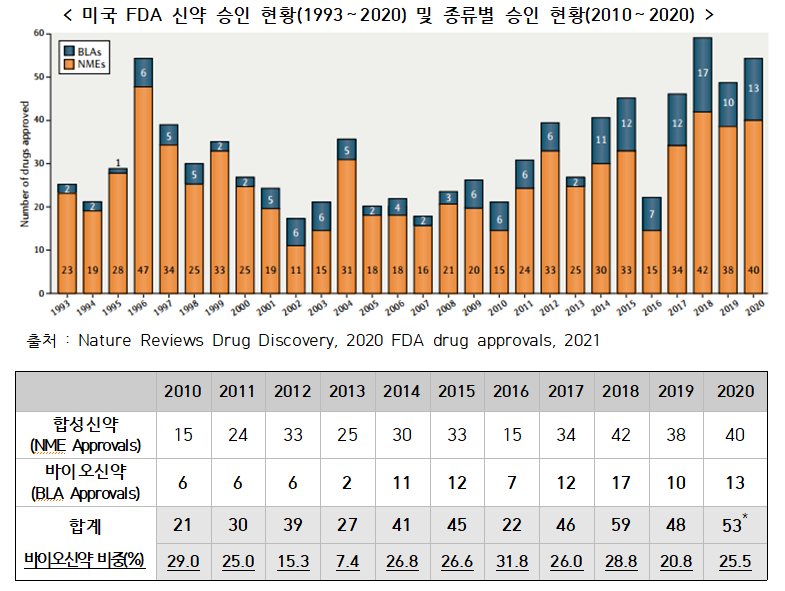
* 위의 수치는 FDA CBER(생물의약품평가연구센터)로부터 승인받은 물질과 2020년 긴급사용승인을 받은 물질은 포함되지 않은 통계임
[참고] 코로나19 대응을 위해 2020년 긴급사용승인(EUA)된 제품 Gilead의 렘데시비르는 지난해 5월 긴급사용승인 이후, 10월 첫 COVID-19 치료제로 FDA 승인 Pfizer의 BNT162b2와 Moderna의 mRNA-1273은 mRNA 기반의 코로나 백신 항체치료제인 Regeneron의 카시리비맙(casirivimab)과 임데비맙(imedevimab)의 병용 사용 및 Eli Lilly의 밤라니비맙(bamlanivimab) 긴급사용승인 |
▣ 항체(12건) 및 올리고뉴클레오타이드 기반 치료제(2건)의 활용범위 확대에 따라 지난해 14개의 제품이 승인
○ 2020년 2건의 항체-약물 접합체(Antibody-drug conjugate, ADC)가 승인되어 현재까지 총 9개
- Gilead는 Sacitizumab Govitecan*를 승인받은 후, 개발업체인 Immuno medics를 210억 달러에 인수
* anti-Trop2 항체에 SN-38이라는 topoiso merase I 저해제를 결합시킨 삼중음성 유방암(triple negative breast cancer, TNBC) 항체-약물중합체
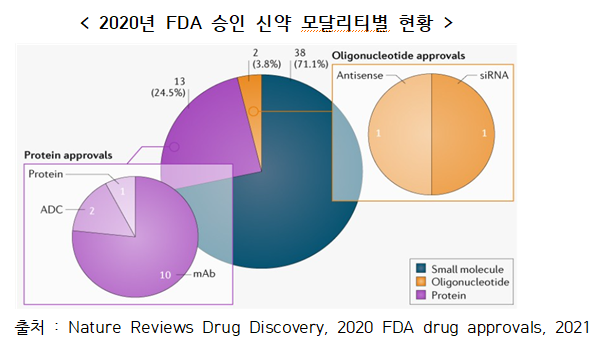
▣ FDA는 RNA 표적 저분자 화합물을 승인함으로써 새로운 치료 기회 제공
○ SMA(척추성 근육위축증)의 치료제로 Nusinersen 및 Risdiplam* 승인
- 저분자 화합물이 특정한 RNA를 표적으로 작용해 본연의 기능을 수행하지 못하도록 억제하는 기전으로 질병을 치료하는 새로운 계열의 치료제
* Genetech에서 개발한 SMN2 Pre-mRNA의 스플라이싱을 조절하는 저분자 화합물을 활용한 유전자 치료법
-
이전글
- 2021년 가장 혁신적인 50대 기업 선정, 코로나19 위기 속 빠른 혁신이 핵심 요인
-
다음글
- 바이든 행정부, 미국의회(상원, 하원), 미국 NSF 역할 확대와 예산 증액 제안
지식
동향


 BioINwatch21-38(6.1)●2020년 미국 FDA 승인 신약 총 53개.pdf
BioINwatch21-38(6.1)●2020년 미국 FDA 승인 신약 총 53개.pdf
 미국 FDA 신약 승인 현황(1993~2020) 및 종류별 승인 현황(2010~2020)
미국 FDA 신약 승인 현황(1993~2020) 및 종류별 승인 현황(2010~2020)
 2020년 미국 FDA 승인 신약 리스트(53개)
2020년 미국 FDA 승인 신약 리스트(53개)