BioINwatch
(BioIN + Issue + watch) : 바이오 이슈를 빠르게 포착하여 정보 제공이종이식에 관한 규제 및 지재권 이슈 논의 요구
- 등록일2021-08-18
- 조회수4055
- 분류기타 > 기타, 레드바이오 > 의료서비스기술
-
발간일
2021-08-18
-
키워드
#이종이식# 규제#지재권#xenotransplantation#intellectual property
- 첨부파일
-
차트+
?
차트+ 도움말
BioINwatch(BioIN+Issue+Watch): 21-57
이종이식에 관한 규제 및 지재권 이슈 논의 요구
◇ 이종이식에 관한 규제 감독 및 특허성 부여가 불명확하여 임상 적용의 걸림돌로 작용. 환자의 접근성을 높이기 위해 국제적인 공통 표준에 대한 지속적이고 체계적인 토론 요구
▸주요 출처 : Nature Biotechnology, Regulatory and intellectual property conundrums surrounding xenotransplantation, 2021.7.7
□ 이종(異種)이식(Xenotransplantation)은 유전자변형 돼지를 통해 장기이식 부족 문제를 개선할 기술로 부상
○ 면역거부 및 이식된 장기의 생존율 등 과학·기술적 문제가 해결되더라도 이종이식*을 둘러싼 규제 및 지재권 이슈로 인한 임상 적용이 어려운 상황
* 돼지 등 동물의 세포나 조직, 장기를 사람에게 이식하는 것
※ 2020년 상반기 국내 장기이식 대기자는 누적 41,262명(남인순의원실, 2020.9)
< 유전자변형 돼지를 이용한 장기이식 단계별 규제 이슈 >
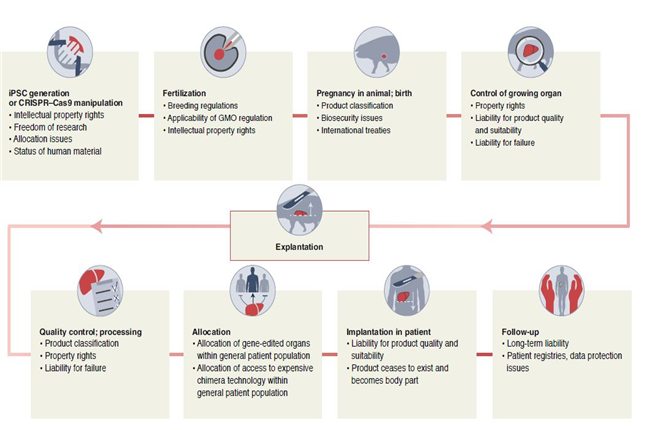
□ Nature, 형질전환 돼지 또는 인간-돼지 키메라에 대하여 3가지 이슈(규제 및 지식재산권)를 제기
○ (불명확한 법적 프레임워크) 유전자가위기술(CRISPR-Cas9)을 이용한 형질전환 돼지나 사람의 역분화줄기세포(iPSC)를 돼지 배아에 도입하는 키메라 장기는 고유한 규정에 미적용
- 사람 세포를 다루는 규정은 ‘인간의 난자’를 과정의 시작으로 보기 때문에 키메라 돼지는 이러한 규범에 의해 규제되지 않음
- 그러나, 일본은 「재생의료를 등 안정성 확보 등에 관한 법률」과 개정된 「의약품 및 의료기기 법」 (2013.11)에서 키메라 돼지를 규정의 범위에 포함
※ 일본은 「특정배아 취급에 관한 지침」의 개정(2019.3)으로 원시선(原始線)이 나타난 이후의 배아 취급과 동물성집합배아의 동물 자궁 내 이식을 허용함으로써 연구 주도권 확보를 위한 노력을 강화
- CRISPR-Cas9 기술을 적용한 유전자변형 돼지에 대한 유전자변형 생물체(GMO, Genetically Modified Organism) 규제 대상 적용 여부에 대한 논쟁
※ EU(2018년 유럽사법재판소는 조작되거나 편집된 동물을 GMO로 분류) vs. 미국 (2017년 국립과학아카데미는 새로운 생명공학 제품에 대한 Horizon-scanning 전략 개발을 촉구)
< 이종 및 세포기반 제품 관련 규제 현황 >
구분 | 특정 규정 | 국내 또는 초국가 | 공공 또는 민간 규정 | 규범적 출처 | 법적 구속력 |
미국 | O | 국내 | 공공 및 위임(FDA) | Framework of the Regulation of Biotechnology | O |
일본 | O | 국내 | 공공 | Act on the Regulation of Human Cloning Techniques (Act No. 146, 6 2000년 12월 6일; 의약품 및 의료기기에 관한 법률(PMD Act, 2013년 11월) | O |
영국 | O | 국내(일부 스코틀랜드 제외) | 공공 및 위임(HTA) | 2004년 Human Tissue Act | O |
중국 | X | - | 중국은 국제 규정을 대기 중 | - | - |
유럽 연합 | O | 초국가 | 공공 | Regulation EC 1394/2007; additional guideline on the quality of biological active substances produced by transgene expression in animals (2013); Directive 2003/94/EC; Directive 2001/83/EC; Directive 2001/20/EC; Directive 2006/86/EC | 규제는 회원국의 직접 구속력 있는 지침과 국내 시행을 포함 |
WHO | O(권장) | 초국가 | 공공(UN) | 회원국들이 이종이식을 허용하기 전에 효과적인 국가 규제를 시행할 것을 권고 | X |
○ (이종이식 제품의 정의와 범위) 이종이식에 대한 해당 규제 범주 (의료기기 또는 의약품)에 대한 논쟁
- 미국과 유럽은 첨단의료제품(Advanced Therapy Medicinal Product)으로 분류
- 조직공학제품(tissue-engineered products)은 일본의 재생의료제품 범위*에 포함
* 사람(또는 동물) 신체의 구조나 기능의 재구성, 복구 또는 형성을 위한 iPSC와 같은 사람 세포의 처리
○ (지식재산권 보호) 유형재산권(이식할 물질 세포)뿐만 아니라 무형재산권 (이종이식 세포 생산관련 지식)은 윤리적, 법적으로 더욱 복잡함
- 유럽(Directive 98/44*) 과 일본(특허법 32조**)은 특허성 제외를 명시하고, 환자의 치료 또는 치료용 제품에 대한 특허권리를 제한
* 사람과 동물의 생식 또는 전능세포에서 키메라를 생산하는 공정을 특허대상에서 제외
** 공공질서, 도덕 또는 공중보건에 위반되는 생명공학 발명은 특허성에서 제외
- 반면, 미국은 장기가 별도 제품으로 분류되는 경우 이에 대한 특허의 집행을 제한
- 정보 자기 결정권과물리적 재산에 대한 권리가 충돌하는 HeLa 세포와 같은 사례*를 피하고자 노력할 필요
* 최초로 실험실 증식에 성공한 사람세포로 공여자(Henrietta Lacks, 자궁경부암 환자)의 동의 없이 수십 년 동안 사용되어 소아마비 백신 개발 등 생명과학 발전에 크게 이바지한 것에 대해 美 하워드휴즈의학연구소는 수백만 달러 규모의 배상을 약속
□ 이종이식은 장기 공급 부족을 해결할 수 있는 중요한 기술이나, ▲ 윤리· 규범적 이슈 ▲ 기술의 미성숙 및 허가 규제 미비 ▲ 지재권 이슈에 대한 심도 있는 논의 필요
○ 해당 분야의 혁신성과 다양성에 비해 기술의 성숙도가 낮기 때문에 글로벌 규제 조화 이전에 다양한 기술적 고려사항에 대한 이해가 선행되어야 함
- 국내에서도 관련 기술 및 산업 경쟁력 제고를 위해 다양한 이해당사자 간의 논의 필요
* 국내 연구진, WHO 기준에 맞춰 돼지 각막·췌도 인체 이식 임상시험을 세계 최초로 시도 (조선비즈, 2020.7.31)
지식
- BioINregulation 바이오 규제 이해관계자 의견수렴제도 개선 방향 2025-04-02
- BioINwatch 신기술(합성생물학, 유전자편집기술 등) 발전에 따른 유전자변형미생물(GMM)의 합리적 규제 방안 2025-03-27
- BioINpro [KRIBB 워킹그룹] 국내외 LMO 관련 바이오신기술 규제 동향 2025-01-15
- BioINregulation 바이오 분야 비용편익분석: '합성생물학 개발·실험 규제완화’를 중심으로 2024-10-07
- BioINwatch USDA, EPA, FDA, 생명공학 규제 조정 프레임워크에 따른 규제 개혁 계획 발표 2024-08-20
동향


 BioINwatch21-57(8.12)●이종이식에 관한 규제 및 지재권 이슈 논...
BioINwatch21-57(8.12)●이종이식에 관한 규제 및 지재권 이슈 논...
 유전자변형 돼지를 이용한 장기이식 단계별 규제 이슈
유전자변형 돼지를 이용한 장기이식 단계별 규제 이슈
 이종 및 세포기반 제품 관련 규제 현황
이종 및 세포기반 제품 관련 규제 현황